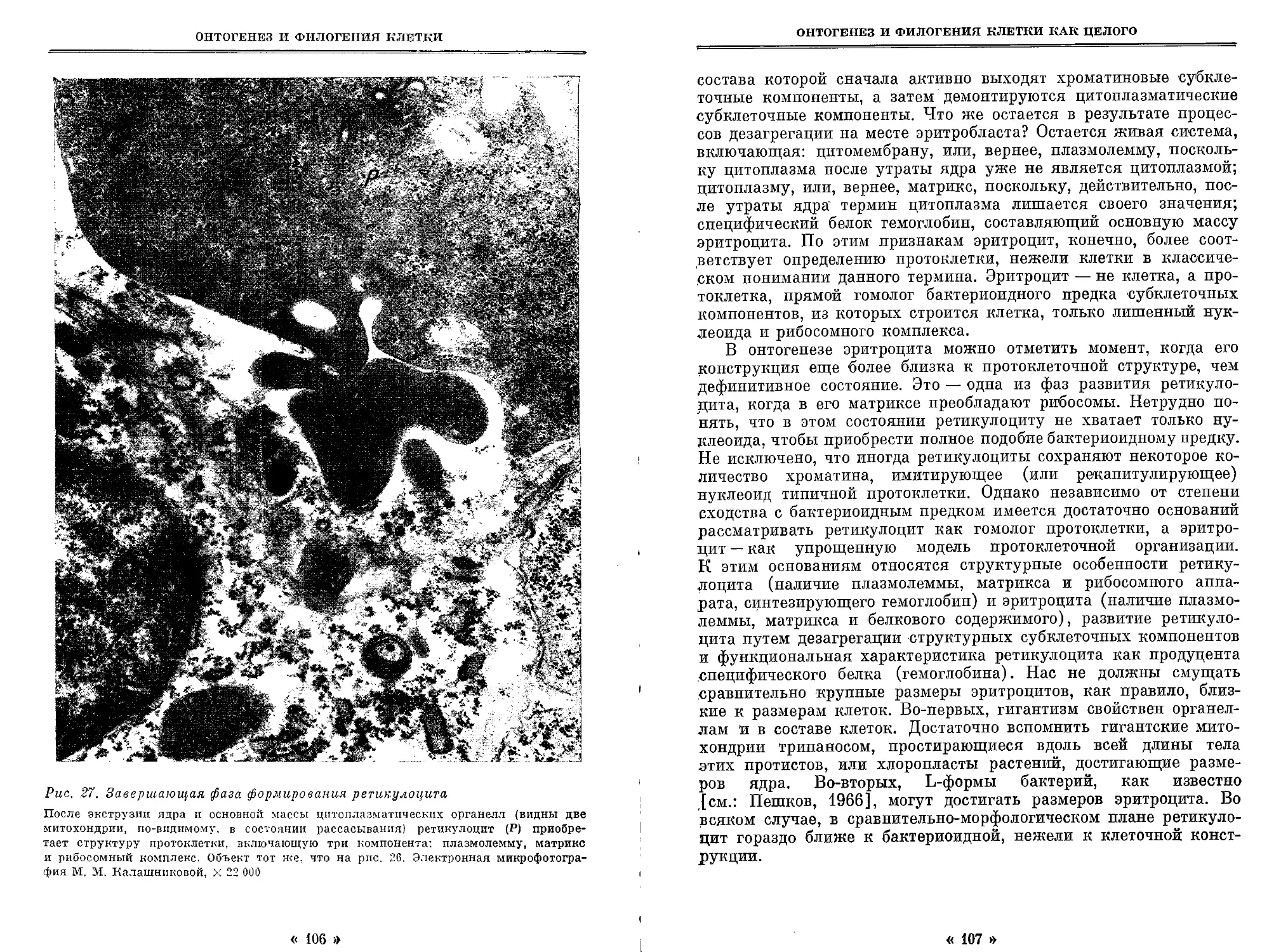
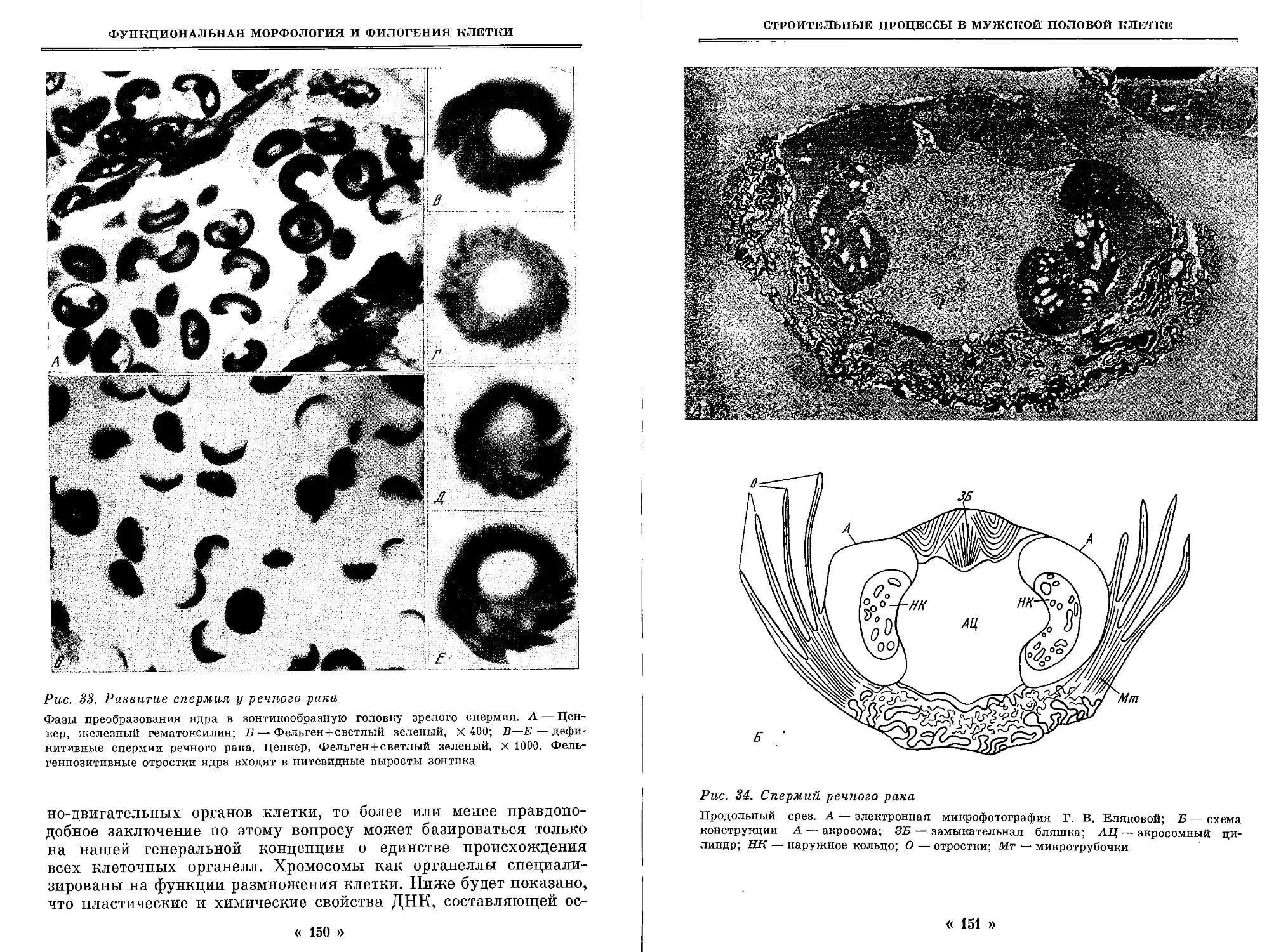
Автор: Студитский А.Н.
Теги: биология клетки и субклеточных частиц цитология биология биология клетки
Год: 1981
Текст
'V.
АКАДЕМИЯ НАУК СССР
Институт эволюционной морфологии
и экологии животных им. А. Н. Северцова
А. Н. Студитский
ЭВОЛЮЦИОННАЯ
МОРФОЛОГИЯ
КЛЕТКИ
в
Издательство «Наука»
Москва 1981
УДК 576.3
Студитский А. Н. Эволюционная морфология клетки. М.: Наука, 1981.
280 с.
В книге рассмотрены процессы структурной динамики клетки, начиная
с телофазы митотического деления, в которой автор видит начальный этап
онтогенеза клетки, рекапитулирующий ее филогенетическое происхожде-
ние из клона-колонии бактериоподобных организмов. Приведен фактиче-
ский материал, демонстрирующий признаки гомологии клеточных орга-
нелл и нх сходства с бактериоподобными организмами в процессах их
развития. Разработана гипотеза об активной роли хромосом в механизме
клеточного деления.
Издание рассчитано на широкий круг биологов — цитологов, гистологов,
эмбриологов, генетиков.
Ил. 61, список лит. 571 назв.
Ответственный редактор
доктор биологических наук
Т. II. ЕВГЕНЬЕВА
21003-579
С Q55 (02)-81 ^27-80, кн- 2- 2001030000 © Издательство «Наука», 1981 г.
ПРЕДИСЛОВИЕ
Книга «Эволюционная морфология клетки» написана вслед за
завершением работы над рукописью книги «Происхождение клет-
ки (основы эволюционной цитологии)» и может рассматриваться
как ее продолжение. Однако это совершенно независимый и само-
стоятельный труд, связанный с предшествующим только общно-
стью теоретической концепции, положенной в основу обеих книг.
Эта теоретическая концепция заключается в идее о происхожде-
нии клетки путем комплексирования, или интеграции, клона-коло-
нии бактериоподобных организмов, объединенных общим пище-
вым актом. В книге «Происхождение клетки...» представлен фак-
тический сравнительно-цитологический материал, позволяющий
поставить проблему происхождения клетки в конструктивном,
т. е. доступном экспериментальной и теоретической разработке
плане.
Сопоставив строение самых примитивных организмов (вирусы
и бактерии) с конструкцией субклеточных компонентов клетки
(плеточных органелл), а также проведя сравнительно-морфоло-
гический анализ основных ядерных и цитоплазматических орга-
нелл, я смог, как мне кажется, доказать структурное и функцио-
нальное подобие бактерий, с одной стороны, и ядерных и цито-
плазматических органелл — с другой и предпринять попытку
воссоздания пути формирования клеточной конструкции в фило-
генезе.
В Заключении к предшествующей книге я отмечал, что новая,
пли обновленная клеточная теория, базирующаяся на идее о син-
бактериогенном происхождении клетки, должна пролить свет на
многие факты структурной динамики клетки, остающиеся морфо-
логическими загадками в свете классической клеточной теории.
К. таким фактам относятся прежде всего процессы развития кле-
точной структуры в жизненном цикле клетки. Факты онтогенеза
клетки, и в первую очередь формирования дочерних клеток в
результате клеточного деления, общеизвестны. Однако, если раз-
витие дочернего организма из материнской яйцевой клетки на
протяжении столетия рассматривается и подвергается исследова-
нию как некая рекапитуляция филогенетического развития много-
клеточных организмов, формирование дочерних клеток из мате-
ринской весьма слабо обследовано в качестве рекапитуляции
исторического процесса конструирования клетки. В равной мере
с филогенетических позиций совершенно не проанализированы
процессы клеточной функционально-морфологической дифферен-
цировки (цитогенеза). Предлагаемая книга представляет собой
« 3 »
ПРЕДИСЛОВИЕ
попытку рассмотреть эти процессы с эволюционно-морфологиче-
ских позиций.
В сборе и подготовке нового фактического материала, которым
обосновывается ряд важных теоретических выводов, приняли уча-
стие сотрудники руководимой мной лаборатории — М. М. Умнова,
Ю. А. Коробко, Г. В. Елякова, Т. П. Евгеньева, Н. И. Демина,
М. М. Калашникова, которым я выражаю мою самую искреннюю
благодарность. Электронно-микроскопические фотографии сдела-
ны М. М. Калашниковой, Г. В. Еляковой и К. С. Абрамяном, ко-
торым мне хочется выразить самую глубокую признательность.
В изготовлении рисунков и схем огромную помощь мпе оказала
Р. П. Женевская, которой я приношу мою сордочпуго благодар-
ность.
Введение
ПРОБЛЕМА
ЭВОЛЮЦИОННОЙ МОРФОЛОГИИ КЛЕТКИ
ж
Эволюционная морфология клетки как специальная научная
дисциплина представляет собой проблему, результаты исследова-
ния которой пока еще трудно предвидеть.
Эволюционная морфология животных организмов возникла как
наука из сравнительной морфологии, которая на протяжении по-
лувека после классических работ Гегенбаура является одним из
краеугольных камней эволюционной теории. В трудах А. Н. Се-
верцова и его учеников и последователей сравнительная морфоло-
гия приобрела принципиально новый аспект — поиск путей и за-
кономерностей эволюции. Одним из важнейших условий становле-
ния эволюционной морфологии как повой отрасли эволюционной
теории было всестороннее использование сравнительно-эмбриоло-
гического метода, на основе которого были сформулированы зна-
менитые модусы филэмбриогенеза и обоснована теория филэмбри-
огепеза. Синтетическое применение сравнительно-эмбриологиче-
ского, сравнительно-экологического и сравнительно-анатомическо-
го методов позволило А. Н. Северцову создать учение о
функционально-морфологическом прогрессе.
В настоящее время невозможно представить себе морфолога,
который, исследуя развитие того или иного органа, не пытался
бы понять закономерности онтогенетических превращений иссле-
дуемого объекта вне зависимости от его эволюционного прошлого.
Почти одновременно с А. Н. Северцовым А. А. Заварзин
| 1925, 1934, 1945, 1947], исследуя закономерности строения и раз-
ц|Г1’ия нервной системы у беспозвоночных, разработал идею о спо-
собах эволюционных изменений тканей — свой знаменитый закон
параллельных рядов тканевой эволюции. Несколько позднее
II. Г. Хлопии [1946] выдвинул теорию эволюционной дивергенции
I нашей. В сравнительно более позднее время — в конце 40-х го-
дов— А. В. Румянцев [1958] применил теорию филэмбриогенеза
к исследованию эволюционных преобразований хрящевой и кост-
ной тканей. В значительно более трудном положении была в эту
эпоху эволюционная морфология клетки.
Для разработки эволюционно-морфологических закономерно-
стей филогении клетки в 30—40-х годах не было материально-
технических условий. На всем протяжении эры световой микро-
он и ши, начиная с работ Пуркине и Шванна и кончая блестящими
исследованиями отечественных цитологов во главе с Д. Н. Насо-
новым, клетка представлялась настолько стабильным компонентом
тканевых и органных конструкций, что ее онтогенетические и
функционально-морфологические изменения, доступные для наб-
« 5 »
ВВЕДЕНИЕ
людения в световой микроскоп, казалось, не имеют отношения к
эволюционной динамике клеточной структуры. До конца 40-х го-
дов в литературе господствовало убеждение, что клетка составля-
ет универсальную и неизменную единицу строения тканей и
органов многоклеточных животных и растений и основу конструк-
ции всех одноклеточных организмов, не подвергавшуюся измене-
ниям с момента возникновения жизни иа Земле и сохраняющую
свою универсальную структуру в течение индивидуального разви-
тия каждого живого существа. Странно, что внимание эволюцио-
нистов не привлекали такие процессы, явно отражающие эволю-
ционное прошлое клетки, как переход от ядерной к безъядерной
конструкции при развитии эритроцитов или кровяных пластинок
млекопитающих, превращения симпластической конструкции в
клеточную и клеточной в симпластическую в мышечной ткани,
превращение клеточного строения в нейронное в нервной ткани
и многие другие факты, проливающие свет на изменчивость кле-
точной структуры в индивидуальном развитии. Клетка оказыва-
лась элементом организации живых тел, по существу лишенным
индивидуального развития.
Внимание морфологов, разрабатывавших вопросы онтогенеза
многоклеточных организмов, сосредоточивалось главным образом
на процессах роста и дифференцировки развивающихся органных
структур, в которых клетке отводилась роль элементарного стро-
ительного блока, участвующего в строительстве органов в преде-
лах присущих клетке строительных функций — увеличения числа
путем размножения, а также перемещения по заданным парамет-
рам. Техника световой микроскопии способствовала сохранению
представлений о клетке как о комочке протоплазмы с ядром внут-
ри, с некоторым подобием внутриклеточной дифференцировки в
виде набора цитоплазматических органелл. Вот почему в цитоло-
гию и гистологию доэлектронно-микроскопической эры не прони-
кали идеи об эволюции клеточной структуры, вытекавшие из
капитальных работ выдающегося ученого и мыслителя нашей эпо-
хи академика А. И. Опарина [1924, 1957, 1960]. Начиная с пер-
вого очерка теории возникновения жизни на земле [Опарин,
1924], Опарин подчеркивал, что жизнь, возникшая в «первичном
бульоне» (растворе высокомолекулярных органических соедине-
ний) докембрийских океанов в виде примитивных протобионтов,
сформировавшихся из еще более примитивных коацерватных ка-
пель, прошла длительный путь эволюционных структурных преоб-
разований, прежде чем из них возникла клетка с ее специфиче-
ской организацией. Что же касается сравнительной цитологии
доэлектронно-микроскопической эры, то в этой сфере исследова-
ний господствовало убеждение, что все живые существа, начиная
с самых примитивных бактерий и кончая сложными многоклеточ-
ными организмами, наделены клеточной структурой. Лишь неко-
торые исследователи правильно интерпретировали конструкцию
« 6 »
ПРОБЛЕМА ЭВОЛЮЦИОННОЙ МОРФОЛОГИИ КЛЕТКИ
пакториальных организмов, отмечая отсутствие у бактерий основ-
ного признака клетки — деления на цитоплазму и ядро в силу
отсутствия как ядра, так и хромосом [Имшенецкий, 1950].
Внедрение в морфологию новых методов исследования, и в пер-
вую очередь электронной микроскопии, коренным образом изме-
нило представление о клеточной конструкции и динамике ее из-
менений в фило- и онтогенезе.
Первыми же исследованиями по электронной микроскопии
I.летки с помощью техники сверхтонких срезов было установлено,
что клетка обладает чрезвычайно сложным устройством, которое
никак не могло возникнуть в виде первичной структуры органи-
ческой материи. Почти одновременно с помощью той же техники
сверхтонких срезов было установлено реальное существование
организмов, лишенных типичной клеточной структуры. Такими
организмами оказались бактерии, синезеленые водоросли и акти-
ном ицеты, относимые в настоящее время к надцарству Prokaryo-
1н, характеризующемуся отсутствием оформленного ядра и кле-
Iочных органелл. Было выяснено также, что ультрамикроскопиче-
< гл с паразиты клеток и бактерий — вирусы и фаги, считавшиеся
еверхмелкими бактериями, «микробами микробов», в действитель-
ности лишены не только клеточной, но и протоклеточной (бакте-
риальной) структуры и представляют собой по существу конст-
рукции из нескольких сотен макромолекул белков и нуклеиновых
кислот, возникающих путем самосборки с помощью энзиматиче-
ских систем протоклеток или клеток-хозяев. В результате стало
и с ио, что формула «все живое — из клеток» перестала соответст-
вовать реальному многообразию строения органического мира и
клетка не только не представляет собой простейшую модель ор-
ган изации живого вещества, а несомненно сформировалась в фи-
логенезе органического мира в результате длительной предшест-
вующей эволюции.
В 1962 г. на основе анализа накопившихся к этому времени
данных о субмикроскопическом строении клетки, протоклетки
(бактериального тельца) и вирусных телец была разработана ги-
потеза об эволюционном происхождении клетки путем комплек-
тирования и интеграции клона бактериоподобных организмов, из
которых в дальнейшем возникли все клеточные органеллы.
| ('.тудитский, 1962]. Предложенная мной гипотеза коренным об-
разом отличалась от известной гипотезы симбиогенеза К. С. Ме-
режковского [Mereschkowsky, 1910], согласно которой формиру-
ющие клетку организмы объединяются в результате симбиотиче-
ской связи. С развиваемой мной точки зрения, превращения
онмбпотически связанных организмов в единый организм совер-
шен но невозможно, поскольку основу симбиоза составляет связь
физиологически (и систематически) разнородных организмов,
объединение которых определяется различиями в метаболизме и
сплавиной с ним организации. Тем не менее ход открытий в обла-
« 7 »
ВВЕДЕНИЕ
сти ультраморфологии и метаболизма клеточных и протоклеточ-
ных организмов определил дальнейшее направление исследований
в сторону разработки гипотезы симбиогеиеза.
В 1960 г. Рис [Ris, 1960] обнаружил сходство кииетонуклеуса,
трипаносомид (представляющего собой гигантскую митохондрию с
фельген-позитивным нуклеотидом) с бактериальным организмом
и сделал вывод о его симбиотической природе. Идея о глубоком
сходстве митохондрий с бактериями разработана Нассом [см.:
Nass, 1969] и высказывалась рядом других авторов. Сходство
пластид растительных клеток с автотрофными бактериями обсле-
довано многими авторами [см.: Ленинджер, 1966; Roodyn, Wilkie,
1968]. На этой основе возрождается теория симбиогеиеза
К. С. Мережковского [Margulis, 1970; Тахтаджян, 1973]. Нет не-
обходимости вступительные замечания к книге отягощать возра-
жениями против современной редакции теории симбиогеиеза.
Здесь важно отметить, что с накоплением знаний о тончайшем
устройстве клетки и предклеточных форм организации живой ма-
терии открылась принципиально новая перспектива разработки
вопросов эволюционной морфологии клетки и утверждения эволю-
ционной морфологии клетки как проблемы. Три формы организа-
ции живой материи — неклеточная (вирусная), протоклеточная
(бактериальная) и клеточная — в настоящее время стали факта-
ми науки, на основе которых оказывается возможной разработка
проблем эволюционной морфологии клетки и возникает эволю-
ционная морфология клетки как научная дисциплина.
В своей предыдущей книге «Происхождение клетки (основы
эволюционной цитологии)» я предпринял попытку обобщить все
известные факты, относящиеся к сравнительной морфологии и
физиологии вирусов, бактериальных и клеточных организмов,
с тем чтобы воссоздать филогенетическую историю клеточной ор-
ганизации. Факты, накопившиеся почти за 30 лет со времени мо-
его первого выступления с гипотезой происхождения клетки, как
мне кажется, подтверждают разработанную мной идею о возник-
новении клеточной конструкции в филогенезе путем комплексиро-
вания клона предковых бактериеподобных организмов. Клетка
представляет собой систему, построенную из субклеточных ком-
понентов — органелл, каждая из которых сохраняет в полной или
частичной мере черты сходства со своими бактериоподобными
предками. Все субклеточные компоненты — ядерные и цитоплаз-
матические органеллы — благодаря единому происхождению от
бактериоподобных предков обладают и чертами структурного
сходства друг с другом, сохраняя полный или неполный набор
элементов строения бактерии (плазмолемма, матрикс, рибосомный
комплекс, нуклеоид).
Подобно тому как открытие клеточной организации живой ма-
терии определило в значительной мере последующую эволюцион-
но-морфологическую интерпретацию процессов развития мпого-
« 8 »
ПРОБЛЕМА ЭВОЛЮЦИОННОЙ МОРФОЛОГИИ КЛЕТКИ
I.ю гоч пых организмов, открытие субклеточной организации клет-
ки п ее эволюционное объяснение должны обеспечить эволюцион-
но морфологическую интерпретацию динамики клеточной струк-
туры в процессах развития и функциональной адаптации много-
||.|нточпых организмов. Содержание эволюционной морфологии
ьлеткп как научной дисциплины полностью прояснится еще не
скоро в связи с накоплением новых данных по ультрамик-
роморфологии клетки, особенно в ее онтогенетической и функ-
циональной динамике. Однако некоторые проблемы эволюцион-
ной морфологии клетки приобретают в настоящее время доста-
10ЧН0 определенные очертания. К ним относится в первую оче-
реди проблема онтогении клетки, которой посвящена первая часть
Min ii книги. Вторая часть содержит изложение н обсуждение
фактов, относящихся к проблеме клеточной дифференцировки под
углом зрения синбактериогеиного происхождения клеточной
с । руктуры.
Главная задача книги заключалась в том, чтобы показать
ннаможность объяснения всех известных фактов развития и
дифференцировки клетки с эволюционно-морфологической точки
зрения. Если мне удалось в какой-то мере решить эту задачу,
следует считать, что эволюционная морфология клетки как науч-
ная дисциплина получила некоторые реальные перспективы раз-
ннтня.
Часть первая
ОНТОГЕНЕЗ И ФИЛОГЕНИЯ КЛЕТКИ
*
Глава первая
ПУТИ РАЗРАБОТКИ ПРОБЛЕМЫ
ОНТОГЕНЕЗА КЛЕТКИ
Проблема онтогенеза, или онтогении, клетки принадлежит к
числу наименее разработанных проблем биологии. Она даже не
сформулирована с достаточной четкостью в литературе. Дискус-
сия по этой проблеме, развернувшаяся в 30-х гг. в отечественной ли-
тературе, относилась в основном к источникам восстановительных
процессов у многоклеточных организмов и свелась к вопросу о
том, может ли дифференцированная ткань порождать путем де-
дифференцировки и деления слабо дифференцированные клетки,
способные к размножению и развитию. Один из инициаторов раз-
работки этой проблемы Б. П. Токин [1935] в дальнейшем не-
сколько изменил ее постановку, выдвинув идею о соматическом
эмбриогенезе как одной из форм индивидуального развития
[Токин, 1959, 1977]. Однако бесспорной заслугой этого выдающе-
гося ученого и мыслителя остается привлечение внимания уче-
ных к вопросу о рекапитуляционном значении репродукционной
динамики в жизненном цикле клетки.
Момент деления клетки, по Б. П. Токину, означает не простую
репродукцию двух зеркально подобных дочерних слепков мате-
ринской клетки, а процесс, сходный с возникновением нового
организма, приступающего к развитию,— нечто вроде формирова-
ния зиготы, начинающей дробление. Отсюда и возможности
дифференцировки, выходящие за пределы гистологической спе-
цифичности клетки, в частности воспроизведения клеткой одной
ткани других тканевых зачатков или даже превращения тканевой
(соматической) клетки в генеративную клетку, способную разви-
ваться в целый организм. Факты, добытые Б. П. Токиным и его
сотрудниками в 30-х гг. о регенерации гидры за счет дифферен-
цированных соматических клеток легли в основу разработанной
им в дальнейшем очень интересной теории соматического эмбрио-
генеза.
Трудность разработки теории онтогенеза клетки в 30-х годах
заключалась в неполноте представлений о клеточной структуре и
ее изменениях на протяжении репродукционного цикла клетки на
уровне светооптпческой техники исследований.
Что было известно о делящейся клетке в те времена, да и в
« 10 »
ПУТИ РАЗРАБОТКИ ПРОБЛЕМЫ ОНТОГЕНЕЗА КЛЕТКИ
nor,иедующее время, вплоть до начала электронно-микроскопиче-
raini эры? Только то, что в клетке появляются хромосомы, кото-
рые подвергаются расщеплению и расходятся к полюсам клетки,
где из пих строятся ядра. Было известно также, что этот процесс
происходит в глубокой связи с веретеном деления, в котором с
/ptiifiiix пор, чуть ли не с момента его открытия [Flemming, 1882],
видели главный механизм деления. Были выяснены также изме-
нения ядрышка и ядерной оболочки — их исчезновение в профазе
и восстановление в телофазе. Что же касается онтогенетического
винчения всех этих процессов, то о нем можно было только фан-
тазировать, так как никаких исходных представлений о роли каж-
дого из звеньев митотического цикла в’ цитологии не сложилось.
Ничего существенного к запасу сведений о митотическом делении
ндра не прибавили и разрозненные данные о делении аппарата
Гольджи путем распада на отдельности (диктиосомы) и их рас-
пределении по дочерним клеткам (диктиокинез), так же как и
немногочисленные факты, относящиеся к делению митохондрий,
сопровождающему митоз (например, при делении сперматоцитов
у кузнечика). Некоторый свет на онтогенетическое значение ми-
тотического деления проливали сведения о дедифференцировке
делящихся клеток, что особенно демонстративно проявлялось в
культурах тканей.
Было известно, что в делящихся клетках подавляются про-
цессы синтеза секретов, иногда исчезают органеллы движения
(жгутики, реснички, миофибриллы) и при культивировании тка-
ней вне организма клетки приобретает неспециализированную
структуру, отличаясь только двумя основными типами роста —
эпителиоидным и мезенхимным. Нервные клетки в культурах не
размножаются, проявляя лишь тенденцию к специфическому
типу роста. Мышечные волокна дают начало клеточным элемен-
там — миобластам, при размножении которых дифференцировка
миофибрилл отсутствует. Однако и этих данных было недостаточ-
но для конкретизации идеи об онтогенезе клеток. Вот почему
вплоть до открытия безъядерной природы бактерий и бактерио-
подобных организмов — монер, как назвал их Рис [1965], исполь-
зуя знаменитый термин Геккеля, и выяснения ультраструктурной
организации клетки, вопрос об онтогенетическом развитии клет-
ки не имел никаких перспектив ни для теоретической, ни для
экспериментальной разработки.
Для того чтобы разрабатывать проблему онтогенеза целых ор-
ганизмов или онтогенетического развития их интегральных ком-
понентов, во-первых, необходимы прежде всего средства исследо-
вания, позволяющие отличать простое от сложного в развиваю-
щемся организме и улавливать способы превращения простого в
сложное. Эмбриология как наука-о раннем онтогенетическом раз-
витии животных организмов была создана Вольфом и Бэром бла-
годаря внедрению микроскопической техники в биологию.
« 11 »
ОНТОГЕНЕЗ И ФИЛОГЕНИЯ КЛЕТКИ
Во-вторых, чтобы изучать эмбриональное развитие как про-
цесс закономерный, т. е. обусловленный определенными причина-
ми, требовалось понимать, что сходства в эмбриональном разви-
тии различных организмов зависят от степени родства этих орга-
низмов, а различия в значительной мере определяются уровнем
организации, достигнутым в ходе эволюции. Эволюционная эмб-
риология Мюллера, Геккеля, А. О. Ковалевского и И. И. Мечни-
кова стала возможной после утверждения теории Дарвина в
биологии. Клеточная теория, как известно, была обоснована
Шванном еще в 1839 г. Но роль клетки в историческом развитии
животных организмов стала очевидной только в результате раз-
работки эволюционной теории.
В-третьих, чтобы разрабатывать научную теорию онтогенеза
живых организмов, требовалось не только различать пути прев-
ращения простого в сложное в ходе развития и понимать, что1
сложные пути строятся на основе более простых, но и видеть
элементарный компонент развития — строительную единицу, за
счет размножения, дифференцировки и роста которой осуществ-
ляются все акты развития. В качестве такой единицы — размен-
ной монеты онтогенеза — в эру светооптического исследования
развития неизбежно утвердилась клетка.
Нет необходимости задерживаться на анализе той огромной
роли, которая принадлежит клеточной теории в разработке науч-
ных, т. е. эволюционных представлений об онтогенетическом раз-
витии. С клетки — зиготы — начинается онтогенез любого много-
клеточного животного и растительного организма. Клетка —
одноклеточный организм — является филогенетическим прообра-
зом зиготы. Первое дробление зиготы имитирует, точнее, рекапи-
тулирует размножение одноклеточного предка путем деления.
Путем размножения клеток создаются первые временные (прови-
зорные) формы существования зародыша — морулы, бластулы,
гаструлы, планулы, имитирующие, или, вернее, рекапитулирую-
щие различные способы формирования первых клонов-колопий
одноклеточными предками современных Eukaryota. Размножение
клеток обеспечивает обособление первых, зачастую временных,
так называемых провизорных органов зародышей — всевозмож-
ные пузырьки, капсулы, трубочки, также имитирующие, или, точ-
нее, рекапитулирующие различные формы объединения однокле-
точных предков в виде клонов-колоний, использованные первыми
многоклеточными организмами в качестве трафаретов для конст-
руирования первых специализированных органов. Можно смело
сказать, что эволюционная эмбриология почти за столетний пе-
риод развития после Геккеля — Ковалевского так прочно связала
разработку конкретных проблем онтогенеза многоклеточных орга-
низмов с клеточной валютой, что не придавала никакого значения
чрезмерной ценности этой валюты и не представляла себе даже
теоретической возможности перехода на другую валюту с более
« 12 »
ПУТИ РАЗРАБОТКИ ПРОБЛЕМЫ ОНТОГЕНЕЗА КЛЕТКИ
мелкой — доклеточной — разменной монетой. Обсуждение этого
поп роса — о возможности существования такой монеты в виде
г груктурных компонентов клетки — не вызывало у эмбриологов
до последнего времени ни малейшего интереса.
Вот почему двум самым капитальным достижениям биологиче-
ской пауки XX столетия — открытию безъядерной конструкции
опктерий и бактериальной конструкции органелл клетки — сов-
ременная эмбриология не уделяет никакого внимания, как будто
эти открытия не имеют никакого отношения к учению об онтоге-
незе живых организмов. До сих пор современные эмбриологи
начинают отсчет онтогенеза с клетки-зиготы и изучают его по'
явлениям размножения, роста и дифференцирования клетки, не
придавая никакого значения тому, что развитие половых клеток
сопровождается сложнейшими процессами развития и размноже-
ния ядерных и цитоплазматических органелл, формирование
зиготы включает пе менее сложные процессы перемещения и
слияния клеточных частей, дифференцировка клетки сопровожда-
ется удивительными процессами изменения органелл и т. д. и т. п.
Всем этим процессам научная, т. е. эволюционная, эмбриология
обязана найти научное, т. е. эволюционное, толкование.
Безъядерная конструкция бактерий и бактериоподобных орга-
низмов — факт, который не может оставаться вне поля зрения
эволюционной эмбриологии. Бактериальная конструкция клеточ-
ных органелл, или, точнее, сходство ультраструктуры и химизма
органелл с ультраструктурой и химизмом бактерий,— тоже
факт, хотя и менее очевидный. Во всяком случае факт, не вызы-
вающий никаких сомнений, заключается в том, что в ультра-
структуре клетки совершенно отчетливо обособлены с помощью
элементарных мембран, проявляющих тенденцию к сдваиванию,
или двойных мембран, основные органеллы клетки, включая
ядерные органоиды, отделенные от цитоплазматических органелл
общей двойной мембраной. Структурное и метаболическое сход-
ство некоторых органелл (в частности, митохондрий и пластид)
с. бактериями в настоящее время не вызывает сомнений. Ставит-
ся вопрос: не отражается ли бактериальное происхождение кле-
точной структуры в процессах онтогенеза клетки? На этот вопрос
возможны три ответа.
Первый: бактериоподобные органеллы (митохондрии и пласти-
ды) не имеют прямого отношения к происхождению клеточной
структуры, так как их связь с клеткой вторична. Бактерии про-
никли и вступили в симбиотическую связь с уже сформированной
клеткой. В формировании основной структуры клетки (цитоплаз-
матического мешка с ядром внутри) бактерии не участвовали,
представляя собой абортивные формы клеток, утратившие оформ:
ленное ядро. Естественно, в онтогенезе клетки никакого отраже-
ния этот процесс не получает.
Второй: бактериоподобные органеллы клетки (митохондрии и
« 13 »
ОНТОГЕНЕЗ И ФИЛОГЕНИЯ КЛЕТКИ
пластиды) и все остальные ее мембранные устройства, включая
ядро, возникли в протоклетке из впячиваний и разрастаний плаз-
молеммы (схема Робертсона [Robertson, 1959; Робертсон, 1963,
1964], которую можно называть гипотезой мембрапогенеза).
В онтогенезе — жизненном цикле клетки — процессы филогенети-
ческого развития цитоплазматических органелл и ядра отражены
в мембранных связях между органеллами и ядром, а также в
формировании органелл (пиносом, фагосом) путем впячиваний
плазмолеммы.
Третий: клетка построена из органелл, возникших путем спе-
циализации из бактериоидных предков, сформировавших клетку
путем комплексирования (гипотеза синбактериогенеза клетки).
В онтогенезе клетки этот процесс несомненно должен получить
отражение, подобно всем основным процессам усложнения кон-
струкции живых организмов в филогенезе.
Здесь следует остановиться на четвертом ответе, получившем
в последние годы довольно широкое признание, согласно которому
клетка несет в своей структуре вполне отчетливый след своего'
эволюционного происхождения из симбиотического объединения
предковых организмов бактериального типа. Такой ответ пред-
ставлен симбиотической гипотезой происхождения клеточной
структуры, принятой за последние годы рядом исследователей
[Margulis, 1970; Тахтаджян, 1973]. Эта гипотеза кажется с перво-
го взгляда довольно правдоподобной, поскольку главный ее до-
вод — сходство митохондрий, а также пластид растительных орга-
низмов с организмами бактериального типа — бесспорен. Однако
с биологической и даже узко морфологической точки зрения сим-
биотическая гипотеза не выдерживает критики.
Общеизвестно, что явление симбиоза заключается в структур-
ном объединении несходных физиологически и далеких в таксо-
номическом плане организмов. Водоросль хлорелла, связанная
симбиотически с клетками зеленой гидры, получает питание от
своего партнера и, в свою очередь, обеспечивает партнера
кислородом в силу физиологического различия обоих организмов.
Но это физиологическое различие вытекает из принадлежности
партнеров к двум далеко разошедшимся таксонам — растительно-
му и животному царствам. Несходство симбионта и хозяина, на
котором базируется их взаимовыгодное сожительство, вытекает из
их неродственных отношений, исключающих возможность объедине-
ния в целостный организм. Различные формы симбиоза бактерий
с одноклеточными организмами известны, например взаимовыгод-
ный симбиоз двух видов бактерий с гигантской корненожкой рода
Pelomyxa [Daniles et al., 1966], сопряженный с замещением бак-
териальной активностью функций всех цитоплазматических ор-
ганелл, но бактерии в цитоплазме пеломиксы остаются бактерия-
ми, отнюдь не превращаясь в ее органеллы.
Второй аргумент заключается в отсутствии у бактериальных:
« 14 »
ПУТИ РАЗРАБОТКИ ПРОБЛЕМЫ ОНТОГЕНЕЗА КЛЕТКИ
оргппнзмов, да и у всех прокариотов, возможностей для взаимо-
проникновения одного из партнеров в цитоплазму другого. Явле-
ния фаго- и пиноцитоза у прокариотов не обнаружены, в силу
чего пути проникновения в матрикс бактерий для других орга-
низмов закрыты. Известные случаи бактериального паразитизма
па бактериях характеризуются локализацией бактерии — парази-
та между плазмолеммой и внешней мембраной инфицируемой
бактерии [Burnham et al., 1968].
Симбиогенная концепция эволюционного происхождения клет-
ки некоторым исследователям представляется неприемлемой с
биохимических позиций, согласно которым митохондрии как пред-
полагаемые потомки прокариотических организмов по характеру
метаболизма не соответствуют условиям докембрийского времени,
когда могло произойти их симбиотическое объединение с другими
прокариотами. Согласно эволюцонно-биохимической концепции
происхождения клетки [Mahler, Raff, 1975], митохондрии возник-
ли в структуре предкового прокариотического организма путем
проникновения эписомной (плазмидной) ДНК, вокруг которой
сформировались мембраны путем впячивания плазмолеммы. Плаз-
мидная гипотеза происхождения клеточной структуры (вернее,
митохондриального аппарата) представляет собой, таким образом
вариант мембранной теории Робертсона.
Первый ответ на поставленный нами вопрос не может быть
принят при обсуждении поставленного вопроса в качестве аль-
тернативы, поскольку в нем заключается отрицание какого-либо
значения безъядерного состояния в филогении клетки. Можно
сказать только, что в настоящее время, после обстоятельных ис-
следований безъядерных организмов (бактерий, синезеленых во-
дорослей и актиномицетов) с помощью современных методов, не-
достаточно отрицать их филогенетическое значение на основании
простого суждения о дегенеративном характере их безъядерной
конструкции, необходимо научно обосновать это суждение в соот-
ветствии со всем арсеналом новейших фактов о строении и функ-
циях бактерий и бактериоподобных организмов.
Разработка вопроса должна, очевидно, вести либо ко второму,
либо к третьему ответам как альтернативным. Исследование
должно обнаружить в онтогенезе клетки либо отражение мембран-
ного пути формирования структуры клетки в филогенезе (по
схеме Робертсона), либо отражение (рекапитуляцию) процессов
комплексирования бактериоидных предков в соответствии с раз-
рабатываемой в этой книге гипотезой. Главным условием для
осуществления этой задачи, по-видимому, является выбор точки
отсчета — определение момента, который можно считать началом
онтогенеза.
По схеме Робертсона, структурная динамика клетки вооб-
ще может не иметь никакого начального этапа. Если клетку рас-
сматривать как систему взаимосвязанных и переходящих одна в
« 15 »
ОНТОГЕНЕЗ И ФИЛОГЕНИЯ КЛЕТКИ
ОПТОГЕНЕЗ КЛЕТКИ НАЧИНАЕТСЯ С ТЕЛОФАЗЫ
п|
я
м
ч
в
4
п
п
в
I
о
с
в
I
I
<
с
I
I
I
<
(
]
]
<
(
J
]
]
]
I
другую мембран, то се онтогенез, очевидно, должен заключаться
в формировании одних мембранных систем за счет других.
К числу этих процессов, однако, относится ряд процессов, обус-
ловленных функционально и осуществляющихся буквально на
всех этапах жизненного цикла клетки: обособление пиносом и
фагосом от плазмолеммы, гладких мембран эндоплазматической
сети от шероховатых, обособление (выраженное мембранной
связью) мембран эргастоплазмы от ядерной мембраны, окончатых
мембран от ядерной оболочки и т. д. И все же наиболее логич-
ным будет точку отсчета наметить на том отрезке клеточного
цикла, когда наиболее демонстративно выявляется процесс ново-
образования основных структурных компонентов клетки как мем-
бранных (цитоплазматической и ядерной мембран), так и зерни-
сто-волокнистых (ядрышка, хроматина). Этот отрезок включает
телофазное состояние разделившегося ядра, когда из эргастоплаз-
матических пузырьков строится ядерная мембрана, из телофазных
хромосом конструируется интерфазная хроматиновая система, из
рассеянных рибосом конструируется ядрышко и в межзональном
пространстве возникают пузырьки, из которых строятся плазма-
леммы дочерних клеток.
Этот этап как точка отсчета в онтогенезе клетки и должен в
первую очередь подвергнуться исследованию.
Глава вторая
ОНТОГЕНЕЗ КЛЕТКИ
НАЧИНАЕТСЯ С ТЕЛОФАЗЫ
ТЕЛОФАЗА И ЦИТОКИНЕЗ
Общеизвестно, что окончательное формирование дочерних кле-
ток осуществляется в телофазе. И, действительно, телофаза яв-
ляется этапом жизненного цикла, который начинается с демонта-
жа главного механизма митотического деления — митотического
аппарата — и завершается отделением дочерних клеток друг от
друга — процессом цитокинеза. Принято различать эти процес-
сы — телофаза считается конечной стадией митотического деле-
ния ядра, цитокинез — периодом отделения дочерних клеток друг
от друга [Мэзия, 1963]. Однако взаимная связь этих процессов
настолько очевидна, что нет возможности рассматривать их неза-
висимо один от другого.
Митотическое деление ядра, как правило, завершается деле-
нием цитоплазмы в отличие от амитоза, с помощью которого в
большинстве случаев конструируются многоядерные системы
(симпласты). Даже при редукции хромосомного набора или даже
при отсутствии хромосом, вызванном лучевой травмой, ложный
митоз (с редуцированным числом хромосом или без хромосом) за-
вершается обособлением дочерних клеток по плоскости, прохо-
дящей поперек веретена [Мэзия, 1963]. Таким образом, телофаза
почти неизбежно завершается цитокинезом, предшествуя ему во
времени. Вот почему телофаза как точка отсчета в клеточном
цикле обязательно включает цитокинез и все сопутствующие ему
явления.
Исследование митотического деления с помощью цейтраффер-
ной съемки, например в широко известных работах Байера и его
сотрудников [Bajer, Mole-Bajer, 1963; Bajer, 1968], показало, что
изменения в плоскости будущего деления клетки (цитокинеза)
обнаруживаются при митотическом делении в период, когда хро-
мосомы еще сохраняют индивидуальность, т. е. в самом начале
телофазы. Таким образом, телофазу следует рассматривать в це-
лом как процесс, завершающий формирование двух дочерних
клеток.
Что же включает телофаза? Нельзя сказать, что, по сравнению
( с другими этапами митотического процесса, телофаза изучена с
достаточной полнотой как в структурном, так и физиологическом
отношении. В исследовании Мэзии [1963], включающем около
400 страниц, анализ данных, относящихся к телофазе, занимает
всего 10 страниц, цитокинезу посвящено несколько больше — 40
страниц. В прекрасной книге И. А. Алова «Цитофизиология и па-
тология митоза» [1972] из 167 страниц, относящихся к физиоло-
гии клеточного деления, телофаза занимает 9 страниц, процесс
цитогенеза — 17. В монографии Ю. С. Ченцова и В. Ю. Полякова
«Ультраструктура клеточного ядра» [1974] телофаза не подверг-
нута специальному рассмотрению, хотя митотический процесс
находится в поле зрения авторов. Очень слабое внимание Мэзия
уделяет интересующей нас проблеме — эволюционно-морфологи-
ческому значению телофазы и цитокинеза. Между тем поставлен-
ные им «проблемы телофазы» имеют самое непосредственное от-
ношение к эволюционной морфологии клеточного деления.
Мэзия рассматривает четыре вопроса: «демонтаж» митотиче-
1 ского аппарата и процессы, характеризующие восстановление
) интерфазного ядра: восстановление хроматинового аппарата ин-
терфазного ядра из телофазных хромосом, восстановление ядрыш-
, ка, восстановление ядерной оболочки. В качестве пятого вопроса
можно добавить процессы, отнесенные Мэзия собственно к цито-
кинезу. Из них непосредственное отношение к теме этой части
книги имеет восстановление или развитие плазмолемм дочерних
клеток, завершающее рассматриваемый этап клеточного цикла.
« 16 »
2 A. н. Студитский
« 17 »
ОНТОГЕНЕЗ И ФИЛОГЕНИЯ КЛЕТКИ
ХРОМОСОМЫ В ТЕЛОФАЗЕ КЛЕТОЧНОГО ДЕЛЕНИЯ
Как отмечалось выше, телофаза не привлекала такого внима-
ния ученых, как предшествующие этапы митотического деления
клетки. Одна из причин слабой изученности телофазного процесса
заключается в том, что он осуществляется в условиях демонтажа
митотического аппарата, в котором современные цитологи усмат-
ривают главный механизм клеточного деления [Luykx, 1970; Lam-
bert, Bajer, 1975]. Вот почему такие огромные усилия современ-
ной цитологией и современной цитогенетической наукой затраче-
ны на анализ первых фаз митотического процесса, в то время как
телофаза привлекает до сих пор сравнительно слабое внимание.
Между тем с эволюционно-морфологической точки зрения
именно телофаза должна привлекать в первую очередь внимание
цитолога, изучающего клеточное деление, поскольку в телофазе
впервые продукты деления — дочерние клетки — принимают свой
структурный облик и приобретают готовность к самостоятельно-
му существованию. К сожалению, недостаточность накопленных
в литературе данных не позволяет сделать окончательных выво-
дов о природе и значении телофазного состояния клетки (или
клеток, если говорить о продуктах деления). Тем не менее то,
что уже известно о телофазном процессе, позволяет определить
главное в его структурной динамике — рекапитуляцию филогене-
тического процесса — формирование клетки за счет комплекси-
рования предковых протоклеточных организмов.
Клетка возникла, согласно развиваемой нами концепции, пу-
тем комплексирования и интеграции предковых организмов бак-
териального типа. Центрально расположенные протоклетки сфор-
мировали ядро — орган деления клетки, состоящий из протокле-
ток, преобразовавшихся в ядерные органеллы — хромосомы и
ядрышки. Из плазмолемм этих протоклеток возникла общая
ядерная мембрана. Все эти процессы получают достаточно демон-
стративное отражение в телофазе. Наиболее ярко эволюционное
прошлое ядра выявляется в структурной динамике телофазных
изменений хромосом.
ТЕЛОФАЗА ДИНОКАРИОНА
Естественно, в самой очевидной форме рекапитуляционный
процесс конструирования ядра за счет протоклеточных строитель-
ных блоков разыгрывается у низших эукариотов, в частности у
динофлагеллят. К сожалению, в имеющихся работах по ультра-
структуре ядра и его репродукционной динамике главное внима-
ние обращалось не на телофазу, а на предшествующие стадии
этого примитивного митотического цикла [Dodge, 1963; Grell,
1964; Chunusoff, Hirschfeld, 1967; Kubai, Ris, 1969; Kubai, 1975].
Из литературных данных по делению динофлагеллят мы зна-
ем, что диномитоз характеризуется своеобразным продольным
« 18 »
ОНТОГЕНЕЗ КЛЕТКИ НАЧИНАЕТСЯ С ТЕЛОФАЗЫ
расщеплением хромосом (с формированием Y- и V-образных
делящихся хромосом), совершающимся в метафазной плоскости,
по с расположением хромосом вдоль оси деления клетки, после
чего начинается их аиафазное движение к полюсам ядра (рис. 1).
Митотический аппарат отсутствует. Микротрубочки образуют
только осевой внутриядерный пучок. Центромер (кинетохоров) в
\ ромосомах нет. Эти своеобразные процессы, совершающиеся
дппохромосомами автономно, без помощи тянущих нитей (микро-
трубочек веретена),— можно применять к ним названия диноме-
тафаза и диноанафаза — переходят в динотелофазу, характеризу-
ющуюся формированием двух телофазных групп хромосом и
перешнуровкой ядерных оболочек.
Мы не знаем способа, посредством которого ядерная оболочка
первой клетки возникла за счет плазмолемм первых протоклеток,
превратившихся в хромосомы,— назовем их протохромосомами.
)(ля динокариона — наиболее примитивного среди ядер низших
эукариотов — характерно сохранение бактериоидного способа
формирования дочерних ядерных мембран — путем простой пере-
тяжки или перешнуровки, с помощью которой формируются до-
черние плазмолеммы бактерий. Очевидно, в диномитозе сохранил-
ся какой-то намек на способ превращения плазмолемм ядерных
протоклеток в кариолемму клетки. Этот процесс мы рассмотрим
ниже. Сейчас важно отметить, что динохромосомы в телофазе об-
разуют две группы, подлежащие распределению по дочерним яд-
рам путем перетяжки ядерной мембраны. Это самая простая из
форм телофаз у эукариотов. В ее простоте, очевидно, подвергается
рекапитуляции величественный акт объединения, интеграции и
специализации первых протоклеток, формирующих клетку.
Группа хромосом, подобных нуклеоидам бактерий, среди зер-
нистости, напоминающей рибосомную зернистость бактерий,—
такова структура телодинокарионов на всем протяжении телофа-
зы, вплоть до перешнуровки ядра на два дочерних динокариона.
Нетрудно представить себе рекапитулируемый этой формой
телофазы филогенетический процесс формирования ядра клетки.
Очевидно, он заключался прежде всего в утрате плазмолемм,
;т счет которых сформировалась ядерная мембрана — кариолем-
ма — клетки. Нуклеоиды трансформировались в динохромосомы.
Матрикс превратился в общую кариоплазму с общей для всего
ядра системой, или аппаратом, рибосом.
ХРОМОСОМНЫЕ ЯДРА В ТЕЛОФАЗЕ
Пет необходимости специально анализировать поведение хро-
мосом в телофазе эумитоза у низших эукариотов. С эволюционно-
морфологической точки зрения в телофазе эумитоза у всех эука-
риотов, начиная с простейших, используется путем рекапитуля-
ции единый механизм новообразования ядра — путем реконст-
« 19 »
2*
ОНТОГЕНЕЗ И ФИЛОГЕНИЯ КЛЕТКИ
S
Рис. 1. Схема четырех типов конструкции ядер и ядерных делений
А—В — ядра и формы протомитоза (ядерного деления без демонтажа ядерной мем-
браны) у простейших: AI — ядро жгутиконосцев Dinoflagellata (динокарион), вклю-
чающее хромосомы, построенные по типу усложненных нуклеоидов бактерий (агре-
гаты мотков ДНК), ядрышко, содержащее нуклеоид с мотком ДНК, окруженным
рибосомным комплексом, и матрикс с рассеянными в нем рибосомами; АН — деле-
ние динокариона (диномитоз) сопровождается расщеплением хромосом (динохромо-
сом) по типу нуклеоида бактерий (каждая хромосома расщепляется на два агре-
гата мотков ДНК); BI — ядро жгутиконосцев Euglenidae (звгленокарион) включает
хромосомы эвгленоидного типа (эвгленохромосомы), состоящие из ДНК (изображен-
ной в виде петель) и рибосомного комплекса (рибосомы изображены точками),
а также крупное ядрышко, тоже содержащее моток ДНК (нуклеоид) и рибосомный
комплекс; ВП — деление эвгленокариона (эвглеиомитоз) сопровождается расщепле-
« 20 »
ОНТОГЕНЕЗ КЛЕТКИ НАЧИНАЕТСЯ С ТЕЛОФАЗЫ
Нунции и интеграции строительных компонентов бактериоид-
ных предков, в частности хромосом. Различие высших форм
этого процесса от низших заключается в усложнении конструкции
хромосом. Но главный принцип конструирования ядра — путем
ого сборки из компонентов бактериоидной конструкции — сохра-
няется на всем протяжении эволюции клетки.
На протяжении эволюционных преобразований митоза наибо-
лее существенным изменениям подвергается способ распределе-
ния органелл материнской клетки по дочерним клеткам в тело-
фазном процессе. У одноклеточных эукариотов растительного ряда
обнаруживается тенденция к сохранению ядерной мембраны де-
лящегося ядра на первых этапах перехода к демонтажу — монта-
жу хромосом в течение митотического цикла. У некоторых видов
(например, одноклеточной водоросли Dunaliella [Marano, 1976])
деление ядра сопровождается делением одиночной пластиды. В те-
лофазе отмечается равномерное распределение комплексов
Гольджи (диктиосом) и эргастоплазматических телец (эргасто-
г.ом, по предлагаемой мной терминологии) по дочерним клеткам.
Наибольший интерес в эволюционных преобразованиях мито-
за, естественно, должны привлекать телофазные процессы, проте-
кающие без демонтажа хромосом до конца митотического процес-
са, как это имеет место у эвгленид, гипермастигид и некоторых
других простейших (см. рис. 1, Б, В~).
К сожалению, у высших эукариотов подобные телофазные со-
стояния современными методами изучены слабо. Однако в тех
случаях, когда эумитоз осуществляется без демонтажа хромосом
н интерфазе, имеющиеся описания позволяют видеть в телофазе
рекапитуляцию филогенетического формирования ядра. По неко-
торым данным [Murray et al., 1965], ядро лимфоцита (тимоцита)
а телофазе содержит довольно бесформенные массы хромосом,
тяготеющих к формирующимся ядерным оболочкам. Эти субмемб-
рпппые скопления хромосом (или хроматина) останутся в ядрах
лимфоцитов и на интерфазный период.
пнем и расхождением хромосом и перетяжкой ядрышка; BI — ядро паразитиче-
ских жгутиконосцев Hypermastigidae включает ядрышко и хроматиновый комплекс;
около ядра локализуется центриолярный аппарат, связанный с жгутиком; ВП— де-
ление ядра гипермастигид (плевромитоз) сопровождается демонтажем ядрышка,
но видимому, с перемещением ядрышкового вещества в конденсирующиеся хромо-
сомы, которые расщепляются и расходятся по дочерним ядрам с помощью микро-
трубочек, связывающих хромосомы с центриолями через ядерную мембрану; П —
типичное ядро (эукарион) многоклеточных животных. Хроматин диспергирован
и квриоплазме в виде петель ДНК и рибосом; ядрышко содержит ДНК-компонент
(нуклеоид) и рибосомный комплекс; ГН—типичный митоз (эумитоз) включает
демонтаж ядрышка и ядерной мембраны с включением ядрышкового вещества
и хромосомы
« 21 »
ОНТОГЕНЕЗ И ФИЛОГЕНИЯ КЛЕТКИ
ТЕЛОФАЗА ЭУМИТОЗА
НУКЛЕОЛЯРНО-ХРОМАТИНОВЫХ ЯДЕР
Телофазный демонтаж хромосом, характерный для высшей
формы эумитоза (эумитоз у многоклеточных организмов с нуклео-
лярно-хроматиновым типом ядра), очевидно, рекапитулирует вто-
рой, вероятно, более поздний способ интеграции протоклеточных
конструктивных компонентов, использованный клеткой при фор-
мировании ядра. У большинства эукариотов хроматин интерфаз-
ного ядра имеет сложную гранулярно-волокнистую конструкцию,
в которой содержатся ДНП, РНП (рибосомы) и белки [Stubble-
field, 1973; Ченцов, Поляков, 1974]. Хромосомы, как было пока-
зано выше, включают те же строительные элементы. Телофазный
процесс в клетках с ядрами нуклеолярно-хроматинового типа за-
ключается в демонтаже хромосом на блоки, из которых строится
хроматиновый аппарат хроматинового ядра.
Естественно, этот процесс отличается от телофазы динокарио-
нов, в которой процесс филогенетической интеграции ядра река-
питулируется с полной демонстративностью. Однако и в случае
эумитоза нуклеолярно-хроматиновых ядер телофаза митоза про-
должает рекапитулировать сборку ядра первых эукариотов путем
интеграции комплекса протоклеток. Во всех формах эумитоза те-
лофаза начинается с объединения анафазных хромосом в группу,
которая представляет собой как бы закладку новообразованного
ядра (рис. 2). Усложнение конструкции хромосом по сравнению
с примитивными динохромосомами не приводит к выпадению
этой важнейшей стадии конструирования ядра из онтогенеза
клетки.
ЯДРЫШКОВЫЙ КОМПОНЕНТ В ТЕЛОФАЗЕ
Поведение ядрышкового аппарата на протяжении эволюции
клетки подвергается существенным изменениям. Хромосомный
аппарат сформировался при переходе от протоклеточной органи-
зации к клеточной как главный механизм клеточного деления.
На ядрышко пала задача обеспечивать в основном метаболические
и пластические функции клетки путем продуцирования рибосом.
Однако и хромосомы, и ядрышки, специализируясь на отправле-
нии двух различных функций, вместе с тем сохраняют свойства и
признаки своих бактериоидных предков, общие для обоих органо-
идов: способность к функциональной гипертрофии вплоть до
L-трансформации, бактериоидный механизм деления путем пе-
ретяжки, способность к передвижению внутри ядра и внутри де-
лящейся клетки. И ядрышки, и хромосомы как потомки высоко-
активных общих бактериоидных предков могут в какой-то мере
рекапитулировать если не все, то часть предковых признаков,
восстанавливая утраченные при специализации черты. Нуклеоло-
хромосомы, сформировавшиеся у некоторых радиолярий в отсут-
« 22 »
ОНТОГЕНЕЗ КЛЕТКИ НАЧИНАЕТСЯ С ТЕЛОФАЗЫ
Рис. 2. Онтогенез клетки начинается с телофазы митотического деления.
Н телофазе происходит монтаж клетки как двухкомпонентной (ядерно-ци-
!«плазматической) системы: строится ядро путем обособления ядерных ор-
.‘инелл посредством ядерной оболочки, конструируемой из мембранных
Фрагментов (везикулов), монтируются интерфазная конструкция хромати-
нового аппарата и ядрышковый аппарат
Поздняя анафаза из культуры мезенхимы золотистого хомячка. Начало формирова-
нии ядерной мембраны путем мембранной трансформации везикулов цитоплазмы
(продуктов дезинтеграции ядерной мембраны и эргастоплазмы материнской клет-
|о>). Электронная микрофотография К. С. Абрамяна
сгвие ядрышек [Grell, Ruthmann, 1964],— это, несомненно, при-
мер рекапитуляции хромосомами предкового признака, локализи-
руемого в других клетках в ядрышковом аппарате. Ядрышковую
структуру приобретают нуклеолохромосомы ядер Бальбиани и
чромосомы-ламповые щетки.
С другой стороны, у многих низших эукариотов (динофлагел-
ляты, эвглениды, некоторые корненожки) ядрышко сохраняется
я ядре на протяжении всего жизненного цикла и подвергается
делению во время митоза вместе с хромосомами и подобно хро-
к 23 »
ОНТОГЕНЕЗ И ФИЛОГЕНИЯ КЛЕТКИ
мосомам. Очевидно, в эволюции клетки ядрышковый аппарат в
какой-то мере может принять на себя часть хромосомных функ-
ций и хромосомный аппарат — какие-то из ядрышковых функ-
ций. Однако, несмотря на различные формы взаимоотношений
между ядрышками и хромосомами при осуществлении различных
функций, ядрышковый аппарат на всем протяжении эволюции
клетки сохраняет тенденцию входить как неотъемлемый ком-
понент в конструкцию формирующегося ядра.
В наиболее демонстративной форме эта тенденция проявляет-
ся у динофлагеллят, эвгленид и некоторых других низших эука-
риотов. Динокарионы, эвгленокарионы и другие типы нуклеоляр-
но-хромосомных ядер приобретают ядрышко в телофазе диноми-
тоза или эвгленомитоза за счет половины материнского ядрышка,
разделившегося путем перешнуровки. Здесь важно отметить, что
сравнительно крупные ядрышки делящихся ядер возникают у
динофлагеллят и эвгленид путем слияния мелких ядрышек в
профазе деления. Таким образом, телофазные ядрышки у пред-
ставителей этих групп — это множественные ядрышки, полинук-
леолы. В дальнейшем мы увидим, что тенденция к демонтажу и
ремонтажу ядрышек в процессах жизнедеятельности и деления
клетки отражает один из важных признаков ядрышкового аппа-
рата, связанных со способом его формирования в филогенезе.
Итак, у примитивных эукариотов ядрышко включается в мон-
таж ядра, подобно хромосомам этих форм,— путем сборки ядер-
ной системы из готовых конструкций — хромосом и ядрышка,
точно рекапитулируя эволюционный путь формирования ядра.
Эумитоз нуклеолярно-хроматиновых ядер сопровождается демон-
тажем ядрышек (как это происходит, например, у корненожки
эвглифы в профазе) и реконструкцией ядрышек в телофазе.
Здесь мы встречаемся с более сложной рекапитуляцией сборки
ядра из протоклеток в филогенезе.
Выше было отмечено, что хромосомы проявляют тенденцию к
включению в свой состав компонентов ядрышковых конструкций.
Нуклеолохромосомы радиолярии аулаканты [Grell, Ruthmann,
1964] — это хромосомы, несущие в себе ядрышковый строитель-
ный материал (РНП), скорее всего, в форме рибосом. Гистохи-
мия ядрышек и динамика перемещения ядрышкового материала
при делении у эвглифы современными методами не обследованы.
Однако данные по гистохимии и ультраструктуре ядрышек и хро-
мосом при делении ядра у высших эукариотов позволяют пред-
полагать, что клетка использует различные типы конструкции
ядрышек и хромосом при митотической реорганизации ядерной
структуры и новообразовании ядра в телофазе.
Общеизвестно, что параллельно с демонтажем ядрышка в про-
фазе обнаруживается накопление РНК в профазных хромосомах
[Мэзия, 1963]. Пиронинофилия метафазных и анафазных хромо-
сом, связанная, очевидно, также с накоплением РНК, описыва-
« 24 »
ОНТОГЕНЕЗ КЛЕТКИ НАЧИНАЕТСЯ С ТЕЛОФАЗЫ
лась многими авторами. Выяснилось, что в метафазных хромосо-
мах клеток HeLa имеется 0,66 мг РПК на 1 мг ДНК [Huber-
man, Attardi, 1966]. Известно также, что к гранулярному
компоненту хромосом принадлежат рибосомы или рибосомоподоб-
пые гранулы РНП [Поляков, Ченцов, 1969; Miller, Hamkalo,
1972; Ченцов, Поляков, 1974; Lafontaine, Lord, 1974; Ghosh,
1976]. Нельзя исключить того, что рибосомы, освобождающиеся
при профазном демонтаже ядрышек, в значительной мере всту-
пают в связь с хромосомами, входя в них в качестве конструк-
тивного компонента [Ченцов, Поляков, 1974]. Профазные, ана-
фазные и метафазные хромосомы — ото нуклеолохромосомы,
подобные хромосомам аулаканты. Одновременно накопление РНК,
регистрируемое по пиронинофильности и по обилию рибосом на
электронных микрофотографиях, обнаруживается в околохромо-
сомном пространстве, особенно между нитями веретепа. Сборка
ядрышек обнаруживается в определенных участках между тело-
фазными хромосомами. Вполне возможно, что одним из источни-
ков формирования ядрышек являются рибосомы, накапливаю-
щиеся в хромосомах на предшествующих стадиях и в телофазе
выходящие в межхромосомное пространство. Имеются данные и
о синтезе РНК в телофазе, проанализированные еще Мэзией
[1963].
В руководствах по цитологии синтез РНП и сборку ядрышек
принято связывать с определенными участками хромосом — так
называемыми ядрышковыми организаторами. Особенно отчетлива
связь ядрышек с нуклеолохромосомами в ядрах клеток Бальбиа-
ни, где ядрышки как бы нанизаны на хромосомы. Это устройство
послужило основой для представления о ядрышке как о специа-
лизированном отрезке хромосомы [Кикнадзе, 1972]. При анализе
этого представления отмечалось [Студитский, 1973], что оно от-
ражает собой только удивительную связь между хромосомами и
ядрышками, демонстрирующую их глубокую гомологшо. В про-
цессе реконструкции ядрышка в телофазе можно видеть рекапи-
туляцию древних состояний ядрышко-хромосомных комплексов,
когда специализация ядрышек и хромосом была в какой-то сте-
пени обратимой и материал ядрышкового комплекса мог целиком
входить в состав хромосом (как в ядрах аулаканты) или обособ-
ляться в виде самостоятельной системы. Репродукционная дина-
мика ядрышкового вещества на протяжении митоза подтверждает
общую закономерность онтогенеза ядерных органелл путем мон-
тажа, демонтажа и реконструкции.
КАРИОЛЕММА И ПЛАЗМОЛЕММА В ТЕЛОФАЗЕ
Ядерная мембрана, как стало очевидным уже после первых
электронно-микроскопических исследований митоза [см.: Porter,
Machado, 1960; Мэзия, 1963], подвергается распаду на мелкие
« 25 »
ОНТОГЕНЕЗ И ФИЛОГЕНИЯ КЛЕТКИ
пузырьки в профазе и восстанавливается из этих или им подоб-
ных пузырьков в телофазе. Развитие ядерной мембраны в тело-
фазе позволяет с большой отчетливостью представить себе про-
цесс монтажа общей ядерной мембраны за счет плазмолемм бак-
териоидных предков, вошедших в конструкцию клеточного ядра.
Где-то на предшествующих этапах митоза клетка приобретает
сходство с исходной протоклеточной системой, из которой когда-
то сформировалась клетка. Общая цитоплазматическая конструк-
ция связана в целое общей цитомембраной, возникшей путем
слияния плазмолемм периферических протоклеток. На перифе-
рии располагаются дифференцирующиеся цитоплазматические
органеллы. Центральное положение занимает комплекс протокле-
ток, из которых конструируется орган размножения — ядро.
В конце профазы и в метафазе центральную зону клетки зани-
мает комплекс основных ядерных органелл — хромосом, среди ко-
торых располагаются остатки демонтированной ядерной оболоч-
ки, возникшей за счет плазмолемм центральных протоклеток.
Хромосомы и пузырьки ядерной оболочки — это те строительные
блоки, из которых будут конструироваться дочерние ядра на про-
тяжении телофазы.
Формирование ядерной мембраны за счет плазмолемм бакте-
риоидных предков в настоящее время следует считать почти бес-
спорным фактом, поскольку этот процесс с полной демонстратив-
ностью отражается во всей феноменологии ядерных изменений
в анафазе и телофазе митотического процесса. Каждая хромосо-
ма несет на себе покров из многочисленных пузырьков, имею-
щих черты строения ядерной мембраны. Тенденция одиночных
хромосом строить индивидуальную оболочку давно известна. Еще.
Вильсон [1963] приводил примеры деления клетки с индивидуа-
лизированными хромосомами, например дробление яйца у аска-
риды с обособлением хромосом в выростах ядерной оболочки или
дробление яйца у рыбы Fundulus с сохранением хромосом в ин-
дивидуализированных оболочках в виде кариомеров. В телофазе
у этого объекта на некоторых стадиях дробления ядро имеет вид
грозди мелких ядер. У клеща Pediculopsis хромосомы обособле-
ны и покрыты индивидуализированными оболочками на всем
протяжении митотического цикла. Для этих необычных вариан-
тов митоза, полузабытых современными руководствами цитоло-
гии, предложен специальный термин «мерокинез». По некоторым
данным в телофазе пузырьки, формирующие ядерную мембрану,
конденсируются вокруг каждой хромосомы [Murray et al., 1965;
Ченцов, Поляков, 1974]. Индивидуализированные мембраны хро-
мосом обнаружены в митозирующих нейробластах кузнечика
[Stevens, 1965], в сперматидах некоторых видов остракод [Zis-
sler, 1968а, в], в хромосомных комплексах спермиев Mytilus
после внедрения в яйцевую клетку [Longo, Anderson, 1969].
« 26 »
ОНТОГЕНЕЗ КЛЕТКИ НАЧИНАЕТСЯ С ТЕЛОФАЗЫ
Клетка высших эукариотов унаследовала от низших эукарио-
ion богатый арсенал ядерных конструкций и механизмов их ре-
продукционных изменений. Формирование ядер путем перешну-
ронкп ядерной оболочки — так называемый амитоз — получил
довольно широкое распространение у высших эукариотов, хотя
иипостпые примеры этого типа деления еще слабо изучены с по-
мощью современных методов исследования [см.: Studitsky, 1974].
Амитоз в последнее время принято считать абортивным, или деге-
неративным, способом клеточного деления. При любом биологи-
ческом значении этого процесса не может вызывать сомнений его
генетическая связь с делением ядра путем перешнуровки ядер-
пой оболочки у низших эукариотов. Однако для огромного боль-
шинства высших эукариотов типична эумитотическая форма
новообразования ядерной оболочки — за счет фрагментов, возни-
кающих при ее демонтаже в профазе. Точная картина рекон-
струкции ядерной оболочки в телофазе митотического деления
clips не создалась, хотя сам факт воссоздания кариомембраны за
счет ее фрагментов, локализирующихся на телофазных хромосо-
мах, не вызывает сомнений. Совершенно неясны причины пере-
хода от прямой перешнуровки ядерной мембраны, характерной
для деления ядра у примитивных форм эукариотов, к демонта-
жу и вторичному монтажу, наблюдаемым у высших эукариотов.
В основе обоих процессов лежит, очевидно, испытанный путь
монтажа сложных конструкций из уже существующих элемен-
тарных блоков. При прямой перешнуровке ядра эти блоки встраи-
ваются в существующую мембрану, не нарушая ее целости.
С примером такого рода строительной активности клетки мы по-
знакомимся в одной из следующих глав при описании отщепле-
ния акцессорных ядер. Второй способ строительства заключается
в полном демонтаже воспроизводимой системы и использовании
мелких строительных блоков для формирования двух равноцен-
ных копий.
ЦИТОКИНЕЗ —
ЗАВЕРШАЮЩИЙ ЭТАП ТЕЛОФАЗНОГО ПРОЦЕССА
Как отмечалось выше, цитокинез — процесс отщепления до-
черних клеток друг от друга— представляет собой завершающую
стадию митотического процесса, биологическое значение которого
заключается в том, чтобы разделить клетку. Цитокинез, или цито-
томия,— это процесс отделения дочерних клеток друг от друга.
Несмотря на довольно большую литературу, относящуюся к цито-
кинезу, накопленные в этой области факты не позволяют строить
достаточно убедительных эволюционно-морфологических обобще-
нии. До последних лет исследователей занимало не столько про-
исхождение цитокинеза, сколько механизм его осуществления
[Мэзия, 1963; Зотин, 1971; Алов, 1972], хотя совершенно очевид-
« 27 »
ОНТОГЕНЕЗ И ФИЛОГЕНИЯ КЛЕТКИ
к 28 »
ОНТОГЕНЕЗ КЛЕТКИ НАЧИНАЕТСЯ С ТЕЛОФАЗЫ
по, что эволюционный подход не только облегчает каузальный
анализ процессов развития, но и является обязательной его пред-
посылкой.
Факты, которыми располагает цитология в области феномено-
логии цитокинеза, сводятся к следующей картине. Растительные
клетки по данным цейтрафферной микрокиносъемки [Bajer, Mole-
Bajer, 1963; Bajer, 1968] обнаруживают чрезвычайно раннее,
приходящееся на начало анафазы, обособление зоны разделения
дочерних клеток в виде мельчайших уплотнений между нитями
веретена в плоскости формирования будущей межклеточной пере-
городки. Эта зона была открыта еще с помощью светооптических
средств исследования и получила название фрагмопласта. Пока-
зано [Porter, Machado, 1960; Bajer, 1968], что фрагмопласт со-
стоит из пузырьков и трубочек, неотличимых от компонентов
эндоплазматической сети. Развитие клеточной перегородки авто-
ры связывают с более крупными пузырьками, локализующимися
в зоне фрагмопласта,— фрагмосомами.
Локализация пузырьков, намечающих плоскость будущего
деления клетки среди волокон (микротрубочек) веретена, харак-
терна п для животных клеток. Во многих работах по электрон-
ной микроскопии митоза отмечено развитие таких пузырьков —
можно называть их теловезикулами — между прядями микротру-
бочек веретена и в прилежащей к веретену цитоплазме. Полоса
таких теловезикул отчетливо выражена, например, на электронно-
микроскопическом изображении телофазы митоза лимфоцита
(тимоцита) в цитированной выше работе Меррей с сотрудниками
[Murray et al., 1965]. Многократно теловезикулы встречались
сотрудникам нашей лаборатории при обследовании митотического
деления в культурах тканей. Отделение дочерних клеток друг от
друга осуществляется по плоскости теловезикулов путем их слия-
ния и постепенного обособления стенок слившейся полости.
Существенную, хотя и не очень ясную роль в телекинезе играет
веретено.
Как можно судить по электронно-микроскопическим картинам,
веретено до конца деления играет роль оси, вдоль которой рас-
ходятся дочерние ядра и дочерние клетки в целом. На удачных
электронных микрофотографиях можно видеть, что замыкание
возникающей двуконтурной стенки между дочерними клетками
(т. е. двух цитомембран примыкающих друг к другу дочерних кле-
ток) осуществляется по поверхности веретена, которое как бы за-
купоривает отверстие, соединяющее клетки (рис. 3). При более
Рис. 3. Веретено участвует в цитокинезе некоторых клеток в качестве оси,
ориентирующей положение клеток в системе клеточного пласта
Цитогенез клеток фолликулярного эпителия яичника муравья Lasius niger. В — пу-
чок микротрубочек веретена. Остатки микротрубочек видны в сформировавшихся
ядрах (В'). Электронная микрофотография M. М. Калашниковой
« 29 »
ОНТОГЕНЕЗ И ФИЛОГЕНИЯ КЛЕТКИ
свободном расположении делящихся клеток, например при рас-
хождении дочерних клеток делящегося лимфоцита, между ними
остается связующее тельце, состоящее из остатков веретена и
окружающей цитоплазмы — (midbody по Murray et. al., 1965).
Таким образом, структурную основу конечного этапа митоти-
ческого деления — телофазы и цитокинеза (назовем этот этап
телокинезом) — составляет сборка двух мембран — ядерной и
клеточной. Кариомембрана строится за счет пузырьков демонти-
рованной кариомембраны материнского ядра, цитомембрана —
за счет пузырьков, возникающих в плоскости цитокинеза. Огром-
ное эволюционно-морфологическое значение телокинеза заклю-
чается в том, что в основе конструирования карио- и цитомемб-
ран лежит общий — везикулярный — принцип.
Каково происхождение везикулов, из которых строится ядер-
ная мембрана новообразованной клетки? Едва ли могут быть со-
мнения в том, что хотя бы часть этих везикулов — кариотело-
везикулов — возникает за счет продуктов демонтажа материнской
ядерной оболочки, хотя участие пузырьков эргастоплазмы в этом
цроцессе не только не исключено, но и вполне вероятно. Этот
процесс, как мы убедились выше, рекапитулирует сборку общей
кариомембраны при комплексировании ядерных протоклеток.
Нетрудно понять, что внутренняя стенка двойной ядерной мемб-
раны представляет собой собственно кариомембрану, возникшую
за счет плазмолемм ядерных протоклеток. Что же касается на-
ружной стенки ядерной мембраны, то она представляет собой
производное плазмолемм прилежащих к ядру цитоплазматиче-
ских протоклеток — эргастосом, из которых по существу строит-
ся вся цитоплазма. Отсюда и тенденция внешней стенки карио-
мембраны к накоплению рибосом.
Теперь обратимся к везикулам, из которых строится раздели-
тельная мембрана дочерних клеток — назовем их цитотеловези-
кулами. Каково их происхождение? С эволюционно-морфологиче-
ской точки зрения цитотеловезикулы, как и кариотеловезикулы,
имеют общее происхождение и общую природу — это элементар-
ный структурный компонент разделительных и комплексирующих
устройств клеточной конструкции. Комплексирование протокле-
ток в форме клеточной конструкции неизбежно сопровождалось
либо редукцией, либо слиянием плазмолемм, прилегающих друг
к другу бактерицидных организмов. Двойные мембраны, разде-
ляющие тела бактериоидных организмов при их комплексирова-
нии, в одних случаях превращались в двойные мембраны клеточ-
ных органелл (ядерпая мембрана, митохондриальные мембраны,
мембраны в комплексах ретикулосом и эргастосом), в других
случаях распадались на пузырьки (пиносомы, фагосомы, одиноч-
ные пузырьки эргастоплазмы и ретикулоплазмы). Демонтаж
двойных мембран путем распада на пузырьки и сборку двойных
мембран из пузырьков можно рассматривать как рекапитуляцию
« 30 »
ОНТОГЕНЕЗ КЛЕТКИ НАЧИНАЕТСЯ С ТЕЛОФАЗЫ
Рис. 4. Схема формирования
кариомембраны (КМ) за счет
кариотеловезикулов и разде-
лительной межклеточной мем-
браны (МКМ) за счет цито-
везикулов (1—3)
древнейшего строительного процесса в истории клетки — сборки
клеточной конструкции из протоклеток.
Монтаж кариомембраны из кариотеловезикулов представляет
собой реальный процесс монтажа одного из важнейших компо-
нентов клеточной конструкции — ядра. Возможное участие в этом
процессе везикулов эргастоплазмы не только не противоречит
идее о его рекапитуляционном значении, но, напротив, подкреп-
ляет ее, поскольку первичное ядро возникло в окружении эрга-
стосом цитоплазмы. Что же касается сборки цитомембран двух
примыкающих дочерних клеток, то слияние цитотеловезикулов
было единственным способом отделения друг от друга двух впер-
вые появившихся дочерних клеток.
Везикулярный пласт в плоскости будущего раздела клетки
строится точно так же, как формируется везикулярная оболочка
новообразованных ядер. Но перинуклеарное пространство только*
отделяет внутреннюю кариомембрану от внешней. А цитомембран-
ное пространство, возникающее между дочерними клетками, от-
деляет их одну от другой (рис. 4). Здесь чрезвычайно важно
подчеркнуть, что по своему структурному характеру двойные
мембраны, отделяющие дочерние клетки друг от друга, неотли-
чимы от двойных ядерных мембран. Различие заключается в том,
что разделительные двойные цитоплазматические мембраны яв-
ляются гладкими, в то время как ядерные двойные мембраны
покрыты с одной стороны или с обеих рибосомами. Но это раз-
личие вторичное.
Так же как наружная ядерная мембрана строится из самого
ходового строительного клеточного материала — из стенок эрга-
« 31 »
ОНТОГЕНЕЗ П ФИЛОГЕНИЯ КЛЕТКИ
Рис. 5. Контактирующие (разделившиеся) клетки семенного канальца
речного рака
Эпителий семенного канальца рака. На внутренних поверхностях плазмолемм —
рнпосомы (показаны стрелками). Электронная микрофотография Г. В. Еляковой
« 32 »
ОНТОГЕНЕЗ КЛЕТКИ НАЧИНАЕТСЯ С ТЕЛОФАЗЫ
стосом, оба листка двойной разделительной цитоплазматической
мембраны представляют собой стенки эргастосом контактирую-
щих клеток. Расщепление материнской клетки шло по пузырь-
кам эргастоплазмы. И если делящиеся клетки принадлежат к
ткани, интенсивно продуцирующей белки, то разделительные
цитомембраны усеяны рибосомами так же густо, как и карио-
мембраны (рис. 5), свидетельствуя о своем происхождении из
эргастоплазматических мембран.
Никаких признаков формирования ядерной мембраны по схеме
Робертсона при новообразовании дочерних ядер не обнаруживает-
ся. Цитомембрана делящейся митотической клетки не проявляет
никаких тенденций к образованию глубоких впячиваний, способ-
ных к превращению во внутриклеточные мембраны. Как для
ядерной мембраны, так и для цитомембраны характерен везику-
лярный способ развития. Вот почему схема Робертсона не полу-
чает никакого подтверждения в процессе новообразования клетки
в телофазе.
Формирование дочерних ядер (телофаза) и отделение дочер-
них клеток друг от друга при митотическом делении представ-
ляет собой согласованный во времени и взаимно обусловленный
процесс, которому предлагается наименование — телекинез. Мон-
таж в телокинезе хромосом, ядрышек и ядерных оболочек можно
рассматривать как рекапитуляции филогенетического конструиро-
вания клеточной организации путем комплексирования протокле-
точных организмов. В телофазе митотического деления формиро-
вание хромосомного или хроматинового аппарата дочернего ядра
рекапитулирует сборку ядра первичной клетки из бактериоподоб-
ных организмов. У низших эукариотов ядрышковый компонент
ядра ведет себя по хромосомному типу, входя в состав дочернего
ядра без последующего монтажа. У высших эукариотов ядрыш-
ковый компонент, подвергающийся демонтажу в профазе, воз-
можно, входит в виде свободных рибосом в хромосомы, приобре-
тающие таким образом сходство с нуклеолохромосомами низших
эукариотов. Монтаж ядрышек в телофазе митоза рекапитулирует
процесс формирования ядрышек в первичной клетке.
Ядерная оболочка в телокинезе монтируется из пузырьков,
образовавшихся при демонтаже материнского ядра (кариотело-
возикулов), рекапитулируя процесс сборки ядра первичной клет-
ки. Разделительная двойная цитомембрана строится между дочер-
ними клетками за счет пузырьков эргастоплазмы — цитотелове-
зикулов, также рекапитулируя монтаж первичной клетки.
Никаких признаков формирования ядра по схеме Робертсо-
на — путем впячивания и разрастания цитомембраны в процессе
новообразования клетки путем телокинеза —яге обнаруживается.
3 А. н. Студитский « 33 »
ОНТОГЕНЕЗ И ФИЛОГЕНИЯ КЛЕТКИ
Глава третья
ОНТОГЕНЕЗ И ФИЛОГЕНИЯ ЯДРЫШКА
КАК МОГЛО ВОЗНИКНУТЬ ЯДРЫШКО
В ФИЛОГЕНЕЗЕ КЛЕТКИ
Среди всех органелл, полученных клеткой при переходе от
протоклеточной к клеточной организации, ядрышко представ-
ляется наиболее загадочным приобретением.
В самом деле, для всех цитоплазматических органелл может
быть предложена гипотеза, объясняющая их происхождение.
Любая органелла, окруженная мембраной, может быть выведена
из другой мембранной органеллы. Наряду с гипотезой Робертсо-
на, изображающей всю мембранную систему клетки продуктом
впячиваний и разрастаний цитоплазматической мембраны, во мно-
жестве исследований описано развитие одного мембранного обра-
зования путем отрастания от другого: гладких мембран эндоплаз-
матической сети от шероховатых, мембран телец Гольджи от
эргастоплазматических мембран, мембран митохондрий от ядер-
ных мембран и т. д. В монографии Фрей-Висслинга и Мюлета-
лера [1968] в качестве основного источника происхождения
мембран цитоплазматических органелл указывается ядерная обо-
лочка, из которой, согласно схемам этих авторов, путем выпячи-
вания одной наружной мембраны ядерной оболочки возникают
канальцы эндоплазматической сети, а из выпячиваний обеих
мембран цитоплазматические органеллы, в частности митохонд-
рии и пластиды. Таким образом, эволюция клеточной организа-
ции обеспечивается широкими возможностями превращения
одной мембранной системы в другую. Поскольку в бактериальной
протоклетке представлена, по крайней мере, одна мембранная
система — в виде плазмолеммы, с гипотезами взаимных превра-
щений мембранных систем при обсуждении проблем происхож-
дения клетки нельзя не считаться. Значительно большие труд-
ности встречает разработка вопроса о происхождении ядрышка.
Ядрышко, как и хромосомы, относится к числу органелл,
лишенных мембраны. Но если в отношении хромосом возникает
возможность искать источник их возникновения в нуклеоиде бак-
терий, то ядрышко никаких более или менее вероятных пред-
шественников среди строительных компонентов прокариотов не
имеет, если не считать рибосомного комплекса, рассеянного в
матриксе. Очевидно, если ядро возникло в соответствии со схе-
мой Робертсона путем окружения выростами впячивания цито-
мембраны, то ядерные органеллы — хромосомы и ядрышки —
могли сформироваться только путем дифференцировки содер-
жимого нуклеоида — макромолекул ДНК. По современным
представлениям, этот путь эволюционного развития ядерной кон-
« 34 »
ОНТОГЕНЕЗ И ФИЛОГЕНИЯ ЯДРЫШКА
струкции достаточно правдоподобен, так как ДНК обладает свой-
ством детерминировать синтез РНК и белков, т. е. тех компонен-
тов, которые входят в состав ядрышек и хромосом. Проще говоря,
ядрышки должны, согласно этой схеме, возникнуть в качестве
производных хромосом. Такой взгляд, как неоднократно отмеча-
лось выше, получил свое развитие в концепции ядрышковых
организаторов.
ЯДРЫШКОВЫЕ ОРГАНИЗАТОРЫ В ХРОМОСОМАХ
Ядрышковые организаторы, т. е. локусы хромосом, продуци-
рующие или организующие ядрышковый материал, известны для
многих объектов, которые приводятся во всех учебниках генети-
ки, цитогенетики и цитологии [Мюнтцинг, 1963, 1967; Де Робер-
тис и др., 1967; Гершкович, 1968; Суонсон и др., 1969] (рис. 6).
В этих объектах чаще всего в качестве примеров приводятся
ядрышкообразующая пара хромосом ржи, шестая хромосома ку-
курузы, организаторы ядрышка в хромосомах — ламповых щет-
ках, в гигантских хромосомах ядер Балбиани. Для некоторых
ядрышковых организаторов точно установлена связь их локали-
зации с центромерами хромосом. Полной ясности в этом вопросе
все же нет. До сих пор ведутся споры о том, как осуществляет-
ся функция ядрышкового организатора: путем синтеза рибосо-
мальной (ядрышковой) РНК и ядрышковых белков или путем
сборки ядрышек из продуктов, синтезируемых в других участ-
ках хромосом. Количество ядрышковых организаторов часто во
много раз превышает количество ядрышек в ядре. В ядрах кле-'
ток человека насчитывают 10 хромосом-носителей ядрышковых
организаторов, в то время как число ядрышек колеблется вокруг
значительно меньшей цифры и никогда не достигает 10
[W. Schnedl, М. Schnedl, 1972].
Усиление внимания к ядрышковым организаторам за послед-
ние годы нетрудно объяснить тем, что в связи с уточнением
средств исследования стали накапливаться данные о присутствии
в ядрышках ДНК, требующие объяснений с позиций современной
генетической теории. По некоторым данным ДНК при определен-
ных условиях выявляется с помощью реакции Фельгена, напри-
мер, в ядрышках клеток регенерирующей печени [David, 1960],
где по старым данным находили только РНК и белки.
В более позднее время [Sadowski, Steiner, 1970] ДНК была
обнаружена биохимически в изолированных ядрышках печени
крыс после удаления околоядрышкового хроматина. Ядрышковая
ДНК, согласно этим данным, составляет 5,17% всей ядерной
ДНК, т. е. в состав ядрышка входит двадцатая часть ядерной
ДНК. Внутриядрышковый хроматин обнаруживается на электрон-
ных микрофотографиях в виде тонких нитей, располагающихся
в центральном, более рыхлом пространстве [Е. Guttes, S. Guttes,
« 35 »
3*
ОНТОГЕНЕЗ И ФИЛОГЕНИЯ КЛЕТКИ
1961; McLeish, 1968; Lord, Lafontaine, 1969; Miller, Beatty,
1969], — можно называть его ядрышковым нуклеоидом.
За последние годы появилось немало работ, посвященных вы-
явлению ядрышковой ДНК в печени крыс и в других объектах
[Nash, Plant, 1965; Ribas-Mundo, 1966; Unuma et al., 1967;
McLeisch, 1968; Perkowska et al., 1968; Ebstein, 1969; Ghosh, Lettre,
1969; Perry, 1969; Chouinard, 1970; S. Ghosh, I. Ghosh, 1970;
Ghosh et al., 1970; Gorovsky, 1970; Whitecar-Briggs, 1970]. Боль-
шинство авторов не сомневаются в том, что ядрышковый хрома-
тин представляет собой материал активности ядрышковых орга-
низаторов [Hsu et al., 1965; LaCour, Wells, 1967; Hsu et al.,
Puc. 6. Схема взаимодействия яд-
рышкового организатора хромосомы
с ядрышком в ядре водоросли Spi-
rogyra crassa
А — покоящееся ядро; Б — ранняя про-
фаза; В — средняя профаза; Г — позд-
няя профаза; Д—метафаза; ядрышко
исчезло [по Godward, 1966]
1968; Macgregor, 1968, 1972;
Miller, 1969; S. Philips, D. Phi-
lips, 1969; W. Schnedl, M. Schne-
dl, 1972; Satir, Dirksen, 1971;
Ghosh, 1976].
Причина повышения содер-
жания ДНК в ядрышке заклю-
чается в усилении синтеза РНК,
с которым, очевидно, связано
повышение потребности в ДНК.
Полагают, что эта потребность
удовлетворяется ядрышковым
организатором, входящим в со-
став ядрышка, где он подверга-
ется множественной реплика-
ции— «амплификации» (см.:
Прокофьева-Бельговская, 1971;
Дэвидсон, 1972; Barsacchi, Call,
1972; Macgregor, 1972). Надо
сказать, что к настоящему вре-
мени не было ни одной серьез-
ной попытки разобраться в ог-
ромном фактическом материале,
относящемся к проблеме ядрыш-
кообразования, классифициро-
вать эти факты и дать каждой
их группе более или менее прав-
доподобное объяснение, не от-
ступая от основной схемы тео-
рии ядрышковых организато-
ров. В монографиях и руковод-
ствах по цитологии, как правило,
приводится какая-то часть име-
ющихся данных, настолько про-
тиворечивых, что общий вывод
о механизмах ядрышкообразо-
« 36 »
ОНТОГЕНЕЗ И ФИЛОГЕНИЯ ЯДРЫШКА
вания представляется чрезвычайно затруднительным [Sirlin, 1962;
Равен, 1964; Ченцов, 1966; Де Робертис и др., 1967; Нау, 1968;
Bernhard, Granboulan, 1968; Pavan, Brito de Cuhna, 1969; Perry,
1969; Tocchini-Valentini, 1971; Fick, Brachet, 1971; Леви, Сике-
виц, 1971; Дэвидсон, 1972; Кикнадзе, 1972].
ЯДРЫШКИ И ХРОМОСОМЫ
Из всех обобщений, относящихся к механизму ядрышкообразова-
ния, пожалуй, наиболее соответствующей истине можно считать
гипотезу о генетической связи ядрышек с хромосомами. Идея
о хромосомальной природе ядрышек высказывалась в мировой
литературе еще в 40-х годах [Lewis, 1940]. В отечественной
литературе эта концепция разработана за последние годы
И. И. Кикнадзе [1966, 1972]. Воззрения Кикнадзе и других авто-
ров, стоящих на сходной позиции, сложились в результате иссле-
дования процессов синтеза РНК в гигантских хромосомах ядер
Балбиани, где интенсивный синтез РНК регистрируется с по-
мощью меченых предшественников на всем протяжении хромо-
сом (более активные локусы перемежаются с менее активными).
Эта картина синтеза РНК, сопровождающаяся формированием
РНК-содержащих вздутий (пуфов) хромосом, и превращения
этих вздутий в более крупные структурные образования — кольца
Балбиани и ядрышки — послужила основанием для гипотезы о
генетическом единстве ядрышек и хромосом как структурных
компонентов ядра. Теперь четко установлено, что ядрышко яв-
ляется специализированным пуфом, основу которого составляет
ядрышковый организатор — участок хромосомы, ответственный за
синтез всей рибосомной РНК клетки [Кикнадзе, 1972]. Точка
зрения, высказанная Кикнадзе в достаточно четкой форме, исхо-
дит из фактов, относящихся к взаимоотношениям хромосом и
ядрышковой РНК в ядрах клеток Балбиани, но распространяется
и на все другие факты ядрышкообразования, поскольку не выхо-
дя за пределы гипотезы ядрышковых организаторов невозможно
придумать никаких других объяснений. Ядрышко состоит в основ-
ном из РНК. Следовательно, построить его могут только ДНК-
содержащие структуры, в первую очередь хромосомы, в частности
ядрышковые организаторы. И, если ядрышки продолжают про-
являть признаки синтеза РНК и белков, утратив связь с хромо-
сомами, значит они несут хромосомную ДНК в своей структуре.
На этих соображениях построена упомянутая выше гипотеза
амплификации.
Принимая во внимание всю огромную совокупность фактов,
относящихся к биологии ядрышка, нельзя не видеть, что эта кон-
цепция чрезвычайно затрудняет понимание всей жизненной актив-
ности ядрышек, в особенности в тех случаях, когда ядрышки или
ядрышковые производные вступают в сложные взаимодействия
« 37 »
ОНТОГЕНЕЗ И ФИЛОГЕНИЯ КЛЕТКИ
с цитоплазмой (например, при некоторых формах секреции или
при развитии ооцитов), утрачивая связь с ядром. Не менее суще-
ственное значение для понимания природы ядрышек и их онто-
генеза имеют процессы размножения ядрышек путем фрагмента-
ции, или почкования, которые можно считать доказанными
[см.: Равен, 1964; Студитский, 1973; Studitsky, 1974]. Очевидно,
биология ядрышек должна подвергнуться пересмотру на более
гибкой основе, по сравнению с концепцией ядрышковых органи-
заторов. Нет сомнений, что открытия последних лет, относящие-
ся к синтезу ДНК с помощью обратных транскриптаз [см.: Крик,
1971; Гершензон, 1973а, б; Дубинин, 1973], окажут свое влияние
и на ход исследований в области основной РНК-содержащей
ядерной конструкции — ядрышка.
Как бы то ни было, из идеи о генетическом единстве хромо-
сом и ядрышек вытекает и некоторая новая перспектива иссле-
дований по онто- и филогенезу ядрышкового аппарата. Хромосо-
мы ядер Балбиани, хромосомы — ламповые щетки и некоторые
другие типы хромосом, активно продуцирующие ядрышковый
(рибосомный) материал, это по своей природе нуклеолохромосо-
мы, т. е. хромосомы, несущие в себе интенсивно репродуцируе-
мый ядрышковый материал. Все, что мы знаем об Б-трансфор-
мации бактерий, сопровождающейся гипертрофией бактериальных
тел и их нуклеоидов, дает основание рассматривать гипертрофию
хромосом Балбиани и хромосом — ламповых щеток как пример
рекапитуляции этого процесса потомками далеких бактериоидных
предков — хромосомами гигантских клеток в условиях сверхин-
тенсивного синтеза белка.
После первых электронно-микроскопических работ [Gall, 1956;
Moses, 1956] можно считать точно установленным, что на всем
протяжении гигантских хромосом — ламповых щеток осуществ-
ляется синтез рибосомоподобных гранул, из которых в дальней-
шем строятся многочисленные ядрышки, располагающиеся по
периферии ядра [Kunz, 1967; Bier et al., 1969; Ebstein, 1969;
Ribbert, Kunz, 1969; Dappel, King, 1970; Bottke, 1973]. Таким
образом, из нуклеолохромосом обособляется нуклеолярная фрак-
ция, из которой путем сборки конструируются ядрышки. Следует
заметить, однако, что здесь только в более демонстративной
форме осуществляется типичный онтогенетический процесс фор-
мирования ядрышек, характерный для любого эумитоза нуклео-
лярно-хроматинового ядра. При переходе к телофазе анафазные
хромосомы — нуклеолохромосомы, содержащие ДНК и нуклео-
лярный материал, освобождаются от рибосом, из которых при
участии рибосом веретена и окружающей цитоплазмы строятся
ядрышки. В этих процессах получает достаточно отчетливое от-
ражение филогенетический процесс конструирования ядрышек у
первых эукариотов.
« 38 »
ОНТОГЕНЕЗ И ФИЛОГЕНИЯ ЯДРЫШКА
В ДИНОКАРИОНАХ МОДЕЛИРУЕТСЯ ФИЛОГЕНЕЗ
ЯДРЫШЕК И ХРОМОСОМ
Обратимся к схеме возникновения ядерной конструкции у наи-
более примитивных эукариотов (рис. 7). Согласно этой схеме,
ядро обособилось в качестве клеточного органа, несущего гене-
ративную функцию, от цитоплазматического окружения, на кото-
рое пала задача осуществлять метаболические и пластические
функции. Хромосомный аппарат возник из комплекса предковых
бактериоидных организмов, объединившихся под общей ядерной
мембраной. В динокарионах — ядрах самой примитивной группы
жгутиконосцев Dinoflagellata — эта конструкция ядра получила
самое демонстративное воплощение. Хромосомы динокарионов —
это нуклеоиды предковых бактериоидных организмов, свободные,
подобно нуклеоидам бактерий, от белков (гистонов) и рибосом —
аппарата метаболических и пластических функций бактерий. Что
же представляют собой ядрышки динокарионов? Можно было бы
сказать, что это продукт сборки рибосомного материала в виде
отдельностей, обособившихся в сформированных ядрах. Однако,
поведение ядрышек динофлагеллят, эвгленид и некоторых других
низших эукариотов на протяжении своеобразного митоза, харак-
терного для этих форм (диномитоза, эвгленомитоза), убеждает
нас в том, что ядрышки динокарионов — это не простые скопле-
ния рибосом, а органеллы, способные к комплексированию в одну
систему и делению этой системы надвое, подобному делению хро-
мосом. Вот почему ядрышки динофлагеллят и эвгленид — самые
примитивные конструкции второго типа ядерных органелл, пред-
ставляют собой, подобно хромосомам, потомков бактериоидных
предков, сохранивших рибосомный аппарат и редуцированный
нуклеоидный компонент бактерий.
Итак, можно считать чрезвычайно правдоподобной схему фило-
генетического развития ядерных органелл — хромосом и ядры-
шек — из бактериоидных конструкций, обособившихся в клетке
под общей ядерной оболочкой. Этот процесс заключался в раз-
витии хромосом путем гипертрофии нуклеоидного компонента и
редукции рибосомного аппарата и в развитии ядрышек путем
редукции нуклеоидного компонента и гипертрофии рибосомного
аппарата.
Динокарион воплощает в себе только один из путей диффе-
ренцировки ядерных бактериоидных компонентов. Хромосомы
динокарионов гомологичны нуклеоидам бактерий, отличаясь от
них только более сложной упаковкой ДНК. Но ядрышки дино-
карионов представляют собой не чисто рибосомные конструкции,
свободные от других строительных и метаболических компонен-
тов, входивших в состав предкового матрикса. Ядрышки пино-
карионов содержат пространства (нуклеоиды), в которых распо-
лагается ДНК, упакованная в виде мотка пряжи, как в нуклеои-
« 39 »
ОНТОГЕНЕЗ И ФИЛОГЕНИЯ КЛЕТКИ
Рис. 7. Схема филогенетического формирования клетки путем комплекси-
рования колонии-клона предковых бактериоподобных организмов (прото-
клеток)
Центральная группа протоклеток обособляется под общей оболочкой в виде ядра,
концентрирующего информационные полимеры (ДНК и РНК хромосом и ядрышка).
Периферическая группа протоклеток специализируется на пластических и метабо-
лических функциях, образуя цитоплазматический комплекс (А). Превращение агре-
гата протоклеток в клетку произошло в результате первого акта деления, которое
осуществилось с помощью ядра, ставшего органом размножения клетки (В, В).
Взаимодействие информационных полимеров, содержащихся в субклеточных компо-
нентах ядра и цитоплазмы, обеспечило развитие индивидуальной и видовой специ-
фичности клетки, репродуцируемой путем деления
де бактерий [см.: Студитский, 1973]. Ядрышки сохраняют и в
своей биологии некоторые свойства предковых бактериоидных
организмов: способность к передвижению, делению, слиянию,
изменению формы, гипертрофии и другие свойства, связанные с
теми или иными особенностями бактериальной конструкции. Вот
почему хромосомы высших эукариотов включают не только ДНК,
но и рибосомы, и белковые вещества, а ядрышки содержат, кроме
рибосом, белки и нити ДНК. Пути дифференцировки хромосом
и ядрышек у высших эукариотов отражают в себе разнообразные
формы взаимодействия между ядром и цитоплазмой, возникав-
шие в ходе эволюции.
« 40 »
ОНТОГЕНЕЗ И ФИЛОГЕНИЯ ЯДРЫШКА
Ядро возникло в клетке как орган, обеспечивающий генера-
тивную функцию клетки. Деление ядра обеспечивает размноже-
ние клетки. Ядро несет в себе органеллы, специализированные
на функции размножения. По вместе с тем ядро составляет не
только генеративный, но и как бы герминативный орган, обес-
печивающий пополнение цитоплазматических органелл, осуществ-
ляющих метаболические и пластические функции. Вот почему
есть основания предполагать, что под защитой ядерной оболочки
происходит не только воспроизводство хромосом, обеспечивающих
процесс размножения клеток, но и конструирование цитоплазма-
тических органелл, с которыми связана вся метаболическая и
пластическая активность клетки. В следующих главах мы рас-
смотрим факты, свидетельствующие о возможности пополнения
состава некоторых цитоплазматических органелл за счет ядра.
В данной главе будет обсужден вопрос о связи с ядром цитоплаз-
матической системы, составляющей одно неразрывное целое с
ядрышком рибосомного аппарата клетки.
РИБОСОМНО-ЯДРЫШКОВЫЙ АППАРАТ КЛЕТКИ
Термин «рибосомный аппарат» довольно широко применяется
в цитологической литературе [Студитский, 1966]. В состав рибо-
сомного аппарата, очевидно, входят все конструкции, содержащие
рибосомы, следовательно все ядерные и цитоплазматические орга-
неллы, за исключением телец Гольджи и мембран гладкого эндо-
плазматического ретикулума, свободных от рибосом. Несмотря на
то что мне довелось использовать этот термин в таком широком
смысле [Студитский, 1966], я полагаю, что в эволюционно-мор-
фологическом освещении содержание термина должно быть суже-
но до границ тех клеточных конструкций, которые используют
рибосомы в самом непосредственном их назначении — строитель-
стве клеточных белков. В этом узком смысле рибосомный аппа-
рат включает всю систему эргастоплазмы — свободные рибосомы,
полисомы, пузырьки и цистерны эргастоплазмы в самых разно-
образных функциональных конфигурациях и наиболее очевидную
рибосомную конструкцию — ядрышковый аппарат.
Во второй части книги рассмотрены данные, относящиеся к
пластическим и метаболическим функциям всех органелл клетки,
осуществляющимся с помощью рибосом. Эти данные покажут не
только генетическую общность, но и функциональное единство
всех клеточных органелл, включая ядрышковый аппарат. Здесь
рассмотрена функция рибосом в составе только одной ядерной
органеллы — ядрышка как неотъемлемой конструктивной и функ-
циональной части рибосомного аппарата. Герминативная функ-
ция ядра наиболее демонстративно выражена в процессах вос-
производства рибосом ядрышковым аппаратом.
« 41 »
ОНТОГЕНЕЗ И ФИЛОГЕНИЯ КЛЕТКИ
Обособление матрикса с рибосомным комплексом как части,
специализированной на выполнении вегетативных функций,
и нуклеоида как части, ответственной главным образом за раз-
множение живой системы, осуществилось уже на протоклеточной
стадии организации живой - материи. Конструирование клеточной
организации пошло по той же схеме, с тем усложнением, что и
метаболическая (цитоплазматическая), и генеративная (ядерная)
часть клеточной конструкции строилась из протоклеток — систем,
объединяющих в себе и метаболический, и генеративный компо-
ненты. Задача разработки наиболее целесообразной клеточной
конструкции заключалась в том, чтобы обеспечить высокую ин-
тенсивность метаболических функций при условии не менее ин-
тенсивной генеративной функции. Вот для чего понадобилась
специализация цитоплазмы на осуществлении метаболических
функций, а ядра — на осуществлении генеративной и гермина-
тивной функций. Наряду с осуществлением функции размноже-
ния клетки ядро приняло на себя функцию воспроизводства
рабочих узлов цитоплазмы. Герминативная роль ядрышек у низ-
ших эукариотов изучена недостаточно. Имеются фрагментарные
сведения о синтезе цитоплазматической РНК в ядрах простей-
ших, в частности амеб. Эти данные приводятся во всех руковод-
ствах по цитологии. Но в отношении участия ядрышек в воспро-
изводстве рибосомальной РНК и сборке цитоплазматических рибо-
сом или их предшественников у высших эукариотов накоплено
столько данных, что приходится удивляться малому количеству
попыток их обобщения.
В большинстве исследований, посвященных этому вопросу,
используется импульсная (наносимая за время краткого пребыва-
ния объекта в среде, содержащей меченый предшественник ис-
следуемого вещества) метка 3Н-уридина, с помощью которой
устанавливается синтез РНК в ядрышке, с последующим выво-
дом метки в цитоплазму. Из всех работ, относящихся к этой
проблеме, с полной очевидностью вытекает вывод, что ядрышко
представляет собой как бы камбиальный (герминативный) ком-
понент рибосомно-ядрышкового аппарата [Birnstiel et al., 1963;
Jones, 1965; Wessing, 1965; Ченцов, 1966; Birnstiel, 1967; Gau-
decker, 1967; Mundell, 1967; Liau, Perry, 1969; Busch, Smetana,
1970; Kumar, 1970; Ченцов, Поляков, 1974]. Основную массу
рибосом поставляют в цитоплазму ядрышки.
ЯДРЫШКОВОЕ ВЕЩЕСТВО ВЫХОДИТ В ЦИТОПЛАЗМУ
Еще более демонстративны морфологические данные о выходе
ядрышкового вещества в цитоплазму. Еще на уровне светоопти-
ческой техники был собран огромный фактический материал,
свидетельствующий о выходе ядрышек или их фрагментов в цито-
плазму в различных онтогенетических и функциональных состоя-
« 42 »
ОНТОГЕНЕЗ И ФИЛОГЕНИЯ ЯДРЫШКА
ниях клетки [Вильсон, 1936]. В обзорной литературе встречаются
разные оценки этих фактов. Одни авторы считают описанные
факты выхода ядрышек и ядрышкового вещества в цитоплазму
достаточно достоверными [Кедровский, 1969]. Другие авторы
относятся к описанным фактам с большим сомнением и даже не
считают их нужным анализировать [Бродский, 1965; Алов и др.,
1966; Busch, Smetana, 1970]. Можно отметить все же, что в числе
описаний выхода ядрышек в цитоплазму имеются работы, сделан-
ные с помощью цейтрафферной киносъемки на живых клетках
в культуре тканей [Lettre, Siebs, 1961]. После выхода ядрышка
в цитоплазму ядро сохраняет способность к митотическому
делению.
Наибольшее количество описаний выхода ядрышек в цито-
плазму относится к процессу оогенеза. Анализируя посвященную
этому вопросу литературу, видный цитолог-эмбриолог Равен
[1964] находил возможным сделать такой вывод: «Выделение
веществ ядрышка в цитоплазму описано в столь многих случаях,
что едва ли можно сомневаться в том, что это общее явление.
Оно наблюдалось у губок, гидроидов, плоских червей, аннелид,
моллюсков, членистоногих и позвоночных. Очевидно, ядрышко
играет большую роль в процессах синтеза, происходящих в цито-
плазме» (с. 79).
Книга Равена вышла в свет в 1962 г. (рус. пер. в 1964 г.).
В ней обобщен фактический материал, относящийся в основном
к эпохе светооптического исследования клетки, завершившейся
на протяжении предшествовавшего десятилетия. За истекшие
после опубликования книги Равена два десятилетия поведение
ядрышка в ооцитах, включая феномен экструзии ядрышкового
вещества в ооплазму, изучено с помощью электронно-микроско-
пического и радиоавтографического методов и в настоящее время
представляется достаточно правдоподобным. Весьма убедитель-
ные картины, интерпретируемые как выход ядрышкового веще-
ства из ядра в цитоплазму растущего ооцита, описаны в ооцитах
асцидии Ciona [Kessel, 1966b], омара [Kessel, 1968], медузы
Thyone [Kessel, Beams, 1963], шелковичного червя [Tashiro
et al., 1968], дрозофилы [Dapplels, King, 1970], клещей Calog-
lyphus [Heinemann, Hagnes, 1970,), сверчка [Cave, Allen, 1971],
двоякодышащей рыбы Protopterus [Scharer, Wurzelmann, 1969],
амфибий [Wischnitzer, 1966; Kessel, 1969], человека и обезьян
[Baker, Fran chi, 1969]. Большое внимание в современной лите-
ратуре уделяется периферическим («свободным») ядрышкам ооци-
тов рыб и амфибий, на которых разработана гипотеза амплифи-
кации — высвобождения цистронов, кодирующих рибосомальную
(ядрышковую) ДНК из хромосом, и конструирования на их осно-
ве ядрышковых образований [Miller, 1966; Прокофьева-Бельгов-
ская, 1971; Дэвидсон, 1972; ТоЫег, 1975]. Чрезвычайно важен
с эволюционно-морфологической точки зрения феномен выхода
« 43 »
ОНТОГЕНЕЗ И ФИЛОГЕНИЯ КЛЕТКИ
ядрышек ооцитов у рыб и амфибий в ооплазму, описанный,
в частности, в сравнительно недавних работах Е. В. Райковой
[1968] у осетровых рыб и Д. А. Чмилевского [1971] у ерша.
Не менее интересны процессы конструирования из ядрышкового
материала, мигрировавшего из ядра в цитоплазму, ядрышкопо-
добных конструкций — цитонуклеол. Такие ядрышкоподобные
конструкции, развивающиеся за счет мигрирующего из ядра
ядрышкового материала, описаны, например, при сперматогенезе
некоторых животных под названием хроматоидных тел [Yasuzu-
mi et al., 1970; Comings, Okada, 1972]. Ядрышкоподобные тела
обнаружены в цитоплазме нейронов продолговатого мозга крыс
[Kishi, 1972], а также нейронов супраоптических ядер мозга
[Le Beux et al., 1971]. В цитоплазме ооцитов амфибий также
наблюдались ядрышкоподобные тела, сходные по структуре с
внутриядерными периферическими («свободными») ядрышками
[Kessel, 1969]. Ядрышкоподобные тела описаны в цитоплазме
ооцитов морского ежа [Harris, 1967], рыб [Scharer, Wurzelmann,
1969] и других животных. Для пронуклеусов оплодотворенных
яиц описан выход ядрышек в цитоплазму [Szollosi, 1965].
Прежде чем перейти к описанию фактических данных, демон-
стрирующих выход ядрышкового вещества в цитоплазму, следует
сказать несколько слов о тех сомнениях, которые вызывают у не-
которых авторов [см., например: Кедровский, 1959] физические
и физико-химические свойства ядерной мембраны, определяющие
ее проницаемость для веществ, поступающих из ядра в цито-
плазму. Эти сомнения выражаются в расчетах и сопоставлениях
размеров ядерных пор и проходящих через ядерную оболочку
макромолекул. Естественно, в свете этих рассуждений транспорт
ядрышка, имеющего диаметр в несколько микрометров, или даже
его фрагментов, измеряемых десятыми микрометра, представляет-
ся совершенно невероятным. Однако необходимо напомнить, что
ядерная мембрана, как и все мембранные структуры клетки,
кроме физических и физико-химических, имеет и биологические
характеристики, к числу которых относится хорошо известное
в настоящее время свойство везикулярной трансформации, ис-
пользуемое клеткой при митотическом делении. Как было ука-
зано выше, везикулярная трансформация ядерной мембраны от-
носится к числу рекапитуляций, отражающих исторический про-
цесс формирования клетки путем комплексирования протоклеток.
Везикулярная трансформация известна и для других мембранных
структур клетки. Известно образование везикулов по периферии
комплексов Гольджи. Из мелких везикулов формируются эргасто-
сомы. Везикулярный процесс лежит в основе цитокинеза. Вот
почему транспорт таких крупных биологических структур, как
ядрышко или его фрагментов, через ядерную мембрану не имеет
прямого отношения к ядерным порам и осуществляется, скорее
всего, путем везикулярной трансформации ядерной мембраны.
« 44 »
ОНТОГЕНЕЗ И ФИЛОГЕНИЯ ЯДРЫШКА
Разумеется, если ядрышковый материал подвергается транс-
порту через ядерную мембрану в форме рибосом, ядерные поры
по своему диаметру вполне подходят для пропуска этих частиц.
Картины выхода рибосомоподобных частиц в цитоплазму много-
кратно приводились в электронно-микроскопической литературе.
Процессы оогенеза характеризуются множеством форм выхода
ядрышка или ядрышковых фрагментов через ядерную мембрану
в цитоплазму [Равен, 1964]. Наиболее демонстративны картины
выхода ядрышек в цитоплазму в ооцитах некоторых рыб, где
множество ядрышек собирается под ядерной оболочкой, образую-
щей выросты, через которые осуществляется выход ядрышек
(см., например, работу Е. В. Райковой [1968], содержащую соб-
ственный фактический материал и обширный список литературы,
а также Шарера и Вицельмана [Scharer, Wyprzelmann, 1979]).
ДИНАМИКА МИГРАЦИИ ЯДРЫШКОВОГО ВЕЩЕСТВА
У ДЕСЯТИНОГИХ РАКОВ
Мои наблюдения совпадают с данными авторов, описавших
транспорт ядрышек или ядрышковых фрагментов из ядра в цито-
плазму, осуществляющийся особенно демонстративно при некото-
рых типах оогенеза. Большой интерес представляет динамика
миграции ядрышкового вещества при оогенезе у десятиногих
раков. По различным вариантам этих процессов можно составить
представление об их эволюционной динамике.
Выход ядрышкового вещества в диссоциированном виде в ци-
топлазму с последующим обособлением ядрышковых конструкций
в цитоплазме наиболее демонстративно отражен в обследованном
мной процессе оогенеза у креветки из Варенцова моря Scleroc-
rangon borealis. Яйцеклетки этого объекта обладают сравнитель-
но небольшими размерами при очень крупной величине ядер,
которые видны на окрашенных препаратах невооруженным гла-
зом (рис. 8). Это уникальные объекты для обследования ядрыш-
кового цикла в оогенезе с помощью банальной светооптической
техники. Крупные размеры позволяют видеть основные компо-
ненты ядрышковых конструкций в ядре и цитоплазме при увели-
чениях не более 1000. Примененная фиксация — жидкость Буэ-
на — разрушает липопротеидные цитоплазматические образова-
ния (мембраны эргастоплазмы, ретикулоплазмы и митохондрий),
но сохраняет рибосомные конструкции — ядрышко и его произ-
водные, комплексирующиеся в цитоплазме.
Как известно, рост ооцитов, сопровождающийся развитием
хромосом—ламповых щеток, начинается с синаптического обособ-
ления хромосом, которые в дальнейшем превращаются в хромо-
сомы—ламповые щетки. У креветки этот процесс осуществляется
на ранних этапах роста ооцитов, в результате чего разлохмачен-
ные хромосомы — ламповые щетки, располагаясь вокруг круп-
« 45 »
ОНТОГЕНЕЗ И ФИЛОГЕНИЯ КЛЕТКИ
Рис. 8. Яичник креветки Sclerocrangon borealis
А— участок с ооцитами на разных этапах роста; Б, В — срезы через ядро и при-
лежащую ооплазму ооцита. В ядре видны ядрышко и хромосомы—ламповые щет-
ки — продуценты ядрышкового вещества, в ооплазме — мелкие зерна мигрировав-
шего ядрышкового вещества (показаны стрелками)
ного ядрышка, заполняют почти всю кариоплазму. Характерной
особенностью ядрышка ооцитов этого вида креветки является раз-
витие центральной вакуоли, вследствие чего ядрышко на срезах
имеет вид кольца. Начиная с ранних этапов роста, яйцеклетка
формирует выраженную двухконтурную оболочку, на которой
располагаются фолликулярные клетки. Способ взаимодействия
яйца с фолликулярными клетками через эту оболочку неясен.
Скорее всего, фолликулярными клетками обеспечивается приток
низкомолекулярных продуктов.
Период роста ооцита сопровождается увеличением размеров
ядра и объема цитоплазмы, связанными, очевидно, с интенсивны-
ми синтетическими процессами в цитоплазме. Перед клеткой на
протяжении ее филогенетического формирования у этого вида
стояла задача создать рибосомную конструкцию, обеспечиваю-
щую осуществление синтетических процессов в цитоплазме в со-
ответствии с объемом и общей организацией данной клетки.
Едва ли могут возникнуть сомнения в том, что гипертрофия
ядрышка и хромосом — ламповых щеток, сопровождающая рост
ооцита, обусловлена интенсивным формированием рибосом, с ко-
торыми связан белковый синтез. Как было показано выше, хро-
мосомы—ламповые щетки — это нуклеолохромосомы, т. е. хро-
мосомы, интенсивно продуцирующие основной ядрышковый
« 46 »
ОНТОГЕНЕЗ И ФИЛОГЕНИЯ ЯДРЫШКА
строительный материал — рибосомы или их предшественников.
Продолжается ли конструирование или сборка рибосом в ядрыш-
ке ооцитов северной креветки, мы не знаем. Однако известная по
сходным процессам у других видов динамика формирования
ядрышек в ооцитах с хромосомами—ламповыми щетками позво-
ляет предполагать, что ядрышко ооцита северной креветки растет
за счет сборки, или аккумуляции, рибосом или их предшествен-
ников. Возможность синтеза р-РНК и конструирования рибосом
непосредственно в ядрышке не исключена потому, что ядрышко
этого вида характеризуется слабой положительной реакцией
Фелъгена.
Выход рибосом или их предшественников из ядра в цитоплаз-
му морфологически регистрируется по двум показателям. Первый
из них заключается в тесной связи ядрышка с ядерной оболоч-
кой. , Нередко к ядерной мембране плотно прижимается поверх-
ность ядрышка, которая покрывает центральную ядерную вакуоль.
Второй можно усматривать в развитии конусовидных выпячива-
ний или ворсинок с зернистым содержимым по поверхности ядра,
особенно в тех его зонах, которые контактируют с разжиженной,
вакуолизированной цитоплазмой.
Вокруг ядра на всем протяжении периода роста располагает-
ся зона свободной от крупных включений, тонкозернистой, слабо
базофильной цитоплазмы. Далее следует зона вакуолизирован-
ной, разрыхленной, светлой цитоплазмы с более крупной базо-
фильной зернистостью. Здесь начинается формирование желточ-
ных зерен, размеры и оксифилия которых повышаются к пери-
ферии, где откладываются готовые желточные зерна.
Самой замечательной особенностью рибосомного аппарата в
этом объекте является формирование специфических рибосомных
конструкций по периферии цитоплазмы, среди формирующихся
желточных зерен. Эти конструкции содержат указанную выше
грубую базофильную зернистость, которая проявляет заметную
тенденцию к повышающемуся к периферии укрупнению. Здесь
происходит, очевидно, сборка ядрышкоподобных конструкций, ко-
торая в некоторых случаях завершается формированием телец
более или менее сфероидальной или разветвленной формы с ва-
куолями, придающими им сходство с ядрышками.
Сходные процессы выхода ядрышкового вещества в цитоплаз-
му ооцитов с последующим распределением в ней в той же фор-
ме, в которой это вещество регистрируется в кариоплазме или в
виде комплексированных образований, описывались у разных
объектов и рассмотрены в книге Равена [1964], посвященной
оогенезу. Выход ядрышкового вещества в форме мелких вакуоли-
зированных гранул, отчетливо обнаруживаемых в цитоплазме,
описан в ооцитах рыжего таракана, рачка Asellus и других видов.
Бретшнайдер и Равен [см.: Равен, 1964] отметили выход мелкой
ядрышковой зернистости с люследующим формированием из нее
« 47 »
ОНТОГЕНЕЗ И ФИЛОГЕНИЯ КЛЕТКИ
специфических гранул в цитоплазме ооцита у моллюска прудо-
вика Limnaea stagnalis.
Обнаруженные мной в цитоплазме ооцитов северной креветки
базофильные тельца заслуживают специального внимания. К со-
жалению, этот объект пока трудно доступен для обследования с
помощью электронно-микроскопической техники. Однако круп-
ные размеры ядра и соответственно включений цитоплазмы по-
зволяют достаточно уверенно говорить о природе обнаруженных
базофильных образований. При окраске квасцовым гематоксили-
ном базофильные тельца проявляют признаки сходства с ядрыш-
ками, включая характерную для ядрышек ооцитов этого объекта
вакуолизацию. Окраска пиронином (с контролем перевариванием
РНКазой) свидетельствует об их РНП-природе. Базофильные
тельца соседствуют с зернами желтка, нередко окружая их пол-
ностью. Таким образом, химизм и структура базофильных телец
свидетельствуют об их принадлежности к рибосомно-ядрышково-
му аппарату. Вот почему их можно называть цитоплазматически-
ми ядрышками — цитонуклеолами.
К классу цитонуклеол можно отнести и так называемые хро-
матоидные тела, или придаточные центриоли (centriol adjunct),
формирующиеся около ядер при спермиогенезе у некоторых пря-
мокрылых. Согласно электронно-микроскопическим данным Ясу-
зуми с соавторами [Yasuzumi et al., 1970], эти образования в
сперматидах кузнечика возникают путем миграции гранулярного
материала (РНП) из ядра в цитоплазму с последующим комплек-
сированием в виде полусфероидальных тел, прилегающих к ядру.
Как полагают авторы, функция этих образований заключается в
том, чтобы поставлять материал для роста аксиальной нити
хвоста спермия. Вероятно, путем сходного процесса — комплек-
сирования рибосом в виде гексагональных кристаллов — форми-
руются хроматоидные тела в цитоплазме [Barker, 1963].
Формирование цитонуклеол — чрезвычайно выразительный
пример герминативной активности ядра, выступающего здесь в
качестве поставщика цитоплазматических компонентов рибосом-
но-ядрышкового аппарата. Цитоплазма ооцитов чрезвычайно на-
пряженно работает как орган синтеза белка, монтирующий мил-
лиарды белковых молекул на рибосомных комплексах. Интенсив-
ный рост ооцита требует не менее интенсивного формирования
рибосомных конструкций, обеспечивающего высокий темп белко-
вых синтезов. Следует полагать, что клетка обращается к сборке
ядрышкоподобных конструкций в цитоплазме для усиления ак-
тивности рибосомно-ядрышкового аппарата. Цитонуклеолы во-
зникают как продуценты или аккумуляторы рибосом в цитоплаз-
ме за счет высокой производительной активности ядрышка как
ядерного компонента рибосомно-ядрышкового аппарата.
Нет необходимости останавливаться на менее выразительной
форме комплексной активности- рибосомно-ядрышкового аппарата
« 48 »
ОНТОГЕНЕЗ И ФИЛОГЕНИЯ ЯДРЫШКА
Рис. 9. Выход ядрышек в ооплазму в ооцитах сибирского осетра
Вуэн, гематоксилин. Микропрепарат Н. В. Акимовой
ооцитов с дезагрегацией ядрышек и ядрышковых фрагментов,
мигрирующих из ядра в цитоплазму. Эта форма обнаружена в
ооцитах некоторых рыб [см.: Равен, 1964; Райкова, 1968;
Scharer, Wurzelmann, 1969] и других объектов. Мне довелось об-
наружить подобный способ проявления герминативной функции
ядра в ооцитах некоторых видов десятиногих раков и рыб.
У сибирского осетра сфероидальные ядрышки, рассеянные в
ооплазме, концентрируются под ядерной мембраной, образующей
выступы или выпячивания, сквозь которые ядрышки выходят в
цитоплазму, где и подвергаются дезагрегации. Процесс легко про-
слеживается на всех фазах с помощью обычной светооптической
техники (рис. 9). Очень крупные ядрышки на разных фазах миг-
рации в ооплазму обнаруживаются в ооцитах мраморного краба
Pachygrapsus marmoratus (рис. 10).
РЕПРОДУКЦИЯ ЯДРЫШЕК ПУТЕМ ДЕЛЕНИЯ
В ОНТО- И ФИЛОГЕНЕЗЕ КЛЕТКИ
Из данных сравнительной цитологии следует, что древнейшим
способом репродукции ядрышек было деление путем перетяжки,
подобное делению бактерий. Такой способ репродукции ядрышек
характерен для древнейших одноклеточных водорослей Dinofla-
gellata и Euglenida. При переходе протомитоза в эумитоз, харак-
теризующийся демонтажем ядрышкового аппарата в профазе, ре-
4 А. Н. Студитский « 49 »
ОНТОГЕНЕЗ И ФИЛОГЕНИЯ КЛЕТКИ
Рис. 10. Выход ядрышек в ооплазму ооцитов мраморного краба. Ценкер,
гематоксилин
продукция ядрышка путем деления заменяется реконструкцией
ядрышек в телофазе за счет рибосомного материала, аккумули-
рованного и репродуцирующегося в хромосомах, как это описа-
но, например, у корненожки Euglypha [см.: Райков, 1967; Сту-
дитский, 1973] или у паразитических простейших грегарин [см.:
Догель и др., 1962]. Онтогенез ядрышка путем реконструкции в
телофазе характерен для всех простейших, использующих для
размножения эумитоз, а также для всех многоклеточных орга-
низмов, начиная с кишечнополостных. Очень интересно в эволю-
ционно-морфологическом плане использование древнего способа
репродукции ядрышек путем деления у высших простейших —
инфузорий [Studitsky, 1930, 1932] и высших многоклеточных —
членистоногих и позвоночных. Чрезвычайно характерные фигуры
размножения ядрышек путем деления обнаружены [Студитский,
« 50 »
ОНТОГЕНЕЗ И ФИЛОГЕНИЯШДРЫШКЛ
1973] в трофоцитах яичника пчелы Apis mellifica, ядрах мышеч-
ных волокон в трансплантированных и регенерирующих мышцах
лягушки, а также в ядрах ооцитов некоторых ракообразных, в ча-
стности травяного краба Carcinus maenas (рис. И). Размножение
ядрышек путем фрагментации отмечено для ооцитов Xenopus
[Van Gansen, Schram, 1972].
Размножение ядрышек путем деления в некоторых объектах
среди высших одноклеточных и многоклеточных эукариотов
можно с полным основанием трактовать как рекапитуляцию
древнего (бактериоидного) способа репродукции этой орга-
неллы.
АКЦЕССОРНЫЕ ЯДРА
В ООЦИТАХ ПЕРЕПОНЧАТОКРЫЛЫХ
Самой выразительной формой комплексной активности рибо-
сомно-ядрышкового аппарата следует считать формирование так
называемых акцессорных ядер растущих ооцитов перепончато-
крылых [см.: Студитский, 1973; Studitsky, 1974]. Этот процесс
заключается в отщеплении от ядра фрагментов, напоминающих
ядро формой, структурой (с ядрышкоподобным образованием в
центре), наличием оболочки и даже способностью к размноже-
нию путем деления и фрагментации, открываемых на микроско-
пических препаратах. Деление или фрагментация акцессорных
ядер сопровождается гантелеобразным делением или фрагмента-
цией центральных ядрышкоподобных телец.
Развитие акцессорных ядер в ооцитах перепончатокрылых
было обнаружено и описано в начале текущего столетия [см.:
Buchner, 1918]. В книге Вильсона [1936] приводится довольно
большая литература, относящаяся к этому вопросу. Сам факт
наличия пузырьковидных телец, сходных с ядрами, в цитоплазме
ооцитов перепончатокрылых не вызывает никаких сомнений,
равно как и судьба этих образований — исчезновение в ходе
дальнейшего развития яйца. Сомнения и недоумения вызывает
природа и способ образования акцессорных ядер.
Если бы речь шла о соматических клетках, отделение от
ядер ядроподобных фрагментов едва ли привлекло бы внимание
исследователей. Процессы дифференцировки нередко сопровож-
даются глубокими нарушениями типичной структуры ядер (стоит
вспомнить превращения ядер при дифференцировке гранулоци-
тов) .
Однако образование акцессорных ядер осуществляется в
половых клетках, несущих в своем ядре, по современным воззре-
ниям, точно измеренный запас информации, в которой запрограм-
мировано развитие целого организма. Вот почему вынос из ядра
путем почкования или фрагментации какой-то части ядерной кон-
струкции создает большие затруднения для генной теории разви-
« 51 »
4*
ОНТОГЕНЕЗ И ФИЛОГЕНИЯ КЛЕТКИ
Рис. 11. Размножение ядрышек путем деления
Последовательные фазы деления ядрышек в ядрах ооцитов травяного краба (А, Б:
Ценкер, гематоксилин, х 900) и в ядрах трансплантированной мышцы лягушки (В:
Формалин, серебрение по Бильшовскому — Гросс, X 900)
« 52 »
ОНТОГЕНЕЗ И ФИЛОГЕНИЯ ЯДРЫШКА
тия, хотя подобные процессы в другой форме, как мы увидим ниже,
имеют довольно широкое распространение. Несоответствие этого
факта общепринятым схемам генной детерминации развития про-
должает смущать цитологов. Можно насчитать не более десятка
работ, в которых процесс развития акцессорных ядер у перепон-
чатокрылых обследован на современном уровне с применением
гистохимической и электронно-микроскопической техники [Cruik-
scank, 1964, 1972; Hopkins, 1964; Hopkins, King, 1966; King, Ric-
hards, 1968; King, Ratcliffe, 1969; King, Fordy, 1970].
Гистохимически в центральных ядрышкоподобных тельцах ак-
цессорных ядер обнаружена РНК. Что же касается ДНК, то она,
по-видимому, в акцессорных ядрах отсутствует. На электронных
микрофотографиях выявлено следующее: мембрана акцессорных
ядер двойная, как типичная ядерная мембрана, хотя наличие
ядерных пор еще точно не установлено. Центральное ядрышко —
подобное тельце имеет плотную мелкозернистую структуру,
сходную со структурой ядрышкового матрикса. Остальное содер-
жимое — неясной природы. Обнаружены признаки отделения ак-
цессорных ядер от основного ядра путем почкования. Таким об-
разом, ядерную природу и ядерное происхождение акцессорных
ядер можно считать подтвержденными на ультраструктурном
уровне. Каково же функциональное и эволюционно-морфологиче-
ское значение этого удивительного процесса?
Наблюдения над развитием акцессорных ядер у матки пчелы
[Студитский, 1973] позволяют сделать предварительный вывод
о том, что этот процесс по своей природе аналогичен (или даже
гомологичен) всем описанным в ооцитах различных животных
процессам выхода ядрышкового материала в ооплазму. Ооцит
пчелы достигает в период роста огромных размеров, обеспечивае-
мых, очевидно, интенсивным синтезом белка, а также не менее
интенсивным желткообразованием, т. е. также специфическим
белковым синтезом. Базофилия ооплазмы свидетельствует о бо-
гатстве рибосомами, на которых в соответствии с общепринятыми
схемами должен осуществляться синтез белков. Специфические
органеллы, связанные с синтезом белков, в виде желточных ядер
или структурированных желточных телец, в ооплазме этого объ-
екта при светооптическом исследовании не обнаруживаются. Та-
ким образом, вся масса рибосом ооплазмы обеспечивается, по-ви-
димому, активностью акцессорных ядер.
Ядрышковый аппарат основного ядра растущего ооцита вклю-
чает центральное ядрышко, имеющее форму тутовой ягоды, и пе-
риферические мелкие ядрышки, примыкающие к ядерной мембра-
не (рис. 12). Форма тутовой ягоды, очевидно, определяется тем,
что центральное ядрышко размножается путем почкования. Пе-
риферические ядрышки можно рассматривать как продукт почко-
вания, подлежащий выщеплению из ядра в составе акцессорных
ядер. Об этом процессе можно судить по гирлянде маленьких,
« 53 »
ОНТОГЕНЕЗ И ФИЛОГЕНИЯ КЛЕТКИ
Рис. 12. Развитие акцессорных ядер в ооцитах матки пчелы
Различные атапы обособления акцессорных ядер от ядра п их дифференцировки
(развития ядронодобной структуры) в ооплазме. Ценкер. Рего, X 900
« 54 »
ОНТОГЕНЕЗ И ФИЛОГЕНИЯ ЯДРЫШКА
светлых, пузырьковидных акцессорных ядер с маленьким ядрыш-
ком в центре, располагающихся вокруг главного ядра (рис. 12).
Как происходит обособление акцессорного ядра от главного, по
светооптической картине сказать трудно.
Самый важный в эволюционно-морфологическом смысле фе-
номен, относящийся к развитию акцессорных ядер, заключается
в том, что эти образования подвергаются сложным превращени-
ям, свидетельствующим об их высокой пластической и метаболи-
ческой активности (рис. 13). Акцессорные ядра передвигаются в
ооплазме, постепенно расселяясь по всей ооплазме, особенно в
периферических ее частях, растут, достигая довольно крупных
размеров, размножаются путем деления' или почкования, приоб-
ретают сложную структуру, включающую центрально располо-
женное тельце типа ядрышка, нитевидные конструкции, напоми-
нающие хромосомы, и зернышки базофильного вещества вроде
хроматина. Между тем гистохимически в акцессорных ядрах уда-
ется выявить только РНК (в «ядрышке» и глыбках «хромати-
на») и белковый (лихтгрюн-позитивный) компонент. В главном
ядре фельген-позитивность обнаруживается только в зернах во-
круг ядрышка и мелкой зернистости по периферии ядра. Акцес-
сорные ядра фельген-негативны.
Судьба акцессорных ядер, как, впрочем, и главного ядра, не-
ясна. Ооциты, залегающие у выхода в яйцевод, забиты резко ба-
зофильными желточными зернами, между которыми при обычной
технике окраски не просматриваются какие-либо ядерные струк-
туры.
Данные, полученные совместно с М. М. Калашниковой и
Н. И. Деминой по гистохимии и электронной микроскопии ак-
цессорных ядер в ооцитах муравьев, позволяют утверждать, что.
развитие этих образований свидетельствует о специфической
комплексной форме активности рибосомно-ядрышкового аппара-
та. Ооцит объекта, подвергнутого электронно-микроскопическому
обследованию (муравей Lasius niger), характеризуется интенсив-
ным околоядерным формированием добавочных ядер (рис. 14).
Главное ядро имеет типичное для ооцитов пузырьковидное
строение с очень большим ядрышком. При гистохимическом об-
следовании вокруг ядрышка главного ядра обнаруживается
фельген-позитивный материал. Ядрышко фельген-негативно, пи-
ронинофильно. На электронных микрофотографиях в ядрышке
обнаруживается периферическая зона чрезвычайно высокой
электронной плотности гранулярного строения. В некоторых уча-
стках к периферической уплотненной гранулярной зоне примы-
кают сфероидальные тельца такого же строения и плотности,
окруженные более грубой зернистостью (рис. 15). Содержимое
ядрышка выполнено рибосомоподобными, рыхло расположенны-
ми зернами, образующими неправильной формы скопления.
« 55 »
ОНТОГЕНЕЗ И ФИЛОГЕНИЯ КЛЕТКИ
Рис. 13. Фазы размножения (путем почкования) акцессорных ядер ооцита
пчелы в ооплазме. Ценкер, Рего, X 400
Рис. 14. Ооцит муравья Lasius nlger
Основное ядро с полостями акцессорных ядер. Ценкер, гематоксилин. Микропрепа-
раты И. И. Деминой
« 56 »
ОНТОГЕНЕЗ И ФИЛОГЕНИЯ ЯДРЫШКА
Рис. 15. Ооцит муравья Laslus niger
Общий вид основного ядра, окруженного акцессорными ядрами. Я— ядро; Ядш —
ядрышко; ЯМ — ядерная мембрана; АнЯ — акцессорные ядра. Электронная микро-
фотография М. М. Калашниковой
« 57 »
ОНТОГЕНЕЗ И ФИЛОГЕНИЯ КЛЕТКИ
Ядерная мембрана основного ядра типичного строения, с мно-
жеством утолщений, напоминающих уложенную складками
мембрану (рис. 16). Внешняя мембрана густо покрыта рибосома-
ми. Кариоплазма содержит рыхлую зернистость, менее плотную,
чем в ядрышке.
Акцессорные ядра, располагающиеся в виде розетки вокруг
основного ядра, одеты двойной мембраной типичного ядерного
строения, также густо покрытой рибосомами. Содержимое акцес-
сорных ядер включает центральное тельце гранулярной структу-
ры, по плотности сходное с плотными тельцами ядрышка основ-
ного ядра, и рыхлую зернистость, близкую по плотности к зерни-
стости кариоплазмы. На препаратах легко обнаруживаются следы
отделения акцессорных ядер от основных в виде обращенных
друг к другу клювовидных выпячиваний оболочек (рис. 16).
На некоторых препаратах хорошо видно рибосомное строение
содержимого ядрышка (нуклеолоплазмы) и кариоплазмы основно-
го ядра и содержимого акцессорных ядер. Цитоплазма чрезвы-
чайно богата рибосомами, рассеянными свободно и в виде скопле-
ний (полисом). В некоторых акцессорных ядрах видны перерывы
мембран, напоминающие ядерные поры. Здесь также видны скоп-
ления рибосом.
Описанные электронно-микроскопические картины строения
ядерного аппарата ооцитов этого вида муравьев не оставляют ни-
каких сомнений в том, что акцессорные ядра представляют собой
продукты отделения фрагментов основного ядра путем почкова-
ния. Складчатые утолщения ядерных мембран, вероятно, обеспе-
чивают их растягивание, с помощью которого формируются поч-
ки акцессорных ядер. Учитывая размеры площадей основного
ядра сравнительно с площадями срезов акцессорных ядер, сле-
дует полагать, что представления старых авторов о росте акцес-
сорных ядер соответствуют действительности. Что же касается
эволюционно-морфологического значения этого процесса, то оно
заслуживает специального обсуждения.
Прежде всего необходимо понять, какой части ядерной кон-
струкции соответствуют акцессорные ядра. Несмотря на внешнее
сходство с основными ядрами по наличию типичной ядерной
мембраны, кариоплазмы и ядрышка, акцессорные ядра далеки
от полного подобия с основными ядрами прежде всего по отсут-
ствию фельген-позитивного материала, который открывается в
основных ядрах. Если ДНК и имеется в кариоплазме или в яд-
Рис. 16. Улътраструктура основного ядра и акцессорных ядер ооцита му-
равья Lasius niger
Стрелками показаны следы отделения акцессорного ядра от основного ядра (склад-
ки на ядерной оболочке) и клювовидные выросты ядерных оболочек, обращенные
друг к другу. Электронная микрофотография М. М. Калашниковой.
Обозначения те же, что на рис. 15
« 58 »
ОНТОГЕНЕЗ И ФИЛОГЕНИЯ ЯДРЫШКА
« 59 »
ОНТОГЕНЕЗ И ФИЛОГЕНИЯ КЛЕТКИ
рышках акцессорных ядер, то в ничтожных количествах. Затем
можно отметить, что зернистость кариоплазмы акцессорных
ядер по электронной плотности ближе к содержимому ядрышек
(нуклеолоплазме), чем к кариоплазме. Таким образом, акцессорные
ядра представляют собой структуру, относящуюся к рибосомно-
ядрышковому аппарату клетки. Подобно тому как при росте
ооцитов с хромосомами — ламповыми щетками ядро выбрасывает в
цитоплазму рибосомный материал в виде готовых рибосомно-
ядрышковых конструкций или диспергированных рибосом, из ко-
торых в цитоплазме строятся рибосомно-ядрышковые конструк-
ции (цитонуклеолы), в ооцитах перепончатокрылых осуществля-
ется рекапитуляция древнейшего процесса конструирования
рибосомно-ядрышкового аппарата в виде отдельных ядрышковых
приборов, одетых ядерной мембраной. Есть все основания счи-
тать акцессорные ядра гомологами бактериоидных предков, река-
питулирующими наиболее древнюю форму их организации. Ак-
цессорное ядро — это подобие бактериоидного предка, вновь при-
обретшего утраченную индивидуальную мембрану, лишившегося
нуклеоида и обогатившегося ядрышковой конструкцией рибосом-
ного аппарата.
Развитие рибосомно-ядрышковых конструкций в виде акцес-
сорных ядер в ооцитах перепончатокрылых позволяет утверж-
дать, что в филогенезе клетки мог быть этап, когда герминатив-
ная функция ядра заключалась не только в репродукции хромо-
сом — органелл, используемых в основном в составе ядерного
аппарата, но и в репродукции рибосомно-ядрышковых структур,
предназначаемых для пополнения цитоплазматического блока ри-
босомно-ядерного аппарата. Все другие формы развития рибо-
сомных комплексов в цитоплазме, включая формирование двой-
ных мембран эргастоплазмы, представляют собой в сущности
упрощенные варианты сборки рибосомно-ядрышковых конструк-
ций в цитоплазме. При сборке эргастоплазматических пузырь-
ков и двойных мембран клетка использует материал, посылае-
мый ядрышком в цитоплазму, включая липопротеиновые белки,
из которых конструируются эргастоплазматические мембраны.
Акцессорные ядра — это цитоплазматические блоки рибосомно-
ядрышкового аппарата, репродуцируемые клеткой из компонен-
тов ядерных конструкций. Они имеют вид ядерных блоков, по-
добных кариомерам, возникающим за счет индивидуальных хро-
мосом, одеваемых ядерной мембраной. Вот почему уместно дать
им наименование нуклеолокариомеры или нуклеоломеры. Цито-
нуклеолы, обнаруженные мной в цитоплазме ооцитов северной
креветки, родственны нуклеоломерам по природе и происхожде-
нию, отличаясь от них способом развития и общей конструкцией,
в которой отсутствует мембрана.
Своеобразный вариант цитонуклеол обнаружен в цитоплазме
яйца морского ежа Афцелиусом [Afzelius, 1957]. Этот вариант,
« 60 »
ОНТОГЕНЕЗ И ФИЛОГЕНИЯ ЯДРЫШКА
названный Афцелиусом «тяжелыми тельцами», на электронных
микрофотографиях представляет собой массу гранул диаметром
в 150 А (очевидно, рибосом), окруженную двухконтурной обо-
лочкой, сходной с ядерной. К числу специализированных форм
цитонуклеол можно отнести все виды концентрических напласто-
ваний двойных шероховатых мембран эргастоплазмы, характер-
ных для некоторых железистых клеток, например гигантских
клеток слюнных желез личинок двукрылых и ооцитов. За этими
формами цитонуклеол можно сохранить предложенное мной наи-
менование эргастосферы.
Особым вариантом рибосомно-ядрышкового комплекса типа
цитонуклеол, но размещенного в ядре, является так называемый
элиминационный хроматин в ооцитах некоторых насекомых.
ЭЛИМИНАЦИОННЫЙ ХРОМАТИН —
ОСОБЫЙ ТИП ХРОМОСОМОНУКЛЕОЛ
Процесс элиминации (вынесения) хроматина из ядра ооцитов
описан для насекомых из семейства жуков-плавунцов, двукры-
лых и тлей [Lima-de-Faria, Moses, 1966; см.: Kato, 1968]. Этот
процесс заключается в том, что в ядре накапливается хроматин,
не связанный топографически с хромосомным комплексом (так
называемый экстрахромосомальный хроматин), в форме сферы
полусферы или полумесяца — в зоне ядра, противоположной той,
где размещаются хромосомы. К концу периода роста экстрахро-
мосомальный хроматин подвергается постепенному рассасыванию
(или выбрасыванию из ядра). На протяжении многих лет после
открытия этот феномен оставался загадкой сравнительной цито-
логии.
Применение новейших методов позволило внести некоторую
ясность в вопрос о природе и биологическом значении экстра-
хромосомального элиминационного хроматина [Kato, 1968]. Вы-
яснилось прежде всего, что экстрахромосомальный хроматин в
отличие от хромосом ооцита характеризуется высоким содержа-
нием ДНК, открываемой реакцией Фельгена. Еще более важным
следует считать открытие в этой структуре высокого содержания
РНК. Уже на стадии преооцитов в делящихся клетках экстра-
хромосомальный хроматин интенсивно включает меченые пред-
шественники ДНК и РНК (Н3-тимидин, Н3-уридин). Высокая
активность синтеза ДНК и РНК сохраняется и на стадиях раз-
вития ооцита. На электронных микрофотографиях в хромосомной
зоне видна сеть нуклеолярного материала (типа нуклеолонемы)
между хромосомами, а в экстрахромосомной зоне — более рыхлая
сеть нуклеолярного вещества, в ячейках которой располагаются
скопления ДНК. Автор заключает, что экстрахромосомальный
хроматин представляет собой специальный механизм, обеспечи-
вающий усиленный синтез ДНК и РНК, необходимых для репро-
« 61 »
ОНТОГЕНЕЗ И ФИЛОГЕНИЯ КЛЕТКИ
дукции белка в цитоплазме ооцита, лишенного возможности пе-
рейти к полиплоидной организации. По мнению автора, экстра-
хромосомальный хроматин — это специфическое гигантское
ядрышко, содержащее большое количество независимой от хро-
мосом ДНК.
С моей точки зрения, элиминационный хроматин, обнаружен-
ный в ооцитах некоторых жуков, двукрылых и тлей, представ-
ляет собой своеобразную рекапитуляцию древних состояний ядра
с широкими возможностями взаимопревращений ядрышковых и
хромосомных компонентов. Элиминационный хроматин — это
комплекс нуклеолохромосом, или, вернее, хромосомонуклеол, ли-
шившихся индивидуальности и работающих как единая структур-
ная система нуклеолохроматин. Едва ли причина выбора данной
конструкции этой системы заключается в том, что ооциты не име-
ют возможности перейти к полиплоидной схеме хромосомной ор-
ганизации. Ооциты рыб и других позвоночных находят выход из
положения в конструкции хромосом—ламповых щеток с допол-
нительным формированием ДНН'-содержащих ядрышек. Очевид-
но, при разработке элиминационно-хроматиновой конструкции
ооцит обращается к древним устройствам белкового синтеза, под-
бирая наиболее соответствующие решаемой строительной задаче.
Обособление в ядрах ооцитов экстрахромосомной ДНК описа-
ны и у других объектов. Для молодого растущего ооцита Xenopus,
начиная с лептотенной стадии, установлено с помощью цитохи-
мической и радиоавтографической техники формирование обшир-
ной полярной полусферы (шапочки), активно включающей 3Н-ти-
мидии [Macgregor, 1968]. Эта ДНК-содержащая шапочка увели-
чивается в размерах до конца пахитенной стадии, после чего
диспергируется. Автор полатает, что эта шапочка представляет
собой скопление ядрышковой ДНК, возникающей путем множест-
венной репликации ядрышкового организатора. Независимо от
этого толкования сам факт развития в ядре специальной внехро-
мосомной ДНК-содержащей ядрышковой конструкции представ-
ляет большой эволюционно-морфологический интерес. Клетка
обращается к организации подобных конструкций в ядре, исполь-
зуя филогенетический опыт конструирования клеточной структу-
ры. Наряду с нуклеолохромосомами в виде хромосом—ламповых
щеток клетка строит хромосомонуклеолы, или ДНК-нуклеолы,
в виде экстрахромосомной полярной шапочки, решая задачу
сверхинтенсивного синтеза белка, сопровождающего рост ооци-
та. И та и другая конструкции рекапитулируют структуру пред-
ковой протоклеточной бактериоидной формы.
Необходимо подчеркнуть, что в большинстве работ, посвящен-
ных взаимодействию ядра и цитоплазмы, мысль исследователя в
значительной мере сковывается убежденностью в детерминирую-
щей роли ДНК во всех проявлениях клеточной жизнедеятельно-
сти. Для огромного большинства биологов кажется абсолютно
« 62 »
ОНТОГЕНЕЗ И ФИЛОГЕНИЯ ЯДРЫШКА
очевидным и достоверным, что из трех специфических носителей
биологической информации — ДНК, РНК и белков — только ДНК
обладает свойством самокопирования и передачи информации
другим информационным полимерам. Вот почему по существу со-
вершенно необследованными с помощью новейших методов оста-
ются состояния развивающихся клеток, в которых не удается об-
наружить ДНК, например ядра растущих ооцитов.
Этот вопрос, как известно, был поднят биохимиками, которым
не удалось обнаружить ДНК в ядрах неоплодотворенных яиц
морского ежа [A. Marshak, С. Marshak, 1955], и в дальнейшем
вызвал оживленную дискуссию [см.: Браше, 1960], которая за-
вершилась общим выводом о трудностях открытия ДНК в
гигантских ядрах. Однако до настоящего времени этот вопрос не
подвергался солидной исследовательской разработке. Имею-
щиеся суждения не позволяют судить о том, все ли стадии роста
ооцита были подвергнуты обследованию.
Проблема самокопирования РНК, не говоря уже о белковых
молекулах и передаче информации РНК и белками, разработана
слабо, хотя сравнительная морфология клетки располагает нема-
лым числом примеров таких состояний клетки, когда участие
ДНК в процессах развития не выявляется современными сред-
ствами исследования. К числу таких примеров относится знаме-
нитая одноклеточная водоросль ацетабулярия.
НУКЛЕОЛОРИБОСОМНЫЙ АППАРАТ АЦЕТАБУЛЯРИИ
Ацетабулярия — одноклеточная водоросль из группы сифо-
новых — представляет собой идеальный объект для исследования
роли ядра в процессах формообразования [Браше, 1960; Brachet,
1968; Джибор, 1968; Bonotto et. al., 1976].
Регенерация шляпки ацетабулярии используется в качестве
самого убедительного доказательства преобладающей или даже
исключительной роли ядра в процессах формообразования. Опы-
ты с перекрестными пересадками ядра разных видов ацетабуля-
рий, приводящие к развитию регенерирующей шляпки в соответ-
ствии с видовой принадлежностью ядра, широко пропаганди-
руются в биологической литературе [Браше, 1960; Сэджер, Райн,
1964; Джибор, 1968]. Между тем только в одной из обзорных
статей Браше [Brachet, 1965] было обращено внимание на то,
что в ядре ацетабулярии ни одним из использованных современ-
ных методов не удалось открыть ДНК. Гигантские ядра этого
удивительного организма, согласно утверждению Браше, «не со-
держат видимого хроматина и не дают реакции на тесты для
ДНК... Таким образом, это исключительно большое ядро дейст-
вительно не содержит ДНК; ее никак невозможно открыть вплоть
до того, как ядро дегенерирует и дочерние ядра начнут двигать-
ся по стволу» (с. 156). К утверждению о фельген-негативности
« 63 »
ОНТОГЕНЕЗ И ФИЛОГЕНИЯ КЛЕТКИ
первичного ядра ацетабулярии Браше возвращается и позже
[Brachet, 1970]. Между тем в ядре ацетабулярии идет интенсив-
ный синтез РНК, открываемый по включению 3Н-уридина. Не-
трудно понять, что если бы даже ядро ацетабулярии содержало
ДНК в минимальном для зиготы (диплоидном) количестве, то
это количество было бы не в состоянии обеспечить интенсивный
синтез РНК и белка на всем протяжении периода роста и диф-
ференцировки водоросли. Объем растения, закончившего рост и
дифференцировку, превышает объем зиготы, по подсчетам Ше-
парда [Shephard, 1965], в миллиард раз. Однако в последние годы
в литературе появились описания «нуклеолярных цистронов»
в тяжеобразном ядрышке ацетабулярии в виде нитей с «лам-
повыми щетками», выявляемых с помощью особой электронно-
микроскопической техники [Spring et. al., 1976]. Невозможно
предположить, что матрицы ДНК, представленные в диплоидном
наборе хромосом зиготы и не подвергающиеся обновлению на всем
протяжении роста и дифференцировки ацетабулярии, могли обе-
спечить репродукцию РНК, необходимой для синтеза этой гигант-
ской массы белка. Вот почему более правдоподобным мне пред-
ставляется вывод о саморепродукции РНК в ядре ацетабулярии.
Ядро этой водоросли не содержит хроматина, выявляемого с
помощью обычной гистологической и гистохимической техники.
Основу ее микроструктуры составляет гигантское, тяжеобразное,
закрученное наподобие связки сосисок ядрышко. Электронно-мик-
роскопическое исследование [Van Gansen, Boloukhere-Presburg,
1965] показало, что рибосомно-ядрышковый аппарат этого орга-
низма включает в ядерной части довольно плотную упаковку ри-
босом в ядрышке и более рыхлое их расположение в кариоплаз-
ме с отчетливо выраженной тенденцией к формированию скоп-
лений (розеток, кучек), напоминающих полисомы (рис. 17).
В цитоплазматической части обнаруживаются мелкие пузырьки
эргастоплазмы и различной сложности полисомы. Самой замеча-
тельной и весьма своеобразной особенностью рибосомно-яд-
рышкового аппарата ацетабулярии является транспорт рибосом
из ядра в цитоплазму. Вокруг ядра располагается довольно ши-
рокое околоядерное пространство в виде цистерны, в которую
от околоядерной каймы цитоплазмы отщепляются почки, густо
наполненные рибосомами. Рибосомы проходят сквозь ядерную
мембрану в околоядерную цитоплазму, которая с помощью почек
транспортирует их в околоядерную полость и отсюда — в цито-
плазму.
Таким образом, организм ацетабулярии представляет собой,
по-видимому, специализированный вариант нуклеолярно-рибо-
сомной конструкции, посредством которой осуществляется рибо-
сомная регуляция пластических процессов без видимого участия
ДНК. Ядрышко ацетабулярии рекапитулирует одну из редких
форм комплексирования бактериоидных протоклеток, сопровож-
« 64 »
ОНТОГЕНЕЗ И ФИЛОГЕНИЯ ЯДРЫШКА
Рис. 17. Схема выхода рибосом из ядра и организации рибосомного аппа-
рата у ацетабулярии [по Ван-Ганзену и Болдухеру-Пресбургу, 1965]
давшегося редукцией ДНК. Для процессов роста и дифференци-
ровки достаточно рибосомной регуляции. С переходом к произ-
водству размножающихся клеток в ядре возникает ДНК.
Онтогенез ядрышка принадлежит к числу наиболее демонст-
ративных примеров рекапитуляции предковых состояний клетки.
Анализ бактериоидной организации позволяет сделать вывод, что
конструирование клеточной организации за счет комплексиро-
вания протоклеток сопровождалось обособлением ядерной конст-
рукции, включающей материал нуклеоидов в виде хромосом,
и рибосомный материал матрикса в виде ядрышек. Назначение
ядерной конструкции заключается в том, чтобы обеспечивать реп-
5 А. Н. Студитский « 65 »
ОНТОГЕНЕЗ И ФИЛОГЕНИЯ КЛЕТКИ
редукцию хромосом — органелл размножения, и ядрышек — ор-
ганелл белкового синтеза, осуществляемого в цитоплазме.
В рибосомно-ядрышковом аппарате, ответственном за белковый
синтез, ядрышко играет роль как бы камбиального, или герми-
нативного, блока, поставляющего рибосомы или их субчастицы
в цитоплазму, где из них формируются рабочие блоки рибосом-
но-ядрышкового аппарата. В онтогенезе клеток наблюдаются про-
цессы, которые можно рассматривать как рекапитуляции различ-
ных филогенетических состояний ядрышка и его производных.
Исходным способом онтогенеза ядрышка является, очевид-
но, прямое деление ядрышка по динофлагеллягному, или эвгле-
ноидному, типу, рекапитулирующему прямое деление протокле-
точных предков. Вторичный способ онтогенеза ядрышка — сборка
ядрышковой конструкции из рибосомного и белкового компонен-
тов нуклеолохромооом, т. е. метафазных и анафазных хромосом.
Онтогенез рибосомно-ядрышкового аппарата в целом включает
различные формы миграции ядрышкового вещества в цитоплаз-
му с последующей организацией различных рибосомных конст-
рукций в цитоплазме. К числу форм миграции ядрышкового ве-
щества в цитоплазму принадлежит: выход целых ядрышек или
ядрышковых фрагментов в цитоплазму (ооциты некоторых ра-
кообразных и рыб); выход рибосом в цитоплазму с последующим
формированием ядрышкоподобных конструкций (цитонуклеол)
в цитоплазме (ооциты креветок, ооциты иглокожих, сперматиды
прямокрылых); вариантом этого способа является обособление
ядрышкового материала, содержащего активную ДНК, в ядре
в виде экстрахромосомного хроматина (ооциты некоторых зем-
новодных) ; выход ядрышкового материала в цитоплазму в со-
провождении ядерной оболочки (акцессорные ядра перепончато-
крылых) ; и, наконец, выход диспергированного рибосомного ма-
териала в цитоплазму с последующим формированием из него
рибосомно-мембранных конструкций в цитоплазме (ацетабуля-
рия). Последний процесс более подробно рассмотрен в следующей
главе, посвященной онтогенезу и филогенезу мембранных кон-
струкций клетки.'
Все процессы миграции ядрышкового вещества в цитоплазму
свидетельствуют о том, что при формировании клеток аппарат
белкового синтеза возник в виде сложной ядерно-цитоплазмати-
ческой конструкции — нуклеолярно-рибосомного аппарата, вклю-
чающего герминативный блок, расположенный в ядре, и рабочий
блок, расположенный в цитоплазме. Ядрышко поставляет в ци-
топлазму материал, из которого строятся рабочие блоки рибо-
сомно-ядрышкового аппарата в цитоплазме. Нельзя исключить и
того, что в онтогенезе клетки сборка ядрышка, осуществляемая в
телофазе, вовлекает также и рибосомы цитоплазматической час-
ти нуклеолярно-рибосомного аппарата.
« 66 »
ОНТОГЕНЕЗ И ФИЛОГЕНИЯ МЕМБРАННЫХ СТРУКТУР КЛЕТКИ
Глава четвертая
ОНТОГЕНЕЗ И ФИЛОГЕНИЯ
МЕМБРАННЫХ СТРУКТУР КЛЕТКИ
РОЛЬ ИСХОДНОЙ ПОЗИЦИИ В РАЗРАБОТКЕ ПРОБЛЕМЫ
В предыдущей главе говорилось о том, что связи между раз-
личными мембранными структурами клетки выявлялись и опи-
сывались во множестве работ по электронной микроскопии. Од-
нако от констатации этих связей и от догадок о происхождении
одной мембранной структуры от другой до обоснования доста-
точно конструктивной гипотезы о путях и механизмах филоге-
нетического развития мембранных систем клетки — весьма боль-
шое расстояние, преодоление которого требует четкой и ясной
исходной позиции.
Основной факт, который должен быть прежде всего принят во
внимание при обсуждении любых гипотез, относящихся к эволю-
ционной динамике клеточных структур, заключается в том, что
исходная протоклеточная организация, представленная низшими
прокариотами, например микоплазмами, включает только одну —
плазмолеммальную мембранную конструкцию и во всяком слу-
чае лишена мембранного ядерного устройства. Внутренние мем-
браны (мезосомы) появляются только у высших прокариотов,
а развитие всей внутренней мембранной системы начинается
только при переходе от протоклеточной к клеточной организации,
главный признак которой заключается в структурном обособлении
ядра и возникновении ядерной мембраны. В предшествующем из-
ложении неоднократно подчеркивалось, что вопрос о происхожде-
нии внутриклеточных мембран может иметь только два решения.
Либо клетка возникла из протоклетки путем разрастания и
структурного обособления функционально специализированных
частей — тогда все внутриклеточные мембраны могли возникнуть
только путем впячивания и разрастания плазмолеммы в полном
соответствии со схемой Робертсона. Либо клетка представляет
собой продукт комплексирования клона протоклеток — и тогда
все внутриклеточные мембраны оказываются производными плаз-
молемм контактирующих протоклеток. Все промежуточные гипо-
тезы, например о развитии митохондриальных мембран за счет
ядерной или ядерной за счет цитоплазматических, лишены всяко-
го эволюционно-морфологического значения, так как они обходят
главный вопрос — способ образования первых внутриклеточных
мембран, послуживших источником формирования всех остальных.
Еще меньшее эволюционно-морфологическое значение имеют ги-
потезы о случайном возникновении внутриклеточных мембранных
конструкций без связи с мембранной организацией протоклетки.
Вот почему при разработке вопроса о филогении внутриклеточных
« 67 »
5*
ОНТОГЕНЕЗ И ФИЛОГЕНИЯ КЛЕТКИ
мембран необходимо опираться на ясную и точную исходную точ-
ку зрения.
Задача книги — обосновать и защитить идею о происхождении
клетки путем комплексирования клона протоклеток, обладающих
Конструкцией бактериального организма. Все внутриклеточные
мембраны первично возникли за счет плазмолемм протоклеток,
объединившихся в клеточный комплекс. Однако вместе с клеткой
и клеточной конструкцией возник и клеточный онтогенез, способ
индивидуального развития клетки, принципиально отличный от
примитивного протоклеточного цикла с простейшим способом
прямого деления нуклеоида и тела протоклетки вместе с его
плазмолеммой. Возникновение клетки сопровождалось не простым
обобществлением плазмолемм протоклеток, вошедших в состав
клетки, а формированием сложнейшей внутриклеточной мембран-
ной конструкции, подвергающейся весьма существенным изме-
нениям на протяжении всего жизненного цикла клетки, в осо-
бенности в период митотического деления. Те простейшие отно-
шения, в которых выражались структурные взаимодействия комп-
лексирующихся протоклеток в момент формирования клеточной
конструкции, уступили место в сформированной клетке гораздо
более сложным отношениям клеточных структурных компонентов,
специализированных на отправлении различных жизненных
функций. Вот почему в онтогенезе клетки процесс ее филогенети-
ческого формирования получил весьма смутное отражение. Только
ясное представление о предполагаемом способе развития кле-
точной структуры в филогенезе может обеспечить достаточно
правдоподобное объяснение динамики изменений клеточной кон-
струкции, и в частности ее мембранных систем в онтогенезе.
ЯДРО МОЖЕТ НЕСТИ ГЕРМИНАТИВНУЮ ФУНКЦИЮ
В ОНТОГЕНЕЗЕ ОРГАНЕЛЛ
При изложении материала предшествующих глав неоднократ-
но подчеркивалась общая тенденция в конструировании клеточ-
ной организации (имеется в виду ее эволюционный прогресс,
осуществляемый естественно материальными факторами истори-
ческого преобразования живой материи), которая заключалась в
обособлении рабочей части клетки от генеративной. Рабочие бло-
ки клетки — органы ассимиляции (белкового синтеза), диссими-
ляции (окислительного метаболизма), сегрегации (аккумуляции
и выведения секретов и конечных продуктов метаболизма), дви-
жения и опоры — вынесены на периферию, в цитоплазму.
Центральная структурная система клетки — ядро — осуществляет
функцию воспроизведения в первую очередь органелл размноже-
ния клетки — хромосом, а также ядерного блока рибосомно-
ядрышкового аппарата — системы ядрышек. В ядре репро-
дуцируются важнейшие клеточные органеллы, без которых
« 68 »
ОНТОГЕНЕЗ И ФИЛОГЕНИЯ МЕМБРАННЫХ СТРУКТУР КЛЕТКИ
неосуществимы главные жизненные функции — накопление и вос-
производство массы живого тела. Материалы, изложенные в пре-
дыдущей главе, позволили сделать вполне достоверное заключение
о репродукционной активности ядрышка, обеспечивающей разно-
образные формы миграции ядрышкового материала в цитоплазму
с последующей реконструкцией ядрышкоподобных устройств в ци-
топлазме. Было указано, что формирование подобных устройств
в большинстве случаев связано со сверхинтенсивной синтетиче-
ской активностью клетки. Как правило, ядрышковый материал
мигрирует в цитоплазму в диспергированном состоянии в виде
одиночных рибосом или их предшественников (молекул РНП).
В настоящее время не осталось никаких сомнений в том, что
из рибосомного материала ядрышек, поступившего в цитоплазму,
строятся гранулярные конструкции эргастоплазмы. Подлежащим
разработке остается вопрос о происхождении мембранного ком-
понента эргастоплазматических устройств.
ОНТОГЕНЕЗ МЕМБРАННЫХ КОНСТРУКЦИЙ ЭРГАСТОПЛАЗМЫ
Здесь необходимы некоторые пояснения. Проще всего было бы
ответить на этот вопрос в том смысле, что клетка строит грану-
лярно-мембранные конструкции эргастоплазмы по той же схеме,
которая используется при строительстве цитонуклеол и других
ядрышкоподобных конструкций в цитоплазме, т. е. путем выноса
строительного материала из ядра и его использования для мон-
тажа мембранных устройств в цитоплазме (рис. 18). Дело, од-
нако, осложняется тем, что ядрышкоподобные конструкции в
цитоплазме (например, акцессорные ядра в ооцитах перепончато-
крылых) не всегда становятся рабочими блоками рибосомно-яд-
рышкового аппарата, а продолжают играть роль органов репро-
дукции рибосом. Задача заключается в том, чтобы понять
онтогенетический путь формирования рабочих блоков рибосомно-
ядрышкового аппарата — гранулярно-мембранных устройств эрга-
стоплазмы.
Среди различных способов формирования рабочих блоков
эргастоплазмы следует отметить прежде всего монтаж эргасто-
плазматических мембран из мелких одноконтурных пузырьков и
рибосомных гранул в цитоплазме, наблюдаемый, например, в ци-
топлазме клеток Бальбиани в слюнных железах личинок двукры-
лых. Можно назвать этот способ сборки органелл мембранной
трансформацией везикулярных конструкций. Пузырьки, на кото-
рых формируются мембраны эргастоплазмы, можно считать го-
мологами пузырьков, на которые распадались новообразованные
двойные мембраны, возникшие за счет плазмолемм комплексиру-
ющихся предковых организмов. Вопрос заключается в происхож-
дении везикулярного строительного материала эргастоплазмы в
онтогенезе клетки.
« 69 »
ОНТОГЕНЕЗ И ФИЛОГЕНИЯ КЛЕТКИ
Рис. 18. Гипотетическая схема участия мембранных компонентов ядерных
органелл в формировании мембранных конструкций эргастоплазмы
А — этап формирования ядра и прилежащей эргастоплазмы путем комплексирова-
ния протоклеток. Ядерные компоненты (хромосомы) отмечены включением мотков
ДНК. Прилежащие мембраны ядерных и цитоплазматических компонентов подвер-
гаются везикуляции; Б — этап формирования двойной ядерной оболочки и мембран
эргастоплазмы. Ядерные мембранные компоненты (оболочки ядрышка и хромосом)
выходят в цитоплазму, где принимают участие в конструировании мембран эрга-
стоплазмы:. Гранулярный компонент эргастоплазмы не изображен
Известно, что ядрышко содержит в себе липопротеидный ма-
териал, обусловливающий редукцию серебра при обработке кле-
ток по методу Бильшовского—Гросса и посредством других ме-
тодов [Das, Alfert, 1963; Stockert et al., 1970; Colman, Stockert,
1972; Risueno et al., 1973, 1976; Moreno Diaz et al., 1976], а также
редукцию осмия из осмиевых фиксаторов [Schwab, 1970].
Можно предположить, что этот материал вошел в состав яд-
рышка в результате разрушения ядрышковой плазмолеммы в фи-
логенетическом прошлом. Можно представить себе, что в ядре
продолжается синтез липопротеидных блоков, которые, мигрируя
вместе с рибосомами в цитоплазму, становятся источником строи-
тельного материала для конструирования мембранных систем эр-
гастоплазмы. Тогда, действительно, ядрышковый компонент ста-
новится камбиальным блоком рибосомно-ядрышкового аппарата.
Однако дело опять осложняется тем, что мембранные устройства,
ядерных органелл — хромосом не только подвергаются разруше-
нию при конструировании ядра, но приобретают значение ис-
точника строительных материалов при воспроизводстве ядерной
мембраны в телофазе. Еще более важно то обстоятельство, что
строительные блоки — пузырьки, из которых посредством мем-
бранной трансформации строится ядерная мембрана, обладают
полным сходством с эргастоплазматическими пузырьками. Вот
« 70 »
ОНТОГЕНЕЗ И ФИЛОГЕНИЯ МЕМБРАННЫХ СТРУКТУР КЛЕТКИ
почему невозможно исключить то, что ядерная мембрана как
конструкция, возникшая в филогенезе за счет плазмолемм бакте-
риоидных предшественников хромосом и ядрышек, содержит в
себе наряду с хромосомными мембранами и блоки ядрышковых
мембран. Таким образом, ядерная мембрана может служить ис-
точником формирования мембранных структур эргастоплазмы
наряду с везикулярным компонентом, возникающим за счет миг-
рации в цитоплазму липопротеидных блоков ядрышка.
Связь эргастоплазматических мембран с ядерной мембраной
описывалась во множестве работ и в настоящее время фигури-
рует во всех схемах клеточной конструкции, приводимых в совре-
менных учебниках и руководствах по цитологии, начиная со зна-
менитой схемы Браше [1968], обошедшей всю мировую научно-
пропагандистскую цитологическую и генетическую литературу
[Руководство по цитологии, 1965; Прокофьева-Бельговская, 1966;
де Робертис и др., 1967; Вилли, 1968; Гершкович, 1968; Введение
в цитологию, 1968; Арронет и др., 1969; Ambrose, Easty, 1970;
Дубинин, 1970; Камшилов, 1970].
В схеме растительной клетки, представленной в известной мо-
нографии Фрей-Вислинга и Мюлеталера [1968], эндоплазматиче-
ский ретикулум, т. е. канальцы эргастоплазмы, также изображе-
ны в связи с ядерной мембраной. Это теперь уже общепринятое
представление о связи эндоплазматической сети с ядерной мем-
браной [Dvorak, 1968] подводит нас вплотную к вопросу о проис-
хождении мембранной системы эргастоплазмы.
Согласно нашей филогенетической схеме двойные мембраны
возникли как продукт объединения плазмолемм бактериоидных
предков, комплексирование которых привело к созданию клеточ-
ной конструкции. Вопрос заключается в том, чтобы понять, чем
заменился этот первичный способ формирования двойных эрга-
стоплазматических мембран, когда клетка приобрела стабильную
мембранную конструкцию. Каков источник формирования новых
эргастоплазматических мембран в онтогенезе клетки? Подводя
итоги всем электронно-микроскопическим данным о связях меж-
ду ядерной мембраной и мембранами эндоплазматической сети,
Фрей-Вислинг и Мюлеталер [1968] решительно поддерживают
концепцию, согласно которой эндоплазматическая сеть возникает
в процессе онтогенеза из ядерной оболочки. Это наиболее правдо-
подобное решение вопроса. Однако в эволюционно-цитологиче-
ском плане оно требует некоторых разъяснений.
Как продукт комплексирования центрально расположенных
протоклеток ядро представляет собой комплекс протоклеточных
производных (хромосом и ядрышек), покрытый общей плазмо-
леммой — внутренней ядерной мембраной. Внешняя ядерная обо-
лочка является продуктом слияния плазмолемм протоклеточных
компонентов, формирующих цитоплазму, в основном эргастоплаз-
матических субъединиц клетки — эргастосом (рис. 19). Примы-
« 71 »
ОНТОГЕНЕЗ И ФИЛОГЕНИЯ КЛЕТКИ
Рис. 19. Схема формирования полостей и цистерн эргастоплазмы в фило-
(А, В) и онтогенезе (В — Д) клетки
При комплексировании бактериоидных телец в форме первой клетки ядерная мем-
брана возникла за счет плазмолемм ядерных телец, из которых сформировалась
внутренняя ядерная мембрана, и плазмолемм примыкающих цитоплазматических
телец, за счет которых развивалась внешняя ядерная мембрана. Двойные цитоплаз-
матические мембраны, отделявшие друг от друга бактериоидные тельца, обладали
тенденцией к распаду на везикулы с формированием общего эргастоплазматиче-
ского пула. В онтогенезе пузырьки и полости эргастоплазмы рекапитулируют эво-
люционный процесс комплексирования предковых бактериоидных телец и концен-
трические напластования
Рис. 20. Реальный процесс экструзии ядрышкового материала (стрелка)
в цитоплазму (А) и схема возможной (риболипопротеидной) природы это-
го материала и формирования из него мембранных и гранулярных компо-
нентов эргастоплазмы (В, В)
А — край ядра и цитоплазма клетки почки золотистого хомячка в культуре. Я —
ядро; ЯМ — ядерная мембрана. Электронная микрофотография К. С. Абрамяна
« 72 »
ОНТОГЕНЕЗ И ФИЛОГЕНИЯ МЕМБРАННЫХ СТРУКТУР КЛЕТКИ
« 73 »
ОНТОГЕНЕЗ И ФИЛОГЕНИЯ КЛЕТКИ
кающая к внешней ядерной мембране цитоплазма по существу —
это матрикс эргастосом, куда через ядерные поры поступает
ядрышковый материал. Ядро окружено кольцом эргастосом, в ко-
торые проникает ядрышковый рибосомный материал из ядра.
Ядерная оболочка, отделяющая ядерное содержимое (или, услов-
но говоря, ядерный матрикс от цитоплазмы, а более точно, от
матрикса околоядерных эргастосом)это не просто разделитель-
ное устройство, расположенное между кариоплазмой и цитоплаз-
мой, а активный механизм, постоянно отделяющий матрикс
ядерной части рибосомно-ядрышкового аппарата от его дочерней
части, поступающей в цитоплазму (рис. 20). Прилежащая к
ядру цитоплазма — это, действительно, комплекс эргастосом, по-
стоянно отделяемых от ядра с помощью ядерной оболочки. Пе-
реднюю стенку эргастосом этого комплекса составляет внешняя
ядерная мембрана, заднюю — мембраны эргастосом, расположен-
ных параллельно ядерной мембране, а боковые стенки — это,
очевидно, те подмеченные всеми электронными микроскопистами
выросты внешней ядерной мембраны, которые связывают ее с
канальцами эндоплазматической сети. С морфологической сторо-
ны заманчиво было бы трактовать околоядерную цитоплазму как
зону постоянного ее обновления за счет ядрышкового резерва
ядра и ядерной мембраны. Однако до получения соответствующих
фактических данных (например, характеристик распределения
эргастоплазматических мембран в периоды высокой пластической
активности клетки) вопрос о способе реализации камбиальной
роли ядра в онтогенезе эргастоплазмы остается открытым. Можно
отметить только, что в тех случаях, когда имеется возможность
исследовать поэтапно процессы активизации эргастоплазмы,
например при индукции синтеза антител лимфоцитами, эргастоп-
лазматические мембраны располагаются вокруг ядра концентри-
ческими слоями [Носсаль, 1966].
Таким образом, воспроизведение эргастосом (элементов, рас-
полагающихся между двойными мембранами эргастоплазмы) в
онтогенезе клетки, очевидно, имеет два пути. Первый заключает-
ся в миграции рибосом вместе с липопротеидными блоками (мак-
ромолекулами) в цитоплазму, где из липопротеидных блоков
путем формирования мелких пузырьков и последующей их
трансформации строятся двойные эргастоплазматические мембра-
ны, вступающие в связь с рибосомами. Второй путь состоит в не-
посредственном отделении от ядра мембранных компонентов эрга-
стоплазмы вместе с поступающими в их матрикс рибосомами.
Возникает вопрос: поскольку вся цитоплазма в свете развиваемой
в этой книге теории является комплексом эргастосом (включаю-
щим в качестве структурных компонентов митохондрии и систему
компонентов Гольджи-ретикулоплазму), не следует ли считать,
что в онтогенезе клетки она целиком развивается за счет ядра?
« 74 »
ОНТОГЕНЕЗ И ФИЛОГЕНИЯ МЕМБРАННЫХ СТРУКТУР КЛЕТКИ
ВСЯ ЛИ ЭРГАСТОПЛАЗМА РАЗВИВАЕТСЯ ЗА СЧЕТ ЯДРА?
На этот вопрос необходимо отвечать, только имея в виду весь
путь филогенеза клетки. У нас нет никаких оснований для того,
чтобы считать ядерный блок клеточной конструкции исходной
формой клеточной организации, которая превратилась в типич-
ную клетку путем выхода из ядра и трансформации в цитоплаз-
матические органеллы ядерных органелл. Наоборот, есть все осно-
вания полагать, что клеточная организация возникла сразу путем
дифференциации центральных протоклеточных компонентов в
виде ядра, а периферических — в виде цитоплазмы. Вместе с тем
подобный способ конструирования клеточной структуры не ис-
ключал, а благоприятствовал разделению клетки на воспроизво-
дительную (камбиальную) и рабочую части, какими сделались
в процессе дифференцировки ядро и цитоплазма. Ядро воспроиз-
водит органеллы размножения — хромосомы, которые во время
митотического деления оказываются в тесной связи с остальным
клеточным содержимым. Ядро воспроизводит рибосомно-нуклео-
лярный аппарат, включая, как мы теперь убедились, и его рабо-
чие части — эргастосомы. Однако эргастосомы по своему первич-
ному происхождению — это протоклетки, потомки бактериоидных
предков клетки. Вот почему они могут проявлять способность к
самовоспроизводству в цитоплазме не только путем самосборки
из блоков, посылаемых ядрышком в цитоплазму, но и путем де-
ления или фрагментации.
Для эргастоплазматических мембран многих клеток характер-
но образование выростов, которые разделяют эргастоплазму на
отдельности. Характерное расположение цистерн эргастоплазмы
секреторных клеток параллельными рядами, вероятно, возникает
путем разрастания выпячиваний мембран. Вполне возможно, что
такие структурные модификации мембранных устройств эргасто-
плазмы представляют собой видоизмененные формы воспроизвод-
ства эргастосом путем деления. Вопрос о саморепродукции кле-
точных органелл путем деления наиболее основательно разрабо-
тан применительно к митохондриям и пластидам.
ОНТОГЕНЕЗ МИТОХОНДРИЙ И ПЛАСТИД
Проблема происхождения митохондрий в онтогенезе была по-
ставлена, собственно, уже в первых исследованиях, которыми
был обнаружен этот важный компонент цитоплазматической ор-
ганизации. Первооткрыватель митохондрий Альтман [Altmann,
1890], как известно, считал обнаруженные им в цитоплазме кле-
ток гранулы — биобласты — элементами клеточной организации,
наделенными значительной степенью автономности и способными,
в частности, к размножению путем деления или почкования.
Здесь можно заметить, что сходство клеточных органелл с их
« 75 »
ОНТОГЕНЕЗ И ФИЛОГЕНИЯ КЛЕТКИ
бактериальными или бактериоидными предками, оставшееся не-
замеченным первыми исследователями хромосом и митотическо-
го деления клетки, бросилось в глаза Альтману, который увидел-
в митохондриях самую важную черту, сближающую их с бакте-
риями,— определенную автономность их жизненной деятельности,
включая самовоспроизведение путем деления. Альтман считал
открытые им гранулы «элементарными организмами», которые,
подобно бактериальным организмам типа микрококков, объедине-
ны в своеобразную колонию в цитоплазме.
Предвидение Альтмана в электронно-микроскопическую эру
получило глубокое и разностороннее подтверждение. Сходство'
митохондрий с бактериями по структуре, химической природе и
функциональным отправлениям признано всеми исследователями:
[см.: Roodin, Wilkie, 1968; Nass, 1969]. Немало авторов признает
симбиотическую природу митохондрий, присоединяясь, таким об-
разом, к наиболее сомнительному выводу Альтмана о природе ми-
тохондрий. И многие исследователи, подобно Альтману, в разра-
ботке вопроса об онтогенезе митохондрий обращаются к идее о
бактериальном способе размножения.
Репродукция митохондрий путем деления была обнаружена
еще на уровне светооптической техники. Наиболее демонстратив-
ные картины деления митохондрий путем гантелеобразной пере-
тяжки были описаны Форе-Фремье [см.: Вильсон, 1940] в цито-
плазме инфузорий. Сходные наблюдения, документированные
вполне убедительными иллюстрациями, принадлежат Хорнингу
[Horning, 1929]. В настоящее время фигуры деления митохонд-
рий у протистов обследованы и описаны на электронно-микро-
скопических картинах [Manton, 1959,1961; Wohlfarth-Bottermann,
1966; Hedley, Wakerfield, 1968]. Самой демонстративной и бес-
спорной формой размножения митохондрий путем деления у про-
тистов оказалось размножение так называемого кинетонуклеуса,.
или блефаропласта, у трипаносомид и бодонид [Ris, 1961; Pitel-
ka, 1969]. Фельген-позитивный блок организмов этой группы в.
действительности представляет собой гипертрофированный ну-
клеоид гигантской митохондрии (мегамитохондрии), которая де-
лится одновременно с ядром. Мне довелось обнаружить фигуры
деления субпелликулярных митохондрий у инфузории Dileptus
gigas [Studitsky, 1930]. Широко известны картины деления или
равномерного распределения митохондрий (хондриокинеза) при
сперматогенезе у насекомых, паукообразных и моллюсков. Об-
зоры, относящихся к этому процессу светооптических данных,,
представлены в книге Вильсона [1936, 1940], который приводит
ряд вариантов закономерного распределения митохондрий при
делении сперматогоний и сперматоцитов, включая полное попе-
речное деление (сперматоциты жука Blaps, сперматогонии тара-
кана Blatta, сперматоциты моллюска Paludina), деление коль-
цеобразного митохондриального агрегата на два полукольца
« 76 »
ОНТОГЕНЕЗ И ФИЛОГЕНИЯ МЕМБРАННЫХ СТРУКТУР КЛЕТКИ
(сперматоциты скорпиона Centrums.) и некоторые другие. Досто-
верность этих описаний не вызывает сомнений.
В последующие годы равномерное распределение митохонд-
рий, сопровождающееся поперечным делением, было изучено с
помощью фазово-контрастного микрофотографирования и преры-
вистого микрофильмирования на ряде объектов, в частности на
сперматоцитах кузнечика и других видах этой группы, удобных
для витального исследования [Camenzind, Nicklas, 1968]. Микро-
фотографии делящихся митохондрий этих объектов приводятся
в соответствующих монографиях и обзорах [Ries, Gersch, 1953;
де Робертис и др., 1976]. К сожалению, о помощью современной
техники (гистохимия, авторадиография, электронная микроско-
пия) эти процессы обследованы недостаточно. Однако факт ре-
продукции митохондрий посредством поперечного деления при
сперматогенезе у многих животных не вызывает сомнений.
Одно из первых исследований деления митохондрий с помо-
щью электронно-микроскопической техники принадлежит Лаку
[Luck, 1965, 1966], который применил технику мечения мито-
хондрий плесени Neurospora и доказал факт их воспроизводства
путем деления. В дальнейшем картины, интерпретируемые как
деление митохондрий, приводились во многих электронно-микро-
скопических работах. Описаны картины деления митохондрий в
клетках печени голодающих крыс после кормления [Fawcett,
1955], в клетках пищеварительной железы улитки в условиях
возбуждения пластических процессов повреждением панциря
[Abolins-Krogis, 1970], в клетках жирового тела насекомых во
время метаморфоза [Larsen, 1970]. Фрей-Вислинг и Мюлеталер
[1968] полагают применительно к растительной клетке, что диф-
ференцированные митохондрии могут активно делиться с помо-
щью образования внутренней перегородки, перетяжки или форми-
рования почки. Последний процесс ведет к образованию инициа-
льной частицы, которая превращается в промитохондрию и
митохондрию путем отрастания от внутренней мембраны крист
увеличенных размеров. В книге приведены достаточно убедитель-
ные электронные микрофотографии, демонстрирующие деление
митохондрий путем почкбвания и развития перегородок из раз-
личных растительных объектов. В своей монографии о митохонд-
риях Ленинджер [1966] приходит к заключению, что митохонд-
рии образуются путем роста и деления предшествующих мито-
хондрий. К сходному выводу приходят и другие исследователи
[Diers, 1966]. В монографии Рудина и Уилки [Roodyn, Wilkie,
1968], специально посвященной биогенезу митохондрий, авторы
оценивают возможность репродукции митохондрий путем деления
в общем положительно, но в весьма осторожной-форме, считая,
что доказательства этого процесса еще не абсолютно точны (per-
haps not yet absolutely rigorous). Наиболее доказательны, по мне-
нию авторов, данные Лака.
« 77 »
ОНТОГЕНЕЗ И ФИЛОГЕНИЯ КЛЕТКИ
Оценивая состояние вопроса о репродукции митохондрий пу-
тем деления и других близких способов размножения (почкова-
ния, фрагментации), нужно прямо сказать, что возможность этого
процесса безусловно вытекает из всей массы накопившихся дан-
ных, включая весьма демонстративные электронно-микроскопи-
ческие картины. Митохондрии обладают свойством размножаться
путем деления. Нельзя не удивляться тому, что авторы приведен-
ных выше обзоров столь малое внимание уделяют бесспорному
факту деления митохондрий, сопровождающего деление сперма-
тоцитов у некоторых насекомых, паукообразных и моллюсков.
Деление сперматоцитов кузнечика и близких к нему видов давно
стало объектом витальных наблюдений и микрокинематографи-
ческой съемки, выявляющей поведение митохондрий во всех
деталях. Митохондрии бесспорно могут размножаться путем деле-
ния. В этом свойстве с поразительной демонстративностью отра-
жается (рекапитулирует) их бактериальная природа, послужив-
шая поводом для обоснования современной теории симбиогенеза
[Ленинджер, 1966; Roodin, Wilkie, 1968; Nass, 1969; Margulis,
1970; Тахтаджян, 1973]. Однако с неменьшей демонстративно-
стью электронно-микроскопические исследования выявляют еще
одну особенность митохондрий — их связь с другими мембран-
ными структурами клетки, заставляющую предполагать о воз-
можности формирования митохондрий не только путем деления,
но и за счет преобразования других мембранных систем или, при-
нимая во внимание сходную конструкцию органоидных мембран,
за счет других органоидов или органелл клетки.
В самом деле, наличие двойных мембран характеризует, кро-
ме митохондрий, все клеточные органеллы: ядро (комплекс хро-
мосом и ядрышек), эргастосомы, ретикулосомы. В литературе
описаны структурные связи митохондриальных мембран с мем-
бранами всех других клеточных органелл. Вот почему появились
гипотезы о происхождении митохондрий от любого из органоидов
клетки.
ВОЗМОЖНЫ ЛИ ВЗАИМОПРЕВРАЩЕНИЯ
МЕМБРАННЫХ СТРУКТУР МИТОХОНДРИЙ
И ДРУГИХ ОРГАНЕЛЛ ЦИТОПЛАЗМЫ?
Одна из последних работ, посвященных митохондриогенезу,
или, как более принято говорить, биогенезу митохондрий, при-
надлежит немецким авторам Штанг-Фоссу и Штаубезанду
[Stang-Voss, Straubesand, 1970], которые проанализировали всю
литературу, посвященную этой проблеме. По их мнению, эта про-
блема насчитывает, по крайней мере, шесть аспектов разработ-
ки в электронно-микроскопической литературе. Один из старей-
ших аспектов связывает развитие митохондрий со специальными
структурными предшественниками — так называемыми микро-
« 78 »
ОНТОГЕНЕЗ И ФИЛОГЕНИЯ МЕМБРАННЫХ СТРУКТУР КЛЕТКИ
тельцами (microbodies). Впервые генетическую связь митохонд-
рий с микротельцами установили на электронно-микроскопиче-
ских фотографиях Руйе и Бернар [Rouiller, Bernhard, 1956],
которые дали и первое описание этих образований — сфероидаль-
ных телец, по размерам значительно уступающих митохондриям,
с одноконтурной мембраной, электронно-плотным, бесструктур-
ным или мелкозернистым содержимым. Превращение микротелец
в митохондрии, согласно Руйе и Бернару, заключается в развитии
второй мембраны и крист, возникающих в виде впячиваний внут-
ренней мембраны, и разрыхлении (просветлении) матрикса.
В дальнейшем, как известно, было установлено, что микро-
тельца Руйе и Бернара подобны или даже идентичны по структу-
ре системе цитоплазматических частиц, участвующих в окисли-
тельных процессах клетки с помощью локализованного в них
фермента пероксидазы. Эти частички получили название — перок-
сисомы [De Duve, Baudhuin, 1966]. По новейшим электронно-мик-
роскопическим данным пероксисомы имеют вид телец, уступаю-
щих по размерам митохондриям, с одноконтурной мембраной и
гранулярным матриксом, включающим характерное, вытянутое
вдоль оси пероксисомы, электронно-плотное образование, своеоб-
разно упорядоченное, кристаллоидной структуры, называемое не-
которыми авторами нуклеоидом. Гистохимическое обследование
неизменно открывает в этих тельцах пероксидазу. Можно было
бы подумать, что с открытием окислительной функции микроте-
лец-пероксисом вопрос о происхождении митохондрий из перокси-
сом как структур особого функционального класса будет снят.
Однако в таблице, классифицирующей современные аспекты раз-
работки проблемы митохондриогенеза в статье Штанг-Фосса и
Штаубезанда, приводится не менее десяти работ, вышедших пос-
ле исследований Руйе и Бернара и продолжающих развивать их
концепцию. Последняя работа, описывающая развитие митохонд-
рий из микротелец в дрожжевой клетке, культивируемой в ана-
эробных условиях, относится к 1969 г. [Plattner, Schatz, 1969].
Можно указать также на работы, в которых открывается тес-
ная структурная связь пероксисом (микротелец) с цистернами
эргастоплазмы и ретикулоплазмы. В работе Роэлса и сотрудни-
ков [Roels et al., 1970] описаны комплексные конструкции пе-
роксисом с полостями эргастоплазмы, в которые могут перехо-
дить нуклеоиды пероксисом (объект — печень жабы). В печени
мыши описаны еще более любопытные комплексные конструк-
ции — пероксисомы-десмосомы, включающие два микротельца,
связанные с десмосомой. Возможны комплексы митохондрии—
десмосомы и гибридные комплексы митохондрии—десмосомы—
пероксисомы. Таким образом, вопрос об участии микротелец-пе-
роксисом (если это одни и те же образования) в митохондрио-
генезе пока нельзя считать решенным. Резко отрицательный вы-
вод об участии микротелец в биогенезе митохондрий, сделанный
« 79 »
ОНТОГЕНЕЗ И ФИЛОГЕНИЯ КЛЕТКИ
авторами монографии о микротельцах Грубаном и Рехциглом
[1972], в сравнительно-морфологическом аспекте едва ли оправ-
дан. Более дальновидные исследователи [Де Дюв и Бодуин, см.:
Рудин, 1971] усматривают в микротельцах-пероксисомах модель
древнейшей домитохондриальной. органеллы с примитивной окис-
лительной функцией, предшествовавшей сложной конструкции и
энергетической специализации типичных митохондрий. Во вся-
ком случае, разработка проблемы йитохондриогенеза в данном
аспекте, с учетом открытия окислительной функции микротелец-
пероксисом (если это одни и те же образования), ничуть не ме-
нее перспективна, чем поиск структурных предшественников
митохондрий среди других цитоплазматических образований, так-
же участвующих в специфических функциях цитоплазмы. Таких
аспектов разработки проблемы есть еще по крайней мере три.
На первое место, пожалуй, следует поставить концепцию Ро-
бертсона о происхождении митохондрий, или, вернее, митохондри-
альных мембран, как и всех остальных мембранных компонентов
клетки, путем впячиваний и разрастаний цитоплазматической
мембраны. Схема Робертсона, в чрезвычайно ясной и демонстра-
тивной форме раскрывающая этот путь формирования митохонд-
рий и всех остальных мембранных структур клетки (включая
ядро из цитомембраны), получила, как неоднократно отмечалось
выше, довольно широкое распространение. На концепции Роберт-
сона следует специально остановиться, поскольку в ней заклю-
чается единственная альтернатива развиваемой мной теории про-
токлеточного происхождения клеточной организации.
Схема Робертсона в приложении к митохондриогенезу изобра-
жает путь формирования митохондрий либо в виде простого
впячивания цитомембраны с последующим ее отделением и разви-
тием из неизвестного источника внешней митохондриальной мем-
браны, либо в виде врастания цитомембраны плоской двуконтур-
ной лентой, формирующей митохондрию посредством закручива-
ния (рис. 21). В первом случае мы имеем дело с образованием
типа пиносомы, которая превращается в митохондрию, одеваясь
внешней оболочкой и образуя впячивания наподобие крист. Во
втором случае мы видим плоские врастания, напоминающие двой-
ные бета-мембраны почечных клеток, которые превращаются в
митохондрии путем закручивания наподобие мезосом в бактери-
альных клетках.
Если обратиться к данным сравнительной цитологии, то ни
тот ни другой вытекающий из схем Робертсона путь митохонд-
риогенеза не находят подтверждения. За время, истекшее после
обоснования Робертсоном своей схемы, в литературе не появилось
никаких более или мепее достоверных описаний онтогенеза ми-
тохондрий за счет пиносом, одевающихся внешней оболочкой, или
за счет врастаний клеточной оболочки типа бета-мембран. Как
известно, идея о герминативной роли клеточной мембраны воз-
« 80 »
ОНТОГЕНЕЗ И ФИЛОГЕНИЯ МЕМБРАННЫХ СТРУКТУР КЛЕТКИ
Рис. 21. Схема последовательных стадий формирования мембранных кон-
струкций клетки путем впячиваний и разрастаний плазмолеммы
Митохондрии возникают путем вторичных впячиваний и разрастаний первичного
впячивания. ЭМ — элементарная мембрана; М — митохондрия; ЯМ — ядерная мем-
брана; Гр — гранула; Р — рибосомы; Ц— цитоплазма; ЭС — эндоплазматическая
сеть; Вп—впячивание; Я — ядро; К — каналец; ТГ — тельце Гольджи [по Роберт-
сону, 1963)
никла у Робертсона на основании данных по формированию ме-
заксона в нервном волокне [Робертсон, 19633. Действительно,
развитие миелиновой оболочки нервного волокна с помощью ме-
заксона, т. е. врастания цитомембраны внутрь шванновской клет-
ки с последующим закручиванием вокруг аксона, представляет со-
бой яркий пример активной роли цитомембраны в морфогенезе
внутренних мембранных структур клетки. Однако этот специфи-
ческий случай представляет собой пример клеточного морфогене-
за, не имеющий прямых гомологий в морфогенетических процес-
сах, протекающих в других клетках. Единственное описание мито-
хондриогенеза по способу врастания цитомембраны, появившееся
после выступлений Робертсона со своей схемой, относится к
нервному волокну, и, если оно подтвердится, этот пример можно
6 А. Н. Студитский
« 81 »
ОНТОГЕНЕЗ И ФИЛОГЕНИЯ КЛЕТКИ
будет считать специальным случаем, реализованным в нервном
приборе в связи с особым способом ее жизнедеятельности. Как
указывает Де Робертис [см.: Де Робертис и др., 1967], вывод о
происхождении митохондрий за счет впячиваний мембраны мат-
рикса аксоплазмы сделан на основании топографической связи
митохондрий со складками мембраны аксона. Этот вывод Де Ро-
бертис подкрепляет ссылкой на морфогенез мезосомы бактерий.
Таким образом, схема Робертсона в приложении к митохонд-
риогенезу не имеет убедительных фактических подтверждений.
Значительно больше данных в современной литературе накопле-
но о происхождении митохондрий за счет внутренних цитоплаз-
матических мембран, а также за счет ядерной мембраны.
Если обратиться к таблице Штанг-Фосса и Штаубезанда, в ко-
торой сведены литературные данные по морфогенезу митохонд-
рий, то среди работ, выявивших тот или иной способ митохондрио-
генеза, на первом месте оказываются исследования, в которых
обнаружены следы развития митохондрий за счет эндоплаз-
матического ретикулума (11 статей за 1956—1969 гг.). Эти следы
в основном заключаются в картинах континуитета эргастоплаз-
матических и митохондриальных мембран. Такие картины обна-
ружены в дрожжевых клетках [Linnane et al., 1962], в клетках
регенерирующей печени мыши [Bade, 1964], в клетках яичника
млекопитающих [Ruby et al., 1969] и других объектах.
Несколько меньше работ, в которых установлен континуитет
между митохондриальными и ретикулоплазматическими мембра-
нами. Наиболее убедительные данные относятся к связи мито-
хондрий с мембранами диктиосом в клетках коры надпочечника
[Lever, 1956], внутреннего сегмента фоторецептора сетчатки
[Berger, 1964], в сперматидах шелковичного червя [Yasuzumi,
Oura, 1965].
Так же как данные по митохондриогенезу путем деления сви-
детельствуют о глубокой гомологии между митохондриями и бак-
териями, все описанные факты континуитета между митохондри-
альными и другими двойными цитоплазматическими мембранами
указывают на родство между цитоплазматическими органелла-
ми — митохондриями, эргастосомами, ретикулосомами. Три
основных компонента цитоплазматической конструкции — эрга-
стоплазма, митохондриальный аппарат и ретикулоплазма — воз-
никли в филогенезе как продукты специализации единой исход-
ной структурной формы — протоклеточного бактериального орга-
низма. Невозможно исключить того, что на первых этапах
формирования цитоплазматической конструкции структурная
дифференцировка рабочих блоков, специализирующихся на от-
правлении четырех основных функций цитоплазмы, была доста-
точно лабильной для сохранения способности к взаимному
превращению: эргастосом или ретикулосом в митохондрии, мито-
хондрий в эргастосомы или даже в ретикулосомы. В следующей
« 82 »
ОНТОГЕНЕЗ И ФИЛОГЕНИЯ МЕМБРАННЫХ СТРУКТУР КЛЕТКИ
Рис. 22. О единстве внешней митохондриальной мембраны и эргастоплаз-
матических мембран свидетельствует осуществление связей внешней ми-
тохондриальной мембраны с рибосомным компонентом эргастоплазмы
Митохондрия в эргастоплазме гигантской клетки слюнной железы личинки мотыля.
Рибосомы располагаются по внешней поверхности митохондрии, как на эргасто-
плазматической мембране. Электронная микрофотография К. С. Абрамяна
части книги мы увидим, какие широкие трансформационные по-
тенции проявляют органеллы клетки при ее функциональной
специализации.
Вполне возможно, что в некоторых случаях континуитет меж-
ду эргастоплазматическими, ретикулоплазматическими и митохон-
дриальными мембранами выявляет один из путей онтогенеза ми-
тохондрий. Родство между эргастоплазматическими и внешними
митохондриальными мембранами с высокой демонстративностью
проявляется в распределении рибосом на обоих типах мембран,
обнаруживаемом в некоторых объектах (рис. 22). Однако трудно
представить себе, чтобы развитие одной специализированной
структуры в цитоплазме осуществлялось, как правило, за счет
других специализированных структур, в частности митохондрий
за счет эргастосом и ретикулосом. Другое дело — ядро как источ-
ник формирования митохондрий. В предшествующих главах было
приведено немало оснований для того, чтобы признать за ядром
« 83 »
6
ОНТОГЕНЕЗ И ФИЛОГЕНИЯ КЛЕТКИ
функцию герминативного аппарата клетки — в частности, по-
ставщика строительных блоков для формирования эргастосом и
всей эргастоплазматической системы. В настоящее время накоп-
лен некоторый фактический материал в пользу этой гипотезы.
О ЯДЕРНОМ ПРОИСХОЖДЕНИИ МИТОХОНДРИЙ
Уже довольно давно электронными микроскопистами было
подмечено, что при эмбриональном развитии некоторых органов,
например печени цыпленка, в молодых гепатоцитах митохондрии
концентрируются вокруг ядра в отличие от клеток взрослой пе-
чени с более или менее равномерным распределением митохонд-
рий. Подобные же топографические отношения отмечены в клет-
ках печени новорожденной крысы. Связь митохондриальной и
ядерной мембран в некоторых объектах была обнаружена также
Гофманом и Григом [Hoffmann, Grigg, 1958]. Наиболее вырази-
тельные данные об участии ядра в формировании митохондрий
получены на растительных объектах.
В монографии Фрей-Вислинга и Мюлеталера [1968] эти дан-
ные обобщены в разработанной авторами схеме, на которой мито-
хондриогенез и онтогенез пластид включает: отпочковывание ини-
циальной частицы путем выпячивания и отшнуровывания участка
ядерной мембраны с кариоплазмой; превращение инициальной
частицы в промитохондрию, или пропластиду, путем отрастания
крист от внутренней мембраны. Фактическое описание развития
пластид из ядра сделано на яйцеклетке растений [Bell, Miiletha-
ler, 1964]. Ленинджер [1966] оценивает возможность отщепления
митохондрий от ядра вполне положительно.
В настоящее время в связи с накоплением данных о специфи-
ческих особенностях структуры и метаболизма митохондрий,
весьма существенно отличающих митохондрии от ядра, трудно
сказать, насколько реален такой простой путь онтогенеза мито-
хондрий, как отщепление от ядра путем почкования. Общеизвест-
но, что митохондриальные мембраны специфически отли-
чаются от ядерной мембраны по способу участия в энергетиче-
ской функции клетки. Митохондриальная ДНК, как известно, по
структуре близка скорее к бактериальной, нежели к ядерной
ДНК [Sinclair, Stevens, 1966; Wolstenholm, Dawid, 1967; Nass,
1969; Wagner, 1969], и во всяком случае по составу и структуре
существенно отличается от ядерной ДНК [Рудин, 1971].
Доказано, что митохондриальная РНК может синтезироваться
в митохондриях [Gibbs, 1968], так что митохондриальные рибо-
сомы возникают, очевидно, в митохондриях. Таким образом, во-
прос о ядерном происхождении митохондрий не так прост и
имеет, может быть, значительно более сложное решение. Одно из
таких решений, возможно, заключается в формировании Мито-
хондрии в цитоплазме de novo.
« 84 »
ОНТОГЕНЕЗ И ФИЛОГЕНИЯ МЕМБРАННЫХ СТРУКТУР КЛЕТКИ
ФОРМИРОВАНИЕ МИТОХОНДРИЙ ПУТЕМ САМОСБОРКИ
В предшествующем разделе были приведены данные, свиде-
тельствующие о сборке в цитоплазме за счет строительных бло-
ков, поступающих из ядра, важнейшего компонента цитоплаз-
мы — эргастосом. Сходные данные в настоящее время накапли-
ваются и относительно митохондрий.
Ленинджер [1966] высказал мысль, что морфогенез митохонд-
рий может включать механизм сборки за счет строительных бло-
ков, пригодных для конструирования этих органелл. По его мне-
нию, каждая мембранная структура клетки, в том числе и ми-
тохондрии, может служить матрицей для формирования новой
мембраны. Возникающие этим способом строительные компоненты
могут быть использованы клеткой для воспроизводства митохонд-
рий de novo. Эта мысль развита в книге Рудина и Уилки [Воо-
dyn, Wilkie, 1968], которые считают сборку митохондрий из под-
ходящих субъединиц in vitro делом не столь далекого будущего.
Морфологические данные, демонстрирующие самосборку мито-
хондрий в клетке, представили Штанг-Фосс и Штаубезанд
[Stang-Voss, Staubesand, 1970].
Эти данные в развернутой форме относятся к митохондрио-
генезу в сперматидах земляного червя Eisenia foetida. В молодых
сперматидах митохондрии не обнаруживаются. Дифференцировка
сперматид сопровождается формированием митохондрий путем
самосборки — неогенеза (по терминологии авторов). Возникают
две группы митохондрий: шесть в дистальной части (области за-
кладки хвоста) и несколько митохондрий — без определенной лока-
лизации. Сборка осуществляется за счет гранулярного материала
(гранулы 45—50 А в диаметре, образующие вторичные гра-
нулы 250 А в диаметре), располагающегося в облаке бесструк-
турного элктронно-плотного вещества в виде сфероидального
уплотнения. Кристы появляются первыми в виде мелких удли-
ненных пузырьков. На следующей стадии из крист строится ми-
тохондриальная мембрана.
Электронные микрофотографии, которыми документирована
работа Штанг-Фосса и Штаубезанда, позволяют считать допус-
тимым вывод авторов о развитии митохондрий в обследованном
ими объекте путем самосборки (неогенеза). Митохондрии на ран-
ней фазе развития сперматид земляного червя Eisenia foetida
отсутствуют и, действительно, должны построиться заново. Ста-
дии формирования митохондрий, прослеженные авторами, пока-
зывают наиболее вероятный способ их развития — путем сгу-
щения гранулярного вещества (матрикса), появления в нем пу-
зырьков будущих крист и развития из крист митохондриальной
мембраны. Но самой замечательной особенностью открытого ав-
торами феномена является ядерное происхождение исходного ма-
териала, из которого строятся митохондрии.
« 85 »
ОНТОГЕНЕЗ И ФИЛОГЕНИЯ КЛЕТКИ
Зернистость, составляющая основу матрикса будущих мито-
хондрий, появляется сначала в кариоплазме, под ядерной мембра-
ной. Следующий этап: зернистость обнаруживается в тесном кон-
такте с мембраной, которая в области прохождения зернистости
подвергается заметным изменениям, напоминающим везикуляр-
ную трансформацию. Потом зернистость оказывается в цитоплаз-
ме, в облаке уплотнения, где будет происходить сборка мембран-
ных и гранулярных компонентов митохондрии. В дополнение к
наблюдениям над неогенезом митохондрий в цитоплазме сперма-
тид авторы приводят электронные микрофотографии фибробла-
стов из штамма LM, в ядрах которых открываются те же карти-
ны самосборки митохондрий за счет гранулярных и везикулярных
блоков. Зрелые митохондрии в кариоплазме фибробластов обла-
дают типичной структурой без дополнительной оболочки, которая
обычно остается вокруг митохондрий, когда они проникают в
ядро из цитоплазмы через впячивания ядерной мембраны.
Таким образом, возможность ядерного происхождения мито-
хондрий следует считать допустимой. Рабочие блоки митохондри-
ального аппарата могут репродуцироваться, следовательно, не
только за счет размножения делением в цитоплазме, но также и
путем самосборки (или отщепления вместе с частью ядерной мем-
браны, как это наблюдается в клетках растений) из строительных
блоков, возникающих в ядре. Следовательно, и в отношении ми-
тохондрий, несмотря на их выраженную тенденцию к самовос-
производству путем деления или почкования, ядро сохраняет
значение герминативного аппарата. Обращаясь к аналогиям в
гистогенетических процессах, можно вспомнить, что обновление
рабочих частей тканевых систем в одних случаях осуществляется
за счет сохранения дифференцированными клетками способности
к размножению (печень), в других — за счет камбиального ростка
(кровь, эпидермис кожи, эпителий кишечника), а в третьих — за
счет обоих средств (мышечный слой сосудов). Рабочие блоки
цитоплазмы, очевидно, располагают возможностью самовоспроиз-
водства в цитоплазме (путем деления или демонтажа с последую-
щим монтажей). Вместе с тем ядро сохраняет функцию герми-
нативного аппарата для воспроизводства цитоплазматических ра-
бочих приборов — эргастоплазмы и митохондрий.
БИОГЕНЕЗ ПЛАСТИД РАСТИТЕЛЬНЫХ КЛЕТОК
Среди всех клеточных органелл пластиды растительных кле-
ток обладают наиболее демонстративно выраженными признаками
относительно автономной конструкции, способной к развитию, от-
носительно автономному метаболизму (синтезу белка, в том чис-
ле ферментов, обеспечивающих весь цикл фотосинтеза), росту и
размножению.
По современным данным хлоропласт представляет собой
« 86 »
ОНТОГЕНЕЗ И ФИЛОГЕНИЯ МЕМБРАННЫХ СТРУКТУР КЛЕТКИ
структурно обособленную систему, обладающую всеми компонен-
тами бактериальной конструкции — плазмолеммой (мембраной),
матриксом, рибосомным аппаратом и аппаратом ДНК, гомоло-
гичным нуклеоиду бактерий. Фотосинтезирующий аппарат хло-
ропласта состоит из сложной системы мембран, сходных с анало-
гичными мембранами фотосинтезирующих бактерий. Относитель-
ная автономность жизненного цикла хлоропластов выражается
в осуществлении фотосинтеза в бесклеточной среде [Осипова,
1967; Чернов, 1970]. На основании всех известных к настоящему
времени данных об относительной автономности жизненной ак-
тивности хлоропластов в литературе сложилось широко распро-
страненное мнение о симбиотической природе этих органелл
[Taylor, 1970]. Один из самых главных доводов в пользу этого
мнения заключается в бесспорной способности пластид размно-
жаться путем деления.
Картины деления хлоропластов и других пластид описывались
еще с помощью светооптической техники. В настоящее время
деление пластид, и в частности хлоропластов, показано на элект-
ронно-микроскопических картинах [Mitrakos, 1960; Diers, 1965,
1966; Gibor, 1967; Schiff, Epstein, 1968; Wollgiehn, 1969; Ros et
al., 1974; Tourte, 1975 а, б] (рис. 23). Получена кинематографи-
ческая документация деления пластид, в частности у водоросли
Nitella [см.: Gibor, 1967]. Наибольший интерес в эволюционно-
морфологическом плане представляет феномен деления пластид,
сопровождающего деление клетки у одноклеточных организмов
(рис. 23, Б).
Если верна разрабатываемая мной гипотеза эволюционного
формирования клетки в процессе репродукции составивших пер-
вую клетку протоклеточных организмов, то в онтонегенезе наибо-
лее древних одноклеточных организмов может найти отражение
этот филогенетический процесс, хотя бы в редуцированной форме.
Факт деления мегамитохондрий (кинетонуклеуса) трипаносомид
и бодонид одновременно с делением ядра известен. Деление ги-
гантского хлоропласта одновременно с ядром у водоросли СЫа-
midomonas вполне вероятно. Еще более демонстративны процессы
одновременного с ядром деления единственной пластиды и един-
ственной митохондрии у очень мелкой одноклеточной водоросли
Micromonas и других сходных организмов [Manton, 1959, 1961,
1966; Marano, 1976].
Если наблюдения над одновременным делением ядерных (яд-
рышко, хромосомы) и цитоплазматических (митохондрии, пла-
стиды) органелл верны, то в этих примерах мы встречаемся с
чрезвычайно демонстративной формой древнейшего способа раз-
множения клетки — путем одновременного деления составляющих
ее субклеточных (бактериоподобных) компонентов. Клетка возник-
ла как комплекс протоклеток, интегрируемых общим ассимиля-
ционным (пищевым) процессом. Но этот комплекс стал организ-
« 87 »
ОНТОГЕНЕЗ И ФИЛОГЕНИЯ КЛЕТКИ
Рис. 23. Деление хлоропластов
А— лист Splnacia. Электронная микрофотография [по Clower, Juniper, 1968]; Б —
клетка Euglena. Схема по электронной микрофотографии [по Schiff, Epstein, 1968]
мом — клеткой — только в результате первого акта размножения —
превращения организма в систему организмов, положившую
напало виду. Изобретение механизма размножения началось
с обособления центрального комплекса протоклеток в виде ядра,
несущего функцию размножения. Но обособление цитоплазмы не
означало полного устранения от функции размножения. В состав
цитоплазмы вошли протоклетки — потомки бактериальных орга-
низмов, размножающихся путем деления. Вот почему в онтогенезе
древнейших клеток мог сохраняться и сохранился в действитель-
ности первичный способ размножения клетки, при котором наря-
« 88 »
ОНТОГЕНЕЗ И ФИЛОГЕНИЯ МЕМБРАННЫХ СТРУКТУР КЛЕТКИ
ду с делением репродукционного аппарата — ядерных органелл —
и скорее всего под его воздействием подвергались делению и
цитоплазматические компоненты первичного комплекса. Необхо-
димо отметить, что в литературе по цитологии растительной клет-
ки имеется немало данных о развитии пропластид путем отшну-
ровывания от ядерной мембраны.
БИОГЕНЕЗ РЕТИКУЛОПЛАЗМЫ (АППАРАТА ГОЛЬДЖИ)
Вопреки сомнениям, высказанным множеством авторов за дли-
тельный период разработки вопроса о функциях аппарата Гольд-
жи, идея о его сегрегационной роли в клетке, обоснованная впер-
вые Д. Н. Насоновым [Nassonov, 1924], в настоящее время может
считаться выдержавшей испытание на современном техническом
уровне исследования клетки.
Сегрегационная, или отделительная, функция клетки— такая
же неотъемлемая характеристика клеточной организации как ас-
симиляционная, диссимиляционная, моторная и генеративная
функции, без которых жизнь неосуществима. И если в настоящее
время можно считать бесспорной структурную связь ассимиля-
ционной (синтетической) функции с рибосомным (эргастоплаз-
матическим) аппаратом, энергетической (диссимиляционной)
функции с митохондриями, генеративной функции с хромосом-
ным и ядрышковым аппаратами, то роль аппарата Гольджи как
в освобождении клетки от конечных продуктов метаболизма, так
и в аккумуляции секреторных продуктов, подлежащих выведению
из клетки, представляется совершенно очевидной. В клетке просто
нет других структурных компонентов, кроме комплексов Голь-
джи, которые могли бы осуществить сегрегационную функцию.
Характерная упаковка элементарных компонентов комплекса
Гольджи — в виде стопки блюдец — как нельзя более соответст-
вует способу осуществления сегрегационной функции — очевидно,
путем дифференциальной фильтрации, завершающейся накопле-
нием конечного продукта в ампулах и цистернах комплексов
Гольджи. Этот способ функционирования, естественно, должен
быть связан с интенсивным изнашиванием мембранных струк-
тур комплексов Гольджи, особенно в связи с тем, что конечные
продукты метаболизма, в частности метаболизма азота, действуют
разрушительно на протоплазму. Вот почему вопрос о способе
обновления субстрата комплексов Гольджи приобретает весьма
существенное значение.
Слабость разработки этого вопроса в литературе объясняется
прежде всего тем, что мембраны комплексов Гольджи очень часто
проявляют тенденцию к слиянию с другими мембранными систе-
мами клетки, особенно с мембранами так называемого гладкого
эндоплазматического ретикулума, составляя иногда с ним нераз-
рывное целое. Отсюда п распространенное убеждение о развитии
« 89 »
ОНТОГЕНЕЗ И ФИЛОГЕНИЯ КЛЕТКИ
комплексов Гольджи за счет эндоплазматической сети. Однако
убедительных данных по взаимопревращению мембран Гольджи
в мембраны фагосом, пиносом и эндоплазматической сети в лите-
ратуре нет. Крайне заманчиво было бы представить комплексы
Гольджи продуктом деления исходного элемента, имеющего фор-
му одиночной цистерны. Такие данные в литературе весьма не-
многочисленны и не вполне убедительны.
В старой литературе неоднократно описывались картины рав-
номерного распределения вещества Гольджи с помощью диктио-
сом по дочерним клеткам при митотическом делении [см.: Виль-
сон, 1936]. Этот феномен получил название диктиокинеза. Две
формы воспроизведения элементов аппарата Гольджи — путем
деления цистерн и межцистернального вещества, а также путем
обособления комплекса молодых элементов от комплекса старых
описывает на электронно-микроскопических картинах Уэйли
[Whaley, 1966]. Эти данные представляют интерес в том отноше-
Рис. 24. Схема возможных способов
воспроизведения элементов аппара-
та Гольджи
Слева — редупликация комплекса путем
деления цистерн (или пластинок), спра-
ва путем обособления части цистерн
(пластинок) и последующего новообра-
зования цистерн (пластинок) [по Clower,
Juniper, 1968]
нии, что путем обособления
новообразующихся цистерн вы-
является наличие межцистер-
нального вещества (.матрикса
ретикулосом, по нашей термино-
логии) , которое подвергается де-
лению посредством двойной но-
вообразующейся мембраны. Де-
ление телец Гольджи описано в
ооцитах Rana pipiens [R. Ward,
E. Ward, 1968]. Мало дан-
ных и о формировании комплек-
сов Гольджи за счет самосборки
из везикулярных блоков.
Е литературе по электронной
микроскопии растительной клет-
ки имеются попытки показать
закладку комплексов Гольджи
в виде концентрических ламел-
лярных систем, каждый сфе-
роидальный элемент которой в
ходе развития как бы раскрыва-
ется и приобретает характерную
блюдцеобразную форму [см.:
Фрей-Вислинг, Мюлеталер,
1968]. Разработано несколько
схем репродукции телец Гольд-
жи путем деления и новообразо-
вания (рис. 24). Более инте-
ресны данные растительной эле-
ктронной микроскопии, ОТНОСЯ-
fl 90 »
ОНТОГЕНЕЗ И ФИЛОГЕНИЯ МЕМБРАННЫХ СТРУКТУР КЛЕТКИ
щиеся к развитию аппарата Гольджи из ядра [см.: Фрей-Вислинг,
1976]. Впервые, по-видимому, Мур и Мак-Элир [Moore, McAlear,
1963] описали формирование телец Гольджи из ядерной оболочки
в покрове апотеция дискомицета Neobulgaria. Вполне убедитель-
ная картина формирования телец Гольджи за счет внешней карио-
мембраны обнаружена у некоторых видов Xanthophyceae [Massal-
ski, Leedale, 1969] [см.: Фрей-Вислинг, 1976; Студитский,
1979].
В дальнейшем формирование элементов комплекса Гольджи
в непосредственной связи с ядерной мембраной отмечалось не-
которыми авторами и в животной клетке. Наиболее правдопо-
добное описание развития элементов аппарата Гольджи за счет
ядерной мембраны дано в работе Ш.танг-Фосса [Stang-Voss, 1970],
выполненной на том же объекте (сперматида земляного червя),
в котором Штанг-Фосс и Штаубезанд [Stang-Voss, Staubesand,
1970] описали ядерное происхождение митохондрий. Этот объект
в начале дифференцировки лишен как митохондрий, так и эле-
ментов Гольджи. Развитие аппарата Гольджи, прослеженное ав-
тором по стадиям дифференцировки сперматиды, начинается с
образования пузырьков в ядерной мембране, где, очевидно, про-
исходит ее разрастание, и далее переходит в формирование вы-
ростов, сохраняющих связь с ядерной мембраной. Отделяющаяся
от ядерной мембраны первая пластинка комплекса Гольджи рас-
полагается параллельно ядерной поверхности и отодвигается от
ядра следующей отщепляющейся пластинкой, начиная формиро-
вать по периферии характерные пузырьки комплекса Гольджи.
Сходную, но, пожалуй, еще более демонстративную картину фор-
мирования комплекса Гольджи за счет ядерной мембраны обна-
ружила в клетках печени новорожденного крысенка сотрудница
нашей лаборатории М. М. Калашникова.
Резюмируя все, что известно к настоящему времени о морфо-
генезе аппарата Гольджи (ретикулоплазмы, по нашей термино-
логии) , приходится констатировать, что этот вопрос далек от
своего решения. В комплексах Гольджи не удалось обнаружить
достаточно убедительных фигур деления. Разрастания цистерн
Гольджи и особенно характерное отщепление пузырьков по пе-
риферии пластинок в комплексах Гольджи носят явно функцио-
нальный характер и хотя и служат общему увеличению мембран-
ной массы, но едва ли могут быть сопоставлены с размножением.
Так же сомнительны и процессы самосборки комплексов Гольджи
за счет везикулярных или пластинчатых блоков. Вот почему, по-
жалуй, наиболее вероятным представляется вариант развития
элементов ретикулоплазмы за счет ядра, как это представляется
на электронных микрофотографиях Штанг-Фосса, Массальски и
Лидейла [Massalski, Leedale, 1969] и М. М. Калашниковой. Един-
ственное возражение, которое можно привести против этого ва-
рианта, заключается в том, что редкость феномена находится в
« 91 »
ОНТОГЕНЕЗ И ФИЛОГЕНИЯ КЛЕТКИ
явном несоответствии с объемом ретикулоплазмы. Чтобы поддер-
живать число комплексов Гольджи, характерное для каждой
клетки, ядро должно проявлять более высокую герминативную
активность, нежели это удается констатировать на обычных элект-
ронно-микроскопических препаратах. Впрочем, никто еще не за-
нимался подсчетом числа комплексов Гольджи в клетке в связи
с необходимой скоростью их формирования на протяжении жиз-
ненного цикла клетки. С другой стороны, в пользу ядерного про-
исхождения аппарата Гольджи можно привести некоторые кос-
венные соображения.
По нашей схеме эволюционного происхождения клетки ядро
сложилось как генеративный орган — аппарат размножения клет-
ки — и как герминативный орган — механизм пополнения цито-
плазматических органелл. Наряду с ядерным источником форми-
рования цитоплазматические органеллы сохраняют способность
к саморепродукции — путем деления и самосборки, причем уро-
вень этой способности находится в прямой зависимости от гомо-
логической близости к предковым формам. Митохондрии и пласти-
ды, сохранившие наибольшее сходство с бактериями, проявляют
и наиболее развитую способность к саморепродукции в цито-
плазме. Эргастосомы, благодаря наличию рибосом, обладают
высокой способностью к самосборке и репродукции путем разра-
стания. Что же касается ретикулосом, то эти органеллы сохрани-
ли от бактериальной организации только мембраны и матрикс,
свободный от нуклеиновых кислот. Вот почему ретикулосомы
утратили способность к саморепродукции путем самосборки или
деления в цитоплазме. Вероятнее всего, весь аппарат ретикуло-
плазмы возникает путем трансформации ядерных образований —
ядерной мембраны и ядерного матрикса.
Второе косвенное доказательство ядерного происхождения ре-
тикулоплазмы заключается в некоторых признаках функциональ-
ного сходства между ядерной мембраной и мембранами ретику-
лоплазмы. Как перинуклеарное пространство, так и полости
цистерн ретикулоплазмы — это сегрегационные пути, куда посту-
пают конечные продукты метаболизма клетки и продукты, под-
лежащие выведению из клетки. Ядро составляет слишком объе-
мистую часть клетки, чтобы обойтись без сегрегационного аппа-
рата. Наряду с другими функциями ядерная мембрана выполняет
и эту работу [Калашникова, Студитский, 1976]. Вот почему она
может служить источником формирования мембран и цистерн ре-
тикулоплазмы. Во второй части книги этот вопрос освещен более
детально.
« 92 »
ОНТОГЕНЕЗ И ФИЛОГЕНИЯ МЕМБРАННЫХ СТРУКТУР КЛЕТКИ
При разработке проблемы происхождения (онтогенеза) мем-
бранных конструкций клетки можно исходить только из двух
гипотез: предложенной Робертсоном гипотезы о филогенетиче-
ском развитии всех внутриклеточных мембран путем впячива-
ний и разрастаний плазмолеммы бактериоидного предка или вы-
двинутой мной гипотезы филогенетического развития клеточной
структуры путем комплексирования клона бактериоидных прото-
клеток с сохранением контактирующих плазмолемм в виде двой-
ных внутриклеточных мембран, а также везикулярных компо-
нентов клетки. Все промежуточные гипотезы, изображающие раз-
витие одной внутриклеточной мембраны за счет другой, например
цитоплазматических мембран за счет ядерной или ядерной за
•счет цитоплазматических, лишены эволюционно-морфологическо-
го значения, так как не объясняют главного — первичного воз-
никновения внутриклеточных мембран.
Согласно разрабатываемой в этой книге гипотезе, ядро пред-
ставляет собой не только генеративный орган клетки, обеспечи-
вающий с помощью хромосом деление клетки, но и герминатив-
ный орган клетки, участвующий в воспроизводстве не только
хромосом, но и ядрышек и трех основных систем цитоплазма-
тических органелл.
Эргастоплазма представляет собой рабочий блок сложного ри-
босомно-нуклеолярно-мембранного аппарата, онтогенез которого
включает формирование эргастосом путем разрастания и отщеп-
ления от ядра участка ядерной мембраны вместе с ее рибосом-
ным комплексом, разрастание и, возможно, деление эргастосом
в цитоплазме, а также самосборку эргастосом за счет рибосом и
везикулярных компонентов, возникающих из строительных бло-
ков, которые поступают в цитоплазму из ядра.
Митохондрии, сохранившие наибольшее сходство со своими
бактериальными предками по строению и химической природе,
могут размножаться путем деления, но, возможно, обладают так-
же свойством репродукции путем самосборки за счет грануляр-
ного и везикулярного строительных блоков, поставляемых ядром.
Мембранная система аппарата Гольджи, или ретикулоплазмы,
по нашей терминологии, в самой малой степени сохранила свой-
ство саморепродукции в цитоплазме в виду утраты рибосомно-
го аппарата и нуклеиновых кислот. Есть основания полагать,
что комплексы Гольджи возникают в онтогенезе путем отшну-
ровывания от ядерной мембраны.
Онтогенез мембранных систем цитоплазмы убедительно под-
тверждает идею о герминативной функции ядра в развитии ци-
топлазматических органелл.
« 93 »
ОНТОГЕНЕЗ И ФИЛОГЕНИЯ КЛЕТКИ
Глава пятая
ОНТОГЕНЕЗ И ФИЛОГЕНИЯ КЛЕТКИ
КАК ЦЕЛОГО
ОНТОГЕНЕЗ ОДНОКЛЕТОЧНЫХ ОРГАНИЗМОВ
Клетка как автономное целое существует только в виде од-
ноклеточного организма. У высокоорганизованных простейших
онтогенез осуществляется посредством сложных морфогенетиче-
ских процессов, связанных с развитием всех структурных приспо-
соблений, характерных для дефинитивного организма. Особенно
демонстративно онтогенетическое развитие у инфузорий, тело ко-
торых, дифференцированное по проксимодистальной оси, подвер-
гается поперечному делению, после чего передняя (материнская)
особь достраивает задний конец, а задняя (дочерняя) передний
конец тела. Для некоторых паразитических инфузорий (Astomata)
характерно неравномерное деление, связанное с последующими
процессами роста и дифференцировки дочерних особей. Однако
в эволюционно-морфологическом плане онтогенетические процес-
сы у инфузорий не представляют существенного интереса, так
как выражают собой результат далеко зашедшей структурной
специализации одноклеточных организмов. Можно отметить
только, что в выборе путей структурной специализации однокле-
точные организмы, как и клетки многоклеточных организмов, ог-
раничены спецификой организации клетки, отражающей ее фи-
логенетическое прошлое. Мы не располагаем в настоящее время
необходимой информацией, добытой с помощью современных
средств исследования, чтобы судить о том, как сооружается та
или иная конструкция в организме высших простейших, напри-
мер ротовая полость и глотка высших инфузорий. Но, исходя из
эволюционно-морфологической концепции клеточной структуры,
мы вправе предполагать, что филогенетическое прошлое клетки,
ее происхождение из протоклеток должны отражаться в способах
конструирования этих аппаратов [Studitsky, 1976].
Клетка строит свои функциональные конструкции с помощью
протоклеток, или субклеток, так же как многоклеточный орга-
низм строит свои органы из клеток. Если конкретно говорить о
ротовом аппарате инфузорий, то, исходя из субклеточной трак-
товки клеточной организации, следует предполагать, что только
субклеточное строение клетки обеспечило возможность форми-
рования подобной конструкции, которая не могла возникнуть на
предшествующем, протоклеточном, уровне организации живой ма-
терии. У бактерий отсутствует свойство захватывать пищевые
объекты с помощью аппарата внутриклеточного пищеварения.
Свойство клетки формировать фагосомы из впячиваний цито-
мембраны и превращение непостоянных структур, связанных с
« 94 »
ОНТОГЕНЕЗ И ФИЛОГЕНИЯ КЛЕТКИ КАК ЦЕЛОГО
фагоцитозом, в постоянные органы захвата пищевых объектов
типа ротовых аппаратов, обусловлены субклеточной организацией
клетки. Подобно впячиваниям, из которых формируются фагосо-
мы, постоянный ротовой аппарат простейших представляет со-
бой преобразованные пространства между протоклетками —
предковыми организмами, сформировавшими клетку. И все за-
мечательные приспособления, входящие в конструкции ротового
аппарата простейших, могли возникнуть в ходе эволюции только
потому, что клетка сохранила и усовершенствовала свою субкле-
точную организацию.
На той же филогенетической основе могли возникнуть и раз-
виваться такие структурные приспособления одноклеточных орга-
низмов, как полимеризация органелл, например ядер и кинетид
в отряде полимастигид, формирование гамет и агамет у форами-
нифер, томитов у гомокариотных инфузорий [см.: Райков, 1967].
Все эти процессы филогенетически обусловлены тем, что клеточ-
ные органеллы, в частности сложные органеллы — ядра, сохра-
няют предковую способность к репродукции путем деления и
свойство комплексирования. Деление клеточного полиэнергидного
(т. е. включающего несколько ядерных систем) тела на моно-
энергидные системы предопределено его комплексным строением.
С равным основанием процесс слияния гамет у простейших мож-
но трактовать как рекапитуляцию комплексирования предковых
организмов. Не представляет сомнений, что дальнейшая разра-
ботка синбактериогенной теории происхождения клетки приведет к
филогенетическому объяснению многих формообразовательных
процессов в онтогенезе одноклеточных организмов. Что же ка-
сается онтогенеза многоклеточных организмов, то все процессы,
в которых дифференцировка тканей сопровождается комплекси-
рованием и дискомплексированием клеток, получают удовлетво-
рительное и вполне правдоподобное объяснение в развиваемой
нами синбактериогенной (протоклеточной) теории происхождения
клеточной структуры.
К числу этих процессов можно отнести: формирование сим-
пластов, выщепление клеток из симпластов, выщепление орга-
нелл и комплексов органелл из клеток, слияние гамет в поло-
вом процессе. К сожалению, не все эти процессы достаточно об-
следованы с помощью современных методов. Однако накопленные
к настоящему времени фактические данные позволяют составить
некоторое представление об отражении филогенетического прош-
лого клетки в этих процессах.
ФОРМИРОВАНИЕ СИМПЛАСТОВ
ОТРАЖАЕТ ФИЛОГЕНЕТИЧЕСКУЮ ИСТОРИЮ КЛЕТКИ
Симпластами принято называть многоядерные конструкции
без различимых границ между околоядерными цитоплазматиче-
скими территориями. Может быть, уместно предложить им наиме-
« 95 »
ОНТОГЕНЕЗ И ФИЛОГЕНИЯ КЛЕТКИ
нование Поликарповы (поли — много, карион — ядро, грея.), точ-
но характеризующее их конструкцию. У низших многоклеточных
животных эти образования изучены слабо [см.: Заварзин, 1934].
По-видимому, у кишечнополостных, губок и турбеллярий, состав-
ляющих три самых примитивных типа многоклеточных животных,
формирование симпластов, например при воспалительной реак-
ции, возможно, но не представляет выраженной закономерности
[Заварзин, 19536]. Характерный симпластический процесс выра-
ботался у высших многоклеточных — моллюсков, членистоногих
и позвоночных. В основном он осуществляется в развитии ги-
гантских клеток инородных тел и поперечнополосатых мышечных
волокон. Для позвоночных характерно также формирование спе-
цифических многоядерных клеток, осуществляющих литический
процесс при остеогенезе,— остеокластов. Кроме того, формирова-
ние многоядерных и гигантоядерных клеток составляет один из
специфических признаков малигнизации.
Гигантские клетки инородных тел представляют собой продукт
трансформации макрофагов, осуществляющих реакцию асептиче-
ского воспаления. Чужеродное тело вызывает скопление клеток
макрофагического ряда: лимфоцитов и моноцитов крови и гистио-
цитов соединительной ткани. По известной схеме Максимова
[1918], любая из этих клеток может превратиться в амебовид-
ную, активно подвижную, склонную к фагоцитозу, клетку, назы-
ваемую макрофагом. Комплекс макрофагов, скопившихся вокруг
чужеродного тела, превращается в гигантскую клетку чужерод-
ных тел.
В эволюционно-морфологическом плане формирование гигант-
ской клетки инородных тел можно рассматривать как рекапиту-
ляцию филогенетического процесса формирования первичного
многоклеточного организма. У нас нет никаких других представ-
лений о причинах комплексирования одноклеточных предковых
организмов в виде многоклеточной или многоядерной системы,
кроме гипотезы о пищевом объединении клона одноклеточных
организмов в комплексный многоклеточный (или многоядерный)
организм. Вокруг пищевого объекта возник клон одноклеточных
организмов. Увеличение объема дало первичному многоклеточному
(или многоядерному) организму преимущество над однокле-
точными в освоении пищевого объекта, поглощаемого массой мно-
гоклеточного (или многоядерного) организма. Отсюда закрепле-
ние наследственностью с помощью отбора этого полезного преоб-
разования конструкции живой материи. Из клона одноклеточных
организмов возникла многоклеточная (или многоядерная) живая
система. Однако механизм превращения одноклеточной (одно-
ядерной) конструкции в многоклеточную (многоядерную) не был
изобретен клеткой в процессе трансформации в многоклеточную
систему. В конструкции клетки сохранились черты, обеспечившие
эту трансформацию.
« 96 »
ОНТОГЕНЕЗ И ФИЛОГЕНИЯ КЛЕТКИ КАК ЦЕЛОГО
Клетка возникла как продукт комплексирования и интеграции
бактериоидных предковых организмов. В клеточной конструкции
сохранился непосредственный след протоклеточного происхожде-
ния: двойные мембраны, разделяющие клетку на субклеточные
территории, часть которых представлена типичными потомка-
ми бактериоидных предков — ядром и митохондриями. Двой-
ные мембраны отделяют одну клетку от другой во всех более или
менее плотных клеточных комплексах. Двойная мембрана пред-
ставляет собой типичное разделительное устройство в клеточных
комплексах, совершенно подобное внутриклеточным разделитель-
ным устройствам,— двойным мембранам клеточных органелл. Вме-
сте с тем межклеточные двойные мембраны отражают в своем
устройстве след первичных объединений бактериоидных предко-
вых организмов, клоны которых дали начало первичным клеточ-
ным организмам.
В самом деле, примыкающие друг к другу периферические
зоны соседних клеток представляют собой собственно сферы рас-
положения периферических субклеточных компонентов, утратив-
ших значительную часть разделительных устройств — внутрикле-
точных симпластов, или, вернее, симпротопластов. Скорее все-
го,—это эргастосомы, утратившие рибосомные комплексы на своей
периферической стенке, составляющей в клетке общую цитомем-
брану. Таким образом, двойные межклеточные мембраны — это по
существу межэргастосомные мембраны, гомологичные двойным
мембранам эргастоплазмы. Различие здесь заключается в том, что
двойные мембраны эргастоплазмы не только разделяют эргасто-
плазму на эргастосомы, но благодаря способности к распаду на
отдельные пузырьки вызывают слияние эргастоплазмы в единую
систему. Гомологичный процесс осуществляется при трансформа-
ции клона макрофагов в гигантскую клетку инородных тел.
Объединение макрофагов вокруг инородного тела всегда со-
провождается тесным их сближением с образованием двойных
межклеточных мембран. Второй этап развития гигантских клеток
заключается в везикулярной трансформации, или везикуляции,
двойных межклеточных мембран. Разделительные межклеточные
устройства превращаются в скопления пузырьков, которые в
дальнейшем подвергаются рассасыванию или демонтажу. В ре-
зультате возникает единая многоядерная конструкция — гигант-
ская клетка инородных тел, также принадлежащая по предлагае-
мой мной терминологии к классу поликарионов.
Сходный способ формирования симпластов используется при
развитии мышечных волокон как при эмбриональном гистогенезе,
так и при регенерационном процессе, изученном в нашей лабо-
ратории. Объединение миобластов в симпласт мышечной трубоч-
ки осуществляется в те же три фазы, которые характеризуют
развитие клеток инородных тел [Shimada, 1971]. Сначала отме-
чается фаза комплексирования миобластов посредством двойных
7 А. Н. Студитский « 97 »
ОНТОГЕНЕЗ И ФИЛОГЕНИЯ КЛЕТКИ
разделительных межклеточных мембран1. На протяжении второй
фазы происходит везикуляция двойных разделительных мембран.
Третья фаза заключается в рассасывании везикулов. Не представ-
ляет сомнений, что в развитии симпластов имеет место рекапи-
туляция древнего способа комплексирования протоклеточных
предков клетки в клеточную конструкцию. Возникает комплекс-
ная надклеточная конструкция, связанная с решением специфи-
ческих для многоклеточного организма функциональных задач.
Однако в образовании симпластов можно видеть не только река-
питуляцию комплексирования бактериоидных предков клетки, по-
средством которого возникла клеточная конструкция. В процессе
формирования симпластов можно видеть также и отражение не-
которых закономерностей самого процесса конструирования
клетки.
Факты, относящиеся к сравнительной морфологии и онтоге-
нии клетки, показали нам, что субклеточная организация, т. е.
разделение клетки на территории, обособленные друг от друга
с помощью двойных мембран, как правило, выявляется только
путем эволюционно-морфологического анализа. Фактически обо-
соблены в клетке с помощью двойных мембран только ядро и
митохондрии, а также пластиды растительных клеток. Ретикуло-
плазма и эргастоплазма составляют открытые системы, не обо-
собленные или не полностью обособленные друг от друга. Пе-
риферическая цитоплазма вообще бедна двойными мембранами,
которые заменяются здесь везикулярными структурами (пузырь-
ками пиноцитоза и фагоцитоза). Однако данные по симпласти-
ческой трансформации клеток позволяют представить себе весь
путь превращения комплекса протоклеток в клетку.
Очевидно, в этом процессе только три функциональных ком-
понента сохранили обособленность от остальных компонентов с
помощью двойных мембран: хромосомы и ядрышко, отделенные
общей двойной мембраной от цитоплазмы, и митохондрии (а так-
же пластиды растительных клеток), отделенные двойной мембра-
ной от эргастоплазмы. Что же касается эргастосом и ретикуло-
сом, то для конструкции клетки, очевидно, было более выгод-
ным придать им лабильные разделительные устройства, имеющие
вид цистерн-везикулов, проявляющих тенденцию к везику-
лярной трансформации. Этот процесс — везикулярная трансфор-
мация в комплексах Гольджи — приобрел специфическое функ-
циональное значение: формированием везикулов по периферии
пластинок Гольджи (ретикулосом) завершается процесс сегрега-
ции материала, подлежащего выведению из клетки. Для эргасто-
плазмы также характерна постоянная везикуляция разделитель-
ных двойных мембран, которая, очевидно, может завершаться
полным рассасыванием (демонтажем) мембранных компонентов,
эргастоплазмы, подобно тому как это происходит с двойными
межклеточными мембранами при формировании симпластов. Та-
« 98 »
ОНТОГЕНЕЗ И ФИЛОГЕНИЯ КЛЕТКИ КАК ЦЕЛОГО
ким образом, анализируя динамику изменений мембранных си-
стем при формировании симпластов, можно сделать вывод, что
процесс везикуляции и демонтажа двойных мембран, очевидно,
сопровождал и конструирование клетки, в результате чего только
часть протоклеточных компонентов сохранила в клетке отчетливо
обособленную форму, в то время как главные цитоплазматиче-
ские конструкции — эргастоплазма и ретикулоплазма — приобре-
ли симпротоплазматическое строение.
ВЫЩЕПЛЕНИЕ КЛЕТОК ИЗ СИМПЛАСТОВ
И ФИЛОГЕНЕТИЧЕСКОЕ ЗНАЧЕНИЕ- ЭТОГО ПРОЦЕССА
Выщепление клеток из симпластов представляет большой эво-
люционно-морфологический интерес, поскольку в этом процессе
опять получает отражение динамика филогенетического развития
клетки.
Клетка возникла исторически в виде комплекса предклеточ-
ных бактериоидных организмов. Выше было сказано, что значи-
тельная часть субклеточных компонентов клетки утратила струк-
турную обособленность в результате везикулярной трансформа-
ции разделительных двойных мембран. Однако клетка сохранила
тенденцию и к противоположно направленному процессу — мем-
бранной трансформации везикулярных образований. В онтогенезе
клетки из скоплений везикулов могут формироваться цистерны
эргастоплазмы, разделяющие друг от друга эргастосомы, а также
цистерны ретикулоплазмы, отделяющие друг от друга ретикуло-
сомы. Мембранной трансформации могут подвергаться везикулы,
из которых возникают мембранные структуры митохондрий в про-
цессе самосборки, описанном в главе об онтогенезе митохондрий.
Еще более демонстративна мембранная трансформация везикулов
(пузырьков эргастоплазмы и ядерной мембраны) в телофазе ми-
тотического деления ядра.
В этом процессе клетка чрезвычайно эффективно использует
механизм мембранной трансформации везикулов для создания
центральной внутриклеточной мембраны, отделяющей ядерную
часть клетки от цитоплазматической. Ядро развивается в телофа-
зе как комплекс ортанелл, приобретающий весьма значительную
структурную автономность в клетке благодаря наличию двойной
мембраны. Ядро проявляет свою структурную автономность в
виде широко известных изменений формы, включающих образо-
вание впячиваний, выпячиваний, выростов, а также активной
подвижности в цитоплазме. Известно, что в спмпластических
структурах, например в мышечных трубочках, возникающих при
развитии мышечной ткани, ядра проявляют способность к интен-
сивному ротационному и линейному движению, которое хорошо
документируется посредством цейтрафферной микрокиносъемки.
Активная подвижность, сопряженная с изменениями формы, заре-
« 99 »
7*
ОНТОГЕНЕЗ И ФИЛОГЕНИЯ КЛЕТКИ
гистрпрована в многочисленных микрокинофильмах митохондрий
клеток в культурах тканей. Таким образом, обособление посред-
ством двойных мембран обусловливает высокую структурную ав-
тономность клеточных компонентов, хотя и не приводит к отде-
лению обособленных компонентов от клетки. Специальные случаи
такого рода будут рассмотрены ниже.
Обобщая данные, относящиеся к мембранной трансформации
везикулярных структур клетки, можно сказать, что клетка распо-
лагает механизмом обособления и даже отделения своих частей
в виде относительно автономных образований, хотя и не исполь-
зует этот механизм в огромном большинстве клеточных онтоге-
незов. Однако этот механизм включается во всех случаях, когда
из спмпластической системы выделяются клетки.
Выщепление клеток из симпластов представляет собой демон-
стративный пример действия механизма мембранной трансформа-
ции везикулярных систем клетки. Формирование клеток из ги-
гантских симпластов инородных тел недостаточно изучено с по-
мощью современных методов. Значительно лучше дело обстоит с
обследованием процессов выщепления миобластов из симпла-
стов — мышечных волокон.
В настоящее время большое внимание привлекает формиро-
вание так называемых клеток-сателлитов, за счет которых, как
полагают, происходит физиологическая и репаративная регенера-
ция мышечной ткани [Mauro, 1961; Maslow, 1969; Church, 1970;
Regeneration of striated muscle..., 1970].
В нашей лаборатории выяснено, что выщепление клеток-сател-
литов из мышечных волокон осуществляется путем появления в
саркоплазме мелких везикулов, которые отделяют часть сарко-
плазмы с ядром, занимающим субсарколеммальное положение, от
всей толщи мышечного волокна. Затем везикулы подвергаются
мембранной трансформации, которая приводит к обособлению са-
теллита от мышечного волокна посредством двойной мембраны
(рис. 25) [Елякова, 1972].
Многие исследователи склонны считать клетки-сателлиты мы-
шечных волокон за особые генеративные клетки, сохраняющие
свойство камбиальности в составе мышечного волокна. Это пред-
ставление трудно согласовать с фактом формирования мио-
бластов — генеративных клеток, обеспечивающих репаративную
регенерацию мышц. Миобласты возникают в любом участке по-
врежденного мышечного волокна, по-видимому, из любого жизне-
способного ядра и окружающего саркоплазмы. В нашей лабора-
тории накоплен большой фактический материал по электронной
микроскопии этого процесса. Выщепление миобластов в повреж-
денном мышечном волокне, в частности при регенерации мышц
за счет трансплантированной мышечной ткани, происходит путем
формирования везикулярной стенки, подвергающейся мембранной
трансформации [см.: Regeneration of Striated muscle..., 1970].
« 100 »
ОНТОГЕНЕЗ И ФИЛОГЕНИЯ КЛЕТКИ КАК ЦЕЛОГО
Рис. 25. Выщепление кзеы (сателлита) из мышечного волокна путем
мембранной трансформации везикулярного разделительного устройства
А— регенерирующая мышца ирисы (завершение формирования влетки-сателлита);
Б — денервированная мышца крысы /дифференцировка клетки-сателлита). Электрон-
ные микрофотографии 1'. В. Е.тяковой
101 >>
ОНТОГЕНЕЗ И ФИЛОГЕНИЯ КЛЕТКИ
Наши данные совпадают с некоторыми литературными [Нау, 1970;
Reznik, 1970], хотя и противоречат более распространенной точке
зрения на сателлиты как на специфические камбиальные («ство-
ловые») элементы мышечной ткани [Bischoff, 1970; Ishikawa,
1970; Muir, 1970].
Выщепление клеток из симпластов, таким образом, действи-
тельно, обеспечено механизмом мембранной трансформации ве-
зикулярных устройств, возникшим в качестве одного из способов
структурной дифференцировки клетки в ее филогенетическом раз-
витии. Этот же механизм действует и в процессах отделения от
клетки комплексов ее органелл в случаях специфической диф-
ференцировки.
й ВЫЩЕПЛЕНИЕ ОРГАНЕЛЛ И ИХ КОМПОНЕНТОВ ИЗ КЛЕТКИ
: И ФИЛОГЕНЕТИЧЕСКОЕ ЗНАЧЕНИЕ ЭТОГО ПРОЦЕССА
Выщепление органелл из клетки, вероятно, не представляет
большой редкости. Более того, если принимать во внимание фи-
логенез клеточной организации, многие факты, которым ранее
не придавалось значения, будут привлекать внимание как формы
диссоциации клетки на субклеточные элементы — органеллы и
комплексы органелл. Вероятно, в этом отношении представит
большой интерес обследование таких процессов, как «взрывание»
периферической цитоплазмы митотически делящихся клеток с вы-
бросом мельчайших частиц цитоплазмы в межклеточную среду;
отпочковывание частиц цитоплазмы от клеток, часто наблюдае-
мое в культурах тканей вне организма; наконец, широко извест-
ное явление отбрасывания закругленных концов отростков ги-
стиоцитов — так называемый клазматоз, от которого произошло
одно из названий гистиоцитов — клазматоциты, а также ряд дру-
гих сходных явлений. Эти процессы пока слабо изучены с по-
мощью современной техники, хотя не представляет сомнений, что
здесь действует универсальный механизм везикуляции цитоплаз-
мы и мембранной трансформации везикулов. Более основательно
обследованы и могут служить примерами диссоциации клетки на
органеллы или комплексы органелл два явления, относящиеся к
онтогенезу кровяных клеток млекопитающих: экструзия ядра из
клеточного тела в онтогенезе эритроцитов и выщепление кровя-
ных пластинок в онтогенезе мегакариоцитов.
Феномен экструзии, или выталкивания, ядра, сопровождаю-
щий формирование эритроцита млекопитающих, широко известен,
и это обстоятельство, по-видимому, составляет главную причину
его слабой изученности. В процессе освобождения клетки от ос-
новного компонента клеточной организации — ядра — нельзя не
видеть глубочайшего противоречия с основным тезисом клеточ-
ной теории — о клеточном строении организмов. Выталкивая ядро,
клетка лишается своей главной структурной характеристики — ду-
« 102 »
ОНТОГЕНЕЗ И ФИЛОГЕНИЯ) КЛЕТКИ КАК ЦЕЛОГО
ализма строения и, таким образом, перестает быть клеткой в
точном значении этого термина. Тем не менее, утратив ядро,
бывшая клетка продолжает существовать в новой форме струк-
турной организации, сначала в виде ректикулоцита, сохраняю-
щего часть компонентов клеточной организации (митохондрий и
цистерн эргастоплазмы, а также свободных рибосом и их комп-
лексов), затем в виде эритроцита, в котором не сохраняется,
собственно, ни одной черты клеточной организации, кроме мат-
рикса и плазмолеммы. Можно было бы сопоставить онтогенез
эритроцита с процессами естественной смерти клеток, которые
также сопровождаются деградацией ядер, как, например, процесс
ороговения клеток эпидермиса. Однако роговые чешуйки эпидер-
миса, утратившие ядра,— это действительно мертвые клетки, не-
способные даже к минимальному метаболизму. Что же касается
эритроцитов млекопитающих, то их жизнедеятельность включает
не только метаболические, но и пластические процессы, харак-
теризующие высокий уровень жизненной активности.
Известно, что эритроцит млекопитающих наряду с функцией
переноса кислорода осуществляет собственную энергетическую
функцию за счет кислорода крови [Коржуев, 1964]. Изменение
и восстановление формы при продвижении по капиллярам свиде-
тельствуют о наличии механизмов, обеспечивающих постоянное
сохранение оптимальной конфигурации эритроцита. Не вызывает
сомнений, что более чем за 120-дневный срок жизни эритроцита
его оболочка и строма, подвергающиеся почти беспрерывному ме-
ханическому давлению при продвижении по узким капиллярам,
должны подвергаться самообновлению. К сожалению, синтетиче-
ские процессы в зрелых эритроцитах изучены недостаточно с по-
мощью современных методов. Мало понятной остается и вся фи-
зиология эритроцита как совершенно своеобразной формы органи-
зации живой материи. Тем не менее длительное существование и
активная жизнедеятельность клетки, утратившей почти все свои
структурные характеристики, составляют бесспорный факт, тре-
бующий специального анализа. В мировой литературе не пред-
принималось попыток дать какое-либо правдоподобное объясне-
ние этому факту, если не считать самых тривиальных суждений,
сводящихся к тому, что эритроцит представляет собой определен-
ное структурное приспособление к переносу кислорода, связанное
с лишением ядра и клеточных органоидов и обрекающее поэтому
эритроцит на утрату способности к размножению и гибель. Меж-
ду тем в свете гипотезы о протоклеточной организации клетки
факт онтогенеза эритроцита получает логичное и вполне правдо-
подобное объяснение.
Электронная микроскопия позволила установить, что экструзия
ядра из эритробласта, как это было показано и с помощью свето-
оптической техники, сопровождается распадом на отдельности —
хроматиновые тела. В следующей части книги показано, какой
« ЮЗ л
ОНТОГЕНЕЗ И ФИЛОГЕНИЯ КЛЕТКИ
высокой двигательной активностью обладают хроматиновые ком-
поненты клетки при осуществлении строительной, генеративной,
секреторной и других функций. Принято считать, что эритробласт
освобождается от глыбок распавшегося ядра, выталкивая их сквозь
оболочку, хотя механизм выталкивания и особенно происхожде-
ние этого механизма остаются совершенно неясными. Если же
иметь в виду способность к самостоятельной активной подвиж-
ности хроматиновых тел, обусловленную их бактериоидным про-
исхождением, нетрудно понять, что в экструзии ядерного материа-
ла из эритробласта проявляется способность клетки к диссоциации
на субклеточные компоненты, благодаря их активной подвижно-
сти.
Еще более демонстративна активная подвижность цитоплазма-
тических органелл, выходящих из эритробласта в составе цито-
плазматических почек,— будем называть их также клазмосомами
(рис. 26). Выходом хроматиновых тел и цитоплазматических
органелл из эритробласта завершается первый этап его превра-
щения в эритроцит. Эритробласт распадается на ядерную и цито-
плазматическую части. Ядерная часть — комплекс хроматиновых
тел — подлежит последующей реутилизации путем поглощения и
переработки макрофагами. Цитоплазматическая часть — тело
ретикулоцита — включает, как показали электронно-микроскопи-
ческие исследования, митохондрии и эргастоплазматические ци-
стерны и мембраны с рибосомами, а также свободные рибосомы.
С позиций протоклеточной теорид ретикулоцит — это комплекс
субклеточных частиц, органелл (в основном митохондрий и эрга-
стосом) в разных фазах агрегации. Поскольку синтез гемоглобина
в ретикулоците продолжается, составляя главную его функцию,
можно считать эту форму агрегатом эргастосом, включающим так-
же энергетический компонент, необходимый для осуществления
синтеза (несколько митохондрий) (рис. 27). Превращение ретику-
лоцита в зрелый эритроцит сопровождается полным демонтажем
и, вероятно, ассимиляцией материала рибосом, эргастоплазма-
тических мембран и митохондрий. Эритроцит приобретает дефи-
нитивную форму и внутреннюю- структуру. Электронная микро-
скопия не прибавила почти ничего нового к данным о строении
эритроцита, добытым с помощью светооптической техники, если
не считать отчетливо выявляемую на электронных микрофотогра-
фиях цитомембрану. Строма эритроцита, скрытая плотно упако-
ванной зернистостью гемоглобина, и цитомембрана составляют
всю структуру зрелого эритроцита.
Совершенно очевидно, что в классической клеточной теории
не могло возникнуть правдоподобного объяснения факта утраты
клеточного строения одним из активнейших элементов крови.
Зрелый эритроцит — не клетка, а особая, своеобразная форма
организации одного из структурных компонентов крови. Эта
форма возникает путем двухступенчатой дезагрегации клетки, из
« 104 »
ОНТОГЕНЕЗ И ФИЛОГЕНИЯ КЛЕТКИ КАК ЦЕЛОГО
Рис. 26. Распад ядра (утрата мембраны и обособление хроматиновых от-
дельностей.) и отделение цитоплазматических почек («клазмосом»), содер-
жащих органеллы, при трансформации эритробласта в эритроцит
Кроветворение в печени новорожденного крысенка. Я— ядро; М— митохондрии;
П—нолиеомы в склазмоеомах». Электронная микрофотография М. М. Калаш-
никовой
« 105 »
ОНТОГЕНЕЗ И ФИЛОГЕНИЯ КЛЕТКИ
Рис. 27. Завершающая фаза формирования ретикулоцита
После экструзии ядра и основной массы цитоплазматических органелл (видны две
митохондрии, по-видимому, в состоянии рассасывания) ретикулоцит (Р) приобре-
тает структуру протоклетки, включающую три компонента: плазмолемму, матрикс
и рибосомный комплекс. Объект тот же, что на рис. 26. Электронная микрофотогра-
фия М. М. Калашниковой, X 22 000
« 106 »
ОНТОГЕНЕЗ И ФИЛОГЕНИЯ КЛЕТКИ КАК ЦЕЛОГО
состава которой сначала активно выходят хроматиновые субкле-
точные компоненты, а затем демонтируются цитоплазматические
субклеточные компоненты. Что же остается в результате процес-
сов дезагрегации на месте эритробласта? Остается живая система,
включающая: цитомембрану, или, вернее, плазмолемму, посколь-
ку цитоплазма после утраты ядра уже не является цитоплазмой;
цитоплазму, или, вернее, матрикс, поскольку, действительно, пос-
ле утраты ядра' термин цитоплазма лишается своего значения;
специфический белок гемоглобин, составляющий основную массу
эритроцита. По этим признакам эритроцит, конечно, более соот-
ветствует определению протоклетки, нежели клетки в классиче-
ском понимании данного термина. Эритроцит — не клетка, а про-
токлетка, прямой гомолог бактериоидного предка субклеточных
компонентов, из которых строится клетка, только лишенный нук-
леоида и рибосомного комплекса.
В онтогенезе эритроцита можно отметить момент, когда его
конструкция еще более близка к протоклеточной структуре, чем
дефинитивное состояние. Это — одна из фаз развития ретикуло-
цита, когда в его матриксе преобладают рибосомы. Нетрудно по-
нять, что в этом состоянии ретикулоциту не хватает только ну-
клеоида, чтобы приобрести полное подобие бактериоидному предку.
Не исключено, что иногда ретикулоциты сохраняют некоторое ко-
личество хроматина, имитирующее (или рекапитулирующее)
нуклеоид типичной протоклетки. Однако независимо от степени
сходства с бактериоидным предком имеется достаточно оснований
рассматривать ретикулоцит как гомолог протоклетки, а эритро-
цит — как упрощенную модель протоклеточной организации.
К этим основаниям относятся структурные особенности ретику-
лоцита (наличие плазмолеммы, матрикса и рибосомного аппа-
рата, синтезирующего гемоглобин) и эритроцита (наличие плазмо-
леммы, матрикса и белкового содержимого), развитие ретикуло-
цита путем дезагрегации структурных субклеточных компонентов
и функциональная характеристика ретикулоцита как продуцента
специфического белка (гемоглобина). Нас не должны смущать
сравнительно крупные размеры эритроцитов, как правило, близ-
кие к размерам клеток. Во-первых, гигантизм свойствен органел-
лам и в составе клеток. Достаточно вспомнить гигантские мито-
хондрии трипаносом, простирающиеся вдоль всей длины тела
этих протистов, или хлоропласты растений, достигающие разме-
ров ядра. Во-вторых, L-формы бактерий, как известно
[см.: Пешков, 1966], могут достигать размеров эритроцита. Во
всяком случае, в сравнительно-морфологическом плане ретикуло-
цит гораздо ближе к бактериоидной, нежели к клеточной конст-
рукции.
« 107 »
ОНТОГЕНЕЗ И ФИЛОГЕНИЯ КЛЕТКИ
ВЫЩЕПЛЕНИЕ КРОВЯНЫХ ПЛАСТИНОК
ИЗ МЕГАКАРИОЦИТОВ
Дезагрегация гигантской кроветворной клетки — мегакариоци-
та — на субклеточные компоненты еще более демонстративна.
Развитие кровяных пластинок путем своеобразного клазматоза
мегакариоцитов было обнаружено и описано еще с помощью све-
тооптической техники. Электронная микроскопия' еще на рубеже
50—60-х годов позволила уточнить представления об этом про-
цессе [см.: Поликар, Бо, 1962]. В настоящее время появилось
немало электронно-микроскопических описаний онтогенеза кро-
вяных пластинок [Behnke, 1969]. В нашей лаборатории также
накоплен довольно большой материал, относящийся к этому про-
цессу.
Отщеплению кровяных пластинок предшествует везикуляция,
посредством которой в цитоплазме мегакариоцитов обособляются
территории, подлежащие отделению. В их состав входят митохон-
дрии и эргастоплазматические пузырьки, или, в нашей трактовке,
эргастосомы, расположенные между цистернами эргастоплазмы
(рис. 28, А). Обособление кровяных пластинок осуществляется
путем мембранной трансформации везикулярных систем. Кро-
вяные пластинки освобождаются от связи с мегакариоцитами по-
средством расхождения двойных разделительных мембран (рис.
28, Б).
Кровяные пластинки включают, собственно, те же субклеточ-
ные структуры, что и ретикулоциты, т. е. митохондрии и рибо-
сомальные эргастоплазматические системы. В настоящее время
имеются литературные данные по электронной микроскопии кро-
вяных пластинок в сгустке свертывающейся крови, демонстрирую-
щие их участие в формировании структур кровяного сгустка
[Jensen, Kilmann, 1968]. Не представляет сомнений, что кровяные
пластинки — это весьма активные структурные компоненты кро-
ви, проявляющие высокую подвижность, способность к изменению-
формы и ярко выраженную функцию организации кровяного сгу-
стка. Вместе с тем это, конечно, не клетки и не просто структур-
ные части клетки, утратившие связь с породившей их клеткой.
Это, несомненно, одна из специальных форм структурной орга-
низации живой материи, отличающаяся от клетки отсутствием:
ядра и, следовательно, деления на ядро и цитоплазму, но обла-
дающая, подобно клетке, относительной автономностью в много-
клеточном организме, хотя и не способная в отличие от клетки:
к размножению путем деления. Что же такое кровяная пластин-
ка, какова ее природа в эволюционно-морфологическом освеще-
нии?
Сравнительно-морфологический анализ без особых затрудне-
ний позволяет установить, что кровяная пластинка — это агрегат-
субклеточных компонентов (органелл) клетки, обладающий спо-
« 108 »
ОНТОГЕНЕЗ И ФИЛОГЕНИЯ КЛЕТКИ КАК ЦЕЛОГО
собностью к относительно автономному существованию в составе
.крови. Это комплекс эргастосом и митохондрий, ведущий свобод-
но подвижную жизнь и проявляющий, очевидно, синтетическую
активность, обеспеченную энергетическим блоком. Кровяная пла-
стинка — это, конечно, не клетка. Однако в отличие от эритроци-
та это и не протоклетка, а комплекс протоклеток, агрегат субкле-
точных компонентов клетки. Нет необходимости углублять этот
анализ, тем более что многие детали конструкции кровяных пла-
стинок еще недостаточно ясны. Однако необходимо подчеркнуть
главное, представляющее наибольший эволюционно-морфологи-
ческий интерес.
Кровяная пластинка — не клетка, так как в ней отсутствует
ядро и, следовательно, разделение на ядерную и цитоплазмати-
ческую части. Это — комплекс субклеточных цитоплазматических
компонентов, обособившийся из клетки. Между тем в своей кон-
струкции этот комплекс имитирует клетку, разделившись на цент-
ральный блок, содержащий митохондрии и эргастоплазматические
мембраны с рибосомами (хромомер), и периферический блок, со-
стоящий из матрикса без митохондрий, мембран и рибосом (гиа-
ломер). Вот почему в онтогенезе кровяных пластинок следует
видеть весьма своеобразную рекапитуляцию филогенетического
процесса клеткообразования путем комплексирования протокле-
точных систем. Развитие кровяных пластинок — это имитация
клеткообразования за счет специализированных субклеточных
компонентов (митохондрий и эргастосом). ведущая к формирова-
нию клеткоподобных блоков, лишенных, однако, многих свойств
ядросодержащих клеток, и в первую очередь способности к раз-
множению путем деления.
ФЕНОМЕН ГЕТЕРОКАРИОНОВ
И ЕГО ЭВОЛЮЦИОННО-МОРФОЛОГИЧЕСКОЕ ЗНАЧЕНИЕ
В 1966 г. Гаррису [Harris et al., 1966; Harris, 1968] удалось
экспериментально вызвать принципиально новый феномен, за-
ключающийся в слиянии клеток, выделенных из разных видов
животных, в единую многоядерную систему, содержащую ядра
(и, возможно, другие органоиды) двух далеко отстоящих друг от
друга в систематическом отношении организмов. Этим живым,
экспериментально сконструированным гетерогенным системам
было присвоено название гетерокарионы.
В качестве фактора, вызывающего формирование гетерокарио-
нов, Гаррис использовал воздействие некоторыми вирусами, оче-
видно, вызывающими в клетках специфические повреждения,
способствующие утрате свойства отличать родственные клетки от
чужеродных и облегчающие взаимную тенденцию к слиянию кле-
ток в более крупные, многоядерные агрегаты — Поликарповы, по
нашей терминологии.
« 109 »
ОНТОГЕНЕЗ И ФИЛОГЕНИЯ КЛЕТКИ
« 110 »
ОНТОГЕНЕЗ И ФИЛОГЕНИЯ КЛЕТКИ КАК ЦЕЛОГО
Гаррис и его сотрудники получили немало вариантов гетеро-
карионов, включая комплексы клеток, принадлежащих к раз-
личным классам позвоночных. Было показано, что в результате
объединения в гетерокарионы ядра исходных клеток подвергаются
некоторой интеграции, которая проявляется в изменении струк-
туры и метаболизма ядер. Ядра крупных эритроцитов, объединен-
ные в гетерокарион с ядрами клеток HeLa, восстанавливают спо-
Рис. 28. Развитие кровяных пластинок путем отщепления (посредством
мембранной трансформации везикулярных компонентов цитоплазмы) комп-
лексов органелл (митохондрий и эргастосом) от-цитоплазмы мегакариоци-
тов в печени новорожденного крысенка
Электронные микрофотографии M. М. Калашниковой: А — х 36 000; Б — большее
увеличение
« 111 »
ОНТОГЕНЕЗ И ФИЛОГЕНИЯ КЛЕТКИ
собность к синтезу ДНК, утраченную при созревании эритроцитов
[Hanis, 1967]. Таким образом, конструирование гетерокарионов
представляет собой не механическое объединение двух клеточ-
ных систем, а более сложный процесс, включающий специфиче-
ское взаимодействие интегрирующихся компонентов. Логично за-
ключить, что в основе механизма конструирования гетерокарионов
лежат древние закономерности комплексирования субклеточных
компонентов клетки, с помощью которых возникла клетка.
Система гетерокарион — это поликарион, по нашей термино-
логии, отличающийся от естественных поликарионов видовой
гетерогенностью состава ядер. Как правило, в нормально разви-
вающемся и функционирующем организме такие системы не возни-
кают, поскольку ядра любой клетки организма являются потом-
ками ядра исходной клетки-зиготы. Однако для конструирования
гетерокариона гетерогенными клетками используется тот же ме-
ханизм, с помощью которого конструируются поликарионы в
нормальном развитии. По Гаррису, слияние гетероклеток в куль-
турах, инфицированных вирусом, происходит в три этапа, подоб-
ных тем, которые открываются при формировании естественных
поликарионов (например, мышечных симпластов): 1) развитие
зоны контакта с образованием многочисленных ворсинок и впя-
чиваний, тесно сближающих клетки; 2) везикуляция двойной
мембраны, ограничивающей клеточные территории; 3) резорбция
везикулов в центральной части зоны контакта и мембранная
трансформация везикулов в зоне слияния гетероклеток.
Развитие гетерокариона с помощью этого механизма с достаточ-
ной демонстративностью рекапитулирует один из важнейших мо-
ментов эволюционного развития клетки с помощью механизма
комплексирования субклеточных компонентов, а именно форми-
рование открытых эргасто- н ретикулоплазматических систем пу-
тем неполного слияния предшественников-протоклеток. Важно от-
метить, что комплексирование гетерокарионов сопровождается
довольно высокой степенью интеграции, которая включает, кроме
выше отмеченных метаболических влияний одной части системы
на другую, и интеграцию генеративного процесса — размножения
гетерокариона. Описаны процессы формирования общих гигант-
ских метафазных пластинок, включающих хромосомы обоих ядер-
ных компонентов гетерокариона, иногда резко отличающихся друг
от друга, например хромосомы быка и норки [Teplitz et al.,
1968]. С нашей точки зрения, подобные объединения хромосом
возникают на основе тех механизмов, которые обеспечивали инте-
грацию протоклеточных предков клетки в виде клеточной конст-
рукции. Дело будущего — выяснить судьбу и взаимные отноше-
ния субклеточных цитоплазматических компонентов, вошедших в
состав гетерокариона из гетероклеток.
« 112 »
ОНТОГЕНЕЗ И ФИЛОГЕНИЯ КЛЕТКИ КАК ЦЕЛОГО
ПОЛОВОЙ ПРОЦЕСС, ЕГО ПРОИСХОЖДЕНИЕ
И ЭВОЛЮЦИОННО-МОРФОЛОГИЧЕСКОЕ ЗНАЧЕНИЕ
Огромное разнообразие форм полового процесса в органической
црироде не может затемнить его основного содержания, которое
заключается в том, что половой процесс обеспечивает повышение
гетерогенности, обусловливающее большую жизненную стойкость
и выживаемость потомства. Слияние половых клеток — гамет —
ведет к обогащению продукта слияния — зиготы — вариантами
белковых синтезов, облегчающими приспособление к меняющимся
условиям жизни. По существу половой процесс в какой-то мере
заменяет активное приспособление к меняющимся условиям жиз-
ни, равно как и активное приспособление к меняющимся услови-
ям жизни в какой-то мере заменяет половой процесс, повышая
гетерогенность белковых синтезов в организме и порождаемых
организмом половых клетках. Слияние половых клеток, таким
образом, составляет механизм повышения белковой гетерогенности
организма, заменяющий собой более громоздкий механизм инди-
видуального приспособления, решающий ту же задачу. Вот поче-
му половой процесс —слияние половых клеток, дающее начало
новому организму,— следует считать одним из величайших при-
обретений эволюции, проложившим дорогу к высшему совершен-
ству организации.
Половой процесс — это слияние половых клеток. Следователь-
но, половому процессу должно предшествовать образование клетки
как формы организации живой материи. В конструкции клетки,
очевидно, заключаются структурные предпосылки полового про-
цесса. Рассмотрим, каковы эти предпосылки.
Половой процесс — слияние гамет — может служить виду, т. е.
воспроизводству организмов, составляющих вид, только при усло-
вии мейотической подготовки, которая заключается в том, что
половые клетки подвергаются так называемому мейотическому,
или редукционному, делению, уменьшающему количество ядер-
ных органелл — хромосом — вдвое. Это первая и, безусловно, не-
обходимая предпосылка полового процесса.
Для слияния половых клеток необходимо объединение их
плазмолемм, приводящее к формированию одной двухъядерной
клетки, содержащей мужское и женское ядра (пронуклеусы).
Это — вторая предпосылка полового процесса.
Наконец, для формирования зиготы — оплодотворенной яйце-
клетки, дающей начало новому организму, необходимо слияние
мужского и женского пронуклеусов в ядро зиготы. Это третья
предпосылка, обеспечивающая возможность развития организма
как целого. Как могли возникнуть эти предпосылки?
В учебниках и руководствах по эмбриологии не принято ста-
вить вопрос о происхождении полового процесса. Считается как
бы само собой разумеющимся, что, подобно всем приспособлениям,
8 А. Н. Студитский « ИЗ »
ОНТОГЕНЕЗ И ФИЛОГЕНИЯ КЛЕТКИ
свойство зачатковых клеток готовиться к половому процессу пу-
тем редукционного деления и свойство половых клеток готовить-
ся к превращению в развивающийся организм путем слияния в
одну клетку возникли из случайных изменений, выгодных для вос-
производства вида и поэтому сохранившихся при реализации от-
бора. При этом не принято обращаться к основному правилу, ус-
тановленному в эволюционной теории Дарвином,— о примате
организма в осуществлении изменчивости, подлежащей апробации
естественным отбором [см.: Студитский, 1974]. Согласно этому
правилу структурные изменения предопределяют ни условия, вы-
зывающие изменения, ни тем более потребности организма в этих
изменениях, а конструкция организма. В конструкции организма
заключены предпосылки изменчивости, подвергающейся в даль-
нейшем испытанию посредством естественного отбора. Ни червь,
ни первичнохордовое не могли подняться в воздушную среду даже
под влиянием самой жесточайшей борьбы за существование в
наземной или водной среде. Членистоногие смогли завоевать воз-
душную стихию лишь с развитием трахейной системы, с кото-
рой связана конструкция их крыльев. Хордовые вышли в воздуш-
ную среду только с развитием пояса передних конечностей, из
которых сконструированы крылья и их функциональные аналоги
у всех позвоночных (включая летучих рыб и летучих мышей).
Эволюционное развитие всех приспособлений, обеспечивающих
половой процесс в органическом мире, также потребовало специ-
альной конструкции организма. Такой конструкцией была суб-
клеточная организация клетки, обусловленная ее эволюцион-
ным развитием путем комплексирования бактериоидных организ-
мов.
У бактерий нет полового процесса, как нет и, очевидно, не
могло и быть структурных предпосылок для его осуществления.
У бактерий отсутствуют: редукционные деления, слияние половых
клеток с формированием общей плазмолеммы и слияние мужско-
го и женского пронуклеусов или хотя бы нуклеоидов в единую
ядерную систему. То что иногда называют половым процессом у
бактерий, в действительности не имеет почти ничего общего с
половым процессом у клеточных организмов. Половой процесс у
бактерий относится к типу так называемой эписомной, или ин-
фекционной, наследственности [Campbell, 1962; Жакоб, Вольман,
1962; Стент, 1965; Hayes, 1966; Браун, 1968; Кудлай, 1969;
Агол и др., 1971].
Половой фактор, или фактор F (фактор фертильности), пред-
ставляет по своей природе инфекционное начало, родственное всем
тимофагам (как можно называть фаги, содержащие, кроме белка,
тимонуклеиновую, или дезоксириобонуклеиновую, кислоту), но
ограниченное способом передачи только посредством контакта ин-
фицирующей (F+) и инфицируемой (F-) бактерий. Перенос F-
фактора осуществляется с помощью специального Р--волоска, че-
« 114 » "
ОНТОГЕНЕЗ И ФИЛОГЕНИЯ КЛЕТКИ КАК ЦЕЛОГО
рез который ДНК Е+-бактерии вводится в Е_-бактерию с частью
ДНК Р+-бактерии.
Трудно сказать, соответствует ли (и в какой мере) половой
процесс бактерий половому процессу эукариотов по своему биоло-
гическому содержанию, т. е. достигается ли посредством введения
в Е~-бактерию ДНК Е+--бактерии вместе с ДНК донора то повы-
шение гетерогенности, которое усиливает жизненную стойкость в
результате полового процесса у клеточных организмов. Несомнен-
но, вместе с ДНК Р+-бактерии в состав ДНК Р_-бактерии вводить-
ся определенное количество детерминант белковых синтезов, обо-
гащающих приспособительные возможности реципиента. С другой
стороны, Р+-бактерия, лишаясь Р~-фактора и выведенного вместе
с ним определенного количества ДНК, как будто сужает круг при-
способительных возможностей. Очевидно, до тех пор, пока не
будут выяснены биологические последствия полового процесса у
бактерий, вопрос о его природе и отношении к половому процессу
у клеточных организмов следует считать открытым. Единствен-
ная особенность, которая должна привлекать внимание при эво-
люционно-морфологическом анализе полового процесса, заключает-
ся в том, что F-фактор оказывается как бы меткой, с помощью
которой осуществляется узнавание F-- и Р+-бактериями друг
Друга.
Содержание F-фактора придает Р+-бактерии существенное от-
личие от Р~-бактерии. F-фактор детерминирует развитие F'-bo-
лоска, с помощью которого F+- и Р~-бактерии вступают в конъю-
гацию — объединение с помощью Р~чволоска, через который
Р_-фактор переходит из Р+-бактерии в Р_-бактерию вместе с
частью ДНК донора. По существу при конъюгации бактерий
осуществляется взаимодействие нуклеоидов, детерминируемое
F-фактором, в результате чего инфицирующий агент переходит
из одного нуклеоида в другой. Если принять во внимание, что
при синаптическом процессе в ходе мейоза у эукариотов также
осуществляется переход ДНК-факторов (агентов менделевской
наследственности) из одной хромосомы в другую, нетрудно прий-
ти к выводу, что конъюгация синаптических хромосом эукариотов
гомологична конъюгации бактерий. К сожалению, для более глу-
бокой разработки этой гипотезы имеющиеся фактические данные
недостаточно изучены с помощью современных средств исследо-
вания.
ПОЛОВОЙ ПРОЦЕСС У ПРОСТЕЙШИХ
Несмотря на то что формирование гамет и их слияние, при-
водящее к развитию зиготы, не обнаружено у некоторых групп
простейших, можно уверенно сказать, что клеточная конструкция,
возникшая впервые у одноклеточных оганизмов, создала усло-
вия для осуществления полового процесса и связанного с ним
скачка в ходе приспособительной структурной эволюции.
« 115 »
8*
ОНТОГЕНЕЗ И ФИЛОГЕНИЯ КЛЕТКИ
Половой процесс у бактерий, как мы видели, ограничен ча-
стичным контактом с помощью Б_-волоска, через который Б_-фак-
тор вместе с частью донорской ДНК переходит из одной бактерии
3 другую. При этом не осуществляются ни полный контакт кле-
ток посредством примыкающих плазмолемм, ни тем более слияние
партнеров, характеризующее половой процесс у эукариотов. Чем
обусловлена неспособность бактерий к слиянию в виде зиготы,
объединяющей в себе две половые клетки? С эволюционно-морфо-
логической точки зрения, причина неполноценности, или, точнее,
отсутствия у бактерий собственно полового процесса, включающе-
го слияние гамет и формирование зиготы, кроется в том, что
бактериям еще чуждо объединение в комплексы, характерное для
эукариотов. Комплексирование клонов бактерий было скачком к
переходу на клеточный уровень организации. Сохраняя прото-
клеточную организацию, бактерии не имели средств для осу-
ществления полового процесса, начиная с глубокого контакта
гамет и кончая полным их слиянием в одну клетку — зиготу. По-
ловой процесс эукариотов с глубокой демонстративностью отража-
ет, или рекапитулирует, путь комплексирования бактериоидных
предков клетки в форме единой клеточной организации.
У простейших обнаружено большое разнообразие форм жиз-
ненного цикла, связанных с половым процессом. И. Б. Райков
в книге «Кариология простейших» [1967] перечисляет, по край-
ней мере, шесть видов полового процесса: слияние (копуляция)
гамет одинакового строения (изогамия); слияние гамет разного
строения (анизогамия); слияние гамет разного происхождения
(аллогамия); слияние гамет общего (от одной клетки) происхож-
дения (педогамия); слияние ядер в одной клетке (автогамия);
слияние целых особей (гамонтов), предшествующее формированию
свободных гамет (гамонтогамия). Специализированный случай
гамонтогамии — конъюгация у инфузорий, заключающаяся во
временном слиянии двух особей на время обмена гаплоидными
пронуклеусами с последующим слиянием пронуклеусов и рас-
хождением конъюгантов — зигот.
Нетрудно видеть, что все формы полового процесса у про-
стейших осуществляются благодаря наличию указанных выше
структурных предпосылок, обусловливающих возможность поло-
вого процесса: мейотического деления, слияния плазмолемм и
слияния кариолемм с формированием общего ядра зиготы из двух
пронуклеусов слившихся гамет.
Бактерии лишены механизма уменьшения вдвое, обеспечиваю-
щего развитие зигот. Но в составе клеточного организма субкле-
точные единицы, потомки бактериоидных организмов, благодаря
своей способности к делению надвое создают возможность фор-
мирования половинных клеточных форм — гамет.
Неизвестно, в какой мере принцип уменьшения вдвое рас-
пространяется на другие субклеточные компоненты клетки, поми-
« 116 »
ОНТОГЕНЕЗ И ФИЛОГЕНИЯ КЛЕТКИ КАК ЦЕЛОГО
мо хромосом. Однако, по крайней мере, для простейших, в особен-
ности для гамет одинакового строения — изогамет, сохраняет свое
значение принцип постоянства ядерно-цитоплазматического отно-
шения, свидетельствующий о том, что уменьшению вдвое подвер-
гаются не только ядерный аппарат, но и в соответствии с ним и
цитоплазматические конструкции. Изогаметы некоторых жгути-
ковых — это просто уменьшенные копии вегетативных особей.
При слиянии гамет удваивается не только количество хромосом,
но и объем цитоплазмы зиготы. К сожалению, процессы созрева-
ния гамет и оплодотворение у простейших слабо изучены с помо-
щью современных средств исследования [Friedmann et al., 1968].
Наиболее основательно с помощью электронно-микроскопической
техники изучен половой процесс, и в частности мейотическое де-
ление у инфузорий [см.: Райков, 1979]. Однако нетрудно понять,
что все предпосылки полового процесса, и в том числе мейотиче-
ское деление, были подготовлены ходом эволюционного превраще-
ния протоклеточной организации в клеточную.
Нам неизвестны формы размножения простейших с синхрон-
ным делением ядерных и цитоплазматических органелл, равно
как неизвестны способы развития гамет путем мейотического
распределения ядерных и цитоплазматических органелл по двум
формирующимся гаметам. Однако сам процесс уменьшения объе-
ма половой клетки вдвое эволюционно подготовлен тем, что веге-
тативная клетка регулярно удваивает свой объем перед каждым
делением или после него. Клетке как бы известны простейшие
арифметические акты: 1X2 = 2; 2:2 = 1, из которых вытекает
возможность не более сложного акта: 1:2 = 7г, составляющего
сущность мейотического процесса. Клетка использует опыт веге-
тативного деления надвое и последующего удвоения объема или
удвоения объема с последующим вегетативным делением для осу-
ществления мейотического деления.
Еще более демонстративна связь субклеточной организации и
субклеточного онтогенеза клетки с процессом оплодотворения.
У простейших процесс оплодотворения — слияния половых кле-
ток — с помощью современных методов изучен недостаточно. По
оплодотворению у многоклеточных эукариотов накоплен большой
фактический материал, который подлежит специальному рассмо-
трению.
ПОЛОВОЙ ПРОЦЕСС У ВЫСШИХ ЭУКАРИОТОВ
Дифференцировка половых клеток у многоклеточных эукарио-
тов выходит за пределы этой главы, представляя значительно
больший интерес для эволюционно-морфологического анализа пла-
стической активности клетки. Эволюция многоклеточных сопря-
жена с глубочайшими приспособительными изменениями половых
клеток. Завоевание водной, сухопутной и воздушной сред Земли,
« 117 »
ОНТОГЕНЕЗ И ФИЛОГЕНИЯ КЛЕТКИ
распространение в беспредельно разнообразных по физическим
условиям пространствах было сопряжено с формированием самых
разнообразных конструкций яйцевых клеток, и особенно их обо-
лочек. Соответственно осуществлялись глубокие эволюционные
трансформации мужских половых клеток, обусловленные при-
способлением к внедрению в женскую половую клетку. Все эти
приспособительные изменения половых клеток, как показано во
второй части книги, стали возможны благодаря субклеточной
конструкции клетки, обеспечившей ее высочайшую строительную
пластичность. Однако, несмотря на огромное разнообразие струк-
турных форм половых клеток, связанных с решением важнейшей
задачи полового процесса — встречи и взаимодействия половых
клеток, половой процесс во всем мире эукариотов осуществляется
благодаря наличию общих структурных предпосылок, которые за-
ключаются в возможности слияния плазмолемм мужской и жен-
ской половой клеток и кариолемм мужского и женского прону-
клеусов. Оба эти процесса обусловлены филогенетическим про-
шлым клетки — конструированием клеточного тела за счет
комплексирования предковых бактериоидных организмов.
Как показал эволюционно-морфологический анализ онтогенеза
клетки, процесс конструирования клетки сопровождался как ин-
теграцией относительно автономных субклеточных компонентов —
ядерного комплекса и митохондрий, отграниченных двойными
мембранами от остальных частей клетки, так и слиянием субкле-
точных компонентов цитоплазмы в открытые системы эргастоплаз-
мы и ретикулоплазмы с неполностью отграниченными строитель-
ными компонентами. Однако в онтогенезе клетки закрытые си-
стемы могут превращаться в открытые посредством везикуляции
двойных мембран (профаза митотического деления ядра) и от-
крытые системы могут превращаться в закрытые путем мембран-
ной трансформации везикулов и цистерн (формирование концент-
рических фигур ретикулоплазмы и эргастоплазмы в секреторных
клетках и ооцитах). Везикуляция мембран и мембранная транс-
формация везикулов составляют структурную основу слияния по-
ловых клеток.
Процесс оплодотворения за последние годы основательно об-
следован с помощью современной техники у многих видов жи-
вотных [см.: Idelman, 1967; Pochon-Masson, 1968]. К сожалению,
отсутствие эволюционно-морфологического аспекта в анализе
этого процесса наложили свой отпечаток на выбор объектов ис-
следования. Большой фактический материал накоплен по оплодо-
творению у млекопитающих, насекомых, моллюсков, иглокожих.
Значительно слабее обследованы низшие эукариоты — губки,
кишечнополостные, турбеллярии. До сих пор никому не удалось
наблюдать оплодотворение у десятиногих раков с их поразитель-
ной безжгутиковой структурой спермиев. Однако совпадение ука-
занных выше структурных предпосылок оплодотворения — особен-
« 118 »
ОНТОГЕНЕЗ И ФИЛОГЕНИЯ КЛЕТКИ КАК ЦЕЛОГО
ностей слияния клеточных тел и ядер мужской и женской поло-
вых клеток — позволяет сделать вывод, что эти предпосылки
определили развитие полового процесса у всех многоклеточных
организмов.
Если обратиться к наиболее детальным электронно-микроско-
пическим описаниям процесса оплодотворения [см.: Idelman,
1967], то нетрудно видеть, что при слиянии мужской и женской
цоловых клеток, действительно, весь ход процесса направлен на
решение двух основных задач — формирование общей цитомемб-
раны зиготы и формирование одного ядра зиготы из двух пронук-
леусов. У аннелиды Hydroides hexagonus [A. Colwin, L. Colwin,
1961] акросома спермин, внедрившегося в яйцо через яйцевую
оболочку, образует около 15 выростов, представляющих собой
первоначально выпячивания акросомной мембраны. При прохож-
дении спермин через желточную оболочку мембрана акросомного
пузырька на апикальном конце подвергается разрыву (в нашей
трактовке — везикулярной трансформации). Материал содержи-
мого пузырька — акросомной гранулы — выделяет фермент, раст-
воряющий желточную оболочку. Выросты дистальной стенки акро-
сомного пузырька входят в контакт с плазмолеммой яйца, как
пальцы, входящие в перчатку. Затем возникшая двойная мембра-
на распадается на везикулы, которые по периферии акросомы
подвергаются мембранной трансформации. Возникает общая мем-
брана, одевающая проникающий в яйцо спермий и прилежащий
участок яйца. Сходные взаимоотношения цитомембран спермин и
яйца описаны и на других объектах.
Везикуляция составляет обязательный этап этого взаимодей-
ствия, приводящий к формированию плазмолеммы оплодотворен-
ного яйца. Слияние пронуклеусов в оплодотворенном яйце вклю-
чает три главных этапа, отражающих путь формирования закры-
тых субклеточных систем в конструирующейся клетке [Gondos,
Bhiraleus, 1970]. Первый этап заключается в глубоком контакте
примыкающих друг к другу кариомембран — с помощью образуе-
мых ими ворсинок и впячиваний. Второй этап характеризуется
везикуляцией общей двухмембранной стенки примыкающих друг
к другу пронуклеусов. На третьем этапе происходит резорбция
(демонтаж) везикулов в центральной части синкариона и слия-
ние везикулов в общую двойную мембрану по периферии зоны
контакта пронуклеусов.
ЭВОЛЮЦИОННО-МОРФОЛОГИЧЕСКОЕ ЗНАЧЕНИЕ
ПОЛОВОГО ПРОЦЕССА У МНОГОКЛЕТОЧНЫХ
Выше отмечалось, что половой процесс в его типичной форме
возник уже на первом этапе эволюции клетки, поскольку разви-
тие гамет и их слияние в зиготу обнаружено уже у низших форм
простейших, а также у одноклеточных водорослей. Отмечалось
« 119 »
ОНТОГЕНЕЗ И ФИЛОГЕНИЯ КЛЕТКИ
также, что развитие полового процесса было подготовлено всем
ходом эволюционной трансформации клона предковых протокле-
точных организмов в клетку. Клетка использовала способ интег-
рации протоклеточных компонентов в клеточный организм для
выработки полового процесса, имеющего столь важное значение
в расширении приспособительных возможностей клетки. Таким
образом, половой процесс представляет собой одну из древней-
ших форм приспособительной структурной активности клетки,
закрепившейся в ходе эволюции как важнейший момент индиви-
дуального развития. При переходе от одноклеточности к много-
клеточности половой процесс сохранил как свое биологическое
содержание — повышение приспособительных возможностей ор-
ганизма, так и основное структурное содержание — уменьшение
объема половых клеток вдвое и возвращение к типичному объе-
му путем слияния мужской и женской гамет в форме зиготы. На
всем протяжении эволюции половой процесс сохраняет эти основ-
ные структурные черты, демонстративно документирующие меха-
низм интеграции клетки из автономных субклеточных систем
в единую клеточную систему.
В процессе онтогенеза клетка как целое подвергается измене-
ниям, которые объяснимы только с эволюционно-морфологических
позиций. К числу таких процессов принадлежат: 1) формирование
симпластов; 2) выщепление клеток из симпластов; 3) выщепление
органелл и их комплексов из клетки; 4) феномен формирования
гетерокарионов; 5) половой процесс.
Электронная микроскопия процессов развития симпластов по-
казывает, что в основе этих процессов лежат механизмы непол-
ного слияния субклеточных компонентов клетки, включающие раз-
витие контактов между ними, везикуляцию возникающей в ре-
зультате этих контактов двойной разделительной мембраны и
частичную резорбцию везикулов, в результате чего возникают
открытые субклеточные конструкции типа эргастоплазмы и рети-
кулоплазмы. Везикуляция разделительных двойных мембран и их
частичная резорбция характерны для всех форм развития сим-
пластов (поликарионов), в частности для образования гигантских
клеток инородных тел и мышечных симпластов.
Тот же механизм, но действующий в обратном направлении,
обнаруживается при выщеплении клеток или комплексов орга-
нелл из клетки, например, при развитии миобластов из мышеч-
ного волокна или при формировании кровяных пластинок из ци-
топлазмы мегакариоцитов: монтаж везикулярных систем и их
мембранная трансформация. Выщепление ядра или продуктов его
диссоциации из эритробласта приводит к формированию специфи-
ческой субклеточной системы — ретикулоцита, представляющего
« 120 »
ОНТОГЕНЕЗ И ФИЛОГЕНИЯ КЛЕТКИ КАК ЦЕЛОГО
собой прямой гомолог предковой бактериоидпой формы по нали-
чию основных структурных бактериоидных признаков (плазмо-
лемма, матрикс, рибосомный комплекс, в некоторых случаях —
следы ДНК).
Формирование гетерокарионов — комплексных многоядерных
систем — путем слияния гетероклеток (например, мыши и чело-
века) также совершается с помощью механизма везикуляции по-
граничных двойных мембран и их резорбции.
Наконец, в половом процессе рекапитуляция конструирования
клетки с помощью механизма двойных мембран и их везикуля-
ции обнаруживается с максимальной демонстративностью. Поло-
вой процесс — слияние гамет — возник, вероятно, одновременно
с конструированием клетки на той же структурной основе (агре-
гации субклеточных компонентов и их комплексов) и на всем
протяжении эволюции сохранил свое рекапитуляционное значе-
ние.
Ассоциации и диссоциации клеток и их субклеточных компо-
нентов широко используются в онтогенезе клетки как целого.
Эти процессы отражают древнейшие фазы филогении клетки,
включая эволюционное преобразование клона бактериоидных пред-
ков клетки в клеточную конструкцию.
Часть вторая
ФУНКЦИОНАЛЬНАЯ МОРФОЛОГИЯ
И ФИЛОГЕНИЯ КЛЕТКИ
*
Введение
КЛЕТКА СТРОИТСЯ ИЗ ОРГАНЕЛЛ
Организм многоклеточных животных и растений построен из
клеток — это основное положение клеточной теории, сохраняющее
значение и в настоящее время. Развитие эмбриологии и онтогене-
тической концепции организма обогатило эту формулу дополни-
тельным теоретическим обобщением: организм не только построен,
но и строится из клеток. Можно выразиться и несколько иначе:
клетки строят многоклеточный организм, если иметь в виду отно-
сительную автономность клеток как строительных компонентов
многоклеточного организма. Однако при этом обязательно пред-
полагается, что организм управляет строительной активностью
клеток, используя их строительные свойства исключительно в
своих интересах. Более того, можно сказать, что организм строит
себя, используя строительную активность клеток, с помощью кле-
ток и клеточных компонентов как регулирующих устройств кле-
точного строительного механизма. Так, в ходе развития
многоклеточных организмов обособляются строительные клеточ-
ные комплексы — ткани, среди которых дифференцируются соб-
ственно строительные блоки — эпителизирующие (покровные и
выстилающие), заполняющие (арматурные), сократимые и опор-
ные ткани, а также связующие, комплексирующие, устройства —
нервы, сосуды, сухожилия, с помощью которых органы объединя-
ются в общее структурное целое.
Значительно меньше внимание морфологов привлекает строи-
тельная активность клеток, выражающаяся в их структурной
трансформации, связанной с осуществлением специфических
функций.
Сказать, что организм строит свои органы с помощью клеток,
которые одновременно обеспечивают функциональные отправле-
ния органа,— значит сказать банальность. Действительно, клетки
не только строят органы, входя в состав строительных материалов
организма — тканей, но и служат организму в качестве микроско-
пических органов, специализированных на отправлении специфи-
ческих функций. Принято говорить, что клетки, специализируясь
на отправлении специфических функций, подвергаются диффе-
ренцировке, дифференцируются. Но при этом далеко недостаточ-
ное внимание уделяется тому обстоятельству, что дифференци-
« 122 »
КЛЕТКА СТРОИТСЯ ИЗ ОРГАНЕЛЛ
ровка клетки, связанная с ее специализацией на отправлении спе-
цифической функции, также представляет собой сложный
строительный процесс.
ДИФФЕРЕНЦИРОВКА — СТРОИТЕЛЬНЫЙ ПРОЦЕСС
Организм строит себя из клеток, приобретая в результате свою
дефинитивную структуру, обеспечивающую всю специфическую
жизнедеятельность организма как формы существования опре-
деленного вида. Но одновременно каждая из клеток, обеспечива-
ющих строительство многоклеточного организма, строит себя как
специфическую конструктивную единицу, ответственную за впол-
не определенный участок функциональных отправлений организ-
ма. Дифференцировка — это не просто специализация структуры
клетки, связанная с ее ролью в строительной и функциональной
активности организма. Дифференцировка — это одновременно
строительный процесс, с помощью которого клетка приобретает
свою дефинитивную структуру, обеспечивающую ее участие в
жизнедеятельности многоклеточного организма. Эта сторона про-
цессов дифференцировки до настоящего времени не привлекала
внимания морфологов.
РАЗВИТИЕ КЛЕТКИ — ЦИТОГЕНЕЗ
Нельзя сказать, что активность клетки, связанная с процессом
строительства дефинитивных клеточных конструкций, была вне
поля зрения исследователей. Дифференцировка клеток на протя-
жении почти полутора столетий служила одной из главных тем
гистологических исследований. Однако огромное большинство ра-
бот, посвященных этой теме, ограничивалось процессами развития
клетки в составе ткани или в составе органа. Термин «гистогенез»
появился в гистологии еще во времена классических трудов Кел-
ликера. Термин «цитогенез» не вошел в употребление до сих пор.
Между тем дифференцировка клетки как процесс ее структурной
трансформации, обеспечивающий осуществление специфической
функции, представляет собой не только определенный отрезок
гистогенеза, т. е. развития ткани, но и цитогенез, т. е. развитие,
или совокупность структурных превращений, собственно клетки.
Эта сторона процессов дифференцировки действительно находи-
лась вне поля зрения науки о клетке.
Причин сложившегося положения с разработкой этой пробле-
мы две. Первая заключается в том, что в процессах дифференци-
ровки главное внимание привлекали структурные изменения, не-
посредственно связанные с функциональной специализацией
клетки: развитие миофибрилл в дифференцирующейся мышечной
клетке, коллагеновых волокон и основного вещества в соедини-
тельной ткани и кости, тонофибрилл и рогового вещества в эпи-
« 123 »
ФУНКЦИОНАЛЬНАЯ МОРФОЛОГИЯ И ФИЛОГЕНИЯ КЛЕТКИ
дермисе, тигроидного вещества и нейрофибрилл в нервной клет-
ке, пигментных зерен в пигментных клетках, секреторных гранул
в секреторных клетках и т. д. Все эти процессы создавали у ис-
следователя впечатление, что дифференцировка как структурное
выражение функциональной специализации не затрагивает основ-
ных структурных компонентов клетки — ядра и цитоплазматиче-
ских органелл, которые обеспечивают общие функции клетки.
Что же касается особых случаев дифференцировки, в которых
структурной трансформации подвергаются ядро и цитоплазмати-
ческие органеллы, например развитие половых клеток или диф-
ференцировка кровяных клеток, то описание этих процессов ог-
раничивалось чистой феноменологией, без каких-либо попыток
выяснения причин трансформации аппарата Гольджи в акросому
дифференцирующихся спермиев или шаровидного ядра гемоцито-
бласта в сегментированное ядро нейтрофила.
Вторая причина заключалась в недостаточности или неполноте
сложившихся представлений о структурах клетки, подвергающих-
ся тем или иным трансформациям в процессах дифференцировки.
Собственно, только в самые последние годы стали подвергаться
исследованию с помощью электронной микроскопии и других сов-
ременных средств такие строительные процессы в клетке, как
спермиогенез, оогенез, развитие клеток крови, развитие рецептор-
ных клеток и другие цитогенезы, в которых клетка с полной де-
монстративностью использует свои интегральные части, включая
ядро и цитоплазматические органеллы, для строительства специа-
лизированных клеточных конструкций. Можно добавить к этому,
что недостаточная точность представлений о некоторых структур-
ных компонентах, выявленных в клетке с помощью электронной
микроскопии и других современных средств исследования, напри-
мер о конструкции эргастоплазмы или ретикулоплазмы (комплек-
сов Гольджи), мешает различать в банальных процессах диффе-
ренцировки, например, секреторных клеток, трансформацию
субклеточных компонентов клетки — например, телец эргасто-
плазмы (эргастосом). Большинство исследователей усматривает в
этом процессе только специфическую активность шероховатого
эндоплазматического ретикулума, синтезирующего секрет, кото-
рый поступает в цистерны ретикулума. Между тем даже в этом
банальном процессе, хорошо изученном с помощью современных
средств исследования, нетрудно видеть специфическую функцио-
нальную трансформацию субклеточных компонентов цитоплаз-
мы — эргастосом, которые в секреторных клетках приобретают
специфическую структуру и характерную локализацию. Клетка
строит специфическую секреторную клетку, используя возмож-
ность трансформации эргастоплазмы в специальные секреторные
органеллы.
« 124 »
КЛЕТКА СТРОИТСЯ ИЗ ОРГАНЕЛЛ
НЕДОСТАТОЧНОСТЬ РАЗРАБОТКИ ПРОБЛЕМЫ ЦИТОГЕНЕЗА
Оценивая современное состояние функциональной морфологии
клетки, можно сказать с полной объективностью, что накоплен-
ный в этой сфере исследования фактический материал до настоя-
щего времени не подвергался теоретическому, т. е. в приложении
к объекту исследования, эволюционно-морфологическому анализу.
Состояние знаний в этой области напоминает общую эмбриологию
времен Вольфа и общую гистологию времен Биша, когда в науке
сложились представления о структурных и функциональных ха-
рактеристиках тканей, а также об основных закономерностях ги-
сто- и органогенезов без понимания того, что основу строения и
развития и функциональной активности органов и тканей состав-
ляют их микроскопические строительные компоненты — клетки.
В функциональной морфологии клетки накоплен огромный фено-
менологический материал. Процессы дифференцировки клеток ос-
вовательно изучены с помощью современных методов исследова-
ния. Но все разнообразие структур клетки, связанное с ее спе-
циализацией на отправлении различных функций, равно как и все
разнообразие цитогенетических процессов, в которых выражается
специфика клеточной дифференцировки, до сих пор не подверга-
лись анализу на основе современных данных об организации
клетки.
Бактериоподобные организмы лишены той сложности органи-
зации, которая приобретается посредством структурной диффе-
ренцировки при функциональной специализации одноклеточных
организмов и в особенности клеточных компонентов многоклеточ-
ных организмов. Функциональная специализация и дифференци-
ровка представляют собой признаки клеточной организации, по-
лучившие наиболее демонстративное выражение с переходом к
многоклеточному строению. Перед современной функциональной
морфологией клетки стоит задача — вскрыть источники структур-
ных ресурсов клетки, объяснить их эволюционное происхождение
и развитие.
ЗАДАЧА ИССЛЕДОВАНИЙ
В ОБЛАСТИ ФУНКЦИОНАЛЬНОЙ МОРФОЛОГИИ КЛЕТКИ
В предыдущей части книги неоднократно указывалось, что из
двух возможных схем происхождения клетки из протоклетки —
бактериоподобного организма — только синбактериогенная теория
позволяет дать более или менее правдоподобное и не входящее в
конфликт с фактами научное объяснение структурной организа-
ции и онтогенетического развития клетки. Идея о субклеточной
конструкции клетки дает возможность свести огромное структур-
ное разнообразие клетки к однообразию основных пяти субклеточ-
ных структурных компонентов, из которых построена клетка.
Принцип субклеточной конструкции клетки разрешает построить
« 125 »
ФУНКЦИОНАЛЬНАЯ МОРФОЛОГИЯ И ФИЛОГЕНИЯ КЛЕТКИ
вполне правдоподобные схемы онтогенеза клетки на основе онто-
генезов входящих в ее состав органелл. Функционально-морфоло-
гическая проблема, включающая проблему дифференцировки, под-
лежит разработке также на основе синбактериогенной теории
происхождения клетки.
Нам предстоит рассмотреть процессы, в которых отражается
строительная активность субклеточных компонентов, обусловли-
вающая дифференцировку различных типов клеток. К сожалению,,
данных по функциональной морфологии клеток, добытых с по-
мощью современных средств исследования, недостаточно для
того, чтобы пересмотреть хотя бы наиболее известные процессы
дифференцировки с эволюционно-морфологических позиций.
Особую трудность составляет недостаточность и неполная яс-
ность данных по трансформациям цитоплазматических субклеточ-
ных компонентов в процессах дифференцировки. Большинство'
авторов, описывающих эти процессы, придерживаются концеп-
ции Портера—Робертсона о дренажной конструкции цитоплазмы
и обращают поэтому внимание не столько на матрикс субклеточ-
ных компонентов цитоплазмы, сколько на разделительные
устройства — двойные мембраны, составляющие в клетке по схе-
ме Портера—Робертсона дренажную сеть (эндоплазматический
ретикулум + цистерны комплексов Гольджи). Поведение субкле-
точных компонентов цитоплазмы в процессах дифференцировки
предстает в описаниях этих исследователей в совершенно невер-
ном освещении. Вот почему анализ строительной активности суб-
клеточных компонентов в процессах функциональной специализа-
ции и соответствующей структурной дифференцировки клетки
придется провести на весьма ограниченном круге процессов и
объектов. К этому кругу относятся: дифференцировка половых,
клеток, гематопоэз, дифференцировка рецепторных клеток.
Глава первая
СТРОИТЕЛЬНАЯ АКТИВНОСТЬ
СУБКЛЕТОЧНЫХ КОМПОНЕНТОВ
ЖЕНСКОЙ ПОЛОВОЙ КЛЕТКИ
РАЗНООБРАЗИЕ КОНСТРУКЦИЙ ЖЕНСКИХ ПОЛОВЫХ КЛЕТОК
В качестве обязательных агентов полового процесса у много-
клеточных организмов выступают мужская и женская половые
клетки — спермий (сперматозоид) и яйцо (ооцит).
В предшествующей части книги указывалось, что формирова-
ние гамет принадлежит к числу приспособительных процессов,.
« 126 »
СТРОИТЕЛЬНАЯ АКТИВНОСТЬ ЖЕНСКОЙ ПОЛОВОЙ КЛЕТКИ
обеспечивающих возможность осуществления важнейшего этапа
полового процесса — сближения, встречи, взаимного узнавания и
слияния половых клеток.
На протяжении всей эволюции многоклеточных организмов,
особенно в животном мире, природа проявила поистине неисчер-
паемую щедрость в формировании структурного разнообразия
женских половых клеток, обеспечивающих воспроизводство поко-
лений вида, и мужских половых клеток, способных преодолеть
все трудности оплодотворения, связанные с приспособительными
изменениями яйцевых клеток. Исследование строения и развития
половых клеток с помощью современных технических средств и
методов по существу только еще начинается. Но те сравнительно
немногочисленные данные, которые получены в этой сфере иссле-
дования, позволяют сделать вывод, что каждый вид животных и,
вероятно, растений характеризуется совершенно своеобразным
устройством и способом развития гамет.
К сожалению, нет возможности рассмотреть изменения гаме-
тогенеза и конструкции половых клеток в порядке эволюционного
усложнения организации животных организмов. Выше отмеча-
лось, что данных, относящихся к этим процессам у низших мно-
гоклеточных животных •— губок, кишечнополостных, турбелля-
рий,— недостаточно для построения сколько-нибудь правдоподоб-
ной гипотезы о закономерностях конструктивных изменений
половых клеток и процессов гаметогенеза в ходе эволюции. Более
того, накопленные в этой сфере исследования факты позволяют
сказать, что эволюционное усложнение организации (морфологи-
ческий прогресс) не отражается заметным образом на эволюцион-
ных изменениях и конструкции половых клеток. По сложности
конструкции и по способу развития спермиев и яйцеклеток выс-
шие позвоночные отнюдь не превосходят, например, иглоко-
жих или ракообразных, не говоря уже о низших позвоночных.
Создается впечатление, что природа обращается со строительным
материалом, из которого формируются половые клетки, не счи-
таясь с эволюционным прошлым вида. Только некоторые таксо-
номические группы отличаются в целом специфическими особен-
ностями строения половых клеток и гаметогенеза. Но внутри
таких групп также наблюдаются весьма существенные варианты
как в конструкции половых клеток, так и в процессах гаметоге-
неза. Вероятнее всего, половые клетки представляют собой совер-
шенно специфическую форму клеток, эволюционные преобразова-
ния которых осуществляются в значительной мере независимо от
хода эволюции развивающихся из них организмов. Вот почему в
^развитии и дефинитивном строении половых клеток можно ожи-
дать отражения (рекапитуляции) древнейших форм клеточной
организации.
« 127 »
ФУНКЦИОНАЛЬНАЯ МОРФОЛОГИЯ И ФИЛОГЕНИЯ КЛЕТКИ
ПОЛОВЫЕ КЛЕТКИ — ЭУГАМЕТЫ —
ВОЗНИКЛИ У МНОГОКЛЕТОЧНЫХ ЭУКАРИОТОВ
Нет возможности хотя бы в основных чертах осветить разви-
тие и дефинитивную организацию половых клеток у простейших.
Несмотря на разнообразие форм полового процесса у одноклеточ-
ных эукариотов, гаметы у большинства видов этого типа построе-
ны сравнительно просто. Макрогамета, соответствующая женской
половой клетке,— это просто большая клетка, микрогамета, муж-
ская половая клетка,— это маленькая клетка, чаще всего обла-
дающая жгутиком. Изогаметы — это две маленькие клетки, слия-
нием которых решается задача формирования диплоидной клетки
таметы. Только в нескольких специализированных группах про-
стейших обнаружены процессы, напоминающие гаметогенез у
многоклеточных эукариотов с формированием макро- и микрога-
мет [см.: Догель, 1951]. Однако специфический гаметогенез —
эугаметогенез, включающий формирование типичной яйцевой
клетки и типичной мужской половой клетки, в виде спермин спо-
собной внедряться в яйцевую клетку, появляется только у мно-
гоклеточных эукариотов.
Биологически переход от примитивных гамет — протогамет
простейших — к специализированным гаметам — эугаметам мно-
гоклеточных эукариотов — легко объясним. Победа в борьбе за
существование была одержана многоклеточными над одноклеточ-
ными так же, как когда-то подобная победа была одержана одно-
клеточными эукариотами над прокариотами в результате увели-
чения размеров и дифференцировки, обеспечиваемой более слож-
ной конструкцией. Для того чтобы удержать преимущество над
одноклеточными многоклеточные должны были приобрести спо-
соб развития, гарантирующий от агрессии одноклеточных. Такой
способ развития заключался, во-первых, в дифференциации га-
мет на маленькую подвижную мужскую половую клетку и на
крупную, менее подвижную женскую половую клетку и, во-вто-
рых, в формировании путем слияния гамет крупной зиготы, обес-
печенной своими размерами, а также развитием яйцевых оболо-
чек от агрессии со стороны низших эукариотов на протяжении
всего периода зародышевого развития.
Трудно сказать, какими были первые гетерогаметы (гаметы
разного размера) у многоклеточных эукариотов. Способ форми-
рования макрогамет был «изобретен» еще одноклеточными эука-
риотами. Он заключается, как нетрудно понять, в увеличении
объема клеточного тела за счет умножения числа цитоплазмати-
ческих субклеточных компонентов. Микрогаметы формируются
путем деления, приводящего к уменьшению объема клеточного
тела вдвое. Однако, кроме немногих, приведенных выше исклю-
чений, макрогаметы и микрогаметы простейших — это просто
большая и маленькая гаплоидные клетки. С переходом к много-
« 128 »
СТРОИТЕЛЬНАЯ АКТИВНОСТЬ ЖЕНСКОЙ ПОЛОВОЙ КЛЕТКИ
клеточности возникают специализированные макрогаметы и мик-
рогаметы высших эукариотов, эугаметы — яйцо и спермий.
Типичные эугаметы обнаружены у всех обследованных низ-
ших многоклеточных эукариотов — кишечнополостных, губок,
турбеллярий. Яйцо гидры это уже не просто крупная клетка. Это
специализированная яйцевая клетка, приобретающая специфиче-
скую конструкцию цитоплазмы, а также яйцевые оболочки путем
сложного взаимодействия с соматическими клетками [см.: Кана-
ев, 1952]. В яйце гидры, как и всех других многоклеточных эука-
риотов, содержится специфическая зернистость, обеспечивающая
питание клеток развивающегося из яйца эмбриона. Оогенез гидры
сопровождается захватом и ассимиляцией соматических клеток —
гомологов фолликулярных клеток высших типов эукариотов. В ре-
зультате этого процесса в ооплазме развиваются микроскопиче-
ские тельца, составляющие специфическую зернистость — так
называемые желточные тельца.
ООЦИТ СТРОИТ ЖЕЛТОЧНЫЕ ТЕЛЬЦА
Формирование желточных телец в цитоплазме ооцитов при-
надлежит к числу самых загадочных процессов онтогенеза клет-
ки, хотя до электронно-микроскопической эры исследователи не
видели существенных различий в накоплении запасных питатель-
ных веществ ооцитами и соматическими клетками, например ге-
патоцитом. Были известны различные формы участия в этом про-
цессе фолликулярных клеток, включая поступление в ооплазму
каких-то зернистостей из фолликулярных клеток (например,
в ооцитах жука-плавунца) [см.: Вильсон, 1936; Равен, 1964].
Однако только с помощью современных методов удалось устано-
вить, что желточные тельца (желточные шары, желточные ядра)
представляют собой не просто капли запасных питательных ве-
ществ (белка, жировых веществ и углеводов), а целую группу
сложных конструкций, возникающих в результате активности
всех органелл и цитоплазмы ооцита, а также органелл фоллику-
лярных клеток. К сожалению, пока не представляется возможным
проследить эволюционные преобразования, которым подвергался
процесс конструирования женской половой клетки, начиная с
низших и кончая высшими многоклеточными эукариотами, так
как только немногочисленные объекты обследованы в этом отно-
шении с помощью современной техники или хотя бы с учетом
современных представлений о конструкции и онтогенезе клетки.
Наиболее сложная конструкция желточного аппарата ооцита
представлена так называемыми желточными ядрами, оформлен-
ными в ооплазме в виде четко обособленных базофильных тел
разнообразной формы [см.: Равен, 1964].
Не вызывает сомнения, что уже у гидры процесс развития
ооцита, хорошо изученный с помощью светооптической техники,
9 А. Н. Студитский << 129 »
ФУНКЦИОНАЛЬНАЯ МОРФОЛОГИЯ И ФИЛОГЕНИЯ КЛЕТКИ
включает формирование желточных телец на основе высокой ме-
таболической активности всех органелл ооцита, а также сомати-
ческих клеток, поглощаемых ооцитом. Еще не совсем ясна биоло-
гическая природа поглощения ооцитом соматических («фоллику-
лярных») клеток — фагоцитоз ли это или специфическая форма
ассимиляции соматических клеток, включающая реутилизацию
органелл и высокомолекулярных блоков цитоплазмы. Несомнен-
но, однако, что и в этом случае наиболее примитивной формы
оогенеза формирование ооцита включает монтаж специфических
конструкций — желточных шаров — с участием питающих («фол-
ликулярных») клеток. У многих видов более высоко организован-
ных эукариотов монтаж желточных шаров изучен с помощью
современной техники или, во всяком случае, с учетом современ-
ных данных о строении клетки.
Конструирование ооцита — женской половой клетки, подго-
товленной к оплодотворению и последующему переходу к конст-
руированию зародышевого организма,— включает множество ва-
риантов, различающихся в особенности формами взаимодействия
с фолликулярными клетками, а также способами формирования
и подачи рибосом в цитоплазму.
Рибосомно-ядрышковый аппарат, как и следует ожидать в свя-
зи с его ролью в синтезе белка, характеризуется чрезвычайно
высокой активностью в процессе оогенеза. В первой части книги
приводились данные, относящиеся к различным формам метаболи-
ческой активности ядрышка в процессе оогенеза: выдача рибосом
диффузным способом с последующим монтажем ядрышковых
структур в ооплазме; различные формы выхода ядрышек и их
фрагментов в ооплазму; выход ядрышек и монтаж околоядрыш-
ковых мембран в цитоплазме (акцессорные ядра перепончатокры-
лых) . Меньше внимания было уделено метаболической активности
хромосом.
СТРОИТЕЛЬНАЯ И ФУНКЦИОНАЛЬНАЯ АКТИВНОСТЬ
ХРОМОСОМ — ЛАМПОВЫХ ЩЕТОК
После ауторадиографического и электронно-микроскопическо-
го анализа метаболической активности хромосом—ламповых ще-
ток в ооцитах рыб, амфибий, рептилий, птиц, насекомых, рако-
образных и некоторых других животных стало очевидно, что
хромосомы активно участвуют в формировании рибосом или их
структурных предшественников. Хромосомы — ламповые щетки —
это по существу нуклеолохромосомы, несущие в себе огромный
запас главного ядрышкового компонента — рибосом. Если обра-
титься к светооптической структуре ядер ооцитов с хромосома-
ми—ламповыми щетками, нетрудно обнаружить, что хромосомы,
особенно на ранних этапах оогенеза, располагаются в ядрах ра-
диально, связывая ядрышко с ядерной мембраной наподобие спиц
« 130 »
СТРОИТЕЛЬНАЯ АКТИВНОСТЬ ЖЕНСКОЙ ПОЛОВОЙ КЛЕТКИ
колеса. В ходе оогенеза растущее ядро сохраняет топографические
отношения ядрышка и хромосом, хотя и с несколько меньшей де-
монстративностью в связи с ростом хромосом в длину. Создается
впечатление, что рибосомы, формирующиеся на хромосомах—лам-
повых щетках, поступают с хромосом в ядрышко, перемещаясь с
периферии к центру. Таким образом, путь рибосом из ядра в
ооплазму включает следующие инстанции: хромосомы—лампо-
вые щетки — ядрышко — ооплазма (вместе с ядрышком или его
фрагментами или диффузным способом).
Таким образом, вырисовывается одна из широко используемых
ооцитом форм монтажа конструкции ядра — конструирование ап-
парата хромосом—ламповых щеток, с помощью которого обеспе-
чивается интенсивная продукция рибосом, необходимая для син-
теза белка в ооплазме. Сейчас еще трудно сказать, с чем связан
выбор этой формы участия ядра в развитии ооцита. Можно было
бы предположить, что тенденция к формированию хромосом—
ламповых щеток определяется общими структурными особенно-
стями ядер у видов данной группы, в частности персистирующим
хромосомным строением ядер. Это предположение оправдывается
для некоторых групп, например для насекомых (в частности, дву-
крылых) , у которых очень велика тенденция к сохранению хромо-
сомной структуры ядра в интеркинезе и формированию ядер
Балбиани во многих органах. У десятиногих раков по нашим наб-
людениям ядра многих органов отличаются интерфазной струк-
турированностью. Однако у всех позвоночных, обладающих хро-
мосомными ядрами (т. е. развитием хромосом—ламповых щеток)
в ооцитах, хромосомная конструкция соматических ядер являет-
ся не правилом, а исключением.
Возможно другое предположение — связь хромосомной конст-
рукции ядра с размерами ооцита. Действительно, среди позвоноч-
ных развитие аппарата хромосом—ламповых щеток обнаружено у
рыб, амфибий, рептилий и птиц, ооциты которых обладают круп-
ными размерами, и не обнаружено или слабо выражено у мле-
копитающих, ооциты которых отличаются малой величиной. Од-
нако это правило трудно приложить к беспозвоночным, с их ог-
ромными вариациями размеров ооцитов в каждой крупной
таксономической группе. Среди ракообразных десятиногие раки
характеризуются хромосомной конструкцией ооцитов, которые об-
ладают сравнительно крупными размерами. Однако у иглокожих
ооциты отнюдь не меньше, а хромосомная конструкция ядер в
оогенезе выражена слабо. Для окончательного вывода явно не
хватает сравнительно-морфологических данных.
« 131 »
9*
ФУНКЦИОНАЛЬНАЯ МОРФОЛОГИЯ И ФИЛОГЕНИЯ КЛЕТКИ
ГЛАВНАЯ СТРОИТЕЛЬНАЯ ЗАДАЧА
ХРОМОСОМ - ЛАМПОВЫХ ЩЕТОК
Хромосомная конструкция ядер ооцитов не вызывает никаких
недоуменных вопросов в современной литературе, хотя совершен-
но очевидно, что структурная модификация ядра выходит далеко
за пределы общепринятых представлений о функции хромосом и
хроматина. Более того, хромосомы—ламповые щетки рассматри-
ваются как весьма удобные объекты для изучения генетической
функции и распределения генов в хромосомах. Между тем имен-
но этот объект с исключительной демонстративностью показывает
широкие возможности использования хромосом для осуществления
задач, не имеющих прямого отношения к хранению и распределе-
нию наследственности с помощью хромосомного аппарата.
Главная задача, ради которой в организме строится ооцит с
хромосомами—ламповыми щетками, заключается в том, чтобы
создать крупную клеточную конструкцию, способную накопить и
хранить запасы строительных материалов, необходимых для стро-
ительства раннего эмбриона. Эта задача осуществляется с помо-
щью рибосомного аппарата, ответственного за синтез белков в
ооплазме. Рибосомы конструируются в ядре. Для того чтобы обес-
печить необходимую интенсивность синтеза, клетка мобилизует
свои ядерные субклеточные компоненты — ядрышко и хромосомы,
из которых строит конструкцию ядрышко—хромосомы—ламповые
щетки. Ядрышко в этой конструкции строится несомненно из
ядрышкового материала ядра. Но это — специализированное яд-
рышко, приспособленное к чрезвычайно интенсивному синтезу
рибосом и выдаче их в ооплазму с помощью различных, указан-
ных выше способов. Характерная особенность всех изученных
нами в оогенезе десятиногих раков форм ядрышек — слабая
фельген-позитивная реакция. В этих ядрышках присутствует
ДНК, участвующая, очевидно, в синтезе белкового компонента и
РНК рибосом. В противоположность ядрышкам хромосомы—лам-
повые щетки начиная с определенного этапа цитогенеза фельген-
негативны.
РЕДУКЦИЯ ДНК В ХРОМОСОМАХ — ЛАМПОВЫХ ЩЕТКАХ
Вопрос о наличии ДНК в хромосомах—ламповых щетках име-
ет длинную историю. С тех пор как А. Маршак и С. Маршак
[A. MarshaK, С. Marshak, 1955] выступили с сенсационным со-
общением об отсутствии ДНК в ядрах развивающихся половых
клеток, появилось немало заявлений о наличии ДНК в этом объ-
екте в замаскированной форме, а также о возможности открытия
ДНК в ядрах ооцитов после центрифугирования, когда ДНК кон-
денсируется в более узком пространстве, где его нетрудно открыть
с помощью реакции Фельгена [Браше, 1960; см. также: Дэвидсон,
1972]. Однако за немногими исключениями все эти заявления
« 132 »
СТРОИТЕЛЬНАЯ АКТИВНОСТЬ ЖЕНСКОЙ ПОЛОВОЙ КЛЕТКИ
опирались ие столько на конкретный структурный цитохимиче-
ский анализ с помощью современных средств исследования,
сколько на убежденность современных биологов в том, что синтез
рибосомных полимеров (белкого компонента и РНК) в хромосо-
мах—ламповых щетках, как и во всех других обследованных объ-
ектах, возможен только на основе транскрипции с ДНК. Между
тем в мировой литературе после выступления супругов Маршак
и разъяснений, данных биохимиками и цитологами, включая реп-
лику Браше [1960], не появлялось ни одной убедительной работы,
демонстрирующей с помощью современных методов наличие ДНК
в дефинитивных хромосомах—ламповых- щетках (а также и в
других объектах этого ряда).
В известных обзорах и монографиях, где обсуждается этот
вопрос, приводятся заявления биохимиков и цитологов (в первую
очередь Браше) и не представляется достаточно убедительных
доказательств наличия ДНК в хромосомах—ламповых щетках.
Данные Изава и соавторов [Izawa et al., 1963] по определению
ДНК в хромосомах—ламповых щетках тритона не решили вопро-
са, так как ДНК определялась по принципу разрушения ДНК-
азота, а не прямым способом. Ни одному исследователю не уда-
валось выявить синтез ДНК в хромосомах — ламповых щетках с
помощью радиоавтографического метода, хотя синтез РНК и бел-
ков с помощью меченых предшественников выявляется с полной
очевидностью. Никому не удалось достаточно убедительно пока-
зать распыление ДНК по широкой площади срезов ядер ооцитов
с хромосомами —ламповыми щетками посредством цитофотомет-
рического метода. Не убеждают в этом и данные, полученные с
помощью центрифугирования и последующей реакции Фельгена
по методу Браше.
Причина трудностей с выявлением ДНК в хромосомах—лам-
повых щетках заключается, по-видимому, в том, что процесс ре-
пликации ДНК на определенном этапе развития ооцитов прекра-
щается и в хромосомах остаются только белок и РНК, т. е. в ос-
новном рибосомный материал, маскирующий остаточную,
бездействующую нить ДНК.
Общеизвестно, что наиболее достоверными методами — реак-
цией Фельгена и радиоавтографическими тестами на включение
предшественников ДНК в хромосомах — ламповых щетках не об-
наруживается. Можно представить себе, что минимальное для
диплоидной клетки количество ДНК пребывает в растущем ооци-
те без репликации, по которой ее выявляют с помощью радиоав-
тографии. Однако трудно допустить, что рост ооцита, сопровож-
дающийся исключительно высоким темпом синтеза РНК и фор-
мирования белковых структур, мог быть обеспечен на всем
протяжении формирования дефинитивного ооцита бессменными
материалами ДНК. Следы ДНК в виде волокнистого компонента,
связывающего рибосомный материал в форме известной конст-
« 133 »
ФУНКЦИОНАЛЬНАЯ МОРФОЛОГИЯ И ФИЛОГЕНИЯ КЛЕТКИ
рукции хромосом—ламповых щеток, вероятно, сохраняются в
хромосомах, но, очевидно, совсем в другом виде по сравнению с
типичной конструкцией хромосом. Скорее всего, этот сохраняю-
щийся в хромосомах минимум ДНК принадлежит факторам мен-
делевской наследственности, наличие которых в женской половой
клетке доказывается генетическими методами. Что же касается
синтеза рибосомальной РНК, то логичнее допустить, что он осу-
ществляется в растущем ооците путем саморепликации (т. е. по
способу РНК^РНК), скорость которой, очевидно, превышает ти-
пичный путь репликации—транскрипции (ДНК-»-ДНК->-РНК).
Попытки выявления ДНК с помощью наиболее совершенных
методов в хромосомах—ламповых щетках продолжаются и по на-
стоящее время с переменным успехом. Еще в 1965 г. был исполь-
зован метод флуоресцентно-микроскопического определения ДНК
в хромосомах—ламповых щетках с помощью реакции на псевдо-
изоцианин, превосходящей по чувствительности метод Фельгена
[Sterba, Schaffner, 1965]. Однако при испытании этого метода на
различных объектах выяснилось, что ДНК в хромосомах—лампо-
вых щетках обнаруживается не во всех случаях. Так, например,
в ооцитах карповых рыб ДНК в хромосомах — ламповых щетках
не удается выявить ии с помощью реакции Фельгена, ни при
применении псевдоизоцианинового метода [Baumeister, 1973].
Между тем, по данным этого автора, в ядрышках ооцитов интен-
сивно включаются предшественники РНК, обнаруживаемые с по-
мощью радиоактивной метки. Трудно представить себе возмож-
ность активной транскрипции РНК на молекулах ДНК, не под-
вергающихся самообновлению (редупликации) на протяжении
длительного срока функционирования хромосом—ламповых
щеток.
Не появлялось в литературе и попыток разобраться в динами-
ке постепенного уменьшения количества ДНК в растущих ооци-
тах с помощью реакции Фельгена. По-видимому, этот процесс
осуществляется с различной скоростью у разных видов. В обсле-
дованных нами объектах, даже принадлежащих к одной группе
животных, падение содержания ДНК, обнаруживаемое с помощью
реакции Фельгена, происходит совершенно по-разному у разных
представителей группы. В растущих ооцитах рака фельген-пози-
тивные участки в хромосомах—ламповых щетках сохраняются,
когда ооцит достигает довольно крупных размеров. На этом
этапе, очевидно, значительное количество ДНК можно открыть в
ооцитах после центрифугирования по Браше. Однако дефинитив-
ный ооцит, достигший максимальных размеров, полностью лишен
фельген-позитивных участков в хромосомах—ламповых щетках,
которые дают выраженные реакции только на белок (окраска
светлым зеленым) и на РНК (окраска пиронином). В таких слу-
чаях, естественно, предварительное центрифугирование не даст
никакого преимущества в выявлении ДНК реакцией Фельгена.
« 134 »
СТРОИТЕЛЬНАЯ АКТИВНОСТЬ ЖЕНСКОЙ ПОЛОВОЙ КЛЕТКИ
У других обследованных нами видов десятиногих раков — кре-
веток и крабов — наблюдается значительно более стремительное
падение содержания фельген-позитивного материала в хромосо-
мах—ламповых щетках. У северной креветки (Sclerocrangon bo-
realis) фельген-позитивный материал в хромосомах — ламповых
щетках сохраняется только в участках, прилежащих к ядерной
мембране, и только до увеличения диаметра ядра вдвое против
лептотенной стадии. В более крупных ядрах ДНК-позитивный ма-
териал не открывается. Сходный тип развития ядер ооцитов у
травяного краба (Caricnus maenas).
СПЕЦИФИЧЕСКАЯ КОНСТРУКЦИЯ ЯДРА ООЦИТОВ
Таким образом, следует признать, что складывающаяся в раз-
вивающейся женской половой клетке ситуация вынудила клетку
использовать субклеточные ядерные компоненты для формирова-
ния специфической конструкции, пригодной для осуществления
того сверхинтенсивного синтеза РНК и рибосомального белка,
который в состоянии обеспечить производство рибосом, необхо-
димых для синтетических процессов в ооплазме. Эта конструкция
включает: 1) хромосомы—ламповые щетки, которые представля-
ют собой продукт превращения типичных фельген-позитивных
хромосом в фельген-негативные хромосомы, продуцирующие ри-
босомы; 2) ядрышко, интенсивно продуцирующее и накапливаю-
щее рибосомы. У десятиногих раков ядрышко составляет цен-
тральную часть ядерной конструкции, продуцирующей рибосомы.
Ядро ооцита северной креветки содержит ядрышко, достигающее
видимости невооруженным глазом (рис. 29). В первой части
книги были приведены данные о различных типах репродукции
ядрышек (выдача свободных рибосом в ооплазму, с последующим
формированием цитоплазматических ядрышек-цитонуклеол, де-
ление и почкование ядрышек с последующим выходом в ооплаз-
му, массированный выход ядрышек в ооплазму). Выход ядрыш-
кового материала из ядер ооцитов в цитоплазму — важнейший
момент в осуществлении рабочего цикла ядрышко-рибосомной
конструкции ооцита. В результате этого процесса становится
возможным рабочий цикл цитоплазматических конструкций ооци-
та, сформированных клеткой для производства желточных телец
и желточных ядер.
ЦИТОПЛАЗМАТИЧЕСКИЕ КОНСТРУКЦИИ ООЦИТА
Имеется много описаний синтеза желтка в ооцитах различных
видов животных (черви — Emanuelsson, 1971; многоножки — Be-
ams, Sekhon, 1966; ракообразные — Beams, Kessel, 1963, 1968;
Dumont, Anderson, 1967; Ganion, Kessel, 1972; насекомые —
Anderson, 1964; Favard-Sereno, 1964; Roth, Porter, 1964; Norre-
« 135 »
ФУНКЦИОНАЛЬНАЯ МОРФОЛОГИЯ И ФИЛОГЕНИЯ КЛЕТКИ
Рис, 29. Некоторые типы конструкции яйцевых клеток с разными формами
ядрышковых аппаратов
А — северная креветка Sclerocrangon borealis. Гигантское ядрышко с центральной
вакуолью; Б — травяной краб Carchius maenas. Шаровидное ядрышко; В — пчела
Apis mellifica. Ядрышко в форме тутовой ягоды; Г — сибирский осетр Acipenser
baeri. Множественный ядрышковый аппарат, с выходом ядрышек в ооплазму
« 136 »
СТРОИТЕЛЬНАЯ АКТИВНОСТЬ ЖЕНСКОЙ ПОЛОВОЙ КЛЕТКИ
wang, 1968; иглокожие — Millonig et al., 1968; оболочники —
Kessel, 1966d; рыбы — Droller, Roth, 1966; амфибии — Spornitz,
Kress, 1971; Dumont, 1972; млекопитающие — Wischnitzer, 1970],
а также обзоров исследований по развитию ооцитов, выполненных
с помощью современной техники исследования [Hadek, 1965;
Stegner, 1967; Norrevang, 1968; Guraya, 1977].
Как отмечалось выше, пока еще нет возможности рассмотреть
цитоплазматические конструкции, связанные с синтезом желтка в
ооцитах в эволюционно-морфологическом плане. Строительство
ооцитов осуществляется у всех низших многоклеточных живот-
ных, причем нет оснований полагать, что желточные аппараты
ооцитов у гидры или у планарии строятся с помощью менее со-
вершенных механизмов, чем у ракообразных, насекомых или
рыб.
Желточные тела содержат белковый, углеводный и липидный
компоненты у животных организмов, и вполне закономерно,
что для формирования этих сложных образований используются
все субклеточные цитоплазматические системы, способные к син-
тетическим процессам [Norrevang, 1968]. Достаточно вспомнить
так называемые желточные ядра, которые по современным дан-
ным представляют собой сложные комплексы митохондрий, эрга-
стоплазматических и ретикулоплазматических компонентов, объ-
единяемых общими мембранами [см.: Равен, 1964]. Для общей
ориентации в устройстве цитоплазматической конструкции ме-
ханизма, синтезирующего желток, можно обратиться к электрон-
но-микроскопическим данным по синтезу желтка у рыбы Lebistes
reticulatus guppyi [Droller, Roth, 1966].
Синтез желтка в ооцитах Lebistes проходит в три этапа. На
первом этапе, который приходится на первый период роста, основ-
ная активность принадлежит эргастоплазме, в которой осущест-
вляется интенсивный синтез белкового компонента желточных
шаров.
На вотором этапе активность эргастоплазмы дополняется
активностью ретикулоплазмы, которая участвует в синтезе угле-
водного и липидного компонентов желточных шаров. Наконец, на
третьем этапе, в синтез желтка включаются фолликулярные клет-
ки, которые образуют длинные ворсинки, внедряющиеся в цито-
плазму ооцита, где они ветвятся и формируют специфические
конструкции в виде гроздей гранул, несущих (или синтезирую-
щих) желточный материал.
D большинстве случаев, особенно при формировании крупных
ооцитов, богатых желтком, развитие желтковых образований вов-
лекает все клеточные органеллы, участвующие в синтезе белка:
ядрышко путем экструзии ядрышкового материала в цитоплазму
и развития из него рибосомно-ядрышковых конструкций; эргасто-
плазму, непосредственно синтезирующую белки; ретикулоплазму
(аппарат Гольджи), участвующую в сегрегации конечного про-
« 137 »
ФУНКЦИОНАЛЬНАЯ МОРФОЛОГИЯ И ФИЛОГЕНИЯ КЛЕТКИ
дукта и обогащении его глико-
геном; и митохондрии, прояв-
ляющие свойство не только
обеспечивать энергетические по-
ЯМ ЯЗш
требности ооплазмы, строящей
желточные тельца, но и непо-
средственно участвовать в син-
тезе и аккумуляции первичных
желточных формирований. Раз-
витие желточного белка обна-
ружено в митохондриях различ-
1 ных видов лягушек [Sung, 1961;
Эр Ward, 1962; Kessel, 1971; Mas-
sover, 1971; Kress, Spornitz,
1972] и моллюсков [Favard, Ca-
rasso, 1958].
В эволюционно-морфоло-
гическом плане строительство
желточных телец привлекает
интерес как рекапитуляция
процесса комплексирования
протоклеточных конструкций,
завершившегося в филогенезе
формированием клетки. Жел-
точное тельце во многих слу-
чаях, по своей сложности на-
поминает подобие клетки, в
особенности когда оно прини-
мает форму побочного ядра
[Nebenkern — см.: Равен,
1964]. В ооцитах некоторых
видов (например, пауков) [см.:
Равен, 1964] желточные или
побочные ядра имеют вид
сложных конструкций с кон-
Рис. 30. Формирование «побочного
ядра» (Nebenkern) в цитоплазме
ооцита паука Tegenaria parictina
Побочное ядро (ПЯ) формируется путем
-концентрического наслоения мембран-
ных компонентов ретикулоплазмы и
эргастоплазмы, а также митохондрий и
рибосомных комплексов. Я — ядро;
ЯМ — ядерная мембрана; Ядш — ядрыш-
ко; Эр — эргастосферы. Схема по элект-
ронной микрофотографии [по Андре из
Равена, 1964]
центрически наслоенными ми-
тохондриями и элементами эр-
гастоплазмы и ретикулоплазмы
(рис. 30). Особый интерес
представляет синтез ДНК, об-
наруженный с помощью Н3-
тимидиновой метки в желточ-
ных тельцах ооцитов некото-
рых видов животных [Mucken-
thaler, Mahowald, 1966; Ema
nuelson, 1971].
« 138 »
СТРОИТЕЛЬНАЯ АКТИВНОСТЬ ЖЕНСКОЙ ПОЛОВОЙ КЛЕТКИ
ВЗАИМОДЕЙСТВИЕ ООЦИТА
С ФОЛЛИКУЛЯРНЫМИ КЛЕТКАМИ
Взаимодействие с ооцитами посредством внедрения в ооплазму
ворсинок фолликулярных клеток представляет собой одну из
наиболее далеко зашедших форм участия фолликулярных клеток
в оогенезе. Нетрудно понять, что эта форма вполне демонстратив-
но отражает свойство ооцита включать в свой состав субклеточ-
ные компоненты других клеток, получающее наиболее полное
проявление в слиянии с мужской половой клеткой. Взаимодейст-
вие с фолликулярными клетками в какой-то мере имитирует оп-
лодотворение, т. е. включение в состав женской половой клетки.
Внедрение ворсинок фолликулярной клетки в цитоплазму ооцита
приводит к конструктивному обогащению механизма, продуциру-
ющего желток. Несмотря на общее происхождение, фолликуляр-
ные и половые клетки подвергаются достаточно глубокой дивер-
гентной дифференцировке, чтобы в результате их взаимодействия
было обеспечено некоторое повышение гетерогенности ооцитов.
Обследованные мной объекты (ооциты перепончатокрылых и
прямокрылых, ооциты голотурий), а также многочисленные объ-
екты, описанные в литературе [Равен, 1964], обнаруживают чрез-
вычайно большое разнообразие форм взаимодействия между ооци-
тами и фолликулярными клетками. Внедрение субклеточных ком-
понентов фолликулярных клеток в ооплазму представляет собой,
по-видимому, наиболее активный способ повышения гетерогенно-
сти половых клеток за счет соматических, приближающийся к
половому процессу. У коловратки Asplanchna, например, весь
набор органелл, участвующих в синтезе желтка (митохондрий,
эргастосом, ретикулосом), вероятно, поступает в цитоплазму
•ооцита из питающих клеток (вителлария) [Bentfeld, 1971]. Сход-
ный процесс описан в яичнике дрозофилы [King, 1960; Cumming,
1969]. У клопа Pyrrhocoris с помощью Н3-уридиновой метки об-
наружен ток РНК из ядер питающих клеток в цитоплазму ооцита
[Mays, 1972].
В других случаях, например, у перепончатокрылых, актив-
ность фолликулярных клеток во взаимодействии с ооцитами огра-
ничивается передачей высокомолекулярных продуктов через обо-
лочку ооцита, без проникновения через нее специальных вы-
ростов-ворсинок. Однако во всех случаях взаимодействия ооцитов
с фолликулярными клетками проявляется общая закономерность,
комплексирования клеточных систем, обусловленная способом
филогенетического происхождения клеток.
« 139 »
ФУНКЦИОНАЛЬНАЯ МОРФОЛОГИЯ И ФИЛОГЕНИЯ КЛЕТКИ
ФОЛЛИКУЛЯРНЫЕ КЛЕТКИ
ПОВЫШАЮТ ГЕТЕРОГЕННОСТЬ ООЦИТА
Ооцит нуждается во взаимодействии с фолликулярными клет-
ками не только для того, чтобы обеспечить свой рост путем прие-
ма пищевых средств от фолликулярных клеток. Ранние фазы раз-
вития ооцитов находятся в лучших условиях в этом отношении,
поскольку у всех животных, обладающих кровеносной сетью,
каждый ооцит оплетен густой сетью капилляров. Однако у всех
животных по мере роста ооцитов первоначальная фолликулярная
оболочка, состоящая из одного слоя плоских фолликулярных кле-
ток, превращается в целую систему крупных фолликулярных
клеток, вступающих в глубокое взаимодействие с ооцитом. Раз-
витие ооцита представляет собой весьма сложный процесс, вклю-
чающий самые разнообразные формы взаимодействия с фолли-
кулярными клетками, ради которых строится своеобразная кон-
струкция ядра и цитоплазмы ооцита. Эта конструкция начинает
свою работу сверхинтенсивной продукцией рибосом с помощью
ядерного аппарата, включающего хромосомную и ядрышковую ча-
сти, и заканчивает ее формированием сложного желточного ап-
парата, заполняющего всю цитоплазму.
Вопрос о происхождении желточных ядер в настоящее время
с внедрением современной техники исследования стал несколько
проясняться. Собственно, весь цитоплазматический аппарат ор-
ганелл, как мы видели, работает на их производство. Однако при-
рода желточных ядер и их биологическое значение продолжают
оставаться загадочными. После того как выяснились способы
участия всех органелл клетки в формировании желточных шаров,
отпадает старая трактовка этих образований как простых гранул
запасного питательного материала. По-видимому, это — скорее
специфические комплексные органеллы, содержащие в себе какой-
то информационный материал, используемый клетками развива-
ющегося эмбриона. В желточных ядрах неоднократно отмечалось
присутствие ДНК. В обследованных мной объектах ооциты реч-
ного рака, креветки желточные тельца всегда приобретали слабо-
фиолетовую окраску. Наличие ДНК в желточных гранулах отме-
чалось и другими авторами [Emanuelson, 1971]. Нельзя исклю-
чить того, что ДНК желточных телец обусловливает их специфич-
ность, необходимую для участия в морфогенетических процессах
при развитии эмбриона.
« 140 »
СТРОИТЕЛЬНАЯ АКТИВНОСТЬ ЖЕНСКОЙ ПОЛОВОЙ КЛЕТКИ
В ходе эволюции возникло огромное разнообразие половых
клеток, с которым связано приспособление к различным услови-
ям полового процесса и репродукции организмов. Дифференциро-
ванные гаметы — эугаметы — сформировались у многоклеточных
эукариотов, вероятно, как специфическое приспособление к ре-
продукции организмов, одержавших победу в борьбе за существо-
вание над одноклеточными эукариотами путем увеличения разме-
ров тела. Ооцит у всех многоклеточных эукариотов, начиная с
кишечнополостных и губок, отличается более крупными и даже
гигантскими размерами, по сравнению с соматическими клетка-
ми. Одна из самых характерных конструктивных особенностей
ооцита — развитие системы желточных телец (желточного аппа-
рата), с которыми связано обеспечение условий развития эм-
бриона.
Строительство желточного аппарата осуществляется ооцитом
путем мобилизации всех ядерных и цитоплазматических органелл.
Рибосомно-ядрышковый аппарат, поставляющий в ооплазму ри-
босомы, обогащается в большинстве случаев хромосомами—лам-
повыми щетками, интенсивно продуцирующими рибосомы, воз-
можно, с помощью упрощенного механизма репродукции РНК
(РНК->РНК) при глубокой редукции основного механизма
(ДНК->-РНК->-белок). Ядрышко ооцитов приобретает специфиче-
скую конструкцию, обеспечивающую интенсивное производство
рибосом и разнообразные способы вывода рибосомного материала
в ооплазму (вывод диффузно рассеянных рибосом, деление и поч-
кование ядрышка с выводом продуктов деления в ооплазму, мас-
сированный вывод ядрышек в ооплазму).
Цитоплазматические конструкции ооцита включают специфи-
ческий компонент — желточные ядра, в строительстве которых
принимают участие основные цитоплазматические органеллы —
эргастосомы и ретикулосомы. Желточные ядра имеют сложный
химический состав (белки, углеводы, липиды), в котором обнару-
живается ДНК, возможно, имеющая отношение к регуляции раз-
вития эмбриона. Желточные ядра развиваются при конструктив-
ном участии компонентов фолликулярных клеток, включая
врастание ворсинок фолликулярных клеток в ооплазму и взаимо-
действие их с развивающимися желточными тельцами.
« 141 »
ФУНКЦИОНАЛЬНАЯ МОРФОЛОГИЯ И ФИЛОГЕНИЯ КЛЕТКИ
Глава вторая
СТРОИТЕЛЬНЫЕ ПРОЦЕССЫ
В РАЗВИВАЮЩЕЙСЯ МУЖСКОЙ ПОЛОВОЙ КЛЕТКЕ
КОНСТРУКЦИЯ СПЕРМИН ПРИСПОСОБЛЕНА
ДЛЯ ВНЕДРЕНИЯ В ЯЙЦО
Еще более сложные строительные процессы осуществляются
субклеточными структурными компонентами клеток при форми-
ровании спермиев.
Выше указывалось, что в ответ на специфическую приспосо-
бительную трансформацию яйца вид вынужден соответственно
изменять конструкцию спермин, чтобы обеспечить половой про-
цесс. Этим объясняется то огромное разнообразие форм сперми-
ев, которое было обнаружено и обследовано еще с помощью све-
тооптической техники [см., например, Вильсон, 1936; Соколов,
1966]. Это разнообразие достигается путем видоизменения форм
спермиогенеза.
По-видимому, в процессах спермиогенеза и конструкциях де-
финитивных спермиев, так же как и в процессах оогенеза и кон-
струкциях зрелых ооцитов, нельзя обнаружить специальных за-
кономерностей их эволюционного преобразования, связанного с
эволюцией животного мира. В каждой таксономической группе в
ходе эволюции выработался специфический способ развития и
создался тип дефинитивной конструкции спермиев, очевидно,
в связи с приспособлением к конструкции яйца. Существенные
различия в способах спермиогенеза и формах дефинитивных спер-
миев обнаруживаются внутри каждой таксономической группы.
Однако сравнительно-морфологический анализ не позволяет уло-
вить в этой сфере каких-либо специальных эволюционных зако-
номерностей. Различают жгутиковые (хвостатые) и лишенные
жгутиков (бесхвостые) формы спермиев. Спермин растительных
организмов в большинстве случаев слабо дифференцированы и
сохраняют все ядерные и цитоплазматические органеллы, упако-
ванные специфическим для каждого вида способом (рис. 31).
Огромное большинство видов животных организмов, начиная с
кишечнополостных, обладает жгутиковыми спермиями. Для всех
членистоногих характерны жгутиковые спермин. Однако спермин
десятиногих раков обладают характерным безжгутиковым строе-
нием — многоотростчатой формой. У многих видов круглых чер-
вей обнаружены жгутиковые спермин, у аскарид спермин имеют
амебовидную форму. В настоящее время начинают накапливаться
электронно-микроскопические данные по строению и развитию
спермиев, обобщенные в нескольких обзорах [Nath, 1956; Idelman,.
1967; Pcchon-Masson, 1968; Phillips, 1970a; Comparative sperma-
tology, 1971].
« 142 »
СТРОИТЕЛЬНЫЕ ПРОЦЕССЫ В МУЖСКОЙ ПОЛОВОЙ КЛЕТКЕ
Рис. 31. Три формы конструкции спермиев растительных организмов
А — водоросль Vaucheria sescuplicana; Б — диатомея Llthodesmium undulatum;
В — водоросль Volvox. Спермий сохраняет основные формы клеточной конструкции,
включая ядро (Я) (в Б и В с персистирующим ядрышком — Ядш), митохондрии
(М) (в А и В проявляющие тенденцию к специфической упаковке) и пластиды (П)
(в В и В занимающие определенное место). Спермий Volvox содержит все ядерные
и цитоплазматические органеллы; Ж — жгутики (А, Б — из Comparative spermato-
logy, 1970)
Поскольку еще не представляется возможным рассмотреть
строение и развитие спермиев в животном мире в эволюционно-
морфологическом плане, можно дать только краткий обзор дан-
ных, относящихся к этому вопросу, с функционально-морфологи-
ческих позиций.
Клетка решает функциональную задачу — проникновение в
яйцо, обладающее специфическим типом строения. Эта задача оп-
ределяет выбор определенной формы и структуры спермия, осу-
ществляемый путем строительства спермия — процесса спермио-
генеза. Проникновение в яйцо — сложная техническая задача,
которая требует от спермия наличия определенных качеств, от-
сутствующих в большинстве соматических клеток. Такие качества
заключаются прежде всего в определенной плотности если не
всего тела спермия, то, по крайней мере, той его части, которая
первой проникает сквозь яйцевые оболочки в ооплазму. Очевидно,
« 143 »
ФУНКЦИОНАЛЬНАЯ МОРФОЛОГИЯ И ФИЛОГЕНИЯ КЛЕТКИ
прохождение спермин в яйцо требует не только механического,
но и химического воздействия на яйцевые оболочки и яйцо, что
должно получить отражение в развитии специальной структуры,
связанной с хранением литического фермента. При наличии опор-
ного и лизирующего блоков слияние половых клеток может быть
обеспечено механизмами комплексирования, о которых говорилось
в конце первой части книги. Как мы увидим ниже, у десятиногих
раков, действительно, процесс оплодотворения обеспечивается в
основном этими рабочими блоками при весьма слабом, сильно ре-
дуцированном действии энергетического и двигательного блоков.
У всех остальных, за немногочисленными исключениями, живот-
ных организмов спермин обладают высокоразвитыми и весьма
разнообразными по форме и структуре энергетическими и локо-
моторными блоками.
СПЕРМИЙ СТРОИТСЯ ИЗ ОРГАНЕЛЛ СПЕРМАТИДЫ
Мы рассмотрели строение и развитие яйца с функциональ-
но-морфологических позиций, чтобы понять, как субклеточные
компоненты клетки осуществляют свою строительную функцию,
конструируя такую специализированную и своеобразную клетку,
как ооцит. Мы убедились в том, что этот процесс приводит к
формированию с помощью всех субклеточных компонентов клет-
ки дефинитивного яйца, главным элементом строения которого
является особая комплексная цитоплазматическая конструкция —
желточный аппарат. Вероятно, будет целесообразно рассмотреть
с тех же позиций строение и развитие спермия.
В общих чертах и развитие, и строение спермиев были осно-
вательно обследованы с помощью светооптической техники. Ре-
зультаты этого обследования можно найти в любом руководст-
ве по цитологии и эмбриологии 30—40-х годов (Иванов, 1937;
Вильсон, 1940). Электронно-микроскопическое исследование уточ-
нило имеющиеся данные и выяснило детали, позволяющие со-
ставить более ясное представление о динамике структурных из-
менений клеточных частей (органелл) при спермиогенезе и о
природе структурных компонентов зрелого спермия.
По данным светооптической техники жгутиковые спермин
обладают ядром — производным ядра сперматиды, перфорато-
рием, или по современной терминологии акросомой — производ-
ным аппарата Гольджи, шейкой, расположенной между передней
и задней гранулами — производными центриолей, и жгутиком,
или хвостом, в котором различают промежуточную часть со спи-
рально расположенными митохондриями, главную часть — более
толстый отдел жгутика и концевую, тонкую нить. Электронно-
микроскопическое исследование подтвердило, что головка спермия
строится из ядра сперматиды, акросома — из аппарата Гольджи,
шейка — из центриолей, промежуточная часть — из митохондрий.
« 144 »
СТРОИТЕЛЬНЫЕ ПРОЦЕССЫ В МУЖСКОЙ ПОЛОВОЙ КЛЕТКЕ
В жгутике обнаружилась характерная для всех жгутиковых об-
разований система протофибрилл, расположенных в виде девяти
пар по периферии и пары жгутиков по оси жгутика. Однако
только электронно-микроскопическое исследование с полной де-
монстративностью показало, что зрелый спермин построен из спе-
циализированных субклеточных единиц и спермиогенез осуществ-
ляется как сложнейший строительный процесс субклеточными
компонентами клетки. Органеллы сперматиды строят спермин так
же, как клетки строят многоклеточные органы, например клетки
спермиогенного эпителия и соединительнотканные клетки строят
семенные канальцы. Но самое замечательное в этом процессе
заключается в том, что при различных типах или способах спер-
миогенеза клетка использует различные по функциональному зна-
чению субклеточные компоненты для решения одной и той же
строительной задачи.
ЯДРА СПЕРМИЯ
МОГУТ ОСУЩЕСТВЛЯТЬ МЕХАНИЧЕСКУЮ ФУНКЦИЮ
Удобнее всего начать описание строительных процессов, осу-
ществляемых субклеточными компонентами сперматиды при
спермиогенезе, с решения задачи конструирования опорного и
локомоторного блоков. Собственно, это одна из главных задач
спермиогенеза — построить клетку высокой прочности, способную
выдержать те механические напряжения, которые связаны с про-
движением спермия по половым путям и сквозь яйцевые оболоч-
ки. Клетка располагает для осуществления этого строительства
только цитоплазматическими органеллами и ядром — телами жид-
кой или полужидкой консистенции. Основной более или менее
перспективный строительный материал клетки — клеточные мем-
браны и высокополимерные молекулы ДНК, обладающие тен-
денцией к полимеризации в виде волокнистых конструкций. Ве-
роятно, механическую роль в клетке могут играть микротру-
бочки с аппаратом центриолей, используемые, в частности, для
строительства жгутика.
Ядро, действительно, трансформируется при спермиогенезе в
основную опорную часть клетки. Сейчас трудно перечислить и
классифицировать все структуры, которые возникают при конден-
сации хроматина в головке спермия (рис. 32). Ядра спермиев,
как правило, резко фельген-позитивны. ДНК упакована в ядре
спермия чрезвычайно плотно, приобретая в некоторых случаях
кристаллическую конструкцию [см.: Браше, 1961; Соколов, 1966].
В гистохимическом и электронно-микроскопическом исследовании
головок спермия петуха и лягушки было установлено спиральное
расположение ДНК, связанное с осуществлением механической
функции [Павлов и др., 1970]. Спиральное расположение хрома-
тина описал Ясузуми [Yasuzumi, 1974] в головке спермия во-
п А. Н. Студитский « 145 »
ФУНКЦИОНАЛЬНАЯ МОРФОЛОГИЯ И ФИЛОГЕНИЯ КЛЕТКИ
Рис, 32. Схемы конструкции спермиев различных животных
Конструкция спермия включает четыре основных строительных компонента: ядро
(Я) — изображено черным; жгутик (Ж) изображен с нитями протофибрилл; мито-
хондрии (М); акросома (А) — показаны ее конструктивные компоненты: АВ — акро-
сомная вакуоль, A (jh) — так называемое м-тело акросомы, If — внутренняя часть
акросомы — так называемый кристаллоид. Типичным для конструкции спермия
считается наличие акросомы, расположенной на переднем (прободающем) конце
спермия (7, 14). Однако у большинства представленных на рисунке форм спермия
акросома отсутствует. На прободающем конце спермия в этих случаях располага-
ется ядро (1, 9, 13), митохондрия 13, 10) или ядерно-митохондриальная конструк-
ция (2, 11). Жгутик может быть один (1, 7, 9—13, 14) или два (2), или заменен под-
вижными отростками (3, 8), или превращен в опорную конструкцию (5)
1 — гидроид Tubularia larynx [Afzelius, 1971]; 2 — турбеллярия; 3 — паразитический
червь Gnathosfonnula jenneri; 4— ракообразное из группы Ostracoda (Gypridopsis sp.);
« 146 »
СТРОИТЕЛЬНЫЕ ПРОЦЕССЫ В МУЖСКОЙ ПОЛОВОЙ КЛЕТКЕ
робья (Passer montanus). Ядрышковая РНК, как правило, отсут-
ствует. Структуры типа рибосом в ядре спермиев не обнаружены.
Характерной особенностью головки спермия, по-видимому, усили-
вающей ее опорную функцию, следует считать плотное сближе-
ние плазмолеммы с ядерной мембраной с минимальным простран-
ством между ними. Наиболее очевидное доказательство приобре-
тения ядром опорной (механической) функции заключается в
формировании безакросомных (анакросомных) спермиев.
Безакросомная конструкция спермиев обнаружена у гидрои-
дов [Lunger, 1971], некоторых нематод и трематод [Silveira, Por-
ter, 1964], а также у низших ракообразных — изопод [Reger,
1964], некоторых насекомых [Makielcki, 1966]. У одного из видов
нематод — Nippostrongylus brasiliensis описана [Jamuar, 1966]
чрезвычайно своеобразная форма спермия, напоминающая руч-
ную гранату или лопатку, в ручке которой помещается удлинен-
ное ядро с микротрубочками, расположенными вдоль централь-
ноосевой части, а в расширенной части, вокруг центральноосе-
вого пучка микротрубочек плотно упакованы специфически
дифференцированные митохондрии. Акросо.мы нет. Очевидно, ме-
ханическая функция, обеспечивающая внедрение спермия в яйцо,
осуществляется ядром. То же можно сказать и о других формах
безакросомных спермиев.
ПЛАСТИЧЕСКАЯ ФУНКЦИЯ ХРОМАТИНА СПЕРМИЕВ
Эти интереснейшие в эволюционно-морфологическом плане
формы мужских половых клеток не привязаны исключительно к
низшим беспозвоночным. Имеются описания спермиогенеза и
строения зрелых безакросомных спермиев и у позвоночных, на-
пример костистых рыб, а также у высших беспозвоночных, на-
пример некоторых насекомых. У костистой рыбы Oligottus macu-
losus [Stanley, 1969] аппарат Гольджи, составляющий источник
формирования акросом у большинства жгутиковых спермиев, на
всем протяжении спермиогенеза не претерпевает каких-либо су-
щественных изменений в структуре и расположении около ядра.
Формирование головки спермия начинается с уплотнения ДНК
внутри ядра. ДНК, уплотняясь, образует серповидную фигуру,
прижатую к ядерной мембране. Эта серповидная фигура стано-
вится основой головки спермия, лишенного акросомы.
Среди насекомых у кокцид (щитовок) использование хрома-
тина для опорной функции спермия чрезвычайно демонстратив-
но: в процессе спермиогенеза хромосомы выходят из ядра и пе-
5— Collembola (Anurida maritima); 6 — многоножка из группы Diplopoda (Spirostrep-
tus); 1 — двустворчатый моллюск (Mytilus edulls); 8 — клещ Amblyomma dissimili;
9—23 — костистые рыбы: Periophtalmus papilii (9), Ethmalosa fimbriata (10), Sardi-
nella aurita (11); 12 — Ophioblennius atlanticus; 13— Scorpaena angolensis; 14— чере-
паха; 2—8, 13, 14 — из Comparative spermatology
« 147 »
10*
ФУНКЦИОНАЛЬНАЯ МОРФОЛОГИЯ И ФИЛОГЕНИЯ КЛЕТКИ
реходят в хвостовую часть, располагаясь друг за другом конец в
конец, в виде головки спермия [Hughes-Schrader, 1946]. Сходное
расположение хромосом — конец в конец — доказано с помощью
авторадиографического метода для нитевидных спермиев кузнечи-
ков [J. Taylor, 1964].
Ядра спермиев нитевидной формы описаны у некоторых видов
планарий [Linden, 1969]. Тонкое, сильно вытянутое ядро с па-
раллельным оси чрезвычайно плотным расположением тяжей ДНК
описано у саранчи Locusta migratoria [Chevaillier, Gusse, 1975].
Собственно, опорную роль ядро играет и в акросомных спер-
миях. Имеется много вариантов взаимодействия ядер и акросом
как опорных структур в головках спермиев различных видов жи-
вотных. Акросома может быть чрезвычайно крупной, по сравне-
нию с ядром, как, например, у морской свинки [Fawcett, 1965],
или значительно уступать в размерах ядру, как, например, у дву-
створчатых моллюсков [Galtsoff, Philpot, 1960; Pasteels, Harven,
1962; Nijima, Dan, 1965] и у низшего ракообразного из группы
лимулюсов (Xiphosura polyphemus) [Andre, 1963]. По описанию
спермиогенеза и строения зрелого спермия у опоссума (Caluro
mys philander) [Phillips, 1970c], ядро и акросома этого объекта
образуют единую механическую систему. Наконец, описано нема-
ло объектов с очень крупной головкой и весьма слабо развитой
акросомой.
У Upeneus prayensis из костистых рыб при отсутствии или очень
слабом развитии акросомы головка включает ядро, имеющее вид
конуса, от основания которого почти до вершины конуса по его
оси проникает цеитриолярный аппарат и микротрубочки хвоста
[Boisson, 1960].
В большинстве случаев ядро и акросома связаны в сложный
комплекс, в котором один из компонентов может глубоко прони-
кать в другой (см. рис. 32).
ОПОРНО-ДВИГАТЕЛЬНАЯ ФУНКЦИЯ ХРОМАТИНА
В СПЕРМИЯХ ДЕСЯТИНОГИХ РАКОВ
Чрезвычайно демонстративна опорная функция хроматина
(ДНК) в безжгутиковых спермиях десятиногих раков. Этот объ-
ект был детально описан в классической монографии Н. К. Коль-
цова [1905], посвященной строению и развитию спермиев деся-
тиногих раков. Кольцов обнаружил в спермиях некоторых видов
этой группы проникновение хроматина в отростки, составляющие
опорно-двигательный аппарат спермиев. В настоящее время точ-
но установлено, что основную массу тела спермиев этой груп-
пы составляет огромная акросома, а ядро имеет вид уплощенной
шапочки, одевающей акросому, с отростками, содержащими фель-
ген-позитивный материал [Yasuzumi, 1960; Chevailler, 1967; Ро-
chon-Masson, 1968; Yasuzum, 1974].
« 148 »
СТРОИТЕЛЬНЫЕ ПРОЦЕССЫ В МУЖСКОЙ ПОЛОВОЙ КЛЕТКЕ
По-видимому, каждый вид десятиногих раков характеризует-
ся специфическим строением спермия и способом спермиогенеза.
Однако общей чертой, характерной для этой группы, является
развитие ядра спермия в виде плоской шапочки (или зонтика)
с фельген-позитивными выростами, входящими в отростки спер-
мия. Наблюдения, относящиеся к взаимодействию спермия и яйца
одного из видов десятиногих раков [Brown, 1966], показали, что
отростки спермия, содержащие фельген-позитивный материал,
действительно, служат для укрепления спермия на поверхности
наружной яйцевой оболочки и играют, следовательно, опорно-дви-
гательную роль.
В работах, осуществленных совместно с Г. В. Еляковой [Сту-
дитский, 1970, 1971; Студитский, Елякова, 1971], на спермиях
речного рака (Astacus leptodactylus) были показаны соотноше-
ния между светооптической и электронно-микроскопической кар-
тинами спермиогенеза (см. рис. 33). В начальном периоде спер-
миогенеза ядро сперматиды при обследовании с помощью свето-
оптической техники обнаруживает тонкозернистую структуру.
Развитие ядра спермия включает появление уплотнений и разрых-
лений хроматина с одновременным впячиванием стенки ядра в
той стороне, где возникает и развивается акросома [см. рис. 33, А].
Рост и дифференцировка акросомы сопровождаются уплощением
ядра, которое наподобие шапочки облегает акросому. В разви-
вающиеся отростки спермия входят ядерные выросты, которые
при обработке по Фельгену выглядят густой бахромой (см. рис.
33, В—Е).
Нитевидный компонент ядра, идентифицируемый как ДНК,
обнаруживается при электронно-микроскопическом обследовании
только внутри ядра, вокруг пучков микротрубочек. В ядерных
выростах, входящих в отростки спермия, нитевидный компонент
исчезает (рис. 34). Таким образом, фельген-позитивный компо-
нент отростков вступает, очевидно, в молекулярную связь либо
с ядерной оболочкой, что менее вероятно, либо с микротрубоч-
ками, образуя с ними единую опорно-двигательную конструкцию.
В настоящее время нет никаких данных о том, как осуществля-
ется превращение этой своеобразной формы ядра в мужской про-
нуклеус при оплодотворении и как сохраняется генетическая ин-
формация в интактном виде при формировании ядерных выро-
стов, в которых ДНК (фельген-позитивный материал) вступает
в молекулярные связи с ядерной оболочкой или микротрубочками.
Единственный бесспорный вывод из имеющихся данных по элект-
ронной микроскопии и гистохимии спермиогенеза у десятиногих
раков заключается в том, что клетка решает важную для нее
строительную задачу, широко используя пластические свойства
ДНК.
Что же касается происхождения этого неожиданного свойства
клетки — использовать ядерную ДНК для конструирования опор-
« 149 »
ФУНКЦИОНАЛЬНАЯ МОРФОЛОГИЯ И ФИЛОГЕНИЯ КЛЕТКИ
Рис. 33. Развитие спермия у речного рака
Фазы преобразования ядра в зонтикообразную головку зрелого спермия. А — Цен-
кер, железный гематоксилин; Б — Фельгенн-светлый зеленый, X 400; В—Е — дефи-
нитивные спермин речного рака. Ценкер, Фельген+светлый зеленый, X 1000. Фель-
генпозитивные отростки ядра входят в нитевидные выросты зонтика
но-двигательных органов клетки, то более или менее правдопо-
добное заключение по этому вопросу может базироваться только
на нашей генеральной концепции о единстве происхождения
всех клеточных органелл. Хромосомы как органеллы специали-
зированы на функции размножения клетки. Ниже будет показано,
что пластические и химические свойства ДНК, составляющей ос-
« 150 »
СТРОИТЕЛЬНЫЕ ПРОЦЕССЫ В МУЖСКОЙ ПОЛОВОЙ КЛЕТКЕ
Рис. 34. Спермий речного рака
Продольный срез. А — электронная микрофотография Г. В. Еляковой; Б — схема
конструкции А — акросома; ЗБ — замыкательная бляшка; АЦ — акросомный ци-
линдр; НК — наружное кольцо; О — отростки; Мт — микротрубочки
« 151 »
ФУНКЦИОНАЛЬНАЯ МОРФОЛОГИЯ И ФИЛОГЕНИЯ КЛЕТКИ
нову строения хромосом, обеспечивают возможность деления
клетки на две равные дочерние части. Хромосомы (в тех случаях,
когда они подвергаются демонтажу в телофазе и вторичному мон-
тажу в профазе) строятся путем конденсации мономеров и оли-
гомеров ДНК в макрополимерные конструкции. Специфичность
последовательностей мономеров в олигомерах (репликонах) ДНК
обеспечивает возможность повторного монтажа хромосом в профа-
зе после демонтажа в телофазе. Клетка свободно рассредоточи-
вает ДНК в интерфазе, собирая из свободных репликонов мак-
рополимеры ДНК в хромосомах. Как правило, мембранный ком-
понент ядра не играет существенной роли в конструировании
хромосом. Однако в других субклеточных образованиях клетки
мембранный компонент нередко оказывается вовлеченным в про-
цесс конструирования опорных блоков клетки. В процессе спер-
миогенеза десятиногих раков ядерный мембранный компонент
участвует в формировании опорных (или опорно-двигательных)
конструкций клетки.
Формирование спермия из сперматиды у десятиногих раков
начинается с глубоких изменений конструкции ядра, которое вы-
брасывает длинные отростки в цитоплазму. В дальнейшем вся
цитоплазма пронизывается ядерными выростами, вступающими в
теснейшее взаимодействие с плазмолеммой. Ядро зрелого спермия
образует мембранный комплекс с плазмолеммой в виде плот-
ных, нередко многослойных, как бы гофрированных устройств,
разделяющих свободные от мембран ядерные пространства, в ко-
торых располагаются микротрубочки и сеть волокон ДНК. Таким
образом, клетка использует мембранный и волокнистый компо-
ненты ядра для строительства опорного (или опорно-двигатель-
ного) аппарата спермия. В отличие от хромосом нитевидные вы-
росты ядра, входящие в опорные нити спермия, включают два
мембранных компонента (кариолемму и плазмолемму), а также
микротрубочки, образующие, по-видимому, молекулярный комп-
лекс с ДНК. Однако и в митотическом делении, и в спермио-
генезе, а в дальнейшем и в половом процессе макрополимеры
ДНК выступают в качестве конструкций, осуществляющих, кро-
ме других жизненных отправлений, опорную функцию клетки.
Наряду с ядром клетка трансформирует и другие органеллы,
обеспечивая им вместе с осуществлением специфической функ-
ции механические свойства, необходимые для реализации поло-
вого процесса.
ПЛАСТИЧЕСКАЯ РОЛЬ МИТОХОНДРИЙ
В СТРОИТЕЛЬСТВЕ СПЕРМИЯ
Упаковка митохондрий в виде плотного комплекса в проме-
жуточной части хвоста спермия была выявлена при исследовании
спермиогенеза еще с помощью светооптических средств исследо-
вания. В настоящее время накоплен большой фактический ма-
« 152 »
СТРОИТЕЛЬНЫЕ ПРОЦЕССЫ В МУЖСКОЙ ПОЛОВОЙ КЛЕТКЕ
териал, демонстрирующий различные формы локализации и упа-
ковки митохондрий в жгутиковых спермиях у различных видов
животных на электронно-микроскопическом уровне (см. рис. 33).
Едва ли можно сомневаться, что при высокой подвижности жгу-
тиковых (хвостатых) спермиев, преодолевающих относительно
весьма длинные дистанции в половых путях, митохондриальный
аппарат осуществляет энергетическую функцию. Некоторые фор-
мы жгутиковых спермиев (например, у птиц) характеризуются
относительно очень крупным промежуточным отделом, содер-
жащим митохондриальный аппарат. Однако во всех случаях объем
митохондриального аппарата доводится до очень высокой меха-
нической прочности путем плотной упаковки как содержимого
каждой отдельной митохондрии, так и всего пакета митохондрий
в целом. Крайним пределом уплотнения митохондриального па-
кета можно считать слияние митохондрий в ходе спермиогенеза
в одну или несколько гигантских митохондрий.
Так, например, две гигантские митохондрии спермия голово-
ногого моллюска Nautilus pompilius располагаются по двум сто-
ронам вдоль сильно вытянутого и уплощенного ядра, занимающе-
го основную часть головки [Arnold, Williams-Arnold, 1978].
Конструирование комплексных митохондриальных органелл
используется также при формировании высокоподвижных мышц.
У некоторых насекомых митохондрии мышечных волокон в ле-
тательных мышцах подвергаются слиянию в виде гигантских ми-
тохондрий [Smith, 1966].
Андре [Andre, 1962] и Идельман [Idelman, 1967] различают
следующие типы развития митохондриального комплекса при
спермиогенезе: 1) формирование побочного ядра в виде 1—4 круп-
ных слитных митохондрий у основания ядра (морской еж, дву-
створчатые моллюски, аннелиды); 2) развитие выраженного про-
межуточного отдела, в котором располагаются в виде манжетки
отдельные (не слитные) митохондрии с хорошо развитыми, ра-
диально расположенными ветвящимися кристами. В упаковке ми-
тохондрий чаще всего используется спиральный принцип (поз-
воночные) ; 3) формирование специфического митохондриального
комплекса, возникающего путем трансформации первичной струк-
туры, характерной для митохондриального комплекса в предшест-
вующей группе, во вторичную, специализированную конструк-
цию (насекомые, брюхоногие моллюски, скорпионы).
В последнее время появилось немало описаний строения и
развития спермиев, отличающихся совершенно своеобразными
формами упаковки митохондрий в митохондриальных комплек-
сах, например гигантских спермиев многоножек [Horstmann, Вге-
ucker, 1969] или ракообразных остракод [Zissler, 1968 a, b; Reger,
Florendo, 1969 а, b] (см. рис. 32). Сейчас еще трудно отнести
эти формы к тому или иному типу. Важно подчеркнуть, что
клетка использует высокоразвитую у митохондрий тенденцию к
« 153 »
ФУНКЦИОНАЛЬНАЯ МОРФОЛОГИЯ И ФИЛОГЕНИЯ КЛЕТКИ
комплексированию, ведущую начало от древнейшего состояния
сформировавшейся в филогенезе клетки, для конструирования са-
мых разнообразных митохондриальных комплексов, обладающих
необходимой при каждом данном способе полового процесса ме-
ханической прочностью при сохранении основной, энергетической
функции. В некоторых группах насекомых митохондрии, входя-
щие в конструкцию спермия, включают специфические кристал-
лические тела [Phillips, 1970а]. К сожалению, митохондрии
спермиев слишком мало обследованы с помощью биохимических
и молекулярно-биологических методов, чтобы можно было выска-
зывать какие-либо суждения о специфике их функции в поло-
вом процессе.
СПЕЦИФИЧЕСКИЙ МЕХАНИЧЕСКИЙ БЛОК
КОНСТРУКЦИИ СПЕРМИЯ — АКРОСОМА
Итак, строительство спермиев как жгутикового, так и без-
жгутикового типов включает активное использование ядра и ми-
тохондрий в качестве механических конструкций, с помощью ко-
торых обеспечивается внедрение спермия в яйцо. ДНК ядра упот-
ребляется клеткой в качестве универсального и пластического
материала. РНК ядра, вернее, весь рибосомно-ядрышковый мате-
риал к концу спермиогенеза в жгутиковых спермиях, по-види-
мому, исчезает. Таким образом, основная часть конструкции
спермия состоит из ядра, образующего головку, и промежуточ-
ной части, сформированной митохондриями. Оба эти рабочих бло-
ка наряду со специфическими функциями используются клеткой
для осуществления механической функции в половом процессе.
Не менее важной в функционально-морфологическом плане кон-
структивной особенностью спермиев следует считать формирова-
ние специфического прибора, обеспечивающего проникновение
спермия в яйцо — акросомы.
Акросома у жгутиковых спермиев располагается на прокси-
мальном конце головки. Это как бы шлем, покрывающий голов-
ку, чтобы облегчить внедрение спермия в яйцевые оболочки —
их перфорацию. Отсюда старое название этой структурной ча-
сти спермия — перфораторий, употребляемое и в настоящее время
для обозначения уплотненной части в проксимальном отделе ак-
росомы. Еще на рубеже XIX—XX столетий с помощью светооп-
тической техники было выяснено, что акросома жгутиковых спер-
миев возникает из аппарата Гольджи в виде тельца, которое
совершает переход от базальной к апикальной части ядра, где
заканчивает дифференцировку. Для безжгутиковых (бесхвостых)
спермиев десятиногих раков только после внедрения электронно-
микроскопической техники было установлено, что гигантская ак-
росома этих объектов формируется из мельчайших пузырьков
эргастоплазмы, приобретает сложное устройство, обеспечивающее
проникновение спермия в яйцо и занимает свое место в цент-
« 154 »
СТРОИТЕЛЬНЫЕ ПРОЦЕССЫ В МУЖСКОЙ ПОЛОВОЙ КЛЕТКЕ
ралыгой части спермия, сжав и оттеснив ядерный компонент к
периферии. Таким образом, к факту трансформации аппарата
Гольджи в активнейшую функциональную конструкцию спермия
прибавился факт подобной же трансформации другого мембран-
ного компонента клетки, и за все годы дальнейшего изучения
этих фактов в литературе не появилось никаких недоуменных
вопросов, связанных с их биологическим значением. Правильнее
будет сказать, что эти факты были восприняты и воспринимают-
ся сейчас как одно из проявлений высокой пластичности клет-
ки, обеспечивающей ее приспособление к самым разнообразным
жизненным ситуациям. Между тем подобно формированию жел-
точных телец женской половой клеткой формирование акросомы
мужской половой клеткой представляет собой один из самых уди-
вительных примеров трансформации структурных компонентов
клетки.
Что такое аппарат Гольджи, или система комплексов Гольд-
жи, с современной точки зрения на конструкцию клетки? Это
система мембран, участвующих в освобождении клетки (гиало-
плазмы) от конечных продуктов метаболизма. Конструктивно —
это часть мембранной системы клетки.
Что такое эргастоплазма с современной точки зрения? Это
тоже система мембран, образующих сеть — эндоплазматический
ретикулум, с двумя вариантами — гладким, примыкающим к
мембранам Гольджи, и шероховатым, покрытым рибосомами,
и, следовательно, каким-то образом участвующим в синтезе белка.
Другими словами, и то и другое — это мембраны, отграничиваю-
щие трубки, полости и цистерны, связанные с окружающей клетку
средой,— дренажная система цитоплазмы. В отличие от митохонд-
рий, представляющих собой бесспорные органеллы, в мембран-
ных. системах не улавливается активно действующая единица,
так сказать, субъект функции — то ли это пузырек-микросома,
то ли комплекс пузырьков — комплекс Гольджи, то ли комп-
лекс двойных гладких или шероховатых мембран, то ли зер-.
нышко-рибосома. И вот на фоне этой неясности появляется
абсолютная и полная ясность: комплекс Гольджи в сперматидах
жгутиковых спермиев отделяет от себя бесспорный индивидуали-
зированный компонент, зачаток одного из важнейших органои-
дов спермия — акросомы. Комплекс пузырьков эргастоплазмы у
безжгутиковых спермиев превращается в зачаток не менее сложно
организованной, индивидуализированной органеллы — акросомы.
Из мембранных комплексов клетки строится индивидуализиро-
ванный органоид с очень четко очерченными структурной и
функциональной характеристиками. Как могло это случиться?
Вне эволюционно-морфологического плана это событие в обоих
его вариантах принимается как факт, не требующий никаких
специальных разъяснений. Клетке потребовалось специальное
приспособление, обеспечивающее внедрение спермия в яйцо,— ап-
« 155 »
ФУНКЦИОНАЛЬНАЯ МОРФОЛОГИЯ И ФИЛОГЕНИЯ КЛЕТКИ
парат, способный выбрасывать особую нить, проникающую через
яйцевые оболочки и выделять особый фермент, разжижающий яй-
цевые оболочки и ооплазму. Изменчивость клетки и отбор ре-
шают эту задачу. Однако подобное суждение о выработке
приспособления клеткой не содержит в себе никакого биологиче-
ского содержания.
Сказать, что клетка может выработать любое нужное ей при-
способление путем отбора любых благоприятствующих измене-
ний — значит ничего не сказать, так как эволюционное измене-
ние ограничено законом Дарвина о примате структур и функций
меняющейся системы над действием условий, вызывающих пер-
вичное появление изменения, которое подлежит действию отбора.
Спермий не мог для осуществления своих функций выработать
такое приспособление, которое выходило бы за пределы струк-
турных возможностей, обусловленных его историческим прошлым,
например приобрести такие органы передвижения, как цирры,
присущие высшим инфузориям (Heterotricha). Цирры — продукт
сложного преобразования ресничек, представляющих собой орга-
ны движения низших инфузорий (Holotricha), которые, в свою
очередь, приобрели эти приспособления путем полимеризации
жгутиковых аппаратов бактерий. Спермию просто не из чего
строить цирры, равно как ему не из чего было бы строить ак-
росому, если бы в его конструкции не было структурных пред-
шественников.
Акросома возникает в онтогенезе спермия из мембранных ком-
понентов комплекса Гольджи (жгутиковые спермин) или эргасто-
плазмы (спермин декапод). С эволюционно-морфологической точ-
ки зрения это может означать только одно: мембранные системы
аппарата Гольджи и эргастоплазмы, действительно, представ-
ляют редуцированные и открытые объединения индивидуальных
межмембранных компонентов — эргастосом и ретикулосом, по при-
нятой нами терминологии. Акросома представляет собой специа-
лизированную органеллу, продукт эволюционной трансформации
ретикулосомы (жгутиковые спермин) или эргастосомы (спер-
мин декапод). Онтогенез акросомы позволяет с полной отчетли-
востью представить себе этот исторический процесс.
КАК СТРОИТСЯ АКРОСОМА ЖГУТИКОВЫХ СПЕРМИЕВ
Акросома жгутиковых спермиев, по данным электронно-мик-
роскопических исследований, возникает как электронно плотное
тельце внутри комплекса Гольджи. Нетрудно убедиться, что на
первых порах это образование — плотное тельце, одетое примы-
кающей мембраной, достаточно точно имитирует конструкцию
своего бактериоидного предка с тем различием, что оно строит-
ся в основном из белка, без дифференцировки нуклеоида и ри-
босомного аппарата.
« 156 »
СТРОИТЕЛЬНЫЕ ПРОЦЕССЫ В МУЖСКОЙ ПОЛОВОЙ КЛЕТКЕ
Важнейшей бактериоидной особенностью развивающейся ак-
росомы жгутиковых спермиев следует считать его способность
к передвижению — от базальной (или боковой) поверхности к апи-
кальной поверхности ядра, где акросома вступает с ядром в ти-
пичные для всех органелл топографические взаимоотношения, от-
деляясь от него двойной мембраной.
В литературе накопилось немало электронно-микроскопиче-
ских данных по дифференцировке акросомы [Idelman, 1967; Com-
parative spermatology, 1970; Dan, 1970; Phillips, 1970 а].
У многих видов строение акросомы достигает огромной и в
значительной мере нерасшифрованной сложности (см. рис. 33).
Не исключено, что у некоторых видов акросома строится из двух
компонентов (ретикулосом), один из которых превращается в
проксимальную палочковидную, а другой — в дистальную зерни-
стую части акросомы. Таковы, например, акросомы спермиев оли-
гохет [Cameron, Fogal, 1963; Reger, 1967; Andersen, 1968]. He ме-
нее сложна конструкция акросом у двустворчатых моллюсков.
Одна из самых важных особенностей конструкции акросом у мно-
гих беспозвоночных заключается в дифференцировке особого ак-
сиального аппарата, содержащего тонкую аксиальную нить, ко-
торая располагается в цилиндрическом, аксиально расположенном
теле.
Сравнительная морфология акросом разработана недостаточ-
но, чтобы можно было установить гомологию всех структурных
частей этой органеллы. Однако гомология аксиальной нити акро-
сомы спермиев у большинства обследованных видов не вызывает
сомнений. Это специальное приспособление, с помощью которого
осуществляется важнейший момент оплодотворения — первичный
контакт спермия с яйцом, включающий прободение яйцевых обо-
лочек. У большинства обследованных видов беспозвоночных взаи-
модействие спермия с яйцом при оплодотворении, так называе-
мая акросомная реакция, включает выбрасывание акросомной
нити, которая проходит сквозь яйцевые оболочки и проникает
в ооплазму, как бы открывая путь тельцу спермия. С эволю-
ционно-морфологической точки зрения аксиальная нить как ор-
ган движения с достаточной уверенностью можно гомологизи-
ровать с жгутиком бактерий.
АКСИАЛЬНАЯ НИТЬ АКРОСОМЫ —
ГОМОЛОГ ЖГУТИКА БАКТЕРИЙ
Свойство бактерий формировать жгутики как при вегетатив-
ном онтогенезе (формирование жгутиков и мезосом у дочерних
особей), так и при «половом процессе» (формирование F^-воло-
сков) неоднократно отмечалось выше. Несмотря на недостаточ-
ность данных по ультраструктуре аксиальной нити, ее связь с
поверхностью («плазмолеммой») и матриксом акросомы бесспор-
« 157 »
ФУНКЦИОНАЛЬНАЯ МОРФОЛОГИЯ И ФИЛОГЕНИЯ КЛЕТКИ
на. Выбрасывание аксиальной нити сопровождается особым про-
цессом разрушения акросомы, которая подвергается как бы выво-
рачиванию, так что аксиальная нить отходит от внутренней
акросомной мембраны. Все эти процессы в какой-то степени выра-
жены и у бактерий.
Итак, акросома жгутиковых спермиев — это ретикулосома,
подвергнувшаяся сложной дифференцировке с возвратом к не-
которым структурным признакам (формирование аксиальной
нити) бактериальных предков. Гомологичные отношения обна-
ружены в онтогенетическом и функциональном циклах акросомы
безжгутиковых спермиев десятиногих раков.
КОНСТРУИРОВАНИЕ АКРОСОМ
У БЕЗЖГУТИКОВЫХ СПЕРМИЕВ ДЕСЯТИНОГИХ РАКОВ
Строение зрелых спермиев и спермиогенез у десятиногих ра-
ков проявляют огромное видовое разнообразие, изученное еще
Н. К. Кольцовым [1905] и пересмотренное в наше время с по-
мощью электронно-микроскопической техники [Pochon-Masson,
1968]. В нашей лаборатории было обследовано строение зрелого
спермия и спермиогенез у речного рака [Студитский, Елякова,
1972].
Акросома зрелого спермия речного рака на сагиттальных сре-
зах при электронно-микроскопическом обследовании выглядит как
массивное округло-цилиндрическое тело (акросомный пузырек,
по терминологии Pochon-Masson, 1968), центральную часть кото-
рого занимает центральный цилиндр или акросомная трубка тон-
козернистого строения, вокруг которой располагается манжетка или
муфта ламеллярной или волокнистой структуры, а на апикальной
поверхности — замыкающая бляшка сложного мембранного строе-
ния (оперкулярный сфинктер по Пошон-Массон) (рис. 34). Мы
не занимались исследованием акросомной реакции, которая вы-
зывается у спермиев морских декапод действием гипотоническо-
го раствора воды [Pochon-Masson, 1968]. Эта реакция у краба
Carcinus maenas заключается в прободении (раскрытии) оперку-
лярного сфинктера и выворачивании (выпячивании) всего акро-
сомного пузырька, в результате чего центральный цилиндр (удар-
ный орган, по Пошон-Массон) высовывается из тельца спермия
в проксимальном направлении. Вероятно, такой же характер но-
сит акросомная реакция и у речного рака. Центральный цилиндр
при оплодотворении у рака играет, очевидно, роль прободающе-
го агента. Акросомная (аксиальная) нить у спермиев декапод не
обнаружена.
Однако если гомология акросомной (аксиальной) нити жгу-
тиковых спермиев и жгутика бактерий вполне вероятна, то го-
мология центрального цилиндра спермиев декапод с акросомной
нитью жгутиковых спермиев и с жгутиком бактерий представля-
« 158 »
СТРОИТЕЛЬНЫЕ ПРОЦЕССЫ В МУЖСКОЙ ПОЛОВОЙ КЛЕТКЕ
ется довольно фантастичной. Однако гомология акросомы спермия
декапод как целого с бактериоидным предком субклеточных ком-
понентов клетки кажется весьма вероятной,
В акросоме спермиев декапод и особенно спермия речного
рака мы впервые встречаемся с тенденцией органеллы к форми-
рованию сложных ламеллярных и микротрубочковых структур.
По данным нашей сотрудницы Г. В. Еляковой, акросома возни-
кает в эргастоплазме сперматиды как плотное скопление мелких
пузырьков (трубочек), отщепляющихся от цистерн эргастоплаз-
мы. Развитие акросомы осуществляется в тесном контакте с ядром,
которое рядом с увеличивающейся в объеме акросомой приобре-
тает характерный вид зонтика. При этом одновременно с ядром,
выросты которого вступают в связь с выпячиванием плазмолем-
мы, образуя плотный переплет многослойных мембран, акро-
сома также подвергается ламеллизации, особенно в зоне форми-
рующейся замыкающей бляшки. Этот процесс напоминает отча-
сти ламеллизацию мезосом, происходящую при делении бактерий.
Замыкающая бляшка, возможно, представляет собой гомолог ме-
зосомы. Вместе с тем процесс формирования контуров структу-
ры замыкающей бляшки напоминает и развитие жгутиков или
их гомологов — микротрубочек, так как на поперечном разрезе
эти контуры могут иметь вид точек. Однако гомологии всех ча-
стей акросомы установить затруднительно. Важно отметить толь-
ко, что акросома спермиев декапод развивается как индивидуали-
зированное целое, как специфическая органелла, сохраняющая
индивидуальность вплоть до начала осуществления своей функ-
ции — внедрения в яйцо. Сходство с бактериальным предком по-
лучает выражение и в способе функциональной активности акро-
сомы — выделении специфического литического фермента. Что
же касается акросомной реакции, включающий несвойственное
бактериям и не наблюдаемое у других органелл выворачивание
содержимого акросомы, то она подлежит дальнейшему сравни-
тельному анализу для вскрытия природы и механизма этого фе-
номена.
Оценивая все фактические данные по развитию, строению и
структурному выражению функциональной активности акросом,
можно сделать важный в эволюционно-морфологическом отноше-
нии вывод о родстве и гомологии этих органелл с другими ор-
ганеллами клетки и о наличии признаков, свидетельствующих о
сходстве акросом с бактериоидными предками субклеточных ком-
понентов клетки. Акросома — производное мембранных систем
клетки. Но онтогенез, дефинитивное строение и функциональ-
ная активность акросом показывают, что эти мембранные систе-
мы — эргастоплазма и ретикулоплазма — в действительности
представляют собой комплексы органелл, индивидуальность кото-
рых редуцирована, но может проявляться в таких ответствен-
ных ситуациях, как трансформация в новый тип органеллы,
« 159 »
ФУНКЦИОНАЛЬНАЯ МОРФОЛОГИЯ И ФИЛОГЕНИЯ КЛЕТКИ
функционально необходимый клетке. Клетка использует, таким
образом, для создания такой специфической и чрезвычайно важ-
ной конструкции все субклеточные компоненты как ядерные, так
и цитоплазматические, не останавливаясь перед глубокой транс-
формацией их функциональной активности в клетке. Практиче-
ски все субклеточные компоненты сперматиды, за исключением
ядрышко-рибосомного аппарата, используются для осуществления
главной задачи — построить мужскую половую клетку, способную
проникнуть в сложно дифференцированное яйцо: хромосомы (хро-
матин), митохондрии, ретикулосомы, эргастосомы. Специальная
задача возлагается на локомоторный аппарат — хвост, или жгу-
тик, достигающий у жгутиковых спермиев высокого совершенст-
ва организации и функциональной активности. Конструкция жгу-
тика (хвоста) спермиев подлежит дальнейшему эволюционно-мор-
фологическому исследованию.
Строительство мужских половых клеток связано с решением
главной задачи — обеспечить спермию возможность внедрения в
женскую половую клетку. Спермий строится из органелл спер-
матиды как конструкция высокой механической прочности, спо-
собная выдержать продвижение по половым путям и в среде
оплодотворения и проникновение через яйцевые оболочки в ооплаз-
му с сохранением своего информационного содержимого. В зави-
симости от условий решения этой задачи механическая функция
может осуществляться ядром, составляющим головку спермия,
причем в ряде случаев ядро строится как основная опорная
структура спермия при полном отсутствии специфического опор-
ного аппарата спермия — акросомы. Специфическую пластиче-
скую функцию несет хроматин в спермиях десятиногих раков,
заходя в опорно-двигательные отростки спермиев.
Митохондрии жгутиковых спермиев осуществляют энергетиче-
скую функцию. Однако их упаковка в промежуточной части хво-
ста преследует решение механической задачи — внедрения спер-
мия в яйцо. Слияние митохондрий в промежуточной части жгу-
тика в виде побочных ядер можно рассматривать как рекапиту-
ляцию эволюционного преобразования клона бактериоидных пред-
ков в клеточную конструкцию.
Специфический механический блок конструкции спермия —
акросома — формируется за счет ретикулосом (жгутиковые спер-
мин) или эргастосом (спермин десятиногих раков) как демон-
стративное выражение бактериальных потенций цитоплазматиче-
ских органелл. В особенно яркой форме бактериоидное предко-
вое состояние проявляется в конструировании аксиальной нити
акросомы — гомолога жгутикового аппарата бактериоидных пред-
ков клетки. Локомоторный аппарат — хвост, или жгутик, дости-
« 160 »
СТРОИТЕЛЬСТВО ЖГУТИКОВЫХ КОНСТРУКЦИЙ СПЕРМИЯ
гает у жгутиковых спермиев высокого совершенства организации
и функциональной активности. Конструкция жгутика (хвоста)
спермиев представляет большой эволюционно-морфологический
интерес.
.Глава третья
СТРОИТЕЛЬСТВО ЖГУТИКОВЫХ КОНСТРУКЦИИ
СПЕРМИЯ
ПРОИСХОЖДЕНИЕ ЖГУТИКОВ ЭУКАРИОТОВ
Жгутиковые (хвостатые) спермин обнаружены уже у низших
многоклеточных организмов. Жгутик — важный и, по-видимому,
древний компонент конструкции спермия. Рассмотрим вопрос о
природе и происхождении этого структурного компонента.
Электронная микроскопия вскрыла основной принцип кон-
струирования жгутиковых устройств эукариотов, хотя не смогла
выявить способ их функционирования. В настоящее время широ-
ко известно, что основной принцип конструкции жгутиков и рес-
ничек у эукариотов, начиная с жгутикового аппарата простей-
ших и кончая ресничками эпителиальных клеток высших позво-
ночных, заключается в распределении девяти пар микротрубочек
по периферии жгутика или реснички и одной пары в централь-
ноосевом положении. В дальнейшем выяснилось, что девять пар
могут быть и девятью тройками микротрубочек, причем парные
или тройные комплексы оказались отличными друг от друга по
взаимному расположению и способам связи одиночных компонен-
тов. Были обнаружены тонкие детали и добавочные компоненты
системы 9 + 2. Описаны связи этой системы с центриолью, которая
также содержит короткие фрагменты протофибрилл числом де-
вять пар. Известно строение базальных гранул жгутиков. Однако
успехи ультрамикроморфологии жгутиков и ресничек до настоя-
щего времени находятся в глубоком несоответствии с развитием
представлений о функциональном значении обнаруженных ульт-
рамикроструктур.
КАК УСТРОЕНЫ ЖГУТИКИ СПЕРМИЕВ
То же можно сказать и о строении и функции жгутиков
спермиев. В настоящее время накоплен большой фактический
материал о тонком строении жгутиков спермиев в различных
группах животных [Kessel, 1966 а, с, 1967; Hinsch, 1969; Peder-
sen, 1969; Ross, Robison, 1969; Reger et al., 1970; Данилова,
1973]. Установлено, что принцип конструкции жгутика и его
опорного устройства (базальной и проксимальной центриолей)
11 А. Н. Стуцитский « 161 »
ФУНКЦИОНАЛЬНАЯ МОРФОЛОГИЯ И ФИЛОГЕНИЯ КЛЕТКИ
совпадает с принципами конструкции жгутиков во всем мире эука-
риотов. Вместе с тем у некоторых видов животных открыты от-
клонения от генерального принципа в конструкции жгутиков
спермиев: расположение протофибрилл по спирали или концент-
рическими кругами. К середине 60-х годов стало выясняться, что
основной компонент конструкции жгутиков — протофибрилла —
по своей организации идентичен с открытым в 1963 г. компонен-
том конструкции цитоплазмы — микротрубочкой. Было установ-
лено, что у безжгутиковых (бесхвостых) спермиев декапод микро-
трубочки располагаются в ядре и его выростах [Pochon-Masson,
1968; Hinsch, 1969; Студитский, Елякова, 1972], причем у неко-
торых видов удалось установить связь микротрубочек с центрио-
лями. За этот же период благодаря применению новой техники
фиксации в электронной микроскопии устройство из микротрубо-
чек было показано для митотического веретена так называемых
цитастеров дробящихся яиц и других объектов. В настоящее вре-
мя микротрубочки как компонент ультраструктуры обнаруже-
ны и изучены в самых разнообразных клеточных устройствах,
хотя представления о способе их участия в функциях этих
устройств не продвинулись ни на шаг. Известно только, что мик-
ротрубочки чаще всего открываются в тех конструкциях клетки,
которые так или иначе связаны с функцией движения. Однако
состояние накопленных сведений по структуре и распростране-
нию микротрубочек не позволяет даже сказать, какую роль —
опорную или двигательную — играют эти образования в осуществ-
лении двигательных актов. Не лучше обстоит дело с вопросом
о природе и происхождении микротрубочек и их комплексов в
клетке.
Нас интересует, естественно, этот вопрос в связи с темой
книги. Как возникли микротрубочки в эволюции клетки и каково
их отношение к субклеточным компонентам клетки? И в прило-
жении к теме излагаемой главы: как возникли жгутики спермиев
и каково их отношение к его субклеточным компонентам?
Недостаточность сравнительно-морфологических данных не
позволяет выделить вопрос о природе и происхождении комплек-
сов микротрубочек в качестве темы самостоятельной главы. Впол-
не уместно обсудить его в связи с обсуждением вопросов функ-
циональной морфологии жгутика спермиев, тем более, что у боль-
шинства эукариотов жгутики спермиев не отличаются существенно
от жгутиков соматических клеток эукариотов, например жгу-
тиковых простейших или жгутиковых клеток кишечнополостных.
Во всех случаях мы находим систему микротрубочек 9 + 2, обра-
зующую центральноосевой компонент жгутика, и базальное уст-
ройство, содержащее систему из девяти комплексов микротрубо-
чек, как в центриолях. Вопрос заключается в том, какова при-
рода комплексов микротрубочек, составляющих основу жгутика,
и как возникли эти комплексы в эволюции клетки.
« 162 »
СТРОИТЕЛЬСТВО ЖГУТИКОВЫХ КОНСТРУКЦИЙ СПЕРМИЯ
ГОМОЛОГИЯ МИКРОТРУБОЧЕК И ЖГУТИКОВ БАКТЕРИЙ
Жгутики бактерий построены из структурного белка — фла-
геллина, глобулы которого уплотнены на периферии и разрыхле-
ны в центральноосевой части, в результате чего жгутики имеют
вид трубочки [Поглазов, 1965, 1970]. Базальное тельце жгутика
бактерий — это уплотнение матрикса, не обнаруживающее специ-
фической структуры. Таким образом, жгутик бактерий не гомо-
логичен жгутику клеток эукариотов, обладающему специфиче-
ской структурой и связанному с особым структурированным
базальным тельцем. Сложный жгутик, включающий систему мик-
ротрубочек 9 + 2,— это эволюционное приобретение эукариотов, не
имеющее гомологов у прокариотов.
На естественно возникающий вопрос о возможной гомологии
жгутиков бактерий и микротрубочек эукариотов можно с доста-
точным основанием ответить положительно. Жгутик эукариотов
состоит из системы 9 + 2 микротрубочек, сходных по строению
(топкий цилиндр) и, вероятно, по функции (элемент двигатель-
ного прибора) со жгутиками бактерий. Не так легко ответить
па вопрос о происхождении жгутиков.
Если возникновение жгутиков у бактерий еще можно как-то
объяснить механизмом самосборки молекул сократимых или опор-
ных белков в виде такой простейшей конструкции, какой вы-
глядит это образование у прокариотов, то развитие жгутика у
эукариотов с его сложной конструкцией 9 + 2 и базальным тель-
цем типа центриоли объяснить механизмом самосборки из белко-
вых макромолекул весьма трудно. Для того чтобы принять это
объяснение, необходимо прежде всего знать причину, которая у
бактерий обусловливает самосборку элементарного жгутика — го-
молога микротрубочки, а у эукариотов вызывает такое усложне-
ние этого процесса, как монтаж периферического и центрально-
осевого комплексов микротрубочек и базального аппарата. Кроме
того, очевидно, необходимо доказать факт самосборки жгутика
эукариотов из диссоциированных макромолекул в искусственной
среде или хотя бы в клетке.
В искусственных условиях самосборку жгутика эукариотов
никому наблюдать не удавалось. Однако в клетке этот процесс,
очевидно, происходит, хотя и в очень усложненной форме. Само-
сборка, по-видимому, лежит в основе репродукции органелл, тесно
связанных с жгутиковыми или микротрубочковыми конструкция-
ми,— центриолей. Наиболее демонстративны эти процессы у не-
которых простейших, размеры которых позволили изучить процесс
формирования центриолей и жгутиков даже с помощью обычной
светооптической техники.
« 163 »
11*
ФУНКЦИОНАЛЬНАЯ МОРФОЛОГИЯ И ФИЛОГЕНИЯ КЛЕТКИ
САМОСБОРКА ЖГУТИКОВ И РЕСНИЧЕК
У паразитического жгутиконосца Barbulanympha центриоляр-
ный аппарат представлен двумя гигантскими центриолями,
каждая из которых включает концевую гранулу на проксималь-
ном конце и шаровидное тело («центросому») на дистальном
конце длинного лентовидного связующего тела, вдоль которого
располагается ряд отходящих от целликулы жгутиков [см.: Рай-
ков, 1967]. В процессе деления центральные гранулы расходятся,
в то время как между «центросомами» строится веретено,
а вокруг каждой «центросомы» возникает центросфера, состоящая
из радиально расходящихся волокон (очевидно, микротрубочек).
В конце анафазы около каждой из расходящихся концевых гра-
нул возникает дочерняя концевая гранула, от которой начинается
рост лентовидного тела [Cleveland, 1934]. Возникновение дочер-
ней центриоли рядом с материнской описано теперь на основе
электронно-микроскопических исследований у многих простей-
ших, а также в различных клетках многоклеточных животных
[см.: Аспиз, 1969]. Достаточно точно установлено, что формиро-
вание дочерней центриоли начинается в большинстве случаев с
появления системы микротрубочек в виде короткого цилиндра,
ось которого обращена перпендикулярно к оси материнской цент-
риоли. Рост новообразованного цилиндра приводит к образованию
типичных центриолей, расположенных перпендикулярно друг к
ДРУГУ (рис. 35).
В большинстве случаев центриоли возникают таким способом,
в котором, очевидно, материнская центриоль индуцирует само-
сборку дочерней центриоли на определенном расстоянии от
материнской и перпендикулярно к ней. Однако имеются данные
и о независимой от предшествующих центриолей самосборке.
Известные у простейших процессы превращения амебоидной
формы в жгутиковую сопровождаются новообразованием у жгу-
тиковой формы системы центриолей, которая отсутствует у аме-
боидной формы [Schuster, 1963]. Аналогичные процессы описаны
и у многоклеточных животных, например, при превращении сек-
реторных клеток в реснитчатые в респираторном зпителии крысы.
Процесс начинается с появления рассеянных в цитоплазме гранул
диаметром 35—90 А, выстраивающихся в виде колец, из которых
развиваются характерные цилиндрические тела центриолей.
Поскольку у жгутиковых простейших центриоли нередко
(может быть, даже во всех случаях) играют роль базальных
телец, с которыми связано развитие жгутиков, можно полагать,
что центриоли — базальные тельца — играют роль активаторов,
или индукторов жгутикообразования. Более того, в некоторых
случаях кольцо микротрубочек центриолей — базальных телец —
непосредственно продолжается в кольцо периферических девяти
пар микротрубочек жгутика. Такое же соотношение обнаружи-
« 164 »
СТРОИТЕЛЬСТВО ЖГУТИКОВЫХ КОНСТРУКЦИЙ СПЕРМИЯ
Рис. 35. Схема формирования центриолярного аппарата в клетках респи-
раторного эпителия эмбриона крысы [по Sorokin, 1968]
Различные этапы репликации центриолей (начиная с левой части схемы) и кон-
струирования па их основе базальных телец и жгутиков (в правой части схемы)
вается между центриолью и аппаратом микротрубочек жгутика
спермиев у многих видов животных.
Имеется несколько вариантов расположения проксимальной и
дистальной центриолей в шейке спермия и их связей, с одной
стороны, с головкой (ядром), с другой — с аппаратом микротру-
бочек жгутика. Как правило, периферические микротрубочки
дистальной центриоли непосредственно переходят в перифериче-
ские микротрубочки жгутика. При оплодотворении центриоли
спермия вместе с головкой, шейкой и промежуточной частью
входят в ооплазму, где легко обнаруживаются при электронно-
микроскопическом исследовании оплодотворенного яйца.
Как известно, центриоли в неоплодотворенных яйцевых клет-
ках не обнаруживаются. Полагают, что центриоли спермия,
внедрившегося в яйцо, по крайней мере в некоторых случаях
(морской еж), используются для конструирования микротрубочек
первого веретена дробления [см.: Де Робертис и др., 1967].
Таким образом, решение вопроса о природе жгутика спермиев
« 165 »
ФУНКЦИОНАЛЬНАЯ МОРФОЛОГИЯ И ФИЛОГЕНИЯ КЛЕТКИ
заключается в том, что эта интегральная часть мужской половой
клетки полностью гомологична жгутиковым приборам жгутико-
носцев и жгутиковых клеток многоклеточных животных, начиная
с кишечнополостных, губок и турбеллярий. Так же, как и в дру-
гих жгутиковых клетках, центриоли играют роль источников раз-
вития комплекса периферических микротрубочек жгутиков.
Исходя из данных о способе репродукции центриолей путем са-
мосборки дочерней центриоли рядом с материнской, можно
заключить, что развитие жгутика осуществляется путем само-
сборки под индуцирующим влиянием центриоли. Однако решение
вопроса о природе жгутика весьма мало продвигает нас в прояс-
нении вопроса о его происхождении.
Выше было указано, что гомология между жгутиком бактерии
и элементарной микротрубочкой жгутика эукариотов представля-
ется вполне вероятной. Но это заключение мало помогает в том,
чтобы понять путь превращения элементарного жгутика бактерий
в комплексный жгутик эукариотов. Никаких переходных форм
между жгутиком бактерий и жгутиком эукариотов не обнаруже-
но. Жгутиконосцы-простейшие обладают жгутиком типичного
строения с базальным тельцем типа центриоли и комплексом
микротрубочек 9 + 2. Нет никаких сомнений в том, что жгутики
спермиев кишечнополостных и губок, так же как и жгутиковые
клетки этих животных, имеют такую же конструкцию жгутика,
как и их предки — жгутиконосцы-простейшие. Не исключено,
что первая клетка, возникшая путем комплексирования клона
бактериоидных организмов, уже приобрела центриолярный аппа-
рат, с помощью которого оказалось возможным формирование
микротрубочек веретена как важнейшего блока митотического
аппарата. Однако и это заключение не облегчает решение вопроса
о происхождении жгутикового аппарата эукариотов. Очевидно,
следует обратиться к гипотезам, имеющим косвенные подтвержде-
ния в сравнительно-морфологическом и функционально-морфоло-
гическом материале.
КАК ВОЗНИКЛИ ЖГУТИКИ ЭУКАРИОТОВ
Момент перехода от протоклеточной и клеточной организации
совпал, как было показано в первой части книги, с формирова-
нием репродукционного блока в системе комплексирующихся
бактериоидных организмов. Этот блок состоял из центральной
группы протоклеток, объединенных свойством одновременно
делиться, обеспечивая возможность последующего деления всего
комплекса. Дифференцировка центрального блока — ядра,—
и периферического блока — цитоплазмы, очевидно, сопровожда-
лась функционально обусловленными изменениями структурных
компонентов комплексирующихся протоклеток. В рабочей части
клетки произошло усиление рибосомных комплексов с одновре-
« 166 »
СТРОИТЕЛЬСТВО ЖГУТИКОВЫХ КОНСТРУКЦИЙ СПЕРМИЯ
менной редукцией нуклеоидов в протоклетках, формирующих
ассимилирующую систему клетки — эргастоплазму. Еще более
глубокая редукция нуклеоидов с одновременной редукцией рибо-
сомного комплекса произошла в протоклетках, формирующих
сегрегационный аппарат клетки — ретикулоплазму. Неполной
редукцией нуклеоида и рибосомного комплекса с одновременной
гипертрофией мезосомных впячиваний сопровождалось развитие
диссимиляционного механизма клетки — митохондрий. В ядре
путем централизации плазмолемм и индивидуализации рибосомно-
нуклеоидиых комплексов сформировались хромосомы и ядрышки.
Наряду с этими процессами должны были осуществляться преоб-
разования бактериальных жгутиков — важнейших структурных
компонентов протоклеточной организации.
Из генеральной гипотезы о происхождении клетки путем
комплексирования клона бактериоидных организмов логически
вытекает как частная гипотеза вывод о преобразовании жгути-
ковых аппаратов комплексирующихся бактериоидных организмов
в комплексные жгутиковые механизмы клетки. В этом общем
выводе заключается основное решение о происхождении жгутиков
эукариотов, и в частности жгутиков мужских половых клеток.
МИКРОТРУБОЧКИ В МИТОТИЧЕСКОМ ПРОЦЕССЕ
С выяснением структуры микротрубочек стало весьма вероят-
ным, что эти образования представляют собой универсальный
компонент всех первичных двигательных конструкций клетки.
Сходство микротрубочек жгутиков эукариотов с жгутиками
бактерий позволяет предположить, что во всех клеточных конст-
рукциях, содержащих микротрубочки, реализуется свойство пред-
ковых бактериоидных форм строить элементарные жгутики бакте-
риального типа. Микротрубочковые комплексы строятся в клетке
как неотъемлемые части рабочих блоков, связанных с осуществ-
лением локомоторной функции. Наиболее демонстративное выра-
жение тенденция к строительству микротрубочковых комплексов
проявляется в митотическом процессе.
Ядро возникло как комплекс органелл, решающих задачу
репродукции клетки путем деления надвое. Расхождение хромо-
сом в анафазе составляет один из важнейших моментов митоти-
ческого деления, в котором с наибольшей демонстративностью
проявляется функция микротрубочек веретена как тянущих нитей
митотического механизма. Принято считать, что активная роль в
этом процессе принадлежит тянущим нитям, а хромосомы ведут
•себя совершенно пассивно [Мэзия, 1963; Алов, 1972; Lambert,
Bajer, 1975]. Однако даже то, что мы знаем о поведении хромо-
сом в профазе, особенно в профазе мейоза, когда гомологичные
хромосомы находят друг друга и вступают в конъюгацию, убеж-
дает в достаточно активной подвижности этих ядерных органелл.
« 167 »
ФУНКЦИОНАЛЬНАЯ МОРФОЛОГИЯ И ФИЛОГЕНИЯ КЛЕТКИ
Совершенно очевидно, что хромосомные белки включают
сократимые варианты, которые обеспечивают как изменение
объекта и формы хромосом, так и их свободное продвижение к
кариоплазме. Вместе с тем не менее очевидно и участие тяну-
щих нитей (микротрубочек) веретена в расхождении хромосом к
полюсам в митотическом и мейотическом процессах. Вот почему
в оценке двигательных устройств хромосом наиболее правдопо-
добным представляется вывод о существовании двойного аппарата,
обеспечивающего их движения: сократимых конструкций самой
хромосомы, вызывающих изменения ее объема и формы, как у
бактерий типа спирилл, и конструкций жгутикового типа, состав-
ляющих аппарат микротрубочек веретена деления.
Таким образом, мы приходим к трактовке микротрубочек как
гомологов жгутиков предковых бактериоидных организмов.
С этой позиции, очевидно, необходимо рассмотреть вопрос о про-
исхождении центриолей и жгутиков эукариотов.
Для объяснения конструкции жгутиков 9 + 2 и 9-компонент-
ной конструкции центриолей, за отсутствием каких-либо переход-
ных моделей, можно обратиться только к особенностям макромо-
лекулярных белковых компонентов микротрубочек, обусловливаю-
щих их тенденцию к этому стандартному расположению. Имею-
щиеся данные по онтогенезу центриолей и жгутиков пока-
зывают, что такая тенденция — располагаться в кольцо из
девяти нар — свойственна уже гранулам, из которых строятся
микротрубочки этих систем. Не исключено, что конструирование
ядерного аппарата при комплексировании бактериоидных предков
клетки сопровождалось мобилизацией базальных телец в ви-Де
центриолей, структура которых — из девяти пар микротрубочек —•
была определена стереохимическими свойствами белков базальных
телец. Этот процесс, очевидно, сопровождал формирование общей
ядерной оболочки, с которой, возможно, был связан один из
вариантов конструирования веретена деления и жгутиков первой
клеточной конструкции.
ЛОКОМОТОРНАЯ ФУНКЦИЯ МИКРОТРУБОЧЕК
Среди жгутиконосцев из группы Hypermastigida, изученной
Кливлендом [Cleveland, 1934—1961], имеются формы, вроде
приведенной выше Barbulanympha, у которых довольно отчетли-
во выступают признаки предполагаемой первичной конструкции
аппарата ядерных микротрубочек и ее активности во время
митотического деления. Перед хромосомами новообразованной
клетки стоит задача — обеспечить целение ядерной и цитоплаз-
матической частей клетки. Для этого хромосомы должны
разойтись от плоскости будущего деления ядра и цитоплазмы и
способствовать действию сил, разобщающих дочерние клетки
друг от друга. Наряду с химическим, лизирующим механизмом
« 168 » ,
СТРОИТЕЛЬСТВО ЖГУТИКОВЫХ КОНСТРУКЦИЙ СПЕРМИЯ
цитокинеза, который рассмотрен,
позже, клетка использует механи-
ческие возможности, заключенные
в сократительной активности са-
мих хромосом и опорных свойст-
вах жгутиков-микротрубочек бак-
териального типа.
Сейчас невозможно восстано-
вить подлинный порядок этого
процесса. Вполне вероятно, что
первичная профаза сопровождалась
демонтажем базальных телец и
жгутиков хромосом и конструиро-
ванием из этого материала пер-
вичных центриолей (рис. 36), ко-
торые становились теперь центра-
ми организации механических ци-
токинетических сил, включая кон-
струирование жгутиковой системы
микротрубочек 9+2.
Естественно, не имея точных
представлений о природе органи-
зующего действия центриолей на
формирование веретена, центро-
сомы (центросферы радиальных
микротрубочек) и жгутика, нельзя
выдвигать окончательных гипотез
о способе организующего действия
первичной центриоли первичной
клетки на формирование этих кон-
струкций. Вполне возможно, что
это действие включает стереохи-
мический эффект — наложения
рассеянных компонентов конструк-
ции на готовый каркас основания
этой конструкции. Нельзя исклю-
чить и ферментативный механизм,
состоящий из специфических по-
лимераз. Бесспорным остается
одно: задача осуществления ци-
токинеза решалась первичной
клеткой путем мобилизации опор-
ных и двигательных конструкций
протоклеток для формирования
механической части аппарата де-
ления клетки: микротрубочек ве-
ретена, базальных телец, центрио-
Рис. 36. Гипотетическая схема
конструирования центриолярного
и микротрубочкового аппаратов
путем самосборки из материала
жгутиков комплексирующихся
протоклеток
« 169 »
ФУНКЦИОНАЛЬНАЯ МОРФОЛОГИЯ И ФИЛОГЕНИЯ КЛЕТКИ
лей, центросом (центросфер) и жгутиков. Жгутик эукариотов,
включая жгутик спермиев многоклеточных эукариотов, возник
как продукт сложной трансформации материала базальных телец
и жгутиков прокариотов.
Разработанная мной гипотеза о происхождении аппарата мик-
ротрубочек, входящих в состав митотического аппарата и жгути-
ков эукариотов, за счет базальных телец и жгутиков прокариотов
вполне согласуется с данными, относящимися к локализации
микротрубочек в цитоплазме. Все цитоплазматические органел-
лы — гомологи ядерных органелл. И если ядерные органеллы —
хромосомы —специализировались на формировании митотическо-
го аппарата и жгутиков, то цитоплазматические органеллы,
вероятнее всего эргастосомы, специализировались на формирова-
нии комплексов микротрубочек в цитоплазме. Как известно, ком-
плексы микротрубочек обнаруживаются в различных участках
цитоплазмы, связанных в той или иной мере с осуществлением
двигательной функции. Возникновение комплексов микротрубо-
чек в цитоплазме представляет собой результат активности цито-
плазматических органелл, сохранивших способность к синтезу
материала базальных телец и жгутиков.
В связи со сказанным можно предложить гипотезу о проис-
хождении ресничного аппарата низших эукариотов — инфузо-
рий — и высших эукариотов, начиная с турбеллярий.
ПРОИСХОЖДЕНИЕ РЕСНИЧЕК
Из изложенного ясно, что происхождение жгутиков эукарио-
тов можно связать только с развитием митотического аппарата
за счет базальных телец и жгутиков центральной — ядерной —
группы предкового комплекса прокариотов. Жгутики низших
эукариотов — жгутиконосцев — и высших эукариотов, начиная с
тубок и кишечнополостных, несомненно ядерного происхождения.
Иначе обстоит дело с ресничками.
Реснички возникли, вероятно, самостоятельно и независимо
в обоих подцарствах — простейших и многоклеточных. Нет ника-
ких оснований для того, чтобы искать какие-нибудь признаки
родства между инфузориями и многоклеточными эукариотами,
например турбелляриями или коловратками. И те и другие при-
обрели черты сходства, в частности ресничный покров, конвер-
гентно. Но эта конвергенция обусловлена тем, что клетка в своем
происхождении несет источник возникновения некоторых общих
признаков, ведущих начало от бактериоидной организации суб-
клеточных компонентов — органелл. Жгутики и другие мпкро-
трубочные конструкции, связанные с митотическим аппаратом,
возникли на самом раннем этапе эволюционного формирования
клетки, так как без этих конструкций оказалось бы невозможной
ее репродукция. Реснички сформировались на более позднем
« 170 »
СТРОИТЕЛЬСТВО ЖГУТИКОВЫХ КОНСТРУКЦИЙ СПЕРМИЯ
этапе эволюции — у высших простейших и низших многоклеточ-
ных как специальные конструкции для осуществления новой
формы двигательной активности. Реснички возникли независимо
от предсуществующих двигательных микротрубочковых аппара-
тов ядерного происхождения — жгутиков, центросферы и верете-
на. Реснички сформировались как продукт дифференцировки
цитоплазматических органелл, скорее всего, эргастосом, в кото-
рых сильнее выражены признаки бактериоидного происхождения
(наличие плазмолеммы, матрикса и рибосомного комплекса).
В ходе эволюции ресничного покрова специализированных рес-
нитчатых клеток выработались морфогенетические связи ресни-
чек и центриолей, раскрывающиеся при развитии ресничек [Soro-
kin, 1968; Kalnins, Porter, 1969]. В связи с формированием цент-
риольно-ресничного аппарата на основе индукции в литературе не
прекращается дискуссия о наличии ДНК в центриолях как орга-
низаторах развития ресничек [Hoffman, 1965; Bandall, Disbrey,
1965; Granick, Gibor, 1967] и базальных тельцах, расположенных
в основании ресничек у инфузорий [Hoffman, 1965; Smith-Son-
neborn, Plant, 1967, 1969; Hufnagel, 1969; Flagell, Jones, 1971].
Возникновение ресничек за счет цитоплазматических органелл
определило и более простой путь их конструирования, независя-
щий от деления клетки. Реснички появляются многократно, само-
стоятельно и независимо в различных систематических группах,
каждый раз, по-видимому, путем мобилизации двигательных кон-
струкций бактериального типа в цитоплазматических органеллах.
Реснички формируются при дифференцировке различных форм
реснитчатых эпителиев на разных этапах онтогенеза многокле-
точных животных, без заметной преемственности структурных
компонентов от клетки к клетке. По-видимому, при митотическом
делении реснитчатых клеток ресничный аппарат демонтируется
и восстанавливается путем самосборки дочерними клетками.
МИКРОТРУБОЧКИ В ОБОЛОЧКЕ ЯДРА
Таким образом, жгутики и реснички сформировались в фило-
генезе клетки независимо и на разных уровнях организации.
Но оба двигательных прибора объединены идентичной конструк-
цией, в которой отражено единство происхождения и исходной
организации ядерных и цитоплазматических органелл. Жгутики
эукариотов сформировались в глубокой связи с реконструкцией
плазмолемм протоклеточных предков в ядерную мембрану клетки.
Системы микротрубочек цитоплазмы и ресничные конструкции
возникали в ходе эволюционных преобразований клетки за счет
внутриклеточных мембран и матрикса, сохранивших свойство
формировать базальные гранулы и жгутики бактериального типа.
Способность цитоплазмы формировать системы микротрубочек в
любой ситуации, связанной с двигательной активностью, имеет
« 171 »
ФУНКЦИОНАЛЬНАЯ МОРФОЛОГИЯ И ФИЛОГЕНИЯ КЛЕТКИ
объяснение только в нашей теории. Жгутикоподобные структу-
ры — микротрубочки — могут возникать внутри клетки эукарио-
тов лишь потому, что цитоплазма состоит из субклеточных ком-
понентов, сохранивших свойство формировать жгутиковые кон-
струкции бактериального типа.
Спонтанное возникновение цитоплазматических микротрубо-
чек еще недостаточно изучено. Что же касается системы ядер-
ных микротрубочек — центриолей, центросферы, веретена деле-
ния и жгутиков, то можно привести некоторые морфологические
данные, подкрепляющие гипотезу об их происхождении за счет
мембранных производных бактериальных предков. Формирование
систем микротрубочек внутри ядер с промитотическим способом
деления (без демонтажа ядерной оболочки) описывалось много-
кратно [см.: The chromosomes of the algae 1966; 1968; Райков,
1967, 1979]. Мик и Мозес [Meek, Moses, 1961] отметили, что
в семеннике рака по завершении периода размножения разви-
вающиеся сперматоциты приобретают некоторые особенности,
Рис. 38. Выход пузырь-
ков с ворсинками (П)
от ядра (Я) в цитоплаз-
му (Ц) в сперматидах
речного рака
Рис. 37. Формирование
выростов жгутикового
типа на внутренней
(собственно ядерной)
мембране сперматиды
речного рака
Я — ядро;
ЯМ — ядерная мембрана;
Мт— микротрубочки;
Ц — цитоплазма [но Еля-
ковой, Горячкиной.
1966]
« 172 »
СТРОИТЕЛЬСТВО ЖГУТИКОВЫХ КОНСТРУКЦИЙ СПЕРМИЯ
связанные, очевидно, с завершением спермиогенеза. Ядерная
мембрана сперматоцитов, в частности, проявляет тенденцию к
формированию телец с системой трубочек внутри, которые отры-
ваются от ядра и переходят в цитоплазму, где подвергаются
дегенерации. В нашей лаборатории этот процесс был обследован
Г. В. Еляковой и В. Л. Горячкиной [Eliakova, Goriachkina,
1966].
Действительно, в сперматоцитах и ранних сперматидах в се-
меннике речного рака (Astacus leptodactylus) по завершении
спермиогенеза, в ноябре—декабре, ядро подвергается структур-
ным изменениям, которые особенно демонстративно выражаются
в превращениях ядерной мембраны. Самое характерное из этих
изменений заключается в том, что внутренняя ядерная мембра-
на образует многочисленные выросты типа тонких ворсинок
(рис. 37). Одновременно формируются выпячивания мембраны,
которые превращаются в пузырьки с обращенными внутрь вор-
синками. Эти пузырьки отрываются от ядерной мембраны, пере-
ь 173 »
ФУНКЦИОНАЛЬНАЯ МОРФОЛОГИЯ И ФИЛОГЕНИЯ КЛЕТКИ
ходят в перинуклеарное пространство, а затем в цитоплазму
(рис. 38).
По диаметру ворсинки ядерной мембраны несколько превы-
шают микротрубочки, составляющие характерный структурный
компонент ядра спермия десятиногих раков. Однако родство этих
образований не вызывает сомнений. Мембранные тельца в спер-
матоцитах речного рака возникают потому, что прекращается
формирование внутриядерных микротрубочек, составляющих важ-
нейший структурный компонент спермиев десятиногих раков.
Онтогенез микротрубочек в ядрах спермиев десятиногих раков
изучен недостаточно. Прямая связь микротрубочек с ядерной
мембраной не прослеживается, хотя и представляется весьма
вероятной. И все же наиболее правдоподобное объяснение свое-
образной структурной активности ядерной мембраны сперматоци-
тов рака по окончании спермиогенеза заключается в том, что.
типичное формирование микротрубочек за счет ядерной мембраны
заменяется своеобразной трубчатой трансформацией ядерной
мембраны.
Этот феномен относится к числу конечных процессов онтоге-
неза клетки. Подобные процессы можно называть телобиотиче-
скими (телос — конец, биос — жизнь, греч.). Они завершают
собой циклы дифференцировки клеток. Однако в телобиотических
процессах могут получать структурное выражение скрытые по-
тенции клеток. В формировании трубчатых пузырьковидных
телец проявляется свойство ядерной мембраны строить микро-
трубочковые конструкции — аппараты движения бактериоидных
предков клеточных органелл.
Жгутики и реснички большинства клеток эукариотов построе-
ны по схеме 9 + 2, означающей девять пар (или точек) микро-
трубочек по периферии и две микротрубочки в центральноосевой
части жгутика. Жгутики хвостатых спермиев построены по этой
схеме. В безжгутиковых спермиях десятиногих раков комплексы
микротрубочек локализуются в ядре и его выростах, заходящих
в радиальные отростки спермиев.
Жгутиковые гаметы появляются у одноклеточных эукариотов.
Спермин многоклеточных эукариотов гомологичны жгутиковым
гаметам простейших, хотя их конструкция значительно сложнее
в связи с решением трудной задачи — внедрения в яйцо.
В сравнительно-морфологическом отношении большой интерес
представляют жгутики простейших жгутиконосцев, возникшие
при конструировании клетки. У некоторых жгутиконосцев (Ваг-
bulanympha) прослежен процесс самосборки жгутиков в процессе
митотического деления. Сходный процесс показан при дифферен-
цировке реснитчатого эпителия. Центриоли играют роль индук-
« 174 »
СТРОИТЕЛЬНАЯ АКТИВНОСТЬ СОМАТИЧЕСКИХ КЛЕТОК
торов самосборки жгутиков. Микротрубочки жгутиков эукариотов
гомологичны жгутикам прокариотов. Наборы микротрубочек
9 + 2, вероятно, возникли в результате комплексирования бакте-
риоидных предковых форм, обладающих способностью к само-
сборке жгутиков. Микротрубочковый аппарат митотического деле-
ния имеет то же происхождение. У некоторых форм жгутико-
носцев микротрубочки веретена и жгутиков образуют при
митотическом делении комплексные конструкции. В противопо-
ложность жгутикам и микротрубочкам веретена, возникшим при
комплексировании ядерной системы органелл, реснички и микро-
трубочки цитоплазмы возникли в результате комплексирования
и дифференцировки цитоплазматических органелл. К числу сви-
детельств происхождения жгутиков эукариотов за счет жгутиков
ядерных субклеточных компонентов принадлежит формирование
пузырьков с микротрубочками из внутренней ядерной мембраны
в сперматоцитах речного рака после завершения периода оплодо-
творения.
Глава четвертая
СУБКЛЕТОЧНЫЕ ОСНОВЫ
СТРОИТЕЛЬНОЙ АКТИВНОСТИ
СОМАТИЧЕСКИХ КЛЕТОК
СТРОИТЕЛЬНЫЕ ФУНКЦИИ ТКАНЕЙ И КЛЕТОК
В предшествующей разработке темы книги неоднократно под-
черкивалось, что жизненный цикл клетки включает как обяза-
тельный элемент пластическую, или строительную, активность,
с помощью которой решается задача дифференцировки, т. е. при-
обретения клеткой структурной специфичности, необходимой для
ее функционирования в составе ткани или органа.
В отличие от половых клеток, дифференцировка которых не
имеет прямого отношения к жизненным функциям самого орга-
низма, соматические клетки, дифференцируясь, обеспечивают
возможность функционирования всех тканевых и органных си-
стем многоклеточного организма. В процессе дифференцировки
клетки становятся структурными компонентами тканей, и в этом
качестве участвуют в осуществлении строительных функций тка-
ней. Одновременно дифференцирующиеся клетки входят в состав
органов, которые строятся тканями, и в этом качестве участвуют
в рабочих функциях органов. Таким образом, клетки служат
организму посредством двух форм жизненной активности —
строительной, или пластической, и рабочей, или функциональной.
Это двойственное проявление жизненной активности клеток
« 175 »
функциональная морфология и филогения клетки
в составе многоклеточного организма достаточно демонстративно
выражается в конструкциях камбиальных тканей, которые содер-
жат в своем составе отчетливо различимую ростковую, или гене-
ративную, часть, состоящую из клеток, способных к размноже-
нию и дифференцировке, и рабочую часть, построенную из диф-
ференцированных клеток. В ростковом слое кожи клетки
выступают в качестве генеративных и строительных элементов
эпидермальной ткани, сооружающей вместе с другими тканями
(соединительной, гладкомышечной, нервной) орган многоклеточ-
ного организма — кожу. В ороговевающем слое эпидермиса клет-
ки превращаются в дефинитивный рабочий элемент кожи — рого-
вые чешуйки, обеспечивающие специфические функции кожи.
В гладкомышечном, соединительнотканном и нервном компонентах
кожи нет заметного структурного разделения на ростковую (кам-
биальную) и рабочую части. Здесь клетки, очевидно, одновре-
менно участвуют в осуществлении тканевой (строительной) и
органной (рабочей) функциях. И если в первом случае клетка
имеет возможность сначала участвовать в тканевом (строитель-
ном), а потом в органном (рабочем) процессах, то во втором,
очевидно, клетка одновременно строит орган (например, кориум
кожи) и участвует в осуществлении его рабочей функции (на-
пример, механической функции кориума). Однако и в первом,
и во втором случаях жизненный цикл клетки включает постепен-
ный переход от недифференцированного (камбиального, пласти-
ческого) в дифференцированное (рабочее) состояние. Тканевая
(пластическая, строительная, камбиальная) активность состав-
ляет не менее важную функцию клетки, чем органная (рабочая)
активность.
В функциональной морфологии клетки огромное место зани-
мает дифференцировка, связанная с осуществлением строитель-
ной функции тканей. В этом процессе клетка приобретает дефи-
нитивную структуру путем дифференцировки своих субклеточных
компонентов.
В ДИФФЕРЕНЦИРОВКЕ ВЫРАЖАЕТСЯ
СТРОИТЕЛЬНАЯ АКТИВНОСТЬ КЛЕТОК
Дифференцировка клеток, сопровождающая строительную дея-
тельность тканей, заключается в приобретении структуры, кото-
рая, с одной стороны, должна способствовать осуществлению
строительных процессов, а с другой — должна обеспечить рабо-
чую активность органа, сооружаемого тканями. Эта двойствен-
ная задача осуществляется клеткой на основе ее субклеточной
(органоидной) организации, обеспечивающей все трансформации,
связанные с дифференцировкой и рабочей активностью клетки.
Однако только в редких случаях, которые, собственно, и должны
привлекать внимание при эволюционно-морфологическом изуче-
« 176 »
СТРОИТЕЛЬНАЯ АКТИВНОСТЬ СОМАТИЧЕСКИХ КЛЕТОК
Рис. 39. Примеры дифференцировки клеточных структур, независимой от
строительной активности клеточных органелл
Опорные нити присасывательного аппарата в пелликуле паразитической инфузории
двух видов рода Ptychostomum [по Студитскому, 1932]
нии клетки, дифференцировка заключается в простой трансфор-
мации субклеточных компонентов клетки (органелл). Эволюцион-
но-морфологический анализ процессов дифференцировки клетки
затрудняется тем, что в большинстве случаев клетка решает
строительную задачу, используя неограниченную способность
своих субклеточных компонентов, и в первую очередь эргасто-
плазмы, к синтезу структурных белков, из которых строятся
рабочие конструкции органов.
Все, что мы знаем о функциональной морфологии клетки,
может внушить вывод о возможности использования функцио-
нально дифференцированных структур клетки для строительства
функциональных структур органов, например микротрубочек для
строительства сократимых структур мышечных волокон, мито-
хондрий для строительства специально дифференцированных
дыхательных клеток, комплексов Гольджи для сооружения спе-
циально дифференцированных выделительных клеток и т. д.
В действительности процесс эволюционной трансформации суб-
клеточных структур клетки только у одноклеточных эукариотов
в какой-то мере заключался в использовании основных органелл
для дифференцировки более сложных, но гомологичных функцио-
нальных структур. У наиболее сложно организованных эукарио-
тов — инфузорий — выделительная система (сократительная ва-
куоль и ее приводящие каналы) возникла, по-видимому, за счет
дифференцировки аппарата Гольджи, цирры высших инфузо-
рий — за счет слившихся ресничек с их микротрубочковым аппа-
ратом, орган поглощения пищи — глотка — за счет фагосомных
мембран, опорные нити в присасывательном аппарате инфузорий
12 А. Н. Студитский « 177 »
ФУНКЦИОНАЛЬНАЯ МОРФОЛОГИЯ И ФИЛОГЕНИЯ КЛЕТКИ
рода Ptychostomum (рис. 39) — за счет элементарных протофиб-
рилл пелликулы.
Увеличение размеров — одно из главных приспособлений,
обеспечивающих победу в межвидовой борьбе,— могло быть обес-
печено у эукариотов только развитием опорных и сократимых
устройств. Клетка решила эту задачу, используя свойство эрга-
стоплазмы строить белковые полимеры, обладающие механиче-
скими свойствами. В результате специфической строительной
активности эргастоплазмы в эволюции многоклеточных эукарио-
тов возникли такие совершенные опорные конструкции, как хи-
тиновый наружный скелет членистоногих, известковые раковины
моллюсков, кератиновые конструкции кожи и коллагеновый ске-
лет позвоночных. Эргастоплазма действует на всем протяжении
эволюции животного мира как продуцент белковых конструкций,
несущих механическую и другие функции в организме, сама не
подвергаясь существенным приспособительным изменениям. Вот
почему функциональная морфология строительной активности
клетки в производстве опорных и многих других конструкций
многоклеточных животных не представляет существенного инте-
реса для эволюционной гистологии. Клетка решает бесконечно
разнообразные строительные задачи с помощью одного и того же
строительного механизма — рибосомного аппарата эргастоплазмы,.
который сам не участвует в формировании этих конструкций
в качестве строительного элемента. Однако в некоторых случаях
клетки используют свои функциональные субклеточные структу-
ры для организации соответствующих функциональных конструк-
ций органов. К числу этих случаев относятся: сегрегационные
устройства почки; конструкции рецепторных клеток.
СЕГРЕГАЦИОННЫЕ УСТРОЙСТВА ПОЧКИ
Работа почки у позвоночных, как известно, заключается в
фильтрации жидкой части крови, в результате чего кровь осво-
бождается от растворенных в ней конечных продуктов метабо-
лизма. Не вдаваясь в детали процесса первичной фильтрации в
клубочковом отделе мочевого канальца, где из крови выводятся
вместе с конечными продуктами метаболизма вода, сахар и солиг
и вторичной, обратной фильтрации сахара, солей и воды в глав-
ных отделах мочевого канальца, можно сказать, что мочевой
каналец осуществляет в почке сегрегационную функцию, реали-
зуемую его эпителием, который отфильтровывает конечные про-
дукты метаболизма в просвет канальца. Другими словами, в си-
стеме клетка мочевого канальца — просвет канальца первый
компонент уподобляется матриксу и мембранам комплекса Гольд-
жи, а второй — содержимому пузырьков и цистерн Гольджи.
Конструкция этого клеточного органоида обеспечивает фильтра-
цию и сегрегацию конечных продуктов метаболизма в клетке
« 178 »
СТРОИТЕЛЬНАЯ АКТИВНОСТЬ СОМАТИЧЕСКИХ КЛЕТОК
в базально-апикальном направлении. В секреторных клетках
сегрегация капель секрета с помощью цистерн комплекса Гольд-
жи происходит в апикальных частях клеток, откуда капли секре-
та эвакуируются в просвет железы. Логично допустить, что клет-
ка мочевого канальца использует аппарат Гольджи для сегрега-
ции конечных продуктов метаболизма, подлежащих выведению
из организма.
Гипотеза Д. Н. Насонова [Nassonov, 1924] о гомологии
аппарата Гольджи многоклеточных животных с сократительной
вакуолью простейших получила подтверждение в глубокой топо-
графической связи комплексов Гольджи с трубочками сократи-
тельной вакуоли, а также в отсутствии ’ типичных комплексов
Гольджи при интенсивном развитии аппарата сократительной
вакуоли у некоторых инфузорий [Elliot, Bak, 1964], хотя некото-
рые авторы [Leedale et al., 1965] считают, что нет доказательств
взаимного родства этих образований.
Электронно-микроскопическое обследование структуры почеч-
ных клеток у высших позвоночных обнаружило, по крайней мере
у некоторых видов (крыса), систему трубочек, напоминающих
приводящий аппарат сократительной вакуоли простейших [Fors-
ter, 1961]. Эта система находится в тесной топографической свя-
зи с комплексами Гольджи.
Еще более демонстративно, хотя и менее понятно с эволю-
ционно-морфологической точки зрения, поведение митохондрий
при дифференцировке почечных клеток. Так называемая базаль-
ная исчерченность в главных клетках мочевых канальцев была
открыта давно с помощью банальной светооптической техники.
Специфической для митохондрий обработкой удалось выяснить,
что элементами базальной исчерченности являются митохондрии.
Дифференцировка почечных клеток сопровождается специфиче-
ской упаковкой митохондрий в виде столбиков, перпендикуляр-
ных к базальной мембране [Kirpitshnikoff, Genevsky, 1946]
(рис. 40). Эти данные подтверждены при электронно-микроско-
пическом исследовании развития почки. Базальные митохондрии
(митохондриальные палочки) отделены друг от друга глубокими
впячиваниями плазмолеммы. Принимая во внимание направление
фильтрации в главных отделах мочевых канальцев в апикально-
базальном направлении, можно заключить, что строительство
базальной системы митохондрий (митохондриальных палочек)
в глубокой связи с базальными впячиваниями плазмолеммы
должно обеспечить высокий энергетический режим работы, совер-
шаемой плазмолеммой и прилежащим матриксом как фильтрую-
щими механизмами клетки (рис. 41). В апикальной части клетки,
очевидно, происходит фильтрация жидкости с помощью систе-
мы трубочек и аппарата Гольджи. Комплексы ворсинок щеточной
каемки, очевидно, обеспечивают быстрое всасывание жидкости
из просвета мочевого канальца.
« 179 »
12*
ФУНКЦИОНАЛЬНАЯ МОРФОЛОГИЯ И ФИЛОГЕНИЯ КЛЕТКИ
Рис. 40. Развитие митохондриального аппарата в клетках мочевого каналь-
ца тритона на разных этапах онтогенеза [по Кирпичниковой, Женевской,
1936]. Рисунок Р. П. Женевской
С эволюционно-морфологической точки зрения важно отме-
тить, что строительство почечной клетки сопровождается, во-перг
вых, организацией системы внутриклеточных канальцев, тесно
связанных с аппаратом Гольджи, а, во-вторых, глубоким расчле-
нением клетки на субклеточные компоненты (систему митохонд-
риальных палочек с разделяющими их впячиваниями плазмолем-
мы и систему ворсинок щеточной каемки). В ряде глав книги
неоднократно подчеркивалось, что бактериальные предки клеточ-
ных организмов не обладали свойством формировать впячивания
типа пиноцитозных или фагоцитозных. Эта способность возникла
с переходом к клеточной организации и представляет собой не-
« 180 »
СТРОИТЕЛЬНАЯ АКТИВНОСТЬ СОМАТИЧЕСКИХ КЛЕТОК
посредственный след комплексирования бактериоподобных пред-
ков в виде клетки. Способность формировать впячивания плазмо-
леммы возникла из тенденции дериватов бактериоидных предков
к неполной диссоциации. Впячивания плазмолеммы — это щели
между субклеточными компонентами клетки. Как межмитохонд-
риальные впячивания плазмолеммы в базальных отделах почеч-
ных клеток, так и межворсиночные пространства (впячивания)
в апикальной части — это разделительные устройства между суб-
клеточными компонентами клетки. Клетка главного отдела моче-
вого канальца строится путем широкого использования субкле-
точных компонентов в качестве строительных блоков.
Сходное расположение (упаковка) митохондрий (митохонд-
риальных палочек) отмечено в клетках выделительных органов
некоторых беспозвоночных (мальпигиевых железах — Wessing,
1969). Очевидно, высокая работая активность плазмолеммы и
прилежащего к ней матрикса в качестве фильтрующих механиз-
мов обусловила это специфическое решение строительной задачи
клеткой выделительного органа. Интересно отметить, что у неко-
торых беспозвоночных строительство и функционирование моче-
вых канальцев связано со специфическим использованием в каче-
стве строительных блоков в выделительной клетке не только
цитоплазматических, но и ядерных органелл. По нашим наблю-
дениям, ядра выделительных органов у десятиногих раков отчет-
ливо структурированы. Под ядерной оболочкой отчетливо обособ-
лены фельген-позитивные зерна, возможно хромосомы. Способ
участия структурированного ядра в осуществлении выделитель-
ной функции неясен. Однако трудно представить себе, что струк-
турированность хроматина в ядрах активно работающих клеток
лишена какого-либо функционального значения.
Фильтрационный процесс обеспечивается конструированием
специфических структур, ориентированных в базально-апикаль-
ном направлении, не только в выделительных органах. Базаль-
ная исчерчениость была открыта также с помощью банальной
светооптической техники в клетках выводных канальцев (слюн-
ных трубочках) слюнных желез позвоночных и беспозвоночных.
На электронных микрофотографиях видно, что и в этом объекте
базальный (подъядерный) отдел клетки построен из митохонд-
рий, ориентированных параллельно оси клетки в базально-апи-
кальном направлении [см., например: Kendall, 1969]. Между
митохондриями также располагаются глубокие впячивания плаз-
молеммы. За счет субклеточных компонентов клетка здесь также
строит конструкцию, наиболее соответствующую функции фильт-
рации, которую она осуществляет.
В еще более демонстративной форме митохондрии используют-
ся в качестве строительных элементов при конструировании ре-
цепторных клеток.
« 181 »
ФУНКЦИОНАЛЬНАЯ МОРФОЛОГИЯ И ФИЛОГЕНИЯ КЛЕТКИ
СУБКЛЕТОЧНАЯ КОНСТРУКЦИЯ РЕЦЕПТОРНЫХ КЛЕТОК
Общие принципы конструирования рецепторных клеток были
установлены благодаря внедрению электронно-микроскопической
техники. В настоящее время накоплен довольно большой матери-
ал по сравнительной ультрамикроморфологии рецепторных кле-
ток, позволивший выяснить некоторые общие закономерности их
развития и создать общие схемы их строения [Поликар, Во,
1962; Винников, 1966, 1971, 1979].
Наиболее характерна по сложности и разнообразию упаковки
субклеточных компонентов фоторецепторная клетка, ульрамикро-
скопическая конструкция которой была исследована Шестрандом
[Sjostrand, 1961] и в дальнейшем многократно подвергалась
переисследованию. Установлено, что типичная фоторецепторная
клетка — палочка сетчатки — конструирует конечный элемент
(наружный членик), осуществляющий функцию приема зритель-
ного раздражения за счет выроста цитоплазмы, сквозь который
« 182 »
СТРОИТЕЛЬНАЯ АКТИВНОСТЬ СОМАТИЧЕСКИХ КЛЕТОК
Рис. 41. Схема конструк-
ции почечной клетки
Митохондрии (М) форми-
руют энергетический блок,
состоящий из единиц, ори-
ентированных по оси
клетки и разделенных впя-
чиваниями базальной мем-
браны; Я — ядро [Sjost-
rand, Rhodin, 1953]
Рис. 42. Конструкция
рецепторной клетки сет-
чатки
Митохондрии (М) упако-
ваны вертикально. Микро-
трубочки центриолей и
жгутика — вертикально,
рецепторные диски (Д) —
горизонтально; Я — ядро
[по Sjostrand, 1957]
проходит стержень, обладающий строением типичной реснички
(рис. 42). Она опирается на типичное базальное тельце, состоя-
щее из двух центриолей и девяти пар микротрубочек каждое,
и включает систему микротрубочек также из девяти пар микро-
трубочек (без центральноосевой пары). В выросте цитоплазмы
обнаруживаются многочисленные мелкие пузырьки, за счет слия-
ния (сборки) которых возникают плоские мешочки, входящие в
контакт с осевым стержнем (ресничкой) наружного членика.
Из этих мешочков развиваются характерные для фоторецептора
диски, имеющие вид плоских цистерн, расположенных в виде
стопки на всем протяжении наружного членика. Стенки дисков
имеют характерное для всех мембранных систем клетки липидно-
белковое строение и обычную для цитоплазматических мембран
толщину (40 А). Специфическая особенность мембран в дисках
наружного членика палочек сетчатки заключается в том, что в
них содержится зрительный пигмент, с помощью которого обес-
печивается поглощение света и возникновение зрительного воз-
буждения.
« 183 »
ФУНКЦИОНАЛЬНАЯ МОРФОЛОГИЯ И ФИЛОГЕНИЯ КЛЕТКИ
Базальное тельце (центриоль) осевого стержня располагается
в дистальной части внутреннего членика, соединенного с наруж-
ным посредством тонкой перемычки, через которую проходит
осевой стержень в наружный членик. Основу конструкции ди-
стальной части наружного членика составляют длинные митохон-
дрии, упакованные в виде продольно ориентированного пучка
(эллипсоида классической гистологии). Под митохондриальной
конструкцией располагается комплекс цитоплазматических орга-
нелл (цистерн Гольджи, пузырьков эндоплазматической сети),
а также продольно расположенных нейропротофибрилл. В эллип-
соидальном расширении, следующем за внутренним члеником, рас-
полагается ядро с узким ободком цитоплазмы, от которой отхо-
дит аксон, направляющийся к соединению с дендритическими
отростками биполярных клеток.
Принципиально сходная конструкция описана для фоторецеп-
торных клеток беспозвоночных. Различие здесь заключается в
размещении строительных субклеточных компонентов. У полихе-
ты Branchiomma фоторецепторная клетка глазного пятна состоит
из ядерно-митохондриального клеточного тела, связанного тонкой
перемычкой с собственно фоторецепторной конструкцией, которая
включает светопреломляющее тельце, митохондриальный блок из
горизонтально расположенных митохондрий и блок также гори-
зонтально расположенных мембран, содержащих зрительный пиг-
мент. Между мембранами располагаются центриоли с микротру-
бочками (рис. 43). Более примитивна конструкция рецепторной
клетки сетчатки полихеты Nereis (рис. 44).
Таким образом, клетка широко использует субклеточные ком-
поненты для конструирования рабочих блоков фоторецепторов.
Природа некоторых из них не вызывает сомнений. Митохондрии
митохондриальных блоков сохраняют типичную структуру.
В стержневом аппарате сохраняется расположение микротрубо-
чек, характерное для реснички и ее базального тельца (центрио-
лей). Значительно более трудно определить природу фоторецеп-
торных дисков. Морфогенез этих образований довольно хорошо
изучен. Они развиваются, как было сказано выше, из комплекса
пузырьков, располагающихся в цитоплазматическом выросте
клетки, прободаемом осевым стержнем. Связь дисков со стержнем
посредством трубчатой структуры толщиной 100—150 А наводит
на мысль о том, что весь наружный членик представляет собой
продукт дифференцировки первоначальной реснички [Поликар,
Бо, 1962]. Однако против такого вывода свидетельствует ти-
пичное мембранное устройство дисков, в особенности их взаим-
ное расположение на расстоянии 120 А, характерное для всех
двойных мембран, т. е. разделительных устройств между орга-
неллами клетки. Правильнее будет считать диски наружного
членика гомологами органелл, приспособленными к осуществле-
нию специфической рецепторной функции. Что же касается свя-
« 184 »
СТРОИТЕЛЬНАЯ АКТИВНОСТЬ СОМАТИЧЕСКИХ КЛЕТОК
Рис. 43. Конструкция рецепторной клетки зрительного органа полихеты
Branchiomma (схема)
Митохондрии (М) и микротрубочки (Мт) центриолей упакованы перпендикулярно
оси рецепторной клетки [по Krause, Lawrence, 1966]
Рис. 44. Конструкция рецепторной клетки зрительного органа полихеты
Nereis
Веерообразная упаковка митохондрий (М) вокруг аксиального филамента (осевой
нити — ОС). Горизонтальная упаковка дисков. ПК — пигментная клетка
зи мембранного комплекса с ресничками, то примеры такого
объединения имеются и в других клетках, например в спермиях,
где жгутик тесно связан с митохондриями. Какие органеллы
клетки при формировании фоторецептора превратились в фото-
рецепторные диски — эргастосомы или ретикулосомы, на уровне
имеющихся сведений определить невозможно.
Конечно, самой интересной с эволюционно-морфологической
точки зрения особенностью дисков наружного членика представ-
ляется локализация в их мембранах (и, вероятно, в прилежащем
матриксе) зрительного пигмента [см.: Винников, 1966, 1971,
« 185 »
ФУНКЦИОНАЛЬНАЯ МОРФОЛОГИЯ И ФИЛОГЕНИЯ КЛЕТКИ
1979]. Возникает вопрос об источнике пополнения белковой части
зрительного пигмента. РНП рибосомы, или рибосомоподобные
образования, располагаются в проксимальном отделе наружного
членика. Синтез белков (включение меченых аминокислот) от-
крыт с помощью радиоавтографического метода в митохондри-
альном комплексе (эллипсоиде наружного членика). Я. А. Вин-
ников полагает, что в области эллипсоида синтезируется, по-ви-
димому, и белковая часть зрительного пигмента — родопсина.
Экспериментально установлено повышение активности эргасто-
плазмы (формирование полисом) в рецепторных клетках глаза
москита под влиянием света [White, Surdeen, 1967]. Если это
верно, то здесь мы встречаемся с редким случаем кооперации
двух мембранных систем, одна из которых поставляет белок, не-
обходимый для функционирования других.
В слуховых рецепторных клетках обнаружена специфическая
упаковка мембранных структур, из которых построены особые
циркулярные полости, образующие как бы внутреннюю оболочку
клетки, а также специальную мембранную конструкцию сферои-
дальной формы в апикальной части клетки. Под системой
периферических мембран размещается слой митохондрий, ориен-
тированных вдоль оси клетки (наружные слуховые клетки).
В ампулярных гребешках располагаются рецепторные клетки,
снабженные волосками, один из которых имеет систему микро-
трубочек реснично-жгутикового типа (9 + 2). В упаковке цито-
плазматических органелл отмечена некоторая закономерность,
связанная с формой рецепторных клеток.
Рецепторные клетки обонятельного эпителия характеризуются
развитием апикального выроста в виде пузырька, располагающе-
гося над поверхностью обонятельного эпителия. От пузырька от-
ходят 6—12 ресничек с типичным устройством микротрубочек
(9+2). В надъ- и подъядерной зонах цитоплазмы располагаются,
два скопления митохондрий.
Накопленные в литературе данные по электронной микроско-
пии органов чувств недостаточны для того, чтобы сформулировать
общие закономерности конструирования рецепторных клеток.
Однако из имеющихся фрагментарных данных, относящихся
главным образом к позвоночным, можно сделать вывод, что кон-
струкция клетки обеспечивает ее трансформацию в любую фор-
му рецепторных клеток, с использованием ее субклеточных ком-
понентов в качестве рабочих блоков рецепторного устройства.
Очевидно, организация клетки как организма при переходе от
протоклеточного к клеточному уровню привела к гигантскому
скачку в рецепторной активности, связанному с органоидной кон-
струкцией клетки.
В отличие от большинства бактерий простейшие характери-
зуются широким спектром реакций на механические, температур-
ные, химические, лучевые и иные воздействия внешней среды.
« 186 »
СТРОИТЕЛЬНАЯ АКТИВНОСТЬ СОМАТИЧЕСКИХ КЛЕТОК
Осуществление этих реакций связано с органоидной организаци-
ей простейших, в частности с наличием дифференциальной чувст-
вительности одних органелл и дифференциальной реактивности
других. У простейших, даже примитивных, например у жгутико-
вых, дифференцированы светочувствительные субклеточные ком-
поненты, жгутик является органом световой рецепции, тактиль-
ной рецепции и т. д. Можно предположить, что с переходом к
многоклеточной организации клеточная конструкция была ис-
пользована организмом для формирования разнообразных рецеп-
торных аппаратов.
Как справедливо полагает видный специалист по цитофизио-
логии рецепторных аппаратов Я. А. Винников [1966], рецептор-
ные клетки во всем животном мире характеризуются большим
сходством, ярко демонстрирующим закономерность, которую
Винников называет принципиальной однозначностью рецепции.
Так называемые первичночувствующие рецепторные клетки (по
терминологии Винникова) обладают универсальным прибором,
воспринимающим раздражения из внешнего мира,— перифери-
ческим отростком, несущим подвижный жгутик или ресничку.
Вторичночувствующие клетки, возникшие на более позднем
этапе эволюции и характеризующиеся отсутствием периферичес-
кого и центрального отростков, также снабжены воспринимаю-
щим аппаратом типа жгутика или реснички. Согласно Винникову,
жгутики или реснички следует рассматривать в качестве особых
подвижных универсальных антенн, активно (автоматически)
воспринимающих те или другие виды энергии внешней среды.
Винников подчеркивает сходство этого прибора с ресничкой или
жгутиком, осуществляющим у некоторых одноклеточных живот-
ных, например у эвглены, одновременно с локомоторной и рецеп-
торную функцию.
Это вполне убедительное эволюционно-морфологическое суж-
дение следует дополнить указанием на прогрессивный характер
эволюционной трансформации клеточной рецепции при переходе
от одноклеточной к многоклеточной организации животных ор-
ганизмов. Мы должны иметь в виду, что ресничный или жгути-
ковый аппарат достался эукариотам в наследство от прокариотов
(бактерий) как продукт комплексирования и дифференцировки
бактериальных жгутиков. Жгутики и реснички эукариотов, вклю-
чая их базальные части (базальные тельца, центриоли) — это не
самостоятельные органоиды, а локомоторные (или рецепторные)
аппараты субклеточных компонентов клетки, и эта их особенность
получает чрезвычайно яркое выражение в конструкции опорного
стержня (реснички) рецепторных клеток. Ресничка настолько
тесно связана со специфическими субклеточными компонентами
рецепторных клеток (например, с дисками наружного членика
фоторецепторных клеток), что некоторые авторы считают диски
как бы продуктом дифференцировки реснички [Поликар, Бо,
« 187 »
ФУНКЦИОНАЛЬНАЯ МОРФОЛОГИЯ И ФИЛОГЕНИЯ КЛЕТКИ
1962]. В действительности, в рецепторной клетке мы имеем
чрезвычайно демонстративный пример строительной активности
клетки, связанный с использованием всех субклеточных компо-
нентов для конструирования специфического одноклеточного ор-
гана.
В организме многоклеточных эукариотов клетка осуществляет
двоякую функцию, участвуя в составе ткани в строительных
процессах и в составе органов в осуществлении рабочих процес-
сов (функций органов). Таким образом, дифференцировка клеток
включает структурную специализацию как на строительных
(например, способность к эпителизации как характерное свойст-
во клеток, проявляющееся в растущих или регенерирующих эпи-
телиальных тканях), так и на рабочих (например, синтез секре-
тов эпителиальными клетками) процессах. В обоих случаях диф-
ференцировка клетки сопровождается переходом от слабо спе-
циализированной к высоко дифференцированной конструкции.
В ходе эволюции одноклеточных эукариотов только у высших
(инфузории) системы специализированных органелл используют-
ся для строительства специализированных функциональных
конструкций (развитие опорных структур, глотки, сложных рес-
ничек и т. д.). У многоклеточных эукариотов эволюционное
усложнение организации, связанное с дифференциацией и услож-
нением функций, препятствует использованию систем органелл в
качестве конструктивных элементов специализированных много-
клеточных органов. Универсальную роль поставщика белков для
конструирования специализированных многоклеточных органов
у эукариотов играет рибосомный аппарат, посредством которо-
го осуществляется синтез опорных, сократимых и других белков,,
входящих в состав всех рабочих конструкций эукариотов. Одна-
ко при функциональной дифференцировке некоторых клеток суб-
клеточные компоненты используются не только как рабочие бло-
ки, но и как строительные конструкции клетки.
В почечных клетках позвоночных и некоторых беспозво-
ночных широко используется строительный принцип осевойг
(базально-апикальной) упаковки митохондриального аппарата с
участием так же ориентированных впячиваний плазмолеммы
(базальная исчерченность). В рецепторных клетках позвоночных
и некоторых безпозвоночных система жгутика (базальное тель-
це + жгутик) используется как основа для упаковки рецепторных
мембран (перпендикулярно к стержню) и митохондриального па-
кета (перпендикулярно или параллельно стержню). Органеллы
рекапитулируют процесс комплексирования, с помощью которого
была сконструирована клетка, для строительства специализи-
рованных клеток.
« 188 »
АССИМИЛЯЦИОННАЯ И СЕКРЕТОРНАЯ АКТИВНОСТЬ КЛЕТКИ
Глава пятая
АССИМИЛЯЦИОННАЯ
И СЕКРЕТОРНАЯ АКТИВНОСТЬ КЛЕТКИ
И ЕЕ ФИЛОГЕНЕТИЧЕСКОЕ ЗНАЧЕНИЕ
АССИМИЛЯЦИОННАЯ ФУНКЦИЯ —
ОСНОВНАЯ ФУНКЦИЯ живого
Среди всех функций живого ассимиляционная функция наи-
более ярко выражает сущность жизни — превращение материи
внешнего мира в специфически организованную живую материю
организма со всеми его индивидуальными и видовыми свойства-
!Ми и признаками.
Любой организм — будь то самая примитивная микоплазма,
состоящая из нескольких сот тысяч макромолекул, или сложней-
шее многоклеточное животное или растение — существует как
организм прежде всего потому, что он строит себя из ассимили-
руемых продуктов внешней среды, синтезируя в своем теле со-
ставляющие это тело специфические вещества, и в первую оче-
редь основной строительный материал живого — белковые макро-
молекулы.
На протяжении многих лет господства в биологической нау-
ке клеточной теории было принято связывать ассимиляционную
функцию организма с ассимиляционной активностью клетки.
Считалось, что клетка это прежде всего продуцент специфиче-
ских белков организмов. Организм строится из клеток, продуци-
рующих специфические структурные и метаболические белки.
Эти рассуждения полностью сохраняют свое значение в том
смысле, что организм осуществляет ассимиляционную функцию
с помощью клеток. Однако со вступлением биологической науки
в молекулярно-биологическую эру при сохранении общей формы
этих рассуждений их содержание коренным образом изменилось.
Мы признаем по-прежнему, что организм ассимилирует продукты
внешнего мира и строит из них свои специфические белки и с
их помощью все остальные химические составные части посред-
ством клеток. Но мы не менее твердо знаем теперь, что клетки
строят свои белки с помощью специфических клеточных частиц,
рибосом, без которых никакой белковый синтез неосуществим.
Синтез белка на рибосомах может совершаться и вне организма,
и вне клеток, в гомогенизированных субстратах. Рибосомы —
универсальные структуры, с помощью которых осуществляется
синтез белков, в том числе структурных и метаболических, опре-
деляющих видовую и индивидуальную специфичность организма
и тканевую принадлежность каждой его клетки. Рибосомы— уни-
версальный ассимиляционный аппарат организма и, вероятно,
универсальный ассимиляционный аппарат всех известных форм
« 189 »
ФУНКЦИОНАЛЬНАЯ МОРФОЛОГИЯ И ФИЛОГЕНИЯ КЛЕТКИ
живого. Без рибосом осуществление ассимиляционной функции
невозможно.
Нет никаких сомнений в том, что рибосомный аппарат полу-
чен эукариотами от своих предков — прокариотов. Бактериаль-
ный организм, начиная от самых примитивных микоплазм и кон-
чая высшими бактериями, содержит рибосомный комплекс,
состоящий из субплазмолеммального блока и рассеянных в ма-
триксе, вокруг нуклеоида, свободных рибосом и их объединений
(полисом). Рибосомный аппарат клетки имеет значительно более
сложную конструкцию, связанную с усложнением организации
при переходе от протоклеточного к клеточному уровню. Выше'
неоднократно указывалось, что устройство рибосомного аппарата
с достаточной убедительностью свидетельствует о происхожде-
нии клетки из комплекса протоклеток, возникшего путем фор-
мирования клона из прародительской протоклетки. Конструкция
протоклетки, идентичная конструкции современной бактерии,
включала в качестве основных структурных узлов плазмолемму,
матрикс, нуклеоид, рибосомный комплекс, а также жгутиковый
комплекс и мезосомный аппарат. Эти шесть элементов на раз-
ных уровнях развития, от чрезвычайно высокого до глубокой ре-
дукции, обнаруживаются во всех пяти субклеточных строитель-
ных компонентах клетки. Рибосомный комплекс подвергается
полной редукции только в сегрегационном аппарате клетки — ре-
тикулоплазме. Все остальные органеллы и системы органелл
клетки содержат рибосомные комплексы, подобно своим бактерио-
идным предкам.
ЭРГАСТОСОМЫ —
ОСНОВНЫЕ ХРАНИЛИЩА РИБОСОМ В КЛЕТКЕ
Рибосомные комплексы составляют основной элемент строе-
ния эргастосом, из которых складывается главный ассимиляцион-
ный аппарат клетки. Выше говорилось о том, что на долю эр-
гастосом приходится строительство белков, входящих в состав
основных строительных материалов многоклеточных животных.
К сожалению, при современном состоянии знаний о топографии
синтеза белков в клетке, нельзя сказать ничего определенного о
механизме ассимиляционного процесса в целом, начиная с синте-
за специфических строительных макромолекул и кончая их ук-
ладкой в виде строительных блоков в различных частях клетки.
Мы ничего не знаем об этой стороне ассимиляционной актив-
ности даже у наиболее хорошо изученных молекулярно-биологи-
ческими методами организмов — бактерий. Если называть струк-
турными блоками те, из которых строится тело любого организма,
в том числе и бактериального организма, а метаболическими бло-
ками те, которые обеспечивают усвоение и расходование (путем
диссимиляции) пищевых средств, то можно уверенно сказать, что
« 190 »
АССИМИЛЯЦИОННАЯ И СЕКРЕТОРНАЯ АКТИВНОСТЬ КЛЕТКИ
в современной молекулярной биологии не сложилось никаких
представлений о производстве и использовании структурных бел-
ков бактериальными организмами.
Как неоднократно указывалось выше, организм бактерий
включает шесть структурных компонентов: плазмолемму, мат-
рикс, жгутик или жгутиковый комплекс, рибосомный комплекс,
мезосому (у граммположительных бактерий) и нуклеоид. За ис-
ключением нуклеоида, все структурные компоненты бактерий
строятся в основном из белков. Белки строятся на рибосомах,
которые вплотную связаны с плазмолеммой, а следовательно,
и ее производными — жгутиками и мезосомой, и свободно распо-
лагаются в матриксе, так что все конструкции бактериального ор-
ганизма находятся в прямой топографической связи с источника-
ми синтезирующихся структурных белков. Но это — почти все,
что мы знаем о конечной фазе ассимиляционного процесса у бак-
терий. Изученные к настоящему времени факты самосборки не-
которых бактериальных структур (жгутиков, мембран) [см.:
Kushner, 1969; Leon et al., 1970; Поглазов, 1975] совершенно не-
достаточны для понимания способа, с помощью которого бакте-
риальная конструкция строится как целое. Таким образом, обра-
щаясь к анализу ассимиляционного процесса на следующем —
клеточном — уровне организации живого, мы можем ставить
вопрос только о том, обеспечивает ли каждый из субклеточных
компонентов свой собственный ассимиляционный процесс или
получает (полностью или частично) строительный белковый ма-
териал. за счет других субклеточных компонентов, прежде всего
за счет эргастосом. Проще всего, по-видимому, этот вопрос ре-
шается в отношении аппарата Гольджи.
КАК ПРОДУЦИРУЮТСЯ БЕЛКИ РЕТИКУЛОПЛАЗМЫ
Аппарат Гольджи — единственный из субклеточных компо-
нентов клетки, лишенный рибосом, и в связи с этой особенностью
утративший способность к синтезу белков. Участие аппарата
Гольджи в производстве секретов выражается в синтезе полиса-
харидов, которые входят в состав мукополисахаридных гранул,
выводимых с помощью аппарата Гольджи из клетки. Единствен-
ный органоид, возникающий за счет аппарата Гольджи,— акро-
сома спермиев, содержит полисахариды и липиды, вероятно, про-
дуцируемые с помощью мембран и матрикса ретикулосом. Что
же касается белковой части акросомы, в частности содержащихся
в ней ферментов, то она возникает, вероятно, за счет активности
рибосом прилежащей эргастоплазмы. Типичные структурные эле-
менты ретикулоплазмы не обнаруживают признаков присутствия
нуклеиновых кислот в своем составе. Их белковые части, очевид-
но, возникают за счет активности других органелл. Выше отме-
чалось, что бесспорная связь аппарата Гольджи с мембранами
« 191 »
ФУНКЦИОНАЛЬНАЯ МОРФОЛОГИЯ И ФИЛОГЕНИЯ КЛЕТКИ
гладкого эндоплазматического ретикулума позволяет считать, что
белки ретикулосом возникают в эргастосомах, откуда переходят
через гладкие канальцы эргастоплазмы в матрикс и мембраны
ретикулоплазмы [Neutra, Leblond, 1966; Claude, 1970]. Второй
источник формирования белков ретикулоплазмы — ядро, из мемб-
ран которого строятся ретикулосомы [Moore, McAlear, 1963;
Stang-Voss, 1970; Фрей-Висслинг, 1976].
КООПЕРАЦИЯ ОРГАНЕЛЛ, ПРОДУЦИРУЮЩИХ БЕЛКИ
Ядро как потенциальный источник формирования всех орга-
нелл клетки, очевидно, может играть роль поставщика и других
структурных белков цитоплазмы. В какой-то мере в формирова-
нии ядра и бесспорно в формировании ядерной мембраны уча-
ствует эргастоплазма, за счет которой строится внешняя ядерная
мембрана. На рибосомах ядрышка строятся, очевидно, рибосо-
мальные белки всех рибосом, входящих в состав эргастоплазмы.
Как отмечалось в главе о биогенезе митохондрий, имеются дан-
ные о происхождении этих органелл и, следовательно, входящих
в их состав белков за счет эргастоплазмы, а также ядерной мембра-
ны. Самые интересные данные относятся к самосборке митохонд-
рий за счет зернистости (скорее всего, рибосомальной), поступаю-
щей в цитоплазму из ядра [Stang-Voss, Staubesang, 1970].
Таким образом, конечный этап ассимиляционного процесса —
строительство субклеточных белковых конструкций — сопровож-
дается широкой кооперацией субклеточных компонентов клетки,
Однако каждая из органелл клетки, обладающая рибосомным на-
бором, очевидно, в состоянии обеспечить производство и упаковку
белковых строительных белков, составляющих белковую основу
органелл. Нет сомнений в том, что на рибосомах хромюсом син-
тезируются белки — это доказано для гигантских хромосом слюн-
ных желез личинок двукрылых [Lezzy, 1967; Кикнадзе, 1972].
Интенсивный синтез белков доказан и для другой саморепроду-
цирующейся конструкции клетки — ядрышкового аппарата [Birn-
stiel, 1963; Ro et al., 1964; Simar, 1969]. По многим данным мож-
но заключить, что митохондрии, а также пластиды растительных
клеток обеспечивают с помощью автономного синтеза структур-
ных белков свой морфогенез и саморепродукцию. Наконец, основ-
ные органеллы ассимиляционной функции — эргастосомы — оче-
видно, также участвуют не только в синтезе, но и в упаковке
структурных белков в эргастоплазме, составляющей главный
структурный компонент цитоплазмы.
Наиболее демонстративной моделью, в которой все субклеточ-
ные компоненты обнаруживают активное участие в ассимиля-
ционной функции, можно считать ооцит. В третьей главе этой
части книги были приведены данные о кооперации органелл ооци-
та в формировании специфического субклеточного компонента —
« 192 »
АССИМИЛЯЦИОННАЯ И СЕКРЕТОРНАЯ АКТИВНОСТЬ КЛЕТКИ
желточных телец и побочных ядер. Здесь следует подчеркнуть,
что в синтезе белков, входящих в состав цитоплазмы ооцита, ак-
тивно участвуют все органеллы клетки. Однако создание полной
картины осуществления ассимиляционной функции, включая
формирование всех белковых конструкций клетки,— дело неблиз-
кого будущего.
ВАРИАНТ АССИМИЛЯЦИОННОЙ ФУНКЦИИ КЛЕТКИ —
ПРОДУКЦИЯ СЕКРЕТОВ
Наиболее демонстративное выражение синтез белков в клет-
ке получает в секреторной функции. Клетка может продуци-
ровать белковые вещества, подлежащие выведению из клетки для
осуществления пищеварительной, опорной (коллагенообразование),
защитной (слизеобразование), регуляционной (гормонообразо-
вание), иммунобиологической (антителообразование) и других
функций. Для прокариотов в связи с интенсивностью их метабо-
лизма задержка продуцируемых метаболических белков, напри-
мер пищеварительных ферментов, в виде капель секретов или гра-
нул просекретов не характерна. Внутриклеточный секреторный ап-
парат с его специфическими структурами, аккумулирующими пи-
щеварительные ферменты или капли слизи, появляется у эука-
риотов. Высокого развития секреторная функция достигает у мно-
гоклеточных животных организмов в связи с конструированием
органов пищеварения, дыхания, эндокринной регуляции и других
специализированных метаболических механизмов. Секреторная
клетка, синтезирующая, аккумулирующая и выделяющая секре-
торные продукты, составляет неотъемлемый компонент организа-
ции всех многоклеточных животных.
Секреторному процессу посвящена большая цитологическая
литература, обобщенная в нескольких обзорах [Kurosumi, 1961;
Шубникова, 1966].
В любом случае осуществления секреторной функции форми-
рование секрета связано с синтезом белка — либо в качестве сек-
реторного продукта, либо в качестве фермента синтетазы, кото-
рый обеспечивает синтез небелкового секрета (мукополисахари-
да, липопротеида,, липида). Таким образом, любой секреторный
процесс осуществляется с помощью рибосомного аппарата клетки.
Как неоднократно отмечалось по ходу изложения книги, все
основные органеллы клетки, за исключением аппарата Гольджи,
сохраняют рибосомные комплексы, унаследованные от бактериоид-
ных предков. Каждая органелла, за исключением ретикулосом,
содержит аппарат синтеза белка, обеспечивающий в той или иной
степени ассимиляционную функцию и, следовательно, обладающий
потенциальным свойством синтезировать секреторный белок или
фермент синтетазу, с которой связано производство небелковых
секретов. Как мы увидим ниже, действительно, все органеллы
13 А. Н. Студитский « 193 »
ФУНКЦИОНАЛЬНАЯ МОРФОЛОГИЯ И ФИЛОГЕНИЯ КЛЕТКИ
клетки в тех или иных условиях проявляют секреторную актива
ность. Однако наиболее ярко секреторная активность проявляется
эргастоплазматическим аппаратом.
Как было сказано выше, синтетическая активность клетки не-
разрывно связана с ее ассимиляционной функцией. Метаболиче-
ские белки, так же как и структурные белки, принадлежат, хотя
и в меньшей степени, к числу специфических белков, характери-
зующих природу клетки. Эргастоплазматический аппарат, обеспе-
чивающий ассимиляционную активность клетки, одновременно
функционирует и как ее секреторный аппарат.
ЭРГАСТОСОМЫ —
ОСНОВНЫЕ ОРГАНЕЛЛЫ СИНТЕЗА СЕКРЕТОРНЫХ БЕЛКОВ
Участие эргастосом в белковой секреции было обнаружено за-
долго до открытия ультраструктуры эргастоплазмы. Термин «эр-
гастоплазма» был предложен Гарнье для обозначения базофиль-
ных структур белковых секреторных клеток, обладающих харак-
терной базальной исчерченностью в конечных отделах белковых:
(околоушных) слюнных желез и экзокринного отдела поджелу-
дочной железы. В настоящее время точно установлено, что
секреторные белки, действительно, синтезируются на рибосомах
эргастоплазмы железистых белковых клеток слюнной или подже-
лудочной железы и обнаруживаются в виде первичного секретор-
ного продукта в просветах цистерн эргастоплазмы, после чего капли
секрета формируются в пузырьках комплекса Гольджи, с помо-
щью которых завершается выработка и эвакуация секрета. В свя-
зи с этой, вполне достоверной схемой секреторного процесса
следует отметить два важнейших с эволюционно-морфологической
точки зрения обстоятельства среди событий, составляющих секре-
торный процесс. Первое из них заключается в поведении струк-
турных компонентов эргастоплазмы.
В неактивном состоянии двойные мембраны эргастоплазмы
(альфацитомембраны, по первоначальной терминологии Шестран-
да) представляются спавшимися, разделяясь пространством ши-
риной в 120 А, характерным для всех внутриклеточных двойных
мембран. Активная секреция сопровождается расширением меж-
мембранных пространств, куда поступает синтезируемый эргасто-
плазмой первичный белковый секреторный продукт. В этом со-
стоянии с яркой демонстративностью выступает субклеточная
(протоклеточная) организация эргастоплазмы. Отделенные друг
от друга широкими межмембранными (периэргастосомальными)
пространствами эргастосомы приобретают структуру, с глубоким
сходством воспроизводящую элементы строения бактериоидных
предков клетки (рис. 45, 46). Эта структура включает: мембрану
(плазмолемму), матрикс и рибосомный комплекс, состоящий из
субмембранных и свободных рибосом (полисом). Не хватает
« 194 »
АССИМИЛЯЦИОННАЯ И СЕКРЕТОРНАЯ АКТИВНОСТЬ КЛЕТКИ
Рис. 45. Схема производства и выделения белкового секрета с помощью
эргастосом (Эр) и ретикулосом (Рет) железистой клетки (по схеме Поле-
нова, 1968, надписи изменены)
И — митохондрии; Я — ядро; Эр — эргастоплазма; Рет. — ретикулоплазма; ГС — гра-
нулы секрета
только нуклеоида, содержащего ДНК, чтобы сходство, основанное
на гомологии, было полным. ДНК в составе эргастоплазмы об-
следованных объектов не обнаружена. Но после того, как ДНК —
гомолог нуклеоида бактерий — удалось открыть в нехромосомных
ядерных органеллах — ядрышках, в цитоплазматических органел-
лах — митохондриях (а также в пластидах растительных клеток)
и в комплексных органеллах типа желточных телец ооцитов, не
вызывает сомнений, что в каких-то объектах сходство эргастосом
с бактериоидными предками будет довершено наличием нуклеоид-
ного аппарата ДНК.
« 195 »
13*
ФУНКЦИОНАЛЬНАЯ МОРФОЛОГИЯ И ФИЛОГЕНИЯ КЛЕТКИ
Рис. 46. Схема производства нейро-
секрета эргастосомами нейрона и
транспорта секрета с помощью ре-
тикулосом [по Поленову, 1966]
Обозначения те же, что на рис. 45
Р — ретикулоплазма
В настоящее время можно
Во всяком случае, уже рас-
крытые электронно-микроскопи-
ческим исследованием особен-
ности устройства эргастосом в
состоянии секреторной активно-
сти позволяют видеть их сход-
ство с бактериоидными предка-
ми. Точно так, как в колонии
бактерий-микоплазм первобыт-
ных морей осуществлялось вы-
деление белков-ферментов, ли-
зирующих белковые пищевари-
тельные продукты (в первую
очередь другие бактериальные
организмы), в составе желези-
стой клетки эргастосомы синте-
зируют и выводят через свои
мембраны в межмембранное
пространство пищеварительные
белковые ферменты, лизирую-
щие белковые пищевые про-
дукты.
РЕТИКУЛОСОМЫ УЧАСТВУЮТ
В СЕГРЕГАЦИИ, АККУМУЛЯЦИИ
И ТРАНСПОРТЕ БЕЛКОВЫХ
СЕКРЕТОВ
Второе, важное в эволюцион-
но-морфологическом отношении
обстоятельство заключается в
кооперации органелл, участвую-
щих в белковой секреции,
считать точно доказанным, что
эвакуация секретов из -железистых клеток осуществляется с по-
мощью аппарата Гольджи. Структурные компоненты комплексов.
Гольджи, ограниченные мембранами (ретикулосомы по нашей
терминологии), активно участвуют в оформлении и эвакуации
капель секреторного продукта из клетки. Способ осуществления
этой функции ретикулосом не вполне ясен. В пузырьках, отде-
ляющихся от ретикулосом, сначала появляется довольно рыхлый
секреторный продукт. По мере продвижения в базально-апикаль-
ном направлении капли секрета подвергаются укрупнению и
уплотнению. Принимая во внимание сегрегационную функцию ап-
парата Гольджи, можно предполагать, что в ретикулосомах: с по-
мощью их матрикса и мембран осуществляется путем специфиче-
ской фильтрации переработка первичного белкового продукта и .
« 196 »
АССИМИЛЯЦИОННАЯ И СЕКРЕТОРНАЯ АКТИВНОСТЬ КЛЕТКИ
его обогащение добавочными, небелковыми продуктами. Процесс
продолжается и после отделения пузырьков с секретом от цистерн
комплексов Гольджи. Таким образом, на примере белковой секре-
ции с чрезвычайной демонстративностью раскрывается биологи-
ческая роль дифференциации субклеточных компонентов клетки.
Для осуществления секреторного процесса требуется, по крайней
мере, два рабочих блока в секреторном механизме: производящий
и эвакуирующий. Оба блока работают на основе глубокой и да-
леко не до конца раскрытой кооперации субклеточных компонен-
тов, или, вернее, их систем: эргастоплазмы и ретикулоплазмы.
В настоящее время хорошо изучены, .с помощью современной
техники, несколько примеров белковой секреции нежелезистыми
клетками, в частности так называемая нейросекреция — форми-
рование специфических секретов-гормонов нервными клетками.
Эти секреты транспортируются не через плазмолемму тела нерв-
ной клетки, а по аксону, в зону контакта с воспринимающим ней-
роном. Однако в принципе процесс формирования нейросекрета
и здесь осуществляется механизмом, состоящим из двух блоков:
производящего и транспортирующего аппарата. Первый состоит
из компонентов эргастоплазмы, второй— из пузырьков ретикуло-
плазмы. Важно отметить, что и в этом случае осуществляется
обособление компонентов эргастоплазмы в виде отдельностей,
воспроизводящих структуру бактериоидных предков, включая
замкнутую мембрану, матрикс и рибосомный комплекс. Недоста-
ет только нуклеоида с комплексом ДНК (рис. 46).
Столь же демонстративна кооперация ассимиляционной и сег-
регационной системы при синтезе сложных белково-полисахарид-
ных секретов (мукополисахаридов).
Мукополисахариды, муцины или слизистые секреты содержат
сложный химический комплекс специфического белка с полисаха-
ридом. В настоящее время с помощью современных методов
точно установлено, что белковый компонент мукополисахаридных
секретов синтезируется слизистыми (например, бокаловидными)
клетками в эргастоплазме, причем все литературные данные по-
зволяют сделать вывод, что этот процесс также сопровождается
обособлением эргастосом в результате расширения межмембран-
ных пространств. Возникший белковый секреторный продукт под-
вергается сегрегации в ретикулоплазме, однако в отличие от чи-
сто белковой секреции в мукополисахаридной секреции активно
участвует аппарат Гольджи — не только путем упаковки секрета
в капли и выведения их из клетки, но и путем обогащения секре-
та полисахаридами, синтезируемыми в ретикулоплазме. В слизей-
образующих клетках фаллопиевых труб кролика описаны специ-
фические органеллы, синтезирующие гликоген [Le Венх, 1969].
Они имеют вид отдельностей эллипсоидальной формы, состоящих
из концентрически наслоенных мембран, связанных с гладким
эндоплазматическим ретикулумом.
« 197 »
ФУНКЦИОНАЛЬНАЯ МОРФОЛОГИЯ И ФИЛОГЕНИЯ КЛЕТКИ
Механизм синтеза полисахаридов в комплексах Гольджи
слизистых клеток неясен, хотя сам факт полимеризации моноса-
харидов в ретикулоплазме не вызывает сомнений. Здесь важно
отметить, что и в этом случае секреторный процесс сопровождает-
ся обособлением субклеточных компонентов эргастоплазмы и ре-
тикулоплазмы и осуществляется на основе глубокой кооперации
обоих рабочих блоков секретирующего аппарата.
Своеобразной формой накопления секреторных гранул можно
считать гранулообразование в гранулоцитах костного мозга. Ус-
тановлено [Bainton, Farquhar, 1966], что ранний этап грануло-
поэза (програнулоцит) в полиморфноядерных лейкоцитах (ней-
трофилах) характеризуется активностью внутренних мембран
комплекса Гольджи, отделяющих пузырьки с азурофильной зер-
нистостью. Для более позднего этапа (миелоцит) характерна ак-
тивность внешних мембран, от которых отделяются крупные пу-
зырьки с типичной нейтрофильной зернистостью. Активная роль
в этом процессе ретикулосом бесспорна, в связи с чем очевидно
наличие полисахаридов в гранулах нейтрофилов.
РОЛЬ ГЛАДКОГО КОМПОНЕНТА ЭРГАСТОПЛАЗМЫ
Необходимо отметить также, что в ряде работ последних лет
отмечается участие в секреторном процессе так называемого
гладкого эндоплазматического ретикулума [см.: Шубникова,
1966]. Как известно, эту структуру принято относить к эндо-
плазматическому ретикулуму (эндоплазматической сети) Порте-
ра в качестве мембранного компонента, лишенного рибосом. От-
сутствие рибосом описывается как первичное (мембраны разви-
ваются в гиалоплазме из везикулов, не покрываясь рибосомами)
или вторичное (покрытые рибосомами «шероховатые» мембраны
лишаются рибосом). Происхождение и структурная природа
гладкого эндоплазматического ретикулума недостаточно ясны.
Первичное и вторичное формирование гладких мембран в цито-
плазме представляют собой, вероятно, совершенно различные про-
цессы. Цистерны эргастоплазмы возникают из мелких пузырьков,
лишенных рибосом, и вступают в связь с рибосомами по мере
обособления эргастосом. Утрата рибосом эргастоплазматическими
мембранами носит скорее функциональный характер, зависящий
от интенсивности синтеза белка. Во всяком случае, связь гладких
мембран с эргастоплазматическими мембранами, с одной стороны,
и с мембранами комплексов Гольджи — с другой, не вызывает
сомнений. Вот почему гладкие цистерны участвуют в процессе
секреции не столько в качестве продуцента каких-то компонентов
секрета, сколько в качестве промежуточного транспортного бло-
ка, связанного с эргастоплазмой и ретикулоплазмой.
В связи с этим выводом можно привести данные, относящиеся
к последовательности процессов синтеза, транспорта и эвакуации
« 198 »
АССИМИЛЯЦИОННАЯ И СЕКРЕТОРНАЯ АКТИВНОСТЬ КЛЕТКИ
секретов. Меченый С14-лизин появляется в эргастоплазме через
3 мин после введения, в гладком эндоплазматическом ретикулу-
ме — через 5 мин и в пузырьках комплексов Гольджи — через
18 мин. Нетрудно сделать вывод, что трубочки эндоплазматиче-
ского ретикулума играют роль транспортного блока в механизме
секреции, являясь, по-видимому, вторичным производным мемб-
ран эргастоплазмы.
МИТОХОНДРИИ СИНТЕЗИРУЮТ БЕЛКИ И ГЛИКОГЕН
Участие митохондриальной системы в синтезе белка и секре-
торном процессе показано на многих объектах [см.: Kurosumi,
1961; Шубникова, 1966]. Прямое превращение митохондрий в гра-
нулы секрета считается сомнительным. Однако накопление бел-
ковых липидных и полисахаридных включений в митохондриях
клеток, синтезирующих белковые продукты, отмечено многими
авторами [Рудин, 1971; Гаузе, 1977]. Бесспорно накопление бел-
ковых включений в митохондриях ооцитов при оогенезе у неко-
торых животных [см.: Norrevang, 1968; данные по накоплению
белка в митохондриях ооцитов лягушек: Massover, 1971; Rana
pipiens: Ward, 1962; Kessel, 1971; Xenopus laevis: Spornitz, Kress,
1971; Spornitz, 1972; Rana esculenta, R. temporaria: Kress, Spor-
nitz, 1972; в митохондриях эпителиально-мышечных клеток гидры:
Davis, 1967; клеток печени человека: Themann, Bassewitz, 1969,
а также тритона: Godula, 1972; Sentein, Humean, 1968 и многих
растительных объектов: Leak, 1968]. Белок накапливается
при этом часто в кристаллической форме. В митохондриях эно-
цитов комара описано накопление кристаллических тел, по-ви-
димому, белковой природы [Gnatzy, 1970]. Отмечено сходство
между бактериальными и митохондриальными белковыми крис-
таллическими включениями [Voelz, 1968]. В некоторых функцио-
нальных ситуациях, например при спермиогенезе [Anderson,
1968], митохондрии синтезируют гликоген.
СИНТЕЗИРУЮТСЯ ЛИ СЕКРЕТОРНЫЕ БЕЛКИ
ЯДЕРНЫМИ ОРГАНЕЛЛАМИ
Менее изучено и часто подвергается сомнению участие в сек-
реторном процессе субклеточных ядерных компонентов (ядерных
органелл).
Косвенная роль ядра в осуществлении секреторного процесса
бесспорна. Для секретирующих клеток характерно крупное,
иногда огромное ядрышко — продуцент рибосом, с помощью ко-
торых осуществляется главный рабочий процесс секреторного
цикла — синтез белков. Интенсивно секретирующие гигантские
клетки слюнных желез личинок двукрылых отличаются развити-
ем гигантских хромосом и ядрышковой системы, также продуци-
рующих огромные количества рибосом. Вопрос заключается в
« 199 »
ФУНКЦИОНАЛЬНАЯ МОРФОЛОГИЯ И ФИЛОГЕНИЯ КЛЕТКИ
том, могут ли хромосомы и ядрышки как ядерные органеллы не-
посредственно участвовать в синтезе, накоплении и транспорте
секрета из клетки.
В общей форме вопрос о ядерной секреции подвергался ана-
лизу в литературе [Бродский, 1965, 1966; Шубникова, 1966], хотя
полное единогласие относительно способа участия ядра в секре-
торном процессе не достигнуто. В. Я. Бродский [1965] считает
доказанным в некоторых случаях активное участие ядра в выра-
ботке клеточного белка, в том числе и секреторного, в частности
в клетках околоушной и внеорбитальной желез. По мнению Брод-
ского, основанному на личных исследованиях, в некоторых фор-
мах клеток, например в ганглиозных клетках сетчатки лягушки,
синтез белка осуществляется в ядре с циклическим выведением
синтезируемого продукта в цитоплазму. В результате анализа
имеющихся данных Бродский считает возможным выделить два
типа клеток — один с преимущественно ядерным и другой с пре-
имущественно цитоплазматическим синтезом белка.
Более определенны суждения Е. А. Шубниковой [1966], ко-
торая на основе анализа приведенных ею данных приходит к вы-
воду о возможности непосредственного образования в ядрах же-
лезистых клеток секреторных продуктов, поступающих в дальней-
шем в цитоплазму. Шубниковой, по-видимому, принадлежат
первые наблюдения над выходом из ядра секреторных клеток
струек хроматина в цитоплазму.
Наиболее обстоятельные, точные и детально проанализирован-
ные данные по ядерной секреции принадлежат Б. В. Кедровско-
му [1959], который с помощью точной гистохимической техники
доказал участие ядер некоторых клеток, в частности ооцитов и
трофоцитов чешуекрылых, в осуществлении белковых синтезов и
выявил структурный механизм этих процессов. По данным Кед-
ровского, как ядрышковый, так и хроматиновый аппарат изучен-
ных им клеток работают в качестве железистых приборов,
поставляющих в цитоплазму секреторные продукты. На опреде-
ленных этапах ядрышковый и хроматиновый компоненты ядер
комплексируются в виде сложных органелл белкового синтеза —
эргид, по терминологии Кедровского, с помощью которых осущест-
вляется синтез белковых гранул. В изображении Кедровского хромо-
сомы—ламповые щетки ооцитов чешуекрылых выглядят как внут-
риядерные железы, продуцирующие белковый секрет. К сожале-
ню, процессы ядерной секреции в ооцитах и трофоцитах не
подвергались после исследования Кедровского анализу с помощью
современной техники. Однако, может быть, задача исследований
ядерной секреции заключается не в том, чтобы пытаться с помо-
щью электронно-микроскопической техники сделать более убеди-
тельными данные, полученные на светооптическом уровне ис-
следования, а искать объекты с более демонстративным и оче-
видным выражением ядерно-секреторного процесса.
« 200 »
АССИМИЛЯЦИОННАЯ И СЕКРЕТОРНАЯ АКТИВНОСТЬ КЛЕТКИ
К числу таких объектов, возможно, принадлежит молочная
железа с ее своеобразным способом отторжения частей в процес-
се секреции. Еще в 1932 г. А. А. Браун наблюдал формирование
секрета внутри ядер молочной железы собаки и морской свинки
в непосредственном окружении капель секрета фельген-позитив-
ным материалом. Ядра с каплями секрета и капли секрета с ор-
ганоидами цитоплазмы в процессе секреции отторгаются и пере-
ходят в просвет железистых альвеол.
Изучены процессы ядерной секреции в некоторых органах с
интенсивной секреторной функцией у десятиногих раков
[Студитский, 1970, 1971].
ЯДЕРНАЯ СЕКРЕЦИЯ
В СЕМЯВЫНОСЯЩИХ ПУТЯХ ТРАВЯНОГО КРАБА
Чрезвычайно демонстративна ядерная секреция в семявыно-
сящих канальцах черноморского травяного краба. (Carcinus шае-
nas). Клетки семявыносящих канальцев этого объекта отличаются
очень крупной величиной и соответственно крупными, вероятно,
полиплоидным^ ядрами. В цитоплазме при обычной светооптиче-
ской технике обнаруживаются базофильные исчерченные сферо-
идальные фигуры типа побочных ядер, числом от двух до пяти,
иногда более, расположенные как в базальной, так и в апикаль-
ной частях клетки. Это, очевидно, эргастоплазматический блок
секреторного механизма (рис. 47). Ядерный блок на первых
фазах секреции при обработке фельген +светлый зеленый состоит
из 2—5 шаровидных тел, ярко окрашиваемых светлым зеленым,
очевидно, ядрышек, окруженных палочковидными глыбками
фельген-позитивного материала, очевидно, хромосомами. Осталь-
ной фельген-позитивный материал также имеет вид палочковид-
ных глыбок, примыкающих к кариолемме или диффузно рассеян-
ных в ядре. Таким образом, секреторный процесс осуществляется
клетками, обладающими структурированными (хромосомными, по
принятой нами терминологии) ядрами. Комплексы ядрышек с
сидящими на нИх хромосомами, очевидно, составляют сложную
органеллу, соответствующую эргиде Б. В. Кедровского. Накоп-
ление секрета обнаруживается по увеличению размеров ядрышко-
вого компонента. Интенсивная окрашиваемость светлым зеленым
свидетельствует о богатстве его белком — возможно, секре-
торным продуктом (рис. 48). Детали последующих фаз накопле-
ния белкового продукта в ядре ускользают от наблюдения при
светооптической технике исследования. Однако конечный резуль-
тат — формирование одной или нескольких капель секрета внут-
ри ядра — чрезвычайно демонстративен. Капли располагаются в
центре ядра, резко выделяясь по интенсивной окраске светлым
зеленым, в окружении палочковидных глыбок хроматина (см.
рис. 48, А, В). Это — весьма яркая картина эргидного типа ядер-
« 201 »
ФУНКЦИОНАЛЬНАЯ МОРФОЛОГИЯ И ФИЛОГЕНИЯ КЛЕТКИ
Рис. 41. Клетки семявыносящего канальца краба Carcinus maenas
В цитоплазме видны крупные эргастоплазматпческие конструкции (эргастосферы—
Эс)
« 202 »
АССИМИЛЯЦИОННАЯ Л СЕКРЕТОРНАЯ АКТИВНОСТЬ КЛЕТКИ
« 203 »
ФУНКЦИОНАЛЬНАЯ МОРФОЛОГИЯ И ФИЛОГЕНИЯ КЛЕТКИ
« 204 »
АССИМИЛЯЦИОННАЯ И СЕКРЕТОРНАЯ АКТИВНОСТЬ КЛЕТКИ
Рис. 48. Накопление и выве-
дение белкового (лайтгрино-
филъного) секрета в ядрах
семявыносящего канальца тра-
вяного краба
Ценкер, Фельген+светлый зе-
леный
А—Е — этапы накопления и вы-
ведения капель в просвет каналь-
ца;
Ж — выведение капли секрета
(С) в базальную часть клетки
«' 205 >>
ФУНКЦИОНАЛЬНАЯ-**©*>Ф£>ЛОГИЯ И ФИЛОГЕНИЯ КЛЕТКИ
ной секреции. Накопленный в ядре секрет в дальнейшем обнару-
живается около ядра в цитоплазме в виде отчетливо оформлен-
ной капли, диффузно распространяющейся в цитоплазме.
Наряду с аппаратом синтеза белкового секрета клетки семя-
выносящих канальцев травяного краба обладают хроматиновым
механизмом аккумуляции и выведения ядерного секрета. Этот
процесс, по-видимому, стимулируется накоплением спермиев
в просветах семявыносящих канальцев в виде шаровидных комп-
лексов, которые уместно называть спермиевыми шарами.
Волнообразность процесса позволяет проследить последова-
тельно все его этапы (рис. 49, 50). Первая фаза заключается в
слиянии капель секрета, которые образуют тяжи, окруженные
хроматиновыми чехлами, ориентированными вдоль апикально-ба-
зальной оси клеток. Вторая, чрезвычайно выразительная фаза,
включает просачивание секрета вместе с хроматиновыми чехла-
ми сквозь ядерную оболочку с последующим образованием секре-
торно-хроматиновой капли (хроматиновой почки) на апикальной
поверхности ядра (см. рис. 49, А—В). Третья фаза характери-
зуется вытягиванием хроматиновых почек в апикальном направ-
лении, в результате чего возникают хроматиновые трубочки,
напоминающие гигантские хромосомы, с капсулой, наполненной
секретом на конце (см. рис. 50, А—Д). Формированием и расса-
сыванием таких капсул (секреторных кариомеров) завершается
секреторный процесс, заслуживающий названия апикальной ядер-
ной секреции. В некоторых случаях апикальная ядерная секре-
ция включает выход цитоплазмы с секреторными кариомерами в
просвет канальца семявыносящей железы, где среди спермиевых
шаров происходит выход секрета.
Процесс ядерной секреции в клетках семявыносящих каналь-
цев травяного краба усложняется базальной ядерной секрецией,
связанной с тем, что спермиевые шары поступают не только в
просветы канальцев семявыносящей железы, но и между ними,
в интерстициальную ткань (см. рис. 48, Ж). Секреция в сторону
интерстициальной ткани может осуществляться секреторными
клетками как в составе интактного слоя, так и в его выпячива-
ниях сквозь мышечную оболочку. Базальная ядерная секреция
включает выход секреторно-хроматиновых почек в цитоплазму и
их продвижение сквозь базальную мембрану и мышечную обо-
лочку в интерстициальную ткань. При сочетании базальной и
апикальной секреции все ядро может принимать вид хроматино-
вых тяжей, ориентированных вдоль апикально-базальной оси
клетки (рис. 51, Е). Возникающие секреторные кариомеры в со-
провождении цитоплазмы могут проникать вглубь интерстици-
альной ткани между спермиевыми шарами.
Процессы ядерной секреции в клетках семявыносящих каналь-
цев травяного краба убеждают в активной подвижности хромати-
на в осуществлении секреторной функции клетки. При анализе
« 206 а
АССИМИЛЯЦИОННАЯ И СЕКРЕТОРНАЯ АКТИВНОСТЬ КЛЕТКИ
Рис. 49. Ядерная секреция в клетках эпителия семявыносящего канала
травяного краба. Ценкер, Фельген + светлый зеленый
А — общп1“1 вид эпителия, X 400; В, В — апикальная ядерная секреция — тяжи хро-
матина, выводящего секрет, х 1200
« 207 »
ФУНКЦИОНАЛЬНАЯ МОРФОЛОГИЯ И ФИЛОГЕНИЯ КЛЕТКИ
« 208 »
АССИМИЛЯЦИОННАЯ И СЕКРЕТОРНАЯ АКТИВНОСТЬ КЛЕТКИ
этих процессов создается впечатление, что клетка, решая возник-
шую перед ней метаболическую задачу, использует именно это
свойство хроматина, чтобы обеспечить не только выработку се-
крета, но и его транспорт в апикальном и базальном направле-
ниях.
ЯДЕРНАЯ СЕКРЕЦИЯ
В СЕМЯВЫНОСЯЩИХ ПУТЯХ РЕЧНОГО РАКА
Открытие ядерной секреции в клетках семявыносящей железы
травяного краба позволило обнаружить сходный, хотя и менее
демонстративный процесс на другом объекте — в семенных ка-
нальцах и семявыносящих путях речного рака Astacus leptodac-
tylus. Наиболее яркие картины ядерной секреции мне удалось
выявить на позднем этапе секреторной активности (в ноябре) по
завершении периода спермиогенеза, когда секрет начинает задер-
Рис. 50. Последовательные фазы апикальной ядерной секреции в клетках
семявыносящей железы травяного краба. Ценкер, Фельген+светлый зеле-
ный
А—В — формирование внутриядерных секреторных хроматиновых тяжей и выход
секреторно-хроматиновых капель (хроматиновых почек) в цитоплазму; Г, Д—фор-
мирование апикальных секреторных хроматиновых канальцев; Е — секреторный
демонтаж ядра
14 A. H. Студитский
« 209 »
ФУНКЦИОНАЛЬНАЯ МОРФОЛОГИЯ И ФИЛОГЕНИЯ КЛЕТКИ
Рчс. 51. Хроматиновые отдельности (оргиды) в ядрах семенных канальцев
(Л. В) и семявыносящих путей (В—Е) речного рака. Ценкер, Фелъ-
ген -г светлый веленыи.
« 210 »
АССИМИЛЯЦИОННАЯ И СЕКРЕТОРНАЯ АКТИВНОСТЬ КЛЕТКИ
живаться в клетках, в результате чего процессы синтеза и тран-
спорта секреторных капель приобретают наиболее четкое морфо-
логическое выражение.
Ядра секреторных клеток семенных канальцев и семявынося-
щих путей речного рака проявляют выраженную тенденцию к
полиплоидизации. В гигантских клетках семявыносящих путей
количество секреторных комплексных органелл — эргид — может
достигать многих десятков (рис. 51). Каждая эргида возникает,
по-видимому, в виде хромосомно-ядрышкового комплекса, в ко-
тором центральное положение занимает ядрышковый компонент,
связанный с группой хроматиновых (фельген-положительных)
зерен, по форме и величине сопоставимых с хромосомами. На-
копление секрета может начаться как внутри эргид, так и в
тесной связи с ними. Капли секрета окружены хроматиновой
(фельген-позитивной) капсулой, представляющей собой, по-види-
мому, производное эргид (рис. 52, А, Б). Транспорт секрета из
ядра в цитоплазму осуществляется как путем выхода секретор-
ных капель через оболочку ядра, так и посредством миграции
целых эргид в цитоплазму. Самой замечательной особенностью
ядерной секреции в семявыносящих канальцах речного рака
является деление ядер, сопровождающее секреторный процесс.
В проксимальном участке семявыносящего канальца этот процесс
приобретает форму отделения ядра, содержащего секрет (секре-
торного ядра), от ядра, функционирующего в качестве продуцен-
та секреторных ядер (генеративного ядра). Секреторные ядра
подвергаются распаду на фельген-позитивные глыбки с освобож-
дением секреторного продукта и поступлением его в цитоплазму.
Обнаруженный в семявыносящих канальцах речного рака свое-
образный процесс ядерного деления (секреторный кариокинез)
будет специально проанализирован в следующей главе.
ЯДЕРНАЯ СЕКРЕЦИЯ
В ПЕЧЕНИ ДЕСЯТИНОГИХ РАКОВ
Не менее интересны с эволюционно-морфологической точки зре-
ния процессы ядерной секреции в пищеварительной железе («пе-
чени», или «гепатопанкреасе») десятиногих раков.
В общей форме этот процесс хорошо известен для печени
речного рака, в частности был предметом исследований
Е. А. Шубниковой [1966] и стал объектом учебного процесса
на кафедрах гистологии университетов [Кирпичникова, Левин-
сон, 1953]. Накопление секрета в железистых клетках печени
речного рака осуществляется путем формирования в апикальной
части постепенно укрупняющейся капли со светлым содержимым.
Одновременно происходит изменение формы и расположения
ядра, которое становится несколько сморщенным и перемещается
в базальную часть клетки, приобретая на окрашенных срезах
« 211 »
14*
ФУНКЦИОНАЛЬНАЯ МОРФОЛОГИЯ И ФИЛОГЕНИЯ КЛЕТКИ
очертания сильно уплощенного полу-
месяца (рис. 53). Предполагается,
что ядро принимает участие в выра-
ботке секрета, изливая какую-то его
фракцию в секреторную вакуоль. Не-
зависимо от трактовки процесса со-
вершенно очевидно, что ядро печеноч-
ной клетки рака действительно под-
вергается в процессе секреции расхо-
дованию своего вещества, поскольку
оно уменьшается в размерах и явно
обедняется фельген-позитивным ма-
териалом.
Ядра в клетках печени рака струк-
турированы, хотя никем не выража-
лось мнение, что фельген-позитивные
глыбки в этих ядрах представляют
собой хромосомы. Как известно, хро-
мосомный набор речного рака содер-
жит очень большое число хромосом
[см.: Вильсон, 1936], однообразной
формы коротких палочек. Фельген-
позитивных глыбок в ядрах печени
рака не так много. Возможно, хро-
мосомы комплексируются не только
с ядрышками в виде эргид, но и друг
с другом в виде небольших скоплений
(розеток). Совершенно демонстратив-
на хромосомно-эргидная конструкция
ядра в клетках печени крабов. Эта
конструкция, например, у камчат-
ского краба включает эргидный ком-
плекс, содержащий несколько эргид
(ядрышек с прилегающими к ним,
.чаще всего перпендикулярно, хромо-
сомами) и субкариолеммальный хро-
мосомный блок. В процессе секреции
ядро, приобретающее характерную
полулунную форму, также распола-
гается в непосредственном контакте
с секреторной вакуолью (см. рис.
Рис. 52. Капли белкового (лайтгринпози-
тивного) секрета в ядрах клеток семен-
ных канальцев (А) и семявыносящего
протока (В) речного рака. Ценкер, Фелъ-
ген.У-1200
« 212 »
АССИМИЛЯЦИОННАЯ И СЕКРЕТОРНАЯ АКТИВНОСТЬ КЛЕТКИ
« 213 »
ФУНКЦИОНАЛЬНАЯ МОРФОЛОГИЯ И ФИЛОГЕНИЯ КЛЕТКИ
Рис. 53. Ядерный (белковый) секрет (ЯС) в виде мелких капель в ядре
гепатопанкреаса речного рака
С — капли секрета в секреторной вакуоли в цитоплазме. Электронная микрофото-
графия М. М. Калашниковой
« 214 »
АССИМИЛЯЦИОННАЯ И СЕКРЕТОРНАЯ АКТИВНОСТЬ КЛЕТКИ
53). Способ расходования в процессе секреции фельген-позитивно-
го материала и здесь остается недостаточно ясным. Наиболее де-
монстративно этот процесс выражен в печени креветок.
Мной обследованы два вида креветок: Sclerocrangon и Panda-
lus из Тихого океана. Пищеварительная железа (условно — пе-
чень) Sclerocrangon, как и у всех десятиногих раков, состоит из
множества секреторных трубочек, объединяющихся в лопасти,
которые связаны с протоком, изливающимся в кишку. При обыч-
ной обработке (Ценкер, квасцовый гематоксилин) можно видеть,
что трубочки содержат более молодую, богатую ядрами часть и
более зрелую, вакуолизированную часть с активно секретирую-
щими ядрами. В богатой ядрами части обнаруживаются фигуры
митотического деления, располагающиеся над ядерным слоем,
ближе к просвету железистой трубочки. Хромосомы имеют вид
коротких палочек. С выходом в телофазу хромосомы сохраняются
и переходят в интерфазные ядра, где располагаются вокруг
ядрышек, образуя эргиды под кариолеммой, а также диффузно
в кариоплазме, так что на срезах контур ядра весь заполнен
хромосомами.
Дифференцировка приводит к развитию двух типов секретор-
ных клеток — пирамидальной клетки с гигантским ядром и мелко-
глыбчатой базофильной зернистостью (эргаетоплазмой) в цито-
плазме, и призматической клетки с крупноглыбчатой зернистостью
(эргаетоплазмой) в цитоплазме. В пирамидальных клетках ядра
сохраняют выраженное хромосомное строение. Хромосомы форми-
руют небольшие комплексы в кариоплазме, а также группируются
вокруг фельген-позитивных ядрышек (кариосом), образуя эргиды.
Лишь в некоторых ядрах видны окрашенные светлым зеленым
ядрышки с фельген-позитивной гранулой (которую можно назы-
вать нуклеоидом) внутри [Студитский, 1973]. В призматических
клетках хромосомы образуют более крупные блоки — также в
субкариолеммальном положении и вокруг фельген-позитивных
ядрышек (кариосом). Самая замечательная особенность ядер приз-
матических клеток заключается в изменчивости их размеров, при
которой уменьшение объема сопровождается снижением фельген-
позитивности хромосом и ядрышек, доходящим до полного ра-
створения ядер с их содержимым в цитоплазме. Этот процесс
может происходить по границе с секреторной вакуолью, сопро-
вождаясь изменением ядра до закругленно-треугольной формы,
а также в цитоплазме призматической клетки. Сходному процес-
су — постепенному лизису хромосом и кариосом — подвергаются
ядра пирамидальных клеток.
В еще более демонстративной форме процесс разрушения хро-
матиновых структур и кариосом (эргид), сопровождающий секре-
цию, обнаруживается в печеночных клетках Pandalus. Здесь ядра
пирамидальных клеток обладают главным образом нуклеоидными
ядрышками и диффузно распределенными в кариоплазме хромо-
« 215 »
ФУНКЦИОНАЛЬНАЯ МОРФОЛОГИЯ И ФИЛОГЕНИЯ КЛЕТКИ
сомами и хромосомными блоками. В процессе секреции хромосо-
мы слипаются в крупные пикнотические группы. Ядрышки обо-
собляются в виде крупных сфероидальных телец, в которых ясно
видны светлые (слабоокрашенные светлым зеленым) дворики, где
располагаются нуклеоиды. Крупные пикнотические глыбки хро-
матина обнаруживаются и в ядрах призматических клеток. В про-
цессе секреции хроматиновые глыбки, освобождаясь от фельген-
позитивного материала, превращаются в бледные фельген-нега-
тивные тени, сохраняющиеся некоторое время в контурах
лизирующихся ядер.
Изложенные данные о ядерной секреции в печеночных клет-
ках креветок позволяют сделать вывод, что здесь, так же как в
семявыносящих канальцах речного рака и травяного краба,
ядерный хроматин активно участвует в секреторном процессе.
Ядро на всем протяжении секреторного цикла сохраняет струк-
турированный характер. Очевидно, для осуществления секреции
необходимо, чтобы хроматин был в конденсированной (хромо-
сомной) форме и находился в связи с ядрышковым аппаратом в
форме эргид. Важно отметить также, что ядрышки приобретают
редчайшую конструкцию — с нуклеоидом, выявляемым по фель-
ген-позитивности. В этом состоянии ядро участвует в секретор-
ном процессе, постепенно расходуя свои фельген-позитивные
структуры до полного их разрушения, с выходом фельген-пози-
тивного материала в цитоплазму.
Будущие исследования покажут, используется ли в этом сек-
реторном процессе ДНК, вышедшая из хромосом в цитоплазму,
в качестве матриц для синтеза РНК, необходимой для синтеза
секреторных белков, или здесь осуществляется своеобразная фор-
ма секреции, требующая разрушения продуцирующих белок
субклеточных компонентов, включая ядерные органеллы. Бес-
спорным остается одно: ядерная секреция в печеночных клетках
десятиногих раков сопровождается разрушением и утратой ДНК
структурными компонентами ядра вплоть до полного лизиса ядер
в печеночных клетках креветок.
ВСЕ СУБКЛЕТОЧНЫЕ КОМПОНЕНТЫ КЛЕТКИ
МОГУТ УЧАСТВОВАТЬ В СИНТЕЗЕ СЕКРЕТОВ
Вот почему следует признать совершенно правильной гене-
ральную схему возможных путей синтеза секрета в клетке, раз-
работанную Е. А. Шубниковой [1966]. По этой схеме все суб-
клеточные компоненты клетки, включая ядро, могут участвовать
в производстве секреторного продукта. Полученные нами данные
по секреторной функции ядерных органелл — ядрышка и хромо-
сом — позволяют несколько уточнить эту схему. В процессе сек-
реции ядрышко и хромосомы как ядерные органеллы активно
участвуют в осуществлении секреторной функции клетки — в
« 216 »
АССИМИЛЯЦИОННАЯ И СЕКРЕТОРНАЯ АКТИВНОСТЬ КЛЕТКИ
производстве, аккумуляции и выведении ядерного продукта не
только из ядра в цитоплазму, но и из клетки в просветы секре-
торных альвеол и канальцев.
Схема Е. А. Шубниковой, однако, оставляет нерешенным воп-
рос, почему все основные клеточные органоиды, специализирован-
ные на отправлении совершенно различных функций (эргасто-
плазма — на синтезе белка, аппарат Гольджи — на сегрегации и
выведении конечных продуктов метаболизма, митохондрии — на
диссимиляционной функции, ядрышко — на производстве рибо-
сом и хромосомы—на функции деления клетки), проявляют та-
кое глубокое сходство в осуществлении секреторной функции?
Без эволюционно-морфологической интерпретации природы суб-
клеточных компонентов клетки этот вопрос неразрешим. Между
тем с учетом эволюционных взаимоотношений клеточных орга-
нелл ответ на этот вопрос не представляет никаких затруднений.
Все органеллы клетки проявляют способность к синтезу секретов
потому, что секреторная функция представляет собой один из
вариантов ассимиляционной функции — свойства продуцировать
белки, которое каждый субклеточный компонент клетки унасле-
довал от своего бактериоидного предка. Каждая органелла клетки
может осуществлять секреторнур) функцию потому, что в при-
роде каждой органеллы заложено свойство синтезировать бел-
ки — главная характеристика автономной живой системы — про-
токлетки, которая в виде органелл продолжает существовать в
каждой клетке эукариотов.
Ассимиляционная функция принадлежит к числу основных
характеристик жизни. Организм строит себя из ассимилируемых
продуктов внешней среды, синтезируя все специфические вещест-
ва, необходимые для осуществления строительных процессов,
в первую очередь белки. Универсальный элемент конструкции
всех субклеточных компонентов клетки, способных к белковому
синтезу,—рибосома — унаследована из рибосомного комплекса
бактериоидных предков клетки. Рибосомы входят в состав конст-
рукции всех органелл клетки, за исключением ретикулосом, спе-
циализированных на сегрегации и эвакуации продуктов метабо-
лизма из клетки, а также на синтезе полисахаридов. Производст-
во сложных белковых комплексов клетки, например желточных
телец ооцитов, осуществляется путем кооперации всех органелл
клетки.
Секреторный процесс с эволюционно-морфологической точки
зрения представляет собой вариант ассимиляционной функции —
производства метаболических белков, подлежащих выведению из
клетки. Главный продуцент белковых секретов — эргастосбма —
проявляет тенденцию к индивидуализации в эргастоплазме в
« 217 »
ФУНКЦИОНАЛЬНАЯ МОРФОЛОГИЯ' И ФИЛОГЕНИЯ КЛЕТКИ
процессе секреции, приобретая выраженное структурное сходство
с бактериоидным предком. Ретикулосомы участвуют в сегрега-
ции, аккумуляции и эвакуации белковых секретов, а также в
синтезе полисахаридного компонента мукополисахаридных секре-
тов. Показано накопление секреторных продуктов в митохонд-
риях. Факт ядерной секреции получает многостороннее подтверж-
дение в процессах ядерной секреции в различных секреторных
органах десятиногих раков. Хромосомы и хромосомные комплек-
сы, а также хромосомно-ядрышковые комплексы (эргиды) прояв-
ляют активное участие в синтезе, накоплении и выведении белко-
вых секретов не только из ядра в цитоплазму, но и из клетки
в просветы выводящих путей и в интерстициальную ткань.
Секреторная активность, так же как и участие в ассимиля-
ционной функции, свидетельствует о глубокой гомологии всех
пяти органелл клетки.
Глава шестая
РЕПРОДУКЦИОННАЯ ФУНКЦИЯ КЛЕТКИ
И ЕЕ ЭВОЛЮЦИОННОЕ ЗНАЧЕНИЕ
ЗАГАДКА МИТОТИЧЕСКОГО ДЕЛЕНИЯ
Из всех функций клетки наиболее демонстративно выражена и
наиболее доступна элементарному морфологическому анализу —
функция размножения.
Задолго до открытия митотического механизма, в 50—60-х го-
дах прошлого столетия, большинство биологов были уверены в том,
что клетки размножаются путем деления. Особенно велика эта
уверенность была у эмбриологов, которые видели своими глазами
дробление бластомеров и картины формирования тканевых и ор-
ганных зачатков путем последовательных клеточных делений.
А. О. Ковалевский, как известно, первый или один из первых
увидел митотический аппарат в клетках развивающихся эмбрио-
нов, первый отметил таинственный факт исчезновения ядерных
очертаний и появления на месте ядер кучки зернышек, расхо-
дящихся по двум дочерним клеткам. Всего одно десятилетие
потребовалось для того, чтобы обнаружить в делящихся клетках
растительных и животных организмов хромосомный механизм и
описать с достаточной точностью феноменологию митотического
деления. Нас отделяет от этого исторического этапа целое сто-
летие. Однако в познании механизма митотического деления,
выяснении способа его осуществления наука продвинулась очень
мало даже в сравнении с теми гипотезами, которые в 70—80-х го-
« 218 »
РЕПРОДУКЦИОННАЯ ФУНКЦИЯ КЛЕТКИ И ЕЕ РОЛЬ В ЭВОЛЮЦИИ
дах XIX в. выдвигались первыми теоретиками этой сферы иссле-
дования — Флеммингом [Flemming, 1882] и П. И. Перемежко
[1878].
Мы должны честно признать, что за истекшее столетие, не-
смотря на необозримое обилие фактов, относящихся к феномено-
логии митотического деления, и большое количество попыток
экспериментального анализа его механизма, мы до сих пор почти
так же далеки от понимания природы и способа осуществления
митотического деления, как и сто лет назад. Достаточно познако-
миться с обзорами и монографиями последних лет, посвященны-
ми феномену митотического деления, чтобы убедиться в справед-
ливости сделанного заключения.
До сих пор не сложилось единой точки зрения ни на кон-
струкцию хромосом, ни на способ их возникновения в профазе.
В литературе насчитывают более десятка схем, относящихся к
строению хромосом и способу упаковки входящих в их состав
материалов [Taylor, 1959, 1964; Рис, 1965; Прокофьева-Бельгов-
ская, 1966; Bajer, 1967; Ченцов, 1967; Суонсон и др., 1969; Кик-
надзе, 1972; Ченцов, Поляков, 1974]. Господствовавшая со вре-
мени первых выступлений Дарлингтона [Darlington, 1939] по
этому вопросу концепция спирализации хромосом в последнее
время сменяется более осторожной формулой конденсации хро-
мосом [Matsui, Sandberg, 1979; Sunkara et al., 1979]. Но ни
спирализация, ни конденсация как представления о способе упа-
ковки хромосомного материала в виде хромосом-органелл не
решают вопроса о силах, вызывающих осуществление процесса
спирализации или конденсации. «Мы не знаем, какой механизм
осуществляет спирализацию хромосом в профазе»,— пишет Мэзия
[1963, с. 129] в своей монографии, посвященной физиологии кле-
точного деления. Нет объяснения самому характерному для мито-
тического деления процессу — метафазному движению хромосом.
По Мэзия, этот процесс находится под контролем митотического
аппарата — системы микротрубочек веретена деления и центрио-
лей, с помощью которых, как он полагает, хромосомы приводятся
в движение. Однако существует немало организмов (например,
жгутиконосцы эвглениды [см.: Leedale, 1965, Райков, 1967,
1979], у которых митотическое (т. е. с образованием хромосом)
деление осуществляется при отсутствии или весьма слабом раз-
витии типичного веретена деления и, следовательно, тянущих
нитей, или по современным представлениям микротрубочек,
веретена.
Нет никаких объяснений для способа осуществления мета-
фазы, в частности формирования метафазной пластинки. Более
того, совершенно непонятно, каково значение метафазы как опре-
деленного этапа митотического цикла. «Мы не можем сделать
никакого определенного заключения о том, что же именно про-
исходит в метафазе,—отмечает Мэзия [1963]—... Метафаза
« 219 »
ФУНКЦИОНАЛЬНАЯ МОРФОЛОГИЯ И ФИЛОГЕНИЯ КЛЕТКИ
поражает нас тем, что она является как бы паузой в потоке
событий, во время которой митотический аппарат находится в
ожидании чего-то, что должно случиться. Таким событием, по-
видимому, является разъединение сестринских хромосом. Но,
быть может, при этом происходит еще и многое другое» (с. 202).
Большие трудности для объяснения представляет механизм
телофазы, когда митотический аппарат разрушается и хромосомы
опять, как в ранней профазе, оказываются предоставленными
самим себе. Трудности относятся не только к объяснению тело-
фазного движения, конденсации и деконденсации хромосом, но и
к факту разрушения митотического аппарата. ««Демонтаж» мито-
тического аппарата поражает нас не меньше, чем его «сборка»»
[Мэзия, 1963, с. 282].
И, наконец, значение последней загадки клеточного деления
продолжает сохранять заключительный этап митотического про-
цесса деления клеточного тела — цитокинез, по общепринятой
терминологии.
Митотическое деление ядра и митотическое деление клетки
для любого цитолога — взаимосвязанные понятия. Профазно^
формирование хромосом означает, что не только ядро, но и вся
клетка в целом вступает в процесс деления, который завершится
делением клеточного тела. Однако к моменту, когда начинается
деление клеточного тела, процессы ядерного деления полностью
завершаются. Ядра делящейся клетки могут быть в этот момент
в различных состояниях телофазного процесса, вплоть до полно-
го его завершения, деконденсации хроматина и приобретения
интерфазной структуры. Но даже на ранних этапах телофазы —
единственный обнаруженный, и обследованный механизм мито-
тического процесса — митотический аппарат уже демонтируется,
дочерние ядра одеваются оболочками и веретено деления разру-
шается. Что же касается других механизмов митотического про-
цесса, которые включаются в его осуществление в период цито-
кинеза, то нам представляется вполне оправданным заключение
Мззии [1963] по этому вопросу: «Если мы рассмотрим разно-
образные механизмы, посредством которых может осуществлять-
ся деление тела клетки, мы едва ли почувствуем себя вправе
делать обобщения» (с. 282).
Нет необходимости обращаться к другим суждениям, обоб-
щающим столетний опыт изучения митотического деления и его
механизмов, тем более, что почти за 20 лет, истекших после
опубликования монографии Мэзии, не появилось столь же об-
ширных по охвату фактического материала и добросовестности
его анализа обобщающих трудов. Выводы, заключения и гипо-
тезы, относящиеся к репродукционной функции клетки, в обзо-
рах, вышедших в свет после книги Мэзии, не вносят ничего
принципиально нового в обоснованные им общие выводы [Kubai,
1975; Fuge, 1977]. Можно привести только несколько суждений,
«-Ж»
РЕПРОДУКЦИОННАЯ ФУНКЦИЯ КЛЕТКИ И ЕЕ РОЛЬ В ЭВОЛЮЦИИ
разделяющих пессимистические заключения Мэзии о состоянии
наших знаний в этой области.
«Реальные механизмы движения хромосом по-прежнему оста-
ются загадочными» [Карпас, 1966, с. 222].
«Так, посредством митоза происходит прямая передача гене-
тической информации и сохраняется непрерывность живого...
Но каковы причины, каковы движущие силы этих процессов?
Этого, увы, мы пока совсем не знаем» [Боген, 1970, с. 167].
«Механизм спирализации хромосом до сих пор остается за-
гадочным... Процессы деспирализации хромосом изучены пока так
же мало, как и их профазная спирализация. Механизмы этого
явления все еще неясны» [Алов, 1972, с. 62 и 131].
Отсюда и общераспространенный взгляд на хромосому как на
пассивный компонент клетки, роль которого ограничена носитель-
ством генетической информации и не выражена в какой-либо
активности в качестве клеточной органеллы. Можно в связи с
этим напомнить предложенное Мэзией [1963] сравнение хромо-
сом в митотическом процессе с покойником, ради которого устраи-
вается вся процедура похорон, хотя сам покойник никакого
участия в этой процедуре не принимает. Так же принято рас-
сматривать и всю процедуру митоза, в которой хромосомам
отводится роль контейнеров с генетической информацией, распре-
деляемых по дочерним клеткам. «В генетическом отношении
митоз можно рассматривать как процесс, имеющий своим назна-
чением передачу дочерним клеткам равной генетической инфор-
мации. Все события, наблюдаемые при митотическом делении,
подчинены этой цели» (Суонсон и др., 1969, с. 141).
Хромосома как органелла клетки и митоз как структурное
выражение репродукционной функции клетки по существу еще
не стали объектами исследования в цитологии. Между тем только
с этих позиций загадки хромосом и загадки митотического деле-
ния получат перспективы решения.
ХРОМОСОМЫ — ОРГАНЕЛЛЫ КЛЕТКИ
Теперь, после эволюционно-морфологического и эволюционно-
онтогенетического анализа, которому были посвящены предшест-
вующие главы книги, а также после анализа данных, относящих-
ся к функциональной морфологии хромосом, едва ли остается
сомнение в том, что хромосомы представляют собой органеллы
клетки, достаточно демонстративно проявляющие гомологичное
сходство с другими клеточными органеллами: ядрышком, мито-
хондриями, эргастосомами, ретикулосомами — сходство, опреде-
ляемое единством их происхождения.
Эти черты сходства выражаются в структуре, носящей следы
происхождения от бактериоидных предков (наличие плазмолеммы
в составе ядерной мембраны, матрикса, рибосомного комплекса,
« 221 »
ФУНКЦИОНАЛЬНАЯ МОРФОЛОГИЯ И ФИЛОГЕНИЯ КЛЕТКИ
гипертрофированного нуклеоида в виде плотно упакованной
ДНК, гомологов бактериальных жгутиков —микротрубочковых
комплексов, составляющих тянущие нити веретена) в химиче-
ском составе (наличии ДНК, РНК и белков), в биологических
свойствах (активной подвижности, изменении формы и объема),
функциональных отправлениях (участии в пластической, механи-
ческой, ассимиляционной и секреторной функциях клетки) и,
наконец, в участии в репродукционной функции клетки.
Способность клетки размножаться путем деления надвое —
одна из самых основных характеристик клеточной организации.
Клетка существует не только потому, что она обладает свойством
ассимилировать и превращать в интегральные части своего тела
пищевые вещества околоклеточной среды. Клетка существует
также и потому, что она обладает свойством репродуцировать
себя, превращаться в две идентичные дочерние клетки. Переход
от протоклеточной к клеточной организации мог осуществиться
только при условии одновременного возникновения аппарата де-
ления в виде обособленного комплекса субклеточных компонен-
тов — хромосом. Клетка возникла как новая, более совершенная
форма организации живой материи, в виде двухкомпонентной
системы, состоящей из цитоплазматического и ядерного комплек-
сов. Важнейшая задача эволюционной морфологии клетки заклю-
чается в том, чтобы доказать главную функцию ядерного комп-
лекса — осуществление клеточного деления.
ЯДРО — АППАРАТ КЛЕТОЧНОГО ДЕЛЕНИЯ
В литературе последней четверти XIX в. и первой четверти
XX в. клеточное ядро нередко характеризуется как аппарат
клеточного деления. Нетрудно понять, как возникло это представ-
ление. Митотическое деление клеточного ядра — зто одновремен-
но и митотическое деление клетки. После открытия митотическо-
го деления чрезвычайно быстро стало ясно, что вступление
ядра в первый этап митотического деления свидетельствует о
начинающемся делении клетки как целого. В настоящее время
каждому биологу очевидно, что клетка, ядро которой вступает в
профазу митотического деления, должна разделиться. За мито-
тическим делением ядра, как правило, следует деление клеточ-
ного тела.
Отсюда и представление о причинной зависимости между ми-
тотическим делением ядра и делением клетки как целого. Одна-
ко за весь столетний период исследования митотического деления
не предпринималось ни одной серьезной попытки, оставившей
след в разработке вопроса, вскрыть природу зависимости кле-
точного деления от митотического деления ядра, другими сло-
вами, выяснить способ, с помощью которого митотическое деле-
ние ядра приводит в движение механизм деления клетки как
« 222 »
РЕПРОДУКЦИОННАЯ ФУНКЦИЯ КЛЕТКИ И ЕЕ РОЛЬ В ЭВОЛЮЦИИ
целого. Немногочисленные литературные данные, относящиеся к
экспериментальному анализу взаимосвязи цитотомии (деления
клеточного тела) с локализацией митотического аппарата, при-
ведены в книге И. А. Алова «Цитофизиология и патология ми-
тоза» [1972]. Автор книги вполне положительно относится к идее
(обоснованной Сванном) об определенной зависимости между
хромосомами, митотическим аппаратом и цитотомией. «Возмож-
но,— пишет он,— что подобно влиянию митотического аппарата
и в этом случае воздействие осуществляется путем выделения
хромосомами каких-то химических веществ типа «структурного
агента» Сванна, или «ядерного фактора»» [Zimmermann, Маг-
sland, 1964] (с. 148).
Нельзя не отметить все же, что этому заключению предшест-
вует замечание о недостаточной ясности механизма влияния
ядерных структур на завершающую стадию митоза. С этим заме-
чанием нельзя не согласиться. Возникает вопрос, каковы в на-
стоящее время условия и перспективы разработки концепции,
относящейся к хромосомной конструкции механизма митотиче-
ского деления. К новым условиям разработки проблемы, опре-
деляющим и ее перспективы, следует отнести прежде всего
появление эволюционного аспекта.
На всем протяжении разработки проблемы на светооптиче-
ском уровне исследователи были лишены возможности использо-
вать исторический метод ввиду отсутствия каких-либо материа-
лов об эволюционных преобразованиях клеточного деления. Для
кариологии одноклеточных организмов была характерна тенден-
ция искать в процессах деления не столько отличительные черты,
сколько сходства с клеткой многоклеточных организмов. В бак-
териологии вплоть до вступления в электронно-микроскопиче-
скую эру господствовала идея о клеточной природе бактерий и о
хромосомном механизме деления бактериальной клетки. Положе-
ние радикальным образом изменилось с переходом к электронно-
микроскопическому методу исследования.
В настоящее время можно твердо сказать, что наметился ло-
гичный и вполне правдоподобный ряд эволюционного усложне-
ния конструкции живой материи, начиная от бактерий и кончая
клетками многоклеточных организмов. В предшествующих главах
было показано, что гомологии в строении бактериальной прото-
клетки и клетки эукариотов следует искать не в отдаленном сход-
стве нуклеоида бактерий с клеточным ядром (по наличию в обеих
структурах ДНК), а в глубоком подобии бактериальной прото-
клетки и всех основных субклеточных компонентов клетки, в том
числе и ядерных органелл — хромосом и ядрышек. Было показа-
но также, что ядерный аппарат более примитивных — однокле-
точных эукариотов значительно отличается от ядер многоклеточ-
ных — высших эукариотов. Принципиальное отличие ядерного
аппарата выявлено у самых низших простейших — эвгленид и
« 223 »
ФУНКЦИОНАЛЬНАЯ МОРФОЛОГИЯ И ФИЛОГЕНИЯ КЛЕТКИ
динофлагеллят, которые, во-первых, лишены типичного митоти-
ческого аппарата (веретена деления) при протомитотическом
(без демонтажа ядерной мембраны) способе ядерного деления и,
во-вторых, по крайней мере динофлагелляты, отличаются строе-
нием и упаковкой ДНК в хромосомах, напоминающей ДНК в
нуклеоидах бактерий. Все простейшие по строению ядра хро-
мосом и всего аппарата клеточного деления существенно отли-
чаются от клеток многоклеточных эукариотов [см.: Райков,
1967, 1979]. Как правило, хромосомы у всех свободно живущих
протистов многочисленны, мелки, слабо дифференцированы по
форме тг конструкции. Некоторое сходство с хромосомами высших
эукариотов приобретают только хромосомы паразитических про-
стейших — жгутиковых и грегарин, чаще всего упоминаемых в
обзорах по кариологии простейших [см.: Райков, 1967, 1979].
Причины этого сходства, вероятно, лежат в приспособлении к
условиям паразитической жизни.
Таким образом, современные сравнительно-морфологические
данные позволяют настаивать на гипотезе о происхождении
ядерного аппарата клетки и одновременно аппарата клеточного
деления за счет центральной группы клона протоклеток, комп-
лексировавшегося в виде примитивного одноклеточного организ-
ма. Обособление этой группы имело цель освободить ядерные
органеллы от всех других задач, кроме генеративных и гермина-
тивных, т. е. задач воспроизводства ядерных и цитоплазматиче-
ских органелл, и одновременно использовать ядерные органеллы
в качестве аппарата деления клетки.
Здесь необходимо подчеркнуть, что роль ядерных органелл
как аппарата клеточного деления неизмеримо возросла с эволю-
ционным переходом организмов к многоклеточной организации.
У самых низших многоклеточных животных, начиная с кишечно-
полостных, губок и ресничатых червей, размножение клеток осу-
ществляется по всем правилам типичного митотического деления,
с четким обособлением хромосом в профазе, четко выраженной
метафазой, анафазным расхождением хромосом и телофазной
реконструкцией ядер, формированием веретена и тянущих нитей,
связывающихся с кинетохорами хромосом. Нетрудно понять, что
переход к многоклеточной организации, главной задачей которого
было увеличение массы тела, потребовал точнейшей отработки
механизма, с помощью которого обеспечивается нарастание мас-
сы — клеточного деления. -
Задача увеличения объема тела уже у губок и кишечнополо-
стных была решена с огромным запасом прочности — стоит
вспомнить такие исполинские формы губок, как кубок Нептуна
(Poterion neptuni) или гигантские виды актиний и медуз, веду-
щих хищный образ жизни и по существу не имеющих никаких
врагов. У всех губок и кишечнополостных митотическое деление
осуществляется по классической схеме эумитоза. Между тем
« 224 »
РЕПРОДУКЦИОННАЯ ФУНКЦИЯ КЛЕТКИ И ЕЕ РОЛЬ В ЭВОЛЮЦИИ
среди жгутиконосцев—очевидных и несомненных предков губок
и кишечнополостных—самые примитивные и поэтому самые
вероятные предковые формы из эвгленид и динофлагеллят отли-
чаются примитивностью митотического деления, выражающейся
прежде всего в слабом развитии или даже полном отсутствии
микротрубочкового аппарата, одновременном делении ядрышка и
хромосом и сохранении ядерной оболочки.
Не менее важная эволюционно-морфологическая закономер-
ность в изменениях ядра и способа его деления в эволюционных
рядах многоклеточных животных заключается в изменении кон-
струкции самих хромосом.
Гипотеза происхождения клетки путем комплексирования кло-
на бактериоидных предковых организмов и ядра путем обособле-
ния центральной группы клона (синбактериогенная теория) пред-
полагает, что первичная клетка получила ядро, состоящее из
совершенно идентичных друг другу хромосом. И действительно,
хромосомные наборы эвгленид и динофлагеллят, как, впрочем,
и многих других простейших, содержат однородные, палочко-
видные хромосомы. Для всех губок, кишечнополостных и турбел-
лярий также характерны многочисленные точечные или палочко-
видные хромосомы, не представляющие большого интереса для
исследования. Поэтому они слабо изучены, для большинства видов
этих таксономических групп хромосомные числа не установлены
и в обзорах по цитогенетике не упоминаются. Лишь с переходом
к более сложным и более совершенным конструкциям многокле-
точных животных наблюдается дифференцировка хромосом, со-
провождающаяся развитием крупных и даже гигантских форм с
расчленением на плечи и отчетливым обособлением центромер.
Знаменитые хромосомы—ламповые щетки в ооцитах в отчетливо
выраженной форме появляются только у высших многоклеточ-
ных, начиная с членистоногих среди беспозвоночных и рыб среди
позвоночных. Гигантские политенные хромосомы обнаружены
только у насекомых на определенных стадиях развития в неко-
торых отрядах (в основном у личинок двукрылых). Все это сви-
детельствует о том, что в ходе эволюционного усложнения орга-
низации многоклеточных животных на хромосомы ложатся все
более и более усложняющиеся задачи, из которых наиболее важ-
ными становятся — деление клетки, а также осуществление неко-
торых специфических функций, обусловленных бактериальным
происхождением хромосом.
Необходимо подчеркнуть, что поддерживаемая мной трактовка
ядра и хромосом как аппарата клеточного деления [Студитский,
1970] отнюдь не имеет задачей отвергать бесспорный факт носи-
тельства ядром и хромосомами факторов менделевской наследст-
венности. В настоящее время не остается никаких сомнений в
том, что факторы менделевской наследственности в виде корпу-
скулов, построенных из ДНК и неотличимых на современном
15 А. Н. Студитский « 225 »
ФУНКЦИОНАЛЬНАЯ МОРФОЛОГИЯ И ФИЛОГЕНИЯ КЛЕТКИ
уровне исследования от всей ДНК хромосом, располагаются в
определенных участках хромосом, подвергаются репликации
вместе со всей ядерной ДНК и обладают механизмом, позволяю-
щим находить и занимать свои места на хромосомах при их
формировании (путем спирализации, конденсации или само-
сборки). Факты, относящиеся к менделевской наследственности,
бесспорны и подлежат не опровержению, а только дальнейшему
уточнению, в первую очередь в смысле выяснения природы фак-
торов менделевской наследственности и механизмов их действия
на вызываемые ими фенотипические изменения. Другое дело-
функция хромосом (и ядрышка) как органелл клетки.
Весь огромный материал, приведенный в предшествующих
главах, не мог не убедить нас в том, что ядерные органеллы ведут
себя подобно всем остальным органеллам клетки, участвуя во
всех функциях, к которым способны органеллы как потомки ког-
да-то автономных организмов —бактериоидных предков клетки.
Но только л хромосомах с такой демонстративностью выражена
способность к равномерному делению надвое, которая у бакте-
риоидных предков обеспечивала репродукционную функцию. Вот
почему, специализируясь в составе клетки на функции деления,
хромосомы приобрели двигательную функцию.
Эта форма передвижения у бактериальных организмов обу-
словлена, очевидно, сократимостью плазмолеммы. Соответствую-
щий двигательный механизм, возможно, действует и при пере-
мещениях хромосом в профазе, метафазе и телофазе, когда уча-
стие микротрубочного аппарата в митотическом акте оказывается
недостаточным. Наличие уплотненного подобия оболочки, одеваю-
щей каждую хромосому, отмечено некоторыми авторами в деля-
щихся ядрах динофлагеллят. Предполагают, что мембранный ап-
парат, одевающий каждую хромосому, выступает у динофлагеллят
в качестве механизма деления хромосом.
Разрабатываемая мной гипотеза исходит из факта активной
подвижности хромосом путем своеобразных скользящих движе-
ний, используемых некоторыми видами безжгутиковых бактерий.
Гипотеза предполагает также химическую активность хромо-
сом — продукцию веществ, вызывающих разжижение цитоплазмы
в плоскости будущего деления клетки. Решению этой задачи
служит метафазное расположение хромосом в плоскости буду-
щего деления клетки.
ВОПРОСЫ ХРОМОСОМНОЙ ТЕОРИИ КЛЕТОЧНОГО ДЕЛЕНИЯ
Задача определения роли ДНК в осуществлении репродукци-
онной функции клетки заключается на современном этапе в том,
чтобы рассмотреть все имеющиеся факты, относящиеся к пове-
дению хромосом и хроматина в митотическом процессе и в ин-
терфазном состоянии клетки, и выяснить, в какой мере они
« 226 »
РЕПРОДУКЦИОННАЯ ФУНКЦИЯ КЛЕТКИ И ЕЕ РОЛЬ В ЭВОЛЮЦИИ
согласуются с выдвигаемой
нами гипотезой. Естественно,
прежде всего необходимо на-
метить общую рабочую схему
действия предполагаемого хро-
мосомного механизма.
Исходное представление за-
ключается в том, что клетка
состоит из органелл, в той или
иной мере обособленных друг
от друга разделительными уст-
ройствами в виде двойных ме-
мбран. Такую конструкцию
клетка получила при формиро-
вании из клона предковых про-
токлеток и сохранила ее на всем
протяжении эволюции как наи-
более соответствующую функ-
циональным потребностям клет-
ки, в том числе репродукционной
функции. Клетка, получившая
необходимое ей в борьбе за су-
ществование биологическое пре-
имущество в виде увеличения
массы, могла сохраниться, толь-
ко обладая возможностью раз-
множаться путем деления. На-
личие разделительных двойных
мембран в теле клеток было
первой предпосылкой к разви-
тию специфической клеточной
функции размножения путем
деления надвое.
Клетке требовалось создать
механизм, способный превра-
тить беспорядочную и фраг-
ментарную мозаику двойных
мембран в одну, расположен-
ную в одной плоскости двойную
мембрану, отделяющую одну
дочернюю клетку от другой. За-
дача эта не только геометриче-
ская. В первую очередь задача
заключалась в том, чтобы со-
здать физико-химические воз-
можности конструирования об-
щей разделительной двойной
Рис. 54. Схема химического дейст-
вия механизма клеточного деления,
заключенного в хромосомах, на под-
лежащие делению структуры
А — действие сил поверхностного натя-
жения, удерживающих сфероидальную
форму ядра и клеточного тела; В —
распространение цитокинетического ве-
щества (цитокинина), продуцируемого
метафазной пластинкой, в плоскости
предстоящего деления клетки; В—Г —
деление клетки осуществляется благо-
даря ослаблению сил поверхностного
натяжения и разжижения протоплазмы
в плоскости деления
« 227 »
15*
ФУНКЦИОНАЛЬНАЯ МОРФОЛОГИЯ И ФИЛОГЕНИЯ КЛЕТКИ
мембраны — преодолеть силы поверхностного натяжения плазмо-
леммы и силы сцепления коллоидных частиц клетки, удерживаю-
щие ее форму и внутреннюю структуру (рис. 54). Путь решения
задачи один — заставить работать на разделение силы поверхност-
ного натяжения клетки. Для этого требовалось создать в клетке
зону разжижения в плоскости будущего деления, чтобы вызвать
врастание плазмолеммы внутрь клетки по контуру будущего де-
ления. Эту задачу должны были решить и стали решать хромосо-
мы митотически делящегося ядра.
Внимание исследователей до сих пор привлекала феноменоло-
гия митотических передвижений хромосом, в которой основную
роль было принято приписывать активности тянущих нитей ми-
тотического аппарата. Мы видели, какие трудности встречает
эта широко распространенная трактовка. Она объясняет по суще-
ству только анафазное расхождение хромосом, не внося ясности
в профазные, метафазные и телофазные их перемещения. В по-
следние годы, однако, внимание исследователей митотического
процесса стали привлекать теперь уже хорошо изученные явле-
ния, относящиеся к ядерному делению низших протистов —
эвгленид и трипаносомид, ядра которых делятся без демонтажа
кариомембраны и с минимальным участием микротрубочкового
аппарата. Некоторые авторы [Leedale, 1968] считают, что у
эвгленид движение хромосом осуществляется автономно. Выска-
зывалось мнение, что в подобных случаях движение хромосом
регулируется не микротрубочковым, а мембранным аппаратом
ядра [Kubai, 1975]. Большинстве, исследователей в настоящее
время отказалось от гипотезы сократительной активности микро-
трубочек («тянущих нитей»), связанной с анафазным передви-
жением хромосом. Теперь принято считать, что удлинение и уко-
рочение микротрубочек, связанное с передвижением хромосом,
зависят от процесса включения — выключения (assembly—disas-
sembly) макромолекулярных элементов в состав микротрубочек
[Kubai, 1975; Fuge, 1977].
МЕТ АФАЗНАЯ ПЛАСТИНКА ВСЕГДА ЛЕЖИТ
В ПЛОСКОСТИ БУДУЩЕГО ДЕЛЕНИЯ КЛЕТКИ
Не нужно проводить специальных исследований, чтобы убе-
диться в глубоком соответствии плоскости деления клетки рас-
положению метафазной пластинки. Именно там, где располага-
лась метафазная пластинка, в животной клетке проходит плоскость
вакуолизации, обусловливающей строительство разделительной
двойной мембраны между дочерними клетками и в растительной
клетке разделительной стенки.
Как указывалось выше, метафазные пластинки простейших в
большинстве случаев строятся из мелких, точечных или палочко-
видных, слабо дифференцированных хромосом. Плоскость распо-
« 228 »
РЕПРОДУКЦИОННАЯ ФУНКЦИЯ КЛЕТКИ И ЕЕ РОЛЬ В ЭВОЛЮЦИИ
ложения метафазной пластинки чаще всего совпадает с пло-
скостью деления клетки. Имеются и исключения из этого правила,
подлежащие дальнейшему исследованию, в частности митозы ра-
ковинных корненожек, у которых весь процесс митотического де-
ления, а следовательно и формирование метафазной пластинки,
происходит внутри раковинки, в то время как цитокинез осу-
ществляется после миграции дочернего ядра в выступ тела до-
черней клетки с отделением дочерней клетки по линии, проходя-
щей вне раковинки материнской клетки. Специальный случай
представляет митоз (протомитоз) у эвгленид (эвгленомитоз),
динофлагелят (диномитоз) и многих других групп простейших,
у которых ядерная мембрана при митотическом делении не под-
вергается разрушению (демонтажу). Однако, и в этом случае
плоскость метафазной пластинки совпадает, во-перцьгх, с пло-
скостью деления ядра,' а, во-вторых, с плоскостью будущего деле-
ния клетки.
Большой интерес’ представляют случаи деления крупных ви-
дов простейших — радиолярий и инфузорий, у которых делению
тела предшествуют амитотические деления гигантских ядер
(у инфузорий — макронуклеусов, представляющих по современ-
ным данным гигантские полиплоидные ядра). У радиолярий
плоскость деления клетки совпадает с плоскостью расположения
гигантской хромосомной метафазной пластинки. Более сложны
отношения между плоскостью деления макронуклеуса, совершаю-
щегося путем своеобразного амитоза, и плоскостью деления тела
инфузорий, хотя, как правило, эти плоскости совпадают. Наибо-
лее интересны случаи, когда в области перетяжки макронуклеуса
элиминируется часть хроматина, локализующаяся в плоскости
будущего деления клетки [см.: Райков, 1967, 1979].
Выше отмечалось, что типичный митотический процесс —
эумитоз—достигает высшей формы структурного выражения у
высших многоклеточных эукариотов в связи с высокой слож-
ностью решаемых путем митотического деления строительных
задач. У многоклеточных животных и растений неизвестны слу-
чаи митотического деления ядер, за которыми не следовало бы
деление клеточного тела. Только разрушение микротрубочек
веретена с помощью колхицина может остановить переход мета-
фазы в анафазу и задержать таким способом цитокинез. Много-
численные исследования клеточного деления с помощью цейтраф-
ферной киносъемки позволяют видеть точное совпадение плоско-
сти метафазной пластинки с плоскостью цитокинеза (рис. 55).
Специальный интерес представляют процессы формирования
многоядерных систем, в которых деления ядер не сопровождаются
делениями клеточного тела. К этим системам принадлежат много-
ядерные клетки в очагах асептического воспаления (гигантские
клетки инородных тел), остеокласты костной ткани и поперечно-
полосатые мышечные волокна.
« 229 »
ФУНКЦИОНАЛЬНАЯ МОРФОЛОГИЯ И ФИЛОГЕНИЯ КЛЕТКИ
Рис. 55. Кадры цейтрафферной микрокиносъемки деления растительной,
клетки (А —8)
Культура эндосперма Ilaemanthus katherinac. Межклеточная стенка строится,
в плоскости расположения метафазной пластинки (показано стрелкой) [по Байеру,
Моле-Байер, 1963)
« 230 я
РЕПРОДУКЦИОННАЯ ФУНКЦИЯ КЛЕТКИ И ЕЕ РОЛЬ В ЭВОЛЮЦИИ
Как возникают гигантские клетки инородных тел? Описания
амитотических делений ядер макрофагов или гистиоцитов, в ко-
торых со времен Максимова [1918] видят источник развития ги-
гантских клеток, сомнительны. Вероятнее всего, прав Максимов,
считавший, что гигантские клетки инородных тел формируются
путем слияния макрофагов. Во всяком случае, по-видимому, ни-
кому еще не удалось видеть ни митотических, ни амитотиче-
ских делений ядер в гигантских клетках инородных тел. Если яд-
ра и не размножаются путем амитотического деления, то и мито-
тические деления ядер здесь не осуществляются. Соответственно
не обнаруживается и цитокинез.
Примерно так же обстоит дело с развитием остеокластов. Эти
многоядерные клетки-симпласты, специализированные на осуще-
ствлении остеолитических функций, формируются так же, как и
клетки инородных тел, путем слияния одноядерных клеток, воз-
можно остеобластов. Никому не приходилось наблюдать в осте-
областах ни достоверных амитозов, ни митотических делений.
Вот почему остеобласты не подвергаются цитокинезу.
Наиболее интересен с позиций хромосомной теории клеточно-
го деления гистогенез поперечнополосатых мышечных волокон.
На основании накопившихся данных по эмбриональному разви-
тию и регенерации мышечных волокон в 40-х годах в гистологии
сложилась точка зрения на эти процессы, согласно которой кле-
точный (миобластический) период гистогенеза мышц в эмбриоге-
незе и при регенерации характеризуется митотическими деления-
ми, в то время как с переходом к симпластическому строению
митотический способ деления ядер сменяется амитотическим.
А. А. Заварзин [1938] полагал, что при регенерации мышц у рыб
в мышечных волокнах возникают миобласты, ядра которых делят-
ся митотически, а после формирования мышечных симпластов
вновь переходят к амитотическому делению, подобно ядрам эм-
бриональных симпластов. Сходные отношения были обнаружены
в эмбриогенезе мышц у рыб и амфибий и при регенерации мышц
у птиц и млекопитающих [Студитский, Стриганова, 1951].
В настоящее время большинство исследователей [см.: Regene-
ration of striated muscle, 1970] отрицают возможность амитоти-
ческих делений ядер в мышечных волокнах. Что же касаетсц
митотических делений миобластов в регенерирующих мышцах,
то эти процессы приписывают особым камбиальным клеткам-саг
теллитам, за счет которых происходит развитие ядер в регенери-
рующих мышечных волокнах. При этом миобласты, возникающие
из сателлитов, образуют путем слияния миосимпласты/ (мышечг
ные трубочки), ядра которых не размножаются, а пополняются
путем миграции из зон размножения и слияния миобластов. .
По моим наблюдениям, амитотические деления ядер в' мышеч-
ных волокнах возможны. При регенерации трансплантированных
мышц на площадях целых срезов через мышцу (икроножную
« 231 »
ФУНКЦИОНАЛЬНАЯ МОРФОЛОГИЯ И ФИЛОГЕНИЯ КЛЕТКИ
мышцу лягушки или крысы) не обнаруживается в разгар пласти-
ческих процессов ни одного митоза, в то время как фигуры, ко-
торые можно трактовать как амитотические деления, встречаются
довольно часто. Но, даже если справедлива гипотеза о накоплении
ядер в мышечных симпластах путем миграции из зон митотиче-
ского деления сателлитов, совершенно очевидно, что клетка ре-
шает задачу строительства симпластической конструкции путем
отказа от митотических делений ядер. Митотически делятся толь-
ко ядра клеток-сателлитов и миобластов. Миосимпластическая
структура создается без митотических делений — в этом содер-
жится сильнейший аргумент в пользу хромосомной теории кле-
точного деления.
ХИМИЧЕСКИЕ И СТРУКТУРНЫЕ ОСНОВЫ
УЧАСТИЯ ХРОМОСОМ В РЕПРОДУКЦИИ КЛЕТКИ
Химический механизм участия хромосом в осуществлении ре-
продукционной функции клетки пока еще недостаточно ясен
[см.: Алов, 1972]. Разработанная выше рабочая схема исходит из
предположения, что феномен везикуляции, ведущий к формиро-
ванию двойной разделительной мембраны между дочерними клет-
ками, связан с выделением хромосомами специфического метабо-
лита, вызывающего разжижение цитоплазмы с последующей ве-
зикуляцией и цитокинезом. Этому гипотическому метаболиту было
предложено название цитокинетический гормон (ЦКГ) [Студит-
ский, 1970]. В настоящее время вещества подобного действия, т. е.
стимулирующие цитокинез, известны и называются цитокинина-
ми [Кулаева, 1967, 1973; Srivastava, 1967]. Показано, что эти
вещества, возникают при деградации ДНК (т. е. основного субст-
рата хромосом), обладают природой пуриновых производных и
специфически действуют на клеточные деления. Изучено их
действие главным образом на растительные объекты, хотя име-
ются некоторые данные и о стимуляции деления животных кле-
ток. Описано стимулирующее действие цитокинина на жизненный
цикл хлоропластов, включая их деление [Seyer et al., 1975].
Исследование цитокининов еще только начинается. Способ их
действия на делящуюся клетку неясен. Для нас важно отметить
два обстоятельства. Первое заключается в том, что цитокинины
представляют собой продукты деградации ДНК. Из этого следует,
что цитокинин (или ЦКГ) может возникать в зоне расположения
метафазной пластинки за счет деградации части ДНК метафаз-
ных хромосом. Второе — объект действия ЦКГ. Цитокинины не
вызывают, а только ускоряют клеточное деление. Они стимули-
руют цитокинез — деление клеточного тела. Из этого следует,
что ЦКГ, выделенный в плоскости метафазной пластинки, будет
стимулировать те процессы, которые ведут к клеточному делению,
т. е., по нашей схеме, разжижение цитоплазмы и везикуляцию,
« 232 »
РЕПРОДУКЦИОННАЯ ФУНКЦИЯ КЛЕТКИ И ЕЕ РОЛЬ В ЭВОЛЮЦИИ
ведущую к формированию разделительной двойной мембраны.
Данных о структурной организации цитокинетического меха-
низма нет. Никому не удавалось идентифицировать вещества, от-
деляемые метафазными хромосомами в плоскость будущего деле-
ния клетки. В пользу идеи о цитокинетическом действии метафаз-
ных хромосом свидетельствуют, однако, факты индукции
митотического процесса в опытах с гетерокарионами. В культурах
клеток, сформировавших гетерокарионы под влиянием инактиви-
рованного вируса Сендай, был обнаружен феномен взаимодейст-
вия ядер, находящихся на разных фазах митотического процесса,
в частности феномен распыления («пульверизации») хромосом
под влиянием интерфазных ядер и конденсации хромосом под
влиянием профазных ядер [Kato, Sandberg, 1968; Ikeuchi,
Sandberg, 1970; Sanbe et al., 1970; Sandberg et al., 1970;
Ikeuchi et al., 1971, 1972]. Авторы открытия считают, что пуль-
веризация хромосом представляет собой процесс преждевременно-
го вступления в митотическое состояние, ведущее к «досрочной»
конденсации митотических хромосом [Sandberg et al., 1970].
При комплексировании интерфазного ядра с метафазным имеет
место индукция формирования ядерной оболочки вокруг мета-
фазных хромосом, на основании чего авторы выдвигают гипотезу
о двух индуцирующих агентах, действующих в митотическом
процессе: один (фактор пульверизации) проявляется в метафазе,
вызывая демонтаж ядерной оболочки и пульверизацию хромосом,
и другой — в интерфазе, обеспечивая реконструкцию и сохране-
ние целостности ядерной оболочки [Ikeuchi et al., 1971]. Наибо-
лее демонстративный эксперимент включал взаимодействие интер-
фазных ядер с метафазными в суспензиях из синхронизированных
культур, подвергнутых действию инактивированного вируса
[Matsui et al., 1972]. Авторы проследили по срокам (5, 10,
20 мин) действие метафазного ядра на интерфазное, завершив-
шееся развитием профазного состояния и демонтажем ядерной
оболочки. Заметим, что метафазные хромосомы, как пока-
зывают многочисленные исследования,— это не чисто хроматино-
вые (дезоксирибонуклеопротеидные), но смешанные ядрышко-
хроматиновые конструкции, поскольку ядрышковый материал,
подвергающийся демонтажу в профазе, рассредоточивается в ме-
тафазпых хромосомах [Das et al., 1965; Поляков, Ченцов, 1969;
Mayfield, Bohner, 1971; Risueno et al., 1976]. Напрашивается
вывод, что производство вещества (ЦКГ), вызывающего демонтаж
ядерной мембраны и везикуляцию цитоплазмы в плоскости цито-
кинеза, связано с взаимодействием метафазного хроматина и яд-
рышек. В пользу этого предположения свидетельствуют следую-
щие факты. Единственная клетка организма многоклеточных,
временно лишающаяся способности к делению — сперматозоид —
полностью лишена ядрышкового вещества (РНК), которое под-
вергается экструзии из ядра на протяжении первых этапов диф-
« 233 »
ФУНКЦИОНАЛЬНАЯ МОРФОЛОГИЯ И ФИЛОГЕНИЯ КЛЕТКИ
« 234 »
РЕПРОДУКЦИОННАЯ ФУНКЦИЯ КЛЕТКИ И ЕЕ РОЛЬ В ЭВОЛЮЦИИ
ференцировки [Picheral, Bassez, 1971]. Вышедшее из ядра спер-
матид ядрышковое вещество (хроматоидные тела) используется
для провизорной функции (синтеза белков хвоста) [Yasuzumi
et al., 1970а, b; Comings, Okada, 1972]. Во многих случаях яд-
рышки пересистируют на всем протяжении митоза, локализуясь,
в частности, в метафазной пластинке [Brown, Emery, 1957; Hsu
et al., 1965; Stevens, 1965]. Кроме того, у низших протистов в
протомитозе ядрышко делится вместе с хромосомами [Leedale,
1958, 1968; Райков, 1967, 1979]. Наличие ядрышка, очевидно, не-
обходимо для этой формы деления. Наконец, при эргидном спосо-
бе деления ядрышковый материал входит в состав эргид, инду-
цирующих плоскости деления ядер. Некоторые факты, свидетель-
ствующие о стимулирующем воздействии хроматина на
формирование разделительной мембраны, относятся к сходному,
но не идентичному процессу — своеобразному амитотическому
делению некоторых ядер.
Рис. 56. Эргидные ядра и картины их расщепления по плоскостям эргид в
семенных канальцах речного ра„ка. Ценкер, Фелъген
А — видны эргидные ядра эпителия семенного канальца (Эта), ядра интерстициаль-
ной ткани (И) и ядра спермиев (On, X 200); Б—Д—ядра эпителия семенного ка-
нальца. Стрелкой показаны щели эргидного деления (эргидпого кариокинеза), X 900
« 2.35 »
ФУНКЦИОНАЛЬНАЯ МОРФОЛОГИЯ И ФИЛОГЕНИЯ КЛЕТКИ
ВОЗМОЖНЫЙ МЕХАНИЗМ АМИТОТИЧЕСКОГО ДЕЛЕНИЯ ЯДЕР
В СЕМЕННЫХ ПУТЯХ РЕЧНОГО РАКА
Недавно выяснилось [Студитский, 1970, 1971], что ядра в
семявыносящих трубочках речного рака (Astacus leptodactylus)
отличаются своеобразным способом деления, напоминающим ами-
тоз. Ядерная мембрана при этом способе деления образует узкие
щелевидные впячивания (чаще всего наискось по отношению к
базально-апикальной оси ядра), постепенно углубляющиеся и
отделяющие новообразованное ядро от материнского. Делению
ядра с помощью этого способа предшествует формирование хро-
матиново-ядрышковых структур типа эргид, подвергающихся рас-
щеплению в плоскости, соответствующей плоскости впячивания
ядерной мембраны, завершающей деление ядра. Из этих наблю-
дений был сделан вывод, что нуклеолярно-хроматиновый (эргид-
ный) комплекс, располагающийся в плоскости будущего деления
ядра, играет роль продуцента ЦКГ, стимулирующего разжижение
кариоплазмы и впячивание ядерной мембраны, обеспечивающих
процесс деления ядра, за которым в той же плоскости следует
деление клеточного тела.
Своеобразие этого необычного способа амитотического деле-
ния побудило меня в дальнейшем изучить его с помощью элемен-
тарной гистохимической техники самым тщательным образом.
К настоящему времени мной накоплен обширный фактический
материал, позволяющий сделать некоторые уточнения предвари-
тельного описания процесса и обосновать гипотезу о его функцио-
нальном значении.
По-видимому, весь эпителий семенных путей речного рака,
начиная с семенных канальцев, где формируются спермин, и
кончая выводными протоками, характеризуется способностью ядер
к этому своеобразному способу деления. На всем протяжении се-
менные пути содержат белковый секрет (интенсивно красящийся
светлым зеленым), в котором располагаются развивающиеся спер-
матоциты, сперматиды (в семенных канальцах) и зрелые спермин
(в семявыносящих трубочках). Белковый секрет продуцируется
эпителиальными клетками семенных путей, которые характери-
зуются интенсивным развитием рибосомного аппарата как в ци-
топлазме (в составе эргастоплазматических комплексов), так и в
ядре (в составе секреции эргид). Исследование процесса секреции
в эпителиальных клетках семенных путей позволяет сделать вы-
вод, что своеобразное амитотическое деление ядер эпителиальных
клеток связано с процессом секреции.
Как отмечалось в одной из предыдущих глав, формирование
секреторного продукта в семенных путях десятиногих раков вклю-
чает различные формы ядерной секреции. Простейшая форма
участия ядра в секреторном процессе — накопление капель секре-
та в полостях эргид с последующей их эвакуацией в цитоплазму.
« 236 »
РЕПРОДУКЦИОННАЯ ФУНКЦИЯ КЛЕТКИ И ЕЕ РОЛЬ В ЭВОЛЮЦИИ
Рис. 57. Эргидный кариокинез в ядрах клеток семенного канальца речного
рака. Ценкер, Фелъген
А—В — эргидные щели. Симметричное расположение расщепившихся эргид (полу-
эргид), X 900; Г — эргидные щели в расщепившемся ядре, X 1600; Д — эргидные
щели из ядра (см. фрагмент Г) при большем увеличении. Симметричное расположе-
ние полуэргид вокруг щели, X 2000
Более сложный способ заключается в демонтаже секретирующего
ядра путем разрушения (скорее всего, посредством везикуляции)
ядерной оболочки, освобождении эргидных блоков и их постепен-
ной деполимеризации вплоть до полной утраты фельген-позитив-
пости и растворения в цитоплазме. Вполне вероятно, что осво-
божденные эргидные блоки до завершения деполимеризации про-
« 237 »
ФУНКЦИОНАЛЬНАЯ МОРФОЛОГИЯ И ФИЛОГЕНИЯ КЛЕТКИ
« 238 »
1
РЕПРОДУКЦИОННАЯ ФУНКЦИЯ КЛЕТКИ И ЕЕ РОЛЬ В ЭВОЛЮЦИИ
должают секретировать секреторный белок по обычной схеме
(ДНК->РНК-*белок). Самый важный в эволюционно-морфологи-
ческом отношении момент ядерной секреции в семенных прото-
ках рака заключается в том, что ядро отделяет секретирующую
часть, подлежащую демонтажу и резорбции, посредством своеоб-
разного процесса, сходного с амитотическим делением.
Простейшие формы этого процесса были описаны мной ранее.
Важно подчеркнуть, что в некоторых случаях удается рассмот-
реть подготовку к делению эргидного аппарата, заключающуюся
в расположении цепочки эргид в плоскости будущего деления яд-
ра наподобие метафазной пластинки. При этом наблюдаются кар-
тины формирования пузырьков в фельген-позитивном материале
эргид, слияния этих пузырьков в щелевидные полости, напоми-
нающие щели между слипшимися метафазными пластинками,
и отделения слившихся эргид друг от друга в виде двух как бы
анафазных пластинок, между которыми врастают впячивания
ядерной мембраны (рис. 56, 57). Таким образом, это своеобразное
амитотическое деление ядра несет в себе какие-то сильно моди-
Рис. 58. Эргидный кариокинез в клетках семявыносящих канальцев реч-
ного рака. Ценкер, Фельген
А — грибовидные ядра; Б — колосовидное расположение хроматинового материала
(эргид и хромосом); В — отщепление секреторных ядер, X 1200
« 239 »
ФУНКЦИОНАЛЬНАЯ МОРФОЛОГИЯ И ФИЛОГЕНИЯ КЛЕТКИ
фицированные признаки митотического деления без участия ми-
тотического аппарата, центриолей и веретена, а только за счет ак-
тивности хроматиново-ядрышковых комплексных органелл (эр-
гид). Электронно-микроскопическая картина эргидного деления
ядер в клетках семенных канальцев с достаточной демонстратив-
ностью выявляет процесс расщепления ядра в плоскости эргидно-
го комплекса с последующим делением клетки по той же
плоскости. По сторонам от плоскости расщепления можно видеть
идентичные по форме и структуре эргиды.
Еще более демонстративно сходство амитотического деления
ядра с модифицированным митозом в проксимальных отделах
семенных путей с высоким призматическим эпителием (рис. 58).
Здесь эпителиальные клетки сильно вытянуты в базально-апикаль-
ном направлении, ядра занимают многорядное положение, ядер-
ная секреция совершается как в базальном, так и в апикальном
направлениях путем отделения с помощью амитотической пере-
шнуровки ядер, подлежащих секреторному демонтажу.
Демонтирующиеся секреторные ядра залегают как в базаль-
ных, так и в апикальных концах секреторных клеток. Процесс
секреторного демонтажа ядер осуществляется по той же схеме:
разрушение ядерной оболочки, демонтаж хроматиновых (эргид-
ных) блоков, утрата фельген-позитивности, полная резорбция.
Однако наибольший интерес для нас в этом процессе представля-
ет способ отделения секреторных ядер (рис. 58, 59).
Процесс секреции в этих отделах семенных путей чрезвычай-
но интенсивен. Участие ядер в секреторном процессе выявляется
по формированию грибовидных ядер, выходящих из основного
многорядного комплекса в апикальные части клеток. Ядра резко
структурированы, входящие в их состав хроматиновые и эргид-
ные блоки резко фельген-позитивны. Исходная форма ядра (ге-
неративные ядра) — эллипсоидная с расширением в базальной
(у базально расположенных) или в апикальной (у апикально рас-
положенных) частях ядра. По периферии ядра, плотно примыкая
к ядерной мембране, распределяются мелкие фельген-позитивные
глыбки (хромосомы или хромосомные комплексы). Центральная
часть ядра занята цепочками округло-угловатых крупных глыбок
фельген-позитивного вещества — эргид. Хромосомы и эргиды
связаны идущими наискось от центра к периферии тонкими тя-
жами фельген-позитивного вещества. Иногда эти тяжи принима-
ют вид стеблей, на которых, как головки цветов в букете, сидят
эргиды (см. рис. 58, Л),
В отличие от других отделов семенных путей с невысоким эпи-
телием, где деление ядер осуществляется без определенной ориен-
тации плоскостей деления (см. рис. 56, 57), для высокопризмати-
ческих клеток характерна ориентация плоскостей деления ядер
перпендикулярно осям клеток. В грибовидной верхушке ядра со-
бирается комплекс эргид, примыкающих к ядерной оболочке, чис-
« 240 »
РЕПРОДУКЦИОННАЯ ФУНКЦИЯ КЛЕТКИ И ЕЕ РОЛЬ В ЭВОЛЮЦИИ
Рис. 59. Расщепление эргидных. ядер по плоскостям эргид в семявынося-
щем канале речного рака
Эргида расщепляется на зеркально подобные половины, с идентичным чередова-
нием утолщений и истончений хроматинового (фельген-позитивного) материала.
Ценкер, Фельген, X 1200
лом 5—7 и более (см. рис. 58). Следующий этап — разрыхление
комплекса с перераспределением эргид в две группы — апикаль-
ную и центральную. Третий этап, напоминающий формирование
метафазной пластинки, заключается в распределении материала
сливающихся эргид в плоскости деления ядра. Эргидная пластин-
ка связана фельген-позитивными тяжами с базальными и апикаль-
ными полюсами ядра. Четвертый этап — формирование просве-
та— как бы анафазной щели в эргидной пластинке. Теперь, эр-
гидные пластинки связаны с базальным и апикальным полюсами
клетки фельген-позитивными тяжами. Пятый этап — врастание в
эргидную щель ядерной мембраны и разделение ядер, вернее,
отделение секреторного ядра от генеративного. Шестой этап уже
прямого отношения к делению ядра не имеет. Он заключается в
демонтаже секреторного ядра и резорбции фельген-позитивного
материала.
Не совсем ясным при данной технике исследования остается
поведение цитоплазмы, примыкающей к плоскости отделения ге-
неративного ядра. Электронно-микроскопические картины пока-
зывают, что эта плоскость переходит в плоскость перешнуровки
цитоплазмы, в результате чего вместе с секреторным ядром отде-
ляется и часть клеточного тела секретирующей клетки, (рис. 60).
Итак, как мы убедились, своеобразное амитотическое деление
ядра в семенных путях рака представляет собой скорее модифи-
16 А. Н. Студитский
« 241 »
ФУНКЦИОНАЛЬНАЯ МОРФОЛОГИЯ И ФИЛОГЕНИЯ КЛЕТКИ
« 242 »
РЕПРОДУКЦИОННАЯ ФУНКЦИЯ КЛЕТКИ И ЕЕ РОЛЬ В ЭВОЛЮЦИИ
Рис. С>0. Эргидный кариокинез в клетках эпителия семенного канальца
речного рака
А—эргидная щель отделяет расщепившиеся ядра. Полуэргиды расщеплены симмет-
рично по сторонам арендной щели (отмечены стрелками и цифрами); Б — эргидное
деление клеток (цитокине:!) семенного эиптелия. Видны три расщепившихся ядра
и мегиклсточная щель, возпикшая ме?кду разделившимися клетками. В расположе-
нии полуэргид в разделившихся ядрах отчетливо сохраняется симметрия, указан-
ная стрелками. Электронные микрофотографии Г. В. Е.тякоиой. X 22 000
« 243 »
16*
ФУНКЦИОНАЛЬНАЯ МОРФОЛОГИЯМИ* ФИЛОГЕНИЯ КЛЕТКИ
Рис. 61. Схема эргидного кариокинеза в эпителии семенного канальца реч-
ного рака
А — монтаж эргид; Б — расщепление эргид и эргидное деление ядра I
I
цированное митотическое деление, нежели простую перешнуров-
ку ядра, которую принято называть амитозом (рис. 61). Для по-!
добного способа деления ядра,’ сопровождающего ядерную секре-
цйю в семенник путях травяного краба (Garcinus maenas), мной
был предложен * термин секреторный кариокинез [Студитский,.
1970, 1971]. Несомненно, в процессе своеобразного амитотическо-!
го (т. е. без формирования хромосом и митотического аппарата)
деления ядра в семенных путях рака мы встречаемся с новым ват
риал том секреторного кариокинеза — отделением секреторного яд-
ра от генеративного с помощью аналога хромосомного аппарата —
комплекса эргид, -который можно называть эргидным аппаратом.
В секреторном кариокинезе в семенных путях речного рака !на!
эргидный аппарат падает функциональная роль хромосомного
аппарата других клеток, которые делятся путем обычного митоза.
Именно эргидный аппарат детерминирует главный момент секре-
торного кариокинеза — отделение секреторного ядра от генера-
тивного по плоскости, в которой выстраивается эргидная пластин-
ка (см. рис. 61). Как указывалось выше, по той же плоскости
происходит и деление клеточного тела (см. рис. 60).
В связи с анализом феномена секреторного кариокинеза в
семенных путях речного рака можно предположить о роли хрома-
тина в демонтаже ядерной оболочки путем везикуляции при
обычном митотическом делении ядра. Не исключено, что этот
процесс также осуществляется с помощью ЦКГ, продуцируемого
хроматиновыми органеллами клетки, подобно тому как демонтаж
ядерной оболочки секреторных ядер в семенных путях речного
рака совершается благодаря активности хроматина, локализован-
ного под ядерной мембраной.
« 244 »
РЕПРОДУКЦИОННАЯ ФУНКЦИЯ КЛЕТКИ И ЕЕ РОЛЬ В ЭВОЛЮЦИИ
Обращаясь к общей эволюционно-морфологической оценке
секреторного кариокинеза в семенных путях речного рака, можно
прежде всего отметить, что па этом объекте опять чрезвычайно
убедительно проявляется активность комплексов ядерных органелл
в осуществлении секреторной функции клетки. Однако в отличие
от других форм ядерной секреции здесь клетка прибегает к кон-
струированию специальных механизмов, обеспечивающих не
только синтез, аккумуляцию и транспорт секреторных белков из
ядра в цитоплазму, но и формирование специфически дифферен-
цированных секреторных ядер, отделяющихся от генеративных
ядер с помощью особой модификации секреторного кариокинеза,
в которой действует вместо хромосомного эргидный аппарат деле-
ния ядра.
Важно отметить, что секреторный кариокинез в семенных пу-
тях речного рака отличается от обычного амитоза (деление пу-
тем простой перешнуровки ядра) также и тем, что эпителий се-
менных путей в результате расщепления ядер путем секреторного
кариокинеза не превращается в симпласт, а сохраняет отчетливо
различимое клеточное строение. ЦКГ, продуцируемый эргидным
аппаратом, вероятно, действует и как цитокинин, стимулирую-
щий процесс цитокинеза.
Мы знаем, что типичный митоз — эумитоз, характеризующий-
ся демонтажом ядерной мембраны в поздней профазе и формиро-
ванием митотического аппарата с центриолями и веретеном деле-
ния, возник в филогенезе не сразу. Ему предшествовали такие
формы деления клетки, как эвгленомитоз и диномитоз низших
простейших, осуществляющиеся без демонтажа ядерной мембра-
ны и монтажа митотического аппарата. У этих организмов про-
цесс клеточного деления совершается за счет хромосомно-ядрыш-
кового аппарата, который обеспечивает деление ядра без
демонтажа ядерной оболочки и последующее деление клеточного
тела. Клетки семенных путей речного рака обращаются к этому
типу деления, чтобы решить задачу интенсивной белковой секре-
ции с помощью ядерных органелл. Вместо хромосом в ядрах этих
клеток действует эргидный аппарат, который не только участвует
в синтезе секрета, но и строит аналог метафазной пластинки —
эргидную пластинку, которая работает как аппарат ядерного де-
ления и, вероятно, как аппарат цитокинеза секреторной клетки.
На протяжении почти столетнего периода, прошедшего после
открытия митотического деления, поведение хромосом как воз-
можных активных агентов репродукционной функции клетки изу-
чалось слабо. Между тем основной и бесспорный факт, заключаю-
щийся в том, что делению клеточного тола (цитокинезу) всегда
предшествует митотическое деление ядра, бесспорно свидетельст-
« 245 »
ФУНКЦИОНАЛЬНАЯ МОРФОЛОГИЯ И ФИЛОГЕНИЯ КЛЕТКИ
вует о связи между этими явлениями как следствием и причи-
ной. Вытекающая из синбактериогенной теории происхождения
клетки хромосомная теория клеточного деления опирается на
очевидный факт сходства хромосом с бактериями по способу раз-
множения делением. Ядро возникло как центральный комплекс
субклеточных компонентов клетки, специализированный на ре-
продукционной функции. Наиболее вероятный механизм осуществ-
ления этой функции — продукция веществ, благоприятствующих
осуществлению цитокинеза,— производных ДНК хромосом. Вы-
двигается гипотеза о разжижающем действии цитокинина, спо-
собствующем преодолению поверхностного натяжения плазмолем-
мы и ее врастанию в плоскость деления клетки. Один из важней-
ших аргументов в пользу этой гипотезы заключается в совпадении
плоскости метафазы с плоскостью цитокинеза. Фактическое под-
тверждение развиваемой гипотезы заключается в своеобразном
способе амитотического деления ядер в семенных путях речного
рака с развитием своеобразного варианта метафазной пластин-
ки — эргидной пластинки, плоскость которой совпадает с плоско-
стью деления ядра.
Хромосомная теория клеточного деления не противоречит фак-
ту локализации факторов менделевской наследственности на хро-
мосомах.
ПОСЛЕСЛОВИЕ
*
Одна из главных задач данной книги заключалась в том,
чтобы обосновать новый эволюционно-морфологический принцип
разработки клеточной теории и экспериментального исследования
клеточной структуры.
Классическая клеточная теория была построена на идее о
неизменности клетки как элемента строения и развития органи-
ческого мира. Клетка считалась атомом органической материи,
ее исходным структурным компонентом, возникшим вместе с по-
явлением жизни на Земле и вошедшим в состав всех ныне жи-
вущих организмов в результате необозримо длинного ряда
делений первичной структурной единицы. Естественно, подобное
представление о природе, происхождении и месте клетки в исто-
рическом развитии органической материи не оставляло никаких
перспектив для внедрения в клеточную теорию исторического
метода и на его основе — развития эволюционной морфологии
клетки.
В настоящее время в результате открытия трех основных
типов конструкции живой материи — вирусной, бактериальной и
клеточной — стало совершенно очевидным, что клетка как слож-
ная форма структурной организации жизни не могла быть пер-
вичным элементом ее эволюции. Клетке несомненно предшество-
вали более примитивные конструкции живого вещества бактери-
альной или вирусной природы. Признание этого факта определило
главную проблему эволюционной морфологии клетки как научной
дисциплины: поиск путей и закономерностей эволюции клетки.
С возникновением проблемы определилась и сама научная дис-
циплина — эволюционная морфология клетки.
Разработанная мной синбактериогенная гипотеза является
одной из возможных гипотез происхождения и эволюции клетки.
После первого выступления с эскизом этой гипотезы [Студутт-
ский, 1962] появились и другие гипотезы — ряд вариантов гипо-
тезы симбиогенеза К. С. Мережковского [Margulis, 1971;
Тахтаджян, 1973], которые мне представляются биологически
малоправдоподобными, и гипотеза Робертсона [1963, 1964] —
мембраногенного происхождения клеточной структуры, которая,
с моей точки зрения, лишена фактического обоснования. Однако
нельзя исключить того, что в ходе разработки проблемы будут
обнаружены новые факты, которые вступят в противоречие с
разрабатываемой мной гипотезой, или, наоборот, послужат укреп-
лению гипотез симбиогенеза или мембраногенеза. Важно то, что
клеточная теория обогатилась идеей эволюционного развития
« 247 »
ПОСЛЕСЛОВИЕ
клетки, позволяющей по-новому рассматривать природу клетки
и ее исторические связи с предклеточными формами организации
живой материи.
Приведенный в этой книге фактический материал, как
мне кажется, позволяет с достаточной убедительностью взять за
основу для разработки проблем эволюционной морфологии клетки
предложенную мной гипотезу ее синбактериогенного происхож-
дения. Этот материал относится к двум основным проблемам
эволюционной морфологии клетки — ее онтогенетического разви-
тия, или онтоцитогенеза, и функциональной структурной специа-
лизации — дифференцировки, или метацитогенеза. Я не вводил эти
названия в основной текст, не придавая им большого терминоло-
гического значения. Здесь они используются для сокращения
изложения. Онтоцитогенез означает индивидуальное развитие
клетки, ограниченное циклом ее воспроизводства, метацитоге-
нез — процесс ее структурной дифференцировки, связанный с
функциональной специализацией.
Если не считать попытки Б. П. Токина обосновать гипотезу
онтогении клетки, отсчитываемой с момента ее деления, огромное
большинство цитологов констатировало факт циклического во-
спроизводства клетки как структурное выражение присущего
клетке свойства — размножаться путем деления. То же отноше-
ние проявлялось большинством цитологов к безграничному мно-
жеству фактов по дифференцировке клетки. Цитологи считали,
что клетке свойственна способность изменять свою структуру в
соответствии с осуществляемой функцией. До открытия предкле-
точной истории организации клетки почти никому не приходило
в голову, что процесс циклического воспроизводства клетки,
онтоцитогенез, равно как и процесс структурной специализации
клетки, метацитогенез, предопределены историческим прошлым
клетки, вытекают из свойств доклеточных форм организации
живой материи, являющихся предковыми состояниями клетки.
Было время, когда с такой же непосредственностью изучались
процессы эмбрионального развития и постэмбриональной функ-
циональной адаптации органов. Целое столетие прошло со време-
ни первых описаний онтогенетического развития органов из эмбрио-
нальных закладок до начала систематических поисков отражения
в этих процессах эволюционного прошлого органов. Немало уче-
ных додарвиновской эпохи описывали дробление оплодотворенного
яйца и возникновение из него комочка клеток, напоминающего
сначала тутовую ягоду, затем полый пузырек и, наконец, дву-
слойную капсулу. Но только в последарвинскую эпоху выдающе-
муся эволюционисту Геккелю пришло в голову, что зигота, мору-
ла, бластула и гаструла в упрощенной форме повторяют (река-
питулируют) стадии исторического развития многоклеточных
животных. То же можно сказать и о процессах онтогенетического
развития органов, начиная с зародышевых листков и их произ-
« 248 »
ПОСЛЕСЛОВИЕ
водных и кончая формированием дефинитивных рабочих струк-
тур. В настоящее время есть только одна наука о развитии
конструкций многоклеточных организмов — эволюционная мор-
фология Э. Геккеля, А. О. Ковалевского, А. Н. Северцова,
И. И. Шмальгаузена, и за пределами этой науки никакое науч-
ное исследование процессов индивидуального развития невозмож-
но. Так же обстоит дело и с эволюционной морфологией клетки.
Различие здесь заключается в том, что в силу ограниченных
технических возможностей исследователь-эволюционист не мог
конкретизировать возможный путь исторического конструирова-
ния клеточной структуры. Клетка была пределом научного по-
знания структурной организации живой материи, к которому ис-
следователь был вынужден сводить все известные ему формы
организации живых существ, включая организмы с неразличимой
клеточной структурой — бактерии и вирусы. Единственной эво-
люционной проблемой классической цитологии было превращение
одноклеточных организмов в многоклеточные организмы. Что же
касается проблемы происхождения клетки, в частности путем
симбиогенеза, по К. С. Мережковскому, то виднейший предста-
витель классической школы цитологов Вильсон [1936] считал
возможным заявить, что о таких проблемах не стоит говорить в
порядочном ученом обществе.
Техническая революция обеспечила гигантский скачок в раз-
витии средств исследования клетки и на его основе — не менее
гигантский скачок в развитии представлений о природе и проис-
хождении клетки.
В книге сделана попытка показать, как можно теперь, опи-
раясь на бесспорный факт эволюционного происхождения клеточ-
ной структуры, рассматривать с эволюционно-морфологических
позиций многие широко известные ранее, а также вновь откры-
тые с помощью новой техники или на новых объектах факты
онтогенетической и функциональной динамики клеточной струк-
туры. Мне кажется, что проведенный мной эволюционно-морфо-
логический анализ позволяет теперь видеть в процессах онтоге-
нетической и функциональной динамики клеточной структуры
отражение ее исторического прошлого, которое, согласно разра-
ботанной мной концепции, включает доклеточное состояние в
виде бактериоидных форм, ставших в ходе эволюции органелла-
ми клетки. Можно повторить, что я не считаю свою гипотезу
единственно правильной, но не скрываю того, что к настоящему
времени она кажется мне наиболее соответствующей тому огром-
ному разнообразию фактов, с которым имеет дело современная
цитология.
С позиций синбактериогенной гипотезы происхождения клетки
получили вполне правдоподобное объяснение такие явления, как
размножение, активная подвижность, выход в цитоплазму яд-
рышка, удивительный феномен развития акцессорных ядер в ци-
« 249 »
ПОСЛЕСЛОВИЕ
топлазме ооцитов перепончатокрылых, размножение путем
деления митохондрий и пластид растительных клеток и особенно
многие, трудно объяснимые явления, относящиеся к онтогенезу
клетки как целого. Я не представляю себе, как с иной позиции,
кроме синбактериогенной гипотезы, можно объяснить такие про-
цессы, как плазматоз, развитие безъядерных эритроцитов и
кровяных пластинок, формирование гетерокарионов и многие
другие проявления структурного динамизма клетки, выражающие
ее комплексную природу.
Не менее важным в эволюционно-морфологическом плане мне
представляется разработанный и использованный в этой книге
новый подход к пониманию структурной адаптации клетки к ее
функциональному назначению. Ни в одном виде структурной
динамики клетки не проявляется с такой очевидностью ее комп-
лексная структура, как в строительстве специализированных
клеток типа женских и мужских гамет или рецепторных клеток.
Неменьший интерес с эволюционно-морфологических позиций
представляют такие структурные адаптации клеток, как форми-
рование секреторных и ассимиляционных пулов органелл. Наибо-
лее существенным в этом плане мне представляется секреторная
активность нуклеолярно-хроматиновых структур типа эргид, обна-
руженных мной в семенных путях ракообразных. Невозможно
представить себе для подобных процессов, сближающих друг
с другом такие, казалось бы, различные по своей природе орга-
неллы, как хромосомы, ядрышки и эргастосомы, другого объясне-
ния, кроме общности их природы и происхождения.
Особое место в книге занимает специальная глава, посвящен-
ная структурным основам репродукционной функции клетки.
В этой главе проанализированы общеизвестные факты, относя-
щиеся к поведению хромосом и ядрышка в процессе клеточного
деления, а также приведены новые, неизвестные ранее данные,
характеризующие новую, открытую мной форму «эргидного»
деления, опять-таки в клетках семенных путей ракообразных, на
основании чего сделан вывод о репродукционной функции нук-
леолярно-хроматинового комплекса. Мне еще раз хотелось бы
подчеркнуть, что этот вывод я отнюдь не противопоставляю
бесспорному факту представительства агентов менделевской на-
следственности в хромосомах. Более того, здесь следовало бы
отметить, что в ходе эволюции значение менделеевской наследст-
венности проявляет тенденцию к повышению. Однако из анализа
данных, относящихся к эволюции нуклеолярно-хромосомного
аппарата, вытекает, что первичной функцией ядерных органелл
была функция деления клетки, к которой вторично присоедини-
лись (или проявились) другие функции, как, например, секретор-
ная или опорная.
Конечная цель всех биологических исследований — управле-
ние развитием, формообразованием и дефинитивной жизнедеятель-
«250 »
ПОСЛЕСЛОВИЕ
ностью живых организмов. Подступы к этой цели заключаются
в законах развития, формирования и всей жизненной активности
живых существ. Естественно, такова конечная цель и эволюцион-
но-морфологических исследований клетки. Вопрос заключается в
том, какое направление в этой сфере исследований проложит пути
к познанию законов, с помощью которых станет возможным уп-
равление теми или иными жизненными процессами.
На протяжении почти полутора столетий классическая кле-
точная теория была законом, на основе которого изучались все
процессы, связанные с развитием, ростом, формообразованием и
в значительной мере с дефинитивной жизненной активностью
живых существ, включая физиологическую и репаративную реге-
нерацию, защитно-воспалительные и иммунобиологические реак-
ции и множество других процессов, осуществляемых с помощью
клеток. Клеточная теория сыграла поистине гигантскую роль в
разработке общей теории индивидуального развития и в особен-
ности в создании универсальной теории строения и развития всей
органической материи, на которой зиждется современное эволю-
ционное мировоззрение. Но вместе с тем было бы неправильным
отрицать и то, что реальная картина микроструктуры органиче-
ского мира, вскрываемая средствами исследования предшествую-
щей эпохи, включала явления, выходящие далеко за пределы
схемы, принятой за основу клеточной теории.
Часть этих явлений привлекала внимание исследователей и
становилась иногда предметом выступлений против универсаль-
ного значения клеточной теории. Возможность превращения
некоторых клеточных комплексов в симпластические послужила
поводом для разработки гипотез о симпластическом принципе
конструкции многоклеточных организмов [см.: Кацнельсон,
1963; Вермель, 1970]. Другие, принципиально сходные явления,
также вступающие в конфликт с основной доктриной клеточной
теории, не вызывали особых разногласий в трактовке, поскольку
их было принято относить к группе производных клеточной ор-
ганизации. Между тем каждое из этих явлений, несомненно
осуществляемых на основе исходной клеточной структуры, требо-
вало специального анализа, позволяющего понять возможности
исторического их происхождения. Значительная часть подобных
явлений рассмотрена в этой книге.
Развитие половых клеток и половой процесс, казалось бы,
вступают в незначительное противоречие с клеточной теорией.
Женская половая клетка — это клетка, только более крупных
размеров. Мужская половая клетка — это тоже клетка, только
очень малых размеров. При этом, однако, упускается из твида,
что женскую половую клетку отличают не только крупные раз-
меры, но и поразительные свойства нуклеолярного аппарата (вы-
ход в цитоплазму, формирование побочных, акцессорных ядер
и т. п.) и способность к отделению направительных телец. Как
« 251 »
ПОСЛЕСЛОВИЕ
возникли эти особенности женской половой клетки, отличающие
ее от массы соматических клеток?
Говоря о мужской половой клетке как о клетке, но только
малых размеров, следует подчеркнуть, что эта клетка в развитой
форме обладает ядром, состоящим из хроматина при полном
отсутствии ядрышкового вещества, и цитоплазматическим телом,
теряющим такой важный прибор, как аппарат Гольджи, и приоб-
ретающим такой специфический аппарат, как акросома, отсутст-
вующая у всех видов клеток. Откуда у клетки способность к
таким удивительным превращениям, в результате которых она
по существу утрачивает типичную клеточную структуру?
Нет необходимости еще раз пересматривать процессы, соста-
вившие главный предмет анализа в книге. Большинство рассмот-
ренных примеров демонстрирует способность клетки в своей
структурной динамике выходить за пределы клеточной структуры
и приобретать «неклеточное» строение или, вернее, конструкцию,
которая никак не укладывается в определение клетки, фигуриру-
ющее в классической клеточной теории. Нельзя не сделать выво-
да, что трудности, испытываемые биологической наукой при
продвижении к ее конечной цели — управлению жизненными
процессами — в значительной мере определяются тем, что клас-
сическая клеточная теория — один из краеугольных камней сов-
ременного биологического мировоззрения — оказалась недостаточ-
ной для охвата всех процессов, лежащих в основе строения и
развития живой материи. Очевидно, настал момент пересмотра
всех фактов, относящихся к структурной организации живых
существ с позиций обновленной клеточной теории, включающей
принцип эволюционного развития клетки.
Предстоит большая работа по анализу многих фактов, частич-
но известных ранее и вновь переоткрытых или открытых заново
с помощью новой техники, чтобы облегчить решение проблем,
оставшихся нерешенными в эпоху развития классической клето-
чной теории. Нет возможности перечислять все эти проблемы.
Одна из них представляется наиболее доступной для переиссле-
дования на основе новой клеточной теории — проблема межкле-
точных взаимодействий.
Морфологи как-то смирились с фактом участия в регуля-
ционных функциях у млекопитающих неклеточного элемента —
кровяных пластинок. Даже теперь, когда с помощью электронно-
микроскопической- техники выяснены детали формирования и
отторжения кровяной пластинки от мегакариоцита и способ ее
участия в динамике свертывания крови, ни в одном из обзоров
не отмечается, что в осуществлении этой функции участвует не-
клеточный элемент строения организма. Еще меньше внимания
обращается на то, что сходный процесс — отторжение фрагмен-
тов цитоплазмы макрофагов путем клазматоза — также приводит
в действие неклеточные структуры, обеспечивающие какие-то
<< 252 »
ПОСЛЕСЛОВИЕ
взаимодействия между клетками. Отторжение фрагментов пери-
ферической цитоплазмы — широко известный факт, характеризу-
ющий клеточное деление. Выброс секретов из клетки при апо-
криновом типе секреции осуществляется фрагментами цитоплаз-
мы, отрывающимися от клетки вместе с секреторным продуктом.
Очевидно, клетка располагает широкими возможностями для ис-
пользования своих органелл (или их комплексов) в качестве
носителей всевозможных сигналов (ферментных, гормональных,
индукционных), обеспечивающих межклеточные взаимодействия.
Нет необходимости пояснять, что сигнализационная активность
клеток принадлежит к числу самых важных средств регуляции
жизнедеятельности организма. Апокриновый компонент, т. е.
фрагмент цитоплазмы, используемый для выброса секрета, изве-
стен и описан в ряде эндокринных органов. Не исключено,
что и в нервной регуляции какая-то часть принадлежит субкле-
точным компонентам, несущим в себе специфические сигналы.
•Известно, что в нервных волокнах осуществляется движение ней-
.роплазмы и заключенных в ней клеточных органелл. В широко
.известных экспериментах по регенерации шляпки у одноклеточ-
ной водоросли ацетабулярии индукционный сигнал, как теперь
принято думать, передается комплексами рибосом, поступающими
-из ядра в цитоплаз.му. Важно отметить, что по данным электрон-
но-микроскопического обследования [Van Gansen Boloukhere-
Presburg, 1965] выброс полирибосом из ядра водоросли ацета-
булярии осуществляется посредством своеобразного почкования,
^заслуживающего названия «ядерный клазматоз». Нельзя исклю-
чить и то, что феномен формирования акцессорных ядер в ооци-
тах перепончатокрылых также относится к этому типу подачи
ядерных сигналов в цитоплазму.
Можно выразить уверенность в том, что в ближайшее время
-все формы обмена сигналами с помощью неклеточных (или суб-
клеточных) частиц привлекут пристальное внимание исследо-
вателей.
Следует еще раз подчеркнуть, что употребляемое мной выра-
жение «новая» или «обновленная» «клеточная теория» отнюдь
не противостоит понятию «классическая клеточная теория». Роль
классической клеточной теории в развитии наук о живой приро-
де огромна и никем не может быть подвергнута какому бы то
ни было умалению. Новая клеточная теория лишь дополняет
эволюционным принципом классическую клеточную теорию.
С открытием неклеточных, или доклеточных, или предклеточных
форм организации живой материи, с одной стороны, и с расшиф-
ровкой ультраструктуры клетки — с другой, возникла эволюцион-
ная морфология клетки, которая ляжет теперь в основу обновлен-
ной, или новой клеточной, теории. Можно соглашаться или не
соглашаться с гипотезами симбио-, или мембрано-, или синбакте-
риогенеза в качестве возможных объяснений происхождения клет-
« 253 »
ПОСЛЕСЛОВИЕ
ки. Но эволюционное развитие клеточной структуры из пред-
шествующей, менее сложной конструкции — это факт, который
требует того или иного объяснения. Такое объяснение может быть
получено только в результате современного эволюционно-морфо-
логического исследования клетки. За последние годы по вопросам,
непосредственно примыкающим к тематике эволюционной морфо-
логии клетки, в мировой литературе появилось много работ, кото-
рые заслуживают упоминания или даже специального анализа в
связи с вопросами, разработанными в фактическом и теоретиче-
ском планах в моей книге.
Идея об отсчете онтогенеза клетки с телофазы митотического’
деления, изложенная в первой главе книги, базируется на бес-
спорном факте строительства дочерних ядер митотически деля-
щейся клетки в телофазе, когда из деконденсированных хромосом
строится хроматиновый аппарат и ядрышко, а из везикулярной
системы прилежащей эргастоплазмы — ядерная оболочка. Актив-
ность хромосом и ядрышкового аппарата, строящих дочерние
ядра, дополняется активностью цитоплазматических органелл,
конструирующих цитоплазматические тела дочерних клеток.
Несмотря на важность рабочих гипотез, дающих объяснение
динамике формирования дочерних клеток в телофазе митотиче-
ского деления, за истекшие годы этот процесс по-прежнему при-
влекает мало внимания. Мы не находим анализа природы и ме-
ханизма телофазы в известной монографии Поликара «Элементы
физиологии клетки» [1976], в монографии «Физиология клетки»
Носта [1975] и во многих других крупных обобщающих трудах
по цитологии, опубликованных за последние годы. Момент рож-
дения дочерней клетки из разделившейся надвое материнской
клетки в виде набора новообразованных ядерных и цитоплазма-
тических органелл продолжает оставаться вне поля зрения цито-
логов, и рекапитуляционное значение этого момента, повторяю-
щего филогенетический акт репродукции первой клетки, возник-
шей из клона-колонии его бактериеподобных предков, но
вызывает интереса исследователей.
Между тем в литературе продолжают накапливаться факты,
свидетельствующие об отражении протоклеточного (прокариоти-
ческого) прошлого в той черте морфофизиологии клеточных ор-
ганелл, которая наиболее демонстративно раскрывается ирг
митотическом делении клетки, а именно в их способности к раз-
множению путем деления, подобно их бактериоидным предкам.
Несмотря на то что в центре внимания исследователей-
цитологов продолжают оставаться химия и ультраструктура
хромосом, накапливающийся фактический материал убеждает в
том, что хромосомно-ядрышковый аппарат возник при переходе
от прокариотической к эукариотической организации как комп-
лекс органелл,-’Каждая из которых сохраняет черты прокариоти-
ческой конструкции, проще говоря, ' бактериоидного строения.
« 254 »
ПОСЛЕСЛОВИЕ
В вышедшем в 1978 г. последнем, 17-м томе известной серии
«Методы биологии клетки» (редактор Д. М. Прескотт) помещены
обширные обзоры, посвященные средствам и итогам исследова-
ний хроматина и хромосомных белков, которыми вновь подтвер-
ждается сложность химического состава конструкции хромосом
и ядрышкового аппарата клетки эукариотов, коренным образом
отличающая эти органеллы от так называемых бактериальных
хромосом, состоящих из одной или двух нитей ДНК. Попытки
изображать специфические ядра динофлагеллят (динокарионы)
с их характерной безгистоновой конструкцией комплексов ДНК
в хромосомах как переходные формы от бактериальной (прокари-
отической) к клеточной (эукариотической) организации можно
оправдать только тем, что нуклеоид динохромосом, действитель-
но, сходен с нуклеоидом прокариотов. Однако во всех остальных
отношениях группа динофлагеллят неотделима от всех низших
(одноклеточных) эукариотов, и термин Mezokaryota, предлагае-
мый для наименования этой группы, имеет совершенно условное
значение. В эволюционно-морфологическом плане в организации
динофлагеллят наибольший интерес должна вызывать безгисто-
новая упаковка ДНК в хромосомах, свидетельствующая, как
указывалось, о сохранении в этой группе следов их проис-
хождения.
Большое внимание в книге уделено сравнительной морфоло-
гии хромосом, из которой вытекает вывод о мультифункциональ-
ности этих органелл, обусловленной их филогенетическим прош-
лым. Гомология ядрышек и хромосом, также вытекающая из их
общего происхождения, представляется в свете вышедшей за
последние годы литературы достаточно достоверным фактом.
Специальное внимание в книге было обращено на обмен функ-
циями между ядрышковым и хромосомным аппаратами, в наибо-
лее демонстративной форме выраженный в конструкции вегета-
тивного ядра водоросли ацетабулярии. Как было указано Браше,
в ядре ацетабулярии в вегетативном состоянии никакими мето-
дами не обнаруживается ДНК, из чего следует заключить, что
весь белоксинтезирующий аппарат сосредоточен в гигантском
ядрышке, продуцирующем огромные количества рибосом, с по-
мощью которых, очевидно, производятся белки, составляющие
массу тела этой гигантской одноядерной водоросли. В моногра-
фиях последних лет, посвященных цитохимии и ультраструктуре
ацетабулярии [см., например: Bonotto et al., 1976], приводятся
некоторые данные, свидетельствующие о наличии молекул ДНК
в ядрах этих водорослей, но убедительность приводимых доказа-
тельств (электронные микрофотографии молекул ДНК) невысока,
поскольку по завершении роста водоросли развитие половых
продуктов сопровождается появлением фельген-позитивной ДНК,
которая может быть принята за ДНК хромосом вегетативного
ядра. Кроме того, остается неясной реальная локализация моле-
« 255 »
ПОСЛЕСЛОВИЕ
кул ДНК — в ядрышке или кариоплазме, в которой хроматино-
вые конструкции не обнаруживаются.
Идея о герминативной функции ядра, т. е. об участии карио-
леммы в формировании мембранных конструкций цитоплазмати-
ческих органелл, была обоснована мной в связи с недостаточно-
стью белоксинтезирующих блоков некоторых органелл, в частно-
сти ретикулосом (структурных элементов комплексов Гольджи),
лишенных рибосомного аппарата. В книге приведены фактические
данные, относящиеся к процессу формирования пузырьков и
цистерн комплексов Гольджи за счет внешней ядерной мембраны.
В недавно опубликованной в русском переводе монографии
Фрей-Висслинга [1976] представлена документация подобного
процесса у некоторых растительных объектов, не оставляющая
сомнений в его реальности.
Вопрос о способности к размножению путем деления приме-
нительно к митохондриям можно считать основательно разрабо-
танным и решенным в положительном смысле [Озернюк, 1978].
Обследование показало поразительное сходство митохондриальной
ДНК у представителей различных систематических групп —
животных, растений и низших эукариотов [Гаузе, 1977], что,
с моей точки зрения, свидетельствует об общности происхождения
митохондрий от единого по своей природе предка, обладающего
бактериоидной конструкцией. Что же касается количества ДНК
в митохондриях, то, очевидно, оно определяется уровнем их бе-
локсинтетической активности. Необходимо отметить, что в
специфических случаях количество ДНК в митохондриях может
возрастать до фельген-позитивности, в частности у жгутиконосцев
из семейств Trypanosomidae и Bodonidae, обладающих характер-
ным «вторым ядром» — кинетонуклеусом (кинетопластом).
В обстоятельной монографии В. Д. Калинниковой [1977]
вопрос о природе кинетонуклеуса всесторонне разработан и полу-
чил достаточно убедительное решение. Кинетопласт можно
рассматривать как относительно автономную конструкцию,
обладающую самостоятельным белоксинтезирующим аппаратом
и способностью к размножению путем деления. Кинетопласт играет
главенствующую роль в дыхательном метаболизме клетки, детер-
минируя развитие дыхательных ферментов, а также крист,
с которыми связана их локализация. Таким образом, митохонд-
риальная природа кинетопласта не вызывает сомнений. Необхо-
димо отметить, что В. Д. Калинникова относит кинетопласт к
промежуточному, а митохондрии других эукариотов — к прока-
риотному уровню организации.
В монографии В. Д. Калинниковой приведена и критически
рассмотрена литература, относящаяся к ДНК хлоропластов
растительных клеток. Из обзора этой литературы следует, что
хлоропласты характеризуются специфической (отличной от
ядерной) ДНК, главным образом циркулярного типа. Подобно
« 256 »
ПОСЛЕСЛОВИЕ
митохондриям, хлоропласты обладают автономной белоксинтези-
рующей системой, включающей автономный рибосомный аппарат.
Упаковка ДНК в некоторых формах хлоропластов обладает вы-
сокой сложностью, в которой можно различить плотную, симмет-
ричную спираль. В крупных хлоропластах выявляется нуклеоид
(пространство, где локализуется ДНК). Несмотря на достаточно
убедительно обоснованный В. Д. Калинниковой вывод о «весьма
существенном сходстве хлоропластов и митохондрий с прокарио-
тами» (с. 108), автор отвергает идею о прокариотном филогене-
тическом прошлом этих клеточных органелл, полагая, что они
возникли в филогенезе на основе «рассредоточения» ядерного
генома.
Актуальность любой теоретической концепции проверяется по
ее отражению в разработке возможно более широкого круга био-
логических проблем. Наряду с приложением синбактериогенной
теории происхождения клетки к вскрытию природы различных
процессов онто- и метацитогенеза, приведенных выше, мне ка-
жется весьма существенным для правильной оценки этой теории
возможность ее использования в разработке некоторых морфофи-
зиологических проблем, в частности проблемы двигательной
активности клетки. Опыт эволюционно-морфологического анализа
клеточных конструкций, участвующих в осуществлении двигатель-
ных актов, позволил обосновать теорию сокращения мышц,
в значительной мере расходящуюся с современной теорией,
построенной на физико-химических предпосылках двигательных
процессов [Студитский, 1976, 1979]. Исходя из синбактериогенной
теории происхождения клетки, основным инициирующим блоком
Двигательных конструкций клеток следует признать ее мембран-
ный аппарат, в наиболее выраженной форме проявляющий сок-
ратительную активность в составе пульсирующей вакуоли про-
стейших. Жгутик и волокнистые компоненты внешней оболочки
бактерий при конструировании первой клетки превратились в
микротрубочки и тонофиламенты, составляющие опорные прибо-
ры у всех эукариотов. Таким образом, вскрытая в экспериментах
с воздействием АТФ на мышечные белки опорная роль миофи-
ламентов отражает их подлинную функцию в составе поперечно-
полосатых мышц, в то время как в мембранном аппарате —
саркоплазматическом ретикулуме — вскрывается инициирующий
фактор акта сокращения.
Сила новой, эволюционной клеточной теории заключается в
том, что она открывает широкую перспективу для анализа зако-
номерностей и движущих сил самого удивительного и загадочного
свойства живой материи — ее способности к структурному при-
способлению клеточной формы к осуществлению разнообразных
функций.
1/217 A. H. Студитский
ЛИТЕРАТУРА
Агол В. И., Атабеков И. Г., Крылов
В. Н., Тихоненко Т. И. Молекуляр-
ная биология вирусов. М.: Наука,
1971.
Алов И. А. Цитофизиология и пато-
логия митоза. М.: Медицина, 1972.
Алов И. А., Брауде А. И., Аспиз М. Е.
Основы функциональной морфоло-
гии клетки. М.: Медицина, 1966.
Арронет Н. И., Арронет В. Н., Жин-
кин Л. Н. Основные вопросы ци-
тологии. М.: Просвещение, 1969.
Аспиз М. Е. Строение, функции и
развитие клеточного центра.— Усп.
соврем, биол., 1969, т. 67, с. 40—52.
Боген Г. Современная биология: Пер.
с нем. М.: Мир, 1970.
Браун А. А. Секреторные процессы в
молочной железе.— Арх. анат. эмб-
риол. и гистол., 1932, т. И, № 5,
с. 223—236.
Браун В. Генетика бактерий: Пер. с
англ. М.: Наука, 1968.
Браше Ж. Биохимическая цитоло-
гия: Пег>. с англ. М.: ИЛ, 1960.
Браше Ж. Биохимическая эмбриоло-
гия: Пер. с англ. М.: ИЛ, 1961.
Браше Ж. Живая клетка.— В кн.:
Живая клетка. Пер. с англ. М.: ИЛ,
1962, с. 11—28.
Бродский В. Я. Неделящееся ядро.—
В кн.: Руководство по цитологии.
М.; Л.: Наука, 1965, т. 1, с. 269—
344.
Бродский В. Я. Трофика клетки. М.:
Наука, 1966.
Введение в цитологию / Под ред.
В. П. Михайлова. Л.: Медицина,
1968.
Вермелъ Е. М. История учения о
клетке. М.: Наука, 1970.
Вилли К. Биология: Пер. с англ. М.:
Мир, 1968.
Вильсон Э. Клетка и ее роль в раз-
витии и наследственности: Пер. с
англ. М.; Л.: Биомедгиз, 1936. Т. 1;
1940. Т. 2.
Винников Я. А. Структурные и ци-
тохимические основы механизма
функции рецепторов органов
чувств.— В кн.: Нервная клетка.
Л.: Изд-во ЛГУ, 1966, с. 7—100.
Винников Я. А. Цитологические и
молекулярные основы рецепции.
Л.: Наука, 1971.
Винников Я. А. Эволюция рецепто-
ров. Цитологический, мембранный,
и молекулярный уровни. Л.: Нау-
ка, 1979.
Воронцов Н. Н. Эволюция кариоти-
па.— В кн.: Руководство по цито-
логии. М.; Л.: Наука, 1966, т. 2,
с. 359—383.
Баузе Б. Б. Митохондриальная ДНК.
М.: Наука, 1977.
Бертвиг О. Клетка и ткани: Основы
общей анатомии и физиологии.
СПб. 1894.
Бершензон С. М. Ревертаза, генети-
ка и рак.— Природа, 1973а, № 7,
с. 18—30.
Бершензон С. М. Обратная транс-
крипция и ее значение для общей
генетики и онкологии.— Усп. со-
врем. биол., 19736, т. 75, с. 323—
339.
Бершкович И. Генетика: Пер. с англ.
М.: Наука, 1968.
Бру бан 3., Рехцигл 3. Микротепьца
и родственные им структуры: Пер.
с англ. М.: Мир, 1972.
Де Робертис Э., Новинский В., Сазе Ф.
Биология клетки: Пер. с англ. М.:
Мир, 1967.
Джибор А. Ацетабулярии — ценней-
ший объект для научных экспери-
ментов.— В кн.: Молекулы и клет-
ки. М.: Мир, 1968, вып. 3, с. 173—
174.
Догель В. А. Общая протистология.
М.: Сов. наука, 1951.
Догель В. А., Полянский Ю. И., Хей-
син Е. М. Общая протозоология.
М.; Л.: Изд-во АН СССР, 1962.
Дубинин Н. П. Общая генетика. М.:
Наука, 1970.
Дубинин Н. П. О сущности явления
наследственности.— Журн. общ.
биол., 1973, т. 34, № 1, с. 3—12.
« 258 »
ЛИТЕРАТУРА
Дубинин Н. П. Проблемы современ-
ной генетики.— Коммунист, № 8,
1973, с. 102—115.
Дэвидсон Э. Действие генов в ран-
нем развитии: Пер. с англ. М.:
Мир, 1972.
Елякова Г. В. Электронно-микроско-
пическое исследование образова-
ния миобластов в регенерирующей
мышечной ткани,—Докл. АН СССР,
1972, т. 202, № 5, с. 1196—1198.
Жакоб Ф., Вольман Э. Поп и генети-
ка бактерий: Пер. с англ. М.: ИЛ,
1962.
Заварзин А. А. Эволюционная дина-
мика тканей.— Арх. биол. наук,
1934, т. 36а, вып. 1, с. 1—64.
Заварзин А. А. Исследования по
сравнительной гистологии мышеч-
ной ткани: О регенерации сомати-
ческих мышц у рыб.— Арх. анат.,
гистоп. и эмбрион., 1938, т. 19,
вып. 3, с. 353—381.
Заварзин А. А. О сравнительном ме-
тоде в гистологии (1925).— Избр.
труды. М.; Л.: Изд-во АН СССР,
1953а, т. 2.
Заварзин А. А. Очерки эволюцион-
ной гистологии крови и соедини-
тельной ткани (1945, 1947).— Избр.
труды. М.; Л.: Изд-во АН СССР,
19536, т. 4.
Зотин А. И. Механизм цитокинеза.—
Усп. соврем, биол., 1971, т. 71,
с. 66-84.
Иванов А. В. Происхождение много-
клеточных животных: Филогенети-
ческие очерки. Л.: Наука, 1968.
Имшенецкий А. А. Бактерии.— БСЭ,
2-е изд., 1950, с. 70—83.
Интерпретация ультраструктуры кле-
точного ядра.— В кн.: Ультра-
структура и функция клетки: Пер.
с англ. М.: Мир, 1965, с. 41—49.
Пост X. Физиология клетки. М.: Мир,
1975.
Калашникова М. М., Студитский
А. Н. Электронная микроскопия
«околоядерной секреции» в клет-
ках печеночных придатков морской
звезды.— X Всесоюз. конф, по
электронной микроскопии 5—8 ок-
тября 1976 г.: Тез. докл. Ташкент,
1976.
Калиникова В. Д. Клеточная орга-
нелла кинетобласт. Л.: Наука, 1977.
Камшилов М. М. Биотический круго-
ворот. М.: Наука, 1970.
Канаев И. И. Гидра: Очерки по био-
логии пресноводных полипов. М.;
Л.: Изд-во АН СССР, 1952.
Kapnac А. М. Механизм перемеще-
ния хромосом в митозе.— В кн.:
Руководство по цитологии. М.; Л.:
Наука, 1966, т. 2, с. 217—221.
Кацнельсон 3. С. Клеточная теория в
ее историческом развитии. Л.: Изд-
во Медгиз, 1963.
Кедровский Б. В. Цитология белко-
вых синтезов в животной клетке.
М.: Изд-во АН СССР, 1959.
Кикнадзе И. И. Функционирование
хромосом.— В кн.: Руководство по
цитологии. М.: Наука, т. 2, 1966,
с. 329—347.
Кикнадзе И. И. Функциональная ор-
ганизация хромосом. Л.: Наука,
1972.
Кирпичникова Е. С., Левинсон Л. Б.
Практикум по общей гистологии.
М.: Изд-во МГУ, 1953.
Клеточное ядро: Морфология, физио-
логия и биохимия: Материалы
Междунар. симпоз. «Структура и
функции клеточного ядра». М.,
1972.
Кольцов Н. К. Исследования о спер-
миях десятиногих раков в связи с
общими соображениями относи-
тельно организации клетки. М.,
1905.
Коржу ев- И. А. Гемоглобин. М.: Нау-
ка, 1964.
Крик Ф. Центральная догма молеку-
лярной биологии: Пер. с англ.—
Цитология, 1971, т. 13, с. 901—910.
Кудлай Д. Г. Эписомы и инфекцион-
ная наследственность бактерий. М.:
Медгиз, 1969.
Кулаева О. Н. Цитокинины и их фи-
зиологическое действие.— Усп. со-
врем. биол., 1967, т. 63, с. 28—53.
Кулаева О. Н. Цитокинины, их струк-
тура и функция. М.: Наука, 1973.
Ленинджер А. Митохондрия. Молеку-
лярная основа структуры и функ-
ции: Пер. с англ. М.: Мир, 1966.
Лёви А., Сикевиц Ф. Структура и
функции клетки. М.: Мир, 1971.
Максимов А. Основы гистологии. П.
Учение о тканях. Пг., 1918.
Мэ-зия Д. Митоз и физиология кле-
точного деления: Пер. с англ. М.:
ИЛ, 1963.
Мюнтцинг А. Генетические исследо-
вания. М.: ИЛ, 1963.
Мюнтцинг А. Генетика: Общая и
прикладная. М.: Мир, 1967.
« 259 »
17*
ЛИТЕРАТУРА
Носсалъ Д. Как клетки производят
антитела.— В кн.: Молекулы и
клетки: Пер. с англ. М.: Мир, 1966,
с. 115—128.
Озернюк Н. Д. Рост и воспроизведе-
ние митохондрий. М.: Наука, 1978.
Око С. Генетические механизмы про-
грессивной эволюции. М.: Мир,
1973.
Опарин А. И. Возникновение жизни
на земле. М.: Моск, рабочий, 1924.
Опарин А. И. Возникновение жизни
на земле. 3-е изд. М.: Изд-во АН
СССР, 1957.
Опарин А. И. Жизнь, ее природа и
развитие. М.: Изд-во АН СССР,
1960.
Осипова О. П. Структурная и моле-
кулярная организация фотосинте-
за.— В кн.: Механизмы интеграции
клеточного обмена. Л.: Наука, 1967,
с. 66—102.
Павлов Е. Ф., Абрамян К. С.,
Мкртчян Н. П. Особенности рас-
пределения хроматина в ядрах го-
ловок спермиев птиц, рептилий и
амфибий в связи с его опорной
функцией.— Биол. журн. Армении,
1970, т. 23, № 12, с. 10—17.
Перемежка П. И. О делении живот-
ных клеток.— Мед. вести., 1878,
№ 31, с. 273—274.
Пешков М. А. Сравнительная цито-
логия синезеленых водорослей,
бактерий и актиномицетов. М.:
Наука, 1966.
Поглазов Б. Ф. Структура и функции
сократительных белков. М.: Наука,
1965.
Поглазов Б. Ф. Сборка биологиче-
ских структур. М.: Наука, 1975.
Поленов А. Л. Секреция.— В кн.:
Введение в цитологию. Л.: Меди-
цина, 1968, с. 138—144.
Поликар А., Бо Ш. Субмикроскопи-
ческая структура клеток и тканей
в норме и патологии: Пер. с франц.
М.: ИЛ, 1962.
Поликар А. Поверхность клетки и ее
микросреда. М.: Мир, 1975.
Поликар А. Элементы физиологии
клетки. М,: Наука, 1976.
Поляков В. Ю., Ченцов Ю. С. Элект-
ронно-микроскопическое изучение
хромонемы в интерфазных и де-
лящихся клеток.— Цитология, 1969,
т. И, с. 1079—1090.
Прокофъева-Белъговская А. А. Мате-
риальные основы наследственно-
сти.— В кн.: Актуальные вопросы
современной генетики. М.: Изд-во
МГУ, 1966, с. 23—64.
Прокофъева-Белъговская А. А. Реп-
ликационная организация хромо-
сом.— Цитология, 1971, т. 13,
с. 679—682.
Равен X. Оогенез. Накопление гене-
тической информации. М.: Мир,
1964.
Райков И. Б. Кариология простей-
ших. М.: Наука, 1967.
Райков И. Б. Ядрышки и РНК.—
В кн.: Введение в цитологию. Л.:
Медицина, 1968, с. 62—66.
Райков И. Б. Ядро простейших. Мор-
фология и эволюция. Л.: Наука,
1979.
Райкова Е. В. Морфология ядрышек
в период роста ооцитов осетровых
рыб.— Журн. общ. биол., 1968,
т. 29, с. 316—333.
Рис Г. Интерпретация ультраструк-
туры клеточного ядра.— В кн.:
Ультраструктура и функция клет-
ки. М.: Мир, 1965, с. 41—49.
Робертсон Дж. Молекулярная биоло-
гия клеточных мембран.— В кн.:
Молекулярная биология: Пер. с
англ. М.: ИЛ, 1963, с. 102—151.
Робертсон Дж. Мембрана живой
клетки: Пер. с англ.— В кн.: Струк-
тура и функции клетки. М.: Мир,
1964, с. 182—210.
Рудин Д. Митохондрии.— В кн.: Ци-
тология ферментов: Пер. с англ.
М.: Мир, 1971, с. 84—139.
Руководство по цитологии / Под ред.
Л. Н. Жинкина, П. П. Румянцева.
М.; Л.: Наука, 1965, т. 1, 1966, т. 2.
Румянцев А. В. Опыт исследования
эволюции хрящевой и костной тка-
ней. М.: Изд-во АН СССР, 1958.
Соколов И. И. Цитологические осно-
вы полового размножения много-
клеточных животных.— В кн.: Ру-
ководство по цитологии. М.; Л.:
Наука, 1966, т. 2, с. 390—460.
Старосветская Н. А., Аспиз М. Е.
Строение и функции цитоплазма-
тических трубочек.— В кн.: Цито-
логия, общая генетика, генетика
человека, цитоплазматические ком-
поненты клетки: Итоги науки. М.,
1971, с. 102—127.
Стент Г. Молекулярная биология ви-
русов бактерий. Пер. с англ. М.:
Мир, 1965.
« 260 »
ЛИТЕРАТУРА
Студитский А. Н. Вопросы эволюци-
онной морфологии клетки в свете
данных электронной микроско-
пии.— Арх. анат., гистол. и эмбри-
ол., 1962, т. 42, № 3, с. 3—29.
Студитский А. Н. Рибосомный аппа-
рат и его возможное значение в
приспособительной активности
клетки.— Усп. соврем, биол., 1966,
т. 62, с. 345—382.
Студитский А. Н. Функция хромати-
нового аппарата клетки.— Усп. со-
врем. биол., 1970, т. 70, с. 353—375.
Студитский А. Н. Перемещения хро-
матина при ядерной секреции в
семявыносящей железе травяного
краба и эволюционное значение
этого феномена,— Докл. АН СССР,
1971, т. 198, с. 1439—1441.
Студитский А. Н. Природа и проис-
хождение ядрышка.— Усп. соврем,
биол., 1973, т. 76, с. 199—221.
Студитский А. Н. Правило Дарви-
на — Северцева и его значение для
современной эволюционной тео-
рии.— Научн. докл. высш, школы.
Биол. науки, 1974, № И, с. 7—19.
Студитский А. Н. Механизм сокраще-
' ния мышц: экспериментально-мор-
фологический анализ. М.: Наука,
1979.
Студитский А. Н., Елякова Г. В. Упа-
ковка ДНК в ядрах спермиев реч-
ного рака.— Изв. АН СССР. Сер.
биол., 1972, № 4, с. 610—615.
Студитский А. И., Стриганова А. Р.
Восстановительные процессы в ске-
летной мускулатуре. М.: Изд-во
АН СССР, 1951.
Суонсон К., Мерц ТЯнг У. Цитоге-
нетика: Пер. с англ. М.: Мир, 1969.
Сэджер Р., Райн Ф. Цитологические
и химические основы наследствен-
ности. М.: Мир, 1964.
Тахтаджяи А. Л. Четыре царства ор-
ганического мира.— Природа, 1973,
№ 2, с. 22—32.
Тимаков В. Д., Каган Г. Я. Биология
A-форм бактерий. М.: Медгиз, 1961.
Токин В. П. Регенерация в свете
проблем онтогении клетки.— В кн.:
Труды I гистол. конф., Москва,
1934. М.: Биомедгиз, 1935, с. 34—47.
Токин Б. П. Регенерации и сомати-
ческий эмбриогенез. Л.: Изд-во
ЛГУ, 1959.
Токин Б. П. Клетка и организм.—
В кн.: Бесполое размножение, со-
матический эмбриогенез и регене-
рация. Л.: Изд-во ЛГУ, 1972, с. 5—
42.
Токин Б. П. Общая эмбриология. 3-6
изд. Л.: Изд-во ЛГУ, 1977.
Фрей-Висслинг А. Сравнительная ор-
ганеллография цитоплазмы,— М..:
Мир, 1976.
Фрей-Висслинг А., Мюлеталер К.
Ультраструктура растительной
клетки: Пер. с англ. М.: Мир, 1968.
Харрис Г., Мэзия Д. Ультраструктура
митотического аппарата.— В кн.:
Ультраструктура и функция клет-
ки: Пер. с англ. М.: Мир, 1965,
с. 162—174.
Хлопин Н. Г. Общебиологические и
экспериментальные основы гисто-
логии. М.; Л.: Изд-во АН СССР,
1946.
Ченцов Ю. С. Структура и химия яд-
рышка, как органоида синтеза
клеточных рибосом.— Усп. соврем,
биол., 1966, т. 62, с. 324—344.
Ченцов ТО. С. Ультраструктура кле-
точного ядра.— В кн.: Структура и
функция клеточного ядра. М.: Нау-
ка, 1967, с. 39—50.
Ченцов Ю. С., Поляков В. Ю. Ультра-
структура клеточного ядра. М.:
Наука, 1974.
Чернов А. И. Фотосинтез изолирован-
ных хлоропластов.— Усп. соврем,
биол., 1970, т. 70, с. 227—238.
Чмилевский Д. А. Синтез РНК и раз-
витие ядрышкового аппарата в
оогенезе ерша.—Цитология, 1971,
т. 13, с. 1233.
Шубникова Е. А. Секреторная дея-
тельность.— В кн.: Руководство по
цитологии. М.; Л.: Наука, 1966,
т. 2, с. 91—117.
Abolins-Krogis A. Alterations in the
fine structures of cytoplasmic orga-
nelles in the hepatopancreatic cells
on shellregenerating snail, Helix
pomatia L.— Z. ZeHforsch., 1970,
Bd. 108, S. 516—529.
Afzelius B. A. The ultrastructure of
the nuclear membrane of the sea
urchin oocite as studied with the
electron microscope.— Exp. Cell
Res., 1955, vol. 8, p. 147-158.
Afzelius B. A. Fine structure of the
spermatozoon of Tubularia larynx
(Hydrozoa, Coelentherata).— J. Ult-
rastruct.. Res., 1971, vol. 37, p. 679—
689.
« 261 »
ЛИТЕРАТУРА
Afzelius В. A., Franzen A. The sper-
matozoon of the jellifish Nausit-
hoe.— J. Ultrastruct. Res., 1971,
vol. 37, p. 186—199.
Allen E. R. Cytochemical and ultra-
structural studies of ribonucleopro-
tein containing structures in oocy-
tes of Acheta domesticus.— Z. Zell-
forsch., 1969, Bd. 101, S. 63—71.
Altmann II. W„.StockerE., Thoenes W.
Uber Chromatin und DNS — Sun-
these im Nucleolus: Elektronenmik-
roskopische, autoradiographische
und lichtmikroskopische Untersu-
chungen in Leberzellen von Rat-
ten.— Z. Zellforsch., 1963, Bd. 59,
S. 116—133.
Altmann R. Die Elementarorganismen
und ihre Beziehungen zu den Zel-
len. Leipzig: Veit und Co., 1890.
Ambrose E. J., Easty D. M. Cell biolo-
gy. L.: Nelson, 1970.
Anderson E. Oocyte differentiation and
vitellogenesis in the roach, Peripla-
neta americana.— J. Cell. Biol., 1964,
vol. 20, p. 131—155.
Anderson W. A. Structure and fate of
the paternal mitochondrion during
early embryogenesis of Paracentro-
tus lividus.— J. Ultrastruct. Res.,
1968, 24, p. 311-321.
Anderson W. A. Cytochemistry of sea
urchin gametes. I. Intramitochond-
rial localization of glycogen, gluco-
se-6-phosphatase, and adenosine tri-
phosphatase activity in spermatozoa
of Paracentrotus lividus.— J. Ultra-
struct. Res., 1968, vol. 24, p. 398—414.
Anderson W. A. Nuclear and cyto-
plasmic DNA synthesis during ear-
ly embryogenesis of Paracentrotus
lividus.— J. Ultrastruct. Res., 1969,
26, p. 95—110.
Andre J. Contribution a la connaissan-
ce du chondriome: etude de ses mo-
difications ultrastructurales pen-
dant la spermatogenese.— J. Ultra-
struct. Res., 1962, Suppl., vol. 3,
p. 185.
Andre J. Existence d’un axe nucleaire
dans le spermatozoide de la Limile:
ces relations avec la reaction acro-
somienne.— J. Microsc., 1963, vol. 2,
p. 21.
. Arnold J., Williams-Arnold L. D. Sper-
miogenesis of Nautilus pompilus. I.
General survey.— J. Exp. Zool., 1978,
vol. 205, p. 13—26.
Bade E. G. Bildung von Mitochondrion
in der regenerierenden Leber der
Maus.— Z. Zellforsch., 1964, Bd. 61,
S. 754-768.
Bainton D. F., Farquhar M. G. Origin
of granules in polymorphonuclear
leukocytes: Two types derived from
opposite faces of the Golgi complex
in developing granulocytes.— J. Cell.
Biol., 1966, vol. 28, p. 277—301.
Bajer A. E. Morphological aspects of
normal and abnormal mitosis.— In:
Formation and fate of cell organel-
les / Ed. K. Warren. New York; Lon-
don: Acad. Press, 1967, p. 90—119.
Bajer A. Fine structure studies on
phragmoplast and cell plate forma-
tion.— Chromosoma, 1968, vol. 24,
p. 383—417.
Bajer A., Mole-Bajer J. Cine analysis
of some aspects of mitosis in endo-
sperm.— In: Cinematography in cell
biology / Ed. G. G. Rose. New York;
London: Acad. Press, 1963, p. 357—
409.
Baker T. G., Franchi L. L. The origin
of cytoplasmic inclusions from the
nuclear envelope of mammalian
oocytes.— Z. Zellforsch., 1969, Bd. 93,
S. 45-55.
Barker D. C. A ribonucleoprotein in-
clusion body in Entamoeba invadi-
ens.— Z. Zellforsch., 1963, Bd. 58,
S. 641—659.
Baumeister H. G. Lampbrush chromo-
somes and RNA-synthesis during
early oogenesis of Brachidario rerio
(Cyprinidae, Teleostei).— Z. Zell-
forsch., 1973, Bd. 145, S. 145—150.
Beams H. W., Kessel R. G. Electron
microscope studies on developing
crayfish oocytes with special refe-
rence to the origin of yolk.— J. Cell.
Biol., 1963, vol. 18, p. 624—649.
Beams II. W., Kessel R. G. The Golgi
apparatus: structure and function.—
Intern. Rev. CytoL, 1968, vol. 23,
p. 209—276.
Beams H. W., Sekhon S. S. Electron
microscope studies on the oocyte of
the fresh-water mussel (Anodonta)
with special reference to the stalk
and mechanism of yolk depositi-
on.— J. MorphoL, 1966, vol. 119,
p. 477—502.
Beams H. W., Sekhon S. S. Fine struc-
ture of the nucleolus in the young
oocyte of a centipede.— Z. Zell-
forsch., 1968, Bd. 85, S. 237—242.
« 262 »
ЛИТЕРАТУРА
Behnke О. An electron microscopic
study of the rat megacaryocyte. II.
Some aspects of platelet release and
microtubules.— J. Ultrastruct. Res.,
1969, vol. 26, p. 111—129.
Bell P. R., Miilethaler K. The degene-
ration and reappearance of mito-
chondria in the egg of a plant.— J.
Cell. Biol., 1964, vol. 20, p. 235—248.
Bentfeld M. E. Studies of oogenesis in
the rotifer, Asplanchna. I. Fine struc-
ture of the female reproductive sys-
tem.— Z. Zellforsch., 1971, Bd. 115,
S. 165-183.
Berger E. R. Mitochondria genesis in
the retinal photoreceptor inner seg-
ment.— J. Ultrastruct. Res., 1964,
vol. 11, p. 90—111.
Berger E. R. Subsurface membranes
in paived cone photoreceptor inner
segments of adult and neonatal Le-
bistes retinae.— J. Ultrastruct. Res.,
1967, vol. 17, p. 220—232.
Berger S. RNA-synthesis in Acetabu-
laria. II. RNA-synthesis in isolated
chloroplasts.— Protoplasma, 1967,
vol. 64, p. 13—25.
Bernhard W., Granboulan N. Elect-
ron microscopy of the nucleolus in
vertebrate cells.— In: Ultrastructure
in biological systems / Ed. A. J. Dal-
ton, F. Haguenau. New York; Lon-
don: Acad. Press, 1968. Vol. 3, The
nucleolus, p. 81—149.
Bier K. Synthese, interzellularer Trans-
port und Abbau von Ribonukleinsau-
re im Ovar der Stubenfliege Musca
domestica.— J. Cell. Biol., 1963, voh
16, p. 430-440.
Bier K., Kunz W., Ribbert D. Insect
oogenesis with and without lampb-
rush chromosomes.— Chromosomes
Today, 1969, vol. 2, p. 107—115.
Birnstiel M. L. Protein synthesis by
isolated pea nucleoli.— J. Cell. Biol.,
1963, vol. 18, p. 41—50.
Birnstiel M. L. The nucleolus in cell
metabolism.— Ann. Rev. Plant Phy-
siol., 1967, vol. 18, p. 25—58.
Birnstiel M. L., Chipchase M. I. H., Hi-
de В. B. The nucleolus, a source of
ribosomes.— Biochim. et biophys.
. acta, 1963, vol. 76, p. 454—462.
Bisalputra T., Bisalputra A. The oc-
currence of DNA fibrils in chloro-
plasts of Laurentia spectabilis.— J.
Ultrastruct. Res., 1967, vol. 17,
p. 14-32.
Bischoff R. The miogenic stem cell in
development of skeletal muscle.—
In: Regeneration of striated muscle,
and myogenesis / Ed. A. Mauro et al.
Amsterdam: Excerpta medica, 1970,
p. 208-231.
Boisson Ch. Mise en place et evoluti-
on du complexe centriolaire au cours
de la spermiogenese d’Upeneus pray-
ensis С. V. (Poisson mullidae).— J.
Microscopie, 1960, vol. 8, p. 103—112.
Bonotto Lurquin P., Mazza A. Re-
cent advances in research on the
marine alga Acetabularia.— Adv.
Mar. Biol., 1976, vol. 14, p. 123—250.
Bottke ~W. Lampenburstenchromoso-
men und Amphinucleolen in, Oocy-
tenkernen der Schnecke Bithynia
tentaculata L.— Chromosoma (Ber-
lin), 1973, Bd. 42, S. 175—190.
Brachet J. Synthesis of macromolecu-
les and morphogenesis in Acetabu-
laria.— In: Current topics in deve-
lopmental biology/Ed. A. Monroy,
A. Moscona. New York; London,
1968, vol. 3, p. 1—36.
Brachet J. L’Acetabularia.— Endeavo-
ur, 1965, vol. 24, p. 155—161.
Brachet J. Concluding remarks.— In:
Biology of Acetabularia / Ed. J. Bra-
chet, S. Bonotto. New York; London:
Acad. Press, 1970, p. 273—291.
Brandt P. W., Pappas G. D. Mitochond-
ria. II. Nuclear mitochondrial rela-
tionship in Pelomyxa carolinensis
Wilson (Chaos chaos).—J. Biophys.
and Biochem. Cytol., 1959, vol. 6,
p. 91—97.
Brawerman G., Eisensladt J. M. Deo-
xyribonucleic acid from the chloro-
plasts of Euglena gracilis.— Biochim.
et biophys. acta, 1964, vol. 9, p. 477—
485.
Brown W. V., Emery H. P. Persistent
nucleoli and grass aystematics.—
Amer. J. Bot., 1957, vol. 44, p. 585.
Buchner P. Vergleichende Eistudien.
I. Die akzessorische Kerne des Hi-
menoptereneies.— Arch. mikrosk.
Anat., 1918, Bd. 91, S. 1—202.
Burnham J. C., Hashimoto TConti
S. F. Electron microscopic observa-
tion on the penetration of Bdello-
vibrio bacteriovorus into gram-nega-
tive bacterial hosts.— J. Bacteriol.,
1968, vol. 96, p. 1366—1381.
Busch H., Smetana K. The Nucleolus.
N. Y.: Acad. Press, 1970.
Camenzind R., Nicklas R. B. The non-
random chromosome segregation in
« 263 »
ЛИТЕРАТУРА
spermatocytes of Gryllotalpa nexafa-
dila: A micromanipulation analy-
sis.— Chromosoma, 1968, vol. 24,
p. 324-335.
Cameron M. L., Fogal W. H. The deve-
lopment and structure of the acroso-
me in the sperm of Lumbricus ter-
restris L.— Canad. J. ZooL, 1963,
vol. 41, p. 753—761.
Campbell A. M. Episomes.— Adv. Ge-
net., 1962, vol. 11, p. 101—145.
Cave M. D., Allen E. R. Synthesis of
ribonucleic acid in oocytes of the
house cricket (Acheta domesticus).—
Z. Zellforsch., 1971, Bd. 120, S. 309—
320.
Chevaillier P. Mise en evidence et etu-
de cytochimique d’une proteine ba-
sique extranucleaire dans les sper-
matozoides des Crustaces Decapo-
des.—J. Cell Biol., 1967, vol. 32,
p. 547—556.
Chevaillier Ph., Gusse M. Evolution de
la composition chimique et de la
structure fine de la chromatine au
cours de la spermiogenese du cri-
quet Locusta migratoria.— J. Mic-
rosc. Biol. Cell., 1975, vol. 23,
p. 153—164.
Chevaillier P., Maillet P. L. Structure
fine et constitution cytochimique du
spermatozoide de la Langoustine
Nephrops norvegicus L. (Crustace
Decapode).— J. Microsc., 1965, vol. 4,
p. 679— 700.
Chouinard L. A. Localization of intra-
nucleolar DNA in root meristema-
tic cells of Allium сера.— J. Cell
Sci., 1970, vol. 6, p. 73—85.
Chunusoff B., Hirschfeld H. I. Nucle-
ar structure and mitosis in the di-
noflagellate Gonyaulax monilata.—
J. ProtozooL, 1967, vol. 14, p. 157—
163.
Church J. С. T. A model for myogene-
sis using the concept of the satelli-
te cell segment.— In: Regeneration
of striated muscle and myogene-
sis / Ed. A. Mauro et al. Amsterdam:
Excerpta medica, 1970, p. 118—121.
Claude A. Growth and differentiation
of cytoplasmic membrane in the co-
urse of lipoprotein granule synthesis
in the hepatic cell. I. Elaboration of
elements of the Golgi complex.— J.
Cell. Biol., 1970, vol. 47, p. 745—766.
Cleveland L. R. 1934—1961. Пит. no
И. Б. Райкову, 1967.
Colman O. D., Stockert J. C. The nuc-
leolus in the vegetative cells of Pe-
nicillium.— Caryologia, 1972, vol. 25,
p. 253-258.
Colwin A. L., Colwin L. H. Fine struc-
ture of the spermatozoon of Hydroi-
des hexagonus (Annelida) with spe-
cial references to the acrosomal re-
gion.— J. Biochem. and Biophys. Cy-
tol„ 1961, vol. 10, p. 211—230.
Comings D. E., Okada T. A.. The chro-
matoid body in mouse spermatoge-
nesis, evidence that it may be for-
med by the extrusion of nucleolar
components.— J. Ultrastruct. Res.,
1972, vol. 39, p. 15—23.
Comparative spermatology: Proc. In-
tern. Symp. held in Rome and Sie-
na, 1—5 July 1969 / Ed. B. Bacetti.
New York; London: Acad. Press,
1970.
Corff S. Mitosis and differentiation in
Hydra morphogenesis.— In: Deve-
lopmental aspects of the cell cycle /
Ed. I. Cameron et al. New York;
London: Acad. Press, 1971, p. 93—
127.
Crippa M.., Tocchini-Valentini G. Syn-
thesis of amplified DNA that codes
for ribosomal RNA (density gradi-
ent centrifugation 2’S’-dimethyl-N-
(4) benzyl-N (4’) (desmethyl) ri-
fampicin) extrachromosomal DNA
(Xenopus laevis) ovaries.— Proc.
Nat. Acad. Sci. USA, 1971, vol. 68,
N 1, p. 2769—2773.
Cruikschank W. J. Formation and pos-
sible function of the «Accessory yol-
knuclei» in Anagaster (Ephestia)
kiiniella. Nature, 1964 vol. 201,
p. 734—735.
Cruikschank W. J. The formation of
«Accessory nuclei» and annulate la-
mellae in the oocytes of the flour
moth Anagaster kiiniella.—• Z. Zell-
forsch., 1972, Bd. 130, S. 181—192.
Culliton B. J. Reverse transcription.
One year later.— Science, 1971, vol.
172, N 3986, p. 926-928.
Cumming M. R. The cytology of the
vitellogenesis stages of oogenesis in
Drosophila melanogaster. General
staging characteristics.— J. Morphol.,
1969, vol. 128, p. 427—442.
Cummings D. J. Isolation and partial
characterization of macro- and mic-
ronuclei from Paramecium aurelia.—
J. Cell Biol., 1972, vol. 53, p. 105—
115.
« 264 »
ЛИТЕРАТУРА
Dan J. C. Morphogenetic aspects of ac-
rosome formation and reaction.—
Adv. Morphogenesis., 1970, vol. 8,
p. 1-39.
Daniels E. W., Breyer E. P., Kudo R. R.
Pelomyxa palustris Greeff. II. Its
ultrastruclure.— Z. Zellforsch., 1966,
Bd. 73, S. 367—383.
Dappels Ch. C. King R. C. The deve-
lopment of the nucleolus of the
ovarian nutric cell of Drosophila
melanogaster.— Z. Zellforsch., 1970,
Bd. 103, S. 34-47.
Darlington C. D. The evolution of ge-
netic systems. Cambridge, 1939.
Das N. K., Alfert M. Silver staining of
a nucleolar fraction its origin fate
during the mitotic cycle.— Ann. His-
tochim., 1963, vol. 8, p. 109—114.
Das N. K., Siegel P., Alfert M. On the
origin of labelled RNA in the cyto-
plasm of mitotic root tip cells of
Vicia faba.— Exp. Cell. Res., 1965,
vol. 40, p. 178—181.
David H. Uber einen Nucleolus mit
Membran.— Z. Zellforsch., 1960, Bd.
53, S. 50-54.
Davis L. E. Inramitochondrial cristals
in Hydra.— J. Ultrastruct. Res., 1967,
vol. 21, p. 125—133.
Desjardins R., Smetana K., Busch H.
A large scale procedure for isolation
of nucleoli from rat liver.— Exp.
Cell. Res., 1965, vol. 40, p. 127—137.
Diers L. Uber die Vermehrung von
Plastiden und Mitochondrion wah-
rend der Oogenese von Sphaerocar-
pus.— In: Problem der biologischen
Reduplikation. B.: Springer Verb,
1965, S. 227—243.
Diers L. Uber die Vermehrung von
Mitochondrion wahrend der Oogene-
se von Sphaerocarpus.— In: Proble-
me der biologischen Reduplikation /
Ed. P. Sitte, Heidelberg: Sitte, 1966.
Dodge J. G. Chromosome structure in
the Dinophyceae. I. Spiral chromo-
nema.—Arch. Mikrobiol., 1963, vol.
45, p. 46—57..
Dorsett D. A., Hyde R. The fine struc-
ture of the lens and photoreceptors
of Nereis virens.— Z. Zellforsch.,
1968, Bd. 85, S. 243—255.
Droller M. J., Roth T. F. An electron
microscope study of yolk formation
during oogenesis in Lebistes reticu-
latus guppyi.— J. Cell. BioL, 1966,
vol. 28, p. 209—232.
Driiner L. Sludien uber den Mecha-
nismus der Zelltheilung. Jenaische.
Z. med. Naturwiss., 1895, Bd. 29.
Dumont J. N. Oogenesis in Xenopus
laevis (Daudin). I. Stages of oocyte
development in laboratory maintai-
ned.— J. Morphol., 1972, vol. 136,
p. 153-180.
Dumont J. N., Anderson E. Vitelloge-
nesis in the horseshoe crab, Limu-
]us polyphemus.— J. Microsc., 1967,
vol. 6, p. 791—806.
Duve C. de, Baudhuin P. Peroxisomes
(microbodies and related parti-
cles).— Physiol. Rev., 1966, vol. 46,
p. 327-357.
Dvorak M. A contribution to the in-
vestigation of the role of the nucle-
ar membrane in the formation of
endoplasmic reticulum.— Folia mor-
phol., 1968, vol. 16, p. 286—293.
Ebstein B. S. The distribution of DNA
within the nucleoli of the amphibia
oocyte as demonstrated by tritiated
actinomycin D radioautography.— J.
Cell. Sci., 1969, vol. 5, p. 27—44.
Eliakova G. V., Goriachkina V. L. So-
me features of the cryafish sperma-
tocyte ultrastructure.— In: VI In-
tern. Congr. Electr. Microsc. Kyoto,
1966, p. 637-638.
Elliott A. M., Bak I. J. The contractile
vacuole and related structures in
Tetrahymena pyriformis.— J. Proto-
zool., 1964, vol. 11, p. 250—261.
Emanuelsson H. Metabolism and dist-
ribution of yolk DNA in embryos of
Ophryotrocha labronica La Greca and
Bacci.— Z. Zellforsch., 1971,- vol. 113,
p. 450—460.
Fain M.-A., Gassier P. Pleomorphisme
mitochondrial dans les corpora alla-
ta de Locusta migratoria migratorio-
idea (RNF).— Z. Zellforsch., 1969,
Bd. 102, S. 543-553.
Favard P., Carasso N. Origine et ultra-
structure des plaquettes vitellines
de la Planorbe.— Arch. anat. mic-
rosc. et morphol. exp, 1958, vol 47,
p. 211-234.
Favard-Sereno C. Phenomene de pino-
cytose au cours de la vitellogenese
proteique chez le Grillon (Orthopte-
re).— J. Microsc. 1964, vol. 3, p. 323—
338.
Fawcett D. W. Observations on the cy-
tology and electron microscopy of
hepatic cells.— I. Nat. Cancer. Inst.,
1955, suppl. 15, p. 1475—1483.
18 A. H. Студитский
« 265 »
ЛИТЕРАТУРА
Fawcett D. W. The anatomy of the
mammalian spermatozoon with par-
ticular reference to the guinea pig.—
Z. Zellforsch., 1965, Bd. 67, S. 279—
296.
Feinendegen L. E., Bond V. P. Obser-
vation on nuclear RNA during mito-
sis in human cancer cells in cultu-
re (HeLa—S3), studied with tritia-
ted cytidine.— Exp. Cell Res., 1963,
vol. 30, p. 393—404.
Fick A., Bracket J. RNA-dependent
DNA-polymerase: possible role in
the amplification of ribosomal DNA
in Xenopus oocytes.— Proc. Nat.
Acad. Sci. USA, 1971, vol. 68,
p. 2774—2776.
Flavell R. A., Jones J. G. DNA from
isolated pellicles of Tetrahymena.—
J. Cell Sci., 1971, vol. 9, p. 719—726.
Flemming W. Zellsubstanz. Leipzig:
Kern und Zelltheilung, 1882.
Forster R. P. Kidney cell.— In: The
cell/Ed. J. Brachet, A. E. Mirsky.
New York; London: Acad. Press,
1961, vol. 5, p. 2.
Friedlender B., Fry M., Bolden A., We-
issbach A. A new synthesis RNA-
dependent DNA polymerase from
human tissue culture cells.— Proc.
Nat. Acad. Sci. USA, 1972, vol. 69,
p. 452—555.
Friedmann J., Colwin A. L., Colwin
L. II. Fine-structural aspects of fer-
tilization in Chlamidomonas rein-
hardi.— J. Cell. Sci., 1968, vol. 3,
p. 115—128.
Fuge H. Ultrastructure of the mitotic
spindle.— Intern. Rev. CytoL, Suppl.,
1977, vol. 6, p. 1—58.
Gahan P. B., Chayen J. Cytoplasmic
deoxyribonucleic acid.— Intern. Rev.
CytoL, 1965, vol. 18, p. 223— 247.
Gall J. G. Small granules in the am-
phibian oocyte nucleus and their re-
lationship to RNA.— .1. Biophys. and
Biochem. CytoL, 1956, vol. 3, N 4,
SuppL, p. 393—397.
Galtsoff P., Philpott D. E. Ultrastruc-
ture of the spermatozoon of the ois-
ter Crassostrea virginica.— J. Ultra-
struct. Res., 1960, vol. 3, p. 241—253.
Gansen P. van, Boloukhere-Presburg M.
Ultrastructure de 1’algue unicellu-
laire Acetabularia mediterranea.— J.
Microsc., 1965, vol. 4, p. 347—362.
Gansen P. van, Schram 4. Evolution
of the nucleoli during oogenesis in
Xenopus laevis studied by electron
microscopy.— ,T. Cell Sci., 1972, vol.
10, p. 339—367.
Ganion L. R., Kessel R. G. Intracellu-
lar synthesis, transport and packing
of proteinaceous yolk in oocytes of
Orconectes immuni.— J. Cell Biol.,
1972, vol. 52, p. 420—437.
Gareau de Loubresse N. Spermiogene-
se d’un gasteropode prosobranche-
Nerita senegalensis; evolution du ca-
nal intranucleaire.— .1. Microsc.,
1971, vol. 12, p. 425—440.
Gaudecker B. von. RNA-synthesis in
the nucleolus of Chironomus thum-
mi as studied by high resolution
autoradiography.— Z. Zellforsch.,
1967, Bd. 82, S. 536-557.
Ghosh S. The nucleolar structure.—
Intern. Rev. CytoL, 1976, vol. 44,
p. 1-53.
Ghosh S., Ghosh I. DNA synthetic pat
tern in the nucleolus. II. Chinese
hamster cells.— J. Cell Biol., 1970,
vol. 45, p. 181—183.
Ghosh S., Lettre R. Demonstration of
DNA synthesis in filamentous struc-
ture of nucleolus.— Naturwissen-
schaften, 1969, Bd. 56, S. 140—144.
Ghosh S. Lettre R., Ghosh I. DNA syn-
thesis Pattern in the nucleolus. I
Chicken fibroblast. II. Chinese ham-
ster cells.— J. Cell Biol., 1970, vol.
45, p. 177—181.
Gibbs S. P. Autoradiographic eviden-
ce for the in situ synthesis of chlo-
roplast and mitochondrial RNA.—J.
Cell. Sci., 1968, vol. 3, p. 327—340.
Gibor A. Inheritance of cytoplasmic or-
ganelles.— In: Formation and fate
of cell organelles / Ed. K. Warren.
New York; London: Acad. Press,
1967, p. 305-316.
Glaumann H., Ericsson J. L. E. Evi-
dence for the participation of the
Golgi apparatus in the intracellular
transport of nascent albumin in the
liver cell.— J. Cell Biol., 1970, vol.
47, p. 555—567.
Gnatzy W. Struktur und Entwicklung
des Integuments und der Oenocyten
von Culex pipiens L. (Dipt).— Z.
Zellforsch., 1970, Bd. 110, S. 401—
443.
Godina G., Peirone S., Bianchi M. Ex-
trusion massive des nucleoles du
noyau de cellules cultivees «in vit-
ro».— Bull. Assoc. Anat., 1971, vol.
151, p. 335—343.
« 266 »
ЛИТЕРАТУРА
Godula J. Intramitochondrial comple-
xes of atypical structures in hepa-
tocytes of Triturus alpestris (Lau-
rent!).— Experientia (Basel), 1972,
vol. 28, p. 453—455.
Gondos B., Bhiraleus P. Pronuclear
relationship and association of ma-
ternal and paternal chromosomes in
flashed rabbit ova.— Z. Zellforsch.,
1970, Bd. ill, S. 149—159.
Gordon B. G. Some ultrastructural as-
pects of spermatogenesis and sperm
morphology in the brine shrimp Ar-
temia salina Leach (Crustacea:
Branchiopoda).—Proc. Iowa Acad.
Sci., 1969, vol. 76, p. 473—486.
Gorovskij M. A. Studies on nuclear
structure and function in Tetrahy-
mena pyriformis II. Isolation of
macro- and micronuclei.— J. Cell
Biol., 1970, vol. 47, p. 613—630.
Granick S., Gibor A. The DNA of chlo-
roplasts, mitochondria, and centrio-
les.— In: Progress in nucleic acid
research and molecular biology.
New York; London: Acad. Press,
1967, vol. 6, p. 143—186.
Grell K. G. The protozoan nucleus.—
In: The cell / Ed. J. Brachet, A. Mir-
sky. New York; London: Acad. Press,
1964, vol. 6, p. 79.
Grell K. G., Ruthmann A. Uber die
Kariologie des Radiolars Aulacantha
scolimantha und die Feinstruktur
seiner Chromosomem— Chromosoma,
1964, Bd. 15, S. 158—211.
Gresson R. A. R., Threadgold L. T. Ex-
trusion of nuclear material during
oogenesis in Blatta orientalis.—
Quart. J. Microsc. Sci., 1962, vol. 103,
p. 141—145.
Guraya S. S. Recent advances in the
morphology, histochemistry of the
developing mammalian ovary.— In-
tern Rev. CytoL, 1977, vol. 51, p. 49—
131.
Guttes E., Guttes S. On the filamen-
us elements in the nucleoli of chick
embryo fibroblasts.— Quart. J. Mic-
rosc.' Sci., 1961, vol. 102, p. 23—26.
Hadek R. The mammalian egg.— In-
tern. Rev. CytoL, 1965, vol. 18,
p. 29—71.
Hadek R. Intranuclear whorls in the
hamster spermatid.— J. Ultrastruct.
Res., 1969, vol. 27, p. 396—401.
Hardin J. H., Spicer S. S., Malanos
G. E. Quantitation of the ultrastru-
ctural components of nucleoli of rat
trigeminal ganglia.— J. Ultrastruct.
Res., 1970, vol. 31, p. 274—281.
Harris H. The reactivation of the red
cell nucleus.— J. Cell. Sci., 1967,
vol. 2, p. 20—32.
Harris II. Nucleus and cytoplasm. Lon-
don: Oxford Univ. Press, 1968.
Harris II., Watkins I. F., Ford С. E.,
Schoofl G. I. Artificial heterokary-
ons of animal cells from different
species.— J. Cell. Sci., 1966, vol. 1,
p. 1-30.
Harris P: Nucleolus-like bodies in sea
urchin eggs.— Amer. Zool., 1967,
vol. 7, p. 753—760.
Hay E. D. Structure and function of
the nucleolus in developing cells.—
In: The nucleus / Ed. A. J. Dalton,
F. Haguenau. New York; London:
Acad. Press, 1968, p. 1—79.
Hay E. D. Regeneration of muscle in
the amputated amphibian limb.—
In: Regeneration of striated muscle,
and myogenesis / Ed. A. Mauro et
al. Amsterdam: Excerpta medica,
1970, p. 3—24.
Hayes W. Sex factors and viruses.—
Proc. Roy. Soc. London. Ser. B, 1966,
vol. 164, p. 230-245.
Heath I. B. Experimental studies of
mitosis in the fungi.— In: Nuclear
division in the Fungi/Ed. I. B. He-
ath. N. Y.: Acad. Press, 1978, p. 89—
176.
Hedley R. H., Wakerfield J. St. J. For-
mation of mitochondria in Boderia
(Protozoa: Foraminifera).— Z. Zell-
forsch., 1968, Bd. 87, S. 429—434.
Heinemann R. L., Hagnes R. D. Repro-
duction, reproductive organs and
meiosis in the bisexual non-parthe-
nogenetic mite Caloglyphus myco-
phagus with reference to oocyte de-
generation in virgins (Sarcoptifor-
mes Acaridae).—J. MorphoL,...1970,
vol. 130, p. 93—102.
Hepler P. K., Newcomb E. H. Fine
structure of cell plate formation in
the apical meristem of phaseolus ro-
ots.— J. Ultrastruct. Res., 1967, vol.
19, p. 448-513.
Hinsch G. W. Microtubules in the
sperm of the spider crab, Libinia
emarginata L.— J. Ultrastruct., 1969,
vol. 29, p. 525-534. . ‘
Hoffman E. H. The nucleic acids of
basal bodies isolated from Tetrahy-
ЛИТЕРАТУРА
mena pyriformis.— J. Cell Biol., 1965,
vol. 25, p. 217.
Hoffman II., Grigg G. W. An electron
microscopic study of mitochondria
formation.— Exp. Cell Res., 1958,
vol. 15, p. 118—131.
Hoffmann-Berling II. Die Bedeutung
des Adenosintriphosphat fiir die Zell-
und Kerntheilung in der Anapha-
se.— Biochim. et biophys. acta, 1954,
15, 266—278.
Hopkins C. R. The histochemistry and
fine structure of the accessory nuc-
lei in the oocyte of Bombus terrest-
ris.— Quart. J. Mikr. Sci., 1964,
vol. 105, p. 475—480.
Hopkins C. R., King P. E. An electron
microscopical and histochemical stu-
dy of the oocyte periphery in Bom-
bus terrestris during vitellogene-
sis.— J. Cell Sci., 1966, vol. 1,
p. 201—216.
Horning E. S. Studies on mitochond-
ria.— Austral. J. Exp. Biol. Med.,
1929, Bd. 6, S. 11—19.
Horstmann E., Breucker II. Spermato-
zoon und Spermiohistogenese von
Spirostrepus spec. (Myriapoda, Di-
plopoda). II. Die Spermiohistogene-
se.— Z. Zellforsch., 1969, Bd. 99,
S. 153—184.
IIsa T. C., Arrighi F. E., Klevecz R. R.,
Brinkley B. R. The nucleoli in mi-
totic divisions of mammalian cells
in vitro.— J. Cell Biol., 1965, vol. 26,
p. 539-553.
Hsu T. C., Brinkley B. R., Arrighi F. F.
The structure and behavior of the
nucleolus organizers in mammalian
cells.— Chromosoma (Berk), 1968,
vol. 23, p. 137—153.
ИиЪегтап J. A., Attardi G. Isolation of
metaphase chromosomes from HeLa
cells.—J. Cell Biol., 1966, vol. 31,
p. 95—105.
Ilufnagel L. A. Properties of DNA as-
sociated with raffinose isolated pel-
licles of Paramecium aurelia.— J.
Cell. Sci, 1969, vol. 5, p. 561—573.
Hughes Schrader S. A new type of
spermiogenesis in Iceryine Coccids
with linear arrangement of chromo-
somes in the sperm.— J. Morphol,
1946, vol. 78, p. 43-83.
Hyde В. B. Changes in nucleolar ul-
trastruclure associated with differen-
tiation in the root tip.— J. Ultra-
struct. Res, 1967, vol. 18, p. 25—54.
Idelman S. Donnees recentes sur 1’in-
frastructure du Spermatozoide.— An-
nee biol. 4-e Ser, 1967, t. 6, fasc. 3—
4, 113—190.
lino T. Genetics and chemistry of bac-
terial flagella.— Bacteriol. Rev, 1969,
vol. 167, p. 1626—1627.
Ikeuchi T., Sanbe M., Weinfeld II.,
Sandberg A. A. Induction of nuclear
envelops around metaphase chromo-
soms after fusion with interphase
cells.—J. Cell Biol, 1971, vol. 51,
p. 104.
Ikeuchi T., Sandberg A. A. Chromo-
soms pulverization in virus-induced
heterocaryons of mammalian cells
from different species.— J. Nat. Can-
cer Inst, 1970, vol. 45, p. 951.
Ikeuchi T., Weinfeld H., Sandberg
A. A. Chromosoms pulverization in
micrunuclei induced by tritiated thy-
midine.— J. Cell Biol, 1972, vol. 52,
p. 97-104.
Ishikawa H. Satellite cells in develo-
ping muscle and tissue culture.—
In: Regeneration of striated muscle,
and myogenesis / Ed. A. Mauro et al.
Amsterdam: Excerpta medica, 1970,
p. 167—179.
Izawa M., Allfrey V. G., Mirsky A. E.
Composition on the nucleus and
chromosomes in the lamp-brush sta-
ge of the newt oocyte.— Proc. Nat.
Acad. Sci. USA, 1963, vol. 50, p. 811.
Jamuar M. P. Studies of spermiogene-
sis in a Nematode, Nippastrongylus
brasiliensis.— J. Cell Biol, 1966, vol.
31, p. 381-396.
Jensen K. G., Kilmann S. A. Blood pla-
telets. Structure, formation and fun-
ction. Baltimore (Maryland): Willi-
ams, Wilkins, 1968.
Jessen II. The morphology and distri-
bution of mitochondria in ameloblast
with special reference to a helix-
containing type.— J. Ultrastruct.
Res, 1968, vol. 22, p. 120—135.
Jones K. W. The role of the nucleolus
in the formation of ribosomes.— J.
Ultrastruct. Res, 1965, vol. 13,
p. 257—262.
Jones P. Paramitotic granulation and
ribosome bodies in erythroblasts.—
J. Ultrastruct. Res, 1962, vol. 7,
p. 308—315.
Kalnins V. I., Porter K. R. Centriole
replication during ciliogenesis in the
chick tracheal epithelium.— Z. Zell-
forsch. 1969, Bd. 100, S. 1—30.
« 268 »
ЛИТЕРАТУРА
Kato К. Cytochemistry and fine struc-
ture of elimination chromatin in Di-
tiscidae.— Exp. Cell. Res., 1968,
vol. 52, p. 507-522.
Kato H., Sandberg A. A. Chromosome
pulverization in Chinese hamster
cells induced by Sendai virus.— J.
Nat. Cancer. Inst., 1968, vol. 41,
p. 1117.
Kendall M. D. The fine structure of
the salivary glands of the desert lo-
cust Schistocerca gregarina Tor-
skal.— Z. Zellforsch., 1969, Bd. 98,
S. 399—420.
Kessel R. G. The association between
microtubules and nuclei during sper-
matogenesis in the dragonfly.— J.
Ultrastruct. Res., 1966a, vol. 16,
p. 293—304.
Kessel R. G. An electron microscope
study of nuclear-cytoplasmic ex-
change in oocytes of Ciona intesti-
nalis.— J. Ultrastruct. Res., 1966b,
vol. 15, p. 181—196.
Kessel R. G. The association between
microtubules and nuclei during sper-
miogenesis in the dragonfly.— J. Ul-
trastruct. Res., 1966c, vol. 16, p. 297—
304.
Kessel R. G. Electron microscope stu-
dies on the origin and maturation of
yolk in oocytes of the tunicate, Cio-
na intestinalis.— Z. Zellforsch.,
1966d, Bd. 71, S. 525— 544.
Kessel R. G. An electron microscope
study of spermiogenesis in the gras-
shopper with particular reference to
the development of microtubular
systems during differentiation.— J.
Ultrastruct. Res., 1967, vol. 18,
p. 677-694.
Kessel R. G. Mechanisms of protein
yolk synthesis and deposition in
crustacean oocytes.— Z. Zellforsch.,
1968, Bd. 89, S. 17—38.
Kessel R. G. Cytodifferentiation in the
Rana pipiens oocyte. I. Association
between mitochondria and nucleo-
lus-like bodies in young oocytes.— J.
Ultrastruct. Res., 1969, vol. 28,
p. 61—77.
Kessel R. G. Cytodifferentiation in the
Rana pipiens oocyte. II. Intramito-
chondrial yolk.— Z. Zellforsch., 1971,
Bd. 112, S. 313—332.
Kessel R. G., Beams II. W. Mikropino-
cytosis and yolk formation in the
oocytes of the small milkweedbug.—
Exp. Cell. Res., 1963, vol. 30, p. 440—
443.
Kessel R. G., Beams H. W. Nuclear ex-
trusion in the oocyte of Thyona bri-
areus.— Exp. Cell Res., 1964, vol. 32,
p. 612—615.
Kezer I., MacGregor H. C., Schab-
tach E. Observations on the mem-
branous components of amphibian
oocyte nucleoli.— J. Cell. Sci., 1971,
vol. 8, p. 1—17.
King К. C. Oogenesis in adult Droso-
phila melanogaster. IX. Studies on
the cytochemistry and ultrastructure
of developing oocytes.— Growth,
1960, vol. 24, p. 265—323.
King P. E. The composition of yolk in
the eggs of Apanteles glomeratus L.
(Braconidae, Hymenoptera).— Proc.
Roy. Entomol. Soc., 1968, vol. 44,
p. 143—158.
King P. E., Fordy M. R. The formation
of «accessory nuclei» in the develo-
ping oocytes of the parasitoid Hy-
menopterans Ophion lutens (4) and
Apanteles glomeratus (4).— Z. Zell-
forsch., 1970, Bd. 109, S. 158-170.
King P. E., Ratcliffe N. A. Oogenesis
in Hasonia vitripennis (Walker)
(Hymenoptera: Pteromalidae).—
Proc. Roy. Entomol. Soc., 1969, vol.
44, p. 143—158.
King P. E., Richards J. G. Accessory
nuclei and annulate lamellae in hy-
menopteran oocytes.— Nature, 1968,
vol. 218, p. 488.
Kirpitschnikoff II., Genevsky R. Les
modifications des mitochrondries
dans le developpment du rein du
Triton taeniatus.— Bull, histol. appl.,
1946, N 3, p. 67— 70.
Kishi K. Fine structural and cytoche-
mical observations on cytoplasmic
nucleoluslike bodies of rat medulla
oblongata. Z. Zellforsch., 1972,
Bd. 132, S. 523-532.
Knudson D. L., MacLeod R. Mycoplas-
ma pneumoniae and Mycoplasma sa-
livarium: electron microscopy of co-
lony growth in agar.— J. Bacterio!.,
1970, vol. 107, p. 609—617.
Kress A., Spornitz U. M. Ultrastructu-
ral studies of oogenesis in some
european amphibians. I. Rana escu-
lenta and Rana temporaria.—Z. Zell-
forsch., 1972, Bd. 128, S. 438-456.
Kubai D. The evolution of the mito-
tic spindle.— Intern. Rev. Cytol.,
1975, vol. 43, p. 167—227.
« 269 »
ЛИТЕРАТУРА
Kubai D. F., Ris H. Division in the di-
noflagellate Gyrodinium cohnii
(Schiller): A new type of nuclear
reproduction.— J. Cell. Biol., 1969,
vol. 40, p. 508—528.
Kumar A. Ribosome synthesis in Tet-
rahymena pyriformis.— J. Cell. Bi-
ol., 1970, vol. 45, p. 623-634.
Kunz IT’. Lampenbiirstenchromosomen
und multiplen Nucleolen bei Ortho-
pteren.— Chromosoma, 1967, Bd. 21,
S. 446-462.
Kurosumi K. Electron microscopic ana-
lysis of the secretion mechanisme.—
Intern. Rev. Cytok, 1961, vol. 11,
p. 1—124.
Kushner D. T. Self-assembly of biolo-
gical structures.— Bacteriol. Rev.,
1969, vol. 33, p. 302-344.
La Cour L. F., Wells B. The loops and
ultrastructure of the nucleolus of
Ipheira uniflorum.— Z. Zellforsch.,
1967, Bd. 89, S. 25—45.
Lafontaine J. G., Lord A. A correlated
light and electron microscope inves-
tigation of the structural evolution
of the nucleolus during the cell cyc-
le in plant meristematic cells (Al-
lium porrum).— J. Cell Sci., 1974,
vol. 16, p. 63—93.
Lambert A. M., Bajer A. Fine structure
dynamics of the prometphase spind-
le.— J. Mitarosc. Biol. Cell, 1975,
vol. 23, p. 181—194.
Larsen W. J. Genesis of mitochondria
in insect fat body. J. Cell Biol., 1970,
vol. 47, p. 370—380.
Leak L. V. Intramitochondrial crystals
in meristematic cells of Pisum sati-
vum.— J. Ultrastruct. Res., 1968,
vol. 24, p. 102—108.
Le Beux У. J. An unusual ultrastruc-
tural association of smooth membra-
nes and glycogen particles: the gly-
cogen body.— Z. Zellforsch., 1969,
Bd. 101, S. 433—447.
Le Beux Y., Langelier P., Poirier L. J.
Further ultrastructural data on the
cytoplasmic nucleolus-resembling bo-
dies or nematosomes. Their relation-
ship with the subsynaptic web and
a cytoplasmic filamentous net-
work.—Z. Zellforsch., 1971, Bd. 118,
S. 147—155.
Leedale G. F. Nuclear structure and
mitosis in the Eugleninae.— Arch.
Microbiol., 1958, vol. 32, p.^—64.
Leedale G. F. The nucleus of Eugle-
na.— In: The biology of Euglena /
Ed. D. E. Buetow. New York; Lon-
don: Acad. Press, 1968, vol. 1.
Leedale G. F., Mefuse B. J. D., Pring-
sheim E. G. Structure and physio-
logy of Euglena spirogira. Pt I, II.—
Arch. Microbiol., 1965, vol. 50, p. 68—
102.
Le Moigne A., Monnol-Sauzin M.-J.
Etude au microscope electronique
d’inclusions nucleaires chez des
planaires (turbellaries, triclades).—
J. Microsc., 1971, vol. 10, p. 107—112.
Leon K. W., Lorch I. J., Danielly J. F.
Reassembly of living cells from dis-
sociated components.— Science, 1970,
p. 1626—1627.
Leltrd R., Siebs W. Some studies of
the nucleolus of cells cultivated «in
vitro».— PathoL-Biol., 1961, vol. 7—
8, p. 819-823.
Lever J. D. Physiologically induced
changes in adrenocortical mitochon-
dria.— J. Biophys. and Biochem. Cy-
tol., 1956, vol. 2, suppl., p. 313—318.
Lewis W. H. On the chromosomal na-
ture of nucleoli.— Bull. Johns Hop-
kins Hosp., 1940, vol. 66, p. 60—64.
Le.zzy M. RNS- and Proteins-Synthese
in Puffs isolierter Speicheldriisen-
Chromosomen von Chironomus.—
Chromosoma, 1967, vol. 21, p. 72—
88.
Liau M. C., Perry R. P. Ribosomal pre-
cursor particles in nucleoli.— J. Cell
Biol., 1969, vol. 42, p. 272—283.
Lima-de Faria A., Moses M. J. Ultra-
structure and cytochemistry of me-
tabolic DNA in Tipula.— J. Cell Bi-
ol.., 1966, vol. 30, p. 177—192.
Linden van der A. G. J. M. Spermato-
genesis, spermiogenesis and sperm
structure in Crenobia (Planaria) al-
pina (dana).— Z. Zellforsch., 1969,
Bd. 97, S. 549—563.
Linnane A. W., Vitols E., Nowland
P. G. Studies on the origin of yeast
mitochondria.— J. Cell Biol., 1962,
vol. 13, p. 345-350.
Longo F. L, Anderson E. Cytological
study of fertilization in the lamel-
libranch, Mitilus edulis. I. Polar bo-
dy formation and development of
the femal pronucleus.— J. Exp. Zo-
ok, 1969, vol. 172, p. 69—96.
Lord A., Lafontain J. G. The organiza-
tion of the nucleolus in meristema-
tic cells: A cytochemical study.— J.
Cell Biol., 1969, vol. 40, p. 633—642.
« 270 »
ЛИТЕРАТУРА
Luck D. J. L. The biogenesis of mito-
chondria in Neurospora: A summa-
ry of present findings.— In: Proble-
me der biologischen Reduplikation /
Ed. P. Sitte. Heidelberg: Sitte, 1966,
p. 314—324.
Lunger P. D. Early stages of sperma-
tozoan development in the colonial
hydroid Campanularia flexiosa.— Z.
Zellforsch., 1971, Bd. 116, S. 37—51.
Luykx P. Cellular mechanisms of chro-
mosome distribution. New York;
London: Acad. Press, 1970.
Macgregor H. C. Nucleolar DNA in
oocytes of Xenopus laevis.— J. Cell.
Sci., 1968, vol. 3, p. 437—444.
Macgregor H. C. The nucleolus and its
genes in amphibian oogenesis.— Bi-
ol. Revs, Cambridge Phil. Soc., 1972,
vol. 47, p. 177-210.
Mahler H. R., Raff R. A. The evolutio-
nary origin of the mitochondrion- a
nonsymbiotic model.— Intern. Rev.
Cytol., 1975, vol. 43, p. 2—124.
Makielski S. K. The structure and ma-
turation of the spermatozoon of Sci-
ara coprophila.— J. Morphol., 1966,
vol. 118, p. 11—42.
Manton I. Electron microscopical ob-
servation on a very small flagella-
te: the problem of Chromulina pusi-
la.— J. Mar. Biol. Assoc. U. K., 1959,
vol. 38, p. 319—333.
Manton, I. Some problems of mito-
chondrial growth.— J. Exp. Bot.,
1961, vol. 12, p. 421—423.
Manton I. Further observation on the
fine structure of Chrysochromulina
chiton, with special reference to the
. pyrenoid.— J. Cell. Sci., 1966, vol. 1,
p. 187-192.
Marano F. Etude ultrastructurale de la
division chez Dunaliella.— J. Mic-
rosc. Biol. Cell, 1976, vol. 25, p. 279—
282.
Margulis L. Origin of eucaryotic cell.
New Haven; London, 1970.
Marshak A., Marshak C. Quantitative
determination of desoxyribonucleic
acid in Echinoderm germ cells.—
Exp. Cell. Res., 1955, vol. 8, p. 126—
146.
Maslow D. E. Cell specifity in the for-
mation of multinucleated striated
muscle.— Exp. Cell. Res., 1969, vol.
54, p. 381.
Massalski A., Leedale G. F. Cytology
and ultrastructure of the Xantho-
phyceae.— Brit. Phycol. J., 1969,
vol. 4, p. 159—172.
Massover W. II. Intramitochondrial
yolk-crystals of frog oocytes. II. Ex-
pulsion of intramitochondrial yolk-
crystals to form single-membrane
bound hexagonal crystalloids.— J.
Ultrastruct. Res. 1971, vol. 36,
p. 603—620.
Matsui S. I., loshida H., Weinfeld H.,
Sandberg A. A. Induction of profa-
se in interphase nuclei by fusion
with metaphase cells.— J. Cell Biol.,
1972, vol. 54, p. 120—132.
Matsui S., Sandberg A. A. Molecular
basis of chromatin condensation in
mitosis.— J. Cell Biol., 1979, vol. 83,
N 2, P. 2, CHO5 (Abs tr.).
Mauro A. Satellite cells of skeletal
muscle fibers.— J. Biophys. and Bio-
chem. Cytol., 1961, vol. 9, p. 493—495.
Mayfield J. E., Bonner J. Tissue diffe-
rences in rat chromosomal RNA.—
Proc. Nat. Acad. Sci. USA, 1971,
vol. 68, p. 2652—2655.
Mays U. Stofftransport im Ovar von
Pyrrhocoris apterus L. Autoradio-
graphische Untersuchungen zum
Stofftransport von den Nahrzellen
zur Oocyte der Feuerwanze Pyrrho-
coris apterus L. (Heteroptera).— Z.
Zellforsch., 1972, Bd. 123, S. 395—
410.
McLeish J. Chemical and autoradio-
graphic studies of intranucleolar
DNA in Vicia faba.— Exp. Cell Res.,
1968, vol. 51, p. 157—166.
Meek G. A., Moses M. J. Microtubula-
tion of the inner membrane of the
nuclear envelope.— J. Biophys. and
Biochem. Cytol., 1961, vol. 10,
p. 121—131.
Mereschkowskij C. Theorie der zwei
Plasmaarten als Grundlage der Sym-
biogenesis, einer neuen Lehre von
der Entstehung der Organismen.—
Biol. Cbl., 1910, Bd. 30, S. 278—288,
289-303, 321—347, 353—367.
Metz С. B. Gamete surface components
and their role in fertilization.— In:
Fertilization / Ed. С. B. Metz,
A. Monroy. N. Y.: Acad. Press, 1967,
p. 1-163.
Melz С. B., Monroy A. Fertilization:
Comparative morphology, bioche-
mistry and immunology. London;
New York: Acad. Press, 1967, vol. 1.
Miller O. J. Visualization of nucleolar
genes.— Science, 1969, vol. 164,
p. 955—957.
« 271 »
ЛИТЕРАТУРА
Miller О, L. Fino structure of lampb-
rush chromosomes.— Nat. Cancer
Inst. Monogr., 1965, vol. 18, p. 79—
89.
Miller O. L. Structure and compositi-
on of peripheral nucleoli of sala-
mander oocytes.—Nat. Cancer. Inst.
Monogr., 1966, vol. 23, p. 53—66.
Miller 0. L., Beatty B. R. Nucleolar
structure and function.— In: Hand-
book of molecular cytology/Ed.
A. Lima-de-Faria. Amsterdam; Lon-
don, 1969, p. 605-619.
Miller 0. L., Ilamkalo B. A. Visualiza-
tion of RNA synthesis on chromoso-
mes.— Intern. Rev. CytoL, 1972,
vol. 33, p. 1—25.
Millonig G., Bosco M., Giambertone L.
Fine structure analysis of oogenesis
in sea urchins.— J. Exp. ZooL, 1968,
vol. 169, p. 293—314.
Mirsky A. E., Ris H. The desoxyribo-
nucleic acid content of animal cells
and its evolutionary significance.—
J. Gen. Physiol., 1951, vol. 34,
p. 451-462.
Mitrakos K. Feinbau und Teilung bei
plastideneiniger Florideen Arten.—
Protoplasma, 1960, Bd. 52, S. 611—
617.
Moore R. T., McAlear J. M. Fine struc-
ture of Mycota. 4. The occurrence of
the Golgi dictyosome in the fungus
Neobulgaria pura (Fr.) Petrak.— J.
Gen. Biol.. 1963, vol. 16, p. 131.
Moreno Diaz de la Espina, Risueno
M. C., Fernandez-Gomez M. E., Tand-
ler C. J. Ultrastructural study of
the nucleolar cycle in meristematic
cells of AUium сера.— J. Microsc.
Biol. Cell, 1976, vol. 25, p. 265- 278.
Moses M. Studies on nuclei using cor-
related cytochemical light and elect-
ron microscope techniques.— J. Bio-
phys. and Biochem. CytoL, 1956,
Suppl. 4, vol. 2, p. 397—406.
Muckenthaler F. A., Mahowald A. P.
DNA synthesis in the ooplasm of
Drosophila melanogaster.— J. Cell
Biol., 1966, vol. 28, p. 199—208.
Muir A. R. The structure and distribu-
tion of satellite cells.— In: Regene-
ration of striated muscles, and myo-
genesis / Ed. A. Mauro et al. Amster-
dam: Excerpta medica, 1970, p. 91—
100.
Markerji R. N. The «nucleal reaction»
in Apan teles sp. with special refe-
rence to the secondary nuclei and
germ cell determinant of the egg.—
Proc. Roy. Soc. London, Ser. B, 1930,
vol. 106, p. 131—139.
Mundel R. D. The occurrence of ribo-
somal proteins in nucleoli of starfish
oocytes.— Biochem. and Biophys.
Res. Communs, 1967, vol. 28, N 1,
p. 117-122.
Murray R. G., Murray A. S., Pozzo A.
The fine structure of mitosis in rat
thymic lymphocytes.— J. Cell Biol.,
1965, vol. 26, p. 601—619.
Nass S. The significance of the struc-
tural and functional similarities of
bacteria and mitochondria.— Intern.
Rev. CytoL, 1969, vol. 25, p. 55—129.
Nash D., Plant W. On the presence of
DNA in larval salivary gland nucleo-
lus in Drosophila melanogaster.— J.
Cell. Biol., 1965, vol. 27, p. 682—686.
Nassonov D. Zur Frage liber den Bau
und die Bedeutung des lipoiden Ex-
kretionsapparates bei Protozoa.— Z.
Zellforsch., 1924, Bd. 2, S. 87—97.
Nath V. Cytology of spermatogene-
sis.— Intern. Rev. CytoL, 1956, vol. 5,
p. 395—454.
Neutra M., Leblond С. P. Synthesis of
the carbohydrate of mucus in the
Golgi complex as shown by electron
microscope radiography of goblet
cells from rats injected with gluco-
se-H3.—J. Cell Biol., 1966, vol. 30,
p. 119-136.
Niijima L., Dan J. C. Acrosome reacti-
on in Mitilus edulis.— .1. Cell Biol.,
1965, vol. 25, p. 243—259.
Nerrevang A. Electron microscopic
morphology of oogenesis.— Intern.
Rev. CytoL, 1969, vol. 23, p. 115-
186.
Pannese E. Expansive growth of the
nuclear envelope and formation of
mitochondria in ganglionic neuro-
blasts.— Z. Zellforsch., 1966, Bd. 72,
S. 295—324.
Pasteels J. J., Harven E. de. Etude au
microscope electronique du sperma-
tozoid d’un Mollusque bivalve, Bar-
nea Candida.— Arch. biol. Belg., 1962,
vol. 76, p. 445—463.
Pavan C., Brito de Cunha A. Gene am-
plification in ontogeny and phylo-
geny of animal.— Genetics, 1969,
vol. 69, p. 289—304.
Pedersen II. Microtubules in the sper-
matid of the rabbit.— Z. Zellforsch.,
1969, Bd. 98, S. 148-156.
« 272 »
ЛИТЕРАТУРА
Pelting С. Ribonucleinsaure-Synthese
der Riesenchromosomen. Autoradio-
graphische Untersuchungen an Chi-
ronomus tenrans.— Chromosome,
1964, Bd. 15, S. 71—122.
Perkowska E., Macgregor H. C., Birns-
tiel M. L. Nucleolar DNA in oocytes
of normal and mononucleolate Xe-
nopus laevis.— Nature, 1968, vol. 217,
p. 649—650.
Perry R. P. Nucleoli: The cellular si-
tes of ribosome production.— In:
Handbook of molecular cytology/
Ed. A. Lima de Faria. Amsterdam:
London, 1969, p. 620—636.
Perry R. P. The nucleolus and the
synthesis of ribosomes.— Intern.
Symp. Genes and chromosomes
structure and function.— Nat. Can-
cer Inst. Monogr., 1965, vol. 18,
p. 325-340.
Philips S. G., Philips D. M. Sites of
nucleolus production in cultured
Chinese hamster cells.— J. Cell. Bi-
ol., 1969, vol. 40, p. 248—258.
Phillips D. M. Insect sperm: their
structure and morphogenesis.— J.
Cell Biol., 1970a, vol. 44, p. 243-277.
Phillips D. M. Development of sperma-
tozoa in the wooly opossum with
special reference to the shaping of
the sperm head.— J. Ultrastructure
: Res., 1970b, vol. 33, p. 369 -380
Phillips D. M. Ultrastructure of sper-
matozoa of the wooly opossum Calu-
romys phicander.— J. Ultrastruct.
Res., 1970c, vol. 37, p. 381-397.
Picheral B., Bassez Th. Ultrastructure
du noyau en rapport avec revolu-
tion des proteines basiques nucleai-
res au cours de la spermiogenese du
triton Pleurodeles waltii Michah.— J.
Microsc., 1971, vol. 12, p. 107—132.
Pitelka D. P. Observations on the ki-
netoplast-mitochondrion and the cy-
tostome of Bodo.— Exp. Cell Res.,
1961, vol. 25, p. 87-93.
Plattner II., Schatz G. Promitochond-
ria of anaerobically grown yeast.
III. Morphology.— Bioch., 1969,
vol. 8, p. 339.
Pochon-Masson J. L’ultrastructure des
spermatozoides vesiculaires chez les
crustaces decapodes avant et au co-
urs de leur devagination experimen-
tale. I. Brachyoures ct anomoures.—
Ann. sci. nat. zool. Paris, 12e Ser.,
1968, vol. 10, p. 1—100.
Porter K., Machado R. Studies on the
endoplasmic reticulum. IV. Ils form
and distribution during mitosis in
cells of onion root cells.— J. Bio-
phys. and Biochem. CytoL, 1960,
vol. 7, p. 167—180.
Possingham J. V. Controls to chloro-
plast division in higher plants.— J.
Microsc. Biol. Cell., 1976, p. 283-288..
Randall J. TDisbrey C. Evidence for
the presence of DNA at basal body
sites in Tetrahymena pyriformis.—
Proc. Roy. Soc. London. Ser. B, 1965,
vol. 162, p. 473—491.
Recher L.,. Whitescarver J., Briggs L.
A cytochemical and radioautographic
study of human tissue culture cell
nucleoli.— J. Cell Biol., 1970, vol. 45,
p. 479—492.
Regeneration of striated muscle, and
myogenesis I Ed. A. Mauro et al. Am-
sterdam: Excerpla medica, 1970.
Reger J. F. The fine structure of sper-
matozoa from the isopod, Asellus
militaris (Hay).— J. Ultrastruct.
Res., 1964, vol. 11, p. 181—192.
Reger J. F. A study on the fine struc-
ture of developing spermatozoa from
the oligochaete, Enchytraeus albi-
. dus.— Z. Zellforsch., 1967, Bd. 82,
S. 257—269.
Reger J. F., Dudkiewicz A. B., Floren-
do N. The fine structure of sperma-
tid-assotiated, extracellular tubules
in the schizopod Misis oculata relic-
ta.— J. Ultrastruct., 1970, vol. 30,
p. 166—171.
Reger J. F., Florendo N. T. Studies on
motile, nontubule-containing, fili-
form spermatozoa of the ostracod
Cypridopsis. I. Spermiogenesis.— J.
Ultrastruct. Res., 1969a, vol. 28,
p. 235—249.
Reger J. F., Florendo N. T. Studies on
motile, nonlubule-conlaining, fili-
form spermatozoa of the ostracod
Cypridopsis. sp. II. Mature sperma-
tozoa.— J. Ultrastruct. Res., 1969b,
vol. 28, p. 250—258.
Renger H. C., Wolslerholme D. R. Ki-
neloplast deoxyribonucleic acid of
the hemoflagellate Trypanosoma le-
wisi.— J. Cell Biol., 1970, vol. 47,
p. 689—702.
Renger II. C., W olstenholme D. R. The
form and structure of kinetoplast of
Crilidia.— J. Cell Biol., 1972, vol. 54,
p. 346—364.
Reznik M. Satellite cells, myoblasts,
and skeletal muscle regeneration.—
« 273 »
ЛИТЕРАТУРА
In: Regeneration of striated muscle,
and myogenesis I Ed. A. Mauro et al.
Amsterdam: Excerpta medica, 1970,
p. 133-156.
Rib as-M undo M. Nucleolar DNA syn-
thesis in leukocytes cultured in vit-
ro.— Exp. Cell Res., 1966, vol. 41,
p. 210—215.
Ribbert D. Die Polytanchromosomen
der Borsten — Bildungstellen von
Calliphora erythrocepliala. Unter
besonderer Beriicksichtigung der
gesclilechtsgebiinde wahrend der
Metamorphose.— Chromosoma, 1964,
Bd. 21, S. 296-344.
Ribbert D., Kunz W. Lampenbursten-
chromosomen in Oocytenkernen von
Sepia officinalis.— Chromosoma
(Berk), 1969, Bd. 28, S. 93-106.
Ries E., Gersch M. Biologic der Zelle /
Ed. B. G. Teubner. Leipzig, 1953.
Ris II. The structure of the kineto-
plast in trypanosomes.— In: X
Congr. interm bio], cellulaire. Paris,
1960, p. 232-233.
Ris II. Interpretation of ultrastructure
in the cell nucleus.— In: The inter-
pretation of ultrastructure / Ed.
R. J. C. Harris. New York: Acad.
Press, 1962, p. 69—88.
Ris II., Plaut W. Ultrastructure of DNA
containing areas in the chloroplast
of Chlamidomonas.— J. Cell Biol.,
1962, vol. 13, p. 383.
Risueno M. C., Fernandez-Gomez
M. E., Gimenez-Martin G. Nucleoli
under the electron microscope by
silver impregnation.— Microscopic,
1973, vol. 29, p. 292-298.
Risueno M. C., Moreno Diaz de la Es-
pina, Fernandez-Gomez M. E., Gime-
nez-Martin G. Ultrastructural study
of nucleolar material during plant
mitosis in the presence of inhibitors
of RNA synthesis.— J. Microsc. Bi-
ol. Cell., 1976, vol. 26, p. 5—18.
Risueno M. C., Gimenez-Martin G.,
Gonzalez-Fernandez A. Ultrastructu-
ral analysis of cytokinesis in plant
cells blocked at prophase.— J. Mic-
rosc. 1971, vol. 10, p. 331—336.
Ro T. S., Muramats M., Busch II. La-
beling of RNA of isolated nucleoli
with UTP-14C.— Biochem. and Bio-
phys. Res. Communs, 1964, vol. 14,
p. 149-155.
Robertson J. D. The ultrastructure of
cell membranes and their derivati-
ves.— In: The structure and functi-
on of subcellular components / Ed.
E. M. Crock. L.: Cambr. Univ. Press,
1959, p. 3-43.
Robertson I. D. Cell membranes and
the origin of mitochondria.— In: Re-
gional neurochemistry, regional che-
mistry, physiology and pharmacolo-
gy of the nervous system / Ed. S. S.
Kety, J. Elkes. New York: London,
1960, p. 493-530.
Robertson J. D. Unit membranes: a re-
view with recent new studies of ex-
perimental alterations and a new
subunit structure in synaptic mem-
branes.— In: Cellular membranes in
development / Ed. M. Locke. New
York; London: Acad. Press, 1964,
p. 1—81.
Roels F., Schiller B., Goldfischer S.
Microbodies (peroxisomes) in the
toad, Bufo marinus: A cytochemical
study.— Z. Zellforsch., 1970, Bd. 108,
S. 135-149.
Roodyn D. B., Wilkie D. The biogene-
sis of mitochondria. L.: Methuen,
1968.
Ros R. J., Gran D. G., Possingham J. V.
Distribution of DNA in dividing spi-
nach chloroplasts.— Nature, 1974,
vol. 251, p. 641—642.
Ross J., Robison W. G. Jr. Unusual
microtubular patterns and threedi-
mensional movement of mealbug
sperm and sperm bundles.— J. Cell
Biol., 1969, vol. 40, p. 426—445.
Roth T. F., Porter K. R. Yolk protein
uptake in the oocyte of the mosqui-
to Aedes aegypti L.— J. Cell Biol.,
1964, vol. 20, p. 313—332.
Rouiller C., Bernhard W. «Microbodi
es» and the problem of mitochondri-
al regeneration in liver cells.— J.
Biophys. and Biochem. Cytol., 1956,
Suppl. vol. 2, p. 355—360.
Ruby J. R., Dyer R. F., Skalko R. G.
Continuities between mitochondria
and endoplasmic reticulum in the
mammalian ovary.— Z. Zellforsch.,
1969, Bd. 97, S. 30-37.
Sadowski P. D., Steiner J. W. Electron
microscopic and biochemical charac-
teristics of nuclei and nucleoli iso-
lated from rat liver.— J. Cell Biol.,
1970, vol. 37, p. 147—161.
Sanbe M., Aua T., Ikeuchi T., Sand-
berg A. A. Electron microscopic stu-
dy of fused cells, with special refe-
rence to chromosome pulverizati-
« 274 »
ЛИТЕРАТУРА
on.— J. Nat. Cancer Inst., 1970, vol.
44, p. 1079.
Sandberg A. A., Aua T., Ikeuchi T.,
Weinfeld H. Definition and morpho-
logic features of chromosoms pulve-
rization: a hypothesis to explain the
phenomen.— J. Nat. Cancer. Inst.,
1970, vol. 45, p. 615.
Salir B., Dirksen E. R. Nucleolar aging
in Tetrahymena during the cultural
growth cycle.— J. Cell Biol., 1971,
vol. 48. p. 143—154.
Scharer B., Wurzelmann S. Ultrastruc-
tural study on nuclear-cytoplasmic
relationships in oocytes of the Af-
rican lungfisch, Protopterus aethio-
picus. I. Nucleo-cytoplasmic path-
ways.— Z. Zellforsch., 1969a, Bd. 96,
S. 325—343.
Scharer B., Wurzelmann S- Ultrastruc-
tural study on nuclearcytoplasmic
relationship in oocytes of the afri-
can lungfish, Protopterus aethiopi-
cus. II. The microtubular apparatus
of the nuclear envelope.— Z. Zell-
forsch., 1969b, vol. 101, p. 1—12.
Schiff J. A., Epstein H. T. The conti-
nuity of the chloroplast in Eugle-
na.— In: The biology of Euglena /
Ed. D. E. Buetow. New York; Lon-
don: Acad. Press, 1968, vol. 11,
p. 285—333.
Schnedl W., Schnedl M. Nucleoluszahl
and Grosse wahrend des Zellzy-
clus.— Z. Zellforsch., 1972, Bd. 12,
S. 374—382.
Schneider L. Morphogenese and Dina-
mik cytoplasmatischer Membra-
nen.— Zool. Anz., 1965, Suppl., Bd.
28, S. 243-272.
Schuster F. An electron microscope
study of the amoeboflagellate, Naeg-
ieria gruberi (Schradinger). I. The
amoeboid and flagellate stages.— J.
ProtzooL, 1963, vol. 10, p. 297—313.
Schwab D. Elektronenmikroskopische
Untersuchungen an der Foramini-
fere Allogromia laticollaris Arnold.
Der herangewachsene Agamont.— Z.
Zellforsch., 1970, Bd. 108, S. 35—45.
Selman G. G., Perry M. M. Ultrastruc-
tural changes in the surface layers
of the newt’s egg in relation to the
mechanism of its cleavage.— J. Cell
Sci., 1970, vol. 6, p. 207—227.
Senlein P., Humean C. Origine mito-
chondriale du vitellus dans 1’oocyte
de Triturus helveticus.— C. r. Acad,
sci., Ser. D, 1968, vol. 267, p. 753.
Seyer P., Marty D., Lescure A. M.,
Peau-Lenoel C. Effect of cytokinin
of chloroplast cyclic differentiation
in cultured tobacco cells.— Cell Dif-
ferent., 1975, vol. 4, p. 187—192.
Shimada Y. Electron microscope ob-
servations on the fusion of chick
myoblasts in vitro.— J. Cell Biol.,
1971, vol. 48, p. 128—142.
Shephard D. Chloroplast multiplicati-
on and growth in the unicellular al-
ga Acetabularia mediterranea.— Exp.
Cell Res., 1965, vol. 37, p. 93—110.
Silveira M-, Porter K. R. The sperma-
tozoids of flatworms and their mic-
rotubular systems.— Protoplasma
(Wien), 1964, vol. 59, p. 240—265.
Simar L. J. Ullrastructure et constitu-
tion des corps nucleaires dans les
plasmocvtes.— Z. Zellforsch., 1969,
Bd. 99, S. 235-251.
Simpson L. The kinetoplast of the he-
moflagellates.— Intern. Rev. Cytol.,
1972, vol. 32, p. 140—207.
Sinclair J. II., Sevens В. J. Circular
DNA filaments from mouse mito-
chondria.— Proc. Nat. Acad. Sci.
U.S., 1966, vol. 56, p. 508-514.
Sirlin J. L. The nucleolus.— Progr.
Biophys., 1962, vol. 12, p. 25—66.
Sjostrand F. The ultrastructure of cells
as revealed by the electron micros-
cope.— Intern. Rev. Cytol., 1956,
vol. 5, p. 455—533.
Sjostrand F. S. The ultrastructure of
the retinal receptors of the vertebra-
te eye.— Ergebn. Biol., 1959, Bd. 21,
S. 128-160.
Sjostrand F. Electron microscopy of
the retina.— In: The structure of the
eye/Ed. G. Smeller. N. Y.: Acad.
Press, 1961, p. 1-29.
Sjostrand F. S., Rhodin J. The ultra-
structure of the proximal convoluted
tubules of the mouse kidney as re-
vealed by high resolution electron
microscopy.— Exp. Cell Res., 1953,
vol. 7, p. 429—456.
Sligh M. A. The biology of cilia and
flagella. N. Y.: Pergamon Press,
1962.
Small J. V., Davies H. G. The haemo-
globin in the condensed chromatin of
mature amphibian erythrocytes: a
further study.— J. Cell Sci., 1970,
vol. 7, p. 15—33.
Smetana K., Freireich E. J., Buseh H.
Chromatin structures in ring-shaped
nucleoli of human lymphocytes.—
« 275 »
ЛИТЕРАТУРА
Exp. Cell Res., 1968, vol. 52, p. 112—
128.
Smetana K., Unuma T., Busch II. Ul-
trastruclural studies on nucleic acids
of nucleolar granular components in
Novikoff hepatoma cells.— Exp. Cell.
Res., 1968, vol. 51, p. 105—122.
Smith D. S. The organization of flight
muscle fibers in the odonata.— J.
Cell Biol., 1966, vol. 28, p. 109—126.
Smitk-Sonneborn J., Plant W. Eviden-
ce for the presence of DNA in pel-
licle of Paramecium.— J. Cell Sci.,
1967, vol. 2, p. 225—234.
Smith-Sonneborn J., Plant W. Studies
on the autonomy of pellicular DNA
in Paramecium.— J. Cell Sci., 1969,
vol. 5, p. 365—372.
Sorokin S. P. Reconstruction of cent-
riole formation and ciliogenesis in
mammalian lungs.— J. Cell Sci.,
1968, vol. 3, p. 207—230.
Spornitz U. M. Some properties of cris-
talline inclusion bodies in oocytes of
Rana lemporaria and Rana esculen-
ta.— Experientia, 1972, vol. 28,
p. 66—67.
Spornitz U. Kress A. Yolkplatelet
formation in oocytes of Xenopus lae-
vis (Daudin).—Z. Zellforsch., 1971,
Bd. 117, S. 235—251.
Spring II., Krohne G., Franke W. W.
et al. Homogenity and heterogenity
of sizes of transcriptional units and
spacer regions in nucleolar genes of
Acetabularia.—J. Microsc. Biol., Cell.,
1976, vol. 25, p. 107—116.
Srivastava В. I. S. Cytokinins in
plants.— Intern. Rev. Cytol., 1967,
vol. 22, p. 349—372.
Stang-Voss Ch. Zur Entstehung des
Golgi-Apparates: elektronenmikro-
skopische Untersuchungen an Sper-
matiden von Eisenia foetida (An-
nelidae).— Z. Zellforsch., 1970a,
Bd. 109, S. 287-296.
Stang-Voss C., Staubesand J. Uber die
Neubildung von Mitochondrien:
elektronenmikroskopische Untersu-
chungen an Spermatiden von Eise-
nia foetida (Annelidae).—Z. Zell-
forsch., 1970b, Bd. Ill, S. 127—142.
Stanley H. P. An electron microscope
study of spermiogenesis in the tele-
ost fish Oligottus maculosus.— J. Ul-
trastruct. Res., 1969, vol. 27, p. 230—
243.
Stegner II. E. Die elektronenmikrosko-
pische Struktur der Eizelle.— Er-
gebn. Anal, und Entwicklungsgesch.,
1967, Bd. 39, S. 1—113.
Sterba G., Schaffner II. Fluoreszenz-
mikroskopischer Nachweis des DNS
in Lampenburstenchromosomen mit
NN - Diathylpseudoisocyaninchlo -
rid.— Histochemie, 1965, Bd. 5,
S. 260—278.
Stevens В. J. The fine structure of the
nucleolus during mitosis in the gras-
shopper neuroblast cell.— J. Cell Bi-
ol., 1965, vol 24, p. 349—368.
Stockert J. C., Fernandez-Gomez M. E.,
Gimenez-Martin G., Lopez-Saez J. F.
Organization of argirophilic nucleo-
lar material throughout the division
cycle of meristematic cells.— Proto-
plasma, 1970, Bd. 69, S. 265—278.
Stubblefield E. The structure of mam-
malian chromosomes.— Intern. Rev.
Cytol., 1973, vol. 35, p. 1—60.
Studitsky A. N. Materialien zur Mor-
phologic von Dileptus gigas Stein.—
Arch. Protistenk., 1930, vol. 70,
p. 155—184.
Studitsky A. N. Uber die Morphologic,
Cytologie und Systematik von Pty-
chostomam chationi.— Arch. Protis-
tenk., 1932, vol. 76, p. 188—216.
Studitsky A. The nature and origin of
nuclear organelles.— Acta fac. med.
Univ. Purkynianae Brunensis, 1974,
N 49, p. 181-237.
Studitsky A. N. The Darwin-Severtzov’
Rule and its significans for the the-
ory of evolutionary origin of the
cell structure.— Evolutionary Biolo-
gy, Praha, 1976, p. 309-324.
Summers 11. G. An ultrastructural stu-
dy of the spermatozoon of Euden-
derrum ramosum.— Z. Zellforsch.,
1972, vol. 132, S. 177.
Sung II. S. Relationship between mi-
tochondria and yolk platlets in de-
veloping cells of amphibian embry-
os.— Exp. Cell Res., 1961, vol. 25,
p. 702—703.
Sunkara P., Wright D., Rao P. M. Pre-
liminary characterization of chro-
mosome condensation factor (s)
from mammalian mitotic cells.— J.
Cell Biol., 1979, vol. 83, N 2, p. 2,
CCO13 (Abstr.).
Szollosi D. Extrusion of nucleoli from
pronuclei of the rat.— J. Cell Biol.,
1965, vol. 25, p. 545—562.
Tashiro V., Matsuura S., Morimoto T.,
Nagata S. Extrusion of nuclear ma-
terials into cytoplasm in the posteri-
« 276 »
ЛИТЕРАТУРА
or silk gland cells in silkworm, Bom-
byx mori.— J. Cell Biol., 1968, vol.
36, p. C5—CIO.
Taylor D. L. Chloroplasts as symbiotic
organelles.— Intern. Rev. Cytol.,
1970, p. 29-64.
Taylor J. Autoradiographic studies of
the organization and mode of dup-
lication of chromosomes.— Symp.
Mol. Biol. Chicago, 1959, p. 304—
321.
Taylor J. II. The arrangement of chro-
mosomes in the mature sperm of
the grasshopper.— ,T. Cell Biol., 1964,
vol. 21, p. 286—289.
Teplitz R. L., Gustafson P. E., Pellelt
0. L. Chromosomal distribution in
interspecific in vitro hybrid cells.—
Exp. Cell. Res., 1968, vol. 52, p. 379—
391.
T etsuaki 0., Sayoko M., Isamu 0. For-
mation and division of giant Mito-
chondria during the cell cycle of
Euglena gracilis in synchronous cul-
ture. I. Some characteristics of chan-
ges in the morphology mitochondria
and oxygen uptake activity of
cells.— Plant Cell Physiol., 1975, vol.
16, p. 313—326.
The cell in mitosis / Ed. L. Levine.
New York; London: Acad. Press,
1963.
The chromosomes of the algae / Ed.
M. Godward. L.: Arnold, 1966.
Themann H., Bassewits D. B. Parakri-
stalline Einschlusskorper der Mito-
chondrion des mensclichen Leberpa-
renchyms. Elektronenmikroskop-
ische und histochemische Untersu-
chungen.— Cytobiologie, 1969, Bd. 1,
S. 135-151.
Thomas R. J. Cytokinesis during ear-
ly development of a teleost embryo:
Brachydanio rerio.— J. Ultrastruct.
Res., 1968, vol. 24, p. 238—338.
Tobler II. Occurence and developmen-
tal significance of gene amplifica-
tion.— In: The biochemistry of ani-
mal development / Ed. R. Weber.
N. Y.: Acad. Press, 1975. Vol. 3. Mo-
lecular aspects of animal develop-
ment, p. 91—143.
Tourte Y. Etude infrastructurale de
1’oogenese chez une Pteridophyte. I.
Evolution des structures nucleai-
res.— J. Microsc., 1975a, vol. 22,
p. 87-108.
Tourte Y. Elude infrastructurale de
1’oogenese chez une Pteridophyte.
II. Evolution des mitochondries el
des plastes.—J. Microsc. Biol. Cell,
1975b, vol. 23, p. 301—316.
Trager IF. The cytoplasm of Proto-
zoa.— In: The Cell / Ed. J. Brachet,
A. E. Mirsky. New York; London:
Acad. Press, 1964, vol. 6, p. 81—137.
Umma T., Floyd L. R., Busch II. Se-
lective removal of the perinucleolar
nucleolus-associated chromatin from
the isolated nucleoli of livers of thio-
acetamide treated rats.— Exp. Cell,
Res., 1967, vol. 52, p. 101—111.
Unzelman J. M., Healey P. L. Develop-
ment and histochemistry of nuclear
crystals in the secretory trichome of
Pharbitis nil.— J. Ultrastruct. Res.,
1972, vol. 39, p. 301-309.
Vignais P. V., Stevens В. J., Iluet J.,
Andre J. Mitoribosomes from Candi-
da utilis. Morphological, physical and
chemical characterization of the mo-
nomer form and its subunits.— J.
Cell BioL, 1972, vol. 54, p. 468—492.
Voelz II. Structural comparison bet-
ween intramitochondrial and bacte-
rial crystalloids.— J. Ultrastruct.
Res., 1968, vol. 25, p. 29-36.
Wagner R. P. Genetics and phenoge-
netics of mitochondria.— Science,
1960, vol. 163, p. 1026—1031.
Ward R. T. The origin of protein and
fatty yolk in Rana pipiens. II. Elec-
tron microscopical and cytochemical
observations of young and mature
oocytes.— J. Cell Biol., 1962, vol. 14,
p. 309-341.
Ward R. T., Ward E. The multiplica-
tion of Golgi bodies in the oocytes
of Rana pipiens.— J. Microsc., 1968,
vol. 7, p. 1007—1020.
Weakley B. S. Granular cytoplasmic
bodies in oocytes of the golden ham-
ster during the postnatal period.—
Z. Zellforsch., 1969, vol. 101, p. 394.
Wessing A. Der Nucleolus und seine
Beziehungen zu den Ribosomen des
Cytoplasmas. Eine Untersuchung an
den Malpighischen Gefiissen von
Drosophila melanogaster.— Ztschr.
Zellforsch., 1965, Bd. 65, S. 445-480.
Whaley W. G. Propasales conclurning
replication of the Golgi apparatus.—
In: Probleme der biologischen Re-
duplikation / Ed. P. Sitte, Heidel-
berg: Sitte, p. 340—371.
While R. H., Surdeen C. D. The effect
of light and light deprivation upon
the ultraslructure of the larval mos-
« 277 »
ЛИТЕРАТУРА
quite eye. I. Polyribosomes and en-
doplasmic reticulum.— J. Exp. Zool.,
1967, vol. 164, p. 461—477.
Wischnitzer S. The ultrastructure of
the cytoplasm of the developing am-
phibian egg.— Adv. Morphogenesis,
1986, vol. 5, p. 179.
Wischnitzer S. An electron microscope
study of cytoplasmic organellae
transformations in developing mou-
se oocytes.— Roux’ Arch. Entwic-
klungsmech. Organismen, 1970a, vol.
196, p. 150—172.
Wischnitzer S. The annulate lamel-
lae.— Intern. Rev. Cytol., 1970b,
vol. 27, p. 65—100.
Wohlfarth-Bottermann К. E. Die elek-
tronenmikroskopische Untersuchung
cytoplasmatischer Strukturen.— Zo-
ol. Anz., 1960, Bd. 23 (suppl.),
S. 393-419.
Wohlfarth-Bottermann К. E. Morpho-
logische Aspekte der Mitochondrien-
Vermehrung.— In: Probleme der
biologischen Reduplikation /Ed.
P. Sitte. Heidelberg: Sitte, 1966,
p. 289—313.
Wollgiehn /{. Plastiden als genetisches
System.— In: Molekulare Biologie
der Zelle / Ed. H. Bielka. Stuttgart:
Fischer, S. 600—610.
Wolstenholme D. K., Dawicl J. B. Cir-
cular mitochondrial DNA from Xe-
nopus laevis and Rana pipiens.—
Chromosoma, 1967, vol. 20, p. 445—
449.
Woodcock Ch. L. F., Bogorad L. Evi-
dence for variation in the quantity
of DNA among plastids of Acetabu-
laria.— J. Cell. Biol., 1970, vol. 44,
p. 361-375.
Yasuzumi G. Electron microscope stu-
dies on spermatogenesis in various
animal species.— Int. Rev. Cytol.,
1974, vol. 37, p. 53—119.
Yasuzumi G., Onra C. Spermatogene-
sis in animals as revealed by elect-
ron microscopy. XV. The fine struc-
ture of the middle piece in the de-
veloping spermatid of the silkworm,.
Bombus mori Linne.— Z. Zellforsch.,
1965, Bd. 67, S. 502—520.
Yasuzumi G., Sugioka I., Tsubo I.,
Matano Y. Spermiogenesis in ani-
mats as revealed by electron micro-
scopy. XIX. Peculiar granular body-
clusters in early spermatid nuclei
of grasshopper.— Z. Zellforsch., 1970,
Bd. 109, S. 450—464.
Yasuzumi G., Sugioka P., Tsubo I. et
al. Spermatogenesis in animals as
revealed by electron microscopy.
XX. Relationship between chroma-
toid bodies and centriole adjunct in
spermatids of grasshopper, Acrida:
lata.— Z. Zellforsch., 1970, Bd. 110,
S. 231-242.
Zihler J. Zur Gametogenese und Bef-
ruchtungsbiologie von Hidra.—
Roux’ Arch. Entwicklungsmech. Or-
ganismen, 1972, Bd. 169, S. 239—267,
Zimmerman A. M., Marsland D. A.
Cell division: effects of pressure on
the mitotic mechanisms of marine
eggs (Arbacia punctulata).— Exp,
Cell Res., 1969, vol. 35, p. 293—303,
Zissler D. Die Spermiogenese des Siis-
swasser — Ostracoden Notodromus
monacha O. F. Muller. I. Die ovalen
und spindelformigen Spermatiden.—
Z. Zellforsch., 1968a, Bd. 96, S. 87—
105.
Zissler D. A. Die Spermiohistogenese
des Siisswasser-Ostracoden Notodro-
mus monacha O. F. Muller. II. Dio
spindelformigen und schlauchformi-
gen Spermatiden.— Z. Zellforsch.,
1968b, vol. 96, S. 106-133.
ОГЛАВЛЕНИЕ
Предисловие .................................. 3
Введение
ПРОБЛЕМА ЭВОЛЮЦИОННОЙ МОРФОЛОГИИ КЛЕТКИ
Часть первая
ОНТОГЕНЕЗ И ФИЛОГЕНИЯ КЛЕТКИ
Глава первая
Пути разработки проблемы онтогенеза клетки... 10
Глава вторая
Онтогенез клетки начинается с телофазы....... 16
Глава третья
Онтогенез и филогения ядрышка................ 34
Глава четвертая
Онтогенез и филогения мембранных структур клетки 67
Глава пятая
Онтогенез и филогения клетки как целого...... 94
Часть вторая
ФУНКЦИОНАЛЬНАЯ МОРФОЛОГИЯ
И ФИЛОГЕНИЯ КЛЕТКИ
Введение
Клетка строится из органелл................. 122
Глава первая
Строительная активность субклеточных компонентов
женской половой клетки...................... 126
Глава вторая
Строительные процессы в развивающейся мужской
половой клетке ............................. 142
Глава третья
Строительство жгутиковой конструкции спермия .... 161
Глава четвертая
Субклеточная основа строительной активности сомати-
ческих клеток............................... 175
« 279 »
ОГЛАВЛЕНИЕ
Глава пятая
Ассимиляционная и секреторная активность клетки и
ее филогенетическое значение..................... 189
Глава шестая
Репродукционная функция клетки и ее эволюционное
значение......................................... 218
Послесловие...................................... 247
Литература....................................... 258
АЛЕКСАНДР НИКОЛАЕВИЧ
СТУДИТСКИЙ
ЭВОЛЮЦИОННАЯ
МОРФОЛОГИЯ КЛЕТКИ
Утверждено к печати Институтом эволюционной морфологии
и экологии животных им. А. Н. Северцова Академии наук СССР
Редактор издательства И. С. Левитина. Художник В. А. Пузанков
Художественный редактор Н. И. Власик. Технический редактор Т. Д. Панасюк
Корректоры А. Б. Васильев, Ю. Л. Посорыгин
ИВ № 17295
Сдано в набор 12.09.80. Подписано к печати 19.12.80. Т-21817. Формат 60х90>/ц
Бумага люксоарт Гарнитура обыкновенная Печать высокая. Усл. печ. л. 17,5
Уч.-изд. л. 19,8 Тираж 2650 экз. Тип. зак. 3501 Цена 2 р. 30 к.
Издательство «Наука» 117864 ГСП-7, Москва, В-485, Профсоюзная ул., 90
2-я типография издательства «Наука» 121099, Москва, Г-99, Шубинский пер., 10