Автор: Гриценко В.В. Орловский П.И. Юхнев А.Д. Евдокимов С.В. Гавриленков В.И.
Теги: хирургия ортопедия офтальмология здравоохранение медицинские науки медицина кардиология кардиохирургия
ISBN: 978-5-373-00314-8
Год: 2007
П. И. ОРЛОВСКИЙ, В. В. ГРИЦЕНКО, А. Д. ЮХНЕВ,
С. В. ЕВДОКИМОВ, В. И. ГАВРИЛЕНКОВ
ИСКУССТВЕННЫЕ
КЛАПАНЫ
СЕРДЦА
Под редакцией академика РАМН
Ю. Л. ШЕВЧЕНКО
топмд
11_ МРЛИАГРУПП
МЕДИАГРУПП
Москва
2007
ББК 54 57
УДК 617 5
И 86
Орловский П. И., Гриценко В. В., Юхнев А. Д., Евдокимов С. В.,
Гавриленков В. И.
И 86 Искусственные клапаны сердца / Под редакцией академика РАМН
Ю. Л. Шевченко — СПб.; ЗАО «ОЛМА Медиа Групп», 2007. - 448 с., ил.
ISBN 978-5-373-00314-8
Книга является первым в России руководством по методологии исследования
и применения искусственных клапанов сердца. В издании представлена самая
полная и новейшая информация обо всех моделях протезов клапанов сердца, при-
меняемых в кардиохирургии в нашей стране и за рубежом Приведены необходи-
мые для специалистов сведения по анатомии, морфологии и биомеханике есте-
ственных клапанов сердца человека. Подробно описаны конструктивные особен-
ности и техника имплантации механических и биологических заменителей сердеч-
ных клапанов.
В книге представлен краткий исторический обзор создания и исследования
искусственных клапанов сердца в нашей страны и за рубежом Показан неоцени-
мый вклад в эту проблему академика РАМН Ф. Г Углова — пионера операций на
клапанах сердца в условиях искусственного кровообращения и инициатора раз-
вития новых моделей механических клапанов.
Книга предназначена для кардиохирургов, кардиологов, разработчиков новых
конструкций клапанов, интернов, ординаторов, аспирантов, студентов медицин-
ских и технических ВУЗов, других специалистов, занимающихся данной пробле-
мой, а также всех, интересующихся историей кардиохирургии
ББК 54.57
УДК 617.5
Научное издание
Ответственный за выпуск И А Корешкин
Редактор Н Ю Крамер
Оформление обложки В А Гусакова
Верстка Н А Платоновой
Оформление вкладки Л П Роговой
Подписано в печать 19 06 2007
Формат 70x100 1/1б Гарнитура Прагматика
Бумага офсетная Печать офсетная
Уч-изд л 34,0 Усл печ л 36,12 Изд № ОП-06-0023-РСВ
Тираж 1500 экз Заказ № 0717460
ЗАО ОЛМА-МЕДИА ГРУПП»
105062, Москва, ул Макаренко, д 3, стр 1
http /www olmamedia ru
ISBN 978-5-373-00314-8
Отпечатано в полном соответствии с качеством
предоставленного электронного оригинал-макета
в ОАО «Ярославский полиграфкомбинат»
150049 Ярославль, ул Свободы, 97
© П. И Орловский, В В Гриценко, А Д. Юхнев,
С. В Евдокимов, В И Гавриленков, 2007
© ЗАО «ОЛМА Медиа Групп», 2007
I
ОБ АВТОРАХ
Орловский Павел Иванович — кардиохирург,
доктор медицинских наук, профессор кафед-
ры госпитальной хирургии Ng 2 СПбГМУ им акад
И П Павлова, автор 250 научных публикации,
в том числе 4 монографий и 22 изобретении Ос-
новное направление научной работы — оценка го-
меостаза больных с искусственными клапанами
сердца
Гриценко Владимир Викторович — кардиохи-
рург, доктор медицинских наук, профессор, заве-
дующий кафедрой госпитальной хирургии № 2
СПбГМУ им акад. И П. Павлова, автор 400 науч-
ных публикаций, в том числе 5 монографий Ос-
новное направление научной работы — исследо-
вание легочной гипертензии и разработка комп-
лексной программы реабилитации больных с по-
роками сердца
Юхнев Андрей Данилович — ведущий инженер
кафедры гидроаэродинамики Санкт-Петербургско-
го Государственного политехнического универси-
тета, автор 50 научных публикаций, в том числе мо-
нографии и изобретения. Основное направление
научной работы — гидромеханика кровообраще-
ния, экспериментальная гидро- и аэродинамика.
о
Евдокимов Сергей Васильевич — генеральный
директор ЗАО КПП «МедИнж», выпускающего ме-
ханические искусственные клапаны сердца, канди-
дат технических наук, автор 130 научных публика-
ций и 82 изобретении Основное направление на-
учной деятельности — разработка искусственных
клапанов сердца и медицинских изделий для сер-
дечно-сосудистой хирургии
Гавриленков Владимир Иванович — кардиохи-
рург доктор медицинских наук, профессор кафед-
ры госпитальной хирургии № 2 СПбГМУ им акад
И П Павлова, автор 65 научных публикаций, в том
числе одной монографии и 5 изобретений Основ-
ное направление научной деятельности — раз-
работка и исследование биопротезов клапанов
сердца
ОГЛАВЛЕНИЕ
5
ВВЕДЕНИЕ (В. В Гриценко, П И Орловский. А. Д. Юхнев) ...... -
ГЛАВА 1. АНАТОМИЯ, МОРФОЛОГИЯ И ФУНКЦИЯ КЛАПАНОВ СЕРДЦА
ЧЕЛОВЕКА (В И Гавриленков, П И. Орловский, А. Д Юхнев В. В. Гриценко) .... 9
У
21
23
26
28
34
Аортальный клапан ............................
Клапан легочной артерии
Митральный клапан ............ ................*
Трикуспидальным клапан .. . .
Морфология клапанов - ..................... • • * • • ....
Литература................- • ..........• •............ • ..
ГЛАВА 2. МЕХАНИЧЕСКИЕ ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
(П И орловский А Д Юхнев С В Евдокимов В В. Гриценко, 1 А Вербовая
Лепестковые клапаны • ..........- .....
Осесимметричные клапаны . . • • •.......................
Поворотно-дисковые клапаны .... - ....
Двустворчатые клапаны . . ......- - ......................
История производства отечественных механических искусственных клапанов
сердца ......... . • -............. .............................
Техника имплантации ............- • .... .....
Литература .................. • • .................................
ГЛАВА 3. БИОЛОГИЧЕСКИЕ ЗАМЕНИТЕЛИ КЛАПАНОВ СЕРДЦА
(В И. Гавриленков. П И. Орловский, А Д Юхнев, В. В Гриценко, Д В Маслевцов) 139
Стгл/кт\/оная стабилизация консеовация и стерилизация биоткани .......140
150
158
168
173
183
194
40
40
47
64
72
86
105
123
Структурная стабилизация консервация и стерилизация биоткани
Каркасные биопротезы ..... . .................... .. ..
Бескаркасные биопротезы и гомографты ................
Клапаны тканевой инженерии...........................
Развитие отечественного биопротезирования
Техника имплантации
Литература .
ГЛАВА 4. ГИДРОДИНАМИКА ИСКУССТВЕННЫХ КЛАПАНОВ СЕРДЦА
(А Д Юхнев П И Орловский, В И Гавриленков, С В Евдокимов, Ю В Лапин) .
Гидродинамика клапанов сердца человека
Физическое моделирование кровотока в клапанах сердца .....
Интегральные гидродинамические характеристики клапанов
Локальные гидродинамические характеристики потока в клапанах
Математическое моделирование структуры кровотока
Отечественные исследования гидродинамики клапанов сердца
Литература
ГЛАВА 5. МАТЕРИАЛЫ ДЛЯ ИСКУССТВЕННЫХ КЛАПАНОВ СЕРДЦА
(А С Евдокимов, П И Орловский, А Д Юхнев)
Физико-химические свойства биоматериалов
Гемосовместимость биоматериалов
Отечественные исследования биосовместимости материалов
Надежность и долговечность клапанов
Прочность конструкции
Литература...
ПроТЕЗИрОВАНИЯ И КЛАПАННО-ЗАВИСИМЫЕ
ОСЛОЖНЕНИЯ (П И Орловский, В В. Гриценко, Т В Вавилова, М И Кадинская,
В С Беркис) в
Ближайшие и отдаленные результаты протезирования клапанов сердца
Специфические клапанно-зависимые осложнения
Профилактика тромбозов и тромбоэмболических осложнении
Литература
ЗАКЛЮЧЕНИЕ (В В Гриценко П И Орловский А Д Юхнев)
211
211
216
. 224
. 232
246
256
291
301
. 302
. 312
317
. .. 343
350
357
366
366
375
392
418
435
ВВЕДЕНИЕ
По-существу, было бы правильнее дать несколько иное название настоящей моно-
графии, а именно «Протезы (заменители) клапанов сердца», т е использовать тер-
мин, включающий в себя не только механические (искусственные), но и биологиче-
ские (естественные) сердечные клапаны Тем не менее, отдавая должное правильной
терминологии, мы сохранили название «Искусственные клапаны сердца », которое тра-
диционно и широко вошло в отечественную практическую медицину как понятие, ана-
логичное протезам или заменителям сердечных клапанов
В нашей стране выполнение первых операций протезирования клапанов сердца от-
носится к 1960-1963 гг Одним из пионеров имплантации механических искусственных
клапанов сердца стала возглавляемая тогда академиком РАМН Ф Г Угловым кафедра
госпитальной хирургии с клиникой I Ленинградского медицинского института им акад.
И. П. Павлова (ныне Санкт-Петербургский Государственный медицинский университет
им акад. И. П Павлова).
Однако проведение уже в те далекие годы операций протезирования митрального
и аортального клапанов у больных пороками сердца наглядно показало что несмотря
на получение хороших и удовлетворительных результатов в ближайшие и отдаленные
сроки наблюдения, функционировавшие в организме оперированных пациентов пер-
воначально разработанные типы шаровых конструкций искусственных клапанов серд-
ца оказались еще весьма далеки от совершенства по целому ряду конструктивных и
функциональных показателей. Основными недостатками шаровых искусственных кла-
панов сердца были их большие габариты высокое сопротивление и нарушение есте-
ственной структуры кровотока в полостях сердца и аорте Опыт клинического наблю-
дения за оперированными больными также показал, что, несмотря на проведение ан-
тикоагулянтной терапии под контролем протромбинового времени у пациентов-носи-
телей шаровых искусственных клапанов сердца, имели место, и довольно часто раз-
личные тромбоэмболические осложнения и тромбозы клапанов Все это послужило
мотивом и основанием к поиску и разработке новых, более совершенных моделей ис-
кусственных клапанов сердца
Идея написания этой книги возникла в результате желания авторов обобщить свой
и мировой сорокалетний опыт разработки и исследования новых экспериментальных
моделей механических искусственных клапанов сердца, в том числе и с тромборезис-
тентным покрытием, а также биопротезов, защищенных более чем 20 авторскими сви-
детельствами и патентами В монографии представлены результаты совместной рабо-
ты сотрудников кафедр госпитальной хирургии Санкт-Петербургского Государственного
медицинского университета им акад И П. Павлова кафедры гидроаэродинамики
Санкт-Петербургского Государственного политехнического университета, медицинского
отдела НПО «Гранит», НЦССХ им А. Н Бакулева РАМН, НИИ ТОиТ М3 РФ Следует так-
же подчеркнуть, что один из ее авторов является руководителем коллектива, приняв-
шего активное участие в разработке, создании и исследовании ряда известных отече-
ственных механических искусственных клапанов сердца, которые в настоящее время
серийно выпускаются в нашей стране на Кирово-Чепецком химическом комбинате и в
НПП «МедИнж» в г Пенза
С начала 60-х гг XX в выполнены многие десятки тысяч операций протезирования
клапанов сердца, оценены ближайшие и отдаленные результаты исследована структу-
ра кровотока в полостях сердца и в аорте, разработаны новые методики исследования
биомеханических и гидродинамических характеристик, тромбообразования и гемоли-
за на искусственных клапанах сердца, биосовместимости материалов для их изготов-
ления, структурной стабилизации биологических заменителей клапанов сердца В ре-
зультате совместной деятельности изготовлены оригинальные измерительные устрой-
------------------------------------------------------ 5
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
ства и испытательные стенды В связи с тем, что до сегодняшнего дня в мире еще не
создан идеальный искусственный клапан сердца, а вопросов, связанных с особеннос-
тями движения крови в сердце и сосудах, становится все больше. тема не теряет
своей актуальности и по сей день, что требует для дальнейшей разработки данной
проблемы продолжения тесного сотрудничества кардиохирургов, инженеров и пред-
ставителей смежных специальностей.
другой важной предпосылкой для написания книги явилось желание проанализи-
ровать историю разработки и исследования заменителей клапанов сердца в России и
за рубежом, отразить закономерности их полувековой эволюции, вспомнить и отдать
должное хирургам, ученым, инженерам-изобретателям и создателям первого и после-
дующих поколений протезов клапанов Без знания этой истории невозможно выбрать
оптимальный путь дальнейшего совершенствования новых моделей клапанов.
Следует отметить, что в нашей стране и за рубежом выпущен ряд монографий, гла-
вы которых частично или полностью посвящены данной тематике. Наиболее известны-
ми монографиями и обзорными статьями являются; «Протезирование клапанов серд-
ца» (Петровский Б. В., Соловьев Г. М., Шумаков В. И., 1966), «Биологические протезы
клапанов сердца» (Малиновский Н. Н., Константинов Б. А., Дземешкевич С. Л., 1988),
«Первые шаги» (Бураковский В. И., 1988), «Сердечно-сосудистая хирургия: Руководство»
(под ред. В. И. Бураковского, Л. А. Бокерия, 1989), «Искусственные органы» (под ред.
В. И Шумакова, 1990), <• Биопротезы клапанов сердца: проблемы и перспективы» (Бар-
бараш Л.С., Барбараш Н.А., Журавлева И. Ю.» 1995), «История сердечно-сосудистой
хирургии» (под ред. Л. А. Бокерия, 1997; 2003), «Биомеханика» (Бегун П. И., Шукейло
Ю. А., 2000), «Болезни митрального клапана. Функция, диагностика, лечение» (Дземеш-
кевич С. Л., Стивенсон Л У., 2000); «Болезни аортального клапана. Функция, диагнос-
тика, лечение» (Дземешкевич С. Л., Стивенсон Л. У., Алекси-Месхишвили В. В., 2004),
«Биомедицинское материаловедение» (Вихров С. В., Холомина Т. А., Бегун П. И. и др.,
2006), «Диагностика и лечение осложнений у больных с искусственными клапанами сер-
дца» (Шихвердиев Н. Н., Хубулава Г Г., Марченко С. П., 2006), «Полимеры медико-био-
логического назначения» (Штильман М. И., 2006), «Prosthetic valves for cardiac surgery»
(Merendino K.A., ed., 1961), «Prosthetic heart valve» (Brewer L. A., ed. 1969), «Cardiac valve
prostheses» (Lefrak E. A., Stan A., 1979), «Tissue heart valves» (lonescu M. I , ed., 1979);
«Cardiac bioprostheses» (Cohn L.H., Gallucci V., eds. 1982); «Advances in caidiac valves»
(DeBakey M.E., ed., 1983); «Guide to prosthetic cardiac valves» (Morse D., Steiner R.M.,
Fernandez J., ed., 1985), «Biological and bioprosthetic valves» (Bodnar E., Yacoub M., eds.,
1986), «Heart valve replacement and future Trends in cardiac surgery» (Rabago G,, Cooley D. A.,
eds., 1987), -Heart valve replacement and reconstruction» (Starek P. J. K., ed., 1987), «Cardiac
surgery, current heart valve prosthesis» (Crawford F. A., ed., 1987), «Replacement cardiac
valves» (Bodnar E., Frater R., 1991), «Mechanical cardiac valvular piostheses» (Akins C. W. //
An. Thorac. Surg. 1991. Vol. 52, № 1. — P. 161-172), «Advancing the technology of
bileaflet mechanical heart valves» (Krian A., Matloff J. M„ Nicoloff D. M., eds., 1998); «Stentless
bioprosthesis» (Huysmans H.A., David T.E., Westaby S., eds., 1999), «Prosthesis Heart Valve:
History of mechanical heart valve replacement» (Campbell A. et al. // BMES. Bulletin. — 2000. —
Vol. 24, № 4. P. 3-10), «Evoluation of mechanical heart valves» (De Wall R A Qasim N
Carr L ^An' Th°rac- Sur9 " 200°- ~ V 69' № 5- - R 1612-1621), «Mechanical heart
valves: 50 years of evolution» (Gott V. L„ Alejo D. E„ Cameron D. E. // An. Thorac. Sura -
200Э. - V 76. - S. 2230-S 2239), «Mechanical heart valve prothesis: identification and
evaluation (erratum)» (Botany J et al. // Cardiovascular Pathology — 2003 — Vol 12 _P.
:Bi°lO02Cal rePlacement heart va,ves: Identification and evaluation»’(Butany J Fayet
C., Ahluwaha M.S et al. // Cardiovasc Pathol. — 2003. — Vol. 12. — p. 119—1394 «The
illustrated compendium of prosthetic heart valves» (Banarjee A , 2004)
Практическая недоступность перечисленных зарубежных книг на фоне отсутствия
40 „ биопротеэам (белее 10 лет) „илетеп^вуег „ ееОевре„в“ос™ „о,=лё”“
6 -----------
ВВЕДЕНИЕ
обобщающего руководства по истории развития, исследования и применения механи-
ческих и биологических протезов клапанов сердца российского и зарубежного произ-
водства.
Настоящая монография состоит из шести самостоятельных глав, включающих в себя
30 разделов, в которых, наряду с литературными данными, приводятся результаты и
собственных исследований. В 1-й главе представлены основные сведения по анатомии,
морфологии и биомеханике естественных клапанов сердца, учет которых является обя-
зательным для обоснования требований к изготовлению идеального протеза, макси-
мально приближенного по своим гемодинамическим и тромборезистентным характе-
ристикам к естественному клапану. 2-я глава посвящена механическим искусственным
клапанам сердца: в ней изложена история развития зарубежных конструкций, история
появления и совершенствования отечественных клапанов, анализируются особеннос-
ти имплантации механических клапанов, включая выбор типоразмера и ориентации,
вида манжеты и шовной техники, а также сохранения створок и подклапанных струк-
тур. В 3-й главе дается описание биологических заменителей клапанов сердца. В ней
изложены процессы обработки биоткани, история создания биологических замените-
лей клапанов сердца за рубежом, рассматриваются перспективные направления раз-
работки клапанов сердца на основе тканевой инженерии, история создания отечествен-
ных биопротезов и трансплантатов, особенности имплантации биоклапанов сердца.
4-я глава посвящена методам и средствам исследования гидродинамики искусствен-
ных клапанов сердца. Она включает описание экспериментальных стендов и методов
измерений, результаты расчета интегральных и локальных гидродинамических харак-
теристик потока в клапанах. Особое место уделено отечественным исследованиям.
В 5-й главе дается описание механических, физических и химических свойств матери-
алов, которые применяются для изготовления искусственных клапанов сердца, обес-
печивают надежность, долговечность и прочность конструкции. Отдельно разбирается
вопрос о биосовместимости материалов. Дается сравнительная оценка эффективнос-
ти использованных в работе экспериментальных и расчетных методов исследования.
В 6-й главе показаны ближайшие и отдаленные результаты протезирования клапанов
сердца, специфические клапанно-зависимые осложнения, профилактика тромбозов и
тромбоэмболических осложнений. В заключение приводятся сравнительные характе-
ристики механических и биологических клапанов, их достоинства и недостатки, пока-
зания к применению.
При написании монографии авторы отдают дань уважения и признательности сво-
им руководителям, учителям и друзьям, ушедшим из жизни, — докт. мед. наук про-
фессору кафедры госпитальной хирургии СПбГМУ им. акад. И. П. Павлова В. Н. Зуб-
цовскому, заведующему кафедрой гидроаэродинамики СПбГПУ докт. физ.-мат. наук
профессору Ю. В. Лапину, канд. физ.-мат. наук доценту этой кафедры О. Н. Бушмарину
и конструктору ЦНИИ «Гранит» канд. техн, наук Е. Ф. Белову. Авторы выражают благо-
дарность специалистам, принимавшим участие в проведении использованных в рабо-
те исследований: заведующему кафедрой патологической физиологии докт. мед. наук
профессору Н. Н. Петрищеву, заведующему кафедрой общей и биоорганической хи-
мии докт. хим. наук профессору К. А. Макарову и канд. техн, наук доценту И. А. Крав-
цовой, заведующей кафедрой биохимии докт. мед. наук профессору Я. В. Галебской,
докт. мед. наук профессору И. Г. Щербаку и канд. мед. наук доценту Т Ф. Субботиной,
заведующему кафедрой оперативной хирургии и клинической анатомии докт. мед. наук
профессору Г. М. Семенову и докт. мед. наук профессору О П. Большакову, директору
НИЦ докт. мед. наук профессору В. В. Томсону (СПбГМУ им. акад. И. П. Павлова), заве-
дующему лабораторией свертывания крови докт. мед. наук профессору Л. П. Папаян
(НИИТиПК М3 РФ), ст. науч. сотр. Л. А. Муковскому (НИИ токсикологии М3 РФ), канд.
техн, наук Н. П. Галич (ЦНИИ «Гранит»), доценту канд. экон, наук В. В Зябрикову (СПбГУ),
сотрудникам кафедры гидроаэродинамики СПбГПУ — заведующему докт. физ.-мат.
наук профессору Е. М. Смирнову, ведущему инженеру В. В. Григорьеву и механику
---------------------------------------------------- 7
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
Э А Вагеру. директору музея докт мед. наук профессору С П Глянцеву (НЦ ССХ
им А Н Бакулева, директор — акад. РАМН Л А. Бокерия) и сотрудникам музея СКБ
медицинской тематики Кирово-Чепецкого химкомбината за предоставленные иллюст-
рации, директору по продажам S. Peters (Medical Carbon Research Institute, Stemfeld,
Germany) за материалы к цветной вкладке из институтского музея, а также принимав-
шим участие в оформлении монографии врачу С А. Карпову и студенту В. А. Юхневу
(СП6ГПУ)
Выражаем глубокую признательность редакции «ОЛМА МЕДИА ГРУПП» (Санкт-Пе-
тербург) за доброжелательное отношение и предоставленную возможность издать эту
монографию Авторы будут крайне благодарны за критические замечания и пожелания
по данной книге.
8
ГЛАВА 1
АНАТОМИЯ, МОРФОЛОГИЯ И ФУНКЦИЯ
КЛАПАНОВ СЕРДЦА ЧЕЛОВЕКА
Восстановление замыкательной и пропускной функции патологически измененного
клапана (клапанов) сердца человека возможно путем его замещения протезом или
трансплантатом, в результате выполнения реконструктивно-пластических или (реже)
эндоваскулярных транскатетерных операций. Для выполнения таких операций, оценки
клапанной патологии с помощью инструментальных методов исследования (прежде
всего эхокардиографии) необходимы знания современных данных по хирургической и
функциональной анатомии, морфологии и биомеханике клапанного аппарата сердца.
Эта информация также необходима конструкторам, инженерам и биотехнологам, со-
здающим заменители клапанов сердца
Сердце содержит два близких по строению входных клапана (митральный и трикус-
пидальный) и два схожих выходных (аортальный и пульмональный) клапана (рис. 1 1,
цв. вклейка, рис. 6). Фиброзые кольца митрального и трикуспидального клапанов, а
также фиброзный каркас аортального клапана, соединенные между собой с помощью
мембранозной части межжелудочковой перегородки, левого и правого фиброзных тре-
угольников, образуют фиброзный каркас сердца (рис. 1 2). Плоскость фиброзного
кольца трикуспидального клапана несколько смещена к верхушке сердца по отноше-
нию к плоскости митрального клапана, а аортальный клапан как бы вклинен между ними.
К фиброзному каркасу фиксируются створки клапанов, а также пучки миокарда пред-
сердий и желудочков. Большая прочность сердечных клапанов сочетается с их высо-
кой эластичностью. Эти качества обеспечиваются их сложной макро- и микрострукту-
рой. Эластичность клапанного аппарата позволяет демпфировать гидравлические уда-
ры в период закрытия клапанов, обеспечивает изменение формы и размеров отдель-
ных структур в течение всего сердечного цикла.
Сердце является биологическим насосом, в котором клапанные структуры
принципиально играют ту же роль, что и клапанные конструкции, применяемые в
технике и обеспечивающие одностороннее движение жидкости (крови) В среднем,
сердце человека совершает около 40 млн сокращений в течение года и перекачивает
около 2,5 млн литров крови При этом отдельные структуры клапана подвергаются
различной нагрузке. Например, во время систолы левого желудочка напряжение в теле
створок митрального клапана в 500-800 раз меньше, чем в точках крепления к ним
краевых хорд Износоустойчивость клапана обеспечивается его специфичным дизайном
и биомеханикой (Brever R.J. et al., 19 6; Thubrikar M. et al , 1980; 1993; Dagum P. et al.,
1999), а также анизотропией, достаточной прочностью высокой эластичностью и
способностью к регенерации отдельных его структур (Harvey W, 1957; Davila J С., 1961;
Swan Н.» 1962; Scott М., Vesely I , 1995)
АОРТАЛЬНЫЙ КЛАПАН
Анатомия клапана аорты считается наиболее изученной поскольку описана давно
начиная с Леонардо да Винчи (1513) и Вальсальвы (1740), и многократно, особенно на
протяжении второй половины XX столетия При этом исследования прошлых лет носи-
ли, преимущественно описательный или, реже, сравнительный характер Начиная с
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
б
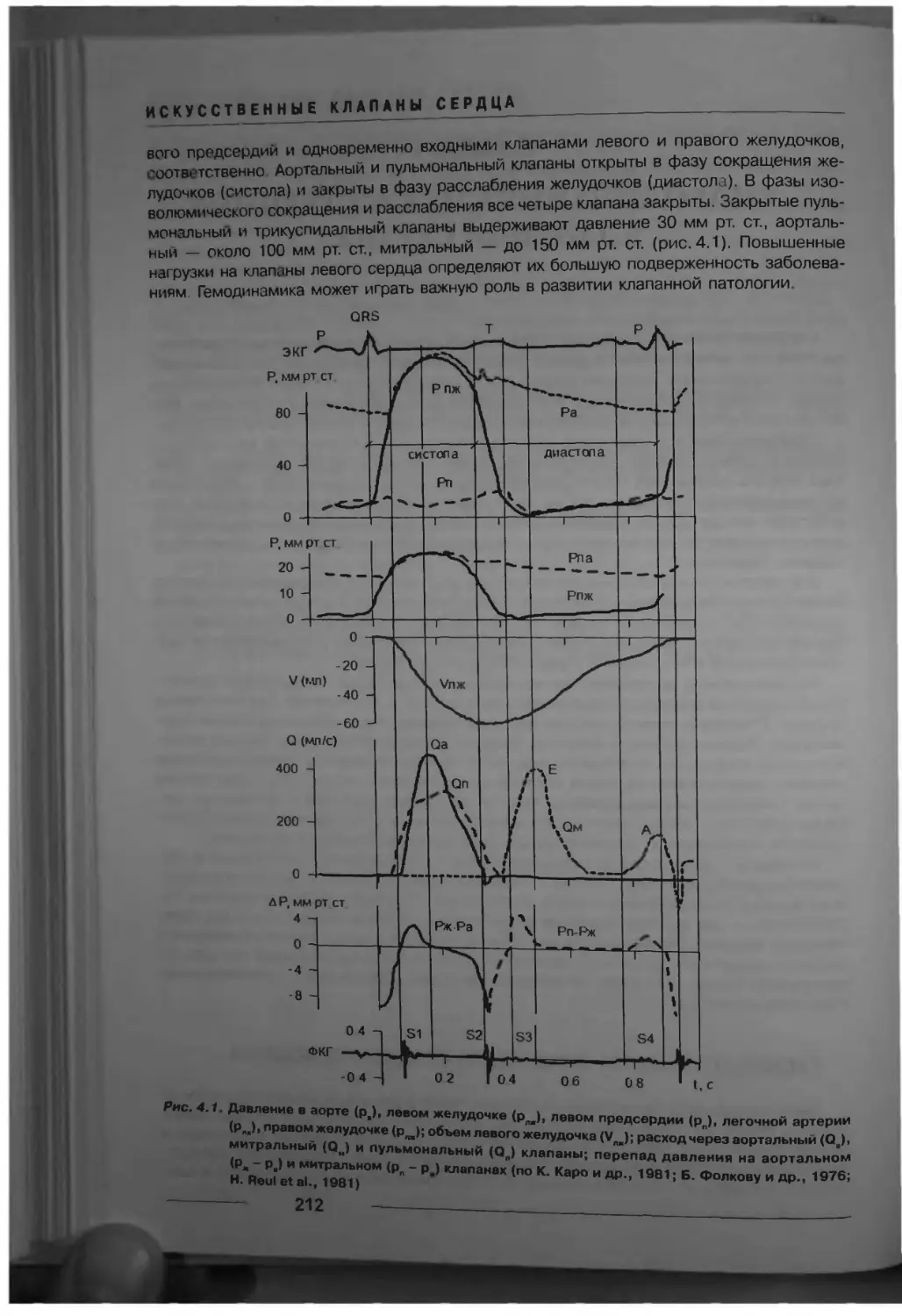
Рис. 1.1. Изображение основания сердца в систолу (а) и диастолу (б) со стороны удаленных
предсердий (по F. Н. Netter, 2003):
1 — задняя межжелудочковая ветвь (а), 1 — фиброзное кольцо митрального клапана (6), 2 — фиб-
розное кольцо митрального клапана (а); 2 — задняя створка митрального клапана (6), 3 — задняя
створка митрального клапана (а), 3 — комиссуры митрального клапана (б), 4 — передняя створка
митрального клапана, 5 — огибающая ветвь левой коронарной артерии 6 — задняя (некоронарная)
полулунная створка аортального клапана 7 — левая полулунная коронарная створка, 8 — правая
полулунная коронарная створка, 9 — левая полулунная створка пульмонального клапана 10 — пра
вая полулунная створка пульмонального клапана, 11 — передняя полулунная створка пульмональ-
ного клапана 12 — артериальный конус 13 — левый фиброзный треугольник 14 — правая коронар-
ная артерия 15 — мембранозная часть межжелудочковой перегородки (отмечена пунктирной ли-
нией), 16 — предсердно-желудочковая перегородка 17 — передняя створка трикуспидального кла-
пана 18 — перегородочная (септальная) створка трикуспидального клапана, 19 — задняя створка
трикуспидального клапана, 20 — фиброзное кольцо трикуспидального клапана, 21 — правый фиб-
розный треугольник, 22 — артериальная ветвь предсердно-желудочкового узла отходящая от пра-
вой коронарной артерии 23 — задняя межжелудочковая ветвь
10-----------------------------------------------------------------
ГЛАВА 1 Анатомия, морфология и функция клапанов сердца человека
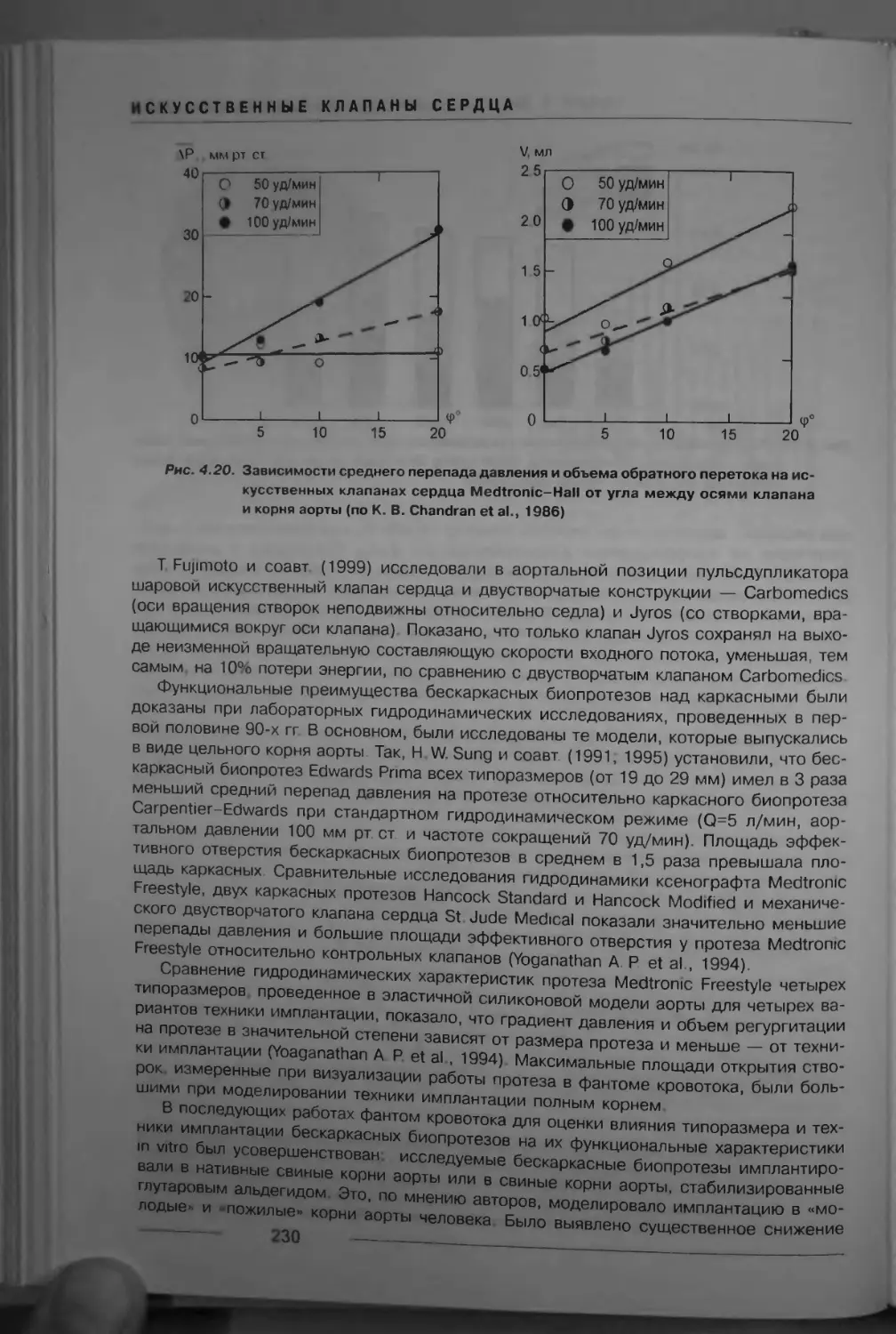
Рис. 1.2. Фиброзный каркас сердца (по Е. И. Чазову, 1982, и С. Л. Дземешкевичу и др., 2000):
1 — основание легочной артерии, 2 — корень аорты с фиброзным каркасом аортального клапана,
3 — фиброзное кольцо трикуспидального клапана, 4 — фиброзное кольцо митрального клапана,
5 — сухожилие аортального конуса 6 — левый фиброзный треугольник- 7 — митрально-аортальный
контакт, или межклапанная (субаортальная) занавеска, 8 — правый фиброзный треугольник,
9 — межжелудочковая перегородка, 10 — сухожилие Тодаро
работы J Zimmerman (1969), в которой автор предложил рассматривать «функцию кла-
пана как продолжение его структуры», большинство исследовании стало носить мор-
фофункциональный характер Такой подход в исследовании функции клапана аорты
через изучение его структуры был, в определенной мере, обусловлен методическими
трудностями прямого исследования биомеханики клапана аорты в целом Исследова-
ния функциональной анатомии позволили определить морфофункциональные грани-
цы клапана аорты, уточнить терминологию (Dagum Р et al, 1999), а также изучить в
значительной степени его функцию (Халькин А М , 1961, Копейкин Н Г, 1967, Констан-
тинов БА и др , 1989, Дземешкевич С Л и др 2004, Brewer R J et al , 1976; Anderson
R et al., 1991, Christie G W, 1992, Sutton J et al , 1995)
Благодаря этим исследованиям клапан аорты в широком понимании стали рассмат-
ривать как единую анатомо-функциональную структуру, относящуюся как к аорте, так и
к левому желудочку (Константинов БА и др ,1989; Anderson R et al., 1991).
По современным представлениям (Anderson R et al , 1991, Sutton J et al , 1995),
клапан (корень) аорты является объемной структурой воронкообразной или цилинд-
рической формы, состоящей из трех синусов, трех межстворчатых треугольников Ген-
ле, трех полулунных створок и фиброзного кольца, проксимальной и дистальной гра-
ницами которого являются, соответственно, вентрикулоаортальное и синотубулярное
соединения (рис. 1.3, 1 4, 1 5)
Реже используется термин «клапанно-аортальный комплекс» (Малиновский Н Н и
др , 1988, Sutton J et al 1995) В узком смысле, под аортальным клапаном иногда
понимают запирательный элемент, состоящий из трех створок, трех комиссур и фиб-
розного кольца (Silver М A., Roberts W.C , 1985) С точки зрения общей механики,
----------------------------—----------------------- 11
ИСКУССТВЕННЫЕ КЛАЛА Н Ы СЕРДЦА
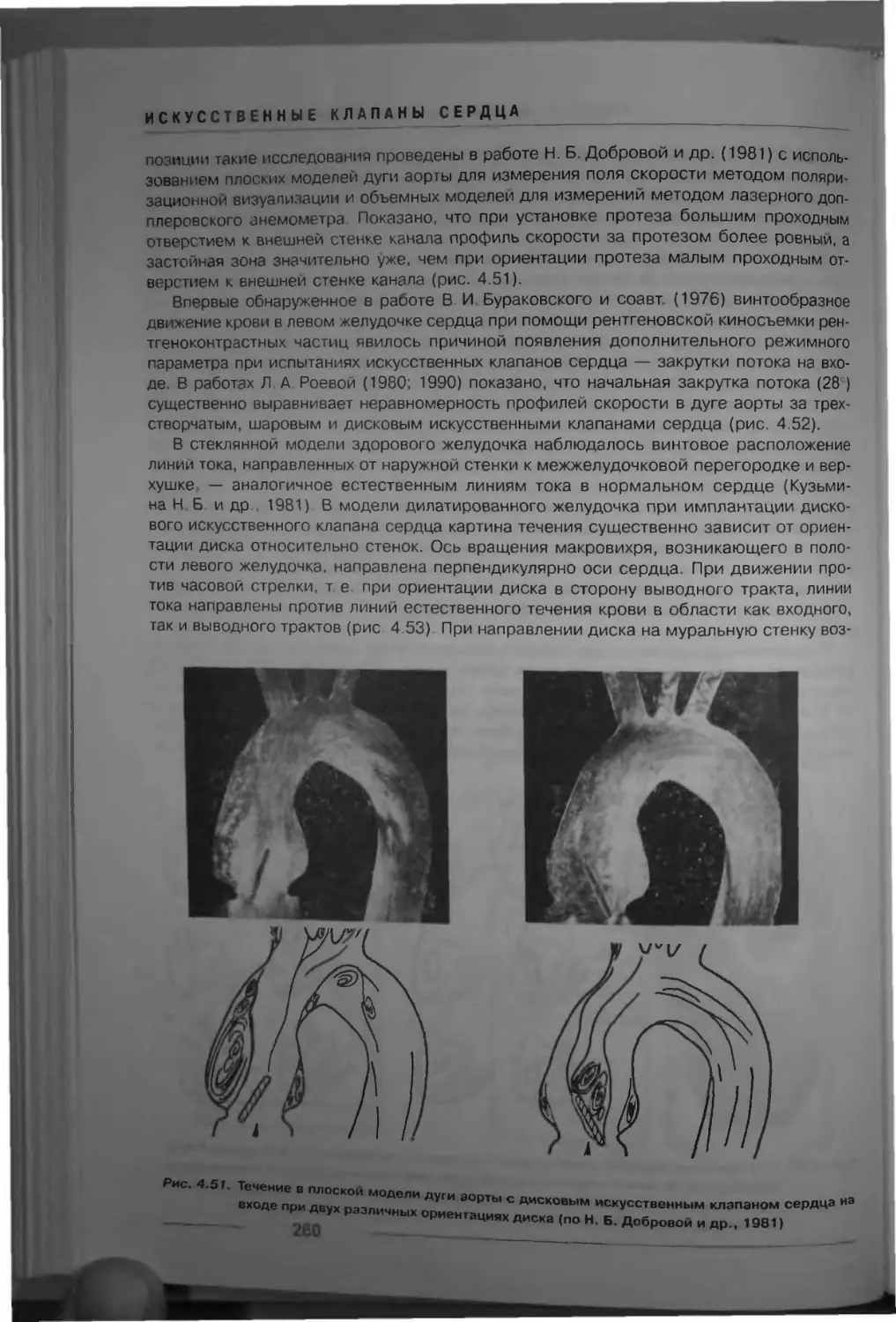
Рис. 1.3. Клапан аорты (по Р. Д Синельникову, 1979):
1 _ синус аорты, 2 — устье правой коронарной артерии, 3 — правая коронарная створка 4 — левый
желудочек; 5 — папиллярная мышца; 6 — хорды 7 — передняя створка митрального клапана,
8 — некоронарная створка, 9 — левая коронарная створка, 10 — ушко левого предсердия;
11 — узелок Аранци, 12 — левая коронарная артерия, 13 — аорта
клапан аорты рассматривают как композитную структуру, состоящую из прочного фиб-
розного (силового) каркаса и размещенных на нем относительно тонких оболочечных
элементов (стенки синусов и створки) Деформации и перемещения этого каркаса про-
исходят под действием внутренних сил, возникающих в закрепленных на нем оболоч-
ках Каркас, в свою очередь, определяет деформации и перемещения оболочечных эле-
ментов (Малиновскии НН и др., 1988) Каркас состоит, преимущественно, из плотно
упакованных коллагеновых волокон (Константинов БА и др , 1980, 1989, Малинов-
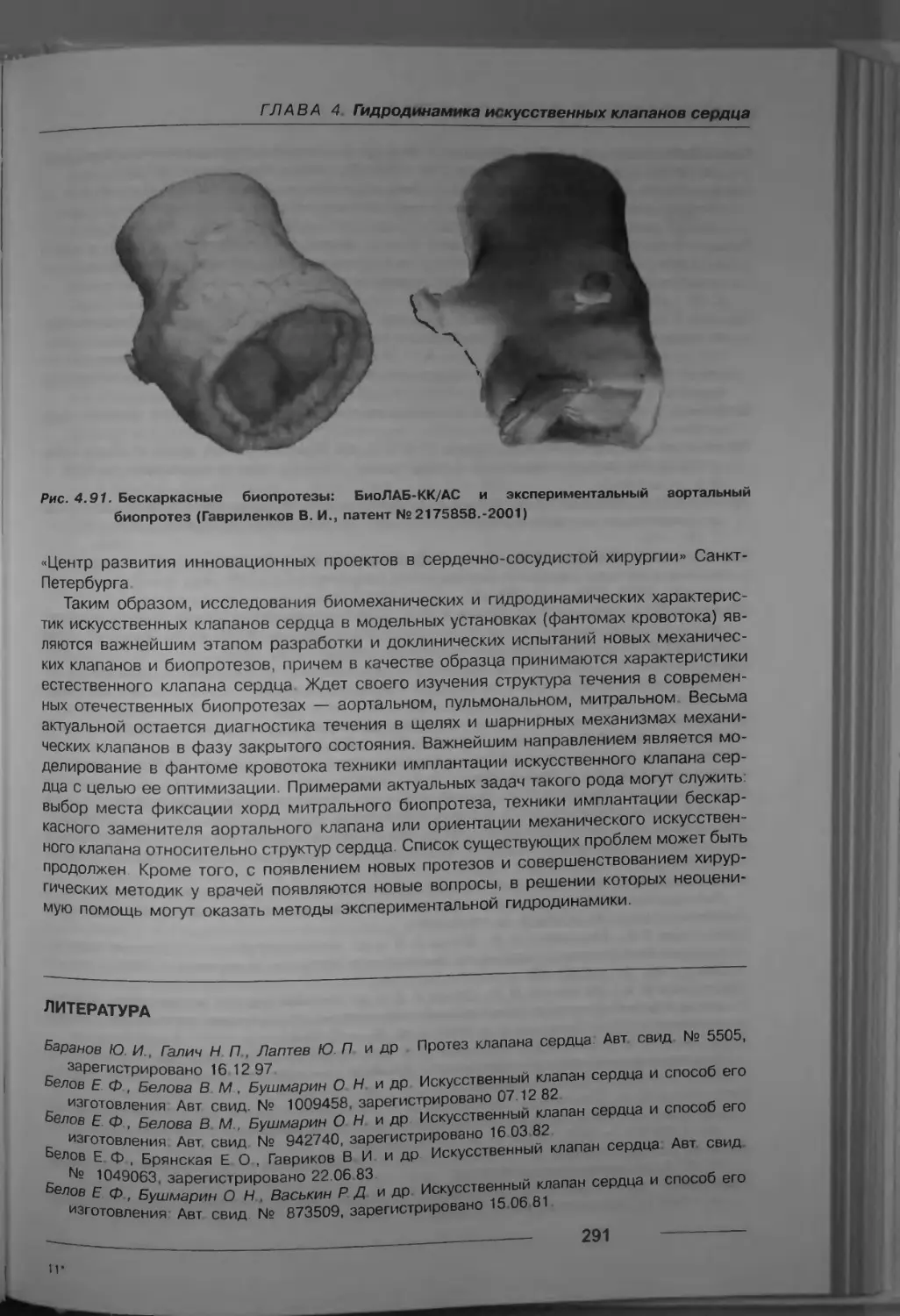
Рис. 1.4. Аллогенный корень аорты:
а - препарат с удаленными створками / - синус Вальсальвы 2 - фиброзная ткань- Q
12 -----------_-------
ГЛАВА 1 Анатомия, морфология и функция клапанов сердца человека
Рис. 1.5. Схемы фиброзных структур корня аорты:
а — в аксонометрии (по J Р Sutton et al 1995) 1 — синотубулярное соединение; 2 — коммисураль-
ный столбик; 3 — фиброзное кольцо основания клапана, 4 — желудочковая опора синуса, 5 — фиб-
розный узелок, 6 — кольцо основания клапана, 7 — вентрикулоаортальное соединение 8 — меж-
створчатый треугольник, б — в разрезе (по Anderson R Н et al, 1991) 1 — мембранозная перего-
родка, 2 — правый фиброзный треугольник, 3 и 6 — левый коронарный синус, 4 — правый коронар-
ный синус; 5 — некоронарный синус; 7 — левый фиброзный треугольник, 8 — септальная створка
митрального клапана, 9— пучок Гиса. 10 — межстворчатый треугольник, 11 — мышечная перего-
родка
ский НН и др , 1988, Zimmerman J., 1969, Anderson R et al, 1991) Такая конструкция
клапана аорты определяет долговечность его функции (Малиновский Н Н. и др., 1988)
Синусы Вальсальвы — расширенная часть начального отдела аорты, ограниченная
проксимально соответствующим сегментом фиброзного кольца и створкой, а дисталь-
но— синотубулярным соединением (Zimmerman J , 1969, Reid К., 1970, Anderson R.
et al, 1991, Sutton J et aL, 1995) Синусы названы согласно отходящим коронарным ар-
териям правый коронарный, левый коронарный и некоронарный (см рис 1 3, 1 5). Стен-
ка синусов тоньше стенки аорты и состоит только из интимы и медии, несколько утол-
щенных за счет коллагеновых волокон При этом в стенке синусов количество эластино-
вых волокон уменьшается, а коллагеновых увеличивается по направлению от синотубу-
лярного к вентрикулоаортальному соединению Плотные коллагеновые волокна распо-
лагаются, преимущественно, по наружной поверхности синусов и ориентированы в ок-
ружном направлении, а в подкомиссуральном пространстве принимают участие в обра-
зовании межстворчатых треугольников, поддерживающих форму клапана (Малиновский
Н Н и др , 1988, Thubnkai М J et al., 1980, Sutton J. et al , 1995) Основная роль синусов
сводится к перераспределению напряжения между створками и синусами в диастолу
(Mercer J L et al , 1973, Swanson W M , Clark R E , 1974, hubnkar M J. et al , 1986) и
установления равновесного положения створок в систолу (Bellhouse В J . Talbot L , 1969).
Синусы разделены на уровне их основания межстворчатыми треугольниками
Фиброзный каркас клапана аорты (см рис 1 5) представляет собой единую про-
странственную структуру прочных фиброзных элементов корня аорты фиброзного коль-
ца основания створок, комиссуральных стержней (столбиков) и синотубулярного со-
единения (Sutton J. at al., 1995, Dagum P. et aL, 1999; David T E , 2002) Синотубулярное
соединение (арочное кольцо, или арочный гребень) — волнообразной формы анато-
мическое соединение между синусами и восходящей аортой.
13
ИСКУССТВЕННЫ Е К ЛАП ДНИ СЕРДЦА
Вентрикулоаортальное соединение (кольцо основания клапана) — округлой фор-
мы анатомическое соединение между выходным отделом левого желудочка и аортой,
представляющее собой фиброзную и мышечную структуру (Anderson R. Н. et al., 1991,
Sutton J. P et al, 1995). В зарубежной литературе по хирургии вентрикулоаортальное
соединение чаще называют «аортальным кольцом» (Westaby S. et al., 2000; Greve H. H
et al., 2001; Milano A. D et al., 2001; Cohen G. et al., 2002; David T. E., 2002, Doss M.
et al" 2003; Ennker J. et al., 2003). Вентрикулоаортальное соединение сформировано,
в среднем, на 45-47% из миокарда артериального конуса левого желудочка (Гаври-
ленков В. Й„ 2004; Sands et al., 1969; Sutton J. P. et al., 1995).
Комиссура — линия соединения (соприкосновения) смежных створок своими
периферическими проксимальными краями на внутренней поверхности дистального
сегмента корня аорты и предлежащая своим дистальным концом к синотубулярному
соединению (Sutton J. at al., 1995; Dagum R et al., 1999). Комиссуральные стержни
(столбики) — места фиксации комиссур на внутренней поверхности корня аорты (Ма-
линовский Н Н. и др., 1988). Комиссуральные столбики являются дистальным продол-
жением трех сегментов фиброзного кольца.
Межстворчатые треугольники Генле (см. рис. 1.5) являются фиброзными или
фиброзно-мышечными компонентами корня аорты и расположены проксимальнее ко-
миссур между смежными сегментами фиброзного кольца и соответствующими створ-
ками (Anderson R. et al., 1991; Sutton J. et al., 1995). Анатомически межстворчатые тре-
угольники являются частью аорты, однако функционально они обеспечивают выход-
ные пути из левого желудочка и подвержены воздействию гемодинамики желудочка, а
не аорты (Anderson R. et al., 1991). Межстворчатые треугольники играют важную роль в
биомеханической функции клапана, позволяя синусам функционировать относительно
независимо, объединяют их и поддерживают единую геометрию корня аорты (Sutton
J. Р et al., 1995). Если треугольники малы или асимметричны, то развивается узкое
фиброзное кольцо или дисторция клапана с последующим нарушением функции ство-
рок. Эту ситуацию можно наблюдать при двустворчатом клапане аорты (Anderson R. Н.
et al., 1991).
Створка — запирающий элемент клапана, своим проксимальным краем отходит от
полулунной части фиброзного кольца, представляющего собой плотную коллагеновую
структуру (рис. 1.6). Створка состоит из тела (основной нагружаемой части), поверх-
ности коаптации (смыкания) и основания. Свободные края смежных створок в закры-
том положении образуют зону коаптации, распространяющуюся от комиссур к центру
створки (Anderson R.H. et aL, 1991; 1996; Sutton J. et al., 1995; Dagum P. et al., 1999;
David ТЕ., 2002). Утолщенная треугольной формы центральная часть зоны коаптации
створки получила название узелка Аранци (см. рис. 1.6).
Створка клапана аорты состоит из трех слоев (аортального, желудочкового и губча-
того) и покрыта снаружи тонким эндотелиальным слоем. Слой, обращенный в сторону
аорты (fibrosa), преимущественно содержит коллагеновые волокна, ориентированные
в окружном направлении в виде пучков и тяжей, и небольшого количества эластиновых
волокон (Sauren W. М. et al., 1980; Christie G W., 1992; Scott М. et al., 1995) В зоне
коаптации свободного края створки этот слой присутствует в виде отдельных пучков.
Коллагеновые пучки в этой зоне «подвешены» межпм , *
vrnnu ппибпичитопкмп о юр „ "идиешены» между комиссуральными столбиками под
углом приблизительно в 125 относительно стенки аорты (Thubnkar М J et al 1986)
В теле сворки эти пучки отходят под углом около 45 от фиброзного кольца" в виде
полуэллипса и заканчиваются на его противоположной гтЛ/т кольца в виде
ловых» пучков и краев створки в виде «подвесного могта. Д tt ориентация “си‘
назначена для передачи нагрузки давлением о -> ста>> 'Sutton e1 al • 1995) пред-
розный каркас клапана (Mercer J L. et al. 1973^ СТ°ЛУ С° СТ8ОРКИ на синусы и фиб-
В ненагруженнои створке пучки фибооз'ы пятят™ „
волнистых линии, расположенных я г»,™ й ТСЯ В C0KPaLLleHH0M состоянии в виде
тельно в 1 мм друг от друГа КолпагеипУ ОМ направлении аа расстоянии приблизи-
У л ДРУГа' Коллагеновые волокна, составляющие пучки в расслаб-
ГЛАВА 1 Анатомия, морфология и функция клапанов сердца чепоеека
Рис. 1.6. Препарат аллогенной створки в боковой проекции (а) и в аксиальной проекции при гидро-
динамическом исследовании (б):
а. 1 — узелок Аранци; 2 — свободный край, 3 — комиссуральный край створки; 4 — желудочковый
край зоны коаптации; 5 — тело, 6 — проксимальный край створки, 7 — зона коаптации б — вид
закрытых створок аллогенного клапана аорты. 8 — центральная зона коаптации; 9 — коллагеновые
пучки
ленной створке имеют также волнистую структуру с периодом волны около 20 мкм.
При приложении нагрузки эти волны распрямляются, позволяя ткани растянуться. Пол-
ностью выпрямленные волокна становятся нерастяжимыми Складки коллагеновых пуч-
ков легко распрямляются при небольшом нагружении створки (Sauren W.M. et al., 1980;
Christie G.W., 1992). Эти пучки хорошо видны (см. рис. 1 6, б) в нагруженном состоянии
и проходящем свете (Гавриленков В. И., 2004).
Постоянство геометрических пропорции элементов корня аорты было изучено ме-
тодом функциональной анатомии (Мурач А. М., 1970; Михаилов С. С., 1987; Reid К.,
1970; Kunzelman К. S. et al., 1994). В частности, было установлено, что отношение
диаметров синотубулярного соединения и основания клапана постоянно и составляет
0,8-0,9. Это справедливо для клапанно-аортальных комплексов лиц молодого и сред-
него возраста
С возрастом происходят качественные процессы нарушения структуры стенки аор-
ты, сопровождающиеся уменьшением ее эластичности и развитием кальцификации.
Это приводит, с одной стороны, к постепенному ее расширению, а с другой, — к сни-
жению эластичности. Изменение геометрических пропорций и снижение растяжимос-
ти клапана аорты наступает в возрасте старше 50-60 лет, что сопровождается умень-
шением площади открытия створок и ухудшением функциональных характеристик кла-
пана в целом (рис. 1.7). Возрастные анатомо-функциональные особенности корня аорты
пациентов должны учитываться при имплантации бескаркасных биологических заме-
нителей в аортальную позицию (Гавриленков В. И. и др., 2000; 2004).
Сравнение структуры клапана аорты человека и млекопитающих было выполнено в
конце 60-х гг XX столетия (Carpentier A et al., 1967; Lorzadi К. et al., 1969; Sands M P. et
al., 1969). В этих работах была показана схожесть ряда анатомических параметров сви-
ного и человеческого клапана в отличие от других ксеногенных корней аорты (Sands
М. Р et al., 1969) В частности, было показано, что у человеческого клапана некоронар-
ный и левый коронарный синусы были, соответственно, самым большим и маленьким.
В то же время у свиного клапана правый коронарный синус был самым большим, а
некоронарный — самым меньшим Тогда же впервые были описаны различия в анато-
------------------------------------------------------ 15
СКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
Рис. 1.7. Внешний вид клапанно-аортального комплекса молодо-
го (а), пожилого (б) человека и, соответственно, вид их
клапанов (в, г) в пиковой фазе открытия при стендовых
исследованиях
мическом строении правого коронарного синуса свиного и человеческого клапана аорты
(Lorzadi К et al 1969) В связи с развитием реконструктивно-пластической хирургии и
протезирования аортального клапана биологическими бескаркасными заменителями
I в последние годы вновь возобновились анатомические исследования клапана аорты
(Kunzelman К S , 1994; Anderson R. Н. et al., 1996, Choo S J. et al , 1999; David T. E.,
2002; Dreger S A et al , 2003)
Нами проведено сравнительное исследование структуры аортального клапана че-
ловека и свиного аортального клапана как потенциального ксенографта (Гавриленков
В. И 2004) Было показано, что ксеногенные клапаны имеют относительно низкии про-
филь и в большинстве случаев (80%) асимметричны вследствие меньшего размера их
некоронарного синуса. Умеренная асимметрия клапана аорты человека обусловлена
меньшим размером его левого коронарного синуса и не столь выражена.
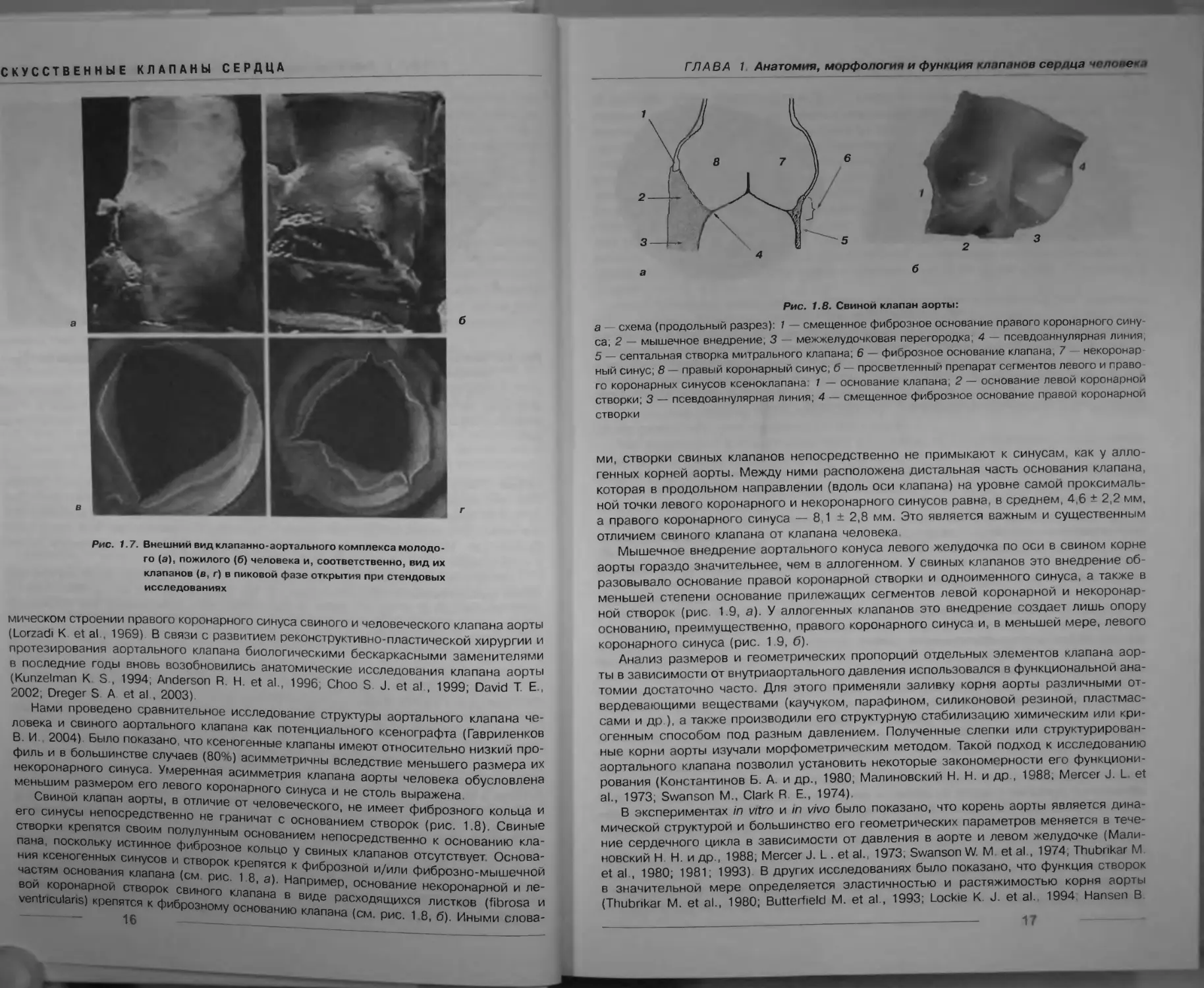
Свинои клапан аорты, в отличие от человеческого, не имеет фиброзного кольца и
его синусы непосредственно не граничат с основанием створок (рис. 1.8). Свиные
створки крепятся своим полулунным основанием непосредственно к основанию кла-
пана, поскольку истинное фиброзное кольцо у свиных клапанов отсутствует Основа-
ния ксеногенных синусов и створок крепятся к фиброзной и/или фиброзно-мышечнои
частям основания клапана (см рис. 1 8, а). Например, основание некоронарной и ле-
вой коронарной створок свиного клапана в виде расходящихся листков (fibrosa и
ventricularis) крепятся к фиброзному основанию клапана (см. рис. 1 8, б). Иными слова-
ГЛАВА 1 Анатомия, морфология и функция клапанов сер;ща чопене* >
Рис. 1.8. Свиной клапан аорты:
а — схема (продольный разрез): 1 — смещенное фиброзное основание правого коронарного сину-
са, 2 — мышечное внедрение, 3 — межжелудочковая перегородка, 4 — псевдоаннулярная линия,
5 — септальная створка митрального клапана; 6 — фиброзное основание клапана, 7 — некоронар-
ный синус; 8 — правый коронарный синус, б — просветленный препарат сегментов левого и право-
го коронарных синусов ксеноклапана; 1 — основание клапана; 2 — основание левой коронарной
створки; 3 — псевдоаннулярная линия; 4 — смещенное фиброзное основание правой коронарной
створки
ми, створки свиных клапанов непосредственно не примыкают к синусам, как у алло-
генных корней аорты. Между ними расположена дистальная часть основания клапана,
которая в продольном направлении (вдоль оси клапана) на уровне самой проксималь-
ной точки левого коронарного и некоронарного синусов равна, в среднем, 4,6 ± 2,2 мм,
а правого коронарного синуса — 8,1 ± 2,8 мм. Это является важным и существенным
отличием свиного клапана от клапана человека.
Мышечное внедрение аортального конуса левого желудочка по оси в свином корне
аорты гораздо значительнее, чем в аллогенном. У свиных клапанов это внедрение об-
разовывало основание правой коронарной створки и одноименного синуса, а также в
меньшей степени основание прилежащих сегментов левой коронарной и некоронар-
ной створок (рис. 1.9, а). У аллогенных клапанов это внедрение создает лишь опору
основанию, преимущественно, правого коронарного синуса и, в меньшей мере, левого
коронарного синуса (рис. 1 9, б).
Анализ размеров и геометрических пропорции отдельных элементов клапана аор-
ты в зависимости от внутриаортального давления использовался в функциональной ана-
томии достаточно часто. Для этого применяли заливку корня аорты различными от-
вердевающими веществами (каучуком, парафином, силиконовой резиной, пластмас-
сами и др ), а также производили его структурную стабилизацию химическим или кри-
огенным способом под разным давлением. Полученные слепки или структурирован-
ные корни аорты изучали морфометрическим методом. Такой подход к исследованию
аортального клапана позволил установить некоторые закономерности его функциони-
рования (Константинов Б. А. и др., 1980, Малиновский Н. Н. и др., 1988; Mercer J. L et
al., 1973; Swanson M., Clark R E., 1974)
В экспериментах in vitro и in vivo было показано, что корень аорты является дина-
мической структурой и большинство его геометрических параметров меняется в тече-
ние сердечного цикла в зависимости от давления в аорте и левом желудочке (Мали-
новский Н. Н. и др , 1988, Mercer J. L . et aL, 1973; Swanson W. M et al , 1974, Thubnkar M
et al , 1980; 1981; 1993) В других исследованиях было показано, что функция створок
в значительной мере определяется эластичностью и растяжимостью корня аорты
(Thubnkar М. et al., 1980; Butterfield М. et al., 1993; Lockie К J. et al., 1994, Hansen В
17
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
Рис. 1.9. Препараты корне аорты:
а - свиного с удаленными створками: 1 - смещенное фиброзное основание правой коронарной
створки; 2 - мышечное внедрение; 3 - мышечная часть вентрикуло-аортального соединения;
4 _ Края иссеченного основания створки; 5 — фиброзная часть вентрикуло-аортального соедине-
ния, б - основание аллогенного клапана аорты с удаленными межстворчатыми треугольниками:
j _ сегмент фиброзного кольца некоронарного синуса; 2 — мышечное основание правого коро-
нарного синуса; 3 — мышечное основание левого коронарного синуса
et al., 1995; Vesely I., 1998; Dagum P. et al., 1999). Вихревым движениям крови в синусах
отводилась важная роль в открытии и закрытии створок (Каро К., 1981, Bellhouse В. J.
et al., 1969; 1972; Van Steenhoven A. A. et al., 1982).
Исследование динамики геометрических параметров клапана аорты было проведе-
но в эксперименте на животных методами высокоскоростной киноангиографии, кине-
матографиии и кинорадиографии (Mercer J. L. et al., 1973; Van Steenhoven A. A. et al.,
1982; Thubnkar M. J. et al., 1980, 1981, 1993; Dagum P. et al., 1999), а также у здоровых
лиц с помощью киноангиокардиографии (Малиновский Н. Н. и др., 1988). Эти иссле-
дования позволили достаточно точно оценить динамику многих элементов корня аор-
ты и только предположительно оценить динамику формы и профиля створки в течение
сердечного цикла. В частности, было показано, что систолодиастолическое расшире-
ние синотубулярного соединения составляет 16-17% и тесно коррелирует с артери-
альным давлением. Диаметр синотубулярного соединения достигает максимальных
значений на пике систолического давления в левом желудочке, облегчая тем самым
открытие створок за счет расхождения комиссур кнаружи, а затем уменьшается после
закрытия створок. Диаметр синотубулярного соединения достигает минимальных зна-
чений в конце фазы изоволюмического расслабления левого желудочка и начинает
увеличиваться в диастолу. Комиссуральные столбики и синотубулярное соединение
благодаря своей гибкости участвуют в распределении максимального напряжения в
створках после их закрытия в течение периода быстрого роста обратного транскла-
панного градиента давления. Также были разработаны математические модели для
объяснения движения створок во время их открытия и закрытия (Малиновский Н Н и
др . 1988, Swanson W. М„ Clark R. Е. 1974; De Hart J et al., 2000). Однако данные мате-
матического моделирования в значительной мере не согласовывались с эксперимен-
тальными данными (Thubnkar М. J. et al., 1993). р
Динамика основания клапана аорты оказывает влияние на нормальную работу ство-
рок клапана или имплантированного бескаркасного биопротеза. Было показано ^то пе-
риметр основания клапана (собаки и овцы) достигал максимального значения в начале
систолы, уменьшался в течение систолы и был минимальным в ее конце“nkar М I.
18
ГЛАВА 1. Анатомия, морфология и функция клапанов сердца человека
et al., 1980; 1986; 1993; Dagum Р. et al., 1999). В течение диастолы периметр клапана
увеличивался. Основание аортального клапана также способно к циклическим асим-
метричным изменениям своего размера за счет сокращения мышечной части вентри-
кулоаортального соединения (межстворчатых треугольников между правым и левым
коронарными синусами, а также оснований левого и правого коронарных синусов)
Кроме этого, были выявлены деформации сдвига и кручения корня аорты. Самые боль-
шие скручивающие деформации отмечены в области комиссурального столбика меж-
ду некоронарным и левым коронарным синусами, а минимальные — между некоро-
нарным и правым коронарным. Имплантация бескаркасного биопротеза с полужест-
ким основанием может изменить податливость корня аорты к скручивающим дефор-
мациям, что приведет к передаче скручивающих деформаций на синотубулярное со-
единение композитного корня аорты и образованию дисторции створок биопротеза
(Dagum Р. et al., 1999).
Нами проведено исследование нормальной биомеханики клапана аорты у молодых
лиц (в среднем 21,6 года) методом чреспищеводной эхокардиографии с последующей
компьютерной обработкой видеоизображения (до 120 кадров в секунду) и анализом
динамики геометрических характеристик элементов клапана аорты в зависимости от
времени и фаз сердечного цикла (Гавриленков В. И и др., 2003). Было показано, что в
систолу существенно изменяются площадь открытия клапана, радиальный угол накло-
на створки к основанию клапана, диаметр основания клапана и радиальная длина створ-
ки. В меньшей степени изменяются диаметр синотубулярного соединения, окружная
длина свободного края створки и высота синусов.
Так, радиальная длина створки была максимальной в диастолическую фазу изово-
люмического снижения внутрижелудочкового давления и минимальной — в систоли-
ческую фазу редуцированного изгнания. Радиальное систолодиастолическое растяже-
ние створки составило, в среднем, 63,2±1,3%. Створка была длиннее в диастолу при
высоком диастолическом градиенте и короче в фазу редуцированного кровотока,
когда систолический градиент был близок к нулю. Окружное систолодиастолическое
растяжение створки и синотубулярного соединения составило, соответственно,
32,0±2,0% и 14,1±1,4%. Радиальный угол наклона створки к основанию клапана изме-
нялся, в среднем, от 22° в диастолу до 93° в систолу.
Систолическое перемещение створок клапана условно подразделяли на пять пери-
одов (рис. 1.10):
1 — подготовительный период приходился на фазу изоволюмического повышения
внутрижелудочкового давления; створки выпрямлялись, несколько укорачивались в ра-
диальном направлении, ширина зоны коаптации уменьшалась, угол увеличивался,
в среднем, с 22° до 60°;
2 — период быстрого открытия створок продолжался 20-25 мс; с началом изгнания
крови у основания створок образовывалась волна инверсии, которая быстро распрос-
транялась в радиальном направлении на тела створок и дальше к их свободным краям;
3 — пик открытия створок приходился на первую фазу максимального изгнания;
в этот период свободные края створок максимально изгибались в сторону синусов,
форма открытия клапана приближалась к кругу, а в профиль клапан напоминал форму
усеченного перевернутого конуса;
4 — период относительно устойчивого открытия створок приходился на вторую фазу
максимального изгнания, свободные края створок выпрямлялись вдоль оси потока,
клапан принимал форму цилиндра, и створки постепенно прикрывались, к концу этого
периода форма отверстия клапана становилась треугольной;
5 — период быстрого закрытия клзпвнэ совпадал с фазой редуцированного
изгнания. У основания створок образовывалась волна реверсии, растягивающая
сократившиеся створки в радиальном направлении, что приводило к их смыканию
вначале по желудочковому краю зоны коаптации, а затем к полному закрытию ство-
рок (6).
19
Рис.
. - оТО„,.„„ы. , х:, •» «—
“ отхВы,„е. 5 - 0„е,рМ ,акрь|ти" 6 3 ~ “Р»'"». < - усгайчи-
-------- 20 ----------
Г/?Д Анатомия, морфология и функция кл шанов сердца человека
Максимальные деформации элементов корня аорты приходились на периоды быс-
трого открытия и закрытия клапана. При быстром изменении формы створок в них могут
возникать высокие напряжения, способные приводить к дегенеративным изменениям
ткани (Thubiikar М. J.at al., 1982; 1983; 1993).
Механизм открытия и закрытия створки с образованием, соответственно, волны ин-
версии и реверсии, а также увеличение радиального угла наклона створки к основа-
нию клапана в фазу изоволюмического повышения давления внутри желудочка можно
отнести к демпферным механизмам корня аорты, снижающим деформации и напря-
жения створок клапана.
КЛАПАН ЛЕГОЧНОЙ АРТЕРИИ
Клапан легочного ствола отделен от фиброзного каркаса сердца мышечной пере-
городкой выходного отдела правого желудочка. Этот клапан не имеет фиброзной опо-
ры. Его полулунное основание опирается на миокард выходного отдела правого же-
лудочка.
Клапан легочной артерии (рис. 1.11), аналогично клапану аорты, состоит из трех
синусов и трех полулунных створок, отходящих своими основаниями от фиброзного
кольца. Полулунные створки берут начало от медиального края фиброзного кольца.
Различают переднюю, левую и правую полулунные створки, проксимальные края кото-
рых продолжаются в латеральном направлении в виде синусов, а свободные их края
выступают внутрь легочного ствола (Гончаров О. Г, 1956). Утолщенная фиброзная часть
центральной зоны коаптации каждой створки носит название узелков Морганьи. Соот-
ветственно створкам называются и синусы клапана легочной артерии. Расширение на-
чального отдела легочной артерии не так хорошо выражено, как в аорте
Комиссуры между створками обозначаются как левая, правая и задняя Левая по-
лулунная створка непосредственно граничит с мышечной тканью выходного отдела пра-
вого желудочка, его перегородкой и частично с верхней частью наджелудочкового греб-
ня. Правая створка также предлежит к миокарду выходного отдела правого желудочка.
Задняя комиссура располагается напротив «межкоронарной» комиссуры аортального
клапана. Элементы клапанного аппарата легочного ствола существенно различаются
по своему строению. Синотубулярное соединение (арочное кольцо, арочный гребень),
комиссуральные стержни и фиброзное кольцо основания клапана соединены между
собой в пространственно взаимосвязанный упругий каркас, к которому крепятся створ-
ки и синусы.
Стенка синусов клапана легочного ствола в области арочного кольца имеет струк-
туру, аналогичную стенке легочного ствола, с хорошо выраженным средним слоем, со-
стоящим из гладких миоцитов и окруженных эластиновыми и коллагеновыми волокна-
ми (см. рис. 1.11, б). По направлению к фиброзному кольцу основания клапана стенка
синусов истончается, количесво эластиновых волокон и миоцитов уменьшается, кол-
лагеновых возрастает и у основания приобретает вид фиброзного тяжа (7). При этом
внутренняя эластическая мембрана постепенно утрачивается.
Фиброзное кольцо основания клапана начинается раздвоением фиброзного тяжа
(7) синуса. Одна его часть (7) образует синусовую стенку фиброзного кольца, перехо-
дящую далее на створку и формирующую ее синусовый слой (8). Другая часть (9) об-
разует основание треугольника фиброзного кольца и оплетает кардиомиоциты (10).
Фиброзное кольцо имеет треугольную форму в поперечном сечении и состоит, пре-
имущественно, из коллагеновых структур, эластической мембраны по его желудочко-
вой поверхности и, в меньшей степени (около 10%), хондроидной ткани (11). Ткани,
составляю! i i.hp среднюю часть фиброзного кольца, переходят в створку и образуют ее
срединный слой (15). Створка имеет трехслойную структуру и состоит из желудочко-
----------------------------------------------- 21
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
Рис. 1.11. Клапан легочной артерии:
а — препарат (по Р. Д. Синельникову, 1979); 1 — левая полулунная створка; 2 — правая полулунная
створка; 3 — тело створки, 4 — правый желудочек, 5 — узелок Морганьи; 6 — передняя полулунная
створка, 7 — ствол легочной артерии; б, в — схема гистологического строения (по Д. Б. Антипасу и
др., 1993): б —участок легочного ствола, арочное кольцо, синус, фиброзное кольцо основания, створ-
ка в — комиссуральный стержень; 1 — интима; 2 — средняя оболочка; 3 — адвентициальная обо-
лочка; 4 — внутренняя эластическая мембрана, 5 — гладкие миоциты, 6 — паравазальная клетчатка;
7 — фиброзный тяж, состоящий из коллагеновых волокон, 8 — синусовый слой створки; 9 — часть
фиброзного тяжа, образующая основание треугольника фиброзного кольца 10 — кардиомиоциты;
11 — хондроидная ткань; 12 — тонкая эластическая мембрана, 13 — коллагеновые тяжи; 14 — желу-
дочковый слой створки, 15 — срединный слой створки; 16 — арочный участок комиссуральных стер-
жней, 17 — переходный участок от арочного к фиброзному, 18 — фиброзный участок комиссураль-
ных стержней; 19 — пучки коллагеновых волокон; 20 — адвентициальная оболочка комиссуральных
стержней
вого (14), срединного (15) и синусового слоя (8). Толщина створки максимальна у фиб-
розного кольца и минимальна в куполе В области узелка полулунной заслонки толщи-
на створки вновь увеличивается Здесь преобладает рыхлый срединный слой, окайм-
ленный эластической мембраной желудочкового слоя В основании створки имеется
значительное количество артериол, вен и капилляров, обеспечивающих ее кровоснаб-
жение. Комиссуральные стержни состоят из трех участков: арочный участок (16),
имеющий строение арочных гребней и являющийся их продолжением; фиброзный уча-
сток (18), состоящий, в основном, из неизвитых коллагеновых пучков, оплетенных рез-
ко извитыми коллагеновыми волоконцами (19), имеющий структуру, сходную с фиб-
розным кольцом основания, и участок перехода (17) от первого ко второму.
Клапан легочного ствола можно рассматривать как композитную структуру, состо-
ящую из прочного, преимущественно коллагенового, каркаса и оболочечных элемен-
тов (створки и синусы), обладающих анизотропными свойствами (Антипас Д. Б. и др..
1993). Биомеханика клапана легочного ствола аналогична биомеханике аортального
клапана.
22
ГЛАВА 1. Анатомия, морфология и функция кллп.шов сердца человека
МИТРАЛЬНЫЙ КЛАПАН
Митральный клапан (рис. 1.12) представляет собой анатомо-функциональную струк-
туру сердца воронкообразной формы, состоящую из фиброзного кольца, створок с хор-
дами, папиллярных мышц, функционально связанных с прилежащими отделами левого
предсердия и желудочка (Воропаев Т. С., 1956; Копейкин Н. Г., 1966; Цукерман Г И. и
др., 1995; Henderson Y et al., 1912; Babburi H. et al., 2003; Butany J. et al., 2003).
Фиброзное кольцо митрального клапана (см рис. 1.1 и 1 2) образовано левым и
правым фиброзными треугольниками и отходящими от них фиброзными тяжами (вет-
вями). Медиальные (передние) ветви, соединенные между собой образуют так назы-
ваемый митрально-аортальный контакт, или субаортальную занавеску, разделяющую
входное и выходное отверстия левого желудочка. Латеральные (задние) тяжи обоих фиб-
розных треугольников формируют заднюю «полуокружность» левого фиброзного коль-
16
Рис. 1.12. Митральный клапан (по F. Netter, 2003):
1 - поперечный синус; 2 - ушко левого предсердия; 3 - задняя створка митрального клапана; 4 -
передняя створка митрального клапана; 5 - передняя папиллярная мышца; 6 - хорды. - задняя
папиллярная мышца, 8 - нижняя полая вена; 9 - коронарный синус; J0 - правые легочные вены
И - левое предсердие; 12 - левые легочные вены; 13 - правая легочная артерия; 14 - левая
легочная артерия; 15 — артериальная связка, 16 — дуга аорты
ИСКУССТВЕНН ЫЕ КЛАПАНЫ СЕРДЦА______________
ца, нередко истонченную и плохо определяемую по его задней трети. Фиброзное коль-
цо митрального клапана является частью фиброзного каркаса сердца (Гаджиев С. А.,
1958, Орлов Г А., 1961; Михайлов С. С., 1987; Цукерман Г. И. и др., 1995, Бураковский
В И. и др , 1996, Дземешкевич С. Л., Стивенсон Л. У., 2000).
Главные створки митрального клапана (рис. 1.13) — передняя (аортальная или сеп-
тальная) и задняя (муральная). Линия прикрепления передней створки занимает ме-
нее половины окружности фиброзного кольца Большая часть его окружности занята
задней створкой. Передняя створка квадратной или треугольной формы имеет боль-
шую площадь, чем задняя. Широкой и подвижной передней створке отводится основ-
ная роль в замыкательной функции митрального клапана, а задней створке преиму-
щественно поддерживающая функция. Количество створок различно —- две створки у
62% людей, три — у 19%, четыре — у 11% и пять — у 8% (Михайлов С. С., 1987).
Участки соединения створок между собой носят названия комиссур. Различают пере-
днелатеральную и заднемедиальную комиссуры. Обычно комиссуры расположены на
расстоянии 3-8 мм от фиброзного кольца митрального клапана. Внутрипредсердным
топографическим ориентиром для правого фиброзного треугольника является заднев-
нутренняя комиссура митрального клапана, и наоборот, для определения патологичес-
ки измененной комиссуры ориентируются по углублению на стенке левого предсердия
в этой зоне. Передненаружная комиссура митрального клапана соответствует области
левого фиброзного треугольника, где достаточно близко проходит огибающая артерия.
Хорды соединяют створки с папиллярными мышцами и количество хорд может дости-
гать нескольких десятков. От передних сосочковых мышц отходят от 5 до 20 хорд, от зад-
них сосочковых мышц — от 5 до 30. Различают хорды 1-го (краевые), 2-го (опорные, или
желудочковые) и 3-го (аннулярные, или базальные) порядка, прикрепляющиеся, соответ-
ственно, к свободному краю, желудочковой поверхности и основанию створок
(см рис 1.13). Краевые хорды могут делиться на несколько концевых ветвей. Кроме того,
выделяют комиссуральные (веерообразные) хорды, представляющие собой мелкие крае-
Рис. 1.13. Схемы створок и хорд митрального клапана (no Т. Saka. et al 1999»-
типы хорд (по С Л Дземешкевичу и др 2000) I — кпаа "*
рядка), III - аннулярные (3-го порядка), хорды 1 - Р е (1-г0 П0РяДка), II - опорные (2-го по-
днял парамедиальная, 4 — задняя парамедиальная"?^1*" главная;2~ задняя главная, 3 — пере-
паракомиссуральная, 7 — передняя комиссуоалкнла передняя паракомиссуральная, 6 — задняя
расщепленная, 10 — задняя расщепленная ствпп™ и задняя комиссуральная, 9 — передняя
ная) состоит следующих отделов 12 — задняя к™ ~ передняя (септальная), задняя (мураль-
средняя гребешковая. 15 - передняя 13 ~ задняя гребешковая. 14 -
треугольники 17 - левый. 18 - правый папилляоны! ~ ПереДНЯЯ ком”ссуральная, фиброзные
задняя медиальная папиллярные мышцы 19 - передняя латеральная; 20 -
24
ГЛАВА 1 Анатомия, морфология и функция клапанов сердца человека
вые хорды (до 5-7) и отходящие от одной центральной комиссуральной хорды. Веерооб-
разные хорды крепятся к свободному краю комиссурального сегмента каждой створки.
Также выделяют паракомиссуральные и парамедиальные хорды, прикрепляющиеся под
углом к соответствующей половине передней створки. Самые мощные хорды 2-го поряд-
ка обычно крепятся на границе между шероховатой и свободной от хорд центральной зо-
ной передней створки. На задней створке, помимо хорд 1-го и 2-го порядка, встречаются
базальные и мышечные хорды, отходящие непосредственно от стенки левого желудочка
Сухожильные хорды обеих створок отходят от двух групп сосочковых (папилляр-
ных) мышц — передней (переднелатеральной) и задней (заднемедиальной). Количе-
ство сосочковых мышц в левом желудочке колеблется от 2 до 6 При этом хорды отхо-
дят от каждой группы мышц как к передней, так и к задней створкам. Обе мышцы рас-
положены перпендикулярно к плоскости митрального клапана и начинаются вблизи гра-
ницы между апикальной и средней третью свободной стенки левого желудочка. Пере-
дняя папиллярная мышца начинается от передней стенки желудочка, а задняя мыш-
ца — от задней его стенки вблизи соединения с межжелудочковой перегородкой
(рис. 1.14). Правая и левая папиллярные мышцы кровоснабжаются, преимущественно,
септальными ветвями, соответственно, правой и левой коронарных артерий (Михай-
лов С. С., 1987; Константинов Б. А. и др. 1989; Цукерман Г И. и др., 1995; Бураков-
ский В. И. и др., 1996; Дземешкевич С. Л., Стивенсон Л. У, 2000; Mirro М. J. et al., 1979;
Acar С. et al., 1996; Babburi H. et al., 2003; Butany J. et al., 2003).
Закрытие и открытие митрального клапана является активным движением, в ко-
тором одновременно участвует большинство компонентов митрального аппарата (Кузь-
мина Н Б., 1967; Рашмер Р. Ф., 1981; Braunwald Е. et al., 1968; 2001). Закрытие мит-
рального клапана начинается в диастолу (фаза раннего диастолического прикрытия
створок) при быстром наполнении желудочка (Little R. С. 1951; Layton С. et al., 1973).
Рис. 1.14. Классификация папиллярных мышц, представленная на поперечном разрезе (по С. Асаг
et al., 1996):
тип I - простая, одиночная мышца; тип II - деление папиллярной мышцы в саггитальной плоскости
с формированием индивидуальной головки, поддерживающей заднюю створку митрального кла-
пана, тип III - деление папиллярной мышцы в коронарной плоскости с формированием индивиду-
альной головки, поддерживающей комиссуру; тип IV - разделенная мышца с множественными го-
ловками, отходящими на различных уровнях от стенки левого желудочка от основания до вершины
короткие комиссуральные хорды прикреплены к изолированным мышечным валикам
ИСКУССТВЕННЫЕ КЛАПАН Ы СЕРДЦА
Вихри, образующиеся за створками клапана, обеспечивают их сближение в диастолу.
Сокращение предсердий увеличивает эффект прикрытия створок.благодаря их натя-
жению предсердными мышечными пучками (Dean A L et al, 1916, Chichi М A et al,
1956. Davis P К В et al., 1963; Brockman S. K., 1966).
В начале систолы створки митрального клапана смыкаются свободными краями
вследствие сокращения левого желудочка и возникновения обратного градиента на
клапане Задняя створка смещается вперед в сторону септальной створки в результа-
те сужения отверстия (на 20-40%) по муральной части фиброзного кольца Более по-
ловины сужения фиброзного кольца происходит во время систолы предсердия, а ос-
тальное сужение — за счет сокращения базальных сегментов миокарда левого желу-
дочка (Salim Е А., 1969). При этом уменьшаются переднезадний (на 6%) и медиолате-
ральный (на 13%) размеры митрального устья, увеличивается зона коаптации створок
и надежность закрытия клапана возрастает Размер переднего сегмента фиброзного
кольца митрального клапана почти не меняется в течение сердечного цикла. Дилата-
ция левых отделов сердца, снижение сократимости их миокарда, нарушение ритма и
проводимости могут влиять на сокращение фиброзного кольца. В фазе раннего изгна-
ния при быстром возрастании давления в левом желудочке изометрическое сокраще-
ние папиллярных мышц поддерживает смыкание створок. Во время фазы позднего
изгнания укорочение папиллярных мышц (в среднем на 34%) способствует предупреж-
дению пролапса створок в полость левого предсердия по мере того, как расстояние
между митральным клапаном и верхушкой сердца уменьшается
В фазу изгнания опорные хорды и фиброзное кольцо стабилизируют клапан в од-
ной плоскости, а основное напряжение приходится на шероховатую зону коаптации
створок. Однако давление на зону коаптации обеих сомкнутых створок уравновешива-
ется, что предположительно обеспечивает образование умеренного напряжения по
шероховатому краю Передняя створка митрального клапана примыкает к корню аор-
ты под углом 90°, что обеспечивает в систолу ее расположение параллельно кровото-
ку, способствуя тем самым снижению напряжения на ней
Открытие митрального клапана происходит не только под влиянием гемодинами-
ческих механизмов, но и при активном участии всех структур митрального аппарата.
Открытие клапана начинается в фазу изоволюмического расслабления левого желу-
дочка за счет увеличения расстояния между его верхушкой и основанием (при измене-
нии формы левого желудочка), а также за счет продолжающегося сокращения папил-
лярных мышц Это способствует раннему расхождению створок В диастолу беспре-
пятственному прохождению крови из предсердия в желудочек способствует эксцент-
ричное расширение задней части фиброзного кольца и соответствующее смещение му-
створки <Ц^ерман Г И. и др., 1995; Дземешкевич С. Л и др., 2000 Brock R С
1952, Chakorn S. A. et al , 1972, Babbun Н et al, 2003)
ТРИКУСПИДАЛЬНЫЙ КЛАПАН
ческих образований^ ^ючаю^фи^о^^^ И3 комплекса анатоми-
сочковые мышцы и прилежащие отделы поавогп пп’о ор и' сУхожильные хорды, со-
Обычно трехстворчатый клана?coX™ °" усердия и желудочка (рис 1 15).
некоторые из них расщеплены (Лопухин Ю М ХГрХ ИМе®Т ТРИ створки’ иногда
тальную), переднюю и заднюю ствооки и кпм’иЛ59 Различают перегородочную (сеп-
реднеперегородочной, передненижней’и задней У₽Ы НаЗЫВаются- соответственно, пе-
стическихволокон отХтеХ'фиброзного'юГ СОДержит большее количество эла-
розного кольца, прилежащий к перегооолпчнпм митрального клапана Участок фиб-
бранознои части межжелудочковой перегородки RfT™’ является продолжением мем-
26 ерегородки Вблизи этой области проходят про-
ГЛАВ 1 Анатомия, морфология и функция клапанол сердца человека
водящие пути сердца Остальная часть фиброзного кольца более рыхлая и содержит
мышечные волокна. Габариты фиброзного кольца в большей степени выряжены в об-
ласти его прилегания к правому фиброзному треугольнику и истончаются по мере уда-
ления от этого треугольника (Нечаев Э. А. и др., 1973, Раменский И. А и др , 1974)
Наружная часть фиброзного кольца (см. рис 1.1, 1 2), прилежащая к передней и зад-
ней створкам, изменяется по форме и размеру (на 19-40%) за счет сокращения и ре-
лаксации миокарда в течение сердечного цикла (Дземешкевич С Л и др., 2000)
В створках трикуспидального клапана также выделяют основание, зону перекрытия
(тело) и зону смыкания Створки клапана (от 2 до 6) поддерживаются сухожильными
Рис. 1.15. Трикуспидальный клапан (по F. Netter, 2003).
1 — восходящая аорта, 2 — поперечный синус перикарда, 3 — верхняя полая вена, 4 — правое пред-
сердие, 5 — перегородочнокраевая трабекула, 6 — мембранозная часть межжелудочковой neper
родки, 7 - передняя створка трикуспидального клапана, 8 - перегородочная (септальная) створка
трикуспидального клапана, 9 - задняя створка трикуспидального клапана. 10 - хорды,
П - задняя папиллярная мышца, 12- передние папиллярные мышцы, 13 - перегородочнокрае-
вая траблекула 14 — перегородочная папиллярная мышца, 15 — наджелудочковый i ребень, 16
легочный конус, 17 — клапан легочной артерии, 18 — ствол легочной артерии
ИСКУССТВЕННЫЕ К ЛАП АН Ы СЕРДЦА
хоодами и сосочковыми мышцами. Основной сосочковой мышцей является передняя,
расположенная на передней стенке правого желудочка. Вместе с наджелудочковым
гребнем перегородочной трабекулой («модераторным тяжем») и париетальной стен-
кой правого желудочка передняя сосочковая мышца разделяет полость желудочка на
приточный и выходной отделы (Берешвили И. И. и др., 1982). Задняя сосочковая мыш-
ца имеет меньшие размеры. Мелкие сосочковые мышцы могут быть на межжелудоч-
ковой перегородке, иногда хорды отходят непосредственно от стенки желудочка. Чаще
всего встречается 3-4 мышцы, иногда до 7-10.
Хорды трикуспидального клапана, как и митрального, делятся на хорды 1 -го, 2-го
и 3-го порядков. Хорды перегородочной створки начинаются от головок небольших со-
сочковых мышц на межжелудочковой перегородке. К передней створке крепятся хор-
ды от передней сосочковой мышцы, а сухожильные хорды задней створки отходят от
группы задних сосочковых мышц трабекулярной части перегородки. В области пере-
днеперегородочной комиссуры створки поддерживаются хордами, идущими от мыш-
цы Ланчизи Функциональное значение хорд, прикрепляющихся к различным отделам
створок, неодинаково. Пересечение хорд основания створки не нарушает замыкатель-
ную функцию клапана. Пересечение хорд зоны перекрытия одной створки не вызывает
регургитацию, двух и более створок — приводит к клапанной недостаточности. Повреж-
дение краевых хорд даже одной створки ведет к нарушению замыкательной функции
клапана (Соловьев Г. М. и др. 1988; Бураковский В. И. и др., 1996).
Взаимоотношение проводящей системы и элементов трикуспидального клапана важ-
но с хирургической точки зрения. В частности, пучок Гиса проходит параллельно ли-
нии прикрепления перегородочной створки трикуспидального клапана, и затем через
правый фиброзный треугольник и фиброзное кольцо в области переднеперегородоч-
ной комиссуры (опасная зона) направляется по нижнему краю мембранозной перего-
родки. Глубина залегания пучка Гиса в области перегородочной створки составляет
1-2 мм При гипертрофии миокарда правого желудочка (при пороках сердца) и ревма-
тическом поражении трикуспидального клапана пучок Гиса может располагаться на глу-
бине 2-4 мм. Кроме этого, правая венечная артерия проходит достаточно близко от
передних сегментов фиброзного кольца (2-4 мм), особенно в области боковой комис-
суры (Быков О С., 1972; Нечаев Э А. и др., 1973; Соловьев Г. М. и др., 1988).
МОРФОЛОГИЯ КЛАПАНОВ
ЧТ° ВСе серАечные клапаны — простые структуры, чей вклад в
действчлоший гпд6 ~ Крови является просто пассивным движением в ответ на
ТаКГ Понимание «пассивных структур» привело к со-
новится очевидным что И иологических заменителей клапанов. Сейчас ста-
цию (Lam J Н С et al 1970^епНЫе Клапаны имеют более сложное строение и функ-
дца предполагает значитялкн / 0ЭТ0МУ создание «активного» заменителя клапана сер-
клапаном сердца, что в перспе^ГХ'нГре^ьТб^Х?^^11 ° еСтеСТВе"НЬ'М
женерии реально олагодаря развитию тканевой ин-
ни при закладке эндокарда^пооирсге Эм6|^онапьнь|х зачатков мезенхимальной тка-
дочковый канал (трикуспидальный и митраТь^ый ^natT^10™ предсеРДн°-желу'
тракт (аортальный и пульмональный клапан^ КЛапаны) и желудочковый выносящий
Начало исследования кровоснаб^ния
менив инъекцию сосудов сердца контрастной П°ЛОжил н Luschka (1852). при-
сердно-желудочковых и полулунных клапан™ ассои Он обнаружил в створках пред-
ные кровеносные сосуды Вместе с то,, „ аорты и легочной артерии многочислен-
уд месте с тем. в ряде руководств по патологическом анато-
Zo — ——
ГЛАВА 1. Анатомия, морфология и функция клапанов сердца человека
мии и гистологии имелись указания о том, что неизмененные клапаны сердца челове-
ка не содержат кровеносных сосудов, а последние появляются в клапанах только при
различных патологических процессах — атеросклерозе и эндокардитах различной эти-
ологии. Сведения об отсутствии кровеносных сосудов базировались в основном, на
гистологических исследованиях. Предполагалось, что при отсутствии кровеносных со-
судов в свободной части створок их питание происходит путем фильтрации жидкости
из плазмы крови, омывающей створки Отмечалось проникновение немногочисленных
сосудов вместе с волокнами поперечнополосатой мышечной ткани в основания створок
и сухожильных хорд (Давыдовский И В , 1938; Криницкий Ш. И., 1940; Вальтер А. В ,
1948; Огнев Б В. и др., 1956, Садовская Н. П., 1964; Христодуло-Финити А. С , 1965;
Джавахишвили Н А и др., 1982; Duran С. et al., 1968).
Однако при инъекции сосудов сердца различными красителями (туши в желатине,
висмута в желатине, водной взвеси черной туши, растворов кармина или трипанового
голубого) было установлено, что сосуды проникают в предсердно-желудочковые кла-
паны, клапаны аорты и легочной артерии вместе с сердечной мышечной тканью, не-
много не достигая свободного края створки.
В рыхлой волокнистой соединительной ткани створок предсердно-желудочковых
клапанов были обнаружены отдельные магистральные сосуды, анастомозирующие с
сосудами рядом расположенных участков сердечной поперечнополосатой мышечной
ткани (рис. 1 16).
Наибольшее количество кровеносных сосудов располагалось в основании и сравни-
тельно меньшее — в свободной части этих клапанов (Копейкин Н Г., 1965; Чекарева Г. А.,
1965; Мартынов Г. В , 1973; Соколов В В. и др., 1985; Кульчицкий К. И и др., 1990;
Wearn J. Т. et al , 1937)
По данным К. И. Кульчицкого и др. (1990), больший диаметр артериальных и веноз-
ных сосудов встречается в митральном клапане В основании створок этого клапана
располагаются, главным образом, магистральные сосуды с узкопетлистой сетью ка-
пилляров, проникающие в базальную часть створки и занимающие 10% ее площади
(см. рис. 1.16, а). В трикуспидальном клапане артериальные сосуды имеют меньшии
диаметр, чем в митральном. В створках этого клапана располагаются, преимуществен-
но, сосуды рассыпного типа и сравнительно широкие петли кровеносных капилляров.
В митральном клапане более интенсивно кровоснабжается передняя створка, в три-
куспидальном — передняя и задняя створки, несущие ochoi ную замыкательную функ-
Рис. 1.16. Кровеносные сосуды клапана сердца, инъецированные тушью (по К. И. Кульчицкому
и др., 1990):
а - сосуды, сопровождающие пучки мышечных волокон передней створки митрального клапана
б - артериальные сосуды, проникающие в хорду из папиллярном мышцы, в - сосуды и летл i ка-
пилляров вблизи основания створки аортального клапана
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
цию Соотношение диаметров артериальных и венозных сосудов в предсердно-желу-
дочковых клапанах сердца людей зрелого возраста составляет 1:1,5. Петли капилля-
ров имеют полигональную форму и располагаются перпендикулярно основанию ство-
рок клапана. Сосуды образуют плоскостную сеть, расположенную под эндотелием со
стороны предсердий. Кровеносные сосуды выявлены также в сухожильных хордах, куда
они проникают из сосочковых мышц правого и левого желудочков на ра тояние до
30°о длины сухожильных хорд (см. рис. 1.16, б). Многочисленные кровеносные сосуды
образуют дугообразные петли в основании сухожильных хорд Клапаны аорты и легоч-
ного ствола по кровоснабжению в значительной степени отличаются от предсердно-
желудочковых. К основанию полулунных створок клапанов аорты и легочного ствола
подходят магистральные сосуды относительно меньшего диаметра (см. рис. 1.16, в).
Короткие ветви этих сосудов заканчиваются петлями капилляров неправильной оваль-
ной и полигональной формы. Они располагаются, преимущественно, вблизи основа-
ния полулунных створок Венозные сосуды в основании клапанов аорты и легочной
артерии также имеют меньший диаметр, чем в основании предсердно-желудочковых
клапанов. Соотношение диаметров артериальных и венозных сосудов в клапанах аор-
ты и легочной артерии сердца людей зрелого возраста составляет 1:1,4. От более круп-
ных сосудов отходят короткие боковые веточки, заканчивающиеся петлями капилля-
ров неправильной овальной и полигональной формы.
С возрастом наблюдается огрубление волокон соединительной ткани, как коллаге-
новых, так и эластических, а также уменьшение количества рыхлой волокнистой нео-
формленной соединительной ткани, развивается склероз ткани створок предсердно-
желудочковых клапанов и полулунных створок клапанов аорты и легочной артерии.
Уменьшается протяженность в клапанах волокон сердечной поперечнополосатой мы-
шечной ткани, а следовательно, снижается ее количество и число проникающих в кла-
паны кровеносных сосудов. В связи с указанными изменениями клапаны теряют свои
эластические и упругие свойства, что оказывает влияние на механизм закрытия ство-
рок и гемодинамику.
В клапанах сердца имеются сети лимфатических капилляров и незначительное
количество лимфатических сосудов, снабженных клапанами Лимфатические капилля-
ры створок имеют характерный вид просвет их весьма неравномерен, один и тот же
капилляр в разных участках имеет различный диаметр. В местах слияния нескольких
капилляров образуются расширения — лакуны различной формы. Петли сетей имеют
чаще неправильную многоугольную, реже овальную или круглую форму. Нередко петли
лимфатических сетей не замкнуты, и лимфатические капилляры заканчиваются слепо.
Петли лимфатических капилляров ориентированы чаще в направлении от свободного
к >ат тв ее основанию. В ряде случаев в створках атриовентрикулярного клапана
была обнаружена двухслойная сеть лимфатических капилляров (Спиридонова Е. П 1962).
Нервные сплетения эндокарда располагаются в различных его слоях главным об-
разом под эндотелием. У свободного края створок клапанов нервные волокна распо-
лагаются. преимущественно, радиально, соединяясь с таковыми сухожильных хорд.
Ближе к основанию створок образуется крупнопетлистое нервное сплетение которое
ТСЯ плетением- находящимся вокруг фиброзных колец. На полулунных
створках эндокардиальная нервная сеть более оелкая V „а , нилулунныл
НЯ становится гл/гтпм м - ЛУУ редкая, у места прикрепления клапанов
на с а овится гу тэи и многослойной (Михаилов С. С 1987 Соколов R r
Клапанные интерстициальные клетки птооиоЛ ’ Ов В‘ в - 2003>
клапана, имеют вытянутую форму с большим чисппк ЩИе ЗЭ пола,иржание структуры
ся через весь матрикс^апанГсущТс™ Т0НКИХ °ТрОСТКОВ‘ К0Т°Рые тян^п-
ная функция противостоит гемодинамическое У УМ И аппаРат Гольджи. Сократитель-
емодинамическому давлению и дополнительно поддержи-
w V — - — -
ГЛАВА 1 Анатомия, морфология и функция клапанов сердца человека
вается выработкой как кардиального, так и скелетного сократительных белков, кото-
рые включают тяжелые цепи а- и р-миозина и различные изоформы тропонина Со-
кращение створки клапана было продемонстрировано в ответ на ряд вазоактивных аген-
тов, предполагающих координирующее действие биологического стимула для успешно-
го функционирования клапана (Filip D, A. et al., 1986; Lester W. M. et aL, 1988; Zacks S.
et al., 1991; Messier R. H. et al., 1994; Mulholland D. L. et al., 1997).
Интерстициальные клетки являются также необходимыми компонентами восстано-
вительной системы клапана. Постоянное движение створок и деформация соедини-
тельной ткани, связанная с ней, производит повреждение, на которое клапанные ин-
терстициальные клетки реагируют с целью сохранения целостности клапана. Восста-
новительный процесс оказывается жизненно важным для нормального функциониро-
вания клапана, и отсутствие этих клеток в современных моделях искусственных клапа-
нов, вероятно, является фактором, способствующим структурным повреждениям био-
протезов (Schneider Р J. et al., 1981; Henney А. М. et al., 1982).
Важным направлением в исследовании интерстициальных клеток является изуче-
ние взаимодействия между ними и окружающим их матриксом, опосредованное фо-
кальной адгезией молекул. Фокальные адгезии — специализированные клеточно-мат-
риксные участки взаимодействия, связывающие цитоскелет клетки с белками матрик-
са через интегрины. Они также действуют как сигнальные участки для трансдукции,
передающие механическую информацию с внеклеточного матрикса, которая может
добиваться ответов, включая, но не ограничиваясь этим, клеточную адгезию, мигра-
цию, рост и дифференциацию. Понимание клеточной биологии клапанных интерсти-
циальных клеток жизненно важно для установления механизмов, при помощи кото-
рых эти клетки взаимодействуют между собой и окружающей средой, для возможнос-
ти воспроизведения этой функции в искусственных клапанах (Sastry S.K. et aL, 2000;
Weber E. et aL, 2002).
В связи с развитием перспективного направления тканевой инженерии клапанов
сердца исследования интерстициальных клеток проводятся с использованием широ-
кого спектра методик. Наличие цитоскелета клеток подтверждено окрашиванием на
виментин, десмин, тропонин, а-актина и миозина гладких мышц, тяжелых цепей а- и
р-миозина, легких цепей-2 кардиального миозина, а- и р-тубулина. Сокращаемость кле-
ток подтверждена позитивным ответом на епинефрин, ангиотензин II, брадикинин, кар-
бахол, хлорид калия, эндотелии I. Клеточная взаимосвязь определена функциональны-
ми щелевыми взаимодействиями и проверена микроинъекциями карбоксифлюорес-
цеина. Матриксная секреция установлена окрашиванием на пролил-4-гидроксилазу/
коллаген II типа, фибронектин, хондроитин сульфат, ламинин. Иннервация установлена
близким расположением двигательных нервных окончаний, что отражается активнос-
тью нейропептида Y тирозин гидроксилазы, ацетилхолинэстеразы, вазоактивного ки-
шечного полипептида, субстанции-Р, кальцитонин ген-связанного пептида. Митогенные
факторы оценены тромбоцитарным-наследуемым фактором роста, основным факто-
ром роста фибробластов, серотонином (5-НТ). Исследованные фибробласты интерсти-
циальных клеток характеризуются неполной базальной мембраной, длинными, тонки-
ми цитоплазматическими отростками, близкой связью с матриксом, хорошо развитым
неровным эндоплазматическим ретикулумом и аппаратом Гольджи, богатством микро-
филаментами, формированием адгезивных связей (Roy A. et aL, 2000; Chester А. Н
et al., 2000; 2001; Misfeld M. et aL, 2002).
Клапанные эндокардиальные клетки формируют функциональную атромбоген-
ную оболочку вокруг каждого клапана сердца, схожую с эндотелием сосудов. Широко
используемый способ замены клапана ликвидирует защитную функцию эндокарда, что
может приводить к отложению тромбоцитов и фибрина на искусственных клапанах,
развитию бактериальной инфекции и кальцификации ткани. Другая вероятная функ-
ция этих клеток — регуляция нижележащих клапанных интерстициальных клеток, похо-
жая на регуляцию гладкомышечных клеток эндотелием. Комплексное взаимодействие
ИСКУССТВЕННЫ Е КЛАПАНЫ СЕРДЦА
существует между эндотелием и соседними клетками, частично опосредованное ра-
створимыми факторами, секретируемыми клетками эндотелия Эти ^клетки образуют
огромную поверхность, покрытую микровыростами на люминальной стороне, таким
образом увеличивается экспозиция и возможное взаимодействие с метаболическими
субстанциями циркулирующей крови (Frater R. W. М. et aL, 1992; Lehner G. et aL, 1997;
Bachetti T et aL, 2000; Perry T. E. et al., 2003).
Эндотелий часто отображает морфологические и функциональные различия, выз-
ванные сдвиговыми напряжениями на стенке сосуда, возникающими при движении
крови, это же относится и к клапанным эндокардиальным клеткам, принимающих как
вытянутую, так и полигональную форму (Петрищев Н. Н., 2003). Изменения в структуре
клетки могут происходить благодаря действию местной гемодинамики на компоненты
цитоскелета клетки или вторичного эффекта, вызванного изменениями в нижележа-
щем внеклеточном матриксе. На уровне ультраструктуры клапанные эндокардиальные
клетки обладают межклеточными связями, плазматическими пузырьками, неровным эн-
доплазматическим ретикулумом и аппаратом Гольджи. Несмотря на то, что они выра-
батывают фактор Виллебранда, как в живом организме, так и в искусственной среде, в
них отсутствуют тельца Вейбель-Палада (специфические гранулы, содержащие фак-
тор Виллебранда), которые являются органеллами, характерными для эндотелия сосу-
дов. Клапанные эндокардиальные клетки характеризуются прочными соединениями,
функциональными щелевыми взаимодействиями и перекрываются краевыми складка-
ми (Manduteanu I. et al., 1988; Guarda E. et al.,. 1993; Lester W. M. et al., 1993; Smith J. A.
et al., 1993).
Эндокардиальные клетки сохраняют свою метаболическую активность даже in vitro:
вырабатывают фактор Виллебранда, простациклин, синтазу оксида азота, демонстри-
руют активность ангиотензин превращающего фермента, усиленно выделяют молеку-
лы адгезии ICAM-1 и ELAM-1, которые важны для связывания мононуклеарных клеток
при развитии иммунного ответа. Все эти маркеры должны учитываться при выращива-
нии идеальной культуры клеток для создания искусственного клапана методом ткане-
вой инженерии, но иммуностимулирующий потенциал самих клапанных эндокардиаль-
ных клеток может ограничить их использование (Simon A. et al., 1993; Siney L. et al.,
1993; Batten P. et al., 2001).
Внеклеточный матрикс клапанов сердца состоит из волокнистых коллагеновых
и эластиновых макромолекул, протеогликанов и гликопротеинов. Коллаген составляет
60% сухого веса клапана, эластин ~ 10% и протеогликаны ~ 20%. Коллагеновый ком-
понент обеспечивает основную механическую устойчивость клапана и представлен кол-
лагенами I (74%), II (24%) и V (2%) типов. Пучки коллагеновых нитей окружены эласти-
новой оболочкой, которая осуществляет взаимодействие между ними. Гликозамино-
гликановые боковые цепи молекул протеогликана имеют тенденцию к формированию
похожей на гель субстанции, в которой взаимодействуют другие молекулы матрикса
для формирования постоянных взаимосвязей и откладываются другие компоненты Гли-
козаминогликаны клапана сердца человека состоят, в основном, из гиалуроновой кис-
лотьц в меньшей степени - из дерматан сульфата, хондроитин-4-сульфата и хондрои-
тин-6-сульфата, с минимальным количеством гепаран сульфата (Murata К et al 1Q81-
Cole W.G et al., 1984; Kunzelman K. S. et al., 1993; Scott M efat lS
Ремоделирование и обновление ткани матрикса регулируются матоиксными ме-
таллопротеиназами (ММП) и их тканевыми ингибитооами „ W
нимают участие в более широком спектое' молекулы также при-
сов. Некоторые металлопротеиназы WX " патол0™^ских процес-
ММП-13) и желатиназы (ММП-2 ММП 9) и их тхя рстициаль“ые коллагеназы (ММП-1,
обнаружены во всех клапанах сердца Пепеияб! ИН™биторы <™-1, ТИ-2, ТИ-3),
рактерен для патологических состояний сердечного кл1₽аб0Т/ы 7еталлопротеиназ ха’
McCawtey L. J et al., 2001; Rabk,n E. et № ett™^ Sege, TJ.
et al.. 2002)
ГЛАВА 1. Анатомия, морфология и функция клапанов сердца человека
Клапаны сердца состоят из трех морфологически разных и функционально значи-
мых слоев матрикса створки — фиброзного, губчатого и желудочкового (рис. 1.17)
Фиброзный слой формирует устойчивый к нагрузкам каркас створки клапана, со-
стоящий из слоев коллагеновых волокон. Эти волокна располагаются радиально в виде
складок для возможности растяжения артериальных клапанов при закрытии. Фиброз-
ный слои лежит около выходной наружной поверхности этих клапанов. Фиброзный слои
предсердно-желудочковых клапанов служит продолжением коллагеновых пучков сухо-
жильных хорд. Он расположен между губчатым (входным) и желудочковым (выходным)
слоями (Fenoglio J. J. et aL, 1972; Missirlis Y R et al , 1977; Chnstov A. M et al., 1999)
Между фиброзным и желудочковым находится губчатый слои (спонгиоза) Губчатый
слой состоит из слабо организованной соединительной ткани в вязкой среде. Доми-
нирующими матриксными компонентами этого слоя являются протеогликаны с произ-
вольно ориентированным коллагеном и тонкими слоями эластина. Боковые цепи мо-
лекул протеогликанов несут сильный отрицательный заряд, что сказывается на их вы-
сокой способности связывать воду и формировать пористый гель матрикса. Губчаты
слой матрикса снижает механические напряжения в створках клапана и поддерживает
их гибкость (Walmsley R., 1978; Culav Е. М. et al., 1999).
Желудочковый слой намного тоньше, чем другие, и изобилует эластичными волок-
нами, которые позволяют тканям противостоять постоянной деформации. Эластин
имеет губчатую структуру, окружающую и соединяющую коллагеновые волокна, и обес-
печивает поддержание их в нейтральном складчатом состоянии. Входной слой клапа-
на (желудочковый — для артериальных клапанов и губчатый — для атриовентрикуляр-
ных) содержит большее количество эластина, чем выходной, что обеспечивает смягче-
ние гидравлического удара при закрытии створок. Эта взаимосвязь между коллагеном
и эластином допускает растяжение створок до 40° без устойчивой деформации При
воздействии малой нагрузки коллагеновые структуры этого слоя ориентируются в на-
ПУЛЬМОНАЛЬНЫЙ КЛАПАН
выходная поверхность
ФИБРОЗНЫМ СЛОИ
ГУБЧАТЫЙ СЛОИ
ЖЕЛУДОЧКОВЫЙ слой
входная поверхность
МИТРАЛЬНЫЙ КЛАПАН
губчатый слои
фиброзный слои
желудочковый слои
выходная поверхность
выходная поверхность
фиброзный слои
губчатый слой
желудочковый слой
входная поверхность
б
входная поверхность
1.17. Схема расположения слоев соединительной ткани в створках клапанов сердца (по L Gross
et al., 1931; A. Mol et al., 2004):
a — пульмональный и митральный клапаны, б аортальный клапан
—_______________— 33 ----------
2 Искусственные
клапаны сердца
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
правлении нагружения, и сопротивление его к дальнейшему росту нагрузки возраста-
ет (Vesely I. et al . 1992; Scott M. et al., 1995; 1996).
Таким образом, представление о клапанах сердца как о простои дупликатуре эндо-
карда является не только упрощенным, но и, по существу, неверным. Клапан сердца —
это орган со сложной структурой, включающий в себя поперечнополосатые мышечные
волокна, кровеносные и лимфатические сосуды, нервные элементы. Как по своему стро-
ению. так и по функционированию клапаны составляют единое целое со всеми струк-
турами сердца Анализ нормальной функции клапана должен принимать во внимание
его клеточную организацию, а также взаимодействие клеток между собой и матрик-
сом Знания, полученные в результате таких исследовании, являются ведущими при
проектировании и развитии протезирования клапанов с использованием тканевой ин-
женерии (Flanagan Т. С. et al., 2003; Sarraf С. Е. et al., 2003).
ЛИТЕРАТУРА
Антипас Д Б., Милованова 3 П , Завалишин Н Н. Строение и механические свойства легочного
ствола и его клапанов у человека// Морфология. — 1993. — Т. 104. — Вып. 3-4/2. — С. 73-80.
Берешвили И. И., Фальковский Г. Э., МохачевО М Морфологические критерии гипоплазии пра-
вого желудочка // Кардиология — 1982 — № 4. — С. 84-88.
Бураковский В И, Бухарин В А., Подзолков В П и др. Врожденные пороки сердца // Сердечно-
сосудистая хирургия / Под ред. В. И Бураковского, Л А. Бокерия. — М., 1996 — Гл. 2. —
С 47-381.
Быков О С Хирургическая анатомия трехстворчатого клапана // Вопросы клинической и экспери-
ментальной медицины / Под ред. И. И. Шафера — Красноярск, 1972. — Вып. 3. — С. 100-102.
Вальтер А В Хронические пороки аортальных клапанов. — Л.; Медицина, 1948. — С 237-240
Воропаев Т С Клапанный аппарат предсердно-желудочковых отверстий в норме и при митраль-
ном стенозе//Вести хир им И И Грекова. — 1956 — № 7. — С. 46-57.
Гавриленков В. И Основы протезирования клапана аорты бескаркасными биопротезами (экспе-
риментальное исследование): Автореф дис до кт. мед наук. — СПб., 2004
Гавриленков В И Особенности троения свиного клапана аорты как потенциального ксенограф-
та для замещения клапана аорты человека // Вестн. хир им. И И Гоекова _2004 __Т 163
№ 3. - С. 28-34
Гавриленков В И., Кузнецов А. А., Перлеи В £ и др. Эхокардиографическая оценка нормальной
2003 -аноИ2И-°СТ89^96ГО " УлЬТра3вуковая и Функциональная диагностика.
Гавриленк В И , Юхнев А Д, МаслевцовД В-Возрастная динамика биомеханических и гидро-
>M-2WX-T^9B“ЛНО2ас°Р2ТаЛ_ь2н5огокомпле№ЗчеЛовека//Вестн хир. им И. И. Гре-
r^®a^№^pyp™^c_^ аНЭТ0МИЯ митРального клапана//Вести, хир. им и И Грекова -
Гончаров О. Г. Хирургическая анатомия клапанного аппэоатл аппт.. м
лечения пороков сердца // Вестн хир. им И. И Грекова. - 1956 - No/С74 те” 6
Гриценко В. В , Орловский П И Илраякми1й - 14,9'• Ь /4-/9
создай» „кс „ Мир яСзГ6°"“ ”
Джавахишвили Н. А., Комахидзе М. Э , Цагарели 3 Г Ссг
Тбилиси: Мецниереба, 1982. ‘ СУДЫ сердца в норме и эксперименте —
Дземешкевич С. Л,, Стивенсон Л. У. Болечни ммтпзп
ние — М.: Гэотар Медицина, 2000 ьного клапана. Функция, диагностика лече-
Дземешкевич С. Л., Стивенсон Л У ' Алекс и Мы vm
Функция, диагностика, лечение - М • Гэотап опл 6 Бопезни аортального клапана
Дисфункция эндотелия. Причины механизмы ^Д’ °4’
Н Н. Петрищева - СПб.: Изд-во СПбГМУ - 20^армакологическая коррекция // Под ред
34
ГЛАВА 1 Анатомия, морфология и функция клапанов сердца человека
Каро К., Педли Е., Шротер Р. и др. Механика кровообращения / Пер. с англ. Е. В. Лукошниковой —
М.: Мир, 1981.
Константинов Б. А., Прелатов В. А, Иванов В, А. и др. Клапаносбереглющие реконструктивные
операции в хирургии пороков сердца. — М.: Медицина, 1989.
Константинов Б. А., Сычеников И. А., Сагалевич В. М. и др. Функциональная анатомия аорталь-
ных клапанов //Хирургия. — 1980. — Т. 3. — № 2. — С. 11-15.
Копейкин Н. Г. К анатомии аортальных клапанов // Учен. зап. Гэрьковского пед. ин-та — Горький,
1967. — Вып. 79. — С. 29-34.
Копейкин Н. Г Строение и упругие свойства атриовентрикулярных клапанов сердца человека //
Учен. зап. (серия анатомия и физиология). — Горький, 1966. — Вып. 58. — С. 68-78.
Копейкин Н. Г. О физико-механических свойствах атриовентрикулярных клапанов сердца чело-
века Ц Кардиология. — 1965. — № 5. — С. 85-86.
Криницкий Ш. И. Воспаление и склерозы клапанов сердца. — 3-е изд. — Ростов н/Д: Ростиздат, 1940.
Кузьмина Н. Б., Калинин Н. М., Ильина М. Б. и др. К вопросу о механизме функции естественных
клапанов сердца // Кардиология. — 1967. - №6. - С. 25-31
Кульчицкий К. И., Соколов В. В., Марущенко Г. Н. Клапаны сердца. — Киев: Здоровья, 1990.
Лопухин Ю М. Топографическая анатомия главных отверстий сердца в норме и патологии // Хи-
рургия. — 1959. — № 10. — С. 66 -73.
Малиновский Н. Н., Константинов Б. А., Дземешкевич С. Л. Биологические протезы клапанов
сердца. — М.: Медицина, 1988.
Мартынов Г. В. О кровоснабжении клапанов сердца людей пожилого и старческого возраста //
Вопросы морфологии кровеносной и нервной систем. — Саратов: Приволж. кн. изд-во, 1973. —
Вып. 4.— С. 31-34.
Михайлов С. С. Клиническая анатомия сердца. — М.: Медицина, 1987.
МурачА. М. Индивидуальные и возрастные различия размеров восходящей аорты и аортального
клапана//Вести, хир. им. И. И. Грекова. — 1970. — Т105. — №.10. — С. 20-22
Нечаев Э. А., СлауцитайсД. К. Клиническое значение некоторых особенностей хирургической ана-
томии трехстворчатого клапана // Вести, хир. им. И. И. Грекова — 1973. — № 7. — С. 133-134.
Огнев Б. А., Саввин В. Н., Савельева Л. А. Кровеносные сосуды сердца в норме и патологии. —
М.: Медгиз, 1956.
Орлов Г А. Строение и механизм двухстворчатого клапана сердца // Грудная хир. — 1961. —
№ 6.— С. 26-31.
Рашмер Р. Ф. Динамика сердечно-сосудистой системы / Пер. с англ. М. А. Безносовой, Т. Е. Куз-
нецовой, под ред. Г. И. Косицкого — М.: Медицина, 1981.
Садовская Н. П. Строение и развитие клапанов сердца позвоночных животных и человека: Авто-
реф. дис. докт. биол. наук. — М., 1964.
Синельников Р. Д. Атлас анатомии человека. Т. II. — М.: Медицина, 1979.
Соколов В. В., Литвинова Л. В. Особенности ангиоархитектоники сосочковых мышц и сухожиль-
ных хорд сердца человека // Арх. анатомии, гистологии и эмбриологии. — 1985. — Т. 88. —
№ 5. — С. 27-34.
Соколов В. В. Сравнительная морфология клапанов сердца. — Ростов-на-Дону: Изд. Рост, гос
мед. ун-та, 2003.
Соловьев Г. М., Иванов С. П., Прохоров А. С. Пороки трикуспидального клапана и пластические
операции на нем / АМН СССР. — М.: Медицина, 1988.
Спиридонова Е. П. Лимфатические сосуды клапанов сердца человека// Сб. науч. тр. Ивановско-
го мед ин-та. — 1962. — Т. 26. — С. 127-129.
Фолков Б., Нил Э. Кровообращение / Пер. с англ. — М.: Медицина, 1976.
Халькин А. М., Худякова М. И. Хирургическая анатомия аортального капана // Грудная хир. —
1961. — №5.— С. 3-7.
Христодуло-Финити А. С. К вопросу о предсердно-желудочковых клапанах сердца человека //
Арх. анатомии, гистологии и эмбриологии. — 1985. — Т 48. — № 3. — С 56-60
Цукерман Г. И., Хассан Али. Скопин И. И. Реконструктивная хирургия пролапса митрального кла-
пана. — М.: Экспедитор, 1995.
Чазов Е. И. (ред.) Руководство по кардиологии. Т. 1. — М.: Медицина, 1982.
Чекарева Г. А. Васкуляризация клапанного аппарата сердца при ревматическом пороке // Арх.
пат. — 1965. — Т 27. — № 3. —С. 31-36.
Anderson В. Н., Devine W., Но S. Y. et al. The myth of the aortic annulus: the anatomy of the subaortic
outflow tract // An. Thorac. Suig. — 1991. — Vol. 52, № 3. — P. 640-646
---------------------------------------------------------35
2*
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
Anderson R Н , Lal М , Но S Y Anatomy of the aortic root with particular emphasis on options for its
surgical enlargement//J Heart Valve Disease — 1996 Vol 5 (Suppl 3) P 249-257
Arts A Reneman R S Dynamics of left ventricular wall and mitral valve mechanics — a model study //
J Biomech - 1989 - Vol 22, №3 -P 261-271
Babburi H Oommen R Broffeno A et al Functional anatomy of the normal mitral apparatus a
transthoracic, two-dimensional echocardiographic study//J Heart Valve Disease —2003 Vol 12,
№2 -P 180-185
Bachetti T, MorbidelhL Endothelial cells in culture a model for studying vascular function//Pharmacol
Res _ 2000 — Vol 42, № 1 - P 9-19
Batten P McCormack A M,RoseM L etal Valve interstitial cells induce donor-specific T-cell anergy//
J Thorac Cardiovasc Surg —2001 — Vol 122, №1 — P 129-135
Bellhouse В J, Bellhouse F H Fluid mechanics of aortic root with application to coronary flow //
Nature - 1968 - Vol 219, №9 —P1058-1061
Bellhouse В J Velocity and pressure distributions in the aortic valve//J Fluid mech —1969 — Vol 37,
№ 3 — P 587-600
Bellhouse В J , Bellhouse F H , Gunning A J Studies of a model mitral valve with three cusps // Brit
Heart J — 1973 — Vol 35, № 10 — P 1075-1079
Bellhouse В J, Talbot L The fluid mechanics of the aortic valve // J Fluid Mech -1969 — Vol 35,
№4 —P 721-735
Braunwald E, Ross J , Sonnenbhck E H Mechanisms of contraction of the normal and falling heart
Little Brown — Boston, 1968
Braunwald E Valvular heart disease, in Braunwald E (ed) Heart Disease, A Textbook of Cardiovascular
Medicine, 6th ed Philadelphia, WB Saunders 2001
Brewer R J , Deck D , Capati В et al The dynamic aortic root Its role in aortic valve function //
J Thorac Cardiovasc Surg —1976 — Vol 72 №3 —P 413-417
Brock R C The surgical and pathological anatomy of the mitral valve //Brit Heart J —1952 — Vol 14
№2 —P 489-513
BrockmanS К Mechanism of the movements of the atrioventricular valves Amer J Cardiol —1966 —
Vol 17, №5 -P 682-690
Butany J , Pnvitera S , David T Mitral valve prolapse an atypical variation of the anatomy // Can
J Cardiol —2003 — Vol 19, №12 — P 1367-1373
Butterfield M , Fisher J, Lockie KJ et al Frame-mounted porcine valve bioprostheses Preparation
?9939-(S7o°6 No?" B;°,78C1ha1n1'“a,lddesi9nconsideratlor’s/ J Thorac. Cardiovasc Surg -
Carpentier AChanard J, Bnotet J M etal Replacement of the mural valve wrth heterotooic hetero-
grafts// Presse Med - 1967 - Vol 75, № 31 - P 1603-1606 neierotopic netero
Chakorn S A Siggere D C Wharton C F P et al Study of normal and abnormal movements of m.tral
valve ring using .effected ultrasound // But Heart J - 1972 - Vol 34 No 5 pTro
ChesterA H MisfeldM SieversH H etal InfhiPnronf а л ’ b — P 480-486
in vitro//J Heart Valve Disease -2001 -Vol 10
^XvalveSs^e '- Vol 9^°^°' aOrt'C "
Ch'C^A-^2 Thorac Surg -
Choo S J McRae G Olomon J P et al Aortic met
and sinuses of Valsalva // J Heart Valve Disease — 1 °f dlfterences between leaflets
Christie G W Anatomy of aortic heart valve leaflets th* mfi. о ° <8’ Nq 4 ~ p 407-415
tion//Eur J Cardiothorac Surg —1992 — Vol А м 1/СеПСе °f Q,utaralclehyde fixation on func-
ChnstovA M Liu L LoweS et al uXrl пн Л N° 1(Supp,) ~ p 25-33
, Laser'induced fluoroscpnco /i im
composition of porcine heart valves//Photochem pk^, . , ce <LIF> recognition of the structural
Cohen G Chnstak.se T, JoynerC D et a? A?e stenhe^ ? T.'"9 ~Vo1 69'№3 -P 382-389
valves? A prospective randomized trial // An Thomr c.7 "®тос)Упаге1са11у superior to stented
ColeW G, Chan D, Hickey A J etal Collagen composition nr 2°°2 ~ Vo1 73'№3 - P 767-778
heart valves /Biochem J - 1984 -у9, 219 n„ p°!"0™а'and myxomatous human mitral
Culav E M Clark C H„ Memlees M J Connect,^ tl 460
physical therapy // Phys Ther - 1999 Vo) 79 ‘'S0Sdes compoS1t>on and ,ts relevance to
Dagum P Green R NistalF J etai Deform=t.n 2 ~p 308-319
determinants//Circulation _ 1999 _Vo| ™softhe aon.croot modes and phys.olog.0
30 “ ,3\°uppi) — p 54-02
ГЛ АВА 1 Анатомия, морфология и функция клапанов сердца человека
David Т Е Aortic Valve Sparing Operations//An Thorac Surg —2002 — Vol 73, №4—P 1029-1030
Davila J. C The mechanics of the cardiac valves Considerations pertinent to the design and construction of
prostheses/ln Prosthetic valves for cardiac surgery, MerendinoK A (ed ), Springfield 1961 — P3-47
DavisP К В., KmmonthJ В The movements of the annulus of the mitral valve//J Caidiovasc Surg —
1963 — Vol. 4, № 4 — P 427-431
De Hart J Peters G W M , Schreurs P J G et al A two-dimensional fluid-structure interaction model
of the aortic valve//J Biomech —2000 — Vol 33, №9 — P 1079-1088
Dean A L The movements of the mitral cusps in relation to the cardiac cycle // Amer J Physiol —
1916 — Vol. 40, №2 —P 206-217
Doss M., Martens S.t Wood J Petal Performance of stentless versus stented aortic valve bioprostheses
in the elderly patient: a prospective randomized trial//Eur J Cardiothorac Surg —2003. —Vol 23
№3. — P 299-304
Dreger S A., Taylor P M , Chester A H etal Immunohistochemical characterization of the inter-leaflet
triangle of the human aortic valve // SHVD congress — 2003
Dreger S A., Taylor P M , Allen S P et al Profile and localisation of matrix metalloproteinases (MMPs)
and their tissue inhibitors (TIMPs) in human heart valves / J Heart Valve Disease — 2002 —
Vol. 11, № 4 — P 875-880
Duran C M. G., Gunning A J The vascularization of the heart valves A comparative study//Cardiovasc
Res — 1968 — Vol 2, №3 - P 290-296
Ennker J , Rosendahl (J, Ennker I C et al Risk in Elderly Patients After Stentless Versus Stented Aortic
Valve Surgery//Asian Cardiovasc Thorac An. — 2003 — Vol 11, № 1 — R 37-41
Fenoglio J J, Pham T. D, Wit A. L et al. Canine mitral complex, ultrastructure and electromechanical
properties//Circ Res. — 1972 — Vol 31, №2 —P 417-430
Filip D A , Padu A , Simionescu M Interstitial cells of the heart valves possess characteristics similar to
smooth muscle cells//Circ Res —1986 — Vol 59, № 2 —P 310-320
Flanagan T C, Pandit A Living artificial heart valve alternatives//Europ Cellsand Materials — 2003 —
Vol 6, № 1 — P 28-45
Frater R W M, Gong G , Hoffman D et al Endothelial covering of biological artificial heart valves // An
Thorac Surg.— 1992 —Vol 53, №2 —P 371-372
GahsZ S,KhatnJ J Matrix metalloproteinases in vascular remodelling and atherogenesis the good,
the bad, and the ugly//Circ Res —2002 — Vol 90, №2 —P 251-262
Gorodkov A , Dobrova N B., Dubernard J et al. Anatomical structures determining blood flow in the
heart left ventricle//J Mater Science: Mater in Medicine — 1996 — Vol 7, № 1 — P 153-160
Greve H H, Farah I, Everhen M Comparison of three different types of stentless valves full root or
subcoronary//An Thorac. Surg —2001 —Vol 71, №5 (Suppl 1). —P. 293-296
Gross L , Kugel M A Topographic anatomy and histology of the valves in the human heart // Amer
J Pathol — 1931 — Vol 7, №2 — P 445-456
Guarda E, Myers P R , Bnlla C G et al Endothelial cell induced modulation of fibroblast collagen
metabolism//Cardiovasc. Res — 1993 — Vol 27, № 5 — P 1004-1008
Hansen В , Menkis AH, Vesely I Longitudinal and radial distensibihty of the porcine aortic root // An
Thorac, Surg — 1995 —Vol. 60. № 2. — P 384-390
Harvey W Movement of the heart and blood in animals An anatomical essay, 1628. In Kenneth J .Franklin
Oxford Blackwell, 1957
Haugen В О , Berg S , Brecke К M et al Measurement of volumetric mitral and aortic blood flow based
on a new freehand three-dimensional color flow imaging method.- an in vivo validation // Eur J
Echocardiography — 2000 — Vol 1, № 1 — P 204-211
Henderson Y, Johnson F E Two modes of closure of the heart valves // Heart — 1912 — Vol 4
№ 1 — P 69-82
Henney A M, Parker D J, Davies M J Collagen biosynthesis in normal and abnormal human heart
valves // Cardiovasc Res — 1982 — Vol 16, № 3 — P 624-630
Kunzelman К S , Grande К J , David T. E et al Aortic root and valve relationships Impact on surgical
repair//J Thorac Cardiovasc Surg — 1994 —Vol 107, №1 —P 162-170
Kunzelman К S, Cochran R P, Murphree S S et al Differential collagen distribution in the mitral valve
and its influence on biomechanical behavior /. J Heart Valve Disease — 1993 — Vol 2, № 2
P 236-244
Lam J H C , Rangamathan N , Wigle H D. et al Morphology of the human mitral valve 1) Choidae
tendineae a new classification //Circulation — 1970 — Vol 41, № 3 — P 449-458
Layton C., Gent G . Pride R et al Diastolic closure rate of normal mitral valve // Brit Heart J — 1973 —
Vol 35, № 10 — P 1066-1074
37
ИСКУССТВЕННЫЕ К ЛАПАНЫ СЕРДЦА_____________________________________________________________________ I
LehnerG. Fischlein Т. Baretton G et al Endotheliahzed biological heart.valve• P^stheses m the non-
human primate model // Eur J Cardiothoiac Suig -1997 -Vol 11 №2 P 498 504
Lester W M Damii A A., Gedeon I et al Interstitial cells horn the atrial and ventricular sides of the
bovine mitral valve respond differently to denuding endocardial injury // In Vitro Cell Dev Biol -
1993 —Vol 29A.№1 -P 41-50
LestetW M Rosenthal A Gianton В et al. Porcine mitral valve interstitial cells in culture //Lab Invest -
1988 — Vol 59, № 5. — P 710-719-
Little R C Effect of ati lai systole on ventricular pressure and closure of A-V valves // Amer J Physiol
1951 -Vol 166, №2 -P 289-295
Loc^ie К J Fisher J Jester N P et al Biomechanics of glutaraldehyde-treated porcine aortic roots
and valves An investigation of the effect of predilation of the elastic aortic root// J Thorac Cardiovasc
Surg —1994 —Vol 108,№6 —P 1037-1042
Lozsadi E ArvayA Comparative anatomical investigation on the heterotransplantation of the aortic val-
ve//Acta Chir Acad Sci Hung —1969 —Vol 10, №2 —P 207-214
Manduteanu I Popov D , Radu A et al Calf cardiac valvular endothelial cells in culture: production of
glycosaminoglycans, prostacyclin and fibronectin//J Mol Cell Cardiol . — 1988 — Vol 20, № 1 —
P 103-118
McCawley L J Matnsian L M Matrix metalloproteinases they’re not just for matrix anymore! // Curr.
Opin Cell Biol —2001 —Vol 13, № 4. — P 534-540
Mercer J L , Benedicty M , Bahnson H T The movements of the dog’s aortic valve studied by high
speed cineangiography The geometry and construction of the aortic leaflet//J Thorac Cardiovasc
Surg —1973 —Vol 65, № 4 -P 511-518.
Messier R H., Bass В L , Aly H M et al Dual structural and functional characteristics of the porcine
aortic valve interstitial population characteristics of the leaflet myofibroblast // J Surg Res —
1994 — Vol 57, № 1 — P 1-21
Micro M J, RogersE W.WeymanA E etal Angular displacement of the papillary muscles during the
cardiac cycle // Circulation — 1979 — Vol 60, № 2 — P 327-333
MtsfeldM., Morrison K., Sievers H et al Localisation of immunoreactive endothelin and characterisation
of its receptors in aortic cusps // J Heart Valve Disease. — 2002. — Vol 11, № 2 — P. 472-476
Missirhs Y F, Armeniades C D U Restructure of the human aortic valve // Acta Anat — 1977 —
Vol 98. № 1 -P199-205
Mol A Bouten С V C , Baaijens F P T et al Review article tissue engineering of semilunar heart
valves current status and future developments//J of Heart Valve Disease — 2004 — Vol 13,
№ 2 - P 272-280
Mulholland D L , Gotlieb A I Cardiac valve interstitial cells regulator of valve structure and function //
Cardiovasc Pathol — 1997 — Vol 6 №1 — P 167-174
MurataK Acidic glycosaminoglycans in human heart valves//J Mol Cell Cardiol __1981 ____Vol 13,
hl— 2.j 281 ^292
at.’nn29//e 1°еип опТТЬе^пп L e.al. Matnx ^"op^temases b.olog.c activity and clocal
implications//J Chn Oncol —2000 —Vol 18 N°8 _______P 1135—1149
Zr ₽ rS S (’COn 1еаГП1П9 Syatems'LLC'a MedlMedia USA Company, 2003.
₽ Ы ' f R S J C®rdl0vascular tissue engineering. Constructing living tissue cardiac valves and
blood vesse s using bone marrow umbilical corrl hicr.a У &bue car° ac va,ves d ,L
Nurs.-2003 - Vol 18. №1 - P “y Peripheral blood cells//J Card.ovasc
Rabkm E, Aikawa M , Stone J R et al Activated ,
and mediate matrix remodeling in myxomatous headи ™yo,lbr°b|asts express catabolic enzymes
№12 -P 2525-2532 "WmatouS heart valves // Circulation - 2001 - Vol 104.
Reid К The anatomy of the sinus of valsalva // Thorax - 1970 v„i м .
Roy A , Brand N J, Yacoub M H Molecular гЬ=г=Д » ° ~ V° 25. Ns 1. - P 79-85
heart valves // J Heart Valve Disease — 2000 ? lnters,ltial cells isolated from human
Saka, T, Окна Y Ueda Y et al D.stance between ? 9' № 3 ~ P 459^464
in normal human hearts //j Thorac Cardiovasc раР||1агУ muscles anatomic study
SallmE A Fiber onentafon and eject™XCZ >n Л' ~V°' 118>№4 “p 636-641
№ 7 - P 954-964 " ln the left ventricle // Biophys J - 1969 - Vol 9.
Sands M P Rittenhouse E A MohnH etal Ananat
aortic valves //An Thorac Surg — 1959 _ Vq. comP^ns°n of human, pig, call, and sheep
SarrafC E. Harns A В McCulloch A D « № 5 - p 407-414
2003 -Vol 36,№2 -P 241-254 ”eartva,ve^dartenalt.ssueengineering//CellProhf -
38 _______________
ГЛАВА 1 Анатомия, морфология и функция клапанов сердца человека
Sastry К, Burndge К Focal adhesions a nexus for intracellular signaling and cytoskeletal dynamic" //
Exp Cell Res — 2000 — Vol 26, № 1 — P 25-36.
Sauren A A , Kuijpers W , Van Steenhoven A A et al Aortic valve histology and its relation with
mechanics — preliminary report//J Biomech — 1980 — Vol 13, №2 —P 97-104
Schneider P J , Deck J D Tissue and cell renewal in the natural aortic valve of rats an autoradiographic
study//Cardiovasc Res. —1981 —Vol 15, №1 —P 181-189
Scott M, Vesely! Aortic valve cusp microstructure: the role of elastin//An Thorac Surg — 1995 —
Vol 60, №2 —P 391-394.
Scott M J, Vesely I Morphology of the porcine aortic valve cusp elastin 11J Heart Valve Disease —
1996 — Vol 5, №2 —p 464-471.
Silver M A , Roberts W C Detailed anatomy of the normally functioning aortic valve in the hearts of
normal and increased weight //Am J Cardiol — 1985. — Vol. 55, № 4 — P 454-461
Simon A , Zavazava N, Sievers H H et al In vitro cultivation and immunogenicity of human cardiac valve
endothelium//J Card Surg — 1993 — Vol 8, №4 —P 656-665
Smey L . Lewis M J Nitric oxide release from porcine mitral valve//Cardiovasc Res.— 1993 — Vol 27,
№ 10 — P 1657-1661
Smith J A . Radomski M W, Schulz R et al Porcine ventricular endocardial cells in culture express the
inducible form of nitric oxide synthase//Br J Pharmacol. — 1993 —Vol 108,№5 —P 1107-1110
Sutton J P, Ho S Y, Anderson R H. et al The forgotten interleaflet triangles a review of the surgical
anatomy of the aortic valve //An Thorac Surg — 1995 — Vol 59, № 2 — P 419-427
Swanson И/ M , Clark R E Dimensions and geometric relationships of the human aortic value as a
function of pressure // Circ. Res. — 1974 — Vol 35, № 6. — P 871-882
Thubnkar M , Heckman J L , Nolan S P High speed cine-radiographic study of aortic valve leaflet mo-
tion//J Heart Valve Disease — 1993 — Vol 2 —N 6 —P 653-661
Thubnkar M, Nolan S P Bosher L P et al The cyclic changes and structure of the base of the aortic
valve//Am Heart J — 1980 — Vol 99, № 2 — P 217-224
Thubnkar M J., Nolan S P AouadJ et al Stress sharing between the sinus and leaflets of canine aortic
valve //An Thorac. Surg — 1986 — Vol 42, №4.-P 434-440
Van Steenhoven A A., Veenstra P C, Reneman R S The effect of hemodynamic factors on the behaviour
of the aortic valve//J Biomechanics — 1982 — Vol 15, №12 —P 941-950
Vesely I Noseworthy R Micromechanics of the fibrosa and the ventnculans in aortic valve leaflets // J
Biomech — 1992 — Vol 25, № 1 —P 101-113
Vesely I The role of elastin in aortic valve mechanics //J. Biomech —1998 — Vol 31, №2. — P 115-123.
Walmsley R Anatomy of the human mitral valve in adult cadaver and comparative anatomy of the valve //
Br Heart J — 1978 — Vol 40, № 2 — P 352-366
Wearn J T, Montz A R , Dowling A S et al The incidence and significance of blood vessels in normal
and abnormal heart valves//Am. Heart J — 1937 — Vol. 13, № 1. — P. 7-13
Weber E., Rossi A , Sohto R et al Focal adhesion molecules expression and fibrillin deposition by
lymphatic and blood vessel endothelial cells in culture //Microvasc Res —2002.—Vol 64, № 1 —
P 47-55
Westaby S , Horton M. Jin X et al Survival advantage of stentless aortic bioprostheses 11 An Thorac
Surg —2000 — Vol 70, № 3 —P 785-791
Zacks S , Rosenthal A . Granton В et al Characterization of cobblestone mitral valve interstitial cells //
Arch Pathol Lab Med —1991 —Vol 115, №6 —P 774-7 9
Zimmerman J The functional and surgical anatomy of the aortic valve // Isr J Med Sci — 1969 —
Vol 5, № 4 — P 862-866
39
ГЛАВА 2
МЕХАНИЧЕСКИЕ ИСКУССТВЕННЫЕ
КЛАПАНЫ СЕРДЦА
Рассмотрим в историческом плане основные модели механических искусственных
клапанов сердца Условно для удобства изложения и возможности ориентации в име-
ющихся конструкциях их можно подразделить на лепестковые и вентильные клапаны,
последние подразделяются на клапаны с поступательным движением запирающего
элемента (осесимметричные), поворотно-дисковые и двустворчатые (Шумаков В И ,
1965) - табл 2 1.
Таблица 2 1
Эволюция механических искусственных клапанов сердца
Запирающие элементы Лепестки Шар, полушар, линза Диск плоский, профилированный Створки плоские, профилированные
Материалы Полимеры, металлы, пиролитическии углерод Полимеры, пиролитический углерод
Движение Изгибное Поступательное Вращательное вокруг одной или двух осей
Анализ сорокалетнего мирового опыта применения протезов клапанов сердца по-
служил основой для формулирования следующих основных требовании к механичес-
ким клапанам. Механическая надежность протеза должна обеспечивать долговечность
его работы в течение жизни пациента Гемодинамические свойства протеза должны
быть близки к естественным и сохраняться во времени (поток должен быть ламинар-
ным, запирающий элемент должен обладать минимальной инерционностью, сопротив-
ление и регургитация на протезе должны быть не выше, чем у естественных клапанов)
Клапаны должны быть биоинертными, не травмировать форменные элементы крови,
обладать минимальным объемом и массой, быть удобными для хирурга при импланта-
ции в любых анатомических условиях Тромборезистентность должна исключать опас-
ность развития тромбоза и тромбоэмболии без использования антикоагулянтной те-
рапии Размеры и форма протеза не должны ухудшать механику сердечных сокраще-
ний Должны быть гарантированы простота хранения, стерильность и отсутствие
шумового дискомфорта
ЛЕПЕСТКОВЫЕ КЛАПАНЫ
(сша).
вателеи (Уоллес Р 1997) Пепвло ы анов сеРдца Работала 51 группа исследо-
существовать в клинической> К°Т°Р°Му Суждено было недолго пр°‘
ца лепесткового типа ствооки кптпгли.’ ° создание искусственных клапанов серд-
а. створки которых изготавливались из синтетических материалов
40 —____
ГЛАВА 2 Механические искусственные клапаны сердца
и работали на двойной изгиб во время каждого сердечного цикла подобно створкам
естественных клапанов Лепестки (створки) этих клапанов были плоские или имели
форму, подобную полулунным створкам аортального или пульмонального клапанов сер-
дца Однако все они были довольно тонкие, имели приблизительно одинаковую тол-
щину на всем своем протяжении, и лишь иногда их основание было несколько толще
свободного края. Лепестковые искусственные клапаны сердца крепились к корпусу
клапана или стенкам сердечной камеры у своего основания, как естественные клапа-
ны сердца. В некоторых конструкциях створки присоединялись к центру основания
корпуса (седла) на дополнительных перекладинах или стойках Группа лепестковых
искусственных клапанов сердца подразделялась на одно-, двух-, трех-, и четырехлепе-
стковые клапаны Все лепестковые протезы клапанов были низкопрофильными, то есть
занимали минимальное количество места в камерах сердца, аорте и легочной артерии
(Cooper Т et al., 1960)
Группа однолепестковых искусственных клапанов сердца немногочисленна Они
применялись, главным образом, для замены не только митрального клапана сердца,
но и аортального и, чаще всего, в условиях эксперимента Так, в 1957 г. Е. Н Berg и
J. С. Stuckey сообщили о применении в эксперименте на собаках одностворчатого ис-
кусственного клапана сердца, корпус которого в виде кольца с углублением на его на-
ружной поверхности изготавливали из тефлона, нейлона или нержавеющей стали
(Stuckey J С et al., 1961) Створка, присоединенная к корпусу шарниром, была сдела-
на из тефлона С W Lillehei (1918-1999), работавший в университете Миннесоты, в эк-
сперименте на собаках разработал однолепестковый протез из силастика, основание
которого было усилено тонкой полоской из спрессованного поливинилового спирта
(рис 2.1). Именно с помощью этого протеза в октябре 1958 г С. W. Lillehei (Lillehei
С. W., et al., 1961) впервые в мире успешно выполнил протезирование аортального кла-
пана сердца в клинической практике у больной с выраженной аортальной недостаточ-
ностью в условиях искусственного кровообращения. Это была первая успешная опе-
рация полной замены клапана сердца у человека. Через 5 лет больная оставалась
в хорошем состоянии После этого еще несколько авторов применили одностворчатые
лепестковые клапаны, как в эксперименте, так и в клинике (Doumanian А V., 1961, Frater
R W, 1961). Созданные модели были принципиально сходны с протезом С W. Lillehei.
Среди одностворчатых протезов наиболее удачной была конструкция R. W. Frater (1961).
Клапан состоял из овального кольца и гибкой створки, имеющей поперечные зоны
жесткости. Это давало створке возможность мягко открываться и закрываться
Рис. 2.1. С. W. Lillehei (по Р. Уоллесу, 1997) и искусственный клапан сердца его конструкции:
а, б, в — этапы имплантации клапана в устье аорты (по Б В Петровскому и др 1966)
41
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
Двухлепестковые протезы представляли собой уже более сложные конструкции,
среди которых встречались и протезы, содержащие хорды Такие протезы были пред-
назначены исключительно для замены митрального клапана, и своей конструкцией в
той или иной степени имитировали его. В 1958 г. C.W. Lillehei выполнил одно из пер-
вых успешных протезирований аортального клапана с использованием двухлепестко-
вого протеза со створками из силиконовой резины.
N.S. Braunwald (1928-1992) работала общим хирургом в больнице Нью-Йорка,
ассистентом в лаборатории С. Hufnagel Джорджтаунского университета, кардиотора-
кальным хирургом в Национальном институте сердца Вашингтона Рассматривая уда-
ленные из организма разрушенные лепестковые протезы собственной конструкции, она
обнаружила их тотальное покрытие слоем соединительной ткани и пришла к выводу,
что подобное покрытие металлического каркаса шарового или дискового клапана мо-
жет уменьшить количество случаев тромбоэмболии. В 1959 г N. S. Braunwald разрабо-
тала митральный протез, состоящий из двух полиуретановых створок, армированных
сеткой из дакрона и объединенных полиуретановым кольцом с тефлоновыми хордами
(рис. 2.2). Этот клапан был впервые применен в клинике в 1960 г. (Braunwald N. S. et
al., 1960). Створки клапана функционировали хорошо в течение нескольких месяцев,
затем становились жесткими и неподвижными. Протез укреплялся в сердце путем под-
шивания его седла к фиброзному кольцу митрального клапана и закрепления хорд на
наружной поверхности левого желудочка. Правильность натяжения хорд контролиро-
валась путем внутрисердечной пальпации или по кривой давления в камере левого
предсердия. Следует отметить, что двустворчатые искусственные клапаны сердца с
хордами, кроме недостатков, присущих всем лепестковым клапанам требовали более
сложной техники имплантации и таили в себе опасность не только разрыва или отрыва
лепестков, но также и хорд. Все эти отрицательные качества послужили причиной от-
каза от их применения в клинической практике. В 1968 г. N. S. Braunwald перешла ра-
ботать в Калифорнийский университет (г. Сан-Диего) с мужем G Braunwald, работав-
шим врачом-кардиологом. В 1972 г. они переехали в Бостон, где она стала профессо-
iM хирургии Гарвардской Медицинской Школы. В 1992 г. она получила премию
Ассоциации женщин-хирургов. В дальнейшем эта премия была названа ее именем.
Премия ежегодно присуждается женщине-хирургу за выдающиеся заслуги в хирургии
D. М. Long и соавт (1961) сообщили о применении в эксперименте и клинике для
замены митрального и аортального клапанов сердца двухлепестковых протезов, со-
стоящих из силастиковых (силиконизированная резина) лепестков, прикрепленных к
Рис. 2.2. N.S. Braunwald
и др., 1966)
и искусственный клапан сердца ее конструкции (по Б. В. Петровскому
ГЛАВА 2 Механические искусственные клапаны сердца
стальному кольцу корпуса перпендикулярно к его плоскости и соединенных друг с дру-
гом боковыми краями на всем своем протяжении. Причем для удобства фиксации про-
теза стальное кольцо опоясывалось спрессованным поливинилом Аналогичным по
форме являлся протез, предложенный D. С. McGoon (1961). Он изготавливался из тка-
ного тефлона и не содержал дополнительного кольца в своем основании Фиксация
искусственного клапана сердца осуществлялась путем подшивания его по окружности
к стенке аорты. Специфическим недостатком двухлепестковых искусственных клапа-
нов сердца являлась их относительно малая пропускная способность, создающая зна-
чительные градиенты давления, и тромбоэмболические осложнения (Кузьмина Н Б.,
1965; Davila J.C., 1966)
Двухлепестковый клапан Gott-Daggett, созданный в 1963 г. в университете штата
Висконсин в г. Мэдисоне учеником C.W. Lillehei кардиохирургом V. Gott (1927 гр ) и
профессором механики R. Daggett, состоял из жесткого кольцевидного корпуса из по-
ликарбоната, покрытого графитом и бензалкониевым гепарином для профилактики
тромбоза, и двух гибких плоских створок в виде «крыльев бабочки» из силастика, ар-
мированных тефлоновой тканью, укрепленных на расположенной по диаметру корпуса
перекладине (рис. 2.3). Компоненты клапана были покрыты графитом, стерилизова-
лись в бензалкониум хлориде и обрабатывались гепарином для увеличения тромборе-
зистентности клапана. Внутренняя поверхность корпуса имела распорки, удерживаю-
щие гибкий диск в закрытом положении (Gott V. et al., 1962).
Следует отметить, что описанная конструкция клапана напоминала первую экспе-
риментальную модель A. Starr и L. Edwards, от которой они отказались в пользу шаро-
вой конструкции Первое клиническое применение двухлепестковых клапанов Gott-
Daggett относится к 1963 г. В дальнейшем конструкция искусственных клапанов серд-
ца Gott-Dagget была запрещена для использования в клинике в 1965 г., когда часть
клапанов пришла в негодность из-за технологических погрешностей при их производ-
стве. Однако некоторые из них функционировали у пациентов в течение 25 лет. Во время
руководства кардиохирургической школой г. Балтимора V. Gott совместно с инженером
J. Bokros оценивали биосовместимость пиролитического углерода. Результатом этих
экспериментов явилось его внедрение в производство искусственных клапанов серд-
ца с конца 1960-х гг.
Наибольшее распространение получили трехлепестковые конструкции искусствен-
ных клапанов сердца, повторяющие геометрические формы полулунных клапанов аор-
ты и легочной артерии. Подобно естественному трехстворчатому клапану, они обеспе-
Рис. 2.3. V. Gott и искусственный клапан сердца Gott—Daggett (по Р. Уоллесу, 1997;
R. A. DeWall et al., 2000)
43
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
чивали минимальное сопротивление потоку крови в открытом состоянии, быстрое зак-
рытие створок и препятствовали их выворачиванию в полость желудочка во время ди-
астолы (Bahnson Н.Т., 1961; Kay Е. В., 1961; Roe В. В. et al., 1965; Davila J. С., 1968)
Чаще всего трехлепестковые искусственные клапаны сердца предназначались для за-
мены полулунных клапанов аорты или легочной артерии. Менее совершенными конст-
рукциями являлись протезы, состоящие из отдельных лепестков, каждый из которых
последовательно подшивался к стенке сосуда. Малейшая неточность в выполнении про-
цесса фиксации приводила к нарушению правильных взаимоотношении между лепес-
тками, что нарушало герметичность всей системы в фазу ее закрытия. Наиболее рас-
пространенными протезами этого типа были лепестковые клапаны Н. Т. Bahnson и
С. A. Hufnagel (рис. 2 4). В 1960 г Н.Т. Bahnson опубликовал сообщение о клиничес-
ком применении таких протезов для замещения полулунных створок аортального кла-
пана Протезы изготавливались из тефлоновой ткани и своей формой имитировали
естественные полулунные створки клапана. Для удобства их фиксации край, который
подшивали к аорте, имел утолщенный валик
Клапаны Н.Т. Bahnson довольно широко применялись в ряде клиник для
замены одного или всех полулунных створок аортального клапана (McGoon D. С., 1961;
Bjork V, 1964) Через год после имплантации происходило разрушение лепестков кла-
пана в результате отложения фибрина и врастания соединительной ткани. Н. Т. Bahnson
также применял створки клапана, изготовленные из ткани нейлона, пропитанной сили-
коном
Аналогичным по форме являлся протез С. A. Hufnagel (1951; 1961). Он изготавли-
вался из крупнопетлистой дакроновой ткани, пропитанной силастиком. На седле про-
теза имелся ободок для подшивания к тканям сердца, который не был пропитан сила-
стиком и поэтому хорошо прорастал соединительном тканью. Для удобства фиксации
три створки протеза укреплялись перед началом операции на металлическом кольце в
тех участках, где должны были быть «комиссуры» (см. рис. 2.4). Металлическое кольцо
могло быть оставлено в восходящей аорте или удалено из нее после подшивания ство-
рок. Преимуществом створок С. A. Hufnagel перед створками Н. Т. Bahnson являлось то,
что они были покрыты силастиком, препятствующим прорастанию протеза соедини-
тельной тканью и отложению на нем фибрина. Клапаны С A Hufnagel довольно широ-
ко применялись в клинической практике (McGoon D С 1961)
Следующая группа трехлепестковых искусственных клапанов сердца была представ-
лена протезами, в которых три лепестка были объединены друг с другом в области
Рис. 2.4 Лепестки искусственного клапана сеолна и т рнк ,
лева РАМН); Н. Т. Bahnson (по Л. А. Бокерия 2003) ис "У3*" НЦССХ ИМ' А’ Н Баку‘
С. A. Hufnagel (по Б. В. Петровскому и др., iS66j ’ ИС,(усственнь'и клапан сердца
ГЛАВА 2. Механические искусственные клапаны сердца
комиссур. К таким искусственным клапанам сердца относились клапаны Е. В Кау (1961)
и C.W. Lillehei (1961).
Е В. Кау (1910 г.р.) совместно с F S. ( ross изобрел дисковый оксигенатор в 1956 г.
В 1958 г. он начал исследовать модели протезов митрального клапана в госпитале
г. Кливленда. Протез Е. В. Кау (рис. 2.5) изготавливался из тканого тефлона, импрег-
нированного полиуретаном Края протеза, которые подшивались к стенке аорты на 4
мм были свободны от этого покрытия. Все лепестки имели геометрические пропор-
ции, аналогично геометрии естественных полулунных створок клапана аорты. Они были
объединены друг с другом в области комиссур. Авторы располагали большим опытом
по применению этого протеза в клинической практике для замены полулунных створок
аортального клапана. В ряде случаев отмечались отрывы протеза от стенки аорты в
области соединения створок друг с другом. Поэтому в 1963 г. авторы модифицирова-
ли протез, дополнив его тремя парами тесемок, прикрепленных в местах соединения
створок друг с другом Во время операции их выводили на наружную поверхность аор-
ты и попарно связывали на прокладках из войлочного тефлона. С W Lillehei применял
для изготовления таких протезов тефлоновый войлок, импрегнированный силастиком.
Принципиально так же был сконструирован и клапан D. С. McGoon (1961). Однако его
створки были не плоскими, а больше походили на естественные полулунные створки
(см. рис. 2.5). Протез D.C. McGoon изготавливался из тканого тефлона и широко при-
менялся в клинике Мейо (McGoon D.C., 1963).
Большая группа трехлепестковых протезов была представлена искусственными кла-
панами сердца, в которых створки не только объединялись в области комиссур, но и
имели общий корпус. Довольно широко в клинической практике применялись протезы
W. Н. Muller-Littlefield (1960), в которых створки и корпус (рис. 2.6) изготавливались
из тефлонового трикотажа (Judson W Е , 1964), а также искусственные клапаны серд-
ца В. В. Roe из силиконовой резины (см. рис. 2.6), выпускавшиеся General Electric и
имплантировавшиеся с 1955 по 1962 г (Mohri Н. et al., 1973).
Малочисленную группу составляли четырехлепестковые искусственные клапаны
сердца. Они предназначались, главным образом, для замены митрального клапана.
В 1960 и 1961 гг. Е. В. Кау и соавт сообщили о различных модификациях четырехлепе-
сткового митрального клапана, изготовленных из нескольких видов пластмасс Наибо-
лее совершенной моделью считался клапан из спрессованного поливинила или теф-
лонового трикотажа, пропитанного силастиком. Протезы состояли из двух больших и
двух промежуточных лепестков меньшего размера: большие имели 4 пары хорд из теф-
рис. 2.5. Искусственные клапаны сердца конструкции D. С. McGoon (по Б. В. Петровскому и др.,
1966) и Е. В. Кау
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
Рис. 2.6. Искусственные клапаны сердца W. Н. Muller-Littlefield (по W. Е. Judson, 1964)
и В. В. Roe (по Н. Mohri et al., 1973)
лона пропитанного полиуретаном, а малые — по одной. Преимуществом данной кон-
струкции авторы считали очень маленькое сопротивление протеза потоку крови.
Все лепестковые клапаны работали на двойной изгиб во время каждого сердечного
цикла Большие нагрузки испытывали также свободные края лепестков При испыта-
нии на скоростных установках, совершающих в единицу времени количество циклов, в
десятки раз превышающих число сердечных сокращений человека, лепестковые ис-
кусственные клапаны сердца разрушались в период времени, эквивалентный 1-6 го-
дам работы в сердце (Цукерман Г. И и др., 1971).
Кроме того, на лепестках оседал фибрин, часто откладывались тромбы с последу-
ющим замещением их соединительной тканью. Соединительная ткань организовыва-
лась, нередко в ней откладывались соли кальция Все это приводило к стенозирова-
нию лепестковых искусственных клапанов сердца или к разрыву их створок в организ-
ме больного через 1-2 года после операции (Bjork V et al , 1964; McGoon DC., 1963;
1964, Morrow A. G., 1964, Braunwald N S. et al , 1968) Было также отмечено, что раз-
рыв лепестковых искусственных клапанов сердца в условиях живого организма насту-
пал значительно раньше, чем во время их испытаний на скоростных установках Это
объяснялось тем, что при стендовых испытаниях протезы подвергались воздействию
только механических нагрузок (двойному изгибу, гидравлическому удару) и не испыты-
вали влияния биологических факторов, существенно изменяющих физико-химические
свойства материалов, из которых они изготовлены Захлопываясь, клапан создавал
сильный гидравлический удар, направленный в сторону левого предсердия, что при-
водило к значительной травме форменных элементов крови и тромбообразованию (Ко-
лесников С А., 1964, Кузьмина Н Б , 1964) Все перечисленные недостатки лепестко-
вых клапанов привели к их вытеснению протезами вентильного типа
По прошествии нескольких десятилетий интерес к лепестковым клапанам возрож-
дается Это связано с появлением новых искусственных полимерных материалов Так
описаны экспериментальные полимерные клапаны сердца Angioflex и Aortech
(рис. 2 7), изготовленные из полиэфируретанмочевины (PEUU), которые оказались до-
статочно устойчивыми к кальцификации- их минерализация была в 100 раз меньше,
чем контрольного биологического протеза Hancock Только через 150 дней после имп-
е!пТаиТгТрпп°ТН°л^У незн™льное тромбообразование отмечалось по линии комис-
сур, на створках (Wisman С В et al, 1982, Bernacca GM et al 1998)
46
ГЛАВА 2 Механические искусственные клапаны сердца
Рис. 2.7. Полимерные искусственные клапаны сердца Angioflex (по S. akatam, 2002) и Aortech
(по H.L. Leo et al., 2005)
Для того, чтобы уменьшить тромбообразование и избежать минерализации, повер-
хность створок клапана была модифицирована лигандами На створках, обработанных
одним из биосовместимых лигандов не было замечено накопления тромбов Первый
лиганд — это фотохимически реактивное производное жирной кислоты, имеющее вы-
сокий аффинитет к сывороточному альбумину, второй — это фотохимически реактив-
ное производное нетромбогенной гиалуроновой кислоты Процесс ультрафиолетовой
активации приводит к ковалентному соединению гемосовместимых компонентов на
поверхности клапана (Clapper D L et al , 1995) В проекте полимерного клапана уделя-
ется также большое внимание минимизации напряжения на створках и уменьшению
застойных зон, что может в значительной степени предотвратить тромбообразование
(Daebntz S Н et al , 2004).
ОСЕСИММЕТРИЧНЫЕ КЛАПАНЫ
Теперь перейдем кРвссм0^ г^пымехХ
ца вентильного типа В клинической пра ательным движением запирающе-
ческих протезов вентильногс^типаь^а еачевицеобра3ные и др ), поворотно-дисковые и
го элемента (шаровые, полушаровые ече ц н & м et g|, 1973) Все эти искусст-
двустворчатые (Цукерман Г И и др 1971 п инцип работы и набор структурных
венные клапаны сердца имеют один и запирающий элемент (occluder) и ме-
компонентов Механические клапаны содер _ ограничительные стойки, или
ханизм, ограничивающий движение этого манжету для пришивания клапана
стопы (struts), а также специальную ^зависимости от изменения
(sewing cuff) Запирающий элемент дви!’ адечНого цикла Если перед клапаном дав-
давления в сердечных камерахв^енР элемент открывается, и кровь протекает
ление выше, чем после него, то запираю^ „н,1Я заПирающий элемент перекрывает
через клапан, при обратном перепаде д рег7рГИтацию крови
проходное отверстие клапана и предс> Р’ £ движением запирающего элемента
Следует отметить, что протезы с посту столетия Подавляющее большинство
были наиболее распространены в 60 /и ТЬ1СЯЧ имплантированных клапа-
из них составляли шаровые клапаны Неск _ --------
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
нов и более чем тридцати летние отдаленные результаты позволяли использовать ша-
ровые искусственные клапаны сердца в качестве стандарта для оценки протезов дру-
гих конструкций (Macmanus Q. et al., 1977*, Sala A. et al., 1982, Miller D. C. et aL, 1983,
1984).
Все шаровые искусственные клапаны сердца имеют корпус с седлом и пришивной
манжетой, шар, являющийся запирающим механизмом клапана, и ограничители хода
(стопы), связанные с корпусом (рис. 2.8). Под действием разности давлений в сердеч-
ных камерах, разделенных искусственным шаровым клапаном, шар или отходит от седла
на расстояние, определяемое ограничителями хода, обеспечивая прохождение крови
через протез, или прижимается к седлу, препятствуя обратному движению крови.
В 1946 г. С. A. Hufnagel (1916-1989) со своими сотрудниками начал разрабатывать
протезы клапанов сердца, главным образом шарового типа. В результате многочис-
ленных экспериментов удалось, наконец, к 1951 г. создать искусственный шаровый кла-
пан из метилметакрилата для аортальной позиции, который является прототипом со-
временных искусственных шаровых клапанов сердца (рис. 2.9). С. A. Hufnagel в 1941 г.
окончил Медицинскую школу Гарвардского университета, затем продолжил хирурги-
ческое обучение в Гарварде, где основал хирургическую научно-исследовательскую ла-
бораторию и исследовал возможность использования сосудистых протезов из мета-
крилата. Затем, в 1950 г., он был назначен профессором экспериментальной хирургии
в Джорджтаунском университете Вашингтона. В следующем году он описал конструк-
цию клапана в виде шара из метакрилата, расположенного в трубе из того же матери-
ала (Hufnagel С. A. et aL, 1961). В этом же году A. Campbell независимо от С. A. Hufnagel
предложил свою конструкцию клапана с шаровым запирающим элементом, помещен-
ным в металлический каркас (caged ball), однако он не провел его имплантацию. Про-
тотипом такой конструкции считается патент бутылочной пробки 1858 г. (см. рис. 2.9).
Клапан С. A. Hufnagel состоял из корпуса, имеющего входную и выходную трубчатые
части, и промежуточного колбообразно расширенного отдела. Внутри корпуса нахо-
дился шар из метилметакрилата. У выходного отдела корпуса имелись вырезки.
, - Хо LC”“." -W-------------
4 'Д К°РПуСа’ 2 ~ шаровой запирающий элемент ? _
пришивная манжета, 5 - упоры (по Б. В. Петровскому и др., 1966) <СТ°ПЫ):
ГЛАВА 2 Механические искусственные клапаны сердца
Рис. 2.9. С. A. Hufnagel и искусственный клапан сердца его конструкции (из музея НЦССХ им.
А. Н. Бакулева РАМН); бутылочная пробка-шар (патент 1858 г., по А. М. Matthews, 1998)
Во время систолы желудочков под действием разности давлений шар отходил к
выходному отделу протеза и упирался в имеющиеся в нем выступы. При этом кровь
свободно проходила через вырезки Во время диастолы желудочков шар плотно при-
крывал входной отдел протеза и препятствовал обратному току кр< > и. Протез впервые
был применен в клинике С A. Hufnagel в 1952 г для коррекции тяжелой аортальной
недостаточности у молодой женщины (Hufnagel С. А., 1953). Он фиксировался в нисхо-
дящую аорту тотчас ниже отхождения левой подключичной артерии Для этого аорту
пересекали поперек, в оба ее конца вставляли клапан и закрепляли его снаружи аорты
кольцами из нейлона, содержащими зубья на внутренней поверхности. по г
было имплантировано более 200 таких протезов, причем антикоагулянтная терапия не
использовалась, а у шаров, исследованных через 30 лет после имплантации, призна-
ков износа не наблюдалось. Позднее метакрилатовыи шар был заменен силиконовь
каучуком с нейлоновым покрытием, чтобы уменьшить вентильный шум
Однако вскоре применение этих протезов повсеместно было оставлено, главным
образом, ввиду нерадикального исправления порока, ак, по данны .
(1958), протез уменьшал объем регургитации крови в левый ж<^ДОчек на 70 .о, ,у у
шая кровообращение организма только дистальнее места ег и яоптального
конструкция исключала его фиксацию на место удаленного естеств _
ЭВ то же время многие исследовательские группы пытались разработать свои шаро-
в то же время многие_ись нзд Однако в опытах на животных
вые клапаны (Kernan М.С , 1957, tins гп. et ai , j н оигпрпимрн-
такие конструкции показывали повышенное тромбообразован
тов на животных исследователи продвинуться не смогли. митпальную по-
Первая имплантация шарового клапана собственной конструкции в
зицию была проведена по закрытой методике английскимЯ11иент СКончался через 14 ч
1955 г. в госпитале Шефилда (Norman ^аниДяНшара. клапан, изготовленный из
из-за дисфункции протеза вследствие выс каки элемента и кнопочно-
прочного оргстекла, состоял из каркаса, шарового запирающего
го крепления к внешней поверхности сердца (рид „ Г больным аортальных
В марте 1960 г. D Е. Harken сообщи; О"а^я субкоронарной позиции, двое
искусственных клапанов собственной констру ц у изготовлены из нержавею-
пациентов выжили. Корпус и ограничители хода i^аРа 0 2 10) Четыре огра.
Щей стали, а сам шар - из силиконизированнои резины (см рис р
ту
ИСКУССТВЕННЫЕ КЛАП АНЫ С ЕРДЦА
Рис. 2.10. Митральный искусственный клапан сердца конструкции J. Т. Chesterman (по A. F. Norman,
1991); D. Е. Harken и искусственный клапан сердца его конструкции (по Р. Уоллесу, 1997)
ничителя хода шара соединялись у вершины. Был еще и другой, наружный ряд стоек,
предотвращающий контакт шара со стенками аорты. Крепление клапана осуществля-
лось пояском из поливинилового спирта, который на протяжении полуокружности при-
шивной манжеты переходил в лоскут треугольной формы из того же материала. Во
время операции полукольцо пришивной манжеты подшивали к внутренней поверхнос-
ти фиброзного кольца аорты на место удаленных створок пораженного клапана, а тре-
угольный лоскут вшивали в разрез стенки аорты. При этом расширялся корень аорты,
что, по мнению авторов, способствовало более свободному прохождению потока кро-
ви через искусственный клапан сердца
Аналогично был устроен и шаровой митральный искусственный клапан сердца, раз-
работанный группой D. Е. Harken (Wagner Е., 1963). Он также имел корпус, ограничи-
тель хода, состоящий из двух рядов стоек для предотвращения соприкосновения с
окружающими стенками, силиконовый шар и пришивную манжету из поливинилового
спирта. D. Е. Harken (1910-1993) приобрел опыт кардиохирурга, ушивая ранения серд-
ца во время Второй мировой воины. В начале карьеры в г. Бостоне он предложил мно-
гочисленные нововведения в хирургии митрального клапана по закрытой методике.
Первое успешное использование предложенного им искусственного клапана сердца
относится к 1960 г. Позже, на основе исследования A Starr, он отказался от второго
(дублирующего) ряда стоек (Harken D. et aL, 1960; 1961; 1968).
Значительную роль в развитии искусственных клапанов сердца сыграли A. Starr и
L. Ed' rds. A. Starr родил я в 1926 г в Нью-Йорке и получил специальность торакаль-
ного хирурга в Колумбийском университете. В 1957 г. после перехода в Орегонский
университет 32-летний кардиохирург встретил в 1958 г. отставного 65-летнего инже-
нера-электрика L Edwards, обладателя 63 патентов, родившегося в Ньюберге (штат
Орегон) в 1893 г. (рис. 2.11) Одним из изобретений L. Edwards был высотный вспомо-
гательный топливный насос, который использовался в самолетных двигателях во вре-
мя Второй мировой воины. После знакомства с A. Starr он загорелся идеей создания
оа^СткТиие™«еРДЦа' ДНЭК° "° предложению они начали совместные раз-
hS 1 п^рпДГп ЫХ-КЛаПаН°В СеРДЦЭ ИХ перВЫМ проектом был каучуковый силико-
оа ованием гЬд клап1ан;не имевший успеха в связи с повышенным тромбооб-
’ ’ а ‘* 1979). Позднее похожий клапан был предложен V Gott
ов связанныГс оХс^вие В ° неудачами применения лепестковых проте-
, связанных с отсутствием биологически инертных, долговечных и эластичных ма-
50 __
ГЛАВА 2. Механические искусственные клапаны сердца
Рис. 2.11. A. Starr (по Р. Уоллесу, 1997) и L. Edwards (из материалов музея НЦССХ
им. А. Н. Бакулева РАМН)
териалов, A. Starr и L. Edwards отказались от принципа копирования строения естествен-
ных клапанов сердца и сосредоточили свое внимание на разработке шарового клапа-
на рассчитывая на его надежность Они надеялись, что шар, находясь в постоянном
движении, будет очищаться от тромбов, в отличие от лепестковых клапанов, имеющих
неподвижную ось крепления. ~ птяпм
С 1960 по 1972 г. они разработали пять моделей шаровых клапанов, р
mdudu Edwards К этому времени относятся и изобрете-
выпускаться под их именем — btarr-towaros. к ли у р nQnkUOx1110M Ппр
ния L. Edwards баллистокардиографа и мембранного оксигенатора. В ,^ьнеишем Оре-
гонская Сердечная Ассоциация, осознав перспективы Развитиа^”°*^
печила финансирование для разработки искусственного кла ппеоапи< иных
купку аппаратов искусственного кровообращения, собак (лабрадоров), операционных
наборов для лаборатории Орегонского универсип та nvnnn оЫТЯжного шка-
„ - Qforr PHward^ были изготовлены около вытяжного шка
Первые образцы клапанов Starr-towaros оыли п^™отлпми После
фа под навесом Домика L спрос на клапаны
Го~п
Ане (Калифорния) в 1961 г L. Edwards ос новаг^цех вР Впоследствии несколько
панов, а испытательная база распелась в J в» Q &poss _
ведущих инженеров его лаборатории D. 8b*atones Shiley Laboratories, Hancock
основали свои собственные компании. Bentley ~ м. 1Й Шаоовой протез Starr-
Laboratories, American Omni Medical, Inc.П®р^тряИвшими из четырех сомкнутых стоек
Edwards имел корпус с ограничителями хода, метилметакрилата и склеивались
(рис. 2.12). Эти детали клапана изготавливали^; манжета _ из
ацетоном. Шар изготавливался из силиконо у клапан был им-
тефлоновой ткани (Starr А, i960; 1961; Edwards М ^1^972^ боль_
плантирован пациенту в 1960 г. ПациеН1 ^Р рофы Год спустя A. Starr и L Edwards
ше, если бы не погиб в результате авто™тр°Фограничительными стойками из не-
имплантировали клапан (с корпусом и че р тефлоновой пришивной манжетой) в
ржавеющей стали, соединявшихся на вери^^ ’ >|ЖИЛИ, В дальнейшем каркас стал
митральную позицию 8 пациентам, 6 из к р молибдена и никеля), биологи-
изготавливаться из Stellite-21 (сплав кобагi =. Р педами Шары из СИЛикона погло-
ческая совместимость которого была дока nnqrnMv стали изготавливать полые
Щали липиды из крови и, нередко, разрушались, поэтому стал
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
Рис. 2.12. Искусственные клапаны сердца Starr-Edwards: с каркасом из оргстекла и с защитным
экраном (по А. М Matthews, 1998)
шары из Stelhte-21 которые на какое-то время послужили заменой силиконовым.
С 1965 г начали применяться упрочненные вулканизацией силиконовые шары, и про-
блема их разрушения была снята В том же году авторы предложили обшивать седло
клапанных протезов пористой синтетической тканью в целях профилактики тромбоэм-
болических осложнении Так, по данным A Starr и соавт. (1967), реализация этой идеи
позволила снизить частоту тромбоэмболии с 63 о (в ранних исследованиях) до 17%.
В 1968 г. весь каркас клапана, включая ограничительные стоики, стал обшиваться вя-
заной тканью для профилактики тромбоэмболических осложнений, однако из-за быст-
рого износа обшивки от нее пришлось отказаться
Продолжая экспериментальные имплантации клапанов у животных с целью сниже-
ния тромбообразования и травмы эндокарда, A Starr и L Edwards предложили эффек-
тивное устройство — защитный силиконовый экран (см. рис. 2 12) Клапаны с экраном
снижали время тромбообразования у животных, оперированных в условиях искусст-
венного кровообращения, без антикоагулянтной терапии в раннем послеоперацион-
ном периоде, и обеспечивали 80% выживаемость (Starr A et al , 1961, 1986). Однако
данное изобретение не было применено в клинике, так как антикоагулянтная терапия у
больных назначалась в ранний период после операции, что снижало тромбообразова-
ние на клапанах Кроме того, травма крови при искусственном кровообращении у че-
ловека была меньше, чем у животного Второй причиной отказа от защитного экрана
послужило увеличение времени искусственного кровообращения и сложность имплан-
тации клапана
В 1962 г группа Stair-Edwards сообщила о разработанной ими конструкции шаро-
в г аортального протеза Протез изготавливался из тех же материалов, что и мит-
альный, однако имел три ограничительные стоики, а не четыре причем каждая стойка
располагалась в обла ти комиссур удаленных полулунных створок аортального клапана
Такая методика фиксации искусственного клапана сердца позволяла предупреждать
перекрытие близко расположенного устья коронарной артерии одной из стоек, что
могло в последующем приводить к нарушениям коронарного кровообращения и ин-
фарктам миокарда Кроме того, пришивная тефлоновая манжета протеза была сдела-
аооты и шаопм° Д0ЛЖН° бЫЛ0 улучшать прохождение потока крови между стенками
Шественного клапана еепТ С°СТОЯНИИ Клапана Главным отличием указанного ис-
ХтеШеШа что позвопЛп ЯВЛЯЛ0СЬ наличие тРе* упоров, располагавшихся в про-
е е седла что позволяло применять шаровые запирающие элементы меньшего диа-
---------- 52 ------------------
_________ГЛАВА 2. Механические искусственные клапаны сердца
метра без нарушения герметичности закрытия проходного отверстия и заклинивания
шара (модель Starr—Edwards 1000) В 1963 г. материал, из которого изготавливали
корпус искусственного клапана сердца, — нержавеющая сталь, обладающая значитель-
ным тромбогенным потенциалом, был заменен в одних модификациях клапана — спла-
вом Stellite 21 (содержал Со, Cr, Mo, Ni), а в других — титановыми сплавами, имеющи-
ми повышенную коррозионную стойкость и низкий удельный вес
Следует отметить, что шаровые протезы Starr-Edwards спасли жизнь многих сотен
тысяч больных при замене митрального, трехстворчатого и аортального клапанов серд-
ца кардиохирургами различных стран мира (Cooley DA et al, 1969, Barnard PM et al,
1970; Barclay R S. et al., 1972) Компания Edwards Lifesciences (бывшая Baxter Healthcare)
выпускала на протяжении почти 20 лет множество модификации протеза Starr-Edwards
Так, например, в аортальных протезах Starr-Edwards 1200 и 1260 был применен си-
ликоновый шар, содержащий 2 о сульфата бария в качестве рентгеноконтрастной мет-
ки Эти модели не имели упоров в просвете седла Аортальный искусственный клапан
сердца 1260 (рис. 2 13) был впервые имплантирован в 1968 г и до сих пор использует-
ся в некоторых странах мира В модели искусственного клапана сердца 2320 шар был
сделан рентгеноконтрастным, а пришивная манжета изготавливалась из тефлоновой
ткани с полипропиленом
В модели 2400 (композитной — см. рис. 2.13) — использовались два сплава сплав
Haynes 21 для шара (рентгенонегативныи) и сплав Stellite 21 — для корпуса Замкну-
тые ограничительные стойки корпуса были покрыты тефлоном и полипропиленом, так
же как и пришивная манжета Позднее были выпущены механические искусственные
клапаны сердца Starr-Edwards следующих моделей: 2300, 2310, 2320, 6000, 6120,
6300, 6310, 6320 и 6400 — рис 2 14 (Starr A et aL, 1987, Schoevaerdts J C. et aL,
1987; Cobanoglu A. et al., 1988, Orszulak TA et al , 1997)
Модель 6400 для митральной позиции с полым металлическим шаром и четырьмя
ограничительными стойками, покрытыми тканью, использовалась в течение несколь-
ких лет, а модель 6120 с силиконовым шаром используется и сейчас (Pluth J. R. et al ,
1991). Последняя состоит из корпуса с четырьмя ограничительными стойками, в отли-
чие от аортальной модели 1260, содержащей три стойки Все остальные модели про
теза Starr-Edwards в настоящее время в клинике не применяются (Morse D et al , 1985).
_ . Starr-Edwards 2400 и 1260 (из музея НЦССХ
Рис. 2.13. Аортальные искусственные клапаны сердц
им. А. Н. Бакулева РАМН и J. Butany et al., 2003)
ИСКУССТВЕННЫЕ КЛАПАНЫ С РДЦА
Рис. 2.14. Митральные искусственные клапаны сердца Starr Edwards 6400, 6320
и его (6320) рентгеновское изображение (из музея НЦССХ им. А. Н. Баку-
лева РАМН и Butany J. et al., 2003)
Важным результатом деятельности исследовательской лаборатории L. Edwards яви-
лась формулировка перспектив дальнейшего совершенствования конструкций искус-
ственных клапанов сердца, касающихся обеспечения профилактики тромбоэмболии,
простоты и безопасности имплантации, увеличения долговечности, сохранения функ-
ции окружающих тканей, снижения турбулентности потока, травмы форменных элемен-
тов крови и шума при работе клапана, а также разработки биосовместимых материа-
лов, совершенствования методов хранения и стерилизации (Hufnagel С. A. et al., 1958,
Starr A et al., 1963; Lefrak E A. et al., 1979).
R. S. Cartwright и соавт (1963; 1964), изучая при гидродинамических испытаниях
причину тромбообразования на шаровых протезах аортальных клапанов, установили,
что наиболее интенсивные возмущения потока возникают в области соединения огра-
ничительных стоек искусственного клапана сердца. В этом же месте было замечено
образование тромбов у одного больного, погибшего после операции замены митраль-
ного и аортального клапанов сердца от тромбоэмболии сосудов головного мозга.
В связи с этим авторы разработали шаровой искусственный клапан сердца, ограничи-
тельные стоики которого были разомкнуты Корпус клапана и ограничители хода шара
изготавливались из титана. Шар был сделан из силастика, пришивная манжета — из
тефлонового войлока, в последующих образцах — из тефлоновой ткани Исследова-
ния R S. Cartwright и соавт. привели к тому, что в ряде конструкций шаровых искусст-
венных клапанов сердца другие авторы также стали изготавливать ограничители хода
шара незамкнутыми (Magovern G. J., 1964; Matthews А. М., 1998). Конструкция мит-
ральнс г апана R. S. Cartwright первоначально имела замкнутые ограничители хода
шара из шести стоек, однако затем их заменили четырьмя незамкнутыми стойками,
аналогично аортальному протезу.
В 1961 г. хирурги Е. Smelloff (1925 г. р ), R. Cartwright и инженеры-механики Т. Davey,
В. Kau man Калифорнийского университета начали разработку своего шарового клапа-
на. Они остановились на оригинальном проекте с прямыми и обратными ограничитель-
ными тоиками (рис 2 15, цв вкладка, рис. 1). Расположенные с обратной стороны
VQftaa °граничительные стоики предотвращали заклинивание шара при использовании
ной аХ7п?нпТРаВЛИЧеСК0Г° Отверстия се^а Такие клапаны применялись в митраль-
nvc - из ™танл я !рикуспидальной позициях Шар изготавливался из силикона, кор-
н зыв^сГпо имени 1ТНЭЯ МЭНЖеТа “ И3 теФЛ0н0В0й ткани. Первоначально клапан
носится 1964 г Ра,п! еР И ~ SCDK ЕГ0 первое киническое применение от
пане Starr-Edwards мР₽топп си™конрарго шара удалось предотвратить, как и в кла-
Starr Edwards, методом вулканизации, которая проводилась в Cutter Laboratories.
54 —--------—-_____________
ГЛАВА~ 2 Механические искусственные клапаны сердца
Рис. 2.15. Искусственный клапан сердца Smeloff-Cutter (по Р. Уоллесу, 1997); Е. Smeloff
(из материалов музея НЦССХ им. А. Н. Бакулева РАМН)
После этого клапан стал называться Smelloff-Cutter (Lee S J. К. et aL 197°, k E A.
At al 1979- Naito Y et al 2003) Его первые клинические испытания относятся к 19bb
’р^льтаХХ N S. «й = Cutter Laboratories "““ZToX'X
обшитым каркасом - Braunwald-Cutter Его ограничительны.з стоики покрывали
вязаным дакроном, а седло — полипропиленом, имп/1® клапан подвергался
(LefrakE. A. et al., 1979) Однако в клиническом использова
быстрому разрушению. ________ заинтересовался проблемой
В 1960-е гг. М. DeBakey (1908 г.р.) - рис. 2.16 - в^ванного
шаровых клапанов — заклиниванием шара в дл ~ .„трг.мяп из которого изготав-
абсорбцией липидов из плазмы крови в силиконовый шаровый клапан, отпи-
ливался шар. Совместно с НI. Cromie, оь
чающийся от протеза Starr-Edwards тек чi о ₽ покрытие Вторая модель имела
титановый шар, а седло и стоики имелгi даi ро ным полиэтиленом, клапан
титановое основание и стоики, покрытые вь Lefrak Е. A et al, 1979,
стал называться DeBakey-Surgitool (Sen/e е " ’ газовая стерилизация
Butany J. Н а!.. 2004). Для данной пнролигйчеокнм
В модели, разработанной совместно с J. _ изготовлен шаровый запираю-
углеродом, а . ,969 г. «3 этого ,яо.иго магеР а клинике а ,968-,978 гг
щий элемент клапана см рис. 2.1b). при ООМП\/ -значительного износа шара и
в дальнейшем его применение было оставлено ввиду з«чипэл^
повышенного гемолиза (Indeglia R. A. et al, » уделялОсь большое внимание та-
При разработке искусственного клапа^ ПрОтеза клапана на место удален-
кой немаловажной проблеме, как спосоо ф (поишивание заменителя кла-
ного нативного клапана Наряду с классическим стали разрабатываться и вне-
пана за его пришивную манжету к фиброэному_ ои’ фИКСаЦии Применение такой
Дряться клапаны с приспособлениями для е перспективным и заманчивым Это
фиксации клапанов к тканям вначале казалось ве ь нео^ходимое для выполнения one-
давало возможность существенно сократить вре , иСКуСственного кровообращения)
рации (сокращение времени аноксии миокард операциях протезирования двух
Фактор времени, как известно, особенно важ
или трех сердечных клапанов.
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
Рис. 2.16. М. DeBakey (по Р. Уоллесу, 1997) и искусственный клапан
сердца его конструкции
Приспособления для механической фиксации искусственных клапанов сердца да-
вали возможность их крепления к фиброзному кольцу в гораздо большем количестве
точек (40-50) чем при имплантации искусственного клапана сердца атравматичными
швами Этим также достигалось уменьшение давления на окружающие ткани в точке
фиксации редполагалось что вероятность прорезывания механических фиксаторов
будет меньше, чем атравматичных швов Кроме того, при механической фиксации про-
тезов отсутствовали узлы, способствующие образованию тромбов по линии швов.
Хирург G J Magovern (1923 гр), работавший в больнице г. Питтсбурга, и механик
Сг mi ( снэватель компании Surgitool) впервые предложили бесшовную механиче-
скую фиксацию шарового клапана (рис. 2.17) Первое клиническое применение проте-
за Magovern-Cromie произошло в 1962 г (Magovern G J., 1964- Lefrak Е A et al 1970).
В дальнбйшем подобные протезы разрабатывались и применялись другими авторами
(Beall А , 1965; Lillehei С. W , 1965).
Протез представлял собой типичный шаровый клапан, содержащий корпус и огра-
ничительные стоики изготовленные из титана, и шар из силикона с барием для рент-
таллически' = оПпРИСП0С0бление бесшовной фиксации состояло из двух ме-
располагались лва пЛ ГТГ являлось частью ^рпуса протеза Между кольца-
при помощи специальной ади ^ри ТтоТи^ы двига7УТЫХ ИГЛ' сближаЛИСЬ
другу Фиксируя поотрч к- гЬийгчг.о Р ° ИГЛЫ двигались по кривой навстречу друг
^r^K^b^^B^nHwecK^npaKTHi^^^13'^' ” ВЫХОДИЛИ НЭруЖу через отверс™я ДРУ'
кусственные клапаны сеолпа haJa Рубежом, главным образом в США, такие ис-
аорты Однако применение' искусХТн8 °Сновном’ ПРИ замене клапана
бесшовной механической Фиксации имо апанов сердца с приспособлением для
,„го “Z Уезжая «онструк-
полезная площадь для потока коови nJ ДЦ 3 рте' в результате чего сокращалась
Несмотря на тс“что исветвенные кл 1РИСПОСОбления имели довольно большой вес.
1 отовлены из титана, они были в 2 Серди,а с этими приспособлениями были
из металла с большим удельным весомXZ”
н ого, при вхождении игл крепления в
______ _______ГЛАВА 2. Механические искусственные клапаны сердца
ткани фиброзного кольцо сердца происходил разрыл тканей < последующим отрывом
искусственного клапана сердца В то же время при использовании изогну гой хирурги-
ческой атравматичной иглы разрыва тканей не происходи! Н 1конец, при примем! нии
приспособления для механической бесшовной фиксации искусственного клапана < р
дца для аортального и пульмонального протезирования имелся непосредс твенный кон-
такт металлических деталей со стенками восходящей аорты или легочной артерии, что
таило в себе опасность возникновения пролежней в тканях.
Основное неоспоримое достоинство шаровых протезов заключалось в их механи-
ческой надежности и долговечности (Clark R et al, 1981, Hayashi J. et al., 1996), а так-
же способности обеспечивать адекватную гемодинамику организма длительное вр» мя
(Morrow A. et al., 1967; Bonchek L. I., 1981). Изготовление шара из специального сили-
кона делало работу этого протеза практически бесшумной, что немаловажно для обес-
печения комфортной жизни пациента. В противоположность лепестковым искусствен-
ным клапанам сердца, шаровые протезы не претерпевали заметных изменении при
испытании на скоростных установках в сроки, эквивалентные многим годам работы в
сердце человека (Harken D Е , 1961; Starr А , Edwards М , 1961, 1963) Так, по данным
A Starr и М. Edwards (1961; 1963), шаровые протезы в стендовой установке не разру-
шались в сроки, эквивалентные более чем 40 годам работы в сердце человека Много-
численные оценки отдаленных результатов после операций замены клапанов сердца
шаровыми протезами показывали улучшение состояния больных по ФК (NYHA) и нор-
мализацию гемодинамики (Morrow A.G., 1967, Stair A et al., 1963; Bjork V. et al., 1964,
Maehler H. E. et al., 1993; Higashita R. et al., 2003).
В то же время, из-за значительной высоты протеза и объема корпуса, шаровой ис-
кусственный клапан сердца в митральной позиции в случае малого объема левого же-
лудочка может перекрывать его выходной отдел, ограничивая выброс систолического
кровотока, травмировать межжелудочковую перегородку и проводящие пути Ин ер-
позиция оставшихся хорд и папиллярных мышц может вызывать нарушение подвижно
сти запирающего элемента Из-за указанных недостатков нецелесообразно использо-
вать шаровые протезы у больных с митральным стенозом и у пациентов, имеющих
небольшую камеру левого желудочка (Barnard С. et al., 1962; Kalke В et al., 1969,
Cooley D. A. et al., 1973, Rahimtoola H., 1978). С ростом частоты сердечных сокраще-
нии, вследствие инерционности шарового запирающего элемента, клапан открывает-
Рис. 2. ,7. Искусственный клапан сердца Magovern- Cromie; «• ^ago^emи“
(из материалов музеев НЦССХ им. А. Н. Бакулева РАМН и Med.cal Ca.bon Research
Institute, Steinfeld, Germany)
57
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
ся и закрывается не полностью, что приводит к высоким градиенту давления и регур-
гитации (Conkle D М et al , 1973) Перечисленные особенности конструкции и гемоди-
намики шаровых протезов приводят к грозным осложнениям — тромбозам клапанов,
тромбоэмболиям и хроническому внутрисосудистому гемолизу, что требует пожизнен-
ной антикоагулянтной терапии Известны случаи механических дисфункций шаровых
искусственных клапанов сердца раскол и выскакивание шара из каркаса, эмболиза-
ция его фрагментов в связи с липидной абсорбцией и дегенерацией силикона
(Bonnabeau R С et al , 1963, 1967, Roberts W. C. et al., 1968, Flegensberg D. S et al.,
1969. Carmen R et at, 1972) Указанные недостатки протезов шарового типа послужи-
ли основной причиной отказа от их использования в начале 80-х гг. и подтолкнули к
поиску менее травматичных для больного малогабаритных конструкций.
Остановимся на протезах клапанов, послуживших переходным звеном между ша-
ровыми и поворотно-дисковыми клапанами Речь пойдет о протезах вентильного типа
с запирающими механизмами в виде чечевицы, конуса, двояковыпуклой или вогнуто-
выпуклой линзы, диска, совершающих поступательное движение во время их работы
Переход разработчиков к нешаровым запирающим элементам в конце 60-х гг. объяс-
няется стремлением уменьшить профиль протеза, сохранить полезный объем сердеч-
ных камер, избежать синдрома малого сердечного выброса, ухудшив при этом обтека-
ние самого запирающего элемента Количество подобных конструкций протезов было
невелико К ним можно отнести клапаны Harken, Кау, Cross-Jones, Cooley-Cutter, Beall
С N Barnard (1922-2001) работал совместно с С. W. Lillehei в Университете штата
Миннесота в середине 1950-х гг (рис 2.18) В 1958 г он возвратился на родину —
в университет Кейптауна в Южной Африке. Именно там он стал первым хирургом, ко-
торый успешно провел пересадку человеческого сердца в 1967 г. Совместно с перфу-
зиологом С. С. Goosen в 1962 г они разработали митральный протез клапана сердца с
запирающим элементом в форме диска с направляющим стержнем (см. рис. 2 18).
Аортальный протез, изготовленный в 1963 г., состоял из стального корпуса, обши-
того тефлоновой тканью, к которому была прикреплена перпендикулярно к плоскости
сечения протеза изогнутая дугой ограничительная стойка, оканчивающаяся кольцом
Запирающий элемент имел форму двояковыпуклой линзы Он и связанный с ним стер-
жень были изготовлены из силастика Протез применялся для замены митрального и
ГЛАВА 2. Механические искусственные клапаны сердца
рехстворчатого лапан в и укреплялся в венозном устье так чтобы стойка ра< пол ira-
лась в полости предсердия, а линза — в полости желудочка Другой аортальный искус-
ственный клапан сердца С. Barnard имел две ограничительные стойки с отве эстиями
(дна из них была укреплена на желудочковой, а другая — на аортальной поверхности
корпуса Линза была более выпуклой и по своей форме приближалась, скорее, к со-
единенным друг с другом основаниями конусам. От вершины каждого конуса отходил
перпендикулярно к нему расположенный стержень, вставленный внутрь кольца соот-
ветствующей стойки (Barnard С. N. et al , 1965) Оба клапана были сделаны в США с
приоритетом университета Кейптауна (UCT)
В 1964 г. С A Hufnagel сообщил о своем опыте по применению в клинике протеза
из полипропилена с запирающим элементом в виде двояковыпукой линзы, изготов-
ленной из силастика, армированного полипропиленом Ограничители хода линзы были
изготовлены в виде четырех незамкнутых стоек (рис. 2.19). Применение линзы вместо
шара позволяло уменьшить высоту протеза и облегчить его вес Вес был уменьшен
также за счет использования пластмассы при изготовлении корпуса и ограничителей
хода линзы (Hufnagel С A et aL, 1964).
В том же году F. Alvarez-Diaz и соавт сообщили об экспериментальной проверке
искусственных митральных клапанов из полипропилена с запирающим элементом в
форме двояковыпуклой линзы (Alvarez-Diaz F et al , 1964) Протез состоял из полого
цилиндрического корпуса, имеющего четыре Г-образные ограничительные стоики, рас-
положенные перпендикулярно седлу пришивной манжеты из тефлоновой ткани и лин-
зы Короткие концы стоек, соприкасаясь с предсердной поверхностью корпуса проте-
за, ограничивали движение линзы в момент открытия клапана (Hopeman АВ et al ,
1970)
Учитывая неудовлетворительные результаты применения лепестковых протезов, в
1963 г. ЕВ Кау совместно с A. Suzuki сосредоточили свое внимание на разработках
низкопрофильных дисковых клапанов (Кау ЕВ et al , 196С) Первое клиническое при-
менение этого клапана произошло в 1964 г Четыре короткие стопы в гидравлическ м
отверстии предотвращали заклинивание тефлонового диска (рис 2 20)
Клапан D. Е. Harken (см. рис. 2.20) был выпущен компанией Surgitek-Suigitool в
1967 г и предназначался для имплантации в митральную позицию Он предст< вл
собой достаточно низкопрофильную конструкцию, напоминающую протез С A Hufnagel,
состоявшую из титанового корпуса, к которому прикреплялись две П-образные огра-
ничительные стойки, перпендикулярные друг другу и обра у эщие закры ы а а<
(Harken DE et al , 1968) Диск был изготовлен из силикона, а пришивная mj нжета —
из дакроновой ткани Несмотря на то, что клапан D Е Haiken показал yj >е л т ри-
тельные результаты при клиническом использовании, функционируя в течение 20 лет
Рис. 2.19. Искусственный клапан сердца конструкции С. A. Hufnagel (по Б. В. Петровскому и др.,
1966; С. A. Hufnagel et al., 1964)
59
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
Рис. 2.20. Искусственные клапаны сердца Kay-Suzuki (по R. A. DeWall et al., 2000) и D. Е. Harken
(по D. Е. Harken et al., 1968)
после имплантации, были описаны случаи заклинивания диска и даже его выскальзы-
вания из каркаса (Hsi D Н. et al., 2003).
Оригинальные искусственные клапаны сердца предложили J. Н. Кау (1921 г.р.) —
хирург госпиталя Лос-Анжелеса — и инженер D. Shiley в 1965 г. (рис. 2.21). Эти клапа-
ны выпускались компанией Shiley Inc. под названием Kay-Shiley в нескольких моди-
фикациях для замены митрального, аортального и трикуспидального клапанов сердца.
Клапан включал в себя каркас с двумя параллельными П-образными тонкими ограни-
чительными стойками из сплава Haynes (без какого-либо покрытия), пришивную ман-
жету из тефлоновой ткани, диск, который изготавливали, в зависимости от модели, из
полиацитамина (Delrin) или силастика (Kay J. Н et al., 1966).
Необычным в других разновидностях подобных искусственных клапанов сердца было
применение так называемых «мышечных защитников». Модель Kay-Shiley TGCD
(рис 2 22) имела четыре «мышечных защитника», разделенных на две пары и располо-
женных под углом 90° к плоскости седла. Они были сделаны из тонкой проволоки, по-
крытой тефлоновой тканью и предназначались для предотвращения интерпозиции
Рис. г.21. D. Shilev и Л <
7 и J KaV (из материалов музея Htirrv
60 У ЦССХ им. А. Н. Бакулева РАМН)
_______________________ГЛАВА 2. Mexa^HecKjfe искусственные клапаны сердца
тканей сердца между седлом протеза и диском, а также для предупреждения выскаль-
зывания диска из корпуса. В модели TGCD, имевшей в своей структуре «мышечные
защитники», располагавшиеся так же, как и в оригинальном искусственном клапане
сердца, была несколько видоизменена конструкция корпуса и увеличен диаметр при-
шивной манжеты в связи с тем. что клапан предназначался только для трикуспидаль-
ной позиции. Диск из Delrin был слабо рентгеноконтрастен. Искусственный клапан сер-
дца Kay-Shiley выпускался 15 лет — с 1965 по 1980 г Другие разновидности протеза
Kay-Shiley представляли собой модификацию оригинального искусственного клапана
сердца Kay-Shiley. Например, в модели Kay-Shiley MGCD (см. рис. 2.22), которая вы-
пускалась с 1968 по 1980 г., исключительно для замещения митрального клапана было
два «мышечных защитника» и они окружали 2/з корпуса, а диск имел рентгенопозитив-
ную метку. Известны также другие модели искусственных клапанов сердца Kay-Shiley
К и Kay-Shiley Т, которые не содержали «мышечных защитников», а диск изготавли-
вался из силастика с рентгенопозитивной меткой (Berroya R В et al , 1972).
В 1964 г. F. S Cross (1921 г р.) — хирург госпиталя Кливленда — и физиолог
R. Т. Jones разработали протез сердечного клапана Cross-Jones (рис. 2.23), который
начал выпускаться компанией Pemco Inc (Cross F S. et al., 1967, 1969, Hammermeis-
ter К. E. et al., 1969). Клапаны использовались для имплантации в митральную, аор-
тальную и трикуспидальную позиции. Диск в форме линзы изготавливали из силико-
низированной резины со встроенным титановым кольцом в качестве рентгенопозитив-
ной метки. Однако это кольцо добавляло излишний вес запирающему элементу, и
поэтому авторы вынуждены были сделать полость внутри линзы, так называемый «воз-
душный карман». Корпус содержал три ограничительные стойки, перекрещивающиеся
в центре. В дальнейшем конструкция была изменена: ограничительных стоек стало
четыре, и они для предотвращения тромбообразования не имели точек соединения у
вершины. Первое клиническое внедрение клапана состоялось в 1965 г
Известный американский кардиохирург С. W. Lillehei, новатор операций на откры-
том сердце, и его ученик A Nakib из Бейрута разработали тороидальный сердечный
клапан Lillehei—Nakib (см. рис. 2.23). Его первые клинические испытания С. W Lillehei
провел в 1967 г. (Lillehei С. W. et al., 1969) Клапан был полностью сделан из титана,
включая запирающий элемент, который имел в центре отверстие круглой формы. В
систолу клапан формировал как центральный, так и периферический ток крови, а в
диастолу отверстие запирающего элемента перекрывалось круглым направляющим
элементом, укрепленным в центре гидравлического отверстия.
Хирургическая карьера А. С. Beall (1929-2002) началась в медицинском колледже
Хьюстона, где в 1967 г, он разработал тефлоновый дисковый клапан Beall-Surgitool
(рис. 2.24; цв. вкладка, рис. 1). Клапан, очень похожий на описанный выше протез Кау-
Shiley, выпускался компанией Coratomic (Lefrak Е. A. et al., 1979). Его запирающий эле-
мент в виде диска изготавливался из силастика, затем тефлона, а после из пироли-
Рис. 2.22. Искусственный клапан сердца Kay-Shiley (по В. О. Бьёрку, 2003) и его модификации
TGCD и MGCD
СКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
Рис. 2.23. Искусственные клапаны сердца Cross-Jones (из музея НЦССХ им. А. Н. Бакулева РАМН)
и Lillehei-Nakib (по R A. DeWall et al., 2000)
тического углерода Вся конструкция стала покрываться пиролитическим углеродом,
за исключением пришивной манжеты, которая выполнялась из дакроновой ткани Глав-
ным недостатком было то, что клапан не обеспечивал адекватную гемодинамику и вы-
зывал гемолиз при высоком градиенте давления (Linhart J W et al , 1969; Henderson
В. J. et al., 1973) Однако случаев структурных отказов этой конструкции описано не
было (Beall AC et al, 1969)
В 1967 г. хирург университета Филадельфии J Davila (1921 г. р ) изобрел уникаль-
ный запирающий элемент для митрального протеза клапана — полипропиленовый по-
лый цилиндр с диском с желудочковой стороны и кольцом со стороны предсердия —
рис. 2 25 (Davila J С et al , 1968) Стенки цилиндра в виде четырех стоек, служивших
для оединения предсердного кольца с желудочковым диском, при работе двигались в
отверстии металлического корпуса
В середине 60-х гг XX столетия D A. Cooley (1920 гр.) работал с изобретателем
поворотно ди ов го клапана D Liotta (рис 2.26). Вместе они разработали шаровой
протез Cooley-Liotta-Cromie, который имел титановый шар и полное покрытие кар-
а да роновым велюром (Cooley D A et al , 1967) Однако из-за износа тканевого
п крытия и гемолиза выпуск клапана был приостановлен В 1966 г разработан протез
Яис.2.24. д. С• Beall и искусственный клапан
(ПО http.// members.evansville net)
62 ---------
сердца Beall-Surgitool
2. Механические искусственные клапаны сердца
Рис. 2.25. Искусственный клапан сердца Davila-Sierra Sliding (из музея НЦССХ
им. А. Н. Бакулева РАМН)
Cooley-Bloodwell-Cutter с силиконовым дисковым запирающим элементом, четырьмя
титановыми ограничительными стойками и корпусом с дакроновым покрытием
(Cooley D A et al., 1967). В 1968 г тромбоз и проблемы эмболии привели к прекраще-
нию производства и данного клапана С этого года D. A Cooley начинает успешные
операции по трансплантации сердца В 1969 г он становится главным хирургом Ин-
ститута сердца штата Техас Улучшенный протез Cooley-Cutter (см рис 2 26, цв вклад-
ка, рис 1), содержащий входные и выходные ограничители хода силиконового диска,
был представлен в 1971 г (LefrakE A et al., 1979). В дальнейшем для предотвращения
износа и улучшения тромборезистентности диск начали изготавливать из пиролити-
ческого углерода с вольфрамовой вставкой для рентгеноконтрастности, а с 1973 г за-
пирающий элемент стал биконической формы Остальные части клапана принципиально
не отличались от других протезов такого типа корпус выполнялся из титана, пришив-
ная манжета — из тефлоновой ткани. Протезы Cooley-Cutter производились и исполь-
зовались до 1978 г для замены как митрального, так и аортального клапанов
Компания Starr-Edwards также производила свою разработку подобных искусствен-
ных клапанов сердца для митральной позиции. Были предложены два протеза. Starr-
Edwards 6500 и Starr-Edwards 6520, которые выпускались с 1970 по 1976 г В моде-
ли 6500 применялся диск из сплава Stellite 21, корпус содержал четыре перекрещива-
ющиеся ограничительные стойки из Stellite 21, пришивная манжета была тефлоновой.
Рис, 2.26. D. A. Cooley и искусственный клапан сердца Cooley-Cutter (из музея НЦССХ
им. А. Н. Бакулева РАМН)
63
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
По периметру основания протеза располагались отверстия эллипсоидной формы для
чскорения вживления в фиброзное кольцо пациента. Модель 6520 отличалась от 6500
диском, выполненным из высокомолекулярного полиэтилена с внедренным в него ти-
тано !ым кольцом Всего было имплантировано ок )ло 3600 таких конструкции искусст-
венных клапанов сердца (Lefrak Е. A. et al., 1979)
Специальные исследования (Beeson J R et al., 1965) показали худшие гидродина-
мические характеристики по сопротивлению и больший объем регургитации вентиль-
ных дисковых протезов, открывающихся перпендикулярно оси кровотока, по сравне-
нию с шаровыми искусственными клапанами сердца, а также повышенное тромбооб-
разование и гемолиз. Поэтому выпуск указанных конструкций как за рубежом, так и в
нашей стране был приостановлен Им на смену пришли поворотно-дисковые клапаны
ПОВОРОТНО-ДИСКОВЫЕ КЛАПАНЫ
Теперь перейдем к группе искусственных клапанов сердца, которые были наиболее
востребованы в клинической практике в 70-80-х гг. XX столетия, а именно — к проте-
зам с поворотным диском (рис. 2.27).
В 1963 г А. В. Cruz (1933-2001), родившийся на Филиппинах, совместно с С. W Lillehei
изобрели для замены митрального клапана сердца принципиально новую конструкцию,
похожую на дисковый протез С. A. Hufnagel, однако в их модели диск имел выпукло-
вогнутую форму, а ограничители хода были сделаны из двух пар стоек разной высоты.
Поэтому диск перемещался не параллельно плоскости корпуса протеза, а поворачи-
вался относительно него (Cruz А. В et aL, 1965). Корпус клапана Lillehei—Cruz—Kaster
изготавливался из металла, а диск — из тефлона или силастика — см. рис. 2.27
(Kaster R. L et al., 1969; Montorsi P. et al., 2003).
F Alvarez-Diaz и соавт. (1964) модифицировали разработанный ими ранее искусст-
венный клапан сердца с поступательным движением дискового запирающего элемен-
та, в котором корпус имел лишь две эксцентрично расположенные ограничительные
стоики, добавив два эксцентрично расположенных выступа, обращенных в просвет сед-
ЛД1 arez^D^^^et а^^Эб^^ °^еспечивала поворотное движение диска при открытии
Рис. 2.27. Искусственный
—~------ 64
клапан сердца Lillehei-Cruz-Kaster
(по Б. В. Петровскому и др., 1966)
ГЛАВА 2. Механические искусственные клапаны сердца
Японский хирург J. Wada (1922 г. р.) обучался кардиохиругии в штате Миннесота в
1950-1958 гг. По возвращении в Японию он становится руководителем отделения сер-
дечно-сосудистой хирургии в медицинской школе Саппоро. В 1966 г. он разработал
дисковый клапан Wada—Cutter (рис. 2.28), в котором диск вращался вокруг оси, рас-
положенной в плоскости корпуса и несколько отведенной от его центра (Wada J et al.,
1969, Bjork V. et aL, 1970, Hallmar G L et aL, 1972). Одна треть диска, обращенная в
сторону малого проходного отверстия, была тоньше Два металлических выступа кор-
пуса, соприкасающихся с диском в его углублениях, при открытии удерживали диск
под углом к потоку крови. В протезе Wada-Cutter шарниры были спроектированы так,
что износ и напряжение от повторяющихся открытий и закрытий клапана сосредотачи-
вались на двух осевых точках крепления на жестком тефлоновом диске Серийный вы-
пуск этих элегантных клапанных протезов начался в 1967 г Следует отметить, что ус-
пех этого клапана был таков, что в первом искусственном сердце, внедренном в 1969 г.
D. Cooley, использовались четыре клапана Wada-Cutter. Однако производство его было
прекращено в 1974 г. из-за чрезмерного износа тефлонового диска в местах прикреп-
ления шарниров, что приводило к дисфункциям клапанов и эмболиям. Однако отме-
чавшаяся при его использовании хорошая гемодинамика стимулировала разработку
протезов Bjork—Shiley и Lillehey-Kaster.
V. О. Bjork (1919 г р.) родился и работал в Швеции (рис. 2 29). В 1948 г. он разрабо-
тал дисковый оксигенатор и применил его в опытах на животных (Bjork V О , 1948).
С 1966 г. он возглавляет хирургическое отделение Каролинского института в Стокголь-
ме. Накопленный опыт имплантации шаровых протезов и дисковых низкопрофильных
клапанов Wada-Cutter, анализ их недостатков заставили V. Bjork искать новую конст-
рукцию. В 1969 г. совместно с D. Shiley (лаборатория Shiley в Калифорнии) был разра-
ботан поворотно-дисковый клапан, который представлял собой логическое продолже-
ние модели Wada-Cutter (Bjork V. О., 1969; 1971; 1977). Дисковый запирающий эле-
мент из материала Delrin белого цвета удерживался при открытии между большим и
малым рентгеноконтрастными U-образными ограничителями, приваренными к корпу-
су из Stellite, — см. рис. 2.29 (Badak М. I. et al., 2004).
Диск мог свободно вращаться вокруг своей оси, распределяя износ по окружности
приточной и отточной поверхностей. В исходной модели искусственного клапана сер-
дца Bjork-Shiley Standard (см. рис. 2.29) диск, выполненный из пиролитического уг-
лерода, мог опрокидываться на угол 60° по отношению к плоскости протеза, а в
закрытом состоянии этот угол составлял 0°. Материалом для пришивнои манжеты был
выбран тефлон. Размеры искусственного клапана сердца по пришивной манжете 17-
33 мм, при этом диаметр гидравлического отверстия составлял 12—24 мм Клапаны,
предназначавшиеся для имплантации в супрааннулярную и субаннулярную аортальную
позицию и интрааннулярную митральную, различались по форме пришивнои манжеты.
Рис р од и ~ 1л/ояа Putter (из музея НЦССХ им. А. Н. Бакулева РАМН)
• 2.28. Искусственный клапан сердца Wada-Cutter (и у
________ 65 ----------
3 Искусственные
клапаны сердца
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
Следует отметить, что клапану Bjoik-Shiley была уготована непростая судьба, в 1971 г.
диск из DeInn, который впитывал жидкость и изменял объем запирающего элемента,
был заменен на графитовый с высокотемпературным углеродным покрытием, а в 1975 г.
в него была добавлена рентгеноконтрастная кольцевая метка. После такой модифика-
ции клапан Bjork—Shiley стал одним из наиболее часто применяемых механических про-
тезов Однако сварное соединение проволочных ограничителей с корпусом начинало
разрушаться в отдаленные сроки после операции, что вызывало дислокацию диска из
корпуса и гибель больного (Garsia del Castillo Н. et al-, 1985, Lindblom D. et al., 1986;
Schondube F A. et al., 1994).
В попытке увеличить угол открытия диска, уменьшить турбулентность потока крови
и, тем самым, снизить сопротивление и предотвратить тромбообразование в малом
проходном отверстии, искусственный клапан сердца Bjork—Shiley был модифицирован
в 1975 г Основное отличие новой модели заключалось в применении выпукло-вогну-
того пиролитического диска для повышения быстродействия. Диск удерживался на
месте благодаря большому и малому ограничителям хода. Последний контактировал с
центральным углублением тыльной стороны диска. Большой ограничитель хода выпол-
нялся за одно целое с корпусом, а малый закреплялся с помощью сварки. Модель с
диском выпукло-вогнутой формы и углами открытия 60° или 70° стала называться Bjork-
Shiley Convexo-Concave (см. рис. 2.29). Это снизило зону застоя за диском и спо-
собствовало уменьшению тромбоэмболических осложнений с 4,2 % до 1,2% в год пос-
ле замещения митрального клапана (Bjork V. et al., 1979; Cortina J. M. et al., 1986). Од-
нако случаи разрушения корпуса клапана продолжались, и в 1986 г. он был запрещен
для клинического применения (Ostermeyer J. et al., 1987). Проведенные экспертизы
показали, что надлом С-образных ограничителей хода диска происходил в месте их
сварки с корпусом протеза В дальнейшем была разработана целая программа по вы-
явлению больных с потенциальным риском поломок искусственного клапана сердца.
Всем пациентам было рекомендовано тщательное наблюдение, а некоторым рекомен-
дована профилактическая замена протезов, особенно с размерами больше 29 мм
(Birkmeyer J. D. et al., 1992).
Проблема механических дисфункций искусственного клапана сердца Bjork-Shiley
ыла решена в 1 г. путем применения корпуса и ограничителей, не имеющих сва-
называткг«ДК|ХкИЙ^ьС| еди*ственной ОП°Р°Й в выходной зоне клапана, который стал
называться Bjork-Sh.ley Monostrut (Bjork V. О. et al., 1985; Nakano S. et al, 1991).
Рис. 2.29. V. О. Bjork (из материалов музея НЦССХ
сердца Bjork-Shiley Convexo-Concave иТ БаКупеаа РАМН); искусственный клап»н
е' а1> 2003> " ег° Роденовское изображение (no J. Botany
66 -----
_____________ ГЛАВА 2. Механические искусственные клапаны сердца
В данном клапане был использован тонкий диск из пиролитического углерода Вход-
ной ограничитель имел также U-образную форму (рис. 2.30). Единственный выходной
ограничитель удерживал диск на месте за центральное углубление с его тыльной сто-
роны
Протез Bjork-Shiley Monostrut изготавливался частично из сплава Haynes 25, исклю-
чающего необходимость сварки и, следовательно, возможность образования трещин в
опорах и эмболизацию диском В клапане применялся диск из высокотемпературного
углерода. Открытие диска на 70 оптимизировало движение крови. Клинические ха-
рактеристики данного протеза были вполне удовлетворительными, структурных нару-
шении, а также тромбозов в зоне малого отверстия не отмечалось. В 1992 г. компания
Soiin Biomedica Cardio купила у компании Pfizer права на клапаны Bjork—Shiley (кроме
выпукло-вогнутой модели) и затем продала их компании Alliance Medical Technologies.
На сегодняшний день клапаны Bjork-Shiley не выпускаются.
R Kaster (1933 г.р.) получил специальность инженера-электротехника в универси-
тете штата Миннесота в 1951 г. Проектированием искусственных клапанов сердца он
занялся в лаборатории С W. Lillehei. Недостатки протеза Lillehei-Cruz-Kaster стали ему
очевидными в 1965 г. Чтобы устранить застойную зону за дисковым запирающим эле-
ментом, он приблизил к центру титанового корпуса ось поворота диска на 1/з диамет-
ра гидравлического отверстия Ограничители хода диска были существенно уменьше-
ны в размерах и перемещены из проходного отверстия на периферию. Диск удержи-
вался между двумя ограничителями и мог открываться на угол до 80° к плоскости
корпуса, в закрытом положении этот угол составлял 18° (суммарная экскурсия дис-
ка — 62°). Все компоненты клапана были рентгеноконтрастными. Новая конструкция
стала называться Lillehei-Kaster — рис. 2.31 (Gibson Т. С et aL, 1974; Lillehei С. W.
et aL, 1974; Lefrak E A , 1979; Olesen К. H. et aL, 1991). Разработкой и исследованием
пиролитического углерода для диска занимался J. С Bokios (см рис. 2.31). Ранее для
этого использовали Delrin или различные пластики, однако они показывали неудовлет-
ворительные результаты из-за чрезмерного износа Начало внедрения клапана Lillehei—
Kaster (Medical Inc., в Миннеаполисе) с диском из пиролитического углерода относится
к 1970 г. Данные протезы хорошо функционируют у многих пациентов до настоящего
времени (Starek Р. J. К. et al , 1976; Olesen К. Н. et al , 1991).
Другая модель этого клапана — Lillehei-Kaster Carbon — выполнялась полностью
из пиролитического углерода Эта конструкция имела замечательный тридцатилетнии
стаж с единственным сообщением о структурном отказе (Stewart S. et aL, 1998). Даль-
нейшим развитием протеза Lillehei-Kaster стал клапан Omniscience (рис. 2.32), выпу-
Рис. 2.30. Искусственный клапан сердца Bjork-Shiley Monostrut и его рентгеновские изображения
(по J. Botany et al., 2003)
-----------------------------------------------------------67
3‘
ИСКУССТВЕННЫЕ КЛАЛАНЫ СЕРДЦА
Рис. 2.31. R. Kaster (из материалов музея НЦССХ им. А. Н. Бакулева РАМН); искусственный клапан
сердца Lillehei-Kaster (по Р. Montorsi et al., 2003); J. C. Bokros — разработчик пиролити-
ческого углерода (по http://www.mcntx.com)
щенный компанией Medical CV, Inc. в 1978 г. (Carrier М et al., 1987; Mikhail A. A. et al.,
1989; Edwards M S. et al, 2002) Он также открывался на угол 801, но отличался изо-
гнутым диском и короткими ограничителями хода Корпус был выполнен из цельной
заготовки безникелевого титана, а вязаная пришивная манжета — из политетрафторэ-
тилена. Диаметр клапанов по пришивной манжете составлял 19-31 мм, а диаметр гид-
равлического отверстия для аортальной позиции 14,4-24,0 мм и 14,4-26,0 мм — для
митральной. Однако из-за конструктивных недоработок диск клапана открывался не
полностью, что неоднократно отмечалось различными исследователями (Watanabe N.
et al., 1989; Teijeira F. J.t 1998). По этой причине наблюдались многочисленные тромбо-
зы протезов, и поэтому клапан не нашел широкого применения.
С 1984 г клапан полностью стал изготавливаться из пиролитического углерода и
получил название Omnicarbon (см. рис. 2.32; цв. вкладка, рис. 2). Его диск имеет рент-
генопозитивную метку. Диаметр тефлоновой пришивной манжеты Omnicarbon состав-
ляет 19-33 мм, а диаметры гидравлического отверстия — 14-24 мм (Thevenet A. et al.,
1995; Abe Т. et al., 1996). В настоящее время клапан выпускается компанией Medical
CV, Inc. (штат Миннесота).
К V Hall, 1917 г. р (рис. 2 33) работая кардиохирургом в госпитале г. Осло, ис-
пользовал различные конструкции искусственных клапанов сердца. В 70-х гг. XX столе-
тия у него появились идеи улучшения поворотно-дискового клапана. Для их реализа-
ции ему требовалась научная и финансовая поддержка. A. Woien, друг, физик и биз-
Рис. 2.32. Искусственные клапаны сердца Omniscience и Omnicarbon (по J. Botany et al., 2003)
--------- 68 -----------—___________________________
ГЛАВА 2 Механические искусственные клапаны сердца
Рис. 2.33. К. V. Hall и схема искусственного клапана сердца его конструкции
несмен, пришел к нему на помощь. В то время A Woien являлся представителем ком-
пании Medtronic Inc. по распространению клапана Lillehei—Kaster в Европе. Для прове-
дения экспертизы разрабатываемого искусственного клапана сердца A. Woien обра-
тился к R Kaster из г Миннеаполиса.
В 1977 г. К. Hall, A. Woien и R Kaster предложили новую структурную деталь пово-
ротно-дисковых клапанов. Они решили заменить ограничитель в выходном отделе дис-
кового протеза на единственную опору, идущую через центр диска, который имел для
нее специальное отверстие. Этот ограничитель, выполненный в форме «гусиной шеи»,
позволял диску свободно перемещаться. Второй, меньший ограничитель, останавли-
вал его движение при полном открытии (рис. 2.34; цв. вкладка, рис. 2). Корпус протеза
изготавливался из титана, а диск — из пиролитического углерода (Hall К. V. et al., 1979;
1985; ButchartE. G., 1981). Манжета для пришивания клапана к фиброзному кольцу из-
готавливалась из вязаного политетрафторэтилена. Протез обеспечивал центральный
поток крови. Угол открытия составлял 70° для митральной позиции (модель М7700) и
75° — для аортальной (модель А7700). Угол закрытия равен 0°. Все компоненты клапа-
на доступны для исследования с помощью рентгеновских лучей Корпус не имел сва-
рочных узлов, и вращающийся центральный диск обеспечивал равномерный износ
протеза. Опытные образцы, сделанные в Миннеаполисе, были впервые клинически
внедрены в 1977 г. В дальнейшем проект клапана был куплен компанией Medtronic Inc
Рис. 2.34. Искусственный клапан сердца Medtronic-Hall (по S. Streckenbach, 2004)
---------------------------------------------------------- 69
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
и клапан стал выпускаться под названием Medtronic-Hall (см. рис. 2.34). Диаметры
пришивной манжеты современного клапана Medtronic-Hall составляют 20-29 мм (для
аортальной) и 23-31 мм (для митральной позиции), а диаметры гидравлических от-
верстий 16-24 мм и 18-24 мм, соответственно. Таким образом, клапан Medtronic-Hall
стал результатом попыток К. Hall и R. Kaster объединить в одной модели самые лучшие
характеристики клапанов Bjork-Shiley и Lillehei-Kaster (Константинов Б. А. и др., 1987).
Дизайн клапана Medtronic-Hall не менялся с момента первого клинического приме-
нения Сегодня его корпус по желанию хирурга может быть повернут относительно
манжеты для оптимальной ориентации протеза непосредственно в процессе опера-
ции Клапан Medtronic-Hall дает превосходные результаты по сравнению как с пово-
ротно-дисковыми, так и с двустворчатыми протезами (Hall К. V. et al., 1988; 1992;
Butchart Е G. et al., 2001).
Протез Medtronic-Hall характеризуется великолепной гемодинамикой, достаточной
долговечностью и низкой тромбогенностью (Nitter-Hauge S. et al., 1989; 1996; Keenan R.
J. et al., 1990). 3a 9 лет (502 протеза) и 20 лет (1776 протезов), по данным Р. J. К. Starek
и соавт (1987), Е. G. Butchart и соавт. (2001), не было зарегистрировано механических
поломок искусственного клапана сердца Один случай структурного отказа был заре-
гистрирован в начале производства этих клапанов в модификации D-16. В дальней-
шем плоский выступ, с которым соударялся диск при закрытии клапана D-16, был за-
менен на круглый. Следует отметить, что модель D-16 больше не выпускается. Клапа-
ны Medtronic-Hall (А7700 и М7700) до сих пор утверждены для клинического
использования в Северной Америке (Brazao A. J. et al., 1999). Последняя модель кла-
пана с увеличенным проходным сечением названа Hall Easy Fit и предназначена для
супрааннулярной имплантации.
В конце 70-х-начале 80-х гг. XX столетия выпуск малогабаритных поворотно-диско-
вых клапанов начался, помимо США, и в других странах. В Англии был предложен ис-
кусственный клапан сердца фирмы AorTech International под торговым названием
AorTech UltraCor (рис. 2.35; цв. вкладка, рис. 2). Диск выполняли из углеродного ма-
териала с добавлением вольфрама и покрытием из пиролитического углерода, а кор-
пус — из единой титановой заготовки (сорт А-70) без сварных соединений, манжета —
из вязаной тефлоновой ткани. Аортальный клапан открывался до 73°, митральный —
до 68°, угол закрытия — О'. Диск и корпус клапана рентгеноконтрастны. Корпус проте-
за вращался относительно пришивной манжеты. Сейчас выпускаются следующие ти-
поразмеры искусственного клапана сердца AorTech UltraCor с диаметрами пришивной
манжеты; аортальные — 19, 21, 23, 25, 27, 29 мм; митральные — 23, 25, 27, 29, 31, 33
мм. Первые сообщения об их применении в клинике относятся к 1984 г. До сегодняш-
него дня структурных отказов клапана замечено не было (Li Н Н et al 1998' Sin Y К et
al., 2000).
Рис. 2.35.
Искусственные клапаны сердца AorTech UltraCor
Monostrut X (no J. Botany et aL, 2003)
; Sorin Carbocast Allcarbon; Sorin
70
___________________ ГЛАВА 2 Механические искусственные клапаны сердца
Клапан Monocast был первым протезом с поворотным диском, сделанным италь-
янской компанией Sorin Biomedical. Протез используется в клинике с 1977 г. до сегод-
няшнего дня (Hurle A et al., 1997; Milano A. et al., 1992). В протезе Sorin Carbocast
(1986) пришивная манжета имела углеродное покрытие. С 1988 г. выпускается протез
Allcarbon (см. рис. 2.35; цв вкладка, рис. 2), корпус которого сделан из Stellite 25
(Haynes 25, Alacrite XSM) и имеет углеродное покрытие Carbofilm. Каплеобразные ог-
раничители, улучшающие гемодинамику, изготовлены с использованием процесса мик-
роотливки во избежание образования неструктурное™ материала Графитовый диск
покрыт пиролитическим углеродом, а внутренняя часть пришивной тефлоновой ман-
жеты — турбостатическим углеродом для улучшения гемосовместимости и снижения
риска разрастания тканей (паннуса). Наружная часть манжеты, предназначенная для
контакта с тканями фиброзного кольца, не имеет такого покрытия. По данным произ-
водителя, это способствует лучшему врастанию тканей. В диске размещена рентгено-
контрастная танталовая проволока. Размеры пришивной манжеты протеза составляют
19-31 мм для аортальной позиции и 19-33 мм — для митральной при диаметрах гид-
родинамического отверстия 14-24 мм. Степень подвижности самого диска составляет
60° от открытого до закрытого положения. Компания Sorin выпускает и другую моди-
фикацию клапана Allcarbon с измененными удерживающими ограничительными стой-
ками, по аналогии с искусственным клапаном сердца Bjork-Shiley Monostrut (см рис.
2.35). Клапан носит название Sorin Monostrut X и имеет одну выходную удерживаю-
щую диск стойку. Протезы Allcarbon и Monostrut X утверждены для продажи в Европе, в
США данные искусственные клапаны сердца не поставляются (Butany J. et al., 2003).
Хотя поворотно-дисковые клапаны проявили свои высокие механические качества
(механическая надежность, долговечность функционирования) и имеют бесспорные
преимущества перед протезами шарового типа (в частности, благодаря низкой про-
фильности), они имеют и ряд недостатков. Остановимся на достоинствах и недостат-
ках этих искусственных клапанов сердца подробнее.
По своей механической надежности клинические варианты дисковых протезов пре-
восходят шаровые (Bjork V., 1977; Clark R. Е. et al., 1981). Диск имеет возможность вра-
щаться относительно своей оси и менять точки соприкосновения с ограничителями
седла, что снижает опасность изнашивания материала. Долговечность этих протезов
более чем достаточна для уверенного прогнозирования нормальной функции в реаль-
ном режиме времени жизни пациента независимо от его возраста. Низкопрофиль-
ность — основное достоинство дисковых протезов. Благодаря разработке такой конст-
рукции удалось, сохранив долговечность, значительно уменьшить габариты протеза,
высота дисковых протезов в закрытом состоянии не превышает 7 мм (у шаровых —
20 мм и более). С клинической точки зрения это означает возможность выполнения
протезирования митрального клапана пациентам с митральным стенозом и маленькой
полостью левого желудочка без опасности развития синдрома малого сердечного выб-
роса в раннем послеоперационном периоде.
В то же время конструкция протезов имеет и ряд недостатков, представляющих
потенциальную опасность и влияющих на клинические результаты. Из-за эксцентри-
ческого расположения диска клапан при открытии имеет два проходных отверстия —
большое и малое. Наличие турбулентного потока крови в малом отверстии и застой-
ных зон за седлом клапана приводят не только к тромбоэмболии, но и к тромбозам.
Причем тромбоз протеза в этой зоне и постепенное напластование соединительной
ткани приводят к заклиниванию диска, катастрофической дисфункции клапана и вне-
запной смерти пациентов на фоне отека легких. В клинических условиях конструктивно
заданный угол открытия диска 70-80° в действительности не реализуется, особенно при
тахиаритмиях, что приводит к возрастанию стенотичности протеза (Дземешкевич С. Л. и
ДР , 2000, Simon Н. et al., 1979, Wisskirchen К. et al., 1979; Daenen W et al, 1981).
Таким образом, создание протезов с опрокидывающимся дисковым механизмом
позволило уменьшить размеры протезов и улучшить их гемодинамические характери-
___________________________________________________71
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
стики Однако основная проблема всех механических клапанных протезов, а именно —
относительно высокий риск тромбоэмболических осложнении и необходимость для
пациентов пожизненного приема антикоагулянтов, осталась нерешенной. Поэтому даль-
нейшая мысль ученых была направлена на поиски клапана с минимальным сопротив-
лением и лучшей тромборезистентностью. отвечающих высоким требованиям, кото-
рые предъявляются ко всем клапанным заменителям
ДВУСТВОРЧАТЫЕ КЛАПАНЫ
В 1958 г. еще во времена начала разработки шаровых протезов J. W Holter впервые
сформулировал концепцию двустворчатых протезов искусственных клапанов сердца
(Butany J. et al., 2003). В 1965 г. В. R. Kalke, получивший образование в Индии и рабо-
тавший в университете Миннеаполиса (Миннесота), предложил С. W Lillehei конструк-
цию полностью титанового двустворчатого клапана с шарнирным механизмом крепле-
ния створок и М-образным ограничителем их движения (Kalke В. R. et al., 1967; 1969).
В первой модели оси поворота располагались ближе к периферии гидравлического
отверстия, центральное проходное отверстие по площади превосходило боковые, а
створки в открытом положении были обращены к набегающему потоку своими криво-
линейными кромками. Однако добиться эффективной работы такой конструкции не
удалось. Поэтому в окончательном варианте оси искусственного клапана сердца
Lillehei-Kalke были приближены к центру, тем самым центральное проходное отвер-
стие было уменьшено относительно боковых, а створки при открытии были обращены
к набегающему потоку своими прямолинейными кромками (рис. 2.36). Такое располо-
жение осей оказалось настолько эффективным, что оно используется во всех извест-
ных двустворчатых конструкциях до сегодняшнего дня
На сегодняшний день двустворчатые искусственные клапаны сердца являются наи-
более популярными в кардиохирургии (Carlson D. et al., 1985). Типичный двустворча-
тый протез состоит из двух полукружных створок, которые открываются и закрывают-
ся в проходном отверстии седла корпуса С наружной стороны корпуса имеется канав-
ка для пришивнои манжеты. Маленькие «ушки» на створках искусственного клапана
сердца вставляются в специальные пазы (углубления) с внутренней стороны корпуса
протеза. Форма этих пазов, напоминающих «бабочку», определяет движение створок
на открытие и закрытие. Створки вращаются вокруг своей оси, позволяя потоку крови
омывать шарниры («ушки» створок и «бабочки»), что помогает минимизировать накоп-
ску ственныи клапан сердца Lillehei-Kalke, его первоначальная и окончательная схе
мы (по В. R. Kalke et al., 1969)
72 ---------------------------
ГЛАВА 2 Механические искусственные клапаны сердца
ленив тромбов в пределах этих областей. Материалом для изготовления створок слу-
жит пиролитический углерод.
В 1968 г компания Surgitool изготовила только один клапан Lillehei-Kalke, который
С. W. Lillehei имплантировал в Корнельском Медицинском Центре Нью-Йорка. К сожале-
нию, пациент умер через 48 ч, а вскрытие не производилось, и идея протезов этого типа
была оставлена в пользу других проектов, над которыми работала группа С W. Lillehei
В 1976 г. инженер X. С Posis предложил хирургу по сердечно-сосудистым заболе-
ваниям университета штата Миннесота D Nicoloff (рис. 2.37) проект двустворчатого
клапана, похожего на первую модель клапана Lillehei-Kalke С этим проектом они об-
ратились к М Villafana (см. рис. 2.37) — основателю компании, выпускающей кардио-
стимуляторы. Продолжение работы над проектом клапана привело к появлению моде-
ли, схожей со второй модификацией клапана Lillehei-Kalke Однако, в отличие от него,
новая конструкция не имела М-образного ограничителя и была полностью выполнена
из пиролитического углерода, кроме того, была уменьшена высота корпуса. Внедре-
ние производства пиролитического углерода проходило под руководством J. С Bokros
(Bokros J. С. et al., 1992).
Многочисленные эксперименты по имплантации клапана телятам показали хорошие
результаты. С. W. Lillehei, возвратившийся из Нью-Йоркского Корнельского Медицинс-
кого Центра, одобрил начало клинического внедрения этого клапана. D. Nicoloff впер-
вые имплантировал свой клапан 3 октября 1977 г. в Миннеаполисе (Nicoloff D. М. et al ,
1981; Arom К. V. et al., 1989). M. Villafana предложил назвать их клапан именем Nicoloff,
однако D. Nicoloff отказался. В то время сын М. Villafana выздоравливал от серьезной
болезни и М. Villafana предложил назвать клапан по имени Святого Иуды Тадеуша, по-
могающего больным в трудных случаях (Villafana М. А., 1989). Эта конструкция, извес-
тная под названием St Jude Medical (рис. 2.38), очень быстро заняла лидирующее по-
ложение на рынке протезов сердечных клапанов и до сих пор является лучшей Этому
способствовали неудачи с клапаном Bjork—Shiley, о которых упоминалось выше. D Nicoloff,
не желая прерывать клиническую практику, отказался от предложенной должности
медицинского директора новой компании. По его просьбе на эту должность назначили
С. W. Lillehei, возглавлявшего компанию до своей смерти в 1999 г.
Корпус и створки St. Jude Medical Standard выполнены из графита и покрыты пи-
ролитическим углеродом. Кроме того, клапаны импрегнированы вольфрамом (5-10%
по весу) для обеспечения рентгеноконтрастности Выемки шарнирных механизмов в
форме «бабочек» расположены во входных выступах корпуса седла. Угол открытия ство-
рок составляет 85° к плоскости корпуса; угол между открытыми створками — 10°, а в
Рис 2 37 D Nicoloff и М. A. Villafana (по http://www.devicelink.com)
_____________________________________________________ 73
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
Рис. 2.38. Искусственный клапан сердца St. Jude Medical Standard (no S. Streckenbach, 2004)
закрытом состоянии створки соединяются под углом 120* по отношению друг к другу
Выходная кромка створки расположена на уровне середины высоты кольца корпуса
(рис 2 39, цв. вкладка, рис. 3). Объем регургитации на протезах этого типа не пред-
авляет клиничес и опасностей (7-11% от ударного объема в зависимости от диа-
метра протеза) Пришивная манжета сделана из полиэфирного волокна (polyester)
ни 1Еная манжета изначально была неподвижна относительно корпуса клапана, в пос-
ледующем эта проблема была устранена, что позволило хирургам во время операции
менять ориентацию клапана Первый протез St Jude Medical выпускался для установ-
ки в митральную, аортальную и трикуспидальную позиции. Размеры для аортальной
позиции по пришивной манжете - 19-25 мм, а для митральной - 25-33 мм За все
вре 1 и по в ния было арегистрировано лишь несколько случаев структурных от-
казов клапанов которые не имели наружного упрочняющего кольца, и произошли, ве-
роятнее всего, из-за деформации корпуса искусственного клапана сердца во время
!^М?ЛнНТЛЦ^И' ^лапан St. Jude Medical Standart производится и продается компани-
И / U 6 п С 1977 г и претерпел за это время несколько модификации манже-
Т ул г|ИС dtcJ ~ Masters (1995), Expanded (1996), Hemodmamic Plus (1996), Silzone
karh n onmT “ Regent’ 19" (Khan S et al > 1994- Carrel T et al , 1996.
Bach D S et al , 2001. Houel R et al , 2001, Sudkamp M et al 2003)
(пиеЛТдтМа°^1ГИеМ М0Д6ЛИ иск7сстве”ного клапана сердца St. Jude Medical Masters
мены \/лрпжирЯ^ирВ°Т°ЖН0СТЬ вращения корпуса в пришивной манжете за счет за-
Основным отличирмИ ° мотки спиральной пружиной и двумя стопорными кольцами
металл^Masters Si,ZOne (рис‘ 241> было применение покрытия
р р м путем ионно-лучевого испарения и осаждения (SZ-покрытие)
Рис. 2.39. Разновидности обшивных манжет искусственного клапана сердца St. Jude Medteak
а — Standard Expanded б — Flex, в — Hemodinamic Plus, г — Mastets (с возможностью поворота)
где 1 — обшивная манжета, 2 — корпус клапана 3 — удерживающая обмотка 4 — стопорное коль-
цо 5 — спиральная пружина (no www sjm com)
74 ---------------
ГЛАВА 2 Механические искусственные клапаны сердца
Рис. 2.40. Искусственный клапан сердца St. Jude Medical Masters и его рентгеновские изображе-
ния (по J. Butany et al., 2003)
SZ-покрытие было применено в надежде на то, что слой серебра будет предотвращать
колонизацию бактерии на протезах и последующий протезный эндокардит (Brutel de la
Riviere A et al., 2000)
Было доказано, что SZ-покрытие снижает адгезию и колонизацию микроорганиз-
мов, — таких как Staphilococcus aureus, Е coh, Klebsiella pneumoniae, Candida albicans
в культуре клеток в опытах на животных (Seipelt R G. et al, 2001) Однако с примене-
нием протеза St Jude Medical Masters Silzone некоторые хирурги стали связывать вы-
сокий риск образования значительной параклапанной фистулы, по сравнению с други-
ми манжетами. Имеется в виду параклапанная фистула, требующая реоперации или
приводящая к смерти пациента (lonescu A et al , 2003).
Была высказана гипотеза о том, что повышенный риск параклапанной фистулы мо-
жет возникать вследствие торможения нормального фибробластического ответа на
врастание пришивной манжеты в ткани пациента (Schaff Н V et al , 2002) В другом
исследовании отмечено отсутствие параклапанной фистулы в периоды 12 и 24 меся-
ца, что составило 98,5±1,5% и 100% для аортального и митрального искусственного
клапана сердца, соответственно (Houel R et al., 2001). Некоторые авторы отмечали вы-
сокий уровень тромбоэмболических осложнений при имплантации искусственных кла-
панов сердца St Jude Medical Masters Silzone, что позволило сделать заключение о
повышенной тромбогеннои опасности SZ-покрытия (lonescu A A et al., 1999,
Рис. 2.41. Модификации искусственного клапана сердца St. Jude Medical. I emodinamic Plus;
Masters Silzone; Regent (no J- Butany et al., 2003)
75
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА _____________
Stalenhoet J. Е. et al., 2003). У одного пациента через год после протезирования заре-
гистрирован случай рабдомиосаркомы левого предсердия (Grubitzsch Н. et al., 2001).
В связи с этим с января 2000 г компания St. Jude Medical объявила о добровольном
снятии с продаж всех клапанов с SZ-покрытием (это касалось и аннулопластических
колец).
В модели искусственного клапана сердца St. Jude Medical Hemodinamic Plus (см.
рис. 2.39, в и 2.41) имеется супрааннулярная пришивная манжета с интрааннулярным
углеродным кольцом корпуса, что позволяет избегать расположения пришивной ман-
жеты в фиброзном кольце после имплантации клапана. Эта новация увеличивает диа-
метр гидравлического отверстия на 2 мм относительно модели Standard без измене-
ния конструкции корпуса, что обеспечивает этой модели гемодинамическое превос-
ходство (Vitale N. et al., 2001; Nimami H. et aL, 2002). Например, модель Hemodinamic
Plus 19 типоразмера имеет гидравлическое отверстие того же диаметра (16,7 мм), что
и модель Standard 21 типоразмера
Модель искусственного клапана сердца St. Jude Medical Regent (см. рис. 2.41)
отличается тем, что углеродное кольцо корпуса перемещено в супрааннулярную пози-
цию вместе с пришивной манжетой, а шарнирный механизм створок полностью опу-
щен в углеродное седло корпуса (Gelsomino S. et al., 2003; Sudkamp M. et al., 2003).
Кроме того, уменьшена толщина стенки корпуса, что обеспечило увеличение диаметра
гидравлического отверстия на 1 мм относительно модели Hemodinamic Plus. На рис.
2.42 изображены разновидности корпуса искусственных клапанов сердца St. Jude
Medical.
Следует отметить, что искусственный клапан сердца St. Jude Medical имеет пре-
восходные отдаленные результаты, хорошие гемодинамические характеристики, низ-
кую частоту тромбоэмболических осложнений и тромбоза протеза. Этот клапан имп-
лантируется уже более 27 лет (с 1977 г.). Он фактически стал «золотым стандартом»,
относительно которого оцениваются другие механические клапаны сердца. В 2000 г.
был имплантирован миллионный образец этого протеза (Ребиков А. Г. и др., 2002;
Fiore А С. et aL, 1998; lonescu A. A. et al., 1999; Jamieson W. R. et aL, 1999; Bertrand S.
et aL, 2000). Однако этот протез имеет и недостатки, присущие всем моделям механи-
ческих клапанов, — хронический внутрисосудистый гемолиз, его применение также
требует пожизненной антикоагулянтной терапии (Hering D. et al , 2005). Надежды на
то, что при применении двустворчатых клапанов можно обойтись только аспирином,
были опровергнуты исследованиями. Коммерческий и, прежде всего, клинический ус-
Рис. 2.42. Разновидности седла корпуса искусственного клапана St. Jude Medical:
г - XnbReX rne0TAD^oCre4eHMe С-еДЛа Standard И He™dina™ Plus; в _ модель Standard,
diameter) id — диамето гиппяя адочнь1И Диаметр или диаметр фиброзного кольца (tissue annulus
----------76
ГЛАВА 2 Механические искусственные клапаны сердца
пех клапанов St. Jude Medical, демонстрирующий преимущества двустворчатой конст»
рукции, побудил других производителен к дальнейшему усовершенствованию устройств
подобного рода. Сравнительные схемы искусственных клапанов сердца St Jude Medical.
Caibomedics и ATS представлены на рис. 2.43.
Рис. 2.43. Схемы двустворчатых искусственных клапанов сердца St. Jude Medical (SJM),
Carbomedics (CM) и ATS (no Z. Feng et al., 2000)
В 1986 г. компания Sulzer Carbomedics представила новый двустворчатый искусст-
венный клапан сердца, названный Carbomedics Standard — Carbomedics Prosthetic
Heart Valve, или сокращенно CPHV (рис. 2.44, цв. вкладка, рис. 3). Створки вращаются
внутри кольца корпуса, в котором в виде углублений (< бабочек») расположены подвес-
ные механизмы. Шарнирный механизм хорошо промывается кровью и не дает крепеж-
ным поверхностям стираться. Клапан имеет ряд эволюционных нововведений, отлича-
ющих его от St. Jude Medical: монолитный корпус из пиролитического углерода не имеет
входных выступов, выходная кромка створки расположена близко к выходному краю
кольца корпуса для придания дополнительной жесткости и предотвращения выскаки-
вания створок. Вокруг корпуса клапана размещается упрочняющее кольцо из титана,
что позволяет менять положение протеза при имплантации, угол открытия створок —
78° (у St. Jude Medical — 85v), за счет этого створки закрываются более синхронно и
быстро и поэтому объем регургитации становится минимальным Мягкая пришивная
манжета изготавливается из дакроновой ткани, обработанной Biolite carbon, повторяет
форму фиброзного кольца пациента, прикрывает створки и входную часть корпуса про-
теза от нарастания паннуса и позволяет свести к минимуму возможность развития па-
раклапанной фистулы. Корпус и створки клапана рентгеноконтрастны Первая клини-
ческая имплантация клапана выполнена в 1987 г.
Рис. 2.44. Искусственные клапаны сердца Carbomedics Standard; Carbomedics R Series,
Carbomedics Pediatric/Small Adult (no J. Butany et al., 2003 и www.carbomedics.com)
_ _____________________________—-------- 77
ИСКУССТВЕННЫЕ КЛАПАНЫ С ЕРДЦА*
На сегодняшний день существует несколько моделей клапанов Caibomedics, отли-
чающихся формой и размерами пришивной манжеты, — Standart, R Senes, Pediatric/
Small Adult, OptiForm, Top Hat, SuMit, Orbis Модель R Series (см. рис. 2 44) имеет умень-
шенный посадочный диаметр пришивнои манжеты без изменений внутреннего диамет-
ра гидравлического отверстия, что позволяет имплантировать более крупные протезы
в интрааннулярную позицию пациентам с узким фиброзным кольцом и, тем самым,
снижается необходимость в аннулопластике по расширению корня аорты.
Клапаны Pediatric/Small Adult (см. рис. 2.44) отличаются меньшими размерами
пришивнои манжеты — 16-19 мм для аортальной позиции и 16-21 мм — для митраль-
ной. Эта модель начала применяться с 1991 г. Ее внедрение было обусловлено тем,
что стандартные клапаны, которые производятся различными фирмами, часто не под-
ходят для протезирования детей и лиц, имеющих маленький рост и узкие фиброзные
кольца Толщина пришивной манжеты из полиэстера уменьшена, что позволяет имп-
лантировать 19-мм седло корпуса искусственного клапана сердца пациенту с 16-мм
отверстием фиброзного кольца. Это обеспечивает повышение интенсивности тока кро-
ви и согласование гемодинамических требований с ростом пациента. При этом снижа-
ется необходимость повторной замены клапана в растущем сердце Его маленькие раз-
меры и супрааннулярная имплантация позволяют хирургу увеличивать размер клапана
на 2-4 мм, предотвращая необходимость расширения корня аорты.
Модели Optiform и Orbis Universal (рис. 2.45) имеют податливые манжеты. Это
позволяет хирургу перемещать клапан, изменяя места вкола и выкола иглы, что осо-
бенно актуально при повторном протезировании, когда у больного имеется жесткое,
ригидное кальцинированное фиброзное кольцо, а гибкая и послушная манжета может
быть пришита даже к тяжело кальцинированному или травмированному фиброзному
кольцу Второе положительное качество пришивной манжеты этого типа заключается в
том, что она является симметричной относительно центральной плоскости корпуса, что
позволяет хирургу менять уровень имплантации клапана. Например, в случае гиперт-
рофии межжелудочковой перегородки при митральном протезировании клапан может
быть «приподнят» для уменьшения обструкции выходного тракта левого желудочка.
Модели Top Hat и SuMit (рис. 2.46) предназначены для супрааннулярной имплан-
тации (Roedler S. et al., 1995; De Brux J L. et al., 1996; Lundblad R. et al , 2001; Gillinov A. M.
et al., 2003). Маленький размер и расположение позволяют хирургу использовать кла-
пан, который на один размер может превосходить искусственный клапан сердца для
интрааннулярной имплантации. Это особенно важно для пациентов с узким корнем
аорты Благодаря своему свойству подходить к разным размерам фиброзного кольца,
эта модель обеспечивает увеличение площади тока крови и снижает градиенты давле-
ния (De Brux J. L. et al., 1996). Модель SuMit была разработана для имплантации в мит-
ральную позицию в ситуации с дефицитом пространства в зоне имплантации Манже-
78 ----—
ГЛАВА 2 Механически^ искусственные кляп.<Нг'1 сердца
Рис. 2.46. Искусственные клапаны сердца Carbomedics Top Hat и Carbomedics SuMit
(по www.carbomedics.com)
та клапана имеет плоский край на выходной стороне, что минимизирует обструкцию
внутри левого желудочка. Все компоненты протеза остаются скрытыми в предсердии
как при супрааннулярном. так и при интрааннулярном расположении манжеты. Осо-
бенно искусственный клапан сердца SuMit показан в ситуации при двухклапанном про-
тезировании и при протезировании митрального клапана с сохранением подклапан-
ных структур. Следует отметить, что за 18 лет использования (на 2000 г было имплан-
тировано более 325 000 протезов Carbomedics) не сообщалось ни об одном случае
структурного отказа клапана (Yamauchi М et al., 1996; Bernal J M. et aL, 1998;
Dalrymple H. M. et al., 2000; Dalrymple-Hay M. J. et al., 2000; Jamieson W. R. et al., 2000;
Alsaddique A. A 2002)
Пытаясь уменьшить объем регургитации через клапан, компания Baxter-Edwards в
1982 г. выпустила аортальный протез названный Edwards Duromedics (рис. 2.47),
имевший улучшенную конструкцию шарниров и так называемую «посадочную губу», ко-
торая помогала створкам более плотно соединяться при закрытии во время диастолы
левого желудочка (Baudet Е. et al., 1995; Podesser В К. et aL, 1998). Корпус протеза
изготавливался из сплава Stelhte, покрытого пиролитическим углеродом. Створки были
сделаны из графита, импрегнированного вольфрамом и покрытого пироуглеродом. Ма-
териалом для пришивной манжеты был выбран дакрон с покрытием Biolite «Посадоч-
ная губа», одновременно с уменьшением объема регургитации, уменьшала и полезную
площадь гидравлического отверстия, что нивелировало ее запирающие преимущества.
Кроме того, она являлась источником турбулентности потока крови. Поэтому в 1988 г.
компания Baxter Healthcare по собственному желанию сняла клапан с продаж, ссыла-
ясь на механическую дисфункцию 12 протезов из общего количества имплантаций, со-
ставивших 20000 (Mastroroberto R et al , 2002) Однако в июне 1990 г. клапан снова
возвратился на рынок в качестве модифицированной модели и стал продаваться как
клапан Edwards Tekna, который широкого распространения так и не получил (Seybold-
Eptmg W. et al., 1998; Hemmer W B. et aL, 2000; Calkavur T. et aL, 2002). Сейчас искусст-
венный клапан сердца Edwards Tekna не выпускается
В 1990 г итальянская компания Sorin Biomedica Cardio, наряду с поворотно-диско-
выми, начала выпуск двустворчатых клапанов Sorin licarbon (рис 2 48, цв. вкладка,
рис. 3) Она объединила изогнутые створки из пиролитического углерода, напоминаю-
щие конструкцию Edwards Duromedics, с титановым корпусом, покрытым углеродной
пленкой, снижающей тромбогенность протеза. Пришивная манжета, сделанная из двой-
ного велюрового политетрафторэтилена, также имела углеродное покрытие Такое ре-
шение упростило технологию производства корпуса по сравнению с его изготовлени-
ем из пиролитического графита Клапан Sonn Bicarbon имеет угол откры /1я 80 , створки
и корпус являются рентгеноконтрастными. Протез исполы ует дизайн лепестков по типу
«воздухоотражателя», предназначенного для снижения турбулентности и уменьшения
областей застоя. Изогнутые створки обеспечивают равенство трех проходных отвер-
----------------------------------------------------- 79
ИСКУССТВЕННЫЕ КЛАЛ АНI Ы СЕ РДЦА
5
4
Рис. 2.47. Искусственный клапан сердца Edwards Duromedics и его схема:
1 — паз шарнира корпуса 2 — корпус; 3 — створка в открытом положении, 4 — шарнир створки,
5 — стеллитовое кольцо жесткости 6 — посадочная поверхность; 7 — створка в закрытом положе-
нии (по Н Б Добровой и др 1989)
Рис 2.48
Искусственный клапан сердца Sorin Bicarbon
(no J. Butany et al., 2003)
80__________________________ _
и его рентгеновское изображение
ГЛАВА 2 Механические искусственные клапаны сердца
стий клапана Кроме того, подвешивающий шарнирный механизм усгро !н таким обра
зом, что пропускает незначительный обратный ток крови вблизи подвесных устройств
(«ушек» створок), а это способствует «промыванию» данной области и поэтому снижа-
ет риск тромбоза даже в закрытой позиции клапана Разновидности шарнирных меха-
низмов двустворчатых клапанов представлены на рис 2 49. Стандартная модель Sorin
Bicarbon имеет диаметры седла искусственного клапана сердца по пришивной манже-
те 19-31 мм и 19-33 мм для аортальной и митральной позиций, соответственно
(Borman J В et al, 1998, 2003, Camilleri L F et al., 2001; Vitale N et al., 2004)
Другая модель искусственного клапана сердца Sorin Bicarbon Fitline отличается
уменьшенной пришивной манжетой для облегчения имплантации и имеет те же раз-
меры Протез используется 14 лет и данных о его механической несостоятельности
нет Однако исследования последних лет выявили износ углеродного покрытия
(см рис. 2.49) на каркасном кольце из титана и на шарнирном механизме «бабочек»
(Агги Р et al , 1994; 1996; Campbell A et al , 1996, Hasenkam J M et al , 1997) Этот
износ не вызывал дисфункцию клапана Несмотря на это, клапан проходит только ста-
дию клинических испытаний в США Он доступен на других рынках, так как разрешен к
использованию European СЕ
Sorin Biomedica выпускает также другой протез Bicarbon Slimline, который отлича-
ется от стандартной модели меньшими размерами пришивной манжеты, что позволя-
ет имплантировать более крупные по гидродинамическому отверстию протезы в за-
данный диаметр фиброзного кольца пациента Подобное устройство протеза снижает
градиенты давления на искусственном клапане сердца и увеличивает эффективную пло-
щадь гидродинамического отверстия протеза, что улучшает общую гемодинамику
Американская фирма Edwards Life Sciences приобрела право на выпуск этого кла-
пана в США и изменила в данном проекте пришивную манжету, оставив общий дизайн
клапана без изменений Таким образом, этот клапан стал называться в США Edwards
Mira — рис 2.50 (De Feo М et aL, 2003) Протез отличается от Sorin Bicarbon тем, что
пришивная манжета его более легкая и имеет силиконовые вставки, предназначенные
для облегчения имплантации Корпус клапана изготавливается из сплава Stellite, по-
крытого пиролитическим углеродом, изогнутые створки — из графита с импрегнацией
вольфрамом и покрытием из пиролитического углерода, пришивная манжета из дак-
рона с углеродным покрытием или без него Основным осложнением данной модели
был отрыв створки К декабрю 1995 г было зарегистрировано 46 случаев отрывов
После снятия клапана с продаж корпоративные исследования компании Baxters выя-
вили причины отрывов — повышенная микропористость материала и кавитационные
разрушения Не обращая внимания на случаи отрыва створок, клапан был возвращен
на рынок, так как компания произвела несколько усовершенствований шарнирного ус-
Рис. 2.49. Разновидности углублений шарнирных механизмов двустворчатых искусственных
клапанов сердца:
а - St Jude Medical б - Carbomed.es в - Sonn B.carbon где прямой стрелкой указано направле-
ние потока в открытом положении створок изогнутыми стрелками обозначены места износа по-
крытия (по М J King at al , 1996)
____ _______________________________ 81
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
Ж
Рис. 2.50. Искусственный клапан сердца Edwards Mira и его рентгеновские изображения
(по J. Butany et al., 2003)
тройства в попытке избежать подобных осложнений. Наиболее значимыми явились
усовершенствование манжетного амортизатора ударов при закрытии створок и улуч-
шение качества контроля за процессом их изготовления. Даже при наличии информа-
ции о механической несостоятельности некоторых протезов до настоящего времени
не существует рекомендаций в пользу их профилактической замены (Podesser В. К. et
al , 1998). Протез Edwards Mira получил знак качества European СЕ в 1998 г., был ли-
цензирован в Канаде в 2000 г. и находится на стадии клинических испытаний в США.
Компания ATS Medical в 1992 г. предложила свой проект двустворчатого клапана.
Оригинальной конструктивной особенностью этого протеза было наличие специаль-
ных пазов на створках и соответствующих им полусферических выступов на внутрен-
ней поверхности корпуса клапана, в отличие от остальных двустворчатых конструкций
(см. рис. 2.43; рис 2.51). Однако этот проект не был собственной разработкой компа-
нии ATS Medical, а еще в 1984 г. рассматривался компанией Sulzer Carbomedics в каче-
стве одного из вариантов для клапанов Carbomedics Такое устройство шарнира обес-
печивает его лучшее промывание, снижает возможность стаза кровотока и, таким об-
разом, возможно сможет уменьшить частоту тромбозов и тромбоэмболических
осложнений Дополнительными характеристиками клапанов ATS Medical являются низ-
кие шумовые эффекты при закрытии и небольшие габариты. Ротационное упрочняю-
щее кольцо выполнено из титана Искусственный клапан сердца ATS Standard пред-
РИС. 2.5,. Разновидности шарнирных механизмов двустворчатых искусственных клапанов сердца:
a ATS, б Carbomedics (по J Butany et al , 2003)
82
ГЛАВА Механические искусственные клапаны сердца
назначен для интрпаннулярнои имплантации (Shiono М. et aL, 1996; West.iby S. et al.,
1996; Van Nooten G. J. et al., 1996, Aoyagi S. et al., 1997; Hasegawa M., 2000; Emery R. W.
et al., 2004; De Feo M et al., 2003). Модель ATS Standard (рис. 2 52) была и готовлена
из пиролитического углерода (корпус), створки — из графита, покрытого пиролитичес-
ким углеродом, импрегнированные 20% вольфрама по весу; материал пришивной ман-
жеты — двойной велюровый дакрон, обеспечивающий контролируемый рост тканей,
со вставками из тефлона для увеличения гибкости материала Кроме того, компания
ATS Medical выпускает модель AP-ATS (advanced performance), отличающуюся формой
пришивной манжеты и предназначенную только для супрааннулярной имплантации
(Labrousse L. М. et al , 2003). Этим клапанам свойственна повышенная возможность
визуализации из-за высокого содержания вольфрама в толще створок. Титановое уп-
рочняющее ротационное кольцо также рентгенконтрастно и его плоский контур похож
на таковой у клапанов Carbomedics. На ранних этапах наблюдения за больными искус-
ственные клапаны сердца ATS показали меньший уровень тромбозов, гемолиза и тром-
боэмболических осложнений по сравнению с другими клапанами Сообщений о струк-
турных отказах протеза не было, и он разрешен для клинического использования в США
с 2000 г
В марте 1994 г. фирма Medtronic в сотрудничестве с фирмой Carbon Implants Inc
начала клиническое испытание своей новой разработки — двустворчатого протеза
Medtronic Parallel (Ellis J. T. et al., 1996). Он был разработан для того, чтобы улучшить
гидродинамические характеристики клапана путем увеличения угла открытия створок
до 90°. Авторы надеялись, что параллельное положение створок обеспечит лучшую
гемодинамику с более низким перепадом давления на клапане. Чтобы ограничить чрез-
мерную регургитацию крови при закрытии, угол между створкой в закрытом положе-
Рис 2 52. Схема искусственного клапана сердца ATS Standard:
/ - проволочный фиксатор, 2 - титановое фиксирующее кольцо, 3 - 0Гран/ч^“'Ик/аПп0Р
открытой створки, 4 - ограничительный упор закрытой створки; 5 - створка, 6 - корпус клала-
ня ... р 7 мдпкиповка пришивном манжеты, 8 — упрочняющее тита-
на из пиролитического углерода, 7 — маркировка р гтоппки /Пп
лл.. пгЬроичрскии выступ седла в выемке створки (по
новое кольцо, 9 — шарнирный механизм — ссрери е у
www.atsmedical com).
83
ИСКУССТВЕННЫЕ К Л А П А Н Ы_ С Е Р Д Ц А ______
НИИ и корпусом был увеличен до 40 У других двустворчатых клапанов указанный угол
составляет 20 30 Но угол 40 потребовал увеличения высоты корпуса протеза По-
мимо этого клапан характеризовался относительно сложным устройством шарнирно-
го механизма который был призван предотвращать утечку крови через закрытый кла-
пан (рис 2 53)
Рис. 2.53. Схемы шарнирных механизмов двустворчатых искусственных клапанов сердца:
а — St Jude Medical- б — Carbomedics в — Medtronic Parallel (по T М Healy et al , 1998)
Из-за сложности конструкции клапан не был внедрен в кардиохирургическую прак-
тику Во время первых клинических испытаний в Испании клапан продемонстрировал
повышенную склонность к тромбозу Поэтому фирма Medtronic в 1999 г. его доработа-
ла и начала новые клинические испытания протеза, который лишен этого недостатка
Клапан получил название Medtronic Advantage (рис. 2.54) На сегодняшний день его
испытания продолжаются (Koertke Н et а!.. 2003)
1 - ~ 2 54 ИСКУССТВеННЫе клапаны се^а Advantage и St. Jude Medical:
седла корпуса 4 - 3 ~
____ р и емки бабочка- (по М С S Shu et al , 2003)
ГЛАВА 2 Механические искусственные клапаны сердца
После завершения проекта клапана Medtronic инициативная группа сотрудников
фирмы Carbon Implants Inc в 1996 г сформировнла новую компанию под названием
Medical Carbon Reseaich Institute Они разработали клапан On-Х (рис 2 55, 2.56, цв
вкладка, рис 3), подобный клапану Medtronic Parallel, содержащий удлиненный корпус,
90 угол открытия створок и угол закрытия в 40 (Chambers J et al.. 1998, Ely J et al '
1998, Walther T et al , 2000, Laczkovics A et al , 2001, Moidl R et al , 2002) Шарнирный
механизм клапана повторяет конструкцию St Jude Medical и Carbomedics — углубле-
ния в корпусе в виде «бабочек» Пиролитический углерод, использованный компанией
Medical Carbon Research Institute, не легируется кремнием, в отличие от других клапан-
ных материалов, имеющих в своем составе высокотемпературные модификации угле-
рода Материал, называющийся пиролитическим углеродом On-X carb )п, предназна-
чен для снижения тромбогенности, усиления прочности и долговечности Корпус кла-
пана сделан из On-X carbon, створки из графита с добавлением 20% вольфрама с
покрытием On-X carbon Пришивная манжета из политетрафторэтилена крепится к кла-
пану при помощи титанового упрочняющего кольца
Рис. 2.55. Аортальный искусственный клапан сердца On-Х и его рентгеновские изображения
(по J. Butany et al., 2003)
Таким образом, клапан On-X отличается уникальным строением углерода с улучшен-
ными механическими характеристиками, по сравнению с оригинальным пиролитичес-
ким углеродом, расположением «бабочки», удлиненным входным отделом седла кор-
пуса, а также тонкими створками Все модели клапана имеют супрааннулярную при-
шивную манжету и интрааннулярное кольцо корпуса Удлиненное седло корпуса
уменьшает угол закрытия створок, вследствие чего объем регургитации при закрытии
клапана снижается а скорость закрытия створок замедляется, снижая воздействие
₽ИС. 2.56. Митральный искусственный клапан сердца Ол-Х и его рентгеновское изображение,
модификация клапана On-X - Conform-X (по J. Butany et al., 20 )
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
кавитации Интрааннулярное кольцо корпуса и клапанные амортизаторы обеспечива-
ют защиту окружающих тканей от травмы. Модификация клапана On-X Conform-X
(см. рис. 2.56) имеет податливую манжету, которая подходит для различных размеров
фиброзного кольца пациента. Данные клапаны получили одобрение в США в 2001 г., в
Европе они пока недоступны
Подведем некоторый итог по преимуществам и недостаткам двустворчатых проте-
зов Основным преимуществом, позволившим занять этим клапанам лидирующее по-
ложение, является самый низкий профиль (среди механических клапанов), наличие
центрального кровотока через клапан, а также устранение «зоны малого отверстия»,
которая и ответственна за тромбозы и дисфункции поворотно-дисковых конструкций.
Однако сохраняется необходимость в пожизненной антикоагулянтной терапии. При
заклинивании одной створки вследствие тех или иных причин не происходит мгновен-
ного нарушения гемодинамики. Гидродинамические свойства двустворчатых протезов
бесспорно выше (особенно при нагрузке и тахикардии), чем у поворотно-дисковых
благодаря подготовленности створок к открытию за счет их изначального наклонного
положения. Их тонкие створки вызывают меньший шум при работе. Качество жизни у
пациентов с двустворчатыми клапанами более высокое, поэтому данные конструкции
практически вытеснили из кардиохирургии поворотно-дисковые протезы.
ИСТОРИЯ ПРОИЗВОДСТВА ОТЕЧЕСТВЕННЫХ
МЕХАНИЧЕСКИХ ИСКУССТВЕННЫХ КЛАПАНОВ СЕРДЦА
В 1962 г. сотрудник отделения приобретенных пороков сердца ИССХ АМН СССР
Г. Т. Голиков предложил свой вариант трехлепесткового тефлонового протеза для ле-
чения аортальной недостаточности — рис. 2.57 (Голиков Г. Т. и др., 1968). Протез вы-
годно отличался от других трехлепестковых клапанов наличием тонкого проволочного
каркаса с изгибами в виде спирали в области искусственных комиссур. Это придавало
клапану необходимую упругость и прочность и делало протез соответствующим меня-
ющемуся размеру корня аорты в течение сердечного цикла. Этот протез клапана в
1962 г впервые в мире был имплантирован в легочную позицию в Институте сердечно-
сосудистой хирургии им. А. Н. Бакулева В. И. Бураковским (Бураковский В. И. и др.,
1963) и в 1964 г в аортальную позицию - С. А. Колесниковым (Колесников С. А. и др.,
1964) О разработанной модели трехлепесткового протеза на жестком каркасе из сталь-
ной проволоки для замены митрального клапана в 1962 г. сообщил Ю. Н. Кривчиков
Рис. 2.57. Лепестковые клапаны сердца Ю. Н. Кривчикова (по Ю и к
нова (по Б. В. Петровскому и др., 196б7 Кривчикову, 1964) и Г. Т. Голи-
86 ------------’
ГЛАВА 2. Механические искусственные клапаны сердца
(см рис. 2.57). Этот клапан впервые был имплантирован Н М. Амосовым (рис 2 58) в
митральную позицию в 1962 г. (Амосов Н. М. и др., 1963) В 1965 r Н М. Амосов и
A. Starr независимо друг от друга предложили обшивать седло механических клапан-
ных протезов пористой синтетической тканью в целях профилактики тромбоэмболи-
ческих осложнений (Амосов Н М. и др., 1965; 1970).
В нашей стране работа над проблемой протезирования клапанов сердца стала ак-
тивно проводиться с 1962 г в НЦССХ им. А. Н. Бакулева. К тому времени в клиниче-
ской практике имелись лишь единичные попытки имплантации механических искусст-
венных клапанов сердца (в основном зарубежного производства) больным с пороками
сердца. Используемые при этих операциях клапанные протезы не всегда удовлетворя-
ли требованиям, предъявляемым к подобным конструкциям. В связи с этим перед уче-
ными СССР была поставлена задача разработать более совершенные модели искусст-
венных клапанов сердца и внедрить их в клиническую практику.
В 1961 г. ученик академика Б. В. Петровского Г. М. Соловьев привез из США шаро-
вой клапан сердца типа Starr-Edwards. Б. В. Петровский при встрече с министром сред-
него машиностроения Е. П. Славским спросил его, можем ли мы изготовить подобный
отечественный Кирово-Чепецкий химический завод располагал передовыми, наукоем-
кими технологиями, в том числе уникальным по тому времени производством фторо-
пластов, которые наиболее пригодны для имплантации. Поэтому в Москву были выз-
ваны главный инженер химзавода Б. П. Зверев и руководитель экспериментальной ме-
ханической лаборатории С В Михайлов (рис. 2.59). Б. П. Зверев (1915-1966) к тому
времени был известен как руководитель работ по созданию и освоению в промышлен-
ности (Дзержинск) отечественного органического стекла, нашедшего применение в
годы Великой Отечественной войны для производства прозрачной авиационной бро-
ни, а также материалов для космического ракетостроения (Кирово-Чепецк). Рассмот-
рев импортное изделие, С. В. Михайлов сказал: «... Людьми сделано, и мы сделаем».
Таким образом, была поставлена задача создания и внедрения в практику отечествен-
ных протезов клапанов сердца. В дальнейшем лаборатория была преобразована в Спе-
циальное конструкторское бюро медицинской тематики Кирово-Чепецкого химическо-
го комбината им. Б. П. Константинова.
Первым был создан митральный шаровой протез МКЧ-01, имеющий клепаный кар-
кас с шестью сомкнутыми ограничительными стойками (см. рис. 2.63). В качестве ма-
териала каркаса использовали нержавеющую сталь 12Х18Н10Т, запирающего элемен-
та — резину на основе каучука СКТВ-1 (плотность 1,06-1,1 кг/м3, приблизительно рав-
ная плотности крови), пришивной манжеты — фторопласт-4, переработанный в
трикотажную ткань Впервые протез был имплантирован в НИИ клинической и экспе-
Рис 2 58 В И. Бураковский, С. А. Колесников, Н. М. Амосов
______________________________________________ 87
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
Рис 2.59. В И. Шумаков, Б. П. Зверев, С. В. Михайлов (по материалам музея СКБ медицинской
тематики Кирово-Чепецкого химкомбината)
риментальнои хирургии Минздрава РСФСР в 1963 г. профессором Г М Соловьевым
21-летней больной Лиде Колесниковой, которая многие годы не имела возможности
двигаться из-за сердечной недостаточности Результаты был успешным Первой в СССР
пациентке с шаровым протезом было предложено остаться в Москве, где она длитель-
ное время работала в библиотеке института под постоянным присмотром врачей К
1968 г появились модернизированные шаровые протезы МКЧ-36 для митральной по-
зиции Металлические детали стали изготавливаться из титановых сплавов ВТ-1-0,
корпус был объединен с ограничительными стойками в одну деталь без применения
сварки, а количество стоек было уменьшено до четырех Ограничительные стойки ста-
ли изготавливаться профильными, то есть имеющими форму капли в сечении, что зна-
чительно уменьшало их сопротивление току крови, снижало завихрение и турбулент-
ность потока Последнее очень важно с точки зрения уменьшения опасности тромбо-
образования Причем стоики ограничителен хода шара не были сомкнуты у его вершины
для предотвращения образования тромбов на месте их перекреста
В наиболее совершенной модели митрального шарового протеза МКЧ-25
(цв вкладка, рис 1), разработанной в 1965 г с серийным производством с 1967 г,
ограничители ода были сделаны с таким расчетом, чтобы в открытом положении се-
чение потока крови между седлом и шаром равнялось сечению гидравлического от-
верстия клапана Общая высота протеза была уменьшена по сравнению с МКЧ-36 Была
увеличена пористость фторопластовой ткани, из которой изготавливалась пришивная
манжета Размер пор стал равняться 0,5 мм Это изменение было основано на экспе-
риментальных данных, показавших, что пришивная манжета протеза с порами большо-
го диаметра (0,5-1 мм) быстрее прорастает соединительной тканью, а рубец в этих
случаях становится более прочным (Braunwald N S et al , 1967, 1971) Поверхность
такой пришивной манжеты после врастания становилась более гладкой и на ней от-
кладывалось меньше тромбов, чем на соединительнотканной поверхности пришивной
П0РЭМИ После^няя модель МКЧ-25 выпускалась трех раз-
меров (МКЧ-1-25, МКЧ-2-25, МКЧ-3-25), что давало возможность индивидуально подби-
Королев ГГидр^эО) °ПТИМаЛЬНЫЙ П0 велич^е протез (Добротин С С и др , 1990.
Аортальный искусственный клапан сердца АКЧ-02 (рис 2 60 цв вкладка оис 1)
0азрз60™„„ . 1965г с серийным „роиз.одетаом с !?67 г. без обши1Тв„у,реинв-
------ 88 —
ГЛАВА 2 Механические искусственные клапаны сердца
го гидродинамического отверстия седла был снабжен специальна ми обратными сто-
пами для уменьшения размера шара, предотвращения его заклинивания, увеличения
проходного сечения клапана (по аналогии с искусственным клапаном сердца Smeloff-
Cutter) Данный клапан выпускался четырех типоразмеров — АКЧ-1-02, АКЧ-2-02, АКЧ
3-02, АКЧ-4-02 (Доброва Н Б и др , 1967, Цукерман Г И и др , 1984)
В 1968 г появился усовершенствованный клапан для аортальной позиции — АКЧ-06
с серийным производством с 1969 г (см. рис 2.60) Шар клапана изготавливался из
силиконовой резины, а корпус вместе с ограничителями хода шара — из титанового
сплава ВТ-1-0. Три упора препятствовали заклиниванию шара в седле, что давало воз-
можность максимально увеличивать диаметр гидравлического отверстия седла проте-
за при сохранении заданного наружного его размера с соотношением диаметра шара
к диаметру сечения гидравлического отверстия клапана 0,8-0,95 На корпусе клапана,
полностью покрытом фторопластовой тканью, имелся паз, к которому крепилась при-
шивная манжета Ограничители хода шара в виде трех изогнутых стоек, расположен-
ных под углом 120° по отношению друг к другу, составляли единое целое с корпусом
протеза Наличие трех стоек давало возможность хирургу при замене клапана аорты
подшивать протез так, чтобы каждая ограничительная стойка располагалась по линии
одной из комиссур удаленных полулунных створок аортального клапана При этом ис-
ключалась возможность расположения одной из стоек у устья коронарной артерии, что
могло приводить к нарушениям коронарного кровообращения Подобно митральным
протезам, стойки ограничителей хода шара не были сомкнуты друг с другом в области
вершины Это уменьшало вихреобразование и устраняло опасность возникновения
тромбов на ограничителях хода Высота стоек ограничителей хода шара была рассчи-
тана так, чтобы в положении открытия клапана сечение потока крови между корпусом
и шаром равнялось гидравлическому отверстию седла. Пришивная манжета состояла
из двух слоев ткани, изготовленной из фторопласта-4 Она имела форму усеченного
конуса, высота которого была достаточной для наложения швов и была выбрана таким
образом, чтобы при имплантации аортального клапана в субкоронарную позицию ее
верхний край был на несколько миллиметров ниже устья коронарных артерий. Конус-
ная форма манжеты предохраняла также от плотного облегания стоек ограничителей
хода шара стенками восходящей аорты или легочной артерии и улучшала условия про-
хождения потока крови между шаром и внутренней поверхностью сосуда. Таким обра-
зом, изготавливался комплект шаровых аортальных искусственных клапанов сердца че-
тырех размеров (АКЧ-1-06, АКЧ-2-06, АКЧ-3-06, АКЧ-4-06) с обшитым корпусом
В последующем была произведена дальнейшая модификация аортальных шаровых
протезов Она заключалась в том, что стойки ограничителя хода шара стали изготав-
Рис. 2.60. Аортальные искусственные
клапаны сердца АКЧ-02, АКЧ-06, АКЧ-15
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
ливать каплевидной формы Был увеличен ход шара и сокращена высота конусной
манжеты в соответствии с экспериментальными данными С W. Lillehei и соавт. (1965),
показавшими, что подобная модернизация искусственного клапана сердца способствует
снижению сопротивления протеза потоку крови. Кроме того, был увеличен размер пор
ткани манжеты до 0,5 мм.
Другая модификация аортального протеза АКЧ-15 отличалась профилированным
корпусом (см. рис. 2.60)
В 1964 г. Г. М. Соловьев впервые имплантировал шаровой искусственный клапан
сердца в аортальную позицию. В этом же году в Институте сердечно-сосудистой хи-
рургии им. А. Н. Бакулева такая операция была сделана Г. И. Цукерманом — рис. 2.61
(Колесников С. А. и др., 1964; Шумаков В. И., 1965; Цукерман В. И. и др., 1971).
Одним из пионеров имплантации шаровых механических искусственных клапанов
сердца в нашей стране в 60-х гг. XX столетия стала и кафедра госпитальной хирургии
Ленинградского медицинского института им. акад. И. П. Павлова, возглавляемая Ф. Г. Уг-
ловым, который совместно с профессором В. Н. Зубцовским (рис. 2.62) в 1964 г. имп-
лантировал шаровый искусственный клапан сердца в митральную позицию (Углов Ф. Г.
и др. 1966; 1967; Зубцовский В Н., 1970).
В процессе работы было создано несколько различных модификаций шаровых ис-
кусственных клапанов сердца. Все созданные протезы по методу своего крепления
разделялись на две группы. К одной из них относились протезы с приспособлением
для бесшовной механической фиксации, к другой — искусственные клапаны, крепле-
ние которых к тканям фиброзного кольца осуществлялось швами за пришивную ман-
жету (цв. вкладка, рис. 1).
Первоначально искусственные клапаны сердца с бесшовной фиксацией были прин-
ципиально схожи с клапанами Magovern-Cromie. В НЦССХ им. А. Н. Бакулева коллек-
тив под руководством В. И. Шумакова и Е. А. Иванова разработал более совершенную
модель подобного протеза КМ (см. цв. вкладку, рис. 1). Для практического примене-
ния изготавливались пять типоразмеров искусственных клапанов сердца с устройством
для их механической фиксации (КМ-1, КМ-2, КМ-3, КМ-4, КМ-5). Этим обеспечивалась
возможность индивидуального подбора оптимального размера протеза (Шумаков В. И.
и др., 1966). Следует отметить, что шаровые протезы с приспособлением для бесшов-
ной фиксации применялись для имплантации больным с различными пороками серд-
ца с 1964 г. в течение непродолжительного периода времени (Петровский Б В. и др.,
1966; 1972).
Рис. 2.61. Г. М. Соловьев и Г. И. Цукерман
ГЛАВА 2. Механические искусственные клапаны сердца
В НЦССХ им А. Н. Бакулева совместно с Кирово-Чепецким химкомбинатом (глав-
ный инженер Б. П. Зверев, начальник СКБ МТ Ю. А. Перимов) был разраГ этан искусст-
венный клапан сердца, напоминающий зарубежный протез Barnard-Goosens, с запи-
рающим элементом не в форме шара, а в форме двояковыпуклой линзы Корпус кла-
пана в виде кольца и ограничители хода запирающей части протеза, (оединенные в
области его вершины кольцом, изготавливались из инертной легкой пластмассы (фто-
ропласт-3) или титановых сплавов. С наружной поверхности на корпусе клапана име-
лась канавка, в которой крепилась пришивная манжета. Запирающую функцию выпол-
няла двояковыпуклая линза, причем поверхность линзы, обращенная к седлу протеза,
была менее выпукла, чем противоположная. Такая различная кривизна поверхностей
была выбрана для улучшения обтекания линзы потоком. Посередине поверхности, об-
ращенной к вершине ограничителей хода и перпендикулярно к касательной, проведен-
ной через нее, имелась цилиндрическая ось. Своим свободным концом она была встав-
лена в кольцо ограничителей хода подвижной части протеза. Назначение оси — пре-
пятствовать перекосу линзы внутри ограничителя хода подвижной части протеза.
Подвижная часть протеза изготавливалась из силиконовой резины Пришивная ман-
жета протеза была аналогична по своему устройству и выполнялась из тех же матери-
алов, что и манжеты шаровых клапанов. Указанный протез имел малый вес и объем.
Кроме того, в СКБ МТ выпускались еще два протеза с нешаровыми запирающими
элементами — полушаровой МКЧ-27 (рис. 2.63), разработанный в 1965 г с серийным
производством с 1967 г., конструкция которого была предложена Н. М. Амосовым и
Ю. Н. Кривчиковым (Кривчиков Ю. Н., 1965), и чечевицеобразный МКЧ-29 (см. рис.
2.63), разработанный в 1966 г. с серийным производством в 1967 г. Следует отметить,
что вентильные искусственные клапаны сердца с запирающими элементами не в фор-
ме шара соприкасались с корпусом протеза одним и тем же пояском контакта, в отли-
чие от шара, соприкасающегося с корпусом во время каждого цикла разными точками
своей поверхности. В шаровом протезе площадь контакта шара с корпусом составляет
приблизительно сотую часть его поверхности Из этого следует, что запирающие эле-
менты, имеющие постоянный поясок соприкосновения с корпусом протеза, могут раз-
рушаться в 100 раз быстрее, чем шар (Шумаков В. И. и др., 1966). Из-за повышенного
гидравлического сопротивления и тромбообразования выпуск данных конструкций был
прекращен (Константинов Б. А. и др., 1985).
В 70-х гг. XX в. под руководством начальника СКБ МТ Ю. А Перимова и начальника
лаборатории искусственных клапанов сердца В. М. Картошкина (рис. 2.64) начались
Рис. 2.62. ф. Г. Углов и В. Н. Зубцовский
Рис. 2.63. Митральные искусственные клапаны сердца МКЧ-01, МКЧ-27 и МКЧ-29 (по материалам
музея СКВ медицинской тематики Кирово-Чепецкого химкомбината)
работы по созданию клапанов с поворотным запирающим элементом Первые такие
клапаны оригинальной конструкции (рис. 2.65), разработанные в 1974 г. с серийным
производством с 1975 г., имели запирающий элемент в виде плоского диска из фто-
ропласта (АКЧ-20) или пиролитического углерода (АКЧ-21). Однако клинические испы-
тания протезов были неудачны из-за повышенного износа запирающего элемента.
Разработанный в это время отечественный пиролитический углерод — углеситал
УСБ позволил создать более совершенную конструкцию клапана с дисковым выпукло-
вогнутым поворотным запирающим элементом из углеситала — Л икс-2 (рис. 2.66;
цв. вкладка, рис. 2). Клапан был разработан в 1982 г. с серийным производством с
1985 г. Клапан Ликс-2 получил широкое распространение благодаря малой массе, удов-
летворительным гемодинамическим характеристикам и низкому профилю. На настоя-
щее время имплантировано более 20000 таких протезов. Воплощенные в конструкции
клапана Ликс-2 технические решения обеспечили улучшение тромборезистентных и
гемодинамических характеристик, увеличили надежность и долговечность клапанов
(Горшков Ю В и др., 1984).
Мелкозернистая структура изотропного пиролитического углерода — углеситала УСБ
позволила получить полированную поверхность диска высокого класса чистоты с хо-
рошими тромборезистентными свойствами Корпус с ограничителями хода диска вы-
Рис. 2.64. Ю. А. Перимов и в. М. Картошкин
V — " — ___
ГЛАВА 2. Механические искусственные клапаны сердца
Рис. 2.65. Аортальные искусственные клапаны сердца АКЧ-20 и АКЧ-21 (по материалам музея
СКБ медицинском тематики Кирово-Чепецкого химкомбината)
полнен из единой заготовки технически чистого титана, обладающего высокой биоло-
гическом инертностью и хорошими физико-механическими показателями. Высокий
класс чистоты поверхности искусственного клапана сердца с повышенными тромборе-
зистентными свойствами достигался оригинальной методикой электрополировки ко-
торая разработана в СКБ МТ Для каждой позиции имплантации выпускается по 6 раз-
меров клапанов Ликс-2 с посадочными диаметрами в пределах 20-30 мм (с шагом 2 мм)
для аортальной позиции и 26-36 мм (с шагом 2 мм) — для митральном Клапаны сер-
дца имеют две конструкции пришивных манжет интрааннулярную — для аортальной
позиции и супрааннулярную — для митральной. Манжеты выполнены из полиэфирно-
го основовязанного полотна с пористостью, необходимой для прорастания соедини-
тельной тканью в процессе вживления клапана. В конструкции использована ориги-
нальная форма ограничителя хода диска со стороны выхода клапана' места крепления
ограничителя хода к корпусу вынесены в зону большого гидравлического отверстия с
более благоприятными условиями обтекания.
Запирающий элемент в клапане Ликс-2, который открывается до 70 (в закрытом
положении — 0°) выполнен в виде выпукло-вогнутого диска, обращенного вогнутос-
Рис. 2.66. Искусственный клапан сердца Ликс-2: дисковый запирающий элемент, корпус, аорталь-
ная пришивная манжета, аортальный и митральный протезы в сборе (по материалам
музея СКБ медицинской тематики Кирово-Чепецкого химкомбината)
93
тью к потоку. Профиль диска выбран таким, чтобы обеспечить наиболее благоприят-
ное распределение сдвиговых напряжений в потоке крови и наиболее полное и быст-
рое открытие и закрытие клапана. Кроме того, наличие выпукло-вогнутого диска по-
зволило перенести ось его поворота к центру гидравлического отверстия и, тем са-
мым, достигнуть более равномерного разделения набегающего потока крови.
Конструкция узла поворота обеспечивает свободное вращение запирающего элемен-
та вокруг его центральной оси, чем обеспечивается равномерный износ диска (Горшков
Ю В. и др., 1984). Анализ отдаленных (более 20 лет) результатов клинического приме-
нения клапанов Ликс-2 подтверждает надежность конструкции (Зорин А. Б. и др., 1988;
Константинов Б. А. и др., 1989; Вязников В. А. и др., 2005).
Становление отечественных искусственных клапанов сердца в России связано с
именем Н. Б. Добровой (1926-2001), родившейся в Москве в семье потомственных
врачей. После окончания МОЛГМИ им. И. М. Сеченова она училась в аспирантуре и
преподавала на кафедре топографической анатомии и оперативной хирургии. Она ра-
ботала под руководством В. П. Демихова, Б. А. Константинова, С. А. Колесникова, а с
1960 г. возглавила первую в стране лабораторию протезирования сосудов Института
грудной хирургии. Н. Б. Доброва, автор 27 изобретений, из которых 10 относятся к
искусственным клапанам сердца, руководила в течение 40 лет работой лаборатории
(переименованной позднее в лабораторию по применению полимеров в медицине
Института сердечно-сосудистой хирургии). Основными исследовательскими направле-
ниями лаборатории являлись разработка алло- и ксенобиопротезов, механических ис-
кусственных клапанов сердца, методов и оборудования для их испытаний, исследова-
ние их свойств и экспериментально-клиническое обоснование их применения в карди-
охирургии. разработка и испытание устройств для вспомогательного кровообращения,
повышение тромборезистентности поверхностей искусственных органов и полимер-
ных изделий для сердечно-сосудистой хирургии. Все отечественные искусственные
клапаны сердца проходили путь от идеи до серийного выпуска при деятельном учас-
тии профессора Н. Б. Добровой (рис. 2.67).
В эти же годы в лаборатории полимеров НЦССХ им. А. Н. Бакулева под руковод-
ством Н. Б. Добровой и главного инженера московского завода «Эмитрон» Н. А. Иофи-
са (см. рис. 2.67) велась разработка альтернативной модели клапана с поворотным
диском — Эмике (рис. 2.68).
Коллектив авторов в составе А. С. Букатова, Р. А. Кеворковой, А. А. Фадеева,
А. В. Агафонова разработал клапан Эмике, который в течение 15 лет был самым попу-
Рис. 2.67. Н. Б. Доброва и Н. А. Иофис
94
ГЛАВА 2 Механические искусственные клапаны сердца
Рис. 2.68. Искусственный клапан сердца Эмике
лярным протезом у российских кардиохирургов. Его серийное производство было на-
чато в 1983 г. Диски для клапанов Эмике поставляло научно-производственное
объединение «Элма» (г. Зеленоград), на котором была разработана технология произ-
водства углеситала УСБ медицинского назначения специально для искусственных кла-
панов сердца. Материал обладал кристаллической структурой графита, а его надмоле-
кулярное строение обеспечивало высокую плотность, прочность и износоустойчивость
(Доброва Н. Б. и др., 1984).
Отличительной особенностью клапанов с поворотным диском Эмике является его
высокие показатели долговечности при хорошей гемодинамической эффективности.
По расчетам Института машиностроения АН СССР клапан Эмике может работать бо-
лее 100 лет. Проверки на стендах в условиях ускоренных испытании подтверждают эти
расчеты.
За весь период применения клапанов сердца не наблюдалось ни одного случая от-
каза клапана из-за его механической дисфункции. Официальная гарантия — 20 лет
Конструкция клапана имеет ряд принципиальных особенностей, защищенных более чем
тридцатью авторскими свидетельствами и патентами. Так, например, запирающий эле-
мент в клапане во время работы медленно вращается вокруг центра, что исключает
наличие локальных мест износа. Бесшумность работы клапана в организме человека
обеспечивается акустическим зазором дужки. Манжета клапана изготовлена из уни-
кального углеродосодержащего материала Витлан Фирма располагает запатентован-
ной технологией внедрения углерода в поверхность титанового корпуса клапана, что
также способствует улучшению тромборезистентных свойств выпускаемых фирмой
клапанов.
Корпус клапана Эмике изготавливается из чистого титана вакуумной выплавки ме-
дицинского назначения, специально разработанного для искусственного клапана сер-
дца. Дополнительная технологическая обработка улучшала его физико-механические
свойства и такие показатели, как биологическая инертность и тромборезистентность
Для изготовления манжет используется основовязаное лавсановое полотно. Для при-
шивных манжет клапанов была подобрана пористость полотна, обеспечивающая быст-
рое и надежное прорастание в процессе вживления клапана. Выпускается четыре мо-
дели клапанов Эмике семи типоразмеров Модель Эмике — цельноштампованный кла-
пан с выпукло-вогнутым диском, расположенным между ограничителями хода скобой
и стойкой; модель Эмикс-Н — с незамкнутой скобой большого ограничителя хода, что
обеспечивает бесшумную работу в организме; модель Эмикс-ДВ — с диском двояко-
вогнутой формы для лучших условий обтекания кровью; модель Эмикс-Н-ДВ объеди-
няет преимущества незамкнутой скобы и двояковогнутого диска (Букатов А С и др ,
1987; Цукерман Г. И и др., 1990; Фаминский Д О., 1991). Для аортальной позиции
выпускается три посадочных размера клапана — 21, 23, 25 мм, для митральной че-
тыре: 25, 27, 29, 31 мм. Манжеты для различных позиции индивидуальны угол откры-
----------------------------------------------------95
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
тия диска 60 Предусматривается возможность вращения корпуса клапана относитель-
но манжеты при необходимости точной ориентации клапана по месту
Актуарная выживаемость больных к 5-му году после операции (по данным НЦССХ
им А Н Бакулева) при митральном протезировании составляла 92,5°ь, при аорталь-
ном _ 94,3°о, при двухклапанном — 86,6% (Кайдаш А. Н. и др., 1985; Бураковский В. И
и др., 1986, Зорин А Б. и др., 1987; Быков В. И , 1994 ) Оригинальная модель клапана
Эмике применялась в исследованиях и экспериментах, проводимых в НИИТиИО
М3 РФ, по созданию искусственного сердца. Государство высоко оценило успешную
разработку отечественных клапанов с поворотно-дисковым запирающим элементом, —
коллективы разработчиков клапанов Ликс-2 и Эмике в 1986 г. были удостоены премии
Совета Министров СССР.
С 1991 г разработчики клапана Эмике организовали новое предприятие Роскардио-
инвест (Москва), на котором начали производство модификации клапана Эмикс-Н
(с незамкнутой скобой большого ограничителя хода) — протез Микс (рис. 2.69;
цв. вкладка, рис. 2).
В настоящее время в ведущих клиниках России и ближнего зарубежья имплантиро-
вано около 25000 искусственных клапанов сердца Микс. Корпус и ограничители хода
диска представляют единое целое и изготавливаются из единой заготовки титана (от-
сутствуют сварные соединения). В клапанах сердца Микс применяется титановый кор-
пус, углеродный диск и манжета Используемое для пришивнои манжеты основовяза-
ное углеродное полотно Витлан обладает инертностью, тромборезистентностью и спо-
собностью обеспечивать быстрое прорастание тканью. В модели Микс-1 применяется
пришивная манжета из полиэфирных нитеи Клапан Микс характеризуется малым вре-
менем открытия (не более 0,04 с) и закрытия (не более 0,025 с). Углеродный диск имеет
выпукло-вогнутую форму и открывается на 70° для обеих позиций. Выпускается 10 ти-
поразмеров клапанов, причем пять — для аортальной позиции (19, 21, 23, 25, 29 мм) и
пять — для митральной (23, 25, 27, 29, 31 мм).
Также следует упомянуть и о протезе Элмак (рис. 2.70), который какое-то время
выпускался московским НПО «ЭЛМА» для митральной, аортальной и трикуспидальной
позиций Клапан Элмак являлся российским аналогом клапана Omnisciense и представ-
юи малогабаритную конструкцию без ограничительных элементов в зоне про-
ходного отверстия, имел дисковый запирающий элемент, изготовленный из монолит-
ного пиролитического углерода Выпускалось 6 типоразмеров данного клапана (21, 23,
25, 27, 29, 31 мм), угол открытия достигал 70° Однако из-за большого числа тромбо-
зов он был снят с производства (Фаминский Д. О. и др., 1994)
Отличительные особенности перечисленных клапанов Ликс-2, Эмике и Элмак пред-
ставлены на рис 2.71 и 2.72
Рис. 2.69. Искусственный клапан сердца Микс
ГЛАВА 2 Механические искусственные клапаны сердца
Рис. 2.70. Искусственный клапан сердца Элмак (из музея НЦССХ им. А. Н. Бакулева РАМН)
Рис. 2.71. Схемы дисковых искусственных клапанов сердца Ликс-2, Эмике, Элмак (I — митраль-
ный, II - аортальный); по Д. О. Фаминскому и др., 1994
Рис. 2.72. Схемы каркасов дисковых искусственных клапанов сердца Ликс-2, Эмике, Элмак
(по Д. О. Фаминскому и др-, 1994)
_________________________________________97-----------------------
4 Искусственные клапаны сердца
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
Отметим положительно зарекомендовавший себя поворотно-дисковыи протез Пла-
никс разработанный белорусским НПО «Планар». Сотрудничество с кардиохирургией
«Планар» начал в 1980 г, когда по заказу кардиохирургов (Островский Ю П.) присту-
пил к изготовлению из специальных сплавов облегченных каркасов для биологических
клапанов сердца.
В 1983 г. НПО «Планар», используя свой опыт обработки оптических линз, техноло-
гию прецизионной обработки кристаллического углерода (стеклоуглерод, углеситал),
разработал и начал изготавливать и поставлять российским фирмам запирающие эле-
менты для искусственных клапанов сердца. В 1988 г. завод Электронмаш НПО «Пла-
нар» приступил к разработкам новых конструкции искусственных клапанов сердца.
К марту 1990 г первая партия клапанов Планикс прошла полные циклы биологических,
стендовых и медицинских испытаний в лучших клиниках Белоруссии, и клапан был реко-
мендован к серийному производству и клиническому применению (рис. 2.73). В 1991 г.
Белорусский НИИ кардиологии совместно с концерном «ПЛАНАР» внедрили в клини-
ческую практику искусственный клапан сердца «Планикс», который был имплантиро-
ван более чем 2 тыс пациентам с клапанными пороками сердца (Островский Ю. П.
1996, 1998; Чеснов Ю. М., 1996).
Клапан Планикс может использоваться для имплантации как в митральную, так и в
аортальную позиции. Выпускается пять типоразмеров аортальных (19, 21,23, 25, 27 мм)
и пять — митральных (23, 25, 27, 29, 31 мм) клапанов. Материал корпуса — титановый
сплав ВТ-16, запирающего элемента (выпукло-вогнутого диска) — углеситал, пришив-
ной манжеты — полиэфирная велюровая ткань. Угол открытия диска аортальных кла-
панов — 73°, митральных — 68°. Обтекаемая форма корпуса и диска, отсутствие огра-
ничительных элементов, выступающих в просвет протеза (аналогично клапанам Элмак
и Omniscience), обеспечивают низкое сопротивление кровотоку и малую турбулентность
Поверхности изготавливаются с высокой точностью и полируются. В конструкцию кор-
пуса введены элементы, обеспечивающие устойчивое вращение диска во время рабо-
ты для его равномерного износа На материале пришивной манжеты нанесены контра-
стные метки для удобства ориентации во время имплантации. При необходимости воз-
можно проворачивание корпуса в манжете.
В СССР разработка двустворчатых искусственных клапанов сердца началась в
СКБ МТ на Кирово-Чепецком химкомбинате с 1981 г Коллективом авторов (Евдокимо-
вым С В , Мельниковым А. П , Горшковым Ю В., Нелюбиным А. А , Картошкиным В М
и др.) была разработана оригинальная конструкция протеза Карбоникс в котором ис-
пользовались уникальные возможности отечественного пироуглерода УСБ. Опытная
Рис. 2.73.
Ю. П. Островский и схема искусственного
скому и др., 1998)
клапана сердца Планикс-М (по Ю. П. Остров
98
ГЛАВА 2 Механические иск•, > таенные хлопаны сердца
партия для клинического применения искусственного клапана сердца Карбоникс-1
(рис. 2.74; цв. вкладка, рис. 3) изготовлена в 1987 г. В 1990 г после всесторонних ис-
следований в лабораторных условиях и в клиниках клапаны Карбоникс-1 получили раз-
решение на клиническое применение и с этого же года начато их серийное производ-
ство (Доброва Н. Б. и др., 1989).
Корпус клапана и створки выполнены из углеродных материалов. В закрытом со-
стоянии створки находятся под углом 30-35° к плоскости корпуса, а в открытом — 85
На основании детальных аэродинамических исследований выбран выпукло-вогнутый
профиль створки (выпуклая сторона обращена в сторону центрального потока), при-
чем корпус выполнен в виде криволинейного диффузора В конструкции впервые реа-
лизован новый оригинальный принцип крепления запирающих элементов, который пре-
дусматривает возможность вращения створок вокруг центральной оси корпуса под дей-
ствием на них потока крови. Такое вращение створок, по мнению авторов, снижает
опасность тромбоза клапана и тромбоэмболических осложнений за счет постоянного
изменения положения локальных зон отрыва потока крови и вихреобразования отно-
сительно седла. Более того, струя крови, проходящая через клапан, поворачиваясь в
течение каждого цикла, обеспечивает равномерное омывание потоком крови всех ок-
ружающих структур сердца. Это дополнительно снижает риск тромбоза, адгезии тром-
боцитов и эритроцитов, а также образование аневризм (Доброва Н. Б. и др., 1989).
Клапаны Карбоникс-1 имеют две конструкции пришивной манжеты: интрааннуляр-
ную — для аортальной позиции и супрааннулярную — для митральной Пришивные ман-
жеты выполнены из полиэфирного основовязаного полотна с пористостью, необходи-
мой для прорастания в процессе вживления. Для каждой позиции имплантации выпус-
кается по 6 типоразмеров клапанов Карбоникс-1 с посадочными диаметрами по
пришивной манжете 20-30 мм (с шагом 2 мм) для аортальной позиции и 24-34 мм
(с шагом 2 мм) — для митральной.
Технические решения конструкции клапана защищены авторскими свидетельства-
ми и патентами РФ, а также патентами США, Японии и Европейским патентом. С 1990 г.
клапан экспортируется в 17 стран Европы, Африки, Азии и Америки под торговой мар-
кой Jyros. В настоящее время имеется положительная информация о 3500 протезах,
имплантированных в 62 центрах мира. Наибольший опыт применения клапанов Jyros
накоплен в Англии, где в шести центрах установлено более 400 протезов. Актуарная
выживаемость к 5-му году составила 89%, а 85% пациентов улучшили свое состояние
по ФК NYHA (Вязников В. А. и др., 2005; Суханов С. Г. и др., 2005)
Рис. 2.74. Искусственный клапан сердца Карбоникс-1 (аортальный и митральный) и схема враще-
ния его створок (по материалам музея СКБ медицинской тематики Кирово-Чепецкого
химкомбината)
---------------------------------------------------------- 99 ----------
4*
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
В 1996 г искусственным клапан сердца Карбоникс-1 получил Сертификат соответ-
ствия России и началось его широкое применение Однако было отмечено несколько
случаев разрушения корпуса и тромбозов клапанов в различных кардиоцентрах При-
чиной этих осложнении по всей видимости, была недостаточная прочность пирогра-
фита ПГИ, из которого изготавливался корпус клапана, и неадекватная антикоагулянт-
ная терапия. В настоящее время проведена модернизация клапана Карбоникс-1 (Гор-
шков Ю. В. и др., 1998).
С 1993 г. группа разработчиков клапанов Ликс-2 и Карбоникс-1 под руководством
С. В. Евдокимова и А П Мельникова организовала в Пензе новое предприятие ЗАО
НПП «МедИнж», оснащенное современным высокоточным, компьютеризированным
оборудованием. Помещения высокого класса чистоты позволили выпускать первый в
России стерильный двустворчатый клапан из пиролитического углерода — Мединж
В настоящее время этот протез признан лучшим отечественным клапаном мирового
класса и широко применяется в кардиоцентрах России и стран СНГ. За основу конст-
рукции был взят клапан Карбоникс-1 Учитывая вновь открывшиеся технологические
возможности, в геометрию створок и корпуса были внесены существенные измене-
ния, которые позволили улучшить структуру прямого потока крови, повысить быстро-
действие клапана, снизить объем регургитации Клапаны прошли технические испыта-
ния в установленном ГОСТом порядке и с 1994 г начались их клинические испытания
Однако в течение первых шести месяцев клинических испытании было зафиксиро-
вано несколько случаев тромбоза протезов митрального клапана. Наиболее вероятны-
ми их причинами были недостаточное промывание узлов крепления створок в корпусе
клапана и активное наползание соединительной ткани — паннуса, приводящее к за-
клиниванию створок, ограничению их подвижности и, как следствие, к нарушению струк-
туры потока крови и активации процесса тромбообразования.
С целью снижения риска тромбозов протезов в 1995 г. была произведена модерни-
зация конструкции клапана, названная Мединж-2 (рис 2.75; цв. вкладка, рис. 3). Впер-
вые в мире была реализована концепция создания регургитационного потока в виде
направленных струй, которые омывают участки протеза, опасные для зарождения тром-
бов (Евдокимов С В. и др., 2004). Был изменен вид шарнира, с помощью которого
створки крепятся в корпусе Новый шарнир близок по виду к шарниру Гука, в котором
зацепление деталей производится выступами. Благодаря этому образуются зазоры в
шарнире, через которые кровь омывает все его поверхности, причем зазор с одной
стороны створки выполнен большим а с другой — меньшим благодаря чему создают-
ся две струи крови, направленные в противоположные стороны и способствующие фор*
мированию закрученного потока крови вблизи закрытых створок На плоскости смыка-
ния створок выполнены дополнительные зазоры для промывания обратным потоком
РИС- 2 75 мХХЬ^аХУСтСмТВеИНЬ,Й •‘лапан сеРДЧа Мединж-2 „ схемы его модификаций:
докимову И др., 2004°И М£,НЖеТ°И И Ме«ин*‘2 с супрааинулярнои манжетой (по С. В. Ев
100 -----
ГЛАВА 2 Механические искусственные клапаны сердца
крови опасных зон тромбообразования Была активизирована функция вр «щения гво
рок вокруг центральной оси корпуса. Период вращения уменьшился с 300 до 100 цик-
лов открытия-закрытия клапана, что обеспечило более интенсивное промывание эле-
ментов клапана протекающей кровью и практически исключило тромбообразование на
протезе (Евдокимов С. В и др , 2004).
Клапаны Мединж-2 прошли полный цикл технических испытании в центрах Мини-
стерства здравоохранения РФ, аккредитованных Госстандартом РФ Проведенные сер-
тификационной лабораторией Госстандарта РФ в НЦССХ им. А. Н. Бакулева испытания
на ресурс (на стенде с 23-кратным ускорением) подтвердили гарантированную долго-
вечность клапанов не менее 20 лет, а прогнозируемую — свыше 100 лет.
Клинические испытания клапанов, проведенные в шести кардиохирургических цен-
трах России, подтвердили быстрое восстановление гемодинамики пациентов в после-
операционном периоде, бесшумность работы, отсутствие необходимости принудитель-
ной ориентации протеза после его вшивания в фиброзное кольцо, обусловленное уни-
кальной способностью клапана — самостоятельным вращением его створок вокруг
центральной оси корпуса; удобство имплантации протеза, обеспечиваемое мягкой эла-
стичной пришивнои манжетой (Бокерия Л А. и др , 2004)
Эта конструкция клапана получила патенты России, США и Европы Клапан Мединж-2
был первым Российским изделием которое получило Гран-При и Золотую медаль с
отличием на Всемирном Салоне «Брюссель-Эврика 95» (рис. 2.76)
В период 1995-1998 гг. проводились расширенные клинические исследования кла-
панов многими российскими кардиохирургами: В И. Шумаковым, М. Л Семеновским,
П. А. Вавиловым, Р. С. Зайцевым, В. В. Соколовым (НИИТиИО, Москва), С. С. Доброти-
ным, В. А. Чигиневым, Е. Н Земсковой, А Б. Гамзаевым, В. В. Соколовым, С. П. Мед-
ведевым (СККБ, Нижний Новгород) Л А. Бокерией, Р М Муратовым, И. И Скопиным,
Рис. 2.76. Вручение Гран-При на Всемирном салоне «Брюссель-Эврика 95». Кубок держат гене-
ральный директор НПП «МедИнж» С. В. Евдокимов (слева) и главный конструктор
А. П. Мельников
101
ИСКУССТВЕННЫЕ К ЛАПАНЫ СЕРДЦА
А Г Ребиковым, А. И. Малашенковым (НЦССХ им. А. Н. Бакулева, Москва), В. К. Нови-
ковым, А. Н Котиным, В Э. Белостоцким (НИИ кардиологии, Санкт-Петербург),
А М. Караськовым, В. М. Назаровым, В. С. Щукиным, И. И. Семеновым (НИИ патоло-
гии кровообращения, Новосибирск), С. Г. Сухановым, В. А. Кашиным (ЦССХ, Пермь),
Э М Идовым, А. В. Михайловым (ОКБ № 1, Екатеринбург) и др. Поступающие реаль-
ные клинические наблюдения, конкретные замечания и предложения кардиохирургов,
касающиеся качества пришивной манжеты, надежности клапана, тромборезистентно-
сти, улучшения гемодинамических и других характеристик протеза, быстро рассмат-
ривались разработчиками и вносились необходимые изменения в конструкцию и тех-
нологию производства клапана. Так, был изменен материал корпуса на УСБ, в несколько
раз повышена механическая прочность створок и корпуса, изменены формы манжет,
увеличена высота корпуса. Благодаря совместной работе инженеров и кардиохирур-
гов в 1998 г. на НПП «МедИнж» было начато производство усовершенствованной моде-
ли клапана Мединж-2. С 1998 г. в течение 6 лет в России и странах СНГ было имплан-
тировано около 15 000 протезов Мединж-2 (Добротин С. С. и др., 2004; 2005; Карась-
ков А. М. и др., 2004; Шумаков В. И. и др., 2004).
В настоящее время клапаны Мединж-2 изготавливаются с интрааннулярной, супра-
аннулярной и надкольцевой формами манжет. Увеличенная высота корпуса, обшитого
полиэфирной тканью, существенно облегчает имплантацию протеза особенно при вы-
раженной деструкции фиброзного кольца. Основные размеры клапанов Мединж-2 по
пришивной манжете: от 17 до 29 мм для аортальной позиции (7 типоразмеров) и от 23
до 33 мм — для митральной (6 типоразмеров).
С 2000 г. проходит клинические испытания модификация клапана Мединж-2, у ко-
торой для предотвращения нарастания паннуса проксимальная сторона манжеты мит-
рального протеза покрывается пористым тетрафторэтиленом (Евдокимов С. В. и др.,
2000). С 2003 г. по предложению Ю Л. Шевченко (Шевченко Ю. Л., Евдокимов С. В.,
2003) для профилактики эндокардита выпускаются клапаны Мединж-2, в манжету ко-
торых введена серебряная нить (рис. 2.77). Указанный клапан отличается тем, что, по
меньшей мере, на части поверхности манжеты закреплена серебряная проволока, при-
чем площадь поверхности серебряной проволоки составляет более 5% площади по-
верхности манжеты. Серебряная проволока, закрепленная на посадочной поверхности
манжеты, изогнута в виде синусоиды с амплитудой, соответствующей разнице диамет-
ров манжеты и посадочного диаметра клапана, и периодом, составляющим 0,1-0,6
диаметра манжеты Серебряная проволока, закрепленная на внешней поверхности
манжеты, имеет вид ломаной линии по всему периметру манжеты, примыкающему к
окружающим сердечным тканям. Диффундирующие из серебряной проволоки ионы
Рис. 2.77. ^^с^ннь.е клапаны сердца Мединж-2 с серебряной нитью на манжете (патент РФ
из пооигт ~ Ю' Л ' ^вдокимов С. В., 2004) и с манжетой, покрытой пленкой
из пористого тетрафторэтилена Экофлон
102 —------------------
ГЛАВА 2. Механические искусственные клапаны сердца
серебра препятствуют росту и развитию бактерии, вызывающих септический эндокар-
дит в области протеза сердечного клапана. Поскольку проволока не нарушает общую
структуру и химический состав тканной манжеты, она не препятствует ее прор ютанию
и не провоцирует образование фистул (Караськов А. М. и др , 2005, Шевченко Ю Л и
др., 2005).
В процессе капсуляции протеза клапана сердца по внешней поверхности манжеты
идет наползание окружающей ткани (паннус). При этом расположенная на внешней
поверхности манжеты серебряная проволока контактирует с паннусом Таким образом,
протез клапана обладает бактерицидными свойствами, обеспечивает возможность ак-
тивной его капсуляции естественной соединительной тканью, что снижает риск его
отторжения, образования фистул и тромбоэмболических осложнений Для усиления
бактерицидных свойств клапана Мединж-2 в его манжету по методике С П Новиковой
(НЦССХ им. А. Н. Бакулева РАМН) импрегнируется гепарин, курантил, ципрофлоксацин
и метронидазол. Бактериологическое исследование (рис 2.78) показало высокую ак-
тивность антибиотиков в манжете в течение нескольких недель после операции Это
является мощным фактором предотвращения раннего и, особенно, позднего протез-
ного эндокардита У трехсот пациентов, в том числе и с септическим эндокардитом, в
течение двух лет после операции не отмечено осложнений, связанных с эндокарди-
том. Учитывая рост больных с септическим эндокардитом, в последнее время увели-
чивается потребность в протезах этого вида. Для более эффективной профилактики
протезного эндокардита клапаны Мединж-2 комплектуются шовным материалом, со-
держащим антибиотики (Бокерия Л. А. и др., 2005).
Фирма «Роскардиоинвест» (Москва), имевшая двадцатилетний опыт производства
клапанов сердца Микс (Эмике), к 2000 г. разработала двустворчатый искусственный
клапан сердца Роскардикс (рис. 2.79).
Высокая гемодинамическая эффективность достигнута благодаря выполнению кор-
пуса протеза с проходным гидродинамическим отверстием круглого сечения при
минимальной толщине стенки седла из высокопрочного титана, имплантированного ато-
мами углерода на заданную глубину, а также приданию створкам специального профи-
ля. обеспечивающего максимальный угол открытия (83°) и быстродействие. Примене-
ние новых методов модификации поверхностей протеза углеродом, выполнение узла
крепления створок в виде плавных, с хорошим омыванием потоком крови сферичес-
ких элементов уменьшает возможность образования тромбов на клапане Придание
Рис. 2.78. Результаты бактериологического теста образцов манжет клапаное
Мединж-2: То — после импрегнации антибиотиков видно снижение
роста бактерий Е. coli и S. aureus, К. — без обработки антибиотиками
103
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
Рис. 2.79. Искусственный клапан сердца Роскардикс (по С. Л. Дземешкевичу и др., 2003) и его
схема
протезу антибактериальных свойств достигнуто путем применения серебросодержа-
щей манжеты. Тромборезистентный углеродосодержащий материал пришивной ман-
жеты обеспечивает удержание шва и уменьшение развития паннуса
Изготавливается 6 типоразмеров искусственного клапана сердца для митральной
позиции с диаметром пришивной манжеты 23-33 мм и 6 типоразмеров — для аор-
тальной с диаметром 19-29 мм. Есть также модификация клапана Роскардикс с увели-
ченной площадью посадки, в которой применяется меньшая по диаметру пришивная
манжета, но при сохранении того же эффективного гидравлического отверстия клапана.
После получения в 2002 г сертификата безопасности протез Роскардикс проходит
широкие клинические исследования в различных кардиоцентрах России. В некоторых
центрах отмечены случаи тромбозов протеза через год после его имплантации, что, по
всей видимости, связано с материалом корпуса и погрешностями в антикоагулянтной
терапии. Однако для полной оценки клинического использования данного клапана не-
обходимо время (Лищук А. Н. и др , 2005; Семенов И. И. и др , 2005).
В 1991 г. Белорусский НИИ кардиологии совместно с концерном «ПЛАНАР» внедри-
ли в клиническую практику двустворчатый искусственный клапан сердца Планикс-Д
(рис 2 80), который с успехом применяется в настоящее время у сотен больных с кла-
панными пороками сердца (Островский Ю. П. 1996; 1998; Чеснов Ю. М., 1996).
Рис. 2.80. Искусственный клапан сердца Планикс-Д и его схема
104-------------—____________________
ГЛАВА 2. Механические искусственные клапаны сердца
ТЕХНИКА ИМПЛАНТАЦИИ
Техника имплантации должна обеспечивать максимальную эффективность работы
механического искусственного клапана сердца с учетом индивидуальных анатомичес-
ких особенностей больного, размеров фиброзного кольца, конструкции клапана, а так-
же предпочтений хирургической бригады. В связи с этим можно выделить несколько
ключевых моментов, о которых должен помнить хирург при протезировании клапанов.
К проблемам митрального протезирования относятся, выбор клапана при малом
объеме левого желудочка и его дисфункции, ориентация клапана, сохранение подкла-
панных структур, восстановление гемодинамики у детей и подростков, которым через
несколько лет после операции в силу роста организма и сердца показана реоперация
и имплантация клапана большего размера. Проблема выбора адекватного клапанного
протеза, особенно для пациентов с узким корнем аорты (<20-21 мм) и большой по-
верхностью тела, также представляет собой актуальную проблему в кардиохирургиче-
ской практике (Малышев Ю. И. и др. 1989; Караськов и др., 2004; Hanayama N et al.,
2002).
При аортальном протезировании аорта вскрывается поперечным разрезом на 5 мм
выше устья правой коронарной артерии, который может быть продлен кзади в направ-
лении некоронарного синуса Вальсальвы. После ревизии клапана выполняется иссе-
чение его створок от комиссуры между правой и некоронарной створками. Следует
помнить, что максимальное удаление кальцинированых створок обеспечивает имплан-
тацию клапана большего размера, улучшает его посадку, снижая риск развития слабо-
сти фиброзного кольца и параклапанных фистул.
Важной задачей является предотвращение перфорации аорты при удалении каль-
циевых депозитов из аортальной стенки, особенно в области комиссуры между левой
и некоронарной створками. После иссечения естественного клапана фиброзное коль-
цо измеряется калибром, и посадочный размер протеза (TAD-tissue annual diameter)
выбирают на один размер меньше. Указанный традиционный метод подбора направ-
лен только на обеспечение соответствия площадей гидравлического отверстия проте-
за (GOA-geometrical orifice area) и фиброзного кольца без учета параметров индивиду-
альной гемодинамики пациента. Однако посадочный диаметр искусственного клапана
сердца должен подбираться не только в соответствии с размером фиброзного кольца,
но и с учетом площади поверхности тела, возраста и уровня предполагаемой физи-
ческой активности пациента после операции
Послеоперационная эхокардиографическая оценка пациентов после замены аор-
тального клапана показывает даже в покое превышение трансклапанных градиентов
давления относительно здоровых лиц. Это вызвано уменьшенной площадью гидравли-
ческого отверстия протеза по сравнению с площадью открытия створок естественного
клапана. Кроме того, дополнительное уменьшение площади отверстия протеза после
операции может быть связано с гипертрофией межжелудочковой перегородки, гипоп-
лазией выходного отдела левого желудочка, прогрессирующей эндотелизацией ман-
жеты и разрастанием тканей (паннуса). Таким образом, можно говорить о протезно-
пациентном несоответствии различной степени выраженности у всех пациентов с им-
плантированными искусственными клапанами сердца. Понятие протезно-пациентного
несоответствия первоначально было введено S. Н. Rahimtoola и соавт (1978), который
отмечал, что «протезно-пациентное несоответствие имеет место тогда, когда после-
операционная площадь эффективного отверстия (ЕОА) протеза меньше, чем у нормаль-
ного клапана»
Согласно современному подходу индивидуального подбора протеза и прогнозиро-
вания послеоперационной гемодинамики, хирург должен руководствоваться значени-
ями площади эффективного отверстия (ЕОА-effective orifice area) используемых искус-
ственных клапанов сердца. Указанный параметр определяется послеоперационным
допплеровским исследованием пациентов по формуле ЕОА(см )=SV/VTI, где SV — удар-
-------------------------------------------------105
ИСКУССТВЕННЫЕ КЛАПАН Ы СЕРДЦА
ный объем (мл), VTI — интеграл скорости кровотока на выходе клапана (мл/см2), полу-
LjpHi-ibiii интегрированием допплеровского сигнала кровотока (Pibarot Р et al , 2001).
Площадь эффективного отверстия может также вычисляться по формуле. ЕОА= QcpKB/
(51 6 ТдР )• где Q' в — среднеквадратичный расход крови через клапан (мл/мин),
др ___средний градиент давления на открытом клапане (мм рт. ст) с использованием
измеренных перепада давления и расхода (Baldwin J. Т, 1997) Таким образом, GOA
характеризует геометрию клапана, а ЕОА — его гемодинамику. Отметим, что GOA для
конкретной модели механического искусственного клапана сердца измеряется фир-
мой-изготовителем с большей точностью, чем для биопротезов
ЕОА суммирует влияние нескольких факторов на послеоперационный трансклапан-
ный градиент: диаметра гидравлического отверстия, типа запирающего элемента, удар-
ного объема, геометрии камер сердца и аорты ЕОА, измеренное для определенной
модели клапана на экспериментальном стенде, имеет меньший разброс значений по
сравнению с измеренным /л vivo, так как данные, полученные in vitro, свободны от вли-
яния индивидуальных особенностей пациентов. Поэтому для сравнения гидродинами-
ческих характеристик клапанов в ходе разработки и оптимизации их конструкций
пользуются данными стендовых испытаний. Однако из-за упрощенной физической
модели кровотока, реализуемой в экспериментальном стенде, а также из-за различия
методов измерений и расчета данного параметра средние значения ЕОА, измеренные
/л vivo и in vitro, могут не совпадать. Поэтому при подборе типа и размера протеза с
учетом индивидуальных особенностей пациента кардиохирург должен отдавать пред-
почтение клиническим измерениям ЕОА Причем точность статистической оценки ЕОА
по данным клинических измерений возрастает с увеличением числа наблюдений
Для сокращения числа факторов, от которых зависит критерий оценки послеопера-
ционной гемодинамики, целесообразно использовать более универсальный, по срав-
нению с ЕОА, параметр Учитывая зависимость ударного объема SV от площади по-
верхности тела пациента BSA, вводят отношение ЕОА к BSA, названное индексом пло-
щади эффективного отверстия клапана iEOA(cm2/m2)=EOA/BSA, который не зависит от
величины ударного объема Для предупреждения протезно-пациентного несоответствия
при протезировании аортального клапана механическими или биологическими клапа-
нами рекомендуется использовать именно этот индекс (Dumesnd J G et al , 1990, Capps
S В. et al., 2000) По данным послеоперационных допплеровских измерений ЕОА уста-
новлено, что стеноз как естественного, так и искусственного аортального клапана, со-
провождаемый средним трансклапанным градиентом давления больше 10 мм рт ст
(в покое), имеет место при iEOA<0,9 см2/м2, а больше 20 мм рт ст (в покое) — при
iEOA<0,6 см2/м2 (рис 2 81).
Из графика следует, что корреляция iGOA (cm2/m2)=GOA/BSA со средним транскла-
панным перепадом давления (в покое) более слабая, по сравнению с iEOA Следова-
тельно послеоперационную гемодинамику можно прогнозировать с большей вероят-
ностью опираясь при выборе размера протеза на iEOA Чтобы оценить клиническую
значимость протезно-пациентного несоответствия, вводится его классификация, лег-
кая степень — при 0,9<iEOA<1 см2/м2, средняя степень — когда 0,6<iEOA<0,9 см2/м2 и
тяжелая - при iEOA<0,6 см2/м2 (Pibarot Р. et al., 1999) Отметим,’ что при отсутствии
полученных в клинике значений iEOA для выпускаемых (или новых моделей) клапанов
можно с меньшей степенью надежности использовать для прогноза послеоперацион-
ной гемодинамики и iGOA, значения которого вычисляются при доклинических изме-
мпжнп пГ“ВИЧ Л И ’ 2004)- Например, при обеспечении условия iGOA>2,0
кое 10 птТгтЧр° Значения среднего трансклапанного градиента не превысят в по-
гнозиоуютгя гпяпмоУСЛ0ВИЯХ физическои нагрузки при »ЕОА>0,9 (либо iGOA>2,0) про-
P^ba^yp^t^L^fs»^)161 АаВЛеНИЯ' Не пРевЬ|шающие 20 мм рт ст (Badly R et al , 1997,
30-кратное ее анализе ранней послеоперационной смертности показали
при тяжелой степени протезно-пациентного несоответствия,
106--------------------
ГЛАВА 2 Механические искусственные клапаны сердца
Степени протезно пациентного несоответствия
iEOA см2/мг
iGOA см2/м
б
Рис. 2.81. Корреляция послеоперационного среднего градиента давления ДР на биопротезах в
покое, индекса площади эффективного отверстия (ЕОА (а) и индекса геометрической
площади гидравлического отверстия iGOA (6); черные кружки — каркасные биопроте-
зы, белые —- бескаркасные (по Р. Pibarot et al., 2001)
по сравнению с легкой степенью протезно-пациентного несоответствия при фракции
выброса левого желудочка больше 40% или меньше 40% — рис. 2 82 (Rao V et al ,
2000). Однако другие авторы не находили увеличения ранней послеоперационной смер-
тности при протезно-пациентном несоответствии тяжелой степени и указывали на воз-
можность клинического использования малых протезов механических искусственных
клапанов диаметром 19-21 мм с хорошими непосредственными и отдаленными ре-
зультатами (Chnstakis G et al , 1996) Поэтому вопросы влияния малого iEOA на выжи-
ваемость в раннем и отдаленном послеоперационном периодах остаются дискусион-
ными и требуют дальнейшего изучения.
Тяжелая
Средняя
Легкая
Степень протезно-пациентного
несоответствия
Рис. 2.82. Относительный риск ранней послеоперационной смертности при различной степени
протезно-пациентного несоответствия и фракции выброса левого желудочка большей
или равной 40% (а) и меньшей 40% (6) — по С. Blais et al., 2003
------------------------------------------------------------ 107
ИСКУССТВЕННЫЕ КЛАПАНЫ С ЕРД Ц А
Несмотря на разноречивость данных, предотвращени проте но-пациентого несо-
ответствия имеет важное значение при хирургическом лечении патологии аортального
клапана поскольку средняя и тяжелая степени несоответствия обусловливают медлен-
ное течение реабилитационного периода, развитие высоких послеоперационных транс-
клапанных градиентов давления, особенно у молодых пациентов с повышенными фун-
кциональными нагрузками, замедление регресса массы миокарда левого желудочка и
переход в более высокий функциональный класс (NYHA), а также оказывают отрица-
тельное влияние на выживаемость (Gonzalez-Juanatey J R. et al., 2001). В настоящее
время прослеживается связь протезно-пациентого несоответствия с послеоперацион-
ными осложнениями, такими как тромбэмболия, геморрагия, структурная дегенерация
клапана и др (Hoffman A et al., 1990, Rao V. et al., 2000; Masuda M. et al., 2004)
Таким образом, на основании современных многочисленных исследований, для кар-
диохирурга предлагается следующий алгоритм профилактики протезно-пациентного
несоответствия: 1) при дооперационном обследовании необходимо вычислить площадь
поверхности тела пациента BSA (м2), исходя из роста Н (см) и веса М (кг) по формуле
BSA = 5,26 хЮ 3 VhxM (Hanayama N. et aL, 2002); 2) умножить BSA на iEOA, равный 0,9
см2/м2 (это произведение и будет минимальным значением ЕОА, которое должен иметь
имплантируемый протез, чтобы избежать средней степени протезно-пациентного не-
соответствия); 3) по таблице послеоперационных значений ЕОА (табл. 2,2) выбрать мо-
дель и размер протеза с ЕОА, большей расчетного значения. При отсутствии в табли-
це такого протеза следует либо изменить в пункте 2 множитель на 0,6 см2/м2 (мини-
мальное значение ЕОА, которое должен иметь имплантируемый протез, чтобы избежать
тяжелого протезно-пациентного несоответствия) и повторить поиск протеза согласно
пункту 3, либо применить супрааннулярную технику имплантации, или выполнить рас-
ширение корня аорты (Семеновский М. Л. и др., 2005; Скопин И И. и др., 2005; Шев-
ченко Ю Л и др., 2005, Шихвердиев Н. Н. и др., 2005; Nakano S. et al., 1992; Pibarot P.
et al., 2000; 2001; Butchart E. G. et al., 2003; Blackstone E. H et al., 2003; Blais C. et al.,
2001, 2003; Belgi A. et al.. 2005).
Таблица 2.2
Значения послеоперационных ЕОА (см2) некоторых зарубежных механичес-
ких искусственных клапанов сердца и биопротезов
Тип клапана Размер протеза, мм Источники
19 21 23
St Jude Medical Standard 1,04+0,19 1,73+0,38 2,13±0,61 Chafizadeh E. R et. al., 1991, Zingg U. etal., 1997
St Jude Medical Hemo- dynamic Plus 1,3+0,3 2,01+0,17 — Zmgg U et al , 1997 De Paulis R et al , 1996
। Carbomedics Standard 1.0±0,4 1,54+0,31 1,63+0,3 Chambers J et al . 1993
Medtronic Intact 0 85 1,02±0,1 1,27+0 11 Durnesnil J G et al , 1990
Carpentier-Edwards Pencardial 2900 1,10 1,3 1,5 Salomon N, W et al , 1991
Medtronic Freestyle 1.29+0,19 1,46+0,32 1 79+0,33 Yun К L et al 1999
I Prim a Edwards 0,8 1 10 1,5 Dossche К et al , 1996
108
ГЛАВА 2. Механические искусственные клапаны сердца
У пациентов с узким фиброзным кольцом аортального клапана и площадью повер-
хности тела более 1,7 м2 ряд авторов рекомендуют имплантировать протезы большей
диаметра, чем 19-21 мм используя для этого различные методики расширения корня
аорты (Караськов А. М. и др., 2005; Барбухатти К О. и др., 2005; Teoh К et al, 1987;
Kratz J. et aL, 1994, Sim E. et al., 1994; Kitamuia M. et al., 1996; Sommers K. et al., 1997;
Castro L. J. et al., 2002).
В 1970 г. R. Nicks и соавт. предложили методику расширения фиброзного кольца
аортального клапана с описанием пяти клинических случаев ее применения (рис. 2.83).
Эта методика увеличивает диаметр восходящей части аорты и фиброзного кольца
аортального клапана, чтобы имплантировать клапан на 1-2 размера больше (4-5 мм),
чем допускало нативное фиброзное кольцо при его умеренной гипоплазии (15-22 мм)
Операция Nicks состоит в следующем после подключения аппарата искусственного
кровообращения, наложения зажима на восходящую часть аорты производится ее
вскрытие поперечно-косым разрезом. Затем после селективной или ретроград-
ной кардиоплегии производится ревизия, иссечение пораженных створок аорталь-
ного клапана и измерение диаметра фиброзного кольца для принятия окончательно-
го решения
Разрез продлевается кзади и книзу через некоронарный синус по направлению к
межстворчатому фиброзному треугольнику с пересечением фиброзного кольца аор-
Рис. 2.83. Расширение фиброзного кольца и восходящего отдела аорты при его гипоплазии
(по R. Nicks et al., 1970):
а — линия разреза: б, в — разрез продлевается кзади и книзу через некоронарный синус по направле-
нию к межстворчагому фиброзному треугольнику с пересечением фибр него кольца о тгально о
клапана, г — подшивание заплаты, д — имплантированный искусственный клапан сердца, е кон-
тур наложенной заплаты (ЛП — левое предсердие, ПП правое предсердие, ПС МК передняя
створка митрального клапана Ао — аорта НС АК — некоронарная створка аортального клапана)
—---------------- 109
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
тэльного клапана до основания митрального клапана. Посла этого из дакронового ар-
териального протеза (по Nicks R. et aL, 1970) выкрэивается заплата языкообразной (кап-
леобразной) формы, вершина которой подшивается к фиброзному кольцу основания
передней створки митрального клапана. Далее края заплаты подшиваются к краям раз-
реза на аорте спереди и сзади (пролен 4-0). Затем производится протезирование аор-
тального клапана, причем подшивание его манжеты к фиброзному кольцу производит-
ся традиционным способом, а край манжеты, прилежащий к заплате, пришивается к
ней посредством непрерывных швов. В настоящее время в качестве заплаты для рас-
ширения фиброзного кольца аортального клапана чаще используют бычий ксенопери-
кард, реже — синтетический материал (БАСЭКС, Gore-Tex). Заплата БАСЭКС — это дак-
роновая ткань, пропитанная желатином, при этом заплата приобретает нулевую пороз-
ность (Скопин И. И. и др., 2003). При наименьшей травматичности операция по Nicks
имеет недостатки: асимметричная реконструкция корня аорты и ограниченные возмож-
ности расширения (до 5 мм) не всегда позволяют имплантировать протез оптимально-
го диаметра, что сохраняет повышенный трансклапанный градиент (Караськов А. М. и
др., 2004) Предложена модифицированная методика билатерального расширения фиб-
розного кольца аорты, включающая рассечение противоположных комиссур аорталь-
ного клапана, с более убедительным результатами в отдаленные сроки после опера-
ции (Manouguian S. et al., 1996).
S. Manouguian и W. Seybold-Eptmg (1976) предложили имплантировать протез адек-
ватного размера, используя для расширения фиброзного кольца переднюю створку
митрального клапана (рис. 2.84). Метод позволяет имплантировать протез на 2-3 раз-
мера больше нативного фиброзного кольца (Караськов А. М. и др. 2004; Скопин И. И.
и др. 2005; Seybold-Eptmg W. et al, 1980; Kawachi Y. et. al. 1992).
Суть операции состоит в следующем: поперечная аортотомия производится по ко-
миссуре между левой и некоронарной створками аортального клапана, корень аорты и
передняя створка митрального клапана аккуратно оттягиваются с подшиванием двух
проленовых нитей-держалок (5-0) к краям аортотомного разреза на уровне комиссу-
ры. После ревизии аортального клапана, тщательного иссечения его створок и замера
диаметра фиброзного кольца для принятия решения о целесообразности процедуры
расширения корня аорты, разрез продолжается через межстворчатый треугольник к
центру фиброзного основания передней створки митрального клапана и в том же на-
правлении вглубь створки (см рис. 2.84, а). Разрез на 1 см в начальную часть пере-
ПС мк
Рис. 2.84. Расширение фиброзного кольца и восходящего отдела аорты при гипоплазии
(по S. Manouguian et al., 1979):
м7тп^ьн^оекпея3пЯТ^ОРЧаТЫЙ треугольник к центру Фиброзного основания передней створки
рального клапана и коп П0дшивание заплаты к краям V-образного дефекта передней створки мит-
“жащий кзаплате ппиши«: ° ~ ИМПЛа— ^апана, г- край обшивной манжеты Лапана.
К ней непрерывным швом (ЛК и НК - левая коронарная и не-
искусственный клапан сердца, ЛП -"левое предсердие)^" М”ТраЛЬН0Г° клапана' ИКС "
110 ------------------
ГЛАВА 2. Механические искусственные клапаны сердца
дней створки митрального клапана позволяет расширить просвет фиброзного кольца
по крайней мере на 15 мм. При необходимости большего расширения разрез пере-
дней створки митрального клапана может быть продолжен вглубь, то есть максималь-
но к ее свободному краю. Посредством данного разреза обнажается соединение ос-
нования аорты с левым предсердием и визуализируется вход в его полость. После опи-
санных манипуляций образуется листовидная апертура между стенкой левого
предсердия и корнем аорты. Затем, с целью обеспечения адекватного хирургического
доступа, разрез стенки левого предсердия в области корня аорты продолжается квер-
ху. После этого выкраивается заплата листовидной формы из дакрона или перикарда,
которая пришивается непрерывным швом к краям V-образного дефекта передней
створки митрального клапана и корня аорты (см. рис 2.84, б) Таким образом, расши-
рение фиброзного кольца аортального клапана позволяет имплантировать протез боль-
шего размера, чем позволяет нативное фиброзное кольцо (см. рис 2.84, в). Апертура в
области анатомического соединения стенки левого предсердия и основания аорты
может быть закрыта включением краев разреза стенки левого предсердия в шов, ко-
торым заплата пришивается к дефекту в передней створке митрального клапана (см.
рис. 2.84, г). При установке искусственного клапана, пришивная манжета подшивается
к фиброзному кольцу традиционным способом, а ее край, прилежащий к заплате,
пришивается к ней непрерывным швом. Необходимо помнить и о возможности приме-
нения модифицированной методики S Manouguian, W. Seybold-Eptmg, при которой не
вскрывается купол левого предсердия (Mayumi Н. et al., 1995). Преимуществом этой мо-
дификации является исключение повреждения левого предсердия, в связи с чем умень-
шается вероятность развития кровотечения из данной области (Kawachi Y et al., 1992).
Операция аортовентрикулопластики была предложена S. Коппо и соавт. в 1975 г. и
Н. Rastan и соавт. в 1976 г. (рис. 2.85). Первоначально операция была предложена для
лечения пациентов с аортальным стенозом и узким фиброзным кольцом аортального
клапана при невозможности имплантации протеза адекватного размера в субкоронар-
ную позицию. В дальнейшем эта операция стала применяться при сочетании тубуляр-
ного, или так называемого «туннельного», субаортального стеноза с гипоплазией фиб-
розного кольца, а также в случаях замены имплантированного в детском возрасте
протеза на клапан большего размера В результате операции степень увеличения фиб-
розного кольца аортального клапана колеблется от 61% до 90% от исходного размера.
Суть операции аортовентрикулопластики состоит в последовательном рассечении
фиброзного кольца аортального клапана, выводного отдела правого желудочка и меж-
желудочковой перегородки с последующим расширением выводных трактов обоих
желудочков и протезированием аортального клапана протезом адекватного размера
Вертикальный аортотомный разрез проходит примерно на 10 мм левее уровня от-
хождения правой коронарной артерии. После аортотомии выполняют ревизию аорталь-
ного клапана и субаортального пространства. После принятия окончательного реше-
ния иссекают створки клапана, разрез продлевают влево от правой коронарной арте-
рии на правый желудочек строго по комиссуре между правой и левой коронарными
створками (см. рис. 2.85, а, б). Как вариант методики, сначала может быть сделана
правая вентрикулотомия для визуализации створок клапана легочной артерии (они
лежат очень близко к точке входа разреза в правый желудочек), после чего разрезы
правого желудочка и аорты соединяют. Далее выполняют разрез межжелудочковой
перегородки (см. рис. 2.85, в). Особенностью данного этапа операции является то, что
разрез перегородки должен быть продлен достаточно далеко, чтобы пройти ниже уров-
ня подклапанного стеноза. Зная необходимый размер протеза, оценивают дефицит
окружности фиброзного кольца аорты, после чего выкраивают заплату ромбовидной
формы из протеза Gore-Tex. Эта заплата фиксируется к межжелудочковой перегород-
ке со стороны правого желудочка до уровня аортального кольца непрерывным швом,
начиная с нижнего угла разреза. Выполняют протезирование аортального клапана ме-
ханическом протезом (см. рис. 2.85, г). По проекционной линии нового фиброзного
---------------------------------------------------- 111
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
АК
лж
разрез Б
ПКА
икс
пж
Ао
-<лж
ВПВ
Ао
Ао
разрез А
АК
ВПВ
ПКА
КЛА
ЛА
ПКА
лж
Л КА
ГГ пж
тк " V
разрез
МЖП
ПЖиМЖП
Рис. 2.85. Операция аортовентрикулопластики при гипоплазии фиброзного кольца аортального
клапана в сочетании с тубулярным субаортальным стенозом (по S. Konno et al., 1975;
Н. Rastan et al., 1976):
a — пространственное расположение разрезов, б — вид сверху и сбоку, в — экспозиция корня аор-
ты и выходного тракта левого желудочка, г — установка искусственного клапана адекватного разме-
ра в субкоронарную позицию; д — реконструкция межжелудочковой перегородки и аорты посред-
ством двухслойной дакроновой заплаты листовидной формы, е — реконструкция выводного тракта
правого желудочка посредством переднего листка заплаты и подшивка нижней части листка к де-
фекту межжелудочковой перегородки вместе со второй частью заплаты
заплата
Ао
заплата
Ао и МЖП
КЛА
кольца аортального клапана с помощью П-образных швов на прокладках к заплате Gore-
Tex подшивали ксеноперикардиальную заплату треугольной формы и выполняли плас-
тику выводного отдела правого желудочка (см. рис. 2 85, д, е). Завершающим этапом
операции является пластика восходящей аорты верхней частью заплаты Gore-Tex. По-
добная техника уменьшает возможность кровотечения из наиболее труднодоступного
места по линии шва между двумя заплатами в корне аорты (Подзолков В. П. и др., 2002)
Методика аортовентрикулопластики существует в различных модификациях, отли-
чающихся материалом заплаты для расширения межжелудочковой перегородки и ти-
пом протеза аортального клапана: Konno-Rastan, Ross-Konno, операция Коппо с ис-
пользованием аортального аллотрансплантата (Подзолков В П. и др , 2002).
М Yamaguchi и оавт (1991) предложили способ, сочетающий преимущества мето-
дов Manouguian и Konno-Rastan Аорту вскрывают перевернутым V-образным разре-
зом, одна но) ска разреза такая же, как и при методике Manouguian, другая идет кпере-
ди, ка по Konno-Rastan без продолжения на межжелудочковую перегородку. В обра-
зовавшийся дефект вшивается V-образная заплата из Gore-Tex с расширением
фиброзного кольца аортального клапана до значительно большего размера чем при
использовании способа Manouguian
Техника фиксации протеза в субкоронарную позицию разнообразна в зависимости
риведем наиболее распространенные методики наложения швов (чаще —
онд 2 0) при имплантации механических клапанов в аортальную позицию (рис. 2.86).
--------112------------------------------
ГЛАВА 2 Механические искусственные клапаны сердца
Рис. 2.86. Разновидности швов при имплантации искусственного клапана в аортальную позицию
(по Medtronic—Hall prosthetic heart valve: surgical, technical and handling considerations,
1991):
a — простой узловой шов; б — прерывистый восьмиобразный шов, в — вывернутый (супрааннуляр-
ный) П-образный узловой матрасный шов с прокладкой, г — невывернутый (субаннулярный) узло-
вой П-образный матрасный шов с прокладкой, д — непрерывный обвивной шов
Простой узловой шов без прокладок (см рис. 2 86, а) можно использовать во всех
ситуациях при достаточно выраженном фиброзе кольца, но без грубого кальциноза.
Техника его выполнения проста: вкол иглы производится со стороны аорты через фиб-
розное кольцо с выколом в желудочек и затем снизу вверх через манжету протеза.
При этом каждый предыдущий шов служит держалкой, подтягивание за которую улуч-
шает экспозицию следующего шва. Прерывистый восьмиобразный шов (см. рис. 2.86,
б) накладывается аналогичным образом с расстоянием между стежками 3-4 мм. Вы-
вернутый (супрааннулярный) узловой матрасный шов с прокладкой (см. рис. 2.86, в)
накладывают прошиванием фиброзного кольца от аорты к желудочку и дальше в ман-
жету клапана. Его применяют также широко, как и предыдущие. Использование про-
кладок особенно целесообразно при наличии тонких структур клапанного аппарата
сердца у больных с ишемической болезнью и с врожденными дисплазиями. При каль-
цинозе, переходящем на фиброзное кольцо клапана, целесообразно укреплять швы
прокладками из тефлона. Швы могут быть комбинированными — часть на прокладках,
часть без них. Данный способ позволяет устанавливать протез в центр отверстия и
способствует профилактике наползания окружающих тканей (паннуса), нарушающего
работу запирающих элементов. Невывернутый (субаннулярный) узловой матрасный шов
с прокладкой (см рис. 2.86, г), накладываемый со стороны желудочка к аорте, пред-
почтительно использовать при имплантации клапанов в супрааннулярную позицию
Таким образом, прокладки швов могут располагаться либо на желудочковой, либо на
аортальной сторонах фиброзного кольца Размещение прокладок на желудочковой сто-
роне позволяет имплантировать протез большего размера, особенно при узком фиб-
розном кольце Непрерывный обвивной шов (см. рис. 2.86, д) удобен и эстетичен, —
отсутствие узелков является своего рода профилактикой тромбообразования, а также
перфорации краями нитей створок биопротезов. Шов быстро накладывается, что зна-
чительно сокращает внутрисердечный этап операции
При прошивании пришивной манжеты и завязывании швов узлы должны распола-
гаться как можно ближе к наружной части манжеты для исключения нарушения под-
вижности запирающего элемента (рис. 2.87).
Завязывание швов лучше начинать с зоны левой коронарной створки и далее по
часовой стрелке, последними завязываются швы в области некоронарной створки
В трудных случаях имплантации протеза, связанных с его плотной посадкой, целесо-
образно накладывать более частые швы, что исключает сужение фиброзного кольца
При кальцинозе фиброзного кольца первыми завязываются швы наиболее удаленной
средней части синусов Вальсальвы, что облегчает подтягивание этой зоны, а в комби-
----------------------------------------------------- 113
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
Рис. 2.87. Рекомендуемое и нерекомендуемое положение стежков на пришивной манжете искусст-
венного клапана Medtronic-Hall (по Medtronic-Hall prosthetic heart valve: surgical, technical
and handling considerations, 1991)
ции чуть более низким наложением (ниже вершины комиссур) комиссуральных швов
дает во можность плотно фиксировать протез даже при жестком соответствии разме-
ров его и кальцинированного фиброзного кольца. Перед ушиванием аорты после имп-
лантации механического протеза или каркасного биопротеза необходимо оценить рас-
ложение устьев коронарных артерий. В области левого устья при его низком распо-
ложении манжета может перекрывать просвет. Такое осложнение возможно и при
обычном расположении устья, но при ошибочном сборивании фиброзного кольца на
манжете протеза, тогда просвет устья остается свободным, но сам синус верхним кра-
onTn°HTa-r™^eT С протезом и служит препятствием для достаточного коронарного кро-
я б па Н<^ знани' Ра п л ения ья правой коронарной артерии необходимо
н г 5 выполнения аорторафии, при высоком расположении устье может ока-
споль овяниоцР01 симальной НУ®6 Разреза аорты. Аорта закрывается двойным швом
мнить О нап!п атравматичного шва. При трудностях посадки протеза следует по-
до >004) и супракоронарной имплантации протеза (Дземешкевич С Л. и
размещению большсхю^п-149 ПО°а н и вого аортального клапана соответствует
створки (рис 2 88) ЛучшрВеР ™Я П апРавлению к зоне иссеченной некоронарной
ние шарнирной оси в стппп °риента5ией яворчатого протеза является размеще-
1987; Laub G W. et al., ^Эг^аТ^ч'аГ^ЭэГо16013^ (Семеновский М Л и ДР"
f»——
”«*"«P~roXZZ^ П например, придиа-
сердца Carbomedics Standard 19 типп У РНЭЯ импланта^ия искусственного клапана
му несоответствию. Поэтоми xwnvnru размера может привести к пациентно-протезно-
ственныи клапан сердца с большим раТмТрТм ^ПЛантировать супрааннулярно искус-
мер Carbomedics Top Hat 23 типоразмео <пиг „ дрод^намического отверстия, напри-
имплантировать супрааннулярно клапан 4t i и В такои же ситуации выгоднее
аметром гидродинамического отвеостия iq r Medlcal Regent 21 типоразмера с ди-
St Jude Medical Standard 19 типопаамы^ 9’6 MM’ Чем интРааннулярно — модель
14,7 мм (см рис 2 89, б) Р с диаметром гидравлического отверстия
Разновидности манжет дпп
2 90 При замене двух клапанов — ^итпй^аПаНа Medtronic Hal> представлены на рис.
положение манжеты искусственного аоо-Х?Г° И аортального — супрааннулярное рас-
ствие с манжетой митрального клапана От ЬН°Г° 1013,1343 минимизирует взаимодеи-
114 • Отметим, что применение клапана с манжетой
ГЛАВА 2. Механические искусственные клапаны сердца
зс
мк
Рис. 2.88. Оптимальная ориентация аортальных протезов: поворотно-дискового (большое отвер-
стие — в сторону некоронарной створки) и двустворчатого (оси поворота створок проте-
за — в сторону правой коронарной створки), по Е. М. Baudet et al., 1985; J. Laas et al.,
1999:
ЗС MK — задняя створка митрального клапана, ПС МК — передняя створка митрального клапана,
ТК — трикуспидальный клапан, ЛА — клапан легочной артерии, Ао — аорта, ЛК — левая коронарная
створка, ПК — правая коронарная створка, НК — некоронарная створка
такого типа можно рассматривать как альтернативу процедуре расширения корня аор-
ты, которая является, безусловно, гораздо более сложной операцией (Chambers Е. Р
et al., 1991).
Доступ к митральному клапану может быть осуществлен через левое предсердие
после выделения межпредсердной борозды или через правое предсердие и межпред-
сердную перегородку Производится тщательная ревизия левого предсердия, — при
обнаружении тромботических масс последние удаляются. Для профилактики тромбо-
эмболических осложнений в послеоперационном периоде у пациентов с хронической
фибрилляцией предсердия, дилатацией левого предсердия или с тромбом в левом
предсердии на основание ушка со стороны просвета левого предсердия накладывает-
ся кисетныи атравматичный шов Выведение клапана в операционную рану облегчает
наложение швов-держалок.
Иссекаются передняя и задняя створки митрального клапана, отступая от фиброз-
ного кольца на 3-5 мм. Отсечение хорд от папиллярных мышц производят на уровне
перехода фиброзной ткани в мышечную. Не следует глубоко иссекать папиллярные
мышцы в связи с возможным повреждением задней стенки левого желудочка. Протез
выбирают на один размер меньше диаметра фиброзного кольца, определяемого по
калибру, однако для предотвращения дисфункции запирающих элементов при боль-
шом размере фиброзного кольца и малом объеме левого желудочка учитывают соот-
ветствие габаритов протеза размерам левого желудочка, определяемым перед опера-
цией ультразвуковым методом, а также визуально во время операции Для предотвра-
щения протезно-пациентного несоответствия обеспечивают индекс площади
гидравлического отверстия клапана iGOA>1,9см2/м2 (Cooley D А., 1992, Yazdanbakhsha
А. R et al., 2000; Masuda М. et al., 2004; Ruel M et al., 2004)
115
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
Carbomedics Standard 19 mm
St Jude Medical
Standard
а
Наружный
диаметр
манжеты
Carbomedics Top Hat 23 mm
St Jude Medical
Hemodynamic
Plus
Диаметр
фиброзного
кольца
St Jude Medical
Regent
Рис. 2.89. Увеличение диаметра гидравлического отверстия искусственных клапанов сердца
при супрааннулярной имплантации на примере:
а — Carbomedics Standard и Carbomedics Top Hat (по www.carbomedics.com); б — St Jude Medical
Standard, St Jude Medical Hemodynamic Plus и Regent (no www sjm com)
При митральном протезировании простой узловой шов без прокладок (рис 2 91, а)
можно использовать во всех ситуациях при достаточно выраженном фиброзе, но без
грубого кальциноза Техника его выполнения проста: вкол иглы производится со сто-
роны левого предсердия через фиброзное кольцо с выколом в желудочек и затем сни-
зу вверх через манжету протеза. При этом каждый предыдущий шов служит держал-
кой, подтягивание за которую улучшает экспозицию следующего шва Начинать лучше
от середины задней створки и двигаться по часовой стрелке. Особое внимание следу-
ет обращать на зону наружной комиссуры: часто она плохо доступна, и возможное до-
пущение избыточного расстояния между стежками приводит к образованию здесь па-
рапротезной фистулы.
Рис. 2.90. Разновидности обшивных манжет аортального клапана Medtronic-Hall (по Medtronic-Hall
prosthetic heart valve: surgical, technical and handling considerations, 1991):
а стандартная коническая, б — интрааннулярная, в — супрааннулярная
----------- 116 _______________________________ ___________________________________—
Рис. 2.91. Разновидности швов при имплантации митрального клапана (по Medtronic-Hall prosthetic
heart valve: surgical, technical and handling considerations, 1991):
a — простой узловой шов, б— прерывистый восьмиобразный шов; в — вывернутый (супрааннуляр-
ный) узловой П-образный матрасный шов с прокладкой; г — невывернутый (субаннулярный) узло-
вой П-образный матрасный шов с прокладкой, д — непрерывный обвивной шов
Прерывистый восьмиобразный шов (см. рис. 2.91, б) накладывается аналогичным
образом с расстоянием между стежками 3-4 мм.
Вывернутый (супрааннулярный) узловой матрасный шов с прокладкой (см. рис
2.90, в) накладывают прошиванием фиброзного кольца от предсердия к желудочку и
дальше в манжету клапана. Его применяют также широко, как и предыдущие. Исполь-
зование прокладок особенно целесообразно при наличии тонких структур клапанного
аппарата сердца у больных с ишемической болезнью и врожденными дисплазиями
При кальцинозе, переходящем на фиброзное кольцо клапана, целесообразно укреп-
лять швы прокладками из тефлона В этих случаях швы могут быть комбинированны-
ми — часть на прокладках, часть без них. Данный способ позволяет устанавливать кла-
панный протез в центр отверстия и способствует профилактике наползания окружаю-
щих тканей (паннус) со стороны левого предсердия, нарушающего работу запирающих
элементов.
Невывернутый (субаннулярный) узловой матрасный шов с прокладкой (см. рис.
2.91, г), накладываемый со стороны желудочка к предсердию, предпочтительно ис-
пользовать при имплантации шаровых клапанов и каркасных биопротезов (Chambers Е. Р.
et al., 1991).
Непрерывный обвивной шов (см. рис. 2 91, д) очень удобен и эстетичен — отсут-
ствие узелков является своего рода профилактикой тромбообразования, а также пер-
форации краями нитей створок биопротезов (Henucht Т. et al , 1969). Кроме этого, шов
быстро накладывается, что значительно сокращает внутрисердечный этап операции.
Можно рекомендовать первым этапом наложить 3-4 матрасных шва в труднодоступ-
ной зоне наружной комиссуры, а затем продолжить непрерывный обвивной шов, кото-
рый может быть прерван на каждом четвертом, третьем или каждом втором стежке.
Узлы швов должны располагаться на внешнем крае обшивной манжеты (рис. 2.92).
После прошивания фиброзного кольца от предсердия к желудочку игла должна вхо-
дить в узкую часть пришивной манжеты снизу вверх через зону ее средней линии, а
выходить также по средней линии широкой части манжеты. В таком случае после за-
вязывания шва пришивная манжета будет правильно облегать фиброзное кольцо, а узлы
—---------------------------------------------— 117
ИСКУССТВЕННЫЕ К ЛАПАН Ы СЕРДЦА
Рис. 2.92. Техника пришивания манжеты при митральном протезировании (по Medtronic Hal
prosthetic heart valve: surgical, technical and handling considerations, 1991):
a _ правильное, б — неправильное наложение швов
шва будут проецироваться радиально и кнаружи, исключая возможность попадания эле-
ментов шва в область движения запирающего элемента Если точки вкола и выкола
иглы на пришивной манжете будут проецироваться на одной вертикальной линии, то
это может приводить к выворачиванию элементов фиброзного кольца, ориентирова-
нию швов в сторону гидравлического отверстия, что является небезопасным в плане
дальнейшей функции протеза
Нити после завязывания узлов не следует обрезать до того момента, пока не будет
уверенности, что запирающий элемент свободно двигается. Полноту движения запи-
рающего элемента проверяют сенсорным щупом (рис. 2 93, а). В случае не полной
экскурсии запирающего элемента следует переориентировать (ротировать) каркас кла-
пана относительно пришивной манжеты (см. рис. 2.93, б). Хирургическая техника дол-
жна гарантировать отсутствие нарушения движения запирающего элемента из-за его
соприкосновения со швами, узлами, остатками папиллярных мышц и сухожильных хорд
(см рис 2.93, в) Хвостики завязанного шва необходимо оставлять как можно более
короткими, чтобы они не «вымывались» током крови в гидродинамическое отверстие
клапана и не нарушали (не заклинивали) ход его запирающего элемента (Kaiser L R
et al, 1997)
(по Medtronic-Hall prosthetic he* rt
1991):
Рис. 2.93. Профилактика дисфункции запирающего элемента
valve: surgical, technical and handling considerations,
ш?ппГлРТеЛеНке ПОЛНОТЫ подвижности запирающего элемента на открытие и закрытие сенсорным
оаюшргп °Р °Риента^ии клапана при помощи ротации держателем, е — интерпозиция запи
задней стрнкой 1гРпКЛаПаНа папилляРными мышцами, хордами, межжелудочковой перегородкой
задней стенкой желудочка или наложенными швами
118 ------------------ -------------------------------------
ГЛАВА 2. Механические искусственные клапаны серд<ы
Рис. 2.94. Оптимальная ориентация митральных протезов: поворотно-дискового (большое отверстие —
в сторону заднебоковой стенки левого желудочка) и двустворчатого (антианатомическое
положение, т. е. расположение осей поворота створок протеза по центру передней и зад-
ней створки митрального клапана); по Е. М. Baudet et al.,1985; С. К. Mok et al., 1988;
Van G. L.Rijk-Zwikker et al., 1996:
ЗС MK и ПС MK — задняя и передняя створки митрального клапана, ТК — трикуспидальный клапан,
ЛА — клапан легочной артерии, Ао —аортальный клапан; НК, ЛК, ПК — некоронарная, левая и пра-
вая коронарные створки
Ориентация большого отверстия поворотно-дисковых клапанов при митральном
протезировании на боковую и заднюю стенку левого желудочка, а двустворчатых кла-
панов в антианатомическом положении створок (рис. 2.94) обеспечивает лучшие ге-
модинамические показатели, троекратное снижение частоты «синдрома низкого сердеч-
ного выброса» и нарушения ритма сердца по сравнению с неоптимальной ориентацией,
соответственно реже возникают тромбоэмболические осложнения (Chambers J. В. et al.,
1992) Однако на практике, если не удается выбрать оптимальную ориентацию клапана в
силу анатомических особенностей, хирург вынужден имплантировать протез таким об-
разом, чтобы обеспечить беспрепятственное движение запирающего элемента
В последнее время в клапанах Мединж-2, St Jude Medical, Carbomedics, Medtronic-
Hall используют пришивные манжеты, предназначенные для имплантации клапана на
различных уровнях фиброзного кольца, — интрааннулярные (стандартные), супраанну-
лярные и субаннулярные Схематичное расположение таких манжет относительно фиб-
розного кольца митрального клапана показано на примере клапана Medtronic-Hall
(рис. 2 95).
При интрааннулярной имплантации, предотвращающей параклаланную фистулу,
пришивная манжета располагается на уровне фиброзного кольца. Показанием для та-
кой имплантации является расширенное и сохраненное фиброзное кольцо При супра-
аннулярной имплантации, применяемой при закрытии дефектов фиброзного кольца,
сохранении створок и подклапанных структур, двухклапанном протезировании, пришив-
ная манжета располагается над фиброзным кольцом Субаннулярная манжета распо-
лагается под фиброзным кольцом и применяется при массивном его кальцинозе или
осложненном бактериальном эндокардите
Сохранение подклапанных структур и папиллярно-аннулярного взаимодействия при
протезировании митрального клапана обеспечивает нормальную кинетику сокращения
-------------------------------—--------------------- 119
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
Рис 2.95. Разновидности пришивных манжет митрального клапана Medtronic-Hall (по Medtronic
Hall prosthetic heart valve: surgical, technical and handling considerations, 1991):
a _ интрааннулярная, б — супрааннулярная, в — субаннулярная
и диастолическую функцию левого желудочка, в связи с чем улучшаются гемодинами-
ческие показатели, вновь появляется фаза изоволюмического сокращения, на 40-50°о
снижается отдаленная летальность (Lillehei W et al., 1964). Данная хирургическая
тактика способствует скрутке стенок левого желудочка, а в сочетании с оптимальной
ориентацией клапана обеспечивает формирование физиологически необходимого зак-
рученного потока крови в левом желудочке и аорте, увеличение ударного выброса и
более экономичную работу сердца Кроме того, сохранение задней створки и хорд
способствует значительному снижению вероятности разрыва задней стенки левого
желудочка и атриовентрикулярного соединения.
Техника сохранения подклапаного аппарата и створок митрального клапана разно-
образна (Шумаков В И и др , 1989; Скопин И. И. и др., 2001, Шевченко Ю. Л. и др.,
2005; Cobbs В. W et al., 1980, Spencer FC et al , 1985; Asano К , 1985; Karlson K. J.
et al., 1988, Horstkotte D et al , 1993, Glower DD et al., 1998) Для сохранения передней
створки митрального клапана производится горизонтальный разрез длиной 5-6 мм в
центральной части зоны ее прикрепления к фиброзному кольцу (рис 2 96, а) Накла-
дывается шов-держалка с прокладкой на фиброзное кольцо для экспозиции, который
служит контрольной точкой при ориентации протеза Затем передняя створка иссекает-
ся по пунктирной линии Оставшиеся ее сегменты ротируются кзади, иссекаются участ-
ки створки без хорд (показано пунктирной линией) — см рис 2.96, б Матрасные швы
на прокладках проводятся через хордальные структуры и фрагменты передней створки,
затем через сохраненную заднюю створку и фиброзное кольцо (см. рис. 2 96, в), а в
заключение — через пришивную манжету искусственного клапана.
Рис. 2.96. Сохранение "вредней створки и подклапанных структур при имплантации митрального
rations 1оог»е ГОП,С **а|1 prosthetic heart valve: surgical, technical and handling consid*
a — разрез передней створки, б —
розному кольцу
ротация кзади ее сегментов
в — подшивание сегментов к фиб
120
ГЛАВА 2. Механические искусственные клапаны сердца
Техника имплантации клапана с сохранением задней створки и подклапанных струк
тур представлена на рис 2.97
Рис. 2.97. Сохранение задней створки и подклапанных структур при имплантации митрального кла-
пана (по Medtronic-Hall prosthetic heart valve: surgical, technical and handling
considerations, 1991):
a — иссечение тела широкой задней створки с сохранением свободного края, к которому прикреп-
ляются хорды б — иссечение пораженной кальцинозом части створки и наложение швов с проклад-
ками на хордальные структуры с подшиванием их к фиброзному кольцу
При любой технике сохранения створок и подклапанного аппарата весьма важно
оставлять как можно больше папиллярных мышц и сухожильных хорд для взаимодей-
ствия с фиброзным кольцом (David Т Е et al., 1986) В случае полного иссечения ство-
рок, фиброзно-измененных, сросшихся и укороченных подклапанных структур для улуч-
шения сердечного выброса применяют имплантацию искусственных хорд Gore-Tex,
соединяющих папиллярные мышцы с фиброзным кольцом митрального клапана (Ми-
лованкин Д А и др., 2005; David Т Е et al., 1991, Cohn L. H. et al , 1994)
По технике И И. Скопина и др. (2001) при полном сохранении передней створки
швы накладываются таким образом, чтобы привести к пликации тела створки вкол в
фиброзное кольцо со стороны предсердия, промежуточный стежок в теле створки и
выкол в краевой зоне (рис 2.98, а) Такой способ можно и пользовать при широком
Рис. 2.98. Полное сохранение передней створки (а) и резекция ее тела с полным сохранением крае-
вой зоны (б) при протезировании митрального клапана (по И. И. Скопину и др., 2001)
--------------------------------------------—-------------- 121 -----------
ИСКУССТВЕННЫЕ КЛАПАНЫ С£РДЦА
фиброзном кольце, тонкой и неизмененной створке, иначе участок пликации получит-
ся массивным и значимо сузит фиброзное кольцо Особенностью способа является
то, что на завершающем этапе хорды краевой зоны равномерно распределяются по
всему основанию передней створки. Этот способ также можно рекомендовать при то-
тальном кальцинозе фиброзного кольца. В этом случае вкол производится в основа-
ние створки.
При резекции тела передней створки с полным сохранением краевой зоны средняя
часть передней створки иссекается, а краевая зона подхватывается в шов фиброзного
кольца (см. рис. 2 98, б). Таким образом, удается избежать образования избыточной
ткани а хорды равномерно распределяются по всему основанию передней створки. При
сохранении основных хорд с рассечением или трапециевидной резекцией средней час-
ти створки передняя створка рассекается в средней части от краевой зоны до фиброз-
ного кольца, и разрез продолжается в обе стороны до уровня комиссур (рис. 2.99, а).
Вариантом данного способа является трапециевидная резекция створки. Наложением
плицирующих швов створка сворачивается и фиксируется в зоне комиссур (см. рис.
2.99, 6). При имплантации протеза в шов подхватывается плицированная передняя
створка. При таком способе возможна имплантация двустворчатых протезов больших
размеров Применение одностворчатых механических протезов в этой ситуации рис-
кованно, так как объем сохраненных подклапанных структур значителен.
При сохранении основных хорд с площадками передней створки выбирают наибо-
лее пригодные хорды, расположенные с обеих сторон средней трети створки. Вся
створка иссекается с оставлением площадок 3 х 4 мм у места прикрепления указанных
хорд. Затем площадки подшиваются к фиброзному кольцу 8-образным швом этибонд
3—0 (рис. 2.100, а, б). При имплантации протеза площадки также подхватываются в
шов. В оригинальной методике места реимплантации хорд соответствуют 2 и 10 часам
при ориентации середины основания передней створки на 12 часов. Этот способ по-
зволяет сохранять аннулопапиллярную непрерывность при минимальном количестве
ткани, располагающейся вблизи протеза. Он может применяться при значительных по-
ражениях передней створки и при относительно небольшом фиброзном кольце
При протезировании подклапанных структур в случае иссечения обеих створок или
при необходимости протезирования подклапанного аппарата передней створки при
сохраненной задней нитями PTFE (Gore-Tex) с прокладками прошивают головки папил-
лярных мышц, а затем фиброзное кольцо вблизи комиссур. Место фиксации на фиб-
розном кольце выбирают в зависимости от хирургической ситуации: объема сохране-
части створки-^01 -сечением или трапециевидной резекцией средней
и трапециевидной резекции (пунктир);
_ швов (по И И Скопину и др , 2001)
ГЛАВА 2. Механические искусственные клапаны сердца
Рис. 2.100. Сохранение основных хорд с площадками передней створки:
а — формирование площадок передней створки; б — фиксация площадок к фиброзному кольцу
до подшивания протеза; в — протезирование подклапанных структур (по И. И. Скопину и др , 2001)
ния подклапанных структур, типа протеза и размера левого желудочка (см. рис. 2.100, в).
Данный способ можно применять при повторных операциях, когда подклапанные струк-
туры были иссечены при первичном протезировании (Скопин И. И. и др., 2001; Мило-
ванкин Д. А. и др., 2005; David Т. Е. et al., 1986; 1991; Cohn L. H. et al., 1994).
Во всех описанных способах предпочтительно применение механических двуствор-
чатых протезов в связи с минимальным риском интерпозиции сохраненных структур.
Еще большую безопасность дает применение биопротезов, но оно ограничено строги-
ми показаниями. Варианты сохранения подклапанных структур со значительным иссе-
чением тела створки позволяют использовать наиболее распространенные в России
одностворчатые механические протезы, хотя это может потребовать перемещения
места прикрепления сохраненных структур на фиброзном кольце ближе к комиссурам
и задней створке.
Непосредственный выбор типа сохранения подклапанного аппарата передней или
задней створки зависит от ряда обстоятельств. Одно из них — ограниченность в выбо-
ре типа протеза. Поэтому при невозможности использования двустворчатого протеза
хирург вынужден отдавать предпочтение способам с более полным иссечением ткани
передней створки. Наиболее благоприятным в этом случае является оставление ос-
новных хорд с площадками передней створки. Способ обеспечивает достаточную связь
папиллярных мышц и фиброзного кольца, менее критичен к состоянию всей створки,
так как большая ее часть иссекается. Места фиксации могут быть изменены в соответ-
ствии с типом применяемого протеза и особенностями патологии фиброзного кольца.
ЛИТЕРАТУРА
Амосов Н. М., Гольдберг В Н. и др. Протезирование митрального клапана // Вестн. АМН СССР,
1963 — № 9. — С. 9-18.
Амосов Н М., Кнышов Г. В. Методы и результаты протезирования клапанов сердца // Грудная
хир. — 1970. — №2. — С. 13-19.
Барбухатти К. О., Болдырев С. Ю., Белаш С. А. и др. Результаты протезирования аортального
клапана и реконструкции корня аорты у больных с узким фиброзным кольцом // Сердечно-
сосудистые заболевания. — Бюл. НЦССХ им А. Н. Бакулева РАМН. 2005. Т. 6. № 5. -
С. 24.
Бокерия Л. А. (ред.) История сердечно-сосудистой хирургии. — М.: Изд-во НЦССХ им. А. Н.
Бакулева РАМН, 2003.
Бокерия Л. А., Скопин И. И., Цискаридзе И. М. и др. Результат протезирования клапанов сер-
дца протезами «МедИнж-2» с манжетой, пропитанной гепарином и антибиотиками Сер-
-------------------------------------------------------- 123
ИСКУССТВЕННЫЕ К Л АЛАНЫ СЕРДЦА
дечно-сосудистые заболевания - Бюл НЦССХ им. А. Н Бакулева РАМН - 2004. - Т. 5. -
Бухато11А~СС’и]фис Н. А. Кеворкова РА и др. Искусственные клапаны сердца ЭМИКС //
Бураковский В. И. Бокерия Л. А. (ред.) Сердечно-сосудистая хирургия: Руководство. - М.:
Бурном В.'и^Бухарин В А , Голиков Г. Т. и др Клиника, диагностика и лечение методом
протезирования недостаточности клапанов легочной артерии // Хирургия. - 1963. - № 1. -
Бураковский В. И., Иофис Н. А., Шумаков В. И. и др. Новый дисковый клапан -ЭМИКС» при
изолированном протезировании митрального клапана //Грудная хир 1986. Ns 1.
С. 10-14.
Бьерк В. О. Рождение хирургии на открытом сердце в Швеции // Из истории сердечно-сосуди-
стой хирургии / Под ред Бокерии Л. А — М.: Изд-во НЦССХ им. А. Н. Бакулева РАМН,
2003. — С. 74-88.
Быков В. И. Хирургическое лечение аортальных и митральных пороков сердца с использова-
нием дисковых протезов ЭМИКС и ЛИКС: Автореф. дис. канд. мед. наук. — ВМА, 1994
Вязников В. А., Дербенев О. А. Отечественные протезы «Карбоникс-1» в хирургии пороков сер-
дца // Сердечно-сосудистые заболевания. — Бюл. НЦССХ им А. Н. Бакулева РАМН —
2004. - Т. 5. - № 11. — С. 27.
Вязников В. А., Дербенев О. А Отечественные протезы *ЛИКС-2» в хирургии пороков сердца//
Сердечно-сосудистые заболевания. — Бюл. НЦССХ им. А. Н. Бакулева РАМН. 2005.
Т. 6. — Ns 5. — С. 41.
Голиков Г Т. Хирургическое лечение аортальной недостаточности: Автореф. дис. докт. мед.
наук. — НИИ ССХ им. А. Н. Бакулева АМН СССР. — М., 1968.
Горшков Ю. В., Евдокимов С. В., Картошкин В. М. и др. Искусственный клапан сердца Авт.
свид. № 1035867 от 1984
Горшков Ю. В., Суходоев Ю. А., Чеканов А Н. и др. Искусственные клапаны сердца ЛИКС-2 и
Карбоникс-1, особенности конструкции и применения: Тез. докл и сообщ IV Всерос. съез-
да сердечно-сосудистых хирургов. — М., 1998 — С 44.
Дземешкевич С. Л., Стивенсон Л. У Болезни митрального клапана Функция, диагностика, ле-
чение. — М.: Гэотар Медицина, 2000.
Дземешкевич С. Л., Стивенсон Л. У., Алекси-Месхишвили В. В. Болезни аортального клапана.
Функция, диагностика, лечение. — М.: Гэотар-Мед, 2004.
Доброва Н. Б., Агафонов А. В., Фадеев А. А. Сравнительная оценка современных отечествен-
ных и зарубежных механических протезов клапанов серд» ia Тез. докл. и сообщ. IV Всерос.
съезда сердечно-сосудистых хирургов — М., 1998. — С 44.
Доброва Н. Б., Зарецкий Ю. В., Зорина А П. и др. Современные двустворчатые модели искус-
ственных клапанов сердца // Грудная хир. — 1989. — № 2. — С. 79-86.
Доброва Н. Б., Зверев Б. П., Ильина М. Б. и др Об исследовании шариковых клапанов на за-
клинивание // Грудная хир., 1967 — № 5. — С. 113-115.
Доброва Н. Б., Иофис Н. А. Низкопрофильный дисковый искусственный клапан серДЦЗ
-Эмике» // Электронная промышленность — 1984 — Вып. 10 (138). — С 85-87
Добротин С С., Земскова Е. Н., Чигинев В А. и др. Двустворчатый протез МЕДИНЖ-2 в кор-
рекции аортальных пороков сердца // Сб. тр.: Протезы клапанов сердца МЕДИНЖ в хирур-
гии клапанных пороков сердца. — 2004. — С. 79-84.
Добротин С. С., Романов Э. И., Добротина И. С и др. Шаровой протез МКЧ-25 в коррекции
изолированного порока митрального клапана // Грудная и сердечно-сосудистая хир. -
бЗДоГоб°12С20оЬНа3а₽ОВ В' М" Мельников А- a ПР°тез клапана сердца: Патент РФ № 2202990
ВаДпинж?В//сд •^ил‘^ппов А. Н., Гончаров Э. В, и др. Эволюция протеза клапана сердца «Ме-
ца — 2004 СР134-°^ЗЫ клапанов сеРДЦа «Мединж» в хирургии клапанных пороков серд-
^на малогаб^пит^к1м п ' ^рапеев и- С. и др Результаты протезирования митрального клапа-
Зорин JГ Б Новик'М ПР°Т!0М "ЭМИКС” // ГР^ная хир - 1987 - № 3 - С 5-8.
отечественными М °' и др' Опь'т пР°тезирования аортального клапана
отечественными дисковыми протезами ..ЭМИКС- и ЛИКС» // Грудная хир. - 1988. -
124
ГЛАВА 2 Механические искусственные клапаны сердца
Зубцовскии В Н Диагностика комбинированного митрального порока и его хирургиче» ко<
лечение в условиях искусственного кровообращения Дис. докт. мед. наук — Л , 19/0
Кайдаш А. Н,. Хурцилава С. Г, Маркосян А. А. и др. Клинический опыт применения отечествен-
ного низкопрофильного дискового протеза клапана сердца с осевым кровотоком / Груд
ная хир. — 1985 — № 2 — С 67-69.
Караськов А М., Железнев С И . Назаров В М. и др. Результаты расширения корня аорты при
узком фиброзном кольце аортального клапана // Сердечно-сосудистые заболевания — Бюл.
НЦССХ им. А. Н Бакулева РАМН. — 2005. — Т 5. — № 11. — С. 30.
Караськов А М., Назаров В М , Железнев С. И. и др. Опыт применения искусственных клапа-
нов сердца «МедИнж» с манжеткой, прошитой серебряной нитью и антибактериальной об-
работкой И Сердечно-сосудистые заболевания — Бюл. НЦССХ им. А. Н. Бакулева РАМН —
2005. - Т 6. — № 5. — С. 34.
Караськов А. М., Назаров В. М, Семенов И, И. и др. Применение низкопрофильных механи-
ческих двустворчатых клапанов «МЕДИНЖ» //Сб. тр : Протезы клапанов сердца «МЕДИНЖ»
в хирургии клапанных пороков сердца — 2004 — С 122-125.
Колесников С А., Цукерман Г И. Голиков Г Г. и др Опыт применения искусственного трех-
створчатого клапана при хирургическом лечении аортальной недостаточности // Грудная
хир — 1964. — № 5. — С. 3-8.
Колесников С А., Цукерман Г И., Доброва Н. Б. и др Полное протезирование митрального
клапана // Грудная хир. — 1964 — No 4 — С. 16-20
Константинов Б А , Громова Г. В , Дземешкевич С. Л и др Частота тромбоэмболических ос-
ложнений у больных после изолированного протезирования митрального клапана полусфе-
рическим протезом // Грудная хир. — 1985. — № 3. — С 24-26.
Константинов Б А., Картошкин В М. Евдокимов С. В и др. Результаты лабораторных и кли-
нических испытании новых отечественных клапанов сердца модели ЛИКС-2 // Грудная
хир. — 1989. — № 2. — С. 12-17
Константинов Б. А. Сандриков В. А., Иванов В А и др. Экспериментально-клиническая оцен-
ка протеза митрального клапана сердца HALL-KASTER // Грудная хир. — 1987. - № 3. —
С. 8-12.
Королев Б А , Добротин С. С., Чигинев В А и др. Сравнительная оценка протезов МКЧ-25,
ЛИКС, ЭМИКС в коррекции митрального стеноза и его рецидива. Тез. докл. и сообщ. I Все-
союз. съезда сердечно-сосудистых хирургов. — М., 1990 — С 448-450.
Кривчиков Ю Н. Искусственные сферически-сегментарные клапаны сердца // Грудная хир. —
1965. — № 2 — С. 104-107.
Кривчиков Ю. Н. Искусственный трехстворчатыи клапан для замещения митрального клапана
сердца // Грудная хир. — 1964 — Ns 1. — С. 115-117.
Кузьмина Н Б Гидро- и гемодинамика искусственных сердечных клапанов // Грудная хир. —
1964 — № 6. — С 101-106.
Лищук А. Н., Колтунов А. Н. Лебедев А А и др Опыт использования механических двуствор-
чатых протезов клапанов сердца «РОСКАРДИКС» // Сердечно-сосудистые заболевания
Бюл НЦССХ им А. Н. Бакулева РАМН — 2005. —Тб — Ns 5 — С 44.
Малышев Ю. И., Тарасов А. Н., Колтышев В. А. Выбор размера и профиля протеза митрально-
го клапана // Грудная и сердечно-сосудистая хир. — 1989. — № 1. — С. 16-24
Милованкин Д А., Михаилов А В , Завершинский Ю. А Непосредственные результаты проте-
зирования хорд нитями PTFE при реконструктивных операциях на митральном клапане //
Сердечно-сосудистые заболевания. — Бюл. НЦССХ им А. Н Бакулева РАМН. 2005,
Т. 6. — № 5. — С. 27.
Островский Ю П. Разработка и клиническое применение протезов клапанов «ПЛАНИКС в хи-
рургии пороков сердца: Автореф. дис. докт мед. наук. Белорусский НИИ кардиологии
М3 республ. Беларусь. 1996
Островский Ю. П Скорняков В И Чеснов Ю М и др Пятилетнии опыт применения протезов
ПЛАНИКС при хирургической коррекции приобретенных пороков сердца / Грудная и сер-
дечно-сосудистая хир. — 1998 — Ns 2. — С. 28-32.
Петровский Б В , Соловьев Г М , Шумаков В И Протезирование клапанов сердца — М . Ме-
дицина — 1966
Петровский Б. В. Шумаков В И , Шилов А. М Опыт применения шарикового искусственного
клапана сердца с механической фиксацией для протезирования митр льног п н
Грудная хир. — 1972 — № 6. — С 28-32
125
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
Подзолков В П Хасан Али, Бондаренко И Э. и др Непосредственные результаты операции
аортовентрикулопластики по Коппо у больных с подаортальным тубулярным стенозом и
гипоплазией фиброзного кольца аортального клапана // Грудная и сердечно-сосудистая
хир — 2002 - № 5 - С. 4-9.
Ребиков А Г, Муратов Р М.. Скопин ИИ и др Сравнительная оценка двустворчатых проте-
зов St Jude Medical и МедИнж в позиции митрального клапана // Грудная и сердечно-сосу-
дистая хир — 2002 — № 4. — С 9-13
Семенов И И Назаров В М., Железнев С И и др. Первый опыт использования отечествен-
ных двустворчатых клапанов «РОСКАРДИКС» // Сердечно-сосудистые заболевания — Бюл
НЦССХ им А Н Бакулева РАМН — 2004. — Т 5 — № 11 — С. 48
Семеновский М. Л , Вавилов П А., Зайцева Р С. и др Супрааннулярные протезы аортального
клапана при узкой аорте // Сердечно-сосудистые заболевания. — Бюл НЦССХ им А Н
Бакулева РАМН — 2004 — Т 5 — № 11 — С 32
Семеновский М Л., Манукян В. Е, Честухин В В. и др Выбор оптимальной ориентации для
митральных откидных дисковых протезов // Грудная хир — 1987 — № 6. — С 27-30.
Скопин И И., Муратов Р. М, Мироненко В А и др Технические аспекты сохранения подкла-
панных структур передней створки при протезировании митрального клапана Ц Грудная и
сердечно-сосудистая хир. — 2001 - №4 — С 13-18
Скопин И. И., Макушин А А., Машина 7 В и др Клинико-гемодинамическая оценка совре-
менных низкопрофильных протезов малого диаметра при изолированных аортальных по-
роках у взрослых // Сердечно-сосудистые заболевания. — Бюл НЦССХ им. А Н Бакулева
РАМН. — 2005. - Т. 6 — № 5 — С. 30
Скопин И И, Какулия П. В., Макушин А А Реконструкция корня аорты у больных с двуствор-
чатым аортальным клапаном // Сердечно-сосудистые заболевания — Бюл НЦССХ
им. А Н Бакулева РАМН. — 2005 — Т. 6 — № 5 — С 52.
Скопин И И., Мироненко В А., Милованкин Д А и др Непосредственные результаты рекон-
струкции подклапанных структур нитью PTFE при протезировании митрального клапана //
Сердечно-сосудистые заболевания — Бюл НЦССХ им А Н Бакулева РАМН — 2004. —
Т 5 — № 11 — С 33
Скопин И И , Муратов Р. М., Мироненко В. А и др Варианты сохранения подклапанных струк-
тур при протезировании митрального клапана // Грудная и сердечно-сосудистая хир —
2001 — №1 — С 26-29
Суханов С Г., Кашин В А., Макарихин А В и др Применение механических двустворчатых
клапанов «Карбоникс» // Сердечно-сосудистые заболевания — Бюл НЦССХ им А. Н. Ба-
кулева РАМН — 2004. — Т 5 — № 11 — С. 39
Углов Ф Г., Зубцовский В Н Методы частичного протезирования и полной замены клапанов
сердца // Вести хир — 1966 — № 8. — С 122-131
Углов Ф Г, Зубцовский В Н Полное протезирование митрального клапана у больной спустя 5
лет после аннулопластики // Вестн хир. — 1967 __№ 11 ___С 152-153
Уоллес Р Развитие хирургии аортального клапана // Из истории сердечно-сосудистой хирург
гии Под ред Бокерии Л. А — М.: Изд-во НЦССХ им А Н Бакулева РАМН, 1997 —
Фаминский Д. О Протезы ЭМИКС и ЛИКС в клапанной хирургии сердца (опыт клинического
применения) Автореф дис. докт мед. наук - НЦССХ им А. Н Бакулева АМН СССР -
Москва — 1991
’ Фадеее А А Агафонов А 6. и др Новый искусственный клапан серди3
ЭЛМ К // Грудная и сердечно-сосудистая хирургия. — 1994 — №5 — С 30-33
г м геД ) ПротезиР°вание клапанов сердца // Научный обзор - Москва. - 1971
отечественныЛй^080^^ Л ’ Г1етросян ю С. и др Клинико-гемодинамическая оценка
ная хи^ргия 2°^^ при длительных сроках наблюдения // ГруД-
°’ Гвах?рия И н и ДР Сравнительная оценка отечественных
1990 — №10 — С зд_4зМИТРальнои позиЦии // Грудная и сердечно-сосудистая хирургия —
НИКС- Автореф0дис3 канпСКаЯ И клиническая °иенка искусственного клапана сердца ПЛА-
русь - Минею * 1996 МеА НаУК ~ Бел°Русск™ НИИ кардиологии М3 республ Белэ-
оЮ Л , Евдокимов С В Протез клапана сердца Патент РФ № 2240756 от 27 11 2004
ГЛАВА 2 Механические искусственные к папа ны серД11в
Шевченко Ю Л , Попов Л В , Далинин В В и др Применение металлического серег *ра в про
филактике протезного эндокардита // Сердечно-сосудистые заболевания — Бюл НЦССХ
им А Н Бакулева РАМН — 2005 —Тб — №5 —С 53
Шевченко Ю Л , Попов Л В , Емельянов В В и др Результаты протезирования митрального
клапана с полным или частичным сохранением клапанного аппарата // Сердечно-сосудис-
тые заболевания — Бюл НЦССХ им А Н Бакулева РАМН — 2005 —Тб - № 5 —С 54
Шевченко Ю Л, Попов Л В., Морозов А В и др Функциональный результат протезирова-
ния аортального клапана при узком корне аорты у взрослых Анализ 79 операции // Сер-
дечно-сосудистые заболевания — Бюл НЦССХ им А Н Бакулева РАМН — 2005 —
Т 6 — No 5 — С 32
Шевченко Ю Л., Попов Л В , Травин И О Применение протезов малого диаметра при узком
корне аорты у взрослых. Ретроспективный анализ 50 операций // Сердечно-сосудистые
заболевания — Бюл НЦССХ им А Н Бакулева РАМН — 2004 — Т 5 — № 11 — С 36
Шихвердиев Н. Н, Семяшкин А М Феномен несоответствия клапанного протеза пациенту в
хирургии аортальных пороков // Сердечно-сосудистые заболевания — Бюл НЦССХ им
А Н Бакулева РАМН — 2005. — Тб- №5 —С 32
Шумаков В И Протезирование клапанов сердца Дис докт мед наук — М , 1965
Шумаков В И , Зверев Б П Искусственные шариковые клапаны сердца // Хирургия — 1966 —
№ 4 — С 26-32
Шумаков В. И , Иванов Е А , Пацев Б Н и др Искусственные клапаны сердца с приспособле-
нием для бесшовной механической фиксации // Грудная хир —- 1966 — № 4 —
С 108-112
Шумаков В И., Семеновский М Л, Вавилов П А и др Пятилетнии опыт протезирования кла-
панов сердца двустворчатыми протезами «МЕДИНЖ-2» // Сб тр.: Протезы клапанов серд-
ца «МЕДИНЖ» в хирургии клапанных пороков сердца — 2004 — С 62-74
Шумаков В И., Семеновский М Л . Соколов В В Протезирование митрального клапана с пол-
ным или частичным сохранением подклапанного аппарата // Грудная хир — 1989 — № 3 —
С 5-9
Aagaard J, Andersen Н L . Lerbjerg L Expanding the use of total mitral valve preservation in
combination with implantation of the CarboMedics heart valve prosthesis // J Cardiovasc Surg —
1999 — Vol 40, № 1 — P 177-181
Abe T, Kamata К, Kuwaki К et al Ten years’ experience of aortic valve replacement with the
Omnicarbon valve prosthesis // An Thorac Surg — 1996 — Vol 61, N° 5 — P 1182-116
Agnew T M, Carlisle R Premature valve closure in patients with a mitral Starr-Edwards prosthesis
and aortic incompetence // Brit Heart J — 1970 — Vol 32, № 4 — P 436-439
Akins C W Mechanical cardiac valvulai prostheses// An Thorac. Surg — 1991 — Vol 52, № 1 —
P. 161-172
Akutsu T Design criteria for artificial heart valves//J Thorac Cardiovasc Surg —1970 — Vol 60.
№ I — P 34-45
Akutsu T, Dreger В , Kolff W J Polyurethane artificial heart valves in animals // J Appl Phys —
1959 — Vol 14, №4. - P 1045-1048
Akutsu T. Mirkovitch V, Kolff W Teflon as experimental replacement for mitral and tricuspid valves //
J Speech Res - 1961 - Vol 1, № 1 - 188-191
Albes J M., Hartrumpf M., Rudolph V et al Are mechanical valves with enhanced inner diameter
advantageous in the small sized aortic annulus? I I An Thorac Surg — 2003 — Vol 76, № 5
P 1564-1570
Alsaddique A A CarboMedics bileaflet prosthesis, experience with 165 uneventful implants //
J Caidiovasc Surg — 2002 — Vol 10, № 5 — P 512-516
Alvarez L , Escudero C, Figuera D et al The Bjork—Shiley valve prosthesis Analysis of long term
evolution //J Thorac Cardiovasc Surg — 1978 — Vol 104, №5. P 1249-1258
Alvarez-Diaz F, Melrose D G Nueva protesis mitral Communication preliminary//Rev Clin Espan —
1964 - Vol 43, № 2 — P 322-325
Anderson И/ A , llkowski D A , Eldiedge J et al The small aortic root and the Medtronic — Hall
valve Ultrafast computed tomography assessment of left ventricular mass following aorta vs I e
replacement // J Heart Valve Dis — 1996 — Vol 5, № 2 — P 329 -335
Anttila V, Heikkinen J, Biancan F et al A retrospective comparative study of aortic valve replacement
with St Jude medical and Medtronic-Hall prostheses a 20-year follow-up study / Scand
Cardiovasc. J — 2002 — Vol 36 № 1 - P 53-59
Antunes J Technique of implantation of the Medtronic Hall valve and other modern tiltmg-dis
prostheses //J Cardiac Surg — 1990 — Vol 5, № 1 — P 86-89
127
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
Untunes М J. Clinical performance of St. Jude and Medtronic — Hall piostheses: a randomized
comparative study / An. Thorac Surg. — 1990. — Vol. 50, № 3. — P 743-747.
Aovap/ S Kaw.ra T, Fukunaga S et al. Cineradiographic evaluation of ATS open pivot bileaflet valves
, J Heart Valve Dis. — 1997. — Vol. 6, № 2. — P. 258-263.
Aramendi J. I., Castellanos E. Serrano A. et al A compaiative study of the St Jude Medical and
Bjork-Shilev Convexo-Concave prostheses in isolated valve replacement // J Cardiovasc Sum
(Torino), — 1991 — Vol. 32. № 5 — P 557-563.
Ans A., Padro J. M„ Camara M. L. et al. The Monostrut Bjork-Shiley valve. Seven years’ experience
J. Thoiac. Caidiovasc. Suig. — 1992. — Vol 103, № 4. — R 1074 -1082.
Amgom M. G. Danielson G. K., Mankin H. T et al. Aortic valve replacement with cloth-covered
composite-seat Starr-Edwards prosthesis A review of 32 months of clinical experience И
J Thoiac Cardiovasc Surg — 1973. — Vol 65, № 2 — P 376-380.
Arrigoni M G., Pluth J H, Danielson G. K. et al. Stuck aortic poppet hazard of close-clearance
cloth-covered prosthetic aortic valves // JAMA. — 1972 — Vol 219, №2 — P. 183-186.
АПи^ R,n^S" C' et al Wear assessmer|t 'П bileaflet heart valves // J Heart Valve
Dis. — 1996. — Vol. 5 (Suppl 1). — P. 133-143
SaZn^29¥.U^ M'nal valve replacement wlth preservation of the posterior leaflet, chordae
tendmeae and papillary muscles using mechanical prosthetic valves // J. Thorac. Cardiovasc
burg — 1985. — Vol. 26, № 1. — p 3-6.
^M^difai RpaAntanrtr Sa,kWa M\? e’ al Hemodynamics and early performance of the St. Jude
9 * aortic valve prosthesis // J. Heart Valve Dis — 2001. — Vol. 10 № 2. — R 436-
functionino aftw^ EpA ' f/0?3 M et aP Replacement of a Bjork-Shiley Delrin aortic valve still
functioning after 25 years // Tex Heart Inst. J. - 2004. — Vol 41 Mo ? _ p nnn лм
acme valve //₽«Pra!thZtic" l^T °’ Exper,ences with replacement of individual cusps of the
P X) Ш Pr°Sthet,C valves ,or cardiac s^9ery» Ed. Merendino K. A , Springfield. - 1961 -
valves in the^ortic^oosrhon-T,31 Doppler echocardiographic study of three different mechanical
1997 - S 6 № 3P - p 2зб!248е °’ eXtemat t0 b°dy surface araa " d Heart Valve Dis. -
heart value/^Eu^of^CardKithn31 Fluid dynanr|,cs of the Carbomedics Kinetic bileaflet prosthetic
Barclay R. S Re,d j м S^ensonTo et ~ ?97' “ V°L 11' № 2 ~ P 287' 292
Starr-Edwards prosthesis // Bn/Heart J ' °f mitral valve replacement with
Barnard C N . Schnre W FraLr p wu, ."7 1972' ~ VpL 34’ № 2. — P 129-133.
aortic prostheses // Surg _ 19K5 experiences with U.C.T. mitral, tricuspid, and
Barnard P M.. HeydenrychJ. J ihtT w ’ 5 ’ 2' ~ R 211"219-
Stellenbosch mitral valve prosthesis h p лг. !! Cllnical experience with the University of
Barnard C, Goosen C Prosthet c renbrL ~ 197°' “ VoL № 6- - P. 1377-1381
№ 7219 — p 25-28. P cement of the mitral valve // Lancet. — 1962 — Vol. 2,
prosthesis//J Cardiovasc Sum6* ^iqqs year fpH°w’uP of the Edwards-Duromedics bileaflet
Baumgartner H, Khan S S , DeRob^s M еГ У°п 36' № 2‘ ~ R 437~442-
area. An in vitro study // Circulation юоо 3 ^oppler assessment of prosthetic valve orifice
Beall A. c. Bloodwell R D Bheker D. Fet . p~ 85’ № 9 “ R 2275- 2283
one-half years' experience // Amer l ГдЛ । r°S??^!lc reP,acement of cardiac valves Five and
Beall A. C, BncKer D„ Cooley D et al ~ 96F ~ V°L 23- № 2 - P 250 257.
Beeson"dR^msW^KEn^ ~ 1965’~ №5.5^а^апа9егпеп‘ of acqU'red
Vol 32. № 4 (Suppl 2). J pe^'29 analys,s of prosthetrc heart valves // Circulation - 1965 -
Behrendt D M. Austen W G C '
“р’збТгvai,e />
SeXl j"mC яСXat,On n ln' J AniL Organs С-'^Э8 ₽0Wreihane heart valves: effects on fatigue
oemal J. M, Rahasa j M Gut i- 1998' ~ Vo1 21, Ns 3. — p 814-819
BenoyaR e f ° Th°rac Sur9 ~ 1 "8°-Voces' 7he CarboMed'cs valve: experience with 1049
Benoya r B Eecano p B M|Ua| ^VoL 65 №J - P , 37_ M3
19R //Thorax — 1972. — Vol 27, N<= 1 — P 87-89.
• fcO-----------
км МКЧ-25
Cooley-Cutter ВеэН Surgitool
Рис. 1. Осесимметричные искусственные клапаны сердца первого поколения
Рис. 2. Поворотно-дисковые
искусственные клапаны сердца
On-X
Carbomedics Standard
Sorin Bicarbon
St. Jude Medical Standard
Карбоникс-1
Puc. 3. Двустворчатые искусственные клапаны сердца
Aspire
Carpentier-Edwards Perimount
Sorin Pericarbon
St. Jude Medical Biocor
БиоЛАБ-В
ПериКор
Рис. 4. Каркасные биопротезы
клапанов сердца
Рис. 6. Естественные клапаны левых камер сердца человека
_ е 7 Супрааннуляриая техника имплантации механических двустворча
I"' клапанов сердца при двойном протезировании (в аортальной пози
ции Carbomedics Top Hat, в митральной - Carbomedics OptIForm)
Рис. 8. Схемы имплантации бескаркасного биопротеза Medtronic Freestyle:
в - с полным иссечением синусов; б-техника «вставки корня», в - техника «полного корня»
(по учебному CD фирмы Medtronic Inc , 1999)
V, см/с
V, см/с
Рис. 9. Профили скорости за аортальным клапаном, измеоеннк^ __
. Г w серенные ультразвуковым допплеровским
методом ,п v.vo: а - здоровый естественный клапан, б - стенозированным естественный клапан,
в - двустворчатый искусственный клапан сердца, г - дисковый искусственный клапан сердца
(по S Metti-Lmk et al , 2005)
Рис. 10. Пульсдупликатор с упругим левым желудочком, предсердием и аортой
(университет г. Чингуа, КНР, 1980 г)
Рис. 11. Установка для измерения структуры потока жидкости в искусственных
клапанах сердца методом трассирующих частиц (Герасский университет,
Бразилия,1990 г.)
Рис. 12. Стенды для измерения прочностных и гидродинамических характери-
стик искусственных клапанов сердца (Vivitro Systems Inc., Канада, . ООО г.)
Рис. 13. Распределения продольной скорости за двустворчатым искусственным клапаном серд*
ца К рбоникс-1 в модели корня аорты, рассчитанные по данным визуализации методом водо-
родных пузырьков
Рис. 14. Распределения скорости (стрелочки), завихренности (а) и максимальных сдвиговых
напряжений (б) за искусственным клапаном сердца BJdrk-Shlley Monoatrat на первом пике диасто-
лического расхода в эластичной модели левого желудочка, рассчитанные по данным визуализа-
ции методом трассирующих частиц (по A. Cenedese et al., 200
а гкппости за искусственными клапанами сердца Medtronlc-
Puc. 15. Распределения продольной скор' * Сврдолик КС-2 (е) и Мединж-2 (в) в модели
Hall (а), Ликс-2 (б), экспериментальным двустворчат
' ' ' корня аорты
-20
20
40 V, см/с
О
Рис. 16. Эволюция распределения скорости за моделью двустворчатого искусственного клапана
сердца на протяжении систолы при турбулентном течении в цилиндрическом канале (по М Krafczyk
et al., 1998)
Рис. 17. Распред^ ление сдвиговых напряжении за моделями дискового и двустворчатого искус
ственных клапанов сердца с подвижными створками (по О. Pilliccioni et al., 2003)
Рис. 18. Векторные поля скорости в модели бескаркасного биопротеза в систолу
(по J. De Hart, 2002)
Рис. 19. Поле скорости на уровне поверхности корпуса в шарнирном механизме физической
модели искусственного клапана сердца Carbomedics в различные фазы систолы, измеренное
лазерным допплеровским анемометром (по Н. A. Simon, 2004)
Углах = 0 52 М/С
t = 001 с(а =2.6°)
V, м/с
V, м/с
й485
1 4 16
] 3.46
2 77
9 0.08
I 1.39
I 0 69
I 0 00
V max “ 5 м/с
t = 0 03 с (а = 36.8°)
Рис. 20. Распределения скорости (вверху) и давления (внизу) во время закрытия створки м« т з-
матическои модели двустворчатого искусственного клапана сердца (по Y. G. Lai et al., 2002)
Pmin= -68 КПа
t = 0 0324c(a = 62 8°)
Рис. 21. Расчетное распределение первых главных напряжений в математической модели искус-
ственного клапана сердца Мединж-2 (красный цвет - места максимальных напряжений)
•пн.Ж.НИЙ • створках математической МОД.ЛИ к.ркасно-
Рис. 22. Расчетные распределении н,пряж*Н^ ₽мц, , СИСтолу (no J. De Hart, 2002)
го (а) и бескаркасного (б) биопротазо. клапаноа с.рдц»
Рис. 23. Клапаны тканевой инженерии: а - экспериментальный, выращенный на полимерной матрице
из костномозговых стволовых клеток в биореакторе за 14 дней (по S .P Hoerstrup et al, 2002); б - коммерческий
биопротез Matrix Р (по http Z/www.autotissue de)
Рис. 24. Структура створки клапана, выращенного в биореакторе методом тканевой инженерии:
а - в пульсирующем потоке - хорошая колонизация клетками, структурированная ткань створки плот-
ным наружным слоем; б - в стационарных условиях - слабая колонизация клетками, неструктурирован-
ная ткань, в - сформированные коллагеновые клетки I типа у кромки створки клапана - коллагеновье
клетки III типа там же (по S.P. Hoerstrup et al , 2002)
ГЛАВА 2, Механические искусственные клапаны сердца
Bertrand S, Houel R., Vermes E et al. Preliminary experience with Silzone-coated St Jude nodical
valves in acute infective endocarditis // J. Head Valve Dis — 2000 — Vol 9 No i _
P. 131-134.
Birkmeyer J. D., Marrin C. A. S., О Connor G T. Should patients with Bjork-Shiley valves undergo
prophylactic replacement? // Lancet — 1992. — Vol 340, № 3 — P 520-523
Bjork VOA new tilting disc valve prosthesis Ц Scand J Thorac. Cardiovasc. Sura — 1969 —
Vol. 3,№1.-P. 1-10
Bjork V O. Aortic valve replacement // Thorax — 1964 — Vol 19, № 2 — P 369-378
Bjork V. O. Aortic valve replacement with the Bjork-Shiley tilting disc valve prosthesis / Brit Heart J —
1971. — Vol. 33, № 1. — P. 42-46.
Bjork V. O. Brain prefusions in dogs with artificially oxygenated blood // Acta Chir. Scand. — 1948 —
Vol. 96, № 1 (Suppl. 137). — P. 1-122.
Bjork V О Henze A , Hindmarah T. Radiopaque marker in the tilting disc of the Bjork-Shiley heart
valve Evaluation of in vivo prosthetic valve function by cineangiography // J. Thorac. Cardiovasc
Surg — 1977. — Vol. 73, № 3 — P. 563-566.
Bjork V CL, Henze A Ten years’ experience with the Bjork-Shiley tilting disc valve // J Thorac
Cardiovasc. Surg. — 1979. — Vol. 78, № 2. — P. 331-342.
Bjork V. O., Lindblom D The Monostrut Bjork-Shiley heart valve // J. Am. Coll. Cardiol. — 1985. —
Vol. 6, № 4. — P. 1142-1148.
Bjork V O., Maiers B. Total mitral valve replacement: late results // J. Thorac Cardiovasc. Surg —
1964 — Vol. 48, № 4. — P 625-634.
Bjork V. O. The history of the Bjork-Shiley tilting disc valve // Med. Instrum. — 1977 — Vol. 11
№ 2. — P 80-83
Blackstone E H, Cosgrove D. M, Jamieson W R E. et al. Prosthesis size and long-term survival
after aortic valve replacement // J. Thorac. Cardiovasc. Surg. — 2003. — Vol. 126, N° 3. —
R 637-643.
Blais C., Dumesnil J. G., Baillot R et al. Impact of valve prosthesis-patient mismatch on short-term
mortality after aortic valve replacement // Circulation. — 2003. — Vol. 108, №8 — P. 983-988.
BHis C, Pibarot P., Dumesnil J G et al. Comparison of valve resistance with effective orifice area
regarding flow dependence // Am. J. Cardiol — 2001. — Vol. 88, № 1. — P 45-52.
Bokros J. C., Stupka J, Haubold A D et al Progress toward design optimization of bileaflet
mechanical heart valves // Proceed. Cardiovasc. Science Technol. — Conf., Bethesda, Maryland —
1992. — p. 71.
Bonchek L. /. Current status of cardiac valve replacement: selection of a prosthesis and indications
br operation // Am. Heart. J — 1981. — Vol. 101, № 1. — P. 96-98
Bonnabeau R. C., Lillehei C. W Mechanical «Ball» Failure in Starr-Edwards prosthetic valves //
J Thorac. Cardiovasc. Surg. — 1963. — Vol 56 №2 — P 258-264
Bonnabeau R. C., Mantim E L. et al. Replacement of the aortic valve with Starr Edwards and
sutureless (Magovern) prosthesis. Comparative lecathetenzation results // Amer J Cardiol —
1967 — vo| 20, № 3. — P. 314-323
Borman J. B., Brands W. G , Camilleri L. et al. Bicarbon valve — European multicenter clinical
evaluation // Eui J. Cardiothorac Surg. — 1998. — Vol. 13, № 6. — P 685-693.
Borman J. в., De Riberolles C. Sorin Bicarbon bileaflet valve, a 10-year experience // Eur. J.
Cardiothorac. Surg. — 2003. — Vol. 23, № 1. — P 86-92.
Braunwald N S.. Bonchek L I Prevention of thiombus formation on rigid prosthetic heart valves by
the ingrowth of autogenous tissue // J. Thorac Cardiovasc. Surg — 1967. — Vol. 54, № 5
R 630 -638
Braunwald N. S., Cooper T Morrow A G. Complete replacement of the mitral valve* successful
clinical application of a flexible polyurethane prosthesis //J. Thorac. Cardiovasc. Surg. — 1960
Vol 40, № 1. — R i-ц.
Braunwald N. S , Morrow A G. Tissue ingrowth the rigid valve: review of clinical and experimen-
tal experience during past year // J Thorac. Cardiovasc. Surg — 1968 — Vol 56, № 3 —
P 307-322
Braunwald N. S, Tatooles C, Tunna M. et al. New developments in the design of fabric-covered
Prosthetic heart valves // J. Thorac Cardiovasc Surg — 1971 — Vol 62, № 5. — P 673-682
rutelde la Riviere A , Dossche К. M, Birnbaum D E et al. First clinical experience with a mechanical
g,.*Va've w,th silver coating // Heart Valve Dis — 2000. — Vol. 9, № 1. — R 123-129.
uraoy j.' Ahluwaha M. S., Munroe C. et al. Mechanical heart valve protheses: identification and
Valuation (erratum) // Cardiovasc. Pathol — 2003 — Vol. 12, № 6. — P. 322-344.
----—--------------------------------------------------------- 129
Ус таенные клапаны сердца
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
Botany J. Naseemuddm A., Nair V et at DeBakey Surgitool mechanical^heart valve prosthesis,
exolanted at 32 years//Cardiovasc Pathol — 2004 — Vol 13, № 6. P. 345 346
Butchart E G Early clm.cal and hemodynamic results with Hall-Kaster valve in Medtronic International
Valve Symposium // Lisbon, Portugal, Congress Books. — 1981. P. 159.
Butchart EG Li H H„ Payne N et al Twenty years’ experience with the Medtronic Hall valve //
J Thorac Cardiovasc Surg — 2001. —Vol 121, № 4.— P 1090-1100
Butchart E G , Rizzoli G , Yacoub M et al. Prosthesis size and long-term survival after aortic valve
replacement // J Thorac Cardiovasc Surg — 2003 — Vol 126, № 3. — P 783 ?^6-
Calkavur T, Yagdi T., ApaydmA et al. Four years' experience with the Edwards-Tekna bileaflet valve
prosthesis // J Heart Valve Dis — 2002 — Vol 11, № 2 P. 263-269.
Camilleri L F, Bailly P, Legault B. J et al Mitral and mitro-aortic valve replacement with Sorin
Bicarbon valves compared with St Jude Medical valves // Cardiovasc Surg. 20 о ,
№2 — P. 272 — 280 ,
Campbell A , Baldwin T, Peterson G et al Pitfalls and outcomes from accelerated wear testing о
mechanical heart valves // J Heart Valve Dis — 1996. — Vol 5 (Suppl. 1). P 124-3 .
Capps S В , Elkins R C, Fronk D M Body surface area as a predictor of aortic and Pulmonary
valve diameter // J. Thorac Cardiovasc Surg. — 2000 — Vol 119, № 4. — P 975-982
Carlson D, Stephenson L Mechanical cardiac valves current status // Cardiol Clin — 198
Vol 3, No 3 - P 439-442
Carmen R , Mutha S C Lipid absorption by silicone rubber heart valve poppets — in vivo and in vi
results 11 J Biomed Mater Res — 1972 — Vol 6, № 2 — P 327-346.
Carrel T, Zingg U, Jenni R et al Early in vivo experience with the Hemodynamic Plus St
Medical heart valves in patients with narrowed aortic annulus // An Thorac. Surg — 199
Vol. 61 — №6 —P 1418-1421.
Carner M , Martineau J P, Bonan R et al Clinical and hemodynamic assessment of the Omniscienc
prosthetic heart valve // J. Thorac Cardiovasc. Surg — 1987 — Vol 93, № 2. — P 300-30
Cartwright R S, Giacobine J, Ratan R et al. Combined aortic and mitral valve replacement/
J Thorac Cardiovasc Surg — 1963 — Vol 45, № 1 — P 35-46
Cartwright R S , Smeloff E A , Davey T В et al Development of a titanium double-caged full-оп ice
ball valve //Trans Amer Soc Artif Int. Organs — 1964 — Vol 10, № 1. — P 231-236
Castro L J., Arcidi J M , Fisher A L et al Routine enlargement of the small aortic root a preventive
strategy to minimize mismatch // An Thorac. Surg — 2002. — Vol. 74,№ 1.-P 31-36
Chafizadeh E R, Zoghbi W A Doppler echocardiographic assessment of the St Jude Me ica^
prosthetic valve in the aortic position using the continuity equation // Circulation 199
Vol 83 — № 2 — P 213-223
Chambers E P, Heath В J Comparison of supraannular and subannular pledgeted sutures in mitra
valve replacement//An Thorac Surg — 1991 — Vol 51, № 1 — P 60-65
Chambers J , Cross J, Deverall P et al Echocardiographic description of the CarboMedics bilea e
prosthetic heart valve//J Am Coll Cardiol — 1993 — Vol 21 — №2 — P. 398-405 *
Chambers J., Ely J L Early postoperative echocardiographic hemodynamic performance of the
prosthetic heart valve a multicenter study//J Heart Valve Dis — 1998 — Vol 7, № 3 — P 569"5
Chambers J В , Deverall P В A study of the stability of orientation in the CarboMedics bilea e
heart valve prosthesis // Eur J Cardiothorac Suig — 1992 — Vol 6, № 3 — P 442-445
Chnstakrs G T, Joyner C D , Morgan C D et al Left ventricular mass regression early after ao
valve replacement//An Thorac Surg — 1996 — Vol 62, № 7 — P 1084-1089 .
Clapper D L , Anderson A В Photochemical coatings to improve tissue compatibility an
thromboresistance of implant devices // Mater Technol — 1995 — Vol 10, № 1 — P 147-4^
clinical life history of prosthetic heart valves // J Cardiovasc Surg (Torino)
1981 —Vol 22, №2. —P 441-443
Cobanoglu A . Fessler C L , Guvendik L et al Aortic valve replacement with the Starr-Edwards
P^sJhes|s a comparison of the first and second decades of follow-up // An Thorac Surg
1988 — Vol 45 — № 2 — P 248-252
Cobbs В W. Hatcher C R , Craver J. M et al Transverse midventncular disruption after mitral valve
replacement // Amer Heart J — 1980 — Vol 99, № 1 — P 33-35
Cohn L H, Reis R L , Morrow A G Left ventncula’r function after mitral valve replacement
Comparative studies following resection or preservation of chordae tendmeae // J Thorac.
Cardiovasc Surg — 1968 — Vol 56, № 1 — p 11-15
130
ГЛАВА 2 Механические искусственные клапаны сердца
Conkle D М., Hannah Н Н Reis R L Effects of tachycardia on the function of the Starr-Edwards
mitral ball valve prosthesis // Amer. J. Cardiol — 1973 — Vol 31, № 1. — P 105-107
Cooley D A Simplified techniques of valve replacement // J Cardiac. Surg — 1992 — Vol 7,
№ 2. — P. 357-359
Cooley D. A., Bloodwell R D , Hallman G Mitral valve replacement with a discoid prosthesis // An.
Thorac Surg — 1967 — Vol. 3, № 6. — P 487-502
Cooley D A , Bloodwell R D , Okies J 5 et al Long-term results after cardiac valve replacements
clinical experience with 2097 patients // In- Prosthetic heart valves (Brewer L. A. ed.) — Spring,
ill , Charles C Thomas, Publisher, 1969. — Ch 35 — P. 530-540
Cooley D. A , Liotta D, Cromle H W et al Aortic valve prosthesis incorporating light weight titanium
ball, dacron velour covere cage and seat // Trans. Amer Soc Artif Int. Organs — 1967 —
Vol. 13, № 1. — P 93-100.
Cooley D A., Okies J. E., Wukasch D. C et al. Ten-year experience with cardiac valve replacement
Results with a new mitral prosthesis //An. Surg — 1973 — Vol 177, № 6. — P 818-826
Cortina J M, Martinell J, Artiz V. et al Comparative clinical results with Omniscience (STM1),
Medtronic-Hall, and Bjork-Shiley convexo-concave (70 degrees) prostheses in mitral valve
replacement // J Thorac. Cardiovasc. Surg — 1986. — Vol 91, № 1. — P 174-182.
Cross F S., Akao M., Jones R. D Comparison of ball and lens heart valve prostheses // Surgery —
1967 — Vol 62, № 4 — R 797-806
Cross F S., Akao M., Jones R D Three years clinical experience with the lens mitral valve I I In
Prosthetic heart valves (Brewer L. A. ed.) — Spring, ill., Charles C. Thomas, Publisher, 1969 —
Ch 39. — P 579-586
Cruz A В, Kaster R L., Simmons R L et al. A new caged meniscus prosthetic heart valve //
Surgery — 1965 — Vol 58, № 5 — P 995-998
Daebritz S H.. Fausten В , Hermanns B. et al. New Flexible Polymeric Heart Valve Prostheses for the
Mitral and Aortic Positions // The Heart Surgery Forum — 2004 — Vol. 7, № 5. — P. 525-532
Daenen W, Nevelsteen A., Cauwelaert Ph Reoperation after Bjork-Shiley valvular replacement I I
J Cardiovasc. Surg. (Torino) — 1981. — Vol 22, №3. -P 485-488
Dalrymple H. M J, Pearce R K., Dawkins M P et al Mid-term results with 1503 CarboMedics
mechanical valve implants // J Heart Valve Dis. — 2000 — Vol 9, № 2 — P 389-395
Dalrymple H M J., Pearce R. K., Dawkins M. P et al. A single — center experience with 1378
CarboMedics mechanical valve implants // An Thorac Surg — 2000. — Vol 69, Ng 2 —
R 457-463
David T E Mitral valve replacement with preservation of chordae tendmeae. Rationale and technical
considerations // An Thorac Surg — 1986. — Vol 41, № 3. — P 680-688
Davila J C. Initial clinical trials of a new, nonthrombogenic mitral-valve prosthesis // An Thorac.
Surg — 1968. — Vol 6, № 1. — P. 99-118
De Brux J L., Subayi J. B., Binuam P. et al Doppler-echocardiographic assessment of the
Carbomedics supra-annular «Тор-Hat» prosthetic heart valve in the aortic position // J Heart
Valve Dis — 1996 — Vol 5(Suppl 3} — P. 336-338
De Feo M., Renzulh A , Onorati F et al Initial clinical and hemodynamic experience with Edwards
MIRA mechanical bileaflet valve // J Cardiovasc Surg — 2003 — Vol 44, № 1 —
P 25-30.
De Paulis R, Sommanva L., DeMatteis G M et al Hemodynamic performances of small diameter
CarboMedics and St Jude valves // J Heart Valve Dis — 1996 — Vol 5 (Suppl. III). —
P 339-343
Dossche К, Vanermen H., Daenen W. et al Hemodynamic performance of the PRIMA Edwards
stentless aortic xenogiaft early results of a multicenter clinical trial // J Thorac Cardiovasc.
Surg — 1996 — Vol 44 № 1 — R 11-14.
Dumesnil J G , Honos G N, Lemieux M et al Validation and applications of indexed aortic prosthetic
valve areas calculated by Doppler echocardiography // J Am Coll Cardiol — 1990 — Vol 16,
№ 4 — P 637-643
Edwards M S., Edwards M M., Edwards L In- Miles Lowell Edwards his ancestors and descen-
dants // Santa Ana, Calif Pioneer Press — 1972. — P 11-26
Edwards M S , Russell G. В et al Results of valve replacement with Omniscience mechanical
prostheses // An Thorac Surg. — 2002. — Vol 74, № 3 — P 665-670
Ellis F н, Bulbulian A H Prosthetic replacement of the mitral valve. I Preliminary experimental
observations // Mayo Clin Proc — 1958 — Vol 33, Ng 4 — P 532-534
131
6*
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
1—“«*====“
7Heart Vafeaf ^алГТуа. ‘/7,7'JT’ “ °’,he ATS mechanical heart valve П
H =’;;й “
systemic embolism of ball fragments Am T r Practure of a Starr-Edwards aortic ball valve
FraterR W M. Mitral valve anatoXnH/Z / CardloL “ 1969 ~ VoL 23 № 3 - P 458-463
Vol 36, № 23 — P 582-593 Prosthetic valve design // Proc Staff. Mayo Clinic — 1961 -
Garsia del Castillo H, Larroifsse-Perp? р к л r+ <-
of a Bjork-Shiley mitral valve nro^thPQie п/а‘ et al ^racture and disc embolization
Gelsom.no S. MoXftr G d! c“ P ZZ, 7 СаГЙЮ| ~ 1985‘ ~ VoL 55, № 3. - P 597-599
replacement with the St Jude Mpdmai d„ * ln viv0 hemodynamic results after aortic valve
stenosis I IJ Cardiac Sura — ж« 9ent mechanical heart valve in patients with pure aortic
Gibson T C, Starck P J MoosS et al F 7 РГ 18(2) ~ P 125-132
the LHIeche.-Kaster m’rtra! valve ur ?gra?hlc and Phonocardiograph.c characteristics of
G.ll.novA M, Blackstone E H ' SJfu U,at,on ~ ’974 - Vol 49, №3.-P 434-440
valve: a multicenter study // An Thnr=>n c e* a ^he Carbomedics Top Hat supraannular aortic
Glower D. D. Landolfo К. P, d^s R n 2003 ~ 75- № 4 - R 1175-1180
mitral valve replacement with or with™ it г-н a ®mParison °f open mitral commissurotomy with
Circulation — 1998 — Vol 98 No i p n? Preservation in patients with mitral stenosis//
Gonzalez-Juanatey J r veoa F ' ' ~ P 120~126
ventricular mass on left ventricular<chastni’>n^UC,e F et al lnfluence of prosthesis size and left
Corti/ Valve Dis — 2001 — Vol ю No q res®rve ln patients with aortic valve prostheses //
Gott V, Daggett R, w.ffen Y et al Reni ’ 5‘ ~ P 6”~618
Nor3 9J?ph,te-coated valve prosthesiT*/'/* 77° canine pulmonary valve and pulmonary artery
*;6 ~ p 713-723 Prosthesis // j Thorac Cardlovasc _ p
Grubttzsch H„ Wollert H G„ Eckel L Rom
Hal^K i/hcS'S 11 An thorac Surg — 2001°™ W'th sl,ver coated mechanical heart valve
паи к V Surgical considerations rn U‘ ~ Vo1 72, № 8 — p 1799^1740
Hall к V Th,r°MC'Ha" head valve // JV0CardiacISSunterfereriCe baSed on a ‘е"-Уеаг experience with
Eur j ТД НM®dtr°nic-Hall valve A desran ,n t~ 1988 ~ Vol 3, № 1 - P 103-105
H^l К V, Kasler~ 1992 ~ Vol. 6 (Suppl p °' Va'V6 Гер,аСете"‘"
HallKSV. Nitter^aLg^s 2A №" '-PpV3d6P'VOtal disk-type prosthetic heart valve // J Oslo City
HallmarG^L 7? AlTt Co11 Cardiol — 1 рП?.'ЬаИ years’ experience with the Medtronic
cfr u L Okies J К MesamprP > . VoL 6* №7.-P 1417-1421
BaS) ^°fgh7e2S'S Long-term Prognos s fJllo'wnn ^i'650"5 after valve reP'acement with Wada-
HammeXster L 7’ № 1 ~ P Valve placement // Adv Card.ol (Ka.ger,
ter/ £ Dillard D H is
Cardiovasc Sur^lf^g^8® w'th an9'ocardi^raphraand hem^"* m'tra' re9u'9'tat,on ln a Cr0SS’
Hanayama N, Christakis G^r ~ Vo1 58, № 4 — P 575_58Qernodynamlc observations//J Tt10raC
p 1822- ia83iment Valve S'ze may be 'rrelevant/Уд'e TbPr°Sthes's mismatch is rare after aortic
Harken о E ^gtloff d м H A" Thorac. Surg - 2002. - Vol 73, № 9 -
Harken D E^So^ftH S ^aylo^H^ H Va'Ve П J ТЬ°ГаС Cardlovasc Surg '
Harken D E, Soroff н <j!ovasc Surg — igg0 ^373.aPd complete prosthesis in aortic msuffici-
SarQery (MerendTno к д J etal Xravalve ' n. ’ № 6 ~ p 744-762
----- ed ) —Springfield ThomaeaCemen’ ln Prosthetic Valves for Cardiac
132 __ hOmas - ’961 - p 508-526
ГЛА В А 2. Механические искусственные клапаны сердца
Hasegawa М Clinical evaluation of ATS prosthetic valve by Doppler echocardiography comparison
with St Jude Medical (SJM) valve // An Thorac Cardiovasc. Surg — 2000. — Vol 6 № 2. -
R 247-252
Hasenkam J M, Pasqumo E, Stacchino C et al Wear patterns in the Sorin Bicarbon mechanical
heart valve: a chmical explant study // J. Heart Valve Dis — 1997 — Vol 6, № 2 — P 105-114
Hayashi J., Nakazawa S, Eguchi S et al Long-term outcome of patients who received Starr—Edwards
valves between 1965 and 1977 // Cardiovasc Surg. — 1996 — Vol. 4, № 2. — P 281-284
He G. W., Grunkemeier G. L , Gately H L. et al. Up to thirty-year survival after aortic valve replacement
in the small aortic root // An. Thorac Surg — 1995 — Vol 59, № 5 — P 1056-1062.
Healy T. M., Fontaine A A., Ellis J. T et al Visualization of the hinge flow in a 5.1 scaled model of the
Medtronic Parallel bileaflet heart valve prosthesis // Exp in Fluids — 1998 — Vol 25, №3 —
P. 512-518.
Henderson B. J, Mitha A. S., Roux В T et al Haemolysis related to mitral valve replacement with
the Beall valve prosthesis I I Thorax — 1973 — Vol 23, № 4 — P 488-491
Hering D, Piper C, Bergemann R et al Thromboembolic and bleeding complications following St
Jude Medical valve replacement results of the German Experience With Low-Intensity
Anticoagulation Study // Chest — 2005. — Vol 127, № 1. — P. 53-59.
Hernmer И/ B., Doss M., Hannekum A et al Leaflet escape in a TEKNA and an original Duromedics
bileaflet valve // An. Thorac Surg. — 2000 — Vol 69, № 5. — P. 942-944
Higashita R , Ichikawa S, Nunami H Long-term results after Starr-Edwards mitral valve replacement
in children aged 5 years or younger //An Thorac. Surg — 2003. — Vol 75, № 3. — P. 826-829.
Hoffmann A., Haefeh R, Vetss Ph et al Influence of different pressure gradients on the late clinical
outcome after aortic valve replacement I I J. Heart Valve Disease — 1992. — Vol. 1, № 1 —
P 51-54
Hopeman A B., Treasure R L , Hall R J Mechanical disfunction in caged-lens prostheses //
J. Thorac Cardiovasc Surg — 1970 — Vol 60, № 1. — P. 51-53
Horstkotte D., Schulte H D, Bircks И/ et al The Effect of chordae preservation on late outcome
after mitral valve replacement. A Rondomized study // J. Heart Valve Dis. — 1993. — Vol. 2,
№ 1 — P 150-158.
Houel R.t Kirsch M., Hillion M L et al. Silzone-coated St. Jude medical valve: a safe valve // J. Heart
Valve Dis — 2001 — Vol 10, № 4 — P 724-727
Hsi D. H, Ryan G F, Taft J et al A 29-year-old Harken disk mitral valve: long-term follow-up by
echocardiographic and cmeradiographic imaging // Tex Heart Inst. J — 2003 — Vol. 30,
№ 4. — P 319-321.
Hedges R К Complications of Starr-Edwards mitral valve replacement // J. Thorac. Cardiovasc.
Surg. — 1965 — Vol. 49, № 5 — P 731-736
Hufnagel C A Aortic plastic valvular prosthesis // Bull Georgetown Univ Med. Center. — 1951 —
Vol. 5, № 1 — R 128-130.
Hufnagel C. A., Conrad P W Prosthesis for aortic valve replacement // In: Prosthetic valves for cardiac
surgery. Ed. Merendmo К A., Springfield — 1961. — P 451-461.
Hufnagel C A , Vilkgas P D., Nahas H Experiences with new types of aortic valvular prostheses //
An. Surg — 1958 — Vol 147, № 4 — P 636-645.
Hufnagel C. A , Vilkgas P D., Nahas H Experiences with new types of aortic valvular prosthesis An.
Surg. — 1953 — Vol 147, № 5 — P 636-644
Hufnagel C A , Conrad P. W, Gillespie J. P. Study of prosthesis for replacement of aortic and mitral
valves // Circulation — 1964 — Vol. 30, No 4 (Suppl 3). — P 97-101
Hurle A , Abad C., Feijoo J et al Long-term clinical performance of Sorin tiltmg-disc mechanical
prostheses in the mitral and aortic position // J. Cardiovasc Surg (Torino) — 1997 — Vol. 38,
№ 4 — P. 507-512.
Indegha R A , Shea M A . Bernstein E F Erythrocyte destruction by prosthetic heart valves //
Circulation. — 1967 (Suppl 2) — P 149-154
lonescu A , Payne N , Fraser A G et al Incidence of embolism and paravalvar leak after St Jude
Silzone valve implantation experience from the Cardiff Embolic Risk Factor Study // Heart. —
2003. — Vol 89, № 9 — P 1055-1061
lonescu A A , Fraser A G High incidence of embolism after St Jude Silzone prosthetic valve
implantation // Circulation 1999 — Vol 100 — P 524
Jamieson W R., Miyagishima R T, GrunkemeierG L etal Bileaflet mechanical prostheses performance
m mitral position // Eur J Cardiothoiac Surg — 1999 — Vol 15, № 6. — P 786-794
133
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
Kaiser L R Kron I L, Spray T L Mastery of Cardiothoracic Surgery // Lippincott Raven Publ
Ka/teBdRIPLlhe^CW ^KasterT L Evaluation of a double-leaflet prosthetic o'
design for clinical use // In. Prosthetic heart valves (Brewer L A. ed.). - Spring, , Cha
Thnmac Pi ihhqhpr __ 1969 — Ch 19 — P 285 302
KaJe В R Manto E P. et al Hemodynam.c features of a double-leaflet^et.c heart valve of
new design // Trans Amer Soc Int Organs — 1967 — Vol.13, № 1. P 105 110.
Karlson К J Ashraf M M, Berger R L Rupture of left ventricle following mitral valve replacement //
An Thorac. Surg — 1988 — Vol 46, № 4 —P. 590-591. „i„r,rnc.nt of thp
KasterR L, Lnllehei C W Helgerund R J et al The design features and the development of the
torroidal prosthetic heart valve//Trans Amer Soc Artif Int Organs — 1969 — vol. io, in. г
P 206 212
Kawachi Y, Tommaga R , Tokunaga К Eleven-year follow-up study of aortic or aortic-mitral anulus-
enlarging procedure by Manouguian’s technique // J Thorac Cardiovasc Surg.
Vol 104, №6 — P 1259-1265 f
Kay E В Mendelsohn D et al. Surgical treatment of aortic valve disease // In Prosthetic valves
cardiac Surgery. Ed Merendmo К A , Springfield — 1961. — P. 485-492
Kay E В , Suzuki A et al Prosthetic replacement of the mitral valve //In. Prosthetic valves for carai
surgery Ed Merendmo К A , Springfield, 1961. — P 402-418 ___
Kay E В Suzuki A Evolution of aortic valvular prostheses//J Thorac Cardiovasc Surg — 19o
Vol 45, №3 - P 372-381
Kay E В , Suzuki A Demaney M et al Comparison of ball and disc valves for mitral valve replac
ment // Amer J Cardiol — 1966 — Vol 18, №4 — P. 504-514.
Kay J H., Kawashima Y Kagawa У et al A new disk valve // Amer. J. Cardiol — 1966. — Vol
№ 1 — P 127-129
Keenan R J, Armitage J M Trento A et al Clinical experience with the Medtronic-Hall vave
prosthesis // An Thorac Surg — 1990 — Vol 50, № 4 — P 748-752.
Kernan M C , Newman M H A prosthesis to replace the mitral valve. J Thorac Surg — 1957.
Vol 33 №5 - P 698-706.
Khan S., Chaux A , Matloft J et al The St Jude Medical valve experience with 1000 cases //
J Thorac Cardiovasc Surg — 1994 — Vol 108, № 5 — P 1010-1017
King M J, Olin Ch L , Fisher J An initial investigation into the wear and damage within the pivots о
three types of bileaflet mechanical heart valves // J Heart Valve Dis. — 1996 — Vol 5 (Suppl 1) "
P 111-114
Kitamura M Satoh M , Hachida M et al Aortic valve replacement in small aortic annulus with or
without annular enlagement // J Heart valve Dis. — 1996 — Vol 5, № 2. — R 289-293
Koertke H Seifert D, Drewek-Platena S et al Hemodynamic performance of the Medtronic
Advantage prosthetic heart valve in the aortic position echocardiographic evaluation at one year //
J Heart Valve Dis — 2003 — Vol 12 №3 — P 348-353
Konno S . Imai Y hda У et al A new method for prosthetic valve replacement in congenital aortic
stenosis associated with hypoplasia of the aortic valve rmq // J Thorac Cardiovasc Surg —
1975 — Vol 70, № 4 — P 909-917
Kratz J M , Sade R M Crawford FA et al The risk of small St Jude aortic valve prostheses // A"
Thorac Surg — 1994 — Vol 57, № 6 — P 1114-1119
Laas J Kleine P, Hasenkarn M J et al Orientation of tilting disc and bileaflet aortic valve substitutes
for optimal hemodynamics // An Thorac Surg — 1999 — Vol 68, № 6 — P 1096-1099
Labrousse L M Choukroun E., Serena D et al Prospective study of hemodynamic performances
of standard ATS and AP-ATS valves // J Heart Valve Dis. — 2003 — Vol 12, № 3 — P 341 -34
Laczkovics A HeidtM., Oelert H et al Early clinical experience with the On-X prosthetic heart valve
J Heart Valve Dis — 2001 — Vol 10, No 1 — p 94-99
Laub G W.. Murahdharan S Pollock S В At al The expenmental relat.onship between leaflet
C==tac One"±! fOr the St Jude Med,cal valve the position // J Thorac
Cardiovasc Surg — 1992 — Vol 103, №3 — P 638—642
Leesever₽KAnrtfrafto°n9Se H Ca''a^an J- c et al Hemodynamic changes following correction of
No 4 prt7iql79RSI US'n9 the Cutter*Smeloff prosthesis // Cuculation — 1970 — Vol 42•
134
ГЛАВА 2 Механические искусственные клапаны сердца
Lillehei С. W., Barnard С N et al Aortic valve reconstruction and replacement by total valve prosthe-
sis // In Prosthetic valves for cardiac surgery. Ed Merendmo К A., Springfield, 1961 — P 527-575
Lillehei C. W., Kaster R. L, Coleman M et al. Heart-valve replacement with Lillehei-Kaster pivoting
disk prosthesis // NY State Med. J. — 1974. — Vol 74, №7. -P 1426-1438
Lillehei C 1/V, Levy M. J., Bonnabeau R C. Mitral valve replacement with preservation of papillary
muscles and chordae tendmeae // J. Thorac Cardiovasc Surg — 1964. — Vol 47 No 4 -
P 533-543.
Lillehei C. W., Levy M J., Lillehei R et al Mitral, aortic and tricuspid valve replacement with the ball
valve // Surgery. — 1965 — Vol 57, № 1 — P. 184-204
Lillehei С W., Nakib A, Kaster R L. et al The toroidal heart valve // In: Prosthetic heart valves
(Brewer L. A ed ). — Spring, ill , Charles C Thomas, Publisher, 1969 — P 278- 284.
Lindblom D., Bjork V. O., Semb В. К H Mechanical failure of the Bjork-Shiley valve Incidence,
clinical presentation and management // J Thorac Cardiovasc Surg — 1986 — Vol 92,
№ 7. — P. 894-911.
Linhart J. 1/V., Barold S S , HildnerF. J. et al Clinical and hemodynamic findings following replacement
of the mitral valve with a Beall valve prosthesis (Dacron Velour-covered Teflon-Disc valve) //
Circulation — 1969 — Vol 39 (Suppl. 1). — P. 127-134.
Long D., Gott W., Sterns Z. et al Reconstruction and replacement of the mitral valve with plastic
prosthesis-prosthetic valvaes for cardiac surgery // In. Prosthetic valves for cardiac surgery Ed
Merendino К A., Springfield. — 1961. — P. 381-401
Lundblad R, Hagen О. M., Smith G et al. The CarboMedics supraannular Top Hat valve improves
prosthesis size in the aortic root // J. Heart Valve Dis — 2001. — Vol 10, № 2. — P. 196-201
Maehler H. E., Schmidt С. H., Neuner P. et al. Twenty-four years’ implant duration of the aortic Starr-
Edwards silastic ball prosthesis: a valve of the past? // Eur J Cardiothorac. Surg — 1993 —
Vol. 7, № 1 — P. 114-116
Macmanus Q, Grunkemeier G., Thomas D et al The Starr-Edwards model 6000 valve A fifteen
year follow-up of the first successful mitral prosthesis // Circulation. — 1977 — Vol 56, №4 —
P 623-625
Magovern G. J., Kent E M., Cromi H W et al Sutureless aortic and mitral prosthetic valves //
J Thorac Cardiovasc. Surg. — 1964 — Vol 43, № 3. — P. 346-357
Manouguian S, Seyboid-Eptmg IV Patch enlargement of the aortic valve ring by extending the aortic
incision into the anterior mitral leaflet new operative technique // J. Thorac. Cardiovasc Surg —
1979 — Vol 78, № 2 — P 402-412.
Mastroroberto P, Chello M., Bevacqua E et al Duromedics original prosthesis, what do we really
know about diagnosis and mechanism of leaflet escape? // Can. J. Cardiol. — 2002. — Vol 16
No 6 — P 1269 — 1272
Masuda M, Kado H Tatewaki H et al. Late results after mitral valve replacement with bileaflet
mechanical prosthesis in children: evaluation of prosthesis-patient mismatch //An Thorac Surg —
2004 — Vol 77, № 3. — P 913-917
Matthews A M. The Development of the Starr-Edwards Heart Valve // Tex. Heart Inst J — 1998 -
Vol 25, № 2 — P 282-293.
Mayumi H, Toshima Y., Kawachi Y et al. Simplified Manouguian's aortic annular enlargement for
aortic valve replacement //An Thorac Surg — 1995 — Vol. 60, № 5. — R 701-706
McGoon D C Prosthetic reconstruction of the aortic valve // Proc Staff. Meet Mayo Clin — 1961 —
Vol 36, № 4. — P 88-96
Medtronic-Hall prosthetic heart valve surgical, technical and handling considerations. 1991
Mikhail A A , Ellis R., Johnson S Eighteen-year evolution the Lillehei-Kaster valve to the Omni de-
sign // An. Thorac Surg — 1989 — Vol. 48, № 1 — P. 61-68.
Milano A , Bortolotti U., Mazzucco A et al Heart valve replacement with the Sorin tiltmg-disc
prosthesis A 10-year experience // J Thorac. Cardiovasc Surg — 1992 — Vol 103, № 2 —
P 267- 275
Miller D C, Oyer P E, Mitchell R S et al Performance characteristics of the Starr-Edwards model
1260 aortic valve prosthesis beyond ten years//J Thorac. Cardiovasc Surg — 1984 — Vol 88,
№ 1. — p 193-207
Miller D C., Oyer P. E Stinson E В et al Ten to fifteen year reassessment of the performance
characteristics of the Starr-Edwards Model 6120 mitral valve prosthesis // J Thorac. Cardiovasc
Surg. — 1983 — Vol 85, № 1 — P 1-9
Mohn H, Hesse/ E A., Nelson R J et al Design and durability test of Silastic trileaflet aortic valve
prostheses // J Thorac. Cardiovasc Surg — 1973. — Vol 65, № 4 — P 576-582
—----------------------------------------------------------------- 135
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
Мок С. К Cheung D L С. Chiu С S IV et al , An unusual lethal complication of preservation of
chordae tendmeae in nutral valve replacement // J Thorac Cardiovasc Surg — 1988 — Vol 95
MoZ:- heart valve at f,ve years I IAn Thorac
Montorsi P Teruzzi G , Calligans G et al Valve adaptation as a cause of disc opening reduction in
mechanical heart valves the case of the Lillehei-Kaster valve // Ital Heart J - 2003. - Vol 4,
postooeratwe chnicai dh ProstPetlc replacement of the mitral valve preoperative and
Vol 35 №7 ^™c^6^6h5emodynamic assessments in 100 patients // Circulation. - 1967 -
M° vIr?agS-'l985 - /пЭ J’(ed } Gu,de ,0 Prosthetic Cardiac Valves // New York, Sponger-
3pp4»t°?ьу леа
prosis®™ Ttac”^ “ аоз"“Р*Зе?5⹓,,¥ ? ,юГГб35 ’0,”C “
"“Sr&Sss: is« j'tSStV « «3«—» d
P 881-887 ,ur,OSTruT va,ve // J Thorac. Cardiovasc Surg. - 1991 - Vol 101, № 4 -
Nakano S , Matsuda H Shima7aki y at ->i лп ,
annulus in 33 patients undemnmn 1 An appraisal of Patch enlargement of the small aortic
1992 - Vol 6 № 2 1 P 347?355 replace™nt // Eur. J. Cardiothorac Surg -
ment // Thorax7'- 1970е-\/о^У25РНо 2 °-p6 The problem of aort,c valve replace-
N'Td;HMeS Hemodynamic pts^T™ W° Pe*<“ °f 19— St
Vol 74, № 4 - P 1120-Тш V3lVe " An Thorac Sur9 ~ 2002 -
Nitter-Hauge S , Abdelnoor M , Svennevio I i
prosthesis A follow-uo studv of 1 юл ™ Flflpen-year experience with the Medtronic-Hall valve
№ Ю - p 1105-1108 consecutive patents // Circulation - 1996 - Vol 94 -
№ 4 — p 525-526 ValVe replacement [letter] // An. Thorac. Surg — 1991 — Vol 51,
Olesen к H Rygg / и., Wennevold A et al Дпгъп ।
prosthesis in 262 patients an L a valve replacement with the Lillehei-Kaster
№ 6 - P 680-689 assessment after 9 to 17 years // Eur Heart J - 1991 - Vol. 12,
Or ulak T A , Schaff H V Puna F I at oi r
years a benchmark for comparison // Ди тг/еП* ^Jatus of the Starr-Edwards aortic valve to 20
Ostermeyerj.HorstkotteD Bennet J' ai tIa°№l9 ~ 1997 ~ Vo1 63, № 3 - P 620-626
strut fracture problem (present state of Informix 79 Pe9ree convexo-concave prosthesis
Vol 35, № 1. _ p 71_72 state of ^formation) // j Thorac Cardiovasc Surg - 1987 -
Pibarot P Dumo nil J Q 11
aorti valve position and its prevention0//С|,Пд a* ,mpact of Pr°sthesis-patient mismatch in the
P 1131-1136 Prevention Ц j Arn Col| Card|Q| _ № g ___
Pibarot P, Dumesnil J G Cartier P c Pt
P'bamfP gPeratl0a 11 An‘ Thorac Surg - 2001 Vo?^^ m?match can be predicted at the
ibarot P., Dumesnil J G , Jobin J et al i ii( , Vo 71 <SuPPl 5) — P 265-268
P^,ctin9 an increase in gradient during maxirnum °* the lndexed effective orifice area at rest in
Pluth J 'Vtk posit,on // Amer J. Cardiol — iggg patients w,th a bioprosthesis in the
Huth J p The starr va(ve U'UI 1У99 — Vol 83, № 4 — P 542-546
° wftfTthP ph Khuen,-Brady G. Eigenbauer^E е^аП rT 1?91 “ V°’ 51 ’ № 2 ~ P 333-334
J Thomr ^vaJ1ds’Duromedics bileaflet prosthe iq дП9 term resu,ts of heart valve replacement
Я=».тЮой s ““'„is 7, W "S. N. 9 -S°PC,2V5=' "
«ин i ii&zMjr I vy /-{ , IVanOW I at I г»
Pastan 11 Circu,atlon — гооо^^о!5 ioTn ™smatch affects survival after aortic
1J6 ~ 01 22' № 4 - P 614-620
ГЛАВА 2. Механические искусственные клапаны сердца
Rodgers В М, Sabiston D. С Hemolytic anemia following prosthetic valve replacement //
Circulation — 1969. — Vol 39, № 5. — P 155—161
Roe В В, Kelley P, Myers J Tricuspid leaflet aortic valve prosthesis // Circulation. — 1965 —
Vol 32, № 5 (supll 2). — P 180-185
Roedler S, Moritz A., Wutte M et al The Carbomedics «Top Hat» supraannular prosthesis in the
small aortic root // J. Cardiac. Surg — 1995 — Vol. 10, № 2. — P 198-204
Ruel M , Rubens F D., Masters R G et al Late incidence and predictors of persistent or recurrent
heart failure in patients with mitral prosthetic valves // J Thorac Cardiovasc Surg. — 2004 —
Vol 128, № 2. — P 278-283
Sala A , Schoevaerdts J C, Jaumin P et al Review of 387 isolated mitral valve replacements by the
Model 6120 Starr-Edwards prosthesis //J. Thorac Cardiovasc. Surg. — 1982. — Vol 84, № 5 —
p 744-749.
Salomon N W, Okies J. E, Krause A. H et al. Serial follow-up of an experimental bovine pericardial
aortic bioprosthesis Usefulness of pulsed Doppler echocardiography // Circulation — 1991 —
Vol 84 (Suppl III) — P 140-144
Schaff H V, Carrel T P, Jamieson W R et al Paravalvular leak and other events in silzone-coated
mechanical heart valves a report from AVERT // An Thorac. Surg — 2002 — Vol 73, № 5 —-
P 785-792
Schoevaerdts J C., Buche M, el Ganani A et al Twenty years’ experience with the model 6120
Starr-Edwards valve in the mitral position // J Thorac Cardiovasc. Surg. — 1987. — Vol 94,
№ 2 - P 375-382
Seipelt R G, Vazquez-Jimenez J F, Seipeltl M. et al The St. Jude «Silzone» valve, midterm results
in treatment of active endocarditis // An Thorac. Surg. — 2001. — Vol 72, № 3 — P 758-762
Servelie M , Arbonville G A ball valve prosthesis with a metalic ball jf Surgery — 1966 — Vol 59,
№2 — P 216-219
Seybold-Eptmg W, Hoffmeister H E. Clinical experience with enlargement of the aortic annulus by
extension of the aortic incision into the anterior mitral leaflet // J Thorac Cardiovasc Surg —
1980 — Vol. 28, № 3. — P 420-422.
Seybold-Eptmg W, Limet R., Scheid H. et al. Intermediate follow up of the TM bileaflet valve //
J Heart valve Dis. — 1998 — Vol 7, № 2 — P 219-224
Shiono M., Sezai Y, Sezai A et al. Multi-institutional experience of the ATS open pivot bileaflet valve
in Japan // An. Thorac Cardiovasc Surg — 1996. — Vol 1, № 1 — P. 21-23
Shu M C. S , Gross J. M., O'Rourke К К et al An integrated macro/micro approach to evaluating
pivot flow within the Medtronic Advantage bileaflet mechanical heart valve // J. Heart Valve Dis —
2003. — Vol 12, № 2. — P. 503- 512.
Sim E. K, Orszulak T A , Schaff H V. et al Influence of prosthesis size on change in left ventricular
mass following aortic valve replacement I I Eur J Cardiothorac. Surg — 1994 — Vol 8, № 2 —
P 293-297
Simon H., Helpap B., Koischwitz S Thrombosierung von Bjork-Shiley ventilen in Mitralposition mit
todlichem Ausgang // Herz. — 1979 — Vol 11, № 2 — P 62-64
Sin Y К, Campbell K, Pillai R The Ultracor tilting disc heart valve prosthesis in the aortic position:
mid-term follow up // J Heart Valve Dis — 2000. — Vol. 9, № 3 — P 688-692
Spencer F. C., Galloway A C., Colvin S В A clinical evaluation of the hypothesis that rupture of the
left ventricle following mitial valve replacement can be prevented by preservation of the chordae
of the mural leaflet // An Surg — 1985 — Vol 202, № 3. — P 673-677
Starek P J К, Beaudet R L , Hall V К The Medtronic-Hall valve. Development and clinical experien-
ce // In Cardiac Surgery Current Heart Valve Prosthesis (Crawford F. A , ed ) — Hanley & Belfus,
Philadelphia — 1987. — P 223-236
Starek P J к, McLaurin L P., Wilcox В R et al Clinical evaluation of the Lillehei-Kaster pivotmg-
disc valve // An Thorac. Surg — 1976 — Vol 22, № 2 — P 362-368
Starr A Total mitral valve replacement fixation and thrombosis// Surg Forum — 1960 — Vol 11,
№ 3 — p 258-260
Starr A. Cobanoglu A Starr-Edwards prostheses past to present // In International practice in
cardiothoiacic surgery (Yingkai W. Peters R M.. ed.). — Boston, Martinus Nyhoff Publishers. —
1986 — p 931-938
Starr A , Herr R H , Wood J A Mitial replacement Review of six years' experience // J Thorac.
Cardiovasc Surg — 1967 — Vol 54, № 2 — P 333-358
Starr A , Pfene W. R et al Cardiac valve replacement; experience with the durability of silicone rubber //
Circulation — 1966. — Vol. 33, № 4 (Suppl 1) — P 115-123
137
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
Stewart S Cianciotta D, Hicks G L et al The Lillehei-Kaster aortic valve prosthesis Long-term
lesults in 273 patients with 1253 patient-year of follow-up // J Thorac. Cardiovasc Surg —
1998 - Vol 95, № 6. — P. 1023-1030
Stieckenbach S Prosthetic valves — P 1 -56 In Clinical Transesophageal Et hocardiography, 2nd
e(j _ A Problem-Oriented Approach Konstadt S. N., Shernan S , Oka Y (eds ) Lippencot Williams
and Wilkins, 2004
Sudkamp M Lercher A J , Muller-Riemenschneider F. et al. Transvalvular in vivo gradients of the
new generation bileaflet heart valve prosthesis St Jude Medical Regent in aortic position // Thorac
Cardiovasc Surg — 2003. —Vol 51, № 3 — P 126-129
Teijeira F J Long term experience with the Omniscience cardiac valve // J Heart Valve Dis — 1998 -
Vol 7. №4 - P 540-547
Teoh К H , Fulop J C, Weisel R D et al. Aortic valve replacement with a small prosthesis //
Circulation - 1987 - Vol 76 (3 Pt2). — R 123-131.
Thevenet A Albat В Long-term follow up of 292 patients after valve replacement with the Omnicarbon
prosthetic valve // J Heart valve Dis — 1995 — Vol 4, № 5. — P. 634-639
Van Nooten G, Caes F, Francois К et al Clinical experience with the first 100 ATS heart valve
implants // J Cardiovasc Surg — 1996 — Vol 4, № 2. — P 288-292
Van Rijk-Zwikker G L , Delemarre В J, Huysmans H A The orientation of the bileaflet Carbomedics
valve in the mitral position determines left ventricular spatial flow patterns // Eur J Cardiothorac
Surg — 1996 — Vol 10, № 4 — P 513-520
Villafana M A «It will never work'» — The St Jude valve // An. Thorac. Surg — 1989 — Vol 48,
№ 1 — P 53-54,
Vitale N, Caldarera I, Muneretto C et al Clinical evaluation of St. Jude Medical Hemodynamic Plus
versus standard aortic valve prostheses The Italian multicenter, prospective, randomized study //
J Thorac Cardiovasc Surg — 2001, — Vol 122, №4 — R 691-698
Vitale N, Cappabianca G , Visicchio G et al Midterm evaluation of the Sorin Bicarbon heart valve
prosthesis single-center experience // An Thorac. Surg — 2004 — Vol 77, № 2. — P 527-
531
Wada J Komatsu S , Ikeda К et al A new hingeless valve // In: Prosthetic heart valves (Brewer L A
ed ) — Spring, ill , Charles C Thomas, Publisher, 1969 — P 304-314
Wagner E Die Verwendung der «Caged-ball» Klappe fur den totalen Erzatz der Aorten-und Mitral-
klappe//Thoraxchirurg Vascular Chirurgie — 1963 — Vol 10, № 3 — P. 331-343
Walther T, Falk V, Tigges R et al Comparison of On-X and SJM HP bileaflet aortic valves Ц J
Heart Valve Dis — 2000 — Vol 9, № 3 — P 403-407
Watanabe N, Abe T, Yamada О et al Comparative analysis of Omniscience and Omnicarbon
protsthesis after aortic valve replacement // Jpn J. Artif Organs — 1989 — Vol 18, № 6 —
Westaby S , Van Nooten G., Sharif H et al Valve replacement with the ATS open pivot ie
prosthesis 11 Eur J Cardiothorac Surg — 1996 — Vol 10, № 5 — P 660-665
Wisman С В , Pierce W. S , Donachy J H et al A polyurethane tnleaflet cardiac valve Pros __
vitro and in vivo studies 11 Trans. Am Soc Artif. Intern. Organs — 1982 — Vol 28, №
P 164-168
Yamaguchi M, Ohashi H, Imai M et al Bilateral enlargement of the aortic valve ring for_ya
replacement in children // J Thorac Cardiovasc Surg — 1991 — Vol 102 — P 202-20
Yamauchi M , Eishi К , Nakano K.. et al Valve replacement with the CarboMedics bileaflet mechani
prosthesis clinical results at midterm//J Cardiovasc Surg (Torino) — 1996 —Vol 37, №
P 285-287
Yazdanbakhsha A P, van den Brinkb R В A , Dekkerb E et al Small valve area index its ,П^®Г!|^
on early mortality after mitral valve replacement // Eur J Cardiothorac Surg — 2000 —
№ 2 - P 222-227 . ss
Yun К L, Sintek C F, Fletcher A D et al Aortic valve replacement with the Freestyle
bioprosthesis five-year experience // Circulation — 1999. — Vol 100 (Suppl II) — P ' je
Zingg U Aeschbacher В , Seiler C et al Early experience with the new masters series of St
Medical heart valve in vivo hemodynamic and clinical results in patients with narrowed ao
annulus // J Heart Valve Dis — 1997 — Vol 6, № 4. — P 535-541
138
ГЛАВА 3
БИОЛОГИЧЕСКИЕ ЗАМЕНИТЕЛИ
КЛАПАНОВ СЕРДЦА
Разработка и применение биологических заменителей клапанов сердца (биоклапа-
нов) насчитывает полувековую историю. Их постоянное усовершенствование и исполь-
зование в клинике в значительной степени связано с недостатками механических кла-
панов: тромбоэмболическими осложнениями, необходимостью пожизненного приема
антикоагулянтов, протезным эндокардитом и острыми дисфункциями Напротив, био-
логические заменители формируют структуру кровотока, близкую к физиологической,
обладают низкой тромбогенностью, в большинстве случаев позволяют избежать при-
ема антикоагулянтной терапии, а постепенное развитие их дисфункций дает возмож-
ность выполнить повторную операцию в плановом порядке
Основоположниками клинического применения биологических заменителей клапа-
нов сердца и создателями первых моделей являются В Barratt-Boyes, D. Ross,
A. Carpentier, W Hancock, W Angell Огромный вклад в разработку этой проблемы вне-
сли, U. Bortolotti, L. Cohn, W. Jamieson, R. Levy, A Milano и T David, а также ряд других
ученых Разработка биоклапанов сердца началась в конце 50-х гг XX столетия парал-
лельно с работами по созданию механических клапанов. Начало применения биологи-
ческих заменителей клапана аорты датируется 1955 г, когда G. Murrey (Murrey G., 1956)
впервые успешно имплантировал аортальный гомографт в нисходящий отдел грудной
аорты пациента (Баррат-Бойз Б., 1997) Первое сообщение об ортотопической имп-
лантации аортального гомографта было сделано A. J. Kerwin и соавт (1962). С этого
года D. N Ross и В Barratt-Boyes регулярно использовали гомографты для импланта-
ции в субкоронарную позицию (Ross D. N., 1964; Бокерия Л. А. и др., 1996, Баррат-
Бойз Б., 1997).
Однако ограниченная доступность аортальных гомографтов (аллографтов) и возра-
стающая потребность в заменителях клапана аорты стимулировали разработку ксено-
генных каркасных и бескаркасных протезов (таблица) В течение последующего деся-
тилетия получаемые экспериментальные и клинические результаты приносили больше
Эволюция биологических заменителей клапанов сердца (биоклапанов)
Конструк- ция Каркасные биопротезы — клапаны, взятые от животных (свиные). бычий перикард Трансплантаты — бескаркасные клапаны
Ксенографты (бескар- касные био- протезы, гетерографты) — клапаны, взятые от животных (свиные), бычий перикард Гомографты — клапаны, взятые от человека Клапаны, созданные методом тканевой инженерии
Материал
Аллографты— клапаны, взятые от другого человека Аутографты— клапаны, взятые от того же человека
Обработка химически стабилизированные нативные
139
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
ра очаровании, нежели успехов. Медленный пр ) ресс в т эй области в 60-е гг. XX сто-
летия был обусловлен слабым развитием иммунологии и недостатком сведений по био-
совместимости ксеногенных тканей в случае применения их у человека.
В терминологии, относящейся к биопротезированию, встречаются понятия, заим-
ствованные из иностранных языков: heterogenic — разнородный, homogeneous — од-
нородный, xenogenic — относящийся к другому биологическому виду, allogenic — от-
носящийся к другой особи того же биологического вида, autogeneous — выделенный
от самого больного, graft — трансплантат.
Первые успехи трансплантологии воодушевили кардиохирургов на поиски новых
решений в области протезирования клапанов сердца. Отдельные кардиохирурги пыта-
лись использовать собственные ткани человека, например широкую фасцию бедра и
аутоперикард, для изготовления створчатых клапанов, фиксированных на металличес-
ком каркасе (Senning A. et al., 1964). Однако клинические результаты в течение бли-
жайших трех лет оказались неудовлетворительными. Тем не менее, анализ отрицатель-
ных результатов позволил в дальнейшем A. Carpentier и соавт. (1969) теоретически и
экспериментально обосновать концепцию биопротезирования.
Биопротезы для сердечно-сосудистой системы получили свое второе рождение на
рубеже 60-70-х гг. XX столетия. С этого периода разработка биопротезов проводилась,
преимущественно, по двум направлениям: первое — развивались конструкции каркас-
ных биопротезов, второе — совершенствовалась технология структурной стабилиза-
ции биоткани Соотношение имлантированных биоклапанов и механических протезов
в последние годы составляет в мировой клинической практике, по данным F. J. Schoen
(2001), 45% и 55%, а по L. Н. Cohn. L. Н. Edmunds (2003) — 40% и 60%, соответственно.
В США это соотношение обратное, т. е. прослеживается тенденция к более широкому
применению биологических заменителей клапанов сердца. В 2002 г. впервые мировые
продажи биологических заменителей превысили продажи механических клапанов на
100 млн долларов США при общей сумме в 800 млн (Schoen F. J., 2001). Это обуслов-
лено, с одной стороны, неудовлетворенностью хирургов отдаленными результатами
прим мнения механических протезов, в частности количеством специфических ослож-
нений и качеством жизни пациентов, а с другой, — разработкой новых перспективных
конструкций и технологий изготовления биопротезов клапанов сердца. К таковым от-
носят бескаркасные биопротезы, или ксенографты.
СТРУКТУРНАЯ СТАБИЛИЗАЦИЯ, КОНСЕРВАЦИЯ
И СТЕРИЛИЗАЦИЯ БИОТКАНИ
Суть концепции биопротезирования клапанов сердца в главных положениях
к тому, что в основе длительной работы биологических протезов должна лежать
бильность их коллагеновой структуры во времени. Эта цель достигается путем со р
нения естественной архитектоники биологической ткани в процессе химической о> р
ботки и консервации при одновременном повышении устойчивости коллагена Ф
ментативному и механическому разрушению, предотвращения клеточных и иммун
воздействий со стороны организма реципиента, уменьшения зон концентрации напр
жения при фиксации биологической части протеза на каркасе (Дземешкевич С. •
др.. 2000). Стабилизация биологической ткани осуществляется путем ее химическ
обработки веществами, способными образовывать прочные интрамолекулярные и ме
молекулярные поперечные связи с аминокислотами молекул коллагена (Малинов^
скии Н.Н. и др., 1988; Барбараш Л. С. и др., 1994; Carpentier A. et al.. 1969). Стабили-
зирующие химические агенты также должны предотвращать кальцификацию и макси
мально сохранять эластические свойства ткани биопротеза, а методы их стерилиза
ции и консервации — сохранять морфологическую целостность и функциональную пол
140 -------
ГЛАВА 3. Биологические заменители клепаное сердца
ноценность биологического материала, достигнутую на этапе стабилизации (Малинов-
ский Н. Н. и др., 1988; Imamura Е. et al., 1992).
Первое применение в клинической практике необработанных ксенотрансплантатов
и каркасных биопротезов для замещения клапанов сердца относится к периоду 1965—
1967 гг., когда A. Carpentier имплантировал 47 пациентам эти заменители, стерилизо-
ванные раствором mercurial. В короткий послеоперационный период (несколько меся-
цев) всем выжившим больным потребовалось репротезирование. В период 1967-
1968 гг. также были имплантированы шесть биопротезов, обработанных раство-
ром формалина. Дисфункция биопротезов развилась в сроки до двух лет (Carpentier А.
et al., 1969).
Биопротезы, обработанные препаратом «Ciaht», также были имплантированы паци-
ентам J. Р. Binet в 1965 г. (Binet J. Р. et al., 1965). Однако данный метод обработки не
получил широкого распространения, так как через короткие сроки после имплантации
эти протезы подверглись выраженным деструктивным изменениям с развитием кли-
нически выраженной дисфункции. Глубокое замораживание с последующим у-облуче-
нием, как метод обработки биоклапанов, был предложен J. Malm в 1967 г Этот метод
обеспечивал достаточно надежную стерилизацию, но не влиял на иммуногенные свой-
ства ксеноткани.
Принципиально новый подход к вопросам обработки ксеноаортальных биоклапанов
связан с применением М. О’Влеп и J. Clarebrough 4% формальдегида (1966). В отли-
чие от предыдущих методов, направленных лишь на обеспечение стерильности и со-
хранения структуры биопротеза, использование формальдегида позволило повысить
жесткость ткани за счет поликонденсации белков. Данный способ обработки был встре-
чен с энтузиазмом, но клинические результаты его применения продемонстрировали
высокую частоту ранних дисфункций — 60% через 2 года и 100% через 4-6 лет. Деге-
неративные изменения ткани были связаны со свойствами самого консерванта. Фор-
мальдегид, имеющий в своей структуре лишь одну реакционноспособную группу (моно-
альдегид), образует с коллагеном мономолекулярные связи В результате фиксирован-
ная формальдегидом ткань со временем подвергалась дегенерации и кальцификации.
A. Carpentier (1969) на I Международной конференции по тканевым протезам на
основании изучения и анализа различных методик обработки предложил в качестве
дубящего агента глутаровый альдегид и сообщил о применении таких биопротезов у
30 больных с максимальным сроком наблюдения в 19 мес. Предложенный A. Carpentier
метод кондиционирования заключался в сочетанном применении метапериодата на-
трия и глутарового альдегида с последующей стадийной обработкой биоматериала: на
начальной стадии — удаление водорастворимых белков посредством электродиализа
или отмывания в солевом растворе, затем — денатурирование мукополисахаридов и
структурных гликопротеинов путем окисления метапериодатом натрия с дальнейшей
нейтрализацией окислителя этиленгликолем.
Заключительным этапом являлась стабилизация ткани в растворе глутаральдегида.
Этот метод превосходил все предложенные ранее по антигенодепрессивному, стери-
лизующему и сшивающему эффектам. Однако эти биопротезы через 2-3 года подвер-
гались массивной кальцификации. Оказалось, что метапериодат натрия способство-
вал кристаллизации фосфатов кальция на коллагене (Малиновский Н. Н. и др., 1988).
Молекулы глутаральдегида образуют необратимые химические межмолекулярные
связи коллагена (поперечные сшивки, или crosslinks), а также связи с белками других
структур нативного клапана (рис. 3.1). В результате такого химического воздействия
биологическая ткань в значительной степени теряет свои индивидуальные иммунные
свойства и становится устойчивой к воздействию коллагеназы. Резко возрастает так-
же устойчивость коллагена к термической денатурации, что свидетельствует о повы-
шении структурной стабильности волокнистого остова биологической ткани.
На основе экспериментальных исследований, проведенных в лаборатории
W. Hancock в начале 70-х гг, был предложен вариант обработки биоткани только глута-
----------------------------------------------------- 141 ---------
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
HN
FIXATIVE
FIXATIVE
Ml
FIXATIVE
Н01ПНЧ1НЖ П1НПКЧ
NH
О [ННОЧНЫ* г ВЯН1
Рис, 3,1. Свойства коллагена:
а _ схема образования поперечных сшивок и одиночных связей между молекулами фиксатора и
е-аминогруппами лизина и гидроксилизина коллагена (по Sung Н. W. et al., 1996); б — средние кри
вые деформирования образцов ксеноаортальных створок в окружном направлении: 1 — нативные
образцы; 2 — образцы, стабилизированные 0,625% глутаральдегидом; 3 — стабилизированные о
диэпоксидом; 4 — смесью 2% диэпоксида и 2% моноэпоксида; 5 — 2% диэпоксидом
ральдегидом. Имплантация таких клапанов началась в 1972 г. в Peter Bent Brigham
Hospital. Однако уже через несколько лет применения этих биопротезов стала очевид
на их ограниченная продолжительность функционирования в организме пациента.
Отметим главные недостатки обработки ксеноклапанов глутаральдегидом. Основ
ным морфологическим субстратом структурных изменений, наступающих в ткани оио
протезов, обработанных глутаральдегидом, является, прежде всего, образование каль
цинатов. Их структура и химический состав аналогичны минералам костной ткани —
гидроксиапатитам. Выделяют две группы факторов, способствующих развитию диет
рофической кальцификации биопротезов, стабилизированных глутаральдегидом.
К первой группе относятся возрастные, половые и индивидуальные особенности или
патологические нарушения гормональной регуляции кальциевого обмена пациента.
К факторам трансплантата относят изменения ксеноткани, происходящие под воздеи
ствием глутаральдегида, — формирование поперечных сшивок коллагена, девитализа
ция клеток, денатурация протеогликанов и изменения механических свойств ткани (Бар
бараш Л. С. и др., 1995; Журавлева И. Ю., 1995; Schoen F. J. et al., 1992; Girardot M. N.
et al., 1994).
Среди факторов реципиента наибольшее практическое значение имеет возраст
(Thandroyen F. Т., et al., 1980). В экспериментальной работе на модели подкожной имя
лантации крысам биоткани R. J. Levy и соавт. (1983) показали, что степень кальцифи
кации обработанной глутаральдегидом ткани находится в прямой зависимости от воз
раста животных. Частота развития дистрофической кальцификации биопротезов у м0
лодых пациентов (до 35-40 лет) составляет от 50% до 90% в сроки наблюдения до
пяти лет после операции. Вместе с тем, структурные изменения ткани имплантирован
ных каркасных биопротезов отмечались только у 10-20% пациентов в возрастной группе
старше 60 лет через десять лет после операции (Al-Khaja N. et al., 1991). Основное
влияние на процесс минерализации биопротезов у пациентов оказывает повышенный
уровень кальцитонина в крови, обусловленный индивидуальным, возрастным и пато
логическим метаболизмом (Дземешкевич С. Л., 1994; Журавлева И.Ю., 1996).
---------142------------------------------------------------------------------'
ГЛАВА 3. Биологические Заменители клапанов сердца
Одним из патогенетических механизмов развития дистрофической кальцифика-
ции является осаждение солей кальция на фосфолипидах мембран клеток стабили-
зированных биотканей (Schoen F. J. et al., 1992; Gross J. M., 2001). По этой гипотезе,
девитализация клеточной мембраны глутаральдегидом приводит к блокированию ак-
тивных кальциевых каналов и пассивному неконтролируемому входу кальция в клетку
по градиенту концентрации, связыванию его с мембранными фосфолипидами и об-
разованию комплексов кальций-фосфолипид-фосфат. Данные комплексы становятся
центрами нуклеации гидроксиапатита. Исследования процессов кальцификации на ор-
тотопической модели животных показали, что на 7-14-й день после операции отло-
жение кальция в девитализированных клеточных элементах ткани биопротезов пре-
кращается и начинает преобладать кальцификация фибриллярных структур аорталь-
ных створок. Следует отметить, что имплантированные подкожно крысам нативные
девитализированные створки подвергаются резорбции без признаков кальцифика-
ции, а биоматериал, стабилизированный глутаральдегидом, кальцифицируется. При
этом степень минерализации ткани находится в прямой зависимости от плотности
поперечных связей молекул коллагена. По-видимому, клеточный механизм кальци-
фикации не является основным в процессе минерализации ткани биоклапанов, об-
работанных глутаральдегидом (Журавлева И. Ю., 1996; Golomb G. et al., 1987; Liao К.
et al., 1995).
Другой механизм кальцификации связан с денатурацией протеогликанов глутараль-
дегидом, что сопровождается уменьшением гидрофильности внеклеточного матрикса,
нарушением катионообменной функции протеогликанов и повышением концентрации
фосфатов кальция в парафибриллярном пространстве (Барбараш Л. С. и др., 1985).
Согласно современным представлениям, в основе механизма кальцификации тка-
ни биопротезов лежат особенности структуры химических связей, образуемых между
коллагеном и глутаральдегидом (Журавлева И. Ю., 1996; Gross J. М., 2001). В работе
Е. A. Woodroof (1978) было показано, что образование поперечных сшивок молекул кол-
лагена происходит, в основном, за счет реакции е-аминогрупп лизина и гидроксилизи-
на с полимерными формами глутаральдегида. Такие связи содержат несколько актив-
ных атомов кислорода, способных к образованию прочных комплексов с катионами
кальция. Именно глутаральдегид формирует в коллагене центры связывания кальция и
является ключевым звеном в патогенезе минерализации ткани биопротезов (Гантиму-
рова И. Л., 1996; Журавлева И. Ю., 1996).
Дегенеративно-дистрофический процесс ткани створок биопротеза также развива-
ется под воздействием механического фактора. Косвенным доказательством его вли-
яния является большая частота развития структурной недостаточности биопротезов в
митральной позиции по сравнению с трикуспидальной (Бокерия Л. А. и др., 1996). Этот
феномен связан с выраженностью гемодинамической нагрузки на ткань биопротеза
(Журавлева И. Ю., 1996). Исследование биопротезов, удаленных в различные сроки
после операции, показало, что кальцификаты локализуются преимущественно в мес-
тах естественного нагружения створок — в области комиссур и основания (Ferrans V. J
et al., 1980; Schoen F. J. et al., 1992). Кроме кальцинатов в области свободного края,
комиссур и основания створок, выявлялись разрывы, надрывы и перфорации их ткани,
расщепление и распад коллагеновых волокон. Эти повреждения, как правило, сопро-
вождались кальцификацией. Механизм минерализации в данном случае связан с экс-
позицией кальцийсвязывающих локусов коллагена вследствие его прямого поврежде-
ния (Барбараш Л. С. и др., 1995; Thubrikar М. J. et al., 1983).
В ряде экспериментальных работ была доказана взаимосвязь механического стресса
и усталостного повреждения створок с развитием кальцификации и тканевой дегене-
рации. Избыточные диастолические напряжения и систолодиастолические сгибатель-
ные и сдвиговые деформации створок биопротезов коррелируют с местом развития
кальцификации и структурной дегенерации их ткани (Thubrikar M.J. et al., 1983,
DeiwickM. et al., 1998).
143
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
Кар асный дизайн биопротеза нарушает естественную геометрию клапана, способ-
tbv т образованию избыточных сгибательных деформаций и напряжении преимуще-
тв?нно в области комиссур, что, в свою очередь, приводит к развитию кальцифика-
ции и дегенерации ткани биопротезов (Butterfield М. et al. 1991; 1993). S. О aki и соавт
(2000 выявили достоверные различия в степени кальцификации тв ро каркасных и
бескаркасных биопротезов, стабилизированных по одной технологии (Medtronic
Freestyle и Mosaic Bioprostheses) Причиной развития механического с ресса и после-
дующей тканевой дегенерации также может являться дисторция и неправильным вы-
бор типоразмера биопротеза во время его имплантации (Хуэулава Г. Г. и др., 2005,
NagyZ. L. et al., 1999)
Многочисленные исследования механических характеристик ткани, стабилизирован-
ной глутаральдегидом, показали, что данный химический агент приводит к значитель-
ным изменениям механических свойств ткани вне зависимое и от действия други
факторов. В частности, обработка аортальных створок глутаральдегидом приводит к
стократному увеличению напряжения их ткани при сдвиговой деформации, что, в вою
очередь, ведет к увеличению механического стресса на створках во время циклов их
открытия и закрытия. Изменения вязкоупругих свойств ткани в виде снижения релак-
сации напряжения и увеличение сопротивления сдвиговым деформациям могут быть
обусловлены выраженной дегидратацией ткани биопротеза под влиянием глутараль
дегида. Стабилизация ксеноклапанов глутаральдегидом приводит к значительному сни-
жению растяжимости и увеличению жесткости их ткани. Эти изменения механических
свойств ткани вызывают нарушение исходной макробиомеханики аортального юлапа
на, способствуя образованию зон механического стресса и деформаций (Christie G. >
1992; Vesely I. et al., 1992; Billiar K. L. et al., 2000; Talman E. A. et al., 2001).
Полифакторность механизмов кальцификации ткани, обработанной глутаральдеги-
дом, обусловливает оправданность патогенетического подхода к применению методов
профилактики данного осложнения, связанного как с самим биопротезом и технологи
ей его изготовления, так и с внутренней средой организма пациента.
Воздействия на факторы реципиента включают системную и локальную антикаль
цификационную терапию с использованием комплексообразующих соединений из труп
пы дифосфонатов. Дифосфонаты являются биологическими аналогами естественного
пироф фата, устойчивые к ферментативному кислотному гидролизу, что обусловлю
вас возможно ть их применения в качестве лекарственных препаратов при лю ом
пособ введения (Барбараш Л. С. и др., 1995). Механизм действия данных препара
то о нован на их способности блокировать вторую фазу минерализации — рост кри
таллов гидроксиапатита. Однако необходимо отметить, что длительное системное при
менени высоких доз дифосфонатов, превышающих терапевтические, может еы вать
по очные ффе ты в виде остеомаляции, нарушения роста трубчатых костей
В определенной степени этих осложнений удалось избежать в эксперименте путем лр°
ведения локальной терапии дифосфонатами в виде полимерных матриц (Levy
е а!., 1985).
Воздействие нд
механизмов кяпи Футоры имплантата
^ескои модификации^еТИ стабилизированнойЧгл\^Я В блокиР°вании определенных
тРУкции биопротезов и различнь,ми веществами УТаральдегиД°м ткани путем хими-
нтикальцифИцИрую ?СНОлогии их изготовлен Э Уакже в с°вершенствовании кон-
ении ДевитализиппХ Щ И Эффект повепхнпЯ (Gross J- М., 2001)
нуХВаНИЯ КОМплексовНкальКЛеТОК’ ПредупРеж^енииКТИВНЬ'Х веществ основан на уда-
лого сг?ИИ ГИдроксиапатита рИИ'Фосфолипид-фоСсЬя?еНеТрации Фосфолипидов и об-
козин ектра Данных соедини ЭкспеРименте была м ’ СП0Собнь,х являться центрами
монийб1еОКСИХОЛевая Кислота НИИ ТВИн“80, декан^лС^ЛеД°ВаНа эФФсктивность широ-
Сагг)Рп|Р°МИд’ тРиметилсЬри| ’ ДеДилтриметиламмп Ф°НОвая кислота, N-nayponncap-
СаФепЬегА et al . , гексадецилтриметилам-
>• ОАнако наибольшее ' Х'100 (Arbust.n. Е et al, 1984;
лространение получил додецилсуль-
1
ГЛАВА 3. Биологические заменители клапанов сердца
фат натрия (Тб). На модели подкожной имплантации было показано, что способ обра-
ботки додецилсульфатом натрия на 80-90% ингибирует минерализацию ксеноаорталь-
ной ткани. Однако при ортотопической экспериментальной имплантации каркасны/
биопротезов, обработанных Тб, были получены противоречивые результаты (Arbustini Е.
etal., 1984; Gallo I. etal., 1986; Hirsch D. etal., 1993; FlamengW. J. et aL, 2001; Gross J. M
2001). Некоторые авторы предлагали для подавления минерализации ткани биопроте
зов проводить комбинированную экстракцию липидов детергентами, этанолом и эфи
рами (Vyavahare N. R. et al., 1997; Shen M. et al., 2001).
Другой способ антикальцификационной модификации ксеноткани основан на вос-
становлении ионообменной функции гликозаминогликанов. Этот метод заключается в
иммобилизации на ткани клапана естественного ингибитора минерализации — хонд-
роитин-сульфата (Nimni М. Е. et al., 1987). Однако данная методика не нашла примене-
ния в клинической практике.
Третье наиболее распространенное направление антикальцификационной обработки
ткани биопротезов заключается в нейтрализации свободных альдегидных групп глута-
ральдегида, являющихся центрами связывания кальция и нуклеации гидроксиапатита
(Gross J. М., 2001; Thiene G. et al., 2002). Для этого использовались аминодифосфона-
ты, соли железа, алюминия, хрома, а-аминоолеиновая кислота, гомоцистеиновая кис-
лота (Журавлева И. Ю. и др., 1989; Гантимурова И. Л., 1996; Girardot J. М., 1990; Chen
W. et al., 1994; Levy R.J. et al., 1994). Экспериментальные исследования, выполненные
как на модели подкожной имплантации, так и на модели ортотопической имплантации
каркасных биопротезов животным, показали, что данные методики позволяют на
80-95% снизить минерализацию ткани, стабилизированной глутаральдегидом (Levy FL J
et al., 1985; Gott J. P. et al., 1992; Ogle M. F. et al., 2003). Вместе с тем, некоторые авто-
ры отмечали, что модификация ткани биопротезов дифосфонатами и катионами ме-
таллов может, наоборот, ускорить процесс ее кальцификации, либо их эффект носит
временный характер вследствие постепенной десорбции из ткани биопротеза (Журав-
лева И. Ю.» 1995; Webb С. L. et al., 1989; Carpentier S. et al., 1995).
Анализ ингибирующего влияния а-аминоолеиновой кислоты на минерализацию раз-
личных тканей корня аорты свиньи показал, что обработка этим веществом в большей
степени подавляет кальцификацию створок аортального клапана по сравнению с аор-
тальной стенкой. В эксперименте была отмечена выраженная кальцификация стенки
аорты биопротезов, обработанных а-аминоолеиновой кислотой, через 3 месяца после
имплантации их животным. При гистологическом исследовании биопротезов, обрабо-
танных этим соединением, были выявлены гематомы и повреждение створок (Chen W.
et al., 1994; Gott J. P. et al., 1997; Ozaki S. et al., 2000).
Таким образом, ни один из протекторов минерализации не обеспечивает надежно-
го эффекта в эксперименте. Различия в результатах исследования минерализации ста-
билизированной биоткани между моделью подкожной и ортотопической имплантации
каркасных биопротезов у животных свидетельствуют о значительном влиянии механи-
ческого фактора на процессы структурной дегенерации этой ткани (Gross J. М., 2001).
Поэтому применение различных технологий антикальцификационной защиты, совер-
шенствование конструкции и технологии дубления глутаральдегидом не позволили
решить проблемы структурной дегенерации и минерализации каркасных биопротезов
(Jamieson W. R. et al., 1994; Barratt-Boyes В. G., 1998; Butany J. et al., 1999).
Последние 10-15 лет при протезировании аортального клапана используют различ-
ные модели ксеноаортальных бескаркасных протезов. Эти биопротезы обработаны
глутаральдегидом и различными протекторами кальцификации. В качестве протекто-
ров используют детергенты Тб (St. Jude Toronto SPV) и XenoLogix (Edwards Lifesciences),
^аминоолеиновую кислоту (Medtronic), а также новые комплексные методики BiLmx
(St. Jude Medical Toronto Root) и No-React (Shelhigh. Inc ), основанные на удалении и
нейтрализации свободных остатков глутаральдегида (Abolhoda A. et al., 1996, Walther Т
al., 1998; Flameng W. et al., 2001; David T E. et al., 2004) Применение бескаркасного
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
дизайна в конструкции ксенографтов позволило снизить частоту структурной дегене-
рации биопротезов до 2-3% в сроки наблюдения от 5 до 9 лет после операции (Jin X Y
et al., 2001; Goldman В. S. et al., 2001; Akar A. R. et al., 2002). Однако следует отметить
что операции выполнялись, в основном, пациентам старше 60 лет. При этом некото-
рые авторы отмечают возможность развития кальцификации и тканевой дегенерации
оескаркасных биопротезов в ближайшие и отдаленные сроки (Murayama Н. et al., 2004).
в 1989 г. Y Noishikt и соавт. предложили использовать для стабилизации биологи-
ческих тканей новый химический агент из класса эпоксисоединений. Эти вещества
ватг^нГтГппккпгИГРУППЫ’ КОТОрые' в отличие от альдегидных групп, способны реагиро-
зином И гиг™ £;амин°грУппами лизина и гидроксилизина, но и с метионином, тиро-
И др 1995) обеспечивая надежную стабилизацию биоткани (Барбараш Л. С.
Многочисленные экспериментальные исследования показали что эпоксиды инги-
ХзоХХ» "“х 8 Ч"“е " ю препаар„в„ь°„Те“о°Хк»
X ,9® чесно, ю ',"2: Жгоавлею И. »•. '995; Кондрате™ Ж. Е.
Tan Z. й а,.. ,99“ «X-
энХдами “ЯЗеЙ' образ»е™*
лева и. ю„ 199бХ0ТХ?Т'9“Г"Щ“ ЛИГаНП“ <БуИГ° Ю-А' ’"6; ЖураВ'
ли, что стабилизаци^эпоксисоелинен3'^1'69^13 с80йств биологических тканей показа,
паральдегидом предельные принести™”"сравн"ь» с обработкой глу-
ментативному гидролизу Полп^мтоп Рактеристики и устойчивость ткани к фер-
равномерность стабилизации тканей обработки эпоксидами является
тенко Ж. Е. и др., 1998; Чеснов Ю М и др ^00Г т 7°ШНИК°В А’ Н ’ 1992; К°НДра‘
1994). ’ ’ и др - 2001. Tang Z. et al., 1995; Shen S. H. et al.,
m vitro высокие гидродинамические хаоакт”6'6 эпоксидами' показали в экспериментах
H.W. et al., 1994) В последние годы (Гавриленков в- И. и др., 1999; Sung
чали шире применяться в клинической нг, ркасные и бескаркасные биопротезы на-
ков А. М. и др., 2001; 2002; СеменовсииХТ(Барбараш Л. С. и др., 2003; Карась-
Отдельные экспериментальные исслелп И ДР'' 2001 ’ хУбУлава Г. Г и др., 2005).
нис ^та6илизации ткани эпоксидами и cbohctbTV0^33™’ ЧТ° НЭ процесс структур-
ние различные условия. Так, значительное ВЭ обработаннь1х тканей оказывают влия-
нии иоткани могут оказывать pH дубяшсгоЛИЯНИе НЭ процесс структурной стабилиза-
оединения и его концентрация (ГавриленкоПРпС|йВ°Ра И его температура, тип эпокси-
Реакция эпоксисоединений и коллагена « ’ - ДР- 2003; Sun9 H.W. et al., 1996).
лиая^оИ степени‘ по сравнению со щелочнк КИСЛОИ среДе происходит медленнее и в
ныс н Я ЗЭ СЧвТ конвертиРОвания Е-аминого 'МИ ^словиями. при которых реакция уси-
попепрКЛе0ФИЛЬНЬ1е Реагрнты. При этом “ л ™3”Ha И Гидроксилизина в более силь-
соглаенп ЫХ СШИВОк коллагена эпоксидами rM авТОры °™ечают увеличение плотности
Ха д°бДРУГИМ ДаННым’ та№е изменХ ВЩпел°ЧН0Й Среде <Levy R-а1- ,997)' а
ботки биоЛам Я ТКЭНИ (Suns н-w et al 19эе1 раствора влияет только на скорость про-
разом лХ оказывает и увеличение S ' Аналогичное влияние на процесс обра-
Хй прХХ: Литера^рь' ocLXPXXePaTVPbl дубящего раствора. Таким об-
1992; Барбаоаш р6^тральнс|й, умеренно и силы?п 8Ь1МИ' О6работку биотканей эпокси-
Степень стап С И др ’ 1995' Levy R j et я. кепочной среде (Шапошников А Н.,
няемого эпокенс ЬН°СТИ и дрУтие сХтва L ' 1"7J Hu С' В et в'-, 1999).
вать поперечные с?ДИНеНИЯ' Моно*Ункционалы?^КаНеИ также зависят от типа приме-
ивки молекул коллагена и 6 ЭПОксиДы не способны образовы-
146 _____ ' следовательно. повышать устойчивость
ГЛАВА 3. Биологические заменители клапанов сердив
ткани к ферментативному гидролизу (Sung H.W. et al., 1996; 1997). Эффективность
полифункциональных эпоксидов зависит от количества глицидиловых групп, строения
и длины углеводородной цепи (Шапошников А. Н. 1992, Чеснов Ю М и др., 2001).
Образование межфибриллярных сшивок коллагена преимущественно полиэпоксидам
с большой длиной углеводородной цепи и разветвленной структурой в большей степ
ни изменяют механические характеристики биоткани (Lee J М. et al., 1994). Повысит
стабильность биоматериала позволяет использование смесей моно- и полифункцио-
нальных эпоксисоединений (Журавлева И Ю., 1995; Кудрявцева Ю А., 1996).
Применяемые в настоящее время методики обработки ксеноаортальных клапанов
эпоксидами направлены, прежде всего, на достижение максимальной степени струк
турной стабильности ткани за счет увеличения концентрации дубящего вещества (
пошников А. Н. 1992; Чеснов Ю М. и др., 2001). Однако такой метод обработки мо ет
существенно ухудшить вязкоупругие свойства ткани ксеноклапанов.
Проведенное нами исследование показало, что использование "
«большого» (1:30) объема дубящего раствора, а также добавление ^оэпок^^^
диэпоксиду позволяет ускорить процессы стабилизации и фиксации нейтоаль-
ткани. Обработку ксеноаортальных клапанов целесоо разно осущ шелочны
ных или, в течение непродолжительного времени (до суток), в * пН (10 )
(pH до 9,0) растворах эпоксисоединений, поскольку при высоких знач^
отмечались признаки денатурации коллагена. Моноэпоксидв г_ ткани и тем сэ-
ра позволяет повысить протеолитическую устойчивость ио _ лиэпок^ида что
мым, снизить концентрацию основного стабилизирующего ф
необходимо для сохранения эластических свойств ткани ппмпплмт к яначитель-
Стабилизация ксеноаортальных створок глутаральдегидом
ному снижению растяжимости и увеличению жесткости тк снижению его изно-
редь, „р„водть к «рулению
соустойчивости. Использование для стабилизв смеси с МОноэпоксидом,
динений, особенно низких концентрации д тические свойства и повысить
позволяет в значительной степени сохранит Высокие концентрации дигли-
устойчивость к циклическим нагрузкам (с Р Зр^'о значительно ухудшают эла-
цидилового эфира этиленгликоля (5 о) в дубящ Р р в и и др , 2003; Маслев-
стические свойства ткани ксеноклапанов ( Р
Цов Д. В., 2005). пяапичные физические условия (давление,
Под режимом стабилизации понимаю р стенки корня аорты и
поток, температура дубящего раствора " ^'^^Хенно влияют на свойства
створки ксеноаортальных биоклапанов. Э У створок и долговечность конструк-
тканей биопротезов, геометрию и Duncan А. С. et al. 1996).
Ции в целом (Christie G.W., 1992; Valente М. . _ DTbl w d. Hancock и соавт.
С целью предупреждения усадки и дистор1^ поотезов раствором 0,2% глу-
(1976) предложили методику дубления ксеноа р 2Q мм рт ст, действующим на
таральдегида под гидростатическим давлени стабилизации привели к практически
створки и стенки корня аорты. Такие у коллагена створок и дублению их в
полному исчезновению гофрированьюс™ геометрии коллагена сопровождалось
выпрямленном состоянии. Нарушение вол тик ткани створок, прежде все-
значительными изменениями меха^4^ eS растяжимости. Эти изменения, в свою
го увеличением жесткости и резким сниже пПОте3а В частности, были выявлены
очередь, отразились в целом на биомехани*Х Р . створок, нарушение механиз-
асимметричность открытия и выраженные д Ф СТВОрок (Broom N. D. et al., 1982;
закрытия клапана и коаптационной ФУН*Ц^ G w -1992). Нарушения макро- и
Lee J. м. et al. 1984, Hilbert S. L. et al , 990, t биопр^тезов отразились на их из-
ыикробиомеханики при такой технологии ДУ структурной дегенерации под-
носоустойчивости. В сроки до 10-15 лет после ^^^^esonW R. etal, 1998).
вергалось около 30-75% биопротезов (Bortolotti U et al, 1 ,
___________________147
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
С целью сохранения гофрированности коллагена и механических свойств ткани ство-
рок Е Lane (1983) предложил метод стабилизации биопротезов глутаральдегидом под
низким положительным давлением 0-4 мм рт. ст. Для предупреждения усадки корня
аорты использовалась механическая вставка. Однако исследования ткани створок, ста-
билизированной в данных условиях, показали, что давление в 4 мм рт. ст. также i ару
шает гофрированность волокон коллагена в области свободного края и тела створки и
приводит к значительным изменениям их окружной растяжимости. Стендовые иссле-
дования биопротезов, обработанных при низком давлении, выявили умеренные дефор-
мации открытых створок. Бескаркасные биопротезы, стабилизированные по этой тех-
нологии («Toronto SPV® Valve», «Edwards Prima Plus Stentless Bioprosthesis»), в отдален-
ные сроки после операции продемонстрировали хорошие гемодинамические
характеристики и низкую частоту структурной дегенерации (Vesely I. et al., 1990;
Goldman В. S. et al., 2001; Jin X.Y. et al., 2001; Bach D. S. et al., 2002; 2004).
Экспериментальные исследования показали, что методика обработки ксеноклапа-
нов в ненагруженном состоянии без воздействия на их створки физических факторов
(градиента давления) позволяла сохранить волнистую геометрию коллагена и мехаь и
ческие характеристики ткани (Lee J. М. et al., 1984; Christie G. W., 1992). С целью пре-
дупреждения усадки корня аорты и максимального сохранения естественных механи-
ческих свойств ткани створок G.W. Christie и соавт. в 1993 г. предложили методику дуб-
ления ксеноклапанов с положительным градиентом 40 мм рт. ст. на стенку аорты
(предилатацией) и нулевым градиентом на створках. Ксеноклапаны, обработанные по
такой методике, показали в эксперименте высокие гидродинамические и макробио-
механические характеристики (Butterfield М. et al., 1993; Lockie К. J. et al., 1994). Вме-
сте с тем, другие авторы полагают, что створки ксеноклапанов, стабилизированные при
таких условиях, нельзя считать абсолютно ненагруженными. Это связано с наличием
внутренних напряжений между желудочковыми (ventncularis) и аортальными (fibrosa)
слоями створок (Vesely I. et al., 1992; 1996). В результате нарушается функция данных
компонентов створки, поскольку желудочковый слои стабилизируется в растянутом со-
стоянии, а фиброзный — в состоянии компрессии. Следовательно, биопротезы, ста-
билизированные при нулевом градиенте давления на створках, не смогут воспроизве-
сти биомеханику нативного аортального клапана. Кроме того, высокое давление (30 мм
рт. ст. и более) на стенку аорты может привести к нарушению механических характери-
стик ткани (Duncan А С. et al., 1996).
Положение створок в течение процесса дубления также может оказывать значитель-
ное влияние на функционирование ксеноаортальных протезов. Е. Imamura и соавт.
(1984) в эксперименте in vitro продемонстрировали, что открытое положение створок
в течение их стабилизации способствует улучшению биомеханики биопротеза в целом,
амический ре им обработки биопротезов с наличием пульсирующего потока
дубящего раствора через клапан позволяет в большей степени сохранить исходные
механи арактеристик ткани створок. В частности, при таком режиме ду( ления
клапана аорты были отмечены большая растяжимость и релаксация напряжения ткани
створок, по равнению со стационарными режимами дубления (Mavnlas D. et al., 1991,
Dun an A. C. e al., 1996) Обработка ксеноклапана в динамическом режиме повышала
т пень табильности ее ткани, что позволяло в 10 раз (с 0,5% до 0,05%) снизить кон-
центрацию глутаральдегида при сохранении того же уровня структурной стабилизации
оллагена. При этом сохранялись естественные механизмы уменьшения стресса в виде
способн ти к большей сдвиговой деформации створок (Song Т et al 1990; Duncan
А С. et al , 1996, 1997). В целом, такая методика обработки обеспечивала механичес-
кие арактеристики ткани створок, сопоставимые с аналогичными показателями на-
тивных створок. Однако подобная технология, по-видимому, из-за ее сложности пока
не нашла широкого применения при изготовлении биопротезов.
кл£ЛазРаботанныи нами динамический режим дубления ксеноаортальных клапанов
ь ни ких концентрации эпоксисоединениий при нулевом градиенте давления на
ГЛАВА 3 Биологические заменители клапанов сердца
створках и их «нейтральном» положении в потоке дубящего раствора позволил ускорить
процесс дубления ткани ксеноклапанов, достигнуть высокой степени ее стабильности,
повысив прочностные и сохранив в значительной степени ее исходные эластические
характеристики (Патент РФ № 2234217). Обработанные таким способом ксеноаорталь-
ные бескаркасные протезы показали высокие биомеханические и гидродинамические
характеристики, близкие к характеристикам нативного клапана (Гавриленков В И и до
1999; 2004).
Основным условием, предъявляемым к методикам стерилизации и консервации
ксеноаортальных биопротезов, является сохранение структурной стабильности и фун-
кциональных характеристик их ткани. Применение таких физических методов стерили-
зации, как у-облучение и обработка оксидом этилена, невозможно в связи с их пря-
мым повреждающим воздействием на ткани, сопровождающимся разрушением попе-
речных сшивок молекул коллагена. Поэтому для стерилизации и консервации
биопротезов используют различные растворимые химические вещества. Традиционно
для этого применяют растворы глутаральдегида, совмещая его дубящий и стерилизу-
ющий эффекты, или формальдегида (Малиновский Н. Н. и др., 1988; Roe S. С. et al.,
1992).
Результаты многочисленных микробиологических исследований подтвердили высо-
кую активность альдегидов в отношении бактерий, грибов и вирусов. Раствор глута-
ральдегида в концентрации 0,5% обеспечивает надежную стерилизацию биопротезов,
начиная с 3-10-х суток от начала обработки (Малиновский Н. Н. и др., 1988; Woodroof
Е. А., 1978; Gorman S. Р. et а(., 1980). Однако длительное хранение биопротезов в таких
растворах может привести к снижению модуля упругости, увеличению предельной де-
формации и ползучести их ткани. Глутаральдегид обладает выраженной цитотоксично-
стью и его свободные остатки в ткани биопротеза могут оказывать повреждающее дей-
ствие на клетки ткани реципиента (Vincetelli A. et al., 1998; Gough J. E. et al., 2002).
В эксперименте in vivo A. C. Grobe и соавт. (2000) продемонстрировали, что ткань био-
протеза, обработанного глутаральдегидом, в области контакта с тканью реципиента
вызывает гибель ее клеток и кальцификацию. С помощью хроматографического ана-
лиза было выявлено значительное поступление глутаральдегида из ткани коммерчес-
ких биопротезов при отмывке их физиологическим раствором. При этом культивация
клеток на поверхности таких биопротезов была возможна только после инактивации
свободных остатков глутаральдегида глутаминовой кислотой (Grimm М. et al., 1992).
Для предотвращения токсического воздействия альдегидов на ткани пациента не-
посредственно во время операции производят отмывку биопротеза физиологическим
раствором (Малиновский Н. Н. и др., 1988). Общее время отмывки занимает 30-45 ми-
нут с двух-, трехкратной сменой раствора (с экспозицией по 15 минут в каждом). Е. Gendler
и соавт. (1984) показали что последовательная отмывка даже в течение 60 минут не-
достаточна для снижения токсичности ткани биопротеза. Следует особо подчеркнуть,
что такой длительный процесс отмывки затрудняет выбор оптимального типоразмера
биопротеза во время операции
Эпоксисоединения, как и глутаральдегид, обладают не только стабили ирующеи,
но и антибактериальной активностью. Поэтому раствор диглицидилового эфира эти-
ленгликоля в концентрации от 2% до 5% используется для хранения ксеноаортальных
биопротезов сроком до 1 года (Шапошников А. Н., 1992). Однако некоторые авторы
считают необходимым усилить антибактериальную активность эпоксидов с помощью
Ю-20% раствора этанола (Chan-Myers Н. В. et al., 1992). Такие смеси, а таюке 70%
Раствор этанола обеспечивая стерильность, не снижают стабильность и устойчивость
ткани к ферментативному гидролизу (Sung Н. W., 1997). Токсичность эпоксидов значи-
тельно ниже относительно глутаральдегида (Lohre J. М. et al., 1992). Однако во время
операции также требуется тщательная отмывка от остатков этого консерванта.
Данные наших исследований показали, что моноглицидиловый эфир этиленгликоля
обладает более выраженным антибактериальным действием, по сравнению с диглици-
__________ ________________________________________ 149-------------------
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
диловым эфиром этиленгликоля. Смесь эпоксидов обладает высоким антимикробным
эффектом, близким к растворам альдегидов и диоксидина. Хранение ксеноаортальных
протезов в растворах эпоксисоединений приводит к ухудшению эластических свойств
ткани их створок Хранение ксеноаортальных протезов в растворе диоксидина позво-
ляет сохранить их стерильность, а также структурную стабильность и механические
характеристики их ткани, достигнутые на этапе дубления (Гавриленков В. И., 2004;
Маслевцов Д. В., 2005; Соколов В. В. и др., 2005).
Таким образом, в последние годы продолжается поиск новых химических веществ
с целью замены глутаральдегида, а также разрабатываются технологии, позволяющие
устранить или уменьшить влияние негативных факторов химической обработки на ткань
биоклапана
КАРКАСНЫЕ БИОПРОТЕЗЫ
Фиксировать биоклапан на опорном каркасе (стенте), покрытом синтетической тка-
нью, впервые в 1967 г. предложил A. Geha (Geha А., 1987). Многие последующие рабо-
ты были направлены на усовершенствование конструкции и свойств опорных каркасов
для фиксации биологической части протеза Выделяя важность способов обработки,
консервации и стерилизации биоклапанов в обеспечении длительного функциониро
вания биопротезов, следует отметить отчетливую зависимость между степенью их ме-
ханической надежности в послеоперационном периоде и конструктивными особеннос-
тями различных видов искусственных опорных каркасов, предназначенных для крепле-
ния биоклапанов При этом размещение и закрепление биологического створчатого
элемента на любой опорной конструкции (каркасе) приводит к уменьшению полезной
площади протеза и создает определенное сопротивление потоку крови, а следователь-
но, увеличивает градиент давления на клапане (Константинов Б. А. и др., 1971,
Hancock W., 1977).
Изначально использовался жесткий опорный каркас, который приводил к отрывам
протеза по линии прикрепления комиссур к стойкам каркаса, а в ряде наблюдении —
к разрывам самих створок. Без сомнения, повышенные нагрузки на створки биопроте-
за при фиксации в каркасах типичной конструкции с тремя стойками способствуют раз-
витию усталостных повреждений коллагеновых волокон в центре створок и в местах
фиксации комиссур. Это тот случай, когда механические и биологические повреждаю-
щие факторы суммируются (Цукерман Г. И. и др., 1972; Малиновский Н. Н. и др.. 1988)
В целях уменьшения нагрузки на створки клапана были предложены и в настоящее
время широко применяются в клинической практике гибкие каркасы, выполненные из
полипропилена с жестким кольцом в основании Напряжение в створках таких биопро*
тезов уменьшалось в экспериментах т vitro на 90% по сравнению с жестким каркасом
Известны гибкие опорные каркасы, изготовленные из стали различных марок и тита-
новых сплавов, а также комбинированные каркасы, содержащие металлические и по-
лимерные элементы конструкции (Фурсов Б. А , 1982; Малиновский Н Н., 1988, Liotta D-
et al, 1979).
Создание цельного металлического каркаса требуемой гибкости практически не
возможно в связи с ограниченной номенклатурой металлов, разрешенных к импланта^
ции. Возможным вариантом изготовления металлического каркаса требуемой жестко
сти с заданной пространственной конфигурацией пришивной манжеты является ис
пользование проволоки различных марок. Кроме того, технология изготовления каркаса
подобной конструкции неизбежно должна включать в себя создание нескольких не
разъемных соединений, например сварных. Последние крайне чувствительны к цикли
ческим нагрузкам, развивающимся при работе протеза, и для ограничения гибкости
требуют применения жестких опорных элементов. Вместе с тем. соединение этих со
ставляющих с гибкими проволочными элементами может усложнить конструкцию и
150 ------------------------- -------------------------—
ГЛАВА 3 Биологические заменители клапанов сердца
внести дополнительные концентраторы напряжений. Для изготовления гибких опор-
ных каркасов оптимальным является материал с низким модулем упругости, то есть
полимер Выбор подобных материалов, разрешенных к имплантации в организм и от-
вечающих медико-техническим требованиям по износоустойчивости и прочности, не-
велик. В нашей стране такими материалами являются лавсан, полиэтилен, полибутил-
тетрафталат (ПБТФ), полипропилен. Фторопласт и полиэтилен неприемлемы для изго-
товления каркасов, так как обладают высокой способностью к накоплению пластической
деформации.
Одним из первых известных каркасных биопротезов, получивших широкое распро-
странение, был биопротез, предложенный W. D Hancock, — Hancock Standard
(рис. 3.2). Выпуск этого протеза начался в 1969 г фирмой Hancock Extracorporeal. Био-
протезы Hancock выпускались как для митральной, так и для аортальной позиции Из-
начально свиной протез пришивался к дакроновому покрытию гибкого полипропиле-
нового каркаса, усиленного рентгенопозитивным металлическим (сплав Haynes) коль-
цом, придававшим протезу жесткость
Каркас биопротеза Hancock был симметричным, пришивная манжета также изго-
тавливалась из дакрона со вставками из силиконовой резины. Протез предназначался
для интрааннулярной имплантации. Биопротез обрабатывался по стандартной мето-
дике глутаровым альдегидом 0,5°о концентрации под высоким давлением. Первые 100
биопротезов фирмы Hancock были имплантированы в 1970 г. и в дальнейшем получи-
ли наибольшее распространение в мировой практике. Уже к концу 70-х гг. XX столетия
число имплантаций биопротезов данного типа составило более 70 000. Интерес к этим
биопротезам с годами сохранился, о чем свидетельствует статистика операций, вы-
полняемых в различных кардиохирургических центрах США (Butany J. et al., 2003).
Как и у других биопротезов, фиксированных глутаровым альдегидом, структурная
дегенерация протеза Hancock Standard была связана с кальцификацией и разрывом .
створок в области коммиссур, в теле и кромке створок, аортальной стенке. Дегенера-
ция биотканей протеза усугублялась ростом паннуса, сопровождалась деформацией
каркаса, разрывами створок и образованием внутристворчатых гематом. Свобода от
труктурной дегенерации протеза Hancock Standard составляла 95%, 67%, 32%, 14% к
5-, 10-, 15-, 20-му году, соответственно, для митральной позиции. Статистика протез-
ного эндокардита не отличалась от других клапанов (Milano A. D. et al., 1988, Khan S. S.
et al., 1998; Santini F. et al., 2001).
₽"C 3-2. W. D. Hancock (из материалов музея НЦССХ им. А. Н. Бакулева) биопротез Hancock
standard и рентгеновское изображение его каркаса (по J. Butanyet а!.. 2003)
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
Повышенный градиент давления на малых типоразмерах протезов послужил толч-
ком к разработке композитного биопротеза Hancock Р rcine Modified Orifice. Протез
Hancock Porcine Modified Orifice для аортальной позиции собирался из двух свиных
клапанно-аортальных комплексов. Правая коронарная створка и соответствующий си-
нус клапанно-аортального комплекса заменялась некоронарной створкой от другого
комплекса. Первые протезы Hancock Porcine Modified Orifice изготавливались компа-
нией Johnson & Johnson Extracorporeal. Начало их клинического применения относится
к 1976 г. В дальнейшем все модели аортальных биопротезов стали изготавливать под
названием Hancock Modified Orifice. В настоящее время протезы выпускаются компа-
нией Medtronic. Свобода от структурной дегенерации биопротеза Hancock Porcine
Modified Orifice составляла 99 *o, 79%, 57% к 5-му, 10-му, 15-му году, сос ъетственно
(Cohn L Н. et al., 1998; Yun К. L. et al., 1995).
В 1982 г. фирма Johnson & Johnson Extracorporeal выпустила усовершенствованные
модели биопротезов под названием Hancock II, отличающиеся каркасом из Delrin ма-
лой высоты, которые предназначались для супрааннулярной имплантации и поэтому
имели низкий градиент давления. Клапаны фиксировались глютаровым альдегидом в
течение 30 мин под низким давлением, а затем под высоким давлением. Кроме того,
они подвергались специальной антиминерализационной обработке раствором Тб, вклю-
чающим додецил сульфат натрия Протезу также были присущи специфические ослож-
нения — в 64% случаев развивались кальцификация и склероз створок, нарастал пан-
нус. Свобода от структурной дегенерации створок биопротеза Hancock II к 15 годам
функционирования в среднем составляла 81% и 66% для аортальной и митральной
позиции, соответственно. Протез одобрен министерством пищевой и лекарственной
промышленности США (FDA) к клиническому применению с 1999 г. (Arbustini Е et al.,
1984; Butany J. et al , 1999; Eichinger W. et al., 2000; David T. E. et al., 2001).
В 1970 г W Angell с сотрудниками начали эксперименты с ксеноклапанами, обра-
ботанными глутаровым альдегидом. Через 5 лет лаборатория Shiley совместно с
W. Angell разработали новый каркасный свинои биопротез (Angell WW. et al., 1979).
Биопротезы стали называться Angell-Shiley (рис. 3 3) и были фиксированы на гибком,
покрытом дакроном каркасе, изготовленном из Delrin. Существовало около 70 различ-
ных каркасов этой модели протезов, по форме близко соответствующих различньм
анатомическим вариантам аортальных ксеноклапанов. Однако такая вариабельность
вряд ли является разумной альтернативой создания хорошей унифицированной конст
рукции. Основание каркасов во всех моделях этих биопротезов было круглое, а мы
ный валик правой коронарной створки обшивался со стороны приточного отдела
синтетической тканью Каркас был более массивным по сравнению с другими биопро
езами. Обработка стерилизация и консервация биопротезов проводилась 0,5% Ра'
ром глутаральдегида Выпуск клапана прекращен в 1980 г из-за повышенной струю
Рис. 3.3. Биопротезы Angell-Shiley (по Л. С. Барбарашу и др., 1995); Medtronic ^.or|S|
(no Medtronic Intact bioprosthesis heart valve: surgical, technical and handling considers
1993) и Medtronic Mosaic (no J. Butany et al., 2003)
152-----------------------------
ГЛАВА 3. Биологические заменители клапанов сердца
турной дегенерации (Angell W. W. et al., 1979; Lefrak E. A. et al., 1979; Kagawa Y et al, 1986).
В 1975 г компания Edwards Lifesciences LLC (в прошлом Baxter Healthcere Inc.,
Ирвин, штат Калифорния) при активном участии A Carpentier предложила свои проек-
ты свиных биопротезов Carpentier-Edwards. Протез Carpentier-Edwards обрабатывался
0,625 % раствором глутарового альдегида при высоком давлении (20 мм рт. ст.) и кре-
пился на гибком проволочном каркасе из Elgiloy (рентгеноконтрастный кобальтонике-
левый сплав) для уменьшения ударных нагрузок при закрытии. Биоткань дополнительно
обрабатывалась протектором кальцификации XenoLogiX. Основным отличием протеза
Carpentier-Edwards от протеза Hancock было наличие трех U-образных проволочных сто-
ек Каркас протеза Carpentier-Edwards для аортальной позиции (цв. вкладка, рис. 4)
был спроектирован асимметричным с целью уменьшения стенотического эффекта мы-
шечного основания правой коронарной створки. Митральный (модель 6625) и аорталь-
ный (модель 2625) протезы предназначались для интрааннулярной имплантации От-
ношение площади отверстия клапана в открытом состоянии к посадочной площади рав-
нялось 0,76. Манжета протеза со вставкой из силиконовой резины изготавливливалась
из пористой политетрафторэтиленовои ткани Манжета аортальной модели этого про-
теза имеет волнистую форму, что позволяет лучше адаптировать основание протеза к
форме фиброзного кольца реципиента при его имплантации. Манжета митрального
протеза имеет плоскую конфигурацию. По прочности и износоустойчивости эти проте-
зы были сравнимы с биопротезами Hancock. Из-за более удобного для имплантации
дизайна корпуса и пришивной манжеты большинство хирургов предпочитают протезы
Carpentier-Edwards, которые доступны и по сей день (Lefrak Е. A. et al., 1979; Glower D. D.
et al., 1998; Chen Y. F et al., 2003).
С целью улучшения гемодинамической эффективности (увеличения площади про-
ходного отверстия на 20%) с 1982 г. разрабатывались протезы для супрааннулярной
имплантации — митральный Carpentier—Edwards Duraflex (модель 6650) и аорталь-
ный Carpentier—Edwards SAV (модель 2650) — рис. 3.4 (Carpentier-Edwards S. А. V.
bioprosthesis 536-6/88-CV USA: Baxter Healthcare, 1988) Последняя модель получила
разрешение министерства пищевой и лекарственной промышленности США (FDA) на
клиническое применение с 2002 г. В новых моделях для сохранения естественной струк-
туры клапана и гофрированности коллагена створок стали применять обработку глута-
ровым альдегидом под низким давлением в 2 мм рт. ст. При этом была уменьшена
высота каркаса, а его цилиндрическая конфигурация заменена на коническую (Сагреп-
ier-Edwards S. А V. bioprosthesis 826-CV. USA: Baxter Healthcare, 1990) Такие коне рук
₽Ис- 3.4. A. Carpentier (по Д. Россу, 2003); митральный биопротез Carpentier-Edwards Duraflex
и его рентгеноконтрастный каркас (по J. Botany et al., 2003)
-------- 153 ----------
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА___________________________________________
тивные изменения снизили риск обструкции коронарных артерий при имплантации
протеза в аортальную позицию и повреждения стенки левого желудочка в митральной
позиции. По данным клинических наблюдений, в течение 5 лет после имплантации 84%
больных были свободны от клапанозависимых осложнений: тромбоэмболий, протез-
ного эндокардита, параклапанной фистулы, антикоагулянтных геморрагий и клапанной
дисфункции (Hartz R. S. et al., 1986; Jamieson W. R. et al., 1990). При имплантации в
узкий корень аорты новых моделей биопротезов с каркасами малой жесткости малей-
шая деформация каркаса могла приводить к дисфункции протеза.
В конце 70-х-начале 80-х гг. получили распространение низкопрофильные биопро-
тезы Liotta (Liotta BioImplant L. Р. В., Biolmplant, Canada, Inc.), в настоящее время
St. Jude Medical Bioimplant, St. Jude Medical Biocor (Biocor Industrie e Pesquisas Ltda,
Belo Horizonte, Brazil) — рис. 3.5; цв. вкладка, рис. 4, разработанные аргентинским хи-
рургом D. Liotta (Domingo Liotta International Foundation-Medical Corp.) и St. Jude Medical
Epic. Эти малогабаритные модели были изготовлены из ксеноаортальных клапанов
после их обработки раствором глутаральдегида разной концентрации и фиксированы
на гибком опорном каркасе под низким давлением 2-4 мм рт. ст. Применение биопро-
тезов Liotta демонстрировало превосходные непосредственные результаты, однако в
отдаленном периоде через 6-8 лет функционирования их биологическая часть оказа-
лась более подверженной структурной дегенерации, чем в протезах с традиционно
«высоким» профилем. Это было связано с повышенной механической нагрузкой на створ-
ки при чрезмерном уменьшении осевых габаритов каркаса (Liotta D., 1985; Navia J. А.
et al., 1985; lus P. et al., 2002). Современная модификация биопротеза носит название
St. Jude Medical Bioimplant (Yamak B. et al., 1999).
В 1979 г. бразильская фирма Biocor Industria e Pesquisas Ltda разработала протез
Biocor, а в 1996 г. этот клапан и фирма-производитель были приобретены компанией
St. Jude Medical (Санта-Паул, Миннесота) и протез стал называться St. Jude Medical
Biocor. Он имеет гибкий ацетилсополимерный (Celcon) каркас с манжетой из дакрона,
к которому крепятся три некоронарные створки, взятые от разных свиных клапанно-
аортальных комплексов. Протез имеет самый низкий профиль из всех современных
биопротезов. Манжета содержит рентгеноконтрастное проволочное кольцо. Фиксация
глутаровым альдегидом проводится под нулевым давлением. Отдаленные клинические
результаты показывали, что свобода от структурной дегенерации створок составляла
96%, 80%, 64°о, соответственно, через 5, 10, 15 лет после операции. Актуарная свобо-
да от тромбоэмболических осложнений за 10 лет составляла 93% и от протезного эн-
докардита — 97, 96, 94% через 5, 10, 15 лет, соответственно. Протез имеет европейс-
кий сертификат и применяется в Европе, Азии, Африке и Латинской Америке. Моди^
фикация клапана St. Jude Medical Epic отличается дополнительной антикальциевой
Рис. 3.5. D. Liotta и низкопрофильные биопротезы: St. Jude Medical Bioimplant — бывший Liotta
(по I. Vesely, 2003) и St. Jude Medical Biocor (no www.sjm.com)
---------154 ------------------------- ----------------------------
ГЛАВА 3 Биологические заменители клала нов сер д / ( а
обработкой этанолом (Linx) и серебряным покрытием (Silzone) манжеты. Методика
Silzone применялась до 2000 г. Протез St. Jude Medical Epic представлен на европейс-
ком рынке с 1998 г. (Vrandecic М. et al. 2000; Bottio Т. et al. 2004; J. Butany et al., 2003)
Английская компания Aortech International начала клинические испытания свиных
биопротезов Tissuemed в 1979 г. (цв. вкладка, рис. 4). Протезы выпускались для мит-
ральной и аортальной позиций. Створки фиксировались глутаральдегидом под низким
давлением (2 мм рт. ст.). В 2002 г. компанию приобрела немецкая фирма Koehler Medteal
LTD, и протезы получили новое название Aspire (Goldsmith I. R. et al., 2001; Kumar P. et
al 2003, Hadjtntkolaou L. et al. 2005). w
’компания Medtronic Inc. c 1984 no 1999 г. выпускала низкопрофильныи биопротез
Medtronic Intact для интрааннулярной имплантации с обработкой ткани клапана глу-
таровым альдегидом под нулевым давлением и дополнительной антикальциевои обра-
боткой толуидиновым синим, из-за чего его створки имели необычно голубой оттенок
(см рис 3 3) К семи годам после имплантации структурных дегенерации протеза не
было, однако имелись повышенные градиенты давления на протезах малого Диаметра
(Barratt-Boyes В. G. et al. 1993; O’Brien М. F. et al. 1995; Jamieson W.R. et al. 2001,
Corbineau H. et al., 2002).
Фирма Medtronic Inc. выпустила в 1994 г. композитный биопротез Medtron с Mosaic
(см рис 3 3) предназначенный для имплантации в супрааннулярную позицию ( р
SuS- «Одель 305. митральный - 310) Это, Оиопротез Ы' «гок,вле,низ свеио-
го корня аорты, у которого правые коронарная створка и сину ПЬного комплек-
коронарными синусом со створкой из другого свиного клапан гибких стойках
са. Низкопрофильныи каркас был изготовлен из е пл, а япптяльного проте-
находились рентгеноконтрастные металлические кольца, анж пооводилась
за имела волнообразный профиль. Структурная ста илизация и ом давле-
глутаровым альдегидом под нулевым градиентом на створк обоаботка прово-
ния на стенке аооты в 40 мм рт. ст. Дополнительная антикальциевая обработка лрово
Р - /Mpritronic Physiologic fixation: advancing porcine
дилась а-аминоолеиновои кислотой (Medtronic, i-туь , naTWneTHero при-
valve fixation technology. USA; Medtronic, 2000). Клинические Результаты
менения этого биопротеза Эг^соответственно для аортальной
панно-зависимых осложнении составл^ ^ киническому применению министерством
и митральной позиции. Биопротез Разрешен к кл (Bch|nger w et а,, 2000;
пищевой и лекарственной промышленности СШ ( ) 2005)
„ J. еЛ,.. 2000; Jameson W. R. et al 2005. KnsoJ WJtJ. 200Я
He совсем удовлетворительные отдаленные p у_ перикардиальные кар-
тезов в 60-е гг. XX в. побудили исследователей Реквизированного глутараль-
касные биопротезы. Эти протезы мзготаВЛ^е для этих протезов чаще изготавлива-
Дегидом бычьего или свиного перикарда. Кар пополнительным кольцом,
ли из полиацитамина (DeInn), нередко он усиливался до
содержащим рентгенпозитивную метку. „^паботаны и внедрены в кли-
Ксеноперикардиальные биопротезы были е^обритания). Серийный выпуск кла-
ническую практику М. lonescu в 1971 г- (Лидс штат КалифОрНия) начался в
панов lonescu компанией Shiley Laboratories • ( КОНСтрукции рентге-
1976 г. Протез lonescu-Shiley Standard (рис. З ^акпоном и три створки, изго-
ноконтрастный опорный каркас из титана, ПОКРВ митральной и аортальной
товленные из бычьего перикарда Протез В“"У имел превосходную гемодина-
позиций. Перикардиальный биопротез lone „пнкуоирующих свиных протезов, су-
Ми,<У с градиентами давления значительно ниж й биоПротез, получивший
чествовавших в то время. Это был первый пер^аР^^ь,шленности США (FDA). Од-
одобрение министерства пищевой и лекарствен' возрастало после 6 лет функци-
нако количество дисфункции этого биопротеза оза или разрыва створок. Рост
евирования в организме в результате развити повторных операции при-
келичества дисфункций этих биопротезов и в связи с эти
_________________ 155
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
Рис. 3.6. Перикардиальные биопротезы: lonescu-Shiley Standard и его рентгеноконтрастный
каркас (по J. Botany et al., 2003); Mitroflow Synergy (no www.mitroflow.com)
вели к полному отказу от их применения. В дальнейшем выпуск этих биопротезов был
прекращен (Brais М. R et al.. 1985. Walley V. М. et al., 1992; Khan S., 1998).
Гемодинамическая эффективность перикардиальных каркасных биопротезов была
обусловлена симметричностью функционирования их створок, высокой пропускной
о обно тью за счет их тонких стенок и поэтому относительно большего проходного
отверстия. Ограниченная износоустойчивость перикардиальных биопротезов в 70-е гг.
Зыла подтверждена при ускоренных стендовых испытаниях: разрушение протеза на-
ступало через 70 млн циклов, в то время как протезы Hancock через 250 млн циклов
оставались без разрушения (Clark R. et al., 1978; Cohn L H. et al., 1989).
l к И Laboratories Inc в 1981 г. также была выпущена низкопрофильная
нии оентгеноконтпя3а onescu~®h’*ey Low Profile с каркасом, содержащим в основа-
шенные гемопинАми^06 проволочное кольцо, покрытым дакроном. Несмотря на улуч-
теза в связи г пяяг>ЧеСКИе характеристики> через 2-5 лет возникала дисфункция про-
биопротеза также быгизореМ СТВОр°х и наРастанием паннуса. Выпуск и этой модели
w=ToJ “а! Я' Р Щен ' 1987 ' (Wa"4V “ « J. « al. 1992;
диал»“ mcTsi”в" <Ж! Г' аортальный "«PW
дает компания Sulzer Carbomedics r Р С'd 6) В настояш.ее время протез про-
натянутого на полимерный (Acetal) капкас ”опротез изготовлен из бычьего перикарда,
за обрабатывается глутаровым альлрР 63 КОммиссУРальных швов. Ткань бипроте-
ния рентгеноконтрастности в манже™^ М П° стандаРтной методике. Для обеспече-
вым порошком (Sulzer Mitroflow w₽hci» Д6Н силиконовь|й наполнитель с вольфрамо-
показатель свободы от струкп/оной nori6' www'mitroflow-com, 6-14-2002). Актуарный
ветственно, в сроки 10 и 12 лет nnmo нерацИи створок составлял 79% и 67%, соот-
В начале 80-х гг. закончилисьиспы^^ (Thu"n L L et al- 2000).
axter Healthcare Inc, (Ирвин, КалиФопнма^и? ?рикаРдиального биопротеза компании
тавливали из бычьего перикарда на орнтг! °ВЫИ Протез Carpentier-Edwards изго-
тапйпа0РТаЛЬН0Г0 протеза CarPentier-Edward^KrHTPaCTH0M каркасе» подобном каркасу
сЬи^^!Г1Д0М проводилась по методике Л^1РУКТУРНая стабилизация клапана глу-
СтвосГи применялась обработка XenoLoaiy8 ^eSs‘free>>- предупреждения кальци-
из сипм крепились к обшивке каркаса из п/ Снижаю1Дая содержание фосфолипидов.
кардиалкнН0В£Й резины (Edwards Life 8с1епсрИТеТРа^ТОрЭтилена’ содержащей вставки
“~ев«а,05.соРт, 2“o2) Пери-
на рынке биолп°СаД0ЧНЫХ диаметРах (19 и 21 превосходн°й гемодинамикой даже
ней) Этот биоппп63°В <приблизительно 40% ям^ И занял значительную часть продаж
Р тез стали чаще имплантиооАят^КаНСКИХ клапанов из животных тка-
156 ЭТЬ ольнь,м с узким корнем аорты. Не-
ГЛАВА 3. Биологические заменители кл^ппноя сердцл
которые кардиохирурги вшивали большие аортальные биопротезы Carpentier-Edwards
в митральную позицию, но изготовитель это не одобряет. Главным фактором, ограни-
чивающим использование биопротеза, вероятно, был негативный опыт имплантации
биопротезов lonescu-Shiley. Поэтому многие опытные кардиохирурги, установившие
раннюю дисфункцию перикардиального биопротеза lonescu-Shiley, по инерции отка-
зывались использовать и другие перикардиальные клапаны. Однако фирма Baxter
Healthcare Inc, судя по всему, провела превосходную работу по анализу причин отказа
предшествующих перикардиальных протезов и изобрела способ, предупреждающий
разрывы створок. Анализ клинического использования протеза Carpentier-Edwards по-
казал, что долговечность этого протеза спустя 10 лет работы в организме не отлича-
лась от продолжительности функционирования стандартных свиных протезов. Отсут-
ствие структурной дегенерации биопротеза Carpentier-Edwards составляло 99%, 94%,
77%, соответственно, к 5-му, 10-му и 15-му году после операции. В последние годы в
Соединенных Штатах перикардиальный протез Carpentier-Edwards является наиболее
рекомендуемым для имплантации (Marchand М. et al. 1998; Butany J. et al., 2001;
Jamieson W. R. et al., 2001; Corbineau H. et al., 2001).
В 2000 п компания Edwards Lifesciences LLC, вышедшая из Baxter Healthcare Inc.,
анонсировала эволюционную модификацию митрального перикардиального протеза
Carpentier-Edwards с плоской манжетой (модель 6900Р) и аортального протеза с вол-
нообразной манжетой для супрааннулярной имплантации (модели 2700 и 2800). Кла-
пан получил название Carpentier-Edwards PERIMOUNT (рис. 3.7; цв. вкладка, рис. 4).
Он отличается от первоначальных перикардиальных биопротезов Carpentier-Edwards
тем, что низкопрофильный гибкий каркас (Elgiloy) и пришивная манжета из силикони-
зированной резины обрабатывались политетрафторэтиленом (PTFE) для уменьшения
тромбогенности и улучшения вживления протеза в ткани (Bortolotti U. et al., 2000;
Firstenberg M. S. et al., 2001; Vitale N. et al., 2003). Компания Medtronic также пыталась
выпускать перикардиальные биопротезы Hancock Т405 и Т410. однако их производ-
ство было остановлено по непонятным причинам.
В 80-х гг. разработанные в университете Сантьяго перикардиальные биопротезы
Labcor-Santiago (352-А и 352-М) начали выпускаться в Labcor Laboratory (Бело Гори-
зонте, Бразилия). Створки обрабатывались глутаровым альдегидом при нулевом дав-
лении и крепились к нерентгеноконтрастному полимерному (Celcon) каркасу, покрыто-
му дакроном. Внутренняя поверхность каркаса покрывалась тонким слоем перикарда
для снижения напряжений и повреждений створок Клинические наблюдения немного-
численны. Клапан поставляется в страны Южной Америки, Азии и Африки (Gonzalez-
Рис. 3.7. Аортальный перикардиальный биопротез Carpentier—Edwards PERIMOUNT (www.ed-
wards.com); митральный перикардиальный биолротез Carpentier—Edwards PERIMOUNT
(www.edwards.com) и его рентгеноконтрастный каркас (по J. Butany et al., 2003)
____________________________________________________________ 157
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
Рис. 3.8 Перикардиальный биопротез Sorin Pericarbon (по J. Butany et al., 2003)
Juanatey JR et al, 1994, Pavie A J et al., 2001)
Компания Sorin (Италия) также внесла свой вклад в производство каркасных пери-
кардиальных протезов В 1985 г она выпустила протез Sorin Pericarbon (рис 3 8;
цв вкладка, рис. 4), который отличался от других биопротезов этого типа тем, что при-
шивная манжета его была покрыта антитромбогенным, гемосовместимым углеродным
покрытием Carbofilm (Caimmi RP. et al., 1998. Bonacchi M. et al., 2002).
Таким образом, каркасные биопротезы, стабилизированные глутаральдегидом, ис-
пользуются в клинической практике более 30 лет для замены практически всех клапа-
нов сердца Однако эти биологические протезы показали ограниченную долговечность,
преимущественно у молодых пациентов, достаточно высокое сопротивление в аорталь-
ной позиции при узком корне аорты (Коп N D. et al, 1995, Aupart М R. et al , 1996).
Большинство исследователей связывают низкую износоустойчивость биопротезов с
наличием каркаса и обработкой ткани глутаральдегидом. Поэтому в настоящее время
ведутся разработки новых консервантов и технологий обработки биоткани, а также
новых моделей каркасных биопротезов
БЕСКАРКАСНЫЕ БИОПРОТЕЗЫ И ГОМОГРАФТЫ
Достаточно высокий систолический градиент давления на каркасных ксеноаорталь-
ных протезах, относительно низкая их долговечность, особенно при малых размерах
корня аорть! пациента, а та оке ограниченная доступность аллографтов стали опреде-
ляющими факторами возрождения и дальнейшей разработки бескаркасных биопроте-
аоРты (stentless bioprosthesis) или ксенографтов, которые были разрабо-
поптр ок ?кппПК|В*^Шени^ гемодинамических характеристик и износоустойчивости био-
ZL' et al ’ 1995’ 0Ъг,еп М F et al., 2000)
sodium carhonatTT6 ° применении консервированных 2-etyl-mercaptomercury benzoxazol-5
j P B?net u cZ ?ХТваХасЛЬНЬ'Х кс®нографтов у пяти пациентов было сделано
рациях протезирования 6 г М F О Brien и J к Claborough сообщили о 23 опе-
формальдегидом Ближ^йшиТ результеГб^^^*3^ ПрОтеЗОМ' Фиксированным 4%
но быстро развивалась п.-г-л? ультать1 6ыли превосходными, однако достаточ
ством конструкции и структуоноГгУаТ ксеногРаФтов. обусловленная несовершен-
ности возникали из-за мышечно абилизаЧии ткани В частности, технические труд-
ции протеза во время имплантАпим°Сп0ВаНИЯ правой коронарной створки и деформа-
зитныи ксенографт, изготовленный оэтому в 1967 г М F О Brien разработал компо-
свиных корней аорты Протез имрпИЗ ТреХ некоР°нарных створок и синусов от трех
вался однорядным непрерывным швом РЧтУЮ « °НУ коаптации створок и имплантиро
g Этот биопротез применялся в период с 1967
ГЛАВА 3 Биологические заменители клапанов сердца
по 1969 г Однако фиксация биоткани клапана формальдегидом не позволяла суще-
ственно увеличить долговечность новой конструкции, что приводило к повторным опе-
рациям (O'Brien М F. et al , 1967, 1970).
Композитный свиной бескаркасный протез Cryolife-O’Brien, CryoLife International,
Marietta, GA (рис. 3.9) модель 300 (Cryolite) является современным вариантом компо-
зитного ксеноаортального протеза, разработанного, как указывалось выше, O’Brien М
в 1967 г Структурная стабилизация биоткани этого ксенографта выполнялась в стаци-
онарных условиях под низким положительным (2-3 мм рт ст.) давлением на створки
(в закрытом положении)
Сшитый из трех подобранных по габаритам некоронарных створок и синусов, полу-
ченных от трех стабилизированных свиных корней, этот протез практически не имеет
приточного отдела и межстворчатых треугольников Имплантируется однорядным не-
прерывным полипропиленовым (3/0) швом в супрааннулярную позицию по субкоро-
нарной технике (O’Brien М F. et а) , 1995, 1998, Garlick R. В et al., 1997)
Первые неудачи, а также разработка и внедрение в клиническую практику каркас-
ных биопротезов, стабилизированных глутаральдегидом, с относительно простой тех-
никой имплантации привели к полному отказу от применения бескаркасных биопроте-
зов аортального клапана Только в 1985 г Н. Н Sievers и соавт снова сообщили о кли-
ническом применении бескаркасного биопротеза, имплантировав ксенографт,
стабилизированный глутаровым альдегидом, в аортальную позицию
Биопротез Toronto SPV разработан в сотрудничестве доктора Tirone David и компа-
нии St Jude Medical Inc В средине 80-х гг Т Е David (рис. 3 10) проводил исследова-
ния разработанного бескаркасного биопротеза на животных с последующей клиничес-
кой апробацией Первые 29 имплантации в клинике были выполнены в конце 80-х гг
(David Т. Е. 1998). В дальнейшем усовершенствованный вариант этого биопротеза
(вклейка) получил коммерческое название Stentless Toronto SPV (St. Jude,
Minneapolis, MN 1991) и стал применяться в Европе с 1995 г, а также с 1997 г и в
США (цв вкладка, рис 5) Бескаркасный биопротез Stentless Toronto SPV представ-
ляет собой стабилизированный глутаральдегидом под низким давлением корень аор-
ты с полностью иссеченными синусами, содержащий округлой формы приточный от-
дел, обшитыи синтетической тканью Ксенографт также обшит синтетической тканью
(дакроном) по наружной поверхности и разработан только для субкоронарной ортото-
пической имплантации (David Т Е , 1998)
СКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА_________________________
Рис. 3.10. Т. Е. David и бескаркасный биопротез Stentless Toronto SPV (по J. Butany at al., 2003)
Возврат к бескаркасным биопротезам в начале 90-х гг. XX столетия в виде «второго
поколения» был представлен тремя типами конструкций, выпускаемых в настоящее
время несколькими фирмами (Medtronic, Baxter, Biocor, St. Jude Medical, Cryolite,
Shelhigh, Sorin) Протез с двумя или тремя иссеченными синусами предназначен для
субкоронарной имплантации, протез в виде цилиндра с частично иссеченными коро-
нарными синусами — для имплантации по технике «вставки корня» (< root-inclusion»)
или в субкоронарную позицию, а также протез в виде цельного корня аорты, предназ-
наченный для полного протезирования корня аорты пациента.
Ксенографт в виде цельного корня аорты может быть использован для импланта-
ции по любому варианту техники Для этого хирург во время операции подрезает про-
тез в зависимости от выбранного варианта техники имплантации. К такому типу ксено-
аортального бескаркасного протеза относится Medtronic Freestyle (Medtronic,
Minneapolis, MN) (рис. 3.11; цв. вкладка, рис. 8). Этот биопротез представляет собой
цельный свиной корень аорты, стабилизированный 0,2% раствором глутаральдегида
Рис. 3.11. Бескаркасные биопротезы Medtronic Freestyle и PrimaTM Edwards (по J. Butany at al., 2003)
—--------- 160 --------------------------- ---------------------------
ГЛАВА 3 Биологические заменители клапанов сердца
при нулевом градиенте давления на створки и давлении 40 мм рт. ст. на стенку аорты
Клапан обработан протектором кальцификации (а-аминоолеиновой кислотой). Приточ-
ный отдел и правый коронарный синус биопротеза обшиты дакроном. Этот протез по-
зволяет выполнять имплантацию в виде цельного корня аорты или «вставки корня >, а
также с полным и неполным иссечением синусов в субкоронарную позицию (Коп N D
et al., 1995; 1999; Krause А. Н., 1997; John A. et al., 2004; Melina G. et al., 2005)
Ксеноаортальный бескаркасный протез PrimaTM Edwards (см. рис. 3.11) модель
2500 (Baxter) представляет собой свиной корень аорты цилиндрической формы, ста-
билизированный 0,625% раствором глутаральдегида при низком положительном дав-
лении (2 мм рт. ст.) на створки Протез покрыт дакроном в его приточном отделе и по
наружной поверхности в области правого коронарного синуса Бескаркасный биопро-
тез Edwards Prima в новой модификации под названием PrimaTM Edwards Plus, вне-
дрен в клиническую практику в Европе в 2000 г., в США — в 2001 г., а с 2003 г исполь-
зуется и в Японии. Аналогично Medtronic Freestyle, этот биопротез может применяться
для имплантации по трем вариантам техники (Konertz W. et al., 1992).
Композитный ксеноаортальный бескаркасный протез Biocor (Labcor) — St. Jude
Medical, 1996 — изготовлен из трех некоронарных створок (см рис 3 5; цв. вкладка,
рис. 4), стабилизированных глутаровым альдегидом при нулевом давлении, обшит ста-
билизированным бычьим перикардом (Vrandecic М. et al , 2000).
Английская фирма Aortech выпускает два типа бескаркасных биопротезов —
Rootelan (рис. 3.12) в виде цельного корня аорты и Elan (рис. 3.13) с тремя иссечен-
ными синусами (Flynn М. et al., 2001). С 2003 г. биопротезы распространяются немец-
кой компанией Koehler-Medical.
Ксеноперикардиальный аортальный бескаркасный биопротез Sorin PericarbonTM
(Sonn Biomedica, Saluggia, Италия) изготовлен из двух лоскутов стабилизированного глута-
ральдегидом ксеноперикарда с широкой зоной коаптации створок (цв. вкладка, рис. 5) и
предназначен для имплантации в субкоронарную позицию (Gegouskov V. A et al., 2003).
Ксеноаортальные композитные бескаркасные протезы Shelhigh Standard (модель
NR-2000) и Shelhigh SuperStentless (модель NR-2000 Plus) изготовлены также из трех
некоронарных свиных створок, стабилизированных глутаральдегидом и обшиты пери-
кардом (рис. 3.14). Ксеноткань биопротезов детоксифицирована от остатков глутараль-
дегида, обработана протектором кальцификации и гепарином. Такая обработка био-
ткани получила название No-React® Клапан, закрепленый на гибком кольце, соединя-
ет преимущества гемодинамики бескаркасных биопротезов и удобство имплантации
каркасных. Фирма Shelhigh также выпускает бескаркасные биопротезы в составе аор-
тальных кондуитов (Szafianek A. et al , 2003).
Рис. 3.12. Бескаркасный биопротез Rootelan (по www.koehler-medicaLcom)
--------------------------------------------------161
7 Искусственные клапаны сердца
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
Рис. 3.13. Бескаркасный биопротез Elan (по www.koehler-medical.com)
Ксеноаортальный бескаркасный протез Unique Suture Line USL (Biosud S. A., Buenos
Aires, Argentina) изготовлен из свиного корня аорты, стабилизированного глутаральде-
гидом, с полностью иссеченными синусами и частично иссеченными межстворчатыми
треугольниками, обшит дакроновой тканью по наружной поверхности, которая близко
к проксимальному краю протеза содержит дакроновую манжету (Navia J. A. et al., 1992;
1998). Протез имплантируется одним рядом узловых швов и тремя надкомиссураль-
ными «подвешивающими» П-образными швами.
Ксеноаортальный композитный бескаркасный протез Carbomedics «Oxford»
Photofix изготовлен из трех некоронарных створок с иссеченными синусами. Его при-
точный отдел обшит перикардом в виде манжеты. Биоткань протеза стабилизирована
новым методом фотофиксации (Moore М. A. et al., 1997; Westaby S. et al., 1999).
Фирма St. Jude Medical изготавливала бескаркасный четырехстворчатый протез
для митральной позиции Quattro (рис. 3.15; цв. вкладка, рис. 5), состоящий из бычь-
его перикарда (Hofmann В. et al., 2001; Middlemost S. J. et al., 2003; Walther T et al.,
2003).
Функциональные преимущества бескаркасных биопротезов над каркасными были
доказаны при сравнительных гидродинамических исследованиях, проведенных в пер-
вой половине 90-х гг. (Yoaganathan A. R et al., 1994). В основном, были исследованы те
Рис. 3.14. Бескаркасные биопротезы Shelhigh SuperStentless (www.shelhigh.com) и Labco.
(www.labcor.com.br)
----~------ 162----------------------------__ ____-
ГЛАВА 3 Биологические заменители клапанов сердца
Рис. 3.15. Бескаркасный митральный биопротез Quattro (по Т. Walther et al., 2003)
модели, которые выпускались в виде цельного корня аорты. Так, H.W. Sung и соавт.
(1995) установили, что бескаркасный биопротез Edwards Prima имел в три раза мень-
ший средний градиент давления на протезе относительно каркасного биопротеза
Carpentier-Edwards при стандартном гидродинамическом режиме (средний расход —
5 л/мин, среднее давление — 100 мм рт. ст. и частота — 70 уд/мин) на всех типоразмерах
(от 19 до 29 мм) Площадь эффективного отверстия (ЕОА) бескаркасных биопротезов,
в среднем, в 1,5 раза превышала площадь каркасных. Сравнительные исследования
гидродинамических характеристик ксенографта Medtronic Freestyle, двух каркасных про-
тезов Hancock Standard и Hancock Modified и механического двустворчатого протеза
St. Jude Medical показали значительно меньшие градиенты давления и большие эф-
фективные площади отверстий (ЕОА) у протеза Medtronic Freestyle относительно кар-
касных клапанов (Bach D. S. et al., 2002; Yoaganathan A. P. et aL, 1994).
Функциональные преимущества бескаркасных биопротезов, как и аллографтов, над
каркасными биопротезами обусловлены их уникальной особенностью, заключающей-
ся в том, что при субкоронарной имплантации корень аорты пациента функционирует
как естественный каркас относительно створок ксенографта. При протезировании по
технике «вставки корня» и, особенно, полном протезировании корня аорты фиброзные
структуры и синусы ксенографта сами выполняют роль каркаса, демпфирующего гид-
родинамический удар (David Т Е. et al., 1990). Отсутствие искусственного каркаса у ксе-
нографтов обеспечивает низкие трансклапанные градиенты давления и высокую эф-
фективную площадь отверстия (ЕОА), что может приводить к большей износоустойчи-
вости бескаркасных биопротезов относительно каркасных (Angel W. W. et al., 1991)
Бескаркасные биопротезы аортального клапана были разработаны с целью улуч-
шения гемодинамики и долговечности относительно их каркасных аналогов. Прошло
Ю-15 лет клинических исследований протезирования клапана аорты этими биопроте-
зами. В отдельных публикациях были представлены непосредственные и отдаленные
результаты сравнительных исследований применения бескаркасных биопротезов, с
одной стороны, и каркасных биопротезов, механических протезов или аллографтов —
с другой. Летальность, характер течения интра- и послеоперационного периодов, вклю-
—----------------------------------------------------163
7*
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
чая уровень инотропной поддержки и частоту развития осложнений, существенно не
отличались в сравниваемых группах пациентов (Thomson Н. L. et al., 1998; Westaby S. et
al., 2000; Gieve H. H, et al , 2001; Ennker J. et al., 2003). Однако большинство публика-
ций подтвердило гемодинамическое превосходство бескаркасных биопротезов над
каркасными. Это гемодинамическое превосходство выражалось более быстрой и пол-
ной регрессией массы гипертрофированного миокарда, меньшими градиентами на
протезе, более высокими ЕОА в покое и, особенно, при физической нагрузке. Так, при
возрастающей физической нагрузке перепады давления существенно повышались
у пациентов с механическими протезами и каркасными биопротезами. В то же время у
пациентов с бескаркасными биопротезами (Medtronic Freestyle, Toronto SPV) градиен-
ты давления увеличивались незначительно, аналогично как у здоровых лиц контрольной
группы и пациентов с имплантированным аллографтом (David Т. Е. et al , 1998; Del
Rizzo D.F et al., 1998, Vrandecic M. et al., 2000; Westaby S. et al., 2000; Silberman S
et al., 2001; Jm X Y, 2002; Bach D. S. et al., 2004). Так, например, систолический гради-
ент давления на аортальном протезе Вюсог составлял, в среднем, в покое 8,1± 3,2 мм
ртст, а при нагрузке в 65% от максимального уровня — 11,9 ±3,6 мм рт. ст,
(Eriksson М. J. et al , 1997; Von Oppell U. О. et al., 2001).
Ламинарный кровоток через аортальный бескаркасный биопротез обеспечивает
нормальный характер и скорость коронарного кровотока пациента. Напротив, значи-
тельный остаточный систолический градиент давления, обусловленный каркасным био-
протезом или механическим протезом, вызывает значительные сдвиги распределения
коронарного кровотока от систолы к диастоле. Эти тонкие различия становились за-
метнее при физической нагрузке, поскольку коронарное кровообращение в большей
мере обеспечивается в диастолу и поэтому зависит от частоты сердечных сокращении
(Jin X.Y., 2002)
Только в нескольких работах (Rao V. et al., 1999; Cohen G. et al., 2002; Doss M et al.,
2003) были представлены гемодинамические данные, существенно отличавшиеся от
опубликованных ранее В этих работах не было установлено гемодинамического пре-
имущества бескаркасных биопротезов (Toronto SPV, Edwards Pnma Plus) над современ-
ными ксеноперикардиальными каркасными протезами (Carpentier-Edwards pericardial,
Penmount). Близкий гемодинамический эффект в сравниваемых группах был обуслов-
лен имплантацией тонкостенных перикардиальных каркасных протезов в супрааннуляр-
ную позицию, позволяющую использовать протез большего размера (Rao V et al., 1999;
Hurle A. et al , 2002).
Лучшая восьмилетняя актуарная выживаемость 91 ±4% пожилых пациентов с бес-
каркасным биопротезом Toronto SPV относительно пациентов с имплантированным
каркасным биопротезом Hancock II 69±8% была показана отдельными авторами
(David Т. Е. et al , 1998, Danton М. Н et al, 2000, Williams R. J. et al , 2001; Bottio T. et al.,
2003). Более высокая пятилетняя актуарная выживаемость в 84% (рандомизированное
исследование) была установлена у пожилых пациентов (73+6 лет, п= 160) с имплан-
тированным в аортальную позицию биопротезом Medtronic Freestyle относительно вы-
живаемости 69 хо пациентов того же возраста (74±6 лет) с имплантированным кар-
касным биопротезом Carpentier-Edwards (Westaby S. et al , 2000; Banbury M. K. et al..
2002; Jamieson W. R. et al., 2002). Однако для окончательного решения этого вопро-
са необходимо многоцентровое проспективное рандомизированное исследование
(David Т. Е., 2002).
Сравнительные исследования каркасных и бескаркасных биопротезов бросили вы-
зов общепризнанному мнению, что тип клапанного протеза не влияет на отдаленную
выживаемость больных после протезирования аортального клапана. Эти работы побу-
дили многих исследователей заново изучить проблему выбора типоразмера протеза,
динамику симптомов и отдаленную выживаемость после замены клапана аорты раз-
еГаГ'2000^°Те3аМИ (ThOrns0n HL et aL’ 1998; Co,l,nson J et al , 1999, Hanayama N.
164
ГЛАВА 3. Биологические заменители клапанов сердца
Ранее считалось, что возраст больного, степень исходной сердечной недостаточ-
ности, исходная фракция выброса левого желудочка и поражение коронарных артерий
являются основными факторами, определяющими непосредственные и отдаленные
клинические результаты, а такие факторы, как размер протеза, резидуальные транс-
протезные градиенты и степень регрессии массы левого желудочка не столь важны.
Это утвержение справедливо для пациентов с умеренными транспротезными градиен-
тами, компенсированными сохраненной функцией миокарда левого желудочка. Одна-
ко такая компенсация не развивается у пациентов с дисфункцией левого желудочка
или у пациентов, которым объемную перегрузку левого желудочка заменили на нагрузку
сопротивлением, т. е. протезом (David Т. Е., 2002). На большом клиническом материа-
ле (1103 имплантации) D F. Del Rizzo и соавт. (1999) показали, что на отдаленный фун-
кциональный результат операции протезирования клапана аорты и, в частности, на ЕОА
и степень регрессии массы миокарда левого желудочка достоверно влияют исходная
степень его гипертрофии и выбор типоразмера протеза. В целом, гемодинамические
характеристики бескаркасных биопротезов клапана аорты оказались близки или срав-
нимы с характеристиками аллографтов (Gross Ch. et al., 1999; Kon N. D. et al., 1999;
Maselli D. et al., 1999; O’Brien M. F., 1999).
Таким образом, относительная простота техники имплантации, низкий риск тром-
боэмболических осложнений, отказ от применения антикоагулянтов и хороший гемо-
динамический эффект позволяют сравнивать бескаркасные биопротезы с аллографта-
ми в аортальной позиции (Gross Ch. et al., 1999; Maselli D. et al., 1999; O’Brien M. F.,
1999). К тому же неограниченная доступность ксенографтов обеспечивает выбор не-
обходимого типоразмера биоклапана во время операции.
В кардиохирургической практике применяются необработанные трансплантаты кла-
панов сердца. Как и в других областях пластической хирургии, первые надежды были
связаны с попыткой использования аутогенных тканей. В частности, применяли био-
клапаны из аутоперикарда и широкой фасции бедра, изготовленные без опорного кар-
каса или на каркасе, а также использовали аутологичный пульмональный клапан для
имплантации в аортальную позицию с одновременным протезированием легочной ар-
терии (Lower R. et al., 1960; Senning A., 1967; Ross D., 1967; Edwards W., 1972).
Практически все перечисленные разработки не нашли широкого применения, од-
нако причины, из-за которых они оставлены, заслуживают особого внимания. Приме-
нение клапанов из аутофасции и аугоперикарда, не укрепленных на каркасе, было не-
эффективным, прежде всего, из-за частых случаев остаточной регургитации в раннем
послеоперационном периоде, что связано с техническими трудностями моделирова-
ния створок при имплантации (Edwards W., 1972). В дальнейшем для моделирования
аутологичных тканей использовалось титановое кольцо, покрытое дакроновым велю-
ром (Carpentier A. et aL, 1968, lonescu М. et al., 1970). Однако co временем и увеличе-
нием числа наблюдений выявились новые проблемы, заставившие всех хирургов отка-
заться от подобных операции и признать, что аутогенные перикард и широкая фасция
бедра являются непригодными тканями для конструирования клапанов. Необработан-
ные биоклапаны из аутотканей через 6-8 мес в митральной позиции и через 2-3 года
в аортальной становились некомпетентными из-за укорочения и одновременного утол-
щения створок в результате их склерозирования. Это позволило заключить, что жиз-
неспособность используемых пластических материалов не является обязательным и
необходимым условием успешного «вживления» (Малиновский Н. Н. и др., 1988).
Идея замены аортального клапана пульмональным аутотрансплантатом сформиро-
валась в 1960 г. и была реализована впервые в клинике D. N. Ross в 1967 г. Эта идея
развилась как логическое продолжение использования аортального гомотранспланта-
та. В связи с развитием протезирования клапанов сердца механическими и биологи-
ческими протезами, с одной стороны, и техническими трудностями имплантации пуль-
монального аутотрансплантата — с другой, интерес к операции D N. Ross исчез. Од-
нако с середины 80-х гг., когда D. N. Ross (рис. 3 16) и другие авторы опубликовали
—--------------------------------------------------- 165
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
Рис. 3.16. D. Ross (по Д. Россу, 2003) и пульмональный ксенографт Cryolife-Ross (www.criolife.com)
хорошие отдаленные результаты, вновь возродился интерес к этой операции, поскольку
замена аортального клапана у детей, особенно при инфекционном эндокардите, оста-
ется актуальнейшей проблемой Имплантированный в аорту легочный клапан (ауто-
графт) не подвергается дегенерации, так как его ткань принадлежит пациенту. В слу-
чае использования собственного легочного клапана у детей наблюдается рост клапан-
ного кольца и створок вместе с ростом организма, а функция клапана по времени
практически не ограничена. На место перемещенного в аортальную позицию легочно-
го клапана обычно имплантируют легочный аллографт.
Однако операция D. N Ross не получила широкого клинического применения ввиду
необходимости одномоментного протезирования и клапана легочной артерии. Во всем
мире лишь около тысячи хирургов оперируют по методу D. N. Ross, поскольку эта опе-
рация намного сложнее других кардиохирургических операции Она требует от хирур-
гов и анестезиологов высочайшего мастерства. В отдаленные сроки наблюдения (15—
16 лет) актуарные показатели свободы от нарушения функции аутотрансплантата со-
ставляли 85% (Robles A et al., 1985). Вместе с тем, операция D. N. Ross чревата
развитием определенных осложнении- в частности, из-за несоответствия размеров
обоих клапанов может развиваться недостаточность пульмонального аутографта в аор-
тальной позиции, нередко встречается умеренная недостаточность и аллопульмональ-
ного клапана, а некоторым больным требуется повторная замена аортального клапана
из-за выраженной регургитации. Осложнениями этой операции могут быть стеноз
коронарных артерий, эндокардит и разрыв створок аутографта. Поэтому в настоящее
время операция D N Ross применяется у очень ограниченного числа пациентов, в ос-
новном у детей, при этом перед операцией производятся тщательные эхокардиогра-
фические измерения и точный подбор аллоклапана для замены клапана легочной ар-
терии Недавно компания Cryolite Inc. выпустила пульмональный ксенографт под тор-
говой маркой Cryolife-Ross (см рис. 3.16), который может быть альтернативой
аллографту при операции Росса Это бескаркасный свиной биопротез, фиксирован-
ный в глутаровом альдегиде под низким давлением.
Таким образом, достоинствами пульмонального аутотрансплантата (операции Рос-
са) являются возможность его роста и устойчивость к инфекции, а недостатками —
необходимость протезирования легочной артерии аллоаортальным или аллопульмо-
нальным графтом и достаточно сложная хирургическая техника.
166--------------------------------------------------------—
ГЛАВА 3. Биологические заменители клапанов сердца
Рис. 3.17. В. G. Bar г at-Boyes (по А. Р. Naef, 2004) и аортальный гомографт (по S. Verghese et al., 2004)
С 1962 г. D. Ross и В. G. Barratt-Boyes (рис. 3.17) начали регулярно применять в кли-
нике аллографты (гомографты). История разработки и применения аллографтов на-
считывает несколько десятков лет. К настоящему времени накоплен достаточный кли-
нический материал и определены основные принципы криобиологии по сохранению
этого вида заменителей клапанов сердца. Забор трансплантата выполняется в течение
24 ч после смерти донора, совместимость трансплантата-реципиента производится
по системе АВО. Мягкая стерилизация трансплантата осуществляется в смеси пита-
тельной среды и антибиотиков не более 24 ч, а строго градуированное замораживание
производится в присутствии криопротекторов (10% диметилсульфоксида или глице-
рина). Хранятся аллографты в жидком азоте (-196 °C) или его парах (-170 °C) и размо-
раживаются при температуре 38-40 °C (Бокерия Л. А. и др., 2002, Arminger L. С. et aL,
1985; Gulbins Н. et al., 2000).
Несмотря на ряд существующих проблем, связанных с пересадкой криосохранен-
ных аллографтов, в настоящее время они используются все шире при замене аорталь-
ного, пульмонального, а также митрального и трикуспидального клапанов сердца Ве-
роятный рост этой продукции на рынке заменителей клапанов исследователи связы-
вают с улучшением всей программы донорства, забора и сохранения материала. В США
основным поставщиком аллографтов является фирма ( ryoLife По данным М О Впеп
(1995), при адекватно выполненной операции (исключая больных с эндокардитом) че-
рез 10 лет не имеют дисфункции 95-100% аллографтов. Отдельные клиники к настоя-
щему времени имеют клинический опыт до 600 имплантаций аллографтов с макси-
мальными сроками наблюдения более 20 лет.
Бесспорным достоинством аллографтов являются физиологичность кровотока, от-
сутствие тромбоэмболий, естественная резистентность к инфекции, в том числе при
эндокардите, возможность имплантации в условиях узкого корня аорты, медленное
развитие дисфункции, которая у взрослых идет по типу регургитации, а у грудных де-
тей может протекать с кальцинозом. К недостаткам аллографтов относят их ограни-
ченную доступность, высокую стоимость и сложность техники имплантации Остаются
полностью нерешенными и неясными вопросы сохранения жизнеспособности клеток
(фибробластов и эндотелиоцитов) аллографтов, способность их к росту у детей (Боке-
рия Л. А., 2002; Elkins R. С. et al., 2001).
167
ИСКУССТВЕ ИНЫЕ КЛАПАНЫ СЕРДЦА_______________________________________
КЛАПАНЫ ТКАНЕВОЙ ИНЖЕНЕРИИ
Современные, доступные для клинического использования биоклапаны сердца, за
исключением пульмонального аутографта, представляют собой нежизнеспособные
структуры, у которых отсутствует потенциал к росту и репарация тканей. Это накла-
дывает существенные ограничения для их использования особенно у детей при кор-
рекции клапанной патологии. Тканевая инженерия клапанов сердца сформировалась
в течение последних 15 лет. Целью этого научного направления является создание
в искусственных условиях живых клапанов сердца с тромборезистентной поверхно-
стью и жизнеспособным интерстицием (Flanagan Т. С. et а!., 2003; Nugent Н. М. et al.,
2003).
Научная концепция тканевой инженерии клапанов сердца основана на идее заселе-
ния и выращивания живых клеток (фибробластов, стволовых клеток и др.) в синтети-
ческом или естественном рассасывающемся каркасе (матрице), представляющим со-
бой трехмерную клапанную конструкцию, а также использование сигналов, регулиру-
ющих экспрессию генов, организацию и продуктивность пересаженных клеток в течение
периода формирования экстрацеллюлярного матрикса и развития тканевого клапана в
целом.
Такой имплантированный клапан интегрируется с тканью больного для окончатель-
ного восстановления и дальнейшего поддержания своей структуры и функции. При этом
на исходной матрице в результате функционирования клеток (фибробластов, миофиб-
робластов и др.) формируется новый коллагеноэластиновый каркас или, точнее, экст-
рацеллюлярный матрикс. В итоге, оптимальная клапанная конструкция, созданная ме-
тодом тканевой инженерии, должна по анатомической структуре и своей функции при-
ближаться к нативному клапану, а также обладать биомеханической адаптируемостью,
способностью к репарации и росту (Vacanti J. R et al., 1999; Fuchs J. R. et aL, 2001).
Для тканевой инженерии клапанов сердца могут использоваться различные источ-
ники забора клеток. Так, могут применяться ксеногенные или аллогенные клетки, хотя
первые связаны с риском переноса зоонозов человеку (Nerem R. М. et al., 2001). Сни-
зить антигенность и предотвратить реакции отторжения организма возможно генети-
ческой модификацией аллогенных клеток (Heath С. А., 2000). Для тканевой инженерии
клапана необходим надежный источник получения клеток. Таким источником являются
аутогенные клетки, забираемые непосредственно от пациента и не дающие иммунных
реакций во время реимплантации (Heath С. А., 2000; Nerem R. М. et al., 2001) Успеш-
ные разработки клапанов сердца произведены на основе аутологичных клеток, полу-
ченных из кровеносных сосудов (артерий и вен). Для получения чистых клеточных куль-
тур разработан метод, основанный на использовании флюоресцентактивированной сор-
тировки клеток — FACS (Shmoka Т. et al., 1995; Hoerstrup S. P. et al., 1998). Смешанная
клеточная популяция, полученная из кровеносного сосуда, метится ацетилированным,
обладающим пониженной плотностью, липопротеиновым маркером, который избира-
тельно абсорбируется на поверхности эндотелиоцитов. Эндотелиоциты впоследствии
можно легко отделить от основной массы клеток, полученных из сосудов, которая бу-
дет представлена смесью из гладкомышечных клеток, миофибробластов и фиброблас-
тов. Источник клеток, будь то артерия или вена, будет влиять на свойства конечной
конструкции клапана. Так, конструкции клапанов с матрицей, засеянной венозными
клетками, по степени сформированности коллагена и механической стабильности пре-
восходят клапаны, засеянные артериальными клетками (Schnell А М. et al., 2001). Вы-
бор периферических вен представляется более удобным источником забора клеток.
Миофибробласты также могут забираться из сонных артерий Вместе с тем, клетки,
полученные из сосудов, существенно отличаются своими характеристиками от есте-
ственных клеток интерстиция клапанов сердца (Filip D. A. et al., 1986) В качестве аль-
тернативного источника клеток могут быть использованы аутогенные клетки пуповины
(Hoerstrup S Р. et al., 2000; Kadner A. et al., 2002).
168------------------------------------------------—
ГЛАВА 3. Биологические заменители клапанов сердца
Прогрессу тканевой инженерии клапанов сердца в последние годы способствуют
исследования стволовых клеток (Chapekar М. S. et aL, 2000) Использование стволовых
клеток красного костного мозга имеет свои преимущества. В частности, простота за-
бора биоматериала и культивирования /л vitro с последующей дифференциацией в раз-
личные типы мезенхимальных клеток позволяет избежать использования интактных
сосудов. Стволовые клетки являются плюрипотентными источниками клеточных рост-
ков, имеют уникальные иммунологические характеристики, способствующие их стабиль-
ности в аллогенных условиях (Liechty К. W. et aL, 2000).
Человеческие стволовые клетки красного костного мозга получают посредством
стернальной пункции или пункции гребня подвздошной кости. Их выделяют из 10-15 мл
аспирата грудины, отделяют от других клеток и культивируют. По достижении необхо-
димого числа клеток (обычно в течение 21-28 сут) производят их засевание (колони-
зацию) на матрицы клапанов, культивируют в питательной среде в статическом поло-
жении (в течение 7 сут в увлажненном инкубаторе при 37 °C в присутствии 5% СО2).
В дальнейшем стимуляция клеточного роста осуществляется через культуральную среду
(биологические стимулы) или через создание физиологических условий роста ткани
клапанов при ее изометрической деформации в аппарате репродукции с пульсирую-
щим потоком — биореакторе (механические стимулы), рис. 3.18. Фибробласты чувстви-
тельны к механическим стимулам, которые способствуют их росту и функциональной
активности (Hoerstrup S. Р. et aL, 1999; Jockenhoevel S. et aL, 2001; Mol A. et aL, 2003).
Пульсирующий поток вызывает увеличение как радиальных, так и окружных деформа-
ций клапана, что приводит к ориентации (вытянутости) заселенных клеток в направле-
нии действия таких напряжений. Это приводит, в свою очередь, к формированию ори-
ентированных волоконных структур створок (цв. вкладка, рис. 23). Постоянный поток
вызывает только касательные напряжения на стенках (Eastwood М. et aL, 1994; Brown
et al, 1998; Hoerstrup S. P. et aL, 2000; 2002; McCulloch A. D. et aL, 2003). Пульсирую-
щий поток благотворно сказывается на клеточной морфологии (Ziegler Т. et aL, 1994),
пролиферации и составе экстрацеллюлярного матрикса (Papadaki М. et al., 1996). Ха-
рактер потока питательной среды, физико-химические условия (pH, рО2 и рСО2) в био-
реакторе также существенно влияют на продукцию коллагена. Так, ламинарный поток,
циклические вихревые токи увеличивают продукцию коллагена, что приводит к улуч-
шению механических свойств клапана (Weston M.W. et aL, 2001; Sodian R. et aL, 2000;
Perry T. E. et aL, 2003; Engelmayr G. C. et al., 2003; Flanagan T. C. et aL, 2003).
Другой подход в выращивании тканевых клапанов состоит в создании эмбриональ-
ных условий в биореакторе вместо моделирования физиологических условий челове-
ческого организма. Выращенные на основе стволовых клеток тканевые биоклапаны
имеют подвижные и пластичные створки, функционально состоятельные при воздей-
ствии высокого давления и потока, превышающего физиологический уровень. Гисто-
Рис. 3.18. Схемы биореакторов с постоянным (а) (по S. Jockenhoevel et al., 2002) и пульсирующим
(б, в) потоком (по К. Dumont et al., 2002; S. P. Hoerstrup et al., 2000); M — засеваемые
матрицы клапанов сердца
169
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
логическое и гистохимическое исследования створок этих клапанов показали наличие
в них активно протекающих процессов биодеструкции матрицы и замещения ее жиз-
неспособной тканью. Ткань организована по слоистому типу с характеристиками про-
теинов экстрацеллюлярного матрикса, подобными характеристикам ткани клапанов
сердца наличием коллагена I и III типа и гликозаминогликанов (цв. вкладка, рис. 23).
Однако не было получено типичного трехслойного строения створок клапана — вент-
рикулярного, спонгиозного и фиброзного слоев (Schoen F. J. et al., 1997). Обнаружен-
ные во всех фрагментах тканевого клапана ASMA-позитивные клетки, экспрессирую-
щие виментин. имели характеристики, схожие с характеристиками миофибробластов
(Taylor Р М. et al., 2000). При электронной микроскопии этих клапанов были обнаруже-
ны клеточные элементы с признаками, характерными для жизнеспособных, секретор-
но активных миофибробластов (актин/миозиновые филаменты, коллагеновые нити, эла-
стин), а на поверхности ткани — эндотелиальные клетки.
На створках клапанов были обнаружены коллаген I, III типов, ASMA и виментин.
Механические свойства створок тканевых и нативных клапанов были сопоставимы. Тка-
невые клапаны показывали превосходную производительность в течение 20 нед и на-
поминали естественные клапаны сердца по своей микроструктуре, биохимическому
профилю и формированию протеинового матрикса (Hoerstrup S. Р. et al., 2000).
Все клапаны сердца, полученные методом тканевой инженерии, имплантировались
животным в легочную позицию, поскольку их механические характеристики не соот-
ветствуют нагрузкам в аортальной позиции. Эксплантированные от животных тканевые
клапаны по своей структуре близки к нативным клапанам, что свидетельствует о даль-
нейшем их развитии и перестройке в условиях in vivo. Будет ли процесс перестройки и
созревания ткани продолжаться в физиологических условиях после имплантации кла-
пана человеку, как это наблюдалось в экспериментах на животных (рис. 3.19), покажут
дальнейшие исследования.
Идеальная матрица должна обладать пористостью не менее 90%, поскольку это
существенно для клеточного роста, доставки питательных веществ и удаления продук-
тов метаболизма клеток Помимо биологической совместимости и способности к био-
деструкции, матрица должна иметь химически благоприятную для засевания клеток
поверхность и соответствовать механическим свойствам естественной ткани клапанов.
Уровень биодеструкции матрицы должен быть управляемым и пропорциональным уров-
Рис. 3.79. Клапаны, созданные методом тканевой инженерии: после 14 дней роста в биореакторе
(no S. Р. Hoerstrup et al., 2000) и после 11 недель функционирования в организме живот
ного (no S. Gunaydin et al., 2000)
170 ________________________________________________________
ГЛАВА 3 Биологические заменители клапанов се^ ццв
ню образования новой ткани для обеспечения гарантии механической стабильности в
течение определенного времени (Hutmacher D. W. et al., 2001).
В настоящее время ведутся разработки синтетических и биологических матриц.
Наиболее распространенными биологическими материалами для создания матриц яв-
ляются донорские клапаны, коллаген и фибрин. Полимерные матрицы разрабатывают-
ся таким образом, чтобы биодеградировать после имплантации, как только импланти-
рованные клетки начнут производить и организовывать свою собственную внеклеточ-
ную матричную сеть. Формирование новой матричной ткани можно регулировать или
стимулировать с помощью факторов роста, цитокинов или гормонов (Putnam A J.
et al., 1996; Pandit A. S. et al., 2000; Tabata Y, 2000).
Донорские клапаны сердца, полученные от человека или животных и лишенные кле-
точных антигенов путем децеллюляризации для снижения их иммуногенности, можно
использовать в качестве матриц. Сохранившиеся протеины экстрацеллюлярного мат-
рикса являются основой для последующей адгезии засеваемых клеток. Существуют
следующие способы удаления клеточных элементов (ацеллюляризации): заморажива-
ние, обработка трипсин/EDTA, детергентами — додецил сульфатом натрия, деоксико-
латом натрия, Triton Х-100, MEGA 10, TnBP, CHAPS, Tween 20, а также многостадийные
способы ферментативной обработки (Steinhoff G. et al., 2000; Zeltinger J. et al., 2001;
Booth C. et al., 2002; Kim W. G. et al., 2002; Kasimir M.T. et al., 2003; Leyh R. G. et al.,
2003). При этом удаляются мембраны клеток, нуклеиновые кислоты липиды, цитоп-
лазматические структуры и растворимые молекулы матрикса с сохранением коллагена
и эластина. Однако идеального способа пока не найдено. Только додецил сульфат на-
трия (0,03-1%) или деоксиколат натрия (0,5-2%) приводили к полному удалению кле-
ток после 24 ч обработки.
Гистологическое исследование удаленных децеллюляризованных биоклапанов (ал-
лографта и ксенографта) в эксперименте на животных (собаке и свинье) показало, что
происходят частичные эндотелизация и врастание миофибробластов реципиента в
основание клапана, отсутствуют признаки его кальциноза (О Brien et al., 1999; Zeltinger
J. et al , 2001). Отмечена умеренно выраженная воспалительная инфильтрация клапа-
на. Однако при клинических испытаниях децеллюляризованного клапана SynerGraftTM
(CryoLife Inc , USA) развивалась ранняя недостаточность клапана В матриксе биопро-
теза определялась выраженная воспалительная реакция, которая вначале была неспе-
цифической и сопровождалась лимфоцитарной реакцией. Дисфункция и дегенерация
биопротеза развивались в течение одного года. Заселения матрикса клапана клетками
не было отмечено, однако были выявлены кальциноз створок и предимплантационные
остатки клеток (Simon Р. et al., 2003).
Засеянные эндотелиальными клетками бесклеточные матрицы и культивированные
в условиях in vitro и in vivo образовывали целостный слой на поверхности створок,
а засеянные интерстициальные клетки нативного клапана показали свою способность
к дифференциации (Steinhoff G et al., 2000, Kim W G. et al., 2002, Bertiplaglia B. et al.,
2003). Однако достичь необходимого физиологического уровня колонизации клеток на
клапанном матриксе в динамических условиях биореактора не удавалось, а импланта-
ция таких клапанов сопровождалась достаточно быстрым (три месяца) утолщением за
счет ускоренной клеточной пролиферации и образования экстрацеллюлярного матрикса
(Steinhoff G et al., 2000, Zeltinger J et al., 2001). Таким образом, на данном этапе ис-
пользование донорских бесклеточных матриц для их колонизации клетками имеет ряд
нерешенных проблем, в том числе иммунологического и инфекционного характера.
Работа над децеллюляризованными биопротезами продолжается.
Следует отметить, что коллаген также является одним из потенциальных биологи-
ческих материалов для изготовления матриц клапанов, способных к биодеградации.
Он может использоваться в виде пены, геля или пластин, губок и в качестве заготовки
на волоконной основе (Hutmacher D. W. et al , 2001; Rothenburger M et al , 2002; Taylor P. M
et al., 2002). Однако применение коллагена связано с рядом технологических трудно-
-------------------------------—--------------------171
ИСКУС СТВЕННЫЕ К Л А П А Н Ы С Е Р Д Ц А___________________________________
стей. В частности, его трудно получить от больного. Поэтому в настоящее время боль-
шинство коллагеновых матриц имеет животное происхождение. Замедленная биодег-
радация животного коллагена может нести повышенный риск заражения зоонозами,
вызывать иммунологические и воспалительные реакции (Chevallay В. et al., 2000,
Flanagan Т. С. et aL, 2002; Taylor P. M. et al., 2002).
Фибрин — еще один биологический материал, имеющий управляемые характерис-
тики биодеградации. Поскольку фибриновые гели могут быть изготовлены из крови
пациента для последующего изготовления аутологичной матрицы, то имплантация тако-
го клапана не вызовет его токсической деградации и воспалительной реакции (LeeK.Y.
et al., 2001). Однако фибрину присущи такие недостатки, как диффузия и вымывание в
окружающую среду и низкие механические характеристики (Ye Q. et al., 2000;
Jockenhoevel S. et al., 2001; Grassl E. D. et al., 2002).
Синтетические материалы также применяют для изготовления матриц клапанов
(Hutmacher D.W. et al., 2001; Lee К.Y et al., 2001; Stock U.A. et al., 2001). Несколько
попыток изготовления матриц клапанов были основаны на использовании полиглакти-
на, полигликолевой кислоты (PGA), полилактической кислоты (PLA), сополимера PGA
и PLA (PLGA) и полигидроксиалканоатов (РНА). Высокопористый синтетический мате-
риал может быть получен из плетеного или неплетеного волокна и с использованием
технологии солевого выщелачивания. Перспективный композитный материал (PGA/
Р4НВ) для изготовления матриц получен из неплетеных петель полигликолевой кисло-
ты (PGA), покрытых поли-4-гидроксибутиратом (Р4НВ). Изготовленная матрица клапа-
на из этого материала стерилизуется оксидом этилена (Agrawal С. М. et al., 2001;
Hutmacher D.W., 2001). Однако значительная начальная жесткость и толщина петель
этих полимеров, их быстрая и бесконтрольная деградация, сопровождающаяся выде-
лением кислых цитотоксичных продуктов, требуют дальнейших исследований и поиска
других материалов.
Использование пластин тканевых культур аутологичных миофибробластов, культи-
вированных на каркасе, с целью формирования опорных матриц за счет стимулирова-
ния продукции этих клеток позволило получить образцы клапанов с активными жизне-
способными клетками, окруженными внеклеточным матриксом Однако механические
свойства тканей этих клапанов пока недостаточны для их имплантации (Уе О. et al., 2000;
Hoerstrup S. Р. et al., 2002).
Необходимый уровень пролиферации и регенерации ткани создаваемого клапана
может быть не достигнут путем только объединения клеток и матрицы. Экспрессия
клеточного гена и формирование ткани может регулироваться или стимулироваться
добавлением факторов роста, цитокинов или гормонов, митогенных факторов или фак-
торов адгезии в матрицах и матриксах Изучается возможность внедрения этих регу-
ляторов в биоматериалы матрицы. В целом, имеется существенный недостаток иссле-
дований по регуляции процесса формирования тканевого клапана биохимическими
стимулами.
Бесклеточный свиной ксеногенный легочный биопротез Matrix Р (рис. 3.20) состо-
ит из децеллюляризованной ткани, обработанной посредством специальной запатен-
тованной процедуры AutoTissue GmbH, включающей обработку антибиотиками, деок-
сихолатом натрия и спиртом. Данный способ обработки, утвержденный МеждунароД"
ной организацией по стандартизации, устраняет все живые клетки и постклеточные
структуры (фибробласты, эндотелиоциты, бактерии, вирусы, грибки, микоплазмы), со-
храняет архитектонику экстрацеллюлярного матрикса, снижает уровень ДНК и РНК в
тканях до минимума, что сводит к нулю вероятность трансмиссии свиного эндогенного
ретровируса (PERV) человеку. Биопротез Matrix Р состоит исключительно из коллагена
и эластина с сохраненной структурной интеграцией.
В ходе экспериментов на овцах была зарегистрирована минимальная реакция со
стороны окружающих тканей через 11 месяцев после имплантации биопротеза Matrix
Р с хорошими показателями его приживаемости, что, в частности, проявлялось в бле-
--------- 172 ------------------------------------------------—
ГЛАВА 3. Биологические заменители клапанов сердца
Рис. 3.20. Биопротезы Matrix Р (по http://www.autotissue.de)
стящей внутренней поверхности его эндокарда Фактически отсутствовали воспалитель-
ные реакции, утолщение и укорочение створок клапана Также был зарегистрирован
низкий уровень кальция ткани биопротеза Matrix Р разница была статистически значи-
ма в сравнении с обработанными глутаровым альдегидом клапанами сердца.
Биопротез Matrix Р адаптируется к индивидуальным условиям пациента в течение
нескольких месяцев после его имплантации. При исследовании по истечении конт-
рольного срока выявлены интактный внеклеточный матрикс и сливной эндотелий. Ксе-
нографт Matrix Р, имплантированный при операции Росса, выполненной у 50 пациен-
тов с врожденными пороками сердца в период с 2002 по 2004 г, показал превосход-
ную производительность и более низкие трансклапанные градиенты давления по
сравнению с криоконсервированными и децеллюляризованными аллографтами
SynerGraftMT, а также бескаркасными биопротезами, обработанными глутаровым аль-
дегидом (Konertz W. et al., 2005). Биопротез Matrix Р предназначен для протезирования
клапана легочной артерии при реконструкции выходного тракта правого желудочка в
хирургии врожденных и приобретенных пороков сердца и при протезировании легоч-
ного клапана в ходе процедуры Росса, доступен в 4 типоразмерах (по внутренне-
му диаметру): для новорожденных (15-17 мм), для детей (18-21 мм), промежуточный
(22-24 мм) и взрослый (25-28 мм)
Прогресс в разработке клапанов на основе тканевой инженерии будет зависеть от
успехов клапанной клеточной биологии (включая вопросы экспрессии гена и регуля-
цию), изучения эмбриогенного и возрастного развития клапанов (включая ангиоген-
ные и неврогенные факторы), точного знания биомеханики каждого клапана, иденти-
фикации адекватных клеток для заселения, разработки оптимальных матриц Для даль-
нейшей разработки более совершенных тканевых клапанов необходимо полное
понимание взаимоотношения между механическими и структурными характеристика-
ми нативных клапанов и стимулов (биологических и механических) для воссоздания
этих характеристик in vitro
РАЗВИТИЕ ОТЕЧЕСТВЕННОГО БИОПРОТЕЗИРОВАНИЯ
В нашей стране научно-практические исследования по проблеме биопротезирова-
ния клапанов сердца начали проводиться в Научном центре сердечно-сосудистой хи-
рургии (НЦССХ) им А Н Бакулева РАМН, Всесоюзном научном центре хирургии (ВНЦХ)
АМН СССР, Кемеровском кардиохирургическом центре с 1966 г то есть с того време-
ни, когда в мире делались только первые шаги в этом направлении В 1984 г. за разра-
ботку проблемы биопротезирования клапанов сердца Н Н Малиновский, Г И Цукер-
---------------------------------------173
ИСКУССТВ ЕННЫЕ КЛАПАНЫ СЕРДЦА______________________________________
ман, Б. А. Константинов, Б. А. Фурсов, В. А. Быкова, С. Л. Дземешкевич, Ю. А. Перимов,
В. М. Сагалевич, Н. А. Завалишин, В. М. Картошкин были удостоены Государственной
премии СССР
В НЦССХ им. А Н. Бакулева РАМН в 1968 г. были выполнены первые операции с
использованием биологических протезов клапанов сердца отечественного производ-
ства С тех пор непрерывно ведется научная работа по совершенствованию конструк-
тивных решений различных видов биологических протезов, созданию новых методов
обработки и стерилизации биоткани, позволяющих увеличить срок безотказной рабо-
ты биопротезов в организме человека.
Для централизации решения всех задач, связанных с разработкой и подготовкой к
клиническому применению новых видов биопротезов для сердечно-сосудистой хирур-
гии, в 1994 г. в НЦССХ им А. Н. Бакулева РАМН (директор академик РАМН Л. А. Боке-
рия) организован научно-производственный отдел медицинской биотехнологии под
руководством В. Т. Коставы (рис. 3.21). Приоритетными направлениями в работе отде-
ла являются: совершенствование имеющихся и создание новых видов биопротезов,
отвечающих разработке новых операций по коррекции сложных пороков сердца; опти-
мизация методов стабилизации биологической ткани, применение биологически ак-
тивных соединений, создающих тромборезистентное покрытие и способствующих ус-
коренной эндотелизации протеза; разработка биопротезов на основе методов ткане-
вой инженерии; производство медицинских клеев для сердечно-сосудистой хирургии.
В 2003 г. завершена сертификация биологических протезов, производимых в Центре,
получена лицензия Министерства промышленности, науки и технологий РФ на произ-
водство медицинской техники в отделе медицинской биотехнологии (Бокерия Л. А
и др., 1996).
Хронологически этапы развития проблемы биопротезирования в НЦССХ им. А. Н. Ба-
кулева РАМН можно разделить на несколько этапов. В первый период (с 1966 по 1971 г.)
велись разработки ксено- и аллоаортальных биопротезов. Этой работой руководили
В. А. Быкова и Б. А. Фурсов (рис. 3.22).
Первые успешные операции по аллотрансплантации и ксенотрансплантации митраль-
ного и аортального клапанов были выполнены в НЦССХ им. А. Н. Бакулева РАМН в 1968 г.
В 1969 г. произведена ксенотрансплантация трикуспидального клапана (Цукерман Г. И. и
др., 1969). Отдаленные результаты первого опыта тридцати операций были неудовлет-
ворительными в связи с износом и разрушением имплантированных биопротезов.
Во второй период (с 1971 по 1982 г) был внедрен метод обработки биоткани ра-
створом глутарового альдегида. Создано несколько моделей гибких опорных каркасов,
рис. 3.23 (Бокерия Л. А. и др., 2002).
Рис. 3.21. Л. А. Бокерия и В. Т. Костава
17<
ГЛАВА 3 Биологические заменители клапанов сердца
Рис. 3.22. В. А. Быкова и Б. А. Фурсов
Коммерческий ксеноперикардиальный протез Бионикс-2, получивший в дальней-
шем название БиоЛАБ-В, а затем БиоЛАБ-КС, был выпущен в НЦССХ им. А. Н. Бакуле-
ва в 1982 г. (рис. 3.24; цв. вкладка, рис 4) по предложению Н. Б. Добровой. Об имп-
лантации биопротеза Бионикс-2 с хорошими отдаленными результатами через 17 лет
в трикуспидальной позиции сообщили Бабенко С. И. и соавт. (2004), Семеновский М. Л.
и соавт. (2004).
Клапан состоит из опорного металлического каркаса переменной жесткости, обши-
того полипропиленовым трикотажем, и трехстворчатого запирательного элемента из
стабилизированной перикардиальной ткани, полученной от телят (БиоЛАБ-КС/ПТ) или
свиньи (БиоЛАБ-КС/ПС), либо глиссоновой капсулы печени теленка (БиоЛАБ-КС/ГТ).
Стабилизация биоткани проводится водным раствором глутаральдегида либо дигли-
цидилового эфира этиленгликоля (Юрлов И А. и др., 2002; Костава В.Т. и др., 2004).
Этот биопротез предназначен для замещения трикуспидального и митрального клапа-
нов при врожденных и приобретенных пороках сердца. Клапан БиоЛАБ-КС обладает
высокими гемодинамическими характеристиками и не требует постоянной антикоагу-
лянтной терапии.
Недостатком данного клапана является использование в качестве биологического
материала толстого, ригидного, подвергающегося довольно быстрой кальцификации
материала — перикарда телят. Через 3-4 года после имплантации створки клапана
теряют свою подвижность из-за отложений кальция, разрывов в местах наибольшего
Рис. 3.23. Варианты каркаса (а и б) и схема обшивки (в) ксеноперикардиального биопротеза Био-
никс-2 (по Л. С. Барбарашу и др., 1996; Б. А. Фурсову и др., 1990)
—----------------------------------------------------------175 -----------
ИСКУССТВЕНН ЫЕ КЛАПАНЫ СЕРДЦА
Рис. 3.24. Ксеноперикардиальный биопротез БиоЛАБ-КС (по www.bakulev.ru)
напряжения биологического материала. Недостатком является и относительная недол-
говечность клапана при работе в левых отделах сердца. Наиболее частыми причинами
выхода клапана из строя являются разрыв или отрыв створок от каркаса протеза, из-
лом опор, пролапс и выворачивание створок (Бокерия Л. А. и др., 2002).
Было установлено, что глиссоновая капсула печени в 3 раза тоньше используемого
для формирования клапана Бионике перикарда телят, однако по своим механическим
свойствам соответствует последнему. Использование нового материала в биопротезе
Биоглис — глиссоновой капсулы печени — делает створки легкими, подвижными, они
свободно плавают в потоке крови и мгновенно реагируют на малейшие перепады дав-
ления Биопротез содержит поддерживающий каркас переменной жесткости сложной
конфигурации, состоящий из рамы с гибкими, плавно закругленными опорами комис-
сур и кольца с жесткими ограничителями перемещений опор комиссур. Каркас обшит
синтетической тканью и снабжен манжеткой. Каркас изготавливают из листовой стали
марки 1Х18Н9Т или титана методом давления с последующей термической обработ-
кой в вакууме. Благодаря неоднократной термической обработке каркаса снижается
напряженность металла на изгибах, что значительно повышает износоустойчивость.
Каркас обшивают дакроновым велюром. Моделирование клапана Биоглис на каркасе
осуществляется по методике Б. А. Фурсова (1972). Коммерческое название биопроте-
за — БиоЛАБ-КС/ГТ В НЦССХ им. А. Н. Бакулева РАМН с 1997 по 2000 г. биопротез
Биоглис имплантирован 16 пациентам.
Работы по созданию и совершенствованию бескаркасного ксеноаортального про-
теза БиоЛАБ-КК/АС (рис. 3.25; цв. вкладка, рис. 5) в НЦССХ им. А. Н. Бакулева ведут-
ся с 1998 г. Ксенографт изготовлен из цельного свиного корня аорты, стабилизирован-
ного 0,625% раствором глутарового альдегида при нулевом давлении на створки при
повышенном внутриоартальном давлении и обшит стабилизированным свиным пери-
кардом. Применение ксеноаортальных клапанов БиоЛАБ-КК/АС связано с минималь-
ным риском тромбоэмболических осложнений и позволяет отказаться от постоянной
антикоагулянтной терапии. Опыт имплантации криосохраненных аллографтов в НЦССХ
им А Н Бакулева был использован при имплантации этого ксенографта Первая опе-
рация была выполнена Л. А. Бокерия в 2001 г (Терехин В. Н , 2002).
Изготовлены первые образцы бескаркасного ксенопротеза митрального клапана,
возможной областью применения которых является протезирование митрального и
трикуспидального клапана, особенно при инфекционном эндокардите и врожденных
пороках, а также у пожилых пациентов. Размеры стабилизированных 0,625% раство-
ром глутарового альдегида ксенокомплексов БиоЛАБ-КК/СМ (см. рис. 3.25) состав-
ляют диаметр по обтуратору — 30-31 мм, межкомиссуральное расстояние — 39-45 мм,
высота передней митральной створки — 22-25 мм, расстояние от задней папилляр"
ной мышцы до фиброзного кольца — 20 34 мм, расстояние от передней папиллярной
мышцы до фиброзного кольца — 17-25 мм.
176-----------------------------------------------------------
ГЛАВА 3. Биологические заменители клапанов сердца
Рис. 3.25. Бескаркасные ксенобиопротезы: аортальный БиоЛАБ-КК/АС и митральный
БиоЛАБ-КК/СМ (по www.bakulev.ru)
Одной из последних разработок НЦССХ им. А. Н. Бакулева РАМН является новая
конструкция трехстворчатого ксеноперикардиального бескаркасного кондуита БиоЛАБ-
пп/мк-з, имплантированного В. П. Подзолковым в 2001 г.
Ксенопротез аортального клапана БиоЛАБ-КБ/А (рис. 3 26) выполнен из стабили-
зированного ксеноперикарда, имеет посадочные размеры от 19-27 мм, высота опор-
ной трубки 55 мм, предназначен для замены пораженного естественного аортального
клапана.
Ксенопротез клапана легочного ствола БиоЛАБ-КБ/Л (см. рис. 3.26) выполнен из
стабилизированного ксеноперикарда теленка (опорный элемент) и стабилизированно-
го перикарда свиньи или глиссоновой капсулы печени теленка (запирательный элемент),
имеет посадочные размеры от 12-28 мм, высота опорной трубки 55 мм, предназначен
для замены пораженного естественного клапана легочной артерии
Разработка технологий изготовления криосохраненных аортальных и легочных ал-
лографтов, антикальцификационной обработки биотканей, применения эпоксисоеди-
нений для стабилизации биоткани проводятся в НЦССХ им. А. Н. Бакулева с 1989 г и
по настоящее время. Криосохраненныи аллогенный аортальный кондуит БиоЛАБ-Кри-
оК/А (рис. 3.27) представляет собой участок восходящей аорты с аортальным клапа-
Рис. 3.26. Бескаркасные перикардиальные ксенобиопротезы: аортальный БиоЛАБ-КБ/А,
легочного ствола БиоЛАБ-КБ/Л (по www bakulev.ru)
177
И С К У С С Т ВЕННЫЕ КЛАПАНЫ СЕРДЦА__________________
Рис. 3.27. Криосохраненные аллографты: аортальный кондуит БиоЛАБ-КриоК/А, легочный кондуит
БиоЛАБ-КриоК/Л и митральный биопротез БиоЛАБ-КриоК/М (по www.bakulev.ru)
ном и может использоваться при замене аортального клапана сердца при врожденных
и приобретенных пороках сердца, реконструкции путей оттока из левого и правого
желудочка (общий артериальный ствол, атрезия легочной артерии, тетрада Фалло
и др.). Этот биоклапан устойчив к инфекции, не требует длительной антикоагулянтной
терапии и позволяет производить коррекцию порока при узком фиброзном кольце
аортального клапана. Впервые криосохраненный аортальный кондуит был применен
В. П. Подзолковым в 1990 г. при коррекции атрезии легочной артерии, а криосохра-
ненный аортальный аллографт — Г. И. Цукерманом при имплантации в аортальную по-
зицию в 1992 г. (Подзолков В. П. и др., 1993; Бокерия Л. А. и др., 2002).
Криосохраненный аллогенный легочный кондуит БиоЛАБ-КриоК/Л (см рис. 3.27)
представляет собой участок легочной артерии с клапаном и предназначен для замены
легочной артерии при аутолегочном протезировании аортального клапана сердца (опе-
рация Росса), реконструкции путей оттока из правого желудочка при врожденных по-
роках сердца (общий артериальный ствол, атрезия легочной артерии, тетрада Фалло
и др.). Первая имплантация криосохраненного аллогенного легочного кондуита выпол-
нена В. П. Подзолковым в 1996 г. (Абалмасов В. Г. и др., 1997; Муратов Р. М. и др., 2004;
Аль-Хаджабед X. Ф. и др., 2005).
Криосохраненный аллогенный митральный биопротез БиоЛАБ-КриоК/М (см.
рис. 3.27; цв. вкладка, рис. 5) представляет собой митральный клапан сердца человека
с хордальным аппаратом, головками сосочковых мышц и предназначен для импланта-
ции в митральную или трикуспидальную позицию при врожденных и приобретенных
пороках клапанов сердца. Благодаря разработке методики криосохранения появилась
возможность создания банка не только аортальных и легочных аллографтов, но и мит-
ральных. Работа, проведенная отделом биотехнологии НЦССХ им. А. Н. Бакулева РАМН,
позволила в январе 1998 г. И. И. Скопину впервые в России имплантировать митраль-
ный аллографт в трикуспидальную позицию.
В НЦССХ им. А. Н. Бакулева РАМН разрабатываются методики по снижению каль-
цификации створок, проводятся исследования по применению эпоксидных соедине-
ний для стабилизации биоткани.
В 80-е гг XX столетия в ВНЦХ АМН СССР на основе исследований мофологии и
биомеханики корня аорты был разработан биопротез БАКС (рис. 3.28), отличающийся
необычностью конструктивного решения. Практически все коммерческие модели био-
протезов имеют каркас в форме «трехзубой короны», тогда как функциональный под-
держивающий каркас протеза БАКС состоит из двух колец, соединенных между собой
шестью гибкими стойками. С учетом большой жесткости фиброзного кольца и необхо-
димости равномерной передачи нагрузок на створки, кольцо основания каркаса вы-
178 _____________________________________________________
ГЛАВА 3 Биологические заменители «лапанов сер дца
Рис. 3.28. Полипропиленовый необшитый и обшитый каркас; общий вид биопротеза БАКС;
С. Л. Дземешкевич (по Н. Н. Малиновскому и др., 1988; С. Л. Дземешкевичу и др., 2000)
полнено цельным. В результате функциональные перемещения биологической части
протеза осуществлялись за счет перемещении гибких стоек и верхнего разрезного
кольца. Каркас изготовлен из полипропилена, покрыт пленкой из фторопласта и тка-
нью из полиэфирной нити. Кроме того, при изготовлении биопротезов БАКС была ис-
пользована технология обработки, включающая в себя, помимо модифицированной
стабилизации глутаральдегидом, ферментативную обработку с целью снижения оста-
точной антигенности биоматериала.
В итоге, этот биопротез представляет собой свиной клапанно-аортальный комплекс,
подвергнутый ферментативно-химической обработке и размещенный на гибком функ-
циональном каркасе. Биопротез БАКС, выпускаемый ЗАО «Медикон ЛТД», предназна-
чен для замещающей имплантации пораженного аортального, митрального и трикус-
пидального клапанов сердца (Малиновский Н. Н. и др , 1988; Кудрина Л. Л., 1992; Се-
меновский М. Л. и др., 2004).
С 1978 г в Кемеровском кардиологическом центре под руководством Л. С. Барба-
раша (рис. 3.29) начата разработка биопротезов клапанов сердца. Функционирующая
в составе Кемеровского кардиологического центра специализированная лаборатория
(директор И. Ю. Журавлева) была создана в 1982 г. и в 2002 г получила название «Нео-
Кор». в начале развития лаборатории разрабатывались биопротезы Биопакс-1 и Био-
пакс-2 (Барбараш Л. С., 1996)
Биологическая часть протеза Биопакс-1 (рис 3.30) представлена цельным или со-
ставным аортальным комплексом заводских пород свиней, который укреплялся на гиб-
ком полипропиленовом каркасе, обеспечивающим снижение механических нагрузок на
створки клапана и улучшающим функциональные параметры. Обшивка и манжета про-
теза изготавливались из биологически инертного полиэфирного полотна. Консерва-
ция осуществлялась при закрытом положении створок в условиях низкого запиратель-
ного давления 0,625% раствором глутаральдегида При размещении клапана в карка-
се наименьшую по площади некоронарную створку располагали в пространстве между
--------------------------__________—---------------- 179 ---
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
Рис. 3.29. И. Ю. Журавлева и Л. С. Барбараш
стойками каркаса, наименее удаленными друг от друга При этом самый слабый учас-
ток области правой коронарной створки прилегал к внутренней поверхности каркаса и
был защищен основанием последнего. Процесс фиксации клапана биопротеза начи-
нался с наложения на вершины комиссур трех П-образных швов, захватывающих учас-
ток прилегающей стенки аорты и стойку каркаса. Аналогичные швы накладывали в
шести точках, прикрепляя, таким образом, приточный отдел по всему периметру осно-
вания каркаса По фестончатому краю каркаса иссекали синусы Вальсальвы и в обла-
сти приточного и выходного отделов, отступя от основания створок 1-2 мм, фиксиро-
вали клапан к каркасу непрерывным матрасным швом без натяжения. Приточный от-
дел дополнительно укрепляли петельным швом, позволяющим прочно фиксировать
биологический материал к полимерной основе (см. рис. 3 30, а) Далее протез кон-
сервировали раствором глутаральдегида до окончательной стабилизации биоматери-
ала при сомкнутых тампонированных створках После завершения консервации из син-
тетической ткани медицинского назначения формировали обшивку протеза, которая
способствовала изоляции биологического и полимерного материала от тканей реци-
пиента, дополнительно укрепляла элементы конструкции, испытывающие максималь-
Рис. 3.30. Фиксация (а) ксеноаортального биопротеза Биопакс-1 к асимметричному каркасу
и обшивка внутренней (б) и внешней (в) поверхностей каркаса биопротеза после кон-
сервации (по Л. С. Барбарашу и др., 1995)
180-
ГЛА В А 3. Биологические заменители клапанов сердца
ные механические усилия, облегчала фиксацию протеза в камерах сердца за счет фор-
мирования манжеты. Предварительно для каркаса каждого размера готовили цилиндр
из дупликатуры ткани, внутренний край которой соответствовал конфигурации фестон*
чатой части опорного каркаса. Внутренний слой этой ткани прикрывал по всему пери-
метру выходной отдел протеза (см. рис. 3 30, б), для чего был использован матрасный
шов. Далее путем выворачивания материала наружным слоем тканевого цилиндра при-
крывали внешнюю поверхность каркаса (см. рис. 3 30, в), и этот участок ткани после
натяжения фиксировали к кольцу основания каркаса, не затрагивая биологический ма-
териал. В оставшийся отрезок ткани закладывали медицинский фетр и из него фор-
мировали манжету протеза, которую располагали по фестончатому краю каркаса. Био-
протез Биопакс-1 применялся до 1991 г. (Барбараш Л. С. и др., 1995; Семеновский М. Л.
и др., 2004).
Биопротез Биопакс-2 (рис. 3.31) отличался оригинальной методикой консервации,
которая проводилась при открытом состоянии створок в потоке диглицидилового эфи-
ра этиленгликоля (Барбараш Л. С. и др., 1995). Повышенный стенотический эффект
мышечного валика основания правой коронарной створки и отрывы створки привели к
созданию симметричного каркаса и монтажу на нем некоронарных створок составного
ксенобиопротеза Процесс приготовления составного ксенобиопротеза на симметрич-
ном каркасе состоял из тщательной обработки ксеноаортальных комплексов с целью
удаления лишних тканей и одновременной отмывки от сывороточных белков, заготов-
ки сегментов аортального клапана, включающих некоронарную створку и соответству-
ющий синус, подбора одинаковых сегментов для данного опорного каркаса и модели-
рования клапана, консервацию в 0,625% растворе глутарового альдегида, обшивки
биопротеза синтетической тканью. При подборе некоронарных сегментов к каркасу
обеспечивали плотный контакт торцовых стенок аорты между собой с созданием еди-
ного комиссурального стержня, по высоте соответствующего бочкообразной стойке
каркаса, а также оптимальную степень соприкосновения створок — не более 3-4 мм у
основания и на уровне аранциевых узелков и около 2 мм в области середины лунок.
Каркас, предназначенный для подшивания клапана, выстилали изнутри синтетической
тканью. Таким образом, композитная биологическая часть и симметричность каркаса
биопротеза Биопакс-2 отличали его от модели Биопакс-1 (Журавлева И. Ю. и др., 1989,
Барбараш Л. С. и др., 1995).
При монтировке составного ксенобиопротеза П-образными швами фиксировали
соседние сегменты между собой и к каркасу в области вновь созданных комиссур.
Затем дополнительные П-образные швы накладывали в трех точках приточной части
соответственно серединам арок каркаса (см. рис 3 31, а). Далее иссекали синусы Валь-
сальвы (см. рис. 3.31, б) и матрацным швом, без натяжения, равномерно прижимая
биологическую ткань к опоре, фиксировали приточный и выводной отделы Приточный
Рис. 3.31. Фиксация створок (а) к симметричному каркасу, иссечение синусов Вальсальвы (б) и
укрепление приточного отдела (в) составного ксенобиопротеза Биопакс-2 (по Л. С. Бар-
барашу и др., 1995)
181
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
отдел дополнительно укрепляли петельным швом, позволяющим плотно прижать к коль-
цу опоры торцовый край клапана (см. рис. 3.31, в). Формирование тканевого покрытия
биопротеза проводилось аналогично ксеноаортальному клапану с асимметричным кар-
касом (Барбараш Л. С. и др., 1995).
Биопротез КемКор (рис. 3.32), разработанный в Кемеровском кардиологическом
центре, изготовлен из аортальных клапанов свиньи, обработанных эпоксисоединени-
ем, и монтирован на гибком опорном каркасе из полипропилена. Этот биопротез пред-
назначен для замещения пораженного аортального (посадочные диаметры 26-28 мм),
митрального (посадочные диаметры 26-32 мм) и трикуспидального (посадочные диа-
метры 26-36 мм) клапанов сердца. С сентября 1991 г. биопротезы КемКор были имп-
лантированы более чем 2000 пациентам в ведущих кардиохирургических центрах Рос-
сии (Моисеенков Г. В., 2003; Караськов А. М. и др., 2004; Одаренко Ю. Н. и др., 2004;
Барбараш Л. С., 2005).
Биопротез ПериКор (цв. вкладка, рис. 4), разработанный в этом же учреждении,
сформирован из аортального клапана свиньи на гибком опорном каркасе. Отличитель-
ными особенностями биопротеза ПериКор являются обшивка каркаса перикардиаль-
ным лоскутом КемПериплас и пришивная манжета, также сформированная из ксено-
перикарда. Этот протез предназначен для имплантации в митральную (посадочные
диаметры 26-32 мм) и трикуспидальную (посадочные диаметры 26-35 мм) позиции
(Барбараш Л. С. и др., 2004; 2005). За счет иммобилизации антибактериальных препа-
ратов биопротез приобретает антибактериальную активность и может быть использо-
ван для имплантации при инфекционном эндокардите.
Ксеноаортальный бескаркасный протез АБ-Моно-Кемерово (рис. 3.33) изготовлен
в виде цельного ксеноаортального комплекса или с удаленными коронарными синуса-
ми и структурной стабилизации свиных клапанов диэпоксидом (посадочные диаметры
17-29 мм). Протез АБ-Моно-Кемерово покрыт стабилизированным ксеноперикардом
КемПериплас в приточном отделе и снаружи правого коронарного синуса с формирова-
нием пришивной мини-манжеты (Аминов В. В., 2004; Шматов Д. В., 2004; Бритиков Д. В.
и др., 2005). В настоящее время протез АБ-Моно-Кемерово снят с производства.
Композитный ксеноаортальный биопротез АБ-Композит-Кемерово (см. рис. 3.33;
цв. вкладка, рис. 5) изготовлен из трех сегментов некоронарных створок с синусами
(посадочные диаметры 17-29 мм). Протез АБ-Композит-Кемерово обшит стабилизи-
рованным перикардом по его наружной поверхности. Отсутствие створки с мышечной
частью позволяет добиться максимальной эффективной площади открытия и миними-
зировать перепад давления на клапане. Эти бескаркасные биопротезы, изготовленные
без синтетических материалов, снижают риск контаминации и развития инфекции в
зоне контакта биопротеза с тканевыми структурами больного. Бескаркасные биопро-
тезы используются в клинической практике с 1994 г. и демонстрируют хорошие ре-
Рис. 3.32. Каркасный биопротез КемКор
182
ГЛАВА 3 Биологические заменители клапанов сер/щ .
Рис. 3.33. Бескаркасные биопротезы АБ-Моно-Кемерово и АБ-Композит-Кемерово
зультаты. В настоящее время более 400 бескаркасных биопротезов моделей АБ-Моно-
Кемерово и АБ-Композит-Кемерово имплантированы в ведущих клиниках России (Бар-
бараш Л, С. и др, 2002; 2003; Караськов А. М. и др., 2001; 2005; Терехин В. Н., 2002;
Муратов Р. М. и др., 2003; Хубулава Г. Г и др., 2004; 2005)
Разработки Кемеровского кардиологического центра в области биопротезирования
клапанов сердца были удостоены 1-и премии основоположника хирургии на открытом
сердце С. W. Lillehei на съезде Европейской ассоциации кардиоторакальных хирургов,
проходившем в Копенгагене в 1997 г.
ТЕХНИКА ИМПЛАНТАЦИИ
Основные принципы техники и тактики имплантации каркасных биопротезов схожи
с таковыми при использовании механических клапанов В отличие от механических и
каркасных биологических протезов, бескаркасные биоклапаны (ксенографты аллограф-
ты и др.) не являются ригидными, устойчивыми к деформации структурами и поэтому
их имплантация может сопровождаться изменением как геометрических, так и функ-
циональных характеристик. Насколько и как изменяется функция бескаркасных био-
клапанов в результате имплантации? Какие факторы необходимо учитывать до и в про-
цессе имплантации бескаркасных заменителей клапанов сердца, чтобы максимально
сохранить их исходные функциональные характеристики9 Какой вариант техники имп-
лантации обеспечивает лучший функциональный результат? Ответы на эти и другие
вопросы пытались получить в ряде экспериментальных и клинических исследований
Сравнение гидродинамических характеристик протеза Medtronic Freestyle, имплан-
тированного в эластичную силиконовую «аорту», показало, что градиент давления и
объем регургитации на протезе в значительной степени зависят от размера протеза и,
в меньшей степени, от варианта техники имплантации (Yoaganathan А. Р. et aL, 1994).
Максимальные площади открытия створок, измеренные при визуализации протеза на
стенде, были большими при моделировании протезирования методом «полного корня».
В последующих работах других авторов (Revanna Р. et al., 1997; Nagy Z. L. et al., 1999)
экспериментальная модель по оценке влияния типоразмера и техники имплантации
бескаркасных биопротезов на их функциональные характеристики /л vitro была усовер-
шенствована. Для этого исследуемые бескаркасные биопротезы имплантировали в
нативные свиные корни аорты, а затем также в свиные корни аорты, стабилизирован-
ные глутаровым альдегидом Это, по мнению авторов, моделировало имплантацию в
«молодые» и «пожилые» корни аорты человека.
183
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
В этих работах было выявлено существенное снижение растяжимости нативных
«молодых» корней-акцепторов аорты, в которые были имплантированы бескаркасные
протезы Toronto SPV (Nagy Z L. et al., 1999) Гидродинамические параметры были луч-
ше, а сгибательные деформации открытых створок меньше при имплантации протеза
Toronto SPV с наружным диаметром на 1 мм меньше внутреннего диаметра корня-ак-
цептора По мнению авторов, умеренно заниженная несоразмерность имплантации
ксенографтов может увеличить их износоустойчивость, зависящую от деформации
створки и сгибательных напряжении Гидродинамическая эффективность «молодых»
композитных корней аорты была существенно и достоверно выше «пожилых» (Nagy Z. L.
et al., 1999) Субкоронарная имплантация как стабилизированных, так и нативных кор-
ней аорты приводила к ухудшению их исходных функциональных характеристик
(Revanna Р et al , 1997)
В нашем исследовании был проведен сравнительный анализ функциональных ре-
зультатов экспериментальных имплантации ксенографтов в аллогенные корни аорты
на небальзамированных трупах лиц молодого и пожилого возраста с последующей
оценкой анатомо-функциональных характеристик удаленных композитных корней аор-
ты при стендовых исследованиях
Сравнительный анализ функциональных результатов двух групп композитных кор-
ней аорты показал, что лучшие биомеханические и гидродинамические характеристи-
ки были получены при использовании техники субкоронарной имплантации с иссече-
нием всех трех синусов ксенографта (Гавриленков ВИ и др , 2001). При сохранении
некоронарного синуса ксенографта нередко формировалась парапротезная «гемато-
ма», существенно искажающая геометрию композитного корня аорты и отрицательно
влияющая на его потоковые характеристики и биомеханику створок (рис 3 34) В кли-
нической практике такое образование парапротезных гематом в области сохраненного
некоронарного синуса ксенографта нередко приводит в послеоперационном периоде
к высокому систолическому градиенту давления, постепенно регрессирующему по мере
рассасывания гематомы При значительных размерах гематомы и дальнейшей ее орга-
низации могут сохраняться высокие остаточные градиенты давления или происходить
ее инфицирование с формированием парапротезного абсцесса (Кучеренко В. С., 2005,
Хубулава Г Г и др., 2005, Коп N. D. et al, 1995)
В нашем исследовании также было показано, что основными факторами, оказыва-
ющими влияние на функциональный результат субкоронарной имплантации разрабо-
танной модели ксенографта (Патенты РФ № 2175858, № 4909719/14, авт свид
№ 1748814), являются растяжимость корня-акцептора, адекватный выбор размера ксе-
нографта и его позиция относительно фиброзного кольца корня-акцептора В частно-
Рис. 3.34. Вид композитного корня аорты в диастолу (а), в систолу (б) с парапротезной «гемато-
мой* в области сохраненного некоронарного синуса ксенографта (НКС) и после его ис-
сечения (в); МВ — мышечный валик основания правой коронарной створки
------- 184--------------------------------------------------—-------------
ГЛАВА 3 Биологические заменители клапанов сердца
сти, протезирование корня аорты не влияет на исходные функциональные характерис-
тики разработанной модели ксенографта Супрааннулярная субкоронарная импланта-
ция, в отличие от протезирования корня аорты, приводит к образованию умеренных
окружных прекомиссуральных деформаций створок ксенографта, а также обеспечива-
ет ему лучшие потоковые характеристики, в сравнении с имплантацией в интраанну-
лярную позицию (Гавриленков В. И., 2004)
Выбор техники операции в случае применения бескаркасного биопротеза в аор-
тальную позицию определяется, прежде всего, его конструкцией Ряд биопротезов (АБ-
Композит-Кемерово, АБ-Моно-Кемерово, Cryolite-O’Brien, Toronto SPV, Sorin Pericarbon,
Shelhigh Standard и Shelhigh SuperStentless, и др ) имплантируют только в субкоронар-
ную позицию Протезы, изготовленные в виде цельного ксеногенного корня аорты
(Medtronic Freestyle, PrimaTM Edwards), могут быть имплантированы в субкоронарную
позицию с иссечением двух или трех синусов, а также в виде «вставки корня» (root-
inclusion) с частичным иссечением коронарных синусов ксенографта Наконец, эти про-
тезы могут имплантироваться по технике «полного корня» (full-root) Большинство хи-
рургов предпочитают использовать технику субкоронарной имплантации при исполь-
зовании цельных ксенографтов (цв. вкладка, рис. 8)
При аортальном протезировании по технике субкоронарной имплантации (рис 3 35)
чаще выполняют поперечную (на 2/3 периметра восходящей аорты несколько выше
синотубулярного соединения), либо косую, реже полную поперечную или полуверти-
кальную аортотомию После тщательного иссечения створок аортального клапана и
максимального удаления кальцинатов визуально оценивают анатомические изменения
и геометрию корня аорты, особенности расположения устьев коронарных артерий.
г Д е
Рис. 3.35. Основные этапы имплантации бескаркасного биопротеза Med ronic Freestyle в субкоро-
нарную супрааннулярную позицию с полным иссечением синусов (по А. Н. Krause, 1997).
а — наложение узловых швов на аортальное кольцо, б — иссечение синусов, в прошивание осно
вания биопротеза, г — наложение П-образных надкомиссуральных швов, д удаление синотубу-
лярного отдела биоклапана е — наложение второго непрерывного «герметизирующего» шва
—----------------------------------------------------------185
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
Выбор размера бескаркасного биопротеза остается дискутабельным. Обычно подби-
рают биопротез с диаметром на 1-3 мм больше максимального калибра, достаточно
свободно проведенного через аортальное кольцо пациента. Иногда выбирают протез с
диаметром, равным диаметру аортального кольца или диаметру синотубулярного со-
единения, в ряде случаев проводят реконструкцию корня При низком расположении
устья правой коронарной артерии применяют субкоронарную имплантацию с разворо-
том биопротеза, помещая его правый синус в некоронарный синус пациента, или вы-
полняют протезирование корня аорты (Терехин В. А., 2002; Konertz W. et al., 1992;
Коп N. D. et al., 1995, Krause A. H., 1997; Siebermann R. P., 1997; Bortolotti U. et aL, 1999;
Gross Sh. et al., 1999; Kalangos A. et al., 2000; David T. E. et al., 2001; Greve H. H. et al.,
2001; Terada H et al., 2004).
На первом этапе имплантации бескаркасных биопротезов в супрааннулярную суб-
коронарную позицию на фиброзное кольцо накладывается проксимальным ряд узло-
вых швов (3—0 тикрон, 2—0 или 3—0 этибонд, 4—0 пролен по усмотрению хирурга) в
плоскости вентрикулоаортального соединения, проходящей, фактически, через осно-
вание фиброзного кольца (см. рис. 3.35, а). На втором этапе отмытые от консерванта
биопротезы, выпускаемые в виде цельного корня аорты, подготавливают к импланта-
ции путем иссечения двух или трех синусов ксенографта (см. рис. 3.35, б). Некоторые
авторы не рекомендуют выполнять на этом этапе иссечение синусов, чтобы не нару-
шать пространственную ориентацию комиссуральных столбиков на следующих этапах
имплантации. Бескаркасные биопротезы, выпускаемые с иссеченными синусами, не
подвергаются этой процедуре. На третьем этапе нити проксимального ряда узловых
швов проводят через основание ксенографта, соблюдая осторожность, чтобы не по-
вредить створки иглой (см. рис. 3.35, в). На четвертом этапе ксенографт помещают в
корень аорты пациента, а нити завязывают и срезают. Для правильной ориентации
комиссур накладывают провизорные П-образные поддерживающие швы на 3-5 мм
выше комиссур ксенографта, проводя их через стенку аорты пациента наружу (см. рис.
3.35, г). Пятый этап операции может выполняться по-разному, в зависимости от ис-
пользуемой модели биопротеза. Если используют модель биопротеза без синусов или
они были иссечены на втором этапе имплантации, то выполняется их «подгонка» под
устья коронарных артерий пациента. При этом рекомендуют сохранять исходную про-
странственную ориентацию комиссур и створок.
Только после выполнения шовной ориентации комиссур иссекают избыток тканей
аорты ксенографта (см. рис. 3.35, д). На шестом этапе имплантации накладывается
дистальный непрерывный обвивной герметизирующий шов (4—0 или 3—0 пролен). Нить
проводится через иссеченный край синуса ксенографта и стенку синуса корня-акцеп-
тора ниже устья коронарных артерии. Дистальный шов начинают накладывать в самой
глубокой проксимальной точке иссеченного синуса ксенографта и заканчивают на вер-
шине близлежащих комиссур (иногда рекомендуют начинать дистальный шов в обрат-
ном направлении — от вершины межкоронарной комиссуры). Концы смежных нитей
выводят на наружную поверхность аорты и связывают между собой (см. рис. 3.35, е).
В ряде случаев перед завязыванием нитей дистального шва вводят фибриновый клей
в парапротезное пространство между некоронарными синусами, чтобы избежать об-
разования парапротезнои гематомы Она может формироваться из-за несоответствия
размеров некоронарных синусов биопротеза и пациента, а также инфицироваться с
бразованием парапротезного абсцесса. Последний этап операции заключается в зак-
рытии аортотомного разреза непрерывным швом (4—0 пролен). У части больных про-
водится пластика аорты нативным аутоперикардом или ксеноперикардом (Терехин В. А.,
002; Konertz W. etal., 1992; Коп N. D. et al., 1995; O’Brien M. E, 1995; 1999; Krause A. H.,
1997; Siebermann R.P., 1997; Kalangos A. et al., 2000; Kirsch M. et al., 2001). Биопротез
Cryolite - O’Brien фиксируется однорядным (пролен 4-0) непрерывным швом в супра-
аннулярную позицию (рис. 3.36).
186 ______________________________________________—
ГЛАВА 3. Биологические замените» н< к»i ап а но в сер, ц
Рис. 3.36. Основные этапы имплантации биопротеза Cryolife-O’Brien в субкоронарную
супрааннулярную позицию (по М. O’Brien, 1995):
а. б — наложение швов на фиброзное кольцо и прошивание основания биопротеза, в — фиксация
биопротеза
При дилатации синотубулярного соединения и аннулоаортальной эктазии в ряде
случаев используется техника имплантации «вставки корня» (root-inclusion). Эта техни-
ка (рис. 3.37) заключается в неполном иссечении коронарных синусов и сохранении
синотубулярного соединения ксенографта с целью обеспечения его исходном простран-
ственной конфигурации. Проксимальный ряд узловых швов накладывается по стандар
тной схеме. Устья коронарных артерий больного имплантируются в адаптированные
отверстия коронарных синусов ксенографта. Верхний край ксенографта и рай аорто
томного разреза сшиваются непрерывным полипропиленовым швом с одновременным
закрытием аорты (Муратов Р. М. и др., 2004; Konertz W et al., 1992, Huysmans H., 1999).
Имплантация биолротеза по технике «полного корня» выполняется значительно реже
(в 4-15%), чем имплантация в субкоронарную позицию. Вначале выполняют полную
поперечную аортотомию несколько выше синотубулярного соединения (рис. 3.38, а).
Затем вырезают устья обеих коронарных артерий пациента вместе с предле а
щей частью синусов, а затем удаляют пораженные створки аортального клапана
(см. рис. 3.38, б). Проксимальный анастомоз накладывают с использованием 28-35 уз-
ловых швов (3-0), которые завязывают на полоске из тефлона или нативного аутопе-
рикарда шириной 1 мм с целью герметизации швов (см. рис. 3.38, в). Иссекают устья
коронарных артерий биопротеза (см. рис. 3.38, г) Реимплантируют устье левой коро-
нарной артерии обвивным непрерывным (5-0 пролен) швом в соответствующий синус
биопротеза (рис. 3.38, д). Выполняют дистальный анастомоз между ксенографтом и
восходящей аортой больного непрерывным швом (4 0 пролен) по типу «конец в ко
нец» На последнем этапе (см. рис. 3.38, е) реимплантируют устье правой коронарной
артерии (Doty J. R. et al., 1998; Коп N. D., 1999, Greve H. H. et al., 2001, Akar A. R. et al ,
2002).
187
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
Рис. 3.37. Этапы имплантации бескаркасного биопротеза Medtronic Freestyle по технике «вставки
корня» (по Н. Huysmans, 1999):
а — поперечная аортотомия; б — иссечение синусов ксенографта; в — пришивание основания ксе-
нографта; г — фиксация биопротеза тремя надкомиссуральными П-образными швами; д — реимп-
лантация устьев коронарных артерий; е — фиксация выходного отдела ксенографта
Следует отметить, что технические ошибки или неточности при имплантации бес
каркасных биопротезов могут приводить к их дисторции, потере подвижности одной
или нескольких створок и вследствие этого — к раннему развитию структурной деге-
нерации и кальцификации. При имплантации необходимо постоянно орошать биопро-
тез физиологическим раствором, чтобы предотвратить высыхание и повреждение тка-
ни створок.
Имплантация бескаркасных биопротезов в аортальную позицию выполняется боль-
ным с гемодинамически значимыми пороками преимущественно старше 40 лет или
более молодым пациентам при непереносимости антикоагулянтов Имплантации ксе-
нографтов выполняются, преимущественно, пациентам в возрасте 60-70 лет и старше.
Этот тип биопротеза является клапаном выбора для пожилых пациентов и с узким кор-
нем аорты (менее 21 мм) или с низкой фракцией выброса левого желудочка, так как
отсутствие каркаса в узком корне аорты пациента обеспечивает высокий гемодинами-
ческий эффект (Барбараш Л. С. и др., 2002; Караськов А. М. и др., 2001; Konertz W.
et al., 1992; Коп N. D. et al., 1995; O’Brien M. F, 1995; Bevilacqua S. et al , 2002)
Тяжелый кальциноз синусов Вальсальвы, аневризма корня и/или восходящей аор-
ты аномалии расположения устьев коронарных артерий (близкое расположение устья
коронарных артерий к фиброзному кольцу клапана или их расположение напротив друг
друга при двустворчатом клапане), наличие неудалимых кальцинатов фиброзного коль-
ца, значительная дилатация синотубулярного соединения рассматриваются как проти-
вопоказания к имплантации бескаркасных биопротезов в субкоронарную позицию.
Выходом из такой ситуации является имплантация ксенографта по технике протезиро-
вания корня аорты (Муратов Р. М и др., 2005; O’Brien М, F.. 1995; Deeb М. G , 1999;
Huysmans Н„ 1999; Коп N. D. et al., 1999, Westaby S. et al., 1999; Kalangos A et al , 2000).
188 -----—--------------------------------------------—-
ГЛАВА 3. Биологические заменители клапанов сер/ ц
Рис. 3 38. Этапы имплантации бескаркасного биопротеза Medtronic Freestyle по технике «полного
корня» (по N. D. Коп, 1999):
а — поперечная аортотомия; б — иссечение устьев коронарных артерий реципиента; в — прошива-
ние аортального кольца больного и основания ксенографта; г — фиксация основания биоклапана к
аортальному кольцу и иссечение устьев коронарных артерий ксенографта, д — реимплантация ус-
тья левой коронарной артерии; е — окончательный вид имплатированного ксенографта после нало-
жения его дистального анастомоза и реимплантации устии коронарных артерии
В норме у молодых здоровых людей диаметр синотубулярного соединения всегда
меньше диаметра фиброзного кольца. Однако у больных с пороками аортального кла
пана, особенно при аортальном стенозе, диаметр синотубулярного соединения часто
превышает диаметр фиброзного кольца. В этом случае подбирают размер биопротеза
по диаметру его синотубулярноого соединения и имплантируют по технике «вставки
корня» или протезирования корня, или выполняют субкоронарную имплантацию с ре-
конструкцией синотубулярного соединения (Кол N. D. et al., 1995, 1999, Bhatnagar
et al., 1997; Siebermann R. R, 1997; David T E. et al., 1998, 2001).
При аневризме корня аорты выполняют изолированное протезирование клапана
(рис. 3.39, а) или в сочетании с протезированием восходящей аорты (см. рис. 3.39, о),
либо имплантируют клапаносодержащий кондуит — см. рис. 3.39, в НА°Уад« S. et al,
1994; Urbanski R Р. et al., 2000; Byrne J. G. et al., 2001; Greve H. H. et al., 2001; Hemmer W. B.
et al., 2004).
He выделяя абсолютных противопоказаний к применению бескаркасных биопроте-
зов, одни авторы рекомендуют воздерживаться от их использования в случаях актив-
ного инфекционного эндокардита (Deeb М G, 1999; Huysmans Н , ) Другие
ры достаточно широко применяли биопротезы Medtronic Freestye, *°С<У’ 0Г2П
при активном инфекционном эндокардите (Santini F. et al., 1 . es а у .,
Muller L. C et al., 2003). Некоторые хирурги (Sakaguchi T. et al., 1999) рекомендуют им-
____________________________________—--------------- 189
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
Рис. 3.39. Операция при аневризме корня аорты (по М. F. O’Brien et al., 1995); протезирование
корня и восходящего отдела аорты клапаносодержащим кондуитом с биопротезом
Stentless Toronto SPV (по Р. Р. Urbanski et al., 2000):
а — имплантация бескаркасного биопротеза Stentless Toronto SPV, б — то же с дакроновым проте-
зом восходящего отдела аорты; в, г — то же с клапаносодержащим кондуитом с фиксацией обвив-
ным или П-образным швами
плантировать ксенографты в субкоронарное положение только при неосложненных
формах, когда инфекционный процесс ограничен пределами створок аортального кла-
пана, поскольку возможно инфицирование синтетической обшивки биопротеза.
Большей устойчивостью к инфицированию, по мнению некоторых авторов, облада-
ют бескаркасные биопротезы, обшитые стабилизированным перикардом (Карась-
ков А. М. и др., 2001; Барбараш Л. С. и др., 2002; Smiawski Н. et al., 2003). Например,
ксенографты фирмы Shelhigh использовались, преимущественно, в экстренных случа-
ях при отсутствии необходимого размера гомографта. Частота реинфицирования бес-
каркасных биопротезов Shelhigh и гомографтов (4%) у пациентов обеих групп была оди-
наковой (Smiawski Н. et al., 2003).
Обычно в послеоперационном периоде пациентам с бескаркасным биопротезом
назначают варфарин (МНО = 2-2,5) в течение 1,5-3 мес (O’Brien М., 1995; Kalangos А.
et al., 2000). Однако с накоплением опыта многие хирурги назначают варфарин паци-
ентам с мерцательной аритмией и высоким риском тромбоэмболических осложнений
(Cartier Р. С. et al., 1999, Kappetem А. Р et al., 2001) или только аспирин (Cartier Р С.
et al., 1999). Отдельные авторы назначают только аспирин тем больным, у которых до-
полнительно выполнялось аортокоронарное шунтирование (Wong К. et al., 2000).
Замена аортального клапана пульмональным аутографтом по методу D. N. Ross
(1967) выполняется у больных с инфекционным эндокардитом аортального клапана,
при его врожденных пороках — преимущественно у новорожденных и грудных детей
(рис. 3.40) Существует несколько модификаций операции Росса — замена корня аор-
ты, цилиндрическая техника, операция Ross-Konn и др (Караськов А. М. и др., 2005).
Описана также и операция Ross II, при которой легочный аутографт имплантируется в
митральную позицию (Kumar A S et al., 2001, Athanasiou Т et al., 2004). В случае при-
менения техники замещения корня аорты выполняют разрез восходящей аорты попе-
речным доступом и ревизию аортального клапана (см рис. 3.40, а). Разрез ствола ле-
гочной артерии производят поперечно и ниже уровня отхождения правой легочной
артерии. Иссечение корня легочной артерии производят осторожно, чтобы не повре-
дить первой септальной ветви левой коронарной артерии (см. рис. 3.40, 6). Обе коро-
нарные артерии отсекают вместе с площадками из окружающей ткани синусов Валь-
190 -----------------------------------------------
ГЛАВА 3 Биологические заменители клапанов сердщ
сальвы. Корень аорты иссекают на уровне аортального кольца по нижнему краю сте-
нок аортальных синусов. Ствол легочной артерии вместе с клапаном сшивают с осно-
ванием корня аорты, и в аутотрафт реимплантируются устья коронарных артерий (см
рис. 3.40, в, г). Аллографт легочной артерии подшивают к отверстию выходного отде-
ла правого желудочка и к дистальному отделу легочного ствола (см. рис. 3 40, д, е)
Бескаркасные биологические (алло- и ксеногенные) заменители атриовентрикуляр-
ных клапанов сердца были разработаны и пока ограниченно внедрены в клиническую
практику с целью почти полного анатомического и функционального замещения есте-
ственных клапанов в случаях невозможности выполнения клапанно-сохраняющей опе-
рации. Имплантация этих заменителей атриоветрикулярных клапанов обеспечивает их
высокую пропускную и хорошую запирательную функцию при сохранении аннулопа-
пиллярной непрерывности желудочков, что обеспечивает высокий функциональный
результат.
Протезирование митрального клапана гомографтом явилось одной из первых опе-
раций в ходе развития клапанной хирургии сердца. Экспериментальные исследования
Рис. 3.40. Этапы имплантации аутографта легочного клапана по технике замены корня аорты
(по N. D. Ross, 1967):
а — доступы к аортальному и пульмональному клапанам, б — иссечение орня аорты и ствол легоч-
ной артерии с клапаном, в, г — подшивание аутографта легочной артерии в аортальную позицию,
д — имплантация устья коронарных артерий в аутографт, подшивание аллографта легочной арте-
рии к выходному отделу правого желудочка и к стволу легочной артерии, е окончательный вид
операции после наложения дистального шва аутографта
191
ИСКУССТВЕН НЫЕ КЛАПАНЫ СЕРДЦА______________________________________
в начале 60-х гг. XX столетия на животных моделях имели вдохновляющие результаты,
демонстрирующие быструю интеграцию гомографта, створки и хорды которого оста-
вались интактными через 1 год после имплантации (Rastelli G С et al , 1965; Acar С
et al., 1994) Тем не менее, первые попытки протезирования митрального клапана мит-
ральным гомографтом в клинической ситуации были связаны с развитием ранней дис-
функции клапана вследствие недопонимания функции клапанного аппарата и из-за
сложности фиксации папиллярных мышц Прогресс, достигнутый в течение последних
20 лет в оценке митрального клапана посредством эхокардиографии, значительно уве-
личил базу знаний клапанной патофизиологии Опыт, полученный в реконструктивной
хирургии митрального клапана, позволил хирургам освоить оперативную технику на
подклапанном аппарате
Суть операции имплантации бескаркасного заменителя атриовентрикулярных кла-
панов сводится к подшиванию верхушек папилляных мышц алло- или ксенографта к
папиллярным мышцам пациента, а затем фиксации фиброзного кольца трансплантата к
фиброзному кольцу реципиента Операция состоит из нескольких этапов (по М Vrandecic
et al., 1995) После иссечения патологически измененного клапана пациента оценива-
ют анатомию его папиллярных мышц, производят измерение калибром атриовентри-
кулярного отверстия и расстояния между фиброзными треугольниками (рис. 3.41, а)
Затем подбирают размер трансплантата, ориентируясь на проведенные измерения, и
имплантат на дежателе помещают в полость желудочка, примеряя его относительно
папиллярных мышц, фиброзного кольца пациента и на предмет совпадения размеров
между фиброзными треугольниками (см. рис 3.41, б) Рассчитывают уровень наложе-
ния швов на сосочковых мышцах. Верхушки имплантата фиксируют к папиллярным
мышцам П-образными швами на прокладках, проведенными через основания папил-
лярных мышц (см рис. 3 41, в).
Рис. 3.41. Этапы имплантации бескаркасного митрального ксенобиопротеза (по М Vrandecic
et al., 1995):
а измерение калибром атриовентрикулярного отверстия б — примерка биоклапана; в — прове-
дение П-образных швов через папиллярные мышцы реципиента и верхушки папиллярных мышц
биоклапана, г — фиксация верхушек к папиллярным мышцам д — пришивание биопротеза к фиб-
розному кольцу е — окончательный вид имплатированного митрального биоклапана со стороны
предсердия
192
ГЛАВА 3. Биологические заменители клапанов сердца
После завязывания П-образных швов (см рис 3 41, г) выполняют второй (верхний)
ряд швов непрерывными или одиночными швами Вначале проводят швы, прови орно
наложенные в области фиброзных треугольников, через маркированные участки фиб-
розного кольца трансплантата (см рис 3 41, д, е) После восстановления сердечной
деятельности обязательно проводится интраоперационная чреспищеводная эхокарди-
ографическая оценка замыкательной функции трансплантата (Vrandecic М et al , 1995)
Техника имплантации криокосервированных митральных гомографтов по С Асаг и
соавт (1996) приводится на рис 3.42. Комплекс митрального аппарата иссекается у
пациентов, подвергавшихся трансплантации сердца, в местах прикрепления папилляр-
ных мышц к стенкам желудочка и миокарда, окружающего фиброзное кольцо мит-
рального клапана Данная манипуляция производится в условиях операционной Крио-
консервация осуществляется в течение 18 ч, в ходе которых гомографты находятся в
банке тканей Применяется 5°о консервирующий раствор диметилсульфоксида без
добавления антибиотиков. Консервация осуществляется при постепенном понижении
температуры до -150°С. Морфологические характеристики папиллярных мышц и рас-
пределение хорд регистрируются для каждого гомографта и записываются в иденти-
фикационную карту Регистрируемые характеристики клапана высота и площадь пе-
редней митральной створки, измеренной обтуратором для аннулопластики, а также
расстояние между вершиной папиллярной мышцы и фиброзным кольцом митрального
клапана Папиллярные мышцы классифицируются в соответствии с их морфологичес-
кими особенностями и подразделяются на 4 типа (см. рис 1 14). Защита миокарда осу-
ществляется посредством холодовой кардиоплегии через корень аорты Доступ к ле-
вому предсердию производится классическим параллельным разрезом через межпред-
сердную борозду Затем осматривается митральный клапан для оценки патологического
Рис. 3.42. Хирургическая техника имплантации митрального гомографта (по С. Асаг et al , 1996):
а — отделение латеральных участков прикрепления папиллярных мышц с тракцией створок клапана
и разделением мышечных валиков реципиента, б — установка папиллярной мышцы гомографта в
разрез между нативной папиллярной мышцей и стенкой левого желудочка, в фиксация папилляр-
ной мышцы, г — подшивание аннулопластического кольца Carpentier до имплантации створок го-
мографта, д — фиксация створок гомографта по окружности к аннулопластическому кольцу
е — окончательный вид операции после протезирования митрального клапана гомографтом с нну-
лопластическим кольцом
____________________________________________________________193
8 Искусственные
клапаны сердца
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
процесса и принятия окончательного решения относительно типа хирургического вме-
шательства При наличии изолированного повреждения, затрагивающего менее поло-
вины клапана (кальциноз или клапанный абсцесс), имплантируется только часть гомог-
рафта при условии, что оставшаяся часть клапана была нормальной. С другой сторо-
ны, при наличии обширных повреждений с вовлечением в патологический процесс всего
клапана осуществляется полное протезирование митрального клапана гомографтом.
При имплантации митрального гомографта сначала иссекается патологически из-
мененная ткань клапана вместе с соответствующими хордами, целостность папилляр-
ных мышц тщательно сохраняется (см рис 3.42, а) Проводится их мобилизация пу-
тем отделения мышечных пластов, прикрепленных к стенке левого желудочка Имп-
лантация гомографта начинается с фиксации папиллярных мышц. Экспозиция
папиллярной мышцы реципиента хорошо видна путем ее тракции за шов-держалку.
Каждая папиллярная мышца гомографта фиксируется к разрезу между нативной па-
пиллярной мышцей и стенкой левого желудочка (см рис. 3 42, б) Головка папилляр-
ной мышцы гомографта, поддерживающая комиссуру, используется как контрольная
точка и помещается на соответствующем участке нативнои папиллярной мышцы. Этот
участок легко определяется, так как комиссуральные хорды неизменно берут начало
от вершины папиллярной мышцы Как правило, папиллярная мышца гомографта под-
шивается бок-в-бок к папиллярной мышце реципиента, чтобы разместиться на более
низком уровне. Для сшивания папиллярных мышц используется двойной ряд матрац-
ных швов, защищенных многочисленными прерывистыми швами (см рис, 3.42, в) Под-
шивается аннулопластическое кольцо Carpentier к фиброзному кольцу реципиента (см.
рис 3.42, г). Размер аннулопластического кольца подбирается исходя из размера пе-
редней створки гомографта, измеренного обтуратором Ткань створок гомографта за-
тем подшивается к кольцу Carpentier посредством 5-0 швов пролена полипропилена (см.
рис. 3 42, д) Различные части клапана подшиваются в следующем порядке, заднеме-
диальная комиссура, передняя створка, переднелатеральная комиссура, задняя створ-
ка Особое внимание уделяется расположению комиссур. В областях передней створ-
ки и комиссур швы накладываются без натяжения В случаях избыточной или недоста-
точной ткани створок гомографта по отношению к аннулопластическому кольцу шовная
линия корригируется для достижения баланса во время пришивания задней митраль
ной створки. После имплантации гомографта результат оценивается путем инфузии фи-
зиологического раствора под давлением в желудочек (гидравлическая проба) С Асаг и
соавт (1996) провели серию имплантаций криокосервированных митральных гомо-граф-
тов 43 пациентам по поводу приобретенной патологии митрального клапана по описан-
ной методике с удовлетворительными отдаленными результатами (через 14 месяцев)
ЛИТЕРАТУРА
Абалмасов В Г, Кокорин С Г., Бондаренко А В и др Использование биологических протезов
клапанов сердца нового поколения // Анналы хирургии — 1997 — № 1. — С 30-33
Аль-Хаджабед X Ф, Муратов Р М, Скопин И И и др Аллографты в легочной позиции при
операции Росса // Сердечно-сосудистые заболевания — Бюл НЦССХ им А Н Бакулева
РАМН - 2005 — Т 5 — № 11 — С 338
Аминов В В Применение бескаркасных эпоксиобработанных ксенобиопротезоа при хирурги
ческой коррекции пороков аортального клапана Автореф дис канд мед наук — Новоси-
бирск, 2004
Бабенко С И , Соболева Н. Н, Бакулева Н. П и др Ксеногенные протезы в хирургии митраль
ного клапана Ц Сердечно-сосудистые заболевания — Бюл НЦССХ им А Н Бакулева
РАМН — 2005. — Т. 5. — № 11 — С 338
Барбараш Л С История развития биопротезирования клапанов сердца в Кемеровском карди
ологическом центре 15-летний опыт // Биопротезы в сердечно-сосудистой хирургии 3
тер симпоз — Кемерово, 1996 — С 26
194
ГЛАВА 3 Биологические заменители клагшнов сердца
Барбараш Л С, Барбараш Н А., Журавлева И Ю Биопротезы клапанов сердца проблемы и
перспективы — Кемерово, 1995
Барбараш Л С, Журавлева И Ю , Кокорин С Г и др Новый биопротез «Перикор ' с антибак-
териальными свойствами // Сердечно-сосудистые заболевания — Бюл НЦССХ им А Н
Бакулева РАМН — 2005 — Т 5 — № 11 — С 341
Барбараш Л С , Моисеенков Г В , Кокорин С Г и др Новые модели бескаркасных биопроте-
зов в хирургии аортального клапана гидродинамическая оценка и первый опыт клиничес-
кого применения // Грудная и сердечно-сосудистая хир — 2002 - №4. - С 13-16
Барбараш Л С, Моисеенков Г В , Сизова И Н и др Бескаркасные эпоксиобработанные ксе-
нобиопротезы в хирургии аортального клапана // Сердечно-сосудистые заболевания —
Бюл НЦССХ им А Н. Бакулева РАМН — 2003 — Т 4 — № 11 — С 347
Барратт-Бойз Б Тканевые клапаны историческая перспектива // История сердечно-сосудис-
той хирургии / Под ред Бокерии Л А НЦССХ им А Н Бакулева РАМН. — М., 1997 —
С 119-124
Бокерия Л А., Каграманов И И, Кокшенев И В Новые биологические материалы и методы
лечения в кардиохирургии — М.. Издательство НЦССХ им А Н Бакулева РАМН 2002
Бокерия Л А., Подзолков В П, Малашенков А И и др Биопротезы в сердечно-сосудистой
хирургии. Современное состояние и проблемы // Грудная и сердечно-сосудистая хир —
2002 - № 1 — С 4-12
Бокерия ЛА., Цукерман Г И, Подзолков В П. и др Опыт и современные направления исполь-
зования биологических материалов в сердечно-сосудистой хирургии // Биопротезы в сер-
дечно-сосудистой хирургии: Матер, симпоз , 10-12 окт. 1995 г — Кемерово: Кемеровский
полиграфкомбинат, 1996 — С. 11-25
Бритиков Д. В., Муратов Р. М., Костава В Г. и др Криосохраненные клапанносодержащие ал-
лографты. опыт создания и клинического применения // Сердечно-сосудистые заболева-
ния — Бюл. НЦССХ им А. Н. Бакулева РАМН — 2005 — Т 5. — № 11 — с. 343
Бураго Ю А Морфология ксеноаортальных биопротезов клапанов сердца после применения
новых методов консервации // Биопротезы в сердечно-сосудистой хирургии: Матер сим-
поз 10-12 окт. 1995 г — Кемерово: Кемеровский полиграфкомбинат, 1996 — С 169-174.
Гавриленков В И Бескаркасный биопротез клапана аортьг Патент РФ № 2175858 от
20.11 2001 // Бюл изобрет — 2001. — № 32.
Гавриленков В И Основы протезирования клапана аорты бескаркасными биопротезами (экс-
периментальное исследование). Автореф дис докт. мед. наук. — СПб., 2004.
Гавриленков В. И. Протез клапана сердца и устройство для его формирования Авт свид
№ 1748814 от 22.03.1992 // Бюл. изобрет — 1992. — № 27
Гавриленков В. И., Анцев Г В., Лунин А М и др Держатель протеза сердечного клапана. Па-
тент РФ № 4909719/14 от 20.04.1995 // Бюл. изобрет — 1995 — № 11.
Гавриленков В И, Кузнецов А А., Перлей В Е и др Эхокардиографическая оценка нормаль-
ной биомеханики аортального клапана // Ультразвуковая и функциональная диагностика —
2003 — № 2. — С 89-96
Гавриленков В И Маслевцов Д В Способ структурной стабилизации биотканей: Патент РФ
№ 2234217 от 20.08.2004 // Бюл изобрет. № 23 — 2004
Гавриленков В И. Маслевцов Д В, Юхнев А Д и др Влияние техники имплантации на пото-
ковые и биомеханические характеристики бескаркасных биопротезов аортального клапана
в эксперименте // Вести хир им И И Грекова — 2001 — Т 160, №5 — С. 45-51
Гавриленков В И, Юхнев А Д Маслевцов Д В Гидродинамические и биомеханические ха-
рактеристики бескаркасных биологических заменителей аортального клапана сердца //
Уч зап. СПбГМУ — 1999 — Т. 6. — № 2. — С 46-51
Гантимурова И Л Взаимодействие коллагеновых имплантатов с ионами переходных метал-
лов // Биопротезы в сердечно-сосудистой хирургии Матер симпоз. 10 — 12 окт 1995 —
Кемерово Кемеровский полиграфкомбинат, 1996 — С. 175-185
Дземешкевич С. Л Биопротезы клапанов сердца причины и патогенез кальцификации // Био-
совместимость — 1994 — Т 2 — №4. — С 165
Дземешкевич С Л., Стивенсон Л У Болезни митрального клапана Функция, диагностика, ле-
чение — М Гэотар Медицина, 2000
Дземешкевич С Л, Стивенсон Л У, Алекси-Месхишвили В В Болезни аортального клапана
Функция, диагностика, лечение — М Гэотар-Мед, 2004
195
8-
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
Журавлева И Ю Патогенез кальцификации биопротезов клапанов сердца и пути ее профи-
лактики // Биопротезы в сердечно-сосудистой хирургии’ Матер симпоз 10-12 окт 1995 -
Кемерово’ Кемеровский полиграфкомбинат, 1996. — С. 92-104
Журавлева И Ю Патогенетическое обоснование и разработка новых способов консервации
ксенобиопротезов клапанов сердца Автореф дис докт мед наук НЦХ РАМН — М , 1995
Караськов А М., Железнев С И. Назаров В М и др Особенности процедуры замещения аор-
тального клапана легочным аутографтом у взрослых пациентов // Сердечно-сосудистые
заболевания — Бюл НЦССХ им А Н. Бакулева РАМН. — 2005. — Т. 5. — № 11 — С 42
Караськов А М Железнев С И Назаров В М и др Причины развития дисфункций биологи-
ческих клапанов и непосредственные результаты хирургической коррекции // Сердечно-
сосудистые заболевания — Бюл НЦССХ им А Н Бакулева РАМН. — 2005. — Тб-
Ng 5 — С 43
Караськов А М., Семенов И И, Демин ИИ и др. Результаты использования эпоксиобрабо-
танных ксенопротезов в хирургии приобретенных пороков трикуспидального клапана //
Сердечно-сосудистые заболевания — Бюл НЦССХ им А Н Бакулева РАМН — 2005 —
Т. 6. - № 5 - С 27
Караськов А М., Семенов И И , Железнев С И и др Резидуальный градиент на бескаркасных
протезах // Сердечно-сосудистые заболевания — Бюл НЦССХ им А Н Бакулева РАМН —
2004 — Т 5 — № 11 — С 338
Караськов А М., Семенов И И, Железников В Е. и др Ремоделирование левого желудочка
после протезирования аортального клапана бескаркасными ксенобиопротезами // Сердеч-
но-сосудистые заболевания — Бюл НЦССХ им А Н Бакулева РАМН — 2003 — Т 4 —
№ 11 - С 349
Караськов А М , Семенов И. И., Синельников Ю С. и др Сравнение непосредственных резуль-
татов операции Росса и протезирования аортального клапана бескаркасными эпоксиоб-
работанными ксенобиопротезами у пациентов с приобретенными пороками сердца // Сер-
дечно-сосудистые заболевания — Бюл НЦССХ им. А. Н Бакулева РАМН. — 2003 — Т 4 —
№ 11. — С 34
Кондратенко Ж. Е, Костава В Т, Бакулева Н П и др Физике-механические и функциональ-
ные характеристики ксеноткани при различных видах стабилизации и обработки // Мед
техника — 1998 — Ng 4. — С 20-23
Константинов Б А , Шилов А М Хирургическая техника протезирования аортальных клапанов
с применением армированных гетеропротезов//Грудная хир —1971 — Ng 5 — С 16-19
Костава В Т Бакулева Н П , Лютова И Г. и др Разработка альтернативного метода стерилиза-
ции биологических протезов «БиоЛАБ раствором формальдегида // Сердечно-сосудистые
заболевания — Бюл НЦССХ им А Н Бакулева РАМН — 2004 — Т 5 — № 11 — С 342
Кудрина Л Л Отдаленные результаты протезирования митрального клапана биопротезом
«БАКС»: Автореф дис канд мед наук — М., 1992.
Кудрявцева Ю А Новые методы консервации биопротезов для сердечно-сосудистой систе-
мы // Биопротезы в сердечно-сосудистой хирургии Матер симпоз , 10-12.10 1995 — Ке-
мерово Кемеровский полиграфкомбинат, 1996. — С 146-151
Кучеренко В С Применение бескаркасных биопротезов в коррекции пороков клапана аорты
Автореф дис канд мед наук — СПб , 2005
Малиновский Н Н, Константинов Б А Дземешкевич С Л Биологические протезы клапанов
сердца — М : Медицина, 1988
Марцинкявичюс А М Сирвидис В М Применение аутологической широкой фасции бедра для
протезирования митрального клапана // Грудная хир — 1971 — No 3 —С 111-113
Маслевцов Д В Обработка биологических протезов клапанов сердца эпоксисоединениями
(экспериментальное исследование) Автореф дис канд мед наук — СПб, 2005
Моисеенков Г В Бескаркасные эпоксиобработанные ксенопротезы в хирургии аортального
клапана: Автореф дис канд мед наук — М.» 2003
Муратов Р М., Крестинич И М., Макаренко В Н и др. Сравнительный анализ результатов про
тезирования аортального клапана криосохраненными аллографтами с применением суб
коронарной техники и методики «свободного корня» // Сердечно-сосудистые заболева
ния — Бюл НЦССХ им А Н Бакулева РАМН — 2005 —Тб — Ng 5 —С 35
Муратов Р М , Скопин И И , Крестинич И М и др Протезирование аортального клапана и корн
аорты бескаркасными биопротезами // Сердечно-сосудистые заболевания — Бюл НЦСС
им А Н Бакулева РАМН — 2003 — Т 4 — Ng 11 — С 35
196 -------------——
ГЛАВА 3 Биологические заменители клапанов сердца
Одаренко Ю Н, Бураго А Ю, Кокорин С Г и др Клинико-морфологическая характеристика
дисфункций биопротезов «КЕМКОР», имплантированью в митральную позицию // Сердеч-
но-сосудистые заболевания — Бюл НЦССХ им. А. Н. Бакулева РАМН — 2004 — Т. 5. —
№ 11 — С 342
Подзолков В П, Зелени кин М А , Горбачевский С В. и др Первый опыт использования ал-
лоаортальных кондуитов при коррекции врожденных пороков сердца // Грудная и сердеч-
но-сосудистая хир — 1993 — № 5. — С 25-27
РоссД Кардиохирургия вчера, сегодня, завтра // В кн История сердечно-сосудистой хирур-
гии (под ред Л А Бокерии), 2003. — С 45-51.
Семеновский М Л, Соколов В В Биопротезирование клапанов сердца два десятилетия с
протезами Кемеровского кардиологического центра // Биопротезы в сердечно-сосудистой
хирургии — Тез докл. Всероссийской конф с междунар. участием (21-23.06 2001 г, Ке-
мерово, Россия) — Новосибирск: ЦЭРИС, 2001 — С 64-65
Соколов В. В., Поддубная Н. В., Белова А Э и др. Отдаленные результаты протезирования
митрального клапана биопротезами с различной обработкой биоткани // Сердечно-сосудис-
тые заболевания. — Бюл. НЦССХ им А Н. Бакулева РАМН. — 2005 — Т 6. — № 5. — С 30.
Терехин В. Н Протезирование аортального клапана ксеноаортальным бескаркасным протезом:
Автореф. дис. канд. мед. наук. — М., 2002.
Фурсов Б. А Биопротезирование клапанов сердца // Автореф дис. докт. мед. наук. — М , 1982.
Фурсов Б А., Картошкин В М., Горшков /О В и др Конструктивные особенности и гидродина-
мические характеристики клапанов сердца «Бионике» // Мед техника. — 1990 — № 6. —
С. 32-35.
Хубулава Г Г, Шихвердиев Н. Н, Кучеренко В С. Биопротезирование клапана аорты бескар-
касными ксенографтами // Сердечно-сосудистые заболевания — Бюл НЦССХ им А. Н.
Бакулева РАМН — 2005. — Т. 5. — № 11. - С 340
Цукерман Г И , Бураковский В М., Голиков Г. Т. и др. Пороки аортального клапана. — М., 1972.
Цукерман Г И., Быкова В. А , Фурсов Б. А. Первый опыт замены митрального и трикуспидаль-
ного клапанов сердца аортальным гомо- и гетеротрансплантатами // Грудная хир. — 1969 —
№ 4. — С. 3-10.
Чеснов Ю. М., Станишевский Л С , Швед М. М и др. Экспериментальные биопротезы для сер-
дечно-сосудистой хирургии // Биопротезы в сердечно-сосудистой хирургии — Тез. докл.
Всероссийской конф, с междунар участием (21-23 июня 2001 г, Кемерово, Россия). —
Новосибирск: ЦЭРИС, 2001. — С 71-72.
Шапошников А Н Эпоксисоединения в консервации биологических протезов клапанов серд-
ца (экспериментальное исследование): Автореф. дис. канд мед наук. — М , 1992.
Шматов Д В Хирургическая коррекция приобретенных митральных пороков с использовани-
ем диэпоксиобработанных ксенобиопротезов: Автореф. дис. канд. мед наук. — Новоси-
бирск, 2004
Юрлов И А., Ильин В. Н., Костава В Т Биопротезы в сердечно-сосудистой хирургии // Груд-
ная и сердечно-сосудистая хир. — 2002 — № 1. — С. 4-12.
Abolhoda A., Yu S., Oyarzun R et al No-React detoxification process: a superior anticalcification
method for bioprostheses //An Thorac. Surg — 1996 — Vol. 62, № 6 — P. 1724-1730
Acar C., Farge A., Ramsheyi A et al Mitral valve replacement using a cryopreserved mitral homo-
graft // An Thorac Surg. — 1994 — Vol. 57, № 6. — P. 746-752.
Acar C., Tolan M., Berrebi A Homograft replacement of the mitral valvegraft selection, technique of
implantation, and results in forty-three patients // J. Thorac Cardiovasc. Surg — 1996, —
Vol 111 — № 3. — P 367-380
Agrawal С M., Ray R В Biodegradable polymeric scaffolds for musculoskeletal tissue engineering //
J Biomed Mater Res. — 2001. — Vol 55, № 1. — P. 141-150.
Akar A R., Szafranek A., Alexiou C et al. Use of stentless xenografts in the aortic position
determinants of early and late outcome // An Thorac Surg — 2002 — Vol 74, № 5 — P. 1450-
1458.
A/-Khaja N , Belboul A., Rashid M et al The influence of age on the durability of Carpentier-Edwards
biological valves. Thirteen years follow-up // Eur J Cardiothorac. Surg — 1991. — Vol. 5, № 12. —
P 635-640
Angell W IV, Angell J D, Sywak A The Angell-Shiley porcine xenograft // An. Thorac Surg —
1979 — Vol 28, № 6 * — P 537-553
197
ИСКУССТВЕННЫ Е КЛАПАНЫ СЕРДЦА_______________________________________________________
Angell IV W Pupello D F Bessone LN et al Effect of stent mounting on tissue valves for aortic
valve leplacement //J Cardiac Surg — 1991 — Vol. 6, N° 4 (Suppl 4). — P 595-599
Aoyagi S Kosuga К, Akashi H et al Aortic root replacement with a composite graft: Results of 69
operations in 66 patients // An Thorac Surg. — 1994 — Vol 58, № 10. — P 1469-1474
Armmger L C„ Thomson R. W Stnckett M G et al. Morphology of heart valves preserved by liquid
nitrogen freezing // Thorax — 1985 — Vol. 40, № 6 — P 778-784.
Athanasiou T Cherian A Ross D The Ross II procedure pulmonary autograft in the mitral posi-
tion //An Thorac Surg — 2004 — Vol 78, № 4 — P 1489-1495
Aupart M R . Sinnelli A L , Diemont F F et al The last generation of pericardial valves in the aortic
position Ten-year follow-up in 589 patients // An Thorac Surg. — 1996 — Vol 61, № 4. —
P 615-619
Bach D S . Cartier P C, Kon ND et al Impact of implant technique following Freestyle stentless
aortic valve replacement // An Thorac Surg — 2002 — Vol 74, №4 - P 1107-1113
Bach D S Goldman В Verner E et al. Durability and prevalence of aortic regurgitation nine years
after aortic valve replacement with the Toronto SPV stentless bioprosthesis // J Heart Valve Dis —
2004 — Vol. 13, № 1. — P 64-72
Bach D S, Kon N D , Dumesnil J G et al Eight-year results after aortic valve replacement with the
Freestyle stentless bioprosthesis // J Thorac Cardiovasc Surg — 2004. — Vol 127, № 6 —
P 1657-1663
Banbury M К, Cosgrove D M, Thomas J D et al Hemodynamic stability during 17 years of the
Carpentier-Edwards aortic pericardial bioprosthesis // An Thorac. Surg. — 2002 — Vol 73,
№5 — P 1460-1465
Barratt-Boyes В G , Jaffe W M , Whitlock R M The Medtronic Intact porcine valve: ten-year clinical
review//J Thorac Cardiovasc. Surg — 1998 — Vol 116, № 6 — P. 1005-1014
Barratt-Boyes В G, Jaffe W M, Ko P H et al The zero pressure fixed Medtronic Intact porcine
valve an 8.5 year review // J Heart Valve Dis — 1993 — Vol 2, № 4 — P 604-608
Bevilacqua S, Gianetti J., Ripoli A. et al Aortic valve disease with severe ventricular dysfunction
stentless valve for better recovery // An. Thorac Surg — 2002. — Vol. 74, № 6 - P 2016-
2021.
Bhatnagar G., Chnstakis G T., Murphy PM et al Technique for reconstruction of the sinotubular
junction // An Thorac Surg — 1997 — Vol 63, № 2. — P. 559-560.
Bilhar К L , Sacks M S Biaxial mechanical properties of the natural and glutaraldehyde treated aortic
valve cusp Part I Experimental results // J. Biomech Eng — 2000. — Vol 122, № 1 — P. 23-30
Bonacchi M, Giunti G, Pnfti E et al Early postoperative outcome and hemodynamic performance
of the Sorin Pencarbon stentless aortic valve // J Heart Valve Dis — 2002 — Vol. 11, № 5 —
P 703-709
Booth C Korossis S A , Wilcox HE et al Tissue engineering of cardiac valve prostheses I
Development and histological characterization of an acellular porcine scaffold // J Heart Valve
Dis — 2002 — Vol 11, № 3 — P 457-462
Bortolotti U Scioti G , Milano A et al The Edwards Prima stentless valve hemodynamic performance
at one year//An Thorac Surg — 1999. — Vol 68, №6 — P 1147-1151.
Bortolotti U, Milano A Thiene G et al Long-term durability of the Hancock porcine bioprosthesis
following combined mitral and aortic valve replacement an 11 -year experience // An Thorac
Surg — 1987 — Vol 44, № 2 — P 139-144
Bortolotti U, Scioti G , Milano A et al Performance of 21 -mm size Perimount aortic bioprosthesis m
the elderly // An Thorac Surg — 2000 — Vol 69, № 1. — P 47-50
Bottio T., Rizzoli G , Thiene G et al Hemodynamic and clinical outcomes with the Biocor valve in the
aortic position an 8-year experience//J Thorac Cardiovasc Surg —2004 — Vol 127, № 6 -
P 1616-1623
Bottio T, Thiene G, Pettenazzo E et al Hancock II bioprosthesis a glance at the microscope in
mid-long-term explants//J Thorac Cardiovasc Surg — 2003 — Vol. 126, № 1 — P 99-Ю5
Brais M P, Bedard J P Goldstein W et al lonescu-Shiley pericardial xenografts: follow-up of up to
6 years//An Thorac Surg — 1985 — Vol 39, № 2 — P. 105-111
Broom N D, Marra D Effect of glutaraldehyde fixation and valve constraint conditions on porcine
aortic valve leaflet coaptation // Thoiax — 1982 — Vol 37, № 8 — P 620-626
Brown R A t Prajapati R McGrouther DA et al Tensional homeostasis in dermal fibroblasts
mechanical responses to mechanical in three-dimensional substrates // J Cell Physiol. — 1998
Vol 175, № 2 — P 323-326
198------------------------------------------------------------------
ГЛАВА 3 Биологические заменители клапанов сердца
Burdon Т А , Miller D С, Oyer РЕ et al Durability of porcine valves at fifteen years in a representative
North American patient population//J. Thorac Cardiovasc Surg — 1992 — Vol 103, № 2 —
P 238-252.
Butany J, Fayet C, Ahluwalia MS et al Biological replacement heart valves. Identification and
evaluation // Cardiovasc Pathol — 2003. — Vol 12, № 1. — P 119-139
Butany J, Leask R The failure modes of biological prosthetic heart valves // J Long-Term Eff Med
Implants. — 2001 — Vol 11, №3-4 —P. 115-135
Butany J, Vanlerberghe К, Silver M D Morphologic findings and causes of failure in 24 explanted
lonescu-Shiley low-profile pericardial heart valve // Hum Pathology — 1992 — Vol 23, №11 —
P 1224-1233
Butany J , Yu W, Silver M. D et al Morphologic findings in explanted Hancock II porcine bioprosthe-
ses // J. Heart Valve Dis — 1999 — Vol 8, № 1. — P 4-15.
Byrne J. G., Mihaljevic T., Lipson W. E et al Composite stentless valve with graft extension for
combined replacement of the aortic valve, root and ascending aorta // Eur J Cardiothorac Surg —
2001 — Vol. 20, № 2. — P 252-256
Caimmi P. P, Di Summa M.r Galloni M et al Twelve-year follow-up with the Sorin Pericarbon
Bioprosthesis in the mitral position // J. Heart Valve Dis. — 1998 — Vol. 7, № 4. — P. 400-406.
Carpemter A., Bloudeau P, Laurens В et al. Mitral and tricuspid valve replacement with frame-mounted
aortic heterografts // J Thorac Cardiovasc. Surg — 1968 — Vol 56, № 3 — P. 383-394
Carpentier A , Lemaigre G, Robert L et al Biological factors affecting long-term results of valvular
heterografts // J. Thorac Cardiovasc. Surg. — 1969 — Vol 58, № 4. — P 467-483
Carpentier A , Nashef A , Carpentier S et al Techniques for prevention of calcification of valvular
bioprostheses // Circulation. — 1984. — Vol 70, № 1 — P 165-168
Carpentier S. M., Carpentier A. R, Chen L et al Calcium mitigation in bioprosthetic tissues by iron
pretreatment the challenge of iron leaching // An Thorac Surg. — 1995 — Vol. 60, № 2 —
P. 332-338
Carpentier-Edwards S.A. V bioprosthesis 826-CV USA: Baxter Healthcare, 1990
Carpentier-Edwards S A V bioprosthesis Specially modified stent: an important development in
low pressure bioprosthesis durability 536-6/88-CV. USA. Baxter Healthcare, 1988.
Carrier M., Pellerin M, Perrault L. P. et al. Experience with the 19-mm Carpentier-Edwards pericardial
bioprosthesis in the elderly // An Thorac. Surg. — 2001 — Vol. 71, № 2 (Suppl. 5). — P. 249-252.
Cartier P C, Dumesnil J. G., Metras J et al. Clinical and hemodynamic performance of the Freestyle
aortic root bioprosthesis // An Thorac. Surg. — 1999. — Vol 67, № 2. — R 345-352.
Chapekar M. S. Tissue engineering: challenges and opportunities // J Biomed Mater Res. — 2000. —
Vol 53, № 5 — P 617-620.
Chen W, Schoen F. J, Levy R. J Mechanism of efficacy of 2-ammo oleic acid for inhibition of
calcification of glutaraldehyde-pretreated porcine bioprosthetic heart valves 11 Circulation —
1994 — Vol. 90, № 1 — P 323-329.
Chen Y. F, Lee C. S., Lin С. C. et al Twenty-year follow-up of the Carpentier-Edwards standard
porcine bioprosthesis in the Oriental population //J. Cardiovasc. Surg — 2003 — Vol 44, № 6. —
P. 691-699
Chevallay B., Herbage D Collagen-based biomatenals as 3D scaffold for cell cultures applications
for tissue engineering and gene therapy // Med. Biol. Eng Comput — 2000 — Vol 38, № 2 —
R 211-218
Christie G W. Anatomy of aortic heart valve leaflets: the influence of glutaraldehyde fixation on func-
tion // Eur J Cardiothorac Surg — 1992 — Vol 6, № 1 (Suppl. 1) — P. 25-33
Cohen G, Chnstakis G T, Joyner C. D. et al. Are stentless valves hemodynamically superior to stented
valves? A prospective randomized trial // An. Thorac. Surg. — 2002. — Vol. 73, № 3. — P 767-775
Cohn L. H., Collins J J., Rizzo R J et al Twenty-year follow-up of the Hancock modified orifice porcine
aortic vavle //An Thorac. Surg — 1998 — Vol. 66 (Suppl 6). — R 30-34.
Cohn L H., Sanders J H.t Collins J J. Aortic vavle replacement with the Hancock porcine xenograft //
An. Thorac. Surg — 1976 — Vol. 22. № 3. — R 221-227
Cohn L H., DiSesa V J., Collins J. J. The Hancock modified-onfice porcine bioprosthetic valve 1976-
1988 //An. Thorac Surg. — 1989 — Vol 48 (Suppl 3) - P 81-102
Collinson J, Henem M , Flather M et al Valve replacement for aortic stenosis in patients with poor
left ventricular function Comparison of early changes with stented and stentless valves //
Circulation — 1999 — Vol 100, № 19 (Suppl 2) — P 1-5
Corbmeau H, Lelong В , Langanay T et al Echocardiographic assessment and preliminary clinical
----------------------------------------------------------------- 199 -----------
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
issults after aortic valve replacement with the Medtronic Mosaic bioprosthesis // J. Heart Valve
Dis — 2001 — Vol 10, № 1 — P 171-176
Corbineau H, De La Tour В , Verhoye J P et al Carpentier-Edwards supraannular porcine
bioprosthesis m aortic position 16-year experience // An Thorac. Surg. — 2001 — Vol 71
(Suppl 5) - P 228-231
Corbineau H, Du Haut Cilly F В , Langanay T. et al Structural durability m Carpentier-Edwards
Standard bioprosthesis in the mitral position a 20-year experience // J Heart Valve Dis. — 2001 -
Vol. 10, № 4 — P 443-448
Corbineau H, Verhoye J P, Tauran A et al Medtronic Intact porcine bioprosthesis in the aortic
position 13-year results // J Heart Valve Dis — 2002 — Vol 11, № 4 — P 537-541
Cunanan С M, Cabihng С M, Dinh T T et al Tissue characterization and calcification potential of
commercial bioprosthetic heart vavles // An Thorac Surg — 2001 — Vol 71 (Suppl 5) —
P 417-421
Dagenais F Cartier P, Dumesnil J G et al. A single center experience with the Freestyle
bioprosthesis midterm results at the Quebec Heart Institute // Semin Thorac Cardiovasc Surg —
2001.—Vol 13, №4 (Suppl 1) — R 156-162
Danton M H , Sarsam M A , Byrne J G et al. Clinical and hemodynamic performance of the Toronto
SPV bioprosthesis // J Heart Valve Dis — 2000 — Vol. 9. № 3 — P 644-650.
David T E. Aortic valve replacement with stentless porcine bioprostheses // J. Card Surg — 1998 —
Vol 13, № 5 — P 344-351
David T E, Ivanov J, Annstrong S et al Late results of heart valve, replacement with the Hancock II
bioprosthesis // J Thorac. Cardiovasc Surg — 2001. — Vol 121, № 2 — P 268-277
David T E, Mohr F И/, Bavaria J E et al Initial experience with the Toronto Root bioprosthesis //
J Heart Valve Dis — 2004 — Vol 13, № 2. — P 248-251.
David T E, Puschmann R, Ivanov J Aortic valve replacement with stentless and stented porcine valves
a case-match study // J Thorac Cardiovasc. Surg. — 1998 — Vol 116, No 2 — P 236-240
David T E, Feindel С M, Scully HE et al Aortic valve replacement with stentless porcine aortic
valves* A ten year experience // J Heart Valve Dis — 1998 — Vol 7, № 2 — P 250-254
Deeb M G Medtronic Freestyle. Multimedia educational software: [CD-Rom] — Minneapolis
Medtronic, 1999.
Deiwick M , Glasmacher В , Baba HA et al In vitro testing of bioprostheses influence of
mechanical stresses and lipids on calcification //An Thorac Surg — 1998 — Vol 66, № 6 —
P 206-211.
Del Rizzo D F, Abdoh A , Cartier P et al Factors affecting left ventricular mass regression after
aortic valve replacement with stentless valves // Semin Thorac. Cardiovasc Surg — 1999 —
Vol 11, №4 (Suppl 1) — P 114-120
Del Rizzo D F, Abdoh A Clinical and hemodynamic comparison of the Medtronic Freestyle and
Toronto SPV stentless valves // J Card. Surg — 1998 — Vol 13, № 2 — P 398-342.
Delcan J L , Chaitman В R, Lopez-Bescos R. et al Hemodynamic evaluation of the Angell-Shiley
porcine xenograft // J Thorac Cardiovasc Surg — 1982 — Vol 84, № 2 — P 297-305
Demirag M , Kirah К, Omeroglu S N et al Mechanical versus biological valve prosthesis in the mitral
position a 10-year follow up of St Jude Medical and Biocor valves 11 J Heart Valve Dis
2001 — Vol 10, № 1 — P 78-83
Doss M, Martens S, Wood J P et al Performance of stentless versus stented aortic valve
bioprostheses in the elderly patient a prospective randomized trial // Eur J Cardiothorac Surg —
2003 — Vol 23, № 3 — P 299-304
Doty J R , Flores J H , Millar R C et al Aortic valve replacement with Medtronic Freestyle
bioprosthesis: operative technique and results 11 J Card Surg — 1998 — Vol 13, № 1 —
P 208-213
Duarte I G, MacDonald M J, Cooper W A et al In vivo hemodynamic, histologic and
antimmeralization characteristics of the Mosaic bioprosthesis // An Thorac Surg — 2001
Vol 71, № 1 — P 92-99
Dumont К, Yperman J , Verbeken E et al Design of a new pulsatile bioreactor for tissue engineered
aortic heart valve formation // Artif. Organs. — 2002 — Vol 28, № 5 — P 710-714
Duncan A C., Boughner D , Vesely I Dynamic glutaraldehyde fixation a porcine aortic valve xenogiaft
I Effect of fixation conditions on the final tissue viscoelastic properties // Biomatenals — 1996
Vol 17, № 19 — P 1849-1856
Duncan A C , Boughner D , Vesely I Viscoelasticy of dynamically fixed bioprosthetic valves II Effect
200 —---------------------------------------------------------------"
ГЛАВА 3. Биологические заменители клапанов сердца
of glutaraldehyde concentration // J Thorac Cardiovasc Surg — 1997 — Vol 113, № 2 —
P 302-310
Eastwood M , McGrouther D A , Brown R A A culture force monitor for measurement of contraction
forces generated in human dermal fibroblast cultures evidence for cell-matrix mechanical signa-
ling // Biochimica Biophysica Acta — 1994 — Vol 1201, № 2 — P 186-192
Edwards Life Sciences website (wwwedwards com), 2002
Edwards W S Late results with fascia lata valves Long-term prognosis following valve replacement //
Adv Cardiol (Kargel Basel) — 1972 — Vol 7, № 1 — P 138-148
Eichinger W, Gunzinger R, Botzenhardt F et al Mosaic bioprosthesis after 5 years // Herz —
2000 - Vol 25, № 7 — P 695-699
Elkins R C, Dawson P E, Goldstein S et al Decellulanzed human valve allografts // An Thorac
Surg — 2001 — Vol 71 (Suppl 5) - P 428-432
Engelmayr G C, Hildebrand D К, Sutherland F W H et al A novel bioreactor for the dynamic flexural
stimulation of tissue engineered heart valve biomatenals // Biomaterials — 2003 — Vol 24,
№ 21 — P 2523-2532
Ennker J, Rosendahl U, Ennker I C et al Risk in Elderly Patients After Stentless Versus Stented
Aortic Valve Surgery // Asian Cardiovasc Thorac An — 2003 — Vol 11, № 1 — p 37-41
Eriksson M J, Brodie L A , DeHgren GN et al Rest and exercise hemodynamics of an extended
stentless aortic bioprosthesis // J Heart Valve Dis. — 1997 — Vol 6, № 6 — Р 653-660
Fann J I, Miller D C., Moore KA et al Twenty-year clinical experience with porcine bioprostheses
//An Thorac. Surg — 1996 — Vol 62, № 5 — P 1301-1311
Ferrans V J Boyce S W, Billingham ME et al Calcific deposits in porcine bioprostheses structure
and pathogenesis // Am J Cardiol — 1980 — Vol 46, № 5 — P 721-734
Filip D A , Radu A , Simionescu M Interstitial cells of the heart valves possess characteristics similar
to smooth muscle cells // Circ Res — 1986 — Vol 59, № 2. — P 310-320.
Firstenberg M S , Morehead A J., Thomas J D et aL Short-term hemodynamic performance of the
mitral Carpentier-Edwards PERIMOUNT pericardial valve Carpentier-Edwards PERIMOUNT
Investigators //An Thorac. Surg — 2001. — Vol. 71 (Suppl 5) — P 285-288
Flameng W J, Ozaki S., Meuns В et al Antimineralization treatments in stentless porcine bioprostheses;
an experimental study // J Heart Valve Dis — 2001 — Vol 10, № 3. — P 489-494
Flanagan T C., Mulvihill A , Black A et al In vitro construction of viable, functional tissue derived from
mammalian heart valve using a natural extracellular matrix scaffold suppl / Proc. Royal Micros
Soc — 2002 — Vol 37, № 4 — P 9-10 (Abstract) http //www nuigalway ie/msi/docs/2002 pdf
Flanagan T C., Pandit A Living artificial heart valve alternatives // European Cells and Materials —
2003 — Vol. 6, № 1 — P 28-45
Flynn M, laccovom A , Path/ V et al The aortic Elan stentless aortic valve; excellent hemodynamics
and ease of implantation // Semin Thorac Cardiovasc. Surg — 2001 — Vol 13, № 4 (Suppl 1) —
P 48-54
Fradet G J, Bleese N , Burgess J et al Mosaic vavle international clinical trial early performance
results // An Thorac. Surg — 2001 — Vol 71 (Suppl 5) — P 273-277.
Fries R, Wendler O., Schieffer H et al. Comparative rest and exercise hemodynamics of 23-mm
stentless versus 23-mm stented aortic bioprostheses // An. Thorac. Surg. — 2000 — Vol 69,
Ng 3 — P 817-822
Fuchs J R, Nassen В A , Vacant! J P Tissue engineering a 21st century solution to surgical
reconstaiction // An Thorac Surg — 2001 — Vol 72, No 2 — P 577-591
Gallo I, Nistal E, Fernandez D et al Comparative study of calcification in the T6-treated and standard
Hancock-I porcine xenografts experimental study in weanling sheep // J Thorac Cardiovasc
Surg — 1986 — Vol 34, № 5 — P 310-315
Garhck R В , О Brien M F The CryoLife О Brien composite stentless porcine aortic xenograft valve
in 118 patients I I Jpn Circ. J — 1997 — Vol 61, № 3. — P 682-686
Gegouskov V A . Eckstein F S, Kipfer В et al The Sorin pericardial bioprosthesis — a stentless
aortic valve with very good hemodynamic performance // Swiss Surg — 2003 — Vol 9. № 5 —
P 247-252
Geha A Evaluation of Newer Heart Valve Prostheses 11 In Roberts A G , Conti C R Current Surgery
of the Heart — London Lippincott Comp , 1987 — P 79-87
Gendler E Gendler S , Nimm M E Toxic reactions evoked by glutaraldehyde-fixed pericardium
and cardiac valve tissue bioprosthesis // J Biomed Mater Res 1984 Vol 18, № 7
P 727-736
Girardot J M Prevention of prosthesis calcification — US Pat N° 4 976 733 1990
— 201 ------------
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
Girardot М N . Torriannl М , Giradot J. М. Effect of АОА on glutaraldehyde-fixed bioprosthetic heart
valve cusps and walls: Binding and calcification studies // Artif. Organs. — 1994 — Vol. 17,
№ 1 — P. 76-82.
Glower D D , Landolfo К P, Cheruvu S et al Determinants of 15-year outcome with 1119 standard
Carpentier-Edwards porcine valves // An Thorac. Surg. — 1998. — Vol. 66 (Suppl 6) —- P 44-52
Goldman В S, David T. E„ Wood J R et al. Clinical outcomes after aortic valve replacement with
the Toronto stentless porcine valve // An. Thorac. Surg. — 2001 — Vol 71, № 5. — P. 302-305
Goldsmith I R., Spyt T.J., Boehm M et al Midterm evaluation of the Tissuemed (Aspire) porcine
bioprosthesis: 493 patients, 506 bioprostheses // An Thorac. Surg. — 2001. — Vol. 71, № 5 -
P. 1471-1476
Golomb G., Dixon M, Smith M. S et al. Controlled-release drug delivery of diphosphonates to inhibit
bioprosthetic heart valve calcification, release rate modulation with silicone matrices via drug
solubility and membrane coating // J. Pharm Sci. — 1987. — Vol 76, № 2. — P. 271-278
Gonzalez-Juanatey J R , Garcia Bengochea J B., Vega M et al Echocardiographic fetures of the
normofunctional Labcor-Santiago pericardial bioprosthesis // J Heart Vavle Dis — 1994 -
Vol 3, № 5 — P. 548-555.
Gorman S P, Scott E M, Russell A. D. Antimicrobial activity, uses and mechanism of action of
glutaraldehyde // J. Appl Bactenol — 1980. — Vol. 48, №2 — P. 161-190.
Gott J P, Girardot M N., Girardot J M. et al Refinement of the alpha ammooleic acid bioprosthetic
valve anticalcification technique // An Thorac. Surg. — 1997. — Vol. 64, № 1. — P. 50-58
Gott J. P, Pan-Chih, Dorsey L. et al. Calcification of porcine valves* a successful new method of
antimmeralization // An Thorac. Surg — 1992. — Vol 53, № 2. — P. 207-216.
Gough J E, Scotchford C. A , Downes S Cytotoxicity of glutaraldehyde crosslinked collagen/polyvmyl
alcohol films is by the mechanism of apoptosis // J. Biomed Mater. Res — 2002 — Vol 61,
№ 1. — P. 121-130.
Grassl E D., Oegema T. R., Tranquillo R. T Fibrin as an alternative biopolymer to type-1 collagen for
the fabrication of a media equivalent // J Biomed Mater Res. — 2002 — Vol. 60, №3 -
P. 607-612.
Greve H H , Farah I, Everhen M. Comparison of three different types of stentless valves full root or
subcoronary // An Thorac. Surg — 2001. — Vol 71, № 5 (Suppl 1). — P. 293-296
Grimm M, Eybl E., Grabenwoger M. et al. Glutaraldehyde affects biocompatibility of bioprosthetic
heart valves // Surgery — 1992. — Vol 111, № 1. — P. 74-78
Grobe A C , Cheung D T, Luo H H et al A study of the junction between glutaraldehyde-treated
allogeneic aorta and host aorta // J Heart Valve Dis — 2000. — Vol. 9, № 4. — R 570-575.
Gross C, Harrmger W, Beran H Aortic valve replacement: Is the stentless xenograft an alternative
to the homograft? Midterm results // An. Thorac. Surg. — 1999. — Vol 68, № 3. — P 919-924
Gross J M Calcification of bioprosthetic heart valves and its assessment 11 J Thorac Cardiovasc
Surg — 2001 — Vol 121, № 3 — P. 428-430.
Gulbins H, Kreuzer E.t Uhlig A et al Mitral valve surgery utilizing homografts early results //
J Heart Valve Dis — 2000 — Vol. 9, № 1 — P 222-226
Gunaydm S, Shtnoka T New fronties in tissue engineering applications of tissue engineering in
cardiovascular surgery//Turk J Med Science — 2000 — Vol 30, № 1 — P 1-7
Hadjinikolaou L., Boehm M C., Ganner C et al Aspire porcine bioprosthesis: ten years' experience//
J Heart Valve Dis. — 2005 — Vol. 14, № 1. — P. 47-53
Hanayama N, Chnstakis G T, Nalhdis H. R. et al. Patient-prosthesis mismatch is rare after aortic
valve replacement valve size may be irrelevant // An. Thorac Surg — 2000 — Vol 73, № 4 —
P 1822-1829
Hancock W D, Sattler F P Arrangement for preparing natural tissue for implantation — US Pat
№ 4.050.893 — 1977
Hartz R S, Fisher E B., Finkelmeier B. et al An eight-year experience with porcine bioprosthetic
cardiac vavles // J Thorac. Cardiovasc. Surg — 1986. — Vol 91, №6 — P 910-917
Hasegawa J, Kitamura S., Kawachi К et al. Rest and exercise performance of allografts, Bicer valves
and St. Jude Medical valves in the aortic position // J Japan Assoc Thorac Surg — 1995 ~"
Vol 43, № 8. — P 1132-1137.
Heath C A Cells for tissue engineering // Trends Biotechnol — 2000. — Vol 18, № 1 — P 17-19
Hemrner W В , Botha C. A., Bohm JO et al Replacement of the aortic valve and ascending aorta
with an extended root stentless xenograft // An Thorac Surg — 2004 — Vol 78, № 6 "
P 2150-2152
Hilbert S L.. Barnck M К, Ferrans V J Porcine aortic valve bioprostheses a morphologic comparison
202 -----------------------------------------------------------------
ГЛАВА 3 Биологические заменители клапанов сердца
of the effects of fixation pressure // J Biomed Mater Res — 1990 — Vol 24, No 6 — P 773-787
Hirsch D, Drader J, Thomas T J et al Inhibition of calcification of glutarald 'hyde prelreated po»cm
aortic valve cusps with sodium dodecyl sulfate preincubation and controlled release studies //
J Biomed Mater Res — 1993 — Vol 27, № 5 - P 1477-1482
Hoerstrup S P, Kadner A., Melnitchouk S et al Tissue engineering of functional trileaflet heart valves
from human marrow stromal cells // Circulation — 2002 — Vol 106, № 12 (Suppi 1) —
P 1143-1150
Hoerstrup S P, Zund G , Cheng S et al A new approach to completely autologous cardiovasculai
tissue in humans // Am Soc Artif Intern Organs J — 2002 — Vol 48, № 2. - P 234-238
Hoerstrup S P, Zund G , Schoeberlein A et al Fluorescence activated cell sorting A reliable method
in tissue engineering of a bioprosthetic heart valve // An Thorac Surg — 1998 — Vol 66,
№ 11 — P 1653-1657
Hoerstrup S. P, Sodian R, Sperling J S et al New pulsatile bioreactor for in vitro formation of tissue
engineered heart valves // Tissue Eng — 2000 — Vol 6, № 1 — P 75-79
Hoerstrup S P, Zund G , Ye Q et al Tissue engineering of a bioprosthetic heart valve stimulation of
extracellular matrix assessed by hydroxyprohne assay I I J ASAIO — 1999 — Vol 45 №3 —
P 397-402
Hoerstrup S P, Zund G., Schnell A M et al Optimized growth conditions for tissue engineering of
human cardiovascular structures // Int J Artif Organs — 2000 — Vol 23 № 6 — P 817-823
Hofmann В , Cichon R , Knaut M et al Early experience with a quadrileaflet stentless mitral valve //
An. Thorac. Surg — 2001 — Vol 71 (Suppl 5). — P. 323-326
HuC. В , Myers К E, Nguyen-Thien-Nhon D et al Nonpolymeric epoxy compounds for cross linking
biological tissue and bioprosthetic grafts prepared thereby // US Pat № 5 880 242 — 1999
Hurle A , Ibanez A , Meseguer J et al A comparative study of the follow-up and hemodynamics in
vivo of 21 mm Carpentier-Edwards supra-annular and Perimount bioprostheses // Rev Esp
Cardiol — 2002. — Vol. 55, № 7 — P 733-737
Hutmacher D W Scaffold design and fabrication technologies for engineering tissues — state of the
art and future perspectives //J Biomater Sci Polym Ed — 2001 — Vo) 12, № 1. — P 107-124
Huysmans H. Medtronic Freestyle: multimedia educational software [CD-Rom] — Minneapolis
Medtronic, 1999
Imamura E, Noishiki Y, Koyanagi H. et al Bioprosthetic valve //US Patent № 5 080 670 — 1992
Imamura E, Sawatani О, Koyanagi H et al Epoxy compounds as a new cross-linking agent for
porcine aortic leaflets, subcutaneous implant studies in rats // J Card Surg — 1989 — Vol 4,
№ 1 — P 50-57.
lonescu M I., Ross D N, Deac R et al Heart valve replacement with autologous fascia lata //
J Thorac Cardiovasc Surg — 1970 —Vol 60, Ng 2 — P 331-333
lus P, Biffis C, Valfre C Acute dysfunction of Liotta mitral bioprosthesis 8 years after implantation //
Hal Heart J. Suppl. — 2002 - Vol. 3, № 7 — P 776-778
Jamieson W R., Burr L H., Munro Al et al Carpentier-Edwards standard porcine bioprosthesis’
a 21-year experience // An Thorac Surg — 1998 — Vol 66, Ng 6 — P 40-43
Jamieson W R, David T. E, Femdel CM et al Performance of the Carpentier-Edwards SAV and
Hancock-Il porcine bioprostheses in aortic valve replacement // J Heart Valve Dis — 200 ? —
Vol 11, № 3 — P 424-430
Jamieson И/ R., Fradet G J, MacNab J S et al Medtronic Mosaic porcine bioprosthesis
investigational center experience to six years // J Heart Valve Dis — 2005 — Vol 14, № 1
P 54-63.
Jamieson W R, Janusz M T BurrL H etal Carpentier-Edwardssupraannularporcmebioprosthesis’
second-generation prosthesis in aortic valve replacement//An Thorac Suig —2001 Vol 71
(Suppl 5). — P 224-227
Jamieson И/ R, Lemieux M D , Sullivan J. A. et al Medtronic Intact porcine bioprosthesis experience
to twelve years // An Thorac Surg — 2001 — Vol 1 (Suppl 5) — P 2 B-281
Jamieson И/ R. Munro A I, Miyagishtma R T etal Carpentier-Edwards SAV bioprosthesis clinical
report // USA Baxter Healthcare, 1990
Jasinski M J , Kadziola Z Keal R et al «Mosaic» Medtronic bioprosthetic valve replacement clinical
results and hemodynamical performance // J Cardiovasc Surg 2000. — Vol 41, №2 —
P 181-186.
Jm X Y Physiological perspectives of stentless aortic valve replacement //In The clinical benefits
203
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
stentless bioprostheses: from perception to reality — 16 Annual meeting of the EACTS — Monaco,
September 22-25, 2002. — P 3
Jin X Y., Westaby S Pericardial and porcine stentless aortic valves: are they hemodynamically
different? // An. Thorac. Surg. — 2001. — Vol 71 (Suppl. 5) — P 311-314
Jockenhoevel S., Chalabi K., Sachweh J. S. et al Tissue engineering. Complete autologous valve
conduit — a new moulding technique // Thorac Cardiovasc Surg — 2001 — Vol. 49, №2. -
P 287-290.
Jockenhoevel S., Zund G., Hoerstrup S P. et al. Cardiovascular tissue engineering A new laminar
flow chamber for in vitro improvement of mechanical tissue properties // Am Soc. Artif Intern.
Organs J. - 2002 — Vol. 48, № 1 — P. 8-11.
John A., Glauner C., Manoutchen MA et al Aortic valve replacement with the Medtronic Freestyle
stentless bioprosthesis // Asian Cardiovasc. Thorac. An. — 2004. — Vol 12, № 3 — P. 213-217
Kadner A., Hoerstrup S P., Tracy J Human umbilical cord cells: a new cell source for cardiovascular
tissue engineering // An. Thorac. Surg. — 2002. — Vol. 74, № 12 — P. 1422-1428
Kagawa Y., Tabayashi К, Suzuki Y et al. Intermediate term results of isolated mitral valve replacement
with glutaraldehyde-preserved porcine xenograft valve: clinical and hemodynamic comparison
between Hancock vavle and Angell-Shiley vavle // Tohoku J. Exp. Med. — 1986. — Vol 150,
№ 1 — P 37-50
Kalangos A.t Tngo-Trindade P, Vala D et al. Aortic valve replacement with the Freestyle stentless
bioprosthesis with respect to spacial orientation of patient coronary ostia // J. Thorac Cardiovasc
Surg — 2000. — Vol.119, №6. — P. 1185-1193
Kasimir M T, Rieder E, Seebacher G. et al. Comparison of different decellulanzation procedures of
porcine heart valves // Int. J Artif Organs. — 2003. — Vol 26, № 4. — P. 421-427
Kerwin A J, Lenkli S. C., Wilson D. R. Aortic valve homograft in the treatment of aortic insufficiency //
New Engl. J Med. — 1962. — Vol. 266, № 17. — P. 852-857
Khan S S , Chaux A , Blanche C et al. A 20-year experience with the Hancock porcine xenograft in
the elderly // An. Thorac. Surg — 1998. — Vol. 66, № 1. — P 35-39.
Kim IV G, Park J. K, Lee W Y. Tissue-engineered heart valve leaflets. An effective method of
obtaining acellulanzed valve xenografts // Int J. Artif. Organs — 2002. — Vol. 25, №6 -
P 791-797.
Kirsch M., Vermes E, Houel R et al The Freestyle stentless aortic bioprosthesis: more about the
subcoronary technique // Eur. J. Cardiothorac. Surg — 2001 — Vol 19, № 3 — P. 369-371
Kirsch M. E., Tzvetkov B.t Vermes E. et al. Clinical and hemodynamic performance of the 19-mm
Medtronic Mosaic bioprosthesis // J Heart Valve Dis. — 2005 — Vol 14, № 3. — P 433-439
Kon N. D., Cordell A R, Adair S M et al. Comparison of results using «Freestyle» stentless porcine
aortic root bioprosthesis with cryopreserved aortic allograft // Semin Thorac. Cardiovasc Surg —
1999. — Vol 11, № 4 (Suppl 1) — PP 69-73.
Kon N. D , Westaby S, Amanasena N et al Comparison of implantation techniques using Freestyle
stentless porcine aortic valve // An. Thorac Surg — 1995. — Vol 59, №5 — R 857-862
Konertz W, Dohmen P. M.t Liu J. et al Hemodynamic characteristics of the Matrix P decellulanzed
xenograft for pulmonary valve replacement during the Ross operation // J Heart Valve Dis. -*
2005 — Vol 14, № 1. — P 78-81
Konertz И/., Hamann P, Hachenberg T et al Aortic annular enlargement with the use of a homograft
valve // J Thorac. Cardiovasc Surg — 1992. — Vol. 40, № 1. — P 222-225
Konertz W, Weyand M , Sidiropoulos A et al Technique of aortic valve replacement with the Edwards
stentless aortic bioprosthesis 2500 // Eur J Cardiothorac Surg — 1992 — Vol 6, № 5 -
P 274-277
Krause A H Technique for complete subcoronary implantation of the Medtronic Freestyle porcine
bioprosthesis // An Thorac Surg — 1997. — Vol 64, № 5. — P 1495-1498
Kumar A S., Aggarwal S., Choudhary S. К Mitral valve replacement with the pulmonary autograft
the Ross II procedure // J Thorac Cardiovasc Surg — 2001 — Vol 122, №2 — P 378-382
Kumar PAthanasiou T, Mussa S. et al Ten year experience with Aspire (Tissuemed) porcine
bioprosthesis: single centre experience // Cardiovasc Surg. — 2003 — Vol 11, № 2. — P 131-137
Lane E Low-pressure fixation of valvular tissue intended for implantation // US Pat № 4 372 743 -
1983
Lee J M, Boughner D. R, Courtman D W The glutaraldehyde-stabilized porcine aortic valve
xenograft. II Effect of fixation with or without pressure on the tensile viscoelastic properties of the
leaflet material //J Biomed Mater Res — 1984 — Vol 18, № 1 ____________P. 79-98
----------- 204 --------------------------------------------------------------——
ГЛАВА 3 Биологические заменители клапанов сердца
Lee J М Courtman D И/, Boughner D R The glutaraldehyde-stabilized porcine aortic valve
xenograft I Tensile viscoelastic properties of the fresh leaflet material//J Biomed Mater Res —
1984 — Vol 18, № 1. — P. 61-77
Lee J M, Pereira C A , Kan L W. Effect of molecular structure of poliglycidyl-ether reagents on
crosslinking and mechanical properties of bovine pericardial xenograft materials // J Biomed
Mater Res — 1994 — Vol 28, № 9 — P 981-992
Lee К Y, Mooney D J Hydrogels for tissue engineering //Chem Rev — 2001 — Vol 101, № 13 —
R 1869-1879
Lefrak E A., Starr A Porcine aortic vavle xenograft // Cardiac valve prostheses New York: Appleton-
Centruy-Crofts — 1979 — P 308-310
Lemieux M D , Jamieson W R , Landymore R W et al Medtronic Intact porcine bioprosthesis clinical
performance to seven years // An Thorac Surg — 1995 — Vol 60 (Suppl 2) — P 258-262
Levy R J, Lerner E Calcification-resistant bioprosthetic tissue and methods of making same I I US
Pat №5 674 298 - 1997
Levy R J, Schoen F J, Levy J T. et al Biological determinants of dystrophic calcification and
osteocalcin deposition in glutaraldehyde-preserved porcine aortic valve leaflets implanted
subcutaneously in rats //Am J Pathol — 1983. — Vol 113, № 2 — P 143-155.
Levy R J, Wolfram J, Schoen F J et al M. Inhibition of calcification of bioprosthetic heart valves by
local controlled-release diphosphonate // Science. — 1985 — Vol 228, № 1 — P 190-192
Leyh R G , Wilhelmi M., Rebe P et al In vivo repopulation of xenogeneic and allogeneic acellular
valve matrix conduits in the pulmonary circulation // An Thorac Surg. — 2003 — Vol 75, № 12 —
P 1457-1463
Liao К, Frater R W, La Pietra A et al Time-dependent effect of glutaraldehyde on the tendency
to calcify of both autografts and xenografts // An Thoiac Surg — 1995 — Vol 60, № 2 —
P 343-347
Liotta D Design studies of cardiac valve prosthesis // Texas Heart Institute J — 1985 — Vol 12,
№ 1 — P 49-55
Liotta D, Bracco D, Ferrari H M et al Implantation subcomissural de la bioprosthesis aortica de
bajo perfil Utilizacion del seno no-coronano у de los trigones subcomissurales // Prensa Med
Argent — 1979 — Vol 66, № 1 — P 11-16
Lohre J M Bachng L , Sagartz J et al Evaluation of two epoxy ether compounds for biocompatible
potential // Artif Organs — 1992 — Vol 16, № 6 — P 630-633
Loisance D Y, Mazzucotelh J P, Bertrand P C etal Mitroflow Pericardial valve Long-term durabili-
ty //An Thorac Surg — 1993 — Vol 56, № 1 — P. 131-136
Lower R R, Stofer R C, Shumay N E et al Autotransplantation of the pulmonic valve into the aorta //
J Thorac Cardiovasc Surg 1960 —Vol 39, №5 —P 680-687
Malm J R Bowman F I. Harris P D et al An evaluation of aortic valve grafts sterilized by electron
beam energy // J Thorac. Cardiovasc Surg — 1967. — Vol 54. № 4 — P 471-477
Marchand M , Aupart M, Norton R et al Twelve-year experience with Carpentier-Edwards Penmount
pericardial valve in the mitral position a multicenter study // J. Heart Valve Dis. — 1998 —
Vol 7, №3. - P 292-298.
Martin T, Van Noort W, Black M Accelerated fatigue testing of biological tissue heart valves Ц Artif.
Organs — 1980 — Vol 4, № 3 — P 243-247
Maselh D. Pizio R, Bruno L et al Left ventricular mass reduction after aortic valve replacement
homografts, stentless and stented valves // An Thorac Surg — 1999 — Vol 67, № 4. —
P 966-971
MathurA N, Hourtovenko C D., Baigne R S etal Stentless Freestyle aortic valve/root bioprostheses
a northern Ontario community hospital perspective//Can J Cardiol 2000 —Vol 16, №6
P 747-756.
Mavnlas D , Missirhs Y An approach to the optimization of preparation of bioprosthetic heart valves //
J Biomech — 1991 — Vol. 24, №5 - P 331-339
Medtronic Intact bioprosthesis heart valve surgical, technical and handling considerations // Medtronic
Inc., 1993
Medtronic Physiologic fixation, advancing porcine valve fixation technology // USA Medtronic, 2000
Melina G., Horkaew P, Amrani M et al Three-dimensional in vivo characterization of calcification in
native valves and in Freestyle versus homograft aortic valves // J Thorac. Cardiovasc Surg
2005 — Vol 130, № 1 — P 41-47
205
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
Middlemost S J, Manga Р The Quattro valve in rheumatic mitral valve disease four-year follow up
J Heart Valve Dis — 2003 — Vol 12, N° 6 — P 758-763.
Milano A D, Bortolotti U, Mazzucco A et al Performance of the Hancock porcine bioprosthesis
following aortic vavle replacement, considerations based on a 15-year experience //An Thorac
Surg 1988 — Vol 46, № 2. - P 216-222
Mol A., Bouten С V C., Baaijens F. P T. et al Review Article- Tissue Engineering of Semilunar Heart
Valves Current Status and Future Developments // J of Heart Valve Disease — 2004 — Vol, 13
№ 2 - P 272-280
Moore M A Pericardial tissue stabilized by dye-mediated photooxidation: A review article //J Heart
Valve Dis - 1997 - Vol 6, №2 — P 521-526
Muller L C, Chevtchik О , Bonatti JO et al. Treatment of destructive aortic valve endocarditis with the
Freestyle Aortic Root Bioprosthesis // An Thorac. Surg — 2003 — Vol 75, № 2. — P 453-456.
Murayama H , Asano S , Oba M et al A case of early failure of the Freestyle stentless bioprosthesis
due to cuspal tear // An Thorac Cardiovasc Surg — 2004 — Vol. 10 № 6 — P 382-385
Murray G Homologous aortic-valve-segment transplants as surgical treatment for aortic and mitral
valve insufficiency // Angiology — 1956. — Vol. 7, №3. — P. 466-471.
Myers D J, Nakaya G, Girardot M N et al A comparison between glutaraldehyde and diepoxide-
fixed stentless porcine aortic valves biochemical and mechanical characterization and resistance
to mineralization // J Heart Valve Dis — 1995. — Vol 4 (Suppl 1) — P 98-101
Naef A P The mid-century revolution in thoracic and cardiovascular surgery part 4 // Interactive
Cardiovasc Thoratic Surg. — 2004 — Vol. 3, № 2. — P. 213-221.
Nagy Z L , Fisher J, Walker PG et al The influence of sizing on the hydrodynamic characteristics
and leaflet motion of the Toronto SPV stentless valve // J Thorac and Cardiovasc Surg — 1999 -
Vol 117, Ng 1 — P 92-98
Nardi C., Scioti G, Milano AD et al Hemodynamic assessment of the Medtronic Mosaic
bioprosthesis in the aortic position // J. Heart Valve Dis — 2001 — Vol 10, № 1, — P 100-104
Navia J A Aortic valve replacement with the Unique Suture Line Stentless USL porcine valve A new,
simple, and safe stentless valve implantation technique // J. Card Surg — 1998 — Vol 13,
№ 5 — P 386-391.
Navia J. A , Belzitti J, Meletti I et al Low profile Liotta bioprosthesis: Late follow — up // Texas Heart
Inst J — 1985. — Vol 12, №4 — P 301 -306
Navia J A , Liotto D S., Caivano F. О Stentless bioprosthetic cardiac valve Ij US patent —
N 5156621-1992
Nimni M, E., Cheung D , Strates В et al Chemically modified collagen a natural biomatenal for tissue
replacement//J Biomed Mater Res — 1987 — Vol 21, № 6 — P 741-771
Nina V J S, O'Brien M. F Prytese valvar ayrtica sem suporte о que aprendemos // Rev Bras Cir
Cardiovasc — 2001 — Vol 16, №2. — P 119-127
Nugent H M , Edelman E R Tissue Engineering Therapy for Cardiovascular Disease // Circ Fes
2003 — Vol 92, № 11. — P 1068-1078
О Bnen M. F, Clarebrough J К Heterograft aortic valve transplantation for human valve disease //
Med J. Aust — 1966 — Vol 2, № 1 — P 228-230
О Brien M. F Heterograft aortic valves for human use Valve bank, techniques of measurement and
implantation//Thome Cardiovasc Surg — 1967 — Vol 53, №3 -P 392-397
О Brien M F, Finney R S., Stafford EG et al Root replacement for all allograft aortic valves
Preferred technique or too radical? // An Thorac Surg — 1995 — Vol 60, № 1 — P 87-90
О Bnen M F, Stafford E G , Gardner MAH et al The Medtronic Intact Xenograft An analysis о
342 patients over a seven-year follow-up period // An Thorac Sura — 1995 — Vol 60, №2 -
P 253-258
O’Brien M F, Gardner MAH, Garlick R В et al The CryoLife-O’Bnen® stentless aortic porcine
xenograft valve // Cardiac Surg — 1998 — Vol 13, №3 — P 376-385
O’Brien M F Implantation technique of the CryoLife-O’Bnen® stentless xenograft aortic valve The
simple, rapid, and correct way to implant and the errors to avoid // Semin Thorac Cardiovasc
Surg — 1999 — Vol 11 (Suppl 1) — P 121-125
О Brien M F. An exceedingly low operative mortality given by stentless autologous, homologous, and
heterologous aortic valves for aortic valve replacement // Semin Thorac Cardiovasc Surg
1999 — Vol 11, № 4 (Suppl 1) — P 12-17
О Bnen M F, Goldstein S , Walsh S et al The Synergraft® valve: A new acellular (non-glutaraldehyde
fixed) tissue heart valve for autologous recellulanzation // Semin Thoracic Cardiovasc Surg
1999 - Vol 11 (Suppl 1) — p 194-200
J06
ГЛАВА 3 Биологические заменители клапанов се г >дц ч
O'Brien М F et al. The Stentless Xenograft Aortic Valve The Whel turns around // Heart, Lung and
Circulation — 2000 — Vol 9, № 1 — P 61-73.
Pandit A S., Wilson D J., Feldman D S. Fibrin scaffold as an effective vehicle for the delivery of acidic
fibroblast growth factor (FGF-1) // J Biomater Appl — 2000 — Vol 14, №2. - P 229-242
Papadaki M , McIntire L V, Eskin S G Effect of shear stress on the growth kinetics of human aortic
smooth muscle cells in vitro // Biotechnol Bioeng — 1996 — Vol 50, №4. — P. 555-564.
Pavie A J., Nzomvuama A N., Bonnet N et al. Aortic valve replacement with the composite Labcor
porcine bioprosthesis in the elderly // J Cardiovasc Surg — 2001 — Vol 42, № 3. — P 317-322
Perry T. E., Roth S J Cardiovascular tissue engineering Constructing living tissue cardiac valves
and blood vessels using bone marrow, umbilical cord blood, and peripheral blood cells //
J. Cardiovasc. Nurs — 2003 — Vol 18, № 1 — P 30-37
Pomar J. L , Jamieson W R., Pelletier L. C. et al. Mitroflow pericardial bioprosthesis experience in
aortic valve replacement > or = 60 years of age // An Thorac Surg — 1998 — Vol 66 (6 SuppL). —
R 53-56.
Putnam A. J., Mooney D J Tissue engineering using synthetic extracellular matrices // Nat Med —
1996 — Vol 2, № 5. — P 824-826
Rabitti G., Bassano C., Creazzo V et al Clinical performance of low-profile bioprostheses: results at
10 years // J Card. Surg — 1991 — Vol 6 (Suppl 4) — P 568-574
Rao V, Chnstakis G T, Sever J A novel comparison of stentless versus stented valves in the small
aortic root // J. Thorac Cardiovasc Surg — 1999 — Vol 117, № 3 — P. 431-436
Rastelli G C., Berghuis J, Swan H J C Evaluation of function of mitral valve after homotransplantation
in the dog //J Thorac Cardiovasc Surg. — 1965 — Vol 49, № 3 — P 459-474
Revanna P, Fisher J, Watterson К G The influence of free hand technique and pressure fixation on
the hydrodynamic function of aortic root and aortic valve leaflets // Eur J Cardiothorac. Surg —
1997 — Vol 11, № 2. — P 280-286
Roe S C, Milthorpe В К., True К et al The effect of gamma irradiation on a xenograft tendon
bioprosthesis // Clin Mater — 1992. — Vol 9, № 3-4 — P 149-154
Ross D. N. Homograft replacement of the aortic vavle // Lancet — 1962 — Vol 2, № 8. — R 487-490
Ross D N Replacement of aortic and mitral valves with a pulmonary autograft // Lancet — 1967 —
Vol 2, № 12. — P 956-958
Rothenburger M, Volker W., Vischer P et al Tissue engineering of heart valves Formation of a
threedimensional tissue using porcine heart valve cells // Am Soc. Artif Intern Organs J —
2002. — Vol. 48, № 4 — P 586-591.
Sakaguchi T, Sawa Y, Ohtake S. et al The Freestyle Stentless Bioprosthesis for Prosthetic Valve
Endocarditis // An Thorac. Surg — 1999 — Vol 67, №2. — P 533-535
Santini F, Musazzi A., Bertohm P et al Stentless porcine bioprostheses in the treatment of aortic
valve infective endocarditis // J Card Surg — 1995. — Vol 10, №2 — P 205-209
Santini F, Luciam G. B., Restivo S et al Over twenty-year follow-up of the standard Hancock porcine
bioprosthesis implanted in the mitral position // An Thorac Surg — 2001 — Vol 71 (Suppl. 5). --
P 232-235
Sarraf С. E, Harns A В , McCulloch AD et al Heart valve and arterial tissue engineering 11 Cell
Prolif — 2003 — Vol 36, № 2 — P 241-254
Schnell A M, Hoerstrup S P. Zund G et al Optimal cell source for cardiovascular tissue engineering
venous vs aortic human myofibroblasts // Thorac. Cardiovasc Surg — 2001 — Vol. 49, № 2 —
P 221-225.
Schoen F. J, Fernandez J., Gonzales-Lav/n L et al Causes of failure and pathologic findings in
surgically removed lonescu-Shiley standard bovine pericardial heart valve bioprostheses. emphasis
on progressive structural deterioration // Circulation — 1987 — Vol 76, №3 — P 618-627
Schoen F J, Levy R J Heart valve bioprostheses antimmerahzation // Eur. J. Cardiothorac Surg. —
1992 — Vol 6, № 1 (Suppl) — P 91-94
Schoen F. J, Levy R J Tissue heart valves. Current challenges and future research perspectives //
J Biomed Mater Res — 1999 — Vol 47, №4 — P 439-465
Schoen F J. Pathology of heart valve substitution with mechanical and tissue prostheses I I In: Silver
MD, Gotlieb Al, Schoen FJ, editors. Cardiovascular pathology Philadelphia (PA)- Churchill
Livingstone — 2001 — P 629-677
Sennmg A Fascia lata replacement of aortic valves // J Thorac Cardiovasc Surg — 1967 —
Vol 54, № 4 — P 465-470
Sennmg A , Tsakins A. Erste Ergebnisse emer euen operativen korrektur der aortenklappenfehler //
Cardiologia. — 1964 — Vol 44, № 2. — P 259-266.
207
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
Shen М.. Kara-Mosteta А , Chen L Effect of ethanol and ether in the prevention of calcification of
biopiostheses /, An Thoiac Surg — 2001 — Vol 71, № 5 (Suppl) — P 413-416
Shen S H, Sung H W, Tu R et al Characterization of a polyepoxy compound fixed porcine heart
valve bioprosthesis // J Appl Biomater — 1994 — Vol 5, № 2. — P. 159-162
ShmokaT Breuer С K, Tanel R E etal Tissue engineering of heart valves Valve leaflet replacement
study in a lamb model // An Thorac Surg — 1995 — Vol 60, №4 — P 513-516
Siebermann R P Implantation of the Toronto SPV stentless porcine bioprosthesis in dilated ascending
aorta//An Thorac Surg — 1997 — Vol 64, № 4 — P 1197-1200
Sievers H H, Stierle U Schmidtke C et al Decellulanzed pulmonary homograft (SynerGraft) for
reconstruction of the right ventricular outflow tract first clinical experience // Z Kardiol — 2003 —
Vol 92, № 1 — P 53-59
Silberman S, Shaheen J, Menn О et al Exercise hemodynamics of aortic prostheses comparison
between stentless bioprostheses and mechanical valves // An Thorac Surg — 2001 — Vol 72
№ 4 — P 1217-1221
Simon P Kasimir M T, Seebacher G et al Early failure of the tissue engineered porcine heart valve
SynerGraft in pediatric patients // Eur J Cardiothorac. Surg — 2003 — Vol 23, № 12 —
P 1002-1006
Smiawski H , Lehmkuhl H , Weng Y Stentless aortic valves as an alternative to homografts for valve
replacement in active infective endocarditis complicated by ring abscess // An Thorac Surg —
2003 — Vol 75, № 3 — P 803-808
SJM Products St Jude Medical Website (wwwsjm com) — 2002
Sodian R, Hoerstrup S P, Sperling J S et al Tissue engineering of heart valves: in vitro experien-
ces // An Thorac. Surg — 2000. — Vol 70, № 1 — P 140-144
Song T, Vesely I, Boughner D Effects of dynamic fixation on shear behaviour of porcine xenograft
valves // Biomaterials — 1990 — Vol 11, № 3 — P 191-196.
Stemhoff G, Stock U, Karim N et al Tissue engineering of pulmonary heart valves on allogenic
acellular matrix conduits Circulation — 2000 — Vol 102, № 19 (Suppl 3) — P 50-55
Stock U A , Vacanti J P Tissue engineering Current state and prospects 11 Annu Rev Med —
2001 — Vol 52, №3 — P 443-451
Sulzer Mitroflow website (wwwmitroflow.com) 6-14-2002
Sung H И/, Hsu C S , Wang S P et al Degradation potential of biological tissues fixed with various
fixatives an in vitro study Ц J Biomed Mater Res — 1997 — Vol 35, № 2 — P 147-155
Sung H W, Hsu H L., Shih С C et al Cross-linking characteristics of biological tissues fixed with
monofunctional or multifunctional epoxy compounds // Biomaterials — 1996 — Vol 17, № 14 -
P 1405-1410
Sung H W, Le T N , Kingsbyry Ch J et al In vitro pulsatile flow evalution of a stentless porcine
aortic bioprosthesis 11 ASAIO Transactions — 1995 — Vol 41, № 1 — P 89-94
Sung H W, Tu R, Shen S H et al A newly developed porcine heart valve bioprosthesis fixed with
an epoxy compound An experimental evaluation // ASAIO J — 1994 — Vol 40, № 2 - P 192-
198
Szafranek A , Akar R , Jasinski M et al Early experience with Shelhigh stentless composite valve A
complete biological replacement of ascending aorta // Kardiol Pol 2003 — Vol 58, № 1 -
P 34-38
Tabata Y The importance of drug delivery systems in tissue engineering // Pharm Sci Technol
Today — 2000 — Vol. 3, №1 — P 80-89
Talman E A , Boughner D R Effect of altered hydration on the internal shear properties of porcine
aortic valve cusp//An Thorac Surg — 2001 — Vol 71, No 5 (Suppl) — P 375-378
Tang Z, Yue Y Crosslinkage of collagen by polyglycidyl ethers // J ASAIO — 1995 — Vol 41
№ 1 — P 72-78.
Taylor P M , Allen S P, Dreger SA et al Human cardiac valve interstitial cells in collagen sponge
A biological three-dimensional matrix for tissue engineering // J Heart Valve Dis — 2002 —
Vol 11, № 2 — P 298-307
Taylor P M, Allen S P, Yacoub M H Phenotypic and functional characterization of interstitial cells
from human heart valves pericardium and skin // J Heart Valve Dis — 2000 — Vol 9, Ne 1 "
P 150-158
Terada H t Kazui T, Yamashita К et al Surgical experience of full root replacement with Freestyle
bioprosthesis indications, surgical technique, and results // Suiq Today — 2004 — Vol 34
№ 1 — P 16-20
208 -----------------------------------------------------------------
ГЛАВА 3 Биологические заменители клапанов сердца
Thandroyen F Т, Whitton / N , Pine D. et al evere calcification of glutaraldehyde-preserved porcin
xenografts in children // Am. J Cardiol — 1980 — Vol 45, № 3 — P 690-696
Thomson D J , Jamieson W R, Dumesnil J G et al Medtronic Mosaic porcine bioprosthesis midterm
investigational trial results//An Thorac Suig — 2001 — Vol 71 №2 — P 269-271
Thomson H L,O Bnen M F., Almeida A A et al Haemodynamics and left ventricular mass regression
a comparison of the stentless, stented and mechanical aortic valve replacement // Eur Cardio-
Thoracic. Surg — 1998. — Vol 13, Ng 5 — P 572-575
Thubrikar M J, Deck J D, Aouad J et al Role of mechanical stress in calcification of aortic
bioprosthetic valve//J Thorac Cardiovasc Surg — 1983 — Vol 86, № 1 — P 115-125
Thuhn L I, Thilen U J, Kymle К A Mitroflow pericardial bioprosthesis in the aortic position Low
incidence of structural valve deterioration in elderly patients during an 11-year follow-up // Scand
Cardiovasc J — 2000 — Vol 34, №2 — P 192-196
Urbanski P. P, Hacker R W Replacement of the aortic valve and ascending aorta with a valved
stentless composite graft technical considerations and early clinical results // An Thorac Surg —
2000 — Vol 70, № 1 — P 17-20
Vacanti J P, Langer R Tissue engineering the design and fabrication of living replacement devices
for surgical reconstruction and transplantation // Lancet — 1999 — Vol 354 (Suppl I) —
P 32-34
Valente M, Minanni M., Maizza A F et al Heart valve bioprosthesis durability a challenge to the
new generation of porcine valves // Eur J Cardiothorac Surg — 1992 — Vol 6 (Suppl 1) —
P 82-90
Verghese S., Padmaja P, Sindhu В et al Homograft valve bank our experience in valve banking //
Indian Heart J — 2004 — Vol 56, № 3. - P 299-306
Vesely / Reconstruction of loads in the fibrosa and ventnculans of porcine aortic valves //
ASAIO J — 1996 — Vol 42, № 5 — P 739-746
Vesely I The evolution of bioprosthetic heart valve design and its impact on durability // Cardiovasc.
Pathol — 2003 — Vol 12, №2 — P 277-286.
Vesely I., Gonsalez-Lavin L., Graf D et al Mechanical testing of cryopreserved aortic allografts
comparison with xenografts and fresh tissue // J. Thorac Cardiovasc Surg — 1990 — Vol. 99,
Ng 1. — P 119-123
Vesely I, Noseworthy R Micromechanics of the fibrosa and the ventnculans in aortic valve leaflets //
J Biomech — 1992 — Vol 25, № 1. — P 101-113
Vmcentelh A , Zegdi R., Prat A. et aL Mechanical modifications to human pericardium after a brief
immersion in 0,625% glutaraldehyde // J Heart Valve Dis — 1998 — Vol ,№ 1. — P 24-29
Vitale N, Clark S C, Ramsden A et al Clinical and hemodynamic evaluation of small Perimount
aortic valves in patients aged 75 years or older // An Thorac. Surg — 2003 — Vol 75, № 1 —
P 35-39
Von Oppell U О , Stemmet F, Levetan В et al Biocor No-React stentless aortic valve — short-term
results // Cardiovasc. J S Afr — 2001 — Vol. 12, № 3 — P 152-158
Vrandecic M., Fantmi F.A., Filho В G. et al Retrospective clinical analysis of stented vs stentless
porcine aortic bioprostheses // Eur J Cardiothorac Surg — 2000 — Vol 18, № 1 P 46-53
Vrandecic M , Fantmi F A., Gontijo B. F. et al Surgical Technique of Implanting the Stentless Porcine
Mitral Valve // An Thorac Surg — 1995 — Vol 60, № 2 — P 439-442
Walley V M, Bedard P, Brais M et al Valve failure caused by cusp tears in low-profile lonescu-
Shiley bovine pericardial bioprosthetic valves//J hora rdiova urg 1987 Vol 93,
№ 4 — p 583-586
Walley V M Keon C A., Khalih M etal lonescu-Shiley valve failure I Experience with 125 standard
profile explants//An Thorac Surg — 1992 — Vol 54, №1. —P 111-116.
Walther T, Falk V, Autschbach R et al Comparison of different anticalcification treatments for
stentless bioprostheses // An Thorac Surg -1998 Vol 66, № 6 (Suppl) P 249-254
Walther T Lehmann S , Falk V et al Midterm results after stentless mitral valve replacement //
Circulation — 2003 — Vol 108 (Suppl II) — P 85-89
Webb C L Schoen F J , Levy R J Covalent binding of ammopropanehydroxydiphosphonate to
glutaraldehyde residues in pericardial bioprosthetic tissue stability and calcification nhibi i
studies // Exp Mol Pathol — 1989 — Vol 50, № 3 — P 291-302.
Westaby S, Bianco R W Katsumata T The Carbomedics «Oxford» Photofix stentless valve (PSV)
Semin Thorac Cardiovasc Surg — 1999 — Vol 11. №4 (Suppl 1) — P 206-209
209
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
Westaby S., Horton М., Jin X. et al. Survival advantage of stentless aortic bioprostheses //An. Thorac.
Surg. — 2000. - Vol. 70, № 3. — P. 785-791.
Westaby S., Jin X. Y., Guiseeppe V. et al. The Sorin stentless pericardial valve: Implant technique and
hemodynamic profile // Semin. Thorac. Cardiovasc. Surg. — 1999. — Vol. 1, № 1. — P. 62-68.
Weston M. W., Yoganathan A. P. Biosynthetic activity in heart valve leaflets in response to in vitro flow
environments // An. Biomed. Eng. — 2001. — Vol. 29, № 5. — P. 752-763.
Wheatley D. J., Crawford F.A., Kay P. H. et al. A ten-year study of the lonescu-Shiley low-profile
bioprosthetic heart vavle // Eur. J. Cardiothorac. Surg. — 1994. — Vol. 8, № 10. — P. 541-548.
Williams R. J., McLean A. D., Pathi V. L. et al. Six-year follow-up of the Toronto stentless porcine
valve // Semin. Thorac. Cardiovasc. Surg. — 2001. — Vol. 13, №4 (Suppl. 1). — P. 168-172.
Wong S. P, Legget M. E., Greaves S. C. et al. Early experience with the Mosaic bioprosthesis: a new
generation porcine vavle // An. Thorac. Surg. — 2000. — Vol. 69, № 6. — P. 1846-1850.
Woodroof E. A. Use of glutaraldehyde and formaldehyde to process tissue heart valves // J. Bioeng. —
1978. — Vol. 2, № 1-2. — P. 1-9.
Yacoub M., Rasmi N. R. H., Sundt T. M. et al. Fourteen-year experience with homovital homografts
for aortic valve replacement // J. Thorac. Cardiovasc. Surg. — 1995. — Vol. 110, № 2. — P 186-
194.
Yamak B.t Ozsoyler, Ulus A. T. et al. Comparison of reoperation findings of the Carpentier-Edwards
(standard) bioprosthesis and the St Jude bioimplant (formerly Liotta) in the mitral position //
Cardiovasc. Surg. — 1999. — Vol. 7, № 6. — P. 730-734.
Yfe Q., Zund G., Benedikt P. et al. Fibrin gel as a three dimensional matrix in cardiovascular tissue
engineering // Eur. J. Cardiothorac. Surg. — 2000. Vol. 17, №4. — P. 587-591.
Ye Q., Zund G, Jockenhoevel S. et al. Tissue engineering in cardiovascular surgery: New approach
to develop completely human autologous tissue // Eur. J. Cardiothorac. Surg. — 2000. — Vol. 17,
№ 3 — P. 449-454.
Yoganathan A. P., Eberhart С. E.t Walker P. G. Hydrodynamic performance of the Medtronic Freestyle
TM aortic root bioprosthesis // J. Heart Valve Dis. — 1994. — Vol. 3, № 5. — P 571-580
Yun K. L, Miller D. C., Moore K. A. et al. Durability of the Hancock MO bioprosthesis compared with
standard aortic valve bioprostheses // An. Thorac. Surg. — 1995. — Vol. 60, № 2. — P. 221-227.
210
ГЛАВА 4
ГИДРОДИНАМИКА ИСКУССТВЕННЫХ
КЛАПАНОВ СЕРДЦА
Структура кровотока в искусственном клапане сердца формируется под воздействи-
ем сложного движения стенок сердца и сосудов — как непосредственно контактирую-
щих с искусственным клапаном сердца, так и опосредованно — через формирование
потока на входе в клапан. Кроме того, важными факторами влияния на движение кро-
ви являются конструкция искусственного клапана сердца и способ его имплантации.
Сформированный в ходе оперативного вмешательства кровоток во многом обус-
ловливает успех операции, сроки выздоровления и качество жизни: во-первых, струк-
тура течения определяет общие энергетические затраты организма по обеспечению
как пульсирующего движения крови, так и процессов кроветворения; во-вторых, воз-
действует как на органы сердечно-сосудистой системы непосредственно (миокард,
стенки сосудов), так и опосредованно — через изменение состава крови (тромбообра-
зование, гемолиз).
Все перечисленные обстоятельства подчеркивают важность предварительной оценки
характера сформированного в результате операции течения в искусственном клапане
сердца. Затраты времени и средств на лабораторную диагностику работы клапанов в
модели сердца оправдываются сохранением жизни пациентов, снижением риска пос-
леоперационных осложнений и улучшением качества жизни.
Методические и экспериментальные основы лабораторных исследований искусст-
венных клапанов сердца закладывались в начале 60-х гг. XX столетия. Это был период
поисков. Появились первые протезы клапанов сердца, были проведены первые имп-
лантации. Первые успешные операции, в целом, вселяли уверенность. Однако много-
численные осложнения и летальные исходы заставляли изобретать новые конструкции
клапанов, искать ответы на новые вопросы, ряд из которых касался структуры течения
крови. Специалисты-гидродинамики пришли на помощь хирургам в их поисках иде-
ального протеза. Основы многих современных подходов к гидродинамическим иссле-
дованиям искусственных клапанов сердца были заложены именно в тот период.
Сегодня методы и средства гидродинамических исследований течения крови в сер-
дечно-сосудистой системе, а также в имплантируемых протезах и устройствах вспо-
могательного кровообращения стали необходимым и широко распространенным ин-
струментом — как для конструкторов искусственных клапанов сердца, так и для прак-
тикующих хирургов. Первые используют данный инструмент для создания оптимального
медико-технического устройства, вторые — для отработки оптимальной техники хи-
рургической коррекции порока. Те и другие преследуют общую цель — улучшить каче-
ство жизни пациента.
ГИДРОДИНАМИКА КЛАПАНОВ СЕРДЦА ЧЕЛОВЕКА
Трикуспидальный и пульмональный клапаны правого сердца регулируют кровоток от
тканей к легким для обогащения кислородом, митральный и аортальный клапаны левого
сердца контролируют кровоток артериальной крови к органам и тканям. Аортальный и
пульмональный являются выходными клапанами левого и правого желудочков, соответ-
ственно. Митральный и трикуспидальный являются выходными клапанами левого и пра-
------------------------------------------------ 211 --------
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
вого поедсердий и одновременно входными клапанами левого и правого желудочков,
соответственно Аортальный и пульмональный клапаны открыты в фазу сокращения же-
лудочков (систола) и закрыты в фазу расслабления желудочков (диастола). В фазы изо-
волюмического сокращения и расслабления все четыре клапана закрыты. Закрытые пуль-
мональный и трикуспидальный клапаны выдерживают давление 30 мм рт. ст., аорталь-
ный - около 100 мм рт. ст., митральный - до 150 мм рт. ст. (рис. 4.1). Повышенные
нагрузки на клапаны левого сердца определяют их большую подверженность заболева-
ниям. Гемодинамика может играть важную роль в развитии клапанной патологии.
Рис. 4. f. (р.). левом желудочке (р„), левом предсердии (р„), легочной артерии
(Р - о ) и митпальнпм ?ЬМ°На»ЛЬНЫЙ клапаны! перепад давления на аортальном
н ’йеиГ’е^аЦ тГ <₽" ' ₽’’ ’“"""и8’' ("° КаР° " W ’ 19В1 = Б‘ фолковУ - 1976=
212
ГЛАВА 4 Гидродинамика искусственных клапанов сердца
Аортальный клапан открывается в начале систолического сокращения левого же-
лудочка и закрывается перед диастолическим расслаблением желудочка. Систола нами
нается в момент открытия аортального клапана (20-30 мс) и продолжается около 1/, вре-
мени сердечного цикла (Bellhouse В. J., 1969). Кровоток через клапан быстро усилива-
ется и достигает максимальной скорости в первой трети систолы после полного
открытия створок. Торможение кровотока через клапан происходит медленнее Обрат-
ный градиент давления тормозит низкоскоростное пристенное течение с образовани-
ем обратного течения в синусах (Каро К. и др., 1981; Reul Н. et al., 1979). В течение
систолы прямой перепад давления, под действием которого кровь движется через аор-
тальный клапан, не превышает нескольких мм рт. ст., обратный же перепад давления
на клапане в норме достигает 80 мм рт. ст. (Yoganathan А. Р. et al., 1995). Клапан за-
крывается в конце фазы торможения потока с формированием незначительного об-
ратного потока. Все клапаны в сердце закрыты в фазы изоволюмического сокращения
и расслабления. Аортальный клапан изменяет свои размеры и форму в течение цикла
сокращения сердца, в основном, по направлению оси аорты. Периметр фиброзного
кольца достигает минимума в конце систолы и максимума — в конце диастолы. Ис-
следования на собаках показали 20% изменение периметра при аортальном давлении
120/80 мм рт. ст. (Thubrikar М. et al., 1993). В течение систолы в синусах наблюдается
образование вихревого движения жидкости (рис. 4.2, 4.3). Вихри способствуют быст-
рому и эффективному закрытию створок. Объем обратного перетока составляет 5% от
прямого (Bellhouse B.J. et al., 1969). В здоровом организме под действием прямого
перепада давления скорость кровотока быстро нарастает до значений 1,4±0,4 м/с
(Rossvoll О. et al., 1991). У детей наблюдаются еще более высокие скорости — 1,5±0,3 м/с
(Hatle L. et aL, 1985). В конце систолы имеет место короткий период обратного крово-
тока, который фиксируется ультразвуковым допплеровским методом. Источником об-
ратного расхода может служить как собственно обратное течение крови через проход-
ное отверстие клапана в фазу закрытия створок, так и движение уже закрытых створок
в сторону левого желудочка.
Профиль скорости в плоскости фиброзного кольца равномерный, но с небольшим
скосом в сторону септальной стенки (Rossvoll О. et al., 1991, Kilner Р. J. et al., 1993).
Кроме того, систолический поток крови через аортальный клапан сохраняет спирале-
Рис. 4.2. Схемы Леонардо да Винчи, изображающие кровоток в аортальном клапане
(по М. Gharib et al., 2002)
________________________________________________213 ------
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
Рис. 4.3. Векторные поля скорости кровотока в аортальном и митральном клапане человека,
измеренные методом магнитного резонанса (по Р. J. Kilner et al. 1993; 2000)
видный характер, сформированный в левом желудочке (рис. 4.4). Закрутка кровотока
в аорте (0-10°) устраняет образование застойных зон, повышает давление вблизи сте-
нок, способствуя более эффективному отбору крови в отходящие сосуды, предупреж-
дает травму форменных элементов крови за счет безотрывного течения (Роева Л. А.,
1980; 1990) Суждения о направлении вращения кровотока в восходящем отделе аор-
ты неоднозначны (Marinelli R. A. et al., 1991). Одни авторы указывали на вращение сис-
толического потока крови через аортальный клапан против часовой стрелки, если смот-
реть по потоку (Захаров В Н. и др., 1989; Орловский П. И. и др., 1998; 2002), другие —
на противоположное направление (Бокерия Л. А. и др., 2003; Городков А. Ю. и др., 2003;
Kilner Р. J. et al., 1993), третьи — вообще не упоминают о спиралевидном характере
систолического выброса крови (Haugen В. О. et aL, 2000; Kozerke S., et aL, 2001;
Yoganathan A. P et al , 2004), четвертые — склоняются к гипотезе зарождения закру-
ченного потока в дуге аорты (Frazm L. J. et aL, 1990). Неустойчивый, а в ряде случаев
разнонаправленный характер вращения потока крови в восходящем отделе аорты и ее
дуге связан, по-видимому, с индивидуальными морфофункциональными особенностя-
ми выходного отдела левого желудочка, аортального клапана, синусов Вальсальвы,
стенки аорты.
Кровоток через пульмональный клапан близок к аортальному, но существенно
меньше его по величине. В здоровом взрослом организме скорости достигают 0,8±
±0,2 м/с, в детском — 0,9±0,2 м/с (Weyman А. Е., 1994) За пульмональным клапаном
также наблюдается закрутка потока, которая направлена в фазу ускорения кровотока
против часовой стрелки (Sloth Е et al., 1994).
При нормальном функционировании митрального клапана участвуют все его эле-
менты — створки, хорды, папиллярные мышцы. При течении крови через митральный
клапан во время диастолы выделяют две фазы. Первый пик скорости (Е-волна) фор-
мируется за счет расслабления левого желудочка, второй (А-волна) — за счет сокра-
щения предсердия (см. рис. 4.1). В фазу изоволюмического расслабления давление в
предсердии становится выше желудочкового, створки приоткрываются и начинается
движение крови из предсердия в желудочек Профиль скорости в проходном отвер-
стии и у кромок створок скошен (Kim W. et al , 1994). Начальное наполнение происхо-
дит в фазу активного расслабления желудочка, при этом пиковые скорости Е-волны в
---------214 ------------—
ГЛАВА 4. Гидродинамика искусственных кл^п /нон с< /<
здоровом организме составляют 0,7±0,2 м/с (Samstad S. О et al, 1989; Oh J К. et al.,
1997). За релаксацией желудочка следует торможение потока крови, и митральный
клапан частично призакрывается. При сокращении предсердия скорость в А-волне
обычно меньше по сравнению с Е-волной. Первоначальные исследования были направ-
лены на объяснение механизма закрытия митрального клапана. В. J Bellhouse (1972)
первым предположил, что вихри, образовавшиеся за створками во время наполнения
желудочка, способствуют частичному закрытию створок. Экспериментальные исследо-
вания подтвердили, что без образования крупных вихрей за створками митральный
клапан оставался бы в открытом состоянии до начала сокращения желудочка, а его
закрытие сопровождалось значительной регургитацией. J. Reul и соавт. (1981) обнару-
жили, что обратный перепад давления в середине диастолы желудочка обеспечивает
не только торможение жидкости, но и начальное прикрытие створок Таким образом,
участие вихрей в механизме закрытия створок относится к началу диастолы. Е. L.Yellm
и соавт. (1981) уточнили, что на механизм закрытия совокупно влияют натяжение хорд,
торможение потока и вихри в желудочке.
Диастолический поток крови, исходящий из левого предсердия через митральный
клапан в левый желудочек, закручен по часовой стрелке при взгляде по потоку (Бура-
ковский В. И. и др. 1976) — см. рис. 4.4. Современные исследования пространствен-
ного скоростного поля в левом желудочке методом магнитного резонанса обнаружи-
Рис. 4.4. Схемы систолического и диастолического движения крови в предсердии, левом
желудочке и аорте
ИСКУССТВЕННЫЕ КЛАПАН Ы СЕР Д ЦА
вают вихревое движение крови (см. рис. 4.3) как в фазу прикрытия створок, так и в
Фазу сокращения предсердия (Kim W.Y et al., 1995). Закр^ка потока обеспечивается
тангенциальной подачей крови из легочных вен в полость левого предсердия, а также
направлением кровотока передней створкой митрального клапана на спиралеобраз-
ные трабекулы внутренней стенки левого желудочка Уместно задаться вопросом: ка-
кой смысл заложен природой в этом феномене — закрутке крови в левом желудочке
сердца и аорте? (Углов Ф. Г. и др., 1984; Орловский П. И и др., 1998; Arts A. et al ,
1989) В закрученном потоке давление у стенок левого желудочка превышает давле-
ние на его оси, что способствует растяжению его стенок в период повышения внутри-
желудочкового давления, включению в процесс механизма Франка-Старлинга и более
эффективной систоле (Каро К. и др., 1981; Фолков Б. и др., 1976, Gorodkov A. et al.,
1996) Закрученный поток интенсифицирует смешивание объемов крови насыщен-
ных кислородом с обедненными Повышение давления вблизи стенок левого желу-
дочка, максимальное значение которого приходится на конечную стадию диастолы,
создает дополнительные усилия на створки митрального клапана и способствует бы-
стрейшему их закрытию (Рашмер Р.Ф , 1981). После закрытия митрального клапана
кровь продолжает вращательное движение (Бураковский В И и др. 1976; Marinelli
R. A. et al., 1991) Левый желудочек в систолу лишь меняет направление поступатель-
ного движения крови, не изменяя при этом направление вращательного движения, сле-
довательно, знак закрутки меняется на противоположный, если по-прежнему смотреть
по потоку.
Профиль скорости в трикуспидальном клапане похож на митральный, но скорос-
ти здесь меньше, так как площадь проходного отверстия такого клапана больше Кла-
пан открывается раньше митрального, а закрывается позже.
ФИЗИЧЕСКОЕ МОДЕЛИРОВАНИЕ КРОВОТОКА
В КЛАПАНАХ СЕРДЦА
Лабораторные исследования с целью улучшения существующих конструкций и со-
здания новых моделей проводят на экспериментальных установках (фантомах крово-
тока), моделирующих условия работы искусственных клапанов сердца в организме.
Первоначально искусственные клапаны сердца размещались в плоских или осесим-
метричных каналах, моделирующих геометрию корня аорты либо входного отдела лево-
го желудочка (рис 4 5) Каналы входили в состав гидро- и аэродинамических установок
как разомкнутого, так и замкнутого типа (Knoch М. et al., 1988). Циркуляция рабочей
среды обеспечивалась, соответственно, насосом или вентилятором. Моделирование
осуществлялось по числу Рейнольдса Для оценки характеристик искусственных кла-
панов сердца в пульсирующем потоке применялось квазистационарное приближение, —
нестационарный процесс открытия клапана моделировался набором стационарных те-
чении, отличающихся величиной скорости и положением запирающего элемента. Про-
водилось сравнение клапанов по гидродинамическому сопротивлению, измерялись
распределения давлений по запирающему элементу для расчета сдвиговых напряже-
нии на поверхности, оценивалась структура течения качественно — методами визуа-
лизации, количественно — зондовыми измерителями скорости.
Универсальную конструкцию имела установка V. J. Modi и соавт. (1983), — она объ-
“ ДЛЯ исследования искусственных клапанов сердца в натуральную ве-
как станипм^п ли^енном масштабе. Кроме того, в обоих каналах можно было задавать
как стационарное, так и пульсирующее течения (рис 4.6).
ке были пазпа6пт^НИЯ Раб°ты искусственных клапанов сердца в пульсирующем пото-
никами специальные стенды, называемые пульсдупликаторами. Источ-
ирующего потока служили либо поршневой привод (рис. 4.7), управляе-
—-------- 216 ------------------
ГЛАВА 4. Гидродинамика искусственных клан шов сердца
Рис. 4.5. Гидродинамическая установка стационарного потока для исследования увеличенных мо-
делей искусственных клапанов сердца:
1 — расходомер; 2 — насос; 3 — измерительная диафрагма; 4 — уравнительный резервуар;
5 — выпрямитель потока; 6 — выходной отдел левого желудочка; 7 — аортальный клапан; 5 — резер-
вуар с водой; 9 — корень аорты (по М Knoch et al., 1988)
Рис. 4.6. Гидродинамическая установка с двумя испытательными “Мерами^ув^иных мо-
делей искусственных клапанов сердца и для клапанов натуральной величины), двумя
режимами работы — стационарного и пульсирующего потоке
1-вход пульсирующего потока; 2 - выпрямляющие У-^
тельная камера для увеличенных моделей исДусст 8 _ ИСПЫТательная камера для искус-
пан; 6 - датчик давления; 7 - точки измерени^eH^a<t(parMa: ,, _ тепЛообменник (по
ственных клапанов сердца; 9 — насос, 10 расход р
V. J. Modi et al., 1983)
217
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
СИСТОЛЫ
I — начало систолы, II — максимум систолического расхода,
III — конец систолы, IV — конец прямого расхода, V — максимум
регургитационного расхода
Рис. 4.7. Пульсдупликатор с поршневым приводом и осесимметричными испытательными
камерами для митральных и аортальных искусственных клапанов сердца:
1 — выпрямитель потока; 2 — модель предсердия; 3 — митральная камера; 4 — электромагнитный
расходомер; 5 — система автоматического регулирования, 6 — поршневой привод, 7 — управляю-
щий сигнал, 8 — микрокомпьютер, 9 — желудочек; 10 — выпрямитель потока, 11 — крепление аор-
тального клапана, 12 — модель аорты; 13 — электромагнитный расходомер, 14 — датчик аорталь-
ного давления, 15 — модель сердечно-сосудистой системы; 16 — клапан регулировки расхода;
17— крепление митрального клапана, 18 — резервуар жидкости; 79 — датчик давления в желудочке
(noT Cochrane et al., 1991)
мый кулачковым механизмом, моделирующим форму физиологической зависимости
расхода от времени (Кузьмина Н. Б., 1967; Cochrane Т. et al., 1991), либо пневмогид-
равлическим приводом (рис. 4.8), в состав которого входили управляемые электро-
магнитные клапаны, задающие импульсы давления физиологической формы (Романов
Г Ф. 1974; Hanle D. D. et al., 1989).
В пульсдупликаторах с поршневым приводом моделировалась динамика сокраще-
ния левого желудочка человека с обеспечением заданного ударного выброса (ударно-
го объема) При этом формы пульсовых волн давления в желудочке, предсердии и аорте
корректировались с помощью различных приспособлений. В пульсдупликаторах с пнев-
могидравлическим приводом моделировалась динамика изменения давления в левом
желудочке, аорте и предсердии, а форма пульсовых волн расхода жидкости и ударный
выброс зависели от характеристик испытуемых клапанов. При своем равноправии оба
подхода имеют свои специфические технические проблемы, связанные с обеспечени-
ем точности и воспроизводимости условий испытаний, наличием взаимовлияния
испытуемых клапанов и элементов пульсдупликатора, гидроударов и пульсаций давле-
ния в испытательных камерах и т п., которые в той или иной мере решаются разработ-
чиками. Поэтому точность предсказания гидродинамических характеристик искусствен-
ных клапанов сердца, ожидаемых после имплантации, на основе исследования их в
пульсдупликаторах является относительной. В ряде случаев данные сравнительных ис-
пытаний моделей клапанов у различных авторов не соответствовали друг другу. Поэто-
му способы моделирования физиологических условий и устройства для испытаний ис-
кусственных клапанов сердца продолжали совершенствоваться.
--------- 218------------------
ГЛАВА 4. Гидродинамика искусственные клапанов сердца
Рис. 4.8. Пульсдупликатор с пневмогидравлическим приводом и осесимметричными испытатель-
ными камерами для митральных и аортальных искусственных клапанов сердца:
1 — накопительный резервуар, 2 — расходомер; 3 — камера предсердия, 4 — митральный клапан,
5 — желудочковый насос, 6 — плоскость измерения, 7 — аортальный клапан; 8 — датчик давления
желудочка; 9 — датчик давления аорты; 10 — аортальная емкость, 11 — электромагнитный расходо-
мер, 12 — аортальная камера, 13 — периферическое сопротивление; 14 — регуляторы давления;
15 — сжатый воздух, 16 — запускающий механизм; 17 — электромагнитные клапаны, 18 — сток (по
D. D. Hanle et al , 1989)
Рас-од в аорте
Даеярние в * елудочке
Давление в аорте
В первых пульсдупликаторах аортальные искусственные клапаны сердца испытыва-
лись, как правило, в осесимметричных прозрачных каналах, моделирующих выхо н
отдел левого желудочка и корень аорты. Для испытании митральных ^аланов
левого желудочка моделировали диффузорным каналом. ~ акие устан гтянлап
довали на точное моделирование физиологических условии, но обеспечивали стандар-
тные, легко в°спроизводимь|е условия гюпытанщи. изготавливали точные ко-
Для более точного моделирования реального тече Р ппа мггпрлпвяния
пии элементов сердечно-сосудистой системы по их слепк . , ММПлантак1ии
влияния ориентации аортального искусственного клапана сердца иссле-
была изготовлена копия дуги аорты — рис 4 9 (Chan ran . Д ' коп’ия левого же-
дования течения за митральным искусственным кл^пан^м . oog\ _ см pMCi 4,9.
лудочка в фазу диастолического мспроТтранение возмущений, вносимых
В таких модельных течениях анализировали pa р Р канала оказывала
в поток искусственными клапанами сердца, вниз по теч®^ rTDVKTvnv течения и гидро-
существенное влияние (наряду с конструкцией клапана) на структуру течения и гидро
динамические характеристикиприменяемой для исследования те-
Следующим уточнением физическом мод , р и стенок аортЫ1 Предсер-
чения в искусственных клапанах сердца яв У У^ в пульсдупликаторах с упру-
дия и желудочка (Reul Н„ 1983; Verdo"^^ течений с подвижными границами
гими элементами изучались характеристик
(рис. 4 10; цв вкладка, рис. 10). ,„тянП„ках (оис 4.11) уточняли геометрию тече-
В некоторых исследовательских Уст®и° (Р(легочных и коронарных артерии) и
ния включением в модель близлежащих сосуд
219
Рис. 4.9. Модели аорты и левого желудочка, изготовленные из плексигласа по слепкам
(по К. В. Chandran et al., 1985; 1989)
приближали условия работы клапанов к физиологическим, моделируя систолу пред
сердия (Heiliger R. et al., 1988).
Были разработаны также пульсдупликаторы (рис. 4.12), в которых обеспечивалось
сокращение аутопсированного сердца с имплантированными искусственными клапа-
нами (Бражников Е. М. и др., 1983). Визуализизация течения в искусственных клапанах
сердца осуществлялась с привлечением рентгеносъемки. Несмотря на точное копиро-
вание геометрии, такие установки не получили широкого распространения из-за слож-
ности и невоспроизводимости результатов.
Наряду со сложными исследовательскими установками, применялись и упрощен-
ные пульсдупликаторы, главными достоинствами которых была воспроизводимость
условий испытаний и повторяемость результатов. Характеристики таких установок опи-
сываются в стандартах для искусственных клапанов сердца (ГОСТ 26997-2003), а при-
меняются они, главным образом, при приемо-сдаточных испытаниях клапанов фирма-
ми-изготовителями (рис. 4.13). На таких установках проходит испытание каждый изго-
товленный искусственный клапан сердца с целью установления степени соответствия
его характеристик требованиям технической документации. Прототипом таких устано-
вок был одноклапанный пульсдупликатор, в котором устанавливался один испытуемый
искусственный клапан сердца, и с помощью электромагнитного клапана он подклю-
чался попеременно к источнику давления или к сливнои емкости.
В дальнейшем эта схема была модернизирована (Перимов Ю. А. и др., 1981): в
гидравлический контур после испытуемого клапана были установлены поплавковый и
обратный клапаны (рис 4.14), благодаря которым удалось создать стабильный режим
давлений на испытуемом клапане и повысить точность измерений. Устройства такого
вида применяются производителями искусственных клапанов сердца на Кирово-Чепец-
ком химическом комбинате и в ЗАО НПП «МедИнж» (Пенза).
220 ----------------—------------------------------------
ГЛА В А 4. Гидродинамика искусственных клапанов сердца
Рис. 4.10. Н. Reul (Helmgoltz Institute of Biomedical Technics, Aachen, Germany); пульсдупликатор
с поршневым приводом и испытательными камерами, моделирующими форму и упру-
гость левого желудочка, корня аорты и предсердия:
1 — регулирующий механизм; 2 — периферическое сопротивление; 3 — регулируемая упругость;
4 — характеристическое сопротивление, 5 — электромагнитный расходомер; 6 — эластичный ко-
рень аорты, 7 — аортальный лепестковый клапан; 8 — эластичный мешочек желудочка; 9 — пор-
шень высокого давления, 10 — электрогидравлический привод; 11 — поршень низкого давления;
12 — твердый корпус из органического стекла; 13 — митральный клапан, 14 — эластичное левое
предсердие, 15 — резервуар предсердия; 16 — регулирующий дроссель; 17— резервуар с жидко-
стью {по Н. Reul, 1983)
В современных экспериментальных стендах
ца и сосудов. Это связано, в первую очеред , n«Da30M их упругопрочностными
протезов, работа которых определяется•
характеристиками. Для исследования как р способы крепления, не наруша-
бескаркасных биопротезов исполь^ °Р а (Гавриленков В. И. и др., 2004). Же-
ющие естественной биомеханики работы L. ТР льк0 в приемо-сдаточных стен-
сткие испытательные каналы для клапано Р испытаний. В настоящее
дах, конструкция которых закреплена в налажен0 производство испытательных
время канадской фирмой Vivitro sVst^ гипоодинамических характеристик искус-
стендов для определения биомеханически
ственных клапанов сердца (цв. вкладка, рис. • _____.—
ИСКУССТВЕННЫЕ КЛАЛ ДН Ы СЕ РД ЦА
Рис. 4.11. Пульсдупликатор с пневмогидравлическим приводом, моделирующим систолу желу-
дочка и предсердия, и испытательными камерами, моделирующими форму и упругость
левого желудочка, аорты и предсердия:
1 — обратная труба, 2 — эластичная дуга аорты, 3 — датчик расхода, 4 — нисходящая аорта;
5 — мембранный дроссель, 6 — аортальный клапан, 7 — дроссель, 8 — митральный клапан,
9 — эластичный левый желудочек, 10— мембранный дроссель; 11 — мембранный насос; 12 — дат-
чик расхода, 13 — эластичное предсердие, 14 — стекловолоконный световод, 15 — резервуар
(по R. Heiliger et al, 1988)
Рис. 4.12. Пульсдупликатор с анонсированным сердцем:
бок Гпо^м^пя3” препарат сердца, 3 — подводящие патрубки, 4 — смотровой патру-
оок (по Е. М. Бражникову, 1983)
---------- 222 ----------------------
ГЛ A BA 4 Гидродинамика искусственных клапанов сердца
Рис. 4.13. Принципиальная схема стенда для гидродинамических испытаний искусственных кла-
панов сердца по ГОСТу:
1 — напорная емкость, 2,3 — испытательные каналы, 4 — испытательная камера митрального кла-
пана, 5 — испытательная камера аортального клапана, 6 — пневмогидроаккумулятор; 7 — аорталь-
ный демпфер 8,9 — мерные трубки обратного перетока, 10 — пульт пневмопривода, 11 — регуля-
тор сопротивления обратной связи (по ГОСТу 26997-2003)
₽ис. 4.14. Одноклапанный пульсдупликатор; методика выполнения измерен
аттестована ВНИИМС (свид. № 106/36-98 от 25.08.1998)
- - 223
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
Развитие и совершенствование экспериментальных установок сопровождалось ус-
ложнением измерительных устройств, применяемых при исследованиях искусственных
клапанов сердца, и методов измерений их гидродинамических характеристик. В уста-
новках стационарного потока перепад давления на клапанах измеряли с помощью про-
стейших U-образных манометров или манометров с наклонными трубками. Такими же
манометрами пользовались и для измерения расхода жидкости по п р па у давления
на расходомерной диафрагме. В пульсдупликаторах контроль за циклически изменяю-
щимся давлением осуществляют электроманометрами, например, основанными на
емкостном принципе преобразования механического воздействия в электрический
сигнал, или на тензоэффекте Для измерения пульсирующего расхода используют элек-
тромагнитные или ультразвуковые расходомеры. Указанные измерительные преобра-
зователи применяются как при клинических исследованиях гемодинамики, так и в ла-
бораторных условиях. Выходные электрические сигналы датчиков первоначально кон-
тролировали по экрану осциллографов и регистрировали на самописцах. С внедрением
вычислительной техники появилась возможность наблюдения и обработки сигналов в
реальном времени
ИНТЕГРАЛЬНЫЕ ГИДРОДИНАМИЧЕСКИЕ
ХАРАКТЕРИСТИКИ КЛАПАНОВ
Основываясь на клиническом опыте, а также на многолетних результатах лабора-
торных испытаний, можно сформулировать медико-технические требования к искусст-
венным клапанам сердца В частности, наряду с медицинскими требованиями, а также
требованиями к биоинертности материалов для изготовления клапанов и долговечно-
сти конструкции, можно выделить основные гидродинамические требования к идеаль-
ному протезу, минимальный градиент давления, малый обратный переток, минималь-
ная генерация турбулентности, отсутствие высоких сдвиговых напряжении в потоке,
отсутствие зон застоя и отрыва потока внутри и за клапаном.
Сопротивление, оказываемое протезом прямому току крови, а также энергетичес-
кие потери оцениваются по величине среднего перепада (градиента) давления ДР
на клапане в открытом состоянии при заданном расходе жидкости Q через клапан. Од-
нако следует заметить, что только средний перепад между давлением перед клапаном
и восстановленным давлением на некотором расстоянии за клапаном пропорционален
потерям энергии Это показал R.S. Heinrich (1996) для различных конструкций проте-
зов в физиологическом диапазоне изменения ударного объема (40-120 мл) и частоты
сокращений (60-100 уд/мин) Перепад давления, измеренный в непосредственной бли-
зости от клапана в зоне меняющегося профиля скорости, не пропорционален энерге-
тическим потерям. Отметим, что величина среднего перепада давления весьма чув-
твительна к условиям испытании, измерения и осреднения сигнала Так, J. Fisher и
соавт (1986) показали, что расположение точки отбора давления, ориентация клапана,
вы ор времени осреднения оказывают заметное (до 15%) влияние на средний пере-
пад давления, сравнимое с различиями между клапанами по этой характеристике,
менно с этим связаны отличия в результатах испытаний одинаковых клапанов одного
тппяк!магдИьТ^иГ^псх,^ЗНаЧеНИЯХ среднего расхода, опубликованных разными ав-
тпоопио 1 S ’ ' аким образом клапаны различных конструкций можно дос-
опнгмд «л авниватЬ| опираясь только на результаты их испытаний одним автором на
одной и той же экспериментальной установке
тоех И СОавт‘ приведены результаты сравнительных испытаний
23 мм для пяти пр^импДВУСТВ0РЧ^Ь'Х аортальных клапанов с посадочным диаметром
70 мл и 70 vn/мим Ro °В удврныи объем — 60 мл, частота сокращений — 60 уд/мин;
риментальныедан^Лп” УД/МИН; 8° МЛ " 100 80 ” 120 УД/мин Экспе-
риментальные данные аппроксимировались степенными зависимостями Хр от Q
ср Кб
--------- 224 -
ГЛАВА 4 Гидродинамика искусственных клапанов сердца
Выбор QcpKB в качестве аргумента для др объясняется удобством сопоставления ре-
зультатов испытаний клапанов в стационарном и пульсирующем потоках, а именно: из-
меренный в стационарном потоке перепад давления ДР при некотором значении рас-
хода Q равен среднему значению прямого перепада давления в пульсирующем потоке
ДР+ при среднеквадратичном расходе Q(pkB, равном Q (Yoganathan А. Р. et aL, 1979).
Зависимость среднего перепада давления от среднеквадратичного расхода близка к
параболической. При среднеквадратичном расходе 300 мл/с, что соответствует состо-
янию покоя организма, минимальный средний перепад давления — 10 мм рт. ст. —
зафиксирован для клапанов St. Jude Medical и Omniscience, у клапанов Duromedics и
Bjork-Shiley Monostrat— 12 мм рт. ст. и максимальный — 14 мм рт. ст. у клапана Bjork-
Shiley Standard. С увеличением среднего расхода различие по среднему перепаду дав-
ления между клапанами возрастает (рис. 4.15).
J. Fisher и соавт. (1986) сравнили те же модели клапанов, но уже с посадочным диа-
метром 29 мм в митральной позиции, где средний расход в покое составлял 150 мл/с.
При таком расходе разница в перепадах давления между клапанами была ничтожной —
менее 0,5 мм рт. ст, а сами перепады не превышали 1 мм рт. ст. Невелики различия в
средних перепадах давления для митральной позиции и при расходах в 300 мл/с: на
клапане Bjork-Shiley Standard перепад 4 мм рт. ст, на остальных — 3 мм рт ст.
Современные клапаны больших типоразмеров создают клинически незначимые пе-
репады давления. Поэтому в исследованиях основное внимание сосредотачивается на
сравнительных испытаниях клапанов малых размеров, создающих наибольшее сопро-
тивление потоку крови. J. Fisher (1995) сравнил шесть моделей двустворчатых протезов
с посадочным диаметром 19 мм при четырех режимах: ударный объем — 60 мл, частота
сокращений — 60 уд/мин; 70 мл и 72 уд/мин; 80 мл и 80 уд/мин; 100 мл и 100 уд/мин.
Различия между клапанами существенны и располагались они в порядке возрастания
перепадов давления (при среднем расходе 300 мл/с) следующим образом: St. Jude
Medical Hemodynamic Plus — 10 мм рт. ст.; Sorin Bicarbon — 12 мм рт. ст.; St. Jude Medical
Standard — 18 мм рт. ст.; Duromedics — 20 мм рт. ст.; ATS — 25 мм рт. ст; Carbomedics —
29 мм рт. ст. Значительные перепады давления свидетельствуют об актуальности сни-
жения сопротивления клапанов малых размеров.
Рис. 4.15. Зависимость среднего перепада давления от среднеквадратичного расхода для меха-
нических искусственных клапанов сердца Bjdrk-Shiley Standard (BSS), Bjdrk-Shiley
Monostrut (BSM), Duromedics (DM), Omniscience (OS), St. Jude Medical (SJM), ксенопе-
рикардиальных биопротезов lonescu-Shiley Standard (ISS), lonescu L0*
(ISLP), Hancock (H) и ксеноаортальных биопротезов Mitral Medical (MM), Wessex Medical
(WM); no J. Fisher et al., 1988
______________ 225 -----------
9 Искусственные клапаны сердца
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
Площадь эффективного отверстия (effective orifice area) вычисляется по форму-
ле ЕОА- Q (51.6 VaP. ) (Baldwin J.T. et al.. 1997) с использованием измеренных
средних значений перепада давления и расхода и имеет размерность площади (см2).
£Од характеризует клапан в открытом состоянии, так же как и средний перепад давле-
ния, но является более универсальной характеристикой, не зависящей от расхода жид-
кости через клапан Для современных аортальных двустворчатых клапанов 19 размера
(посадочный диаметр от 19,8 до 21.8 мм) J. Fisher (1995) получил следующие значения
ЕОА: для St Jude Medical Hemodynamic Plus — 1,83 см2; Sorin Bicarbon — 1,72 cm2;
St Jude Medical Standaid — 1,33 cm2; Duromedics — 1,28 cm2; ATS — 1,17 cm2;
Carbomedics — 1,11 cm2.
J.T Baldwin и соавт. (1997) исследовали характеристики модифицированного кла-
пана Carbomedics — Carbomedics Kinetic, который имеет большую площадь эффектив-
ного отверстия, по сравнению с клапаном St. Jude Medical, как в аортальной позиции —
2,32 против 2,09 см2 (клапаны 23 размера), так и в митральной — 4,14 против 3,96 см2
(клапаны 29 размера). Это преимущество достигнуто за счет подбора индивидуально-
го угла открытия для каждого размера клапана
Индекс производительности клапана (performance index) определяется как от-
ношение площади эффективного отверстия к площади, рассчитанной по посадочному
диаметру PI = ЕОА / Snoc. Таким образом, обобщаются экспериментальные данные
измеренного среднего перепада давления для клапанов различных размеров. Данный
коэффициент характеризует только тип клапана или относительные конструктивные па-
раметры различных размеров одного протеза Геометрически подобные клапаны од-
ного типа, но разных размеров имеют одинаковые значения PI. В работе J. Т. Baldwin
(1997) рассчитаны коэффициенты производительности для клапанов St. Jude Medical и
Carbomedics Kinetic: 0,47 и 0,55 — для 23 размера и 0,57 и 0,62 — для 29 размера.
Напомним, что более высокая производительность клапана Kinetic достигнута специ-
альным подбором угла раскрытия створок, индивидуального для каждого размера
Аортальные клапаны 23 размера при ударном объеме 70 мл и частоте сокраще-
нии 70 уд/мин (Fisher J. et al , 1988) имели следующий объем обратного перетока
при закрытии* 1,5 мл для Bjork—Shiley Standard; 2,5 мл — St. Jude Medical и
Duromedics; 3 мл — Bjork-Shiley Monostrat и 3,5 мл — Omniscience; а объем обратно-
го перетока через закрытый клапан составлял 4,5 мл для Bjork-Shiley Monostrat; 5,0 мл
St Jude Medical, 5,5 мл — Duromedics; 7,0 мл — Bjork-Shiley Standard и 9,5 мл —
niscience. Для митральных клапанов 29 размера величина обратного перетока при
закрытии составляла: 5,5 мл для Bjork-Shiley Standard; 6,0 мл — St Jude Medical и
Duromedics, 7,0 мл Omniscience и 8,5 мл — Bjork-Shiley Monostrat и обратного
перетока через закрытый клапан: 2 мл для Bjork—Shiley Monostrat и 3 мл — для ос-
тальных клапанов (рис. 4 16). У исследованных шести типов современных двуствор-
чатых аортальных клапанов 19 размера объемы обратного перетока при закрытии
лежали в пределах 0,5-1,5 мл, а утечки через закрытый клапан составили 2-4 мл
(Fisher J , 1995).
На величину обратного перетока влияют особенности конструкции эксперименталь-
ной установки Данные, полученные на пульсдупликаторе, моделирующем упругость
левого желудочка, корня аорты и предсердия (Heiliger R et al., 1988), несколько отли-
чались от приведенных выше: объем обратного перетока для клапана St. Jude Medical
9s ня? on3MeP°o доставлял 8 мл; 29 размера - 14 мл, а для клапана Duromedics 21 и
25 размеров — 2,5 мл; 29 размера — 9 мл.
ппонр^п^И^^еИТ неАОСТаточности клапана (фракция регургитации) показывает
R НейюрГ и иИОейр°1бЪеМа Обратного перетока и ударного объема. I = 100 ( V / VyA ).
St. Jude Medical RJ показали, что коэффициент недостаточности для клапанов
ров Для 21 паамрДДи0 сравнению с клапанами Duromedics соответствующих разме-
™%“ТаВЛ"Л° 13% " 10%; 25 ~ “ 6%; для 27 - 17% и
--------- 226
ГЛАВА 4. Гидродинамика искусственных клапанов сердца
Рис. 4.16. Обратный переток (объем регургитации) в аортальной позиции для механических ис-
кусственных клапанов сердца (Bjork-Shiley Monostrut, St. Jude Medical, Duromedics,
Bjork-Shiley Standard, Omniscience), ксеноаортальных биопротезов (Mitral Medical,
Wessex Medical) и ксеноперикардиальных биопротезов (Hancock, lonescu-Shiley Low
Profile, lonescu-Shiley Standard); no J. Fisher et al., 1988
Все рассмотренные выше характеристики протезов оценивают работу клапана толь-
ко в одну из фаз сердечного цикла Суммарные потери энергии за весь цикл опреде-
ляются интегрированием по времени произведения перепада давления на объемный
расход жидкости:
t»
ДЕ, = $AP(t) Q(t)dt; ЛЕэакр = $AP(t) Q(t)dt; ДЕ^ = $AP(t) Q(t)dt,
f0 f, t2
где ДЕ+ — потери энергии на клапане в открытом состоянии, \Е —потери энергии при закры-
тии клапана, ДЕ^ — потери энергии на клапане в закрытом состоянии, t0 — начало прямого тока
жидкости через клапан, t] — конец прямого тока жидкости через клапан, t2 — закрытие клапана,
— конец сердечного цикла (Struber М et al., 1996)
Общие потери энергии за цикл вычисляются суммированием трех слагаемых, при-
веденных выше (Jansen J. et aL, 1991).
Энергетические потери на аортальных клапанах 23 размера для ударного объема
70 мл и частоты сокращений 70 уд/мин приведены в работе J. Fisher и соавт. (1988):
Для клапана St Jude Medical — 117 мДж; Bjork—Shiley Monostrat — 127 мДж; Duromedics —
147 мДж; Bjork-Shiley Standard — 167 мДж; Omniscience — 177 мДж (рис. 4.17).
Другие авторы для близких условий испытаний (расход 5 л/мин) приводили следу-
ющие значения энергетических потерь: для клапана St. Jude Medical 23 размера —
132 мДж и для Carbomedics Kinetic того же размера — 124 мДж (Baldwin J. Т. et al., 1997).
° этой же работе показано, что потери энергии пропорциональны минутному расходу:
ДДя St. Jude Medical 23 размера при 2 л/мин — 46 мДж; 5 л/мин — 132 мДж, 7 л/мин —
^61 мДж Кроме того, для обоих исследованных клапанов во всех режимах рассчитаны
^отери энергии по фазам сердечного цикла. Так, для St. Jude Medical 23 размера при
5 л/мин потери энергии на клапане в открытом состоянии составляли 81 мДж, потери
энергии при закрытии клапана — 14 мДж, а потери энергии на клапане в закрытом
состоянии — 37 мДж. Исследования шести современных моделей двустворчатых
клапанов 19 размера показали для ударного объема 70 мл и частоты сокращении
УД/мин следующие значения потерь энергии за цикл St. Jude Medical Hemodynamic
—---------------------------------------------------- 227
9*
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
Рис. 4.77. J. Fisher (Department of Mechanical Engineering, University of Leeds, UK); потери энергии
в аортальной позиции для механических искусственных клапанов сердца (St. Jude
Medical, Bjork-Shiley Monostrut, Duromedics, Bjork-Shiley Standard, Omniscience), ксе-
ноаортальных (Mitral Medical, Wessex Medical) и ксеноперикардиальных биопротезов
(Hancock, lonescu-Shiley Standard, lonescu-Shiley Low Profile); no J. Fisher et al., 1988
Plus _ 113 мДж, Sorin Bicarbon — 120 мДж, St Jude Medical Standard — 167 мДж,
Duromedics — 187 мДж, ATS — 260 мДж, Carbomedics — 293 мДж (Fisher J., 1995).
К Schichl и соавт. (1998) исследовали шесть искусственных клапанов сердца, вклю-
чая отечественный дисковый клапан Микс на одноклапанном пульсдупликаторе. При-
чем для оценки энергетических потерь в митральной позиции моделировалась физио-
логическая форма кривой митрального расхода с двумя максимумами: первый соот-
ветствовал фазе расслабления желудочка, второй — систоле предсердия. Форма
кривой определялась по данным ультразвуковых допплеровских измерении in vivo. Аб-
солютные значения потерь энергии в митральной позиции были заметно меньше, по
сравнению с аортальной (рис. 4.18). Сделана попытка оценить влияние формы модель-
ной кривой митрального расхода на потери энергии. Количественные оценки такого
влияния были завышены, так как в экспериментах одновременно с формой менялась и
длительность прямого расхода жидкости через митральный клапан.
М. Struber и соавт (1996) продемонстрировали возможность решения сложной за-
дачи выбора оптимальной пары клапанов (аортальный-митральныи) путем минимиза-
ции суммарных энергетических затрат, причем выбор производили между дисковыми
и двустворчатыми протезами четырех типоразмеров
Повторно отметим, что на гидродинамические характеристики искусственных кла-
панов сердца заметное влияние оказывают параметры стендов (фантомов кровотока)
и модельных жидкостей, в которых они были исследованы. Анализ такого влияния и
приближение параметров к их физиологическим значениям будут способствовать
объективности полученных характеристик. Сравнению перепадов давления на искусст-
венных клапанах сердца, измеренных при использовании различных модельных жид-
костей, а также в условиях стационарного и пульсирующего потоков, посвящена рабо-
та А. Р. Yoganathan и соавт. (1979) Совпадение результатов при измерении перепада
давления на шаровом и дисковом клапанах в воде (ц = 0,01 П) и в высокомолекуляр-
---------- 228 ____________________________________________________—
ГЛАВА 4. Гидродинамика искусственных клапанов сердца
Рис. 4.18. Потери энергии на механических искусственных клапанах сердца в митральной пози-
ции — Duromedics, Carbomedics, Bjork-Shiley Monostrut, St. Jude Medical, Bjork-Shiley
Standard, Микс (по K. Schichl et al., 1998)
ном растворе, моделирующем вязкость крови (ц = 0,035 П), свидетельствовало о неза-
висимости их коэффициентов сопротивления от числа Рейнольдса в диапазоне
Re= 1200-2100. Важным результатом этой работы следует считать совпадение изме-
ренных перепадов давления на шаровом и дисковом клапанах в стационарном потоке
со значениями среднего перепада давления, измеренного в пульсирующем потоке при
среднеквадратичном расходе, равном расходу стационарного течения (рис. 4.19). За
время осреднения выбиралось время прямого течения жидкости через клапан. Полу-
ченные результаты подчеркивают правомерность сравнительных стендовых испытаний
в упрощенных условиях стационарного потока с использованием воды в качестве ра-
бочей жидкости.
К. В. Chandran и соавт. (1986) исследовали влияние неточности установки искусст-
венного клапана сердца Medtronic-Hall относительно оси аорты при его имплантации.
Определено, что при отклонении осей на 5° средний перепад давления и объем обрат-
ного перетока увеличиваются примерно на 40% (рис. 4.20).
Рис. 4.19. Зависимость перепада давления на искусственных клапанах сердца Smelott-Cutter и
Bjork-Shiley от расхода жидкости (измерения в стационарных потоках жидкостей раз-
ной плотности); сравнение зависимостей перепада давления в стационарном потоке от
расхода с зависимостями среднего перепада давления в пульсирующем потоке от сред
неквадратичного расхода на тех же клапанах (по А. Р. Yoganathan et а .,
_______________________________________________-__________ 229 ----------
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
Рис. 4.20. Зависимости среднего перепада давления и объема обратного перетока на ис-
кусственных клапанах сердца Medtronic—Hall от угла между осями клапана
и корня аорты (по К. В. Chandran et al., 1986)
Т Fujimoto и соавт (1999) исследовали в аортальной позиции пульсдупликатора
шаровой искусственный клапан сердца и двустворчатые конструкции — Carbomedics
(оси вращения створок неподвижны относительно седла) и Jyros (со створками, вра-
щающимися вокруг оси клапана) Показано, что только клапан Jyros сохранял на выхо-
де неизменной вращательную составляющую скорости входного потока, уменьшая, тем
самым на 10°о потери энергии, по сравнению с двустворчатым клапаном Carbomedics
Функциональные преимущества бескаркасных биопротезов над каркасными были
доказаны при лабораторных гидродинамических исследованиях, проведенных в пер-
вой половине 90-х гг В основном, были исследованы те модели, которые выпускались
в виде цельного корня аорты. Так, Н W, Sung и соавт (1991, 1995) установили, что бес-
каркасный биопротез Edwards Pnma всех типоразмеров (от 19 до 29 мм) имел в 3 раза
меньший средний перепад давления на протезе относительно каркасного биопротеза
Carpentier-Edwards при стандартном гидродинамическом режиме (Q=5 л/мин, аор-
тальном давлении 100 мм рт ст. и частоте сокращений 70 уд/мин). Площадь эффек-
тивного отверстия бескаркасных биопротезов в среднем в 1,5 раза превышала пло-
щадь каркасных Сравнительные исследования гидродинамики ксенографта Medtronic
Freestyle, двух каркасных протезов Hancock Standard и Hancock Modified и механиче-
ского двустворчатого клапана сердца St Jude Medical показали значительно меньшие
перепады давления и большие площади эффективного отверстия у протеза Medtronic
Freestyle относительно контрольных клапанов (Yoganathan А Р et al , 1994).
Сравнение гидродинамических характеристик протеза Medtronic Freestyle четырех
типоразмеров проведенное в эластичной силиконовой модели аорты для четырех ва-
ри н ов техники имплантации, показало, что градиент давления и объем регургитации
на протезе в значительной степени зависят от размера протеза и меньше — от техни-
и имплантации (Yoaganathan А Р et al , 1994) Максимальные площади открытия ство-
ро и меренные при визуализации работы протеза в фантоме кровотока, были боль-
шими при моделировании техники имплантации полным корнем
В последующи ра от фантом кровотока для оценки влияния типоразмера и тех-
ники имплантации бе каркасных биопротезов на их функциональные характеристики
in vitro ыл у овершенствован исследуемые бескаркасные биопротезы имплантиро-
вали в нативные свиные корни аорты или в свиные корни аорты, стабилизированные
глутаровым альдегидом Это, по мнению авторов, моделировало имплантацию в «мо-
дые и пожилые корни аорты человека Было выявлено существенное снижение
ГЛАВА 4 Гидродинамика искусственных кляпансн сердца
растяжимости нативных «молодых» корней-акцепторов аорты после имплантации в них
бескаркасных протезов Stentless Toronto SPV (Nagy Z. L et al., 1999) Гидродинамичес-
кие параметры были лучше, а сгибательные деформации открытых створок меньше
при имплантации протеза Stentless Toronto SPV с наружным диаметром на 1 мм мень-
ше внутреннего диаметра корня-акцептора. По мнению авторов, умеренно занижен-
ная несоразмерность имплантации ксенографтов может увеличивать их износоустой-
чивость, зависящую от деформации створки и сгибательных напряжений. Гидродина-
мическая эффективность «молодых» композитных корней аорты была существенно и
достоверно выше «пожилых» (Nagy Z. L et al., 1999). Субкоронарная имплантация как
стабилизированных, так и нативных корней аорты приводила к ухудшению их исходных
функциональных характеристик (Revanna R et al., 1997)
Важный вопрос выбора размера бескаркасного биопротеза решался в работах
Z. L.Nagy и соавт (1999) и А. Р. Yoganathana и соавт. (1994). В первом исследовании
бескаркасные биопротезы Stentless Toronto SPV 19, 21 и 23 размеров вшивались в ко-
рень аорты с диаметром фиброзного кольца 21 мм. В ходе испытаний оценивались
растяжимость композитных корней аорты, индекс сгибательной деформации створок
(BDI), перепад давления, площадь эффективного отверстия и индекс производитель-
ности (PI). С учетом двух характеристик — BDI и PI — авторы рекомендовали приме-
нять недорасширенный биопротез, то есть с наружным диаметром на 1 мм меньше ди-
аметра фиброзного кольца (рис. 4.21). Во второй работе исследованы бескаркасные
биопротезы Medtronic Freestile 21, 23, 25, 27 размеров, также вшитые в корень аорты с
диаметром фиброзного кольца 21 мм PI также как и в первом исследовании, рассчи-
тывался по значениям ЕОА для каждого протеза и площади фиброзного кольца аорты
Для данного биопротеза авторы рекомендовали использовать технику имплантации с
перерасширением на 2 мм, то есть диаметр биопротеза должен превосходить диаметр
фиброзного кольца аорты Вывод сделан на основе анализа зависимости только од-
ной характеристики — индекса производительности (PI) от величины перерасширения
(AD) фиброзного кольца (см. рис. 4.21).
В ходе оптимизационных испытаний новых конструкций механических искусствен-
ных клапанов сердца оценивают влияние их конструктивных элементов на гидродина-
мические характеристики. М. Knoch и соавт (1988) провели тщательный анализ зави-
рис. 4.21.
Зависимость индекса производительности (PI) и индекса сгибательной
(BDI) от перерасширения (разницы между наружным размером клапана "
Фиброзного кольца аорты) для бескаркасных биопротезов Ме^гопГс Frees'y'e (по
А. Р. Yoganathan et al., 1994) и Stentless Toronto SPV (no Z. L. Nagy et al., 1999)
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
Рис. 4.22. а — зависимость коэффициента сопротивления искусственного клапана сердца от угла
открытия (а) дискового запирающего элемента клапанов Bjork-Shiley, Convexo-Concave,
Bjork-Shiley Monostrut, Omniscience, Medtronic Hall и створок клапанов St. Jude Medical
Standard, Duromedics; б — относительный вклад элементов конструкции (запирающий
элемент — белый цвет, корпус — серый, ограничители хода — черный) в коэффициент
сопротивления искусственных клапанов сердца Bjork—Shiley, Convexo-Concave, Bjork-
Shiley Monostrut, Omniscience, Medtronic—Hall — St. Jude Medical, Duromedics (по M. Knoch
et al., 1988)
симости коэффициента сопротивления увеличенных моделей клапанов (3 1) в стацио-
нарном потоке. Показано, что коэффициент сопротивления линейно уменьшается при
увеличении угла открытия запирающих элементов (рис. 4.22).
В этой же работе измерены отдельно сопротивления седла, ограничителей хода и
запирающих элементов искусственных клапанов сердца. Минимальный вклад в общее
сопротивление (1,1%) вносят ограничители хода клапана Medtronic—Hall, максималь-
ный (21,1%) — ограничители хода Bjork-Shiley Convexo-Concave. Минимальное отно-
сительное сопротивление (33,9%) имеют створки клапана St. Jude Medical Standard, мак-
симальное (69,8%) — дисковый запирающий элемент клапана Bjork-Shiley Convexo-
Concave (см рис. 4.22).
ЛОКАЛЬНЫЕ ГИДРОДИНАМИЧЕСКИЕ
ХАРАКТЕРИСТИКИ ПОТОКА В КЛАПАНАХ
Рассмотренные в предыдущем разделе «макроскопические» гидродинамические ха-
рактеристики клапанов перепад давления, потери энергии, регургитация — не опи-
сывают локальные особенности потока крови, такие как вихреобразование, застойные
зоны, области рециркуляции. Знание особенностей скоростного поля в искусственных
клапанах сердца необходимо для определения корреляции их гидродинамических ха-
рактеристик с осложнениями клапанной этиологии. Распределение скорости за клапа-
ном позволяет определить положение областей высоких градиентов скорости и ре-
циркуляционных зон. Застойные зоны более подвержены тромбообразованию по
сравнению с областями больших сдвиговых напряжений Распределение сдвиговых
НИИ мохет бЬ|ТЬ использовано для определения степени разрушения формен-
ных элементов крови. 1
232
ГЛАВА 4. Гидродинамика искусственных клапанов сердца
Рассмотрим методы экспериментального исследования полей скорости, завихрен-
ности и сдвиговых напряжений за искусственными клапанами сердца. Значения этих
величин для пространственного нестационарного течения зависят от трех простран-
ственных координат и времени. Формы графического представления таких сложных
течений разнообразны. Это может быть распределение скалярной величины (проек-
ции вектора, элемента тензора) по выбранному направлению в виде двухмерного гра-
фика (профиля), распределение скалярной величины по сечению в виде трехмерной
поверхности, либо двухмерной карты изолиний. Распределение векторной величины
по сечению (векторное поле) принято изображать множеством стрелочек, указываю-
щих направление векторов с длинами, пропорциональными модулю локальной скоро-
сти. Максимально наглядное изображение эволюции скоростного поля во времени
достигается применением средств анимации.
Для измерений характеристик поля скорости используют как методы визуализации
течения, так и зондовые методы, например, пленочный термоанемометр, лазер-
ный допплеровский анемометр, ультразвуковой допплеровский измеритель ско-
рости. Принцип действия первого основан на зависимости теплообмена между нагре-
той пленкой и жидкостью от скорости течения. Оба допплеровских измерителя исполь-
зуют эффект изменения частоты излучения (света, ультразвука) при движении источника
относительно приемника.
Н. Nygaard и соавт. (1992; 1994) измерили распределения скорости и турбулентных
сдвиговых напряжений за здоровыми и стенозированными аортальными клапанами
человека, а также за имплантированными искусственными клапанами сердца Starr-
Edwards и St. Jude Medical с помощью пленочного термоанемометра. У здоровых па-
циентов турбулентные напряжения не превышали 4 н/мг, со стенозированными аор-
тальными клапанами достигали 40 н/м , а с имплантированными искусственными кла-
панами сердца — 120 н/м2. Рассчитанный по результатам измерений относительный
индекс гемолиза в исследованном сечении, учитывающий как величину сдвигового
напряжения, так и время его действия, равнялся 0,003 102, 0,2-10 ; и 30-ЮЛ соот-
ветственно, для трех групп пациентов (рис. 4.23).
В лабораторных экспериментах наглядные результаты были получены методом ви-
зуализации микрочастицами. К. В. Chandran и соавт. (1989), исследуя поток за искус-
ственными клапанами сердца Starr-Edwards, Carpantier-Edwards, Bjork-Shiley, St. Jude
Medical в полости, моделирующей геометрию левого желудочка в фазу диастолы, под-
твердили, что более предпочтительна ориентация диска в сторону задне боковой стен-
ки левого желудочка, уменьшающая размер застойных зон (см рис. 2.94; 4 24, а). Для
Рис. 4.23. Распределения скорости за здоровым аортальным клапаном человека, за искусствен
ными клапанами сердца Starr-Edwards и St. Jude Medical, измеренные в пациентах ме
тодом пленочного термоанемометра (по Н. Nygaard etal., 1992)
________ _________ 233 ---------
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
двустворчатого клапана St Jude Medical гидродинамически оптимальной признана ори-
ентация осей поворота створок протеза по центру передней и задней створок мит-
o JbHoro Лапана (см рис. 2.94; 4.24, г). Таким образом, для двустворчатого искусст-
^ного клапана сердца рекомендована антианатомическая ориентация протеза при
имплантации, снижающая вихреобра. ование.
а б в г
Рис. 4.24. Схемы течения жидкости в стеклянной модели левого желудочка в середине диастс
за митральными искусственными клапанами сердца Bjork-Shiley (BS) и St. Jude Medical
(SJ) в зависимости от их ориентации (по К. В. Chandran et al., 1989): оптимальные (а, г)
и неоптимальные (б, в) ориентации протезов
Наиболее распространенным в условиях лабораторного эксперимента стал метод
двухкомпонентного лазерного допплеровского анемометра. С его помощью были про-
ведены подробные измерения скорости в стационарном и пульсирующем потоках, в же-
стких прозрачных моделях аорты, левого желудочка и легочной артерии (Yoganathan А. Р
et al., 1988) — рис. 4.25 Показано, в частности, что единственный шаровой клапан,
использующийся клинически, Starr-Edwards, и обладающий высокой надежностью,
имеет посредственные гидродинамические характеристики. Поток через проходное от-
верстие седла и вокруг шара формировал периферическое струйное течение, отрыва-
ющееся от шара В пик систолы скорость в проходном сечении достигала 2,2 м/с Зона
низкоскоростного возвратного течения в следе за шаром наблюдалась в пик систолы
и фазу торможения потока. В фазу торможения скорость в центре канала низкая.
В начале систолы за шаром образовывалась обширная зона следа, которая увеличи-
валась в размерах и существовала до конца систолы. Максимальная скорость возврат-
ного течения составляла 0,25 м/с. Поле скорости в митральной позиции подобно аор-
тальной. Вихревые зоны способствуют тромбообразованию на клапане. Существова-
ние обширной застойной зоны приводит к повышенному перепаду давления на шаровом
клапане относительно поворотно-дисковых и двустворчатых. Индекс производитель-
ности составлял 0,3-0,36 Регургитация состояла только из обратного перетока при
закрытии, так как шар в закрытом состоянии обеспечивал практически полную герме-
чно ь Типичный объем регургитации составлял 5 мл за удар. Высокие турбулент-
ные касательные напряжения возникали на границах струй. Интенсивность турбулент-
но ти в пи систолы не уменьшалась. В пристенных слоях и у поверхности шара турбу-
лентные напряжения, опасные для развития гемолиза, достигла 3500 дин/см2.
систолу на выходе дискового клапана Omnicarbon формировались два струйных
течения корости через большое отверстие и через малое проходное отверстие оди-
наковы и составили 2,1 м/с на расстоянии 7 мм от седла. Радиальный размер зоны
±Г11еЧеНИЯ Оце"ивался в 2 мм, а скорость в ней достигала 0,05 м/с. В фазу
тр д попеРечнЬ|И Размер этой зоны увеличивался до 8 мм У противоположной
того в ппмгто^°М ПР°ХОДНОМ отверстии зона обратного тока еле различима Кроме
* ньпсзонах малого проходного отверстия в фазы ускорения и торможе-
ГЛАВА 4. Гидродинамика искусственных клапанов сердца
Рис. 4.25. А. Р. Yoganathan (Department of Biomedical Engineering, Georgia Institute of Technology,
USA); профили скорости и турбулентных сдвиговых напряжений за искусственным кла-
паном сердца Starr-Edwards; профили скорости во взаимно перпендикулярных сечени-
ях за клапанами Omnicarbon и Duromedics, измеренные лазерным допплеровским ане-
мометром (по А. Р. Yoganathan et al., 1988)
ния потока наблюдались з^Х^м/Гс °^Хн^размедо^апана уменьша-
п₽оизвод7д;ьн5Т/с)^
0,4-0,65. Струйные высокоскоростные течения (до 5 _
закрытом положении и седлом, с одной Р булентные напряжения в щеле-
промывают область щели, но с другойст р течением жидкости через от-
вых зазорах значительно выше, по СРВВН ть форменные элементы крови. В боль-
крытыи клапан, а следовательно, могут ра РУ течения также существовали узкие
шом проходном отверстии на границах стру' - МаксиМальные сдвиговые на-
области больших турбулентных САВИГ°ВВ1* . Ji. дин/см2 на расстоянии 7 и 13 мм от
пряжения в пик систолы достигали 120' Q меньше, по сравнению с шаровым
клапана, соответственно, то есть были з турбулентные сдвиговые напряже-
клапаном. В фазы ускорения и торможени обласТи больших сдвиговых напряже-
ния были меньше. В малом проходном сеч |Х напряжении на расстоянии
« более широкие, профили „рбуле»™х “““ X»"'
15 мм от клапана имели максимумы на гр
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
Две полукруглые изогнутые створки двустворчатого клапана Duromedics делили на-
бегающий поток на три неравные струи — две большие через боковые проходные от-
верстия и малую — через центральное отверстие Профиль скорости в сечении, пер-
пендикулярном створкам, имел три максимума и два минимума из-за торможения жид-
кости в следах за створками. В фазу торможения течение было наиболее возмущенное,
и поток через центральное отверстие увеличен в размерах по сравнению с фазой ус-
корения В боковых и центральном потоках на расстоянии 8 мм от клапана скорости
достигали в пик систолы 2,2 м/с Эти значения скоростей сохранялись до расстояния
в 13 мм На расстоянии 20-30 мм от клапана струи сливались. За седлом в пристеноч-
ной области располагались зоны отрыва потока, имевшие наибольшие размеры вбли-
зи шарнирных механизмов В закрытом состоянии утечки происходили через щель меж-
ду створками и седлом На расстоянии 1 мм от щели скорости достигали 2-3 м/с,
а турбулентные сдвиговые напряжения — 3000 дин/см Большие турбулентные сдви-
говые напряжения были характерны для слоев с высоким градиентом скорости, возни-
кающих за створками. По оси потока турбулентные сдвиговые напряжения достигали в
пик систолы 1150 и 1500 дин/см2 на расстояниях, соответственно, 8 и 13 мм за клапа-
ном Наибольшие возмущения потока были характерны для течения в центральном от-
верстии, а турбулентные сдвиговые напряжения достигали в нем 1700 дин/см2 на рас-
стоянии 11 мм от корпуса Возможно, на более близких расстояниях значения напря-
жений были еще выше.
A A. Fontane и соавт. (1996) провели измерение скоростного поля за искусственны-
ми клапанами сердца Starr-Edwards, Bjork—Shiley, St Jude Medical трехкомпонентным
лазерным допплеровским анемометром. Это позволило получить полную информацию
о пространственном течении за клапанами В двустворчатом клапане St Jude Medical
течение близко к одномерному — проекции вектора скорости на плоскость, перпенди-
кулярную оси клапана, на порядок меньше осевой составляющей скорости. Напротив,
в дисковом клапане Bjork—Shiley Monostrut течение существенно трехмерное, особен-
но в малом проходном отверстии (рис. 4 26). Пара вихреи с противоположно направ-
ле м вращением, занимающая примерно 2/з поперечного сечения, сохранялась на
значительном расстоянии вниз по потоку за дисковым клапаном
Высокое временное разрешение метода лазерного допплеровского анемометра
позволяет регистрировать турбулентные пульсации скорости, а по ним рассчитывать
сдвиговые напряжения в потоке важные величины для оценки гемолиза на искусст-
Рис. 4.26 Структура вторичных течений
сердца St. Jude Medical и Biork-Sh *’Пв^ечном сечении за искусственными клапанами
_________2““ ДОППЛв₽О«!“"м анемометром (епУ0 А°1О5Х;ХТ199ТбГКОМП°НеНТНЫМ Ла3вР'
236 ------—. ’ f
Bjork-Shiley Monostrut
z, мм х = 15 мм Q = 30 л/мин
ГЛАВА 4 Гидродинамика искусственных клапанов сердца
венных клапанах сердца. D. D. Hanle и соавт (1989) рассчитали распределение сдвиго-
вых напряжений в аортальной позиции за клапанами Smeloff-Cutter. Bjork—Shiley, St Jude
Medical и lonescu-Shiley (рис. 4,27). Максимальные сдвиговые напряжения были зафик-
сированы за перикардиальным биопротезом lonescu-Shiley — до 112 н/м< Максималь-
ные сдвиговые напряжения в остальных клапанах составили 74-106 н/м2
Метод ультразвукового допплеровского измерения скорости потока позволяет про-
водить количественный анализ скоростного поля как in vivo (цв вкладка, рис 9), так и
в экспериментальных установках, моделирующих упругие свойства аорты и желудочка
D. Morvan и соавт. (1984) измерили двухкомпонентным ультразвуковым датчиком поле
скорости в осевом сечении модели упругого желудочка. D. Farahifar и соавт (1985) на
той же экспериментальной установке измерили две составляющие скорости (продоль-
ную и радиальную) за клапанами Smeloff-Cutter и Bjork-Shiley в нескольких сечениях
модели упругой аорты (рис. 4.28). В результате, было установлено, что эластичность
стенки играет важную роль в подавлении гидродинамических возмущений в аорте
Рис. 4.27. Распределение скорости (вверху) и сдвиговых напряжений (внизу) за шаровым
искусственным клапаном сердца Smeloff-Cutter и перикардиальным биопротезом
lonescu-Shiley, измеренные лазерным допплеровским анемометром (по D. D. Hanle
et al., 1989)
₽ИС. 4.28. Развитие течения в модели упругой аорты (вид сверху и сбоку) за шаровым искус-
ственным клапаном сердца Smeloff-Cutter в систолу, измеренное ультразвуковым
допплеровским методом (по D. Farahifar et al., 1985)
237 ---------
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
Однако в непосредственной близости от клапана структура течения определялась, глав-
ным образом, особенностями конструкции протеза, а влияние эластичности аорты было
относительно меньшим.
Ра: витке измерительной и вычислительной техники привело к созданию новых при-
боров и методов клинической и лабораторной диагностики скоростного поля в искус-
ственных клапанах сердца. Так, в исследованиях in vivo характеристики скоростного
поля за искусственными клапанами сердца стали измерять с помощью метода маг-
нитного резонанса, пространственное разрешение которого близко к разрешению ме-
тода лазерного допплеровского анемометра. Метод фазово-контрастного магнитного
резонанса основан на эффекте фазового сдвига сигнала магнитного резонанса, про-
порционального скорости движения крови в магнитном поле. В работах J. Schwitter
(2000) и S Kozerke и соавт. (2001) были измерены распределения скорости за здоро-
вым аортальным клапаном, а также за клапаном с недостаточностью створок и за кла-
паном St Jude Medical, имплантированным в аортальную позицию (рис 4.29), Высокая
стоимость подобных измерений не позволяет применять их в общедоступной диагно-
стике клапанных пороков.
В последнее время в лабораторных исследованиях первое место занимает метод
трассирующих частиц (PIV — particle image velocimetry), точность и быстродействие
которого определяются разрешением телекамеры, быстродействием компьютера и
структурой программного обеспечения. Метод позволяет по длине треков частиц, дви-
жущихся вместе с жидкостью, рассчитывать по одному кадру векторное скоростное
поле всего течения. При современной мощности компьютеров становится возможным
в реальном масштабе времени обрабатывать видеоизображение и наблюдать эволю-
цию распределения скорости пульсирующего течения жидкости в искусственных кла-
панах сердца (цв вкладка, рис. 11, 14).
Структура потока за экспериментальным трехстворчатым клапаном была получена
в работе Ch Bru скег и соавт. (2002) в виде профилей и векторного поля скорости в
плоскости симметрии и в поперечном сечении канала в фазу максимального расхода
(рис. 4,30). Тонкие открывающиеся под большим углом створки вносят в поток мини-
мальные возмущения и обеспечивают их безотрывное обтекание.
W. L. Um и соавт. (1997) использовали метод трассирующих частиц для сравнитель-
н и о енк п раметров гидродинамики каркасного биопротеза с известными механи-
ReCk-Qh искусственными клапанами сердца — шаровым Starr-Edwards и дисковым
jor iey На рис. 4.31 представлена визуализированная картина течения, вектор-
v. см/с
Рис. 4.29. Профили скорости в начала
него резонанса за искусствами.*^* И *°НЦе систолы- измеренные методом магнит-
ным в аортальную поэмки» < ” клапаном сердца St. Jude Medical, имплантирован-
____________ Р альную позицию (по J. Schwitter, 2000)
- В ------------------
ГЛАВА 4 Гидродинамика искусственных клапанов сердца
Рис. 4.30. Визуализация и векторные поля скорости, осредненные по 50
циклам, в фазу максимального расхода за эксперименталь-
ным трехстворчатым искусственным клапаном сердца
(по Ch. Brucker et al., 2002)
ные поля скорости и области максимальных сдвиговых напряжений, полученные при
исследовании клапанов в стационарном потоке. Максимальные сдвиговые напряже-
ния в потоке за биопротезом St. Vincent вдвое превышали значения сдвиговых напря-
жений за искусственными клапанами сердца Starr-Edwards и Bjork—Shiley. В следую-
щей работе W. L. Lim и соавт. (2001) провели испытания этих же клапанов в пульсирую-
щем потоке
В качестве примера измерения нестационарного поля скорости за митральным кла-
паном в прозрачной эластичной модели левого желудочка методом трассирующих ча-
стиц приведем работы Р Р. Vlachos и соавт (2001) и О. Pierrakos (2002). На рис. 4.32
построены мгновенные векторные поля скорости и контуры распределения завихрен-
ности в диастолу. Видеосъемка велась со скоростью 256 кадров/с, пространственное
разрешение векторного поля скорости составляло 0,8 мм. В результате использова-
ния этого метода было установлено, что антианатомическая ориентация митрального
двустворчатого протеза заметно уменьшала возмущения потока в левом желудочке.
Многообразие конструкций дисковых и двустворчатых искусственных клапанов сер-
дца включает протезы с плоскими и профилированными запирающими элементами.
Выбирая профиль створок, разработчики клапанов стремятся минимизировать разме-
ры застойных зон и снизить величину сдвиговых напряжений, действующих на фор-
менные элементы крови, тем самым пытаются уменьшить сопротивление клапана, ко-
личество тромбозов и уровень гемолиза. М. Grigioni и соавт. (2001) сравнили профили
скорости и сдвиговых напряжений за искусственными клапанами сердца St. Jude
Medical Hemodinamic Plus с плоскими створками и Sorin Bicarbon с профилированными
створками в плоскости симметрии канала. Развитие профиля скорости за обоими кла-
панами имеет схожий характер — три максимума скорости сглаживаются вниз по те-
чению, и на расстоянии полутора диаметров канала профиль за клапаном St. Jude
Medical Hemodinamic Plus становится равномерным в центре Открывающиеся под мень-
шим углом створки клапана Sorin Bicarbon направляют поток через боковое проходное
—--------------------------------------------------- 239
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
Рис 4.31 Визуализация течения методом трассирующих частиц с расчетом векторных полей ско
рости и распределений сдвиговых напряжений в клапанах Starr-Edwards, Bjork-Shiley
и ксенопротезе St. Vincent при Re=5000 (по W. L. Lim et aL, 1998)
отверстие в сторону стенки и
течения в синусах По иному оаз^ирл!^' уменьшают протяженность зоны обратного
клапаном St Jude Medical HemodinamiJ w распреАеление сдвиговых напряжении За
свое положение и амплитуду отногитрпи US ДВЭ максимУма (до 200 н/м2) сохраняют
Р сширение областей повышенных Н° центральн°и оси кроме того, наблюдается
ном Sonn Bicarbon, благодаря изогнх/тпгтГ°ВЫХ напряжений вниз по потоку. За клапа-
ак следствие распределение сдвиглрк И Створок Формируется трехмерное течение
нию На расстоянии диаметра канала о"'Х *апряжении качественно меняется по тече-
ныи максимум сдвиговых напряжении КЛапана в центРе возникает локаль-
ни по течению (рис 4 33) н/м который постепенно уменьшается
~ 240 —
ГЛАВА 4 Гидродинамика искусственных клапанов сердца
а б
Рис. 4.32. Распределения скорости (стрелочки) и завихренности (интенсивность серого) в мо-
дели левого желудочка с имплантацией искусственного клапана сердца St Jude
Medical в анатомическую (а) и антианатомическую (6) позиции, рассчитанные по
измерениям методом трассирующих частиц (по О. Pierrakos, 2002)
Рис. 4.33. Профили средней скорости (слева) и максимальных турбулентных сдвиго-
вых напряжений (справа) за двустворчатыми искусственными клапанами
сердца St. Jude Medical Hemodinamic Plus и Sorin Bicarbon (по M. Grtgioni
etal., 2001)
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
Влияние конфигурации створок на структуру течения за биопротезами отмечено в
работе A P.Yoganathan и соавт. (1983). Методом лазерного допплеровского анемомет-
рэ измерены профили скорости и сдвиговых напряжений за перикардиальным био-
ротезом lonescu-Shiley и ксеноаортальным би протезом Carpantier—Edwards. Метод
обработки створок обоих биопротезов аналогичный — глутаровым альдегидом, кон-
фигурация створок различна — у перикардиального проходное отверстие ровное, без
изгибов, у ксеноаортального — неправильной формы с сильно искривленными краями
створок. Равномерные в непосредственной близости от створок профили скорости уже
на расстоянии одного диаметра канала от корпуса клапана имеют различный характер:
за ксеноаортальным биопротезом в профиле выделяются два максимума скорости и
две дополнительные области больших градиентов скорости, а следовательно, и боль-
ших сдвиговых напряжений, вызывающих повреждение форменных элементов крови
(рис. 4.34).
R. S. Meyer и соавт. (2001) исследовали структуру потока через закрытые клапаны с
использованием водно-глицериновой смеси в качестве рабочей жидкости при следую-
щих параметрах: Омин = 5 л/мин, Рж =120 мм рт. ст., f=72 уд/мин, dP/dt = 3000 мм рт.
ст/с (физиологическое значение dP/dt = 2000 мм рт. ст./с). Измерения методом трех-
компонентного лазерного допплеровского анемометра были проведены в местах струй-
ных течении за закрытыми запирающими элементами, эти места предварительно оп-
ределялись посредством визуализации течения. Например, для клапана Medtronic-Hall
это место крепления к корпусу малого ограничителя хода и область центрального от-
верстия запирающего элемента, а для двустворчатых клапанов St. Jude Medical и
Carbomedics — места шарнирных креплений. Все исследованные клапаны — Medtronic-
Hall, St. Jude Medical, Carbomedics — закреплялись в митральной позиции, поля трех
составляющих скорости за ними измерялись в фазу систолы, величины рейнольдсо-
вых (турбулентных) напряжений рассчитывались. На рис. 4.35 показаны распределе-
ния скорости (как функции времени и пространственных координат) для клапанов
Medtronic-Hall и St Jude Medical на расстоянии 0,5 мм от седла клапана.
В клапане Medtronic-Hall профили скорости измерялись поперек малого проходно-
го отверстия с шагом 0,2 мм Пик скорости (около 4 м/с) в начале систолы связан с
фазой закрытия клапана и непродолжителен. В щели между корпусом и закрытой створ-
и на( людалось струйное течение с постоянной скоростью 2,6 м/с на протяжении 2,6 с
при полуширине 1,4 мм. Для клапана St. Jude Medical пиковое значение скорости при
h, мм
РИС. 4.34. Профили за перикардиальным .onescu-Shiley (а) и ксеноаорталь-
на расстоянии ошоТ S ®иопротезами Для Двух расходов (170 и 420 мл/с)
_____ ° Кали ра за седлом (по А. Р. Yoganathan et al., 1983)
242 —
ГЛА В А 4 Гидродинамика искусственных клапанов сердца
Рис. 4.35. Распределение скорости и касательных напряжений в зависимости от времени (t) и ко-
ординат (х, у) в щелях клапана Medtronic-Hall и St. Jude Medical в фазу закрытого поло-
жения запорных элементов (по R. S. Meyer R. S., 2001)
закрытии составляло 0,7 м/с, а уровень постоянной скорости з^ОО^мс
вышал 0.1 м/с. Для клапана Carbomad.cs на расстоянии 1 к~ о
после закрытия клапана формировалось струйное тем ( б составляющая
краем створки с аксиальной скоростью до 2,2 м/с. этой оайоне шар-
скорости, направленная по оси поворота створок, достигал ГТоуйных течения с акси-
нирного механизма наблюдались два меньших по разм р гпХоанялись на протя-
альными скоростями до 1,3 м/с. Описанные струйные течения сохранялись на протя
жении всего времени систолы (400 мс). в вине каскадов
Скорости и максимальные Ре-ольдсовью "ХТнХюТ^^^^^^^^
профилен. В начале систолы в папанеiMedt мс наибольшие напряжения
ние напряжений до 18000 дин/см а далеев значение рей.
равнялись 3 дин/см (при у-1 мм) В «-"апа в течение СИСтолы наблюда-
нольдсова напряжения в 10 раз меньше ( 80 д /^ Carbomedics фиксиро-
лись напряжения порядка 450 дин см . Ja за р лин/см2) в зонах больших гра-
валось наличие больших сдвиговых напряжении (3600 дин/см )
Таким образом, в дисковых клапанах макси ав даухстводаатых -
тый клапан наблюдаются в районе ^го"^0ДсравНивать абсолютные значения ско-
в районе шарнирных креплении сборок, д р 0 клапана каждого типа нельзя
ростеи и турбулентных напряжении по измер ,onORnrn яазооа который имеет не-
Указанные величины сильно зависят от ширтипа Тем не менее, проведенные
который разброс значении даже в юпапанах Д направленности и эволюции струй-
исследования позволяют судить о местопол » клапанов.
ных потоков на протяжении фазы закрытого сост
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦ/1
Одним из направлений совершенствования конструкций двустворчатых искусствен-
ных клапанов сердца является разработка узлов крепления створок. Так, шарнирные
механизмы клапанов St Jude Medical, Carbomedics (цв. вкладка, рис. 19), Оп-Х, Medtro-
nic Parallel имеют углубления в корпусе Напротив, крепление створок клапанов Мединж-2,
Карбоникс-1 и ATS осуществляется с помощью выступающих элементов корпуса По-
иски конструкции идеального шарнирного механизма нацелены на обеспечение его наи-
л\чшего омывания кровью и требуют постоянного контроля разрабатываемых моде-
лей методами гидродинамического эксперимента (рис. 4.36, а) Отбраковка неудачных
конструкций на стадии лабораторных исследований позволяет избежать неудач на ста-
дии клинической апробации, сохраняя, тем самым, жизнь пациентов.
Гидродинамика шарниров изучена недостаточно, что приводит к появлению неудач-
ных конструкций — например, клапан Medtronic Parallel имел повышенное тромбооб-
разование в шарнирах. Шарниры дважды омывались кровью в течение цикла сокраще-
ния — при открытом и закрытом состояниях клапана. Скорости обратного потока были
выше относительно прямого. Если плавные обводы углубления и полукруглого выступа
створки клапана St Jude Medical Regent формировали плавное течение без рецирку-
ляционных зон в шарнире, то шарнирный механизм клапана Medtronic Parallel с вне-
запными расширениями и сужениями потока служил источником вихревого нестацио-
нарного течения с застойными зонами, а турбулентные касательные напряжения дос-
тигали 2600 дин/см2 (Ellis J. Т. et al., 2000; Leo Н. L. et al., 2002).
Течение в шарнирном механизме клапана Medtronic Parallel было исследовано
J. Т. Ellis и соавт (1996) методом лазерного допплеровского анемометра. J. М. Gross и
соавт (1996) сравнили результаты расчетов с визуализацией методом водородных пу-
зырьков Однако наиболее подробное исследование Т. М. Healy и соавт. (1998) было
проведено в стационарном потоке на пятикратно увеличенной модели шарнирного
механизма с использованием метода визуализации краской. Зоны застойного тече-
ния, обнаруженные в эксперименте, совпали с областями локализации тромбов в реаль-
ном протезе, подтвердив, тем самым, адекватность моделирования (см. рис 4.36, б).
Случаи разрушения двустворчатых клапанов в организме не раз отмечались в лите-
ра )е Одной из во мокных причин является кавитация. Кавитация — процесс обра-
в и схлопывания пузырьков пара в результате местного понижения давления
ниже критического уровня. В жидкости содержится множество микропузырьков, кото-
скорости и застойные эоны (ooZa sZo Л°Т0К: 3 ~ большие скорости. А -
(поТМ Healy etal 1998) ' двустворчатый клапан Medtronic Parallel
ГЛ A BA 4. Гидродинамика искусственных клапанов сердца
рые быстро вырастают до размера пузырьков при снижении окружающего давления
до критического значения при данной температуре. При превышении критического
давления пузырьки схлопываются. Интенсивный процесс схлопывания кавитационных
пузырей порождает ударную волну и высокоскоростные потоки, вызывающие повреж-
дение материалов.
Лабораторные исследования механики движения створок обнаружили появление
больших отрицательных давлений при закрытии между кромкой створки и корпусом кла-
пана. Такие кратковременные понижения давления могут приводить к появлению и схло-
пыванию кавитационных пузырей. Схлопывание вблизи твердой поверхности вызывает
повышение давления и появление напряжений, превышающих порог упругих деформа-
ций.
Кавитационное разрушение имеет вид язвенной коррозии. Наблюдаемые подобные
разрушения материала у эксплантированных искусственных клапанов сердца позволя-
ют предположить существование кавитации при нормальных физиологических услови-
ях (Kafesjian R. et aL, 1989; Klepetko W. et al., 1989). Кавитационные разрушения наблю-
дались только у механических клапанов и только в митральной позиции. Кавитация
возникает у входной поверхности запирающего элемента митрального клапана в мо-
мент его соударения с корпусом при закрытии (рис. 4.37). Кавитация включает зарож-
дение, развитие и схлопывание пузырьков. Процесс занимает несколько сотен микро-
секунд. Схлопывание пузырьков вызывает характерные высокочастотные колебания дав-
ления, которые обычно и используют для обнаружения кавитации (Chahme G. L. et al.,
1996; Zapanta С. M. et al., 1996). В искусственных клапанах сердца кавитация зависит
от скорости движения запирающего элемента (Richard G. et al., 1994; Lee C. S. et aL,
1996), скорости сокращения желудочка (Graf T. et al., 1991; 1992), течения через щель
закрытого клапана (Makhijani V. В. et al., 1994, Bluestem D. et al., 1994), метода приши-
вания клапана (Wu Z. J. et al., 1995), характеристик материала запирающего элемента
(Lee С. S. et al., 1996; Sneckenberger D. S. et al., 1996). Можно сформулировать пять
главных гидродинамических причин кавитации: пульсации давления, торможение пото-
пузырей вблизи кромок запирающих элементов закрытого клапана.
а - развитое прямое течение жидкости; б - замедление потока; в - начало закрытия створок.
г окончание закрытия створок (no Е. Rambod et al., 1999)
____ 245 ---------
СКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
вихреобразование на кромке (LamsonTC. et aL, 1991), сгущение линий тока и ре-
ргитщионные струи (Makhijani V В. et al., 1994). Последняя причина, по современ-
ы. представлениям, является основной. При формировании регургитационных струй
идкостъ выбрасывается с высокой скоростью из щели между кромкой запирающего
пемента и корпусом Струи, смешиваясь с окружающей жидкостью, образуют сдвиго-
ые слои с интенсивными вихрями, давление в центре которых понижается до уровня,
^обходимого для инициирования кавитации (HeZ. et aL, 2001). Теория подтверждает-
4 наблюдением кавитационных разрушений в месте соприкосновения запирающего
пемента с седлом Расчеты показывают, что скорость в таких потоках может дости-
чь 14 м/с (Makhijani V. В. et al., 1994) Вихреобразование на кромке створки также
»азывает значительное воздействие на возникновение кавитации.
МАТЕМАТИЧЕСКОЕ МОДЕЛИРОВАНИЕ
СТРУКТУРЫ КРОВОТОКА
Экспериментальные методы исследования структуры течения в искусственных кла-
1анах сердца имеют ограничения в части предсказания воздействия сдвиговых напря-
рний на форменные элементы крови как в пространственном разрешении, так и при
лучении переходных процессов. Эти ограничения уменьшают клиническую значимость
«езультатов исследовании, так как не описывают структуру «микро»возмущений кро-
отока в клапанах. Математическое моделирование позволяет описать структуру тече-
Н1я внутри корпуса клапана, то есть в области, недоступной экспериментальным мето-
лам исследования движения жидкости Расчетные методы незаменимы и для описа-
п|я течения вблизи стенки сосуда, где проведение измерений обычно осложняется
ниянием стенки Например, интерпретации результатов метода трассирующих час-
мц мешает «засветка» отраженным светом от границы жидкости с твердым телом. Су-
цественные ограничения экспериментальных методик делают расчетные методы не-
аменимым инструментом оценки закономерностей движения крови Вычислительная
ндродинамика позволяет рассчитать поле скорости как за клапаном, так и непосред-
гвенно в клапане, определить границы областей возмущенного течения, застойных зон.
Развитие методов численного моделирования гидродинамики сердечных клапанов
'пределяется медицинскими и экономическими соображениями. Во-первых, достаточ-
ю точные математические модели являются прекрасной предпосылкой для постанов-
и научных исследований медицинской направленности. Во-вторых, численные моде-
’и н б> ают разработчиков клапанов способами обоснования и предсказания харак-
ристик клапанов, оптимизируя и удешевляя тем самым процесс совершенствования
* конструкции. В-третьих, быстрые оценки, основанные на математических моделях,
югут и пользоваться в медицинских устройствах совместно с методами визуализа-
!in при диагностически процедурах, снабжая врачей оперативной информацией в ре-
пьном времени с целью улучшения ухода за пациентами.
Для овременного уровня развития компьютеров и программного обеспечения раз-
ити г математических моделей клапанов сердца с целью решения перечисленных за-
’зч является перспективным направлением. Трудности моделирования связаны с ре-
чением задачи взаимного движения жидкости и створок клапана, а также разномасш-
ТЬЮ пР°Цессов так, прямой поток через гидравлическое отверстие имеет
масштаб 25 мм, а течение в шарнирных механизмах механических кла-
мимо ММ Риходится моделировать и решать нестационарные задачи, описыва-
нупри г расхода’ задаваемые ритмом сердечных сокращений, так и срыв
«чнтности пик-!л/Ртга°РС>К И Ограничителей хода. Необходимость моделирования турбу-
4жной полью кптлпВ0'ПерВЬ1Х| "турбулизацией потока в пик систолы и, во-вторых, той
рую играет турбулентность потока в механизмах активации тром-
------ 246 ----------------
________________________ГЛАВА 4 Гидродинамика искусственных клапанов сердца
боцитов, образовании тромбов и эмболизации. Временные масштабы также отлича-
ются на порядки от нескольких секунд для процессов деформации эритроцитов под
действием сдвиговых напряжений до миллисекунд для кавитационных явлений при зак-
рытии клапана. Всеобъемлющая математическая модель, описывающая даже несколько
из перечисленных проблем, на сегодняшний день не создана. Однако развитие мате-
матических моделей крайне важно для решения поставленных задач, в первую оче-
редь — для помощи в исследовании влияния структуры потока на функцию клапанов и
на развитие их пороков и, во вторую очередь, — для улучшения существующих и со-
здания новых моделей искусственных клапанов.
Двухмерные модели течения в клапанах сердца, развитые в 70-е гг., основывались
на уравнении Навье-Стокса в переменных завихренности и функции тока. Для трех-
мерных моделей такой подход неудобен. В ранних работах геометрия естественных и
искусственных клапанов была сильно упрощена, так как численные методы применя-
лись на простых декартовых сетках (Au A. D. et al., 1975). Однако даже в то время учи-
тывали движение створок с помощью задания соответствующих граничных условий
(Hung Т. К. et al., 1971). A. D. Au и соавт. (1977) рассчитали ламинарное течение через
поворотно-дисковый клапан при числе Рейнольдса Re=100, что значительно ниже его
физиологического значения, и попытались предсказать тромбообразование. F. N. Under-
wood и соавт. (1977; 1979) рассчитали отрыв потока за осесимметричным дисковым
запирающим элементом при Re = 500. S. R. Idelsohn и соавт. (1985) методом конечных
элементов рассчитали течение в осесимметричных дисковом и шаровом, а также в
поворотно-дисковом клапанах при Re = 900-2000. W. J.Yang и соавт (1983), К. Thalas-
soudis и соавт. (1984) и D. М. Stevenson и соавт. (1985) для расчета уравнения Навье-
Стокса в переменных завихренности и функции тока применили криволинейные сетки
и учли турбулентность (к-е модель). Все перечисленные работы использовали двух-
мерную или осесимметричную постановки (рис. 4.38).
Z. J. Huang и соавт. (1994) для расчета поворотно-дискового клапана увеличили число
узлов расчетной сетки до 90 000 при Re = 10-1000. М. J. King и соавт. (1985) провели
расчет методом конечных элементов для двустворчатого клапана в приближении ста-
ционарного двухмерного потока при Re = 3000.
В исследовании G. Dubini и соавт. (1991) показана эффективность применения ме-
тода конечных элементов для расчета полей скорости и давления на примере обтека-
ния трех типов клапанов. В расчетах М. М. Black и соавт. (1994) подчеркнута необходи-
мость аналитического подхода к описанию течения в клапанах. На расчетной модели
4.38. Расчетные контуры турбулентных сдвиговых напряжений (вверху) и
в осесимметричной модели дискового искусственного клапана сердца при Re - 5000
(по К. Thalassoudis et al., 1984)
247
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
течения через двустворчатый клапан проведено сравнение результатов полученных на
моделях стационарного и пульсирующего течений. Отмечены ограничения модели ста-
ционарного обтекания.
М Lei и соавт (1992) описали стационарное обтекание аортального поворотно-дис-
кового клапана в канале, моделирующем синусы корня аорты Экспериментальное ис-
следование модели проведено методом лазерного допплеровского анемометра при
Re = 800 Расчет проведен в двухмерном приближении Показано, что стационарное
обтекание имеет существенно трехмерный характер, — выявлены два симметричных
спиральных вихря, распространяющихся за клапаном вниз по потоку. Таким образом,
двухмерный расчет не дает адекватного описания течения в дисковом клапане.
М J King и соавт (1994) провели параметрические расчеты конструкции двустворча-
тых клапанов варьируя угол открытия, кривизну створок и положения осей их поворота.
В конце 90-х гг в результате прогресса компьютерной техники стало возможным
решать трехмерные задачи течения в клапанах сердца Е. В Shim и соавт. (1997) про-
вели расчет трехмерного обтекания поворотно-дискового клапана стационарным по-
током при Re = 210 и 450 В расчете предполагалась симметричность течения относи-
тельно плоскости симметрии клапана и использовалась сетка с 32 000 узлами для по-
ловины канала В результате были получены вихревые структуры, сходящие с кромки
дискового запирающего элемента. М. J King и соавт (1996, 1997) выполнили трехмер-
ный расчет для четверти двустворчатого клапана, учитывая его симметрию относитель-
но двух взаимно перпендикулярных плоскостей. В расчете входная скорость менялась
синусоидально для моделирования физиологического потока с Re = 3000 в систолу
С. Kins и соавт. (1997) с помощью многоблочный сетки с 22 000 узлов рассчитали пол-
ное трехмерное течение в открытом поворотно-дисковом клапане при входном стаци-
онарном потоке при Re = 2000—6000 М Krafczyk и соавт (1998) применили метод
Латисса-Больцмана для 5 000 000 частиц при расчете трехмерного течения в трехмер-
ной модели открытого двустворчатого клапана с пульсирующим входным потоком с
систолическим числом Re = 1800.
Для моделирования взаимодействия «жидкость—твердая граница» С S. Peskin
(1972) разработал метод «погруженной» границы (immersed boundary) для объедине-
ния потока крови и структур сердца в единую расчетную область. С. S. Peskin (1977)
применил этот метод для расчета течения в митральном клапане, закрепленном в труб-
ке и в левом желудочке, а М R McCracken и соавт (1980) — в искусственных клапанах
сердца В первых работах метод применялся лишь при малых Re, а в работе С S. Peskin
и соавт. (1980) расчеты были проведены для Re = 200 DM McQueen и соавт. (1982)
разработали метод расчета распределения давлений и скоростей в двухмерной моде-
ли левого желудочка с подвижными стенками (рис 4.39) Метод «погруженной» грани-
цы был применен для описания наполнения желудочка через естественный митраль-
ный клапан, при удалении хорд, а также при имплантированных искусственных клапа-
н ердца - шаровых и дисковых. Одним из важных приложений метода является его
использование при конструировании новых клапанов, - выбор оптимальных конструк-
ивных параметров осуществляется на основе анализа рассчитанного скоростного поля
пмг^НаЛИЗе “Я эксцентриситета (расстояния оси поворота от оси симметрии)
нп 101303143 и кривизны диска на открытие клапана и качество обтекания уста-
чрнию vrnJ^Tменьшеоие эксцентриситета и профилирование диска приводят к увели-
v поосЬилиппрТ81™9 Определено также, что тыльная сторона диска лучше омывается
авт (1989^пагНп°Г° ДИСКа П0 сравнению с плоским (см. рис 4 39) С S. Peskin и со-
•жидкость—твеолаяТтдНИЛИ Мет0Д погРУженной границы для учета взаимодействия
считаны течения r грг^ НИца нз тРехмеРнУю геометрию С помощью него были рас-
“ХХЖ И Клапанах (PeSk,n С S et al . 1997), правда, только при низ-
лировалась турбуле^тность^ечениГ хараХная^я 4°’ * Раб°ТЭХ ^е'
ханических искусственных клапанов’ сеопиа пораженных естественных и ме-
248
ГЛ A BA 4 Гидродинамика искусственных клапанов сердца
Рис. 4.39. С. S. Peskin (Courant Institute of Mathematical Sciences, New York University, USA); расчет-
ные линии тока диастолического наполнения левого желудочка с дисковым искусствен-
ным клапаном сердца на входе для плоского и профилированного диска (по С. S. Peskin
et al., 1980; D. M. McQueen et al., 1982)
Первоначально расчетные модели, описывающие поведение естественного аорталь-
ного клапана, не учитывали взаимодействие его створок с потоком крови В реальнос-
ти взаимодействие кровотока и окружающих тканевых структур оказывает решающее
влияние на процессы открытия и закрытия створок J De Hart и соавт. (2000) предло-
б
Р”с- 4 40 Мгновенное векторное поле скорости кровотока в модели сердца с пульсирующими
камерами желудочков, предсердий, аорты и легочной артерии в диастолу а и систол
(б); в систолу хорошо видна регургитация через митральный клапан по
etal., 1989)
249
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА ____
жили использовать метод конечных объемов для расчета двухмерного нестационарно-
го течения в аортальном клапане с учетом взаимодействия жидкости со створкой аор-
тального клапана, а позднее они же (2000) применили метод конечных объемов для
трехмерной геометрии естественного аортального клапана и бескаркасного биопроте-
за С целью уменьшения затрат течение рассчитывалось только для 1/6 части клапана,
учитывая его симметричность относительно трех плоскостей Причем расчет был про-
веден как для модели каркасного клапана (изотропный клапан в жестком корне аор-
ты), так и для более сложной модели бескаркасного биопротеза, в которой учитыва-
лись упругие свойства стенки аорты (цв. вкладка, рис. 18). Расчеты проведены для за-
ниженного, по сравнению с физиологическим, числа Рейнольдса Re=600 и завышенного
числа Струхала St = 0,3 Течение жидкости считалось ламинарным (рис. 4.41) Физио-
логические значения безразмерных гидродинамических параметров потока в аорталь-
ном клапане в состоянии покоя составляют Re = 4500 и St = 0,06
f = 0.125c
t = 0,175 с
Рис. 4.41. Эволюция векторного поля скорости в
(по De J. Hart et al., 2003)
f = 0,2125с
фазу систолы для модели каркасного биопротеза
250
ГЛАВА 4 Гидродинамика искусственных л Папанов сорд! .
Кинематика движения створок клапана определяется движением жидкости и выр
жается в различии конфигурации створки при ее открытии и закрытии. При открыт» ।
деформации свободных краев створок значительны, в фазу максимального открытия
форма проходного отверстия близка к окружности, а при закрытии принимает тр<
угольную форму Подобная расчетной конфигурация створок зафиксирована на ст
реоизображениях, полученных /л vitro (Gao Z. В. et al., 2000) В результате расчета вза
имодействия клапана с движущейся жидкостью и пульсирующего давления построено
нестационарное векторное поле скорости в клапане Начальное ненапряженное сости
яние клапана соответствует фазе закрытого состояния и отсутствия потока через кл
пан В фазу ускорения во всем расчетном объеме, включая и синусы, наблюдает м
однонаправленный ток жидкости, в фазу полного раскрытия створок — высокоскорос
тной поток по всей площади проходного отверстия и низкоскоростной — в синуса
В конце фазы полного открытия начинается торможение потока В фазу торможен»
за створками формируется рециркуляционное вихревое движение жидкости и створы
начинают закрываться. После смены знака перепада давления клапан закрывается, при
этом происходит медленное обратное движение жидкости и быстрое окончание фазе
закрытия (рис. 4.42).
L. Ge и соавт (2003) особое внимание уделили методам численного моделирова
ния крупномасштабного течения в механических искусственных клапанах сердца, в ч
стности влиянию сеточного разрешения на результаты расчетов Для упрощенной мо-
дели двустворчатого клапана в синусе корня аорты исследовано влияние симметр! о
на начало потери устойчивости течения при увеличении числа Re. Показано, что пото*
за створками наиболее чувствителен к поперечному разрешению сетки Малое кле-
точное разрешение вносило искусственную нестационарность в поток жидкости. По
этому для расчета клапанов рекомендовано оптимальное число узлов 1-2 млн. Болеь
того, было показано, что даже при низких Re=1200 течение имеет развитую трехмер
ную структуру (рис 4 43). Таким образом, опровергаются утверждения ряда авторов
симметричности течения относительно плоскостей симметрии клапанов даже для бэ
лее высоких чисел Re.
Отметим, что для описания процессов тромбообразования и эмболии потребуете.»
еще более высокое разрешение сетки. S. Prakash и соавт. (2001) показали, что pacnei
касательных напряжений на стенках коронарных артерий требует большего разреш
ния расчетной сетки, по сравнению с расчетом поля скорости Понятно, что изучен! i
вопросов травмы форменных элементов крови в искусственных клапанах сердца тр*3
бует не меньшего разрешения.
t-O.Oc / = 0.05 с / = 0,0875 с t- 0,125 с
4.42. Эволюция векторного поля скорости в фазу систолы для модели каркасного биолро..
(по De J. Hart et al., 2003)
251
Ряс. 4 43. Мгновенная картина линий тока и векторного поля скорости в поперечном сечении корня
аорты для модели двустворчатого искусственного клапана сердца в систолу при Re=1200
(по L. Ge et al., 2003)
R’ e fe' о авт ( 002 последовали нестационарные явления, возникающие
при течении в механических искусственных клапанах сердца, - пульсирующий поток,
вихреобразование. закрытие запирающего элемента Показано, что для получения пол-
ной характеристики функции клапана необходимо рассчитывать поле скорости на про-
тяжении всего цикла сокращения,
uo ЧТ° процессы турбулизации и ламинаризации течения в клапанах сердца
НИ В однои м°Дели Требуется разработать численные методы,
но r иггпд читать ламинаРные и турбулентные области, существующие одновремен-
ТОД В== ТеЧеНИИ В настоящее врем* для таких расчетов используется ме-
од моделирования крупных вихрей
чения ус^о^няютсяЯиН°г^У развитию омпьютернои техники и программного обеспе-
панах от bbvxmpdLriy веРшснствуются расчетные модели течения жидкости в кла-
ных к турбулентным БолГРеХМеРНЫМ’ °Т стационарных к пульсирующим, от ламинар-
мерные и трехмерные ста^ион^е^Гт^ГХХео6™6^ МОДеЛеЙ составляют
течения Только r потопы,р ’ а также Двухмерные пульсирующие ламинарные
переходного и турбулентного^ежимо^ течения° МОЖНОСТЬ решения трехмерных задач
соавтР(2002) ^pexS^ G Ке1|У и соавт <1999). Т. Shipkowitz и
рическую трубку (цв вкладка, рис 16 17) D МMen В КЛапане> помещенном в цилинд-
(1996), М J. King и соавт (199R iqqtV ° М МсОиееп и соавт (1985), Т David и соавт
делях корня аорты и левого желудочка рассчитывали течения в осесимметричных мо-
В исследовании М J King и соавт (199^ о
мерного течения в двуствоочятлм сравнивались результаты расчета трех-
потока (Re=3000) с измерениями лазеонь^лп^ В ФЭЗе систолического ускорения
лась полезность разработанной тоехмрпнпйД плеровским анемометром Утвержда-
описания течения за существую1пиьлм . Р нестационарной расчетной модели для
М Krafczuk и соавт (1998) - цв вкла проектиРУемыми двустворчатыми клапанами
расчета трехмерного пеоехолнлгп гь Кй’ ^ИС ~~ пр°Демонстрировали результаты
го клапана сердца Carbo^^^^^ течания в модели искусственно-
--------- 252 S ПРИ различных углах открытия створок (Re = 1800)
ГЛАВА 4 Гидродинамика искусственных клапанов сердца
В исследовании Т. Shipkowitz и соавт (2002) на основе численного и физического
моделирования (измерения методом трассирующих частиц) оценено влияние положе-
ния створок относительно корпуса и высоты корпуса на распределение давления по
створке, а следовательно, и на величину угла открытия Расчет проводился для стаци-
онарного обтекания створок.
В работе D. Bluestein и соавт (2002) на математической модели показано влияние
техники имплантации клапана на структуру течения и на опасность тромбообразова-
ния. Проведен двухмерный расчет пульсирующего турбулентного течения для двух ва-
риантов крепления двустворчатого клапана в аортальной позиции — с осью клапана,
параллельной оси корня аорты и наклоненной под углом 15°. Подчеркивается, что даже
неуловимый в условиях хирургического вмешательства наклон в 5° приводит к замет-
ным возмущениям скоростного поля На рис. 4 44 и 4.45 видно, как расположенные
под увеличенным углом атаки створки провоцируют вихреобразование, увеличение за-
стойных зон, уменьшение размеров невозмущенного струйного течения На рис. 4.45
показана траектория движения форменного элемента крови вблизи створки
При имплантации искусственного клапана сердца под углом, помимо роста сдвиго-
вых напряжений, увеличивается и время их действия на форменные элементы Это при-
водит к более высокому риску тромбообразования при имплантации клапана под уг-
лом по сравнению с имплантацией вдоль оси аорты
Рис. 4.44. Мгновенное векторное поле скорости плоского турбулентного течения в фазу ускорения
потока в корне аорты при ориентации двустворчатого искусственного клапана сердца
под углом 15» к оси потока и траектории турбулентного течения в центральном проход-
ном отверстии:
а — зоны рециркуляции, б — зарождение вихря; в — отрыв вихря (по D Bluestein et al 2002)
------ --------------------— 253 ----------
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
Рис. 4.45. Расчетное распределение сдвиговых напряжений (т) плоского турбулентного течения,
направленного по оси х, в фазу ускорения потока для двустворчатого искусственного
клапана в корне аорты (значения сдвиговых напряжений отложены по вертикальной оси;
пунктиром показана траектория движения форменного элемента крови вблизи створ-
ки); по D. Bluestem et al., 2002
Главными причинами травмы крови и образования тромбов являются контакт ф р-
менных элементов с искусственными поверхностями и сдвиговые деформации Изве-
стно, что степень травмы крови есть функция величины сдвиговых напряжений и вре-
мени их воздействия на форменные элементы крови (рис. 4 46, а) Зная положение и
скорость отдельных элементов крови во время их движения в клапане, можно опреде-
лить длительность воздействия поля сдвиговых напряжений. В исследованиях
М. Giersiepen и соавт. (1990), L Wurzinger и соавт (1986) предложен способ оценки
степени травмы крови с учетом совокупного влияния этих двух факторов Концепция
уровня активации форменных элементов предлагает учитывать «историю» воздействия
сдвиговых напряжений на отдельные элементы, суммируя (вдоль траектории движе-
ния элемента) произведения локальных значений сдвиговых напряжений на время их
действия (см рис. 4 46, б), причем каждый из сомножителей возводится в степень,
численные значения которой определяются экспериментально при модельных исследо-
ваниях травмы крови в образцовых сдвиговых турбулентных течениях Предполагаемый
индекс гемолиза Е рассчитывается по формуле
N
Е = -Г
^турбулентную составляющие - ин-
ктории, t - время действия сдвигового напряжения т' г Количество Рассчитанных тра-
Процесс построения поля осреднении.* Р ~ эмпирические коэффициенты
зующий точечное сканирование ростеи и сдвиговых напряжений, исполь-
рным или термоанемометром с последующим
254 —_____
ГЛАВА 4 Гидродинамика искусственных клапанов сердца
Рис. 4.46. Травма форменных элементов крови:
а — зависимость гемолиза от величины сдвигового напряжения и времени его действия на фор-
менный элемент (по D Arora et al , 2003), б — «истории» действия сдвиговых напряжений вдоль
траектории движения форменного элемента 1 — траектория у створки клапана ориентированного
под углом, 2 — траектория у створки клапана, ориентированного по потоку, 3 — траектория вдали
створки клапана, ориентированного под углом, 4 — траектория вдали створки клапана, ориентиро-
ванного по потоку (по D Bluestein et al 2002)
осреднением по ансамблю занимает достаточно много времени и сил Метод трасси-
рующих частиц с использованием видеокамеры позволяет регистрировать скоростное
поле непрерывно во времени и в пространстве Несмотря на случайный характер рас-
положения точек измерения, необходимая их плотность достигается объединением ин-
формации с нескольких видеокадров Отслеживая траектории отдельных форменных
элементов крови (рассчитываются по известному полю скорости) в полях сдвиговых
напряжений, соответствующих моментам прохождения элементов, можно определить
временную зависимость действия сдвигового напряжения на выбранный элемент Опи-
сание движения отдельных частиц жидкости называется лагранжевым подходом, в от-
личие от эйлерового описания, присваивающего величину скорости (сдвигового на-
пряжения) каждой точке пространства
$ Alun и соавт (2001) и Y G Lai и соавт. (2002) рассчитали процесс закрытия створки
и его влияние на возникновение кавитации в механических искусственных клапанах сер-
дца Из-за сложности проблемы авторам пришлось ограничиться расчетом двухмер-
ной модели кромки створки Были рассчитаны поля скорости и давления в окрестнос-
Ти створки при ее повороте от 0° до полного закрытия (64° по отношению к оси кана-
ла) На цв вкладке, рис. 20, представлены карты изолиний скорости, а также построены
линии тока для трех моментов времени фазы закрытия створки Максимальные скоро-
ди отмечены вблизи кромки створки, причем с увеличением угла поворота скорость
жидкости в этом месте возрастает до 13,3 м/с (при 63,83°) При этом скорость самой
кромки створки составляла 2,1 м/с С увеличением угла поворота створки у ее кромки
Расширялась область отрицательных давлений в жидкости Минимальное рассчитан-
ное давление достигало 69 КПа (-517 мм рт ст)
аким образом, подтверждение результатов расчетных моделей тестовыми экспе-
риментами позволит в дальнейшем заменить дорогие экспериментальные исследова-
ния более дешевыми расчетными С одной стороны, расчетные методы позволяют до-
тичь более высокого пространственного и временного разрешения, с другой сторо-
Ь|’ огРаничения времени расчета и мощности компьютеров заставляют отказываться
'----~----------------__________________ 255
ИСКУССТВЕННЫЕ КЛАЛ АН Ы СЕРДЦА
от моделирования турбулентности и взаимного влияния жидкости и запирающих эле-
ментов клапана Сегодня одни исследователи упрощают в расчетных моделях геомет-
рию течения другие для сложной геометрии рассматривают упрощенные режимы те-
чения
ОТЕЧЕСТВЕННЫЕ ИССЛЕДОВАНИЯ
ГИДРОДИНАМИКИ КЛАПАНОВ СЕРДЦА
Сопротивление искусственного клапана сердца потоку крови зависит от его конст-
руктивных параметров — угла открытия запирающего элемента, его формы, располо-
жения относительно корпуса Выбор оптимального сочетания данных характеристик
может заметно улучшить функциональные параметры протеза. Детальные оптимиза-
ционные исследования дисковых клапанов на аэродинамической трубе и в пульсдуп-
ликаторе (Евдокимов С. В , 1980) показали, что оптимальной формой диска является
выпукло-вогнутая, обращенная вогнутостью к восходящему потоку. При плоско-выпук-
лой форме, которая использовалась в клапанах Bjork-Shiley Standard, возможен эф-
фект гидродинамического зависания диска и неполного открытия клапана (рис 4.47).
В исследованиях было показано, что увеличение угла открытия диска, с одной сторо-
ны, приводит к уменьшению градиентов давления на клапане, но с другой, вызывает
увеличение объема регургитации Более сложное влияние на объем регургитации ока-
зывает положение оси вращения диска (эксцентриситет), см. рис. 4.47 Кривизна по-
верхности диска оказывает влияние как на моменты сил, действующих на диск при его
открывании и закрывании, что определяет быстродействие клапана, так и на величины
сдвиговых напряжении в пограничном слое, которые могут вызывать травму формен-
ных элементов крови В соответствии с предложенной автором многопараметричес-
кой оценкой были выбраны оптимальное значение кривизны диска R /D=1,4; R2/D = 1,7,
аэродинамичеТко^И^1еНТа МОМента сил нормальной составляющей силы
МКЧ-59 и Biork-Sh I Э<?>ФеКТа М» от угла поворота а запирающих элементов клапанов
го п гидродинамичес о^ сопос *° Э Ж°Г° П°ТОКа); коэффициенты прямого £ и обратно-
запирающего элемента а и различном" "аНа ЛИКС'2 "РИ раЗЛИЧНЫХ углаХ отхрыТИЯ
потока) Различном эксцентриситете е = е/О0 (для пульсирующего
256
ГЛАВА 4 Гидродинамика искусственных клапанов сердца
угол открытия — 65°, эксцентриситет e/D = 0,2 Результаты этих исследовании были
использованы при разработке отечественных клапанов Ликс-2 и Эмике
Проведенные исследования 38 моделей дискового клапана с различными конструк-
тивными параметрами позволили сформулировать следующие выводы (Доброва Н Б
и др 1 1989) Искусственные клапаны сердца с уменьшенным значением эксцентриси-
тета позволяют получить выигрыш в сопротивлении Минимальное сопротивление име-
ют клапаны со следующими сочетаниями значении относительных эксцентриситета и
кривизны: е = 2e/D0 = 0,40 и р = D^R = 0-0,15 в канале диаметром 29 мм, р = 0-0,25
в канале диаметром 40 мм, е = 0,25 и р = 0,20 в канале диаметром 29 и 40 мм Экспе-
рименты подтвердили, что существуют такие сочетания эксцентриситета и кривизны
диска, при которых диск не открывается на полный расчетный угол Для полного от-
крытия искусственных клапанов сердца типа Эмике с малым эксцентриситетом необ-
ходимо применять диски с большей кривизной Увеличение угла поворота диска по-
зволяет заметно снизить сопротивление клапана, особенно в канале с диаметром, рав-
ным его посадочному размеру (рис. 4.48). Однако увеличение угла может привести и к
росту времени открывания и закрывания клапана и обратного перетока на нем в ре-
альных гемодинамических условиях Из характера зависимости коэффициента сопро-
тивления от угла поворота диска следует, что нецелесообразно увеличивать угол пово-
рота диска более 70° для митральных и более 75° — для аортальных искусственных
клапанов сердца.
Необходимо еще раз подчеркнуть существенную неоднородность течения по вре-
мени на протяжении цикла сокращения Высокоскоростное движение жидкости по все-
му сечению клапана происходит в фазу открытия, открытого состояния клапана и в
фазу его закрытия В фазу закрытого состояния створок по всему сечению отмечается
низкоскоростное рециркуляционное движение, соседствующее с высокоскоростными
струйными течениями в щелевых зазорах между запирающими элементами и седлом
клапана. Сложность одновременного решения таких разнохарактерных, разномасштаб-
ных задач объясняет изолированный анализ систолического и диастолического тече-
ний вблизи клапана, применяемый до настоящего времени Первоначально исследо-
вания течения в фазу прямого движения жидкости (систолу) через искусственный кла-
пан сердца проводили в каналах простейшей конфигурации цилиндрических,
используя квазистационарный подход, то есть заменяли нестационарный процесс на-
бором течений при различных скоростях в стационарном потоке и при полностью от-
крытом запирающем элементе. Л М Вильданов и соавт (1998) в ходе исследовании
Рис. 4.48. Схема дискового искусственного клапана сердца и зависимость его коэффициента
сопротивления от эксцентриситета оси поворота е и кривизны диска р
ровои и др., 1989)
——_ 257
10 Искусственные клапаны сердца
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
развития течения за шаровым и дисковыми искусственными клапанами сердца в ци-
линдрическом канале методом фотохромной визуализации установили, что при числе
Рейнольдса наоегиющего потока, равном 1000 происходит турбулизация течения за
клапаном Известно что в состоянии покоя для митрального клапана Re-2 000, а для
аортального Re=5000 Для количественной оценки структуры потока определены раз-
меры зон возвратных течении за клапаном Эмпирические зависимости имеют вид
। г( =0,08 (1-0,13 (x/r0)2)Re03 для шарового клапана и h/ro = OsO27(1-O,42(x/r )2)Re06 для
х < О.75годля дискового клапана Bjork-Shiley Standard где х — продольная координата
г (или h) — радиус (или поперечный размер) зоны возвратных течений, г0 — радиус
канала (рис 4 49) Авторами предложено пять различных критериев для оценки возму-
щений кровотока за искусственными клапанами сердца нерегулярность профиля ско-
рости, интенсивность возвратных течении, уровень неустойчивости, максимальный
уровень касательных напряжений средний уровень касательных напряжений
Развитие течения в левом желудочке и его эволюцию на протяжении цикла сокра-
щения исследовали Н Б Кузьмина и соавт, 1981 (рис. 4.50) с использованием рентге-
носъемки в ходе моделирования кровотока в аутопсированном сердце При этом от-
мечалось сходство структуры течения за естественным митральным клапаном в аутоп-
сированном сердце, сокращаемом массажером (Кузьмина Н Б и др., 1981), с
наблюдаемым в эксперименте на здоровом интактном сердце собаки (Бураковский В И
и др 1976) Авторы обнаружили, что на протяжении сердечного цикла формируются
НЫМ фотохромной визуализации течения (по л'м'В 8‘аПС,аГ<1, "°стР°енные "° даН‘
чекия (по Л. М. Е ильданову и др., 1998)
ГЛАВА 4 Гидродинамика искусственных клапанов сердца
три характерные конфигурации движения крови (см рис. 4.50). штопорообразное дви-
жение по спирали, направленное по часовой стрелке (во время заполнения желудоч-
ка), циркуляционное движение, осуществляющееся в том же направлении (в заполнен-
ном желудочке при закрытых клапанах) и движение по «петле» (в период выброса из
желудочка)
При удалении аппарата митрального клапана полость левого желудочка расширя-
ется и деформируется. В начале открытия имплантированного шарового искусствен-
ного клапана сердца его запирающий элемент отжимается к наружной стенке желу-
дочка На наружную стенку направляется поток, поступающий в полость в начале от-
крытия. По мере открытия протеза за шаром образуется возмущенная вихревая зона,
которая активно вовлекается в поток в связи с ограниченностью канала течения и со-
измеримостью последнего с протезом Основной поток, носящий неосесимметричный
характер, взаимодействует с местной вихревой зоной за шаром, образуя при этом
циркуляторное движение в виде макровихря, вращающегося против часовой стрелки
(если смотреть от основания желудочка) и распространяющегося от наружной стенки
к выводному тракту, и постепенно занимает всю полость К началу выброса жидкости в
аорту шарик поднимается к опорному седлу и одновременно смещается от наружной
стенки к аорте, что связано с перемещением макровихря в сторону выводного тракта
(см. рис. 4.50). Ось макровихря расположена вдоль продольной оси сердца и опреде-
ляет, таким образом, его вращение против направления трабекулярных каналов. Это
может явиться серьезной причиной травмы эндокарда с последующим фиброэласто-
зом левого желудочка. Авторы предполагали, что введение в шаровой клапан направ-
ляющего аппарата, изменяющего направление вихря, может уменьшить возможность
развития фиброэластоза.
С появлением дисковых и двустворчатых искусственных клапанов сердца, форми-
рующих на выходе нецентральный поток крови, важным направлением исследований
стало определение ориентации клапана как в аортальной, так и в митральной позици-
ях При решении этого вопроса оценивались как потери давления на клапане, так и
структура поля скорости Естественно, в таких экспериментах моделировали сложную
геометрию камер сердца и пространственное расположение сосудов. Для аортальной
ю*
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
позиции такие исследования проведены в работе Н Б. Добровой и др. (1981) с исполь-
зованием плоских моделей дуги аорты для измерения поля скорости методом поляри-
зационной визуализации и объемных моделей для измерений методом лазерного доп-
плеровского анемометра. Показано, что при установке протеза большим проходным
отверстием к внешней стенке канала профиль скорости за протезом более ровный, а
застойная зона значительно уже, чем при ориентации протеза малым проходным от-
верстием к внешней стенке канала (рис. 4.51).
Впервые обнаруженное в раооте В. И Бураковского и соавт (1976) винтообразное
дв1 жение крови в левом желудочке сердца при помощи рентгеновской киносъемки рен-
тгеноконтрастных частиц явилось причиной появления дополнительного режимного
параметра при испытаниях искусственных клапанов сердца — закрутки потока на вхо-
де. В работах Л . А. Роевой (1980; 1990) показано, что начальная закрутка потока (28°)
существенно выравнивает неравномерность профилей скорости в дуге аорты за трех-
створчатым, шаровым и дисковым искусственными клапанами сердца (рис. 4.52).
В стеклянной модели здорового желудочка наблюдалось винтовое расположение
линий тока, направленных от наружной стенки к межжелудочковой перегородке и вер-
хушке, — аналогичное естественным линиям тока в нормальном сердце (Кузьми-
на Н Б и др., 1981) В модели дилатированного желудочка при имплантации диско-
вого искусственного клапана сердца картина течения существенно зависит от ориен-
тации диска относительно стенок. Ось вращения макровихря, возникающего в поло-
сти левого желудочка, направлена перпендикулярно оси сердца. При движении про-
тив часовой стрелки, т. е. при ориентации диска в сторону выводного тракта, линии
тока направлены против линии естественного течения крови в области как входного,
так и выводного трактов (рис 4 53) При направлении диска на муральную стенку воз-
Рис. 4.51.
Течение в плоской модели
входе при двух различных
260 ------
дуги аорты с дисковым искусственным клапаном сердца на
ориентациях диска (по Н. Б. Добровой и др., 1981)
ГЛАВА 4. Гидродинамика искусственных клапанов сердца
Рис. 4.52. Л. А. Роева (Научный центр сердечно-сосудистой хирургии им. А. Н. Бакулева РАМН,
Москва); профили осевых скоростей в аортальном канале с трехстворчатым, шаровым
и дисковым искусственными клапанами сердца на входе в осевом (штриховая линия) и
закрученном на угол 28° (непрерывная линия) потоках, измеренные методом гидроди-
намического двуствольного зонда (по Л. А. Роевой, 1980; 1990)
р«с. 4.53. Течение жидкости в стеклянных моделях левого желудочка - здорового и дилатирован-
ного с имплантированным дисковым искусственным клапаном сердца (по Н. Б.Кузьми-
НОЙ и др., 1981)
?61
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА_________________________________
никэющии поток направленный по часовой стрелке, нигде не пересекает естествен-
ных линии тока Кроме того, при ориентации на муральную стенку за счет близос-
ти стенки жел дочка уменьшена возможность срыва струи со свободного края запи-
рающего элемента Следовательно, можно считать такую ориентацию диска более
удачной
Исследование развития профиля скорости за искусственным клапаном сердца по
времени цикла сокращения проведено В. Н. Юречко и соавт. (2001) методом фотохром-
ной визуализации течения (рис. 4.54). Кривая расхода была разбита на несколько уча-
стков Исследования проводились в интервале каждого участка для получения полной
картины течения. Было выделено несколько стадий функционирования клапана. На пер-
вой стадии лепестки начинают открываться, скорости небольшие. Для этой стадии важ-
но состояние потока за клапаном после его закрытия. Так как после закрытия скорость
резко падает, то формируются застойные и циркуляционные зоны, которые после на-
чала открытия клапана должны вымываться Для этой стадии характерно формирова-
ние профиля скорости в виде двух пиков и небольшой застойной зоны между ними,
как показано на рис. 4.54, при Т = 128мс На второй стадии лепестки полностью от-
крыты, поток через клапан ускоряется. Можно наблюдать формирование трех облас-
тей струйного течения, но пиковые скорости еще невелики. Скорость в областях струй-
ного течения увеличивается при Т = 143 мс, а между лепестками формируется зона
струйного течения (см. рис. 4.54). Далее пиковая скорость между лепестками стано-
вится равной пиковой скорости в областях струйного течения в периферийных зонах.
При Т = 371 мс скорости достигают пиковых значений, и пиковые величины во всех об-
ластях струйного течения приблизительно одинаковые. На границе раздела между цен-
тральной зоной струйного течения и правой областью струйного течения формируется
вихревое образование, которое вызывает неустойчивость профиля на выходе из сину-
са И, наконец, на третьей стадии происходит замедление потока и закрытие клапана.
Скорости во всех областях падают, что можно видеть на рис. 4.54, при Т = 457 мс. Сни-
жение пиковой скорости в центральной струе связано с тем, что на границах между
в <жстолГзТи<скусств^иП₽0бЛеМ Механики РАН’ Москва); эволюция профиля скорости
зуализации (по В К ЮрёХ^^ООП^ ₽°СКаРДИКС П° ВИ’
----- 262 _
ГЛАВА 4. Гидродинамика искусственных клап гнов сердца
зонами струйных течений формируются зоны зэмкнутых циркуляций, которые тормо-
зят центральную струю. При Т = 528 мс профиль скорости в плоскости становится не-
устойчивым. У правого лепестка формируется обратный поток, который способствует
его закрытию, а между лепестками скорость потока падает до нуля, У левого лепестка
формируется обширная зона замкнутой циркуляции против часовой стрелки. Клапан
закрывается Несинхронность открытия и закрытия створок вызвана действием силы
тяжести на створки горизонтально расположенного клапана.
В лабораторных исследованиях механических клапанов сердца на первый план выд-
вигаются задачи уменьшения опасности тромбообразования и кавитации на протезах.
Так, при проектировании новых конструкций шарнирных механизмов проводят тщатель-
ные исследования структуры течения в фазу закрытого запирающего элемента — опре-
деляют направленность и интенсивность струйных течений через щели (рис. 4.55), а также
разрабатывают программы расчета течений внутри шарнирного механизма. Модерни-
зированный шарнир клапана Мединж-2 за счет неравенства зазоров с одной и другой
стороны закрытой створки создает две струи, направленные в противоположные сторо-
ны, которые закручивают поток, формируя более физиологичную структуру течения.
Комплексное исследование характера естественного кровотока в левом желудочке
и аорте методами морфометрии слепков, магнитно-резонансной томографии сосудов,
магнитно-резонансной велосиметрии (рис. 4.56), аналитического описания закручен-
ных течений позволило получить количественные характеристики закрутки кровотока в
аорте и рекомендовать учитывать эту особенность аортального кровотока при проек-
тировании новых моделей клапанов сердца (Бокерия Л. А. и др., 2002). Закрученное
течение по часовой стрелке в аорте отмечено и другими авторами.
Остановимся подробнее на истории развития гидродинамических исследований
искусственных клапанов сердца в Санкт-Петербургском государственном политехни-
ческом университете (бывшем Ленинградском политехническом институте).
Первые исследования на кафедре госпитальной хирургии (заведующий — акаде-
мик Ф. Г. Углов) I Ленинградского медицинского института им. акад. И. П. Павлова и ка-
федре гидроаэродинамики (заведующий — профессор Ю. В. Лапин, рис. 4.57) Ленин-
градского политехнического института им М. И. Калинина по определению коэффици-
ентов гидродинамического сопротивления искусственных клапанов сердца в
стационарном потоке были проведены на простейшей гидродинамической установке
(рис. 4.58). Напорный бак (2), шланги (1, 4), набор стеклянных каналов (3), наклонные
а
р™. 4.55. Демонстрация струй регургитационного потока через закрытые двустворчатые искусст
венные клапаны сердца на стендах НПП «МедИнж».
а - Мединж-2; б - St Jude Medical, в - Carbomedics
------- ------------------ 263 -----------
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
G О О О
О (Ь о © о о Q
0 О О Ф Ф О 0
р 0 Ф р 0 ф 9
0 ф b Ъ о Ф
р q q е ф о
о— о< 6 Ь
а
Рис. 4.56. Систолическое (а) и диастолическое (6) векторные поля скорости в восходящей аорте
пациента, измеренные методом магнитного резонанса; вверху — аксонометрическое
изображение векторного поля; внизу, на проекции в поперечном сечении аорты, про-
дольная составляющая направлена к наблюдателю, поток закручен по часовой стрелке
вдоль течения (по Л. А. Бокерия и др., 2002)
трубки для измерения давления и мерный стакан для измерения расхода — вот ее
составные элементы (Зубцовскии В Н и др, 1972). На такой установке доцент ЛПИ
О Н Бушмарин (см рис 4.57) и профессор I ЛМИ В Н. Зубцовский (см рис 2.62), врач-
хирург П. И Орловский в 1972 г исследовали отечественные шаровые клапаны АКЧ-02,
АКЧ-06, МКЧ-36, МКЧ-25, КМФ-3, полушаровые биопротезы МКЧ-27, чечевицеобраз-
ные МКЧ-29, свиные каркасные биопротезы МКЧ-47 в цилиндрическом канале (модель
аорты) и диффузорах с углами раскрытия 18° и 65° (модель входного тракта левого
политехнПИН И Н Бушмарин (Санкт-Петербургский государственный
политехнический университет)
----- 264 _____
ГЛАВА 4 Гидродинамика искусственных клапанов сердца
1
Рис. 4.58. Гидродинамический стенд стационарного потока (объяснение — в тексте)
желудочка в различные моменты диастолы) при числах Рейнольдса от 2000 до 7000
(рис 4 59).
Более приближенными к реальной ситуации стали исследования характеристик кла-
панов в пульсирующем потоке пульсдупликатора мембранного типа (Углов Ф Г. и др ,
1978) Возможность регулирования частоты сокращений, соотношения длительности
систолы и диастолы, минутного расхода, периферического сопротивления позволяла
моделировать разнообразные условия работы искусственных клапанов сердца в пуль-
сирующем потоке Для соблюдения гидродинамического подобия при испытаниях ре-
альных клапанов в качестве рабочей жидкости использовали 36% водно-глицериновую
смесь (рис 4.60).
По измерениям пульсирующих давлений, ударного расхода, средних утечек, рас-
стояния запирающего элемента от седла искусственного клапана сердца рассчитыва-
лись длительность систолы и диастолы, средние значения давлений, максимальные
перепады, скорость изменения давления, средние систолический и диастолический
перепады давления, давления открытия и закрытия, ударная работа левого желудочка,
площади эффективного отверстия, коэффициент сопротивления (рис 4.61), время от-
крытия и закрытия клапана (Углов Ф Г и др , 1978)
₽ис- 4.59. Зависимость коэффициентов сопротивления митральных искусственных клапанов
сердца в цилиндрическом и диффузорном (с углом раскрытия )
----.--- ------------------------------------—---- 265
И С К У С С ТВЕННЫЕ КЛАПАНЫ СЕРДЦА_____________
О. Схема пульсдупликатора с лазерной приставкой для исследования кинематики
движения запирающих элементов искусственных клапанов сердца
5 г
О
°'05 °" 0.15 0,20 0,25
4'61' разно"Г К°Эффициен™в сопротивления чечевицеоб-
UZ ;T?SZOrO И ШаР°ВОГ° искусственнь,х клапанов
и аортальн??^^3 “ МИТральной (сплошная линия)
ртальнои (пунктирная линия) позициях
266 ---------------
ГЛ A BA 4 Гидродинамика искусственных клапанов сердц 9
Для обеспечения стандартных условии испытаний был сконструирован портатив-
ный пульсдупликатор (рис. 4.62) с автоматическим поддержанием артериального и
венозного давлений, обеспечивающий равномерный профиль скорости на входе в кла-
пан (Любомиров Я. М. и др., авт свид. № 1111751, 1984),
Именно в ходе исследования искусственных клапанов сердца в пульсирующем по-
токе были обнаружены эффекты гидродинамической подвески шарового запирающего
элемента и его автоколебаний в некоторых режимах (рис. 4 63) Предложен конструк-
тивный способ устранения данных нежелательных движений шара.
Для контроля заклинивания запирающих элементов и для проведения оптимизаци-
онных исследовании искусственных клапанов сердца по величине обратных утечек был
сконструирован одноклапанный пульсдупликатор Разработанная методика измерений,
основанная на прямом измерении объема, уменьшила погрешность измерений обрат-
ных утечек при закрытии и в фазу закрытого состояния клапана до 0,1 мл Именно
такая высокая точность измерений позволила определить зависимость объема обрат-
ных утечек от конструктивных параметров клапана (Лапин Ю В и др., 1988)
Причины и характер тромбообразования на искусственных клапанах сердца иссле-
довались методом визуализации течения, основанном на явлении электрофореза.
В качестве рабочей жидкости использовался раствор едкого калия, катод изготовли-
вался в виде гребенки из тонких 50 мкм теллуровых стерженьков, анодом служил тита-
новый корпус клапана. При подаче постоянного напряжения образовавшаяся гидро-
золь теллура визуализировала течение линиями отмеченных частиц. Применяя квази-
стационарный подход к описанию течения в клапане, моделировали различные фазы
обтекания: открытие (однократным открытием запирающего элемента под действием
силы тяжести), течение через полностью открытый клапан в цилиндрическом канале
или в диффузорном канале. Было исследовано течение через шаровой (МКЧ-25), по-
лушаровой (МКЧ-27), чечевицеобразный (МКЧ-29) искусственные клапаны сердца и
стабилизированный формальдегидом ксенобиопротез (рис 4 64) Для регистрации
использовалась кинокамера. Удалось определить направление движения жидкости,
точки отрыва пограничного слоя от поверхности запирающего элемента, характер вих-
реобразования, границы отрывных областей (Орловский П. И , 1975, Зубцовский В. Н.
и др., 1976).
Рис. 4.62. Портативный пульсдупликатор (по Я. М. Любомирову и др
авт. свид. № 1111751, 1984)
______________________267
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
ч.
h
0.15 0.3 0,45 0.5
Рис. 4.63. Траектории движения шарового запирающего элемента искусственного клапана серд-
ца АКЧ-06 и влияние его автоколебаний на коэффициент гидродинамического сопро-
тивления (ц) в канале, геометрически подобном корню аорты
Распределение давлений по поверхности запирающего элемента определялось
продувкой дренированных увеличенных моделей клапанов в каналах различной формы
при числах Рейнольдса 5000-15000 (рис 4 65, 4.66)
По измеренным величинам давления на поверхности элементов протеза и канала
определяли величину скорости потока на границе пограничного слоя, применяя тео-
рему Бернулли (Углов Ф Г и др., 1978, 1980)
Рис. 4.64. Визуализация течения теллуровым методом через искусственные клапаны сердчз
МКЧ-25, МКЧ-27, МК-29 и каркасный ксенобиопротез
--------- 268 ---------------------- -----------------------------------
ГЛАВА 4 Гидродинамика искусственных клапанов сердца
Рис. 4.65. Воздушный стенд стационарного потока для измерения распределения давления
по поверхности увеличенных моделей искусственных клапанов сердца
Рис. 4.66.
Распределение давлений и сдвиговых напряжений по поверхности модели шарового
запирающего элемента искусственного клапана сердца (А — уровень разрушения эрит-
роцитов; Б — уровень морфологических изменений эритроцитов)
диктовалась однопараметрическая
Для расчета величин сдвиговых напрЯ^^ие результаты в конфузорной области,
методика Кочина-Лойцянского, дающая напряжений R мо_
то есть в области максимальных сдвиго щег0 при гидравлическом УД Р _
Величину избыточного давления, во п0 формуле Чугаева ( г
мент закрытия аортального клапана, определяли Ф ТЯ11мОна0.
Др., 1980). осесимметричного обтекания с а_
Рассчитывались параметры течения запирающего элемента искусств ение
ным потоком идеальной жидкости коР^У канале Конечно-разностн Ре_
панов сердца (шар чечевица) в диффуз х реШалось методом устан к ис.
Для функции тока в цилиндрических к00р поверхности тока, которые
зультатом расчета явились осесимметри ________ 269
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
тинной картине обтекания корпуса и лобовой части запирающего элемента, но не опи-
сывали отрывной характер течения за его миделевым сечением (Углов Ф Г. и др , 1980),
рис. 4 67
Более сложный и приближенный к реальному течению расчет Н. М Бессонов и со-
авт. (1988) провели для осесимметричной модели шарового клапана, использовав урав-
нения Навье-Стокса, описывающие течение вязкой жидкости Результаты расчета хо-
рошо согласовывались с экспериментальными данными О. Н Бушмарина и соавт (1990)
по коэффициенту сопротивления шарового искусственного клапана сердца (рис. 4.68)
Остановимся на трех оригинальных исследованиях, приоткрывающих загадки тече-
ния крови в организме, которые были проведены сотрудниками кафедры госпитальной
Рис. 4.67. Профили поверхностей тока при обтекании искусственного клапана сердца с шаровым
запирающим элементом в диффузорном канале
Рис. 4.68.
кой жидкости в шапДеЛеНИе сдвиговых маг*ряжений при осесимметричном течении вяз-
(пунктирная линия) °М искусственном клапане сердца: зависимость рассчитанного
числа Рейнольдса " ИЗМерениОго (сплошная линия) коэффициента сопротивления от
270
В., 4 Гидродинамика искусственных клапанов сердца
хирургии I Ленинградского медицинского института им акад И П Павлова и кафедры
гидроаэродинамики Ленинградского политехнического института им М И Калинина с
целью уточнения параметров кровотока для использования их при конструировании
искусственных клапанов сердца
Методика исследования динамики спиралевидной структуры внутренней поверхно-
сти левого желудочка состояла в измерении параметров трабекулярного аппарата слеп-
ков левых камер сердец людей, умерших не от заболеваний сердца (Углов Ф Г. и др
1984). Слепки изготавливались с помощью заполнения камер сердец, остановившихся
в разные фазы цикла сокращения, быстротвердеющей массой протакрил (рис 4 69)
Для количественного описания движения внутренней стенки левого желудочка из-
мерялись углы между характерными линиями трабекулярности и секущими плоскостя-
ми, параллельными фиброзному кольцу митрального клапана Полученные данные
привели к заключению о том, что сокращение сердца сопровождается двумя парал-
лельными процессами изменением объема желудочков за счет преимущественного
уменьшения его поперечных осей и разворотом внутренней стенки вследствие дефор-
мации желудочка вокруг продольной оси Спиралеобразная форма линий трабекуляр-
ности, а также эффект разворота трабекул, сухожильных хорд и папиллярных мышц
должны способствовать формированию закрученного потока крови в фазу диастолы
по часовой стрелке, если смотреть со стороны митрального клапана (Углов Ф Г. и др ,
1984), см. рис. 4 4, рис 4 69
Разработана методика кинорегистрации движения внешней поверхности сердца с
синхронной записью электрокардиограммы, сигналов расходомера и датчиков давле-
ния Для этого на поверхность левого желудочка закреплялось 20 меток, по движению
которых рассчитывались ротационное и колебательное движения сердца, а также его
деформации кручения и сжатия Эксперименты, проведенные на собаках, подтверди-
ли характер сократительного и вращательного движения левого желудочка, отмечен-
ного при анализе слепков Причем, если для слепков рассматривались отдельно «сис-
толическая», «диастолическая» и «промежуточная» фазы, то при киносъемке in vivo стало
возможным анализировать движение сердца по 25 кадрам в секунду
Для определения направления и величины закрутки потока крови было изготовле-
но оригинальное устройство (рис 4.70), состоящее из ферромагнитной четырехлопас-
Ри°- 4.69. Слепки камеры левого желудочка сердца в различные фазы сердечной деятельности:
а - диастола; б - промежуточное состояние, в -систола
- .__. 271 ----------
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦ^
Рис. 4.70. Исследование структуры кровотока в аорте собаки специальным устройством
катетером для гидродинамических измерений потока крови в сердце (по Е. Ф. Бе
лову и др., 1985)
тной крыльчатки, двух датчиков Холла и измерителей магнитной индукции (Белов Е. Ф.
и др 1985 авт. свид. № 1209155). Калибровочные эксперименты доказали, что крыль-
чатка измеряет угловую скорость жидкости в предположении ее квазитвердого враще-
ния с точностью 4% при угловых скоростях, превышающих 3 рад/с. В эксперименте на
собаках крыльчатка в цилиндрическом кожухе закреплялась последовательно в пяти
сечениях аорты, захватывающих ее восходящий и нисходящий отделы (Лапин Ю В. и
др., 1988). На самописце синхронно записывались сигналы измерителей магнитном
индукции, электрокардиограммы, расходомера и датчиков давления. Максимальные
значения средней скорости вращения у стенки, измеренные в экспериментах, соста-
вили ±3,7 см/с, максимальный угол закрутки (±10 ) зафиксирован в непосредственной
близости от аортального клапана. В нисходящей аорте угол закрутки снижается до 2 ,
вращение направлено против часовой стрелки, если смотреть по потоку. Это направ-
ление соответствует направлению вращения, формируемого в левом желудочке. Раз-
нонаправленный характер вращательного движения за аортальным клапаном связан,
по-видимому, с индивидуальными морфофункциональными особенностями выходного
отдела левого желудочка (Орловский П И и др., 1998).
На основе всестороннего исследования гидродинамических характеристик суще*
ствующих отечественных механических клапанов сердца, а также, исходя из литера-
турных данных о закрученном потоке в камерах сердца и аорте, были сформулирова-
ны требования к новому искусственному клапану сердца: малые габариты, хорошо
обтекаемые конструктивные элементы и закрученный поток на выходе. Этим требова-
ниям отвечал изобретенный авторами (рис. 4 71) трехшариковый искусственный кла-
пан сердца (Белов Е Ф. и др., 1981, авт свид № 873509) — рис. 4 72.
Методика оптимизационных исследовании по коэффициенту сопротивления была
разработана для стационарного воздушного потока. Исследовали модели клапанов в
натуральную величину с изменяемыми конструктивными параметрами (Бушмарин О Н.
и др., 1990) Обширный экспериментальный материал, полученный в физиологичес-
ком диапа. оне чисел Рейнольдса, обобщен аппроксимационными зависимостями. Так,
для шарового клапана получено следующее соотношение. = (а ((1 — S) / S)! +
+ a2((S / (О S) 5 Re 0 25 + AJ (1 + А2 exp(-A3h)), где А=а S+a D+a , а — постоянные ко-
эффициенты, S — отношение площади проходного отверстия к посадочной, D — отно-
шение диаметра шара к диаметру проходного отверстия, h — отношение удаления шара
ГЛАВА 4 Гидродинамика искусственных клапанов сердца
Рис. 4.71. Е. Ф. Белов и Н. П. Галич (ЦНИИ «Гранит», Санкт-Петербург)
от седла клапана к диаметру шара. Re - число Рейнольдса Отметим, что конструк-
тивные параметры шаровых клапанов, применяемых в клиническом практике близки к
оптимальным параметрам, найденным по разработанной методике (рис
Методика оптимизации, примененная к модели трехшарикового ’
дующее соотношение: ^ = (3/(1 - a2D2)/a2D2) +a3)Re ( +(а4+а5 0 7 ® ’Ана_
у — угол между центрами проходного отверстия и шарика в открыт
лиз формул показывает, что сопротивление трехшарикового ^а"аь* 4
ближено к сопротивлению шарового (Бушмарин О. Н. и др., ’ потока коови с
Опираясь на результаты исследования xapai ер ррличины закрутки,
помощью оригинального устройства для измерения направлени испытаний
а также используя методики и стенды для проведения опти^ (Бушмарин О Н.
авторы уточнили конструктивные параметры трехше обретены
И . 1990) и упростили технологи» его' ХныХХиги-
5)“tL им Срезом. перечисленные конструкции сорте-
ИКОВЫХ искусственных клапанов сердца.
Рис. 4.72. Экспериментальные модели трехшар ы0 1049063 (по Е Ф Белову и др.
а - авт свид № 873509.6 - авт свид № 1009458 в - авт свид N.
1981, 1982, 1983)
273
ИСКУССТВЕННЫЕ КЛАПАН Ы СЕРДЦА
Рис. 4.73. Зависимость коэффициента сопротивления модели шарового искусственного клапана
сердца от числа Рейнольдса и конструктивных параметров — величины относительного
проходного отверстия и безразмерного расстояния шарового запирающего элемента
от корпуса
Рис. 4.74. Схема модели трехшарикового искусственного
клапана сердца с регулируемыми конструктив-
ными параметрами для проведения оптимизаци-
онных испытаний
Рис. 4.75. Экспериментальные искусственные клапаны
закрученный поток:
сердца, формирующие на выходе
а трехдисковый, б — трехсекторныи (Белов Е ф
6 двустворчатый с изогнутыми створками (Галич Н П
и др , 1982, авт гвид № 942740),
и др . 1989, авт. свид № 1540818)
вили семейство клапанов, обладающих малыми
де закрученный поток (Орловский П. И. i
угла закрутки сформированного на выходеТотока г___
нову конструкций которых была положена идея сущГсГвован^я
274 —- . ________
размерами и формирующие на выхо-
и др., 1998) Исследования сопротивления и
। позволили сравнить клапаны, в ос-
, . ------------...j закрученного течения в
ГЛ A BA 4. Гидродинамика искусственных клапанов сердца
камерах сердца и аорте и его энергетической целесообразности. Две модификации
трехшарикового, трехсекторный, двустворчатый с изогнутыми створками, трехдиско-
вый клапаны создают углы закрутки потока 0°, 8°, 13°, 15°, 24 , соответственно (Лапин
Ю В. и др-, 1988), Для всех клапанов этого семейства увеличение закрутки связано с
увеличением коэффициента сопротивления. По коэффициенту сопротивления трехша-
риковый клапан несколько уступает шаровому протезу, но выигрывает в размерах (Буш-
марин О. Н. и др., 1990).
Применяемая в настоящее время на кафедре гидроаэродинамики Санкт-Петербур-
гского государственного политехнического университета комплексная программа ис-
следования гидродинамических и биомеханических характеристик заменителей сер-
дечных клапанов состоит из двух частей Первая — исследование интегральных био-
механических и гидродинамических характеристик протезов для оценки их
гидродинамической эффективности и прогнозирования долговечности; вторая часть —
это исследование структуры течения, применяемая для выявления и минимизации об-
ластей возможной травмы форменных элементов крови и образования тромбов. Рабо-
та клапанов моделируется на гидродинамическом стенде с пульсирующим потоком жид-
кости. Для детального изучения скоростного поля дополнительно применяется моде-
лирование течения в фазу максимального расхода на стенде со стационарным потоком
Следует отметить, что все элементы методики были отработаны на серийных механи-
ческих искусственных клапанах сердца, обладающих стабильными характеристиками
Только после этого началось использование методики при исследованиях биологичес-
ких протезов, обладающих индивидуальной структурой, во-первых, и более чувстви-
тельных к условиям испытаний — во-вторых.
Моделирование кровотока в клапанах сердца проводится на двух эксперименталь-
ных стендах. Стенд со стационарным потоком замкнутого типа (рис. 4.76) обеспечива-
ет расход до 10 л/мин и равномерный профиль скорости на входе рабочего участка
Жидкость из нижнего резервуара центробежным насосом нагнетается в верхний, в
котором поддерживается постоянный уровень за счет дополнительной перегородки и
сливной трубы. Движение жидкости по расположенному вертикально рабочему участку
осуществляется за счет перепада давления между верхним и нижним резервуарами.
Расход жидкости регулируется вентилем и измеряется с точностью 2% по перепаду
давления на диафрагменном расходомерном устройстве U-образным жидкостным ма-
нометром. Равномерный поток на входе рабочего участка формируется во входном
устройстве, состоящем из хонейкомба, сетки и конфузора, профиль которого рассчи-
тан по методу Туйетса Рабочая камера, моделирующая корень аорты, представляет
собой оптически прозрачный канал из оргстекла цилиндрический внутри и квадратный
снаружи для минимизации оптических искажений, обусловленных разницей показате-
лей преломления жидкости и оргстекла Размеры канала и осесимметричного расши-
рения, моделирующего геометрию корня аорты (синусы Вальсальвы), выдержаны со-
гласно требованиям ГОСТа 26997-86.
Стенд с пульсирующим потоком (см. рис. 4.76) представляет собой пульсдуплика-
тор (Доброва Н. Б. и др., 1979, авт. свид. № 728864) с усовершенствованной рабочей
камерой. Внесенные изменения позволяют, в частности, испытывать естественные не-
обработанные клапаны, каркасные и бескаркасные биопротезы (Гавриленков В. И. и др.,
патент № 2237452 2004) а также визуализировать движение жидкости и запирающих
элементов 'клапана (Юхнев А. Д. заявка № 2006106661. 2006). Пульсирующий поток
создается в эластичной камере, моделирующей во времени размеры и форму левого
желудочка сердца Задающим устройством является источник пульсирующего давле-
ния. Форма кривой желудочкового давления близка к физиологической, истоличес
кое давление в желудочке регулируется в диапазоне от 100 до мм ^т' CJ' **
н°е давление — от 50 до 200 мм рт ст., предсердное — от 5 до 50 мм рт . '
вившийся режим работы задается плавной регулировкой периферического
сопротивления. При этом ударный объем изменяется от 20 до мл.
-------- ------------------ 275 ---------
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
вычис^1ительн1ЬСИ₽У,°и4ИМ И стационарным потоками, оснащенные измерительно-
вычислительным комплексом:
1 - видеокамера. 2 - датчик давления, 3 - датчик пагхпп» л
ральныи искусственный клапан ceonoa fi _ £ Р Д ' 4 ~ ультразвуковой датчик, 5 - мит-
ромагнитный клапан, в - компьютео Q - РОртальныи искусственный клапан сердца, 7 - элект-
нитныи расходомер, 12- усилительна - п деомонитор- 10 ~ эхокардиограф, 11 — электромаг-
водородны, пузырьков. 16 — частотомер * управления' 14 ~ линия задержки, 75 — генератор
электромагнитных клапановПастоты'Пп^'^^и0011’ управления электронным пультом
Длительности систолы от 0 2 до о 4 ' C°«H™ в от 40 до 120 уд/мин и
ляет ± 0,1 уд/мин, по давлениям н ^абильн°сть работы стенда по частоте состав-
+ 1 г, 1 и Давлениям в камеоах + л 1 мм л
- I МЛ В качестве рабочей жидкости испольНетгаж Р ' П° удаРномУ объему
ду осями митрального и аоотальнпт Уется физиологический раствор Угол меж-
стичного телудочк^I составлдот 34° пГ"00’ на входе и выходе эла-
__ у ьоДУпликатор снабжен комплектами патруб-
_____ГЛА ВА 4 Гидродинамика искусственных клапанов сердца
ков для испытания митральных и аортальных механических искусственных клапанов с
посадочными диаметрами (Df ) от 19 до 31 мм Диаметр и длина входного патрубка
перед митральным клапаном равняются его посадочному диаметру
Начальный участок выходного патрубка выполнен в виде осесимметричного рас-
ширения, моделирующего геометрию корня аорты (синусы Вальсальвы), за которым
следует цилиндрический участок длиной, равной Dnoc Для визуализации движения
жидкости методом водородных пузырьков и запирающих элементов механических ис-
кусственных клапанов сердца предусмотрены специальные рабочие камеры (Юхнев
А Д., заявка № 2006106661, 2006) Для исследования естественных аортальных кла-
панов сердца и бескаркасных биопротезов разработано устройство крепления корня
аорты (Гавриленков ВИ и др , патент №2237452, 10.10 2004), не нарушающее био-
механику работы этой сложной пространственной структуры, состоящей из фиброз-
ного каркаса и оболочечных элементов с различными упруго-прочностными характе-
ристиками
Экспериментальные стенды оснащены измерительно-вычислительным комплексом,
который включает в себя измерительные преобразователи (тензодатчики давления
ПДД-4 (ЗАО «Тимос») и 4-канальный электромагнитный расходомер MF-46 (Nihon
Konden)), системы визуализации движения жидкости и элементов клапана (устройство
генерации водородных пузырьков (СПбГПУ), видеокамеру Sony CCD-TR502E и эхокар-
диограф (Kontron), компьютер Pentium-200MMX с устройствами ввода сигналов датчи-
ков и изображений (12-битный аналого-цифровой преобразователь L-154 (L-Card) и
плату видеозахвата Zoltnx Face-to-Face), а также компьютерные программы ввода и
обработки данных (Power Graph 2.0 (ООО «Интероптика-С»), Pinnacle Studio Plus 10
(Pinnacle Systems GMBH), Grapher 5 0 (Golden Software), Adobe Photoshop 6 0 (Adobe
Systems), Tecplot 7.5 (Amtec Engineering), Video-Test-Dynamic (ООО «Иста-Видеотест»),
MEAN и VELOCITY (СПбГПУ)).
Биомеханические характеристики, определяемые в ходе испытаний, позволяют оце-
нивать гидродинамическую эффективность работы клапанов и прогнозировать долго-
вечность биопротезов Гидродинамическая эффективность определяет энергетические
затраты, требуемые для прокачки жидкости через клапан
При экспресс-анализе проводится испытание клапанов (как в аортальной позиции,
так и в митральной) в стандартном режиме, соответствующем параметрам покоя орга-
низма, а именно частота сокращений f = 70 уд/мин, длительность систолы = 0,33 с,
минутный расход Qm н= 5 л мин Запись сигналов проводится в течение 10 с При пол-
ном исследовании измерения проводятся в течение 35 с в режиме возрастающего
расхода от 2 до 12 л/мин для нескольких значений частоты сокращений 70, 90 и 110 уд/
мин, что соответствует параметрам работы клапанов при физической нагрузке на орга-
низм Программой испытаний клапанов предусматривается измерение их геометри-
ческих размеров (до и в ходе испытаний), пульсирующего расхода через клапан Q(t) и
перепада статического давления на нем ДР T(t), давлений в камерах желудочка (P.(t)),
аорты (Pa(t)) и предсердия (Р Jt)) Регистрация и запись сигналов 5 датчиков и синх-
роимпульсов осуществляется программой Power Graph Частота опроса каждого кана
ла 100 Гц Перед экспериментом проводятся калибровки всех измерительных каналов,
кроме того, учитывается уход нуля датчиков за время измерения Синхронно с изме
Рением пульсирующих давлений и расхода проводится визуализация движения ство
Рок в аксиальной проекции со стороны выхода клапана через оптическое окно видео-
камерой, а в боковой проекции — через эластичную заполненную водой оболочку уль-
тразвуковым датчиком эхокардиографа (рис 4 77, 4 78)
С помощью программы MEAN рассчитываются режимные гидродинамич
Раметры (рис 4 79-4 83) минутный расход — для всего цикла
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
Рис. 4.77. Визуализация движения створок биопротезов в пульсдупликаторе — в фазы закрытого
состояния, открытия створок и полностью открытого клапана:
а — нативныи аортальный клапан б — экспериментальным бескаркасный биопротез в — каркас
ный ксенобиопротез Wessex Medical
среднеквадратичный расход — для фазы прямого тока жидкости через открытый клапан
Чр.е= . V" jQ2(t)dt
и средний обратный перепад давления для фазы обратного тока жидкости через за
крытый клапан
\Р = —f \P(t)dt
Т 1
278
ГЛ А В А 4 Гндродинамика искусственных клапанов сердца
а
Рис. 4.78. Визуализация движения створок биоклапанов в продольном сечении на пульсдуплика-
торе методом ультразвукового сканирования:
а — нативный ксенографт; б — ксенографт, стабилизированный глутаровым альдегидом
а также гидродинамические характеристики работы клапанов: средний прямой пере-
пад полного давления на открытом клапане
ДР =— jAP(t)dt,
Т.п Т
площадь эффективного отверстия клапана в открытом состоянии
ЕОА =
^ср кв
бтбДр
индекс производительности открытого клапана
pi = еод / Snoc,
коэффициент эффективности открытого клапана
DC = ЕОА / So ,
объем обратного перетока при закрытии клапана
VMKP = fQ(t)dt
3
и через щели закрытого клапана
= fQWdt-
V
суммарный объем обратного перетока (объем регургитации)
V = V + V
v закр утеч
потери энергии на открытом клапане
ДЕ. = jAP(t)Q(t)dt.
То
потери энергии при закрытии клапана
ДЕмкр = jAP(t)Q(t)dt,
3
279
ИСКУССТВЕННЫЕ К ЛАЛАНЫ СЕРДЦА~
потери энергии на закрытом клапане
АЕу1еч = J AP(t)Q(t)dt
Тут
и суммарные потери энергии на клапане
ДЕ ~ АЕ + ДЕ + ДЕ ,
+ закр утеч
где Q(t) — мгновенный средний по сечению расход через клапан, измеряемый датчи-
ком электромагнитного расходомера, APCT(t) — мгновенный перепад статического дав-
ления на клапане, измеряемый дифференциальным датчиком перепада давления,
AP(t) = ДРСТ(1) +
pQ2(t)f 1
2 <S2ex
s2
вых J
1
перепад полного давления, учитывающий потери скоростного напора за счет разности
площадей сечений, в которых измеряется перепад статического давления, So —пло-
щадь, рассчитанная по внутреннему диаметру клапана, Snoc — площадь, рассчитанная
по посадочному диаметру клапана, Sex и SBb4 — площади входного и выходного сече-
ний, между которыми измеряется перепад статического давления (меняются местами
в соответствии с изменением направления потока жидкости через клапан) Т — время
цикла сокращения, TQ — время прямого тока жидкости через клапан, Тлр— время дей-
ствия прямого перепада давления, Тз— время обратного тока жидкости при закрытии,
— время обратного тока жидкости через щели закрытого клапана (Юхнев А Д и
ДР-, 2004). _
По среднему прямому перепаду давления (ДР+) сравнивались искусственные кла-
паны сердца с одинаковыми посадочными диаметрами, равными 29 мм. На рис. 4.79
построены перепады давления для четырех значении минутного расхода 3,5; 5,0; 6,5 и
8 л/мин. При Омии = 5 л/мин дР для клапанов St. Jude Medical и Мединж-2 составил
3-4 мм рт ст., а для Medtronic-Hall, Ликс-2, Bjork—Shiley, Эмике лежал в диапазоне от
до 6 мм рт. ст. Во всем диапазоне исследованных расходов клапаны St.Jude Medical
Медин к-2 имели минимальный средний прямой перепад давления (Орловский П. И.
Др , мм рт. ст.
15 -|
позиции пульсдупликат г по'и искусственных клапанах сердца в аортальной
Мединж-2-30, Medtronic-HaH 29 лХ1 ’о'""” JU<,e ’
2gQ ’ Ликс-2-30, Bj6rk—Shiley-29, Эмикс-29)
эмикс
ГЛАВА 4. Гидродинамика
искусственных клапанов сердца
Pi
| 3,5 л/мин
] 5 л/мин
] 6,5 л/мин
0.6
0,3
llllllll
SJM
см
МИ-2
мн
BS ЛИКС-2 ЭМИКС SO
о
Рис. 4.80. Коэффициенты производительности механических искусственных клапанов сердца в
аортальной позиции при частоте сокращений 70 уд/мин (St. Jude Medical-29,
Carbomedics-27, Мединж-2-ЗО, Medtronic-Hall-29, Bj6rk-Shiley-29, Ликс-2-30, Эмикс-29,
Sorin-27)
Использование безразмерной гидродинамической характеристики — коэффициен-
та производительности PI (performance index) — позволило обобщить эксперименталь-
ные данные по среднему прямому перепаду давления для искусственных клапанов сер-
дца различных посадочных размеров (см. рис. 4.80). Чем выше значение PI, тем ниже
перепад давления на клапане. По индексу производительности лидируют двустворча-
тые клапаны с плоскими запирающими элементами St. Jude Medical и Carbomedics, у
них Р| лежит в диапазоне 0,53-0,64 Второе место занимают двустворчатый клапан
Мединж-2 с профилированными створками и поворотно-дисковый Medtronic-Hall с
плоским запирающим элементом (PI = 0,47-0,52). Для поворотно-дисковых клапанов с
профилированным диском Ликс-2, Bjork-Shiley, Эмике, Sorin индекс производительно-
сти ниже — 0,43-0,46.
Главным отличием гидродинамических характеристик биопротезов является увели-
чение их индекса производительности с ростом расхода за счет свойства растяжимо-
сти биоткани В первую очередь, это относится к бескаркасным протезам. Сравне-
ние индексов производительности биопротезов различных типов выделило три груп-
пы — каркасные биопротезы с минимальным значением индекса (PI = 0,28-0,31 при
4DKB= 300мл/с), бескаркасные (PI = 0,36-0,37) и каркасный перикардиальный с макси-
мальной производительностью, достигаемой за счет узкой пришивной манжеты
' ~ 0,45) При увеличении расхода бескаркасные биопротезы, стабилизированные
Диэпоксидными соединениями (АБМ и Э), значительно повышают свою производитель-
2плТЬ’ В Отличие от стабилизированных глутаровым альдегидом (Гавриленков В. И. и др.,
^004) Последние, подобно каркасным биопротезам, имеют ограниченную возможность
Улучшения производительности при больших расходах (см. рис 4.81).
Объем обратного перетока через закрытый клапан определяется величиной прило-
женного обратного перепада давления. На рис. 4.82 представлены значения и
Ри 80 мм. рт. ст. Минимальные утечки зафиксированы у клапана Ликс-2 1,8 мл, мак-
симальные у клапана Эмике — 7,8 мл. Минимальный объем обратного перетока при
закрытии — 4 мл у клапана Мединж-2, максимальный — у клапана Bjork-Shiley 8,1 мл.
° суммарному объему обратного перетока клапан Мединж-2 занимает второе место
°Сле клапана Ликс-2 (минимальный объем).
281
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
V. мл
мл/с
.81. Зависимость коэффициента производительности от среднеквадра-
* тичного расхода для каркасного ксеноперикардиального биопротеза
Бионикс-2 (Б), каркасных ксеноаортального биопротезов КемКор (КК)
Mec*,cal (WM), бескаркасных биопротезов АБ-Моно-Кемерово
и БиоЛАБ-КК/АС (БЛ), экспериментального бескаркасного био-
протеза (Э)
среднеквадра-
^утеч
^закр
10-
h 1111
ЛИКС-2 им -
5 _
0
ЛНКС-2 МИ-2 SJM —------------—----------
Рис 4 R9 ЛЛг>-> - ЭМИ КС
• Обратный переток (объем регургитации» „„
сердца Ликс-2-30, Мединж-2 зо е» 1 я я механических искусственных клапанов
__________ЭМИКС-29 8 а°Ртальной позиции’пульсд^пликатора9' Med,rOniC-Ha,‘-29- BJork-Sbi.ey-29,
282 ---------
ГЛАВА 4 Гидродинамика искусственных клапанов сердца
хЕ. Дж
SJM ЛИКС-2 МН МИ-2 BS ЭМИКС
Рис. 4.83. Потери энергии на механических искусственных клапанах сердца St. Jude Medical-29
Ликс-2-30, Medtronic-Hall-29, Мединж-2-30, Bjork-Shiley-29, Эмикс-29 в аортальной
позиции пульсдупликатора
Суммирование потерь энергии, рассчитанных по фазам сердечного цикла, позво-
лило оценить эффективность функционирования искусственных клапанов сердца в те-
чение всего цикла При Омин = 5 л/мин минимальные суммарные потери энергии (ДЕ)
на клапанах St. Jude Medical и Ликс-2 — 0,10-0,11 Дж, на Medtronic-Hall, Мединж-2 и
Bjork—Shiley — 0,13 0,17 Дж, максимальные потери энергии — на клапане Эмике —
0,23 Дж в 2,3 раза превышают потери энергии на клапане St. Jude Medical. Для иссле-
дованных клапанов ДЕ составили 10-20%, ДЕ еч — 15-55%, а ДЕ* — 30-60% от ве-
личины суммарных потерь энергии В среднем, по всем клапанам при Омин = 5 л/мин
потери энергии в открытом состоянии и потери энергии в закрытом состоянии были
равны (по 43 %), а потери энергии при закрытии составили, в среднем, 14% (см.
рис. 4.83). Однако при увеличении расхода соотношение меняется и потери энергии
на клапане в открытом состоянии составляют наибольшую долю от общих потерь энер-
гии. Минимальные суммарные потери энергии остаются на искусственном клапане
сеРДЦа St. Jude Medical, вторую группу составляют близкие по значению ДЕ на клапа-
нах Ликс-2, Мединж-2 и Medtronic-Hall Максимальные потери энергии — на клапанах
jork—Shiley и Эмике.
В митральной позиции все клапаны были также исследованы в диапазоне значений
минутного расхода от 2 до 8 л/мин. Измеренные при одинаковых значениях минутного
расхода средние перепады давления на клапанах примерно в 2,5 раза ниже по сравне-
нию с аортальной позицией Это объясняется увеличением времени прямого тока жид-
кости через клапаны, а следовательно, уменьшением среднего прямого расхода. За-
висимости др от Q близки к параболическим, как и для аортальной позиции. При
мин ~ 5 л/мин максимальное различие в перепадах давления на клапанах не превыша-
ло 0,5 мм рт ст Минимальный перепад давления измерен на клапане St Jude Medical.
Биомеханические показатели работы клапана рассчитывались с помощью програм-
МЬ| обработки изображении Video-Test-Dynamic (ООО «Иста-В идеотест») по видеоза
писям. S(t) — площадь открытия створок клапана, измеренная по их свободному краю,
— безразмерная средняя площадь открытия створок, Sn/1/So безразмерная пло
аДь при полном открытии створок, S /So — безразмерное пиковое значение площа-
Достигаемое в конце фазы открывания створок, Snn/SnitK — отношение площади пол
Г° 0ТкРЬ1тия к пиковой скорости, DL^ = (D‘r]Ot — Dnoc) / Dnoc — относительное растяже
'—______________________________________________________ 283 ----------
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
ние фиброзного кольца DLcT= (Dcth —Dcth) / DCT(1 относи льное рас яжение сино-
тубулярного соединения, BDI — индекс сгибательной деформации (в аксиальной про-
к ии), BDI = (1BDI) 6. BD)Mav — максимальное значение BDI, D — диаметр, изме-
ренный при нулевом давлении, D — диаметр измеренный при работе протеза на пуль-
сдупликаторе в стандартном режиме (Гавриленков ВИ и др , 2001) О хорошей
биомеханике протеза свидетельствовали его высокая растяжимость, малые индексы
сгибательных деформаций створок и их полная замыкательная функция (рис 4 84) Гид-
родинамическую эффективность определяли в первую очередь, по высокому индексу
производительности PI (либо коэффициенту эффективности DC) и низким обратным
утечкам
В ходе исследования структуры течения в искусственных клапанах сердца оценива-
лось возмущающее действие клапана на поток крови, или, иными словами, опасность
травмы форменных элементов и образования тромбов при течении крови через кла-
пан При экспресс-анализе скоростного поля на стенде со стационарным потоком про-
водилась качественная визуализация течения в клапане методом визуализации линий
отмеченных частиц, состоящих их водородных пузырьков Генерирующая пузырьки спи-
раль располагалась перед седлом клапана Исследование для аортального клапана
проводилось при числе Re = 5000 (Орловский ПИ и др,, 2001)
Полное исследование предусматривало количественную визуализацию временны-
ми линиями водородных пузырьков (рис 4 85) Для определения пространственного
распределения скорости на стенде со стационарным потоком визуализация проводи-
лась в четырех поперечных сечениях за клапаном Расстояние между поперечными се-
чениями равнялось радиусу испытательного канала, диаметр которого соответствует
а -СТВО₽ОК бИО,<ЛаПаНОВ В Фа3* "‘’'«’“’го открытия (бескаркасные биопротезы):
d экспериментальный б — БиоЛАБ кк/дг о
'ы г — Wessex Medical д — КемКор е — Б ' о дЬ-Моно Кемерово каркасные биопроте-
м-пни створок ионикс-2 где Д окружные прекомиссуральные дефор*
284
ГЛАВА 4 Гидродинамика искусственных клапаьн в сср щ.•
Рис. 4.85. Визуализация профилен скорости за дисковыми Ликс-2-30, Bjork-Shiley-29, Medtronic-
Hall-29 и двустворчатыми Мединж-2-30, St. Jude Medical-29, Carbomedics-27 искусст-
венными клапанами сердца методом водородных пузырьков при Re = 2000
посадочному диаметру клапана В каждом сечении профили скорости визуализирова-
2002)ЧеРе3 4 ММ В двух взаимн0 перпендикулярных направлениях (Yukhnev AD et al
Для исследования эволюции профиля скорости в течение систолы визуализация
проводится на пульсдупликаторе в непосредственной близости за клапаном в фазах
ускорения потока (Q = 0,50 ), максимальной скорости (Q = Q ) и при торможении
- 0,5 Qma) Видеорегистрация в каждом сечении проводится в течение 2 мин, необ-
ходимьх для генерации 30 пачек по 4 импульса Частота схода временных линий — от
2.5 до 125 Гц, выдержка — 1/2000 с
На основе анализа изображения линий отмеченных частиц строятся границы харак-
терных зон течения Струйные течения с большими скоростями характеризуются ус-
тойчивой во времени картиной линий отмеченных частиц Застойные зоны с малыми
скоростями рециркуляционного движения жидкости расположены в областях куда не
попадают линии отмеченных частиц, генерируемых в сечении перед клапаном Сдви-
говые течения с большими касательными напряжениями, расположенные между зас-
тойными зонами и струйными течениями, характеризуются неустойчивой картиной
линии отмеченных частиц, их искривлением, формированием и распадом вихревых
структур (рис 4 86, 4 87)
Для количественного описания скоростного поля по 30 оцифрованным изображе-
Ниям снимаются координаты двух ближайших к генерирующей нити временных линии
Рассчитываются с помощью программы VELOCITY 30 мгновенных профилей продоль-
н°и скорости, а по ним — профиль средней продольной скорости По 14 профилям
СреДнеи скорости в программе Tecplot строится распределение скорости по попереч-
н°му сечению канала (цв вкладка, рис 15) Результаты представляются в виде трех
- 85
Рис. 4.86. Визуализация линий тока в дисковом искусственном клапане сердца Ликс-2 и схемы
структуры течения (через малое проходное отверстие, перпендикулярно диску, и через
большое проходное отверстие):
а — седло клапана, б — створка клапана в — струйное высокоскоростное течение, г — области
вихреобразования с большими сдвиговыми напряжениями д — застойные низкоскоростные зоны
низкими сдвиговыми напряжениями
мерной поверхности или плоской карты изолинии осредненной скорости (Yukhnev A D
et al, 2002)
С помощью описанной методики проведено сравнение скоростного поля на выходе
двух популярных дисковых искусственных клапанов сердца — отечественного Ликс-2 и
зарубежного Medtronic-Hall Клапаны отличаются формой запирающего элемента У
Medtronic-Hall — диск плоский с небольшим отверстием в центре, у Ликс-2 ДисК
выпукло-вогнутый Кроме этого, у Medtrontc-Hall имеется S-образныи с каплевидным
расширением в центре ограничитель хода, расположенный по оси клапана и проходя-
щий через отверстие диска второй ограничитель расположен в плоскости седла в про-
свете малого проходного отверстия клапана Ограничители хода у клапана Лике нахо-
дятся в гидродинамической тени запирающего элемента и не видны в просветах про
ходных отверстий
Для сравнительного анализа скоростного поля построены распределения скорости
в безразмерном виде (цв вкладка, рис 15) Клапан Medtronic-Hall формирует на вы
ходе три струйных течения Струя через большое проходное отверстие имеет прямоу
гольную форму в сечении, а две струи через малое отверстие — круглую форму Струи
ное течение через большое проходное сечение клапана Лике имеет серповидную фор
286
ГЛАВА 4 Гидродинамика искусственных клапанов сердца
. „..отм искусственном клапане сердца Мединж-2
Рис. 4.87. Визуализация линий тока в двуств р ЛтпРПстие перпендикулярно створкам,
и схемы структуры течения (через центральное отверстие, перпенд ку
и через боковое отверстие): _ вь1СОкоскоростное течение; г - области
а — седло клапана, б — створка клапана РУ __ застойные низкоскоростные зоны
вихреобразования с большими сдвиговыми напряжен
с низкими сдвиговыми напряжениями
иных течений в два раза превышают
му В обоих клапанах максимальные ск0р°С^чен^ расширяются к периферии. У^ень
среднерасходную скорость. Оба струин застойные зоны в расширении ’
шая (в сравнении с клапаном Me 1001 шой угол открытия и небольшая т
моделирующего синусы корня аор™ чески безотрывное его обтекаа11 попереч-
диска Medtronic-Hall обеспечивает Р 2 занимает значительную ч вносят
время зона отрыва за диском клапан - ничители хода у этого кл НГгГ1П|С_на11
ного сечения на выходе клапана Напро Ограничители хода клапана е ю
минимальные возмущения в поток КР° Олоазования, несмотря на их пиШЬ на
являются источником интенсивного вих проходном сечении исчеза
Формы Отрыв за ограничителем хода в малом Р 1Х
расстоянии 40 мм от корпуса 1а Мединж-2 формируются
На выходе искусственного клапана сердцемед боковые отверстиями
течения — две широкие серпообразные вкладка, рис 15) МакС1^а ерас.
малая струя через центральное отверс сечении удвоенного значен створок
рости струйных течений достигают в отверстии за узлами крепл
ходной скорости В центральном проход _____— 287
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
видны обширные застойные зоны, занимающие до половины площади этого отверстия
Отметим, что вращение створок клапана Мединж-2 относительно оси корпуса обеспе-
чивает постоянное перемещение этих потенциально опасных областей, снижая, тем
самым, вероятность тромбообразования
Для двустворчатого отечественного искусственного клапана сердца Карбоникс-1
исследовано развитие скоростного поля по оси канала Для этого построены распре-
деления осредненной продольной скорости в четырех поперечных сечениях за клапа-
ном (цв вкладка рис 13) При развитии течения вдоль канала наблюдается расшире-
ние боковых струй и вытягивание центральной струи в направлении, перпендикуляр-
ном осям поворота створок Отрывные зоны за створками исчезают уже во втором
сечении (z = 20mm), а за узлами крепления — на расстоянии в два раза большем
В четвертом сечении (z = 40mm) отмечается выравнивание скоростного распределе-
ния.
Разработанные к настоящему времени методики исследования биомеханики и гид-
родинамики искусственных клапанов сердца достаточно универсальны. Они позволя-
ют испытывать естественные клапаны сердца, а также их механические и биологичес-
кие заменители, причем как в аортальной, так и в митральной позициях. Работа клапа-
нов моделируется в широком диапазоне режимных параметров, колебания которых не
превышают 1°о Ошибки при измерении пульсирующих расходов и давлений не пре-
вышают 2°о а распределения скоростей — 10% Гидродинамические параметры и ви-
зуализация движения жидкости и запирающих элементов клапанов записываются син-
хронно и обрабатываются на компьютере
Гидродинамические испытания, проведенные с использованием описанной мето-
дики, явились важным элементом разработки нескольких протезов клапанов сердца
Авторами совместно с ЦНИИ «Гранит» спроектированы два новых малогабаритных ме-
и ких искусе венных клапана сердца — дисковый Гиацинт и двустворчатый Сер-
долик (рис 4 88)
Гиацинт КГ 1 (Б 'е И<^усственные клапаны сердца - дисковый
ствХчагыа г ₽аНОВ Ю- И- И ЯР ’ 1997- авт- СВ“А- № 5505) и дву-
№2335) И СеРАОЛИК КС 2 <Гал- Н ". И др., 1996, авт свид
/г.?
ГЛАВА 4 Гидродинамика искусственных клапанов сердца
Наряду с материаловедческими, прочностными, технологическими были проведе-
ны и гидродинамические исследования всех модификаций, а также окончательных
моделей клапанов В ходе оптимизационных экспериментов уточнены обводы седла,
выбраны углы открытия запирающих элементов и расстояние между створками Тем
самым удалось ликвидировать заклинивание и вибрацию створок, наблюдаемые у пер-
воначальных вариантов конструкций, обеспечить полное их открытие В ходе сравни-
тельных испытаний доказана высокая гидродинамическая эффективность моделей,
подготовленных к серийному производству За счет уменьшения толщины створок, по
сравнению с серийными отечественными искусственными клапанами сердца, мини-
мизированы возмущения потока, вносимые створками обоих клапанов (Орловский П. И
и др , 2001)
Научно-исследовательская работа по созданию нового бескаркасного ксеноаорталь-
ного протеза на кафедре госпитальной хирургии № 1 СПбГМУ включала разработку
комплексной программы стендовых испытании По новой программе были подробно
исследованы почти две сотни образцов биологических клапанов Прежде всего, была
изучена биомеханика естественного аортального клапана как образца для всех типов
биопротезов (Gavrilenkov VI et al , 2000) Показано определяющее влияние растяжи-
мости корня аорты на функционирование створок клапана Выяснено, что в возрасте
50-60 лет наступает снижение растяжимости (рис 4.89), сопровождаемое ухудшени-
ем гидродинамических характеристик клапанно-аортального комплекса (Гаврилен-
ков В И. и др , 2000)
По результатам чреспищеводного эхокардиографического исследования нормаль-
ной биомеханики аортального клапана у 10 волонтеров выделено 5 периодов переме-
щения створок клапана подготовительный, быстро нарастающего открытия, пик от-
крытия, устойчивого открытия, быстрого закрытия Кроме того, рассчитаны средние
значения геометрических параметров клапана аорты у здоровых лиц ширина зоны
коаптации, углы наклона створок, индексы окружного перемещения створки, радиаль-
ной и окружной деформации створки радиальное и окружное систоло-диастоличес-
кое растяжение створки (Гавриленков В И и др , 2003) Отмечается близость рассчи-
танных параметров у здоровых людей к результатам, полученным при моделировании
работы здоровых молодых аллографтов на пульсдупликаторе
С учетом данных стендовых испытаний выбран динамический режим структурной
стабилизации биоткани свиных клапанно-аортальных комплексов раствором диэпок-
сида (Гавриленков В. И Маслевцов Д В , патент №2234217, 2004) Проведенные ис-
19 23 29 34 39 44 49 54 59 64 69 74 79 Возраст, лет
р*»с. 4.89. Зависимость растяжимости (DL) клапанно-аппаратного комплекса человека
от возраста
И Искусственные клапаны сердца
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
следования показали преимущество биомеханических и гидродинамических характе-
ристик таких биопротезов по сравнению с биопротезами, обработанными в стацио-
нарном режиме В группе ксенографтов, стабилизированных глутаровым альдегидом,
в динамическом режиме отсутствовала деформация створок (BDI - 0,05 ± 0,05), а ин-
декс производительности (Р1 = 0,51 ±0,02) был больше, по сравнению с ксенографта-
ми. стабилизированными в стационарном режиме (PI = 0,39 ± 0,02, BDI = 0,41 ± 0,03),
Гавриленков В И и др., 1999
Было изучено влияние техники имплантации бескаркасных биопротезов на их по-
токовые и биомеханические характеристики Преимущество полного иссечения си-
нусов этих биопротезов перед методикой иссечения только коронарных синусов до-
казано меньшими значениями индекса сгибательной деформации (0,50 ± 0,04 про-
тив 0,84 ±0,02) и большим коэффициентом эффективности (0,84 ±0,05 против
0,64 ±0,04)
Детальный анализ с расчетом индексов сгибательных деформации (BDI) для каж-
дой створки показал, что преимущественное уменьшение BDI наблюдается у левой
коронарной и некоронарной створок при использовании метода полного иссечения
створок (рис 4 90)
Была разработана оригинальная модель бескаркасного ксеноаортального протеза
с волнообразным основанием и техника его имплантации в супрааннулярную позицию,
включая выбор размера протеза с учетом растяжимости корня-акцептора (Гаврилен-
ков ВИ и др , 2001) В настоящее время новый бескаркасный ксеноаортальный про-
тез (Гавриленков В И , 2001, патент №2175858) подготовлен к клинической апроба-
ции (рис. 4 91)
Описанная программа стендовых испытаний была применена для оценки характе-
ристик бескаркасных протезов, изготовленных в лаборатории биопротезирования На-
учного центра сердечно-сосудистой хирургии им. А Н Бакулева РАМН (Москва), с це-
лью выбора режима стабилизации глутаровым альдегидом Проведено исследование
биомеханических и гидродинамических характеристик тридцати образцов биопроте-
зов, стабилизированных при различных режимах (Скопин ИИ и др., 2002)
В качестве еще одного примера использования разработанной методики необхо-
димо отметить сравнительные гидродинамические испытания нескольких вариантов
экспериментального клапана из тетрафторэтилена и каркасного биопротеза Carpentier-
Edwards Полимерный клапан рекомендован для применения в насосе вспомогатель-
ного кровообращения как более эффективный Новый насос разрабатывался в НП
1-я группа 2-я группа
а
иссечен^'сим«сов?>О97-а?ИИ "° ст°оркам У композитных корней аорты в 1-й (полное
крытия (а) и Фазе v" 'иссечение коронарных синусов) группах в фазе пикового от
створки, НКСФ_ некоронарная°с^Г ™ ~ " "РаВаЯ К°Р°НаРНЬ'в
290
ГЛАВА 4 Гидродинамика искусственных клапанов сердца
Рис. 4.91. Бескаркасные биопротезы: БиоЛАБ-КК/АС и экспериментальный аортальный
биопротез (Гавриленков В. И., патент №2175858.-2001)
«Центр развития инновационных проектов в сердечно-сосудистой хирургии» Санкт-
Петербурга
Таким образом, исследования биомеханических и гидродинамических характерис-
тик искусственных клапанов сердца в модельных установках (фантомах кровотока) яв-
ляются важнейшим этапом разработки и доклинических испытаний новых механичес-
ких клапанов и биопротезов, причем в качестве образца принимаются характеристики
естественного клапана сердца Ждет своего изучения структура течения в современ-
ных отечественных биопротезах — аортальном, пульмональном, митральном Весьма
актуальной остается диагностика течения в щелях и шарнирных механизмах механи-
ческих клапанов в фазу закрытого состояния. Важнейшим направлением является мо-
делирование в фантоме кровотока техники имплантации искусственного клапана сер-
дца с целью ее оптимизации Примерами актуальных задач такого рода могут служить
выбор места фиксации хорд митрального биопротеза, техники имплантации бескар-
касного заменителя аортального клапана или ориентации механического искусствен-
ного клапана относительно структур сердца. Список существующих проблем может быть
продолжен Кроме того, с появлением новых протезов и совершенствованием хирур-
гических методик у врачей появляются новые вопросы, в решении которых неоцени-
мую помощь могут оказать методы экспериментальной гидродинамики.
ЛИТЕРАТУРА
Баранов ю. И., Галич Н П . Лаптев Ю. П и др Протез клапана сердца Авт свид № 5505,
беловРеГИСТРИР°ВаНО 16 1297
ов Е ф t Белова В М, Бушмарин О Н и др Искусственный клапан сердца и способ его
6елоЗГгТ°ВЛеНИЯ АВТ свид- № 1009458, зарегистрировано 07 12 82
е Е Ф., Белова В М, Бушмарин О Н и др Искусственный клапан сердца и способ его
Белс>ЗГрТовления ^вт свид № 942740, зарегистрировано 16 03 82
в е ф ( Брянская Е О , Гавриков В И и др Искусственный клапан сердца Авт свид
Белов Р°Д9°63 заРегистРиРоеано 22 06 83
t Ф, Бушмарин О Н . Васькин Р Д и др Искусственный клапан сердца и способ его
зготовления Авт свид № 873509. зарегистрировано 15 06 81
291
11*
ИСКУССТВЕННЫЕ КЛАПАНЫСЕРДЦА
Белов Е Ф Бушмарин О. Н., Орловский П. И. и др. Катетер для гидродинамических измере-
НИИ потока крови в сердце: Авт свид. № 1209155, зарегистрировано 08 10.85.
Бессонов Н М Колешко С. Б. Численное исследование стационарных течений в искусственных
клапанах сердца на основе решения уравнений Навье-Стокса на неортогональных сетках
методом расщепления у Моделирование в механике. 1988. Т 2. № 4. С. 3-13.
Бокерия Л. А., Городков А Ю., Кикнадзе Г И и др. Анализ структуры течения крови в левом
желудочке* сердца и аорте на основе точных решений нестационарных уравнений гидроди-
намики вязкой жидкости Ц Сердечно-сосудистые заболевания. 2002. Т. 3 — № 7. -
С. 99-112
Бокерия Л А , Городков А Ю., Николаев Д А. и др Анализ поля скоростей закрученного пото-
ка крови в аорте на основании трехмерного картирования с помощью магнитно-резонанс-
ной велосиметрии // Бюл. НЦССХ им. А. Н. Бакулева РАМН. Сердечно-сосудистые заболе-
вания Проблемы моделирования гидродинамики, тканевая инженерия, трансплантология,
клиника — 2003 — Т. 4. — № 9. — С. 70-74.
Бражников Е М и др. Устройство для исследования клапанов в изолированном трупном серд-
це' Авт свид. 228855 — 1983.
Бураковский В. И., Доброва Н. Б., Кузьмина Н. Б. и др. Характер потока крови в левом желу-
дочке сердца (экспериментальное исследование) // Экспер. хир. и анестезиол. — 1976. —
№ 3. - С. 13-16
Бушмарин О. Н., Зябриков В В., Юхнев А.Д., Орловский П. И. Измерение закрутки потока за
искусственными клапанами сердца // Сб. науч. тр. «Гидрогазодинамика», ЛГТУ, 1990 —
С. 141-146.
Бушмарин О. Н., Зябриков В В., Юхнев А.Д Орловский П. И. К вопросу оптимизации искус-
ственных клапанов сердца по коэффициенту сопротивления // Сб. науч. тр. «Гидрогазоди-
намика», ЛГТУ 1990. — С. 133-141.
Бушмарин О. Н , Зябриков В. В., Юхнев А.Д. и др. Исследование гидродинамических характе-
ристик трехшарикового искусственного клапана сердца ГПМ М-1//Отчет по НИР
№ 0183 00.31 503, ЛПИ, кафедра гидроаэродинамики. — Л., 1985.
Бушмарин О. Н., Юхнев А.Д., Орловский П. И., Гавриленков В. И, К истории исследования ис-
кусственных клапанов сердца на кафедре гидроаэродинамики // Научно-технич. ведомос-
ти СПбГПУ. — 2004. — № 2. — С. 146-159.
Вильданов Л М, Етонов М. П, Юречко В. Н. Гидродинамика искусственных клапанов сердца //
Препринт № 612, Ин-т проблем механики РАН, 1998.
Гавриленков В. И. Бескаркасный биопротез клапана аорты: Патент РФ № 2175858, зарегист-
рирован 20 11 01 г. // Бюл изобр — № 32. — 2001.
Гавриленков В И., Кузнецов А А , Перлеи В Е и др Эхокардиографическая оценка нормаль-
ной биомеханики аортального клапана // Ультразвук, диагн — 2003. — № 2. — С 89-96.
Гавриленков В. И., Маслевцов Д. В Способ структурной стабилизации тканей, используемых
^отезиРования и пластики при коррекции клапанных пороков сердца' Патент
№ 2234217 — 2004
Гавриленков В. И., Маслевцов Д В., Юхнев А Д Устройство для установки клапана аорты или
ескаркасного биопротеза клапана аорты при проведении исследований в пульсирующем
потоке. Патент № 2237452. — 10.10 2004
Гавриленков В И, Маслевцов Д. В , Юхнев А Д. и др. Биомеханические и потоковые характе-
200/- № Сда^а™™_20каркасных биопРотезов аортального клапана // Вести, хир. -
Маслевцов Д В , Юхнев АД и др. Влияние техники имплантации на лото
й ^гпрпмкЛОМеХа/ТпеСКИе характеРистики бескаркасных биопротезов аортального клапана
в эксперименте // Вести, хир. — 2001 — № 5. — С 45-51
Маслевцов Д- в- Возрастная динамика, биомеханические и гид-
2000.— Т. 159 - No 4ИСТ_Вас^П^°-а°Р—него комплекса человека // Вести, хир
^актеоистики бе^аХ^ ’ _Масл1°в Д В Гидродинамические и биомеханические ха-
зап СПбГМУ — 1999 —Тб —ТГг*3|м^ителей аортального клапана сердца // У4-
Ns 2335’, з°ре?истрировадо ^6 07 )6.‘ К' М' ПР°Те3 клапана сеРДиа: Авт' СВИ
Ns 1^5^81 ^зареп/кГтрирован^Ов^'^вЭ^ ^ " ЯР’ Пр°Те3 клапана сеРдца АвТ СВИД
------— 292 —
_______________________Гидродинамика искусственных клапанов сердца
Городков А. Ю. Анализ структуры внутрисердечного закрученного потока крови на основании мор-
фомертии трабекулярного рельефа левого желудочка сердца // Бюл НЦССХ им
А.Н. Бакулева РАМН. Сердечно-сосудистые заболевания. Проблемы моделирования гидроди-
намики, тканевая инженерия, трансплантология, клиника. — 2003 — Т. 4. — № 9. — С. 61-66.
Городков А. Ю„ Николаев Д. А. Анализ динамических характеристик закрученного потока кро-
ви в аорте на основании измерения геометрических параметров проточного канала с по-
мощью магнитно-резонансной томографии // Бюл НЦССХ им. А. Н. Бакулева РАМН. Сер-
дечно-сосудистые заболевания. Проблемы моделирования гидродинамики, тканевая инже-
нерия, трансплантология, клиника. — 2003. — Т. 4. — № 9. — С. 67-69
Доброва Н. Б., Агафонов А В., Фадеев А. А. Сравнительная оценка современных отечествен-
ных и зарубежных механических протезов клапанов сердца // Тез. докл. Ill Всерос. съезда
серд.-сосуд, хирургов, 1996.
Доброва Н. Б., Бушмарин О Н., Евдокимов С. В. и др. Устройство для испытания искусствен-
ных клапанов сердца: Авт. свид. № 728864, зарегистрировано 26.12.79.
Доброва Н Б, Зарецкий Ю. В. Гидродинамика дисковых искусственных клапанов сердца с раз-
личными конструктивными характеристиками // Мед. техника. — 1989. — № 6. — С. 3-9.
Доброва Н. Б., Роева Л. А., Бычков Ю М. и др. Влияние ориентации асимметричной конструк-
ции дискового клапана на структуру потока в аорте // Биомеханика кровообращения, дыха-
ния и биологических тканей. — Рига, 1981. — С 220-227.
Евдокимов С. В. Исследование гидродинамических характеристик искусственных клапанов сер-
дца различных конструкций в лабораторных условиях: Автореф. дис. канд техн. наук. -
Л., 1980.
Захаров В. Н., Полуэктов Л. В., Кремлев Н. И. и др. Биогидромеханика движения крови в поло-
стях сердца и магистральных сосудах: клинико-эксперимен. исслед. / Новосибирский
ин-т биоорганической химии, СО АН СССР, 1989.
Зубцовский В. Н., Бушмарин О. Н., Орловский П. И. и др. Структура потока при обтекании ис-
кусственных клапанов сердца // Сб. «Бионика» — 1976. — № 10. — С. 103-109.
Зубцовский В. Н., Бушмарин О. Н., Смирнов А.Д, Орловский П. И. Исследование гидродина-
мического сопротивления искусственных клапанов сердца // Грудная хир. — 1972 — № 3. —
С. 26-34.
Каро К., Педли Т., Шротер Р., Сид У, Механика кровообращения. — М., 1981.
Клапаны сердца искусственные // ГОСТ 26997-2003.
Кузьмина Н. Б. Изучение функциональных свойств искусственных клапанов сердца (экспери-
ментальное исследование): Дис. канд. — М., 1967.
Кузьмина Н. Б., Марков П. П., Агафонов А. В. и др. Гидродинамика потока в полости левого
желудочка сердца в норме и при протезировании митрального клапана // Биомеханика кро-
вообращения, дыхания и биологических тканей. — Рига, 1981. — С. 228-234.
Лапин Ю. В., Бушмарин О. Н. Зябриков В В. и др.Исследование гидродинамических характери-
стик экспериментальных образцов искусственных клапанов сердца с закрученным потоком
на выходе: Отчет по НИР № 0.186.0025785, ЛПИ, кафедра гидроаэродинамики. — Л., 1988.
Любомиров Я. М., Бушмарин О. Н.. Любомиров А. М. и др. Устройство для испытания искусст-
венных клапанов сердца* Авт. свид. № 1111751, зарегистрировано 08.05.84.
Орловский П. И Гидродинамическое исследование искусственных клапанов сердца. Автореф
дис. канд. мед наук Л., 1975.
Орловский П. И. Гомеостаз больных с механическими искусственными клапанами сердца в от-
даленные сроки наблюдения (клинико-экспериментальное исследование). Автореф. дис.
Докт. мед. наук. — СПб., 2002. л
Орловский П. И, Гриценко В. В Углов Ф. Г. и др. Следует ли учитывать наличие закрученного
потока крови в левом желудочке сердца и аорте при конструировании искусственных кла-
панов сердца? // Вести, хир. — 1998. — Т. 157. — № 1. — С 10-16.
Орловский П. И., Юхнев А. Д„ Гриценко В. В. и др. Сравнительные г^Р^^ами„чДс.ки^
дования механических искусственных клапанов сердца//Уч. зап.
— С 101—105
Парашин В. Б., Иткин Г. П. Биомеханика кровообращения: Учеб, пособие / Под ред. С. И Щу-
кина -- м.: Изд-во МГТУ им Н Э. Баумана, 2005. w
Оеримов Ю. А., Юрченко И. И., Картошкин В. М., Евдокимов С В. и др Л’
тания искусственных клапанов сердца: Авт. свид. № 1045451, зар^г^Тр!1рд Безносовой
^тмер р ф Динамика сердечно-сосудистой системы / Пер^ с н
т Е. Кузнецовой, под ред. Г И. Косицкого — М : Медицина, 1981
293
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
Poet а Л А Исследование течения вязкой жидкости в изогнутых каналах (применительно к те-
чению крови в аорте): Автореф дис. канд техн. наук. М.. МЭИ, 1980.
Роева Л А Разработка протезов основных узлов сердечно-сосудистой системы на основании
экспериментальных исследований гидродинамики сердца и магистральных сосудов: Авто-
реф дис. докт техн, наук — Рига, 1990.
Роева Л А . Кондратенко Ж. Е, Фурсов Б А и др Экспериментальное гидромеханическое обо-
снование использования ксеноперикардиальных клапаносодержащих кондуитов для хирур-
гического лечения восходящей аорты // Мед техника. — 1994 — № 6. — С. 18-22.
Роева Л. А , Чубарова Е Я. Архитектоника левого желудочка сердца и особенности течения
крови при постинфарктной аневризме // Мед. техника. — 1998.
Романов Г. В. и др. Устройство для испытаний искусственного клапана сердца: Авт. свид.
№ 388754. — 1974
Скопин И И., Муратов Р. М., Терехин В. Н и др Особенности гидродинамики и биомеханики
бескаркасных биологических протезов, изготовленных под нулевым давлением // Серд.-
сосудистые заболевания. — 2002. — Т 3. — № 5 — С. 181.
Углов Ф. Г, Зубцовскии В. Н,, Орловский П И и др Распределение давления на поверхности за-
пирающих элементов искусственных клапанов сердца // Мед. техн. — 1978. — №2. - С. 6-11.
Углов Ф. Г., Гриценко В. В., Юхнев А.Д. и др. Гидродинамические исследования современных
механических искусственных клапанов сердца // Вести, хир. — 2004, № 1. — С. 14-19.
Углов Ф Г, Зубцовскии В Н, Большаков О. П и др Топография рельефа внутренней поверхно-
сти стенки левого желудочка сердца в фазе диастолы // Арх анат — 1984. — 9. — С. 33-41.
Углов Ф. Г., Зубцовскии В. Н, Орловский ПИ и др Исследование возможных причин механи-
ческого гемолиза эритроцитов на протезах аортального клапана с шаровым запирающим
элементом // Грудная хир. — 1980 — № 6. — С. 13-17.
Углов Ф. ГЗубцовскии В. Н., Орловский П. И. и др. Исследование временных характеристик
движения запирающих элементов искусственных клапанов сердца в пульсирующем пото-
ке // Вести, хир — 1978 -№4 — С. 11-18.
Фаминскии Д. О., Фадеев А А., Агафонов А В , Доброва Н. Б Новый искусственный клапан
сердца Элмак // Грудная и сердечно-сосудистая хир. — 1994. — № 5. — С 30-33.
Фольков Б , Нил Э Кровообращение / Пер с англ. — М : Медицина, 1976
Юречко В Н., Корчагин С. И., Омельянчук А М. и др. Экспериментальное исследование дву-
створчатого искусственного клапана сердца Роскардикс // Мед. техника. — 2001 — № 2. -
С.29-39
Юречко В. Н., Омельянчук А М., Юречко Р Б и др Исследование функциональных характери-
стик искусственных клапанов сердца // Мед техника. — 2003. — № 2. — С. 30-38.
Юхнев А. Д Устрой во для исследования искусственного клапана сердца в фантоме кровото-
ка, заявка № 2006106661, 2006.
Юхнев А. Д, Орловский П. И., Гриценко В В Гидродинамические исследования искусственно-
го клапана сердца Мединж-2 // Сб.: Протезы клапанов сердца Мединж в хирургии клапан-
ных пороков сердца — 2004 — С. 163-171.
Levafig O.,Froysaker Т et al. • In situ» evaluation of the aortic pivoting disc valve prosthe-
sis П Scand J Thorac. Cardiovasc. Surg. - 1975 - Vol 9 - P 81-84
AklnvO?60 №e6U- R 1837-X'Cal CardiaC Va,VU,ar prostheses 11 An- Thorac- Surg. - 1995. -
ArtTorgt ns. - 2003т-^оГб -7>И2-123O< 3 meChanical b,leaflet m,tral protheSiS /Z
Enq -а2П0^Л- УпГ™ er'Cp ^U'^°n °' mechanical ™tral heart valve closure//Ann B.omed.
Proc' of the?'" lnfS<rn^rf B,oocl Carnage measures for ventricular assist device modeling //
Mex.cc 2003 J r “c^.C°mp- m°de,,n9 °' ,ree boundary problems. - New
J. Р^бТ-г/Т1 ГП'<Га' Va'Ve mechanics ~ a model study/Z
heart va'^Comput^S^Td^-PwV- J J-Tzzq-oo?06 f'°W thTOU0h Э P'°Sthe"C
he^t'valve6"/Comp of &omed' Res^^igT?0’ tdronibo9en,c sites 1°r a tiltmg-disc prosthetic
BaldwmJ T Campbell A Luck Г В/ =ТСГ J?77 ~ Vol1° - P- 165-182
heart valve // Eur J of Cardmihrcd dynam,cs of the CarboMedics Kinetic bileaflet prosthetic
d ciur J or Cardiothorac Surg - 1997. - Vol. 11 - P. 287-292
---------- 294 —____________
ГЛАВА А Гидродинамика искусствен^. к клапанов сердце
Bellhouse В. J. Velocity and pressure distributions in the aortic valve // J. Fluid Meeh. — 1969 —
Vol. 37. — P. 587-600.
Bellhouse В J. The fluid mechanics of a model mitral valve and left ventricle // Cardiovasc Res —
1972. - Vol. 6. - P. 199-210.
Bellhouse B. J., Bellhouse E. Fluid mechanics of model normal and stenosed aortic valve // Circ
Res. - 1969. - Vol. 25. - P. 693-704.
Black M. M„ Hose D. R., Lamb C. J. et al. In vitro heart valve testing. — P steady versus pulsatile
flow // J. Heart Valve Dis. — 1994. — Vol. 3, № 2. — P. 212-215.
Bluestein D., Einav S., Hwang N. H. C. A squeeze flow phenomenon at the closing of a bileaflet
mechanical heart valve prosthesis. // J. Biomech. — 1994. — Vol. 27. — P. 1369-1378.
Bluestein D.t Li Y. M., Krukenkamp I. B. Free emboli formation in the wake of bileaflet mechanical heart
valves and the effects of implantation techniques // J. Biomech. — 2002. — Vol. 34. — P. 1533-1540.
Brucker Ch., Steinseifer U., Schroder И/., Reul H. Unsteady flow through a new mechanical heart
valve prosthesis analyzed by digital particle image velocimetry // Meas. Sci. Technol. — 2002. —
Vol. 13. — P. 1043-1049.
Carabello B. A., Grossman W. Calculation of stenotic valve orifice area // In: Cardiac catheterization
and angiography, Lea and Feabiger, Philadel., 1986. — P. 143-154.
Castellini R, Marassi M., Pinotti P et al. Optical measurement of flow properties in artificial heart
valves.
Cenedese A., Del Prete Z., Miozzi M. et al. A laboratory model of the left ventricle of human heart //
Paper 23-3-12 Inf. Symp. Applic. Laser Techn To Fluid Meeh. Lisbon. Portugal 12-15 July, 2004.
Chahine G. L. Scaling of mechanical heart valves for cavitation inception: observation and acoustic
detection // Heart Valve Dis. - 1996. — Vol. 5(2). — R 207-215.
Chandran К. B., Fatemi R., Hiratzka L. E, Harris C. Effect of wedging on the flow characteristics past
tilting disc aortic valve prosthesis // J. Biomech. — 1986. — Vol. 19, № 3. — P. 181-186.
Chandran К. B., Khalighi B., Chen C. J. Experimental study of physiological pulsatile flow past valve
prostheses in a model of human aorta — 1. Tilting disk vales and the effect of orientation //
J. Biomech. — 1985. — Vol. 18, № 10. — P. 773-780.
Chandran К. B., Schoephoerster R , Dellsperger К. C. Effect of pi esthetic mitral valve geometry and
orientation on flow dynamics in a model human left ventricle // J. Biomech. — 1989. — Vol 22,
№ 1. — P. 51-65.
Cochrane T., Kenyon C. J., Lawford P. V. et al. Validation of the orifice formula for estimating effective
heart valve opening area // Clin. Phys. Physiol. Meas. — 1991. — Vol. 12, Ns 1. — P. 21-37.
Cohen M. V. Gorlin R. Modified orifice equation for the calculation of mitral valve area I I Am. Heart
J. — 1972. — Vol. 84. — P. 839-840.
David T., Hsu С. H. Dynamic analysis and geometry models for the design of bileaflet prosthetic
mechanical heart valves // Med Eng Phys. — 1996. — Vol. 18. — № 6. P. 463-476.
De Hart J. Fluid-structure interaction in the aortic heart valve: a three-dimensional computational
analysis // Ph. Thesis.-Eindhoven University. — 2002.
De Hart J., Peters G. W. M., Schreurs P. J. G.. Baai/ens F. P T. A computational fluid-structure
interaction analysis of a fiber-remfoiced stentless aortic valve // J. Biomech - 2003. —
Vol. 36. — R 699-712
De Hart J., Peters G. W. M.t Schreurs P. J- G., Baaijens F. P. T. A two-dimensional fluid-structure
interaction model of the aortic valve // J. Biomech. - 2000. — Vol 33. — P. 1079-1088.
te Hart J., Peters G. W. M , Schreurs P. J. G, Baaijens F P. T. A three-dimensional computational analysis
of fluid-structure interaction in the aortic valve // J. Biomech. 2003. — Vol. 36_ — P 103 11
Draft replacement heart valve guidance, Version 4.1. FDA, USA, Rockvil), MD, 1994.
°ob/n/ G„ Hetrabissa R., Fumero R. Computational fluid dynamics of artificial heart valves // Int
J- Artif Organs — 1991. — Vol. 14, Ne 6. — P. 338-342. и
S,'S j. T„ Healy T M., Fontaine A. A. et al. Velocity measurements and flow patterns within t e i g
region of a medtronic parallel bileaflet mechanical heart valve with clear ousmg //
Disease ______iqqa \/rj r p aqi_rqq
a's j. T.. Travis B. R., Yoganathan A. P. An in vitro study of the hinge and near-field’ £™ard
dynamics of the St. Jude Medical Regent bileaflet mechanical heart valve // Ann. Biomed. E g.
2000 — Vol _______ P RRO
e/'s ; T; Yoganathan A. ^'comparison of the hinge and '’^,n9e "°*
Medical Hemodynamic Plus and Regent bileaflet mechanical heart va v //
SurQ- - 2000 — Vol. 119. — P 83-93.
295
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
Fa h з/ D.. Cassot F Bodard H.. Pehssier В Velocity profiles in the wake of two prosthetic heart valves
using a new cardiovascular simulator // J Biomech. 1985. Vol. 18, N° 10. P. 789-802
Fishe J Comparative study of the hydiodynamic function of six 19 mm bileaflet heart valves // Eur
J. of Cardiothorac. Surg. — 1995. — Vol. 9. — P. 692-696.
Fisher a:k G. R Wheatley D. J. Design of a function test apparatus for prosthetic heart valves.
Initial results in the mitial position // Clin Phys Physiol. Meas. — 1986. — Vol 7, № 1. — P. 63-73
Fisher J. Reece I. J. Wheatley D J. In vitro evaluation of six mechanical and six bioprosthetic val-
ves //Thorac. Cardiovasc. urg — 986. — Vol 4 — P. 157-162.
Fisher J., Wheatley D. J. Hydrodynamic function of ten prosthetic heart valves in the aortic position //
Clin. Phys. Physiol. Meas. — 1988. — Vol. 9, № 4. — P. 307-317.
Fontane A. A , Ellis J. T.. Healy T M. et al. Identification of peak stresses in cardiac prostheses.
A comparison of two-dimensional versus three-dimensional principal stress analyses // ASAIO
J. — 1996. - Vol. 42. — P. 154-163.
Frazm L J., Lanza G., Vonesh M. et al. Functional chiral asymmetry in the descending thoracic
aorta // Circulation. — 1990. — Vol 82, № 6. — P. 1985-1994.
Fujimoto T, Hiruma N.. Tsutsumi У et al. Effect of spiral flow on the performance of prosthetic heart
valves // Proc Cardio bioeng Meeting. — 1999 — P. 28.
Gabbey S., Kresh J. Y. Bioengineering of mechanical and biological valves // In: Guide to prosthetic
cardiac valves N Y, Springer, 1985. — P. 239-256
Gao Z. B., Pandya S., Hosein N. et al. Bioprosthetic heart valve leaflet motion monitored by dual
camera stereo photogrammetry // J. Biomech. — 2000. — Vol. 33, № 2. — P 199-207.
Gavrilenkov V., Perley V, Maslevtcov D., Yukhnev A Biomechanics of human aortic root and valve //
2nd Int. meeting of the Onassis cardiac surgery center. — 2000 — P. 126
Ge L., Jones S.C., Sotiropoulos F. et al 2003. Numerical simulation of flow in mechanical heart
valves: grid resolution and the assumption of flow symmetry // J. Biomech. Eng. — Vol. 125. —
P. 709-718.
Giersiepen M, Wurzinger L., Optiz R et al Estimation of shear stress-related blood damage in heart
valve prostheses — in vitro comparison of 25 aortic valve // Int. J. Artifitial Organs. — 1990. -
Vol 13, № 5. - P. 300-306.
Ghanb M., Kremers D., Koochesfahani M et al., Leonardo vision of flow visualization // Exp in
Fluids. — 2002. — Vol. 33, № 2. — P. 219-223.
Gorlin R., ( orlm S G. Hydrolic formula for calculation of area of stenotic mitral valve, other cardiac
valves and central circularity shunts // Am Heart J — 1951. — Vol 41 — P. 1-29
Gorodko D brova N В , Dubernard J. et al Anatomical structures determining blood flow in the
heart left ventricle // J Mater Science: Mater, in Medicine — 1996. — Vol. 7, № 1. — P. 153-160
Graf T., Fisher H.. Reul H., Rau G. Cavitation potential of mechanical heart valve prostheses // Int. J.
Artif. Organs. — 1991. — Vol. 14 — P. 169-174
Graf T,. Reul H., Dietz W. et al. Cavita ion of mechanical heart valves under physiological conditi-
ons// J. Heart Valve Dis. — 1992. — Vol. 1 — P 131-141.
Grigioni M Daniete D’Aven,о Barbaro V. The influence of the leaflets’ curvature on the flow field
in two bileaflet prosthetic heart valves // J. Biomech. — 2001. — Vol. 34. — P. 613-621.
Gross J. M Shu M. C. S„ Dai F. F. et al. A micro-structural flow analysis within a bileaflet mechanical
heart valve hinge // J Heart Valve Disease — 1996 — Vol. 5 — P 581-590
Hanle D D„ Harrison E Yoganathan A P et al In vitro flow dynamics of four prosthetic aortic
a ^orriPara,lve analysis//J Biomech - 1989 — Vol 22, Ns 6/7 — P 597-607
PhiiadPinhiT^PA °PPler Ultra ound m Cardiology Physical Principles and Clinical Applications. —
nnnadelphia, PA: Lea & Febiger, 1985.
aUbased on MeaSurement of volumetric mitral and aortic blood flow
Fur i PrhnnorH 1 ^"d’mensional color flow imaging method: an in vivo validation //
Eur J Echocardiography. - 2000 - Vol. 1, No 1 _ p 204-211.
usmo a tHina^d sk'valvp m a Mechanisms of mechanical heart valve cavitation: investigation
using a tiling disk valve model // Heart Valve Dis. - 2001 - Vol 10 - P 666-674
SMedtronic°Paral ellileaflH1heart 31 V'sua,ization of the hin9e flow in a 5: 1 scaled model of the
He^er'r? £2"а heart valve prosthesis//Exp Fluids - 1998 - Vol 25 -P 512-518
valves and tilting di c valvT^/ r Рге||ГП1ПагУ results of a comparative test of mechanical bileaflet
^aives and tHtmg disc valves // B.omedmn.sche Teckn.c - 1986 - Vol. 31 - No 7-8 - P
valves // Artif C Hydroc,ynamic investigation of mechanical bileaflet
__ Vol 12( № 5 __ p 431-443
~--------- 296 -
ГЛАВА 4. Гидродинамика искусственных клапанов сердца
Heinrich Я S„ Fontaine A. A., Grimes R. Y. et al Experimental analysis of fluid mechanical energy
losses in aortic valve stenosis: importance of pressure recovery // An Biomed Eno — 1996 —
Vol. 24 - P. 685-694. ’
Huang Z J-, Merkle C. L., Abdallah S. et al. Numerical simulation of unsteady laminar flow through a
tilting disk heart valve: prediction of vortex shedding // j Biomech — 1994 — Vol 27 —
P. 391-402.
Hung T К, Schuessler G B. Computational analysis as an aid to the design of heart valves I I Chem
Eng. Prog. Symp Ser — 1971. — Vol. 67. — P 8-17.
Idelsohn S. R., Costa L. E., Ponso R. A comparative computational study of blood flow through
prosthetic heart valves using the finite element method // J. Biomech. — 1985. — Vol. 18. —
№ 2. — P 97-115.
Jansen J., Willeke S., Reiners В et al. Advances in design principle and fluid dynamics of a flexible
polymeric heart valve // ASAIO Trans. — 1991. — Vol. 37. — P 451-453.
Kafesjian R, Wietmg D. И/, Ely J. et al. Characterization of cavitation potential of pyrolitic carbon I I
Proc. Int. Symp Heart Valve Dis , London, 1989. — R 12-16.
Kelly S. G..Verdonck P. R.,Vierendeels J. A. et al. A three-dimensional analysis of flow in the pivot
regions of an ATS bileaflet valve // Int J Artif Organs. — 1999. — Vol. 22, Ng 11. — P 754-763.
Kilner P. J., Yang G. Z., Mohiaddm R. H. et al., Helical and retrograde secondary flow patterns in the
aortic arch studies by three-directional magnetic resonance velocity mapping // Circulation —
1993. — Vol. 88. — Ng 12. — P 2235-2247
Kilner P. J., Yang G. Z t Wilkes A. J. et al., Asymmetric redirection of flow through the heart // Nature. —
2000. — Vol. 404. — № 4. — P. 759-761.
Kim И/. Y., Walker P. G., Pederson E. M. et al. Mitral ammular function assessed by 3D imaging for
mitral valve surgery // J. Heart Valve Dis. — 1995, Vol. 3. — P 483-490.
Kim W, Bisgaard T, Nielsen S.L et al. Two-dimensional mitral flow velocity profiles in pig models using
epicardial Doppler echocardiography // J. Am Coll Cardiol. — 1994. — Vol 24 — P. 532-545.
King M. J., Corden J., David T., Fisher J. A three-dimensional,time-dependent analysis of flow througha
bileaflet mechanical heart valve comparison of experimental and numerical results // J. Biomech. —
1996. — Vol. 29, № 5. — P 609-618.
King M J., David T., Fisher J An initial parametric study of fluid flow through bileaflet mechanical
heart valves using computational fluid dynamics // J Eng Med. — 1994. — Vol 208. — P 63-71.
King M. J., David T., Fisher J. Three-dimensional study of the effect of two leaflet opening angles on
the time-dependent flow through a bileaflet mechanical heart valve // Med. Eng. Phys. — 1997. —
Vol. 19, № 3. — P. 235-241.
King M J.,Corden J., David T, Fisher J. A three-dimensional, time-dependent analysis of flow through
a bileaflet mechanical heart valve: comparison of experimental and numerical results //
J Biomech. - 1996. — Vol 29 — P 609-618
Kins C., Kwak D., Rogers S. E Chang I. D. Computational approach for probing the flow through
artificial heart devices // Biomech. Eng. — 1997. — Vol. 119. — R 452-460.
Klepetko l/V Leaflet fracture in Edwards-Duromedics bileaflet valves // J. Thorac. Cardiovasc Surg. -
1989. — Vol. 97 — P 90-94.
Knapp R j' Daily J. W., Hammitt F. G. Cavitation New York. McGraw-Hill Int Book Co., 1970.
Knoch M., Reul H., Kroger R., Rau G. Model studies at mechanical aortic heart valve prostheses —
part 1: Steady-state flow fields and pressuie loss coefficients // Trans, of ASME., J Biom. Eng. —
1988. — Vol. 110._______ P. 334-343
Kozerke S., Hasenkam J., Nygaard H et al., Heart motion-adapted MR velocity mapping of blood
velocity distribution downstream of aortic valve prostheses: initial experience // a 10 ogy. -
2001 — Vol. 218. — No 3 — R 548-555. , .
Krafczyk M.. Cerrolaza M , Schulz M. Rank E. Analysis of 3D transient b,°°Qd0 fl0WwPa®®'n£ ^ro,U92
an artificial aortic valve by Lattice- Boltzmann methods //J Biomech. 1998
P-453-462. , f. .
^IYG, Chandran К C, Lemmon J. A numerical simulation of mechanical heart valve closure fluid
dynamics // J. Biomech. - 2002. - Vol 35 - P 881-892 rav.tation in a
damson re., Stinebrmg D. R„ Deutsch S. et al. Real-time in vitro observation of cavitato
prosthetic heart valve //ASAIO Trans — 1991. — Vol. 37. — P. 351 Joo.
Lee C S„ Aluri S.. Chandran К В Effect of valve holder flexibility on"s
mechanical heart valve piostheses: an in vitro study //J- Rea av
p- Ю4-113.
297
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
Lee С S., Chandtan К В. Chen L. D Cavitation dynamics of Medtronic Hall mechanical heart valve
prosthesis: fluid squeezing effect // J. Biomech. Eng. — 1996. — Vol. 118. — R 97-105.
Lei M, van Steenhoven A A , van Campen D. H Experimental and numerical analyses of the steady
flow field around an aortic Bjork-Shiley standard valve prosthesis // J Biomech. — 1992
Vol 25, № 3. - P 213-222.
Leo H. L., He Z M,, Ellis J., Yoganathan A. Micro flow fields in the hinge region of Carbomedics bileaflet
mechanical valve design // J Thorac. Cardiovasc. Surg. — 2002. — Vol 124. — P 561-574
Lim W L., Chew Y T., Chew T. C.. Low H. T. Steady flow dynamics of prosthetic aortic heart valves: a
comparative evaluation with PIV techniques // J. Biomech. — 1998. — Vol. 31, № 5. — P 411-421
Lim W L. Chew Y T, Chew T. C, Low H. T. Pulsatile flow studies of a porcine bioprosthetic aortic
valve in vitro; PIV measurements and shear-induced blood damage // J Biomech. — 2001 -
Vol. 34. - P 1417-1427.
Makhijani V В , Yang H. Q., Smghal, A. K.t Hwang N. H. C. An experimental computational analysis
of MHV cavitation- effects of leaflet squeezing and rebound //J. Heart Valve Dis. 3 (suppl. I). -
1994. — P 235-248.
Marinelli R A, Penney D G., Marinelli W A et al. Rotary motion in the heart and blood vessels: a
review h J Appl. Cardiol. — 1991. — Vol. 6, № 2. — P. 421-431.
McCracken M R., Peskin C. S. A vortex method for blood flow through heart valves // J. Comput.
Phys. - 1980. — Vol. 35. — P 183-205.
McQueen D. M„ Peskin C. S. Computer-assisted design of butterfly bileaflet valves for the mitral
position // Scand. J. Thorac. Cardiovasc. Surg. — 1985 — Vol. 19, № 2. — P 139-48.
McQueen D M., Peskin C. S. Yellin E. L. Fluid dynamics of the mitral valve physiological aspects of
a mathematical model // Amer. J. Physiol. — 1982. — Vol. 242, №6 — P. 1095-1110.
Meyer R S., Deutsch S., Bachmann С. B., Tarbell J. M Laser doppler velocimetry and flow visualisatio
studies in the regurgitant leakage flow region of three mechanical mitral valves // Artif. Organs. —
2001 - Vol 25, № 4. — P 292-299.
Milo S, Gutfinger C., Chu G Y, Ghanb M Bubble formation on St. Jude Medical mechanical heart
valves: an m-vitro study // J. Heart Valve Disease. — 2003. — Vol. 12. — P 406-410.
Modi V. J., Akutsu T. Cardiac simulation facility for prosthetic heart valve studies // Proc. 6-th World
Congress on Theory of Machines and Mechanisms, 1983
Morvan D., Cassot F, Fnggi A., Pelissier R. In vitro study of intraventricular flow // Life Support
Systems. — 1984. — Vol. 2. — P. 209-220.
Motti-Link S., Wolf I, Hastenteufel M. et al. Non-invasive assessment of differences between bileaflet
and tiltmg-disk aortic valve prosthesis by 3D-Doppler profiles // Interact. Cardiovasc. Thorac
Surg. - 2005 — Vol. 4. — P. 383-387
Nagy Z L., Fisher J., Walker P. G., Watterson K. G. The effect of sizing on the in vivo hydrodynamic
characteristics and leaflet motion of the Toronto SVP stentless valve // J Thorac Cardiovasc
Surg. — 1999. — Vol. 117. — P. 92-98.
Nygaard K, Paulsen P K., Hasenkam J. M. et al. Quantitation of the turbulent stress distribution
downstream of normal, diseased and artifirial aortic valves in humans // Eur. J Cardiothorac.
Surg. — 1992. — Vol. 6, № 11. — R 609-617
Nygaard H., Paulsen P.K., Hasenkam J. M. et al. Turbulent stresses downstream of three mechanical
aortic valve prostheses in human beings // J. Thorac. Cardiovasc Sura — 1994. — Vol Ю7,
№ 2. — P 438-446
Oh J. К, Appleton С. P, Hatle L К et al Th₽ ™
1M70" Wlth ^o-d'^ensional and Doonlor Ол.ьПУа3^е assessment of left ventricular diastolic
p'997,;- Vo' 10. - P 246-270 РР еГ echocardl°graphy // j. Anl. Soc Echocard.ogr -
t'eskm C. S„ McQueen D. M. A aPn₽rai m
Peskin *c ‘s9 Mlt^f,U'dS Z/ ln Bl0l°9ical Fluid DwaScs?R1PU\er %mulatl0n of biological systems
м2жС S" McOue^ D M Fluid dynamir-j^f Tk 1(E"'ngton С P and Pedley T J ed ), 1995
J n!|TtlCal Modelin9 Oology, Physiology and CpIi ЭПЙ 'tS valves ,n Case stud'es 'n
Pesk?n r q «Гг, "7 410' UPPer Saddle Wver N i° p Blology'ed HG Othmer, FR Adler, MA Lewis.
Peskin C S., McQueen D M. Modelmn I’ NJ' Prent|ce Hall.
PesLn°C9S th/w *^art 11 CornPut- Phys. - 1980 '° for numerical analysis of blood flow
Pesxin C. S„ McQueen D M A throo,я- U’ ~ VoL 37. — P. 113-189
^esKin C S , McQueen D. M A thmp н
H Contractile fibers // Comput РЬ^-Тэвд method for blood flow m the heart.
lacy. - Vol. 82. - p 289-297
ГЛАВА 4. Гидродинамика искусственных клапанов сердца
Peskin CS Flow patterns around heart valves: a numerical method //J Cornput Phvs — 1972 —
Vol. 10. - P. 252-271.
Peskin C. S. Numerical analysis of blood flow in the heart // Cornput Phys - 1977 — Vol 25 —
P. 220-252.
Pierracos O. Hemodynamic flow characterization of St. Jude Medical bileaflet mechanical and
bioprosthetic heart valve prostheses in a left ventricular model via diQital particle image velocimet~
ry // M. S. Thesis. — Virginia Polytechnic Institute, 2002.
Pilliccioni O., Krafczyk M.f Cerrolaza M. et al. Bidirectional fluid structure simulation of blood flow
based on the Lattice-Bolfzmann method: two-dimensional analysis for SJM and MH valves // Int.
Congress Comp. Bioeng, Zaragoza, Spain, 2003.
Prakash S.t Ethier C. R. Requirements for mesh resolution in 3D computational hemodynamics //
Biomech Eng. — 2001. — Vol. 123. — P. 134-144.
Rambod E, Beizaie M.t Shusser M. et al. A phisical model describing the mechanism for formation
of gas microbubbles in patients with mitral mechanical heart valves // Ann. Biomed. Eng —
1999. — Vol. 27, № 4. — P. 774-792.
Rashtian M. Y., Stevenson D. M., Allen D. T. et al. Flow characteristics of four commonly used
mechanical heart valves // Am. J. Cardiol. — 1986. — Vol. 58, № 4. — R 743-752
Reul H., Talukdar N. 1979. Heart valve mechanics. In Quantitative Cardiovascular Studies Clinical
and Research Applications of Engineering Principles, ed. NHC Hwang, DR Gross, DJ Patel —
P. 527-564. Baltimore, MD. — P. Univ. Park Press.
ReulH. In vitro evaluation of artificial heart valves // Advances Cardiovasc. Phys — 1983. — Vol. 5. —
P 16-30.
Reul H., Talukder N., Muller E. W. Fluid mechanics of the natural mitral valve //J. Biomech. — 1981. —
Vol. 14, № 5. — P. 361-372.
Revanna P, Fisher J., Watterson K. G. The influence of free hand technique and pressure fixation on
the hydrodynamic function of aortic root and aortic valve leaflets // Eur. J. Cardiothorac. Surg. —
1997. — Vol. 11, № 2. — P. 280-286.
Richard G., Beavan A., Strzepa P. 1994.Cavitation threshold ranking and erosion characteristics of
bileaflet heart valve prosthesis I Heart Valve Dis. 3 (Suppl. I). — S. 94-101.
Rosenfeld M., Avrahami I., EinavS. Unsteady effects on the flow across tilting disk valves J. Biomech.
Eng. — 2002. — Vol. 124. — P. 21-29.
Rossvoll O., Samstad S., Torp H. G. et al. The velocity distributation in the aortic annulus in normal
subjects: a quantitative analysis of two-dimensional Doppler flow maps // Am. Soc.
Echocardiogr. — 1991. — Vol. 4. — P. 367-378.
Samstad S. O., Torp H. G., Linker D. T et at. Cross sectional early mitral flow velocity profiles from
colour Doppler // Br. Heart J. — 1989. — Vol. 62. - P. 177-184.
Schichl K., Affeld K., Dreysse S. Test procedure for artificial mitral valves // Int. J. Artificial Organs. —
1998. — Vol. 21, № 1. — P. 37-42.
Schwitter J. Valvular heart disease: assessment of valve morphology and quantification using MR //
Herz. — 2000. — Vol. 25, № 4. — P. 342-355.
Scotten L. N., Racca R G., Nugent A. H. et al. New tilting disc cardiac valve prostheses // J. Thorac.
Cardiovasc. Surg. — 1981. — Vol 82. — P. 136-146.
Scotten L N., Walker D. K., Dutton J W. Modified Gorlme equation for the diagnosis of mixed aortic
valve pathology // J. Heart Valve Disease. — 2002. — Vol. 11. — P 360-368.
Shim E. в., Chang K. S. Numerical analysis of three-dimensional Bjork-Shiley valvular flow in an aorta //
J. Biomech. Eng. — 1997. — Vol 119.— R 45-51. .
Shipkowitz T, Ambrus J., Kurk J., Wickramasmghe К Evaluation technique for bileaflet mechanica
valves // J Heart Valve Dis. - 2002. - Vol. 11, № 2. - P. 275-282. hilooHot
Simon H. A. Influence of the implant location on the hinge and leakage flow fields through bileaflet
mechanical heart valves // M. S. Thesis. Georgia Institute of Technology, 2004.
Sloth E„ Houhnd К. C.. Oyre S. et al. Three-dimensional visualization of velocity proflies in the human
main pulmonary artery with magnetic resonance phase-velocity mapping // m. ea
1994 — Vol 128 _______ P 1130-1138
Sneckenberger D. S„' Stinebring D. R., Deutsch S. et al. Mitral heart valve cavitation in an artificial
heart environment // Heart Valve. — 1996. — Dis. 5(2). — P. 216 227 ,hrnlirih ,ri|paflpt
Stevenson D. M„ Yoganathan. A. P. Numerical simulation of steady ‘urbuient low though trdeaflet
aortic heart valves—I. computational scheme and methodology //
Vol. 18. _ p 899-907.
299
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
eve ison D. М Yoganathan А Р, Williams F Р Numerical simulation of steady turbulent flow through
tnleaflet aortic heart valves—II. results on five models // Biomech. 1985. Vol. 18. p. 909-926
f, ber M Capbell A , Richard G., Laas J. Hydrodynamic function of tilting disc prostheses and
bileaflet valves in double valve replacement // Eur. J of Cardiothorac. Surg. — 191 6 — Vol 10 -
R 422-427
Sung H.W, Kmgsbyry Ch. J, Quintero L.J. et al. In vitro evalution of a stentless porcine aortic
biopi osthesis: a preliminary study//ASAIO Transactions — 1991. — Vol 37, № 2. — P 172-174
Sung H W, Le T. N, Kmgsbyry Ch J et al In vitro pulsatile flow evalution of a stentless porcine
aortic bioprosthesis // ASAIO Transactions. — 1995. — Vol. 41, № 1. — P. 89-94.
Thalassoudis К, Mazudar J. Mathematical model for turbulent blood flow through a disk-type
prosthetic heart valve // Med and Biol. Engineering and Computing.— 1984.—Vol.22,
№ 6. — P. 529-536.
Thubnkar M., Heckman J. L, Nolan S. P High speed cine-radiographic study of aortic valve leaflet
motion // J. Heart Valve Dis. — 1993. — Vol. 2. — P. 653-661.
Underwood F. N., Mueller T. J. Numerical study of the steady axisymmetric flow through a disk-type
prosthetic heart valve in a constant diameter chamber // J. Biomech Eng. — 1977. — Vol. 99. -
P. 91-97.
Underwood F. N., Mueller T. J. Numerical study of the steady axisymmetric flow through a disk-type
prosthetic heart valve in an aortic-shaped chamber // J. Biomech. Eng. — 1979. — Vol. 101. —
P. 198-204.
Verdonck P. R., Dumont k., Segers P et al. Mock loop testing of On-X prosthetic mitral valve with
Doppler echocardiography // Artif. Organs. — 2002 — Vol. 26. — P. 872-878.
Vlachos P P, Pierrakkos O., Phillips A., Telionis D P. Vorticity and turbulence characteristics inside a
transparent flexible left ventricle // Bioeng. Conf. ASME. — 2001. — Vol. 50. — P 493-494
Weyman A. E. Principles and Practices of Echocardiography. Philadelphia, PA: Lea & Febiger, 1994.
Wurzinger L , ptiz R , Eckstein H Mechanical blood trauma. An overview // Angeiologie. — 1986. —
Vol 38, № 3. — P. 81-97.
Wu Z. J., Gao В Z., Hwang N. H. C. Transient pressure at closing of a monoleaflet mechanical heart valve
prosthesis: mounting compliance effect // J Heart Valve Dis — 1995 — Vol. 4. — P 553-567
scoub MH, hn L. H. Novel approaches to cardiac valve repair From structure to function:
part 1 // Circulation — 2004 — Vol. 109, № 4. — P. 942-950
Yang W. J., Wang J. H. Turbulent flows through a disk-type prosthetic heart valve // J. Biomech.
Eng. — 1983. — Vol 105, № 3. — P. 263-267
Pes^in Y°ran C. et al. Mechanisms of mitral valve motion during diastole // Am J
Physiol. Heart Circ. Physiol. 1981. — Vol. 241. — P 389-400.
anath n A P., Corcoran W. H. Harrison E C. Pressure drops across prosthetic heart valves under
s ?ady ar d pulsatile flow — in vitro measurements // J Biomech — 1979 — Vol 12, № 1. ~
R153-164
к' Eberharcft • Walker P G Hydrodynamic performance of the Medtronic Freestile
aortic root bioproi thesis // J. Heart Valve Disease. — 1994. — Vol 3, № 3. — P 571-580
Од90ПАдП Au^ReJ'oJ°neS n C Fluid mechan,cs of heart valves //Annular Review Biomed. Eng. -
'UU4 — Vol. 6, № 2. — P 331-362
°9the t гпУр 9 H ' M?0 У R' Jones M in vitro velocity and turbulence measurements in
CarborT and ПпДгпЛГ mecl;a!2ical aortlc heart valve prostheses: Bjork-Shiley Monostrut, Omni-
’ ToDuromediCS // J- Thorac Cardiovasc Surg — 1988, — Vol 95 № 5. — P. 929-939.
Shfley*and C roantier Ed Wll!!arnS F'P et al ,n Vltro dynamic characteiistics of lonescu-
P 459-469° P nter'Edwards t,ssue bioprostheses // Artificial Org. - 1983 - Vol 7, №4 -
УО9&оатеЬ,с1| EnanXTH;,ndbHToCh * MeChanics of heart // B™z,no JD, ed The
hX™i d Sseeva г V я f°k, B°Ca Ra'On' CRC Press- ChaP,er 13. - 1995 - P. 440-453
heart valve Liks and Carhomk^//^’^ °' V' The flow field ln the v'C'n'ty of two Russian artificial
(SuppM) - P ад" 0П kS " Acta of B'°engineenng and Biomechanics. - 2002. - Vol 4
’prostlSti^heartTS/^42 al ln°dservation of cavitation on
1 w vol 4г. — p. 550-555
ГЛАВА 5
МАТЕРИАЛЫ ДЛЯ ИСКУССТВЕННЫХ
КЛАПАНОВ СЕРДЦА
По определению Национального института здоровья США, биоматериалами назы-
ваются любые вещества (кроме лекарственных) или их соединения искусственного или
естественного происхождения, которые могут использоваться в системах или частях
систем для излечения, улучшения или замещения ткани, органа или функции организ-
ма на любой период времени (Boretos J.W. et al., 1984).
К биоматериалам для изготовления искусственных клапанов сердца предъявляют-
ся следующие требования: сохранение механических свойств во времени (прочность,
гибкость, долговечность, усталостная устойчивость, гладкость поверхности, техноло-
гичность); биосовместимость (нетоксичность, биофункциональность, отсутствие каль-
цификации, воспалительного, антигенного, иммуногенного и аллергического ответов);
гемосовместимость (отсутствие тромбозов и тромбоэмболических осложнений, гемо-
лиза, денатурации белков); неканцерогенность; химическая инертность; биодегради-
руемость, коррозионная устойчивость; рентгеноконтрастность (Бокерия Л А. и др.,
2002; Sioshani R, 1995; Campbell A. et aL, 1996; Chen J.Y et al., 2002) Для успешной
разработки биоматериалов в настоящем и будущем необходима совместная работа
специалистов в области материаловедения, цитологии, биохимии, молекулярной биоло-
гии, генетики, физики и хирургии.
Биоматериалы, применяемые для изготовления протезов клапанов сердца, подраз-
деляются на: органические (коллаген, эластин, ткани естественных клапанов сердца
человека и животных, перикард, твердая мозговая оболочка, широкая фасция бедра,
глиссоновая капсула печени); полимерные (полиметакрилат, нейлон, полипропилен,
силиконовый каучук, политетрафторэтилен); керамические (пиролитический углерод);
металлические — нержавеющая сталь, сплавы металлов (Севастьянов В И., 1990; Вих-
ров С. П. и др., 2006; Штильман М. И., 2006; Helmus М N. et al., 1993; Peppas N.A. et
al., 1994; Kawamoto N. et aL, 1997).
По определению Европейского общества по биоматериалам: «Биосовместимость —
это способность материала действовать, вызывая адекватную реакцию со стороны
организма в каждом конкретном случае его применения». Основные свойства матери-
алов, которые определяют функцию искусственного клапана сердца в организме и от
которых зависит их биосовместимость, подразделяются на механические, физические
и химические. Требования, предъявляемые к имплантантам, можно свести к трем: со-
вместимость материала и среды, в которой он должен функционировать; соответствие
механических и физических свойств функции, выполняемой имплантантом; относитель-
ная простота производства и доступность необходимых компонентов (Севастьянов В. И.
и ДР . 1987; Гриценко В. В. и др., 1996; Немец Е. А. и др.. 1999; Elves M.W., 1981;
Leuer L. Н et aL, 1996; Seyfert U. T. et aL, 1998).
Как следует из глав 2 и 3, элементы механических искусственных клапанов сердца
и биопротезов, при изготовлении которых использовались и используются биомате-
Риалы, разделяются на: 1 — пришивные манжеты (полипропилен, поливиниловыи
СПиРт (ивалон), фторопласт, полиуретан, пенополиуретан (поролон), политетрафтор-
этилен (тефлон), политетрафторэтилен с углеродным покрытием, полиэстер, полиэс-
тр с серебряным покрытием или серебряной нитью, дакрон с углеродным покрытием,
углеРодосодержащий материал Витлан, лавсан с углеродным, серебряным, пористым
_____________________________________________________301 ---------
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
и тетрафторэтиленовым покрытиями); 2 — запирающие элементы механических ис-
кусственных клапанов сердца, лепестковые (нейлон, полиамид, дакрон, поливинил
тефлон с пропиткой силиконовым каучуком, полиуретан, полиэфируретан, полипропи-
лен), шаровые (метилметакрилат — оргстекло, кобальтохромовые сплавы Haynes и
Stellite, титановый сплав, пиролитическии углерод, силиконовым каучук); полушаровые
(силиконовый каучук); дисковые (тефлон, полиацитамин Delrin, титан, кобальтохромо-
вый сплав Stellite, полиэтилен, армированный титановым кольцом, силиконовым кау-
чук, новый каучук, армированным полипропиленом, пиролитический углерод); поворот-
но-дисковые (тефлон, силиконовый каучук, фторопласт, полиацитамин Delrin, графит,
покрытый пиролитическим углеродом, пиролитический углерод, углеситал); двуствор-
чатые (пиролитический углерод, графит, покрытый пиролитическим углеродом, углеси-
тал); запирающие элементы биопротезов (твердая мозговая оболочка, широкая фас-
ция бедра, ткани естественных клапанов сердца человека и животных, перикард, глис-
соновая капсула печени, коллаген, эластин); 3 — корпусы механических клапанов
(полипропилен, поликарбонат, нержавеющая сталь, кобальтохромовые сплавы Haynes
и Stellite, сплав Alacnte XSM, титан, титановым сплав, графит, покрытые пиролитичес-
ким углеродом, углеситал, титан и титан, имплантированный атомами углерода); био-
протезов (нержавеющая сталь, титан, титановый сплав, лавсан, полиэтилен, полибу-
тилтетрафталат, полипропилен, кобальтохромовый сплав Haynes, дакрон, кобальтони-
келевый сплав Elgiloy, полиацитамин Delrin, полимер Acetal); биоинженерных клапа-
нов — полимеры коллагеновой, полигликолевой и полимолочной кислот
ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА БИОМАТЕРИАЛОВ
Полимеры по своей тромборезистентности разделяются на три группы, способ-
ствующие тромбообразованию, нейтральные и задерживающие образование тромбов
Представителями первой группы являются нейлон, полистерин. Ко второй группе от-
носятся дакрон, тефлон, полиуретан, полиэтилен и ряд других полимеров. В третью
группу входят силастик, поливинил-пирролидон и некоторые другие соединения. Оп-
ределяющим фактором в этих группах является химическая структура полимеров (Сму-
рова Е В. и др , 1976; Сэноо Манабу, 1981; Новикова С П., 1996; Kim S. W. et al., 1996;
Favia P. et al., 1998)
Полимеры наиболее широко исппль-чит о
меры имеющихся областей качестве медицинских материалов. При-
ны сердца, каркасы для биопротезол Ю1ючают лепестковые искусственные клапа-
кусственное сердце, сосудистые поотр^^^п6' ДЛЯ клапанов тканевой инженерии, пе-
шихмакромолекул, состоящих, в свою сериалы состоят из боль-
молекул мономеров. Эти длинные мп по 0Чередь’ из большого числа повторяющихся
ковалентными связями При пеоекпР1имоКУЛЬ1 являются цепочками атомов, связанных
Другом посредством слабых вторичных макромолекулы взаимодействуют друг с
ан-дер-Ваальса) Ковалентный хапяггоп И (в°Я0Р°Дные связи и взаимодействия
кул локализует электроны, и поэтомч па Межатомног° соединения в пределах моле-
водность (Petite Н. et al., 1994) имеры имеют низкую термо- и электропро-
На механические и тепловые еллмг
чающих состав основных и побочных гп ПОлимеров влияет несколько факторов, вклю-
молекул. Пластическая деформация по?7™' СТруктурУ Цепей и молекулярную массу
макромолекулярные цепи скользить доиг °АИТ' когда механические силы вынуждают
нПию "еРа-ИЛИ его СТРУКГУРЫ. увеличиваю,,?Jp°CMTe/1bH0 друга- Изменения в составе
ной гпипеи’ повышают прочность И Снижают пп сопрс1Тивление Относительному деиже-
бочн РУППе' увеличиваюЩие ее жесткость астичность материала. Замены в основ-
Увелич/РУППЬ1 также способствуют усложнениюЯТСТВУ*°Т движению цепей. Большие по-
ет их <ттцИе ДПИНЬ| макромолекулы также лепяо продесса рэскручивания макромолекул
осительному движению (Огибался п лл Ц6ПИ менее ^обильными и препятству-
--------- 302 _______ П' М- и др- 1975: Немец Е. А. и др, 1994).
— —
ГЛАВА 5. Материалы для искусственных клапанов сердца
Для деградации полимеров необходимо разрушение их макромолекулярной струк-
туры, для чего необходимо изменение межатомных ковалентных связей в цепях или
изменение межмолекулярных взаимодействий между цепями. Первого можно достичь
путем разделения цепи или взаимного соединения смежных цепей, что имеет малую
вероятность в физиологических условиях. Соединение цепей достигается путем объе-
динения (абсорбции) или устранения (выщелачивания) составляющих элементов с низ-
кой молекулярной массой. Химические реакции, такие как окисление и гидролиз, и
способы стерилизации также могут изменить свойства полимеров К примеру, воз-
действие высоких температур (121-180°С), пара, химических реагентов (оксид этиле-
на) и радиации может изменить форму и механические свойства полимерных матери-
алов. Полимеры могут содержать различные добавки, следы катализаторов, ингиби-
торы и другие химические соединения, необходимые для их синтеза Через какое-то
время в физиологической среде эти соединения могут выщелачиваться с поверхности
полимера. Химические соединения, высвобождаемые из полимеров, могут индуци-
ровать неблагоприятные местные и системные реакции хозяина, являющиеся причи-
ной клинических осложнений. Это высвобождение имеет отношение к гибким полиме-
рам, таким как поливинил хлорид, который содержит низкомолекулярные добавки (пла-
стификаторы) для увеличения его пластичности (Сэноо Манабу, 1981, Cooke F. W.
et al., 1996).
В дополнение к спонтанной деградации были разработаны полимеры со свойством
управляемой деградации. Среди биодеградирущих полимеров наиболее широко при-
меняют полимолочную кислоту, полигликолевую кислоту и их сополимеры. Эти мате-
риалы деградируют до меньших фрагментов и мономеров, типа молочной кислоты,
которая может быть элиминирована в ходе нормальных метаболических процессов
организма. Биодеградирущие полимеры используют при изготовлении шовного мате-
риала, в тканевой инженерии, при управляемом введении лекарств. Механические свой-
ства полимеров, представленные в табл. 5.1, зависят от нескольких факторов, включаю-
щих состав и структуру макромолекулярных цепей и их молекулярную массу (Schoen F. J.
et aL, 1988; Ratner В. D. 1993; Wilson G. J. et aL, 1995; Tweden K. S. et al , 1997)
В сравнении с металлами и керамиками, полимеры имеют более низкую прочность,
но большую деформируемость. Полиуретан был впервые синтезирован О Bayer в 1937 г.
и использовался при производстве створок клапанов, покрытий механических клапа-
нов и искусственного сердца. Однако этот материал имеет один недостаток абсорб-
ция белков, в результате которой развивается тромбоз и бактериальная инфекция
(Colman R. W. et aL, 1987; Hilbert S. L. et aL, 1987; Courtney J. M. et aL, 1994). К сожале-
Табяшш 5.1
Механические свойства полимеров
. В. Park et al., 1992; по J. Kohn et al., 1996)
Полимер Модуль Юнга, Е (ГПа) Предел прочности на разрыв, вцтзСМПа) Растяжимость, %
Полиметилметакрилат Нейлон Полиэстер Полимолочная кислота Полипропилен Политетрафторэтилен Силиконовый каучук ^Полиуретан 2,2 2.8 1.84 1,2-3 1,1-1.55 0,5 10 0,16 30 76 48 28-50 28-36 17-28 2,8 50 1.4 90 0 2-6 400-900 120-350 160 0
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
нию, ученые были не способны найти подходящую замену такому материалу с такими
же механическими свойствами и относительной биосовместимостью. Поэтому они на-
чали исследования возможных улучшений полиуретана в попытке улучшить его био-
совместимость (Валуев Л И , 1981, Frautschi J. R. et al., 1993, Hyde J. A. et al., 1999,
Rang I. K. et al., 2001)
Возможным решением проблемы биосовместимости является синтез полимернс го
сплава, состоящего из полиуретана и фосфолипидного полимера. Исследование этого
сплава показало значимое снижение протеинов, абсорбируемы на поверхности, кон-
тактирующей с кровью. Новый сплав полиуретана с добавлением политетраметилам-
моний оксида и диизоцианат дифенилен метилена вместе с удлинителями цепей
З-тринетиламмоний-1,2-пропанедиолиодид и З-диметиламино-1,2-пропанедиолиодид
также ограничивает начало тромбоза (Kohn J. et al., 1996).
Полиэфируретан разработан для постоянных имплантантов и демонстрирует впе-
чатляющее сочетание механических свойств и биосовместимости. Этот термопласти-
ческий эластомер формируется как продукт реакции полиола, ароматического дии-
зоцианата и низкомолекулярного гликоля, используемого как удлинитель цепей. По-
верхность створок некоторых лепестковых клапанов, контактирующая с кровью,
изготавливалась из полиэфируретана. Полиэфируретан может быть устойчив к обра-
зованию тромба, если он имеет ультрагладкую контактирующую поверхность. Тромбо-
резистентность объясняется способностью полиэфируретана избирательно абсорби-
ровать альбумин сыворотки крови (Wang D. A et al., 2001). Сердечные клапаны из по-
лиуретана могут быть функционально надежными при минимальной кальцификации в
искусственной среде. В живом организме эти характеристики будут зависеть от устой-
чивости полиуретана к тромбообразованию и биодеградации Модификация поверх-
ности гепарином, таурином или аминосиланом может улучшить свойства полиуретана
и повысить его долговечность (Доброва Н. Б. и др., 1981; Szycher М , 1983; Alexander Н.
et al., 1996; van Delden C. J et al , 1997).
Большое распространение для изготовления клапанов получили металлы. К ним
предъявляются требования биологической инертности, стойкости к коррозии, высо-
кой механической прочности и хорошие усталостные характеристики. Часто приме-
няли нержавеющие стали различных марок, некоторые сложные сплавы, например
виталлиум, состоящий из 65 Ь кобальта, 30% хрома и 5% молибдена, а также сплавы
титана (Вильямс Д. Ф. и др , 1978, Бядретдинова М А. и др., 1986) Последние ока-
зались более перспективными ввиду биологической инертности, малого удельного
веса, по сравнению с другими металлами, высокой устойчивости к коррозии и боль-
шой механической прочности (Ratner В D., 1993, Cooke F. W. et al., 1996). Основные
сплавы, применяемые при изготовлении искусственных клапанов сердца, представ-
лены в табл 5 2
Металлические сплавы обеспечивают лучшие прочностные и антикоррозионные
свойства по сравнению с чистыми металлами. На атомарном уровне металлы состоят
из положительно заряженных ионов, погруженных в облако свободных электронов Эта
структура атомарного уровня ответственна за характеристики и отличительные свой-
ства металлов. Металлические связи позволяют атомам группироваться в определен-
ные, повторяющиеся, трехмерные кристаллические решетки, которые могут визуали-
зироваться в виде кубических или шестиугольных структур из твердых сфер. Свобод-
мо^оЭЛеКТ^°НЫ ответственнЬ| 1а электро- и термопроводность металлов Поскольку
awnJ0MHbie связи в металлах не имеют пространственного направления, плоскости
^ЗИТЬ относительно Друга, допуская пластическую деформацию
^□LIIUcll Г J., 1Уоо)
зей. Чем бопер \/гтп-ТВа материалов также обусловлены характером межатомных свя-
таллов данные гвя^иЧпВЫ СВЯЗИ атомов с ионами, тем более инертен материал У ме-
ства металлов пепяют тносительно слабые Следовательно, хотя механические свой-
их подходящими для многих применений в биомедицине, необ-
304
ГЛАВА 5 Материалы для искусственных клапанов сердца
Ia6iuii/i ^.2
Составы сплавов для производства искусственных клапанов сердца,
массовые % (по Н. Alexander et al., 1996)
Элемент Нержавеющая сталь Со-Сг-Мо Ti TP6A1-4V
5,5-6,5
AI С 0,03 0,35 0,00 0,08
Со — 59-65 —
Сг Fe 17 68 26-30 0,75 0,3-0,5 0,0125-0,015 0,25 0,0125
Н —
Мо 2 5-7 —
Ма N 2 1 0,25 0,03-0,05 0,05
NI 10 1 0,18-0,40 0,13
О —
р 0,03 —
S 0,03 —
Si 0,75 1 99 89-91
Ti V — — — 3,5-4,5
ходило принимать ео внимание их восприимчивость , к ^п^ерхности, свои-
взаимодействия клеток и тканей с “’^""ХГ^Хток влизкораслело-
ства материалов имплантантов имеют боль ярт электронную структуру и вза-
женных атомов на одной стороне поверхности имеют более высокий энергети-
имодействие между атомами. Поверхностные ныМИ в толще вещества,
ческий уровень по сравнению с атомами, Распол°^ перестраиваются или
В результате, они стремятся к уменьшению св постижения более стабильного
образовывают химические связи с молекулами для достиже
энергетического уровня (Coleman D. L. et а.,пПрЛИпуется в водном растворе при
Физиологическая окружающая среда о ычн электролитами, с добавлением
температуре 37сС и pH 7,3 с растворенными г ’ может приводить к их корро-
клеток и протеинов. Погружение металлов в химических реакций В течение
зии— деградации и удалению металла пор ие бИОматериалы могут вы звобож-
электрохимического процесса коррозии м а перед имплантацией через хими-
дать ионы и снижать биосовместимость матеР пкО^хающего воздуха или при окис-
ческое взаимодействие металлов с кислород ется оксидная пленка. Посколь
лении в растворе кислоты на их поверхности ют функцию электрических и
ку оксиды являются керамиками, которые ведущие к коррозии, предотвра
тепловых изоляторов, электрохимические р примеру, имплантанты, изготовлен
щаются (Ebert R. et al., 1982; MrtanuraY, 1989>p^nnP" кратковременном применении
ные из нержавеющей стали, хорошо показали анию неровностей на поверхносг
но восприимчивы к щелевой корро: ии и о ра металлов, применяемых в п
при имплантации на длительные сроки, икр сердца, представлена на рис _
изводстве механических искусственны кл сплавы, обладают более благоп
Титан и его сплавы, так же как кобальтохромовые спла^^ аллергических реакции,
ным сопротивлением коррозии. Кроме тог , и были вызваны никелево
таких, которые наблюдались с нержавеющей сталью
перчувствительностью окружающих тканей.
305
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
Рис. 5.1. Микроструктура металлов, применяемых в производстве механических искусственных
клапанов сердца (по В. R. Schlenker, 1974; I. J. Polmear, 1995):
а — нержавеющая сталь, б — титановый сплав, в — кобальтохромомолибденовый сплав
Некоторые механические характеристики металлических биоматериалов представ-
лены в табл 5.3. С несколькими исключениями, высокая устойчивость к растяжению и
усталости металлов, по сравнению с керамиками и полимерами, делают их материа-
лами выбора для изготовления имплантатов, несущих механические нагрузки
Механические свойства имплантата зависят не только от типа металла, но и от техно-
логии производства. Тепловые и механические условия обработки могут повлиять на мик-
роструктуру материалов. К примеру, при холодной обработке металла (прокат или ковка)
результирующая деформация делает материал прочнее и тверже, но более химически
активным Другим преимуществом металлов на основе титана в качестве материалов для
имплантатов является их благоприятное отношение прочность-удельный вес Стабиль-
ная пленка из оксида титана, которая формируется на поверхности титана и его сплавов,
придает им превосходящую устойчивость к коррозии, по сравнению с нержавеющей ста-
лью и кобальтохромовыми сплавами (Газарян А С и др , 1981, Brunski J В., 1996 )
Подходящие характеристики титана включают устойчивость к коррозии, биосовме-
стимость, низкие модуль Юнга и плотность К материалам, из которых изготавливают
запирательные элементы искусственных клапанов сердца, кроме того, предъявляются
дополнительные требования Они должны иметь удельный вес, близкий к удельному
весу крови, гладкую поверхность, способствующую снижению образования на ней тур-
булентных потоков крови Эти материалы не должны вызывать отложения фибрина на
воей поверхности и не прорастать соединительной тканью Наоборот, пришивная ман
ета, пр дна наченная для фиксации клапана к окружающим тканям, должна хорошо
Габлица 5 3
Некоторые механические свойства металлических биоматериалов
(по J. В. Brunski, 1996)
_—. Материал Плотность, р (г/см3) Модуль Юнга, Е (ГПа) Предел упругости, guts (МПа) Предел проч- ности на разрыв, CTUTS (^1^ ) Предел усталости,
Нержавеющая сталь 8 8 190-200 220-1210 590-1350 241-820
Со-Сг-Мо т, 7,8 210-253 450-1600 660-1900 210-950
1 1 Ti-6A1 4V 3 LL 06 110 116 490 950 900-1030 620-760 970-1100 300 620
_____-------------------ГЛАВА 5 Материалы для искусственных клапанов сердца
прорастать соединительной тканью, чтобы обеспечить надежную и длительную связь
протеза с тканями организма у
Керамики - материалы, состоящие из металлических и неметаллических элемеи
тов, связанных друг с другом посредством ковалентных и/или иных типов связей Как
в случае с металлами, межатомарные связи в керамиках способствуют формированию
распространенных трехмерных кристаллических структур В отличие от металлически
связей, электроны в ионных и ковалентных связях расположены между формирующи
ми связь ионами/атомами Следовательно, керамики - типичные представители элек-
тро- и термоизоляторов. Сильные ионные и ковалентные связи также делают керами-
ки твердыми и ломкими, потому что плоскости атомов/ионов не могут скользить друг
относительно друга Керамики ломаются при любых небольших пластических дефор-
мациях и они чувствительны к образованию трещин или других дефектов Ионная
и/или ковалентная структура керамик также влияет на их химические свойства Глав
ные недостатки, ограничивающие использование керамик в качестве материалов для
изготовления имплантатов. — их хрупкость и плохие растяжимые свойства Хотя они
обладают высокой прочностью при сжимающей нагрузке, керамики ломаются при низ-
ких напряжениях на растяжение и изгиб (Агафонов А. В и др , 1979, Евдокимов С В и
др., 2001; Agathopoulos S et al , 1995)
Немаловажным событием в истории развития искусственных клапанов сердца была
разработка нового материала, который прочно занял лидирующее положение среди
прочих и до сих пор остается одним из самых применяемых материалов при изготов-
лении протезов клапанов Речь идет о пиролитическом углероде Разработка этого
материала началась после опытов V Gott (1961) над собаками в университете Вискон-
сина Он изучал тромбообразование на материалах, из которых в тот период изготав-
ливались заменители клапанов. V. Gott устанавливал в нижнюю полую вену собак ма-
ленькие трубочки, изготовленные из различных материалов которые закупоривались
сгустками крови за время от нескольких минут до двух часов Нанесение слоя из гра-
фита, смешанного с гепарином, связанного с хлоридом бензалкония, устраняло фор-
мирование сгустков у животных более чем на 2 недели.
Публикации V Gott о биосовместимости графита привели к формированию специ-
ального направления в исследованиях компании General Atomic, из которой впослед-
ствии образовалась Sulzer Carbomedic Inc В 1963 г медицинскому подразделению
General Atomic было дано задание разработать новую разновидность углерода для ис-
пользования в имплантируемых медицинских конструкциях. К этому времени промыш-
ленность наиболее развитых стран выпускала широкий ассортимент углеграфитовых
материалов Однако большинство таких материалов традиционной электродной техно-
логии не имели биологического применения, главным образом, вследствие их боль-
шой пористости и низкой механической прочности Появление технологий получения
углеродных материалов из газовой фазы при термическом разложении (пиролизе)
углеводородов на нагретой поверхности позволило создать так называемые пироугле
родные материалы (пироуглерод) с уникальным сочетанием свойств
Пиролитическим углерод, механические свойства которого представлены в табл 5 4,
принадлежит к семейству турбостатических углеродов, которые имеют сходную стру
W с графитом Пиролитический углерод, со свойственной ему плотностью, гладкой
структурой и технологичностью, впервые применен для изготовления искусственны
клапанов сердца J Bokros и V Gott в 1966 г Его электрическая проводимость полезна
Для придания ему электростатического заряда, отталкивающего клетки крови Этот
Уникальный материал является одним из самых биосовместимых материалов, создан-
ных человеком (Gott V L 1972, Goodman S L. et al., 1996) Обработанный пиролитичес-
кий углерод является черным,’ гладким, плотным, хрупким и упругим материалом Гра-
фит и гладкий углерод имеют меньшую механическую прочность, чем пиролитическип
Углерод Кроме того, средний коэффициент эластичности почти такой же, как и у всех
Углеродов Прочность и плотность пиролитического углерода намного выше, по срав-
------- ------------- 307
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
Механические свойства различных типов углерода
(по J. Black, 1992, J. В. Park et al., 1992; L. L. Hench, 1996;
В. Ф. Татаринову, 2004)
Таблица 5 4
Механические свойства Графит Пиролити- ческий углерод LTI Графит с пироуг- леродным покрытием Pnolite Пироли- тический углерод Оп-Х Пироли- тический углерод ПГИ Угле- ситал УСБ Угле- ситал УСП
Легирование, массовые % — 12 (Si) — — — 10-20(В) 12-18 (В)
Плотность, кг/м3-103 1,5-1,9 1,5-2,2 1,5-2,2 1,9 1,8-2,1 1.8-2,1 1,8-2,1
Размер кристал- литов, м 109 15-250 3-5 — — 16-20 10-15 9-10
Твердость ГПа 0,5-1,2 2,7-2,8 2.7-3.0 — 0.3-0,6 1.0-1.3 0,9-1,4
Предел прочности 0,1-0.3 0.4-0,5 0,5 0,1-0,2 0,2-0,3
на изгиб, ГПа 0 3-0,4
Модуль Юнга, ГПа 4-12 27-31 35 26 13-14 21 23-25
Деформация раз- рушения % 0.1-0.7 1,5-2,0 1.5-2,0 — —
Сопротивление, на излом, МПа^м 1.5 0,9-1,1 1,0-2,6 1.7 — — —
nei ию с графитом и гладким углеоотюм лпа
углерод, легированный кремнием испопкчио^ сердечных клапанов пиролитический
таллическом графитовом основании Кре JhhsV ТОЛСТОГ° покрытия на поликри-
их воиств, таких как жесткость плит Р И до®авляется Для улучшения механичес-
пот рь в биосовместимости (Bolz A At^iiaon” заосоУстойчивость, без существенных
Испытания, проведенные в 1965 г noxlS? ° Н ’ 1"6)
свойствами обладают покрытия из И7птппп а™’ ЧТ0 ЛУЧШИМИ тромборезистентными
какой либо дополнительной обработки к-/0™ пиролитического углерода, причем без
боток новый материал — низкотемпрпатч повврхности в 1969 г, после 6 лет разра-
л тированный кремнием, названный PvrJ7PHb,M изотропнь,й пиролитический углерод,
лические материалы в протезах Лаптоп?' ~ НЭЧал выте^ять полимерные и метал-
Для лементов механических клапанов Ru Сердца ВпеРвые изотропный пироуглерод
г°^еб/Ремя за РУбежом ХсственНТМеНеН 6 США Широ*° известные в на-
Carbomedics изготавливают из изотропнотНп'е клапаны сеРДДа St Jude Medical и
rm yroliti Carbon), легированного кпрмНыИР0 нГ^Р°Да LTI ^Low TemPerature Isotropic
слоем7 cY₽M Газофазного пиролиза углеводородов ИзотропнЬ1Й пироуглерод LTI по-
стоем Следует отметить, ню LTI игпТ°оЯ°Р°Д0В 8 Установках с псевдоожиженным
км на графитовой подложке оппрпо 5я тольк<-) в виде покрытия толщиной
o6nafiB конструкции «лапана (рис 5 2) Технг °И конфигураДии Для изготовления эле-
Ппа^ каждои Детали (Sharma С Р 19йл предУСматРивает индивидуальную
Практическое применение спотол? 984' Bokros J с- et al., 1991 1992)
Щиной°ГРаНИЧеНО И3-3а нев°зможности°по°ВаННОго на технологии псевдоожиженного
остаточной для изготовления монолитных отложения С Т°Л‘
3Qg л |<,'ЗДсЛИИ
ГЛ А ВА ^.Материалы для искусственных клапанов сердца
Рис. 5.2. Разлом створки двустворчатого клапана, изготовленной из графита (1) с покрытием
пиролитическим углеродом LTI (2) толщиной 400 мкм (по R. О. Ritchie, 2004)
К началу 70-х гг XX столетия в нашей стране в ВНИИ «Графит» (Москва) и в Госу-
дарственном институте прикладной химии (Санкт-Петербург) были независимо полу-
чены два принципиально новых пироуглеродных материала: монолитный изотропный
пиролитический углерод, легированный бором, — углеситал (УСБ) и изотропный пиро-
графит (ПГИ) Основным отличием этих материалов является то, что они получаются в
виде монолитных отложений на стационарных графитовых подложках По морфологии
и структуре ПГИ и УСБ идентичны ПГИ состоит полностью из углерода, а УСБ легиро-
ван бором При примерно равной плотности УСБ превосходит ПГИ по прочностным
показателям в 1,5-2 раза Их главным отличием от зарубежного материала Pyrolitte
является монолитность, так как Pyrolitte является, по существу, композитом, основу
котор го составляет мелкозернистый графит, покрытый изотропным пиролитическим
углеродом толщиной всего 100-200 микрон (Кристенсен Р, 1982)
Благодаря модернизации технологии производства УСБ, проведенной в 80-е гг XX
столетия на московском предприятии «Элма» (Калугин В И. и Козыркин Б И ), а затем
на московской фирме «Три Карбон» (Агафонов А В и Петров В П ) и на Кирово-Че-
пецком химкомбинате им Б А Константинова (Татаринов В Ф и Евдокимов СВ), этот
материал начал успешно применяться для изготовления дисков отечественных клапа-
нов Эмике, Микс, Ликс-2 В первом отечественном полностью углеродном клапане Кар-
боникс створки были изготовлены из УСБ, а корпус — из ПГИ Для изготовления ство-
Рок наиболее применяемого в нашей стране отечественного клапана Мединж были раз-
работаны и внедрены новые технологии получения углеситалла марки УСП для
изготовления створок клапана и углеситалла марки УСВ для изготовления корпуса про-
теза, которые позволили существенно улучшить качество УСБ, по сравнению с суще-
ствующими технологиями (Татаринов В Ф., 2004) Несмотря на широкое применение
80 всем мире искусственных клапанов сердца из изотропных пироуглеродных матери-
алов, проблема их совершенствования остается актуальной Например, необходимо
повысить рентгеноконтрастность УСБ для обеспечения контроля функции искусствен-
Нь,х клапанов в сердце (Агафонов АВ и др , 1984, Калугин В И. и др , 1984, Евдоки-
мов С В и др , 1985 2001, Татаринов В Ф , 2004)
Для улучшения биосовместимости биоматериалов применяют различные способы
модификации их поверхности На процессы взаимодействия биоматериала с кровью
влияют структура, рельеф, физико-химические свойства поверхности Модификация
Данных характеристик направлена на регуляцию биомолекулярной адсорбции, прикреп-
И роста клеток, предупреждение активации систем коагуляции и комплемента
ard с А et al , 1984, Huang N et al , 2002, 2004)
309
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
Биологическая модификация поверхности может проводиться путем связывания
тьбумина прививания гепарина, иммобилизации гирудина, засевания эндотелиаль-
ными Jiei ками (Montz A et al., 1991; Feng L et al., 1994, Bos G. W et al., 1998; Kudo F. A
et tI Ю02) Поверхность, покрытая такими биологическими молекулами, связывает
белки плазмы, например фибриноген, тем самым предотвращая коагуляцию крови.
Установлено, что покрытие некоторыми видами белков, такими как фибронектин, кол-
лаген, витронектин, внеклеточный матрикс, олигопептид, может улучшать адгезию эн-
дотелиальных клеток. Но для полученного таким образом эндотелиального слоя оста-
ется проблемой поддержание его функции в течение длительного времени. Для нане-
сения ковалентного покрытия альбумином на химически инертные полимеры
применяют предварительную у-, фото-, плазменную активизацию их поверхностного
слоя. Перспективным направлением является гибридная биологическая модификация
поверхности: эндотелиальные клетки-гепарин-альбумин и эндотелиальные клетки-пеп-
тид-полиэтиленоксид (Кравцова И. А. и др., 1981; Севастьянов В И. и др., 1993, Holt D. В.
et al, 1994; IkadaY., 1994; Fischlem T et al., 1996).
Химическая модификация подразумевает нанесение новых молекул на поверхность
биоматериала, например полиэтиленоксида, имеющего большие молекулярный вес и
структуру макромолекулярной цепи. Уникальные свойства оксида полиэтилена заклю-
чаются в том, что он имеет очень низкую межфазную энергию с водой и является во-
дорастворимым, один конец его структурной цепи прикрепляется к материалу, а дру-
гой остается свободным. Материал имеет превосходную биосовместимость при длине
цепи полиэтиленоксида, содержащей более 100 структурных единиц. Одна из основ-
ных гипотез биосовместимости с кровью оксида полиэтилена основана на улучшении
микрогемодинамики посредством быстрых движений длинной макромолекулярной цепи
(Andrade J. D. et al., 1987; Могга М. et al., 1993; Clapper D. L. et al , 1995; Chrzanowski FA.
et al., 1998).
Физическая модификация поверхности проводится плазменным методом или ион-
ной имплантацией с образованием покрытия из органических или неорганических ве-
ществ Плазменный метод может применяться на различных материалах, включая по-
лимеры, металлы, керамику сложной формы и малых размеров Материал помещает-
ся в вакуумную камеру, в которой генерируется плазма. На вход камеры подается
органический или неорганический мономер, который под воздействием плазмы раз-
лагается на активные группы, образующие тонкий устойчивый поверхностный слой.
Например, при модификации поверхности полиэтилентетрафталата мономером триэ-
т л нгликолем в постоянной и пульсирующей плазме адсорбция белков уменьшается
в 5 раз (Beyer D. et al., 1997).
Модификация поверхности металла, керамики и полимерных материалов методом
ионной имплантации (Na*. Н2+, Не+, О+, О2+, N+, N2+, Аг', К , КГ и др.) проводится при ком-
?мп :ратуре, энергии 150 КэВ, поверхностной концентрации 10’4—10 ионов/см
Такая модификация изменяет полярность и смачиваемость поверхности, улучшает ан-
т л тные и антикальцификационные свойства материалов, адгезию эндотели-
альных клеток. Например, сосудистый протез из политетрафторэтилена с поверхно-
стью, модифицированной имплантацией ионами Не , не тромбировался в кровенос-
ном русле собаки в течение 120 дней, а необработанный тромбировался за 3 дня.
экспериментальной модели искусственного клапана сердца способом ионно-плаз-
f нн го напыления на титановую поверхность клапана наносилось алмазоподобное уг-
л роди je покрытие путем подачи на мишень из спектрально чистого углерода плотно-
стью 1,2-2,0 г/см ионного тока плотностью 6-7 мА/см2 (Белов Е Ф. и др., 1985, Ама-
натов Л. С. и др., 1998; Орловский П И и др., 1999). В отечественных протезах
П|Эимене,1 метод имплантации углерода в титановый каркас, доза импланта-
(ИоФис н Т Менее о ионов/см2, при давлении 8 103 Па и температуре 250-450 С
пеярпуипг тм ’ - яЛ К недостаткам метода относится трудность модификации
ложной формы и высокая стоимость (Sioshani R, 1995)
310 -____________________ ________________________________
ГЛАВА 5, Материалы для искусственных клапанов сердца
Покрытие биоматериалов твердой пленкой TiN, SiC, А12О3, алмазоподобного углерода
проводится методами плазменного или ионного напыления (Dion I et al , 1993) Преиму-
ществами этого процесса является возможность использования деталей сложной фор-
мы, относительно низкая цена, большая прочность и износоустойчивость покрытия
(Thomson A. et al., 1991; Tran Н. S. et al., 1999). Биосовместимость данных покрытий близка
к пиролитическому углероду LTI. Покрытие оксидом титана (ТЮ) значительно улучшает
тромборезистентные свойства биоматериалов — рис. 5.3 (Галич Н.П. и др., 1989; 1999;
Sunny М.С. et al., 1991; Yuhta Т. et al., 1994, Huang N. et aL, 1998; Zhang F et aL, 1998;
2003; 2004; Jones M. I. et aL, 2000). Однако отмечены повышенные износовые характе-
ристики алмазоподобного углеродного покрытия клапанов Sorin Bicarbon в ускорителях
пульса (Dauskardt R. Н. et aL, 1993; Bodnar Е. et aL, 1996; Arru R, et al, 1996).
Для оценки физико-химических и механических свойств биоматериалов применяют
различные инструментальные методы. Идентификация биоматериалов проводится хи-
мическим анализом, инфракрасной спектроскопией, ядерно-магнитным резонансом
Молекулярная масса и молекулярно-массовое распределение, степень «сшивки» оп-
ределяются вискозиметрией, осмометрией, гельпроникающей хроматографией, сте-
пень набухания — лазерным светорассеянием, дилатометрией. Макромолекулярная
структура исследуется дифференциальной сканирующей калориметрией, рентгено-
структурным анализом, электронной микроскопией, инфракрасной спектроскопией,
механическими испытаниями, ядерным магнитным резонансом. Тепловые характерис-
тики определяются термогравиметрическим и термомеханическим анализами, порис-
тость, электрические и адгезивные свойства — электрофизическими и физико-меха-
ническими методами, низкотемпературной адсорбцией газов, сорбционные характе-
ристики — весовым методом, прочность на разрыв и сжатие, модуль упругости,
ползучесть, релаксация напряжений — статическими и динамическими нагрузочными
испытаниями, ускоренным старением. Характеристики поверхности биоматериалов
определяются: термодинамические — измерением контактного угла, электрические и
химические — ^-потенциалом и потенциалом покоя, инфракрасной и флюоресцентной
спектроскопией с Фурье-адсорбцией, топографические — аугеровской и романовской
спектроскопией, кристалличность и степень молекулярной упорядоченности элект-
ронной спектроскопией для химического анализа (Севастьянов В. И. и.др., 1990; Шу-
маков В. И., 1990, Baszkm A. et aL, 1980; Shellock F. G. et al., 1991, Cacciafesta R et aL,
1994; Feng L. et aL, 1994, Barmada H. et aL, 1998).
Рис- 5.3. Микрофотограммы, полученные методом растровой электронной
— 1 мм! из титана, покрытого пленкой оксида
образцов дисков (диаметр 5 мм, толщина 1 мм) з Р извлеченные
титана (а), пиролитического углерода (б) и нержавеющ ’ ппимемения
из правого предсердия собаки на 90-й день хронического эксперимента без применения
антикоагулянтов (по N. Huang et al., 2002)
311
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА_________________________________
ГЕМОСОВМЕСТИМОСТЬ БИОМАТЕРИАЛОВ
Образование тромбов на искусственных клапанах сердца явление сложное, про-
исходящее под воздействием ряда факторов. Этот процесс может начаться при взаи-
модействии неблагоприятных факторов на материале, являющимся нейтральным или
даже задерживающим тромбообразование. На параметры гемосовместимости оказы-
вают влияние следующие свойства биоматериала: физико-химические и механичес-
кие параметры поверхности (соотношение полярных и неполярных групп, соотноше-
ние кислотных и основных групп, количество групп, образующих водородные связи,
наличие и природа модифицирующего покрытия, величина поверхностного натяжения
и межфазной поверхностной энергии, присутствие примесей и включений); набухание
(степень набухания, структура межфазной воды); соотношение кристаллической и амор-
фной фаз поверхности и объема, текстура поверхности (гладкость, шероховатость,
пористость); характер распределения доменов, механические свойства поверхности и
объема; склонность к биодеструкции (Севастьянов В. И. и др., 1990; Ruckenstem Е.
et al., 1984)
На параметры гемосовместимости также оказывают влияние условия взаимодей-
ствия материала с кровью: гемодинамика (сдвиговые напряжения, стационарный, пуль-
сирующий, ламинарный, турбулентный режимы течения, застойные зоны, кавитация);
сорбция компонентов крови in vitro, ex vivo, in vivo; вид животного; цельная кровь, плаз-
ма, сыворотка, белки, клеточные компоненты крови; антикоагулянты и другие лекар-
ства; радиоактивные метки (3Н, 14С, 51Сг, 1111п, ,251, 1311 и др.); метод измерения; контакт с
воздухом; растворенные газы (Севастьянов В. И. и др., 1990, Groot Р. G. et al., 1990).
В частности, при кратковременном контакте с кровью полимеров (от минут до несколь-
ких часов) наблюдаются: набухание; адсорбция ионов и белков; адгезия и разрушение
клеточных элементов крови; активация факторов свертывания; локальные тромбозы;
инициирование местной воспалительной реакции, активации системы комплемента,
фибринолиза и эмболизации (Vroman L. et al., 1987). При продолжительном контакте
(от нескольких часов до дней) происходят изменения в характере адсорбции белков;
усиление реакции клеточных компонентов крови; развитие процессов коагуляции, фиб-
ринолиза, хронической воспалительной реакции, процессов эмболизации. При длитель-
ном контакте биоматериала с кровью (месяцы, годы) возможны: эмболизация, кальци-
фикация, биодеградация, капсуляция фиброзной тканью; рост паннуса (Шумаков В. И.
и др , 2003). Так, например, кольца из силастика, помещенные в левое предсердие и
подшитые к фиброзному кольцу митрального клапана, тромбировались (Seidel W С.,
1963), в то время как силастиковые шарики в различных моделях шаровых клапанов
никогда не покрывались тромбами. Объяснить это явление можно тем, что силастико-
вые кольца находились в полости левого предсердия, где имеет место более низкая
скорость кровотока, менее резкие перепады давлений на протяжении сердечного цик-
ла с меньшими абсолютными величинами давлений, чем в левом желудочке сердца и
восходящей аорте, в которых располагаются запирающие элементы протезов. Опре-
деленное значение имеют также постоянные удары шара различными точками о седло
клапана, способствующие механической очистке его поверхности.
Рядом исследователей было установлено, что интенсивность тромбообразования
на различных материалах зависит, в большей степени, от гладкости их поверхности, а
не от химических свойств (Hakim R М. et al., 1994). Однако при выявлении физико-
химических свойств материалов, определяющих способность образования тромбов на
их поверхности, при сравнении различных материалов в одинаковых условиях, не была
установлена четкая зависимость между степенью тромбообразования на них и смачи-
ваемостью или несмачиваемостью поверхности (Paul R. et al., 1998)
Определенную роль в возможном образовании тромбов на том или ином материа-
и гХ«те1ЛаТ?РИЧеСКИИ потенциал его поверхности. Р. N. Sawyer (1967) и В. D. Ratner
показали, что форменные элементы крови и эндотелий, выстилающий
ГЛАВА 5 Материалы для искусственных клапанов сердца
стбнки сердечно-сосудистой системы, зэряжвны отрицательно. При повреждении эн-
дотелия возникает положительный электрический потенциал, способствую)i(ий осаж-
дению на этом участке тромбоцитов и лейкоцитов. Поэтому некоторые авторы пыта-
лись предотвратить тромбообразование на аллопластическом материале созданием
на его поверхности отрицательного электрического заряда. К сожалению, четкой кор-
реляции между отрицательным зарядом поверхности аллопластических материалов и
тромбообразованием на них получено не было.
Биосовместимые материалы (пиролитический углерод), углеродные покрытия, из
которых изготавливаются современные поворотно-дисковые и двустворчатые конст-
рукции клапанов, способны снижать тромбообразование и тромбоэмболические ослож-
нения, но полностью их не устраняют. По клиническим и экспериментальным данным,
лучшими тромборезистентными качествами обладают политетрафторэтилен, пироли-
тические углероды и полиуретаны (Евдокимов С. В. и др , 1985; Калугин В. И. и др.,
1984; Иофис Н.А. и др., 1998; Bokros J. С. et al., 1992; Ely J. et aL, 1998) Большое
значение в исследованиях придается механическим свойствам материалов и поверх-
ности конструкции клапанов. Трещины и царапины могут приводить к нарушению био-
совместимости и снижению надежности материала клапана (Gilpin С. В. et al., 1993).
Механизм тромбообразования на биологических поверхностях до конца не установ-
лен, что объясняется каскадным, до конца не изученным характером свертывания кро-
ви. На рис. 5.4 показана схема тромбообразования на поверхности инородного тела.
Первый акт взаимодействия крови с любым инородным имплантантом заключается в
адсорбции на его поверхности белков плазмы и контактных факторов свертывания кро-
ви (Holland N. В. et al., 2000).
Если происходит адсорбция фибриногена, то инородное тело становится активным
по отношению к тромбоцитам. Их количество на инородной поверхности возрастает.
Адгезия тромбоцитов — слипание их с поверхностью — вторая стадия процесса Вслед
за адгезией происходит разрушение тромбоцитов, их слипание между собой и с по-
верхностью. Одновременно адсорбируют и контактные факторы свертывания крови.
Смсгсми CHepi ынмннн крови
Контактная активация
р— 1>яктериальн»я система
Эндо» оксин
( грп мотрн цятел ы »ыс
бактерии)
XII
Плазминоген
Калликрснн
XI 1а_* Внутренний путь
Хемотаксис
*• Плазмин
Фибрипо.пп ическан система
Адгезия]-----1— Тромбе»шты Лейкоциты
| Эр1ГГрОИИТЬ1 I
Внешний путь
Ю(С1Очиам система
Хемотаксис
Поверхность
------------(альтернггнвнын
путь)
* Система комплемента
С1 (классический путь)
__________1
Иммунным комплекс
5.4. Механизм тромбообразования на чужеродной поверхности: ^^^о^ХХ^ями
И фибринолитической систем крови с системой комплемента и клеточными реакциями
(по В. И. Севастьянову и др.. 1990)
313
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦ£ _____
Они инициируют каскад ферментативных реакций, который заканчивается выделени-
ем в кровь тромбина Этот фермент вызывает дополнительную адгезию и агрегацию
тромбоцитов, а также катализирует специфический гидролиз белка крови — фибрино-
rgna с выделением фи рин-мономера Он самопрои^ вол но ассоциирует (полимери-
зуется) с образованием нерастворимых, сшитых между собой нитей фибрина Практи-
чески, образование тромбов происходит на инородной поверхности в течение одной
минуты Параллельно с сорбцией белков на материалах и в местах поврежденного эн-
дотелия начинает формироваться вначале тромбоцитарный, а затем и фибриновый
тромб Возникает это потому, что при дисфункции эндотелия под влиянием тромбина
и сдвиговых напряжений обнажается матрикс субэндотелия и присутствующие в нем
адгезивные белки коллаген, тромбосподин, фибриноген, фибронектин, витронектин,
фактор Виллебранда и др , для которых на мембране тромбоцитов имеются рецепто-
ры семейства интегринов (PGIa, PGIb, PGI 11^11^ и др ) и которые экспрессируются на
поверхности тромбоцитов только после их активации — высвобождения ионов Са2+
Так происходит адгезия тромбоцитов к субэндотелию и материалам искусственного
клапана сердца Самая устойчивая адгезия обеспечивается связью гликопротеидных
комплексов PGI llb/llla с фактором Виллебранда и фибриногеном (Балуда В П и др.,
1999, Баркаган 3 С и др , 1999, Tuntto V. Т. et aL, 1987).
Одновременно с адгезией тромбоцитов происходит их активация и «распластыва-
ние» под действием внешних стимулов тромбин, коллаген, эпинефрин, низкие сдви-
говые напряжения в кровотоке и др Активация тромбоцитов сопровождается отделе-
нием от них микровезикул, содержащих мембранные гликопротеины lb, II и III , белки
филамин, талин, миозин, обладающие прокоагулянтными свойствами (Savage В et al,
1991; Schmaier А Н., 1997) Активация тромбоцитов проявляется изменением их дис-
ковидной формы в сферическую с образованием активных форм (диско-эхиноциты,
сфероциты, сфероэхиноциты), мелких и крупных агрегатов тромбоцитов, секрецией
содержимого а-гранул (фактор Виллебранда, АДФ, серотонин, фибриноген тромбос-
подин, Ф\/, XI, IV, тромбоцитарный фактор роста, ингибитор активатора плазминогена,
p-тромбоглобулин, фактор активации тромбоцитов и др ). Этот процесс обозначают как
реакция «высвобождения» (De Catenno R et al., 1984) Активация тромбоцитов прояв-
ляется синтезом тромбоксана ТХА2, а главное — активацией и экспрессией гликопро-
теидных комплексов PGI П^И^, служащих рецепторами для фибриногена За экспони-
рование комплекса PGI liyil^ отвечает несколько механизмов, поэтому возможна агре-
гация тромбоцитов даже в случае полного ингибирования арахидоновой кислоты
л э ор 4ии белков параллельно с активацией тромбоцитов работающим искус-
ствен ь 1 клапаном сердца запускается коагуляционное звено свертывающей систе-
ы >Е появляют я предпосылки к тромбообразованию В этом процессе большее
значение придается «внутреннему» механизму — активации ФХИ, XII , (XII -Зф) при со-
прикосновении последнего с чужеродной поверхностью клапана (Баишев И М , 1998,
Schousboe I et al., 1999) Далее в результате активации ФУ, VII, VIII, IX X, XI, XIII проис-
ходит образование протромбиназного комплекса (Bauer КА et al , 1990, Baugh R J
et al, 1998) Под его влиянием путем протеолиза образуется тромбин, индуцирующий
эндотелиальную дисфункцию и играющий ключевую роль в процессе свертывания кро-
ви те. превращает фибриноген в фибрин, что является конечным этапом образования
внутрисосудистого тромба (Зубаиров Д М , 2000) Параллельно с «внутренним» запус-
кается и внешний» путь коагуляции крови
HAnvH.^T6 Ва*ное значейие в патогенезе тромбообразования на клапане имеет и
ной = сосу?ист°-тР°мбо^таРного звена гемостаза, связанного с эндотелиаль-
о в порп^паИеИ’ НЭ ЧТ° указывает прогрессирующее увеличение в кровотоке марке-
бранда (Гоимюк'а |дСУАИС101пп\еНАИ ~~ количества эндотелиоцитов и фактора Вилле-
оранда (Грицюк А И и др , 1994; Орловский П И , 2002)
В со ранении активиость Эндотелия преобладает над прокоагулянтной
дд ржании тромборезистентности сосудистой стенки принимают
314 _________________ _
ГЛАВА 5 Материалы для искусственных клапанов сердца
участие множество факторов фермент АДФаза, синтез и секреция эндотелием из ip.
хидоновой кислоты антиагреганта и дилататора простациклина — PGI Баланс м д
ТХА2 и PGI2 является основой гемостаза. Тромборезистентности сосудистой стенки
способствует отрицательный заряд гликокаликса эндотелия (поэтому материал i об-
ладающие высоким сопротивлением и несущие на себе отрицательный заряд, являют-
ся антитромбогенными), отсутствие лигандов на эндотелии к рецепторам адгезии 1ром-
боцитов, эндотелиальный фактор релаксации — NO, белок тромбомодулин, энд лелин
стимулирующий высвобождение PGI2 и NO, фибринолитические ферменты-активно
ры плазминогена (профибринолизина) двух типов (тканевого — t-pA и урокиназного),
ингибиторы указанных активаторов и др Причем фактор Виллебранда стимулирует
начало тромбообразования, связывая тромбоциты с поврежденным эндотелием,
a t-pA, напротив, ограничивает рост тромба и вызывает его лизис, стимулируя превра-
щение плазминогена в плазмин и расщепление фибриногена Понижение t-pA, плаз-
миновой активности у больных с искусственными клапанами сердца и хронической сер-
дечной недостаточностью указывает на истощение антиагрегационного потенциала
сосудистой стенки (DeLangis РА et al , 1986, Blockmans D et al, 1990)
Антикоагулянтная активность, структура и функция эндотелия у больных с хронг.
ческой сердечной недостаточностью и с искусственными клапанами сердца может из-
меняться в зависимости от множества стимулов; операционной травмы, отложения
фибрина, протезного эндокардита, активации лейкоцитов при воспалительной реак-
ции, действия вирусов, бактерий, липопротеинов, иммунных комплексов, медиаторов
воспаления, цитокинов и др в сторону прокоагуляции Действие вышеперечисленных
факторов реализуется как правило, через активные формы кислорода и активацию в
организме процессов перекисного окисления липидов, развитие «окислительного
стресса» и снижение содержания факторов антиоксидантной защиты, вследствие чего
повреждается эндотелий, ускоряется гибель кардиомиоцитов, нарастает тромбоген-
ная опасность Большое значение в развитии эндотелиальной дисфункции, тромбоци-
тарной активации и тромбообразования у таких больных имеют и гидродинамические
факторы: сдвиговые напряжения, отрывные и рециркуляционные течения, застойные
зоны, турбулентность, кавитация, нарушение структуры кровотока в камерах сердца и
аорте, механическое повреждение эндотелия эритроцитарными, а также тромбоцитар-
ными агрегатами, хронический внутрисосудистый гемолиз (Yoganathan А Р et al., 1992,
Schoephoerster R T. et al , 1993)
Кроме тромборезистентности сосудистой стенки, в крови циркулируют и з щитные
ингибиторы факторов свертывания — антикоагулянтная и фибринолитиче» а п
восвертывающие системы AT-III — главный ингибитор тромбина, ФХ, IX, VII и калли-
креина, гепарин, гепариноиды, кофактор гепарина II, гепарин-антитромбиновы ?
темы, протеин С и S и др (Elisen MG et al , 1998). Тем самым предотвращается чрез-
мерное распространение коагуляционного каскада свертывания Все реакции
инактивации, индуцированные активированным протеином С, зависят от связывания
тромбина с тромбомодулином (Di Се.а Е. et al, 1997) Приобретенный дефицит АТ-11),
кофактора гепарина II, протеина С и S, плазминогена и его тканевого активатора, ге-
нетические дефекты — резистентность к активированному протеину C-CTV Лейден, VII,
VIII, тромбомодулина, фибриногена, гипергомоцистеинемия, наличие антифосфолипид-
Ных антител, антифосфолипидного синдрома, волчаночного антикоагулянта
ни” с вторичным дефицитом протеина С и S при длительном применении ор льных
антикоагулянтов яеляются факторами риска индрома постоянного'
свертывания (ПВС-3) и тромбообразования (Петрищев Н. Н и др., 2003. Вавилова Т В
и ДР , 2004, Dahlback В . 1997) Важную роль в развитии дисфункции эндо ели и тро
бообразования у больных с хронической сердечной недостаточностью и с иск} .
нь!ми клапанами сердца играют и нарушения почечного> крове>обР^ия Значи-
тельное место в этом отводится неирогуморальным сдви , кинмновой систем
ям активности ренин-ангиотензии-альдостероновои и калликреин-кининовои систем
____________ 315
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
(Шейман Д , 1997 Urata Н et al. 1996) Тромбы могут отрываться током крови и зано-
ситься в конечные артерии, закупоривать их, вызывать инфаркты (некроз) сердца, моз-
га Поэтому гемосовместимость имплантанта требует использования нетоксичных и
тромборезистентных материалов Несмотря на высокие тромборезистентные качества
клапанов, выполненных из углеродных материалов, тромбообразование и тромбоэм-
болические осложнения при их имплантации составляют большую проблему, и разра-
ботка новых биологически инертных материалов, отвечающих требованиям эндотели-
ального покрова а также тестов их проверки продолжаются (Барбараш Л С. и др., 1996,
Новикова С П , 1996, Greisler Н Р, 1990, Bernacca G М и соавт, 1998, Wheatley D J
et al 2000)
Разработка медико-биологических материалов — новое научное направление, воз-
никшее в последние 30 лет и интенсивно развивающееся на стыке многих наук — хи-
мии биологии, медицины, биохимии, биофизики Несмотря на отсутствие фундамен-
тальных знаний о причинах и механизме тромбообразования на чужеродной поверхно-
сти, поиск путей создания гемосовместимых материалов не прекращается В настоящее
время из большого разнообразия направлении в данной проблеме наибольшее рас-
пространение получили гидрофилизация поверхности с целью снижения поверхност-
ной энергии на границе раздела фаз «материал-кровь»; иммобилизация уже извест-
ных и вновь разрабатываемых биологически активных веществ, способных оказать вли-
яние на процессы тромбообразования
Созданию материалов с тромборезистентными свойствами на основе гидрогелей
посвящено большое количество работ, в которых обсуждаются, в основном, теорети-
ческие аспекты их предполагаемой гемосовместимости Считают, что сильногидрати-
рованный слой, содержащий воду, обеспечивает непрерывность водной фазы при пе-
реходе от жидкой среды к твердой поверхности материала, что предохраняет компо-
ненты крови от нежелательного контакта с твердой инородной поверхностью и создает,
тем самым, благоприятные условия для повышенной гемосовместимости Существуют
два пути получения материалов, для которых работа адсорбции приближается к нулю
это сверхгидрофильная поверхность со свободной межфазной энергией, равной нулю,
и сверхгидрофобная поверхность, для которой эта величина равна свободной энергии
воды 72,8 эрг/см2 (Ikada Y, 1984, Feng L. et al , 1995)
Поскольку создание материалов, которые бы не вызывали процессов сорбции, ад-
гезии или активации компонентов крови, — задача, невыполнимая на уровне совре
менных знании, наиболее реальной является разработка способов модифицирования
поверхности веществами с уже заданной способностью влиять на процессы тромоо-
образования в нужном направлении (антикоагулянты, антиагреганты тромбоцитов, фио-
ринолитические вещества) Иммобилизация таких биологически активных веществ, как
правило являющихся полиэлектролитами, позволит придать поверхности свойства гид
рогелевых структур Основными требованиями к способам модифицирования являют
ся эффективность (обеспечение тромборезистентности на длительные сроки), универ
сальность (обработка разнообразных материалов без изменения исходных физике
механических характеристик), технологическая простота (возможность обработки
готовых изделий разнообразной формы и размеров) Из антикоагулянтов наиболее эф
фективным доступным и стабильным является широко используемый в клинической
практике природный антикоагулянт прямого действия — гепарин Исследования в о
ласти получения гепаринсодержащих материалов привели к разработке ионных и ко
валентных методов иммобилизации (Валуев Л И , 1981 Платэ Н А и др 1986, Noishiki
et al , 1981, Evangelista R A et al., 1986)
Способность альбумина образовывать комплексы с различными низко- и высоко-
молекулярными биореагентами позволяет осуществить формирование тройного ком-
плекса - альбумин-гепарин-ацетилсалициловая кислота» (Ammit A J etal, 1997) Аце-
тилсалициловая кислота способна воздействовать на фомбоцитарно-эритроцитарное
звено гемостаза и, в первую очередь, на агрегацию тромбоцитов Поэтому иммобили
316
ГЛАВА Материалы для искусственных клапанов сердца
зация тройного комплекса должна обеспечить сочетание антиадгезионных, антикоагу-
лянтных и антиагрегационных свойств На модифицированных тройным комплексом
поверхностях поливинилхлорида, полиэтилена, полиуретана наблюдали значительное
уменьшение адгезии тромбоцитов, снижение константы агрегации тромбоцитов на
20-30%, уменьшение количества тромботических масс в 1,5-2 раза (Немец Е А и др ,
1994) Представляется перспективным применение в качестве белкового компонента
всего набора плазменных белков, одновременное использование которых расширит
спектр биологического воздействия модифицирующего слоя Количество гепарина,
связанного с поверхностью, в этом случае в 2-2,5 раза больше, чем при использова-
нии альбумина. По имеющимся данным, иммобилизованный гепарин, так же как и ге-
парин в растворе, проявляет антикоагулянтную активность только в присутствии анти-
тромбина IB (AT-JJJ) — важнейшего ингибитора, нейтрализующего активность тромбина
и любой другой сериновой протеазы внутреннего пути свертывания крови путем обра-
зования стехиометрического комплекса между энзимом и ингибитором В отсутствие
гепарина комплексообразование идет медленно, в то время как присутствие антикоа-
гулянта вызывает многократное ускорение этой реакции Человеческий фактор Вил-
либранда активно связывается с гепарином, однако физиологическое значение и ха-
рактер этого взаимодействия мало изучены (Новикова С. П., 1996).
Таким образом, механизм тромбообразованния на искусственных клапанах сердца
имеет полиэтиологическую природу Многолетний опыт клинического применения кла-
панов свидетельствует о том, что тромборезистентность и их судьба внутри сердечных
камер во многом зависят не только от материала, из которого они изготовлены, но и
от конструкции самого протеза, способа его крепления и ряда других факторов
ОТЕЧЕСТВЕННЫЕ ИССЛЕДОВАНИЯ
БИОСОВМЕСТИМОСТИ МАТЕРИАЛОВ
Параллельно с началом работ по созданию первых отечественных искусственных
клапанов сердца, лаборатория по применению полимеров в сердечно-сосудистой хи-
рургии Института грудной хирургии (ныне НЦССХ им А. Н Бакулева РАМН), организо-
ванная в 1960 г (руководитель Н Б Доброва), приступила к выбору материалов для их
изготовления. Были разработаны методики по исследованию металлов, полимеров,
синтетической ткани, позволившие выбрать отечественные материалы для изготовле-
ния шаровых искусственных клапанов сердца — нержавеющая сталь Х18Н10Т и титан
ВТ-1 -0, силиконовый каучук и лавсановый трикотаж Эти материалы были изучены на
био- и гемосовместимость сотрудниками лаборатории А Д Дрогайцевым, В В. Навроц
кой и М Б. Ильиной С 1980 г важной частью работ по созданию поворотно-дискового
протеза стал поиск материала для его запирающего элемента. Совместные исследо-
вания с московскими институтами — НИИ «Графит», НИИМВ, НПО «Электроугли», по
зволили разработать отечественный углеситал, к производству которого приступило
НПО «Элма» (Зеленоград) Изучение гемосовместимости и тромборезистентности по-
зволили усовершенствовать серийно выпускаемые материалы и получить медици с
кие полимеры - новые марки силиконового каучука, поливинилхлорида
Для модификации поверхности полимеров с целью придания им т^?м
свойств под руководством С. П Новиковой был предложен метод формирования ин-
терполимерных конъюгатов физиологически активных веществ путем1 *емосор> цi .
с 1994 г лаборатория проводит сертификационные испытания материалов и изд.
<С^ЛЯ сердечно-сосудистой хирургии. пппоппмпягь пол
Активная работа по повышению гемосовместимости матери эксперимен-
руководством В И Севастьянова в лаборатории Всесo»3Horo^ентРа "°.“венных
тарным исследованиям гемосовместимых свойств биоматериалов для искусственнь
- 317 ----------
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
шанов НИИТиИО М3 РФ. Методические рекомендации (редакционная коллегия
Н. Б Доброва, Т И Носкова. С Л. Новикова, В. И Севастьянов) для оценки биосовме-
стимых свойств искусственных материалов, кон актирующих с кровью рекомендова-
ны Комиссией по инструментам аппаратам, приборам и материалам, применяемым
пя искусственного кровообращения и сердечно-сосудистой хирургии Комитета по
новой медицинской технике Минздрава СССР и утверждены в 1990 г.
Система медико-биологических испытаний включает три уровня исследований:
предварительная оценка гемосовместимости материала по взаимодействию с белка-
ми и клеточными элементами крови, активации свертывающей системы крови и сис-
темы комплемента в условиях in vitro; оценка взаимодействия материала с кровью в
условиях ex iivo, оценка взаимодействия материала или готового изделия с организ-
мом в условиях /л vivo. Методы, используемые на первом уровне исследования, позво-
ляют провести экспресс-оценку большого количества образцов с целью дать предва-
рительную характеристику биосовместимых свойств и отобрать материалы для прове-
дения дальнейших испытании Эти методы могут быть также использованы при
тестировании различных модификаций одного и того же материала непосредственно
в процессе разработки Второй уровень исследований направлен на оценку тромборе-
зистентных свойств материалов в условиях контакта с нативной кровью без добавле-
ния антикоагулянтов или гемостабилизаторов Третий, завершающий этап исследова-
ния, предусматривает получение окончательного заключения о пригодности материа-
ла в виде готового изделия для клинических использований Образец испытывается
непосредственно в месте его предполагаемого функционирования (Sevastianov V. I.
et al., 1984).
Испытания биоматериалов при их взаимодействии с кровью в условиях in vitro (скри-
нинг-контроль) включают следующие методы: определение полного времени сверты-
вания крови (clotting time) на поверхности испытуемого материала; определение вели-
чины гемолиза, индуцированного поверхностью полимера; радиоизотопный — для ре-
гистрации кинетики ранних стадии адсорбции белков плазмы крови на поверхности
биоматериала и измерения количества адгезированных и активированных тромбоци-
тов на поверхности биоматериала; метод сканирующей микроскопии для определения
степени «распластывания» тромбоцитов; оценка времени образования тромбиногена
и тромбинового времени, определение активации 5-нуклеотидазы в мембранах адге-
зированных тромбоцитов; исследование активации ферментов контактной фазы свер-
ывания крови; гемолитический метод определения степени активации комплемента
верхностью искусственного материала При проведении исследования используют
тстические методы, основанные на достижении времени тромбообразования (опре-
деление полного времени свертывания крови в трубках из тестируемых материалов,
определение полного времени свертывания крови на поверхности пластин или пленок
из тестируемых материалов), статические методы без достижения времени тромбооб-
разования ( центрифужный» тест определения адгезии тромбоцитов) динамические
тесты (< колоночные» и «циркуляционные» тесты), статические и динамические методы
определения полного времени свертывания крови (специальные камеры без контакта
с воздухом, статические и проточные динамические камеры, вращающийся диск и его
модификации); Севастьянов В И. и др , 1990
В условиях /л vitro делают первичную и вторичную оценку материала после его кон-
такта с кровью Осмотр тестируемого материала производят при помощи оптической
микроскопии, гравиметрического анализа, сканирующей и трансмиссионной электрон-
чпкг । Л* 0СгаПИИ- РИ исследовании свертывающей системы крови анализируют ма-
гию ZkahT’ количество тромбоцитов, лейкоцитов, эритроцитов и их морфоло-
оиногрнА и ^СЛИНОВОе’ пРотРомбинов°е и тромбиновое время, концентрацию фиб-
специфическою Щлрги?Г° гемоглобина в плазме крови, время рекальцификации,
тивность кониентпли ^ктивность Факторов свертывания, фибринолитическую ак-
р цию фибринопептидов, продуктов распада (ферментов) фибрино-
------- 318 ___________________________________________________
ГЛАВА 5. Материалы для искусственных клапанов сердца
гена и фибрина, агрегацию тромбоцитов, реакцию высвобождения тромбоцитов Фа-
гоцитарную активность лейкоцитов, осмотическую и механическую резистентность
эритроцитов, активность лактатдегидрогеназы и факторов системы комплемента СЗ и
С5, характеристику элюированных белков.
Испытания материалов в условиях ex wo позволяют оценивать результат взаимо-
действия с кровью образцов биоматериалов различной конфигурации (диски трубки
нити) при заданных параметрах взаимодействия. При этом на материалах можно ис-
следовать адгезию тромбоцитов. Эта группа включает следующие методики- опреде-
ление тромборезистентности материалов по количеству адгезированных тромбоцитов -
тромбоцитарный тест, метод исследования динамики пристеночного тромбообразова-
ния на образцах в виде трубок; оценка тромборезистентности материалов методом
артериовенозного шунтирования; оценка тромборезистентности волоконных материа-
лов в виде нити.
Испытания материалов в условиях /л u/vo предусматривают проведение острых и
хронических экспериментов. Этот уровень исследования предназначен для окончатель-
ного изучения материала в виде функционирующей конструкции при имплантации в
брюшной отдел аорты или ушко правого предсердия, К исследованиям материалов in
vivo относятся: острые интракорпоральные тесты с использованием интраваскулярных
катетеров (тест «vena cava» — кольца Готта) и хронические интракорпоральные тес-
ты— «vena cava» и оценка степени эмболизации почек. Параметры, определяемые при
оценке гемосовместимости искусственного клапана сердца m vivo, включают: степень
его дисфункции, величину и тип тромба, интенсивность тромбоэмболии, степень тром-
боэмболических повреждений дистальных органов и тканей, изменение состава и фун-
кций компонентов циркулирующей крови, гемолиз, уровни IV тромбоцитарного факто-
ра и Р-тромбоглобулина, количество фибринопептида А, соотношение содержания фиб-
риногена и фибрина, локализация тромбов; исследование тромборезистентных
свойств и биосовместимости искусственных волоконных материалов в хроническом
эксперименте.
Критериями тестов для исследования биологической устойчивости материалов яв-
ляются признаки изменения их свойств и структуры — потеря механической прочнос-
ти, изменение веса образца, его коррозия, набухание и необратимая деформация.
Кроме того, при анализе поведения эксплантанта по истечении срока испытания в хро-
ническом эксперименте критериями предтоксикологического исследования служат
данные, полученные гистологическими методами (интенсивность клеточной реакции,
признаки отдаленной цитотоксичности образца или его иммуногенность). К методам
этой группы относятся: определение биологической устойчивости материалов в сыво-
ротке крови, оценка биодеградации и биосовместимости искусственных материалов
методом подкожной имплантации животным в хроническом эксперименте.
В последних исследованиях лаборатории применения биополимеров в сердечно-
сосудистой хирургии (рук. С. П. Новикова) предложены новые аутоселективные тром-
борезистентные бислойные покрытия на основе полиэлектролитных комплексов хито-
не с синтетическим аффинным полимером, несущим специфический лиганд к про-
ферменту фибринолиза — плазминогену. Рассмотрены различные способы получ ния
аффинных полимеров для создания биоспецифического слоя в бислойных покрытиях,
слученные бислойные покрытия предложены для модификации медицинских изде-
лий, контактирующих с кровью (Краюхина М. А. и др., 2003). Проведены исследования
полимера природного происхождения — поли-3-окси-бугирата, обладающего биосов-
местимостью, способностью подвергаться биодеградации с образованием нетоксич-
Ных для организма продуктов распада, а также адсорбировать и пролонгирование вы-
делять лекарственный препарат, вследствие чего полимер является перспективным для
изделии медицинского назначения Рассмотрена и определена возможность исполь
зования поли-3-оксибутирата для поверхностной модификации металлов и других ма-
ериалов медицинского назначения (Шустрова О. В., 2003).
ИСКУССТВЕННЫЕ КЛАЛА Н Ы СЕРДЦА
В 1985-1995 гг в НПО «Гранит» и I Ленинградском медицинском институте (ныне
Санкт-Петербургский государственный медицинский университет) им. акад. И П Пав-
лова проводились совместные исследования по оценке био- и гемосовместимости
материалов, разработке покрытий и конструкций искусственных клапанов сердца
С целью определения положения застойных зон, то есть потенциально опасных участ-
ков тромбообразования на клапанах, была создана специальная установка (Галич Н. П
и др „1990), представляющая собой аэродинамическую трубу замкнутого типа (рис. 5.5).
Для создания достаточно однородного потока перед клапаном в канале устанавлива-
лась специальная выравнивающая решетка-хонейкомб (см. рис. 5.5, г), а для опреде-
ления скорости потока в трубе в нее вмонтирована трубка Вентури (см. рис. 5.5, д)
Воздух в установке приводился в движение вентилятором, в поток через специальный
штуцер вводили дозированную смесь для напыления, состоящую из мелких (не более
10 мкм) частиц каолина, талька, окиси цинка, оросила, жиров какао, приготавливае-
мую в специально сконструированном устройстве. В трубе происходило перемешива-
ние смеси с воздухом В местах застойных зон на клапане происходило оседание час-
тиц смеси и, таким образом, обнаруживались места возможного тромбообразования
В результате появлялась возможность вносить изменения в конструкцию клапана с це-
лью предотвращения образования застойных зон. Так было улучшено обтекание седла
экспериментального трехшарикового клапана путем его профилирования специальны-
ми выходными обтекателями. Тем самым были уменьшены размеры отрывных застой-
ных зон.
Как следует из многочисленных публикации, пиролитический углерод для изготов-
ления искусственных клапанов сердца является прочным и биологически инертым ма-
териалом Однако учитывая высокую стоимость двустворчатых конструкций искусст-
венных клапанов сердца, целиком выполненных из подобных материалов, становится
весьма целесообразным разработка таких клапанов из более дешевого материала ти-
тана ВТ-0-1, хорошо зарекомендовавшего себя в клапанностроении. С целью улучше-
ния тромборезистентных качеств титана на его поверхность наносится различными
способами у леродное покрытие. Например, такое покрытие (л 1 мкм) имеется на кар-
касе искусственного клапана сердца Sorin Bicarbon. Указанный клапан успешно импла-
тируется в некоторых странах (Borman J. В. et al., 1998), хотя имеются отдельные со-
общения о снижении адгезионной стойкости такого покрытия в ускорителях пульса
клапане уСтановки для о^енки «тромбонакопления» на искусственном
~ клапане сердца (Н. П. Галич и др., 1990, авт. свид. № 1623640):
ор, 2 трубка Вентури, 3 — штуцер 4 — искусственный клапан сердца 5 — хонеикомб
320
_________________________— _еЛ 5 Материалы для искусственных клапанов сердца
(Dauskardt R. Н et al. 1994; Hasenkam J. M. et al. 1997). Обнадеживающие результаты
(иГфисННАРаиЛдрИИ1998ТаЛИ ИСПЫТаНИЯ искУсственнь1х клапанов сердца Роскардикс
На протяжении ряда лет на НПО «Гранит» (Санкт-Петербурт) проводились работы
по нанесению алмазоподобного углеродного покрытия способом ионно-плазменного
напыления на титановый каркас различных конструкций искусственных клапанов серд-
ца (МКН, АКЧ, Ликс-2, Эмике и экспериментальных моделей Сердолик и Гиацинт) Ад-
гезионная стойкость покрытия оценивалась в ускорителях пульса СУИ-23 на самом
предприятии — разработчике искусственных клапанов сердца, а также на Кирово-Че-
пецком химкомбинате (изготовитель серийных искусственных клапанов сердца) и в
головном учреждении (НЦ ССХ им А. Н Бакулева РАМН). Согласно заключениям этих
организаций, алмазоподобное углеродное покрытие на шаровом искусственном кла-
пэне сердца МКЧ-25 (Кирово-Чепецкии химкомбинат) выдержало ресурс испытания в
течение 13 лет, а дисковые искусственные клапаны сердца отработали 200 млн циклов
<открывания-закрывания» и не было обнаружено явного повреждения алмазоподоб-
ного покрытия в местах контакта диска с корпусом и ограничительными элементами
искусственных клапанов сердца (Доброва Н. Б и др., 1993; Галич Н П. и др., 1996). Мы
понимаем, что адгезионная стойкость покрытия может быть нарушена при более дли-
тельных сроках испытаний искусственных клапанов сердца — как на стенде, так и в
организме человека. Однако, с нашей точки зрения, работы в области покрытий искус-
ственных клапанов сердца должны быть продолжены.
Параллельно с оценкой адгезионной стойкости покрытия проводилось комплекс-
ное исследование его гемосовместимости на пластинках, дисках, втулках и на цель-
ных конструкциях клапанов, выполненных из титана ВТ-1-0 При выборе тестов руко-
водствовались рекомендациями основных учреждений, предусматривающих условия
острых экстракорпоральных (in vitro -> ex vivo) и хронических интракорпоральных те-
стов (in vivo)', Севастьянов В. И. и др., 1987; 1990 Доброва Н Б. и др , 1991 Оценка
гемосовместимости биологических материалов по тесту агрегационной активности
тромбоцитов импедансным агрегометром АИ-300 (in vitro) проводилась совместно
с сотрудниками кафедры патологической физиологии (зав. кафедрой профессор
Н Н. Петрищев) для семи образцов, титан ВТ-1-0 с механической обработкой под-
ложки, пиролитический графит с механической обработкой подложки и алмазоподоб-
ным углеродным покрытием; титан с механической обработкой подложки и алмазо-
подобным углеродным покрытием, титан с химической обработкой подложки и алма-
зоподобным углеродным покрытием; титан с механической обработкой подложки и
покрытием оксидом титана; титан с химической обработкой подложки и покрытием
оксидом титана; пиролитический графит с механической обработкой подложки
без покрытия Показано, что наиболее перспективными материалами, с точки зре-
ния тромборезистентности, являются пиролитический графит и титан с механиче-
ской обработкой подложки и алмазоподобным углеродным покрытием, а также
^итан с химической обработкой подложки и покрытием оксидом титана (Орлов-
ский П. И , 2002).
В лаборатории полимеров НЦ ССХ им. А Н. Бакулева РАМН (Доброва Н Б и др ,
1989) проводились исследования тромборезистентных свойств дисков, выполненных
Из титана ВТ-1-0 с двумя видами покрытия: углеродом (с бором) и алмазоподобным
Углеродом (патент РФ No 2051646), изготовленных на НПО «Гранит» (СПб) с толщиной
покрытия 0,5-2 мкм Изучение проводилось в острых опытах ex vivo по показателю
“Фомбоцитарного теста >, т. е по среднему количеству адгезированных тромбоцитов
На поверхности материала после контакта с нативной кровью животного. В качестве
контроля использовались пленки из медицинского фторопласта Ф-4 В результате про
ВеДенного исследования средняя величина (по 6 экспериментам) показателя тро м о
^тарного теста» на площадь — 8 103 мкм составила для фторопласта Ф-4 13,2-3,8
^тана ВТ-1 _0 с покрытием углеродом с бором - 9,6±4,1% и с алмазоподобным угле-
—________ 321 ---------
Искусственные клапаны сердца
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
родным покрытием - 5.2±1,9%. Достоверного различия в показателе «тромбоцитар-
ного теста» на образцах с разной толщиной покрытия не обнаружено. Результаты
испытаний показали, что из двух исследованных покрытий алмазоподобное является
предпочтительным, так как проявляет более высокие тромборезистентные свойства (Га-
лич Н П и др , 1988, Гриценко В. В. и др., 1994).
В Российском центре по экспериментальным исследованиям гемосовместимых
свойств биоматериалов для искусственных органов НИИТиИО М3 РФ проводились ис-
пытания гемосовместимых свойств образцов дисков ВТ-1-0 с ал м азо подобным угле-
родным покрытием, изготовленных на НПО «Гранит». Определяли относительный по-
казатель адгезированных тромбоцитов (ОПАТ) радиоизотопным методом, 51Сг тром-
боциты (~8 105 1/мкл) с эритроцитарной взвесью (—5,5 1061/мкл) крови кролика в
статике при 37сС и экспозицией 60 мин. Сделано заключение о том, что ионоплазмен-
ное напыление алмазоподобного углерода на титан уменьшает количество адгезиро-
ванных тромбоцитов в 2,5 раза по сравнению с титаном без покрытия, р < 0,01 (Сева-
стьянов В. И., 1988)
Высокотромбогенные материалы, вызывая резкую активацию контактной фазы, за-
пускают «внутренний» путь фибринообразования и происходит потребление факторов
свертывания, в частности протромбина. Совместно с сотрудниками лаборатории кон-
сервации крови (зав лабораторией — 3. Д. Федорова, проф. Л. П. Папаян, НИИТиПК
М3 РФ) показано, что чем выше тромбогенность материала, тем больше проходит вре-
мени до появления нитей фибрина. Чем быстрее образуется фибрин, тем больше про-
тромбина остается в сыворотке, тем хуже его потребление, тем медленнее происхо-
дит образование протромбиназы Известно, что стекло значительно сильнее активиру-
ет контактную фазу свертывающей системы крови, чем силикон. Учитывая данное
обстоятельство, нами был применен тест потребления протромбина in vitro для срав-
нительной оценки тромборезистентных свойств заведомо высокотромбогенного мате-
риала — стекла, стекла, обработанного силиконом ГКЖ-94 (материал, обладающий
хорошими тромборезистентными свойствами — контроль); а также титана ВТ-1-0 с 10-
11 классом шероховатости без покрытия и с алмазоподобным углеродным покрытием.
Кровь помещали в полупробирки, инкубировали при 37 °C два часа, после чего полу-
пробирку центрифугировали (1500 об/мин, 5 мин). Дальнейшие исследования потреб-
ления протромбина проводили по известной методике (Иванов Е. П., 1991) Потребле-
ние протромбина в крови после ее контакта со стеклом равнялось 90,12 ±3,32%, пос-
ле контакта с силиконизированным стеклом — 30,81 ±3,64%, с титаном ВТ-1-0 без
покрытия 62,38 ±3,45%, с алмазоподобным углеродным покрытием — 58,21 ± 2,72°о
Таким образом, титан ВТ-1-0 с алмазоподобным углеродным покрытием обладает по-
вышенными тромборезистентными свойствами, по сравнению с обычным титаном (Уг-
лов Ф. Г. и др., 1984; Орловский П. И., 2002).
Определение тромборезистентности непрозрачных материалов проводилось оцен-
кой активированного парциального тромбопластинового времени и активированного
времени ре льцификации после инкубации цитратной человеческой плазмы в емкос-
тях, которыми служили пробирки-контейнеры из исследуемых материалов: титан ВТ-
1-0 с 10-11 классом шероховатости, титан ВТ-1-0 с алмазоподобным углеродным по-
крытием. В качестве контроля бралось силиконизированное стекло и его принимали
за идеально тромборезистентную поверхность. Исследование проводилось на установ-
ке для определения тромборезистентности непрозрачных материалов in vitro — рис. $
елов Е. ф и др , 1988) В случае титана ВТ-1-0 с алмазоподобным углеродным по-
крытием индекс тромборезистентности составлял по тесту АВР 16,5%, по тесту АПТВ
’ ±>, усредненный индекс 30,1%. Для титановой поверхности без покрытия этот по-
казатель был более низкий — 7,7%.
Одним и методов оценки возможного тромбообразования на искусственных кла-
сеРдца является лабораторное моделирование их работы в установке с исполь
ием молока в качестве рабочей жидкости (Доброва Н. Б. и др., 1980). При этом
----- 322 ------—__________________________________________-
ГЛАВА 5 Материалы для искусственных клапанов сердца
Рис. 5.6. Схема установки для определения тромборезистентности непрозрачных
материалов in vitro:
1 — корпус; 2 — кривошипно-шатунныи механизм, 3 — держатель 4 — водяная
баня; 5 — контейнер, 6 — линза; 7 — световод; 8 — лампа, 9 — регулятор фокуса
(Е Ф Беляев и др., 1988, авт свид № 1426205)
возникает необходимость в измерени у Р «тромбонакопление» проводилось на
Исследование искусственных клапанов сердца а на рис 5 7 (рацпредложе-
установке пульсдупликаторе, схема котор qft. котором в качестве аналога кро-
ние № 1243 СПбГМУ им. акад И. П. Павлова, 1 J’ НР 2004). в МОлоко добавля-
ем использовалось молоко 5-7°о жирности а^ натрий (Na) и растворяющуюся в
ли 0,8-1,0% по весовой массе соль, Хературе 20-30 °C в течение
молоке. Затем раствор выдерживали при ком ом состав коровьего молока (° )
4-6 ч и применяли при той же температуре. _ 3 9- белки — 3,2; минеральные
составлял: вода — 87; молочный сахар "Г ’ ’ соли в количестве 0,8-1,0% при-
вещества — 0,7; витамины; ферменты. Д ррпичине электропроводности крови,
давало молоку электропроводность, близкую белковых частиц в молоке После
увеличивало коагуляцию, а также прочность ж использовать электромагнитные ме-
введения в молоко соли появлялась возмо ак более точные по сравнению с
тоды измерений потока в циркуляционной системе,
Другими методами (например, механически включений повышала достоверность
Увеличенная прочность белковых и жир Применение молока жирность
их отложений на поверхностях испытуемое системе для испытания искусств
5-7% в качестве рабочего тела в циркуля1^\ жировых и белковых включении в м
Hbix клапанов сердца обусловлено размер g также близкой величиной вя -
ке, соизмеримых с форменными элемента с поваренной солью) происхо
сти молока и крови. Становление раствора ( ^ем жировых частиц молока под д
течение нескольких часов и объясняется упр 32З
12-
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
Рис. 5.7. Схема устройства для исследования искусственных клапанов сердца на «тромбонакоп
ление» и гемолиз (рацпредложения СПбГМУ №779, 1988; № 1243, 1998):
1 — компрессор, 2 — пневматический привод — прибор «Синус-2», 3 — верхняя колба. 4 — нижняя
колба, 5 — восходящая труба, 6 — нисходящая труба, 7 — камера «левого желудочка», 8 —цитраль
ный клапан, 9 — аортальный клапан, 10 — воронка для заполнения системы, 11 — устройство
забора проб крови 12 — коммутатор, 13 — нагреватель верхней колбы, 14 — нагреватель нижне
колбы, 15 — нагреватель нисходящей трубы; 76 — нагреватель восходящей трубы 17 индика
температуры, 18 — электромагнитный датчик, 19 — датчики давления в камерах «левого желуд04
ка», «левого предсердия» и «аорты»; 20 — расходомер электромагнитным РКЭ-3, 27 — монитор
рургический МХ-01
ствием соли Прочность жировой, а также белковой частицы зависит от наличия в н
воды Чем меньше в частице воды, тем она монолитнее и, соответственно, пром
более устойчива к внешним воздействиям Соль вступает во взаимодействие с
цей жира или белка, обезвоживая ее сердцевину Проникновение соли в жировые
тицы осуществляется за 4-6 ч, после чего указанный процесс либо затихает, либо пр
кращается
324
ГЛАВА 5 Материалы для искусственных клапанов сердца
Интенсивность взаимодействия соли с жировыми и белковыми включениями в мо-
локе зависит и от температуры молока Чем температура молока выше, тем слабее
жировые частицы, тем, следовательно, интенсивнее идет проникновение соли в ее
ядро Но повышение температуры молока чревато изменением не только прочности
частиц, но вязкости и однородности молока. Следовательно, становление раствора и
его применение должно происходить при одной и той же температуре, например ком-
натной 20-30 С Добавление соли в молоко жирностью 5-7%, выдержка полученного
раствора в течение 4-6 ч и применение его в тепловом диапазоне 20-30 С приближа-
ет условия испытания процесса in vitro к условиям щ vivo и, тем самым, предлагаемый
способ дает возможность повысить точность результатов испытании клапана, а также
их достоверность
Кроме того, предлагаемый способ позволяет определить начало «тромбообразова-
ния» на искусственных клапанах сердца по замедлению скорости потока раствора мо-
лока через клапан, а по изменению числа Рейнольдса определить уровень турбулент-
ности. Компрессор 1 (см. рис. 5 7) подает сжатый воздух на пневматический привод 2
работы желудочка — «Синус-2». Воздух поступает по двум каналам под давлением
0,5 10 Па и 0,15 10 3Па Прибор «Синус-2» вырабатывает частоту ударов, максималь-
ное и минимальное давление, а также величину заполнения удара, т. е величину,
определяемую соотношением т/Т, где Т — период, ат — длительность систолы Пуль-
сирующее давление от прибора «Синус-2» подается на камеру желудочка 7 Кроме же-
лудочка 7, аппарат содержит гнезда 8 и 9 клапанов эталонного и испытуемого, соеди-
нительные трубки, датчики давления 19 электромагнитный расходомер 20, монитор
хирургический 27.
Благодаря предложенному соленому раствору молока, монитор медицинский МХ-01
давал возможность определить расход, давление в систоле Рс, давление в диастоле
Рд, среднее давление за период, перепад давления на искусственном клапане сердца
частоту сердечных сокращений, временные параметры работы клапана, ударный объем
и регургитацию, число Рейнольдса и Струхала, необходимые для фиксации процесса
«тромбонакопления» Все искусственные клапаны сердца были испытаны при «частоте
сердечных сокращений» 70 и 90 уд/мин, в диапазоне минутного расхода QM н от 2 до
8 л/мин. Заливали приготовленный раствор (молоко и соль) через воронку и подавали
в желудочек, выполненный из эластичного материала — полиуретана, который пере-
давал давление в систему соединительных трубок из силиконизированного каучука в
результате чего жидкость циркулировала, проходя через испытуемый клапан Электро-
магнитный расходомер жидкости РКЭ-3 10 фиксировал количество проходимой жидко-
сти через поперечное сечение трубки в единицу времени и сигнал передавался на мо-
нитор 27 Все эти величины можно наблюдать на экране и фиксировать на самописце
Способ испытания клапанов включал в себя следующую последовательность опе-
раций испытуемый искусственный клапан сердца обезжиривали любым разрешенным
Для медицинских изделий способом, например 76% спиртом, клапан взвешивали на
аналитических весах, поверхность его подвергали визуальному осмотру с применени-
ем оптических устройств и фиксировали ее состояние, клапан устанавливали на стен-
де с принудительной циркуляцией жидкости, в стенд заливали раствор пастеризован-
ного молока 5-7% жирности и поваренной соли 0,8-1,0% общего объема, стенд вклю-
чали, обеспечивали физиологически необходимый режим работы сердца, клапан
одерживали в этом режиме 20 мин, при этом наблюдали за функционированием кла-
пана и его параметрами, клапан извлекали из стенда, просушивали в течение 3 ч
08 °C), взвешивали и подвергали визуальному осмотру, а также под микроскопом, ана
Пировали результаты испытания и делали выводы о «тромбонакопления на клапане
Результаты экспериментального исследования «тромбонакопления» на различных
конструкциях механических искусственных клапанов сердца в стендовой установке пуль
сДУпликатора на 6% молоке в аортальной и митральной позициях при «ЧСС» 70 уд/мин
и Расходе 5,0 л/мин представлены в табл. 5 5 и 5 6, а также на рис. 5 8
325
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
Таблица 5.5
Показатели тромбонакопления» на искусственных клапанах сердца
в аортальной позиции in vitro (M±m)
Тип искусственного клапана сердца Вес клапана, г Вес сухого остатка, г
до эксперимента после эксперимента
St Jude Medical-29 3,5947±0,0002 3,5971±0,0001 0,0024±0,0007
CarboMedics-27 4,8282+0 0003 4,8334±0,0001 0,0052+0,0002’
Мединж-2-30 4,4492±0,0003 4,4576±0,0002 0,0084+0,0003**
Микс-29 2,4990±0,0003 2,5167±0,0002 0,0177+0,0003***
Ликс-2-30 3,3826±0,0005 3,5038+0,0003 0,1212±0,0004***
’ р < 0,05, *’ р < 0,01 р < 0,001 — статистическая достоверность различия показателя отно-
сительно контроля (искусственный клапан сердца St Jude Medical)
Из табл. 5 5 следует, что «тромбонакопление» на искусственных клапанах сердца
в аортальной позиции возрастало в порядке их расположения: St. Jude Medical-29
(0,0024 + 0,0007 г), имеющего минимальное «тромбонакопление», и искусственный кла-
пан сердца Ликс-2-30 (0,1212 ± 0,0004 г), имеющего максимальную величину при ста-
тистической достоверности различия между всеми икусственными клапанами сердца
(р<0,05, р<0,01; р<0,001) Такие же закономерности отмечались и при исследовании
искусственных клапанов сердца в митральной позиции (см табл. 5.5).
В этой позиции «тромбонакопление» было заметно выше: St. Jude Medical-29 (0,0046 ±
± 0,0007 г), Ликс-2-30 (0,1376 ± 0,0006 г) при статистической достоверности различия
между всеми искусственными клапанами (р<0,05, р<0,01; р<0,001), причем общая тен-
денция к повышенному «тромбонакоплению» имелась у поворотно-дисковых искусст-
венных клапанов сердца (Микс-29, Ликс-2-30) как в митральной, так и в аортальной
позициях. Самое высокое «тромбонакопление» отмечено у искусственного клапана сер-
дца Ликс-2-30, который, по сравнению с искусственным клапаном сердца Микс-29,
имеет меньший угол открытия. У двустворчатых искусственных клапанов сердца самое
минимальное «тромбонакопление» отмечено на искусственном клапане сердца St Jude
Medical-29, максимальное — на Мединж-2-30 и промежуточное положение занимает
искусственный клапан сердца Carbomedics-27 (Орловский П. И., 2002).
Таблица 5-Ь
Показатели «тромбонакопления» на искусственных клапанах сердца
в митральной позиции in vitro (M±m)
Тип искусственного клапана сердца Вес клапана, г Вес сухого остатка, г
до эксперимента после эксперимента
St Jude Medical-29 3,5947±0,0006 3,5993±0,0001 0,0046±0,0007
Carbomedics-27 4,8282±0,0003 4,8374±0,0001 0,0092+0,0002*
Мединж-2-30 4,4492+0,0001 4,4756±0,0001 0,0264±0,0007**
Микс-29 2.4990±0 0003 2.5632±0,0002 0,0642+0,0005***
Ликс-2-30 3,3826+0.0002 3,5202±0,0003 0,137б±0,0006***
сительнп клмтпппа Р ° 00! статистическая достоверность различия показателя отно-
сительно контроля (искусственный клапан сердца St Jude MediCal)
---------- 326 _
ГЛАВА 5 Материалы для искуссп энных клапанов сердца
я» на искусственных клапанах сердца
Рис. 5.8. Количественные показатели «тромбонакоплени ^сс>) 70 уд/мин и расходе 5,0 л/мин
(in vitro} в аортальной позиции пульсдупликатора вИДНы следы сбившихся ели-
(искусственные клапаны сердца извлечены из установки.
вок в плохо обтекаемых местах клапанов)
клргтммости биоматериалов и искусственных
Для сравнительной оценки гемосовме & । Ленинградском медицин-
клапанов сердца по тесту гемолиза эритроцитов е ментальная установка (рац
ском институте им. акад И П Павлова была созд 57 и натурное изображение на
пРедл № 779), схема которой представлена на р
Рис. 5.9.
327
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
Рис. 5.9. Стенд для исследования искусственных клапанов сердца на гемолиз
и «тромбонакопление»
Сравнительная оценка гемолиза эритроцитов проводилась в экспериментально
установке — пульсдупликаторе, имитирующем работу левой половины сердца, кото^
рая состояла из насоса, системы циркуляции с силиконовым покрытием, терморегу
ляции t = 36-37 °C и комплекса измерительной аппаратуры В качестве «рабочей хиД
кости» использовалась цельная свежезаготовленная стабилизированная кровь крупно
го рогатого скота (коров)
Забор крови осуществляли в день эксперимента перед забоем животных из сонн^
артерии во флаконы с консервантом «Глюгицир» в соотношении крови и консерванта
до гематокритного числа 32-34% Кровь заливали в установку в количестве 800,0±15 мл
328
ГЛАВА 5. Материалы для искусственных клапанов сердца
Для стандартизации условий эксперимента каждую серию опытов проводили в усло-
виях полной герметизации установки с кровью одного животного-донора, у которого
ее забирали в объеме 4—5 л. После каждого эксперимента контур проходил обработку
раствором детергента, а затем дистиллированной водой. Стендовая установка позво-
ляла производить исследование искусственных клапанов сердца в аортальной и мит-
ральной позициях при давлениях и расходах крови, равных физиологическим, при «ЧСС»
70 и 90 уд/мин, ударного объема 85±5 мл, длительности фазы изгнания (систолы)
40±5% от полного цикла Полное время работы искусственных клапанов сердца в уста-
новке составляло 120 мин.
В аортальной и митральной позициях установки на гемолиз испытывались искусст-
венные клапаны сердца, представленные на рис 5 8 Производилась оценка свобод-
ного гемоглобина (НЬ в) до и после эксперимента, а также индекса гемолиза (IH). то
есть общее количество свободного гемоглобина в г/л, выделившегося в установке при
пропускании через искусственные клапаны сердца 100 л крови, 1Н=10 (100 - Ht) ЛНЬ.е/
/(Q t HbJ, где Ht — гематокритное число (%); V — объем крови в контуре (л),
ЛНЬ в — изменение свободного гемоглобина в плазме крови до и после эксперимента,
мг %; Q — минутный объем крови (л/мин), t — время испытаний, мин; НЬ — гемоглобин
(мг %). Это позволяло стандартизировать условия эксперимента и получить достовер-
ную оценку гемолиза для различных конструкций искусственных клапанов сердца (Да-
выденко В В и др , 1989; Юречко В Н. и др , 2001, Галилеева А Н , 2004)
В табл 5 7 представлены показатели концентрации НЬСВ и IH в плазме крови в нача-
ле и конце опытов, а также IH при сравнительном исследовании искусственных клапа-
нов сердца на гемолиз с приблизительно одинаковыми диаметрами по обшивной ман-
жете в митральной позиции экспериментальной установки при двух режимах циркуля-
ции — «ЧСС» 70 и 90 уд/мин и расходе 5,0 и 6,5 л/мин. В аортальной позиции установки
постоянно находился искусственный клапан сердца Микс-29 На основании получен-
Таблиьа 5.7
Концентрация НЪСВ и IH в плазме крови при исследовании искусственных
клапанов сердца в митральной позиции пульсдуплпкатора при «ЧСС»
70 и 90 уд мин и расходе 5,0 и 6,5 л мин (М±т)
Тип искус- ственного клапана сердца «ЧСС» 70 уд/мин — — «ЧСС» 90 уд/мин
НЬсО»г/л IH. % НЬся,г/л IH, %
исходный после эксперимента исходный после эксперимента
Ликс-2 30 0,052± ±0,007 0,680± ±0.018 0,84± ±0,01*** 0 580± ±0,006 0,794+ ±0,012 0,91± ±0,012**’
Микс-29 0,053± ±0 002 0,460± ±0,017 0,74+ ±0,05** 0,065+ ±0,005 0,574± +0 002 0,78± +0 01*'
Мединж- 2-30 0 050± ±0,005 0,384± ±0,009 0,40± +0,02* 0.061± ±0,007 0 496± ±0,009 0,48±0,03*
Carbo- jnedics 27 0,049± ±0 007 0,380+ ±0.011 ~~0,39± ±0 03 0 049± ±0,003 0 462± ±0 011 0,40±0,01*
St Jude Medical-29 0,055± ±0,003 0,232+ ±0,012 0 28± ±0,01 0 053± +0,004 0 320+ ±0,010 0 30+0,01
• ₽ < 0.05, ** р < 0.01. *** р < 0,001 - статистическая достоверность различия показателя отно
сительно контроля (искусственный клапан сердца St Jude Me ica
329
ИСКУССТВ ЕННЫЕ КЛАПАНЫ СЕРДЦА
ных данных был рассчитан индекс гемолиза (IH) для каждой модели искусственого кла-
пана сердца (рис. 5.10). Наименьший IH отмечен на искусственном клапане сердца St.
Jude (0.28 ±0,01 %) при «ЧСС» 70 уд/мин и (0,30 ±0,01 %) — при 90 уд/мин; наиболь-
шие! IH отмечен у искусственного клапана сердца Ликс-2 (0,84 ±0,01 %) и (0,91 ± 0,02 %)
при «ЧСС» 70 и 90 уд/мин, соответственно, при статистической достоверности разли-
чия относительно искусственного клапана сердца St. Jude Medical (р <0,001).
Практически одинаковые показатели IH отмечены с искусственными клапанами сер-
дца Carbomedics и Мединж-2, и они оказались достоверно ниже показателей IH с ис-
кусственными клапанами сердца Микс и Ликс-2. С искусственным клапаном сердца
Мединж-2 IH был достоверно выше, чем с искусственным клапаном сердца St. Jude
Medical-29 (р < 0,05) Статистический анализ средних значений IH для всех исследо-
ванных моделей искусственных клапанов сердца в митральной позиции показал уве-
личение IH с ростом «ЧСС», причем разница между искусственными клапанами сердца
Carbomedics и Мединж-2 была недостоверной.
В аортальной позиции стендовой установки на гемолиз сравнивались искусствен-
ные клапаны сердца тех же типоразмеров, причем в митральной позиции постоянно
находился искусственный клапан сердца Микс-29. В табл. 5.8 и на рис. 5.11 представле-
ны значения концентрации НЬсв и IH в плазме крови до и после эксперимента на пульс -
дупликаторе при «ЧСС» 70 и 90 уд/мин работы установки и расходе 5,0 и 6,5 л/мин.
Как и в предыдущем эксперименте, наименьший IH отмечен у искусственного клапа-
на сердца St Jude Medical-29 — 0,25±0,03 % и 0,27±0,02 % при «ЧСС» 70 и 90 уд/мин,
соответственно, и наибольший IH у искусственного клапана сердца Ликс-2 — 2,01 ±0,01 %
и 2,96±0,02 % при аналогичных режимах работы установки, при статистической досто-
верности различия между искусственными клапанами сердца (р < 0,001), причем по-
казатели IH при увеличении «ЧСС» увеличивались. Промежуточное положение по IH
между искусственными клапанами сердца Ликс-2 и Мединж-2 занимал искусственный
клапан сердца Carbomedics 0,33±0,01 % и 0,36±0,01 %, при соответствующих режимах
работы установки
Показатель IH у искусственного клапана сердца Carbomedics был ниже относитель-
но искусственного клапана сердца Мединж-2, у которого IH был выше, чем у искусст-
венного клапана сердца St Jude Medical-29, однако оставался достоверно ниже, чем у
искусственного клапана сердца Микс и Ликс-2 (р< 0,01, р< 0,001). Показатели IH у
поворотно-дисковых искусственных клапанов сердца на всех режимах работы установ-
пу/шедупликатооа пТРУКЦИИ искусственнь,х клапанов сердца в митральной позиции
пульсдупликатора при расходе 5,0 л/мин и 6,5 л/мин
330
ГЛАВА 5 Материалы для искусственных клапанов сердца
1/ю шт/ 5.8
Концентрация НЬСВ и IH в плазме крови при исследовании искусственных
клапанов сердца в аортальной позиции (М±т)
Тип искус- ственного клапана сердца «ЧСС» 70 уд/мин «ЧСС» 90 уд/мин
НЬсв,г/л IH, % НЬс,,г/л IH, %
исходный после эксперимента исходный после эксперимента
Ликс-2-30 0,050± ±0,006 0,710± ±0,011 2,01± ±0,01*** 0,051± ±0,007 0,820+ ±0,005 2,96± ±0,02* *
Микс-29 0,052± ±0,001 0,634± ±0,013 0,84± ±0,03** 0,052± ±0,003 0,689± ±0,012 0,89± ±0,01**
Мединж- 2-30 0,049± ±0,003 0,378± ±0,012 0,35± ±0,02* 0,054± ±0,001 0,490± ±0,011 0,44± ±0,03*
Carbome- dics-27 0,052± ±0,004 0,355± ±0,013 0,33± ±0,01* 0,056± ±0,002 0,455± ±0,012 0,36± ±0,01*
St Jude Medical-29 0,049± ±0,007 0,228± ±0 012 0,25± ±0 03 0,056± ±0,003 0,301± ±0.010 0,27±±0,02
* р < о,О5 ** р < 0,01, *** р < 0,001 — статистическая достоверность различия показателя отно-
сительно контроля (искусственный клапан сердца St Jude Medical)
ки в аортальной и митральной позициях статистически достоверно были выше (р < 0,05),
чем у двустворчатых искусственных клапанов сердца, у которых IH был выше в мит-
ральной позиции относительно аортальной, по-видимому, из-за кавитационных эффек-
тов в регургитирующих струях в момент закрытия клапанов (Орловский ПИ, 2002, Га-
лилеева А. Н., 2004)
«ЧСС» 70 уд/мин
Нс- 5,1 щ различных конструкций искусственных клапанов сердца в аортальной позиции
пульсдупликатора при расходе 5,0 л/мин и 6,5 л/мин
331
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА __________
Совместно с сотрудниками кафедры общей и биоорганической химии (зав. кафед-
рой — проф. К А Макаров) и НИЦ (директор — профессор В. В. Томсон) СПбГМУ им.
акад И. П Павлова проводилось исследование гемосовместимости материалов и ис-
кусственных клапанов сердца по резистентности эритроцитов в хроническом экспери-
менте в условиях общего обезболивания животных — собак (тиопентал натрия, миоре-
лаксанты. интубация трахеи, ИВЛ) при имплантации шаровых искусственных клапанов
сердца из титана ВТ 0-1 с 10-11 классом шероховатости, аналог АКЧ-02, малых типо-
размеров 10-12 мм в нисходящий отдел аорты без искусственного кровообращения и
антикоагулянтов 14 беспородным собакам весом от 20 до 25 кг, 21,4±2,2 кг. Импланти-
ровались 3 каркаса шаровых искусственных клапанов сердца без покрытия и запираю-
щего элемента, 3 каркаса шаровых искусственных клапанов сердца без запирающего
элемента с углеродным покрытием (Макаров К. А. и др., 1980), 4 шаровых искусствен-
ных клапана сердца с запирающими элементами без покрытия каркаса, 4 искусствен-
ных клапана сердца с углеродным покрытием Корпуса искусственных клапанов малых
типоразмеров изготавливались в СПГПУ и НПО «Гранит», запирающие элементы — на
Кирово-Чепецком химкомбинате, углеродное покрытие каркасов — на кафедре общей
и биоорганической химии СПбГМУ.
После левосторонней торакотомии в IV межреберье, мобилизации аорты, наложения
зажимов проводилась имплантация искусственного клапана сердца в нисходящий отдел
аорты на 2-3 см ниже левой подключичной артерии и фиксация при помощи лигатуры,
проведенной по наружной стенке аорты соразмерно канавке для пришивной манжеты
искусственного клапана сердца и герметизации линии разреза аорты атравматичным
швом Регистрацию функции клапанов осуществляли измерением перепада давления на
них аппаратом «Мингограф-34», а расхода крови — электромагнитным расходомером
РКЭ-3. Естественный аортальный клапан собак специальным приспособлением, введен-
ным через левую сонную артерию, разрушался с целью адекватной функции импланти-
рованного искусственного клапана сердца. Для определения резистентности эритроци-
тов использовали метод кислотных и осмотических дифференциальных эритрограмм ге-
паринизированной венозной крови (Гительзон Н. И. и др., 1959; Углов Ф. Г. и др., 1979),
взятой до, а также на 7-е, 21-е, 35-е, 56-е сутки после операции. Животных содержали в
клетках и выводили из эксперимента большими дозами тиопентала натрия.
До операции максимальное значение кислотного гемолиза отмечалось на 4-й ми-
нуте, а весь процесс гемолиза заканчивался к 5,5-6-й минуте, максимальное значение
осмотического гемолиза отмечалось при 0,44% NaCI и заканчивалось при 0,56% NaCI
(рис. 5.12).
опеоативнк КИСЛОТНОЙ и осмотической эритрограмм (6) животных (собак) перед
оперативным вмешательством
332
______________ГЛАВА 5. Материалы для искусственных клапанов сердца
Сравнительный анализ показателей резистентности эритроцитов и эритрограмм
установил существенное различие кинетики гемолиза при взаимодействии крови с
покрытыми графитом и непокрытыми поверхностями искусственных клапанов сердца,
а также с их различными конструкциями, обладающими гидродинамическим сопротив-
лением и вызывающими определенное возмущение кровотока. Через 7 суток после
имплантации каркаса клапана АКЧ-02 без запирающего элемента сопротивление кро-
вотоку было незначительным. Кислотные эритрограммы имели небольшой сдвиг впра-
во с максимумом гемолиза на 4,8 минуте и окончанием к 6-й минуте, а осмотичес-
кие— влево с максимумом гемолиза на 0,40% NaCI и окончанием при 0,56 % NaCI
(рис. 5.13), что указывало на преобладание в кровотоке более резистентных эритро-
цитов и ретикулоцитов. Через 1,5-2 недели после операции эритрограммы возвраща-
лись к исходному уровню независимо от наличия углеродного покрытия поверхности
каркаса. При имплантации клапана АКЧ-02 с запирающим элементом сопротивление,
а значит и возмущение кровотока увеличивалось (ДР+ = 20-^30 мм рт ст.).
Для адекватности экспериментов градиент давления (ДР. ) на шаровых клапанах был
приблизительно одинаковым, и разрушение эритроцитов в первые 7 суток после опе-
рации, по-видимому, происходило под влиянием нарушения структуры кровотока, сдви-
говых напряжений, турбулентности, кавитации, регургитации, кровопотери из раневой
поверхности, механических факторов при ударах шара о седло, контакта чужеродного
материала с кровотоком. Поэтому выявить влияние углеродного покрытия на резис-
тентность эритроцитов в этот период времени не представлялось возможным. Сдвиги
эритрограмм указывали на появление в кровотоке большого количества молодых форм
эритроцитов с низкой резистентностью вследствие их ускоренного разрушения.
Через 2 недели после имплантации шаровых клапанов с углеродным покрытием
эритрограммы имели тенденцию к нормализации с максимумом гемолиза по кислот-
ным эритрограммам на 4,8 минуте, по осмотическим — 0,36% NaCI и окончанием по
кислотным эритрограммам к 6,5 минуте, по осмотическим — при 0,56% NaCI, что уже
соответствовало норме (рис. 5.14). Эти изменения указывали на наличие в крови эрит-
роцитов с повышенной резистентностью.
В то же время при имплантации клапанов с углеродным покрытием тенденция к
нормализации эритрограмм отсутствовала и превалировал правый сдвиг кислотных
эритрограмм с максимумом гемолиза на 5,2 минуте и окончанием к 7,2 минуте и ле-
вый сдвиг осмотических эритрограмм с максимумом гемолиза на 0,3% NaCI и оконча
нием к 0,56% NaCI (рис. 5.15).
Позитивные изменения эритрограмм наблюдались только к концу 3-и недели, и весь
процесс гемолиза был более длительным. Последующие исследования показали, что
5. ГЗ. Показатели кислотной (а) и осмотической (б) эритрогрзмм животных (собак)
на 7-е сутки после операции
'—_ _____ - - ----* 1500
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
Рис. 5.14. Показатели кислотной (а) и осмотической (6) эритрограмм животных (собак) на 14-е
сутки после имплантации клапанов с углеродным покрытием (пунктирная кривая -
норма)
у животных с имплантированными клапанами, покрытыми углеродом, эритрограммы
приближались к норме уже к концу 3-й недели: максимум кислотной эритрограммы
уменьшился до 4,6 минуты и длительность сократилась до 6-й минуты, соответствен-
но у осмотической — максимум до 0,40% NaCI и длительность 0,56% NaCI, что соот-
ветствовало норме К концу 5-й недели те и другие эритрограммы соответствовали
норме Эритрограммы животных с непокрытыми шаровыми клапанами имели замед-
ленную тенденцию к нормализации — приближались к норме только к концу 5-й неде-
ли и соответствовали норме к концу 8-й недели.
Таким образом, проведенный эксперимент показал, что в первые сутки после имп-
лантации любых конструкций клапанов происходил гемолиз эритроцитов, причем раз-
рушению подвергались, в основном, эритроциты с наименьшей резистентностью (ста-
рые, незрелые), поэтому на кислотных эритрограммах наблюдался сдвиг влево, а на
осмотических — вправо. Причем, в зависимости от типа клапана и его покрытия на-
блюдались следующие изменения: максимальный гемолиз возникал у животных с
АКЧ-02 без покрытия, создающим максимальное возмущение кровотока и разруше-
ние форменных элементов крови У животных с АКЧ-02 с углеродным покрытием кар-
тина эритрограмм была более спокойная, гемолиз меньше, что подчеркивает положи-
тельное влияние углеродного покрытия, так как гемодинамические влияния на крово-
Рис. 5.15. Показатели кислотной (а) и осмотической (б) эритрограмм животных (собак) на 14-е сут
ки после операции имплантации клапанов без
334-------------------
покрытия (пунктирная кривая — норма)
ГЛАВКА 5. Материалыдляискусственных клапанов сердца
ток у непокрытых и покрытых конструкций были одинаковыми У животных с каокасом
АКЧ-02 (без запирающего элемента) возмущения потока были минимальными что от
ражалось на незначительных сдвигах эритрограмм, причем с углеродным пХпием
картина эритрограмм быстрее приближалась к норме У Р Д П0КРытием
На 7-е сутки в ответ на выраженный гемолиз в кровоток поступали молодые эрит-
роциты При этом возникал так называемый «ретикулоцитарный пик- что и отоажа
лось на кислотных эритрограммах - сдвиг вправо, на осмотических - влево В после
дующие сроки (21-е, 35-е, 56-е сутки) отмечалась нормализация показателей причем
у разных конструкции клапанов (без и с запирающим элементом, а также с покрытием
и без покрытия) разная. Эта закономерность отражена на графиках кислотных эрит-
рограмм (см. рис. 5.14, 5.15). Отмечено статистически достоверное различие (р < 0 05)
по гемолизу между животными с клапанами АКЧ-02 с запирающим элементом и угле-
родным покрытием и без покрытия, что указывало на большую гемосовместимость
углеродного покрытия Отмечена также статистическая достоверность (р < 0,05) раз-
личия по гемолизу между животными с цельным клапаном и каркасом клапана, что
подчеркивает влияние на показатели гемолиза гидродинамического сопротивления
клапана Проведенные исследования резистентности эритроцитов показывают необ-
ходимо ть эазработки искусственных клапанов сердца с минимальным сопротивлени-
ем, применения углеродных материалов и покрытий с повышенной тромборезистент-
ностью (Углов Ф. Г. и др , 1979)
Проводилось исследование ультраструктуры и функции тромбоцитов в хроничес-
ком эксперименте на 14 собаках при имплантации им в нисходящий отдел аорты без
искусственного кровообращения (техника имплантации описана выше) 6 шаровых ис-
кусственных клапанов сердца (аналог АКЧ-02). 3 каркаса с углеродным покрытием (Уг-
лов Ф. Г. и др , 1979; Макаров К А , 1980) и 3 — с непокрытым каркасом; 4 каркаса
искусственных клапанов сердца без запирающих элементов, из них 2 — покрытых
углеродом и 2 — непокрытых; 2 полушаровых искусственных клапанов сердца (аналог
МКЧ-27), из них в одном случае с покрытием углеродом, в другом — без покрытия,
2 чечевицеобразных искусственных клапанов сердца (аналог МКЧ-29) с каркасом, по-
крытым углеродом и не покрытым Животные не получали антикоагулянтов и исследо-
ваны до и на 1-е, 7-е, 14-е, 21-е, 36-е, 56-е сутки Тонкие срезы препаратов, после
выделения тромбоцитов, фиксирования глютаральдегидом, четырехокисью осмия, обез-
воживания в возрастающей концентрации спиртов конструирования уранил-ацетатом и
Цитратом свинца, изготавливали на ультратоме LKB-3 и изучали на электронном мик-
роскопе Jem-7a. Оценку агрегационной активности тромбоцитов проводили параллельным
изучением их ультраструктуры электронной микроскопией, биохимическими методами, а
также исследовали коагулограмму и тромбоэластограмму. Регистрацию функции искус-
ственных клапанов сердца осуществляли измерением перепада давления на клапанах
аппаратом «Мингограф-34», а расход крови — электромагнитным расходомером РКЭ-3
Результаты исследования гемосовместимости материалов клапанов по морфоло-
гии и Функции тромбоцитов in vivo показали, что наблюдаемые электронно-микроско-
пические изменения ультраструктуры тромбоцитов полностью соответствовали пока
эателям их функциональной активности. Непосредственно после каждой операции, а
также через сутки после нее наблюдалась значительная гиперкоагуляция крови с акти-
вацией тромбообразующих факторов свертывания угнетением антисвертывающеи и
Фибринолитической систем На тромбоэластограммах (рис 5 16) отмечалось ускоре-
ние всех трех фаз свертывания крови — уменьшение времени Ретрак^^^Ь1Т^°
"еРиода свертывания «R» по Гартерту до 5,7±0,03 мин, до операции - 8 0±0,09 мин,
Уменьшение «к» - времени образования сгустка неполной ретракции до 1,8-0, ,
операции — 3,5±0,08 мин и удлинение максимальной амплитуды ретра ц У
д0 93±1 6 мм> до операц*и _ 55±019 мм, отмечалось снижение
так- активности крови по повышению толерантности плазмы к геп®р*^ коови по
также депрессия фибринолиза по снижению фибринолитическои активности крови
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
Рис. 5 16. Тромбоэластограммы животного (собаки) на 1-е (а) и на 7-е (б) сутки после импланта
ции шарового клапана АКЧ-02 без углеродного (а) и с углеродным (б) покрытием
Бидвелл На 7-е сутки после операции — имплантации покрытого углеродом, а также
непокрытого каркаса клапана без запирающего элемента основные показатели коагу-
лограммы и тромбоэластограммы приближались к исходным величинам дооперацион-
ного периода Медленнее всего нормализовывалось содержание фибриногена и по-
вышалась фибринолитическая активность крови Аналогичная картина гемостаза на-
блюдалась и после имплантации покрытых углеродом и не покрытых клапанов АКЧ-02
с запирающими элементами (Углов Ф Г и др , 1979)
При электронно-микроскопическом исследовании тромбоцитов на 7-е сутки наблю-
далась приблизительно одинаковая картина, умеренная тенденция к снижению элект-
ронной плотности матрикса «-гранул, а также появление «пустых», лишенных грануло
мера тромбоцитов, большинство из которых имело нормальную ультраструктуру На
личие в ближайшем послеоперационном периоде тромбоцитов с матриксом гранул
пониженной электронной плотности, а также «пустых» тромбоцитов может быть объяс-
нено наличием раневой поверхности и утилизацией гранул в процессе тромбообразо-
вания Выброс содержимого гранул в кровоток и появление «пустых» тромбоцитов
может стимулироваться АДФ из разрушенных эритроцитов, о чем свидетельствовали
данные увеличения гемолиза по осмотическим и кислотным эритрограммам Извест-
но, что в условиях нарушенного тромбообразования, кровотечения различной этиоло-
гии у человека отмечается изменение электронной плотности гранул и появление ги-
гантских форм молодых тромбоцитов (Вашкинель В К и др , 1982)
Наличие в кровотоке большого количества тромбоцитов, лишенных грануломера,
должно влиять на изменение показателей их функциональной активности, опр де яе
мой биохимическими методами, поскольку известно, что «-гранулы являются но* ите
лями всех биологически активных субстанций тромбоцитов В эксперименте показате
ли функциональной активности тромбоцитов коррелировали с данными электронно
микроскопического исследования Действительно, на 7-е сутки у животных с клапанами
покрытыми углеродом из-за наличия функционально не активных форм тромбоцитов
наблюдалось увеличение времени свертывания крови до 8,3±0,02 мин, снижение по
казателеи адгезии тромбоцитов до 18,2±2%, агрегации — до 5,1 ±2,1 мин, ретракц
кровяного сгустка 38±2%, удлинение «R» и «К» времени тромбоэластограммы (см рис
5 16 6) уменьшение количества тромбоцитов до (140±2,5) 10 /л крови за счет их ути
лизации на раневой поверхности, разрушения и, вероятно, развития ДВС-синдр°ма
На 14-е и 21-е сутки когда влияние раневой поверхности можно было исключить, на
блюдалась тенденция к нормализации показателей функциональной активности трем
боцитов вначале у животных с простейшими конструкциями (каркас клапана без запи
рающего элемента), не оказывающими значительного возмущения на кровоток
В дальнейшем нормализация функциональной активности тромбоцитов наблюда
лась у животных с клапанами АКЧ-02 с углеродным покрытием, а на 56-е сутки насту
336
ГЛАВА 5 Материалы для искусственных клапанов сердца
пала полная нормализация, выражающаяся в появлении в кровотоке большого количе-
ства гигантских форм молодых и структурно охранных тромбоцитов У животных с
шаровыми клапанами, не покрытыми углеродом, за этот период времени нормализа-
ции активности тромбоцитов не наблюдалось В картине крови превалировало боль-
шое количество деформированных микроформ а показатели их функциональной ак-
тивности отличались от исходных величин, указывая на склонность к тромбообразова-
нию Тромбоциты, выделенные из кровотока в первые часы после операции —
имплантации покрытых и непокрытых дисковых клапанов МКЧ-29, имели значительные
структурные изменения- присутствовало большое количество «пустых» форм лишен-
ных грануломера, а также деформированных пластинок с большим количеством округ-
лых псевдоподий На срезах препаратов четко виднелись отдельные псевдоподии раз-
мером меньше 1 мкм, отделившиеся от тромбоцитов Отмечено также большое коли-
чество тромбоцитов с матриксом а-гранул пониженной электронной плотности,
Аналогичная картина наблюдалась и во фракции, выделенной из кровотока после ус-
тановки полушарового клапана МКЧ-27 В обоих случаях наблюдались агрегирующие
тромбоциты, образующие микротромбы, а также гигантские формы >4 мкм в диамет-
ре, имеющие нормальную ультраструктуру Значительная травма форменных элемен-
тов крови отмеченная при электронно-микроскопическом исследовании, высокий
перепад давления (70-80 мм ртст) на полушаровых и дисковых протезах приводили
к тому, что уже к концу первых суток после операции наблюдался полный тром( оз
указанных конструкций независимо от покрытия, связанный с неблагоприятными гид-
родинамическими факторами Таким образом, более быструю нормализацию ультра-
структуры и функции тромбоцитов у животных с шаровыми клапанами, покрытыми уг-
леродом, и уменьшение степени гемолиза можно объяснить повышенными тромборе-
зистентными качествами покрытия клапанов сердца и биоматериалов
Для оценки гемосовместимости искусе ание тромборезистентности кар-
по степени эмболизации почек проводил с 10-11 классом шероховато
касов искусственных клапанов сердца титан^ ой манжеты и без запирающего
ти (аналог АКЧ-02), диаметром 10-12 мм, оез покрытия при имплан-
элемента с углеродным покрытием (авт свид ' 10 2±1 8 кг 6 нисходящий отдел
тации конструкций 16 беспородным со ака^ ® шественного кровообращения в ро
аорты на 2-3 см выше почечных артерии , овия эксперимента описаны выше)
ническом эксперименте, без антикоагулянте» фОметрическим способом Cywi
Состояние почечной паренхимы исследовало 24-е сутки после операции кс
et al., 1985, Орловский П И , 2002) на 1-е, - . ’в различной степени выраж:ен-
периментальные исследования выявили зонь клапанов (рис 5.17), у которых
ности, особенно у собак с непокрытыми кар Больший объем инфарктов по ,
занимали от 0,5% до 2,78% ренального объе иМПлантации непокрытых карка_
встречающихся у этих животных на 14-е сутк ханием участков некроза "оч
сов клапанов, можно объяснить, во-первых набухан!.некротических масс, обнаружи-
паренхимы с интенсивной резорбцией и °РГ тромбоэмболиями, что, в “
ваемых под микроскопом, во-вторых, повт п0Вышенным гемолизом ритр
Редь, коррелирует с гиперкоагуляцией крови __
низкой резистентностью в эти сроки. ,О1гПГ|3а почечной паренхимы _иваЮ_
С другой стороны, наименьший объем результатом постепенн постин-
Ределяемый, в среднем, на 24-е сутки, мож нием паренхимы почки в оагуля_
Щегося фиброза на месте инфаркта и см р с вающейся в эти роки ий
Фарктного рубцевания Нельзя забывать и о Ра^аностьЮ обратимость изменен^
Ции крови с усиленной фибринолитич х воЗМожного коллатера тром-
вызванных тромбоэмболией почек, зави убедительно показали вь1П0Лнен-
т°ка Таким образом, результаты 3KCnepV углеродом каркасов кла каркаса, не-
борезистентность покрытых алмазоподобным^углер Д пОверхноСти каркас
ных из титана ВТ-1-0" уменьшение образ
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
а б
Рис. 5.17. Препараты почек собаки:
а — разрезы почек собаки на 14-е сутки после имплантации каркаса клапана без покрытия {опреде-
ляется зона инфаркта верхнего полюса левой почки, справа — нормальная паренхима), б — зона
инфаркта верхнего полюса правой почки у собаки на 24-е сутки после имплантации каркаса клапа-
на с алмазоподобным углеродным покрытием
кроза почечной паренхимы и, как следствие этого, снижение тромбоэмболических ос-
ложнений при внедрении алмазоподобного углеродного покрытия в практику констру-
ирования искусственных клапанов сердца (Углов Ф Г и др , 1996).
Целью последующей работы явилось исследование удельного сопротивления ма-
териалов, применяемых для изготовления искусственных клапанов сердца
Сопротивление материала толщиной d прямоугольного сечения (рис 5 18), заме-
ренное в направлении, параллельном поверхности, можно выразить равенством
Я = р/ / db. где R — сопротивление, р — удельное сопротивление, d — толщина, b —
ширина I — длина участка Если I- Ь, тогда R = р/ d = Rs. поэтому сопротивление Rs
одного квадрата материала зависит не от размера квадрата, а только от удельного
сопротивления и толщины
Величина Rs называется сопротивлением слоя материала и выражается в омах на
квадрат Если толщина известна, то удельное сопротивление легко получить из урав-
нения р = dRs (Маиссел Л и др , 1977) Измерение сопротивления слоя материалов,
применяемых для конструирования искусственных клапанов сердца, проводилось че-
тырехзондовым способом (см рис 5 18) При размещении зондов на материале полу
бесконечного объема удельное сопротивление выражается равенством
I 1/S, + 1/s2-1/(s,+s2)-1/(s2+s:)
метод определения сопротивления слоя; зонды устанонлены в один ряд
ООО -
ГЛАВА 5 Материалы для искусственных клапанов сердца
Когда s, = s2 = s3 - s, это равенство принимает вид р = U Источник постоянною
тока попеременно подключался то к одной, то к другой паре зондов Таким образом, с
помощью зондов, геометрия которых отклонялась от квадрата примерно на 7%, получе
ны отсчеты с точностью до 1% Производилось измерение удельного сопротивления
титана ВТ-1-0; алмазоподобного углеродного покрытия титана ВТ-1-0 (патент РФ №
2051646), оксида титана, полученного методом магнетронного распыления, пирографита
В результате измерения установлено, что самое высокое удельное сопротивление
было у титана ВТ-1-0, покрытого оксидом титана, который, как показали эксперимен
тальные исследования зарубежных авторов, по своим тромборезистентным качествам
превосходит алмазоподобное углеродное покрытие и пиролитический углерод в экс-
периментах in vitro (Zhang F et al , 1998) — табл 5 9
Таблица 5. °
Удельное сопротивление материалов, применяемых при изготовлении
механических искусственных клапанов сердца
Материал Удельное сопротивление, Ом см
Титан ВТ-1-0 55 106
Пирографит 0,4
Алмазоподобное углеродное покрытие (2мкм) на титане ВТ-1-0 1 105-1 107
Титан ВТ-1-0, покрытый оксидом титана 1 10'°
Известно, что биологическая инертность
хности. В связи с этим были оценены эле (САП) в физиологическом раство-
на ВТ-1-0 и спресованного алюминиевого Р насыщенного каломельного Элект-
ре NaCI и в консервированной крови отн°с дный потенциал на САП имел более
рода в пересчете по водородному нулю. условиях оксигенации крови элек-
отрицательное значение, чем на титане ’ в физиологическом растворе
тродный потенциал на САП составлял 0,Ю6 В) Более отрицательное
(-0,534 В); на титане, соответственно (О, °му, обеспечивало преимущество
значение электродного потенциала на ’гоегаЦионной активности тромбоцитов м
его тромборезистентности по измерени fn Vltro (Кравцова И. А и др-,
тодом определения оптической плотности свойства титана ВТ-1-0 и более отри
В другом экперименте электрохимиче п0 прочности, были исследованы।
тельного по заряду САП, не уступающег меров (аналог АКЧ-02), В^ПОЛУ а-
имплантации шаровых клапанов малых ti сс шероховатости 10-11). ез
из этих материалов (диаметр седла мм ^ез искусственного КРОВ° элект.
ющих элементов в нисходящий отдел ар именте (30 дней) Результ оцеНи-
ния и без антикоагулянтов в хроническ - кровью и окружающими ткан п0
рохимического взаимодействия матери завершения эксперимент , ная
вались по взвешиванию конструкции до и значительная коррозионн е_
потеря веса клапана из САП — 1 w ' ОП1хЯГа клапана из САП и т ипРМя как
римента установлено, что поверх*ОСТЬ * лн0СТью эндотелизирована, ® 0- лишь
добным углеродным покрытием ^ыла покрыта эндотелиальной в
конструкция из титана без покрытия была^покрь^ вь1Сокая ^ектроо^^
частично Очевидно, что электрохимии ермСТИки углеродного п приводить
цательность, а также диэлектрические тилке конструкции, что_ жительные
ствовали более быстрой эндотелиальн поверхности Однако н
к уменьшению тромбообразования на 339
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
сроки экспериментов, а также упрощенная конструкция клапана без запирающего эле-
мента, не вызывающая значительных возмущений в кровотоке, не позволяли в этом
эксперименте высказать окончательного суждения о тромборезисгентных качествах
САП и углеродного покрытия (Кравцова И. А, и др., 1979)
Для оценки гемосовместимости биоматериала в НЦССХ им. А. Н. Бакулева РАМН
исследовали тромборезистентность втулок из титана ВТ-1-0 и из титана, покрытого
алмазоподобным углеродом (патент РФ №2051646, разработка НПО < Гранит») с тол-
щиной покрытия 0,5-2 мкм в хронических опытах на собаках при имплантации втулок
во внутригрудной отдел нижней полой вены через правое предсердие, без искусст-
венного кровообращения и антикоагулянтов, тест «vena cava» модифицированный
тест Готта (Доброва Н Б. и др., 1989). Через 1,5 месяца установлено, что на внутрен-
ней стороне втулок с алмазоподобным углеродным покрытием имелось отложение фиб-
риновой пленки, равномерно покрывающей всю поверхность с утолщением на нижней
полуокружности На втулках с углеродным покрытием (с бором) и аналогичным сроком
наблюдения толщина фибриновой пленки визуально была больше. На контрольных втул-
ках из фторопласта Ф-4 через 2,5 часа после имплантации просвет почти полностью
обтурировался тромботическими массами. На основании проведенных исследований
было сделано заключение, что титан ВТ-1-0 с алмазоподобным углеродным покрыти-
ем проявляет более высокие тромборезистентные качества (Углов Ф. Г и др., 1996).
В эксперименте (ВНИИТиИО М3 РФ) клапан Сердолик КС-2 (патент РФ 2051646,
разработка НПО «Гранит») с тромборезистентной защитой на основе алмазоподобно-
го углеродного покрытия имплантировался в нисходящий отдел аорты организма те-
ленка весом 86 кг в хроническом эксперименте, в течение 62 сут, с разрушением есте-
ственного аортального клапана (Толпекин В. Е. и др , 1994). В послеоперационном пе-
риоде животное получало антиагреганты (аспирин по 1,0 г 2 раза в сутки и курантил
40 мг/сут). Исследовались перепады давления на клапане, клинические и биохимичес-
кие анализы крови, КОС, газы, гемолиз, время свертывания крови, фибриноген, мие-
лограмма костного мозга. После вскрытия животного оценивалось наличие тромбов
на клапане, состояние манжеты, тромбов в почках и сосудах кишечника. Отмечалось
незначительное увеличение билирубина, в основном за счет непрямого до 2 мг/ %.
Концентрация фибриногена была незначительно изменена по сравнению с исходной.
В миелограмме отмечалась умеренная гиперплазия, пойкило- и анизоцитоз, гемолиз —
2-8 мг/ %. В течение первого месяца состояние теленка было хорошее — вырос, имел
хороший аппетит, прибавил в весе на 12,5 кг. С 45-го дня после имплатации клапана
стал вялым, появилось серозно-гнойное отделяемое из ноздрей В легких сухие и влаж-
ные хрипы, плохо ел, не вставал. Поскольку возможностей стабилизировать состояние
животного не было, так как указанные явления были расценены как функциональное
стенозирование грудной аорты в месте фиксации клапана за счет роста теленка и,
возможно, тромбоза, решено эксперимент прекратить. Теленок забит введением боль-
ших доз наркотиков На вскрытии аорта перед клапаном на 1,2 см больше в диаметре,
чем за клапаном Тромбов на створках клапана не отмечалось. Манжета клапана была
покрыта гладкой соединительной тканью. Макроскопически тромбов в почках, сосудах
кишечника не обнаружено. На основании данного эксперимента было сделано заклю-
чение, что клапан Сердолик КС-2 № 30-93 в течение 62 суток пребывания в организме
теленка показал хорошие функциональные и тромборезистентные свойства
оксикологическое исследование образцов титана ВТ 0-1 по ОСТ 1.90173-5 с по-
крытием на основе углерода выполнялось в НИИ токсикологии М3 РФ (Санкт-Петер-
ург) на 84 белых крысах-самцах линии \Mstar, массой 168,4+2,1 г. Под внутрибрюшин-
гпьи4и|И^ПеНТаП°ВЬ,М наРК030м мг на 100 г массы тела) имплантировались под кожу
дрлрны Jat1P8b,e ---нки 6 6 мм и 5 х Ю мм. Все подопытные животные были раз-
контоппрм- оТпТ животных включенных в 1-ю группу, являлись операционным
покрытия /к л nr г ° И группы имплантированы титановые пластинки (ВТ 1-0) без
ш роховатости 10-11); 3-я группа представлена 9 животными с имп-
340 —------------
------------------------ГЛАВА_5_ Материалы для искусственных клапаны сердца
лакированными титановыми пластинками с углерод^Г^^ ионно’
плазменного напыления; в 4-и группе из 7 животных имплантировали титановые плас
тинки, покрытые углеродом с присадкой карбида бора; 5-ю группу составили 7 живот-
ных, которым вживляли образцы из титана с углеродным покрытием, нанесенным пи
ролитическим способом; 17 животным 6-й группы имплантировали пластинки с
углеродным покрытием с присадкой карбида кремния и карбида бора- в 7-й rovnne
17 животным были вживлены образцы титана с алмазоподобным углеводным покпыти
ем (патент РФ № 2051646, разработка НПО «Гранит») За подопытными животными на-
блюдали в течение 3 месяцев. Резорбтивное и токсическое действие оценивали с по-
мощью стандартных тестов, применяемых для токсикологической экспертизы матери-
алов медицинского назначения (Саноцкий И. В., 1970). Из эксперимента животных
выводили декапитацией под эфирным наркозом.
Каких-либо видимых признаков отличия в поведении от животных контрольной груп-
пы не наблюдалось. Статистически достоверное увеличение массы тела наблюдали
у животных 3-й группы (р<0,05), начиная с 1-й недели, и это отличие сохранялось на
протяжении всего срока наблюдения. Более быстрое увеличение массы тела отме-
чалось и у животных 5-й, 6-й и 7-й групп, но начиналось оно в более поздние сроки
(5-6-я неделя). Колебания в массе тела у животных 4-й группы были статистически
недостоверны. В целом, масса тела у животных, которым имплантировали пластинки с
углеродным, пиролизным, кремнииуглеродным или алмазоподобным углеродным по-
крытием, через два месяца после имплантации существенно превышала таковую у жи-
вотных контрольной группы.
Несмотря на существенные отличия в массе тела у животных, изменения массовых
коэффициентов внутренних органов в конце опыта (13-15-я неделя) не имели значимых
различий. У животных 3-й группы наблюдали достоверное снижение массового коэффи-
циента печени р<0,05. Другой интегральный показатель — ректальная температура тела
на протяжении всего опыта колебалась в пределах 37,8-38,5 °C и различия в колебаниях
были статистически незначимы. Вместе с тем, показатель, характеризующий общий об-
мен — VO2, оказался более чувствительным. Через 4 недели после имплантации титано-
вых пластинок было выявлено повышение VO2b 3-й группе до 55,2 мл/минкг (р<0,05).
В дальнейшем это различие нивелировалось, однако через 12 недель вновь появилась
тенденция к повышению VO у животных 3-й группы Детоксицирующую функцию печени
оценивали по времени продолжительности гексеналового сна, а также по скорости и
количеству обезвреженной бензойной кислоты, определяемой по количеству выведен-
иой с мочой гиппуровой кислоты (проба Квика-Пытеля). Через 4 недели после имплан-
тации наблюдали достоверное увеличение продолжительности гексеналового сна в 3-й
гРУппе животных (р<0,05). В дальнейшем различия не носили значимого характера. Ко-
личество гиппуровои кислоты, выводимое с мочой, также практически не менялось в те-
чение всего срока наблюдения у животных 2-й, 3-й, 5-й и 7-й групп.
Результаты наблюдения свидетельствовали о том, что имплантация титановы пла-
стинок не вызывала существенного изменения со стороны обезвреживающей функции
нечени подопытных животных. В отличие от функции печени, функциональные показа-
тели почек проявляли большую лабильность на протяжении всего периода наблюде-
ния. Величина диуреза у подопытных животных, измеряемого через 18 часов, суще
ственно уменьшалась через 2 недели после имплантации пластинок у животных и и
групп. При этом количество выпитой жидкости уменьшалось незначительно по срав-
“ению с контролем. Так, в среднем количество выпитой жидкости в контроле колеба-
ть в пределах 15,5-21,6 мл, тогда как животные 3-й и 4-и групп выпивали
с°в 11,8-18,8 мл. Уменьшение диуреза наблюдали и у животных в 5-и и 6-и группа^
Однако через 12 недель после имплантации титановых пластинок
Дкости и количество выведенной мочи как в опытных, так и в 0_
^ственно не отличалось. Уменьшение диуреза, как правило, <по
Гением концентрации белка в моче. Особенно выражено это было у животных
________— 341
ИСКУССТВЕННЫЕ К Л А П А Н Ы С Е Р Д Ц А
I уппы у которой количество белка повышалось в 4-5 раз Незначительное повыше-
ние белка наблюдали и у животных 5-й группы через 2 недели после операции Через
месяца концентрация белка в моче опытных и контрольной групп животных практи-
чески не отличалась Концентрационная способность почек, которую оценивали по ме-
тоду Тульчинского с помощью красителя фенол рот, напротив, повышалась через 2 не-
д ;ли после имплантации пластинок у животных 3-и и i-й групп. Чер з 12 недель от
н ^чал; опыта способность почек к выведению красителя восстанавливалась.
Др гие параметры, характеризующие функциональное сос ояние почек, не меня-
лись Например удельный вес мочи колебался в пределах 0,9-1,1 г/мл как в конт-
рольной, так и в опытных группах Содержание сахара в моче не превышало 0,1-0,3/6.
Анализ картины периферической крови, который проводили через 4, 8 и 12 недель
у животных 2-й и 3-й групп (в опыт брали по 3 крысы) выявил незначительные расхожде-
ния в структуре периферической крови в опытных и контрольн эй группах. Через 8-12 не
дель наблюдали статистически достоверное увеличение количества лейкоцитов (р < 0,05).
Таким образом, исследование функции почек, способности печени к детоксикации,
периферической картины крови у животных, которым имплантировали титановые пла-
стинки показало, что наиболее существенные изменения наблюдались у животных 3-й
группы Кроме того, отклонения показателей отмечали в 5-й и 7-й группах, однако они
носили кратковременный характер и восстанавливались в течение 4-6 недель.
Функцию центральной нервной системы оценивали по чувствительности животных
к суммации подпороговых импульсов (СПИ), определяемой по известной методике
С. В Сперанского (Саноцкий И. В., 1970) Величина СПИ в вольтах, выработанной до
опыта, существенно понижалась в 1-ю неделю после операции, что было наиболее
выражено в 1-й, 3-й и 5-й группах животных. Повышенную раздражительность живот-
ных можно было объяснить операционным вмешательством, тем не менее в 3-й груп-
пе порог раздражения повышался до 3,8 Вт. В дальнейшем величина СПИ в контрольной
и подопытных группах животных принципиально не отличилась. К концу наблюдения
порог раздражения во всех группах животных понижался до 7-8 Вт.
Функцию сердечной деятельности оценивали по ЭКГ, регистрируемой во II отведе-
нии ивотных при этом помещали в специальный станок, предусматривающий (ня-
тие электросигнала атравматичным способом Через 4 недели после операции наблю-
дали статистически значимое урежение частоты пульса в 3-й группе животных при од-
новременном уменьшении вольтажа зубца S2, р < 0,05. В свою очередь, эти показатели
Э Г имели существенные отличия и в контрольной группе животных Остальные п эра-
метры с КГ в контрольной и подопытной группах животных не имели сколь-либо значи-
мы ра личий. Через 8 недель после операции параметры ЭКГ также не имели выра-
женны изменении как в опыте, так и в контроле и можно было заключить, что имплан-
т ты титана не влияли на параметры ЭКГ животных (Орловский П. И. и др., 1991)-
Та им образом, информация, полученная в опытах на животных, а также в исследо-
вания о возможной токсичности титана для человека весьма скудна и свидетельству-
ет о практической индифферентности самого титана (Доклады ВОЗ, 1986) Все суще-
ствующие критерии безопасности и вредности титана были получены для его солей
или окислов. Поэтому рассчитывать на выраженное резорбтивное действие импланта-
тов титана не при одилось однако различные добавки, напыляемые на поверхность
пластин, могли при рассасывании оказывать токсический эффект. Действительно, та-
кие изменения были выявлены, преимущественно, в 3-й группе животных, которым
были имплантированы образцы титана с углеродным покрытием более быстрое нара-
стание массы тела, повышенное VO$ через 4 недели, некоторое снижение способное
ти печени к детоксикации отклонение в функции почек и др Вместе с тем выявлен-
ппа РУ“ НОСИЛИ’ как правило, временный характер и уже через 8 недель после
луч мТр п”ИЙ исследуемых параметров были статистически недостоверны. По-
читрльмлт пт^пп АаЮТ основания заключить, что имплантаты титана не вызывают зна
нения исследованных параметров у животных Необходимо, однако,
342 --------------- _--------------------------------
ГЛ A BA 5. Материалы для искусственных клапанов сердца
обратить внимание на довольно выраженное резорбтивное действие имплантата с уг-
леродным покрытием, особенно проявляющееся в первые минуты после опеоаиии
В отделе токсикологических исследований и испытаний полимерных изделий ВНИИИ
МТ о ГХВооХСйЬ«ТОКСИК°ЛОГИЧеСКОе испытание Двустворчатых клапанов Сердо-
лик КС-2 (ГОСТ 26997-86), изготовленных из титана ВТ-1-0 (ТУ 15-063-85 ОСТ 19017)
с алмазоподобным углеродным покрытием (патент РФ №2051646) и запирающими
элементами из пироуглерода (ТУ 1900480689-93) с таким же покрытием для имплан-
тации в митральную и аортальную позицию. Проведены санитарно-химические токси-
кологические испытания представленных образцов клапанов Исследовались вытяжки
и значения pH экстрактов, восстановительные примеси, определяемые по расходу 0,02Н
раствора тиосульфата Na, затраченного на титрование, УФ-поглощение в области длин
волн 220 360 нм, анализы вытяжек методом атомно-абсорбционнои спектроскопии
гемолитический эффект экстрактов в опытах in vitro с эритроцитами кроликов, влия-
ние вытяжек на клеточный тест-объект (сперматозоиды крупного рогатого скота),
а также индекс токсичности. Вытяжки после контакта с клапанами вводили паренте-
рально белым мышам с оценкой раздражающего, общетоксического эффектов и реак-
ции лимфоидной ткани, внутренних органов, их весовых коэффициентов по сравнению
с контролем Анализ вытяжек показал, что отличие значений pH экстрактов от контро-
ля не превышало 0,51 ед, что не выходило за пределы допустимого уровня показате-
ля, равного ±1,0 ед; восстановительные примеси, определяемые по расходу 0,02 Н
раствора тиосульфата натрия, затраченного на титрование, составили 0,12 мл 0,02 Н
раствора тиосульфата натрия, при допустимом значении критерия 1,0; УФ — поглоще-
ние в области длин волн 220-360 нм равнялось 0 Анализ вытяжек методом атомно-
абсорбционной спектроскопии показал содержание кадмия < 0,0001 мкг/мл, свинца
<0,01 мкг/мл, цинка <0,1 мкг/мл, хрома, магния, меди и никеля также <0,1 мкг/мл,
указанные значения не превышали допустимых уровней. Экстракты не проявляли ге-
молитического эффекта в опытах in vitro с эритроцитами кроликов: гемолиз — 0%, при
допустимом значении — 2%. Не отмечено отрицательного воздействия вытяжек на
клеточный тест-объект (сперматозоиды крупного рогатого скота) в опытах in vitro ин-
декс токсичности не выходил за допустимые пределы 60-120%
При парентеральном введении вытяжек белым мышам не отмечено местного раз-
дражающего и общетоксических эффектов: при местном введении вытяжек регионар-
ные лимфатические узлы, внутренние органы, а также их весовые коэффициенты у
животных, подвергавшихся воздействию вытяжек из образцов, не имели отличий от
контроля. Образцы клапанов с алмазоподобным углеродным покрытием отвечают тре-
бованиям, предъявляемым к изделиям медицинского назначения, контактирующим с
тканями организма: в условиях эксперимента материалы клапанов проявили достаточ-
ную химическую стабильность, вытяжки из изделий не оказывали отрицательного воз
Действия на биологические объекты. Искусственные клапаны сердца Сердолик КС-2,
Разработанные НПО «Гранит» совместно с СПбГМУ им. акад И П Павлова, рекомен-
дованы ВНИИИ МТ М3 РФ к применению в кардиохирургии по показателю ”ет°ксичн°'
сти, а сами клапаны имеют показатели превосходства (5,6,7), соответствия , *
обеспечивают опережающий уровень развития науки и техники (Лаппо В. . и др , '
Таким образом, результаты исследований показали повышенную тР°м
Ость ^н^ззоподобного углеродного покрытия, низкий токсическим эфф
Удельное сопротивление.
КЛАПАНОВ
НАДЕЖНОСТЬ И ДОЛГОВ верояТность их безот-
Под надежностью искусе—
казной работы в организме пациен нение, то можно _—------
сердца любое клапанно-зависимое о 343
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
отказов (Edmunds L Н. et al., 1996): нарушение структуры клапана (износ, разрушение,
миграция запирающего элемента, кальциноз, разрыв створки, деформация каркаса);
нарушение функции клапана (заклинивание тромбом, паннусом, окружающими тканя-
ми или шовным материалом, параклапанная фистула, неправильный выбор размера
или ориентации, недостаточность или стеноз, клинически значимая гемолитическая ане-
мия); тромбоз; эндокардит; эмболические осложнения; антикоагулянтные кровотечения
Вероятность безотказной работы применительно к каждому из перечисленных ос-
ложнений зависит от времени, прошедшего с момента операции. В связи с этим, она
определяется либо с использованием линеаризованных величин, которые вычисляют-
ся как процентное отношение количества осложнений к количеству пациенто-лет, либо
актуарным методом с помощью кривой свободы от осложнения. Актуарный метод яв-
ляется предпочтительным, так как позволяет более точно учесть фактор времени. Кри-
вая свободы от осложнения строится с использованием метода Каплана-Мейера
(Bodnar Е., 1993) и представляет собой график, по оси абсцисс которого отложены
интервалы времени, начиная с момента имплантации, а по оси ординат — вероятность
отсутствия исследуемого осложнения (свобода от осложнения) на каждом интервале
времени. Несмотря на относительную сложность метода, актуарные кривые можно
довольно легко построить с использованием обычных программных средств, таких как
системы электронных таблиц (Евдокимов А. С., 2004).
Функция свободы от клапанно-зависимых осложнений является монотонно убыва-
ющей, то есть вероятность безотказной работы уменьшается с течением времени, при-
чем каждый зафиксированный в отдаленные сроки случай отказа уменьшает эту веро-
ятность. Таким образом, теоретическая вероятность любого отказа искусственного кла-
пана сердца больше нуля. В связи с этим, международный стандарт ISO 14971:2000
определяет понятие риска как комбинацию вероятности нанесения ущерба в резуль-
тате использования изделия и тяжести этого ущерба. Нужно понимать, что использо-
ва! ие медицинских устройств, в частности искусственных клапанов сердца, связано с
некоторой степенью риска. Решение о проведении операции по имплантации искусст-
вен ы клапанов сердца требует, чтобы возможные риски уравновешивались прогно-
зир^ змым улучшением состояния паимоитс
Возможные риски должны быть пп °СЛе опеРаЧии
клапанов сердца с целью опоеделрмм<?аН лизированы изготовителем искусственных
вня техники (ISO 14971:2000) Риги ИХ приемлемости с учетом общепризнанного
н тью допустимый, частично nonvr™^М?гут ыгь Распределены по категориям: пол-
Концепция трех областей п. У и’ допустимый.
(ISO 14971:2000), приведенной на dhc^Tq6^^ пр?иллюстРиРована диаграммой риска
ердца может быть обозначен точкой ид аждЬ|й вид отказа искусственных клапанов
оси абсцисс этой точки будет являтьХ ДИаграмме риска. При этом координатой по
тказа, а координатой по оси ординат — НОСТЬ УщеРба при возникновении данного
тандартом рекомендуется испольапрдт роятн°сть возникновения этого события
носительные дискретные уровни Та Не абсолютнь1е значения координат, а от-
н начительно недомогание, не TpeOvmniee Э СЦИС могут быть отложены показатели:
но недомогание, требующее медикаментп! Медикамевтозного лечения; незначитель-
бующее оперативного вмешательствZГ™ ЛеЧения> У»ние состояния, не тре-
щее к т|льства’ Ухудшение состояния tdp6v^HMG состояния> требующее оперативного
ми- ппя тальномУ исходу По оси ординат чХ» Щее Экстренной операции или приводя-
чения ктически невозможно, маловепоятнп чения показателей могут быть следующи-
X ичХРВаЛ0В’ Граниды ^л^стТХриска°и ИН0ГДа’ довольно часто, часто" Зна-
ИзготопиВИТеЛЬ искусстввнных клапанов аспределение отказов по интервалам за-
сердца стремится все риски свячдмРДЦа ПРИ пР°веДении анализа риска
есть для /лестить в областях допустимого ° использованием протеза клапана
или летальное 308 С вь,соким Ущербом (необу ^изиологически незначимого риска. То
летальность пациента) вероятность оХ.^Димость оперативного вмешательства
344 -------- ь2Тказа дол*на быть очень низкой. В то же вре-
мя отказы с невысоким ущербом (незначительные
щиеся медикаментозному лечению) могут
возникновения писк нарушения структуры клапана
Среди рисков клапанно-зависимых осл с тромбоэмболическими осложне-
занимает особое место По сравнению, н ммкиии искусственных клапанов серд-
ниями, последствия нарушения механическ тпебуют экстренного хирургического
ца не поддаются медикаментозному лечени обеспечения структурной надеж-
вмешательства Поэтому для разработчиков проблема обес
ности и долговечности протезов клапанов в мрханических и биологических проте
Оценка риска нарушения структуры кла1\^ клапана у биологических протезов не
зов различна. Последствия нарушения стру ческиМИ протезами. Ухудшение у них
столь катастрофичны, по сравнению с м своевременно поставить Диа™
развивается постепенно, поэтому есть воз нарушение структуры механиче
и подготовить пациента к операции. В то ж миграцией запирающих эле
го протеза, например, связанное с разрушен Q в0 многих случаях приводит к
тов, требует экстренного проведения опер ность нарушения структуры 0
ти пациента В связи с этим допустимая в механиЧеских. В клиническом чт0
гических протезов намного выше, чем дл ^pwarCjS periMOUNT coo Щ ’
применении аортальных биопротезов Carp на через 20 лет после импл
актуарная свобода от нарушения струк^ры ое увеличение BepaqTH0CJ^war(jS сот/
составляла 70-80%. причем наблюдалось резкому имплантации
вения указанного осложнения через потез0в Carpentier-Edwards янта11ИИ еще
secfiles/AR00163 pdf). У митральных 6иопр на через 16 лет пооле импла 6оль_
туарная свобода от нарушения edwards-co^/sgcf'165/^ от нару^ния их
меньше и составляла в среднем 48 о ( раов актуарная свобода RPHb разви-
современных механических "РО^^Х.
структуры составляет практически 10 rpDntia предъявляет оче ечн0Сти.
тия механических искусственных клапано анической надежности и
не всегда
ния к изготовителям по обеспечению . мация о разрушениях р апан0В из-
Необходимо отметить, что. хотя информаци м^нических протезов клала
становится гласной, практически у всех ^45
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
вестны случаи дисфункции. Так. опубликована информация о случаях отказа клапанов
St Jude Medical, о катастрофических разрушениях клапанов Bjork—Shiley. Duramedics
(Доброва Н. Б. и др , 1997; O’Neill W. W. et aL, 1995) В СССР и России наблюдались
разрушения корпуса первых клапанов ЭМИКС, были случаи выпадения дисков в клапа-
нах ЛИКС-2, разрушения створок и корпуса у первой модификации клапанов МЕДИНЖ
и клапанов Карбоникс Известен казуистический случай, когда пациент с шаровым про-
тезом аортального клапана АКЧ-02 играл в волейбол и при его падении на спину ша-
рик клапана из-за возникшего неадекватного гидроудара вылетел между дужками кор-
пуса протеза.
Количество случаев нарушения структуры механических клапанов несравнимо мало,
по сравнению с другими клапанно-зависимыми осложнениями, поэтому их прогнози-
рование и предотвращение является сложной конструкторско-технологической пробле-
мой в связи с недостаточной информацией о воздействиях организма на протез На-
пример, недостаточно исследованы величины нагрузок на протезы клапанов, которые
могут возникать при экстремальных, резких физических нагрузках у пациента, наруше-
ниях ритма сердца, повышении систолического и диастолического давления Отдель-
ной проблемой является исследование величины нагрузок, которые может испытывать
протез клапана при реанимационных процедурах, при прямом или непрямом массаже
сердца Поэтому в настоящее время нет общепринятых критериев предельной нагруз-
ки, которую должен выдерживать искусственный клапан сердца, и ее выбор остается
на усмотрение разработчика (Картошкин В. М. и др., 1978).
В условиях массового производства важным фактором структурной надежности
протезов является их технологическая воспроизводимость. У каждого конструкторско-
го размера элемента клапана имеется разрешенный разработчиком допуск на его от-
клонение. Величина отклонения определяется как технологическими возможностями
производственного оборудования, так и требованием к стоимости клапана Физико-
механические характеристики материалов, из которых изготавливаются клапаны, так-
же различаются и зависят от воспроизводимости условий производства. Поэтому фак-
тическая прочность клапана является статистической величиной и может существенно
отличаться от среднего значения
согласно ISO 12006-1:1999
ническим испытаниям, однако критериев ^на^08 Сердца Должны подвергаться меха-
в стандартах не приводится. Изготовит₽пи Результатов механических испытаний
нии, о еспечивающую минимимальный пи™ °ЛЖ6Н СЭМ опРеДелить методику испыта-
пмрТЬЮ допустимого риска на рис. 5.19) Кпп ме<аническ0и дисфункции (область пол-
а для повышения надежности hckvcptr^6 Т°Г°’ должна вестись постоянная оценка
впр^ °ВеЧН°СТЬ или РесУРс работы ncxvr4HHblX 101303,408 сердца (ISO 14971 2000)
нять * ^ количество рабочих циклов ппиТиеННЬ'Х клаоанов сердца определяется как
ежеглл И Функции (Кеворкова РА идп 1ояа\Т°пЫХ 101303,4 безотказно будет выпол-
ствуют наг°К0Л° 4 1°7 рабочих циклов. Пои атп сРеДнем. клапан сердца совершает
родинами РУЗКИ, величиной в несколько килп™М НЭ элементы протеза клапана воздей-
ниченио ческои эффективности и тоомбпп»РаММ’ друг°й стороны, требования гид-
клапана геометрические размеры элрмрЗИСТеНТН°СТИ наклаДЬ1вают жесткие огра-
мо ™ вьпы°Г Т0Г0’ кровь шляется ХаТочНТ0В’ °Пре“^х прочность протеза
вития исжиг ЭТЬ коррозию или деградацию МЯН° химически активной средой, которая
ГсГиХТ^ГЫХ КЛапанов сердХТоа7пТеРИаЛОВ Протеза- 33 пятьдесят лет раз-
клапанных протооТ Фи** К°МПР°МИССНЫХ РешенийВПечатляющих успех0В 6
ГНОЗИП7ЮТ г,,.30 Ф рмь|"г,Р°изводители гг>о ИИ’ обеспечивающих долговечность
Теперь стало лговечность. превышающую рэменных механических клапанов про-
клапана сеолна ТЫМ наблюДение 3*ГпаннА^™ *ИЗНИ человека ~ более 100 лет
Для биопротезовХепаНеСК0ЛЬКО Яесятков лет "1' У КОТОрЬ1Х механический протез
ностью не решена (Ada^ мТеТ^оо^ яол™ечности в настоящее время пол-
346 _ ’ Планку долговечности в 6-7 лет рабо
ГЛАВА 5. Материалы для искусственных клапанов сердца
ты разработчики перешагнули, но сроки наработки протезов 10 и более лет пока явля
ются отдельными достижениями и не стали правилом
В современных международных стандартах ANSI/AAMI/ISO 5840-1996 (Сердечно со
судистые имплантаты - Протезы клапанов сердца), EN 12006-1-99 (Неактивные mdvd-
гические имплантаты - Особые требования к сердечно-сосудистым имплангатам 4 1
Заменители клапанов сердца) и стандарте стран СНГ ГОСТ 26997-2003 (Клапаны сеодц.
искусственные - Общие технические условия) изложены единые требования к долг о-
вечности искусственных клапанов сердца. Материалы, из которых изготавливают клапа-
ны, должны проверяться на коррозионную стойкость и на устойчивость к воздействию
крови При отсутствии деградации материалов основной характеристикой долговечно :-
ти является ресурс. Для механических искусственных клапанов сердца стандартами ус-
тановлено требование к ресурсу в количестве (3,8-4,0) 108 рабочих циклов, а для био-
протезов (2-2,8) 10 циклов (Martin Т. et aL, 1980). Подтверждением соответствия этому
требованию являются испытания клапанов в ускоренном режиме (в 10-30 раз превыша-
ющем физиологическую частоту циклов) на специальных устройствах, где клапаны отра-
батывают необходимое количество циклов. При этом предполагается, что испытуемый
клапан должен в течение каждого цикла испытывать нагрузки не меньше, чем при рабо-
те в организме человека. Испытаниям подвергаются не менее трех аортальных и трех
митральных клапанов наибольшего, среднего и наименьшего размеров. Требования к
конструкции устройств для испытания искусственных клапанов сердца на ресурс в стан-
дартах не установлены Более того, в отечественном и зарубежных стандартах по-раз-
ному формулируются требования к моделированию нагрузок на испытуемый клапан
В п 8.6 ГОСТ 26997 устанавливается требование: «Перепад давления через закры-
тый клапан должен составлять не менее 10 КПа (75 мм рт. ст.), при этом должно быть
обеспечено полное открытие и закрытие испытуемого клапана в течение каждого ци! -
ла Значения нагрузок, действующих на элементы клапана, должны быть не меньше
значений аналогичных нагрузок, создаваемых на стенде для испытания клапанов в со-
ответствии с 8.4 (пульсдупликаторе)». В п 7.4 ИСО 5840 устанавливается требование
производить на закрытых аортальных клапанах минимальную разницу пикового дав-
ления в 11,7 КПа (90 мм рт.ст.) и минимальную разницу пикового давления 15,6 КПа
(120 мм рт.ст) на закрытых митральных клапанах. Эти разницы давления должны под-
держиваться в 95% испытательных циклов».
Отечественные и зарубежные испытательные устройства различаются по принципу
Действия.
За рубежом используются устройства, принципиальная схема которых изображена
на рис. 5.20. Испытуемый клапан 1 помещается в поршень 2, который совершает воз-
вратно-поступательное движение в камере 3 с частотой около 20 Гц. При пер м щ
НИЯХ поршня происходит открывание—закрывание испытуемого клапана и соответству-
ющее перемещение жидкости по камере 3. Для обеспечения циркуляции идко ти
камер з з соединена патрубком 4. в котором установлен регулятор 5 скорости дви
ния :идкости и, соответственно, величин давлении на испытуемом клапане Меняя
амплитуду движения поршня и регулируя сопротивление патрубка, испытатель доби-
вается, чтобы испытуемый клапан полностью открывался и закрывался, а перепад дав
ления на закрытом испытуемом клапане составлял 120 мм рт.ст. /п
В России используются устройства по авторскому свидетельству 9 ( еР
Мов Ю. А , Золотухин А. В., Черняков Ф. Д.. Баталов Г. Г., Евдокимов С. В 1977) С ема
испытательной камеры этого устройства представлена на рис 5.21. Испытат льная
Камера 1, заполненная водой, ограничена мембраной 2, связанной с элементом пр i
вода 4, совершающего возвратно-поступательное движение с частотой около
Демпфирующей мембраной 3. В камере 1 выполнена втулка 5, в которой' закреплен
испытуемый клапан 6 В камере / выполнены дополнительные каналы 8 и Я шун ф
«Шие канал во втулке 5. В каналах 8 и 9 установлены Работающ'\7Х^
н°м направлении клапаны 10 и 11 с регулируемой пропускной способностью. Пр д
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
Рис. 5.20. Принципиальная схема стенда испытаний искусственных кла*
панов сердца на долговечность (по R. Clark et al., 1978; по Н. Reul
et al., 998); объяснение — в тексте
12 15
Рис. 5.21. Принципиальная схема кэмрпь,
сердца на долговечно™. tn Р СТенда для испытании искусственных клапанов
_________ о лQ ("° авт* свид* № 655102, 1977); объяснение - в тексте
348 — _ _
ГЛАВА 5. Материалы для искусственных клапанов сердца
жении мембраны 2 происходит перемещение жидкости через испытуемый клапан 6 и
через шунтирующие каналы 8 и 9 С помощью регулировки хода мембраны 2 и сопро-
тивления шунтирующих каналов 8 и 9 добиваются полного открытия и закрытия клапа-
на и создания заданных нагрузок на элементах клапана
Для определения характера и величин нагрузок, действующих на искусственный
клапан сердца в организме, были проведены специальные исследования в остром эк-
сперименте на собаках (Перимов Ю А. и др , 1979) и на пульсдупликаторе, имитирую-
щем работу сердца. Было показано, что нагрузки, возникающие при ударе запирающего
элемента об ограничители его хода, при открытии и закрытии клапана, существенно
превышают квазистатические нагрузки при его открытом и закрытом положениях По-
скольку величина ударных нагрузок пропорциональна скорости соударения взаимодей-
ствующих элементов, была предложена методика испытаний, в которой эквивалентность
нагрузок при работе клапана в организме и на стенде ускоренных испытаний на ресурс
обеспечивалась адекватностью скоростей удара запирающего элемента испытуемого
клапана при его работе на пульсдупликаторе и на устройстве ускоренных испытаний на
ресурс (Евдокимов С. В 1980, Киселев С Н и др , 1981) Эта методика успешно приме-
нялась при испытаниях на ресурс шаровых и поворотно-дисковых клапанов
Для двустворчатых клапанов применяется более сложная методика испытаний На
клапан-образец, являющийся копией испытуемого клапана, наклеиваются тензометри-
ческие датчики для регистрации нагрузок, действующих на него Клапан-образец по-
мещается в пульсдупликатор, на котором моделируются физиологические условия ра-
боты клапана в организме При работе клапана-образца на пульсдупликаторе регист-
рируются возникающие на клапане-образце нагрузки Затем клапан-образец
устанавливается в устройство для ускоренных испытаний на ресурс и устанавливается
режим, при котором на клапане-образце создаются нагрузки, адекватные нагрузкам,
действующим при испытании его на пульсдупликаторе При этом регистрируются воз-
никающие перепады давления на клапане-образце Затем на его место устанавлива-
ется непосредственно испытуемый клапан без изменения установленного режима и
при этом на клапане контролируются перепады давления, которые должны соответ-
ствовать перепадам, зарегистрированным на клапане-образце Внешний вид вышеопи-
санного устройства для испытания искусственных клапанов сердца на ресурс, приме-
няемого в настоящее время на ЗАО НПП «МедИнж», показан на рис 5 22
Рис. 5.22. Стенд для ускоренного испыта”И’,"СТСХ"Н„ЫХ
клапанов сердца на ресурс ЗАО НПП «МедИн
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
При испытаниях биопротезов клапанов сердца описанные выше устройства и мето-
дики обеспечивают меньшую достоверность Обычно каркасы биопротезов изготавли-
ваются из полимеров, у которых время релаксации соизмеримо с длительностью цик-
ла при ускоренных испытаниях механических клапанов. Створки биопротезов при вы-
соких частотах также начинают функционировать неадекватно. Для них критичными
становятся не только устойчивость к механическим нагрузкам, но и устойчивость к
деградации, старению и кальцинозу. Поэтому для оценки ресурса биопротезов исполь-
зуют низкочастотные (7-10 Гц) устройства Для определения фактической долговечно-
сти биопротезов клапанов сердца ГОСТ 26997 допускает использовать метод их под-
контрольной клинической апробации Естественно, такой подход обусловливает повы-
шенный риск для пациента, но постепенное нарушение функции биопротезов обычно
дает время на подготовку больного к повторной операции и позволяет, в большинстве
случаев, избежать летального исхода.
ПРОЧНОСТЬ КОНСТРУКЦИИ
В соответствии с требованиями стандарта ISO 12006-1:1999 протезы клапанов сер-
дца должны проходить следующие прочностные испытания: испытания на отрыв и вы-
рывание пришивной манжеты; испытания крутящего момента для поворачиваемых кла-
панов; испытания статическим давлением; испытания на деформацию.
Прочностным испытаниям подвергаются не менее трех протезов клапанов сердца с
наибольшим, средним и наименьшим посадочными диаметрами и не менее одного
клапана каждого промежуточного размера. Стандарт не регламентирует ни точной ме-
тодики испытаний, ни количественных значении. Выбор режимов испытаний и опреде-
ление допустимых величин измеряемых параметров производится изготовителем с
учетом мирового опыта производства протезов клапанов сердца.
Испытания статическим давлением позволяют оценить запас прочности протеза
клапана при физиологических нагрузках в организме По требованиям стандарта ISO
5840-1996 должно проводиться измерение гидростатической нагрузки, при которой
происходит отказ (например, разрушение створки или корпуса) или вылет створок.
Разумеется, эта нагрузка должна быть выше, чем максимальная физиологическая на-
грузка с учетом динамического фактора.
Артериальное систолическое давление крови у пациентов с гипертонической бо-
лезнью может достигать 200 мм рт. ст. По требованиям американского министерства
пищевой и лекарственной промышленности, при этой величине давления должна да-
ваться пожизненная гарантия на искусственный клапан сердца Кроме того, при рабо-
те в организме компоненты протеза клапана сердца испытывают динамические нагруз
ки, которые могут быть выше, чем статические при одном и том же давлении крови
Вклад динамической составляющей зависит от конструкции протеза клапана сердца.
Например, для клапана Carbomedics динамический фактор, определяемый как отно
шение максимальной величины напряжений в динамике к величине напряжений в ста-
тике при одном и том же давлении, составляет не более 1,1 (Ryder J. К., Cao Н., 1996).
В то же время в другой работе указывается, что поверхностные напряжения при воз
действии динамической нагрузки в 5,5 раза превосходят поверхностные напряжения
при квазистатическои нагрузке (Ritchie R., 1996). Таким образом, для каждой модели
искусственного клапана сердца динамический фактор должен быть определен экспе
риментальным путем in vitro.
Проведение прочностных испытаний особенно важно для механических протезов
клапанов сердца, изготавливаемых из изотропного пиролитического углерода Этот
материал обладает отличной износостойкостью и биологической инертностью, однако
при этом харакгеризуется повышенной хрупкостью В связи с этим, предъявляются
350 --------—________ ____________________________—
ГЛАВА 5. Материалы для искусственных клапанов сердца
особые требования к проектированию, изготовлению и контролю клапанов из пироли-
тического углерода (Arru Р. et al., 1987; Elizondo D. R. et al., 1996).
Во многих работах проводилось исследование усталостных характеристик у компо-
нентов искусственных клапанов сердца из монолитного изотропного пиролитического
углерода (Татаринов В.Ф., Зол кин П. И., 1999) и графита, покрытого пиролитическим
углеродом (Доброва Н. Б. и др., 1974; Зубарев Р. П и др., 1976; Kepner J., Cao Н., 1996;
Ma L., Sines G., 1996; Ritchie R., 1996) Делается вывод, что понятие усталости е клас-
сическом понимании не применимо к пиролитическому углероду Разрушение компо-
нентов из пиролитического углерода при воздействии циклической нагрузки может
происходить в результате роста микротрещины. Результаты исследований показали,
что при циклических нагрузках до 80% от разрушающей образования и развития тре-
щин не происходит (Доброва Н. Б. и др, 1987; Татаринов В. Ф., 2004; Kepner J., Cao Н.,
1996). Таким образом, для обеспечения работы искусственных клапанов сердца в орга-
низме в течение неограниченного периода времени необходимо, чтобы разрушающая
нагрузка была, по крайней мере, на 20% выше, чем максимальные динамические фи-
зиологические нагрузки.
Предел прочности изотропного пиролитического углерода является случайной ве-
личиной с нормальным законом распределения. На рис. 5.23 показано распределение
предела прочности углеситалла, произведенного НПП «Пироуглерод» (Пенза) в 2002 г,
полученное в результате испытания на трехточечный изгиб 258 образцов из различных
партий материала
Коэффициент вариации предела прочности составляет около 20% при среднем зна-
чении предела прочности 337 МПа. Большой коэффициент вариации создает сложно-
сти при определении запаса прочности искусственных клапанов сердца. Чтобы исклю-
чить фактор случайности, можно проводить испытания предела прочности для всех
партий материала, используемого при изготовлении клапанов, и если измеренный пре-
дел прочности партии ниже некоторой заданной границы, то исключать всю партию из
производственного процесса. Нижнюю границу предела прочности нужно выбирать
исходя из гарантируемого запаса прочности искусственных клапанов сердца. Напри-
мер, для клапана Мединж-2 нижняя граница предела прочности, равная 250 МПа, га-
рантирует запас прочности не менее 3 при динамическом факторе около 3,8 (Евдоки-
мов А. С. и др., 2001; 2004).
Кроме того, чтобы гарантировать запас прочности, можно проводить для каждого
клапана операцию тестового нагружения. При этом к протезу клапана сердца прикла-
дывается статическое давление, величина которого в несколько раз выше максималь-
5.23. Распределение предела прочности на
изгиб изотропного пиролитического углерода
______________351
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
ных физиологических нагрузок с учетом динамического фактора, но при этом компо-
ненты клапана не должны повреждаться
Кроме давления крови, на клапан также действуют нагрузки в диаметральном на-
правлении окружающими тканями Под их воздействием происходит деформация кор-
пуса клапана, что может привести к заклиниванию или вылету створок В связи с этим,
для механических клапанов необходимо проводить испытания на величину деформа-
ции, При этом к протезу клапана сердца в диаметральном направлении прикладывает-
ся нагрузка, равная 10 Н, и замеряется диаметральная деформация корпуса Величи-
на деформации не должна допускать заклинивание или вылет створок Величину де-
формации можно уменьшить за счет изменения параметров упрочняющего
металлического кольца вокруг корпуса
Одним из альтернативных подходов к оценке надежности искусственных клапанов
сердца является математическое моделирование их напряженно-деформированного
состояния в различных режимах работы Этот подход, по сравнению с эксперимен-
тальным исследованием прочностных характеристик, обладает рядом преимуществ.
Прежде всего, для проведения моделирования не требуется изготовление самого
изделия, что особенно ценно при разработке новой модели клапана, так как в этом
случае затраты на проведение математического моделирования намного меньше зат-
рат на изготовление изделия Результаты моделирования выявляют наиболее опасные
зоны с точки зрения надежности, и конструкция клапана может быть скорректирована
с учетом полученных данных
Неоспоримым достоинством математической модели является ее наглядность
В ходе экспериментальных исследований прочности механических клапанов зачастую
трудно определить зону начала разрушения, так как развитие трещины в хрупких ма-
териалах, каким является изотропный пиролитический углерод, происходит мгновен-
но, а распространение трещины может происходить на значительные расстояния
В математической модели легко определить зоны с наибольшими напряжениями, в ко-
торых наиболее вероятно первоначальное зарождение трещины Кроме того, при не-
обходимости можно смоделировать динамику разрушения, чтобы проследить механизм
зарождения и развития трещины и в дальнейшем сравнить полученную картину с ре-
зультатами экспериментов
В то же время у математического моделирования есть и ряд недостатков Во-пер-
вых, абсолютная величина напряжений, вычисляемая в результате расчетов, зависит
от множества факторов связанных с особенностями создания модели Чем сложнее
геометрия исследуемой модели и меньше зоны максимальных напряжении, тем боль
ше влияние этих факторов В некоторых случаях результаты расчетов геометрически
идентичных моделей с одинаковыми граничными условиями могут различаться на де
сятки процентов
которая тем точнее, чем более лРтАпТ,ЭеХМеРНЬ1Х моделей неизбежна аппроксимация,
нелинейно увеличивает требования и- изирована модель Однако детализация модели
дели Определить приемлемый vdorpm^,яислительным ресурсам и время расчета мо-
расчета нескольких моделей с оячпми - ппроксимаЦии можно только по результатам
решения задачи в десятки раз НОИ детализацией, что увеличивает общее время
Наконец, математическая мп
kohctJOB НапримеР' геометрическиеНпХ',рЬ1Вает ста™стические вариации реальных
конструктивных допусков Чтобы оценить ' ИЗДелий ecer«a находятся в пределах
юшим**51, не°бх°Димо строить и рассчитнш яние значений этих размеров на прочность
частноТвл Р Т° Очень тРУДОемкий процесс* ^’Ножеатво моделей, изменяя интересу-
одновпрмоИЯНИЭ геометРических разменов ня Т°рыи’ тем не менее, показывает лишь
ХХТГ! ВЛИЯНИе дольки»ХРзОМРппвПРт?ОСТЬ Изделия и часто не учитывает
обоабг,т^Делировании ваРиации физико-мГ?? Также трудно оценить при математи-
обработки поверхности Физико-механических свойств материалов и качество
352
_----------------------ГЛАВА5 Материапы дп искусственных клепаное сердца
Таким образом, к результатам математического моделирования во многих случаях
следует относиться критически Расчет необходим на этапе проектирования нового
клапана для того, чтобы определить зоны максимальных напряжений, оценигь теоре
тическии запас прочности изделия и, возможно, скорректировать конструкцию еще до
начала изготовления экспериментальной партии Для серийно выпускаемых клапанов
моделирование указывает зоны, где необходим особенно тщательный контроль раз-
меров и качества обработки поверхности Тем не менее, адекватность моделирования
должна быть обязательно подтверждена экспериментально на репрезентативной вы-
борке большого объема
Чаще всего для расчетов моделей искусственных клапанов сердца используют ме-
тод конечных элементов При использовании этого метода трехмерная модель разби-
вается на множество неперекрывающихся элементов простой формы (тетраэдров пи-
рамид, гексаэдров) При расчете систем дифференциальных уравнений вычисления вы-
полняются не по всей области, которая, в большинстве случаев, имеет сложную
геометрическую форму, а в областях конечных элементов с учетом условий непрерыв-
ности и граничных условий Таким образом, точность решения определяется, в значи-
тельной мере, точностью аппроксимации модели конечными элементами
Математическое моделирование методом конечных элементов включает в себя сле-
дующие этапы построение трехмерной геометрической модели средствами систем
автоматического программирования (CAD-систем) или с помощью программного опи-
сания модели, разбиение геометрической модели на множество конечных элементов,
задание граничных условий, решение, интерпретация результата
Основной задачей при построении трехмерной геометрической модели является
как можно более точное ее соответствие реальному изделию Для деталей клапанов
это требование особенно важно из-за их сложной формы Особое внимание приходит-
ся уделять радиусам сопряжения и скругленным кромкам вблизи зон контакта, так как
именно там наиболее вероятна концентрация напряжении
В большинстве случаев трехмерная геометрическая модель строится с использо-
ванием CAD-систем, таких как SolidWorks, AutoCAD или КОМПАС 3D Готовая модель
может быть передана в систему конечно-элементного расчета с использованием стан-
дартных форматов представления трехмерной геометрии, наиболее популярным из
которых является формат IGES
После того, как трехмерная геометрическая модель передана в программу конеч-
но-элементного расчета, выполняется ее разбиение на множество конечных элемен-
тов Это наиболее ответственный, сложный и творческий этап построения математи-
ческой модели, который отнимает до 80% времени исследователя От того, насколько
качественно выполнена эта работа, зависит время выполнения расчета модели и адек-
ватность получаемых результатов
Плотность конечно-элементной сетки определяется исходя из следующих предпо-
сылок чем выше плотность (меньше размер конечных элементов), тем выше точность
аппроксимации и точность результата В то же время, чем выше плотность, тем боль
шее количество конечных элементов требуется для разбиения одного и того же объе-
ма Если учесть, что размерность матрицы, обрабатываемой на каждом шаге вычисле-
нии, приблизительно пропорциональна квадрату количества конечных элементов, то
даже незначительное увеличение плотности элементов приводит к существенному уве-
личению времени решения и занимаемого объема оперативной памяти ЭВМ Таким
° разом, определение плотности сетки — всегда компромиссное решение между же
лаемой точностью результата и вычислительными возможностями В лияние пе
Численных выше факторов на результаты расчетов могут быть проиллюстрированы
на примере математического моделирования концентратора напряжении в кон
ЦИИ’ показанной на рис 5 24 (Евдокимов А С , 2002, 2003)
ертикальная стенка конструкции жестко закреплена, к краю горизонталь Гпяр-
и прикладывается сила F, действующая вертикально вниз Анализируются п р
-------- ------------------ 353 —--------
ку твенные клапаны сердца
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
—
Рис. 5.24. Пример модели с концентратором напряжений; конечно-элементная модель
клапана Мединж-2
ные напряжения, возникающие в сопрягающем радиусе между вертикальной и гори-
зонтальной стенками. Подобные схемы нагружения встречаются часто в механических
искусственных клапанах сердца, например в узле крепления створок к корпусу клапана
Мединж-2.
При задании условий моделирования важно определить нагрузки, которые уду
прикладываться к модели. Это может быть точечное приложение силы заданной вели-
чины, приложение давления, деформация на заданное расстояние и т. д. В больший
стве случаев целью математического моделирования искусственных клапанов сердца
является определение запаса прочности изделия при заданной схеме приложения на
грузки. Запас прочности клапана определяется как отношение величины нагрузки, при
которой происходит разрушение, к максимально возможной прилагаемой нагрузке
реальных условиях В частности, при моделировании работы клапана в организме че
ловека максимально возможная нагрузка определяется как максимальная физиологи
ческая нагрузка с учетом динамического фактора. Рассчитать максимально возмож
ную нагрузку на закрытый клапан можно по следующей формуле:
F =133,3 ДР S /с,
где ДР — максимально возможный градиент давления на закрытом клапане (мм рт ст),
S — площадь поверхности запирающих элементов, обращенной к обратному потоку кро
ви (м2); kd — динамический фактор, который определяется экспериментально для каж
дой модели клапана.
Нагрузка является распределенной и приложена по нормали к поверхностям запи
рающих элементов, обращенным к обратному потоку крови. После выполнения расче
та математической модели необходимо корректно интерпретировать полученные Ре
зультаты. Основными получаемыми результатами при моделировании статических на
грузок являются деформации и напряжения, которые вычисляются для каждого
конечного элемента.
Определить, наступает или нет разрушение при заданных нагрузках, можно на ос
новании какого-либо критерия разрушения, такого как критерии максимальных дефор
маций, критерии максимальных напряжений, критерий Мизиса, критерий Баландина и
т. д. Выбор критерия зависит, в первую очередь, от свойств моделируемого материй
ла. Для изотропного пиролитического углерода часто применяется критерий макси
________________________ГЛАВА 5- Материалы дляискусственных клапанов сердца
мальных главных напряжении: если отношение максимальной величины первого глав-
ного напряжения к пределу прочности материала на растяжение больше единицы или
отношение максимальной по модулю величины третьего главного напряжения к пре-
делу прочности материала на сжатие больше единицы, то наступает разрушение
С другой стороны, критерий разрушения Баландина позволяет учесть различие в пре-
делах прочности на растяжение и сжатие изотропного пиролитического углерода по-
этому в ряде случаев его применение предпочтительно. В то же время прочностные
свойства углеситс лл ;ще не до конца изучены, и в некоторых случаях разрушение ма-
териала не удается описать этими критериями. Продолжается работа по исследова-
нию материала и выбору критерия разрушения, адекватного получаемым эксперимен-
тальным данным.
Величина критерия разрушения во многих случаях прямо пропорциональна величи-
не прикладываемых нагрузок. Тем не менее, возможна и нелинейная зависимость, по-
этому необходимо последовательным приближением определить величину нагрузок,
при орой выбранный критерии разрушения равен 1. Эта величина используется при
определении теоретического запаса прочности изделия, который может быть вычис-
лен по формуле:
где ^разр ~ нагрузка, при которой критерий разрушения равен 1; Г — максимально воз-
можная физиологическая нагрузка на клапане.
Чтобы проверить адекватность модели, рассчитанный теоретический запас проч-
ности сопоставляется с фактическим запасом. Фактический запас прочности можно
определить с помощью испытаний репрезентативной выборки образцов, эквивалент-
ных рассчитанной математической модели, и последующей проверкой гипотезы о сред-
нем нормально распределенной случайной величины Приведенные выше принципы
можно проиллюстрировать на примере математического моделирования клапана Ме-
динж-2 максимального типоразмера в митральной позиции при воздействии систоли-
ческого давления Его конечно-элементная модель приведена на рис. 5.24. Клапан яв-
ляется симметричным относительно плоскости смыкания створок. В связи с этим, рас-
сматривается половина модели клапана, причем на плоскости разреза корпуса
задаются условия симметрии, а контакт со второй створкой имитируется с помощью
жестко закрепленного параллелепипеда. Модель корпуса протеза является симметрич-
ной относительно центральной оси, поэтому может быть построена программными
средствами ANSYS с использованием языка APDL Створка протеза клапана сердца
Мединж-2 имеет сложную геометрическую форму, поэтому ее трехмерная модель стро-
ится с помощью программного CAD-пакета, после чего передается в ANSYS посред-
ством IGES-файла. Корпус полностью разбит на гексаэдрические элементы Для створки
применяется комбинированное разбиение: центральная часть разбита на гексаэдри-
ческие элементы, а узлы крепления к корпусу — с помощью тетраэдрических элемен-
те Рассчитанная максимальная физиологическая нагрузка с учетом динамического
фактора, действующая на закрытый клапан, составляет 55 Н. Это значение использу-
ется при математическом моделировании. Результаты моделирования приведены на
ЦВ. вкладке, рис. 21.
На рисунках видны концентраторы первых главных напряжений как на створке, так
и на корпусе, причем максимум напряжений располагается вблизи поверхности на-
пряжения на корпусе в 1 4 раза выше, чем на створке, и равны при заданной нагрузке
81 МПа. Зависимость напряжений от прикладываемой нагрузки является линеинои.
Принимая минимально допустимый предел прочности материала равным mi ia,
получаем запас прочности исследуемого клапана для максимально возможной дина
мической нагрузки в организме К s 3.
тз*
355
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
Метод конечных элементов позволяет также проводить моделирование кинематики
искусственного клапана сердца в процессе работы. Эта задача является более слож-
ной, чем статический расчет, так как требует больших вычислительных ресурсов, зада-
ния дополнительных граничных условии с учетом гемодинамики. Для механических
клапанов моделирование кинематики усложняется еще и взаимодействием их компо-
нентов в относительно небольших контактных зонах, что требует высокой плотности
элементов и усложняет расчет.
Долговечность полиуретановых клапанов сердца зависит от утомляемости, кальци-
фикации и структуры. Шесть гибких створчатых протезных сердечных клапанов, про-
изведенных из полиэфир-уретан-карбамида, прошли длительное тестирование на каль-
цификацию и утомляемость, проведенное G. М. Вегпасса и соавт. (1997). Они показа-
ли, что 3 клапана превысили 800 млн циклов без отказа. Три клапана вышли из строя
на 775-м, 460-м и 544-м циклах, соответственно Кальцификация наблюдалась во всех
клапанах в области высокого напряжения. Сравнение с подобными клапанами из по-
лиэфир-уретана (ПЭУ) предполагало, что эти клапаны выйдут из строя быстрее, чем
из полиэфир-уретан-карбамида (ПЭУК). Локализованная кальцификация развилась у
ПЭУК створок клапанов на основном участке ПЭУ створок, близко к области соприкос-
новения трех створок. Несостоятельность в ПЭУ клапанах проявилась изнашиванием,
ассоциированным с кальцификацией. Высокие нагрузки в той же области могут сде-
лать ПЭУК створки уязвимыми к кальцификации. Оба полимера проявили одинаковую
реакцию, в течение статического тестирования, на кальцификацию в искусственном
среде и в живом организме и продемонстрировали более низкий уровень кальцифи-
кации, чем биопротезные типы клапанных материалов.
Долговечность полиуретановых клапанов сердца зависит от толщины и материала
створок. Долговечность гибкого трехстворчатого клапана определяется толщиной его
створок. Толщина створок также является основной определяющей гидродинамичес-
кой функции. Были исследованы клапаны (п=31) с полиэфир-уретановыми створками
(ПЭУ, п=22) или полиэфир-уретан-карбамидными створками (ПЭУК, п = 9) с различной
толщиной створок. Клапаны были подвержены тесту на ускоренное утомление при тем-
пературе 37 °C и наблюдалось их повреждение. Толщина створок варьировала от 60 до
200 мкм. Толщина ПЭУ клапанов не носила никакой связи с долговечностью, которая
была меньше, чем 400 млн циклов. ПЭУК клапаны, напротив, выдержали 800 млн цик-
лов Долговечность ПЭУК клапанов была напрямую связана с толщиной створок (г = 0,93,
р< 0,001), с хорошей выносливостью, полученной при толщине клапана примерно
150 мкм. Таким образом, полиуретановые клапаны могут использоваться с хорошими
гидродинамическими свойствами и с достаточной долговечностью с дальнейшим кли
ническим использованием
Моделирование кинематики биопротеза клапана сердца приведено в работе De
Hart J. и соавт. (2003) Кинематика движения створок определяется движением жидко-
ти и выражается в различии конфигурации створки при ее открытии и закрытии При
открытии деформации свободных краев створок значительны. В фазу максимального
открытия форма проходного отверстия близка к окружности, а при закрытии принима
ет треугольную форму. Чрезвычайно важным для оценки долговечности биопротезов
является анализ распределения напряжении в створках. Такие расчеты выполнены как
для каркасного (De Hart J. et al., 2003), так и для бескарасного клапанов в течение
систолы (цв вкладка, рис. 22), причем распределение напряжений рассчитано в тече-
ние всего цикла работы клапанов и с учетом взаимодействия створок с движением
жидкости.
Циклические напряжения лепестков определяют их усталость. При открытии P3
гивающие напряжения в середине створки преобладают с аортальной стороны
на, а напряжения сжатия — с желудочковой стороны. Большие напряжения выз
сильным изгибом створки. Подобная расчетной конфигурация створок зафиксиро
на стереоизображениях, полученных in vitro в работе Z. В. Gao и соавт. (2000). Рас р
356
5. Материалыдл^искуссгвенных клапанов сердца
деление напряжений очень неравномерно по телу створки. В начале закрытия напря-
жения сжатия доминируют с желудочковой стороны, а растягивающие — с аорталь-
ной. На заключительной стадии закрытия напряжения в створках возрастают_необ-
ходимо противостоять повышению перепада давления на клапане. Поведение створок
в диастолу не рассчитывалось.
Из современных отечественных исследований прочности характеристик естествен-
ных клапанов необходимо отметить работы, проводимые на кафедре прикладной био-
механики Санкт-Петербургского государственного электротехнического университета
под руководством академика АМТН П. И. Бегуна. Измерения характеристик напряжен-
но-деформированных элементов клапанов сердца, разработка математических моде-
лей клапанов и расчетных схем направлены на обоснование выбора оптимальной так-
тики и технологии хирургических операций (Бегун П И. и др., 2000; 2004; 2005).
Проблема повышения надежности искусственных клапанов сердца является акту-
альной и обширной. В этой главе рассмотрен лишь небольшой аспект, касающийся
нарушения структуры протезов. В то же время другие клапанно-зависимые осложне-
ния, такие как тромбоз, протезный эндокардит, тромбоэмболии, являются более час-
тыми и их последствия зачастую оказываются очень тяжелыми (Horstkotte D. et al.,
1995). Несмотря на значительные успехи в разработке искусственных клапанов серд-
ца, достичь характеристик естественного клапана сердца с точки зрения надежности
все еще не удается. Тем не менее, работы по совершенствованию конструкций и ма-
териалов протезов клапанов сердца, как механических, так и биологических, ведутся
во всем мире. Использование современных технологий при проектировании, исследо-
вании и производстве клапанов позволяет надеяться на их дальнейшее совершенство-
вание, которое обеспечит пациентам долгую полноценную жизнь.
ЛИТЕРАТУРА
Способ изготовления протеза клапана cep-
м.. ООО «Зеркало-М», 1999.
Агафонов А. В., Зарецкий Ю. В., Кеворкова Р А. Малогабаритные дисковые искусственные кла-
паны сердца // Электронная промышленность — 1984. — Вып. 10 —- № 138. — С. 89-91
Агафонов А. В., Киселев С. Н. Анализ динамики ИКС // Механика композитных материалов —
1979. — №3. — С. 537-539.
Аманатов Л. С., Галич Н. П., Орловский П. И. и др
дца: Патент № 2115388 от 07.1998
Балуда В. П., Балуда М В., Гольдберг А. П. и др. Предтромботическое состояние. Тромбоз и
его профилактика / Под ред. В. П. Балуды. — М.: ООО «Зеркало-М», 1999.
Баркаган 3. С., Момот А. П. Основы диагностики нарушений гемостаза. — М.: Ньюдиамед—
АО, 1999.
Бегун П. И., Шукейло Ю. А. Биомеханика. — СПб.: Политехника, 2000. понд
Бегун П. И., Афонин П. Н. Моделирование в биомеханике. — М.: Высш, школа, 2UU4.
Бегун п. И., Салман А К, Синтоцкий Г. Ю., Смирнова М Ю. Влияние характеристик.предо Р-
дно-желудочковых клапанов на результаты рентгенохирургических операции // Здравоох-
ранение и медтехника. — 2005. - № 1 — С. 14-15. „ибппочмгтймтнпгти
Белов Е. Ф.' Гриценко В. В , Орловский П. И. и др. Способ определения тр
непрозрачных материалов. Авт. свид № 1426205 от 22.05 198 г пгп клапана
Белов Е. Ф.' Брянская Е О , Гавриков Е И и др. Способ изготовления ку
сердца // Авт. свид. СССР № 1155263 от 05.1985. ™^ллпр™гтрнтнос-
Белов Е ф., Гриценко В. В., Орловский П И. и др. Способ ^ред^еНдд„Т
. СССР № 1426205 от 05 1988
' Кокшенев И В Новые биологические материалы и методы
, коченев «ссх д н еакулева рАМН 2002
। др. Искусственный клапан сердца из сплава
1986. — № 1- — С. 31-35
Белов Е. Ф.г Брянская Е. О , Гавриков Е И и
< __________________ _
Белов Е ф.г Гриценко В. B.t ирлим™ л*; юяя
ти непрозрачных материалов' Авт. свид. СССР № 14262 от
Бокерия Л. А., Каграманов И. И.,
лечения в кардиохирургии. — М.: Изд-во
Бадретдинова М А., Иванова Р Г., Иофис Н А и
на основе Co-Cr-W-Ni // Мед. техника. — 1 —
357
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
Вашкинель В К, Петров М. Н Ультраструктура и функция тромбоцитов человека — л • Havx
1982. ’ У а’
Валуев Л И Гепаринсодержащие полимерные материалы // Итоги науки и техники ВИНИТИ
Серия. Химия и технология высокомолекулярных соединений. — М 1981 — Т 16 —
С. 168-210 ’ ’
Вильямс Д Ф. Роуф Р Имплантанты в хирургии / Пер. с англ. — М.: Медицина, 1978.
Вихров С. П Холомина Т. А.. Бегун П. И. и др. Биомедицинское материаловедение; Учебн
пособие. — М.: Горячая линия — телеком, 2006.
Газарян А С., Князева В. А., Нарайкин О С. Динамический расчет стержневой конструкции
модели ИКС Расчеты на прочность. — М., 1981. — Вып. 22. — С 190-203
Галилеева А Н. Профилактика тромбоэмболических осложнений у больных с механическими
искусственными клапанами сердца в отдаленные сроки наблюдения (экспериментально-
клиническое исследование): Дис. канд. мед. наук. — СПб., 2004.
Галич Н. П, Орловский П. И, Лаптев Ю. П. и др. Способ испытания искусственных клапанов
сердца: Авт. свид СССР № 1623640 от 10.1990.
Галич Н П., Орловский П И, Лаптев Ю П и др Способ изготовления искусственного клапана
сердца: Патент РФ №2051646 от 01.1996.
Галич Н П., Орловский П. И., Гриценко В. В Новые тромборезистентные материалы // Петер-
бургский журнал электроники. — 1996. — №2(11), — С. 65-66.
Галич Н. П., Орловский П. И, Лаптев Ю П. Искусственные клапаны сердца с углеродным по-
крытием и улучшенной структурой кровотока // Судостроительная промышленность: Науч -
ех. сборник (ЦНИИ «Румб», серия: общетехническая). Вып. 17. — 1988._С 43-48.
РиЦенко В., Орловский П. И., Галич Н. П. и др. Выбор материала для конструирования дву-
кдппигТл Г° искусственного клапана сердца Сердолик КС-2 // 1 -я Российско-французская
кардиологическая конференция Intercardio 27-29.03.1994. — СПб 1994 — Г 57-58
РИ1мазопппи^УГЛОВ Ф Г> °РЛ0ВСКИЙ П И' и др’ Оценка биосовместимости материалов с ал-
леи 1995 /Ьрп углеродным покрытием III Всерос. съезд сердечно-сосудистых хирургов,
г л9?? РУДНЭЯ И сеРД^но-сосудистая хир. - 1996. - № 6 - С. 159
РИ*1994 ’ М0С0Ва Е‘ Н' ГРИЦЮК ИА- Практическая гемостазиология. — Киев: Здоров’я,
А за у больных ппсп^НК° В °РЛ0ВСКИЙ П' И' и др сравнительное исследование гемоли-
дца с шаоовым и имплантации от ч твенных конструкций искусственных клапанов сер-
логия — 1989 — Т. 29,ВаЮ№дМСЯ ^2^28^ ДИСК0ВЫМ запиРаю‘Дим элементом // Кардио-
титана ВТ O^c^qbvmh Б.и.С:ДаРеНК0 £ АКТ испь,тания тромбогенных свойств образцов
боратория полимеров HCCX^A^H угЛероднь,м (с бором) и апмазоподобным // Ла-
Доброва Н Б. Иофис н а Тозыркии К ^аКулевалРАМН‘ “ 12.09 89.
шения элементов искусственных клапанол гап Ha™3 ПРИЧИН возм°жног° износа и Разру'
№2 — С 8-12 анов сердца дискового типа // Мед. техника. — 1987. —
дца как следст^Тупруг^’деФоо66 ДисФУн«Ция механического протеза клапана сер-
сосудистая хир. — 1997, _ 2рмади^ ег° корпуса {in vitro анализ) // Грудная и сердечно-
Доброва Н. Б , Носкова Т И Нови корд г п
оценке биосовместимых свойств ис^ег™/1 ДР‘ Сборник методических рекомендации по
М., 1991. искусственных материалов, контактирующих с кровью. -
Доброва Н. Б . Кузьмина Н. Б., Агафонов А я г а
сердца: Авт. свид. СССР №78702? п ю ’ Спос°б исследования искусственных клапанов
Доброва Н. Б., Сидаренко Е. С., Фадеев\ А Пппт
тромбогенных свойств циркония е ’Ротокол заключения результатов исследования
корпусов механических клапанов’грп°лмГ^ВпВлИ наде*ности алмазоподобного покрытия
лева РАМН. — 21.12.1993 РДЦЭ Лаборатория полимеров ИССХ им. А. Н. Баку-
вые информационные технологии ^^монтных моделей для анализа в пакете ANSYS // Но-
за, 2002 темы. Тр. V Междунар научно-технич. конф — Пен-
напряжений И Сб. тр ||| конф попк^поДИХ результать| моделирования концентраторов
(Москва, 23-24 апреля 2003 п / Пп ателеи программного обеспечения CAD-FEM GmbH
__________________ } 1 П°Д Ред А- С- Шадского. - М.: Полигон-пресс, 2003.
обо ___
ГЛАВА 5- Материалы для ь скусственных клапанов сердца
Евдокимов С. В. Исследование гидродинамических характеристик искусственных клапанов серд-
ца различных конструкций в лабораторных условиях: Автореф. дис. канд техн наук - Л 1980
Евдокимов А. С. Математическое моделирование напряженно-деформированного состояния
протеза клапана сердца «Мединж-2» // Протезы клапанов сердца «Мединж» в хирургии кла-
панных пороков сердца. Сб. тр., Изд. НЦССХ им. А. Н. Бакулева РАМН - 2004 —
С. 144-149. '
Евдокимов С. В., Мельников А. П. Искусственный клапан сердца из пиролитического углеро-
да // Мед. техника. — 1985, — № 4. — С. 23-25.
Евдокимов С. В., Муйземнек А. Ю„ Татаринов Е Ф. и др. Исследование факторов, влияющих
на надежность протезов клапанов сердца из пиролитического углерода: Тез докл. и со-
общ. VII Всерос. съезда сердечно-сосудистых хирургов — М., 2001 — С. 23
Евдокимов С. В., Татаринов Е. Ф, Назаров В. М. и др. Обеспечение тромборезистентности
механических протезов клапанов сердца «Мединж-2»: Тез. докл и сообщ. VII Всерос. съез-
да сердечно-сосудистых хирургов. — М., 2001. — С. 248.
Зубаиров Д. М Молекулярные основы свертывания крови и тромбообразования. — Казань.
ФЭН, 2000.
Иофис Н.А., Кеворкова Р А., Самков А. В. и др. Искусственный клапан сердца и способ его
изготовления: Патент РФ № 2109495 от 04.1998.
Искусственные органы / Под ред. Шумакова В. И. — М.: Медицина, 1990
Калугин В. И., Козыркин Б. И Куроленкин Е. И. и др. Материалы для запирающих элементов
искусственных клапанов сердца // Электронная промышленность — 1984. — Вып.10
(138).- С. 88-91.
Картошкин В. М., Перимов Ю. А., Евдокимов С. В. и др. Измерение нагрузок в протезах клапа-
нов сердца в лабораторных условиях. Физические методы и вопросы метрологии биоме-
дицинских измерений: Тез. докл. V Всесоюзной конф., — 1978. — С. 143-145.
Кеворкова Р. А., Иофис Н. А , Дзевишек Е. В. и др. Повышение долговечности искусственных
клапанов сердца «ЭМИКС» // Мед. техника. — 1989. — №6. — С. 9-15.
Киселев С. Н., Газарян А. С., Князева В. А. и др. Расчетное и экспериментальное исследова-
ние элементов ИКС при статических и динамических нагрузках // Вибротехника (Виль-
нюс). — 1981. — № 1/41. — С. 17-28.
Кравцова И. А., Зубцовский В. Н., Орловский П. И. и др. Некоторые вопросы электрохимичес-
кого взаимодействия медицинских материалов с кровью // Сб.: Применение новых биопо-
лимерных материалов в медицине. I Л МИ им. акад. И. П. Павлова. Л., 1979. — С. 72-74.
Лаппо В. Г, Перова Н. М., Ланина С. Я. Заключение токсикологических испытаний образцов
ИКС «Сердолик» КС-2 №34/1449. ВНИИИ МТ, М3 РФ. — 14.07.94.
Макаров К. А., Кравцова И. А., Перимов Ю. А. и др. Способ получения покрытия на титановых
протезах: Авт. свид. №755888 от 15 08.80.
Немец Е д., Севастьянов В. И. Взаимодействие гепаринизированных полимерных материалов
с белками плазмы крови и тромбоцитами // Мед. техника. — 1994. — № 2. — С. 18-22.
Немец Е.А., Севастьянов В. И. Сравнительная эффективность применения гематологических
методов для анализа прокоагулянтной активности медицинских материалов // ед. техни
ка. — 1999. — №6. — С. 18-22. - .. То,
Новикова С. П. Способы повышения тромборезистентности полимерных поверхностей // .
докл и сообщ. Ill Всерос съезда сердечно-сосудистых хирургов. — ’Tor,,'Q
Орловский П. И., Галич Н. П, Доброва Н. Б. и др. Выбор и оценка биосовмес™^ "
ла для конструирования двустворчатого искусственного клапана сердца < PMHn_rocv_
алмазоподобным углеродным покрытием // В сб.: «Актуальные про лем' ’ академ
диетой, легочной и абдоминальной хирургии». Посвящ. . рМу
РАМН Ф г Углова (под ред. проф. В. В. Гриценко, проф. С. М. Лазарева). - СПб.. ГМУ.
1999 ~ 34 3
Орловский П. И , Галич Н П.. Муковский Л А и др Токсикологическое исследование £атериа-
лов для искусственных клапанов сердца // Вести, хир. 1 • _ гепдца в от-
Орловский П. И. Гомеостаз больных с механическими искусственными Автореф дис
Деленные сроки наблюдения (клинико-экспериментальное исследование). Автореф. дис
Оефищев НД нХдред ) Дисфункция эндотелия. Причины, механизмы, фармакологическая
коррекция — СПб.: Изд-во СПбГМУ, 2003
359
ИСКУССТВЕННЫЕ К Л АПАНЫ СЕРДЦА
Саноцмш И. В Основные понятия токсикологии // В кн.: Методы определения токсичности и
опасности химических веществ (токсикометрия). — М., 1970. — С. 9-29.
Севастьянов В. И. Биоматериалы для искусственных органов: Искусственные органы (под ред.
В. И. Шумакова). — М., 1990. — С. 214.
Севастьянов В. И.. Кулик Э А, Ким С. В. и др. Адсорбционные свойства поверхности поли-
мерных материалов при их взаимодействии с белками // Биосовместимость. — 1993. —
Т 1 - №1. — С. 3-11.
Севастьянов В И.. Лаксина О. В., Новикова С. П. и др. Современные гемосоместимые мате-
риалы для сердечно-сосудистой хирургии / Под ред. В. И. Шумакова. — М.: ВНИИМИ. 1987.
Севастьянов В. И , Розанова И. Б., Цейтлина Е. А. и др. Методология отбора гемосовместимых
биоматериалов в условиях in vitro для искусственных органов // Мед. техника. — 1990. -
№4. — С.26-34.
Севастьянов В И. Акт испытания гемосовместимых свойств образцов дисков с углеродным
напылением. НИИИИ МТ М3 РФ, №20/88, 25.05, 1988.
Смурова Е. В., Доброва Н. Б. Создание полимерных материалов с тромборезистентными свой-
ствами // Итоги науки и техники. ВИНИТИ. Серия: Химия и технология высокомолекуляр-
ных соединений. — М., 1976. — Т 10. — С. 30.
Сэноо Манабу (под ред.) Полимеры медицинского назначения. — М.: Медицина, 1981.
Татаринов В. Ф. Разработка и исследование свойств углеситалла для искусственных клапанов
сердца «МедИнж-2»// В сб.: Протезы клапанов сердца «МедИнж» в хирургии клапанных
пороков сердца. М.: Изд-во НЦССХ им. А. Н. Бакулева РАМН, 2004. — С. 172-175.
Технология тонких пленок- Справочник / Под ред. Л. Майссела, Р. Глэнга. — М.: Сов. радио, 1977.
Толпекин В. Е., Мелемука И. В. Имплантация искусственного клапана сердца «Сердолик КС-2»
№ 30-93: Протокол исследования № 57/94 НИИТи ИО М3 РФ от 2.09.94.
Углов Ф Г., Гриценко В. В., Орловский П. И. и др. Оценка биосовместимости материалов с ал-
мазоподобным углеродным покрытием: Тез. докл. и сообщ III Всерос. съезда сердечно-
сосудистых хирургов // Грудная и сердечно-сосудистая хир — 1996. — №6. — С. 159.
Углов ф Г, Зубцовский В. Н., Орловский П. И. и др. Изменение ультраструктуры и функции
тромбоцитов при имплантации искусственных клапанов сердца у животных // В сб.: При-
менение новых биополимерных материалов в медицине: I ЛМИ им. акад. И. П. Павлова. —
Л , 1979. — С. 74-79.
Углов Ф Г., Зубцовский В. Н., Орловский П. И. и др. Гемолиз эритроцитов при экспериментальном
протезировании искусственных клапанов сердца у животных // В сб.: Применение новых био-
полимерных материалов в медицине: I ЛМИ им. акад. И. П. Павлова. — Л., 1979. — С. 79-82.
Углов Ф. Г., Орловский П И Гриценко В. В. Двустворчатый протез клапана сердца с тромбо-
резистентной защитой’ III Всерос съезд сердечно-сосудистых хирургов, дек. 1996 // ГруД"
ная и сердечно-сосудистая хир. — 1996. — №6. — С. 159-160.
Углов Ф. Г., Орловский П. И., Федорова З.Д. и др. Исследование тромборезистентности мате-
риалов тестом потребления протромбина // Вест. хир. — 1984. — Т. 133. — № 9. — С 3-5.
Штильман М. И. Полимеры медико-биологического назначения. — М.: Академкнига, 2006.
Шумаков В. И., Толпекин В. Е., Шумаков Д. В. Искусственное сердце и вспомогательное кро-
вообращение. — М.: Янус-К, 2003.
Юречко В. Н., Корчагин С. И., Омельянчук А М. и др. Экспериментальное исследование зави-
симости уровня гемолиза крови от конструкции искусственного клапана сердца // Мед.
техника. — 2001. — №4. — С. 39-43
Adamczyk М. М., Vesely I. Biaxial strain distributions in explanted porcine bioprosthetic valves //
J. Heart Valve Dis. — 2002. — Vol. 11, № 5. — R 688-695
Agathopoulos S , N'kolopoulos P Wettability and interfacial interactions in bioceramic-body-liqu'd
system // J Biomed Mater. Res. — 1995. — Vol. 29, №4. — P. 421-429.
Alexander H., Brunski J. B., Cooper S. L. et al. Classes of materials used in medicine / In Biomaterials
science: An Introduction to Materials In Medicine. Ratner B. D., Hoffman A. S., Schoen F J-
Lemons J. E. (Eds.). — Academic Piess, NY, 1996 ____P 37-130
AmТыЛЛ ? Nei" Stud'es Of the nature °’ the bindin9 by albumin of platelet activating factor
AndradeC ! /ZeJ Chem' “ 1"7- ~ VoL 272' № 30- - R 18772-18778.
ASAici i лав? a ii ?°<e>er e* a'' 3ur1aces and blood compatibility, current hypotheses //
j. — 1УВ7 — Vol. 10, № 1. — R 75-84.
ArfUDis'-nw&S vn|CT',c° C, et aL Wear assessmen1 in bileaflet heart valves // J Heart Valve
Uis. iyyb — Vol. 5 (Suppl. 1) — r 133-143,
360
ГЛАВА 5 МатеР"алы для искусственных клапанов сердца
Агги Р„ Santi М., Vallana F et al. A new РУС film for biomaterial applications I In. Vincenzini P (ed)
High tech ceramics, Amsterdam Elsevier Science publish. B.V., 1987. — p 117-126
Barmada H., Cohen D. Surface analysis of bileaflet prosthetic heart valve leaflet leadinci edae //
ASAIO J. - 1998. - Vol. 44, № 4. - P. 294-298. У "
Baszkin A., Lyman D. J. The interaction of plasma proteins with polymers. I Relationship between
polymer surface energy and protein adsorption/desorption //J. Biomed Mater Res — 1980 —
Vol. 14, №4. — P. 393-403.
Bauer K. A., Kass B. L., ten Cate H. et al. Detection of factor X activation in humans // Blood —
1990. — Vol. 74, №20. — P. 2007-2015.
Bauer K. A., Kass В L., ten Cate H. et al. Factor IX is activated in vivo by the tissue factor mechanism //
Blood. — 1990. — Vol. 76, № 6. — P. 731-736.
Baugh R J., Broze G. J. Jr, Krishnaswamy S. Regulation of extrinsic pathway factor Xa formation by
tissue factor pathway inhibitor // J. Biol. Chem. — 1998. — Vol. 273, №8. — P 4378-4386
Bernacca G. M., Gulbransen M. J, Wilkinson R. et al. In vitro blood compatibility of surface-modified
polyuretanes // Biomater. — 1998. — Vol. 19, № 13. — P 1151-1165
Bernacca G. M., MacKay T. G., Gulbransen M. J. et al. Polyurethane heart valve durability: effects of
leaflet thickness and material // Int. J. Artif. Organs. — 1997. — Vol. 20, №2 — P. 327-331.
Beyer D., Knoll W., Ringsdorf H. et al. Reduced protein adsorption on plastics via direct plasma
deposition of triethylene glycol monooallyl ether // J Biomed. Mater. Res. — 1997. — Vol. 36,
№ 1. — P 181-189.
Biomatenals science: an introduction to materials in medicine / Eds B. Rather, A S. Hiffman, F. J.
Schoen et al. — San Diego: Academic Press, 2004. 2nd Ed.
Black J. Biological performance of Materials // Marcel Dekker. — N.Y, 1992
Blockmans D., Vermulen J. Thrombogenicity of artificial organs // Int. J Artif. Organs. — 1990. —
Vol. 13, № 11. — P. 723-728.
Bodnar E., Агги R, Butchart E. G. et al. Wear in mechanical heart valves // J. Heart. Valve Dis. —
1996. — Vol. 5, № 1. — P. 149-156.
Bodnar E. Prediction of valve failure. Statistical modeling and pattern recognition I I J Heart Valve
Dis. — 1993. — Vol. 2, №4. — P. 490- 492.
Bokros J. C., Haubold A. D., Akins R. J. et al. The durability of heart valve replacements: past
experience and current trends // In Bodnar E., Frater R. (eds) Replacement Cardiac valves.
Permagon press, inc. — New York, 1991. — P. 21-48.
Bokros J. C, Stupka J., Haubold A. D et al. Progress toward design optimization of bileaflet
mechanical heart valves // Proceed. Cardiovasc. Science technol. Conf, Bethesda. Maryland,
1992. — P. 71.
Bolz A., Schaldach M. Artificial heart valves, improved blood compatibility by PECVD a-SiC coating //
Artficial Organs. — 1990. — Vol. 144, № 4. — P. 260-269.
Boretos J. W., Eden M. Contemporary Biomaterials, Material and Host response, clinical applications //
New Technology and legal Aspects. Noyes Publications, Park Ridge — NY 1984. — P. . .
Borman J. B., Brands W. G., Camilleri L. et al. Bicarbon valve — European multicenter clinical
evaluation // Eur. J. Cardiothorac. Surg. — 1998. — Vol. 13, №6 — P 685-693.
Bos G. IV, Scharenborg N. M„ PootA. A. et al Adherence and proliferation of endothelial cells on surface-
immobilized albumin-heparm conjugate//Tissue Eng. — 1998. д p,
Brunski J B. Metals // Biomaterials Science: An introduction to Materials n e ’Cine. о7_сп
Hoffman A. S„ Shoen F. J, Lemons J. E. (eds.) Academic Press, San Diego 1996^
Cacciafesta P„ Humphns A. D. L„ Jandt К D. et al. An ultra-flat titanium su _ Transac-
adsorption studies by atomic force microscopy // Sixth World Biomatenals Congress Transac
tions. — Minneapolis: Society for Biomaterials, USA, 1994. P. ,.,₽яг testino of
Campbell A., Baldwin T., Peterson G et al. Pitfalls and outcomes rom ac _ 124-132
mechanical heart valves // J. Heart Valve Dis - 1996. - Vol 5 (SuPP^ ,, j Heart
Cao H. Mechanical performance of pyrolytic carbon in prosthetic ea v
Valve Dis - 1996. - Vol. 5 (Suppl 1). - R 32-49. and op„ca|
haV' Len3 Y X ‘ T'an X B- e‘ aL Ant'thrOmbf°?^5?O Tin fdms // Biomatenals - 2002 -
bandgap and hemocompalibility mechanism of Ti(Ta 5)O2
Vol. 23. № 24. — R 2545-2552. q.irface Modification of Mechanical
Janowski F. A., Goodman M.t Tarnoff M. et al. The Effec __ p ^9-190
Aortic Valves on Thrombogenicity // Scanning. — 1998. — °-
__ ________________ 361 -----------
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА ___
Clapper D L Anderson А. В Photochemical coatings to improve tissue compatibility and
thiomboresistnnce of implant devices // Mater Technol — 1995 — Vol 10, № 1. — P 147-149
Coleman D. L , Gregonis D E Andrade J D Blood-materials interactions the minimum interfacial
tree enei gy and the optimum polar/apolar ratio hypothesis //J Biomed Mater Res 1982 —
Vol 16 №2 - P 381-398.
Colman В И/ Hirsh J.. Marder V J et al (ed.) Haemostasis and thrombosis. Basic principles and
clinical practice — 2 nd ed - Philadelphia: J B. Lippincott, 1987 — P 1335-1347
Cooke F W Lemons J E, Ratner В D Properties of materials in biomatenals Science An
Introduction to Materials In Medicine Ratner В D , Hoffman A S , Schoen F J., Lemons J E
(eds.) — Academic Press, NY, 1996 — P 11-35
Courtney J M . Forbes C. D Thrombosis on foreign surfaces // Br Med Bull — 1994. — Vol 50,
№4. — P 966-981.
Cylwik В Darewicz J Karasewicz В Morphometric investigations of dog kidney infarcts after
embolization of the renal artery with spongostan // Internat. Urol, and Nephrol — 1985 —
Vol 17, №2 -P 109-114
Dahlback В Resistance to activated protein C as risk for thrombosis: molecular mechanisms,
laboratory investigation, and clinical management // Semin Hematol — 1997 — Vol 34, №3 -
P 217-234
Dauskardt R. H, Ritchie R О Pyrolytic carbon coatings // In Hench L. L , Wilson J (eds) An
introduction to bioceramics — Singapore, world Scientific publ. Co., 1993 — P. 261-279.
Dauskardt R H, Ritchie R О, Takemoto J К et al. Cyclic fatigue and fracture in pyrolytic carbon
coated graphite mechanical heart valve prostheses role of small cracks in life prediction //
J Biomed Mater Res — 1994 — Vol 28, №5 — R 791-804
De Catenno R, Gazzetti P, Mazzone A et al Platelet activation in angina at rest Evidence by paired
measurement of plasma betathromboglobulin and platelet factor-4 // Eur Heart J — 1988 —
Vol 9, №8 - P 913-922
De Hart J Fluid-structure interaction in the aortic heart valve a three-dimensional computational
analysis — Ph Thesis Eindhoven, 2002
De Hart J, Peters G W M, Schreurs P J G , Baaijens F P T A three-dimensional computational analysis
of fluid-structure interaction in the aortic valve // J Biomech — 2003 — Vol 36. — P 103-112
DeLangis P. A , Yen T F Electronic antihemocoagulation//Biomater Med Devices Artif Organs —
1986 — Vol 14. №3-4 — P 195-225.
Di Cera E, Dang Q D, Ayala Y M Molecular mechanisms of thrombin function // Cell Mol Life
Sci — 1997 — Vol 53, №9 — P. 701-730
Dion I, Rouais F, Trut L et al TiN coating, surface characterization and hemocompatibility Ц
Biomatenals — 1993 — Vol 14, № 3 — P 169-176
Dion 1,1 о и у H , Baudet Е et al Hemocompatibility of diamond-like carbon coating I I Biomed
Mater Engng. — 1993 — Vol 3, № 1 — P 51-55
Ebert R Schalda h M Ceramic as material for cardiovascular device // World Congress on Medical
Physics and Biomedical Engineering — Hamburg, 1982. — Vol 3 — P 7-12
Edmund L H I pro th ti valve thrombogenicity releated to design or material9 (Review) // Texas
Heart Inst. J — 1996 -Vol 23 № 1 — P 24-27
Ehsen M G , Van dem Borne P A , Bouma BN et al Protein C inhibitor acts as a procoagulant by
inhibiting the thrombomodulin — induced activation of protein C in human plasma // Blood
1998 - Vol 91, №5 - P 1542-1547
Elizondo D R Boland E D Ambrus J A et al Mechanical cardiac valve prostheses wear
characteristic and magnitudes in three bileaflet valves // J Heart valve Dis — 1996 — Vol 5
(Suppl 1) - P 115-123
Immunologfcal aspe ts of biomatenals // Fundamental aspects of biocompatibility D F
Wiliams(ed) — Florida, 1981 — P 159-173
Е1У J' Accuntiu J A et al Puie pyrolytic carbon preparation and properties of new
^atenal, ON-XR carbon for mechanical heart valve prostheses // J Heart valve Dis - 1998 -
Vol 7, №6 — P 626-633
V Coatin0 of P°lyether-polyurethanes and polyethylene with a
heparin-po|y(Viny|aicohol)//Biomatenals — 1986 — Vol 7, №3 — P 206-211
tions P'asma treatments and plasma deposition of polymers for biomedical appl|Ca*
tions / Sud & Coat Technol - 1998 - Vol 98 - P 1102-1106
----------- 362 ------------------------------ .________________________________
________________________222^15 Матерплы для искусственных кла iнов сердца
Feng L , Andrade J D Protein adsorption on low temperature isotropic carbon V How is it related to
its blood compatibility9 // J Biomater Sci Polym Ed — 1995 — Vol 7, Ng 5 — p 439-452
Feng L, Andrade J D Protein adsorption on low temperature isotropic carbon III Isotherms,
competitivity, desorption and exchange of human albumin and fibrinogen // Biomaterials —
1994 - Vol 15, № 5 - P 323-333.
Feng L, Andrade J D Protein adsorption on low-temperature isotropic carbon I Protein
conformational change probed by differential scanning calorimetry // J Biomed Mater Res —
1994 — Vol 28, Ng 6 — P 735-743
Fischlein T, Fasol Fl In vitro endothelialization of bioprosthetic heart valves // J Heart Valve Dis —
1996 — Vol 5, № 1 — R 58-65
Frautschi J Fl., Phillips R E., Schoen F J et al In vivo performance of a prosthetic polymer heart
valve. Pathological evaluation // Surfaces in Biomaterials Symposium Cambndge MA — 13-
15 09 1993
Gao, Z. В , Pandya, S., Hosein, N et al Bioprosthetic heart valve leaflet motion monitored by dual
camera stereo photogrammetry // J. Biomech — 2000 — Vol 33, №2 - 199-207
Gilpin С. B., Houbold A D, Ely J L. Fatigue crack, growth and fracture of pyrolytic carbon composi-
tes // Bioceramics. — 1993 — Vol. 6, Ng 1 — P 217-224
Goodman S. L, Tweden K. S, Albrecht R M. Platelet interaction with pyrolytic carbon heart-valve
leaflets I I J Biomed Mater Res — 1996 — Vol 32, №2. — P 249-258.
Gott V L Synthetic materials for valve construction Long-Term Prognosis following valve replacement
Adv Cardial — Karger, Basel, 1972 — Vol 7 - P 12-24
GreislerH P Interactions at the blood/matenal interface//An Vase Surg — 1990 — Vol 4, № 1 —
P 98-103
Groot P G., Sixma J J Platelet adhesion: a concerted action of hemodynamic and biochemical
processes // New Trends in Haemost — Berlin- Springer-Verlag. 1990 — P 80-88
Hakim R M, Ault H., Himmelfarb J Interaction of blood with artificial surfaces // Thromb and
Hemorrh I Lascalro, A Schaper (ed ) — 1994 — P 8883-8902
Hasenkam J M, Pasqumo E, Stacchmo C et al Wear patterns in the Sorin Bicarbon mechanical
heart valve a chinicai explant study // J Heart valve Dis — 1997 — Vol 6. №2 — P 105-114
Helmus M N, Hubbell J A Material Selection // Cardiovasc Pathol — 1993 - Vol 2. № 1 —
P 52-71.
Hench L L Ceramics, Glasses and Glass-Ceramics // In Biomaterials Science: An Introduction to
Materials In Medicine Ratner В D., Hoffman A S , Shoen F. J., Lemons J E (eds ) Academic
Press, San Diego, 1996 — P 73-84
Hilbert S L , Ferrans V J, Tomita Y et al Evaluation of polyurethane trileaflet cardiac valve prosthe-
ses//J Thorac Cardiovasc Surg — 1987 — Vol 94, Ng 3 — P 419-429
Holland N В , Marchant R E Individual plasma proteins detected on rough biomaterials by phase
imaging AFM//J Biomed Mater Res — 2000 — Vol 51, №2 — P 307-315
Holt D В , Eberhart R C , Prager M D Endothelial Cell binding to Dacron Modified with Polyethylene
Oxide and Peptide //ASAIO J — 1994 — Vol 40, №6 - P 858-863 _
Horstkotte D , Burckhardt D Prosthetic valve thrombosis // J Heart Valve Dis lass
Huang N, Yang P, Cheng X et al Blood compatibility of amorphous titanium oxide films^synthesized
by ion beam enhanced deposition // Biomaterials — 1998. — Vol 1 , 5 Rmmatenals —
Huang N, yang P, Leng Y X et al Hemocompatibility of titanium oxide films //
Huang°N Sang ^LengYX^al State-of-the-art of surface modification <J ^omatenals appbedf
for cardiovascular devices // Key note speaker on 3" Internationa
engineering 10-13 09 2002, Chengdu, China — P 453-456. mQtpria|e interface //
Huang N., Yang P, Leng Y X et al Surface Modification for controlling the
www.paper.edu cn — 2004 ,, , .. . (Ok.o n.q _ iggq — Vol 8,
Hyde J a , Chinn J A., Phillips R E Polymer heart valves // J Heart valve D s
fkada Y Surface modification of polymer for medical applications // Biomaterials
Vol 15( № 10 —P 25-36 я attachment and activation
Jones M I, McColl I. R , Grant D M et al Protein adsorption ancI p - Biomed Mater
on Tin, TiC, and DLC coatings on titanium for cardiovascular application //
Res. — 2000 — Vol 52, № 2 — P 413-421
363
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА____________________
K^amoto N Mori Н. Terano М. Blood compatibility of polypropylene surfaces in relation to the crystalline-
anioiphous microstructure // J. Biomater Sci Polymer Ed. 1997. Vol. 8, № 11. P. 859-877,
oner J Cao H Effect of repetitive impact on the mechanical strength of pyrolytic carbon //
J Heart Valve Dis. — 1996 — Vol. 5, № 1 P 50-58.
Kun S WJacobs H. Design of nonthrombogenic polymer surface for blood-contacting medical
devices // Blood Purification. — 1996 — Vol. 14, №2. — P. 357-372.
Kohn J Langer R. Bioresorbable and Bioerodible Materials 11 In Biomaterial Science: An introduction
to Materials in Medicine. Ratner B.D., Hoffman A. S., Schoen F. J. et al (eds.). — Academic
Press San Diego, 1996. — P 64-73.
Kudo F. A Nishibe T., Miyazaki К et al Albumin-coated knitted Dacron aortic prostheses. Study of
postoperative inflammatory reactions // Int. Angiol. — 2002. — Vol. 21, №3. — P..214-217.
Leuer L. H., Gross J M, Johnson К M Material properties, biocompatibihty and wear resistance of
the Medtronic pyrolytic carbon // J. Heart valve Dis. — 1996. — Vol. 5 (Suppl. 1). — P. 105-110.
Ma L.. Sines G Fatique of isotropic pyrolytic carbon used in mechanical heart valves // J. Heart valve
Dis. - 1996. — Vol. 5 (Suppl. 1). — P 59-64.
Martin T., Van Noort W., Black M Accelerated fatigue testing of biological tissue heart valves //Artif
Organs. - 1980. — Vol. 4, № 3. — P. 243-248
Mitanura Y Development of a ceramic artificial heart valve I I J. Biomater, appl. — 1989 — Vol 1,
№ 1. - P. 33-35.
Morra M., Occhiello E, Garbassi F Surface Modification of blood contacting polymers by
Poly(ethyeneoxide) // Clinical Materials. — 1993. — Vol. 14, №2. — R 255-265.
О Neill W. W., Chandler J. G., Gordon R. E. et al. Radiographic detection of strut separations in Bjqrk-
Shiley convexo-concave mitral valves // N. Engl. J. Med — 1995 — Vol. 33, № 4. — P 414-419
Park J. B., Lakes R. S. Biomatenals // Plenum Press, New York. — 1992.
Paul R.. Marseille O., Hintze E. et al In vitro thrombogenicity testing of artificial organs // Int. J. Artif.
Org. — 1998. — Vol. 21. №9. — P. 48-52.
Peppas N. A . Langer R. New challenges in biomaterials // Science. — 1994. — Vol. 263, №9. —
P 1715-1720.
Petite H., Frei V, Hue A. Use of diphenylphosphoryl-azide for cross-linking collagen-based biomate-
nals U J. Biomed Mater. Res — 1994. — Vol 28, № 1. — P. 159-164.
Polmear l. J Light alloys: metallurgy of the light metals —Arnold, London, 1995.
Rang I. K.t Seo E J., Huh M. W et al. Interaction of blood components with heparin-immobilized
polyurethanes prepared by plasma glow discharge // J. Biomater. Sci Polym. Ed. — 2001. —
Vol. 12, № 10. — P. 1091-1108.
u face modification of polymers: chemical, biological and surface analytical challen-
ges // Biosensors & bioelectronics — 1995. — Vol. 10, №6. — P 797-804
Ratner B. D. New ideas in biomatenals science — a path to engineered biomaterials // J. of Biomed.
Mater. Res. — 1993. - Vol 27, №6. — P. 837-850
ей H.. Pc hast K. Durability wear testing of heart valve substitutes [Review] // J. Heart valve
Dis. — 1998. —Vol. 7, Ng 2 — P. 151-157.
Rit ie R. . Fatigue and fracture of pyrolytic carbon: a damage-tolerant approach to structural integrity
and life prediction in ceramic heart valve prostheses // J. Heart Valve Dis — 1996. - Vol. 5,
(Suppl 1). — p 9 — 31
^rac^ure mechanics in life prediction and quality control of medical implants//
A M Inti materials and processes for medical devices conference, St. Paul, Minnesota, 25-27.08,
2004
Ryder J K., Cao H. Structural integrity assessment of heart valve prostheses: a damage tolerance
I' pp П -ep arbg“ecl'cs Prosthet'c Heart Valve // J. Head Valve Dis. - 1996. - J. - Vol- 5
.fiU9nuW„Z м Selec,lve recognition of adhesive sites in surface-bound fibrinogen by
p n?97e'ini Э °n nonact,vated Platelets // J Biol. Chem. - 1991. - Vol 266, №52. -
SaVZ\P On bl0phys,cs of intravascular thrombosis // Am. J Surg. - 1967. - Vol. 14,
I — H bu
Schmaier A H Contact activation: a revision // Thromb Haemost. - 1997. - Vol. 78. №1. -
' ^d) Va'Ve pr?stheses foundation and clinical performance // In M. Szycher
d) Bo on rabble polymers, metals and composites. - Lancaster, Technom,c. 1983 - R 239-261
364
ГЛАВА 5. Материалы для искусственных клапанов сердца
Schoen F.J., Hilbert S. L., Ferrans V. J. et al. Tissue-derived biomaterials and their use in
cardiovascular prosthetic devices // Med Piog. Technol. — 1988 — Vol. 14, № I. — P 115-163
Schoephoerster R. T, Oynes F, Nunez G. et al. Effects of local geometry and "fluid dynamics on
regional platelet deposition on artificial surfaces // Arterioscler Thromb — 1993 — Vol 13
№ 12. - P. 1803-1813.
Schousboe I., Feddersen K., Rojklaer R Factor XII is kinetically favorable plasminogen activator //
Thromb Haemost. — 1999. — Vol. 82, №3. — P 1041-1046.
Sevastianov И /., Tseytlina E. A. The activation of the complement system by polymei materials and
their blood compatibility // J. Biomed. Mater. Res. — 1984. — Vol. 18, № 8 — P. 969-979
Seyfert U. T, Wenzel E. Interactions of Blood with Artifical surfaces. Clinical aspects of bio-
incompatibility, retrospectives and prospectives // Lectures 15th International Congress of
Thrombosis, 16-21.10.1998. — P. 31-39.
Sharma С. P. LTI carbons: bloodcompatibility // J Colloid Interface Sci — 1984. — Vol. 97, №2. —
P. 585-586.
Shellock F. G., Curtis J. S. MR imaging and biomedical implants, materials and devices: an updated
review// Radiology. — 1991. — Vol 180, №3. — P. 541-550.
Sunny M. C, Sharma С. P. Titanium-protein interaction: change with oxide layer thickness //
J. Biomater. Appl. — 1991. — Vol. 5, № 6. — P. 89-98.
Szycher M. An assessment of elastomers for biomedical applications // In: Biocompatible Polymers,
Metals, and Composites, M. Szycher (ed.) Lancaster PA- Technomic, 1983. — P. 103-164.
Thomson A., Law E G. Rushton N. et al. Blood compatibility of diamond-like carbon coating //
Biomatenals. — 1991 — Vol. 12, №1 — P 37-40.
Tran H. S., Puc M. M., Hewitt С. И/. et al. Diamond — like carbon coating and plasma or glow discharge
treatment of mechanical heart valves // J. Invest. Surg. — 1999. — Vol. 12, № 3. — P 133-140.
Turitto V. T, Baumgartner H. R. Platelet-surface interactions // In: Colman R.W., Hirsch J., Marder
V. J.. Salzman E. W. (eds.) Hemostasis and Thrombosis. — 2nd ed. — Philadelphia Lippincott,
1987. — P. 555-571.
Tweden K. S., Cameron J. D., Razzouk A J. et al. Biocompatibility of silver-modified polyester tor
antimicrobial protection of prosthetic valves // J. Heart Valve Dis. — 1997. — Vol. 6, №2. —
P 553 — 561.
Urata H., Nishimura H., Ganten D. et al Angiotensin-converting enzyme-independent pathways of
angiotensin II formation tissues and cardiovascular diseases // Blood Press. — 1996. — Vol. 5
(Suppl. 2). — P. 22-28.
Van Delden C J., Lens J. P, Kooyman R. P. H et al Heparinization of gas plasma-modified polystyrene
surfaces and the interactions the these surfaces with proteins studied with surface plasmon
resonance // Biomatenals. — 1997. — Vol. 18, № 12. — P. 845-852.
Vroman L. The importance of surfaces in contact phase reactions // Sem Throm/Haemost. —
Vol. 13, № 1. — P. 79-85. .
Wang D.A., Ji j„ Feng LX. Selective binding of albumin on stearyl poly(ethylene oxide) c°uP'n9
polymer-modified poly(ether uiethane) surfaces// J. Biomater. Sci Polym. d. °
Ns 1 " P 123—146
Wheatley D J, Raco L, Bemacca G M. et al Polyurethane: material for the next Q^eration of heart
valve prostheses?//Eur. J Cardiothorac Surg. — 2000. — Vol 17. « • ’ h < rnronarv
Wilson G. J Courtman D W, Klement P et al. Acellular matrix: A biomatenals approach fo 2
artery bypass and heart valve (eplacement // An. Thorac. Surg.
P- 353-359
Yoganathan A P„ Reul H.. Black M M. Heart Valve Replacements: Problems
Cardiovascular Biomatenals, G. W Hastings (ed.). - Berlin: Spnnger-Verlag. . p
Yohta T., Kikuta Y„ Mitamura Y et al. Blood compatibility of sputter-deposited alumina turn. //
J. Biomed Mater. Res. — 1994. — Vol. 28, № 2. — R 217-224. titanium oxide
Zhong F, Uu X., Mao Y. et al. Artificial heart valves: improved _ 19g8 _ vol. 103-
coatings prepared by ion beam assisted deposition // Surf. Coa
104. — p. 146-150.
ГЛАВА 6
РЕЗУЛЬТАТЫ ПРОТЕЗИРОВАНИЯ
И КЛАПАННО-ЗАВИСИМЫЕ ОСЛОЖНЕНИЯ
Популяция больных с механическими искусственными клапанами сердца и биопро-
тезами из года в год увеличивается и в настоящее время в мире живет около 2 млн
человек — носителей клапанов, нуждающихся в психофизиологической и социально-
трудовой реабилитации, профилактике и лечении специфических клапанно-зависимых
осложнений. Это представляет большую социальную проблему в системе здравоохра-
нения для любого государства, требующую углубленного изучения показателей внут-
ренней среды организма (гомеостаза) пациентов, выживаемости, летальности и раз-
работки протезов клапанов сердца с лучшими гемодинамическими качествами (Боке-
рия Л А , 1999; Евдокимов С. В. и др., 2000; De Wall R. A. et al., 2000).
БЛИЖАЙШИЕ И ОТДАЛЕННЫЕ РЕЗУЛЬТАТЫ
ПРОТЕЗИРОВАНИЯ КЛАПАНОВ СЕРДЦА
Госпитальная или ближайшая в течение 30 дней летальность после операции изо-
лированного протезирования митрального или аортального клапана, в том числе и с
сочетанным аортокоронарным шунтированием (AKLLI), 15-20 лет назад составляла 10
20% (Arom К. V. et al., 1985, DiSesa V J. et al., 1982). В последние годы периоперацион-
ная летальность значительно снизилась до 3-8% и обусловлена наличием у больны
выраженной хронической сердечной и легочной недостаточности, тяжелых хроничес-
ких заболеваний легких, полиорганной недостаточности, диабета и развитием в пос-
леоперационном периоде различных осложнении: кровотечения, острой гнойной ин-
фекции, инфаркта миокарда, острого нарушения мозгового кровообращения и т Д-
(Fiore А. С. et al., 1998, Butchart Е. G. et aL, 2001; Edwards F H. et al , 2001). Снижение
летальности в последнее десятилетие связано с улучшением хирургической техники
имплантации клапанов, совершенствованием методики проведения искусственного кро-
вообращения, защиты миокарда посредством внедрения кровяной антеградной и Рет
роградной кардиоплегии, анестезиологического и реанимационного обеспечения, атак
же применением более совершенных моделей искусственных клапанов сердца и био
протезов Госпитальная летальность остается более высокой при экстренных и срочных
операциях, выполняемых по жизненным показаниям, при реоперациях (повторных one
рациях) и сочетанных хирургических вмешательствах (рис 6.1 и табл. 6 1).
Летальность в отдаленные сроки после операции составляет, по данным разных ав
торов, от 4,5% до 10,6% (Ребиков А. Г. и др., 2002; Шумаков В. И. и др , 2004: Добро-
тин С. С. и др., 2005; Хубулава Г Г и др , 2005; Khaja N. et al , 1989, Aagaard J et al.
2001). Причины летальности пациентов, подвергшихся протезированию митрального
или аортального клапана, в отдаленном послеоперационном периоде связаны с про
должительностью и исходной тяжестью заболевания, кардиомегалией, низкой сокра
тительной способностью миокарда, прогрессирующей хронической сердечной недо
статочностью, тромбозом клапанов, тромбоэмболиями, острым нарушением мозгово
го кровообращения, протезным эндокардитом и заболеваниями коронарных артерии-
Иногда возникает внезапная смерть, особенно с механическими искусственными
клапанами сердца, имплантированными по поводу митрального стеноза или узкого
----— 366 --------------- ------------------------—'
ГЛАВА 6. Результаты протезирования и мапанно-завис^ые аспп^ння
Первичная Первичная Первичная Первичная Плановая Экстренная Срочная Реоперация
плановая экстренная срочная по жизнен- операция операция операция по жиз-
операция операция операция ным пока- ненным
заниям показаниям
Рис. 6.1. Госпитальная летальность после изолированного протезирования митрального
клапана (по Т. Gudbjartsson et al., 2003)
корня аорты, когда при ремоделировании левого желудочка и аорты могут возникать
дисфункции клапанов и прогрессировать протезно-пациентное несоответствие (Burke
А. Р. et al., 1994; Butchart Е. G., 1994). Отмечено, что большинство осложнений и ле-
тальных исходов возникает в первые 3-5 лет после операции, затем наступает стаби-
лизация выживаемости.
Критерием функциональной эффективности имплантированного клапана в поддер-
жании стабильности гомеостаза является актуарный показатель выживаемости боль-
ных — отсутствие летальности от клапанно-зависимых осложнений У 90% пациентов,
подвергшихся протезированию митрального или аортального клапана, в значительной
степени ликвидируются или уменьшаются признаки хронической сердечной недоста-
точности, благодаря чему они переходят в I-II функциональный класс (по классифика-
ции NYHA). Лишь небольшая группа пациентов остается в III или IV ФК, что связано,
обычно, с низкой сократительной способностью миокарда до операции, высокой ис-
Ia6.nuк/ 6.1
Госпитальная летальность после протезирования аортального клапана
(по W. R. Jamieson et al., 1999)
Тип операции Число пациентов Операционная смертность, %
Изолированное аортальное протезирование 263,7 4,3
Множественное протезирование клапанов 3840 9,6
Протезирование аортального клапана + АКШ 22713 8,0
Множественное протезирование клапанов + АКШ 1412 18,8
Протезирование аортального клапана + пластические СИЯ 7,4
операции на других клапанах сердца <700
Пластические операции на аортальном клапане 597 5,9 Q 7
Протезирование аортального клапана + устранение 1723 У, (
аневризмы аорты Я А
Протезирование аортального клапана + другие операции 356 О,*+
(устранение аневризмы левого желудочка, септальных
Дефектов и др.)
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
ходной легочной гипертензией и сопутствующей патологией (Орловский П И., 2002,
Cohn L Н et al, 1993) Показатели выживаемости и качества жизни лучше у больных с
искусственными клапанами сердца в аортальной позиции, чем в митральной Однако
выживаемость может претерпевать существенное ухудшение с увеличением градиен-
та давления на искусственном клапане, нарастанием хронической сердечной недоста-
точности и продолжительностью срока послеоперационного наблюдения (Людиновс-
кова РА. и др , 1997; Шевченко ЮЛ и др , 1999, Murakami Т et al., 1998).
Существенное влияние на состояние гомеостаза в организме, выживаемость и ка-
чество жизни оперированных больных оказывают гемодинамические параметры рабо-
ты искусственного клапана сердца Как видно из табл 6.2, все искусственные клапаны
сердца оказывают сопротивление кровотоку, особенно при нагрузке; шаровые клапа-
ны имеют больший перепад давления, чем поворотно-дисковые, а двустворчатые от-
личаются самым минимальным сопротивлением В клинической практике подробное
исследование гемодинамических характеристик искусственных клапанов сердца пред-
ставляется сложным Поэтому об эффективности работы клапанов судят по пиковому
и среднему перепаду давления на клапане, выявляемому как в покое, так и при нагруз-
ке трансторакальной и чреспищеводной допплерэхокардиографией (ДЭхоКГ), значе-
ния которой имеют хорошую корреляцию с данными, полученными при катетеризации
полостей сердца (Буравихина Т.А и др., 1998; Zabalgoitia М et al , 1997).
Перегрузка давлением и/или объемом, вызываемая патологией аортального клапа-
на, приводит к росту давления в полости левого желудочка и его компенсаторной ги-
пертрофии Тяжелая аортальная недостаточность вызывает перегрузку объемом лево-
го желудочка с увеличением его конечно-диастолического объема и развитием экс-
центричной гипертрофии миокарда левого желудочка. При тяжелом аортальном стенозе
концентрическая гипертрофия миокарда левого желудочка происходит без нарастания
конечно-диастолического объема вплоть до наступления поздней стадии процесса, уве-
личивая, таким образом, соотношение толщины стенки и радиуса полости желудочка
Оба патологических процесса приводят к увеличению массы миокарда левого желу-
дочка Положительный эффект после протезирования аортального клапана заключает-
ся в уменьшении перегрузки объемом и давлением левого желудочка, что способству-
ет ремоделированию и регрессу его массы в ближайшие и отдаленные сроки наблю-
дения (Haider A W. et al., 1998)
Несмотря на то, что клиническое и прогностическое значение уменьшения массы мио-
карда левого желудочка выяснено еще не до конца, это понятие широко используется как
Таблица 6.2
Показатели гемодинамических параметров работы различных типоразмеров
механических искусственных клапанов сердца, имплантированных
в митральную и аортальную позицию, М±т
Протезы клапанов Позиция Автор Градиент давления Площадь эффектив- ного отверстия, см2 Коэффициент производи- тельности клапана, отн. ед.
М А средний, мм рт. ст. пиковый, мм рт. ст.
Шаровые клапаны АКЧ-1-02 (21 мм) — + Тарич- ко Ю В и др 1990 13,4 ±0,4‘ 39 8±1,1 — — —
АКЧ-3-02 (24 мм) — + 11,6±0,5 28,1+0,7 — — _ —J
368
ГЛАВА 6. Результаты протезирования и клапанно-зависимые осложнения
Окончание mab. I Ь 2
Протезы клапанов Позиция Автор Градиент давления Площадь эффектив- ного отверстия, см2 Коэффициент производи- тельности клапана, отн. ед.
средний, мм рт. ст. пиковый, мм рт. ст.
M А
Шаровый Цукерман 7,05+0,75 1,79+0,04 0,20±0,01
клапан МКЧ-2-25 + Г И и др , 1990 10 48+0,66 2 02±0,12 0,22±0 06
Ликс-2-28 + — Цукерман 3,98+0,44 — 2,52±0,25 0,55±0.02
Эмикс-27 + Г И и др , 1991, 1996 7,85±0 89 4,27+0,47 — 3,17±0,24 2,45+0,1 0,70±0.05 0,54+0,01
7,59+0,79 2,84±0,20 0,62±0,04
Medtronic- Hall (24+3) Medtronic- Hall (29+3) + + Tatmeni S et al., 1989 9±4 15±6 3,0+1 1 7,0±2,9 21+7 35+12 2,0±0,6 3,4±0,9 —
St Jude . 4- Tatineni S 11 ±4 24±7_ 2,2+1 1 —
Medical (24±3) St Jude Medical (29±3) + — et al 1989 18+7 2,5+1,4 5,1±3,5 41 + 12 3 4±0 6 —
Мединж- 2-21 — +
Мединж- 2 25 — 4- Земскова E H и др , 2000 12.5±1,98 11,1±1,56 23,5±1,98 20,9+1,79 — —
Эмикс-27 Ликс-2-28 Мединж- 2-27 Мединж- 2-21 Мединж- 2-25 + + + + Добротин С С и др , 2001 7,8 6 8 5,9 17,5±3,2 12,6±0,6 18,0 16,5 14,8 2,3 2 1 2,5 Ill I I
Carbome- dics-21 Carbome- dics-25 + + Цукерман Г И и др , 2001 20 6± 1,6 15.7±1,8 — —
Примечание В числителе — показатель в покое, в знамен
369
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
мера оценки эффективности протезирования аортального клапана. Можно предполо-
жить что степень уменьшения мэссы миокарде левого желудочка должна ассоцииро-
ваться с клиническим результатом операции, который, особенно у пациентов молодо-
го возраста, имеет принципиальное значение для их физической адаптации после-
дующего трудоустройства в профессиях, связанных с физическим напряжением
(Громова Г В и др., 1993; Гриценко В. В. и др., 1999).
Исследования, проведенные у больных после протезирования аортального клапа-
на, показали, что риск развития кардиологических осложнений оказался значительно
меньше у тех пациентов, у которых было достигнуто уменьшение массы миокарда ле-
вого желудочка (Verdecchia Р et al, 1998). При этом, при имплантации оптимальных по
размеру протезов по поводу изолированного аортального стеноза масса левого желу-
дочка значительно уменьшалась и у ряда пациентов достигала нормальных значений
уже в течение первых 18 месяцев. Регресс массы желудочка продолжается до 5 лет
после операции. Ситуация, когда неадекватные гемодинамические характеристики про-
теза не приводят к существенному уменьшению массы миокарда левого желудочка,
чем определяется неудовлетворительный результат операции, рядом авторов расце-
нивается как протезно-пациентное несоответствие (Скопин И. И. и др., 2000; Lee J.W
et al., 1999, Kuhl Н R et al., 2002).
Понятие «протезно-пациентное несоответствие» применимо к нескольким различ-
ным клиническим ситуациям. Оно используется для описания абсолютно малого кла-
пана (менее 21 мм), относительно малого размера клапана (21-22 мм) у пациентов
большой площадью поверхности тела, избыточного трансклапанного градиента давле-
ния после имплантации, особенно на фоне физической нагрузки, сниженного индекса
эффективной клапанной площади (1ЕОА) и различных комбинаций этих проявлений
Градиент давления на искусственном клапане сердца увеличивается с уменьшением
его диаметра по пришивной манжете и в аортальной позиции относительно митраль-
ной с одним и тем же типоразмером искусственного клапана. Это связано с более
высокими скоростями кровотока на протезах в аортальной позиции. Поскольку гради-
ент давления на искусственном клапане сердца зависит от многочисленных факторов,
для восстановления гомеостаза и уменьшения массы миокарда после операции у боль-
ных при узком фиброзном кольце аортального клапана и малых размерах левого желу-
дочка выбор протеза является большой и серьезной проблемой (Скопин И И. и ДР.
2000, Kuhl Н. Р. et al., 2002). Эффективные площади отверстия и средние градиенты
давления общедоступных биопротезов представлены в табл, 6.3.
Актуарный показатель выживаемости пациентов после операции протезирования
аортального или митрального клапана тесно коррелирует с гемодинамической эфФек"
тивностью имплантированных клапанов, а также факторами риска На сегодняшний день
для оценки вероятности летального исхода существует 6 систем оценки риска у кар-
диохирургических больных, из них наибольшее распространение получила система
EuroSCORE, в которой учитываются длительность анамнеза заболевания (>20 лет),
выраженность клинических проявлений порока, наличие почечной, печеночной и ле
точной недостаточности, функциональный класс заболевания (NYHA), хроническая сер-
дечная недостаточность, симультанное проведение оперативного вмешательства на
сердце и/или на других органах; коронарная недостаточность, инфаркт миокарда; ост
рое нарушение мозгового кровообращения в анамнезе, кальциноз клапанов, нарУше
ние техники имплантации протезов; узкий корень аорты (<20 мм); малый диаметр лево
го желудочка, пол (отличие по развитию коронарных артерий), степень системной и ле-
гочной гипертензии (>60 мм рт. ст); фракция выброса левого желудочка (<30 %); индекс
массы миокарда левого желудочка (<80 г/м2); сердечный индекс (<1,6 л • мин ' м2). мер-
цательная аритмия, активный инфекционный эндокардит; реоперации, возраст (
лет); повышенный индекс массы тела (более 34-40 кг/м2); тромбоэмболические ос-
ложнения в анамнезе, тромб левого предсердия, занимающим > 1/з его объема; ги-
кое левое предсердие (>70 мм в диаметре); кардиоторакальныи индекс (>0,6
370 ___________________ _____________________________
ГЛАВА 6. Результаты протезирования и клапанно-зависимые осложнения
Га блица о. 3
Значения площади эффективного отверстия и среднего систолического
градиента давления у больных с имплантированными биопротезами
в аортальной позиции
Протезы клапанов 19 мм 21 мм 23 мм 25 мм 27 мм
EOA, CM2 MSG, мм рт. CT. EOA, CM2 MSG, мм рт. CT. EOA, CM2 MSG, мм рт. CT. EOA, CM2 MSG, мм рт. CT. EOA, CM2 MSG, мм рт. CT.
Hancock Standard 1,0 25 1.0- 18- 1.3- 7- — 13- — —
(Rossiter S. J. et aL, 1980) 1,3 30 1,5 24 17
Hancock Modified Onfi- 0,9 12- 1.4 10- 1.4 11- 1.7 10- — —
ce (Zusman D.R etal., 1981) 19 17 16 12
Hancock II (David T. E. etal, 1992) — — 1,2 — 1,3 — 1.5 — 1.6 —
Medtronic Intact (Kadirl. etal , 1997) — — 1.5 17 1.6 19 17 1.9 15 —
Medtronic Mosaic 1,2 16 1,3 14- 1.5 12- 1.8 11- 2,0 9-
(Corbineau H. et al., 2001) 15 13 12 10
Carpentier-Edwards 0,85 26 1,3- 18- 1.3- 15- 1.2- 13- — —
Standard (Bove E. L. etal., 1985) 1.4 21 1.6 30 2,1 21
Carpentier-Edwards Supraannular (PlumeS K. etal., 2002) — 17 1,2 11 1,4 12 2,1 16 9
Carpentier-Edwards 0,95 18-19 1.1 13- 1.5 11- 1,4 IQ- 11 1.6 10
Pericardial (Marquez S et al , 2001) 14 14
Mitroflow Pericardial (Jennings L. M. et al , 2002) 1,3 — 1.4 — 1,7
Toronto SPV (Danton M H et al , 2000) — — — 8 1.6- 1.8 3- 7 1.4- 1.9 3,5- 7 1,7- 2,3 3- 5
Medtionic Freestyle 1.0- 18- 13- 7- 1.4- 7- 1 л 1.7- 2.0 5- 9 2,0- 2,3 5- 7
(Cartier PC et al , 1,4 22 1.4 13 1,5 I 4
1999) 1.9 2,1 6 2,4 5
Edwards Pnma (Jin X Y et al , 2001) 1.6 9 1.6 9 0
—
_ маг — гоедний систолическим градиент
Примечание ЕОА — площадь эффективного отверстия, р м
Увеличение относительного объема сердца (>1000 см /м ) и др. (Хру Шумаков
Кайдаш Д.Н., 1996; Ситар Л. Л. и др., 1997; Шихвердиев Н пОказатель выживаемос-
в- И и др., 1999; Natsuaki М et al. 1998). Поэтому актуарный показате
371 ---------
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
ти больных даже с одинаковым типоразмером искусственного клапана сердца в мит-
ральной или аортальной позициях варьирует у разных пациентов в широких пределах
В частности, с шаровыми механическими искусственными клапанами сердца — МКЧ,
АКЧ Starr-Edwards — в митральной и аортальной позициях к 5-25-му году после опе-
рации актуарные показатели выживаемости колеблются от 85% до 23% (Добротин С С
и др , 1990 OiszulakT A et al , 1997), табл 6 4.
Снижение выживаемости пациентов в отдаленные сроки после операции, кроме
факторов риска связано также с негативными сторонами шаровых искусственных кла-
панов сердца большими габаритами и массой, повышенным градиентом давления,
инерционностью запирающего элемента, приводящими к снижению ударного выброса
и повышению тромбообразования (Громова ГВ и др , 1993, Metzdorff М Т. et al., 1987)
Однако, по мнению некоторых авторов, применение шаровых искусственных клапанов
сердца оправдано в митральной позиции при больших объемах левого желудочка, вы-
раженном кальцинозе, или в аортальной — при диаметре корня аорты >30 мм, ввиду
их долговечности механической надежности, удовлетворительных гемодинамических
качеств на протяжении более 30 лет работы в организме Поэтому шаровые искусст-
венные клапаны сердца еще рано списывать из кардиохирургической практики (Коро-
лев БА и др , 1990, Starr A et al , 1993).
С поворотно-дисковыми искусственными клапанами сердца Ликс-2 и Эмике (Микс)
(Цукерман Г И и др , 1996, Ситар Л Л и др , 1997), Bjork-Shiley (Jegaden О et al.,
1991, Ans A et al., 1992), Sorin (Milano A et al , 1992, Hurle A et al., 1997), Omniscience
(Akalm H et al , 1992, Teijeira F J , 1998), Omnicarbon (Thevenet A et al 1995, IguroY et
al., 1999, Misawa Y et al , 2001, Hurle A et al , 2002, Di Summa M et al 2002), Lillehei-
Kaster (Olesen К H. et al , 1991; Stewart S et al., 1998), Medtronic-Hall (Antunes M J
et al , 1988 Nitter-Hauge S. et al , 1989, Akins C.W, 1996) в аортальной позиции к
5-25-му году актуарный показатель выживаемости больных несколько выше, чем с ша-
ровыми клапанами, и составляет от 89% до 44%, а в митральной — от 87% до 42%
Поворотно-дисковые искусственные клапаны сердца, особенно Medtronic-Hall, имею-
щ 1 наибольший угол открытия и конкурирующий по гемодинамической эффективно-
сти с двустворчатыми механическими клапанами сердца, отличаются известными пре-
имуществами перед шаровыми клапанами по лучшей гемосовместимости, снижению
тромбоза искусственных клапанов сердца и тромбоэмболических осложнений, мень-
шим потерям энергии кровотока и сопротивлению, быстродействию, малым размерам
и массе, лучшей структуре кровотока
Таблица 6.4
Актуарные показатели выживаемости пациентов после изолированного
протезирования митрального клапана механическими искусственными
клапанами и биопротезами разных конструкций
Протезы Источник, год Выживаемость, %
клапанов 5 лет 10 лет 15 лет 20 лет 30 лет
Starr-Edwards Teply J F et al 1981 Sala A et al , 1982 Miller D C etal 1983 GodjeO L etal 1997 78 78 71 85 56 72 47 75 i I I ° I I I ш 37 23
МКЧ 25 Добротин С C и др 1996, Цукерман Г И Ярыгин А С и 1990 ДР 1991 — 73 62 35
372
ГЛАВА 6 Результаты протезирования и клапанно-зависимые осложнения
Ироде. iHcnnn таб.т h -/
Протезы клапанов Ликс-2 и Эмике (Микс) Источник год Выживаемость, %
Евжанов др , 1990 Калина Н В и др 1998 Людиновскова и др 2001 5 лет 87 10 лет 72 15 лет 42 20 лет 30 лет
Omniscience/ Omnicarbon Damle A etal 1987 Peter М et al., 1993 Thevenet A et al 1995 Torregrosa S etal 1999 91 (4г) 77 (4 г) 91 70 88 (9 л ) 81 41 48 43 I I I I —
Medtronic-Hall Vallejo J L. etal 1990 Fiore A C etal 1998 Butchart E G etal, 2001 79 70 71 58 58 39 36 — .......
Мединж-2 Добротин С С и др 1999 2004 Ребиков А Г и др , 2002 Шумаков В И и др 2004 85.3- 95 3 — — — —
St Jude Medical DiSesa V J et al 1989 Kratz J M et al . 1993 Aoyagi S etal 1994 Masters R G etal 1995 Fiore AC et al 1998 Camilleri L F et al 2001 Remadi J P et al 2001 65 (4 г) 80 88 75 65 89 (4 г) 88 63 81 53 76 58 61 51 61 I I I I I I I 1 1 1 1 1 1 1
Carbomedics Bortolotti U etal 1991 Rabelo R et al , 1991 De Luca L et al , 1993 Copeland J G et al 1995 Nistal J F et al 1996 Yamauchi M et al 1996 Santini F et al 2002 90 75 (4 г) 93 (Зг) 81 83 92 86 84 87 60 51 59 — —
Hancock Stan- dard Cohn L. H et al . 1989 Burdon T A etal 1992 Sarris G E et al , 1993 KhanS S etal 1998 82 74 79 60 55 58 50 29 14 —
Hancock II Carpentier- Edwards Standard David ТЕ et al 2001 Akins C Wet al 1990 LouagieYetal 1992 Bernal J M etal 1995 Pelletier L C etal 1995 Van Doorn C A et al , 1995 Murakami T etal I996 Mai chand M etal 1998 69 53 61 89 83 75 52 45 46 80 62 (8 л ) 53 75 53 (11 л) I I I I I I I I g « о» I I I 1 1 I I 1 — 1 1 1 1 1 1 1 1 1
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
Окончс hw табл. 6.4
Протезы клапанов Источник, год Выживаемость, %
5 лет 10 лет 15 лет 20 лет 30 лет
Carpentier- Edwards Pericardial Takahara Y et al , 1995 Aupart M R. et al , 1997 Marchand M. et aL, 1998 Neville P H. etal , 1998 Poner N. C. et al , 1998 78 84 59 (9 л) 71 53(11 л) 54 (12 л) 58 — — —
Medtronic Mosaic Jasinski MJ et al , 2000 100(3 г) — — — —
При имплантации поворотно-дисковых клапанов, по сравнению с шаровыми, более
значимо улучшаются морфофункциональные показатели сердца. Их гемодинамическое
преимущество благоприятно сказывается и на течение ближайшего и отдаленного пос-
леоперационного периода, особенно у больных с мерцательной аритмией, а острая сер-
дечная недостаточность и «синдром низкого сердечного выброса» становятся в два раза
реже, чем с шаровыми клапанами (Wessels A. et al., 1988; Tatmeni S. et al., 1989; 1994).
Заметное гемодинамическое преимущество отмечено у больных при имплантации
двустворчатых искусственных клапанов сердца Мединж-2 (Сингуровский А. М., 1997,
Белостоцкий В. Э. и др., 1998; Ребиков А. Г. и др , 2002; Добротин С. С. и др., 19 ,
2005; Шумаков В. И. и др., 2004); Карбоникс-1 (Горшков Ю. В. и др., 1998; Ярыгин А. С.
и др , 1998; Вязников В. А. и др., 2004); St. Jude Medical (Watanabe S. et aL, 1989;
Jamieson W. R. et aL, 1999; Lund O. et aL, 2001; Natsuaki M et aL, 2002; Stalenhoef J
et aL, 2003; Suedkamp M et aL, 2004); Carbomedics (Цукерман Г. И. и др., 2001,
Bjornerheim К. et aL, 1997; Dalrymple-Hay M J. et aL, 2000; Aagaard J et aL, 200 ,
Bergoend E. et aL, 2004); Sorin Bicarbon (Borman J. B. et aL, 1998; Erdil N. et aL, 2003,
Laali M. et al, 2003; Vitale N. et aL, 2004; Whitaker D. C. et aL, 2004); ATS (Aoyagi S. et aL,
1997; Fraile J. et aL, 1998; Emery R.W. et aL, 2001; Ozeren M. et aL, 2001; Van Nooten
G. J. et aL, 2003) как в митральной, так и в аортальной позиции относительно поворот-
но-дисковых и, тем более, шаровых по градиенту давления на клапане, эффективной
клапанной площади, производительности клапана, уменьшению объемов камер серД
ца, массы миокарда, а также по актуарным показателям выживаемости и стабильности
хороших результатов от 93% до 52% к 5-15 годам в митральной позиции и от 96% Д°
61% — в аортальной. Лучшие показатели выживаемости больных с двустворчатыми
искусственными клапанами сердца объясняются их преимуществами по гемодинами^
ческим качествам и высокой биологической инертности материалов (пиролитическии
углерод).
Как отмечают многочисленные авторы, актуарные показатели выживаемости боль
ных к 5-10-му году после протезирования митрального или аортального клапана меха
ническими клапанами или биопротезами приблизительно одинаковы и составляют
60-50% (Miller D. С. et aL, 1983; Bernal J. M. et aL, 1995; Fiore A. C. et aL, 1998; Remadi J-
et aL, 2001; David T. E. et aL, 2001).
На улучшение актуарных показателей выживаемости больных влияет и техника им
плантации клапанов. Сохранение створок клапанов и подклапанных структур при про
тезировании митрального клапана предотвращает такое опасное осложнение во вре
мя операции, как разрыв задней стенки левого желудочка с массивным, порой, смер
тельным кровотечением, обеспечивает нормальную геометрию и кинетику сокращения
миокарда левого желудочка, улучшает его диастолическую функцию с восстановлени
ем вновь фазы изоволюмического сокращения и внутрисердечной гемодинамики 0
374 —--------------- ---------------------------------—
ГЛАВА 6. Результаты протезирования и клапан но-зависимые осложнения
целом. Сохранение клапанно-желудочкового взаимодействия способствует естествен-
ному движению стенок левого желудочка, а в сочетании с оптимальной ориентацией
поворотно-дисковых и двустворчатых искусственных клапанов сердца обеспечивает
формирование физиологически обусловленного закрученного потока крови в левом же-
лудочке и аорте, эффективной диастоле и систоле, увеличению ударного выброса и
более экономичной работе сердца в целом.
Частота синдрома низкого сердечного выброса и нарушения ритма сердца с оптималь-
ной ориентацией клапанов возникают в 3 раза реже, чем с неоптимальной Соответствен-
но реже возникают линеарные показатели тромбоэмболических осложнений — 1,95% па-
циенто-лет с оптимальной ориентацией и 2,31% пациенто-лет — с неоптимальной (Се-
меновский М. Л. и др., 1987; Van Rijk-Zwikker G. L. et al., 1996; Travis В R. et al., 1998).
СПЕЦИФИЧЕСКИЕ КЛАПАННО-ЗАВИСИМЫЕ
ОСЛОЖНЕНИЯ
В объединенном документе STS/AATS общества торакальных хирургов США даны
определения специфических несмертельных клапанно-зависимых осложнений неинфек-
ционного и инфекционного происхождения, приводящие к снижению актуарных пока-
зателей выживаемости, качества жизни и росту инвалидности (Edmunds L. Н. et а.,
1996). К неинфекционным клапанно-зависимым осложнениям относятся структурная
дисфункция клапана — любые изменения функции имплантированного клапана вслед-
ствие его износа, поломки, заклинивания створок или разрыва шовной линии, приводя
щие к стенозу или регургитации. К неструктурной дисфункции клапана относят любые
дисфункции клапана, не имеющие отношения к его поломке, разрастание п *
соответствие размера клапана и окружающих структур, параклапанная ’
водящая к стенозу или регургитации. Тромбоз клапана — лю ои тро ’ эмбо-
ся внутри или вблизи имплантированного клапана и влияющий на ег° Пеоиоде по
лия — любой ее эпизод, происходящий в раннем послеопераци носить как пери-
окончании действия анестезии или позднее, причем эм олия инсЬаокт мио-
ферический, так и центральный (церебральный) характер, воз и достоверно
карда если эмболия произошла в раннем послеоперационн 6олии подразделя-
доказано наличие эмбола в коронарной артерии. Цере рапьн стьЮ обратимые
ются на следующие виды, транзиторные ишемические
неврологические нарушения до 24 часов, прех0А^И ениями длительностью бо-
статус с полностью обратимыми неврологически неврологический статус
лее 24 часов, но менее 3 недель; инсульт па специфическим клапанно-
Длительностью более 3 недель или приводящий к см Р * ся также антикоагулянтные
зависимым осложнениям неинфекционного генеза °™ х или внеШних кровотече-
геморрагии, то есть любые эпизоды значительных внут юшие трансфузий, и хро-
нии, приводящие к госпитализации, инвалидности и ВЫпаженности.
нический внутрисосудистый гемолиз различной степе инфекционного происхож-
Кроме того, выделяют клапанно-зависимые 0 любой инфекционный процесс с
Дения протезный эндокардит, под которым пони KTVDHaw/HecTpyKTypHaA его дисфун-
вовлечением протеза клапана сердца или любая стру ые с протезным эндокар-
дия, тромбоз или эмболия, параклапанные фистулы»_ ем большинстве, требуют
Дитом. Клапанно-зависимые осложнения, в своем п ВЬ|С0Кой летальностью (Шума-
Реопераций (повторных операций), сопровождающи 1994, Lytle В W et al, 1996).
ков В. И и др., 2004; Ярыгин А С. и др., 1990, u ’ _ ’ й проводится с использова-
Анализ несмертельных клапанно-зависимых п0 КуМулятивному методу,
нием метода Kaplan-Meier (Kaempchen S. ^па’-\гр7шествующие в настоящее время
предложенному G. L Grunkemeier и соавт. (20 )• гтОЙЧИВы в отношении усталос-
^еханические протезы клапанов сердца чрезвычаи
ИСКУССТВЕ ИНЫЕ КЛАПАНЫ СЕРДЦА
ти материалов и структурной дисфункции клапана, что объясняется высокотехнологич-
ным уровнем контроля качества при их производстве. Актуарные и линеарные пока-
затели структурной дисфункции механических клапанов составляют 90-95% и 0-0,3%
пациенто-лет, соответственно (Кнышов ГВ. и др , 1990; Цукерман Г. И и др., 1990,
Ярыгин А. С и др. 1990, Малашенков А. И. и др., 1991, Широкова О. Р и др., 2005,
Encsson A et al., 1992) Длительное наблюдение за больными с шаровыми механичес-
кими клапанами МКЧ, АКЧ, Starr-Edwards, а также поворотно-дисковыми Ликс-2, Микс,
Эмике, Medtronic-Hall и двустворчатыми Мединж-2, Карбоникс-1, St Jude Medical,
Carbomedics и др. показали что эти клапаны чрезвычайно устойчивы к структурным
поломкам. Ряд не использующихся в настоящее время механических протезов, таких
как Bjork—Shiley Convexo-Concave, обладали хрупкостью ограничителя хода и были ис-
ключены из клинической практики (Ericsson A et aL, 1992). В отличие от механических
клапанов, структурная дегенерация биопротезов, наоборот, является наиболее частым
несмертельным клапанно-зависимым осложнением Так, длительное наблюдение за
используемыми в настоящее время каркасными биопротезами второго поколения,
включая свиной Medtronic Hankock II и перикардиальный Carpenter-Edwards, показали,
что в аортальной позиции (табл. 6.5) более чем у 90% биопротезов структурная деге-
нерация не развивается в течение 12 лет, в то время как в митральной позиции она
наступает значительно раньше вследствие более выраженных систолических нагрузок
на створки протеза (Poirer N С. et al., 1998, Dellgren G. et al., 2002). На рис. 6.2 показа-
на структурная дегенерация ксенобиопротеза из-за кальциноза створок.
Таблица 6 5
Актуарные показатели структурной дегенерации каркасных аортальных
биопротезов и выживаемости пациентов в отдаленные сроки наблюдения
(12-15 лет), по данным зарубежных авторов, М±т
Протез клапана Источник, год Число больных Средний возраст, лет Средний срок на- блюдения, мес Время до структур- ной дегене- рации, лет Актуарные показатели выживае- мости без структур- ной дегене- рации, % Актуарные показате- ли выжи- ваемости без ре- операции, %
Hancock II Porcine David T E et al , 2001 723 65±12 68±40 12 94±2 89±5
Carpentier- Edwards Pericardial Dellgren G et al , 2002 254 71±9 60±31 12 86±9 83±9
Carpentier- Edwards Pericardial Poirier N C et al ., 1998 598 65 57.7 12 93±2 91±2
Medtronic Intact Corbmeau H etal 2002 188 72±8 86,4±50,4 13 91+3,3 —
Carpentier- Edwards SAV Porcine Jamieson W R et al 1998 1657 65.5+11.9 70.8±58,8 12 83.4±2.1 —
Hancock 1 и Medtronic Mosaic ’ Burdon T A. et al 1992 857 59±11 87.6 15 63±3 57±3
ГЛАВА 6 Результаты протезирования и клапанно-зависимые осложнения
~...——--Х"."
Х»°~»” о (по В. И. »>Р—
и др., 1989).
Вероятность структурной д®генер^ИвУМитр2,ьной позтии^озникает У*е через 8
панов (Hancock или Carpentier Edwar ) 15 лет (jam,eson W R Е et al-'
лет после операции и достигает 6 °
KhanS S et al., 1998) главным препятствием для хороших от-
Эта ограниченная долговечность являете приТом. ЧТо вероятность Аеген^х
даленных результатов после их имплант ’ гора3до ниже, чем у более мл
ции биопротезов у 70-летних пациентов и стар . 2001) структурная деге
возрастных групп (Pelletier L С. et al , - или аортальной регургитацией
рация биопротезов проявляется митр стенозом вследствие кальци
створки клапана или митральным аортапь рменн0 гпмати-
рок. иногда оба варианта встречаются одки в ВИде шума и изменени ниЮ
Появление новой аускультативной сим нием к неинвазивному ис п0Ка-
ческого статуса пациента должны служить ОдНая ДЭхоКГ) и определ -j ддб)
Функции протеза (трансторакальная и> ^еспи"за доказана (Pener Р
заний к репротезированию, если J^„ерации митральных би^^хВ биопротезов
Актуарные показатели структурной де наиболее распростране
15 лет после операции с четырьмя типам РППеоаций колеб-
продемонстрированы в табл 6 6 _ линеарные показателир в в и
Для механических клапанов актуарные соответственно г у у
"»™ , пределах от 99.2-82% и н й « - 2“'1 ПР“
и др , 2004 Mantega R et al. 1998. с Д ять|е по поводу их ст2Хходов (Bernal
пациентов с биопротезами клапанов, пр |М процентом летальнь нная летали-
рации, сопровождаются особенно су^твеннь.м пр^ . реоперационная
J М et al, 1995, Akins С W et al, 1990, cen ___377
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
Табпица 6.6
Актуарные показатели структурной дегенерации митральных биопротезов
(по данным зарубежных авторов)
Протез клапана Источник, год Возраст, лет Актуарные показатели структурной дегенерации биопротеэов, %
5 лет 10 лет 15 лет
Hancock Cohn L. H. et al., 1989 <40 — 68 —
41-69 — 84 —
>70 — 84 —
Hancock II David T E et al , 2001 <65 — — 76
>65 — — 89
Carpentier- Akins C W. et al.. 1990 <40 — 71 —
Edwards 41-50 — 82 —
Standard 51-60 — 65 —
61-70 79 —
>70 — 98 —
Jamieson W. R. et al., <35 79 51 —
1995 36-40 99 68 48
51-64 98 72 42
65-69 98 74 64
>70 100 90 90
Corbineau H. et al., < 35 — — 0 (14 л )
2001 36-50 — 22 (14 л.)
51-60 — — 34 (14 л.)
61-65 — 50 (14 л.)
66-70 — — 93 (14 л.)
>70 — — 96 (14 л.)
Carpentier- Au part M R. etal., <60 47 — —
Edwards 1997 >60 100 — —
Pericardial Marchand M etal., <60 — 78(11 л ) —
1998 61-70 — 89 (11 л ) —
>70 100 (11 л.) —
Pelletier L C. et al , >59 100 64 (8 л ) —
1995 60-69 100 91 (8 л.) —
>70 100 100(8 л ) —
Neville P H. et al., 1998 <60 — 70 —
>60 — 100 —
Poirer N C etal., 1998 £60 100 78 —
60-69 100 78 —
>70 100 100 - ___ ___
но ть (л тально ть после повторных операций) при протезировании митрального кла-
пана значительно снизилась в течение последнего десятилетия до 10% Это также ка-
ется и пациентов, перенесших многократные реоперации протезирования митраль-
ного цапана (Tyers G. F. et al., 1995). Так, в Brigham и Women’s Hospital в период с 1990
по г летальность после реоперации по поводу протезирования митрального кла-
пана составила менее 6% (Cohn L. Н. et al 1993)
Снижению реоперационной летальности способствовали улучшение защиты мио-
карда, своевременный отбор пациентов для реоперации, усовершенствование перФУ"
^оТ0/Л1НеСДеДИ0Л0ГИческ0Г0 и Реанимационного обеспечения (Cohn L. Н et al.
' mi 1 |П ' е' а'м 1993) Актуарные показатели реопераций после протезиро-
вания митрального клапана биопротезами представлены в табл 6.7
378 --------------- -----------------------------------
ГЛАВА б^Резу iьтаты протезирования и клапанно-зависимые осложнения
lau iui/a 6. 7
Актуарные показатели реопераций после протезирования митрального
клапана биопротезами (по данным зарубежных авторов)
Тип клапан- ного протеза Источник, год Актуарные показатели реоперации, %
К 5-му году К 10-му году К 15-му году
Hancock Cohn L H. et. al., 1989 96 79 Л 1
Perier P. et. al., 1989 88 59 Ч 1
Bernal J. M et. al., 1991 92 69 25
Sarris G. E. et. al., 1993 93 69
Khan S S. et al., 1998 — 44
Hancock II David T. E. et. al., 2001 98 85 69
Carpentier- Perier P et. al., 1989 91 64
Edwards JamiesonW R E et al, 1991 94 64 39
Standard Sarris G. E. et. al., 1993 91 57 (8 л )
Van Doorn C A et. al., 1995 95 69
Glower D. D. et. al., 1998 94 65 30
Carpentier- Pelletier L. C. et. al., 1995 98 67 (8 л ) —
Edwards Murakami T et. al., 1996 100 77
Pericardial Aupart M. R et al., 1997 — 90 —
Marchand M et. al., 1998 — 83(11 л ) —
Neville P. H. et. al., 1998 — 76 (12 л ) —
Poirer N. C. et al., 1998 99 76 —
Medtronic Fradet G. J et al., 2001 97 (4 г) * —
Mosaic Jasinski M. J. et. al., 2000 100(3 г) — —
В проведенных на большом клиническом матери е и ^®^°ва^Я^^ебовавшего
казатели выживаемости после аортального биопротезирования е
90% — в течение
П»™Р„„ операций, составляют более.95% в « R й а| 2Ю1;
10 лет и до 70% — в течение 15 лет (Poirer N. С. _ их ИМПлантации
Dellgren G. et al., 2002) Дегенерация биопротезов насг/ (Gru|Penieier G L. et al.,
молодым пациентам, особенно в возрастной гр У влияние возраста больных на
1994; Vongpatanasin W. et al., 1996). В табл. 6.8 показано влияни
структурную дегенерацию биопротезов.
Tanwua 6.8
труктурная дегенерация биопротезов через 10 лет после имплантации
в зависимости от возраста пациента на момент операции
(по G. L. Grunkemeier et al., 1994)
Возраст пациента, лет Дегенерация,%
< 40 42
40-49 30
50-59 21
60-69 15
__ >70 10 J
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА _
Формированию параклапанной фистулы в ранние или поздние сроки после опера-
ции может способствовать развитие протезного эндокардита или массивный кальци-
ноз фиброзного кольца, а также технические погрешности во время имплантации кла-
пана (рис. 6 3).
Гемодинамически значимые параклапанные фистулы обычно вызывают рефрактер-
ную гемолитическую анемию, в отличие от клинически незначимой степени хроничес-
кого внутрисосудистого гемолиза, который наблюдается после имплантации практи-
чески всех механических, в особенности шаровых и поворотно-дисковых, клапанов (Ор-
ловский П. И , 2002; Ahmad R et al., 1976)
Технические ошибки в виде слишком больших промежутков между швами способ-
ствуют образованию участков потеза без плотного контакта с фиброзным кольцом кла-
пана, что со временем приводит к формированию фистулы Если параклапанная фис-
тула гемодинамически значима и вызывает гемолиз, сопровождающийся анемией и
требующий гемотрансфузий, то выполняется ушивание фистулы или репротезирова-
ние клапана — рис. 6 4 (Караськов А. М и др., 2004, Genoni М. et al., 2000).
В результате усовершенствования хирургических методов встречаемость паракла-
панных фистул за последнее время снизилась и составляет, по линеарным показате-
лям, от 0% до 1,5% пациенто-лет как для механических клапанов, так и для биопроте-
зов (Цукерман Г И и др , 1990; Copeland J. G , 1997; Saung Z Р et al , 2000). Отдель-
ные авторы отмечали рост параклапанных фистул после имплантации механических
двустворчатых клапанов, по сравнению с биопротезами, считая, что это связано с ис-
пользованием выворачивающего шва и более узкой пришивной манжеты (Gallucci V
et al , 1988, Burckhardt D et al , 1988)
Несмотря на совершенствование техники операций, послеоперационного ухода и
антибиотикопрофилактики, протезный эндокардит остается одной из нерешенных про-
блем кардиохирургии и встречается до 3% осложнений после протезирования клапа-
нов сердца (Chastre J et al , 1995) Несмотря на то, что материалы, из которых изго-
тавливаются механические искусственные клапаны сердца, обладают тромборезистен-
тными свойствами, источником инфекции могут быть швы, фиксирующие протез к
Рис. 6.3. Параклапанная фистула:
калЛда ?°Те3а Меди"ж’2 в митральной позиции (по А М Караськову и др . 2004) б — транстора-
определяртся^отпГРа<^ИЯ ПРИ ин<^екци0НН0м эндокардите протеза митрального клапана, справа
спектр параклапаннп^РГИТаЦМИ доходящии до крыши гигантского левого предсердия слева —
МР — протез митоапкнпгпД°СТаТ0ЧНОСТИ ПрИ непрерывн°-волновой допплерэхокардиографии.
LV - левый желудочек (по iTiT ~ ЛеВ°е предсердие MR ~ параклапанная регургитация.
и желудочек (по Г В Кнышову и др , 2004)
---------- 380 ______________’ _____-
ГЛАВА 6 Результаты протезирования и клапанно-зависимые осложнения
а
Рис. 6.4. Операции: а
... -> - ушивание параклапанной фистулы искусственного клапана сердца
М.^ж-г . аорпяль.ой naa.ua.. 6 - ~
иетакоторогообраВо™™»"™»””’"'””"™11"™”1 ° “
„ „к»^о™«.пьные таомботические эндокардиальные
тканям сердца, где образуются неба р тоанзиторной бактериемии (Кны-
повреждения, способные инфицироватьс Р р й п03иции чаще возникает
шов Г. В и др , 2004) При поражении протеза в> аорталого _ ег0 об-
его недостаточность (67%), а при поражении пр~ в 550^ случаев протезного
струкция (71%). Абсцессы фиброзного
эндокардита. Инфекционный эндокарди Р которые развиваются чаще (60%)
струкцию створок, но и абсцессы пришивног> котор^^Р _ 2?% (Ca|der.
в течение первого года после операции, поздним протезным эндокарди-
wood S В. et al., 1985, 1986) В отличие от больныхс ^дни^р^ быст.
том, ранний протезный эндокардит характер> У сердечная недостаточность из-
рым развитием нарушений гемодинамики кольца развивается приблизительно
за поражения клапанных протезов или фи р апетального клапана имеет худ-
в 60% случаев, шок - в 33% Протезный энДОка^ит^ Ртаких пациентов часто возни-
ший прогноз по сравнению с митральным P пППвепения операции, ее типом, воз
кают большие трудности, связанные со времен инфицирования Протезный эн-
можностью надежной имплантации нового прот часто, как аортального, однако
докардит митрального клапана встречается н может проявляться септице
развитие протезного эндокардита митральн' фиброзного кольца, септически
мией, формированием гнойных затеков, a MKV эффективной профилактики
тромбоэмболий С внедрением в клиническу ции ПОЛОсти рта и устранение рру
фекции во время операции, дооперационн .“Хастота протезного эндокардита в
гих возможных очагов инфекции привели У. 95 Baumgartner W
последнее время заметно снизилась (Шевче"^докарДита выше в течение первых
1983) Вероятность формирования протезн уменьШаясь, она стабилизирУ
6 месяцев после операции затем, прогре Актуарные и линеарные пока
постоянном уровне риска (Braunwald Е 2001) „ биопротезов е. митраль^
стоты протезного эндокардита для механи^ к 5-15 годам послеопераци
НОЙ позиции показаны в табл 6 9 и составляютк5Д5 (Добротин С С и ДР , 1999,
блюдения 100-91% и 0-0,6% пациента-лет, с RernaCji J. Р et al 2001)
Шумаков ВИ и др , 2004, Fiore А С et al.. • з81
И С К У С С Т ВЕННЫЕ КЛАПАНЫ СЕРДЦА_________
Таблица 6. У
Значения актуарных и линеарных показателей частоты протезного
эндокардита механических клапанов и биопротезов в митральной позиции
(по данным отечественных и зарубежных авторов)
Тип протеза Источник, год Линеарный показатель, % пациенто-лет Актуарный показатель, %
МКЧ-25 Громова Г. В. и др., 1994 2,8 —
Starr-Edwards Miller D. С. et al., 1983 0,5 97
Akins С. W. etal., 1987 0,4 95
Godje 0. L. et al., 1997 — 99 (10-му г)
Imanishi K., 1994 —
Эмике и Ликс-2 Людиновскова P. А. и др., 1997; Цукерман Г. И. и др., 1990 0,35 —
Omniscience/Omni- Carrier М. et al., 1987 0,8 98
carbon Peter М. et al., 1993 0 100
Otaki M et al , 1993 1,5 —
Torregrosa S. et al., 1999 0,2 99 (10 л.)
Medtronic—Hall Keenan R. J. et al., 1990 0,5 98
Akins C. W., 1991 0,1 100
Fiore A. C. et al., 1998 — 94 (10 л.)
Butchart E. G. et al., 2001 0,4 94 (10 л.)
Карбоникс-1 Вязников В. А. и др., 2004 2,7 —
Мединж-2 Шумаков В. И. и др., 2004 1.3 97,7
Ребиков А. Г. и др., 2002 1,6 84,5
St. Jude Medical Antunes М. J. etal., 1988 0,5 97
Kratz J. М. et al., 1993 0,4
Aoyagi S. etal., 1994 0,1 100
Fiore A. C. etal., 1998 100 (10 л.)
Khan S. S. et al., 2001 0,3 —
Carbomedics De Luca L. etal., 1993 0 100
Copeland J. G etal., 1995 0,3 96
Nistal J F. etal., 1996 0 100
Yamauchi M. et al., 1996 0 100
Santini F et al., 2002 100
ATS Emery R.W. et al., 2001 0,81 —
ON-X Laczkovics A. et al., 2001 0,5 —
Hancock Standard Bernal J. M.et al., 1991 0 3
Sarris G.E etal., 1993 93
Bortolotti U etal., 1995 0,3
Hancock II David T E. etal., 2001 91 (15 л )
Carpentier-Edwards Porcine Pelletier L C. etal., 1989 Akins C W. et al., 1990 0,4 1.0 о —
Louagie Y et al , 1992 100
SarrisG. E. etal., 1993 91
Van Doorn C A. et al., 1995 97
382 Glower D. D. etal., 1998 0,3 97 —
ГЛАВА 6 Результаты протезирования
и клапанно-зависимые осложнения
Окончание та б./. 6, Q
Тип протеза Источник, год Линеарный показатель, % пациенто-лет Актуарный показатель, %
Carpentier-Edwards Pericardial Medtronic Mosaic Pelletier L С et al, 1995 Murakami T et al 1996 Aupart M N et al., 1997 Marchand M et al , 1998 Neville PH et al , 1998 Poirer N. C. et al., 1998 Jasinski M J etal., 2000 Fradet GJ et aL, 2001 Thomson D. J. et al , 2001 0,3 0,86 0,4 0,1 0,6 0,3 0,8 0,8 93 (10 л) 94 (10 л ) 97(10л ) 94 (12 л ) 95 (10 л) 100 (3 г) 97
В зависимости от сроков развития, протезный эндокардит принято разделять на
ранний (в течение 60 дней после операции) и позднии (более 60 дней). Ранний про-
тезный эндокардит встречается в 35-37% случаев и обычно является следствием бак-
териального обсеменения клапана либо в ходе имплантации интраоперационно, либо
гематогенным путем в послеоперационном периоде из раны или венозного катетера
при внутривенных инфузиях. Преобладают в этом периоде эпидермальный и золотис-
тый стафилококк (28,1-33% и 17-18,8% случаев, соответственно), энтерококк — 6,3%,
зеленящий стрептококк — 3,1%, грамнегативные бактерии и грибковая флора. Описа-
ны случаи инфекционного эндокардита вирусной этиологии (Кнышов Г. В. и др , 2004,
Sobnno J. et al., 1991; Bower S. P. et al., 1993; ACC/AHA, 1998), несмотря на то, что в
большинстве случаев поздний протезный эндокардит (встречаемость 60-63%) связан
с некардиальной септицемией.
По данным D. Horstkotte и соавт. (1995), чаще всего позднии протезный эндокардит
возникает как осложнение после стоматологических манипуляций (20,3%), урологичес-
ких манипуляций и уросепсиса (13.9%), интенс хитов (6,5%). манипуляций на
стоянных венозных катетеров (7,4%), пне исследования пищеварительного трак
дыхательных путях (5,6%). фиброскопического нальных хирургических вмеша-
та (4,6%), травмы, раневой инфекции (4 6 о), Д< может быть таюке обусловл
тельств (3,7%), родов (0,9%). В неко орь а ТНЫМИ возбудителями, в частност
внутрибольничным инфицированием маа0ВИРУ . । 1996). Возбудителями позднег
эпидермальным стафилококком (Vongpa ала эпидермальный стафилококк
протезного эндокардита чаще являются стр ’ й эндокардит естеств
терококк и другие бактерии, вызывающие инфекци
клапанов сердца (АСС/АНА, 1998). Пипяртс я на основании характерны
Диагноз протезного эндокардита устанав ПОизнаков сердечной недостаТ<^знИКНО’
томов (повышение температуры, появлен или иного клапана сердца,’ ди0.
наличия дополнительного шума в проекц - на клапане по данным
вения септической эмболии, появления в ожет выявить нарушение п
графин - ЭхоКГ (рис. 6.5). Эхокардиография ^жет^^ ТранСПИщеводная ЭхоКГт_
створок протеза и наличие вегетации на ьц иХ размеры, локализ итеЛь-
зволяет выявить вегетации, абсцессы ЭхоКГ иногда бывает . аЬ 1993)
лизация вегетаций на механических кла мИ протеза (Zabalgoitia • в том
на из-за затенении, создаваемых комп арТериальной и вен°зн ют п’оложи-
Неоднократные бактериологические по у микроорганизмов ^ЧонегАативный про-
числе и при высокой температуре, на У ииентов имеется культур
тельный результат, хотя у небольшой части
тезныи эндокардит.
383
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
Рис. 6.5. Вегетация аортального клапана:
а — инфекционный эндокардит фиксация запирательного элемента вегетацией, б —трансторакаль-
ная эхокардиография слева — вегетация пролабирует в диастолу в левый желудочек, справа —
вегетация прикрывает просвет протеза в систолу V — вегетация, АР — протез аортального клапа-
на, LA — левое предсердие; RV — правый желудочек (по Г В Кнышову и др , 2004)
Актуарные и линеарные показатели частоты встречаемости протезного эндокардита
в аортальной позиции составляют 97-85% и 0,6-0,9% пациенто-лет, соответственно, в
аортальной позиции несколько выше, чем в митральной (Antunes М. J , 1990, Aupart М
et al, 1994, Glower D D et al , 1998, Poirer N C et al , 1998) Пятилетняя свобода от без
протезного эндокардита, по данным большинства крупных исследований, составляет
более 97% (David ТЕ et al , 2001, Dellgren G et al., 2002) Риск развития протезного
эндокардита для механических клапанов несколько выше, чем для биопротезов (Ivert
Т S et al., 1984)
Протезный эндокардит бескаркасных биопротезов и аллографтов встречется реже,
поэтому эти клапаны могут быть более полезны при замене механического протеза во
время реоперации по поводу протезного эндокардита (Dearani J. A et al., 1997, Santi-
ni F et al , 1995, 1998) Внутривенная антибактериальная терапия назначается под к н-
тролем чувствительности гемокультуры и должна быть начата как можно скорее Опь
показывает, что при инфицировании маловирулентными микроорганизмами (чаще
стрептококки) большинство пациентов с протезным эндокардитом может быть и лече
но консервативно Однако эта терапия тем более когда речь идет об инфицировании
высоковирулентной флорой (стафилококки, грибковая инфекция), должна быть допол-
нена введением антисептиков, а также проведена коррекция иммунного статуса орга-
низма Протезный эндокардит нередко требует неотложной, а иногда и срочной опе-
рации (Pelletier L С et al , 1989)
Показания к оперативному лечению протезного эндокардита следующие Ран^а
протезный эндокардит, сопутствующая застойная сердечная недостаточность и
панная дисфункция, параклапанная фистула или частичный разрыв фиброзного к0^в
при его абсцедировании, даже при стабильном состоянии пациента, особенно при
лечении в патологический процесс более 40% окружности фиброзного кольца, вс П
ковые инфекции а также вызванные наиболее вирулентными штаммами золоти
стафилококка Serratia marcescens и синегнойной палочкой, так как эти микроорган
мы высокоинвазивны, а антибактериальная терапия в таких случаях обычно неэфФ
тивна Показаниями к оперативному лечению являются также бактериемия; вегетац
превышающие 10 мм в диаметре в которые недостаточно хорошо проникают анти
отики наличие абсцессов аневризм, системных септических эмболии (Шорохов
и др , 1997 Шумаков В И и др., 1999, Караськов AM и др , 2003 Муратов Р М ДР
2004, 2005; Медведев АП и др , 2005; Miller DC et al , 1989, Verheul H A et al 19
Aranki S F et al , 1995)
аневризм, системных септических эмболий (Шорохов Е
384
ГЛАВА 6 Результаты протезирования
и клапанно-зависимые оспожн^ния
Во время операции иссечение клапана и аннулярных вегетаций должно быть об-
ширным и тщательным Некротические массы и инфицированные ткани должны быть
удалены После местного применения антисептиков разрушенное инфекцией фиброз-
ное кольцо митрального или аортального клапана реконструируют при помощи ауто-
или ксеноперикарда, глиссоновой капсулы печени и др Фиксирующие протез швы на-
кладывают на реконструированное фиброзное кольцо, что необходимо для достиже-
ния надежной фиксации нового протеза Примеры способов выполнения технических
элементов при закрытии и дренировании локальных абсцессов и инфекционных дест-
рукций фиброзного кольца митрального клапана показаны на рис. 6.6 6 7 (Cohn L Н
et al., 2003)
Послеоперационный период должен включать 6-недельный курс внутривенной адек-
ватной антибиотикотерапии. Ранняя послеоперационная летальность при протезном эн-
докардите обусловлена, главным образом, продолжающимся сепсисом, полиорганной
недостаточностью, резистентностью локальной инфекции к проведенной терапии
и формированием в последующем параклапанной фистулы (Кнышов ГВ и др , 2004,
Jault F et al, 1997; Edwards M В et al., 1998)
Наиболее опасным осложнением в отдаленный период наблюдения у больных, пе-
ренесших реимплантацию искусственного клапана сердца, является его реинфекция
Вероятность реинфицирования протеза после повторной операции зависит от реак-
тивности организма и возможности хирурга полностью устранить все очаги инфекции
при первичной операции (Miller D. С et al., 1989) Результаты лечения протезного эн-
докардита нуждаются в улучшении Частота развития параклапанных инфекций у паци-
ентов с протезным эндокардитом может достигать 40%. Летальность при раннем про-
тезном эндокардите составляет 30-80%. а при позднем — 20-40% (Vongpatanasin W
etal, 1996; David Т Е., 1999)
К клапанно-зависимым осложнениям относится и хронический внутрисосудистый
гемолиз, обусловленный прямым механическим повреждением форменных элементов
крови работающим искусственным клапаном сердца, искаженной структурой кровото-
ка при обтекании клапана, турбулентностью, отрывными течениями, разрежениями,
увеличением физической нагрузки, любой хронической инфекцией, разрастанием пан-
нуса, структурной дегенерацией биопротезов, тромбозом искусственного клапана сер-
6.6. Предпочтительная техника имплантации митрального био Р имального упот-
онным эндокардитом. Прокладки изготовлены из перикарда с Целью
_ I u rvihn et al..
ребления синтетических материалов (ло L. п. v
з, б в — стадии операции
385
Искусственные
клапаны сердца
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
Рис. 6.7. Предпочтительная реконструкция митрального фиброзного кольца после формирования
абсцесса, как осложнения инфекционного эндокардита, с применением перикардиаль-
ных лоскутов:
а — реконструкция фиброзного кольца после его расслоения б — реставрированное кольцо до ус-
тановки протеза (по L Н. Cohn et al., 2003)
б
дца, нарушением тканевого покрытия и эндотелиальной выстилки седла искусствен
ного клапана, почечно-печеночной недостаточностью и др. (Ширко И В. и др., 1У »
Гриценко В. В. и др., 2001; Орловский П. И. и др., 2001; Shioi К et al., 1993). При таких
ситуациях процесс изменения гомеостаза принимает форму отрицательного спирале
образного течения с быстрым развитием необратимых изменений, приводящих Раз^
витию синдрома хронического диссеминированного внутрисосудистого свертывания
полиорганной недостаточности, являющихся причиной тромботических осложнен
(Баранова И Н и др., 1988; Ismeno G. et al., 1999). На развитие хронического внутри
сосудистого гемолиза влияют и аутоиммунные механизмы, избыточное появление ак
тивных форм кислорода и активация перекисного окисления липидов при гипоксии
(Козинец Г. И. и др., 1997, Жлоба А. А., 2000; Ройтман Е. В. и др., 2000). Гемоглобин и
ионы железа, высвобождаемые при хроническом внутрисосудистом гемолизе, са
являются мощными активаторами перекисного окисления липидов (Калиман П. А. и ДР->
1998). Уровень хронического внутрисосудистого гемолиза не изменяется от срока им
плантации искусственного клапана сердца при удовлетворительной его функции, н
влияют на уровень хронического внутрисосудистого гемолиза мерцательная аритмия
и степень хронической сердечной недостаточности (Konishi Y. et al., 1982). При исполь
зовании нормально функционирующих современных механических или каркасных ио
логических протезов гемолиз редок Из табл 6 10 следует, что хронический внутрисо-
судистый гемолиз у больных с механическими искусственными клапанами се^^а
встречается с частотой по актуарным и линеарным показателям в 99,7-99,8°о и 0,
0,52% пациенто-лет, соответственно Такой значительный разброс частоты хронике
ского внутрисосудистого гемолиза не позволяет объективно оценить преимущества то
386 ---------------------------------------------—— ------
ГЛАВА 6. Результаты протезирования и клапанно-зависимые осложнены
Таблица Ь. 10
Значения актуарных и линеарных показателей частоты тромбоза и хрони-
ческого внутрисосудистого гемолиза у больных с механическими искусст-
венными клапанами сердца в зависимости от модели и позиции имплантации
клапана (по данным отечественных и зарубежных авторов), М±т
Тип Источник, Позиция Актуарный показатель, % Линеарный показа- тель, % пациенто-лет
протеза год мит- раль- ная аор- таль- ная Тромбоз клапана Хрониче- ский внутри- сосудистый гемолиз Тромбоз клапана Хрониче- ский внутри- сосудистый гемолиз
Эмике и Лике МКЧ- 25 Эмике и Лике Карбоникс-1 Мединж-2 Мединж-2 St. Jude Medical St Jude Medical Omniscience Medtronic-Hall St. Jude Medical Starr-Edwards Bjork-Shiley Standard St Jude Medical Omniscience Medtronic-Hall Starr-Edwards Bjork-Shiley Standard St Jude Medical Omniscience Medtronic-Hall Carbomedics Carbomedics St Jude Medical Цукерман Г. И и др , 1991; 1993 Вязников В А. и др., 2004 Шумаков В И и др., 2004 Ребиков А. Г. и др., 2002 Aoyagi S. et. al., 1994 Akahn H. et. al , 1992 Antunes M J et al., 1990 Butchart E G et al., 1988 Copeland J. G , 1995 Horstkotte D et al., 1994; 1995 + + + + + + + + + + + + + + + + + + + + + + + + + + 98,7 96,9 100 97,0 99,8 99,7 0,13 1.0 0,8 0,2±0,02 1.1 1.1 0,15 0,36 0,09 0,53 0,02 0,32 0,55 0,38 2,85 0,11 0 0,64 0,27 0,36 0,36 0,06 0,09
387
14*
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
Окончание табл, 6.10
Тип протеза Источник, год Позиция Актуарный показатель, % Линеарный показа- тель, % пациенто-лет
мит- раль- ная аор- таль- ная Тромбоз клапана Хрониче- ский внутри- сосудистый гемолиз Тромбоз клапана Хрониче- ский внутри- сосудистый гемолиз
Starr-Edwards (6120) Imanishi К , 1994 + — — — — —
Bjork-Shiley Jegaden 0. — + — — 0,37 —
Standard St. Jude Medical et. al , 1994 + —
St Jude Medical Kass R M. — + — — 0,3 —
et. al . 1990 + — -— — 0,3
Medtronic-Hall Vallejo J L et al , 1990 + J —- — 0.52
или иной конструкции искусственного клапана сердца или биопротеза. Кроме того, в
настоящее время отсутствуют унифицированные точные биохимические тесты оценки
состояния степени тяжести гемолиза (Skoulangis J. et al., 1993).
Хронический внутрисосудистый гемолиз даже на клинически незначимом уровне
приводит к нарушению реологии крови (Левтов В. А. и др., 1982; Федорова 3 Д. и Дрм
1989), прогрессирующей гемолитической анемии (Сербин В. И. и др., 1983; Rodriguez
Cuartero А, 1998), нарушению гемостаза и тромбообразования вследствие выброса из
разрушенных эритроцитов тромбопластиноподобного материала (Выговская Я. И.,
Леонова М В. и др , 1990), пигментной функции печени (Seyr М. et al., 1993),
дероза почек (Somody Е. et al., 1993), почечной недостаточности (Wain W. Н. et al , 19 )•
железодефицитной анемии (Heilmann Е. et al., 1976), способствует развитию септичес
кого эндокардита (Милонов О. Б и др., 1988).
Лечение хронического внутрисосудистого гемолиза у больных с искусственными
клапанами сердца проводится индивидуально в зависимости от его степени, Дин^^!
ки развития и вызываемой причины (Дмитриева В А. и др., 1981, Kuypers F. А., 199 )
В случае декомпенсированного хронического внутрисосудистого гемолиза показан
ограничение физической нагрузки, поддержание эритропоэза и восполнение потерь
железа (препараты железа, фолиевая кислота и др.); для стабилизации мембран РиТ
роцитов назначают токоферол, стероидные гормоны у больных с положительными ауто
иммунными тестами, при выраженной анемии — гемотрансфузии, эритропоэтин по
контролем показателей гемоглобина, гаптоглобина, лактатдегидрогеназы (Шевчен
ко Ю. Л. и др., 1996; Ismeno G et al., 1999). Параллельно проводят комплекс меропри
ятии по борьбе с интоксикацией, воспалительными очагами, почечно-печеночной н
достаточностью, особенно при протезном эндокардите. В случае обнаружения дисфУ
кции искусственного клапана сердца, как причины хронического внутрисосудистог
гемолиза, показана реоперация — ушивание параклапанной фистулы, закрытие неэн
дотелизированного участка пришивной манжеты искусственного клапана серди3* УД
ление тромбов, замена клапана (Cerfolio R. J. et al., 1997). Своевременное выявлен
ГЛАВА 6 Результаты протезирования и клтанно-зависи *ые осложнения
хронического внутрисосудистого гемолиза и его лечение позволяет избежать разви
тия его разнообразных осложнений, в том числе и синдрома хронического диссемини-
рованного внутрисосудистого свертывания, способствующего тромботическим ослож-
нениям.
тромбэмболии и тромбоз клапанов являются самыми распространенными клапан-
но-зависимыми осложнениями послеоперационного периода у пациентов с механи-
ческими и биологическими протезами митрального клапана, приводящими к ухудше-
нию качества жизни и инвалидности. Чаще всего они встречаются у пациентов с
механическими клапанами (Цукерман Г. И. и др., 1993; Ismeno G. et aL, 1999). Более
50% пациентов после протезирования митрального клапана с хронической фибрил-
ляцией предсердий и другими факторами риска (низкая фракция выброса, тромбо-
эмболические осложнения в анамнезе, большие размеры левого предсердия, тромб
в его полости и др.) подвержены тромбоэмболическим осложнениям, несмотря на
адекватную антикоагулянтную терапию, а также повышенной вероятности тромбоза
механических клапанов в случаях изменения в протоколе антикоагулянтной терапии.
Тромбоэмболии относительно редко встречаются у пациентов после протезирования
митрального клапана с малым объемом левого предсердия, синусовым ритмом и
нормальным сердечным выбросом. Кроме того, у пациентов с устаревшими типами
клапанных протезов, получающих более интенсивную антикоагулянтную терапию,
может развиться тяжелое гипокоагуляционное кровотечение (Вавилова Т В., 2004;
Miller D. С. et al., 1983).
Среди многочисленных этиологических факторов риска развития тромботических
осложнений выделяют основные: неадекватность антикоагулянтной терапии, активность
ревматического процесса и инфекционного эндокардита, особенно протезного эндо-
кардита с крупными вегетациями; замедление и стаз кровотока, связанные с низким
минутным объемом кровообращения, гиповолемией, мерцательной аритмией, наруше-
нием сократительной способности миокарда (Люсов В. А. и др., 1989; Кондратьев А. С.
и др., 1990; Virchow R., 1856; Rabago G. et al , 1986; Delahaye J. R et al., 1990). Коагуло-
патия потребления и синдром диссеминированного внутрисосудистого свертывания,
легочная гипертензия могут приводить к увеличению фибриногена, дисбалансу тром-
боксана и простациклина, эндотелина-1, способствовать дисфункции эндотелия и тром-
бообразованию (Мартынюк Т. В. и др., 1997; Bick R. L. et al., 1998). Кроме того, пара-
клапанные фистулы и регургитация на искусственном клапане сердца приводят к еще
большему искажению структуры кровотока с развитием повышенных отрывных тече-
ний, сдвиговых напряжений, турбулентности, кавитации, вызывающих дисфункцию эн
дотелия, хронический внутрисосудистый гемолиз и тромбообразование (Sallam
et al., 1983; Saad R. M. et al, 1991; Pohl M. et al., 2000).
В многочисленных исследованиях суммирован тромбоэмболический потенциал раз
личных типов клапанов и прослеживается связь между гемодинамическими характери
стиками протеза и частотой тромбоэмболических осложнений. Вероятность формир
вания тромбоэмболий при адекватной антикоагулянтной терапии у пациентов с-Д
тупными в настоящее время моделями двустворчатых и поворотно-дисковы г ai
схожа с таковой у пациентов с биопротезами (Neville Р. Н. et al., • ’ •
1"8’- Remadi J. R et al., 2001; Thomson D. J. et al., 2001; Santini F et а- псложне-
B табл. 6.11 представлены линеарные показатели тром оэм сердца и
ний и антикоагулянтных геморрагий у больных с искусственными линеа0НЬ|Х лока-
биопротезами в митральной позиции. Из таблицы видно, что час механических ис-
зателей тромбоэмболических осложнений с разными конструкц паиИенто-лет, чаще
^ственных Клапанов сердца и биопротезов ;ыше, чем в аортальной в
• 2% пациенто-лет В митральной позиции эти показ ~ большего времени
илу более низких скоростей кровотока, высоких застойных свертывания (Цукер-
°нтактной активации форменных элементов крови и факт р 1999)
Г и и др., 2000; Cannegieter S. С. et а!.. 1999; Katircioglu S. F. et al.,
______ 389 ---------
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
Таблица 6.11
Линеарные показатели частоты тромбоэмболических осложнений
и геморрагий, обусловленных антикоагулянтной терапией, у больных
после имплантации механических искусственных клапанов сердца
и бнопротезов (по данным отечественных и зарубежных авторов)
Линеарные пока- Линеарные пока-
Источник, год затели тромбе- затели антикоагу-
Протезы клапанов эмболии, лянтных геморра-
% пациенто-лет гий, % пациенто-лет
МКЧ-25 Громова ГВ и др , 1993 2,1 -
Starr-Edwards Miller D. С. et. al., 1983 5,7 3,7
Akins С W et al., 1987 3,9 2,4
Agathos E A et al., 1993 6,6 2,2
Godje 0 L et al , 1997 1,3 0,6
Эмике и Ликс-2 Цукерман Г И и др., 1991; 1993 1,52 —
Omniscience/Omni- Akahn Н et al., 1992 1.0 2,7
carbon Peter M et al , 1993 1,7 0,9
OhtaS et al , 1995 1,1 0,8
Thevenet A. et aL, 1995 0,9 1.1
IguroY et aL, 1999 1.0 0,6
Torregrosa S et al , 1999 0,6 0.8
Medtronic-Hall Antunes M J et. al , 1988 4,2 1.5
Beaudet R L et al., 1988 2,1 3,2
Akins C W, 1991 1,8 3,2
Butchart E. G et al., 2001 4,0 1,4
Мединж-2 и Ребиков А Г и др., 2002 1,6 1.6
Карбоникс-1 Вязников В А и др , 2004 0,7 —
St. Jude Medical Kratz J М et al., 1993 2,9 2,2
Jegaden О et al., 1994 1,5 0,9
Aoyagi S et al., 1994 1,1 0,3
Nistal J F et. al , 1996 3,7 2,8
Camilleri L F et al , 2001 1,9 1,5
Khan S S et al , 2001 3,0 1.9
Carbomedics Copeland J G et al , 1995 0,6 1.5
Nistal J F et. al , 1996 0,9 2,8
ATS Yamauchi M et al , 1996 1.6 3,3 1.8 1.1 1,4 1,5
Emery R W et al , 2001 4,9
ON-X LaczkovicsA et al 2001 0
Hancock Standard Pener P et al., 1989 1.0
Bortolotti U et al , 1995 0,7
Carpentier-Edwards Porcine Akins C Wet al, 1990 Jamieson W et al , 1987 1.4 2 4 1.2 0,7
Van Doorn C A et al . 1995 Ц9 1.7
Glower D D et al., 1998 0,7
Carpentier-Edwards Pericardial Pelletier L C et al , 1995 Murakami T et. al , 1996 1,5 0,6 0,7 1,2 0,6 1.7 1.4 0,2 0,3 0
Aupart M N et al , 1997 1,2
Marchand M et al , 1998 1,0
Neville P H et al , 1998 1 1
Medtronic Mosaic 39C Poirer N C et al„ 1998 Fradet G J et al , 2001 Thomson D J et al , 2001 0.3 1.1 0,9
ГЛАВА 6 Результаты протезирования
и клапанно-зависимые осложнения
Некоторое увеличение показателей тромбозов и тромбоэмболических осложнений
у больных с искусственными клапанами сердца, исследованных отечественными авто-
рами, по-видимому, объясняется наличием у них более высокого уровня коагуляции и,
соответственно, низкого риска антикоагулянтных геморрагий, чем у больных, представ-
ленных зарубежными авторами с линеарным и актуарным показателем антикоагулянт-
ных геморрагий — 0,2-6,4% пациенто-лет и 92-68%, соответственно (Butchart Е G
et al., 1991) Проблема баланса между антикоагулянтной терапией у больных с искус-
ственными клапанами сердца и гипокоагуляционными геморрагиями вызывает ожив-
ленные дискуссии (Gray R. J., 1996).
Редким и чрезвычайно опасным осложнением является тромбоз протеза клапана
(рис 6 8), риск которого не превышает 0,2% пациенто-лет, он чаще встречается у па-
циентов с механическими клапанами (Цукерман Г. И. и др , 2002; Venkataraman К et al.,
1980; Lengyel М. et al., 2001) Частота актуарных и линеарных показателей тромбозов
механических искусственных клапанов сердца колеблется от 97% до 100% и от 0% до
1,1% пациенто-лет, причем в митральной позиции эти показатели выше, чем в аор-
тальной. Такой значительный разброс показателей тромбоза искусственных клапанов
сердца и тромбоэмболических осложнений можно объяснить различными исходными
факторами риска и уровнем антикоагулянтной терапии у больных (Константинов Б. А.
и др , 1985; Kuntze С. Е et aL, 1998). По сводным данным многоцентрового рандоми-
зированного исследования зарубежных кардиохирургических центров, все случаи тром-
бозов искусственных клапанов Carbomedics зарегистрированы у больных с нарушени-
ем режима антикоагулянтной терапии ниже рекомендуемого уровня по MHO (INR) (2,5-
3,5) и протромбиновому времени (1,5), у некоторых пациентов антикоагулянтная
терапия была прервана В связи с этим актуарный показатель тромбоза клапанов у
больных с искусственными клапанами сердца Carbomedics составлял к 5-му году 97%,
линеарный — 0,64% пациенто-лет в митральной позиции, а в аортальной позиции
тромбоза искусственных клапанов сердца не отмечалось (Copeland J G , 1995) На 4000
имплантаций искусственных клапанов сердца Ликс-2 и Эмике тромбоз составлял 1%
(Паджев М А. и др., 1997).
В случае развития хронического диссеминированного внутрисосудистого сверты-
вания, как основной причины тромбоза клапанов и тромбоэмболических осложнений,
терапия проводится исходя из данных о циркуляции активированных факторов свер-
тывания, так называемый потенциальной гиперкоагуляции, обусловленной постоянной
циркуляцией в кровяном русле тканевого тромбопластина (Федорова 3 Д. и др.,
De Jonge E.et aL, 1998). Это требует введения нефракционированного гепарина или
Рис. 6.8. Тромбоз митрального протеза Omnicarbon:
а ~ вид макропрепарата тромба, б — чреспищеводная допплерэхокардиогра
ГО (no м Zielinska et al , 2001) . ___________
-- -------------------------------------------------- _ •
ИСКУССТВ ЕННЫЕ КЛАПАНЫ СЕРДЦА___________________________________________
низкомолекулярных гепаринов под контролем активированного парциального тромбоп-
лзстинового времени, количества тромбоцитов, тромбинового времени (Сапелкин С. В.
и др., 1998, Maharaj S. et al., 1999), свежезамороженной плазмы, являющейся источ-
ником протеина С, протеолитических ферментов (контрикал, трасилол, гордокс), спо-
собствующих блокаде плазменного и лейкоцитарного протеолиза, снижению интокси-
кации и остановке кровотечения. Для купирования «сладж-синдрома» и нарушения
микроциркуляции рекомендуется назначение антиагрегантов и средств, улучшающих
реологию крови (трентал, депиридамол, реополиглюкин и др.). В тяжелых случаях при
отсутствии анемии, диспротеинемии, при ацидозе и/или интоксикациях для блокады
системы мононуклеарных фагоцитов, улучшения функции эндотелия, сосудисто-тром-
боцитарного звена гемостаза, калликреин-кининовой системы, простаноидов, протео-
лиза требуется подключение плазмофереза, особенно показанного при развитии у
пациентов «гепаринорезистентности» в результате накопления в кровотоке белков «ос-
трой фазы» воспаления, циркулирующих иммунных и других крупномолекулярных ком-
плексов, а также гипербарооксигениции, УФО-крови, внутривенной лазеротерапии (Ки-
риченко Л. Л. и др., 1993; Лычев В. Г., 1998). При «тромботической» форме синдрома
хронического диссеминированного внутрисосудистого свертывания для диагностики
тромбоза клапана большое значение придается трансторакальной и чреспищеводной
ЭхоКГ, включая оценку спонтанного эхоконтрастирования камер сердца, а также транс-
краниальную эхографию и сонографию с исследованием маркеров тромбинемии (Цу-
керман Г. И. и др., 2000; Montorsi Р. et al., 2000; Ozkan М. et al., 2000). При помощи этих
исследований проводится мониторинг в начале тромболитической терапии, если па-
циент не находится в состоянии кардиогенного шока, под контролем уровня плазми-
ногена, фибриногена, тромбинового времени, активированного парциального тромбоп-
ластинового времени для оценки фибринолитического фона больного, и при ее неэф-
фективности, особенно при неадекватной гемодинамике в сочетании тромбоза клапана
и паннуса, прибегают к реоперации — удалению тромботических масс с искусственно-
го клапана сердца — или его замене (Курдов К. К. и др., 1997, Поляков В. П. и др.,
1998; Цукерман Г. И. и др., 2000; Koller Р. Т. et al., 1995). Следует отметить, что тромбо-
литическая терапия при тромбозе искусственных клапанов сердца часто бывает неэф-
фективной. При этом, частота церебральных или периферических тромбоэмболий на
фоне тромболитической терапии составляет 12%. Летальность при проведении опе-
раций по поводу тромбозов клапанов составляет 10-15% (Lengyel М. et al., 2001). Ко-
личество повторных тромбозов после удаления тромба достигает 40%, поэтому
мы рекомендуем замену протеза всем пациентам, которым проводится оперативное ле-
чение.
ПРОФИЛАКТИКА ТРОМБОЗОВ
И ТРОМБОЭМБОЛИЧЕСКИХ ОСЛОЖНЕНИЙ
Система гемостаза у больных с механическими искусственными клапанами серди3
подвергается постоянному агрессивному воздействию. Наличие в активном кровотоке
инородного тела, травма крови, хронический ревматический или инфекционный эндо
кардит, изменения гемодинамики в течение многих лет жизни предрасполагают к тром-
оо разованию на искусственных клапанах сердца и обязывают клинициста и пациен
тов проводить пожизненную профилактику тромбозов искусственных клапанов серди3
°ЭМ олических осложнений Популяция больных с механическими искусствен
eTZZnaHaMTPW И3 Г0Да в год Увеличивается. Поэтому во врачебной практике
больных rZf06 олее актуальным вопрос правильного ведения указанной категории
м, что ы уменьшить частоту тромбозов искусственных клапанов серди3 и
------ 392 --------------------------------
ГЛАВА 6. Рмуль^ть^ротезирования^ клапанно-звенные осложнен^
тромбоэмболических осложнений, увеличивающих летальность и снижающих качество
жизни пациентов в ближайшие и отдаленные сроки наблюдения.
Препаратами выбора длительной тромбопрофилактики являются антикоагулянты
непрямого действия. Среди них наиболее распространенным во всем мире препара-
том является Варфарин, который с 2002 г. стал доступен и для пациентов России Пре-
парат относится к группе монокумаринов и используется для контролируемой гипоко-
агуляции с 1947 г., когда он впервые был применен у больного с инфарктом миокарда.
Варфарин пришел на смену Фенилину (группа индандионов), который является ток-
сичным, менее эффективным и требует приема 2 раза в сутки из-за короткого перио-
да полужизни.
Антикоагулянты непрямого действия не вмешиваются самостоятельно и непосред-
ственно в процесс тромбообразования, а влияют на него через синтез факторов свер-
тывания. Группу антикоагулянтов непрямого действия принято называть также ораль-
ными антикоагулянтами, или антивитамин К препаратами. Витамин К поступает в орга-
низм с пищей (зеленые овощи, говяжья печень и др.) и образуется в организме за
счет бактериального синтеза в кишечнике. Витамин К — жирорастворимый витамин, и
его содержание зависит от активности липаз поджелудочной железы, наличия желчи,
всасывающей способности кишечника и степени его утилизации гепатоцитами. Дефи-
цит витамина К возникает при несбалансированном питании, панкреатической недо-
статочности, механической желтухе, нарушении всасывания (синдром мальабсорбции,
ишемия кишечника), лечении антибиотиками и непрямыми антикоагулянтами Действие
витамина К проявляется на заключительных стадиях синтеза II, VII, IX, X факторов свер-
тывания крови, а также синтеза естественных антикоагулянтов — PC и его кофактора
PS. По механизму действия антикоагулянты непрямого действия являются антагонис-
тами витамина К и ингибируют витамин К-редуктазу. В результате этого образуются
неспособные к активации витамин К-зависимые факторы (II, VII, IX, X) и снижается спо-
собность к свертыванию крови. Очевидно, что при таком механизме действия тера-
певтический эффект применения антикоагулянтов непрямого действия проявляется не
сразу. Для разных препаратов этот период «отсрочки» различен — от 12 до 48 часов и
зависит от периода полужизни факторов свертывания (Бокарев И. Н и др , 2000)
Противопоказаниями для приема антикоагулянтов непрямого действия считаются
исходно сниженная активность факторов протромбинового комплекса (менее 70 Х>),
геморрагические диатезы, нарушение функции печени и почек, язвенная болезнь, бе-
ременность. Особую осторожность необходимо соблюдать при использовании антико
агулянтов непрямого действия в раннем послеродовом периоде, у пожилых людей, при
заболеваниях поджелудочной железы, печени, почек, синдроме мальабсор ции, при
еме антибиотиков.
Общепризнанным методом контроля степени антикоагуляции у больных с искусхт
венными клапанами сердца является предложенное в 1935 г. A. J. Qwc
протромбинового времени (ПВ), называемое тестом Квика (Hirsh J. et al, у b Р -
тромбиновое время — это время образования сгустка in vitro при до авлении
тканевого тромбопластина (тканевого фактора). Результаты определения п Квику
нового времени могут быть представлены в виде показателя протр , п
(активность факторов протромбинового комплекса, выраженная в п
тромбинового отношения или протромбинового индекса.
ПО = ПВ плазмы больного / ПВ нормальной плазмы,
ПТИ = (ПВ нормальной плазмы/ПВ плазмы больного) ней мозга лег-
Поскольку тромбопластин — частично очищенный экстрак_ е характерис-
ких или плаценты млекопитающих — имеет различные те*н международным коми-
тики, с 1983 г. Комитетом по стандартизации в гематологи' стандартизован-
тотом по тромбозу и гемостазу ВОЗ рекомендовано исп варьирования
нь,е тромбопластины. Это позволяет избежать зна Da3Hb|X лабораториях
Результатов оценки протромбинового времени, полученных в разных
________393
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
^Добровольский А Б и др., 1995). Таким образом, в мировую клиническую практику
было введено международное нормализованное отношение — MHO (INR —- interna-
tional Normalized Ratio)
( ПВ плазмы больного \мич
мНU = -------------------1 ।
\ ПВ стандартной плазмы /
МИН — международный индекс чувствительности.
Благодаря тому, что при расчете МНО в каждом конкретном случае учитывается
влияние чувствительности используемого тромбопластина на величину протромбино-
вого времени, достигается возможность осуществления единой тактики дозировки
антикоагулянтов непрямого действия независимо от того, в какой лаборатории и на
каких реагентах происходило исследование данного показателя.
Оценка уровня анти коагуляции у больных с искусственными клапанами сердца по
протромбиновому индексу, что до сих пор, к сожалению, еще часто имеет место в оте-
чественной клинической практике, далеко не безупречна Результаты определения про-
тромбинового индекса весьма разноречивы ввиду различной чувствительности тром-
бопластина, используемого в медицинских учреждениях, где под диспансерным наблю-
дением находятся составляющие группу повышенного риска больные с искусственными
клапанами сердца У 90% больных с искусственными клапанами сердца величина про-
тромбинового индекса, определяемого по месту жительства больных, на 30-80 % от-
личается от результатов оценки степени гипокоагуляции, полученных в клинико-диаг-
ностических лабораториях, по уровню международного нормализованного отношения.
Вследствие этого при подборе оптимальной терапевтической дозы антикоагулянтов
непрямого действия возможны существенные погрешности, создающие у больных —
носителей искусственных клапанов сердца реальную угрозу развития тромбофилии,
тромбозов искусственных клапанов сердца, тромбоэмболических осложнений или ан-
тикоагулянтных геморрагий независимо от конструкции механического клапана (Реко-
мендации Всероссийской ассоциации по изучению тромбозов, геморрагий и патоло-
гии сосудов, 2003, Орловский П И. и др., 1999, Цукерман Г. И. и др., 2000, BakerW F,
1998) Терапевтический интервал международного нормализованного отношения — тот
«коридор» гипокоагуляции, который эффективно защищает больного от возможных
тромботических и тромбоэмболических осложнений, но в то же время делает терапию
антикоагулянтами непрямого действия безопасной.
Регулярный контроль за международным нормализованным отношением и систе-
мой гемостаза, к сожалению, неудобен и нагрузочен для больного Поэтому ведутся
разработки экспресс-методов самоконтроля на дому, доступных хорошо обученному
пациенту Существующие приборы — портативные коагулометры (ProTIME Monitor 1000,
Coumatrak, Model 512 Coagulation Monitor, CoaguChek Plus-Pro, Pro/DM, S, Rapidpoint
/Oag, INRatio и др ) — дают возможность определять протромбиновое время в пробе
капиллярной крови самим пациентом с высокой воспроизводимостью и сходимостью
с результатами стационарной лаборатории. Эти приборы привлекательны также своей
про гой в работе, скоростью получения ответа и могут быть с успехом использова
ны для контроля поддерживающих доз антикоагулянтов непрямого действия При ис
поль вании портативных коагулометров у больных с искусственными клапанами сер
дца должны соблюдаться следующие условия.
1 Необходимо информированное согласие больного, в том числе на регулярное
посещение врача и учет результатов измерений
2 Должно быть проведено обучение пациента процедуре и интерпретации резуль
татое разработан индивидуальный алгоритм изменения дозы
3 При МНО < 1,5 и МНО > 5 необходим визит к врачу, при МНО > 8 обязательно
исследование венозной крови в стационарной лаборатории.
394 ---------------------- ---------------------_-------
ГЛАВА 6. Результаты протезированияиклапаино-зааисимые осложнения
4 . Непременным условием является приверженность больного лечению
5 . Контакт с ответственным гематологом не реже 1 раза в 6 мес, информирован-
ность лечащего врача
6 Обязательное использование систем контроля качества прибора и участие в си-
стеме внешнего контроля.
Необходимость контроля МНО и подбора дозы антикоагулянтов непрямого действия
диктуется индивидуальной чувствительностью к Варфарину, которая зависит, в основ-
ном, от каталитической активности микросомального фермента печени СУР2С9 семей-
ства Р-450, метаболизирующего Варфарин (Вавилова Т В и др , 2003) Активность этого
цитохрома детерминирована генетически носительством *1, *2 или '3 аллеля в его гене
При наиболее часто встречающемся диком генотипе *1*1 (65% в российской популя-
ции) каталитическая активность максимальная, целевое значение МНО достигается в
течение 5-7 дней, а поддерживающая недельная доза составляет более 40 мг/нед
Носительство *2 или *3 аллеля снижает активность метаболизма Варфарина, ускоряет
достижение целевого значения МНО. Для таких пациентов недельная доза препарата
значительно меньше, а риск развития геморрагических осложнений выше. При нали-
чии лаборатории ПЦР-диагностики желательно генотипирование пациента, которому
предстоит длительная или пожизненная терапия Варфарином, по цитохрому СУР2С9.
Это исследование позволит прогонозировать ответ на прием Варфарина и сделать ан-
тикоагулянтную терапию более безопасной (Higashi М. К et al2002) В 2004 г был
идентифицирован ген витамин К редуктазы (VKORC) — белка-мишени действия Вар-
фарина (Li Т, 2004). Предполагают, что нарушения в его генетическом кодировании
могут вести к развитию варфаринорезистентности Работы в этом направлении про-
должаются.
Международный комитет по Стандартизации в гематологии и Британское общество
гематологов еще в 1984 г., а также АССР — NHLBI (American College of Chest Physicians
and National Heart, Lung and Blood Institute) в 1992 г. рекомендовали для профилактики
тромбообразования руководствоваться значениями МНО у больных с искусственными
клапанами сердца в пределах 3,0-4,5 (Dalen J Е. et al., 1992) Однако при таком высо-
ком МНО параллельно со снижением линеарных показателей тромбозов клапанов и
тромбоэмболических осложнений нарастала частота антикоагулянтных геморрагий
Выходом из такой ситуации послужили исследования зарубежных авторов, по данным
которых частота тромбозов искусственных клапанов сердца и тромбоэмболических
осложнений не увеличивалась, если уровень МНО поддерживался в меньших пределах
(2,5-3,5), но только в сочетании с оптимальной дозой антиагрегантных препаратов —
аспирин 100 мг/сут (Altman R. et al., 1991) Поэтому в 1994 г в материалах специализи-
рованного доклада Американской Ассоциации Сердца было предложено у ольных с
механическими искусственными клапанами сердца последнего поколения ^иен™РО
ваться на значение МНО (2,5-3,5), при котором частота тромбозов и тромбоэмбл -
ческих осложнений не увеличивалась, но зато снижалась частота антикоагулянт
моррагий и улучшалась фибринолитическая функция крови (Добровольским
1995: Laffort Р pt 2ППГП
п™™ больных с Шарп».».. „оаорогво-диоховы-ь «ХХ™“
механическими искусственными клапанами сердца с мерцательной' действия
нусовым ритмом даже в аортальной позиции без антикоагулянтов возоастали по-
оказалась неудовлетворительной, — тромбоэмболические осло инеарные пока-
жи в 2 раза (Шарыкин А. С. и др., 1977; Andersen V. et al., 1993>
затели тромбоэмболических осложнений у лиц, получавших ан _ пациенто-лет,
го Действия, составляли 3,4% пациенто-лет, а у не получавш (Шаоыкин А С. и др ,
по другим данным — 4,3% и 17,6% пациенто-лет, соответств 0ЙРп03ИЦии. прини-
77). У больных с искусственными клапанами сердца в ми эмболических осложне-
мавших антикоагулянты непрямого действия, частота тро _____ 33 3% пациенте-
иии составляла 8,2% пациенто-лет, а у нерегулярно принима
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА______________________________________________
лет, в аортальном позиции эти показатели были меньше и, соответственно, составляли
6,4% и 10% пациенто-лет (Чернов В. А. и др., 1988), 7,6% и 22,8% пациенто-лет (Цу-
керман Г И. и др., 1991). У больных с искусственными клапанами S. Jude Medical, при-
нимавших только антикоагулянты непрямого действия или только антиагреганты или
находившихся без всякой терапии антикоагулянтами, линеарный показатель тромбо-
эмболических осложнений составлял, соответственно, 2,6%, 9,2% и 15,6 % пациенто-
лет что подчеркивает необходимость регулярного проведения антикоагулянтной тера-
пии и недопустимость ее отмены или перерыва (Andersen V et al., 1993).
Дискуссии о режимах антикоагулянтной терапии у больных с механическими искус-
ственными клапанами сердца продолжаются. Обсуждаются вопросы оптимального
уровня антикоагуляции у больных с конструкциями клапанов различных поколений:
более низкая антикоагуляция рекомендована больным с клапанами St. Jude Medical,
Medtronic-Hall (Butchart E. G., 1988), особенно в аортальной позиции и у лиц молодого
возраста с синусовым ритмом. Являются дилеммой и оптимальные режимы антикоа-
гулянтной терапии у больных в разных возрастных группах: у пожилых лиц, у детей и
подростков, а также у беременных и у лиц с церебральными эмболиями и инсультами.
Вместе с тем, еще недостаточно изучено у больных с искусственными клапанами
сердца состояние сосудисто-тромбоцитарного звена гемостаза, в котором первосте-
пенное значение в формировании тромбообразования приобретает состояние тром-
боцитов, их готовность к взаимодействию между собой и с сосудистой стенкой. По-
этому в настоящее время весьма актуальным ставится вопрос комплексного подхода к
выработке стандартов лабораторного контроля и фармакологической коррекции как
коагуляционного, так и сосудисто-тромбоцитарного звена гемостаза.
Под нашим наблюдением находилось 97 больных с механическими искусственны-
ми клапанами сердца в возрасте 45,9±8,7 лет, из которых методом случайной выборки
была укомплектована основная группа из 68 больных (38 мужчин и 30 женщин) с при-
обретенными ревматическими пороками сердца в отдаленные сроки наблюдения
(4,5±0,2 лет) после изолированного аортального (л = 27), митрального (л = 36) и двух-
клапанного (л = 5) протезирования клапанов сердца механическими искусственными
клапанами сердца Мединж-2. На момент обследования больные основной группы на-
ходились в l-Н функциональных классах (ФК) NYHA без клинических и лабораторных
признаков активности ревматического процесса, протезного эндокардита, тромбозов
искусственных клапанов сердца, тромбоэмболических и других специфических ослож-
нений. У них были выявлены факторы риска тромбообразования: у 5 (7,3%) больных —
II степень легочной гипертензии, мерцательная аритмия — у 9 (13,3%), кальциноз кла-
панов у 15 (22%), i<ардиомегалия — у 5 (7,3%), сопутствующие заболевания некардио-
геннои природы у 4 (5,9%). Находясь под наблюдением в лечебных учреждениях
Санкт-Петербурга и Ленинградской области, пациенты получали антикоагулянты непря-
мого действия (Фенилин или Варфарин) под контролем показателя протромбинового
индекса.
Поскольку известно, что у больных с ревматическими пороками сердца уже исход-
но имеются существенные нарушения коагуляционного и сосудисто-тромбоцитарного
звена гемостаза (Грицюк А. И с соавт., 1994), а имплантация механических искусст-
венных клапанов сердца, усугубляя эти нарушения, приводит к дополнительной акти-
вации тромбообразования, нам представилось целесообразным оценить лишь изме-
нения гемостаза, обусловленные наличием искусственого клапана сердца В связи с
этим, контрольная группа была укомплектована больными с ревматическими порока-
ми сердца без искусственных клапанов сердца, которая готовилась к операции и со-
ла из 20 больных, подобранных методом случайной выборки, аналогично основ-
по Диагнозу ревматические пороки сердца с изолированным поражением
(42 1+R7 пТ \ * аоРтального (Ю) клапана, полу (по 10 мужчин и женщин) возрасту
^обп^ппЯммаСТаДИИ развития заболевания (I-II Фк по NYHA), факторам риска тром-
отсутствие клинических и лабораторных признаков активности рев-
—-------- 396 __________________________________________________
ГЛАВА 6. Результаты протезирования и клапанно-зависиыые осложнения
магического процесса, наличие у 5 (25%) больных Il-Ill степени легочной гипеотензии
у 5 (25%) - мерцательной аритмии, у 6 (30%) - кальциноза клапанов, у 5 (25%) -
кардиомегалии, а также сопутствующих заболеваний некардиогенной природы у 2 (10%)
больных. В контрольной группе больные не получали антикоагулянты непрямого дей-
ствия и другие препараты, влияющие на гемостатические функции Вторая контрольная
группа состояла из 10 здоровых лиц.
Комплексное исследование системы гемостаза оценивалось по 18 параметрам ко-
агулограммы с включением показателей: активированного времени рекальцификации
(АВР) с индексом коагуляции (ИК), активированного парциального тромбопластиново-
го времени (АПТВ) с индексом АПТВ, протромбинового времени, рассчитанных на его
основе протромбинового индекса (ПТИ) и МНО (тромбопластин фирм «Диамед» и «Тех-
нология-Стандарт» с индексами 1,2 и 1,1, соответственно), тромбинового времени (ТВ),
концентрации фибриногена, антитромбина III (AT-III), лизиса эуглобулиновых фракций
(ЭГ-лизис), паракоагуляционных (ПКТ) тестов, растворимых фибрин-мономерных ком-
плексов (РФМК), D-димера. Дополнительная информация о параметрах коагуляции и
фибринолиза была получена с помощью турбидиметрического экспресс-метода в мо-
дификации Т. ф. Субботиной и др. (2001).
Для оценки сосудисто-тромбоцитарного звена гемостаза исследовали количество
тромбоцитов, морфофункциональное состояние внутрисосудистой активации тромбо-
цитов (ВАТ) по методу А. С.Шитиковой и др. (Шитикова А. С., 1991), то есть способ-
ность тромбоцитов изменять свою форму в процессе активации в кровеносном русле
Тромбоциты венозной крови, фиксированные глутеральдегидом, сохраняют прижизнен-
ную морфологию, которая хорошо видна в фазово-контрастном микроскопе. По мор-
фологическим свойствам тромбоцитов оценивали сумму их активных форм (дискоэхи-
ноцитов, сфероцитов и сфероэхиноцитов) в процентах от общего числа, процент тром-
боцитов, вовлеченных в агрегаты, количество малых (по 2-3 тромбоцита) и больших
(по 4 тромбоцита и более) агрегатов на 100 свободных тромбоцитов
Агрегационную активность тромбоцитов (ААТ) оценивали по методу G. V. R. Born на
агрегометре «SOLAR» (Беларусь). Агрегацию индуцировали малыми и пороговыми до-
зами АДФ «Sigma» (США): 2,5-1,25-0,625-0.313 мкг/мл Методом малоуглового све-
торассеяния — МУС (Деркачев Э. Ф. и др., 1998) оценивали функциональную актив-
ность тромбоцитов (ФАТ) при физиологической концентрации ионов кальция без пред-
варительной отмывки от плазмы. Регистрация интенсивности рассеяния света от
лазерного источника осуществлялась на приборе «Лайт-Скан» (фирма «Люмэкс», Санкт
Петербург). В качестве индуктора использовался раствор АДФ. Основные параметры
Для оценки ФАТ: ЕС — концентрация АДФ, при которой наблюдается 50% от макси-
мальной начальной скорости агрегации и Vmax — скоростная расчетная характеристика,
которая при стандартизации условий агрегации отражает эффективность соударени
клеток и зависит от количества мест связывания на их поверхности. елич^^
максимального действия АДФ на агрегацию (ЕС50) для нормальных клеток н
в Диапазоне 120-240 nM. a
Для оценки гемостаза больные основной группы проходили в ^лин1^к соста-
обследование не реже 1 раза в 2 месяца на протяжении 5 лет на люд _ обследо-
вило около 4,5 тыс. исследований. Учитывая, что каждый пациент^п исполь3о-
вание по 25-35 параметрам, общее количество показателей, кот р' цитарного
ваны в работе для оценки состояния коагуляционного и С0СУ^ тыс Больные с по-
вена гемостаза у больных основной группы, составило бол „линике проходили
Роками сердца контрольной группы аналогичное обследовани
однократно только при первичной госпитализации. мипркга и МНО, харак-
В зависимости от величины показателей протромбиновог формирования лод-
ризующих адекватность антикоагулянтной терапии и кр J клинике были раз-
РУпп, все больные основной группы при первичном °бсл®Д 0) Указанные под-
Делены на две подгруппы - А (л = 22, МНО>2,0) и В (л = 46. МНО<2.0).
397 -------—
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
группы больных также были однородны по диагнозу, полу, возрасту, стадии заболева-
ния и факторам риска тромбообразования Мы определили пограничный уровень
МНО=2,0 — наименьшее значение, рекомендованное для больных с механическими
аортальными искусственными клапанами сердца
Исследования коагуляционного звена гемостаза выявили существенные изменения
в обеих подгруппах больных по сравнению как со здоровыми лицами, так и с больны-
ми с пороками сердца ревматической этиологии, готовящиеся к операции (табл. 612).
Из табл 6.12 следует, что показатели коагуляционной активности системы гемос-
таза были значительно и достоверно выше у больных подгруппы В относительно А
(р < 0,05, р < 0,01, р < 0,001), а некоторые показатели даже приближались к контрольной
группе здоровых лиц, что указывало на недостаточную гипокоагуляцию антикоагулян-
тами непрямого действия
Таблица 6.12
Показатели коагуляционного звена гемостаза у больных с искусственными
клапанами сердца Мединж-2 в отдаленные сроки наблюдения (4,5±0,2 лет)
при первичном обследовании, М+т
Показатель гемостаза Основная группа (л = 68) Контрольная группа (больные с поро- ками сердца), л = 20 Контрольная группа (здоровые лица), л = 10
Подгруппа А (л = 22, МНО>2,0) Подгруппа В (л = 46, МНО<2,0)
Международное нормализован- ное отношение 2,32 ± 0,12*6) 1,28 ± 0,09*3,*4) 0,9±0,05 0,81±0,02
Протромбиновый индекс, % 51.7 + 3.14*61 85,6 ± 3,29*3|,5> 97,1 +4,7 93,21±9,8
Индекс АВР 0,66 ± 0,0Г3)*6’ 0,85 ±0,01*” 0,85 ±0,02 1,0±0,15
Индекс АПТВ 0,64 ±0,02*3)*6) 0,83 ± 0,01*” 0,87 ± 0,05 0,96±0,10
ТВ,сек 21,98±0,70*2)*4’ 25,37+0,77*3) 17,3±0,49 17,0±0,40
ТПГ мин 712в±о125*31*61 6.16+0,16‘2> 4,96±0,13 4,80±0,17
Антитромбин-Ill, % 101,02±3,15*5) 82,98 ± 1,94*3) 89,42±3,41 123.10±5,97
Фибриноген, г/л 2,59 ± 0,09*”*6) 2,15 ± 0,07*2) 2,56 ±0,11 2,82±0,08
Количество тром- боцитов, 109/л 209.58 + 10,12 177,61 ± 5,01 *6) 225,42 ±15,17 247,07+17.93
Ортофенантро- линовый тест, мл/дл 4,50±0,27*”*5) 5,59 ± 0,50*2) До 4.0 До 4,0
ПКТ. % 5*з)*б) 73*3, 0 0
D-димер. % 15*з)*б) 70*з> 0 0
Активность фи- бринолиза туби- Не отличалась от контроля Увеличение активности Не отличалась от показателей
диметрическим экспресс-мето- дом у 100% у 70% 3) здоровых лиц
А и R^nfirnon^ ' J Р статистическая достоверность отличий между подгруппами
•Л * О 001 - гтХТ НЫХ С "ветвенными клапанами сердца; •> р < 0.05 «р < 0.01.
роками’сердца и здороХ^ицД°СТ°ВеРНОСТЬ 0ТЛИЧИЙ с контрольными группами больных с по-
398
ГЛАВА 6 Результаты протезирования и клтаннО-зависМ11ыл
у больных с пороками сердца контрольной группы изменений коагуляционного те-
мостаза не было, за исключением статистически малозначимого увеличения актива
ции и агрегации тромбоцитов, по сравнению с нормальными значениями здоровых лиц
(р < 0,05). Из табл. 6.12 следует, что больные подгруппы В, показатели коагуляции ко-
торой не были сбалансированы по МНО, имели статистически достоверное различие
относительно контрольной группы больных с пороками сердца до операции по МНО
(р < 0,05), ПТИ (р < 0,01); тромбиновому времени (р < 0,001) и фибриногену (р < 0 05)
В подгруппах больных была выявлена гипокоагуляция, обусловленная приемом анти-
коагулянтов непрямого действия Она проявлялась удлинением АВР, АПТВ, характери-
зующих общую коагуляционную активность и внутренний путь активации (за счет вли-
яния на фактор IX) и, конечно, увеличением МНО Однако при сравнении показателей
свертывающего звена гемостаза обеих подгрупп отчетливо выявлялась статистически
достоверная разница в уровне гипокоагуляции. Так, в подгруппе А степень гипокоагу-
ляции соответствовала рекомендуемому уровню МНО и была достаточна для больных
с двустворчатыми клапанами сердца
В подгруппе В, по сравнению с подгруппой А и, тем более, с контрольной группой
здоровых лиц, имелась тенденция к гипокоагуляции по всем проведенным парамет-
рам, но значения показателей коагулограммы у больных с искусственными клапанами
сердца находились на нижней границе референтных величин. Такой уровень значений
коагулологических тестов определяется как изокоагуляция для практически здоровых
лиц и является недостаточным для больных с искусственными клапанами сердца, пред-
расположенных к развитию тромбозов искусственных клапанов сердца и тромбоэмбо-
лических осложнений
В табл 6.12 отмечено также снижение концентрации фибриногена в обеих подгруп-
пах больных, более выраженное у пациентов подгруппы В, по сравнению с контрольной
группой здоровых лиц Причина гипофибриногенемии не может быть объяснена гемо-
дилюцией или снижением белково-синтетической функции печени Логичным объяс-
нением такого снижения концентрации фибриногена при нормальном его синтезе и
фоновой склонности к гиперфибриногенемии (ревматизм) может быть только его по-
требление в процессе внутрисосудистого тромбообразования
В нашем исследовании у больных с искусственными клапанами сердца мы выявили
тромбоцитопению и гипофибриногенемию, указывающих на повышение уровня посто-
янного внутрисосудистого свертывания (ПВС), несмотря на прием антикоагулянтов
непрямого действия и снижение общей коагуляционной активности по лабораторным
тестам in vitro. Это заставило нас искать изменения в противосвертывающей системе, а
также исследовать маркеры тромбинемии и активацию фибринолиза — плазминемию.
Как следует из табл 6 12, тест толерантности плазмы к гепарину (ТПГ), отражаю-
щий баланс между свертывающей и антикоагулянтной системами, был закономерно
удлинен в обеих подгруппах, причем достоверно и в большей степени в подгруппе
(Р 0,001) Активность AT-III была сохранена, а в подгруппе В, при недостаточной ги
но оагуляции на фоне приема АНД, достоверно снижена (р 0,001), хотя и остав
в пределах референтных величин для выбранного лабораторного метода ГОПП||Я
При сравнении показателя AT-III с контрольной группой больных с П°Р°* -
До операции установлено, что адекватная терапия антикоагулянтами _f(|
ствия у больных подгруппы А приводила к достоверному повышени непря-
(Р < 0,05) В то же время, при несбалансированной терапии антик0 АТ_щ даже п0
Мог действия (подгруппа В) имелось достоверное снижение активн
сравнению с его фоновым уровнем у больных контрольной гРУ^’б^ени^ эндогенных
Нарушения в свертывающем звене системы гемостаза, потреолен g По
антикоагулянтов сопровождались изменениями и в фи ринолр я разница в
оказателю лизиса эуглобулиновых фракций нами выявлена достоверно
состоянии плазминовой системы Так, у пациентов подгруппы В
(Р 0,001) повышена активация фибринолиза, по сравнени
399
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
пы А Причем в подгруппе А время эуглобулинового лизиса указывало на снижение фиб-
ринолитической активности, тогда как в подгруппе В имелось лишь 10 пациентов с ак-
тивацией фибринолиза. Возможно, это было связано с недостаточной информативно-
стью (чувствительностью) самого метода — времени эуглобулинового лизиса сгустка
или со значительным снижением количества фибриногена у больных подгруппы В, что
вносило ошибку в достоверность проводимого исследования.
Все вышеперечисленные изменения в системе гемостаза косвенно подчеркивают
риск возникновения тромбоза у больных с искусственными клапанами сердца на фоне
активации свертывания, несмотря на прием антикоагулянтов непрямого действия. Од-
нако для этого требуются прямые доказательства повышенной генерации тромбина —
повышения внутрисосудистого свертывания крови, агрегации тромбоцитов и тромбо-
образования Для этого необходимо исследование маркеров активации системы ге-
мостаза. Для идентификации тромбинемии мы исследовали повышение уровня высо-
комолекулярных производных фибриногена — комплексов фибрин-мономера с про-
дуктами расщепления фибриногена/фибрина (РФМК) с помощью паракоагуляционных
тестов и ортофенантролиновым методом.
Как следует из табл. 6 12, в подгруппе больных В положительные ПКТ регистриро-
вались у 73°о больных, а в подгруппе А — только у 5%. Так как известно, что ПКТ (эта-
ноловый, р-нафтоловый, протаминсульфатный) мало информативны из-за качествен-
ной оценки результатов, нами был применен паракоагуляционный ортофенантролино-
вый тест При определении ортофенантролиновым методом концентрация РФМК была
достоверно (р < 0,01) выше в подгруппе больных В, хотя концентрация РФМК в под-
группе больных А была также выше референтных величин для этого метода
Наиболее специфичным из методов выявления тромбинемии является определе-
ние в плазме больных D-димера — маркера, отражающего повышение свертывающего
потенциала крови. По частоте встречаемости положительного теста на D-димер (уро-
вень D-димера более 500 нг/мл) пациенты в подгруппах А и В различались с высокой
степенью достоверности (р < 0,001), — у 70/о больных подгруппы В было выявлено
наличие D-димера полуколичественным латексным методом против 15% в подгруппе А
Становится очевидным, что у пациентов подгруппы В имела место генерация тром-
бина с последующей активацией системы фибринолиза и появлением плазминемии.
Однако и в подгруппе А у ряда пациентов с МНО >2,0 имелись признаки повышенного
внутрисосудистого свертывания: регистрировался уровень D-димера выше 500 нг/мл
у 30 j больных D-димер, являясь более чувствительным и специфичным тестом, чем
паракоагуляционные тесты, чаще выявлял признаки тромбинемии и плазминемии в
подгруппе больных В. У 70% больных подгруппы В отмечалась активация фибринолиза
и турбидиметрическим экспресс-методом Следует отметить, что наиболее высокие
при н ки акт вации системы фибринолиза были выявлены у больных с низкой кон-
центрацией фибриногена (<2,0 г/л) и МНО (<1,7)
Можно также предположить, что у больных с искусственными клапанами сердца
основные нарушения гемостаза были связаны с локальным нарушением гемодинами-
ческих параметров обтекания в зоне протеза. Образование тромбов достоверно повы-
шается с увеличением скорости и величины сдвига, которые способны непосредственно
ктивировать тромбоциты, индуцировать высвобождение АТФ, АДФ, серотонина из
отиы гРанУл и приводить к агрегации тромбоцитов Такие нарушения структуры кро-
точ И Реологических свойств крови могут служить причиной прямой активации кле-
гриии^ЗВеНа гемостаза с последующим тромбообразованием и в отсутствии экзо-
нами ^^едования П0^твеРВДют циркуляцию у больных с искусственными клапа-
повышенная *Х ^ОрМ тР°мбоцитов с образованием агрегатов Возможно, именно
нии, но не служит Лп°СТЬ К ^ормированию малых агрегатов и ведет к тромбоцитопе
вания с развитием °пределенного времени источником массивного тромбообразо-
Р м озов искусственных клапанов сердца и тромбоэмболических
400
ГЛАВА 6. Результаты протезированияи клапанно-зависимые осложнение
осложнении Известно, что внутрисосудистое тромбообразование у больных с попона-
ми сердца на почве ревматизма или инфекционного эндокардита, не имеющих пооте-
за сердечного клапана связано как с активацией коагуляционного так и сосудисто
тромбоцитарного звена гемостаза (Грицюк А И. и др., 1994). В таком случае логично
предположить, что при появлении инородного тела (искусственного клапана) в каме-
рах сердца, где имеют место сложные потоки крови, разные скорости сдвига, застой-
ные зоны, отрывные течения, гемолиз, турбулентность, кавитация, где контакт с по-
верхностью клапана в отдельных участках сохраняется относительно долгое время
создаются условия для активации тромбоцитов. Исходя из этого, состояние тромбо-
цитов интересовало нас и потому, что они являются «первой линией обороны» систе-
мы гемостаза в условиях тромботической агрессии, которой, несомненно можно счи-
тать наличие искусственног клапана сердца. Метод морфофункциональной оценки
внутрисосудистой активации тромбоцитов (ВАТ) выявил существенные различия у боль-
ных с искусственными клапанами сердца при разной степени гипокоагуляции на фоне
приема антикоагулянтов непрямого действия.
Показатели внутрисосудистой активации тромбоцитов у больных подгрупп А и В
представлены в табл 6.13, из которой следует, что показатели ВАТ в обеих подгруппах
больных статистически достоверно отличались друг от друга Число тромбоцитов в под-
группе А составляло (209,58±10,12) • 109/л, в подгруппе В — значительно ниже (177,61 ±5 01) х
х 109/л, р< 0,001 Сумма активных форм тромбоцитов, число тромбоцитов, вовлечен-
ных в агрегаты, число малых агрегатов на 100 свободно лежащих тромбоцитов также
статистически достоверно превалировало в подгруппе В, по сравнению с подгруппой
А (р < 0,01; р<0,05).
Недостаточная степень гипокоагуляции у больных подгруппы В приводила к актива-
ции тромбоцитов, появлению активных форм в свободном кровотоке и формированию
агрегатов, которые при благоприятных условиях могли становиться «трамплином» для
последующей лавинообразной агрегации и тромбообразования
Можно также предположить, что еще более активный процесс происходил in situ.
Одновременно снижалось количество тромбоцитов в периферическом кровотоке Число
тромбоцитов колебалось от 501 109/л до 110 10/л в подгруппе больных А и от
275 1 09/л до 100 1 09/л в подгруппе В Количество тромбоцитов в подгруппе В нахо-
дилось на нижней границе референтных величин У отдельных пациентов в данной под-
группе регистрировалось снижение количества тромбоцитов даже до 100—110 1 09/л.
Обсуждая возможные причины тромбоцитопении у больных с искус ственными кла-
панами сердца, можно исключить ее продуктивный, гемодилюционныи или перерасп-
ределительный характер. У наших пациентов отсутствовало нарушение кроветворения
или дефицит витамина В (по результатам клинического анализа крови). После опера-
тивного вмешательства прошло более года и был восстановлен глобулярный о ъем
крови, среди больных не было лиц с низким гематокритом Отсутствие выраженной
сердечной недостаточности и спленомегалии исключало распределительную тром оци
топению. Поэтому единственным возможным объяснением снижения количества тром
боцитов может быть их потребление в ходе образования агрегатов или микросгустк
Тромбоцитопения потребления является результатом и ускоренной У™™1
Скорость компенсации новым пулом клеток тромбоцитов за счет их с03Ре®ан
НЬ1Х с искусственными клапанами сердца, по-видимому, недостаточна.ОМпгтатической
'Цируемые в «стрессовых условиях» тромбоциты обладаю ' TD0M_
эффективностью, — даже сниженное их количество не уменьшает Ри Такая тром-
боцитов в процессах тромбообразования при постоянном стимулирог' ’ Q С8ер_
боцитопения потребления может быть признаком постоянного внутр
Звания (ПВС), вышедшего за пределы физиологического уровня искусст-
Нарушения в тромбоцитарном звене гемостаза связа пгтяиление показателей
венного клапана сердца. Подтверждением этому служило соп контрольных
активности тромбоцитов у больных с искусственными клапанами сердца Р
401
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
Таблица 6.13
Показатели сосудисто-тромбоцитарного звена гемостаза у больных с искусст-
венными клапанами сердца Мединж-2 в отдаленные сроки наблюдения
(4,5±0>2 лет) при первичном обследовании, М±т
Показатель гемостаза L Основная группа (л = 68) Контрольная группа (больные с поро- ками сердца), л = 20 Контрольная группа (здоровые лица), л = 10
Подгруппа А (л = 22, МНО>2,0) Подгруппа В (л = 46, МНО<2,0)
Количество тромбоцитов, 109/л 209,58 ± 10.12 177,61 + 5,01 *5’ 225,42 ± 15,17 247,07± 17,93
Сумма активных форм тромбоци- тов, % 20,56±2,21*31 37,03±1.02*,|*4> 17,61 + 1,97 10,72±1,14
Количество тромбоцитов, вовлеченных в агрегаты, % 11,02+1,13*3> 13,42+2,З*’1*31 7,74+1,53 5,25±0,17
Число малых агрегатов на 100 свободных тром- боцитов 4,44+0,54 9,86±0,92*г'*5) 3,81±0,73 1,82±1,04
Число средних и больших агрега- тов на 100 сво- бодных тромбо- цитов 0,15±0,07*5) 0,21±0,05*5) 0,05±0,01 0.09+0,02
Степень агрега- ции, % (доза АДФ = 2,5 мкг/мл) 60,5 ± 8,4*4' 62,1 ± 12,2*5) 40,7 ± 5,8 35,3±6,1
Степень агрега- ции, % (доза АДФ = = 1,25 мкг/мл) 43,1 ± 10,7*31 49,5 + 11,5*4> 34,6 ± 5,6 30,12±6,7
Степень агрега- ции, % (доза АДФ = = 0,625 мкг/мл) 22,1 +7,1*31 26,3 ± 9,8*3) 16,5 ±4.7 5.32±2,35
Степень агрега- ции, % (доза АДФ = = 0,313 мкг/мл) 8.1 ± 2,5*3) 20.9 ± 8,4*г>*5» 5,15 + 2,1 —-
^0’05' 1Р < О’СИ статистическая достоверность отличий между подгруппами А и В
•^пЛеп пгиННЫХ больных с искусственными клапанами сердца, *3)р < 0,05, *4,Р < 0-01’
статистическая достоверность отличий с контрольными группами больных с
пороками сердца и здоровых лиц
402
ГЛАВА 6 Результаты протезирования И клзпанно.з.шисим,.^ лг
групп. Для сравнения мы выбрали подгруппу пациентов А с МН0>2 0 и наименьшими
отклонениями исследуемых параметров, а также более благополучную в части гипоко-
агуляции Как видно из табл 6.13, показатели ВАТ у больных подгруппы А статистичес-
ки достоверно отличались в большей степени от показателей контрольной группы здо-
ровых лиц в части суммы активных форм тромбоцитов (р< 0,001), числа тромбоцитов
вовлеченных в агрегаты (р< 0,001) и числа малых агрегатов тромбоцитов (р < 0,001)
Что же касается ВАТ у больных с искусственными клапанами сердца подгруппы А и
больных с пороками сердца до операции (вторая контрольная группа), то и здесь име-
лись отличия, хотя и в меньшей степени (р < 0,05; р < 0,01).
Как видно из табл 6 13, ВАТ у больных подгруппы В была выражена в большей сте-
пени, чем у больных подгруппы А при статистической достоверности различия относи-
тельно контрольных групп (р < 0,05; р < 0,001, р < 0,01) В то же время ВАТ у больных с
пороками сердца до операции (контроль) была также более выражена относительно
контрольной группы здоровых лиц и референтных величин (Шитикова АС и др., .1996).
Исследование ААТ на традиционном оптическом агрегометре также выявило отли-
чия в обследованных подгруппах: если при индукции дозой 2,5 мкг/мл степень агрега-
ции в обеих подгруппах больных почти не отличалась, то при индукции дозой АДФ 1,25
мкг/мл степень агрегации в подгруппе больных В была на 6,5%, а при индукции дозой
0,625 мкг/мл — на 9 8% выше, чем в подгруппе А, а доза 0,31 мкг/мл вызывала у этих
больных степень агрегации 20,9%.
Оценка ФАТ методом МУС выявила также значительные нарушения активации тром-
боцитов ни у одного из обследованных нами больных с искусственными клапанами
сердца показатели ЕС5 (74,5 ± 16,6), и V (40,4 ± 7.9) даже не приблизились к значе-
ниям контрольной группы, соответственно 191,2 ± 60,0 и 54,2 ± 5,6, р < 0,001 и р < 0,01,
что указывало на высокую чувствительность тромбоцитов к АДФ Статистически дос-
товерные изменения по всем показателям сосудисто-тромбоцитарного звена гемос-
таза данным методом отмечены также у больных подгруппы В.
Представленные показатели свидетельствуют о том, что даже в относительно бла-
гополучной подгруппе больных А, у которой были выполнены рекомендации по приме
нению антикоагулянтов непрямого действия и уровень гипокоагуляции находился в
соответствии с рекомендуемыми величинами МНО, активность тромбоцитов была су
щественно повышена не только по сравнению с контрольной группой здоровых лиц,
но и с пациентами контрольной группы с пороками сердца до операции и имеющими
ревматическое поражение клапанов
При имплантации искусственных клапанов сердца больным с ревматическими п
роками активация тромбоцитов усугубляется и наслаивается на повышенную ПР°К
гулянтную активность крови в случае неадекватного приема антикоагулянтовi непря
го действия При этом развивается тромбоцитопения, которая может bl^ RHVtdh-
только эффектом потребления тромбоцитов в ходе активации и о
сосудистых агрегатов — развитием распространенного или диссемини в ан.
Рисосудистого свертывания (ДВС) Это было доказано НераРми тромбине-
тикоагулянтном и фибринолитическом звене гемостаза, а пркомендуемых
мии И плазминемии Прием антикоагулянтов непрямого Действия в Р^ндуем^
Дозах уменьшает, но не устраняет полностью повышенную а
и предотвращает, по нашим данным, развитие тромбоцитопении v больных с
Таким образом, комплексный анализ показателей системы гемос ^отезирова_
искусственными клапанами сердца в отдаленные сро пампгп действия выявил
ния Папанов сердца на фоне приема антикоагулянтов непр а м звене Эти
признаки активации ПВС крови с преобладанием процесса в р р развиТию ло-
изменения свидетельствуют о потенциальной готовности эти ых ^^знов сердца
кальных тромбоэмболических осложнений и тромбозов иску_ призванные погасить
Протекторные свойства антикоагулянтов непрямого деи ’_ осложнений даже
процессы свертывания и защитить пациентов от тромбоэмболических
_________ 403 ---------
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
при правильно подобранной терапевтической дозе препаратов, в соответствии с меж-
дународными и российскими рекомендациями, не защищают больных с искусствен-
ными клапанами сердца от активации первичного гемостаза. Это подчеркивает необ-
ходимость дополнительного использования антиагрегантных препарс эв у больных с
искусственными клапанами сердца У значительного числа больных регистрировалась
тромбинемия. В случае несоответствия терапии антикоагулянтами непрямого действия
принятым рекомендациям и недостаточной степени гипокоагуляции у больных с искус-
ственных клапанами сердца усиливаются процессы ПВО и возникает состояние, кото-
рое может быть охарактеризовано как ПВС-3, или синдром ХДВС (Бокарев И.Н., 2000)
Полученные результаты явились основой для разработки программы обследования
и коррекции нарушений гемостаза у больных с искусственными клапанами сердца в
отдаленные сроки наблюдения. Исследование изолированного показателя МНО не по-
зволяет оценить степень развития ПВО у больных с искусственными клапанами серд-
ца, так как даже при правильно подобранной терапевтической дозе антикоагулянтов
непрямого действия у пациентов может быть выявлена активация как тромбоцитарно-
го, так и коагуляционного звена гемостаза. Поэтому для комплексной оценки состоя-
ния системы гемостаза нами предлагается алгоритм следующих лабораторных
методов для оценки ПВС-3: исследование МНО, подсчет количества тромбоцитов, оп-
ределение концентрации фибриногена, определение D-димера, показателей морфо-
функциональной активности тромбоцитов (сумма активных форм тромбоцитов, коли-
чество тромбоцитов, вовлеченных в агрегаты, число малых агрегатов). Фармакологи-
ческую коррекцию выявленного ПВС-3 нужно проводить в соответствии с уровнем и
степенью активации системы гемостаза, а адекватность лечения необходимо оцени-
вать с применением вышеперечисленных методов Своевременная диагностика ПВС-3
у больных с искусственными клапанами сердца в отдаленные сроки наблюдения по-
зволит снизить количество клапанно-зависимых осложнений (тромбозов искусствен-
ных клапанов сердца, тромбоэмболических осложнений), улучшить качество жизни и
отдаленные результаты протезирования клапанов сердца.
Таким образом, несмотря на идентичность подгрупп А и В, у больных подгруппы В в
80 о сохранялся высокий риск развития тромбозов искусственных клапанов сердца и
тромбоэмболических осложнений. Это связанно с неэффективностью традиционного
ам >улаторного наблюдения за данной категорией пациентов: отсутствие стандартизо-
ванных методик и индивидуального подбора терапии, редкий лабораторный контрол□
гемостаза (меньше 1 раза в 3 месяца), отсутствие активных вызовов больных и связи с
кардиохирургическим стационаром, отсутствие контроля за сосудисто-тромбоцитар-
ным звеном гемостаза и, наконец, недостаточная оснащенность лабораторий.
Ра раб тайная нами программа мероприятии, направленная на коррекцию сист
мы гемостаза у больных с искусственных клапанами сердца, была индивидуальна. Учи-
т । п шенную клонность искусственных клапанов сердца к тромбозам и тромбо
эмболическим осложнениям в раннем послеоперационном периоде из-за неустойчи-
вой гемодинамики, раневой поверхности эндокарда, отсутствия эндотелизации
ан еты и твенного клапана сердца при наличии дополнительных факторов риска
тромбоэмболических осложнений (тромб левого предсердия или ушка, тромбоэмбо-
лии ки! осложнения в анамнезе, инфекционный эндокардит, особенно с вегетация-
ми, кальциноз клапанов, синдром низкого сердечного выброса, мерцательная арит-
мия, многоклапанное протезирование) в реанимационном отделении на следующий
день после операции при отсутствии кровопотери по дренажам в 20 часов больному
ЮППП РЛвнутривенно вводился нефракционированный гепарин (НФГ) в дозе 5000-
tooSh Str°™тролем АПТВ’ второе было на 10 сек выше исходного 60,4±3,2 Кон-
значался^ОАКР6Же' Чем Через 6 часое в этот *е День в 18 чаС°° НЭ’
менялся и а Рфарин в дозе 5 мг (per os) На 2-е сутки после операции НФГ от
~о! "“Т низголекулярный гепарин (НМГ) - Клексан в дозе 40 мг
нь в 0 часов под контролем анти-Ха активности (0 23±0,02)
404
ГЛ A BA 6. Результаты протезирован», и клапанно-завнс^ые пс^и^
фоне НМГ больной продолжал получать Варфарин в дозе 5 мг в 18 часов ежедневно
до выхода МНО на уровень 2,5-3,5. После этого НМГ отменялся и больной получал
только Варфарин с поддержанием МНО в пределах 2,5-3,5. В реанимационном отде-
лении определение МНО производилось ежедневно.
При отсутствии перечисленных факторов риска тромбоэмболических осложнений
на следующий день после операции и без кровопотери по дренажам в 20 часов боль-
ному НФГ не вводился, а назначался НМГ (Клексан) в дозе 40 мг подкожно и Варфа-
рин в дозе 5 мг 1 раз в день (per os). На 2-е и последующие сутки антикоагулянтная
терапия проводилась идентично.
Необходимо отметить довольно высокую чувствительность больных к Варфарину в
раннем послеоперационном периоде, что отмечалось и другими авторами (Baker W. F.,
1998; Horskotte D. et al., 1993). Мы достигали терапевтического уровня МНО на 4-5-е
сутки после операции. Иногда в дальнейшем в динамике наблюдения за больными
приходилось увеличивать или уменьшать дозу Варфарина. Возможно, это было связа-
но с нарушением печеночной функции в ранние сроки после операции на фоне прове-
денного искусственного кровообращения, анестезии и лекарственной терапии.
Варфарин — оральный антикоагулянт из группы монокумаринов, широко использу-
ется для профилактики тромботических и тромбоэмболических осложнений у больных
повышенного риска. В США его принимают более 1 млн пациентов в год. С 2002 г. он
зарегистрирован в России и все чаще используется отечественными кардиологами и
кардиохирургами. К достоинствам Варфарина можно отнести низкую токсичность, хо-
рошую переносимость и всасывание в желудочно-кишечном тракте, длительный пери-
од полужизни в плазме крови, который обеспечивает стабильную гипокоагуляцию при
однократном ежедневном приеме (Бокарев И. Р. и др., 2000).
Варфарин метаболизируется в печени цитохромами семейства Р-450, преимуще-
ственно СУР2С9. От активности CYP2C9 зависит и концентрация Варфарина в плазме
и, соответственно, степень гипокоагуляции (Miners J. О. et al., 1998). Типичными суб-
стратами для CYP2C9, кроме Варфарина, являются нестероидные противовоспалитель-
ные средства, ингибиторы рецептора ангиотензина, противоэпилептические и антиди-
абетические препараты. Описаны случаи резкого повышения МНО и даже тяжелых кро-
вотечений у пациентов, которым на фоне приема Варфарина назначались другие
субстраты CYP2C9 (Mannucci Р. М., 1999). Следует отметить, что генетические поли-
морфизмы присущи практически всем белкам системы Р450. Ген CYP2C9 находится на
Ю хромосоме в районе 10q24.2 (Goldstein J. A. et al., 1994). В кодирующей части гена
к настоящему времени идентифицировано шесть структурных полиморфизмов. Для бе-
лой расы наиболее частыми являются две миссенс-мутации: CYP2C9 2 и CYP2C9 3.
Каталитическая активность ферментов, кодируемых CYP2C9*2 и CYP2C9*3, снижена как
/л vitro, так и in vivo, причем это снижение более значительно для CYP2C9 3. В настоя
щее время получены первые данные о частоте встречаемости полиморфизмов гена
CYP2C9 в российской популяции: дикий тип (генотип *1*1) — 67,7%, генотип
16,1%, генотип *1*3 - 12,9%, генотип ‘2*2 и *2*3 - 2,2% и 1,1%, соответственно
(Pchelma S. N. et al., 2005). *
Нами были выявлены существенные отличия в чувствительности к Варфарину о
ных с искусственными клапанами сердца при анализе групп с различнымi г
CYP2C9. Носители *2 и *3 аллелей имели отчетливо выраженную тенд ц
шению сроков достижения терапевтического уровня МНО и нуждались и ии
меньшей недельной дозе Варфарина для его поддержания (та л. .
У лиц с генотипом *1*3 была короче, по сравнению с диким типом, более мем^раж
высокой степенью достоверности. Нами отмечен также неста ильн носителей
колебания МНО при малейшем изменении дозы Варфарина у °ль
2 и *3 аллелей. Наши данные совпадают с результатами исследовзни
авт- (1999), М. Margaghone и соавт. (2000), J. Taube и соавт. {2000). A. R Tabr
(2002), F. Peyvandi и соавт. (2003), отмечающих необходимость
405
ИСКУССТВЕННЫЕ КЛАЛ АНЫ СЕРДЦА
Таблица 6.14
Зависимость длительности фазы индукции и поддерживающей дозы
Варфарина у больных с искусственными клапанами сердца Мединж-2
от структурных полиморфизмов гена СУР2С9 в отдаленные сроки
наблюдения (4,5±0,2 лет) при первичном обследовании, М±т
Генотип N Длительность фазы индукции, дни Поддерживающая доза Варфарина, мг/нед
Дикий тип СУР2С9*1*1 Носители аллелей *2 или *3 Генотип СУР2С9*1*3* Р\-2 р 1-3 30 7 3 5,47±0,65 3,14+0,94 1,67+0,67 0,057 0,012 42,85±2,80 30,54±3,70 23,33±5,83 0,033 0,027
* Критерий достоверности различий по U-тесту Манн-Уитни
фарина для достижения терапевтического уровня МНО и недельной поддерживающей
дозы для носителей *2 и *3 аллелей.
Таким образом, сопоставление показателей МНО и генотипов CYP2C9 показывает
тесную взаимосвязь дозирования Варфарина со структурными полиморфизмами гена
CYP2C9. Учитывая высокую частоту встречаемости двух мутантных аллелей СУР2С9*2
и *3 в популяции и среди больных с искусственными клапанами сердца и возможность
прогнозирования реакции на прием Варфарина в зависимости от генотипа, представ-
ляется целесообразным предварительное генотипирование пациентов с искусствен-
ными клапанами сердца, которым планируется антикоагулянтная терапия Варфарином.
Это позволит сделать длительную антитромботическую защиту у больных с искусст-
венными клапанами сердца более безопасной и эффективной.
Биологические клапанные протезы менее тромбогенны, чем механические и не тре-
буют длительной антикоагулянтной терапии, если пациенты не относятся к группе вы-
сокого риска развития тромбоэмболии или не имеют в анамнезе тромботических ос-
ложнений, связанных с протезом (David Т. Е. et al., 1985). Линеарные показатели раз-
вития тромбоэмболических осложнений для пациентов с каркасными биопротезами
составляют 0,5-1% пациенто-лет (David Т. Е. et al., 1998; Glower D. D. et aL, 1998). Этот
риск меньше у пациентов с бескаркасными биопротезами (Dellgren G. et al., 2002), см.
табл. 6.11. Антикоагулянтная терапия у пациентов с биопротезами в течение первых 3
месяцев после операции варьирует в различных клиниках. Существует повышенный
риск развития тромботических осложнений до эндотелизации контактных поверхнос-
тей (Heras М. et al., 1995). Согласно последним рекомендациям АСС/АНА, уровень МНО
у пациентов с клапанными биопротезами в митральной или аортальной позиции дол-
жен составлять 2-3 в течение первых 3 месяцев после операции (Hirsh J. et al., 2003).
При отсутствии риска тромбоэмболии через 3 месяца после вмешательства терапия
прекращается. Монотерапия малыми дозами аспирина у пациентов в группе низкого
риска и в сочетании с Варфарином в группе высокого риска продолжается пожиз-
ненно Выживаемость пациентов с биопротезами в группе высокого риска, получаю-
щих комбинированную терапию аспирином и Варфарином выше по сравнению с мо-
нотерапией Варфарином (АСС/АНА, 1998). В настоящее время выбор искусственно-
го клапана сердца или биопротеза является предметом дискуссий и схематически
представлен на рис. 6.9.
Проведение антиагрегантной терапии с помощью аспирина значительно снижает
1оой?^ВИ™Я тромбоэмболии у пациентов в группе низкого риска (Goldsmith I. et al.,
пациентов с выявленными на предоперационном этапе факторами риска раз
--------- 406 -----------------------------------------------——
ГЛАВА 6 Результаты протезирования и клапанно-зависимые осложнения
Рис. 6.9. Выбор механического искусственного клапана сердца и
в зависимости от возраста пациента (по S. Z. Park et al., 2000)
биопротеза
тромбоза целесообразно оеоользо.ать "рз^ВаХ»-
возможности коррекции этих факторов, так как тезами будет необходима ло-
ном в послеоперационном периоде у больных с б^Р0Т®Х0Хми"риск развития
жизненно. При использовании аспирина у пацие , антикоагуляции у больных
тромбоэмболии такой же, как и при использовании г« рТе ^сДнА, 1998).
с механическими протезами, но кровотечения н рпапией чаще наблюдаются со
Кровотечения, обусловленные антикоагулянтной
стороны пищеварительной, урогенит^Н°^ антикоагулянтных геморрагий с различ-
коррелируют с МНО. Линеарные показа TO_nR R зависимости от степени гипоко-
ными типами механических клапанов и и прот колеблются в широких пределах
агуляции, частоты контроля параметров м т Такой значительный разбро
0-6,4% пациенто-лет (Meschengieser S. . ными авторами, труднообъясним,
линеарных показателей, представленный мн иповни гипокоагуляции и факторы
так как в ряде сообщений не приводятся у больных уровни
Риска. м активацию тромбоцитов у больных с
Учитывая повышенную адгезию, агрегац я Теоапия проводилась каждому
ревматическими пороками сердца, антиагрега_ , рин 75-100 мг/сут) В после
больному еще перед оперативным вмешательст япитмии тромбоэмболических ос
операционном периоде при наличии мерцательн тромбофилиях больным с ИСКУ^
ложнений в анамнезе, генетически обу ловл анная терапия антикоагулян
венными клапанами сердца назначалась ком мг/сут. Известно, что лечени
непрямого действия с аспирином (АСК) в А использованием АСК в оптима
профилактика тромбоэмболических осложнен антитромбоцитарного в
Рекомендуемых дозах является адекватным спос^ и смертности боль-
ствия и приводит к значительному сокращению заболев d Е et аЦ 1992,
ных от тромбоэмболических осложнений ( ит ппйЯН е
Hayashi J. I. et al., 1994). партся ацетилирование и ингибирование
Основным механизмом действия АС яв ферментов простаглан
ииюю«С„геназы - СОХ (Awrtr, Е. Н., “"X» ’“"TToS'X»
боксанового пути. Причем активность С°><-1, '^°Рпочках, в моноцитах), подавля
тромбоцитах и в других клетках организма 1
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
в 2 раза сильнее, чем активность СОХ-2, которая имеется в большинстве ядерных кле-
ток и активируется эндотоксинами, воспалительными стимулами, цитокинами, факто-
рами роста, стимуляторами опухолей.
Тромбоциты не могут синтезировать СОХ-1 и остаются неактивными в течение все-
го периода жизни (7-10 дней) Поэтому ингибиция СОХ-1 тромбоцитов является ос-
новным направлением антитромботического действия аспирина, который в низких до-
зах (50-120 мг/сут) необратимо ацетилирует Туг385 и Ser530 По другим данным, един-
ственная доза в 160 мг может полностью подавлять активность СОХ-1 циркулирующих
тромбоцитов, как и 30-50 мг при ежедневном приеме в течение 7-10 дней (Bennet J S.
et al., 2001)
Активация клеток при приеме АСК не устраняется полностью, так как не прерыва-
ется фосфатидилинозитольный и тирозинкиназный пути передачи сигнала, поэтому не
блокируются эффекты сильных агонистов больших доз тромбина и коллагена, которые
стимулируют тромбоциты независимо от циклооксигеназного пути (Шитикова А. С.,
2003). АСК снижает раннюю цитоскелетную реорганизацию тромбоцитов и, следова-
тельно, развитие доступности рецепторных мест в GPIIb/llla, стабилизацию в нем фиб-
риногена, вмешивается в систему ингибиции тромбоцитов оксидом азота, снижает
образование тромбина на фосфолипидной поверхности кровяных пластинок и тромбо-
цитарной пробке, а при дозе 300 мг/сут — и в плазме, предотвращает окисление фиб-
риногена Так, 100 мг/сут АСК оказались эффективными для профилактики тромбозов
у больных с искусственными клапанами сердца (Awrtry G Р., 2000).
Необходимо учитывать, что у отдельных пациентов имеется относительная или вы-
раженная резистентность к АСК, которая проявляется в неспособности этого антитром-
боцитарного препарата предотвращать тромботические процессы Резистентность к
аспирину отмечается у 14-70% больных, что зависит как от дозы применяемого пре-
парата, так и от метода оценки сосудисто-тромбоцитарного звена гемостаза Больные
с тромбоэмболическими осложнениями, тромбоциты которых плохо реагируют на при-
ем АСК, имеют худший прогноз (Шитикова А. С., 2003). Резистентность к аспирину
может быть обусловлена повышением его гидролиза в крови, включением альтерна-
тивных путей активации тромбоцитов, а также при экспрессии тромбоцитарной СОХ-2,
что может быть при увеличении тромбопоэза и воспалении
Таким образом, подбор дозы аспирина у больных с искусственными клапанами сер-
дца представляет собой серьезную клиническую проблему, так как реакция больного
на аспирин может изменяться, а терапия антиагрегантами у больных при наличии, на-
пример, фибрилляции предсердий или поражения коронарных артерий проводится
постоянно Очевидно, что у больных с искусственными клапанами сердца необходим
постоянный клинико-лабораторный мониторинг аспирина и подбор индивидуальной
эффективной дозы в ежедневной практике.
В настоящее время можно выделить две группы методов для проведения лабора-
торного мониторинга за аспиринотерапией В первую группу можно включить тесты,
которые характеризуют биохимические последствия ингибиции СОХ, то есть снижение
активности самой СОХ и количества генерируемых PGG2, PGH2, ТХА2, повышение уров-
ней метаболитов липоксигеназного пути, а также соотношения конечных продуктов
простагландинового пути в сосудах, эндотелии и тромбоцитах. Однако данные методы
малодоступны и дороги (Кадинская М. И , 2004)
Ко второй группе относятся тесты, отражающие эффект аспирина на функциональ-
ные финальные реакции первичного гемостаза в организме Но они отличаются по чув-
ствительности и доступности. Так, длительность кровотечения можно использовать,
в основном, для угрозы повышенной кровоточивости, особенно при приеме больших
доз АСК Метод проточной флюорометрии с применением флуоресцентных маркеров
мембранной стимуляции из-за своей дороговизны также не может широко использо-
ваться в ежедневной практике лабораторий Фотометрическое исследование агрега
ции тромбоцитов оказалось менее чувствительным в отношении установления повы-
ГЛАВА 6 ^>езУльт’аты пРотезирования и клалзя^о-эаа>ЮимА/е ОГПЛ||<м<>мип
шенной активации тромбоцитов (Шитикова А. С„ 2003), как и метод основанный на
принципе светорассеяния.
С практической точки зрения, для контроля за аслиринотерапией у больных с ис-
кусственными клапанами сердца мы рекомендуем более простой и досг/пный метод -
исследование морфофункциональной активности тромбоцитов, характеризующий внут-
рисосудистую активацию и агрегацию тромбоцитов, так как изменение морфологичес-
кой формы тромбоцитов является чувствительным способом оценки ранних фаз их
активации (Белязо О. Е. и др., 2001, Шитикова А С., 2001)
Снижение процента дискоцитов и увеличение доли активных форм в цельной крови
обнаруживают при ДВС, при апластической и пернициозной анемиях и др. При приме-
нении данного морфофункционального метода установлено, что и у здорового челове-
ка в циркулирующей крови небольшая часть тромбоцитов активирована (Шитикова А. С ,
2001). Однако в патологических условиях изменение именно этого показателя оказа-
лось более чувствительным при оценке внутрисосудистой активации кровяных пласти-
нок. по сравнению с индексом внутрисосудистой агрегации, содержанием в бестром-
боцитарной плазме p-тромбомодулина и ф4, а также с данными исследования индуци-
рованной агрегации in vitro
При патологии, приводящей к активации тромбоцитарного звена гемостаза, в кро-
вотоке увеличивается не только доля тромбоцитов с измененной формой, но и возра-
стает количество внутрисосудистых агрегатов (Awrtry Е. Н , 2000) Применение этого
метода при мониторинге терапии аспирином для профилактики тромбоэмболических
осложнений позволило нам подбирать индивидуальную эффективную дозу препарата
и предотвращать возникновение осложнений у больных с искусственными клапанами
сердца. Следует отметить, что сегодня возможно применение и других антиагреган-
тов — производных тиенопиридина (тиклид, плавике — клопидогрель) Они подавляют
АДФ-индуцированную агрегацию тромбоцитов, влияя на их рецепторы P2Y12 Однако
применение тиклида в нашей практике было ограничено возникновением возможных
нежелательных побочных эффектов (нейтропения вплоть до развития агранулоцитоза)
и дороговизной плавикса Небольшое число наблюдений в нашей практике не дает ос-
нований сделать заключение о целесообразности применения этих препаратов у боль-
ных с искусственными клапанами сердца.
При выявлении у пациентов ПВС-3 с активацией сосудисто-тромбоцитарного и/или
коагуляционного звена гемостаза проводилось лечение, направленное на снижение
активности процессов свертывания Терапия включала в себя коррекцию терапевти
ческой дозы антикоагулянтов непрямого действия при недостаточном уровне ,
назначение 100-125 мг/сут АСК при выявлении активации тромбоцитарного звена и
применение лечебных доз НМГ (Клексана) при активации коагуляционного звена и на-
личии признаков тромбинемии л 99 н. |У
Показатели гемостаза до и после коррекции в динамике исследов нь у
подгрупп А и В с ПВС-3, госпитализированных в клинику госпитальной хирур -
СПбГМУ им. акад И П Павлова и включенных в основную группу наблюдения Эффек-
тивность проводимой терапии оценивалась через 14 24 дня от начал кониентоация
Дующим лабораторным показателям: МНО, количество тром оци L число
фибриногена, выявление D-димера, количество активных форм тр
тромбоцитов, вовлеченных в агрегаты, число малых агрегатов (таi л _ непрямого
к« видн0 „ та6л 6 15. „ „да „„„да™
Действия, АСК и НМГ у обследованных больных с ЛВС 3 связи с увеличени-
жительная динамика и нормализация лабораторных показател _ ского уровня
ем протромбинового времени достоверно увеличивалось до_т шапось КОЛичество
значение МНО (р < 0,05), из-за снижения тробинемии и В тромбоцитов
тромбоцитов (р < 0,05); почти в 2 раза снижалась сумма акт * ^акже числ0 ма.
лых 0,0011 И Число тРомбоцитов, вовлеченных в агрегаты (р^ л'иквидацией троби-
Ь1Х агрегатов (р < 0 01) К моменту окончания лечения
_____ 409 ------—
ИСКУССТВЕННЫЕ КЛАПАНЫСЕРДЦА
Та б ища 6 15
Динамика показателей гемостаза у пациентов с механическими
искусственными клапанами сердца Мединж-2 в отдаленные сроки
наблюдения (4,5±0,2 лет) при комплексном лечении ПВС-3 (п = 22), М±щ
Показатели гемостаза До лечения После лечения
МНО Количество тромбоцитов -109 /л Концентрация фибриногена, г/л Сумма активных форм тромбоцитов, % Количество тромбоцитов, вовлеченных в агрегаты, % Число малых агрегатов на 100 свободно лежащих тромбоцитов D-димер, % 2,13±0,19* 176,41±10,32* 2,72±0,14 25,02±2,12*** 16,83±2,66** 7,94±1,09** 52*** 2,61±0,19 197,45+6,63 2,73+0,08 14,30±1,07 7,46+1,39 4,07±0,87
*р < 0,05, ** р < 0.01; *** р < 0.001 — статистическая достоверность различий показателей до и
после лечения
немии D-димер не определялся Достоверных изменений концентрации фибриногена
выявлено не было
Для более детального анализа изменений в системе гемостаза при лечении боль-
ных с ПВС-3 22 пациента были разделены на две подгруппы: в подгруппе С (л = 11)
имела место активация только тромбоцитарного звена гемостаза, в подгруппе D (л - 11)
регистрировалась активация тромбоцитарного и коагуляционного звена гемостаза и
имелись признаки тромбинемии
В подгруппе больных С проводилась коррекция гемостаза подбором терапевтичес-
кой дозы антикоагулянтов непрямого действия с добавлением 100-125 мг/сут АСК
Результаты исследования представлены в табл 6.16
Как видно из табл 6 16, показатель МНО увеличивался и достигал терапевтическо-
го интервала (р < 0,05) В ходе терапии почти в 2 раза уменьшались показатели акти-
вации тромбоцитарного звена сумма активных форм тромбоцитов, тромбоцитов, вов-
леченных в агрегаты и количество малых агрегатов (р < 0,001) Выявлялась отрицатель
ная корреляция снижение МНО приводило к активации тромбоцитарного звена —
увеличивалась сумма активных форм тромбоцитов (г= -0,54; р<0,05), число тромбо-
цитов, вовлеченных в агрегаты (г= -0,67, р<0 05), число малых агрегатов (г = -0,59,
р < 0,05) Имелась положительная корреляционная связь между количеством тромбо-
цитов и суммой их активных форм (г = 0,60, р<0,05)
В связи с этим, при ПВС-3 с активацией только тромбоцитарного звена гемо та
лечение было направлено не на увеличение количества тромбоцитов, а на сниж ни э
их активности Так, после проведенного лечения АСК и коррекции терапевтической дозы
ОАК отрицательная корреляционная связь между уровнем МНО и показателями акти
вации тромбоцитарного звена сохраняла свое значение, увеличение МНО сопровож-
далось снижением суммы активных форм тромбоцитов (г = -0,67, р < 0,05), числом
тромбоцитов, вовлеченных в агрегаты (г =-0,54, р < 0 05) числом малых агрегатов
0,61, р 0,05) Связь между количеством тромбоцитов и суммой их активных форм
стала недостоверной
При наличии признаков активации всех компонентов системы свертывания у паци
ентов подгруппы D проводилась терапия, направленная, в первую очередь, на умень
шение или ликвидацию тромбинемии С этой целью использовался НМГ (Клексан) 6
дозе от 20 до 40 мг/сут Одновременно проводилась и коррекция терапевтической дозы
410 ------------------------ —---------------------------
ГЛ A BA 6 Результаты протезирован»,, и клаланно-зависимыР осложнения
Динамика показателей гемостаза у пациентов с ПВС-3 подгруппы С
с механическими искусственными клапанами сердца Мединж-2
в отдаленные сроки наблюдения (4,5±0,2 лет) с активацией тромбоцитарного
звена гемостаза при лечении ОАК и АСК (п = 11), М±т
Показатели гемостаза До лечения После лечения
МНО Количество тромбоцитов, 109/л Концентрация фибриногена, г/л Сумма активных форм тромбоцитов, % Количество тромбоцитов, вовлеченных в агрегаты, % Число малых агрегатов на 100 свободно лежащих тром- боцитов D-димер, % 2,19 ±0,33* 197 82 ±16,21 2 51 ±0,16 24,05 ±2,06" 12,96±1,50’" 6,49±0,69"* 0 2,53±0 23 207,36±9,87 268±0 15 14,09±0,96 5 82±0 60 3 18±0,32 0
’ р < 0,05 ** р < 0,01; *** р < 0,001 — статистическая достоверность различия показателей до и
после лечения
антикоагулянтов непрямого действия Уменьшение тромбинемии способствовало сни-
жению ВАТ, а дополнительное назначение АСК в дозе 100-125 мг/сут приводило к нор-
мализации ВАТ Данные исследования представлены в табл 6 17.
Достижение терапевтического уровня МНО (р<0,01) характеризовало степень ан-
титромботической защиты и было основным условием успешной коррекции всех нару-
шений в системе гемостаза Снижение уровня тромбинемии способствовало нормали-
зации количества тромбоцитов за счет уменьшения их потребления, а одновременное
назначение АСК приводило к улучшению показателей ВАТ
В связи с тем, что недостаточный коагуляционный потенциал крови у больных под-
группы D приводил к развитию тромбинемии при корреляционном анализе показате
Таблица 6 17
Динамика показателей гемостаза у пациентов подгруппы
с механическими искусственными клапанами сердца Мединж в отдал н
сроки наблюдения (4,5+0,2 лет) при активации тромбоцитарног м+
и коагуляционного звена гемостаза; лечение АНД, АСК и (н___»
Показатели гемостаза До лечения После лечения
МНО Количество тромбоцитов, -109 /л Концентрация фибриногена г/л Сумма активных форм тромбоцитов % Количество тромбоцитов, вовлеченных в агрегаты, % ^исло малых агрегатов на 100 свободно лежащих тром- боцитов D-димер, % 2,08+0,21 154.55 +9.54** 2.93±0,21 26.00±3,80*' 20 70±4,93 9 38±2 02* 100*** 2 68±0 30 187 55±8 21 2 79±0 07 14 50+1 98 9 09±2 68 4.96±1 11 0
Р 0,05, ** р < о 01 *** р< 0.001 — статистическая достоверность разли после лечения показателей до и
411
И С К У С С Т ВЕННЫЕ КЛАПАНЫ СЕРДЦА
лей гемостаза до начала лечения, была выявлена отрицательная корреляционная связь
между снижением уровня МНО и D-димером -0,68; р< 0,05). В то же время име-
лась положительная корреляционная связь между МНО и числом тромбоцитов (г = 0,53;
р < 0,05)
Повышение уровня фибриногена в крови является известным фактором риска раз-
вития тромбообразования (Аверков О В. и др., 1997) В случае наличия искусственно-
го клапана сердца активация коагуляционного гемостаза и тромбинемия ведут к внут-
рисосудистому свертыванию и потреблению фибриногена, что проявляется снижени-
ем его концентрации в плазме, а одновременная активация тромбоцитов в результате
тромбинемии, гемолиза и др., по-видимому, приводит к парадоксальной корреляции
между уровнем фибриногена и ВАТ Поэтому снижение количества фибриногена отри-
цательно коррелировало с активацией тромбоцитарного звена — повышалась сумма
активных форм тромбоцитов (г = -0,56; р<0,05), увеличивалось число тромбоцитов,
вовлеченных в агрегаты (г = -0,62; р < 0,05), число малых агрегатов (г = -0,52; р < 0,05)
При ПВС-3 с активацией тромбоцитарного и коагуляционного звена гемостаза у
больных подгруппы D снижение уровня МНО приводило также к появлению маркера
тромбинемии (D-димера), признаков коагулопатиии потребления — снижению количе-
ства тромбоцитов, а их активация сочеталась с уменьшением концентрации фибрино-
гена. После проведенной коррекции терапевтической дозы антикоагулянтов непрямо-
го действия, введения НМГ с использованием малых доз АСК все корреляционные связи
параметров гемостаза у больных с искусственными клапанами сердца стали недосто-
верными
Таким образом, выявленные корреляционные связи гемостаза подтвердили тесную
взаимосвязь степени антитромботической защиты, уровня тромбинемии, реакции по-
требления, состояния тромбоцитарного звена гемостаза и коррекцию этих нарушений
в ходе комплексной терапии Недостаточная антикоагулянтная терапия проявлялась
снижением уровня МНО ниже значений, рекомендуемых зарубежными и отечествен-
ными хирургами и кардиологами для механических двухстворчатых искусственных кла-
панов сердца для лиц с протезом митрального клапана 2,5-3,5, для больных с проте-
зом аортального клапана при отсутствии дополнительных факторов риска тромбооб-
разования — 2-3
В этой ситуации инактивация витамин К-редуктазы приводит лишь к частичному
переводу факторов II, VII, IX и X в PIVKA. Значительная часть этих прокоагулянтов цир-
кулирует в кровотоке в виде активных форм Это позволяет им участвовать в процес-
сах внутрисосудистого тромбообразования, инициируемого наличием инородного тела
в камерах сердца Активация системы гемостаза приводит к образованию ключевого
фермента свертывания крови — тромбина Тромбин, являясь многофункциональным
белком, запускает процессы активации тромбоцитов и фибринообразование В резуль-
тате активируется внутрисосудистое свертывание, которое приводит к потреблению
фибриногена и тромбоцитов. Степень активации недостаточна для развития острого
синдрома ДВС, так как часть факторов внешнего пути свертывания все же синтезиру-
ется в виде PIVKA
Тромбинемия у больных с искусственными клапанами сердца всегда свидетельствует
об активности процессов свертывания и выходе этих процессов за пределы /л situ.
Лабораторное выявление тромбинемии — одна из основных задач, решение которой
позволяет объективно характеризовать предтромботические состояния Основной за-
дачей коррекции нарушений гемостаза у больных с искусственными клапанами серди3
является устранение тромбинемии, если она выявлена в момент обследования
Важнейшее значение в этом случае имеет обнаружение D-димера При наличии
Д димера недостаточно только увеличивать дозу антикоагулянтов непрямого действия^
так как патофизиологическая цепочка реакций уже запущена, и разорвать порочный
круг возможно лишь активным купированием тромбинемии В этом случае анти-Ха ак-
тивность препаратов НМГ позволяет делать это с максимальной безопасностью при
412
_________ГУ7ДВЛ 6 Результаты протезирован,,, и клапанно-зависимые осложнения
достаточной эффективности Одновременный подбор оптимальной терапевтической
дозы антикоагулянтов непрямого действия на фоне введения НМГ окончательно ‘-га
сит» тромбинообразование Снижение уровня тромбинемии уменьшает индуцирующее
влияние тромбина на тромбоциты, и лишь добавление к терапии АСК позволяет не
только предотвратить их потребление, но и нормализовать количество активных внут-
рисосудистых форм Адекватность выбранного пути коррекции подтверждается исчез-
новением корреляционных связей между степенью антитромботической защиты и ак-
тивностью внутрисосудистого тромбообразования.
Антикоагулянтная терапия у детей и пожилых лиц проводится по тем же принци-
пам, однако необходимо учитывать возрастные, поведенческие и личностные особен-
ности пациентов (подвижность, невнимательность детей, недооценка ими опасности
повреждений, повышенная травматизация, забывчивость пожилых, наличие сопутству-
ющей патологии и терапии, склонность к кровотечению и т д.)
Во время беременности прием антикоагулянтов непрямого действия противопока-
зан, так как возможно их эмбриотоксическое действие с развитием патологии костной
ткани и центральной нервной системы. При наступлении беременности антикоагулян-
ты непрямого действия должны быть немедленно заменены на НФГ или НМГ гепари-
ны. Указанные препараты должны быть подобраны по удлинению АПТВ/АЧТВ в 1,5-2
раза и по уровню анти-Ха активности За 12-24 часа до планового родоразрешения
гепарины отменяют
Пациентам с искусственными клапанами сердца, получающим антикоагулянты не-
прямого действия, в случае выполнения инвазивных процедур за 4-5 дней до опера-
ции дозировку антикоагулянтов непрямого действия снижают до МНО — 1,5, а за 2-3
дня до операции антикоагулянты непрямого действия отменяют и назначают терапев-
тические дозы НМГ с их отменой за 12-24 часа до операции Такая тактика ведения
больных с искусственными клапанами сердца с обязательной комплексной оценкой си-
стемы гемостаза не реже одного раза в 2 месяца позволила нам избежать развития
тромбозов искусственных клапанов сердца и тромбоэмболических осложнений в тече-
ние 5 лет наблюдения
Важное значение в проведении контроля терапии антикоагулянтами непрямого дей-
ствия имеет организация работы лаборатории. При амбулаторном наблюдении опти-
мальным является обследование таких больных в утренние часы со срочной выдачей
результатов анализа Необходимо сразу после получения результата дать пациенту
рекомендации по коррекции дозы антикоагулянтами непрямого действия, зафиксиро
вать значение МНО и рекомендуемую дозу Варфарина в карте и назначить срок следу-
ющего исследования Это может сделать специально подготовленный для приема та
кого рода больных врач общей практики, терапевт-кардиолог или компетентный врач
клинической лабораторной диагностики. В следующее посещение ольнои при н
чии информации в его карте наблюдения за приемом антикоагулянтов нелрямог
ствия может быть также консультирован любым из названных специалисте _ пппр_
ведении терапии антикоагулянтами непрямого действия необходимо со
деленные правила . m гтан-
1 Терапия антикоагулянтами непрямого действия (Варфарин) лыть не_
дартной дозы препарата, указанной производителем' витамина
сколько меньше у тех пациентов, у которых есть предпось дл поиема кон-
К (нарушение желчеотделения и всасывания в кишечнике^нео х препарат при-
курирующих препаратов, наличие *2 и *3 аллелей в гене
нимается 1 раз в сутки в 16-20 часов „ацргпазу Первые 24-
2 Действие антикоагулянтов непрямого действия лроявля синтезированные
36 часов в крови продолжают циркулировать факторы их п0лужизни Для
печенью до начала лечения Латентный период зависит о Р й Также Отсро-
Достижения максимального эффекта может понадобиться отмены препаратов
ченно идет и восстановление активности прокоагулянтов после отмене
413
И С К У С С ТВЕНКЫЕ КЛАПАНЫ СЕРДЦА________________________________
Терапия антикоагулянтами непрямого действия не дает эффекта «на кончике иглы» и
не является быстро управляемой. Продолжительность лечения зависит от состояния
больного В случае передозировки препарата антикоагулянты непрямого действия не-
обходимо отменять сразу, не снижая дозы.
3 Исследование протромбинового времени и расчетных показателей МНО при те-
рапии антикоагулянтами непрямого действия выполняется в венозной крови с соблю-
дением всех правил проведения доаналитического этапа: кратковременное наложение
жгута* нетравматичный забор венозной крови самотеком в пластиковую пробирку или
в вакуумную систему, исследование крови не позднее, чем через 4 часа после ее взя-
тия Первое исследование МНО необходимо выполнить не позднее, чем через 36 ча-
сов после приема Варфарина
4 Во время подбора дозы препарата МНО определяется не реже 1 раза в 1-2 дня
до тех пор, пока не будет достигнут его необходимый уровень и два следующих друг
за другом результата не будут одинаковыми. Далее исследование выполняется 1 раз в
неделю, а после 1 месяца стабильности — 1 раз в месяц или даже раз в 2 месяца
5 . В ряде случаев может потребоваться внеочередное определение МНО — при
уменьшении поступления витамина К из кишечника (диарея, голодание, прием анти-
биотиков и др ) или использовании препаратов, конкурирующих с Варфарином за ци-
тохром СУР2С9, в первую очередь нестероидные противовоспалительные средства и
ингибиторы рецепторов к ангиотензину.
Протромбиновое время не отражает в полной мере воздействие антикоагулянтов
непрямого действия на коагуляционный гемостаз, так как не позволяет оценить содер-
жание витамин К-зависимого фактора IX. Поэтому у пациентов необходимо периоди-
чески определять АПТВ, которое в случае приема антикоагулянтов должно удлиняться,
но не более, чем в 2 раза Большее увеличение АПТВ чревато геморрагическими ос-
ложнениями. Определение АПТВ в течение первого месяца терапии необходимо соче-
тать с исследованием МНО — 1 раз в неделю. Далее АПТВ исследуется каждые 1-1,5 ме-
сяца Для пациентов с искусственными клапанами сердца сочетанная терапия антико-
агулянтами и антиагрегантами для профилактики тромбоэмболий должна быть
использована при наличии дополнительных факторов риска — большие размеры ле-
вого предсердия, низкая фракция выброса, фибрилляция предсердий и др (табл. 6 18)
В лаборатории клинической гемостазиологии Центра лабораторной диагностики
СПбГМУ им акад. И. П. Павлова в период с ноября 2002 г. по настоящее время наблю-
дались и продолжают наблюдаться 162 больных, получающих длительную антитромбо-
тическую профилактику Варфарином, в том числе 51 пациент с искусственными кла-
панами сердца Из всех наблюдаемых пациентов 88 начали антикоагулянтную терапию
в клиниках университета, у 72 пациентов осуществлялся контроль над приемом препа-
рата АНД, доза которого была определена в других учреждениях Исследование про-
тромбинового времени и расчетных показателей МНО определялось в венозной крови
с соблюдением всех правил проведения доаналитического этапа Пациенты посещают
Центр лабораторной диагностики утром, сдают кровь, получают ответ МНО в течение
30 минут и рекомендации консультирующего гемостазиолога о сохранении или кор-
рекции дозы препарата, которая проводится в тот же день при вечернем приеме анти-
коагулянта Намечается дата следующего визита в лабораторию Больным, находящим-
ся на стационарном лечении, доза антикоагулянтного препарата и сроки контроля за его
действием подбираются лечащим врачом при активной консультации врача лаборатории
В табл 6.19 представлен алгоритм подбора дозы Варфарина, который был апроби-
рован и успешно применяется в лаборатории клинической гемостазиологии СПбГМУ
им акад И. П. Павлова По результатам исследования МНО на 2-и день больные могут
быть разделены на 3 группы Правильность такого деления подтверждается и даль-
нейшим наблюдением за состоянием гемостаза у больных не только в период индук-
В пери°А приема больными поддерживающей дозы Варфарина- 1-я группа
ье с высокой чувствительностью к Варфарину, они быстро достигают терапевти-
414 _________________
ГЛА В А 6 Результаты протезирования
* мапанно-завионмые осложнения
1(1блиц(1 f> 1S
Профилактика тромбозов и тромбоэмболических осложнений у больных
с искусственными клапанами сердца в соответствии
с рекомендациями АССР (по J. Anshell et al., 2004)
Уровень до- казатель- ности Группы больных, которым показана профилактика Рекомендуемая профилактика
1С+ Механические искусственные клапаны сердца все больные АНД гепарин/НМГ до достижения терапевтическо- го значения МНО
1A 1С+ Протезы Мединж-2, St Jude Medical, Carbo- medics без дополнительных факторов риска в аортальной позиции, поворотно-дисковые и двустворчатые клапаны в митральной позиции АНД МНО = 2-3 АНД, МНО = 2,5-3,5
1С+ Механические искусственные клапаны сердца с дополнительными факторами риска, в том числе шаровые протезы, наличие эмболических осложнений АНД МНО=2.5-3.5 + аспирин 75-100 мг/сут
1С Все больные с искусственными клапанами сердца, которым терапия АНД должна быть прервана — НМГ
ческого значения МНО при стандартном начале терапии^часто дают^=^^ гипо-
коагуляцию даже при тщательном лабораторном к ’ дозы медленно восста-
мотивированные колебания МНО в период п дд р Пг>₽пяоата или уменьшении его
навливают свертывающую способность при отмене1 составляют
дозы; 2-я группа - больные с обычной на
большую часть пациентов они достигают Р ение или уменьшение дозы пре-
сутки терапии, имеют предсказуемый отве У од назначения поддержи-
парата, стабильны по результатам исследован сниженной чувствительностью к
вающей дозы Варфарина; 3-я группа — б0ЛЬ”“ нь|МИ для них характерно мед-
Варфарину, иногда они называются варфарин-р увеличении дозы препарата
ленное нарастание МНО, «ригидность» значен
и его быстрое восстановление после отмены ар трг.апевтическое значение МНО
В 1-й группе уже на 2-й день может быть достигнуто
снизить вдвое — до 2,5 мг и
Если МНО не превышает 2,5, то дозу препарат ^сли М^О при первом же
провести исследование на следующий день или ч р Варфарин на один день
измерении превысило значение 2,5, то нео *оди измерение МНО на 3-4-й день
и продолжить прием препарата с 2,5 мг/сут лед сохранить дозу в 2,5 мг, умень
позволит, в зависимости от полученного резуль • сутки Если достигнуто и
шить ее на 50% или остановиться в приеме Варф Р продолжить прием пре-
сохранено значение МНО на уровне 2-3 на 5 6-и д остановитьСЯ в приеме Варфа-
парата в той же дозе Если МНО превышает , ы составляют небольшую 4
рина и уменьшить дозу до 1,25 мг Больные Й9ГтоУпациенты-носители полиморфиз-
ОТ лиц, принимающих Варфарин Как прав
мов гена цитохрома 2С9 семейства Р-450 ~ пациентов с обычной чувству -
Принцип дозирования препарата во 2-и ГРУ момента достижения тер
ностью к Варфарину такой же — увеличение ^ХОдИМо отменить препара
ческого значения МНО В случае превышения
ИСКУССТВЕННЫЕ КЛАПАН Ы СЕРДЦА
Таблица 6.19
Схема подбора дозы Варфарина больным с искусственными клапанами
сердца в зависимости от чувствительности к препарату
(по Т. В. Вавиловой и др., 2002)
Степень гипокоагуляции и дозирование Варфар ина
МНО (в 9-11 ч) Дозы Варфарина (17-19ч) МНО (в 9-11 ч) Дозы Варфарина (17-19 ч) МНО (в 9-11 ч) Дозы Варфарина (17-19ч)
Г ервая доза препарата 5 0 мг — 5,0 мг — 5,0 мг
Высокая чувствительность к Варфарину Обычная чувствитель- ность к Варфарину Низкая чувствитель- ность к Варфарину
День 1-й Исследова- ние не про- водится 5,0 мг Исследова- ние не про- водится 5,0 мг Исследова- ние не про- водится 5,0 мг
День 2-й 2.0-2,5 - >2,5-* 2 5 мг отменить на один день, про- должить с дозы 2,5 мг 1,5-2,0 — 5,0-7,5 мг <1,5 — 7,5 мг
День 3-4-й 2 0-3,0 — >3 0 — 1,25-2,5 мг отменить на 1 день, продол- жить с дозы 1,25 мг 1,5-2,0 — 2,0-3,0 — 7,5-10,0 мг 5,0-7,5 мг <1,5- 1.5-2,0 - 10.0 мг 7,5 мг
День 5-6-й 2,0-3,0 -* >3,0 — Сохранить дозу Отменить на 1 день, продол- жить с ДОЗЫ 1,25 мг через день 1,5-2,0 - 2,0-3,0 — 3.0-4,0 — >4 0 — 10,0 мг Сохранить дозу Уменьшить дозу на 30% Отменить на 1 день, продол- жить с до- зы на 30% меньше <1,5- 1.5-2,0 — 2,0-3,0 — 3,0-4,0 — >4 0 — 12 5-15 мг 10-12,5 мг Сохранить дозу Умень- шить дозу на 30% Отменить на 1 день, продол- жить с до- за на 30% меньше
сутки и продолжить терапию сниженной дозой Варфарина Большая часть больных
принадлежит именно к этой группе Достигнуть необходимого уровня гипокоагуляции
я в э, юм а 5-6-е сутки. В случае Сниженной чувствительности к препарату
достижение МНО - 2 происходит медленнее, дозу антикоагулянтов непрямого действия
приходится увеличивать активнее, сроки подбора терапии затягиваются у каждого боль-
ного индивидуально (3-я группа)
---------416___________________________________ _____________________________
ГЛ А В A 6 РбЗуЛЬТЗТЫ ПрОТеЗИРОВИНМЯ И упэпэиип пл
----------------------—__” клапанно-зависимые осложнения
Предложенный алгоритм был использован не только при индукции, но и в гн-оиол
поддерживающей дозы Однако в это время большее значение приобрегает не ежед-
невная, а недельная доза препарата, то есть можно дозировать Варфарин, чередуя дозы
(например, 5 мг и 7,5 мг через день или 2 раза в неделю - 10 мг, остальные дни - по
7,5 мг). Увеличение МНО более 4,0 опасно развитием геморрагических осложнении
(гематурия, кишечные кровотечения и др ) Если клиническая ситуация не требует та-
кой выраженной гипокоагуляции, то препарат должен быть отменен на одни сутки, а
затем доза его должна быть снижена с внеочередным контролем МНО после ее кор-
рекции. В случае развившегося антикоагулянтного кровотечения (кровоточивость де-
сен, маточные и носовые кровотечения, макро- или микрогематурия, гастродуоденаль-
ная геморрагия) оно должно быть купировано введением свежезамороженной плазмы
или использованием препаратов витамина Kt-конакиона (не викасола!) одновременно
с отменой на 3-4 дня Варфарина
Из 51 пациента с искусственными клапанами сердца, наблюдавшихся в поликлини-
ческих условиях в лаборатории клинической гемостазиологии СПбГМУ им акад
И П Павлова, отмечен один случай макрогематурии, которая была купирована отме-
ной приема Варфарина. У 8 пациентов, у которых отмечались преходящие эпизоды
малых геморрагий (кровоточивость десен, носовые кровотечения, умеренная гемату-
рия), наряду с отменой приема Варфарина потребовалось назначение конакиона
У 3 пациентов, у которых макрогематурия, носовые кровотечения и кровотечения из
десен возникали в связи с передозировкой Варфарина самим больным или в случаях
редкого контроля за МНО лечащим врачом в период индукции препарата, потребова-
лось одновременно с отменой Варфарина назначение двум больным конакиона в дозе
2,5 мг per os ежедневно в течение 3 сут и одному больному дополнительно 800 мл
свежезамороженной плазмы
При отмене Варфарина и поддержании МНО на уровне не более 1,5 в группе на-
блюдавшихся нами больных с искусственными клапанами сердца были выполнены у
10 больных экстракции зубов, диагностическое abrasio cavi uteri, операции по поводу
вентральных грыж, секторальная резекция молочной железы Операции были выпол-
нены с минимальной кровопотерей на фоне введения фраксипарина с возобновлени-
ем терапии Варфарином в полной поддерживающей дозе на следующий день после
проведения хирургического вмешательства.
Для систематизации сведений о проведении антикоагулянтной терапии и самодис-
циплинирования больных с искусственными клапанами сердца целесообразно веде-
ние дневника, в котором пациент отмечает принятую дозу препарата, результат иссле
дования МНО и делает замечания об изменении диеты, полимедикации и первых сим
птомах кровоточивости Нами был впервые применен и анализирован опыт ведения
таких больных, получающих Варфарин, в условиях лаборатории клинической гемоста
зиологии. Полученные положительные результаты согласуются с данными зару ежны
авторов, которые считают более эффективным и безопасным наблюдение таких
ентов в специальных клиниках, занимающихся контролем за проводимоеi ан
лянтной терапией (ACC — anticoagulation clinic; AMS —anticoagu,a^°" r JL
service), Chiquette E et al., 1998. В случае такого наблюдения больно” ?емоооаги-
Рапевтическом диапазоне МНО до 70% времени, уменьшается кол^ .. р м et а|,
ческих и тромботических осложнений, а также стоимость лечения ( Варфа-
000) Предложенный алгоритм ведения больных, подбора и К°РР особые обстоя-
Рина не должен быть догматичным. У каждого пациента могут ие больно-
тельства, которые необходимо учитывать, — это искусство врачi м олжны быть
го к проводимому лечению Однако общие принципы терапии ар еетического зна-
с°блюдены регулярный лабораторный контроль и поддержан
чения МНО, отмена препарата на 1-2 (или более) дня при
читывая полиэтиологичность факторов риска развития У
и клапанами сердца и биопротезами целого ряда специ
---_ 417
высоких цифрах МНО
с искусственны-
осложнений, их
СкУсственные клапаны сердца
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
профилактика и лечение должны носить комплексный характер и быть направленны-
ми прежде всего, на коррекцию нарушений гемос аза Для профилактики тромбоза
кусственных клапанов сердца, тромбоэмболических осложнении, лечения мерцатель-
ной ритмии и восстановления гомеостаза целесообразно широкое внедрение в кли-
ническую практику сочетанных кардиохирургических операций. К таким хирургическим
вмешательствам относятся (одновременно с устранением патологии клапанного аппа-
рата сердца, хирургических манипуляций на атриовентрикулярном узле и устьях ле-
те чных вен для восстановления синусового ритма) перевязка ушка левого предсердия,
объемредуцирующие операции при дилатации левого предсердия как факторов по-
вышенного тромбообразования и источника тромбоэмболических осложнении При ис-
пользовании современных конструкций искусственных клапанов сердца возникает от-
носительный стенотический эффект, сопровождающийся эндотелиальной дисфункцией,
хроническим внутрисосудистым гемолизом, нарушением коагуляционного и сосудисто-
тромбоцитарного звеньев гемостаза, ренин-ангиотензин-альдостероновой и калликре-
ин-кининовой систем, дисбаланса водных секторов организма, приводящих к развитию
хронической сердечной недостаточности, к синдрому хронического диссеминированно-
го внутрисосудистого свертывания и к тромбообразованию. Параллельно с назначени-
ем антикоагулянтов непрямого действия и антиагрегантов для профилактики этих на-
рушений и лечения должны находить широкое применение экзогенные антиоксидан-
ты, атиаритмические препараты, цитопротекторы, антагонисты кальциевых каналов,
ингибиторы фосфолипаз, антилипидимическая терапия, ингибиторы ангиотензин-пре-
вращающего фермента (ИАПФ), p-адреноблокаторы, сочетание ИАПФ и антагонистов
рецепторов ангиотензина-ll, коррекция минерального обмена, водных секторов орга-
низма и др.
Таким образом, несмотря на высокие тромборезистентные и гемодинамические
качества искусственных клапанов сердца, выполненных из углеродных материалов и
представленных биопротезов, тромбоз и тромбоэмболические осложнения при их им-
плантации составляют большую проблему. Поэтому разработка новых моделей искус-
ственных клапанов сердца с улучшенными гемодинамическими характеристиками из
биологически инертных материалов и биопротезов на основе тканевой инженерии,
отвечающих требованиям, предъявляемым к их эндотелиальному покрову, является, по-
пр жнему, актуальной проблемой современной кардиохирургии.
ЛИТЕРАТУРА
Алмазов В А , Шляхто Е. В Терапия хронической сердечной недостаточности // Новости фар-
мокотерапии — 1997 — № 1. _ с. 5-8.
Баранова И Н., Дубровский В С. Шамсиев Н и др. Хронический внутрисосудистый гемолиз и
анемия у больных с риобретенными пороками сердца после протезирования двух и трех
клапанов // Гематол и трансфузиол — 1988. — №7 — С. 9-12
Г 2001 Момо П Диагностика и контролируемая терапия нарушений гемостаза —
Белостоцкии В. Э., ин Н Прокопчук Е Ф. и др Опыт клинического использования дву*
творчатого протеза Мединж» Тез. докл и сообщ IV Всерос. съезда сердечно-сосуд хи-
рургов — М.. 1998 — С 37.
Бокарев И Н Проблема постоянного и диссеминированного внутрисосудистого свертывания
крови Как их понимать? // Тромбоз, гемостаз и реология. — 2000. — № 2. — С. 5-8.
окадев Н , Ко юва Т В. Принципы рациональной терапии оральными антикоагулянтами /
|ромооз, гемостаз и реология. — 2000 — Т 2 — №4 —С 16-21
^^лева ^АМН^^9^И ПОсез?^зз9СОС^ИСТ°И ХИ^^ГИИ “М Из^в0 HLJ^CCX ИМ АН
попоил м Швили Умаров В М и др Опыт хирургического лечения митрального
v ле // Гпмг1ЛИЛЛЯЦИИ пред‘ ердий с использованием операции на атриовентрикулярном
^ле // Грудная и < ргщачно сосудистая хир - 2000 - № 1. - С 17-23
418
ГЛАВА6. Результаты протезирования и клапаню-зависимые осложнения
Бокерия Л. А., Рябинина Л. Г., Шаталов К В. и др. Консервативное лечение хронической с о-
дечной недостаточности в условиях кардиохирургической клиники // Кардиология
1998. — Т. 38, № 1. — С. 4-9. " *рдиилогия- -
Буравихина Т. А., Корнеев Н. В., Кузнецова Л. М. и др. Клиническое руководство по ультоазви-
ковой диагностике. — М.: Видар, 1998. — Т. 5 у
Вавилова Т В. Система гемостаза у больных с механическими искусственными клапанами сер-
дца: Авторефер. дис. докт мед наук. — СПб , 2004. -
Вавилова Т. В., Орловский П. И., Кадинская М. И. и др. Лабораторный контроль антикоагулян-
тной терапии у хирургических больных. — СПб.. Изд-во СПбГМУ, 2002
Вавилова Т. В., ( ироткина О В, Орловский П. И и др. Структурные полиморфизмы гена
CYP2C9 и их значение в профилактике тромбэмболических осложнений варфарином у боль-
ных с искусственными клапанами сердца // Уч. зап. ГМУ им. акад И. П. Павлова — СПб
2003. — Т X. — № 4. — С. 40-45.
Выговская Я. И Влияние гемолизированных эритроцитов на свертывающую систему крови //
Пробл. гематол — 1967. — Т. 12. — №9. - С. 26-29.
Галилеева А Н Профилактика тромбоэмболических осложнений у больных с искусственными
клапанами сердца в отдаленные сроки наблюдения (экспериментально-клиническое иссле-
дование): Автореф. дис канд. мед. наук. — СПб., 2004.
Горшков Ю В., Суходоев Ю А , Чеканов А Н. и др Искусственные клапаны сердца ЛИКС-2 и
Карбоникс-1, особенности конструкции и применения: Тез докл и сообщ. IV Всерос. съез-
да сердечно-сосудистых хирургов — М., 1998. — С. 44.
Гриценко В. В., Мочалов О. Ю. Принципы поэтапной реабилитации больных пороками сердца //
Мир медицины. — 1999. — №7-8. — С. 26.
Гриценко В. В , Давыденко В. В., Орловский П. И и др Показатели хронического внутрисосу-
дистого гемолиза у больных с различными конструкциями искусственных клапанов сердца
в отдаленные сроки наблюдения // Вести, хир. — 2001. — Т. 160. — №5 — С. 21-24.
ГрицюкА. И., Амосова Е. Н., Грицюк И. А. Практическая гемостазиология. — Киев: «Здоров’я», 1994.
Громова Г В , Людиновскова Р. А Дземешкевич С Л. и др. Отдаленные результаты протези-
рования митрального клапана у больных с приобретенными пороками сердца биологичес-
кими, шаровыми, дисковыми протезами // Грудная и сердечно-сосудистая хир — 1993 —
№3. - С. 29-32.
Деркачев Э. Ф.. Миндукшев И. В , Кривченко А И. и др. Новый метод исследования активации
и агрегации тромбоцитов // Сб. науч, работ к 100-летию кафедры патофизиологии
СПбГМУ — 1998. — С 297-313
Дмитриева В А., Дубровский В С.. Ишмухаметова Д Н. и др. Хронический внутрисосудистый
гемолиз после протезирования клапанов у больных с приобретенными пороками сердца //
Вести хир. — 1981 — Т 140 — №8 — С. 94-97.
Добровольский А Б., Косырев А Б. Протромбиновый тест: методика выполнения и клинич _
кое значение // Информ, бюл Ассоциации медицинской лабораторной диагностик
1995. - Вып. 2. — С. 34-38. ~ о ммт_
Добротин С С , Земскова Е. Н Клинико-гемодинамическая оценка протеза «Мединi _
ральнои позиции* Тез. докл и сообщ VII Всерос. съезда сердечно сосудисты
М , 2001 ____С 23
Добротин С С, Земскова Е. Н.. Журко С. А и др Отдаленные результаты п^т®^“Н^ц“сХ
тального клапана протезом «Мед-Инж-2» // Сердечно-сосудистые за ол
им. А Н. Бакулева РАМН. — 2005. — Т. 5. — № 11. — С. 28. OLJTailMM пемствоочатого
Добротин С С, Земскова Е Н Чигинев В. А. и др Результаты ^пл сердечно сосудис-
протеза «Мединж» при ревматических митральных пороках // РУ
тая хир - 1999. — № 5 — С. 43-46 катального клапана во
Добротин С. С., Медведев А. П., Чигинев В. А. и др. Тромбоз прот _ ^6 — С. 69-71.
время беременности // Грудная и сердечно-сосудистая хир.^ _ МКЧ-25 в коррекции
Добротин С. С. Романов Э И Добротина И С. и др ШаРов°ИХеЧно сосудистая хир -
изолированного порока митрального клапана // Грудная
1990 — №5. — С 26-29 . Факторов, влияющих
вАокимов С. В , Муйземнек А. Ю.. Татаринов Е Ф. и др Иссл®^ углеРода- Тез. докл. и со-
на наДежность протезов клапанов сердца из пиролитическ __ С. 23
общ Ун Всерос. съезда сердечно-сосудистых хирургов
-___ 419
15*
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
Ев* .нов \ К\рдов К. Какабаев Б. и др. Отдаленные результаты протезирования митрального
клапана дисковым протезом: Тез. докл. и сообщ. Ill Всерос. съезда сердечно-сосудистых
хирургов —- М., 1996 — С. 48 -49
Евп оенко А В. Князев М. Е, Алеев В. В. и др. Сочетанное хирургическое лечение пороков
митрального клапана и фибрилляции предсердий: Тез. докл. и сообщ. VII Всерос. съезда
сердечно-сосудистых хирургов. — М., 2001. — С. 24.
Зел Пскова Е Н.. Щербакова С В Ультразвуковая оценка гемодинамических показателей дву-
створчатого протеза ^Мединж» в аортальной позиции // Сердечно-сосудистая хирургия на
рубеже веков Тез конгресса, посвящ. 90-летию со дня рождения акад. РАМН Б. А. Короле-
ва. — Н. Новгород, 2000. — С. 113'114.
Зорин А Б.. Немков А. С , Лебедев Д. С. и др. Сочетанное лечение пороков сердца и аритмий
при операциях на открытом сердце // Вести, аритмологии. — 2000. — № 15. — С. 58.
Кадинская М И Комплексная лабораторная оценка состояния системы гемостаза у больных с
механическими искусственными клапанами сердца в отдаленные сроки наблюдения: Авто-
реф дис канд мед наук — СПб , 2004. — 30 с
Кайдаш А Н. Протезирование митрального клапана дисковым протезом при кальцинозе, рас-
пространяющемся за пределы фиброзного кольца // Грудная и сердечно-сосудистая хир. —
1996. — №4. - С 25-30
Калина Н В , Иванов В А., Громова Г В. и др Отдаленные результаты изолированного проте-
зирования митрального клапана дисковыми протезами (Эмике, Лике): Тез. докл. и сообщ
2-й Ежегодной сессии НЦССХ им А. Н. Бакулева РАМН. — М., 1998. — С. 25.
Караськов А. М и др. Хирургическое лечение инфекционного эндокардита аортального клапа-
на с использованием бескаркасных ксенобиопротезов: Метод, рекомендации. М3 РФ. Но-
восиб НИИ патологии кровообращения им Е. Н. Мешалкина. — Новосибирск, 2003.
Караськов А.М, Семенов И И. Назаров В М и др. Использование клапанов «МедИнж» при
хирургическом лечении парапротезных фистул // Протезы клапанов сердца «МедИнж» в хи-
рургии клапанных пороков сердца (сб. тр.). — М.: Изд-во НЦССХ им. А. Н. Бакулева РАМН,
2004.
Кассирский г. И Тактика ведения больного после протезирования клапанов сердца при рев-
матических пороках // Кардиология. — 1986. — Т. 26. — 5. — С. 111-113.
Кнышов Г В., Коваленко В Н. (ред) Инфекционный эндокардит Ц Киев: МОРИОН, 2004.
Кнышов Г В , Ситар Л. Л., Ищенко О. А. Вопросы хирургического лечения нарушении функции про-
тезов клапанов сердца // Грудная и сердечно-сосудистая хир. — 1990. — Ns 10. — С. 8-11.
Коган-Пономарев М. Я., Добровольский А. Б. Благоприятное влияние длительной терапии кап-
топрилом на гемостаз // Кардиология. — 1996. — Т. 36. — № 5. — С. 40 43.
Козинец Г И., Макарова В. А. (ред.) Исследование системы крови в клинической практике //М
Триада-Х — 1997
Кондратьев А С , Михайлова И А . Петрищев Н. Н. Влияние скорости кровотока на процесс
тромбообразования в микрососудах // Биофизика. — 1990. — Т. 35. — Ns 3. — С. 469-472.
Константинов Б А., Громова Г. В., Дземешкевич С. Л. и др Частота тромбоэмболических ос-
н ^ний у больных после изолированного протезирования митрального клапана полу
рическим протезом // Грудная хир. — 1985. — № 3. — С. 24-26.
Константинов Б. А , Черепенин Л П., Таричко Ю. В. и др. Атриопластика при хирургической
коррекции митрального порока, осложненного левой атриомегалией // Грудная и серД^Ч"
но-сосудистая хир. — 1990. — Ns 2. — С. 3-7,
о л в Б. А., Добр тин С С., Чигинев В А и др Сравнительная оценка протезов МКЧ-25,
Пикс 'микс > в коррекции митрального стеноза и его рецидива. — Тез. докл и сообщ 1
В ).з. съезда сердечно-сосудистых хирургов — М 1990. — С. 448-450
Косырев А Б Добровольский А. Б. Современные методы лабораторного контроля антикоагу
л нтной терапии // Лаб. медицина. — 1998. — № 1._С. 20-24.
Курдов Мурад эв А Особенности тромболитической терапии после протезирования мит
рально клапан Тез. докл и сообщ III Всерос. съезда сердечно-сосудистых хирургов
М 1996 - С 301-306.
Лечение оральными антикоагулянтами: Реком Всерос ассоциации по изучению тромбозов,
геморрагии и патологии сосудов им А Шмидта-Б А Кудряшова. — М., 2003.
ычрр в Г Диагностика и лечение диссеминированного внутрисосудистого свертывания кро-
и 2-₽ изд. перрраб и доп - Н Новгород Изд во НГМА. — 1998.
420 ----------—_____________ _____________________________
ГЛАВА 6. Результаты протезировании клапанно-зависимь,е осложнения
Людиновскова Р А.. Иванов В. А Громова Г В. и др Диспансерное наблюдение <а больными
с протезированными клапанами сердца // Грудная и сердечно-сосудистая хио 1ОД? "
№2. - С 54-56 ’
Людиновскова Р. А., Иванов В. А., Громова Г В. и др Уменьшение числа осложнений в огла
ленном периоде у больных с приобретенными пороками сердца после протезирования мит-
рального клапана дисковыми протезами за последние 10 лет: Тез. докл и сообщ VII Все
рос. съезда сердечно-сосудистых хирургов — М., 2001 — С 40
Люсов В. А , Белоусов Ю В , Бородкин В. В. Тромбозы и аритмии сердца // Кардиологи» -
1989> __ т. 29 - 10. - С. 10-15.
Малашенков А. И., Нарсия Б. Е, Русанов Н И Частичная транслокация протеза митрального
клапана при кальцинозе фиброзного кольца и стенки левого предсердия // Грудная и ер-
дечно-сосудистая хир — 1991. — №3, — С. 59-60.
Мартынюк Т В., Масенко В. П., Чазова И. Е. и др. Эндотелиальная дисфункция у больных с
легочной гипертензией // Кардиология. — 1997. — Т. 37 — 10. — С.25-29.
Медведев А. П„ Чигинев В А., Приходько В, П и др. Паравальвулярные абсцессы, как осложнение
активного инфекционного эндокардита, варианты хирургического лечения // Сердечно-сосу-
дистые заболевания Бюл. НЦССХ им А. Н Бакулева РАМН — 2005, — Т 6 — 5. — С. 27
Милонов О Б., Мовчук А. А., Готье С. В и др Хирургическое лечение желчнокаменной болезни
у больных с протезами клапанов сердца // Хирургия. — 1988. — №9. — С. 103-107.
Муратов Р. М., Малашенков А. И., Скопин И И и др. Влияние типа протеза на результаты хи-
рургического лечения активного протезного эндокардита аортального клапана / Грудная и
сердечно-сосудистая хир. — 2004. — № 6 — С. 34-40.
Муратов Р. М., Скопин И. И., Аль-Хаджабед X. Ф и др. Протезирование корня аорты бескаркас-
ными клапанами при инфекционном эндокардите аортального клапана // Сердечно-сосуди-
стые заболевания Бюл. НЦССХ им. А. Н. Бакулева РАМН. — 2005. — Т 5. — 11. — С. 340.
Орлов Н. А , Семеновский М Л., Орлова Л А Влияние годичной терапии ингибиторами анги-
отензинпревращающего фермента рамиприлом и каптоприлом на морфофункциональное
состояние левого желудочка и качество жизни у больных в отдаленные сроки после опе-
рации протезирования митрального клапана // Кардиология. — 1997. — Т. 37. — №2. —
С. 16-21.
Орловский П. И. Гомеостаз больных с механическими искусственными клапанами сердца в от-
даленные сроки наблюдения (клинико-экспериментальное исследование): Автореф дис
докт. мед. наук. — СПб., 2002.
Орловский П. И. Гриценко В. В., Давыденко В. В и др Показатели хронического вн ри о у-
дистого гемолиза у больных с различными конструкциями искусственных клапанов сердца
в отдаленные сроки наблюдения // Вести хир. — 2001. — Т. 160. — 5 — С 1
Орловский П. И., Гриценко В. В., Петрищев Н Н. и др. Оценка состояния системы гемостаза у
больных с искусственными клапанами сердца в отдаленные ( роки наблюдения чей
СПбГМУ им. акад. И П Павлова. — 1999 — Т VI. — №2 — С. 55-62. ппптрзов
Паджев М. А., Фаминский Д. О., Фарулова И. Ю. и др. Тромбоз n0B0p°J^° 54-55
в митральной позиции // Грудная и сердечно-сосудистая хир. — , после
Парпиев Р. С., Гулямов Д. С., Махмудов М. М. и др. Тромбоэмболические всерос
протезирования митрального клапана у детей и подростков Тез докл и
съезда сердечно-сосудистых хирургов. — Новосибирск, 1999 - тромбозом
Поляков В П.. Горячев В В., Белый В. С и др Успешный тромболизис _
Лапана CarboMedics в трехстворчатои позиции // Грудная и Р
1998. — №3. _ с 65-66 клмтпяпьными пороками сер
Попов Л. В., Пец И. Д„ Волкова Л В Атриопластика у больных с ми_р рдмн __ 2005 _
ДЦа//Сердечно-сосудистые заболевания Бюлл НЦССХ им.
ребиков А. Г„ Муратов М. М.. Скопин И. И. и др. Сравнительная
зов St. Jude Medical и Мединж в позиции митрального клапан
Дистая хир. - 2002. - №4. - С. 9-13 пппАилактикеи лечени Iтром
сапелкин С. В., Покровский А. В. Роль эноксапарина (клексана) a np ^gg8 _ т 4. _ № 3-4 -
^эмболических осложнений // Ангиология и сосудистая хир
С 119-123. , „™,,яльной ориентации для
^меновский М. Л. Манукян В. Е„ Честухин В. В и ДР Выбор on _ №б _ с 27-30
Митральных откидных дисковых протезов // Грудная хир
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА__________________ _
СерОин В И Мызина Н В Евдокимова А И и др Внутрисосудистый гемолиз эритроцитов
после хирургической коррекции пороков сердца у детей и подростков // Педиатрия -
1983 -№8 - С 36-39
Сидоренко Б А . Преображенский Д В Антитромботические препараты, применяемые при
лечении сердечно-сосудистых заболеваний (ч Л) // Кардиология — 1996 — Т 36. — №2. -
С 76-87
Сингуровский А М Протезирование митрального клапана двустворчатым протезом «Мединж» //
Грудная и сердечно-сосудистая хир — 1997 — №2 — С 169.
Ситар Л Л Попов В В Бендет Я А Факторы риска в отдаленные сроки после сочетанного
митрально-аортального протезирования по поводу ревматических пороков сердца // Груд-
ная и сердечно-сосудистая хир — 1997 — № 2. — С. 46
Ситар Л Л Попов В В Бешляга В М и др Сравнительный анализ функционирования моно-
дисковых протезов в аортальной позиции отдаленные результаты // Грудная и сердечно-
сосудистая хир — 1997. — № 2 — С. 43
Скопин И И Макушин А А , Давыдова ГБ и др. Пороки аортальных клапанов с узкими фиб-
розными кольцами — выбор метода хирургической коррекции // Грудная и сердечно-сосу-
дистая хир — 2000 — №2 — С. 15-20
Субботина Т Ф Петрищев Н Н., Гриценко В В и др. Турбидиметрический экспресс-метод в
оценке параметров гемостаза у больных с искусственными двустворчатыми клапанами сер-
дца // Вести хир им Грекова — 2001 — Т. 160. — №5. — С 25-28
Таричко Ю В Иванов В А Шевелев И И и др Результаты замены аортального и митрально-
го клапана сердца механическими протезами Тез. докл и сообщ I Всесоюз. съезда сер-
дечно-сосудистых хирургов — М , 1990 — С. 434-436
Федорова 3 Д, Бессмельцев С С, Котовщикова М А Методы исследования агрегации, вяз-
кости и деформируемости эритроцитов // Метод рекомендации Ленингр НИИ гематоло-
гии и переливания крови — Л , 1989
Федорова 3 Д , Чуслов А Г, Ханин А 3 и др Экспресс-диагностика и коррекция острого ДВС-
синдрома — клинико-лабораторная диагностика тромбоза и тромботических состояний //
Метод рекомендации — СПб ,1991 — С 80-83
Хрусталев О А Анализ факторов, влияющих на прогноз больных с ревматическими пороками
сердца осложненными недостаточностью кровообращения, в процессе 5-летнего наблю-
дения // Кардиология — 1995 — Т 35 — № 2 — С 41-44
Хубулава Г Г Шихвердиев Н Н, Марченко С П Отдаленные результаты использования ме-
ханических протезов // Сердечно-сосудистые заболевания Бюлл НЦССХ им А Н Бакуле-
ва РАМН — 2005 — Т 5 — № 11, — С 34
Цукерман Г И Малашенков А И, Дубровский В С. и др Повторные операции у больных с
механическими протезами клапанов сердца Тез докл. и сообщ II Всерос съезда сердеч-
но-сосудистых хирургов — СПб , 1993 — С. 43-44
Цукерман Г И Малашенков А И Муратов Р М и др Результаты изолированного протезиро-
вания аортального клапана двустворчатыми протезами Carbomedics и Мединж-2 Тез докл
и сообщ V Ежегодной сессии НЦССХ им А Н Бакулева РАМН — М , 2001 — С 30
Цукерман Г И Малашенков А И Скопин И И и др Результаты хирургического лечения боль-
ных с обструкцией механических протезов клапанов сердца // Грудная и сердечно-сосуди-
стая хир — 2000. — № 2 — С 4-9
Цукерман Г И Фаминский ДОГзархия И Н и др Сравнительная оценка отечественных ме-
ханич ски протезов в митральной позиции // Грудная и сердечно-сосудистая хир
1990 — № 10 — С 39-43.
Цукерман Г и Фаминский Д О , Малашенков А И и др 12-летний опыт применения проте-
зов Эмике и Пикс Тез докл и сообщ III Всерос съезда сердечно-сосудистых хирургов —
М 1996 — С 39
Чернов В А . Горбина А М , Соловьев Г М Поздние тромбоэмболические осложнения при про-
тезировании клапанов сердца // Кардиология — 1988 — Т 28 — №9 — С. 21-27
Шарыкин А С Тромбоэмболические осложнения после протезирования аортального клапана И
Кардиология — 1977 - Т 17 — № 1 _ с 23-28
Шевченко Ю Л Хирургическое лечение инфекционного эндокардита - СПб Наука, 1995
по Шимердиев Н Н , Хубулава Г Г и др Отдаленные результаты протеэирова-
гое.НовосибХск01999 - С 38СО°бЩ V ВСеР°С СЪеЗДЭ сеРДечно'сосУДИСТЫХ ХИРУР'
ГЛАВА 6 Результаты протезирования иосложнения
Ширко И В., Голованов Ю В Гидродинамика механического гемолиза // ,
блемы биомеханики. — 1993 — Вып 1. — С 160-179 Р -иные про-
Широкова О Р, Медведев А П, Чигиев В. А и др Опыт лечения дисфункций искусственных
клапанов сердца // Сердечно-сосудистые заболевания Бюлл НЦССХ им А н Бякипо.о
РАМН — 2005 —Т6-5—С55 ьакулева
Шитикова А. С Изменение формы тромбоцитов как показатель их внутрисосудистой актива
ции // В сб.‘ Клинико-лабораторная диагностика предтромботических состояний- - СПб
1991 — С. 38-52 ’
Шитикова А. С. Механизм действия ацетилсалициловой кислоты на процессы гемостаза //
Медицин, академ журн — 2003. — Т 3 — № 1 — С. 23-35 * '
Шитикова А. С., Каргин В. Д., Белязо О Е и др Морфологическая оценка повышенной внутри-
сосудистой активации тромбоцитов: Метод рекомендации № 94/8 Рос НИИ Гематологии и
трансфузиологии — СПб , 1996.
Шорохов С. Е, Поляков В. П., Белый В С. и др Грибковый эндокардит после операции мит-
рально-аортального протезирования // Вести, хир — 1997. — Т 156 — №6 — С 64
Шульце Г Н., Вендель Г П., Лихтенберг А и др Определение INR (International Normalized
Ratio) — прогресс в стандартизации антикоагулянтной терапии после протезирования сер-
дечных клапанов // Грудная и сердечно-сосудистая хир — 1995 — № 3 — С 25-28.
Шумаков В И., Семеновский М Л., Асмоловский А. В Протезирование аортального клапана
при инфекционном эндокардите // Грудная сердечно-сосудистая хир — 1999 — №4 —
С 14-20.
Шумаков В И., Семеновский М. Л, Вавилов П А и др Шести летний опыт протезирования кла-
панов сердца двухстворчатыми протезами «МедИнж-2» // Грудная и сердечно-сосудистая
хир. - 2004 — №5 — С. 16-22
Шихвердиев Н Н., Хубулава Г Г, Марченко С П Диагностика и лечение осложнений у боль-
ных с искусственными клапанами сердца — СПб ООО «Издательство фолиант», 2006
ЯрыгинА С., Приходько В П Случай повреждения запирательного элемента протеза аорталь-
ного клапана // Грудная и сердечно-сосудистая хир — 1990 — №4. — С 67-68
Ярыгин А. С., Стариков В И , Приходько В П Клиническое применение отечественных искус-
ственных клапанов «Карбоникс-1»: Тез докл и сообщ IV Всерос съезда сердечно-сосуди-
стых хирургов — М., 1998 — С. 49.
Aagaard J., Tmgleff J., Hansen C. N. et al Twelve years’ clinical experience with the Carbomedics
prosthetic heart valve // J Heart valve Dis — 2001 — Vol 10, № 1 — P 177-189
ACC/AHA Guidelines for the Management of Patients With Valvular Heart Disease A report of the
American College of Cardiology/Amencan Heart Association Task Force on Practice Guidelines
(Committee on Management of Patients With Valvular Heart Disease) //J Am Coll Cardio
1998 - Vol 32, № 10 — P 1486-588 9 _
Agathos E A.t Starr A Mitral valve replacement // Curr. Probl. Surg. — 1993 — Vo » 9
P 481-486 .
Ahmad R., Manohitharajah S M, Deverall В В et al Chronic hemolysis following mitral valve rep acement
a comparative study of the Bjork-Shiley, composite-seat Starr-Edwards, and
homograft valves//J Thorac. Cardiovasc. Surg — 1976.—Vol 71 №2 -- rnme P450
Aithal G P., Day C R, Kesteven P J L et al Association of polymorphisms in the cyt _ _
CYP2C9 with warfarin dose requirement and risk of bleeding complications // ar
Akalfn H, Corapcioglu E. T., Ozyurda U et al Clinical evaluation of the № 2 —
prosthesis, follow-up of the to 6 years // J Thorac Cardiovasc. Surg
P 259-266 тклгяг Suio —
Akins С И/ Long-term results with the Medtronic-Hall valvular piosthesis
1996-Vol 61, № 4. - R 806-812 c iqqi _ Vo| 52. № 1 -
ms C iV Mechanical cardiac valvulai prostheses // An Thorac urg
P. 161-168 -Edwards prosthesis//
'n® C W Buckley M J. Daggett W M et al Ten-year toHow-up $ Cardiac Surgery -
Pabago G , Cooley D A (eds ) Heart Valve Replacement
Futura, 1987. t r priv^rds oorcme bioprosthe-
^ms С. И/ , Carrot D L, Buckley M J et al Late results with Carpentie
S|s // Circulation — 1990 — Vol 82 (Suppl 4). — P 65-69
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
А/тяпое С Schleich J М, Laurent М Pregnancy and anticoagulant therapy Indications and
strategies / Arch Mai Coeur Vaiss — 2000. Vol 93, №5 — P 613 618
Altman R.. Rouvier J Gorfinkel E et al Corpasion of two levels of anticoagulant therapy in patients with
substitute heart valves//J Thoiac Cardiovasc Surg. — 1991 — Vol. 101, №3 — P. 427-431.
Andersen P V Alstrup P Long — term prognosis m patients with mechanical aortic valves without
anticoagulant therapy A follow - up study over 1-15 years // Ugesknft for Laeger - 1993 -
Vol 155, № 14 — P 1050-1053
Ansell J, Hirsh J Poller L et al The Pharmacology and Management of the Vitamin К Antagonists
The Seventh ACCP Conference on Antithrombotic and Thrombolytic Therapy // Chest — 2004 —
Vol 126, № 1 — P 204-233
Antunes M J Clinical performance of St Jude and Medtronic-Hall prostheses a randomized
comparative study//An Thorac Surg — 1990 —Vol 50, № 5 P 743-747.
Antunes M J Wessels A , Sadowski P G. et al Medtronic-Hall valve replacement in a third-world
population group A leview of the performance of 1000 prostheses//J Thorac Surg — 1988 —
Vol 95, №4 - P 980-985
Aoyagi S, Kawara T Fukunaga S. et al Cmeradiographic evaluation of ATS open pivot bileaflet val-
ves // J Heart valve Dis — 1997 — Vol 6, №3. — P 258-263.
Aoyagi S., Oryoji A , Nish Y et al Long-term results of valve replacement with the St Jude Medical
valve //J Thorac Cardiovasc Surg — 1994 —Vol 108, № 10 — P 1021-1029
Aranki S. E, Adams D H , Rizzo R J et al Determinants of early mortality and late survival in mitral
valve endocarditis // Circulation — 1995 — Vol. 92, №2. — P. 143-148.
Ans A Padro J M , Camara ML et al The Monostrut Bjork-Shiley valve Seven years’ experience I
J Thorac Cardiovasc Surg — 1992 — Vol 103, № 5 — P. 1074-1082
Arom К V, Nicoloff D M Kersten ТЕ et al Six years of experience with the St Jude Medical
valvular prosthesis // Circulation — 1985 — Vol 72, №2 — P 153-159
Aupart M, Neville P, Dreyfus X et al The Carpentier-Edwards pericardial aortic valve: intermediate
results in 420 patients // Eur. J Cardiothorac Surg. — 1994 — Vol 8, Ng 2 — P 241-277.
Aupart M. R, Neville P H., Hammami S et al Carpentier-Edwards pericardial valves in the mitral position
ten-year follow-up // J Thorac. Cardiovasc Surg. — 1997. — Vol 113, №3. — P 492-495
Awrtry E H Loscalzo J Aspirin //Ciculation — 2000 — Vol 101 — P 1206-1218.
Baker W F Thrombosis and hemostasis in cardiology review of pathophysiology and clinical practice
(part II) // Recommendation for antithrombotic therapy // Clin Appl Thromb / Hemost — 1998 —
Vol 4, №2. — P 143-147
Barsellona D., Mameh G , Marongiu F Inhibition of blood coagulation activation and oral anticoagulants
in patients with mechanical heart valve protheses // Thromb. Res. — 1996 — Vol 81, №3
P 403-406
Baumgartner W A , Miller D. C, Reitz BA et al Surgical treatment of prosthetic valve endocarditis /
An Thorac Surg — 1983 — Vol 35, №1 — P 87-104
Beaudet R L Nakhle G , Beaulieu C R et al Medtronic-Hall prosthesis valve related deaths and
complications//Can J Cardiol — 1988 — Vol 4, №2 — P 376-380
Bennet J S, Mousa S Platelet function inhibitors in year 2000 // Thromb Haemost — 2001 —
Vol 86, Ng 1 — p 1^7
Berard J, Dufour P t Subtil D et al Pregnancy in women with a mechanical heart valve Review о
the literature [Review] // J de Gynecol Obstet er Biol de la Reproduct — 1997 — Vol 26
Ng 5 — P 455-464.
Bergaend E, Aupart M , Kendja F et al Twelve years experience with Carbomedics bileaflet valves //
Arch Mai Coeur Vaiss — 2004 — Vol 97 № 3. — P 214-220
Bernal J M Rabasa J M, CagigasJ C et al Valve-related complications with the Hancock I porcinj
bioprosthesis twelve-to fourteen-year follow-up study//J Thorac Cardiovasc Surg —1991
Vol 101, №3 —P 871-875
Bernal J M Rabasa J M, Lopez R et al Durability of the Carpentier-Edwards porcine bioprosthesis
role of age and valve position // An Thorac Surg — 1995 — Vol 60, № 2 — P 248-252
Bick R L Kaplan H Syndromes of thrombosis and hypercoagulability congenital and acqune
thrombophilias//Clin Appl Thromb Hemost — 1998 — Vol 4, № 1 — P 25-50
Bjornerheim К, Ihlen H., Simonsen S et al Hemodinamic characterization of the Carbomedics mitral
valve prosthesis//J Heart valve Dis — 1997 — Vol 6, №2 — P 115-122
Bodnar E Butchart E G , Bamford J et al Proposal for reporting thrombosis, embolism and bleeding
after heart valve replacement // j Heart valve Dis - 1994 - Vol. 3, Ng 1 - P 120-123
— 424 — '
ГЛАВА 6. Результаты протезирую и клапапноу^симые осложнения
Borman J В Brands W. G Camilleri L et al Bicarbon valve — Eurmnan mnHir>Qrti .
ation // Eur J Cardiothorac Surg. - 1998. - Vol 13, №6 -Х2Г
Bortolotti U., Milano A., Mossuto E et al Porcine valve durability a comparison between Hancock
standard and Hancock II bioprostheses // An Thorac Suig. - 1995 - Vol 60 № 1
220 ’ * ггю-
Bortolotti U, Milano A., Testofm L et al The CarboMedics bileaflet prosthesis initial experience at
the University of Padova // Clin Rep — 1991 — Vol 4, № 2 — p 345-349 P ”
Bove E L , Marvasti M. A., Potts J L et al Rest and exercise hemodynamics following aortic valve
replacement a comparison between 19 and 21 mm lonescu-Shiley pericardial and Carpentier
Edwards porcine valves//J Thorac Cardiovasc Surg — 1985 — Vol 90, №3 — P 750 754
Bower S P, Tucker P E Fungal meningitis and intracerebral hemorrhage complicating prosthetic
valve endocarditis // Pathology — 1993. — Vol 25, № 1. — P 87-91.
Braunwald E Valvular heart disease // Braunwald E (ed ). Heart Disease, A Textbook of Cardiovascular
Medicine, 6th ed Philadelphia — WB Saunders, 2001
Brophy M T, Fiore L. D, Lan / et al Comparison of a standard and sensitive thromboplastin in
monitoring low intensity oral anticoagulant therapy//Am J elm pathol. — 1994 — Vol 3 №1 —
P 126-127.
Burckhardt D., Stnebel D., Vogt S et al Heart valve replacement with St Jude Medical valve
prosthesis long-term experience in 743 patients in Switzerland // Circulation — 1988 —
Vol 78, №1 — P 118-124
Burdon T A , Miller D C, Oyer P. E. et al Durability of porcine valves at fifteen years in a representative
North American patient population // J. Thorac. Cardiovasc. Surg — 1992 — Vol 103, №2. —
P 238-242
Burke A P., Farb A , Sessums L et al Causes of sudden cardiac death in patients with replacement
valves An autopsy study // J Heart Valve Dis — 1994 — Vol 3, № 1 — P. 10-16
Bussey H I., Force R W, Bianco T. M. et al. Rehance on prothrombin time rations causes significant
errors in anticoagulant therapy // Arch Intern Med — 1992 — Vol 152, №2 — P 278-282
Butchart E. G Editorial The significance of sudden and unwitnessed death after heart valve
replacement // J Heart Valve Disease — 1994 — Vol 3, № 1. — P 1-4
Butchart E. G., Lewis P A, Bethel J. A et al Adjusting anticoagulation to prosthesis thrombogenicity
and patient risk factors // Circulation — 1991 — Vol 84 (Suppl III) — P 61-69
Butchart E. G , Lewis P A , Grunkemeier G L et al. Low risk of thrombosis and serious embolic events
despite low-internsity anticoagulation Experience with 1004 Medtronic-Hall valves //Circulation —
1988 — Vol 78 (Suppl 1) — P 66-77.
Butchart E G, Li H H., Payne N. et al. Twenty years’ experience with the Medtronic Hall valve //
J Thorac Cardiovasc. Surg — 2001 — Vol 121, №6 — P 1090-100
Calderwood S B., Swmski L A., Karchmer A W et al Prosthetic valve endocarditis analysis factors
affecting outcome of therapy // J Thorac Cardiovasc. Surg — 1986 — Vol 92. №4. — _
Camilleri L F, Bailly P , Legault В J et al Mitral and mitro-aortic valve replacement ^ 5°
Bicarbon valves compared with St Jude Medical valves // Cardiovasc Surg
No 2 __p 272—280
Campbell P. M.. Radensky P W, Denham C R Economic analysis of systematic an’‘^“la‘'°n
management vs routine medical care for patients on oral warfann therapy // ।
CanneSrS C .^orn M ^Rosendaal F~f^antcoagulant treatment m P^^^^Xn'
heart valves how to reduce the risk of thromboembolic and bleeding c p
Med — 1999 — Vol 245, №2 — P 369-374 „r the Omniscience
Carrier M, Martineau J P, Bonan R etal Clinical and hemodynamic assessme _ 300-304
prosthetic heart valve // J Thorac Cardiovasc Surg — 198 - ° rf ’nce of the Freestyle
Cart/er P c, Dumesml J G , Metres J et al Clinical and hemodynamic perfw 345 348
aortic root bioprosthesis//An Thorac Surg — 1999 — Vol . ’ replacement with
Ceh Y Y. Glower D D., Landolfo К et al Comparison of survival afteI XXc Surg - 2001 -
biologic and mechanical valves in 1139 patients // J Thorac
Vol. 122, №3 - P 569-577 , _ япяРт1а complicating mitral
Certoho R j.f Orszulak T A , Daly R C et al Reoperation for hemolyt _ 479_484
r.va've repair//Eur J Cardiothorac Surg - 1997 - Vol 11 NeJ mechanlCal heart valves
han tv s, Anand S, Ginsberg J S Anticoagulation of Pre9nant ™° Vol 160 № 2 - P 191 196
9 systematic review of the literature // Arch Int. Med — ___
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
Chastre J . Trouillet J L Early Infective endocarditis of prosthetic vavles // Eur Heart J - 1995 -
Vol 16 (Suppl В) — P 32-38.
Chesebro J H, Adams P C, Fuster V Antithrombotic therapy in patients with valvular heart disease
and prosthetic heart valves//J Am Coll Cardiol - 1986 - Vol 8, № 1 - P 41-56
Cohn L H Aranki S F Rizzo R J et al. Decrease in operative risk of reoperative valve surgery //
An Thorac Surg — 1993 — Vol 56, № 1 — P 15-18
Cohn L H Collins J J, DiSesa V J et al Fifteen-year experience with 1678 Hancock porcine
bioprosthetic heart valve replacements // An Surg. — 1989 — Vol 210, № 2. — P 435-439
Cohn L H., Edmunds L H Cardiac Surgery in the Adult // New York McGraw-Hill, 2003 - Chapters
32 38
Copeland J G The Carbomedics prosthetic heart valve in the mitral position, results of in multicenter
international trial//J Cardiac Surg — 1997 —Vol 12, №4 P 205-209
Corbineau H DeLaT.B, Verhoye J. P et al Carpentier-Edwards supraannular porcine bioprosthesis
in aortic position 16-year experience // An Thorac Surg, — 2001 Vol 1 uppl) —
P 228-232
Corbineau H. Du Haut Cilly F В, Langanay T et al. Structural durability in Carpentier Edwards
Standard bioprosthesis in the mitral position: a 20-year expenence//J Heart Valve Dis —2001 -
Vol 10, №3 — P 443-448
Corbineau H Lelong В , Langanay T et al. Echocardiographic assessment and preliminary clinical
results after aortic valve replacement with the Medtronic Mosaic bioprosthesis // J Heart Valve
Dis — 2001 — Vol 10, № 1 — P 171-175
Corbineau H, Verhoye J P, Tauran A et al Medtronic intact porcine bioprosthesis in the aortic
position 13-year results // J Heart Valve Dis — 2002 — Vol 11, №3. — P. 537-542
Crawley F, Bevan D , Wren D Management of intracranial bleeding associated with anticoagulation
balancing the risk of further bleeding against thromboembolism from prosthetic heart valves //
J Neurol Neurosurg Psychiatry — 2000 — Vol 69, №3. — P 396-398
Dalen J E, Hirsh J (eds ) Third ACCP consensus conference on antithrombotic therapy // Chest —
1992 — Vol 102, No 2 — P 303-309
Dalrymple-Hay M J, Pearce R К, Dawkins S et al Mid-term results with 1503 CarboMedics
mechanical valve implants // J Heart Valve Dis — 2000 — Vol 9, № 2 — P 389-395
Damle A , Coles J., Teijeira J et al A six-year study of the Omniscience valve in four Canadian
centers//An Thorac. Surg — 1987 — Vol 43, №3 — P 513-518
Danton M H Sarsam M A , Byrne J G et al Clinical and hemodynamic performance of the Toronto
SPV bioprosthesis // J Heart Valve Dis — 2000 — Vol. 9, № 3. — P 644-649-
David T E Surgery of the aortic valve // Cur Probl Surg — 1999 — Vo! 36, № 3 — P 426-432
David T E, Armstrong S, Sun Z The Hancock II bioprosthesis at 12 years // An Thorac Surg
1998 — Vol 66 (6 Suppl) — P 95-99
David T E, Ho W I., Chnstakis G. T Thromboembolism in patients with aortic porcine bioprostheses I I
An Thorac. Surg — 1985 — Vol 40, № 1 — P 229-234.
De Jonge E, Levi M, Stoutenbeek CP et al Current drug treatment strategies for disseminated
intravascular coagulation // Drugs — 1998 — Vol 55, №6 — P 767-777
De Luca L Vitale N Giannolo В et al Mid-term follow-up after heart valve replacement with CarboMedics
bileaflet prostheses//J Thorac Cardiovasc Surg — 1993 — Vol 106 — P 1158-1162
De Wall R A , Qasim N Evoluation of mechanical heart valves // An Thorac Surg — 2000
Vol 69, №5 — P 1612-1621
Dearani J A Orszulak T A , Schaff H V et al Results of allograft aortic valve replacement for complex
endocarditis//J Thorac Cardiovasc Surg — 1997 — Vol 113, № 2 — P 285-289
Delahaye J P, Poncet Ph , Malquarti V et al Cerebrovascular accidents in infective ent о rdi1
role of anticoagulation // Eur Heart J — 1990 — Vol 11, №9 — P 1074-1078
Dellgren G David T E, Raanani E et al Late hemodynamic and clinical outcomes of aorti va*v
replacement with the Carpentier-Edwards Penmount pericardial bioprosthesis / J Thorac
Cardiovasc Surg — 2002 — Vol 124, № 1 — P 146-152
Dellgren G , Feindel С M., Bos J et al Aortic valve replacement with the Toronto SPV long-term
clinical and hemodynamic results // Eur J Cardiothorac Surg - 2002 - Vol 21, № 4 -
P 698-702
Di Summa M Poletti G, Brero L et al Long-term outcome after valve replacement with the
Omnicarbon prosthesis // J Heart Valve Dis — 2002 — Vol 11, No 4 — P 517-523.
426
ГЛАВА 6. Результаты протезирования и Мап^.зя„^^ осложт^
Dl Sesa I/ J. Cohn L. H, Collins J J. et al Determinants of operative survival following combined
mitral valve^replacement and coronary revascularization // An Thorac uu 9(
Eckman M H, Levine H. J, Pauker S G Effect of laboratory variation in the prothrombin — f пм
ratio on the results of oral anticoagulant therapy // N Engl J Med - 1993 Vol 8 N« 5
P 697-702.
Edmunds L. H Thrombotic and bleeding complications of prosthetic heart valves // An Thnrar
Surg. - 1987 - Vol 44, № 3 - P 430-445 H
Edmunds L H., Clark Fl. E, Cohn L H et al Guidelines foi reporting morbidity and modality after
cardiac valvular operations Ad Hoc Liaison Committee for Standardizing Definitions of Pro thetic
Heart Valve Morbidity of The American Association for Thoracic Surgery and The I ociety of
Thoracic Surgeons // J Thorac Cardiovasc Surg — 1996 — Vol 112, №3. — P 708-711
Edwards F H, Peterson E. D., Coombs L P et al Prediction of operative mortality aft r valve
replacement surgery//J. Am. Coll Cardiol — 2001 — Vol 37, No 4 — P 885-889
Edwards M В , Ratnatunga С. P, Dore C J et al Thirty-day mortality and long-term survival folk wing
surgery for prosthetic endocarditis a study from the UK heart valve registry // Eur J Cardiothoiac
Surg — 1998 — Vol. 14, №1 — P 156-161
Emery R W., Petersen R. J., Kersten T. E et al The initial United States experience with the ATS
mechanical cardiac valve prosthesis // Heart Surg Forum — 2001 — Vol 4, №2 — P 346-351
Erbstosser H , Kothe К During therapy following heart valve prosthesis // Z Gesamte Inn Med —
1990. — Vol. 45, № 12. — R 358-362
Erdil N, Cetin L., Ates S Midterm experience with the Sorin Bicarbon heart valve prosthesis for
rheumatic disease // J. Cardiovasc Surg (Torino) — 2003 — Vol 44, № 5 — P 597-603
Ericsson A., Lindblom D , Semb G et al. Strut fracture with Bjork-Shiley 70 degrees convexo-concave
valve an international multi-institutional follow-up study//Eur J Cardiothorac Surg — 1992. —
Vol. 6, № 2. — P 339-343
Fiore A. C., Barner H В , Swartz MT et al Mitral valve replacement randomized trial of St Jude
and Medtronic Hall prostheses // An Thorac Surg — 1998 — Vol 66 № 3. — P 707-712
Fradet G J. Bleese N., Burgess J. et al Mosaic valve international clinical trial early performance
results // An Thorac. Surg. — 2001. — Vol 71, №2. — P 273-277
Fraile J, Martinell J., Artiz V et al ATS medical mechanical valve prosthesis in reoperation Advancing
the tehnology of bileaflet mechanical heart valves // Darmstadt Springer, 1998 — P 101-110
Gallucci V., Mazzucco A , Bortolotti U et al The standard Hancock porcine bioprosthesis^ overall
experience at the University of Padova // J Card Surg — 1988 — Vol 3, №2 — P 337-34 .
Genoni M, Franzen D , Vogt P et al Paravalvular leakage after mitral valve replacement improved
long-term survival with aggressive surgery9 // Eur J Cardiothorac Surg 000 — Vo
№ 1 — p. 14-19
Glower D D , Landolfo К P, Cheruvu S et al Determinants of 15-year outcome with 1119 s^2^rd
Carpentier-Edwards porcine valves // An Thorac. Surg — 1998 — Vol 66. ° .
Godye О L , Fischlem T., Adel hard К et al Thirty-year results of Starr-Edwards prosthe.
aortic and mitral position//An Thorac Surg — 1997 — Vol 63 №3 — . . nts in
Gohlke-Barwolf C, Acar J., Bodnar E et al Guidelines for prevention of thromboe
valvular heart valve disease//J Heart valve Dis — 1993 — Vol 2, s mmhnnroohvlaxis
Goldsmith I, Lip G Y, Mukundan S et al. Experience with low-dose aspinn a® p p ^eart
for the Tissuemed porcine aortic bioprosthesis a survey f five year P
Valve Dis. — 1998 — Vol 7, №3 — P 574-580 imon rvP9C subfamily //
Goldstein J A, de Morais S M. F. Biochemistry and molecular biology of the hun
Pharmacogenetics - 1994. - Vol. 4 - P 285-299 mechanical valves
Gray R j Current status of anticoagulation and thrombosis relae
[Review] // Texas Heart Inst J - 1996. - Vol 23, Ns 1 - P Jb 41 car(J|ac
Greenberg в , Quinones M A , Koilpillai C et al Effects of long- circulation — 1995 —
tructure and function on patients with left ventricular dys unc
Vol 91, Ns 18 — P 2573-2581 , e ... r,sk of porcine structural
Grunkemeier G L, Jamieson W R, Miller D C et al Actua!'1®' vf^ У?108 № 3 _ p 709-716
valve deterioration//J Thorac Cardiovasc Surg. — 199 _mont4 for evaluating heart valves
bvnkeme.erG L., Johnson M S D, Naftel D C Sample size leqr .ements for eva^^ У
with constant risk events // J. Heart valve Dis - 1994 - vol J, - Thofac Sdrg _
G^nkemeter G L , Wu Y Actual versus actuarial event-free percentages
2001 — Vol 72, № 3. — P 677-686
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
Gi П zrtsson Г, Ar nki S, Cohn L. Н. Mechanical/Bioprosthetic Mitral Valve Replacement // Cohn
L H., Edmunds L H. (eds.). Cardiac Surgery in the Adult New York: McGraw-Hill, 2003.
Hat ?r A IV Larson M G . Benjamin E J et al Increased left ventricular mass and hypertrophy are
associated with increased risk for sudden death // J. Am. Coll. Cardiol — 1998. — Vol. 32
№ 6 — R 1454-1460.
Hayashi J I. Nakazawa S.. Osuma F. et al. Combined warfarin and antiplatelet therapy after St Jude
Medical replacement for mitral valve disease // J. Am Coll. Cardiol. — 1994. — Vol. 23, №5 —
P 672-675.
Heras M , Chesebro J H., Foster V. et al High risk of thromboemboli early after bioprosthetic cardiac
valve replacement // J Am Coll. Cardiol. — 1995. — Vol 25, № 4. — P. 1111-1119
Higashi M К Veenstra D. L , Kondo L M. et al. Association between CYP2C9 genetic variants and
anticoagulation-i elated outcomes during warfarin therapy // JAMA — 2002. — Vol. 287-291,
№ 13. — R 1690 — 1698.
Hirsh J., Dalen J. E., Deykin D. et al. Oral anticoagulants Mechanism of action, clinical effectiveness,
and optimal therapeutic range // Chest. — 1992. — Vol 102 (4 Suppl). — P. 321 — 326.
Hirsh J. Foster V Guide to anticoagulant therapy. Part II: oral anticoagulants // Circulation. — 1994 —
Vol. 89, № 11. — P. 1469-1480.
Hirsh J , Foster V, Ansell J American Heart Association / American College of Cardiology foundation
guide to warfarin therapy : review // Circulation. — 2003. — Vol 107, № 7. — P. 1692-1711.
Horstkotte D., Burckhard D. Prosthetic valve thrombosis // J. Heart valve Dis. — 1995. — Vol 4,
№ 1. - P. 141-153.
Horstkotte D., Riess H Thromboembolic complications following heart valve replacement: the role of
patient — related coagulability // J Heart valve Dis. — 1998. — Vol 7, № 6. — P. 598-601.
Horstkotte D., Schulte H. D, Bircks W et al. Lower intensity anticoagulation therapy results in lower
complication rates with the St Jude Medical prosthesis // J. Thorac. Cardiovasc. Surg. — 1994. —
Vol 107, №Ю — P 1136-1145.
Horstkotte D., Scholte H. D., Bircks W. et al Unexepected finding concerning thromboembolic
complications and anticoagulation after complete 10 year follow up of patients with St. Jude
Medical valves // J. Heart valve disease. — 1993. — Vol. 2, № 2. — P 291-301.
Huber К C., Gersh B. J , Bailey К В. et at. Variability in anticoagulation control predicts thromboembo-
lism after mechanical cardiac valve replacement: a 23-year population-based study // May. Clm.
Proc. — 1997. — Vol. 72, № 12 — R 1103-1110
Horle A . Abad C, Feijoo J et al. Long-term clinical performance of Sorin tilting-disc mechanical
prostheses in the mitral and aortic position // J Cardiovasc. Sura — 1997 — Vol. 38, №5. -
P 507-512
Horle A Gomez-Plana J., Mesegoer J et al. Nine-year follow up of the Omnicarbon prosthesis in
the aortic position // J Heart Valve Dis. — 2002 — Vol. 11, № 4 — P. 524-528.
Iguro Y. Moriyama Y, Yamaoka A et al. Clinical experience of 473 patients with Omnicarbon
prosthetic heart valve // J Heart valve Dis. — 1999. — Vol 8, № 6. — P. 674-679
/ anishi K. Long-term clinical results with the Starr-Edwards model 6120 mitral valve prosthesis
Nippon Kyobu Geka Gakkai Zasshi — 1994. — Vol. 42, №6.-P 914-923
fsmeno G., Renzulli A., Carozza A. et al Intravascular hemolysis after mitral and aortic valve
replacement with different types of mechanical prostheses // Int J Cardiol. — 1999. — Vol. 69,
№2 -p. 179-183.
T S. .Dismukes И/. E, Cobbs C. G. et al Prosthetic valve endocarditis // Circulation — 1984
Vol 69, № 1 — R 223-229.
Jameison И/ R. Edwards F H., Schwartz M. et al. Risk stratification for cardiac valve replacement.
National Cardiac Surgery Database //An Thorac. Surg. — 1999 - Vol. 67, №4 — P 943-94 I.
amieson И/ R Burr L., Allen P et al. Quality of life afforded by porcine bioprostheses illustrated by
и ^?eT^ratl0n CarPerrtier-Edwards porcine bioprosthesis // Rabago G., Cooley D A. (eds.).
Heart Valve Replacement and Future Trends in Cardiac Surgery. New York: Futura, 1987.
m/eson . Ling H . Burr L H et al. Carpentier-Edwards supraannular porcine bioprosthesis
evaluation over 15 years // An Thorac. Surg. — 1998. — Vol 66 (6 suppl ) — P 49-54
। R-- Miyagishirna R T., Grunkemeier G. L. et al. Bileaflet mechanical prostheses performance
/am(p^aLPoS p Eur^j Cardlothorac- Surg. - 1999 - Vol. 15, № 6. - P 786-794.
btonrncthoca ’« yerS F °' JaniJSZ M- T- et al Age as a determinant for selection of Porain.
ЬюогЛт«ь J r Car?'®c valve 'eplacement: Experience with Carpentier-Edwards standaid
braprosthee® // Can. J Cardiol. - 1991 - Vol. 7,Ns1.-P 181-189
428
ГЛА MJ. Результат» протезирования и клапанмо.эаик:имые осяожне„„,
Jasinski М J Kadziola Z . Keal R et al. «Mosaic» Medtronic bioprosthetic v live repi.-кшп nt clime .1
results and hemodynamical performance//j Cardiovasc Surg (Torino) onn v zf
№ 1. - P. 181-186. J' ’ -Vil 41
Jault F„ Gandjbakhch I.. Rama A. et al Active native valve endocarditis determinant nr .> . .
death and late mortality // An. Thorac. Surg — 1997 — Vol 63, №7 — p 1737 "1,45^
Jegaden O.. Eker A., Delahaye F et al. Thromboembolic iisk and late survival .fie, m,t .1 Vlh,p
replacement with the St Jude Medical valve // An. Thorac. Surg - 1994 - Vol 58 №6
P. 1721-1728.
Jegaden 0., Llojeh K„ Montagna P. et al. Late results of isolated aortic valve replacement by Bi r
Shiley prosthesis Apropos of 596 cases Ц Arch. Mai. Coeur. Vaiss — 199i — Vol 84 No 1 -
P. 47-54.
Jennings L M, El Gatit A., NagyZ L. et al. Hydrodynamic function of the second-generation mitroflow
pericardial bioprosthesis // An. Thorac. Surg. — 2002. — Vol. 74, № 1. — P 63-69.
Jin X. Y., Ratnatunga C., Pillai R. Performance of Edwards pnma stentless aortic valve over ei ht
years // Semin. Thorac. Cardiovasc. Surg. — 2001. — Vol. 13, № 4 (Suppl 1). — R 163-167.
Kadir I., Izzat M B., Wilde P. et al. Dynamic evaluation of the 21-mm Medtronic Intact aortic
bioprosthesis by dobutamine echocardiography// An. Thorac. Surg. — 1997 — Vol 63 No 5 —
P. 1128-1135.
Kaempchen S., Guenther T, Toschke M. et al. Assessing the benefit of biological valve prostheses:
cumulative incidence (actual) vs. Kaplan-Meier (actuarial) analysis // Eur J Cardiothorac Surg. —
2003. — Vol 23, № 5. — P. 710-713.
Kass R. M., Tsai T P, Blanche C. et al. Ten-year experience with the St Jude Medical valve for primary
valve replacement // Thorac. Cardiovasc. Surg. — 1990. — Vol. 100 № 1. — R 44-54.
Katircioglu S F., Ulus A. T, Yamak В et al. Acute mechanical valve thrombosis of the St Jude Medical
prosthesis // J. Cardiac. Surg. — 1999. — Vol 14, №3 — P 164-168
Keenan R J, Armitage J. M., Trento A. et al. Clinical experience with the Medtronic-Hall valve
prosthesis // An. Thorac. Surg — 1990. — Vol. 50, №3. — P. 748-754.
Khan S. S., Chaux A., Blanche C. et al. A 20-year experience with the Hancock porcine xenograft in
the elderly // An. Thorac. Surg — 1998. — Vol. 66, № 1. — P. 35-41.
Khan S. S., Trento A., DeRobertis M et al. Twenty-year comparison of tissue and mechanical valve
replacement // J. Thorac. Cardiovasc. Surg. — 2001. — Vol. 122, №2 — P. 257-264
Kimura К, Kawada T, Endo S. et al. Anticoagulant therapy and obstetric management in a piegnant
patient with mechanical prosthetic valve // Kyobu Geka. — 1996. — Vol 49, № 10 — P. 821—
826.
Kitchen S., Wooley A M., Watson C et al. INR determinations using recombinant thromboplastins
are influenced by factor V levels // Thromb Haemost. — 1997. — Vol 78 №4. — P 700-706.
Koller P T., Arom К. V Thrombolytic therapy of left-sided prosthetic valve thrombosis // Chest. —
1995. — Vol. 108, № 7. — P 1683-1689
Komshi Y, Tatsuta N„ Minami К et al. Hemolysis after implantation of prosthesis heart valves /
Arch Jap Chir. — 1982. — Vol. 51, №3. — P 495-503
Kontozis L. Skudicky D„ Hopley M J et al Long-term follow-up of St Jude Medical P'°sth®®‘s '
young rheumatic population using low-level warfarin anticoagulati n an i is
distribution of causes of death // Am. J. Cardiol. — 1998. — Vol. 81, № — _ _ pment-
f<fatz J. M , Crawford F. A , Sade R. M. et al St Jude prosthesis for aortic and m t I va P
a ten-year experience // An. Thorac. Surg — 1993. — Vol. 56, №
Kuh/ H p, Franke A., Puschmann D et al. Regression of left ventricular mass о у _ _
valve replacement for pure severe aortic stenosis // Am. J. Cardio
kuntze C. £, Blackstone E. H., Ebels T. Thromboembolism and mechanical heart valves, a rando
study revisted // An. Thorac. Surg. - 1998 - Vol. 66, № 1. “ PQ 101_ . 7 №4 _ p 387-
uypers F A Red cell membrane damage I I J. Heart valve Dis.
396
Laal1 M- Le Guyader A , Lepnnce P et al. Valvular replacement with the ^b°2 -
Results after 7 years in 104 patients // Arch. Mai. Coeur Vaiss
^czkovics A., Heidt M„ Oelert H. et al. Early clinical experience with the On-X prosthetic
11 J' Heart Valve Dis- - 2001 - VoL 10' № 1- " P 94 "Г’, pffects of the association of
P. Roudaut R., Roques X et al. Early and long-term (one year) effects
.______ 429
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
aspirin and oral anticoagulant on thrombi and morbidity after replacement of the mitral valve with
the St Jude Medical prosthesis: a clinical and transesophageal echocardiographic study // j Am.
Coll. Cardiol. — 2000. - Vol. 35, №3. — R 739-746.
Lassem J. F, Brandslund L. Autonsen S. International Normalized Ratio for prothrombin times in
patients taking oral anticoagulants: critical difference and probability of significant change in
consecutive measurements // Clin. Chem. — 1995. — Vol 41, №3. — R 444-447
Lee J W., Choi К J., Lee S G. et al. Left ventricular muscle mass regression after aortic valve
replacement // J Korean Med. Sci. — 1999. — Vol- 14, №3. — P. 511-518
Lee L H. Thrombotic and haemorrhagic complications in patients with mechanical heart valve
prostheses attending the Singapore general hospital anticoagulation clinic // An. Acad. Med
Singapore. — 2000. — Vol. 29, № 1. — P 71-74.
Lengyel M. Vandor L The role of thrombolysis in the management of left-sided prosthetic valve
thrombosis a study of 85 cases diagnosed by transesophageal echocardiography // J. Heart
Valve Dis. — 2001. — Vol. 10, № 3. — P. 636-641.
Li T Identification of the gene for vitamin К epoxide reductase // Nature 2004. — Vol. 427, №3. —
P 541-544.
Louagie Y., Noirhomme R, Aranguis E. et al. Use of the Carpentier-Edwards porcine bioprosthesis:
assessment of a patient selection policy // J. Thorac. Cardiovasc. Surg. — 1992. — Vol, 104
№5. — P. 1013-1019.
Lund O., Nielsen S. L., Arildsen H. et al. St Jude’s bi-leaflet aortic valve prosthesis throughout two
decades Quality profile and risk factors // Ugeskr. Laeger. — 2001. — Vol. 164, № 1 — P 55-60
Ly J. F, Grunkemeier G L , Sutheiland H. D. et al. The ultimate prognosis after valve replacement,
an assessment at twenty years // An. Thorac. Surg. — 1981. — Vol. 32, № 1 — R 111.
Lytle B. W., Pnest В. P., Taylor P. C. et al. Surgical treatment of prosthetic valve endocarditis //
J Thorac. Cardiovasc. Surg. — 1996. — Vol. 111, № 1. — P 198-207.
Maehler H. E, Schmidt С H., Neuner P. et al. Twenty-four years’ implant duration of the aortic Stair-
Edwards silastic ball prosthesis: a valve of the past? // Eur. J. Cardiothorac. Surg. — 1993. —
Vol. 7, № 1. — P. 114-116.
Maharaj S., Bayliff C. D., Kovacs M. J. Successful anticoagulation with dalteparin in a patient with
mechanical heart valves // An Pharmacother. — 1999. — Vol. 33, № 11 — P 1188-1191.
Мапписа P M Genetic control of anticoagulation I I Lancet — 1999 — Vol. 353. — R 688-689.
Manteiga R., Carlos Souto J., Aites A. et al. Short-course thrombolysis as the first line of therapy for
cardiac valve thrombosis // J. Thorac. Cardiovasc. Surg. — 1998 — Vol. 115, № 4. — R 780-784
Marchand M.f Aupart M., Norton R. et al Twelve-year experience with Carpentier-Edwards
PERIMOUNT pericardial valve in the mitral position: a multicenter study // J. Heart Valve Dis. -
1998. — Vol. 7, № 2. — R 292-297.
Margaghone M., Coiaizzo D., D Andrea G. et al. Genetic modulation of oral anticoagulation with
warfarin // Thromb. Haemost. — 2000. — Vol. 84 — P 775-778
Marquez S , Hon R T., Yoganathan A P. Comparative hydrodynamic evaluation of bioprosthetic heart
valves // J. Heart Valve Dis. — 2001. — Vol. 10, №3. — P. 802-810.
Matchar D. В, Samsa G P., Cohen S J. et al. Improving the quality of anticoagulation of patients
with atrial fibrillation in managed care organizations: results of the managing anticoagulation
services trial // Am J. Med. 2002. — Vol. 113, № 1. — P 42-51
McGiffin D. С., О Brien M. F., Galbraith A. J et al. An analysis of risk factors for death and mode
specific death after aortic valve replacement with allograft, xenograft, and mechanical valves //
J Thorac. Cardiovasc Surg — 1993. — Vol. 106, №4.________R 895-903.
Meschengieser о S., Fondevtla C. G., Frontroth J. et al. Long-intensity oral anticoagulation plus low
dose aspirin vercas high-intensity oral anticoagulation alone: a randomized trial in patients with
R 9?oa-9C16 Pr°SthetlC h6art valves /Z J Thorac- Cardiovasc. Surg - 1997 - Vol 113, № 5. -
MetzdorffM. T, Grunkemeier G. L , Starr A Current long-term results with the silastic ball prosthetic
м Vh d P a K* (ed )' Heart va,ve ReP*acement and Reconstruction. Chicago: Year Book
Med. Publ. Inc., 1987. — R 201-210
Milano A Bortolotti U. Mazzucco A et al Heart valve replacement with the Sorin tilting-disc
Prosthesis. A 10-year experience // J Thorac Cardiovasc. Surg. - 1992 - Vol ЮЗ. №2. -
H zo/-275.
M"%vFw^err^ncntS °f °.U,COnie ,n sur9ica"V treated patents with native valve endoca.ditis
(NVb) // j Card Surg. — 1989 — Vol 4, №2. — P 331-336
—-------- 430 ------------ -— ----------------------------------------------
____________Г-ЛАВА 6^езУльта™пР°т^^""« и ^панно.завиС1,мые
Miller D. С., Oyer Р Е„ Stinson Е. В et al Теп to fifteen year reass.-c.ncni ..
characteristics of the Starr-Edwards Model 6120 mitral valve prosthesis //J Thora P^°;n’ance
Surg. — 1983. — Vol. 85, № 1. - P 1-11. tsis /Jthora. Cardiovas.
Miners J. O„ Birkett D. J. Cytochrome P450 2C9 an enzvme of mamr
metabolism // British Journal of Clinical Pharmacology - 1998. - Vol 45Р№б'- p 525^"^
Misawa Y„ Fuse K , Saito T et al. Fourteen year experience with the Omnicarbon piosthet heart
valve // ASAIO J. - 2001. - Vol. 47, № 6. - P. 677-682. P
Montorsi P. Cavoretto D, Ballenni G Thrombosis of mechanical heart valve piostheses revisenn
the role of fluoroscopy I I Br. J. Radiol. — 2000 — Vol. 73, № 865. - p. 76-79 ’ 9
Murakami T„ Eishi K., Nakano S. et al Aortic and mitral valve replacement with the Carpentier-Edward
pericardial bioprosthesis- 10-year results // J Heart Valve Dis. - 1996 — Vol 5, N° 1 — p 45-49
Murakami T, Kikugawa D., Endoh К et al. Long-term follow-up of patients with small St Jude aortic
valve prostheses // J. Thorac. Surg. — 1998. — Vol 51, №9 — p 749.752,
Natsuaki M Systemic hypertension as a risk factor for complications with on aortic mechanical valve //
ASAIO J. — 1998. — Vol. 44, № 5. — P. 486-490
Natsuaki M., Itoh T., Okazaki Y et al. Influence of St. Jude medical valve in patients with aortic stenosis
and small aortic annulus on cardiac function and late survival result // Artif Organs — 2002 —
Vol. 26, № 10. — R 840-846.
Neville P H., Aupart M. R, Diemont F F et al Carpentier-Edwards pericardial bioprosthesis in aortic
or mitral position: a 12-year experience // An. Thorac. Surg. — 1998 — Vol 66(6 Suppl) —
P. 143-149.
Nistal J. F, HurleA., Revuelta J. M. et al. Clinical experience with the CarboMedics valve early results
with a new bileaflet mechanical prosthesis I I J Thorac. Cardiovasc Surg — 1996 — Vol 112,
№ 1. — P. 59-66.
Nitter-Hauge S., Abdelnoor M Ten-year experience with the Medtronic-Hall valve prosthesis a study
of 1104 patients I I Circulation. — 1989. — Vol 80 (Suppl. 1) — P 143-149
Ohta S., Ohuchi M., Katsumoto K. et al. Comparison of long-term clinical results of the three models
of the Bjork-Shiley valve prosthesis and the Omnicarbon valve prosthesis // Nippon Kyobu Geka
Gakkai Zasshi. — 1995. — Vol. 43, №7. — P 1569-1574.
Olesen К H.t Rygg I. H., Wennevold A et al Aortic valve replacement with the Lillehei-Kaster
prosthesis in 262 patients: an assessment after 9 to 17 years // Eur. Heart J. — 1991. — Vol 12,
№ 6 — P 680-689.
Orszulak T. A,, Schaff H. V., Puga F J. et al Event status of the Starr-Edwards aortic valve to 20
years: a benchmark for comparison // An. Thorac Surg — 1997 — Vol. 63, № 3 — P. 620-626.
Otaki M, Kitamura N. Six years' experience with the Omnicarbon valve prosthesis // Cardiovasc.
Surg — 1993. _ vol 1, №3. — P 594-560
Ozeren M., DoGan О. И, Dolgun A et al Clinical results of the ATS prosthetic valve in 240 implants
and review of the literature // J Heart Valve Dis — 2001. — Vol. 10, №3. — P 628-635.
Ozkan M., Kaymaz C., Kirma C. et al. Intravenous thrombolytic treatment of mechanical pros e^c
valve thrombosis: a study using serial trasesophageal echocardiograp / J Am oil a 10
2000.-Vol 35, №7 — P 1881-1889 inQr(cnrinf
Pelletier L O, Carrier M., Leclerc Y. et al. Porcine versus pericardial bioprostheses a compan 0
late results in 1593 patients//An Thorac Surg — 1989 — Vol 47« № 2, n ।
Pelletier L C., Carrier M., Leclerc Y. The Carpentier-Edwards pericardial Ьюрг
experience with 600 patients I I An. Thorac Surg - 1995. - Vol 60, № 2. - _
Pengo V., Barbero F., Banzato A. et al. A comparison of a moderate with modem g HaernoSt. —
anticoagulant treatment in patients with mechanical heart valve prostheses //
Pengo V, PeruzziP, Marzari a' Й. Vantages of a cardiologic ambulatory care facJJspecifically
organized for patients undergoing treatment with oral anticoagulan iug /
1989. - vol. 19, № 12. - P. 1125-1128. . replacement with
er'er P, Deloche A , Chauvaud S et al A 10-year comparison of _ 1989 —Vol 48,
Carpentier-Edwards and Hancock porcine bioprostheses / Ап. iorac
₽ene< p„ Swanson J., Takriti A. et al. Decreasing operative risk in lb° ^gedingSPof the Thud
odnar E., Yacoub M (eds ). Biological and Bioprosthetic av
International Symposium. — New York: Yorke Medical Books, 1Jbt>
Proceedings of the Thud
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА________ ______________
Peter М . Weiss Р, Jenzer Н. R. et al. The Omnicarbon tilting-disk heart valve prosthesis: A clinical
and Doppler echocardiogram tollow-up // J Thorac. Cardiovasc. Surg. 1993. — Vol. 106,
№3. - P. 599-611.
Peyvandi F.t Spreafico M., Sibom S. et al. A study of 130 Italian patients on anti-coagulant treatment:
how variant alleles of gene CYP2C9 influence requirement dose of warfarin during the induction
period of tieatment // XIX International Congress on Thrombosis and Haemostasis. Birmingem, UK,
12-18.07.2003. — J. of Thrombosis and Haemostasis. — Suppl. 1. — July 2003. — Abstr. P. 1986.
Plume S. K., Sanders J. H. The Carpentier-Edwards stented supra-annular pericardial aortic valve
prosthesis, clinical durability and hemodynamic performance // Curr. Opin. Cardiol. — 2002. -
Vol. 17. № 1. - P. 183-187.
Pohl M . Wendt M. O.t Pelzer S. Characterization of mechanical in vitro hemolysis and sub-hemolysis
2: Variables of state and dimensionless characteristic valves of hemolysis // Biomed. Tech. Berl. —
2000 — Vol. 45, №3. — P. 51-56.
Poirer N.C., Pelletier L.C., Pellerin M et al. 15-year experience with the Carpentier-Edwards
pericardial bioprosthesis // An. Thorac. Surg. — 1998. — Vol. 66 (6 Suppl), № 1. — P. 57-62.
Rabago G., Fraile J., Martinell J. et al. Factors influencing thromboembolism after mitral prosthetic
implants // Z Kardiol. — 1986. — Vol. 75 (Suppl 2). — P. 341-344.
Rabelo R., Brasil J., Castro A. et al. CarboMedics bileaflet prosthesis: initial experience at the University
of Padova // Clin. Rep. — 1991. — Vol. 4, № 1. — P. 157-160.
Remadi J. P., Baron O., Roussel C et al. Isolated mitral valve replacement with St. Jude medical
prosthesis: long-term results: a follow-up of 19 years // Circulation. — 2001. — Vol. 103, №7. —
P 1542-1550.
Rodriguez-Cuartero A Hemolytic anemia due to prosthetic mechanical valves // Sangre (Bare). —
1998. — Vol. 43, № 5. — P.468.
Rossiter S. J., Miller D. C., Stinson E. B. et al. Hemodynamic and clinical comparison of the Hancock
modified orifice and standard orifice bioprostheses in the aortic position // J. Thorac. Cardiovasc.
Surg. — 1980. — Vol. 80, №1,-R 54-60.
Russmann S., Gohlke-Barwolf C., Jahnchen E. et al. Age-dependent differences in the anticoagulant
effect of phenprocouman in patients after heart valve surgery // Eur. J. Clin. Pharm. — 1997. —
Vol. 52, № 1. — R 31-35.
Saad R M., Wolfe M. W. Progressive hemolytic anemia due to delayed recognition of a Beall mitral
valve prosthesis // Chest. — 1991. — Vol. 99, № 2. — P. 496-498.
Sala A., Schoevaerdts J. C., Jaumin P. et al. Review of 387 isolated mitral valve replacements by the
Model 6120 Starr-Edwards prosthesis // J. Thorac. Cardiovasc. Surg. — 1982. — Vol. 84, № 3. —
P 744-752.
Sallam A. M., Hwang N. H. C. Red blood cell hemolysis in a turbulent jet // Biomech. Symp. Houston,
Texas, 1983. — P. 83-86.
Santini F Bertohni P., Vecchi B. et al. Results of Biocor stentless valve replacement for infective
endocarditis of the native aortic valve // Am. J. Cardiol. — 1998. — Vol. 82, № 5. — P. 1136-1142.
Santini F., Casah G., Viscardi F. et al The CarboMedics prosthetic heart valve: experience with 1084
implants // J. Heart Valve Dis. — 2002. — Vol. 11, № 1. — P. 121-126
Santini F, Musazzi A , Bertolini P. et al. Stentless porcine bioprostheses in the treatment of aortic
valve infective endocarditis // J. Card. Surg. — 1995. — Vol. 10, № 1. — P. 205-211
Sams G. E., Robbins R. C., Miller D. C. et al. Randomized, prospective assessment of bioprosthetic
valve durability: Hancock versus Carpentier-Edwards valves // Circulation. - 1993. — Vol. 88,
№5. - R 1155-1165.
Saung Z. P, Michael J. R. Current status of stentless aortic xenografts // Curr. Opinion in Cardiology-
2000 - Vol. 15. - P. 74-81.
Seyr M., Hasibeder W., Furtwaegler W. et al. Multiple organ failure after mitral valve repair with
in^r®vascL)'ar hemolysis and its recovery due to mitral valve replacement // Intensive Care
Medicine. — 1993. — Vol. 19, №6. — P. 358-360.
ShioiK, Nagata Y., Mase T etal. Evaluation of intravascular hemolysis by haptoglobin administration
q h 3 u P^sthetic valve replacement // Jap. Circul. J. — 1993. — Vol. 57, №4. — P 322-327.
! я ’ S'l Mat/off J. et al. The St Jude valve. Thrombolysis as the first line of therapy f°r
cardiac valve thrombosis // Circulation. — 1993. — Vol. 87, № 1. — P 30-37
R-> Skudicky D. et al. Frequency and severity of intravascular hemolysis after
ппйяпсо J6placemem with Medtronic-Hall and St Jude Medical prostheses and
N 7 P 'Ti C ^Pe’ P0Sit'°n’ SiZe and number I I J Cardiol - 1993. - Vol. 71.
•'= • — r.. ЭОГ — ОУ1
432
ГЛАВА 6. Результаты протезирования н клапанно-зависимые осложни
Sobrino J., Marco F, Miro J. M. et al Prosthetic valve endocarditis caused hv Cnnin, ♦
pilosum // Infection. - 1991. - Vol. 19, № 2. - R 247-252 У CorynehaGter,",n
Somody E, Ferneres J., Dumazer P et al. Renal hemosiderosis caused by chronic hemolysis in oatient
with a Saint-Jude mitral valve prosthesis // Arch. Malad. Coeur. Vaiss - 199? _ vni «7
№1. _ r ш-113. Ol 0L ”
Stalenhoef J. E, Mellema E. C., Veeger N. J. et al. Thrombogenicity and reoperation of the St Jude
Medical Silzone valve: a comparison with the conventional St. Jude Medical valve // l Нрдгг
Valve Dis. - 2003. - Vol. 12, № 5. - R 635-639.
Starr A.. Grunkemeier G. L. Beyond 24 years with the aortic Starr-Edwards silastic ball valve: a valve
of the past? No: (comment) // Eur. J. Cardiothorac. Surg. — 1993. — Vol 7, №3. _ r 113-114
Stewart S., Cianciotta D., Hicks G. L et al. The Lillehei-Kaster aortic valve prosthesis. Long-term
results in 273 patients with 1253 patient-year of follow-up. // J. Thorac. Cardiovasc Surg —
1998. — Vol. 95, №6. — P. 1023-1030.
Suedkamp M., Lercher A. J., Mueller-Riemenschneider F. et al Hemolysis parameters of St Jude
Medical: Hemodynamic Plus and Regent valves in aortic position // Int. J. Cardiol. — 2004 —
Vol. 95, №. 1. — P. 89-93.
Svensson P. J., Follrud C., Thulin L. et al. New system for testing mechanical heart valves. Self-
monitonng at home of anti-vitamin К therapy means greater freedom for patient //
Lakartidnmgen. — 1999. — Vol. 96, №20. — P. 2478-2482.
Tabrizi A. R., Zehnbauer B. A., Borecki I. B.et al. The frequency and effects of cytochrome P450 (CYP)
2C9 polymorphisms in patients re-ceiving warfarin // J. Am. Coll. Surg. — 2002. — Vol. 194,
№ 3. — P. 267 — 273.
Tatmeni S., Barner H. B., Pearson A. C. et al. Rest and exercise evaluation of St Jude Medical and
Medtronic-Hall prostheses. Influence of primary lesion, valvular type, valvular size and left
ventricular function // Circulation, 1989. — Vol. 80 (Suppl I). — P. 116-123.
Tatineni S., Barner H. B., Pearson A. C. et al. The monostrut versus Medtronic-Hall prosthesis: a
prospective ranomized study // J. Heart valve Dis. — 1994. — Vol. 3, №3. — P. 254-259
Taube J., Halsell D., Baglin T. Influence of cytochrome P-450 CYP2C9 polymorphisms on warfarine
sensitivity and risk of over-anticoagulation in patients on long-term treatment // Blood. — 2000 —
Vol. 96. — P. 1816-1819.
Teijeira F. J. Long-term experience with Omniscience cardiac valve //J- Heart valve Dis. — 1998 —
Vol. 7, № 5. — P. 540-548.
Thevenet A., Albat B. Long term follow up of 292 patients after valve replacement with the Omnicarbon
prosthetic valve // J. Heart Valve Dis. — 1995. — Vol. 4, №3. — R 634-642.
Thomson D. J.t Jamieson W. R., Dumesnil J. G. et al. Medtronic Mosaic porcine bioprosthesis- midterm
investigational trial results // An. Thorac. Surg. — 2001 — Vol. 71, №2. — P. 269- .
Tiede D.J., Nishimura R. A., Gastineau D. A. et al. Modern management 0 e 1
anticoagulation [Review] // Mayo. Clin. Proc. — 1998. — Vol. 73, №7. — P ~ Птп|гагьоп
Torregrosa S., Gomez-Plana J., Valera F. J. et al. Long-term clinical experience with the
prosthetic valve // An. Thorac. Surg. — 1999. - Vol. 68, №4. - P. 881-886. nmsthetic
Travis B. R., Heinrich R. S., Ensley A. E et al. The hemodynamics effects of me<*an °d^s of
valve type and orientation on fluid mechanical energy loss and pressure rop ।
ventricular hypertrophy // J. Heart valve Dis. - 1998. - VoL 7 № 3. - н
Turpie A. G. G., Gent M„ Laupacis A. et al. A comparison of aspirin th placep _
with warfarin after heart valve replacement // N. Engl. J. Med.
Tyers G. F.2Jameson W. R.. Munro A. I. et al. Reoperation in bioiogical
populations: fate of the reoperative patient // An. Thorac. Suig
P. 464-470 , fhe Medtronic-Hall
Vallejo J. l., Gonzalez-Santos J. M„ Albertos J et al. Eight years expen 6
valve prosthesis//An. Thorac. Surg. — 1990. — Vol. 50, ’ or,iar₽ment with the Carpentier-
Van Doorn C. A., Stoodley K. D., Saunders N. R. etal. Mitral valve r P Eur j Cardiothorac.
Edwards standard bioprosthesis: performance into the secon
Surg. - 1995 - Vol. 9. Ns 2. - R 253-258. onticoaaulation for mechanical
Uan N°oten G. J„ Van Belleghem Y., Caes F. et al. Lower-intensity ^Va|ve Dis. _ 2003 -
heart valves: a new concept with the ATS bileaflet aortic va v
v°l. 12, №4. — R 495-501.
433
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
Van Ri k-Zwikker G L , Delemarre В J , Huysmans H A The orientation of the bileaflet CarboMedics
valve in the mitral position determines left ventiicular spatial flow patterns // Eur J Cardiothorac
Surg — 1996 — Vol 10 №5 — P 513-520.
Venkataraman К Beer F, Mathews N P et al. Thrombosis of Bjork-Shiley Aortic Valve Prostheses //
Radiology — 1980 — Vol 137, №1 — P 43-47.
VerdecchiaP Schillaci G., Вогдют C etal Prognostic significance of serial changes in left ventricular
mass in essential hypertension // Circulation — 1998. — Vol. 97, № 1. — P 48-56.
Verheugt E W Anticoagulation after artificial valve replacement with or without atrial fibrillation how
much is really needed? // Thromb Haemost — 1999 — Vol 82 (Suppl 1). — P 130-135
Verheul H A , Van den Brink R. В , Van Vree/and T. et al Effects of changes in management of
active infective endocarditis on outcome in a 25-year period // Am. J Cardiol. — 1993 —
Vol 72. № 3. - P. 682
Verstraete M, Verhaeghe R.. Routledge A P Anticoagulants in the eldeily // Butchart E G., Bodnar
E (eds ) Thrombosis, Embolism and Bleeding. London ICR Publishers — 1992 — P 356-361
Virchow R Gesammelte abhandlungen zur wissenschaftlichen medicine, Frankfurt, Meidmger Sohn
and Co - 1856 - P 219-232
Vitale N, De Feo M., Renzulli A et al Ten-year outcome with the Sorin bicarbon and Baxter Mira
bileaflet prostheses in the aortic position // J Heart Valve Dis. — 2004 — Vol 13, № 4 —
P 632-637.
Vongpatanasin W, Hillis L D, Lange R A Prosthetic heart valves // N Engl J Med — 1996 —
Vol 335, №2 — P 407-413
Wain W H, Dury P J, Ross D N Aortic valve replacement with Starr-Edwards valves over 14 years //
An Thorac. Surg — 1982 — Vol 33, №6. — P. 562-569
Wardlaw J M The place of thrombolysis the management of cerebral embolism after heart valve
replacement//J Heart valve Dis — 1993 — Vol 3, №6 —P 611-612
Watanabe S, Nakano К, Misumi H et al St Jude Medical valve replacement clinical experience
with 1039 patients // Nippn Geka-Gakkai-Zasshi — 1989. — Vol. 90, № 9. — P 1513-1516
Wesse/s A , Sadowski R G Medtronic-Hall valve replacements in a third-world population group a
review of the performance of 1000 prosthesey // J Thorac Cardiovasc Surg — 1988 —
Vol 95, № 6 — P 980-993
Wheatley D J . Raco L , Bernacca G. M. et al Polyurethane: material for the next generation of heart
valve prostheses? // Eur J Cardiothorac Surg — 2000 — Vol. 17, № 4. — P 440-448
Whitaker D C, James S E, Walesby R К A single-center experience of the Sorin Bicarbon heart
valve prosthesis, long-term clinical, hematological and hemodynamic results // J Heart Valve
Dis — 2004. — Vol 13, № 1 — p 97-102.
Wijdicks E F, Schievink W. I., Brown R D. et al The dilemma of discontinuation of anticoagulation
therapy for patients with intracranial hemorrhage and mechanical heart valves // Neurosurg -
1998 — Vol 42, №4. — P 769-773
Yamak В, Iscan Z, Mavitas В et al. Low-dose oral anticoalation and antipletelet therapy with St
Jude Medical heart valve prosthesis // J Heart valve Dis — 1999 — Vol 8, № 6 — P 665-673
Yamauchi M, Eishi К, Nakano К et al Valve replacement with the CarboMedics bileaflet mechanical
prosthesis: clinical results at midterm // J Cardiovasc Sure (Torino) — 1996 — Vol 37, № 2 -
P 285-291
Yu V L , Fang G D, Keys T F et al Prosthetic valve endocarditis, superiority of surgical valve
replacement versus medical therapy only // An Thorac Surg - 1994 - Vol. 58, №4 -
P 1073-1077
Zabalgoitia M Garcia M Pitfalls in the echo-Doppler diagnosis of prosthetic valve disorders //
Echocardiography - 1993 - Vol. Ю, № 1. - p 203-211
^а^то°и/а M । K°Pec • Oneschuk L et al Use dobutamine stress echocardiography in assessing
c ^'ca aortrc prostheses comparison with exercise echocardiography // J Heart valve Dis
— 1997 — Vol 6 № 1 — p 253-257
Da/? Volta s A comPar|son of a moderate with moderate - high intensity oral anticoagulant
Уо! Pat’en^wrth^mecharHcal heart valve prostheses //Thromb Haemost — 1997
Нен^М ’ Firschke C Fulminant thrombosis of mechanical mitral valve prosthesis //
пеан — 2001 — Vol 86, № 1 — p 16-18
modifieiTord^P^rt Carter J E et al Hemodynamic and clinical evaluation of the Hancock
modihed-onfice aort.c btoprosthesis Ц Circulation - 1981 - Vol 64 N<> 2 (pt 2) - P 189-196
434 ---------------- * “ —
ЗАКЛЮЧЕНИЕ
Рост популяции больных с механическими искусственными клапанами сеодиа и
биопротезами определяет актуальность проблемы их психофизиологической и Son
ально-трудовои реабилитации. При этом одним из перспективных направлении повы
шения уровня реабилитационного потенциала оперированных больных в отдалённыР
сроки наблюдения является профилактика и лечение клапанно-зависимых осложнрнии
исследование показателей внутренней среды организма (гомеостаза) пациентов nav
чение их выживаемости и летальности, а также дальнейшая разработка протезов кла-
панов сердца с лучшими гемодинамическими характеристиками
Протезы клапанов сердца, предназначенные для эффективного лечения органичес-
ких поражении клапанного аппарата, являются одними из самых сложных и уникаль-
ных медицинских устройств, используемых в кардиохирургии Их конструктивные осо-
бенности, дизайн и технология изготовления вполне сопоставимы с достижениями
в современном автомобилестроении или в изготовлении самых дорогих и изящных
ювелирных изделий Полувековая история создания, совершенствования и исследова-
ния протезов клапанов сердца богата использованием разнообразных инновационных
предложений.
В процессе эволюции искусственных клапанов сердца сформировались два прин-
ципиально отличающихся вида заменителей клапанов сердца механические (искусст-
венные) и биологические (естественные) Механические искусственные клапаны изго-
тавливают из неорганического или искусственного материала, который представлен
металлами, керамикой, полимерами Основой же биологических клапанов является
естественный биологический материал, который представлен нативным человеческим
клапаном — аутографтом (имплантация пациенту собственного клапана легочной ар-
терии в аортальную позицию) или специально обработанным человеческим клапаном,
взятым от трупа (аллографтом или гомографтом) а также клапаном, взятым от живот-
ного в преморбидном состоянии (ксенографтом) По существу, речь идет о трансплан-
тате и трансплантации естественного (бескаркасного) клапана в отличие от каркасног
биопротеза, для изготовления которого используется различная комбинация материа-
лов При этом основа каркаса представлена жестким или полужестким кольцом из не-
органического или искусственного материала, а закрепленные на нем створки кл пана
выполнены из специально обработанного биологического материала (створки серде <
ных клапанов, перикард, капсула Глиссона и т д ), взятого от животных (свиньи, круп
ного рогатого скота).
Конструктивные различия, имеющие место между двумя видами искусственных
панов сердца, нашли свое отражение в особенностях их функции Так, если
сердечному клапану человека функцию механические искусственные клапаны
осуществляют через иной, заложенный в них механизм, то биологическиеj ’
охраняя структуру кровотока, весьма близко воспроизводят функцион
н <м естественного клапана сердца Тем не менее, ни один из двух вид твовать
ных клапанов сердца не отвечает всем требованиям, которым должен недостат-
идеальный протез. Скорее всего, каждый из них имеет свои достои показании к их
КИ, которые всегда необходимо иметь в виду и учитывать при вв' чт0 в подавля
использованию в конкретных группах пациентов СледУ^^тРвенные клапаны серд-
ящем большинстве стран чаще используют механические ку явнению с биопро-
ца Так, по данным F J Schoen и соавт (2001), их использование соотношение
тезами, составляет 3 2 и только в США их применение имеет оир существенным
В процессе эволюции механических искусственных клапан шаровыми клапа-
°бразом менялся их дизайн от первого поколения, представ поворотно-диско-
нами (Hufnagel с 1952 г и МКЧ-01 с 1963 г) к усовершенствованным повор
ИСКУССТВ ЕННЫЕ КЛАПАНЫ СЕРДЦА
вым клапанам второго поколения (Lillehei-Cruz-Kaster с 1963 г и АКЧ-20 с 1974 г) и
затем к современным двустворчатым клапанам третьего поколения (St. Jude Medical с
1977 г и Карбоникс с 1987 г.). Шаровой клапан долговечен, однако имеет высокий про-
филь, который ограничивает его применение при малых размерах желудочка и аорты,
способствует образованию турбулентных потоков и отрывных зон, обладает высокой
тромбогенностью, характеризуется большим сопротивлением Поворотно-дисковый
клапан, который имеет более низкий профиль по сравнению с шаровыми протезами,
расширяет перспективы и возможности имплантации, но и он оказывается не в состо-
янии воспроизводить физиологическую структуру кровотока, вызывая повреждение
форменных элементов крови и тромбообразование Обладая относительно малым со-
противлением, самым низким профилем, двустворчатый искусственный клапан серд-
ца также оказывает повреждающее воздействие на форменные элементы крови. Тече-
ния в узких зазорах его шарнирных механизмов, формирующаяся кавитация при за-
крытии створок не исключают наличие гемолиза и тромбообразования. В целом же,
двустворчатые модели механических клапанов сердца, бесспорно, имеют свои суще-
ственные преимущества и в настоящее время доминируют в клинической практике.
Современное поколение механических искусственных клапанов сердца представ-
лено как поворотно-дисковыми, так и двустворчатыми конструкциями. Запирающие
элементы отечественных протезов изготавливают из углеситала, а корпус из углесита-
ла или титана (иногда с имплантацией углеродом). Запирающие элементы зарубежных
клапанов выполняют из графита (в некоторых случаях с добавками вольфрама для обес-
печения рентгеноконтрастности) и покрывают пиролитическим углеродом, а седло из-
готавливают из кобальто-хромового сплава или титана с углеродным покрытием, или
также из графита, покрытого пиролитическим углеродом, или полностью из пиролити-
ческого углерода (у ряда конструкций с импрегнацией вольфрамом). Пришивную ман-
жету, изготовленную из полимерного волокна, присоединяют к внешней стороне кар-
каса искусственного клапана для фиксации протеза к фиброзному кольцу иссеченного
нативного клапана.
Основными преимуществами механических искусственных клапанов являются их
долговечность и износоустойчивость. Почти 100-летний расчетный ресурс их работы
обычно превышает продолжительность жизни человека. Долговечность протезов зави-
сит, главным образом, от конструкции и используемых материалов Механические кла-
паны более тромбогенны — в этом их недостаток — и поэтому требуют проведения
пожизненной антикоагулянтной терапии, тогда как пациенты с биологическими клапа-
нами при наличии у них синусового ритма могут ограничиваться приемом только анти-
агрегантов Передозировка антикоагулянтов может способствовать внутреннему или на-
ружному кровотечению с угрозой для жизни Разрастание и наползание на протез ок-
ружающих тканей (паннус) приводит к прогрессирующему стенозу и нарушению
движения запирающих элементов и дисфункции клапана. Специфическая звуковая сим-
птоматика функционирующего клапана, обусловленная взаимодействием его подвиж-
ных частей, вызывает психологический дискомфорт у оперированных пациентов. Не-
смотря на высокую износоустойчивость, их разрушения были зафиксированы как сре-
ди поворотно-дисковых, так и среди двустворчатых конструкций В частности, в связи
с этим было прекращено производство дискового клапана Bjork-Shiley, а двустворча-
тый клапан Duromedics был модифицирован и получил новое название Edwards-Tekna
азрушение клапана Bjork-Shiley из-за разлома выходного ограничителя хода приво-
дило к эмболизации мигрирующим диском Материаловедческий анализ указывал на
причины разрушения несовершенство сварного шва и усталостные напряжения в
ограничителе В двустворчатых клапанах максимальные напряжения действуют в шар*
нирных механизмах. К факторам, определяющим износ трущихся элементов, относят-
ся их форма (плоскость по плоскости, сфера по плоскости), кинетика относительного
пГ'!НИЯ (скольжение1 качение, вращение), материалы (пиролитический углерод по
итическому углероду, углеситал по металлу, пиролитический углерод по углерод*
436 ------------------------------------------------------
ЗАКЛК) 1 НИ
ному покрытию металла) В клапане Duromedics эрозия створок, шарнирною м.
ма и корпуса приводили к разрушению шарнира и эмболизации створ,ои К нХ.™
ственным причинам разрушения относили появление кавитационных микропоо ин н и
лансированность напряжении из-за несимметричного закрытия створок МодиФик'™™
клапана включала изменение радиуса закругления кромки створки, контактируюшг и г
корпусом, включение силиконового кольца в крепление манжеты для демпфиров, ,ия
удара створок при закрытии, уменьшение зазора между прямолинейным участком кром
ки створки, контактирующим с корпусом вблизи шарнирного механизма для уменьши-
ния асимметрии в движении створок
В прошлом материалы для изготовления клапанов сердца отбирались не согласно
критериям биосовместимости, а скорее, основывались на результатах интуитивного
поиска и постоянного совершенствования технологии как их изготовления, так и о- р i-
ботки поверхности В настоящее время биосовместимость является основным требо-
ванием, предъявляемым к таким материалам Тем не менее, должны также учитывать-
ся требования к механическим (прочность материала на разрыв и сжатие, твердо ть
усталостная выносливость, износостойкость) и физико-химическим свойствам (элект-
ро- и теплопроводность, термостойкость, химические реакции с окружающими тканями,
рентгеноконтрастность) материалов Кроме того необходима их оценка на предмет
устойчивости к длительному динамическому напряжению, поскольку эти материалы
после имплантации протезов клапанов сердца подвергаются постоянному воздействию
различных по интенсивности и частоте физических нагрузок Безусловно, также долж-
на учитываться инертность материалов к различным видам их стерилизации автокла-
вирование, обработка газообразным оксидом этилена, воздействие /-излучения
Коммерческий успех и широкое клиническое внедрение механических клапанов в
целом обеспечивается следующими главными технологическими инновациями исполь-
зованием синтетического биосовместимого материала — пиролитического углерода
(1966 г), новаторским двустворчатым дизайном (1977 г), модификациями пришивных
манжет (1995 г) и разработкой эффективных программ антикоагулянтной терапии
Пиролитический углерод, благодаря своей превосходной биосовместимости, жест-
кости, химической инертности, износо- и термостойкости, приобрел широкое приме-
нение при изготовлении практически всех современных моделей искусственных кла-
панов сердца. Он — второй по прочности материал после естественного алмаза Он
использовался при изготовлении более чем 30 различных моделей протезов сердеч
ных клапанов, общее число которых к настоящему времени приближается к 4 млн Пока
ни один другой материал, нашедший применение при изготовлении постоянно контак
тирующих с кровью искусственных клапанов сердца, не мог превзойти востре ован
кость пиролитического углерода Современные исследования в области совершенств
вания свойств пиролитического углерода направлены на улучшение его тром орези
тентных свойств методами модификации поверхности лазерным осаждением'У
плазменной имплантацией полимеров, текстурированием атомарным кис^ vc_
Наиболее распространенная в настоящее время д| у яворчатая КОН(^Р кповотока
ственного клапана сердца обеспечивает минимальный уров нь мущ от_
За счет открытия тонких створок под большим углом, наличия вь’с^°1‘ папане,
крытия и закрытия запирающего элемента и низкого градиента д в тоомбообра-
что, в конечном итоге, значительно уменьшает интенсивность ПР°Ц поотезИрования
зования и травмы крови происходящие в организме 6о^ьны^ п каобоникс) не тре-
кл п нов сердца Вращение створок вокруг оси клапана ( ает д0П0лнитель-
специальной ориентации створок при имплантации и о
Ныи механизм снижения тромбонакопления яется путь приближения
Одним из направлении улучшения структуры кровотока явл льного клапана че-
к°нструкции искусственного клапана к форме естественного тичного полимера
ловека, т е создание трехстворчатого клапана из углерода игi . механизма Д6уствор-
Р°должающиеся поиски оптимальной конструкции шарн р
437
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
чаты\ клапанов в настоящее время основываются на детальных гидродинамических
исследованиях микроструктуры течения в узких зазорах. Исследования включают в себя
визуализацию течения и измерения лазерным допплеровским анемометром и мето-
дом трассирующих частиц в увеличенных прозрачных моделях шарниров, а также чис-
ленное моделирование течения крови с учетом ее реологических характеристик.
' Современные клапаны выпускают с различными модификациями обшивных манжет,
обеспечивающих возможность выбора способа имплантации, исходя из морфофунк-
циональных показателей фиброзного кольца и вида клапанного порока. Например, кла-
паны Мединж-In, St. Jude Medical Standard, Carbomedics Standard предназначены для
интрааннулярной имплантации, а Мединж-Su, Мединж-Ex, St. Jude Medical HP, St. Jude
Medical Regent, Carbomedics Top Hat, Carbomedics SuMit — для супрааннулярной. Од-
нако, несмотря на улучшение гемодинамических характеристик этих клапанов, их суп-
рааннулярная имплантация сопровождается повышенным риском развития параклапан-
ных фистул, особенно при кальцинированном фиброзном кольце. Современные раз-
новидности обработки манжет включают тромборезистентные углеродные (Микс, Sorin)
или серебряные (St. Jude Medical Silzone) покрытия, импрегнацию гепарином, куран-
тилом и антибиотиками, прошивку серебряной нитью или покрытие защитной пленкой
из политетрофторэтилена для профилактики образования паннуса (Мединж). Возмож-
ность поворота клапана относительно обшивной манжеты позволяет хирургу выбирать
оптимальную ориентацию клапана после имплантации, а также избегать заклинивания
запирающего элемента окружающими тканями. Перспективы развития механических
клапанов связаны с дальнейшим совершенствованием двустворчатых конструкций. Но-
вые направления включают поиски атромбогенных биосовместимых материалов, путей
реализации максимально близкой к естественной искусственной гемодинамики на про-
тезе и отказ от антикоагулянтной терапии.
Параллельно с созданием и внедрением в клиническую практику искусственных ме-
ханических клапанов сердца осуществлялась разработка и клиническое применение
каркасных биопротезов из искусственного каркаса и биологической ткани (Hancock с
1969 г. и Бионике с 1982 г.). Каркасный биопротез состоит из металлического или поли-
мерного каркаса с полиэтиленовым волоконным покрытием и химически обработанной
биологической ткани, которая пришивается к каркасу для формирования запирательно-
го створчатого элемента Сегодня применяется более десятка каркасных биопротезов.
Главными преимуществами каркасных биопротезов является их хорошая биосов-
местимость, что проявляется низкой тромбогенной активностью, близкой к естествен-
ной гемодинамикой, низким уровнем гемолитических осложнений и отсутствием шу-
мового эффекта из-за применения биологических материалов. Имплантация каркас-
ных биопротезов обычно сопровождается меньшим числом клапанно-зависимых
осложнений по сравнению с механическими клапанами. Больным с имплантированны-
ми биопротезами и сохраненным синусовым ритмом требуется лишь временная анти-
коагулянтная терапия. К недостаткам каркасных биопротезов следует отнести стено-
зирование проходного отверстия, деформацию створок, их кальцификацию и струк-
турную дегенерацию, что, в конечном итоге, приводит к ограниченному периоду
вр гмени их функционирования. Кальцинированная ткань становится ригидной и не
способной адекватно выполнять функцию открытия и закрытия створок. Обычно, чем
старше пациент, тем медленнее протекает процесс кальцификации, что может быть
связано со снижением уровня кальция в крови у пожилых пациентов. Временной ре
урс каркасного биологического клапана составляет в среднем около 10 лет, что во
много раз меньше, чем у механических клапанов сердца.
Для снижения стенозирующего эффекта, напряжений в створках и развития каль
циноза иологической ткани в настоящее время в клинической практике все чаще ис
пользуют бескаркасные биопротезы (трансплантаты), которые, как и каркасные биоло-
гические заменители клапанов, имеют богатую историю своего создания. Сегодня в
линическои практике используют не менее десятка различных бескаркасных биопро
438 ----------------- —-------------------------------
________________________________________.______________________ЗАКЛЮЧЕНИЕ
тезов. Криосохраненные трупные аллографты применяют для протезирования клала
нов сердца с 1962 г. Естественная биологическая структура и форма трансплзнГта
обеспечивает его высокие функциональные характеристики, а содержащая жизнесп
собные, живые клетки ткань трансплантата делает его наиболее биологически совм .'
тимым, по сравнению с механическими клапанами или ксено-трансплантатами Одна
ко, несмотря на эти преимущества, долговременная функция и износоустойчивость
аллотрансплантатов остаются недостаточными. Сохраняется риск повреждения клал i-
нов, связанный с хроническим отторжением, - инородная ткань вызывает иммунный
ответ. В этом отношении хорошо зарекомендовали себя бескаркасные заменители кла-
панов второго поколения (Stentless Toronto SPVс 1991 г. и АБ-Моно-Кемерово с 1994г)
имеющие улучшенные гемодинамические характеристики Другим общим недостатком
аллотрансплантатов является их ограниченная доступность вследствие дефицита до-
норских органов и тканей. Кроме того, следует иметь в виду более сложную технику и-
имплантации, по сравнению с каркасными биопротезами и механическими клапанами
сердца. Возможным способом облегчения имплантации аллотрансплантатов может быть
использование рассасывающегося каркаса.
Дальнейший коммерческий успех биопротезов связан с технологическими иннова-
циями — методами стабилизации биоткани, антикальциевой обработкой и бескаркас-
ной конструкцией. Технология обработки ткани является первостепенно важной зада-
чей для длительного функционирования биопротезов, так как стабилизация биологи-
ческого материала способствует сохранению большинства его исходных свойств
Молекулы глутаральдегида образуют необратимые химические межмолекулярные свя-
зи коллагена, а также связи с белками других структур естественного клапана В ре-
зультате такого химического воздействия биологическая ткань в значительной степени
теряет свои индивидуальные иммунные свойства и становится устойчивой к воздей-
ствию коллагеназы. В последнее время для улучшения биомеханических и гидродина-
мических свойств биопротезов обработку свиных клапанов стали проводить в потоке
стабилизирующего раствора при нулевом градиенте давления на створках и сохране-
нии умеренного градиента давления на стенке корня аорты (около 40 мм рт. ст).
В качестве альтернативы традиционному глутаровому альдегиду предложены вещества
растительного (генипин) и бактериального (реутерин) происхождения, метод фотофик-
сации ксенотканей, а также соединения из класса полиэпоксидов
На кальциноз ткани — главный фактор дегенерации и критической недостаточности
биопротезов — влияют тип и концентрация стабилизирующих химических агентов, воз
никающие механические напряжения и деформации створок биопротеза, а также сост®
яние пациента. Технология антикальциевой обработки ткани направлена на экстракци^
липидов и нейтрализацию свободных остатков глутаральдегида, что препятствуе
жению кальция и увеличивает срок службы биопротезов Устранение из ыточн
формаций и напряжений в створках достигается также путем усовершенств совео-
струкции биопротезов, технологии структурной стабилизации биоткани, а льного
Шенствованием техники имплантации Реже применяют методы пр
Ферментативного удаления клеточных элементов. Экстракцию липидов солей
Ществляют растворами этанола, додецилсульфата натрия, толуидин в и-ами-
елюминия. Для нейтрализации свободных остатков глутаральдеги
ноолеиновую или гомоцистеиновую кислоты, а также пропиленгликоль^ обус-
Преимущества бескаркасных трансплантатов над каркасными субкоронарной
ловлены их уникальной особенностью, заключающейся в том ого каркаса для
имплантации корень аорты пациента исполняет функцию еСТ «вставки корня» и,
створок биологического клапана. При протезировании по тех рЫ биоклапана
особенно, «полном протезировании корня аорты» фибрознь о^еспечивает низкий
выполняют роль каркаса. Отсутствие искусственного карка открытия в по
тРансклапанный градиент давления и высокую эффективну' бескаркасных био-
Кое и, особенно, при физической нагрузке, а лучшая биомеханика
___ ________ 439 "
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
клапанов определяет их большую износоустойчивость относительно каркасных. Даль-
нейший поиск новых технологий обработки биоклапанов, направленных на повышение
износоустойчивости, приведет к появлению нового поколения этих заменителей клз-
панов сердца Можно ожидать отхода от технологии обработки глютаровым альдеги-
дом, которая на сегодняшний день является промышленным стандартом.
Перспектива дальнейшего развития нового поколения биологических клапанов бу-
дет зависеть от глубины понимания биомеханики естественного клапана, а также спе-
цифического назначения его структурных элементов Исследование морфологии, кро-
воснабжения и иннервации створок, определение биомеханических свойств клапанных
структур, наряду с математическим моделированием функции клапана, будут играть
важную роль в разработке нового поколения биоклапанов.
Основная проблема всех существующих биологических заменителей клапанов сер-
дца состоит в отсутствии способности к регенерации их ткани. Было бы оптимальным,
чтобы ткань трансплантата являлась не только биологически совместимой, но и обла-
дала способностью к росту и репарации. В этом отношении весьма перспективной
может оказаться разработка биоклапанов, изготовленных методом тканевой инжене-
рии, которая еще не вышла за рамки эксперимента.
Научная концепция инженерии клапанов сердца основана на идее заселения и вы-
ращивания живых клеток (фибробластов, стволовых клеток и др.) в синтетическом или
естественном рассасывающемся каркасе, представляющем собой трехмерную клапан-
ную конструкцию, а также использование сигналов, регулирующих экспрессию генов,
организацию и продуктивность пересаженных клеток в течение периода формирова-
ния экстрацеллюлярного матрикса и развития тканевого клапана в целом. Такие био-
клапаны после имплантации стимулируют деятельность эндогенных клеток-предше-
ственников или дифференцированных клеток окружающих тканей, способствуя допол-
нительной колонизации in vivo. Главной предпосылкой для разработки оптимальной
структуры биоклапана, созданного методом тканевой инженерии, будут являться точ-
ные знания о строении и функции естественных клапанов сердца, достижения клапан-
ной клеточной биологии, успехи в изучении эмбриогенного и возрастного развития
клапанов, идентификация адекватных клеток для заселения, разработки оптимальных
матриц и др
Продолжается поиск оптимального материала для матриц биоклапанов, так как даже
наиболее доступный в настоящее время материал (неплетеная нить полигликолевои
кислоты, покрытая поличетырехгидроксибутиратом) пока не соответствует предъявля-
емым требованиям в связи с быстро развивающейся и неконтролируемой ее деграда-
цией. Постепенное разрушение материала идеальной матрицы должно контролиро-
ваться с целью обеспечения механической стабильности биоклапана в период фор-
мирования экстрацеллюлярного матрикса. Материал матрицы, приготовленный из
биодеградирующего вещества и соответствующий механическим свойствам коллагена
творок, может стать перспективным решением. Наконец, альтернативный подход —
создание безматричной биоткани Однако в настоящее время механические свойства
такой ткани не соответствуют рабочим нагрузкам естественных клапанов
Клетки, используемые для выращивания биоклапана, разнообразны. Эндотелии
венозных сосудов представляет собой многообещающий клеточный ресурс для ткане
вой инженерии в ближайшем будущем. Другие методики основаны на использовании
стволовых клеток красного костного мозга, полученных из эмбриональных тканей или
тканей взрослого человека при помощи пункции его грудины или крыла подвздошной
кости Главным недостатком клеток, взятых от животных или другого человека, являет-
я их иммуногенность. Следовательно, для исключения иммуногенности и ускорения
клинического применения биоклапанов, изготовленных методом тканевой инженерии,
наиболее уместным представляется использование аутологичных клеток
Большое значение в выращивании тканевых биоклапанов имеет влияние биологи-
ческих и механических стимулов. В качестве биологических стимулов можно исполь-
440
ЗАКЛЮЧЕНИЕ
зовать факторы роста. К механическим стимулам относятся деформации и напряже-
ния, возникающие на створках клапана под воздействием циклически изменяющегося
давления и потока жидкости в биореакторе. Эффективность биореакторов, используе-
мых для выращивания биоклапанов, может быть существенно повышена путем разра-
ботки и применения устройства способного осуществлять контроль и авторегуляцию
напряжении и деформаций, возникающих как в тканях, так и воздействующих на них
по принципу обратной связи в процессе формирования и развития тканевого клапана
Кроме того, при использовании биореактора необходимо реализовывать возможность
мониторирования значений параметров условий роста ткани (pH, рО и рСО ) для под-
держания оптимальной среды Другой подход мог бы состоять в применении эмбрио-
нальны усл шии в биореакторе вместо моделирования физиологических условии
взрослого р анизма. В разработку эиоклапанов на основе тканевой инженерии долж-
но быть привлечено немало представителей различных специальностей Только такой
комплексный научный подход к решению этой проблемы приведет к скорейшему про-
грессу в этом многообещающем направлении сердечно-сосудистой хирургии.
Показания к выбору того или иного протеза клапана сердца определяются, прежде
всего, опытом и мотивацией хирурга, а также наличием возможности выбора самого
протеза. Кроме того, они зависят от размера фиброзного кольца аортального или мит-
рального клапана, объема полости левого желудочка и ряда других, менее значимых
факторов. В ситуациях, когда встречается разрушение фиброзного кольца митрального
или аортального клапана (грубый кальциноз, осложненный эндокардит с развитием абс-
цессов), при имплантации двустворчатого или поворотно-дискового клапана с исполь-
зованием техники обратного шва происходит недостаточная фиксация протеза с фор-
мированием в последующем параклапанной фистулы. В этом случае, с целью снижения
вероятности образования параклапанной фистулы, возможно выполнение пластических
операций по укреплению фиброзного кольца. Пациентам с малым объемом левого же-
лудочка предпочтительнее имплантировать низкопрофильные механические протезы,
что необходимо для профилактики обструкции выводного тракта левого желудочка
Правильный индивидуальный выбор механического искусственного клапана сердца
или биоклапана продолжает оставаться важной задачей для получения хорошего и про-
должительного реабилитационного эффекта у больных, перенесших коррекцию кла-
панного порока сердца. Хирург и пациент должны взвешивать риск и выгоду при выбо-
ре протеза сердечного клапана. Так, пациентам моложе 65 лет необходимо устанавли-
вать механический искусственный клапан сердца с целью снижения риска структурной
дегенерации биологического протеза и повторной имплантации клапана в более стар-
шем возрасте Пациентам, которым показана пожизненная антикоагулянтная терапия,
например с фибрилляцией предсердий, тромбоэмболическими осложнениями в анам-
HeaCj гиперкоагуляцией, тяжелой дисфункцией левого желудочка, другими механичес
кими клапанными протезами, имплантированными ранее в другую позицию, показана
имплантация механических искусственных клапанов сердца независимо от возраста У
пациентов с хронической почечной недостаточностью и гиперкальциемией в случае
гиперпаратиреоза характерна повышенная частота структурной дегенерации биопр
тезов, поэтому они также требуют имплантации механического клапана
С другой стороны долговечность биологических заменителей клапанов сердца на-
прямую зависит от возраста У детей и молодых лиц их дегенерация может происхо-
дить в течение нескольких лет и даже месяцев. Поэтому биопротезы предпочтительнее
применять в возрасте старше 60-70 лет, особенно при наличии у больных синусового
ритма. У пациентов данной возрастной группы биопротезы медленнее подвергаются
структурной дегенерации, кроме того, больные не испытывают дискомфорт, связан-
ный с необходимостью постоянного приема антикоагулянтов. Рекомендовано приме-
нение биопротезов пациентам, имеющим противопоказания к проведению антикоагу-
лянтной терапии, например женщинам, планирующим беременность, по причине
тератогенности Варфарина. пациентам, отказывающимся от проведения антикоагулян-
_______________ 441------------
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
тной терапии, а также пациентам с гастроинтестинальными кровотечениями в анамне-
зе или с профессиональными факторами риска Результаты 20-летнего наблюдения за
пережившими этот срок больными показали, что структурная дегенерация биологичес-
ких протезов является их самым большим недостатком. Долговечность меньше у мит-
ральных биопротезов, нежели у аортальных Более быстрая дегенерация митральных
биопротезов может быть объяснена более высоким систолическим давлением на их
створки в митральной позиции, по сравнению с диастолическим давлением на аор-
тальные створки
Госпитальная или ближайшая (в течение 30 дней) летальность после операции изо-
лированного протезирования митрального или аортального клапана, в том числе и с
сочетанным аортокоронарным шунтированием, 15-20 лет назад составляла 10-20%.
В последние 10-15 лет она значительно снизилась — до 3-8% Снижение летальности
связано с улучшением хирургической техники имплантации клапанов, совершенство-
ванием методики проведения искусственного кровообращения, защитой миокарда по-
средством внедрения кровяной антеградной и ретроградной кардиоплегии, анестези-
ологического и реанимационного обеспечения, а также применением более совершен-
ных моделей искусственных клапанов сердца и биопротезов. Летальность в отдаленные
сроки после операции составляет 4,5-10,6% Большинство осложнений и летальных
исходов возникает в первые 3-5 лет после операции, затем наступает стабилизация
выживаемости
У 90% пациентов, подвергшихся протезированию митрального или аортального кла-
пана, в значительной степени исчезают или уменьшаются признаки хронической сер-
дечной недостаточности, благодаря чему они переходят в I-II функциональный класс
по классификации NYHA. Небольшая группа пациентов остается в III или IV функцио-
нальном классе, что обычно связано с низкой сократительной способностью миокарда
до операции, высокой исходной легочной гипертензиеи и сопутствующей патологией
Лучшие показатели выживаемости и качества жизни имеют больные с искусственными
клапанами сердца в аортальной позиции, относительно митральной. Существенное вли-
яние на выживаемость и качество жизни оперированных больных оказывают гемоди-
намические параметры работы протезов клапанов сердца. Практически все применяе-
мые сегодня протезы клапанов сердца оказывают сопротивление кровотоку, особенно
при нагрузке шаровые клапаны имеют больший перепад давления, чем поворотно-
дисковые, двустворчатые отличаются меньшим сопротивлением, и самым минималь-
ным сопротивлением обладают биоклапаны, особенно бескаркасные Техника имплан-
тации протезов клапанов сердца должна обеспечивать максимальную эффективность
их работы с учетом индивидуальных анатомических особенностей больного, размеров
фиброзного кольца, конструкции протеза клапана, а также предпочтений хирургичес-
кой бригады В связи с этим, можно выделить несколько ключевых моментов, которые
необходимо учитывать при протезировании клапанов В частности, к проблемам мит-
рального протезирования относятся выбор клапана при малом объеме левого желу-
дочка и его дисфункции, ориентация клапана, сохранение подклапанных структур, вос-
становление гемодинамики у детей и подростков, которым через несколько лет после
операции в силу роста организма и сердца показана реимплантация клапанного про
теза большего размера Протез клапана выбирают на один размер меньше диаметра
фиброзного кольца Для предотвращения дисфункции запирающих элементов при боль
шом размере фиброзного кольца и малом объеме левого желудочка необходимо У4*^
тыва ь соответствие габаритов протеза размерам левого желудочка
роблема выбора адекватного клапанного протеза для пациентов с узким корнем
орты ( 20-21 мм) и большой поверхностью тела также представляет собой актуаль
ную проблему в кардиохирургической практике Послеоперационная эхокардиографи
ческая оценка пациентов после замены аортального клапана показывает даже в покое
олее вы окне трансклапанные градиенты давления относительно здоровых лиц Это
вы вано меньшей площадью гидравлического отверстия протеза, по сравнению с пло-
442 _____________ _________________________________________
_______________________________________________________________ЗАКЛЮ ЧЕНИЕ
щадью открытия створок естественного клапана Помимо узкого проходного отверстия
протеза, повышенный градиент давления может быть обусловлен также гипертрофией
межжелудочковой перегородки, гипоплазией выходного отдела левого желудочка
Таким образом, у большинства пациентов с имплантированными искусственными
клапанами сердца и биопротезами можно говорить о протезно-пациентном несоответ-
ствии различной степени выраженности Понятие «протезно-пациентное несоответ-
ствие» первоначально было введено S Н. Rahimtoola и соавт (1978), которые отмена-
ли, что «протезно-пациентное несоответствие имеет место, когда послеоперационная
эффективная площадь отверстия (ЕОА) протеза меньше, чем у нормального клапана»
Это понятие применимо к нескольким различным клиническим ситуациям. Оно исполь-
зуется для малых клапанных протезов (менее 21 мм), для протезов размера 21-22 мм
у пациентов с большой площадью поверхности тела (1,7-1,8 м2), повышенного транс-
клапанного градиента давления после имплантации, особенно на фоне физической на-
грузки, сниженного индекса площади эффективного отверстия клапана (iEOA) и раз-
личных комбинаций этих проявлений
Несмотря на разноречивость данных по влиянию «протезно-пациентного несоот-
ветствия» на послеоперационную летальность, снижение этого несоответствия имеет
важное влияние на функциональный результат хирургического лечения патологии аор-
тального клапана. Средняя и тяжелая степень несоответствия замедляет течение реа-
билитационного процесса, что обусловлено сохранением высоких остаточных транс-
протезных градиентов давления, ограничивающих регресс массы миокарда левого
желудочка, особенно у лиц, ведущих активный образ жизни. Протезно-пациентное не-
соответствие отрицательно влияет на качество жизни пациентов и отдаленную выжи-
ваемость Для его предотвращения у больных с узким фиброзным кольцом аортально-
го клапана и площадью поверхности тела более 1,7 м2 ряд авторов рекомендуют имп-
лантировать механические протезы большего диаметра, чем 19-21 мм, используя для
этого различные методики расширения корня аорты (Nicks R. et al, 1970; Коппо S et
al, 1975; Manouguian S и Seybold-Eptmg W., 1976, Rastan H. et al, 1976, Yamaguchi M.
et al, 1991), выполнять супрааннулярную имплантацию механических клапанов или
бескаркасных биоклапанов (аллографтов, ксенографтов).
На гемодинамические параметры работы искусственных клапанов сердца оказыва-
ет влияние и их ориентация В аортальной позиции поворотно-дисковые клапаны дол
жны размещаться большим отверстием по направлению к зоне иссеченной некоро
парной створки. Лучшей ориентацией двустворчатого протеза является размещение
шарнирной оси в сторону правой коронарной створки Отметим выгодное отличие кла~
пана Мединж-2 с постоянным вращением створок вокруг центральной оси корпуса
отсутствие необходимости в ориентации протеза при его имплантации В митральной
позиции большое отверстие поворотно-дисковых клапанов должно быть направл
на боковую и заднюю стенку левого желудочка, а двустворчатые клапаны дол^нв1
лантироваться с антианатомическим положением створок. Это обеспечива ого
гемодинамические показатели, снижение частоты «синдрома низкого
выброса» и профилактику нарушений ритма сердца, по сравнению с неоп™
ептациеи Однако на практике, если не удается выбрать оптимальную °Р отез та_
Пана в силу анатомических особенностей, хирург вынужден имплантиро элемента
хим образом, чтобы обеспечить беспрепятственное движение запира ии мит_
Сохранение створок клапанов и подклапанных структур при ПР __ разрыв
Рального клапана предотвращает опасное осложнение в момент коовотечением,
аднеи стенки левого желудочка с массивным, порой смертель левого желу-
еспечивает нормальную геометрию и кинетику сокращения ми а снйжает
очка, улучшает гемодинамику и диастолическую функцию левог папиллярных
тДаленную летальность Весьма важно сохранить как можно иссечения створок
мышц во взаимодействии с фиброзным кольцом В случае полн целью улучшения
патологически измененных подклапанных структур ряд автор
— ______ 443
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
сердечного выброса, производят имплантацию искусственных хорд Gore-Tex между па-
пиллярными мышцами и фиброзным кольцом митрального клапана
Актуарный показатель выживаемости пациентов после операции протезирования
аортального или митрального клапана тесно коррелирует с гемодинамической эффек-
тивностью имплантированных клапанов, а также с факторами риска. Так, у больных с
шаровыми механическими искусственными клапанами сердца в митральной и аорталь-
ной позициях актуарные показатели выживаемости от 5 до 25 лет после операции сни-
жаются от 85% до 23% Актуарный показатель выживаемости больных с поворотно-
дисковыми искусственными клапанами сердца в митральной позиции несколько выше,
чем с шаровыми клапанами, от 5 к 25 годам уменьшается от 87% до 42%, а в аорталь-
ной — от 89% до 44%. У больных с имплантированными двустворчатыми протезами
актуарные показатели выживаемости стабильно хорошие — от 93% до 52% в митраль-
ной и от 96% до 61% в аортальной позициях, соответственно, к 5-15 годам после опе-
рации Более высокие показатели актуарной выживаемости больных с двустворчатыми
искусственными клапанами сердца объясняются их лучшими гемодинамическими ха-
рактеристиками и материалами (пиролитический углерод) Как отмечают многочислен-
ные авторы, актуарные показатели выживаемости больных к 5-10-му году после про-
тезирования митрального или аортального клапана механическими клапанами или био-
протезами приблизительно одинаковы и составляют 50-60%.
На снижение актуарных показателей выживаемости, качества жизни и рост инва-
лидности оказывают влияние специфические клапанно-зависимые осложнения (меха-
нические дисфункции, параклапанная фистула, протезный эндокардит, реоперации,
хронический внутрисосудистый гемолиз, тромбозы и тромбэмболии, антикоагулянтные
геморрагии)
Существующие в настоящее время механические протезы клапанов сердца чрез-
вычайно устойчивы в отношении усталости материалов и структурной дисфункции кла-
пана что объясняется высокотехнологичным уровнем контроля качества при их произ-
водстве Актуарные и линеарные показатели структурной дисфункции механических
клапанов составляют от 90% до 95% и от 0% до 0,3% пациенто-лет, соответственно.
В отличие от механических клапанов структурная дегенерация биопротезов, наоборот,
является наиболее частым несмертельным клапанно-зависимым осложнением Так,
длительное наблюдение за больными с имплантированными каркасными биопротеза-
ми второго поколения, включая ксенопротез Medtronic Hankock II и перикардиальный
Carpentier-Edwards, показали, что в аортальной позиции более чем у 90% биопротезов
структурная дегенерация не развивается в течение 12 лет, в то время как в митраль-
ной позиции она наступает значительно раньше вследствие более выраженных систо-
лических нагрузок на створки протеза Вероятность структурной дегенерации у дос-
тупных в настоящее время каркасных ксенопротезов (Hancock или Carpentier-Edwards)
в митральной позиции возникает уже через 8 лет после операции и достигает 60%
через 15 лет Эта ограниченная долговечность является главным препятствием для хо-
роших отдаленных результатов после их имплантации
Формирование параклапанной фистулы может быть связано с техническими слож-
ностями имплантации искусственного клапана текущим инфекционным эндокардитом
или грубым кальцинозом фиброзного кольца Встречаемость параклапанных фистул
за последнее десятилетие снизилась и составляет, по линеарным показателям, от 0%
до 1,5% пациенто-лет как для механических клапанов, так и для биопротезов
Актуарные и линеарные показатели частоты протезного эндокардита для механи-
ческих клапанов и биопротезов в митральной позиции составляют к 5—15 годам после-
операционного наблюдения от 100% до 91% и от 0% до 0,6% пациенто-лет, соответ-
ственно Для аортальной позиции эти показатели выше и составляют от 97% до 85% и
от 0,6% до 0,9% пациенто-лет, соответственно Бескаркасные биопротезы и аллограф-
ты в меньшей степени подвержены инфицированию с развитием протезного эндокар-
дита в связи с отсутствием или наличием небольшого объема синтетического матери-
444 ----—------------------ ------------------------—
ЗАКЛЮЧЕНИЕ
—
поэтому эти клапаны могут быть более полезны при замене механического проте-
go время реоперации в связи с развитием протезного эндокардита Летальность
при раннем протезном эндокардите колеблется от 30% до 80%, а при позднем — от
20% до 40%.
Для механических клапанов актуарные и линеарные показатели реоперации в тече-
ние 20 лет колеблются в пределах от 99% до 82% и от 0,3% до 1,5% пациенто-лет
соответственно В проведенных на большом клиническом материале исследованиях ак-
туарные показатели выживаемости после аортального биопротезирования без реопе-
раций составляют более 95% в течение 5 лет, около 90% в течение 10 лет и до 70% -
в течение 15 лет.
Хронический внутрисосудистый гемолиз у больных с механическими искусственны-
ми клапанами сердца встречается с частотой по актуарным и линеарным показателям
от 99 8% до 99,7% пациенто-лет и от 0,06% до 0,52% пациенто-лет, соответственно
Своевременное выявление хронического внутрисосудистого гемолиза и его лечение
позволяет избежать развития его разнообразных осложнении, в том числе и синдрома
хронического диссеминированного внутрисосудистого свертывания, способствующе-
го тромботическим осложнениям.
Тромбэмболии и тромбоз клапанов являются самыми распространенными клапан-
но-зависимыми осложнениями у пациентов с имплантированными механическими
протезами митрального клапана. К факторам риска развития тромботических ослож-
нений относят, неадекватность антикоагулянтной терапии, активность Ревма^ч^_'
го процесса и инфекционного эндокардита, особенно протезного эндокардит
ными вегетациями; замедление и стаз кровотока, связанные с низким Уда '
росом, минутным объемом кровообращения, гиповолемией, мерцательн и ’
нарушением сократительной способности миокарда Наиболее часто он тппм_
ся у пациентов с механическими клапанами. Частота линеарных покааа^
боэмболических осложнений с разными конструкциями механических е от
клапанов сердца и биопротезами колеблется от 0% до 6,6 о пациант ’ й эти
1.5% до 2% пациенто-лет В митральной позиции и особенно в трику ных'зон,
показатели выше в силу более низких скоростей кровотока, высоких жактОров
большего времени контактной активации форменных элементов кр
Редким и чрезвычайно опасным осложнением является тромбоз ов
риск которого яе npe.co.ao, 0.2% пациенто-лет. и о-
механическими клапанами. Частота актуарных и линеар до 97% и от 0% до
механических искусственных клапанов сердца колеблется от показатели
1,1% пациенто-лет, соответственно, причем в митральной п начение имеет
выше, чем в аортальной. Для диагностики тромбоза клапана эхоконтрас-
трансторакальная и чреспищеводная ЭхоКГ, включая оценку с едованием мар-
тирования камер сердца, а также транскраниальная эхограф МОНИторинг тромбо-
керов тромбинемии. При помощи этих исследований проводи & состоянии кардио-
литическои терапии в начале лечения, если пациент не наход^ особенно в сочетании
генного шока При неэффективности тромболитической терап . ьтате нараста-
с неадекватной внутрисердечной гемодинамикой, развившеис _ тромботи-
ния паннуса или тромбоза клапана, прибегают к реоперации' Летальность при
ческих масс с искусственного клапана сердца или замене р0_
проведении операции по поводу тромбозов клапанов коле л поэтому мы реко-
горный тромбоз после удаления тромба возникает у 40 х> па ОГ1ер’атИвное лечение
мендуем замену протеза всем пациентам, которым проводит сердца, играя роль
Все известные сегодня механические искусственные кп ной антикоагулянт-
Раздражителя системы гемостаза, требуют проведения по' ^оличесКих осложне-
ной терапии для профилактики тромбозов клапанов M^rfD0 являются антикоагу-
ний. Препаратами выбора для длительной тромбопрофил
445
ИСКУССТВЕНН ЫЕ КЛАПАНЫСЕРДЦА ______
пянты непрямого действия (АНД) Среди них наиболее распространенным во всем
мире препаратом является Варфарин, который с 2002 г стал доступен и для пациен-
тов России
Степень гипокоагуляции, которой необходимо придерживаться при приеме АНД,
зависит также и от конкретной клинической ситуации. Об этом свидетельствуют пос-
ледние рекомендации уровня МНО, предложенные Российской ассоциацией по изуче-
нию тромбозов, геморрагии и патологии сосудов в 2002 г Они разработаны на осно-
вании отечественного опыта и рекомендаций Американской ассоциации исследовате-
лей сердца (АНА) и Американского колледжа грудных врачей (АСС). Рекомендуемая
степень гипокоагуляции для профилактики тромботических осложнений зависит от
показаний к приему АНД и обычно соответствует уровню МНО 2-3. В ряде случаев тре-
буется более выраженная гипокоагуляция (2,5-3,5) с учетом модели клапанного про-
теза его позиции, количества имплантированных клапанов, сопутствующих факторов
риска развития тромбоза антифосфолипидного синдрома В нашей практике мы стре-
мимся к достижению МНО 3 (приемлемый диапазон — 2,5-3,5) у пациентов с поворот-
но-дисковыми клапанами в митральной позиции и при многоклапанном протезирова-
нии В случае высокого риска тромботических осложнений дополнительно используем
малые дозы аспирина 80-100 мг/сут однократно. Для пациентов из группы низкого
риска, особенно с двустворчатыми искусственными клапанами сердца в аортальной
позиции, должный уровень МНО составляет 2,5 (приемлемый диапазон — 2-3), а те-
рапия аспирином проводится по индивидуальным показаниям
Биологические клапанные протезы менее тромбогенны, чем механические, и не тре-
буют длительной антикоагулянтной терапии, если пациенты не относятся к группе вы-
сокого риска развития тромбоэмболии или не имеют в анамнезе тромботических ос-
ложнений, связанных с протезом Линеарные показатели развития тромбоэмболичес-
ких осложнений для пациентов с каркасными биопротезами колеблются от 0,5 до 1%
пациенто-лет Этот риск меньше у пациентов с бескаркасными биопротезами. Антико-
агулянтная терапия у пациентов с биопротезами в течение первых трех месяцев после
операции варьирует в различных клиниках. Существует повышенный риск развития
тромботических осложнений до эндотелизации контактных поверхностей Согласно
последним рекомендациям АСС/АНА, уровень МНО у пациентов с клапанными биопро-
тезами в митральной или аортальной позиции должен составлять 2-3 в течение пер-
вых 3 мес после операции При отсутствии риска тромбоэмболии через три месяца
после вмешательства терапия прекращается. Монотерапия малыми дозами аспирина
у пациентов в группе низкого риска и в сочетании с Варфарином в группе высокого
риска продолжается пожизненно Выживаемость пациентов с биопротезами в группе
высокого риска, получающих комбинированную терапию аспирином и Варфарином,
выше по сравнению с монотерапией Варфарином Для пациентов с протезами клапа-
нов сердца сочетанная терапия антикоагулянтами и антиагрегантами для профилакти-
ки тромботических осложнений должна быть использована при наличии дополнитель-
ных факторов риска (большие размеры левого предсердия, низкая фракция выброса,
фибрилляция предсердий и др.) Проведение антиагрегантной терапии с помощью
аспирина значительно снижает риск развития тромбоэмболии у пациентов в группе
низкого риска При использовании аспирина у пациентов с биопротезами риск разви-
тия тромбоэмболии такой же, как и при использовании полной антикоагуляции у боль-
ных с механическими протезами, но кровотечения наблюдаются реже.
Антикоагулянтные геморрагии наиболее часто наблюдаются со стороны пищевари-
тельной, мочеполовой центральной нервной систем и обычно коррелируют с МНО
Пациенты с усовершенствованными двустворчатыми и поворотно-дисковыми клапана-
ми нуждаются в поддержании МНО в интервале 2,5-3,5. Поэтому риск кровотечений
на фоне антикоагулянтной терапии значительно ниже у пациентов с современными
протезами клапанов, имеющими улучшенные гемодинамические характеристики Ли-
неарные показатели антикоагулянтных геморрагий с различными типами механических
446 ------- - _____-----
ЗАКЛЮЧЕНИЕ
клапанов и биопротезов в зависимости от степени гипокоагуляции, частоты контола
параметров гемостаза колеблются в широких пределах от 0% до 6 4% паииентп п₽т
Таким образом, несмотря на впечатляющие успехи, достигнутые в разработке ме
ханических и биологических протезов клапанов сердца, хорошие результаты опеоаоий'
высокие тромборезистентные и гемодинамические качества искусственных клапан™
сердца, выполненных из углеродных материалов, тромбозы и тромбоэмболические
осложнения при их имплантации составляют большую проблему Поэтому дальнейшее
совершенствование механических протезов и биоклапанов, техники их имплантации
разработка биоклапанов на основе тканевой инженерии являются, по-прежнему
альными проблемами современной кардиохирургии, решение которых возможно тол^о
с привлечением широкого круга специалистов. юлько
447
Альфа-Диагностика
ООО «Альфа-Диагностика» является официальным дилером ведущего мирового
производителя в области лабораторной диагностики — компании РОШ (Германия).
Для диагностики больных кардиологического профиля РОШ предлагает экспресс-
анализаторы и тест-системы, которые позволяют быстро провести качественную
диагностику заболевания
Тест-система «Тропонин Т сенситив»
Бесприборный экспресс-тест для полуколи-
чественного определения Тропонина Т. кото-
рый является золотым стандартом в диагнос-
тике инфаркта миокарда. Достоверный ре-
зультат в течение 15 минут в формате «да/нет».
Кардиак Ридер
Экспресс-анализатор для количественного
определения кардиомаркеров:
1. Тропонин Т (диапазон 0,03 -2,0 нг/мл)
2. Миоглобин (диапазон 30-700 нг/мл)
3. Д-димир (диапазон 100-4000 нг/мл)
4. NT-proBNP (диапазон 60-3000 пг мл)
Время анализа: 8-12 минут.
Коагучек Экс Эс
Новый портативный прибор для определения
протромбинового времени (МНО) для паци-
ентов, применяющих оральные антикоагу-
лянты. Прибор работает на специально раз-
работанных тест-полосках «коагучек Экс Эс
тест».
Диапазон измерения для МНО — от 0,8 до 8,
Время анализа - 60 секунд.
ООО «АЛЬФА-ДИАГНОСТИКА»
Тел.: (495) 580 29 02
wwMLalph a-diaQ iKtst i с s. ru