Автор: Гутник С.П. Сосонко В.Е. Гутман В.Д.
Теги: технология минеральных масел технология нефти и аналогичного сырья химия органический синтез нефтехимический синтез
ISBN: 5—7245—0016—7
Год: 1988
Похожие
Текст
для техникумов
С.П.Гутник
В.Е.Сосонко
В.Д.Гутман
Расчеты
по технологии
органического
синтеза
Допущено Министерством
химической промышленности
в качестве учебного пособия
для средних специальных учебных заведений
МОСКВА
«химия»
1988
ББК 6П7.50
Г972
УДК 665.652.8(076.1)
Рецензенты:
доцент кафедры химии и технологии
осиовиого органического синтеза
Московского института тонкой химической технологии
им. М. В. Ломоносова, канд. техн, наук В. Ф. Чеботаев
и преподаватель Ленинградского политехнического техникума
Л. Г. Потехина
Гутник С. П., Сосонко В. Е., Гутман В. Д.
Г972 Расчеты по технологии органического синтеза: Учеб, посо-
бие для техникумов. — М.: Химия, 1988. — 272 с.: ил.
ISBN 5—7245—0016—7
Приведены расчеты материальных балансов, а также термодинамиче-
ские, кинетические и тепловые расчеты наиболее важных процессов основ-
ного органического и нефтехимического синтеза (пиролиз, хлорирование,
алкилирование, окисление, гидрирование, дегидрирование и др.). Для каж-
дого процесса даны расчеты основного и вспомогательного оборудования.
Подробно рассмотрены параметры состояния и теплофизические характе-
ристики сырья и продуктов.
Для учащихся химико-технологических техникумов.
^2803010000—204 св пл. для Сред. __
*050(01)—88 спец. учеб, заведений — 34—88
Учебное пособие
ГУТНИК САВЕЛИЙ ПЕРЦЕВИЧ
СОСОНКО ВАЛЕРИЙ ЕФРЕМОВИЧ
ГУТМАН ВЛАДИЛЕН ДАВИДОВИЧ
Расчеты по технологии
органического синтеза
Редактор //. /7. Лысова
Художественный редактор В. М. Киселева
Технический редактор О. В. Тюрина
Корректор Н. А. Иванова
ИБ № 2169
Сдано в наб. 08 02 88. Подписано в печать 27.04 88. Формат бумаги 60X9071». Бум.
тип. № 2. Гарнитура литературная. Печать высокая. Усл. печ.л. 17,0. Усл. кр.-отт. 17,0.
УЧ.-ИЗД. л. 19,23. Тираж 8900 экз. Заказ 69. Цена 90 к.
Ордена «Звак Почета» издательство «Химия». 107076, Москва, Стромынка, 21, корп. 2.
Московская типография № 11 Союзполиграфпрома при Государственном комитете СССР
по делам издательств, полиграфии и книжной торговли. 113105, Москва, Нагатинская
ул., д. 1.
ISBN 5 7245 0016 7 © Издательство «Химия», 1988 г.
ОГЛАВЛЕНИЕ
Предисловие ...................................................... 5
Рекомендуемые обозначения и единицы измерения.................. 7
Введение. Элементы расчетов химико-технологических процессов . . 8
Материальный расчет............................................ 8
Характеристики потока ............................................ 9
Показатели стадии химического превращения......................13
Тепловой расчет................................................22
Расчет основного аппарата....................................... 27
Расчет вспомогательного оборудования...........................30
Процессы пиролиза углеводородов................................37
Получение этилена из этаиа.....................................38
Материальный расчет.........................................38
Технологический расчет реактора.............................44
Технологический расчет закалочно-испарительного аппарата . . 59
Процессы хлорирования и оксихлорироваиия углеводородов ... 66
Получение тетрахлорметана и тетрахлорэтилена...................67
Материальный расчет.........................................67
Технологический расчет хлоратора............................80
Получение 1,2-дихлорэтана оксихлорированием этилена .... 86
Материальный расчет................................ . . 87
Технологический расчет реактора.............................92
Процессы алкилирования............................................104
Получение этилбензола в присутствии хлорида алюминия ... 104
Материальный расчет.......................................105
Технологический расчет алкилатора...............................ПО
Получение этилбензола в присутствии фторсодержащего катализатора 114
Материальный расчет.......................................117
Технологический расчет алкилатора..............................130
Процессы окисления................................................135
Получение этиленоксида эпоксидированием этилена ................. 136
Материальный расчет........................................... 137
Технологический расчет контактного аппарата....................144
Расчет абсорбционной колонны...................................147
Получение ацетальдегида окислением этилена ... ... 152
Материальный расчет............................................153
Технологический расчет.........................................161
Процессы дегидрирования и гидрирования............................169
Получение формалина окислительным дегидрированием метанола . . 169
Материальный расчет............................................169
Технологический расчет основного оборудования..................174
Получение стирола из этилбензола..................................188
Материальный расчет............................................188
Технологический расчет реактора................................196
Получение циклогексана............................................207
Материальный расчет.................................... 209
Технологический расчет реактора первой ступени ............. 216
Синтезы на основе оксида углерода.................................222
Получение метанола на низкотемпературном катализаторе ... 222
Материальный расчет стадии конверсии природного газа . . . 223
Технологический расчет трубчатой печи..........................226
Материальный расчет стадии синтеза метанола....................235
Технологический расчет реактора синтеза метанола...............243
Получение уксусной кислоты ...................................... 247
Материальный расчет............................................249
Технологический расчет.........................................255
Библиографический список ............ 262
Приложения .......................................................264
ПРЕДИСЛОВИЕ
В «Основных направлениях экономического и социального
развития СССР на 1986—1990 годы и на период до 2000 года»
отмечалась необходимость повышения качества подготовки
специалистов, прежде всего за счет более широкого внедрения
эффективных методов и целевых форм обучения, электронно-
вычислительной техники [1].
Настоящее учебное пособие предназначено для выполнения
учащимися средних специальных учебных заведений матери-
альных расчетов ряда производств основного органического и
нефтехимического синтеза, технологических расчетов реакцион-
ных аппаратов этих производств при курсовом и дипломном
проектировании. Выполнение учащимися таких расчетов спо-
собствует глубокому пониманию теоретических основ химиче-
ской технологии; позволяет оценить правильность принятых в
проекте условий ведения технологического процесса и аппара-
турного оформления; в дальнейшем даст возможность технику-
технологу принимать обоснованные решения в производствен-
ных ситуациях.
Основное внимание в пособии уделено расчетам стадии хи-
мического превращения сырья, так как методы расчетов гид-
ромеханических, тепловых и массообменных процессов, аппа-
ратуры, применяемой на стадиях подготовки сырья и разделе-
ния продуктов реакции, подробно изучаются в курсе «Процессы
и аппараты химической промышленности». При выборе про-
цессов учтены главные направления научно-технического про-
гресса, позволяющие существенно улучшить технико-экономи-
ческие показатели производства: внедрение принципиально но-
вых технологических схем (производства метанола, уксусной
кислоты, тетрахлорметана совместно с тетрахлорэтиленом и
др.), аппаратов большой единичной мощности (производства
этилена, метанола, этилбензола, стирола и др.), энергосбере-
гающих технологий (производства этиленоксида, циклогек-
сана и др.) [2].
Курсовое и дипломное проектирование являются завершаю-
щими этапами подготовки специалистов по технологии органи-
ческого синтеза и выполняются после изучения учащимися
5
специальных дисциплин и основной учебной литературы [3—
10]. В связи с этим в пособии не даны описания технологиче-
ских схем производств, подробно рассмотренных в учебниках
[3—7], а приведены только расчеты этих процессов. Для вы-
полнения курсовых и дипломных проектов преподаватель раз-
рабатывает варианты заданий, в которых предусматривает все
необходимые для расчета параметры технологического процес-
са. Усредненные значения параметров, включенные авторами
в состав исходных данных или используемые в расчетах, при-
няты на основании литературных данных и данных проектной
и технологической документации. Это позволило допустить не-
которые упрощения, которые, не снижая достоверность полу-
чаемых результатов, облегчают расчет курсовых и дипломных
проектов и способствуют лучшему пониманию учащимися фи-
зико-химической сущности промышленных процессов.
Выполнению расчетного раздела проекта обязательно
должно предшествовать тщательное изучение элементов рас-
четов химико-технологических процессов, изложенных во вве-
дении. В связи с этим пособие может быть использовано для
практических занятий по технологии органического синтеза.
Авторы выражают благодарность преподавателю Ленин-
градского политехникума Л. Г. Потехиной и доценту кафедры
химии и технологии основного органического синтеза Москов-
ского института тонкой химической технологии им. М. В. Ло-
моносова В. Ф. Чеботаеву за ценные замечания и большой
труд по рецензированию пособия.
РЕКОМЕНДУЕМЫЕ ОБОЗНАЧЕНИЯ
И ЕДИНИЦЫ ИЗМЕРЕНИЯ
Величина Обозна- чение Единицы измерения
Длина / м, мм
Масса tn кг, т, г
Время •г с, мин, ч, сут, год к, °C
Температура 7, t
Количество вещества п моль, кмоль
Площадь S, F м2
Объем, вместимость V м3, дм3, л кг/м3, г/см3
Плотность р
Молярная масса вещества м кг/моль, г/моль
Относительная молекулярная масса мг —
вещества Молярный объем вещества Vm м3/моль, дм3/моль, л/моль
Молярный поток вещества Пт моль/с, кмоль/ч
Молярная доля компонента А в ХА Доли ед., %
смеси Объемная доля компонента А в Фа Доли ед., %
смеси Массовая доля компонента А в смеси WA Доли ед., %
Молярная концентрация компонента А СА кмоль/м3, моль/л
Массовая концентрация компонента Ра кг/м3
Скорость химической реакции и моль/(с-м3)
Степень конверсии а Доли ед., %
Селективность р Доли ед., %
Выход продукта ₽' Доли ед., % кг/с, кг/ч, т/сут, т/год
Мощность (производительность) ап- N
парата, установки Молярная теплота химической реак- Ят Дж/моль, кДж/моль
ции Теплоемкость молярная Ст Дж/(моль- К)
Теплоемкость удельная и объемная С Дж/(кг-К), Дж/(м3-К>
Количество теплоты Q Дж, кДж, ГДж, МДж
Тепловой поток Ф Вт, кВт, МВт
Поверхностная плотность теплового Ф Вт/м2, кВт/м2
потока Теплота фазового превращения: молярная Дж/моль, кДж/моль
удельная Г Дж/кг, кДж/кг
Энтальпия молярная И Дж/моль, кДж/моль
Энтальпия удельная h Дж/кг
Давление р Па, кПа, МПа
Динамическая вязкость р. Па-с, МПа-с
Кинематическая вязкость V м2/с
Поверхностное натяжение о Н/м
Линейная скорость потока W м/с
Объемная скорость газа, жидкости Уоб с-1, ч_|
Объемный расход Vt м3/с, м3/мин, м3/ч
Массовый расход ГПх кг/с, кг/мин, кг/ч, т/сут
Частота вращения п с-1, мин-1
7
ВВЕДЕНИЕ
ЭЛЕМЕНТЫ РАСЧЕТОВ
ХИМИКО-ТЕХНОЛОГИЧЕСКИХ ПРОЦЕССОВ
Расчет химико-технологического процесса — наиболее трудоем-
кий и ответственный раздел курсового и дипломного проектов.
В состав данного раздела, как правило, входят: расчет мате-
риального баланса производства (цеха, установки, стадии, ап-
парата), расчет основных расходных коэффициентов и техно-
логический расчет, включающий тепловой расчет, расчет основ-
ного и вспомогательного оборудования.
МАТЕРИАЛЬНЫЙ РАСЧЕТ
Цель материального расчета — определение расхода сырья и
вспомогательных материалов для обеспечения заданной про-
изводительности по целевому продукту (иногда определение
выхода целевого и побочных продуктов исходя из расхода
сырья). Поэтому до выполнения материального расчета необ-
ходимо:
изучить существующие методы получения продукта или пе-
реработки сырья, выбрать наиболее экономически эффектив-
ный метод (на данном уровне развития химической промыш-
ленности) ;
детально рассмотреть теоретические основы выбранного
метода, проанализировать влияние различных технологиче-
ских факторов на термодинамику и кинетику химического про-
цесса (температуры, давления, отношения поступающих исход-
ных веществ, объемной скорости, свойств и состояния катали-
затора, времени пребывания реагентов в аппарате и др.), вы-
брать оптимальные условия проведения процесса;
ознакомиться с основными физико-химическими характери-
стиками сырья, вспомогательных материалов и продуктов, а
также с требованиями стандартов или технических условий к
их качеству;
изучить технологическую схему процесса, обратив особое
внимание на режим работы аппаратов, материальные расчеты
которых предстоит выполнить;
на основе всестороннего изучения действующего производ-
ства, технологической и конструкторской документации, лите-
ратурных данных решить (совместно с руководителем диплом-
ного или курсового проекта), какие конкретные предложения
по совершенствованию технологии и оборудования будут вне-
сены в технологическую схему процесса и отражены в рас-
четах;
8
составить схему материальных и энергетических потоков
производства, стадии.
Это позволит осознанно выполнить материальный расчет,
учесть все особенности работы отдельных аппаратов, избе-
жать неточностей при составлении материальных балансов ап-
паратов, стадий, сводного материального баланса производства.
Только на основе схемы материальных потоков и выпол-
ненного материального расчета можно проводить технологиче-
ские расчеты, определить расходные коэффициенты, необходи-
мые для калькуляции себестоимости получаемого продукта,
оценить экономическую эффективность процесса, наметить пу-
ти его дальнейшего совершенствования. Данные материально-
го баланса позволяют провести анализ влияния изменения
основных технологических параметров на технико-экономиче-
ские показатели процесса (в расчетно-исследовательских про-
ектах) .
Материальный баланс основан на стехиометрических зако-
нах: сохранения массы вещества, эквивалентов, кратных и про-
стых объемных отношений, Авогадро. Материальный баланс
составляют по уравнению целевой реакции, учитывая протека-
ющие побочные реакции. Теоретический материальный баланс
рассчитывается на основе стехиометрического уравнения целе-
вой реакции, и для его составления достаточно знать молярные
массы реагирующих веществ. Практический материальный ба-
ланс учитывает состав исходного сырья и готовой продукции,
степень конверсии, селективность процесса, молярное (объем-
ное, массовое) отношение реагентов, потери сырья и готового
продукта на всех стадиях производства. Сравнение данных
теоретического и практического материальных балансов (тео-
ретических и практических расходных коэффициентов) позво-
ляет выявить возможные пути усовершенствования данного
процесса, его интенсификации.
Материальный баланс для непрерывных процессов состав-
ляют в расчете на часовую производительность цеха или уста-
новки, для периодических процессов —в расчете на операци-
онную производительность (производительность цикла). Для
выполнения материальных расчетов удобнее использовать рас-
ходы веществ, выраженные в кмоль/ч, м3/ч, кг/ч.
ХАРАКТЕРИСТИКИ ПОТОКА
Количество вещества системы п — одна из основных величин,
определяемая числом структурных элементов (атомов, моле-
кул, ионов и других частиц), содержащихся в системе.
Молярная масса — отношение массы вещества к количеству
вещества:
M=mln. (1)
9
Молярный объем — отношение объема вещества к количе-
ству вещества:
Vm^Vln. (2)
Молярная доля компонента смеси — отношение количества
вещества компонента, содержащегося в смеси, к общему коли-
честву вещества смеси:
Хл=пА/л. (3)
Объемная доля компонента смеси — отношение объема ком-
понента, содержащегося в смеси, к общему объему смеси:
<Pa=Va/V. (4)
Показатель «объемная доля» используется, как правило, для
характеристики газовых смесей и для идеальных газов на ос-
новании закона Авогадро совпадает с показателем «.молярная
доля».
Массовая доля компонента смеси — отношение массы ком-
понента А, содержащегося в смеси, к общей массе смеси:
wA=mA/m. (5)
Молярное отношение — отношение количества вещества
компонента к количеству вещества остальной части смеси.
Объемное отношение — отношение объема компонента к
объему остальной смеси.
Массовое отношение — отношение массы компонента к мас-
се остальной смеси.
Молярная концентрация — отношение количества вещества
компонента к общему объему смеси:
cA=nA/V. (6)
Массовая концентрация — отношение массы компонента к
общему объему смеси:
Ра=/па/Г. (7)
Технологические расчеты ряда производств органического
синтеза, в которых преобладают газофазные процессы, требу-
ют применения газовых законов, характеризующих состояние
газа и устанавливающих взаимосвязь параметров состояния.
Приведенные в дальнейших расчетах объемные расходы газов
отнесены к нормальным условиям (Tq=273 К, ро= 101 325 Па).
Молярный объем любого идеального газа при нормальных ус-
ловиях равен 22,4 м3/кмоль (закон Авогадро).
Для определения параметров состояния идеального газа
используют уравнение Менделеева — Клапейрона'.
pV=nRT=(m/M)RT, (8)
где р — давление газа, Па; V—объем газа, м3; п—количество вещества,
моль; m — масса газа, кг; М — молярная масса газа, кг/моль; R — уиивер-
10
сальная газовая постоянная, равная 8,314 Дж/(моль-К); Т — температура,К
(T=t°C+‘2T3).
Для приведения объема газа данной массы к реальным ус-
ловиям применяют уравнение состояния:
PiV1/7’l=p0V0/7’0. (9)
Для определения общего давления смеси газов используют
закон Дальтона — давление смеси газов, химически не взаимо-
действующих друг с другом, равно сумме парциальных давле-
ний компонентов:
P=Pi+P2+pa+•••+Рп. (10)
Из этого следует, что парциальное давление компонента газо-
вой смеси равно произведению общего давления на объемную
(молярную) долю данного компонента:
рл=рфл, рп=рхп. (11)
Пример 1. Определить парциальные давления компонентов газовой сме-
си состава (<р„ %): СН4—22,18; С2Н4—13,05; С2Н6—62,15; N2—2,62. Общее
давление газовой смеси 2'МПа.
Решение. Парциальные давления компонентов составят (в МПа):
Рсн<=2 • 0,2218=0,4436; рС2н4=2 • 0,1305=0,2610;
рс2не=2 0,6215=1,2430; pN2=2-0,0262=0,0524.
р=2,0000 МПа.
Из закона Дальтона вытекает очень важное следствие: ес-
ли известен молярный (объемный) состав газовой смеси, то
все ее физические константы (молярная масса, плотность, теп-
лоемкость и т. д.) можно вычислить по правилу аддитивности
(смешения). Так, средняя молярная масса газовой смеси
равна:
McM=xiMi+x2M2+ ... Ч-ХяМл, (12)
а средняя плотность газовой смеси (при нормальных усло-
виях) :
РсИ=МсИ/22,4. (13)
Пример 2. Определить среднюю молярную массу и плотность (при нор-
мальных условиях) газовой смеси следующего состава (х, %): СН4—11,05;
С2Н2—1,28; С2Н4—83,08; С2Н6—4,59.
Решение. Молярные массы компонентов (в г/моль):
Мсн4=16; /Ис2н2=26; Мс2н4=28; Мс2нв=30.
Средняя молярная масса газовой смеси:
Мсм=0,1105-16+ 0,0128-26+0,8308-28+0,0459-30=
= 1,768+0,333+23,262+1,377=26,740 г/моль.
Средняя плотность газовой смеси:
РсМ=26,740 : 22,4=1,194 кг/м*.
11
В ряде материальных расчетов необходимо определить ко-
личество компонентов газовой смеси, растворяющихся в жид-
ком продукте или в его водном растворе.
Пример 3. Определить объем компонентов циркуляционного газа, раст-
воряющихся в 104 т метанола при температуре 35 °C. Состав циркуляцион-
ного газа (в м3). СН4 —238 155; Н2— 1 394 840; N2 — 14 125; СО—16648;
СО2 — 30 499; СНзОН — 8 174; Н2О — 426. Общий объем циркуляционного газа
1 702 867 м3, общее давление газа 7,5 МПа.
Решение. Определяют парциальные давления компонентов газа, раство-
ряющихся в жидком метаноле (в Па):
Рсн4= (238 155/1 702 867) -7.5-106 = 10,5-105.
По аналогии (или определив вначале объемную долю каждого компонента
газа) находят (в Па):
Ph2=61,4-10s; pN2=0,6-10s; pCo=0,7-10s; рсо2=1,3-105.
Растворимость компонентов газа в метаноле при давлении 105 Па и темпе-
ратуре 30—40 °C [11, с. 201] составляет (в м3/т):
Т(сн« — 0,375: Цна — 0,096; 7n2 — 0,233; 7со — 0,259; 7со2 — 2,8.
Объем компонентов циркуляционного газа (в м3), растворяющихся в жидком
метаноле, определяют по формуле
Ра=7(Ра/р)Щ, (14)
где 7 — растворимость компонента в жидком метаноле, м3/т; Ра — парциаль-
ное давление компонента, Па; р — давление, при котором определена раство-
римость компонента, Па; т — масса метанола, т.
Рсн4=0,375(10,5-10s/lО5) 104=410 м3;
Унг=0,096 (61,4 -10s/10s) 104=613 м3.
По аналогии находят:
Vn2=15 м3; Рсо=19 м3; Рсо2=379 м3.
Данные о составе, промежуточные и сводные материаль-
ные балансы удобнее представлять в виде таблиц. Поскольку
расчет состава газовой или жидкой смеси, переход от одной
характеристики состава к другой представляет определенные
трудности, приведем пример такого расчета.
Пример 4. Рассчитать состав этановой фракции в производстве этилена
пиролизом этана, если общий расход этановой фракции равен 2071,401 кмоль/ч
и она имеет следующий состав (<р, %): С2Н4— 0,73; С2Н3— 89,80; С3Н6—
4,69; С3Н8 —4,70; С4Нв —0,08.
Решение. Для определения состава молярного потока вещества умножа-
ют общий расход на молярную (объемную) долю каждого компонента в
газовой смеси:
Пг<С2Н4)=2071,401 (0,73/100) = 15,121 кмоль/ч.
Для определения объемного расхода компонентов умножают количество
вещества компонента на молярный объем (22,4 м3/кмоль) или находят общий
объемный расход смеси
Vx(ci4)=2071,401 -22,4=46 399 м3/ч
и затем умножают его на объемную долю компонента в смеси:
Уг(С2Н4)= 15,121-22,4=339 м3/ч нлн К(С2Н,)=46 399-0,73/100=339 м3/ч.
12
Для определения массового расхода компонентов умножают количество
вещества компонента на его молярную массу:
тг(С2Н4) = 15,121-28=423 кг/ч.
Для определения массовой доли каждого компонента в смеси делят его
массовый расход на общую массу смеси.
®сгн«=423/64 684 = 0,0065 или 0,0065-100=0,65%.
Аналогично рассчитывают молярный и объемный потоки,
массовую долю остальных компонентов этановой фракции.
ПОКАЗАТЕЛИ СТАДИИ
ХИМИЧЕСКОГО ПРЕВРАЩЕНИЯ
Изменение состава материальных потоков на стадии химиче-
ского превращения определяется главными показателями этой
стадии — степенью конверсии сырья и выходом конечных про-
дуктов. Степень конверсии исходного вещества — отношение
количества (объема, массы) этого вещества, вступившего в
химическое взаимодействие, к количеству (объему, массе) это-
го же вещества в потоке на входе в реактор:
СС = Плревр/Писх Vnpe вр/ ~ Щпревр/^исх* (15)
Если в химическом превращении участвует несколько исход-
ных веществ, то процесс характеризуется степенью конверсии
каждого из них. Выход конечного продукта — отношение его
количества (объема, массы) к теоретически возможному коли-
честву (объему, массе) в расчете на поданное сырье или к ко-
личеству (объему, массе) исходного сырья с учетом стехиомет-
рических соотношений.
В технологии органического синтеза целевой реакции со-
путствует ряд побочных. Поэтому для определения фактическо-
го расхода сырья и выхода побочных продуктов используют
показатель «селективность». Селективность — отношение ко-
личества (объема, массы) целевого продукта к теоретически
возможному его количеству (объему, массе) в расчете на прев-
ращенное сырье или к количеству (объему, массе) превращен-
ного сырья с учетом стехиометрических соотношений:
Р=Лфакт/Птеор== Vфакт/Пеор=Ц^факт/Ц^теор. (16)
Пример 5. В процессе пиролиза метана для получения ацетилена по
реакции
2СН4 =* С2Н2+ЗН2
в печь пиролиза подано 2000 м3 метана. Газ пиролиза содержит 570 кг
метана и 533 кг ацетилена. Определить степень конверсии метана, выход
ацетилена, селективность процесса.
Решение. Масса исходного метана:
(2000/22,4)-16= 1429 кг.
Объем метана в газе пиролиза;
(570/16) -22,4=798 м3.
13
Прореагировало метана:
2000—798=1202 м3 или (1202/22,4)-16=859 кг.
Степень конверсии метана:
а= 1202/2000=859/1429= 0,601 (60,1 %).
Теоретически из 2000 м3 метана можно получить ацетилена:
[2000/(2-22,4)1-26=1161 кг.
Выход ацетилена:
^'=533/1161 = 0,46 (46%) или ₽'= (533/1429) [(16-2)/26] =0,46.
Теоретически из 1202 м3 метана можно получить ацетилена:
[ 1202/ (2 • 22,4) ] • 26=698 кг.
Селективность процесса:
Р= 533/698= 0,76 (76%) или ₽= (533/859) [(16-2)/26] =0,76.
Выход продукта равен произведению степени конверсии на селективность
процесса:
Р'=0,601-0,76=0,46 (46%).
Изменение состава материальных потоков в случае обрати-
мых химических реакций, условия проведения которых близки
К равновесным, рассчитывают, используя константы равнове-
сия. Константа равновесия — отношение констант скоростей
прямой и обратной реакций; значение ее для данной реакции
зависит только от температуры.
Для обратимой реакции:
П1А+и2В п^С+п^)
Яе=[С]"з[Л]я‘/([А]»«[В]«»), (17)
где [А], [В], [С], [D] — равновесные молярные концентрации реагирующих
веществ.
Константа равновесия может быть также рассчитана по
значениям парциальных давлений или молярных (объемных)
долей компонентов газовой смеси в момент равновесия:
Кр=рспзрвп«/(рля1рвп2), (18)
K„ = Xc',3XD'I4/(XAn1XB"2). (19)
Зависимость между Кс, КР, Кп.
(20)
где Ди — изменение числа молей газообразных реагирующих веществ (Ди=
= п3+п4—И]—Иг).
Зависимость константы равновесия от температуры опреде-
ляется уравнениями Вант-Гоффа (уравнения изохоры и изоба-
ры):
dlnKJdT’-----gv/(№), (21)
d In KPl&T~—qPl (RT2), (22)
14
где qv и ?₽—теплоты химических реакций при постоянных объеме и давле-
нии соответственно.
Для расчета констант равновесия удобнее пользоваться
формулами, полученными путем интегрирования указанных
уравнений в узких пределах температур:
2,3031g (Kc^lKcm) = (qv/R) (1/72—1/7.), (23)
2,3031g (КР(2)/КР(») = (?Р/Я) (UTi-lITt). (24)
Эти уравнения позволяют рассчитать константы равновесия
Кс(2), Хр(2) при температуре Т2, если известны их значения Кс(1),
Xp(i) при температуре Ti и значения теплот химических реак-
ций qv, qP. Величины qp и qv связаны следующим соотноше-
нием:
дР=ди—&nRT. (25)
Зависимость теплоты реакции от температуры описывается
законом Кирхгофа:
4Q/47=Cmcx—Скои, (26)
где Сисх, Скон — суммарные молярные теплоемкости исходных веществ и
конечных продуктов соответственно, Дж/(моль-К).
После интегрирования этого уравнения получаем:
(?2 ?1)/(72 7.)=Сисх—Скон.
Использование указанных формул представляет определен-
ные трудности, поэтому для расчета констант равновесия не-
которых химических реакций предложены эмпирические зави-
симости. Так, для вычисления КР синтеза метанола по реакции
СО+2Н2 == СН3ОН
предложены уравнения Фроста (28) и Темкина—Чередничен-
ко (29), а для расчета Кр этого же процесса, протекающего по
реакции
СО2+ЗН2 ** СН3ОН+Н2О,
— уравнение (30) [12, с. 43]:
lgKP=3925/7—9,84 1g Г+0,00347 Т+14,8, (28)
1g КР=3971/7—7,492 1g 7+0,00177 Т—0,311 • 10-772+9,218, (29)
1g КР= 1581,7 Т—8,7639 1g 7+2,1105-10~37—1,9303-10~772+15,0921. (30)
Значения КР для ряда реакций приведены в справочниках (см.
Приложения, табл. 1).
При отсутствии справочных данных константу равновесия
в стандартных условиях (7=298 К; неравновесные начальные
концентрации или парциальные давления газообразных реаги-
рующих веществ равны единице) можно определить по урав-
15
нениям Вант-Гоффа (изотермы химической реакции):
дб°=—2,303 Д7 Ig Кр, (31)
Д7 °=—2,303 RT 1g Кс, (32)
где Дб° — энергия Гиббса (изобарно-изотермический потенциал), кДж/моль,
Д7°— энергия Гельмгольца (изохорно-изотермический потенциал), кДж/моль.
Пример 6. Рассчитать константу равновесия реакции СО+Н2О СО2+
+Н2 при температуре 200 °C.
Решение. Изменение энергии Гиббса находят по формуле
AG°=AW°—7Д5°, (33)
где Д/7° — изменение энтальпии реакции, кДж/моль; Д$° — изменение энтро-
пии реакции, кДж/(моль-К)-
Используя справочные данные (см. Приложения, табл. 2; [13, табл. 44]),
находят:
ДД°298 = ДД°СО2 + ДД°Н2-ДД°СО-ДД°Н2О =
=—393,51 + 0— (— 110,53)—(—241,81) =
=—393,51 +110,53+241,81 = —41,17 кДж/моль;
Д5°=50со2+5°Н2—3°со—S°H2O=
=213,66+130,52—197,55—188,72=—42,09 Дж/(моль-К) =
=—0,042 кДж/(моль К);
ДС°29в=ДД°2<)3—ГД529в=—41,17—298 (—0,042) =—28,65 кДж/моль.
1g К₽( 29в)=—(—28,65) / (2,303 8,314 10~3 • 298) =5,0212,
Кр(298)= 1,050-106.
Константу равновесия при 7=200+273= 473 К находят по формуле (24)
2,303 1g (Ар(473)/Кр(298)) = (gPIR) (1/473-1/298).
Теплота реакции при 7=298 К равна 41,17 кДж/моль, при 7= 473 К —
40,53 кДж/моль.
С достаточной точностью принимают:
др= (41,17+40,53) /2=40,85 кДж/моль.
2,3031g (Кр(473)/Кр(298))= [40,85/(8,314 -10-3)] (1/473-1/298) =
= [40,85-1000- (298—473) ]/(8,314 - 473-298) = —6,100,
1g (Кр(473)/Кр(298)) =-2,6487=3,3513, Кр(473)/Кр(298)=0,002246,
Кр(473) = 0,002246-1,05-105=235,83.
По справочным данным константа равновесия реакции равна 238,7 (см.
Приложения, табл. 1).
Для идеальной газовой смеси константа равновесия КР не
зависит от давления. Для реальных газов Кр зависит от дав-
ления и при его повышении уменьшается, поэтому в уравнение
для расчета константы равновесия реакций, протекающих при
повышенном давлении («20—30 МПа), вводят поправочный
коэффициент.
Изменение состава материального потока в обратимом рав-
новесном газофазном процессе рассчитывают следующим обра-
16
зом. Задаются (исходя из экспериментальных или справочных
данных) значением степени конверсии и определяют изменение
состава газовой смеси. Рассчитывают константу равновесия
реакции по значениям парциальных давлений компонентов и
сравнивают полученное значение со справочным, определен-
ным по заданной температуре процесса. Если расчетное и
справочное значения константы равновесия совпадают (или
достаточно близки), то степень конверсии принята верно. Ес-
ли расчетное значение константы равновесия больше справоч-
ного, то степень конверсии завышена (поскольку числитель
выражения для расчета константы равновесия включает зна-
чения концентраций или парциальных давлений продуктов ре-
акции) и необходимо принять меньшее ее значение; если рас-
четное значение константы равновесия меньше справочного,
то следует принять большее значение степени конверсии.
Пример 7. Определить изменение состава парогазовой смеси при конвер-
сии метана водяным паром, протекающей по реакции
СН4+Н2О СО+ЗН2.
Температура в зоне катализа 840 °C; степень конверсии метана 0,84 (уточ-
няют расчетом), общее давление 2,0 МПа. Состав исходной смеси и коли-
чество компонентов:
сн4 Н2 n2 со со2 Н2О X
Vz, м3/ч 97 945 6709 948 152 606 272 686 379040
ф», % 25,84 1,77 0,25 0,04 0,16 71,94 100,06
Решение. При степени конверсии метана 0,84 реагирует метана:
97 945-0,84 = 82 274 м3/ч.
Остается непрореагировавшего метана: 97 945—82 274=15 671 м3/ч.
Расход водяного пара: 82 274 м3/ч.
Остается непрореагировавшего водяного пара: 272 686—82 274=190 412 м3/ч.
Образуется оксида углерода. 82 274 м3/ч.
Общее количество оксида углерода в парогазовой смеси: 152+ 82 274=
= 82 426 м3/ч.
Образуется водорода: 3-82 274=246 822 м3/ч.
Общее количество водорода в парогазовой смеси: 6709+246 822=253 531 м3Ль
Состав и количество продуктов конверсии:
сщ Н2 Na СО со2 Н2О 2
Vz, м3/ч 15 671 253 531 948 82426 606 190412 543 594
Ф.» % 2,88 46,64 0,18 15,16 0,11 35,03 100,00
Определяют парциальные давления (в МПа) компонентов смеси по формуле
(11):
Рсн4=2,0 0,0288=0,0576; рНз=2,0 • 0,4664 = 0,9328;
рсо=2,0 • 0,1516=0,3032; рн2о=2,0 • 0,3503=0,7006.
Константа равновесия Кр составит:
КР =
РсоР3н2
Рсн.Рн2о
100 =
0,3032-0,9328s
0,0576-0,7006
100 = 609,8,
2—69
17
где 100 — коэффициент (учитывает различие в единицах измерения давле-
ния: в справочниках приведены значения Кр, рассчитанные через парциаль-
ные давления, выраженные в атмосферах).
Находят справочное значение константы равновесия при температуре
840°C (см. Приложения, табл. 1):
Кр(927)=24 73,0, Kp(es7)=313,3.
Перепаду температур Ю0°С (927—827) соответствует изменение константы
равновесия на 2473,0—313,3=2159,7 ед. Перепаду температур 13 °C (840—
827) будет соответствовать изменение константы равновесия на
2159,7-13/100=280,8 ед.
Константа равновесия Кр при температуре 840 °C: 313,3+280,8=594,1.
Полученное расчетное значение константы равновесия отличается от справоч-
ного на 15,7 (609,8—594,1), что составляет:
15,7-100/594,1=2,6%.
При необходимости более точного расчета принимают степень конверсии,
равной 0,835. При такой степени конверсии реагирует метана: 97 945-0,835=
=81 784 м3/ч.
Общий объем газовой смеси: 379 046+2-81 784=542 614 м3/ч.
Общее количество компонентов парогазовой смесн (в м3/ч):
метана: 97 945—81 784= 16 161;
воды; 272 686—81 784= 190 902;
оксида углерода: 152+81 784=81 936;
водорода: 6 709+ 3-81 784=252 061.
Определяют парциальные давления компонентов смеси (в МПа):
Рен,=2,0(16 161/542 614) =0,0596; рН2=2,0(252 061/542 614) =0,9291;
Рсо=2,0(81 936/542 614) =0,3020; рН2о=2,0(190 902/542 614) =0,7036.
Константа равновесия Кр составит:
0,3020-0,92913
~ 0,0596-0,7036
100 = 577,6,
что меньше справочного значения на
((594,1—577,6)/577,6] 100=2,8%.
Отклонения значений константы равновесия от справочного ее значения прн
степени конверсии, равной 0,840 и 0,835, практически одинаковы. Следова-
тельно, значение степени конверсии необходимо принять равным
(0,835+ 0,840) /2= 0,8375.
При такой степени конверсии реагирует метана:
97 945-0,8375=82 029 м3/ч.
Состав и количество продуктов конверсии:
СП4 Н2 Na СО СО» н2о 2
Vx, м3/ч 15916 252 796 948 82181 606 190 657 543 104
<р4, % 2,93 46,55 0,17 Парциальные давления компонентов 15,13 0,11 смеси составят (в 35,11 МПа): 100,00
Рсн«=0,0586, Рн2=0,9310, рсо=0,3026, рн2о=0,7022.
18
Рис. 1. Алгоритм определения степени конверсии метана
Константа равновесия
О,3026-0,93103
Кр~ 0,0586-0,7022
100 = 593,4,
что меньше табличного на 1(594,1—593,4)/594,1}-100=0,12%.
Ограничиваются данной степенью приближения.
Как следует из приведенного примера, уточнение значения
степени конверсии представляет определенные трудности и
увеличивает объем расчета, поэтому это удобнее делать на
ЭВМ. На рис. 1 приведен алгоритм определения степени кон-
версии метана в процессе синтеза метанола. Условные обозна-
чения, используемые в программе, приведены ниже:
2*
19
Расчетное Программ- ное
Объемный расход компонентов после реакций конверсии гомологов метана, м3/ч: метана V. VI
водяного пара v2 V2
оксида углерода v3 V3
водорода vt V4
Общий расход газовой смесн после реакций кон- vs V5
версии гомологов метана, м3/ч Степень конверсии метана a X
Объемный расход метана при его конверсии во- V6 V6
дяным паром, м3/ч Объемный расход компонентов после реакции конверсии метана, м3/ч: метана v7 V7
водяного пара vs V8
оксида углерода Vs V9
водорода Vio V10
Общий расход газовой смесн после реакции кон- Vn Vll
версии метана, м3/ч Общее давление в системе, Па p p
Парциальное давление компонентов после реак- ции конверсии метана, Па метана Pch t PCH4
водяного пара Ph2O PH2O
оксида углерода pco PCO
водорода Ph2 PH2
Значение константы равновесия: расчетное KP KP
справочное Ap(T) KPT
Программа:
10 PRINT ’ВВЕДИТЕ ОБЪЕМНЫЕ РАСХОДЫ КОМПОНЕНТОВ, ОБЩИЙ
РАСХОД ГАЗОВОЙ СМЕСИ, ОБЩЕЕ ДАВЛЕНИЕ В СИСТЕМЕ’
20 INPUT VI, V2, V3, V4, V5, Р
30 PRINT ’ВВЕДИТЕ КОНСТАНТУ РАВНОВЕСИЯ’
40 INPUT KPT’
50 LET Х=0.5
60 V6=V1*X
70 V7=V1—V6
80 V8=V2—V6
90 V9=V3+V6
100 V10=V4+3*V6
110 V11=V5+2*V6
120 PCH4=V7*P/V11
130 PH2O=V8*P/V11
140 PCO=V9*P/VU
150 PH2=V10*P/Vl 1
160 КР=РСО*РН2|3*Ю0/(РСН4*РН2О)
170 IF KP=KPT THEN 210
180 IF ABS(KP—KPT)<=KPT/200 THEN210
190 IF KP<KPT THEN X=X+0.01
195 LET X=X—0.01
200 GOTO 60
210 PRINT ’СТЕПЕНЬ КОНВЕРСИИ РАВНА X’
220 END
20
Степень конверсии исходных веществ (или одного из ис-
ходных веществ) может быть также рассчитана с помощью
кинетических уравнений. Любой химико-технологический про-
цесс включает три стадии: 1) подвод реагирующих веществ в
зону реакции; 2) собственно химическая реакция; 3) отвод
продуктов из зоны реакции.
Для гетерогенных каталитических процессов, идущих на
твердом катализаторе, первая стадия включает диффузию
реагирующих веществ к поверхности катализатора и активи-
рованную адсорбцию, а третья стадия —• диффузию продуктов
реакции с поверхности катализатора и активированную де-
сорбцию. Общая скорость процесса определяется наиболее мед-
ленной (лимитирующей) стадией. При низких температурах
химическая реакция идет медленнее стадий подвода реагентов
и отвода продуктов, общая скорость процесса определяется
скоростью второй стадии и процесс протекает в кинетической
области. С повышением температуры скорости диффузии и
адсорбции (десорбции) увеличиваются медленнее, чем ско-
рость химической реакции, процесс переходит в диффузионную
область, а общая скорость процесса определяется скоростями
первой и третьей стадий. Если скорости всех стадий соизмери-
мы, то процесс протекает в переходной области. Общую ско-
рость химико-технологического процесса определяют по урав-
нению
и=кДС, (34)
где и — скорость процесса; к — коэффициент пропорциональности; ДС—
движущая сила процесса.
Скорость химической реакции — изменение количества реа-
гирующих веществ в единицу времени, отнесенное к единице
объема аппарата или катализатора. По закону действующих
масс (Гульдберг и Вааге, 1867) скорость химической реакции
прямо пропорциональна произведению молярных концентраций
(для газов — парциальных давлений) реагирующих веществ,
взятых в степени, равной стехиометрическому коэффициенту
соответствующего вещества в уравнении реакции. Сумма пока-
зателей степени при концентрациях реагирующих веществ в
фактическом кинетическом уравнении для скорости данной ре-
акции называется ее порядком.
Кинетические уравнения реакций:
первого порядка (—dc/dr)=Kc; (35)
второго порядка: (—dc/dt) =K,CtC», (36)
где (—dc/dt) — истинная скорость химической реакции (первая производная
концентрации по времени); К — константа скорости.
21
Константу скорости реакции первого порядка определяют
по уравнению
2,303, а
= (37)
где т — время реакции; а — исходное количество вещества, х— количество
вещества, вступившего в реакцию к моменту времени т.
Константу скорости реакции второго порядка определяют
по уравнению
2,303 1 Ь(а-х)
К т a-b^a(b-x) *
Рассчитав по эмпирическим формулам время пребывания
реагирующих веществ в аппарате и константу скорости при
заданной температуре, находят степень конверсии исходного
вещества.
ТЕПЛОВОЙ РАСЧЕТ
Технологические процессы в промышленности органического
синтеза протекают в широком температурном диапазоне, для
их осуществления, как правило, необходимо предварительно
подогревать сырьевую смесь, отводить или подводить тепло в
зависимости от типа химической реакции.
Цель теплового расчета: определение теплового потока
хладагента или теплоносителя и их расходов, температуры
предварительного подогрева одного из потоков (сырья, цирку-
лирующих жидкости или газа), расхода одного из потоков
(сырья или циркулирующего продукта, испаряемого внутри ап-
парата); уточнение температурного режима аппарата (напри-
мер, проверка адиабатичности режима его работы).
Уравнение теплового баланса аппарата в общем виде:
Ф1+ Ф2+ ®4== ®s+ Ф#+ Ф?-}" Фв4" (39)
где Ф| и Ф5 — тепловые потоки поступающего сырья и продуктов реакции;
Ф2 и Ф6— теплота экзотермических и эндотермических реакций; Ф3 и
Ф? — теплота экзотермических и эндотермических фазовых превращений
(конденсации, кристаллизации, испарения, растворения, плавления и др.);
Ф4 и Ф3 — тепловые потоки теплоносителя иа входе в аппарат и выходе из
него; Ф8 — теплопотери в окружающую среду.
При выполнении тепловых расчетов непрерывных процес-
сов тепловые потоки выражают в Вт, кВт, а расходы ве-
ществ — в кмоль/с, кг/с, м3/с, при расчете периодических про-
цессов тепловые потоки выражают в Дж/цикл, кДж/цикл, а
расходы веществ — в кмоль/цикл, кг/цикл, м3/цикл.
Тепловые потоки поступающего сырья и продуктов реакции
(Фь Ф5), как правило, определяют по формулам
Ф=ттсГ, (40); Ф=Утс«, (41); Ф=пхСт1, (42);
22
где Ф — тепловой поток, Вт; тт—массовый расход, кг/с; VT— объемный
расход, м3/с; пт — молярный поток вещества, кмоль/с; с — удельная или
объемная теплоемкость, Дж/(кг-К) или Дж/(м3-К); Ст — молярная тепло-
емкость, Дж/(кмоль-К); t — температура потока, °C.
В приведенных выше формулах для расчета тепловых по-
токов расход сырья (продуктов) определяют на основании дан-
ных материального расчета, а значения теплоемкостей нахо-
дят по справочнику (см. Приложения, табл. 2—5).
Внимание! Любая справочная величина, используемая в
расчете, должна быть обоснована: указаны литературные ис-
точники, номер страницы, таблицы, номограммы, графика,
•формулы, по которой она рассчитана.
Поскольку теплоемкость всех веществ, особенно находя-
щихся в газообразном состоянии (большинство реакций в ор-
ганическом синтезе идет в газовой фазе), как правило, растет
с увеличением температуры, при выполнении тепловых расче-
тов определяют истинную молярную теплоемкость компонентов
при заданной температуре по общему уравнению Cp°=f(T).
Теплоемкость простых веществ и неорганических соединений
рассчитывают по формуле (43), теплоемкость органических ве-
ществ — по формуле (44):
С„°=а+Ь7+с772, (43)
Сре=а+ЬТ+сТ», (44)
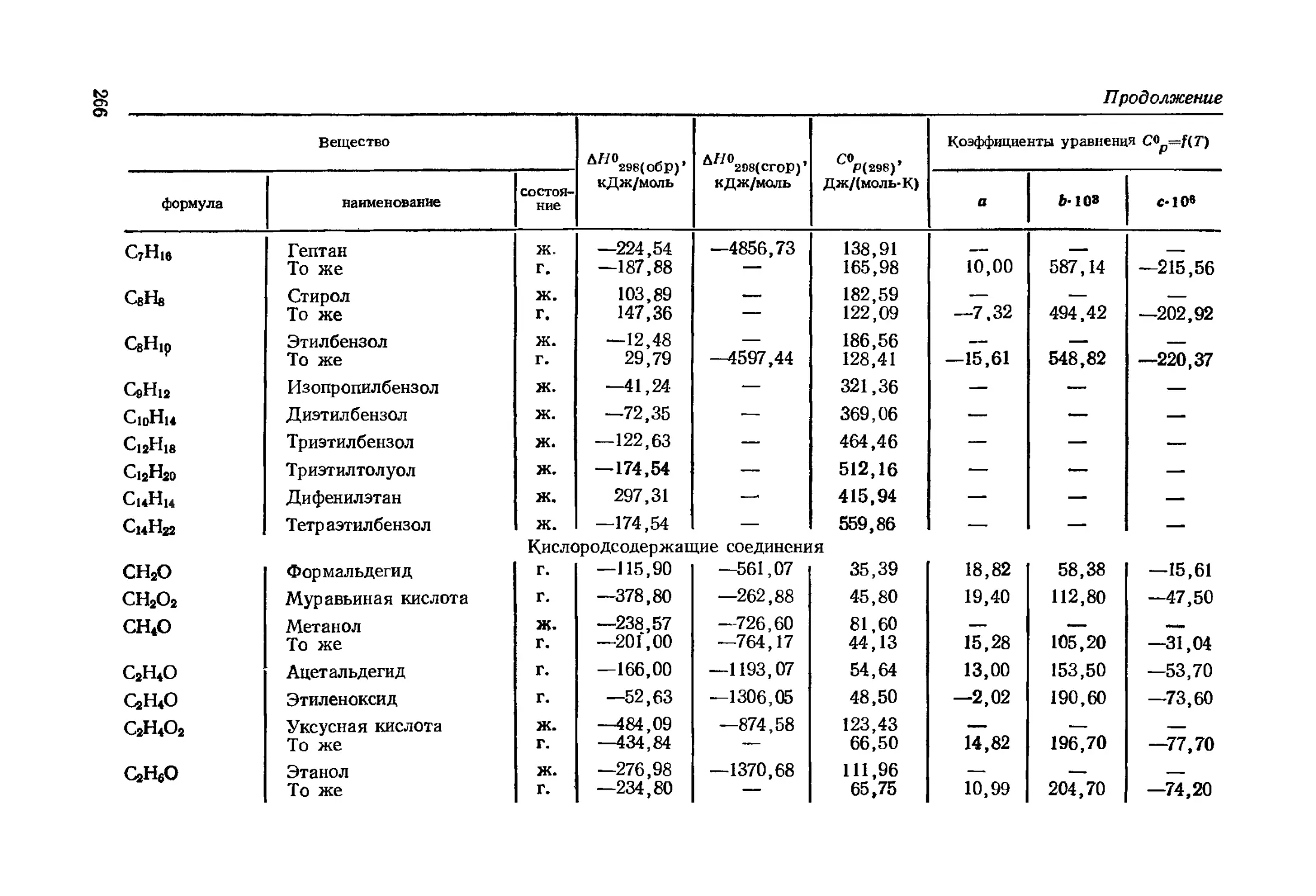
где С°р — молярная теплоемкость при постоянном давлении, Дж/(моль-К);
а, Ь, с', с — коэффициенты общего уравнения С°Р=(Т), Т — температура, К.
Значения коэффициентов уравнений (43) и (44) находят по
справочнику (см. Приложения, табл. 2, 3). Отсутствие в таб-
лице значений коэффициентов уравнения Cp°=f(T) означает,
что теплоемкость данного вещества не зависит от температуры
либо такая зависимость еще не определена. Отсутствие в таб-
лице значения коэффициента с' означает, что третий член урав-
нения равен нулю. В справочниках также приводятся значения
молярных теплоемкостей веществ при 7=298 К (/=25°С).
Пример 8. Вычислить истинную молярную теплоемкость газообразного
кислорода при температуре 257°C (7= 257+273=530 К).
Решение. Молярную теплоемкость кислорода определяют по формуле
(43), так как кислород — простое вещество. Значения коэффициентов нахо-
дят по справочнику (см. Приложения, табл. 2): а=31,46, Ь-103=3,39, следо-
вательно, 6=3,39-10“3; с'-10~6=—3,77, следовательно, с'=(—3,77-Ю6).
Сро=а+Ь7’+с772=31,46+3,39-1О-3-53О+(—3,77-1О‘)/53О2=
=31,46+3,39 • 0,530— (3,77 • 10s)/(5,32 • 104) =31,46 +1,80—1,34=
=31,92 Дж/(моль-К).
Пример 9. Вычислить истинную молярную теплоемкость сероводорода
при температуре 100°С (7=100+273=373 К).
Решение. Молярную теплоемкость сероводорода определяют по формуле
(43), так как сероводород H2S — неорганическое соединение. Значения коэф-
23
фициеитов (см. Приложения, табл. 2): а=29,37, 6= 15,40-10-3.
С%=а+Ь7=29,37+15,40-10~3-373=29,37+15,40-0,373=
= 29,37+ 5,74=35,11 Дж/(моль-К).
Пример 10. Вычислить истинную молярную теплоемкость газообразного
бензола при температуре 250°C (7=250+273=523 К).
Решение. Молярную теплоемкость газообразного бензола определяют по
формуле (44), так как бензол — органическое вещество. Значения коэффи-
циентов (см. Приложения, табл. 3): а=—21,09; 6=400,12-10~3; с=—169,87Х
хю~6.
С°р=а+ЬТ+сТ2=—21,09 + 400,12-10-3-523—169,87-10-6-5232=
=—21,09+400,12 • 0,523— 169,87 • 0.5232=—21,09+209,26—46,46=
= 141,71 Дж/(моль-К).
Полученное расчетом либо принятое по справочнику значе-
ние молярной теплоемкости может быть использовано для оп-
ределения удельной или объемной теплоемкости по формулам:
с=С°р-1000/М, (45); с=С°Р-1000/22,4, (46);
где с — удельная или объемная теплоемкость, Дж/(кг-К) или Дж/(м3-К);
М — молярная масса, г/моль; 22,4 — молярный объем, м3/кмоль.
Теплоемкость химического соединения при отсутствии спра-
вочных данных можно рассчитать по эмпирическим формулам.
Теплоемкость газов и паров при 7=298 К приближенно рас-
считывают по их молекулярному составу, используя следую-
щую формулу:
Ср=4187[(2-л+3)/М], (47)
где ср—удельная теплоемкость, Дж/(кг-К); п — число атомов в молекуле
соединения; М — молярная масса, г/моль
Теплоемкость твердых и жидких веществ рассчитывают по
значениям атомных теплоемкостей (см. Приложения, табл. 6),
используя правило аддитивности.
Ссы=^^С$хц (48)
где ССм—теплоемкость смеси газов, Дж/(моль-К); С4— молярная теплоем-
кость компонента, Дж/(моль-К); хг — молярная доля компонента в смеси,
доли единицы.
Пример 11. Вычислить удельную теплоемкость газообразного формаль-
дегида по его молекулярному составу.
Решение. Число атомов в молекуле формальдегида СН2О п=4; моляр-
ная масса М= 12+1-2+16=30 г/моль.
Удельная теплоемкость:
с°р=4187[ (4-2+3)/30] = 1535 Дж/(кг-К).
Полученное значение теплоемкости газообразного формальдегида соответ-
ствует температуре 7=550 К (277°C), т. е. формула дает значительную
погрешность.
24
Пример 12. Вычислить молярную теплоемкость жидкого бензола.
Решение. В молекуле бензола С6Н6 шесть атомов углерода и шесть ато-
мов водорода. Значения атомных теплоемкостей находят по справочнику
(см. Приложения, табл. 6). Теплоемкость бензола составит"
С°р= 11,72 • 6 +17,99 • 6= 178,26 Дж/ (моль • К),
что соответствует температуре 7=466 К (193 °C). В данном случае погреш-
ность вычисления теплоемкости несколько меньше, чем при расчете по фор-
муле (47).
Пример 13. Вычислить среднюю объемную теплоемкость при температу-
ре 150°C газовой смеси состава (ср, %): СН4—12,58; С2Н4— 2,03; С2Н6—•
78,20, N2 —2,05; О2 —5,14.
Решение. Определяют по справочнику молярную теплоемкость компонен-
тов смеси при 7=150+ 273= 423 К (см Приложения, табл. 2, 3). Теплоем-
кость органических веществ находят по формуле (44):
С°р(сн4)=14,32+74,66-10-3-423—17,43-10-6-423’==
= 14,32+31,58—3,12=42,78 Дж/(моль-К);
С°Р(С2Н4>=11,32+122,01 -10-3-423—37,90-10-6-4232=
= 11,32+51,61—6,78=56,15 Дж/ (моль • К);
С°Р(С2н6)=5,75+ 175,11 • 10-3-423—57,85-10“6 -4232=
=5,75+74,07—10,35=69,47 Дж/ (моль - К).
Теплоемкость простых веществ находят по формуле (43)
С°р(№)=27,88+4,27- 10~3-423=29,69 Дж/(моль-К);
С°р(ог)=31,46+3,39 • 10-3 • 423—3,77 • 105/4232=30,78 Дж/ (моль • К).
Среднюю объемную теплоемкость газовой смеси вычисляют по формулам
(46), (48):
Сем =[ 1 / (22,4 • 100) ] (42,78 • 12,58+56,15 • 2,03+69,47 • 78,20+
+29,69-2,05+30,78-5,14) = [1/(22,4-100)] (538,17+113,98+5432,55 +
+60,86+158,21) =2,814 кДж/(м3-К).
Теплоту экзотермических (Ф2) и эндотермических (Фе) ре-
акций находят по формуле
Ф=1000?тпт, (49)
где Ф — теплота экзотермических и эндотермических реакций, кВт; qm — теп-
лота химической реакции, кДж/моль; — количество вещества, вступившего
в реакцию, кмоль/с.
Теплоту химической реакции находят по двум величинам:
энтальпии образования и энтальпии сгорания. Энтальпия об-
разования —• изменение энтальпии при образовании одного мо-
ля химического соединения из простых веществ (поэтому эн-
тальпии образования простых веществ, находящихся при стан-
дартных условиях в устойчивом состоянии, приняты равными
нулю). Энтальпия сгорания — изменение энтальпии при сгора-
нии одного моля химического соединения до продуктов пол-
ного окисления (СО2(г), Н2ОЖ, SO2(r), N2(r), С12(Г), НС1(раСтвор)).
Изменение энтальпии реакции (следствие из закона Гесса)
равно разности энтальпий образования продуктов и исходных
веществ или энтальпий сгорания исходных веществ и продук-
25
тов реакции (с учетом стехиометрических коэффициентов).
Теплота реакции и изменение ее энтальпии имеют одинаковую
величину, но противоположные знаки.
Пример 14. Определить теплоту реакции
С2Нв+2Н2О(г> 2СО+5Н2.
Решение. Рассчитывают изменение энтальпии реакции по энтальпиям
образования (см. Приложения, табл. 2, 3):
ДН°298 = 2 ДЯ °298(КОН)—2 ЛЯ ° 293(нсх)~
=2ДА/°со+5ДН°н2—ДА/°с2н6—2ДА/°н2О(г)=
=2 (—110,53) +5-0— (—84,67) —2 (—241,81) =
=—221,06 +84,67+483,62=347,23 кДж/моль.
Теплота реакции имеет обратный знак:
qm=—347,23 кДж/моль.
Пример 15. Определить теплоту реакции
С2Н2+ЗН2 2СН4.
Решение. Определяют изменение энтальпии реакции по энтальпиям сго-
рания (см. Приложения, табл. 2, 3).
ддо293=2д^°293(исх)— 2дд°293(кои) =
=ДД°С2Н2 + ЗДЯ°Н2—2ДЯ°сН4= (—1299,63) +3(—285,83)—2(—890,31) =
=—1299,63—857,49+1780,62=—376,50 кДж/моль.
Теплота реакции имеет обратный знак:
?п=376,50 кДж/моль.
Для сравнения: теплота реакции, рассчитанная по энтальпиям образования,
равна 376,45 кДж/моль.
Теплоту реакции по энтальпиям сгорания рассчитывают
только для органических веществ. При отсутствии справочных
данных энтальпию сгорания органического вещества можно
определить:
1) по методу Хендрика как теплоту реакции сгорания до
продуктов полного окисления (по энтальпиям образования);
2) по уравнению Коновалова:
gm=204,2n+44,4rn+ (50)
где п — число атомов кислорода, необходимое для полного сгорания одного
моль вещества; m — число моль образующейся воды; х — поправка (терми-
ческая характеристика), постоянная в пределах данного гомологического
ряда. Значения термических характеристик находят по справочнику (см.
Приложения, табл. 7).
Пример 16. Рассчитать теплоту сгорания ацетилена при 7=298 К по
уравнению Коновалова.
Решение. Теплота сгорания ацетилена по реакции
НС=СН+2,5О2 —>• 2СО2+Н2О<ж)
26
при 25 “С и постоянном объеме равна:
9m=204,2 • 5+44,4+213,4=1278,8 кДж/моль.
Теплоту сгорания ацетилена при постоянном давлении (энтальпию сгорания)
находят по формуле (25):
qp=qv—bnRT= 1278,8—(2—1—2,5) -8,314• 10~3-298=1282,5 кДж/моль.
Справочное значение энтальпии сгорания равно:
ДЯ°298=—1299,63 кДж/моль.
Тепловые потоки теплоносителей Ф4, Фе (оборотная вода,
рассол, масло, другие органические вещества) находят по
формуле (40). Теплоту экзотермических и эндотермических
фазовых переходов (парообразования, конденсации и др.) Фз
и Ф? определяют по формуле
ф=я1гг, (51)
где Ф — тепловой поток, кВт; тх — массовый расход, кг/с; г — удельная
теплота фазового перехода, кДж/кг.
Значения удельных теплот фазового перехода находят по
справочнику (см. Приложения, табл. 9, 12—14) либо рассчи-
тывают по эмпирическим формулам. Так, теплоту испарения
неполярных жидкостей при нормальной температуре кипения
рассчитывают по формуле
Гт/7’кнп=36,61 +19,14 1g 7К„„, (52)
где rm — молярная теплота испарения, Дж/моль; 7КПП— температура кипе-
ния при нормальном давлении, К.
Пример 17. Определить теплоту испарения бензола при нормальном дав-
лении.
Решение. Температура кипения бензола при нормальном давлении 80,1 °C
(7=353,1 К).
гт=353,1 (36,61 +19,14 1g 353,1) =353,1 (36,61 +19,14-2,548) =30 156 Дж/моль
или г=30 156/78=386,6 кДж/кг.
Справочное значение теплоты испарения бензола:
г=393,8 кДж/кг.
Теплопотери аппарата в окружающую среду на основании
экспериментальных данных принимают до 5% от общего при-
хода (расхода) теплоты в зависимости от температуры про-
цесса, степени изоляции аппарата, места его установки (на
открытой площадке или в помещении).
РАСЧЕТ ОСНОВНОГО АППАРАТА
Расчет основного реакционного аппарата выполняют на осно-
ве материального и теплового расчетов.
Цель расчета — определение числа аппаратов и их основ-
ных размеров. Как правило, выполняется поверочный расчет
27
принятой конструкции аппарата с целью проверки обеспечения
заданной производительности — количества целевого продукта,
получаемого в единицу времени.
Объем реакционной зоны аппарата непрерывного действия
находят по формуле
Vp=Vzt, (53)
где Ур— объем реакционной зоны, м3, Ут — объемный расход реагентов,
м3/с; т — время пребывания реагентов в аппарате, с.
Площадь сечения аппарата:
S=V-Jw, (54)
где S — площадь сечения аппарата, м2; w — линейная скорость потока в ап-
парате, м/с.
Диаметр аппарата цилиндрической формы (в м):
P=l,13ys. (55)
Высота (длина) реакционной зоны аппарата (в м):
H=Vp/S=wt. (56)
Для аппаратов, загруженных катализатором, объем рабочей
зоны равен объему катализатора (VK, м3), который определя-
ют по объемной скорости газа (жидкости) или производитель-
ности катализатора.
Объемная скорость — объем газовой смеси (или жидкости),
проходящей через единицу насыпного объема катализатора в
единицу времени:
Уо6=Уг/Ук, (57)
откуда Ук=Ут/Уоб. (58)
Производительность катализатора — масса (объем) целево-
го продукта, получаемого с единицы объема (массы) катализа-
тора в единицу времени:
^=ЛГпрод/Уж, (59)
откуда VK = NnpoA/NK.
Реакционный объем аппарата периодического действия ра-
вен:
Ур=УсутТ/(24<рзап), (60)
где УСут — суточный объем перерабатываемых веществ, м3; т — общее время
технологического цикла, ч; <раап — степень заполнения аппарата (принимают
от 0,4 до 0,9).
Диаметр штуцеров ввода и вывода реагентов определяют
по формуле
</=1,13УУг/«>,
(61)
28
В расчетах необходимо использовать значение расхода га-
за (газовой смеси) при реальных условиях [см. уравнение (9)К
Оптимальные скорости движения реагентов выбирают на осно-
вании справочных и экспериментальных данных (см. Прило-
жения, табл. 18).
В зависимости от назначения и конструкции основного ап-
парата выполняют различные расчеты, в частности определя-
ют площадь поверхности теплообмена (для реакторов, рабо-
тающих в изотермическом режиме), длину реакционного змее-
вика трубчатого реактора с огневым обогревом, рассчитыва-
ют фильтры (циклоны) в реакторах с псевдоожиженным сло-
ем катализатора, переливные устройства колонных аппаратов,
перемешивающие устройства емкостных аппаратов и др.
Часто необходимо выполнить поверочный расчет площади
поверхности теплообмена, например, трубчатки каталитическо-
го реактора, встроенных в реактор или внешних тепловых эле-
ментов, предназначенных для подвода (отвода) тепла. Так,
выполнив тепловой расчет и определив значение теплового по-
тока, который следует отвести от аппарата хладагентом или
подвести теплоносителем (так называемую тепловую нагруз-
ку), площадь поверхности теплообмена рассчитывают по фор-
муле
Т= Ф/СкДГср), (62)
где F— площадь поверхности теплообмена, м2; Ф — тепловая нагрузка на
аппарат, Вт; к — коэффициент теплопередачи, Вт/(м2-К); ДТср— средняя
разность температур (средний температурный иапор), К.
Коэффициент теплопередачи к является характеристикой
сложного теплообмена и зависит от коэффициентов теплоот-
дачи по обеим сторонам разделяющей поверхности, а также
от термических сопротивлений стенки с учетом слоев загряз-
нений с обеих сторон.
Для труб, у которых отношение наружного диаметра к
внутреннему dnldBK^.2, коэффициент теплопередачи определя-
ют по формуле:
к=(1/а1+2|'ст+1/а2)-1, (63)
где «1 и а2— коэффициенты теплоотдачи, Вт/(м2-К); 2гСт— сумма терми-
ческих сопротивлений стенки с учетом слоев загрязнений с обеих сторон,
м2-К/Вт.
Коэффициенты теплоотдачи зависят от ряда факторов и
могут быть определены для разных случаев теплоотдачи с по-
мощью критериальных уравнений, чаще всего для случая теп-
лообмена на границе между стенкой и теплоносителем — с по-
мощью критерия Нуссельта:
a=NuX/Z, (64)
где Nu — критерий Нуссельта, зависит для конвективного теплообмена от
29
других критериев подобия (Fo, Re, Gr, Рг), характеризующих данный про-
цесс (конкретный вид зависимостей см. [9, 10, 14, 15]); Л — теплопроводность
среды, Вт/(м-К); I — определяющий геометрический размер, м.
Критерий Прандтля, учитывающий физические свойства
среды, можно рассчитать по формуле
Рг=срД, (65)
где с—удельная теплоемкость среды, Дж/(кг-К); ц— динамическая вяз-
кость среды, Па-с; Л — теплопроводность среды, Вт/(м-К).
Значения критерия Прандтля (или необходимых для его
определения свойств) для различных веществ приведены в
справочниках (см. Приложения, табл. 12, 16, 17). Приблизи-
тельные значения критерия Прандтля для газов, которые мо-
гут быть использованы при выполнении расчетов, даны ниже
{10, с. 150]:
Одноатомные газы 0,67 Трехатомные газы 0,80
Двухатомные газы 0,72 Четырех- и миогоатом- 1,00
иые газы
Значения динамической вязкости воды на линии насыще-
ния, жидкостей, газов и паров находят по справочнику (см.
Приложения, табл. 11, 12, 16, 17).
Динамическую вязкость газовых смесей определяют по
формуле
1Ис»</всм=Х17И1/Ц1 +х2Л12/ц2+ ... +XiMiliii, (66)
где Л1см, Mi, М2, ..., Мг — относительные молекулярные массы смеси газов
и ее компонентов; цсм, Ць Щ— динамические вязкости смеси газов
и ее компонентов, Па-с; Xi, х2, ..., хг — молярные доли компонентов в смеси.
РАСЧЕТ ВСПОМОГАТЕЛЬНОГО ОБОРУДОВАНИЯ
В любом производственном процессе кроме основных реакци-
онных аппаратов используется вспомогательное оборудование
для осуществления гидродинамических, тепловых, массообмен-
ных процессов, для перемещения материалов. Это оборудова-
ние в значительной мере является общим для различных про-
цессов химической промышленности, стандартизированным.
Цель расчета вспомогательного оборудования сводится в
основном к определению вместимости и числа аппаратов (мер-
ников, сборников, резервуаров, промежуточных теплообменни-
ков и др.) технологической схемы.
Основным общим критерием для емкостных аппаратов яв-
ляется их вместимость, номинальное значение которой выби-
рают из унифицированного ряда (ГОСТ 9931—79).
На рис. 2 показаны стальные сварные горизонтальные и
вертикальные цилиндрические аппараты типов ГЭЭ и ВЭЭ с
30
Исполнение 1
г
Рис. 2. Емкостные стальные
(ГОСТ 9931—79):
а.— тип ГЭЭ; б — тип ВЭЭ
Исполнение 1 Исполнение 2
сварные цилиндрические
аппараты
двумя эллиптическими днищами (исполнение 1) и с эллипти-
ческим днищем и крышкой (исполнение 2); в табл. 1 приведе-
ны основные размеры корпусов этих аппаратов.
Пример 18. Рассчитать вместимость и число сборников для жвдкого-
продукта, если расход материала mt=27 500 кг/ч, его плотность р=900кг/м3,
время заполнения сборника т=0,25 ч.
Решение. Вместимость сборника определяют по формуле
У=штт/(р<рзап)• (67)
Степень заполнения сборника <рзап при хранении жидкостей составляет
0,8—0,9. Принимают <pSan=0,8, тогда
У=27 500• 0,25/(900• 0,8) =9,55 м3.
По табл. 1 устанавливают, что полученным данным соответствует емко-
стной стальной цилиндрический аппарат, имеющий следующие характеристики
(выбирают один из нескольких возможных вариантов):
Тнп ГЭЭ, исполнение 1,
горизонтальный с
двумя эллиптиче-
скими днищами
Вместимость ио- 5,00
минальная, м3
Диаметр внутренний, мм 1400
Длина цилиндрической 2785
части, мм
Площадь поверхности 16,5
внутренняя, м2
Таким образом, необходимо установить два сборника.
При подборе насосов для перекачивания жидких продуктов
определяют их основные характеристики. Работа любого насо-
са характеризуется напором и мощностью при заданной пода-
че насоса (расходе жидкости). Полезную мощность насоса рас-
считывают по формуле
N=VxpgHI(-q-l000), (68)
где N — мощность, потребляемая насосом, кВт; Vx— подача насоса, м3/с;.
р — плотность перекачиваемой жидкости, кг/м3; g — ускорение свободного-
падения, м/с2; т] — общий к. п. д. насоса, доли ед.
31
Таблица 1. Основные размеры корпусов ГЭЭ и ВЭЭ
VHOM- “3 D& мм /, мм FB, м2 VHOM. м3 Db, мм 1. мм Рв.м2
0,500 600 1570 3,74 12,5 2000 3315 29,5
700 1070 3,42 2200 2560 28,5
800 730 3,23 2400 1970 27,3
0,630 900 690 3,71 16,0 2000 4430 36,5
1000 470 3,64 2200 3480 34,8
0,800 800 1325 4,73 2400 2740 33,1
900 960 4,69 20,0 2000 5705 44,5
1000 685 4,32 2200 4535 42,1
1,00 800 900 1000 1725 1275 940 5,73 5,35 5,12 1 25,0 2400 2600 2800 3625 2905 2320 39,8 38,3 37,4
1200 485 4,94 2000 7300 54,5
1,25 1000 1200 1260 705 6,12 5,78 2200 2400 2600 5850 4730 3850 51,2 48,1 46,3
1,60 1000 1705 7,52 2800 3135 44,5
1200 1015 6,94 32,0
1400 575 6,77 2400 6280 59,8
2,00 1000 1200 1400 2215 1370 835 9,12 8,27 7,91 2600 2800 3000 3200 5165 4270 3535 2920 56,8 54,6 52,8 51,5
2,50 1200 1815 9,94 40,0
1400 1160 9,34 2400 8050 73,1
1600 715 9,13 2600 6675 69,1
3,20 1200 1400 1600 2430 1615 1060 12,3 11,3 10,9 50,0 2800 3000 3200 5670 4665 3915 65,9 63,5 61,5
4,00 1200 3140 14,9 2400 10260 89,8
1400 2135 13,6 2600 8560 84,5
1600 1460 12,9 2800 7195 80,3
1800 975 12,5 3000 6080 76,8
5,00 1200 4025 18,3 63,0 3200 5160 74,0
1400 2785 16,5 2800 9305 98,8
1600 1955 15,4 3000 7920 94,1
1800 1370 14,8 3200 6775 90,3
6,30 1400 3630 20,2 80,0 2800 12 070 123,1
1600 2605 18,6 3000 10 330 117,0
1800 1880 17,7 3200 8890 111,5
2000 1340 17,1 100,0 143,5 136,5
8,00 1600 1800 3450 2550 22,9 21,4 3000 3200 13 160 11 380
2000 1885 20,5 , 125,0 3000 16 700 176,8
10,0 1600 4445 27,9 3200 14 490 168,0
1800 3335 25,9 160,0 3000 21 650 223,5
2000 2520 24,5 3200 18 840 211,5
2200 1902 23,6 200,0 3000 27 310 276,8
12,5 1600 5690 34,1 3200 23820 261,5
1800 4315 31,4 3400 20910 248,0
32
Таблица 2. Технические характеристики центробежных насосов
Марка VT, мЗ/ч Н, м п, с—1 ча Электродвигатель
тип "ном- кВт 11ДВ
Х2/25 1,5 25,0 50,0 — АОЛ-12-2 1,1 —.
Х8/18 8,5 11,3 14,8 48,3 0,40 АОЛ-31-2 3,0 —
Х8/30 8,5 18,0 BA0-3I-2 3,0 0,82
17,7 А02-32-2 4,0 —
24,0 48,3 0,50
30,0 { ВАО-32-2 4,0 0,83
Х20/18 20,0 10,5 13,8 48,3 0,60 { А02-31-2 3,0 —
18,0 । ВАО-31-2 3,0 0,82
Х20/31 20,0 18,0 25,0 31,0 . 48,3 0,55 [ А02-41-2 | ВАО-41-2 5,5 5,5 0,87 0 84
Х20/53 20 34,4 44,0 53,0 . 48,3 0,50 f А02-52-2 { ВАО-52-2 13 13 0,89 0,87
Х45/21 45 13,5 17,3 21,0 48,3 0,60 ( А02-51-2 1 ВАО-51-2 10 10 0,88 0,87
X45/3I 45 19,8 25,0 31,0 48,3 0,60 г А02-52-2 1 ВАО-52-2 13 13 0,89 0,87
Х45/54 45 32,6 А02-62-2 17 0,88
42,0 48,3 0,60 А02-71-2 22 0,88
54,0 А02-72-2 30 0,89
Х90/19 90 13,0 А02-51-2 10 0,88
16,0 48,3 0,70 А02-52-2 13 0,89
19,0 А02-62-2 17 0,88
Х90/33 90 25,0 А02-62-2 17 0,88
29,2 48,3 0,70 А02-71-2 22 0,90
33,0 А02-72-2 30 0,90
Х90/49 90 31,4 A02-7I-2 22 0,88
40,0 48,3 0,70 А02-72-2 30 0,89
49,0 А02-81-2 40 —
Х90/85 90 56,0 А02-81-2 40
70,0 48,3 0,65 А02-82-2 55 —
85,0 А02-91-2 75 0,89
XI60/29/2 160 20,0 ВАО-72-2 30 0,89
24,0 48,3 0,65 А02-72-2 30 0,89
29,0 А02-81-2 40 —
XI60/49/2 160 33,0 А02-81-2 40
40,6 48,3 0,75 А02-82-2 55 —
49,0 A02-9I-2 75 0,89
3-69
33
Продолжение
Марка V'T, мз/ч Н, ы п, с—1 Электродвигатель
тип "ном- кВт 11ДВ
XI60/29 160 29,0 24,15 0,60 А02-81-4 40 —
А02-82-4 55 —
Х280/29 280 21,0 ) А02-81-4 40 —
25,0 1 24,15 0,78 А02-82-4 55 —
29,0 J А02-91-4 75 0,92
Х280/42 280 29,6 ) 35,0 1 42,0 J 24,15 0,70 / A02-9I-4 1 А02-92-4 75 100 0,92 0,93
Х280/72 280 51,0 1 АО-101-4 125 0,91
62,0 1 24,15 0,70 АО-102-4 160 0,92
72,0 J АО-103-4 200 0,93
Х500/25 500 19,0 ) 22,0 1 25,0 J 16,0 0,80 f A02-9I-6 1 А02-92-6 55 75 0,92
Полный напор насоса определяют по формуле
Н=Н?+ (.P2—Pi)l(pg) +hK+h„.
Технические характеристики центробежных насосов пред-
ставлены в табл. 2.
Пример 19. Подобрать иасос для перекачивания жидкого продукта по
условиям примера 18. Дополнительные данные:
Избыточное давление в резер-
вуарах, Па:
расходном pi 300
приемном р2 102 000
Геометрическая высота подъ- 20
ема жидкости Нт, м
Гидравлическое сопротивление
трубопроводов, м:
всасывающего 1
нагнетательного йн 8
Решение. Объемный расход перекачиваемого продукта (подача насоса)
при его плотности р=900 кг/м3 составит:
VT=mT/(3600p) =27 000/(3600-900) =8,3- 10~s м3/с.
Полный напор насоса определяют по формуле (69):
Я=20 + (102 000—300) / (900 9,81) +1+8=40,5 м.
Принимают к. п. д. насоса т]=0,6 и определяют полезную мощность насоса
по формуле (68):
N= (8,3• 10-s 900 - 9,81 • 40,5) / (0,60 • 1000) =4,95 кВт.
Мощность электродвигателя принимают с запасом 25%, тогда его требуемая
мощность составит:
Л1ДВ= 1,25-#=1,25-4,95=6,2 кВт.
34
По табл. 2 устанавливают, что полученным данным соответствует цент-
робежный насос марки Х45/54, который в оптимальных условиях работы
имеет следующие технические характеристики: Ут=45 м3/ч, /7=42 м, т]н=
= 0,6 Насос снабжен электродвигателем А02-71-2 с номинальной мощностью
Лном=22 кВт, к. п. д т]дв=0,88, частотой вращения вала п=48,3 с-1.
Необходимо установить два насоса, в числе которых один рабочий, а
другой резервный.
Для очистки газов от твердых частиц используют тканевые
фильтры. Технические характеристики тканевых фильтров
представлены в табл. 3.
Пример 20. Подобрать тканевый фильтр для газа, расход которого
У°т=9700 м3/ч, температура /=45 °C, разрежение в системе Др=300 Па.
Решение. Расход газа в условиях процесса определяют по формуле (9):
Тгр0 9700
т7’0р1 “ 3600
(45+273)101 325
273( 101 325—300) ~ 10 м Iе-
Допустимая удельная нагрузка тканевого фильтра составляет обычно о>г=
= (8—10) -10-3 м3/(м2-с).
Принимают шг=9-10-3 м3/(м2-с), тогда общая площадь поверхности фильтра
составит:
ДФ= VJwr=3,15/(9-IO-3) =350 м2.
По табл. 3 устанавливают, что полученным данным наиболее соответствует
фильтр марки ФРКИ-60 с площадью фильтрующей поверхности Дф=360 м2.
Таким образом, следует установить один фильтр. Запас фильтрующей поверх-
ности составит:
(360—300) -100/300=20%.
Для транспортировки газа используют газодувки. Мощность,
развиваемую электродвигателем при установившемся режиме,
находят по формуле (в Вт):
А=УтДр/(Т]гТ]пер), (70)
где Vt — расход газа, м3/с; Др — разность давлений после и до газодувки,
Таблица 3. Технические характеристики тканевых фильтров
Марка Число, шт. Размер рукава
секций п рукавов z dp, мм 1, м
ФРКИ-30 30 I 36 )
ФРКИ-60 60 2 72 } 135 2,0
ФРКИ-90 90 3 108 J
ФРКИ-180 180 4 114 1 о п
фрки-360 360 8 228 f 1
ФРУП-15 15 ) Г 1,5
ФРУ11-20 20 [ 2 28 130 ( 2,0
ФРУП-25 25 J 1 2,5
ФРУШ-37,5 37,5 3 42 1
ФРУ1У-50 50' 4 56 ) 130 2,5
3*
35
Таблица 4. Технические характеристики газодувок
Марка VT-10-s, м3/ч Др, Па п, с—1 Электродвигатель
тип i "ном- кВт Ядв
ТВ-25-1,1 3,0 10 000 48,3 А02-71-2 22 0,88
ТВ-100-1,12 6,0 12 000 48,3 А02-81-2 40 —
ТВ-150-1,12 9,0 12 000 48,3 А02-82-2 55 —,
ТВ-200-1,12 12,0 12 000 48,3 А02-91-2 75 0,89
ТВ-250-1,12 15,0 12 000 49,3 А02-92-2 100 0,91
ТВ-350-1,06 21,0 6000 48,3 А02-82-2 55 —
ТВ-450-1,08 27,0 8000 49,5 А2-92-2 125 0,94
ТВ-500-1,08 30,0 8000 50,0 BA0-315S-2 132 —
ТВ-600-1,1 36,0 10 000 49,4 A3-315М-2 200 —
РГН-1200А 0,6 30000 16,7 А02-62-6 13 —
2А-34 2,3 80 000 25,0 4A250-S443 75 —
ТВ-42-1,4 3,6 40 000 48,3 А02-82-2 55 —
ТВ-50-1,6 3,6 60 000 49,3 А02-92-2 100 —
ТВ-80-1,2 6,0 20000 48,3 А02-82-2 55 —
ТГ-170-1,1 10,3 28 000 49,3 А02-92-2 100 _—.
ТГ-300-1,18 18,0 18 000 50,0 ВА0-315М-2 160 —
Па; т]г и т]пер — к. п. д. газодувки и передачи от электродвигателя к газо-
дувке.
Технические характеристики газодувок представлены в табл. 4.
Пример 21. Подобрать газодувку для подачи газа в условиях примера
20, если давление после газодувки р= 113 125 Па, т]г=0,60, т]Пер=0,98.
Решение. По формуле (70) мощность, развиваемая электродвигателем,
составляет:
М=[3,15(113 125—101 325)]/(0,60-0,98)=63214 Вт=63,2 кВт.
По табл. 4 устанавливают, что полученным данным соответствует газо-
дувка марки ТВ-200-1,12, имеющая следующие характеристики: Ут=
= 12 000 м3/ч, Др=1200 Па, тип электродвигателя А02-91-2, АНом=75 кВт,
т]дВ=0,89.
Для разделения газожидкостных смесей применяют сепара-
торы вертикального или горизонтального исполнения. Допусти-
мую (критическую) скорость газа в сепараторе определяют по
формуле (в м/с):
®кр=АУ (рж—рг) / рг, (71)
где А — коэффициент, зависящий от конечного содержания жидкости в газе;
рж и рг — плотности жидкости (для воды при температуре 45 “С р»=
= 1000 кг/м3) и газа, кг/м3.
Значения коэффициента А при различном конечном содер-
жании жидкости в газе сКОн приведены ниже:
Сепаратор Вертикальный Горизонтальный
Скон, г/кг 2 5 10 2 5 10
А 0,030 0,047 0,061 0,075 0,117 0,150
36
Для эффективного разделения газожидкостной смеси в вер-
тикальных аппаратах высота сепарационной части Но должна
быть не менее 0,6 м (в горизонтальных — длину зоны осаж-
дения Lo принимают равной не менее 3 м). Применение гра-
витационных сепараторов с 7/q<0,6 м и Lo<3 м нецелесооб-
разно, так как при этом ухудшается сепарация и необходимо
уменьшать допустимые (критические) скорости. В гравитаци-
онных сепараторах скорость на входе должна в 10—12 раз
превышать скорость потока в сечении аппарата.
Пример 22. Рассчитать газожидкостный сепаратор для отделения влаги
от газа, если его объемный расход при £=45 °C и р=150 кПа составляет
Ут=900 м3/ч, плотность газа рг=1,12 кг/м3, конечное содержание влаги
Скон=3,2 г/кг.
Решение. Выбирают с учетом параметров газа гравитационный сепара-
тор вертикального исполнения, в котором поток газа движется снизу вверх,
тяжелая фаза (вода) —сверху вниз.
Интерполяцией находят, что при Скон — 3,2 г/кг, А=0,037 (см. с. 36).
тогда критическая скорость газа равна-
шкр=0,037У (1000,00—1,12) /1,12= 1,1 м/с.
Принимают среднюю скорость газа в сепараторе ю=1,0 м/с, определяют
диаметр сепаратора:
Р=1,13УИТ/Ш =1,13У900/(3600-1,0) =0,565 м.
С учетом стандартизированных размеров выбирают стальной цилиндри-
ческий аппарат с внутренним диаметром D=600 мм и высотой сепарацион-
ной части /7о=6ОО мм.
Принимают ttiBX=10w и рассчитывают диаметр патрубка входного шту-
цера:
Р=1,13У900/(3600-10) =0,179 м.
Принимают Dy 180, ру 0,1.
Для равномерного распределения скоростей потока по сечению сепарато-
ра расстояние между входным и выходным штуцерами должно быть не
меньше:
Я=Яо+Д/2=600+600/2=900 мм.
ПРОЦЕССЫ ПИРОЛИЗА УГЛЕВОДОРОДОВ
Высокотемпературный пиролиз жидких и газообразных углево-
дородов — главный процесс получения низших олефинов, яв-
ляющихся базовыми исходными веществами для основного ор-
ганического и нефтехимического синтеза. Установившийся рост
доли полиолефинов в общем объеме пластических масс, вы-
пуск которых к 2000 г. превысит объем производства 1985 г.
в 2,3—2,6 раза [2, с. 19], обусловливает изменение сырьевой
базы производства олефинов. Как полагают, потребление бен-
37
зина прямой перегонки в качестве сырья для этиленовых ус-
тановок будет снижаться в ближайшие 5—7 лет за счет увели-
чения потребления этана и сжиженных газов [16].
ПОЛУЧЕНИЕ ЭТИЛЕНА ИЗ ЭТАНА
Пиролиз этана осуществляют в трубчатых печах в среде водя-
ного пара при температуре 830—900(оС и давлении, близком
к атмосферному. Описание технологической схемы см. [4, с. 43;
7, с. 32].
МАТЕРИАЛЬНЫЙ РАСЧЕТ
Исходные данные:
годовая производительность установки по этилену 250000 т;
годовой фонд рабочего времени 8000 ч;
состав исходной этановой фракции (<р,-, %): С2Н4 — 0,73;
С2Н6 —89,80; С3Н6 —4,69; С3Н8 —4,70; С4Н8 —0,08;
массовое отношение водяной пар : этановая фракция = 0,4 : 1,0;
температура процесса 845 °C.
Последовательность расчета:
а) определяют степень конверсии этана в этилен по целевой реакции
пиролиза;
б) рассчитывают объемный расход компонентов этановой фракции на
входе в трубчатую печь (основной аппарат пиролнзиой установки);
в) определяют изменение состава газа в процессе пиролиза и состав
газа иа выходе из трубчатой печи.
Схема потоков узла пиролиза приведена иа рис. 3.
На энергетические
чо-с> нужды
'7 -об закалочную колонну
t>-S-
Рис. 3. Схема потоков узла пиролиза:
J — этановая фракция; 2 — водяной пар; 3 парогазовая смесь; 4 — топливный газ; 5 —
воздух; 6, 7 — пирогаз; 8 — умягченная вода; 9— продукты сгорания; 10 — пар высокого
давления;
П1 — печь пиролиза; ATI—АТЗ — теплообменники; ЗИА1 — закалоччо-нспарительный ап-
парат
38
Кинетика основной реакции процесса пиролиза С2Н6=₽*
удовлетворительно описывается уравнением пер-
вого порядка [17, с. 113]:
К=(2,303/т) 1g [аЦа—*)],
где К—константа скорости реакции, с-1; т — время, прошедшее от начала
реакции (оптимальная продолжительность пребывания реагентов в зоне
высоких температур), с; а, х — количество реагента исходное и вступившее
в реакцию соответственно, %-
Константу скорости реакции определяют по формуле [6, с. 150]:
lg К= 14,676—15 800/7,
где Т — температура процесса, К (7=845+ 273=1118 К).
IgK=14,676—15800/1118=0,544; К=3,5 С"'.
Продолжительность пребывания реагентов в зоне высоких
температур определяют по формуле [6, с. 151]:
lgi=—12,75+13 700/7;
lgT=—12,75+13 700/1118=—0,496=1,504; т=0,32 с.
Определяют степень конверсии этана:
3,5= (2,303/0,32) 1g [100/(100—*)J; х=67,3%.
Следовательно, степень конверсии этана а=0,673. Фактиче-
ская степень конверсии этана в этилен меньше за счет повы-
шения давления до 0,5 МПа и наличия в этановой фракции
более тяжелых компонентов. При температуре 845 °C и време-
ни контакта т=0,32 с степень конверсии этана в этилен со-
ставляет 60% (а'=0,6) [6, с. 151, рис. 48].
Селективность процесса по основной реакции равна:
Р=а'/и=0,6/0,673=0,89.
Часовая производительность установки в расчете на 100%-й
этилен составит:
250 000-1000/8000=31 250 кг/ч или 31 250/28=1116,071 кмоль/ч.
Расход этана, находящегося в составе поступающей на пиро-
лиз этановой фракции:
1116,071/0,6=1860,118 кмоль/ч.
Общий расход этановой фракции:
1860,118/0,898=2071,401 кмоль/ч.
Определяют состав этановой фракции (расчет см. Пример 4)
на входе в трубчатую печь (табл. 5).
Количество водяного пара на входе в трубчатую печь (по-
ток 2):
64 684-0,4=25 874 кг/ч или 1437,444 кмоль/ч.
39
Таблица 5. Состав этановой фракции (поток 1)
Компонент пх, кмоль/ч VT> м3/ч тт, кг/ч №г, %
с2н4 0,73 15,121 339 423 0,65
С2Н6 89,80 1860,118 41666 55804 86,27
С3н6 4,69 97,149 2176 4080 6,31
С3Н3 4,70 97,356 2181 4284 6,62
С4н8 0,08 1,657 37 93 0,15
2 100,00 2071,401 46399 64 684 100,00
Количество парогазовой смеси на входе в трубчатую печь (по-
ток 3):
64 684+25 874=90558 кг/ч.
По основной реакции
С2Не ** С2Н4+Н2 1
расход этана составляет 1116,071 кмоль/ч или 33482 кг/ч; об-
разуется:
этилена: 1116,071 кмоль/ч или 31 250 кг/ч;
водород: 1116,071 кмоль/ч или 2232 кг/ч.
Всего конвертируется этана:
1860,118-0,673=1251,859 кмоль/ч.
По реакции образования метана
C2Hg+H2 ** 2СН4 2
расходуется:
этаиа: 1251,859—1116,071 = 135,788 кмоль/ч или 4074 кг/ч;
водорода: 135,788 кмоль/ч или 271 кг/ч;
образуется метана:
135,788-2=271,576 кмоль/ч или 4345 кг/ч.
Остается этана в составе пирогаза:
1860,118—1251,859=608,259 кмоль/ч или 18248 кг/ч.
Пропилен в составе этановой фракции конвертируется по
двум реакциям:
С3Н6 = С2Н2+СН4, 3
С3Н6+ЗН2 =ЗСН4 4
По реакции 3, согласно экспериментальным данным, расходу-
ется 8,5% пропилена, что составляет:
97,149-0,085=8,258 кмоль/ч или 347 кг/ч;
40
образуется:
ацетилена: 8,258 кмоль/ч или 215 кг/ч;
метана: 8,258 кмоль/ч или 132 кг/ч.
По реакции 4 расходуется 26% пропилена, что составляет:
97,149-0,260=25,259 кмоль/ч или 1061 кг/ч;
образуется метана:
25,259-3=75,777 кмоль/ч или 1212 кг/ч.
Расход водорода составляет 75,777 кмоль/ч или 151 кг/ч. Оста-
ется пропилена в составе пирогаза:
97,149—8,258—25,259=63,632 кмоль/ч или 2672 кг/ч.
Пропан в составе этановой фракции конвертируется по сле-
дующим реакциям:
2С3Н8 =₽* С4Нв+2СН4+Н2, 5
2C3Hg C4Hg+2CH4, 6
2C3Hg ** CsHio+CH4+H2, 7
2C3Hs С4Н10+С2Н4+Н2, 8
С3Н8+2Н2 == ЗСН4. 9
По реакции 5 расходуется 55,0% пропана, что составляет:
97,356-0,55=53,546 кмоль/ч или 2356 кг/ч;
образуется:
бутадиена: 53,546/2=26,773 кмоль/ч или 1446 кг/ч;
метана: 53,546 кмоль/ч или 857 кг/ч;
водорода: 26,773 кмоль/ч или 53 кг/ч.
По реакции 6 расходуется 6,0% пропана, что составляет:
97,356-0,06=5,841 кмоль/ч или 257 кг/ч;
образуется:
бутиленов: 5,841/2=2,920 кмоль/ч или 163 кг/ч;
метана: 5,841 кмоль/ч или 94 кг/ч.
Всего содержится бутиленов в пирогазе:
2,920+1,657=4,577 кмоль/ч или 256 кг/ч.
По реакции 7 расходуется 8,5% пропана, что составляет:
97,356-0,085=8,275 кмоль/ч или 364 кг/ч;
образуется:
пентенов: 8,275/2=4,138 кмоль/ч или 290 кг/ч;
метана: 4,138 кмоль/ч или 66 кг/ч;
водорода: 4,138 кмоль/ч или 8 кг/ч.
41
По реакции 8 расходуется 10% пропана, что составляет:
97,356-0,1=9,736 кмоль/ч или 428 кг/ч;
образуется:
бутана: 9,736/2=4,868 кмоль/ч или 283 кг/ч;
этилена: 4,868 кмоль/ч или 136 кг/ч;
водорода: 4,868 кмоль/ч или 9 кг/ч.
По реакции 9 расходуется 17,5% пропана, что составляет:
97,356-0,175=17,037 кмоль/ч или 750 кг/ч.
Расход водорода составляет:
17,037-2=34,074 кмоль/ч или 68 кг/ч.
Образуется метана:
17,037-3=51,111 кмоль/ч или 818 кг/ч.
Остается пропана в пирогазе:
97,356—(53,546+5,841+8,275+9,736+17,037) =2,921 кмоль/ч или 129 кг/ч.
Бутадиен взаимодействует с этиленом по реакции
С4Н6+С2Н4 =* СвНв+2Н2. 10
В эту реакцию вступает 23,5% образовавшегося бутадиена,
что составляет:
26,773-0,235=6,292 кмоль/ч или 340 кг/ч.
Расход этилена составляет: 6,292 кмоль/ч или 176 кг/ч;
образуется:
бензола: 6,292 кмоль/ч или 491 кг/ч;
водорода: 6,292-2=12,584 кмоль/ч или 25 кг/ч.
Остается бутадиена:
26,773—6,292=20,481 кмоль/ч или 1106 кг/ч.
Всего образуется метана по реакциям 2—7, 9:
271,576+8,258+75,777+53,546+5,841 +4,138+51,111=470,247 кмоль/ч
или 7524 кг/ч.
По реакции
СН4+Н2О == СО+ЗН2 11
конвертируется 2,6% метана, что составляет:
470,247-0,026=12,226 кмоль/ч или 195 кг/ч.
Расход водяного пара: 12,226 кмоль/ч или 220 кг/ч;
образуется:
оксида углерода: 12,226 кмоль/ч или 342 кг/ч;
водорода: 12,226-3=36,678 кмоль/ч или 73 кг/ч.
42
Остается:
метана: 470,247—12,226=458,021 кмоль/ч или 7329 кг/ч;
водяного пара: 1437,444—12,226=1425,218 кмоль/ч или 25 654 кг/ч;
где 1437,444 — молярный поток водяного пара на входе в трубчатую печь
(поток 2), кмоль/ч.
Образуется водорода по реакциям 1, 5, 7, 8, 10, 11:
1116,071 +26,773+4,138 +4,868+12,584+ 36,678= 1201,112 кмоль/ч
или 2402 кг/ч.
Расход водорода по реакциям 2, 4, 9:
135,788+ 75,777 + 34,074=245,639 кмоль/ч или 492 кг/ч.
Остается водорода в пирогазе:
1201,112—245,639=955,473 кмоль/ч или 1910 кг/ч.
Этилена в составе этановой фракции содержится
15,121 кмоль/ч (см. табл. 5), образуется по реакции 8
4,868 кмоль/ч, расходуется по реакции 10 6,292 кмоль/ч.
Остаток 15,121+4,868—6,292=13,697 кмоль/ч представляет
собой потери на стадии выделения этилена из пирогаза. В со-
Таблица 6. Состав пирогаза (поток 6)
Компонент /гх, кмоль/ч Xj. % VT, м3/ч mT, кг/ч ®f. %
Сухой газ:
метан 458,021 13,97 10 260 7329 11,29
ацетилен 8,258 0,25 185 215 0,33
этилен 1129,768 34,46 25 307 31 633 48,74
этан 608,259 18,55 13 625 18 248 28,11
пропилен 63,632 1,94 1425 2672 4,12
пропан 2,921 0,09 65 129 0,20
бутадиен-1,3 20,481 0,62 459 1106 1,70
бутилены 4,577 0,14 102 256 0,39
б\тан 4,868 0,15 109 283 0,44
пентены 4,138 0,13 93 290 0,45
бензол 6,292 0,19 141 491 0,76
водород 955,473 29,14 21 403 1910 2,94
оксид углеро- 12,236 0,37 274 342 0,53
да
S 3278,914 100,00 73 448 64904 100,00
Водяной пар 1425,218 — 31925 25 654 —
В с е г о... 4704,132 — 105373 90558 —
43
ставе пирогаза (на выходе из трубчатой печи) содержится
этилена:
1116,071 +13,697= 1129,768 кмоль/ч или 31 633 кг/ч.
Потери этилена составляют:
13,697 -100/1129,768= 1,2 %,
что соответствует оптимальному технологическому режиму.
Коксообразованием в процессе пиролиза пренебрегают.
По результатам расчета составляют табл. 6.
Необходимые округления при определении массовых потоков компонен-
тов (в кг/ч) обусловлены точностью расчетов и необходимостью соблюдения
закона сохранения масс.
Расчет основных расходных коэффициентов. Для получения
31 250 кг/ч 100%-го этилена затрачивается 64 684 кг/ч этановой
фракции и 25874 кг/ч водяного пара (см. табл. 5).
Рассчитывают расходные коэффициенты:
по этановой фракции: 64 684/31 250=2,070 кг/кг;
по водяному пару: 25 874/31 250=0,828 кг/кг.
что соответствует показателям эксплуатации промышленных
установок [18, с. 37].
Образуется дополнительно на 1 т этилена, кг:
пропилена: 2672/31,250=85,5;
бутадиена-1,3: 1106/31,250=35,4;
бензола: 491/31,250=15,7.
ТЕХНОЛОГИЧЕСКИЙ РАСЧЕТ РЕАКТОРА
Назначение, устройство и основные размеры.
Определение числа реакторов
Трубчатый пиролизный реактор с огневым обогревом (труб-
чатая печь) предназначен для высокотемпературного пиролиза
жидких и газообразных углеводородов с получением газооб-
разного этилена. Для расчета выбрана четырехпоточная труб-
чатая печь градиентного типа с излучающими стенками топки
и трубными экранами двухстороннего облучения. Печь состоит
из радиантной (топочной) и конвективной камер; в последней
происходит предварительный нагрев этановой фракции в сме-
си с водяным паром.
Техническая характеристика печи:
Тепловая нагрузка, кВт 12-10®
Нагрузка по этановой фракции, кг/ч 7370
Производительность по этилену, кг/ч 3730
44
Техническая характеристика камер:
Конвек- тивная Радиантная
Площадь поверхности теплообмена труб, м2 Давление рабочее, мПа; но 130
на входе 0,55 0,35
на выходе 0,35 0,17
Диаметр труб, мм 102X8 114x8
Рабочая длина труб, мм 5500 8500
Расчетная температура стенки труб, °C 800 990
Определяют число трубчатых печей для обеспечения задан-
ной производительности. На установку подают 64 684 кг/ч эта-
новой фракции (см. состав потока 1); следовательно, необ-
ходимо трубчатых печей:
л=64 684/7370=8,8.
По данным табл. 6, образуется 31 633 кг/ч этилена; следова-
тельно, требуется трубчатых печей:
/2=31 633/3730=8,5.
Таким образом, необходимо установить 9 трубчатых печей.
Последующие тепловой и конструктивный расчеты ведут
на одну печь.
Тепловой расчет трубчатой печи
Исходные данные:
состав материальных потоков 1, 2 и 6 см. Материальный рас-
чет;
состав топливного газа — поток 4 (ср,-, %)
СН4 —71,85; С2Н4 —0,83; С2Н6 —0,11; Н2 —26,61; СО —0,60;
температура, °C:
этановой фракции на входе в 105 воздуха (коэффициент избыт- 25
печь перегретого пара на входе в печь 230 ка 1,05; относительная ность 80%) топливного газа влаж- 20
парогазовой смеси на входе в радиантную камеру пирогаза на выходе из ради- 620 845 продуктов сгорания топливно- го газа 600
антной камеры
давление перегретого пара 1,0 МПа.
Цель расчета — определение расхода топливного газа на
сжигание в панельных горелках трубчатой печи.
Уравнение теплового баланса печи в общем виде:
Ф1 + Ф2+ Фз+ Ф4+ Фб= Фб+ ф?+ Фв"Ь Флот,
где Ф|, Ф2, Фз, Ф«, Ф6 — тепловые потоки этановой фракции; перегретого
45
водяного пара; топливного газа, поступающего на сжигание; сгорания топ-
ливного газа; поступающего в печь воздуха соответственно, кВт; Ф6 — теп-
лота, расходуемая на осуществление химических реакций, кВт; Ф7, Ф8 —
тепловые потоки пирогаза и продуктов сгорания соответственно, кВт; ФПОт —
теплопотери в окружающую среду, кВт.
Для определения значений Ф1 и Ф3 используют исходные
данные и данные табл. 5.
Рассчитывают значения средних молярных теплоемкостей
этановой фракции (7’= 105+273=378 К) и топливного газа
(Т=20+273=293 К):
о/ Ct, С^поо.
i’ '° Дж/(моль-К) Дж/(моль-К)
Этановая ток 1): С2Н4 с2н8 СзН6 С3Н8 с4н8 фракция (по- 0,73 89,80 4,69 4,70 0,08 52,03 63,67 76,85 90,56 107,59 0,3798 57,1757 3,6043 4,2563 0,0861
Топливный ток 4): СН4 с2н4 с2н8 н2 СО 2 газ (по- 100,00 71,85 0,83 0,11 26,61 0,60 34,70 43,82 52,09 28,82 29,07 65,5022 24,9320 0,3637 0,0573 7,6690 0,1744
S 100,00 — 33,1964
Тепловые потоки этановой фракции и топливного газа:
Ф1= [2071,401/(9-3600)] • (65,5022-105) =439,708 кВт;
ф3= (Vr/22,4) 33,1964 -20=29,64 К кВт;
где V, — расход топливного газа, м3/с.
Тепловой поток перегретого водяного пара (поток 2):
Ф2= [25 874/ (9 • 3600) ] 2896,7=2313,247 кВт,
где 25 874 — расход перегретого пара, кг/ч (рассчитано ранее); 2896,7 —
энтальпия перегретого пара при температуре 230 °C и давлении 1 МПа,
кДж/кг (см. Приложения, табл. 15).
Для определения значений Ф4 и Ф5 рассчитывают низшую
объемную теплоту сгорания топливного газа и количество
воздуха, необходимого для сжигания. Низшую удельную тепло-
ту сгорания любого топлива находят по формуле Менделеева:
ДЯ°сгор=339,1 юс +1030Юн— 108,9 (ю>о—ws) —25,1 к>нго,
где ДЯ’сгор — низшая удельная теплота сгорания, кДж/кг; а>с, и>н, и>о,
и>а, а>н2о — массовые доли углерода, водорода, кислорода, летучей серы и
воды соответственно, %.
46
Для определения элементного состава топливного газа рас-
считывают его массовый состав:
м, xt. % Mrxl W;, %
СН4 16 0,7185 11,4960 92,25
С2Н4 28 0,0083 0,2324 1,87
с2н6 30 0,0011 0,0330 0,26
н2 2 0,2661 0,5322 4,27
со 28 0,0060 0,1680 1,35
S — 1,0000 12,4616 100,00
Определяют массовую долю элементов в топливном газе по
формуле
w^WiArtiJMr,
где Аг — относительная атомная масса элемента; гц — число атомов элемен-
та в соединении.
wc=92,25-12-1/16+1,87-12-2/28+0,26-12-2/30+1,35-12-1/28=71,577%;
№«=92,25 • 4/16 +1,87 • 4/28+0,26 • 6/30+4,27 • 2/2=27,652 %;
шо=1,35-16/28=0,771%.
Массовые доли летучей серы и воды равны нулю.
Низшая удельная теплота сгорания топливного газа:
Д7/°сгор=339,1 -71,577+1030-27,652—108,9-0,771=52 669,4 кДж/кг
или (52 669,4-12,4616)/22,4=29 301 кДж/м3.
Тепловой поток сгорания топливного газа:
Ф«=29 301 Vr кВт.
Теоретическое количество воздуха, необходимого для сжигания
1 кг газа:
Lo= [0,0267wc+0,08wh+0,01 (ws—№<j) ] /0,23=
= (0,0267-71,577+ 0,08-27,652—0,01 -0,771)/0,23=17,89 кг/кг.
При коэффициенте избытка воздуха а =1,05 действительный
расход воздуха составит:
17,89-1,05=18,78 кг на 1 кг газа
или [(18,78/1,293) 12,4616]/22,4=8,08 м» на 1 м3 газа.
где 1,293 — плотность сухого воздуха при нормальных условиях, кг/м3.
При температуре воздуха 25 °C и относительной влажности
80% его влагосодержание составляет 16,29-10~3 кг/кг [9, При-
ложение XIX] или
16,29-10~3-29/18=26,24-10-3 м3 Н2О на 1 м3 сухого воздуха,
где 29 и 18 — молярные массы воздуха и воды, г/моль.
47
Расход влажного воздуха: 8,0804-0,026=8,106 м3/м3. Теплоем-
кость влажного воздуха при температуре 25°C (298 К):
29,37-0,21 +29,12-0,79+33,61 -0,02624=30,05 Дж/(моль-К)
или 30,05/22,4=1,342 кДж/(м3-К),
где 29,37; 29,12 и 33,61 — молярные теплоемкости кислорода, азота и водя-
ных паров соответственно, Дж/(моль-К).
Тепловой поток поступающего в печь воздуха (поток 5):
Ф5=8,106 • Vr • 1,342 • 25= (271,96К) кВт.
Определяют теплоты реакций (в кДж/моль)*:
С2Н8^ьС2Н4+Н2
С2Н6+Н2^±=2СН4
С3Н6^С2Н2+ СН4
СзНв+ЗН2^ЗСН4
2C3H8=f±:C4He+2CH4+ Н2
2C8H8^=tC4H8+2CH4
2С3Н8^=ьС8Н1о+СН4+Н2
2СзН8^=ьС4Ню+С2Н4+Н2
С3Н8+2Н2^ЗСН4
С4Н6+ С2Н4^С6Н6+2Н2
СН4+Н2О^СО+ЗН2
ДН^-ХАН"^,^ ХД^°2д8(ИСХ)
52,30—(—84,67) = 136,97
2(—74,85) — (84,67) = —65,03
—74,85 +226,75—20,41 = 131,49
3 (—74,85) —226,75=—2,20
2(—74,85) +162,21—2(—103,85) =220,21
2 (—74,85) + (—0,13)—2 (—103,85) =57,87
—74,85+ (—20,94)—2 (—103,85) = 111,91
52,30—126,15—2 (—103,85) = 133,85
3 (—74,85)—(—103,85)=—120,70
82,93—52,30—162,21 =—131,58
—110,53— (—241,81)—(—74,85) = 206,13
* Значения энтальпий образования см. Приложения, табл. 2, 3.
Рассчитывают теплоту, расходуемую на осуществление хи-
мических реакций, по формуле (49):
Ф6= [1000/(9-3600)] 2 (ЛтИЗрс)) = 1000/(9-3600) ] [1116,071 • 136,97+
+135,788 (—65,03) + 8,258 • 131,49 + 25,259 (—2,20) + 26,773 220,21 +
+2,920-57,87+4,138-И 1,91+4,868-133,85+17,037 (—120,70) +6,292(—131,58) +
+ 12,226-206,13] = [1000/(9-3600)] 151 883,432=4687,760 кВт.
Для определения теплового потока пирогаза рассчитывают
молярные теплоемкости компонентов пирогаза при Т=845+
+273=1118 К- С учетом состава газа средняя молярная теп-
лоемкость составит:
Ссм= (76,00 • 13,97+67,85 • 0,25+100,36 • 34,46 +129,21 • 18,55+163,55 • 1,94+
+186,33 -0,09+173,92 • 0,62+209,32 • 0,14 + 241,80 - 0,15 + 260,83 • 0,13+213,92 • 0,19+
+30,96 29,14+32,95• 0,37)/100=84,30 Дж/(моль-К).
Теплоемкость водяного пара 42,00 Дж/(моль-К).
Тепловой поток пирогаза (поток 6):
Ф7= [ (3278,914 • 84,30+1425,218 • 42,00) / (9 • 3600) ] •845=8769,830 кВт.
Для определения теплового потока продуктов сгорания рас-
считывают количество продуктов сгорания, образующихся при
48
сжигании 1 кг топливного газа:
/Псо2=0,0367ш с=О,0367 -71,577=2,627 кг/кг;
/Пн2о=0,09шн=0,09-27,652=2,489 кг/кг;
»По2=0,23£о («—1) =0,23 -17,89 0,05=0,206 кг/кг;
тм2=О,77£оа=О,77• 17,89-1,05= 14,464 кг/кг.
Общее количество продуктов сгорания:
2,627+2,489+0,206+14,464= 19,786 кг/кг.
Проверка: l+aL0= 1 + 1,05-17,89= 19,785 кг/кг.
На 1 кг топливного газа подают 18,78 кг воздуха, в кото-
ром содержится влаги
18,78-16,29-10-3=0,306 кг.
Всего влаги в продуктах сгорания содержится
2,489 + 0,306=2,795 кг/кг.
Удельный объем продуктов сгорания:
(2,627/44+2,795/18+0,206/32 +14,464/28) 22,4=0,7380 • 22,4= 16,53 м3/кг.
Объемная доля диоксида углерода:
(2,627/44) 100/0,7380=0,0597-100/0,7380=8,09%.
Аналогично рассчитывают содержание остальных компонентов.
Состав продуктов сгорания [ср, (х,), %]: СО2— 8,09; Н2О —
21,04; О2 —0,87; N2 — 70,00.
Объем продуктов сгорания в расчете на 1 м3 подаваемого
на сжигание топливного газа:
16,53 12,4616/22,4=9,20 м3/м3.
Рассчитывают молярные теплоемкости компонентов продук-
тов сгорания при Т=600+273=873 К- Средняя молярная теп-
лоемкость продуктов сгорания:
(50,91 • 78,09+39,31 • 21,04+33,93 • 0,87+31,61 • 70,00) /100=34,81 Дж/(моль К)
или 34,81/22,4=1,554 кДж/(м3-К).
Тепловой поток продуктов сгорания (поток 9):
Фв=9,20- Vr-1,554-600=8578,08Vr кВт.
Общий приход теплоты в печь составит:
Фпрнх=439,708 +2313,247+ 29,64Vr+29 301,00Уг+271,96Уг-
=2752,955 +29 602,60 Vr кВт.
Принимают, что теплопотери в окружающую среду составля-
ют 5% от общего прихода теплоты:
Фвот=0,05(2752,955+29 602,60Vr) = 137,648+1480,13Vr кВт.
4—69
49
Общий расход теплоты составит:
Ф₽.ех=4б87,760+ 8769,830+ 8578,08 Vr+137,648+ 1480,13Vr=
= 13 595,238+10 058,210Vr кВт.
Расход топливного газа определяют из уравнения теплового
баланса печи:
2752,955+29 602,59Vr= 13 595,238+10 058,21 Vr,
Vr= (13 595,238—2752,955)/(29 602,60—10 058,21) =0,55475 м3/с
или 0,55475-3600=1997 м3/ч.
Уточняют статьи теплового баланса:
Ф3=29,64-0,55475=16,443 кВт;
Ф4=29301-0,55475=16254,730 кВт;
Фз=271,96-0,55475= 150,870 кВт;
Фв=8578,08-0,55475=4758,690 кВт.
Составляют тепловой баланс трубчатой печи (табл. 7). Тепло-
потери уточняют по уравнению теплового баланса печи.
Расход сухого воздуха в горелки печи:
8,08-1997=16 136 м3/ч.
Количество продуктов сгорания топливного газа:
9,20-1997=18 372 м3/ч.
Для выполнения дальнейшего расчета печи определяют теп-
ловой поток парогазовой смеси на входе в радиантную камеру
при Т= 620+273=893 К-
Таблица 7. Тепловой баланс трубчатой печи
Приход кВт % Расход кВт %
Тепловой поток 439,708 2,29 Теплота, расхо- 4687,760 24,45
этановой фракции Тепловой поток перегретого пара Тепловой поток 2313,247 16,443 12,06 0,08 дуемая на осуще- ствление химиче- ских реакций Тепловой поток 8769,830 45,73
топливного газа Тепловой поток 16254,730 84,78 пирогаза Тепловой поток 4758,690 24,82
сгорания топлив- ного газа Тепловой поток 150,870 0,79 продуктов сгора- ния Теплопотери в 958,718 5,00
воздуха В с е г о... 19174,998 100,00 окружающую среду В с е г о... 19 174,998 100,00
50
Рассчитывают среднюю молярную теплоемкость этановой
фракции при Т=893 К:
с2н4 СаНв С3Нв с3н8 с4н8 2
Xi, % 0,73 89,80 4,69 4,70 0,08 100,00
С,, Дж/(моль-К) 90,05 115,99 142,70 168,16 187,75 —
CiXi/100, Дж/(моль-К) 0,6574 104,1590 6,6926 7,9035 0,1502 119,5627
Тепловой поток парогазовой смеси на входе в радиантную
камеру:
Ф9= [(2071,401 119,5627+1437,444-39,60)/(9-3600)] -620= 5828,496 кВт,
где 1437,444 — расход перегретого пара, кмоль/ч;
39,60 — теплоемкость водяного пара, Дж/(моль-К).
Тепловая нагрузка конвективной камеры включает расход
теплоты на нагревание сырья (этановой фракции) и перегре-
того водяного пара от температуры на входе в печь до темпе-
ратуры на входе в радиантную камеру:
Фк=5828,496—439,708—2313,247=3075,541 кВт.
Тепловая нагрузка радиантной камеры включает расход теп-
лоты на реакцию пиролиза и нагрев парогазовой смеси от 620
до 845°C (температура на выходе из радиантной камеры):
Фр=4687,760+8769,830—5828,496=7629,094 кВт.
Общая тепловая нагрузка печи:
Фполезн=3075,541 +7629,094=10 704,635 кВт.
Теплопотери в окружающую среду и с продуктами сгорания
составляют (в расчете на низшую теплоту сгорания топливно-
го газа):
(5,00+24,82) /84,78=0,35 или '35%;
к.п.д. печи: 1—0,35=0,65 или 65%.
Расчет трубчатой печи
Подробную методику расчета трубчатой печи см. [19, с. 159].
Расчет радиантной камеры
Площадь поверхности нагрева радиантных труб определяют по
формуле
Fp= Фр/фр,
где Fp — площадь поверхности радиантных труб, м2; Фр—тепловая нагруз-
ка радиантной камеры, кВт; фр — поверхностная плотность теплового по-
тока радиантных труб, кВт/м2.
4*
51
Поверхностную плотность теплового потока экранных реак-
ционных труб в печах рассчитываемой конструкции принимают
равной 60 кВт/м2, тогда
Fp=7629,094/60= 127 м2.
Площадь поверхности теплообмена радиантных труб в приня-
той конструкции печи составляет «130 м2.
При наружном диаметре радиантных труб dH = 0,114 м об-
щая рабочая длина труб равна:
/р=др/(лй„)=130/(3,14-0,114) =363 м.
Рабочая длина одной трубы 8,5 м, число труб «=363/8,5=43.
Принимаем число труб в каждом потоке равным 11, тогда
общая длина труб в каждом реакционном змеевике (потоке)
составит 8,5-11 = 93,5 м.
Фактическая поверхность труб:
Fp=U-4-3,14-0,114-8,5=134 м2.
По существующим нормам шаг размещения экранных труб
/=0,25 м. При шахматном расположении труб расстояние меж-
ду вертикальными рядами
8=^3/2=0,25-1,73/2=0,215 м.
Расстояние от излучающих стен до трубного экрана принима-
ют равным 1 м, расстояния от нижней и верхней труб до по-
толка и пода печи принимают равными шагу размещения труб
(0,25 м). Тогда для п=11 высота радиантной камеры соста-
вит:
ftp= (11—1 j .0,25+0,25/2+2-0,25=3,125 м.
Ширина четырехпоточной радиантной камеры:
2-1+38=2-1+3-0,215=2,645 м.
При принятой рабочей длине труб 8,5 м объем радиантной
камеры составит:
Ур=3,125-2,645-8,5=70,3 м3.
Поверхностная плотность теплового потока:
7629,094/70,3=108,5 кВт/м2,
что соответствует оптимальным условиям эксплуатации печи
(до 120 кВт/м2).
При температуре 845 °C оптимальная продолжительность
пребывания реагентов в зоне высоких температур составила
Топт = 0,32 с (рассчитана ранее). Пиролизу подвергают смесь
углеводородов, поэтому общее время пребывания тОбЩ газовой
смеси в зоне реакции для всех углеводородов одинаково. Об-
щее время пребывания газовой смеси в зоне реакции связано
52
с оптимальным временем следующим соотношением:
Тобщ (1 >8—2,1) Топт.
Определяют время пребывания смеси в радиантных трубах
для рассчитанной конструкции трубного экрана (4 потока по
11 труб, rfTp= 114X8 мм, /=8,5 м). Предварительно рассчиты-
вают плотность парогазовой смеси на входе в радиантную ка-
меру и пирогаза на выходе из нее, линейную скорость парога-
зовой смеси.
Плотность парогазовой смеси:
при нормальных условиях (273 К и 0,101325 МПа):
ро'=9О 558/[(2071,401+ 1437,444)22,4] = 1,152 кг/м3,
где 90 558 — массовый расход парогазовой смеси, кг/ч; 2071,401 и 1437,444 —
молярные расходы этановой фракции и водяного пара, кмоль/ч;
на входе в радиантную камеру при 7"н=6204-273 =893 К,
рн=0,35 МПа:
Рнач = ро'ТоРн/ (7кро) = 1,152 • 273 0,35/ (893 • 0,101325) = 1,216 кг/м3.
Плотность пирогаза:
при нормальных условиях:
ро"=9О 558/105 373=0,859 кг/м3.
где 105 373 — объемный поток пирогаза на выходе из печи (см. табл. 6),
м3/ч;
на выходе из радиантной камеры при 7^=8454-273= 1118 К
и рк=0,17 МПа:
Ркон= ро"7оРк/(7'кРо) =0,859-273-0,17/(1118-0,101325) =0,352 кг/м3.
Средняя плотность парогазовой смеси в радиантной камере:
рс₽=( 1,216+0,352) /2=0,784 кг/м3.
Массовая скорость парогазовой смеси в радиантной трубе:
№=90558/(9• 3600-4-0,785-0,0982) =92,7 кг/(м2-с),
где 4 — число потоков; 0,098 — внутренний диаметр трубы, м.
Линейная скорость парогазовой смеси:
на входе в радиантную камеру:
ш>Нач=92,7/1,216=76,2 м/с;
на выходе из радиантной камеры:
wKOH=92,7/0,352=263,4 м/с;
средняя скорость:
wcp= (76,2+263,4) /2= 169,8 м/с-
Время пребывания смеси в радиантных трубах:
ТобЖ= (8,5 • 11) /169,8=0,55 с.
53
Полученное общее время пребывания близко к минимальному
времени:
1=0,32-1,8=0,58 с,
следовательно, значение оптимального времени пребывания
принято правильно.
Проверяют правильность принятого значения потери давле-
ния в радиантной зоне:
Др=0,35—0,17=0,18 МПа.
Потерю давления (гидравлическое сопротивление змеевиков)
находят по формуле
экв W‘/(2dmpcp),
где Др — потеря давления, Па, X — коэффициент гидравлического сопротив-
ления; /экв— эквивалентная длина труб одного потока, м; dBH— внутренний
диаметр трубы, м; W— массовая скорость парогазовой смеси, кг/(м2-с);
рСр — средняя плотность парогазовой смеси, кг/м3.
Для определения коэффициента гидравлического сопротивле-
ния вычисляют значение критерия Рейнольдса по формуле
Re= Wcp^/bh/Vcm,
где Vcm—кинематическая вязкость парогазовой смеси в реакционном змее-
вике, м2/с.
Средняя- температура парогазовой смеси:
fcp= (620+845)/2=732,5 ’С.
Динамическая вязкость этановой фракции при этой температу-
ре принимается по основному компоненту — этану и составля-
ет 270-10~7 Па-с, динамическая вязкость водяного пара —
341 -10~7 Па-с (см. Приложения, табл. 11).
Молярная (объемная) доля водяного пара в парогазовой
смеси:
1437,444/(2071,401 +1437,444) =0,41.
Динамическую вязкость газовой смеси определяют по форму-
ле (66).
Средняя молярная масса смеси:
Л1ср=0,41 • 18+0,59 • 30=25,08;
jriAIi/p-i = (0,41 -18)/(341 • 10-7) =21,64-104 (Па-с)-1;
х2/И2/ц2= (0,59• 30)/(270-10~7) =65,56-10* (Па• с)
|Хсм=[25,08/(21,64+65,56)] •10-4=287,6-Ю-7 Па-с.
Плотность парогазовой смеси:
при Т’н=893 К:
р/= Ро' (То/Гн) = 1,152 (273/893) =0,352 кг/м3;
54
при ^=1118 К:
рк'=р0" (Т'о/Т’к) =0,859 (273/1118) =0,210 кг/м3
Средняя плотность парогазовой смеси:
р'с₽= (0,352+0,210) /2=0,281 кг/м3.
Кинематическая вязкость парогазовой смеси:
vCM= (287,6-10~7)/0,281=100,2-10~6 м2/с.
Критерий Рейнольдса:
Re= (169,8 • 0,098) / (100,2 -10~6) = 166 072.
Принимают среднее значение высоты выступов шероховатости
/=0,0001 м [15, с. 62, табл. Ш-2]. Тогда относительная шеро-
ховатость равна Z/rfBH = 0,0001/0,098=0,001.
По графику [15, с. 445; рис. 2] при Re=l,66-105 и Z/dBH=0,001
находят значение коэффициента гидравлического сопротивле-
ния Х=0,021.
Определяют эквивалентную длину труб одного потока ра-
диантного змеевика по формуле
/акв=Л/,тр+ (л— 1)4^bh,
где Ггг — полная длина трубы, м; ф — коэффициент, зависящий от типа сое-
динения труб.
Принимают ф=50, тогда
/экв= 11 - 9,5+ (11—1 )• 50 - 0,098= 153,5 м.
Потеря давления в реакционном змеевике печи:
Др= (0,021 • 153,5-92,72)/(0,098-2-0,784) =0,18 МПа,
что совпадает с принятым значением потери давления.
Расчет конвективной камеры
Температуру дымовых газов, покидающих радиантную камеру,
находят из уравнения теплового баланса топки:
(Фз + Фл+ Фб)т]т — Фю^ Фр,
где Т]т — к. п. д. топки, принимают равным 0,97; Ф10 — тепловой поток про-
дуктов сгорания на выходе из радиантной камеры, кВт.
Ф10= (16,443+16 254,730+150,870) -0,97—7629,094=8300,288 кВт.
Тепловой поток продуктов сгорания при температуре 600 °C
(поток 9) Фв=4758,690 кВт; следовательно, при постоянной
теплоемкости температура продуктов сгорания составила бы:
600 • 8300,288/4758,690= 1046 °C.
Учитывая рост теплоемкости с увеличением температуры, при-
нимаем температуру продуктов сгорания равной 1000 °C и вы-
55
числяем молярные теплоемкости компонентов при Т=1273 К и
среднюю молярную теплоемкость продуктов сгорания по рас-
считанному ранее их составу:
С„= (55,12 • 8,09+43,65 • 21,04 +35,54 • 0,87+33,32• 70,00) /100=
=37,276 Дж/(моль-К) или 37,276/22,4=1,664 кДж/(м3-К).
Тепловой поток продуктов сгорания:
Ф'1о=9,2О • 0,55475-1,664• 1000=8492,557 кВт.
Фактическая температура продуктов сгорания:
1000 8300,288/8492,557=977 °C.
В таком интервале температур (Д/=23°С) теплоемкость мож-
но считать постоянной. При значительных отклонениях тем-
пературы продуктов сгорания от принятой ее уточняют мето-
дом последовательного приближения.
Площадь поверхности нагрева конвективных труб опреде-
ляют по формуле (62):
FК= Фк/С^ДТ'ср).
Коэффициент теплопередачи в конвективной камере вычисля-
ют по формуле:
K=l,l(ai+ct2),
где си — коэффициент теплоотдачи конвекцией от продуктов сгорания к
трубам, Вт/(м2-К).
Коэффициент теплоотдачи конвекцией ai находят по фор-
муле [15, уравнение (6.31):
aI=c₽(M<MRe°-6Pr°-33,
где с — постоянная; для шахматного пучка труб с=0,33, Р — коэффициент,
зависящий от числа рядов труб в пучке; полагая, что число рядов будет
более 10, принимают р=1; Хг — коэффициент теплопроводности продуктов
сгорания, Вт/(м-К).
Критерий Рейнольдса и Прандтля вычисляют при средней
температуре продуктов сгорания в конвективной камере:
/Ср= (600+977)/2=788,5 °C.
Скорость газов рассчитывают для самого узкого сечения пуч-
ка. В камере конвекции устанавливают трубы с рабочей дли-
ной /Тр=5,5 м, наружным диаметром dH=0,102 м, в одном го-
ризонтальном ряду в шахматном порядке установлено «1 = 4
трубы с шагом /=0,172 м. Наименьшая площадь свободного
сечения составит:
fr= [ (Л1—l)/+3dH—П1&и] lTf;
fr= [(4—1)0,172+3-0,102—4-0,102] -5,5=2,28 м’,
56
Линейная скорость продуктов сгорания в самом узком сечении
пучка:
w=18 372 (273 +788,5)/(3600-273-2,28) =8,7 м/с.
Расчет теплофизических параметров продуктов сгорания
Динамическую вязкость смеси рассчитывают по формуле (66).
Значения вязкостей компонентов продуктов сгорания рассчи-
тывают по справочным данным (см. Приложения, табл. И).
Расчет динамической вязкости продуктов сгорания:
СОа Н2О О2 N2 £
Mi, кг/моль 44 18 32 28 —
Xi, % 8,09 21,04 0,87 70,00 100,00
MrXi/100 3,560 3,787 0,278 19,600 27,225
pi-107, Па-с 414 358 490 410 —
[*,Л1,/(100щ)]-10-7 0,00860 0,01058 0,00057 0,04780 0,06755
Цсм=27,255-10“70,06755=403- 10“7 Па-с.
Плотность продуктов сгорания:
Рсм= (Мсм/22,4) (То/Т) = (27,225/22,4)273/(273+788,5) =0,313 кг/м8.
Объемную теплоемкость продуктов сгорания находят из
значения тепловых потоков Фе (при температуре 600гоС) и Фю
(при температуре 977°C):
с= (Ф8+ ®io)/(2 V„.cfcp) = (4758,690+8300,288)/(2-5,103-788,5) =
= 1,623 кДж/(м3-К),
где Vn.c — объемный поток продуктов сгорания, равный 18372/3600=*
=5,103 м3/с; fop — средняя температура продуктов сгорания, °C.
Удельная теплоемкость продуктов сгорания:
с= 1,623 - 22,4/27,225= 1,335 кДж/ (кг - К).
Критерий Прандтля для двухатомных газов Рг = 0,72 [10,
с. 150].
Теплопроводность продуктов сгорания определяют по фор-
муле (65):
Х=фсМ/Рг = 1335• 403• 10-70,72=0,0747 Вт/ (м • К).
Критерий Рейнольдса:
Re=wdpCM/licM=8,7-0,102-0,313/(403- Ю~7) =6892.
Коэффициент теплоотдачи конвекцией:
cti=0,33 (0,0747/0,102) 6892°.6 - 0,72».33=43,6 Вт/(м2 • К) -
Коэффициент теплоотдачи конвекцией может быть также
определен по формуле
ai=0,34£W'°.6/a°-\
57
где Е — коэффициент, зависящий от физических свойств продуктов сгорания;
W — массовая скорость продуктов сгорания, кг/(м2-с).
Значение коэффициента Е при различной средней темпера-
туре газа приведено ниже:
Температура, °C 200 400 600 800 1000
Е 18,0 20,5 22,5 24,0 25,0
Для средней температуры продуктов сгорания /Ср= 788,5 °C,
коэффициент Е=23,9;
№=18 372/ (3600 • 0,313 • 2,28) =7,151 кг/ (м2 • с) 1
а1=(0,34-23,9-7,151°.6)/0,102М= 65,9 Вт/(м2-К).
Поскольку данное значение коэффициента теплоотдачи больше
ранее рассчитанного, принимают коэффициент теплоотдачи
ai = 43,6 Вт/(м2-К).
Коэффициент теплоотдачи излучением аг определяют по
эмпирическому уравнению Нельсона:
«2=0,025<ср—2,
«2=0,025-788,5—2=17,7 Вт/(м2-К).
Коэффициент теплопередачи от продуктов сгорания к парога-
зовой смеси:
к= 1,1 (43,6+17,7) = 67,4 Вт/(м2-К).
Для определения средней разности температур между теп-
лоносителями находят температуру парогазовой смеси на вхо-
де в конвективную камеру из уравнения теплового баланса:
Ф1 + ®2= Ф11 + Ф12>
где Фп—тепловой поток этановой фракция после смешения, кВт; Ф12 —
тепловой поток перегретого водяного пара после смешения, кВт.
Объемная (молярная) доля водяного пара в парогазовой
смеси равна 0,41 (рассчитана ранее), парциальное давление
водяного пара при общем давлении смеси 0,55 МПа составит:
0,55-0,41=0,225 МПа.
Для первоначального расчета принимают температуру парога-
зовой смеси 130 °C. Энтальпия перегретого водяного пара при
р=0,225 МПа и /=130 °C составляет 2725,3 кДж/кг (см. При-
ложения, табл 15). Рассчитывают молярные теплоемкости ком-
понентов этановой фракции при Т= 130+273 = 403 К (см. При-
ложения, табл. 2, 3) и среднюю молярную теплоемкость:
Сср= (0,73 • 54,33+89,80- 66,92+4,69 - 80,63+4,70 •95,49+0,08 -112,48) /100=
=68,8503 Дж/(моль-К).
58
Тепловой поток до смешения:
439,708+2313,247=2752,955 кВт.
Тепловой поток после смешения:
(2071,401 68,8503 • 130+25 874 • 2725,3) / (9 • 3600) =2748,598 кВт.
Расхождение в балансе незначительно (0,16%), следовательно,
температура парогазовой смеси после смешения принята
верно.
Температурная схема теплообмена:
977°СПрОДУКТЫСГ°Ра^ 600°С, Д/тах=600-130=470°С;
620 »С _Парогазовая см^ 130 °C, Д/т1П=977—620=357 °C.
Средняя разность температур между теплоносителями:
Д/с₽= (470+357)/2=413,5 °C, Д7’ср=413,5 К.
Площадь поверхности нагрева конвективных труб:
F=3 075 541/(67,4-413,5) = 110 м2.
Таким образом, необходимо установить 16 рядов горизон-
тальных труб. Суммарное число труб п= 16X4 = 64.
Фактическая площадь поверхности теплопередачи:
F=3,14-0,102-64-5,5=112,7 м2.
Высота, занимаемая трубами в конвективной камере, при шаге
размещения труб /1 = 0,148 м составит:
й= (16—1)-0,148=2,22 м.
ТЕХНОЛОГИЧЕСКИЙ РАСЧЕТ
ЗАКАЛОЧНО-ИСПАРИТЕЛЬНОГО АППАРАТА
Назначение, устройство и основные размеры.
Определение числа аппаратов
Закалочно-испарительный аппарат (ЗИА) предназначен для
резкого охлаждения пирогаза, тепло которого используют для
получения водяного пара высокого давления, последний нап-
равляют на паровые турбины, являющиеся приводами комп-
рессоров установки.
Закалочно-испарительный аппарат представляет собой вер-
тикальный кожухотрубчатый теплообменник, соединенный ко-
роткой циркуляционной трубой с барабаном-паросборником.
ЗИА — одноходовой аппарат; пирогаз направляют в трубное
пространство, умягченная (химически очищенная) вода цирку-
лирует в межтрубном пространстве. Подробно о работе этого
аппарата см. [7, с. 36].
59
Техническая характеристика ЗИА:
Диаметр кожуха внутренний, мм 1000
Толщина стенки обечайки кожу- 32
ха, мм
Длина (высота) общая, мм 6300
Число труб (drp=32X 150
Х4 мм)
Длина трубы, мм 4800
По данным табл. 6, выход пирогаза равен 90 558 кг/ч, сле-
довательно, необходимое число закалочно-испарительных ап-
паратов составит:
«=90 558/10700=8,5,
где 10 700 — нагрузка ЗИА по пирогазу, кг/ч.
Таким образом, следует установить девять закалочно-ис-
парительных аппаратов (по числу трубчатых печей).
Последующие расчеты ведут на один ЗИА.
Тепловой расчет аппарата
Исходные данные:
в трубном пространстве ЗИА охлаждается пирогаз, который
содержит: сухого газа — 73 448/(9-3600) =2,267 м3/с; водяного
пара — 31 925/(9-3600) =0,985 м3/с;
компонентный состав пирогаза см. табл. 6;
температура пирогаза, °C: на входе — 845; на выходе — 420;
давление пирогаза 0,45 МПа;
в межтрубное пространство подают умягченную воду при тем-
пературе 323 °C, соответствующей температуре кипения при
давлении 12 МПа (см. Приложения, табл. 16).
Цель расчета — определение паропроизводительности и теп-
ловой нагрузки (теплового потока) аппарата.
Уравнение теплового баланса аппарата в общем виде:
Ф1 + Фа= Фз+ Ф4+ Ф ПОТ,
где Ф1, Фа, Фз, Ф4 — тепловые потоки поступающего пирогаза, умягченной
воды, уходящего пирогаза и получаемого насыщенного водяного пара соот-
ветственно, кВт; Фпот—теплопотери в окружающую среду, кВт.
Для определения значений Ф1 и Фз рассчитывают средние
объемные теплоемкости пирогаза при температуре 7’1=845+
+273=1118 К и 7’3=420+273 = 693 К соответственно (см.
табл. 8).
Объемная теплоемкость водяного пара:
при Г,= 1118 К с=42,00/22,4= 1,8750 кДж/(м3-К);
при 7з=693 К с=37,49/22,4=1,6737 кДж/(м3-К).
Тепловой поток пирогаза на входе в ЗИА (поток 6):
Ф1= (2,267-3,7634+0,985-1,8750) -845=8769,83 кВт.
60
Таблица 8. Расчет средних объемных теплоемкостей
Компонент <рр % Л=1118 К Л =693 К
Дж/ /(моль-К) C/p/dOO-22,4). кДжДм’-К) cit Дж/ /(моль К) С,Ч>,/(100-22,4), кДж/(м3 К)
сн4 13,97 76,00 0,4740 57,69 0,3598
с2н2 0,25 67,85 0,0076 59,91 0,0067
с2н4 34,46 100,36 1,5439 77,67 1,1949
с2н6 18,55 129,21 1,0700 99,32 0,8225
СзН6 1,94 163,55 0,1416 120,13 0,1040
СзНз 0,09 186,33 0,0075 143,98 0,0058
С4Н6 0,62 173,92 0,0481 139,51 0,0386
С4Нз 0,14 209,32 0,0131 161,72 0,0101
С4Ню 0,15 241,80 0,0162 184,10 0,0123
СзНщ 0,13 260,83 0,0151 199,39 0,0116
С6Н6 0,19 213,92 0,0181 174,61 0,0148
Н2 29,14 30,96 0,4028 29,64 0,3856
со 0,37 32,95 0,0054 31,15 0,0051
S 100,00 — 3,7634 — 2,9718
Тепловой поток пирогаза на выходе из ЗИА (поток 7):
Ф3= (2,267-2,9718+0,985-1,6737) -420=3521,99 кВт.
Тепловой поток умягченной воды (поток 8):
Ф2=Щх-1455 кВт,
где тх — массовый расход умягченной воды (паропроизводительность)г
кг/с; 1455 — удельная энтальпия кипящей воды при р=12 МПа, кДж/кг
(см. Приложения, табл. 14).
Общий приход теплоты:
Ф1+ ®2=8769,83+1455 тх кВт.
Принимаем, что теплопотери в окружающую среду составляют
5% от общего прихода теплоты, тогда
Фпот=0,05• (8769,83+1455 тх) =438,49+72,75 тх кВт.
Тепловой поток насыщенного пара (поток 8):
Ф4=тх-2638 кВт,
где 2638 — удельная энтальпия насыщенного пара при р=12 МПа, кДж/кг
(см. Приложения, табл. 14).
Паропроизводительность аппарата (поток 10) находят из
уравнения теплового баланса:
8769,83+1455 тх=3521,99+2638,00 тх+438,49+72,75 тх,
тх=4809,35/1255,75=3,82986 кг/с или 3,82986-3600=13 787 кг/ч.
61
Таблица 9. Тепловой баланс ЗИА
Приход кВт % Расход кВт %
Тепловой поток поступающего пи- рогаза 8769,83 61,1 Тепловой поток уходящего пирога- за 3521,99 24,6
Тепловой поток умягченной воды 5572,44 38,9 Тепловой поток получаемого на- сыщенного водя- ного пара Теплопотери в ок- ружающую среду 10 103,17 717,11 70,4 5,0
В с е г о... 14 342,27 100,0 В с е г о... 14 342,27 100,0
Потерями воды в процессе парообразования пренебрегают.
Уточняют статьи теплового баланса:
Ф2=3,82986-1455=5572,44 кВт;
Ф4=3,82986-2638= 10 103,17 кВт;
Фпот=438,49+72,75-3,82986=717,11 кВт.
Тепловая нагрузка аппарата:
фа=ф4—ф2=Ю 103,17—5572,44=4530,73 кВт.
Составляют тепловой баланс ЗИА (табл. 9).
Расчет аппарата
Необходимую площадь поверхности теплопередачи определяют
по формуле
Га=Фа/ф. (72)
Тепловая нагрузка аппарата составляет Фа=4 530730 Вт
(см. тепловой расчет аппарата).
Поверхностная плотность теплового потока:
Ф=кДГСр.
Температурная схема теплообмена:
Пирогаз
845 °C ---*• 420 °C»
Умягченная вода
323 °C -«---------- 323 °C,
Д/тах=845—323=522 °C,
Afmin=420—323=97 °C.
Средняя разность температур [9, уравнение (11-28)]:
Д/ср= (522—97)/[2,303 1g (522/97) ] =252,5 °C, Д7'ср=252,5К.
62
Коэффициент теплопередачи определяют по формуле (63):
к= (1/а1+2гст+1/а2)-*,
где си — коэффициент теплоотдачи от пирогаза к стенке трубы, Вт/(м2-К);
аз — коэффициент теплоотдачи от стенкн трубы к кипящей воде, Вт/(м2-К).
Для расчета коэффициентов теплоотдачи определяют тепло-
физические параметры теплоносителей при соответствующих,
температурах.
Теплофизические параметры пирогаза при средней темпе-
ратуре:
/ср= (845+ 420) /2=632,5 °C или 905,5К.
Теплопроводность определяют по формуле (65):
1=С[1/РГ.
Удельную теплоемкость находят по формуле
с=
где с — удельная теплоемкость, Дж/(кг-К); Ф—тепловой поток, Вт; т —
массовый расход, кг/с; t — температура, °C.
Массовый расход пирогаза составит:
т=90 558/(3600-9) =2,795 кг/с,
где 90 558—массовый расход пирогаза на установку, кг/ч (см. табл. 6);
9 — число аппаратов.
Удельная теплоемкость:
при /=845 °C с=8 769 830/(2,795-845) =3713 Дж/(кг-К);
при /=420 °C с=3 521 990/2,795-420=3000 Дж/(кг-К).
Значения тепловых потоков см. табл. 8.
Средняя удельная теплоемкость при /Ср=632,5 °C:
с= (3713+3000)/2=3356 Дж/(кг-К).
Динамическую вязкость пирогаза определяют по формуле (66).
Для упрощения расчета динамической вязкости пирогаза (со-
став пирогаза см. табл. 7) приняты следующие упрощения:
в один поток «этан» объединены этан, пропан и бутан;
в один поток «этилен» объединены этилен, непредельные
углеводороды и бензол;
в один поток «водород» объединены оксид углерода и водо-
род.
Значения динамической вязкости компонентов пирогаза на-
ходят по справочнику (см. Приложения, табл. 11).
63
Расчет динамической вязкости пирогаза:
сн4 с2н4 с2н6 н2 н2о X
пт, кмоль/ч 458,021 1237,146 616,048 967,699 1425,218 4704,132
Хг, % 9,74 26,30 13,10 20,57 30,29 100,00
Mt 16 28 30 2 18 —
XiM./lOO 1,558 7,364 3,930 0,411 5,452 18,715
jXi-107, Па-с 252 255 246 188 310 —-
h.Af,/(100m)]-10- -7 0,00618 0,02888 0,01598 0,00219 0,01759 0,07082
Цсм= (18,715/0,07082) 10‘ -7=264-10-7 Па-с.
Принимают критерий Прандтля для многоатомных газов
Рг=1,0 [10, с. 150].
Теплопроводность пирогаза:
Х= (3356 -264-10-7) /1,0=0,0886 Вт/ (м • К).
По справочнику (см. Приложения, табл. 16) находят тепло-
физические параметры (при 323°C и давлении 12 МПа):
водяного пара: рп=69,72 кг/м3 (при р= 101325 Па рп=0,579 кг/м3);
умягченной воды: рж=666,3 кг/м3; Х=49,67-10-2 Вт/(м-К); Рг=1,12;
0=9,195-10-3 Н/м; г=1 797 180 Дж/кг.
Коэффициент теплоотдачи от пирогаза к стенке трубы аппара-
та определяют по формуле
ai=NuX/d.
Для выбора формулы, по которой рассчитывают критерий
Нуссельта, определяют критерий Рейнольдса по [9, уравнение
(6-40)]:
Re=Wg-
Ранее было рассчитано, что в один закалочно-испарительный
аппарат поступает тп = 2,795 кг/с пирогаза.
Массовая скорость пирогаза в трубном пространстве:
W=2,795/ (0,785 0,0242 • 150) =41,2 кг/ (м2 • с).
где 0,024 — внутренний диаметр трубы, м; 150 — число труб.
Критерий Рейнольдса:
Re=41,2-0,024/(264-10-7) =37 455.
Формула для расчета критерия Нуссельта [9, уравнение
(11-35)]:
Nu=0,023Re°-8Pr°'4,
Nu=0,023-374550-8-1°-4=104,84.
Коэффициент теплоотдачи от пирогаза к стенке трубы:
ai=104,84(8,86-10-2/0,024) =387 Вт/(м2-К),
64
Коэффициент теплоотдачи от стенки трубы к кипящей воде
определяют по формуле [9, уравнение (11-58)]:
а2=ХУр^/о NuКИП-
Критерий Нуссельта при кипении [9, уравнение (11-57)]:
NuK„„=54(K0-6/Pr°-3).
Критерий К находят из выражения [9, уравнение (11-59)]:
К=ф/{рпГИ’),
где w — произведение среднего диаметра пузырьков, возникающих при кипе-
нии, на число пузырьков, образующихся в единицу времени, м/с.
Определяют w по формуле [9, уравнение (11-60)]:
w=O,O78(po/pn)1-1=O,078(0,579/69,72)1.>=40,11 • 10~5 м/с,
где р0 —плотность водяного пара при давлении р0=Ю1325 Па, кг/м3.
К=ф/(69,72 • 1 797 180-40,1Ы0-3)=<р/50 258.
Критерий Нуссельта:
Кикяп=54ф0-3/(50 2580-3 • 1,12°-3) =78,87- 10-3ф°-3.
Коэффициент теплоотдачи:
«2=49,67• 10-2У (666,3 9,81)/(9,195-10-3) 78,87- 10-3ф°-6=33,03ф°-6.
Гст=П+г2+гз=0,00009 +0,004/17,5 +0,00018=0,0005 м2-К/Вт,
где Г1 и г2 — сопротивления слоев загрязнений с обеих сторон стенки трубы,
м2-К/Вт [9, табл. 15]; 0,004 — толщина стенки, м; 17,5 — теплопроводность
нержавеющей стали, Вт/(м-К) (10, табл. XXVIII].
Коэффициент теплопередачи:
к= [1/387+0,0005+1/(33,03ф°-®)]
Поверхностная плотность теплового потока:
252,5
* р 1 /387 + 0,0005 + 1/(33,03 ф®.®)
252,5
= ------------1; 0,003084ф + 0,030276m®-4 — 252,5 = 0.
0,003084 + 0,030276 ф"®-3 Y v
Для определения значения поверхностной плотности теплового
потока по методу линейной интерполяции задаются значения-
ми <р и подставляют их в полученное выше уравнение.
Принимают <pi = 70 000 Вт/м2, тогда
0,003084-70 000+ 0,030276-70 0000-4—252,5=—33,99.
5—69
65
Принимают <р2 = 85 000 Вт/м2, тогда
0,003084-85 000+0,030276-85 000®-4—252,5=12,48.
Истинное значение поверхностной плотности теплового потока:
85000 — 70000
Ф = 85 000 — —------ ~ - 12,48 = 80 972 Вт/м2.
12,48— (—33,99) ’ '
Коэффициент теплопередачи:
к=ф/Д7'ср=80 972/252,5 = 320 Вт/(м2-К).
Площадь поверхности теплопередачи:
Га=4 530 730/80 972=56 м2.
Запас площади поверхности теплопередачи:
[(69—56)/56]-100=23%.
ПРОЦЕССЫ ХЛОРИРОВАНИЯ
И ОКСИХЛОРИРОВАНИЯ УГЛЕВОДОРОДОВ
Промышленный хлорорганический синтез, развивающийся зна-
чительными темпами, позволяет получать широкий ассортимент
хлорсодержащих органических продуктов, которые находят
применение во всех отраслях народного хозяйства. Среди
хлорорганических продуктов большое значение имеют тетра-
хлорметан (четыреххлористый углерод), тетрахлорэтилен
(перхлорэтилен) и 1,2-дихлорэтан.
Тетрахлорметан является промежуточным продуктом при
получении хладона-11 и хладона-12, вспенивателей в производ-
стве пластмасс; используется для извлечения металлов из пи-
рита, протравливания семян и других целей. Перхлорэтилен
применяется в текстильной промышленности, для обезжирива-
ния металлов, химической чистки одежды, в производстве хла-
дона-113.
1,2-Дихлорэтан — промежуточный продукт синтеза винил-
хлорида; использование для получения винилхлорида в качест-
ве сырья этилена (взамен ацетилена) способствовало значи-
тельному росту объема производства 1,2-дихлорэтана и созда-
нию более эффективных методов его получения.
66
ПОЛУЧЕНИЕ ТЕТРАХЛОРМЕТАНА
И ТЕТРАХЛОРЭТИЛЕНА
Совместный способ получения тетрахлорметана и тетрахлор-
этилена является экономически выгодным благодаря гибкости
процесса и относительно дешевому сырью. В качестве сырья
можно использовать углеводороды Ci—С3 и хлоруглеводоро-
ды. В основе процесса лежит реакция, которая в случае вы-
сокотемпературного хлорирования метана может быть пред-
ставлена следующим уравнением:
ЗСН4+ЮС12—> СС14+СС12=СС12+ I2HC1.
Процесс ведут в газовой фазе при температуре 565—585РС
с дальнейшей конденсацией и ректификацией продуктов реак-
ции. В качестве побочных продуктов образуются гексахлорбен-
зол, гексахлорэтан, гексахлорбутадиен и др., которые (за ис-
ключением гексахлорбензола) подвергают хлоролизу. В этих
условиях степень использования хлора достигает 85%, а се-
лективность по тетрахлорметану в расчете на метан составля-
ет 70%. Описание технологической схемы см. [4, с. 151,
рис. 51].
МАТЕРИАЛЬНЫЙ РАСЧЕТ
Исходные данные:
годовая производительность агрегата по перхлоруглеводородам
(отношение СС14: С2С14= 1:1) 31 000 т;
годовой фонд рабочего времени 7250 ч;
расход хлоруглеводородного сырья (в кг на 1 т образующихся
перхлоруглеводородов СС14+С2С14): жидкие хлоруглеводоро-
ды — 70; жидкие рециркулирующие хлоруглеводороды из ем-
костей сырого продукта — 655; жидкий 1,2-дихлорэтан из ре-
актора хлорирования этилена — 270;
объем продуктов отпарки сырца перхлоруглеводородов 20 м3
на 1 т перхлоруглеводородов;
степень использования хлора 0,85;
селективность по СС14 в расчете на метан 0,70;
состав исходного углеводородного сырья (<р,-, %):
Этилен технический (по- Природный газ* (по-
ток 2): СН4 0,5 ток 3) СН4 94,0
С2Н4 98,0 С2Н6 4,2
с2н6 0,5 n2 1,5
n2 0.5 СО2 0,3
со2 0,5
* Углеводороды Сз—Св. присутствующие в природном газе, отделены
иа стадии подготовки сырья
5*
67
состав хлоруглеводородного сырья:
Жидкие хлоруглево- Жидкие рециркулирую-
дороды (поток 4) щие перхлоруглеводо-
Wi, %: роды (поток 5) wt, %: 29,20
СС14 77,30 СС14
С2С14 6,00 С2С14 54,55
СНС13 5,50 С2С16 9,60
С2НС13 4,20 С4С16 4,70
С2Н4С12 7,00 С6С16 1,85
С12 0,05
НС1 0,05
Продукты отпарки Жидкий 1,2-дихлорэтан
сырца перхлоругле- (поток 7) Wi, %:
водородов (поток 6) Xi, %:
СС14 6,75 СС14 5,00
С12 55,75 С2Н4С12 93,80
НС1 37,50 НС1 1,20
Последовательность расчета:
а) определяют компонентный состав материальных потоков хлоруглево-
дородного сырья на входе в хлоратор;
б) рассчитывают изменение состава реакционной смеси, расход и состав
природного газа и технического этилена;
в) составляют материальный баланс хлоратора;
г) определяют состав потоков на входе в закалочную колонну, состав
газовой фазы и кубовой жидкости на выходе из колонны;
д) рассчитывают расход технического этилена на прямое хлорирование,
составляют материальный баланс реактора;
е) определяют состав сырца перхлоруглеводородов на входе в колонну
отпарки, а также передаваемого на стадию выделения товарных продуктов;
ж) составляют сводный материальный баланс стадии совместного по-
лучения тетрахлорметана и тетрахлорэтилена.
Схема потоков стадии получения тетрахлорметана и тетрахлорэтилена
приведена на рис. 4.
Часовая производительность агрегата по перхлоруглеводо-
родам:
31 000 -1000/7250=4276 кг/ч
в том числе:
по СС1«*. 4276/2=2138 кг/ч или 2138/154=13,883 кмоль/ч;
по С2С14: 2138 кг/ч или 2138/166=12,880 кмоль/ч.
Определяют расход хлоруглеводородного сырья на входе в
хлоратор:
жидкие хлоруглеводороды:
70-4276/1000=299 кг/ч;
жидкие рециркулирующие перхлоруглеводороды из емко-
стей сырого продукта:
655-4,276=2801 кг/ч;
68
Рис. 4. Схема потоков получения тетрахлорметана и тетрахлорэтилена:
•/ — хлор; 2, 12, 15 — этилен; 3 — природный газ; 4— жидкие хлоруглеводороды; 5 —ре-
циркулирующие перхлоруглеводороды; 6 — продукты отпарки сырца перхлоруглеводоро-
дов; 7—1,2-дихлорэтан; 8— общий поток сырья; 9— продукты хлорирования; 10, 16 —
газовая фаза; 11 — отходящий хлороводород; 13 — кубовая жидкость; 14 — жидкая фаза;
17—кубовый продукт; 18 — флегмовая жидкость; 19— сырец перхлор углеводородов; 20 —
смесь целевых продуктов; 21, 22 — вода;
РТ1 — реактор газофазного хлорирования; КЛ1 — закалочная колонна; Cl, С2 —сепара-
торы; Е1 — сборник; РТ2 — реактор жидкофазного хлорирования; КЛ2 — колонна отпарки
жидкий 1,2-дихлорэтан из реактора хлорирования этилена:
270-4,276=1155 кг/ч;
продукты отпарки сырца перхлоруглеводородов:
20-4,276=86 м3/ч нли 86/22,4=3,839 кмоль/ч.
Состав жидких хлоруглеводородов (поток 4):
ссц С2С14 СНС13 СаНСЬ СаЩСг X
a>i, % 77,3 6,0 5,5 4,2 7,0 100,0
/пт, кг/ч 231,1 17,9 16,5 12,6 20,9 299,0
м. г/моль 154 166 119,5 131,5 99 —
Пх, кмоль/ч 1,501 0,108 0,138 0,096 0,211 2,054
% 73,08 5,26 6,72 4,67 10,27 100,00
Состав жидких рециркулирующих
емкостей сырого продукта (поток 5):
перхлоруглеводородов из
ссц G2C14 СгС1в С4С1в СбС16 С12 HCI X
W{, % 29,20 54,55 9,60 4,70 1,85 0,05 0,05 100,00
тх, кг/ч 817,9 1528,0 268,9 131,6 51,8 1,4 1,4 2801,0
М, г/моль 154 166 237 261 285 71 36,5 —
Пт, кмоль/ч 5,311 9,205 1,135 0,504 0,182 0,020 0,038 16,395
*/, % 32,40 56,15 6,92 3,07 1.П 0,12 0,23 100,00
69
Состав продуктов отпарки сырца
(поток 6):
перхлоруглеводородов
Xi, %
пт, кмоль/ч
тх, кг/ч
W., 7о
ССЦ
6,75
0,259
39,9
16,33
С12
55,75
2,140
151,9
62,15
на
37,50
1,440
52,6
21,52
х
100,00
3,839
244,4
100,00
Состав жидкого 1,2-дихлорэтана из реактора хлорирования
этилена (поток 7):
ссц С2Н,С1а НС1 S
Wi, % 5,00 93,80 1,20 100,00
mt, кг/ч 57,7 1083,4 13,9 1155,0
tit, кмоль/ч 0,375 10,943 0,381 11,699
Xi, % 3,20 93,54 3,26 100,00
По реакции
С2НС13+ЗС12 2СС1,+НС1
1
расходуется:
трихлорэтилена: 0,096 кмоль/ч или 12,6 кг/ч;
хлора: 3-0,096=0,288 кмоль/ч или 20,5 кг/ч;
образуется:
тетрахлорметана: 2-0,096=0,192 кмоль/ч или 29,6 кг/ч;
хлороводорода: 0,096 кмоль/ч или 3,5 кг/ч.
По реакции
СНС13+С12 —>СС14+НС1 2
расходуется:
трихлорметана: 0,138 кмоль/ч или 16,5 кг/ч;
хлора: 0,138 кмоль/ч или 9,8 кг/ч;
образуется:
тетрахлорметана: 0,138 кмоль/ч или 21,3 кг/ч;
хлороводорода: 0,138 кмоль/ч или 5,0 кг/ч.
По реакции
2С2Н4С12-1-8С12—* C2CI4+2CCI4+8HCI 3
расходуется:
1,2-дихлорэтаиа: 11,154 кмоль/ч или 1104,3 кг/ч;
хлора: (8/2) • 11,154=44,616 кмоль/ч или 3167,7 кг/ч;
70
образуется:
тетрахлорэтилена: 11,154/2=5,577 кмоль/ч или 925,8 кг/ч;
тетрахлорметана: 11,154 кмоль/ч или 1717,7 кг/ч;
хлороводорода: 44,616 кмоль/ч или 1628,5 кг/ч.
Всего образуется тетрахлорметана:
0,192+ 0,138+11,154=11,484 кмоль/ч или 1768,6 кг/ч.
Необходимо получить дополнительно тетрахлорметана:
13,883—11,484=2,399 кмоль/ч или 369,4 кг/ч.
По уравнению основной реакции
СН4+4С12—*СС14+4НС1 4
расходуется:
метана: 2,399 кмоль/ч или 38,4 кг/ч;
хлора: 4-2,399=9,596 кмоль/ч или 681,3 кг/ч;
образуется хлороводорода:
9,596 кмоль/ч или 350,3 кг/ч.
При выходе тетрахлорметана в расчете на превращенный
метан 0,70 необходимо ввести в процесс метана (без учета
метана, содержащегося в техническом этилене):
2,399/0,70=3,427 кмоль/ч или 54,8 кг/ч.
Объемный расход природного газа составит:
3,427/0,94=3,646 кмоль/ч,
где 0,94— молярная (объемная) доля метана в природном газе, доли ед. Состав природного газа (поток 3):
сна СгНе n2 СО2 S
<Рг(Хг), % пх, кмоль/ч 94,0 4,2 1,5 0,3 100,0
3,427 0,153 0,055 0,011 3,646
тх, кг/ч 54,8 4,6 1,5 0,5 61,4
и>„ % 89,26 7,49 2,44 0,81 100,00
Необходимо получить дополнительно тетрахлорэтилена:
12,880—5,577=7,303 кмоль/ч или 1212,2 кг/ч.
Тетрахлорэтилен образуется из этилена, а также из этана, со-
держащегося в природном газе и техническом этилене, поэто-
му в хлоратор необходимо ввести технического этилена:
(7,303—0,153) /0,985=7,258 кмоль/ч,
где 0,985 — молярная доля углеводородов С2 в техническом этилене, доли
ед.; 0,153 — количество этана в природном газе, кмоль/ч.
71
Состав технического этилена на входе в хлоратор (поток 2):
сн4 С2Н4 QHe n2 со2
% 0,5 98,0 0,5 0,5 0,5 100,0
я», кмоль/ч 0,036 7,114 0,036 0,036 0,036 7,258
Шх, кг/ч 0,6 199,2 1,1 1,0 1,6 203,5
Wi, % 0,29 97,89 0,54 0,49 0,79 100,00
Всего в хлоратор поступает метана:
3,427+0,036=3,463 кмоль/ч или 55,4 кг/ч.
Остается метана (учитывая его расход на реакцию 4):
3,463—2,399=1,064 кмоль/ч или 17,0 кг/ч.
По реакции
6СН4+15С12 —> С6С1в+24НС1 5
реагирует (по экспериментальным данным) 62% оставшегося
метана, что составляет:
0,62-1,064=0,660 кмоль/ч или 10,5 кг/ч.
Расходуется хлора:
(15/6)-0,660=1,650 кмоль/ч или 117,3 кг/ч.
Образуется:
гексахлорбензола: 0,660/6=0,110 кмоль/ч или 31,4 кг/ч;
хлороводорода: (24/6)-0,660=2,640 кмоль/ч или 96,4 кг/ч.
Всего из хлоратора выходит гексахлорбензола:
0,182+0,110=0,292 кмоль/ч или 83,2 кг/ч.
По реакции
4СН4+11С12 —С4С1в+16НС1 6
реагирует 26,5% оставшегося метана, что составляет:
0,265-1,064=0,282 кмоль/ч или 4,5 кг/ч;
расходуется хлора:
(11/4)-0,282=0,776 кмоль/ч или 55,1 кг/ч;
образуется:
гексахлорбутадиена: 0,282/4=0,070 кмоль/ч или 18,4 кг/ч;
хлороводорода: (16/4)-0,282=1,128 кмоль/ч или 41,2 кг/ч.
Всего из хлоратора выходит гексахлорбутадиена:
0,504 +0,070=0,574 кмоль/ч или 150,0 кг/ч.
По реакции
2СН4+7С12—-CjCle+SHCl i
реагирует 11,5% оставшегося метана, что составляет:
0,115-1,064=0,122 кмоль/ч или 2,0 кг/ч;
расходуется хлора:
(7/2) 0,122=0,427 кмоль/ч или 30,3 кг/ч;
образуется:
гексахлорэтана: 0,122/2=0,061 кмоль/ч или 14,5 кг/ч;
хлороводорода: (8/2) -0,122=0,488 кмоль/ч или 17,8 кг/ч.
Всего:
выходит из хлоратора гексахлорэтана:
1,135+0,061 = 1,196 кмоль/ч или 283,4 кг/ч;
поступает в хлоратор этана:
0,153+0,036=0,189 кмоль/ч или 5,7 кг/ч.
Тетрахлорэтилен образуется из этана через 1,1-дихлорэтан
по реакции
С2Нв+5С18—>С8С14+6НС1. 8
При этом расходуется хлора:
5-0,189=0,945 кмоль/ч или 67,1 кг/ч;
образуется:
тетрахлорэтилена: 0,189 кмоль/ч или 31,4 кг/ч;
хлороводорода: 6-0,189=1,134 кмоль/ч или 41,4 кг/ч.
Этилен хлорируется до тетрахлорэтилена по основной реак-
ции
С2Н4+4С12-^С2С14+4НС1. 9
При этом расходуется:
этилена: 7,114 кмоль/ч или 199,2 кг/ч;
хлора: 4-7,114=28,456 кмоль/ч или 2020,4 кг/ч.
образуется:
тетрахлорэтилена: 7,114 кмоль/ч или 1180,8 кг/ч;
хлороводорода: 28,456 кмоль/ч или 1038,8 кг/ч.
Общий расход хлора:
0,288+0,138+ 44,616+9,596+1,650+0,776+0,427+0,945+28,456—2,160=
=84,732 кмоль/ч или 20,5+9,8+ 3167,7+681,3+117,3+55,1+30,3+67,1 +
+2020,4—153,3=6016,2 кг/ч.
При степени использования хлора 0,85 расход хлора в хло-
ратор (поток 1) составляет:
84,732/0,85=99,685 кмоль/ч или 7077,9 кг/ч.
73
Остается хлора в продуктах реакции:
99,685—84,732=14,953 кмоль/ч или 1061,7 кг/ч.
Всего образуется хлороводорода:
0,096 + 0,138+44,616 +9,596+2,640+1,128+0,488+1,134+ 28,456=
=88,292 кмоль/ч или 3,5+ 5,0+1628,5+350,3+96,4 +41,2+17,8+41,4+1038,8=
=3222,9 кг/ч.
Количество хлороводорода на выходе из хлоратора:
88,292+1,859=90,151 кмоль/ч или 3290,8 кг/ч.
Количество диоксида углерода на выходе из хлоратора (см.
состав потоков 2 и 3):
0,011+0,036=0,047 кмоль/ч или 2,1 кг/ч.
Количество азота на выходе из хлоратора:
0,055+0,036=0,091 кмоль/ч или 2,5 кг/ч.
Количество тетрахлорэтилена на выходе из хлоратора:
9,313+12,880=22,193 кмоль/ч или 3683,9 кг/ч,
где 9,313 — количество тетрахлорэтилена на входе в хлоратор (рассчитано
по составам потоков 4,5), кмоль/ч; 12,880 — количество образовавшегося
тетрахлорэтилена, кмоль/ч.
Количество тетрахлорметана на выходе из хлоратора (рас-
считано с учетом составов потоков 4—7 и образовавшегося
Таблица 10. Материальный баланс хлоратора
Компонент Входит (поток 8)* Выходит (поток 9)
кмоль/ч | кг/ч кмоль/ч | кг/ч
сн4 3,463 55,4
с2н4 7,114 199,2 — —
С2Н6 0,189 5,7 — —
ecu 7,446 1146,6 21,329 3284,6
С2С14 9,313 1545,9 22,193 3683,9
С2С16 1,135 268,9 1,196 238,4
С4С1б 0,504 131,6 0,574 150,0
С6С16 0,182 51,8 0,292 83,2
СНС!3 0,138 16,5 —- —
С2НС13 0,096 12,6 •— —
C2H4C12 11,154 1104,3 — —
С12 101,845 7231,2 14,953 1061,7
n2 0,091 2,5 0,091 2,5
со2 0,047 2,1 0,047 2,1
НС1 1,859 67,9 90,151 3290,8
Всего... 144,576 11842,2 150,826 11 842,2
• Для расчета состава потока 8 используют данные о составе потоков 1—7.
74
тетрахлорметана):
7,446+13,883=21,329 кмоль/ч или 3284,6 кг/ч.
Составляем материальный баланс хлоратора (табл. 10).
Расчет закалочной колонны КЛ1
Исходные данные:
степень использования хлора 0,85;
количество кубового продукта, подаваемого из колонны выде-
ления тетрахлорэтилена, 85 кг на 1 т перхлоруглеводородов;
состав кубового продукта (ш,-, %): С2С14— 90,0; С2С1б— 7,0;
С4С16 — 2,2; С6С16 — 0,8;
количество флегмовой жидкости, подаваемой в закалочную ко-
лонну из емкости сырого тетрахлорметана, 4400 кг на 1 тонну
перхлоруглеводородов;
состав флегмовой жидкости (wt, %): СС14— 60,00; C2CI4 —
36,00; С2С16 —0,42; С4С16 —0,15; С6С16 —0,05; С12 —2,50;
НС1 — 0,88.
Количество кубового продукта, подаваемого в закалочную
колонну из колонны выделения тетрахлорэтилена:
85-4,276=363,5 кг/ч.
Состав кубового продукта на входе в закалочную колонну (по-
ток 17):
С2СЦ С2С1в С4С16 СвС16 X
Wi, % 90,0 7,0 2,2 0,8 100,0
тх, кг/ч 327,2 25,4 8,0 2,9 363,5
Пх, кмоль/ч 1,971 0,107 0,031 0,010 2,119
Xi, % 93,02 5,05 1,46 0,47 100,00
Количество флегмовой жидкости, подаваемой в закалочную
колонну из емкости сырого тетрахлорметана:
4400-4,276=18 814,4 кг/ч.
Состав флегмовой жидкости на входе в закалочную колонну
(поток 18):
Wi, %
тт, кг/ч 11
пх, кмоль/ч
%
CCI4 СйС!4
60,00 36,00
288,6 6773,2
73,303 40,802
58,30 32,45
С2С1в С4С1в
0,42 0,15
79,0 28,2
0,333 0,108
0,26 0,08
G;Clg С12
0,05 2,50
9,4 470,4
0,033 6,625
0,03 5,27
НС1 х
0,88 100,00
165,6 18 814,4
4,537 125,741
3,61 100,00
Состав подаваемых в закалочную колонну продуктов реак-
ции рассчитывают по составам потоков 9, 17 и 18 (табл. 11).
В газовую фазу на выходе из закалочной колонны перехо-
дит:
75
практически весь хлор, кроме возвращаемого в хлоратор
(см. состав потока 5):
21,578—0,020=21,558 кмоль/ч или 1530,7 кг/ч;
весь азот и диоксид углерода;
практически весь хлороводород, кроме возвращаемого в
хлоратор (см. состав потока 5):
94,688—0,038=94,650 кмоль/ч или 3455,0 кг/ч;
94% тетрахлорметана:
0,94-94,632=88,954 кмоль/ч или 13698,8 кг/ч;
82% тетрахлорэтилена:
0,82-64,966=53,272 кмоль/ч или 8843,1 кг/ч;
20% гексахлорэтана:
0,2-1,636=0,327 кмоль/ч или 77,6 кг/ч;
12% гексахлорбутадиена:
0,12-0,713=0,086 кмоль/ч или 22,3 кг/ч;
10% гексахлорбензола:
0,1-0,335=0,033 кмоль/ч или 9,5 кг/ч.
Доля отгоняемых продуктов реакции (94, 82, 20, 12 и 10%)
принята с учетом их температур кипения и молярного состава
потока.
Рассчитывают состав газовой фазы на выходе из закалоч-
ной колонны (табл. 12).
Состав кубовой жидкости, отбираемой из закалочной колон-
ны в емкость сырого тетрахлорэтилена, определяют по разно-
сти составов потоков на входе в закалочную колонну (см.
табл. 11) и газовой фазы на выходе из нее (см. табл. 12).
Таблица 11 Состав продуктов реакции на входе в закалочную колонну
Компонент mv кг/ч wt, % г?г, кмоль/ч *i. %
СС14 14 573,2 46,98 94,632 33,96
c2ci4 10784,3 34,76 64,966 23,31
С2С16 387,8 1,25 1,636 0,59
186,2 0,60 0,713 0,25
СвС16 95,5 0,31 0,335 0,12
ci2 1532,1 4,94 21,578 7,74
n2 2,5 0,01 0,091 0,03
со2 2,1 0,01 0,047 0,02
НС1 3456,4 11,14 94,688 33,98
S 31 020,1 100,00 278,686 100,00
76
Таблица 12. Состав газовой фазы на выходе из закалочной колонны
(поток 10)
Компонент mv кг/ч w,. '% пх, кмоль/ч %
ссц 13 698,8 49,56 88,954 34,34
С2С14 8843,1 31,99 53,272 20,57
С2С16 77,6 0,28 и, 327 0,13
C4CU 22,3 0,08 0,086 0,03
С6С16 9,5 0,03 0,033 0,01
С12 1530,7 5,54 21,558 8,32
n2 2,5 0,01 0,С91 0,04
СО2 2,1 0,01 0/47 0,02
НС1 3455,0 12,50 94,t50 36,54
2 27 641,6 100,00 259,018 100,00
Состав кубовой жидкости на выходе из ны (поток 13): закалочной колон-
СС14 с2а4 С2С13 С4С1в Cede С12 НС! 2
тх, кг/ч 874,4 1941,2 310,2 163,9 86,0 1,4 1,4 3378,5
W., % 25,88 57,46 9,18 4,85 2,55 0,04 0,04 100,00
лг, кмоль/ч 5,678 11,694 1,309 0,627 0,302 0,020 0,038 19,66
% 28,87 59,46 6,66 3,19 1,53 0,10 0,19 100,008
Газовая фаза из закалочной колонны охлаждается и раз-
деляется в сепараторе С1. В газовую фазу на выходе из сепа-
ратора (поток 11) переходит:
весь азот и диоксид углерода;
59% хлора из потока 10 (см. табл. 12):
0,59-21,558=12,719 кмоль/ч или 903,1 кг/ч;
93,5% хлороводорода:
0,935-94,650=88,498 кмоль/ч или 3230,4 кг/ч;
тетрахлорметана (см. состав потока 7): 0,375 кмоль/ч или
57,7 кг/ч.
С целью очистки отходящего хлороводорода в реакторе РТ2
проводят жидкофазное хлорирование этилена хлором, содер-
жащимся в газовой фазе из сепаратора.
На улавливание хлора по реакции
C2H4-I-CI2—> C2H4CI2 10
расходуется хлора: 12,719 кмоль/ч или 356,1 кг/ч.
При степени хлорирования этилена 82% (по эксперимен-
тальным данным) в реактор необходимо подать этилена:
12,719/0,82=15,511 кмоль/ч или 434,3 кг/ч.
77
Состав технического этилена на входе в реактор РТ2 (по- ток 12):
сн4 С2Н4 С2Нв n2 со2
Хг, % 0,5 98,0 0,5 0,5 0,5 100,0
пх, кмоль/ч 0,079 15,511 0,079 0,079 0,079 15,827
пгт, кг/ч 1,3 434,3 2,4 2,2 3,5 443,7
Wi, % 0,29 97,89 0,54 0,49 0,79 100,00
Остается этилена: 15,511—12,719=2,792 кмоль/ч или 78,2 кг/ч.
Образуется 1,2-дихлорэтана: 12,719 кмоль/ч или 1259,2 кг/ч.
Подают в хлоратор 1,2-дихлорэтана (см. состав потока 7):
10,943 кмоль/ч или 1083,4 кг/ч.
Поступает 1,2-дихлорэтана в абсорбер хлороводорода:
12,719—10,943=1,776 кмоль/ч или 175,8 кг/ч.
В жидком 1,2-дихлорэтане, поступающем в хлоратор:
растворено хлороводорода: 0,381 кмоль/ч или 13,9 кг/ч;
уходит в абсорбер хлороводорода:
88,498—0,381=88,117 кмоль/ч или 3216,5 кг/ч.
Составляют материальный баланс реактора РТ2 (табл. 13).
Таблица 13. Материальный баланс реактора РТ2
Входит кг/ч % Выходит кг/ч %
Газовая фаза из Жидкий ДХЭ в
сепаратора С1 хлоратор (поток
(поток 11): 7):
СС14 57,7 1,38 СС14 57,7 5,00
С12 903,1 21,52 С2Н4С12 1083,4 93,80
n2 2,5 0,06 НС1 13,9 1,20
СО2 2,1 0,05 —
HCI 3230,4 76,99 Итог о... 1155,0 100,00
Итог о... 4195,8 100,00 Отходящий хло-
роводород в аб-
Этилен техниче- сорбер (поток
ский (поток 12): 16):
СН4 1,3 0,29 175,8 5,05
С2Н4 434,3 97,89 СН4 1,3 0,04
с2н6 2,4 0,54 С2Н4 78,2 2,24
n2 2,2 0,49 с2н6 2,4 0,07
со2 3,5 0,79 n2 4,7 0,13
, - со2 5,6 0,16
Итог о... 443,7 100,00 НС1 3216,5 92,31
В с е г о... 4639,5 — Итог о... 3484,5 100,00
В с е г о... 4639,5 —
78
Определяют состав жидкой фазы из сепаратора С1 (по-
ток 14), поступающей в емкость сырого тетрахлорметана, по
разности составов потоков 10 и 11.
Состав жидкой фазы из сепаратора С1 (поток 14):
СС1а С2С14 CaCle CjCle СвС13 Cl2 HC1 X
тх, кг/ч 13641,1 8843,1 77,6 22,3 9,5 627,6 224,6 23445,8
«Ч, % 58,18 37,72 0,33 0,09 0,04 2,68 0,96 100,00
th, кмоль/ч 88,579 53,272 0,327 0,086 0,033 8,839 6,152 157,288
Х„ % 56,32 33,87 0,21 0,05 0,02 5,62 3,91 100,00
Состав сырца перхлоруглеводородов, поступающего из ем-
костей для хранения сырых перхлоруглеводородов в колонну
отпарки сырца (поток 19), определяют по разности составов
поступающих потоков 13 и 14 и выходящих потоков 5 и 18.
Состав сырца перхлоруглеводородов на входе в колонну от-
парки (поток 19):
СС1а СгС1д СаСк C4CI3 CgCle Cl2 HC1 2
тх, кг/ч 2409,0 2483,1 39,9 26,4 34,3 157,2 59,0 5208,9
«Ч, % 46,25 47,67 0,76 0,51 0,66 3,02 1,13 100,00
пт, кмоль/ч 15,643 14,959 0,168 0,101 0,120 2,214 1,615 34,820
X., % 44,93 42,96 0,48 0,29 0,34 6,36 4,64 100,00
Состав сырца, передаваемого из колонны отпарки на ста-
дию выделения чистых перхлоруглеводородов, определяют по
разности составов потоков 19 и 6.
Состав сырца перхлоруглеводородов, передаваемого на ста-
дию выделения чистых перхлоруглеводородов (поток 20):
ссц C2CI4 QCle С4С1в CcCle Cl2 HC1 X
тх, кг/ч 2369,1 2483,1 39,9 26,4 34,3 5,3 6,4 4964,5
% 47,72 50,02 0,80 0,53 0,69 0,11 0,13 100,00
пх, кмоль/ч 15,384 14,959 0,168 0,101 0,120 0,074 0,175 30,981
Xi. % 49,66 48,28 0,54 0,33 0,39 0,24 0,56 100,00
В закалочной колонне КЛ1 в результате резкого охлажде-
ния выходящих из реактора РТ1 продуктов реакции хлор и
хлороводород полностью переходят в газовую фазу. Содержа-
ние этих веществ в сырце перхлоруглеводородов после его от-
паривания в колонне КЛ2 зависит от степени конденсации га-
зовой фазы в холодильнике-конденсаторе и степени разделе-
ния газожидкостной смеси в сепараторе С1. Массовые доли
хлора и хлороводорода в сырце перхлоруглеводородов не
должны превышать 0,10—0,15%. В противном случае необхо-
димо повысить температуру конденсации и увеличить степень
отдувки хлора и хлороводорода в сепараторе С1.
Составляют материальный баланс стадии получения пер-
хлоруглеводородов (табл. 14).
79
Таблица 14. Материальный баланс стадии получения
перхлоруглеводородов
Входит кмоль/ч кг/ч Выходит кмоль/ч кг/ч
Хлор Этилен техниче- ский Природный газ Жи дкие х л ор угле - водороды Кубовый продукт колонны выделе- ния тетрахлорэти- лена 99,685 23,085 3,646 2,054 2,119 7077,9 647,2 61,4 299,0 363,5 Сырец перхлор- углеводородов на стадию выделения Отходящий хлоро- водород 30,981 93,139 4964,5 3484,5
В с е г о... 130,589 8449,0 В с е г о... 124,120 8449,0
Расчет основных расходных коэффициентов. Для получения
4276 кг/ч перхлоруглеводородов (отношение СС14:С2С14=1 : 1)
необходимо: 7077,9 кг/ч хлора; 647,2 кг/ч технического этиле-
на; 61,4 кг/ч природного газа (см. табл. 14).
Расходные коэффициенты составят:
по хлору: 7077,9/4276=1,655 т/т;
по техническому этилену: 647,2/4,276=151,36 кг/т;
по природному газу: 61,4/4,276=14,36 кг/т.
ТЕХНОЛОГИЧЕСКИЙ РАСЧЕТ ХЛОРАТОРА
Назначение, устройство и основные размеры.
Определение числа хлораторов
Хлоратор предназначен для термического газофазного хлори-
рования углеводородов с целью получения тетрахлорметана и
тетрахлорэтилена. Хлоратор представляет собой вертикальный
цилиндрический полый аппарат с конической верхней частью.
Обечайка хлоратора выполнена из углеродистой стали. Внут-
ренняя поверхность стальной обечайки защищена от коррозии
и термических воздействий специальной футеровкой. Наружная
поверхность хлоратора снабжена рубашкой, в которой цирку-
лирует охлаждающая вода для охлаждения металлической
стенки.
В верхней (конусной) части аппарата предусмотрено ин-
жекторное устройство, через которое осуществляют ввод реаги-
рующих компонентов. Благодаря высоким скоростям потока в
инжекторе достигается хорошее перемешивание исходных ве
ществ на входе в зону реакции.
80
Техническая характеристика хлоратора:
Диаметр обечайки внут- 2800 Вместимость полезная, м3 16
ренний, мм 25 Площадь поверхности теп- 70
Толщина стенки сталь- лопередачи рубашки, м2
ной обечайки, мм Диаметр, мм:
Толщина футеровки, мм 300 входного штуцера 200
Диаметр рубашки внут- 2890 выходного штуцера 400
ренний, мм Высота реакционной Температура в зоне реак- 565—585
4200 ции, °C
зоны, мм Давление в аппарате (ра- 170-270
Высота аппарата общая, мм 9000 бочее), кПа
Средний объемный расход газов в хлораторе в соответствии
с данными табл. 10:
Vo=[( 144,576+150,826) -22,4]/(2-3600) =0,919 м3/с.
Объемный расход газов при максимальной температуре 585+
+273 = 858 К и минимальном давлении 170 кПа:
17=0,919 [(858-101,325)/(273• 170,000)] = 1,722 м3/с,
где 101,325 — давление при нормальных условиях, кПа.
Время пребывания реагентов в зоне реакции т составляет
10—15 с. Принимают максимальное значение т=15 с, тогда
необходимая вместимость хлоратора:
V₽= ViT= 1,722 • 15=25,83 м».
Число хлораторов для обеспечения заданной производительно-
сти:
/1=25,83/16=1,6.
Таким образом, необходимо параллельно установить два
хлоратора, при этом запас производительности составит:
[(16-2—25,83)725,83] .100=24%.
Тепловой расчет хлоратора
Исходные данные:
материальные потоки (см. состав потоков 2—7): хлор —
99,685/(2-3600) =0,0138 кмоль/с; природный газ — 3,646/(2-
-3600) =0,0005 кмоль/с; технический этилен — 7,258/(2-3600) =
= 0,0010 кмоль/с; жидкие хлоруглеводороды — 299,0/(2-3600) =
=0,0415 кг/с; жидкие рециркулирующие перхлоруглеводороды
из емкостей сырого продукта — 2801/(2-3600) =0,389 кг/с; про-
дукты отпарки сырца перхлоруглеводородов — 3,839/(2-3600) =
= 0,0005 кмоль/с; жидкий 1,2-дихлорэтан 1155/(2-3600) =
= 0,1604 кг/с;
6—69
81
температура потоков, °C: хлор, природный газ, технический эти-
лен — 25; хлоруглеводороды и рецикл (сырой продукт) — 20;
продукты отпарки сырца перхлоруглеводородов — 30; продук-
ты реакции — 585.
Цель расчета — определение количества теплоты, отводимой
охлаждающей водой.
Уравнение теплового баланса хлоратора в общем виде:
Ф1 + Ф2+ Фз+ Ф4+ Ф&+ Фб= Ф?+ Фв+ Фд+ Фпот,
где Фь Ф2, Ф3> Ф4, Ф5, Фе — тепловые потоки газообразного сырья (хлор,
природный газ, технический этилен), жидких хлоруглеводородов, жидких
рециркулирующих перхлоруглеводородов, продуктов отпарки сырца, жидко-
го технического 1,2-дихлорэтана и продуктов реакции соответственно, кВт;
Ф6 — теплота экзотермических реакций, кВт; Ф? — теплота, расходуемая на
Испарение жидких компонентов сырьевой смеси, кВт; Фэ — теплота, отво-
димая охлаждающей водой, кВт; ФПот — теплопотери в окружающую среду,
кВт
Тепловые потоки сырья и продуктов определяют по форму-
лам (40) и (42); значения теплоемкостей находят по справоч-
нику (см. Приложения, табл. 2—4).
Тепловой поток газообразного сырья (потоки 1—3):
Ф,=(0,0138-33,93+0,0005-35,71+0,0010-43,56) -25=13,25 кВт.
Тепловой поток жидких хлоруглеводородов (поток 4):
ф2= (0,0415/100) (1,289 7,0+0,962 4,2+0,858 • 6,0+0,950 5,5+
+0,862-77,3)-20=0,75 кВт.
Тепловой поток жидких рециркулирующих перхлоруглеводоро-
дов (поток 5):
Фз= (0,389/100) (0,858-70,8 + 0,862-29,2) -20=6,68 кВт.
Тепловой поток продуктов отпарки сырца перхлоруглеводоро-
дов (поток 6):
Ф4= (0,0005/100) (0,545-154-6,75+34,13-55,75+29,11-37,50) -30=0,53 кВт,
где 0,545 — удельная теплоемкость паров тетрахлорметана, кДж/(кг-К);
154 — молярная масса тетрахлорметана, г/моль.
Для упрощения расчета все компоненты, присутствующие в
потоке 7, объединены в поток «дихлорэтан». Тепловой поток
жидкого 1,2-дихлорэтана (поток 7):
Ф5=0,1604-1,289-20=4,14 кВт.
Рассчитывают теплоты реакций (в кДж/моль):
Реакция Д^°г-е=^-Д^0293(кон)“^-'^^°29В(исх)
С2НС1з+С12-^2СС14+НС1 2(—100,42) + (—92,31)—(—7,53) =
CHCla+Clr^CCU+HCl =—285,62
2СгН4С12+8С12-»-С2С14+2СС14+8НС1 —100,42+(—92,31)—(—101,25) =
=—91,48
—15,06+2 (—100,42) +8(—92,31)—
—2 (—129,7)=---694,98
82
СН4+ 4С12=^ССЦ+4НС1 —100,42+ 4 (—92,31)—(—74,85) = =—394,81
6СН4+ 15С12=г±С6С16+24НС1 —229,96+24 (—92,31) —6 (—74,85) = =—1996,30
2СН4+7С12=^С2С16+8НС1 —141,42+8 (—92,31) —2 (—74,85) = =—730,20
С2Н6+5С12^=С2С14+ 6НС1 —15,06+6(—92,31)—(—84,67) = =—484,25
QH,+4С12=ё±С2С14+4НС1 —15,06+4 (—92,31) —52,30=—436,60
Теплота экзотермических зования гексахлорбутадиена реакций (теплота реакции обра- принята равной теплоте реакции
образования гексахлорбензола):
Ф6= [ 1 000/ (2 • 3600) ] [285,62 • 0,096+91,48 • 0,138 +694,98 • 5,577+
+394,81 -2,399+1996,30(0,110+ 0,070) +730,20-0,061 +484,25-0,189+
+436,60 • 7,114] = [ 1000/ (2 3600) ] - 8464,54023= 1175,63 кВт.
Общий приход теплоты:
Фпри№ 13,25+0,75+6,68+0,53+4,14+1175,63=1200,98 кВт.
Количество веществ, испаряющихся в хлораторе (кг/ч):
эетрахлорметан — 231,1+817,94-57,7= 1106,7; тетрахлорэти-
лен— 17,9+1528,0=1545,9; гексахлорэтан — 268,9; гексахлор-
бутадиен— 131,6; гексахлорбензол — 51,8; трихлорэтилен —
12,6; трихлорметан—16,5; 1,2-дихлорэтан — 20,9+1083,4 =
= 1104,3.
Теплоту, расходуемую на испарение жидких компонентов,
определяют по формуле (51). Значения теплот испарения ком-
понентов находят по справочнику (см. Приложения, табл. 9),
теплоты испарения гексахлорбутадиена и гексахлорбензола
приняты равными теплоте испарения гексахлорэтана:
Ф7= [ 1 /(2 3600) ][ 1106,7 194,7 +1545,9 209,2 + (268,9 +131,6+ 51,8) • 215,5+
+ 12,6-239,3+16,5-248,3+1104,3 323,4=1 000590,17/(2-3600) = 138,97 кВт.
Тепловой поток продуктов реакций (поток 9; с целью упро-
щения расчета в поток «тетрахлорэтилен» включены гексахлор-
бензол, гексахлорбутадиен, гексахлорэтан, а в поток «хлор» —
азот, диоксид углерода и хлороводород):
ф3= [1/(2-3600)] [(83,2+150,0+ 283,4+ 3683,9) -0,693+3284,6-0,656+
+ (2,1 +1061,7+2,5) (37,21/71) + 3290,8 (30,63/36,5) ] 585=
= [8386,0426/(2-3600)] -585=681,36 кВт.
Принимают, что теплопотери в окружающую среду составля-
ют 5% от общего прихода теплоты:
Ф„от=0,05-1200,98=60,05 кВт.
Количество теплоты, отводимой охлаждающей водой, находят
6* 83
Рис. 5. Схема хлоратора (слева) и
распределение температур в стенке
(справа):
/р — температура реакционной зоны, i\ —
температура футеровки со стороны реакци-
онной зоны, — температура стальной
обечайки со стороны футеровки, /3 — тем
пература стальной обечайки со стороны
охлаждающей воды, tB — температура ох-
лаждающей воды, бф — толщина футеров-
ки; бст — толщина стальной обечайки;
£>Л-=2200 мм, £>_ =2800 мм, D„=2850 мм;
L>P«=2890 мм
из уравнения теплового баланса хлоратора:
Фэ= Фприх— ®7— Фз— Фпот= 1200,98—138,97—681,36—60,05=320,6 кВт
или Фд=320 600 Вт.
Рассчитывают расход воды на охлаждение наружной стен-
ки хлоратора. Принимают начальную температуру воды tK=
=20 °C и считают, что в процессе теплообмена температура
воды повысилась на 20 °C, тогда расход воды составит:
тв= Ф9/ (СвЛ/т))=320 600/ (4187 • 20 • 0,9) =4,254 кг/с,
где т] — к. п. д. рубашки хлоратора.
Расчет хлоратора
Цель расчета — определение температуры наружной поверхно-
сти стальной обечайки хлоратора.
Температура наружной поверхности обечайки хлоратора не
должна превышать 60—65 °C, что обеспечивает целостность
стальной обечайки. Схема хлоратора и распределение темпе-
ратур в его стенке показаны на рис. 5.
Значения температур ti, t2, t3 находят из соотношения
<р=«! (fP—б) = (Хф/5ф) (f i—f2) =а2 (f3—/в),
где <р — поверхностная плотность теплового потока, Вт/м2; си — коэффициент
теплоотдачи от реакционного газа (продуктов реакции) к футеровке хлора-
тора, Вт/(м2-К); а2— коэффициент теплоотдачи от наружной поверхности
хлоратора к охлаждающей воде, Вт/(м2-К); Хф—теплопроводность футеров-
ки, Вт/(м-К); 5ф—толщина футеровки, м.
Средняя разность температур теплоносителей составит:
Afc₽=585—(20+40)/2=585—30=555 °C; ДГС₽=555 К.
Коэффициент теплоотдачи от наружной поверхности хлоратора
84
к охлаждающей воде определяют по формуле (64):
a2=NuX/dSKB.
Теплофизические параметры охлаждающей воды при средней
температуре /в=30°С находят по справочнику (см. Приложе-
ния, табл. 16):
р=996 кг/м3; |1=804-10-6 Па-с;
Х=61,8-10-2 Вт/(м-К); Рг=5,42.
Площадь сечения кольцевого зазора между наружной по-
верхностью стальной обечайки и внутренней поверхностью ру-
башки хлоратора:
S=0,785(£)p2—Гн2) =0,785(2,892—2,852) =0,18 м2.
Линейная скорость охлаждающей воды в рубашке хлоратора:
И)=тв/(р5) =4,254/(996-0,180) =0,024 м/с.
Эквивалентный диаметр кольцевого зазора:
^экв=Рр—Гн=2,89—2,85=0,04 м.
Критерий Рейнольдса:
Re=wd3 кн р/р = (0,024 • 0,04 996) / (804 • 10~6)=1189.
Критерий Нуссельта находят по формуле [9, уравнение
(11-38)]:
Nu = 0,023Ее°-8Рг°'4 (Dp/Он) °-4S=0,023 1189°-3- 5,42°-4- (2,89/2,85) “«= 13,1.
Коэффициент теплоотдачи от наружной поверхности хлора-
тора:
а2=(13,1-61,8-10~2)/0,04=202,4 Вт/(м2-К).
Коэффициент теплоотдачи от реакционного газа (продуктов
реакции) к футеровке хлоратора:
«1=(1/к—2гст—1/Cfe)
Удельная плотность теплового потока с учетом 15 %-го запаса
составит:
<р= 1,15 Фд/f = (1,15 320 600) /70=5257 Вт/м2.
Коэффициент теплопередачи:
к=ф/Д7ср=5257/555=9,5 Вт/(м2-К).
Сумма термических сопротивлений стенок с учетом слоев за-
грязнений с обеих сторон:
Zk Гст—Г14"Гз + бф/Хф + бст/Я-ст,
где Г1=0,00009; г2= 0,00018 —сопротивления слоев загрязнений, м’-К/Вт
[9, табл. 15].
85
Для футеровки:
6ФАф=0,300/3,49=0,08596 м2-К/Вт;
для стальной стенки:
6ст/Хст=0,025/46,5=0,00054 м2 • К/Вт;
где Хф и ХСт—теплопроводность футеровки и стали, Вт/(м-К) [10, табл.
XXVIII]; 6Ф и SCT—толщина стенки обечайки и футеровки (см. рис. 5), м.
Гст=0,00009 +0,00018 +0,08596+0,00054=0,08677 м2-К/Вт.
Коэффициент теплоотдачи от реакционного газа к футеров-
ке реактора:
а,= (1/9,5—0,08677—1/202,4)-‘=73,8 Вт-м2/К.
Температура футеровки со стороны продуктов реакции:
f,=fP—<р/а,=585,0—5257/73,8=513,8 °C.
Температура внутренней поверхности стенки хлоратора:
12=fi—ф (6ф/Хф) =513,8—5257 (0,300/3,490) =61,9 °C.
Температура наружной стенки хлоратора:
fз=ф/a2+fB=5257,0/202,4+30=56,0 °C.
Такая температура соответствует оптимальному режиму ра-
боты.
ПОЛУЧЕНИЕ 1,2-ДИХЛОРЭТАНА
ОКСИХЛОРИРОВАНИЕМ ЭТИЛЕНА
В настоящее время основным способом производства винил-
хлорида-мономера из этилена является так называемый «сба-
лансированный» процесс с утилизацией хлороводорода, обра-
зующегося на стадии пиролиза 1,2-дихлорэтана. На стадии по-
лучения 1,2-дихлорэтана оксихлорированием этилен, воздух и
хлороводород подают в реактор с псевдоожиженным слоем
катализатора — А120з/5,5% (CuCl2-|-Cu2Cl2), где протекает це-
левая реакция:
СН2=СН2+0,5О2+2НС1 —> СН2С1—СН2С1+Н2О; — ДЯ°г98=239,19 кДж/моль.
Процесс ведут при температуре 210—230 °C, давлении
0,35—0,50 МПа и молярном отношении исходных веществ
СгН4 : О2 : НС1 = 1 : (0,75—0,80) : (1,85—1,90). Теплоту экзотер-
мических реакций отводят с помощью встроенного теплообмен-
ника, в котором из кипящего под давлением конденсата обра-
зуется водяной пар. В таких условиях степень конверсии эти-
лена достигает 98,0—98,5%, хлороводорода — 99,6—99,8%, вы-
ход 1,2-дихлорэтана в расчете на превращенный этилен состав-
ляет 94,0%. Описание технологической схемы см. [3, с. 254—
256, рис. 3.42; 4, с. 155, рис. 52].
86
рис. 6. Схема потоков реактора оксихлориро-
вания:
J — этилен; 2 — хлороводород; 3 — воздух; 4 — продук-
ты реакции; 5 — конденсат, 6 — пароводяная эмульсия
МАТЕРИАЛЬНЫЙ РАСЧЕТ
Исходные данные:
годовая производительность установки
в расчете на 100%-й 1,2-дихлорэтан
250 000 т;
годовой фонд рабочего времени 8000 ч;
потери 1,2-дихлорэтана на последую-
щих стадиях 2,5%;
степень конверсии этилена 0,983;
селективность по 1,2-дихлорэтану в расчете на этилен 0,940;
состав технического этилена [<р,- (хг), %]: метан—1,200; эти-
лен — 98,000; этан — 0,795; пропилен — 0,005;
степень конверсии хлороводорода 0,997;
состав технического хлороводорода [<pt (х£), % ] хлор — 0,20;
водород — 0,47; азот — 0,74; хлороводород — 98,16; этан —
0,24; тетрахлорэтилен — 0,10; 1,2-дихлорэтан — 0,09.
Последовательность расчета:
а) определяют расход технического этилена и его состав;
б) рассчитывают изменение состава газовой смеси в процессе окисли-
тельного хлорирования;
в) определяют расход хлороводорода и состав технического хлороводо-
рода;
г) рассчитывают расход воздуха;
д) уточняют состав продуктов окислительного хлорирования и состав-
ляют материальный баланс стадии.
Схема потоков стадии оксихлорирования приведена на рис. 6.
Часовая производительность установки по 100%-му 1,2-ди-
хлорэтану:
250 000-1000/8000=31 250 кг/ч.
В реакторе оксихлорирования необходимо получить 1,2-дихлор-
этана (с учетом потери 2,5% 1,2-дихлорэтана на последующих
стадиях):
(31 250-100)/(100,0—2,5) =32051 кг/ч или 32 051/99=323,747 кмоль/ч,
где 99— молярная масса дихлорэтана, г/моль
Расход этилена с учетом селективности процесса:
323,747/0,940=344,412 кмоль/ч.
В реактор оксихлорирования необходимо подать:
100%-го этилена с учетом степени конверсии:
344,12/0,983=350,368 кмоль/ч;
й/
технического этилена:
350,368/0,98=357,518 кмоль/ч.
Состав технического этилена по компонентам (поток
СН4 СгЩ с2нв СзНв X
Хг, % 1,200 98,000 0,795 0,005 100,000
пх, кмоль/ч 4,290 350,368 2,842 0,018 357,518
тх, кг/ч 68,6 9810,3 85,3 0,8 9965,0
и»., % 0,688 98,448 0,856 0,008 100,000
По целевой реакции
СН2=СН2+0,5О2+2НС1 —> С1СН2—СН2С1+Н2О I
образуется:
1,2-дихлорэтана: 323,747 кмоль/ч или 32 051,0 кг/ч;
водяного пара: 323,747 кмоль/ч или 5827,4 кг/ч;
расходуется:
этилена: 323,747 кмоль/ч или 9064,9 кг/ч;
хлороводорода: 2-323,747=647,494 кмоль/ч или 23 633,5 кг/ч;
кислорода: 0,5-323,747=161,874 кмоль/ч или 5180,0 кг/ч.
Расход этилена на побочные реакции:
344,412—323,747=20,665 кмоль/ч.
По реакции
СН2=СН2+ЗО2—»-2СО2+2Н2О 2
реагирует 63% этилена (по экспериментальным данным) от об-
щего его расхода на побочные реакции, что составляет:
0,63-20,665=13,019 кмоль/ч или 364,6 кг/ч.
Расходуется кислорода: 3-13,019=39,057 кмоль/ч или
1249,8 кг/ч.
Образуется:
диоксида углерода: 2-13,019=26,038 кмоль/ч или 1145,7 кг/ч;
водяного пара: 26,038 кмоль/ч или 468,7 кг/ч.
По реакции
СН2=СН2+2О2—*2СО+2Н2О 3
реагирует 30% этилена, что составляет:
0,3-20,665=6,200 кмоль/ч или 173,6 кг/ч;
расход кислорода: 2-6,200=12,400 кмоль/ч или 396,8 кг/ч;
образуется:
оксида углерода: 12,400 кмоль/ч или 347,2 кг/ч;
водяного пара: 12,400 кмоль/ч или 223,2 кг/ч.
88
По реакции
СН2=СН2+ЗНС1+2О2 —>С13С—СНО+ЗН2О 4
реагирует 4% этилена, что составляет:
0,04-20,665=0,826 кмоль/ч или 23,1 кг/ч;
расходуется:
хлороводорода: 3-0,826=2,478 кмоль/ч или 90,4 кг/ч;
кислорода: 2-0,826=1,652 кмоль/ч или 52,9 кг/ч;
образуется:
хлораля (трихлорацетальдегида): 0,826 кмоль/ч или 121,8 кг/ч;
водяного пара: 2,478 кмоль/ч или 44,6 кг/ч.
По реакции
СН2=СН2+ЗНС1+ 1,5О2 —> С1СН=СС12+ЗН2О Б
реагирует 2,5% этилена, что составляет:
0,025-20,665=0,517 кмоль/ч или 14,5 кг/ч;
расходуется:
хлороводорода: 3-0,517=1,551 кмоль/ч или 56,6 кг/ч;
кислорода: 1,5-0,517=0,775 кмоль/ч или 24,8 кг/ч;
образуется:
трихлорэтилена: 0,517 кмоль/ч или 68,0 кг/ч;
водяного пара: 1,551 кмоль/ч или 27,9 кг/ч.
По реакции
СН2=СН2+4НС1+2О2—* С12С=СС12+4Н2О 6
реагирует 0,5% этилена, что составляет:
0,005-20,665=0,103 кмоль/ч или 2,9 кг/ч;
расходуется:
хлороводорода: 4-0,103=0,412 кмоль/ч или 15,0 кг/ч;
кислорода: 2-0,103=0,206 кмоль/ч или 6,6 кг/ч;
образуется:
тетрахлорэтилена: 0,103 кмоль/ч или 17,1 кг/ч;
водяного пара: 0,412 кмоль/ч или 7,4 кг/ч.
Расход хлороводорода по реакциям 1, 4—6:
647,494 +2,478+1,551+0,412=651,935 кмоль/ч или 23 795,5 кг/ч.
Селективность процесса в расчете на хлороводород:
647,494/651,935=0,993 или 99,3%.
89
Расход хлороводорода с учетом его степени конверсии:
651,935/0,997=653,897 кмоль/ч или 23 867,2 кг/ч.
Остается хлороводорода в продуктах реакции:
653,897—651,935=1,962 кмоль/ч или 71,7 кг/ч.
Выход 1,2-дихлорэтана в расчете на поданный хлороводород:
647,494/653,897=0,99 или 99%.
Расход технического хлороводорода с учетом его состава:
653,897/0,9816=666,154 кмоль/ч.
Состав технического хлороводорода по компонентам (по-
ток 2):
С12 Н2 Na НС1 С2Н3 C2G4 C2H4CI2 X
Х„ % 0,20 0,47 0,74 98,16 0,24 0,10 0,09 100,00
n-t, кмоль/ч 1,332 3,131 4,929 653,897 1,599 0,666 0,600 666,154
tn-,, кг/ч 94,6 6,3 138,0 23 867,2 48,0 110,6 59,4 24 324,1
1,2-Дихлорэтан, присутствующий в техническом хлороводо-
роде, теряется на последующих стадиях.
По реакции
Н2+0,5О2 *=* Н2О 7
расходуется:
водорода: 3,131 кмоль/ч или 6,3 кг/ч;
кислорода: 0,5-3,131 = 1,565 кмоль/ч или 50,1 кг/ч;
образуется водяного пара: 3,131 кмоль/ч или 56,4 кг/ч.
Расход кислорода по реакциям 1—7:
161,874 + 39,057+12,400 +1,652+ 0,775 + 0,206+1,565=217,529 кмоль/ч
или 6961,0 кг/ч.
Расход кислорода с учетом коэффициента избытка воздуха:
217,529-1,25=271,911 кмоль/ч или 8701,2 кг/ч.
Остается кислорода в продуктах реакции:
271,911—217,529=54,382 кмоль/ч или 1740,2 кг/ч.
С воздухом поступает азота:
271,911-0,79/0,21=1022,903 кмоль/ч или 28 641,3 кг/ч,
где 0,79 и 0,21 — объемная (молярная) доля азота и кислорода в сухом
воздухе.
Всего подают воздуха (поток 3):
271,911 + 1022,903=1294,814 кмоль/ч или 37 342,5 кг/ч.
90
В продуктах реакции (с учетом состава потоков 1 и 2) со-
держится:
азота: 4,929+1022,903=1027,832 кмоль/ч или 28779,3 кг/ч;
этилена- 350,368—344,412=5,956 кмоль/ч или 166,7 кг/ч;
этана: 2,842+1,599=4,441 кмоль/ч или 133,3 кг/ч;
тетрахлорэтилена: 0,666+0,103=0,769 кмоль/ч или 127,7 кг/ч;
1,2-дихлорэтана:
323,747 + 0,600=324,347 кмоль/ч или 32110,4 кг/ч;
водяного пара (образуется по реакциям 1—7):
323,747+26,038+12,400+ 2,478+1,551+0,412+3,131 =369,757 кмоль/ч
или 6655,6 кг/ч.
Составляем материальный баланс стадии окислительного
хлорирования 1,2-дихлорэтана (табл. 15).
Таблица 15. Материальный баланс стадии окислительного хлорирования
Входит кмоль/ч кг/ч Выходит кмоль/ч кг/ч
Технический эти- Продукты реакции
лен (поток 1): (поток 4):
СН4 4,290 68,6 С12 1,332 94,6
С2Н4 350,368 9810,3 n2 1027,832 28779,3
C2HS 2,842 85,3 О2 54,382 1740,2
С2Не 0,018 0,8 со 12,400 347,2
со2 26,038 1,962 1145,7 71,7
Итог о... 357,518 9965,0 нс!
Технический хло- н2о 369,757 6655,6
роводород (поток сн4 4,290 68,6
2): С2Н4 5,956 166,7
С12 1,332 94,6 С2н6 4,441 133,3
н2 3,131 6,3 с3н6 0,018 0,8
n2 4,929 138,0 С2С14 0,769 127,7
НС1 653,897 23 867,2 С2Н4С12 324,347 32 110,4
C2Hs 1,599 48,0 СС13—сно 0,826 121,8
С2С14 0,666 110,6 СНС1=СС12 0,517 68,0
С2Н4С12 0,600 59,4
Итог о... 666,154 24 324,1
Воздух (поток 3):
n2 1022,903 28 641,3
О2 271,911 8701,2
Итог о... 1294,814 37 342,5
В с е г о... 2318,486 71631,6 В с е г о... 1834,867 71 631,6
91
Расчет основных расходных коэффициентов. Расходные ко-
эффициенты (в кг/кг) рассчитывают по данным табл. 15:
по этилену: 9810,3/32 051=0,306;
по хлороводороду: 23 867,2/32 051=0,745;
по техническому этилену: 9965,0/32 051=0,311;
по техническому хлороводороду: 24 324,1/32 051=0,759;
по воздуху: 37 342,5/32 051 = 1,165.
ТЕХНОЛОГИЧЕСКИЙ РАСЧЕТ РЕАКТОРА
Назначение, устройство и основные размеры.
Определение числа реакторов
Реактор представляет собой стальной вертикальный цилиндри-
ческий аппарат, футерованный изнутри торкретбетонным по-
крытием. Для равномерного распределения технологического
воздуха по сечению реактора в нижней части его предусмотре-
на сферическая тарелка с патрубками, направленными вниз.
Распределительное устройство для смеси этилена с хлороводо-
родом состоит из патрубков, направленных также вниз и вхо-
дящих в патрубки для воздуха. Таким образом достигают до-
статочной степени перемешивания реагентов и создают восхо-
дящий поток для образования псевдоожиженного слоя катали-
затора.
Для снятия избыточного тепла предусмотрен вертикальный
змеевик, в трубы которого подают циркулирующий (под дав-
лением) и частично испаряющийся водяной конденсат. В верх-
нюю часть реактора вмонтирован трехступенчатый циклон для
улавливания катализаторной пыли из газообразных продуктов
реакции.
Исходные данные:
температура процесса 220 °C;
давление в реакторе 5,0 МПа;
характеристика катализатора:
размер частиц по фракциям, мкм 250—190 190—85 85—45 45—30
w, % 50 43 3 4
плотность катализатора (кг/м3): частиц р=1750; насыпная
рн= 1050.
Площадь сечения реактора определяют из соотношения
S=VT/®p,
где S — площадь сечения реактора, м2; — объемный расход газовой смеси
в условиях процесса, м3/с; wv — рабочая скорость газовой смеси, м/с.
92
Объемный (усредненный) расход газовой смеси при тем-
пературе 273 К и давлении 101 325 Па:
Ио=[ (2318,486+1834,867) -22,4]/(2-3600) = 12,922 м3/с,
где 2318,486 и 1834,867 — количество газовой смеси иа входе и выходе,
кмоль/ч (см. табл. 15).
Объемный расход газовой смеси при температуре 220-{—
+ 273 = 493 К и давлении 500 000 Па:
VT= 12,922 (493-101 325)/(273-500 000) =4,73 м3/с.
Плотность газовой смеси в условиях процесса:
pr=mT/l/x=71 631,6/(3600-4,73)=4,21 кг/м3.
Рабочая скорость газовой смеси wp должна находиться в
пределах:
tt’Kp<Wp<Wy,
где wHp и wy — скорости начала псевдоожижения (критическая скорость) и
уноса частиц из зоны реакции, м/с.
Критическую скорость определяют по формулам [10,‘с. 102]:
^кр=КекрЦсМ/(рг</э); ReKp=Ar/(1400+5,22VAr);
Аг= [d33 рг ( р— pr) g] /Ц2см,
где da — эквивалентный диаметр частицы катализатора, м; рг — плотность
газовой смеси в условиях процесса, кг/м3; р — плотность частиц катализато-
ра, кг/м3; р.см—динамическая вязкость газовой смеси при температуре
220 °C, Па-с; ReKp— критерий Рейнольдса, соответствующий скорости псев-
доожижения; Аг — критерий Архимеда.
Средний эквивалентный диаметр частицы рассчитывают по
формуле
d3=(St«'i/dI-)-1,
где wt — массовая доля частиц определенного размера; d4 — среднеситовой
диаметр частиц определенной фракции.
Среднеситовой диаметр частиц катализатора, мкм:
d1= (250+190)/2=220,0; d2= (190+85)/2=137,5;
d3= (85+45)/2=65,0; d4= (45+30)/2=37,5.
d3= (0,50/220,0+0,43/137,5+0,03/65,0+0,04/37,5)-1=144 мкм.
Динамическую вязкость газовой смеси рассчитывают по фор-
муле (66); для упрощения расчета:
в поток «дихлорэтан» включают хлорорганические соеди-
нения, хлор и хлороводород:
ХС2Н4С12=0,04+0,05+0,03+0,11 + 0,07+17,68= 17,98 %;
в поток «метан» включают все углеводороды:
Хсн4=0,24+0,32+0,23=0,79%.
93
Таблица 16. Расчет динамической вязкости газовой смеси
Компонент Mf х£. доли ед. Ц2-107, Па-с (ЛГгхг/и,.)-10-’
n2 28 0,5602 15,686 253 0,06200
о2 32 0,0296 0,947 232 0,00408
со 28 0,0068 0,190 252 0,00075
со2 44 0,0142 0,625 234 0,00267
н2о 18 0,2015 3,627 168 0,02159
С2Н4С12 99 0,1798 17,800 143 0,12448
сн4 16 0,0079 0,126 166 0,00076
2 — 1,0000 33,001 — 0,21633
Динамическую вязкость компонентов газовой смеси при
температуре 220 °C находят по справочнику (см. Приложения,
табл. 11). Расчет динамической вязкости газовой смеси при-
веден в табл. 16.
Цсм= (39,001/0,21633) • 10-^=180-10-’’ Па-с.
Критерий Архимеда:
Аг= [ (144 • 10~6)3 4,21 • (1750,00—4,21) • 9,81 ] / (180 • 10~7) 2=664,5.
Критерий Рейнольдса, соответствующий скорости псевдоожи-
жения:
ReKP= 664,5/ (1400+5,22/664,5) =0,433.
Критическая скорость (скорость псевдоожижения):
Шкр= (0,433-180-10-7)/(4,21 • 144-10-6)=0,013 м/с.
Для расчета скорости уноса частиц wv используют следующее
соотношение [20, уравнение (1.26)]:
и’у/и’кр= (1400+ 5,22/Аг) / (18+0,61 /Аг).
wy= [0,013 (1400+5,22/664,5) ] / (18+0,61 /664,5) =0,592 м/с.
Условие образования псевдоожиженного слоя:
Wy/a»Kp=0,592/0,013=45,5,
что соответствует экспериментальным данным [20, с. 87].
Так как частицы катализатора достаточно мелкие, то для
осуществления процесса в реакторе диаметром 3,0—3,6 м
принимают число псевдоожижения Kw = 26. Рабочая скорость
катализатора:
£Ир=АгеШкР=26-0,013=0,34 м/с.
94
Порозность псевдоожиженного слоя находят по формуле
[20, уравнение (11.102]:
е= (ео4-О,9Да>)/(1 4-0,9Дда),
где во — порозность неподвижного слоя.
Для принятого катализатора:
е0=1—р„/р=1—1050/1750=0,4;
Дш=10р—wKP=0,340—0,013=0,327 м/с;
е= (0,44-0,9 • 0,327) / (1,04- 0,9 0,327) =0,48.
Действительная скорость газовой смеси в свободном сечении
слоя:
«1д=«|р/е=0,34/0,48=0,71 м/с.
Площадь сечения реактора:
5=4,73/0,34=13,9 м2.
Внутренний диаметр реактора (без футеровки):
D= 1,13/13^9=4,2 м.
Использовать для осуществления процесса реактор такого
диаметра нецелесообразно, так как сложно распределить вос-
ходящий газовый поток по его сечению. Принимают реактор
с внутренним диаметром обечайки Dy 3200 (ГОСТ 9617—76)
и толщиной футеровки 100 мм.
Диаметр реактора (в футеровке):
Г>Ф=3200—2-100=3000 мм.
Площадь сечения реактора:
51=0,785Р2ф=0,785-32=7,1 м2.
Число аппаратов, необходимое для обеспечения заданной про-
изводительности:
n=S/S1=13,9/7,l = l,96.
Таким образом, необходимо установить два реактора.
Тепловой расчет реактора
Исходные данные:
Материальные потоки (см. табл. 15): технический этилен —
357,518/(3600-2) =0,0497 кмоль/с; технический хлороводород —
666,154/(3600-2) =0,0925 кмоль/с; воздух — 37342,5/(3600-2) =
= 5,1865 кг/с; продукты реакции— 1834,867/(3600-2) =
= 0,2548 кмоль/с;
температура, °C: технического этилена—125; технического
хлороводорода—160; воздуха — 150; продуктов реакции — 220.
95
Цель расчета — определение количества теплоты, отводимой
кипящим конденсатом.
Уравнение теплового баланса в общем виде:
Ф1 + Ф24- Фд+ Ф4— ®в+ Фб+ Флот,
где Ф], Ф2, Ф3, Фз — тепловые потоки технического этилена, технического
хлороводорода, воздуха и продуктов реакции соответственно, кВт; Ф4—
теплота экзотермических реакций, Фз — теплота, отводимая кипящим конден-
сатом, кВт, ФПот—теплопотери в окружающую среду, кВт.
Для определения значений Фь Ф2, Ф5 рассчитывают сред-
ние молярные теплоемкости технического этилена при 7\ =
= 125+273=398 К, технического хлороводорода при Т’2=160+
-|-273=433 К и продуктов реакции при 73 = 220+273 = 493 К.
Значения теплоемкостей находят по справочнику (см. Прило-
жения, табл. 2—4). Для упрощения расчета в поток «дихлор-
этан» включены галогенсодержащие органические соединения,
а в поток «этилен» — пропилен.
Расчет средних молярных теплоемкостей:
хр % С-, Дя^(моль К) C.xJlOO, ДжДмоль К)
Технический этилен:
СН4 1,200 41,27 0,4952
С2Н4 98,005 53,88 52,8051
с2н6 0,795 66,28 0,5269
2 100,000 — 53,8272
Хлороводород: 35,80 0,0716
С12 0,20
н2 0,47 28,96 0,1361
n2 0,74 29,13 0,2156
НС1 98,16 29,10 28,5648
с2н6 0,24 70,72 0,1697
С2Н4С12 0,19 94,92* 0,1803
2 100,00 — 29,3381
Продукты реакции: 36,19 0,0253
С12 0,07
n2 56,02 29,98 16,7948
о2 2,96 31,58 0,9348
со 0,68 30,24 0,2056
со2 1,42 45,09 0,6403
НС1 о,н 29,25 0,0322
Н2О 20,15 35,42 7,1371
сн4 0,23 46,89 0,1078
с2н4 0,32 62,26 0,1992
с2н6 0,24 78,02 0,1872
С2Н4С12 17,80 101,40** 18,0492
2 100,00 — 44,3135
• Ст=0,9588*99=94.92 Дж/(моль К).
“ Ст~1,0242*99=101,40 Дж/(моль К).
96
Тепловые потоки:
технического этилена (поток 1):
©1=0,0497-53,8272-125=334,40 кВт;
технического хлороводорода (поток 2):
Ф2=0,0925-29,3381 • 160=434,20 кВт;
воздуха (поток 3):
Ф3=5,1865-1,019-150=792,76 кВт,
где 1,019 — удельная теплоемкость воздуха при 150 °C [9, приложение XIII]
продуктов реакции (поток 4):
©5=0,2548 44,3135 220=2484,04 кВт.
Рассчитывают теплоты
Реакция
СН2=СН2+0,5О2+2НС1->
->-СН2С1—СН2С1 + Н2О
СН2=С Н2+ЗО2-*-2СО2+2Н2О
СН2=СН2+2О2->2СО+2Н2О
СН2—С Н2+3 НС1+2О2—►
->-СС13—СНО+ЗН2О
СН2= СН2+ЗНС1 +1,5Ог->
->СНС1 = СС12+ЗН2О
СН2=СН2+4НС1+2О2->
->СС12=СС12+4Н2О
Н2+0,5О2ч^Н2О
реакций (в кДж/моль):
A/f029S = XA/f02gg(KOHj 2Д№258(исх)
—129,70 + (—241,81) —52,30—
—2(—92,31)=—239,19
2 (—393,51) +2 (—241,81) —52,30=
____1322 94
2 (—110,53) + 2 (—241,81) —52,30=
=—756,98
—273,83+3 (—241,81) —52,30—
—3(—92,31)=—774,63
—7,53+3 (—241,81) —52,30—
—3(—92,31)=—508,33
—15,06+4 (—241,81) —52,30—
—4 (—92,31) =—665,36
—241,81
Теплота экзотермических реакций:
Ф4= [ 1000/ (2 • 3600) ] (323,747 -239,19 +13,019 • 1322,94+6,200 756,98+
+0,826-774,63+ 0,517-508,33+ 0,103-665,36+3,131-241,81) =
= ( 1000 • 101 081,967) / (2 • 3600) = 14 039,16 кВт.
Общий приход теплоты:
ФпРях=334,40 +434,20+792,76+14 039,16= 15 600,52 кВт.
Принимают, что теплопотери в окружающую среду составля-
ют 5% от общего прихода теплоты:
ФЛот=0,05-15 600,52=780,03 кВт.
Определяют количество теплоты, отводимой кипящим конден-
сатом:
Фв=ФпРих— Ф6— Фпот=15600,52—2484,04—780,03=12336,45 кВт.
Составляют тепловой баланс реактора (табл. 17).
7—69
97
Таблица 17. Тепловой баланс реактора
Приход кВт % Расход кВт %
Тепловой поток тех- 334,40 2,1 Тепловой поток про- 2484,04 15,9
нического этилена д у кто в реакции
Тепловой поток тех- 434,20 2,8 Теплота, отводимая 12336,45 79,1
нического хлороводо- кипящим конденсатом
рода Теплопотери в окру- 780,03 5,0
Тепловой поток воз- 792,76 5,1 жающую среду
духа
Теплота экзотерми- 14 039,16 90,0
ческих реакций
В с е г о... 15600,52 100,0 В с е г о... 15 600,52 100,0
Расчет реактора
Исходные данные:
объемная скорость газовой смеси на входе УОб = 330 ч-1; тем-
пература, °C: процесса — 220; конденсата, поступающего на
охлаждение,— 170;
давление конденсата 0,8 МПа;
расположение змеевика — вертикальное.
Определяют: объемный расход газовой смеси на входе в
реактор:
VCM= (2318,486-22,4)/2=25 967 м3/ч,
где 2318,486 — расход газовой смеси, кмоль/ч (по данным табл. 15);
объем катализатора в реакторе:
Vk=1zcm/V'o6=25 967/330=78,7 м3,
высоту слоя катализатора в неподвижном состоянии:
/70=VK/Si=78,7/7,l = ll,l м,
где Si=7,l—площадь сечения реактора (рассчитано выше), м2,
высоту псевдоожиженного слоя:
Н=НВ(1 —во)/ (1—е) = 11,1 [ (1,00—0,40)/(1,00—0,48)] = 12,8 м,
степень расширения слоя:
т]о=Я/Я0= 12,8/11,1 = 1,15,
гидравлическое сопротивление слоя:
Дрсл= (1—Со) gHB= 1750 (1,0—0,4) • 9,81 11,1 = 114 336 Па.
98
Площадь поверхности теплообмена встроенного змеевика
определяют по формуле (62):
F=®J(K&Tcp).
Тепловая нагрузка на змеевиковый теплообменник (см.
табл. 17):
Фа= 12 336,45-103 Вт.
Средняя разность температур между газовой средой и кипя-
щим конденсатом:
AfCp=220—170=50 °C; Д7'сР=50К.
Коэффициент теплопередачи определяют по формуле (63):
к=(1/а1+2гст+1/а2)_1,
где си — коэффициент теплоотдачи от псевдоожиженного слоя к стенке тру-
бы змеевика, Вт/(м2-К); а2— коэффициент теплоотдачи от стенки трубы
змеевика к кипящему конденсату, Вт/(м2-К).
Максимальный коэффициент теплоотдачи от псевдоожи-
женного слоя к стенке трубы змеевика рассчитывают по фор-
муле
а1=Ми1см/«1э.
Удельная теплоемкость газовой смеси:
ссм=44,3135-1000/39,001 = 1136 Дж/(кг-К),
где 44,3135 — молярная теплоемкость газовой смеси, Дж/(моль-К);
39,001—средняя молярная масса газовой смеси, г/моль (рассчитаны ра-
нее).
Принимают критерий Прандтля для двухатомных газов Рг =
= 0,72 [10, с. 150], тогда теплопроводность газовой смеси
равна:
Хем=СсмЦсм/Рг= 1136• 180-10-70,72=0,0284 Вт/(м-К),
Критерий Нуссельта при движении газа через псевдоожижен-
ный слой определяют по формуле [15, уравнение (VI.38)]:
Nu (1-е) -1 [Хсм/(СсмРг) ] °-43=mCRe»-23 (ск/ссм) °-6 (р/рг) °-66,
где рг, р — плотность газовой смеси и частиц катализатора, кг/м3; m —
константа, равная 3,5-10—•; С — коэффициент; ск — удельная теплоемкость
катализатора, кДж/(кг-К).
Значение коэффициента С принимают равным 1,47 [15,
с. 135], значение удельной теплоемкости катализатора — по
каолину: ск=920 Дж/(кг-К) [10, табл. XXV].
Критерий Рейнольдса:
Re= щРйэРг/|Лсм=0,34 • 0,72-10~3 • 4,21 / (180 • 10~7) =55,8.
Nu= (1,00—0,48)-> [0,0284/(1136 • 4,21) ]t’.43=3,5 • 10-4 • 1,47 • 55,8°-23 X
Х(920/1136)°-8(1750/4,21)0-66 ; 0,0109Nu=0,0598; Nu=5,5.
«! =5,5-0,0284/(0,72-10~3) =216,9 Вт/(м2-К).
7
99
Коэффициент теплоотдачи от стенки трубы змеевика к ки-
пящему конденсату рассчитывают по формуле, полученной на
базе уравнения [15, уравнение (VI.61)]:
а2=97,3ро>53 (Zcr(2)—<к)2,зэ,
где р—давление кипящей воды (конденсата) при температуре 170 °C, рав-
ное 0,8 МПа (см. Приложения, табл. 13).
Принимают следующие обозначения:
t\ — температура псевдоожиженного слоя;
^ст(1> — температура стенки со стороны псевдоожиженного слоя;
/Ст<2)— температура стенки со стороны кипящего конденсата;
tK — температура конденсата.
Д1сЛ=Й---^CT(1)J Д1ст=1ст(1)—^ст(2)1 Д^к==^ст(2)
а2=97,3 0,80-58Д<к2,33=85,5Д£к2,33.
Записывают систему уравнений:
СС1Д/сл=Д^ст/2^» f ct=CC2^^<> (О
Д^ср=Д7'ср=Д^сл_1'Д^ст4_Д^к. (2)
Сумма термических сопротивлений стенки с учетом сопротив-
лений слоев загрязнений с обеих сторон:
V
Гст=Г1 + Г2 + Г з,
где и, г2 — термическое сопротивление слоев загрязнений со стороны газовой
смеси и водяного пара соответственно, м2-К/Вт; г3 — термическое сопротив-
ление стенки, м2-К/Вт.
/•1= 1/11 600=0,00009 м2-К/Вт;
г2=1/5800=0,00017 м2-К/Вт;
г3=0,011/17,5=0,00063 м2-К/Вт,
где 0,011—толщина стенки трубы змеевика, м; 17,5 — теплопроводность
нержавеющей стали, Вт/(м-К) [10, табл. XXVIII].
2 гст= 0,00009+0,00017+0,00063=0,00089 м2 • К/Вт.
Подставляют значения ai, 2гст> а2, &Тср в уравнения (1) и
(2):
216,9Д^л=Д1ст/0,00089=85,5Д1к2-33; (1')
Д/сл+Д/ст+Д^к=50; (2)
Д(сл= (85,5/216,9)Д1к2-33=0,396Д<к2-33;
Д?ст=0,00089 • 85,5ДЛЛ33=0,076Д/к2-33.
Подставляют значения А/Сл и Л/ст в уравнение (2х):
0,396Д1к2-33+0,076Д^2-33+Д^=50;
0,472Д1к2-33+Д1к—50=0.
Принимают Д//к=5,0°С, тогда
«д=0,472 5,02-33+5,0—50,0=—24,930249.
100
Принимают Д/"к=8,0вС, тогда
#2=0,472 • 8,02’33+8,0—50,0= 17,998704.
ДГК—Д/'к
Д/к = ДГ'К - —к- — #2 =
Уг— У1
8,00 — 5,00
#=0,472-6,742-33 + 6,74—50,0=—3,0.
Методом последовательного приближения получают Д/к=
= 6,94 °C при у=0.
Коэффициент теплоотдачи:
а2=85,5-6,942-33=7804 Вт/(м2-К).
Коэффициент теплопередачи:
к= (1/216+ 0,00089+1/7804)-'=177 Вт/(м2-К).
Площадь поверхности теплопередачи:
F= 12 336 450/(177-50) = 1394 м2.
Площадь поверхности теплопередачи принимают с запасом
15%:
Fa= 1,15-1394 = 1600 м2.
Длину трубы змеевика принимают равной высоте псевдоожи-
женного слоя 1=Н= 12,8 м, тогда число труб в змеевике:
п=Fa/ (raW) = 1600/ (3,14 • 0,122 • 12,8) = 326.
Количество образующегося водяного пара:
/пп=ФаТ]/г=12 336 450-0,9/(2057-103)=5,4 кг/с или 5,4-3600=19 440 кг/ч,
где г — удельная теплота парообразования; ц —к. п. д. змеевика.
При давлении 0,8 МПа г=2057-103 Дж/кг (см. Приложе-
ния, табл. 13); принимают т] = 0,9.
Принимают, что в водяной пар (р = 0,8 МПа, /=170 °C)
превращается 10% циркулирующего в системе конденсата,
следовательно, расход конденсата составит:
тк= 19 440-100/10=194 400 кг/ч или VK= 194 400/897=217 м3/ч,
где 897 — плотность конденсата иа линии насыщения при температуре 170 ’С,
кг/мз (см. Приложения, табл. 16).
Выходящая из встроенного змеевика пароводяная эмульсия
с температурой 170 °C поступает в паросборник, предназна-
Рис. 7. Циклон НИИОГАЗ:
Н — высота общая, hi — высота входного патрубка; йа — вы-
сота выходной трубы, Из — высота цилиндрической части;
h4 — высота конической части Di — диаметр выходной тру-
бы, b — ширина входного патрубка
ченный для сбора конденсата и отделения
от него пара. Пар, имеющий давление
0,8 МПа, используется на установке, кон-
денсат с помощью насоса возвращают в
змеевик реактора. В паросборник подают
химически очищенную воду, а часть конден-
сата выводят из системы для предотвраще-
ния загрязнения системы охлаждения ре-
актора.
Номинальную вместимость паросборни-
ка рассчитывают по формуле (67):
Гном= ККТТ]/(р.
Принимают время заполнения паросборни-
ка конденсатом т=3 мин, степень заполне-
ния <р=0,8; коэффициент запаса т] = 1,15,
тогда
Июм=217,0 • 3,0 • 1,15/ (0,8 • 60)=15,6 м3.
Принимают по ГОСТ 9931—79 цилиндрический стальной ап-
парат со следующей технической характеристикой [21, табл.
16.2]:
Тип
Вместимость
номинальная, м3
Вертикальный Диаметр обечайки внут- 2000
с двумя эллипти- ренний, мм
ческими днищами Высота цилиндрической 4430
(ВЭЭ), исполне- части, мм
ние 1, теплоизоли- Рабочее давление, МПа 0,8—1,0
рованный Рабочая температура, °C 170—190
16
Расчет циклона
Циклон смонтирован в верхней части реактора оксихлориро-
вания и предназначен для отделения частиц катализатора,
увлекаемых восходящим потоком газовой смеси. Расчет ведут
на основе данных, полученных ранее при определении основ-
ных характеристик псевдоожиженного слоя.
Выбирают для расчета циклон НИИОГАЗа типа ЦН-15
(рис. 7) с основными параметрами [10, табл. 3.1]:
Диаметр аппарата D
Диаметр выходной трубы 0,600
О,
Ширина входного патруб- 0,280
ка b
Высота входного патрубка 0,660
Высота выходной трубы Ла 1,740
102
Высота цилиндрической
части /1з 2,26 О
Высота конической части /ц 2,00 0
Общая высота циклона Н 4,38 D
Коэффициент сопротивле- 160
ния go
Принимают скорость входа газовой смеси в циклон гивх=
= 15 м/с (см. Приложения, табл. 18), тогда площадь сечения
входного патрубка составит:
Sn=bh!= Vx/(nwBX) =4,73/(2-15) =0,158 м2,
где п—2 — число реакторов оксихлорирования.
Определяют ширину входного патрубка:
6,= (0,66/0,28) b=2,3486; Sn=2,34862;
6=V0,158/2,348=0,259 м.
Ориентировочное значение диаметра циклона:
2)ц= (1/0,28)6=3,846- 0,259=0,925 м.
Полученное значение диаметра циклона проверяют по фор-
муле
Da=DT/ (1—10 Woc/Wr) ,
где Рт— наружный диаметр выхлопной трубы циклона, м; wOc—скорость
осаждения частиц катализатора, м/с; wr — скорость газовой смеси, м/с.
Скорость осаждения частиц определяют по формуле [10, урав-
нение (3.5, а)]:
Woc=y [LypCM(p— Pr)g]/Pr2,
где Ly — критерий Лященко; ЦСм—динамическая вязкость газовой смеси,
определена ранее и составляет рсм=180-10~7 Па-с; р и рг — плотность
частиц катализатора и газовой смеси, определены ранее и составляют р=
= 1750 кг/м3 и рг=4,21 кг/м3 соответственно; g—ускорение свободного па-
дения, м/с2.
По найденному ранее значению критерия Архимеда Аг=
= 664,5 определяют критерий Лященко по диаграмме [10,
рис. 3.1] : Ly=8.
Юос=><[8-180-10~7- (1750,00 —4,21) -9,81]/4,212= 0,518 м/с.
Диаметр выходной трубы:
£>1=0,6Оц=0,6-1,030=0,618 м.
При принятой толщине стенки трубы 5 мм наружный диаметр
выходной трубы:
От=0,618 +0,005-2=0,628 м.
Скорость в циклоне обычно составляет 12—14 м/с. Принимают
wr=13,5 м/с; тогда диаметр циклона
£>ц=0,628/ (1—10 • 0,518/13,5) = 1,02 м.
Принимают Дц=1,03 м (1030 мм).
Скорость газовой смеси в выходной трубе:
шт = Ут/ (п• 0.785D12) = 4,73/ (2 - 0,785 • 0,6182) = 7,9 м/с,
что допустимо (обычно twT=4—8 м/с).
103
Условная скорость газовой смеси шц, отнесенная к площа-
ди сечения цилиндрической части циклона:
Юц=у%/(п-0,7850ц2) =4,73/(2-0,785-1,ОЗ2) =2,84 м/с,
что допустимо (обычно шц=2,5—4,0 м/с).
Высота цилиндрической части циклона:
Лз=2,26-1,03=2,33 м.
Высота конической части циклона:
/14=2,00-1,03=2,06 м.
Гидравлическое сопротивление циклона рассчитывают по
формуле [10, уравнение (3.12)]:
Др=^о®ц2рг/2=160 2,84!-4,21/2=2716 Па.
Для эффективной очистки газовой смеси от уносимых частиц
катализатора в каждом реакторе оксихлорирования преду-
сматривают три циклона, соединенные последовательно.
ПРОЦЕССЫ АЛКИЛИРОВАНИЯ
Увеличение темпов роста производства алкилароматических
углеводородов во всем мире обусловлено растущей потреб-
ностью в получаемых на их основе пластических массах, син-
тетических каучуках, детергентах и других продуктах Поэто-
му каталитическое алкилирование бензола олефинами зани-
мает одно из ведущих мест в процессах основного органиче-
ского и нефтехимического синтеза. На производство этилбен-
зола (ЭБ) в СССР расходуется около 35% от общего потреб-
ления бензола.
Основным промышленным методом получения этилбензола
является каталитическое алкилирование бензола этиленом
(этиленовой фракцией), протекающее по реакции:
CeHe+CH2=CH2—>C6H5C2HS, —Д//°29з=113,81 кДж/моль.
Аппаратурное оформление процесса зависит от агрегатно-
го состояния реагирующих веществ.
ПОЛУЧЕНИЕ ЭТИЛБЕНЗОЛА В ПРИСУТСТВИИ
ХЛОРИДА АЛЮМИНИЯ
Выбранная для расчета технологическая схема получения
этилбензола включает следующие основные стадии:
1) подготовка сырья (осушка бензола и очистка этилено-
104
вой фракции от серосодержащих органических соединений и
ацетилена);
2) алкилирование бензола этиленовой фракцией и нейтра-
лизация полученного алкилата;
3) улавливание бензола из отходящих газов с возвратом
жидкого бензола в реактор алкилирования;
4) ректификация этилбензола-сырца.
Алкилирование ведут при температуре 90—100 °C и не-
большом избыточном давлении до 0,2 МПа. Теплота экзотер-
мических реакций алкилирования расходуется на подогрев
вводимого в реактор алкилирования сырья до температуры
реакции. Избыточная теплота отводится за счет испарения
части бензола.
Молярное отношение бензол: этилен составляет (2,8—
3,3) : 1 без учета бензола, возвращаемого со стадии улавли-
вания Кроме целевой реакции, протекают побочные реакции
образования диэтилбензола (ДЭБ) и полиалкилбензолов.
С целью снижения выхода побочных продуктов в реактор-
алкилирования возвращают ДЭБ со стадии ректификации,
который вступает в реакцию переалкилирования:
CeH4(C2Hs)2+C6H6 —► 2С6Н5С2Н5.
В этих условиях селективность по этилбензолу в расчете
на этилен составляет 76—78%.
Описание технологической схемы см. [3, с. 135].
МАТЕРИАЛЬНЫЙ РАСЧЕТ
Исходные данные:
годовая производительность в расчете на 100%-й этилбензол
150 000 т;
годовой фонд рабочего времени 8000 ч;
состав этиленовой фракции [<р«(х»), %]: СН4—15,8; С2Н2—
0,2; С2Н4 —55,0; С2Н6—16,9; С3Н6 —6,0; Н2— 1,3; N2 —3,5;
О2 — 0,7; СО —0,6;
селективность по этилбензолу в расчете на этилен 0,78;
количество диэтилбензола, возвращаемого со стадии ректифи-
кации 250 кг на 1 т получаемого этилбензола;
молярное отношение бензол: этилен на входе в реактор (без
учета циркулирующего бензола, возвращаемого со стадии
улавливания) 3:1;
расход хлорида алюминия 10 кг на 1 т образующегося этил-
бензола;
потери этилбензола на стадиях выделения 3%.
Последовательность расчета:
а) определяют расход компонентов этиленовой фракции на входе в
реактор алкилирования;
105
б) рассчитывают расход бензола, катализатора и количество диэтилбен-
зола, возвращаемого в реактор алкилирования со стадии ректификации;
в) определяют состав отходящих газов;
г) рассчитывают состав алкилата;
д) выполняют тепловой расчет реактора, определяют количество испа-
ряющегося бензола и составляют обобщенный материальный баланс стадии
алкилирования
Часовая производительность стадии алкилирования по
100 %-му этилбензолу:
(150 000-1000/8000) [(100+3)/100] =19 312 кг или 19 312/106=182,189 кмоль/ч.
Расход этилена с учетом селективности процесса:
182,189/0,78=233,576 кмоль/ч.
Определяют расход этиленовой фракции, учитывая объемную
долю этилена:
233,576/0,55=424,684 кмоль/ч.
Рассчитывают состав этиленовой фракции:
% кмоль/ч тх, кг/ч
сн4 15,8 67,100 1074
С2Н2 0,2 0,849 22
С2Н4 55,0 233,576 6540
с2н6 16,9 71,772 2153
с3н6 6,0 25,481 1070
н2 1,3 5,521 11
n2 3,5 14,864 416
о2 0,7 2,973 95
со 0,6 2,548 71
2 100,0 424,684 11452
Молярное отношение бензол : этилен на входе в реактор
равно 3:1, следовательно, расходуется бензола:
233,576-3=700,728 кмоль/ч или 54 657 кг/ч.
Массовая доля воды в бензоле после азеотропной осушки со-
ставляет 0,002%, следовательно, с бензолом поступает воды:
54 657-0,002/(100,000—0,002) «1 кг/ч или 0,056 кмоль/ч.
Расход алюминийхлорида:
10-19 312/1000=193 кг/ч или 1,446 кмоль/ч.
Количество диэтилбензола, возвращаемого со стадии рек-
тификации:
250-19 312/1000=4828 кг/ч или 36,030 кмоль/ч.
Для определения состава отходящих газов рассчитывают
содержание в них хлороводорода, этилена, бензола, оксида
106
углерода. Метан, этан, водород, азот и кислород, входящие в
состав этиленовой фракции, переходят в отходящие газы пол-
ностью. Влага в составе бензола взаимодействует с хлоридом
алюминия по реакции:
А1С13+ЗН2О А1 (ОН) 3+ ЗНС1,
при этом реагирует хлорида алюминия:
0,056/3=0,019 кмоль/ч или 3 кг/ч.
Образуется:
гидроксида алюминия: 0,019 кмоль/ч или 2 кг/ч;
хлороводорода: 0,056 кмоль/ч или 2 кг/ч.
В отходящие газы переходит (по экспериментальным дан-
ным) :
1% подаваемого этилена:
233,576-0,01=2,336 кмоль/ч или 65 кг/ч;
90% подаваемого оксида углерода:
2,548-0,9=2,293 кмоль/ч или 64 кг/ч;
0,3 кг бензола на 1 т этилбензола:
0,3 19 312/1000=6 кг/ч или 0,077 кмоль/ч.
Состав отходящих газов:
кмоль/ч х,. % тх, Ki
сн4 67,100 40,2 1074
с2н4 2,336 1,4 65
с2н6 71,772 43,0 2153
С6Н6 0,077 См.* 6
н2 5,521 з.з И
n2 14,864 8,9 416
о2 2,973 1,8 95
со 2,293 1,4 64
НС1 0,056 См.* 2
2 166,992 100,0 3886
• В связи с малыми значениями х с6Нв (0.046%> и хНС1
(0.034%) в дальнейших расчетах их не учитывают.
Для определения состава алкилата рассчитывают измене-
ние состава сырьевой смеси в процессе алкилирования.
По реакции переалкилирования:
СбН5—(С2Н6)2+С6Н6—>2С6Н5—C2HS 1
расходуется бензола: 36,030 кмоль/ч или 2810 кг/ч;
образуется этилбензола: 36,030-2=72,060 кмоль/ч или
7638 кг/ч.
107
Следовательно, алкилированием бензола получают этилбен-
зола:
182,189—72,060=110,129 кмоль/ч или 11 674 кг/ч.
По целевой реакции
CeHe+CJHi—>СВНВ—С2НВ 2
расходуется:
бензола: 110,129 кмоль/ч или 8590 кг/ч;
этилена: 110,129 кмоль/ч или 3084 кг/ч.
По реакции
С6Н6+2С2Н4 —* СвН4— (С2Н6) 2 3
расходуется:
38,2% от поступающего этилена, что составляет:
0,382-233,576=89,226 кмоль/ч или 2498 кг/ч;
бензола: 0,5-89,226=44,613 кмоль/ч или 3480 кг/ч;
образуется диэтилбензола: 44,613 кмоль/ч или 5978 кг/ч.
По реакции:
СвНб+ЗС2Н4—>-СвНз— (C2HS)3 4
расходуется:
11 % от поступающего этилена, что составляет:
0,11-233,576=25,693 кмоль/ч или 719 кг/ч;
бензола: 25,693/3=8,564 кмоль/ч или 668 кг/ч.
образуется триэтилбензола: 8,564 кмоль/ч или 1387 кг/ч.
По реакции
СвНв+4С2Н4—»• СВН2—— (СгНв)4 5
расходуется:
этилена (с учетом его расхода по реакциям 2—4 и содер-
жания в отходящих газах):
233,576—110,129—89,226—25,693—2,336=6,192 кмоль/ч или 174 кг/ч;
бензола: 6,192/4=1,548 кмоль/ч или 120 кг/ч;
образуется тетраэтилбензола: 1,548 кмоль/ч или 294 кг/ч.
По реакции
СвНв-1-С3НВ —► CfiHj—С3Н7 6
расходуется:
пропилена: 25,481 кмоль/ч или 1070 кг/ч;
бензола: 25,481 кмоль/ч или 1988 кг/ч;
108
образуется изопропилбензола: 25,481 кмоль/ч или 3058 кг/ч.
По реакции
2С6Нв+С2Н2-^(С6Н6)2—С2Н4 7
расходуется:
ацетилена: 0,849 кмоль/ч или 22 кг/ч;
бензола: 2-0,849=1,698 кмоль/ч или 132 кг/ч;
образуется дифенилэтана: 0,849 кмоль/ч или 154 кг/ч.
По реакции
2С6Н6+СО-^ (С6Н5)2—СНОН
8
расходуется:
оксида углерода: 2,548—2,293=0,255 кмоль/ч или 7 кг/ч;
бензола: 2-0,255=0,510 кмоль/ч или 40 кг/ч;
образуется дифенилкарбинола 0,255 кмоль/ч или 47 кг/ч.
Общий расход бензола по реакциям 1—8 составляет:
110,129+36,030+44,613+8,564+1,548+25,481 +1,698+0,510=
=228,573 кмоль/ч или 17 828 кг/ч.
В составе отходящих газов содержится бензола: 0,077 кмоль/ч
или 6 кг/ч.
Остается в составе алкилата:
бензола: 700,728—228,573—0,077=472,078 кмоль/ч или 36823 кг/ч;
хлорида алюминия: 1,446—0,019=1,427 кмоль/ч или 190 кг/ч.
Состав алкилата:
nv кмоль/ч х,- % mv кг/ч а>1. %
С6Н6 472,078 64,0 36 823 54,8
С6Н5—С2Н5 182,189 24,7 19 312 28,7
C6H4-(C2H5)S 44,613 6,1 5978 8,9
С6Н3-(С2Н5)з 8,564 1,2 1387 2,1
С6Н2—(С2Н5)4 1,548 0,2 294 0,4
с6н5—С3Н7 25,481 3,5 3058 4,5
(С6Н5)2-СНСНз 0,849 0,1 154 0,2
(С6Н5)2—СНОН 0,255 См.* 47 0,1
А1С13 1,427 0,2 190 0,3
А1(ОН)з 0,019 См.* 2 См.*
2 737,023 100,0 67 245 100,0
* В связи с малыми значениями *<свн5)2снон
ьейших расчетах их не учитывают.
(0,0023) н *A|(OH)j
(0,0002%) в даль-
Состав алкилата соответствует оптимальному технологиче-
скому режиму [4, с. 255].
109
Расчет основных расходных коэффициентов. Определяют
расходные коэффициенты (в кг/кг):
по бензолу. (17 828+6)/19 312=0,923;
по этилену: 6540/19 312=0,339;
по этиленовой фракции. 11 452/19 312=0,593,
где 17 828 — расход бензола по реакциям 1—8 кг/ч; 6 — потери бензола с от-
ходящими газами, кг/ч, 19 312 — производительность стадии алкилирования
по 1ОО°/о-му этилбензолу, кг/ч, 6540 и 11 452 — расход этилена и этиленовой
фракции соответственно, кг/ч.
ТЕХНОЛОГИЧЕСКИЙ РАСЧЕТ АЛКИЛАТОРА
Назначение, устройство и основные размеры.
Определение числа алкилаторов
В качестве основного аппарата—алкилатора — принят вер-
тикальный цилиндрический полый аппарат со сферическими
днищами, выполненный из углеродистой стали. Внутренняя
поверхность аппарата футерована кислотоупорной плиткой.
Сферические днища крепятся к обечайке при помощи плоских
приварных фланцев с уплотнительной поверхностью типа
«выступ — впадина». Реактор заполнен смесью бензола с про-
дуктами реакции и жидким алюминиевым комплексом (ЖАК).
Исходное сырье (свежий и возвратный бензол, этиленовая
фракция, возвратный диэтилбензол и ЖАК) подают в нижнюю
часть алкилатора через распределительный коллектор Dy 500,
ру 1,6. Жидкие продукты (алкилат) отводят через один из
боковых штуцеров Dy 150, ру 1,6. Парогазовая смесь выводит-
ся через штуцер Dy 400, ру 1,6 в верхнем днище аппарата.
Избыточное тепло отводится за счет испарения части бен-
зола при температуре 90 °C, т. е. процесс ведут при кипении
реакционной массы.
Техническая характеристика алкилатора:
Диаметр стальной обечайки внутренний, мм 2400 Вместимость аппарата, м3: полная 50
Толщина стенки обечайки, 14 полезная 38±2
мм Толщина футеровки, мм Высота цилиндрической ча- 80 11800 Производительность по этилбензолу в расчете на 1 м3 алкилатора, кг/ч 180-200
сти, мм
Высота общая, мм 15 000
Число аппаратов для обеспечения заданной производитель-
ности (при минимальной вместимости алкилатора):
я= 19 312/ [ 180 (38,0—2,0) 1 =2,98.
Таким образом, необходимо установить три аппарата, соеди-
ненные параллельно.
но
Тепловой расчет алкилатора
Исходные данные:
материальные потоки, кмоль/с: этиленовая фракция —
424,684/(3-3600) =0,0393; технический бензол — 700,728/(3-
-3600) =0,0649; диэтилбензол — 36,030/(3-3600) =0,0033; отхо-
дящие газы—166,992/(3-3600) =0,0155; жидкий алкилат —
737,023/(3-3600) =0,0682;
состав материальных потоков см. Материальный расчет; тем-
пература, °C: на входе в алкилатор — 20; на выходе из алки-
латора— 90.
Цель теплового расчета — определение количества испарив-
шегося бензола в алкилаторе.
Уравнение теплового баланса аппарата в общем виде:
Ф1+ Ф2+ Фз+ Ф4=Фз+ Фс+ Ф?+ Фв+ Фпот,
где Фь Ф2, Ф3, Ф5, Ф6, Ф7 — тепловые потоки этиленовой фракции, жидкого
бензола, диэтилбензола, отходящих газов, алкилата и паров бензола соот-
ветственно, кВт, Ф4— теплота экзотермических реакций, кВт; Ф8 — расход
теплоты на испарение бензола, кВт; Флот — теплопотери в окружающую среду,
кВт.
Для определения значений Ф1 и Ф5 рассчитывают средние
молярные теплоемкости этиленовой фракции при температуре
20+273=293 К и отходящих газов при 90+273=363 К.
Расчет средних молярных теплоемкостей:
хг. % Се Дж/(моль К) С^/100, Дж/(моль-К)
Этиленовая фракция:
СН4 15,8 34,70 5,4826
С2Н2 0,2 43,70 0,0874
С2Н4 55,0 43,82 24,1010
С2Н6 16,9 52,09 8,8032
С3Н6 6,0 63 55 3,8130
н2 1.3 28,82 0,3747
n2 3,5 29,13 1,0196
О2 0,7 28,06 0,1964
со 0,6 29,07 0,1744
S 100,0 — 44,0523
Отходящие газы:
СН4 40,2 39,12 15,7262
с2н4 1,4 50,62 0,7087
С2Н6 43,0 61,69 26,5267
н2 3,3 28,84 0,9517
n2 8,9 29,43 2,6193
о2 1,8 29,83 0,5369
СО 1,4 29,55 0,4137
2 100,0 — 47,4832
Тепловой поток этиленовой фракции:
Ф1=0,0393-44,0523-20=34625 кВт.
Ill
Тепловой поток отходящих газов:
Ф5=0,0155-47,4832-90=66,239 кВт.
Тепловой поток технического бензола:
Ф2= (0,0649+л0) -134,218-20=174,215 + 2684,36пв кВт,
где по — количество циркулирующего бензола в системе холодильник-конден-
сатор — алкилатор, кмоль/с.
Определяют тепловой поток диэтилбензола; значение мо-
лярной теплоемкости диэтилбензола находят по справочни-
ку (см. Приложения, табл. 6):
Ф3=О,ООЗЗ-369,06-20=24,358 кВт.
Рассчитывают теплоты реакций 1—7 (в кДж/моль):
Реакция
СбНе+C2H4->CeHs—С2Н5
С6Н4— (C2H6)2+C6H^2Q;Hs—С2НВ
С6Н6+2С2Н4->С6Н4(С2Н5)2
СбНб+ЗСгН^СвНИСзНф
С6Н6+4С2Н4->СвН2(С2Н5)4
СбНв+ СзНв-^СбНз—С3Н7
2С6Н6+С2Н2->(С6Н5)2С2Н4
2С6Н6+СО->(С6Н5)2СНОН
AWj298—SAH°2Sg(KOKj SA HIJ2gfi(HCX)
—12,48—49,03—52,30=-----113,81
2 (— 12,48) —49,03— (—72,35) =—1,64
—72,35—49,03—2 • 52,30=—225,98
—122,63—49,03—3 -52,30=—328,56
—174,54—49,03—4 -52,30=—432,77
—41,24—49,03—20,41 =—110,68
297,31 —2 - 49,03—226,75=—27,50
—46,17—2 • 49,03— (—110,53) =—33,70
Рассчитывают теплоту экзотермических реакций по фор-
муле (49):
Ф4= [1000/ (3-3600)1 (110,129 -113,81+36,030 -1,64+44,613-225,98+
+8,564-328,56+1,548-432,77 + 25,481 • 110,68+ 0,849-27,50+0,255-33,70) =
= 1000 • 29 010,4103/(3- 3600) =2686,149 кВт.
Общий приход теплоты:
фпрЯх=34,625 +174,215+2684,36пб+24,358+ 2686,149=
= (2919,347+2684,36л0) кВт.
Для определения теплового потока алкилата рассчитывают
его среднюю молярную теплоемкость при температуре 363 К
(см. состав алкилата):
Ст= 152,07 • 0,64+186,56 • 0,247 + 369,06 • 0,061 +464,46 • 0,012+559,86 • 0,002+
+321,36 0,035+415,94 • 0,001 + 94,48 0,002= 184,465 Дж/(моль К).
Тепловой поток жидкого алкилата:
Фв=0,0682-184,465-90=1132,246 кВт.
Тепловой поток паров бензола:
Ф7= 101,77-90лв=9159,Зл6 кВт.
Расход теплоты на испарение бензола:
Фв 78-391,3/16=30521,4по кВт,
112
где 391,3 — удельная теплота испарения бензола при темпера-
туре 363 К, кДж/кг [22, с. 342].
Принимают, что теплопотери в окружающую среду составля-
ют 3% от общего прихода теплоты:
Фпот=0,03 (2919,347 + 2684,Збив) =87,580+80,53/гв кВт.
Общий расход теплоты:
Фрасх=66,239+1132,246+9159,30Яб+30 521,40пв+87,580+80,53л6=
= 1286,065+39 761,23/гв кВт.
Количество циркулирующего бензола находят из условия
равенства прихода и расхода теплоты:
2919,347+ 2684,36ne= 1286,065+39 761,23/г6;
37 076,87/16=1633,282; /г6=0,04405 кмоль/с.
Количество бензола, испаряющегося на стадии алкилирова-
ния:
0,04405-3-3600=475,740 кмоль/ч или 37 108 кг/ч,
что составляет 37,108/19,312=1,92 т на 1 т получаемого этил-
бензола и соответствует оптимальному технологическому ре-
жиму.
Всего в алкилатор подают бензола (с учетом циркулирую-
щего бензола):
700,728+475,740=1176,468 кмоль/ч или 91765 кг/ч.
Общее количество отходящих газов (с учетом испаряющегося
бензола):
166,992+475,740=642,732 кмоль/ч или 3886+37108=40 994 кг/ч.
Составляют материальный баланс стадии алкилирования
(табл. 18).
Таблица 18. Материальный баланс стадии алкилирования
Входит кмоль/ч кг/ч Выходит кмоль/ч кг/ч
Бензол техниче- ский: С6Н6 Н2О Итог о... Этиленовая фрак- ция Диэтилбензол Алюминийхлорид 1176,468 0,056 1176,524 424,684 36,030 1,446 91 765 1 91 766 11452 4828 193 Отходящие газы Алкилат 642,732 737,023 40 994 67 245
В с е г о... 1638,684 108 239 В с е г о... 1379,755 108 239
8—69
113
Таблица 19. Тепловой баланс алкилатора
Приход кВт % Расход кВт %
Тепловой поток эти- 34,625 1,1 Тепловой поток от- 469,706 15,4
леновой фракции ходящих газов
Тепловой поток тех- 292,461 9,6 Тепловой поток ал- 1132,246 37,3
нического бензола килата
Тепловой поток ди- 24,358 0,8 Расход теплоты на 1344,468 44,3
этилбензола испарение бензола
Тепловой поток про- 2686,149 88,5 Теплопотери в окру- 91,173 3,0
цесса жающую среду
В с е г о... 3037,593 100,0 В с е г о... 3037,593 100,0
По рассчитанному количеству испаряющегося бензола уточ-
няют тепловые потоки:
Ф2= (0,0649+0,04405) • 134,218-20=292,461 кВт;
Ф7=0,04405-101,77-90=403,467 кВт;
©8=0,04405 • 78 • 391,3= 1344,468 кВт.
Тепловой поток отходящих газов составляет:
66,239+403,467=469,706 кВт.
Составляют тепловой баланс алкилатора (табл. 19). Значение
Фпот определяют по разности прихода и расхода теплоты.
ПОЛУЧЕНИЕ ЭТИЛБЕНЗОЛА В ПРИСУТСТВИИ
ФТОРСОДЕРЖАЩЕГО КАТАЛИЗАТОРА
Выбранная для расчета технологическая схема получения
этилбензола (процесс «Алкар») состоит из нескольких ста-
дий, основными из которых являются [23, с. 239]:
1) подготовка сырья (осушка бензола и удаление раство-
ренного в нем кислорода; очистка и компримирование эти-
лена) ;
2) алкилирование бензола этиленом и трансалкилирование
полиэтилбензолов в этилбензол циркуляционным бензолом;
3) фракционирование и очистка циркуляционного бензола
с выделением товарного этилбензола, непрореагировавшего
бензола, фторида бора Н полиэтилбензолов;
4) абсорбция и десорбция фторида бора.
Особенностью данного процесса является проведение реак-
ции алкилирования и переалкилирования (трансалкилирова-
ния) в разных аппаратах.
114
Алкилирование ведут при температуре 180—220 °C и дав-
лении 3,3—3,6 МПа. Тепло экзотермических реакций алкили-
рования отводят алкилатом, циркулирующим в системе «реак-
тор — котел-утилизатор».
Молярное отношение бензол: этилен составляет примерно
1 : 1 по свежему бензолу и (2,5—2,7) : 1 с учетом циркулиру-
ющего бензола. Кроме целевой реакции протекают побочные
реакции образования полиэтилбензолов. Общая степень кон-
версии бензола 32—34%.
Трансалкилирование протекает по схеме
СбНе-«(С2Н5) л+СвНб —* CgHsCaHg 4- CgH?—л (С2Н5) л—1 (где п 2).
Полиэтилбензолы, образовавшиеся в реакторе алкилиро-
вания, после отгонки этилбензола возвращают в реактор
трансалкилирования. Процесс трансалкилирования протекает
при температуре 170—240 °C и давлении 2,5 МПа; —ДЯ0298«
«0. Степень конверсии полиэтилбензолов составляет 36,7—
36,8%, бензола—10,80—10,85%.
Схема потоков стадий алкилирования и ректификации
процесса «Алкар» приведена на рис. 8. Ниже дано краткое
описание процесса.
Свежий технический бензол после азеотропной осушки и удаления
растворенного в нем кислорода охлаждают до 70 °C и смешивают с цирку-
лирующим бензолом, прошедшим адсорбционную очистку от боратов. Полу-
Рис. 8. Схема потоков стадий алкилирования и ректификации процесса
«Алкар»
1, 3. И, 13 — бензол; 2 — этилен; 4, В, 16, 24 — фторид бора; 5, 7 — продукты алкилиро-
вания. 6 — циркулирующий алкилат; 9 — продукты трансалкилирования; 10 — продукты
синтеза, 12 — «загрязненный» бензол; 14, 17, 18, 22, 23 — полиэтилбензолы; 15 — кубовая
жидкость, 19, 20, 21, 25 — этилбензол;
СП1, СП2— смесители; РТ1—реактор алкилирования, РТ2 — реактор трансалкилирова-
ния, КУ1—КУЗ — котлы-утилизаторы; КЛ1—колонна отгонки бензола; КЛ2 — колонна
отгонки этилбензола, КЛЗ — стриппер; El, Е2 — сборники
8*
115
чеиную смесь насосом подают в реактор алкилирования РТ1. Очищенный
этилен сжимают до давления 3,8 МПа и подают в смеситель СП1, располо-
женный на линии нагнетания насоса. На входе в реактор алкилирования в
смесителе СП2 происходит смешение бензола и этилена с циркулирующим
алкилатом, в линию которого предварительно подают циркулирующий в
системе фторид бора. Выходящий из нижней части реактора РТ1 алкилат
делится иа два потока: «20% алкилата направляют на ректификацию в
колонну отгонки бензола КЛ1, основной поток возвращают в реактор. Цир-
кулирующий алкилат охлаждают до температуры 160—200 °C в котле-ути-
лизаторе КУ1, где получают водяной насыщенный пар низкого давления.
В нижнюю часть реактора трансалкилирования РТ2 через подогреватель
подают полиэтилбензолы из куба колонны отгонки этилбензола КЛ2; пред-
варительно полиэтилбензолы смешивают с циркулирующими фторидом бора
и бензолом. Продукты процесса трансалкилирования, выходящие из верхней
части РТ2, смешивают с алкилатом из реактора алкилирования РТ1 и подают
в колонну отгонки бензола КЛ1.
Колонна отгонки бензола КЛ1 предназначена для выделения из алки-
лата легколетучих компонентов — фторида бора и бензола. В процессе
алкилирования и трансалкилирования при взаимодействии фторида бора с
водой и спиртами происходит образование различных производных борной
кислоты, имеющих общее название «бораты» (в расчете не учитываются).
Бораты — трудиолетучие сиропообразные вещества, накопление которых в
системе может привести к отравлению катализатора, забивке ректификаци-
онного и теплообменного оборудования, коррозии. Для предотвращения
попадания в куб колонны КЛ1 боратов в нее подают фторид бора, который
одновременно повышает парциальное давление паров боратов и уносит их
в верх колонны, предотвращая увеличение гидравлического сопротивления
тарелок и кипятильника.
Боковой погон колонны (циркулирующий бензол, содержащий до 6%
этилбензола) проходит очистку от боратов в адсорберах, заполненных гра-
нулами оксида алюминия (поглотительная способность А12О3 5—7%). Очи-
щенный от боратов бензол нагревается поступающим на очистку циркули-
рующим бензолом от 45 до 130—135 °C и направляется в реакторы алкили-
рования и трансалкилирования. Предварительно из системы должны быть
выведены парафины и циклопарафины, содержащиеся в бензоле, имеющие
близкие температуры кипения, ио не подвергающиеся алкилированию. Эти
соединения ие являются ядами для катализатора, ио накапливаются в про-
цессе алкилирования, действуют как разбавители и снижают производитель-
ность агрегата. Поэтому часть «загрязненного» бензола через адсорбер вы-
водят из системы для предотвращения накопления неароматических соеди-
нений, содержание которых не должно превышать 8—12%.
Выходящие из верхней части колонны КЛ1 пары с температурой 170 °C
и давлением 0,9 МПа поступают на конденсацию в котел-утилизатор КУ2,
где за счет конденсации паров бензола и охлаждения газожидкостной смеси
до 150°С образуется водяной насыщенный пар низкого давления. Газожид-
костная смесь стекает в сборник флегмы Е1. Газы из сборника флегмы ох-
лаждаются до 45 °C в аппарате воздушного охлаждения, газожидкостная
смесь разделяется в сепараторе (жидкость поступает в сборник Е1, а иескон-
денсировавшиеся газы — циркулирующий фторид бора — выводятся на ста-
дию адсорбции и десорбции фторида бора, откуда после подпитки свежим
фторидом бора н компримирования возвращаются в реакторы алкилирования
и трансалкилирования, колонну отгонки бензола). Бензол из сборника Е1
в виде флегмы подают в колонну отгонки бензола. Куб колонны обогрева-
ется с помощью кипятильника (теплоноситель — горячее масло). Кубовую
жидкость колонны КЛ1 подают в качестве питания в колонну отгонки этил-
бензола КЛ2. Ректификационная колонна КЛ2 предназначена для выделения
товарного этилбензола. Пары из верхней части колонны с температурой
165 °C поступают на конденсацию в котел-утилизатор КУЗ. Конденсат из
116
котла КУЗ стекает в сборник Е2, откуда этилбензол подают в качестве
флегмы в колонну КЛ2, а избыток (товарный продукт) через аппарат воз-
душного охлаждения, где он охлаждается до 45—50 °C, направляют в хра-
нилище. Кубовую жидкость колонны КЛ2, состоящую из полиэтилбеизолов,
подают в реактор трансалкилирования РТ2 и стриппер полиэтилбеизо-
лов клз.
Стриппер КЛЗ представляет собой ректификационную колонну и служит
для удаления легкой фракции из полиэтилбензолов, вывода из системы тя-
желых продуктов, которые не подвергаются трансалкилированию. Темпера-
тура в кубе стриппера 315—320 °C. Пары из верхней части стриппера, содер-
жащие в основном ди- и триэтилбензолы, с температурой 240—245 °C посту-
пают непосредственно в паровую трубу кипятильника колонны КЛ2. Кубовую
жидкость стриппера через холодильник, где она охлаждается водой до
ПО—120°C, направляют в хранилище.
МАТЕРИАЛЬНЫЙ РАСЧЕТ
Материальный расчет процесса получения этилбензола вклю-
чает материальные расчеты стадий алкилирования, трансал-
килирования, отгонки бензола и этилбензола. Схема мате-
риальных потоков приведена на рис. 8.
Расчет стадии алкилирования
Исходные данные:
годовая производительность агрегата по 100%-му этилбензолу
350 000 т;
годовой фонд рабочего времени 8000 ч;
состав технического бензола (поток 1) (wt, %): С6Н6 — 99,5;
С5Н9СН3 —0,02; С6Н5СН3 —0,02; С7Н16 —0,41;
состав технического этилена (поток 2) [<рг(хг), %]: СН4— 0,012;
С2Н2—0,001; С2Н4 —99,900; С2Н6 —0,080; С3Н6 —0,005; СО2 —
0,002;
состав циркулирующего бензола (поток 3) (wt, %): С6Нб—
83,40; С5Н9СН3—0,52; С7Н16—10,11; С6Н5С2Н5 — 5,97;
состав циркулирующего фторида бора (поток 4) [ср,- (х,), %]:
BF3 — 23,420; СН4 —9,506; С2Н6 —63,201; СО2— 1,560; С6Нб—
2,313;
степень конверсии бензола 0,328;
потери этилбензола на стадии фракционирования 0,18%.
Последовательность расчета:
а) определяют количество этилбензола, которое необходимо получить
на стадиях алкилирования и трансалкилирования, количество и состав «за-
грязненного» бензола, количество и состав полиэтилбеизолов, выводимых из
системы;
б) рассчитывают количество израсходованного сырья и образовавшихся
продуктов по реакциям алкилирования бензола, количество и состав техни-
ческих этилена и бензола;
в) определяют количество и состав циркулирующих фторида бора и
бензола;
г) определяют состав продуктов процесса алкилирования.
Полный материальный баланс реактора алкилирования, составляют после
выполнения теплового расчета (определения количества циркулирующего
алкилата).
117
Производительность агрегата по 1 GO %-му этилбензолу:
350 000-1000/8000=43 750 кг/ч или 43 750/106=412,736 кмоль/ч.
С учетом потерь при последующем выделении на стадиях алки-
лирования и трансалкилирования необходимо получить 100%-го
этилбензола:
43 750(100,00+0,18)/100,00=43 828,8 кг/ч или 413,479 кмоль/ч.
Потери этилбензола составляют:
43 828,8—43 750,0=78,8 кг/ч или 0,743 кмоль/ч.
Определяют общее количество «загрязненного» бензола, выво-
димого из адсорберов очистки от боратов (массовую долю
этилбензола — см. состав потока 3):
78,8/0,0597=1319,9 кг/ч.
Количество бензола, теряемого с «загрязненным» бензолом:
1319,9-0,834=1100,8 кг/ч или 14,113 кмоль/ч.
По целевой реакции:
С6Н6 + С2Н4-> СбНд-С2Н5 1
расходуется бензола:
413,479 кмоль/ч или 32 251,4 кг/ч.
Из стриппера выводят 7 кг полиэтилбензолов на 1 т про-
дукционного 100%-го этилбензола (по экспериментальным
данным), что составляет:
43 750-0,007=306,2 кг/ч.
Состав полиэтилбензолов (wi, %): диэтилбензол — 55,0; три-
этилбензол— 15,0; тетраэтилбензол — 30,0.
Состав полиэтилбензолов, выводимых из системы (поток 23):
СвН4(СгН5)2 с8н8(с2н5)3 CsH2(C2Hs)4 2
% 55,0 15,0 30,0 100,0
mT, кг/ч 168,4 45,9 91,9 306,2
пт, кмоль/ч 1,257 0,283 0,484 2,024
Расход бензола на получение полиэтилбензолов составляет
2,024 кмоль/ч или 157,9 кг/ч. В готовом продукте остается 0,01%
бензола, т. е. 4,4 кг/ч или 0,057 кмоль/ч.
Необходимо подать свежего бензола (без учета расхода
на образование тяжелых остатков):
1100,8+32 251,4+157,9+4,4=33 514,5 кг/ч или 429,673 кмоль/ч.
С этим количеством бензола поступает толуола (массовые до-
ли бензода и толуола — см. состав потока 1):
33 514,5-0,02/99,55=5,7 кг/ч или 0,073 кмоль/ч.
118
По реакции
CeHs—СН3+ЗС2Н4 СвН2 (С2Н5) з—СН3 2
расходуется этилена: 3-0,073=0,219 кмоль/ч или 6,1 кг/ч;
образуется триэтилтолуола: 0,073 кмоль/ч или 12,8 кг/ч.
Расход этилена по целевой реакции 1:
413,479 кмоль/ч или 11 577,4 кг/ч.
Расход этилена на образование полиэтилбензолов, выводимых
из системы (см. состав потока 23):
1,257-2+0,283-3 + 0,484-4=5,299 кмоль/ч или 148,3 кг/ч.
Всего необходимо подать в систему свежего этилена:
413,479+5,299+0,219=418,997 кмоль/ч или 11731,8 кг/ч.
Общий расход технического этилена (с учетом состава пото-
ка 2):
418,997/0,999=419,416 кмоль/ч.
Состав технического этилена (поток 2):
сн4 С2Н2 С2Н4 С2Н6 с3н6 СО2 X
XI, % Пх, кмоль/ч тх, кг/ч 0,012 0,050 0,8 0,001 0,004 0,1 99,900 418,997 11731,8 0,080 0,336 10,1 0,005’ 0,021 0,9 0,002 0,008 0,4 100,00 419,416 11744,1
По реакции С6Нб+СзНб —* СеНе—С3Н7 3
расходуется:
пропилена: 0,021 кмоль/ч или 0,9 кг/ч;
бензола: 0,021 кмоль/ч или 1,6 кг/ч;
образуется изопропилбензола: 0,021 кмоль/ч или 2,5 кг/ч.
По реакции
гСбНб+СзНз —> (СзНб)2—С2Н4 4
расходуется:
ацетилена: 0,004 кмоль/ч или 0,1 кг/ч;
бензола: 2-0,004=0,008 кмоль/ч или 0,6 кг/ч;
образуется дифенилэтана: 0,004 кмоль/ч или 0,7 кг/ч.
Всего необходимо подать в систему свежего бензола:
33 514,5+1,6+0,6=33 516,7 кг/ч или 429,702 кмоль/ч.
Общий расход технического бензола (с учетом состава пото-
ка 1):
33 516,7/0,9955=33 668,2 кг/ч.
119
Состав технического бензола (поток 1): С«Н5 — СНз C,Hie S
С6Н6 C5HS — СНв
w„ % 99,55 0,02 0,02 0,41 100.00
тх, кг/ч 33516,7 6,7 6,7 138,1 33 668,2
«т, кмоль/ч 429,702 0,080 0,073 1,381 431,236
Xi, % 99,644 0,019 0,017 0,320 100,00
Принимают, что в реакторе алкилирования образуется 73,6%
от суммарного количества этилбензола, получаемого в реактор-
ном узле, что составляет:
43 828,8-0,736=32 258,0 кг/ч или 304,321 кмоль/ч.
По целевой реакции 1 расходуется:
бензола: 304,321 кмоль/ч или 23 737,0 кг/ч;
этилена: 304,321 кмоль/ч или 8521,0 кг/ч.
Остается этилена:
413,479+5,299—304,321 = 114,457 кмоль/ч или 3204,7 кг/ч.
По реакции
С6Нв+2С2Н4 —> С6Н4(С2Н5)2 5
реагирует 96,5% (по экспериментальным данным) оставшегося
этилена, что составляет:
114,457-0,965=110,451 кмоль/ч или 3092,5 кг/ч;
расход бензола: 110,451/2 = 55,225 кмоль/ч или 4307,6 кг/ч;
образуется диэтилбензола: 55,225 кмоль/ч или 7400,1 кг/ч.
По реакции
СбНв+ЗС2Н4 С6Н3(С2Н5)з 6
реагирует 1,5% оставшегося этилена, что составляет:
114,457-0,015=1,717 кмоль/ч или 48,1 кг/ч;
расход бензола: 1,717/3=0,573 кмоль/ч или 44,7 кг/ч;
образуется триэтилбензола: 0,573 кмоль/ч или 92,8 кг/ч.
По реакции
СвНв+4С2Н4 —> СбВДООД 7
реагирует 2% оставшегося этилена, что составляет:
114,457-0,02=2,289 кмоль/ч или 64,1 кг/ч.
Расход бензола: 2,289/4 = 0,572 кмоль/ч или 44,6 кг/ч.
Образуется тетраэтилбензола: 0,572 кмоль/ч или 108,7 кг/ч.
Общий расход бензола по реакциям 1, 3—7:
304,321+55,225+0,572+0,573+0,021+0,008=360,720 кмоль/ч или 28136,1 кг/ч.
Количество газообразного фторида бора (катализатора), по-
даваемого в реактор алкилирования:
304,321-0,785/100=2,389 кмоль/ч или 162,5 кг/ч,
где 0,785 — расход фторида бора иа 100 кмоль образующегося этилбензола,
кмоль.
120
Расход циркулирующего фторида бора (с учетом состава по-
тока 4):
2,389/0,2342=10,201 кмоль/ч.
Состав циркулирующего фторида бора (поток 4):
BF3 сн4 C2Hfi со2 с6н6 X
Xi, % 23,420 9,506 63,201 1,560 2,313 100,000
«t, кмоль/ч 2,389 0,970 6,447 0,159 0,236 10,201
тх, кг/ч 162,5 15,5 193,4 7,0 18,4 396,8
С учетом степени конверсии в реактор алкилирования необ-
ходимо ввести 100%-го бензола:
28 136,1/0,328=85 780,8 кг/ч.
С циркулирующим бензолом из колонны отгонки бензола
К.Л1 (через адсорберы очистки от боратов) должно быть вве-
дено бензола:
85 780,8—18,4—33 516,7=52 245,7 кг/ч или 669,817 кмоль/ч.
Расход циркулирующего бензола (с учетом состава потока 3):
52 245,7/0,834=62 644,7 кг/ч.
Состав циркулирующего бензола (поток 3): СеН4 CsHe — СНз С7Н16 CeHs СдНв X w, % 83,40 0,52 10,11 5,97 100,00 тх, кг/ч 52 245,7 325,8 6333,3 3739,9 62 644,7 «т, кмоль/ч 669,817 3,879 63,333 35,282 772,311 х„ % 86,729 0,502 8,201 4,568 100,00 На основании полученных данных рассчитывают состав про- дуктов стадии алкилирования (поток 7): пх, кмоль/ч Xj, % тх, кг/ч СН4 0,050+ 0,970=1,020 0,084 16,3 С2Н6 0,336+ 6,447= 6,783 0,559 203,5 С6Н6 429,702 + 0,236+ 669,817— 60,869 57 644,7 —360,720 = 739,035 С5Н9СН3 0,080+ 3,879= 3,959 0,326 332,5 С7Н16 1,381+63,333=64,714 5,330 6471,4 С6Н6—С2Н5 35,282+ 304,321 = 339,603 27,971 35 997,9 С6Н5—С3Н7 0,021 0,002 2,5 С6Н4(С2Н5)2 55,225 4,548 7400,1 С6Н3(С2Н5)3 0,573 0,047 92,8 С6Н2(С2Н5)3СН3 0,073 0,006 12,8 С6Н2(С2Н5)4 0,572 0,047 108,7 (С6Н5)2С2Н4 0,004 См.* 0,7 BF3** 2,389 0,197 162,5 СО2 0,008+0,159=0,167 0,014 7,4
2 1214,138 100,00 108 453,8
* В связи с малым значением *(СбН5)2С2Н4 (0-0003%) учитывают. ♦♦ Потерями BFa пренебрегают. в дальнейшем расчете ее ие
121
Расчет стадии трансалкилирования
Исходные данные:
состав подаваемых в реактор циркулирующих фторида бора и
бензола (см. состав потоков 3 и 4);
состав полиэтилбензолов (wo %): диэтилбензол — 87,0;триэтил-
бензол — 10,0; тетраэтилбензол — 3,0;
степень конверсии: полиэтилбензолов 0,367—0,368; бензола
0,1080—0,1085.
Последовательность расчета:
а) определяют количество полиэтилбензолов, превращающихся в этилбен-
зол по реакциям 8—10; количество и состав полиэтилбеизолов, подаваемых
в реактор трансалкилирования;
б) рассчитывают количество и состав циркулирующих фторида бора и
бензола, подаваемых в реактор трансалкилирования;
в) уточняют состав продуктов процесса трансалкилирования (поток 9)
и составляют материальный баланс реактора.
В реакторе трансалкилирования получают этилбензола:
43 828,8—32 258,0=11 570,8 кг/ч или 109,158 кмоль/ч.
Этилбензол образуется за счет последовательно идущих реак-
ций трансалкилирования: тетраэтилбензол превращается в три-
этилбензол и этилбензол, триэтилбензол — в диэтилбензол и
этилбензол, диэтилбензол — в этилбензол. Для упрощения ра-
счета его ведут по следующим суммарным реакциям:
С6Н2(С2Н5)4+ЗС6Н6 —* 4С6Н5—С2Н5, 8
С6Нз(С2Н5)3+2С6Н6 —ЗС6Н5—С2Н5, 9
С6Н4(С2Н5)2+С6Н6 —> 2С6Н5—С2Н5. 10
Количество полиэтилбензолов, превращаемых в этилбензол,
определяют по разности между их количеством, образовавшим-
ся в реакторе алкилирования (см. состав потока 7), и количест-
вом, выводимым из системы (см. состав потока 23):
диэтилбензол: 55,225—1,257=53,968 кмоль/ч или 7231,7 кг/ч;
триэтилбензол: 0,573—0,283=0,290 кмоль/ч или 46,9 кг/ч;
тетраэтилбензол: 0,572—0,484= 0,088 кмоль/ч или 16,8 кг/ч.
Расход бензола:
53,968+0,290-2+0,088-3=54,812 кмоль/ч или 4275,4 кг/ч.
Образуется этилбензола:
53,968-2 + 0,290-3 + 0,088-4=109,158 кмоль/ч или 11 570,8 кг/ч.
Всего расходуется полиэтилбензолов:
7231,7+46,9+16,8=7295,4 кг/ч.
122
При степени конверсии 0,3675 в реактор необходимо подать по-
лиэтилбензолов:
7295,4/0,3675=19851,4 кг/ч.
Состав полиэтилбензолов из колонны отгонки этилбензола
(поток 14):
С6Н<(С2Н6)2 CeH3(CaH5)s X
wi4 % 87,0 10,0 3,0 100,0
mx, кг/ч 17 270,7 1985,1 595,6 19851,4
nt, кмоль/ч 128,886 12,254 3,135 144,275
Остается полиэтилбензолов после протекания реакций 8—10:
диэтилбензола: 128,886—53,968=74,918 кмоль/ч или 10 039,0 кг/ч;
триэтилбензола: 12,254—0,290=11,964 кмоль/ч или 1938,2 кг/ч;
тетраэтилбензола: 3,135—0,088=3,047 кмоль/ч или 578,8 кг/ч.
Количество газообразного фторида бора (катализатора), по-
даваемого в реактор трансалкилирования:
109,158-4,57/100=4,988 кмоль/ч или 339,2 кг/ч,
где 4,57— расход фторида бора на 100 кмоль образующегося этилбензола,
кмоль.
Расход циркулирующего фторида бора (с учетом состава по-
тока 4):
4,988/0,2342=21,298 кмоль/ч.
Состав циркулирующего фторида бора (поток 8):
BF, сн4 С2Н6 СО2 свне X
«P/Xi), % 23,420 9,506 63,201 1,560 2,313 100,00
пт, кмоль/ч 4,988 2,025 13,460 0,332 0,493 21,298
mx, кг/ч 339,2 32,4 403,8 14,6 38,5 828,5
При степени конверсии бензола 0,1082 необходимо подать в
реактор бензола:
4275,4/0,1082=39 513,9 кг/ч или 506,588 кмоль/ч.
Подают бензола в составе циркулирующего бензола:
39 513,9—38,5=39 475,4 кг/ч или 506,095 кмоль/ч.
Расход циркулирующего бензола (с учетом состава потока 3):
39 475,4/0,834=47 332,6 кг/ч.
Состав циркулирующего бензола (поток 13):
Wi, %
тх, кг/ч
пх, кмоль/ч
с6н«
83,40
39 475,4
506,095
CsHb — СНз
0,52
246,1
2,930
с7н,6
10,11
4785,3
47,853
С5Н5 — CgHg
5,97
2825,8
26,658
х
100,00
47332,6
583,536
123
Таблица 20. Материальный баланс стадии трансалкилирования
Входит кмоль/ч кг/ч Выходит кмоль/ч кг/ч
Циркулирующий бензол: С6Н6 С6Н9—СН3 с7н16 С6Н5—С2Н5 506,095 2,930 47,853 26,658 583,536 128,886 12,254 3,135 144,275 4,988 2,025 13,460 0,332 0,493 21,298 749,109 39 475,4 246,1 4785,3 2825,8 47 332,6 17 270,7 1985,1 595,6 19 851,4 339,2 32,4 403,8 14,6 38,5 828,5 68 012,5 Алкилат в колон- ну отгонки бензо ла: СН4 с2н6 С6Н6 С5Н9—СН3 с7н16 С6Н5—C2HS С6Н4(С2Н5)2 С9Н3 (С2Нз) з С6Н2(С2Н5)4 BF3 со2 2,025 13,460 451,776 2,930 47.853 135,816 74,918 11,964 3,047 4,988 0,332 749,109 32,4 403,8 35 238,5 246,1 4785,3 14 396,6 10 039,0 1938,2 578,8 339,2 14,6 68012,5
Итог о... Полиэтилбензолы: С6Н4(С2Н5)2 С6Н3(С2Н6)3 С6Н2(С2Н5)4
Итог о... Циркулирующий фторид бора. BF3 СН4 С2Н6 СО2 С6Н6
Итого...
Всего: В с е г о...
Количество бензола на выходе из реактора:
39 513,9—4275,4=35 238,5 кг/ч или 451,776 кмоль/ч.
Количество этилбензола на выходе из реактора:
11570,8+ 2825,8=14 396,6 кг/ч или 135,816 кмоль/ч.
Составляют материальный баланс стадии трансалкилирова-
ния (табл. 20).
Поскольку после реактора трансалкилирования в системе не
происходит химических превращений, в дальнейших материаль-
ных расчетах приняты следующие упрощения:
а) в один поток «инертные» объединены метан, этан, диоксид
углерода;
б) в один поток «неароматические углеводороды» объеди-
нены гептан и метилциклопентан;
в) в один поток «тяжелые остатки» объединены изопропил-
бензол, дифенилэтан, триэтилтолуол.
124
Расчет стадии отгонки бензола
Исходные данные:
количество и состав алкилата, поступающего из реакторов ал-
килирования и трансалкилирования, см. состав потоков 7 и 9;
количество и состав циркулирующего бензола, подаваемого из
колонны отгонки бензола в реакторы алкилирования и транс-
алкилирования, см. состав потоков 3 и 13.
Массовая доля неароматических углеводородов в циркули-
рующем бензоле:
0,52+10,11 = 10,63.
Количество углеводородов:
1319,9 0,1063=140,3 кг/ч,
где 1319,9 — общее количество «загрязненного» бензола (поток 12), кг/ч.
Состав «загрязненного» бензола, кг/ч: бензол —1100,8,
этилбензол — 78,8, углеводороды — 140,3.
На основании данных о составе потоков 7 и 9 рассчитыва-
ют состав алкилата на входе в колонну отгонки бензола (по-
ток 10):
тх, кг/ч Wp %
Инертные 16,3 +203,5+ 7,4+ 32,4+ 403,8+ 0,38
+14,6=678,0
С6Н6 57 644,7+35 238,5=92 883,2 52,64
С6Н5—С2Н5 35 997,9+14 396,6=50 394,5 28,56
С6Н4(С2Н5)2 7400,1 + 10 039,0=17 439,1 9,88
С6Н3(С2Н5)3 92,8+1938,2=2031,0 1,15
С6Н2(С2Н5)4 108,7+578,8=687,5 0,39
Неароматические углеводо- 332,5+ 6471,4+ 246,1+4785,3=11 835,3 6,71
роды
Тяжелые остатки 2,5+12,8+0,7=16,0 0,01
BF3 162,5+339,2=501,7 0,28
2 176 466,3 100,00
Суммируя содержание компонентов в потоках 3, 12 и 13,
определяют состав бензольной фракции (циркулирующего
бензола) на выходе из колонны отгонки бензола (поток 11):
тх, кг/ч Wj, %
СбН6 52 245,7+ 39 475,4+1100,8=92 821,9 83,40
С6Н5С2Н5 3739,9+ 2825,8+ 78,8= 6644,5 5,97
Неароматические углево- 325,8+ 6333,3 +4785,3 +246,1 + 140,3= 10,63
дороды = 11 830,8
2 111297,2 100,00
125
Принимают, что количество подаваемого 100%-го фторида
бора равно количеству BF3 в питании колонны, т. е. 501,7 кг/ч.
Количество циркулирующего фторида бора:
501,7/0,4094=1225,3 кг/ч,
где 0,4094 — массовая доля в BF3.
Состав циркулирующего фторида бора (поток 16):
BF3 Инертные СвНв 2
w„ % 40,94 54,41 4,65 100,00
тх, кг/ч 501,7 666,7 56,9 1225,3
Из верхней части колонны выводят:
фторида бора: 501,7+501,7=1003,4 кг/ч;
инертных: 678,0 + 666,7=1344,7 кг/ч;
неароматических углеводородов: 11 835,3—11 830,8=4,5 кг/ч;
бензола: 92 883,2—92 821,9—4,4+56,9= 113,8 кг/ч;
где 4,4 — количество бензола в продукционном этилбензоле, кг/ч.
Всего из верхней части колонны выводят: 2466,4 кг/ч
Фторид бора через сборник флегмы и сепаратор передают
на стадию абсорбции и десорбции, откуда он возвращается в
реакторный узел и колонну отгонки бензола (поток 24).
Инертные (678,0—666,7=11,3 кг/ч), поступившие в систе-
му с техническим этиленом, и неароматические углеводороды
(4,5 кг/ч) удаляют из системы при ее продувке.
Состав кубовой фракции (поток 15):
тт, кг/ч тх, кг/ч
Бензол 4,4 Триэтилбензол 2031,0
Этилбензол 50 394,5—6644,5= Тетраэтилбензол 687,5
Диэтилбензол =43 750,0 17 439,1 Тяжелые остатки 16,0
2 63 928,0
В расчете не учтены количество циркулирующей флегмы
(определяется при расчете колонны) и массообмен между ко-
лонной отгонки бензола и десорбером фторида бора.
Составляют материальный баланс колонны отгонки бензо-
ла (табл. 21).
Расчет стадии отгонки этилбензола
Исходные данные:
количество и состав кубовой фракции- колонны отгонки бензо-
ла, подаваемой в колонну отгонки этилбензола, см. состав по-
тока 15;
126
Таблица 21. Материальный баланс колонны отгонки бензола
Входит кг/ч % Выходит кг/ч %
Алкилат: Бензольная фракция.
инертные 678,0 0,38 с6н6 92 821,9 83,40
с6н6 92883,2 52,64 с6н5-с2н5 6644,5 5,97
С6Н5—С2Н5 50394,5 28,56 неар оматические 11830,8 10,63
СбН4(С2Н5)2 17 439,1 9,88 углеводороды
СбНз(С2Н5)3 2031,0 1,15 ——
С6Н2(С2Н5)4 687,5 0,39 Итого 111 297,2 100,00
иеаро магические 11 835,3 6,71 Циркулирующий фто
углеводороды рид бора.
тяжелые остатки 16,0 0,01 BF3 1003,4 40,68
BF3 501,7 0,28 инертные 1344,7 54,52
— С6Н6 113,8 4,62
Итог о... 176466,3 100,00 неароматические 4,5 0,18
Циркулирующий фто- углеводороды
рид бора: —.
BF3 501,7 40,94 Итого 2466,4 100,00
инертные 666,7 54,41 Кубовая фракция:
С6Н6 56,9 4,65 СбНб 4,4 —-
—-—- С6Н5—С2Н5 43750,0 68,44
Итог о... 1225.3 100,00 С6Н4(С2Н6)2 17 439,1 27,28
с6н3(С2н5)3 2031,0 3,18
С6Н2(С2Н5)4 687,5 1,07
тяжелые остатки 16,0 0,03
Итог о... 63928,0 100,00
В с е г о... 177 691,6 — В с е г о... 177 691,6 —
количество и состав кубовой фракции колонны отгонки этил-
бензола (полиэтилбензолов), подаваемой в реактор трансал-
килирования, см. состав потока 14.
Материальный расчет колонны отгонки этилбензола выпол-
няют одновременно с расчетом стриппера КЛЗ. Отношение ко-
личества флегмы, орошающей стриппер, к количеству выво-
димой из него кубовой жидкости (поток 23) составляет 12,9—
13,0 и уточняется при расчете стриппера.
Принимают, что указанное отношение равно 12,95, тогда
количество орошающей стриппер флегмы (кубовой фракции
колонны отгонки этилбензола) составляет:
306,2 12,95=3965,3 кг/ч.
Определяют состав кубовой фракции, подаваемой в стрип-
пер (поток 18):
C«H4(C2Hs)2 СвНзЩз/Щз СвЩЩзНЩ В
Wi, % 87,0 10,0 3,0 100,0
mx, кг/ч 3449,8 396,5 119,0 3965,3
пх, кмоль/ч 25,745 2,447 0,626 28,818
127
Суммируя содержание компонентов в потоках 14 и 18, рас-
считывают общее количество и состав кубовой фракции, вы-
водимой из колонны отгонки этилбензола (поток 17):
С6Н4(С2Н5)2 СЕНз(С2Н5)з С6Н2(С!Н5)< 2
И»ь % 87,0 10,0 3,0 100,0
тх, кг/ч 20720,0 2381,5 714,6 23816,7
пТ, кмоль/ч 154,631 14,701 3,761 173,093
Учитывая содержание компонентов в потоках 23 и 18, оп-
ределяют состав паров, выводимых из стриппера в колонну
отгонки этилбензола (поток 22):
СсН4(С2Но)2 СвНз(С2Н6)з С,Н2(СаН5)< 2
тТ, кг/ч 3281,4 350,6 27,1 3659,1
wt, % 89,7 9,6 0,7 100,0
пх, кмоль/ч 24,488 2,164 0,142 26,794
Определяют состав паров из колонны отгонки этилбензола
без учета орошающей флегмы (поток 19)*:
СбНз С,НЕ - с2н. Тяжелые остатки
т-х, кг/ч 4,4 43 750,0 16,0 43770,4
Wi, % 0,01 99,95 0,04 100,0
nt, кмоль/ч 0,057 412,736 0,098 412,891
* Состав потока 25 идентичен составу потока 19.
Отношение количества флегмы, орошающей колонну отгон-
ки этилбензола, к количеству выводимой из него кубовой жид-
кости, составляет 2,86—2,87 и уточняется при технологическом
расчете. Принимают указанное отношение равным 2,865; тогда
количество орошающей колонну флегмы составляет:
23 816,7-2,865=68 234,8 кг/ч.
Состав флегмы, орошающей колонну отгонки этилбензола
(поток 20):
Wi, % тх, кг/ч СВН« 0,01 6,8 СзНеС2Нб 99,95 68 200,7 Тяжелые остатки 0,04 27,3 2 100,0 68234,8
Суммируя рассчитывают содержание компонентов в потоках состав дистиллята колонны отгонки 19 и 20, этилбензо-
ла (поток 21): Шх, кг/ч сенв И,2 СзН5С2Н5 111 950,7 Тяжелые остатки 43,3 2 112 005,2
Wi, % 0,01 99,95 0 04 100,0
128
Таблица 22. Материальный баланс колонны отгонки этилбензола
Входит кг/ч % Выходит кг/ч %
Кубовая фракция ко- лонны отгонки бензо- ла: с6н6 С6Н5—С2Н5 С6Н4(С2Н5)2 С6Н3(С2Н5)з С6Н2(С2Н5)4 тяжелые остатки 4,4 43 750,0 17 439,1 2031,0 687,5 16,0 68,44 27,28 3,18 1,07 0,03 Кубовая фракция: C6H4(C2Hs)2 С6Н3(С2Н6)з С6Н2(С2Н6)4 20 720,5 2381,6 714,6 87,0 10,0 3,0
Итого: Пары из колонны: С6Н6 СеНз—C2IIg тяжелые остатки 23 816,7 И,2 111 950,7 43,3 100,00 0,01 99,95 0,04
Итог о... Пары из стриппера: С6Н4(С2Н5)2 С6Нз(С2Н5)з СбН2(С2Н5)4 63 928,0 3281,4 350,6 27,1 100,00 89,7 9,6 0,7
Итог о... 112005,2 100,00
Итог о... Орошающая флегма: С6Н6 СеНз—С2Н5 тяжелые остатки 3659,1 6,8 68 200,7 27,3 100,00 0,01 99,95 0,04
Итог о... 68 234,8 100,00
В с е г о... 135 821,9 — В с е г о... 135821,9 —
Таблица 23. Материальный баланс стриппера
Входит кг/ч % Выходит кг/ч %
Кубовая фракция колон- ны отгонки этилбензола: С6Н4(С2Н5)2 СбНз(С2Нз)з С6Н2(С2Н6)4 3449,8 396,5 119,0 87,0 10,0 3,0 Пары в колонну отгон- ки этилбензола: С6Н4(С2Н6)2 СбН3(С2Н5)з СбН2(С2Н6)4 3281,4 350,6 27,1 89,7 9,6 0,7
Итог о... Кубовый продукт: С6Н4(С2Н5)2 СбН3(С2Н5)з С6Н2(С2Н5)4 3659,1 168,4 45,9 91,9 100,0 55,0 15,0 30,0
Итог о... 306,2 100,0
В с е г о... 3965,3 100,0 В с е г о... 3965,3 —
9—69
129
Таблица 24. Материальный баланс процесса получения этилбензола
Входит кг/ч % Выходит кг/ч %
Технический этилен: СН4 С2Н2 С2Н4 С2н6 с3н6 со2 0,8 0,1 11731,8 Ю,1 0,9 0,4 0,01 99,89 0,09 0,01 Этилбензол: с6н6 СбНь—С2Н5 тяжелые остатки 4,4 43750,0 16,0 0,01 99,95 0,04
Итого... Полиэтилбензолы: СбН4(СгН5)2 СбНз(СгН5)з СбН2(СгН5)4 43770,4 168,4 45,9 91,9 100,00 55,0 15,0 30,0
Итог о... Технический бензол: С6Н6 С5Н9-СН3 С6Н5-СНз с7н16 11 744,1 33516,7 6,7 6.7 138,1 100,00 99,55 0,02 0,02 0,41
Итог о... Загрязненный бензол: с6н6 С6Н5—С2Н5 неароматические углеводороды 306,2 1100,8 78,8 140,3 100,0 83,40 5,97 10,63
Итог о... 33 668,2 100,00
Итог о... Газы продувки: инертные неароматические углеводороды 1319,9 н,з 4,5 100,00
Итог о... 15,8 —
Всего... 45 412,3 — В с е г о... 45412,3 —
На основании результатов расчета составляют материаль-
ные балансы колонны отгонки этилбензола (табл. 22) и стрип-
пера (табл. 23), а также суммарный материальный баланс
процесса (табл. 24).
Расчет расходных коэффициентов. Расходные коэффициен-
ты (в кг/кг):
по 100%-му бензолу: 33 516,7/43 750,0 = 0,766;
по техническому бензолу: 33 668,2/43 750,0=0,770;
по 100 %-му этилену: 11 731,8/43 750,0=0,268.
ТЕХНОЛОГИЧЕСКИЙ РАСЧЕТ АЛКИЛАТОРА
Назначение, устройство и основные размеры.
Определение числа алкилаторов
В качестве основного аппарата — реактора алкилирования —
принят вертикальный полый цилиндрический аппарат со сфе-
рическими днищами, выполненный из углеродистой стали. Ре-
актор заполнен твердым катализатором, высота слоя которо-
го равна 7 м. Исходное сырье (свежие технические бензол и
130
этилен, циркулирующие бензол, алкилат и фторид бора) пода-
ют в реактор через штуцер в верхнем днище; продукт выводят
через штуцер в нижнем днище.
Техническая характеристика алкилатора:
Диаметр внутренний, мм 2800 Вместимость аппарата, м3 51,7
Толщина стенки, мм 50 Объем катализатора, м3 43
Высота цилиндрической части, мм 8200 Производительность по этил- бензолу в расчете на 1 м3 750—800
Высота общая, мм 10 200 катализатора, кг/ч
Принимают производительность катализатора 775 кг/(м3-ч),
тогда необходимый объем его составит:
14=32 258/775=41,6 м3,
где 32 258 — количество этилбензола, образующегося в реакторе алкилиро-
вания, кг/ч.
Число аппаратов, необходимых для обеспечения заданной
производительности:
п=41,6/43=0,98.
Таким образом, необходимо установить один аппарат.
Тепловой расчет алкилатора
Исходные данные:
материальные потоки, кмоль/с: технический этилен—-419,416/
/3600=0,1165; технический бензол — 431,236/3600=0,1198; цир-
кулирующий бензол — 772,311/3600=0,2145; циркулирующий
фторид бора—10,201/3600=0,0028; продукты алкилирова-
ния—1214,138/3600=0,3373;
составы материальных потоков см. Материальный расчет;
температура, °C: технического этилена—100; технического бен-
зола— 70; циркулирующего бензола—130; циркулирующего
фторида бора — 35; продуктов процесса алкилирования на вы-
ходе из реактора—180; циркулирующего алкилата на входе
в реактор— 160.
Цель расчета — определение количества циркулирующего
алкилата.
Уравнение теплового баланса реактора в общем виде:
Ф1 + Фг+ ®з+ Ф4+ ®з+ Фе= Ф?+ Фпот,
где Ф], Фг, Фз, ®4, ®з, Ф? — тепловые потоки технического этилена, техни-
ческого бензола, циркулирующего бензола, циркулирующего фторида бора,
циркулирующего алкилата и продуктов алкилирования соответственно, кВт;
Ф6 — теплота экзотермических реакций, кВт; ФЛОт — теплопотерн в окружаю-
щую среду, кВт.
9*
131
Тепловой поток газообразного технического этилена (по-
ток 2):
Ф1=0,1165-51,56-100=600,674 кВт,
где 51,56 — молярная теплоемкость технического этилена (принята по
100%-му этилену) при 7'1 = 100+273=373 К.
Тепловой поток жидкого технического бензола (поток 1):
Ф2=0,1198-146,97-70=1232,490 кВт,
где 146,97 — молярная теплоемкость технического бензола (принята по
100%-му бензолу) при 7'2=70+273=343 К-
Тепловой поток жидкого циркулирующего бензола (поток 3):
Ф3=0,2145(162,27-0,87231 + 138,91 -0,08201 + 186,56-0,04568) -130=
=4502,312 кВт,
где 162,27 — молярная теплоемкость жидкого бензола при 78=130+273=
=403 К, Дж/(моль-К); 0,87231 —молярная доля бензола (с учетом метил-
циклопентана) в циркулирующем бензоле; 138,91 и 186,56 — молярные теп-
лоемкости жидких гептана и этилбензола, Дж/(моль-К).
Для определения значений Ф4, Ф5, Ф? рассчитывают средние
молярные теплоемкости циркулирующего фторида бора при
7’4 = 35+273=308 К, циркулирующего алкилата при 7’s=160+
+273 = 433 К, продуктов процесса алкилирования при Т7=
= 180+273=453 К-
Расчет средних молярных теплоемкостей:
xt. % cf, Дж/(моль-К) С-х/100, Дж/(моль-К)
Фторид бора: 9,506 35,67 3,3908
СН4
С2Н6 63,201 54,19 34,2486
С6Н6 2,313 86,04 1,9901
BF3 23,420 51,33 12,0215
СО2 1,560 37,92 0,5915
S 100,000 — 52,2425
Циркулирующий алкилат: 43,38 0,0364
сн4 0,084
с2н6 0,559 70,72 0,3953
С6Н6 61,195 169,92 103,9825
с7н16 5,330 138,91 7,4039
С6Н5-С2Н5 27,971 186,56 52,1827
с6н5-с3н7 0,002 321,36 0,0064
С6Н4(С2Н5)2 4,548 369,06 16,7848
С6Н3(С2Н5)з 0,047 464 ,46 0,2183
С6Н2(С2Н5)3СН3 0,006 512,16 0,0307
СбН2(С2Н5)4 0,047 559,86 0,2631
BF3 0,197 59,46 0,1171
со2 0,014 43,50 0,0061
S 100,000 — 181,4273
132
Продукты процесса алкилирования: СН4 0,084 44,56 0,0374
с2н6 0,559 73,20 0,4092
С6Н6 61,195 175,02 107,1035
С?Н16 5,330 138,91 7.4039
C6HS-C2H5 27,971 186,56 52,1827
С6н5—С3Н7 0,002 321,36 0,0064
CaH4(C2Hs)2 4,548 369,06 16,7848
С6Нз(С2Н5)з 0,047 464,46 0,2183
С6Н2(С2Н5)з 0,006 512,16 0,0307
С6н2(с2н5)4 0,047 559,86 0,2631
BF3 0,197 60,43 0,1190
со2 0,014 44,08 0,0062
2 100,000 — 184,5652
Примечание. Метилциклопентан включен в состав бензола.
Тепловой поток циркулирующего фторида бора (поток 4):
Ф4=0,0028-52,2425-35=5,120 кВт.
Тепловой поток циркулирующего алкилата (поток 6):
Фв—п-181,4273-160=29 028,368п кВт,
где п — количество алкилата, кмоль/с.
Таблица 25. Тепловой баланс реактора алкилирования
Приход кВт % Расход кВ-в %
Тепловой поток технического эти- лена Тепловой поток технического бен- зола Тепловой поток циркулирующего бензола Тепловой поток циркулирующего фторида бора Тепловой поток циркулирующего алкилата Теплота экзотер- мических реакций 600,674 1232,490 4502,312 5,120 37 916,274 13216,065 1,0 2,2 7,8 66,0 23,0 Тепловой поток продуктов про- цесса алкилиро- вания Теплопотери в окружающую сре- ДУ 54 599,259 2873,676 95,0 5,0
В с е г о... 57 472,935 100,00 В с е г о... 57 472,935 100,0
133
Тепловой поток продуктов процесса алкилирования (по-
ток 5):
Ф7= (0,3373+п) • 184,5652-180= (11 205,692+33 221,736п) кВт.
Определяют теплоты реакций 1—7 (в кДж/моль)*:
Реакция
С6Нб+С2Н4—>СеНб—С2Нз
СбНв+2С2Н4—>С6Н4 (С2Н5) 2
С6Н6+ЗС2Н4->С6Н3(С2Н5)3
С6Н6+4С2Н4->С6Н2(С2Н5)4
С6Н6+СзНб-^СеНвСзН?
2C6HS+С2Н2—>- (С6Н5) 2С2Н4
С6Н5—СН3+ЗС2Н4->С6Н2(С2Н5)3СН3
ДЦ°294 2Д^°298(КОН) ^Д^°298(ксх)
—12,48—49,03—52,30=—113,81
—72,35—49,03—2 • 52,30=—225,98
—122,63—49,03—3 52,30=—328,56
—174,54—49,03—4 • 52,30=—432,77
—41,24—49,03—20,41 =—110,68
297,31—2 49,03—226,75=—27,50
—174,54—12,01—3 • 52,30=—343,45
* Энтальпия образования триэтнлтолуола принята равной энтальпии образования
тетраэтилбензола.
Таблица 26. Материальный баланс стадии алкилирования
Входит кмоль/ч кг/ч Входит
Технический этилен: СН4 С2Н2 с2н4 С2Н6 СзН6 СОг 0,050 0,004 418,997 0,336 0,021 0,008 419,416 429,702 0,080 0,073 1,381 431,236 669,817 3,879 63,333 35,282 772,311 0,8 0,1 11731,8 10,1 0,9 0,4 11 744,1 33 516,7 6,7 6,7 138,1 33 668,2 52 245,7 325,8 6333,3 3739,9 62644,7 Циркулирующий фто- рид бора: BF3 СН4 СгНз СО2 СбН6
Итог о... Технический бензол: С6Н6 С5Н9СНз СбН5СНз с7н16 Итог о... Циркулирующий ал- килат: СН4 с2н6 С6Н6 С5Н9СНз С7Н16 СзНзСгНз С6Н5С3Н7 С6Н4(С2Н5)2 С6Н3(С2Н5)3 С6Н2(С2Н5)3СН3 С6Н2(С2Нз)4 (С6н5)2с2н4 BF3 со2
Итог о... Циркулирующий бен- зол: С6Н6 С5Н9СН3 С7н16 СзНзСгНз
Итог о...
Итог о...
В с е г о...
* Количества CtHsCaH7 и (CeHs)iC2H4 рассчитаны иа основании данных о составе
134
Рассчитывают теплоту экзотермических реакций по форму-
ле (49):
Ф6= (1000/3600) (304,321 • 113,81 +55,225-225,98+0,573-328,56+ 0,572-432,77+
+0,021 • 110,68+0,004 27,50+0,073 343,45) = (1000/3600) - 47 577,8339=
= 13 216,065 кВт.
Общий приход теплоты:
ФпРИх=600,674+1232,490+4502,312+ 5,120+29 028,368п+13 216,0650=
= 19 556,661+29 028,368п кВт.
Принимают, что теплопотери в окружающую среду составляют
5% от прихода теплоты:
фпот=0,05(19 556,661+29 028,368/г) =977,833+1451,418/1 кВт.
Общий расход теплоты:
Фрасх=П 205,692+33221,736/1+977,833+1451,418п=12 183,525+
+34 673,154/1 кВт.
кмоль/ч кг/Ч Выходит кмоль/ч кг/ч
2,389 162,5 Продукты процесса ал- килирования: СН4 4,970 79,5
0,970 15,5 С2Н6 33,068 992,1
6,447 193,4 СбН6 3601,246 280 897,2
0,159 7,0 С5Н9СН3 19,288 1620,2
0,236 18,4 с7н16 315,344 31 534,4
10,201 396,8 С6Н5С2Н5 С6Н5С3Н7* 1654,869 0,102 175 416,1 12,2
3,950 63,2 С6Н4(С2Н5)2 СбН3(С2Н5)3 СбН2(С2Н5)зСНз 269,083 2,783 0,355 36 057,1 450,8 62,4
26,285 788,6 С6Н2(С2Нз)4* 2,782 528,6
2862,211 223 252,5 (СбНз)2С2Н4 0,019 3,4
15,329 1287,6 BF3 11,652 792,4
250,630 25063,0 со2 0,825 36,4
1315,266 0,081 213,858 2,210 0,282 2,210 0,015 9,263 0,658 4702,248 6335,412 139 418,2 9,7 28657,0 358,0 49,6 419,9 2,7 629,9 29,0 420028,9 528 482,7 В с е г о... 5916,386 528482,7
потока 7.
135
Количество циркулирующего алкилата находят из уравнения
теплового баланса:
19 556,661+29 028,368/1=12 183,525+34 673,154/1;
5644,786/1=7373,136;
/1=1,30618 кмоль/с или 4702,248 кмоль/ч.
Уточняют значения тепловых потоков:
Ф5= 1,30618 181,4273 • 160=37 916,274 кВт;
Ф7= (0,33730+1,30618) • 184,5652-180=54 599,259 кВт.
Значение ФПот уточняют по разности прихода и расхода теплоты.
Составляют тепловой баланс алкилатора (табл. 25).
Составляют материальный баланс реактора алкилирования
(табл. 26).
Для выполнения технологических расчетов основного оборудования
агрегата ниже приведены технические характеристики ряда аппаратов.
Реактор трансалкилирования РТ2 представляет собой вертикальный ци-
линдрический аппарат со сферическими днищами, диаметр 3000 мм, высота
18 000 мм, вместимость 120 м3; объем катализатора 116 м3.
Колонна отгонки бензола КЛ1 — вертикальная ректификационная колон-
на с 70 клапанными тарелками, диаметр 4000 мм, высота общая 45 000 мм.
Колонна отгонки этилбензола КЛ2 — вертикальная ректификационная
колонна с 60 клапанными тарелками, диаметр 3000 мм, высота общая
40 000 мм.
Стриппер КЛЗ—вертикальная ректификационная колонна с 12 клапан-
ными тарелками, диаметр 1000 мм, высота общая 10 000 мм.
Колонна азеотропной сушки бензола (на схеме не показана) — верти-
кальная ректификационная колонна с 40 клапанными тарелками, диаметр
1800 мм, высота общая 28 000 мм.
Адсорбер для очистки циркулирующего бензола от боратов — вертикаль-
ный цилиндрический аппарат, заполненный оксидом алюминия, диаметр
3000 мм, высота общая 10 000 мм, вместимость 72 м3.
ПРОЦЕССЫ ОКИСЛЕНИЯ
Процессы окисления углеводородов занимают значительное мес-
то в промышленном органическом синтезе благодаря ценности
получаемых продуктов, доступности и низкой стоимости боль-
шинства окислителей.
Среди процессов окисления ненасыщенных углеводородов
большое значение имеют эпоксидирование этилена с образова-
нием этиленоксида и карбонилирование этилена до ацетальде-
гида.
Являясь одним из многотоннажных продуктов основного ор-
ганического и нефтехимического синтеза, этиленоксид широко
136
применяется для получения многих веществ. Большая часть
производимого (до 55%) этиленоксида используется для полу-
чения этиленгликоля. Продукты на основе этиленоксида приме-
няют в производстве моющих средств, в целлюлозно-бумажной
промышленности, производстве химических волокон, фармацев-
тических и косметических препаратов; при обработке металлов
и обогащении руд; при добыче и переработке нефти; в произ-
водстве противопожарных средств, пеногасителей и т. д.
Ацетальдегид является полупродуктом для получения уксус-
ной кислоты и уксусного ангидрида, н-бутанола и 2-этилгекса-
нола, пластификаторов, синтетического каучука, поверхностно-
активных и других веществ.
ПОЛУЧЕНИЕ ЭТИЛЕНОКСИДА
ЭПОКСИДИРОВАНИЕМ ЭТИЛЕНА
В настоящее время для получения этиленоксида используют
только этилен (раньше для этой цели применяли этанол, аце-
тилен, обратный коксовый газ). Около 90% производимого эти-
леноксида получают прямым окислением этилена по реакции
СН2=СН2+0,5О2 —► СН2—СН26, —ДЯ°298= 104,93 кДж/моль.
В продуктах реакции кроме этиленоксида содержатся диок-
сид углерода, вода, формальдегид и ацетальдегид. Окисление
ведут в присутствии серебряного катализатора техническим кис-
лородом или кислородом воздуха.
Окисление этилена кислородом воздуха осуществляют при
давлении 0,85 МПа и температуре до 265 °C в трубчатых реак-
торах со стационарным слоем катализатора. В таких условиях
степень конверсии этилена составляет 42%>, селективность про-
цесса— 60%• Описание технологической схемы см. [3, с. 148,
рис. 3.17].
МАТЕРИАЛЬНЫЙ РАСЧЕТ
Исходные данные:
годовая производительность контактного узла по этиленокси-
ду 45 000 т;
годовой фонд рабочего времени 7500 ч;
степень конверсии этилена 0,42;
селективность процесса 0,60;
количество продувочных газов 7000 м3 на 1 т этиленоксида;
состав продувочных газов (<р, %): С2Н4— 2,400; С2Н4О— 0,016;
СО2 — 7,900; N2+O2+H2O — 89,684; давление (МПа): в кон-
137
----£7-----T /7/2 ^ис’ Схема потоков контакт-
ного узла производства этиленок-
сида.
1 — этилен, 2 — воздух, 3 — циркуляци-
онный газ, 4— газовоз душная смесь;
5, 7 — контактный газ; 6 — конденсат;
8 — абсорбционный газ, 9 — продувоч-
ный газ, 10 — абсорбент, 11 — насы-
щенный раствор, 12 — водный конден-
сат, 13— водяной пар,
ATI, AI2—теплообменники, РТ1 — ре-
актор синтеза, С1 — сепаратор; КЛ1 —
колонна абсорбционная
тактном аппарате — 0,86; в
абсорбционной колонне—
0,80;
температура процесса аб-
сорбции 10 °C;
степень абсорбции этиленоксида 0,98—0,99;
степень гидратации этиленоксида в процессе абсорбции 0,02.
С целью упрощения материального расчета его выполняют
для случая, когда процесс осуществляют в одну ступень (кон-
тактный аппарат второй ступени остановлен на ремонт).
Последовательность расчета:
а) определяют изменение состава газовоздушной смеси по реак-
циям 1—2;
б) рассчитывают расход свежего этилена и воздуха, объемный расход
циркуляционного газа;
в) определяют состав газовоздушной смеси на входе в контактный ап-
парат и состав контактного газа;
г) рассчитывают изменение состава газа в процессе абсорбции этиленок-
сида, состав свежего н насыщенного сорбента.
После выполнения расчета составляют таблицу материального баланса
стадии получения этиленоксида. Схема материальных потоков стадии при-
ведена на рис. 9.
Часовая производительность контактного узла по этилен-
оксиду:
45 000-1000/7500=6000 кг/ч или 6000-22,4/44=3054 м3/ч.
По основной реакции
С2Н4+0,5О2 ** С2Н4О 1
расходуется:
этилена: 3054 м3/ч или 3818 кг/ч;
кислорода: 3054/2=1527 м3/ч или 2182 кг/ч.
При селективности процесса 0,60 общий расход этилена со-
ставляет:
3818/0,60=6363 кг/ч или 5090 м3/ч.
По реакции
С2Н4+ЗО2 =* 2СО2+2Н2О
2
138
расходуется:
этилена: 6363—3818=2545 кг/ч или 2036 м3/ч;
кислорода: 2036-3=6108 м3/ч или 8726 кг/ч;
образуется:
диоксида углерода: 2036-2=4072 м3/ч или 7999 кг/ч;
водяного пара: 4072 м3/ч или 3272 кг/ч.
Расход этилена с учетом его степени конверсии:
6363/0,42=15 150 кг/ч или 12 120 м3/ч.
Для определения расхода свежего этилена и воздуха рассчи-
тывают количество продувочных газов и их состав.
Количество продувочных газов:
7000-6000/1000=42 000 м3/ч,
где 7000 — количество продувочных газов, м3/т этилеиоксида.
Содержание водяных паров в продувочных газах определя-
ется параметрами процесса абсорбции. При давлении абсорб-
ции 0,8 МПа и температуре 10 °C объемная доля водяных па-
ров в абсорбционном газе (и в продувочных газах) составляет:
100-0,00125/0,8=0,156%,
где 0,00125 — парциальное давление паров воды при температуре 10 °C, МПа
(см. Приложения, табл. 13).
Суммарная объемная доля кислорода и азота в продувочных
газах:
100,000— (0,016+2,400+7,900+0,156) =89,528%.
Объемные доли кислорода <роа и азота <рм2 в продувочных газах
находят с учетом объемного состава сухого атмосферного воз-
духа и расхода компонентов в процессе получения этиленок-
сида.
Расход свежего кислорода должен компенсировать его за-
траты на реакции окисления этилена V оа и потери при продув-
кв УпрфОа-
Расход кислорода на окисление этилена:
Рог = 1527+6108=7635 м3/ч.
Количество азота, переходящее в продувочные газы из свежего
воздуха: Кщрфы2- При объемном отношении N2:O2=79:21 всу-
хом атмосферном воздухе:
Рпр-фна: (V02 + Рпр-фог) =79 : 21;
42 000фыг/(7635+42 000фО2) =79/21;
Фы2= (28 722+158 000фО2)/42 000=0,68386+3,76190фОа;
ф№ +фог=89,528 % =0,89528;
0,68386+3,76190фо2+ 1,00000фО2=0,89528;
Фо2=0,0444 или 4,44%; фм2=0,85088 или 85,088%.
139
Определяют состав продувочных газов (поток 9):
С2Н4 с2н4О n2 о2 со2 н20 2
<р., % 2,400 0,016 85,088 4,440 7,900 0,156 100,000
к, м3/ч 1008,0 6,7 35 737,0 1864,8 3318,0 65,5 42 000,0
тх, кг/ч 1260 13 44 671 2664 6518 53 55 179
w„ % 2,283 0,024 80,957 4,828 11,812 0,096 100,000
Расход компонентов сухого воздуха:
кислорода: 7635,0+1864,8=9499,8 мэ/ч или 13 572 кг/ч;
азота: 35 737 м3/ч или 44 671 кг/ч.
Расход сухого воздуха: 45 236,8 м3/ч или 58 243 кг/ч.
Объемная доля водяных паров в воздухе:
<рН2О= 100-0,00323/1,20000=0,269%,
где 0,00323 — парциальное давление паров воды при 25 °C, МПа (см. При-
ложения, табл. 13); 1,20000 — давление поступающего воздуха, МПа.
Количество водяных паров в воздухе:
45 236,8 -0,269/ (100,000—0,269) = 122 мэ/ч или 98 кг/ч.
Общий расход свежего воздуха (поток 2):
45 236,8+122,0=45 358,8 м3/ч или 58 341 кг/ч.
Расход свежего этилена (поток 1) должен компенсировать за-
траты на реакции окисления и потери при продувке и состав-
ляет:
5090,0+1008,0 =6098,0 м8/ч или 7623 кг/ч.
Объемный расход циркуляционного газа Уцг находят из
условия равенства общего расхода этилена сумме расходов све-
жего этилена Кэт и этилена в циркуляционном газе на входе в
контактный аппарат:
6098,0+ УЦгфэт= 12 120,0 мэ/ч;
Уц.г=(12 120,0—6098,0)/0,024=250 916,7 м3/ч.
Состав циркуляционного газа (поток 3):
С2Н4 С2Н4О N2 о2 со2 Н2О 2
<Р», % 2,400 0,016 85,088 4,440 7,900 0,156 100,000
VT, м3/ч 6022,0 40,1 213 500,0 11 140,7 19 822,4 391,5 250916,7
кг/ч 7527 79 266 875 15 915 38 937 315 329 648
W,, % 2,283 0,024 80,957 4,828 11,812 0,096 100,000
Состав газовоздушной смеси (циркуляционного газа, возду-
ха и этилена) на входе в контактный аппарат (поток 4):
с2н4 С2Н4О n2 о2 СО2 Н2О 2
Vx, м3/ч 12 120,0 40,1 249 237,0 20 640,5 19 822,4 513,5 302 373,5
<рг, % 4,008 0,013 82,427 6,826 6,556 0,170 100,000
тх, кг/ч 15 150 79 311546 29 487 38 937 413 395612
% 3,830 0,020 78,750 7,454 9,842 0,104 100,000
140
Остается этилена в контактном газе:
15 150—6363=8787 кг/ч или 7030 м3/ч.
Расход кислорода по реакциям 1 и 2:
1527 + 6108=7635 м3/ч или 10 908 кг/ч.
Количество компонентов в контактном газе:
кислорода. 20 640,5—7635,0=13 005,5 м3/ч или 18 579 кг/ч;
этиленоксида: 40,1+3054,0=3094,1 м3/ч или 6079 кг/ч;
диоксида углерода: 19 822,4 +4072,0=23 894,4 м3/ч или 46 936 кг/ч;
водяного пара- 513,5 + 4072,0= 4585,5 мэ/ч или 3685 кг/ч.
Состав контактного газа (поток 5):
С2Н4 с2Н4О n2 О2 со2 П2О а
vt, м3/ч 7030,0 3094,1 249 237,0 13 005,5 23 894,4 4585,5 300 846,5
<р«, % 2,337 1,029 82,845 4,323 7,942 1,524 100,000
тх, кг/ч 8787 6079 311546 18 579 46 936 3685 395 612
% 2,221 1,537 78,750 4,696 11,864 0,932 100,000
Выходящий из контактного аппарата газ охлаждают при
давлении 0,86 МПа до температуры 10 °C. Определяют состав
контактного газа после охлаждения.
Объемная доля водяных паров
(100-0,00125)/0,86=0,145%.
Количество водяного пара:
(300 846,5—4585,5)-0,145/(100,000—0,145) =430,2 м3/ч или 346 кг/ч.
Конденсируется воды:
4585,5—430,2=4155,3 м3/ч или 3339 кг/ч.
Растворимость компонентов контактного газа в воде: СОг —
2,8 кг/т; С2Н4О— 15,5 кг/т.
Растворяется:
этиленоксида: (3339-15,5)/1000=52 кг/ч или 26,5 м3/ч;
диоксида углерода: (3339-2,8)/1000=9 кг/ч или 4,6 м8/ч.
Остается в контактном газе:
этиленоксида: 3094,1—26,5=3067,6 м3/ч или 6027 кг/ч;
диоксида углерода: 23 894,4—4,6 = 23 889,8 м3/ч или 46 927 кг/ч.
Растворимостью остальных компонентов в воде пренебре-
гают.
Количество компонентов в конденсате (поток 6), кг/ч: во-
да— 3339; этиленоксид—52; диоксид углерода — 9.
Количество конденсата 3400 кг/ч.
141
Состав контактного газа на входе в абсорбционную колонну
(поток 7):
с2н4 С2Н4О N3 Оа со2 н2о £
Vx, м3/ч 7030,0 3067,6 249237,0 13005,5 23889,8 430,2 296660,1
<Р«. % 2,370 1,034 84,014 4,384 8,053 0,145 100,000
тх, кг/ч 8787 6027 311546 18579 46927 346 392212
Wi, % 2,240 1,537 79,433 4,737 11,965 0,088 100,000
Учитывая состав потоков 3 и 9, определяют состав абсорб-
ционного газа (поток 8):
с2н4 С2Н4О Na О2 со2 Н2О 2
Vx, м3/ч 7030,0 46,8 249 237,0 13 005,5 23 140,4 457,0 292 916,7
<Рг. % 2,400 0,016 85,088 4,440 7,900 0,156 100,000
тх, кг/ч 8787 92 311 546 18 579 45 455 368 384 827
Wi, % 2,283 0,024 80,957 4,828 11,812 0,096 100,000
Поглощается этиленоксида:
3067,6—46,8=3020,8 м3/ч или 5935 кг/ч.
Степень поглощения этиленоксида:
3020,8/3067,6=0,985,
что соответствует оптимальному технологическому режиму.
По реакции
С2Н4О+Н2О С2Н4О-Н2О
гидратируется этиленоксида в водно-гликолевом растворе
3020,8-0,02=60,4 м3/ч или 119 кг/ч.
Образуется моноэтиленгликоля: 60,4 м3/ч или 167 кг/ч.
Расход воды: 60,4 м3/ч или 48 кг/ч.
Растворимость этиленоксида в сорбенте при 10 °C:
30,45 кг/м3 или 30,45-100/(1012,5+30,45) =2,9%,
где 1012,5 — плотность сорбента, кг/м3.
Растворяется этиленоксида в сорбенте:
5935—119= 5816 кг/ч.
Расход свежего 10%-го водно-гликолевого раствора:
5816(100—2,9)/2,9= 194736 кг/ч.
Количество компонентов в свежем водно-гликолевом растворе
(поток 10):
моноэтиленгликоль: 194 736-0,1 = 19 474 Кг/ч;
вода: 194 736—19 474=175 262 кг/ч.
142
Таблица 27. Сводный материальный баланс стадии получения этиленоксида
Входит кг/ч Выходит кг/ч
Свежий этилен Воздух: n2 о2 Н2О 7623 44 671 13 572 98 58 341 19474 175262 194 736 260 700 Насыщенный раствор сорбента: С2Н4О С2Н6О2 СО2 н2о 5816 19 641 1472 175 192 202 121 52 9 3339 3400 1260 13 44 671 2664 6518 53 55 179 260 700
Итого... Свежий сорбент: С2Н6О2 Н2О
Итог о... Конденсат: С2Н4О со2 н2о
Итог о...
Итого.. Продувочные газы: С2Н4 С2Н4О n2 О2 СО2 Н2О
Итог о...
В с его... В с е г о...
Растворяется диоксида углерода:
23 889,8—23 140,4 =749,4 м®/ч или 1472 кг/ч.
Остается воды в насыщенном растворе сорбента:
175 262—(368 + 48)+346=175 192 кг/ч.
Количество компонентов в насыщенном растворе сорбента (по-
ток 11):
моноэтиленгликоль: 19 474+167=19 641 кг/ч;
вода: 175 192 кг/ч;
этилен оксид: 5816 кг/ч;
диоксид углерода: 1472 кг/ч.
Количество насыщенного раствора сорбента: 202 121 кг/ч.
Составляют сводный материальный баланс стадии получе-
ния этиленоксида (табл. 27).
Расчет основных расходных коэффициентов. Количество
этиленоксида, поступающего на стадию ректификации (см.
табл. 27):
5816+52=5868 кг/ч.
143
Степень гидратации этиленоксида на стадии ректификации рав-
на 8%.
Гидратируется этиленоксида:
5868-0,08=469 кг/ч.
Остается товарного этиленоксида (без учета механических по-
терь) :
5868—469=5399 кг/ч.
Образуется моноэтиленгликоля:
469-62/44=661 кг/ч.
Всего образуется моноэтиленгликоля:
661 + 167=828 кг/ч,
где 167 — количество моноэтиленгликоля, образовавшегося на стадии син-
теза этиленоксида, кг/ч.
Расходные коэффициенты:
по этилену: 7623/5399=1,412 кг/кг;
по воздуху: 58 341/5399=10,806 кг/кг или 10,806-22,4-1000/29=8347 м3/т.
Образуется дополнительно этиленгликоля:
828/5399= 0,153 кг/ч.
ТЕХНОЛОГИЧЕСКИЙ РАСЧЕТ КОНТАКТНОГО АППАРАТА
Назначение, устройство и основные размеры.
Определение числа аппаратов
Контактный аппарат предназначен для газофазного окисления
(эпоксидирования) этилена с получением этиленоксида. Для
расчета выбран вертикальный цилиндрический стальной кожу-
хотрубчатый аппарат (со стационарным слоем катализатора,
который находится в трубах) с выносным паросборником коль-
цевой конструкции. Температурный режим аппарата поддержи-
вают за счет испарения в межтрубном пространстве конденсата
и образования насыщенного водяного пара.
Подробно описание контактного аппарата см. [24, с. 232].
Техническая характеристика контактного аппарата:
Диаметр внутренний, мм Высота общая, мм 3400 10 930 Давление, МПа: в трубном пространст- 0,86
Вместимость аппарата, 32 ве
м3 9000 в межтрубном прост- 2,4
Число труб (dTp=25X Х2 мм) ранстве Температура газовой сме-
Длина трубы, мм 6600 си, °C:
Площадь поверхности 3820 на входе в аппарат 200—220
теплообмена, м2 на выходе из аппарата 240—265
144
Аппарат снабжен штуцерами для ввода и вывода газа Dy600,
ру 1,6, штуцерами для подвода конденсата Dy 50, ру 6,4 и выво-
да пара Dy 150, ру 6,4. Подача газовоздушной смеси на одну
трубку контактного аппарата составляет 8,0±0,8 м3/ч.
Определяют, учитывая объемный расход газовой смеси, по-
даваемой в контактный аппарат (см. состав потока 4), требуе-
мое число трубок:
302 373,5/8=37 797.
Число контактных аппаратов: 37 797/9000=4,2.
Таким образом, необходимо установить четыре контактных
аппарата.
Нагрузка по газовой смеси на одну трубку составит:
302 373,5/36 000=8,4 м3/ч,
что допустимо, так как максимальная нагрузка может состав-
лять 8,8 м3/ч.
Объем катализатора, загружаемого в один контактный аппа-
рат:
К=0,785 • 0,0212 • 6,2 • 9000= 19,3 м3,
где 0,021—внутренний диаметр трубы, м; 6,2 — высота слоя катализатора
в трубах, м
Количество этиленоксида, получаемого с 1 м3 катализатора
на основной ступени контактирования, составляет 80 кг/ч. Про-
изводительность одного контактного аппарата по образующе-
муся этиленоксиду равна 19,3-80=1544 кг/ч, четырех аппара-
тов— 4-1544 = 6176 кг/ч, следовательно, достаточно установить
четыре аппарата. Запас производительности по катализатору
равен:
(6176—6000) • 100/6000= 2,9%.
Тепловой расчет аппарата
Исходные данные:
в контактный аппарат подают 302 373,5/(4-3600) =20,998 м3/с
газовоздушной смеси; выводят из аппарата 300 846,5/(4-3600) =
=20,892 м3/с контактного газа;
составы материальных потоков см. Материальный расчет;
температура: газовоздушной смеси на входе в аппарат 220 °C;
контактного газа на выходе из аппарата 265 °C.
Цель расчета — определение тепловой нагрузки и паропро-
изводительности контактного аппарата.
Уравнение теплового баланса в общем виде:
Ф1 +®2= Фз"Ь ®4"b Фпот,
где Фь Фз — тепловые потоки газовоздушной смеси и контактного газа со-
10—69 145
Таблица 28. Расчет средних объемных теплоемкостей газовоздушной
смеси (493 К) и контактного газа (538 J\)
Компонент <рг, % /=220+273=493 К <рг, % Г=265+273=Б38 К
ct, Дж/ /(моль-К) с,<Р,/(22,4 100). кДж/(мг К) Дж/ /(моль К) с,<р,/(22 4 100), кДж/(м3 К)
С2Н4 4,008 62,26 0,1114 2,337 65,99 0,0688
С2Н4О 0,013 74,06 0,0004 1,029 79,22 0,0364
n2 82,427 29,98 1,1032 82,845 30,18 1,1162
о2 6,826 31,58 0,0962 4,323 31,98 0,0617
со2 6,556 45,09 0,1320 7,942 46,05 0,1633
Н2О 0,170 35,41 0,0027 1,524 35,87 0,0244
X 100,000 — 1,4459 100,000 — 1,4708
ответственно, кВт; Фа — теплота экзотермических реакций, кВт; Ф4 — тепло-
та, отводимая кипящим конденсатом, кВт; ФпОт — теплопотери в окружаю-
щую среду, кВт.
Для определения значений Ф] и Ф3 используют данные о со-
ставе потоков 4 и 5.
Расчет значений средних объемных теплоемкостей газовоз-
душной смеси при 7'1 = 220+273=493 К и контактного газа при
Уз = 265+273 = 538 К приведен в табл. 28.
Ф1=20,998 -1,4459 • 220=6679,42 кВт;
Фз=20,892 1,4708 • 265=8142,91 кВт.
Определяют теплоту реакций 1 и 2 (в кДж/моль):
Реакция ДН”и,=2ДН»298(хон)—ХДН»298(ясх)
С2Н4+0,5О2->С2Н4О —52,63—52,30=—104,93
С2Н4+ЗО2->2СО2+2Н2О 2- (—393,51) +2(—241,81)—52,30=
=—1322,94
Рассчитывают теплоту экзотермических реакций по форму-
ле (49):
Ф2= [1000/(4-3600-22,4)] (3054-104,93 + 2036-1322,94) =9343,88 кВт.
Общий приход теплоты (поток 4):
Фприх= Ф1+Ф2=6679,42+9343,88=16 023,30 кВт.
Принимают, что теплопотери в окружающую среду составляют
3% от общего прихода теплоты:
Фпот=0,03-16 023,30=480,70 кВт.
Находят теплоту, отводимую кипящим конденсатом, из общего
уравнения теплового баланса:
Ф4= Ф„рЕХ—Ф3—Фпот=16 023,30—8142,91—480,70 =7399,69 кВт.
146
Таблица 29. Тепловой баланс аппарата
Приход кВт % Расход кВт %
Тепловой поток газовоздушной смеси 6679,42 41,7 Тепловой поток контактного газа 8142,91 50,8
Теплота экзотер- мических реакций 9343,88 58,3 Теплота, отводи- мая кипящим кон- денсатом Теплопотери в окружающую сре- ДУ 7399,69 480,70 46,2 3,0
В с е г о... 16 023,30 100,0 Всего 16 023,30 100,0
Паропроизводительность аппарата:
7 399 690/1 855 000 = 3,989 кг/с или 14,36 т/ч,
где 1855 000 — удельная теплота парообразования при давлении 2,4 МПа,
Дж/кг (см. Приложения, табл. 14).
Составляют тепловой баланс аппарата (табл. 29).
РАСЧЕТ АБСОРБЦИОННОЙ КОЛОННЫ
Назначение и устройство.
Определение числа колонн
Абсорбционная колонна предназначена для поглощения водой
этиленоксида из контактного газа. Для расчета выбран сталь-
ной вертикальный колонный аппарат с колпачковыми тарелка-
ми (тип ТСК). Число абсорберов принимают по числу контакт-
ных аппаратов — четыре.
Исходные данные:
расход контактного газа (поток 7): тк=392 212/4=98 053 кг/ч;
Кк = 296 660,1/4 = 74 165 м3/ч;
количество абсорбционного газа (поток 8): гиа = 384 827/4=
= 96 207 кг/ч; Ка = 292 916,7/4=73 229 м3/ч;
расход свежего сорбента (поток 10): тс= 194 736/4 = 48 684 кг/ч;
количество насыщенного сорбента (поток 11): £ = 202 121/4=
= 50 530 кг/ч;
температура, °C: контактного газа на входе— 10; абсорбционно-
го газа на выходе—10; свежего сорбента на входе — 5; насы-
щенного сорбента на выходе—10; давление абсорбции /?а =
= 0,86 МПа;
10*
147
плотность насыщенного абсорбента рж=1013 кг/м3;
расстояние между тарелками (проверяется гидравлическим рас-
четом) 800 мм.
Определение диаметра абсорбционной колонны
Диаметр абсорбционной колонны в наиболее нагруженной ниж-
ней части ее определяют по формуле [25, уравнение (III.81)]:
__ Д/рЖ ~|~ У тк (kQC + 35) /~|/Рг (Рж — Рг)
а “ kQC + 35
где £)а — диаметр абсорбера, м; L — расход насыщенного сорбента, кг/ч;
тк — расход контактного газа на входе в абсорбционную колонну, кг/ч;
рж — плотность насыщенного сорбента, кг/м3; рг — плотность контактного
газа прн температуре 273 + 10 =283 К и давлении 0,86 МПа, кг/м3; ^ — ко-
эффициент, для колпачковой капсульной тарелки fco=O,25 [25, с. 265J; С —
коэффициент, зависящий от расстояния между тарелками.
Значения коэффициента С при различном расстоянии меж-
ду тарелками для абсорберов приведены ниже:
//т, мм 300 400 600 800 1000
С — 412 522 550 100
При //, = 800 мм 6=550.
Плотность контактного газа при температуре 273 К и давле-
нии 101 325 Па:
Ро=/Пк/Гк=98 053/74 165=1,322 кг/м3.
Плотность контактного газа при температуре 283 К и давлении
8,6-105 Па:
рг=1,322-273-8,6-10®/(283-101 325) = 10,82 кг/м3.
Диаметр абсорбера:
__ 50530/1013 +У 98 053(0,25-550+~35)/~[/10,82(1013,00 — 1Q1) _
а~ 0,25-550 + 35 “
= 2,63 м.
На основании рассчитанного принимают значение диаметра аб-
сорбера в соответствии с базовыми размерами обечаек £>а =
= 2800 мм (ГОСТ 9617—76).
Принимают по ОСТ 26—808—73 тип тарелки ТСК-Р со сле-
дующей характеристикой [26, табл. 8.6]:
Рабочая площадь тарел- 4,74
ки Др, м2
Площадь прохода паров 0,769
До, м2
Площадь слива ДСЛ1 м2 0,686
Периметр слива П, м 2,096
Длина пути жидкости 1Ж, 1,826
м
Число колпачков на тарел- 238
ке т, шт.
Диаметр колпачка dK, мм 100
148
Гидравлический расчет основных параметров тарелки
Гидравлический расчет выполнен по [26, с. 222—233].
Цель расчета — определение высот сливного порога
Лпор, подпора жидкости над сливным порогом йсл, открытия
прорези /гпр и сопротивления тарелки Др (рис. 10).
В ходе гидравлического расчета определяют правильность
выбора расстояния между тарелками (77т = 800 мм) по значению
относительного уноса жидкости (У<0,1).
В соответствии с исходными данными отношение тк: тс=
= 98 053 : 48 684=2,01 >2, следовательно, при определении вы-
соты слива /гсл следует также учитывать унос жидкости.
Относительный унос жидкости рассчитывают по формуле
У=(*1/о)[шр/(//т-/гпн) ]"i,
где ki — коэффициент, для колпачковых тарелок *!=23,0-10~5; о — поверх-
ностное натяжение, Н/м; wp— скорость газа в рабочем сечении колонны, м/с;
//т — расстояние между тарелками, м; h-liK — высота газожидкостной смеси
(пены), образующейся на тарелке, м; щ—показатель степени; для колпач-
ковых тарелок «1 = 1,16.
Средний объемный расход газа в рабочем сечении колонны
при температуре 283 К и давлении 8,6-10s Па:
К= [(74 165+73 229)/(2-3600)] [283-101 325/(273-8,6-10s)] =2,50 м»/с.
Скорость газа в рабочем сечении колонны:
wp = VrIFp=2,50/4,74 = 0,527 м/с.
Высоту пены рассчитывают по формуле
*пн = (k2/o°’33) (*3Щр2рг + *4*сл+*пор),
где Дел — высота подпора жидкости иад сливным порогом, м; hUQf — высота
сливного порога на' тарелке, м.
Для колпачковой тарелки:
*2=0,23; *з=4,4-10-2; *«=4,6.
Для воды при /сР = (10+5)/2=7,5°С о=760-10~4 Н/м (см. При-
ложения, табл. 16).
Высоту подпора жидко-
сти над сливным поро-
гом находят по формуле
Лсл=0,68(Уж/77)0-®7,
Рис. 10. Схема колпачка:
hcn — высота подпора жидкости над
сливным порогом; hnop — высота
сливного порога иа тарелке; hnp —
высота открытия прорези;
высота (глубина) барботажа; —
высота установки колпачка
149
где Vx — действительный расход жидкости, протекающей через переливиое
устройство, м/с.
Гж=/Пс/(3600рж) =48 684/(3600-1013) =0,0133 м3/с;
ЯСл=0,68(0,0133/2,0960)°-67=0,023 м.
Высоту открытия прорези рассчитывают по формуле
/1пр = 0,4бУ [Уг/ (Щ^КпЯ) ] 2рг/(рж-рг).
Для установки выбирают колпачок с прямоугольными про-
резями шириной Ь=4 мм и числом прорезей в колпачке zKn=26.
При числе колпачков га = 238:
з_____________________________________
Япр=О,46У [2,50/(238 26 0,004) ] 210,82/ (1013,00—10,82) =0,022 м.
Принимают высоту прорези для капсульного колпачка hBf =
=20 мм. Глубину барботажа рассчитывают по формуле
/1г.б= (0,7/рж)р°’36,
где р— давление в абсорбционной колонне, Па.
hT 6= (0,7/1013,0) -860 000°’®s=0,083 м.
Высота сливного порога на тарелке:
Япор = Яг.б-Ясл+Яцр + Йу,
где Яу — высота установки колпачка.
Принимаем /гу=9 мм, тогда
Япор =0,083—0,023 +0,002+0,009=0,089 м.
Высота пены:
Япн= (0,23/0,076°-33) (4,4-10-2-0,5272-10,82+4,6-0,023+0,089) =0,176 м.
Относительный унос жидкости:
У= (23,0-10-5/0,076) [0,527/(0,800—0,176)] 1-16=0,0025.
Расстояние между тарелками //т = 800 мм выбрано правильно,
так как У=0,0025, что меньше 0,1. Действительная нагрузка
сливного устройства по жидкости;
Ужд = V»+тку/ (ЗбООрж) = 0,0133+98 053 0,0025/(3600 1013) = 0,0134 м8/с.
Действительная величина подпора жидкости:
Яслд=0,68 (0,0134/2,096) °-67=0,023 м.
Значение /гслА не отличается от рассчитанного ранее значе-
ния Йсл-
Для принятой тарелки проверяют надежность работы слив-
ного устройства, скорость жидкости в котором (во избежание
захлебывания) должна отвечать условию:
Щж.СЛ= Ужд/Гсл<ЯвТ/тя2,
где Яв и па — коэффициент и показатель степени, зависящие от вспеииваемо-
сти жидкости.
150
Для случая абсорбции углеводородов Л5=0,225 и «2=0,80.
Скорость жидкости в сливном устройстве:
«<ж.сл=0,0134/0,686= 0,0195 м/с;
ksH^=0,225-0,8°-80=0,1882.
Так как 0,0195<0,1882, захлебывания не произойдет.
Скорость жидкости в зазоре между основанием тарелки и
нижней кромкой сливного стакана определяют по формуле
шж 3= Удж/(/7а) <0,45,
где а=0,06 м для колпачковых тарелок.
wx 3=0,0134/(2,096-0,06) =0,107 м/с.
Выбранная однопоточная тарелка обеспечит нормальную
работу сливных устройств, так как wx,3 — 0,107, что меньше 0,45.
Сопротивление сухой тарелки определяют по формуле
Apc=tcPr£0o2/2,
где t — коэффициент сопротивления сухой тарелки; и)0 — скорость газа в
паровых патрубках тарелки, м/с.
Для колпачковой тарелки:
= 1,73</к-°-25= 1,73 - 0,1 -°-25=3,1,
где dK — диаметр колпачка, м.
Юо=уг/Д0=2,50/0,769=3,251 м/с;
Арс=3,1-(10,82-3,2512)/2=177 Па.
Перепад уровня жидкости на тарелке определяют по формуле
АЛ = 0,1 Хэ-----М±.ду)2----
/72(Йпор + ЙдсЛ)8й
где Ха — эквивалентный коэффициент сопротивления перетоку жидкости по
тарелке; 1Х — длина пути жидкости на тарелке, м; Гдж — действительная
нагрузка сливного устройства по жидкости, м3/с; g— ускорение свободного
падения, м/с2.
Для тарелок с капсульными колпачками:
Хз = 16/ж = 16 1,826=29,22
1,826-0,01342
Ай = 0,1 -29,22 -----:1---------------=0,016 м.
2,0962(0,089 + 0,023)39,81
Сопротивление слоя жидкости на тарелке:
ApK= [йг.б+(йпр+Ай)/2]рж§= [0,083+ (0,022+0,016)/2] -1013-9,81 = 1014 Па.
Общее сопротивление тарелки: Др= 177+1014= 1191 Па.
Число ступеней изменения концентраций определяют графи-
чески [9, с. 583], оно составляет 7VT=14. Принимают, что к. п. д.
тарелки rj = 0,35, тогда фактическое число тарелок в колонне
равно:
ЛГф= 14/0,35 =40.
151
Общую высоту абсорбционной колонны определяют по формуле
Н= (Л^ф—1) Дт +Дсеп + Дкуб,
где Нт—расстояние между тарелками, м; Нсеп — высота сепарационной
части, м; Нкуо — высота кубовой части, м.
Для колонных аппаратов диаметром 2800—4000 мм //Сеп=
= 1200 мм, 7/куб=3000 мм [27, табл. 8.2J, тогда
Н= (40—1)-0,8 +1,2+3,0=35,4 м.
Таким образом, для обеспечения заданной производительно-
сти необходимо установить четыре абсорбционные колонны диа-
метром 2,8 м и высотой 35,4 м с капсульными колпачковыми
тарелками ТСК-Р.
ПОЛУЧЕНИЕ АЦЕТАЛЬДЕГИДА
ОКИСЛЕНИЕМ ЭТИЛЕНА
В промышленности ацетальдегид получают из трех видов сырья:
этилена, этанола, ацетилена. В связи с тем что ацетилен как
химическое сырье за последние 15—20 лет был вытеснен эти-
леном и пропиленом, а процесс получения ацетальдегида из эта-
нола характеризуется многостадийностью и высокой капитало-
емкостью, наиболее перспективным является метод получения
ацетальдегида из ацетилена. В СССР первое производство аце-
тальдегида прямым окислением этилена в присутствии водного
раствора солей меди и палладия введено в эксплуатацию в
1970 г. Процесс включает две стадии:
синтез ацетальдегида (карбонилирование):
СН2=СН2+2СиС12+Н2О СНз—СНО+2СиС1+2НС1;
регенерация каталитической системы кислородом воздуха:
2CuC1+2HC1+0,5O2 —> 2CuC12+Hs>0;
суммарное уравнение:
СН2=СН2+0,5О2 —> СН3—СНО, — ДЯ°298=218,3 кДж/моль.
Процесс осуществляют в одну или две стадии: при односта-
дийном процессе карбонилирование и окисление ведут в одном
реакторе, в двухстадийном -— в разных.
Двухстадийный процесс проводят при давлении 0,8—1,4 МПа
и температуре 104—112 °C. В таких условиях степень конверсии
этилена достигает 98%, селективность по ацетальдегиду — 93%.
Основными преимуществами двухстадийного процесса явля-
ются отсутствие циркуляции этилена, менее жесткие требования
к чистоте исходного этилена, большая безопасность процесса.
Описание технологической схемы см. [3, с. 158; 4, с. 449].
152
МАТЕРИАЛЬНЫЙ РАСЧЕТ
Исходные данные:
годовая производительность установки по ацетальдегиду
92 000 т;
годовой фонд рабочего времени 8000 ч;
состав технического этилена %]: этилен — 99,9; этан —
0,1;
степень конверсии этилена 0,98;
доля этилена, расходуемого на образование продуктов окисле-
ния, %: ацетальдегид — 93,00; уксусная кислота — 1,00; диоксид
углерода — 2,50; щавелевая кислота — 0,60; кротоновый альде-
гид— 0,30; высокомолекулярные и полимерные продукты —
0,90; этилхлорид — 0,08; монохлорацетальдегид — 1,03; дихлор-
ацетальдегид-— 0,30; трихлор ацетальдегид — 0,15; трихлорме-
тан — 0,07; дихлор метан — 0,07;
потери, %: ацетальдегида на стадии ректификации — 2,0; эти-
лена на стадии синтеза — 2,1;
объемная доля кислорода в отработанном воздухе 4,0.
Схему потоков см. на рис. 11.
Часовая производительность установки по ацетальдегиду:
(92 000/8000)1000=11500 кг/ч или 11500/44=261,364 кмоль/ч.
С учетом 2% потерь на стадии ректификации необходимо полу-
чить ацетальдегида на стадии синтеза:
261,364-100/(100—2) =266,698 кмоль/ч или 11734,7 кг/ч.
Рис. 11. Схема потоков стадии синтеза ацетальдегида:
/, /6 — этилен, 2, 13, 15— окисленный каталнзаторный раствор; 3 — газожидкостная смесь;
4, 5 — продукты реакции, 6 — кубовая жидкость со стадии ректификации; 7—ацетальде-
гид-сырец, 8 — каталнзаторный раствор на окисление, 9— воздух; 10 — конденсат; 11 —
активированный каталнзаторный раствор, 12 — катализаторно-воздушная смесь; 14— от-
работанный воздух,
РТ1, РТ2 — реакторы, КЛ1 — отпарная колонна; CI — сепаратор
153
Расходуется этилена на получение ацетальдегида:
266,698/0,93=286,772 кмоль/ч.
Расходуется этилена с учетом степени конверсии:
286,772/0,98 =292,624 кмоль/ч.
Содержится этилена в продуктах реакции:
292,624—286,772=5,852 кмоль/ч.
Расходуется этилена с учетом потерь на стадии синтеза:
292,624-100/(100,0—2,1) =298,901 кмоль/ч или 298,901-28=8369,2 кг/ч.
Потери этилена (поток 16):
298,901—292,624 = 6,277 кмоль/ч или 175,8 кг/ч.
Расходуется технического этилена:
298,901/0,999=299,200 кмоль/ч.
Количество этана, содержащегося в техническом этилене:
299,200—298,901=0,299 кмоль/ч или 9,0 кг/ч.
Выполняют материальный расчет системы из двух реакто-
ров (условно принимают, что окисление этилена происходит
воздухом и хлороводородом).
По основной реакции
С2Н4+0,5О2 —* СНзСНО 1
расходуется:
этилена: 266,698 кмоль/ч или 7467,5 кг/ч;
кислорода: 0,5-266,698=133,349 кмоль/ч или 4267,2 кг/ч;
образуется ацетальдегида: 266,698 кмоль/ч или 11 734,7 кг/ч;
По реакции
С2Н4+О2 —> СНз—СООН 2
расходуется:
этилена: 0,01-286,772= 2,868 кмоль/ч или 80,3 кг/ч;
кислорода: 2,868 кмоль/ч или 91,8 кг/ч;
образуется уксусной кислоты: 2,868 кмоль/ч или 172,1 кг/ч.
По реакции
С2Н4+ЗО2 —* 2СО2+2Н2О 3
расходуется:
этилена: 0,025-286,772=7,169 кмоль/ч или 200,8 кг/ч;
кислорода: 3-7,169= 21,507 кмоль/ч или 688,2 кг/ч-
154
образуется:
диоксида углерода: 2-7,169=14,338 кмоль/ч или 630,9 кг/ч;
водяного пара: 14,338 кмоль/ч или 258,1 кг/ч.
По реакции:
С2Н4+2,5О2 —► Н2С2О4+Н2О 4
расходуется:
этилена: 0,006-286,772=1,721 кмоль/ч или 48,2 кг/ч;
кислорода: 2,5-1,721=4,302 кмоль/ч или 137,7 кг/ч;
образуется:
щавелевой кислоты: 1,721 кмоль/ч или 154,9 кг/ч;
водяного пара: 1,721 кмоль/ч или 31,0 кг/ч.
По реакции
2С2Н4+О2 —> СН3—СН=СН—СНО+НгО 5
расходуется:
этилена: 0,003-286,772=0,860 кмоль/ч или 24,1 кг/ч;
кислорода: 0,5-0,860=0,430 кмоль/ч или 13,8 кг/ч;
образуется:
кротонового альдегида: 0,430 кмоль/ч или 30,1 кг/ч;
водяного пара: 0,430 кмоль/ч или 7,8 кг/ч.
По реакции
пС2Н4+0,5пО2 •—* [—С2Н4О—6
расходуется:
этилена: 0,009-286,772= 2,581 кмоль/ч или 72,3 кг/ч;
кислорода: 0,5-2,581 = 1,290 кмоль/ч или 41,3 кг/ч;
образуется высокомолекулярных и полимерных продуктов (мас-
совый расход определяют по сумме расходов этилена и кисло-
рода): 2,581 кмоль/ч или 113,6 кг/ч.
По реакции
С2Н4+НС1 —> С2Н5С1 7
расходуется:
этилена- 0,0008-286,772=0,229 кмоль/ч или 6,4 кг/ч;
хлороводорода: 0,229 кмоль/ч или 8,4 кг/ч;
образуется этилхлорида: 0,229 кмоль/ч или 14,8 кг/ч.
По реакции
СУЩ+С^+НС! —» СИСНгСНО+НгО 8
155
расходуется:
этилена: 0,0103-286,772=2,954 кмоль/ч или 82,7 кг/ч;
кислорода: 2,954 кмоль/ч или 94,5 кг/ч;
хлороводорода: 2,954 кмоль/ч или 107,8 кг/ч;
образуется:
монохлорацетальдегида: 2,954 кмоль/ч или 231,8 кг/ч;
водяного пара: 2,954 кмоль/ч или 53,2 кг/ч.
По реакции
С2Н4+1,5О2+2НС1 — СНС12—СНО+2Н20 9
расходуется:
этилена: 0,003-286,772 = 0,860 кмоль/ч или 24,1 кг/ч;
кислорода: 1,5-0,860=1,290 кмоль/ч или 41,3 кг/ч;
хлороводорода: 2-0,860=1,720 кмоль/ч или 62,8 кг/ч;
образуется:
дихлорацетальдегида: 0,860 кмоль/ч или 97,2 кг/ч;
водяного пара: 1,720 кмоль/ч или 31,0 кг/ч.
По реакции
С2Н4+2О2+ЗНС1 —> СС13—СНО+ЗНгО 10
расходуется:
этилена: 0,0015-286,772= 0,430 кмоль/ч или 12,0 кг/ч;
кислорода: 2-0,430=0,860 кмоль/ч или 27,5 кг/ч;
хлороводорода: 3-0,430=1,290 кмоль/ч или 47,1 кг/ч;
образуется:
трихлорацетальдегида: 0,430 кмоль/ч или 63,4 кг/ч;
водяного пара: 1,290 кмоль/ч или 23,2 кг/ч.
По реакции
С2Н4+2О2+6НС1 —>• 2СНС1з+4НгО 11
расходуется:
этилена: 0,0007-286,772=0,201 кмоль/ч или 5,6 кг/ч;
кислорода: 2-0,201=0,402 кмоль/ч или 12,9 кг/ч;
хлороводорода: 6-0,201=1,206 кмоль/ч или 44,0 кг/ч;
образуется:
трихлорметана: 2-0,201=0,402 кмоль/ч или 48,0 кг/ч;
водяного пара: 4-0,201=0,804 кмоль/ч или 14,5 кг/ч.
По реакции
С2Н4+О2+4НС1 —>• 2СН2С12+2Н2О 12
156
расходуется:
этилена: 0,0007-286,772=0,201 кмоль/ч или 5,6 кг/ч;
кислорода: 0,201 кмоль/ч или 6,4 кг/ч;
хлороводорода: 4-0,201=0,804 кмоль/ч или 29,4 кг/ч;
образуется:
дихлорметаиа: 2-0,201=0,402 кмоль/ч или 34,2 кг/ч;
водяного пара: 0,402 кмоль/ч или 7,2 кг/ч.
Всего расходуется кислорода по реакциям 1—6, 8—12:
133,349+2,868+ 21,507 + 4,302+ 0,430+1,290 +2,954+1,290 +0,860+
+0,402+0,201 = 169,453 кмоль/ч или 5422,6 кг/ч.
Всего расходуется хлороводорода:
0,229+2,954+1,720+1,290+1,206 +0,804 = 8,203 кмоль/ч или 299,5 кг/ч.
Всего образуется водяного пара:
14,338+1,721+0,430+ 2,954 +1,720 +1,290+ 0,804 +0,402=23,659 кмоль/ч
или 426,0 кг/ч.
Расход воздуха на окисление находят из уравнения
0,209 Vx—фо2 (Vx—V02) = V02,
где Vx — расход воздуха, м3/ч; 0,209 — объемная доля кислорода в воздухе,
доли, ед.; Ф02 — объемная доля кислорода в отработанном воздухе, доли ед.;
Vot — расход кислорода иа окисление этилена, м3/ч.
Расход кислорода на окисление этилена:
V02 = 169,453• 22,4 = 3795,7 мэ/ч.
Расход воздуха:
0,20914—0,04 (К—3795,7) =3795,7; 0,169Vx=3947,5; 14=23 358 м’/ч.
Рассчитывают состав воздуха:
кислород: 0,209-23 358=4881,8 м3/ч (217,938 кмоль/ч) или 6974,0 кг/ч;
азот: 23 358,0—4881,8=18 476,2 мэ/ч (824,830 кмоль/ч) или 23 095,2 кг/ч.
Содержится кислорода в продуктах реакции:
217,938—169,453=48,485 кмоль/ч или 6974,0—5422,6=1551,4 кг/ч.
Количество отработанного воздуха (поток 14):
48,485+824,830=873,315 кмоль/ч или 24 646,6 кг/ч.
Составляют таблицу материального баланса стадии синтеза
(табл. 30).
Так как в действительности в реакторе РТ1 окисление эти-
лена осуществляется катализаторным раствором, допускают,
что расход последнего равен расходу кислорода и хлороводоро-
да на образование продуктов реакции.
157
Определяют расход катализаторного раствора:
11 734,7/6,0=1956 ма/ч,
где 11 734,7 — производительность установки по ацетальдегиду, кг/ч;
6,0 — производительность катализаторного раствора по ацетальдегиду, кг/м8
катализаторного раствора.
Принимают, что плотность катализаторного раствора равна
1100 кг/м3, тогда его расход составит:
1956-1100=2 151 362 кг/ч.
Рассчитывают состав катализаторного раствора:
Wi, %
mt, кг/ч
PdCl2
0,2
4303
CuClg
12,2
262 466
СН3СООН
3,3
70 995
на
1,5
32 270
нао
82,8
1 781 328
S
100,0
2 151 362
Допускают, что количество катализаторного раствора на вы-
ходе из реактора уменьшится за счет прореагировавших воды
и хлороводорода:
2 151 362,0—(299,5+5422,6) =2 145 639,9 кг/ч,
где 5422,6 — расход кислорода на образование продуктов реакций, кг/ч
(рассчитано выше).
Таблица 30. Материальный баланс стадии синтеза
Входит кг/ч кмоль/ч Выходит кг/ч кмоль/ч
Этилен техниче- ский: С2Н4 с2н6 8369,2 9,0 298,901 0,299 Продукты реак- ции: СНзСНО СНзСООН Н2С2О4 СН3СН= =СНСНО СН2С1СНО СНС12СНО СС13СНО СН3СН2С1 СН2С12 СНС13 н2о С2Н4 полимеры с2н6 О2 n2 со2 11734,7 172,1 154,9 30,1 231,8 97,2 63,4 14,8 34,2 48,0 426,0 163,8 113,6 9,0 1551,4 23095,2 630,9 266,698 2,868 1,721 0,430 2,954 0,860 0,430 0,229 0,402 0,402 23,659 5,852 2,581 0,299 48,485 824,830 14,338
Итог о... Воздух: о2 n2 8378,2 6974,0 23095,2 299,200 217,983 824,830
Итог о... Хлороводород 30 069,2 299,5 1042,813 8,203
Итог о... Потери этилена 38 571,8 175,1 1197,038 6,277
В с е г о... 38746,9 1350,216 В с е г о... 38 746,9 1203,315
158
Таблица 31. Материальный баланс реактора РТ1
Входит кг/ч % Выходит кг/ч %
Этилен техниче- ский: с2н4 СгНв 8369,2 9,0 99,9 0,1 Продукты реак- ции: СНзСНО СНзСООН Н2С2О4 СН3СН= =снсно СН2С1СНО СНС12СНО СС13СНО СН3СН2С1 СН2С12 СНС13 Н2О с2н4 полимеры с2н6 со2 11 734,7 172,1 154,9 30,1 231,8 97,2 63,4 14,8 34,2 48,0 426,0 163,8 113,6 9,0 630,9 84,3 1,2 1,1 0,2 1,7 0,7 0,5 0,1 0,3 0,3 3,1 1,2 0,8 4,5
Итог о... Катализаториый раствор: PdCl2 CuCl2 СНзСООН НС1 Н2О 8378,2 4303,0 262 466,0 70 995,0 32 270,0 1 781 328,0 100,0 0,2 12,2 3,3 1,5 82,8
Итог о... 2 151 362,0 100,0
Итог о... Потери этилена Катализаториый раствор: PdCl2 CuCl2 CH3COOH HC1 H2O 13 924,5 175,8 4303,0 262 466,0 70 995,0 31 970,5 1775 905,4 100,0 100,0 0,2 12,2 3,3 1,5 82,5
Итого... 2 145 639,9 100,0
В с е г о... 2 159 740,2 — Beer 0... 2 159 740,2 —
Составляют таблицу материального баланса реактора РТ1
(табл. 31).
Рассчитывают материальный баланс отпарной колонны.
В колонну КЛ1 поступает реакционная смесь с катализаторным
раствором из реактора РТ1 для отделения ацетальдегида и по-
бочных продуктов от катализаторного раствора. Для поддержа-
ния постоянной концентрации катализаторного раствора в ко-
лонну подают постоянное количество кубовой жидкости со ста-
дии ректификации (1,8—2,0 т на 1 т ацетальдегида, температу-
ра 84—94°C). Принимают, что в газовую фазу переходят 95,7%
ацетальдегида и все компоненты, кроме щавелевой кислоты и
катализаторного раствора.
Количество ацетальдегида, переходящего в газовую фазу:
11 734,7-0,957=11230,1 кг/ч.
159
Таблица 32. Материальный баланс отпарной колонны
Входит кг/ч Выходит к1г/ч
Продукты реакции: ацетальдегид и дру- гие кислородсодер- жащие соединения хлорор ганические соединения углеводороды Н2О СО2 12 091,8 489,4 286,4 426,0 630,9 13 924,5 2 145639,9 22 296,0 2 181 860,4 Ацетальдегид-сырец: СНзСНО СНзСООН СН3СН=СНСНО хлорорганические соединения углеводороды Н2О СО2 11 230,1 172,1 30,1 489,4 286,4 22 722,0 630,9 35 561,0 504,6 154,9 4303,0 262 466,0 70 995,0 31 970,5 1 775 905,4 2 146 299,4 2 181 8f0,4
Итого Катализаторный раствор Кубовая жидкость со стадии ректификации Итого... Катализаторный рас- твор: СН3СНО Н2С2О< PdCl2 CuCl2 СНзСООН НС1 н2о
Итог о...
В с е г о... В с е г о...
Расходуется кубовой жидкости из отделения ректификации:
1,9-11734,7=22 296,0 кг/ч.
Составляют таблицу материального баланса отпарной ко-
лонны (табл. 32).
Выполняют материальный расчет реактора РТ2.
Расход воздуха (см. табл. 30, поток 9): 30 069,2 кг/ч.
Расход катализаторного раствора, поступающего на окисление
(см. табл. 32, поток 8): 2 146 299,4 кг/ч.
Расход конденсата (поток 10):
0,2-11 734,7=2347 кг/ч,
где 0,2 — удельный расход конденсата, т иа 1 т ацетальдегида.
Расход активированного катализаторного раствора (поток 11):
1,85-11 734,7=21 709,2 кг/ч,
где 1,85 — удельный расход катализаторного раствора, т иа 1 т ацеталь-
дегида.
Рассчитывают количество катализаторного раствора, подавае-
мого на активацию:
(30 069,2 +2 146 299,4+2347,0+21 709,2)—(2 151 362,0+24 646,6) =
=24416,2 кг/ч,
160
где 2 151 362,0—расход катализаторного раствора в реактор РТ1 (поток 2),
кг/ч; 24 646,6 — количество отработанного воздуха (см. состав потока 14),
кг/ч.
Потери катализаторного раствора при активации:
100— (21 709,2/24 416,2) • 100= 11,1 %,
что соответствует оптимальному технологическому режиму.
Составляют таблицу материального баланса реактора РТ2
(табл. 33).
ТЕХНОЛОГИЧЕСКИЙ РАСЧЕТ
Технологический расчет процесса получения ацетальдегида
включает технологические расчеты реакторов РТ1, РТ2, отпар-
ной колонны КЛ1.
Технологический расчет реактора РТ1
Назначение, устройство, основные размеры.
Определение числа реакторов
Реактор РТ1 предназначен для окисления этилена в ацетальде-
гид катализаторным раствором. Для расчета выбран вертикаль-
ный змеевиковый реактор, состоящий из {/-образных труб, со-
единенных в нижней части ретурбентами. На шести последних
витках змеевика предусмотрена паровая рубашка для подогре-
ва катализаторного раствора в пусковой период.
Таблица 33. Материальный баланс реактора РТ2
Входит (поток 12) кг/ч Выходит (поток 13) кг/ч
Воздух (поток 9): кислород азот 6974,0 23095,2 Катализаторный рас- твор: в реактор РТ1 (поток 2) на активацию (поток 15) 2 151 362,0
Итог о... Окисленный катализа- торный раствор (по- ток 8) Конденсат (поток 10) Активированный ката- лизаторный раствор (по- ток 11) 30 069,2 2 146 299,4 24 416,2
2347,0 21 709,2 Итог о... Отработанный воздух (поток 14): кислород азот 2 175 778,2 1551,4 23 095,2
Итог о... 24 646,6
В с е г о... 2 200424,8 В с е г о... 2 200424,8
11—69
161
Объемный расход катализаторного раствора, рассчитанный
ранее, составляет:
Ут= 1956/3600=0,5433 м’/с.
Определяют вместимость реактора, принимая время пребыва-
ния веществ в зоне реактора т=65 с:
Vp = =0,5433 • 65=35,3 мэ.
Рассчитывают внутренний диаметр реактора при скорости дви-
жения жидкости w=4,4 м/с (такая скорость обеспечивает пу-
зырьковый режим движения катализаторного раствора):
d = 1,13V Vr/w =1,13f0,5433/4,4=0,397 м.
Принимают внутренний диаметр реактора dp=400 мм, тогда
общая длина реактора составит:
I = Vtl (0,785dp2) = 35,3/ (0,785 • 0,42) = 281 м.
Для обеспечения заданной производительности достаточно
установить один титановый реактор.
Техническая характеристика реактора РТ1:
Диаметр внутренний, мм 400
Толщина стенки, мм 10
Высота общая (с учетом 12000
ретурбентов), мм
Длина общая, м 283
Число (7-образных труб (сек- 12
ций) Вместимость, м3 35,3
Площадь поверхности пуско- 60
вой рубашки, м2 Давление в рубашке, МПа 0,6
Тепловой расчет
Исходные данные:
составы материальных потоков см. в табл. 31;
температура: катализаторного раствора на входе в реактор
108 °C; на выходе из реактора 112 °C.
Цель расчета — определение температуры поступающего
этилена.
Уравнение теплового баланса в общем виде:
Ф1 + ФгЧ- Фз = Ф4"1_Ф5_1_ Флот,
где Ф1, Ф2, Ф$, Ф5 — тепловые потоки этилена, катализаторного раствора на
входе в реактор, продуктов реакции, катализаторного раствора на выходе из
реактора соответственно, кВт; Фз — теплота экзотермических реакций, кВт;
Флот — теплопотери в окружающую среду, кВт.
Тепловой поток этилена определяют из уравнения теплового
баланса:
Ф1= (Ф4 + Ф5+ Флот)—(Ф2 + Фз).
Среднюю удельную теплоемкость катализаторного раствора
рассчитывают при температуре 7=108+ 273 = 381 К (хлорид
162
палладия, хлорид меди и хлороводород объединяют в один по-
ток «хлорид меди»). Удельные теплоемкости компонентов рас-
считывают по значениям молярных теплоемкостей, определен-
ных по справочнику [13, табл. 44]:
Ск.р=0,555 • 0,1390+2,057 • 0,033 +4,248 - 0,8280=3,662 кДж/(кг • К).
Ф2= (2 151 362,0/3600) -3,662-108=236 348,6 кВт.
Определяют теплоту целевой реакции. Значения энтальпий об-
разования находят по справочнику (см. Приложения, табл. 3):
СН2=СН2+0,5О2 —* СНзСНО,
Д/70298 = ЛД°298(СНзСНО)—ЛД°298(С2Н4) =—166,00—52,30 = —218,3 кДж/моль.
Рассчитывают теплоту экзотермических реакций Ф3. С целью
упрощения расчета вводят коэффициент, учитывающий увеличе-
ние теплоты за счет побочных реакций на 6,5%:
Ф3= [11 734,7-1000/(44-3600)]-218,3-1,065=17 223,4 кВт.
Среднюю удельную теплоемкость продуктов реакции определя-
ют, сделав следующие допущения:
в поток «ацетальдегид» объединены все кислородсодержа-
щие органические соединения;
в поток «трихлорметан» объединены все хлорорганические
соединения;
в поток «этилен» объединены этилен и полимеры.
с„р = 1,458 • 0,851 + 0,973 • 0,033 +1,882 • 0,040+4,187 • 0,03 +
+0,951-0,046=1,518 кДж/(кг-К);
Ф4= (14 100,3/3600) -1,518-112=665,9 кВт.
Рассчитывают Ф5 (допуская, что средняя удельная теплоемкость
катализаторного раствора практически не изменяется в ходе
процесса):
Ф6= (2 145 639,9/3600) -3,662-112=244 450,4 кВт.
Принимают, что теплопотери составляют 3,5% от общего расхо-
да теплоты, тогда общий расход теплоты равен:
Фрасх= (665,9+244 450,4) • 100/(100—3,5) =254 006,5 кВт.
Определяют теплопотери в окружающую среду:
ФПОт=254 006,5—(665,9+244 450,4) =8890,2 кВт.
Рассчитывают тепловой поток этилена:
Ф1=254 006,5—(236 348,6+17 223,4) =434,5 кВт.
Определяют температуру подогрева этилена методом линей-
ной интерполяции. Принимают температуру подогрева t'x =
= 90 °C, тогда теплоемкость этилена при 7=90+273=363 К со-
ставит:
С°р=50,607 Дж/(моль-К) или с=1,807 Дж/(кг-К).
11* 163
Таблица 34. Тепловой баланс реактора РТ1
Приход кВт % Расход кВт %
Тепловой поток эти лена 434,5 0,2 Тепловой поток про- дуктов реакции 665,9 0,3
Тепловой поток ката- лизаторного раство- ра 236348,6 93,0 Тепловой поток ка- тализаторного рас- твора 244 450,4 96,2
Теплота экзотермиче- ских реакций 17 223,4 6,8 Теплопотери в окру- жающую среду 8890,2 3,5
В с е г о... 254 006,5 100 В с е г о... 254 006,5 100,0
Рассчитывают тепловой поток этилена
Ф/= (8378,2/3600) -1,807-90=378,5 кВт.
Так как Ф'1<ФЬ принятая температура подогрева недоста-
точна.
Принимают температуру подогрева /,,а=120оС, тогда тепло-
емкость этилена при Т—120+273 = 393 К составит с= 1,908 кДж/
/(кг-К), а тепловой поток этилена:
Ф1"= (8378,2/3600) • 1,908-120=532,9 кВт.
Так как Ф"1>Ф1, то принятая температура подогрева слишком
высока.
Необходимое значение температуры находят интерполя-
цией:
/Л=90+ [(434,5—378,5)/(532,9—378,5)] • (120—90) = 100,9 °C.
Такое значение температуры соответствует оптимальному тех-
нологическому режиму.
Составляют таблицу теплового баланса реактора РТ1
(табл. 34).
Технологический расчет реактора РТ2
Реактор РТ2 предназначен для окисления катализаторного рас-
твора кислородом воздуха при давлении 1,4 МПа и температу-
ре 104—109 °C. Конструкция реактора РТ2 аналогична конст-
рукции реактора РТ1.
Расход жидких продуктов на входе в реактор равен
2 170 355,6 кг/ч (см. табл. 33).
Определяют объемный расход жидких продуктов:
Vt=2 170 355,6/(1100-3600) =0,5481 м3/с,
где 1100 — плотность катализаторного раствора, кг/м3.
164
Принимают время пребывания веществ в зоне реакции т=
= 60 с, тогда необходимая вместимость реактора:
Vp=VtT=0,5481-60=33,0 мэ.
Определяют внутренний диаметр реактора, принимая ско-
рость движения жидкости w = 2,8 м/с (такая скорость обеспечи-
вает пузырьковый режим движения катализаторного раствора):
d= 1,13VH7® =1,13|'0,5481/2,8=0,500 м.
Принимают внутренний диаметр реактора rfp=500 мм, тогда
общая длина реактора составит:
/= Vp/(0,785dp2) =33,0/(0,785-0,52) = 168 м.
Для обеспечения заданной производительности достаточно
установить один титановый реактор.
Техническая характеристика реактора РТ2:
Диаметр внутренний, мм 500 Высота обшая (с учетом ре- 12 923
Толщина стенки, мм 10 турбентов), мм
Вместимость, м3 33
Технологический расчет отпарной колонны КЛ1
Назначение, устройство, основные размеры.
Определение числа колонн
Колонна предназначена для испарения ацетальдегида и побоч-
ных продуктов реакции, поступающих из реактора РТ1, за счет
дросселирования катализаторного раствора от давления 1,20 до
0,13 МПа (температура реакционной смеси понижается при этом
на 7—10 °C).
Для расчета выбран вертикальный титановый цилиндриче-
ский аппарат с эллиптическими днищами. В верхней части ап-
парата предусмотрено устройство циклонного типа для лучше-
го разделения парогазовой смеси, в нижней части смонтирован
воронкогаситель.
Расход реакционной смеси, поступающей в колонну, равен
2 181 860,4 кг/ч (см. табл. 32).
Допустимую скорость газа (см. Пример 22) при условии
четкой сепарации определяют по формуле (71):
о|д=АУ(ря1—рг)/рг-
Принимают значение коэффициента А, зависящего от конечного
содержания жидкости: А=0,03 (см. табл. 9). Плотность катали-
заторного раствора рж= 1100 кг/м3. Для определения плотно-
сти парогазовой смеси рг используют данные о составе газовой
фазы (см. табл. 30, 31).
165
Рассчитывают молярный поток парогазовой смеси (ацеталь-
дегид а* сырца):
СН3СНО
СНзСООН
с4н6о
Хлорорганнческие соединения
С2Н4
Н2О
СО2
тх, кг/ч Mt, кг/кмоль пх, кмоль/ч
11 230,1 44 255,230
172,1 60 2,868
30,1 70 0,430
489,4 92,74* 5,277
286,4 28 10,229
22 722,0 18 1262,333
630,9 44 14,338
1550,705
35 561,0
* Расчет средней молярной массы см. Пример 13.
Определяют плотность смеси при нормальных условиях:
р0=35 561,0/(22,4-1550,705) = 1,024 кг/ма.
Плотность смеси в условиях процесса:
рг= 1,024-273-130 000/ [(2734 100) • 101 325] =0,962 кг/м9.
Допустимая скорость газовой смеси:
Ид=0,03V (1100—0,962)/0,962= 1,01 м/с.
Принимают, что действительная скорость газовой смеси состав-
ляет 80% от допустимой:
шд = 1,01 -0,8=0,81 м/с
Определяют необходимый диаметр отпарной колонны:
d= 1,13V35 561,0/ (3600 • 0,81) = 3,95 м.
Принимают диаметр отпарной колонны d=4000 мм.
Характеристика колонны КЛ1:
Диаметр внутренний, мм 4000
Высота цилиндрической 12 000
обечайки, мм
Толщина цилиндрической обе- 14
чайки, мм
Давление, МПа
0,3
Тепловой расчет
Исходные данные:
составы материальных потоков на входе и выходе см. Мате-
риальный расчет, табл. 32;
тепловые потоки продуктов реакции и катализаторного раство-
ра см. табл. 34;
температура, °C: продуктов реакции и катализаторного раство-
ра на входе в колонну КЛ1 (на выходе из реактора РТ1) — 112;
ацетальдегида-сырца и катализаторного раствора на выходе —
100.
166
Цель расчета — определение температуры tx кубовой жид-
кости со стадии ректификации на входе в отпарную колонну.
Уравнение теплового баланса в общем виде:
Ф1+Ф2=Фз- Ф, »• Ф6+Фпот,
где Ф1, Ф2, Фз, Фз — тепловые потоки жидких продуктов, кубовой жидкости
со стадии ректификации, парогазовой смеси и катализатсрной жидкости
соответственно, кВт; Ф$ — теплота, расходуемая на испарение продуктов,
кВт; Фпот — теплопотери в окружающую среду, кВт.
Тепловой поток жидких продуктов на входе в колонну рас-
считывают по данным табл. 34:
Ф1=665,9+244 450,4=245 116,3 кВт.
Тепловой поток кубовой жидкости со стадии ректификации:
Ф2= Фз+ Ф4+ Ф5+ Фпот------------------Ф].
Для определения значения теплового потока Ф3 рассчитыва-
ют среднюю удельную теплоемкость парогазовой смеси при Т=
= 100+273 = 373 К. Молярную теплоемкость компонентов оп-
ределяют по сравочнику (см. Приложения, табл. 2,3).
Расчет средней удельной теплоемкости парогазовой смеси:
тх, кг/ч W,, % с,, ДжДмоль-К) 100), кДж/(кг К)
СНзСНО* 11260,2 31,66 62,79 0,452
СНзСООН 172,1 0,48 77,39 0,006
СНС13** 489,4 1,38 72,43 0,008
с2н4 286,4 0,81 51,56 0,015
Н2О 22722,0 63,90 34,23 1,215
со2 630,9 1,77 41,37 0,017
S 35 561,0 100,00 — 1,713
* В поток «ацетальдегид» объединены ацетальдегид и кротоновый альдегид.
*♦ В поток «трнхлорметан» объединены все хлор органические соединения.
Рассчитывают тепловой поток парогазовой смеси:
Фз= (35 561,0/3600) 1,713-100= 1692,1 кВт.
Для определения значения Ф4 находят удельные теплоты ис-
парения ацетальдегида, уксусной кислоты, трихлорметана и во-
ды. Теплоту испарения ацетальдегида рассчитывают по форму-
ле (52) при температуре кипения 7=21+273 = 294 К:
Д//Исп=294(36,61 + 19,14 1g 294) =24 653 Дж/моль;
гснзсно=24 653/44=560,29 кДж/кг.
По справочнику находят значения удельной теплоты испаре-
ния уксусной кислоты [10, табл. XLV], воды [10, табл. LVI] и
трихлорметана (см. Приложения, табл. 9):
Гснзсоон=389,81 кДж/кг; гн2о=2260,00 кДж/кг;
гснс1з=228,60 кДж/кг.
167
Рассчитывают теплоту, расходуемую на испарение продуктов:
Ф4= (11 260,2 • 560,29+172,1 • 389,81 + 489,4 • 228,60+
+22 722,0 • 2260,00) /3600=16 066,6 кВт.
Рассчитывают тепловой поток катализаторного раствора:
Ф5= (2 146 299,4/3600) -3,662-100=218 631,5 кВт,
где 3,662 — удельная теплоемкость катализаторного раствора (рассчитана
ранее), кДж/(кг-К).
Принимают, что теплопотери равны 4,5% от общего прихода
теплоты и определяют расход теплоты:
Фрасх= (1692,1 +16 066,6+218 631,5) 100/(100—4,5) =247 529,0 кВт.
Рассчитывают теплопотери в окружающую среду:
Фпот=247 529,0— (1692,1 + 16 066,6 + 218 631,5) = 11 138,8 кВт.
Определяют тепловой поток кубовой жидкости со стадии ректи-
фикации:
Ф2=Фрасх—Ф1=247 529,0—245 116,3 = 2412,7 кВт.
Учитывая, что теплоемкость воды практически не изменяется
с возрастанием температуры и может быть принята равной с=
= 4,187 кДж/(кг-К), рассчитывают температуру поступающей
кубовой жидкости со стадии ректификации:
Д=24 12,7-3600/(22 296,0-4,187) =93,0 °C,
что соответствует оптимальному технологическому режиму.
Составляют таблицу теплового баланса отпарной колонны
(табл. 35).
Таблица 35. Тепловой баланс отпарной колонны
Приход кВт % Расход кВт %
Тепловой поток жид- ких продуктов 245 116,3 99,0 Тепловой поток па- рогазовой смеси 1692,1 0,7
Тепловой поток кубо- вой жидкости со ста- дии ректификации 2412,7 1,0 Теплота, расходуемая иа испарение продук- тов Тепловой поток ка- тализаторной жидко- сти Теплопотери 16066,6 218631,5 11 138,8 6,5 88,3 4,5
В с е г о... 247 529,0 100,0 В с е г о... 247 529,0 100,0
168
ПРОЦЕССЫ ДЕГИДРИРОВАНИЯ И ГИДРИРОВАНИЯ
Процессы дегидрирования и гидрирования органических соеди-
нений широко применяются в промышленности для получения
ряда многотоннажных продуктов основного органического и
нефтехимического синтеза.
Производство мономеров для пластических масс и синтети-
ческих каучуков, высших олефинов, являющихся сырьем поверх-
ностно-активных веществ различных классов, ароматизация
нефтяных фракций — далеко не полный перечень процессов, где
используют реакции дегидрирования.
Гидрированием в промышленном масштабе получают такие
продукты, как циклогексан и гексаметилендиамин, являющиеся
сырьем в производстве полиамидных волокон, спирты Сз—С4
нормального строения, высшие жирные спирты; реакции гидри-
рования протекают при получении жиров, искусственного жид-
кого топлива и других веществ.
ПОЛУЧЕНИЕ ФОРМАЛИНА
ОКИСЛИТЕЛЬНЫМ ДЕГИДРИРОВАНИЕМ МЕТАНОЛА
По ориентировочным подсчетам, к 2000 г. мировой выпуск фор-
малина (37%-й водный раствор формальдегида) возрастет до
5 млн. т, что связано с использованием его в производстве пла-
стических масс, изопренового каучука и других химических про-
дуктов.
Среди методов получения формальдегида наибольшее про-
мышленное значение приобрел процесс окислительного дегид-
рирования метанола на серебряных и железомолибденовых ок-
сидных катализаторах, протекающий по следующим основным
реакциям:
СНзОН СН2О+Н2, —Д//°298=—85,10 кДж/моль;
СН3ОН + 0,5О2 =₽= СН2О+Н2О, —ДД°2д8= 156,71 кДж/моль.
На серебряном катализаторе процесс осуществляют под дав-
лением, близким к нормальному, при температуре 600—700 °C и
объемной скорости 24 000—-26 000 ч-1. В таких условиях выход
формальдегида в расчете на превращенный метанол достигает
80—90%.
Описание технологической схемы см. [3, с. 169, рис. 3.23].
МАТЕРИАЛЬНЫЙ РАСЧЕТ
Исходные данные:
годовая производительность агрегата по формалину 61 000 т;
годовой фонд рабочего времени 8400 ч;
169
массовая доля формальдещда, %: в продукционном формали-
не— 37,0; в формалине-сырце — 29,0;
потери формалина на стадии ректификации 3,0%;
параметры подаваемого воздуха: температура 25 °C; давление
0,17 МПа;
степень конверсии метанола 0,55;
доля превращенного метанола, расходуемого: по реакции 1 —
0,27; по реакции 2 — 0,60; по реакции 3 — 0,11; по реакции 4 —
0,02;
состав технического метанола, (wt, %): метанол — 99,9; во-
да—0,1.
Последовательность расчета:
а) определяют общий расход метанола на процесс, количество и состав
контактного газа;
б) рассчитывают расход воздуха на получение формальдегида, содержа-
ние в нем водяных паров;
в) составляют материальный баланс контактного аппарата, определяют
состав формалииа-сырца и выхлопных газов на выходе из абсорбционной
колонны.
Часовая производительность агрегата:
по формалину: 61 000-1000/8400=7262 кг/ч;
по формальдегиду: 7262-37/100= 2687 кг/ч или 2687/30=89,567 кмоль/ч.
С учетом потерь на стадии ректификации необходимо получить
в контактном аппарате формальдегида:
89,о67-1 03=92,254 кмоль/ч или 2768 кг/ч
Протекающие реакции:
СНзОН *=* СНгО+Нг, 1
СН3ОН+0,5О2 =* СНгО+Н/), 2
СНзОН + 1,5О2 =•= СО2+2Н2О, 3
СНзОН =* СО + 2Нг. 4
Расход метанола по реакциям 1 и 2: 92,254 кмоль/ч или
2952 кг/ч.
Расход метанола по реакциям 1—4:
92,254/(0,27+0,60) = 106,039 кмоль/ч или 3393 кг/ч,
где 0,27 и 0,60 — доля метанола, превращенного в формальдегид по реак-
циям 1 и 2.
Подают метанола с учетом степени конверсии:
106,039/0,55=192,798 кмоль/ч или 6169 кг/ч.
Количество воды в техническом метаноле:
6169-0,1/99,9=6 кг/ч или 0,333 кмоль/ч.
170
Остается метанола в контактном газе:
192,798—106,039= 86,759 кмоль/ч или 2776 кг/ч.
По реакции 1 расходуется метанола:
106,039-0,27=28,631 кмоль/ч или 916 кг/ч;
образуется:
формальдегида. 28,631 кмоль/ч или 859 кг/ч;
водорода: 28,631 кмоль/ч или 57 кг/ч.
По реакции 2 расходуется:
метанола: 106,039-0,60=63,623 кмоль/ч или 2036 кг/ч;
кислорода: 63,623-0,5=31,812 кмоль/ч или 1018 кг/ч;
образуется:
формальдегида: 63,623 кмоль/ч или 1909 кг/ч;
водяного пара: 63,623 кмоль/ч или 1145 кг/ч;
По реакции 3 расходуется:
метанола: 106,039-0,11 = 11,664 кмоль/ч или 373 кг/ч;
кислорода: 11,664-1,5=17,496 кмоль/ч или 560 кг/ч;
образуется:
диоксида углерода: 11,664 кмоль/ч или 513 кг/ч;
водяного пара: 11,664-2=23,328 кмоль/ч или 420 кг/ч.
По реакции 4 расходуется:
метанола: 106,039-0,02=2,121 кмоль/ч или 68 кг/ч;
образуется:
оксида углерода: 2,121 кмоль/ч или 59 кг/ч;
водорода: 2,121-2=4,242 кмоль/ч или 9 кг/ч.
Всего образуется:
водорода: 28,631+4,242=32,873 кмоль/ч или 66 кг/ч;
водяного пара. 63,623+23,328=86,951 кмоль/ч или 1565 кг/ч.
Общий расход кислорода:
31,812+17,496 = 49,308 кмоль/ч или 1578 кг/ч.
Молярное отношение О2: СН3ОН равно:
49,308/192,798 = 0,256.
Расход сухого воздуха:
49,308/0,21=234,800 кмоль/ч.
где 0,21 — объемная (молярная) доля кислорода в сухом воздухе.
171
Таблица 36. Материальный баланс стадии контактирования
Входит кмоль/ч кг/ч Выходит кмоль/ч кг/ч
Спиртовоздушная смесь: СНзОН о2 n2 Н2О 192,798 49,308 185,492 4,881 6169 1578 5194 88 Контактный газ: СН3ОН СН2О СО со2 N2 Н2 Н2О 86,759 92,254 2,121 11,664 185,492 32,873 91,832 2776 2768 59 513 5194 66 1653
В с е г о... 432,479 13 029 В с е г о... 502,995 13 029
Количество азота в воздухе:
234,800—49,308=185,492 кмоль/ч или 5194 кг/ч.
Объемная доля водяных паров в воздухе:
3230-100/(0,17-106) = 1,90%,
где 3230 — парциальное давление водяных паров в воздухе при температуре
25 °C, Па (см. Приложения, табл. 13); 0,17-106 — общее давление воз-
духа, Па.
Количество водяных паров в воздухе:
234,800-1,90/(100,00—1,90) =4,548 кмоль/ч или 82 кг/ч.
Суммарное количество водяных паров:
в спиртовоздушной смеси: 0,333+4,548=4,881 кмоль/ч или 88 кг/ч;
в контактном газе: 4,881+86,951=91,832 кмоль/ч или 1653 кг/ч.
Составляют материальный баланс стадии контактирования
(табл. 36).
Объемная (молярная) доля метанола в спиртовоздушной
смеси (44,6%) соответствует оптимальному технологическому
режиму [4, с. 474].
В выхлопные газы абсорбционной колонны переходят пол-
ностью оксид и диоксид углерода, азот, водород, суммарное
количество которых составляет 232,150 кмоль/ч.
Объемная доля водяных паров в выхлопных газах:
1740-100/(0,13-106) = 1,34%,
где 1740 — парциальное давление водяных паров при температуре 15 °C, Па
(см. Приложения, табл. 13); 0,13-106 — общее давление выхлопных га-
зов, Па.
Количество водяных паров в выхлопных газах:
232,150-1,34/(100,00—1,34) =3,153 кмоль/ч или 57 кг/ч.
172
Количество формалина-сырца:
2768/0,29=9545 кг/ч,
где 0,29 — массовая доля формальдегида в формалине-сырце.
Количество воды в формалине-сырце:
9545—2768—2776=4001 кг/ч или 222,278 кмоль/ч.
Следовательно, на орошение абсорбционной колонны необхо-
димо подать воды:
4001 +57—1653=2405 кг/ч.
Состав формалина-сырца и выхлопных газов на выходе из
абсорбционной колонны:
кмоль/ч xt. % тх, кг/ч Ы',. %
Формалин-сырец: 86,759 21,62 29 08
СН3ОН 2776
СН2О 92,254 22,99 2768 29,00
Н2О 222,278 55,39 4001 41,92
S 401,291 100,00 9545 100,00
Выхлопные газы:
СО 2,121 0,90 59 1,00
со2 11,664 4,96 513 8,71
n2 185,492 78,83 5194 88,20
н2 32,873 13,97 66 1,12
Н2О 3,153 1,34 57 0,97
235,303 100,00 5889 100,00
Полученный состав выхлопных газов соответствует оптимально-
му технологическому режиму.
Степень конверсии метанола в формальдегид принята 87%.
Для проверки правильности выполненного расчета определяют
степень конверсии метанола по формуле [6, с. 462]:
а = 100— 100
Фсо2 + Фео
0,528 фц2 + фн2 — Фео ~ 2<рСо2’
а = 100 — 100
___________4,96 + 0,90___________
0,528-78,83+ 13,97 — 0,90- 2-4,96
= 86,91%,
что практически совпадает с принятой.
Расчет основных расходных коэффициентов. Расходные ко-
эффициенты:
по метанолу: 106,039-32/(7262-0,999) =0,468 кг/кг,
где 106,039 — расход метанола по реакциям 1—4, кмоль/ч; 7262 — часовая
производительность агрегата по формалину, кг; 0,999 — массовая доля ме-
танола в техническом метаноле;
173
по воздуху (см. табл. 36):
(13 029—6169)/7262=0,945 кг/кг или 945/1,29=732,5 мэ/т,
где 1,29 — плотность воздуха в нормальных условиях, кг/м3;
по воде:
2405/7262=0,331 кг/кг,
где 2405 — расход воды на орошение, кг/ч.
ТЕХНОЛОГИЧЕСКИЙ РАСЧЕТ ОСНОВНОГО ОБОРУДОВАНИЯ
Технологический расчет реактора
(контактного аппарата]
Назначение, устройство и основные размеры.
Определение числа реакторов
Реактор (контактный аппарат) предназначен для окислитель-
ного дегидрирования метанола в формальдегид в газовой фа-
зе на пемзосеребряном катализаторе. Для расчета выбран
вертикальный стальной цилиндрический аппарат, смонтирован-
ный непосредственно над верхней трубной решеткой подкон-
тактного холодильника. В нижней части аппарата на свобод-
но лежащую решетку, покрытую двумя слоями сеток, засыпан
катализатор. Над слоем катализатора предусмотрено распре-
делительное устройство, имеющее 24 щели размером 200x50 мм
для равномерного распределения потока спиртовоздушной
смеси.
Разогрев катализатора производят тремя нихромовыми
электроспиралями (d=0,4 мм, (7=220 В).
Техническая характеристика контактного аппарата:
Производительность, кг/ч: Диаметр внутренний, мм 2000
по формальдегиду 2800 Высота (без подконтактного 2150
по спиртовоздушной 13 500 холодильника), мм
смеси Объем катализатора, м3 0,4
Аппарат снабжен штуцером входа спиртовоздушной смеси
Dy 500, ру 1, двумя взрывными мембранами Dy 600, ру 1, лю-
ком-лазом Dy 500, ру 0,4.
По данным табл. 36, на стадии контактирования образуется
2768 кг/ч формальдегида, расход спиртовоздушной смеси со-
ставляет 13 029 кг/ч.
Необходимое число реакторов:
п=2768/2800=0,989 или и= 13 029/13 500=0,965.
Таким образом, нужно установить один реактор (контакт-
ный аппарат).
174
Тепловой расчет
Исходные данные:
расход спиртовоздушной смеси 432,479/3600=0,1201 кмоль/с;
количество контактного газа 502,995/3600=0,1397 кмоль/с;
температура: на входе в аппарат 100—120 °C; на выходе из
аппарата 680 °C.
Цель расчета — уточнение температуры спиртовоздушной
смеси на входе в контактный аппарат.
Уравнение теплового баланса в общем виде:
©1 + ©2= ©з+ ©ПОТ,
где ©1, ©з — тепловые потоки спиртовоздушной смеси и контактного газа
соответственно, кВт, Ф2 — теплота, выделяющаяся за счет химических реак-
ций, кВт; ©„от — теплопотери в окружающую среду, кВт.
Для определения значений Ф1 и Фз рассчитывают средние
молярные теплоемкости спиртовоздушной смеси при tcp—
= (100+120)/2= 110°С (7’1 = 110 + 273 = 383 К) и контактного
газа при Гз=680+273=953 К:
X,. % С,, Дж/(моль-К) CjXj/100, Дж/(моль К)
Спиртовоздушная смесь
СНзОН 44,58 51,02 22,7447
О2 11,40 30,19 3,4417
n2 42,89 29,52 12,6611
н2о 1,13 34,32 0,3878
2 100,00 — 39,2353
Контактный газ:
СНзОН 17,25 87,35 15,0679
СН2О 18,34 60,28 11,0554
СО 0,42 32,27 0,1355
СО2 2,32 51,82 1,2022
n2 36,88 31,95 11,7832
Н2 6,53 30,45 1,9884
н2о 18,26 40,25 7,3496
S 100,00 — 48,5822
Тепловой поток спиртовоздушной смеси:
©1=0,1201-39,2353^=4,7122k кВт
Определяют теплоты реакций 1—4 (в кДж/моль):
Реакция
СН3ОН(г)=^СН2О+Н2
СНзОН(г) +0,502=f±CH20+H20(r)
СНзОН (г) + l,5O2=f±CO2+2H2O (г)
СН3ОН(г)=(±СО+2Н2
Д#02Эа=ЕЛН°298(КОН) ХДП”298(нсх)
—115,90—(—201,00) =85,1
—115,90+ (—241,81)—(—201,00) =
=—156,71
—393,51 +2 (—241,81)—(—201,00) =
=—676,13
—110,53—(—201,00) =90,47
175
Рассчитывают теплоту Ф2, выделяющуюся за счет химиче-
ских реакций, по формуле (49):
Ф2= 1 000 [28,631 (—85,1) +63,623 • 156,71 +11,664• 676,13+
+2,121 (-90,47)1/3600=1000-15 228,3556/3600=4230,099 кВт.
Тепловой поток контактного газа:
Фз= 0,1397 • 48,5822 • 680=4615,115 кВт.
Принимают, что теплопотери в окружающую среду составляют
3% от общего прихода (расхода) теплоты:
Фпот=4615,115-3/(100—3) = 142,736 кВт.
Общий расход теплоты:
Фрасх= Фз + Фпот= 4615,115+142,736=4757,851 кВт.
Температуру спиртовоздушной смеси находят из уравнения
теплового баланса:
4,712 2k+4230,099=4757,851;
527,752/4,7122= 112 °C,
что соответствует принятому интервалу температур.
Составляют тепловой баланс контактного аппарата
(табл. 37).
Минимальная температура спиртовоздушной смеси на входе
в контактный аппарат должна быть на 20—25 °C выше темпе-
ратуры кипения метанола в спиртоиспарителе. Температура ки-
пения метанола при нормальном давлении равна 64,7 °C; при
0,2 МПа — 84 °C; при 0,5 МПа — 112 °C [22, с. 404].
Из данных теплового баланса контактного аппарата (см. табл. 37) вид-
но, что приход теплоты в аппарат определяется теплотой, выделяющейся за
счет химических реакций (88,9%). Отсюда следует, что температура подогре-
ва спиртовоздушной смеси зависит от молярного соотношения кислорода и
метанола иа входе в систему. Если в результате теплового расчета будет
получено значение температуры ниже минимально допустимого, необходимо
Таблица 37. Тепловой баланс контактного аппарата
Приход кВт % Расл^д кВт %
Тепловой поток спир- товоздушной смеси Теплота, выделяю- щаяся за счет хими- ческих реакций 527,752 4230,099 И,1 88,9 Тепловой поток кон- тактного газа Теплопотери в окру- жающую среду 4615,115 142,736 97,0 3,0
В с е г о... 4757,851 100,0 В с е г о... 4757,851 100,0
176
уменьшить молярное соотношение кислорода и метанола, что повлечет за
собой уменьшение доли метанола, расходуемого по экзотермическим реак-
циям окисления (реакции 2 и 3), и повышение температуры подогрева спир-
товоздушной смеси.
Расчет реактора (контактного аппарата)
Объемный расход спиртовоздушной смеси:
Гвх=432,479-22,4=9688 м3/ч.
При объемной скорости Уое=25000 ч-1 необходимый объем
катализатора равен:
Vk=Vbx/VO6=9688/25 000=0,388 м3.
В принятом стандартном аппарате объем катализатора V*'—
= 0,4 м3, следовательно, запас производительности по катали-
затору составляет:
(0,400—0,388) • 100/0,388=3%.
Высота слоя катализатора в аппарате:
hK= VK/S=0,4/(0,785-2,02) =0,127 м.
Объемный расход контактного газа при температуре Г=680 +
+ 273 = 953 К и давлении р=0,22 МПа:
Увых= (502,995-22,4/3600) [953-101 325/(273-0,22-10е)] =5,03 м3/с.
Линейная скорость газа в сечении контактного аппарата:
w= Рвых/5=5,03/(0,785-2,02) = 1,6 м/с,
что соответствует оптимальному технологическому режиму
[28, с. 200].
Технологический расчет спиртоиспарителя
Назначение, устройство и основные размеры.
Определение числа аппаратов
Спиртоиспаритель предназначен для испарения жидкого мета-
нола и получения спиртовоздушной смеси. Для расчета выбран
вертикальный стальной цилиндрический аппарат с циркуляци-
онной трубой и выносной греющей камерой, выполненной в виде
кожухотрубчатого теплообменника.
Греющая камера представляет собой пучок труб, верхние
и нижние концы которых завальцованы в трубные решетки,
приваренные к обечайке. Греющая камера соединяется с цир-
куляционной трубой переходной (вверху) и нижней камерами.
Переходная камера тангенциально соединена с сепаратором —
цилиндрическим сосудом с коническим днищем, сообщающимся
с нижней камерой циркуляционной трубой. В верхней части
12-69
177
сепаратора расположен секционный объемно-сетчатый брызго-
отделитель.
Циркуляция раствора в аппарате осуществляется по замкну-
тому контуру: сепаратор — циркуляционная труба — нижняя
камера — греющая камера — переходная камера — сепаратор.
Метанол, поднимаясь по трубам греющей камеры, нагревается
и вскипает по мере подъема. В переходной камере парожид-
костная смесь насыщается воздухом и направляется в сепара-
тор, где происходит разделение жидкой и паровой фаз. Спирто-
воздушная смесь, проходя брызгоотделитель, освобождается от
капель и выходит из аппарата, а метанол возвращается по цир-
куляционной трубе в греющую камеру, где происходит его ис-
парение.
Техническая характеристика спиртоиспарителя:
Длина общая, мм
Ширина, мм
Высота, мм
5460 Число труб греющей камеры 227
2720 (dTp=57X3,5 мм)
12 420 Длина трубы, мм 4000 Площадь поверхности тепло- 162 обмена, м2
Аппарат снабжен штуцерами входа метанола в циркуляци-
онную трубу £>у450, ру 1, штуцерами входа воздуха Dy 300, ру 1
и выхода конденсата Dy 100, ру 1, штуцером выхода спиртовоз-
душной смеси Dy 800, ру 0,4.
Для расчета принимают агрегатную схему компоновки обо-
рудования, по которой на один контактный аппарат приходится
один спиртоиспаритель.
Тепловой расчет
Исходные данные:
теплоноситель — водяной насыщенный пар, образующийся при
охлаждении контактного газа конденсатом в подконтактном хо-
лодильнике, давление пара 0,3 МПа, температура 133°C;
температура, °C: жидкого метанола — 25; воздуха—120; спир-
товоздушной смеси на выходе из испарителя-—85;
в спиртоиспаритель подают: жидкого метанола—192,798/3600=
= 0,0536 кмоль/с или 6169/3600=1,7136 кг/с; сухого возду-
ха —(49,308+ 185,492)/3600=0,0652 кмоль/с;
количество: паров воды в воздухе 4,548/3600=0,0013 кмоль/с,
воды в техническом метаноле 6 кг/ч; спиртовоздушной смеси
на выходе из испарителя 0,1201 кмоль/с;
данные о количестве и составе материальных потоков см. в
табл. 36.
Цель расчета — определение расхода греющего пара.
Уравнение теплового баланса в общем виде:
Ф1 + ф2+ Фз= Ф4+ Ф5+ Флот»
178
где Ф], Ф2, Фз, Ф< —тепловые потоки жидкого технического метанола, воз-
духа, греющего пара и спиртовоздушной смеси соответственно, кВт; Ф5 —
теплота, расходуемая на испарение метанола и воды, кВт; Фпот —' теплопо-
тери в окружающую среду, кВт.
Тепловой поток жидкого технического метанола:
®!= (0,0536-81,60+6-4,187/3600) -25=109,518 кВт,
где 81,60 — молярная теплоемкость жидкого метанола (см. Приложения,
табл. 3), Дж/(моль-К); 4,187 — удельная теплоемкость воды, кДж/(кг-К).
Тепловой поток воздуха:
Ф2= (0,0652-29,725+0,0013-34,42)-120=237,938 кВт,
где 29,725 — средняя молярная теплоемкость сухого воздуха, Дж/(моль-К);
34,42 — молярная теплоемкость водяного пара, Дж/(моль-К)-
Значения молярных теплоемкостей компонентов воздуха и
жидкого метанола рассчитывают при 7=120+273=393 К. Для
определения теплового потока спиртовоздушной смеси Ф4 ис-
пользуют данные табл. 36; среднюю молярную теплоемкость
спиртовоздушной смеси рассчитывают при 7=85+273=358 К-
Расчет средней молярной теплоемкости спиртовоздушной
смеси:
сн3он о2 n2 н2о S
Xi, % 44,58 11,40 42,89 1,13 100,00
Ci, Дж/(моль-К) 48,96 29,73 29,41 34,09 —
C,Xi/100, Дж/(моль-К) 21,8264 3,3892 12,6139 0,3852 38,2147
Тепловой поток спиртовоздушной смеси:
Ф4=0,1201 • 38,2147 • 85=390,115 кВт.
Расход теплоты на испарение метанола и воды:
Ф5= 1,7136-1050,1 + (6/3600) -2297,0= 1803,280 кВт,
где 1050,1 и 2297,0—удельная теплота парообразования метанола и воды,
кДж/кг (см. Приложения, табл. 12, 13).
Принимают, что теплопотери в окружающую среду состав-
ляют 1% от общего прихода (расхода) теплоты:
Флот = (390,115+1803,280) -1/(100—1) = 22,156 кВт.
Общий расход теплоты:
Фрасх=Ф4+Ф5+Фпот=390,115+1803,280+22,156=2215,551 кВт.
Тепловой поток греющего пара находят из уравнения теплового
баланса:
Фз= Фрасх—®!—©2=2215,551—109,518—237,938 = 1868,095 кВт.
Расход греющего пара:
1868,095/(0,9-2171) =0,96 кг/с или 3440 кг/ч,
12*
179
где 2171—удельная теплота парообразования при р=0,3 МПа, кДж/кг (см.
Приложения, табл. 14); 0,9 — к.п.д. теплообменника.
Составляют тепловой баланс спиртоиспарителя (табл. 38).
Расчет спиртоиспарителя
Выполняют поверочный расчет площади поверхности теплооб-
мена.
Необходимую площадь поверхности теплообмена определяют
по формуле (62):
Т,= Фа/(кД7Ср).
Расчет ведут по зонам нагрева метанола от 25 до 85 °C
и испарения его при 85 °C.
Тепловая нагрузка аппарата по зоне нагрева:
Фан= 109 518 (85—25)/25=262 843 Вт.
Тепловая нагрузка по зоне испарения: ФИСп= 1803 280 Вт.
Температурная схема теплообмена:
Водяной пар
133 °C -<-------133 °C -t-- 133 °C
Метанол
25 °C-----------► 85 °C --->- 85 °C
v - -> ' . - — ................_
Зона нагрева Зона испарения
Средняя разность температур:
в зоне нагрева:
Д/тах= 133—25= 108 °C, Д/тт= 133—85=48 °C,
Д/«ср= (108—48)/[52,303 1g (108/48)] =74 °C, ДГ1сР=74 К;
в зоне испарения:
Д/срис"=133—85=48 °C, ДТСрисп=48 К.
Таблица 38. Тепловой баланс спиртоиспарителя
Приход кВт % Расход кВт %
Тепловой поток мета- нола Тепловой поток воз- духа Тепловой поток гре- ющего пара 109,518 237,938 1868,095 5,0 10,7 84,3 Тепловой поток спир- товоздушной смеси Теплопотери иа испа- рение Теплопотери в окру- жающую среду 390,115 1803,280 22,156 17,6 81,4 1,0
В с е г о... 2215,551 100,00 В с е г о... 2215,551 100,00
180
Коэффициент теплопередачи определяют по формуле (63):
K=(l/ai+S rci+l/ote)-1,
где ai — коэффициент теплоотдачи от греющего водяного пара к стенке
трубы, Вт/(м2-К); осг—коэффициент теплоотдачи от стенки трубы к нагре-
ваемому метанолу (зона нагрева) и кипящему метанолу (зона испарения),
Вт/(м2-К).
Данные о теплофизических параметрах воды, водяного пара
и метанола при соответствующих температурах находят по
справочнику (см. Приложения, табл. 11—13, 16):
метанол:
при/=25 °C р'=767,5 кг/м3;
при /=85°С р=730,5 кг/м3; рп=2,47 кг/м3; г=1072-103 Дж/кг;
о= 17,13-10-3 Н/м; р=277,5-10-6 Па-с; Л= 18,70-10~2 Вт/(м-К);
при /=55°С р=760,5 кг/м3; р=373,5-10-6 Па-с;
Х=20,64-10-2 Вт/(м-К); с=2840 Дж/(кг-К); Рг=5,14;
вода:
при 1=133°C р=932,3 кг/м3; р.=207,2-10~6 Па-с,
Х=68,57-10-2 Вт/(м-К); г=2171-103 Дж/кг.
Коэффициент теплоотдачи от конденсирующегося водяного
пара к стенке трубы высотой Н определяют по формуле:
[10, уравнение (4.55)]:
«1 =
1,21-68,57-10-2
932,32-2171103-9,81
207,2-10-«-4
1/3
<p-Vs = 2,33-105(p-1/s.
Коэффициент теплоотдачи от стенки трубы к потоку метанола
(в зоне нагрева) определяют по формуле (64):
a2"=NuZ/d.
При скорости движения метанола в трубном пространстве W—
=0,05 м/с критерий Рейнольдса равен:
Reр/р=0,05-0,05-760,5/(373,5 • 10-6) =5090.
Режим движения — переходный, следовательно, критерий Нус-
сельта рассчитывают по формуле [9, уравнение (11-36)]:
Nu=0,008Re°-9Pr°-«=0,008 • 50900-9 • 5,14°-43=35.
Коэффициент теплоотдачи от стенки трубы к нагреваемому
метанолу:
а2"=35-20,64-10-2/0,05 = 144 Вт/(м2-К).
Определяют коэффициент теплоотдачи от стенки трубы к
кипящему метанолу (в зоне испарения) по формуле [10, урав-
181
некие (4.60)]:
а2исп=6[?.2р/(цо7'кип) р^ф2/®,
где Ь — безразмерный коэффициент; ф — поверхностная плотность теплового
потока, Вт/м2.
Так как эта формула справедлива при умеренной плотности
теплового потока (^0,4<ркр), то рассчитывают критическую по-
верхностную плотность теплового потока по формуле [10, урав-
нение (4.64)]:
Фкр = 0,14гУрп ^ogp,
фкр =0,14-1072- 10s VМ7 17,13-10~s-9,81-730,5 = 785 114 Вт/м2,
0,4фКр = 0,4-785 114=314 046 Вт/м2.
Поверхностная плотность теплового потока для принятого ис-
парителя:
Ф=Фисп/7:'=1 803 280/162=11 131 Вт/м2.
Так как <р-С0,4<ркр> то, следовательно, принятая для расчета
а2исп формула применима.
Коэффициент b определяют по формуле [10, уравнение (4.62)]:
6=0,075- [1 + Ю(р/рп—1)-2/»1,
6=0,075- [1 + 10(730,5/2,47—I)-2/3] =0,0919.
а2исп= 0,0919-
(18,70-10~2)2 730,5
277,5-IO"8-17,13-10-»-358
1/3 ,
ф2/» = 2,16ф2/3.
Сумма термических сопротивлений стенки трубы с учетом
слоев загрязнений:
2 гст=г1+г2+г3= 0,00018 + 0,0035/17,5 + 0,00035 = 0,00074 м2-К/Вт,
где Г1 и г3— сопротивление слоев загрязнений с обеих сторон стенки трубы,
м2-К/Вт [9, табл. 15]; 0,0035 — толщина стенки трубы, м; 17,5 — теплопро-
водность нержавеющей стали, Вт/(м-К) [10, табл. XXVIII].
Из основного уравнения теплопередачи и уравнения аддитив-
ности термических сопротивлений следует:
1 ДТср __1 . „ .1
к ф а:
1 ДГср 1
к
«2
4-0,00074 + ' , * •
2,16ф°>®7
Ф 2,33- 105ф-°.33
При Д7’Ср=48 К получают:
У1=0,0000043ф1-33+0,00074ф+0,463ф°-33—48=0.
Принимают ф1=20000 Вт/м2, тогда:
«/1=0,0000043-20 000‘-33+0,00074-20 000+ 0,463-20 0000-33—48=
=2,259+12,160+14,800—48,000=—18,781.
182
Принимают <р2=40000 Вт/м2, тогда
#2=0,0000043-40 0001-33+0,00074-40 000+0,463-40 0000-33—48=
=5,678 + 29,600 +15,285—48,000 = 2,563.
Истинное значение поверхностной плотности теплового потока
при у=0:
п>, — ф, 40 000 - - 20 000 Л
Ф = ф2 - 2 — У2 = 40 000 - • --где = 37 598 Вт/м2.
У2 У1 2,ооо ( 1о,7о1)
Коэффициент теплоотдачи от греющего водяного пара к
стенке трубы:
ai=2,33-105-37 598-,/з=7204 Вт/(м2-К).
Коэффициент теплоотдачи от стенки трубы к кипящему мета-
нолу:
а2исп=2,16 • 37 5982/3 = 2424 Вт/ (м2 • К).
Коэффициент теплопередачи по зоне нагрева:
«1= (1/7204+0,00074+1/144)-‘ = 128 Вт/(м2-К).
Коэффициент теплопередачи по зоне испарения:
к2= (1/7204 + 0,00074+1/2424)-*=774 Вт/(м2-К).
Площадь поверхности теплообмена:
F=F1+f2=262 843/(128-74)+ 1 803 280/(774-48) =76,3 м3.
Так как при расчете процесса теплопередачи для случая кипения жид-
кости отклонения экспериментальных данных от рассчитанных по формуле
[10, уравнение (4.60)] лежат в пределах ±35% [10, с. 163], то площадь
поверхности зоны испарения должна быть увеличена. Кроме этого, возмож-
но попадание воздуха в кипящий метанол, что резко снижает коэффициент
теплопередачи; следовательно, для спиртоиспарителя, работающего в дан-
ных условиях, необходим большой запас площади поверхности теплообмена.
Технологический расчет подконтактного холодильника
Назначение, устройство и основные размеры.
Определение числа аппаратов
Подконтактный холодильник предназначен для быстрого охлаж-
дения контактного газа до 140—160 °C во избежание разложе-
ния образовавшегося формальдегида.
Для установки выбран вертикальный стальной кожухотруб-
чатый теплообменник с противоточным движением теплоноси-
теля в межтрубном пространстве и контактного газа в труб-
ном пространстве. Теплоноситель — паровой конденсат (р=
= 0,3 МПа, /=133 °C).
В холодильнике предусмотрено шахматное расположение
труб (по вершинам правильных шестиугольников). Температур-
183
ные напряжения, вызываемые разностью температур между
кожухом и трубами, могут привести к разрушению аппарата;
во избежание этого на корпусе установлен линзовый компен-
сатор.
Техническая характеристика холодильника:
Диаметр внутренний, мм 2000
Высота общая, мм 5500
Число труб (dIP=25X 1752
Х2,5 мм)
Длина трубки, мм 4000
Площадь поверхности тепло- 550
передачи, м2
Аппарат снабжен штуцером выхода контактного газа Dy 600,
Ру 1, шестью штуцерами входа конденсата Dy 80, ру 1 и шестью
штуцерами выхода пароводяной эмульсии Z)y 150, ру 1.
Принимают агрегатную схему компоновки оборудования —
контактный аппарат смонтирован непосредственно на подкон-
тактном холодильнике.
Тепловой расчет
Исходные данные:
в холодильник подают 502,995/3600=0,1397 кмоль/с контакт-
ного газа;
состав контактного газа см. в табл. 30;
температура: на входе в холодильник 680 °C; на выходе из хо-
лодильника 150 °C.
Цель расчета — определение тепловой нагрузки холодильни-
ка и расхода парового конденсата.
Уравнение теплового баланса холодильника в общем виде:
Ф[= ф2+ Фз+ Фпот,
где Ф] и Ф2 — тепловые потоки контактного газа на входе в холодильник
и на выходе из него, кВт; Фз — теплота, отводимая испаряющимся конденса-
том, кВт; Фпот — теплопотери в окружающую среду, кВт.
Тепловой поток контактного газа на входе в холодильник
Ф1 определен в тепловом расчете контактного аппарата: Ф1 =
=4615,115 кВт.
Для определения значения Фг рассчитывают среднюю мо-
лярную теплоемкость контактного газа при Т= 150+273=
=423 К-
Расчет средней молярной теплоемкости контактного газа:
СН3ОН СН2О СО СО2 Na На Н2О X
xt, % 17,25 18,34 0,42 2,32 36,88 6,53 18,26 100.00
Ct, Дж/(моль-К) 54,23 40,72 29,88 43,19 29,09 28,94 34,71 —
С{х{/100, ДжДмоль-К) 9,3547 7,4680 0,1255 1,002 0 10.7284 1.8898 6.3380 36,9064
Тепловой поток контактного газа на выходе из холодильника:
Ф2= 0,1397-36,9064-150=773,374 кВт.
184
Таблица 39. Тепловой баланс холодильника
Приход кВт % Расход кВт %
Тепловой поток кон- тактного газа на вхо- де 4615,115 100,00 Тепловой поток кон- тактного газа на вы- ходе Теплота, отводимая испаряющимся кон- денсатом Теплопотери в окру- жающую среду 773,374 3610,985 230,756 16,8 78,2 5,0
Всего... 4615,115 100,00 В с е г о... 4615,115 100,00
Принимают, что теплопотери в окружающую среду составляют
5% от общего прихода теплоты:
Фпот=0,05-4615,115=230,756 кВт.
Теплоту, отводимую испаряющимся конденсатом (тепловую на-
грузку холодильника), находят из уравнения теплового ба-
ланса:
Фз= Ф1—Фа—Фпот=4615,115—773,374—230,756 = 3610,985 кВт.
Расход конденсата:
т=3610,985/2171=1,663 кг/с или 5987 кг/ч,
где 2171—удельная теплота парообразования при р=0,3 МПа, кДж/кг (см.
Приложения, табл. 14).
Составляют тепловой баланс холодильника (табл. 39).
Расчет подконтактного холодильника
Выполняют поверочный расчет площади поверхности теплооб-
мена. Необходимую площадь поверхности теплообмена опреде-
ляют по формуле (62) Тепловая нагрузка определена в тепло-
вом расчете подконтактного холодильника (см. табл. 39) Фа =
=3 610985 Вт.
Температурная схема теплообмена:
контактный газ
680 °C-----------------------------► 150 °C,
конденсат
133 °C---------► 133 °C,
Afmax=680—133=547 °C (547 К).
Л/т1п=150—133= 17 °C (17 К).
________А^тах — А/т,п_______547 — 17____
ср “2,303 1g (A/max/A/min) ~ 2,3031g(547/17) “
= 153 °C, АГср = 153 К.
185
Коэффициент теплопередачи определяют по формуле
к= (1/0С1+ 2гст+ l/as)-1,
где ОС] — средний коэффициент теплоотдачи от контактного газа к стейке
трубы, Вт/(м2-К); а2—коэффициент теплоотдачи от стенки трубы к кипя-
щему конденсату, Вт/(м2-К)-
Определяют средний коэффициент теплоотдачи от контакт-
ного газа к стенке трубы [29, уравнение (V-40)]:
где Лтр — коэффициент, учитывающий физические свойства контактного газа
при средней температуре; IF — массовая скорость контактного газа в труб-
ном пространстве, кг/(м2-с); d — внутренний диаметр трубы, м.
Теплофизические параметры контактного газа находят при
средней температуре
Zcp=(680+150)/2=415°C.
Рассчитывают среднее значение молярной теплоемкости кон-
тактного газа для интервала температур 150—680 °C (значения
Ст при 150 и 680°C рассчитаны ранее):
Ст= (48,5822+36,9064)/2=42,7443 Дж/(моль-К).
Динамическую вязкость контактного газа определяют по фор-
муле (66). Для упрощения расчета делают следующие допу-
щения:
в поток «метанол» включают метанол и формальдегид;
в поток «диоксид углерода» включают диоксид и оксид
углерода.
Расчет динамической вязкости контактного газа:
сн3он СО2 N2 Н2 Н2О 2
Xi, % 35,59 2,74 36,88 6,53 18,26 100,00
Afr 32 44 28 2 18 —
AfiXi/100 11,389 1,205 10,326 0,131 3,287 26,338
Ui-107, Па-с 231 304 315 156 237 —_
(MiXi/100)-10-7, Па-с 0,0493 0,0040 цсм= (26,338/0,1008) 10-7 Удельная теплоемкость контактного 0,0328 =261-10- газа 0,0008 7 Па-с. 0,0139 0,1008
с=42,7443 • 1000/26,338 = 1623 Дж/ (кг • К).
Принимают, что критерий Прандтля для двухатомных газов
Рг=0,72 [10, с. 150], тогда теплопроводность контактного газа:
Л =1623•261•10-7/0,72 =0,0588 Вт/ (м • К).
Площадь сечения трубного пространства подконтактного холо-
дильника:
Sip=0,785 • 0,022 • 1752=0,55 м2.
186
Массовая скорость контактного газа в трубном пространстве:
W'=mT/SIp= 13 029/(3600-0,55) =6,58 кг/(м2-с),
где m-t — расход контактного газа, кг/ч (см. табл. 30).
Коэффициент, учитывающий физические свойства контактного
газа, определяют по формуле [29, уравнение (V-29)]:
Лтр = 17,2-10-3(Х/м°-е) (Рг/0,73)0-4,
Ар=17.2-10-э[0,0588/(261 10~7)°-3] (0.72/0,73)°-4=4,68.
Средний коэффициент теплоотдачи:
«!=4,68 • 6,58°’3 • 0,02-°-2=50 Вт/ (м2 • К) -
Определяют коэффициент теплоотдачи от стенки трубы к кипя-
щему конденсату по формуле
OC2=NU*X//.,
где Л — теплопроводность конденсата, Вт/(м-К); /.— определяющий пара-
метр, м.
При 133°С Х=68,6-10~2 Вт/(м-К), /*=7,05-10~6 м (см.
Приложения, табл. 16, 19).
Для выбора формулы, по которой рассчитывают значение
критерия Нуссельта, необходимо знать режим движения кон-
денсата в межтрубном пространстве.
Критерий Рейнольдса определяют по формуле [14, с. 166]:
Re*=Вер,
где В — коэффициент, учитывающий теплофизические свойства кипящего
конденсата, м2/Вт; ср — поверхностная плотность теплового потока, Вт/м2.
При 133°С В=9,03-10~6 м2/Вт (см. Приложения, табл. 19).
При тепловой нагрузке Фа=3 610985 Вт и площади поверхно-
сти теплообмена Fa=550 м2.
<р= Фа/Ва=3 610 985/550=6565 Вт/м2.
Re*=9,03 10-6 6565=0,06.
Так как Re*>10-2, то для определения критерия Нуссельта
используют формулу [14, с. 165]:
Nu*=0,125Re*°-e5Pr°’33
(при Re*<10-2 Nu.=0,0625Re*°-5Pr°-3s).
При температуре 133 °C Рг=1,29 (см. Приложения, табл. 16):
Nu.=0,125 • 0,06°-в5-1,29°-зэ= 0,0218.
Коэффициент теплоотдачи от стенки трубы к кипящему кон-
денсату:
02= 0,0218 • 68,6 10-2/ (7,05 • 10~6) = 2121 Вт/ (м2 • К).
Сумма термических сопротивлений стенки трубы с учетом слоев
187
загрязнений с обеих сторон:
2 '•ст=Г1+г2+гз=0,00009 + 0,0025/17,5 +0,00018 =0,000413 м2-К/Вт,
где Г] и rs—сопротивления слоев загрязнений с обеих сторон трубы, м2-К/Вт
[9, табл. 15]; 0,0025 — толщина стенки трубы, м; 17,5 — теплопроводность
нержавеющей стали, Вт/(м-К) [10, табл. XXVIII].
Коэффициент теплопередачи:
к= (1/50+0,000413+1/2121)-‘=48 Вт/(м2-К).
Площадь поверхности теплопередачи:
Га=з 610 985/ (48 • 153) =492 м2.
Запас площади поверхности теплопередачи:
(550—492) • 100/492= 12®/0.
ПОЛУЧЕНИЕ СТИРОЛА ИЗ ЭТИЛБЕНЗОЛА
Основными промышленными методами получения стирола яв-
ляются каталитические процессы газофазного дегидрирования
этилбензола и эпоксидирования пропилена гидропероксидом
этилбензола, в последнем стирол получают совместно с пропи-
леноксидом (так называемый «Халкон-процесс»).
По технико-экономическим показателям производство сти-
рола каталитическим газофазным дегидрированием этилбензо-
ла наиболее выгодно, и этот процесс остается в настоящее вре-
мя определяющим. Получение стирола по принятой для расчета
наиболее современной энерготехнологической схеме в агрегате
повышенной единичной мощности состоит из двух стадий: дегид-
рирования этилбензола с получением стирола-сырца; ректифи-
кации стирола-сырца с выделением стирола-ректификата, этил-
бензола, толуола, бензола.
Дегидрирование этилбензола осуществляют в адиабатиче-
ском двухступенчатом реакторе (со встроенным промежуточным
теплообменником) на железохромкалиевом катализаторе по
реакции
С6Н6—СН2—СНз С6Н6—СН=СН2+Н2, —АЯ°29з=—117,57 кДж/моль.
Процесс ведут под давлением до 0,5 МПа при температуре
580—610 °C, массовом отношении водяной пар: этилбензол, рав-
ном (1,7—2,1): 1, и объемной скорости по жидкому этилбензолу
0,5 ч-1. В этих условиях степень конверсии этилбензола состав-
ляет 55—60%, селективность по стиролу 88—90%.
Описание технологической схемы см. [4, с. 481].
МАТЕРИАЛЬНЫЙ РАСЧЕТ
Исходные данные:
годовая производительность установки по стиролу-ректификату
310000 т;
188
Рис. 12. Схема потоков стадии
дегидрирования:
I — этилбензол, 2 — возвратный этил-
бензол, 3— насыщенный водяной пар;
4, 6 — парогазовая смесь; 5, 8, 9 — пе-
регретый водяной пар; 7 — контактный
газ;
ИП1 — испаритель; ATI — перегрева-
тель; ДТ2 — межступенчатый теплооб-
менник; РТ1 — реактор дегидрирования
годовой фонд рабочего вре-
мени 7920 ч;
массовая доля стирола в сти-
роле-ректификате 99,85%;
состав свежего этилбензола
(ю,, %) этилбензол —
99,965; бензол — 0,035;
состав возвратного (цирку-
ляционного) этилбензола
%): этилбензол —
93,94; стирол — 2,76; толу-
ол — 3,30;
потери на стадии ректификации, %: стирола 1,25; этилбензо-
ла 0,08;
суммарная степень конверсии этилбензола 0,56;
селективность по стиролу 0,89;
массовое отношение водяной пар: этилбензол (уточняется при
расчете) 2,0;
степень конверсии этилбензола в стирол на первой ступени де-
гидрирования (уточняется при тепловом расчете) 0,31.
Последовательность расчета:
а) определяют расход этилбензола на процесс, состав свежего и воз-
вратного (циркуляционного) этилбензола;
б) рассчитывают расход водяного пара в испаритель и в узел смешения;
в) определяют изменение состава парогазовой смеси на первой и вто-
рой ступенях катализа, состав газа после первой ступени и на выходе из
реактора дегидрирования.
Схема потоков стадии дегидрирования приведена иа рис. 12.
Часовая производительность установки:
по стиролу-ректификату: 310 000-1000/7920=39 141 кг/ч;
по 100%-му стиролу: 39 141-0,9985=39 082 кг/ч.
С учетом потерь на стадии ректификации в реакторе дегид-
рирования необходимо получить стирола:
39 082-100,00/(100,00—1,25) =39 577 кг/ч или 39 577/104=380,548 кмоль/ч.
189
С целью упрощения расчета принимают, что в процессе де-
гидрирования этилбензола протекают следующие реакции:
СбН5—С2Н5 ** С6Н5—СН=СН2+Н2, 1
Cells'—С2Н5+Н2 =* CgHs—СН3+СН4, 2
с6н6—с2н5 ** с6н6+сн2=сн2, 3
2C6HS—С2Н5 = СвН5—СН=СН—С6Н6+2СН4. 4
По основной реакции 1 расходуется этилбензола:
380,548 кмоль/ч или 40 338 кг/ч.
По реакциям 1—4 расходуется этилбензола:
380,548/0,89= 427,582 кмоль/ч или 45 324 кг/ч.
Необходимо подать этилбензола с учетом его степени конвер-
сии:
427,582/0,56=763,539 кмоль/ч или 80 935 кг/ч.
С учетом потерь на стадии ректификации в реактор дегидриро-
вания подают этилбензола:
763,539-100,00/(100,00—0,08) =764,150 кмоль/ч или 81 000 кг/ч.
Потери этилбензола на стадии ректификации:
764,150—763,539=0,611 кмоль/ч или 65 кг/ч.
Остается непревращенного этилбензола в контактном газе:
764,150—427,582=336,568 кмоль/ч или 35 676 кг/ч.
В реактор дегидрирования поступает:
свежего этилбензола: 427,582+0,611=428,193 кмоль/ч или
45389 кг/ч;
возвратного (циркуляционного) этилбензола: 336,568—
—0,611 — 335,957 кмоль/ч или 35611 кг/ч.
Рассчитывают состав свежего этилбензола (поток 1)
с6н5 — C2HS CeHs 2
Wt, % 99,965 0,035 100,000
тъ кг/ч 45 389 16 45 405
nx, кмоль/ч 428,193 0,205 428,398
x„ % 99,952 0,048 100,000
Рассчитывают состав возвратного (циркуляционного) этил-
бензола (поток 2):
Wi, %
т-с, кг/ч
Л4, г/моль
Лг, кмоль/ч
Xi, %
CgHs — CaHg CeHs — C2Ha
93,94 2,76
35 611 1046
106 104
335,957 10,058
93,42 2,80
CfiHs — CHa S
3,30 100,00
1251 37 908
92 —
13,598 359,613
3,78 100,00
190
Для снижения температуры кипения в жидкую этилбензоль-
ную фракцию в испарителе добавляют водяной пар. Массовую
долю водяного пара в образующейся парогазовой смеси находят
по формуле
®н2о = IphjO^Hjo/CphjO^HjO 4-РэбЛ1эб)1 100,
где рн2о и раб — парциальные давления паров воды и этилбензольной фрак-
ции при температуре кипения; Л1Н2о и МЭб — молярные массы воды и этил-
бензольной фракции.
Так как этилбензольная фракция состоит в основном из
этилбензола, молярную массу фракции принимают равной мо-
лярной массе этилбензола.
Парциальное давление паров воды при температуре кипения
155°C составляет 0,5579 МПа (см. Приложения, табл. 13),
парциальное давление этилбензольной фракции при общем дав-
лении в испарителе 1,2000 МПа равно 1,2000—0,5579=
= 0,6421 МПа.
а»нго = [0,5579-18/(0,5579-18 + 0,6421-106)] 100 = 12,86%.
Общее количество подаваемого в реактор этилбензола:
45 405 +37 908=83 313 кг/ч.
Расход водяного пара в испаритель (поток 3):
83 313 • 12,86/ (100,00—12,86) = 12 295 кг/ч.
Рассчитывают по суммарному содержанию компонентов в по-
токах 1, 2, 3 состав парогазовой смеси после испарителя
(поток 4):
СвН5-С2Нб CeHs—С2Нз СвН5-СН3 СвНв Н20 2
mt, кг/ч 81 000 1046 1251 16 12 295 95 608
w„ % 84,72 1,09 1,31 0,02 12,86 100,00
пт, кмоль/ч 764,150 10,058 13,598 0,205 683,056 1471,067
Хг, % 51,95 0,68 0,93 0,Щ 46,43 100,00
В сырьевой поток на входе в реактор дегидрирования вво-
дят водяной пар для снижения парциального давления этил-
бензола, повышения его степени конверсии и подавления побоч-
ных реакций. Расход водяного пара определяют из уравнения
теплового баланса узла смешения:
Pin (Ап —Лп /)=/Нг(Аг —Аг ),
где тг и т„ — массовый расход газовой смеси и поступающего водяного
пара, кг/ч; Лг' и Л/ — энтальпия газовой смеси и водяного пара до смеше-
ния, кДж/кг; hr" и Лп" — энтальпия газовой смеси и водяного пара после
смешения, кДж/кг.
Принимают следующие значения температуры, °C: парога-
зовой смеси после перегревателя — 550; водяного пара, посту-
191
Таблица 40. Расчет средней энтальпии парогазовой смеси
Компонент % 7=550+273=823 К 7-610+273=883 К
Л£, кДж/кг w,ft,/100. кДж/кг ft,-, кДж/кг WfftJlOO, кДж/кг
СбНэ—“С2Н5 84,72 1294,2 1096,4 1458,0 1235,2
СбН5—С2Н3 1,09 1223,3 13,3 1375,8 15,0
С6Н5—СНз 1,31 1224,3 16,0 1381,2 18,1
С6н6 0,02 — — — —
Н2О 12,86 3594,5 462,3 3725,8 479,1
100,00 — 1588,0 — 1747,4
пающего из промежуточного теплообменника, — 655; парогазо-
вой смеси на входе в реактор — 610.
Рассчитывают среднюю энтальпию парогазовой смеси
(табл. 40).
Значения энтальпии органических соединений и перегретого
водяного пара см. Приложения, табл. 8, 15. Предварительно
определяют парциальное давление паров воды в парогазовой
смеси:
Рн2о = 0,45-0,4643 = 0,2 МПа,
где 0,45 — давление парогазовой смеси, МПа; 0,4643 — молярная доля паров
воды в смесн (см. состав потока 4).
Энтальпия водяного пара (р=0,9 МПа):
до смешения (/=655°C): h„'=3821,0 кДж/кг;
после смешения (/=610 °C); Лп"=3720,4 кДж/кг.
Определяют расход водяного пара в узел смешения (по-
ток 5):
тп (3821,0—3720,4) =95 608 (1747,4—1588,0),
тп=151 490 кг/ч.
Количество водяного пара на входе в реактор дегидрирования:
151 490+12 295=163 785 кг/ч.
Массовое отношение водяной пар : этилбензол:
163785/81 000=2,02,
что соответствует оптимальному технологическому режиму.
Суммируя содержание компонентов в потоках 4 и 5, опреде-
192
ляют состав парогазовой смеси на входе в реактор дегидриро-
вания (поток 6):
СвН5-С2Н6 СсН5-С2Н3 свн5-сн3 СвНе нао £
тх, кг/ч 81 000 1046 1251 16 163 785 247 098
w„ % 32,78 0,42 0,51 0,01 66,28 100,00
пт, кмоль/ч 764,150 10,058 13,598 0,205 9099,167 9887,178
% 7,73 0,10 0,14 — 92,03 100,00
Для упрощения расчета принимают, что на первой ступени
протекает только основная (целевая) реакция конверсии этил-
бензола (см. реакцию 1), при этом расходуется этилбензола:
764,150-0,31=236,886 кмоль/ч или 236,886-106=25 110 кг/ч,
где 0,31—степень конверсии этилбензола в стирол на первой ступени де-
гидрирования.
Образуется:
стирола: 236,886 кмоль/ч или 24 636 кг/ч;
водорода: 236,886 кмоль/ч или 474 кг/ч.
В парогазовой смеси после первой ступени содержится:
стирола: 10,058+236,886=246,944 кмоль/ч или 25 682 кг/ч;
непрореагировавшего этилбензола: 764,150—236,886=527,264 кмоль/ч или
55 890 кг/ч.
Рассчитывают состав парогазовой смеси после первой сту-
пени катализа:
тх, кг/ч W,, % пх, кмоль/ч *Р %
CeHs—С2Н5 55 890 22,62 527,264 5,21
С6н5—С2Н3 25 682 10,39 246,944 2,44
С6Н5—СНз 1251 0,51 13,598 0,13
16 0,01 0,205 —
Н2О 163 785 66,28 9099,167 89,88
н2 474 0,19 236,886 2,34
247 098 100,00 10 124,064 100,00
Массовая доля стирола в контактном газе (в расчете на орга-
нические соединения):
25 682-100/(55 890+25 682+1251 + 16)=31%,
что соответствует нормам оптимального технологического ре-
жима (30—32%).
На второй ступени дегидрирования по реакции 1 реагирует
этилбензола:
380,548—236,886=143,662 кмоль/ч или 15 228 кг/ч;
13—69
193
образуется:
стирола: 143,662 кмоль/ч или 14 941 кг/ч;
водорода: 143,662 кмоль/ч или 287 кг/ч.
Количество стирола на выходе из реактора дегидрирования:
246,944+143,662=390,606 кмоль/ч или 40 623 кг/ч.
Расход этилбензола по реакциям 1—4 составляет
427,582 кмоль/ч, следовательно, по реакциям 2—4 расходуется
этилбензола:
427,582—380,548=47,034 кмоль/ч или 4986 кг/ч.
По реакции 2 реагирует 60% этилбензола, что составляет:
47,034-0,6=28,220 кмоль/ч или 2992 кг/ч;
расходуется водорода: 28,220 кмоль/ч или 56 кг/ч;
образуется:
толуола: 28,220 кмоль/ч или 2596 кг/ч;
метана: 28,220 кмоль/ч или 452 кг/ч.
Всего содержится толуола в контактном газе:
28,220+13,598 = 41,818 кмоль/ч или 3847 кг/ч.
По реакции 3 реагирует 37% этилбензола, что составляет:
47,034-0,37=17,403 кмоль/ч или 1844 кг/ч;
образуется:
бензола: 17,403 кмоль/ч илн 1357 кг/ч;
этилена: 17,403 кмоль/ч или 487 кг/ч.
Всего содержится бензола в контактном газе:
17,403 +0,205=17,608 кмоль/ч или 1373 кг/ч.
По реакции 4 реагирует 3% этилбензола, что составляет:
17,034-0,03=1,411 кмоль/ч или 150 кг/ч.
Образуется:
дибензилидена: 1,411/2=0,705 кмоль/ч или 127 кг/ч;
метана: 1,411 кмоль/ч илн 23 кг/ч.
Образовавшийся при дегидрировании этилен разлагается по
реакции
С2Н4 =₽* СН«+С. 5
При степени разложения этилена 0,95 его расход составит:
17,403-0,95=16,533 кмоль/ч или 463 кг/ч.
Остается этилена в контактном газе:
17,403—16,533 = 0,870 кмоль/ч или 24 кг/ч;
194
образуется:
метана: 16,533 кмоль/ч или 265 кг/ч;
углерода: 16,533 кмоль/ч или 198 кг/ч.
Образовавшийся углерод конвертируют водяным паром по
реакции
С+Н2О СО+Н2. 6
Расходуется водяного пара: 16,533 кмоль/ч или 296 кг/ч;
образуется:
оксида углерода: 16,533 кмоль/ч или 463 кг/ч;
водорода: 16,533 кмоль/ч или 31 кг/ч.
Всего образуется метана по реакциям 2, 4, 5:
28,220 + 1,411 + 16,533=46,164 кмоль/ч или 740 кг/ч.
Метан конвертируют водяным паром по реакции
СН4+Н2О = СО+ЗН2. 7
При степени конверсии метана 0,8 расходуется:
метана: 46,164-0,8=36,931 кмоль/ч или 591 кг/ч;
водяного пара: 36,931 кмоль/ч или 665 кг/ч;
образуется:
оксида углерода: 36,931 кмоль/ч или 1034 кг/ч;
водорода: 3-36,931 = 110,793 кмоль/ч или 222 кг/ч.
Остается метана в контактном газе:
46,164—36,931=9,233 кмоль/ч или 149 кг/ч.
Всего образуется оксида углерода по реакциям 6 и 7:
16,533+36,931=53,464 кмоль/ч или 1497 кг/ч.
Оксид углерода конвертируют водяным паром по реакции
СО+Н2О СО2+Н2. 8
При степени конверсии оксида углерода 0,99 расходуется:
оксида углерода: 53,464-0,99=52,929 кмоль/ч или 1482 кг/ч;
водяного пара: 52,929 кмоль/ч или 953 кг/ч;
образуется:
диоксида углерода: 52,929 кмоль/ч или 2329 кг/ч;
водорода: 52,929 кмоль/ч или 106 кг/ч.
Остается оксида углерода в контактном газе:
53,464—52,929=0,535 кмоль/ч или 15 кг/ч.
Общий расход водяного пара по реакциям 6—8:
16,533 +36,931+52,929=106,393 кмоль/ч или 1914 кг/ч.
13*
195
Остается водяного пара в контактном газе:
9099,167—106,393 =8992,774 кмоль/ч или 161 871 кг/ч.
Образуется водорода по реакциям 1, 6—8:
143,662+16,533+110,793+52,929=323,917 кмоль/ч
или 287+ 31+222+106 = 646 кг/ч.
Расходуется водорода по реакции 2:
28,220 кмоль/ч или 56 кг/ч.
Остается водорода в контактном газе:
236,886+323,917—28,220 =532,583 кмоль/ч или 474 + 646—56=1064 кг/ч.
Рассчитывают состав контактного газа на выходе из реак-
тора дегидрирования (поток 7): %
тх, кг/ч пх, кмоль/ч х,, %
С6Н5—СзН5 35 676 14,44 336,568 3,24
СбНэ—С2Н3 40 623 16,44 390,606 3,76
С6Н5—СНз 3847 1,56 41,818 0,40
С6Н6 1373 0,55 17,608 0,17
24 0,01 0,870 0,01
сн< 149 0,06 9,233 0,09
со2 2329 0,94 52.929 0,51
со 15 0,01 0,535 0,01
Н2О 161 871 65,51 8992,774 86,67
Н2 1064 0,43 532,583 5,13
Тяжелые продукты 127 0,05 0,705 0,01
2 247 098 100,00 10 376,229 100,00
Расчет основных расходных коэффициентов. Для получения
39 141 кг/ч стирола-ректификата расходуется по реакциям 1—4
45324 кг/ч этилбензола.
Расходный коэффициент по этилбензолу:
45 324/39 141 = 1,158 кг/кг
Дополнительно образуется (кг на 1 т стирола-ректификата):
толуола: 2596/39 141 = 0,066;
бензола: 1357/39 141 = 0,035.
ТЕХНОЛОГИЧЕСКИЙ РАСЧЕТ РЕАКТОРА
Назначение, устройство и основные размеры.
Определение числа реакторов
Реактор предназначен для парофазного каталитического дегид-
рирования этилбензола в стирол в токе водяного пара. Для
установки выбран вертикальный цилиндрический стальной ади-
абатический реактор шахтного типа с двумя слоями катализа-
196
тора и встроенным вертикальным двухходовым межступенча-
тым теплообменником с П-образными трубками. Теплообменник
предназначен для подогрева газовой смеси, выходящей из пер-
вой ступени катализа, до начальной температуры (на входе в
слой катализатора) за счет теплоты перегретого водяного пара.
Техническая характеристика реактора:
Диаметр реактора внутренний, мм 6500
Высота общая, мм 9140
Характеристика железохромкалиевого катализатора:
Плотность, кг/мэ Производительность ка- 2370—2380
кажущаяся р 2 300 тализатора за период
насыпная рн 1 400 пробега, кг продукта на
Срок службы (пробег), 15 840 1 кг катализатора
ч Объем катализатора в 100
реакторе, м3
При длительности пробега 15840 ч и производительности
катализатора за этот период 2370 кг/кг производительность
катализатора по стиролу-ректификату за 1 ч составит:
W„=2370/15 840=0,15 ч~1.
Необходимый объем катализатора для обеспечения заданной
производительности
yK=JV/(JVKpH) =39 141-1,0125/(0,15-1400) = 188,7 м3,
где N — производительность реактора по стиролу-ректификату с учетом
1,25% потерь, кг/ч.
Количество этилбензола (углеводородной смеси) на входе
в реактор составляет (см. состав потока 6):
тэ6=247 098—163 785 =83 313 кг/ч.
Необходимый объем катализатора для обеспечения заданной
производительности:
Ук=тэв/(р8бУоб) =83313/(867-0,5) = 192,2 м3,
где Уоб — объемная скорость жидкого этилбензола, ч_|.
Число реакторов для обеспечения заданной производитель-
ности:
п= 192,2/100= 1,92.
Необходимо установить два реактора, соединенные параллель-
но. Запас производительности по катализатору:
(100,0 •2—192,2) -100/192,2=4%.
197
Тепловой расчет
Исходные данные:
в реактор дегидрирования подают 247098/(3600-2) =34,319 кг/с
парогазовой смеси;
состав потоков 6, 7 и потока на выходе из реактора см. Мате-
риальный расчет-,
температура парогазовой смеси, °C: на входе в реактор — 610;
на выходе из первой ступени (уточняется расчетом)—530—540;
на входе во вторую ступень реактора — 610; на выходе из ре-
актора (уточняется расчетом)—570—590;
температура водяного пара на выходе из промежуточного теп-
лообменника 655 °C.
Тепловой расчет первой ступени катализа
Цель расчета — определение температуры парогазовой смеси
на выходе из первой ступени катализа.
Уравнение теплового баланса в общем виде:
Ф1 = ф2+ Фэ + Фпот,
где Фь Ф3 — тепловые потоки парогазовой смеси на входе в реактор и выхо-
де нз первой ступени катализа соответственно, кВт, Ф2— теплота, расходуе-
мая на осуществление химических реакций, кВт; Фпот — теплопотери в окру-
жающую среду, кВт
Тепловой поток парогазовой смеси на входе в реактор рас-
считывают, используя определенные ранее значения средней
энтальпии парогазовой смеси (см. табл. 40) и энтальпии водя-
ного пара после смешения (см. с. 192).
Ф,= [95 608/(2-3600)] • 1747,4+[151 490/(2-3600)] -3720,4=
= 101 483,11 кВт.
Для расчета Ф2 определяют теплоту реакции дегидрирова-
ния (реакция 1); значения энтальпий образования Д//02вв (см.
Приложения, табл. 3):
147,36—29,79= 117,57 кДж/моль;
Ф2= [236,886/(2 3600)] -117,57- 10э=3868,15 кВт,
где 236,886 — расход этилбензола на первой ступени катализа, кмоль/ч.
Для определения температуры парогазовой смеси на выходе
из первой ступени катализа, используя данные о составе смеси,
рассчитывают средние энтальпии парогазовой смеси при тем-
пературах 530 и 540 °C (табл. 41). Значения энтальпий органи-
ческих соединений и перегретого водяного пара находят по
справочнику (см. Приложения, табл. 8, 15), предварительно
рассчитывают парциальное давление водяного пара (молярную
198
Таблица 41. Расчет средней энтальпии парогазовой смеси
Компонент №.. % 7=540+273=313 К 7=530+273=803 К
ht, кЦъфлълъ ™Д/100, кДж/моль ht, кДж/моль юД/100. кДж/моль
С6Н5—С2Н5 22,62 1266,9 286,6 1239,6 280,4
С6Н5-С2Н3 10,39 1197,8 124,5 1172,4 121,8
С6Н5—СНз 0,51 1198,2 6,1 1172,0 6,0
Н2О 66,28 3571,3 2367,1 3549,7 2352,7
С6Н6, Н2 0,20 — — — —
2 100,00 — 2784,3 — 2760,9
Примечание. Так как значения “'СдНд и wh2 малы Ю1 и 0,19% соответствен
ио), то значения ^свНе и йн2° Расчете не учитывают.
долю водяного пара см. состав парогазовой смеси после первой
ступени катализа):
Рн2О = P-^HjO = 0,4-0,8988 =3 0,36 МПа.
Принимают, что теплопотери в окружающую среду состав-
ляют 1,5% от общего прихода теплоты:
фпот=0,015 101483,11 = 1522,25 кВт.
Тепловой поток парогазовой смеси на выходе из первой ступени
находят из уравнения теплового баланса:
ф3=ф1_фг_фпот=Ю1 483,11—3868,15—1522,25=96 092,71 кВт.
Энтальпия парогазовой смеси:
Лг= Фз/тг=96 092,71/34,319=2800,0 кДж/кг,
где тт — количество парогазовой смеси, проходящей через слои катализа-
тора, кг/с.
Температура парогазовой смеси:
813+ [(2800,0—2784,3)/(2784,3—2760,9) ] • (813—803) =820 К или 547 °C
Температура парогазовой смеси на выходе из первой ступе-
ни катализа соответствует оптимальному технологическому ре-
жиму реактора, следовательно, степень конверсии этилбензола
(0,31) принята верно.
Тепловой расчет межступенчатого теплообменника
Цель расчета — определение температуры перегретого водяного
пара на входе в теплообменник.
Рассчитывают среднюю энтальпию парогазовой смеси на
входе во вторую ступень катализа (на выходе из теплообмен-
199
ника) при температуре 7=610+273=883 К (см. Примечание
к табл. 41):
%-. % ht, кДж/кг wth,/100. кДж/кг
С6Н5—С2Н5 22,62 1458,0 329,8
С6Н5—О+з 10,39 1375,8 142,9
С6Н5—СН3 0,51 1381,2 7,0
Н2О 66,28 3720,4 2465,9
с6н6, н2 0,20 — —
2 100,00 — 2945,6
Тепловая нагрузка теплообменника:
34,319(2945,6—2800,0) =4996,85 кВт.
Тепловой поток водяного пара на выходе из теплообменника
при температуре 655 °C:
Фп=151 490-3821,0/(2-3600) =80 394,90 кВт,
где 151490—расход водяного пара, поступающего в узел смешения (по-
ток 5), кг/ч; 3821,0 — энтальпия водяного пара при давлении 0,9 МПа и
температуре 655 °C, кДж/кг.
Тепловой поток водяного пара на входе в теплообменник:
80 394,90 + 4996,85 =85 391,75 кВт.
Энтальпия водяного пара на входе в теплообменник:
85 391,75 • 2 • 3600/151 490=4058,5 кДж/кг,
что при давлении 0,9 МПа соответствует температуре водяного
пара 760 °C.
Тепловой расчет второй ступени катализа
Цель расчета — определение температуры парогазовой смеси
на выходе из реактора дегидрирования.
Уравнение теплового баланса в общем виде идентично урав-
нению теплового баланса первой ступени катализа. Тепловой
поток парогазовой смеси на входе во вторую ступень катализа:
Ф1=34,319-2945,6 = 101 090,05 кВт.
Для определения количества теплоты, расходуемой на хими-
ческие реакции Ф2, рассчитывают теплоты реакций 2—3, 5—8.
Теплотой реакции образования дибензилидена (реакция 4) пре-
небрегают; теплота реакции 1 рассчитана ранее.
200
Расчет теплот реакций (в кДж/моль):
Реакция
С6Н5—С2Н&+ —СН3+СН,
С6Н5—СзН5<±СбНб+С2Н4
c2iwch(+с
с+н2о^=со+н2
СН4+Н2О^СО+ЗН2
СО+Н2О^СО2+Н2
ДЯ°298—SA^°2g8(KOH) ^^^°298(исх)
—74,85+50,00—29,79=—54,64
52,30+82,93—29,79= 105,44
—74,85—52,30=—127,15
—110,53— (—241,81) = 131,28
—110,53— (—241,81)—(—74,85) =206,13
—393,51—(—241,81)—(—110,53) =
=—41,17
Количество теплоты, расходуемой на химические реакции:
Ф2= [1000/(2-3600)] (143,662-117,57—28,220-54,64+17,403-105,44—
-16,533-127,15+16,533-131,28+36,931 -206,13—52,929-41,17) =
=0,139 22 685,16=3150,72 кВт.
Ориентировочное понижение температуры во второй ступени
катализа:
(610—547)3150,72/3868,15=51 °C.
Температура на второй ступени катализа:
610—51=559 °C
Для определения температуры контактного газа на выходе
из реактора рассчитывают его средние энтальпии при темпера-
турах 550 и 570 °C, используя данные о составе газа (поток 7).
Значение энтальпии водяного пара принято при давлении
0,35-0,8667=0,3 МПа. Так как содержание в контактном газе
бензола, этилена, метана, диоксида углерода, оксида углерода,
водорода и тяжелых продуктов незначительно, при расчете
средней энтальпии эти компоненты не учитывают (табл. 42).
Таблица 42. Расчет средней энтальпии контактного газа
Компонент и;, % Г=550+273=823 К Г=570+273=843 К
ht, кХХж/кг кДж/кг К, кДж/кг wlhl^ °0’ кДж/кг
с6н5—С2Н5 14,44 1294,2 186,9 1348,8 194,8
С6Н5—С2Нз 16,44 1223,3 201,1 1274,1 209,5
С6Н5—СНз 1,56 1224,3 19,1 1276.6 19,9
Н2О 65,51 3593,6 2354,2 3637,1 2382,7
С6Н6, С2Н4, СН4, СО, СО2, Н2 и тя- желые продукты 2,05
2 100,00 — 2761,3 — 2806,9
14—69
201
Таблица 43. Тепловой баланс реактора дегидрирования
Приход кВт % Расход кВт %
Тепловой поток парогазовой смеси Тепловой поток водяного пара на входе в теплооб- менник 101483,11 85391,75 54,3 45,7 Тепловой поток контактного газа Теплота на прове- дение химических реакций Тепловой поток водяного пара иа выходе из тепло- обменника Теплопотери в окружающую сре- ДУ 96422,98 7018,87 80394,90 3038,11 51,6 3,8 43,0 1,6
В с е г о... 186874,86 100,0 В с е г о... 186874,86 100,0
Принимают, что теплопотери в окружающую среду состав-
ляют 1,5% от общего прихода теплоты:
Ф„от=0,015-101 090,05=1516,35 кВт.
Тепловой поток контактного газа на выходе из реактора нахо-
дят из уравнения теплового баланса:
Фз=Ф1— Фг— ФпОТ=101 090,05—3150,72—1516,35 =96 422,98 кВт.
Энтальпия контактного газа:
Лг=96 422,98/34,319=2809,6 кДж/кг.
Температура контактного газа:
843+(2809,6—2806,9)20/(2806,9—2761,3) =844 К или 571 °C.
Определяют суммарную теплоту, расходуемую на осуществле-
ние химических реакций (на обеих ступенях катализа):
3868,15+3150,72=7018,87 кВт.
Составляют тепловой баланс реактора дегидрирования
(табл. 43).
Расчет реактора первой ступени
Принимают, что объемное отношение катализатора в первой и
второй ступенях реактора равно 1,00:1,08, следовательно, объ-
ем катализатора
в первой ступени: 100-1,00/(1,00+1,08) =48 м3;
во второй ступени: 100—48= 52 м3.
202
Расчет времени пребывания смеси в зоне катализа
Время пребывания парогазовой смеси в зоне катализа рассчи-
тывают по формуле
т=Ут/(Уке0),
где Vr— расход парогазовой смеси при температуре 610 °C (883 К) и давле-
нии 0,45 МПа, м3/с; VK — объем катализатора в реакторе, м3; Во — пороз-
ность слоя катализатора.
Расход парогазовой смеси при нормальных условиях (273 К,
101325 Па):
=9887,178 • 22,4/3600=61,52 м3/с.
Расход парогазовой смеси в условиях процесса:
VT=61,52-883-101 325/(273-0,45-10®)= 44,8 м3/с.
Порозность слоя катализатора:
€<г= 1—рн/р= 1—1400/2300=0,39,
где рн и р — насыпная и кажущаяся плотность катализатора, кг/м3.
т=44,8/(2-100-0,39) =0,57 с,
что соответствует оптимальному технологическому режиму.
Расчет межступенчатого теплообменника
Межступенчатый теплообменник предназначен для подогрева
парогазовой смеси после первой ступени катализа перегретым
водяным паром (поток 9).
Цель расчета — определение площади поверхности теплопе-
редачи, выбор теплообменного аппарата.
Исходные данные:
температура, °C: перегретого водяного пара на входе — 760;
перегретого водяного пара на выходе — 655; парогазовой смеси
на входе — 547; парогазовой смеси на выходе — 610;
давление перегретого водяного пара 0,9 МПа;
диаметр трубы 25x2,5 мм;
значения температур потоков парогазовой смеси и водяного
пара см. на рис. 12.
Перегретый водяной пар поступает в трубное пространство,
а парогазовая смесь — в межтрубное пространство. Необходи-
мую площадь поверхности теплопередачи находят по форму-
ле (62):
Fa= Фа/(кЛ7ср).
По данным теплового баланса межступенчатого теплообменни-
ка рассчитывают тепловую нагрузку теплообменника:
Фа= (85 391,75—80 394,90) • 103=4 996 850 Вт.
14* 203
Определяют среднюю разность температур между теплоно-
сителями двухходового (по трубному пространству) межступен-
чатого теплообменника.
Температурная схема теплообмена при противотоке:
водяной пар
655 °C -«------- 760 °C,
парогазовая смесь
547 °C-------------► 610 °C;
Д<шах=760—610= 150 °C,
Д/Ш1п=655—547= 108 °C.
Средняя разность температур между теплоносителями [10,
уравнение (4.81)]:
Д/ _ ----------------------Л------------------- ;
2,303 1g [(Д^гпах + Д^тШ + А) /(Д/тах + Д^пип — А)]
А .= У&2П — №пгс = УЮ52 — 632 = 84 °C;
б;„=760—655= 105 °C; б/„гс=610—547=63 °C;
84
Д*СР“ 2,303 1g [(150 + 108 + 84)/(150 + 108 — 84)] 124 С’ ДГ = 124 К-
Коэффициент теплопередачи определяют по формуле (63):
№ (1 /И1 + S Гст+ 1/Иг)-1,
где eq — коэффициент теплоотдачи от перегретого водяного пара к стенке
трубы, Вт/(м2-К); ос2—коэффициент теплоотдачи от стенки трубы к паро-
газовой смеси, Вт/(м2-К)-
Для расчета коэффициентов теплоотдачи определяют тепло-
физические параметры теплоносителей.
Теплофизические параметры перегретого водяного пара при
средней температуре tCp= (760 + 655)/2=707,5°С (980,5 К) и
давлении р=0,9 МПа см. Приложения, табл. 17, критерий
Прандтля рассчитывают по формуле (65). Для упрощения рас-
чета теплофизических параметров парогазовой смеси в один
поток «этилбензол» объединяют этилбензол, бензол и толуол.
Удельную теплоемкость парогазовой смеси (в данном случае
при постоянном объеме) рассчитывают по формуле
cv—CpIK,
где К. — коэффициент Пуассона.
Динамическую вязкость газовой смеси рассчитывают по
формуле (66). Теплоемкости и вязкости компонентов парогазо-
вой смеси при температуре (Ср= (547+610) /2=578,5°С
(851,5 К) рассчитывают по справочным данным (см. Приложе-
ния, табл. 2, 3, 11, 17).
204
Расчет теплофизических параметров парогазовой смеси:
С6Н5 — CjHs С6Н5 — С,Нз н2О Н2 £
Дж/(моль-К) 291,94 266,56 39,17 30,12 —
ьу., % М„ г!ыолъ 23,14 10,39 66,28 0,19 100,00
106 104 18 2 —
637 266 1442 29 2374
• 10, Дж/(кг-К) Xi, % 5,34 2,44 89,88 2,34 100,00
МгХг/1(Х), г/мОЛЬ 5,66 2,54 16,18 0,05 24,43
pi-107, Па-с 218* 218* 292 180 ——
[x,Aft/(100jxt)] 10-7 0,02596 0,01165 0,05541 0,00028 0,09330
* Значения вязкости приняты по бензолу.
Исм=24,43 -10-70,0933=262-1О-7 Па с.
Принимают /С=Ср/су== 1,3, тогда
Cv(CM>=2374/1,3=1826 Дж/(кг-К).
Теплопроводность парогазовой смеси вычисляют по формуле
[10, уравнение (4.10)]:
X = BCvJIcm,
где В=0,25(9К—5) =0,25(9-1,3—5) = 1,675.
1=1,675-1826 262-10-7=80,13-10-3 Вт/(м-К).
Критерий Прандтля:
Рг=2374-262-10-7(80,13-10-3) =0,78.
Теплофизические параметры теплоносителей:
Перегретый водя- ной пар (трубное пространство) Парогазовая смесь (межтрубное про- странство)
Температура t, °C 707,5 578,5
Плотность р, кг/м3 1,846 •
Динамическая вязкость р-107, Па-с 366 262
Удельная теплоемкость с, Дж/(кг-К) 2287 2374
Теплопроводность Х-103, Вт/(м-К) 95,95 80,13
Критерий Прандтля Рг 0,87 0,78
Расход водяного пара в межступенчатом теплообменнике:
та= Фа/^—й2) =4 996 850/[(3720,38—3581,52) • 103] =35,98 кг/с,
где Bi и h2 — энтальпия перегретого водяного пара при температуре 610 и
547 °C и давлении 0,9 МПа, Дж/кг (см. Приложения, табл. 15).
Принимают минимальное для турбулентного потока значе-
ние критерия Рейнольдса Re'=10000, тогда необходимое число
труб диаметром dTP=25x2,5 мм составит:
K=mn/(0,785dRe/p) =35,98/(0,785-0,02-10 000-366-10~7) =6262,
следовательно, для создания турбулентного потока перегретого
205
водяного пара максимальное число труб должно быть не бо-
лее 6262.
По ГОСТ 9929—82 выбирают теплообменник типа «У» с
17-образными трубками, с внутренним диаметром кожуха D =
= 2000 мм и длиной прямого участка трубы /=4000 мм, шагом
отверстий для труб /=32 мм.
Принимают, что трубки в верхней трубной решетке разме-
щены по вершинам правильного треугольника. Число труб оп-
ределяют по формуле
п=3а(а—1)4-1, а=(&4-1)/2,
где а и 6 — число труб на стороне и диагонали наибольшего шестиугольника.
Значение Ь определяют из соотношения
D=t(b— 1)+4с/„;
2,0=0,032(6—1)4-4-0,025; 6=60;
а = (604-1) /2=30,5; л=3 30,5(30,5—1)4-1= 2700.
Учитывая наличие в парогазовой смеси катализаторной пы-
ли, число труб уменьшают на 9—10%. Общее число труб равно
2470; число труб на один ход трубного пространства п=
= 2470/2=1235.
Площадь сечения трубного пространства:
Si = 0,785d2«=0,785 • 0,022 -1235 = 0,388 м2.
Уточняют значение критерия Рейнольдса:
Re=m„d/ (STPp) = 35,98 • 0,02/(0,388.366-1 О*7) =50 673.
Режим движения устойчивый, турбулентный, следовательно,
критерий Нуссельта рассчитывают по формуле [9, уравнение
(11-35)]:
Nu=0,023Re°-8Pr°’4=0,023-50 673°'8-0,87°-4= 126,3.
Коэффициент теплоотдачи от перегретого водяного пара к стен-
ке трубы теплообменника:
ai=NuX/d = 126,3 • 95,95 • 10-э/0,02= 606 Вт/ (м2 • К).
Коэффициент теплоотдачи от стенки трубы теплообменника к
парогазовой смеси определяют по формуле
«2=NuZ/dH.
Площадь сечения межтрубного пространства теплообменника:
S2= 0,785 (D2—nd2,) =0,785(2,02—1235-0,0252)=2,534 м2.
Эквивалентный диаметр межтрубного пространства:
dBBB= (D2—nd\)l(D+ndK) = (2,02—1235-0,0252)/(2,04-
4-1235-0,025) =0,098 м.
206
Для расчета критерия Рейнольдса определяют расход парога-
зовой смеси после первой ступени катализа:
тг=247 098/(2-3600) =34,319 кг/с.
Критерий Рейнольдса:
Re=Шгйэкв/(S2p.) = 34,319 • 0,098/(2,534 -262-10-7) = 50 658.
Расчетная формула критерия Нуссельта для аппарата с одно-
кратно-перекрестным движением парогазовой смеси [10, урав-
нение (4.31)]:
Nu=O^ReWr0-36 (Рг/Ргст) °-2s.
Для газовых потоков Рг/Ргст=1. При <р—10° еФ=0,42 [10,
табл. 4.5], тогда
Nu=0,4 • 0,42 • 50 658°>6 • 0,78°-8в= 102.
Коэффициент теплоотдачи от стенки трубы к парогазовой
смеси:
а2= 102 -‘80,13 • 10-3/0,098=83 Вт/ (м2 • К).
Сумма термических сопротивлений стенки с учетом слоев за-
грязнений с обеих сторон:
Srст=гст( 1) "ЬГст(2) + гСТ(3)=0,00018 +0,0025/17,5+ 0,00035=
= 0,000673 м2-К/Вт,
где 0,00018 и 0,00035—сопротивления слоев загрязнений со стороны водя-
ного пара и парогазовой смеси соответственно, м2-К/Вт [9, табл. 15];
0.0025 — толщина стенки трубы, м; 17,5 — теплопроводность нержавеющей
стали, Вт/(м-К) [Ю, табл. XXVIII].
Коэффициент теплопередачи
к= (1/606 + 0,000673 +1/83) =70 Вт/(м2- К).
Необходимая площадь поверхности теплопередачи:
Д=4 996 850/(70-124) =576 м2.
Площадь поверхности теплопередачи выбранного теплообмен-
ника:
Fa = ndcp/n=3,14- 0,0225 4 • 2470 =698 м2,
где dcP= (0,025+0,020)/2=0,0225 м.
Запас площади поверхности теплопередачи:
(698—576) 100/576=21 %.
ПОЛУЧЕНИЕ ЦИКЛОГЕКСАНА
В качестве сырья для получения полиамидов используют капро-
лактам и адипиновую кислоту, производство которых базиру-
ется в основном на бензоле. В настоящее время около 90%
207
Рис. 13. Схема потоков процесса получения циклогексана:
/ — бензол; 2 — азотоводородная смесь; 3— циркуляционный газ; 4—7— газовая смесь;
3 — продувочные газы; Р» 10, 12 — циклогексан; 11 — танковые газы; 13 — готовый про-
дукт; 14 — конденсат; 15 — водяной пар;
ИШ — испаритель бензола; ATI — подогреватель; РТ1, РТ2 — реакторы; ХК1—ХКЗ—хо-
лодильники-конденсаторы; Cl, С2 — сепараторы; Е1—сборник циклогексана
капролактама получают по окислительной схеме, первой ста-
дней которой является гидрирование бензола до циклогексана
по основной реакции
С6Н6+ЗН2 =<± С6Н12, —ДЛ/0298=206,07 кДж/моль.
По выбранной для расчета технологической схеме процесс
ведут в паровой фазе на никельхромовых катализаторах под
давлением до 2 МПа, при максимально допустимой температуре
240 °C, объемной скорости по жидкому бензолу 0,8—1,0 ч~* и
молярном отношении Нг:N2: С6Нб= (5—6):(2—3): 1. В этих
условиях степень конверсии бензола составляет 90—95%. Схе-
ма потоков процесса получения циклогексана приведена на
рис. 13. Краткое описание процесса дано ниже.
Бензол поступает в трубное пространство испарителя ИШ, где он сме-
шивается с циркуляционным газом, подаваемым компрессором, и свежим
водородом. Нагрев смеси и испарение бензола в испарителе осуществляют
за счет тепла газовой смеси, поступающей из реактора второй ступени РТ2.
Из испарителя ИП1 исходная газовая смесь поступает в обогреваемый водя-
ным паром подогреватель ATI, который служит для нагрева газа при пуске,
а в период эксплуатации — для предотвращения конденсации паров бензола
из газовой смеси. Пройдя колонну форконтакта, где на медьмагниевом ка-
тализаторе происходит очистка от серосодержащих соединений, газовая
смесь поступает иа гидрирование бензола в реакторы РТ1 и РТ2, соединен-
ные последовательно. Степень конверсии бензола в циклогексан в трубчатом
реакторе РТ1 составляет 93%; в реакторе колонного типа РТ2—100%. Тепло
экзотермической реакции в реакторе РТ1 отводят за счет испарения части
парового конденсата в межтрубиом пространстве и образования вторичного
водяного пара.
208
Газовую смесь после реактора РТ2 охлаждают в подогревателе исход-
ной газовой смеси ATI, затем конденсируют пары циклогексана в холодиль-
нике-конденсаторе ХК1. В сепараторе С1 циклогексан отделяют от циркуля-
ционного газа, который направляют в испаритель ИП1.
С целью предотвращения накопления в системе инертных примесей
часть циркуляционного газа охлаждают водой в холодильнике-конденсаторе
ХК2, отделяют от сконденсировавшегося циклогексана в сепараторе С2 и
выводят из системы.
Жидкий циклогексан из сепараторов С1 и С2 поступает в сборник Е1,
снабженный обратным холодильником-конденсатором ХКЗ, и передается
насосом в систему очистки от примесей.
Более подробное описание технологической схемы см. [30, с. 29].
МАТЕРИАЛЬНЫЙ РАСЧЕТ
Исходные данные:
годовая производительность по циклогексану 58 500 т;
годовой фонд рабочего .времени 8400 ч;
состав технического бензола (юг-, %): С6Нб — 99,91; СьНбСНз —
0,03; С6НПСН3 — 0,03; С5Н9СН3 — 0,02; С7Н16 —0,01;
потери циклогексана с продувочными и танковыми газами 0,2%;
объемное отношение компонентов на входе в реактор первой
ступени Нг: Иг : С6Н6=5,5: 2,5: 1,0;
степень конверсии бензола в циклогексан, %: в реакторе первой
ступени (уточняется расчетом)—90—95; в реакторе второй
ступени — 100;
температура в зоне катализа реактора первой ступени 180 °C;
давление в реакторе первой ступени 1,9 МПа;
температура конденсации 35 °C;
давление в сепараторе С1 1,7 МПа.
Последовательность расчета:
а) определяют состав газовой смеси на входе в реактор первой ступени;
б) уточняют степень конверсии бензола в циклогексан, сравнивая зна-
чения константы равновесия Кр, определенное по эмпирической формуле и
рассчитанное по значениям парциальным давлениям компонентов;
в) определяют изменение состава газа в реакторах первой и второй
ступени;
г) рассчитывают состав продувочных газов, циркуляционного газа, рас-
ход свежего газа.
Схему материальных потоков получения циклогексана см. рнс. 13.
Часовая производительность по циклогексану с учетом 0,2%
потерь:
(58 500-1000/8400) • 1,002=6978,2 кг/ч
или 6978,2-22,4/84=1860,9 м8/ч.
По уравнению реакции
С6Н6+ЗН2 =₽* C6Hi2
209
расходуется:
бензола. 1860,9 м3/ч или 6479,8 кг/ч;
водорода: 3-1860,9=5582,7 м3/ч или 498,4 кг/ч.
Расход технического бензола:
6479,8 • 100/99,91 =6485,6 кг/ч.
Рассчитывают состав технического бензола по компонентам
(поток 1):
ач, %
тх, кг/ч
Mi, кг/кмоль
Vx, м3/ч
СвНв
99,91
6479,80
78
1860,9
СвНосн3
0,03
1,95
92
0,5
СвНцСНз
0,03
1,95
98
0,4
СдНдСНз
0,02
1,30
84
0,3
С;Н,в
0,01
0,60
100
0,1
s
100,00
6485,6
1862,2
В соответствии с заданным объемным отношением компо-
нентов в реактор первой ступени подают:
водорода: 1860,9-5,5=10 235,0 м3/ч;
азота: 1860,9-2,5=4 652,2 м3/ч;
остается водорода в циркуляционном газе после реактора вто-
рой ступени:
10 235,0—5582,7=4652,3 м3/ч;
выходит после реактора первой ступени азотоводородной смеси:
4652,2+4652,3=9304,5 м3/ч.
Определяют объемную долю циклогексана в циркуляцион-
ном газе с учетом частичной конденсации циклогексана из газо-
вой смеси. Давление насыщенного пара циклогексана при 35°С
составляет рп=20,4-103 Па (см. Приложения, табл. 10). При
давлении газовой смеси в сепараторе Pcm=17-105 Па объемная
доля циклогексана в циркуляционном газе:
<р= (рп/рсм) -100= [20,4-103/(17,0- 10s)] -100= 1,2%.
Пренебрегая для упрощения расчета растворимостью азота
и водорода в циклогексане, находят количество циклогексана
в газовой смеси на входе в реактор первой ступени:
9304,5-1,2/(100,0—1,2) = 113,0 мэ/ч или 423,8 кг/ч.
Состав газовой смеси на входе в реактор первой ступени
определяют, суммируя количество компонентов в потоке 1 и
рассчитанные количества циклогексана, водорода и азота. Ор-
ганические соединения, содержащиеся в техническом бензоле
в количестве 0,5+0,4+0,34-0,1=1,3 м3/ч или 1,95+1,95+1,30+
+ 0,60=5,80 кг/ч, в дальнейшем расчете объединены под об-
щим названием «примеси».
210
Состав (поток 4): газовой смеси на входе в реактор первой ступени
СбН6 СвН12 н2 n2 Примеси £
Vx, м3/ч 1860,9 113,0 10235,0 4652,2 1,3 16 862,4
<₽«, % 11,03 0,67 60,70 27,59 0,01 100,00
тх, кг/ч 6479,8 423,8 913,8 5815,2 5,8 13 638,4
w„ % 47,51 3,11 6,70 42,64 0,04 100,00
Принимают, что степень конверсии бензола в реакторе пер-
вой ступени равна 0,93, следовательно, реагирует:
бензола 1860,9-0,93=1730,6 м3/ч;
водорода 1730,6-3=5191,8 м3/ч.
образуется циклогексана: 1730,6 м3/ч.
Рассчитывают состав газовой смеси на выходе из реактора
первой ступени (поток 5):
Vt, м’/ч Ф,. %
С6Нв 1860,9—1730,6=130,3 1,12
свн12 113,0+1730,6=1843,6 15,80
н2 10 235,0—5191,8=5043,2 43,21
n2 4652,2 39,86
Примеси 1,3 0,01
S И 670,6 100,00
С целью уточнения степени конверсии рассчитывают кон-
станту равновесия реакции получения циклогексана.
Определяют константу равновесия КР при температуре Т—
= 180+273=453 К по эмпирической формуле [30, с. 16]:
1g ЛР=9590/7—9,9194 1g Т+0,0022857+8,565,
1 g =4,4232, КР=26 500.
Определяют константу равновесия реакции по значениям
парциальных давлений компонентов. Парциальные давления
(в МПа) рассчитывают по формуле (11):
РС6Н6 = 0,02128; рС6н,2 = 0,30020; рН2 = 0,82099.
Кр=рсвн6/(рсбнвр3н2) =0,30020-1000/(0,02128-0,820993) =25 493,
где 1000 — коэффициент (учитывает различие в единицах измерения давле-
ния в эмпирической формуле для расчета КР коэффициенты уравнения опре-
делены по значениям давлений, выраженных в атмосферах).
Сравнивают значения Кр, рассчитанные по значениям пар-
циальных давлений компонентов и по эмпирической формуле.
Так как 25493<26 500, то принятая степень конверсии бензола
0,93 занижена.
Принимают степень конверсии бензола 0,932, тогда в реак-
торе первой ступени расходуется:
бензола: 1860,9 0,932=1734,4 м3/ч;
водорода: 3-1734,4=5203,2 м3/ч;
образуется циклогексана: 1734,4 м3/ч.
211
Уточняют состав газовой
вой ступени (поток 5):
смеси на выходе из реактора пер-
СбНв СвН12 н2 n2 Примеси
Vt, м3/ч 126,5 1847,4 5031,8 4652,2 1,3 11 659,2
фй % 1,09 15,84 43,16 39,90 0,01 100,00
тх, кг/ч 440,5 6927,7 449,2 5815,2 5,8 13 638,4
Wit % 3,23 50,80 3,29 42,64 0,04 100,00
Рассчитывают парциальные давления компонентов (в МПа):
рСвнв =0,020615; РсвН12= 0,301055; рН1 = 0,819983.
Константа равновесия:
КР= [0,301055/(0,020615-0,8199833) ] • 1000=26 488.
Полученное значение константы равновесия практически совпа-
дает с рассчитанным по эмпирической формуле (Кр=26 500).
Если значение константы равновесия, определенное по парциальным дав-
лениям, значительно отличается от рассчитанного по эмпирической формуле,
необходимо принять иную температуру процесса (в пределах 170—200 °C
понижение температуры на 10 °C увеличивает значение константы равнове-
сия примерно в 3,2 раза). При отклонении не более чем на 10—15% уточ-
няют значение степени конверсии.
В реакторе второй ступени реагирует 126,5 м3/ч бензола,
расходуется 3-126,5=379,5 м3/ч водорода и образуется
126,5 м3/ч циклогексана; остается 5031,8—379,5= 4652,3 м3/ч
водорода.
Количество циклогексана на выходе из реактора второй
ступени:
1847,4+126,5=1973,9 м3/ч.
Количество газовой смеси на выходе из реактора второй
ступени (поток 6):
1973,9 +4652,3+4652,2+1,3=11 279,7 м3/ч.
Потери циклогексана с продувочными и танковыми газами
составляют 0,2% или 1860,9-0,002=3,7 м3/ч; возвращается в
реактор первой ступени (см. состав потока 4) 113,0 м3/ч цикло-
гексана.
Количество циклогексана, конденсирующегося в сепара-
торе С1:
1973,9—3,7—113,0=1857,2 м3/ч или 6964,2 кг/ч.
Растворимость компонентов газа в циклогексане при темпера-
туре 35 °C и давлении 10s Па: Н2 — 0,120 м3/т, N2—-0,250 м3/т.
В циклогексане при давлении 17,0-105 Па растворяется:
водорода: 0,120-17,0-6,964=14,2 м3/ч или 1,3 кг/ч;
азота: 0,250-17,0-6,964=29,6 м3/ч или 37,0 кг/ч.
212
Всего из сепаратора С1 выходит жидкой фазы (поток 9):
1857,2+14,2+ 29,6+1,3=1902,3 м®/ч или 7008,3 кг/ч.
Рассчитывают состав газовой смеси после сепаратора С1
(поток 7):
Vt, М3/Ч %
С6н12 1973,9—1857,2=116,7 1,24
Н2 4652,3—14,2=4638,1 49,46
N2 4652,2—29,6= 4622,6 49,30
2 9377,4 100,00
По составу потока 7 рассчитывают состав продувочных га
зов (поток 8):
СеНц
Н2
n2
VT, м’/ч
3,7
3,7-49,46/1,24=147,6
3,7-49,30/1,24=147,1
2
298,4
Определяют состав циркуляционного газа (поток 3):
V., м’/ч
свн12 113,0
н2 n2 4638,1—147,6=4490,5 4622,6—147,1=4475,5
2 9079,0
Расход свежей азотоводородной смеси должен компенсиро-
вать затраты водорода на реакцию гидрирования, потери азото-
водородной смеси при продувке и на растворение в циклогек-
сане.
Состав свежей азотоводородной смеси (поток 2):
Vt, м’/ч
Н2 5582,7+147,6+14,2=5744,5
N2 29,6+147,1 = 176,7
2
5921,2 м3/ч
Продувочные газы охлаждаются в холодильнике-конденса-
торе ХК2 при температуре 10 °C. Парциальное давление паров
циклогексана при этой температуре равно 6,33-103 Па (см.
Приложения, табл. 10), объемная доля циклогексана в газе
после холодильника-конденсатора составляет:
[6,33 • 103/ (17,0 • 105) ] 100=0,37 % -
213
Количество водорода и азота в продувочных газах:
298,4—3,7 =294,7 м3/ч.
Количество циклогексана в продувочных газах после холодиль-
ника-конденсатора ХК2 и сепаратора С2:
294,7-0,37/(100,00—0,37) = 1,1 мэ/ч или 4,2 кг/ч.
Количество циклогексана, поступающего из сепаратора С2 в
сборник Е1 (поток 10):
3,7—1,1 =2,6 м3/ч или 9,8 кг/ч.
Сбрасывают на факел газа (из сепаратора С2):
294,7+1,1=295,8 м3/ч.
Растворенные в циклогексане азот и водород отделяются при
дросселировании газа до давления 2,0- 105Па. Образуются тан-
ковые газы, объемная доля циклогексана в которых составляет:
[20,4 • 103/ (2,0 • 105) ] • 100= 10,20%.
Количество циклогексана в танковых газах рассчитывают так
же, как его количество в продувочных газах:
(14,2+29,6)-10,20/(100,00—10,20) =5,0 м3/ч или 18,8 кг/ч,
где 14,2 и 29,6 — количество водорода и азота, растворенных в циклогек-
сане, м3/ч.
Количество танковых газов (поток 11):
14,2+29,6+5,0=48,8 м3/ч.
Общие потери циклогексана составляют 6978,2-0,002=14 кг/ч,
потери с продувочными газами — 4,2 кг/ч, следовательно, с
газами дросселирования после их охлаждения в холодильнике-
конденсаторе ХКЗ теряется:
14,0—4,2=9,8 кг/ч или 2,6 м3/ч.
Возвращается в сборник Е1 (поток 12):
18,8—9,8=9,0 кг/ч или 5,0—2,6=2,4 м3/ч.
Сбрасывают в атмосферу после холодильника-конденсатора
ХКЗ:
48,8—2,4=46,4 мэ/ч.
Сбрасывают газа на факел:
295,8+46,4=342,2 м3/ч.
Составляют материальный баланс получения циклогексана
(табл. 44).
214
Таблица 44. Материальный баланс процесса получения циклогексана
Входит м3/ч кг/ч Выходит мЗ/Ч кг/ч
Бензол техниче- ский: бензол толуол метилцикло- гексан метилцикло- пентан н-гептан 1860,9 0,5 0,4 0,3 0,1 6479,80 1,95 1,95 1,3 0,6 Циклогексан тех- нический: циклогексан толуол метилцикло- гекс ан метнлцикло- пентан н-гептан 1857,2 0,5 0,4 0,3 0,1 6964,2 1,95 1,95 1,3 0,6
Итог о... 1862,2 6485,6 Ит ого... 1858,5 6970,0
Азотоводородная смесь: азот водород 176,7 5744,5 220,9 512,9 Продувочные газы: азот водород циклогексан 147,1 147,6 1,1 183,9 13,2 4,2
Итог о... 5921,2 6485,6 Итог о... 295,8 201,3
Циркуляционный газ: азот водород циклогексан 4475,5 4490,5 113,0 5594,4 400,9 423,8 Танковые газы: азот водород циклогексан 29,6 14,2 2,6 37,0 1,3 9,8
Итог о... 9079,0 6419,1 Итог о... Циркуляционный газ: азот водород циклогексан 46,4 48,1
В с е г о... 16 862,4 13 638,5 4475,5 4490,5 113,0 5594,4 400,9 423,8
Итог о... 9079,0 6419,1
В с е г о... 11 279,7 13 638,5
Расчет основных расходных коэффициентов. Расходные ко-
эффициенты рассчитывают по данным табл. 44.
Расходные коэффициенты:
по техническому бензолу: 6485,6/6964,2=0,931 кг/кг;
по азотоводородной смеси: 5921,2/6,9642=850 м3/т,
215
ТЕХНОЛОГИЧЕСКИЙ РАСЧЕТ РЕАКТОРА ПЕРВОЙ СТУПЕНИ
Назначение, устройство и основные размеры.
Определение числа реакторов
Реактор первой ступени предназначен для гидрирования бензо-
ла на стационарном никельхромовом катализаторе и является
основным в системе двух последовательно соединенных реакто-
ров. Реактор представляет собой стальной сварной вертикаль-
ный цилиндрический сосуд с приваренными сферическими дни-
щем и крышкой. В трубное пространство загружают около 40%
от общего объема катализатора, что обеспечивает степень кон-
версии бензола 90—95% • Тепло, выделяющееся в результате
реакции, отводят кипящим в межтрубном пространстве реакто-
ра при давлении 0,6 МПа водным конденсатом.
Техническая характеристика реактора первой ступени:
Диаметр обечайки внутрен- 1800 Рабочее давление, МПа:
ний, мм Толщина обечайки, мм 18 в трубном простран- стве 1,6—2,3
Высота аппарата, мм Число труб (йтр=38ХЗмм) Длина трубы, мм 9030 1010 6500 в межтрубном про- странстве Рабочая температура, °C: До 0,8
Площадь поверхности теп- лопередачи (теплообмена), м2 720 в трубном прост- ранстве (максималь- ная) 240
Объем катализатора в трубах, м3 2,5 в межтрубном про- странстве До 170
Реактор снабжен штуцерами входа и выхода продукта
Dy 200, ру 4,0, входа конденсата Dy 200, ру 1,6, выхода парово-
дяной смеси Dy 250, ру 1,6.
Характеристика катализатора:
Размер таблеток:
d, мм
h, мм
Насыпная плотность рн,
кг/м3
4—6
4—6
1100—1300
Общий объем катализатора, загружаемого в систему:
14=2,5/0,4=6,2 м3.
Принимают объемную скорость в расчете на жидкий бензол
Vo6—0,8 ч-1 (плотность бензола рб=880 кг/м3), тогда объем
катализатора, обеспечивающий заданную производительность,
составит:
14'= (6485,6/880)/0,8=9,2 м3,
где 6485,6 — расход технического бензола, кг/ч.
216
Определяют число систем реакторов для обеспечения задан-
ной производительности:
л=9,2/6,2=1,48
Необходимо установить две системы реакторов, каждая из
которых включает два последовательно соединенных реактора:
первый по ходу сырья трубчатый (VK=2,5 м3), второй — колон-
ный (VK=3,7 м3). Запас производительности по катализатору:
(6,2-2—9,2) -100/9,2=35%.
Последующие расчеты ведут на один трубчатый реактор.
Тепловой расчет
Исходные данные:
состав потоков 4 и 5 см. Материальный расчет-,
температура, °C: на входе в реактор — 135; на выходе из реак-
тора — 180;
давление насыщенного водяного пара 0,6 МПа.
Цель расчета — определение тепловой нагрузки реактора и
расхода теплоносителя (парового конденсата) в межтрубное
пространство.
Уравнение теплового баланса реактора в общем виде:
Ф1 + ®2= ®з+ Ф1+ Фпот,
где Фь Ф3 — тепловые потоки газовой смеси на входе в реактор и выходе
из него, кВт; Ф2— теплота экзотермической реакции, кВт; Ф4— теплота, от-
водимая конденсатом, кВт; ФПОт — теплопотери в окружающую среду, кВт.
Определяют значения Ф1 и Ф2, предварительно рассчитывая
средние объемные теплоемкости газовой смеси на входе в реак-
тор (/=135 °C) и выходе (/=180 °C) из него (табл. 45).
Таблица 45. Расчет средних объемных теплоемкостей газовой смеси
Компонент 7=135+273=408 К 7=180+273=453 К
Ч>(, % С,, Дж/ /(моль-К) С1ф,/(22,4 100), кДж/(м3-К) Фр % Ct, Дж/ /(моль К) £„,,,/(22,4-100). кДж/(м3-К)
Свн6* 11,04 113,88 0,5613 125,30 0,0615
с6н12 0,67 154,30 0,0462 15,84 172,33 1,2187
н2 60,70 28,91 0,7834 43,16 29,00 0,5588
N2 27,59 29,62 0,3649 39,90 29,81 0,5310
2 100,00 1,7558 100,0 — 2,3700
* С учетом примесей.
15—69
217
Тепловой поток газовой смеси на входе в реактор:
Ф1= [ 16862,4/(2-3600)] -1,7558-135=555,13 кВт.
Определяют теплоту реакции гидрирования бензола:
А/7°298= SA/7°298(koh)— 2Л//°298(исх)=-123,14—82,93=
=—206,07 кДж/моль;
qp=206,07 кДж/моль.
Определяют количество теплоты, выделяющейся за счет эк-
зотермической реакции:
Ф2= [(6927,7—423,8)/(2-3600-84)] -206,07-103=2215,28 кВт,
где 6927,7 и 423,8 — количество циклогексана на выходе и входе, кг/ч.
Рассчитывают тепловой поток газовой смеси на выходе из
реактора:
Фз= [11 659,2/(2-3600)] -2,3700-180=690,81 кВт.
Принимают, что теплопотери в окружающую среду состав-
ляют 5% от общего прихода теплоты:
фпот= (555,13+ 2215,28) -0,05=138,52 кВт.
Теплоту, отводимую кипящим конденсатом, находят из общего
уравнения теплового баланса:
Ф4=555,13+2215,28—690,81—138,52 = 1941,08 кВт.
Составляют тепловой баланс реактора первой ступени
(табл. 46).
Принимают, что к. п. д. процесса теплообмена равен 0,9,
и определяют количество образующегося вторичного водяного
пара в межтрубном пространстве реактора первой ступени:
тп= 1941,08-0,9/2095,0=0,834 кг/с,
где 2095,0 — удельная теплота парообразования при давлении 0,6 МПа и
температуре 158 °C, кДж/кг (см. Приложения, табл. 14).
Таблица 46. Тепловой баланс реактора первой ступени
Приход кВт % Расход кВт %
Тепловой поток газо вой смеси 555,13 20,0 Тепловой поток газо- вой смеси 690,81 24,9
Теплота экзотермиче ской реакции 2215,28 80,0 Теплота, отводимая кипящим конденсатом Теплопотери в окру- жающую среду 1941,08 138,52 70,1 5,0
В с е г о... 2770,41 100,0 В с е г о... 2770,41 100,0
218
Таким образом, следует подать на испарение 3002 кг/ч кон-
денсата.
Расчет реактора первой ступени
Цель расчета — выполнение поверочного расчета площади по-
верхности теплопередачи реактора.
Площадь поверхности теплопередачи определяют по форму-
ле (62):
Fa = Фа/(кЛ7'ср).
Тепловая нагрузка аппарата определена в тепловом расчете:
Фа=1 941 080 Вт.
Средняя разность температур между газовой смесью и паровым
конденсатом:
Д/ср= 180—158=22 °C; АТС₽=22 К.
Коэффициент теплопередачи определяют по формуле (63):
к= (l/ai+ 2 Гст+Цаг)-1,
где «| — средний коэффициент теплоотдачи от газовой смеси к стенке трубы,
Вт/(м2-К); «2 — коэффициент теплоотдачи от стенки трубы к кипящему
конденсату, Вт/(м2-К).
Средний коэффициент теплоотдачи от газовой смеси к стен-
ке трубы определяют по формуле (64):
ai = NuXСМ/d.
Рассчитывают теплофизические параметры газовой смеси
при температуре 180°C (453 К):
плотность газовой смеси при давлении 101 325 Па и темпе-
ратуре 0 °C (см. состав потока 5):
pocM=mt/VT= 13 638,4/11 659,2= 1,17 кг/м3;
плотность газовой смеси при температуре 453 К и давлении
1,9 МПа:
Рсм= 1,17 [(273-1,9- 10в)/(453-101 325)] = 13,22 кг/м3;
средняя удельная теплоемкость газовой смеси:
ссм=2370/1,17=2026 Дж/(кг-К),
где 2370 — средняя объемная теплоемкость газовой смеси при температуре
180 °C (см. табл. 45), Дж/(м3-К).
Динамическую вязкость газовой смеси определяют по фор-
муле (66). Значения динамической вязкости компонентов газо-
вой смеси см. Приложения, табл. 11, состав смеси см. табл. 45.
15'
219
Расчет динамической вязкости газовой смеси:
свн6
Ф«, %
Mr
фЖ/ЮО
цг-107, Па-с
(фЖ/100щ)-10-7, (Па-с)-1
1.Ю
78
0,858
116
0,00740
С6Н1а На Na 2
15,84 43,16 39,90 100,00
84 2 28 —
13,306 0,863 11,172 26,199
105 ну 238 __
0,12672 0,00738 0,04694 0,18844
Рс«= (26,199/0,18844) -10-7= 139-10-7 Па-с.
Принимают значение критерия Прандтля для двухатомных
газов Рг==0,72 [10, с. 150], тогда теплопроводноеть смеси
равна:
Хсм=СсмНсм/Рг=2026-139-10-7/0,72=39,11 -10“3 Вт/ (м - К).
Объемный расход газовой смеси при температуре 453 К и дав-
лении 1,9 МПа:
Уг= [11 659,2/(2-3600)] [453-101 325/(273-190 000)] =0,146 мэ/с.
Площадь сечения трубного пространства реактора:
STP=0,785d2n=0,785 0,0322 • 1010=0,812 м2,
где d — внутренний диаметр трубы, м; п — число труб.
Фиктивная скорость газовой смеси в сечении трубного прост-
ранства реактора:
wo=Vr/STP=0,146/0,812=0,18 м/с.
Критерий Рейнольдса при движении газа в трубном простран-
стве через неподвижный слой катализатора [15, с. 135]:
Ке=гг>(Арсм/|лСМ
Диаметр нешарообразных частиц d4 принимают равным ди-
аметру шара, площадь поверхности которого равна площади
поверхности частицы цилиндрической формы (d'=4 мм; h—
= 6 мм):
F4=nd'(h+d'/2) =3,14-0,004(0,006 +0,004/2) =0,0001 м.
Диаметр частицы:
d4=y77n=yo,0001/3,14=0,0056 м.
Критерий Рейнольдса:
Re=0,18 • 0,0056 • 13,22/ (139 • 10-7) = 958.
Критерий Нуссельта рассчитывают по формуле [14, уравнение
(VI.35)]:
Nu=0,813Re°-®/eM4/‘i=0,813-958®-e/2,726-0-<W5e/(,-032=137,
где d— диаметр трубы, м.
220
Рис. 14. Графическое определение <р
Средний коэффициент тепло-
отдачи от газовой смеси к стен-
ке трубы;
«Xi = 137 • 39,11 • 10-3/0,032=167 Вт/ (м2- К)
Коэффициент теплоотдачи от
стенки трубы к кипящему кон-
денсату определяют по формуле,
полученной на базе уравнения
[10, (4.65)]:
a2=6,83-ep°'4(p0’7,
где е — коэффициент, учитывающий физические свойства жидкости, для ки-
пящей воды е=1 [10, с. 163]; р — давление в системе, МПа; <р — поверхност-
ная плотность теплового потока, Вт/м2.
«2=6,83 • 1 • 0,6°-4 • <р0,7=5,57<р°-7.
Сумма термических сопротивлений стенки с учетом слоев за-
грязнений с обеих сторон:
2гст=Г1+/-2+/-з=1/11 600+0,003/17,5+1/5800=0,00043 м2-К/Вт,
где 11 600 и 5800 — теплопроводность загрязнений стенок со стороны органи-
ческих паров и водяного пара соответственно, Вт/(м2-К) [10, табл. XXXI];
0,003 — толщина стенки трубы, м; 17,5 — теплопроводность нержавеющей
стали, Вт/(м-К) [Ю, табл. XXVIII].
Коэффициент теплопередачи:
к=[ 1/167+0,00043+1/(5,57<р»-7) ]-* = (0,0064+0,1795-<р-°'7)-*.
Определяют поверхностную плотность теплового потока
(<р=Фа/^) из уравнения
<р=кД7’ср=22/(0,0064 + 0,1795<р-°-7);
откуда 0,0064<р+0,1795<р°-3—22=0.
Полученное уравнение решают графически (рис. 14). Задаваясь
значениями поверхностной плотности теплового потока от 2500
до 3500 Вт/м2, строят график функции y—f(q>) (при <pi =
= 2500 Вт/м2 yi=—3,4; при <р2 = 3500 Вт/м2 у2 = 3,5) и опреде-
ляют значение <р, при котором у—0: <р=3000 Вт/м2.
Коэффициент теплопередачи:
к=<р/Д7’ср=3000/22=136 Вт/(м2-К).
Необходимая площадь поверхности теплопередачи:
Га=1 941 080/(136-22) =649 м2.
Запас площади поверхности теплопередачи:
(720—649) • 100/649= 11%.
221
СИНТЕЗЫ НА ОСНОВЕ ОКСИДА УГЛЕРОДА
В настоящее время мировое производство кислородсодержащих
органических соединений на основе оксида углерода возросло
до 25—30 млн. т в год. Особое место среди этих соединений
занимает метанол, являющийся сырьем многоцелевого назначе-
ния, и уксусная кислота, используемая для получения эфиров
целлюлозы, пластических масс, инсектицидов, фотокиномате-
риалов и т. д.
Использование оксида углерода для получения различных
веществ расширяется в связи с развитием нового перспектив-
ного направления в органическом синтезе, названного «Химия
Сгмолекул», а также применением угля в качестве альтерна-
тивного сырья взамен природного газа и нефти.
ПОЛУЧЕНИЕ МЕТАНОЛА
НА НИЗКОТЕМПЕРАТУРНОМ КАТАЛИЗАТОРЕ
Процесс получения метанола по выбранной для расчета наибо-
лее современной энергосберегающей технологии можно разде-
лить на два самостоятельных процесса: 1) конверсия природ-
ного газа (с предварительной сероочисткой) в синтез-газ;
2) синтез метанола-сырца (с последующей ректификацией).
Конверсию природного газа осуществляют в трубчатой печи
на никелевом катализаторе по реакции
СН4+Н2О СО+ЗН2, —ДЯ°298=—206,13 кДж/моль.
В природный газ на входе в узел сероочистки дозируют
смесь продувочных и танковых газов (эту смесь называют «про-
дувочные газы») из отделения синтеза метанола в таком коли-
честве, чтобы объемная доля водорода в газе, поступающем на
сероочистку, составляла 7—8%.
Процесс ведут под давлением 2—3 МПа, при температуре
820—860 °C и объемном отношении водяной пар : природный газ,
равном (2,5—3,5): 1. В этих условиях степень конверсии метана
составляет 80—90% • Описание технологической схемы см.
[7, с. 330].
Синтез метанола осуществляют в адиабатическом реакторе
со сплошным слоем медьсодержащего катализатора по реакции
СО2+ЗН2 =₽ СНзОН+Н2О, —ДЯ°298=49,3 кДж/моль.
Процесс ведут под давлением 5—10 МПа, при максимально
допустимой температуре 290 °C, объемной скорости 7000—
10 000 ч-1 и молярном отношении Н2:СО=(5—7): 1. В этих
условиях степень конверсии синтез-газа составляет 4—5%, се-
лективность— 83—87%. Описание технологической схемы см.
[3, с. 307].
222
МАТЕРИАЛЬНЫЙ РАСЧЕТ СТАДИИ КОНВЕРСИИ ПРИРОДНОГО ГАЗА
Исходные данные:
годовая производительность агрегата по метанолу-ректификату
750 000 т;
годовой фонд рабочего времени 7 200 ч;
расход природного газа 925 м3 на 1 т метанола-ректификата;
давление процесса конверсии 2,0 МПа;
температура на выходе из зоны катализа 860°C;
объемное отношение водяной пар: природный газ 2,83:1;
степень конверсии метана (уточняется расчетом) 0,83.
состав природного газа (<р(, %):СН4— 97,9; С2Н6— 0,6; СзН8 —
0,2; С4Н10 — 0,1; N2 — 0,8; СО2 — 0,4.
состав продувочных газов (<рг, %): СН4— 14,36; СН3ОН — 0,45;
Н2 — 79,70; N2—1,60; СО —1,45; СО2 — 2,41; Н2О — 0,03;
объемная доля водорода в газе, поступающем на сероочистку,
7,5%.
Последовательность расчета:
а) рассчитывают объемный расход компонентов парогазовой смеси на
входе в трубчатую печь (основной аппарат стадии);
б) определяют изменение состава газа после конверсии гомологов метана;
в) рассчитывают состав газа после прохождения реакций конверсии ме-
тана и оксида углерода.
Часовая производительность агрегата по метанолу-ректифи-
кату:
750 000/7200=104,167 т/ч.
Расходуется природного газа:
104,167-925 = 96 354 м3/ч.
Рассчитывают состав природного газа:
СН4 СаНв CgHg QHio Na СОа
% 97,9 0,6 0,2 0,1 0,8 0,4 100,0
Vr, м3/ч 94 331 578 193 96 771 385 96354
Расходуется водяного пара:
96 354-2,83= =272 682 м3/ч.
Определяют объемный расход продувочных газов Vx, для чего
составляют уравнение:
КО,797/(96 354+ К) =»0,075,
где 0,797 и 0,075 — объемная доля водорода в продувочных газах и в газе,
поступающем на сероочистку, соответственно. К=10 010 м3/ч. Рассчитывают состав продувочных газов: СН4 СН3ОН Н2 Na СО СОа Н2О X
<щ, % 14,36 0,45 79,70 1,60 1,45 2,41 0,03 100,00
К, м3/ч 1438 45 7978 160 145 241 3 10010
223
Суммируя составы природного газа, продувочных газов и
водяного пара, определяют состав парогазовой смеси на входе
в трубчатую печь (изменением состава смеси в процессе серо-
очистки пренебрегают):
фр %. VT, мЗ/ч фр % Vv м3/
сн4 25,27 95769 н2 2,10 7 978
с2н6 0,15 578 N, 0,25 931
С3Н8 0,05 193 СО 0,04 145
с4н10 0,03 96 со2 0,16 626
СНзОН 0,01 45 н2о 71,94 272 685
2 100,00 379046
В трубчатой печи протекают реакции
СНа+НзО СО+ЗН2, 1
СО+НзО ♦= СО2+Н2, 2
С2Нв+Н2 —> 2СН4, 3
С3Н8+2Н2 —> ЗСН4, 4
С4Н10+ЗН2 —> 4СН4. 5
По реакциям 3—5:
расходуется водорода: 578+193-2+96-3 = 1252 м3/ч;
образуется метана: 578-2 + 193-3 +96-4 = 2119 м3/ч.
Общее количество метана (образующегося и поступающего
с парогазовой смесью) равно: 95769+2119=97 888 м3/ч.
При степени конверсии метана 0,83 по реакции 1 реагирует
метана: 97 888-0,83=81247 м3/ч (столько же расходуется во-
дяного пара и образуется оксида углерода). Образуется водо-
рода:
81247-3=243 741 м3/ч.
Рассчитывают состав парогазовой смеси после прохождения
реакций 1, 3—5:
Vt, м’/ч фр %
СН4 97 888—81 247=16 641 3,07
СНзОН 45 0,01
н2 7978—1252 +243 741 =250 467 46,25
n2 931 0,17
со 145+81247=81 392 15,03
со» 626 0,12
Н2О 272 685—81 247=191 438 35,35
2 541 540 100,00
224
Для уточнения степени конверсии метана рассчитывают
константу равновесия Кр реакции 1.
Определяют парциальные давления (в МПа) компонентов
смеси по формуле (11):
Рсн4 = 0,0614; рн2о=0,7070; рСо=0,3006; рН2=0,9250.
Константа равновесия Кр реакции 1 составит:
Кр= [рсор3н2/(рсн4рн2о)] -100= [0,3006-0,92503/(0,0614-0,7070)] -100=548,
где 100 — коэффициент (учитывает различие в единицах измерения давле-
ния; в справочниках приведены значения КР, рассчитанные через парциаль-
ные давления, выраженные в атмосферах).
Параллельно с основной эндотермической реакцией I (конверсии метана)
протекает экзотермическая реакция 2 (конверсии оксида углерода). Про-
текание реакции 2 (по экспериментальным данным) повышает температуру
в зоне катализа на 40—50°C (Л/ уточняется в тепловом расчете). Реакция 2
протекает с заметной скоростью после накопления определенного количества
оксида углерода, образовавшегося по реакции 1; затем обе реакции идут
параллельно.
С достаточной точностью отношение продуктов конверсии метана по
реакции 1 определяется константой равновесия этой реакции при темпера-
туре в зоне катализа
—Д//2,
где /кон — температура парогазовой смеси на выходе из зоны катализа, °C;
Д/ — повышение температуры в зоне катализа за счет экзотермической реак-
ции 2.
После окончания реакции 1 продолжается реакция 2, которая завер-
шает суммарный процесс конверсии природного газа и определяет состав
парогазовой смеси на выходе из трубчатой печи.
Справочное значение константы равновесия Кр при темпе-
ратуре 860—45/2=838 °C составляет 550,87 (см. Приложения,
табл. 1). Рассчитанное значение константы равновесия доста-
точно близко к справочному (погрешность 0,5%), следователь-
но, степень конверсии метана 0,83 принята верно.
Если рассчитанное значение константы равновесия значительно отлича-
ется от справочного, то для упрощения расчета изменяют значение темпера-
туры в зоне катализа (в пределах 820—860 °C). При незначительном откло-
нении рассчитанного значения константы равновесия от справочного (3—5%)
уточняют степень конверсии метана.
Для реакции 2 при 860 °C константа равновесия Ас=0,8626
(см. Приложения, табл. 1).
Для определения состава газа на выходе из трубчатой печи
принимают, что по реакции 2 прореагировало х м3/ч оксида
углерода. Тогда в момент равновесия в парогазовой смеси со-
держится (в м3/ч):
оксида углерода: 81 392—х;
водяного пара: 191 438—х;
диоксида углерода: 626+х;
225
водорода: 250 467+х.
= [СО2] [Н2] (626 + х) (250467 + х)
с [СО] [Н2О] (81 392 —х) (191 438 —х) ’
0,1374х2+486 436х—13 283 828 273=0;
v _ —243218± Д/243 2182 + 0,1374 • 13 283 828 273
112 '---------------0/1374----------------------
—243218 + 246 942
0,1374
—243218 + 246 942 .
х. =------------------= 27 103 м3/ч
1 0,1374
Второе значение х2 недействительно.
Рассчитывают состав конвертированного газа на выходе из
трубчатой печи:
Vx, м’/ч <₽,. %
Сухой газ:
СН4 16 641 4,41
СН3ОН 45 0,01
н2 250 467+27103=277 570 73,59
n2 931 0,25
СО 81 392—27 103=54 289 14,39
со2 626+27 103 = 27 729 7,35
Ито го... 377 205 100,00
Водяной пар 191 438—27 103=164 335 —
Всего... 541540
На 100 м3 поступающего на конверсию природного газа об-
разуется 100-377 205/96 354 = 391,5 м3 конвертированного газа.
Функционал составит:
= [Н2]-[СО2] = 277 570 - 27 729 _
' [СО] + [СО2] 27 729 + 54 289 ’ ’
что соответствует оптимальному технологическому режиму.
Составляют материальный баланс трубчатой печи (табл. 47).
технологический расчет трубчатой печи
Назначение, устройство и основные размеры.
Определение числа реакторов
Трубчатая печь предназначена для конверсии природного газа
водяным паром с целью получения синтез-газа. Многорядная
трубчатая печь состоит из топочной (радиантной) камеры и
блока использования тепла дымовых газов (конвективной ка-
меры) со встроенным вспомогательным котлом. В радиантной
226
Таблица 47. Материальный баланс трубчатой печи
Входит мз/ч 4>i. % Выходит мЗ/ч <Р{- %
Газовая смесь: Конвертированный
СН4 95769 90,04 газ:
с2н6 578 0,54 сн4 16 641 4,41
СзН₽ 193 0,18 СНзОН 45 0,01
С4Ню 96 0,09 Н2 277 570 73,59
СНзОН 45 0,04 N2 931 0,25
н2 7 978 7,50 со 54 289 14,39
N2 931 0,88 со2 27 729 7,35
со 145 0,14
со2 626 0,59
Итог о... 106361 100,00 Итог о... 377 205 100,00
Водяной пар 272 685 — Водяной пар 164335 —
В с е г о... 379 046 — В с е г о... 541 540 —
камере размещены реакционные трубы, образующие трубные
экраны. Трубы заполнены катализатором и соединены с коллек-
торами входа парогазовой смеси и выхода конвертированного
газа. Для обеспечения протекания эндотермической реакции
конверсии метана сжигают топливный газ, подаваемый в па-
нельные горелки.
Техническая характеристика реакционных труб:
Число труб (dTp=138X
Х16 мм)
Число рядов
Число труб в ряду
810 Высота трубы, мм
Длина обогреваемой части
18 трубы, мм
45 Объем катализатора в тру-
бах, м3
16 000
14 000
100
Трубы изготовлены из стали 20Х25Н20С2 (ГОСТ 5632—72).
Для принятой конструкции трубчатой печи объемная ско-
рость природного газа составляет 1100 ч-1, парогазовой смеси —
4500 ч-1.
В печь подают 96 354 м3/ч природного газа (см. Исходные
данные), следовательно, необходимый объем катализатора со-
ставит:
VK=96 354/1100=87,6 м3.
По данным табл. 47, расход парогазовой смеси равен
227
379046 м3/ч, следовательно, требуемый объем катализатора
Vk=379 046/4500=84,2 м3.
Необходимо установить печей:
«=87,6/100=0,876.
Устанавливают одну печь, запас производительности по ка-
тализатору составит:
(100—87,6) 100/87,6= 14%.
Тепловой расчет
Исходные данные:
в трубчатую печь подают: 10 631/3600=29,545 м3/с газовой
смеси; 272 685/3600=75,746 м3/с водяного пара;
из трубчатой печи выходит: 377 205/3600=104,779 м3/с конвер-
тированного газа; 164 335/3600=45,649 м3/с водяного пара;
состав материальных потоков см. в табл. 47;
состав топливного газа (<рг, %): СН4— 18,520; С2Н6— 0,051;
С3Н8 —0,003; С4Н10 —0,004; СН3ОН — 0,430; N2 — 1,610; Н2 —
75,620; СО — 1,380; СО2 — 2,352; Н2О — 0,030;
температура, °C: парогазовой смеси на входе в печь — 520;
конвертированного газа на выходе из печи — 860; воздуха (ко-
эффициент избытка 1,1; относительная влажность 80%)—20;
воздушно-топливной смеси на входе в печь — 90; продуктов сго-
рания топливного газа — 1000;
Цель расчета — определение расхода топливного газа на
сжигание в горелках трубчатой печи и уточнение темпера-
турного режима печи.
Уравнение теплового баланса печи в общем виде:
Ф] + Фй+ Фз+ Ф4-!- Фб= Фб+ ф?+ Фз + Фпот,
где Фь Ф2, Ф4, Ф? и Фе—тепловые потоки парогазовой смеси, поступающей
на конверсию; топливного газа, поступающего на сжигание; воздуха, посту-
пающего в топку; конвертированного газа и продуктов сгорания соответст-
венно, кВт; Фз, Ф6 и Фз — теплоты сгорания топливного газа, экзо- н эндо-
термических реакций соответственно, кВт, ФПОт — теплопотери в окружающую
среду, кВт.
Для определения значений Фь Ф2, Ф3 используют данные
табл. 47 и данные о составе топливного газа. Рассчитывают
значения средних объемных теплоемкостей газовой смеси (7'=
= 520 + 273=793 К), топливного газа (7=90+273=363 К).
Значения молярных теплоемкостей компонентов при соответст-
вующей температуре рассчитывают, используя справочные дан-
ные (см. Приложения, табл. 2, 3).
228
Расчет средних теплоемкостей:
Ч>,. % С(1 Дж/(моль-К) СгЧ.(/(22Л 100), кДж/(ма К)
Газовая смесь:
СН4 90,04 62,57 2,5151
С2Н6 0,54 108,23 0,0261
С3Н8 0,18 157,01 0,0126
С4Ню 0,09 200,69 0,0081
СН3ОН 0,04 79,18 0,0140
Н2 7,50 29,95 0,1003
n2 0,88 31,27 0,0123
со 0,14 31,59 0,0020
со2 0,59 49,95 0,0132
2 100,00 — 2,6911
Топливный газ:
СН4 18,520 39,12 0,3234
СаН6 0,051 61,69 0,0014
С3Н8 0,003 87,55 0,0012
C4Hio 0,004 116,21 0,0002
СНзОН 0,430 49,38 0,0095
н2 75,620 28,84 1,9727
n2 1,610 29,43 0,0211
со 1,380 29,55 0,0182
со2 2,352 40,94 0,0430
н2о 0,030 34,14 0,0004
2 100,000 —. 1,3911
Теплоемкость водяного пара при 520 °C равна 1,7209 кДж/
/(м3-К).
Рассчитывают тепловые потоки парогазовой смеси, поступа-
ющей на сжигание, и топливного газа:
Ф1 = (29,545 • 2,6911 + 75,746 • 1,7209) • 520= 109 126 кВт;
Ф2=Гг-1,3911-90=125Гг кВт.
Находят по справочнику значения энтальпий сгорания ком-
понентов топливного газа (см. Приложения, табл. 2, 3) и рас-
считывают его энтальпию сгорания:
<₽р % —ДН°яь кДж/моль —д^жфДггл-юо), МДж/м'
Топливный газ:
сн4 18,520 890,31 7,361
С2н6 0,051 1559,88 0,036
C3H3 0,003 2220,03 0,003
С4Ню 0,004 2877,13 0,005
СНзОН 0,430 764,17 0,147
Н2 75,620 285,83 9,649
со 1,380 282,98 0,174
n2, со2, Н2О 3,992 — —
2 100,000 — 17,375
229
Рассчитывают теплоту сгорания топливного газа:
Фз= 14-17,375-1000= 17 375-Уг кВт,
где Vr — расход топливного газа, м3/с; 1000 — коэффициент перевода МДж
в кДж.
Находят по справочнику значения энтальпий образования
веществ (см. Приложения, табл. 2, 3) и рассчитывают теплоты
экзотермических реакций 2—5 (в кДж/моль):
Реакция
СО+Н2О (г) ч±СО2+ Н2
С2Не+Н2->-2СН4
С3Н8+2Н2->ЗСН4
C4Hio+3H2-+4CH4
ХДН‘,2д8(кон) ^-Д^°298(исх)
(—393,51)— (—110,53)—(—242,81) =—41,17
2(—74,85)—(84,67) =—65,03
3 (—74,85)—(—103,85) =—120,70
4 (—74,85)—(—126,15) =—173,25
Рассчитывают теплоту экзотермических реакций:
ф6= [ (7,703—0,174) • 41,17+0,161 - 65,03 +0,054 • 120,70+
+0,027-173,25] -1000/22,4=14 805 кВт.
Определяют теплоту эндотермической реакции 1 Д//°298 и
теплоту Ф6 по формуле (49):
ДТД298=—!! о,53— (—74,85) — (—241,81 )= 206,13 кДж/моль;
Ф6= [81 247/(3600)] [206,13-1000/22,4] =207 682 кВт.
Рассчитывают среднюю объемную теплоемкость конвертиро-
ванного газа (состав см. в табл. 47) при температуре Т—860+
+ 273=1113 К:
фь %
С,, Дж/(моль-К)
С, <₽,/(22,4 -100),
кДж/(м3-К)
сн4
4,41
76,54
0,1506
СНзОН
0,01
94,62
0,0004
со
Н2
73,59
31,01
1,0189 0,0037 0,2121
Na
0,25 14,39
32,72 33,01
со2
7,35
53,71
0,1762
100,00
1,5619
Объемная теплоемкость водяного пара равна 42,16/22,4=
= 1,8821 кДж/(м3-К).
Определяют тепловой поток конвертированного газа:
Ф7 = (104,779 • 1,5619+45,649 • 1,8821)860=214 629 кВт.
Рассчитывают расход кислорода на сжигание топливного
газа и количество продуктов сгорания (диоксида углерода и
водяных паров). Расчет ведут на 100 м3 поступающего топлив-
ного газа (состав газа см. Исходные данные) по реакциям
СН4+2О2 —* СО2+2Н2О, 6
С2Н8+3,5О2 —* 2СО2+ЗН2О, 7
СзНв+5О2 —► ЗСО2+4Н2О, 8
С4Ню+6,5О2 —> 4СО2+5Н2О, 9
230
СН3ОН+1,5О2 —> СО2+2Н2О, СО + 0,5О2 —* СОг, Н2+0,5О2 —> Н2О. 10 11 12 Hi2o- м3
фр % Реакция vo2- “3 Vrri , м3 СО 2.
сн4 18,520 6 18.520-2 18,520-1 18,520-2
с2н6 0,051 7 0,051-3,5 0,051-2 0,051-3
с3н8 0,003 8 0,003-5 0,003-3 0,003-4
С4Ню 0,004 9 0,004-6,5 0,004-4 0,004-5
СНзОН 0,430 10 0,430-1,5 0,430-1 0,430-2
со 1,380 11 1.380-0,5 1,380-1 .—
Н2 75,620 12 75,62-0,5 — 75,620-1
2 98,360 — 76,405 20,457 113,705
Расход кислорода на сжигание 100 м3 топливного газа с
учетом коэффициента избытка воздуха:
Го, =1,1-76,405 t= 84,046 м8.
Расход воздуха:
Ув=84,046 •100/21 =400,219 м8,
где 21 —объемная доля кислорода в воздухе, %.
Расход азота (поступает с воздухом): 400,219—84,046=
= 316,173 м3.
При температуре воздуха 20 °C и относительной влажности
80% его влагосодержание равно 11,94-10-3 кг/кг [9, Приложе-
ние XIX] или:
11,94-10-3-29/18= 19,24-10-3 м3 Н2О на 1 м3 сухого воздуха,
где 29 и 18 — молярные массы воздуха и воды, г/моль.
Объем водяных паров, поступающих с воздухом:
19,24-10~3-400,219=7,700 м3
В продуктах сгорания содержится:
диоксида углерода с учетом его количества в топливном га-
зе: Vco2 = 20,457 + 2,352 = 22,809 м3;
водяных паров с учетом их количества в воздухе и топлив-
ном газе: Рн2о= 113,705+7,700+0,030= 121,435 м3;
азота с учетом его количества в топливном газе: Vn2 =
=316,173+1,610=317,783 м3;
кислорода: +о2 =84,046—76,405=7,641 м3.
Рассчитывают состав продуктов сгорания, полученных при
сжигании 100 м3 топливного газа:
N2 О, со2 нао 2
V, м3 317,783 7,641 22,809 121,435 469,668
4>г, % 67,65 1,63 4,86 25,86 100,00
231
Для определения теплового потока продуктов сгорания Фе
рассчитывают значение средней объемной теплоемкости смеси
продуктов сгорания при температуре Т= 1000+273= 1 273 К:
с= (55,12-4,86+43,65-25,86 +35,55-1,63 +33,32-67,65)/(22,4-100) =
= 1,656 кДж/(м3-К).
Тепловой поток продуктов сгорания:
Ф8= (469,668/100) Рг-1,656-1000=7778 Рг кВт.
Тепловой поток поступающего воздуха определяют, учиты-
вая, что на 100 м3 топливного газа поступает 400,219 м3 сухого
воздуха, в котором содержится 84,046 м3 кислорода и 316,173 м3
азота и 7,700 м3 водяных паров (рассчитано ранее). Значения
теплоемкостей компонентов рассчитывают при температуре Т—
=90+273=363 К-
Ф4= [(84,046-29,83+316,173-29,43+7,700-34,14)/(22,4-100)] Рг90=
=485 Рг кВт
Общий приход теплоты в печь составит:
Фприх — 109 126+125Рг+17 375Рг+485Рг+14805=
= 123 931+ 17 985 Рг кВт.
Принимают, что теплопотери составляют 5% от общего прихода
теплоты:
Фпот=0,05(123 931 + 17 985Рг) =6197+899Рг кВт.
Общий расход теплоты составит:
ФРасх=207 682+214 629+7778Рг+6197+899Рг=428 508+8677Рг кВт.
Расход топливного газа определяют из уравнения теплового
баланса печи:
123 931 +17 985Рг=428 508+8677Рг;
Рг= (428 508—123 931)/(17 985—8677) =32,722 м3/с;
Рг=32,722-3600=117799 м3/ч.
Уточняют значения тепловых потоков:
Ф2= 125-32,722=4090 кВт;
Ф3= 17 375 • 32,722=568 545 кВт;
Ф4=485 • 32,722= 15 870 кВт;
Ф8=7778-32,722=254512 кВт;
ФИО1=6197+899-32,722=35 613 кВт.
Составляют тепловой баланс трубчатой печи (табл. 48).
Расход влажного воздуха в горелки печи:
(400,219+7,700) 32,722/100= 133,48 м«/с
или 133,48-3600=480 526 м3/ч.
232
Таблица 48 Тепловой баланс трубчатой печи
Приход кВт % Расход кВт %
Тепловой поток паро 109 126 15,3 Теплота эндотермиче- 207 682 29,2
газовой смеси Тепловой поток топ 4090 0,6 ской реакции Тепловой поток про 254 512 35,7
дивного газа Теплота сгорания топ- 568 545 79,8 дуктов сгорания Тепловой поток кон- 214 629 30,1
дивного газа Тепловой поток воз 15 870 2,2 вертированного газа Теплопотери в окру- 35 613 5,0
духа Теплота экзотерми- ческих реакций 14 805 2,1 жающую среду
В с е г о... 712 436 100,0 Всего 712 436 100,0
Количество продуктов сгорания топливного газа:
469,668 32,722/100=153,69 мэ/с
или 153,69-3600=553 267 м3/ч
В материальном расчете принято, что в результате экзотер-
мической реакции 2 температура в зоне катализа повышается
на 45 °C. Поэтому температура конвертированного газа после
протекания реакций 1,3—5 равна 860—45=815°С.
Уточняют температурный режим трубчатой печи.
Теплота экзотермической реакции 2:
[ (7,703—0,174) /22,4] 41,17 • 1000 = 13 838 кВт,
где 41,17 — теплота реакции 2, кДж/моль.
Приход теплоты без учета теплоты реакции 2:
712 436—13 838=698 598 кВт.
Тепловой поток конвертированного газа находят из уравне-
ния теплового баланса (без уточнения значения теплопотерь и
пересчета значения Уг):
Ф?7— Флрих—(Фб+ Фз+ Флот) =698 598—
—(207 682+ 254 512 +35 613) =200 791 кВт.
Температуру конвертированного газа (tx, °C) после прохожде-
ния реакций 1, 3—5 определяют из уравнения
/х=Фт7(^С),
где V — количество конвертированного гача иа выходе из печи, м3/с;
с — средняя объемная теплоемкость конвертированного газа, кДж/(м3-К)
Для определения значений средней молярной теплоемкости
конвертированного газа после прохождения реакций 1, 3—5
используют рассчитанные ранее (при нахождении значения Ф?)
233
значения молярных теплоемкостей компонентов при температу-
ре 860 °C, так как значительного их изменения в принятом ин-
тервале температур (40—45 °C) не происходит. Состав газа см.
на с. 224.
Сш= Sc,«р,/100= 2,350+14,342+4,963 +0,064+0,056 + 0,009+
+ 14,904=36,688 Дж/(моль-К);
с=36,688/22,4= 1,6379 кДж/(м3-К);
Ф7'= 150,428-1,6379Д=246,379^=200 791 кВт;
Д=200 791/246,379=815 °C.
Температурный режим печи определен верно, так как полу-
ченное значение температуры конвертированного газа совпада-
ет с принятым ранее.
Расчет элементов трубчатой печи
Для принятой конструкции трубчатой печи допускается поверх-
ностная плотность теплового потока (в расчете на внутренний
диаметр трубы) до 100 кВт/м2. По данным табл. 48, тепловой
поток, проходящий через поверхность стенок труб, составляет:
Ф=207 682+214 629—109 126—14 805=298 380 кВт.
Площадь поверхности обогреваемой части реакционных труб
при внутреннем диаметре 0,106 м, длине обогреваемой части
14 м и числе труб 810 равна:
5=3,14-0,106-14-810=3774 м2.
Поверхностная плотность теплового потока:
ф= 0/5=289 380/3774=79 кВт/м2,
что в пределах допустимых значений.
Для определения скорости парогазовой смеси в слое ката-
лизатора находят площадь сечения трубного пространства:
F=0,785-0,1062-810=7,14 м2.
Объемный расход парогазовой смеси на выходе из трубчатой
печи (см. табл. 47) при температуре 7=860+273= 1133 К и
давлении р=2 МПа составит:
VT=(541 540/3600) [1133-101 325/(273-2-106)] =31,63 м3/с.
Скорость парогазовой смеси в трубном пространстве при пороз-
ности слоя катализатора ео=0,4:
фиктивная: w0= К//7=31,63/7,14=4,23 м/с;
истинная: w=ay0/e0—4,23/0,4= 10,6 м/с.
Более полный расчет трубчатой печи см. на с. 51, а также
[19, с. 153].
234
МАТЕРИАЛЬНЫЙ РАСЧЕТ СТАДИИ СИНТЕЗА МЕТАНОЛА
Исходные данные:
часовая производительность агрегата по метанолу-ректификату
104,167 т/ч;
массовая доля метанола в метаноле-ректификате 99,95%;
состав газовой смеси на входе в реактор синтеза (<р„ %):
СН4—12,12; СНзОН —0,39; Н2 —80,37; N2 —0,72; СО —3,53;
СО2 — 2,85; Н2О — 0,02;
объемный расход конвертированного газа и его состав см. в
табл. 47;
температура, °C: синтеза — 250; конденсации — 40;
давление конденсации 7,5 МПа;
количество образующихся побочных продуктов, кг на 1 т мета-
нола-ректификата: диметилового эфира — 8; спиртов Сз — 6;
спиртов С4 — 21.
Последовательность расчета:
а) рассчитывают объемный расход и состав газовой смеси иа входе в
реактор синтеза метанола;
б) определяют изменение состава газовой смеси в процессе синтеза;
в) вычисляют количество сконденсировавшегося метанола и растворен-
ных в нем газов, количество и состав газовой смеси после сепарации;
г) определяют состав газовой смеси после циркуляционного компрес-
сора и состав свежего газа, сравнивая его с составом газа после трубчатой
печи (см. табл. 47);
д) определяют состав продукционного метанола-сырца.
Схему материальных потоков стадии синтеза метанола см. на рис. 15.
Рис. 15. Схема потоков стадии синтеза метанола:
1 — синтез-газ, 2 — циркуляционный газ; 3, 6. 7 — газовая смесь; 4 — основной поток; 5 —
байпасный газ, 8—продувочные газы, 9, 12—метанол-сырец; 10 — танковые газы, 11 —
возвратный метанол,
РТ1 — реактор, АТ!—АТЗ — теплообменники; ХК1, ХК2 — холодильники-конденсаторы;
С1 — сепаратор, Е!—сборник метанола-сырца
235
Объемная доля метанола в циркуляционном газе определя-
ется условиями конденсации и рассчитывается по формуле
[12, с. 44]:
1g фснзон=6,542—1874,1/7"— 1g ро,
где ро — общее давление в системе; р0=7,5 МПа.
1g Фснзон=6,542—1874,1/313— 1g 7,5=—0,320=1,680;
фснзон=0,48 % •
Объемный расход циркуляционного газа Уцг находят из ус-
ловия сохранения количества метанола при смешении свежего
Усв и циркуляционного газов
Уцг-0,0048+45= (Уцг+377 205) -0,0039,
где 0,0048 и 0,0039 — объемные доли метанола в циркуляционном газе и
газе, подаваемом в реактор синтеза; 377 205 и 45 — объемные расходы све-
жего газа и метанола в нем, м3/ч (см. табл. 47).
Уцг= 1584 555 м3/ч.
Объемный расход газовой смеси на входе в реактор VBx-
Vbx= Vcb+ Уцг= 1 584 555 +377 205= 1 961 760 м3/ч.
Определяют состав газовой смеси на входе в реактор синтеза
(поток 3):
СН4 СНзОН Н2 N2 СО СО 2 н2о X
фг, % 12,12 0,39 80,37 0,72 3,53 2,85 0,02 100,00
Ут, м3/ч 237765 7651 1576667 14 125 69 250 55910 392 1 961760
Функционал составит:
_ [Н2] — [СО2] 1576 667 — 55 910 _ )2
[СО] + [СО2] ₽ 69 250 + 55 910 ~ ’
что соответствует оптимальному технологическому режиму.
В реакторе необходимо получить 100%-го метанола:
104 167-0,9995 = 104 115 кг/ч,
с учетом 0,8% потерь с продувочными и танковыми газами:
104 115-1,008=104 948 кг/ч или 73 464 м3/ч.
По реакции
СО2+ЗНг =>= СНзОН+Н2О 13
расходуется:
диоксида углерода: 73 464 м3/ч;
водорода: 73 464-3=220 392 м3/ч.
образуется водяного пара: 73 464 м3/ч.
236
По реакции
2СО+4Н2 & (СН3)2О+Н2О 14
образуется диметилового эфира: 8-104,167=833 кг/ч или
406 м3/ч;
расходуется:
оксида углерода: 406-2=812 м3/ч;
водорода: 406-4=1624 м®/ч;
образуется водяного пара: 406 м3/ч.
По реакции
ЗСО+6Н2 = С3Н7ОН+2Н2О 15
образуется спиртов Сз: 6-104,167= 625 кг/ч или 233 м3/ч;
расходуется:
оксида углерода: 3-233=699 м3/ч;
водорода: 6-233=1398 м3/ч.
образуется водяного пара: 2-233=466 м3/ч.
По реакции
4СО+8Н2 =* С4Н9ОН+ЗН2О 16
образуется спиртов С4: 21-104,167=2188 кг/ч или 662 м3/ч;
расходуется:
оксида углерода: 4-662= 2648 м3/ч;
водорода: 8-662 =5296 м3/ч;
образуется водяного пара: 3-622=1986 м3/ч.
Количество оксида углерода в газе после прохождения ре-
акций 13—16: 69 250—812—699—2 648=65091 м3/ч.
По реакции
СО+ЗН2 =* СН4+Н2О 17
реагирует 0,6% оксида углерода (по экспериментальным дан-
ным), что составляет: 65091-0,006=390 м3/ч;
расходуется водорода: 3-390=1170 м3/ч;
образуется метана и водяного пара: по 390 м3/ч каждого.
Количество оксида углерода после прохождения реакций
13—17: 65091—390=64 071 м3/ч.
По реакции 2 реагирует 75% оксида углерода, что состав-
ляет: 64 071-0,75=48 053 м3/ч;
расходуется водяного пара: 48053 м3/ч;
образуется диоксида углерода и водорода: по 48 053 м3/ч каж-
дого.
237
Рассчитывают состав газовой смеси на выходе из реактора
синтеза (поток 6):
мЗ/ч ф,-. %
СН4 237 765+390=238 155 13,19
СНзОН 7651+73 464=81 115 4,49
(СН3)2О 406 0,02
СзН7ОН 233 0,01
С4Н9ОН 662 0,04
н2 1 576 667—220 322—1624—1398—5296—1170+ 77,25
+48 053=1 394 840
Н2 14 125 0,78
со 69 250—812—669—2648—390—48 053= 16 648 0,92
со2 55 910—73 464+48 053 = 30 499 1,69
Н2О 392 + 73 464+ 406+ 466+1986+390—48 053=29 051 1,61
1805734 100,00
Функционал составит:
[Н2] — [СО2] 1 394 840 — 30 499
f~ [СО] + [СО2] “ 16 648 + 30 499
что соответствует оптимальному технологическому режиму.
Соотношение продуктов синтеза на выходе из реактора оп-
ределяется константой равновесия реакции 2 при температуре
250 °C:
Кс= (30 499-1 394 840)/(16 648-29 051) =88.
Справочное значение /Сс=90,7 (см. Приложения, табл. 1), сле-
довательно, доля конвертированного оксида углерода (75%)
принята верно.
Если рассчитанное значение константы равновесия значительно отлича-
ется от справочного, то для упрощения расчета изменяют значение темпера-
туры в зоне катализа (в пределах 240—290 °C) При незначительном откло-
нении расчетного значения константы равновесия от справочного (до 5%)
уточняют долю конвертируемого оксида углерода.
Определяют количество метанола, конденсирующегося в се-
параторе, и количество растворенных в метаноле газов. Расчет
ведут методом последовательных приближений.
На первом этапе расчета принимают, что газы в метаноле-
сырце не растворяются, а органические примеси и вода полно-
стью переходят в метанол-сырец. Количество несконденсировав-
шихся газов равно:
1 805 734—81 115—406—233—662—29 051 = 1 694 267 м3/ч.
Так как объемная доля метанола в газовой фазе равна
0,48% (рассчитана ранее) и воды — 0,025%, то количество
газообразного метанола составит: 1694267-0,480/(100,000—
—0,505)-=8174 м3/ч;
238
водяного пара: 1694 267-0,025/(100,000—0,505)=426 м3/ч;
где 0,505 — суммарная объемная доля метанола и воды, %.
Конденсируется:
метанола: 81 115—8174=72 941 м3/ч (104 201 кг/ч);
воды 29 051—426= 28 625 м3/ч.
Общее количество несконденсировавшихся газов:
1 694 267 +8174+426 = 1 702867 м3/ч.
Определяют парциальные давления (в Па) растворяющихся в
жидком метаноле газов по формуле (11):
Рсн4 = 10,5-105; Рн2 = 61,4-10®; Pt<2 = 0,6-10®;
Рсо ~ °>7-105; рсо2 == КЗ-10®.
Растворимость компонентов газа в метаноле при давлении
105 Па и температуре 30—40°С составляет (в м3/т): СН4—
0,375; Н2 —0,096; N2 —0,233; СО — 0,259; СО2 — 2,8 [11, с. 201].
Определяют (см. Пример 3) количество растворенных компонен-
тов газа в метаноле-сырце (в м3/ч):
метана: 0,375-10,5-104,201=410;
водорода: 0,096-61,4-104,201 =614;
азота: 0,233-0,6-104,201 = 15;
оксида углерода: 0,259-0,7-104,201 = 19;
диоксида углерода: 2,8 • 1,3 • 104,201 =379.
Остается в газообразном состоянии (в м3/ч):
метана: 238 155—410=237 745;
водорода: 1 394 840—614=1 394 226;
азота: 14 125—15=14 110;
оксида углерода: 16 648—19=16 629;
диоксида углерода: 30 499—379=30 120.
Всего: 1 692 830 м3/ч.
Кроме того, в составе газа содержится:
метанола 1 692 830-0,48/(100,00—0,505) =8167 м3/ч;
водяного пара. 1692830-0,025/(100,00—0,505)=425 м3/ч.
Конденсируется:
метанола: 81 115—8167=72 948 м3/ч или 104 211 кг/ч;
воды: 29 051—425=28 626 м3/ч или 23 003 кг/ч.
Общее количество несконденсировавшихся газов:
1 692 830+8167+425 = 1 701 422 м3/ч.
На втором этапе уточняют значения парциальных давлений
газов, растворенных в жидком метаноле. Расчет подтверждает,
что парциальные давления практически не изменились.
239
При увеличении количества жидкого метанола на 104 211—
—104201 — 10 кг/ч количество диоксида углерода (обладающе-
го максимальной растворимостью) в метаноле-сырце возрастает
всего на 2,8-1,3-0,010=0,03 м3/ч, поэтому изменением количе-
ства растворенных газов пренебрегают.
Рассчитывают состав метанола-сырца (поток 9):
М1 w кг/км ОЛЬ мЗ/ч । <Pf % тх, кг/ч Wf %
сн4 16 410 0,39 293 0,22
СНзОН 32 72 948 69,93 104 211 78,95
(СНз)зО 46 406 0,39 833 0,63
Спирты Сз 60 233 0,22 625 0,47
Спирты С4 74 662 0,63 2188 1,66
н2 2 614 0,59 55 0,04
Ng 28 15 0,01 19 0,01
со 28 19 0,02 24 0,02
со2 44 379 0,36 745 0,57
Н2О 18 28 626 27,46 23 003 17,43
2 — 104 312 100,00 131 996 100,00
Рассчитывают состав газовой смеси (поток 7): после сепаратора
сн4 СН3ОН н2 n2 со СО2 н2о г
Vx, м3/ч 237 745 8167 1 394 226 14 110 16 629 30 120 425 1 701422
<р„ % 13,97 0,48 81,94 0,83 0,98 1,77 0,03 100,00
Расход циркуляционного газа составляет Рцг= 1 584 555 м3/ч
(рассчитано ранее), следовательно, расход продувочных газов
равен:
Рпр=1 701 422—1 584 555 = 116 867 м3/ч.
Рассчитывают состав продувочных газов по компонентам
(поток 8):
сн4 СНзОН н2 n2 СО соа Н2О X
Vx, м3/ч 16 326 561 95761 970 1145 2069 35 116 867
<р„ % 13,97 0,48 81,94 0,83 0,98 1,77 0.03 100,00
Состав циркуляционного газа (поток 2) определяют по раз-
ности составов потоков 7 и 8:
VT, м3/ч Ч>,-. %
СН4 237 745—16 326= 221 419 13,97
СН3ОН 8 167—561=7 606 0,48
н2 1 394 226—95 761 = 1 298 465 81,94
n2 14 110—970=13 140 0,83
со 16 699—1 145=15 484 0,98
со2 30 129—2 069=28 051 1,77
Н2О 425—35=390 0,03
2 1 584 555 100,00
240
Определяют расход и состав свежего газа, который должен
компенсировать затраты на реакцию синтеза метанола и побоч-
ные реакции, потери при продувке и растворении в жидком ме-
таноле (поток 1):
vt, м8/ч %. %
сн4 410+16 326—390=16 346 4,33
СНзОН 45* 0,01
Н2 220 392+1 624+1 398+5 296+1170+614+ 4-95 761—48 053=278 202 73,76
N2 15+970=985 0,26
со 812 + 699+2 648+390+ 48 053 +19+1145=53 766 14,25
со2 73 464+ 379+ 2 069—48 053=27 859 7,39
Н2О 48 053 +28 626+35—73 464—406—466—1 986— —390=2 —
377 205 100,00
* Задано в Исходных данных.
Для проверки результатов расчета состав свежего газа может быть
определен по разности составов потоков 3 и 2.
Полученный состав свежего газа практически совпадает с составом га-
зовой смесн, выходящей из трубчатой печи стадии конверсии природного
газа (см табл 47), следовательно, взятые для расчета исходные данные
соответствуют нормальному технологическому режиму стадии синтеза.
Определяют состав продукционного метанола-сырца. Потери
метанола с продувочными и танковыми газами составляют
(см. с. 236): 104948—104115=833 кг/ч.
С продувочными газами теряется 561 м3/ч или 801 кг/ч;
с танковыми газами — 833—801=32 кг/ч или 22 м3/ч.
Остается в сборнике жидкого метанола: 104 211—32=
= 104 179 кг/ч. Дополнительно поступает со свежим газом ме-
танола: 104 179—104 115=64 кг/ч или 45 м3/ч.
Кроме метанола, в танковые газы переходит:
75% растворенного диоксида углерода, что составляет
379-0,75=284 м3/ч или 558 кг/ч;
100% растворенных в метаноле-сырце газов (метан, водород,
оксид углерода, азот);
50% диметилового эфира, что составляет 203 м3/ч или
416 кг/ч.
Объемная доля водяных паров в танковых газах равна
0,03% (см. состав потока 8).
Количество сухого газа: 22 + 284+410+614+19+15+203=
= 1567 м3/ч.
Общее количество танковых газов с учетом водяного пара:
1567-100,00/(100,00—0,03) = 1567,5 м3/ч.
Количество водяного пара: 1567,5—1567,0=0,5 м3/ч или
16—69
241
0,4 кг/ч. Рассчитывают состав танковых газов (поток 10):
СН4 СН3ОН (CHS)2O Н2 N2 СО СО2 Н2О 2
Vt, м3/ч 410,0 22,0 203,0 614,0 15,0 19,0 284,0 0,5 1567,5
% 26,16 1,40 12,95 39,17 0,96 1,21 18,12 0,03 100,00
Количество танковых газов соответствует оптимальному тех-
нологическому режиму.
Танковые и продувочные газы смешивают, охлаждают захо-
ложенной водой (или жидким аммиаком), сконденсировавшийся
метанол возвращают в сборник. Степень конденсации метанола
из смеси газов равна 75%, следовательно, возвращается в сбор-
ник 833-0,75=625 кг/ч метанола (поток 11). Растворимостью
газов пренебрегают. Всего поступает в сборник жидкого мета-
нола:
104 211—32 +625=104 804 кг/ч.
Следовательно, избыток метанола составляет:
104 804—104 115 =689 кг/ч или 689-100/104 804=0,66%
и представляет собой безвозвратные потери на стадии ректифи-
кации метанола-сырца.
Состав продукционного метанола-сырца (поток 12) рассчи-
тывают на основе данных о составе потоков 9, 10 и 11:
СН3ОН (СНз)2О Спирты Сз Спирты Са СО2 Н2О 2
тт, кг/ч 104 804,0 416,5 625,0 2188,0 187,0 23002,6 131223,1
w, % 79,86 0,32 0,48 1,67 0,14 17,53 100,0
Массовая доля воды в метаноле-сырце соответствует опти-
мальному технологическому режиму [12, с. 97].
Составляют материальный баланс стадии синтеза метанола
(табл. 49).
Расчет основных расходных коэффициентов. Для получения
104,167 т/ч метанола-ректификата затрачивают 925 м3/т при-
родного газа (см. с. 223) и 117 799 м3/ч топливного газа (см.
с. 232). Объемная доля природного газа в составе топливного
равна 20%, следовательно, расход природного газа на сжигание
составляет:
117 799 • 0,2/104,167=226 м3/т.
Общий расход природного газа на 1 т метанола-ректификата
(расходный коэффициент):
925 + 226=1151 м3,
что соответствует показателям эксплуатации промышленных
агрегатов синтеза метанола [12, с. 115].
242
Таблица 49. Материальный баланс синтеза метанола
Входит кг/ч М«/Ч Выходит кг/ч м*/ч
Свежий газ: СН4 СН3ОН Н2 n2 СО со2 Н2О 11 676,0 64,0 24 840,0 1231,2 67 207,5 54 723,0 1,6 16 346,0 45,0 278 202,0 985,0 53766,0 27 859,0 2,0 Продукцион- ный метанол- сырец: СНзОН (СН3)2О с3н7он СзН9ОН со2 Н2О 104 804,0 416,5 625,0 2188,0 187,0 23 002,6 73363,0 203,0 233,0 662.0 95,0 28 625,5
Итог о... 159 743,3 377 205,0 Итог о... 131 223,1 103 181,5
Циркуля- ционный газ: СН4 СН3ОН н2 n2 СО со2 н2о 158 156,4 10 865,7 115 934,4 16 425,0 19 355,0 55 100,2 313,4 221 419,0 7606,0 1 298 465,0 13 140,0 15 484,0 28 051,0 390,0 Циркуляци- онный газ: СН„ СН3ОН н2 n2 СО СО, н2о 158 156,4 10 865,7 115 934,4 16 425,0 19355,0 55 100,2 313,4 221419,0 7 606,0 1 298 465,0 13 140,0 15 484,0 28 051,0 390,0
Итог о... Продувоч- ные и тан- ковые газы: СН„ СНзОН (СН3)2О н2 n2 со со2 н2о 376 150,1 11 954,0 208,0 416,5 8605,0 1231,2 1455,0 4622,0 28,5 1584 555,0 16 736,0 146,0 203,0 96 375,0 985,0 1164,0 2353,0 35,5
Итог о... 376 150,1 1584 555,0
Итог о... 28520,2 117 997,5
В с е г о... 535 893,4 1 961 760,0 В с е г о... 535 893,4 1805 734,0
ТЕХНОЛОГИЧЕСКИЙ РАСЧЕТ РЕАКТОРА СИНТЕЗА МЕТАНОЛА
Назначение, устройство и основные размеры.
Определение числа реакторов
Реактор предназначен для получения газообразного метано-
ла из синтез-газа, поступающего со стадии конверсии природ-
ного газа.
16*
243
Для расчета выбран вертикальный цилиндрический стальной
аппарат шахтного типа, в котором на фарфоровые шары уло-
жен в четыре слоя катализатор в виде гранул размером
5x5 мм.
Температурный режим реактора поддерживают подачей хо-
лодного (байпасного) газа между слоями катализатора.
Техническая характеристика реактора:
Диаметр внутренний, мм 4 400
Высота общая, мм 17 500
Объем катализатора, м3 141
Производительность 1 м3 катализатора СНМ-3 по метанолу-
сырцу составляет 12—13 т/сут. Производительность реактора
131,223 т/ч (см. табл. 49), следовательно, суточная производи-
тельность равна 131,223-24=3150 т, а необходимый объем ка-
тализатора для обеспечения заданной производительности VK=
=3150/12=262,5 м3.
Необходимое число реакторов «=262,5/141 = 1,86.
Следовательно, требуется установить два реактора. Запас
производительности по катализатору: [(141-2—262,5)/262,5] •
•100=7,4%.
Дальнейшие расчеты выполняют на один реактор.
Тепловой расчет
Исходные данные:
количество газовой смеси на входе в реактор синтеза (поток 3) —
1 961 760/(2-3600) =272,467 м3/с, на выходе из реактора синте-
за (поток 6)— 1 805734/(2-3600) =250,797 м3/с;
состав материальных потоков 3 и 6 см. Материальный расчету
температура, °C: газовой смеси на входе в реактор — 210; га^
зовой смеси на выходе из реактора — 250; холодной (байпас-
ной) газовой смеси — 45.
Цель расчета — определение расхода холодного (байпасно-
го) газа (поток 5), который необходимо ввести в реактор на
второй, третий и четвертый слои для обеспечения теплового ре-
жима аппарата.
Максимальный расход холодного (байпасного) газа состав-
ляет до 60% от поступающего в реактор газа [12, с. 114].
Уравнение теплового баланса реактора в общем виде:
Ф1 + Фг“ Фз+ Фпот,
где Ф] и Фз — тепловые потоки газовой смеси на входе в реактор и выходе
из него соответственно, кВт; Ф2 — теплота экзотермических реакций, кВт;
Фпот — теплопотери в окружающую среду, кВт.
Рассчитывают (табл. 50) значения средних объемных тепло-
емкостей газовой смеси при 7’1=45+273=318 К, 7’2=210+
244
Таблица 50. Расчет теплоемкости газовой смеси
Компонент % -’л С., Дж/(моль-К) С;ф,7(22,4-100), кДж/(м3-К) £ о £ О о л 3 ¥ о Фр % С., Дж/(моль-К) o' 0 л 4 si
поток 4, 7=483 К поток 5, 7=318 К поток 6, 7=523 К
СН4 СНзОН (СНз)2О С8Н7ОН с4н9он н2 n2 со со2 н2о 12,12 0,39 80,37 0,72 3,53 2,85 0,02 46,31 58,85 29,06 29,94 30,19 44,85 35,31 0,2506 0,0102 1,0427 0,0096 0,0476 0,0571 0,0003 1,4181 36,30 45,59 28,81 29,24 29,26 38,56 33,73 0.1964 0,0079 1,0337 0,0094 0,0461 0,0491 0,0003 1,3429 13,19 4,49 0,02 0,01 0,04 77,25 0,78 0,92 1,69 1,61 100,00 48,60 61,81 96,30 131.30 166,69 29,16 30,11 30,38 45,75 35,72 0,2862 0,1239 0,0009 0.0006 0,0030 1,0056 0,0105 0,0125 0,0345 0,0257 1,5007
2 100,00
+273=483 К, 7з=250+273=523 К. Значения молярных тепло-
емкостей находят по справочнику (см. Приложения, табл. 2, 3);
составы газа см. Материальный расчет.
Определяют тепловые потоки Ф] и Фз:
Ф1 = (272,467— V*) • 1,4181 • 210 + Vx1,3429 45=
=81 141—297,801+60,431 К=81 141—237,37К кВт;
Фз=250,797-1,5007-250=94 093 кВт,
где Vx — количество холодного (байпасного) газа, мэ/с.
Находят по справочнику (см. Приложения, табл. 2, 3) зна-
чения энтальпий образования соединений ДЯ°298 и рассчитыва-
ют теплоты реакций 2, 6—10 (в кДж/моль):
Реакция
СО+ Н2О(г) = СО2+ Н2
СО2+ЗН^СНз—ОН(Г> + Н2О<Г>
2СО+4Н2=^(СНз)2О+Н2О(г)
ЗСО+ 6Н2^С8Н7ОН(Г)+2Н2О(Г)
4СО+8Н2^С4Н9ОН(Г)+ЗН2О(г)
СО+ЗН25РьСН4+Н2О(г>
Д^°2В8— 2Д/^°298(кон)—‘2АН°298(исх)
(—393,51)—(—ПО,53)—(—241,81) =
=—41,17
(—241,81)+ (—201,00)—(393,51) =
=—49,30
(—241,81) + (—184,05)—
—2(—110,53)=—204,80
2 (—241,81) + (—257,53)—
—3(—110,53)=—409,65
3(—241,81) + (—274,43) —
—4(—110,53)=—557,74
(—74,85) + (—241,81)—(—110,53) =
=—206,13
245
Таблица 51. Тепловой баланс реактора синтеза метанола
Приход кВт % Расход кВт %
Тепловой поток газо- вой смеси 58 386 60,2 Тепловой поток газо- вой смеси 94093 97,0
Теплота экзотермиче- ских реакций 38 618 39,8 Теплопотери в окру- жающую среду 2911 з.о
В с е г о... 97 004 100,0 В с е г о... 97 004 100,0
Рассчитывают теплоту экзотермических реакций Ф2 по фор-
муле (49), используя данные о количестве продуктов, образую-
щихся по реакциям 2, 6—10 (см. Материальный расчет)-.
Ф2= 1 000 [ (48 053 - 41,17 +73 464 • 49,30+406 204,80+233 • 409,65+
+662-557,74+390-206,13)/(2-3600)]/22,4 =38 618 кВт.
Принимают, что теплопотери в окружающую среду состав-
ляют 3% от общего прихода теплоты:
Фпот=0,03(81 141—237,3714+38 618) =3593—7,1214 кВт.
Объемный расход холодного (байпасного) газа находят из
уравнения теплового баланса реактора:
81 141—237,37 Vx+38 618 = 94 093+3593—7,12 Vx;
Vx=95,865 м3/с или 345 114 м3/ч,
что составляет 100-95,865/272,467=35,2% от общего объемного
расхода газа и соответствует оптимальному технологическому
режиму.
Объемный расход основного потока: 980 880—345114=
= 635766 м3/ч.
Уточняют статьи теплового баланса:
®i=81 141-237,37-95,865 =58 386 кВт;
Фпот=3593—7,12-95,865=2911 кВт.
Составляют тепловой баланс реактора синтеза метанола
(табл. 51).
Аналогично выполняют подробный тепловой расчет реактора для опре-
деления доли байпасного газа, подаваемого в газовую смесь после прохож-
дения каждого из четырех слоев катализатора. Температуру на входе в
каждый слой принимают равной 210 °C. В первом слое катализатора обра-
зуется 65—70% метанола, 100% диметилового эфира и спиртов Сз, 50%
спиртов С«; во втором слое — около 15% метанола, 50% спиртов С«; 100%
метана; в третьем и четвертом слоях—10% и 5% метанола соответственно.
Расход оксида углерода при его конверсии водяным паром рассчиты-
вают по уравнению реакции 2. Объемный расход подаваемого между слоя-
ми холодного (байпасного) газа находят из уравнения теплового баланса
смешения:
РгСг1г+ Ув.тСб.г1б.с= ( Vr+ V6.r) Ссыпем,
246
где Vr, Ve г —объемные расходы газа на выходе из слоя катализатора и
холодного (байпасного) газа, м3/с; сг, се г, ссм — объемные теплоемкости га-
за на выходе из слоя катализатора, байпасного газа н газа на входе в
последующий слой катализатора соответственно, кДж/(м3-К); tT, tc.T, tat —
температуры газа на выходе из слоя катализатора, байпасного газа и газа
на входе в последующий слой катализатора соответственно, °C.
Расчет реактора
Объемный расход газовой смеси на выходе из реактора (см.
состав потока 6) при температуре Т=250+ 273=523 К и дав-
лении р=8 МПа составит:
Увых=[1 805 734/(2-3600)] [523-101 325/(273-8-103)] =6,09 м3/с.
Время пребывания газовой смеси в слое катализатора (при
порозности слоя катализатора е=0,4):
фиктивное: Тф=Ук/Увых=141/6,09=23 с;
истинное: т=Тфб=23-0,4=9,2 с.
Полученное значение времени пребывания соответствует оп-
тимальному технологическому режиму.
Объемный расход газовой смеси на входе в реактор состав-
ляет УВх= 1961 760 м3/ч (рассчитано ранее), следовательно,
объемная скорость газовой смеси равна:
Уоб= Увх/Ук = 1 961 760/(2-141) =7000 ч-«,
что соответствует условиям проведения технологического про-
цесса.
Высота слоя катализатора в реакторе:
/г= !/,,/£= 141/(0,785-4,42) =9,3 м
при общей высоте реактора 17,5 м.
Расчет диаметров штуцеров для входа и выхода газов (жид-
костей) производят по формуле (61). Методику расчета тепло-
обменника-рекуператора, входящего в технологический узел
стадии синтеза, см. [11, с. 208].
ПОЛУЧЕНИЕ УКСУСНОЙ КИСЛОТЫ
Процесс получения уксусной кислоты карбонилированием ме-
танола в присутствии каталитической системы, включающей
карбонильный комплекс с промотирующими добавками, освоен
в промышленности с 1970 г. Уравнение целевой реакции:
СНз—ОН+СО —► СНз—СООН, —Д/7о298= 123,3 кДж/моль.
Процесс осуществляют при давлении 1,5—4,0 МПа и темпера-
туре 175—245 °C в присутствии значительного избытка оксида
углерода. В этих условиях селективность в расчете на метанол
247
Рис. 16. Схема потоков стадии синтеза уксусной кислоты:
1 — оксид углерода; 2— метанол, 3 — дистиллят, 4 — кубовые остатки; Б, 7, 9 — отдувоч-
ные газы; 6, 8, 10 — жидкая фаза;
РТ1 — реактор, ATI, АТ2 — подогреватели, АТЗ — холодильник-конденсатор; Cl, С2, СЗ —
сепараторы; КЛ1 — колонна отгонки легких фракций
составляет 99%, в расчете на оксид углерода — 90%. Процесс
включает следующие основные стадии: синтез уксусной кисло-
ты; улавливание легких фракций; очистку уксусной кислоты;
приготовление и регенерацию катализатора. Схема потоков
стадий синтеза и отгонки легких фракций приведена на рис. 16.
Ниже дано краткое описание процесса получения уксусной кис-
лоты.
В реактор синтеза барботажного типа РТ1, снабженный пе-
ремешивающим устройством, насосом из сборника подают ме-
танол, который предварительно нагревают водяным паром от 40
до 140—180°С в подогревателе ATI. Оксид углерода поступает
в реактор через барботажное кольцо, в результате чего обра-
зуется дисперсная фаза, способствующая быстрому растворению
газа в реакционной смеси. Время пребывания веществ в реак-
ционной зоне (0,25—0,30 ч) регулируют уровнем жидкости в
реакторе (75—80% от его вместимости), а полноту процесса
синтеза при давлении 2,8 МПа и температуре 185 °C — тщатель-
ным перемешиванием всех потоков, поступающих в реактор,
с помощью мешалки.
Реакционная жидкость (уксусная кислота и раствор катали-
затора с промотором) из реактора РТ1 поступает в сепаратор
С2, где за счет снижения давления до 62 кПа происходит час-
тичное испарение жидкости и снижение температуры до 116 °C.
Здесь же происходит отделение пара от жидкости. Жидкость,
содержащую катализатор, из нижней части сепаратора С2 воз-
вращают в реактор РТ1, а пары, выходящие из верхней части
сепаратора, поступают в колонку отгонки легких фракций КЛ1.
Эти пары содержат уксусную кислоту, метилиодид, иодоводо-
248
род, воду и незначительные количества метанола, метилацетата,
несконденсировавшихся газов.
Из верхней части колонны КЛ1 отбирают метилиодид с па-
рами воды и уксусной кислоты, конденсируют в холодильнике-
конденсаторе и разделяют в сепараторе СЗ на две фазы: тяже-
лую и легкую. Тяжелую фазу, содержащую в основном метил-
иодид, возвращают в реактор РТ1; часть легкой фазы использу-
ют в качестве флегмы для орошения колонны КЛ1, а часть воз-
вращают в реактор синтеза.
Из куба колонны КЛ1 выводят тяжелую фазу, состоящую из
метилиодида и уксусной кислоты; этот поток самотеком посту-
пает в сепаратор С2 и таким образом иодоводород и родий
возвращают в цикл.
Сырую уксусную кислоту отбирают из средней части колон-
ны легких фракций КЛ1 и направляют на стадию очистки.
Из верхней части реактора синтеза РТ1 выводят отдувочные
газы, содержащие пары метилиодида, уксусной кислоты и воды.
После охлаждения в холодильнике-конденсаторе АТЗ газовую
фазу отделяют от жидкой в сепараторе С1, после чего жидкость
возвращают в реактор синтеза, а газ направляют на очистку.
материальный расчет
Исходные данные:
годовая производительность агрегата в расчете на 100%-ю
уксусную кислоту 160 000 т;
годовой фонд рабочего времени 8450 ч;
состав материальных потоков:
технический оксид углерода — поток 1 (<р, %): Н2— 1; N2—
2,0; СО — 97,0;
метанол — поток 2 (ср, %): СН3ОН — 99,9; Н2О — 0,1;
дистиллят колонны отгонки легких фракций — поток 3
(щ, %): СН31 —48,9; СН3СООН — 22,4; СН3СООСН3 — 4,0;
Н2О — 24,7;
кубовые остатки колонны отгонки легких фракций — поток 4
(w, %); СНзСООН — 90,3; С2Н5СООН — 0,1; Н2О — 7,7;
HI — 1,9;
отдувочные газы реактора — поток 5 (<р, %): Н2 — 5,2; N2 —
4,2; СО —30,1; СО2 — 2,7; СН31 — 26,0; СН3СООН — 11,2;
СНзСООСНз— 1,1; Н2О — 19,5;
жидкая фаза из реактора — поток 6 (w, %): СН31 — 9,7;
СН3СООН — 70,0; СН3СООСН3 — 0,9; С2Н5СООН — 0,1; Н2О —
16,3; HI —3,0;
отдувочные газы сепаратора С1 — поток 7 (<р, %): Н2 — 12,0;
N2 —9,7; СО —68,8; СО2 —4,9; СН31 — 4,1; СН3СООН — 0,1;
СН3СООСН3 — 0,1; Н2О — 0,3;
249
количество пропионовой кислоты, образующейся в процессе,
1 кг на 1 т уксусной кислоты;
избыток оксида углерода от стехиометрического расхода 16,4%.
Последовательность расчета:
а) рассчитывают расход сырья и количество продуктов по реакциям
получения уксусной кислоты и побочных продуктов;
б) определяют состав материальных потоков 1—4 и состав реакционной
массы;
в) рассчитывают состав отдувочных газов реактора синтеза, газовой и
жидкой фаз сепаратора С1;
г) определяют состав жидкой фазы из реактора, газовой и жидкой фаз
сепаратора С2;
д) составляют материальный баланс реактора и стадии синтеза уксусной
кислоты.
Часовая производительность реактора по 100%-й уксусной
кислоте:
160 000-1000/8450=18935,0 кг/ч или 315,583 кмоль/ч.
В соответствии с исходными данными образуется пропионовой
кислоты: 1 • 18,9= 18,9 кг/ч или 0,255 кмоль/ч.
По реакциям
СНзОН+СО =»= СНзСООН, 1
СНзОН+2CO+2HZ =* С2Н5СООН+Н2О 2
расходуется:
метанола: 315,583+ 0,255 =315,838 кмоль/ч или 10106,8 кг/ч;
оксида углерода: 315,583 + 0,255-2=316,093 кмоль/ч или 8850,7 кг/ч;
водорода: 0,255-2=0,510 кмоль/ч или 1,0 кг/ч;
образуется водяного пара 0,255 кмоль/ч или 4,6 кг/ч.
По реакции
CO+HjO =₽* СО2+Н2 3
расходуется 1,85% от общего расхода оксида углерода, что со-
ставляет:
316,093-1,85/(100,00—1,85) =5,958 кмоль/ч или 166,8 кг/ч.
Расходуется водяного пара: 5,958 кмоль/ч или 107,2 кг/ч;
образуется:
диоксида углерода: 5,958 кмоль/ч или 262,1 кг/ч;
водорода: 5,958 кмоль/ч или 11,9 кг/ч.
Всего расходуется по реакциям 1—3
оксида углерода: 316,093+5,958=322,051 кмоль/ч или 9017,5 кг/ч;
водяного пара: 5,958—0,255 =5,703 кмоль/ч или 102,6 кг/ч;
образуется водорода: 5,958—0,510=5,448 кмоль/ч или 10,9 кг/ч.
250
Фактически подают сырья:
технического метанола: 10106,8-100,0/99,9=10116,9 кг/ч,
в том числе воды: 10 116,9—10 106,8=10,1 кг/ч;
оксида углерода:
322,051 (100+16,4)7100=374,867 кмоль/ч или 10 496,3 кг/ч,
где 16,4 — избыток оксида углерода от стехиометрического расхода, %.
Рассчитывают состав технического оксида углерода (по-
ток 1): Н2 N2 со X
(р/х,), % ит, кмоль/ч 1,0 2,0 97,0 100,0
3,865 7,729 374,867 386,461
М, г/моль 2 28 28 —
И1т, кг/ч 7,7 216,4 10496,3 10 720,4
Остается оксида углерода в реакционной массе:
374,867—322,051=52,816 кмоль/ч или 1478,8 кг/ч.
Расходуется:
дистиллята колонны отгонки легких фракций: 18935-1,8=
=34083 кг/ч;
кубовых остатков: 18935-0,0665=1259,1 кг/ч;
где 1,8 и 0,0665 — массовые отношения подаваемых на синтез продуктов
очистки уксусной кислоты и 100%-й уксусной кислоты.
Определяют расход и состав потоков 3 и 4.
Наличие метилацетата в дистилляте колонны отгонки легких фракций
объясняется тем, что, хотя на стадии синтеза он практически ие образуется,
иа последующих стадиях вследствие протекания реакций
СНзОН+СНзСООН СНзСООСНз+НгО 4
СНзСООСНз+Н! СНзСООН+СН31 Б
метилацетат накапливается в системе, так как реакция 5 протекает медлен-
нее реакции 4.
Рассчитывают состав дистиллята (поток 3):
СНа1 СНзСООН СНзСООСНз Н2О В
Wi, % 48,9 22,4 4,0 24,7 100,0
тх, кг/ч 16 666,6 7634,6 1363,3 8418,5 34 083,0
Рассчитывают состав кубовых остатков (поток 4):
СНзСООН С2Н6СООН Н2О HI X
Wi, % 90,3 0,1 7,7 1,9 100,0
тх. кг/ч 1137,0 1,3 96,9 23,9 1259,1
251
Определяют состав реакционной массы:
Н2
N2
со
со2
СН31
СНзСООН
СН3СООСН3
С2Н5СООН
Н2О
HI
ki/ч
7,7+10,9=18,6
216,4
1478,8
262,1
16 666,6
18 9о5,0 + 7634,6 + 1137,0=27 706,6
1363,3
1,3+18,9=20,2
10,1+8418,5 + 96,9—102,6= 8422,9
23,9
2 56179,4
Молярный поток отдувочных газов реактора синтеза:
52,816-89,0/30,1 = 156,167 кмоль/ч,
где 52,816 — количество оксида углерода в реакционной массе, кмоль/ч;
89 — степень отдувки оксида углерода, %; 30,1 — объемная доля оксида
углерода в отдувочных газах, %.
Состав отдувочных газов реактора (поток 5):
Ф(. % лт. кмоль/ч Mit г/моль кг/ч
н2 5,2 8,121 2 16,2
n2 4,2 6,559 28 183,6
со 30,1 47,006 28 1316,2
со2 2,7 4,216 44 185,5
СН31 26,0 40,603 142 5765,6
СНзСООН Н,2 17,491 60 1049,5
СНзСООСНз 1.1 1,718 74 127,1
НгО 19,5 30,453 18 548,1
2 100,0 156,167 — 9191,8
Определяют молярный поток отдувочных газов из сепара-
тора С1:
47,006-98,5/68,8 =67,298 кмоль/ч,
где 98,5 — степень отдувки оксида углерода, %; 68,8 — объемная доля окси-
да углерода в отдувочных газах из сепаратора С1, %.
Состав отдувочных газов сепаратора С1 (поток 7):
ф,-. % лх, кмоль/ч тт, кг/ч
Н2 12,0 8,076 16,2
n2 9,7 6,528 182,8
СО 68,8 46,301 1296,4
со2 4,9 3,298 145,1
СНз1 4,1 2,759 391,8
СНзСООН 0,1 0,067 4,0
СНзСООСНз 0,1 0,067 5,0
Н2О 0,3 0,202 3,6
S 100,0 67,298 2044,9
252
Учитывая составы потоков 5 и 7, рассчитывают состав жид-
кой фазы сепаратора С1 (поток 10), тх, кг/ч; N2 — 0,8; СО—•
19,8; СО2 — 40,4; СН31 — 5373,8; СНзСООН — 1045,5;
СН3СООСН3—122,1; Н2О — 544,5; что в сумме составляет
7146,9 кг/ч.
В реактор подают: 10 116,9 кг/ч метанола (поток 2),
10 720,4 кг/ч технического оксида углерода (поток 1),
34 083,0 кг/ч дистиллята (поток 3). Всего поступает в реактор
54 920,3 кг/ч.
Уходит из сепаратора С1: 2044,9 кг/ч отдувочного газа (по-
ток 7), 54920,3—2044,9=52 875,4 кг/ч жидкой фазы.
Время пребывания веществ в реакторе составляет 15—
18 мин, следовательно, количество жидкой фазы, отбираемой из
реактора с целью обеспечения максимальной степени конверсии
метанола (с растворенными в ней газами), составляет:
52 875,4-60/18=176 251,3 кг/ч.
Учитывая количество газов в реакционной массе и в отду-
вочных газах сепаратора С1 (поток 7), рассчитывают количе-
ство газов, растворенных в жидкой фазе, тх, кг/ч: Н2 — 2,4;
N2 — 33,6; СО — 182,4; СО2—117,0; что в сумме составляет —
335,4 кг/ч.
Отбирают из реактора жидкой фазы:
176 251,3—335,4= 175 915,9 кг/ч
Рассчитывают состав жидкой фазы из реактора (поток 6):
СН31 СНзСООН СНзСООСНз C2H5COOH Н2О HI X
Wi, % 9,7 70,0 0,9 0,1 16,3 3,0 100,0
тх, кг/ч 17063,9 123141,1 1583,2 175,9 28674,3 5277,5 175915,9
В сепаратор С2 подают также кубовые остатки (поток 4) в
количестве 1259,1 кг/ч. Жидкую фазу из реактора дросселиру-
ют и разделяют в сепараторе С2. В отдувочные газы на выходе
из сепаратора переходит 335,4 кг/ч всех растворенных газов,
23,9 кг/ч иодоводорода из кубовых остатков (см. состав потока
4), 20,2 кг/ч пропионовой кислоты (см. состав реакционной мас-
сы) , что в сумме составляет 379,5 кг/ч.
Учитывая состав реакционной массы и отдувочных газов се-
паратора С1 (поток 7), рассчитывают количество остальных
компонентов отдувочных газов (поток 9), тх, кг/ч: Н2 — 2,4;
N2 — 33,6; СО — 182,4; СО2 — 117,0; СН31 — 16 274,8;
СНзСООН —27 702,6; СН3СООСН3— 1358,3; С2Н5СООН — 20,2;
Н2О — 8419,3; HI — 23,9; что в сумме составляет 54 134,5 кг/ч.
Учитывая составы потоков 4, 6 и 9 (см. рис. 16), рассчиты-
вают состав жидкой фазы сепаратора С2 (поток 8), кг/ч:
СН31 — 789,1; СНзСООН — 96 575,5; СН3СООСН3 — 224,9;
С2Н5СООН —157,0; Н2О — 20351,9; HI — 5277,5; что в сумме
составляет 123 375,9 кг/ч.
253
Таблица 52. Материальный баланс реактора
Входит кг/ч кг/с % Выходит кг/ч кг/с %
Метанол: Отдувочные
СНзОН 10 106,8 99,9 газы:
н2о 10,1 0,1 Н2 16,2 0,19
- N2 183,6 2,12
Итог о... 10116,9 2,810 100,0 со 1316,2 15,23
со2 185,5 2,15
Технический СНз! 5765,6 66,70
оксид углеро- СНзСООН 1049,5 12,14
да: СНзСООСНз 127,1 1,47
СО 10496,3 97,91 Н2О 548,1 0,152 См.*
н2 7,7 0,07 —
n2 216,4 2,02 Итог о... 9191,8 2,553 100,00
Итог о... 10720,4 2,978 100,00 Жидкая фаза:
н2 2,4 .—-
Дистиллят: n2 33,6 0,02
СНа1 16666,6 48,90 СО 182,4 0,10
СН3СООН 7634,6 22,40 со2 117,0 0,07
СН3СООСН3 1363,3 4,00 СНз! 17 063,9 9,68
н2о 8448,5 24,70 СНзСООН 123 141,1 69,87
СНзСООСНз 1583,2 0,90
Итог о... 34 083,0 9,468 100,00 С2Н5СООН 175,9 0,10
н2о 28 674,3 16,27
Жидкая фаза Н1 5277,5 2,99
из сепаратора
С1: Итог о... 176251,3 48,959 100,00
n2 0,8 —
СО 19,8 0,28
со2 40,4 0,57
СН31 5373,8 75,19
СНзСООН 1045,5 14,63
СН3СООСН3 122,1 1,71
н26 544,5 7,62
Итог о... 7146,9 1,985 100,00
Жидкая фаза
из сепаратора
С2:
СН31 789,1 0,64
СНзСООН 96 575,5 78,28
СН3СООСН3 224,9 0,18
С2Н6СООН 157,0 0,13
н2о 20351,9 16,49
HI 5277,5 4,28
Итог о... 123 375,9 34,271 100,00
В с е г о... 185 443,1 51,512 — В с е г о... 185 443,1 51,512 —
* Состав отдувочных газов (в %) рассчитан без учета содержания в газах водяного
пара.
254
Таблица 53. Материальный баланс стадии синтеза
Входит кг/ч Выходит кг/ч
Метанол: Отдувочные газы из сепа-
СНзОН 10 106,8 ратора С1:
н2о Ю,1 н2 16,2
— — - n2 182,8
Итог о... 10116,9 СО 1296,4
со2 145,1
Технический оксид углеро- СНз! 391,8
да: СНзСООН 4,0
СО 10 496,3 СНзСООСНз 5,0
Н2 7,7 н2о 3,6
n2 216,4 —
Итог о... 2044,9
Итог о... 10 720,4
Отдувочные газы из сепа-
Дистиллят: ратора С2:
СН31 16666,6 н2 2,4
СНзСООН 7634,6 n2 33,6
СНзСООСНз 1363,3 СО 182,4
Н2О 8148,5 со2 117,0
HI 23,9
Итог о... 34 083,0 сн31 16274,8
СНзСООН 27 702,6
Кубовые остатки: СНзСООСНз 1358,3
СНзСООН 1137,0 C2HSCOOH 20,2
С2Н5СООН 1,3 н2о 8419,3
Н2О 96,9
HI 23,9 Итог о... 54 134,5
Итог о... 1259,1
В с е г о... 56 179,4 В с е г о... 56179,4
Составляют материальный баланс реактора (табл. 52).
Составляют материальный баланс стадии синтеза уксусной
кислоты (табл. 53).
Расчет основных расходных коэффициентов. Расходные ко-
эффициенты:
по метанолу техническому: 10 116,9/18935=0,534 кг/кг;
по оксиду углерода: 10 720,4/18 935 = 0,566 кг/кг.
ТЕХНОЛОГИЧЕСКИЙ РАСЧЕТ
Назначение, устройство и основные размеры.
Определение числа реакторов
Реактор предназначен для синтеза уксусной кислоты в газо-
жидкостной среде из метанола и оксида углерода в присутствии
иодоводородной кислоты, катализатора — солей родия и промо-
255
тора — метилиодида. Для расчета выбран вертикальный сталь-
ной емкостной цилиндрический аппарат с механическим пере-
мешивающим устройством. Оксид углерода подают в реактор
через барботажное кольцо диаметром 1400 мм, расположенное
в нижней части аппарата. В образующей кольцо трубе предус-
мотрено 185 отверстий диаметром 10 мм. Значительная скорость
газа в отверстиях (5,0—8,0 м/с) обеспечивает образование дис-
персной фазы и интенсивное растворение газа в реакционной
смеси.
Готовый продукт отводят через переливной карман в сред-
ней части реактора. Уровень жидкости в период эксплуатации
поддерживают в пределах 75—80% высоты аппарата, что обес-
печивает оптимальное время пребывания исходной смеси в ре-
акторе (15—18 мин), гарантирующее полное превращение ме-
танола в уксусную кислоту.
Техническая характеристика реактора:
Диаметр внутренний, мм
Толщина стенки, мм
Высота, мм:
корпуса
общая с приводом ме-
3 600 Вместимость, м3:
22 геометрическая
полезная
6 900 Рабочая температура, °C
11 800 Рабочее давление, МПа
59,4
49,6
175—190
2,8—2,9
шалки
Реактор снабжен штуцерами входа оксида углерода Dy 100,
ру 4 и метанола £>у200, ру4, выхода продукта Dy 150, ру4.
В качестве перемешивающего устройства принята турбинная
мешалка открытого типа с плоскими наклонными лопатками с
приводом от электродвигателя.
Определяют полезную вместимость реактора:
Рр=ттт/рж=51,512 (18-60) /1150=48,4 мэ,
где тх, т— массовый расход реакционной массы (см. табл. 52) и максималь-
ное время ее пребывания в реакционной зоне, кг/с и с соответственно;
рж — плотность реакционной массы, кг/м3.
Так как полезная вместимость принятого реактора равна
49,6 м3, для обеспечения заданной производительности доста-
точно одного реактора.
Тепловой расчет
Цель расчета — определение температуры жидкой фазы, по-
даваемой из сепаратора С2.
Исходные данные:
состав материальных потоков см. в табл. 52;
температура, °C: метанола — 25; оксида углерода — 35; дистил-
лята колонны отгонки легких фракций — 45; жидкой фазы се-
256
паратора Cl — 50; жидкой фазы сепаратора С2—110—120; на
выходе из реактора — 185.
Уравнение теплового баланса реактора в общем виде:
®i + Ф2+ ®з+ Ф«+ ®s+ Фе= ®т+ ®в+ Фпот»
где Ф1, Ф2, Фз, Ф«> Фз, Фт, Фз — тепловые потоки метанола, технического
оксида углерода, дистиллята, жидкой фазы сепаратора С1, жидкой фазы
сепаратора С2, отдувочного газа и жидкой фазы из реактора соответственно,
кВт; Фе — теплота экзотермических реакций, кВт; фИОт — теплопотери в
окружающую среду, кВт.
Тепловой поток метанола:
®!=2,810(81,60/32)25=179,14 кВт,
где 81,60 — молярная теплоемкость жидкого метанола при 25 °C, Дж/(моль-К)
(см. Приложения, табл. 3); 32 — молярная масса метанола, г/моль.
Для определения значений Ф2—Фг, Ф?, Фе используют дан-
ные табл. 52. Рассчитывают средние удельные теплоемкости по-
токов. Значения молярных теплоемкостей компонентов при со-
ответствующей температуре определяют по справочнику (см.
Приложения, табл. 2, 3, 5).
Рассчитывают среднюю удельную теплоемкость техническо-
го оксида углерода при температуре 35°C (308 К):
со Н2 N2 X
Wi, % 97,91 0,07 2,02 100,0
Ci, Дж/(моль-К) 29,19 28,81 29,20 —•
CiWtKM, 100), кДж/(кг- К) 1,0207 0,0101 0,0211 1,0519
Тепловой поток технического оксида углерода:
Ф2=2,978-1,0519-35=109,64 кВт.
Рассчитывают среднюю удельную теплоемкость дистиллята
при температуре 45°С (318К):
CHSI СНзСООН СН3СООСН3 Н2О 2
Wi, % 48,9 22,4 4,0 24,7 100,0
С,, Дж/(моль-К) 127,2 123,43 193,30 75,42 —
CiWiKM,-100), кДж/(кг-К) 0,4380 0,4608 0,1045 1,0349 2,0382
Тепловой поток дистиллята:
Фз=9,468-2,0382-45=868,40 кВт.
Рассчитывают среднюю удельную теплоемкость жидкой фа-
зы сепаратора С1 при температуре 50°C (323 К):
Wt, %
С„ Дж/(моль-К)
Сtw,-/ (Mi-100),
кДж/(кг-К)
со со2
0,28 0,57
29,29 38,87
0,0029 0,0050
СН31 СНзСООН СНзСООСНз Н2о 2
75,19 14 63 1,71 7,62 100,00
127,20 123,43 193,30 75,42 —
0,6735 0,3010 0,0447 0,3193 1,3464
17—69
257
Тепловой поток жидкой фазы сепаратора С1:
Ф4= 1,985-1,3464-50= 133,63 кВт.
Рассчитывают среднюю удельную теплоемкость жидкой фа-
зы сепаратора С2 при средней температуре /ср= (110+120)/2=
= 115° С (388 К):
сн31 СНзСООН СН3СООСН3 с2н6соон Н2О HI X
«Ч, “Л 0,64 78,28 0,18 0,13 16,49 4,28 100,00
Сг, Дж/(моль-К) 127,2 123,43 193,30 193,30 75,42 51,46 —
C,Wil(M,-100), 0,0057 1,6104 0,0047 0,0034 0,6909 0,0172 2,3323
кДж/(кг-К)
Тепловой поток жидкой фазы сепаратора С2:
Фб=34,271 • 2,3323-Д=79,93k кВт.
Рассчитывают теплоты реакций синтеза уксусной кислоты и
побочных реакций (в кДж/моль), определяя значения теплот
образования веществ по справочнику (см. Приложения, табл.
2,3):
Реакция
CO+CH3OH-^CHSCOOH
СН3ОН+2СО+2Н2->-
->С2Н5СООН+Н2О(Ж)
СО+Н2О (г):«^СО2+н2
дл/иМ8-=£дни2д8(кон j —
—484,09— (—238,57)—(—110,53) =
=—134,99
—455,80+ (—285,83)—(—238,57)—-
—2(—110,53)=—282,00
—393,51—(—241,81)—(—110,53) =
=—41,17
Определяют теплоту, выделяющуюся за счет экзотермиче-
ских реакций:
Фе = (315,583 -134,99+0,255 282,00 +5,958 • 41,17) /3600= 11 921,60 кВт.
Рассчитывают общий приход теплоты:
Фп₽их=179,14+109,64 +868,40+133,63 + 79,93/ж+11 921,60=
= 13 212,41+79,93k кВт.
Рассчитывают среднюю удельную теплоемкость отдувочных
газов при температуре 185°C (458 К):
О’,, % ДжД моль-К) CjO’j/OWj-IOO), кДж/(кг К)
Н2 0,19 29,01 0,0276
n2 2,12 29,84 0,0226
со 15,23 30,07 0,1636
со2 2,15 44,21 0,0216
СН31 66,70 55,34 0,2599
СНзСООН 12,14 88,61 0,1793
СНзСООСНз 1,47 115,46 0,0232
S 100,00 — 0,6978
258
Тепловой поток отдувочных газов:
Ф?=2,401-0,6978-185 +0,152-2788,5+107,2-2002,5/3600=793,43 кВт,
где 2788,5 — энтальпия водяного пара прн температуре 185 °C (см. Прило~
женил, табл. 13), кДж/кг; 2002,5 — удельная теплота парообразования при
температуре 185 °C с учетом расхода теплоты на испарение воды, пошедшей
на образование диоксида углерода (см. Приложения, табл. 13), кДж/кг.
Рассчитывают среднюю удельную теплоемкость жидкой фа-
зы из реактора при температуре 185°C (458 К):
wt, % с,, ДжДмоль К) C,w,/(M,-100), кДж/(кг-К)
n2 0,02 29,84 0,0002
со 0,10 30,07 0,0011
со2 0,07 44,21 0,0007
СН31 9,68 127,20 0,0867
СНзСООН 69,87 123,43 1,4373
СНзСООСНз 0,90 193,30 0,0235
С2Н5СООН 0,10 193,30 0,0026
н2о 16,27 75,42 0,6817
HI 2,99 51,46 0,0120
100,00 — 2,2458
Тепловой поток жидкой фазы из реактора:
Ф8=48,919 2,2458 • 185=20 324,52 кВт.
Теплопотери в окружающую среду принимают равными 5%
от общего расхода теплоты:
Фпот = (793,43 + 20 324,52) 5/ (100—5) = 1111,47 кВт.
Общий расход теплоты:
Ф₽асх=793,43 +20 324,52+1111,47 =22 229,42 кВт.
Температуру жидкой фазы сепаратора С2 находят из урав-
нения теплового баланса реактора:
13 212,41 +79,93^=22 229,42; tx=\ 12,8 °C.
Так как полученное значение температуры находится в за-
данных пределах, время пребывания реагирующих веществ в
реакторе, количество отбираемой жидкой фазы и возвращаемой
дросселированной охлажденной жидкости из сепаратора С2 в
реактор выбраны верно. В этих условиях температура процесса
17*
259
Таблица 54. Тепловой баланс реактора
Приход кВт % Расход кВт %
Тепловой поток мета- нола 179,14 0,8 Тепловой поток отду- вочных газов 793,43 3,6
Тепловой поток окси- да углерода 109,64 0,5 Тепловой поток жид- кой фазы 20 324,52 91,4
Тепловой поток дис- тиллята Тепловой поток жид- кой фазы сепаратора С1 Тепловой поток жид- кой фазы сепаратора С2 Теплота экзотермиче- ских реакций 868,40 133,63 9017,01 11921,60 3,9 0,6 40,6 53,6 Теплопотери в окру- жающую среду 1111,47 5,0
Beer о... 22 229,42 100,0 Beer о... 22 229,42 100,0
в реакторе в основном зависит от температуры возвращаемой
из сепаратора жидкой фазы и разность между ними составляет
около 70 °C.
Тепловой поток жидкой фазы сепаратора С2:
©5=79,93-112,8=9017,01 кВт.
Составляют таблицу теплового баланса реактора (табл. 54).
Расчет элементов реактора
Цель расчета — определение частоты вращения вала мешалки,
мощности электропривода, размеров барботера.
Для определения частоты вращения вала мешалки принима-
ют, что отношение диаметра реактора к диаметру окружности,
описываемой лопастью мешалки, равно трем; окружная ско-
рость <в = 5,0 м/с; диаметр вала мешалки dB—150 мм.
Определяют диаметр мешалки:
dM=£5/3=3600/3=1200 мм.
Выбирают [26, табл. 9.2] стандартизованную турбинную ме-
шалку с ^=1250 мм.
Рассчитывают частоту вращения:
n=<o/ndM=5,0/(3,14-1,25) = !,27 с-'.
Принимают [26, Приложения, табл. 11] стандартизованное зна-
чение п=1,33 с-1.
Так как газ (технический оксид углерода) вводят в жидкую
реакционную фазу через барботер, расположенный под мешал-
260
кой, необходимо знать частоту вращения вала мешалки, соот-
ветствующую началу диспергирования п0.
Для определения «о используют уравнение
nAJ (og/рж)1/4=А+В (D/dM),
где с—поверхностное натяжение жидкости, принимают по 50%-й уксусной
кислоте; сг=12,2-10~э Н/м [9, Приложение V]; g — ускорение свободного
падения, м/с2; рж — плотность жидкой фазы, кг/м3; А и В — константы, для
турбинных мешалок А=1,22; В=1,25.
«0 • 1,25/ [ (12,2 10~3 9,81) /1150]J/4 = 1,22 +1,25 (3,6/1,25);
12,38и0=4,82; по=О,39 с-1.
Так как п>п0, то степень диспергирования достаточна.
Мощность электропривода определяют по формуле:
М= [MM+Mn/UOOOn) ] К2,
где Na — мощность электропривода, кВт; N„ — мощность, затрачиваемая иа
перемешивание, Вт; М и К.2—коэффициенты, учитывающие наличие барбо-
тера и возможные перегрузки; ч—к.п.д. передачи от электродвигателя к
валу мешалки, принимают ч=0,85.
Принимают, что вал мешалки уплотнен с помощью двойного
торцевого уплотнения, для которого Nyn определяют по форму-
ле [26, уравнение (9.21)]:
/Ууп=1 о 440dB 1,3= 10 440 0,151 -3=886 Вт.
Рассчитывают центробежный критерий Рейнольдса:
Иец=шг2мрж/|Л= 1,33-1,252-1150/(0,14-10“3) = 1,7-107,
где pi — динамическая вязкость жидкой фазы; при температуре 185 °C для
70%-й уксусной кислоты |Л = О,14-1О~3 Па-с [10, рис. V].
Для открытой турбинной мешалки при Re4>l,0-106 по диа-
грамме [9, рис. 10-2] находят коэффициент сопротивления С =
= 1,98. Определяют мощность, затрачиваемую на перемешива-
ние:
An=CdWp,K= 1,98- 1,25е- 1,33s-1150= 16 348 Вт.
Принимают, что коэффициент, учитывающий наличие барботе-
ра, Ki=2,4; коэффициент, учитывающий возможные перегрузки,
/<2=1,2. Тогда мощность электропривода составит:
[(16 348-2,4+886)/(1000-0,85)] -1,2=56,6 кВт.
Выбирают электродвигатель Мэ=75,0 кВт с частотой вращения
вала иэ=24,0 с-1 (1440 мин-1).
Определяют основные размеры барботера. Для расчета вы-
бирают барботер в виде трубы, образующей кольцо. Диаметр
трубы барботера определяют по формуле (61):
d6=l,13yvT/a>.
261
Объемный расход технического оксида углерода при темпе-
ратуре 35+273=308 К и давлении 3,3 МПа составит:
Уг= [386,461-22,4/3600] [308-101 325/(273-3 300 000)] =0,083 м»/с,
где 386,461 —количество технического оксида углерода иа входе в реактор
(см. состав потока 1), кмоль/ч.
Принимают скорость газа в сечении трубы барботера w=
= 15 м/с (см. Приложения, табл. 18), тогда
d6=l,13V0,083/15=0,084 м.
Принимают диаметр трубы барботера dTp=95X3,5 мм. При
внутреннем диаметре трубы de—88 мм средний диаметр барбо-
тажного кольца равен:
£)K=15d6= 15-88= 1320 мм.
Принимают £>к=1400 мм. Расстояние между барботажным
кольцом и наиболее низко расположенной лопастью мешалки
составит:
/i=0,25dM=0,25-1250 =313 мм.
Рассчитывают фактическую скорость газа в сечении трубы
барботера:
шф = К/ (0,785d26) = 0,083/ (0,785 • 0.0882) = 13,7 м/с.
Скорость газа в отверстиях барботера определяют по формуле
[26, уравнение (9.73)]:
=3,4yds Рж/рг-
Плотность технического оксида углерода при температуре 308 К
и давлении 3,3 МПа равна:
рг=т/Ут=2,978/0,083=35,88 кг/м3,
где т — расход технического оксида углерода (см. табл. 52), кг/с.
и>о=3,4}'0,088-1150/35,88=5,7 м/с.
Принимают диаметр отверстия в трубе барботера с/Отв=Ю мм
и определяют общее число отверстий:
nOTB = l4/(0,785d2OIBwc) =0,083/(0,785-0,012-5,7) = 185.
Отверстия размещают по окружности барботажного кольца,
тогда шаг расположения отверстий равен:
/=л£>к/Потв=3,14-1400/185=24 мм.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Основные направления экономического и социального развития СССР на
1986—1990 годы и на период до 2000 года. М.: Политиздат, 1986. 95 с.
2. Комплексная программа химизации народного хозяйства СССР на период
до 2000 года. М.: Политиздат, 1985. 32 с.
262
3. Капкин В. Д., Савинецкая Г. А., Чапурин В. И. Технология органическо-
го синтеза. М.: Химия, 1988. 392 с.
4. Лебедев Н. Н. Химия и технология основного органического и нефтехи-
мического синтеза. 3-е изд. М.: Химия, 1981. 608 с.
5. Белов П. С. Основы технологии нефтехимического синтеза. М.: Химия,
1982. 279 с.
6. Юкельсон И. И. Технология основного органического синтеза. М.: Химия,
1968. 846 с.
7. Адельсон С. В., Вишнякова Т. П., Паушкин Я. М. Технология нефтехими-
ческого синтеза. М.: Химия, 1985. 608 с.
8. Гутник С. П., Кадоркина Г. Л., Сосонко В. Е. Примеры и задачи по тех-
нологии органического синтеза. М.: Химия, 1984. 192 с.
'9 . Плановский А. Н., Рамм В. М., Каган С. 3. Процессы и аппараты хими-
ческой технологии. М.: Химия, 1968. 848 с.
10. Павлов К. Ф-, Романков П. Г., Носков А. А. Примеры и задачи по курсу
процессов и аппаратов химической технологии. Л.: Химия, 1981. 560 с.
11. Методы расчетов по технологии связанного азота/Под ред. В. И. Атро-
щенко. Киев: Вища школа, 1978. 312 с.
12. Технология синтетического метанола/Под ред. М. М. Караваева. М.: Хи-
мия, 1984, 240 с.
13. Краткий справочник физико-химических величин/Под ред. А. А. Равделя
и А. А. Пономаревой. Л.: Химия, 1983. 232 с.
14. Краснощеков Е. А., Сукомел А. С. Задачник по теплопередаче. М.: Энер-
гия, 1969. 264 с.
15. Флореа О., Смигельский О. Расчеты по процессам и аппаратам химиче-
ской технологии. М.: Химия, 1971. 448 с.
16. Черных С. П., Аврех Г. Л. ЦХии. пром. 1986. № 1. с. 5—8.
17. Расчеты химико-технологических процессов/Под ред. И. П. Мухленова.
Л.: Химия, 1976. 304 с.
18. Черный И. Р. Производство мономеров и сырья для нефтехимического
синтеза. М.: Химия, 1973. 264 с.
19. Кузнецов А. А., Кагерманов С. М., Судаков Е. Н. Расчеты процессов и
аппаратов нефтеперерабатывающей промышленности. Л.: Химия, 1974.
344 с.
20. Катализ в кипящем слое/Под ред. И. П. Мухленова и В. М. Померанце-
ва. Л.: Химия, 1978. 232 с.
21. Лащинский А. А. Конструирование сварных химических аппаратов: Спра-
вочник. Л.: Машиностроение, 1981. 382 с.
22. Варгафтик Н. Б. Справочник по теплофизическим свойствам газов и жид-
костей. М.: Наука, 1972. 720 с.
23. Липович В. Г., Полубенцева М. Ф. Алкилирование ароматических угле-
водородов. М.: Химия, 1985. 272 с.
24. Окись этилена/Под ред. П. В. Зимакова и О. Н. Дымента. М.: Химия,
1967. 330 с.
25. Расчеты основных процессов и аппаратов нефтепереработки: Справоч-
ник/Под ред. Е. Н. Судакова. М.: Химия, 1979. 569 с.
26. Машины и аппараты химических производств. Примеры и задачи/Под
общ. ред. В. Н. Соколова. Л.: Машиностроение, 1982. 384 с.
27. Трегер Ю. А., Карташов Л. М., Кришталь И. Ф. Основные хлорорганиче-
ские растворители. М.: Химия, 1984. 224 с.
28. Справочник нефтехимика/Под ред. С. К. Огородникова в 2-х т. Л.: Хи-
мия, 1978. Т. 2. 592 с.
29. Справочник азотчика/Под ред. Е. Я. Мельникова. В 2-х т. М.: Химия,
1987. Т. 1. 464 с.
30. Производство капролактама/Под ред. В. И. Овчинникова и В. Р. Ручин-
ского. М.: Химия, 1977. 264 с.
263
ПРИЛОЖЕНИЯ
Таблица 1. Значения констант равновесия реакций конверсии метана
СН4+Н2О^СО+ЗН2 (1), СО+Н2О^СО2+Н2 (2)
Реакция I Реакция 2
t, °C 1 * t, °C К2 | л сс К2 1 t, °с Кг
327 5,058-10-’ 175 421,6 450 7,67 850 0,896
427 2,687-10”4 200 238,7 500 5,11 890 0,792
527 3,120-10-2 250 90,7 527 4,45 900 0,768
627 1,306 300 41,2 600 2,65 927 0,720
727 26,56 327 28,4 627 2,40 1000 0,590
827 3,133-Ю2 340 24,1 700 1,74 1027 0,553
927 2,473-103 380 15,2 727 1,49 1100 0,473
1027 1,428-104 400 12.27 800 1,06 1127 0,452
1127 6,402-10 427 9,52 827 0,967
Таблица 2. Термодинамические свойства простых веществ
и неорганических соединений
Вещество Л^°298 (ОбР)’ кДж/моль Д^°298(СГОР)’ кДж/моль ѰР(298)’ Дж /(моль-К) Коэффициенты уравнения Cap=f(T)
формула состоя- ние а fc-I03 С'-10— 5
С (графит) Т. 0,00 —393,51 8,54 16,86 4,77 —8,54
С12 Г. 0,00 — 33,93 37,03 0,67 —2,85
н2 г. 0,00 —285,83 28,83 27,28 3,26 0,50
n2 г. 0,00 .— 29,12 27,88 4,27 —
О2 г. 0,00 — 29,37 31,46 3,39 —3,77
А1С13 т. —704,17 -— 91,00 77,12 47,83 .—
BF3 г. —1136,58 50,46 52,05 28,03 —8,87
СО г. — 110,53 —282,98 29,14 28,41 4,10 —0,46
СО2 г. —393,51 — 37,11 44,14 9,04 —8,54
НС1 г. —92,31 — 29,14 26,53 4,60 1,09
HI ж. — — 51,46 -— —
Н2О ж. —285,83 -—. 75,42 -—. —. —
г. —241,81 — 33,61 30,00 10,71 0,33
H2S г. —20,60 —578,98 33,44 29,37 15,40 —
NH3 ж. —69,87 — 80,75 — — —
г. —45,94 35,16 29,80 25,48 —1,67
264
Таблица 3. Термодинамические свойства органических соединений
Вещество Д^°298(Обр)’ кДж/моль лш 298(сгор)’ кДж/моль С°р(298)" Дж/(моль-К) Коэффициенты уравнения COp=f(7)
формула наименование состоя- ние а 6-103 с-10»
сн4 Метай Г. Углевод —74,85 ороды — 890,31 35,71 14,32 74,66 —17,43
С2Н2 Ацетилен г. —226,75 —1299,63 43,93 26,44 66,65 —26,48
С2н4 Этилен г. 52,30 —1410,97 43,56 11,32 122,01 —37,90
С2Н8 Этан г. —84,67 — 1559,88 52,64 5,75 175,11 —57,85
с8н4 Пропадиен г. 192,13 —1945,28 58,99 13,05 175,31 —71,17
С3н6 Пропилен г. 20,41 —2059,85 63,89 12,44 188,38 —47,60
СзНв Пропан г. —103,85 —2220,03 73,51 1,72 270,75 —94,48
С4Н6 Бутадиен-1,2 г. 162,21 —2595,03 80,12 17,74 234,43 —84,73
С4Н6 Бутадиен-1,3 (дивинил) г. 110,16 —2542,95 79,54 8,08 273,22 —111,75
С4Н8 Бутен-1 г. —0,13 —2720,40 85,65 21,47 258,40 —80,84
С4Н10 Бутан г. —126,15 —2877,13 97,45 18,23 303,56 —92,65
С5Н10 Пентен г. —20,94 —3378,12 83,01 —42,43 475,30 —182,51
С8Н12 Пентан ж. —173,33 —3509,20 172,90 — — —
То же г. —146,44 —3536,15 120,21 6,90 425,93 —154,39
СвНв Бензол ж. 49,03 —3267,58 135,14 59,50 255,01 —
То же г. 82,93 —3301,51 81,67 —21,09 400,12 —169,87
С4Нц Циклогексан ж. —156,23 —3919,90 156,48 — — —
То же г. —123,14 —3953,00 106,27 —51,71 598,77 —230,00
с?н8 Толуол ж. 12,01 —3910,28 156,06 59,62 326,98 —
ьэ CD ел То же г. 50,00 -3947,94 103,64 —21,59 476,85 —190,33
Вещество
формула наименование
с7н1в Гептан То же
CeHg Стирол То же
СвНф Этилбензол То же
С9Н12 CioHh С,2Н18 Ci2H2o CuH14 С14Н22 Изопропилбензол Диэтилбензол Триэтилбензол Триэтилтолуол Дифенилэтан Тетр аэтилбензол
СН2О СН2О2 СН4О Формальдегид Муравьиная кислота Метанол То же
С2Н4О CsH4O С2Н4О2 Ацетальдегид Этиленоксид Уксусная кислота То же
CsHbO Этанол То же
Продолжение
Л^°298(СГОР) ’ КДЖ/МОЛЬ С» , Р(298) Дж/(моль-К) Коэффициенты уравнения C®p=f(T)
состоя- ние кДж/моль а Ь-10« с-10’
Ж. Г. —224,54 —187,88 —4856,73 138,91 165,98 10,00 587,14 —215,56
Ж. г. 103,89 147,36 — 182,59 122,09 —7,32 494,42 —202,92
ж. г. —12,48 29,79 —4597,44 186,56 128,41 —15,61 548,82 —220,37
ж. —41,24 — 321,36 — — —
ж. —72,35 •— 369,06 — — —
ж. —122,63 — 464,46 — — —
ж. —174,54 — 512,16 — — —
ж. 297,31 415,94 — — —
ж. —174,54 — 559,86 — — —
Кислс г. )р оде одер ж а и —115,90 дие соединени —561,07 Я 35,39 18,82 58,38 —15,61
г. —378,80 —262,88 45,80 19,40 112,80 —47,50
ж. г. —238,57 —201,00 —726,60 —764,17 81,60 44,13 15,28 105,20 —31,04
г. —166,00 —1193,07 54,64 13,00 153,50 —53,70
г. —52,63 —1306,05 48,50 —2,02 190,60 —73,60
ж. г. —484,09 —434,84 —874,58 123,43 66,50 14,82 196,70 —77,70
ж. г. —276,98 —234,80 —1370,68 111,96 65,75 10,99 204,70 —74,20
С2Н6О с3н6о Диметиловый эфир Ацетон То же
С3НвО Пропанол-1 То же
С3Н6О2 СзН3О2 CiHeO С4Н6О С4Н10О Метилацет ат Пропионовая кислота Кротоновый альдегид Масляный альдегид Бутанол То же
CisHi2O Дифенил карбинол
СС14 Тетрахлорметан (четы- реххлористый углерод) То же
СНС13 Трихлорметан (хлороформ) То же
С2С14 Тетрахлорэтилен (пер- хлорэтилен)
С2С1в С2НС13 С2Н4С12 С6С16 СС1з—сн=о м СНз1 СП Гексахлорэтан Трихлорэтилен Дихлорэтан Г ексахлор беизол Хлораль Подметан То же
г. —184,05 65,81 16,18 183,90 —58,70
ж. —248,11 —1785,73 125,0 — —
г. —217,57 — 74,90 22,47 201,80 —63,50
ж. —304,55 —2010,41 148,60 .— —
г. —257,53 — 87,11 13,10 277,50 —98,44
ж. — — 193,30 — —
ж. —455,80 — 193,30 — — —
г. —144,24 — — — — —
г. —205,16 — 99,70 — — —
ж. —325,56 —2671,90 183,26
г. —274,43 — 110,00 14,68 358,10 —129,00
ж. —46,17 — — — — —
Галогенсодержащие соединения
ж. —132,84 —260,65 131,70 — — —
г. —100,42 — 83,76 59,36 97,00 —49,57
ж. —132,21 —428,06 116,30 — — —
г. —101,25 — 65,73 29,50 148,90 —90,70
г. —15,06 — — — — —
г. —141,42 — 136,46 — — —
г. —7,53 — — — — —
г. —129,7 1134,41 79,53 — — —
г. —229,96 — — — — —
г. —273,83 — — — — —
ж. —13,76 — 127,20 — —
г. 13,97 —• 44,14 19,67 92,67 —32,28
Таблица 4. Удельная теплоемкость хлорорганических соединений
t, °C ср, кДж/(кг-К)
ССЦ C2CI4 С6С16 СНС1з С2НС13 СгН4С1г
Жидкое состояние
0 0,829 0,816 0,824 0,925 0,941 1,276
20 0,862 0,858 0,885 0,950 0,962 1,289
30 0,879 0,868 0,917 0,980 0,970 1,300
40 0,892 0,879 0,953 0,988 0,979 1,310
60 0,917 0,900 1,056 1,005 0,996 1,335
80 0,942 0,937 — 1,026 1,013 1,372
100 0,960 0,962 — 1,051 1,029 1,410
Парообразное состояние
0 0,519 0,573 — 0,519 0,594 0,774
100 0,586 0,620 — 0,607 0,657 0,891
200 0,620 0,648 — 0,670 0,699 1,004
300 0,636 0,665 <— 0,703 0,720 1,105
400 0,645 0,674 — 0,733 0,740 1,192
500 0,649 0,686 — 0,762 0,761 1,276
600 0,657 0.694 — 0,779 -—. 1,347
700 0,670 0,707 — 0,795 — —
800 0,678 0,715 — 0,808 — —
900 0,687 0,724 — 0,816 — —
1000 0,691 0,736 •— 0,825 — —
Таблица 5. Молярная теплоемкость газообразного метилацетата CHSCOOCH9
т, к Ср. Дж/(моль-К) т, К Ср, Дж/(моль-К)
298 85,31 700 152,88
300 85,65 800 164,64
400 104,85 900 174,68
500 123,14 1000 183,34
600 139,16
Таблица 6. Атомная теплоемкость
Состояние вещества С/, Дж/(моль ат-К)
С н N О F S Р остальные элементы
Твердое 7,53 9,62 11,30 16,74 20,92 22,59 23,01 25,94—26,78
Жидкое 11,72 17,99 — 25,10 29,29 30,96 29,29 33,47
268
Таблица 7. Числовые значения термической характеристики
Группы атомов, типы связей х, кДж/моль
Ординарная связь С—С 0,0
Двойная связь с=с 87,9
Тройная связь CsC 213,4
Фенильная группа R— С6Н6 100,4
Спиртовая группа R—СН2ОН 50,2
Эфирная группа R-O-R' 87,9
Альдегидная группа R—СНО 75,3
Кетогруппа Кислотная группа: R—СО—R' 50,2
в одноосновной кислоте R—СООН 0,0
в двухосновной кислоте НООС—R—СООН 12,6
Таблица 8. Энтальпия алкилбензолов и стирола
т, к h, кДж/кг
СвНв—СНз СвН5-С2Нз С6Н5-С2Н5
298 195,70 200,40 210,40
400 330,30 338,80 354,00
500 498,43 508,93 532,28
600 696,78 706,23 741,43
700 920,02 926,37 975,98
800 1164,20 1164,80 1231,40
900 1425,60 1419,00 1504,40
1000 1701,70 1686,40 1792,50
Таблица 9. Удельная теплота испарения органических веществ*
1, °C г, кДж/KI
СС14 C2CJ4 СНС1з С2НО1з С2Н4С12
0 218,0 247,5 271,0
20 209,8 241,8 267,9 262,8 353,5
25 — 238,9 260,0 — —
^КИП 194,7 209,2 248,3 239,3 323,4
100 179,2 218,0 228,6 231,0 318,0
140 163,3 202,5 203,5 215,1 292,9
180 147,8 186,6 175,8 197,5 265,7
200 137,0 177,0 155,3 182,5 241,6
220 125 6 167,4 134,8 167,4 217,6
260 83,7 144,3 0 125,5 146,4
300 — 109,6 — — —
• Для С2С1в при ^инп г««215,5 кДж/Ki,
269
Таблица 10. Давление насыщенных паров
циклогексана
t. °C р*10-Ъ Па | t. °C р !0~з, Па
10 6,33 60 51,88
20 10,33 70 72,49
25 13,01 80 99,08
30 16,23 90 132,72
40 24,62 100 174,62
50 36,23 но 226,00
Таблица 11. Динамическая вязкость газов и паров
ji-107, Па с
Вещество 100 °C 200 °C 300 °C 400 °C 500 °C 600 °C 700 °C 800 °C
н2 103 121 139 154 169 183 197 210
n2 208 246 280 311 339 366 390 413
о2 244 290 331 369 403 435 465 493
со 209 246 278 309 338 363 387 410
со2 184 226 264 299 332 362 381 418
Н2О 123 161 198 232 266 299 331 361
сн4 133 161 185 208 227 246 265 282
С2Н2 127 154 178 202 223 243 261 278
С2Н4 127 156 182 206 228 249 268 287
С2н6 115 141 164 190 214 238 262 286
с6н6 92 121 146 172 198 223 .
C6H5CHS 89 112 134 155 174 195 — —
С6н12 88 109 129 148 167 186 .
СНзОН 123 157 191 226 261 296 .—
СНзСНО —— 140 167 193 211 —
С2Н4С12 105 136 165 187 ’— — — —
Таблица 12. Теплофизические свойства метанола на линии насыщения
t, °C Рп, кг/мз р, КГ/мЗ г, кДж/кг О103, Н/м ц 10’, Па-с 7.-1O2, Вт/(м-К)
10 0,10 800,8 1201,6 23,50 698 21,20
20 0.17 791,5 1191,1 22,60 578 21,17
30 0,28 782,5 1178.6 21,80 509 21,00
40 0,45 774,0 1163,9 20,90 446 20,82
50 0,69 765,0 1147,2 20,10 396 20,69
60 1,02 755,5 1130,4 19,30 381 20 59
70 1,49 746,0 1109,5 18,45 371 19,10
80 2,11 735,5 1084,4 17,60 290 18,80
90 2,83 725,0 1059,3 16,66 265 18,60
100 4,04 714,0 1030,0 15,61 240 18,30
270
Таблица 13. Свойства насыщенного водяного пара в зависимости
от температуры
t, °C р. МПа ^Ж’ кДж/кг кДж/кг г» кДж/кг Л °C р, МПа ^Ж’ кДж/кг Лп' кДж/к1 Г, кДж/кг
0 0,00062 0 2493,1 2493,1 90 0,07150 377,10 2662,0 2285,0
5 0,00089 20,95 2502,7 2481,7 130 0,27550 546,8 2726,0 2179,0
10 0,00125 41,90 2512,3 2470,4 150 0,48550 632,7 2753,0 2120,0
15 0,00174 62,85 2522,4 2459,5 170 0,80800 719,8 2776,0 2056,0
25 0,00323 104,75 2541,7 2436,9 180 1,02300 763,8 2785,0 2021,0
50 0,01258 209,50 2589,5 2380,0 190 1,28000 808,3 2792,0 1984,0
80 0,04830 335,20 2644,0 2310,0 200 1,58500 852,7 2798,0 1945,0
Таблица 14. Свойства насыщенного водяного пара в зависимости
от давления
р» МПа /, °C ^Ж’ кДж/кг йп- кДж/кг Г, кДж/кг р. МПа 1, °C кДж/кг hw кДж/кг кДж/кг
0,1 99,1 415,2 2677 2264 1,0 179,0 759,6 2784 2024
0,2 119,6 502,4 2710 2208 2,0 211,4 904,2 2802 1898
0,3 132,9 558,9 2730 2171 3,0 232,8 1002,0 2801 1800
0,5 151,1 637,7 2754 2117 5,0 262,7 1143,0 2780 1637
0,6 158,1 667,9 2768 2095 8,0 293,6 1294,0 2726 1432
0,8 169,6 718,4 2776 2057 12,0 323,1 1455,0 2638 1183
Таблица 15. Энтальпия перегретого водяного пара
t, °C h, кДж/кг
0,1 МПа 0,2 МПа 0, з МПа 0,4 МПа 0,5 МПа 1,0 МПа 1,5 МПа
130 2736,8 2727,6 .—.
170 2816,0 2809,9 2803,5 2796,9 2789,9 —
180 2835,7 2830,1 2824,3 2818,3 2812,1 2777,3 —
190 2855,4 2850,3 2845,0 2839,6 2833,9 2802,9 —
200 2875,2 2870,5 2865,6 2860,6 2855,5 2827,5 2795,3
250 2974.2 2970,9 2967,5 2964,2 2960.7 2942,8 2923,4
300 3074,1 3071,7 3069,2 3066,7 3064,2 3051,3 3037,9
350 3175,3 3173,4 3171,5 3169,5 3167,6 3157,7 3147,6
400 3278,0 3276,5 3274,9 3273,4 3271,8 3264,0 3256,1
450 3382,2 3380,0 3379,6 3378,4 3377,1 3370,7 3364,2
500 3487,9 3486,9 3485,8 3484,7 3483,7 3478,3 3472,9
550 3595,4 3594,5 3593,6 3592,7 3591,7 3587,2 3582,5
600 3704,5 3703,7 3702,9 3702,2 3701,4 3697,4 3693,5
650 3815,4 3814,7 3814,0 3813,3 3812,6 3809,1 3805,6
660 3837,8 3837,1 3836,4 3835,7 3835,0 3831,6 3828,6
271
Таблица 16. Теплофизические свойства воды (на линии насыщения)
р, МПа t. °C р, кг/м3 Х-102, Вт/(М-К) |х-10\ Па с V- 106, М2/С р-103, Н/м Рг
0,1 10 1000 57,5 1310 1,310 76,2 9,52
0,1 20 998 59,9 1000 1,010 72,7 7,02
0,1 30 996 61,8 804 0,805 71,2 5,42
0,101 100 958 68,3 282 0,295 58,9 1,75
0,275 130 935 68,6 212 0,226 52,9 1,32
0,630 190 907 68,3 174 0,191 46,6 1,Ю
1,280 190 876 67,0 145 0,166 40,0 0,97
8,761 300 713 53,9 91 0,128 14,3 0,98
13,118 330 640 48,8 81 0,127 7,7 1,25
Таблица 17. Теплофизические свойства перегретого водяного пара
О о Р, КГ/мЗ с, кДж/(кг-К) И-107, Па-с X-103, Вт/(м-К) р, КГ/мЗ |1-107, Па-с хе р, КГ/мЗ с, кДж/(кг>К) |1-107, Па-с X-103, Вт/(м-К)
р=0,8 МПа р=0,9 МПа р= 1,0 МПа
550 1,888 2,187 304 74,54 2,406 2,189 305 74,63 2,648 2,191 305 74,72
600 1,779 2,215 326 81,22 2,266 2,217 326 81,31 2,494 2,219 326 81,40
650 1,681 2,246 346 88,00 1,962 2,248 346 88,09 2,356 2,266 346 88,18
700 1,596 2,280 365 94,90 1,860 2,282 365 94,99 2,233 2,283 365 95,08
Таблица 18. Рекомендуемые скорости газов и жидкостей в трубопроводах
Среда W, м/с Среда W, м/с
Газы: при естественной тяге при небольшом давлении при большом давлении Жидкости: при движении самотеком в напорных трубопроводах 2—4 4—15 15—25 0,1—0,3 0,5—2,5 Водяной пар: насыщенный: р=20—50 кПа р>50 кПа перегретый 40—60 15—40 30-50
Таблица 19. Значение коэффициента В и определяющего параметра I»
Показатель по °C 120 °C 130 °C 140 °C 150 °C 160 °C
В-106, М2/Вт /.-106, м 51,80 25,90 22,80 14,20 10,70 8,05 5,13 4,70 2,58 2,82 1,33 1,73
272