Текст
МИНИСТЕРСТВО ОБЩЕГО И ПРОФЕССИОНАЛЬНОГО
ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
Ярославский государственный технический университет
Кафедра химической технологии органических веществ
Рекомендовано советом
химнко-технологического
факультета
Использование пакета прикладных программ
для расчета основных процессов и аппаратов
химической технологии органических веществ
Методические указания к курсовому
и дипломному проектированию
Ярославль 1997
30
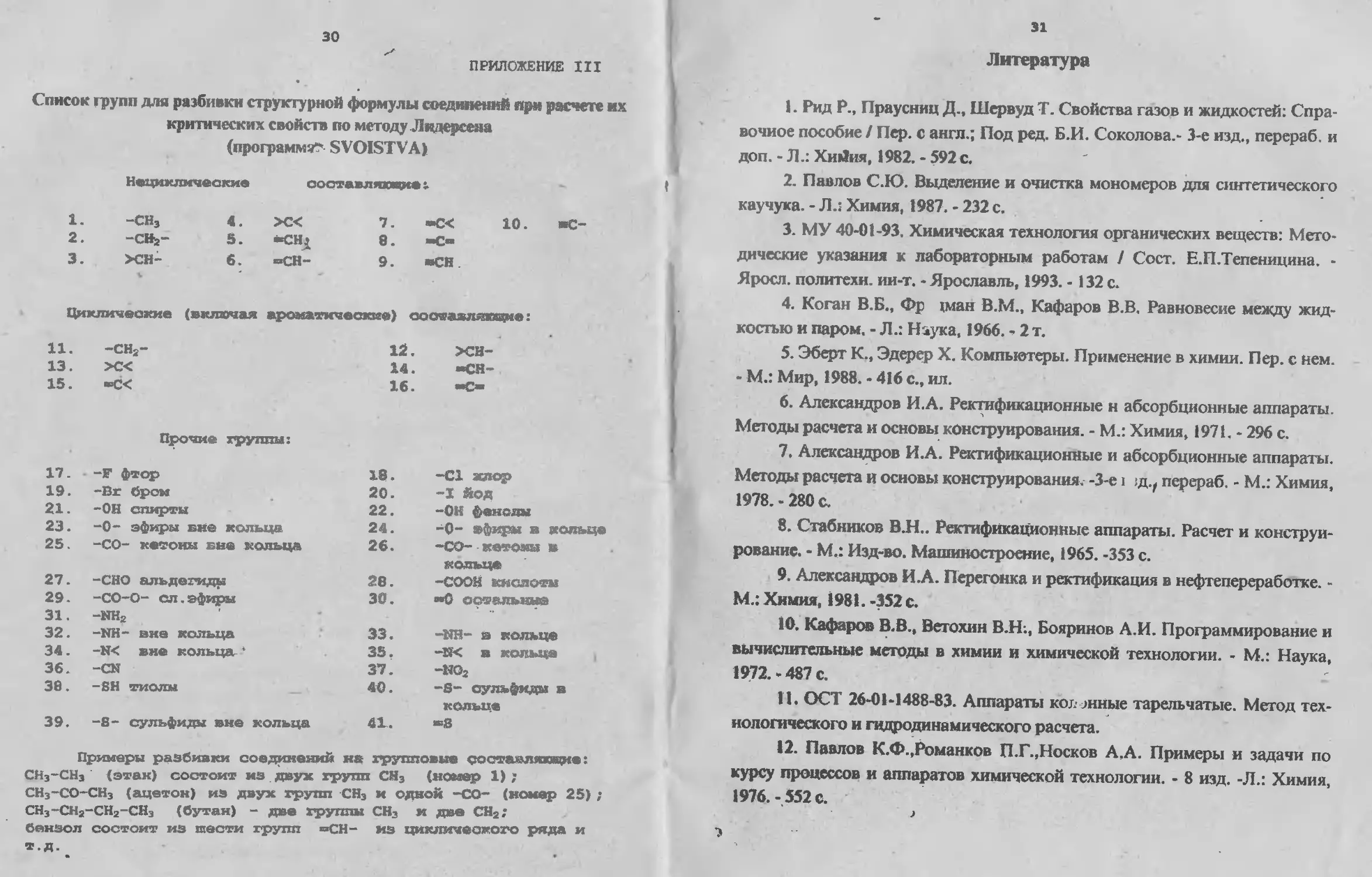
ПРИЛОЖЕНИЕ III
Список групп для разбивки структурной формулы соединений при расчете их
критических свойств по методу Л вдерсеяа
(программа?' SVOISTVA)
Нециклические
соотавлях^се г
1. 2. 3. -СН3 -CHs- >сн- 4. 5. 6. >С< ёСНЛ “СН- 7. "С< 10. 8. -С~ 9. «СН ИС-
Циклические (включая ароматические) составляющие:
11. 13. 15. -СН2- >С< -С< 12. >СН- 14. -СН~ 16. «О
Прочие группы;
17. - -F фтор 10. -С1 хлор
19. -Вг бром 20. -I ЙОД
21. -ОН спирты 22. -ОН фенолы
23. -0- эфиры вне кольца 24. -0- эфиры в кольце
25. -СО- кетоны вне кольца 26. -СО- метоны в
27. -СНО альдегиды 28. кольце -СООН кислоты
29. -СО-О- ел.эфиры -НН? -NH- вне кольца 30. «0 остальные
31 32. 33. -НН- в кольце
34. -N< вне кольцвг-' 35. -Ы< в кольца ।
36. -CN 37. -ко2
38. -ВИ тиолы 40. -S- сульфиды
39. -S- сульфиды вне кольца 41. кольца «В
Примеры разбивки соединений на групповые сося вляхадие •-
СН3-СН3 (этак) состоит из двух групп СН3 (номер 1) ;
СН3-СО-СН3 (ацетон) из двух трупп СН3 и одном -СО- (номер 25) ;
СН3-СН2--СН2-СНз (бутан) - две группы СН3 и две СН2;
бензол состоит из шести трупп «СИ- ив циклического ряда и
т.д.
31
Литература
I. Рид Р., Праусниц Д., Шервуд Т. Свойства газов и жидкостей: Спра-
вочное пособие / Пер. с англ.; Под ред. Б.И. Соколова.- 3-е изд., перераб. и
доп. - Л.: Хийня, 1982. - 592 С.
2. Павлов С.Ю. Выделение и очистка мономеров для синтетического
каучука. - Л.: Химия, 1987. - 232 с.
3. МУ 40-01-93. Химическая технология органических веществ: Мето-
дические указания к лабораторным работам / Сост. Е.П.Тепеницина. -
Яросл. политехи, ин-т. - Ярославль, 1993. - 132 с.
4. Коган В.Б., Фр зман В.М., Кафаров В.В. Равновесие между жид-
костью и паром. - Л.: Наука, 1966. -2 т.
5. Эберт К,, Эдерер X. Компьютеры. Применение в химии. Пер. с нем.
- М.: Мир, 1988. - 416 с., ил.
6. Александров И.А. Ректификационные и абсорбционные аппараты.
Методы расчета и основы конструирования. - М.: Химия, 1971. - 296 с.
7. Александров И.А. Ректификационные и абсорбционные аппараты.
Методы расчета и основы конструирования. -3-е i ;д., перераб. - М.: Химия,
1978.-280 с.
8. Стабников В.Н.. Ректификационные аппараты. Расчет и конструи-
рование. - М.: Изд-во. Машиностроение, 1965. -353 с.
9. Александров И.А. Перегонка и ректификация в нефтепереработке. -
М.: Химия, 1981. -352 с.
10. Кафаров В.В., Ветохин В.Н;, Бояринов А,И. Программирование и
вычислительные методы в химии и химической технологии. - М.: Наука,
1972.-487 с.
И. ОСТ 26-01-1488-83. Аппараты кол знные тарельчатые. Метод тех-
нологического и гидродинамического расчета.
12. Павлов К.Ф.,Романков П.Г.,Носков А.А. Примеры и задачи по
курсу процессов и аппаратов химической технологии. - 8 изд. -Л.: Химия,
1976. -552 с.
УДК 547:681.3.06 (07)
МУ 40-19-97. Использование пакета прикладных программ для расчета
основных процессов и аппаратов химической технологии органических ве-
ществ: Методические указания к курсовому и дипломному проектированию/
Сост. А.В. Тарасов, Б.Н. Бычков. - Ярославль, 1997. - 31 с.
Рекомендуется для самостоятельного использования студентами при
технологических расчетах в процессе выполнения курсовых и дипломных
проектов. Содержатся материалы, кратко описывающие основные расчет-
ные зависимости, лежащие в основе предлагаемых программ, а также поря-
док подготовки и ввода необходимых исходных данных.
Предназначены для студентов специальности 2501, а также других хи-
мико-технологических специальностей, v
Ил. 1. Приложений 3. Библиогр. 12.* ,
Рецензенты: кафедра химической технологии органических веществ
Ярославского государственного технического университета; С.Ю. Павлов,
д-р техн, наук, проф., заместитель директора НИИ “^рсинтез”
© Ярославский государственный
технический университет, 1997
Введение
В ходе выполнения курсовых н дипломных проектов студенты специ-
альности "Химическая технология органических веществ" сталкиваются с
большим объемом трудоемких ручных расчетов, связанных с подбором
температурных параметров работы различных видов технологического
оборудования (ректификационные и абсорбционные аппараты, теплооб-
менные аппараты (конденсаторы, кипятильники и т.д.)), а также численным
нахождением корней уравнений в методе Андервуда (расчет флегмового
числа) и' методе Михайловского (материальный баланс ректификации).
Традиционно методом подбора решается уравнение Кремсера (расчет про-
цесса абсорбция), находится доля неполной конденсации (испарения) н др.
Существенная экономия времени возможна при применении для решения
подобных задач персональных компьютеров. Кроме того, существует ряд
методов расчета, например, паро-жидкостного равновесия, ректификации
с неидеальной жидкой или паровой фазой и др., которые вообще невоз-
можны без использования вычислительной техники. Компьютер может
быть использован и для быстрого поиска или расчета тех или иных свойств
органических соединений, необходимых для расчета.оборудования, а так-
же для выбора стандартизированных параметров различных видов обо-
рудования. С другой стороны, полная замена ручных расчетов вычисле-
ниями на ЭВМ нецелесообразна в связи с уходом от понимания студентами
физической сути процессов химической технологии. Поэтому сотрудни-
ками и студентами кафедры был разработан рад программ, не просто об-
легчающих ручные расчеты, ио и помогающих лучше усвоить лекционный
материал. В данном пособии кратко представлены основные расчетные за-
висимости, используемые студентами специальности ХТОВ при выполне-
нии курсовых и дипломных проектов и работ ( со ссылкой на соответ-
ствующую литературу), в также краткое описание имеющихся на кафедре
программ, реализующих эти зависимости, порядок подготовки и ввод в
программу необходимых для расчета исходных данных.
1. Расчет процессов паро-жидкостного равновесия
1.1. Теоретические основы процесса
-* •
В основе расчетов основных методов выделения и очистки продуктов
в процессах химической технологии лёжат законы паро-жидкостного рав-
новесия. В общем случае равновесие характеризует состояние на теорети-
ческой тарелке; на реальной же тарелке колонного аппарата равновесие не
достигается.
Однако широко использующаяся методика перехода от теоретических
к реальным тарелкам через коэффициент полезного действия позволяет ис-
пользовать эти законы для технологического расчета ректификационных и
абсорбционных аппаратов.
В общем случае равновесие характеризуется равенством фугитив-
ности i-ro компонента в паровой и жидкой фазах [1, с. 267]:
f±V - fi1 (1)
Фугитивность компонента в паровой фазе связана с давлением сле-
дующим образом:
fiv - ♦i.Yir₽ , (2)
«
где #i - коэффициент фугитивности i-ro компонента в паровой фазе. При
давлении менее нескольких атмосфер для большинства соединений можно
принять его равным 1 [1, с.268];
Xi - содержание i-ro компонента в газовой фа е;
Р - давление в системе.
Хорошим приближением для фугитивности компонента в жидкой фа-
зе можно считать выражение [1, с. 267]:
fi^ji-Xi-Pi” , (3)
где ji - коэффициент активности j-ro компонента в жидкой фазе;
Xi - содержание i-ro компонента в жидкой фазе;
Pi° - давление насыщенных паров i-ro компонента в жидкой фазе.
С учетом всего вышесказанного можно записать:
- 31-Х±.Р1° . (4)
При расчете состава, давления или температуры реальных многоком-
понентных смесей основные трудности возникают при определении коэф-
фициентов активностей i-ro компонента (давление насыщенных паров
чистого компонента легко найти в справочниках).
Если принять, что 31 “ 1, то уравнение (4) превращается в из-
вестный закон Рауля, представляющий лишь грубую аппроксимацию и
только для очень похожих компонентов. Поэтому коэффициент актив-
ности играет ключевую роль в расчетах равновесия жидкость-пар. Боль-
шинство применяемых в его расчетах методик основывается на строгом
термодинамическом соотношении, известном как уравнение Гиббса-Дю-
гема [1, с. 270]. Не останавливаясь на основных положениях н выводах из
него, приведем только наиболее часто использующееся в расчетах коэффи-
циентов активностей уравнение Вильсона, полученное на основании урав-
нения Гиббса-Дюгема (для двух компонентов):
in (Зх> —1П <X1+X.J2X.2) +Х2. (Х12/ (Xj+Xl2.X2) -А.21/ (Хг+Х21»Х1.) ) ,
in ( j2) —In (х2+Х21«Х1) +Х1» (Xi2/ (Х1+Л12.х2) -Х21/ (х2+Х21»хх) ) , (5)
Неизвестными величинами в уравнении Вильсона являются Хц2 н X2i
- параметры бинарного взаимодействия первого компонента со вторым и,
соответственно, второго с первым. В соответствующей литературе [1, 2]
приведены формулы для расчета коэффициентов активности и в многоком-
понентных смесях, однако в связи с их громоздкостью в данной работе они
не приводятся. Не менее популярным является и другое уравнение для рас-
четов коэффициентов активности - уравнение NRTL [1, с. 275], которое, од-
нако, содержит ие два, а три неизвестных параметра и требует большего ко-
личества исходных данных для их расчета.
1.2. Экспяриментал ное изучение паро-жидкостного
равновесия. Обработка результатов
Таким образом, расчет коэффициентов активности компонентов
жидкой смеси сводится к определению параметров бинарного взаимодей-
ствия в уравнении Вильсона или NRTL для всех возможных комбинаций
компонентов. Эти параметры для ряда бинарных систем приведены в ли-
тературе, например [2], а также могут быть найдены обработкой экспери-
ментальных данных о паро-жидкостном равновесии, полученных в ходе
выполнения лабораторного практикума на приборах Джиллеспи {2, 3] или
опубликованных в специальной литературе [4]. Считается, что эксперимен-
6
тальные данные удовлетворительно описываются с помощью уравнений
Вильсона или NRTL, если средняя квадратичная разность расчетных и экс-
периментальных давлений меньше -инструментальной точности экспери-
мента, (обычно 2-3 % относительных).
Поэтому параметры бинарного взаимодействия в уравнениях Виль-
сона, NRTL и других рассчитывают численными методами таким образом,
чтобы абсолютное значение функции F было минимальным:
tn
F = S( Pi,pac4. ~ Pi.sMcn. )> (6)
где m - число экспериментальных точек;
₽i, эксп, - экспериментальное давление системы;
₽1,расч. “ + За«Х2«₽2° • (7)
«
В качестве расчетных процедур можно использовать любые стандарт-.
ные методы поиска минимума функций [5]. J.
Для обсчета экспериментальных результатов изучения парожидкост-
* Q
ного равновесия разработана программа NRTL, в'роторой коэффициенты
бинарного взаимодействия уравнений Вильсона н NRTL отыскиваются
сначала с помощью метода Монте-Карло с последующим уточнением их е
помощью метода Ньютона [5]. В качестве исходных данных для расчета
требуется указать: в каких условиях (изобарических или изотермических)
снимался эксперимент, название разделяемой пары компонентов, их пара-
метры уравнения Антуаиа для расчета давления насыщенных паров
(приложение к пособию [1| ), общее число экспериментальных точек. Для
каждой экспериментальной, точки необходимо ввести:
• • равновесные составы жидкой и паровой фаз, в мольных долях;
• температуру, давление и весовой коэффициент, показывающий сте-
пень доверия данной экспериментальной точке (в общем случае -1 для каж-
дой точки).
Расчетные значения параметров бинарного взаимодействия выво-
пцггся на печаз ь вместе с исходными данными и полученными'расчетными
значениями составов, коэффициентов активности, давлений и ряда других
параметров для -аждой экспериментальной точки.
7
Полученные подобным образом параметры уравнений Вильсона и
NRTL можно использовать для расчета процессов ректификации с учетом
неидеальности жидкой фазы (раздел 2).
Поскольку первоначальные значения переменных задаются случай-
ным образом, а целевая функция имеет несколько локальных минимумов,
расчет рекомендуется повторить несколько раз для получения результата с
наилучшим описанием экспериментальных данных.
1.3. Теоретическое предсказание паро-жидкостного
равновесия
Экспериментальное изучение паро-жидкостного равновесия - дорого-
стоящее и трудоемкое мероприятие. Поэтому при отсутствии литератур-
ных данных или невозможности экспериментальных исследований
(например, отдельные примесные компоненты недоступны в чистом виде)
можно попытаться оценить коэффициенты активности компонентов с по-
мощью метода UNIFAC. В основу метода положена идея о том, что каж-
дая функциональная группа в молекуле ( например, -снз,-сна,-соон и
др. ) вносит свой определенный вклад в отклонение от идеального состоя-
ния жидкой фазы. Было сделано допущение, что этот вклад зависит только
от концентрации данной группы в смеси и не зависит от порядка связи раз-
личных групп в молекуле. Обработка большого объема эксперименталь-
ного материала позволила рассчитать параметры взаимодействия для более
чем 70-ти различных функциональных групп. К сожалению, в настоящее
время получить все возможные параметры не представляется возможным,
хотя для основных не экзотических групп такие параметры рассчитаны
[1, с. 314; 2, с. 214].
Метод UNIFAC позволяет рассчитать коэффициенты активности
произвольного количества компонентов в жидкой смеси. А на основании
коэффициентов активности компонентов бинарной смеси прн бесконечном
разбавлении возможен расчет параметров бинарного взаимодействия в
уравнении Вильсона. Эти параметры, как уже отмечалось, могут быть ис-
пользованы в расчетах паро-жидкостного равновесия на ЭВМ.
Программы FACT1, FACT2 и FACT3 реализуют указанный метод и
отличаются только набором групп для разбивки структурных формул из-
учаемых соединений. Кроме того, программы FACT1 и FACT2, в случае
отсутствия литературных значений каких либо. необходимых параметров,
не выдают решения, а программа FACT3 принимает отсутствующий пара-
метр равным нулю (идеальное состояние). Расчет, естественно, в этом слу-
чае будет менее точен.
Поскольку возможная погрешность метода колеблется от незначи-
тельной до 25 %, проводить расчет неидеальиой многокомпонентной рек-
тификации только на основании метода UNIFAC, особенно для ключевых
компонентов, очевидно не вполне корректно.
В приложении к пособию [1] приведены списки, номера групп и
несколько примеров разбивки структурных формул изучаемых соединений^
Проведи подобную разбивку вручную, в программу необходимо ввести число
и содержание компонентов в смеси, общее число различных групп и количе-
ство каждой группы в каждой молекуле. При выборе режима "расчет пара-
метров уравнения Вильсона" вычисление автоматически происходит дважды
для смеси, содержащей 0,0001 мольных долей сначала первого, а затем вто-
рого компонента соответственно. На печать выводятся либо коэффициенты
активности, либо параметры уравнения Вильсона (по выбору/
2. Расчет процессов ректификации
Одним из основных процессов разделения и очистки соединений в
промышленном производстве органических веществ является ректификация
[6-9]. Существует несколько подходов к моделированию (расчету) ректи-
фикационных аппаратов, отличающихся по сложности и полноте описа-
ния происходящих в колонне процессов, а также по способам решения си-
стем уравнений математической модели процесса. Графический расчет
процесса ректификации бинарных (двухкомпонентных) смесей с использо-
о'.нием у-х диаграммы является примером удобного, даже красивого руч-
ного расчета [ 7, с. 50], однако в общем случае для многокомпонентных
смесей подобных "ручных" методов не существует.
9
Одним из наиболее общеупотребнмых видов расчега является сле-
дующий: записывается система уравнений теплового и материального ба-
ланса для каждой (обычно теоретической) тарелки аппарата, а также для
кипятильника и конденсатора [6, с. 83] (см. рисунок);
Ls-i.Xi^i-fG;+WB) .yi^-(LB+UB) •Xi1B+Gn+i.yi,B+i+Fn •z<^i=0 (8)
Ln^JljK,n-l-(Gn+Wn)«Hii>n*(IJii+Un)*hjK,n +Gn+l-Hn,n+l+Fn’bjK,f =
“АНхол,в (9 j
yi,n=ki,a.Xi,n; Zxi,H=l; £yi,n=l; (10)
i=i i=i
ki,B= di)
Pi°--exp(Ai-Bi / (Ci+t)); (12)
n=2...(N-l),
где N - число теоретических тарелок в аппарате;
L - живость, стекающая с вышележащей тарелки, кмоль/с;
G - пар, поднимающийся на вышележащую тарелку, кмоль/с;
W - боковой отбор в виде пара, кмоль/с;
U - боковой отбор в виде жидкости, кмоль/с;
F - питание, поступающее на тарелку, кмоль/с;
Нп - энтальпия пара, кДж/кг;
h« - энтальпия жидкости, кДж/кг;
АНхол - тепло, вносимое или отбираемое с данной тарелки, кДж/кг;
А(, Bi, Cj - параметры уравнения антуана для расчега давления на-
сыщенных паров.
Совместное решение приведенных уравнений возможно только с по-
мощью специальных математических процедур и невозможно без примене-
ния вычислительной техники. Часто, с целью упрощения решения задачи,
приведенную выше систему уравнений сводят к более простой за счет при-
нятия некоторых допущений. Например допущение об идеальности паро-
вой и жидкой фазы Приводит к упрощению расчета константы фазового
равновесия до простой зависимости Ki«₽i°/₽. Допущение о незначитель-
ности изменения энтальпий паровых и жидких потоков по высоте аппарат а
приводит к постоянству расхода паров и жидкого орошения на любой
тарелке аппарата и, как следствие, к исключению из модели аппарата урав-
нений теплового баланса. Однако без использования ЭВМ оставшуюся си-
стему уравнений все равно не решить. Довольно часто в расчетах делается
допущение об идеальности паровой фазы и постоянстве расходов парового
и жидкого потоков по высоте аппарата, а учет неидеальности жидкой фазы
производится с помощью уравнений NRTL или Вильсона. Во всех описан-
ных выше случаях решение задачи производится методом "поверочного"
расчета, при котором для’ задания числовых значений необходимых мно-
жителей в системе уравнений (8-12) приходится задаваться числом тарелок
(теоретических), количеством и составом питания, количеством дистилля-
та, кубового продукта, боковых отборов по пару и жидкости (если они
есть), а также количеством орошения (или флегмовым числом). Необходи-
мо также зафиксировать и положение тарелки (тарелок) питания. При по-
добном задании исходных данных решение системы уравнений даст поль-
зователю профиль температур и потоков, а также составы жидкости и пара
на каждой тар' хе аппарата, в том числе и составы дистиллята и кубового'
11
продукта. Меняя те или иные параметры работы колонны (давление, число
тарелок и положение тарелки пиаания, количество дистиллята или ороше-
ния) и повторяя расчет, пользователь как-бы проверяет, как будет работать
в этом случае колонна. Поэтому расчет и называют "поверочным". Необ-
ходимо подчеркнуть, что, как правило, расчет приходится повторять мно-
гократно, чтобы получить удовлетворительный по всем параметрам ре-
зультат. Это связано с большими затратами машинного времени, что и яв-
ляется единственной причиной, заставляющей упрощать полную систему
уравнений математического описания процесса. В случае одновременного
допущения идеальности паровой и жидкой фаз, а также и постоянства рас-
хода потоков на каждой тарелке колонны, удается найти и аналитическое
решение системы уравнений (8-12). Это делает возможным "проектный"
расчет основных параметров ректификационного оборудования, причем
даже без использования вычислительной техники. И хотя мы говорим об
этих методах в самом конце, исторически сложилось так, что именно они
наиболее часто используются (или по крайней мере использовались) для
расчета ректификации многокомпонентных смесей, близких к идеальным.
Так, решение уравнений материального баланса в методе, предложенном
Михайловским [ 8, с. 131], сводится к нахождению настроечного параметра
No, удовлетворяющего следующим условиям:
п
X(xk,d.F.Xi,f)/(D.xkrd+W.xk/W-(ak/ai)No+1, (13)
где JC]c,a и xk,w - содержание ключевого компонента в дистилляте н кубе
соответственно.
Решение уравнения (13) заключается в нахождении такого значения
No, при котором сумма концентраций компонента в дистилляте (Хх±,а)
будет равна 1. При известном количестве дистиллята D, питания г и кубо-
вого остатка w можно рассчитать и состав кубового продукта.
Для расчета минимального флегмового числа по методу Андервуда
подбирают настроечный параметр Q, удовлетворяющий следующему ра-
венству [ 7, с. 96]:
п
S < at- Q ) - 1-q, (14)
i-i
где q - доля питания в жидкой фазе.
12
Само флегмовое число вычисляют по формуле [ 7, с. 96]
Ptnin+1 - z (xi/d«ai)/( <Xi- Q) . (15)
Минимальное теоретическое число тарелок рассчитывают по уравне-
нию Фенске-Андервуда
Hnin в 19 ( ( Xju.K.d/Xj.x.d) • (Xt.k.w/Xj.k.w) ) /IQ (Ct) , (16)
где Xn.K.d,XP.K.d,XT.K.w,X/I.K.w - содержание легкого и тяжелого
ключевых компонентов в дистилляте и кубе соответственно, а а - их отно-
сительная летучесть при средних условиях в колонне.
Минимизация объема (а значит и цены) аппарата производят по ме-
тоду Джиллиленда [ 7, с. 97], хотя этот показатель в настоящее время не
впоЛне соответствует оптимальным параметрам процесса в целом. Ряд дру-
гих, более современных критериев оптимизации приведены в специальной
литературе, например [9].
Все выше перечисленные подходы реализованы в следующих про-
граммах:
1. Программа REKTIF5. Расчет процесса ректификации нефтей, ши-
роких нефтяных фракций и индивидуальных углеводородов в простых и
сложных ректификационных колоннах с произвольным числом точек ввода
питания, количеством боковых отборов по пару и жидкости и количеством
выносных циркуляционных орошений. Паровая и жидкая фаза рассмат-
риваются как идеальные, расчет давлений насыщенных паров компонентов
производится по уравнению Ашворта [9, с. 40 ], расчет энтальпий паровой
и жидкой фаз по уравнениям из [9, с. 46]. Система уравнений теплового и
материального баланса решается методом, предложенным в работе [6,с. 83].
В пакет программ входит также программа подготовки файла с ис-
ходными данными для расчета (программа POD2) и программа обработки
результатов расчета (программа OBR). Для расчета необходимо подгото-
о вить следующие исходные данные:
• средняя температура кипения, молекулярная масса и плотность в Нем3
для каждого компонента (нефтяной фракции); *
• число тариюк аколонне;
• общее число точек вводов йитания;
13
• номер тарелки, куда подается питание (тарелки нумеруются снизу ко-
лЛны); расход питания на эту тарелку, кг/ч; температура, с которой питание
подается эту тарелку, “С и состав пн линия, в массовых долях, подаваемый на
эту тарелку для каждого поток:’ питания;
- ♦ наличие холоднльника-д«ф»егматора вверху колонны (Y/N);
/ • флегмовое число в колонне;
• температура во флегмовой емкости, °C;
* отбор дистнллятатл жидкой фазе, кг/ч;
: • отбор дистшимта в паровой фазе, кг/ч;
• наличие кипятильника внизу колонны (Y/N);
• число боковых отборов по пару и жидкости, не считая отбора дистил-
лята и куба;
• номер тарелки отбора и расход отбора, кг/ч для каждого отбора;
• наличие в колонне циркуляционных орошений (Y/N), и если они име-
। ются, то их число;
• номер тарелки вывода циркуляционного орошения; расход орошения,
кг/ч и расход жидкости, проваливающейся с вышележащей тарелки, кг/ч
(для каждого орошения);
• ориентировочно диаметр колонны , м; давление верха и низа колонны,
в мм рт ст; температуры верха и низа колонны, °C ; средние молекулярные
массы для верха и низа колонны;
• подача водяного пара в низ колонны (Y/N), и если пар подается, то рас-
ход водяного пара, подаваемого в низ колонны, кг/ч.
По окончании ввода этой информации пользователь задает нмя фай-
ла исходных данных, в который будет записана введенная информация.
^Для последующих расчетов нет необходимости создавать этот файл заново,
достаточно изменить некоторые цифры в нем с помощью любого текстово-
го редактора.
Хочется отметить, что эта программа рассчитана только на хорошо
подготовленных д ля подобных расчетов пользователей.
2. Программа REKT. Производит поверочный расчет многокомпо-
нентной ректификации с учетом неидеальности жидкой фазы с помощью
уравнения Вильсона при допущения постоянства материальных потоков
в»
внутри отдельных секций аппарата. Решение системы уравнений матери-
ального баланса производится методом "трехдиагональных матриц"
[10, с. 266]. Для расчета необходимо подготовить следующие исходные дан-
ные:
• число компонентов;
• число теоретических тарелок в колонне;
• параметры уравнения Антуана и молекулярная масса для каждого
компонента;
• параметры бинарного взаимодействия всех возможных пар компонен-
тов для уравнения Вильсона (если смесь иеидеальная);
• число точек ввода питания, и для каждого ввода номер тарелки, долю
питания в паровой фазе иа этой тарелке, состав питания в мольных долях и
его количество в кмоль/ч;
• количество дистиллята, кмоль/ч; ,
• флегмовое число колонны;
• точность расчета( 0,001 „0,0001);
• давление верха колонны, МПа;
• перепад давления на 1 тарелке, Мпа. ® .
По окончании ввода этой информации пользователь задает имя фай-
ла исходных данных, в который будет записана введенная информация.
Для последующих расчетов нет необходимости создавать этот файл заново,
достаточно изменить некоторые цифры в нем с помощью любого текстово-
го редактора.
Хочется отметить, что и эта программа предназначена только для хо
рошо подготовленных для подобных расчетов пользователей.
3. Программа MRS. Проектный расчет процессов многокомпонент-
ной ректификации идеальных смесей с использованием для расчета матери-
ального баланса метода Михайловского (см. уравнение (13)), для расчета
минимального флегмового числа - метода Андервуда (см. уравнение (15))
для расчета минимального числа тарелок - уравнения Фенске - Андервуда
(16), а для оптимизации параметров колонны - метод Джиллиленда [7, с.97].
Для нахождения корней в вышеназванных уравнениях используется метод
деления отрезка пополам [5]. Для расчета необходимо подготовить сле-
дующие данные
15
• коэффициент относительной летучести ( по отношению к тяжелому
ключевому компоненту ) при температуре питания; молекулярная масса; со-
держание в питании, кмоль/ч для каждого компонента:
• номера легкого и тяжелого ключевых компонентов;
• содержание легкого ключевого компонента в кубе и содержание тяже-
лого ключевого компонента в дистилляте, кмоль/ч.
Имеется вариант этой программы, дополнительно рассчитывающий
и температурный режим работы колонны, для чего необходимо ввести
вместо коэффициентов относительной летучести компонентов параметры
уравнения Антуана (давление рассчитывается в миллиметрах ртутного
столба, температура в Кельвинах) н давление верха колонны . Эта про-
грамма - REKTIF.
Обе эти программы позволяют в диалоговом режиме исправлять не-
правильно введенные исходные данные или менять некоторые параметры и
повторять расчет. Окончательные результаты расчетов можно вывести по
выбору на экран компьютера или на печать.
3. Гидравлический расчет колонных аппаратов
В результате, технологического расчета основных параметров ректи-
фикационных и абсорбционных аппаратов становятся известны давление,
температура, составы и расходы технологических потоков. На их основе
можно определить плотность, вязкость, поверхностное натяжение и другие
физико-химические свойства внешних и внутренних потоков в колонне.
Следующим этапом в расчете колонного аппарата является определе-
ние его диаметра, межтарельчатого расстояния и некоторых конструк-
тивных размеров внутренних устройств колонны, обеспечивающих устой-
чивую и эффективную работу колонного-аппарата. Эти величины получа-
ют в результате гидравли ескрго расчета тарельчатых аппаратов.
Существует большое количество методик подобного расчета [7,с.171],
однако в основу программ KOLP, SIKL и SITO гидравлического расчета
колпачковых, ситчатоклапанных и ситчатых тарелок положен отраслевой
стандарт Министерства химического и нефтяного машиностроения
“Аппараты колонные тарельчатые” {11]. В эти программы заложен основ-
16
ной ряд тестированных типоразмеров указанных видов тарелок, из кото-
рого и выбирается наиболее подходящий. Необходимы для расчета сле-
дующие исходные данные:
• нагрузка по жидкости, кг/с;
• нагрузка по пару, кг/с;
• плотность жидкости, кг/м3;
• плотность пара, кг/м3;
• допустимое гидравлическое сопротивление тарелки, Па;
• коэффициент уменьшения нагрузки по питанию;
• коэффициент увеличения нагрузки по питанию;
• коэффициент вснениваемости ( см. прил. П);
• исходная глубина барботажа, м ( см. прил. И),
• диаметр отверстия сита, м (д ля ситчатых тарелок);
• поверхностное натяжение жидкости, мН/м.
в
Диаметр отверстия сита принять равным 0,005 м, в случае сред без
механических примесей, инкрустаций и прочих загрязнений, а также при
коррозийной активности разделяемой смеси. Диаметр отверстия сита при-
нять равным 0,008 м в случае наличия загрязнений и некоррозионн, ix и
слабо коррозионных сред.
4. Расчет теплообменных аппаратов
Одним из наиболее часто встречающихся видов технологического
оборудования на химических предприятиях являются теплообменники.
Среди них наиболее распространены кожухотрубчатые теплообменные ап-
параты. Основной расчетной величиной при их'выборе является требуемая
поверхность теплопередачи, определяемая по формуле [12, с Л 70]
F»Q/(K.At), (17)
где Q - тепловая нагрузка на аппарат, Вт;
к - коэффициент теплопередачи, Вт/(м2.К);
At - средняя движущая сила процесса, рС или К.
Наибольшая техническая трудность возникает при определении ко
эффициента теплопередачи К, в основе расчета которого лежат известные
17
критериальные и эмпирические зависимости. Сам коэффициент теплопере-
дачи рассчитывается по формуле [12, с. 170]
K-l/(l/ai+l/a2+X 81/11)), {18}
где «1 и a2 - частные коэффициенты теплоотдачи для холодного и горя-
чего теплоносителя, а E8i/li - сумма термических загрязнений на стенках
аппарата [12,с. 507].
Термические сопротивления стенок и загрязнений являются справоч-
ными величинами, а коэффициенты теплоотдачи зависят от того, внутри
или снаружи труб движется или испаряется жидкость или конденсируется
пар, а сами трубы могут быть расположены горизонтально или вертикаль-
но.
Так, для конденсирующегося пара на горизонтальном пучке труб a
рассчитывают по формуле [12, с. 166]
а - 2,02.1.(р2.п«Ь/(p«G) )0,33, (19)
где п и L -число и длина труб в трубном пучке теплообменника;
1 - коэффициент теплопроводности конденсат" Вт/(м.К);
р - плотность конденсата, кг/м9;
р - вязкость конденсата, Па/с;
G - расход конденсирующего пара, кг/с.
При кипении жидкости внутри вертикальных труб а рассчитывают
по формуле [12, с.167]
a - 0,075.(Х+1О.(Рп/рж))~О'Овб.(12/<Умт.Тю<п))О'33.дО'е6, (20)
где v - коэффициент кинематической вязкости жидкости;
a - поверхностное натяжение, Н/м;
q - удельная тепловая нагрузка, Вт/м2.
При теплоотдаче при турбулентном движении жидкости внутри труб
коэффициент теплоотдачи считают по формуле [12, с. 156]
а - l/L.O,P7.1.Re0,08.I?r0'43.(Pr/PrOT)0'25 , (21)
° где Re и Рг критерии Рейнольдца и Прандтля соответственно.
При поперечном обтекании пучка труб (межтрубное пространство)
коэффициент теплоотдачи считают по формуле [12, с. 159]
a - X/L.0,4.Ra0'6.Pr°'36-(₽r/PrCT)°'25.0,85 .
18
Эти и ряд других расчетных зависимостей реализованы в программе
ТЕРЬО. Программа производит расчет и выбор из стандартного ряда го-
ризонтальных кожухотрубчатых теплообменников, подогревателей, де-
флегматоров и вертикальных термосиф^нных кипятильников. В зависи-
мости от типа рассчитываемого теплообменника в качестве исходных дан-
ных требуются следующие величины:
1. Для расчета горизонтальных кожухотрубчатых подогревателей
(греющий агент - водяной пар):
а) для трубного пространства (рабочий поток - нагревающаяся жидкость):
• расход теплоносителя, кг/ч;
• плотность теплоносителя, кг/м1;
• средняя теплоемкость потока, кДж/кг;
• начальная и конечная температуры потока, °C;
• динамический коэффициент вязкости, Па°с;
• коэффициент теплопроводности, Вт/(м-К).
б) для межтрубного пространства (рабочий поток - конденсирующийся во-
дяной пар):
• расход теплоносителя, кг/ч;
• начальная и конечная температуры потока, °C;
• скрытая теплота испарения, кДж/кг.
2. Для расчета горизонтальных кожухотрубчатых дефлегматоров:
а) доя трубного пространства (рабочий поток - нагревающаяся жидкость):
• расход теплоносителя, кг/ч;
* плотность теплоносителя, кг/м1;
• средняя теплоемкость потока, кДж/кг,
• начальная и конечная температуры потока,°C;
• динамический коэффициент вязкости, Пя»с;
• коэффициент теплопроводности, Вт/(м.К).
б) для межтрубного пространства (рабочий поток - конденсирующийся
пар):
• расход теплоносителя, кг/ч;
19
• плотность теплоносителя, кг/м3;
• плотность конденсата, кг/м1;
• начальная и конечная температуры потока, °C;
• скрытая теплота испарения, кДж/кг,
® динамический коэффициент вязкости, Па«с;
• коэффициент теплопроводности, Вт/(м»К).
I
3. Для расчета горизонтальных кожухотрубчатых теплообменников
для каждого потока:
• начальная и конечная температура, °C;
» массовый расход, кг/ч;
« плотность потока, кг/м1;
• теплоемкость потока, кДж/кг;
® вязкость потока, Па«с;
• коэффициент теплопроводности потока, Вт/(К.м).
4. Для расчета вертикальных кожухогпубчатых кипятильников
(греющий агент-водяной пар):
а) для трубного пространства:
• тепловая нагрузка на кипятильник, Вт;
• плотность испаряющейся жидкости, кг/м1;
• плотность образующегося пара, кг/м1;
» начальная и конечная температуры потока, “С;
• скрытая теплота испарения, кДж/кг;
• динамический коэффициент вязкости жидкости при температуре кипе-
ния, Па-с;
• коэффициент теплопроводности, Вт/(м-К);
• поверхностное натяжение, Н/м.
б) для межтрубного пространства:
• расход теплоносителя, кг/ч;
• начальная и конечная температуры патока, °C;
® скрытая теплота испарения, кДж/кг.
20
5.Расчёт физико-химических свойств веществ
Несмотря на огромное количество справочных данных по свойствам
веществ, невозможно себе представить^что когда-нибудь будут иметься все
экспериментальные данные по свойствам многих тысяч веществ, представ-
ляющих интерес для науки и техники.
Поэтому всё большее значение приобретают методы предсказания
свойств чистых соединений на основе теории или на основе корреляции
экспериментальных значений. В настоящее время используются два раз-
личных подхода к расчету физико-химических свойств соединений. Один
из иих - принцип (закон) соответственных состояний.
Этот принцип состоит в том, что те свойства, которые зависят от
межмолекулярных сил, Связаны с критическими свойствами дня всех ве-
ществ одинаков<2.дЭто единственный, наиболее общий (и надо сказать
удобный) базис для разработки корреляций ирасчётных методов.
В таких корреляциях приведенные давление объем и температура вы-
ражаются в виде доли критического свойства:
•Pr=P/₽o; Vr=V/Va; Тг»Т/Тс. (23)
К сожалению, принцип соответствующих состояний менее точен для
сильно полярных соединений, что заставляет усложнять известные методи-
ки или разрабатывать новые. Поэтому, в случае, когда нельзя выявить на-
дежной зависимости между приведенными параметрами и свойствами ве-
ществ, приходится прибегать к эмпирическим методам расчета. Нельзя ска-
зать, что это хуже, потому что часто эмпирические зависимости более точ-
ны, но для них нельзя гарантировать одинаковую точность для всех ве-
ществ (они не базируются на какой-либо общей для всех соединений тео-
рии).
Таким образом, для расчета свойств соединений в случае практиче-
ски полного отсутствия какой-либо экспериментальной информации
(кроме структуры соединения и температуры кипения при атмосферном
(или другом) давлении), необходимо предварительно рассчитать (найти)
некоторые его константы, которые наиболее полно характеризуют это ве-
щество.
Среди таких констант наиболее часто используются критическая тем-
пература, . критическое давление и критический объём. Одним из удобных
21
методов их расчета является метод Лидерсена [1, с. 19]. Метод использует
структурные составляющие для определения критических температуры,
давления, объема (Та, Ра, Vo) . Расчет ведется по формулам:
Тс - ТЬ.(0,5б7+£ДТ-(ЕДТ)21-1 , (24)
Рс - М*(0,34 + 1ДР)-2 , (25)
Vo - 40 + LAV , (26)
где Дт , ДР , ДУ определяются как вклад каждой структурной группы
молекулы в критическую температуру, давление и объём, а М - молеку-
лярная масса соединения, 1
Структурные сост (ляющие для разбивки структурных формул сое-
динений представлены в прил. III.
Точность расчета по методу Лидерсена довольно высока; ошибка для
тс составляет обычно меньше 2 % (реже 5 %), для ₽с и vc как для Тс, но
возможны и удвоенные значения.
Одной из характеристических констант чистого вещества является
фактор ацентричности и [1,с. 26]:
-In ₽о-5,92714+6,09648нЭ'1+1,28862*1п Q-0,169347Ц)6
*----------------------------------------------j, (27)
15,2518-15,6875*0 -13,4721-ln О+0,43577Щ6
ГД® Q “ ТЬ/Тс .
Эта величина отвечает за несферичность молекул и в некоторой сте-
пени характеризует её полярность. Применимость корреляций, исполь-
зующих фактор ацентричности, должна ограничиваться нормальными га-
зами и жидкостями, ни в коем случае не следует использовать такие корре-
ляции для сильно полярных веществ и соединений с водородными связями.
В настоящее время разработано достаточное количество различных мето-
дик для предсказания различных свойств органических соединений.
Jaavea* плоежостж жидкости
Из всех имеющихся методов расчета плотности жидкости наиболее
точным считается метод Ганна и Ямады [1, с. 66].
22
Метод требует для расчета знание одного значения плотности жид-
кости при какой-либо температуре (роп и Ton) :
Vr°(TrF)r[l-w.r. (TrR) ]
Р * Pon" (28)
Vr°(Tr).[l-w.r.(Tr) ]
где тг” - топ/то;
Vr° « 0,33593-0,33953.Тг+1,51941.1г8-2,02512.TeS+l,11422.Tr4
(если 0,2 < тг < 0,8) или
Vr° « 1,0+1,3. (1-Тг) 0'5.1п(1-Тг) -0,50879- (1-Тг) -0,91534. (1-Тг) 8
(если 0,8 < Tr < 1);
2
Г - 0,29607 - 0,09045 . Тг - 0,04842 • Тг .
Точность метода обычно очень высока, если используются точные
значения опорной плотности и критической температуры, ошибка обычно
меньше 1 %.
Расчет теплоемкости жидкости
Имеются несколько методов расчета теплоемкости жидкости, осно-
ванных как на методах групповых составляющих, дающих обычно боль-
шую точность, так и на использовании принципа соответственных состав-
ляющих. Последние методы более удобны с точки зрения реализации их на
ЭВМ, из ряда примерно одинаковых по точности методов можно выделить
достаточно простой метод Штерлинга и Брауна (I, с. 150], в качестве осно-
вы для расчета использующий значение теплоемкости газа при постоянном
давлении Ср°. Эта величина может быть найдена как из справочных дан-
ных, так и на основе метода групповых составляющих; Ср° обычно пред-
ставляется в виде полинома от температуры:
Ср° - А + В-Т + с.!8 + D.T3. (30)
Значения констант А, В, С И D можно взять из приложения к пособию
[1] или рассчитать по методу Рихани и Дорэсвейми [1, с. 207].
Ошибка в методе Штерлиига и Брауна составляет до 20...30 % и зави-
сит от класса вещества (для полярных - хуже) и от точности исходных кон-
стант для расчета.
23
Расчет давления насыщенных паров жидкостей
Для удобного представления зависимости "давление пара-
температура" чаще всего используется уравнение Антуана In(P,f)=A-
В/(С+Т). Параметры А, В, С в этом уравнении находят по эксперимен-
тальным данным "давление пара-температура" методом наименьших квад-
ратов. Для предсказания этой зависимости предлагается несколько мето-
дов, одинаковых по точности расчета (примерно 1...3 %), (например, урав-
нение Риделя-Планка-Миллера [1, с. 177]
G
In (Pv₽.760.Pc)~ - --- (l-Tx2+k.(3+Tr).(l-Tr)3) , (31)
Tr
где G - 0,4835+0,4605.1»;
In Ра
h « ТЬ/Тс-----------;
1-ТЬ/То
1»/G - (1+ТЬ/Тс)
к . -------------------.
(3+ТЬ/То) <1-ТЬ/Та)2
где ТЬ * нормальная температура кипения жидкости.
Расчет теплоты парообразования «истого соединения
Удобной для использования является корреляция с применением фак-
тора ацентричиости Питцера [1, с. 185]
AHv - Н.Тс7,08 (1-Тг)0'354+1С , 95.W. (1-Тг)0 ’456 , (32)
Формула достаточно точна и может быть использована при значении
Тг > 0,6.
Расчет вязкости жидкости
До сих пор еще не разработано ни одной корреляции для расчёта вяз-
кости жидкостей в широком интервале температур с использованием прин-
ципа соответствующих состояний. Известны несколько эмпирических ме-
24
тодов расчета на основе групповых составляющих, все они не отличаются
особой точностью (ошибка может достигать 50 %).
В приложении к пособию [1] даны значения констант VISB и VISTO,
полученные обработкой экспериментальных данных и позволяющие точно
определить вязкость жидкости по формуле:
1g Ц « VTSB«( (1/Т) - (1/VTSTO).) . (33)
В случае отсутствия этих констант в справочнике можно грубо оце-
нить вязкость жидкости с помощью метода Морриса [1, с. 384].
Расчет коэффициента теплопроводности чистых жидкостей
Для неуглеводородов может быть использована формула [1, с. 453]:
2,64710'3 3+20 (1-Тг)2/3
Л - --------------------------— . (Э4)
ц ,э 3+20 (1-ТЬ/То)2,3
Возможная ошибка формулы в среднем 10-15 %.
Для всех органических жидкостей можно воспользоваться формулой,
предложенной Миссенаром:
3+20 (1-тг)2/3
Л . Ко------------------- (35}
3+20 (1-273/Тс) 2/3
84.10"6. (ТЬ-Ро)0 ’’.СрЮ
Ро - плотность жидкости при 0 ° С, моль/см3;
Cpio - теплоемкость жидкости при 0 ° С, кал/(моль«К);
N - число атомов в молекуле.
Точность этой формулы не выше предыдущей.
Расчет поверхностного натяжения чистых жидкостей
Для полярных жидкостей можно воспользоваться формулой [1, с.518]
о - Рс2/3.тс1/3^р.( ----- )го , (36)
' 0,4
где Qp - 0,lS74+0,369-w-l,769-X-13,697.X2-0,51.w2+l,298,w.X;
ш = 0,210+0, S385-W-14,61«Х-32,07-Х2-!, 656»wZ+22,03-w-X;
25
X - lg ₽vj>r+l,70«w+l,552,
где Pvpr - приведенное давление паров при Тг-0,6.
Для неполярных соединений справедливо следующее выражение
[1.С.518]:
о - ₽о2/3.Тс1/3«0« (1-Тг)11/9 , (37)
ТЬ/Toln Ра
где Q»0,1207«(l+ ------------)-0,281.
1-ТЬ/Тс
Возможная ошибка обоих методов в пределах 5-10 %.
Расчет свойств ор лнических соединений, необходимых для техноло-
гических расчетов (теплоемкость, плотность, теплота парообразования,
давление насыщенных паров, вязкость жидкости и газа) иа основе этих и
ряда других зависимостей из пособия [1] может быть реализован в двух ва-
риантах. первый вариант основан иа ряде констант, приведенных в прило-
жении к работе [1J, которые можно использовать в расчете свойств веществ:
температура кипения, опорная плотность, критические температура, давле-
ние, объём; параметры интерполяционных уравн. лий д ля расчета давления
•насыщенных паров соединения, вязкости жидкости, теплоемкости жид-
кости и другие. Программа, использующая эти исходные данные, называет-
ся SVO2.
Второй вариант основан на приведенных выше зависимостях 'для рас-
чета тех же свойств соединений на основе только структурной формулы и
температуры кипения соединения (программа SVOISTVA).
Для расчета на ПЭВМ свойств индивидуальных веществ
(теплоемкости, давления насыщенных паров, вязкости, плотности, тепло-
проводности и скрытой теплоты парообразования) на основе групповых
составляющих необходимо подготовить:
• название соединения;
• структурную формулу соединения;
• брутто формулу:
• групповые составляющие для расчета критических параметров по ме-
тоду Лндерсеиа (см. прил. Ш);
• температуру кипения соединения при атмосферном давлении, "С.
26
Список принятых обозначений к разделу 5
то - критическая температура, К
Ра - критическое давление, атмл
Vo - критический объём, см3/моль
ть - температура кипения при атмосферном давлении, К
и - молекулярная масса соединения
тг « т/то - приведенная температура
Рг « Р/Рс - приведенное давление
Vr « v/vo - приведенный объём
V - мольный объём, см’/моль
р - плотность жидкости, г/см3
R - универсальная газовая постоянная, 1,98 кал/(моль.К)
Сро - идеально-газовая теплоемкость, кал/(моль.К)
Pvp - давление насыщенных паров, мм рт. ст.
AHv - теплота парообразования, кЛл/моль
ц - вязкость, сП
X - теплопроводность жидкости, кал/(моль.К)
Ср1 - теплоемкость жидкости, кал/(моль.К)
<т - поверхностное натяжение жидкости, дин/см.
27
ПРИЛОЖЕНИЕ I
Список групп для равбивки соединений при расчете
по методу UNTFAC ( программа FACT1)
1 -сн,
2 -СН2-
3 -сн<
4 XX
5 СН2-СН-
б -сн-сн-
7 СН2«С<
в ~са=с<
9 М>С<
10 АСИ
11 АС-
12 АССН3
13 ACCHj-
14 АССН<
15 -ОН
16 СН30Н
17 Н2О
18 АСОН
19 СН3СО-
20 -СН2СО-
21 -СНО
22 СН3СОО-
23 -СНгСОО-
24 НСОО-
25 СН30-
26 -CHjO-
27 XLH-O-
28 ₽СН2О-
о 29 СНзКН2
30 -CHjNHj
31 >СНЫН2
32 СН3»Н-
гекоан 2СН» + 4СН2;
2-метилпропан ЗСНз + СН
2,2-диметилпропан 4СН3 + XX
гекоек-1 СН» + ЗСН2 + сн2»сн
гексен-2 2СН3 + 2СН2 + СН=СН
2-метилбутеи-1 2СН3 + СН2 ♦ СН2«С
2-метилбутен-2 ЗСН3 + СН=С
2,З-диметилбутёи-2 4СН3 + С“С ч
бензол 6АСН
стирол 5АСН + АС + СН2“СН
толуол 5АСН + АССН3
этилбензол 5АСН + ДССН2 + СН3
кумол 5АСН + АССН + 2СН3
пропаиол-2 2СН3 + СН + ОН
метанол
вода
фенол 5АСН + АСОН
ацетон СН3СО ♦ СН3
пентанои-3 2СН3 + СН2 +СН2С0
ацетальдегид СН3 + СНО
бутилацетат СН3 + ЗСН2 + СН3СОО
бутилпрописнат 2СН3 + ЗСН2 + СН2СОО
етилформиат СН3 + СН2 + НСОО
диметиловкй эфир СН3 + СН3О
диэтиловый эфир 2СНЭ + СН2 + СН2О
диизопропиловый эфир 4СН3 + СН + СН-О
тетр ?гидрофуран ЗСН2 + FCH2O
метиламии
пропиламми СН3 + СН2 ♦ СН2МН2
иэолропиламнн 2СН3 + CHNH2
и ».Д.
28
33 -сн2кн- 50 -CC12- 67 -CsC-
34 >CHNH- 51 -CHCI3 68 CH38OCH3
35 CH3N< 52 -CC13 69 ACRY
36 -ch2n< 53 CC14 (акрилонитрил)
37 ACNH2 54 ACC1 70 >C-CC1-
38 C5HsN 55 СНэНО2 71 АСУ
39 C5H4N- 56 -CH2NO2 72 DMFA
40 CSH3N< 57 >chno2 73 -DMF-
41 CH3CN 58 ACNO2 (диэтилформамид
2 -CH2CN 59 CS2 2CH3 + DMF)
43 -COOH 60 CH3SH 74 -CF3
44 НСООН 61 -CH2SH 75 -CF2t
45 -СНгС1 62 фурфурол . 76 >CF~
46 -CHC1- 63 (CH2OH) 2 -COO-
47 -ССК 64 -I (Эфирная
48 CH2C12 65 -Br группа
49 -CHC12 66 CH»C- для третичкохчэ углерода)
Список групп, используемых в расчетах
по методу "UNIFAC" (для программы FACT2)
1) СН3, 2) СН2, 3) СН, 4) С, 5) СН"СН2, 6) СН-СН, 7) СН-С,
8) СН2-С, 9) АСН, 10) АС, 11) АССН3, 12) АССН2, 13) АССН,
14) СН2СН2ОН, 15) СНОНСНз, 16) CHOHCHj, 17) СН3СН2ОН,
18) СНСНлОН, 19) СНзОН, 20) И2О, 21) АСОН, 22) СН3СО, 23) СНаСО,
24) СНО, 25) СООСНз, 26) СООСН2, 27) СН3О, 28) СН20 , 29) СН-О,
30) ГСН2О, 31) СНзМНз, 32) СН2НН2, 33) CHNHj, 34) CH3NH,
35) СН2МН, 36) CHNH, 37) ACNHj, 38) СН3СН, 39) СН2СН, 40) СООН,
41) НСООН, 42) СН2С1, 43) СНС1, 44) СС1, 45) СН2С12, 46) СНС12,
47) СС12, 48) СНС1Э, 49) СС13, 50) СС14, 51) АСС1, 52) СНзМО2,
53) CH2NO2, 54) СНМО2, 55) ACNO2, 56) С&2.
Примеры разбивки молекул на группы:
этан - 2СНз, пропан - 2СН3+СН2, изобутан - ЗСН3+СН
1-бутен - СН=СН2+СН2+СНз, 2-бутен - СН»СН+2СН3
бензол - 6АСН, толуол - 5АСН+АССН3, этилбензол - 5АСН+
АССН2+СНз, этанол - СН3СН20Н, метанол - СН30Н, изопропанол -
СНОНСН3+СН3, вода - Н2О, фенол - 5АСН+АСОН, ацетон - СН3СО+- СН3,
пропионовый альдегид - СН3+СН2+СНО и т.д.
29
ПРИЛОЖЕНИЕ II
Рекомендуемые значения глубины барботажа
Пази— грч процесса глубина барботажа, м
Вакуумная колонка (рабочее давление 0,004 до 0,025 включ. МПа) 0,030
Атмосферная колонна (рабочее давление от 0,025 до 0,3 вжлюч. МПа) 0,050
Колонна под средним давлением (от 0,65 МПа включительно) 0,3 до 0,075
Коломна под повышенным давлением (свыше 0,65 МПа) 0,100
Коэффициент всленнваемости
Система Процесс к
Непеиявдося , Ректификация нефти,углеводородных гавов,кроме легких углеводородов типа метана и этана 1,00
Слабопеияямеся •тористые системы (фреон) 0,90
Умеренно пенящиеся Атмосферная переработка нефти, углеводородные абсорберы и де- сорберы, аминокь’э и гликолевые регенераторы 0,85
Сильно Вакуумная перегонка мазута, аминовые и гликолевые абсорберы, глицерин,
пенящиеся
Очень сильно пекявдося деметанизаторы Разделение метилэтилкетонов 0,75 0,60
Стойкая пена Очистка средств протравки, мокяцих веществ 0,15
30
ПРИЛОЖЕНИЕ III
Список групп для разбивки струкгурной формулы соединений при расчете их
критических свойств по методу Л вдерсена
(программ;/!’ SVOISTVA)
Нециклические составлякарсах
1. -СН3 4. >с< 7. -С< 10. с-
2. -CHS- 5. -CHi 8. -С»
3. >сн- в. =сн- 9. сн.
Циклические (включая ароматические) асатазлявдне:
11. -сн2- 12. хн-
13. >с< 14. -СН-
15. «=С< 16. •О
Прочие группы:
17. -Г фтор 18. -C1 хлор
19. -Вг бром 20. -I йод
21. -ОН спирты 22. -0К фенолы
23. -0- эфиры вне кольца 24. -0- «фирм 8 кольцо
25. -СО- кетоны вне кольца 26. -СО- кетоны в
27. -СНО альдегиды 28. кольце -COOH кислоты
29. -СО-О- сл.эфиры 30. "0 остальные
31. 32. -КН2 -NH- вне кольца 33. -ИН- в кольце
34. -М< вне кольца * 35. -К< и кольца
36. -СМ 37. -но-.
38. -SH тиолы 40. -S- сульфиды 8
39. —S— сульфиды вне кольца 41. кольце =8
Примеры разбивки соединений на хруиловые составляющие:
СНз-СНэ (этак) состоит из двух групп СН3 (номер 1) ;
СН3-СО-СН3 (ацетон) из двух групп СНЭ и одной -СО- (номер 25) ;
СН3—СН2—СН2-СН3 (бутан) - две группы СНз к две СН2:
бензол состоит из шести трупп =СН- из циклического ряда и
т.Д.
31
Литература
1. Рид Р., Праусниц Д., Шервуд Т. Свойства газов и жидкостей: Спра-
вочное пособие / Пер. с англ.; Под ред. Б.И. Соколова.- 3-е изд., перераб. и
доп. - Л.: Хийия, 1982. - 592 с.
2. Павлов С.Ю. Выделение и очистка мономеров для синтетического
каучука. - Л.: Химия, 1987. - 232 с.
3. МУ 40-01-93. Химическая технология органических веществ: Мето-
дические указания к лабораторным работам / Сост. Е.П.Тепеницина. -
Яросл. политехи, ии-т. - Ярославль, 1993. -132 с.
4. Коган В.Б., Фр 1ман В.М., Кафаров В.В. Равновесие между жид-
костью и паром. - Л.: Наука, 1966. -2 т.
5. Эберт К., Эдерер X. Компьютеры. Применение в химии. Пер. с нем.
- М.: Мир, 1988. - 416 с., ил.
6. Александров И.А. Ректификационные н абсорбционные аппараты.
Методы расчета и основы конструирования. - М.: Химия, 1971. - 296 с.
7, Александров И.А. Ректификационные и абсорбционные аппараты.
Методы расчета и основы конструирования. -3-е i :д#/ перераб. - М.: Химия,
1978. - 280 с.
8. Стабннков В.Н.. Ректификационные аппараты. Расчет и конструи-
рование. - М.: Изд-во. Машиностроение, 1965. -353 с.
9. Александров И.А. Перегонка и ректификация в нефтепереработке. -
М.; Химия, 1981. -352 с.
10. Кафаров В.В., Ветохин В.Н;, Бояринов А.И. Программирование и
вычислительные методы в химии и химической технологии. - М.: Наука,
1972.-487 с.
11. ОСТ 26-01-1488-83. Аппараты кол ?нные тарельчатые. Метод тех-
нологического и гидродинамического расчета.
12. Павлов К.Ф.,Романков П.Г.,Носков А.А. Примеры и задачи по
курсу процессов и аппаратов химической технологии. - 8 изд. -Л.: Химия,
1976. -552 с.