Автор: Рид Р. Праусниц Дж. Шервуд Т.
Теги: физика химические технологии
ISBN: [54-13-| 54-14]: 54.03/.4 (031)
Год: 1982
Текст
СОДЕРЖАНИЕ
От рсдак iopa перевода
Прсдпс.юв не
Глава 1. ОПРЕДЕЛЕНИЕ ФИТИКО ХИМИЧЕСКИХ СВОЙСТВ 12
] 1. Введение
] 2 Расчет свойств
1.3. Типы расчешых методов
1 4. Организация книги
Лктержура
12
13
14
Глава 2. ХАРАКТЕРИСТИЧЕСКИЕ КОНСТАНТЫ ЧИСТЬ/Х
КОМПОНЕНТОВ 19
2.1 Содержанке главы 19
2.2 Критические свойсва 19
2 3 Фактор анентричности 26
2 4 Точки плавления и кипения 27
2.5. Дипольные моменты 27
2.6. Фактор полярности Стила 28
2 7. Параметры потенциалов межмолскуляриою взаимодействия 28
Обозначения 30
Литература 30
Глава 3 СООТНОШЕНИЯ МЕЖДУ ДАВЛЕНИЕМ, ОБЪЕМОМ
И ТЕМПЕРАТУРОЙ ЧИСТЫХ ГАЗОВ И ЖИДКОСТЕЙ
3 1 Содержание главы
3.2 . Двух параметрические корреляции
3.3 Трехпараметричсскнс корреляции
3.4 Аналитические уравнения состояния
3.5 . Уравнение сосгояния Редлиха — Квонг.»
3 6. Уравнение состояния Барнера - Адлера
3.7. Уравнение состояния Суги —Л»о
3.8. Уравнение состояния Бенедикта — Вебба — Рубина
3.9. Обобщенные формы уравнения состояния Беиедики — Вебба —
Рубина
3 10 Уравнение состояния Ли — Эрбара — Эдмистера
3.11 Вириа.чьное уравнение
3.12 Обсуждение соотношении для определения Р — V— Т свойств чи-
стых газов
3 13. Р — V - Т свойства жидкоси’й — общие положения
3 14 Определение мольного об»,ем.» жидкости при нормальной темпера-
туре кипения
3,15. Определение плотности жидкостей
3 16. Обсуждение методов определения ii.k>hiocim жидкостей
Обозначения
Литература
3]
31
34
44
60
72
Глава Т. КОМБИНАЦИОННЫЕ ПРАВИЛА ДЛЯ СМЕСЕЙ
4.1 Содержание главы
4.2 Методы, основанные на 11снот|.зовлчнн нрштонпа спогветсгве|Ии>'х
состояний для CMCCCII
76
Уравнение состоянии Варнера — \д »ера
Уравнение состояния Сути — Лк»
Уравнение состояния Венедикта — Вебба - Рубина
5
Вторые нирнальные коэффншкт, гы л тя
Правила смешения
Обозначения
Литература
Глма 5 ТСРЫОДИНАМИЧССКИР СВОЙСТВУ
5.1 Содержание главы
5 2 Основные термодинамические причинны
5.3 Функции отклонении оз идеально, о состояния
5 4 Вычисление функций отклонения от нделтьного состоянии
5.5 Производные свойства
5.Ь Теплоемкость реальных газев
5.7 Истанные крптпческие точки смесей
а.9 Парофазиая фугишвт-ОстЬ компонента смеси
Обозначения
Литература
Ггаваб ДАВЛЕНИЯ ВАРОВ И ТЕПЛОТЫ ПАРООБРАЗОВАНИЯ
чистых жидкостей
Содержание главы
Теории и корреляции остова jHn'e на использовании , рн i,iti;:.i сочт
Корреляция Л нт уа на д.,я давления паров
Уравнение Риделя дтя давления пироп
Сравнение Фроста--Колкуорфа Тодоса для дазлеиия карст
Уравнение Риделя - Планка — Мил тера для лалюния и<'|'ов
Уравнение Теча — Стиля для давления паров
Корреляционное уравнения
Обсуждение методов рас-етл н корреляциг дсв'Си'И inpon. реко-
мендации
Ге мота парообразования спетых веществ
ментальным значениям давления паров
расист ХНу на основании при.шина сот тветсгвепчых состоянии
РаСчст пг> уравнениям для давления паров
Теплота парообразования при нормачпеой температуре кипения
дацип
6.18 Те.i.ioia -г.шипения
6.19 Теплота субтима'ии
Обозначения
Литература
Г,аеа7. ТГР.ИОДИНАХУИЧГСКИГ СВОЙСТВА
Г AJA
7.3 Идеальногазовая теплоемкость
7.4 . Стандартная теплота образования
7.5 Идеяльнотл твоя энтропия
ИДСА ТЫ/01 О
204
205
240
Обозначения
Глава 8. НАРОГАЭОЖИДКОСТНОЕ РАВНОВЕСИЕ В МНОГО-
КОМПОНЕНТНЫХ СИСТЕМАХ
263
Глава 9 ВЯМ\ОСГЬ
(.одержание главы
Определение и единицы измерения вязкости
Теория вязкости и других переносных свойстн газ,<
Расчат вязкости газов при низких давлениях
Вязкое^ газовых смесей при низких давлениях
Влияние давлении на вязкость чистых газов
Влияние давления на вязкость газовых смесей
Вязкость жидкостей
Влияние ьысокого давления па вязкость жидкостей при
низких
Влияние температуры на пязкоегь жидкостей
Расчгг вязкости жидкостей при низких темпера гурах
Расчет вязкости жидкостей при ш.теоких температурах
Обозначения
346
346
346
347
349
360
368
376
379
379
380
382
399
401
405
406
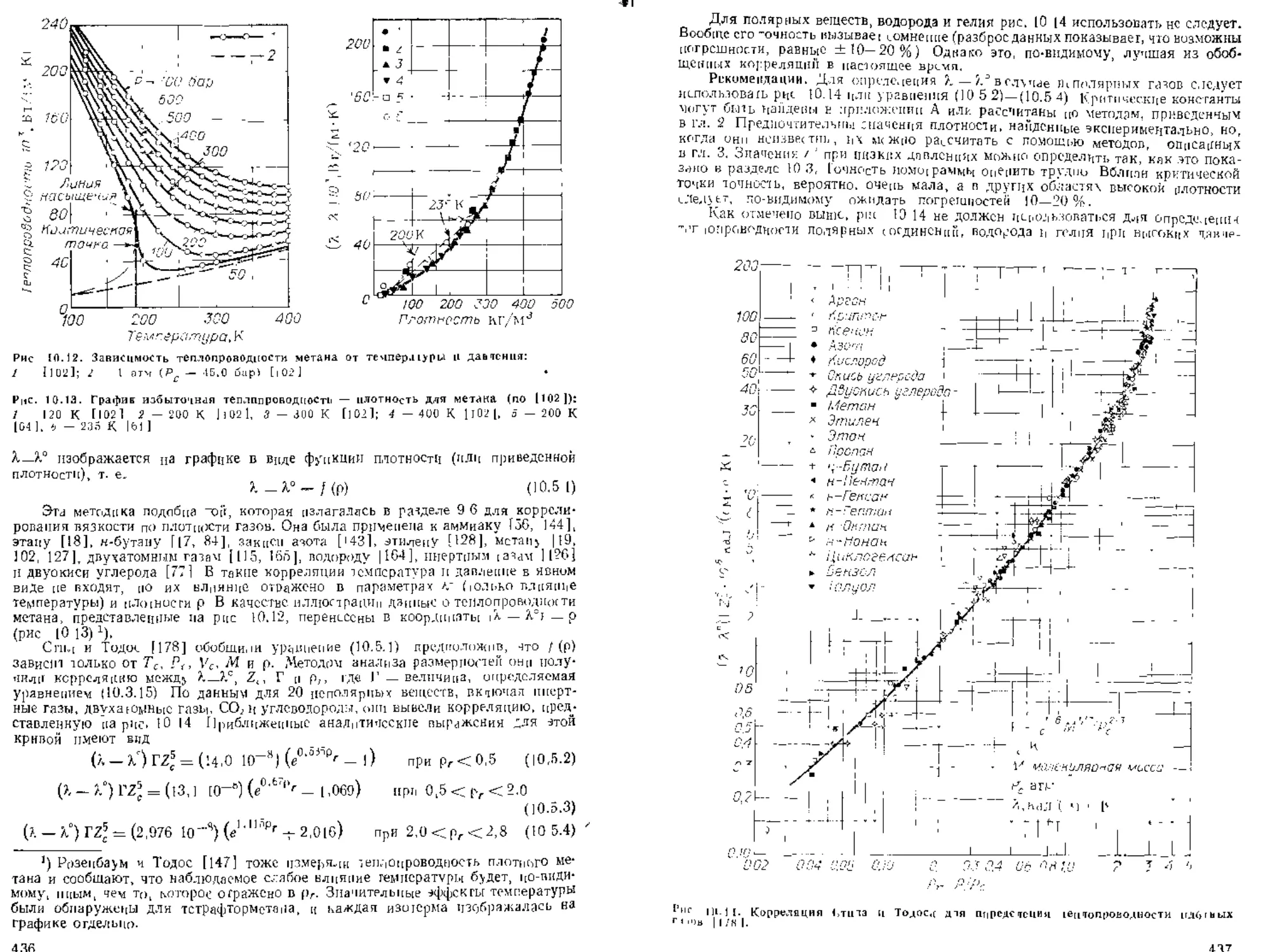
Глава !<) ГЕН ПОП РОВОЛНОСТЬ 4|0
10 I. Содержание ытавы
10 2. Теория теп.юпрозодиости газов
10 3. Теп-тогровол।.ость многоатомных газон
10 4. Влияние температурь, на тенлогроводность газов при низких да-
влениях
sO.o. Вливиие давлеипд на тестпРоВоддссть г^зов
10 6. Теплопроводность газовых смесей поп низких давлениях
ТО 7. В.тиями? levneparypbi и давтевпя па теплопроводность газовых
смесей
10 8. Теплопроводное) ь жидкое гей
10 9 Расчет теплопроводности чистых жидкостсп
10 |0 Втиянпс тем гературы па теплопроводность жидкостей
10 II Влияние jan.TO iuu на теплопроводности Дчндкостсй
|о.12 Теплопроводность смесей жидкгкттей
Обозначения
Литература
•ж
11 4 Коэффи । и, u (гы диффузии н бинарных г,изо вых системах i рп и из 141х
давлениях эмпирические корреляции
11.5. Сравнение методов расиста коэффициентов диффузии в бинарных
газовых системах при низких давлениях
II С. Втияиие давления на диффузию в газах
11.7. Влияние температуры на диффузию в газах
II 8. Диффузия в Многокомпонентных газовых смесях
11.9. Диффузия в жидкостях теория
II 10. Расчет коэффициентов диффузии в бинарных ягиДких смесях пр t
бесконечном разбав.теннн
II.II. Котреттрационнзя зависимость коэффициент диффузии в бинар-
ных смесях жидкостей
11.12. Влияние температуры на диффузию в жидкостях
II 13. Диффузия в многокомпонентных смесях жидкостей
11.14. Диффузия в растворах электролитов
Обозначения
Литература
485
•194
505
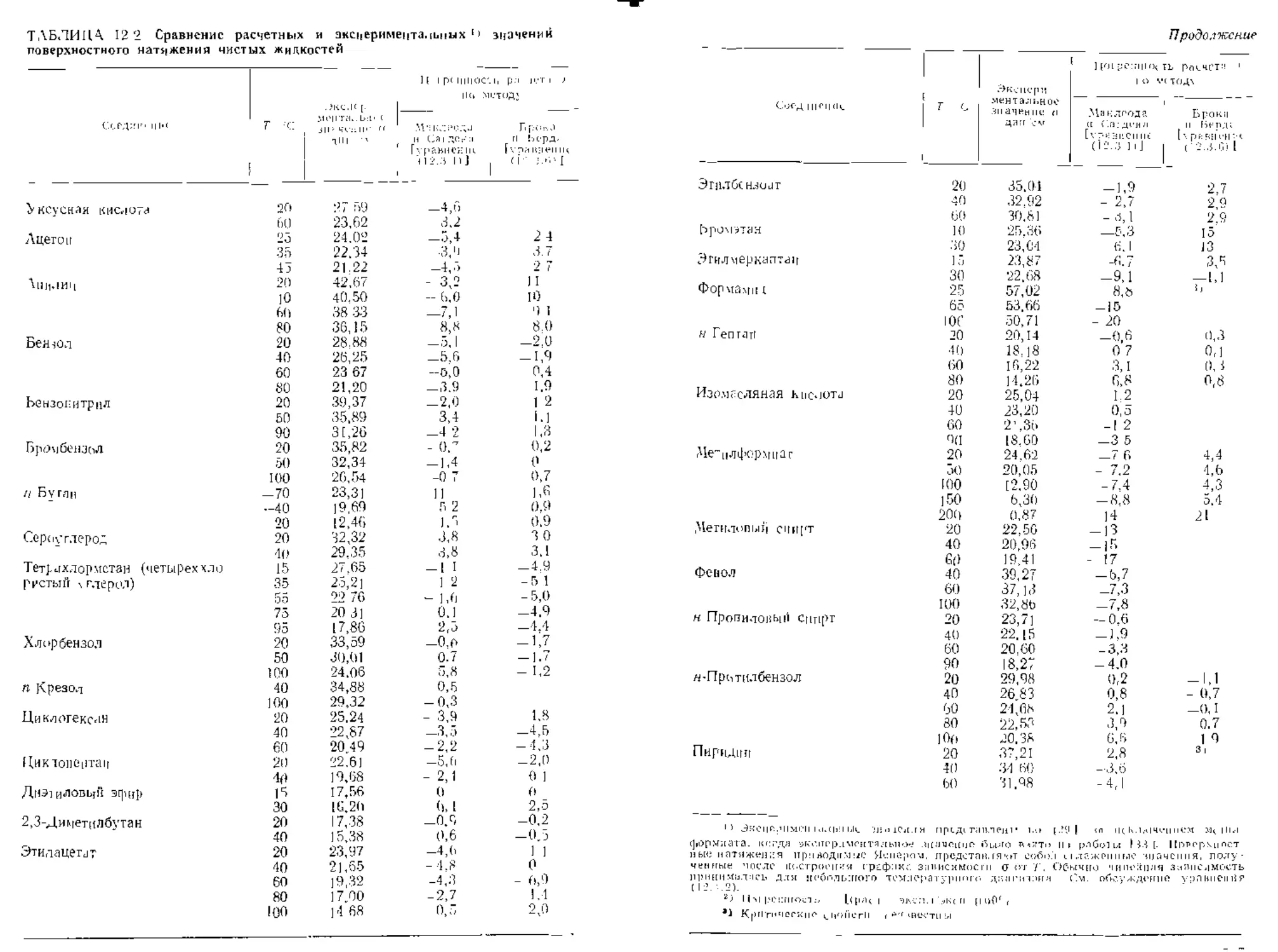
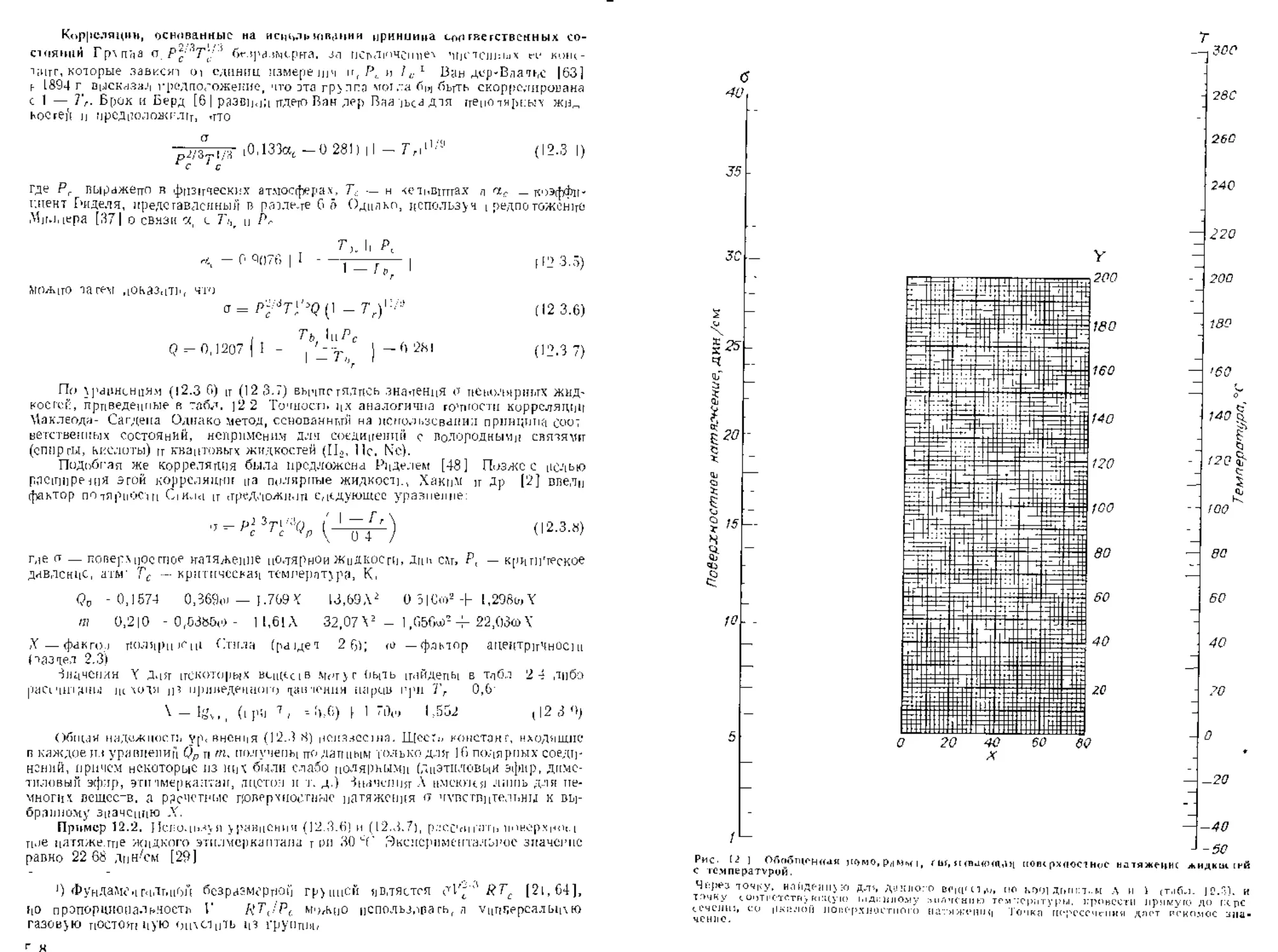
Г.ниа /2. ПОВЕРХНОСТНОЕ НАТЯЖЕНИЕ
12.1. Содержание ьлавы 512
12.2. Введение 513
12 3. Расчет тюве тхпостпого натяжения чистых жидкостей 513
|2.4 Изменение поверхностного натяжевня с темгературоц 521
12.5. Поверхностное натяжение неводных смесей 523
12.6. ] юверхностцое ггагяже,чис водных р.четворов 528
Обозначения 531
Литература 532
Приложение А БАЗА ДАННЫХ ПО СВОЙСТВАМ 533
Приижение В. СЛОВАРЬ СОЕДИНЕНИИ ПО
Приложение С. ПАРАМЕТРЫ ПОТЕНЦИАЛА ДЕННАРДА -
ДЖОНСА, ОПРЕДЕЛЕННЫЕ ПО ДАННЫМ
0 ВЯЗКОСТИ ">79
Предметный указатель 581
ОТ РЕДАКТОРА ПЕРЕВОДА
Оптимальная разрабо,ка процессов химической технологии и аппаратуры ддя
их проведения возможна лишь при наличии падежной информации по пара-
метрам фазового равновесия и ,еплофизическим свойствам химических соедине-
ний н их смесей, составляющим от 50 до 90 % исходных данных при проектирова-
нии Для практики предрсч-итсльными являются экспериментальные данные,
однако п< определение в широких интервалах параметрон состояния и составов
бывает затруднительным, а ино,да и просто невозможным. В значительном числе
случаев инженеру приходится обращаться к расчету свойств.
кисго.тс.г ыми. Особую популярность завоевало второе издание кнцгр «Свойства
газ<ш и жидкостей’, перевод которой опубликован в Советском Союзе в 1971 г.
В |977 г выш.ю в свет третье амер ик." некое издание. Годом раньше скончался
проф. I К Шервуд, внесший большой вклад в создание «Свойств газов и жидко-
Более 60 % методик, описанных в пивом издании — новые, более совершен-
ные, а оставшийся материал подвергся сущес-вениой критической переработке.
В книге появилась большая глава о расчесе параметров парогазожидкостного
равновесия, которая будет особенно интересна читателям, так как по расчету
фазового равновесия за последние годы у нас значительных публикаций нс было.
Присутствие этом главы в книге во многом связано с появлением в коллективе ав-
-орс® проф./!ж. М I !рауспица, который на протяжении многих лет является приз-
нанным лидером зарубежной прикладной термодинамики фазового равновесия.
Самостоятельную ценность представляет и собрание характеристических кон-
1Танг нескольких сотен веществ, которое может составить осюву информацион-
ного <.>беС1'Счеш1Я машинных систем расчета свойств.
Книга Р. Рида, Дж- Праусчинл и Т. Шервуда интересна не тотько по содер-
жанию, с-ща привлекает к себе внимание отточенностью форм изложения, хоро
лим языком, ясной струит у рой, полнотой перекрестных ссылок, общей направлен-
ностью па реализацию расчетных методов на ЭВМ.
Этот справочник ио расчетам свойств газов и жкдкоС|ей будет безусловно
полезен инженерам занятым исследованием и разработкой цооиессов и аппара-
тов химической техполг>Г1ш
Перевод книги на русский язык выпол ten М М. Гиндиной. Следует отмоешь
также участие в работе сотрудников лаборатории автоматизации проектирова-
ния Ден! 1И14химмаша Г М Бельчиковой и Е Б. Войцеховской, которые реализо-
вали на ЭВМ значительную часть описанных в книге методов в рамках программ-
ной системы расчета тспдофизическнх свойств СИФАР.
ПРЕДИСЛОВИЕ
Информация о надежных значениях свойств материалов необходима при разра
ботке и проведении промышленных процессов. На протяжении многих лег собран'
н обработано огромное количесгио данных, но быстрый прогресс технологии в ш'
ных областях постоянно поддерживает существенный разрыв между потребностью
в данных н их наличием. Инженер все еще вынужден полагаться в пс[гвую очерет.!
на здравый смысл, на опыт п на разнообразные методы расета физнко х'имическ и
свойств.
свойств чистых компонентов и смесей, ди плении панов и тепло i (разовых переходов
теплоемкостей, поверхностного иатяжениг, вязкости, теплопроводности, коэфф
циецтип диффузии и параметров фазового равновесия. Для (емонстранин степени
надежности того или иного ме~ода приводя гем таблицы цравнемну рзечетных
данных с экспериментальными. Большинство методоз проиллюстрировано при
мерами В меньшей степени сравнения к примеры характерны для ме-одов, Кд
торыс, с точки зрения авторов, менее ирнгодны и ценны дли практического нспол
зовапия, По мере возможное!!! и тексте приведены рекомендации О'иосителыы1
наилучщих методов определения каждого свойства и наиболее надежных мето-
дик экстраполяции и интерполяции имеющихся д.зииых
Несмотря на то, что книга предназначается для инженеров, занимающихся
практической Деятельностью а конкретно для специалисток но р,заработке гм
П(»лоп!ЧСских процессов них аппаратурному оформлению, она может быть потезпн
для всех инженеров и научных вабстнпкод, имеющих дето с жидкостям.! и г.
Первое издание этой книги было ш.уб.гикова.чо и 1958 г , а второ; в 19Ы,
Каждое издание является по существу новой книгой, гак как новые расчетные мс
। оды появляются ежегодно а в течение 8—10 лет белее ранние методы замепяюгс ।
более точными или более общими Большинство новых мотоюв щ, силой природе —
эмпирические, хотя часто имеются теоретические предпосылки д.чя корреляций;
по мере возможности в книге приводятся теологические положзнпя с целью обос-
нования продла, аемсго расчетного метода
Третье мадпрпс характеризуется двумя ‘-.зяниыми еггли'шге.чьиычц чертам:..
•ьогл института за новые групповые составляющие илеалыюгазовых свойств.
I У )бр ХЗ(П ЦП II тьн я |няитиияЧ1б рпэрия Т Д1ИНГТ Н1 1 3 чрлдцн
д I I V Г I F HI! 3 I п ОТВ ( I 1
1)11 I II 1 Т 1 ! (Ml с н |Н щи н ПЬН 14 ПН4 н I НЗЯ з Г 1 атогич Г пзг I
очень пом( ipm. гпоомотрев материалы рукописи, качающиеся кплопрювоДиочн
„.ичкогтгй ( 1> Врс (енелщ. Т. Я-к. Фаррел. Т С Кролнконскни и J Бак
бЮшии! Кпроинч'Н (роявили исключительное сотрудничество tipri иртцчесчо.ч
II м тр н ш и f 1 ( и i II г зц | -Щ ч вых идей п мет дш- j i hi и в
г г । гн 1| ( « I । । rli 13 дзрны ыти
I 1 1 1 | з t 1 Г 11 1 1 I 13-T1IL ь I в 11 I- ill Ь И In ( M t из < >ил )
< ь I " I' ] < । ( 5\ 1 т ine I ч 1 1 л I t П
Темикл:-!. Ф. \ .1, 1я.ТЬ(н (ЩЦЩСрСИТСТ ВатерЛОО], Э Мэсои (\ниье1)Щ1ТеГ
р.рщца) 1 В-.н-Воль.-чЩ (Евразом!. П. Э. .Тили (университет Псдью) и Л Fall
vol-д.-р- (Нанипнальнля физическая лаоораторня, Тедлинпон)
Мы |'‘.'1.4год-,риы Марин Пенг за со терпение и мастерство при печатаний р» ПО-
Il н п \ г I I МН I Ч 1 НЬЬ II ICSHLll J CI I I
Нэнси Рид мы О0Я3.1НЫ выразить осооую признательность. Помимо у-пстия
в) г tilt а п I unit inn тяни Де Hcipni inn Bi исмх из тьнут
। тоггчщость располагать лгтера-ерпьн ссылки, выступила с разумной критики!!
t^ooepm с >'иа
Л'кон М. Прошении
Тапас К. Шервуд
равновесия пар -жидкость и жидкое^—жидкость, о приложение Л представляет
собой базу дачных, который содержит наиболее важные константы для 468 ор-
ганических и неорганических веществ Подготовка этих таблиц была начата
Нэнси Рид. которая более год,, исследовала литературные источники. CIcpBi.in
вариант таблиц был тросмотрен сотрудникам! нескольких промышленных кор
поранпн которые добавили недостающие ла иные и сообщили с расхождениях с дан-
ными, содержащимися п их базах. Мы искренне благодарны за подпит, /У р. Вро
девельду и Т. Щж. Фаррелу из «Юииои Карбайд» (. . Ф CncHCeiiy и С Ь Адлере
из «Ке.члог-Пуллмеп», Р. Н Джонсону и J. Домешу из «Эксон Г^иссрч Вид Энджя-
'тчрнпг», А. X. Ларсену из «Монсаитоо, И. Л Чью из «|Делл Дивелопченть н
С. ф Чью из «Хоякоь».
Несмотря на то что окончательный выбор |'еком<’нт\ег,ых методов был вссгд >
варианты глав и делали ценные критические замечания, 13 других случаях мы
получали копии неонуб-гиковарных работ, содеуж.тврже в некоторых случаях кор
реляции, которые была лучпе опубликованных. Особую благодарность авторы вы-
ражаю! Т Э. Доберту и Р. П. Ленперу из университета штата Пепсйльвдппя за
материалы Американского нефтяного института, Дж. Эрблру из университета
штата Оклахома За предоставление параметров Главе для смесей и аз ознакомле-
ние с новыми разработками в области вязкости жидкостей, А. Петер щ <Cira'.r
10
Глада 1
ОПРЕДЕЛЕНИЕ ФИЗИКО-ХИМИЧЕСКИХ
СВОЙСТВ
1.1. ВВЕДЕНИЕ
р J С. Slalcr I’liysicss. McGi du -Hill, Nc^ York, [955
1ЮШИМСЯДС
1.2. РАСЧЕТ СВОЙСТВ
— RT
несколько уменьшаетеи
1-3- ТИПЫ РАСЧЕТНЫХ МЕТОДОВ
рошо
Методы, цаиболсе точные в общем с-'УчаЗ. могут быть ic самыми лучшими
дтя конкретной цели. Дня многих инженерных Задач треб\к>тся вообще-то лишь
приближенные значения свойств, н тогда прсдиочтнте-тьнсе простой расчетный
никаких), чем более точная, но сложная корреляция. При низких и умеренных
давлениях инженерами используется простой 1азовый закон, хотя они распо-
лагают и более точными корреляциями. Совсем не просто длть совет, когда следует
отказаться от более простого и отдать предпочтение более сложному, но и более
iочному методу
Принцип (таков) соответственных состоянии. Оч кв-тястск обобтетцеч
юг о положения, что те свойства, которые зависят от межмодекулярцых сил. свя-
заны с критическими свойствами для всех веществ одинаково. Это единственный
наиболее важный базис Для разработки корреляций и расчетных методов, Ван-
дер Ваальс показал, что э-цуг принцип должен быть теоретически справедлив для
всех веществ, Р—V—Т свойства которых могут быть описана лвухкопстаитным
уравнением состояния, та к им как уравнение ('). Пи также справедлив, если меж-
молекулярпая потенциальная фхнкция требует только двух характеристических
параметров Закон хорошо выпе-тпяетгя не только для самых простых молекул,
но п во мио! их других случаях, когда ориентация молекул нс является настолько
важной, как, например, для полярных молекул или молекул с водородными cusp
для многих неполярных веществ Представляет собой почти постоянную величину
порядка 0.27, то корреляция упрощается и Z для больнюя группу соединений
является функцией только Рг и 7\. Разработанные н.т этой базе корзелядци от-
клонений от и.деалнпогазопого закона представлены в гл 3
Успешное использование принципа соответственных состояний для кор-
реляции Р—V—Т данных явилось причиной появления многих подобных кор-
реляций других свойств, зависящих в первую очереди от межмолекулярных сил-
Многие из них оказались, однако, бесполезными для ннжечеров-пэактико»
Очень распространены модификации закона, разработанные с целью повышения
точности дли простоты использования. Путем выражения йЛр в виде йункшн, Рг
н Тг получены хорошие корреляции вяекости газов при высоких давлениях.
Но гак как Mi известна -;и>пь в редких случаях и рассчитать ее совеем непросто,
эта величина в других корреляциях была заменена на Т|о5 или на группу
U1 6 Здесь Т|с — вязкость ира Тс, по при низком давлении, 1]^ — вяз-
кость при температуре Т и низком давлении; группа, включающая М, Р, и Т,,
получена методом анализа размерностей. Могут быть предложены и другие спо-
собы использования т] , каждый из которых основан на принципе соответственных
состояний, нс все они являются эмпирическими в смысле приложения к перенос-
riH\1 свойствам
Аналогичным ценным ба ищом для разработки расчетных методов является
Статистическая механика Умваения, описывзюшпе Различные свойства, вклю-
чая переносные, выводятся из выражение для функции потенциальной энергии
межмолекулярного взаимодействия. Эта функция во многом эмпирична, однако
результирующие узависнин лля свойств удивительно нечувствительны т. потен-
функции оказываются весьма подходящими для некоторых систем. Как и для
принцип? соответственных состояний, отклонения от резулмтфующих уравне-
ний можно обработать эмпирически.
Неполярные и полярные молекулы. I loPe.neriiie < ферниосм) ецммсfpii'iirrr\
молекул, например С1Ц, хорошо описывается двухкоистаптным законом соответ-
1.4. ОРГАНИЗАЦИЯ КНИГИ
Налесные экспери!чс1|Тальпыр Лл
I 11 нпг п л\ 1ешще i i it i tmi
Различные расчетные методы, кот;
) р ex е |
н л д I
ьорреляини ггадеЗ'Гы -.•О.ц.ко г «t:-y;ini
1 Г Р t I D 1(1
Т т 1 т
очевь близко к действительному, и расчетное зн
в компрессоре также находится в хорошем сопл
против д04 фудЗ'Ч на I т продукта. (Эгс число ха,
компрессора.1 Линии постоянной энтропии п.з ри.
депо, что алиаоатл. гроходятая через точку лл-.
НиГ. I < >11 LI11.111
ристики i n-Hoiuei’Mc
Дтг использования оольшичства расчетны?
а в приложении А даны таолний их пиле
в гл.о—о. В этих главах Приводятся наиоолее точные уравнения состоят!*
Однако Даны также и фундаментальные термодинамические соотношеиин. котоот
могут оыть примерены к другим уравнениям состояния, сети они окажутся оо.ж
приемлемыми для конкретных целей применения-
веществ, теплоемкости, теплоте образования и airrpoiiii i 1ь сопоржи" otno
методов расчега и корреляции фазового равновесия. В гл. *) 11 'пиемиаются м<.
тоды расчета вязкости, теплопроводности и коэффициентов диффузии Поверх
постное натяжение кратко рассмотрено в гд ]д
(льем использованной литературы оказался очень в.-лик. Списки -ч нтеое гц
ных ссылок, помещенные в конце каждой главы, отражают просмотренный м.лч
окал лишь частично. Иа большого числа известных расчетных методов тля де,ал.
ними. Однако никакое сравнение нельзя считать адсква^
даеыых П|'1'ре|Ип<1Стеи в случае новых соединении. (.редис,
•геннс по(решности. —.................... ' - ................-
приводимое в таблицах сравнения.
неприменимость метола для неркольг
поедет явления
только па ЭВМ. Едва ли это следует считать недостатком. посьо.т1.к’
время вычислительные машины широко ряспрост ранены, вол^шую m.. ..
тическом освоении сложных корреляции оказывают настольные клавишные з'ВМ.
1 1НШП0 01 н! И П\ тярными В (1 с ГЦ ДНИс ГЧДЦ X тя о Г * Я I -
который является довольно произвольным.
деяться, что потребность в таких методах и в книгах подооною р
шаться по мере получения экспериментально!! информации н д<
। аГ т>е lip ,ц в xiiMri 1
и прикладном пауке
1 ИТР 1'ЛТУРА
ХАРАКТЕРИСТИЧЕСКИЕ КОНСТАНТЫ
ЧИСТЫХ ВЕЩЕСТВ
2.1. СОДЕРЖАНИЕ ГЛАВЫ
.2. КРИТИЧЕСКИЕ
СВОЙСТВА
Равнениям
ис'.-i । L v)
I - Ш I
(2 2 3)
19
SG — удельный вес жидкого углеводорода при 60 Д', отчесеиньнй к y.ic'Kaovv
веем воды при той же температуре.
)i настонтцее время нельзя распространи । ь корреляцию Нокэя ца углеводороды,
которые можно отнести к различным классам соединений, нащ ииер ароматические
углеводороды с олефиновыми боковыми цепями.
Предлагались н другие методы расчета критической температуры, некоторые
>гз них обсуждались в предыдущем издании этой книги [27 | Кроме того, позднее
Рао и др. [25J коррелировали критическую температурь с мотьнещ рефракцией
я парахором (см- гл 12) для отдельных гомологических рчдон, а Матур и др
117] игтюльзоаали и качестве коррелирующего фактора молекулярную массу.
I o.l Д >) Огле [7] Иров с. । и широкое сравнение экспериментальных и рассчитанных
различными методами значении критической температуры Он» приш.ри к выиоду,
что наиболее точен метод Лидерсена. Метод Покэя тоже бью включен в их провер-
ку. н<> не с модифицированными константами, приведенными в табл 2.5.
Среди мно|Их предложенных способов расчета критического давления метод
Лядс|1ссна считается простым в использовании и наиболее тонным нс- тоть <о дтя
углеводородов [3! ], но и вообще для органических соединений [7 |.
После обширного сразненпя экспериментальных данных и расчетных Зцачс
т ни, найденных ио различным вычислительным схемам, Голд ц Огле [71 у станс
пили. что метод Лидерсскз наиболее надежен » при (щрсдслст!пи KpijunecKriro
объема. Однако Спенсер и Доберт считают, что для углеводородов н?с<о-т''ь'о бо-
-0,9076 Г 1.0 ,
где Рг поражено в физических' атмосферах. а; — критический коэффициент Рц-
деля (см гл Оф и вирпЖеипе, заключенное в кн.-дратпые скобки в уравнений
(2.2.5), представляет собой величину, обратную критическому коэффндиентУ
сжимаемости. Для того чтобы с иаиболнией точностью определите V, по методу
если хе применяв расчетные значения Т, u Pt,
Другой метод групповых составляющих Для определения критического 0Л1,-
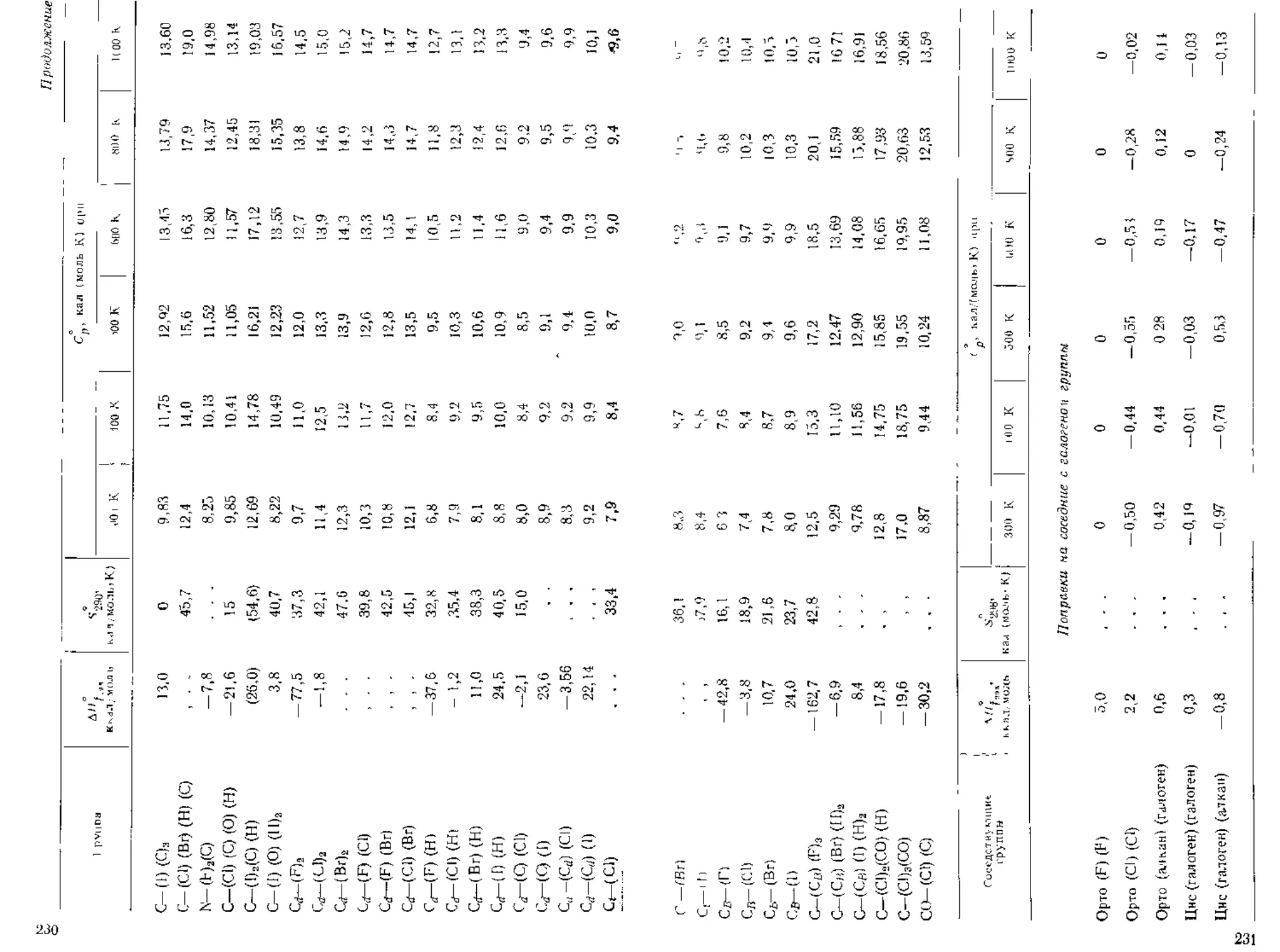
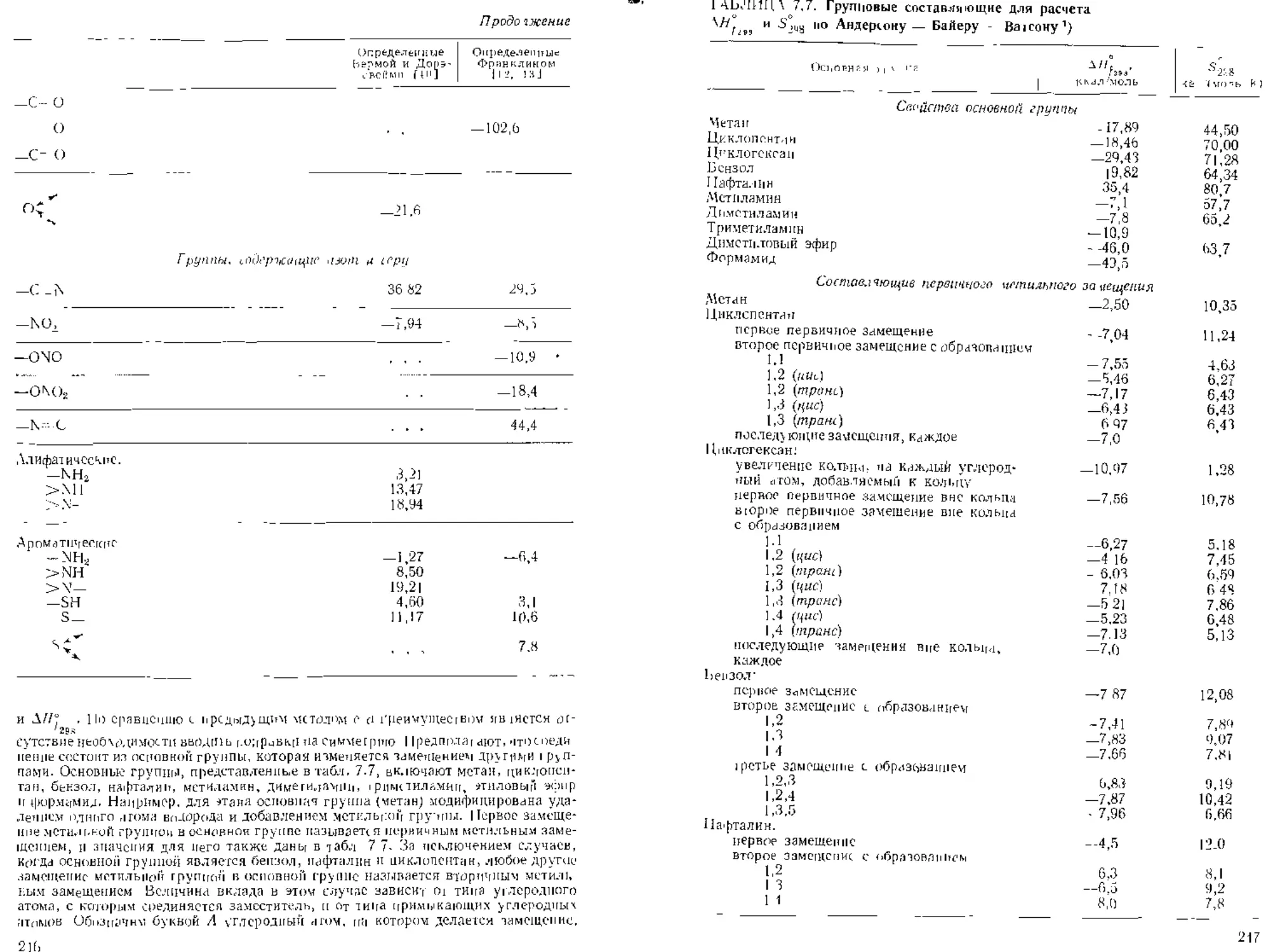
ТАБЛИЦА 2 1 Составляющие для определения критических свойств
гго методу Лидерсена 115] ')
I I S
-UI .li.1 un шчгские сочпавлятщие 0,227 35
( н. 0.02J 0 227
-□ 1 0,0] 2 е,210 51
_с_ (1 on 0 2]0 11
-( н2 0,01 S (.198 15
—(’11 0 018 0 ]98 15
^с (),0 0,198 30
-С 0.0 0.198 Зе
-<СН 0,005 0 153 (36)
0,005 0,153 (36)
Цак iwiicKue соапамлющие
- СН2 — 0,0]3 0 ]«) 44,5
-СП 0,012 0,192 46
—С — ( O.007) (О.)54) (31)
=С] ] 0.O1 1 0,154 37
0,011 0.154 36
-с- 0 01] (). 154 36
Составляющие 0 ;я групп, содержащих галогены
— F 0.018 0,224 18
(]| 0,0] 7 0,326 40
- Bl il.Ol'l (0,50) (70)
—1 0,012 (0,83) (95)
Сытачляю'цис 0/я групп, содержащих кислород
011 (спирты) 0,082 0,06 (18)
- ОН (фенолы) 0.031 (- 0,02) (')
Продо aeaut
- 1
—0 — 1Вне колы:;!] 0.0^1 0 (6 20
— 0 - (I) Jvj.lb’lC' (1) г> 14) (0 12) (31
—С^О (вис k<i,i' ia) b.'Ui' !,(!
—С- 0 (в кольце) гО.ОДЗ) (0,2) >|.|
!!С=0 (альдегиды! 11 ()4л 0.33 73
—СООН (кис.гогы) О. (1К5 |0 4) *<>
— ("00— ((ЛОЖНЫ!' Ч|1И]'Ы1 0,04 > 0 17 *0
— 0 (за нсключе-iiiCM и,||.ииьи выдр. (рОД) (0 U) 1 1 )
случаен}
Cocinaii.i'iHMfiii <>?'< ?p,mut юдор-щици:, ,130'4
->Н, 0,0(3 ] 0,(ц)5 23
\11 (Пае Ko.ni.naj 0 3,31 0 1,35 (37)
— \’Н (в и >льце) (0.024) (O.Otb (2-)
—ittite колада) 0 0 1 ] 0 17 U2i
— \— in ко.-?,це| (0 0( 7) (О, ,31 । )j)
— С\ (г) 060) (0.3<ji (60)
-VO, (0 0.65) (0,42, (73)
Состав vuouaie 0?л epyrat содержащих с.’Р!/
-SH 0,01 з 0 27 5й
— S— (Вес кЛльпа. 0,015 0.27 55
— S— (в кольце) (0 ОС*) (0/24) {131
— S (о.ооЗ) (0,21! (I7)
Проше е.остеишшелшг
-Si- 0 03 (V*)
- В -
(),ГИ)
ТАБЛИЦ3 2 2 Погрешности расчета критических свойств
по мето«у Лидерсеиа
пения
Зналогшна погрешиости лля Рс- з,ожет 6i.it.. не-
сколько большая; немного выше, чем погрешность ме-
oet-овачно! о на корреляции
Циклопарафины (нафюнь)
Алкнпы (ацетилены)
1,359397
(1,658122
1,095340
0,746733
0.14757*
!. 057010
0,436843
— 9,071646
0.277495
9,39,3899
-0.396178
0,'227320
0,862244
0,811961
0,655628
0.799872
0,994809
0.069286
Значения для мыиих групп приведены в 2.4, а ЛЦ nn.oieicn «мо-
лекулярной массой» группы В больп иистве случаев уравнение (2 2.7) совместна
о тайл. 2.4 обеспечивает более точное определение критического объема, чем лю‘
бон другой метод Вполне падежный метод, основанный на групповых составляю-
щих. для расчета 1ф разработал также Федоре [5].
В критической точке коэффициент сжимаемости определяется как
(2.2 8)
Очевидно, Что прд известных Рс, V,. и 7> паити критический коэффициент
сжимаемости нетрудно. Кроме того, он может быть вычислен по специальным ме-
тодикам |27]. Эти методики пе обсуждаются здесь, поскольку обычно уравнение
(2 2 5) дает достатошо точные значеипя Zc, даже если некоторые или псе другие
критические величины, входящие в нет, иредстоиг рассчитать. Критический коэф-
фициент с/кимаемс'ст,! необходим редко, ан исключением тех случаев, когда <ш
используется как параметр н методиках определения других свойств, но эти ме-
тодики часто не требуют точного значения 7.с. Для ряда веществ значения крити
чосиш о коэффициента сжимаемости табулированы в приложении 3 Все они были
полечены по уравнению (2.2 8),
Еще одни редко применяемый метод определения критических свойств со
ctohj в использовании корреляции других физических свойств, в такие кор-
размерному виду В этом случае можно получить приближенные значения кри,и-
'ic:‘kh\ величин, по толике при низкотемпературных данных. Ц качестве примера
указанной, подхода рассмотрим метод Ганиа Ямады для расиста объемов
’! ЛГ».'1ИЦЛ 2 4 Групповые составляющие для определения
критическою объема но методу Ветере
Ппг-..L,- Д! 1
Апнктнчрскнс (вне кольца)
в основнои псин С" О (в KO.TL’JCl 1 500
СНд. СН2. СН, С н боковой цепи 3,360
НС—О (альдсчиды)
СН3 СН2. СН. С 2.888 1 652
-COOII
-сп2-сп,-с- 2,940 -соо 1 60"
=сн, = с,- 2,908 2,648 —\н2 2 181
ЦИКЛИЧССКПС (в КОЛЬЦО! —NH (вне кольца! 2.333
Cl 12 СН, С 2.8)3
-СН, —С— 2.338 —NH (в кольце) 1 736
а 0.770 1,237 —\— (вне ко.п»ц<) 1,793
13г 0,899 0.702 N (в кольце) 1 883
—ОН (спирты) 0,704 —CN 2 784
—ОН (фенолы) ЧО2 1 IX г,< 1
—О-- (пне кольца) 1 О7о
—О— (в кольце) 0,790 SI) 1 537
-О (ычжеиды) -0,252 —S— (вис кольца) О 591
—S - (в кольце! 0 9 1
—С=О (вне кольца) 1,765
насыщенной жидкости, обсуждаемый также в разделе 3 15 ,9} вольный обьеи
жидкости дастся уравнением (3 15 I) как
_ыГ)
(2 2 Ч)
где 1’Л' и Г — функции приведенной )емпературы Т/Т? Jcm. уравнения (3 13 4)—
(3.15 6)]: га — фактор аиентричносги, описанный в разделе 2 3; Fst. — масштаби-
рующий параметр, характерный Для вещества.
По уравнению (2.3.1) на основании данных о давлении Ларов вблизи нормаль-
ной точки кипения и первого определения Р, и Tt рассчитывается значение ы
Затем, используя это <в и значения мольного объема жидкости V цо крайней мере
яри двух температурах, можно нанти Гс гз равнения (2.2 9) путем итерационных
вычкетенпй (метод проб я ошибок). Далее может быть найдено значение l’v.
После этого критические давление и объем определяются сеют юшецнгмц
((1,2920- ().!)%7u) RT,
|2 2.10)
(0,2918 — 0,0928»») RT,
повторяется до тех пор, пока ina'icuiin ы окажутся сходящимися При таком ме-
-6 ( с -) ~ (Clls) t - (61 (0,0! I) *- .- (5) (0,016) -0,175
£ S,, = (G) (0,154) , 0.227 (- (5) (0,224) = 2,271
£AV = (6) (30) ' 55 — (5) (IS) = 3C1
По уравнениям (2.2,1)—(2.2.3)
T__________ЗОЩ__________
' ~ 0,567 -f- 0,170 — (0, 176)-
'^IWTIW -j 36 7 ‘“'1
Vc = 40 -|- 361 = 401 см3/моль
Экспериментальные значения Тс и Рс, приводимые Амброузом и Спрейком
Г11, составляют 566 К и 30,8атм. Погрешности равны 3,0 и 13,3 %, соответственно.
1 [ентафтортолуол не использовался Лидерсеном в разработанном им методе. Ни-
каких экспериментальных значений критического объема, необходимых для срав-
нения, не имеется.
Пример 2,2, Исно.тьзуя метод Ветере, отэеделлп. критический объем изо-
бутилового спирта,
Решение. По табл. 2.4
ГГ> "П-д av, 1 &viM<
-СН, 3 360 15,03 50,50
-сн3 3,360 15,03 50,50
—СН 3,360 13,02 43,75
-СИ,- ,3,360 14,03 47,14
—Of £ 0,704 17,01 11,98
203,87
Слеловатсльно
!, — 33,04 -» (203,87)’ 029 — 270,9 см3,\ю.1ь
Экспериментальное значение Ус равно 273 ои3/моль
2.3. ФАКТОР АЦЕНТРИЧНОСТИ
гт ч'К'ого веществ । в пыж ,ся факюр ацен
л - = — |у PVp; । при 1'г — 0.1} — 1 000
isf.T I
с А нВ, найденными цз ''сновании kcmiiibi'TOb Г., и 7,,. Р - 1, то
и 4- 1^ Р -- I (.2 3 31
где Р, выражено в физических атмосферах, a 6 . Ть'Тс с^то сочтнощ, ннс впервые
было предложено Эдмистером [4)
Аналогично, если было выбран0 соотношение ,7и Кеслера Для давления на
ров [уравнения (0.2 6) (6 2.8)1, то
_ 1пРс-5.9271 I ' Uj'jfUSn 1 Н l,288b21<.l'-0,16(i3|768
‘° ’ i5,25l8 - 15,08756 ‘“3.472Ui,0 ; 0,4357^
Ли и Кеслер [ [3? сообщают, что уравнение (2.3 4) дас, значения й>, очень
близкие к тем, которые были выбраны Насею и Дспнсроч 121 I в их критическом
обзоре фактора аислтричностн для углеводородов.
Пример 2.3 iН'рсделктн факсгр ниснтричности ддя н гктана Hi аридо*,
иИя А имеем • 7), — 398,8 К: 'Г, -- Ьб8,8 К, Рс — 24,5 атм.
Решение. 9 - 398,8/568,8 — 0,701 Цо уравнению (2 3.3)
" -ТГ=7|ГЯТ1я21'’- 1
П<> сравнению (2 3 4)
'йо“ ;128862 «с»|
ff>ix данных о давлении папок, равно 0 391
<1,291 - О Г)8'\ ,
Это хравнение результат применений Р — Г— 7 Ксфре.тядин, использую,ней ш
(см гл 3) для критической точки, где Z — 7: Уравнение (2 3 5) является лищь
очень приближенным, '<то звангересова!,ный читатель может тегко \С|аНовитЬ
па основании приложения А Действительно, если 7.с будет определяться по урав
нению |2 3 5), то лучше рассматривать это 7,- ка,; новый параметр, а не как истин-
ных критический коэффициент .............. • ---‘’...........................
ежимаемост.1, рассчитываемый по урэвненвю
2.4. ТОЧКИ ПЛАВЛЕНИЯ И
КИПЕНИЯ
< Н>ТДЧГ1г I. 1<(,1,1.1
название
\Hi; A.S. и в
:ав1!сит стмежмолскулярчых сил. A5f явчиекч
.................... ГОТ ЛС.п.'.„,л
-.'Илен |д] предложил ип7ерпо.<1Я11иоЕ1|Ыи метод .для коррелирования пор-
•г-мперятур плавления в ।ом(<ло, ячеек,ix рядах .Тля таких рядов график
2.5. ДИПОЛЬНЫЕ МОМЕНТЫ
Типо.ть-1ые моменты молекул часто использую.сн и корреляциях свойств nci-
шриых веществ. Лучшим источником значений этих констант являются таб-
лицы Мак-Клеллапа [18], которые заменили предтес,вопившие им краткие об-
зоры, такие, например, как |2Ч] и [30]. Для тех редких случаев, когда необхо-
димо рассчитать значение днполиюгп момента, имеются методы векторных груш
новых составляющих, ходи применение этих методов обычно требует значитель-
ных усилий. Большинство таких методов рассмотрено в кчи( е Минкина и др. [19].
ч|ля многих веществ диполю иле моменты приведены в приложении А: никакого
влияния температуры не прослеживается, поскольку дипольные моменты нечув-
стнытс.тr,fп,| >. этой Гсрсмсппо|'| Кроме того, мы не указываем, были намерены
2.6. ФАКТОР ПОЛЯРНОСТИ СТИЛА
Уравнение (6.2.6) связывает приведенное давление паров с фактором аионт
ричности к приведенным давлением Fenn это рассчитанное приведенное чкктоние
паров обозначить (Р.. П/)', то фактор Полярности Стила определяется как
при Т, =0.6
'1 АБЛИЦА 2.5. Значения фактора полярности Стила
'И i '
Метиловым спирт 0,037 Вода 0,023
Этиловый спирт 00 Хлористый водород 0,003
н-Пропиловый спирт -0.057 Ацето гг 0,013
Изопропиловый спирт -0,053 Фтористый месил 0,012
H-Ev иловый спирт -0 07 Окись этилена 0,0|2
Диметиловый эфир 0,002 Метнлацетат 0,005
Хлористый ме’ил 0,007 Днэтилоиый Эфир -0,003
Х-теристый этил 0.005 Этилмсркатан 0.004
Аммиак 0,013
2.7, ПАРАМЕТРЫ ПОТЕНЦИАЛОВ МЕЖМОЛЕКУЛЯРНОГО
ВЗАИМОДЕЙСТВИЯ
СТ ( У _ 2,3551 -0 0874®
^---'•,7015 < О, 169Х>
А. Д>
Глава ,]
СООТНОШЕНИЯ МЕЖДУ ДАВЛЕНИЕМ,
ОБЪЕМОМ И ТЕМПЕРАТУРОЙ
ЧИСТЫХ ГАЗОВ И ЖИДКОСТЕЙ
з,1. содержание главы
3.2. ДВУХПАРАМЕТРИЧЕСКИЕ КОРРЕЛЯЦИИ
НеиДеальцостЬ газа может быть удобно выражена через коэффициент сжцмае-
мости Z:
[ де Г мсльн -.и объем; Р — абсолютное давление, Т — термодинамическая
кигература; /( — универсальная газовая постоянная.
Если мольный обт.ем выражен в см’/моль, абсолютное давление — в атмо-
сферах, а температура — в кельвинах, то /?= 82,04 Для идеального газа 2=
— I. Для реальных газов 7. обычно меньше единицы, за исключением области
очень высоких температур и давлений. Уравнение (3.2.|) можно использовать
также Длг определения Z жидкости; в этом случае коэффициент сжимаемости
обычно много Meiii.iiie сдинты.
Коэффициент сжимаемости часто коррелируется с приведенной температу-
рой Т, и приведенным давлением Рг'.
(3.2.2)
ществ; цс рекомендуются они и Для гелия, водорода, неона, если ire применяются
специальные, модифицированные критические константы [77, 81, 84]. Для очень
высоких давлений и температур употребляются диаграммы приведенное давле-
ние — приведенная температура — приведенная плотность, разработанные
Бредвельдоч н Праусиицем |16[.
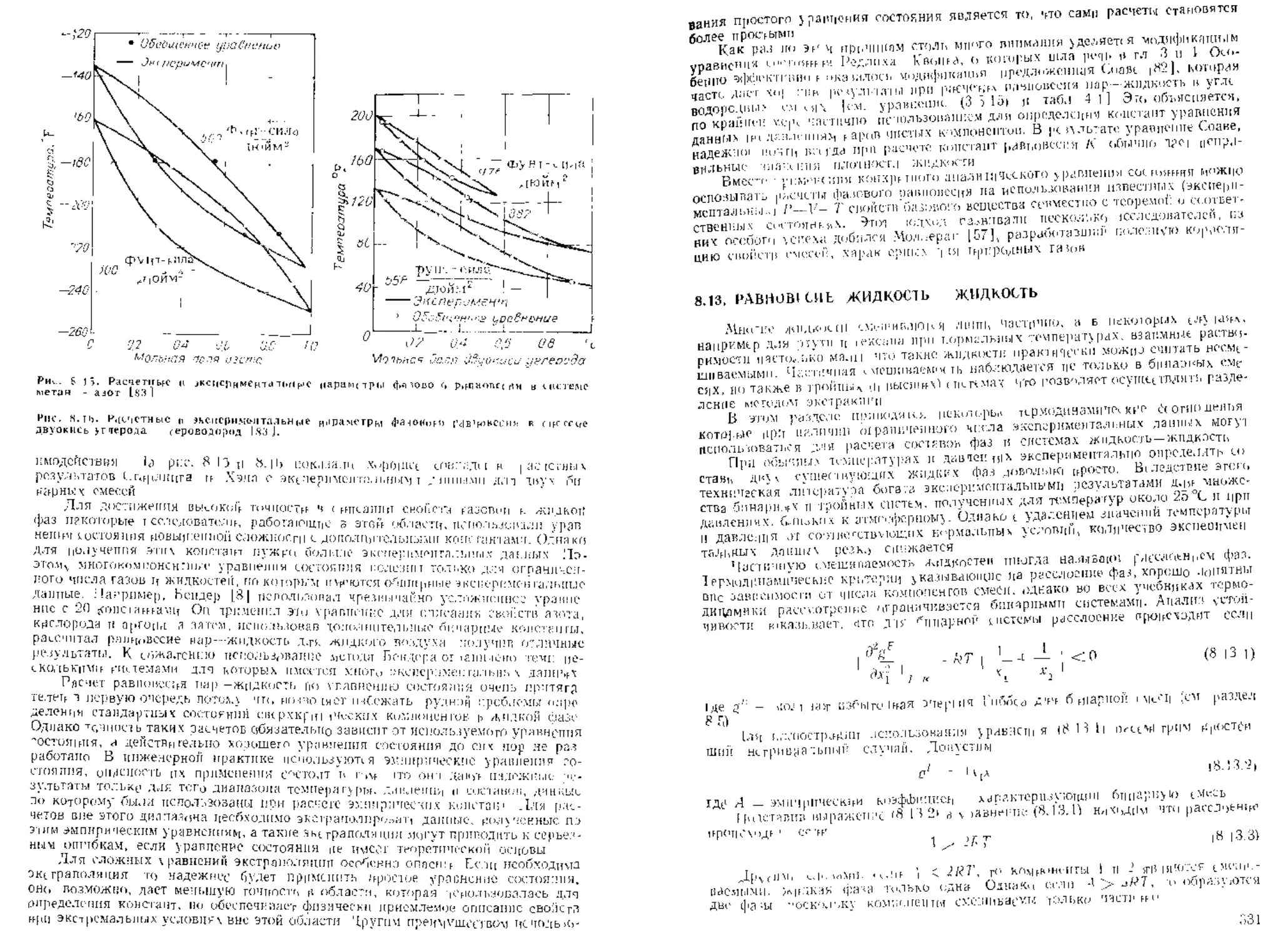
В литературе опубликовано много диаграмм, подобных изображенным на
пне. 3 I —3.3. Все они несколько отличаются друг от друга, что обусловлено тем,
как каждая из них отражает авторский отбор экспериментальных данных, к тем,
как Эти данные сглаживаются, ^Ьгаграммы, представленные йз рис. 3 1—3.3,
' Еслг! т(Сг1Г'.и,[>1(>ц_я Оршанские единицы измерения, т е если I'' выражено
рутУфунг моль. У — в фуцг-сила/дюйм2, 7 — в градусах Репкина, то R _
10.73. В международной системе единиц (СИ) Г измеряется в м’/кмолЬ. Р...................-
паскалях. Т — в кельвинах; в зюч случае /? — 8314 Н-м/(кмоль-К) пли
гочць, та,, же, как и любые другие опубликованные двух гармонические графики,
но их преимущество состоит в том, что чо них, непосредственно находится оба.ем.
Кривые пр"всденно,<> объема ^Г( пострсены с использованием пдеачыюп? при-
веденного объема, примем е качестве масш1абиру,ощей бралась величин., RT Р.
а не Vc [120]-
Уравнение (3.2.2) представляет собой пример закона соответственных с<>-
I и якни Согласно этому закону, хотя и ж точно, предполагается, что приведен-
। 1,1 < конфигурационные свойства11 всех галев и жидкостей по сущееi ну одинаковь,,
гель их сравнивать при одинаковых приведенных температурах и давлениях.
_1.1> Р—V—Т свойств этот закон даст.
гг _ 2- = 122М22 - а {Т
Z — Zj2(Tr,Pr)
(3 2 4)
-ТОЯ1ДИ
представляют собой масштаоиртгошие величины.
виде, по полечившие, однако, широкого ] .ichi|><>CTp<
ования таблицы значении Г, п Р. приведены в при.д<
') Приведенное свойство грсдс_авляет собой OTuo'uci'iiC
Свойство
Cno’iCiBO в критической точке
2 Например, используя посеянные Лсчнарда —Джонса (С1ч. раздел 2.7),
приведенную температуру можно определить как Т,'(в/А), а приведенное давле-
ние - - как Р'(е/о:|)
Привев^нос t'n'ir Р
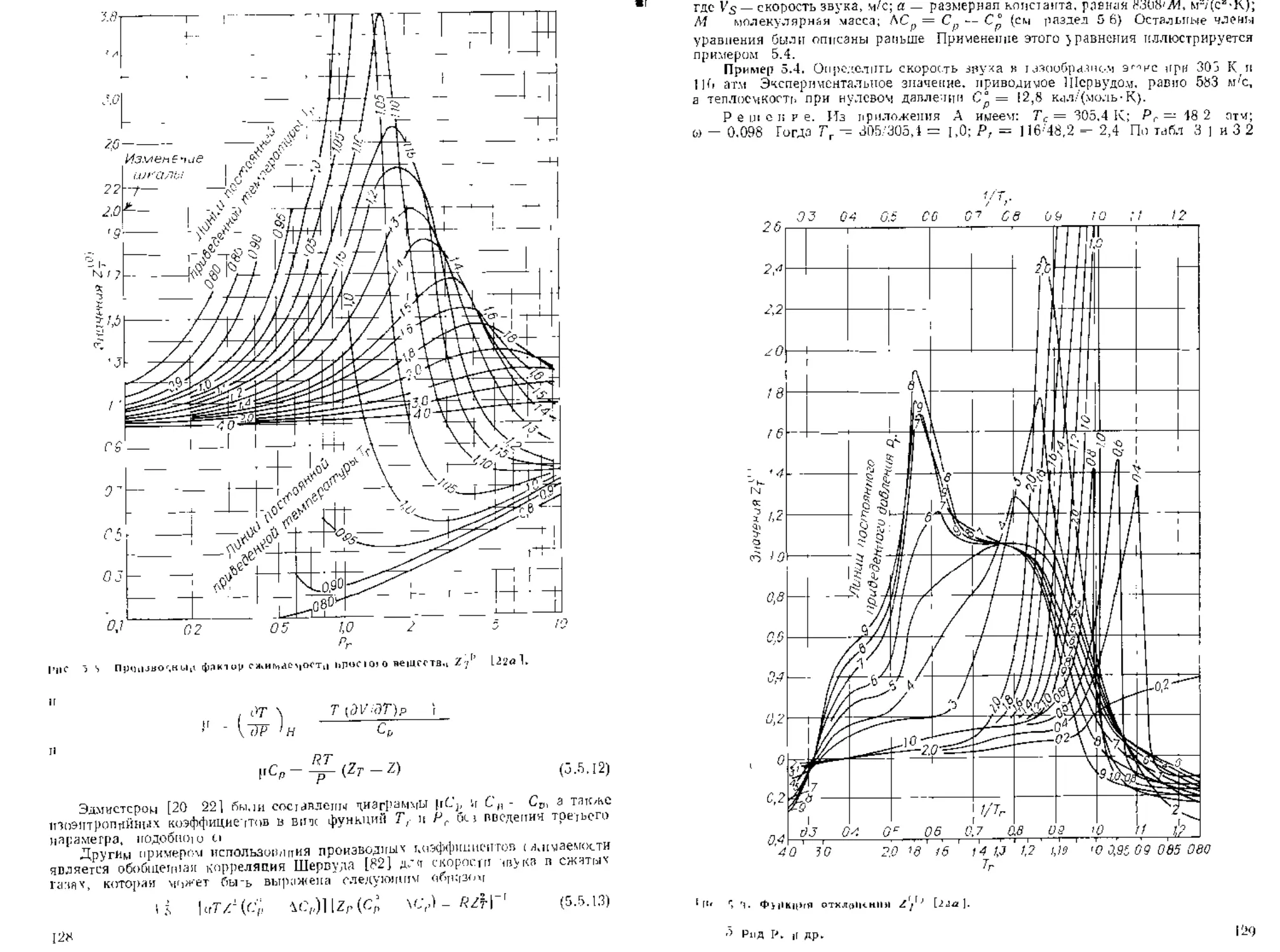
Гщ 3.3 ОП,,б чти и ня диаграмма коэффициент.^ < жимасщост и (83 I.
из. ТРЕХПАРАМЕТРИЧГСКИЕ корреляции
Зависимости u.z и) являет
и< I < .511111)1. 11. ' I: I -
и давления?
ЖСННЙ. которые при
модификации чаще всего включают топе
'.I . I 1.11П
ваютлиоо с приведенным давлением гаров при какои-лшю опредмеш
денной температуре лиоо с каким-ниоу.ть во.т:ометри'|гск/1ч свои<‘т1Ч'М
чсстве третьего параметра ис к
опнсывадотсм две оощце хорошо
Предположим, что существ
ПИК I Hl'IlllliK' tl'VII Kuril
женным на рис. 3.1—с
.’111)11 11.' IМ М 1‘.
точности. Именно так оыло сделано при рязраб«|ье тао.тии Лядерс?ца—I |>ин-
корна —Хо'.'гвня. которые впервые появились в |9о5 г. [7U1. а затем оРгли мт'дифщ-
цировзны [47]. Там значения Z представлены в иидс фч кццп /, i А., причем
приводятся соответс*вующце таолины для различных значении z . Эдвардс ь
стен насыщенных паров неполярных сое:
В качеств? третьего коррелирующей
фактор аиептричпоСти Питиеоа [90. 92. 941
2.3. Этот параметр является показателем и
жсл использоваться н
HanpiWCp. значение а == 0 соответствует сферической симметрии в разреженном
газе. Отклонения от повеления, характерного для просею bemeeinn. очевидцы,
если и > 0. Не выходя за рамки настоящего изложения, можно считать, что все
молекулы с одинаковыми факторами ацентричиости имеют одинаковые функций
Z — I (Тг. Рг\ по уравнению <з 2 2). В данном случае вместо подготовки отдель-
воспользоваться лицеиным разложенном
в котором функция Z"'' характеризует пиисдсние иреричс^ких аи-тскул <> ч-ieir z ' ’
представляет собой функцию отклонения.
Питцер и др. составили таблицы Х1''1 и/11' в виде функций Гг и /Д [931,
а Эдмистер представил эти функции в виде диаграмм [291. Опубликовано несколь-
ко работ по модификации и расширению этого подхода па большие диапазоны Тг
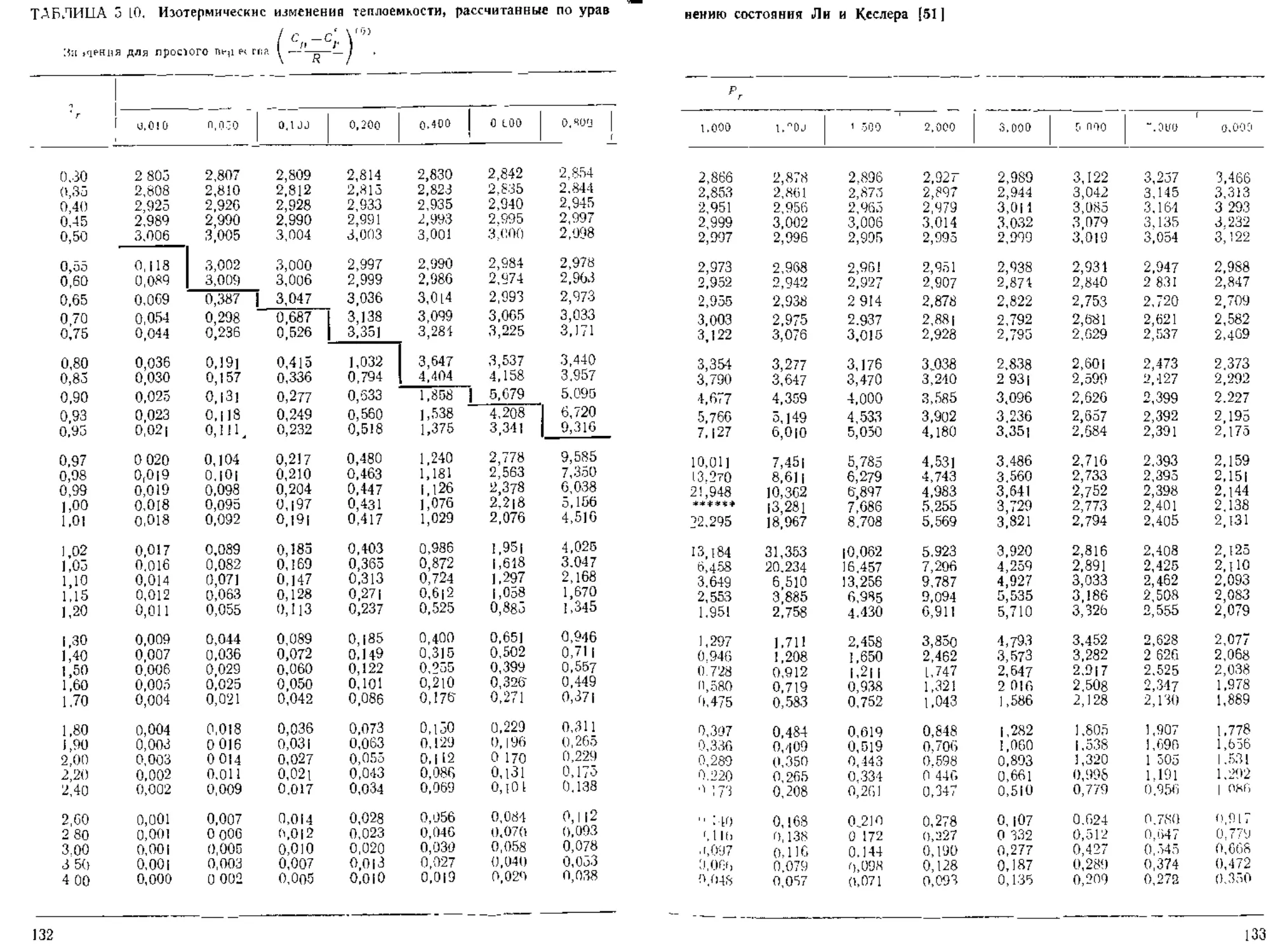
и Р, [68, 107]. Табл. 3.1 и 3.2 подготовлены Ли и Кеслером [591. Их метод рас-
чета описан ниже в разделе 3 9. По табл 3.1 и 3.2 можно определять 7. как для
газов, так и для жидкостей 1 >. Табличные значение 7‘ ' хорошо согласуются с
оригинальными значениями Питцера и др по всем диапазоне совпадения значе-
ний Тг и Рг. Табличные значения функций отклонения Z1' Ли и Кеслера
(табл. 3,2) несколько отличаются от приводимых Питцером и Керлом, однако
широкомасштабная проверка [59, 1241 показала, что чАвые значения характери-
зуются большой точностью
Табл. 3 I и 3.2 Не предназначались для сичьно полярных газов п жидкостей.
Тем не мснсс они часто для них используются, при этом достигается удивительно
высокая точность, за исключением диапазона низких температур вблизи областр
насыщенного пара Г|редложены спедиальчье методики модификации уравнения
1) Для смесей см. уравнения (4.6.3)—(4.6.7)
HP
1 одна из них не полечила широкого распространения.
е внимание оыло уделено опоощенномч соотношению Питцера — Кертз.
,юсъ точным и универсальным для чистых газов Для расчета нужно
ко знг.'н-иие фактора анентричьости. критические температуру и лтв-
। in т т т к hi ние — цтиг тц пе ин, ,и и полезный резу.ть-
1 т fill тг в I ны с т ii in [ t»0 1|' 117].
о io. ' iiii11 .!.. ; >.л|1.ц|.т. «шч ц.|||,1 :и у, к .I i,,i.inuirjpvhei jh J при
— 0,/1. Топа
I’- 7,RT'P = (0,77) (82,04) (36С>,о).Д0,4 Ц34см®/моль
В работе |-1] привсются Значение V_______ |'О9 схЛмоль.
Тамм образом
V = Z-RTlP— 1097 см’/мол:
3.4, АНАЛИТИЧЕСКИЕ УРАВНЕНИЯ СОСТОЯНИЯ
Аналитическое уравнение состояния представляет собой алгебраическое со-
отношенне между давлением, температурой и мольным объемом. Как будет пока-
зано в последующих разделах этой глгвы, предлагалось много различных форм
такой связи Все они должны удовлетворять критерию термодинамической устой-
чивости а критической точке:
Кроме гею, згинсамьк урлвьения состояния должны предсказывать неко-
торые другие характеристики, которые обычно свойственны газам и жидкостям,
что отмечалось Мартином [72—761 и Эбботтом [ I [, Пакоией любое уравнение со-
стояния должно сводится к закону идеального газа, когда давление стремится
Наиболее известным анаяиттесиим уравнением состояния является уравне-
— b) - RT
(3.4.3)
«Рс
Т\5ЛИЦ\ 3 1. Значения Z(,l) {54]
1
') I О 2ini I , too I 'J.6UI, | O't'U
ТЛГ>,'1ИЦЛ 3 2 Значения Z(,) [591
I-
Г i I .1 I П ,Г|П । !_>. ' Cl 1 | I' I H|l | !!,>(& I' ''.'J |
(>..!C1 (LIO 0,43 0,50 0 0008 —I) 0009 — 0.0019 - 0 0009 -0 0009 0 (.040 —0.0016 0.0048 - 0.0047 -0 0045 —0.0081 - '(.0093 —0,0095 —0.0094 o.OOOO - 0.0161 0 (118.5 —0.0190 —0.0187 0,0181 -0 0323 —0,0370 - 0,0380 -0,0374 -0.0360 -0,0484 -0,0554 —0,0,->70 - 0,0560 -0.0539 _0,(XM5 0.0738 - (i 0,-58 -0.0745 --0.0716
6.55 - 0 0314 0.0043 -0.0086 _0,9172 - 0.0343 —(>,05|3 - 0.0682
O.60 -0 0205 | —f1.1 1 —И.0082 0.0161 0.0326 -0 0-187 — 0,0616
0.65 -(iOI37 - 0,0772 | -0,0078 -(i.O|,5o -0,0309 -0.Ш1 -О 0(>l I
-0,0093 -0.0507 -0,1161 -0OJ48 -0 0294 -0 0438 -0.0579
- 6,0064 - 0,0334 —0,07441 -0,0143 -0,0282 -0.0417 -0,0550
(i.8O -0,0044 -6.0228 —0.0187 -0(160 -0 0272 -0,0401 -0.0526
OS' -O.002O -0,0152 -0 0310 - 0 0715 | —0.020,8 - () 0301 -0.0509
0,90 0,93 0,95 —0.0019 -0,0015 -0.0012 - ('.0099 -0,0075 —0.0062 — 0.029.6 -0,0154 -0.0126 -0 0142 —0,0326 —0,0262 - 0,1118 | -0,0396 - 0 0503 — 0.0514 - 0.0540
-0.0763 --0,0589 - 0.1662 —0.1110 I
0,97 -0,0010 -0,0050 —0.0101 -0,0208 -0,0450 -0.0770 -0 1647
0.98 -0 0009 —0,0044 —0,0090 -0,0184 -0,0390 -0.0641 -0 1110
0 99 - 0 6008 — 0.0039 —0,0079 -0 0161 -0.0335 -0.0531 -0 0796
l.oO -0 0007 -0.0034 -0 006(i —О.0140 -0.0285 - 0.0435 —(1,0588
1.01 —О.оооб —0,0030 -0.0060 -0,012(1 —0.0240 -0 0351 -0,0429
1.02 - 0 0005 -0.0026 —0.0051 — 0,0102 _0,0198 -0.0277 - 0.0303
1,05 -0,(1003 —C,00]5 0 0(129 -0.0054 —0,0092 - 0.0097 -0,0030
1 1(1 - 0.0000 0,00(K) 0 0001 0,0007 0.003S 0.0100 (1.0236
1 16 0 0(l(i2 (1.001 1 0.0023 0.0052 0,0127 0,0237 0.0396
1,2(i () 0004 d,O01<l 0 0039 0,0084 (1,0190 0.032G 0,0499
1,30 0.0006 0,0030 O.oOOl 0,0125 0,0267 0.0449 0.0612
1,4c) 0.0007 (),0036 0,0072 (1,0147 0,0306 (1,0477 O.OCCI
1,50 0 0008 0 0039 0,0078 0,0158 0,0323 0,0497 (1,0677
1.60 0.0008 0.00-10 0,0080 0,0|62 0,033(1 0 0501 0 0677
0,0008 0,0040 0,0081 0,0163 0,0329 0.0497 0.0667
1,80 0 0008 0.0040 0.0081 0,0162 0 0325 0,0488 0,06F>2
1 ,<»(! 0,0608 0.0040 0,0079 0,0159 (i"0318 0 0477 0,0635
2,00 0,0008 (1.0(139 0 0078 0,0155 0.0310 0 0464 0 0617
2 20 0,0067 C 0037 0.0071 0.0147 0 0293 (1.0'137 0.0579
2,4n 0.0007 (i,0035 0.00711 0,0139 6,0276 0,0411 0,11544
2,60 (i.O(K) I 0,0033 0.0056 0 0131 0 0260 0 0387 0,0512
2,80 0.0006 0,0031 0.0002 0.O124 0,0245 0,0365 0.9483
3,(l(i (1.0006 (1,0029 0,0059 0,0117 0,0232 0.0345 O,04a6
3.50 ci 0005 0,0026 (1,0052 0,0(03 0,0204 0 0303 0,0401
1.90 0.0005 (1.0023 0 0046 0,009. 0,0182 и 0270 0.0357
3.5. УРАВНЕНИЕ СОСТОЯНИЯ РЕДЛИХАКВОНГА
Уравнение Редд их<—Квонга, сформулированное в I !)4!.i j , является ii.ik.5:
удачным двухпарэметрическтг уравнением состоя;;;^; |10Jу. Oito ичсст ви;;
Не существует никаких таблиц, которые сел ржал и бы значения а и ддн ищ
рокого Круга чистых компонентов. Примеряя условия (3.4.i) и (3 4 2) к .равне-
нию (3.5 I), можно показать, что
(3.5.2)
где ; О* — ijpocio числа
(3 3 3)
- ((9) (2)/? - (Ж' _ О 4274S02327 ., , . Р"’' 4>
21/3 - 1
0,086G 10350. ...
Таким образом, а и Ь могут бьпь легко определены по значениям кртгьчеодм
температур и давлений.
Уравнение состояния Редлиха—Квонга представляет собой кубическое у рев*
пение относительно объема или коэффициента сжимаемости Z. В последнем
случае уравнение имеет вид:
Z3 — Z2 -|- (А* - В‘г _ В*) Z - W3‘ _ О
(3 5 5)
аР
(1.5 7)
QbPr ЬР
' Т, ~ "RT
(i 5 8)
Уравнения (3.5.1) и (3.5 6) идентичны по форме Обычно их называют ориги-
налом уравнения Редлнха—Квонга, чт^бц отличить Ст многих модифицированных
фирм этого ураВ|[ёния, предложенных после 1949 г. Прежде чем перейти и рас-
смотрению этих модификаций, следует отметить, что авторы нсдавне-о исследо-
вания большого числа двухконстантных уравнений состояния Бьерре и Бак [14]
нашли что как раз общая форма уравнения (3.5,1) является наиболее точной-
мспеялюе использовали0 опигин <ла уравнения Редлиха—Квонга как надеж-
ст'-. л расширить диапазон применимости [16].
1]оедст!1нляк>гся в вгде «'туикнии фактора ацеггтричности [17. 21. 22.
мо-цифси,-апни предполагают включение функции отклонения, на-
7-Zt;t< + AZ (3.5.9)
где Zrk - -значение коэффициента сжимаемости, вычисленное по оригиналу урав»
чеч-Ц; Pe.vrnxa—Квонга; AZ — корректирующий член, который определяется раз-
R большинстве случаев для нахождения AZ используются сложные функции
/’г- а иногда jt фактора апсптрИчнссти оз. В качестве примера, рассмотрим
Р, ----0.04666626, D2 = —0,11386032; D3 = —41,76451266
Л = 40,47298767; D&= 12,55135462; De = -12,5583112
Моднфикаш я Грея и др. была разработана для описания поведения газов
и диапазоне температур до Т, < 1,1 при Р, 2.0. Коэффициенты сжимаемости,
расс'гкмкльте гл, урав.чепняч (3.5.9) и (3.5.10). хороню согласуются с табличными
значениями Питцера—Керла Соколов и др, [109*1 нашли, что для углеводородов
осиее точной является другая модификация [2. 99].
Наиболее успешными модификациями уравнения Редлтсха—Квонга являются
-е, л которых параметры а л b выражаются как функцгт температуры (8, )7,
10’ 13.3 1 <36 И?1] Щедрин и ДР [ 17], например, выражали о и & в виде полино-
мои обратных степеней приведенной температуры и, обрабатывая эксперимент
ильные дагпые с помощью оегрессионпого диализа, получили константы для
25 вещессв Оказалось, что, когда эти константы используются для вычисления
ыо.Помечри веских свойств веществ в Жидком, газообразном или сверх критическом
состоянии, средняя norpeiniiocib расчетов составляет менее 1,5%.
Чр}гоб известной модиф;(и,(цяей уравнения Редлиха— Квонга является выра-
Qu V I h '
" Rf
в котором Q,, и Я„ определяются по уравнениям (3.5.4) и (3.5 5), b находится по
сравнению (.3.6.3), а величии Г, как показано ниже, варьируется в зависимости
t > 'Ii'jki предложенной модификации. В оригинале уравнения Редлиха—Квонга
(3.5 !2)
<3.5 19)
ТМлЛИЦХ J i Сравнение функций /
15.,тъе — Киш । (8]
Г — 1 ' (0,1) ; i 2i<„) (t; 1 i)
Сощте 108)
(3 5.14)
I r (MS) ' i,o71<3 —0 I76w2) (I - (on.1,5)
За исключением области приведениях температур, превышающих Л|<непи>|
Тг, близкие к единице, раз шчныс функции F удивительно хорошо coi.-tccviOrcH
между собой (табл 3.3).
параметр,™ фазового р ав iiubcci (я нар—жидкость и поправок к энтальпии на давле-
ние |j,ip(ie и Кинг |о) применяли их модификацию Для смесей как углеводородов,
так и чсудтеводородов, a Bh.wch i 13*>| покнзал. что его форма уравнения лает
хорошие результаты по [нчтравкам к энтальпии на д-влеиие не только дли поляр-
ваются в г.т
3.6. УРАВНЕНИЕ СОСТОЯНИЯ БАРНЕРА - АДЛЕРА
Барнер и Адлер [6] уравнение сощоинМ Иоффе )43, СО),
чтобы получить Р- V--T еоотнощенпе, которое является наиболее точным для
области насыщенного или слегка перегретого прра. Уравнение и его константы
даны в табл. 3 4. а на рис. .3 4 в качестве примера показано прекрасное совпадение
расчетных и экспериментальных значений Z д,дя «шептана Диапазон примени -
мости уравнения соответствует знамени ши Vr >. 0,6 и 7Г О 1,5.
Зовдние этою уравнения для определения термодинамических свойств рассматри-
вается в |.(. 5 Уравнение состояния в представленном здесь виде (см. табд 3.4)
применяется в расисте на I молк газа. Для того чтобь, получить экстенсивную
форму уравнения, достаточно заменить К па V/V, где V — общий ,обьем_газа,
a N — общее число молей.
ТАБЛИЦА 3.4 Модификация Барнера — Адлера уравнения
состояния Иоффе
3.7. УРАВНЕНИЕ СОСТОЯНИЯ СУГИ — ЛЮ
ТАБЛИЦА 3.5. Уравнение состояния Суги и Лю
где
RT,
R7.
Продолжение
.1 12718
n n^ficl
1 Л7
ч 78068 10 ’ , “,0750- 10 'со
6,5927 10 2 — 3,0890 10-,«
I 4083 0) " + I 0353 10 со
2,8115 10 J — 9,8715 10 эсо
d' — — 1,1178-10-3 — G.G578-10 "'со
</' 2 3658- 10-3 - 4,6647-10
d- - 1,о314 '(Г’5 — 2,6384 К)-'со
d‘ = - 2.6225 10 ' 4- 4,4515-10 'со
<l[ __J.1441 10 7 4- 1,8492-10' чсо
2 0681 11- '' I 1,3076 10~%>
Ю
V ц-2)(/~3) <_
Li 2 zr1
Ю . 10
^u-'HZ-Z) Хуу-пц-З)
е‘ = 2.1163-К'-34- 5,8262-10 Зсо
q- 4 3405- 10-i-4,667S 10~1а
ej --—1,9317-10 ‘4-8,8237-10 Gco
е-‘ — —9 1644-10 г Н 1,7942 10_'3ш
ej - 2 [ИМО-* — 4,7493-10"''со
е‘-----1,4070-10~ s — 1.324G-Ю_ясо
е'о — 3,1756-10'а — 8.3832 1О~''со
3.8. УРАВНЕНИЕ СОСТОЯНИЯ БЕНЕДИКТА — ВЕЬБА — РУБИНА
P=RTo 1- ^BnRr-A0-^^4-(bHT-a)(^ ' оарв ।
I -yr(l I-( — V!’2)
(3 « 1)
ТАБЛИЦА 3 6, Константы уравнения состояния Бенедикта—Вебба—Рубина [24]
В уравнении (З.о Со {То) — лнмак ми. о... Ьг.,—0
верх соединений, кроме к Св, н Сц, н С|0 н I lab, [Находится го уравнению
ДС' • (Т) | QG1 | У/-)1 ] У4Ь' (Ш)
где Й - (Т - Ти),7'0, sTnT„ вырржеиы в 1 радусах Ренкинг
Для Н-С8, Ч-С9, Н‘С;о и Пг5
О 1303000Г4-!2 I 130.2536983 2 497 809 1Ю0| О,2ОЮ17(
\С^ (Г) = Qj - Qj -I- QJ-' + QtTJ
Для соединений, исследованных Орасм, функции Q и Тв даны в таОл. 3 7
Там же приведены значения температуры Т| (К). Это самая низкая температура,
при ксторой применимы уравнения (3.8.3) или (3 S 4); сгли необходимо экстрапо
лировать Св на еще более низкие температуры, го можно использовать уравнение
ЮТ
<-4 v-; i
dT
(3 S3)
В Случае веществ. Для которых DCDT — 0, температура Г, либо раина нулю
либо настолько ннзка, что не поможет никакая экстраполяция. Если нужна
। роизводная Со "О тс”п' ротУ1< в интервале <т до Тв. то се следует тлуыгн,
дифференцируя уравнения (3 я 3) или (3.S I).
I
Gif»//
I ЛБЛИ11Л 3.8. Константы уравнения состояния
Ьенстикга—Вебба —Рубина, предложенные Кауфманом [34 1
Коэффициенты полинома Сп
с; (о м' — Л, -А.Гг
У', I 4-
nKi.-2-Б'.'тсн 0.299680 7.32792
1 кнтеи -3,58381 29.4598
xieTiyiai'CTit 0.398698 1,2234?
И Ьт.пиен 3,308014 2,0219,3
-12,0342 9.7-1Х€Ю - 2,810-10
-02,1758 58,9453 -20.9.321
-<?,7?41,98 -0,196283 — О 251860
__3,15673 1,20515
Водород и язот рассматриваются особо Для азота константы t,c эввяст
от гсхггс^ра-гуры Для водоро.т Са нс зависит от температура, л тояртлнты buy
uS'tcHHiorca согласно следующим соотношения-»!’
Ь - 0 08682 2.
197.15)4
RT
(3.8 6)
| 0,8281 цР(, Т >459,69 "R
у — < 0,828] — 0,00051 (459,69 — Т}
I 0,6751 при Т < 160 С.9 ‘R
(3.8.7)
Ч X \Т'г 1
>,ы А, — коэффициенты (табл. 3.8).
(3 8 м
Ти|!им образом, чтобы определить kotict.ih'h уравнения Бенедикта—Вебба —
г.на для чистьх ксмлпсчечтоо под винчениях температургщ превышающих
3 9 ОБОБЩЕННЫЕ ФОРМЫ УРАВНЕНИЯ СОСТОЯНИЯ
БЕНЕДИКТА - ВЕББА - РУБИНА
'‘спешное использование оригинала уравнения Бенедикта— Вебб:, —Рубина
расчетах волюметрических я термодинамических свойств чистых газов и
модификап 1я приводится к обобщенной йорме применимой ,<о мнечи.ч т'-пам
предложили одинпядцатиконстлпгчее обобщенное уранчекие сос-олция Бснс-
родов типа догний трпродный газ п легкий нефтяной газ.
,'1и л Кеслер (59] разработали модифицированное '.'раннеппс состояния
Бенедикт-)—Вебба— Рубина, используя грс.хпарамстрическую корреляцию Пит-
цера. Чтобы применить аналитическую форму это’о уравдент-я, следует поза-
ботиться о выборе метода решения. Коэфрициент сжимаемости реально, о вещества
связывается со свойствами простого вещества, для которого ы - 0, я ч-oKjana,
выорапиою в качестве эталона. Предположим, что требуется рассчитать коэффи-
циент сжимаемости вещества при нскотцрь.х значениях температуры и давле.иця.
Используя критические свойства эцэго вещества, ензнала слсдуе, определить
Huii приведенный объем простого вещества'
Константы дразнения для простою вещества даны в табл. 3 9. После опре-
деления V<!1', рассчитывается коэффициент сжимаемости простого вещества
Z'3’
Д<,лес, используя те же приведенные параметры, определенные ранее, снова
решаем уравнение I1 9 I) относительно V/’’, по уже с константами для эталонного
веществ», (табл. 3.9), обоЗц<,ч11ч искомою величину через рУ'1- После этого на
О •'
Т\Г>.1ИГ|А 39 Константы уравнения (3.9.1)
Ксэффицпеш п пересующего пас веществ.- рассчитывае^я но
хряииепшо
2 2(<|> , (Z</?. _Z<°>) (39.4)
_ 0,3978.
Уравнение (J.9.4t использовалось для определения значений Zи Z <\
приведенных в табл. 3J и 3 2. В результате проверки, которая осуществлялась
ЗЛО. УРАВНЕНИЕ СОСТОЯНИЯ ЛИ - ЭРЬАРА — ЭДМИСТЕРА
Уравнение Ли—Зрбара—Вдмистера, как и уравнение Бенедикта—Вебба —
Рубина, предназначено в первую очередь для углеводородных систем 158). Оно
представляет собой модификацию более раннего \ равнения тех же авторов [57 ].
Уравнение приведено в табл 3,10, т описание его возможностей и точности дано
в разделе '.,4, поско.]1щх э,о уравнение разработано главным образом для онреДе-
:е:п)я airia.ibiiini п констант фазового равновесия у>лсподородиых смесей, нс
водюмстрицеских свойств Для расчетов по уравнений Ли—Эрбара—Эдмисгера
достаточно знать значения 7>, Рг и о Для смесей правила связей констант уравпе-
1йя с составом .тагм в разделе 4.7,
ГЛГ|Д[|ЦА 3 К1 Уравнение состояния Ли — Эрбара — Эдмнстера
RT а Ъс
-Т-6 -6)+ I +5) U IU I)
RT-
b - (0,086313 4- 0,002w) -jj-Щ (3 10 2)
<( _ | >0,216106-г О U286(.<w) - (0,037472 + 0 14С€87<ю) Т, Д- (0,16106 -f-
0.62372’w) + (0 9-1937 I Rl~ {Л Ю 3)
t_ [('1.161164 i-D.iiO'MSi,,; 7-I'2 |-
(0 387082 + 0,(1788420)) Г/-] (3 10 4)
39
Продолжение
l' - f~
- (" 277-.-H
2jj'! wrfrpotja
0,' 189927“' + 0.0750887,, 2)
; - (<J,£72547; k‘ + 9.l‘J425s7r-2) ДД
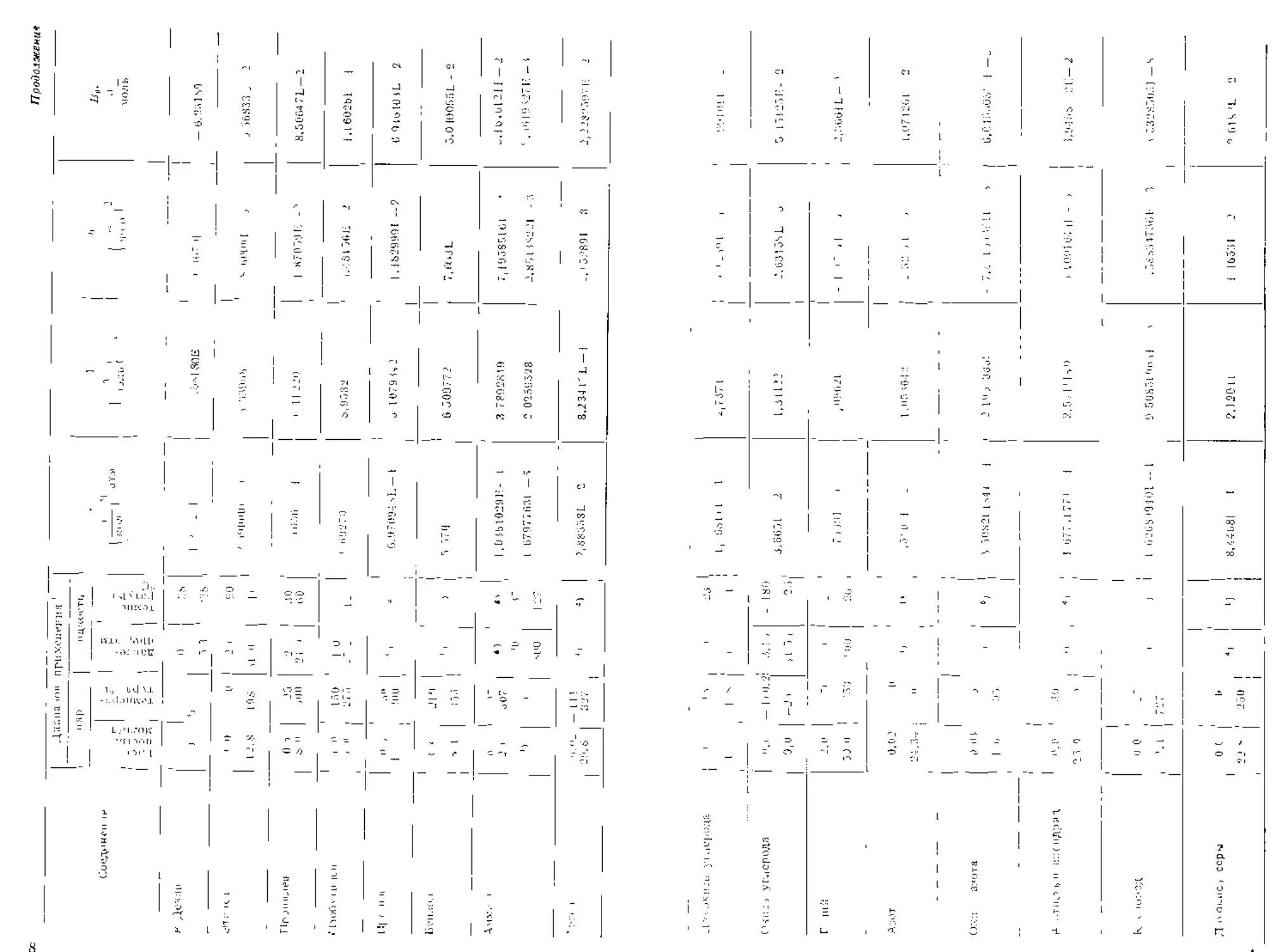
3-11. ВИРИАЛЬНОЕ УРАВНЕНИЕ
Польътннство об£','ждз?у.ъ1х выше дндлв-гйческих уравнений состояния
пнлючдст давление в явном виде и по форме похоже на полоном по обратным
стопеням объемов. Это цодтвержлястся и при рассмотрении вириального уравне-
ния состояния
RT J RT!3 , BTC
i ФФГ
Значения а и b не мог}i
соединений, не проявляющих
-IOB. ,-1ЛЬЛеГИД(,В. ширлдсв 1(
эфиров ; спел ьд\ сиг приближенное выражение
а ------2,] 10 |') '(,г — 4,4(18 р ’’и*
(3 ||.7)
(3 11.8)
(де Цр ____днислпьный момент, дебай: Р, ____критическое Др-'еМе, атм;
критическая температура, К.
В случае же веществ с водородными связями (спирты, вода и т д ) а и Ь —
константы, специфические Дтя каждого вещества Для спиртов с нерачпетвлеиной
и разветвленчой цепью атомов углерода коэффициент а постоянен и равен 0,0878
(кроме фенола, для которого а - —0,136). Для ал кил галогенидов а -- 0, незави-
симо от величины рг, за исключением моноалкилгалогенидов, для которых
рекомендуются снсциальпнс значения а 1128 ]. Величина b обычно изменяется от
0,04 до 0,06; для п'-которых спиртов ес значения приведены Цонппулосом [127]
Вещества с водородной связью склонны К ассоциации, и второй вмриальцый
коэффицисН! Н п диапазоне низких приведенных температур проявляет сильную
зависимость от темГ|Срат'’Ры (когда преобладает член Ь. Гр).
Пример 3.2. Определи-!, второй иприальпый коэффициент мсцптпаой) пн •
кетона при 120 °C.
Решение. По приложению Л находим Тс — 571 К; Р,,= .32,3 атч;
ы — 0,400 И цр = 2,8 дебай Определяем Тг = (120 + 273)/571 = 0,689, затем,
применяя уравнения (3.11 4) и (3.11.5), получаем J-0'— —0,675, / 1' = —0,690
апо уравнению (3 11.43) р, — <] СР) (2,8)s (32,3/5712) 77,7. Из уравнений (3 117)
и (3.11 6) а — --0,0] 67 и-1 = —0,156. Так как в метилизобутилкетоне вег водо
родных связей, b = 0. Далее, используя уравнения (3 II 3) и (3.|| 6) имеем
(В) (32,3)
(82 04) (57!)
— 0,675 ф- (0,400) ( — 0,600) Д_ ( — 0,156)
й — —1605 см’.'моль
Экспериментальное Значение составляет —1580 см3/мо,ть [44].
Ветере 1132] рекомендовал несколько иной способ определения второго
вириального коэффициента для полярных молекул:
(3.11 9)
(3.11. Ю)
(3 11 II)
^ 0,1042 -2^11 । 1>'2388 °’°'1С j I-502JO-3
Здесь "I — фактор ацентричности; <о(| определяется по уравнению
(3 11.13)
где Ту — нормальная температура кипения. К; М — молекулярная масса.
Если рассчитанное по уравнению (3.11.13) значение сор отрицательно, его
следует полагать равным пулю.
В уравнении Ветере функции g"'1 и g11 ’идентичны функциям, предложенным
Питцером и Керлом |9| |, а член Wpg'-'Добавлен для полярных соединений. Метод
Ветере нс пригоден для воды, СН3ОН и C3HSOH
Пример 3 3. Постирать пример 3 2, испо-тьзуя корреляцию Ветере.
Решен и е. '[ля метилиаобутилкстопа при 120 °C Г, = 0,689, ш — 0.400.
Ту = 389,6 К ii 4] - |00,161. Следовательно
ч>в
(389,6)1’72
~ 100,161
-263 = 22,2
По уравнениям (3.11.10) (3.11 12) получаем g"1, -- —0.663, g11 ’ = —0,753
И %'•= — 3,05- 10_J. Из уравнения (3 11.0) чахолнч Второй пнрпал'.цыл <оэфф11-
- -°“3 1 <0.400> (-0.7S3) (22,2,1 - 3,05 |,Н)
В = —1496 cms моль
3.|2. ОБСУЖДЕНИЕ СООТНОШЕНИЙ ДЛЯ ОПРЕДЕЛЕНИЯ P-V—T
СВОЙСТВ ЧИСТЫХ ГАЗОВ
точки.
3.|3, Р _ У _ Т СВОЙСТВА ЖИДКОСТЕЙ — ОБЩИЕ ПОЛОЖЕНИЯ
Haci,пленных жидкостей (главным оир;:3ом углеводородов и их п[
3.14. ОПРЕДЕЛЕНИЕ МОЛЬНОГО ОЬЬЕМА ЖИДКОСТИ
ПРИ НОРМАЛЬНОМ lEMnFPA'TiPL КИПЕНИЯ
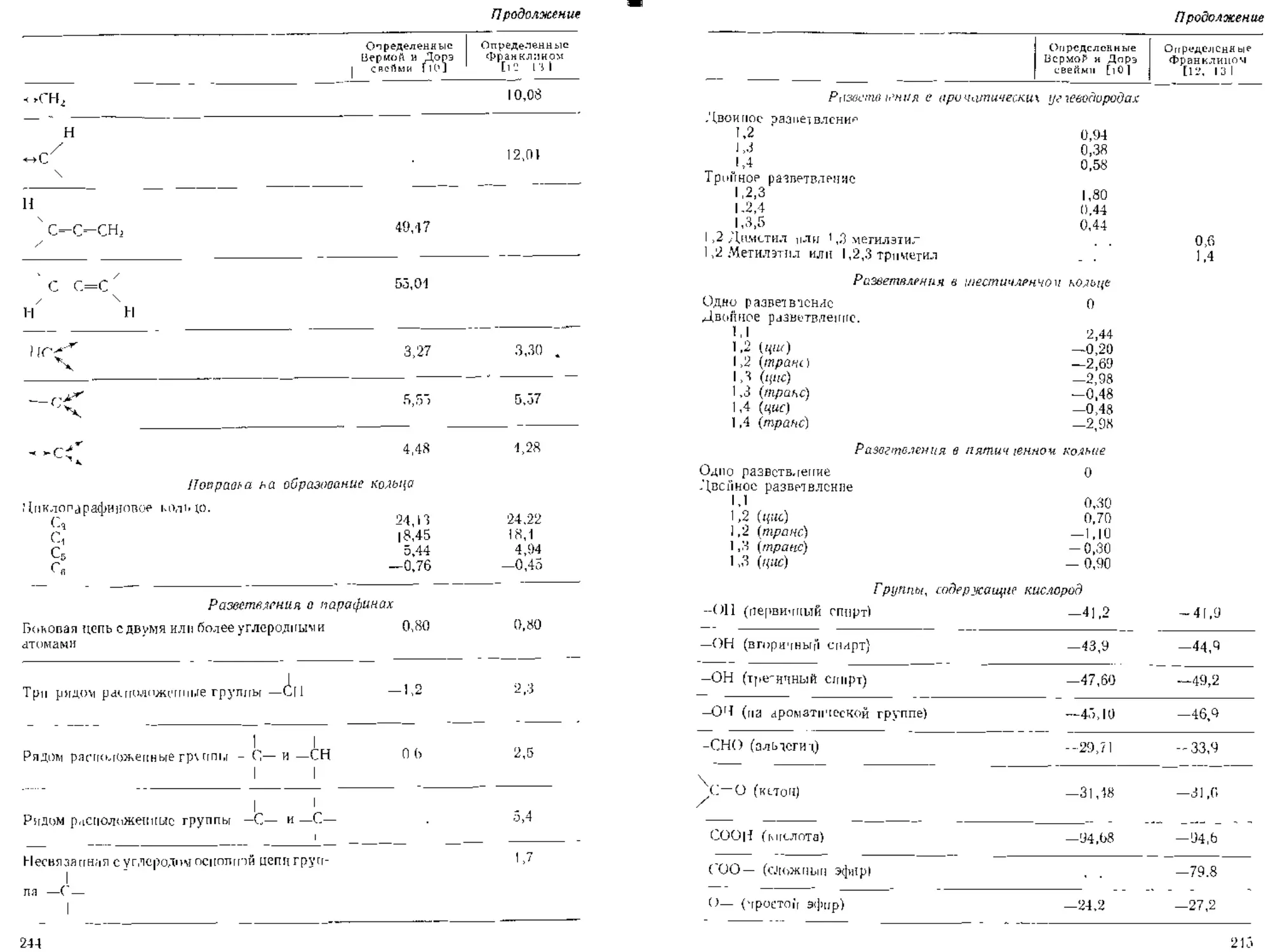
ТАБЛИЦА 3 II Аддитивные сос1ав.|ян>тие для расчета
мольных ((бьемов У/,
У'лерод 7 14.8
Водород 3.7
Кислород (за цск-люиеннем припсденпьдх ниже сдучаеи) 7 7.4
н метиловых слож-псх ,д простых эфирах в аги.товых сложны» п простых эфирах СаН4 В ВЫСШИХ Простых (1 сложных лрирж' и кислотах соединенный .’ S. Р. X с диадой связьк) в первичных аминах но вторичных рмипах 7 31,5 0,1 I1.D 12.0 8.3 I5.fi 10,5 12,0 27
Хлор 24,5 24.fi
Фтор 10,5 38,5 8,7 37
Иод
1 ер.1 21 25.G
7 -0,0
—7 -«,5 — 15.0 —30,0
ан ciы11н тс — i -47,5
Ме-ап 37," (58 (5 7 — 7,2 -21,5
Пропан 74,5 1114 ОД > л -0.7
Гептан 1Ь2 [58 1-8 -Оф 0.5
ЦикЛ01екс.1ц 1 17 58 -1.2 1.7 1.0
Этилен 49,4 138 -6,0 -0,8 -10
Бензол 96.5 158 -0,1 1 6 0,5
Фторбензол 102 58 -0,9 —0*5 — 1.0
Бромбензол [20 58 1 6 2,1 — 1.6
Хлорбензол 1 10 58 о'.о 0,0 1.7
Иодбепзол 130 58 1 о —0,4 —05
Метиловый спирг 42,5 58 - Г) 5 -1.2 2,7 -13
н-Прпииловып спирт 81.8 58 -L4 -0,5
Диметплоный эфир 53,8 58 2 0 [ з -4 5
Эсилтропиловый эфир Ацетон [29 77,0 58 58 —0,5 -ОФ -0‘5 —4.5
Уксусная кислота 64,1 58 —2 7 —и 6.7
Изомасляная кислота 109 58 0,3
Метилформиат (>2,8 J06 58 0,0 0Ф -03
Этилалетат 58 0,9 -0.9 2 5
Диэтиламин 109 58 3,5 2.8 2,7
Ацетонитрил Хлормстап 67,4 50,6 Г>8 58 10 —0.8 —2,4 0,2
Тетрахлормета и (четырех- 102 58 1,0 2',8 11
хлористый углерод) Дифтордихлорметан 80,7 551 —0,8 —4,6 0 9
Этилмеркаптан 75,5 58 0,9 2,0 2,5
Циэтилсульфит 118 58 1.3 0.9 3.2
Фосген 69,5 58 0,2 1.5 0.7 2,7
Аммиак 25 0 58 12
Хлор 45 5 58] -2.1 7,7 8,1
Вода Соляная кислота 30>> 57 58 3,5 -0,8 J2 2,9
Двуокись серы 43,8 1113] 0,0 — 12 —3,7
Средняя погрешность
ведсчн составляющие Дтя различных атомсв и функциональных групп. Точность
Этого метода отражена в табл 3.12, в которой сравниваются расчетные и экспери-
ментальные лепные мольных объемов при нормальной температуре кипения для
широкого круга веществ. Средняя ошибка для рассмотренных жидкостей состав-
ляет 3,0 % 1).
’) Правило Шредера было расширено с пелит учета палиния я молекуле
га.'ююиов, серы, тройных связей и т. д.
Правило Шредера было развито .Ле Па Г561 Составля|0Щ|1е Ле Ба для объемов
Даны в таб-1. 3 Н, и В табл. 3.12 приводится (равнение расчетных и опытных
результатов. Средняя ошибка составляет 4 %. Несмотря на это, метод Ле Ба
-тучше правк-та Шредера, так как имеет более общий характер и ошибка здесь
практически кетказательна Другие эддн'Ивпыс методы рассмотрены Федор-
сом /35]
соотношением
~ (6) (7) т (5) (Г) + 24,5 — 7 + (3) (7) ~ ИЗ см;‘/'моль
noipeiBiNcib--------------~ O'**
Метод Ле Ба. По табл 3.[[-.С- 14,8, Н = 3,7.0 = 24,6, кольцо = -15,0.
Следовательно
?(,= (6) (14,8) + (5) (3,7) + 24,6— 15,0= [17 см’/молъ
Погрешность = 15' 'J 100 — + 1,7'/о
Метод Типа и Калуса. По уравнению (3.14.1)
Vfi - 0,285 Vj.'0'8 = (0,285) (ЗОв)1'0^ = 115 см3/моль
115 — 115
Погрешность =--------—---100 =0%
3.15. ОПРЕДЕЛЕНИЕ ПЛОТНОСТИ ЖИДКОСТЕЙ
Существует ряд методой, которым» можно пользоваться для определения
удельного объема или плотности чистой жидкости Лаже в тех случаях, когда нет
никаких данных. Наиболее точные из них описаны ниже Все эти методы основаны
емсв жидкости только па линии насыщения:
JL.-. г<°4( -«Г)
(3.|5.1)
Здесь V — удельный объем жидкости, Кч — мяепггабирующий параметр
определяемый в терминах объема при Тг — 0,6.
0,3862 - 0,0866<о
(1 13 2)
uo’ii-irbif объем насыщенной жАдкссти прй приведенной температуре
данные по л отсутствуют, по 1\: можно вычислить приближенно но
В большинстве случаев масипабирчющий параметр К- бантик но значении
.<, 1 . Однако, ьотла известен чотьный"объем цасдЩ₽Н)Ю|| жидкости при любо»
-лмпер.’.турс, ве.члчина V.c шкст бь,ть исключена (см. уравнение (3 15 7)1
В уравнении (3.15 1) V/” и Г — фхнкши Приведенной температура, а о —
фактор анентричности. ,Тпя 0,2 Г- sj 0,8
1 !С) =0,3,3593- 0,ЗЗО.'ЗГГ - (,5[°4[Г;- 2 025127'^.-1- 1.Ц422Л
(' 0 2ЭД7- 0,090^5ГЛ — П,вШ2Т2 (3(5 0)
С известным значением V при некоторой опорной температуре, Г. е с
nprt Т*, у равнение (3 15.1) можно использовать для любой другой температуры Г,
т«кже как и для 7'-’’, и этим исключить Уэс. Таким образом
уу|(Т.)||-«гу’,)|
I ™ (Т!г{) [I _ мГ (Т?) (
(3 15 7)
Из всех имеющихся методов расчета объемов насыщенной жидкости этот
Представляется наиболее точным. Однако его не следует применять при Т. >
>0,99, поскольку прп Тс= 1 функция V/1 становится неопределенной.
Известно, что этот метод, применимый для неполярных и слабо полярных
веществ. Дает хорошие результаты для ацетонитрила и спиртов. Лю и Др 168]
предложч-пг похожее аиалттиКсексе соотношение Для определения мольных
объемов жидкостей. Они также нСпользовалч масштабирующий параметр Г арча и
Ямады. Точность цх методики аналогична точности оригинального метода.
Метод Йена и Вудса. .'(идерсен. f рщгкорн и Хоеген (70| разработали меюд,
основанный на принципе соответственных состояний, для определения плотности
чистых жидкостей при любом давлении и температур6 ниже Тг = 1,0 как функции
Т„ Рг и критического коэффициента сжимаемости 7.: Первоначально корреляция
была опубликована в табличной форме, а Йен и Вудс | [41 ] модифицировали эту
корреляцию, повысив точность и представив ес в аналитической форме:
Pj/Pr- I ]- V Л, ([ _rr)f's
(3.15 8)
где Рз — мелькая ллогность насыщенной жидкости; — критическая плотность;
Тг-- приведенная температура;
К, 17,4425 — 211.5782; )- 989,62527 - J 522 062? (3 159)
К,- - 3,28257 - l3,U77/t 4- 107 48442? -384,2112< при 2. <0,26
(3.15.10)
К, = 60,2091 — 402,0632. 501,OZj + 641,02? ri и Zr> 0,26 (3 15.J|)
Л'з — О (3.15.12)
/<, = 0,93 - Кг (3.15.13)
Лл« определения плотцосш гере<)хлажД''пноГ1 жидкости при давлении Р
(большем, чем давление паров Р1Т), предложено следующее уравнение:
' (! 13.14)
Первый член в правой части представляет ообой поправку на разность девле
ний APr - (Р — Pv-p}!Pi для соединений с Z,. = 0,27; второй учитывает стхчоис-
пие 2. от опорного значения 0,27. Если Zc = 0,27, то 6/ = 0.
Величина Дрг равна
д,,г = Е - F in Д/’г + G едр (Н £>Р,) (3 15 15)
Константы Е, F,0. Н даны в табл. 3.13 как функции Т,, Однако если ДРГ <;
<0,2, то вместо использования уравнения (3.15.15) следует определить Др,
при ДРЛ — 0,2 в воспользоваться уравнением
АР.
(3.15.16)
Если Zc отлично от 0,27, то не равно нулю и вычисляется по формуле
- 1 ‘I- 7 1п spr I’к esP (i,ipr) (3. [5 17)
Константы Этого уравнения даны в табл 3.13. Констаиты же, используемые
для определения /, J, К и L, приведены в табл. 3.14 только для дискретных
значений Zc. т. е. 0,23; 0,25; 0,24) (для 2. = 0,27 они равны 0). В большинстве
вычислений необходима интерполяция.
Проверка этого метода, проведенная почти для 100 жидкостей, полярных и
неполярных, насыщенных и переохлажденных, при температурах от точки замор"
зания до близких к критической точке и значениях приведенного давления до .30.
показала, что ошибка обычно была ниже 3—6%, Если отсутствуют данные
ТАБЛИЦА 3 13. Константы уравнений (3. |5.15) и (3.15.17)
Е = 0,714 4- |,626(] - Т,)'>3 4 * * - 0,646 (1 - Тг)-;з 4-
4 3,699(1 - Тг) - 2,198 (1 ~ТГ)'!3
О.гбЗТ2’0'’57
“ ],04-0,8(—InTj'1’’1’
G = 0.05 4- 4,221 (1.01 - 7'г)с’75 ехр [—7,848(1,01 —74)1
// - -10,6 + 45,22 (1 - Гг),/3 - 101,79(1 - Т.)2'1 +
4- Ц4.44 (1 - 7» - 47 38 (1 — ТЦ1'3
/ — <т( 4- <4 (I - Гг)1/3 -Н а3 (I - Гг)-'"! + О; (1 - /г) 4 (1 - П) /3
/= Ml - Л-^’ + М! -Л):/3+М1 7 r) i /»6 (1 — 7'4 *'1
/< = г|+Мг4-с;г2 + с/;
L = d, + (I - 4- dz (i - Г^3 4- dk (1 - Tf) 4- d„ (1 - T,}'’ ’
ТАБЛИЦА 3 14. Константы уравнения (3.15.17)
7 - 11.29 | ас =- о ;=> /е = и.зз ZC = 0..3
-0,0817 0,0933 0,0890 0,05626 0 0)937 -0,01393
а2 0,3274 —0,3445 -0,4344 с2 0,3018 -0,03055 —0,003459
—0,5014 0,4042 0,7915 0,619! 0 0631(1 -0,1611
'Ч 0.38.0 -0,1342 — 0 2083 0,05473 -0,7654 0,3367 -0,3809 0 0
- 0,02.30 0,0200 (1,0674 d, -21,0 -16,0 —6,550
- 0,0124 -0,003363 -0 06109 55,]74 30,699 7,8027
0,1625 — 0,07960 0,0626[ -33 637 19 645 15,344
— 0.2I3D 0,08546 -0,2378 -28,100 -81,305 -37 04
?'з 0,08643 —0,02170 0 1665 d6 2.3 277 41,031 20 169
о критической плотности или они сомнительны, то для их определенна можно
использовать различные расчетные методики, Тах как уравнения (315.8) и
f,3 15.15) содержат р, только в левой части, в качестве опорного значения плотности
жидкости можно использовать какое-либо надежно определенное значение плот-
ности насыщенной жидкости при низкой температуре. Когда указанныеуравнения
записаны с использованием такого опорного значения плотности и на их основе
получены рабочие уравнения, рс исключается из всех форм Применение этой
модификации не приводит к заметному увеличению времени вычислений.
.Методы Чью и Праусница [20], Ликмана. Эккерта и Лраусница [69]. Исходя
из своей более ранней корреляции, основанной на принципе соответственных
состояний [691, Чью и Праусниц предложили коррелировать плотность жидкести
с Р, Т, Zc, Рс, 7V и фактором ацентричности:
„„„.О^Х^ОаИ1'9
(3 15 |8)
где Р\р — давление паров; Р — давление в системе; Рс — критическое давление;
Zc — критический коэффициент сжимаемости; N — функция фактора ацентрич-
пости и приведенной температуры
,\ - (1.0-0,89<ь) [ехр (б,9547 -76,28537, - И1,3060Т; - 203,54727®+
+ 82 76317)) J (3. .5.19)
Величина ps представляет собой мольную плотность насыщенной жидкости
пои 7Г и /\,р. Она определяется из уравнения
Р» ' г
Функции Vr в уравнении (3.15.20) можно выразить как
(3.15 2U)
<3.15.21)
-3||.1Ч1>Н)1я коэффициентов'
0 2109|
1.82484
-О.О8447С
О 087037
0,34095
Величина р,, входящая в уравнение (3.15.20), может бить рассчитана, если
другую опорную плотность использовать в таком ?ке -обгцеьт подходе, как п описан-
||ЫЙ в методах Ганна —Ямадм и Йена—Вудса
* . По точности эго। метод сравним с методом Йена—Вудса. Однико некоторые
трудности вызывает вычисление логарифмической функции в уравнении (3 15 21)
при значениях Т,, близких к единице.
Метод с использованием коэффициента сжимаемости жидкости. Ктэфф,;-
циент сжимаемости жидкости можно определить по ypaB-jcjtHio (3 2.11 но Р
в таком случае должно быть равно давлению насыщенных паров при 7’ или больше
его За исключением области высоких приведенных темгератур коэффициент
сжимаемости жидкости почти пропорционален давлению при постоянной темпе-
ратуре Так как мольный объем пропорционален отношению Z Р, он практически
499
Метод Ганна и Ямады Опорное значение Тн равно 20 °C, а Т1, — 0,587.
Используем уравнения (3 16.4)—(3 15 16)
[/(«) = 0,487
1/!) —0,383
__ (О.185
- [0,226
при Т — 0,848
при = 0,587
при ТГ == 0,818
при Т? =- 0,587
Затем по уравнению (3.15.7), где Vя = 74,05 см’/моль
(0,487) j 1 — (0, [90) (0, [85)]
' ' (0,383) [1 - (0,190) (0,226)|
= 94,9 см3/моль
Оа Q__пх о
Погрешность = —' gg —100 = 0,1 %
Метод Йена и Вудса Сначала определяем значения К в уравнениях (3.15.9)—
(3.15 13), используя Zc = 0,274
Кт = 1,634
а затем
р> (Т, - 0,848)
К2 = 0,843; Kj=«0; 7^ = 0,0872
; 1,635 (1 - а,848)|/3 7 0,843 (1- 0,818)2'3 4-
+ 0,0872 (1 — 0.8I8)1'4 ---2.1?,
- Д - Is--’7'6
По; рсгьцос ~ь ~ ‘(00 = 2,8%
Метод Чью и Праусница. Значенья V"’', Р’Д и V)2' для Тг =0,848 и 0,587,
определенные гз уравнения (3 15 21), приводятся ниже:
7 г | Г^’ 'г1’ | VP
О 848 0,485 -0,00907 —0,206
0,587 0,386 —0,1 [8 0,0824
Используем уравнение (3 15.20' со з шепнем фактора ацеитричносп ‘л—
pt/ps = 0,485 Н- (0,190 (-0,00907) + (0.I90)3 (-0,206) - 0,476
P/Ps - 0,386+ (0,190) (-0,118) + (0,190)2 (0,0824) - 0,367
По первому из этих двух соотношении
Если, однако, соотношения при Т, -- 0,848 и 0,587 разделить одно на другое,
рс сокращается, и, исцилЬзуя V при Тг — 0,587, равное 74,05 см’/моль, имеем
Vs=--------(М76)---- CM'/S,U,,b
Hr.i ( ешность для этих двух случаев составляет, соответственно, 1,1 н 0,8 %.
Обычно предпочитают использовать в качестве опорного значешя другую плот-
ность, а не рЕ.
Метод е использованием коэффициента сэцимаелилти жидкости Для олреде
ления коэффициента сжимаемости жидкости используются табл 3.1 и3.2 Приве-
денная температура равна 0,848. Для того чтобы получить давление пара при
150 ’С, можно воспользоваться уравнением Гарлахера. которое применимо в широ-
ком диапазоне условий (см раздел 6.6 и приложение А) Расчетная величина
давления паров 17,2 атм. Таким образом, Рг — 17,2/54,2=0,317. Далее из
табл. 3.1 н 3 2 определяется коэффициент сжимаемости при Тг = 0,848 и Рг =
= 0.317. Интерполяцию здесь выполнить непросто. Предположим, что Т,~
— 0,848 0,85. Тогда, поскольку* Z •= Рг, можно составить следующую таблицу
0,16'26
—0,0652
Таь как после приближенного вычисления давления паров известно Рг — 0,3,
iijien эьстраполеции соотношений Z<''7Pr и/Д /р, для этого приведенного дав-
ления можно легко определить Z '^IP, ~ Q.166, Z"’iPr - G.O&J. Затем
ZRT Z RT RT/^2_ , ()ZU)
(3<М/ 7W l-J/3) |6Ь . (0 |%) ( _ 01Э69)| =9?/,
3.16. ОБСУЖДЕНИЕ МЕТОДОВ ОПРЕДЕЛЕНИЯ ПЛОТНОСТИ
ЖИДКОСТЕЙ
D предыдущих разделах особое внимание было уделено корреляциям, исно-
ванпьсн цэ принципе соответственных состояний, которые в наибмьшей степени
подходят для машинных расчетов. Выше ничего не было сказано о том, что для
расчета мольных объемов жидкости могут также использоваться некоторые урон-
ггешгя состояния газовой фЛы (например, для Углеводородов — ураияе.ч1.'<,
Бенеднктл—Вебба—Рубина), поскольку обычно они мецее точны, чем другие,
упомянутое здесь При всех методах расчета (кроме метода с пспользовгнием
коэффициента сжимаемости жидкости) требуется знать по меньшей мерс одно
значение плотности жидкости; часто это — критическая плотность, хотя можно
устроить ,ак, чтобы в качестве опорного значения использовать величину плот
носит при любых определенных температурах и давлении.
Для насыщенных жидкостей ниже ТГ - - 0,99, предпочтительнее использован,
Метод Ганна—Ямады [уравнение (3.15.1)]. так как он несколько более точем
Cnciicep и Пеннер I [ [ IГ сделали обзор всех уравнений, пригодных Для oj рсделе-
ипя плотности насыщенной жидкости, и после тщательного изучения нашли, что
ьорреляпия Гднна —Ямады является наиболее точной. Тем не менее они все же
подчеркнули, что если в корреляции Рекета [96] критический коэффициент сжи-
маемости заменить некоторой эмпирической константой, характерной для изучае-
мого вещества. то эти уравнение дает нсскслько лучшие результаты, чей метод
Ганна—Ямады. Танце константы табулированы. Ямада и Ганн [ [39 | также пред-
ложили несколько модифицировать уравнение Рекета. Их модификацию можно
где
(3.16.3)
£„— 0,29056 — 0,08775®
т«) = (Г — Тг)''7 7^2/1
— мольный объем жидкости при опорной (привсдегеной) температуре rf.
У этого простого уравнения точность почти такая же, что и у корреляции Ганна—
Ямады. Для большинства неполярных насыщенных жидкостей погрешность
составляет меньше I %.
удавнед.ии Рекета.
0,190 Цо уравнениям (3.16.1)— (3 (6.3)
lLr - 0,29056 — (0,06775) (0,(90) = 0,274
V - (74,05) (0,274)' °'193 =^94Д см’,'мои.
П<‘| peiuiw.TL
жидкостям, можно использовать корреляции Йена—Вудса ]уравнение (3.15.3)]
или Чью и пр [уравнение (3.15.18)] Последняя не рекомендуется при приведен-
ных те'.гератургх врпис Т. 0,99. Об<, уравнения хорошо йроиеренм длн чисти х
пен(ССгв, полярных и неполярцы^• Специально для полярных веществ 11икаинх
мс-огоя разрабо'апо цс было, нс о5а упомянутых метода дают приемлемые резуль-
таты _1',я Золее точных определений следует обращаться к корреляциям, разрабо-
танным епгциальио для полярных жидкостей [41. 51, 118].
В достаточно полном исследопапии корреляционных Методов определения
эффектов температурь' и давления в случае чистых углеводородов. Реа и др. (98]
рекомендовали корреляцию Чью и др. для учета влияния давления, а для нахожде-
ния объему касышенной жидкости предложили модифицированное уравнение
Рекета [96, Кроме того, они предетпввди в anajwTti4ecuoft форме графическую
корреляцгкт Дю для лпрсде-тсния влияния давления на обт.ем жидкости 16б],
чтобы ее можно было использовать в машинных расчетах. Хапменс [43] тоже
изучал углеводороды с низкой молекулярной массой и предложил уравнение,
соотносящее ор-обарическую плотность жидкости с приведенной твметературой.
Для очень сильно сжатых жидкостей м<й ут оказаться полезными специальные
корреляционные методы |34, 45].
Корреляции, связывают-|е рд с ру и температурой при насыщенна, описаны
в работе 1(03!.
Греческае
Глава 4
КОМБИНАЦИОННЫЕ ПРАВИЛА ДЛЯ&МЕСЕЙ
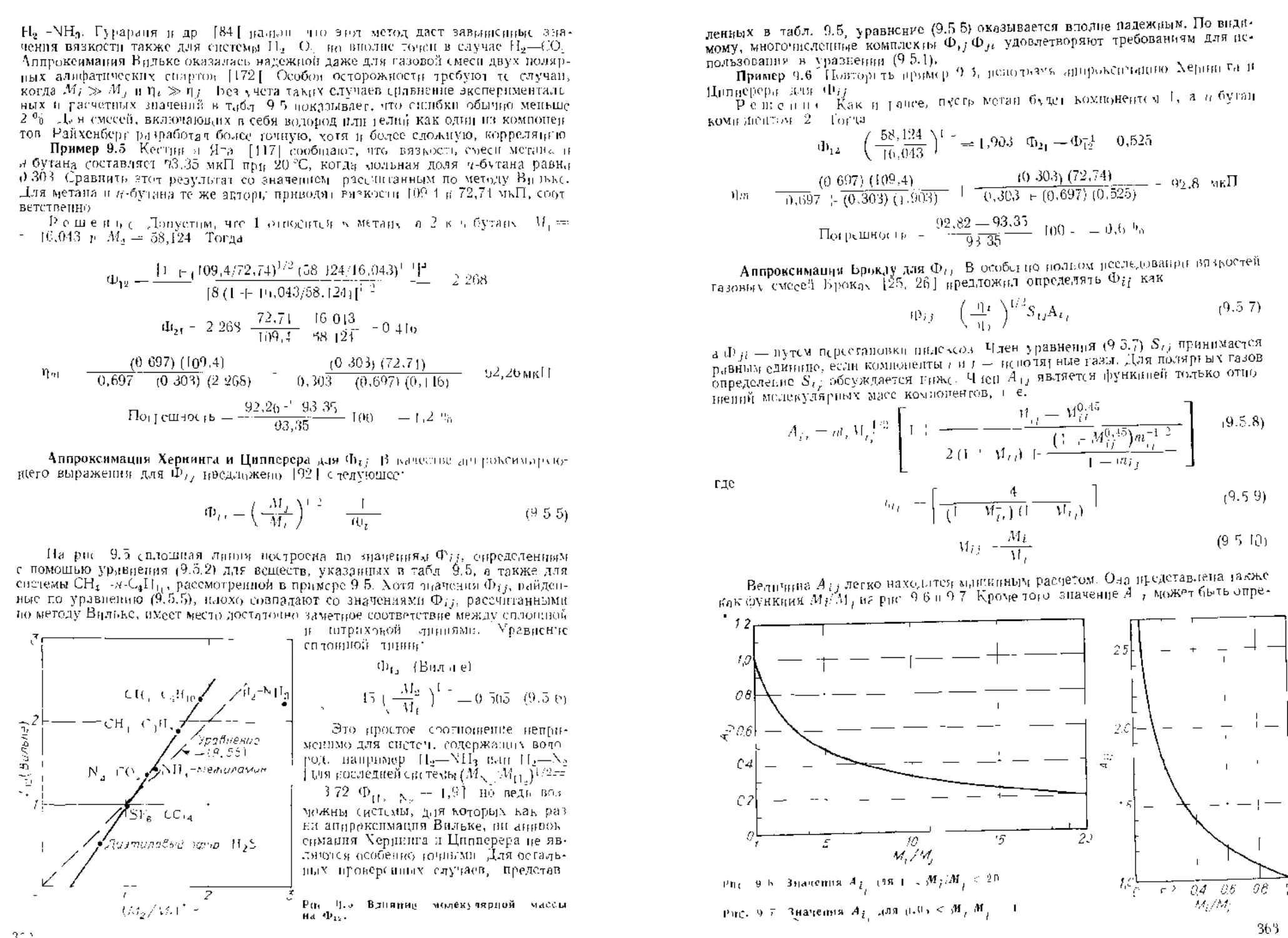
СОДЕРЖАНИЕ
ГЛАВЫ
ОСНОВАННЫЕ НА
ИСПОЛЬЗОВАНИИ
ПРИНЦИПА
4.2. МЕ1ОДЫ,
СООТВЕТСТВЕННЫХ СОСТОЯНИЙ ДЛЯ СМЕСЕЙ
В разделе 3 3 обсуждались двд метода, в ко’орьх используется принцип
соответственных состояний. Коэффициент сжимаемости связывается с приведен-
ной температурой, приведенным Давлением и по уравнению (3 3.1) с фактором
ацентричиости Для использования того же метода для смесей, необходимо сфор-
мулировать I равила, связывающие псевдокритические постоянные счеси с соста-
ном. Известно большое количество таких Правил fl], ] 5, 21 ].
Псевдокригическую температуру 1'с1П обычно с удовлетворительной Tt ч-
ностью определяют как простую сумму мольных составляющих- Это правило
чтсто паа явают правилом Кэя [13]:
Сравнение значений 7',-,р рассчитанных но уравнению (4.2.]) со значениями,
определенными по другим, бодес сложным правилам, показывает, что разница
обычно не превышает 2°й, если для всех компонентов выполняются условтя
Определение цСевдокритического давления как суммы чол i.hm* составляющих
критических давлений компонентов обычно не дает удовлетворительных результа-
те аа исключением тех случаев, когда компоненты имеют похожие критические
давления или критические объемы. Наиболее простым правилом, дающим приемле-
мые резусуьтаия, является модифицированное поавило ilpaycinma и
Глн;щ [1А[
(4.2.2)
смесь во
всех случаях аппрсксимиру-
= 5>л
(4 2.3)
•ния <4.2 I)—(4.2.3) не включены параметры бинарных (пли выс-
,ств т. Поэтому эти правила смешения не всегда могут верно ото-
MCTOnWI. ИСПОЛЬЗУЮЩИМИ принцип соответственных
прохожих чр\г на друга компонентов, особенно,
х являются пс.,тарными и имеют тенденцию ассо-
тоол,’творительнмх усамльтятов в расчете свойств
Если имеются экспериментальные лаиные ио всем оипариым составляю цим
,-меси. Представляется разумным использовать такую информацию для модифика-
ции )(севлокритическ|1Х правил. Несмотря ца то. что существую! широкие возмож-
ности аыборя, один чэ подходов, заключающийся в преооразоваиив уравнения
(4.2.1) из линейной в квадратную форму, наиболее часто оказывался успешным:
<4 2 4’
где
Наидччшисацачепия получаются обратным пересчетом из экспернмеиталь»
ных дл1н'ых методом последовательных приближений. Если принять k* равным I,
то уравнение (4.2.4) превращается в Г4 2.1). Имея значения k'f- для всех возможных
пар компонентов, можно рассчитывать свойства многокомпонентной смеси.
В табл. 4.3 приведены значения й* для многих пар веществ [ 11.
Однако от такого подхода не следует ожидать слишком миогги о Во-первых,
уравнение (4.2 5), возмож ю, и не самое лучшее для выражения Т{ С точки зре-
ния молекулярной теории гораздо легче оправдать использование среднего
геометрического из 7V, и Т . Во-вторых, tie учитываются параметры тройных или
более высскцХ взаимодействий. В третьих, нс стоит, по-врдимпму, слишком пола-
гаться на то, что для данной бинарной смеси имеется единственное значение k’,
которое при этом не является функцией состава. Температуры или давления.
Только опыт может придать уверенность в использовании подходов подобного
Далее рассмотрим, как аналитические уравнения состояния, у поминавшиеся
в гл. 3, могут быть модифицированы для смесей.
4.3. УРАВНЕНИЕ СОСТОЯНИЯ РЕДЛИХА — КВОНГА
Для уравнения Редлиха—Квонга в оригинальном виде, Представленного
н разделе 3.5, параметры 21* и В* выражаемые уравнениями (3.5.7) и (3.5 8|,
должны быть определены ДЛЯ смесей. Как предлагается в первоисточнике
Ч В некоторых статьях TCij^ 7'1;Г(; (1 — kt-). Ясно, чю
<|Д(ю л it, же, хотя оцн могу i быть ад ко соотнесены друг с другом.
ТАБЛИЦА 4.1. Функции F^ а уравнении (4.3.6)
Fj опредсляе-с<1 । <> \ раИкснчю (3 Г> и)
г„ - I + (0,0 + 1.21»!,-I lj
<о( + <0
--------
ТГ;; — критическая температура нзнимодеиствия. полу-
ченная обра,ным пересчетом из экснсриментал’т.-
иых даИ(1(,|Х иди по правилу подобному Урапнепню
J еТлХ
Ft. f, —определяются по уравнений (3 5 15); параметр
взаимодейс-пия k.j равен приблизительно нолю
для углевсдород-утлеводородных пар, для'не-
скольким других сисем значения &ч npejci.is-
лепы в т.,бт. 1 j
При допущении, что Рд и — конегии im I к;и, и уравнен ня х (3.0 4) и (З.о о) |,
Уравнения (4.3.1) и (4.3.2) делают возможным прямее непользованис соотноди-нин
(3 5.7) и (3.5 8) для определения Я)(( п 8‘, если псевдокритические темпер-,тсрь j
давление смеси определены как
(4 3 Зз
pl,
ТЛЬЧИПЛ 12 Значения £./ для модификации уравнения
Редлиха Квонга, разработанной Соаве [8J
1 СТ.КШода С(рО"-.дор<;,< 1 Л:.4ОТ | утле-ола
Мстчи 0 12 0,08 0,02 -0.02
Этилен 0 !5 0.07 0,04
Этан 0.15 0,07 0,06
Пропилен 0.03 0,07 0,06
Пропан 0 b 0,07 0.08
1 Робитаи 0 )5 0,№ 0,08
н-Бттиц 0,15 0.06 0 08
Изс,ПСН7.|К 0.10 0,06 0.08
и-11ентан 0 15 0,06 0 08
1,-1 Г ЛТ Г 0. [5 0,0о 0.08
и Гептан 0,15 0,04 0,(?4 0.08
,, Г"т,.' у... ч 0.IJ (1,(8
и-Нопаи 0.1о 0,03 0,08 0 (18
н-Дскаи 0,15 0,03
Дв'окись чгтерод.! 0 1-5 0,03 0,12 0,(8 -0 04
I (пклси ексаи 0,15 0,03 0,03 0,08 0,08
Метилниклогексди 0.15
Беитсл 0,15 0,03 0.08
Т.8 -П'П П 0,(5 (1.(3 0,08
О Ксилол 0.15 0,03 0.08
Л-Кси.ТОЛ 0,15 (1.03 0.08
п Кснсю.'Г 0,15 0.03 0.08
илбенчол 0, (о 0,03 0 08
Те же псевдо»р'-<тИ'1Сские rp.iBn.ia применимы к модификации уравнения
Реддика- Квонга, сделанной I реем, Рентой и Зудкевичсм, и мо,у( использо-
ваться для расчета Тг„, и Рг,,ъ уравнении; (3 5.10) для определения AZ,„, В этом
соотношении
wOT^ V иы, (4 3 5)
Модификация уравнения Редлихэ— Квонга, описываемая соотношением
(3.5ц I), для смесей' будет иметь вид
где 12,; и £2>> определены уравг синими (3 о 4) и (3.3 5к Все авторы рекомендуют
(4.3 7)
где b дастся уравнением (3.5.3), т. е.
(4.3.8,
Коэффициент /„, выражается различными способами, В табл. 4.1 представ-
лены рекомендуемые выражения для ЛТ1 применительно к оригянлтыту урдпне
кию Редлих.1 Квонга и модификациям Вильсона [27], Барне—Кинга [21 и
Сочве 14, 22].
4-4- УРАВНЕНИЕ СОСТОЯНИЯ БАРНЕРА АДЛГРЛ
Эго уравнение состояния описано а р-одедс ч Ц,< о,,.
следующие уравнения
(4 4 4)
(4 4 7)
Бс.Г1ГЧ1Н’Гч / Il I' трещин ГнСЯ ’ТОЧНЫМ 0;ч чин М,если ИЧЛОС'ГиЫ ЗНяЧСНИЙ
чтя вг'Ч’т-',ы щ пар Уш пар<:?гпиьг 4/) .\ар,1ктерпяуют бинарное взаимо-
д и тви г I hi ь 1 rie и, rii т nit inj ( n aiii-ciii b ehii
и ip i | ы IL i к I i । д i e < Ll I 1 L i в пн 11 j it ip i i езячм я и твия.
виенвые Предложенным Пью н ripavcri 'пом [(>] В гаол. 4 о приг.одится ряд знэче-
ТАБЛИЦА 4 3. Значения Л по Барнеру и Квинлану '!)
КОМг-ОИС'ПТ
‘ \ - 1
М»т Эл плен 1,01 1,03 и или Из<'б\ тан ИзоГптал 1,00
Т|т 1П ч-Пентаи .00
Прояилер 1,06 11 чспен 1 а .00
Пропан 1,07 --1 ск;ге Cl О
к Бт'тан 1,11 . ГГТ,Т * •! 1,0.'!
Изобутаи 1 11 Цикле! сксан 1,01
и-Пентаи Изопентан г’15 f- ИЛИ 113Г''!С(| Изопентан 1,00 1,00 1,01 1,02 1,00
ч.-Гексан н Гептан Циклогексан Наф~а.тин 1,19 1,22 1. 16 1,23 Циклсгегсан
я Гаксан н Гептан 1,00
Этилен i*Jt н 11 t 00 л О1\1 ян 1,01
Пропилен 1,02 1 02 1 05 1 05 1.08 1 с-т'-дл 0,98
Пропан н-Б'тан Изо’бутан ь-Пентан Цн1'ЛС'ек,.<1(1 н Гептан к Октан 1,00 1,00 0,99
Изопентан ] .08 / Октан 1,01
и.1 сксан Циклогексан 1,09 Азот Мега г 0,97
« Гептан 1.13 1,0’ Эта,: 1,02
Нафталин 1,15 1 Пентен 1,13
Э*аи Пропиле t 1.01 I 1 CKCPI, 1,25
Пропан 1,01 АзО( п-Гексаи 1,26
«.Бт'тяк 1,03 1,03 " I оптан 1.3[
Изо’бетан п Октаи 1,34
«-Псптаи Изопентан и Гексан 1,05 1,05 1,08 Аргон Кислород Азот 0,99 0.99
н 1ептап 1,10 Дпсокксь \ гсс а* 1, , г ,1.94
Циклогексан 1,06 ради Этан 0 92
Бензол 1,04 1 (гтшгмен 0.93
Нафтали п 1,11 ( 0.93
t, Пуган 0,93
Пропилен Пронин 1,00 11 чфТаЛнр 1,07
н-Бутак ИзоЬутан пот СерипСТЫр рс ,Mci йн 0,93
/т-Пентаи Изопентан Бензол 1,02 1,03 1,03 ДОрпД Пропан г 1 )ептли Двтокисп VT 0,92 0,96 0,92
Ппопан н.Бутан 1.0[ лср'от 1
ИэобУтан 1,01 Н . 1 ,Р ,, 0,91
и Пентан 1.01 '>’.'11 0,92
Изопентан 1,02 1 [рори.-е г 0.95
Бензол 1.00 !; нН'11 11 г (И) 4
.\лир)|. и,и । । ЛОрГП Пр "г и ОДЗ
пни параметров 11 ], которые были получены образомм пересчетом из пара-
л,егров Чью—ПрзусиЯ/м Ботыпитгстяо к/ к слияние Теи /л
менее даже небольшое Отклонение этих значений от едциш>ь> может весьма ошс-
тпмо отразиться на величине рассчитываемого свойства.
Для учета взаимодействия нар простых компонентов k' Мо-кет быть прибли-
женно скоррелировано с оз ношением нритцческих обкем<н| чкс|>.'> 1>|,.кчкэто
давления и состава. Для случаев, когда Табл. 4.3 нс содержит соогветс|пующс|0
значения ине может быть использован график в а рис. 4.1, следует принять какое
либо значение £' или получить ио крайней мере несколько экспериментальных
Р — V—Т эпдЧсшш, по которым может быть определено /с* .
Когда 1/д -* I, то нс обязательно Приходит К Рс чистого комндиенга А,
поскольку Zcx — 0,291 — 0,08<n^.
4.5, УРАВНЕНИЕ СОСТОЯНИЯ СУТИ - ЛЮ
Для у равнения состояния Суги—Лю, о котором шла речь в разделе 3 7 и основ-
ные характеристики которою даты в табл а 5, предложены следующие правиле
для определения ТЧь. рс,п и
I тМД/М I
(4.5.1)
--!Х-(^2>
t’/' м"-,'
w,n J"* У w (4.5.3)
ZC/n (/.241 - О.ОЗОщ,, (4.5.4)
Параметром бинарного взаимодействия в этом случае является k\-, значение
которого обычно близко к нулю Связь его с параметром £*, и уравнении Барнера —
Адлера далеко не проста. Значений k'ti практически не имеется, и эту величину
следует либо принимать равной нуд ю, 'i»f>o определять г,о экспериментальным
данным. Если IP предполагается равным нулю, то правила Для псевдокритически к
температуры и давления сводятся к соответствующим правилам для урав юпия
РеДлихо—Квонга в оригинальном виде, г. с. уравнения (4.3.3) п (4 3 4).
4,6, УРАВНЕНИЕ СОСТОЯНИЯ БЕНЕДИКТА - ВЕББА _ РУБИНА
Уравнение Бенедикта—Вебба—Рубина представлено в разделе 3 8 Авторы
предложили связывать все восемь констант с coc-авом уравнениями вида
Предложенные значения г для каждсй константы Бенедикта—Вебба—Рубина
были следующие
Несмотря та то, что ->тя простые правила смстсчяя исгои ьэовз-'тись во многих
работа х, все же с целью повышения точности п расширения применимости г равне-
ния предлагались различнее их модификации Шготлер и Бенедикт [25], Оран
116], Гуньони и тр. [10], а также Б шиной и Робинсон [3] показали. что i рави.к,
для может бьль переделано в
ч. -в s ».v./v42 1Ш>
Если параметр ( ,/ равен единице, то уравнение (4.6 2) превращается в пра-
вило смешения для уравнения Бенедикта—Вебба—Рубина в оригинальном виде.
Отклонения L,j от единицы становятся более важными для смесей при низких
температурах, Гуцьонн и др. ГЮ] определили значения Б(/ для смесей COs —
этан При этом было найдено, что L (/ является слабой функцией температуры и его
значения меняются <>т 0,87 при 10 °C до 0,82 при —57 X. Тем »е менее обычно Этот
параметр считается независимым от температуры, давления ч состава Приблизи-
тельные значения L,'i могут быть подучены приравниванием £;/ к 1 —kfj, где
kij - параметр взаимодействия, предложенный Чью и Праусницсм |6]. Другие
авторы |3, 24, 25] цреллэ! a.'jn модификации оригинальных правил смешения
Бенедикта Вебба Рубина, которые, однако, ис голучил j распространения, за
исключением уравнения (4.6.2].
Для модификации уравнения Бенедикта—Вебба—Рубина, разработанной Ди
> Кеслером (сч раздел 3.9), правила смешения выражаются уравнениями
Уп (4.6.3)
4SS'.M'o + r“T (4.6.4)
(0.2905- 0,085м,)RTri (4.6.5)
<“,п — S -v,w, (4 6.6)
(0,2905 _0,085ю,„) RT.m (4-6 7)
CTti же правил., исп(отьзуго(ся н тогда, когда значения волюметрических
xap.ii; .еристпк переделяются но табл 3.1 и 3 2. Проверка проводилась только па
смесях \тдеводородов
4.7. УРАВНЕНИЕ СОСТОЯНИЯ ЛИ — ЭРВАРА — ЭДМИСТЕРА
Уравнение состояния Ли.Эрбара иЭдмистера, представленное в разделе 3.10,
разработано ими первоначально применительно к смесям паров углеводородов-
Константы этого уравнения для чистых веществ даются зависимостями (3.10.1)—
(3.10.4). Комбинационные правила для смесей представлены в табл. 4.4.
ТАБЛИЦА 4 4. Правила смешения Лн, Эрбара и Эдмистера
Ьт -
(4 7 2)
r'T - S yftl! (‘<‘7»'
(i 7 3)
(4 7 4)
2,0, если ин I. пн j не Н2, СО2, N2 или СН«
О, если 1 или / нс Н2. СО2, N2 или СН4
0. если i или / нс H<
4.8. ВТОРЫЕ ВИРИАЛЬНЫЕ КОЭФФИЦИЕНТЫ ДЛЯ СМЕСЕЙ
У сеченное вирпальное у равнение, представленное в разделе 3.11, представ-
ляет собой единственное уравнение для реальных газов, для которого известно
точное соотношение для коэффициентов смеси:
Например, для смеси трех компонентов 1, 2 п 3
Р'ш - *1б1
(4 8 2)
Вторые вириальпыс коэффициенты чистых компонентов Bi, Вг, В2 Mot ут быт:,
найдены способами, списанными в разделе 3.11 (например, уравнения (3 11.3)-
(3.11.5)]. По критическим температурам, критическим давлениям и факторам
аиснтричюстн для чистых веществ Для определения вириального коэффициент
взаимодействия для смеси по уравнению (3.11.3) необходимо принять какие-либо
правила для расчета Т: tn;/ Эта задача рассматривалась с теоретической
точки зрения Леландом и Чсппслиром 115], а также Рамайа и Стилом [20]. Для
типовых инженерных расчетов применительно к нормальным газам и жидкостям
полезны следующие простые правила [17, 26].
(4 8.3)
(4.8 4)
(4.8.5}
(4.8 6)
Ьс^мижнс. «и сом ион.i. ния надежны только для молекул, которые не сильп >
химической структуре. В первом прибли
+ ипи i it j riimpi i i им<действия может быть принята равной нулю
utivo.ii'.KoBati список лтих коис нпт для целого ряда бинарных систем [6]. Реко
мснд I ।цы т 11 е мо 11 [1 Ш)[ ь и ине критические константы для случаев, когда
пары молекул содержат квантовый газ (Н2, Нс иля Ье).
4 0. ПРАВИЛА СМЕШЕНИЯ
(4.9 I)
ио Y пропорционаллно У. Это соотношение основывается на предположении, что
молекулярный диаметр взаимодействия есть среднее арифметическое молекуляр
пых диаметров i н f:
(4 9 2)
F.. _
(4 9 3)
где IF пропорционально энергии.
Энергию взаимодействия очень часто связывают с критической температурой,
поэтому уравнение (4.9.3) обычно встречается в комбиизинонных гравилат, смеше-
ния для ГС/;. [например, уравнение (4.8.3)].
В дополнение к этим грубым правилам необходимо заметить, ч ,и иория даст
второй пирпальпый коэффициент для смеси Вт в виде квадратичного разложения
по мольной дате [см. уравнение (4.8.1)], а третий вириальный коэффициент для
смеси — как кубическое разложение и т. д. 1 акне выражения вдохновили многих
исследователей на формулирование комбинационных правил, которые подходят
под вириальцое разложение для смеси.
Например, предположим, что кто-то хочет выразить параметр смеси Q™ как
среднеквадратичную по составу велй'ПГну:
ч-- S S w}Ql}
(1-9.1)
Такие члены, как Q,, и включают только свойств? чистых компонентов
Трудности возникают, когда рассматривается параметр Q.,. Если этот параметр
Приравнивается среднеарифметическому, г •
Если же Qi, считают сред1им геомс рпческим значением, -о
(4W)
(_ сравнениями (4 9.)) и (4 9.7)
«.-sw;M (4"°‘
Для бинарной |_мес i к^поиентов 1 и '2 сравнение (4 (J иррпгмаег вит
0,,,-уА ! Q'iJ'j Ю, (4.9 Ю)
н. если — 1 0, уравнение (4 9.|0) провр/мц^езся в з-рзРпенве (1 ч 5).
При использовании уравнений (4 9 4i , <4 гУй)
Г S оо',.'5':Ф2 <”|И
Длн сь<сси двух КумпоцеН|ов ( и 2 уравнение (4 <j прцничаез вид
Q,„ ^Q. .L t'^Q; ‘Qs;i u-° I2*
Сравнение (4 9.И) может бьпь проиллюстрировано квадратичным правилом
Кечедимо—Вебба—Рубина (уравнение (4б2)1. При L,’-- 1,0 рлзаращземсл
к уравнению (4 9 6)
До (.их пор обсуждение клсалоен только способов объяснения уравнения
(4 9 4). В некоторых случаях для описания свойства смеси выбирают, однако,
кубическую фирму разложения:
^(п - UЕ 11
Если для всех I, j, k
(QiQflJ1 1 <10И1
то получается уравнение (4.6.1) с t - 3 Если бы.ю выбрано срсДИеарифмезл'К,.
скос, то все р^вно получается уравнение (4.6 1), и<) с г~ (- Правда, параметры
тройного рзаимодейетвпя пспользуют'я редко (см- тем ic менее. Г141)
]) Эта форма имеет c'n.ic.i тозько, если все Q ~2> 0.
В общем случае, когда выра.кают как
о,. I S «I ii^t
П(?!
1Л1
Ли 'южет быть определено в виде простой суммы модьцых составляющих.
В заключение важно опчетш-ь, что вес правила смещения, предложенные
правила н г:ая;дом c-Д'чае может быть оправдано путе-a сравнения расчетных
значении свойств с экспериментальными Такие сравнения приводя,ся Далее
в in 5. В общ^м, пвелечне параметров бинарною взаимодействия в правила
смешевия для уравнений состояния часто по. является важным, особенно когда
опрсдеднотуя суммарные свойства смеси, танце тик V,.;, Ищ. Однако эти пара-
метры могут становиться очень важными при расчете парциальных мольных
свойств. Эта важность усиливается прч определении парциальных мольных
свойств комьонечта, мольная доля которого в смеси мала.
4.10- ПРАВИЛА СМЕШЕНИЯ ДЛЯ СМЕСЕЙ ЖИДКОСТЕЙ
Для снесся жидкостей, молекулы которых цс ситьцо отличаются друг от
друга, при смеренных давлениях хорошие реву л i-таты дает использование ааксиа
где Т — мольный обт.ем чистой жидкости / при температуре смеси.
Для использования корреляций плотности чистых жидкостей, приводимых
в разделе 3.15, применительно к смесям должны быть выбраны соответствующие
правил смешения не разработано
следует определят!- как. суммы
возникают проблемы Данные нсевтокрптические значения не яв,тяК|тся истин-
ными Критическими значениями. >огя в истинной Критической точке V'- -* \’Сп1
Детиином у) Эти обстоятельства не отражены в методе Йена—Вудса, если исполь-
Проблема ,<ри।ичсскои точки была учтена в корреляциях плотности жидм>-
ск'й, разработан пых Чью п Г|рауеинцем, а также Ли кмаиом, Эккертом и Праус.ии-
цем [см уравнения (3 |5 N —(3 (5.2()| Псевдокритическая температура одре-
(4 10 2у
где Ф; — объемная доля, определяемая соотношением
S -Л
k.. _ иарчМегр бинарного взаимодействия, который следует определять по
экспериментальным данным, котя для парафиновых смесей 17] оп может быть
скоррелирован со значениями критических объемов чистых номпонечтоз Обычно
kj-. имеет значении ог0до0,2.
Рассматриваются два диапазона Для одного Т,, — 7, Тс,п < 0.03, для дру-
гого 1.0 > ТГт 7> 0,93. При Тг.:1 < 0,93 уразисы<я (3.15 181—(3.15 2|) исполь-
зуются так же, Как и для чистых веществ, причем значения Г, определяются из
выражений (4.10.2)—(4.|0 4) и
При Тг,л > 0,93 для гарантии, что при ТГт = 1.0 и Vr — 1,0, введены
скорректированные псевдокритические температуры и давления.
гт сп
(4.10.8)
Здесь ТСт и VCm — псевдокритические значения, определяемые уравнениями
(4.10.2) и (4.10.5); Тсг и VCT — истинные критические температуры и объемы
смеси; D (Т'г^у — функция отклонения, выраженная через значения Т'г '
’ - 1| |290l,01 -5738.997' !- 2849 857?
m ) rm rni
4- 1'7fl?Z_\ 1 nmi T' <-l9
(1 I-J 9)
Уравнеппе (4.10.7) решается относительно Т‘с методом последовательных
приближений- Методы определения истинных свойств смеси Тс п V<- рассматри-
ваются в гл. 5. Результаты расчета удельных объемов жидкости вблизи критичс
скоп точки чувствительны к величинам 7> , что легко объяснимо, постольку
в этом диапазоне объем жидкости резко меняется с температурой.
Предлагались методы, в которых уравнение Рекета для плотности жидкости
распространяли о;> углеводородные снеси [19. 23]. Чиу и др. [51 предложили
отличающуюся от других корреляцию между приведенной плотностью и приведен-
ной температурой, но использовали при этом идентичные правила смешения для
псевдок итической температуры. Эти соотношения Ограничены в Применении
углеводородными системам!’ при низких температурах, причем весьма удаленных
от крто-т ческой точки
Воп и Праусщгп !291 у качыаают, что закон Канете ft Матиаса для перпендику-
лярных диаметров может быть распространен на смеси путем выражения среднего
арифметического из значений плотностей паровой и жидкой фаз смеси в виде
-(инейной (функции давления в диапазоне от низких давлений до критической
точки смеси.
Габбинг. [9] сделал обзор теории смесей простых жидкостей с упором на
пертрубационпые методы.
Ьекомендацни. фля аппроксимации объемов жидких смесей от низких до
умеренных давлении обычно бывает достаточно закона Амага [уравнение (4.10 I) j.
Согласно этому закону, при смирении двух или более жидкостей при постоянных
температуре п давлении обьемы аддитивны Хотя при температурах, значительно
npesw.tiatcwrx точку кипения, или при пзлячг п в снес» ПОДлрНЬгХ КЮ.МПОиеНТОП,
метут возникать значительные ошибки [28].
Ьо.тее точный метод расчета плотностей смесей жидкостей, применимый в ши-
Роткх интервалах температтры и давления (вплоть до критической точки) оспсвап
на использований уравнений (3,15 18)—(3 15.21;, а также (4 10.2)—(4.10.9),
которые о 1Исываю( модификацию метода применительно к смесям Для псльзова-
11Яя этим методом необходимо знать критические свойства чистых компонентов.
В случае использования метода при приведенных температурах, превышающих
0,93. должна быть известна истинная критическая температура смеси. Наконец,
для точных расчетов надо располагать значениями параметра бинарпщо взаимо-
действия [утшвненис (4.10.4)1. В настоящее время этот параметр может Сыть
заранее предсказан только для смесей алифатических углеводородов [7[. Для
приближенного определения этого параметра для смесей других жидкостей весьма
полезным может оказаться даже ограниченный объем экспериментальной инфор-
Верхний индекс
Нижние индексы
Глава 5
ТЕРМО ДИН АМИЧЕСКНЕ СВОЙСТВА
5.1. СОДЕРЖАНИЕ ГЛАВЫ
5.2. ОСНОВНЫЕ ТЕРМОДИНАМИЧЕСКИЕ ПРИНЦИПЫ
Энтальпия. внутренняя энергия, энтропия, фугитившсть и т Д. являются
важными термодинамическими свойствами. При диализе тсхнсхтогических процес
сов или проектирований оборудования изменения такт свойств часто могут быть
<виЗацы с параметрами процесса, например с увеличением температуры жидкости
пли газа п теплообменнике. Поэтому важно уметь рассчитывать изменения stiix
свойств как функций температуры. давления и других независимых переменных
Я - 1(Р I)
В первом случае процесс осуществляется по стадиям: температура поддержи-
вается постоянной па уровне Т, и определяется изотермическое изменение Н от Pi
до Рг. затем это изменение добавляется к изобарическому изменению Н от I j до 7Д
при давлении Р2. Второй случай подобен первому, однако теперь изме евие Н
сначала определяется при /’> от Т। до /'е, затем при 7'.> от Р, до Р«_ Эти пути расчета
схематично показаны на рис 5.1. >;а котором путь ДОС соответствует уравнению
<5.2 2), а АВС — уравнению (5 2 3) Результирующее значение ЛН = Цг — Ht
соответствует переходу системы из состояния А в состояние С. Очевидно, что
возможен любой другой путь, папрнмер AEFGHC, яо в этом случ.ге надо иметь
згмчешгя (М/дР)т и (д/Рд'Г)? зля нескольких изотерм и itaodap.
Часц1ые производные энтальпии (или других термодинамических свойств)
представляют собой тангсцсы углов наклг— .... ................. т 1 п,..
определения численных значений этих
производных необходимо зцать и Дав
ленио и температуру, т. е. производ-
ные являются функциями двух везя
висимых интенсивных переменных, как
В гл. 7 рассматривается величина
<0Н/дТ)иа. Эта производная назы-
вается теплоемкостью вещества при
постоянном давлении (Ср) Верхний
индекс" указывает на то, что в дан
ном случае речь идст о нулевом абсо-
лютном давлении, т. е. вещество
находится в состоянии идеального
Данные по теплоемкости при вы
соких давлениях имеются лишив рсд
ких случаях. Поэтому дтя определения
лона изиюрм и изобар на рис 5 1. Для
Чзсъермы
AQRC, i
пользуются
KOH|VpOM
Члены (7/° — и {Н — i- p.lrj называются функциями отклонения or
идеального состояния (изотермическими намерениями). Они связызают термодина-
мическое свойство (в данном случае энтальпию) при некоторых Р, Т с опорным
состоянием (Р — О для энтальпин) при той же температуре 7' В разделе 5 3
показано, что функции отклонения термодинамических свойС1В могут быть
выражены только через Р—V—соотноше! ия или, чтс то же самг с, найдены из
уравнения состояния. С другой стороны, член j С° dT рассчитывается для состоя-
ния идеального газа, а значение С3? определяется так, как_оп (сано в гл. 7.
5.3. ФУНКЦИИ ОТКЛОНЕНИЯ ОТ ИДЕАЛЬНОЮ состояния
Пусть L является значением какого-либо термодинамического свойства
чистого компонента (или смеси определенного состава) при некоторых Р, Т
Если L определяется как значение L при той же температуре (и Ирп том же со
ставе, если это смесь), но в идеальногазовом состоянии и при опорном давлении
Р’’, то изотермическое изменение термодинамического свойства определяется как
L — £°или£° — L.B опорной точке при Т, Р° мольный объем вычисляется по
у равнению
RT
Как показано ниже, изотермические измене! ия термодинамических свойств
могут быть выражены через Р—У______Т свойства вещества. Известны два общих
подхода. Первый более удобен, если Р—V—Т свойства описываются уравнением
состояния в явном виде относительно Р. Все аналитические уравнения состояния,
приведенные в гл. 3, имеют такой вид Второй подход применяется чаще в тех
случаях, когда температура и давление яаляются независимыми Переменными.
Например, корреляции, основанные на принципе соответственных состояний
В рамках первого подхода выведем соотношение для изотермичссксгс измене-
ния энергии Гельмгольца, из которого легко могут быть получены выражения для
изотермических изменений всех прочит термодинамических свойств. При постоян-
ных температуре и составе изменение свободной энергии Гельмгольца с мольным
объемом V имеет вид
Интегрируя эго уравнение при постоянней темперагуре п составе в пределах
о, опорного значения объема VJ до объема системы V, получаем:
no.iyiciue численных зн,,ченин ao уравнение (5.3.3) зитрудньнс, т<ц< h,ik
один предо.! интегрирования относится к реальному состоянию, а другой к опор-
пому вдеальнсгазовому состоянию. Поэтому следует разбить интеграл на две
А — А° = — j PdV — J PdV
(5.3.4)
Первый интеграл требует знания свойств реального газа, т. е. функции
Р = [ (V) при постоянной температуре Т, в то время как второй опись|Ваег идеаль-
ный газ и может быть взят сразу. Однако, чтобы избежать трудностей, которые
вносит бесконечность в качестве предела интегрирования, следует в правой части
добавить и вычесть величину (RTiV) dV Тогда
А-А’- _ j (Р _^dV_RT^
(5.3 5)
Функция изотермического Отклонения А [уравнение (5.3.5)] зависит от
выбора Следует заметить, что А — А° не исчезает даже для идеально,© , аза,
если только не выбирается равным V. Другие функции отклонения легко выво-
дятся из уравнения (5.3.5)
Н - Н° = (А — Д’) + т (S - S°) + RT (Z - 1) (5.3.8)
U _ и = (А — А°) + Т (S — 5 ) (5 3.9)
G — G°= (А — А°)+ RT (Z— 1) (5.3.10)
Отношение фугитивность/дааление, которое не является, строго говоря,
изотермическим изменением термодинамической функции, может быть выражено
аналогичным способом:
где Z = PV/RT.
.р (Z— I) — InZ
(5.3.11)
Tcr;iri nt) \ равнению 15 3 5)
—
RT
= — RT h> '
V
Энтропия, экi<(.'iьпин и вну1ррц[яя 3tti_piisn пи уравнения^ <5 3.7)___________(5.3 9)
равнн
П -II-' _ (4 - .-Г’) Т (-S — 3 ) - RT (/ — I) -Pl’ — RT -
Зег 1’ Ь bRT a 3a . )' -- b
-----ёГё I'1 ---- = -------- -n"?---------------------Й-- ll ------
2bTa’y P P -b 2Л7°'П V
U —U: —(A —A*)
T(S-S‘)-
>bT° 3
По уравнению (5 3.11), где
Z
RT V _ b
(Г-4)
RTX
Наконец, по уравнению (5.3.10)
c. cs-WT
|V< b}
-RT In
путяяг снова в качестве опорного сссгоягигя выбирается сосгоякие идеальпоуо
гмза при той же темцерт-|уре и составе, что и р исследуемой системе Опорное
давление равно Р-, и применяется уравнение (5 3.1). В этом случае начинают,
однако, с энергии Гцббса, а не с энергии Гельмгольца. Аналоги уравнения (5 3 4);
G-G> = j I' dp _x j I dp | [ V <!P = j Г — dP rRT ".n^- =
/” и P- r,
(5 3.12)
-f’rj (Z — l)ri InP | RTl«~ (5,3 13)
Дтя изотермически' изменении энтропии
S-S" - ~т}(в^а-)г-к j [i - z-r(2?)p’ «„р-ОгД
0
(5 3 14)
энтальпии и внутренней энергии
Н — 11° - (G-G°) | T (5 - S’) 1 (53 I")
U — U°^ (G — G°) 4- T(S — ,S°) - RT (Z - 1) (5 3.16)
Иютермнческое изменение энергии Гельмгольца выражается как
А _ А" = (G — GJj — RT (Z — I) (5.3.17)
В Лом случае также простая алгебраическая подстановка Показывает, что изо-
термические изменения термодинамических функций Н — Н°r U — UQ и In (fiP\
не зависят от выбора Р° (или Й°),
5.4. ВЫЧИСЛЕНИЕ ФУНКЦИЙ ОТКЛОНЕНИЯ ОТ ИДЕАЛЬНОГО
СОСТОЯНИЯ
90
Уравнение Редлиха—Квонга (разделы 3 5 и 4 3)
Р - РТ _ а
~ V -b ~ Tt;'2V (у _|_6)
2 __ _К_______а_____
v-b RTS/i(V±b)
л -Л" = _И'1пЦ^-^- П, - кт 1,1
S-S- =«!., '^1--^ » Ш +S|„
а, Ь даются уравнениями (3 5 2) — (3 3 8), а также (4 3.1) и (4 3.2).
Соавовская модификация уравнения Редлиха — Квонга
(разделы 3.5 и 4.3)
RT Йц _ RTbF
И V -b ~ Qb V (V Ц-Ь)
7 - V Qa bF
~ V-b" Qb V + b
где
_ _ _ / Йо, Qa, \1/2
где
„ 1 V v , г , / ЙЛ< Йс/ ь <. r\l/2/ fol fo, \
1 2 1 уИЛ (|-‘«Ца1н 157‘‘W<) (_ -рп + трг)
/ш( _ 0,480 4- 1,574(0^ — 0,176w?
R>, R;. b._, b,. k;/ даются ура^ениямн (3 5 3) и (3.5.15) и приводятся в
табл 4.1 и 4 2
Уравнение Барнера—Адлера (разделы 3 6 и 4.4)
р _ RT ( V — а‘ь с*Ь2____________d‘bs e*b* |
V-b +(V-b)i {V-b)s + (V-i)< J
2_ V-a'b c‘b2 d’b* e'b*
(V - 6)2 — (V - Ь)г + (V -6)4
Л-Я’ = /?Г /(a’ + c' + rf' + e*-!) fn +
•) В таблице приподится сыражсния только для изотермических изменений функ-
ции 4 —A'-, S —8° Выражения для H—ll°. U—U°. G — и In (f'P) могут быть получены
не г|осрсдет|1е>. н о из уравнений (5 3 й) — (5 3 11).
Продолжение
Коноаггтъ j-iiOifa >р.иноиямп (Joi)
— (3 6 161 л также (4 ! I) — (4 4 7) и
b*RT
2Г.г , 1G_
TTr ~'iT\
сравнение Ct,2i. -iTi« (ратдегы 3 7 и 4 5)
К'ч|</-;(ГТ| ,,| ц |,|Г1.(>дя 1 см и । ,|6i 3 5 II ДчК>1 CF аравиец ня -.Hi (( 5 i I — (4 -5 4)
97
Продолжение
Уравнение Венедикта - Вебба — Рубини (разделы 3.8 н ! 6}
Примечание Все иопст-чпы предполас аются не1авис иммми от температуры
Константы приводятся в табл 3 G или 3 7, а , акже дакдея уравнением (4G |).
Уравнение eJu — Эрбара - Эдиистера (разделы 3.10 н 4 7)
RT а Ьс
v -ь~ v (V —Ь)~ ' /TV - by (V + Ь)
_ V _ a’RT bc/RT
" V=b V-b т (У - b\ (ЙТ^Г
da 1
Для о.1|1сладецця л. с см. уравнения (3 10 3) и (3 10.4)
= ~df J
Значения b и правила смешения чаются уравнением (3.]0.2) и в табл 4.4.
Вириа>ъног уравнение (разделы 3 ]] и 4.8)
^7~ BRT
Р " V + " Й2
В
л-л-_ Д-
Уравнение (3 113) дает В = ЦТ), правила смешения даются уравнениями
(4 8.|)-(4 8.7).
иллюстрируется на примере расчета изотермического изменения энтальпии При
расчете изотермических изменений энтропии, отношения фугитивность/давленке
и производных функций (раздел 5 5) применяются аналогичные правила.
Расчет начинается с определения приведенного давления и приведенной
температуры при данных Р и Т. Если рассматривается чистое вещество, то зна-
чения Т; и Рс Могут быт!- взяты из приложения А пли рассчитаны цо соотноше-
1ИЯМ, приведенным в гл. 2. Для смесей соответствующие псевдокритнчсС1<1|С свой-
ства определяются по уравнениям (4 б 3)—(4.6.7) Зная Тг и Рг, по методике,
описанной в разделе 3.9, можно определить V,0', . 2(0) и Z(4 Затем по рас-
считанным Тг, У1/’’ и Z',,> может быть найдено изотермическое отклонение энталь-
1ии простого вещества
г Atи“Ь'-(^Н-(чЫ! ,5,4'!)
//° —// _ / H'-ti \<V I со и И \<Р) ( 1Г — Н tWl
РТс ' ' I RTC ) Ц RTC / ~ \ RTe / J
(5.4.3)
(5.4.3) можно переписать в следующем виде
№_// ( Н°~Н \(0) /№-Д\(И
-лтг = \—т^) '-Ч^даТ-) <м'4>
если изотермическое изменение энтальпии определить как
(ЧЧ''Ч4(ЧЧ,вЧЧЧ’1 |5->
Значения, помещенные в табл. 5.2 и 5.3 [511 были рассчитаны по уравнениям
(5 4 I) и (5.4 5) В этих расчетах со14' принималось равным 0,3978.
Энтропия. Изотермическое изменение эрурорда выражается аналогичном
образец
99
Т\Г>.1ИЦ\ 52 Изтермкческие изменения э>|Iатьпни. рассчитанные ни уравнению
т
0,30 0,35 0,40 0.45 0,50 6,045 •5,906 5,763 5.615 0,043 5,904 5,761 5,612 5,463 С 040 •5 901 5 609 С 034 5.895 ,5,603 г 453 (> 022 3.882 5.738 5, ,590 5 44'9 6.011 ,1,870 > 726 5427 ,',999 6.858 5.713 5414
0,55 0.032 .5,312 5.309 5.303 5.200 5 278 5 2(?5
0,60 0.027 | | 5.162 5 159 5.153 ,5.111 6,129 5J16
0.65 0,023 0,118 | 5,008 5,002 1,991 4,980 1,9о8
0.70 0,020 0.101 0 213 I I -1,8-18 4,838 4.828 4,818
0,75 0,017 0,088 0 183 | 4.687 1.079 4,672 1 664
0 80 0,015 0.014 0,078 0 160 0,345 4.4507 4,501 4 499
0,85 0,069 0,14| 0,30(1 1 4,309 4,313 1.316
0.90 0,012 0,062 0,126 0.264 0 596 | j 4 074 1 094
0,93 0.01 1 0,058 0.118 (',246 9.545 0.960 I 3.920
0.95 0 0Ц 0 056 0 113 0,235 0 516 0 886 j 3,76.3
0,97 0,0| 1 0,054 0 169 6,223 0,499 0.824 1..356
0,9b 0 010 0,053 0 107 (7,221 0 478 0.797 1.273
0.99 0,0|0 0.052 0.105 0.216 0.466 (1.773 1,206
1,00 0,010 0,051 О 103 0,212 0,455 0,750 1.151
1.01 0,010 0,050 0 101 0,208 0,445 ((.728 1,|02
1,02 0,010 0,049 ().О99 (1,203 4,434 0.407 0 708 1,0(50
1,05 0,009 0.046 0.094 0.102 0 (551 0,955
1 10 0.008 0.042 0.08(5 0 175 ') 367 0 581 (1.827
1.15 (1,008 0.039 0 (179 0 160 '>'.334 0 523 0,732
1 20 0.007 0,036 0 073 0,148 0.305 0 474 0,657
1,30 0,000 0,031 0 063 (1 127 9,259 0,399 0,341 0,545
1,40 0.005 0,027 0 0.55 0.110 0,224 0,46,3
1,50 0,005 0,024 0,048 0,097 0,19(5 0.297 0.400
1,60 (',004 (),02| 0,043 0,086 0,173 0,261 0,350
1.70 0 001 0 019 0,038 0 076 0.153 0,231 0,300
1,80 0.003 0,017 0,031 0.068 0,137 () 20(5 0 275
1.90 0,003 0,015 0.031 0,062 0.123 0.185 () 216
2,00 0,003 0,014 (),02ь 0,056 dill (>. 167 0,222
2.20 0 002 0,012 0.023 0,046 0.092 0 137 0.182
2,40 0,002 0,01(1 0,019 0,038 0,0/1) 0,1 14 0 150
2.60 0.002 0,06* 0,(116 0.032 0,0(>4 0,0'15 0 125
2,80 0,001 0,007 0,014 0,027 0 054 0,080 0.105
3,00 0.001 0,006 0 (11 I 0,023 (1.0-15 0,007 0,088
3,50 о,(Ю| 0,004 0,007 0,015 0,009 0,020 0,043 0,056
-1,00 0,000 ч,()02 0,00,5 0,017 0,026 0,033
сос|окния Ли и Кее,пери |51|
5.987 5,970
(i,845 5.833
5,71)0 .5,687
*.551 5,538
5.401 5 388
\252 5.239
5,10| 5.091
4,950 4,945
4,808 4.797
1,655 1,646
4,494 4.188
4 310 4,310
1,108 4,118
.•>,953 3,976
3.825 3,865
3,6,58 3,732
3.544 .3,652
3.376 .3,558
2,584 3,441
1,796 3.283
(.027 ,3,039
1.359 2,(134
1.120 1487
U.G68 1,239
0,857 1,076
6,698 0,860
0,588 0,716
0,505 0.611
0,440 0 531
0,387 0.466
0 344 0 413
0,30- 0 368
0,276 0,330
0 226 0.269
0.187 0,222
'1.155 0,18б
9.1.30 0.154
и. 109 0.129
'.',Ж9 0,081
О 041 0.048
7957 5.927
5,814 5.783
5,668 5,630
5,519 5.186
5.36'1 5 336
5,220 5 187
6.073 л 041
4,927 4,896
4.781 1.752
4,632 4 607
1,178 4.43!)
4.312 1,302
4 127 4 112
4,000 4.020
3.904 3 940
3,796 ,3,853
3.736 3 806
3,670 3 758
3,598 3,706
3,516 16Г>2
3,422 .3,595
3.030 3.398
2,203 2,965
1,719 2,479
1.443 2 079
1,11о 1,560
0,915 1,253
0,774 1,046
0.667 0,894
О 583 0,777
0 515 0.683
0,458 0,606
0,411 0,541
(1,331 (1,437
0,275 0,359
О 228 0,297
0.190 0,240
(1.159 0.205
0,099 0.127
0,058 0,072
5.628 5.440
5.409 5,278
5.311 0,|13
5.154 4,950
4.999 4,791
1,849 4,638
4.704 4,492
4,065 4,353
4.432 4,221
4,303 4 095
4,178 3,074
4,056 3.807
3.935 3,744
3,863 3,678
3,815 3,634
3,767 ,3,591
3,713 3,569
3,719 3,548
3,695 3,52b
3.671 3,505
3.647 ,3,484
3.575 3,42(1
3,453 3,315
3,329 3 211
3.202 ЗД07
2.942 2,899
2,679 2,692
2.421 2.486
2.177 2.285
1.95,3 2.091
0.756 0,858
0.014 0,689
0.495 0.545
0,270 0.2G4
0,110 0001
101
ТАБЛИЦА 5 3. Изотермические изменения энтальпии, рассчитанные по уравне
, -- Н и и
Отклонения от энлчсннй для простого вещсстял |-----I
‘г 1
! 0.050 ; о.т 1 , О2ОО ! о.ют | 0,607 | 0,500 j
0,30 11,098 11,096 И,095 11,091 11,083 11.0'6 11,069
0,35 10,655 10,654 10,653 10,650 10,646 10,043
0 40 10,121 10,121 10,121 10,120 10,121 10,12! 10,121
0,45 9,515 9 515 9,516 9,517 9,519 9,521 9,523
0,50 8,868 8,869 8,870 8,872 8,8,-6 8.880 8,884
0,080 8.211 8 2)2 8,215 8,221 8 226 8,232
0,60 0,059 | 7,568 7.570 7,57,3 7,579 7 585 7,591
0,65 0,045 0,247 | 6.949 6,952 6,959 6,966 6,973
0,70 0,034 0,185 0,415 1 6,360 6,367 6,3'3 5,809 6..381
0,75 0,027 0,142 0,306 | 5,796 5,802 5,816
0,80 0,021 0,110 0.234 0,542 5,266 | 4,753 5,271 5,278
0,85 0,017 0,087 0,182 0,401 4,754 4,758
0,90 0 014 0,070 0,144 0,308 0,751 | 4,254 4,248
0,93 0,012 0,06i 0,126 0,265 0,612 1,236 1 1 3,942
0,95 0.011 0,056 0,115 0,241 0,542 0,994 | | ЗЛ37
0,97 0,010 0,052 0,105 0,219 0.483 0 837 1 616
0.98 0,010 0,050 0,101 0,209 0,457 0,776 0,722 1.324
0.99 0,009 0,048 0,097 0,200 0,433 1,154
1.00 0,009 0,046 0,093 0,191 0,410 0,675 1,034
1 01 0,009 0,044 0,089 0,183 0,389 0,632 0 910
1.02 0 008 0,042 0,085 0, ]73 0,370 0,594 0.863
1,05 0 007 0,037 0,075 0,153 0.318 0,498 0,691
].Ю 0,006 0 030 0,061 0,123 0,251 0,381 0,50/
1,15 0,005 0 025 0,050 0,099 0,199 0,296 0,385
1,20 0.004 0,020 0,040 () 080 0,158 0,232 0,297
1,30 0.003 0,013 0,026 0.052 0,100 0,142 0,177
1,40 0,002 0 008 0,0|6 0 032 0,060 0,083 0,]00
1,50 0.001 0,005 0,009 0,018 0,032 0,042 0.048
1,60 0 000 0,002 0,004 0,007 0,012 0,013 0,011
1,70 0 000 0,000 0,000 —0,000 —0,003 —0,009 —0,017
1,80 0 000 0,001 —0,003 -0.006 —0,015 —0,025 -0,037
1.90 —0 001 —0 003 -0,005 —0,011 —0,023 —0,037 —0,053
2,00 0,001 —0 ооз —0,007 0,015 - 0,030 0,047 - о 065
2 20 —0,001 —0,005 —о.ою —0,020 —0,040 —0,062 -0,083
2,40 -0,001 -0,006 —0,012 —0,023 —0,047 —0,071 —0,095
2,60 —0,001 —0,006 —0,0|3 -0,026 —0,052 —0,078 -0,104
2,80 —0,001 -0,007 —0,014 —0,028 —0,055 -0,082 -0,110
3,00 —0,001 -0,007 —0,014 —0 029 —0,058 —0,086 —0,114
3,50 —0,002 —0 008 —0 016 —0,031 —0,062 —0,092 —0,122
4,00 —0,002 —0,008 —0,016 —0,032 —0,064 —0,096 -0,127
102
нию состояния Ли и Кеслера (51 |
1 1.000 1 so.' । 1 300 2.OUt) | з иоо | 3.000 7.000 | I0.000
11,062 11,055 11,044 11,027 10,992 10,935 10,872 10,781
10,640 10,637 10 632 10,624 10,609 10,581 0,57.4 10,529
10,121 10,121 10,121 10,122 10,123 10,128 10.135 К), 151]
9,525 9,527 9,53] 9.537 9,549 9,576 9,611 9,663
8,888 8,892 8,899 8 909 8,932 8,9/8 9.030 9,111
8,238 8.24J 8,232 8,267 8,298 8.360 о,425 8,53]
7,596 7,003 7.614 7,632 7,669 7,745 7,824 7,950
и,98О и,987 6,997 7.0)7 7,059 7,147 7,239 7.38]
,5,388 6,395 6,407 6 429 6,475 6,574 6,677 6.837
5,824 5,832 5.845 5,868 5,918 6,027 6,112 6,318
5,285 5,293 5,306 5,330 5,385 5,50G 5.632 5,824
4,763 4,771 4,784 4 810 4,872 5,008 5 149 5.358
4.249 4,255 4.268 4 298 4,371 4,530 4 688 4.916
3,934 3,937 3,951 3,987 4 073 4,251 1.422 4.662
3,712 3,713 3,730 3,773 3,873 4,068 4 218 4.497
3,470 3,467 3,492 3,551 3,670 3,885 4,077 4,336
3.332 3,327 3,363 3,434 3,568 3,795 3,992 4,257
3,164 3,164 3,223 3,313 3 464 3,705 3,909 4.178
2,471 2 952 3.065 3,180 3,358 3,615 3,825 4.100
1.375 2,595 2.880 3,051 3,251 3,525 3 742 4,023
1.180 ; 7?-» 2,650 2,906 3,142 3,435 3.661 3,947
0,877 0,878 1 496 2,381 2,800 3,167 3,418 3 79'1
0,617 0,673 0,617 1 261 2,167 2,720 3,023 3,362
0,459 0,50,3 0.487 0,604 1,497 2,275 2,64] 3,019
0 349 0,381 0,381 0,361 0.934 1,840 2.273 2,692
о.°оз 0,218 0,218 0,178 0,300 1.066 1,592 2,086
0,111 0,115 0 108 0,070 0,044 0.501 1,0)2 1,547
0,049 0,046 0,032 —0,008 —0,078 0,] 42 0,556 1,080
0.005 -0,004 - 0,023 —0 065 —0,15] —0,082 0,217 0.G89
—0,027 -0,040 —0 063 - 0 109 —0,202 —0 22,3 —0,1)28 0,369
—0,051 —0,6G7 —0,094 0 143 -0.241 - 0 3]7 —0,203 0,112
-0.070 - 0,088 0.1b —0 169 —0.271 —(1 38! —0,330 —0,092
-0,085 105 - 0.136 —(1.190 —0.295 0,428 —0 421 0,255
—0.Ю6 -0,12ч —0.163 -0.221 —0,331 -0,493 —0,55] —0 489
-0 12(1 - 0,141 0.181 —0,242 - 0,356 —0,530 —0,63] —0,045
0.130 -0,155 —0,194 —0.257 —0.37Г. —0.507 —0,687 —0,754
-0.137 —0.164 0,204 - 0,269 0.391 —0.591 —0,729 —0,836
- 0 112 —0.170 —0.21 1 —0 278 —0,403 -0,61) - 0.763 —0,899
0 152 —0,181 -0,224 - 0.294 —0,425 —O.G50 —0 827 —1,015
о 1 Об —0,188 -0,233 —0.306 0,142 —0,680 —0,874 —1,097
Если уравнение (54 (>| записать мк
клонсния ( )'|; могут быть найдены но табл
Отношение фугитивность давление. Как 1
и функция от-
Когда уравнение (5.4 10; записывается как
коэфф1шиец||4 футитпнпосш для простого вещества к епк-топснья от этих пгачс-
отметить, <гю в таблицах содержатся значения десятичных, а
। геи арифмов соответствующих величии.)
в этом разделе, Йен и Александер 1.03] получили обобщенное ссотношснис для
\Н HVT. Pi, Z ), использовав таблицы коэффициентов ежкмае-
мости, составленные Лидерсепом, ГринКорном п Хоутеном (541. л также х'рав
нения (5 3.13)—(5.3 15). Эта хозредяпия представлена в таб^г 5 8 и ин рис 5.2--
находится между 0,23, 0,25, 0,2" пли 0.29, то нужно интерполировать. Дль зна-
чений Z. меньше 0,23 или богине 0,29 эсстрапо ,нцию делаю нс следует, по
рлечега , иР, П1И икжгп црнгиецягь урависчия (4.2 1)(4 2 2), аопределить
суммированием мо.гьиых составляющих компонентов, если в состав смеси не
нами смешения Ганна 1351.
Обсуждение. При проверке йунккии отклонения, нредетаэлезных н лол
главе для /ф — И результаты расчета могут сравниваться с эксперименталь-
ными данными, из которых большая часть относится к простым углеводородам
и постоянным легким газам. Теперь сдобно дать сводку методов расчета мольных
объемов газообразных смесей -)
Мольные объемы гадовых смесей !^’тетг'ывяюигей ггроверкп Всех методик
расчета нс проводилось. Авторы отдельных методов, так же как и авторы этой
книги, провели ограниченное число срапиский. В основном ошибки составляли
менее 2 3 %, исключая око.гокритнческую область п смеси, содержащие зкачи-
тельные количества сн.к неполярных компонентов
О Йен н Александер пспотьзовап. средпемотьиые сл.ачегня Рс,1:
-) Методы, рекомендованные для расчета мольных объемов чистых газов,
приводятся в разделе 3.12, а чииых жидкостей — в разделе 3 15 Жидкие смеси
рассматриваются в разделе 4 10 Уравнения ,'|и--Кеслера н Бенедикта -
Вебба — Рсбпна также исиользуютг я для расчета мольных объемов чистых
жидкостей и смесей «кндких ют-ких углеводородов (щиакс методы, описанные
[АБЛИЦХ 5 I Изотермические изменения эшропии, рассчитанные ио уравнению
0,30
0,35
0.40
0,45
0,'О
0,55
0,60
0,65
0,70
0,85
0,90
0,93
0,95
11,614 10 01)8
11,185 У.579
10,802 9 196
10,453 8,847
10 137 8,531
0,038 3,245
0,029 | 7,983
0,023 0,122
0.018 0.09G
0,015 0,078
0,013 0,064
0,011 0,051
0,009 0,046
0,008 0,012
0,008 6,039
9 319
8.890
8,506
8,157
7,811
7,555
7,294
7,052
0,206
0,164
0,134
0,11!
0,091
0,085
0,080
6,870
6,610
6.368
0.179
0,168
6,193
5,933
5,694
5.407
5,248
5.026
4 785
0.463
0,408
0.377
7,574
7,140
6.755
6,404
6 089
5 803
5,544
5,306
5,082
4,866
7,304
6,869
6,483
6.132
5,816
5.531
5,036
4,814
4,600
0.97 0,007
0,98 0,007
0,4)9 0,007
1,00 0,007
1,01 0,007
1,02 0,006
1.05 0,006
I 10 0.005
1,15 0 005
1,20 0,004
О 037 0,075
0.036 (’,073
0.035 0.071
0,034 0,069
0,033 0,067
0,032 0,065
0.030 0,060
0,026 0,053
0,023 0,047
0,021 0,042
0,157 0 3.50
0.153 0,33’
0,148 0,326
0,144 О,ЗГ>
0,139 0,304
0,135 0,294
0,124 0,267
0,108 0,230
0,096 0,201
0 085 0,177
1,30 0,003
1,40 0,003
1,50 0,002
1,60 0,002
1,70 0,002
1,80 0,001
1,00 0,001
2,00 0,001
2,20 0,001
2,40 0,001
2,60 0,001
2,80 0,000
3,00 0,000
3,50 0,000
4,00 0,000
0,017 0,033 0.068 0,140
0,014 0,027 0,056 0,114
0,011 0,023 0.046 0,094
0,010 0,019 0,039 0.079
0,008 0.017 0,033 0,067
0,007 0,014 0,029 0,058
0,006 0.013 0,025 0,051
0,006 0,011 0,022 0.044
0,004 0,009 0 018 0,035
0,004 0,007 0,014 0,028
0,003 0,006 0,012 0,023
0,002 0,005 0,010 0,020
0.002 0,004 0,008 0,017
0.001 0,003 0,006 0,012
ООО! 0,002 0 001 0,009
4,649
4,418
4,145
0,750
0,671
0,607
0,580
0,555
0,532
О,5|0
0,491
О 439
0,371
0,319
0.277
0,2|7
0,171
0,143
0,120
0,Ю2
0,088
0,076
('.067
*',053
0,042
1.035
0,029
0.025
0,017
0,013
4,388
4.166
3,912
3,723
3 556
I 056
0,971
0.903
0.847
0 799
0.757
О 656
0.537
0,452
0,389
0,298
0,237
0,194
0,168
0,137
0.1 17
0,102
0,089
0,070
0,056
0,046
0,039
0,033
0.023
0,017
состояния Ли и Кеслера (51 ]
7,099
0,663
6,276
5,924
5,608
6,935
6,497
6.109
5,757
5 411
6,497
6,052
5,660
5,30(5
4 989
5,324 5,137
5,066 4.900
4.830 4,663
4,6(0 4 446
4,399 4 238
4.191 4,034 3,840 3,615 3,310
3,976 3 823 3,646 3.425 3,135
3,738 3,599 3,434 3,231 2,964
3,569 3,444 3,295 3,108 2,860
3,433 3,326 3,193 3,02.3 2,790
3,259 3,188 3,081 2,932 2,719
3,142 3,106 3,019 2,884 2 682
2,972 3.010 2,953 2,835 2,646
2,178 2,893 2,879 2.784 2,609
I..391 2,73(5 2.798 2,730 2,571
7,847 5,683 5,578
5.376 5,194 5,060
4.967 4,772 4,619
4,603 4,401 4,234
4,282 4,074 3,899
3,998 3,788 3,607
3,747 3,537 3,353
3,523 3.815 3,131
3,322 3,1(7 2,935
3.138 2,939 2.761
2,970 2,777 2,605
2,812 2,629 2 463
2,663 2,491 2 334
2,577 2,412 2.262
2,520 2,362 2.215
2.463 2,312 2,170
2,436 2,287 2,148
2,408 2,2(53 2,126
2,380 2 239 2,105
2,352 2,213 2.083
1,225 2,49о 2,706 2,673 2,533
9,965 1.523 2,328 2,483 2,415
0,742 1,012 1.557 2,081 2.202
0,607 0,796 (,(26 1,6'49 1.968
0.512 0,651 0,890 1,308 1,727
2.325 2,191 2,062
2,242 2,121 2,001
2,104 2.007 1,903
(.966 1.897 1,8(0
1,827 1,789 1722
0 385 0,478 0,628 0,Ь91 1,299
0.303 0,372 0,478 0,663 0,990
0,246 0,299 0.381 0,520 0,777
0,204 0,247 0,312 0,421 0,628
0,172 0,208 0,261 0 350 0,519
0,(47 0.(77 0.222 0.293 0,4,38
0 127 0.153 0,191 0,255 0,375
0 111 0,134 0,167 0,221 0 325
(1.087 0,105 0.130 0,172 0 251
0,070 0.084 0,104 0,138 0201
1,554 1,581 1,556
1,303 1,386 1,402
1,088 |,208 1260
0,91.3 1.050 1,130
0.773 0.915 1,013
0,331 0,799 0,908
0,570 0,702 0,815
0,497 0,620 0,733
0,389 0,492 0,599
0,311 0.399 0,496
0,058 0,069
0,(118 0,58
0,041 0,040
0,029 0.034
о,021 6.025
0,086 0.113 0,161
0,072 0,094 0 137
0.061 0,080 0.116
0,042 0 056 0,081
0,031 (10.Ц 0,059
0,255 0,329 0.416
0,213 0,277 0.353
0,|81 0,236 0,303
0.126 0.166 0,216
0,093 0,123 0,162
ТАБЛИЦЗ 5.3 Изотермические изменении энтропии, рассчитанные ,то уравнении
1 30 О.оОЗ
I 40 0.002
1,50 0,001
1.00 0.001
1.70 0.001
1 «О 0.0Q1
1.90 0,001
2.00 0.000
2,20 9,000
2,40 (1,000
2 00 0.000
2,30 0.000
Л 00 0.000
3.50 О,ООО
4,00 <\000
0 013 (',020
о 010 0,019
0 007 О.ОЦ
0.005 0.0Ц
О 004 0,003
0.003 0,00ч
0.003 0.005
0,002 0,004
0.001 0,003
0091 0.002
0.001 0.0(1?
0,001 0,001
о.ооо о.оо]
О ООО 0.001
0,052 0,102
0,037 0,072
|).О27 0.053
0 1121 0,04(1
О,01о 0,031
О ОН 0.024
<),0|') 0 Ок>
0.008 0.016
0,003 0.011
0.004 0,0()8
О.(|()3 0.006
О 003 о 005
<600'2 0 001
0.001 6,003
О 001 0.0()2
OHS 0.1'Ji)
0.104 0.133
(1.076 0,097
0.057 0,073
0.044 0,055
() 0.35 0,044
0,028 0.036
0.023 0,029
0,016 0,021
0,012 0,015
0.000 0.012
0,008 0.010
0,006 0 ()()8
0,004 0.006
0,003 0 005
состояния Ли >i Кеслера [51 |
1(,.58« 16,547
13,27а 15.251
13,89b I 1 877
12,496 12.482
0.911 '.,907
8 799 8.794
7.810 7,80/
6.933 6.930
6 155 0.152
5.458 5 455
1.826 4,822
4.238 4.232
3.894 1,885
3.658 3.647
.3.406 3.391
3.264 3,247
3,093 3 С82
2..39!; 2.868
1 ЗСь 2.5|3
1.113 1,055
0.820 0.831
0.577 0,640
0.137 0,489
0.343 0,385
<1.226 0,254
0.158 0,178
0 115 0,130
(1.08b 0 098
0,067 0,(176
0.053 0 060
11.043 0.019
0.035 0.040
О 025 0.029
0 019 0.022
0.015 0.018
0 012 0,014
0.010 0.012
0.007 0,009
О 006 0,007
16,488 16.390
15.211 15.141
13 849 1 1 803
12,462 12.430
11 129 II.II17
9,897 9.88-'
8.787 8 777
7.801 7.794
6 926 6 927
6,149 6 47
5,153 .’>.452
4.820 4 822
4 230 1 236
3 884 3.896
3 618 3,669
3.401 3.137
3 268 3.318
3 12(> 3.195
2967 3.067
2 781 2.933
2.557 2.790
1,443 2.283
0.618 1,241
О 502 0,654
0 412 0,447
0.282 0,300
О 200 0.220
0,147 'J.166
0,112 0.129
0 087 0,102
0,070 0,083
(1057 0.069
О 048 0,058
« 035 0.043
(>,027 0.034
0,021 0,928
0.018 0.023
0.015 0.02Q
0,0)1 0,015
0.099 0.012
6 |95 15 8.37
15 «I1 14.751
13,7(4 13,541
12.367 12.248
I ] 063 К'.985
ч 853 9.8«6
8,760 8,73о
7,784 7,779
6.910 6.929
6.149 6,174
5.4п1 5.501
1 839 4.898
4 2ь7 4,351
3.941 1.016
3 728 3.851
.3,517 3.661
3,412 3,Г>69
.3 306 3,477
.3.200 3.387
3.094 3,297
2,986 3,209
2 655 2.949
2,067 2,534
1,471 2 138
0,991 1 767
0,48] 1.147
0.290 0.730
0,206 0.479
О 159 0,331
0.127 0.248
6.105 0.195
0,089 0,160
0,077 0.13b
0.060 0.105
0,048 0,086
0.041 0.071
0,0.35 0,065
С',031 0.058
О 024 0.046
О 020 0.038
15.168 11.925
14.496 14.153
13,376 13,144
12,145 Ц.999
10,920 10,836
9,769 <1.732
8.723 8,720
7 785 7,8|1
6,952 7,002
6 21.3 6,285
5.555 5,648
4969 5.082
4 442 4,878
1.151 4.300
3 966 4 125
3.788 3,957
3.70| 3,875
.3,616 3,796
ЗЛ50 3,640
3,369 3,565
3 134 3.348
2,767 3.013
2,428 2.708
2.113 2 430
1,569 ],944
1,138 1,544
0.823 ],222
0,604 0,969
0,456 0,775
0.355 0.628
0.280, 0.518
0.238 0.434
0.178 0,322
0.143 0,254
0,120 0,210
0,104 0,180
0,093 0,158
0,073 0 122
(1.060 0.100
ТАБЛИЦА 56 Коэффициенты футитнвности, рассчитанные по уравнению состоя
0е4)"'
0,30
0,35
0,40
0 45
0,50
0,55
0,60
0,65
3,708 4,402 — 4.696 • 4,985 —5.261 -5,412 —5,512
- 2.47| - 3,|G6 -3.461 -3,751 -4.029 --4,183 -4.285
_ |. 566 -2.261 --2,557 -2,848 - 3.128 -3.283 3,387
-0.879 - -1.871 2,162 -2.444 - 2,601 -2,70-7
-0,344 - 6О4(> - 1 336 -1,628 - 1,412 -2,070 -2,177
-0.008 -0 611 0.911 - 1 204 — 1,488 - 1,647 - 1,755
-0,007 | -0,269 — 0.566 _ 0,859 -1,114 1,304 -1,413
- 0.005 - 0,026 l -0,283 -0,575 0,862 - 1,023 —1,|32
-0.004 -0,021 -0,04,3 1 -0,341 - 0.627 -0,780 - 0,899
—0.003 -0,017 - 0,035 1 -0.144 -0,430 -0,592 0,703
0,30
0,85
0,90
0,93
0,95
-0,003 -0,014 -—0,029 -0,059 -0,264 - 0,426 -0,537
-0.002 -0.012 -0,024 -0.049 | —0.123 -0 285 —0,396
-0,002 -0,010 -0,020 -0,041 - 0,086 | -0,16(1 -0,276
_о’()02 -0009 0,018 -0,037 -0 077 -0,122 1 -0,214
-0,002 -0.008 - (1017 - 0,0,35 -0,072 - 0,113 | -0, |75
0,97
0,98
0,99
1,00
1,01
0 002 - 0.008 -0 0IG -0,033 - () 057 - 0,10а —0,|48
-0 002 -0.008 0,016 -0,032 -0,065 -0,101 -0,|42
-ОШ -0007 -0О|5 —0.03) -0003 -0.0% -0.137
-0001 -0007 - 0.015 —0,030 —0,061 -0,095 -0,132
-0 001 -0.007 -0,01-1 -0.020 -0.059 0,09| -0,127
1.02 - 0,001 -0,007 -0.014 -0,028 - 0,057 -0,088 -0,122
105 -0 001 -0.006 - 0,013 - 0,025 -0,052 -0,080 -0.1Ю
1,10 _ 0,0()1 —0.005 -0,0|| —0,022 -0,045 —0,069 -0,093
1,15 -0,001 —9.00а -0.099 -0.019 -0.039 -0,059 — 0 080
1,20 -0,001 -0.004 -0.008 -0 017 -0.034 -0,051 -0,069
1,40
1,50
1,60
1.70
-0,00| _ 0.003 - 0.006
-0 001 -0,003 0.005
-0,000 -0.002 -0,094
-6.000 0,002 _ о.ООЗ
-0.000 -0.001 - 0,002
- 0.0| 3
-0.010
- 0,008
-0.006
-0.005
0.026 -0.039 -0,052
-0,020 -0.039 —0,040
-0,010 -0.624 -0,032
- 0,012 —0 019 —0.025
—0,010 -0,615 -0,020
1.80
1,90
2,00
2 20
2,40
—0,000 —0.001 -0 002 —0.004
-0(ЮО _0,061 - 0.002 -0,003
- 0,090 -O.0CI -0,001 -0,002
-0,000 0.0(1!) -0.001 -0,001
-0,000 -0.000 —ОоОО -0,001
-0,008 —0,012
-0.006 -0 009
-9,Ш - 0 007
-0.003 -0.004
-0.001 -0,002
—0,015
-0.012
-0,009
-0,005
-0,003
2,60
2,80
3.00
3,50
4.00
0.О00 0,1 ЮО -0 000
0,000 О ООО 6,000
0.000 (1.000 (1,900
6,000 0 00(1 о.оОО
о ООО о ООО О ООО
0.009 —0,00(1 -9.001 -0.001
0,009 0,000 0 000 9,001
(.'.ООО 0 061 0.001 0.002
С0|)1 0,001 0.002 0,003
0 001 <1,002 0.003 6,0о4
пин Ли и Кеслера |511
1.озо j 1 2(10 зет 1 2,000 1 nfil. 1 J.O.JO 1 7,000 1 1«0Х>
5.584 5,638 --5,607 - 5,750 -5,810 -5,782 —5.679 -5.461
—4,359 4,416 1.479 4.547 -4,611 -4.608 — 4.530 -4,352
3,463 —3,522 3,588 -3,66! -3,735 3,7о2 -3,694 3,545
2.785 2,845 2.913 -2.990 —3,071 3,104 -3,063 2,938
-2,256 —2,317 -2 387 -2 468 -2,555 -2,601 -2.572 -2,468
] ,835 1,897 1 969 -2,052 -2,145 -2,201 -2,183 - 2 096
-1,494 _ I 630 — 1 71 п - I.8|2 - 1,878 - 1.869 - 1,795
1,214 -1,278 -1 332 -1 439 1,Г>3() — 1,612 -1,61) - 1,549
—0,981 1,045 -1 120 -1,208 - 1,3|2 -1.391 - 1,396 - 1,344
-0,785 -0,850 -0.925 - 1.0|5 - 1,121 -1,204 - 1.215 -1,172
0 619 0 685 0,760 -0,831 -0.958 - 1,046 - 1,062 - 1,026
0,479 -0,541 -0 620 -0,71| - 0,819 - 0.9| 1 —0,930 - 0,90|
-0,359 —0,424 -6 000 —0,591 —0,700 -0,794 -0,8| 7 -0,793
0,296 0,361 0,437 —9,527 —0,637 -0,732 - 0.756 —0,7.35
-0,258 —0,322 -0 398 -0.488 -0,598 -0,693 -6,719 -0,699
0.223 0,287 -0.362 -0,4’>2 —0.561 -0.657 - 0.683 - 0 665
0 206 —0,270 0,344 -0,434 -0,543 -0.639 —0.666 - 0,649
0 191 0,254 0 328 9,417 • -0,526 -0,622 -0 649 -0,633
0,176 0.238 -0 312 0,40! -0,509 -0,605 - 0,633 -0 617
-0.168 -0.224 -0 297 0,385 —0 493 - 0,589 -0,617 -0,602
0,16! 0.2|0 —0,282 -0.370 -0.477 -0,573 - 0,601 - 0.588
0.143 0 |80 0 242 - 0.327 -0,433 0,529 -0.557 -0 546
—0.120 0,148 0,193 -0,267 - 0,368 -0,462 -0.491 -0,482
(’,102 0 125 0,| 60 -0,220 -0.3|2 —0,403 -0,4.33 -0 426
—0,088 —0,106 -0 135 -0.184 - 0.266 -0,352 —0,382 -0.377
0.066 0,080 О.ЮО -0,1.34 —0,195 - 0 269 -0,296 —0,293
0.051 - 0,061 0.076 • 9,Ю1 —0,146 -0 205 —0,229 —0,226
0,039 0,047 0 059 0.077 -0,1 | 1 -0,157 —0,176 —0,173
- 0 031 0.037 0,046 -0,060 -0,085 -0,120 -0,135 —0,129
—0.024 -0,029 -0,036 -0,046 —0,065 -0,092 -0,102 0.091
0,019 О.О^о 0.028 0,036 0,050 -0,069 -0,073 -0,066
0,015 0,0|8 0,022 -0,028 -0,038 - 0 052 - 0,054 - 0,043
0 012 0,0| 4 0.017 - 0,02| - 0,029 —0 037 -0,037 -0,024
-0,007 0,008 0,009 -0,012 _0 016 — <3,0|7 -0,012 0,004
—О,003 -0,004 —0,004 -0,005 -0.006 - 0 003 О.ООб 0,024
—0.00] 0,001 0,001 -0,001 0,001 0,007 0,017 0,037
0 001 0,001 0,002 0.003 0,005 0,014 0,025 0,046
0 002 0,003 0,003 0,005 0.009 0,0|8 0,031 0,053
0 004 0.000 0,006 0 008 0.013 0,025 0 038 0,061
(1.005 0.006 0,007 о.ою О.О|6 0 028 0,041 0.064
'I МкЧШП j 7 Коэффициенты фугитивности, рассчи>анные ио уравнении» сосгин
О 30
О 35
0.40
0.45
0,50
0,55
0,60
0,70
0.75
0,93
0,9ч
0,97
0.98
0 99
1.00
1.01
-0.000 -0.00'2 -0.001
-0,000 - 0,002 -6,004
-0,00'0 -0.002 -0,003
-0.000 - 0 001 —0.003
-0.1)00 -0.01)1 - 0,603
-0.009 -0,1118 - 0,029 -0,042
- 0,90S -0,016 0,0'25 -6.035
-0.907 - 6,014 -0.02' -0.030
-О.ООи -0 01-' 0.018 -0.02Г,
-0,005 -ООЮ _0 f!16 -').02|
1.02 -0,000 -0.001
1.05 (1.000 -0001
1,|0 0,006т -0.000
1,15 9.000 0.000
1,20 0.000 0 001
1.3(1 0.000 0.001
1.40 О.(1()О 0.002
1.50 0,000 0,002
1,60 0 009 0,002
1.70 0.009 (1,002
1.80 0.000 0.002
1.90 0.000 0,0(12
2.0() 0.600 0 002
2,20 О ООО о,002
2 40 0,000 0,002
0.002
О 001
0.000
О,О(И
0.0()2
() 003
О 003
0,003
0 003
0.004
0.003
о.ооз
0.003
0.003
0,003
-0 004 0,002 0,000 0,002 О.ооз 0 009 -0.005 0.001 (.1 005 0.007 -0,013 -0,006 0,002 0,008 0,012 0,017 -9,007 0.004 0,011 0,017
0,(105 0 011 0,017 0,(123
0.006 0 013 <> 020 0,027
0,007 0.014 0 02| 0.028
0.007 0,(П4 0,0|4 0.02 ( 0,029
0.007 0,021 0.029
0.007 0.014 0,021 0.028
0.007 0,011 0(121 (1.028
0,007 0.013 О.02() 0.027
0,006 0(113 0,019 0,025
0,006 0.0|2 0 0|8 0,024
2.60
2,86
3.06)
3.50
4.0(1
0 000 0,001 0,()(13 0.006 <1.(01 0,017 0,023
0.000 О.ОО| о.ооз 0.005 0,011 0 016 0,02|
("ЮО 0.001 0 003 0,005 0,010 O.OIS 0.02(1
0.000 0,061 0002 0,004 0,009 0013 0.018
1) 000 О ОГ) (Ю02 ООО! 0 008 0 012 0,016
ни» Ли и Кеслера 151 I
1 'Ж | 1.200 1 и» - ;н"-' lU.'Jill'
-ХМ 1 «.818 -8.828 8. «41 8.8811 -8.953 -9,02'’ <1 |
-6.5l.i7 1. ", 7 ". ),5«7 -6.606 -(>.645 0 ,28 -6.800 -6.919
1.951 - 1.962 -4.974 4.995 -5.035 1 -0.195 5.312
3.766 3.774 3./86 3.806 -5.845 .'1 О'Л< -4.001 -4 114
. > 877 -2.884 - 2 896 2,91-5 -2,9сЗ -3 027 5 |()1 - 3 2(18
2 199 2 207 -2.2|8 -2.236 -2 273 > 312 -2.110 -2,510
1 0'.' - 1.684 1.69,7 - 1.(12 _(.74/ -1,812 1 8,5 - 1 967
-1.271 1 о"8 1 287 -1 304 -1,336 1,397 — 1.1 об - I 339
п.9с2 0 938 — 0,967 0.983 - 1.013 1.070 -1.124 -1 201
-(1 700 0 707) -0,714 -0.728 -0 809 -0.858 -0 920
п. 199 -0.501 -0.512 - 0.52(5 -0.551 - о,0()() 0,645 -0,473 -0,709
-<1.338 -0 343 -0 35! -(.1.364 -0,388 -0.432 —0,530
-о 210 0 015 -0.222 -0,234 0,256 _O,29f> —0 333 0 381
-0.140 П 1 г. 1 0.158 -0.170 -0,190 0,228 -0.262 -031(1
0 |08 -0 114 -п.121 0.132 0,15] -0 |8? - 0.220 -0 2Ь5
- 0 075 0.080 -0.087 -6 097 -0, | 16 -0 149 -0.180 -0.-223
о.озо 0.064 -0 081 (1.099 - 0.132 0 162 -0,263
-<1 044 0.050 0,056 _ O.Otil) -0.084 tj.ll> — 0 144 -0 184
—0 (31 0 O3h 0.042 -0.052 -0.0(59 0.099 0 1 >7 -() 166
-(' 024 -0.024 -0,030 -0.038 -0 054 -11.081 - 0,1 1 | -0 149
-6.019 - () 0|3 - О.о 0.026 -0,041 _0.С)69 -0,095 -0,132
-0.007 0,002 0,008 0,007 —О.НОо -0.029 -.0.052 -0.085
0.007 0.0L2 0.025 0 0-11 0,042 f>.026 0.008 -0 019
о (Но 0,022 0.034 0.056 <> 0/4 0 069 0,0о7 0,036
о 023 0,02° 0.011 (1 004 0.093 0 102 0.096 0.081
О.ОЗо 0.038 0.049 0.071 О,Ю9 0 142 0.160 0 148
0.031 о,он 0.053 0.074 0,1 12 (',161 0.18| 0,191
0.03(, 0,043 0,055 0,074 0 1 12 0,167 0,197 0.2,8
о.озб 0.043 0 05ь 0.074 0,110 0.167 0,204 0,234
о.озь 0 013 0.054 0,072 0.107 0.165 0.205 0,242
0,035 0.042 0 ОоЗ 0 ()7<1 0.104 0. 101 п.203 0 246
0.034 0,041 0 052 (>,06-8 0,101 Г, 15, 0,‘>00 0 246
0,031 0.040 и,®) 0,060 0.097 0 152 0.196 0 244
0,032 0,038 0.0-17 0,062 (1.058 0,1)91 0,143 0, ,86 0.236
0.03(1 0.036 9 044 0.080 0, |3 L 0 |76 0 227
(MIL'S 0.034 0,012 0.055 0,080 6,127 0.167 0,217
0.027 0.032 (> 039 0,052 0,1)76 0,120 11.158 0 208
0.025 0.030 0,037 0,049 0,072 Г. 1 1 J 0 101 0,199
0.002 0 026 0,033 0,043 0.063 0. ,01 0.134 0,179
о 02,) о 023 0 029 (МП* о.ол- (1,090 0,121 0,| 63
ТАБЛИЦА 5.8 Уравнения Йена и Александера
для изотермических изменений эита н>иии 1.103]
IKpeipf/mni чар, Р, — п,01 — 30
//•-» _____________________________________________
Тс ехр [ с; (Л)-] -с, 1 СД4 СЬР2Г
где
{ } — 1 _(?2 — С, — С,Р, : С2 * 1 -- ardy (C’j - С3?л I 0,50J
2С = 0,29, диапазон нрнксдс......... iеднераtvp 0,8 < 7Г< 8 0
С’] — 166 охр (—5, |67'г' + о,()17
С2 = 0,62 схр [ — 18,4 (7, — 1,0)] — 0,05
С4^ 6,%9 (7, _ 6,75)‘'5° ехр [ —0,3175 (Т, — 0,75,]
0’5-0,213ехр [-0,1045 (/'’Л35)]
Г8 — 0 0564 (7, -0,’и1'6’ехр [-2,869 (Г, -О,5) |
Ао- |,|О — 0,314 (7’, -8)а
1 — 0,000 149ЭГ9’1’ ехр (—1,2977 )
ш ------------------------------1- "
О,]879 _ |,О82б [Тг — 0,65) ь*6
Zc = 0,27, диапазон приведенных те^перат} р 0,9 Л Т, '' 4,0
40ехр (_5,77г)
1 Т,-0,81 1
с3~ °>JGexP I-26'2 (^г — 1.0)1 +CW1
С;, - 17,25 ехр [ 16,7 (Г, - 1,0)1 + 2,75
С4 - 0.444 (Тг - 2,0) - 0,0215 (Тг - 2,0)2 +
+ 0,0610 (Г, - 2,0)3 — 0,0404 (Тг — 2,0)’ + 0,6561
| - 0,0697 (Т, — 2,0) — 0,0734 {Т, — 2,0)2 —
С6 xj - 0,0533 (7, - 2,0)ь 0,0125, если < 2,25
| 0, если 7, > 2,25
С'в^= 0,00301 {Т, —0,8) ехр [—0,87 {Т, — О,8)2]
- 8,5-Н 10,5 (7,-4,6)2
m - *2°
’ 0,1052 4- 1,2044 (7, — 0,4429)W3
Продолжение
Zc— 0,25, диапазон приведенных температур 0,75 <1 Тг <5 2,0.
С, = 0 87 ехр [9,845(1,6 _ 7,)] + 0,023955 ехр И ,24057,)
С2 = 0,47148 ехр [39,35 (1,0 _ 7,)] 0,142
Са = ,3918 ехр [122 (1 - 7,)] |- 2,0
С4 = |, 193«7Г - 0,207267/ — 0.90649
C't. — 3 о схр (—2,527,)
Сс- 0,004277 {!- —0,895} схр [—0,946(7, — 0,895)2|
—607,-'-170
0,0853 | 1,50 78 ( 7, — 0,595'2
Zc = 0,23, дигпазон приведенных -ехше|атур (),8< Т, <" 1.7
1 0,003147 схр (6,07597,) —
- 61,12 (.7, —- 1,0) ехр [-19,933 (7, - 1,0)1 +
+ 1,9930 схр 0,911 [10 (7, -0,88)|10:
С2 - ехр (17,671 • 1/637,) + 0,17-
- 1, |738 схр [-17.193 (1 7, — 1.05 |) 1
Ся — схр (52,268 - 49.1887,) 4 24,249 ехр [- 920,5 (7, — 1,1}21
С4 — 0 0032456 ехр (3,29177,, _ ехр (17,37, — 30.6)
С8 — 1,9772 ехр ( -2.18397,)
Сь — 0,000336 ехр (| ,6|7,) — 0.600Q054711 -5
А'„ - 515 — 2507,
m ~ —0,023 4- 1,0741 (7, —0,474ЩГ1,7Тз
Насыщенный пар
= 0,29 HQ-H 5,4рО.б?-17
Тс 1 - 1,227 । — |п
-0,27: № — Н 5,87е/3163
Тс 1 + 1,229 (— lii?,)’-B“,5«
z = 0,25 Н°-Н C[r)PX62232
I 0,76218 (— и р,)О.Б3042
-0,23 Н* — Н 71()рО.6И,15
‘ с 1 Р 0,76727 (_ 1,1 Л>,)0.4втов
Продолжение
\ - 0,29;
Zc — (i,27
Ihptox iiiK'ie'i'iii'i :*.:n)i,(,i 'Mi, P, - 0 6] 30, T, o.O 4 0
- 0 29
Д ~:i — 0.097,72 107 //>, _ 4,2} — 9 60] 235 IT, _0,77i —
— 17 3(1389 (Г, - 0,77)-— 0 3195707 (Pr _ 4.2) IT, ~ 0 77)
i l,3G«f)92 In P,--4,227091, (In Pr} (In T,i |
I 3,181639 (In P,) (In /г)2 I 9.707447
Zt = ),27
/7°— fl
----— — () I 368774 tPr - -1.604)
— 14.56975 (Tr — 0,79749! _ 7,8|2724 (7r _0.7974912 -
— 0.1642482 (T. — о 79719) iP- — 4 664, I ()3(',85| h Pr
| 4.463472 (In P,\ (In I,) - 1.525831 (In Pr \ (h: 7r)- 4- 10 86085
Zt - о.25
H ^-- --0.1074637, (Pr - 1.2)- | 5.80132 (Tr - 0.77» _
- 15.18011 (7, -0.771--0 1470876 ,Pr- |.2t (7r -0,77) 4-
- 0.7800774 In P, . 3 154()58 (In/’,) (In
2.988533 (In Prl (In T,P 12,28618
IT —H
0 (18644293 [Pr — 4,2) — 12,9388<' IT, — 0 77) —
_ |0 8|3| i (Tr — () 77)-- 0 1.568094 (Pr — 4.2) (77 — 0.77) —
I 0.7460842 in P, , 3,17422 (In Pr) (In Г,) I
-b 2,93(1.566 (In Pr< (In > r]' - (2,72129
Hi.
Для раскт^ i/>ncvni! rt iciBi.i' чксй. aJCp>K,iiiiii\ ieyi ien<a< piiju
iMc.’'.yioimie ура,<п‘‘гии
Отклонение энтаT|>i>iiK от Hjcaibiior<ijoboh,
Hu ojho из э(их сравнений примемптельпо х смесям, содержащим реуме-
водороды, критически не оценивалось. В болыи и нс тве случаев для ло|учения
ючцых резу/ц.гатов требуюгс', харамеtргч бинарного взаимодействия
Приведенные выше ур авре., и я состояния для углеводородных it ueyi .'к водо-
родных смесей отличаются сложностью, и обычна для их эффективного исполь-
зования iiy/Kria ЭВМ. Уравнение состояния Редлиха—Квонга, возможно, не-
сколько менее точное, является более простым ио форме. Усеченны.'! вкриальцым
у равнением также легче воспользоваться, чем прочими уравнениями состояния,
хотя их точность в случае смесей может оказаться низкой, если неточно вычислить
перекрестный («'пффндиеит Й12
•*»с Отклонение
"ОТЫ |'28 I).
и 2‘i !чодцфимиин и> ра-
npiiMCHi'i1.1 ы;р[itлт(НЯ Йена— \ ((т.саичс-р i,_ "CiioKniriian ria n|iiInnnire coorricr-
ci-jeiiHUX состояний т irpiibc/vi, i,i;i n aifii far., r or дтн-гиго Z(
Часто хорошие результат:.! получаются яри использовании табл. 52 и 53
нзмснснип энтальпии жидких
непосредственно для расче'1?!
смесей [28. 10, 92, |01].
Теплоты парообразования смесей moi у, бцъ также получены из эксперимен-
тальных данкых по фазовому разковесию [50, 9, |, но для обеспечения надежных
значений энтальпии требуются очень тлчн, е данные
Для расчета энтальпий (и плотностей) углеводородных смесей, содержащих
водород, рекомендуеюя обобщенный метод Чью и Дила [ 13} Хуанг и Доберт
[391 показали, как можно рассчитывать энтальпии кидких (и газообразных)
смесей нефтяных фракций, и Гормли и Лснуар [291 _ энтальпии смесей алифати-
ческих углеводородов б состоянии насыщенной жидкости и насыщенного паря
Изотермические отклонения атропин и коэффициентов фугитивности.
При расчете нзотермнче! ких отклонении эгтроии1! и коэффициентов фугитив
пости чистых газов или смесей, когда это возможно, необходимо следовать реко-
мендациям но расчету энтальпии, сделанным рапсе (Корреляция Иена—Алексан-
дера применима юлько для энтальпии) Для расчета 5е — 5 може, быть исполь-
зована табл. 5.1. если до этого выбрано аналитическое у равнение состояния,
а величина In (ДР) определяется ио уравнению (5.3.11) Если выбран метод Ли—
В заключение нужно указать, что изотермические отклонения энтальпии,
энтропии и коэффициенты фугитивности ив являются независимыми и связаны
соотношением
КГ
(5.4.15)
где Р° — давление в идеальнотазовом опорном состоянии (см. раздел 5 3).
Пример 5.2. Рассштат,, изотермические отклонения эита.тышн и энтропии
пропилена при [25 “С и 10 МПа Бир и др. [7] приводят экспериментальные
значения IIе — И — 244.58 Дж/г; S° — S — 1,4172 Дж/(г-К) (Опорное идеаль-
ногазовое значение давления для энтропии Р° — 0.1 МПа)
Решение. Из приложения Л имеем М — 42,081, Тс = 365,0 К; Р- —
— 4D.G атм. Z — 0,275; ш = 0, ] 48. Таким образом, Тг = (125 + 273.2)7365,0 =
= 1,09 и Рг= (10) (9,87)715,6 - 2.16.
Метод Ли—Кеслера Уравнения (5 4 4) и (5 4 8) используются совместно
с табл. 5.2—5.3
(тгР11-
=’’57
полицию полученных результатов
где
________тРг (1 — РДХД____
“’1-с,(ДП | + с,-сЛ-с,р?
I _| -С,-С,- СД.-С, Д arrlgic, - C,f,)-0,50p
Для Ze = 0.27о цолучгем Н° — И = 23] Дж/(т-К)
Изотермическое отклонение энтропии не может быть рассчитано данным
методом
Метод, основанный на использовании уравнения состояния Чтобы проиллю-
стрировать использование какого-либо уравнения состояния, выберем молифи
цированное Соаве уравнение Рсдлиха—Квонга. Применяя табл 5.] для чистого
зещества, получаем:
KI Qj RTbF
Р ~ 1 -b ~ Qb I (У + b)
Л_4-_ет(-1пДД- ₽,„СфД_|„Д)
Qa = 0,42748; — 6,08664
R = 82,04 смя-атм/(моль-К)
„ QbRTc _ _[0Д8664) (82.04) (365,0) =рс_9, ^/мадь
[3 И । (0.148) (! ,6J)j = 242 Дж/,
Р = .0 МПа — 9б,7 а,м,
Г - |23°С = 398,2 К
Г = Х{| |-(о,48О 4- l.57w-0.176^)(l - 7C/)J-- J
= 1,39 Дж/(г К)
Э,от метод даст заниженное „а 2 Д.к'Г значение 1/° — // и ззниженное па
Метог) Пена Александера, основанный на принципе соответственных состоя-
ний По габл 5 8, учитывая, что 0,275 лежи г между Zc = 0,27 и 0,29. следует
+ 10 480 г (1.57) 0.148)-(0,176) (0, [48)'|-[I - (l,09)°-3J|2 = 0,861
Так как давление и темгературав этом случав известны, а найденное значение
объема равно 147,5 см’/моль, ю Z — 0,446. Для расчета А — 4° примем опорное
123
122
1 огдл u<> \ [MBrieHiiio (o 3 di
И ~U - |< 1 - 1 ) \-T о -- Vi + RT a - П| -
4.3[ "> -- З.ЧбЗ -- ('1,446 — i I
42?OS1
----- (я 3I4) <39? ?>
23b Дн<Л
(5.5.2)
J24
')и -Kewiep;;
находятся тем же способом, что и описанный
дт,
Подобное выражение может быть запис.ою для [(<Л‘Г:<)Т,)р при нсноль
зовании постоянных опорною вещехтпа пз т.тб/г 3 9 (факн'р лиеьтрччности оп< р
него вещества —^-октапн <'/‘1 0 3974)
Г , йр>
W
Р +
Кроме тою. [(дР, 7)! г'У'1 дается (цтдобиы-.г выражением с гк|Сгояиныг”'
для опорною вещества (табл 3 9)
В другом методе расчета этих производных нсполт.зхстся производный
коэйн|ч|11испт саенмаемости Определим две функции
,5.5 б)
Нетрудно показать
Элмистер впервые предложил связать Z(, и Z? с приведенными < вопс-вамп
(21, 22 | Г1<:зжс в корреляции [(>9] оначеиия Х;, и Z/ были связаны с Т„ Р/ и «;
-“г;” 15ю
Zt -zy'-'-o.Z'!' (3.3 |О)
Функции простых вешеств Z.1' и 2т''П]>иведе1-ы на рис 5.6 и 3 8, а функции
отклонении Z;,1’ и Z'r" на рис 57 и 59
Для иллюстрации прпое шмости фчнкции Z;, и Z; припояится так называе-
мая иаблииа Бриджмена^ (табл 5.9). Например, если нужно определит’- произ-
водную то {д]1)г=- (RT-:'P) (ZT _ Z) и (дР]г - —1 Следовательно,
«)!-//дР)т = (RTiP) (Z- i,)
Для того чтобы ж'полюопать производные коэффициенты сжимаемости для
газовых смесей, нужно п<> уравнениям (4 2 |)—(4.2 3) рассчитать иссвдокритиче-
ские константы. Значения Zp и Zr для жидкостей недавно были определены
Хсн и Лю |381,
125
Пример 5-3. Определить К (dVrdP)j- и (dVlflT)p для пропана при 60 °C и
84 атм Экспериментальные значения этих величии равны 2.15-10'* м3/кг,
—1,93-10"’ м3/(кг-атм) и 6,92 10'в м’/(кг-К), соответственно [73].
Решение. Из приложения Д для пропана М — 44,097, Тс — 369,8 К,
Рс= 41,9 атм и <ь= 0,152. Тогда Тг - (60 + 273,2).'369,8 = 0,90 и Рг-
= 84/41,9 — 2,0. По уравнению (3.3.1) и табл. 3.1 и 3.2 Z<“‘ — 0,311 к Z1" -
= —0,106. Таким образом
Z - Z101 + cuZ(l’ = 0,311 + (0,152) ( 0,106) = 0,296
V = S = -^^.g273- = 2’18 “2'18 '»-
126
— —0,10. Тогда по уравнениям (5л 9) и (5.5.10)
По табл. 5.9
RT7B
(82,04) (60 -1-273,2) (0,018)
(842) (44,097)
RZ,
(82,04) (0,345)
(84)(44,097)
Погрешности составляют I;
Многие другие термодинамические соотношения могут быть выражены как
Щ остые частные производные и вычислены в терминах Z. 7.у и 2у Двумя такими
наиболее общими соотношениями являются разность С(, — Cv н коэффициент
Джоуля—Томпсона, т е
127
L 2 20 1.
|Ic„-^L(zr-z)
(3.5.12)
T (гЖДПр
Эдмистсром [20 221 Rm.ih сосиплепы диаграммы |rf-';, к C'„ - CD, а также
И1оэ1гтрог?кйлмх к«?ффицле’гт<1В и Btiv функций Т, и Л“,. Си j введения третьего
параметра, подобною и
Другим примером использоюития производных коэффиицсигов (я.имаемостн
является обобщенна!, корреляция Шервуда [^2] доя (.'коростн шукз п сжатых
кт/;(сд AC,,))|zf.(Q: - A-z^-r1 (б.мз)
где Vs _ скорость звука, м/с; а — размерная коне) анта. равная КЖ'Л!. м5/(са-К);
М молекулярная масса; ЛСр = Ср — С° (см раздел 5 6) Остальные члены
уравнения били описаны раньше Применение этого уравнения иллюстрируется
примером 5.4.
116 атм Экспериментальное значение, приводимое Жсрвудо.м. равно 533 м'с,
а теплоемкости при нулевом давлении С° = 12,8 к<1л/(моль-К).
’ Рид Р. |( Др.
ТАБЛИЦА 5.9. Таблицы Бриджмена в терминах Z? и Zp [69]
= — (dF)r — I
RZr
(dV)p = — (дР)у = —р—
tdS)p = — (dP)s =
[dU)p=- (№)u = Cp-RZr
(?H)p — (dP)n = Cp
(dG)p = — (<3P)g-S
(dA)p=-(dP)A~-(S + RZj)
(dV)r = ~(dT)v
PS), -= - WT)s -
(W)r _ - (ЗГ)„ - - (Zt- Z,,
(3«)r - - (ST)» -T P-т - Z)
(8C)r _ - m0 = - » - -
(ал)г^-(37-м=-Ь?£
- - Wr-> (' C,Z„ - Ю])
mv — w« - - t _
(87/),. - on„ - 4r (- c„z„ I- KZ'( - ezz()
(3O)V _ - (8V)0 - - (-si, + »ZZr)
(8Z),----(8 nA -
(8ff)s = - (8S)„ - CtZ, +
(8H)S —
(SC), _ - PS)G -- (SZ, - C„Z)
(M)s^-(Ж)л„ ^-(-C„z„ |-яг''-| szr)
130
Продолжение
(cW)y (- ZCp ; RZZj CpZp - RZ:T)
(!)G)u = - W')g - (RZTZ- ZCP + SZT - SZP)
(дА)и - (дС)Л = -^ (- CpZp 4- RZ2r - SZT - SZp)
(dG)n -z - (cW)G = -p- (- SZ - CpZ + SZTI
(дА)ч = - (dH)A [(Si RZp} (Zt ~Z}~ CpZp]
(dA)a = _ (dGtj (ZS- ZPS + RZZf)
и рис 5 6-5.9 Z(:)= 0.374, Zll,= -0,094, Z^*= 0,072, Z<,‘>-0,05, Z<P> =
= 0,55, Z'P— 0,43 Таким образом
Z = Z’°’ + wZ<i’ =0,374 + (0,098) (—0,094) -0,365
Zp=Zpp) H oZa1'1 - 0,072 ~ (0,098) (-0,05) _ 0,067
Zr - Zr' + <aZj'1 = 0,55 -t (0,099) (0,43) = 0,595
Из табл 5.10 и 5 11 и уравнения (5.6.4):
(С^йу_4;И1 (fcciy= 12 09s
Тогда
Ср - Ср -= (1,987) [4.64 4- (0,098) (12,095)] = 11,57 кал, (моль К)
при Тг= 1,0, Рг = 2,4 Тогда, учитывая что М — 30,070
(8308)(305) (0,365)2(12,8 + 11,57)
(30,070) [0,067 (12,8 |- 11,57) - (1,987) (0,595)3]
— 295 000 м2,с2
У$ = 543 м с
Погрешность = 100 = — 6,9 %
5,6. ТЕПЛОЕМКОСТЬ РЕАЛЬНЫХ ГАЗОВ
В гл. 7 представлены методы расчета теплоемкости чистых газов в идеаль-
иогазовоы состоянии как функции температуры. В идеальногазовом состоянии
для газовой смеси
Теплоемкость реального газа связана с идеальногазовой теплоемкостью при
топ асе температуре и cociase соотношением
Ср •— Ср | ДСр (5 6.2)
Соотношение (5 6 2) применяется для чистого газа либо для газовой смеси
ностояни(>|0 состава. Величина ДСр — »то поправка к теплоемкости на давление,
5* 13]
ТАБЛИЦА 3 Ю. Изотермические изменение теплоемкости, рассчитанные по урав
п.П-70
1 1 и.010 0.1JJ 0,200 0.400 | 0 100 | О.чцу |
0.30 2 805 2,807 2,809 2,814 2,830 2,842 2.854
0,33 2,808 2,810 2,812 2,815 2,823 2.835 2.844
0,40 2,925 2,926 2,928 2,933 2,935 2,940 2,945
0,45 2,989 2,990 2,990 2,991 2,993 2.995 2,997
0,50 3.006 3,005 3,004 3,003 3,001 3.000 2,998
0,118 3,002 3,000 2,997 2,990 2,984 2,978
0,60 0,089 | | 3,009 3,006 2,999 2,986 2,974 2,963
0,65 0.069 0,387 | 3,047 3 036 3,014 2,993 2,973
0 70 0,054 0,298 0,687 1 3,138 3,099 3,065 3,033
0,75 0,044 0,236 0,526 1 3,35] 3,284 3,225 3,1/1
0,80 0,036 0,19] 0,415 1,032 3,647 3,537 3,440
0,85 0,030 0,157 0,336 0,794 | 4,404 4,158 3.957
0,90 0,025 0,131 0,277 0,633 1,858 | 5,679 5.095
0,93 0 023 0,118 0,249 0,560 1,538 4.208 I 6,720
0,93 0,02| 0,111. 0,232 0,518 1,375 3,341 1 9,316
0,97 0 020 0,104 0,217 0,480 1,240 2,778 9,585
0,98 0,0|9 0. |0| 0,210 0,463 1,181 2,563 7,350
0,99 0,019 0,098 0,204 0,447 1,126 2,378 6,038
1,00 0.018 0,09о 0,197 0,431 1,076 2.2|8 5,156
1,01 0,018 0,092 0,191 0,417 1,029 2,076 4,516
1,02 0,017 0,089 0,185 0,403 0,986 1,95| 4,026
1,05 0.016 0,082 0,169 0,365 0,872 1,618 3.047
1,10 0,014 0,07] 0,147 0,313 0,724 1,297 2,168
1.15 0,012 0,063 0,128 0,27| 0,6(2 1,058 1,670
1,20 0,011 0,055 0,113 0,237 0,525 0,883 1,345
1,30 0,009 0,044 0,089 0,185 0,400 0,65] 0,946
1,40 0,007 0,036 0,072 0,149 0,315 0,502 0,711 0,557
1,50 0.006 0 029 0.060 0,122 0,255 0,399
1,60 0,005 0,025 0,050 0,101 0,210 0,326 0,449
1.70 0,004 0,021 0,042 0,086 0,176 0,271 0,371
1,80 0,004 0,018 0,036 0,073 0,150 0,229 0,311
1,90 0,003 0016 0,031 0,063 0,129 0,196 0,265
2,00 0,003 0014 0,027 0,055 0,1 12 0 170 0,229
2,20 0,002 0.011 0,021 0,043 0,086 0,131 0,175
2,40 0,002 0,009 0.017 0,034 0,069 0,101 0.138
2,60 0,001 0,007 0,014 0,028 0,956 0,084 0,112
2 80 0,001 0 006 0,012 0,023 0,040 0.070 0,003
3.00 0,001 0,005 0,010 0,020 0,039 0,058 0,078
0,001 0,003 0,007 0,013 0,027 0,040 0,033
4 00 0,000 0 002 0,005 0,010 0,019 0,020 0,038
132
нению состояния Ли и Кеслера (51 ]
1.000 1."0j 1 500 2.000 .3. 000 -.(шц ' o.OOJ
2,866 2,878 2.896 2,927 2,989 3,122 3,257 3,466
2,8йЗ 2,861 2,875 2,897 2,944 3,042 3,145 .3,313
2,951 2,956 2,965 2,979 3,011 3,085 3.164 3 293
2,999 3,002 3,006 3,014 .3,032 ,3 079 3.135 3.232
2,997 2,996 2,995 2,995 2,999 3,019 3,054 3,122
2,973 2,968 2,961 2,951 2,938 2,931 2,947 2,988
2,952 2,942 2,927 2,907 2,871 2,840 2 831 2,847
2,955 2,938 2 914 2,878 2,822 2,753 2,720 2 70$)
3,003 2,975 2.937 2,88| 2,792 2,681 2,621 2,582
3,122 3,076 3,015 2,928 2,795 2,629 2,5.37 2,469
3,354 3,277 3,176 3.038 2.838 2,601 2,473 2.373
3,790 3,647 3,470 3,240 2 931 2,599 12,427 2,292
4,677 4,359 4,000 3,585 3.096 2,620 2,399 2.227
5,760 5,149 4,533 3,902 3.236 2,6о7 2,392 2,195
7,127 б, ою 5,050 4,180 3.35] 2,684 2,391 2,175
10,01] 7,451 5,785 4,53] 3.486 2,710 2.393 2,159
13.270 8,611 6,279 4,743 3.560 2,733 2,395 2,151
21,948 10,362 6,897 4,983 3,641 2,752 2,398 2,144
««**** 13,281 7,086 5,255 3,729 2,77,3 2,401 2.138
22.295 18,967 8.708 5,569 3,821 2,794 2,405 2,131
13,184 31,353 10,062 5.923 3,920 2,816 2,408 2,125
6,4-58 20,234 16.457 7,296 4,259 2,891 2,425 2,110
3.649 6 510 13,256 9,787 4,927 3,033 2,462 2,093
2,553 3,885 6,985 9,094 5,535 3,186 2,508 2,083
1.95! 2,758 4.430 6,911 5,710 3,326 2,555 2,079
1,297 1,711 2,458 3,850 4,793 3,452 2,628 2,077
0.946 1,208 1,650 2,462 3,573 3,282 2 620 2,068
0 728 0,912 1,2| | 1,747 2,647 2,9|7 2.525 2,038
11,580 0,719 0,938 1,321 2 016 2.508 2,347 1,978
6,475 0,583 0,752 1,043 1,586 2,128 2,130 1,889
0,307 0,484 0,619 0,848 1,282 1.805 1,907 1,778
0,336 0,409 0,519 0.706 1,060 1.538 1,696 1,656
0,289 0,350 0,443 0.598 0,893 1,320 1 505 1.53!
0.220 0,265 0.334 0 446. 0,661 0,998 1.191 1.292
' 173 0,208 0,261 0,347 0,510 0,779 0.956 | OSI>
11 140 0,168 0 210 0,278 0, |07 0.624 0.780 о<!|7
'.Но 0,138 0 172 0,227 0 332 0,512 1.4 ,
.1,097 О.НС 0.144 0,190 0,277 0,427 0.545 0,668
0 оп, 0.079 6,098 0,128 0,187 0,289 0,374 0,472
0.048 0 057 (1,071 0,093 0,135 0,209 0,272 (1.350
133
ТАБЛИЦА 5.11. Изотермические изменения теплоемкости, рассчитанные по урав
неиию Ли и Кеслера [51]
o.tuo 0 0.30 | 0.1ПО 0 20D 0.10У о.боо С 600
0.30 8.462 8,445 8,424 8.381 8,28! 8,192 8,102
0,35 9 775 9 762 9,746 <1 7 1 4 9,646 9,568 9,499
0.40 11.494 11,484 12.633 11.438 11.394 11,343 11,291
0.45 12.651 12.643 12.613 12,573 12.532 12.492
0,50 13.111 13 106 13,099 13.084 13,055 13,023 12,995
0.55 0.511 1.3,035 13,030 13,021 13,002 12,98! 12,961
0.60 0 345 12,679 12,675 12,668 12,653 12,637 12.620
0,63 0 242 1,518 12,148 12,145 12,137 12,128 12,117
0,70 0 174 1,026 2,698 11,557 11,564 11 563 11,559
0,75 0 129 0,726 1,747 10,967 10.995 11,011 11.019
0,80 0 097 0 532 1.212 3,511 10,490 10,536 10.5GG
0,85 0.075 0,399 0,879 2.247 j 9,999 10,153 10 245
0.90 0,058 0.306 0,658 1 563 5,486 9.793 10,180
0 93 0,050 0,263 0,560 1.289 3 890 9« ** * 9 ! 10.285
0,95 0,046 0.239 0,505 1,142 3,215 9,389 9,993
0,97 0,042 0.217 0,456 1,018 2,712 6 588 « « * * 9 *
0.98 0.040 0,207 0,434 0.962 2.506 5,711 999999
099 0,038 0.198 0 414 0,911 2,324 5,027 999999
1.00 0 037 0,189 0,394 0,863 2,162 4,477 10,511
1.01 0,035 0,181 0,376 0,819 2,016 4,026 8,437
1,02 0,034 0.173 0.359 0.778 1 884 3,648 7.044
1,05 0.030 0.152 0,313 0,669 1.559 2,812 4,679
1,10 0,024 0 123 0,252 0,528 1,174 1,968 2,919
1.15 0,020 0,101 0.205 0,424 0,9|0 1,460 2,048
1.20 0,016 0,083 0,168 0,345 0,722 1,123 1,527
1 30 0,012 0,058 0.116 0,235 0,476 0,175 0,938
1,40 0.008 0.042 0,083 0 166 0,329 0,484 0,624
1 50 0,006 0,030 0,061 0 120 0,235 0,342 0,437
1,60 0 005 0,023 0,045 0 089 0,173 0,249 0,3(7
1,70 0,003 0,017 0,034 0,068 0,130 0.187 0,236
1,80 0,003 0,013 0,027 0,052 о.юо 0 143 0,180
1,90 0 002 0.011 0 021 0.041 0.078 0,111 0,140
2,00 0,002 0,008 0,017 0,032 0.062 0,088 0.110
2,20 0,00! 0 005 0,011 0 021 0,040 0,057 0 072
2,40 0.001 0.004 0.007 0,014 0,028 0,039 0,042
2,60 0.001 0.003 0,005 0,010 0 020 0.028 0,035
2,80 0,000 0,002 0 004 0,008 0,014 0,021 0,026
3,00 0,000 0.001 0,003 0.006 0,011 0.0|6 0,020
3,50 0.000 0.001 0,002 0 003 0,006 0,009 0 012
4,00 0,000 0,001 0.001 0.002 0.004 0.006 0,008
1.00С ; 1 >,200 1 500 2.000 | 3.000 | 5 000 7,000 | >0,000
8,011 7,920 7,785 7,558 7,103 6,270 5.372 4.020
9,430 9,360 9,256 9 080 8.728 8.013 7,290 6,285
11,240 11.188 11,110 10.980 10,709 10,170 9,625 8 803
12,451 12,409 12.347 12,243 12,029 11.592 11,183 10 533
12.964 12,933 12,886 12 805 12,639 12,288 11,946 11,419
12 939 12,917 12 882 12 823 12,695 12,407 12,103 11 673
12,589 12,574 12,5о0 12,506 12,407 12,165 11,905 11,526
12,105 12,092 12,060 12,026 11,943 11.728 11.494 11.141
11,553 11 536 11,524 11,495 11,416 11,208 10.985 10.661
11,024 11,022 11,013 10,986 10,898 10,677 10,448 10,132
10,583 10,590 10,587 10 556 10,446 10,176 9.917 9.591
10,297 10,321 10,324 10,278 10,111 9,740 9.433 9,075
10,349 10,409 10 401 10.279 9.940 9,389 8,999 8,592
10,769 10,875 10,801 10,523 9,965 9.225 8,322
11,420 11,607 11,387 10,865 10,055 9,136 8,621 8,152
13.001 999999 12,498 11,445 10,215 9,061 8 485 7.986
999999 * S * **л 11,856 10,323 9,037 8,420 7,905
' 9 * 9 9 9 *99999 * 9 9 9 9 * 12,388 10,457 9,011 8,359 7,826
9999*9 13,081 10,617 8 990 8,293 7 747
999999 ****** 10.805 8,973 8,236 7,670
19-9999 99999» 4 9 9 9 * 9 4.44-4 11,024 8 960 8,182 7,595
7,173 2 277 *99999 444444 11 852 8,939 8 018 7 377
3,877 4,002 3,927 «99999 9« 44 4 4 8,933 7,759 7.031
2 587 2,844 2,236 7 716 12,812 8,849 7,504 6.702
1,881 2,095 1,962 2,965 9,494 8.508 7,206 6,384
1.129 1,204 1,327 1,288 .3 855 6 758 6 365 5.735
С)./43 0,833 0,904 0,905 1,652 4,524 5,193 6,035
0.517 0,580 0 639 0 666 0,907 2,823 3,944 4,289
0,374 0,419 0 466 0,499 0.601 1 7оэ 2,87] 3,545
0,278 0,312 0,349 0,380 0.439 1,129 2,060 2,867
0,2]2 0,238 0,267 0,296 0,337 0,764 1 483 2,287
0.164 0 185 0 209 0,234 0,2о7 0,545 1,085 1,817
0.130 0,146 0 166 0,187 0,217 0,407 0,812 1 446
0,085 0.096 0,110 0,126 0,150 0,256 0.492 0,041
0,058 0,066 0,076 0,089 0,109 0.180 0.329 0,644
0,042 0 048 0,056 0,066 О 084 0.137 0,239 0,466
0.031 0,036 0 042 0 05] 0,067 0,110 0.187 0,356
0.024 0,028 0 033 0 041 0,055 0,092 0,153 0,285
0,015 0,017 0,021 0 026 0 038 0.067 0,108 0,190
о.ою 0,012 0 015 0,019 0,029 0,054 0,085 0,146
134
135
которая может быть определена как частная производная изменения энтальпии
при постоянных давлении и составе
— (Н — !Г^т, состав (5 6.3)
Изотермическое изменение энтальпия может 6lith вычислено по уравнениям
состояния, приведенным и ,абл. 3 1. или па оспованвп метода Ли—Кеслера по
уравнениям (5.4 1)—(5 4,5)
Ср - С) - \Сп - (ДСР)'J> тш(\С,,) 11 (5 G 1)
Составляющие поправок к теплоемкости на давление для простого вещества
(АС;,)"' приясдятся в табл. 5 10, а функция отклонения (ДСР)''-'— в табл. 5.11
О виде функций Тг п Рг Если уравнение (о.Ь 4) и табл. В. 10 и 5.11 используются
д.тн смесей, то n<ewv,критические параметры следует определят,, но уравнениям
(4 (, 3)—(4.6.7) Первоначально эти правила были разработаны на основании
данных по смесям углеводородов, но они могут оказаться удовлетворительными
и в других случаях, если смесь це содержит сильно п:лярны> компонентов,
Табл 5 10 н 5 1! несколько отличаются ог более ранней корреляции Эдмистсра
[24 J, особенно в критической области, рде всегда трудно достигнут'- высокой тон
носги Использование уравнения (5 6.4) и табл. 5,10, 5 11 иллюсгрнровалось
примером 5 4.
5,7, ИСТИННЫЕ КРИТИЧЕСКИЕ ТОЧКИ СМЕСЕЙ
В гл. 4 основное внимание было обращено на вычисление констант смесей.
Эти константы необходимы при расчете Р— V—Т свойств смесей или произвол
пых свойств по большинству Л(Стодов, основанных на принципе соответственных
состояний. Однако псевдокритические ьспстанты часто значительно отличаются
от истинных критических свойств смесей Расчетные методики для истинных
критических свойств могут быть опеиепы напрямую посредством сравнения
с экспериментальными данными; для цсевдокричических параметров опенка
может' быть только косвенной, поскольку физически псевдокрнтнческое состоя-
ние не существует-
В этом разделе кратко ра<с.матриваются методы расчета истинных критиче-
ских свойств смесей Применимость большинства из ннх ограничивается угле-
водородными смесями и смесями углеводородов, содержащих также СО2, Н23, СО
и постоянные газы, Процедуры расчета точек крикондентерма и криконденбара
слабо ризвиты [S3] и здес= не описываются.
Критическая температура смеси. Истинная крнгическпи температура смеси
обычно не являема линейной функцией мольных составляющих критических
темпер пур чистых компонентов Ли [52] предположил, что если состав выра-
жается как
(6.7.1)
го „севдокритическая температура смеси может быть вычислена по уравнению
TCT-Wci
(5.7Л)
где у — мольная доля /-го компонента; VC/— критический обьем /-го компо-
нента; TCl — кршическая температура /но компонента; Тст — истинная кри,и-
чсская температура смсс,,.
Чью и Прауснин [14] предложили похожую методику, определяя поверх-
постную долю 0,- как
V?3
(й'7,Ь)
136
Они связывают 0у и Тс/ уравнением тс7= £0/ГС/ - SS6‘°;Ti/ (5.7,4) 1 < I
где т(/ — параметр взаимодействия Значение т,, считается равным нулю, а ты --;) w>M! быть рассчитано для различных типов бинарных взаимодействий уравнению -D^'EVf (3.7 5)
где
^7= r/_%f. (5-".6)
5? = | 1 (6.7.7} Ниже приведены коэффициенты уравнения для нескольких различных типов
пар компонентов [84], причем 0 s7 0,5'
Папа комчоиектоп - 1 ‘ \ с \ л г.
Содержащая арсматцче- -0,0219 1,227 -24,277 147,073 -259,433
ские соединения Содержащая H2S Содержащая СО2 -0.0479 _0 0953 —5,725 2,185 70,974 -33,985 — 161 319 179,068 -264,Г>22
Содержащая С2Н2 Содержащая СО Все прочие —0,0785 -0.0077 —0,0070 -2 152 -0,095 0.287 93,084 -0,225 -1,343 722.676 3,528 5,443 -3,033
На рис 5 10 привелся;: зависимость псевдокритнческой температуры бинар
137
усшлиесв tjdc'ie i а д.ш uuuni мс(идив cuviauM.'id менее t x\ для
многокомпонентных углеводородных смесей получаются большие ошибки (сред-
няя погрешность равна ]] К). Для смесей углеводородов с неуглеводородями
метод Чью —Прауснвца дает меньшие отклонения [77].
Из методоп, рекомендованных Спенсером [851, соотношение Ли (5 7.2)
проще в использовании и несколько более точно, если только смесь не содержит
неуглеводородов.
Пример 5.5. Рассчигвтз псепдокритнческую температуру для смесей, содер-
жащей метай, этан и н бутан Мольный состав
0,193
уСа =-,0,470
Ли [52] приводит экспериментальное значение 354 К-
Решение Из приложения А имеем
| Тс' '<
Мсгап 190,6 99,0
Этан 305,4 148
н-Бутан 425,2 255
Alt'moc) Ли Используя уравнение (5 7 1), получаем:
0,492
Тогда по уравнению (5 7-2)
тч = (0,!]0) (190,6) = (0,398) (305,41 -(0,492) (425,2) -352 К
Погрешность = 2 К
Метод Чыо—Праусница. Сначала по уравнению (5 7 3) определяются зна-
чения поверхностных долей 0/.
Поверхилгтнл я
Лолч 0/
Метан
л-Бутан
0,134
0,427
0,439
1,000
138
Затем по уравнению (5 7 5) находится тг, с использованием значений А ==
-0,0076, В - 0,287, С -1,343, D - 5'443 и С = -3,038
4>г
Метан Этан 0,231 0,045 ]],2
Метан и Ьутан 0,381 0,144 44,3
Этак н Бутан 0,104 0,025 9,1
Далее по уравнению (о 7 4)
Тст = (0,(34) (190,6) 4- (0,427) (305,4) -I- (0,439) (425,2) -ф
+ (2) (0,]34) (0,427) (11,2) -ф (2) (0,134) (0,439) (44,3) -ф
+ (2) (0,427) (0,439) (9,1) = 353 К
Погрешность — f К
Критический об(.ем смеси, Количество известных экспериментальных дан-
ных по критическим объемам смеси невелико. Поэтому диапазон применимости
н точность расчетных методов нс совсем установлены. I ривс и Тодос [34 [ предло-
жили для углеводородных смесей приближенный графический метод, однако
чналигическая методика Чью и Прауспмца [J4], модифицированная Шиком гг
Прауспиае\> 177], представляется более тонной. При расчете поверхностной
доли 0;, определяемой уравнением (5.7.3), критический объем смеси дается урав-
нением, аналогичным уравнению 5 7.4
(5.7.8)
где V,, — критический объем /’-го компонента; v[; — параметр взаимодействия-
T,i — 0, а значение v(J- (i /) может быть рассчитано следующим образом
ф,-Л+ В6Ь F<X I-D62 (5.7.9)
(5.7 10)
Ниже приведены значения коэффициентов уравнения (5 7 9) для нескольких
типов пар компонентов при О sj 6В sj 0.5 [841
Л ромбический уг депо до
род — ароматический ялс-
подород
Содержащая не менее одного
парафина циклического Стро-
Парафин нормального строе-
ния — ароматический угле-
водород
Содержащая СО2 или ll»S
Есе прочие
0,0753
- 0,4957
0, J397
-2,9672
1,8337
698,89
|39
Спенсер и др. [8о] проверили уравнение (о 7.8) на 23 бинарных углеводород-
ных смесях п 8 бинарных смесях углеводорода с нсуглеводородом Погрешность
составил;! в среднем ]0,5 % , причем особенно плохие результаты были получены
для систем этан—циклогексан, этилен—пропилен, а также для нескольких си-
стем, содержащих нссглеводороды. Одплко такую большую погрешности можно
отчасти объяснить неточностью эксперимента. Измерять К,г намного труднее,
чем Т т или Р<т Спенсер и др [65] заметили, что иогда VC/ дается коррели-
дней
(5 7.12)
.целения и знака, и значения этой величины не существует.
Пример 5.6. Рассчитать псевдок-рптц-кский оиьем смеси толуоиз и н-jCKcaiid,
содержащей 50,5 % (мол) и-reKCdHd. Экспериментальное значение равно
325 с\г7моль [96].
Решение, Используем уравнение (5 7 8). Из нриложевия Л имеем:
1Z ОТО 3;' .. М /'J .г -..И/. . т __________________._____
По у р.п зиению
(0,505) (370J’’J) Д- (0,495) (31б'2'3)
По уравнению (5.7.11)
13702/3 —316-
В=| 370^+316'
Затем по уравнению (5 7 9)
I- Vbi г £6р = 0,0753 г( - 3,332)(0,0525) +-
(2 220) (0,0525)2 _ 0,094
370 - 316
Vc/ - (0.531) (370) + (0,469) (316) + (2) (- 32) (0,531) (0,469) -
____ 328 см’<моль
„ 328 - 325 «
Погрешность — — 32-------- 100 —
Критическое давление смеси. Заппсихгэсть крцтическшо .'.авлеинч cmccjI от
мольною состава часто нелинейна, поэтому и расчет Г‘с~ часто бывает ненадеж-
ным Ниже оп щипается два подхода к расчету.
Креглевский и Кэн [49], использовав теорию конформных растворов, вы-
вели приближенное выражение для £,.? При расчетах l’Cj по этому выражению
требуется знать Ttl, Поэтому Креглевский и Кэй предложили также методопрс-
лелеппя этого свойств?. Однако Спенсер и др [85] нашли, что если Тсг рассчи-
тывать ip уравнению (о 7 2), то получаются более точные значения Р(/. При рас-
4CjC Р, г ш.гчала следуО] определить мольные объемы всех компонентов V" смеси
при Тг — 0,6. Креглевский [18] составил таблицы значений таких мольных
140
объемов многих чистых жидкостей. С другой стороны, значения объемов можно
опрсгслц”н меюдами, описанными в г.т 3 Затем для бинарной сусси компонен-
тов > и 2 i-ci альзует:я //оследоватсльвый набор уравнений
(5.7.13)
где '/х v yi~ вольные доли. Далее определяются значения поверхностных долей:
(5 7.17)
27;
о) - ©jo, + w202 -[- (2а>1г _ ££>г — ®2) 6,62
где со фактор ацсвтричностп, Окончательно
(5.7 20)
(5.7.21)
Значение 7.у. как указывалось выше, определяется по уравнению (5.7.2).
Спенсер и др, [84, 85[ опробовали этот подход и нашли, что средняя погреш-
ность при сравнении расчетных и экспериментальных данных составляет примерно
1 атм Сравнение проводилось для 907 экспериментальных точек. В рассмотрение
те были включены системы с метаном, так как все применяемые корреляции
иают для таких смесей значительную погрешность Метод иллюстрируется при-
мером 5 7. В большинстве случаев уравнение (5 7.22) можно упростить, рдссчи-
1ывая Р’г Т* и w как среднемольные значения P,v Tct п о; чистых компонентов
143, 84, 85] Погрешность увеличивается при этом всего лишь до величины
Пример 5.7. Вычислить критическое давление смеси’ лана и бензола, со-
держащей 39,2 % (мол.) этана, Известно, что истинные критические давление и
гемпературл равны соответственно, 83,8 атм и 225,9 “С [441-
Ре ш с и и е. Свойства чистых компонентов по Приложению А
CCOtICTBO Ьензол Сходство | Этак
/г, К 305.1 562,1 0,098
Р, атм 48,2 48,3 Vj, СхЛмОЛЬ 148
141
По заггным Креглевского [48], V* (этана) — 54.87 см’.'моль и V* (бензола) =
— 93,97 см’/моль. По уравнениям (5 7 13)—(5 7 21), если этап — вещество ],
а бензол — вещество 2, имеем:
v, = 1(54,87)'
, 7 сн3 модь
’ = (54,87) (0,392) 4- (93,97) (0.608) 4- 1(2) (72,7) —
- 54,87 — 93,97f (0,392) (0,608) = 77,8 см’.'моль
8, ------------<°+><Ы'87^___________ ».з,0
(0,392) (54,8?)2'3 + (0,608) (93,97)2-'J
(2) (72,7)1
(54,87)1/3/ЗО5,4 4- (93,97)'л’/562, |
л,з ( (305,4) (О,ЗЮ) (362,1) (Q.690)
I (54,87)|/3 + (93.97)1'3
(54,87)'
<о12 _
= 0 |34
со = (0,098) (0,310) + (0,212) (0,690) 4- [(2) (0,134) —
- 0,098 — 0,212] (0,310) (0,690) = 0,167
462 (48,2) (0,310)+ (48,3) (0,690)
(77.8у1/3 (305,4) (0,310) (562,1) (0,690) ~ 4 ’
(54,87)1/3 (93,97)1/3
Прежде чем использовать уравнение (5 7.22), нужно рассчитать Тс-, По урав-
нениям (5.7.1) и (5.7.2)
0 _---------- (0.392) (148)____________= 0 269
1 (0,392) (|48) + (0,608) (259) ’ °
Тст = (0,269) (305,4) + (0,73|) (562,1)= 493 К
Тогда по уравнению (5.7 22)
Рст = 47,4 (1+ [б,808 (4 93) (0,167)] (]-^|- 1)] =68,5 атм
Погрешность = Ю0 — — ж1*;.
Спенсер и др. [84], применив к этой сильно нелинейной системе метод Крег-
левского и Кэя, полудили среднюю погрешность —13%. Для большинства
других систем имели место гораздо меньшие ощиСки.
Другой метод предсказания критических давлении смесей был разработан
Чью и Прауснинем [14]. Они связали РСт с Тс„ иУ,,л с помощью модифициро-
ванного уравнения состояния Редлиха—Квонга /см. раздели 3 5 и 4.3);
+++ + »«)
(5.7.23)
142
1де 1\/ и Уг/ вычисляются методами описанными ранее в этом
фициенш смеси для определения Рг/- находятся по уравнениям
yiilt>.RTCj
S '/tbi - S
(5 7 24)
(5.7 26)
при учете
(5.7.27)
(5 7.28)
(5 7 29)
(5.7.30)
Значения параметра взаимодействия k;? обычно колеблются в интервале от
0,1 до 0,01. Для большого числа бинарных систем они приведены в работе [14].
Cncifc',p и др [85] сообщают, что в среднем расхождение между значениями
Р(Г, вычисленными по корреляции Чью—Прауснипа, и экспериментальными
составляет 2 атм, если метан не является одним из компонентов смеси. В последнем
атудае orK.TOHurrfOT будут много больоге. Для систем, содержащих метан, предло-
жен ряд других методик расчета Рс?- [1, 34, 89 [, но их применимость иди ограни-
чивается углеводородами, или они являются графическими итеративными.
Пример 5.8. riosiopnib пример 5 7, используя метод Чью—Прауспица для
Решение Свойства чистых этана и бензола даны в примере 5.7. По мето-
дам Чью— Праупннца, предназначенным для расчета Тс} и ^г, получаем Тсг =
~ 493 К п VCI — 184 см3/моль. Для этой бинарной системы kit = 0,03 [14].
Тогда
Qb, =0,0867 — (0,0125) (0,098) + (0,011) (0.098)2 = 0,0856
Qi -- 0,0846
_ м>5| см8/моль
Ьт = (0,392) (44,51) + (0,6С^) (80,80) 66,57 см3/моль
(^)3
(82,04) (305,4)
148 — 44.5J
,] Г(48,2)(148) (148 + 44.51) 3
J L [(82,04) (305,4)J2 J и’
= 0,421
143
(О 424) (82,04)" (305.4)-
моть‘
(1/4) (0,424 4- 0,421) (82.04) (401 9)1,4 (148 ! 259)
1713 “ 0,291 - (0,04) (0,098 4-0,212)
= 203 9 [06смв.атм К0'о,'мо.иг
<im = 10s |(0 392)’- (% 57) 4- (0,608)2 (439,4) + (2) (0 392) (0,608) (203.l>)J =.
(82,01) (49.4)
Х/.Д 4 tlr г
------—----------------------- — (0,5 лтч
(493)Ь2 (184) (184 4-06,57)
П01 pLHIliOCTB =
Рекомендации. 1. .Tin расчета иссицной критической leMueparypu yi.ieso-
ДОродной смеси следует использовать метод Ли lypaBiieHnc (5 7.2)]. Если смесь
содержит неуглсводороды, то более предпочтительной является корреляция
Чью—Ilpa\ спица [уравнение (5.7.4)], хотя параметр гыаимодействил т,; может
.2. Для расчета истинного юри-ичсского объема смеси рекомендуется исполь-
зовать уравнение 7 3). Однзко, так же как и в предыдущем случае, параметр
пзгшмодействия уы может быть определен только дчя о, раничениого числа бинар-
зован метод Крсглсвсього—Кэн или Ч ьщ—Поауспица. Ни один из этих- методов
Во всех случаях корреляции были разработаны и первоначально проверены
по данным дли углсводород1|Ых смесей. При использовании этих расчетных мето-
дов для смесей исуглеведородов надежной оценки погрешностей дать нельзя-
5,8. ТЕПЛОЕМКОСТЬ ЖИДКОСТЕЙ
Обычно пользуются трех,» видами теплоемкости жидъесы'.: С,1;_. Со± и С^_.
Первая пелнчина представляет собой изменение этальпип с гемперэту рои при
постоянном давлении Вюрая .характеризует изменение энтальпии насыщенной
жидкости с температурой- Третья показывает, какая потребуется энергия Для
воздействия на изменение температуры таким образом. Чтобы жидкость оставалась
ношением
/ АР
х dT ,
144
Рис. 5.11. Теплоемкость жидкого riponiiюна.
картина изменения теплоемкости показана на рис. 5.11 па примере Пропилена.
Вблизи нормальной точки кипения большинство Органических жидкостей
имеет теплоемкости 0,4—0,5 каЛ'(г-К). В этом температурном интервале давление
практически не влияет на теплоемкость (27].
В работе [27 ] экспериментальные данные по теплоемкостям жидких угле-
водородов представлены в виде номограмм, « в работах [36, 37, 90] — в аналити-
ческой форме. Таблицы данных по теплоемкостям жидкостей приведены Сан
Хосе [75].
Методы расчета теплоемкости жидкостей делятся на четыре основные кате-
гории: 1) теоретические; 2) групповых составляющих, 3) основанные на принципе
соответственных состояний и 4) основанные на использовании термодинамиче-
ского цикла Ватсона. Методы каждой катсюрпи, кроме нерпой, описываются
ниже, а в конце раздела даются рекомс-ндаци >. Теоретические методы основаны
на вычислении теплоемкости жидкостей при постоянном объеме посредством
раздельного рассмотрения каждого тина аькхмулирсиктия энергии. Надежных
расчетныхметодикдля нужд инженеров цссоздапс, хотя Бонди р, 9] предложил
несколько полезных приближений, которые особенна ценны для высокомолеку-
Mi риых жидкостей и полимеров. Рапсе Сакиадь'сом и Коутсом бы а и опубликованы
результаты использования подобного подхода [74].
145
, | 311 а ч е ' pi ЧПГ, ||Н|, ] ) г Значь Гг>|>||1 rnieli
4 1ка1'овоя Кис юродсодержащая
-СНа 8,50 —О— 8,4
—С|1а— 7,26 ^С=О |2,66
—СН— 5,00 —С-0 12,66
1 —С— 1,76 1 II
о
О юфиноеач —С—ОН 19,1
-С||а 5,20 -С—О- 14,5
=С-1 5,10
-СН2ОН 17,5
3 80 Л jKUHceaa —СНОН 18,2
।
-С:Н 5,90 -СОН 26,6
-С= 5,90 -ОН 10,7
В Ho.ibtft -ONO2 28,5
—СН - 4,4 Азотсодержащая
- С= или —С - 2,9 Н 1 H-N— 14,0
-СН- 5,3 |[
-СИ2- 6,2 1 - У— Ю,5
14G
Продолжение
J руппа | 3нве“Г>' Г руппа 3нтоЧЮ
1 —N— 7,5 •-С1 (третье или четвертое 6,0 замещение на .1 го^е уг лсрода)
—N= (в кольце) 4 3
-С = К 13,9 —Вт 9,0
Серусодержащая — F 4,0
—SH 10,7 8.G
S— 8,0
Г алогенсодержащая Водородная
—С1 (первое иди второе за- мещение на атоме угле- рода) 8,6 —Н (для муравьиной кис- лоты, формиатов, циа- нистого водорода и т. д ) 3,5
L) Следует добавлять по 1,5 на каждую углеродрую । руплу, удовлетворяющую сле-
дующему условию: ато должна быть углеродная группа, соединенная ординарной связью
с углеродной группой, которая, л спою очередь соединена двойной или трорной снятью
с третьей углеродной группой. В некоторых случаях ото условие для углеродной группы
может выполняться более одного рааа. В таких случаях величина 4.5 должна добавляться
ьсякхр раз. когда выпо.чняетея условие.
Исключения пч правила добавления 4.3-
I. Для групп — СИ3 такие добавки не вводятся.
2 Для группы —СНг —, удовлетворяющей условию добавления 4,-5, елддует вместо
d.5 добавлять только 2.5. Тем не менее, если для группы — СН, — условие добавления вы.
иоляяется более одного раза, то тогда первый раз следует добавить 2,5, а в кахгдом после-
дующем случае — по 4.5 1см. пример 5.5)
г-ямн обозначается просто как С. Углерод, связанный двойной связью с другим
атомом углерода, обозначается как Q, при этом только необходимо указать
атомы, которые присоединены к двум свободным связям, Аналогично, углеродный
атом, связанный тройной связью с другим атомом углерода, обозначается как С;
и имеет только одну свободную связь, Углерод ароматичсско] о углеводорода
обозначается как Сд, а в алленовой группе (>С—С=С<) как Са. В табл. 5.14
приводятся значения составляющих для многих типов углеродных атомов, позво-
ляющие рассчитать константы полинома и вычислить Ср как функцию темпера-
туры. Приводятся также несколько поправочных членов Погрешность, даваемая
методом, обычно меньше 1 кал'(моль>К), что иллюстрируется примером 5 II.
Метод Бенсона для расчета свойств идеального газа по своей природе подобен
списываемым и дается в разделе 7 3.
Пример 5.9, Вычислить теплоемкость жидкого 1,4-цС|-та.1Ис1|П при 20 С,
используя метод групповых составляющих Чью—Свенсона.
Решение. По табл, 5.12
CllL (20 °C) = 2 (CHa~) -I- 2 (—СН=) + (—CI I8—)-|- поправки,
указанные в табл. 5.|2 — (2) (5,20) Н (2) (5,10) j-
-I 7,26-! 2,5 J 4,5 = 34,9 кал/(молг.-К)
147
ТАБЛИЦА 5 13 Групповые составляющие для определения
мольной теплоемкости жидкости нс, методу Миссенара,
кал,(моль-К) [581
1 .счлерл^ра. 'С
— 23 0 И 1 “ 1 "
— н 3,0 3,2 3,5 .3,7 4,0 4,5
СП, 9.2 9,55 9,9,7 10.4 10,95 1 1 г>п
—сн2— j 6,6 6,95 7,15 - .1
1 -СП •V' 5,7 ->,% 0,15 6,35 0,7
-С- 20 2,0 2,0 2,0 2,0
-С = С- 11,0 11,0 11,0 11,0
О 6.9 7 11 Т ] 7,2 7,3 7,4
10.0 ЮЛ 10,4 10,6 10,8 11,0
он 8.0 10.5 12,5 14 75 17,0
—СОО— (сЛож 13,5 13,6 14,1 11,6 16,1 15,5
-СООН 17,0 17.7 18.8 20,0 21,5 22, j
—nh2 11,0 110 15 0 1G 0
—NH— 12,2 12.2 12,2
- \- 2,0 2,0 2,0
CN 13,4 13, Г> 13 G
no2 15,4 15,5 15.7 16,0 16,3
—NII-NH-- 19,0 19,0 19,0
СвНа (фенил) 25,0 27 0 28.0 29,6 31,0 32,5
С10М— (пяфтил) 43,0 44,0 45,0 47,0 49,0 51,0
Г,, 8 б 8 6,0 Л 9 6,45 0 75
С! Ь,9 7.0 7.1 7 2 7,35 7,5
- Вг «4 8,5 8 6 8,7 8,9 9,1
о 4 9,-5 9,65 9.8
-S- 8,9 9.0 9,2 9 1
ТАБЛИЦА 5.14. Полиномиальные коэффициенты уравнения Луриа
и Бенсона для определения теплоемкости жидкости [53а]
Сд= А -г НТ + СТ1 + кал '(«пл,.. К)
I [>11112 А с Л
с—(С) (Н)3 8,459 2 ИЗЕ—3 -5.605Е-5 1.723Е--
с- (С)2(П)2 - 1,383 7Ю19Е-2 --2.063Е- 4 2.269Е “
С-(С)ЦН) 2,489 -4.617Е—2 3J81E- 4 --4.565Е—7
С-(СЦ 9,116 —2.354F—1 1.287Е-3 _ j,9O(5F. -9
- ж Я 1 "3 I.776E—2 — ..526Е-4 2.542Е -7
С,[-|С) !Н) 5,792 —1.228Е—2 G.036E—5 — I.926E—8
Сц—(О2 8 005 —9.456Е-2 4.620Е-4 —6.547Е-7
<>- (Cd) (Hi 8.127 - 7,171E-2 3.894Е-4 —5.462Е—7
1,3.756 — 1 338Е- 1 6,553Е—4 —9.447Е —7
Сд-(СвХС) 5,745 - |,085Е-1 5.898Е—4 --6.983Е—/
С—(Crf)2(H)2 9,733 3.497 -IjOOF.—1 5,522Е—4 —G.832E—7
C-fcd) (С) (]])2 — ЬбСЗЕ—2 1,80812—4 3.277Е 7
C-(Cd) (C)S(II) С—(Св) (С) (Н)2 - 2 232 — 1.773Е —2 2 812Г —1 4 I99E 7
30,192 —2.812Е-1 1.002Е- 3 -1 1I5E—6
Q—(Н) 30 122 —2.081Е—I 5.945Е- 4 -3.430Е-7
Cf-(Q -10,407 1,00215—I — 5.679Е—4 6.G67E 7
Св (Н) — 1 842 5,778 Е—2 — 1 71GE-4 I 995Е—7
Св-(С) 28 807 —2.824Е-) 9 779Е -4 -1 ЮЗЕ-0
Св—(Св) —3,780 2.563Е— 2 1,190Е-5 -9 774Е—8
Попра вки А 1 " Г- 1 1 D
Цис-положсиие с двойцов 14,299 - 1.616Е-1 6.069Е- 4 —7,7|6Е—7
, вячью
HjiMOtiponaitoBoe кольцо 28,469 —2.696Г-1 6,5.31F—1 — 1.636Е—7
Цик.юбугановое кольцо 6,060 —3J11E-2 —2,161Е—4 8.349Е-7
Цнклопснтановое кольцо 34,261 -3.803Е—1 1.16JE—3 —],||8Е— 6
Спироцснтановое кольцо 32,469 -1.Ч91Е -I 1.820Е- 4 41090Е—7
Цик.чогексы-овое кольцо 13,021 — 1,4681*—1 2.802Е-1 —3, ]Ь5Е—8
Цдклщептаьовое колько 2Ц1,72 —2.311 8.235Е -3 —9.600Е-6
Цчклооктановое кольцо 1691,9 — 1,680Е+1 5.523Е-2 —6.033Е-5
Цлклопептеиовое кольцо 13,650 • -I, |26Е-1 7.257Е-5 3.400Е—7
Циклогексеновое кольце» 5,360 —3.456Е—2 -2.232Е-4 7.324Е—7
И щлогепгатриеновое —22,158 3.O85E-I -2,059Е - 3 2.86,ЗЕ—6
КОЛЬЦО
Цикл<)октлте|раеяовое кольцо — 1.060 2.739Е- 1 — 1.972Е-3 3.IG7E—6
Декзгидроиафталиновое колыю (иис- и транс-) 141,85 - 1,510 4.773Е-3 — |,872Е—6
1,2,3,4-Тетрагидрояафть- 1Г|| - 212,67» 2,203 —7,07112—3 8.R65E-о
149
148
Темплин и Зузик [90] приводят значение СР/ — 35,1 кал'(М0Л1>-К) при
20 °C
Пример 5.10. Используя метод групповых > есав-зяющих Миссепара, нычис
лкть теплоемкость жидкого изопропилового спирта при 0°С
Реше я и е. По табл. 5.13
СР1 (0сС)^- 2 (_СНЭ) + (-СП) + (-ОН) - (2) (9,55)+ 5,7 - 8,0 =
= 32.8 кат (моль К)
Экспериментальное значение равно 32,46 кал/(моль К) [32].
Пример 5,11. Вычислить тещтоемкоегь жидкою 1,1-дч\1ети,п1цклопеп’,1| а
при 300 К, используя метод групповых составляющих Луриа и Бенсона.
Решение, |, |-Диметили.йк.1опентан состоит из следующих' групп.
4 С—(С)2(П)2 1 С-(С), I 2 С—(С) (Н)3
По данным табл, 5.14, учитывая поправку на кольцо никлопентапа. i олучаем’
Ср =4 (- 1,383 + 7.049 '.0-"-Т - 2.063 Ю’4?2 + 2,269. jO-’T3) I-
+ (9,116 -2,354 Ю-’Т + 1.287 • JO"3?'2 - J,906 К)"*?1) - 2 (8.459 +
-1-2,113 10's7-5,605 |0-5T2-;-1,723 [Сг'Т3) + (34.261-3,803 Ю-’Т ,
+ 1,161 10 ’7s — 1,1 ]8 IO"4?3) — 54,763 — 0.3307-I-1,511 1(Г372 -
— 1,772 |0-sr3
При 300 К значение Ср = 43.9 калЦмо^ь-К). Луриа н Бенсом [53а] при-
водят соответствующее экспериментальное значение, равное 44,8 ьалО’мо. ь-К).
Методы, основанные на использовании принципа соответственных состоя-
ний. В ряде имх мгомв, преДи.гЗнаиепкых для /ыеист;; renjoewC'iTii жид (ости,
используются зависимости, имеющие форму уравнения (56,4) и- Бонди [8]
дает обзор многих уравнений такого вида, Он модифицировал уравнение Роулин-
сона |70], получив
—-2,56 + 0,436 (1 - Г,)'1 4- «[2,91 +4,28(1 - Т^'Т;1 +
+ 0,296 (1 -7Г)-'] (5 8 2)
н Отметил подобное же соотношение Штерн,жига и Брауна:
—Ср = (0,5 + 2,2«) [3,67 I 11,64(1 - Гг)'— 0,634 (1 -7г)-<]
15 « 3)
Уравнения (5.8.2) и (5.8 3) применяются для расчета С'Р . Ян и Стил [ 105]
предложили следующие корреляции для расчета С01_
I) неполярные жидкости
Са£ — Ср — (АС,;)1 1 + « (АСа) 11 (5 8.4)
!) Например, по табл. 5.10 и 5.11 можно вычислить изотермические измене-
ние теплоемкости Ср — С° как жидкости, так и газа Имеются также сообще-
ния о том, что хорошие результаты можно получнп>, используя аналитическую
форму функции отклонения теплоемкости Ли — Кеслера [51 ] для расчета rcn-io-
емкости жидких углеводородов [16].
0 % 14,87 37,0
0 94 12,27 29,2 12,30 29,2 -126 ч ч
0 92 10 60 27,2 10,68 27,4 -|23 ч
0.90 9,46 '2*3,1 9.54 25.9 —121 Ч ч
0.88 8,61 25,4 8,67 24,9 117.5 ч
0.86 7.93 24,8 8.00 24.2 -115 1 j 1)
0.84 7.45 21,2 7,60 23,5 -112,5 1) 1)
О 82 7..0 23,7 7,26 23,0 110 J) *) ч
0.80 6,81 23,3 7,07 22,6 [08 ч
0,78 6,57 22,8 6,80 22,2 107 ч ч ч
0,76 6,38 22,5 6,62 21,9 106 1)
0.74 6,2,3 22,2 6,41 22,5 — 105 —0,69 -4.22 -29.5
0,72 6,11 21,9 6,08 23,6 - 107 о.ю -7,20 —29’. |
0,70 6,0] 21,7 6 01 24 5 -ПО 1,31 —10.9
0.68 5,91 21,6 5.94 25,7 -113 2,36 -15,2 —22,8
0,66 5,83 2| 8 5.79 27,2 118 .3,06 —20,0 —7.94
0,64 5,74 22,2 5.57 29,3 -124 3,24 -25,1 14,8
0.62 5,64 22,8 5.33 31,8 — (32 2,87 -30.5 43,0
0,60 5,54 23,5 5 12 34,5 -141 1.94 —36.3 73,1
0,58 5,42 24.5 4,92 37,6 -151 0,505 -42.5 102
0,56 5,30 25.6 4,69 41.1 — 161 — 1,37 —49,2 128
0.54 5,17 26.9 4,3.3 45.5 - 172 —3.58 -56.3 149
0,52 5,03 28 4 3.74 50,9 184 —6,02 64,0 165
0,50 4.88 30.0 2,87 57,5 -198 —8,56 —72,1 179
0,48 4,73 31,7 1.76 65,0 -21.3 -11,1 —80,6 (92
0,46 4,58 .33,5 0,68 72,6 —229 -13,3 —89,4 206
0,44 0,42 0,40 4,42 4,26 4,08 35,4 37,4 39,4 0,19 78,5 —244 -15,0 -98,2 221
9 Д.11(ннгч дач 1 ico>< ’<>. (iCJ14 температур выше г = 1 и (ДСо)0'/0 считался 0 71 нет pannbiMtt соответствующее значения
2) полярные жидкости
с^_с; = лс!?01 -ьх(дса)(3₽’ +
-- № 0С’а)(1р) -I- «2 ( \С</'Р| -I- Хы (ДС0)'5/’) (Г) 8 5)
Lio X— фактор полярности Сима ^см раздел 2.6).
Значения (ДСП) п) р другие е зависимости or приведенной температуры
представлены в табл. 5.15. Если вместо C„L нужно получить СРГ, то для этого
предлагается следующее приближенное соотношение
(I 4-w)°’85exp(-0,7074-31,0|4Л +34.3617;) (5.8.6)
1 араведллвое в интервале 0,85 < Tr sj 0,99. При температурах ниже Тг = 0,8
можно прииЯ(Ь, что CPL Са1_-
151
В другом методе, 'снованном на использован m принципа соответственных
состояний и разраСотаииом Лиманом и Дечнером [55], в качестве коррелиру-
ющего параметра для чистого компонента был введен радиус вращения. Перво-
начально предложенный Томпсоном [93] Этот параметр использовался в itoppc-
ляпни для давления паров 164] и в методах расчета второго вириальиого коэффи-
циента [61 ]. а также переносных свойств плотных газов и жидкостей [6] Метод
расчета теплоемкост i жидкости Лимана—Денвера является эмпирическим.
По ЭтсЛ1у методу
+ A-R'T} г А/Т/ 4- к(Б1 - -В^) - К2(В4 + В5тг2) (5.8.7)
Здесь С5£ — теплоемкость насыщения [см. уравнение (58.1)), кал^моль-К);
С° ____идеалькогазовая теплоемкость, R — радиус вращения; к — коэффициент
ассоциации, определяемый как
1 —Ть'г - Un>r
где Рс выражено в физических атмосферах, а = Ть1Тс.
Параметры С» и D„ описываются как
(5.8.9)
нужно знать
Константы Лимана—Депнера приведепы в табл. 5.16.
Для того чтобы воспользоваться методом Лимапя—Денвера,
нормальную точку кипения, критические температуру и давление, пдеальногазо-
вую теплоемкость, т также раднус вращения. Наиболее трудно определить по-
следний параметр Его значение можно получить, основываясь на молекулярной
структуре, если известен момент ипсриии относительно каждой оси [93]. Пассю
и Деннер [64 ] сообщают значения R п к для 250 соединений. Эти данные приво-
Нг>же Т- 0,8 значение C,L фактически равно Сф. В интервале 0,8 <
< Тг< 0,99 с учетом погрешности эксцерименга около 0,2 калимо,|Ь-К) для
веек жидкостей справедливо соотношение
,—- л_с\р (8,G557V — 8,385)
(5.8.Ю)
Эк! четыре метода расчета теплоемкости жидкости, основанные на исполь
зовапии принципа соотнетстнеиных состояний, иллюстрируются примерами
5.12___5 14. Расчетные v экспериментальные значения срапциваются э табл 5.18.
Точность и примепимоегь этих методик обсуждаются после описания метода,
в котором используется термодинамический цикл Ватсона.
Пример 5.12. Вычистить тен.гоемкоегь Жидкого цш>2-бутеца при 76,6 С
(349,8 К), применяя корреляции, основанные на использовании принципа соот-
ветственных состояний (Роулинсона—Бонди и Штернлиша—Брауна).
ТАБЛИЦА 5.16 Константы Лимана Деннера в уравнении (5.8,7) [55]
д 10,1273 Л, -0,8949 в. 0 31446
яа 15,3546 Д5 —0,01489 в2 2,5346
3,2008 А, 0,2241 в, —2,0242
19,7302 Ла —0,04342 в. —0.07055
Вь 0 07264
152
ТАБЛИЦА 5.17. Радиусы вращения и коэффициенты
ассоциации [64 [
Радиус в->Д'Ч-С
ПиЯ, А щ-ч. А
Метан 1,1234 0,0000 «•Тетрядекан 7,3578 0,0000
1,8314 0,0000 я-Пентадека t 7,8387 0,0000
Пропан 2,4255 0,0000 н-Гексалекан 8,3180 0,0000
я-Ъутан 2,8885 0,0000 Циклогексан 3,2605 -0.9985
2-Метилпроиан 2,8962 —0,6884 Метилиик.тО1ек<ап 3,7467 —1,8288
н-Пентан 3,3850 0,0000 1.1-ДиМСТИ.Т 1ИК- 4,0925 -2,8029
2-Мет илбутан 3.3130 0,7643 !логексан
2,2-Димет ил пропан 3,1530 —1.1136 цис-1, 2-Лимегил- 4,0612 —2,6532
н-Гексан 3,8120 0,0000 1 циклогексан
2-Метил пентан 3,8090 —0,8930 транс-1 2-Диме- 4,1814 —2,9308
1 илниклогексап
3-Мет илпептап 3,6797 -0,6343 (<ис-1,3-Дим етил- 4,0549 -2.5495
2,2-ДиметилбутаМ 3,4846 -1,1611 циклогексан
2 З-Диметилбутаи 3,5209 -0,8695 транс-} ,3-Ди.мети.т- 4,1462 -2,9371
«-Гептан 4 2665 0,0000 циклогексан
2-Мет>|Л гексан 4 2779 0,8844
цис-1,4-Дим ст и- 4 [446 - -2 9658
З-Мстилгексан 4,1454 —0,6597 циклогексан
2.2-Диметилпепган 4,0001 -1,2464 транс-1 4,-Диме- 4,1670 —2 8887
2,3-Диметилпеьтан 3,9210 -0,7324 тил ни к.чогексан
2,4-Дим ет илпситач 3,9634 —0,6858 Этен 1.5382 0,9391
3 3-Дим етилпептан 3 7952 — 1,1610 Пропен 2 2283 0,3590
1 -Бутен 2,7458 -0,0103
2,2,3-Тримет|1Лбу- 3,6960 —1,3293
ran цис-2-Бутеп 2,7765 0,20)4
«-Октан 4,6804 0,0000 гпра«<.-2-Бутен 2,7123 0,7144
2-Мети,тгептан 4.7401 _0 9121 2-Мет илпропеи 2.8281 -0,1428
3-Мет илгелтам 4,5932 -0,6792 1-11ентеи 3,1956 1,1055
•I-Метил гептан 4,5581 —0,5431 /{иб-2-Нентен 3,2763 —0,2598
2,2-Димстилгексан 4 4956 -1,3428 <праяс-2-Г1сцтси 3,2826 -0,3495
2,3-Димет11.1гсксам 4,4084 -0,8089 2-Мстил-1-бутен 3,2239 0,2859
2.4-Лимет11Лгексаи 4 3463 -0,7135 2-.Мстил-2-бУтен 3,2301 1,0668
2.5-Дим етплгексан 4,5932 -1,1169 1-Гексен 3,6472 —0,2243
3,3-Диметилгексан 4,3197 -1,2865 шранг-2-ГексеН 3,6964 — 1.2781
3,4-Димет ил гексан 4,4000 —1,0135 1-Гептен 4,0971 0,6549
22,3-Триметилпен- 4,1618 —I 4562 1-Октен 4,5342 —0,0195
13н 1 -Нонен 4,9687 —0 0299
2,2,4-Триметилпен- 4,1714 — 1,3313 1-Децен 5,4017 0,6240
тан 1-Ундецсн 5 8389 0 0256
2,3,3-Триметил- 4 0859 — 1 4284
пертан 1-Додецея 6 2966 - 0,2172
2,3,4-Триметилпец- 4 2052 —1 0783 1-Тридецеи 6,7514 —0,2574
та и 1-Тетрадецен 7,2244 —0,2025
1-Ленталенеи 7,6969 -0,4251
я-Ноиан 5,1263 0,0000 ЬГексадецен 8,1872 -0,7231
2.2,3,3-Тетраметил- 4,1556 —1,8930
1ентан 1,2-Бутадисп 2,7497 1,4910
« Декан 5,5390 0,0000 2.3-Пентгдиеп 3,0552 0.5219
н Ундекан 5 9867 0.0000 Этин (ацетилен) 1.10945 4,8845
г-Додекая 6 4321 0,0000 Пропин 1,8864 3,2221
ЬБутин 2,7130 -2,2156
153
Продолжение
Радиус Р, Л .* > ...
Соединен не враще- С оедпнен не враще
пия, А пия, Д
Бензол 3,0037 -0,2179 :Дифтордих.торме 3,0259 -1,1524
Метилбензол 3,4431 0,(628 тан
Этилбензол 3,8211 —0,2047 Трнфторхлормстан 2,8099 0,8004
1,2-Дим е 1 ил бензол 3,7889 —0,0213 Фтортрихлорметан 3,3037 -2,3227
1,3-Днметилбепзол 3.8966 0.1918 |,2-Дифтор-1,1.2,2- те-грах.'юрэтан 3,9935 — 1,2653
1,4-Дяметилбеиэол Изопропитбензол 3,7962 0,3475 1,1,2-Трифтор- 3,8158 -1,0572
4,(870 —0,6791 1.2,2-трих-орэтан
1-Мет и.т-2-эт ил- 4,1296 -1,2412
бензол 1,1,2,2 Тетэафтор- 3,6751 1,3001
1-Метил-З-этил- 4 2845 -0,9775 1,2-дихлорэтаи
бензол 4 1662 Хлорпентафтор- 3,4819 -0,0921
]-Метил-4-этял- 0.6550 этан
бензол Хлортрифторэтен 3 3448 —0,4045
1,2,3-Триметил- Хлорметан 1,4500 2 7997
4,0996 0,7296 Дихлорметан 2,3423 1,4060
1,2,4-Тримегил- бензол 4,1678 0,8416 Трихлормегая 3,1779 0,4105
Тетрахлорметан 3,4581 -2,0378
1,3,5-Тримет ил- 4,3408 0,9603 Хлорэтан 2,2812 1,3946
бензол 1,1-ДчхлорЭтан 2,9945 0,48(7
1-МетиЛ-З-изопро- пилбензол 4,5790 —3,0710 1,2-Днх.торэтан 2,8510 1,9778
1-Метил-4-изопро- 4.5231 -0,3729 1,1,1-Трихдорэтан 3,3566 2,4867
пилбензол Хлор этен цис 1,2-Дихлор- 2 1220 3,0132 0,4357 — 1,1799
1,2,3,4'Тетраме- тилбеязол 4,3779 7,1270 эгер
4,4920 3,8842 транс-1,2-Дихлор • этен Трихлорэтен 3,0132 -0,2465
1,2,3,5-Тетраметил- бензол
3,7592 -1,6978
1,2,4,5-Тетраме- тилбензол 4 4542 1,8030
Хлорбензол 3,5684 0 8499
Фторметан 1,4186 4,2800 Бромметан 1,1796 1,9341
Трифторметан 2,3194 2,Н31 Бромэтан 1,9877 3,2628
Бромбензол 3,47(4 0,5914
Тетрафторметан 2.6350 -0,0475 Подметан 1,0458 2,7737
Фгорэтан 2,1758 2,3345
1,1-ДифторэТан 2,4976 2,6225 Иодбензол 3,2688 0.0752
1, |, 1 -Трифторэтан 2,6718 1,8538 Диметиловый эфир 2,1274 2,0857
1|ерфторэтан 3,3797 0,2252 Метил этиловый 2,6409 1.7172
Перфтор-я-бутан Пер фтор -я-гекса н 4,4430 0,1000 Диэтиловый эфир 3,1395 1,3295
5,5208 0,4932 ЭтИЛпрОЛИ.ТОВЫЙ 3,5468 1,2872
Перфтор-я-гепуан Псрфторциклогск- 6 0216 4,6834 2,2991 2 2770 эфир
тан Диизопропнлочый 3,6805 1,2304
. 1ерфторметилцик- 4 894| 2,1612 эфир
логексан Винил этиловый 2,9902 1,3107
Перфтор этен 3,1498 -0,5233 Эфир Окись этилена 1,9005 2 7162
Фторбензол 3,3454 -0,3441 1,2-Дим етилокси- 3,3998 3,1514
Перфторбензол 4,6577 0,0623 этан
Фтордцхлорметан 2,8801 0,0378 Метанол 1,5300 14,2961
Дифторхлорметан 2,5893 0,7926
154
Продолжение
Радиус Радиус
Д Соединение пня, А
Эгвнол 2,2495 14,7937 Метил этнлехльфид 2,8091 2,5851
I-Пропанол 2,7359 13,1172 Диэтилсульфид 3,2067 1,3356
2-Проианол 2,7264 14,7128 Метил п реп H.ncv.n ь- 3,3174 -0,6659
2-Мстнл-|-пропа- 3,(816 10,6592 фи гт
НОЛ Метилизопропил- 3,2385 0,2(68
2-Мечи;1-2-пэспа- 3,0190 12,1625 сульфид
НпЛ Этилб\тилсу,|Ьфид 4,0643 —0.6389
| Ьстанол 2-Бутапол 1 [.иклогексанол Фенол 3,2250 3.1507 3,4341 3,5496 [0,5692 10,4651 7 8767 4,383| Метантиол Этантиол 2-Метил-2-пропап- 1.6114 2,3408 3,1096 2,3417 1,7729 0,8852
о-Крезол 3,7164 3,7663 |-Пептатиол 3,7911 0,1439
«-Крезол 3,8349 4,1207 Цианистый водород 0,6496 11,5466
и-Крезол 3,7360 5.9420
Формальдегид 1,2124 6,25 (8 Ацетонитрил !,82|3 6,1861
Ацетон 2,7404 3,1677 Пропионитрил 2,3618 4,6585
Пентафторхлор- 4,0101 0,1284 Бутиронитрил 3 2094 3,5995
ацетон Беизонитр Ил Монометиламин 3,7432 1,6623 1,5804 5,8615
Нерфторацетон 3,8076 1,6516
Метилэтилкетон Метил -н-прспил- 3,1395 3,6265 2,4878 1,5783 Дыме? ял амин Триметиламин 2,2644 2,7356 4,3322 0,2762
Мети изопропил ке- 3,4148 0,2187 Этиламян Диэтил амин 2,3085 3,1606 3,9599 I 8686
Диэтил кетон 3,48(7 2,3917 Пропил амин 2,7889 3.0940
Метил изобутил ке- 3,5722 3,0128 Анилин 3,3926 3,3293
тон Нитрометан 2,3063 5,0823
Хксуспая кислота 2,5950 7,2091 Водород 0,3708 —3,0010
Пропионовая кис- 3,0500 8,8116 Азот 0,5471 2,8266
лота Кислород 0,6037 2,1474
Масляная кислота 3,5505 11,9043
Изомасляная кис- 3.3418 |0,70|5 Фтор 0,7140 3,0189
Хлор Вода Двуокись хлора Закись азота 0.9873 2,3329
5цетангидрид Мстилформиат Этилфоомиат 3,5727 2.3604 2,8697 20,6471 2,8389 2.0680 0,6150 1,7115 0,5302 9,4339 5,3350 18,956|
11ропилформиат 3,4192 1.4367
Изоб} тил формиат 3,5561 3,2871 Окись азота 1,1907 3,9052
Двуокись азота 1.4286 23,7186
Четилацетаг 2,86(6 3,2788 2,9482 Окись углерода 0.5582 3,1931
Э-илацетат 3,3479 Двуокись углерода 0,99(8 7,3589
11ропилацстат 3,7785 2,4937 Двуокись серы 1,6739 4.8707
Чстилпропионаг 3,3035 2.8068
нтилпроиисшат 3,7124 2,7627 Трехокись серы 2,2027 9,9043
Метилбутираг Четилизобутират Этилизобутират Днметилоксалат 3.7720 3,6271 4.0484 3 8714 2,0266 2,0875 2,7152 7,2279 Сероводород Сероуглерод Фтористый водород Хлористый водород 0,6384 1,4241 0.2005 0,2989 3,8(49 1,7156 11,8167 5 4689
Димстплсульфид 2,3719 1,1055
J 5 3
Продолжение
С 'ед' jjejj не
Радиус I
вгаще- I
•••• ь I
Ьромисть,й ВОДОрОД
Йодистый водород
Трехфтористый
хлор
Аммиак
Трехфтористын бор
ДвуфториСтый ки-
слород
Трех фтористый
Трехфтористый
фосфор
Хлористый нитро-
Треххлористый бор
0.1568 1.8699
0.141? 4,0720
2,3066 4,4848
6,922)
2.3559 7,2179
1.8057 —0,3173
2,2624 —0,1056
2,3574 1,5503
1,8458 4,8125
3,2794 —2,4[23 ।
Трехбромистый бор
Хлористый карбо-
Сер чистыл карбо-
Циан
Гидразин
Гелий
Криптон
Ксенон
3,6718 —0,8700
2,8269 —0,1005
1,1760 2,2985
1,1232 6 3992
1,5119 6,6724
0,8077 -13,5387
0,8687 —0,0228
1,0760 0,1792
1,1376 0,0435
1,2956 —0,2990
Решение. Из приложения А имеем: Т, = 435.6 К; и = 0,202; CPVAP
А-0.105; CPVAP В = 7,054-[О'2; CPVAP С = -2,431 • |0'5; CPVAP D —
= _О.147-10-8. При 349,8 К
С° =0.105 + (7 054 IO*2) (349,8)+ (-2,431 10'») X
X (349.8)2 +(_0,|47. IO'?) (349,8)8 = 21,80 кал (моль-К)
Приведенная температура равна 349,8/435,6= 0,803.
Метод Роушнсона—Бонди 1урзвненце (5 8.2)];
CPL= (1,98) (6,29) + 21,80= 34,3 кал/(моль-К)
Так как экспериментальное значение равно 36,5 кал/(моль-К) [78], то
Погрешность = 100 ~ — 6.0%
Метод Штернлинга—Брауна [уравнение (5.8.3)]:
—М0,3-| (2.2) (0,202)] 'з,67 + (11.64) (I -0.803)' [•
Ср, - (1,98) (6,52) -I- 21.80 34,7 к.1л/(чоль Ki
1 |oiрешцость = joo _ _ 4,90/
156
Пример 5.13. Вычислить теплоемкость жидкого этилмсркаитана при 42 °C
(315,2 К), используя метод Яна—Стила. Экспериментальное значение равно
28,7 ка.т/(моль-К) [56].
Решение. Из приложения Л имеем. Т( = 499 К: о> — 0,190; CPVAP
Л= 3,564; CPVAP В = 5,615-IO'2; CPVAP С - —3,239 Ю'-; CPVAP D =
~ 7,552-Ю'9. При 315,2 К
Сс —3,564 ((5,615 10’-) (315.2) | (-3,239 10') (315 2)2 +
+ (7 562 10'е) (315,2)3 - 18.28 кал (М(Мь К)
Поскольку этилмеркапт?!, является слабо полярной жидкостью, используем
уравнение (5.8 5). По табл. 25 А'=- 0,004. Приведенная температура Тг =
— 315,2''499— 0,632. Из тайл 5 15, применив линейную интерполяцию, нахо-
дим. (ACO)(0'” = 5,47; (ДСп)(1/,) = 30,3; (ЛСс)1-''1 - -|27, (ДС0)(ад 309;
(ДС0)(,;,) =—27,3; (ДС0)(5'',) = 26,1 Тогда по уравнению (5 8.5)
С<т; — Ср 5,47 (0.190) (30,3) - (0,004) (- 127) -)• (0.0CI4)2 (309) +
-4- (0. |90)2 (—27,3) + (0,004) (0. ПО) (26.1) = 9,75 кал (моль К)
CaL = 9,75 -Н 18,28 =28 калДмоль К)
По| решн<)Сть = ——gg-y—- 1°0----------2,3 %
Пример 5.14. Повторить пример 5 13, используя метод Ломана—Дсниера.
Решение. Из табл, 5.17 Для этилмеркапгапа (этантиола) К = 2,3408 А
и к= 1,7729. Взяв значения Т, и Ср из примера 5 13 и использовав уравне-
ние (5.8.7) и табл 5.16, можно получить
Cs —Ср = 10,1273+ [- (5,3546 + (3,2008) (2 3408)] (0,632) +
+ [ [9.7302-1- (—0.8949) (2,3408)] (0.632)’ + (— 0,01489) (2,3408)2,'(0,632)2 +
- (0,2241) (2,3408)/(0,632)а + (- 0.04342)/(0.632)’ + (1,7729) [0,31446 +
+ (2,5346) (0,632)2 + (-2,0242) (0,632)’] + (1,7729)2 [- 0 07055 - (0,07264) X
X (0,632)2J = 10,24 кал, (моль К)
Cs = 10,24 + 18,28 = 28,52 кол,/(мо.->ь • К)
Погрешность — 28"'^ ? [СЮ — — 0,6.%
Заметим, что при такой низкой'температуре
Термодинамический цикл Bai сора. Ватсон [95 [ цредно южт;л, что теплоемкость
>чожет быть определена путем вычисления изменений энтальпии в термодинамиче-
ском цикле следующим образом: I) насыщенная жидкость при температуре Т\
нагревается до Та, причем поддерживаются условия насыщения; 2) жидкость при
7'г исиарЯе-гся и изотермически расширяется при низком даптечии. до достиже-
ния состояния идеального газа; 3) будучи в |1Делльш>г;’.<овом состоянии, вещество
охлаждается от температуры Та до Т;, 4) вещество изотермически сжимается при
температуре Tt до состояния насыщенного пара ц конденсируется, Для этого
цик,уа сумма энтальпии всех стадий равна нулю Ec.'iH Га граблнж.|ть к Т(, то
RT, '
представляют собой идеалыюгазовне эцтз |ЬПц|О и теп тоемкость,
Ь11Ия иаемщеннедо пара ц — те идоемкоегь (исыщеиной жид-
кости (dHvJdT).
157
Вычисление КзжДьгО члена правой части уравнения (5 8.1 ]) рассматривается
отдельно.
Производная (d!dTr) [(/Л — #<>•/)’'Я7>| отражает изменение с приведенной
температурой отклонения приведенной энтальпии вдоль кривой насыщенного
пара Для получения (//'— Hsv)!RTc можно применить любое уравнение рас-
чета отклонения энтальпии, представленное ранее в этой главе, а затем для вы-
числения производной можно использовать численное или аналитическое диффе-
ренцирование.
Кроме того, отклонение энтальпии Можно выразить в терминах приведенной
температуры и давления
dp,
(5.8.12)
Эти две частные производные были представлены в графической форме при
использовании двухпараметрической [95] и трехпараметрической формы (с Zb)
[68 f принципа соответственных состояний. Позднее Чью и Свенсон f 11 ] выдви-
нули предположение о тоу, что если использовать уравнения из табл. 5,8 примени-
тельно к насыщенному пару, то можно получить производную в аналитической
форме. В этом случае
(5.8-13)
Константы D, E, F и G для различных значений Zc даны в табл- 5.8, Вели-
чина Рг— приведенное давление пара при интересующем нас значении Тг-
Для чистых веществ Рг является функцией Тг
По уравнению (5 8.13) имеем;
(5 8.14)
где
Чтобы воспользоваться уравнением (5-8.15), следует найти Zc для чистого
компонента (или смеси) и определить по табл_ 5.8 значения констант D, Е, F и G-
Величины Рг и (d 1ц Р,) dTr находятся по какой-либо корреляции для давления
паров (см. гл. 6), применимой к рассматриваемой жидкости.
Определение констант D, Е. F и G путем интерполяции в тех случаях, когда
значения Zc лежат в промежутках между имеющимися в табл. 5.8, является не-
простым делом, поскольку табличные значения функции Zr не укладываются на
простые кривые. Поэтому рекомендуется вычислять значение (didT r) f(//° —
— Hsv)IR‘c 1 ПРИ ДОУ* значениях Z,, находящихся по обе стороны от искомого
Z(. и затем посредством линейной интерполяции находить производную.
Значения (didT,.) f(//° — Msv)/RTi [ положительны и увеличиваются с тем-
пературой. При низких давлегинх, когда поведение газовой фазы приближается
к идеальногазовому, эта производная весьма мала и ею можно практически пре-
небречь,
Другой член уравнения (5 8.11) {d:dT,} (\HviRT,} отрицателен и обычно
более важен. Его трудно вычислить с высокой точностью. Один из самых простых
путей расчета этой производной — предположить, что теплота парообразования
меняется с температурой согласно уравнению Ватсона (6.1b I).
(5.8.16)
158
где — теплота парообразования при некоторой опорной температуре Ti.
Показатель степени п является функцией свойств вещества и, возможно, темпе-
ратуры. Однако часто ето считают константой, равной (1,38. С этим значением
(5 8 17)
Уравнение (5.8.16) дает трнемлемые значения (d dT7) RT:) пр» высо-
ких приведенных температурах, но Для условий ниже нормаль ной точки кипения
оно может быть неудовлетворительным. Чью и Дил 112 [, рассмотрев эту проблему,
считают, что по сравнению с уравнением (5,8. ]6) более удовлетвори ге-тьной фор-
мой Для выражения является
Чью и Дил получили п из корреляции Фпшгийпа (26], а Л и В _ цо экспе-
риментальным данным Д//е и CDL при низких температурах. (Часто В имеет
значение около 39 кал/г.)
В какой-то мерс подобный подход к определению Д//ь как функции темпе-
ратуры разработали Чыо и Свенсоч [111- Уравнение (5.8.16) модифицируется
до вида
AW
(5 8.20)
где 0 _ параметр, который Должен определяться ио экспериментальным данным,
Тогда при опорной температуре 7rt
dTr 7ri ~ RTt
Опорное состояние выбирается при той температуре, для которой известны
данные по теплоемкости жидкости (экспериментальные или определенные по ка-
кому-либо методу групповых составляющих. упомяиному ранее в этом разделе).
Тогда, имея значение Со при Tt и С° при Т^, уравнение (5.8.11) можно записать
RTC
Второй член правой части уравнения (5.8.21) вычисляется при Тг1, как они-
еаио ранее в данном раздале. Величина Д//^ обычно неизвестна, но &Нг.ь Не'
трудно рассчитать по методам, рассмотренным в разделе 6. |5, или найти в прило"
жении А. Таким образом, уравнение (5.8.19) используется для расчета АЯ01
по данному значению hllof,- Уравнение (5.8.21) может быть тогда решено относи-
тельно параметра 0методом последовательных приближений, Когда 0 известно, то
Г 0,38 / 1 - 7, )[ ГД//т. ..
dTr {btJ ~ Ll -Tr 1 Ц 1 " 1 - Т J] | RTC Х
Уравнение (5.8.22) сводится к уравнению (5 8.17), если 0=0. Заметим, что
0 зависит от выбора Тг . Использование данных по низкотемпературной теплоем-
кости жидкости значительно увеличиваетточюсть расчета по методу Ватсона [11].
Метод иллюстрируется примером 5.15.
159
Пример 5.15. Hbi'ii'c.Tiri, - c । моем но.r>, .ьцдкогэ n-ксилола на линии насыще-
ния; СОд — dllл, :dT np;t 300 JC. Коррупции и Гиг цинге 115] приводят значение
Со-, равное 70,2 кал.'(мо,ть-К).
Р е in е и и е. В качестве опорной выбрана температура 20 °C- Значение СЯ£
определяемся по табл. 5.12
Со, (2О’’С) - 4 (-CII)
2(J;_)x2t Ql3) - М) (5,3) -г (2) (2 <*) г
~ (2) (8 Si ^41.6 кил (моть ;\)
Из приложения \ имеем: Л1 = 100,168, 7' -- 411,5 К, Г, = 616.2 К, Рс =
— 34,7 атм; 7- — 0,260; CPVAP А = —5,993, CPVAP В - 1,443-10’', CPVAP
С — —8,058-Ю'’; СР','АР D — 1,629-10’8; SHVh = 8600 мл/модь.
1 Вычислим С° црн ДО С (293 К) ц 300 СС (573 К};
С°.19Я = - 5,90 3 + (1.443-10’1) (29,3) 8,058-Ю'") (2932) +
-- ( .629 КГ’4) (2'i3J) =2,98 калДмоль К)
(Аналогично
CZ'5.5 —53,,3 кал/(мо-ть К)
2. Определим (d In P',;dT. t, P, при 20 и 300 "С При 20 °C может быть ис-
пользовало ур.'.г.цгние Хптуыii.i для давления паров (6 3-1) с константами из при-
ложения Д’
Р = 6.0 мм р;. <.т.;
d In Р, liT:
'dTr ’ - (?' — С)2
"'-(ЯШЖ 2-46,<,-‘
(3346,(,5) (616,2) _
(293 - 57,84,2
При 300 СС для расчета Р н (d hi Pr}'dTr может быть использовано любое из
рассмотренных в ,л. 6 уравнений, применимое в широком интервале давления
паров. Воспользуемся уравнением Глрлахсра (6.6 I), константы которого даются
в приложении А-
- ИГ'"’*1 5-5«> 1»5Я |-6,|9~
•Г-14.820 ,,, рт
Дифференцируя уравнение (6.0.1), можно получить
d 1ц Рг т - В Г? С T-2DP Т3
dTr ~ с I — DPT2
Подставляя константы Гярлахера, имеем:
-ITT ~а
3. Определим 1|> по уравнению (5.8.15). По п- 2 Этого примера при 20°C Рг =
- 2,46-10’1. Испсльзуя кснстаигы из табл, 5 8, можно получить
гс = 0,25) (5,03
гс = 0,27) =8,57
ф(Р, — 2,46-10
ф(Рг — 2,46-10’’;
160
1.1 kii'i оорлтом
i)(Pr- 2.46 10 1 Zc—02b)- II.t<
УИЛЛОГИЧНО
|ЦР, 0.562 Z 0,26) -2,27
4 Вычистим no })>,iR|ieiinW (5 K.I4)
- <2 !f> KTi)()| Ю(3-,3)-0 )0S ери 20‘C
-- (0.562) (2,27) (8.27) )0 6 ирп 300’C
5. Bhi'iiK Лим p iio vpannecHio (5.8 21) Знг1ЧСыИЯ 7\ - 20 C. 293 К. ц ТГ| —
О 4*5. Тогда
^nv24i О ЗВ Ihl -0.475) 44.6 - 2м 8 ,,,,
() 987) ,616 2) 1-0-175 - 1.087
Одн.)ко значения неизвестно. Испольття значение -
8600 кы моль upii Т„ 4Ц .5К (’/'(, — 0,668), по правитищо (5 8 10) получаем
«гпо \н I 1 ~ °-668 V
8600 — АНг,г(|1 (^ । _0 4-Г)-)
Тогда величина Р может быть найдена но Двум последним сравнениям мето-
(KieiicaoBaтелы-.ых н)|Иб.тижсН||й JJpn лом пол'чается, что f) — 0,16 и
“'’D'i ~ 4(Ю каш'моль
и Про 300 С(/'г~ 0,930) но уравнению (5 8.22)
1 _ 1138 . р ,й ( । ~ О.ц3 51 Г Ю490
)7r’ RT, , 1—093 ' ,IOV Н *" Г— 0.475; J I. (1.9871(6)6,2) Х
, | _0,Q3 учи , и 1 ь <1-о.гмг
^1 — 0.4/5) J
(у 73,9 кал'(м1>-)Ь К)
73 q _ то о
По, (xuihocti, - -д 2 - 100 - 5 3",
Обсуждение и рекомендации. В ном разделе ошк-шп пять методик расчета
г< и loeMKTjcni жи лК()<_т<_|| каы функции leMiicparvp ,ь Все он а требуют знания С'
Простые соотношения Роулинсона—Бонди и Штернлнига—Брауна, основан-
||ЫС на использовании принципи 0>отвегС1ве||цы\ состоянии )уравненис (5,8.2)
। (3.8.3)I, требуют в качестве исзодныч данных в дополнение к С° только крити-
ческую температуру и фркгор анектрич.юсти. Их точность удивительно вьсока,
таток проверки точности srn\ корреляций) Несмотря на к, что для полярных
соединений ,ри низких тсмрературих эти кдрреляпин не дают удовлетворительных
ргзультатон, погрешность в общем случае не превышает б—10 %.
^етод Яна—Стплд [уравнения (а 8 4) и (5.8.5)! также требс/ст знания ‘Г,,
') и, е< л и жидкости полярная, фактора полярности Стила. Ян н Стил сообщают.
6 |’1|Д н и др
ТАБЛИЦА 5.18. Сравнение расчетных и экспериментальных значений теплоемкости жидкостей
Ъ| ЩССТЬС Экслеримен - Значение 1) нал/(»иЛ1 К л HTcp.iT гра Погрешность расчета Чло методу
Роумнцсона и Бонди Сравнение Штерн л ни j а и Брауна [ураинен не (5.S 3)] Яна II Стилл {уравнения (5.Ь 4> и (Б 8 Ч 1 Лимана н Денпера (ура внен ис (3.8.7)] UBCHCO1I л
Метан 102,3 13,1 [99] 16 5,6 2,8 1,1
140,5 14,3 16 0,5 1,0 - 2,2
180,9 22,2 17 —8,3 —2,2 -2,3
Пропан 100 20,3 [47] 11 18 -24
150 21,0 7,8 7,8 6,7 11
200 22,3 6,8 3,8 *Ч 3 т
305,3 27,5 [72] 9,8 9,0 6,7 9,2
344,7 35,9 4,6 6,9 —0,9 0,1 12,3
н-Пентан 150 33,8 [571 —5,2 —2,5 4,9 —23
200 34,5 । 4 -0,9 | 7 3,7 11
250 36,7 0,1 -0,2 0,7 0,3 —3.9
300 40,1 1,2 0,8 1 я 0,1 —0,3 — 0,2
363 46,2 12] 2,7 —0,2 0,2 —0,5
443 65,3 — 7,1 — 8,2 — 10 —8,6
н-Гетан 200 48,1 [19, 57] — 7 1 — 5,6 2,4 - 8,7
300 53,9 —0,7 0 0,6 -0,1 2,8
400 64,6 [19] —0,3 2,4 0,1 0,1 2,3
503 85,0 [21 —4,5 -4,0 4,9 - 4,6
н-Декап 250 71,1 77,8 [57] —6,2 —4,9 0,1 0,4
320 — 2,1 -0,8 1,0 —0,3
Циклогексан 303,3 37,4 43,0 [4] —0,5 — 1,4 1 1 —3,0 4,1
360,9 0,6 0,1 —0,9 -3,2 4,6
I
цис-З-Бутеч 210,9 305,3 349,8 26,6 31,4 36,5 1781 8,9 8,3 3,6 7,8 4,9 9,2 5,8 1,0 —6,1 — 7,7 I -30 1 “1J
Изопоопилбензол 305,3 50,7 1781 — 1 ,2 —0,7 1,7 2,3 9,8
331,1 53,9 1 4 —0,9 0,3 0,4 8,2
366,4 58,1 — 2,4 — 1,8 — 1,8 — 1,6 5,9
Этиловый Спирт 208 21,8 [451 69 74 -4,7 -32
294 26,3 38 46 8,9 8,4 —7,7
383 38,0 [25] 1,8 15 7,8 4,3 1 —7.7
Ацетон 180 28,0 [46] 2,3 5,0 —0,4 — 8,9
209 28,2 2,0 3,4 -0,1 ' -4,5
297 29,8 2,8 3,6 — 5 0 0„3 2,6
Окись этилена 170 19,7 [30| 8,1 1 [ —2,0 6,7
230 '9,7 6,6 4,9 4,5 1.6 [ ]
280 20,7 4,3 2,1 0 —0,1 8,9
Диэтнловый эфир 186 36,3 163] — 8,5 —7,5 4 X
214 37,6 -8,6 —8,3 —3,6 —7,1 —5,1
290 40,8 —5,5 -5,0 —5,1 -6,5 1 —0,9
Хлорэтан 150 23,0 [331 — 6,8 Ч 9 — 5,8 1 1.0
200 22,9 —8,4 -8,7 0,9 I 3,5
250 23,6 ] ] — 13 — 7,7 — 1,8 1 1,7
290 24,7 — 11 -13 — 11 —1.7 1 -0,6
Эгилмеркаитан 154 27,0 [561 -7,0 —3,4 — 1,5 1 —32
208 26,7 — 3,8 — 3,7 —2,7 --2,3 | -19
275 27,6 — 0,9 — 2,7 -2,3 — 2,1 , —7,7
315 28,7 0,9 — 0,6 —2.3 -0,6 1 ~2'2
X пор 200 15,9 1311 2,2 —2,6 —8,2 —7,7
240 15,7 4,9 -2,7 1,1 —5,2 1
’) КО'Да име,'п,сь значения С„ ти Сь, и они пересчитывались в 6^ Аналогичао, если метод расчет-1 е давал ti 1ЧСН не HCjiocne
ствеино . то вычисленное значение также пересчитывалось в <7, *
‘41 Погрешность [(вычисленное значение — экс1ернмепталнпие зя.>чение)/в снеримептальное значение! 100 %
( t,.. , 5 10! Mini и. ч- у union .Лед В гао.т. 3 iО ЗатрУДНП"
ю.тьпо представить в аналитической форме, и при проведении авторами проверок
исполь-юпалась процедура определения аначекий составляющих ДСр посредством
пятточечной полиномиальной нптерпо.1 ящ,и Метод неприменим для диапазона
приведенных температур, меньших (),4 или больших приблизительно (J.95.
Метод Лимана и Феннера, основанный на использовании причинна соответ-
методу па ЭВЧ ,
результаты. .'1тя расчетов следует зцать критические температур' V Давление,
|СПлоемкос1ь жидкости и теплоту парообразования, а также корреляцию давления
ЖИДКОСТИ всегда аахотнлась по методу групповы' । истав.тяющих Чью — Свенсона
при 20 'С (табл 5.12), а теплота парообразования — из приложения А Срзвне-
температурах (менее 20 -'С). Проверочные расчеты по этому методу, проведенные
водородов Л %).
Трудно оперить :очпос,ь корреляции для расчета теплоемкое,И жидкости.
Экспериментальные данные разбросаны в широком гемперагурном интервале, и
данные разных исследователей часто не < огласую.ся между собой
В результате изучения этих методов рекомендуется в любом температурном
интервале применять методы нз—Стила или Лимана -Денвера. В этом случае
погрешность должна быть менее 5''о, за исключением иб.щсти очень высоких
приведенных температур Описанные выше методы были развиты для 'Н1с_ы,х
мольная теплоемкость смеси равна сумме мольных составляющих чистых комно-
то.1ько Для углеводородов и обычно точны.
5.9. ПЛРОФАЗНАЯ ФУГИТИВНОСТЬ КОМПОНЕНТА СМЕСИ
Ид термодинамики и,вестпо. что химический потенциал или фути|ивпс,сть
можно связать с энергией Гиббсе и,щ I стлцольпа Использование последнего
1н>те,н,нала приводит к уравнению
объем системы и количества компонентов в молях ща исключением /-го! являются
ностояипымп. Следователэно функцию энергии Гельмгольц,, можно употребить
рсречцированием. Поскольку представленная таким образом функция выра-
жается как разиос,ь удельных энергий Гсльмпщьиа между реальным состоянием
и вь1б(>аЩ|Ы.\1 опорным состоянием, перед дифференцированием нужно умножить
исходное выражс-иие на Л' — общее количество молей Тогда
(5 9 2)
По рчзцост! химических потенциалов связана с фугитивностью coot ,omr щкм
ji, — pi =- RT h< (> ч 3)
Ф\ГШИВИОСИ. ОТНОСИТСЯ Г, 1-.J1 компоненте C-'leCll. 0 — К Опорном V co-
расчет
П 9 4)
” A
ID 5)
По ypaiMieiwtM (5 У 51 upOXi при V =-ZA’PT P \'J — \!-‘T:P" имеем’.
/^I.iI -£L]<iV-RT^Z (3 9 7)
P„ J IA 11 1ЛЛ',[<] V J -
= £Tln®r (5 9.8)
где Ф; — коэффициент фугитивнеют 1-т>> компонента в газовой смеси.
Чтобы получить пригодное соотношение Для расчета Ф,. c/ieijer проин icrpii-
1'<>тмть уравнение (5.9.7), по до этого нужно вычислить производную от Р по Х,.
1 акпм образом, подходит любое уравнение состоянии. явное относительно да гиме-
ния, благодаря тому, чт в Этом случае зависимость состава от всех параметров
может быт)' выражена в аналитической форме.
Для аналитических уравнений состояния, приведенных в и. 3. правила сме-
шения даны в тл 4 следовательно, можно вычислил, интеграл, входящий в урав-
нение (5.9.7). Например, оригинальное уравнение Редлиха—Квонга приводится
Судет иметь вид
ЛЯГ
I? габд 5.(9 приведены используемые на практике уравнения расчеи [рФ,.
полученные для всех аналитических травлений состояния
Трудно оценить ДтИ выражения, поскольку сложно определить сами коАфи
инснты ф\ гитивностн. По всей вероятности, сели уравнение состояния является
......Т.‘. . -. .. .......... -I. ...... ..... г,,,-,. ...... Ы... .
ТАБЛИЦА 5 19. Выражения для коэффициентов фугитивности
In Ф,
Уравнение Редлига — Квонга а оригинальном виде
[уравнение (3.5.1), табл. 5.1, раздел 4.3]
—V-______-InZX. “* М„ i У-.
bRT* 1
Соавовская модификация уравнения Редлиха — Квонга
[уравнения (3.5 И) и (3.5.15), табл. 5.[. и 4-1]
1„ф, I)-и , 1» +
x -2 / ।------w------”
“<Г>=Ш mF
где F определено в табл 4.1, a F, определяется уравнением (3.5.15)
Уравнение Барнера — Адлера
Не удобно для использования в явном виде
Уравнение Суги — Лю (табл. 3.5 и 5.1, раздел 4.5)
1 ,т ф, 1П f + O.Qgffye а(р,-«.) VM
р V - ь + с bRTx s V 4
а / cPi г 0,08/?у,в „ \
^-5 (]/-u & + f) V+c
lo
1 I </—!)₽.+ T; ’ 3 * j
a, =J] W6-* - fi: =
166
Продолжение
- w. 5 = '/il'kbk
. у 2,5 j-J,5 \ О, V
ъ.ь = I -I (I - klk)
V T<-k
8 — U l/k^k' 4k = ~r>—
к Рск
d^/. eaj — тангенсы углов наклона t рсфикев ф\ иьиий й* и е* в табл. 3.5 по от-
ношению к со
Уравнение Ли — Эрбара — Эдмистера
(табл. 3.10, 4.4 и 5 1, раздел 4 7)
1,,Ф' - -Ы{Т [(Ч I" 1'44-‘
С;-А
л;=а°‘52
k-i
- 'Г S к,Т11.4'’
*-|
Уравнение Бенедикта — Вебба — Рубина
[уравнение (3.8.г), раздел 4.G, табл j 1 |
in®, .-l»z : ' +
ir |Sr(»H,)''.-(A,)' к- I «(А)'.'ф-Ч
Л »-(^)'" ИГх
L-Чт^-' "-(^1
BttpnctfbHoe iii'mi:ni.h:,e (вк.тюаающсе солы«> вторан вирия тьный Коэффициент В)
(разделы 3 II и 4 8, табл. 5.1)
1п-1> ф£«.я„-1п/
157
предсказывая волюметрические свойства, tio it даст точные aua'ictittn произвол
Как ottiiCaKo вг.| у, пыра,кения Дли раечсы парафанюй ф\ t итивнис си имеюi
Гю.р.шое значение в вычислениях равновесия Пар—жидкость
И.
Глава 6
ДАВЛЕНИЯ ПАРОВ И ТЕПЛОТЫ
ПАР00БРА30ВАНИ Я
ЧИСТЫХ ЖИДКОСТЕЙ
6.1. СОДЕРЖАНИЕ ГЛАВЫ
В этой главе Описываются методы расчета и корреляции давлений паров чистых
жидкостей, а также теплоу парообразования, поскольку их определение основы-
вается на данных давления паров — тенпсратура-
6.2. ТЕОРИЯ И КОРРЕЛЯЦИИ. ОСНОВАННЫЕ НА ИСПОЛЬЗОВАНИИ
ПРИНЦИПА СООТВЕТСТВЕННЫХ СОСТОЯНИЙ
Если пдровая фаза чистой жидкости находиich в рдвнчвесии с жидкой фазой,
то условие равенств! химических потсициплоп, температуры и давления для обеих
фаз приводит к vpiDiCHHio Ki,iv3HVca_K.'iarieftpoiti
<#\р _ \ Hv__ o .
dT ~TbVv '(Ит»;Рур) &z0 1
170
ihifvp
d (IT)
A//p
R \Z„
(6 2 2)
Ьолынинство уравнений ^для расчета
и корреляции давлений паров полу
чаются путем интегрирования уравнения
(6.2.2). После интегрирования' должна
быть выбран.! форма зависимости грунт.!
kiivib7.v от температуры, а константа,
получаемая при интегрировании, опреде-
ляется по одной точке давление паров —
температура.
В самом простом случае предполагается, что группа SI/V/R &ZU имеет по-
стоянное значение, которое не зависит от температуры. Обозначая постоянную
интегрирования буквой А, из уравнения 16.2 2) можно получить
111 PVp — 71
(0.2 3)
где В =ч ДГ^/R Д£о_
Соотношение (6.2.3) иногда называют уравнением Клапейрона. Оно удиви-
тельно хорошо подходит для аппроксимации давления паров в узких интервалах
температуры. Величины АЯг и Д2Ь за исключением области вблизи критической
точки слг|бо зависят от температуры, и, поскольку их значения уменьшаются
с возрастанием температуры, в результате возникает компенсационный эффект.
Однако в широких интервалах температуры уравнение (6.2.3) обычно плохо опи-
сывает данные по давлению г аров. ЭтР видно по рис. 6.1 Ордината представляет
собой отношение |(Ракчи - /цтпУ^эвеп 1 ЮО, а абсцисса — приведенную темпе-
ратуру Тг -Т-Тс- ЗначениеРрас.| получено по уравнению (6.2.3), константы .4 и
В которого определяются по экспериментальным данным при Тг — 0,7 и 1,0.
Если бы уравнение (6 2.3) представляло собой точную корреляцию, то отсутствие
ошибок характеризовалось бы горизонтальной нулевой линией. В области высо-
ких приведенных тем Гератур имеет место достаточно хорошее соответствие между
расчетными и экспериментальными результатами Для кислорода, а также для
типичного углеводорода — 2.2,4-триметИлпентаца и плохое Для ассоциированной
жидкости — н-бутилового спирта. Амброуз [2] указывает на сложность кривых,
Изображенных па рисунке, и Отмечает, что для воспроизведения изменений их кри-
визны, которые очевидны, требуется уравнение давления паров по крайней мере
с че|Ыромя константами. Кроме того, важно отмстить, что изменение кривизны
обычно происходит в диапазоне 7'г от 0,8 до 0,85. Это обстоятельство используется
в нескольких более поздних разработках.
Продолжая рассмотрение уравнения (6.2.3), укажем, что в практике принято
использовать нормальную точку кигекия и критическую топку для получения об-
общенных констант. Выражая давление в физических атмосферах, а температуру
в КСЛ1.В11 нах или градусах Репкина и принимая Р ~~ РЧТ — Г<. а также Р — 1,
/' — Ть, можно преобразовать уравнение (6.2.3)
l,(PvPr =/t (| _ (6.2.4)
(62,5)
Как следует из рис. 6.1, Ли ней пая форма зависимости Pvp от УТ непригодна
Для ассоциированных веществ .Уравнение (6 2.3) обычно Дает завышенные резуль-
таты подавлению паров при icMnep.rrypax ниже Т t, (см. рис. 6.1 или табл. 6.1).
171
^’равнение (6 2 -1) может служить примером двухпараметрпческг.й корреляции
лястся
1<‘жепис I [)пцер<1
Функции Л’ и/ 1 п]|Г>т,)6у-'1цр< ваны в широких ни (Срвн-их приведенной тем
iiepaiy ры [15, 29. ,3и, 68 | п представлены Ли п Кеслером в елмуюшей аи.ллитп
ческой форме |43]-
/ " - 5.927(4------у — -128862 11(7; 0,(693477) (0 2 7)
/' —15 2518— - 13.47Р1 In 7~f 0,435777) (6 2.8)
Значения фак горон анентрпчностн о. Для многих веществ лапы в приложении
А. 1ем не менее, когда ti<пользуется уравнение (6.2.6). то рекомендуемся (и рас-
СЧИГ1.Г|Ц|ТЬ не ” ~ ~...... • ........
(6.2 6) при
,'1и-Ксслсровск<(Я форм;; .сравнения i [итсра обычно розво-
....г.... ...,__пенни давлеции каров с i|OrpeUiH<>ciЫо от 1 до 2 % в дицпа
зоне Между Т/, и Г,. При температурах меньше, чем 7;,, она может давать зани-
женные на несколько процентов значения 7tl,
.lei ко проверит!-", что уравнения (6.2.6)—(6.2 8) удовлетворяют определению
фактора лиен1рнчпости |уран!|енне (2 3.И].
Пример 6.1. Расс-.итатг, давление паров в гидбепюта при 74.1 и 186,8 С.
ценолыуя сравнение (6.2.4) и уравнение Ли--Ксслсра. Соответствующие зкще-
f\ — 35,6 атм
Уравнение (б.2.-1'). Сначала но х равнению (6.2.5) рассчитывается Л при учете,
что ТЬ/ -- 409,3.6)7.1 =~ 0,663
Itt 35,6
С.тсдопагсльпо
1,17^^7 028 (1-7;')
Сравнение Ли — kec.iepa. Г (о уравнению (0.3 1) при 7;, = 0.663 получаем
«и - 0,299. Тог,in по уравнению (6.2.6)
И/\-вг — Г0' (rr) I 0,2997 । (7Г)
Для рассматриваемых случаев
11'lrpetiiinc-)i> расчета <шределятас1. к;,к
6.3. КОРРЕЛЯЦИЯ АНТУАНА ДЛЯ ДАВЛЕНИЯ ПАРОВ
Антуан [7 I предложи I широко 1,сцг>,Г['зуемуЮ простое vio-indjiiK ntuto хрув-
пенря (’6.2 "I.
При С — 0 уравнение (6.3 I) превращается в х равнее ие Клапейроцд (и 2 3)
nix iieiueCTp (Pvp — в мм рг ст .7’ _ в кельвинах). Диапазон,,t прим^нимосп!
Эги коэффициентов по температуре невелики и во многих случаях соответствуют
интервалу давлений приблизительно от 10 др 1500 мм рт . i Сравнение Антуана
Кокс | |9 | предложил графическую корреляции, р ксторзи ординала, соот-
вето (В уюта я l\i-. имеет лог:, рифм и чес кую шкалу На по, ,с координат проводи гея
или какого-либо другого эталонного вещества Поскольку давление паров водьг
хорошо известно как функция темнератл ры то абсцисса градуируется в единицах
1 емпературьт- Давления паров других веществ в таких координатах представ
ляются в виде почти прямых линий. Кэлингхрт и Ьвнс | [4 I показали, 'цо темпе
ратурная ткала на такой диаграмме Кокс;, почти 'жнивцлегтиа функции (Т +
4 С)~1. Iде значение С Ддя многих жидкостей, кипящих г интервале температур
о г 0 До 100 42. пр иблизителImo равно 43 К Таким ибрдзом. диаграмма Кокса
очень напоминает графическое представ.тепис уруьнения Антуана Для Давления
паров. Кроме гщо, заслужите, внимания следующее важное для праК|Икь об-
стоятельство. на диаграмме Кокса прямые .тинци. соответствующие отдельным
членам гомологического ряда, при Экстрйно-.яцви обычно сходятся в одной точке.
Эта точка, называемая бесконечно хваленной, полезна тем. что дает одно значе-
ние давления паров для нового члена гомологического ряда. .Ирайзбах 121 | при-
водит таблицу таких бесконечно сдаленных точек для многих гомологических
рядов.
И < приложения А находим
35 ')3. По уравнению (6.3 11
2<140.46
₽- 16.G5T3—-5=—------_ /
Экспериментальное значение равно 7[.2 мм рт с,. 161
Погрешность _ ' 100 - 0 3 "и
В диапазоне от 10 дц 1500 мм рт ет с равнение Ашу Зна представляет собой
'пличную корреляцию для давления паров При давлениях свыше 1500 мм рт су
6.4. ИНТЕГРИРОВАНИЕ УРАВНЕНИЯ КЛАУЗИУСА _ КЛАПЕЙРОНА
"т.'(ичаЮ(Ся большим разнообразном, поскольку для достижения большей годно-
сти каждый автор обычно вводит свои поправочные коэффициенты.
Из двух членов уравнения <6 2 2) Д//п и \ZV, которые должны ныражагюя
в циде фунKttuii температуры (илц дав щиия), стщча.ча буде, рассмотрен первый-
173
Отмечая значения, отньссщ1'еся к насыпи иному пару, индексом SV, а относящиеся
к насыщенной жидкости — индексом S!-. величину AZr, можно определить кцк
Часто величину Д20 полагают равной елн пине, тцбо аппроксимируют простой
аналитической Функцией, либо рассчитывают по уравнению состояния, которое
предполагается применимым как к насыщенно!! жидкой, т.щ и к насыщенной Паро-
вой фазе (in. 3).
матером 1271 Объемы насыщенных пара и жидкости расечнтывакнея но уравпе
нию состояния (похожему да уравнение Ван-дер Вал.тьса). Обобщая мр.тнекис
е помощью ныраженпн (3 1 I) п (3 4 21, Можно пока «ять, ''то
Ураанение(6.4,2) иредссэлии.ет собад хорошую аппроксимацию пру приведен-
ных температурах, близких к Т,,. пли меньших, олиако при Тг > Т(, иснодьзо
вать его следует е осторожностью.
Для выражения i\Hv в виде функц 1и температоры обычно применяется один
из двух подходов' \HV представляется как линейная функция температуры или
используется корреляция Ватсона [уравнение (6.[6 1) ] Первый метод — только
приближенный и непригоден при высоких температурах. Однако если 'Vp СчЦ-
'|ЗтЬ константой и
\Hy-a ЬТ (6.43)
то, используя уравнение (6 2.2), можно получить
Член этого уравнения, содержащий 1п Т> появляется всльдс1ВИе принятия
линейной зависимости V/c от 7". Непосредственно уравнение (6 4 4| применяется
редко, по общая его форма проявляется в ряде корреляций, которые часто моди-
фицируются добавлением Других членов. Выражение (6.4.4) называют уравне-
нием Реыкитга или уравнением Кирхгофа для давлений паров.
e.S. УРАВНЕНИЕ РИДЕЛЯ ДЛЯ ДАВЛЕНИЯ ПАРОВ
Ридель |771 предложил корреляцию давления паров, (Ч-щЩ/пшую на модифи-
кации уравнении (6 4.4) [641:
/)Г
Член 7° иамеренто включен в корреляцию Для учета того, что значение ,\ZV
не р?вно единице г ри высоких темлерату рах (и \HV i,e является динейной функ-
цией температуры в этой области) Гр.щазателв степени 6 при Т ее играет сущест
венной роли _ мечут использоваться г другие похожие значения fl, 39|бсз<хо-
Метр «.
d In Тт
174
Пуси. «с — коэффициент РидСЛЯ В Критической точке. Предположил, Что
(6 5 !)
,1‘ -ЗУЛ В - _ 36Q; С* -42С2 + -Л,
Г)---------Q Q =0,0838 (3,758 - а 1
(0.5.5)
Зная значения Л. , '!'/ И у, . можно ио уравнениям (6 5.4) п № 5.5) рассчитать
д,|влеипе паров Отлетим, что в уравнении не используется нормальная точка
кипения Однако поскольку'нелегко (Или даже нежелательно) вынис-тЯть « с по-
мощью определяющею его уравнения в критической точке, часто о. находят нт
уравнений (6.5 4) и (6 5 5), ПоДьтлпляя в нцх Р — 1 атм it Т = Tt,. После этого
имеем-
_ 0 3154 а 4 1нРс /( г г.
с ' О,О838>|’,, _ In Tb/ ( "'Г>
% - -35 + , 42 In Tbr -T'kr
(6.6 7)
Пример 6,3. Повторить приме)) 6.1, исполыуя корреляцию Риделя
Решение. В принтере 6.1 для этплбснзола дано Ре ~ 35,6 атм, Ть =
= 409,3 К и Г, — 617,[ К Поэтому Ть. = 409,3/617,1 •- 0,663. По уравнению
(6.5.7)
ф(| _-г _ 35 - , 12 lii 0,G(>3 — (0,663)° = 1,9525
используя ур.тэкеиие (6.5.6)
(0,315) (1,9525) - In 35,6
c (0,0838) (1.9525) - lit 0,663 ’/1РОи
lt.Plfl -10.15Я - 1^49 _ - |3|- ],, । 0,29587’°
При 74,1 n 18G,8T. подучаем
74,1 0,563 99,9 100 —0,1
186,8 0,745 2509 2494 0.6
175
6.6. УРАВНЕНИЕ ФРОСТА КОЛ КУОРФА — ТОДОСА
ДЛЯ ДАВЛЕНИЯ ПАРОВ
Фрс'Сг к Ко,|куорф |25 [ тоже нн~ег;nipt,вали уравнение (6.2.2), полагая. что
ilh ггпределястси уравнением (6.4.3). Однако они иснолнзоваЛЧ не \7.;. 1,0.
со 6 О
свел [стпамн
1одос к ci О сотРхДпики [У. 30. Рб, 75, 76 80, 81 I детч-тьио исследовали x p.iu-
HCtttie (6 0 I). Они предложил!1 выражение для констчнгы С'
С — 0,781нЙ — 2,67 (663)
Исцолмуя \ равнения (6.6.2) и (6 6 3) (i перетодя к приschqi1.'pi'Meipn'M,
можно получит1' Уравнение (6 6 1) в виде
- a(-L-i) , T’.f'yy _ „,64)
Коцсг.кпт В (Можне сере кдить. дописывая урпвчеплс (6.6.4) для норма. [ЫЮн
ючки кипения, г. с Р -- I .inf, Т Т/>
1"Ре ' -^[(1 РСТ\) ~ 1|
] - 1 Лг - 0,7816 1и Т\
Иниестны ,|Л.Т(1типные Метода p.ideia константы В дтя углеводородов [121
Предложены также соотиеяцепня, альгернлтрвные уравнению (tl.fi.4) 150] В tio-
itlCM cjIV'I,to уравнение (Г,6 4) является предпочтительны'!, хотя otto ti несколько
неудобно в itctio.'i .зопании, поскольку содержит /\Р в неявном виде. Уравнение
Фроста —^одкуорфа применялось также (laccto и Дендером ]б71, которые для
повышения его точности в качестве коррелирующего параметра ввели радиус вра-
щения мо.'1С[,-у.г|>| (см раздел 5.8).
Пример 6.4. ПоВ[орить пример 6. ], ticnon .а\я .looftuietittyto корреляцию
Фроста- Колкуорф.,-Тодоса для давления tiapoB
Р с tit с И ( с Для этилбензола (Р -- 35,6 ,пм. )ft_ - О.РЬЗ), чтобы опре-
делить Д, МоЖС( быть ПСНо.тИОВанС' ypjtttlCHHO ((?.6 5)-
21,7
I 1,(0663
По уравнения^ (6 6 3) и (6.6 4)
I'./e,,,, - и I.,»(1 -1) -I (в, I,,/. -')
Давле t и я парен расойt т. t tt tt t>tc мето чем посте 1г вате । (аччу ц|гцп । ижений д 1Я
7. '. 1 - । я', /’ ,ас
— —
74 1 0,563 [01 100 1
|8(> 8 0,74,о 24'<1 2404 -0,1
б,1ИК<>ваш(ь)Ми эксперрмеиталькы.ми данными для 242 веществ, [.ни рассчитали
таблицы зцамецин Н у С для каждого ид ?тнх веществ б)вИ г^едтожц-ти также
П|>цб,1[[женн\ю корреляцию Отих констант с парахором ) ц фактором РИСНтрП1!-
Прнмер 6.5. 11ов?о|-ит1> пример (5 1 нс поЛ(.',''я коне i ;щ 11 ‘ iapiax
ytr.l Для 1П1лбСИЗО.тп
Решение Из нридожения А имеем. Н \ К \ - - 58, 100 H\RB
0742.54 HW- - 5.802; HARD- 5,73
347,8 99,7 100
18b, 8 460.0 2510
H.'Pi Э|иЛбеи31>ла в диапазоне МежД\ 300 и р00 К щи petttHvCit. расчета ниже
мл и значение Р, - 27 000 мм рт
нщиня 27 0Ь0 мм рт ст I-3L
в то время как в приложение А трется ве
Ь.7. УРАВНЕНИЕ РИДЕЛЯ — ПЛАНКА МИЛЛЕРА
ДЛЯ ДАВЛЕНИЯ ПАРОВ
базируясь нн выражении
inPvp - 1 + у , ст D73
(6 7 1)
177
темпера')уpy кипения и сг рг.пич^штя Риделя т с уравнение (6 5.3) Связав а,
и й ! см. уравнение (6 Ч 5\1, ей пчлучнл (541 С|Л'Яйи.еиие дл^ приведенного давле-
ния паров
(6 7.2)
G ^0,4833 - О,46О5Л (6.7.3)
ЗаннсЬ(пая упавнсике (6.7 2) для .юрмалt-цой точки кипения, можне рассчи-
тать значение k.
t _ »с-(1- Г»,> (С - 4|
(3 - 7\) (I - Т\?
Примерб.6. I (овтг'1 ii1 к п iniMep 6 I, испольня ьорре.тяшчо Риделя I l."anh,i
Мидлера.
Решение В примере 6.1 для этилбензола П|)]1в">дя'|Ся Я,- =• 35,6 ртм
7',, — 0,663 и А — 7,028. Тогда по уравнению (6 7.3)
G = 0,4835 4- (0.4605) (7,028) = 3,720
а по уравнению (6.7 4)
_ 7,028 3,720 — (I 4- 0,663)
(3 - 0,663) (!— 0,063)2
Уравнение Риделя—11лапка—Миллера (6.7.2) для давления паров этилбен-
зола будет иметь влд
1г. Р ,Рг ₽ ^42“°. I, _ т- + 0.И4 (3 -I- Т) (I - Т,)’|
|’езуЛ|.тать| расчета приведена ниже
74,1 0,563 101,9 100
1,0
186,8 0,745 247» 2494 - 0,6
6.6. УРАВНЕНИЕ ТЕКА-СТИЛА ДЛЯ ДАВЛЕНИЯ ПАРОВ
Важной попыткой улучшить прежние подходы к интегрированию уравнения
Клаузиуса—Клапейрона явилось предложение Тека ii Стнла [84] иСполъзопать
уравнение (6.16.1) для связи Д/7Г с температурой Был выбран показатель степени
п — 0,375, а функция Ватсон,а разложена в степенной ряд по приведенной темпе-
ратуре Тг В разложение \HV включен корректирующий член, учитывающий все
стороны влиянии температуры на ^Zv. Он должен был обладать несколькими
свойствами: стреми гьсЯ к пулю При низких температурах, когда Д/,, ~ 1,0; обес-
печивать минимум значения A(A,/AZE вблизи Гг — 0,8'(см. раздел 6.16): иметь
такую формм, при коюроп уравнение давления паров дает приемлемое значение
а в критической точке [см. уравнение '6 5 2)|. С уперм этих условий конечное
уравнение може, быть записано в виде
In /\рг — А ( [.[48<)3 — 7'- — 0,117[97'г —0,931747^ -0,375 In 7Г) +
Г —6011 о 0733/1-3 1738', _| . .1
I (1,042. -_Р4(.2ни)|-^ГТ2-0^_11!7з57Г 0.010 l)|
(6.8 I)
178
где
(6 8-2)
оминается попчшен-юй точностью три расчет; .давлений паров полярных веществ
и веществ с водородными связями при низких температурах (ниже 7*1. Следует
отметить, чг<> для itc.ti'inbB'.iBuv.e.n уравнения Чека--Стила необходима зрзтп Гр.
Проверка уравнения <6 8 [1, проведенном 1еком к > тнлим длч С9 ветес|П.
меньше | % , е максимальные ошибки редко превосходила о % во всех диапазонах
темперлуры Менее широкая проверка, предпринятая авторами книги, подтвер-
дила уровень точности корреляции, н<> при этом было установлено, что расчетные
значения весьма чувствительны к выбраичоч^у значению величины
При Всех температурах, кроме близких к 7'г, расчет Р •. г чувств и годен также к вы-
бранному значению Т,. Меньшая чувстпнтельнос-н отмечалась по отношению
к выбранному значению 7t, т е. _iZJгАЛ’,- ! дли высоких приведенных тем-
ператур 'Г, и ДРУ1,/ДРГ -з 0,5, котда 7 < 77,.
Пример 6,7. Повторить пример 6 I, кип.п.зчя у равнение |ска~Стнла для
[Явления парен.
В дополнение к этим конС[Э.1гнм необходимо знать также теплоту парообразова
пип. при Ть- Уилхойт и 3 води некий (94] прпподя-- сндЧееие 85 00 мл^|Ол к. Тогда
('о сравнению (6 8 2}
_________________8500___________________
([/•87) (617 I) (I - О.ббЗ)1’’37''
10,123
R примере6 1 найдено, что/г —• 7,028. Решая уравнение (6.8.1) с учетом
- Ь'Р, и Тг ~~ Th • получаем « — 7,4(8. Отметим, «то это значение несколько
"тлиидется от а,, оирсдслсцпого урав-шеищо Риделя в примере 6 3,
Уравнение (6.8 1) теперь принимает вид
I .РхРг - 10 423 (1,14894 ~
0 I 171 ‘ЗТГ — О G31747J — 0.375 !п Тг) +
0,6298(7; 0,7 - Q
0 I (61 — 1)
Расчетные зпачег.вд давлений паров эдеих'мзсгЛа при течперэтурах 74,1 я
186,8 °C и погрешности р,течет,т приведет,! ниже
т [ ? I ^рлСч-
_____J__________''-1" ’
74,[ 0 56.3 Ю[
[86,8 0,745 248‘
160 1,1
2494 - 0,3
6 9 КОРРЕЛЯЦИОННЫЕ УРАВНЕНИЯ
вносят вклn.u.i, тначетшн которых быстро уаывакл, поэтому добавление nucuiHx
членов оказывает малое влияние на явления ВсЛЗШн х коэффициентов _1Ля бол ь-
6.10. ОБСУЖДЕНИЕ МЕТОДОВ РАСЧЕТА И КОРРЕЛЯЦИЙ ДАВЛЕНИЯ
КАРОВ, РЕКОМЕНДАЦИИ
160
ТАБЛИЦА G l Сравнение расчетных it экспериментальных значений давления
1 1 ,<
1 (Vjj’h'A)
259 2 0,510 32,0 24 1.6
273,4 0,538 ”1,2 15 0,3
290,1 0,371 |Г'1,1 8,3 -0,1
,320,5 0,631 558 4 1 ”, -0,7
350.9 0.691 1512 -|0 0,6
З'Д.З 0 768 4 24! —1,5 0,1
446,4 0,8-8 13 260 ОЦ -0,5
470 6 0,926 19 970 0.5 -1,5 J)
508,1 1,0(1 35 250 -4,5 4)
О in Г. .. l'i.iu. । it — Тза.э.о. '
', ln.1,.1, .ь '. 'i >
, 1, < ' 1 .11 ' 1 4 II 11,111 i и гельнсс. чем взя
олнаке, необходимо располагать значениями :\HV, Следует заметить, что только
в немногих случаях, когда критические параметры неизвестны и нс могут быть
с уверенностью рассчитаны, могут иметься в наличии экспериментальные значе-
ния &HV (см- раздел 2 2) По этой причине такие методы расчета в данной главе не
рассматривались.
Рекомендации в порядке приор.пега'
t. Если Рчр < 10 мм pi ст , то ни один из методов, описанных в эти главе,
не даст точных результатов
2. Если Pvo < 1500 мм Рт с, и для вещества имеются (например в 1рило-
женнн А) соответствующие константы, -о рекомендуется использовать уравнение
А имеются константь! Гарлахера—Брауна, те давление даров определяется по
уравнению |6 В 1). При рас.че ах днНтсння каров в околокрнгичоской области сна-
чала следует провести проверку, действительно ли табулированные константы
обеспечиваю! надежнее определение кра шческо, о дгвлепия, значение которого
Дапо в приложении А.
4. Если вещество нс является полярным, то вес уравнения — у равнение Ли—
Кеслера (6 2 С), уравнение Риделя (6.5 4), уравнение Фроста—Колкуорфа—То-
деса (6.6.4), уравнение Риделя—Пладка—Миллера <6 7-2) и уравнение Тека—
Стила (6 8 1) — обеспечивают точный расчет давления Паров- Для пользования
Стила кроме этих ьоиС| ;п,г необходимо i ниже располагать значением А//„(1
5 Для полярных жидкосгей, особенно для веществ с водородными связями,
все методы дают результаты меньшей тнкости Метод Тек.| —Стила в большинстве
случаев будет, пожалуй, самым точным.
Расчетные методы, описанные в этой ыаве, разработаны для вешеств с нор-
малиной молекулярной масс,ч1 Для очень тяжелых yi лсводородов, Для которых
i'mc'ciosi мало экспериментальных дачных, разработана корреляция, основанная
1«2
1(||ров ацетона
пригожиискои теории жидкостей, содержащих нолисегмситпьге молекулы-
Эта корреляция |80с | используется для расчета Давлений паров очень высококи-
инцих углеводородов, включая и те, молекулы которых содержат нафюновые или
рочатцческис циклы-
6.11. ТЕПЛОТА ПАРООБРАЗОВАНИЯ ЧИСТЫХ ВЕЩЕСТВ
Д//р = ,\UB -- Р..;, (I £ — \ 1_) =
«- Wf-RTlZg-Zi.) _г
-!We-RThZ0
Многие расчетные методы берут начало с уравненья (Г> 2 2). п<чому что, как
। ю показано, величина кне связана с наклоном кривой, изображающей зави-
симость давления паров от температуры. Другие Методы основаны на принципе
соответственных состояний. В разделах 6.12—6.16 дан обзор наиболее Точных
1 |.1Стп трудно установить первоначальный источник многих «ткспсримены.П|-
1 н\а -nauciniii тсилот парообразования. Некоторые ио них онрсдслнлись путем
калориметрических измерений, однако во многих Случаях так называемое экспс-
'||-ментальцос значение было получено непосредственно из уравнения (6 2 2).
183
I llpi
:dT
П]
ПО УРАВНЕНИЮ
КЛАУЗИУС\— КЛАПЕЙРОНА
6,12, РАСЧЕТ
И ЭКСПЕРИМЕНТАЛЬНЫМ ЗНАЧЕНИЯМ ДАВЛЕНИЯ ЛАРОВ
переделения производной dl’
I5l2fiz
гте 6г— температчpniiiii иптермл. /1 — чис-ю рассмитрнваеуцх точек. iHmchHiu-
Результирующее значение \11_, ei>oibCгствуе। средне» из семи точек пт тем-
Пример 6.8 Рлеечитат» \/Л гр i 30 < , не hjя габ.тицч
«НЯ ППроО ВОД-.1
иапня. кмес:»: ’< -
равно
RT-
II3t2i (Г>)
(1.987) (303-1
184
ti.13. РАСЧЕТ НА ОСНОВАНИИ ПРИНЦИПА СООТВЕТСТВЕННЫХ
СОСТОЯНИЙ
1X5
Пример 6.4. Ikii.i.n.
шик1 соответственных со
11: IIKII, > I 'I Ь I 'I I 1.1 IIIMI JO
I I II It Llth 1 ]ц 1 I э И 1 I I t I I И I 11| Ш1-
-ТОИ'ШИ. р.ЧОГЧкТаГЬ ТоП; СП г.| царОООрЭЗОваНИЯ пропио-
в н-онгаиа при 1/1 С. .Литературные значения равны
|| Bi-rr'TH.'lllln I I о. '10
;'Ч
Г о j
11ропиононыи нлидегил
H-CiKr.in
40b 0,313 321 0,047 7,008
568.0 0.Л94 414,2 0,781 b,294
Значение Д/7а//?7'. рассчитывалось по уравнению (6<|ЗЛ).
Теплота парообразования пропионового альдегида:
\HV |7,W) (i <i«7) (496) - oW нал,'моль
По. решил..'I ь
6760
Тербон парообразования н-0Мана:
Х//с - (6 294) (1Л8/) (f,b8,8) -= 7| |0 кал/моль
,1 71|0 — 7254 ...
По, решп0С|Ь =.- ---—гт----- 100 _ — 2 0 %
6.14. РАСЧЕТ AHV ПО УРАВНЕНИЯМ ДЛЯ ДАВЛЕНИЯ ПАРОВ
Рассмотренные в разделах 6.2—6.8 корреляции давления паров могут Сыть
использованы для расчета теплит парообразования. Безразмерную группу ’(>
можно определить па урависиия (6.3.1), представленного в виде
, _ ДЯВ -dlnPvp,
- RTCSZ„'" d(\iT,)
(6.14.I)
Дифференцируя рассмотрен
ные рацее уравнения для давле-
ния паров, можно получи г ь раз-
личные выражения Для^., кото-
рые приведены в табл. 6-2. При
пользовании этими выраже-
ниями надо сначала определить
необходимые для основного
уравнения параметры.
ip itJH ирип.ига:
I I J J J 2 - (?2 I, J -- [8 I
ТАБЛИЦА 6.2 Группы 11. соответствующие различным уравнением для
Клапейрон.., уравнение (6-2 4) Л (6 14.2)
Ли — Кеслера, уравне ние (6.2.6) 6,09648 — | ,288627\ ] ,0|6Т? — — и> (|5,6875 — |3,472]7Л - 2,6|5Г’) (6 14 3)
Антуана, уравнение (6 3.]) В t Т. \2 ’77 1, т~ С,1\ ) (6.14.4)
Риделя, уравнение (6 5.4) в' -|- с'тг-\ &Ут’г (6.14.5)
Фроста — Колкуорфа — Тодоса, уравнение (6.6.4) (Р, Т.) (6.14 6)
Риделя — Планка — G [1 -ь Т2г-г 3^(1 — Т’;)2] (6.14.7)
Миллера. уравнение (6.7.2)
Тека—Стила, уравне- ние (6.8.1) А (] — 0,3757г — 0.Л719Г; —0,063487'?) -г- + (| ,042а( — 0.46248А) (Тег~1 _ 0,040) (6.14.8)
где
к = 5,269| — 2.0753А — 3,1738ft
На рис. 6 4 представлены зпа гения 4 Для пропана, рассчитанные по опублико-
ванным экспериментальным данным о Д//и и волюметрическим свойствам насы-
щенных фаз Данные, (Слученные различными исследователями, находятся в до
< таточном соответствии: расхождения за исключением области, близкой к Tr = 1,
не превышают I % Кривая на рис. 6 4 имеет явно выраженный минимум около
значения Тг = 0,8. Поскольку
(6 14 9)
можно получить
( <? п.щ-п, (Ь ,л |0)
dl\ Т} dwT,)*
При низких значениях величины Т,,
также меньше 0. При высоких значениях
7\ знак неравенства меняется на проти-
воположный. Случаю dty/dT,. — 0 соответ
сгвует точка перегиба. Общий несколько
187
от обратной 'емпературы показан на рис. 6.5 Рис. i>.6 ii.T-TiocTpnpycT, как разные
равнения _|-|Я давления парой предсказывают форму кривой, изображенной Ия
поэтому кривая провсдсчи т<>тько
ПриЗеден^ая темпераггура
гропана.
inci.iiaличи|цш;|и|i|,|с корреляции AZ, | например. еравнсине (Ь.42)] иеточni,i.
Лучще Д7Т( определять по Р—V /' соо-нщиенияМ' <ц|цсе квьтм н г,(. 3. ки> ля
1iacbiiiieiiHnr<1 пар;,, так ii для n.ic^ineiciojj ,м1ДлоС|||
h 15 ТЕПЛОТА ПАРООБРАЗОВАНИЯ ПРИ НОРМАЛЬНОЙ
ТЕМПЕРАТУРЕ КИПЕНИЯ
Теплота парообраЗрвнпИ! .|[гц иирцчльиси темiюраг\рр кипения ( \7flp)
нв.ляяся ьпцстатад iitciOv' aemepiBci, кртфио («им i><‘ni3.'!i,ay)e) в коррмя-
днях свойств Любая из коррупции, paccvoi pciiuiip в разделах 6 12- Ь 14. может
г,:/гь рьиоль |оцац j для oniH'K-TPiiiin 'V7Ilj, если Т Ian. I [иже n6cj-
I8rl
ждаются вопросы использования таких корреляций и в дополнение к этому пред-
лагается несколько специальных методов.
Расчет ^Нсь по соотношениям для давлений паров. В щб-Т 6.2 представлены
уравнения для ф = &llv/(RT, &ZV), соответствующие наиболее точным уравне-
ниям давления паров, Каждое из этик уравнений может быть использовано для
определения ф (Tf,). Исключение составляет уравнение Тека—Стила, в котором
используете? в качестве входной переменной. Зная чр (7\) и ^ZB(Tb),
•можно определить A/70f(.
В корреляции Антуана исиОльзуются специальные константы (например, из
приложения А). Для еоот«оил«ий Клапейрона, Ди—Кеслера, Риделя, Фроста—
Кицкуорфа—Тодоса и Риделя—Планка—Миллера выражения для ф даны
в табл. 6.2. Для ф (Th) может быть показано, что
ty(Tb)
На рис. 6.7 и 6.8 представлены аначенияф {Т ь), соответствующие упомянутым
уравнениям для давления паров в двух случаях. 11а рис. 6 7 приведена зависимое |Ь
ф (Т’ь) от Ti, при критическом давлении, равном 40 атм. На рис. 6 8. показана
зависимость ф (Т^р) от Рс । ри Th = 0,66- Кроме уравнения Клапейрона. разные
соотношения для давлений паров дают похожие результаты. Если &ZVI) находят,
используя Р—V—Т соотношения, рассмотренные в ;л. 3, io уравнения Риделя,
Фроста—Колкуюрфа—Тодоса или Риделя—Щанка—Миллера даюг точные Зна-
чения АЯр,,-
Следует особо с станов пься ни тех случаях, когда для расчетаф используется
уравнение Клапейрона [см. уравнение (6.14.2) в табл. 6.21. Значение ф равно h
независимо от приведенной температуры:
ф(7>)=-ф(7-д) = Пг
(6.15.2)
190
чсiob \Я:. . Bf'.iiBisni.i up;, -i'lf'M обычно приравнивается единице. В такой
оор.че соотношение (С. 15.3) пазт.из.пот уравнением Лжизкалоне |26]. Проверки
||бк;|3ыв;иот, нл, а।о уиавнеивс пбычно Дает .чтвиштенныс не несколько процентов
значения А//^, Для huhimnscur,я точш'ск! j равнения Чжиакалоие в работах
123, 41 ) предлагавiсп нспо.и.зевать корректирующее члещ;, однако лучшие ре-
зультаты М|Л \г ш,ян достигнуты, oc.'ih нрименяюхя гсотношення, рассматривзе-
чне и;|ж<
.Метод Piide.ix. Риде.и. |78] несколькооодн<|||ц1цр<>|(а.1 уравнение (6 153).
г 1111 ' - ~ 1
о 930 - Т;
При проверке мегод,| Ридслч (табл. G 3) hoiрсшности расчета iio4ui вечда
составляли деньте 2%.
Метод Чена. Чец 113] скомбинировал уравнение (6 13 3) и подобное ему
шись при этот, от фактора ацентрнчностп- В записи для нормальной точки кипе
пил это выражение имеет вид
3.9737'i -3,938
ли Г;-И Т Z
(В.15 5)
ГАБ.1ИЦА 6 3 Сравнение расчетных и экспериментальных
значений
Ср<диее отктоиепие, %
соедиы •
Насыщенные углеводороды
Ненасыщенные углеводороды
Цнклондрафины и аромати-
ческие углеводороды
Спирты
Азот- и серусодержаише ор-
|анические соединения
Гнлогерпроиаводные органи-
ческие соединения
Инертные газы
Азот- и серусодсржащие не-
органические соединения
Неорганические галогениды
Скеиды
1ругие полярные соединения
22
3,6
3.4
0.6
94
0,4
191
JHHE
Ip
uentuot
- Л-КГ.Ц,
, 1,киака.тоие.
'•'равнение (6 15 7) стдцопится подобным |1СК1)торым другим корреляциям,
упоминавшимся Винне, <с ,и ,\Z. принять равным I — Р~' Т<>чноС|Ь сравнения
(О [7 7) такая же, как и уравнения Риделя (6.15 4) Висвацат и Кулоор |9] | не
• ........... ...... .те самсе соотношение, предложив )’ — 0,69 и К *
[.() уравюнпс (6 15 7) принимает вид уровне, ия
,HVi к ц< d>) икиии) Г|ДО| ноши, a'Vikkc ,ДН с Лейдле-
РоЧ |47| ц Федор' [И1 пре,мОЖ||.11 аддитивно 1 рушк вые методы
Сравнение расчетных значений с литературными данными.
В таб.|. С 3 пре дс ..результате) сравнения значений Affрассчитанных ис-
юдимц, оппсаkiii.imh в зтом разделе, с экспериментальными данными. Методы Ри-
деля, Пш нсра Чела и Ветере I у равнения (G 15.-4)—(6 15 С)] удобны в исподнзова-
0,647.
(0,647) (hi 17.0 -
(1 093) (I .ЧР7) (49о) - 0,930-0.64,-'
6700
6.16. ЗАВИСИМОСТЬ _M/P ОТ ТЕМПЕРАТУРЫ
ДЯр,
\ 1 .
(6.16.1)
В разделе 5 8 эта iewa рассматривается несколько подробнее и пред.та-
• ается мсчоднм, ко'орая связывает низкотемпературное значения тсплот
парообразования с |ец.'|0смкостыо жидкости.
" Ркд Р. к др.
193
(6.J62)
ТЬ
(б 16 3)
а параметры <? и р буд\т иметь следующие значения:
i 7
Жидкие металлы 0,20957 —0,17467
Квантовые жидкости 1’ 0,14543 0,52740
Неорганические и органические жид- кости ') reii'i'i, недород, дейтерий, tteoij. 0,35298 0,13856
По сравнению с уравнением (6.16,1) (при п = 0,38) уравнение (6.]6.2) дает
несколько меньшие значения &Hv при Г < и несколько завышенные при
Т> Tt>. Для жидких металлов и квантовых жидкостей уравнение (6.16.2) не-
сколько точнее, чем уравнение (6.16 1), а для неорганических н органических жид-
костей средняя погрешность расчета по Э(Им уравнениям, согласно Фишу и Лиль-
мс1цу, примерно одинакова.
6.17. ОБСУЖДЕНИЕ МЕТОДОВ РАСЧЕТА ТЕПЛОТЫ
ПАРООБРАЗОВАНИЯ, РЕКОМЕНДАЦИИ
погрешность расчетов возрастает вблизи точек плавления и критической.
195
&ниь
= $.”6 + R InT’b
(6.17.1)
где Tb выражено в кельвинах, а AS06 — в кал/(моль-К).
Фиштайн [23 J повысил точность уравнения (6.17. |), используя корректирую-
щий член в виде множителя, который зависит от класса соединений. Позднее Ве-
тере [90] предложил корреляцию ASBfcB виде функции Ть и М. Соответствующие
выражения даны в табл- 6.4. Значения ^Неь, рассчитанное по этим уравнениям,
почти всегда не отличаются от экспериментальных данных более чем на — 5 %,
а в большинстве случаев погрешность ниже 3 %.
Пример 6.11. 11 с вторить пример б. ] 0, hCiio-'u.j) я д.гя расчета Д5В(, у равнение
Ветере.
Решение. Из приложения А имеем: 7$ — 32] К и Л1 = 58,08. Приме-
няя второе уравнение из табл. 6.4, получаем.
ASBfc = 10,604 -f-3,664 1g 32] + 0,09354 ] ,035 П)-3 Д8~
-1,345 Ю"» Д’ -21.37 каМхйл,. К)
Таким образом
ДНВ - (21,37) (321) = 686]
Пгнрсшик lb _ ('SC'Ю0- 1,5%
относительно соответствующих значений тенлот испарения эталонного (ба-
адюго) вещее пи, для кетерг’ю зависимость Д77в — Т хороню известна. | |д эту
196
ТАБЛИЦА 6 4 Уравнение Кистяковского в модификации Ветере
Значс < и я 1 [, ~ ''Syf, "Ь1' '1Я|e,i 1,1 “ кал,-'(моль- Ю. Т6 - в кем юг:-:ах, м -
Спирты, кислоты, метил-
амин
Другие полярные соеди-
нения ’)
Углеводороды
19,388+3 ]269 lg Т,-, — г, ]5й-'С -
т2 Г3
— 0,035021 —^- - 5,Ю5Ь-Ю^^-
\SCb^ 10,60;. + 3,664 !g 7), I 3 01334^-
-i- I 035-10-’-^--1,315.10-0-^5-
Д5й) = 13,9] + 3 27 ]g Al — ] 33 x
,z [7’;,-(263.4)" K1]i W'
M
') Лая cao»,nux зфигов гассчвтаниые значения А\ь
6,18, ТЕПЛОТА ПЛАВЛЕНИЯ
Изменение энтальпии при отвердевании или плавлении обычно называют теп-
лой плавления. Теплота плавления зависит от кристаллической структуры Бе-
гства в твердой фазе. До сих пор гопЫтки получить какие-либо обобщенные кор
мяшгй оказались безуспешными Для определения теп-тоты план,кипи Atf,n
.жгт titJTi, i-H.'tii .n.'iiii) vii.'iniu.'ii иг i\.'t;iv.!Hve.4 - г л m icinx >n,j. папа ко в xi им iviv
ie необходимо иметь данные о зависимости температуры Плав.щиия uj даз-тегИя,
rrulH.h- Вечно имеются В и.кТКЩя Л,е11)| и UCC.HlUli iB.'1'ГСЛ я.
1 основе современной дырочной теории жидкостей, ио результаты, полуночные
) их методу, плохо согласуются с экспериментом- Кучинский 142] связдл тси
лу плавления с модулем сдвига твердого тела. Он получил хорошее согласова-
ic теории с экспериментом для восьми металлов. Было также показано, что для
рзоагомных веществ эырош/я пламенна npuS.uiwi ельно равна газовой hoctohji
.й Я 133 b Иаилуппее теоретическое рассмотрена т-от.уо.а было сделано
ОНЛИ (11 I, который Связал энтропию плавления молекулярные кристаллов < их
юв.тоия с друтих.и физическими свойствами Добавление метинщ ij'l .нщ Но
ТАБЛИЦА 6 5. Значения теплот и энтропий плавления
простых углеводородов ।1
_ I ч 1
( оедии еп не k й J5' =1/
Метан — 182,5 90,7 16,04 14,03 225 2,48 122 0.12
Этан —183,3 89,9 30,07 22.73 683 7,60 117 0,19
Лропан — 187,7 85,5 44,09 19.10 842 9.85 102 0,19
«•Бутан -138.4 134,8 58,12 19.17 1 114 8,26 92,1 0,21
Изобутан —159,6 113,6 58,12 18,67 1 085 9,55 87,6 0,2]
«•Пенган -129,7 143,5 72,15 27,81 2 006 13,98 85,4 0,33
Изопентан —159,9 i 13.3 72,15 17,06 ] 231 10,86 81,0 0,2]
Неопентан -16,6 256,6 72,15 10,79 779 3,03 75,4 0,14
«•Гексан —95,4 177,8 86,17 36,14 3 114 17,51 80,0 0,45
2-Метилпентан — 153,7 119,5 86,17 17,41 1 500 12,55 77,1 0,23
2,2-Диметилбутан -99,9 173,3 86,17 1,61 139 0,80 73,0 0,02
2,3-Диметилбутан —128,5 144,7 86,17 2,25 194 1.34 75,7 0,03
«•Гептан -90,6 182,6 100,2 33,47 3 350 18,37 75,6 0,44
2-МетиЛгексан -118,3 155,0 100,2 21,91 2 195 14,16 73,] 0,30
З-Этилпентан -118,6 154,6 100,2 22,78 2 283 14,77 73,8 0,31
2,2-Диметилпентан -123,8 149,4 100,2 ]3,89 1 392 9,33 69,6 0,20
2,4-ДиМСтнлпснтан — 119,2 154,0 100,2 16,32 1 635 10,62 70,4 0,23
3,3-Диметилпеятан —134,5 138,7 100,2 16,86 1 689 12,18 70,7 0,24
2,2,3-Триметилбу- так —24,9 248,3 100,2 5,39 540 2,18 69,0 0,08
«•Октан —56,8 216,4 114,2 43,40 4 956 22,90 71,9 0,60
З-Метилгептац -120,5 152,7 114,2 23,81 2 719 17,8] 71,3 0,33
4-Метилгептан —120,9 152,3 114,2 22,68 2 590 17,01 70,9 0,32
«•Нонан —53,5 2]9,7 128,2 28,83 3 696 16,82 68,4 0,42
«•Декан —29,6 243,6 142,3 48,24 6 865 28,18 66,0 0,73
«•Додекан -9,6 263,6 170,3 51,69 8 803 33,40 6] ,3 0,84
н-Октадекан 28,2 301,4 254.4 57,65 14 660 48,66 51.5 1.12
«• Нонадекан 32,1 305,3 268,5 40,78 10 950 35,88 50,3 0,81
«•Эйкозан 36,8 310,0 282,5 59,11 16 700 53,87 48,8 1,21
Бензол 5,5 278,7 78,1 30,09 2 350 8,43 94,1 0,32
Толуол —94,9 178,3 92,1 17.1 I 575 8,83 86,8 0,20
Этилбензол —94,9 178,3 106,1 20,63 2 188 12,27 81,0 0,25
о-Ксилол -25,1 248,1 106,1 30,61 3 250 13,10 82.9 0,37
«-Ксилол —47,9 225,3 106,1 26,04 2 760 12,25 82,0 0,32
198
Продолжение
Изопропилбензол —96,0 ]77,2 120,1 14.15 1700 9,59 74,6 0.19
1,2,3-Триметилбен- —25,4 247,8 120,1 16,6 1990 8,03 79,6 0,2]
] ,2,4-Трнметилбен- —43,8 229,4 ]20,1 25,54 3 070 13,4 78,0 0,33
1,3,5-Триметилбен- —44,7 228,5 120,1 19,14 2 300 10,1 77,6 0,25
Циклогексан 6,5 279,7 84,1 7,57 637 2,28 85,4 0,09
Метилциклогексан —126,5 146,7 98,1 16,4 I 610 10,97 77,2 0,21
Эгнлциклогексан —111,3 ] 60,9 112,2 17,73 1 930 12,00 73,9 0,24
1,1-Диметилцикло- —33,5 239,7 112,2 1,32 ]48 0,62 70,2 0,02
гексан
,2-Диметилцикло- —50,0 223,2 112,2 3,50 393 1,76 72,9 0,0а
Гексан (цис-изо-
мер)
1,2-Диметилцикло- —88,1 185,1 112,2 22,34 2 507 13,54 71,7 0,3]
гексан (транс-изо-
мер)
между и температурой плавления. Данные табл. 6.5 демонстрируют относи-
тельное постоянство теплоты парообразования при нормальной температуре ки-
пения. Отношение bHnJbHvi,, однако, меняется очень сильно: в таблице значе-
ния этого отношения колеблются от 0.02 до 1.12. Поскольку теплота парообразо-
вания увеличивается с уменьшением температуры, то отношение тепловых эффек-
тов плавления и испарения при температуре плавления изменяется вероятно от
6.19. ТЕПЛОТА СУБЛИМАЦИИ
Твердые вещества испаряются без плавления (сублимируют) при температурах
ниже температуры тройной точки Сублимация сопровождается увеличением эн-
тальпии, которое соответствует теплоте сублимации. Последняя определяется
суммой теплот плавления и парообразования, даже если вещество не может суще-
ствовать в жидкой фазе при данных температуре и давлении,
I !аилучп1им образом теплота сублимации A//s может быть рассчитана на основе
данных о давлении паров твердого вещества, если таковые имеются. В этом случае
может быть использовано уравнение Клаузиуса—Клапейрона (6.2.1).
199
Только в немногих случаях давление сублимации в точке плавления известно
с кикой к, точностью. Оно может быть рассчитаю с помощью методов определения
давления паров жидкости (если известны T'j и 7\) путем экстраполяции данных
ло точки плавления. Однако такую методику нельзя рекомендовать для общего
<'сл1.зон;г-1 и я. так как ни одна из корреляций по давлению парой но дает точных
результатов а диапазоне очень низких давлений Даже если бы были известны зна-
чения Р- |'рн Гч-,, необходимо иметь цо крайней мере одно значение давления
паров твердого вещества, '-тобы рассчитать SH, с помощью интегральной формы
уравнения Клаузиуса—Клапейрона Этим объясняется отсутствие полезных
обобщенных методов определения теплоты сублимации по давлению паров.
Другая трудность обусловлена фазовыми переходами в пределах твердой
шазы Поскольку точка отвердевания является границей Фазового перехода пер-
вого рода 11 между .(aponi.iv и твердым состояниями, твердое вещество может иметь
некоторые характеристики, обычно присущие жидкости например свободное вра-
щение. Во многих случаях при значениях температур, несколько более низких,
чем температура плавления, происходит еще одни фазовый переход первого
рода — от кристаллической Структуры к аморфной. Теплоты плазленця и субли-
мации для этих фаз твердого зещсства имеют различные значения. Обычно дан-
ные по тенлотам плавления и сублимации, приводимые в литературе, относятся
к аморфному состоянию Бонди 110] пришел к выводу, что корреляции &Нт и
ЛЯ, могли бы быть лучше, если бьг они были получены на основании рассмотрения
кристаллической фазы, т с. при использовании самой низкой температуры фазо-
вого переходя первого рода. При этом имеет место наибольшая упорядоченность
кристаллической структуры вещества. Фазовые переходы в твердоч состоянии
рассмотрены также в работе Престона и Др [711-
В некоторых случаях оказывается возможным определить тчиоту субли-
мации ио термохимическим данным, используя стандартные методы расчета При
этом необходимо иметь значения теплот образования твердого веществ;) и его па-
ров. Для определения теплот сублимаипн неисследованных веществ такой метод
чаще всего неприемлем, так как теплоты образования, приводимые в справочных
таблицах включают в себя экспериментальные значения теплот сублимации. Пели
известны энергии диссоциации твердой и газовой фаз, то можно рассматривать
|ЩКЛ, включающий сублимацию твердого вещества, диссоциацию газа и реком-
бинацию элементов, из которых состоит твердое вещество.
Бонди [10] предложи,- аЛДитивю-групповой метод расчета ЛЯ5 при тем-
пературах, соответствующих фазовым переходам первого рода, для молекуляр-
ных кристаллов органических веществ и неорганических гидридов, пергалогени-
дов и перкчрбоннлоэ. Обычно минимальная температура фазового перехода пер-
вого рода немногим ме> ьше температуры плавления. Для парафинов, «апркмер.
обе температуры идентичны Для других же веществ имеет место значительная
разница. Так, циклогексан плавится при 6,5 СС, а его минимальная (емпература
фазового перехода первого роДз составляет —87 ЭС. Для расчета температур фазо-
вых переходов первого рода не существует каких-либо общих методов. Метод
Бонди____приближенный. Решая, какую групповую составляющую выбрать, во
многих случаях надо пзоязлять большую осторожность.
Для инженерных целей можно, в копне концов, рассчитывать теплоту субли-
мации грубо как сумму Д/fc. и &Нп,, определив их предварительно порознь. Теп-
лота плавления составляет обычно четверть этой суммы. Поэтому результаты могут
оказаться неплохими даже при грубом определении &Н,п-
') Фазовый переход первого рода характеризуется тем, что происходит скаи-
Косбр.ппое изменение значений объема, энтальпии и эн|ргпии фаз, находя-
щихся в равновесии К фазовым переходам первого рода относятся парообразова-
ние н плавление Переходы второго рода встречаются Значительно реже i ха-
рактеризуйся тем, -по в этом случае значения объема, энтальпии н энтропии
ог фазы ь фа <е меняются непрерывно, а теплоемкости п коэффициенты сжима-
емости ___ скачкообразно.
2 ) Исключение составляет /(бутан (температура и.(явления 135 К. (смне-
ратурэ фазового перехода первого рода около 107 К).
20U
ОБОЗНАЧЕНИЯ
’02
92. Vis«anaih D. $.. and X. I? Kuloor. Ccn Z Chem. Eng , 45 29 (|%7|. 93 Vat-
Глава 7
ТЕРМОДИНАМИЧЕСКИЕ СВОЙСТВА
ИДЕАЛЬНОГО ГАЗА
7.1. СОДЕРЖАНИЕ ГЛАВЫ И ОСНОВНЫЕ ОПРЕДЕЛЕНИЯ
В настоящей главе описываются методы расчета теплоты образования, теплоем-
кости и энтропии (или энергии Гиббса) органических соединений в идеаль|югаао-
вом состоянии.
Энгальпня и теплоемкость идеального газа не являются функциями давления.
Поэтому для Этих свойств не имеет смысла устанавливать опорные значения давле-
ния. Для энтропии и энергии Гиббса опорное давление принято равным 1 атм.
Терлота образования соединения определяется, как изменение энтальпии
при постоянной температуре в реакции образования вещества из элементов в их
стандартных состояниях. В такой схеме реакции принимается, что элементы перво-
начально находятся при температуре реакции, давлении 1 атм и в их наиболее
устойчивой конфигурации, например двухатомный кислород — в состоянии
идеального газа при температуре Т, углерод — в форме графита и т. д Обычно
нет необходимости знать теплоты образования элементов, так как при расчете
стандартной теплоты реакции, вследствие сохранения атомов, теплоты образова-
нии всех элементов компенсируют друг друга. Для реакции в общем виде
а\ + 6В - сС -j- dD
изменение стандартной теплоты образования продуктов реакции С и Г) из веществ
А и В в стехиометрических количествах при условии, что исходные нсщества и
продукты реакции являются химически чцетыми и находятся при температуре 'Г
н давлений 1 атм, дается уравнением
ДД'Г =с ЫГ1т (С) + d ^н'1т (D) -
— а Ы1°1т (А) — Ь ДЯ,Г(В)
(7.1.1)
уравнением
дя? -дя; + ( ДС°<ГГ
>т '2ОД 1 J °
298
(7.1 2)
Здесь ДС° ___разность между теплоемкостями соединения и элементов, из
которых оно состоит, причем каждый элемент находится в своем стандартном со-
стоянии (как отмечено ранее) и теплоемкость каждо, о умножается на соответству-
ющий Стехиометрический коэффициент.
203
турой, объединяют уравнения (7 1.1) и (7.1 2)ф
— fSr (С) 4- dST (D) — .-iSj. (Л) — bS^fB)
(7.1.4)
энтропия может быть вырижера через i'°r,s исхедных и конечны* продуктов
регниши phcjcoiнчнп уравнению (7 1.3):
т
•15г- 1>Лв+ S i s,C‘„(!)dU,T (7 13)
( ! Й8
II иакопес., изменение стандартной энергии Гиббса д.тя химической реакции
мсжн< выразить как
хйт \н'т~ T\ST (7.1.6)
где и Sf находятся но уравнениям (7 1 3; и (7.1 5)
7.2. МЕТОДЫ РАСЧЕТА
’ 12l.ii, (Лмнорые на участников реакцпн являются элементами, то С° обозна-
чаем гегг.юсм.-ость элемента в ею стандартном состоянии; эи состояние может нс
быть идеальногазовым (как, wmpwwp, для углеР0Д'4 В таких случаях толжна
быть ц:весгса •сси.'госмкость элемента п его действительно-)! С|апдартном еосго-
204
7.3. ИДЕЛЛЬНОГАЗОВЛЯ ТЕПЛОЕМКОСТЬ
с' 4 -I- ЙТ’ -г CT1-\-DT'
(7.3.1)
где величина С’ выражена в кал'(моль. К), Т — в кельвинах.
Дру । им удойным источником сведений о теплоемкости С° являются таблицы
J ANAF [ 18] и книга Стэлла ц др. [33], и которые значения С°табулированы как
Функция температуры для нескольких сотен органических соединений- Пассю
и Денвер [22], я также Ххаиг и Доберт 117] приводят константы полиномиаль-
ного уравнения четвертого порядка для многих углеводородов. Тннх п др. |3|
также составили таблицы значений А, В, С и D [в уравнении (7.3.1) ] для большого
числа соединений. Ян и Мок [32] используют нкспонелциальнуга температурную
функцию для корреляции зависимости С’р <л >емнературы и приводят константы
Для многих углеводородов и нсуглеводородов. Номограмма Тснса [34] позволяет
быстро найти приближенные значения С° для Парафинов.
Для вычисления С° хюжчо воспользоваться и теоретическими методами при
1 .жнс i>i иапь ’iCKi/iT>]>i,ic цгпи молекул, например лцстдлси, с помощью привс-
С(ин,ь в табл. 7.1 связей, и» злго расчет С° (238 К) производится быстро и, как
205
ТАБЛИЦА 7 1. Составляющие связей для расчета С°, В и ДЯ]
при 2S8 к [4 |
карбон ильноД
правило, с удовлетворительной точностью В табл 7.5 сравниваются расе’линн
пые и литературные значения С',’,- Применение метс>да показано в примере 7 )
Пример 7-1- Используя табл 7 1, вмчиСонгь и к'альнсиаЗовую
этиладетата при 298 К.
Решение- П> табл. 7.1 имеем:
С"р -8(С_Ц) + (С -СО) :-(О-( О) + (()-()) + к - С) == 8 (1 7 b-1-3 7
-} 2,2 -|- 2,7 4- 1.98 = 24,г> к-> г I моль - К)
Сталл [33] приводит Для этой темпера|урн значение 27,16 кал'(моль К)
Метод I инха, Дюрана и Рэмелхоу [35]. Э,о ,i,;,u тивно-групновип метод р;и-
। С° углеводородов, в котором используете я уравнение
= s ~ ву-”7''')
(7 3 2)
206
Значения констант <4,, В,. Cf, п,, В2, С2 и п2 даны в табл. /.2 для большого
'iHc.aa групп углеподородов Функция, зависящая от температуры (в круглых
скобках), определяется для каждой i-й группы, и результаты суммируются.
Уравнения (7.3 2) является модификацией более простой формы уравнении,
предложенной ранее Яном и Моком (42], и дает, как правило, точные результаты.
Тинх II др провели широкое сравнение расчетных значении С° с экспсртегггаль-
ными для 42 Viлсводородов |1] И нашли, что погрешность и среднем меидие
0,5%.
Метод ii.t.tioC] рируется примером 7.2. а в табл. 7 5 приводится сравнение рас-
четных значении С’ с литеоатурными. Их таблицы следует, что оа исключением
пееиодьиих случаев, ошибки гораздо меньше 1 %-
Пример 7.2. Пспо..ьзуя мето.’ групповых составляющих Гинха и др . вычис-
лить идеа.тьнэга.топук) теи.тосмкость изопрена (2-метил-1,3-бутадиеп) при 800 К.
Р е f) е н и е.
Для СНЛ при 800 К по уравнению (7.3.2) и табл. 7.2'
—СГГ3 ^4.7366 + 20.44 Юехр (----=12.63
\ 800 ,м89 )
Далее
Н
\ / — 134,8699 \
1,0606+ 31.4786 ехр 800о7«В~) = |8’44
4,9218
|- 62,582] ехр
/ —052,9594 \
80(Л"м )
"“8819"p(^SCWS2,-)-'flM
Таким образом
С„ =>л 12,93 + 18.44 !-16,04 -47.42 КдлДмоль-К)
с) = У -I- £ nfij I У VlT^ + у „ATS (7.3..1)
207
ТЛЬЛИЦА 7.2 Групповые составляющие дли расчета идеальногазовой теплоемкости по Тинху, Дюрану и Рэме.тхоу [35]
1Р>чпп ' Л ь ' " 1 1 1 1 В I " ।
—СН3 Группы агифапшч/’гких углеводородам Ь.ТХЛ 20,4410 10)3,8229 1,015') 0 0 0
-сн2 3,0820 136,8702 788,7759 1 0 120,3019 832 8,31,3 1,0452
—С-Н —0,6214 75,9932 601,8911 0,9953 (-1,3229 1013,8229 1,0189
- -2.4690 3'3,6797 733.9538 1,039b 81,7633 10)3,3229 1,0189
—сн. 3 4,382 1о,3919 527,1308 0.9G44 0 0 0
—с- 2 4980 24,0973 1133,5126 1,0774 20,4410 101',,822') 1,04ь9
СИ 1 6533 12,4438 21,3585 0.5 0 0 0
—С- 1„5307 36,4231 321,4962 0,9013 30,7839 527,1303 0,964 4
11 'с—Ul2 1,6606 31,4786 134,8699 0,8030 0 0 0
С— (,н. 4,92)8 62,5821 6 52,9594 0,9990 40,8819 1013,8229 1,0489
I
/ '\ -0,0015 102,8316 511,5828 0,9573 81,7633 1013,8229 1,0489
ХС=( / “\ н 2,6362 78,5993 874,4157 1,0464 61,3229 1013,8229 1,0489
н н
/С (цис) 3,1836 62,2851 1110,9532 1,0843 40,8819 1013,8229 1,0489
Н
/С~' н (транс) 5,9189 60,2442 990,4639 1,0590 40,8819 1013,8229 1,0489
хс=с= =СНа 7,5007 66,6656 578,8631 0,9870 40,8819 1013,8229 1,0489
:=сн, 8,5582 49,9143 700,3515 1,0163 20,4410 1013,8229 1,0489
н'
^с=с н / н в,0606 64,5906 949,4988 1,0596 40,8819 1013,8229 1,0489
Группы ароматических углеводородов
нс:? 1,4345 10,8720 1174,9378 1,1387 0 0 0
Продолжение
Группа а । В* । 1 в- 1 ' \
1,3635 79.6089 1269,0479 1,1387 74,9247 986,1985 1,0928
2,3297 47,6491 1587.2948 1,1915 43,4881 1174,9378 1,1387
Трехчленное кольцо —1,7223 Поправка на образование кольца 30,1047 4304,6037 1,3222 32.9162 1237,7501 1,1173
Пятичленное кольцо, циклопентан —5.5560 86,9988 1281,9257 1.1221 82,7124 545,5184 0,9912
Пятичленное кольцо, циклопентен —2,3485 70.5966 1877,9329 1,1852 70.5846 813.0059 1,0604
Шестичлсннсс кольцо, циклогексан —1,8728 95,6365 4371,2289 1,3210 99.2549 545.5184 0.9912
Шестичлсннос кольцо, циклогексен —4,7552 91.0076 972,7163 1,1001 87,0564 756,9254 1,0481
Поправка на разветвление в циклопарафинах
Разветвление в пятичленном коль- це:
простое 2,6826 102,9302 1040,8363 1,0906 104.7224 1062,1344 1,1013
двойное
1 1 позиция 5,4945 115,3182 1362,2334 1,1394 122.2821 951,9636 1,0909
I, цис-2 5,1851 116.5713 1170,5749 1.1148 122,2821 951.9636 1.0909
1, транс-2 5,0336 117.2347 1084,4398 1.1022 122,2821 951,9636 1,0909
1. ЦНС-fi 5.0330 117,2347 1084,4398 1,1022 122,2821 951.Ч63и 1,0909
], транс-3 5.0336 117,2347 1084,4398 1,1022 122.2881 951,9636 1.0909
Разветвление с шестичлепном кола-
простое 1,5560 112,8656 2470,4850 1.2344 113.1267 3061,5552 1,2706
4 53и7 124.6332 3819,4942 1 3044 1 : .г>289 2405,6012 1 1,2375
нис-\,2 3,6537 126,7920 2640.9182 1,2462 130,5289 2105,6012 1,2375
гпраяс-1,2 2,9896 128,1617 2189,0807 1,2193 130,5289 24 0 5 6012 1.2375
«ис-1,3 4.7228 125,9626 3032,2880 1,2601 130,5289 24 05,6012 1,2375
транс-1,3 ,3,8571 127,3311 2403.6929 1.2294 130,5289 2405.6012 1,2375
цис-] ,4 3,8571 127.3311 2403.6929 1,2294 130.5289 2405,6012 1.2375
транс-1.4 3,4805 126,8064 2616,9819 1,2473 130,5289 2105,6012 1.2375
Поправка на разветвление < s ароматических углеводородах
Двойное рэтпетпленис'
1.2 положение 2,2108 93.1940 1137,6065 1.1076 93,8766 1381,8801 1.1442
1,3 положение 0,4109 94.1667 1266,8220 1.1287 93,8766 1381,8801 1,1442
1.4 положение 1,0741 93.3095 1414,2979 1,1428 93,8766 1381,8801 1.1442
Тронное разветвление:
1,2,3 положение 3.2258 106.7469 1416,3668 . 1.1311 108,0631 1496,1891 1.1513
1,2,4 положение 3,7823 105.6478 1513,4331 1,1414 108.0631 1496.1894 1,1513
1,3,5 положение 1,4321 107,5030 1482.6086 1,1443 108.0631 1496,1894 1,1513
Специальная поправка > на несколько первых групп — СЯ2 в нормальных рядах
Для первых трех —СН2 в пара- финах:
первая —СН2 —1,6075 59,4196 653,8562 0,9992 57.8390 779,2506 1,0174
первая и вторая —СН2 —0,5912 74,1066 745,5631 1.0220 74,5838 694,6245 1,0053
первая, вторая и третья —СН2 £ 1 —0,3156 89,9889 750,0491 1,0258 91,2438 652,7659 0,9996
110,6626 1065,8703
212
ТАБЛИЦА 7.3. Групповые составляющие для расчета идеальногазовой
теплоемкости по Рихаии и Дорэсвейми [26]
Гтугтпа | а Ъ 10= 1 .... d 10»
Группы - СНа алифатических углеводородов 0,6087 2,1433 —0,0852 0,01135
- (ilia 0,3945 2,1363 -0,1197 0,002596
— 0,112 0,5266 1,8357 —0,0954 0,001950
—ё—н -3,5232 3,4158 -0,2816 0,008015
-i- -5,8307 4,4541 —0,4208 0,012630
н —
\.=сн, 0,2773 3,1580 -0,1918 0,004130
х-сн, -0,4173 3,8857 —0,2783 0,007364
н н
/с”с\ -3,1210 3,8060 —0,2359 0,005504
II
0,9377 2,9904 —0,1749 0,003918
н
\-cz / \ -1,4714 3,3842 —0,2371 0,006063
/с-с\ 0,4736 3,5183 -0,3150 0,009205
н
с=с=сн2 2,2400 4,2896 —0,2566 0,005908
\=с=сна 2,6308 4.1658 —0,2845 0,007277
н н -3,1249 6,6843 —0,5766 0,017430
213
Продолжение
1 с 1-н \
I рЦППЫ apo>ia/,ui' ясских i/’.кьодородов
— 1.4572 1,9147 -0,1233 0,002985
-1,3883 1,5159 —0,1069 0,002659
0,1219 1,2170 —0,0855 0,002122
Составляющие, обусловленные образован! w.« кольца
Трехчленное кольцо -3,0^0 - 0,0300 0,0747 — 0,005514
Четырех членное кольцо -8,6550 1,0780 0,0425 0,000250
Пятцчленное цолыьг
пентан - 12,2850 1,8609 --0,1037 0,002145
пентен -6,8813 0.7818 -0,0345 0.000591
Шестичленное колрио
гексан -13,3923 2,1392 -0,0429 —0,001865
т ексен - 8.0238 2,2239 -0,1915 0,005473
Кислородсодержащие группы
-ОН 6,5128 —0,1347 0,0414 -0,001623
-О - 2,8461 —0,0100 0,0454 -0,002728
11
—с=о 3,5184 0,9437 0,0614 —0,006978
у-о 1.0010 2,0763 -0,1636 0,004494
О
о- н 1,4055 3,4632 —0,2557 —0,006886
о
_сУ 2,7350 1,0751 0,0667 -0,009230
'о-
-3,7344 1,3727 - 0 1265 0,003789
2i t
Продолжение
1 < 10<
с - Азотсодержащие группы 4,5104 0,5461 0,0269 -0,003790
—N = C 5,0860 0,3192 0,0259 -0,002436
—nh2 4,1783 0,7378 0,0679 —0.007310
411 / -1,2530 2,1932 —0,1604 0,001237
z _ —3,4677 2,943,3 -0,2673 0,007828
«7 2,4458 0 3436 0,0171 —0,002719
—NOS 1,0898 2,640! -0,1871 0,004750
-SH Серусодержащис группы 2.5597 1,3347 -0 1189 0,003820
-s- 4,2256 0,1127 —0,0026 —0,000072
4,0824 -0,030' 0.0731 —0,006081
-8O3H 6,9218 2,4735 0,1776 - 0,022445
F Галогенсодержащие группы 1.4382 0,3452 -0,0106 -0.000034
-Cl 3,0660 0,2122 —0,0]28 0,000276
—Br 2,7605 0,4731 -0,0455 0,001420
—I 3.2L5I 0,4901 —0.0539 0,001782
215
i
i
5315 У I
IP&15SS1
О
ssgplg fs5i-||-gfi|sgg-S-|§s-’-Ss-ss JJ| I ||l
SS|5f-ll-
I
i
| S § 2 s 1 а г 1
И
!55|!h||S§535pS55S53
sBigsi?
fSsIgslHssisSpsSSSss
=
8
sS555s55-s
51
as-sssgg
!5??И?!!5§^3|Ш5355 L
5-!-l;-ss:-s-g
si
SS5fsH
gS5sg?-sIlssS§’-§§s=-&§S:-
ss555-;-5:-|
5351§S3
l&Bs-S^sigSS-sssfSss-ssSs
У
2
=
216
J йр=д; ;SH3!!«b j
fflnhilBB OffiflffiffiffiJriOl
217
5
i
I
П родолжение
ГР>п^-’ днц!8. ь ки а > мол ti У °С98, , Ср, кал/(моль*К) прп
400 К 5С0 К бсо к 803 К 1000 к.
300 к '
Поправки на группы расположенные рядом
Алкан (roui) 0,80
Алкен (гои<) 0,50
Цис 1.00 а) 4) — 1,34 -1,09 —0,81 —0,61 —0,39 —0,26
Орто 0,57 - 1,61 1,12 1,35 1,30 1,17 0,88 0,66
.г- Ср, кал МО’ь* К) при
Ко.-ьно (о] Р, С) кк ат.моль кал/(моль, К) 1 300 к 1 100 к 500 К соо к ыю к Ю0> к
Поправки для циклических соединений
Циклопропан (б) 27,6 32,1 -3,05 —2,53 —2,10 —1,90 —1.77 — 1,62
Циклопропсн (2) 53,7 3,3,6
Циклоб^тан (8) 26,2 29,8 —4,61 —3,89 —3,14 — 2,64 — 1,88 — 1,38
Циклобхтен (2) 29,8 29,0 —2,53 —2,19 — 1,89 —1,68 —1,48 —1,33
Циклопснтаи (10) 6,3 27,3 —6,5 -5,5 —4,5 —3,8 —2,8 — 1,9
Циклопентен (2) 5,9 25,8 —5,98 —5,35 —4,89 —4,14 —2,93 —2,26
Циклопентадиен 6,0 28,0 —4,3
Циклогексан (6) 0 18,8 —5,8 — 4,1 —2,9 — 1,3 1,1 2,2
Циклогексен (2) 1,4 21,5 —4,28 —3,04 — 1,98 -1,43 —0,29 0,08
Циклогеитан (1) 6,4 15,9
Циклооктан (8) 9,9 16,5
Нафталин 8,1
лпродюдержащие соединения
СО—(СО) (Н) —260 6,72 7,83 8.90 9,89 11,43 12,12
СО—(СО) (С) — 29,2 5,46 6,32 7,16 7,87 9,00 9.76
СО—(О) 1Сй) —32,5 5,97 6,7 7,41 8,02 8,87 9,36
СО-(О) (Св) - 32,5 2,18 2,75 3,98 5,03 6,29 7,06
СО—(О) (С) —35,1 4,78 5.97 6,70 7,40 8.02 8,87 9,36
СО-(О) (Н) —32,1 34.93 7,03 7,87 8,82 9,68 11.16 12,20
СО—(Cj) (Н) —31,7 7,03 7,87 8,82 9.68 11,16 12,20
СО—(Св)2 —38,1 5,26 6,Л 7,67 8.48 9,62 9.85
СО—(Св) (С) —30,9 5,68 6,92 7,70 8,36 9.39 9,76
СО—(Св) (Н) —34,6 6,40 7,72 8,91 9,85 11,49 12,09
СО- (С)2 —31,4 15,01 5,59 6,32 7,09 7,76 8,89 9.61
СО (С) (Н) —29,1 34,93 7,03 7,87 8,82 9,68 11,16 12,20
СО—(НЦ —26,0 53,67 8,47 9,38 10,46 1 1,52 13,37 14,81
О-(Св) (СО) —32,5 2,06 2,70 3,11 3,42 3,88 4,18
о-(СОЦ — 50,9 —0,41 1,78 3,20 4,00 5,13 5,85
О—(СО) (О) — 19,0 3,7 3,7 3,7 3 7 4.2 4 0
о (СО) (Са) —46,9 1,44 2,98 3,98 4,49 4,97 5,20
О- (СО) (С) —44,3 8,39 3.90 3,61 4,19 4,62 4,99 4,82
О- (СО) (Н) - 58,1 24,52 3,81 4,98 5,80 6,34 7,19 7,75
о- (О) (С) (-4,5) (9,4) (3,7) (3,7) (3,7) (3,7) (4,2) (4,2)
о- (О)2 (-19.0) (9,4) (3,7) (3,7) (3,7) (3,7) (4,2) (4 2?)
•) Нели одна из групп представляет собой третичный бутил, то поправка ха цис-положен не составляет 4,0. тичиими бутильными, то поправка на цис-положение составляет 10,0. Если должны вводиться две поправки i •> Зиаченве составляет 1,2 для 2-бутен а. но равно нулю для других дггенон и 0, о для трненов 1) Число и скобках рядом с каждый кольцом есть число симметрии Если обе - руины по обе сторон ы
•) О составляющих ДЕ для других ко.сьцеиых структур см работу Chem. Rev., 69 : 279 (1464)
Продо мнение
К □.'! Ы( (1 |<Г) °* Ь 1 ДА,° , ккал/мсл ь Д.У° , кал/( моль* К) S- - ; ( МОЛЬ К > ПО1Г
за» к 400 К I 5ои к 600 К 800 К Ю00 К
0-(0) (Н) — 16,27 27,85 5,17 5,79 6,28 6,66 7,15 7,51
О О2 —32,8 Ю,1 3,4 3,7 3,7 » 3,8 4,4 4,6
О—(Q) (С) —31,9 9,7 3,4 3,7 3,7 3,8 4,4 4,6
о-(ед2 —21,1 1,09 1,22 1,50 1,99 2,85 3,51
О—(Св) (С) — 22,6 3,4 3,7 3,7 3,8 4,4 4,6
О-(СВ) (Н) —37,9 29,1 4,3 4,5 4,8 5,2 6,0 6,6
О—(С)2 — 23,7 8,68 3,4 3,7 3,7 3,8 4,4 4,6
О—(С) (Н) —37,9 29,07 4,33 4,45 4,82 5,23 6,02 6,61
Cd-(СО) (О) 9,0 5,59 7,00 7,48 7,75 8,02 8,13
Cd—(СО) (С) 9,4 3,73 4,48 5,02 5,40 5,95 6,37
Cd-(CO) (Н) 8,5 3,79 4,90 5,84 6,64 7,80 8,74
Cd-(O) (Cd) 8,9 (4,40) (5,37) (5,93) (6.18) (6,50) (6,62)
Cd-(О) (С) 10,3 4,10 4,61 4,99 5,26 5,80 6,08
с^(О) (Н) 8,6 4,16 5,03 5,81 6,50 7,65 8,45
С^—(СО) 9,7 2,67 3,14 3,68 4,15 4,96 5,44
Св—(О) —0,9 — 10,2 3,9 5,3 6,2 6,6 6,9 6,9
с (Ч-О)2 (Н)2 —7,6 5,60 7,05 8,39 9,68 11,58 12,87
С—(СО) (С)3(Н) —1,8 — 12,0 6,21 7,56 8,00 8,21 9,18 9,63
С—(СО) (С) (11)4 —5.2 9,6 6,2 7,7 •8,7 9,5 11 1 12,2
С—(СО) (С)3 1,6 5,07 6,88 7,81 8,27 8,80 8,62
С—(СО) (Н), —10,1 30,41 6,19 7,84 9,40 10,79 13,02 14,77
1
С--(П)2(С12 —13,6 1,59 3,95 6,20 7,39 7,62 8,48
(О)2(С) (Н) — 16,3 5,06 7,28 9,03 9,41 10,31 10,75
с- (О)2(Н)2 —15,1 2,83 5,06 7.52 9,12 10,32 11 29
С—(О) (Св) (Н)2 —8,1 9,7 3.71 6,27 8,28 9,79 11.79 13,20
с-(О) (Св) (С) (Н) -6,08 5,14 7.30 8,83 9,43 10,23 10 6
С—(О) (Са) (Н)г —6,9 4,66 6,97 8,65 9,88 11,54 12,73
с- (О) (С), — 6,60 —33,56 4,33 6,19 7,25 7,70 8,20 8 24
С—(О) (С),(Н) —7,2 -11,00 4,80 6,64 8,10 8,73 9.81 10,40
С-(О) (С) (Н)2 — 8,1 9,8 4,99 6,85 8,30 9,43 11,11 12,33
С—(О) (Н)э —10,1 30,41 6,19 7,84 9,40 10,79 13,03 14,77
Напряженная струн- дн^ , Со, каломель К) пря
ккал/моль кал/(моль К)| это к 400 к SO0 К 1 600 к 800 к | 1000 К
Поправки на напряженную структуру или кольца
Кислород простою эфира (гош) 0,3 —0,10 —0,89 — 1,10 —0,73 —0,60 —0,23
Дитретичные эфиры 7,8 —3,94 —5,64 -7,15 —8,83 12,04 14 90
Этилеиоксид 27,6 31,4 —2,0 —2,8 -3,0 — 2,6 —2,3 —2,3
Н.С СИ,
Триметиленоксид 26,4 27,7 —4,6 —5.0 -4,2 -3,5 2,6 0,2
СН2
Продо гжение
Напряженная струк- тура или кольца S298' кал/(МОЛЬ- К) Ср, кал/(моль-К) при
300 к 400 К 500 К ь«) к яоо к ' )0l)U к
Тетрагидрофуран Н2С С112 6,7 —4,25 —4,54 — 4,07 -3,55 —3.09 —2,61
Н.С ^Н2 \ / (3 Тетрагидропиран СН™ / \ Н2С сн2 2,2 — 4,28 —3,04 -1,98 — 1,43 -0.29 0,08
Н2С сн2 \о/
1,3-Диоксап сп2 / \ Н2С О 0,9 —2,51 —2,88 -2,28 -1,49 —0,26 0,56
И4; \ zZ 1,4-Диоксан 5,4 —4,16 —4,57 —3 11 —1,88 — 1,09 —0,47
H2CZ ( Н2
1 1 Н2С сн2 \ /
Фуран
НС СН
НС СН
V
Дигидропиран
СН2
Циклопентанон
/С \
Н2С CIJ2
Н2С—сн2
—8,53 —7,19 —5,31
—3,72 —2,26 —1,22
П родолжение
Напряженная ьтрук- С кал/(чоль Ki при
тура пли кольца ккал/моль Кал/(мс*ль*К) 300 К 400 К SCO к | бои К 800 к 1000 К
Циклогексанон О 2,2 —8,10 —5,57 —4,24 —1,9! 0,70 !,97
н,с сн2
1 1 Н2С спа \ / сн2 Сукциновый ангидрид нас СН2 1 1 4,5 —7.90 —6,02 —4,49 —3,58 —3,35 —3,06
// \ / Ч ООО Глутаровый ангидрид СН2 / \ Н2С сн2 0,8 —7,93 —6,04 —4,50 —3,59 3,35 —3,07
// \ / ^ ООО Малеиновый ангидрид 3,6 —5,12 —3,38 —2,02 —2,19 —0,37 —0,0!
С С // \/=5 ООО
| ккал моль кал/(м<>л1. Ь 1 чю К 40(1 К 1 .1 (VO "1 Ki II fi.'ii i\ | I'.ni' i\
; | ьЫ1 К |
C-(\)(Hi3 — 10.08 30.41 Азотсодержащие соединения 6,19 7,84 9,40 10,79 11,02 14,77
С—(N) ((') (Hi2 —6,6 9,8 5,25 6.90 8,28 9,30 11.09 12.31
С— (\) (С)2(11) —5 2 — 11,7 4,67 6,32 7,64 8,39 о,,->6 10,21
с-(\‘) (Os —3,2 —.34,1 4,35 6.16 7,31 7,91 х.4О 8 50
\ (С) (Hi3 4,8 29,71 5,72 6.51 7.32 8,07 ".И 10.47
\-(С)2(Н) 15.4 8,94 4.20 5.21 6,13 6,83 7,9(1 “,65
- о 24,4 —13,4(1 3,48 4,56 5.43 5,97 '1,56 J JK
N-(М) (Н), ] 1,4 29,13 6,10 7,38 8,43 9.2.’ 1О.а4 (1.32
N-(М (О (II) 20,9 9.61 4,82 5.8 6,5 /,0 7,8 6,3
\'-(N) (СЦ 29,2 —13,60 1,36 2,50 3,31 3,87 4 G2 4.0fi
1\-(М IC..J (Н) 22,1 3,28 4,05 4,75 5,Я 6,28 В,91
N/—<Н) (16,3) (12.3) 2,95 4.58 6,45 7.71 о, и 9,92
N/-(С) 21,3 2,48 3,34 3,95 4.'-'0 4.59 4,60
М/—(Сл) 16,7 2,60 3,22 3,81 4.22 4,79 3,12
М- (Н) 25.1 26,8 4Д8 4,89 5,41 5 94 6.77 7,42
N 4—(С) 32.5 8,0 2,70 4,10 4,92 5,34 5,69 э,71
Ь.-(Сл) (И). 4.8 29,7] 5,72 6,51 7.32 8,07 9,4] 10.4/
N—(Сл) (С) (11) И,9 3,82 4,89 5,71 6,28 7, J9
N—(Св) (С)2 26,2 0,62 2,02 3,27 4,13 5,23 5,59
Т > X , п р ед. 1 я н; ;>.ет euCoil азот с дву мя связями л нмия .i\; Ny - ((.предсiапл нет собой пиридины.'Ь(и атом а юта N , 11 ||рдс । т । i;:>n'T соСи
азот с двоПаой сви -ью л а юсосдинсн няк Для орто в пар а-чамешенни в и н ридиьс следует доб.ц.л ч । ь к Д/Zj зцичепче i .а I кал,-ми и
Предо 7ЖСН1
I 1'1 uir;i 71 5 208’ С°. кал (моль К) при
К| эл.молс, 3)0 к 400 К 500 К | био К 80(1 к | Iоьо к
N-(Cb)2(H) 16,3 2,16 3,12 4.13 5,10 6.76 7,88
Cb-(M —0,5 —9,69 3,95 5,21 5,94 6,32 0,53 6.56
23,0 2,12 4,18 5.51 6 77 6,86 7,05
CO—(.XI) (H) - 29,6 34,93 7,03 7,87 8,82 9,68 11,16 12,20
CO—(N) (C) —32,8 16,2 5,37 6,17 7,07 7,66 9,62 11 19
X-(CO) (H), — 14,9 24,69 4,07 5,74 7,13 8,29 9,96 11.22
M—(CO) (С) (I!) —4,4 3,9 3,87 5,08 5,95 6,76 6,87 6,54
-X—(CO) (C)2 1,83 3,79 5,24 6,19 7,И 7 42
N-(CO) (Св) (H) 0,4 3,03 3,91 4,60 5,58 6,23 6,32
N—(CO)2(H) — 18,5 3,59 5,54 6,70 7,39 7,95 8 19
X—(CO)2(C) —5,9 1,07 3.10 4,31 5,00 5,48 G.47
X-(CO)2(CS) —0,5 0,98 3,06 4,23 4,85 5,28 5,29
C—(CIS) (C) (H)2 22,5 40,20 11,10 13,40 15,50 17,20 19,7 2! 30
C-(CN) (C)2(H) 25,8 19,80 11,00 12,70 14,10 15,40 17,30 18.60
C—(CN) (C)2 29,0 —2,80 8,65 11,16 12.89 14.05 16,19
U—(C1NJ2(L)2 28,40 14,72 17,79 20,00 21,61 23,78 24,96
Cd-(CX) (H) 37,4 36,58 9,80 11,70 13,30 14,50 16,30 17,30
Crf-(CN) (C) 39,15 15,91 9,74 11,28 12,48 13,26 14,45 14,93
Cd-(CK)2 84,1 13,60 16,55 - 18,68 20,25 22,34 23,59
Cd—(NO)2(H) 44,4 12,3 15,1 17,4 19,2 21,6 23,2
Cb-(CN) 35,8 20,50 9.8 П,2 12,3 13,1 14,2 14,9
63,8 35 10 10,30 11 ,л0 12,10 12,70 1 ! (.11 11.30
C-(NOJ (C) (H)2 — 15,1 48,4 12,59 15,82 18,52 20,65 23,79 25,90
K C-(NO2) (C)2(H) — 15,8 26,9 11,99 15,21 17,72 19,6] 22,18 23.70
C—(NOj) (Оз 3,9 9,89 13,34 15,86 17,62 19,41 20.86
C-(NO8)2(C) (H) — 14,9 17,32 22,82 27,07 30,21 34,35 36,83
O-(NO) (C) —5,9 41,9 9,10 10,30 11,2 12,0 13.3 13,9
O-fNOi) (C) — 19,4 48,50 9,54 11,54 13,26 15,60 16,39 17,38
Ср, .ал (моль-К) при
Кольцо ЗоуЦ,
ккал,моль кал'(моль-К) зоо к 400 к 500 к | 6(М1 К 8Г>0 К 1С(Ю К
Поправки на наличие кольца азотсодержащих соединениях
Этиленимин 27,7 31,6 —2,07 —2,18 —2,17 - 2,05 --1.94 —1.88
H2C CH2 \^z--
u Азетидин 26,2 29,3 —4,73 —4,52 —4,08 -3.61 —2.66 0.01
сн2 О \
.X н
Пирролидин Н2С—сн2 6,8 26,7 —6,17 —5,58 —4 80 — 4,00 —2,87 —2.17
сн2
П родм.'Нл'нш
о < KU.I <мч. я>- К) 1 Ц 11
' I
ла ч | too к । аоо к | 1 <яю к
Пиперидин СН2 1.0 —0.56 0,37 1,08 1.56 1,' 1 —0.46
11гг Ъп HSC сн2 н CjH12N2 V —9.44 —8.70 —7.00 -5,36 .3 21 — 1 84
||„С СИ. СИ, II,) (11. сн \ Сукциничид 8 5 2,1(> 4,08 0.1-1 8,01 9.11 ч.77
HSC —CH,
/! '
О \ О
н
I
,. 1 j мчгт-МОЛЬ | к 1л (Mo-ib• К) 1 „ । 1 111 1 11
100 к | 400 к | 100 к. | i.ou к; | SW к | .ООП к
С—(F)a(O — 158.4 42,5 Галогенсодсржищие группы 12,7 15,0 16,4 17.9 19.3 20,0
c-(F)2(h) (о — 109.3 39,1 9.9 12,0 13,7 15.1 16.7 17,8
с—(F) (Н|,(С) — 51,5 35,4 8.1 10.0 12,0 13,0 15.2 16,6
С-(F)2(Q2 —97.0 17,8 9,9 11.8 13.5 14,4 16.1 16.6
С—(F) (Н) (С)2 — 49.0 14,0 7,30 9.04 10,47 1 1.56 13,10 14.01
С—(F) (С)з —48,5 6,80 8.86 10.20 11.16 12,43 12.72
C-(F)2(C1) (С) —106,3 40,5 13,7 16,1 17,5 18,6 19,8 20.4
С-(C1)S(C) —20.7 50.4 16.3 18,0 19.1 19,8 20.6 21,0
С—(С1)а(Н) (С) (-13.9) 43,7 12.1 14,0 15,4 16,5 17.9 18,7
С-(С1) (Н)2(С) —16,5 37,8 8,9 10,7 12,3 13,4 15.3 16,7
С-(С1)2(С)2 —22,0 22,4 12,2 14,88 15,95 16.48 16.96 17,02
С—(С1) (Н) (С)2 —14,8 17,6 9.0 9,9 10,5 11,2 13 9 14.6
С—(С1) (С)3 —12,8 —5,4 0,3 10,5 11,0 11,3 12,4 12.7
С—(Вг)3(С) 55,7 16,7 18,0 18,8 19,4 19,9 20,3
С-(Вг) (Н),(С) — 5.4 40,8 9,1 11,0 12,6 13,7 1 5 5 16,8
с—(Вг) (Н) (С), —3,4 8.93 10,66 11,96 12,84 14.05 14.72
С—(Br) (С), — 0.4 —2,0 9,3 11,0 11.5 12,3 13,3 13,3
с—(1) (Н)2(С) 8.0 43,0 9,2 11.0 12,9 13,9 15,8 17.2
с—(1) (11) (С)2 10,5 21,3 9,2 10,9 12,2 13,0 14,2 14,8
С-(1) (С) (Cd) (Н) 13.32 8,13 10,02 11,82 12,6 14,0 14,9
c-(l) (Q) (Н)2 8,19 8,82 10,91 12,97 14,04 15.95 17.34
Продолжение
1 pvuca S->9U' k,i n. моль, K) C;|, кал (моль К) «ji'ii
100 к 100 к (>|Ю к «по к 1( 00 к
с- (1) (C);i 13,0 0 9,83 11,75 12,92 13,4,5 13,79 13.60
С-(Cl) (Вг)(Н) (С) 45,7 12,4 14,0 15,6 16,3 17,9 19,0
N—(Ь)2(С) — 7,8 8,25 10,13 11,52 12,80 14,37 14,98
C—(Ci) (С) (0) (Н) — 21,6 15 9,85 10,41 11,05 1 1,57 12,45 13,14
С—(!)2(С) (Н) (26.0) (54,6) 12,69 14,78 16,21 17,12 18,31 19,03
с—(I) (0) (11)2 3,8 40,7 8,22 10,49 12,23 13,55 15,35 16,57
О—(На — 77,5 37,3 9,7 11,0 12,0 12,7 13,8 14,5
Cd-(C1)2 — 1,8 42,1 11 4 12,5 13,3 13,9 14,6 15,0
Crf—(Br)2 47.6 12,3 13,12 13,9 14,3 14,9 15,2
Crf-(F) (Cl) 39,8 10,3 12,6 13,3 14,2 14,7
Crf—(F) (Brl 42,5 10,8 12,0 12,8 13.5 14,3 14,7
Or—(Cl) (Br) 45,1 12,1 12,7 13,5 14,1 14,7 14,7
Fa—(F) (H) —37,6 32,8 6,8 8,4 9,5 10,5 11,8 12,7
Cd—(Cl) (Hl - 1,2 ,35,4 9,2 10,3 11,2 12,3 13,1
Crf—(Br) (H) 11,0 38,3 8,1 9 5 10,6 12,4 13,2
Crf—(!) (H) 24,5 40,5 8,8 10,0 10,9 11,6 12,6 13,3
C^(Q (Cl) —2,1 15,0 8,0 8,4 8,5 9,0 9,2 9,4
Cd-(C) (!) 23,6 8,9 9,2 9,1 9,4 9,5 9,6
Q-(Q) (Cl) — 3,56 8,3 9,2 9.4 9,9 9,9 9 9
Crf—(С^) (1) 22,14 9,2 9 9 10,0 10,3 10.3 10,1
C.-(C1) 33,4 7,9 8,4 8,7 9,0 9,4 <9,6
С—ГВг! 36,1 8.3 ч,7 9,0 ,, -
С, । 1) )7.9 8,4 « 8 0,,( ч
Св— (Г) — 42,8 16,1 6 3 7,6 8,5 9,8 10,2
Св-(О) — 3,8 18,9 7,4 8,4 9,2 9,7 10,2 10,4
Сь- (Вг) 10,7 21,6 7,8 8,7 9,4 9,9 10,3 10,5
Св- (1) 24,0 23,7 8,0 8,9 9,6 9,9 10,3 10,5
С-(Су) (Р)3 — 162,7 42,8 12,5 15,3 17,2 18,5 20,1 21,0
С—(Св) (ВГ) (Н)2 — 6,9 9,29 11,10 12,47 13,69 15,59 1671
С—(СД) (I) (Н)2 8,4 9.78 11,56 12,90 14,08 15,88 16,91
С—(С1).(СО) (Н) — 17,8 12,8 14,75 15,85 16,65 17,93 18,56
С-(С1)Э(СО) — 19,6 17,0 18,75 19,55 19,95 20,63 20,86
СО—(О) (С) — 30,2 8,87 9,44 10,24 11,08 12,5,3 13,59
1 < , кал.7ма.чь К) ipn
группн ' „КОЛ.МОДЬ кал (моль* К) 30(1 к 1 «0 К 300 К | (.(>0 к «00 К июо к
Поправки на соседние с галогенов группы
Орто (F) (Р) 5,0 , - . о 0 0 0 0 0
Орто (Cl) (С1) 2,2 . . . —0,50 — 0,44 -0,55 —0,,5( —0,28 —0,02
Орто (алкан) (галоген) 0,6 . . . 0,42 0,44 0 28 0,19 0,12 0,1 1
Цнс (галоген) (галоген) 0,3 - , —0,19 —0,01 —0,03 —0,17 0 — 0,03
Цис (галоген) (алкан) — 0,8 . , - —0,97 — 0,7(1 0,53 —0,47 —0,24 —0,1,3
< Гб< 21 ‘81 28’91 10*01 88'6 6'88 8(j) (Sl-э s
>3'8 OS‘8 21'8 31'8 60'8 £9‘2 03'18 It'l — (0Э) (I I) —s
19'6 68‘8 92'2 60'2 38'9 69‘5 8t‘5I 95'18- (D) (S)-CO
£0'91 IZ‘Sl CZ'tl GS'EI 05*11 18'6 53‘9Z- P'J) (5os)—?OS
96'91 98*51 f-6'tl SG'fl №‘!l 83*89- -eos
36'51 39'4'1 IS'tl 5>‘£l OS' и >6'6 63'62 — (*□» (O)-’OS
0'91 81'SI zz'ei 36'31 tri I 81'01 06'03 tZ'6'J- ’(D)-’OS
88*51 88*51 8641 se'8i 26* 11 35'11 5S'8Z- ”(рЭ)-гО8
36*51 ZL'Z\ I9'tl £8'81 OG'II 68'6 8S'§9-- (7Э) (1'Э)_го5
29'5 88‘9 09‘t 86'8 ire 98' 1 Zt'tl (гО$-| (Э)-РЭ
29'8 28*2 >8'9 £'6‘S 2O‘t VO'S £5'31 (гО5)
It'S SI *> 99'8 u's 29*3 8'3 (гО5>-эЭ
oo'u 6«* 11 62'6 83'8 25'9 11'8 >s*s- г(И) fOS) (ЯЭ1 -j
63'VI It‘3 1 20'01 29‘8 66'9 00'8 >1'2- г(Н) (гО$) С’Э) —Э
9t'2 16 2 bfr'9 02'5 S£'t 38'3 19'0- (=OSIE(">) -3)
08'01 >9'6 4V‘h 90* L 55*9 3t't 39'3 - (Н) (s0s)’O)-9
SI ’tl 93'31 26‘6 09'8 80'2 88‘S 89‘Z - г(н) (гО5> (Э)-Э
22‘tl 50'ei 62'01 0>‘6 ts‘z 61’9 lt'08 80'01 - 8(II) (W -9
£3 1 1 St’'11 St'll 02'6 60‘6 52‘S o'si —
ZI‘l 1 86'01 62'01 09*01 80'01 R«‘R 01'81 I t‘t 1 г(Э>—OS
H'S 96*> S'I V 89‘8 VI '8 Z9'8 t'z (OS)-w )
83 31 .'<>‘01 S5‘6 >6'9 9£'6 (H'V ‘’till IQs) - i
I, ' u1, 1 1b I >-£' 1 ')() s LU 1
ггйгг S6*or 91*6 96*2 3f9 ST» err- Ull 4jyj IJT "J
2t'tl 30'81 62'01 0t*6 t8‘Z 61*9 lt‘08 80*01 — 8(H) (OS)-D
t'S 8'5 6 S 1*9 0‘9 Z't 98'81 >0'8 5ts)—S
OI‘S 82‘t 51 't 32'8 68'8 68'3 9‘tl (ffD) (S)—S
31*5 88'5 19'5 IS'S St'S 83'5 28‘3I 90*2 0) (s)—S
l2> 08'8 t2'3 t3‘3 10'3 00'3 06'55 'PJJ-S
00'S 39'V tO't 12'8 68'8 30 8 91*61 (Э) (3Э)-5
82'6 t6 L 63‘9 85'9 89'5 6Z‘t 8t'9I ts't— 'F3)-S
2S 5 ZZ‘S 95'9 80*5 33‘t Z6‘6 (П) CD-S
81'5 It'S ZO‘9 30'5 96't 66't 51'81 IS* 11 ’b)-$
>8'Z 6б"9 £0‘9 Z9*S 93'5 31'5 99'31 96*11 (H) ra-s
11'2 08'2 82'9 19'9 05'9 98'5 82'58 39‘t (H) (Э1-s
00'5 I t't 60't 88'8 29'8 OS‘8 lt‘3l- 86*01 (S)U)-D3
St‘8 59’2 09'9 18'9 80'5 9lt 0'8 95*8 (s) (H)—?D
06*9 06'9 09‘9 03'9 08'5 06'8 05'01 8'1- (s)—
6>3‘VI lt‘3l 20'01 Z9‘8 66‘9 00'9 9F9- (s)5(h) О-Э
0l‘8I 86‘I I SI ‘or 02'8 92*9 11 t £Z‘t— (S)s(H> (*э)-э
01'8 52'8 51'8 St‘2 23'9 25't lt't£— 55'0— (S')e('Jl—э
29'01 06‘6 69'8 82'2 15'9 58‘t 38'11 — t9‘3— (s) (H)’(3)—o
51‘tl 9o‘3I 26'6 09‘8 8O'Z 88*5 88'6 59'5— (s>s(H) (3) -Э
2Z‘tI 30'81 62*01 Ot‘6 >8'2 61 ‘9 lt‘08 R0‘0l— (s)e(H>-Э
X 6<K,1 X 1)1)8 я oo" X 000 >1 00 t x ooi (_'{ 4L'OlV)/iri' 4 •TUCK,
jda (X neont/irsn' °э
SlWMl'OQOdU
П род/'Л'М'ени
10 W
23b
Решение. Из табл. 7.3 находим:
1 р 10' . ю« 1 </•1
-СПз 0.6037 2,1433 -0,0852 0,0011.35
Z
< h (' inc' — 3,12(0 3.8060 0,2359 0,005504
('-( х - | -171-1 8,3842 - 0.2371 0.006063
hz
4,0824 - 0.0301 0,07.31 -0,006081
0,0937 9,3031 -0,4851 0,006621
Таким образих.
ПР1
с5 ТАБЛИЦА 7,5, Сравнение расчетных и литературных значений
* теплоемкости веществ в идеальногазовом состоянии
Веществ. | / р Kt ’Tlirpi'l 11II<J<_Т|, 2J 11*111 составляю 1 5Й.“Я? I ”
Лроп,и1
«-Гептан
2,2,3-Тричетил1’лт<ц|
транс- 2-Бутсн
3,3-Дим ет ил-1-б; теп
3-.Метил-1 _3-бу । адиен
2-Пептии
л-Эти.чтолуол
2 >,М етил н афтал и п
иис-1.3’ Диметид циклопен тан
2-Ьутанол
п-Крезол
Изопропиловый эфир
rt-ДиоКСЗН
— 0,8
3,(1
ОД
0,2
1.0
0,1
6,6
4,3
-2.0
-1.2
-ОД
0,4
— 0,5
-2,2
- 0,4
0
0,1
1,6
,31
1Д
0,6
I
Т| > 11 ч сти-1 ачпп
Проппонитрил
21[итробутан
3 Пиколин
1.1-. /ифчорэтан
Ъктафторциклобутан
Врочбеизол
1 рихлорэтилен
Бхтилметнлсу льфид
2- Метил-2>бутантиол
Проямлдисульфид
З-Метиитиофсн
'?1),s г IG 6(0 0 '',1
SOO .11,01 0 -6.3
298 21,93 0,'l 0 0
800 45.62 0 0
29» 17,4b >t) 14 4,0
800 32,14 Ц8 —7,6
29» 29,51 **) 0,9 2.0
«00 59,44 0.2 0
298 23,80 •tj ’) 5.0
800 58, J 2 -0,2
298 16,24 27' 2 7 5 3
800 29,09 5 1 0Д
298 37,32 -7д' -6Д -5.9
800 58.05 -6.6 11
298 23,35 3) 2 3 —4,9
800 47.78 0 5 1 -j
298 /9,17 '2.8 O.’( — 9,0
800 26,94 -0,1 -4,3
298 33,64 'o' 0 2,2
800 66,53 — 1.0 -3,6
298 34,30 •— 1 9 0 - 0.3
800 66,28 -0,2 0,7
298 44,30 0,4 0,2 0,9
800 83,7 0 — 0.3 4 I
298 22,67 io' 2,0 4 5
800 45.95 — 1 9 2.0
Число веществ
Средняя погрешность
и Чстод Тинха >1 др применим только к углеводородам.
Phiu'ihi’ И< таб.1 7 4 выриснвас.м дужные
гр\гпов^е состав
С—(С) (Н),
13,(i2
11,07
К.72
7,30
1.07
Таким образом. С,', (800 К) = 66,|5 к<м''(мо.1ь-К).
Слалл 1! др. (331 приводят значение 66,23 ки.'11(молъ• V).
Обсуждение и рекомендации, В габл. 7.5 лается сравнение меж i\ расчетным)
и литературными значениями С’ при 298 и 800 К. Очевидно, что метод Бенсона,
ратурах.
В этом разделе не дастся исчерпывающего обзора большиеств i методов оас-
Оечор ipy гнх методов сделан в предыдущем издании этой клип) 123 J пврядс
Других киш по термохимии [9, 14, 19. 41 ]. Методы, представленные и настоящем
издании, стит.ногся наиболее точными и общимк для инженерных применений.
7.4. СТАНДАРТНАЯ ТЕПЛОТА ОБРАЗОВАНИЯ
со2 (г 1
Н,0 (ж )
HF (г.)
НС1 (Г )
НВт (г )
-94,051 HI (г.) 6,20
-68,315 80а (г) -71,00
—64,20 H2SO4-115НгО (ж ) _212,192
-22,|0 П3РО4(кр) —305.7
—8,70
= 1(0-11) 2 (0-С) 1- (С—С) + 8 (С-Н) = (4) (3,27.) -
•|-(2)(7.2о) [ 2.73 + (8) । — 3,83) —0,11 ккал/мо.ль
Сталл |33] приводит значение _0.78 ккал!ш>ль.
Метод Бенсона. Метод групповых составляющих, предложенный Бенсоном н
,| др |4, 6, 111, описин в разделе 7,3, а в Табл 7.4 приведены групповые составля-
ющие 'ыпя определения широкого круга соединений Техника расчета ил-
по'трирустся примером 7 6. расчетные и литературные значения сравниваются
и тлбд, 7.8. Расхождения между h-imii составляют около 1 ккал/моль.
Пример 7.G. Вычислить геп-нгу образования метилмегакрилиа При 2‘)8 К,
act, иьзуя метод Бенсона
Решение Структурная формула соединения
СН2-С(СНа)-СОО-СН3
'> Fcth принято, что продуктом сгорания является вода (жидкость), то опре
u-.i'iCcioe апачеице теплоты сгорания ni.itne, чем в том случае, когда продуктом
rnpauii'i считюгся пода (нар). Как привяло, в литературе приводятся бблышк
la'ic'tilH
241
и i pi 11повые дели нт табл 7 4
С-(О) (НУ,
О (СО) (С)
СО- (01 (С„()
'.d (<*) (СО)
-10,08 •'
Бенсон и Др. | G ] пртодяг экеперимептатьное значение —
= —79,3 ькал/моль.
Методы Франклин? и Вермы—Дорасвейми, Meio.nt р,цче;<1 ХН’ подобные
методам (рупповых составляющих, были разработаны Франклином | [2. .131,
Л также Вермой и Дорэсвейми |40]. В этих работах сказано что оба метода щ>тио
.(НЮТ рассчитывать Х!1^ при раз шчных температурах, но, с другой стороны- как
указывалось и разделе 7,1 значение A исиол ьэущтся для. од ре то тения теплового
эффекту реакции, ко opto'), кдк Это показывает уравнение (7 1.3), может Сыта naif
дсн по значениям Н2 и С°, исходных реагентов и конечных продуктов реакции.
Поэюму в табл 7.6 представлены групповые составляющие ДН^ только для
Пример 7.7. Нслольля метод гр\тюг-ых составляющих. предложенных
Франклином, а также Вермой и Дорэсвеймв. вычислить i//j шщ-1.3-диметил-
Ш1кЛОПЬ)П,1)1<1.
х\ет од
(3) ( - 4,941
Поправка ни кольцо С„
* ТАБЛИЦА. 7 G, Групповые составляющие для расчета , ккал моль
I Onpeae.tettHbie Весчоа т< Дор3 1 ; Яки mi J 11.' ) | Определен:, ыс । ,р7;“’',"-гг
А ,• ч’/юдоруйпьн’ группы -СЦ.( - 10,25 —10,12
1 -СИ; - 1,94 —4.93
-<Л -[.29 -1.09
с о.га '1.80
-СЩ 0.19 6,25
С- 32,24 33.42
С - 27 38 27.31
(П 27,10 27,(0
ZC=C[I, 15 02 15.00
С-СК 20,50 (G.89
ОС ,30,40 \ 24 57
С--Сх 20 10 20,19
н
и н
с-с' (е(1|С> 17,96 18,88
П
’ 1- 17,83 17,83
И
(-С-СН, Г.1,30
Продолжение
Поправь а на образование кольца
' [пклопарафиновое I,пль ю.
5,44
—0,76
Разветвления о парафинах
Боновая цепь с двумя или более углеродными
атомами
Три рядом раеиоложсниые группы —(ill
1 I
Рядом расположенные rpv tmi.i - С— и —ОН
Рядом расположенные группы —С— и —С—
Несвязанная с углеродом лепотой цепи груп-
244
Продолжение
Определенные I Определенные
Вермой и Дорэ I Франклином
свейми [10 ] [12, | ;i I
—ОН (вторичны"i спирт'
—43.9
—ОН (тре'ичный спирт)
—ОЧ (па ароматической группе)
-СНО (аль-icrn i)
С-О (ксточ)
СОО|{ (кислота)
ООО— (сложпып эфир)
О— (простой эфир)
Предо юкение
-NO
—ONO
—ON()2
Алифатические.
- NH2
'Щределеикие
Ь?рмой и Дорэ-
. вс г м и (I")
— 102,6
3,21
13,47
18,94
— i 27 —6,4
8,50
19.21
4,ЙО 3,1
11,17 1(1,6
... 7.»
° .По сравнению с к ре дыду щим методом о о греимущесгвом яшястся си-
нение состоит ил основной группы, которая изменяется замещением другими i руп-
пами. Основные группы, представленные в табл. 7.7, включают метан, цикдопсн-
тан, бензол, нафталин, метиламин, димегидампи, ।рнмчиламин, этиловый эфир
и формамид. Например, для этана основная группа (метан) модифицирована уда-
лением одного агома водорода и добавлением метильной грутны. Первое замеще-
ние мстил ы-ой группой в основной группе называет» я первичным метильным заме-
щением, п значения для него также дань, в табл 7 7- За исключением случаев,
когда основной группой является бензол, нафталин н диклопентан, любое другое
замещение метильной группой в основной еру пне называется вторичным метили
ним замещением Величина вклада в этом случае зависит си типа углеродного
итпмов Обозиачнм буквой Л углеродный <поч. nil котором делается замещение.
1 Ab.'IHIl \ 7,7. Групповые составляющие для расчета
и -S>us 110 Андерсону— Байеру - Ваюону1}
'1етаи
Циклопент.,н
Циклогексан
13снзол
I Гафта, ши
Метиламин
Д11метплах)Ип
Триметиламин
Димсти.товый эфир
Формамид
Саейстоа основной cpmuibi
-17,89
— 18,46
—29.43
|9,82
35,4
-7,8
-10,9
- -46,0
—49,5
44,50
70,00
7|,2«
64,34
80 7
57,7
65.2
63.7
Составляющие первтиюго метильного замещения
-2.50
Метан
Циклспентан
чернее первичное замещение
второе первичное замещение с образованием
- -7 04
1,2 (троне')
1,3 (транс}
последующие замещения, каждое
I(нклогексэн:
увеличение ко.тьц.,. на каждый углерод-
ный игом, добавляемый к колиам
первое первичное замещение вне кольца
Btopoe первичное замещение вне кольца
с образованием
—6,43
6 97
10,35
11,24
4,63
6,43
6,43
6 43
— 10.97
1.28
10,78
1,2 (трат}
- 6.03
1,3 (транс}
1.4 Сцис}
1,4 impanc}
последующие замещения вне кольцу,
каждое
—5.23
7.45
6.59
6 48
7.86
G48
первое Замещение
второе замещение е образованием
1 рстье замощение е образадаипем
-7.66
На'фталин.
первое замещение
второе замещение с образованием
• 7,96
12,08
7,80
9.07
7.81
9,19
10,42
6.66
12.0
8,0
217
ПроИол-кение
Основе ая 1 ру о п,
Метиламин —5,7
Диметиламип бД
Тримстиламип --4,1
ФорМаМид (замещение, пр,- углеродном атоме) - ‘1,0
Составляющие вторичного чети л' ого зачетен1.: ч
1 । -4,75 10,00
1 —4,92 0.18
3 -4,42 9,72
4 -5 0 11,0
1 ь 4,68 10,76
2 ) -6,31 5,57
о 2 —6,33 7 15
2 3 —б 2.5 б’бЗ
2 4 —з’§3 7,46
•> ,5 -8,18 6,72 •
з ) -8,22 2,81
з 9 —7 00 3,87
,3 з —5,Ю .3,90
д 4 —4,94 1,88
,3 j -9,2 1,3
или — В ПрССп,|Х сложных эфи — 7,0 14,4
Замещение водорода в группе - зовании сложного эфчра -ОН при обра- 9,5 16,7
Добавочные поправки д /я углеводородов
Добавочная поправка на д, ,ину каждой боко- вой цепи.
более 2 С в боковой цепи циклолептана -0,45 0 12
более 2 С в боковой цеди циклогексана 0.32 —0,39
более 4 С в боковой цепи бензола —0,70 -0,02
Добавочная поправка па двойную связь
смежные Двойные связи 13,16 -3.74
сопряженные двойные свяги ДВСпнзя связь, смежная с ароматическим КОЛЬЦОМ —4,28 —5,12
в боковой кепи более 5 G - 2 0 —2,65
в боковой цепи более 4 С 1,16 —2.65
Составляющие крстиск I'emvil, ianeinaiOiifi'i проста' ceni'i
32,88 —2,40
30,00 — 0.2)
28 2,3 —0.11
28,39 —1,19
27,40 -2,16
26,72 -0,28
2S,70 —0,66
74 58 — 9.8'j
69,52 —4,10
65,50 -1,97
2-18
Продолжение
l,„^t
Составляющие замещения метильной группы на неуглеводородную
—ОН (алифатическая, мета-, пара-) —32,7 2,6
—ОН (ерю-) —NO, -47,7 1,2 2,0
QPJ 39,0 4.0
-CI 0(для первого CI р
-Вг при углероде); 4,5 (для каждого последующего) 10,0 3,0 2)
—Р —35,0 — 1,0 2)
—I 24 8 5.0 2)
=0 (альдегид) — 12,9 — 12.3
=0 (кетон) — 13,2 —2,4
—СООН —87,0 154
—SH 15,8 5,2
—CeHs 32,3 21,7
-NH, 12 3 —4.8
а буквой В — примыкающий к А с номером высшего типа (см. ниже). Номера
типов следующие:
СНа
СП,
сн
Так, замещение водорода в пропане группой СН, (для образования н-бутана)
представляет собой вторичное метильное замещение типа □'I — 1, В — 2. Вторич-
ное метильное замещение водорода в метильной группе (боковой цепи) толуола
для образования этилбензола является замещением типа А — I, В -- 5.
В табл. 7.7 представлены специальные вторичные замещения, которые слу-
жат для превращения карбоновых кислот в метиловые Н этиловые сложные эфиры.
Даны также составляющие для Двойных или тройных связей и для неуглеводо-
родных групп. Приведенные для этих ipynn значения соответствуют замещен»
метильной tруппы. а це атома водорода. Метод |1.|люстрирусгся примером 7.8.
В табл. 7 8 приведено сравнение литературных и расчетных значений A7/j.
Пример 7.8. Рассчитать Д/Г; п крезола методом Андерсона, Байера и Ват-
Р е ш < о и с. Очевидно, что в качестве основной группы выбирается бензол-
ТогДа толуол ьгштсзируется первичным замещением. Затем образуется п ксилол,
249
7.5. ИДЕАЛЫЮГАЗОВАЯ ЭНТРОПИЯ
Как у казывалск ь в разделе 7 1. Sy является энтропией вещества в идеальио-
। а зовом состоянии при давлении в I итм. связанной с энтропией вещества в идеаль-
но-} пг)ряпг>чс(;ном твердом состоянии при О К Величина Sy не является эчтрокиеи
образования в том же смыс-щ, что V/^. Полезность S2 состоит в том, что она при-
меняется для определения стандартной энтропия реакции посредством ехммиро-
мое умножается на соответствующий стехиометрический коэффициент. Эта мето-
дик/) рлбот'К'гособит, так как благодаря сохранению атомов в химической реак-
ции, втаихшо уничтожаются абсолютные эн-ропии всех участвующих в ней эле-
ментов Кроме того, полагают, что прекращаются изменения энтропии в реакциях
между веществами в идеальноупорядочеииом твердом состоянии при О К, т е.
выполняется третий закон термодинамики Подобный подход нельзя использо-
вать для стандартного теплового эффекта химической реакции, который не равен
нулю даже при О К
Экспериментально величин^ S'' можно определить п<? значениям теплоемко-
стей н тсплот фазового перехода при нагревании вещества от О К до Т. Энтропия S°
может бьть определена также при использовании соотношений, полученных из
стат истичсской механики, если имеется достаточная информация по молекулярной
структуре и спейтрам Для АН’такой подход невозможен Для определения Aff^
при некоторой температуре всегда следует использовать экспериментальные дай
ные по тепловому эффекту химической реакгин или теплоте сгорания. Это значе-
ние Д/Уу может быть пересчитано на другие температуры по уравнению (7 12).
Уравнение (7 5.1) дает равноценное соотношение для расчета стандартной эн*
1 рении реакции отнесенной к опорной температуре 248 К При наличии зна-
чений идеальцогазовой теплоемкости экспериментальных и рассчитанных г,о
одному из методов, изложенных в разделе 7 3, Для определения изменений эчтро-
в этом разделе предлагаются три метода эасчета величины лак указано
выше, зная значения С’р (Т). по уравнению (7.1.5) можно найти AS£ Кроме того,
имея значения (см. раздел 7 4) и С’, с помощью уравнения (7 I 3) можно
Начитать величину A//J-. З.ггем, используя уравнение (7.. 6) м(>жн<)Вычис.'к1Т1.
сгандарттю энергию Гиббса AGJ для реакции, а константа равновесия может
бьпь определена па уравнению
Дб7 - ИТ 1н Л (7 5 2)
С Другой стороны величина AGj может быть прямо вычислена. Для решения
э,оп задачи предложено мало методов. Одна достаточно надежная методика пред
ставлена в разделе 7.6
Для того чтобы определить энтропию образования соединения, следует напи
сать реакцию его синтеза, и тогда AS« будет являться энтропией этой реакции
о=аех[а|П( (7 5.3)
Нанримср, у ироиан,! две — СНЯ группы по концам не, п Каждая имеет ось
симметрии третьего порядка- Вращение этих внутренних групп дает Ощг ~
— (3) (3), равное числу перестановок Итак, рассматриваемая молекула имеет
единственную ось симметрии второго порядка, поэтому rText — 2. Тогда а =
— (2) (З2) = 18. Некоторые дополнительные примеры:
Бензол (6) (2) 1 12
Метан 3 12
«•Крезол 2 3
1,3,5-Трпмсгилбс1пол 2 ,<i 161
| ,2,4-'| риме|илбепЗол ] з3 27
1[иклогсксан (э 1 (j
Метанол 1 з 3
трет Бутиловый еннрт 1 3< 81
Ацетон 2 ,32 18
Уксусная кислотч | з
Анилин 2 1 2
Триметнлачни 3 з3 81
252
ТАБЛИЦА 7 9 Сравнение расчетных и литературных значений
энтропии при 298 К
Отклонение ') при расчете Ю МетоЛУ
<'0СДигЮ|' не 1 5298' кал,'(моль- К1 [33] составляю- щих связей (табл 7 |) Бенсона | (таб.|Л₽7 4) Байера - (т ЛлС°7°7)
1 ipr nju 64 51 0.15 -0,01 0 34
ч-Гептаи 102,27 —0,01 —0,09 -0,70
2,2,3-Триметилбу1ан 91 61 2| 0 18 —3 63
•/ipciHc-2-Бутеи 70Д6 —0 20 0,16 1.01
3,3-Диметил-1 -бутен 82,16 0,41 1,20 0 04
2-,Мстил • 1,3-бут адиен 75,44 1,48 -0,21 -0 44
2-ПентйН 79,30 0 16 —0 06
т-Этилтолуол 95 34 —2,28 -0,22 —0Д5
2-Мет илнафталир 90.83 10 1,22 1 95
иис-1,3-Днметилцикло- 87,67 -26 0.21 0.71
печтан 2-Бутанол 85 81 — 1,90 0 49 —3,61
и-Крезол 83 09 1,09 3,74
Изопропиловой эфир 93'27 3,63 4,95 10
'с Диоксан Метилэтилкетон 71,66 80,81 -19 0,43 0,26 -3,61
Утилаиетат 86,70 0,94 3,23
Гриметпламип 69 02 0.05 0,02
ГТропионитрил 68’50 —0,10 9 53
2-Нитробутап 9[’б2 2 53 — 10
1,1-Дифторэтап 1 >кт аф-| орииклобу । ап 67,52 — 14 —0,22 0,90
95 69 -30 1,|8 -4
Ьромбепзол 77 53 0,34 1,89 1,69
Трихлорэтилен 77 ДЗ 6,23 -0,19 0.13
Ьутилметилсу.дьфнд 98 43 -0 10
2-МстиЛ-2 бутантиол 92 48 2,77 —0,06 -4,87
Нропилдисульфид 118,30 -0,44 0,12
ЦМетилтиофеи 76,79 —0 74
253
5;ч, ^(!(С-||) Н- > (С—С) 2 (< -I) — R 1ио 1 R |( 11 = (6) (12,90) -
(2i (-16,40) (2) (24,65) — 1,987 1’1 ! ? 1.987 1 т 2 — 93 I |Щ,)/(мо,)Ь N)
Литературное значение рдвцо 94.3 кал (моль К) |б].
Метод Бенсона. 1рунговые составляющие приведены в табл. 7.4, а сам мСюд
еиисаи и разделе 7.3, посвященном расчету теплоемкости 11спол1.зозан:1е метода
для определения 3) . иллюстрируется примером 7-10, п в табл. 7.9 сравниваются
некоторые расчетные и дитеразypI(j,|e Значения
Пример 7.10. (leno.t)..ля групповые составлющсе Ьснсона ijs г,(б., 7 4,
вычислит!, значегюе SC,. для метллизопропплдетс'па.
1 Таким образом
|С (О (Ж! - (2) (30 4])
_ (О,ОН) (СО)
(i0.82
С-(СО) (Н)8
Симметрия .
Экспериментальное значение равно 88,5 кал’'(моль-К) [2].
Метод Андерсона. Байера и Ватсона. Эю, аддигнвно-iруши-’ваи мето.) иден-
тичен тем, которые описаны в разделе 7.4 для расчета '\Н° . Значения 5° , из-
'inn 2ие
мерякмея в кал/(моль-К). Составляющие приведены в ij6.i. 7.7, Никаких попра'
век на симметрию и изомерию не нужно
Ватсона для расчета 5’^, метилизопропилкетына
Решение- Основная ругнм, выбранная но rao.i
— это метан
Основная группа, мег^н
Первичное метильное замещение при образовании эггиа
Вторичное метильное замещение тип,) А — I, В - 1 при обра-
зовании пропана
Вторичное метильное замещение типа А - 1. В — 2 при обра-
зовании я-бутана
Вторичное метильное замещение типа А — 2, В = 2 при обра-
зовании 2-мстилбутана
Вторичное метильное замещение тина А — 2, В — 3 при образо-
вании 2,3-диметилбутаиа
44,50
10,35
10.00
85,31
Как указано в примере
88,5 кая^моль-К)
равно
методам, описанным в этим разделе, с .чптературп1.1ми данными. Наиболее точным
является метод Беисопи и др., групповые составляющие которого приведены
в табл. 7-4. За исключением нескольких случаев, отклонение между вычисленными
и Экспериментальными .значениями меньше. 0,5 кнл^моль-К) Отклонения, полу-
ченные прп испсльзов.н(ии мСТнДа составляющих связен из забл 7 1. колеблются
более
результаты ожлоисиня Сс’Ставлщот примерно
) в этом последнем мс-с'Дс не треоуется вводить поправки ни на
симметрию, jjjt на изомерию
" Рихани [25], а также Рнхгии и Дорэсвеймп [27] предлагали другие метол»
распета М Последний j-з методов применят!, не рекомендуется, поскольку п нем
поправки на симметрию и изомерию умножаются па температуру, что делает и*
размерно чес<1)лас<>ваш>ими, п кроме т<»гг>, им приписан цевернь|п алгебраичс-
скпй знак |31 ]
7,6, СТАНДАРТНАЯ ЭНЕРГИЯ ОБРАЗОВАНИЯ ГИББСА
Для прямого расиста AG° предложено мало методов, В большинстве случаев
отдельно <>преде,тчются Mi и АД, (млгг 5:). а потом для расчета изменения энер-
гии Гиббса в реакнгн t сполззуегеи уравнение (7.1.6). Однако Ван-Кревелен и
Чермип 137, 38] предтожили для расчета AG? корреляцию в виде линейной фуик
пии гемпсрату ры I уравнение (7.6.1)]. Константы уравнения А и В являются адди-
(нвннми функциями 1 руип, приведенных в табл, 7 10,
Гру п новые составляющие конс|ацт Л и В даны для двух широких диапазонов
1?мцературь|, так как простою линейного уравнения, применимого во всем темпе-
ратурном интервале от 300 до 1500 К, подобрать не удллоо Поскольку
- M/^ — TAS" (7.G 2)
то появляется шгланНс связать A//J’ с А п —ДД° с В. Г|о этою дедать дли индиви-
дуального расчета \//f и AS° це рекомендуется.
Применяя этот метод, следует делать поправки на симметрию п изомерию.
Поправка на симметрию равна In Oext (см. раздел 7.5). Эта поправка добав-
ляется к значению параметра В. Поправки на симметрию для ужо включены
ь составлявшие, представленные в табл. 7.10.
Поправка на изомерию, равная _____R 'п т), также добавляема к Значению В,
ыс Г) — число оптических изомеров.
.метод иллюстрируется примером 7.12 Сравнение расчетных и литературных
значений да но в табл. 7.11. В общем c.iy " а с \G° может быть вычислено с ошибкой
те более 5 ккдл/моль С такой ошибкой нетрудно предсказать возможность проте-
кания реакции, не не всегда можно точно рассчитать равновесные концентрации.
Пример 7,12- РассЧиГить ciаидар’ную энергию образов,,Н[|Я Гиббса 1,2-
рсшсл и е. Групповые составляющие-, ваятые из табл 7.10ф
-10,943 2,215
- 5,193 2,430
_ _ —
—0,700 2,910
2 (7.80) 2(0)
0
-дГТЙг
— 1.241 7,417
255
ТАБЛИЦХ 7 10 Групповые составляющие для расчета \(jj 13/, Зв]
сн4 Алкановые -18,948 группы 2,225 -21,250 2,596
<kl А I : X —10,943 -5,193 2,215 2,430 - |2,3|0 -5,830 2,436 2,544
—СН 1 -0,705 2,910 -0,705 2,910
—С— 1,958 3,735 4 38о 3,350
1 н.с= СН2 Алкеновые 11,552 группы 1,545 9,450 1,888
[12С-- [[ С\ 13,737 1,655 12,465 1,762
HjC- С [6,467 [,915 16,255 1,966
н /с’ и \ [7,663 1,965 16,180 2,116
/с' \ 17,187 [,915 [5,815 2,062
/ 4 с— / =cz — 20,217 25,135 2,295 2,573 19,584 25.135 Uh ! “ Г
Н2С" =C-C[1S 45,250 [,027 43,631 1.311
ПаС ~ 11 49,377 1.035 48.170 1,20s
256
iipwiowice.iv.ie
1,471
52,460 1,463 52,460 ] ,-|83
Сопряженные алкеновые группы
5,437 0,675 4,500 0,832
7,407 1,035 6,980 । ,088
С— 9,’,52 1,505 10,370 J,308
Ллмцоеые группы
JIG- 27,048 -0,765 26.700 —0,704
26,938 —0,525 26,555 —0,550
Apowwtt'iecKw группы
A 3.047 0,615 2,605 0,706
-c' 4,675 1.750 5.010 0,988
3.513 0,568 3,998 0,485
Кольцевые образования
Трехчленное кольцо 23,458 —3,046 22,915 —2.966
Чстырехчленное кольцо 10,73 -2,65 10,60 2 50
Г1яти,(лсш1ое кольцо 4,27,5 -2,350 2,665 2 182
Шестичленное tco.'ibao - 1,128 1,035 — 1,930 1.504
Пентеновое кольцо -3,657 -2,395 2,250
Iсксеновое кольцо —9,102 -2,045 —8,810 —2 071
Разветвления ( ’ а тапас
Побивая цецьсдвумя или более углеродными атома- 1,31 0 1.31 0
ми
'1 ри рядом расположиные 2,12 0 2,12 0
' [ упиы —("И
продолжение
Продолжен ие
Зядом расположенные 1,80 0 1,80 0 11
) руппы —cLl-|—G с—о —29,28 0,77 -30.15 0,83
Чве рядом pacnocoweii'iwe группы —С— 2.58 0 2,58 0 с=о —28.08 0.91 -28,08 0,91
Разветвления в Разветвления в цятп- i.ieiiROM кольпе цимопарафинах о НС-ОН —87,660 2,473 -90,569 2,958
одно разветвление двойное разветвление 12 (цш.) -1,04 -1 85 0,38 0 0 0 — 1,69 — 1,190 0,38 0 —0,160 0 О -с-он —98,39 2,86 —98,83 2,93
1,2 (трат) 1,3 (w) 1,3 (транс) Разветвления в шссти- i-iennoNi кольце: одно разветвление —2 55 -1 20 —2,35 0 0 0 -0 945 —0,370 -0,800 -0,266 -0,166 -0,264 о. -92,62 2,61 -92.62 2,61
-0,93 0 0,230 —0, |92 Н2С = С^О —14.515 0,295 -14,515 0,295
двойное разветвление 1,2 (yui) 0,835 —0,19 —0.367 0 1,745 1,470 0,045 -1,647 0,260 — 1,11 -0,995 —0,556 —0,276 —0,398 —0,185 —0 290 0 -0,245 1 |С=С=О -12,86 0.46 -12.86 0,46
1,2 (транс) 1.3 (цис) 1,3 (транс) 1,4 (цис) 1,4 (транс) Разветвления в ароматп ческлх углеводородах -2,41 - 2,70 -1 60 — 2,80 0 0 0 0 0 с—с=о НСЛ -9,62 0,72 Лаотсодержащие группы 31,179 —0.826 -9,38 30,874 0.73 -0,775
двойное разветвле н<е 1,2 1,02 0 1,02 0 C--N 30,75 —0.72 30,75 —0,72
м тройное разветвление 1 23 1.2,4 1,3,5 —0,31 0,93 0 0 -0,31 0,93 0 -N-C 46,32 -0.89 46,32 -0,89
1,91 1.Ю 0 0 о 2 10 1 10 0 0 NHd -11.606 2,556 — 12.972 2,784
0 0 0 -\н2 2.82 2,71 -6.78 3,98
Н2О Л ислороисиоерм ищие ерупнп -58,076 1,154 —59,138 1,3|6 Nil 12,93 3,16 12,93 3,16
-ОН —4’,56 1.28 -41,56 1,28 - _ — - . — —
-О- -15,79 —0.85 ХК- 19,46 3,82 |9,46 3,82
ос'” -18.37 0.80 -16,07 0,40 ) 11,32 1,11 12,26 0,96
112СО -29,118 0,653 —30,327 0,854 -\о, -9,0 3,70 -14,|9 4,38
258
259
THS 11Щ\ 11
Сравнение расчетных и литсра)урных
значений иавдартной энергии образовании
Г носка
Ьец.ест,,,, Литератур - -3<^.9s H'J Отклонение 1 тенд и 4q<- Reuqrn,,, . ।итсрату и ПОИ 11|;,'|СННС Ч..1111 Отклонен при расч Hi: Melo тепа и 9
Пропан —5,61 0,57 Анилин Т> 81 4,06
п-Гептап 1,91 -0.04 Этилами!) 8.91 0,37
З-Метилгекс.зн 2.4-Диметилпс1иаи 1.10 0,74 -0.02 0.32 Пиридин 45,4b 5,86
2,2 З-Триметилбутан 1.02 0.54 ЛиУСТИЛОПМЙ Эфир Ацетальдегид - 26.99 - 31.86 — 1.09 —0,55
Циклопентан 9,2,3 -0.37 Ацетон 36,58 - J.Of
Циклогексан 7,59 -0.43 Метилформнат 71.03 18
Метилцнклопентан Этилен 8,55 16,28 - -0.50 0.69 Уксусная кислота -90.03 4.07
1-Бх'тсн 17.04 --0.67 Этплалстат ч-Пропнловый спирт - 78,25 - 38.95 13 - 0,95
2-Бутен (t(uci 15,74 - 0.50 Изопропиловый спирг - 11,49 .3.1«
2-Бутеи (транс) 15,05 0.04 Фенол 7.86 2.66
1 .'З-Ьутадисп Ацетилен 36.01 50.00 0.29 2.23 Фосген -49,42 -7.52
Метилацегилен 46,47 2.03 .Мстилхлорид - 15,01 - З.1.'
Бензол 30.99 -0.26 Метиленхлорид 16.1G 1.15
Этилбензол 31.21 - 0.59 Хлороформ — 16,.38 — 0.2J
о-Ксилол 29,18 —0.71 Гетэахлормет.и) — 13,92 8..35
Л(-КСИЛОЛ Этилмеркаптап 28,41 - 1.12 8’58 Этплбромид Дихлордифторчстан - 6.29 -94.3 - 1,62 0,90
Ди этил сульфид 4,25 7.55 Фторбензол — 16,50 --4.8Г
Тиофен 30.30 -9.80 Хлорбензол 23.гО 1.00
Из уравнения (7.6.1)
_\С,5Я1 -=- — 1 241 — (7,417’ IO-J) (ijO'i) — 66 85 икал/м" ,ь
<"-i /мл [33| приводит значение A(?J =26.6 п. При атой теиис)'и'ре
-5Л1’ — —8,06 и AS’ --?,()• К) •• Ясно. чт<) пэраче, [ ы 1 и — Л ке отттг'р гжам г
эти значения.
262
Think
ПАРОГАЗОЖИДКОСТНОЕ РАВНОВЕСИЕ В
МНОГОКОМПОНЕНТНЫХ СИСТЕМАХ
8.1. СОДЕРЖАНИЕ ГЛАВЫ
И химической промышленности смеси газов и жидкостей часто разделяют на соста-
вляющие их компоненты такими диффузионными процессами, как ректификация,
абсорбция и экстракция. При проектировании этих процессов разделения нсоб
чодимо количественно определять парциальные равновесные свойства смесей
Проектные расчеты должны, конечно, базироваться на надежных эксперимепталь
пых данных для конкретной смеси в диапазонах температур, давлений и составов,
соответствующие реальным промышленным условиям. К сожалению, располагать
। одобными данными удается крайне редко. Скорее, наоборот, типичными являются
io случаи, когда имеются только фрагментарные данные и необходимо сводить и
коррелировать эти лимитированные данные для того, чтобы затем с максимальным
успехом интерполировать и экстраполировать их. В настоящей главе обсуждаются
некоторые предназначенные для этих целей методы Рассматриваются только
растворы неэлектролитов. В основном упор делается па расчет фу гитивностей
а жидких растворах; cpyj итивностям в газовых смесях посвящен раздел 5.9
Научная литература по вопросам парогазожидкостного равновесия, публи-
куемая вот уже более 100 ле-1, достигла огромного числа наименований' она наечи
тыв.,ет тысячи статей и свыше 100 книг и монографий- В табл. 8.1 перечислены
гвюрь] и названия некоторых книг, которые могуг быть использованы для полу-
чения необходимых при расчете данных ц для более детального ознакомления
с рассматриваемыми здесь вопросами. Список, приведенный в табл. 8.1, нс яв-
ляется полным', в нем даны лишь те публикации, которые представляются наибо-
лее полезными для инжейера-практика. работающего в химической промышлен-
ности.
Существует важное различие между расистом составов равновесных фаз и
расчетом типичных волюметрических, энергетических пли переносных свойств
। азов и жидкостей известного состава. В последнем случае нас интересует свойство
смеси в полом, в то время как в первом — парциальные свойства индивидуальных
компонентов, которые составляют смесь Напршср. для расчета падения давле-
ния в Движущейся по трубе жидкой смеси необходимо знать вязкость и плотность
этой смеси, причем Для конкретною, интересующего нас состава Однако если
речь идет о составе пара, находящегося в равновесии с жидкой смесью. то знание
свойств жидкой смеси этого конкретного состава уже нс является весьма сущест-
венным; нужно обязательно знать, как некоторые из ее свойств (в особен нести энер
г,1я Гиббса, зависят от состава 11р1| расчетах фазовою равновесия необходимо
тать парциальные соойс^а, 3 их. как правило, определяют Дифференцируя дан-
ные ио юставу Так как дифференцируются экспериментальные данные, то проис-
ходят потери точности часто очень шачительнме. Поскольку при расчетах фазо-
к'л о равновесия чаше всего пижны парциальные свойства, а не суммарные, (о не-
т.Ивнгс.чьно, Ч|О Установление параметров фазового равновесия обычно более
трудно и менее точно, чем расчет других свойств, которые необходимы про разра-
ботке процессов химической технологии.
263
ТАБЛИЦА 8 1 Некоторые книги ко парожидкостному равновесию
Термодинамика сазов и жидкостеи
Chao К. С , Gieenkorn R A .«Tliei-
niodvnaiinc-. of Fluids: Dekker,
New York. Г175 (англ )
щий введение в статистическую тер-
модинамику газов и жидкостей.
Представлена также термодинамика
поверхностных явлений
/Ian-iT.to по равновесию пар—жид-
кость при нормальных давлениях
Hala Е., Wichterle J., Polak J.,
Bopblik I'.. «Vapor-Liquid Equilib-
rium Data at Normal Pressures.»
Perqanioti, Oxford, 1968 (англ )
Собрание экспериментальных дгч»
них по бинарным смесям
Ьиблио! рафия термоди нами1 еских
исследо вдпий
Hicks С Р., Marsh К. N .William-
son A. G-, McLure J. A., GoringС. L •
«Bibliography of Thermodynamic
Studies», Chemical Society, Lon-
don, 1975 (анр1.)
Ппиведепа литература
по равнове-
Растворимость неэлектролитов
Hildebrand I. Н , Scott R. L.: Классическое произведение в этой
«Solubility of Nonelcctrolytcs», 3d области, в котором дается прекрас-
ed., Reinhold, New York, 1950 (rep- пый обзор фшпческои химии рас-
rinicd hy Dover New York, 1964) творов c ioukh зрения химика. Не-
(знг-1 ) смотря hi устарелость, книга тем
нс менее отражает физический
взгляд на то. как молекулы «ведут
себя» в смесях
Регулярные растворы
Hildebrand .1 II., Scott R. I ..
«Regular Solutions», Prentice-Ha|l,
Enqlev. ood Clif's, N. J , 1962(англ.)
Ре1улярные и родственные им рас-
творы
Hildebrand .1. Il , J. 4. Prausnilz
.and R L. Scott' «Regular and Re-
latec Solutions», Van Nostiand Rein-
hold, New York, 1970 (англ.)
Обновляет .материал книги Гиль-
дебранда 1950 г Предназначена в
первую очередь для химиков
Дальнейшее обновленце материала
книги Гильдебр тда. Предназначе-
на в первую <1черсдь для химиков
Справочник по равновесию пар —
ЖИДКОСТЬ
Hirata л). S., <ind Nagahania: «Coin-
pute.'-aided Data Bock of Vapor-
l.iguid Equilibria». ECevic, Am-
sterdam, 1975 (англ.)
Подютовленнос с помощью ЭВМ
пых по бинарным системам. Дан-
ные обработаны по уравнению Виль-
сона, а при повышенных давлени-
ях — по модифицированному урав-
нению Редлих । — knoiiT'i
26t
Продолжение
Международная серия данных. Из-
бранные данные по смесям
КсЫйаг Н. V. (F.ditor-in-Chief),
and В. J. Zwolin'ki (Executive
Officer),* Internal ional Data Serie':
Selected Data on .Mixtures», Ther-
inodynaruics Research Center, Chemi-
stry Department, Texas A and
M University, College Station, Tex.
77843 (continuing since, 1973) (англ.)
Фазовое равновесие в смесях
King М. В.. «Phase Equilibrium ’П
Mixtures». Pergamon, Oxford, 1969
(англ )
Фазовое равновесие в разработке
процессов химической технологии
Mull Н. R.: «Phase Equilibrium in
Process Design». Wiley-Intersciciicc,
New Yotk, 1970 (англ)
Публику io гея данные о разнообраз-
ных измеренных термодинамиче-
ских свойствах бинарных смесей.
Эги свойства часто описываются
эмпирическими уравнениями
Хорошее пособие общего характера,
отражающее разнообразную тема-
тику по термодинамике смесей
числовых примеров, ориентирован-
ная па инженеров
Молекулярная термодинамика иаро-
жидкоспиио равновесия
Praiisnitz .1 М • «Molecular lher
inodynamics of Fluid-Phase Equi-
libria», Prentice-Hall, Englewood
Cliffs, N. .1., 1969 (англ.)
Машинный расчет ларожидкоегцо-
го равновесия многокомпонентных
смесей
Рассматриваются термоди мимиче-
ские основы для машинного расчета
равновесия пар — жидкость Лапы
программы для ЭВМ
Повышенный курс Содержит мно-
го примеров. Рассматриваются
пршщшщ молекулярной термоди-
намики. Несмотря на устарелость,
содержит мною полезной инфор-
мации
Расчет равновесия жидкость - пар
и жидкости — жидкость
Rt-non II.. I-. A.'selinca'.i. С C’llten,
and С RaiirihauIt• «C.alcul sur oi-
dinateni des iquifibres liquide — va-
peur el liqoidc — liquid?». Editi-
ons Technip, Pans, I97| (франц.)
Жидкости и жидкие смеси
Rowlinson, J . S «I (quids and I i-
quid Mixtures», 2d ed., Butler
worth, l.ondoii, Г)69 (англ.)
ские основы машинных расче-
тов равновесий пар — жидкость и
жидкость ~ ЖИДКОСТЬ Л.1НЫ про-
граммы ддя ЭВМ
тнст'шескзя механика
263
Предо 1жсние
16 Жидкостная экстракция
Треибал Р., «/Кидкоетпая экстрак-
ция» М., «Химия», 1963
классической Термодинамики
!Н с ППЖеННр и ыми рритоже-
1энблИ('Гра^'ИЯ данпьц по равно-
весию пар жидкости
Wichlerle I.. J . 1 I tick, and Г. llal.t
A apor liquid Fguilibiipn! Data
Bibliography*, El'evjer. \mster-
dam. 1973 (англ.)
точников, относящихся к данным
о бипарньх и многокомпонентных
смесях Включает многие ссылки
на литературу социалистических
13 Равновесие жидкость — жидкость
Francis A W.- «I.iqi|1(| I iqui«l
Fqtiil.'britints», IViJcy-Intcrscince,
Хеч.' York, РбЗ (англ )
Феноменологическое рассмотрение
равновесия жидкость — жидкость.
Термодинамическое рассмотрение
практически отсутствует Лаца об-
ширная библкографтн
19 Равновесие между жидкостью и па
ром
Хала Э «Равновесие между жид-
костью и паром», М-, Изд иностр
лит . 1962
Отлрчтый обзор, включающим рас-
смотри и не а цеп ср им ей । ял ьпых мс'
пенно, могут бьць проверены только путем эксперимента
Таким образом, эта ,лдва качественно сличается от других ьтав кв;нп. Она
нс дает конкретных рекомендаций, как определят!, те пли иные свойства, и пред-
ставляет собой только введение н руководство по применению некоторых (далеко
тивной стратегии расист? копкреытых параметров фа iobci о равновесия при проск-
тпрова-иш технологических процессов.
8.2, ОСНОВНЫЕ ТЕРМОДИНАМИЧЕСКИЕ СООТНОШЕНИЯ
РАВНОВЕСИЯ ПАР _ ЖИДКОСТЬ >'
Рассмотрим Жидкую смесь, коюрая при температуре 'Г и давлении Р нахо-
дится в равновесии со смесью парой при тех же температуре ц давлении Интере
сующие нас неличинв, — это температура, давление и составы обеих фаз Если
11 Для белее детального рассмотрения вопроса см, на, ip.iNtep, |561, |6of
И |81|.
2Ь6
Для каждого компонента i смеси условие термодинамическою равновесия
,ается выражением
'ПСЦЧМЛЬПЫМИ
-
который ХЮ
\ I.. IКI Ц'| 11И М
очычпо описываемых
Вели'ли:а Ф.- зависит от температуры и давления а в мпогоком, онентнои
меси еще и от всех мольных долей паровой фазы, а не только от у;. Коэффициент
ависит
ПИЛ Ое >
рения наименее летучего компонента (или выше нее), «низким» считается давление
меньше нескольких атмосфер. Однако дли смесеи. содержащих сильно ассоиииру-
т.оэффиниенш ф\ гигив|1осги могхт существенно отличаться от единицы
шях. много меньших чем ] атм 11 Для смесей, содержащих один komuo
очень низкой лсгучсстью и другой с высокой, например декан — метан при
коэффициент фугитивности легкого компонента может быть близким к еди-
фнцИСНТ фугитивности тяжелого компонента будет МНОГО больше единицы Под
.(л.ныи анализ этого вопроса дан в гл 5 раооты |Go]
Коэффициент фучитнвносп! компонента i в жидкой фазе Соотносится с соста-
вом этой фазы черед коэффициент активности у,. В принципе, миже1 быть исноль-
ювана любая шкала состава, выбор той или ипои из нцх это вопрос ynoficiBn
Для некоторых водных растворив применяю, единицы моляльности (число молей
- ,ikti(bhl>ctt. KH’-ttioi'eiir.i । Стандартная фугюивпость f° — Это фугитнв-
' Полезная корреляция для коэффициентов фугитивно-чи ггт',< низких ля-
ь il'iii пх лчц cmeccii. BK.wv.iKwiix харволсп,тьные кислоты, дана Дж. Хейденом
4ж. <)'Кснцсчом i/rid. Eng С,hem. Process Des. Div.. 14 3. 1975).
2£>7
8.3. ФУГИТИВНОСТЬ чистой жидкости
Для тастега фугц| нвцосги чистой жидкости при оцределенпых техщерлп р<
и давлении необходимо знать первичные термодинамические свойства: давление
насыщенных паров, которое зависит только от температуры, и плотность жидкости,
которая зависит в первую очередь от температуры и в меньшей степени от давления
является более важным из дзух указанных свойств, Креме того, необходимы ио
.неметрические данные (уравнение состояния) для чистого лара i при температуре
системы, хотя пока давление паров осается невысоким эго требование имеет
мсньптсс значение, часто им можно даже пренебречь.
Фугитивность ' истой жидкости I при температуре 1' и давлении R дается соот-
ношением
RT
где Pvu — аязтепие тырив Гем. t лаву 6); верхний индекс я обозначает насыщение.
Коэффициенты фугитивности Ф,' рассчитываются из волюметрических данных
для паровой фазы (см раздел 5 9); для типичных чсассоинироваит1ьтх жидкостей
Моль| ып обьем жндкостл V j эго отношение.мо.|еку.'тя]пгой массы к плот
обьема 11 11рн температуре, значительно превышающей кпитичсскую, жидкость
порти несжимаема В этом случае влияние давления ра жидкофазную фугитивность
невелико, если только давление но очень высоко пли температура нс очень низка.
Экспоненциальный член в уравнении (8 3 1) называется поправкой Пойыннги.
Ячидксй воды. 11оск<т.1Ьку Ф! для чистой жид кос. в нее гд,। ниже едиппцы, то фJ i д-
'> О В О Т|ОМ о 1 р ।:
ТАБЛИЦА К 2 Фугитивность жилкой воды
100 0,9422 0,949 0,978 1,21
300 07,01 64,0 65,3 77 2
500 680,8 569 568’> 663'
600 154 J 115'1 1119 ’) 1414
Гиг.ОЩГи r<< к иС
значительно превышающих давление насыщения, произведение Д>' ца поправку
Поштгинга вполне может превысив единицу, И тогда фугитивность будет больше
давления паров
Пру 500 и 600 Т ,тапле| не паров превышает 600 функила/дюкм-, г. е. чистая
жидкая во,".а цо может существовать при этих температурах и давлении
600 фхшт-сила/дюйхг Text не менее фугитивность может быть рассчитана с помощью
недалекой экстраполяции н то 1рявке Пой-инга мы пренебрегаем влиянием дав-
ления (ОЧ мщгь.чый оббсч жидхоегт'.
Из табл 6.2 следует, чго давление пароп является определяющей вслипщн.й
пароп определяется мето ламп, рассмотренными вц б Помимо этого, для нспо
лирных (или слабо полярных! жидкостей отношение фугитивнос-и! к давленью
может бытг, рассштанг, iro обобщенным (составленным при пспсльвосапип npini
пипа (гчинсгавсннык состоянии) таблицам Для жидкостей (см раздел 5 4).
8.4. УПРОЩЕНИЯ В УРАВНЕНИИ РАВНОВЕСИЯ ПАР - ЖИДКОСТЬ
Уравненье (8 2 I) — эго строгое фундаментальное соотношение Для равно-
весия нар—жидкость > равнения (8 2.2), Г8.2.3) и (8 3 1) тоже можно считать
строгими, без каких либо упрощений, кроме тех, которые упомянуты е следующем
за уравнением (8 2 |) абзаце Подстановка щлражепий (8.2.2), (8 2 3) и (8.3.1)
в уравнение ('8.2. |) даст
(8.1.1)
(8 4 2)
За рещким цхклю щипец поправка F, близка к слиииие, кот ia общо давление
в нахождении у
I допускается, п,<, у, _ 1, ;о уравнение
Входящая в ср'ишские (3 4.1) величин, у. зависит от темпера|\ ры. состава и
Давления О.тиако н условиях, далеких от принятых критических. и только про.
Ьевысоккх вначеиььх (.шлеи,,> его влияние нт у: кел1,ачительио |см уравнение
8.5. КОЭФФИЦИЕНТЫ АКТИВНОСТИ. УРАВНЕНИЕ ГИББСА —
ДЮГЕМА И ИЗБЫТОЧНАЯ ЭНЕРГИЯ ГИББСА
Возможны следующие важные случаи применения уравнения (8.5,)).
' Если имеются экспериментальные данные no yj в форме зависимости от х:,
то можно проинтегрировать уравнение (8.5.1) и сосчитать у2 как функцию х2 Это
значит, что данные ио коэффициентам активности одного компонента бинарной
смеси могут быть использованы для предсказания значений коэффициентов актив-
ности другого компонента.
2 Когда имеются полные экспериментальные данные как для у,, так и для
’з 13 форме функции состава, можно проверить их на термодинамическую совме
стимость, определив, описываются или нет они уравнением (8 5.1). Если данные об-
наруживают несогласуемос'ь с уравнением (8 5 1), то следует считать их инадеж-
НЫКИ-
3. Если имеются ограниченные данные по yj и у2, можно проинтегрировать
уравнение Гиббса—Д,огема и получить термодинамически достоверные уравне
пня. которые соотносят yi и ?2 с г.
Эти уравнения включают в себя настраиваемые параметры, которые затем
могут быть определены по ограниченным данным. Именно этот случай применения
уравнения Гиббса—Дюгема наиболее интересен для инженеров-химиков Однако
сдинор интегральной формы уравнения Гиббса—Дюгема нс су'ществуе. Воз-
можны многие формы. Для того чтобы получить конкретное соотношение между
у и х, нужно разработать модель, которая была бы совместимой с уравнением
Гиббса—Дюгема
С практической точки зрения полезность уравнения Гиббса—Дюгема лучше
всего мэжетбы-'Ь реализована посредством концепции избыточной энергии Гиббса,
*_ е. превышения наблюдаемого уровня энергии Гиббса дли смеси гю oiHuineunio
То величине, характерной для идеального раствора при тех же значениях темпе-
, ратури, давления и состава. По определению, идеальный раствор — это такой
раствор, для которого все -yi -= 5. Полная нябыточнен энергия Гиббса GF для би-
нарного раствора, содержащего п, молей компонента ) и п2 молей компонента 2,
определяется соотношением
Уравнение (8.5 2) определяет GF как функцию двух величин: у2- Применяя
' уравнение Гиббса—Дюгема, можно связать индивидуальные коэффициент! актив-
ности Yj или у2 с величиной G£
ЯГI,h-1
Уравнения (8.0.2)—(8 5 4) полезны о том смысле, что позволяли интерполи-
ровать и экстраполировать по координате состава ограниченные данные Для
того чтобы осуществить эти действия, необходимо, во-первых, выбрать определен-
ную математическую модель для G£, которая имела бы вил функции состава- Вс-
вторых, необходимо по ограниченным данным найти фиксированные значения
констант такой модели В-третьих, пало рассчитать коэффициенты актилносш
для любого желаемого состава путем дифференцирования в соответствии с урав-
нениями (8.5.3) и (8.0.4).
Для иллюстрации изложенного выше, рассмотрим простую бинарную смесь
Предположим, что необходимо определить коэффициенты активности для бинар-
ной смеси во всем диапазоне составов пои фиксированной температуре Т Однако
часто экспериментальные данные имеются только для одного состава, на ,ример,
ж, = х3 .= 1/2. Исходя из этого единственного чпачеиня, рассчитываем 1'1 (х, - %)
и Vs (ха = 1/2). Для упрощения предположим, что поведение молекул Симмстрич-
НП, т. е У! (х, - 1 j = Уз (х8 = i/2)
Необходимо принять модель, связывающую G£ с составох! в соответствии
с условиями, что при фиксированном составе величине G£ пропорциональна •», Ц-
+ Иг й что GE — 0, если х, — 0 ц л2 . О, Из всех возможных моделей на (ботее
простой будет следующая
Здесь — избыточная энергия Гиббса, приходящаяся на Моть ьмссп,
А — константа, зависящая от температуры Мольная доля г может быть доста-
точно просто связана с числом молей it соотношениями
Константу А находим путем подстановки соослошения (8.5.5) в уравнение
(8 5 2) при использовании значении у, и уа, «переде,ленных экспериментально при
равных составах
И- «IL I ’ , । ... .< lx'
Лнфферсннирун уравнение (8 5 5) согласно 1и,1ра>кч1и>ш (8 5 3)
имеем'
,фф(
те.
НРТЛ
явственно. Тем по мчи о„о может оказаться полезным даже для смесей с непол-
ной смешиваемостью, но при этом рассматривается только гомо, синая область
жидкой фазы.
В иротн11ощ>ложность уравнению Вильсгна, уравнения ИРТЛ и
ЮНИКВАК применимы как для описании равновесия пар - жидкость, так п
для равновесия жндкость—жрдкояр1. Понятно, что ддаше о iwnvuoii раетво-
. рпмости (см. раздел 8 10) могут быть использованы для определения параметров
моделей 'НР1Л пли ЮНИКВАК, но о'НЮдь не для определемк t иаоаметров
модели Вильсона. .Модель ЮНИКВАК математически более сложна, чем НРТЛ,
раиваемых параметра: 2) параметры ЮНИКВАК проявляют меньнгую зави-
симость ол температуры, поскольку модель имеет более глубокое теоретиче-
ское обоснование; 3) модель применима для растворов, которые ыогут содер-
жать как малые так и большие молекулы, в том числе полимерные, поскольку
первичной переменной состава в этой иоделг служит поверхностная доля (дне
мол ьная).
Упрощения: однопарамегрнческие модели, Часто бывает, что эксперимента.!ь
ные данные для яакой-дибо бинарной епгтелы ;<аС(0ЛЬКО фра/менгарпь!, что
просто невозможно выделить два (или три) значимых параметра бинарного вза-
имодействия. В этих случаях стремятся использовать двухчленное (однопара
метрическое) уравнение Маргулеса. Такое решение нельзя считать удовлетвори-
тельным, поскольку коэффициенты активности в реальной бинарной смеси редко
бывают ci ммс'трнчными по отношению к мольной доле, В болыппнстпе случае,!
лучшие результаты достигаются при использовании подслой Ван-Лаара, Виль-
сона, НРГЛ пл| ЮНИКВАК с уменьшением числа настраиваемых параметрон
I [pH переводе уравнения Ван-Лаара в оДнопараметрнческую форму отно-
шение Л'И часто Может быть заменено отношением мольных обьсмов А1/! ---
= Vf/P' Это упрощение не годится, однако, для бинарных смесей, содержащих
один (или два» полярных компонента-
Перед тех, как перейти к упрощению уравнения Вильсона, следует oimc
тить, ИЛО
где V' — мольный обисх, ihctoi) жткцсти i. X ( - snepreiij.iecbHi, параметр’
характеризующий взапмодейств ,с молекулы : с молекулой i.
Уравнение Вильсона может быть переведено в одпсиараметрпческую форму,
ес/п предположить, что — кц ,,
par
Вильсон iPJ I разрыва, tpex ираметрпческую ферм,. lWro у р<тв.,ет1т1Я,
! 11: Н!1 ' IГ И 11ДIO :..-|'1, Mil.lbix' I I. Milli'K V. J я I I л н
,а дано Репоном и Нраусчищ'м J76I Тр.-чщра
1ЛБЛИЦА 8.3. Некоторые уравнения модели избыточной энергии Гиббса и соответствующие им
выражения для коэффициентов активности в бинарных системах1)
1!i имсиоиляде Параметры I бинарного I 1 рзя.чмодей- 1 I ствчя 1пт, 1ну.
Двухчленное .Мар- ёЕ = RT In 7L= /1х=
гулеса -) RT In у. = Л*1
Трехчленное .Чар- g£ - x,ij Н 8(xt- х») RT 1и у, (Л — ЗВ)х§- 4Вт ‘
1улеса 2) prill Т2 = (Л - ЗВ)х| 4Bxt
h 4(W RT 1пу2 - 11 ( 1 -
B't ibcoia g' ^luUl А1;гг)~ А In Infl! -|-Л1.ха) —ч z
RT 1 ) у- — 11. (х. — Лгт* 1) — Ч \ [ Л1г Л21 \
Ч X,- л12сг .14Л-л, 1
Чсть|рехчле1-нос 'XR-i |Л Ь (%!— Xj) ; *г)л| RT In — (.1 - jli — 5С) xlj — (ft 4С).тЗ -г 12С'./
Мнргулеса г) л? in ;Л — т , sc’.i 4 -
НРТЛ ')
'Si- V.,,
РГ ' ъ ~Rf
ЮПИК1ИХ ''I
Эккертом [961, а также Шрайбером и Эккертом [77], дает хорошие результаты .тля
широкого круга бинарных смесей. Хнранума и Хопма [40] добились покрюро|.:
успеха, связывая X,, с энергетическими вкладами межмолекуляриых сил и сит
ди 1'оль-дппо.'гиного взаимодействия
лглеет меньший мольный объем, в то время как для компонента I, пмеющет
больший вольный обтек, Р=(2/г/ ((,'/, Такое предположеш е основы;
Параметры и Л;; рассматриваются как энергии вза |Модойсгния it-.ц
холящиеся пе пл молекулу, а на Семент. В этом конкретном случае едини ।
|1ый сегмент соответствует одной молекуле компонента 2.
>цо в модели ЦРи можно уменьшить число настраиваемых параметров бн
панною взаимодействия, если принять обоснованное нре.чттолсокеиие синее;,
тельце а|? и заменить в уравнении (8.5 ,2) параметр IIPT.’I g,t Нд параметр
Вильсона Л;,. Крупп предлагает несколько корреляции для g/:. в основном для
полных систем
Наконец, Абрамс и Праусннц |3| показали, что уравнение |ОНИКВ\К
мож.'т быть ^прошено, если иредгто.тажить, чт?
,8: i4i'
8.Ь. РАСЧЕТ БИНАРНОГО РАВНОВЕСИЯ ПАР - ЖИДКОСТЬ
веве.чцхо
Сначала рассмотрим изотермический случай. Надо псе троить дне днат раммы:
- " с .........—-оторой постоянной температуре Г. Поскольку давление
что можно использсвать уравнение (8.4.1) с — т.
2 Предполагается, что имеется несколько эксперимента.1,ьиы\ точек для
смеси при температуре Т. Произвольно, только для ясности выражений, пола
тают, что таких точек пять е пяти значениям х соответствуют пять экспери-
ио Уравнениям
3. Для каждой топки рассчитывают избыточную мольную энергию Гиббса gF'
5 Дифференцированием по уравнениям (8 5 3) и (8 5 4) находят у, ц у
как функции х *. 6 Выбирают ряд произвольных значений хг в Диапазоне от х, -- Ci до х, -
из . |. Для каждого х( решают методом (|ОСледователы1ых приближении систему двух уравнении фазовою равновесия (уравнения (8.6') и (8 6.2)1 otiioc:i- 1ч1<> V, и Т В этих уравнениях используется значение полного давления [>, которого строятся диаграммы равновесия. Совместное решение уравнений (8.6 1) и (8.6 2) требует использозания >,<
ТОД. < последом тельных приближении потому, что при .данном .с неизвестны как i, п Т. а 7\.Г| н представляют собой сильно нелинейные функции Т В до-
пение к этому коя|фк1'исг1ты активности у( (i у2 могут также изменяться с тем- атУ1>()й, как и с х, о зависимости от того, какое уравнение было выбрано на е 4 [)рц совместном решении двух уравнений равновесия, наиболее нра- вно будет задаваться разумным Значением темнерату'ры для каждого избран - о значения Xj Используя такое допущение но температуре, следу-ст рассчитать у-. цо уравнениям (8.6.1) и (8.6.2). 1 !осле этого проверяется выполнение ус.тс- i/i -г "2 ~ 1 При нсвыло.-)яе1|ии следует повторить расчет с другим значением пернтуиы. Таким способом для фиксированною Р и для каждом, выбраииои юнца х следует находить соответствующие равновесные значения у а ! Для повышения эффективности расчетов изотермического или изобарическое.
оногс равновесия пар — жидкость следует использовать ЭВМ. При цеоб- имости можно включить в расчет поправку Ff (уравнение (8.1 Ij] В юкиы чае расчеты будут несколько более сложными в .,еталях.но не в nriuiiiiii'e -ествы о 1уб-лнков.|нные программы таких расчеюи для ЭВМ |68 ]. Кома рассчитывают рапиовесне описанным выше способом, точность лрэбо-
:И(.'чета зависит в первую очередь от того, насколько верно уравнение для g1 сывает поведение смеси в конкретных условиях температуры, давления и :ава, для которых проводится расчет. Точность описания част) зависит яс тько от алгебраи 1ескои форм!,1 уравнения Для g1'. сколько от натежнютн когстант. В свою очередь эта надежность зависит от количества и клнеетза
*) Здесь ь p<il4ctjj вносшся некого).пя ошибка, uoir>M\ иг> урльцения (8 5.3,
(8 5 4) основаны на изосаро-нзотермкксс^ом уравнении 1 нббса Дюгсма
большинстве практических расчетов эта o'liiifiKq i;c является серьезной С.м
б и приложение (V я I66J
' »луч1<|ие» параметры бинарного взаимодействия, используются экеисрименталь-
(' ные данные. Поскольку экспериментальные данные всегда имеют ограниченную
' точность, часто случается, что оцц могут брсть с одинаковым успехом представ-
лены несколькими наборами параметров бинарного взаимодействия в пределах
погрешности эксперимента |3 I. Только в редких случаях, когда эксперименталь-
ных данных много и опа отличаются высокой точностью, н некоторой степени
оправдано нсиотьзовапне более чем трех иастрарпаемых параметров.
8.7. ВЛИЯНИЕ ТЕМПЕРАТУРЫ НА РАВНОВЕСИЕ
ПАР - ЖИДКОСТЬ
Учет н.1цн(1ця температуры на величину мольной (мбыто-чнй THepfint Гиб-
бса еЕ япляс гс5г очень сложной задачей. Ее решение связано с определением '£ —
мольвой избыточной энтропии смешения, о которой обычно мало чтп известно.
На практике часто используют одно из двух приближений.
I Атермические раствори. Это 1<р)|бли<кеицс усгананлияаст gc- — 7Ч£.
т. е доптскается. что к<>млоиепты смешиваются при г«к.тоянной температуре без
изменения энтальпии ()Л = 0). Такое допущение приводит к заключению, что
паи постоянном составе величина |п у; нс зависит от Г или, инимн словами, ве
личина (>F-RT не зависит от температуры.
что равносильно. -- 0 ] акое допущение имеет следствием то. что при постоян-
ном составе пелниниа !л изменяется обратно пропорппоцальио температуре или,
иными стовамн- величина ц но зависит ют температуры
Но одно из этих приближений не прексдвляет особой ценности, хоти второе
часто все ж.е лучше первого Хорошие экспериментальные данные отражающие
влияние температуры на коэффициенты активности, встречаются редко. Если
такие данные все же имеются, то получается, что для диапазона умеренных гем-
ператуп онц могут быть оииСанЫ эмпирическим выражением вида
(hi ?,) ''при постоянном составе) с
эмпирические константы, з.нзпсяии'е от состава
видно, что если
мые Знл’ СПИН
в большинстве случаев с ц а!Т имеют сравни-
'Tepft'ujuiiLiMijка связывает втпЯНис температуры
ности у; с паргн.п),нон мольной энтальпией /?;'
коэффициент актив-
по Г,
где - энтальпия i и жидкости в стандартном еосгоянии в качестве которого
(|быч| о принимается состоинп- ’ выой жидкоси при температуре п давлении
системы Хотя п оседь редко т,о зегречдются экспериментальные данные
и если Оци есть, их можно использовать для получения ипформакш.
такие данные имеются уравнение (8.7.2) нужно использовать с осторожностью!
потому что величина Л - h'' в свою очередь также завися’ от 'емпердтмры и
при этом шюгда очень сильно
Некоторые из уиавненнй л-тя с; . приведенные в тяб.т 8.3, содержат Т
в явном виде Одкако из этого вовсе не следует, что константы таких уравнений
пе зависят от темпора|уры Приводимая явная температурная зависимость —
К счастью, основное влияние температуры на рав|Юьссие пар- жидкость
оказывается черед давление паров чистых компонентов наг, более точно, черед
фугитивности чистых компонентов в жидком состоянии Ivpauneiit,c 18.
1 (оэтому коэффициенты активности зависят к,л к от температуры, так и от состав;,,
и температурную зависимость коэффициентов активности можно считать слабо
выраженной по сравнению с зависимостью давлений паров чистых жидкостой
от температуры .Цля типовой смеси подтем температуры на Ю СС приводит к воз
растатно давлений паров чистых жидкостей в 1,5—2 раза, а изменение коэфеп;
пненгов И1-тШ1иостп составит скорей несколько процентов, т. е Ее.шчни у. кэтор,,,,
часто меньпе погрешности эксперимента. Таким образом, если не пропсход it
кость можно пренебречь влиянием температурь) на i>'. Однако j.pi расчетах рав-
новесия жидкость—жидкость (т. е для случая, когда Давления нарпн ннобип
lie играют никакой роли) влияние температуры на %Е, хси, я и весьма малое может
серьезно повлиять иа величину параметрон равновесия Изменения кочф4тИ(>.Т|<.>,|
тов активности, даже небольшие, могут оказывать сильное влияние h.i ргвноис-
сие жидкость — жидкость в многокомпонентных смесях (см. раздел S ]3),
8.8. БИНАРНОЕ РАВНОВЕСИЕ ПАР - ЖИДКОСТЬ: ПРИМЕРЫ
В качестве введения в изложение общих идей рассмотрим два довольно
простых метода обработки ц пересчета данных по равновесию над — жидкость
Далее последует введение в описание более точных, цо и мЭгСчат!пески боле< слож-
ных процедур,
Пример 8 |. По результатам siarepiiyeina.ii.Hi'ire п-с ;1--||Ж111.1Д раыипел:.,
пар—жидкость для бинарной системы метанол (I)—1,2-дихлорэтан (2) в пяти
точках при темиеэатУре 50 °C рассчитать данные для диаграммь ',p'i
50°C и предсказать данные для диаграммы Р -i/ х i,pit (ЧИС
Экспериментальные данные при 50 'С 190]
483,8 70 65.7
493,2 90 8] ,4
где А’ > (/J - С) И' = [D + С}~1
Koijciauibi !-> и С Определяются из график.। w।iCu'tOcni x,v, (у1 RT)'1
от х, Точка пересечения кривой с осью ординат при х, 0 дает Т> — С. а ерн
। соответственно D i- С.
Мочьчач пзб1.1тоикая энергия Гиббса расс'и(ть вчег'.'<..... уравие нно
- х, in У) »з । у. |8
|) По габл 8 3 А' - AiR/’ u в' Р R1
ТАБЛИЦА 8 4. Экспериментальные эначенни коэффициента активнос|и,
соответствующие линеаризованной тависимости Ван-Лаара, для системы
метанол (I) 1,2-днх.норэган (2) при 50 °C
1,7b
1,40
0,5b0
1,12
0,604
Д.'15| цЯ]П имеющихся экспериментальных точек кс.ффидпеы ы
.................. ..... ....,----------—- .— - акц1впост,|
у, и у4 определяются по уравнению (8 4.1) с Ft — 1 и данным о давлениях па-
ров i чистых компонентов.
В табл. 8.4 приведены значения х}х. (бЧРТ)'1, которые необходимы для
определения констант Вап-Лаара, На рис. 8.1 показан график линезризованно!о
уравнения Ван-Лаара Представленные результаты получены при использова-
уравнения Ван-Лаара Представленные результаты получены при
нии BohCT.iUT Антуана для давлений паров (см, приложение А).
Но рис. 8.1 можно Определить постоянные Ван-Лаара'
Теперь мслцо пасся пять у, и т; для любой мольпоп доли
(6 6 3)
Используя уравнения (8 8.3) и (8.8.4) и данные о давлениях паров чистых ком-
понентов, можно iiai’iTH t/t. у2 и полное давление Р- Эдесь два неизвестных: yt
(или f/j) и Р' Иля их определения необходимо решить совместно два уравнения
фазового равновесия
Рассчитывая равновесие Пар — жидкость при 60 °C, допустим, что влияние
температуры па коэффициенты активности соответствует приближению II в
разделе 8.7:
таты расчета
Даплеиця паров чистых компонентов при b( L рассчитываются ко Урав-
нении Антуана. Два у равьенцн фазово-с равновесия [уравнения (£.8.3) и 8,^.6)]
опять решаются совместно для полу
ТАБЛИЦ,! 8 5 Расчетные »начения параметров равновесия пар —
ЖиДкоС|Ь в системе метано!) (I) - 1,2-дихлорэтан (2) при аО^и^бО С
5 5,56 5,28 |,0| 1,01
|0 4,53 4,33 1,02 1,02
20 3,15 3,04 I 09 1,09
40 1,82 1,79 1,37 1,36
60 1,28 1,27 |,95 1,91
80 1,06 1,06 3,01 2,91
90 1,01 101 3,85 3.70
34,1 33,9 339,6 494,2
46,9 46,8 402,8 587,3
56,4 56,5 465,9 682,7
61,3 62,1 495,1 732,2
63,8 65,0 502 0 743,6
716 73,1 493 9 7,36,2
80 О 82 | 468.7 702,7
-09 0,4 _1,4 ।
0,2 0,9 8,3 15
1.1 2,2 19 19,
],3 1,8 _],3 17,
0,5 |,2 I 1 26,
_0,5 -0,1 -1,0 22
S 17 6,4
7,6 102,3
&1/ “° Гр.кл — J/эьсп, — ^расч Р/псп-
Решение. Как и в примере 8.1
данных выберем уравнение Ван-Лаара
ТАБЛИЦ \ Sb Экспериментальные значения коэффициентов активности,
соответствующие линеаризованной тависимости Вап-Лаара,
для системы //-пропанол (1) - вода (2) при 760 мм р,- ci.
|00*. Т -< " 1 1 <,ч _
7,50 89,05 6,84 1,0| 0.445
17.9 67.95 3,10 1.17 0.448
48.2 87,80 1,31 1 ? । 0,615
71,2 89 20 1,07 2,28 0.720
85.0 91 70 0,99 2,85 0,848
Коистз4Т1,| Антуана берутся из приложения А
ется из уравнения (8 8 21 Констант!,। Антуана берутся из приложения А
Резу.ть-аты расчета приведены в табл. 8.6 График, соотвстсгну oaiiift ли-
неаризованной форме уравнения Ван Лаара, представлен на one. 8.3.
По топкам пересечения на рис. 8 3 получаем
(8.8.8'
Коэффициенты актпвпеттн у, и
Чтобы получить данные для n>xipoctit<n дпагрямчы равновесия пар я-д/д-
кость при 1000 мм Рт сГ , нужно решить совместно два уравнения равновесия!
йюсГ
(8 8.12)
Уравнения Ван-Лаара! и не зависят от темпера "У Р >1 О Шак,) l\ , и f\v> сильно
зависят от (смгературы
Пеизяестттыми в уравнениях равной, спя являются у._ и 7 Чтобы решить эту
систему уэ<.впецнц, над'т иенотмовать такж^ соотношения Антуана для чисты'
компонентов.
Расчетные зависимости содерлта” температуру в неявном виде Решение
системы уравнений равновесия остшее.в'яется методом постедоватмьных
Хотя нтераiнвньге рчсчсты легче 1грсво;;итн на ЭВМ. в стом примере Можно
Cijcrpo получить результат вручную Разтелии одно из уравнении равновесия па
Другое, найдем
ТАБЛИЦА 8 7 Расчетные значения параметров равновесия пар—
жидкость в системе н-пропанол (1) — вода (2) при 1000 мм рг. ст.
5 7,92 1,01 98,4 ,11.6
10 5.20 1,05 96,0 ч, б
20 2,85 1,16 95,3 40.5
40 1,50 1.51 95,0 42.2
оО 1,27 1 73 95,2 44 9
60 1,14 1,98 95,5 48,8
so 1,02 2,51 98,2 64 6
90 1,01 2,79 100,6 78,5
В примерах 8.1 и 82 делались не только упрощения термодинамических
соотношений, но и не проводилась количественная оценка влияния ttornettnion и
эксперимента ва результаты расчета
Детальное обсуждение появившихся ныпе крайне софистицир< паевых cia-
тистическпх мегодов оптимального определения параметров уравнении по экс-
периментальным данным о равновесии пар—жидкость выходит за рамкк настоя-
щей главы. 7см не менее, несколько елок об этом могут оказаться полезными для
читателей,которые хотели бы получить максимально возможную точность ,рн
обработке данных.
Очень эффективный метод обрабщки данных описан Фабри и Ренонсы [23!
которые основали свой анализ на принципе максимального правдоподобья, при-
нимая во внимание возможные («>гре|циости эксперимента для всех экстриме; -
талыю определяемых величин
Похожая методика Абрамса п Прауснина 13], основанная на использовании
численного метода Бритта н ,'1юке [15/, определяет рассьитыэ.темос давление
(функцию сш'.зи) ь.тк
гу2учис! г I
</гФ2 1
_ ЮОПу]
— *1Vi
где , берется при температуре и давлении системы. Наиболее вероятными
значениями парамс1ров (поянлжошимгсп в функции, выбранной для описания
gL) будут тс, которые минимизируют функцию 1
Ж^Ч/ЦО.. ЛЦе
Всрхнпй индекс .11 характеризует измеряемое значение, а верхний (шдскс ()
относится к истинному значению переменной; о8 — дисперсии измерясьых вели-
чин. т е. показатели возможной экспериментальной иеопределеииост.1. Они мо-
гут изменяться от одной точки к другой, ио не обязательно.
Используя экспериментальные данные Р—Т~ х—у н уравнение
ЮНИК.ВАК е рассчитанными значениями параметров ц13- и21 и ц.,,— «ц, Абрамс
и Прауснни определяют значения х'*, i/‘, Т'^ и Р?, причем последнее рассчитывают
по уравнению (8 8.15). Затем оценивают I предварительно установ! во;,
значения параметров Ю11ИКВЛК, рассчн(ывню, повое значение / и т. л п е
помощью соответствующей программы для ЭЗИ находит параметры, которые
к другой относительное изменение i меньше 10 В копне расчетного процесса
Дисперсия подгонки а'у определяется выражением
Поскольку все экеперпнсптальчыс
Данные Характеризуются некоторой
тагов, то, сте;юватель]1с, параметры, полученные в результате обработки данных,
нс являются Уникальными, т е. существует много наборов оарамст[ов которые
могут одинакон-э хорошо представлять экенерпмент'ллы.'ыг- литые п пределах
Неопределенности эксперимента Рпс. 8 4 иллюстрирует это отсутствие уппкаль
вести. На нем показаны результаты обработки и приведения тынных'для би-
нарной смеси этанол (!)- вола (2) при 7С "С Обрабатывались эксперимента и•
ные данные MepT.'i;i ?55| но методике ЮИИКВАК с лисиерсияхиг
С, — p) s, — 10 2, о,-> = 0 о мм [о. <_ 1, nj- — 0.1 I'
Для этой бинарной систему качестео опта
очень высоко лс. — 5 J0*1.
Эллипс па рис. 8.4 ясно показывает, i.jo
параметр и12~nlt строго коррелируется
с параметром и21 — и22, существуют многие на-
боры этих параметров которые могут представ-
лять экспериментальные данные одинаково хо
рошо Использованные при обработке экспери
ментальные данные сопсем необязательно сья
запы с единственным комплектом «'лучших'
параметрон. Реалистическая обработка данных
может определить лишь область парамет-
к уравнению Ю|1ИК.В4К, по похожие резуль
тэты получаются и при цсп<'.|ьзованн11 других уравнений для цг По экспери-
ментальным данным может быть определена только область приемлемых пара-
метров. Эта область для двух параметрических уравнений представляет собой чаъ ь
плоскости, для трехпарамстрнчсских уравнений — некий объем. Если уравнение
для g ' хорошо описьтвасг поведение смеси, то область фнсмлемых параметров
при увеличении количества и качества экспериментальных данных начинает
суживаться. Однако, принимая во цци-мачнс отрлнпчепиые возможности каь
теории, так и эксперимента, вряд ли стоит ожидать что эта область может су-
Как отмечалось многими авторами, а особенно Эббог1ом и В.ш-Нессом [2],
они бки эксперимента в определении состава кара у обычно всегда больше, чем
при измерении давления Р, температуры Т и состава жидкой фазь х Отсюда по-
является возможность созданря срав(щ(ельйо простой методики, по коюрой об-
рабатываются только данные Р—к—Т Информация пор, если тджогна имеется,
Не используется 8). Главное в Этой методике — минимизировать расхождения
между расчетными и экспериментальными результатами но давлению
Давление рассчитывается как
где Ъ определяется по уравнению (8 1 2)
Таким обрядом, теперь выбрана термодинамически совместимые уравнения
пих предъявлены в табл. 8.3. Уравнения содержат некоторое число настраивае-
мых параметров бинарною взаимодействия Эти параметры находятся с помощью
ЭВМ путем MiiiiiiMii3aiii|H отклонег-nii расчетных значении давления от экспери-
ментальных
В случае низких давлений можно предположить, что F, -• F° = 1 Однако
иРп более высоких давлениях поправки /, к Z2 станопят'-я функциями давлении.
Ч Вместо расшаренной формы (88 1Г) тогда ирсдиочгитетьнес £
использовать два расширения — первое по уравнению (8.8 15) п второе
-) Обычно этот метод называй ся методом Баркера
темпера rx pi । и еостав'ш щ-ров </t ч i/2 Эти состапы рассчитываются по форнхлам
Итак, схема обработки и приведения экспериментальных данных является
итеративной Для начала необходимо взять какое-либо приближенное значе-
ние у для каждого х После первой fncoawiii новый комплект расчетных значе-
ний у находится по х равпеищо 1'8.8.191. б.ходимостп достигается, если в резуль-
тате итерационного процесса рассчитанные значения у отличаются от опреде-
ленных на предыдущей итерации на пренебрежимо малую величину, при условии
минимизации отклонений Давления
8.8- РАВНОВЕСИЕ ПАР - ЖИДКОСТЬ В МНОГОКОМПОНЕНТНЫХ
СИСТЕМАХ
Уравнения для расчета равполеы»; ,:ар — жидкость в многокомпонентных
системах, в принципе те же, что п дтя бинарных систем. Для системы, содержа-
щей А’ компонентой, пх'жно совместно решить (V уравнений (8.4.(i — по одному
на каждый компонент Необходимо знать значения давлений насыщенных паров
каждого компонента как чистой жидкости при интересующей нас температуре.
Если вес значения давлений паров малы, ю и полное давление невелико В таком
случае поправку Г, [уравнение (8.4 2)] можно считать равной единице
Коэффициенты активности У/ находятся из нЬ1ражсния для избыточной энер-
гии Гиббса, обсуждаемой п разделе 8 5. Для смеси .V компонентов избыточная
энергия Гиббса определяется как
RT^, П 111 f,
где т число молей i-rn кохпопенха.
Mo.ii,мая избыто тая энергия Гиббел йСсоотносцтся с (jE простым образом:
(8.9 2)
где чт — обшсс число молен равное У
Индивидуальные коэффициенты активности могут быть получены яз CiL.
если записать уравнение Гиббса—ДюгеМа Для многокомпонентной системы при
постоянных температуре и давлении Это уравнение имев] вид
находятся из обобщенной формы уравнения
R1 ту, -
(8 9.4)
') Если для расчета коэффициентов фхгихпнностн в паровой оазе цеполь-
зхется правило фугитивности Льюиса, то поправки Г, и F2 зависят от давления
и температуры, но не зависят от и. Использование правила Льюиса приводит
к математическим упоошенияи. не, так как едко по себе это травило мало при-
годно, при наличии ЭВМ нет необходимости в ею исцо.чьдглзинтш.
Ключсг.ой нроблемей в расчете w токпмпгпн. и, щи о фазиио.’о |>4Uiioue.i ।
является ...... па пне i'i.i ражешш для д'', которое яиля.'|осн ''я । xopoinen ;n'i,p<>u. н
манией с иен, и-i и смеси. С этой целью уравнения для g~' бипар ш>1> < месей пер, чн.
лентяе в таб-ч 8 3, могут быть распространены и ла многокомгюпснюыс системы
Некоторые из ли уравнений применительно к многокомпоненшым спечем;у
представлены в табл. 8.8
KoHn.enniii, избыточной энергии Гиббса особенно полезна для многокомщ,
нентных систем, потому что по многих случаях может быть сдела,' обесис'-шыш,
щпй хорошмо ,очнссть переход от бинарных c,i<tcm к многокомпонентным, в pt
зультате которото в конечном выражении для дь содержатся ,олько параметры
бинарного взаимодействия. Когда Это имеет место, достигается большая экономия
по проведению эксперимента, так как требуются данные не для самой многокомш,
рентной смеси, а только по ее бинарным составляющим. Например, коэфф;,
препчы активности в тройной смес„ (состоящей из компонентов 1, 2, 3) с хоро-
шев точностью часто м<луг быть рассчитаны только по эксперимстальным дан
ним для трех бинарных смесей, состоящих из компонентов 1 п 2, 1 и 3, 2 и 3
Многие физические модели для бинарных систем учитывают только ,ю
парные межмолекуляриые взаимодействия, 1. е. столкновение двух (по не более)
молекул Радиусы молекулярного взаимодействия в неэлектролитах невелики,
поэтому часто оказывается доиустимЪ|М рассматривать взаимодействия только
между ближайшими молекулами, а затем суммировать все эти попарные взаимо
ДСЙСТВ1 я Полезным следствием таки* упрощающих допущений являете!, го, ч,о
при лещлгтде к тройным (или еь,сш(1.'|) системам требуется информация только
о бинарных, т. е двухчленных взаимодействиях, копстанг, характеризующих
тройные (ил,, высшие) взаимодействия, пе появляется Однако не для ьсех физ,,
ческик моделей используются указанные упрощения, часто требуйся доцо,.|[и
тельные допущения, если конечное выражение Для Должно содержать толы-о
постоянные, которые рассчитываются по бинарным данным
Для иллюстрации на простейшем гримере рассмотрим двухчленное соитно
дпегся уравнениями (8.5 9) и (8.5.10). Обобщение его щ, систему
компнпепг >,>, I рив,>дит s в лажепИ|С>
где мнощццль '/2 необходим для устраненья повторною учета мо.текуляр
пых игр Коэффициент Л,, рассчитыпается по данным для пар;/ [При сум-
мировании ,,с уравнению (Й.5.5) ,4 >j = /1^ --- 0 и 4A/t ]
Дл51 тронной системы уравнение (8.9 5) чринпмае- лиг
I- hs-Vi (8 0.6,
Коэффициенты активности получаются дифференцированием х равнения
(8 9 G) соответственно выражению (8 9.4) ирп учете того, что х; nt!nr, г,к
пр общее число молекул. I |ос,те днффсрсницро,>аппя щи комионспга h по-лу-
и'от,,=21;(а.-Ф4„) ,«7)
Ллч тропной системы уравнение (8.9 7) принимает п,,1;:
КТ 1 1 Yi '' 4jй'г г .1,5X5 ( 1 !г г 4|2 — 12.,) х2<, (8 9.8)
₽7 In уj = 1 jа-Х'^ I- 423 <з Ф (-412 4 '1гз — 4,з) (j <j 18.9.9)
КГ} (Уз = -1,14 - 42з4 ф (.4,, + ,4,5 _ 4П) МФ (8 9. ,0)
ТАБЛИЦ* 88. Три выражения для мольной ««быючдой энергии Гиббса
бн"а|”“
взаимодействий ______________________________________
I Мольная кзбцточкая
Автор. н.1ЭП.г||ие I энергия Г>к><кз
колпюнеит а
где T’j
8.=
ПЙ>3'1«оы Я и f расчитываются но ^pJBiieiuiu (8 10 4'-*).
Все постоянные п этих уравнениях могут быть получены по бинарным дан-
ным; данных о тройственных взаимодействиях пе требуется.
Уравнения (8 9.8)—(8 4 10) основаны на использовании простейшей модс.ц-
для g£. Эта модель адекватна только для смесей, которые можно считать идса.ть
ними, т е когда молекулы компонентов смеси похожи друг на друга по размеру
и химической природе. Примером может служить смеси бензол цшелогекеач —
толуол. Для большинства смесей, с которыми приходится иметь дело в химиче-
ской технологии, требуются более Сложные модели g&.
Сначала необходимо выбрать модель для gL. Затем, в зависимости от выбран
ной модели, можно по бинарным данным рассчитать некоторые (или все) постоян-
ные этой модели. Во вторую очередь дифференцированием [,ю уравнению (8.9 4, ]
определяются индивидуальные коэффициенты активности.
Поскольку мы располагаем выражением для коэффициентов активности как
функции состава жидкой фазы и температуры, можно рассчитать параметры фа-
зового равновесия пар—жидкость, решая совместно все уравнения равновесия.
Для каждого i-ro компонента в смеси
где Fi определяется выражением (8.4.2).
Уравнения равновесия в высшей степени нелинейны, поэтому совместное их
решение может бы?ь осуществлено только итеративными методами. Наиболее
эффективно такие методы могут быть реализованы на ЭВМ.
Пример 8.3. Простой пример, показывающий, как бинарные данные метут
быть использованы для расчета равновесия в тройной системе приведен в работе
Стила, Полинга и Мэнли [84], которые исследовали систему 1-бутен (I) — изо-
бутан (2) — 1,3 бутадиен (3) в интервале 40—160°Г.
Решен и е. Стил и др. измеряли в изотермическом режиме полные давления
как функции состава жидкой фазы в трех бинарных системах. Давления паров
всех трех чистых компонентов рассчитывались в зависимости от температуры по
уравнению Антуана
где PVp выражено в фудт-сила/дюйм2, a f — в °F. Значения констант a, b и с
чистых компонентов приведены в табл. 8.9.
Для каждой бинарной системы общее давление Р определяется выражением
р = S= S (W-»«)(р-PvpJ)/«р
(8.9 13)
где у( — коэффициент активности i-го компонента в жидкой смеси; У, — мольный
объем чистой i-й жидкости; —второй вириальный коэффициент чистого сг0
пара. Используются значения у,, Vf, В( при температуре Системы Г.
Уравнение (8 9.1.3) предполагает, что отклонения паровой фазы от идеаль-
ности описываются (в терминах объема) вириалышм уравнением, усеченным после
второго члена (см. раздел 3.11). Итак, поскольку’все компоненты Химически
ТАБЛИЦА 8,9. Константы уравнения Антуана для [-бутеиа (1),
изобутана (2) и 1,3-бутадиена (3) при температурах 40— 160'F
[уравнение (8.9,12)] [84]
12 0502
12,1465
12,1118
4067 25 413 786
4|70,45 430,786
4|2f]44 414,039
ТАБЛИЦА 8 10. Параметры чистых компонентов: 1-бутена (1), изобутана (2)
X 1,3-бутаднена (3) [84 |
Темпе ратура, |<1’ ( ... сила Дюйм2' ' (7-».,)/«' (Фя.т-спла.'дюТмЧ-'
<21 <3 н> (5) (3)
40 24,22 26,63 23,39 130 16,79 17,25 16.03
70 22 78 22,78 21,96 160 14,65 15,25 14 02
100 19,51 19,87 19,03
подобны и разница в размерах молекул невелика, авторы работы [84] использо-
вали правило Льюиса для фугитивности, по которому Вг,- = 0,5 {Btt
Для каждого hhctoio компонента значение —B^/RT представлено
в табл. 8 10,
Для предсивлелпя мольной избыточной энергии Гиббса бинарной жидкой
смеси использовалось одноиарамстрическое (двухчленное) уравнение Маргулеса
RT
(8.9.14)
По уравнению (8.9.14)
1п 7г = lny- = A'fjxf (8.9.15)
Уравнение (8.9.15) при обработке данных по полному давлению бинарных
смесей записывается для каждой температуры с целью получения постоянных
Маргулеса А ;•>. Постоянные Маргулеса для трех исследованных смесей приведены
в табл. 8.11.
Для расчета фазового равновесия в тройной системе Стил и др, предполо-
жили, что мольная избыточная энергия Гиббса определяется как
^"=/112¥1хз+ ^]3К1Хз ^23ХгХ1 (8.9.16)
Коэффициенты активности уг, у2 и уа находятся затем дифференцированием
[см. уравнения (8.9.8)—(8.9 |0) при учете, что A'if = A/-/RT].
Параметры фазового равновесия пар—жидкость можно определить, записы-
вая для каждого компонента
!/z/’=Y1*,Pvp[F; (8 9.17)
где в совмещении с предыдущими допущениями
ТАБЛИЦА 8 11 Постоянные Маргулеса А'ц для трех бинарных смесей,
образованных 1-бутепом (1), изобутаном (2) и 1,3-бутадиеном (3) [84)
Стил и ого коллеги находят, что рпссчитанные данные по равновесию пар -
жидкосгт. тройной системы находятся л отличном соответствии с их экспепимсн
гальпымн данными
Пример 8.4. Есть простая методика расчета миогокомпонецтнего равновесия
пар -жидкость, согласно когорой иредг|олагае*ся, что для многокомпонентной
смеси
(по всем
Р с in е и ,< е Для иллюстрации справедливости уравнения (8.9.19) рэссм>.>
трпм смесь грех компонентов: ацетонитрила, бензола и четыреххлористоц, угле
рода которую исследовали Кларк и Мисссн при 45 СС |2]].
Три комплекта данных ио бинарным смесям коррелировали с помощью
разложения редлися—Кистера, которое эквивалентно уравнению Maprv.'ieia
Вес констач1Ы приведены в тибл 8 12.
ТАБЛИЦА 8 12 Константы Редлиха—Кистера для трех бинарных смесей,
образованных ацетонптрнлом (1), бензолом (2) и четыреххлористым
углеродом (3) при 45° С [см. уравнение (8.9.20)] [21]
Если уравнение (8.9.20) для каждой бинарной смеси подс'авляется в урав-
нение (8.9.19), то получается избыточная энергия | иббса для тройной смеси.
Кларк и Миссеи сраипилн значения избыточных энергий Гиббса, рассчитанных
таким образом, с полученными по экспериментальным данным для тройной си-
стемы согласно выражению
Рассчитанные и Экспериментальные значения избыточной энергии Гиббса
находятся в хорошем соответствии. Результаты представлены в таб-т. 8.(3
Сравнение расчетных н экспериментальных результатов для более чем Г>0 со-
ставов показало, что среднее отклонение (не принимая во внимание знака)
было раннэ только 1 кзл/моль. Поскольку неопределенность экспериментальных
значений из-за погрсишостц опыта составляла величину порядка 3 ка.т/мсль,
Кларк и Миссен сочли, чго уравнение (8.9.19) является превосходным при
бтиженйем д.чii описания поведении этой тройной системы.
ТАБЛИЦА 8 ]3 Рассчитанные и наблюдаемые значения мольных
избыточных энергий Гиббса для системы ацетонитрил (1)—бензол (2) —
четыреххлористый углерод (3) при 45° С (21)
С.-ч-ттг.ь, >!ЛЛ'М->Л
риХт римХ
(1 I 0 7Ь'< 22 103 0,373 0,244 1'0 164
0.422 0 128 255 254 0.109 0, [79 165
(1,553 0,328 гзз 185 0,289 0 506 170 109
Хсроших экспериментальных исследований тронных систем не так уж
много, поэтому трудно судить, до какого предела можно распространить пози-
тивное заключение Кларка и Мнссеиа па другие системы Представляется веро-
ятным, что дач смесей типичных органических жидкостей уравнение (8 9.19)
обычно даст падежные результаты, хотя п наблюдались некоторые отклонения
особенно для систем с выраженной водородной связно Во многих случаях ощибки,
привносимые уравнением (8.9.19), имеют то; же порядок, Ито и ошибки экспери-
мента но бинарным системам.
Пример 8. ] кхмогря на то. ч । о лечу щен не адшпшигост» [у [.анп^лие (8.9.10)]
вас.то является хорошей аппроксимацией, для сильно непдеальпых смесей могут
иметь место зноч,(голыше расхождения между результатами расчетов ц экспери-
ментальными данными по p;iKi(Qi>ecino ,, хшогокомиопептных смесях Однако та-
кие расхождения существенны только |югдз когда они превышают неопределен-
ность экспериментальных данных Для обнаружения существенны* отклонений
необходимы данные высокой точысстп, а такие данные встречаются редко осо-
бенно для ipoilHM* систем, длч чстырг-хкомпопектных систем и систем более
высоких порядков их практически нс существует. Для пл.'носч рантш этого п°ло
женин рассмотрим тройную систему хлороформ—этанол—гептан при 50°С,
исследованную Эбботтом п др [| | Скача.™ были получены очень точные данные
для трех бинарных систем. Эти данные обработали по методу Баркера также,
как это делали Эбботт н Ван-Несс [2 [н другие исследователя [68] Существенной
чертой этого метода является то, что f нем испольэучогся только данные Р — х
/при постоял:ш, температуре) п нс используются данные по составу пара у.
пятнч.теннос уравнение Мартулеса и модифицированное уравнение Маргулеса т';
(8.9.22)
&12&21х! х 2
Еми в уравнении (8.9.22) ?.2I = ?-i2 — D, а в У|
— D и Т| — 6, то оба Offfr сводился к выражению
(8.9 24)
которое эквивалентно четырехчленному уравнению Маргулеса, представлен-
Если к тому же принять Г> — 0, то уравнения (8.9.22) п (8 9.23) сводятся
к трехчленному уравнению Маргулеса
Для двух бниарных систем хлороформ—renWi и хлороформ—этанол
экспериментальные данные обрабатывались по уравнению (8.9.22), а для нары
этанол гептан использовалось уравнение (8.9 23). Значения параметров, полу-
при расчете tiooin.ix лан.тенчй для каждое бинарной снеси дает прекрасное совпа-
Гиббса в иц,'.(
ТАБЛИЦА 8.(4. Параметры бинарных взаимодействий в уравнениях (8.9.22),
(8.9.23) и среднеквадратичные отклонения ДР полнпго давления для системы
хлороформ—этанол и-гептан яри 50° С {(]
I Хлороформ (II — I этанол (2) Хлороформ (I)— I i«-PTaH (3) I ' |'<"тан '(2)
_д> 0.4713 0,3507 3,4,301
^21 [ 6043 0,5262 2,4440
<Х12 0,1505 И,!9о0
0,1505 2,3806
0 9 (369
—0,365[
А. 0,5855
АР, мм рт. ст 0 56 0,54 0.34
Эбботт и др. рассмотрели два упрощения:
упрощение а: С0—С1 = Сг = С3 О
упрощение б; CL -и С? = Сд =0; С&
где величины А'-— параметры бинарного взаимодействия, представленные
в табл. 8.14.
Упрощение б впервые предложено Волем в 1953 г [94] на основе полуэмни-
рнческого подхода.
При сравнении расчетных значений полных давлений Для тройных систем
с экспериментальными были получены отклонения, превышающие погрешность
эксперимента: ____________________ _________________
38,8
бинарным данным, эти ограничения часто не являются серьезными для инженер-
ной работы. На практике часто случается так, что погрешности эксперимента по
бинарным системам столь же велики, что и ошибки, которые появляются при рас-
чете многокомпонентного равновесия по моделям для g£. параметры которых оп-
ределяются при использовании только бинарных данных.
Если уравнение (8.9.19) представляет собой особо простую аппроксимацию,
то уравнение ЮНИКВАК 1| уравнение Вильсона могут быть распространены на
многокомпонентные смеси не только без использования такой аппроксимации, но
8.10. РАСЧЕТ КОЭФФИЦИЕНТОВ АКТИВНОСТИ
Как чже указывалось в разделах 3.5 и 8.6, коэффициенты активности в би-
нарных жидких смесях часто можно рассчитать ио небольшому количеству эк-
спериментальных данных о парожидкостном равновесии такой смеси при исполь-
зовании какой-либо эмпирической (или полуэмипрической) избыточной функции,
типа показанных в табл. 8 3 Эти избыточные функции дают термодинамически
согласованный метод интерполяции или экстраполяции ограниченных бинарных
экспериментальных дайнах для смеси и для распространения информации по
бинарным смесям на многокомпонентные. Часто, однако, бывает, что данных но
смеси мало или они вообще отсутствуют, что приводит к необходимости рассчи-
тывать коэффициенты активности с помощью какой-либо подходящей корреля-
ции. К сожалению, таких корреляций разработано немного. Развитие теории жид-
ких смесей находится все еще на ранней с.гтдии, и, если достигнут некоторый про-
гресс в описании поведения смесей, содержащих небольшие сферические непо-
лярные молекулы, например аргон - ксенон, то для смесей, состоящих ид мо-
лекул больших размеров, особенно нз полярных или проявляющих водородные
связи, теория развита недостаточно. Поэтому немногие имеющиеся корреляции
в основном являются эмпирическими. Это означает, что расчета коэффициентов
активности можно проводить только для смесей, похожих на те, данные по кото-
рым использовались при разработке корреляции. Следует подчеркнуть, ч;о даже
при таких ограничениях точность расчета, за малым исключением, вряд лц будет
высокой, поскольку в расчетах для конкретной бинарной системы нс использу-
ются, по крайней мере, некоторые надежные данные для той или иной системы,
которая наиболее близка к первой. В последующих разделах сделан обзор не-
скольких полезных для инженерных применении корреляций коэффициентов
активности.
Тенрин ре,улнрных растворов. Следуя идеям, впервые выдвинутым Ban дер-
Ваальсом, Ван-Лаар, Гильдебранд ц Скэтчард, работая независимо Друг от Друга
[39], показали. что для бинарных смесей неполярных молекул коэффициенты
активности у, и могут быть выражены следующим образом
RTln^ = Г'-Фдсп + c2i - 2си) (8.10 1)
KI llTVj ш V24Jt -]- l22— ZC)2) (О.[(1.Ц)
Здесь УЧ — мольный объем чисой <-й жидкости при температуре Т, R -
универсальная газовая постоянная. Ф, п ©а — объемные доли, определяемые как
(8 10 3)
Ф2
a x обозначает мольную долю.
Для чистой жидкости плотность энергии сцепления с„ Определяйся в виде
&U: u „ .
где ДС/, — энергия, необходимая для того, чтобы изотермически перевести Жид-
кость » из состояния насыщения в состоянье идеального таза. При температурах
значительно ниже критических
ДУ/ = Д//р -RT (8(0.6)
где ДНП( — мольная теплота парообразования чистой т-й жидкости при темпера-
туре Т.
Плотность энергии сцепления с1г харакгертует ciiJii.i вчапм'.дейетг.ия межд..
молекулами компоненте I и 2. Эго кшюченая величии;! и урлжсииях A hr ]
|Де — параметр бинарного взаимодействия, отрицательны!1 плг положи,е ,
нъм. но всегда очень небольшой по величине по сравнению с единицей
Уравнения (8.)0 1) г (8 10.2) можио представить в виъ>
(8 Лм
(де bi — параме-р растворимости определяемый соотиоикиньм
В качестве приближения Гильдебранд и Скэтчард (1рС'Д(|ОлоА-илн, что /12
— 0 В этом слугае уравнения (8 10.8) и (8 1.) 9) не будут содержать параметрон
бинарного взаимодействия, а коэффициенты активности у( и у2 могут рассчиты-
ваться при использовании только данных для чистых компонентов.
Несмотря на то, чю и А зависят от температуры, сеория регулярных ри'.т-
воров полагает избыточную энтропию равной кулю Отсюда c.ieayci, что ири
постоянном составе
RT In Yt = const (8.10 Hi
Поэтому правые чаеж уравнений (8.[0.8) и (8.10 9) могут быт). .и.(иисты
при любой тсмперагу-pe, для которой удобно рассчитывать все свойства Во мно-
гих случаях гакей температурой является 25 °C. Некоторые типичные ипаченая
параметров растворимости и мольные объемы жидкости пэеДстав.теиы н т.чбл 8.1 й
й[а рис. 8.5—S 7 приведены результаты расчета параметров равнотсии intp -
жидкость (при допущении (t2 = б) Для типичных неполярных смесей расчетные
результаты находятся в хорошем соответствии с экспериментом.
Уравнения модели регулярных растворов могут быть ле, ко распространены
на многокомпонентные смеси. Для ком, к,ней (a k
к г, = 11 ££ А - А -) A <s 1и 1->>
где
Aj = (А - fij)2 . (8 В 1.3)
Если все параметры бинарного взаимодействия I'j ирсднолага:о(ся рав-
ными нулю, то уравнение (8.10.12) упрошае-си до вида
где
(f< 10
В выражении (8 ТО. 15) суммирование осуществляется ,0 всем ьом-гпеигам
включая h.
Удивляет лростота уравнения (8 10 14). Согласно этсму уравнении,, в много
компонентной смеси Коэффициенты активности всех компонентов при любом cot -
таве и любой температуре могут быть рассчитаны при |Н'Пи.илован| и только па-
раметров растворимости и мольных объемов ЧИСТЫХ КОМ;ЮнСНГ<П> в жидком со-
стоянии. Для смесей углеводородов уравнение (8.10 14) часто являет; я хорошим
приближением.
Несмотря па то, что i арамегр бинарного взаимодействия /12 для псолярныл
смесей обычно горазд-, меньше единицы, его значение может быть сушесгвениым,
особенно, если разница между и б2 мала. Для иллюстрации, примем 7 — ЭОС)К,
фф — [00 смУмоль б1 — 7,0 и б2 7,,' (кал/схг’Л'Л При бссконеЧ! ом разб.зв-
ТАБЛИЦХ 8 15. Мольные объемы жидкости и параметры растворимости
некоторых неполярных веществ 11
Cxcii'iieiiHiiie газы при 90 К
Ааот
Окись ' I теро.и
Аргон
Кислираз
Метан
Че-ырехфгорис-цй углерот
Этен
Жидки'. pacutJopwiexu при25еС
Перфт"р-ч re;i~;iu
Неопентан
Изопентан
я-Петттат;
и-Гекеаи
1-Гскссп
н Октан
н Гексадеюн,
Циклогексан
Четыреххлорпс’ык утлерсн
Этилбензол
Толуол
Бензол
Стирол
Тотрахлорзти.тсн
Сероуглерод
Ленин (Ф„ 1) находим по сравнению (8 108), что у~ — 1,04, если — п
Однако если / 0 — 0,01, получаем у“ — 1 24, а если /р — 0,03, то yj” - 1,77
Эти результаты показывают, ч,с> значения рассчитываемых коэффициентов актив
ности часто чувствительны к малым изменениям 1,3 и часто расчетные резуль-
таты могут быть значительно улучшен:,I, если имеется хотя бы одна эксперимен-
тальная точка для определения'+.
Попытки создать корреляции 113 особых успехов не имели. При псследовапт’н
бинарных к’>п<>геппых смесей Базуа и Праусннц [6] не смогли найти удовлет-
ворительной зависимости /1а <>т свойств чистых компонентов, однако Чен: с Цан-
дером [20] а также Престон и Прауснии [71 ] обнаружили приближенные связи
Этих величин Во многих типовых случаях значение /1с положнте.н.нэ и сильно
возрастает при увеличении разницы в размере и химической природе молекул
компонентов Например, для смесей двуокиси углерода с парафинами при низ-
ких |емпера'|урах Престон нашел, что ?12 — —0,02 (Mei.ni), /]2 = +0,08 (этан),
/15 — +0,08 (попан), /12 =+0,09 (бутан).
Поскольку /,2 является по существу эмпирическим параметром, то он зависит
от температуры. Тем не менее для типичных неполярных смесей в широком ин-
тервале температуры эта зависимость выражена очень слабо.
Для смесей ароматических и насышент-ых углеводородов Функ и Прауснии
[30] установили систематическое изменение /12 в зависимости < т структуры насы-
щенного компонента (см. рис. 8 8). В этом случае может быть найдена хорошая
корреляция, так как имеется сраппцтельпо много экспериментальных данных
и круг веществ ограничен по своей химической природе На рис. 8.Доказано
влияние величины /12 на расчетные значения относительной лету'чести в одной ти-
пичной из рассмотренных Функом и Праусницем бинарных систем. 7_
Натра неспособность установить корреляцию lLi для различною рода смесей
обусловлена недостаточным пониманием сил межмолскулярного взаимодействия,
особенно при небольших расстояниях
между молекулами.
Некоторые исследователи пытались
распространите теорию реуглярных раст-
воров на смеси, содержащие полярные
компоненты, но поскольку рассматривался
ограниченный класс компонентов, то такое
распространение имеет только полуволн-
чественный характер. При расширении
теории регулярных растворов полагали,
что плотность энергии сцепления может
быть разделена на отдельные составляю-
щие от неполярных (дисперсных) и по-
лярных си,т
(8 10 16)
Уравнения (8 10.1) н (8 10 2) цснолыуются со следующими подстановками:
+ (8.Ю.17)
<22 — У - л: (8 Ю 18)
с]2 - Zj/2 I-Tj.T2-h 4'12 (8 10.19)
где X, — неполяный параметр [ астворнмости (ДУ ^л.щнЬ т< ~ по-
лярный параметр растворимости [if — (Ai^,/Vtz-)n0T„ J,
Как показали Ваймер и Праусниц [91 ] на Примере своей Корреляции коэффи-
циентов активности при бесконечном разбавлешнт углеводородов в непроявляю-
Ющих водородные связи полярных растворителях, пренебрегать параметром би-
нарного взаимодействия cpi2 нельзя.
Дальнейшее расширение сферы применимости уравнения Скэтчарда—
Гильдебранда с целью охвата компонентов с водородными связями мало обосно-
вано теоретически, поскольку допущения теории регулярных растворов будут
ошибочны для смесей, содержащих та;<не компоненты. Тем не мопсе некоторых
иодуколкчественных успехов в этом отношении добились Хансен и др. [35],
а также авторы работ [18], которые занимались разработкой критериев выбора
растворителей для красок и других покрытий Нулль и Палмер [60] также ис-
пользовали модифицированные параметры растворимости для разработки эмпи-
рической корреляции коэффициентов активности.
Коэффициенты активности при бесконечном разбавлении. Эксперименталь-
ные значения коэффициенте активности при бесконечном разбавлении особенно
полезны в случае расчета параметров, используемых при определении избыточной
энергии Гиббса (ем. табл. 8.5). Предположим, что имеются данные пэ коэффициен-
там активности у" и ?“ Для бинарной смеси при бесконечном разбавлении. Они
могут быть использованы для расчега двух настраиваемых коИСтант в любом вы-
ражении для Напрцмер, рассмотрим уравнение Йан-Лаара'
(8.10.20)
Как указывалось в разделе 8,5, оно дает
ет|„Т2.в(,+'Ш)-
(8.10.22)
В пределе, когда xt—»0 или х2—»0, уравнения (8.10.21) и (8 10 22) пр,],
нимают вид
/?Т1ц?”-тА (8.1023)
RT 1и _ В
попучецпьге с использованием каной Либо К-ррс'-чятм, „..и пр, -оцм wx
апазонс составов Для полностью cMen,niMioi'<.iхс.я жсдкостсн особенно полезно
уравнение Вильсона. Параметры Д12 и Лг1 ннхоДитсн c<>3Mcc'rHiot реп синем
к Эк В табл 8.[6 тредсгавлёш!! типичные результаты, полученные Шрайбером тертом. Средняя оП|Рбка в определении значений сосана пара, нолученпад при
полу бер : если льзованпи только данных лишь немногим больше ветичпиы ошибки, чецчой при нсполu-озанци данных но у для всего диапазона сметаi on. I[]рай- и Эккерт показа.1!,! также, что хорош ,с рсзул,татЬ1 часто можно получи,,), использовать либо V^, либо Y™ (а че обе ли величины) Кома им, кис, дан-
сона. 100о голько по?", разумно использог.ат!. oniioiiapaMcip'i'iccKoc уроненис В,)3(,- . и чем уже шпорилось выше [см уравнение (8.5.12)]. Широкая корреляция для данных по у00 в бинарных системах разэабоюпа оггп, Дилом и Дерром [65 | Она может исг10зь.з:>катьс>1 для предсказания у* , углеводородов и тнпичтпдх органических компонентов например сложных св, альдегидов, спиртов, кетонов, нитрилов, в диапазоне температур 25— С. Соответствующие уравнения и таблицы собраны Трейба.том [89] и с нс-
ТАБЛИЦА 8 16. Качество описания бинарных данных уравнением Вильсона
при использовании предельных коэффициен|ов ак>ивнпсц| 1771
Ацст11н ((.G5) бензол (1,52)
Чегыреххлозкстып углерод (5,66) — ацетони-
трил 79,301
Этан<,л (18,1) — н-текса!] (9.05)
Хлоэофоэм (2,1Ю) — мссан<х| (Ч 46)
Ацетон (8,75) — вода (8,60)
l()ii
которыми изменениями воспроизведены в табл 8.17 и 8.18. Точность коррсля
пии существенно меняется от одной системы к другой; если величина у* нс
отличается на один или несколько порядков от единицы, то среднее отклонение
значений у” составляет около 8%.
Использование табл 8.|7 иллюстрируется примером, который опои,, напо-
минает I:римср, приведенный Трсйбалом
Пример 8.6. Определить коэффициенты активности i:ptt бесконечном раз-
бавлении для бинарной системы этанол — вэда при 100‘С.
Гниение. Найдем сначала у» для этанола Индекс 1 относится к эта-
нолу. индекс 2 — к воде. По табл. 8. |7 а - —0 420, к — 0 517. с ~ 0,2.30.
0 — I), а .V, — 2, По уравнению (а), помещенному в конце табл. 8.17. имеем:
у» (этанол) — 5,875.
Далее, для роды, опять пользуемся табл. 8 17 Теперь индекс 1 относится
к воде, а 2 — ц этацолу, Имеем:
7” (вода) — 3,9.
Эти paC'ieiные результаты .хорошо сот-часуются с экспериментальными дан-
ными Джонса и др. [43]
Азеотропные данные. Многие бинарные >нс.вЬ|Ы 5иляюк‘.я .и.ео,репными,
т. е такими, у которых состав жидкой смеси одинаков с составом равновесного
пара Если лявесонн азеотропные условия (температура, давление, состав), то
коэффициенты активности находятся легко. Эти коэффициенты метут быть затем
использованы д.тя расчета двух параметров по какому либо провзволцно ныбпан-
цому нз табл. 8.3 поражению для избыточной Энергии 1 цббса Обширные данные
ио азеотропным смесям собраны в |4||.
признает вид.
Зияя обще.' давление i‘ и давлснц» паров чистых компонентов PVP| ц Pvp2,
Можно определить у. и у2. Используя эти значения коэффициентов активности
шепнем двух уравнении вида
(8.10 28)
(8 10 29)
для которых должно соблюдаться условие ху = 1 — х2. Функции /, и /2 пред-
ставляют собой термодинамически совместимые уравнения, форма которых
зависит от выбора выражения для избыточной Эцертин Гиббса Совместное ре-
шение уравнений т8. |0.28) и (8 |О29), в принципе, несложно, хотя необходи-
мые алгебраические преобразования могут потребовать некоторого труда, осо-
бенно если /т н /» имеют сложную .форму.
Пример 8-7- 1 [рои.тлюстзнруем сказанное выше небо.тьнтим ирцмером, по-
хожим ца приведенный Треибалом в работе [89]. для системы Этллаиетат (I) —
эттщол (2) Этп система образует азеотроп nlni 59 м'т рт ст , 71 8?С н -
-- 0.462,
Решение Для заданных условий иСц ыьзуем сравнение (8.|0 27)-
У| = 760/631 = 1,204; уу == 760y58! - 1 307
где (Ф| н 581 —Значенья давлений- паров .щетых компонентов, выраженные
ТАБЛИЦА 8.17. Константы корреляции коэффициентов активности при бесконечном разбавлении для гомологических рядов
растворимых веществ и растворителей [651
Кислоты
Первичные спирты
Вторичные спирты
Третичные спирты
Спирты, общий случай
Аллиловые спирты
Альдегиды
Алкеновые альдег иды
Углеводороды нормального строения
Вода 25 — j.00 0,622 0,590 0 490 0 (al
50 —0,80 0.290 0 (a)
JOO —0,620 0.517 0,140 0 (a)
25 —0,995 0.622 0,558 0 (a)
60 —0,755 0,583 0.517 0.460 0 (a)
100 —0 420 0,230 0 (al
Вода 25 —J.220 0,622 0,170 0 (6)
60 —1.023 0,58,3 0 252 0 (b)
100 —0,870 0.517 0,400 0 (6)
Вода 25 —1.740 0,622 0.110 (cl
60 —1,477 0,583 0.252 (<?)
100 —1,291 0,517 0,400 (c)
Во '1а 25 —0,525 0,622 0,475 0 (rfl
60 0,33 100 -0,15 0,583 0,39 0 (d)
0.517 0,34 0 (d)
Вода 25 —1,180 0,622 0,558 0 la)
60 —0,929 0,583 0,460 0 (a)
100 —0.650 0.517 0.230 0 'a)
Вода 25 —0,780 0,622 0.320 0 (a)
60 —0.400 0,58.3 0 210 0 (a)
100 —0,03 0.517 0 0 (a)
Вода 25 —0,720 0,622 0.320 0 (al
60 —0.540 0,583 0.210 0 (a)
100 —0,298 0.517 0 0 (a)
Кетоны Вода 25 60 100 —1,475 — 1,040 —0.821 0,622 0,583 0,517 • 0,900 | 0.330 0.200 0 0 0 (ft)
Ацетали Вода 25 —2,556 0.622 0,486 (el
60 —2,184 0,583 0,451 («)
100 — 1,780 0.517 0,426 (И
Простме’эфиры Вода 20 —0,770 0,640 0,195 0 (X)
Нитрилы Вода 25 —0.587 0,622 0.760 0 ’a)
60 —0.368 0.583 0.413 0 (a)
100 —0.093 0,517 0 0 (a)
Алкеновые нитрилы Вода 25 —0,520 0.622 0,760 0 (a)
GO — 0,323 0.583 0,413 0 (a)
100 —0,074 0.517 0 0 (a)
Сложные эоиры Вода 20 —0,930 0.640 0,260 0 (ftl
Форматы Вода 20 —0,585 0,640 0,260 0 (a)
Моноалкилхлориды Вода 20 1.265 0,640 0,073 0 (a)
Парафины Вода 16 0.688 0,642 0 0 (a)
Ачкилпроиэводные бензола Вода 25 3.554 0,622 —0.4G6 (/)
Спирты Парафины 25 1.900 0 0,475 —0.00049 (dl
60 1,460 0 0,390 —0,00057 (d)
100 1,070 0 0,340 —0,00061 (d)
Кетоны Парафины 25 0.0877 0 0,757 —0,00049 (ft)
60 0,016 0 0,680 —0.00057 (ft)
100 —0,067 0 0.605 —0,00061 (»)
Другие раствори 'ые вещества.
Вода Спирты нормаль- 25 0,7п0 0 0 —0,630 (a)
ного строения 60 0.680 0 0 -0,440 (a)
100 0.617 0 0 —0.280 (a)
Продолжен ие
11 т СТ |'<||’11 ИНС (1 1 Растиори-сть (В) I I’bivpa | 2 1 " ’ нснис
Веда Вюрнчпые спор 80 1,208 0 0 —0,690 (С)
Зола Кегоны нормаль- 9 Я 1 857 0 0 1,019 U)
ного строения 60 100 1.193 1,231 0 0 0 —0,73 0 557 с) (Г)
Кегоиы Спирты нормаль- ОП —0,088 0,50 0,00049 —0,630
ного строения 60 кю — 0,035 —0,035 0,138 0,33 0,20 —0,00057 -0.00061 — 0,440 —0,280 (Я) (в>
Альдо; и ты Спирт ы нормаль >й - 0,701 (1 1 7(, 0,320 —0,00049 —0,630 (Й1
hoi о строения 60 - 0,239 0,133 0,210 — 0,00057 —0,440 ео
Сложные лриры Спир । ы и. >р м. |,ль - 25 0 212 0,176 0,2о0 — 0,00019 0,630
ного строения 00 100 0,055 0 0,138 0,112 0,240 0 220 —0,00057 -0,00061 — 0,440 —0,280 &
Апеталп Спирты норгиль ного строения 60 — 1,10 0,138 0,451 — 0,00057 —0,440 о
T.ip~n)j|jju ,1 Кетоны 25 60 90 0, 1821 0,1145 0,0716 0,00049 -0,00057 -0,00061 0,402 0,402 0,402 (/1 г
(d) 1е?Г = “ + ^.^Ц-1- +-^ + ^-з] + П(^-^
, ,. . , I I , 2 \
(е) Igv — а I- кА । s , . • .» I
Л, /V, )
<П leif- »4-«Л1 1 : (т^ i)
и шт- « + ,-£- ь;(^- + д!;) + ч(-’,-аУ= + 1
Л '4Н’»Г+''(Л'1~'','>2+*Г
О 18ТГ-» I •£ ч(-^- I-J. i-^j-4(s'>-AJJ+»v
(,) 18Т--С •;Л^1(»1-Ч2 + »(л!Г + ^)
.V,,
V',
N 2 — общее
-V" — ЧИСЛО
таким
число углеродные атомов в молекулах I и 2, соответственно;
углеродных атомов в соответствующих ветвях разветвленных соединений, включая полярную группу,
образом, для третичного бутилового спирта
N' = N" = АГ = 2
ТАБЛИЦА 8.18. Константы корреляции коэффициентов активности при бесконечном разбавлении для гомологических оядов
углеводородов в специфических растворителях 85 четких рядов
рТзтура Растпоритсль
гептан J метил- фурфурол | фенол | этанол 1днэтллен этилен• гликоль
1 ” 1 Значение г
25 —0,00049 0 0,0455 0,0937 0,0625 0,088 0,191 0 275
—0,00055 0 0,033 0,0878 0,0590 0.073 0,161 0 179
— 0,00058 0 0.025 0,0810 0,0586 0,065 0 173
—0,00061 0 0,019 0,0686 0,0581 0,059 0,134 0,158 0,226
1 Значение 6
25 0,2105 0,143а 0,1152 0,0836 0,1421 0,2125 0,181 0,2022 0,275
0,1608 0,1212 0,1142 0,087а 0.1054 0,1575 0.129 0, 1472 0,2195
0,0531 0,0734 0,1035 0,0767 0,0996 0,1492
Зна чеаис k
25 0,1874 0,2079 0,2178 0,2406 0,2425 0,3124 0,3180 0,4147
0,1478 0,1754 0,1675 0,1810 0.1753 0.2406 0,2545 0,3516
0,1051 0,1427 0,1185 0,1480 0,1169 0,1569 0,1919 0,2772
Раствори* Уравнение I
чело (I) Значение а
25 Парафины (о) 0 0 0,335 0,916 0,870 0,580 0,875
50 0 0 0,332 0,756 0.755 0,570 0,72 0,815 1.208
70 0 0 0,331 0.737 0,690 0,590 0,725 1,134
90 0 0 0,330 (1,771 0,о20 0,610 0,08 0,72 1 089
25 Алкил про- (а) -0,260 0,18 0,70 1,26 1.20 1,06 1,678
30 изводные цикло- -0,220 0,650 1,120 1,040 1,01 1,46 1.61 2,36
70 гексана 0,195- 0,131 0,581 1,020 0,935 0,972 1,550 2,22
90 0,180 0,09 0,480 0,930 0,843 0,925 1,25 1,505 2,08
25 Алкилпро- (0) 0,466 0,328 0 277 0,67 0,694 1,011 1,08
50 изводные бензола -0,390 0,243 0,55 0,580 0,938 0,80 1,00 1,595
7(1 - 0,362 0,225 0,240 0,45 0,500 0,900 0,96 1.51
90 0,350 0,202 0,239 0,44 0,420 0,862 0,74 0,935 1.43
25 Алкилпро- (а) 0.10 0,53 0,169 0,46 0,595 1,06 1,00
50 изводные ш фталина 0,14 0,53 0,141 0.40 0,54 1,03 0,75 1,00 1,92
70 -0,173 0,53 0,215 0,39 0,497 1,02 0,991 1,82
90 0,204 0,53 0,232 0,445 0,83 1,01 1,765
25 Алкилпро* (а) 0,28 0,244 0,179 0,552 0,378 1,43
50 изводные тетралина 0,24 0,528 0,364 1,00 1.38
70 0,21 0,220 0,217 0,447 0,371 1,33
90 0,19 0.373 0,348 0,893 1,28
25 Алкилпро* (о) -0,43 0,871 1,54 1,411 2,4b
50 изводные декалина -0,358 1.367 1.285 1,906 2,25
70 -0,355 0,356 0,80 1,253 1,161 2,07
90 -0,320 1,166 1,078 1,68 2,06
wogody
Для $ytK uift it '"г выбираем уравиешгя Ван-Лаара, нрдвсде^нь/е » табл 8.3
После ал7<,бр.'1ичс('1.1и ирообразоваiiftij нолхчаем выражения для А п В в явном
во всем диапазоне составов гомогенных областей. Предположим, что раствори,
мость (мольная доля) компонента I в компоненте 2 равняется х* , а компонента 3
в компоненте | соответственно х£. Индекс s означает насыщение, а штрихами
обозначены две жидкие фазы. Если хГ и хГ известны при некоторой темпе-
ратуре Т. то можно определить коэффициенты активности для обоих komuohcij-oo
в )<>могенных областях 0 s7 xj =; %;' и 0 С х” С х'~.
Для определения коэффициентов активности необходимо выбрать какое-
либо термодинамически совместимое аналитическое выражение, которое святы
васт коэффициенты активности у, и у2 с мольной долей х (см, раздел 8 5) Та-
кое выражение содержит одну или более констант, характеризующих бинарную
систему Э-ц константы обычно зависят от температуры, хени ее влияние часто
невелико-Две такие константы можно определив из уравнении равновесии
жидкость—жидкость, которые имеют вид'
(W)5' =(Т1х|)5''; (У^)'- = (у2х2/ (8.10 30)
Предположим, что было выбрано двухкомгонентнос выражение дтя моль-
ной избыточной энергии Гиббса gL Тогда (см. ратдел 8 5)
где fi. f-> — известные функции, А, В — ны звььтиые константы.
Константы А и В могут быть найдены совместным решением уравнении
(8.10.30) и (8.10.31) с использованием экспериментальных значений х,' и х] ,
а также уравнений материального баланса
Расчет, в принципе, прост, хотя алгебраические преобразования могут по-
требовать некоторого труда (это зависит от сложности функций Д и /г).
Для иллюстрации в табл. 8. |9 представлены результаты, полученные Брайе-
ном 114] для пяти бинарных водных систем. Индекс 2 относится к иоде. Для
расчетов использовались уравнения Вач-Лаара и трехчленное (дзухпараметриче-
скос) уравнение Маргулеса (см. табл. 8.3) В табл. 8 19 даны расчетные зна-
чения коэффициентов активности при бесконечном разбавлении, которые нахо
дятея в простой связи с константами 4 и В [скг уравнения (8 10 23) и (8. |0.24] ]
ТАБЛИЦА 8 19 Предельные коэффициенты активности, рассчитанные но
значениям взаимных растворимостей в пяти бинарных водных системах [141
Анилин ИзобутИл оный |00 9(1 0,01475 0,0213 0,372 0,5975 1.8337 1,59‘)о 0,0193 0 6076, 0 4020 —0,4514 —3 0478
спирт 1 Бутй) от 90 0,0207 0 030 1.6477 11,2440 0,3072 —4,1НИ
Фенол 43,4 0.02105 0 7325 1,6028 —0,1408 0,2872 --8,2901
Окись пропи- 30,3 0,166 0,375 1,1103 1,07-13 0,7763 0.7040
расчеты Брайена доказывают, что результаты чувствительны К выбору
выражения для мольной избыточной энергии Гиббса Брайен при сравнении
результатов расчета с экспериментальными дяниыкй по равновесию пар —жидкость
вашей, что уравнение Маргулеса даст плохие результаты, а уравнение Вап-Ла-
ара—приемлемые, .хотя и невысокой ’о'нюети.
Расисты подобного рода могут быт;, проведены и по трехнарамстрическому
уравнению для и5, однако в этом случае третий параметр должен определяться
независимо. Для таких расчетов по уравнению НРТ.Т Реион и Праусниц (751
разработали специальною номограмму.
Вообще говоря, данные ро втягшпой растворимости позволяют нлходята
только приближенные значения коэффициентов активности, хотя, конечно лучше
хоть такие расчеты, чем никаких, Их результаты чувствительны че только к вы-
бору выражения для gp. но даже и к малым ошибкам эксперимента по определе-
нию взаимной растворимости.
Методы групповых составляющих. При разработке ко >реляии,| термодинами-
ческих свойств часто бывает удобным рассматривать молекулу как агрегат функ-
циональных групп, то)Да некоторые термодинамические свойства чистых газов
и жидкостей, например теплоемкость пли критический объем, могут быть рас-
считаны путем суммирования групповых составляющих. Лангмюр очень давно
предложил распространить Эту концепцию на смеси. Было сделано несколько
попыток создать истоды расчета теплое смешения и коэффициентов активности
по групповым составляющим. Угомдкетг только два метода (оба для коэффициен-
тов активности), которые дают приемлемые результаты даже для сильно неидсаль-
ных смесей, причем когда .чайных почти или вовсе нет. Эти методы, носящие
название АСОГ н ЮНП'ЙАК г’ в принципе похожи, но разнятся в деталях.
В основе любого метода расчета по групповым составляющим лежит идея,
заключающаяся в том, что, хотя химическая технология имеет дело с тысячами
химических соединений, тех. tie менее число функциональных групп, из которых
состоят эти Соединения, значи-ельро меинпе. Поэтому, если предположить, что
физическое свойство гада или жидкости есть сумма вкладов функциональных
групп молекулы можно получить метод юррелянии свойств большого количе-
ства газов и жидкостей через значительно Мсныпес число параметров, характе-
ризующих вклады отдельных- групп
Любой метод групповых сс’еит.тякших обязательно является приближен-
ным, поскольку вклад дайной группы в одной молекуле совсем необязательно
будет таким же в другой молекуле. Основой методов групповых составляющих
является предположение об аддитивности: вклад одной ipynnw в молекуле пред-
полагается независимым от любого из вкладов других групп молекулы. Данное
положение справедливо только в ток случае, если на роль любой группы в моле-
куле its влияет природа других групп этой молекулы.
Например, мы нс ожидаем, что вклад карбонильной группы в кетоне (скажем,
в ацетоне) будет таким же. как и вклад карбонильной группы в органической
кислоте (например, в уксусной). С другой стороны, опыт показывает, что вклад
карбонильной группы, например, в ацетоне близок (ec-Tjf не идентичен) вкладу
карбонильной группы в другом кетоне, скажем, в бутан<>не-2
Точность корреляции повышается с конкретизацией различий групп. Напри-
мер, при рассмотрении алифатических спиртов в первом приближении не де-
лается различия между гидроксильными группами, находящимися в различных
позициях (первичных или вторичных), однако для второго приближения уста-
новить эти различия Желательно. В пределе, делая нее больше и больше таких
различие. мы открываем лучшую «группу»— Саму молекулу. В этом случае
теряются преимущества метода групповых составляющих. Для пользы дела
должен бьль достигнут компромисс. Число различных групп должно оставаться
небольшим, однако достаточным, чтобы учитывать существенные влияния моле-
кулярной структуры па физические свойства.
Распространение кокдадции групповых составляющих на смеси чрезвы-
чайно соблазнительно, поскольку число чистых газов и ж-ядкоетей, испольчуе-
’) ЛСОГ = ASOG. (Analytic.)! Solution of Groups, г. e. аналитический
раствор'груоп), 10НИФЛК -- UNIFAC.
гдс X/ — мольная доля компонента n eve, t>: s;- — "поло размерных rpj п,> и мо
лекуле /
Патамстр 5/ нс зависит от (емпсратуры. Суммирование осиие'твляегся по
всем компонент, включая компонент i.
Для расчета у^ необходимо чцать все грушювне ме.шче ДпЛг Y, ^индекс I;
относится к определенной группе в молекуле ’1
S X! S '/tJ-
(S 10 3'J)
где «ь, — чисдо взацмодснстоующпх групп !г и молекуле J.
Коэффниьедт аксщзаосtи уС‘ определяется выражением
s Z VK
(S1.) 3?)
где Г, — уозфсриц,(С1,| актпв.кСти rpVhinu k п смеси: ('*, ьоэф^игпенг акгцз-
рости группы h н с,пндартпом состоянии. Э>о стандартное состояние
запись? от молекулы '
Коз^фш'иент актьзн<>ст(, дается сравнением В^лксим
(<ч 1'1 ал)
Уравнение (8 К) 38) пспочьчуется также для оррсдепении Г), к
однако в таком случае он<> применяется для ч.меси^ 1,лпп. цч которых сле-сы
чистьш коспуасиг (. Нлорпмер ссьц ,-м компонент вода гёк"н1' пли Gcr-
Здесь и.еедцолагаегея, чго в огпоннжми груяковы'
дспаегся рятличий хгждч группами СНг н СН;|.
оензп 1Г.Г11Ч-и п< j г:ir iirnuj и кт| н.. гг и.1 in-л иr.-i ;ii . 1 r I'lll И 1 \1 1 i н i |Я и, 1 те i ] i г |Ц Hi к т 1 >Е / J „ t П t (ГЦ 01 ц Ьс 1 to тля m 1
41' а Г Г ;<1Го рзг.понсегя спс-ем по которым пет эксисрим1-н>нльнь:.х дани1'1'. В основ- по Iiiinit ют t Н)НИ 1 AR < т дм Г 1ет (\ А( OI в т т j к ф Lunin-пы 1 в 1 ’ 1 ' « 1 ’м > 1 ’1 'г| ' । 1 1 '1
Для । 111 Hill C.'ll'.'IK'll'HllIT Jl'Cl llll.'ll VM 'll ГГ.1 I [ронлво-щтсн oi'psooTixi э.,-сиерименга.|нно опреде,и'ыч.1х 'inTiei.iik коэф-
ф|Ш.И' ствкг ец к г at thi’i > ti тя п м ini i i ip ineipoE । ii if t i uni' । шм цен (it i и i| inpiii rpv и e н »те1 т| тити i н\ и i n -irtt i i ii | и i it Hot -< для pa hit i j.(। in util ai тпвц тп
II ТП' те » 1 .'Г-1 ' г и гл 1 1 fin А Пер leliTi [Ьцо Hl ti тетнь ш 1 1с 7е(л- ~ а । in 11 а 1111<!нtiа ।. 11ы1' .кастудярныи коэффициент активности разделяется оз две части Одпс характер" 'мс” вк.та г он условленны и различиями в мэноре молекул, a дру - 11 т I iei ti 111 \ 11 к шип мп t яр пт । е мм д и it и я и В м ALOI первая часть определяется npt Нспользонанпн нроизиольнэ вторая-
1101 II Деляе ГЪ «1 i i Ю1П ноете чисть так и уранц<||ня Флори лаггипсл лтя атермнчеекях систем БтораЯ ii.ic-гь опрс- тся (,о уравнению Ьь.н.еола в приложении к функциональным группам т 1 i tint nt iji lee tTnithii irii ircJiiHiHIil । < nllei TUtti вора tpvttn» < Уравнением kJllHRBAK (см. таол. b.o). Во-первых модель IRBAK уже содержит коиыиагарнтю часть '.чи(ыва(ошую различия в раз- ] с iiiiii ис чни । J. 1J it i' ы t г th te 1 ие ioч-аствии. be нг.рых. pu I'tepb: функциональных групп п площади поверх и птагмолеиствИя рассчитываются по ^Таиным о мо.теку.тгрпот структуре 1х компонентов, которые опреде.п к>тсч независимо, ' разненис ЮНИКВАЬ. хорошо прелстанлнет равновесие к,.к пар—жидкость. । ид| г —т-илк т1 в мн'>т Темп н нтных । тч \ pi ашцх рати пне i ЭЛ Тр mil Наприм Р iricB Т ) Tt к т i> т 1ые ||
ВОЛУ норны, гпцрты. нитрилы ц т. д. Применительно к ьногокомпонентнеш урыпгепое ЮЫИКВАК для коэф'Ьнпиен'а акшвцоити (миЛекутярцого; it" и in i iimcei isrt,i:
(е Ю.39)
где
(,.10.10)
ТАБЛИЦА 8.20. Групповые параметры объема и площади1)
Номер I группы ' Номер 1 Группа группа 1 Примеры разбивки | на группы
1 IA сн2 Алкапиая группа
сн8 Конечная группа углеводородной 0,9011 0,848 Этан: 2СН3
IB цепи
снг Средняя группа углеводородной цепи 0,6744 0,540 «•Бутан: 2СН3, 2СН2
IC сн Средняя группа углеводородной пени 0.4469 0,228 Иаобутан ЗСН3, ICH
2 с=с Олефиновая группа (только а-олефип) 1.3454 1,176 а-Бутеп: 1С=С, 1СН2, 1СН3
,3 АСМ Ароматическая углеводородная труп- 0,5313 0,400 Бензол 6ACII
4 АССНа Ароматическая у глерпд-алкапная группа
4А АССНа Общий случай 1,0396 0,6(10 Этилбензол 5АСН, 1АССН,,' 1СН3
4В АССН3 Толуольная группа 1,2663 0.968 Толуол: 5АСН, 1АССН3
СОН Спиртовая группа, включает бли жаншую СН2
5В СОМ Общий случай 1,2044 1,124 Этанол 1СН3, ICOH
мсон Метанол 1,4311 1.432 Метанол- 1МСОН
5С сном Вторичный спирт 0,9769 0,812 Иаопроиацол 2СН3, ЮНОН
6 иго Нода 0,9200 1,400 Вода: 1Н20
7 АСОН Ароматическая углерод-спиртовая группа 0.8952 0,680 Фенол- 5АСН, IACOII
8 со Карбонильная rpvin.i 0,’713 0,640 Апеюи 2СН3 ICO
9 СНО Альдегидная группа 0,9980 0,948 Пропионовый альдегид: 1СН3, 1СН*,Г"'Я 1СМО
10 СОО Эфирная группа (сложные эфиры) 1,0020 0,880 Мегалацетат 9С115, КОО
и о Эфирная группа (простые эфиры) 0.2439 0.240 Диэтиловыи эдир ОСН,. ЗСМо, 10
CNHa Первичная аминная группа, вклго
чает ближайшую СН2
12А C.VU2 Общий случай 1,3692
12В МСКН2 Метиламин 1,5959
13 NH Вторичная амгнная группа 0.5326
14 АСХНг Аром<11ическая углерод аминная 1,0600
группа
1,236 л-1 Юониллмин: iCH3, 1СН,, 1С.\
1,544 Метиламин: IMCNHS
6,396 Диэтилвмнн 2СИз, 2СП3, 1М1
0,816 Анилин 5АС1-1,, 1АСКН2
15
ссм
16
17
15В
16А
16В
MCCN
CCN
Нитрильная группа, включает бли-
жайшую СН2
Ацетонитрил 1,8701
Общий случай 1,6434
1,724 Ацеюпп грил 1MCCN
1,416 Пропионитрил. 1CCN, 1С113
CI Хлорилиая группа
Ci-1 Cl в соединении с последним атомом 0,7660
углерода
Cl-2 С1 в соединении со средним атомом 0,8069
углерода
СНС1а Дихлориднаи группа, только конеч- 2,0672
ная
0,720 1.2-Дихлорэтан. 2СНг, 2CI-1
0,728 1.2,3-Трихлорпропан- 2СНг, 1СН,
2С1-1, LC1-2
1,684 1,1-Дихлорэтан 1СНа, 1СНС12
АСС! Ароматическая углерод-хлоридная
группа
1,1562 0,844 Хлорбензол. 5АСН, 1АСС1
RT
Z>,’ X',
В этих уравнениях xt — мольная доля компонента i Н у p,r!incriir>i \ (8 10.101
И (8.10 111 суммирование идет но всем компонентам, ик.носач компонент > Bl
личина 0, — доля ижгцади, л'В; - сегментная доля, которая похожа на объем
ную долю. Параметры чистых компонентов г, п </,- характеризуют соответственно,
Молекулярные ваддерваат.еовскне объем!,, ц площади поверхности молску.1.
В модели Ю11ИКВАК два настраиваемых бинарных параметра т,-,- и т,-,
входящих в уравнение (8 10.41), го.лжны рассчитываться г,о экспериментальным
данным по фазовому щшнсиссию Для систем, содержащих три и более ромго
нентов, нс требуется .гарамсгрпв, характеризующих гройные или более множо
ственныс взаимодействуя.
В методе 1О11Р1ФАК [28] непосредственно tс гч-гьзус’ся комбинаторная
часть коэффициентов активности ЮПИКВАК [уравнение (8 Ю Ш)] Э:о уравно
пие включает только свойства чисты* компещеитов. Параметры щ и огреде
.чяются суммированием грурцозых параметров объема и г1Д|Ощади (7Д и Qt),
приводимых а тэбл 8 20.
~ E <?. = 2
(8.10 42)
где xj/’ всегда является ислыч числом ,г определяет число ipyпп тцпа /< в Хц,-
леку.пс I.
Групповые тгрзметрп /? и Qk рассчитываются по значениям ванлерваалр
Совского гру.щового объема Г^,); и по значениям площадей поверхности Л-,.,
приводимых Бонди [10]:
(8 10 ii)
Коэффигпгснты норма.ги^аггаг' 13, 17 и 2,3 ТО* определены по jpanelгпя*’
(бьема и площади зкеншей поверхносш с Jnniniioi о СНг в полиэтилене
Остаточная (энергетическая) часть иоэффнциепта акти-шостп [ура«де।>11с
(8.10 11)] заменяется на выра/кенис, полученное при использование! Konuciiiniri
'} ( Ol I
шему 50 групповых процентов СОН и 50 групповых процентов СН8 при тем-
пературе смеси, в то время как Г^'1 для группы СОН в бутаноле относится к рае
твору, содержащему 25 групповых процентов СОН, 50 [рущювых процентов
СН2 к 25 групповых процентов СН3
Коарфнциен! активности группы определяется по выражению, сходному
с уравнением (8 10.41):
(8.10 45)
Уравнение (8 10.45) применимо и к 1 i.11, В уравнении (8 10.45, 0;|! —поверх-
ностная доля группы т., а суммы включают все различные группы. Величина 0,„
рассчитывается подобно (1/:
(8 10 46)
где Хт_____мольная доля группы т в смеси.
Параметр группового взаимодействия 'Ртп определяется выражением
(8.10.47)
где Umn — мера энергии взаимодействия групп тип.
Параметры группового взаимодействия am,i должны рзссчнгЬ1ВВТ:.ся по
экспериментальным данным о фазозом равновесии. Следует отметить, что a.n,-i
измеряется в кельвинах и что о,,^ -j= аП1П. Параметры а,„п и рассчитываются
при использовании базы данных, содержащей экспериментальные результаты
в широких диапазонах параметров состояния и составов. Некоторые значения
параметров грунтового взаимодействия атп представлены в табл 8.21, В лабо.
раториях нескольких университетов ведутся работы по обновлению и расширь,
нию данных табл. 8 21.
Комбинаторная сощавляюшдя коэффициента активности [уравнение
(8.10 40)] зависит т^ько or размера и формы присутствующих молекул С уве-
личением координационного числа г для больших цепных молекул отношение
qt:г стремится к 1, и в таких предельных случаях уравнение (8.10,40) переходит
в уравнение Флор и — Хаггинса, используемое в методе АС.бГ,
Остаточная составляющая коэффициента активности [уравнения (8.10.41)
и (8. Ю.-45)] зависит от размеров площадей групп и от характера групповых
взаимодействий. Если все грушгьг одинаковы, то уравнения (8 ТО.44> ц (8 10.45)
становятся схожими ца уравнения, используемые в методе АСОГ.
функциональные группы упоминавшиеся в этом разделе, даны в табл. 8.20.
Поскольку каждая из перечисленных в -аблгие групп имеетсиои собственные зна-
чения R a Q. то предполагается, что подгруппы, входящие в состав основных
групп, т е. и.тцрнмер 1А. 1В и 1С, имеют одинаковые энергетические параметры
взапмодействия. Далее приводятся два примера, которые иллюстрируют, во-
первых. состаз и применение табл 8.20 и. во вторых, использование метедз
ЮНИфАК для расчета коэффициентов активности.
пасмом (2\ У бензола шесть групп АО | (rpvnrd 8) Поэтому
ZH2 (IB) и одна группа СОН
(5А). Поэтому v(^ = L v<7> - 1, I, r\ = 0,9011, R[n - 0,6741, ---=
s=l,2044 и !,t -- (1) (0,0011) 4- (h (,>,бт.|4) 4-(i) (1,2044)7= 2,7799, подобно
ТАБЛИЦА"^ 21. Параметры группового взаимодействия атп. К1)
Зн.ж «х > означает недостаточность или отсутствие данных
| сн, 1 с=с 1 АСН АССН, COH | 11.0 | ACOH j co | сно
сн3 0 —200,0 32,08 26,78 931,2 1452 1860 1565 685,9 1
с=с 2520 0 651,6 1490 943,3 578,3 X 1400 x 2
АСН 15,26 — 144,3 0 167,0 705,9 860,7 1310 651,1 X 3
АССНг — 15,84 — 309,2 — 146,8 0 856,2 3000 740,0 3000 x 4
СОН 169,7 254,2 83,5 92,61 0 — 320,8 x 462,3 480,0 5
Н2О 657,7 485,4 361,5 385,0 287,5 0 462,6 470,8 234,5 6
АСОН 3000 X ,3000 3000 X —558,2 0 x x
СО 3000 3000 101,8 75,00 — 106,5 -532,6 X 0 — 49,24 8
сно 343,2 X X X 3000 — 226,4 x 39,47 0 9
соо 348,0 X 325,5 3000 167,5 x —266,5 333,6 x 10
о 2160 х - 75,50 3000 — 13,44 X x -39,81 X 11
CNHa — 16,74 90,37 —38,64 х —109,8 -527,7 X x x 12
NH 3000 8,922 37,94 X —700,0 — 882,7 x x X 13
ас\н2 3000 X 3000 3000 X 236,6 x x x 14
ссм 27,31 43,03 —66,44 — 150,0 337,9 227,0 x 447,7 X 15
С! — 119,6 242,1 — 90,43 52,69 357,0 618,2 x 62,00 x 16
СНС12 31,06 — 72,88 X х X 467,0 x 37,63 X 17
АСС! 121.1 X 1000 х 586,3 1472 x X X 18
1 2 3 4 5 6 7 8 9
1 <<ю 1 ° 1 CNHS j NH [ ACNHj C.™ Cl CHC1, 1 “° )
СН, 687,5 472,6 422,1 800,0 1330 601,6 523,2 60,45 194,2
г=г х х 349,9 515,2 x 691,3 253,8 259,5 X 2
АСН 159,1 37,24 179,7 487,2 680,0 290,1 124,0 X -99,9 3
АССНг 110,0 680,0 X X b40,0 3000 33,84 X X 4
СОН 174,3 — 204,6 -166,8 3000 X 79,85 194,6 X 69,97 5
Н2О X X 385,3 743,8 — 314.6 118,5 158,4 247,2 190,6 6
АСОН — 482,2 X X X X x X x X
СОО | 0 1 CNH, ; NH ACNH, CCN cue, | ACC1 |
СО — 180,1 473,5 х X x —307,4 628.0 874,5 X 8
СНО X X X X X X X X X
СОО 0 — 26,15 X X x X X X X 10
о -290,0 0 х x X X X X X 11
CNH, х X 0 x X X X X — 10,0 12
NH х х х 0 X X X X — 60,0 13
ACNH, х х х x 0 X X X 3000 14
CCN х X х X X 0 -100,0 X 25.0 15
С1 X х х х X 100,0 0 -308,5 X 16
СНС1а х X X X X X 790,0 0 X 17
АСС1 X х 3000 3000 110,0 3000 X X 0 18
10 11 12 13 14 15 16 17 18
•) Обновленный и более полный список параметрон можно получить по специальному запросу
Дж М. Нраусница.
и ?2=(1) (0 848) + (I) (0,540) 4- (1) (1,124) - 2 512. Необходимые параметры
групповых взаимодействий по табл. 8 21:
Поюбпо этому
•IB —
При постоянной температуре коэффициенты акгивпостП группы k (k —
IB, 3 или 5А) являются функцией группового состава-
Д^я эквимольной смеси
В Чистом бензоле (I)
В чистом ялропаноле:
Пример 8.10. Рассиитать коэффициенты активности дли системы 4иеюн (1) -
«-пентан (2) при 307 К n = 0,047.
rs = (2) (0,9011) + (1) (0,7713) - 2,5735, qx = (2) (0.848) -
r2 = (2) (0.90| 1) + (3) (0,6744) = 3,8254, ?2 = (2) (0,848) >
-J. (3) (0,540) - 3,316
, = ........ <2'5735>(°1°^ . ... - 0.П32П Ф. = 0967е
(2,5735) (0,047)-|-(3,8254) (0.953) ' 0,(1 l; - 1
e =_________(2,336) (0,047)_______
1 (2,336) (0,047) (3,316) (0,953) - <AUcW>, t>2 - u,,
Zi =-- (5) (2,5735 — 2,336) - 1,5735 = -0,3860
k = (5) (3,8254 - 3,316) - 2.8254 = -0,2784
l,r ’° -+ <5> <2'336>thSt - “3,KI
-f- °0°Q3^- [(0,047) (0,3860) -r (0,953) (0,2784)] = - O.(|4O3
CH, = 1А; CH. = 1 В, СО = 8
<Ti>s = 15G5 К; аед —3000 К
Д,1Я чпетгнн
О 271
(О 271) (О ОООИ57] ' )О,726)(0,00011)
I' 1 0,040 ] I - ]i, |o',720) (0 00611)
0,726 - (0'274)(0.000057) (0,726) (9,0061])
_ Э,82«4
S®- ••’J.-.m Л.-0ОТ»
Оя == 0,0092
(11,0002) (0,000057)I -
0,5’87 -0.4721)
(0.0092) (0,00611) p
<) 47’1) (0,0051 | -H (9 0092) J 1
О 1.10 '1 - in |<i) 5187 -О,472|)(0,1’001]) -О 009'2| -
(О.й(87 ,- 0,48'21) (0.000057) ,
У? - 0 4721 + (0,0092)(0,000057)
_______О0£2__________________I _ 2 аз к)
0,472Г! (О,ОО61|) —0 0092 J j " '
- (2) (0,0017 - 0.2654) |- (1) (2,9310) — 0,8284) = 1,57^2
I 5792 - 1,5389 гпи у, -4 СО
С<ютг>етств\'|спо1с T<i'iiepiivi?4Ta,ti,ni>ie значения, ло Ло н др. [50], равны 4,
8.Ц. РАСТВОРИМОСТЬ ГАЗОВ в жидкостях
Расткоркмост!, .«мна в м-reiiTjiie ,фИ фугитивноеiч метана а паровой фач<
к Kj;i.'7Jiuei-Kr.'ji lewicparipe растворителя, растворимость газа обычно возрастает
<. температурой (рис. 8 11)
Определенные экспсэиментдльиыс значения растворителей публикуются
в литературе уже более 100 лет однако большая их пасть — данные низкого ка
чества. Хотя ро пастоядаыу полного и крнти гного собрания имеющихся данных
в литературе нс существует известны несколько справочников ио растворимости
(т абл 8 22)
К (ижа-тепию, о публикациях со рае(ворцмостям газов используется большое
кс.отчество различных единиц измерения Наиболее часто встречаются два без-
размсрни'Х козффиогн'нга 1) коэффициент Бунзена, определяемый как обьем
IПересчп 1 ашс-ыХ на 0сС и 1 агм) газа, растворенного в единице обьема раствори-
тель пуп температуре системы Г п при парциальном давлециц растворимого,
равном I атм, 21 коэффициент Оствальда, определяемый как объем газа при
температуре системы ?' п парциальном давлении р. растворенный в единице объ-
ема растворителя. Есл,, растворимость мала И газовая фаза идеальна, то коэф-
фициент Оствальда >е зависит от р. связь между коаффпинен'гами определяется
<ооттчие|;и₽м'
Коэффициент О.тс.а.тгща - (коэффициент Бунзена)
где 7' выражено в ке.тсвгшах. Френд и Адлер (29] рассмотрели эти и другие
коэффтс г,сита ,".тя измерения растворимостей и пх 1 рнмснеппс в инженерных-
расчетах
ТАБЛИЦА 8.22. Некоторые справочники по растворимости газов в жидкостях
I Рясгп,,|,их:оггь неорганических |( мсгаллорггиических соединении
Scrdcli A «Solubj(itfc- of Morgan.с a:,d Metal-Organic Compounds, <Vaff No
strand, New York, 1958, and «Solubilities of Inorganic and Organic Compounds».
No-t'-aird, New York, 1952.
2 растпоримосъ нсоргаиитсскпх и органических соединений
Stephen, II., and T Stephen: ^Solubilities oi lixorg<ui[C and Organic Compound..»,
Perp.'inob Press, Ox'ord, and Macir.illari, Nw York, 1063
Beilli/kt, R aiiil If I . Clever: Chew Rev , 66 : 395, (1966).
Wiihelin, I-’, and R. Battino Cbeti. Rev, 73:1(1973).
Такие едпггрцы измерения характерцы для старых- с,нгсй. В /шС'Л&лыцС' mw
принято выражать р;1С|В(>рИмости ti мольных долях или шч отц.чоиагъ ко’эффп
илеиты Генри
Закон 1снрц является хорошей ,и,си'<>,тс,1Маш«Т| при , соадчипх значеньях
растворимое га Пусть для бинарных систем гндскс 2 oti'ociih.h к раствочясмому
газу, а индекс 1 — к жидкому рствопип.ih> Гог,та зарои I'cnrt'n моЖич записать
следующим образом
I,- ч -<I
где х - мольная Додя, / — фут щ niHiOc Гр, If — константа 1 СпрИ
делаемая как
Индекс 2,1 показывае! что коре।аята Генри И стнекигся к | ,к тсо| иному 2
В растворителе 1 Верхний индекс Р.,.Р1 указывает, что давтештс стремы (тц
хг—♦ 0) равно давленью насыщенных паров растворителя | при тс'Ицратууе 7
Константа Генри зависит ог температуры (я часто очен,. сильно)
Если давление газа велико, то следует принимать во внимание влияние дав-
ления на величину константа ГеирР. В этом случае yp.iBtreurie (Sit 1) ириттсаег
более общий вид
W Ру;>г — Давление п<1?оь р
гол ировакиое).
Идеал,,чая растворимое,ъ
"1АЬ.|ИЦ\ 8.24 Растворимости iujob в нескольких жидких растворителях
при 25‘С и парциальном давлении 1 дцд, 'юч .цьк ,0'
Н3
си4
<~Од
8
I6C
14.CH
1л. 7
') (Л, уравеедае (Ч II Jl
pl N П П РЯ P [ [ II I)
в<
’фф(
Коэффнии;
Расчет равно есия пар—жилке.. .... ..........._.г.г.._ .
нос-ри для жидкой фазы. Ц.[Я каждого кочш^ц'Н-р / s(mbiiCiii'p равнсиял я. тг
ш'сывастг'я в згде
Ф.
риннснисм I.
коип<
|)авпг1всс„ч пар — /кпдкостт. но уранлешто соетоянич
на ЭВМ.
неи'ов. | |pe;iiio;i<vK;t\ также, что пики
жидкой фазы л, ..., х‘,-. Необходимо ।
и вес мольные д|;.|.| паровой (разы <.'|, у...
1емцер;пура
Веете
N-l 'J
к "Г - ’
например, vpanneii.h- Венедикта- Вебба- I’jCima stum нидр, и каком ею нс ноль
зовал Орай (621 1\<>[1("гац।v ! Орай вырля-ает «як
S£AV.MV..r |8I2J"
и , '’(Зе 1
329
' e^'ie^iiTiypQ
1П уравн<и,(я («.В’' Имесу-
(8 1 -5."ъ
Z?f
ТАБЛИЦА 25 Значения в—ых растворной дзя бирарнмх систем
при 25 -С 191 ________________ _ _ _ - -
------ ( I , ь , I I 1> 1
_ Гг „ 1)141 О OD433
Вода 1.1,2 Грцсторло), '5 ^. ,4 000515
Вода Толуол .у о 0368
Во;,т Анилин __ _ _ . ___
ТАБЛИЦА 8 26. Значения цараме|роя НРТЛ,
работы |0] для расчета равновесия *юкость-
прн 25 °C
нспольаовг-нные .ихорами
,ки.1косгь Н тро»,ч,|Х системах
8.1-1. ФАЗОВОЕ РАВНОВЕСИЕ В РАС) ВОРАХ ПОЛИМЕРОВ
(S.14 I)
К’ОМПОИСШЭ
- Maccoiwii is (n< мо-гьиая
1'4/, - M CPj + ( ‘ ф2 ; уф?
IM; 2)
где т — V’t'.'l'i . Растраиваемая константа у. называется пнраме।ром взаТ1м.,-
дейстння 'k'topi Для типичных растворов полимеров велитциа 1/т пренебре-
жимо мала но сравнению <_ единицей, и поэтому ею можно ппснебреч’,. Пара-
лимера так как последняя и системах полимер — раствоцпе-н, осип вол (к,п
В теории у также не зависит от концентрации полимера, однако в док твите, i ь-
hoctii он (H.'ibho меняется е изменением концентрации особенно в смесях содер-
жащих полярные молекулы, для которых теория Флори — Xai'iiiiic.i япляетсч
Лишь грубим приближением.
В бинарных смесях ло.тнмср.т и расиюрикля летучим является только рас
полное давление равно парциальному давлению растворителя
I n, раси’ори 1июг;оерц Koa-Mywem .oKtijiwocHi даерся в виде
7\1Д /ь
(^.14.3)
ТЛБЛИЦХ N 27 Значения параметров Флори х и-"я некоторых систем
Полимер—растворитель при температурах, олитких к комнатной |80[
I (ату р 1л 1.1: и й
11олнд.1.четцл-
Потиизсбт 11Т
Лец
Эти.татте 1 ат
Циклогексан
Hiiri>o6cn.nj,r
Гексадекан
Цьклогекслп
11олцетмрол
По.ч а от..
Гхи<\ч
Циклоп кг ,ц)
Лисготт
Дпоксат!
системы растворитель полимер ограниченная смешиваемость имеет место, если
(Р И 6,
8.15. РХСТВ0РИМ0СТ1» ТВЕРДЫХ ВЕЩЕСТВ В ЖИДКОСТЯХ
Эти капсствеппые эачлю'н'нря проистекают из количественного термодинами
четкого анализа который попволнтся в нескольких работах (см . например. [ЗС|
и |6С>|).
р.кгворимое. Предис,.i1 мнм, |то твердая фаза является чпсчмм всщесдцом
.. а 'ХС/, рассчитывается по значениям мотыктй теплоемкое!;! hihti'Ki
\С,) — Сй ([1астп.,рин(1е в сситояииц
(8 15 2)
”. юстатг'Чдоц степенью сочности можно замеки’ь нормальною темсгер.тз> ру
яйцня Тна температуру тройной точмт Т/ н допустить, 'сто и'лпчипа
Вв,>дя родемповку
приведенные к «.ос. гоянcrhi перс'
зфф:щ>
:li I'.. N.
вязкость
9.1. СОДЕРЖАНИЕ ГЛАВЫ
стен. В каждой из них рекомендуются ме~оды. П коррелирования вязкости с тем
нературой; 2) расиста вязкостей, когда не пмеекч никаких ^ксверщситальных
9.2. ОПРЕДЕЛЕНИЕ И ЕДИНИЦЫ ИЗМЕРЕНИЯ ВЯЗКОСТИ
дается как cocTHouieiine силы сдвига на единицу площади в любой гонке к тра
диенту скорости Таким обоазом, вязкость является мерой сич внутреннего тре-
Плотность равна n молеку.1! в единице ибьеча Молекулы, дш1жу|цп<х!| в газе,
сталкиваются ii могут передана и, количество движения пли энергию сс.'ш имеете,.
|,ик> групп молекул, если существует градиент концепграни.i. Рсту.тьяирукицн',
ноток количества движения, энергии или массы компонента между двумя слоями
приичмг'.егеч ирочорпионд.тын,™ градиенте количества двмжен-зн, эгн-ртин ц.чи
массовой плотности у с
।де плотное11, уменьшается в i.nnpaB.iciiiiii I ?' р’ может быт, массовои п.т.|
иосттю tii, n.iciiH'X-rbX) количества движения итт,, .'ч:Сю 11.'1,оялст1>ю wi'iun
СупТ. Коэффициент процориионалинос-ц, который даст элементарная «инстичс
екая теории для нсох трех указанных потоков равен vl.:3. где с средняя скорост,,
молекулы, a L — средняя длина свободного npodeia молекулы.
Уравнение (9.3 1) используется также для определении iicpci-оснь х коэффи-
циентов— коэффициента Лиффуяии 71, вязкости 1| и теплопровод тости а т е
df,
1 in Н Э,
Поток массы
Уравнения (9.3 2)_(9 3 1) определяют lepetio, пые коэффициенты 11, р ц 7..
Сели средняя гкоростц молекулы пропора:юни,->1,нл (/?/' Ч>':, л средняя длина
свободного пробега пропориионалвпа (ро!Г' то
о/ ?.<-
/'-----у (consll V|,ny)r-; (9.3 j)
(CcU)---
(0 3 6)
(9.3 7)
имеющих максвелловское дасир(-депеши- скодостсп
ten н я из, постоял пых множителей.
где Ч вяак<.>Д1т., мкН 5 V! — молекулярная ма, cj Т — i ем и ер а ту Рч, 17 —
радиус твердой сферы, А.
Подобные ур;1впсци,| Д,,!. / ,, Р приведены в г;:. [О и Ц
Влияние межмолекудярнв|Х сил. Если необходимо '.щ-стэ. что ,|оле:ы.,:,; при
тЯГ|1ВД;о*оя или сттялкива/Отси дргт ог друга no,i действием
сил то обычно используется теория Чапмена и Эискога 113, ИЗJ Важнейшими
S.4. РАСЧЕТ ВЯЗКОСТИ ГАЗОВ ПРИ НИЗКИХ ДАВЛЕНИЯХ
В основном методнен расчета вяаЮстц газа базируются н.чи на теории <Тэл-
мсиа— Энскога, пли на принципе соответственных состочьии Оба Э‘и подхода
рассмотрены ниже Рекомендации даны в конце раздела.
Теоретический подкоп. ёравнение Чвниепа Энскога вполсх??;, н^'л<>
приведено в разделе У 3 |см. уравнолце (9.3 9)1) ] Чтобы иснольтоваг:. <.гп для
расчета вязкостей, iiy>KiU) найти диаметр столкновений а и интеграл столкновении
Q... В случае решения уравнения (9.3.9) получается как сложная функции
безр.зз.мертемпературы 7'". Функциональная зависимость меняется с выбором
межмоле кулярного потенциала Как
показано на рис 9.1, j (г) представляет
собой потент'иалзрую анергию в.чаимо-
ден^твях между двумя молекулами,
находящимися ил расстоииии т друг от
значение тг (г) отрпча
iPHthi цвают^я
Корр
юторьш цо существу раней единице,
fibi.i опущен в уравнении (У.3 9)
-) Отрицательным градиентом <| iг)
kT
Сооти<ш:еш1С между ф (г) и г называется межмолекулярной 1.окнииа.|Ыи>ц
функцией Такие функции, выражаемые только :• помощью параметров е ц <>,
носят 'laaButmc двух»арачстрнческкх п.отенвда.’нп. Потенциал Летп^рда-
Джонеа 12-С> |см. уравнение (9 4 2) J является примером такого типа Предложено
также Ы1ю; о других лотенциальлыл функций < 1гни»и либо дч'ю.7нг,те,тлнымц га
раметрамн Однако важно то, что |1<д>бходцм<> знагв л irl _т / (г), чтобы цолучть
£?;.• но уравнению (9.3.6) Рабочее уравнение дли q в любом случае будет иметь
Неполярные газы. Потенциал ,rlei),iap(ia — Тжоии 12-6 определяется как
Такие соотношения часто основи ваются на нсзиач।пе.-1,1N' теоретических пред
посылках и потому широко i.pi-тнкуютсц. Одцлк<> |Ютен:1изл Леннардл Джонса
является, пожалуй, один*! из наиболее легко поддающихся обработке соотноше
к точной форме зависимости т| (,•), уравнение (6.4 2! применяется широко
С использованием зтогс дотениизаа интеграл столкновений был определен
вялом псслеаовтелей 11'2. 93 103. 119. 121. 1171 Ной,1н'..тьл а no. ii51 nw-w-
ZlKVlICy зля
114 3
94
2 3551 - (О 0871) (0,394) (] (/)
(24,5/568,б)1"'
I Ь- (568,6) |0,79(0 + (0,1693) Ю,394) | — 188 0 К
Пр» 37,8"<,
W~ -.0.03,
Тогда i'o уразнечню (ОА.З) при Г* = 0,637 ритеграт ' т^лкновеции
= 2,022. Следовательно, по уравнению (9.3 9)
(20,W)(114.232)0'2(JJJ1 2) А Г1
" ~ (6,62)^.022)---------*КГ1
гт,„..... __ 569-582 ,Л(_ а:
Полярные газы- Для полярных молекул более подходит потенциальная
функция, предложенная Штокмакером и рассмотренная в других работах [11,93.
15о]. [ |о существу эта функция идентична потенциалу Леппарда—Джоцса 12 6
кроме дополнительного члена, учитывающего гостов иные л ищтль-ди дольные
ствуют, соотношение Шгокмайера упрощается до потенциала Леннарда - Джонса.
Мончяь я Мэсси: ) ] 17) получили приближенные значения пит?;рала столююг.е-
иий 12,,. цсполыуя эту потенциальную функцию Значения приведены
я^тчсп-я л.трэдстрод полярности, который определяется кар
-L _ (| 13' (| 1 зб-)
(9 4 9)
_С94 ip'|J
а дсбаях, а !'<, — мольный об|,ем жидкости г.рц иорма.ц.ион
ця в кубических сантиметрах на мс.тн
() Диполоный момент ;ip измеряв гея в дебая' ( .тебай 10 ,а (дни C'i’)1-’ —
— 3,162 Ю' (П-м4)1''2. I акпм образом, если >. измеряется з джоулях <[, \ц,
а ч — в метрах, го 6 безразмерная величина.
ТАБЛИЦА 9 1 Интегралы столкновений Й., дли вяткости. рассчитанные
с помощью потениизта Штокмайера ||47s|
0,1
0,2
0,3
0,4
0,5
0.6
0 7
0,8
0,0
1,0
!'б
1,8
2,0
2,5
3.0
4 0
5,0
6.0
7.0
4,1005 3,2626 4,266 .3,305 4,833 3,511» 5,742 3,9(4 6,729 4,433 8,624 5,570 10,34 0,637 11,89 7,G(8
2,8399 2,836 2,930 3,168 3 5(1 4,329 5.126 5.874
2,5310 2.522 2,580 2,749 3004 3,640 1,2Ь2 4,895
2,2837 2,277 2.329 2,460 2,663 3,187 3,727 4,249
2,0838 2,081 2,130 2,243 2.417 2,862 3,329 3,786
1,9220 1,924 1.970 2,0’2 2,225 2.614 3,028 3,435
1 7902 1 793 1,840 1,931 2,070 2,417 2.788 1 156
1,6823 L689 1,733 1,820 1,944 2.258 2,596 2,933
1,5929 1,501 1,044 1 7'?“. ) 838 2,124 2,435 2,746
1 45'4 1,463 1,504 1’574 1>70 1,913 2,181 2.451
1’3551 1,365 1.400 1.461 1,544 1,754 1,089 2,228
1,2800 1.289 1.321 1,374 1.447 1,630 1 838 2 033
1,22)9 1,231 1,259 1,300 1,370 1,532 1’718 1,912
1 1757 1,184 1.209 1,251 1,307 1.451 1,618 1,795
1.0933 1,100 1119 1 150 1,193 I 304 1,435 1,578
1,0388 1,044 !,’()59 1.083 1,117 1,204 1,310 1,428
0.99963 1,001 1,016 1 035 1,062 1,133 1,220 1,319
0,98988 0,9732 0.9830 0,9991 1,02] 1,079 1,153 1,230
0,92876 0 9291 0,9360 0.9473 0,9628 1,005 1,058 (.'.21
0,89616 0 8970 0 9030 0,91(4 0,9230 0,9о45 0,9955 1,044
0.87272 0.8741 0,8780 0.8845 0,8935 0,9181 0,9505 0,9893
О,853?9 0,85-19 0.8580 0,8632 0,3703 0,8901 0,9)64 0.9482
0,83795 0,8388 0,8414 0,8456 0,8515 0,8678 0.8895 0,9160
0,82435 0 82.51 0 8273 0,8308 0,8356 0,8493 0,8676 0,8901
0,6018) 0,8024 0,8039 0,8063 0,8101 0,820) 0,833/ 0,8504
(1,78363 0.7840 0,7852 0,7872 0.7890 0,7976 0,8081 0,8212
0,76834 0,7687 0 7696 0,7712 0.7733 0,7794 0,7878 0,7983
0,75518 0,7554 0,7562 0,7575 0,7592 0 7542 0,77)1 0.7797
0,74364 0.7435 0,7445 0,7455 0,7470 0 7512 0,7568 0,7642
0.71982 0,7200 0,7204 0,7211 0,7221 0,7250 0,7289 0,7339
0,70097 0,70(1 0.7014 0,7019 0.7026 0,7047 0,7076 0,7112
0,68545 0,6855 0,6858 0.6861 0,6867 0,6883 0,6905 0,6932
0,67232 0,6724 0,6726 0,6728 0,6733 0,6745 0,6762 0 G784
0,65099 0.6510 0,65(2 0,6513 0.6516 0,6524 0,6534 0.6.540
0,61397 0,6111 0,6143 0,6145 11.6147 0,6148 0,6148 0.6147
0.5,8870 0,5889 0,5894 0.5900 0,5903 0,5901 0,5895 0,5885
353
1 АЬ,1)1Ц\ 4 2 Параметры потенциала Шгоккмайера |147в1
— li/r 1 ’ | — с
HSO 1.85 •у Д9 775 1,0
N'16, (.47 3,13 358 0,7
HC.i 1,08 3,36 32s 0,34
I ]Вг 0,80 3.41 417 0,14
111 0,42 4,13 313 0,029
SOj 1,63 1.04 31/ 0,42
нл 0,<Ю 3,19 343 0,2[
N(X)i 1.83 ,5 11л 690
CI1O3 1,013 •5.31 0,07
СЦ..С.], ] др 4,52 -183 0.2
('IV4 1 87 3.94 111 0 5
ClldDr 1.80 4,25 382 0,4
c2itc] 2.03 4,45 423 О 4
сн3Ън 1,70 3,69 417 0.5
С2И5ОН 1,69 4,31 431 0,3
ч-С,Н;ОИ 1.60 а * 1 495 0 2
и.эд-С3Н OI-l 1,69 4,64 5| 8 0,2 0.19 0,08 0.60
(СПцкО 1,30 4,21 5,49 432 362
2,88 4 50 549
ся,соосн? 1,72 5,04 418 0.2
СН3СООСг1 и 1,78 5,24 499 0,16
ch,no2 2,15 4,16 290 2,3
аммиака .VI _ [7,031 Неполярная доля интеграла столкновений Даеюя уравне
ши и i9 4.3)•
1,(6И5_____________0.52487
^ехр 1(0,77320) (1.378)] '
________2Л0П8______________
охр 1(2.43787) (1,377)] - '
Интеграл столкновении для no-iapuhix газов определяется
0, « -<«
Уравнению
Наконец.
iio уравнению (У.3.9)
(2о.>») (17.03))''- (493.2)'- _
" (3.15?(1.434) -1’"
172 - 169
1 io, pcu.K'CTh------------ 140 - 1.8
Me годы, оснонанныс на использовании принципа сот ве|Сгвенных состояний
Некоторое методе расчета вязкости газа могут бчгь гтроелгжягы <>г ypar.ixnuti
(9.3.8). где ira основании элеменга|л10н теории твердых сфер
где Л/ — безразмерная вязкость
•тожеяные ( олубсвым
вя «ость при критической температуре, iro гр,। шык.л' давтк ьип
Р: — критическое давление атм, Т( — критическая температура, К; ц вя).
кость, мкП.
Аналогичное ( равнение было предложено Тодосом с сотрудникам,: прпб.те-
Неполярные газы. Для ьедолярпь| к газов
ns- 4 r-LOT^J GiS-2.04.)'р'"'”'/ , I.Q-k- -‘''''Д ,-()!
Полярные газы. Ц.гя почнрны' гяюз с водород,юи ^ый, Г.
л; — (С),755'Г, — О 05j)
Для полярных IQ50B I е образу 10ШН' водородну го спи; о, ',’,<2.5
В(.л,н(на /, козфАчпЫеит сжимаемости в критнчсскон точке, остальное
величины имею, то же единицы измерения, что и в предыдущем случае.
Малек и Стил [138] предложили дру| нс формы уравнений (0 1.1Т) и (9 4 19).
в коюзых )]$ связяно С w и X, где ш — фактор ацситрп'Т1|ОСтн. а X — фактор
ио.тярпости Стила 'обе эти константы рлссмотрет1ы г гл. 2)
Сравнения Тодеса н др. не следует использова ть для водорода, гелпя и двух-
атомных га и, еиов. Это ограничение нс оговаривалось для уравнений (9.4. П)
та гов для полярных газов, доторы; существенно ассоциируются в паровой Фазе.
Рапхенберг (170] иредложи-q другое с.сютношеппе. основанное цг рсгодь-
зова.цШ npiiH'i'ii:;i _оответстаен,,ыз сото))toщ
совершенно aiia.icrii'tc-i знаиешпо т,-, определенному
веществ
ТАБЛИЦА 9.3. Групповые [170CJ составляющие С для определения а* (в мкП)
сст.1 г^я- йк г,, и.!Я
К1ПЯ ( 1|”" |П'цак
-СПз 9.04 ОС — (а кольце) 3 59
)СНг (вне кольца) 6.47 F 4,46
С) 10,06
УСЫ— (нце кольца) 2,67 —Вс 12,83
- ОН (спирты) 7.96
(вне кольца) 1,53 ^.О (вне кольца) 3,59
-СП, 7,68
=СП— (вне кольца) 6,53 —О (вне ко.тьпл) 12,02
\С= (вне кольца) 1,78 —СПО (альдегиды) 14.1Й
—C00II (кислоты) 18 65
— ( 11 7 а । —СОО— (сложные эфиры > 13,41
д-С— Imie кольцо) 5,24 или НСОО /формилты) -NH, 9,71
\СН, (ь кольце) 6,91
х NH (тне колыы) 3,68
^.СН— (в кольце) 1.16 —N— (в кон.цс) 4,97
\С(^ (в кольце) 0 23 —CN 18.13
;S (и ,чо.Т1,це) 8 86
"1— (в кельне) 5,90
где а* выражено в микропуязах, М— молекулярная масса 7'- -- критическая
температура, К; ", —число атомных гругп (-го типа.
I руиноиые составляющее С, приведены в табл. 9 3. В настоящее время этот
адЛитивныИ метол применим только к органическим соединениям.
Значения вязкостей газов, рассчитанные по этим трем методам основанным
на испо.'|ьзовави]1 принципа соответственных состоянии сравниваются с экспо
риментальнымп значениями в табл. 9.4. ,Методы иллюстрируются примерами
Пример 9.3. Используя корреляции, ось.овацпые па huio.'i.зон,типи прин-
ципа соответственных состояний, рассчитать вязкость двуокиси серы при низком
давлешп' п температуре 40 °C. Критические свойства: Тс -- 439,8 К, Рс —
= 77,8 атм, а Л)—64.063. Экспериментальное значение равно 135 мкП
Решение. Метод Тодэга и др. £ — * - 0,0188 По хране-
нию (9 4.17) при Тг = 140 I 273 2)/430.8 = 0.727
г,; ^(4.619) (0.727)г,’Г|8 -2 04 10 7'7) р 1,94 с-'7.7) + ил
2,516
Г1 ’ 0 0188
ПогрешноС1Ь =——196------------------0 , %
Метод Голубееа По уравнению (9.4 |6)
)]’ = (3 5) (64,О63)1/-' -(77'S) - 186 Mi.ll
(lOO.S)1'
ТАБЛИЦА 9 4 Сравнение расчетных и экспериментальных значений
вязкости газоь при низких давлениях
Ацетон
Бензол
Изобутон
Лв\оы1СЬ чг.тсро/.а
Сероуглерод
Четыреххлорцстып \ глс-род
Циклогексан
Э|Ян
Непозярн'м газы
Пентан
Пролы
Прописи
. 1в\Ь U'pi'i
/7о гт
325
0,0
225
141
ИишрииЛЩ-.т
12о
160
240
320
Ю5
130
0 Я
Хтори-тыИ чегяле t
120
|04
(13
100
127
Пропл «!> 1
125
По уравнению (О 5 [4)
.0.965
Пример 9.4. По корреляции Ранхеябсрга уравнение (9.4.21) рассчитать
вязкость ацетилена при 10[°С. Экспериментальное значение рав^о 125 мкП.
Решение По табл. 93 имеем: ^niCi = (2) (7,41) -= 14,82. Тогда,
располагая значениями М = 26,038 и Тс — 303,3 К
<Г =—= (20,038)|/2 --- Ю6 мкП
Поскольку Тг = (101 + 273,2)'308,3 = | 2|. по уравнению (9.4.21) полу-
чаем:
(Ю6) (1,21)
- [27 чкП
,, 127-126
Погрешность =-----------
Рекомендации для расчета вязкости чистых газов при низком давлении. Непо-
лярные газы. Если значения е//г и о имеются в приложении С, то д^я расчета
вязкости используются эти значения с уравнением (9.3.9). Погрешности редко
превышают I %. Когда значенья указанных параметров отсутствуют, исполь-
зуется метод Тодоса и др., основанный на принципе соответствующих состояний
[уравнение ,9 4 (7)], или метод групповых составляющих Райхёнберга, основан-
ный на принципе соответствующих состояний [уравнение (9.4.21)] Ожидаемые
погрешности. однако, низкие и обычно составляют I—3%.
Полярные газы. Наиболее точным является уравнение (9.3.9) с интегра-
лом столкновений, полученным по уравнению (9 4.7), значения г,'k, с и 6 при этом
берутся из табл. 9.2 (или могут быть получены из друтих аналогичных таблиц).
Ожидаемая погрешность расчета находится между [ ц 3 %. Если соединение не
указано п табл. 9 2, рекыщидуется лСмольвова-ш соотношение Райхепберга
совместно с табл, 9 3. Погрешности различи,.!, ио обычно они меньше 4 %
9 5. ВЯЗКОСТЬ ГАЗОВЫХ СМЕСЕЙ ПРИ НИЗКИХ ДАВЛЕНИЯХ
К сожалению, вязкость газовой смеси редко бывает линейной функцией
состава как это видно по рис. 9.4. Возможны даже максимумы, в которых вяз-
кость смеси превышает значение г) для любого чистого компонента, например
система 4 (аммиак—водород) Однако ни об одном случае минимума вязкости нс
сообщалось. Тенденция, подобная той. которую проявляет система аммиак—
водород, встречается наиболее часто в полярно-неполярных смесях, ,де вязкости
чистых компонентов отличаются весьмд незначительно, максимумы более Ярко
выражены, когда отношение молекулярных масс отличается от единицы.
С-рогая кинетическая теория £ГэпМйна—Эрскога может быть расширена
для определения вязкости многокомпонентной газовой смеси при низких давле-
ниях. Конечные выражения довольно сложны и состоя г из отношения двух детер-
минантов. которые содержат элементы, включающие в себя мольные доли, моле-
кулярные массы, вязкости чистых компонентов, температуру н разнообразные
интегралы столкновений. Пренебрегая членами второго порядка, точное решение
может быть гппрокС|1МИровэио рядом как
(О ">.!)
делах приведены методы расчета
Аппроксимация Вилькедая il’j;. Вц.цье |2]Ь], ?< пользовав медть,
таи: ую Сюэср^снд(>м на основе кинетической теоррч, получил
иадраз-
„ ... ..... . параме-
трон Ф<; :> Фу< Поело определения этих
параметров также нетрудно показать,
что некоторые системы будут проявлять
максимум вязкости- Для бинарной си-
стемы компонентов 1 и 2, (’ll >4?) мак-
симум вязкости имеет место при неко-
тором составе между чиним компонен-
том 1 и чистым компонентом 2, если (ч/ч]?)
,1, , _ II I <1.т>‘ОДТД'Д. |9 г, 2|
[8 (1 - ДЙ./.Му)]1^
ВояичНиа находится нутом персцаиовки индексов пт
%----у- -4г'ф'1 с М
Т.ля 'ишаопоп Cm icMni, eocTonuieii и; Ko'iiiOneinOn I
<9.5 1) (9.5.3)
'/i’ll Pa’l-2
i/i + У^1^ ' Уг t-
и 2, ио уравнениям
0> 5 4)
где T|,„ — Вязкость (М(Д||
4. — вязкости чистых компоненте.
b -1- г 1-Ц; Wi)' 'I
{« 11 4- (.'L/AIyjlf-
Ф ,у - tTlj
поднер,а.пль широком проверке Вилькс [218] сравнил расчетные значения
с зкснсримоитялькмчи лаидш'и для 17 бинарных систем и нашел, что среднее
отклонение составляет менее 1 %; в еравпенНе было включено несколько случаев,
шг.нстве случаен сравнивалась только неполярные смеси, причем били получены
для некоторых систем, содержащих в качестве одного из компонентов водород
Но данным табл. 9 5 метод Вилькс приводит к вязкостям, большем чем экснери-
\нп
Пример 9.
[8(1 -I- 1'1,043/58.12'1, [: -
?'«ч 7--~‘ 10 О'3, .
______(0 697) (1р9,41
0.697 (0 304) (2 •
2('3
(0,1 1Ь)
п м
1 Ю| J сш-ю». |Ь — —
Аппроксимации Хернинга и Циппсрсра дай >11,; |) м
г«егО выражения для 'i',j ПРСдлпжеп,) 192 ( седеющее'
с помощью уравнения (9.5.2) лл? веществ, указанных п -апл 9.5, а также для
системы CHj -д-С4И|(, рассмотренной в примере 9 5 Хотя лоачення найдси-
нь|с го уравнению (9.5.5), ило.хо совпадают со значениями Ф,;. рассчитанными
ленных в табл. 9.5, уравнение (9.5 5) оказывается вполне падежным. По види-
мому, многочисленные комплекия удовлетворяет требованиям для пс-
пользосаште н уравнении (9.5.1),
Пример '1.6 [LaropiTb iipuMrp 9 5, iicnoti.T'-i, ,ц,iip,,KCn'i.|Hiiю \e|niiii r,i |i
Himiiepep.i T'lii <l>,/
P e и: e и и i Как ц jauee, пуегк метан fieu’i ьо\:н((не||т< я I, а к бугаи
КОМИ ,Ill'll’ Л| 2
'1>,д Ф1(-ФГ/ O,5>5
, _______ (0 697j (!0°.4)______ Ю 303) (72,74) _ „
0,097 ,'-(0.303)0.91'3) 1 О.ЗОЗ r (0,69;) (0.525; - ''
no y2_____9.3,3;
Пси р<.шн<)< । и - ’ j.---------- lot)- — 0,6
3G3
ТАБЛИЦА 9 j. Сравнение расчетных и эксг1ернме1па.11,ных значений нязкони бинарных idiHBbix смесей
J.11 .-l.'ll ,10 <1.11* ,,< I 1. .|Тц oc.jxpllCMV
Рксп<Т'1гмеп 1 'TIC ОЛПГПС > э;:х inn . 1 I1CC4I1T1II 11 U X lie методу
I9I5K0CTII BlI.T.Ki । Il l.mcp, p Ьрочах
Видор,, i—d_<or 100 (1,0 210,1 i 157. 207J
0 ,202 2P5.8 1.4 | 9 -1 2.5
0,400 100,3 5,6 - 1,0 «6
0 SCO 152,3 12,0 —2 0 16 0
1.0 104,2
Чет.ш nootii.il 23 0.0 «1,0 UH 3 1
0,2 «5 0 -0 4 — (',2 3 9 - 0,6
89,9 -0,8 — 0 7 3,1 —0.7
0.0 95,(1 — 0,4 3,0
0,8 102,0 -0/, — 0.5 l.o 0,8
1.0 110.0 1,8
225 (,,() В1.0 111 1 1.5
0,2 i 16,0 0.0 0,0 2.1 U,6
0,1 B2,0 0.0 — 0,5 3.5 1.0
(1 b' Г.9,0 0.0 -0,6 4.0 1 2
0 8 B7,0 0.0 —0.3 3.3 1 i
1.0 167 (1 0,0
Шсс1'пхл<1|>|1С1.1ч се- 3.) pa тан|iexxio|'ti ri.iii 0,0 0,246 0,5>)9 161 3 161,5 1 о 7 4 8 4,0 4.4 3.0 4.8
0,74 1 159.9 , j
1,0 I 59,u 5.2
Азот—двуокись угле- рода 20 0,0 0,218 0.405 0,767 1.0 146,6 153,5 161,8 172.1 175,8 112 -1,3 — 1,8 -1,1 1,1, О.2 —3,0 —9.1 -0.9
Воде Ki. - i'i ч и <| и 1.! 0,0 105.9 1 1.
0.32-! 120 0 1 3 0 “I
0.464 122,4 -10,9 ,6.0 -1,1
0,601 1’23,« -12.0 - 1'1,0 — 1,2
0,805 118,4 --10,8 18 0 — 4 7
0 9Г),(.>
. Ill -• ГН Т JHl.lft ):|н|р 58 0.0 1:37.9 В8 — 4 3
Ц|,,() — о 3 1 1 —2 1
серин, 1Д11 ро т
0.500 96,8 — -’.8
0,‘96 83,5 — 5,2 0,1 5 4 -1.0
1 ,о 74,2 1 1 9
Аммиак—мет ил а хи-и 150 ‘1,0 130,7 И
0.25 134,5 0.3 -о.с -1 0,0
0,75 142,2 -0,3 —0,6 0,2
1 0 146,0
400 0,0 204,8 31
0,25 212,» —0,7 0,8 -1 —0,3
228,3 - 0,7 0 7 -0,1
1,0 2.36 ,0
Откятиюн" - Г(рпСЧ.— жси. )/зксп. 1 IПС% ..
Мл'Тпд неприменим д-n'i систем, содерллцих недород или по.,яр ibii- сосципсни
делено по номограммам, представленным Брокау [25. 26] Выражение дns> аппро-
хепмаиви Л , выест вид
(7,7
Пр>
8.6. ВЛИЯНИЕ ДАВЛЕНИЯ
НА ВЯЗКОСТЬ ЧИСТЫХ
ГАЗОВ
Вязкость газов сильно зависит
от давления только в некоторых
областях давления и температуры.
Обычно изменения давления не су-
щественны при очень высоких при
веденных температурах или низких
даны экспсрментальные зиачения
вязкости некоторых газов, сообща-
емые Ксетнпом 11 Ляйдеифростом
|113 | Для газов пои приведенной
температуре значительно выше едп-
мало. Заметно возрастает вязкость
ксенона с увеличением Давления
при 2Г>°С (Тг1,03). В случае
гн/сокое
1гме,отся
давление, для которого
данные, равно 2иатм. т
= 0,27; это, однако низкое приве-
денное давление При несколько
более высоких даилсвиях следует
ожидать резкого возрастания нязкостц Ра рис 9 9 пре,детавлевы данные о вяз-
кости н-бутана. Ясно, что вблизи ливня насыщения паров и критической точки
давление оказьгвает чнатительнсе влияние на вязкость.
Влияние давления, может быть, лучше всею отражает р„с. 9 10, которын
хотя и приблизительно, показывает ход изменения нязкостн как с давлением,
так п с температурой Этот рисунок будет обсуждаться позднее, сейчас необходимо
лишь заметить, что вязкость дана в приведенном виде, т с делится на значение
веденвьгх давлениях, за исключением области, близкой к состоянию насыщенного
пара, влияние давления невелико. Более низкий предел кривых Рг свидетель-
ствует о состоянии разбавленною , аза, и , неявного в разделе 9.4. В таком состоя-
нии газа вяякость возрастает с температурой. При высоких приведенных давле-
ниях видно что имеется широкий диапазон температур, где р умепыпастся с тем
пературой В этой области поведение низкости Слизко воспроизводит жидкое
состояние, и, как Xnpoiiio показано на рис. 9.12 возрастание температуры при-
водит к снижению вязкости. Наконец, при очень высоких приведенных темпе-
ратурах опять проявляется „о малое, в тиянкг даюи-ння на вязкость ,t <Ар'с)Г 0.
tiepe'inc lett
Чайлдс и Хэйли М3] выве.щ кригерин, кот, рые показывают бу,тег it.iit нет
н.н|Я11ие давления значительным, fix результаты суммированы в приближенном
виде на рис. й 11. Пр» любых данных приведенных температуре и давлении можно
уравнения, рассмотренные в разделе 9 4) или плотным (т. е таким для которого
должна прнмсня ibcin поправка на давление). Разделяющая линия расположена
таким образом. ч,о необходимая коррекция п.ютн'то газа состап.тгет I % или
менее Гел.тоуаси i, Сейдж ]67] рассматривает влияние давления, близкого к ат-
мосферному.
Существует также предел давления, илю- к-'г"рогс уравнения нл.'гкот
ги газов. обсужд.К!-
(НОЮ L,
| 0.093324 р;
iB.K'Hini, мкН. (>.- ~ p;p, - IV'V — приведенная вязкость гязд; с =
• 7’J '7.if i дс критическая температура 7 : выражена в кельвинах, а крита-
ickoh дап.тсние /•“ •- в физических атмосферах; -И — молекулярная масса.
Эта корреляция опубликована Джосси. Стилом н Тодесом и применима
диапазоне 0 1 яс. рг < .3 Значения критического объема Гс табулированы
приложении 4
должно бы показ,,,вать, что теорию StCKOra (уравнение (9.62)1 также нсл»(н
применять
В табл. 96 нредс ,ав,гснь, некоторые знанени; вязкостей плотных гот,,!
pact читанные по уравнениям (9.6 4)--(9.6.7). Соо щетств, е междх экспе|н1.'.к ц
</ibi'(Ho ,,с (ipeUi.nnaKfT |() - 15%.
Пример 9.8. Р.кл-'(н г,, 11, ня <к<х.ть аммиак при 171 С к (36 лтх, 3iuiiC;'i
ме„ ।и '(ьнос значение равно 197 мкП |ЗГ> |,
Решение. Хммцак — полярный газ. ноэгомх должны использовать:?
Уравнения ||) 6.5, — (9 О 7) Однако сняча.та нужно оцретели,ь привсденсуь
пязкосг,, Ih Шчсюжсння А имеем: TL W5 6 К Р,- ЦЗатм. V'
72.5 см:|'мои, и» — 0.250 Таким образом, Тг 414 405 6 I 09 р,
— 136 |Ц 3 - 1.22. Ко->||х1’и111|е|ГТ сжимаемости расечн 1ыв.,сгС)| по >м|р|1слицнн
Идтнсра I v pan некие (3.3 1)] с Z1'" и 2711 определенными Ио табл. Зд к 3 >
Z"" — 0.558; Z'" - 0,096 Зогла 7 -7'" wZ " 0 558 (0,250) (0 096)
- 0 582 и
р _ ,. PI ,. _______(|_36)_(72.5)_____
''' “ р, !''с' ~7РТ (0 558) (82.07) (14 |)
т, 19821.|()-‘. г,„ - 5,2683. - (,.--(-
Г, 1,6552; [), - 1,2760
у, 0,1319 у, 1 7035, Ъ| 79 8678
6, •, 2,9496, б2-- 2.9190, б,.- к, м(><,
(| ,i(’8
где р>) выражню в дебая.х, /*, — в r|,(i;ичсокнх aiMoei|cpax и /‘г — к кельвинах.
Для неполярных- веществ q- 0 Нсычотря па то, иго э;а прост,чи корреляция
широко не пронеря.-щен, она т.о видимому, дает iKirpcnnioc' и и том ...................
ТАБЛИЦА 9 6. Сравнение расче|НЫХ и эксперимента (Ьных значений
вязкости плотных гадов
Ло.тж(Н) использоваться храьяснре (9.6.6). Значение : определяется к.-д
Т[/б/д.|' :-р~3- (W5 6г%(|? о)Чш.З:':' ' 0.0285 Знатсрнс < равно 157 mJ I
Т<няа
(н - 15?) (О 0283) - 0 0607 |(9.04й) (0..187) 0(,)|i.^
О |92 мкП
||0(р<‘ШЮС ь
Корреляции, основанные на оношенцях вязкости. Ч.-илие ,,с< (едоватс.ц
Т(н).и>жи.Т(( что вязкость ((логного газа может быть выражена как ,, р
образом |],д— 3 44 4,15 — 7,89, что очень блн ж<, к значений 7 77 рекомсн
доваиномз Уехарой ,, Ватсоном [20!)] в |914 г.'
Р а и xei|6ep г [170й| разработа,, более (Очную корреляцию для 1] i]'. ю,порой.
имеет ь,|Д
', Джорсн и up [ 1<)8 | в н< „.рреляцн,, показываю , ч,(, (>)f — >],’) г гблпж
к 4,3, .тем 4 45, как наНД< к. < ьав|Течнн (9 и 1) Таким обр ,зон, ^гюгветствж
иО'| (и тучнее
пых газов (рис. 9.10), определить вязкость я-бутана при 400 Т п 2000 i[iyui-
сидз'фут2. Экспериментальное значенье равно 462 мкП |55[.
Р е in с п V с. Для н-бутаиа и? приложения Л имеем Т, - -- 425:5 К Р,
= 37.б aiM, Н — 7i3j2 ' Поскольку 400 Т — 477.6 К. иолу-чаеи Г,
- 447.6И25.2 - 1д2. ЭдТачснТ;с Рг - 2000/(14,606) (37,5) - 3,63, a t,-
^Г^6МГ/2Р2/3--(425 5)' ^’(SS.iS)-2 (37,5)2/3- 0,0321 lb ж,шепни т]Д -
== 7.7 находим Л.- - 7,7Д),0321 — 240 мкП По рис 9.10 при Гг 1,12, Рг -
— 3,63 имеем i/i| - 2,0, тогда Т| = (2,0) (210) — 480 мкН. Погрешность -
около 4 %.
Пример 9.10. Ilers тори ц> пример 9.S, используя метод Райхсиберга.
Рсшснге В этом случае Тг = 1,09 и Рг = 1,22. По определениям ,4, В,
С О D, данным за уравнением (0.6.9), пря — J.A9 вмееп ,4 — 0.273, Я ="
- 0,144, С — 0,12|; D 5.434. И) приложения А находим- рР = 1.5 лебая
Pi -- 111,3 атм. Тс = 405,6 К. 1 нкихт образов, ц ~= (668) (1,5)2 (111,3) (10,т,6)2 -
— 1,01. По уравнению (9.6 9)
_Д_ _ । ,|. [[ _ (0,43) (1,0|)| -----------(0.273) (1,22)^----___________=
’I (0.144) (1,22) ) |1 . (0,121) (1,22)'’’131 ]*1
= 1,22
При tf — 157 мкН значение г| - 192 мкП.
192 — 197
1 lolрешность =----------- 106 -= — 2,5 %
Рекомендации: низкость плотных газов. Выстриг, но н|'т:б । ii.kch,io< опреде-
ление вязкости плотного газа может быть проведено по рис 9.16 при значении г] .
найденном ш отношения П;ъ - 7,7.
Солее точный распет вязкости плотного таза може, быь, сделан i:t> уравне-
ниям (9 6.4)—(9.6.7), В этом случае требуется зиять плотность га та. а если ог-
сутствуют эксперимента,[Ы ыс данные, следует использовать корреляции, рас-
смотренные в г-т. 3. Vpauiiцше (9.6 9) также допустимо применят,, для pjc'isra
вязкости чистого газа при высоких Давлениям, используя только приведенные
температуру и даплепие. Погрешности ебипх методов не превышают прпблизи-
тетыю 1 %, за тккГ|О'|сппем облает!, очень высоких давлений
9,7, ВЛИЯНИЕ ДАВЛЕНИЯ НА ВЯЗКОСТЬ ГАЗОВЫХ СМЕСЕЙ
‘Кому-либо принятому правилу смешения. Дин н Сигл предпочли применить
модифицированные правила Нрауснипя и Ганна (гл. 4), т.п.
.-J-'.. С» 7.2) (9.7.3)
-УХ-. (9.7,4)
^mRTc,„ (9.7.5)
Эти значения псевдокритичсских параметров используются для расчета рс и
Уравнение (9 7 1) можно применять только для неполярных смесей, как
указывалось, оно может быть использовано как для газов при высоком давлении,
так и для жидкостей при высокой температуре, но точность для жидкостей, при-
веденная плотность для которых превышает приблизительно 2, предполагается
невысокой. Уравнение никогда широко не проверялось для области жидкости.
Когда же была проведена проверка на дезяти газовых смесях с. различной плот-
ностью (}39& экспериментальных точек), средняя погрешность была равна 3,7 %;
большинство смесей составляли легкие углеводороды или углеводороды и инерт-
ные газы. График уравнения (9.7.1) показан на рис. 9.]!>. Для простых смесей
достигается удивительное соответствие. А'етодика иллюстрируется । римером 9 | ь
Подобная же корреляция была предложена Гиддингсом {73\ В этом случае для
определения псевдокрнтических констант были приняты другие правила. Хорошие
результаты были получены для смесей легких углеводородов, найдено также, что
корреляция может быть улучшена, если '(молекулярную массу» смеси, определен-
ную по мольным долям, использовать как третий коррелирующий параметр.
Гамбилл 168] сделал обзор методов расчета и в нескольких статьях обсу
дил методику корреляции tj,,. с составом систем легких углеводородов [33, 54,
28.054.
ы2 - 0,098
=- (i),1865) (282,4) -I- (0,81351 (305,4) _ 301,1 К
:n - (0,1865) (28,054) + (0,8135) (30,070) - 29 69
- (9,(865) (129) -f- (0,8135) (448) = (44,5 лч^колс
\т -= (0,1865) (0,270) 4- (0,8(33) (0,285) = 0,2&3
= (0,1865) (0,085) -L (0,8135) (0.098) - О.ОЯС
RTC
(0,283)(82,07)(301,1)
—..... 144.5
----------------------- = 0.0358
(29,60) '-(48,4)- 3
Для определения р.,, корреляцию Питнера [уравнение (3.3. Н| табл '.
2 можно пс'|ЮДьн>вать с Тгт— 423:'301 -= 1,40. Тогда
120
',nRT (0.767) (82,07) (423)
—-------—--------------гтгт--------------- =222 СМ' МОЛИ
[20
144,5
' 222
= 0,6,51
Вязкость смеси при низком давлении может быть определена любым мет
Дом, рассмотренном в разделе 9.5. Поскольку Эте»т пример иллюстрирует пре:
ложеииый Дином и (Дилом метод расчета вязкости при высоком давлении, Л"
tично нспользопать Tix же метод расчета вязкости при низком давлении, 1. с
уравнению (9.5 13) г)— 128,1 мк( [. 3 огда по уравнению (9 7,1)
— [28,1) (0,0358) =- 1.08 << 6; i _
= 187 мкП
188
378
докрптиисскимн icctic 1 иtiгаvrti, он[|СДелеш!ыми цо модифицированным правилам
ПрауснШ'Я н Ганна. Ожидаемые н<>грсчниоет1т составляют менее 10 % для смесей
газов с низкой молекулярной массой Ття смесей "епо.аяррых газов с высокой
молекулярной массой и смесей, содержащих один нли более полярных компо-
нентов, на одни с ловлс|ворнте.11.игай метод еще нс разработан. Вес же можно
использовал в ' ||;щ|Юи| с (9 7 1). тю ьрн эъэм пД/.ои' более нысокцс по-
грешности
9.8. ВЯЗКОСТЬ ЖИДКОСТЕЙ
9.9. ВЛИЯНИЕ ВЫСОКОГО ДАВЛЕНИЯ ИЛ ВЯЗКОСТЬ ЖИДКОСТЕЙ
ПРИ НИЗКИХ ТЕМПЕРАТУРАХ
Вязкость жидкостей ннЛо. щфма.няк.'й точи ( нчщнпя обычно щ загщ.ит
от средних давлений, по пр к очей , высоких щщ.кнцял было за чечен) зцач( 1 ц л > ное
370
увеличение вязкости 11 Влияние
чавления па вязкость некоторых
жидксьтеп нлл.острирУется
ше влияние давлении [10. /'). 1(!Ь
ihmi давлениях
г > г 1 гтние вя’к ><лн
jt-. lO UOO атм. Ьольшцнство результатов Бриджмена показывает. чг<> графически
зависимость вязкости от давления изображается прямой линиек до давлении
имеющего сложное
увеличения
линейным,
SdBIILlIVlCTb
рлт'риых вязкостей жидкостей при высоких давлениях. Андраче |Й] предложил
зависимость включающую в r-еоя отношения удельных ооъемов л коэффициенты
адпапатической сжимаемости для сжимаемых и несжимаемых жидкостей: но эта
зависимость является только приближенном на линейном Участке кривой t]L — Р,
зирноп статье Гамбилла [<и]
9,10. ВЛИЯНИЕ ТЕМПЕРАТУРЫ НА ВЯЗКОСТЬ ЖИДКОСТЕЙ
Вяжость жидкостей уменьшается с увеличением тсмцсрагурьь Для иллю-
страции па рис. 9.17 представлен график зависимости логарифма вязкости бен-
зола от обратной величины температуры В широком интервале температур
от области несколько выше нормальной точки кипения др области вблизи точки
замерзания график является линейным, т.е.
1р. - Лев ' (9 ]0.J)
Уравнение (9.I0 I) обычно известно как корреляция Андраде поскольку
он первым предложил чту фюрму на основе анализа теории вязкости жидкостей
|6. 7]. За годы, прошедшие со времени появления уравнения (9. jO. I), предложены
буквально сотни других соотношении вязкость температура м.uux
могут быть ianiicaвы в <ледуюшсм обобщенном виде’
П/Л (И -le^P ВЧ'1 *
(".10.2)
жидкостей при высоких давлениях и темпера|урах определяются корреляциями
других типов, т. теми, которые обсуждаются в разделе 9 12.
|Др функции /т 'I ?г отличаются широким разнообразием форм [82, 187, 189, 2201.
Другие варианты коррелируют с Tt' Г 113b] л ибо предусматривают олгп' пли
более дополнительных констант 115, EjO 60, 74. 85. 98, 140 14 1—146, 20О,'2П |.
Одна из форм, которая оказывается вполне точной при пизьих le'i.'iepaiурах
<581, напоминает Уравнение Антуана (см. гл. 6)’
Несмотря па многие предложенные модификации, уравнение (9.16.1) ( ,х
ипр является наиболее широко используемой корреляцией для установлен!;'’
рлнянця температуры на вязкость жидкостей. Однако оцо часто не имеет успех.,
ери низких температурах, так как иногда вязкост,, жидкостей резко возрастав"
(,рп приближении к точке замерзания. Уравнение (9 Ю 1) непригодно также прп
значениях приведенной температуры выше 0 7—0,75. В этой области вязкость
•к,[Д|«”-тей уменьшается очень быстро с температурой. Область высоких темпе-
ратур обсуждается в разделе 9 ,2.
Предпринимались различные попытки связатн константы Л и В уравнения
Андраде сдавлением паров, теплотой парообразования или другими физическими
ьвоцечвамп |61, 104, 105, 153], но они ле имели особого успеха.
Отклонения от экспоненциальной функции могут бы,ь учтены с помощью
графика, аналогичного диаграмме давления паров, разработанной Коксом
Лпрсни | J00--102] приводит описание такого графика, где шкала вязкости пре-
образована таким образом, что зависимость т)д _ Т становится линейной ддя
некоторых веществ, данные о вязкости которых известны. Затем было установ-
лено, Что графики зависимости »]д от Т для аналогичных соединений тоже будут
линейными, если применяется специальная, преобразопанная подобным же
способом шкала т)д. Этот принцип использован в трафиках для определения
вязкости, выпущенных Американским обществом испытания материалов (ASTM)
ц широко применяемых в нефтяной промышленности для описания вязкосп
нефти как функции температуры-
9.11. РАСЧЕТ ВЯЗКОСТИ ЖИДКОСТЕЙ ПРИ НИЗКИХ ТЕМПЕРАТУРАХ
очень бо.ц.пюе число статен, предлагающих способы определе-
ния вязкости жидкостей при низких температурах (7’г менее 0 73 О йО), когда
огсхтствмот -ткспер;1ме|паль11Ь'с данные. I(i всех пред.'ю/кенных методов здесь
представлены чепчре самых лучших п наиболее общих, ио пп одни из шп не
является особенно надежным и все они эмцизическне. Расчетные значения вяз-
кости жидкое, сей сравниваются с экспериментальными в тггб.т 9.1'2 Во многих
случаях отчеча-окя большие погрешности, поэтому особо по.тчепкрвачм. что,
отыскать эксперимеиталы|Ь|е значения вязкости В приложении А даны многие
значения констан г Я и 7\, для использования в х равнении ('}. 11 5) Эти константы
с достаточно^ уверенностью могут применяться при расчете вязкости жидкостей
< г температур, приблизительно на 20—30 СС превышающих точку :змс-раания,
до 'шаченип 7 . 0 75
Метол Оррика и Эрпард 1154]. Это : мс,(1, -.^но цщ>с । i у у, соеs 1Я|и-
i>U>e для определелнг .4 л В в y(.HiBHV>JJ|T /9 1 I. I)
(4 П.1)
ii.HiiiiocTb жидкости I;см’,
жиД|чОС|И, сП: р/.
>1 ЯЗКоСТЬ
,11 молекулярная масса; 7' температура, К.
( рупповые составляющие для получения значепни т1 и /J дниы и табл 9.7
Для жидкостей нормальная температура кипения которых ниже 2<) С, исполь-
зуется Значение рд при этой температуре для жидкостей температура замерза-
ния которых вглше 20 °C, следует применять значение рд ь точке плавления. Me-
ro,1 не предназначен для соединений, со сержаших азот или серу Оррик и Эрбар
проверили этот меюд на 188 оргапцче. ки х жидкостях Погрешности и 'менялись
и ншрокнх пределах гю аснеры сообщают что среднее иткюпп/цс го< тлэляло
15 % Это блш)ь<> к среднему значению 16 % иривсдсцсте в сабл 9 12 ыя более
I M.i 1ИЦ\ 9.7. Групповые составляющие для определения А и В
» уравнении (4.11 1) по Оррику и Эрбзру
\томы сгдсР'Па 1 _) 17 (—6.95 -4 0,2 (н) 5 - ‘>9п
.9 ( (г R — 0,15 0,.И
К -С - R R -1,20 400
1рч!Ш.1Я свизв 0,21 -90
11я rii4.it иное кольцо 0,10 -0,45 32
теслич.ггипое кольцо 250
Apovarti'iethoc Ko.n.iin 20
op |О-.<аме ней tie —0,12 100
Чогг-за\;ещс11це (1,05 -31
(1ара-глмеш.с11)1е —0.01
Хлор -0,61 220
Врем —1,25 365
1 [от — 1.75 100
-ОН —3,00 (600
-СОО- —1,00 420
- о - -0,38 (40
- С :О 0,50 350
-COOI] -0,90 770
Экспериментальное шаченис равно 0,394 сП,
д -= _6,95 — (0,21) (4) — 3,00 - — [0,79
В — 275 (99) (4) 1(00 -= 2271
Ю приложения А имеем- (>[_ — 0,809 г/см3 при 20 ГС, ,-И
виснир (9.11 1)
tn _____________ _ to то
1П (0.809) (74 125 - 10'7<’ ’
— 393 К n<i.'iy чаем r]L — 0,30'i СП
(Ipii /'-
_ ч.сг.т.-' —
По, решност- - - pJ44
' Х'ратуре ниже ши-Аталтаюй точки кипения может быть рассчитана ц(, эмпириче-
ТАБЛИЦА 9 8 Структурные составляющие для вычисления 0 в уравнении
(9.11.2) [203J
0,013
0,105’)
0,381 2)
где г,£_ _ ппзкость жидкости, сП: од — плотность, г/см1, 0 — коцстанга вяз-
кости, определяемая по значениям, представленным в табл. 9 8, Т,= Т,Т( —
приведенная температура.
Экспериментальные значения вязкости жндкосген сравниваются с расчет-
ными I' табл. 9.12. Погрешности совершенно различны, но в общем для ароматиче-
ских BCHieciB (кроме бензола), моногалогеипых соединений, непредельных ве-
ществ н парафинов нормального строения с высокой молекулярной массой по-
грешности обычно меньше 15 %. Этот метод не следует использовать для спиртов,
кислот, нафтенов, гетероциклических веществ, аминов, альдегидов и полигало-
генных соединений. Метод иллюстрируется примером 9.13.
Пример 9. 1.3. Рисгчитить ля иметь хлороформа прп 60 '’С по методу Томаса.
Плотность пр,, этой_ температуре 1,413 г/см1.
Решение Критическая температура хлороформа 536,4 К, тогда Тг ~
_ //>-э , / OZ: / __ п ы>, АО
1,413' -
что на 11% больше экспериментального значения 0,390 сП [123].
Метод Морриса [148]. /крутой метод, использу юпий групповые составляю-
щие для расчета вяткост жидкостей, был предложен Моррисоч. который пред-
ПОЛОЖИЛ, ЧТО
(9.11.3)
Параметр т|* является константой для каждого класса соединена г, Значения
его дань; в табл. 9 9. По уравнению (9 11.3) кажется, что величина Ц* должна бы
ТАБЛИЦА 9,'.. Псевдокри-гическая вязкость т)‘ (148 [
11 зиср чРТСЯ В С[1
У глсводороды
Галогспзамеще пше углево
Производные берто-га
Галогензамещерные произ-
водные бетона
Спарты
0,08/5
0,148
0,0895
0,123
0,08/9 1
Органические кислоты 0,1(7
Простые Эфиры, кет(шы, аль- 0,096
дегиды, ацетаты
Фенолы 0,0126
Смешанные 0,10
1 \R. Ц1Ц X 9.10. Структурные составляющие для определения J [148 [
-
( н... CH.,. UI 0,0825 СП3, СН3, СН, присоедн и.0520
I я.п.гензамещепиая i Н( 0.0 0,0893 ценные ь кольцу
I «'.югензамещенная СП; \'О2 присоединенная к 0 4170
Галсгсн.зГ|Ме1цен1:ая ( Н 0.0667 кольцу
। .1.т,>гчч। . \В' Ш'ппаи । 0.0 NH-., присоединенная ,< С 764 5
। а 0,2058 кольцу
t ] 0,1470 ?, CI, присоединенные к 0,0
Г 0,1344 кольцу
1 0,1908 ОН для (рвргов 2,0446
Двойная связь -0,0742 СООП для кислот 0,8896
C0Hj бензольное кольцо 0,3558 С—О для кетонов 0 3217
Дсшодиигсльный Н в кольце 0,1416 О=С—О для ацсг?|Ов СМ369
С112 как насыщенный член 0,1707 ОН для фенолов 3,4420
ко, шца —О— для пэостых эфиров 0,1090
быть вязкостью г. критической точке, ио. тюско.тьку это соотношение неприменимо
при высоких приведенных температурах т}* лучше всего интерполировать как
эмпирическую констант).
Приведенная температура Т. равна TlTc, a J является функцией структуры.
Значение J рассчитывается цо уравнению
J= [0,0577 £(М,)]1/а
(9 J 1 4)
1 де bi — групповые составляющие, значения ко/орых представлены в табл. 9 10,
'м — число, показывающее, сколько раз группа появляется в молекуле.
Моррис проверил метод па 70 органических соединениях. Средняя norpei
iioctt составила 12 % Менее широкая проверка предс|авлеца в табл. 9 12, из
которой следует, что погрешности отличаются очень резко. Обычно меньшая
точность была получена при наиболее низких температурах и для начальных
членов топологических рядов. Слишком малой оказалась проверка для веществ
с разнетвтевной структурой, чтобы можно было показать применимость метода
в таких случаях, это иллюстрируется примером 9. [4.
Пример 9.14. Используя метод Морриса, рассчитать вязкости жил кого я-про-
пплбензола при 0; 25 и 50 СС. Экспериментальные значения равны 1,178 0,796
и 0.586 сП, соответственно.
Решение. По табл О.ч находим значение ij- для производных бензола;
>{' ~ 0,0895, Приложение Л тает ?’<- : - 638 К, j J расчитывается по сравнению
ГО I 1 Л\ „ -,.Х . п 111.
Jfcj/ii CrH, бензо,,Ы(ое кольцо-|-дополнительный Н в ююь-
це + (СНг-]-СП» + СН,), присоединенные к кольцу =*•
Горда по уравнению (9 I ( 3)
Pi*'iy.it,таiм расчсгт ,цодч', в снде.гннуго мГмниу
Метод Ван-Вельцена. Кардозо и Лангенкампа. Г[о< .ie ч|'с-,11ы>н1Й1и> ц.дроо-
ною исследования влиянт я структуры на вязкость жидкостей Ван-Всльнен и др
[21 i 2121 предложили следующую модификацию уравнения (9 10.1):
где ip вязкость жидкости, сП Т —температура, [\, ZJ и /у ~ параметры,
связанные со структурой,
Чтобы определить эгн параметры, нужно снам-та ианти эквивалентную
длину цепи /V*
“V + I AV,
где А деке luTie.'ib.ioc q»ci,; атомов углерода в молекуле, а АЛ'; — структурные
сост?п-1Я1Ош.не к। таб... 9.Н. Если Сфуктурпая пли функциональгая группа ДА',
проявляется >, р:-)3 н молекуле, то нужно добавлять поправки я, ДА', Некоторые
сос,авляютче указанные в табл. 9.11, необходимо использовать крждый
раз, когда проявляется определенна^ функциональная группа, другие внесен-
ные в эту таблицу значения представляют собой дополнительные поправки, ко
торые применяются для изменений основной групповой составляющей. Несколько
tpHMepoc, данных ниже, иллюстрирую! методику вычисления А".
Призер 9.15. Рассчигать Д'" для бензофенона. \Ю|юформ,>, ЛЕметп.гдрфс-
> илампна, Л, Л'-диэгнлапилнна, аллилового спирта и л'-ыы'ротолус.та,
Реше и >i е. Для бензофенона (С6Н ,COCtH5) ,V = 13 (тис.-о атомов угле-
.< 113) -- 1,68 Кроме того, поправка для ароматических |<с>с>нов равна 2,70 на
Л' - 13-,- (,68-L (2) (2,70)= 20,08
Для хлорсформп А1 — (. Каждый ш трех атдаю хлора имеет составляющую
ДА',, равную 3,21 Помимо этого, поправочный член для структуры С (С1)х равен
1,91 — 1,459с, где в данном случае х - 3. Следовательно
Лг* - | (3) (З.-Ч) (,Ч| - (],4ГЛ) (3) = 8,16
В случае А'-метплднфеииламнпа |(Сс] r3)^N(Cl]3’) ] Д' — 13. Это третичный
амин, так что АЛ'; -** 3,27 Необходима такжд поправка, равна» 0.6 для каждой
аромаюческой группы (сц. сноску 6 к табл. 9 Щ Горда
V -- 13 4 3,27-1- (2) (0,6) - 17,17
Для Л,Л’-диттп.чапялппа liCaH6i N )С,Н5)Д А’-Ю Опять используется
сосивляютиаи для третичного амица (3,27) но поправка ipefiyeicst *гол(КО на
38о
В случае аллилового Спирта (СН>=-<~1 (CI13О1-Ц V -= 3 Да я ле рвении о стщрта
ЛЛ’| — 1 ft.CiOG _О.276Л - J0.60G -- (0,276) (3) 9.778. Кроме того, как для
а.чкенр вторая еис-'-имяющая ЛА!г 0,152 — 0,042,V -- DJ52 —
— <(>,012) (3)---0,278 Таким обратом
,V* = 3 -|- 9,778 - 0 278 12.50
1(ак<н>с», для и ни г, отолуола |Д1 (4ХО2(СН3) | Л -= 7 (.ociai'' )::1Ля для
<>ро,магического шлросоеднкепня ДЛ'г 7,812 — 0.23G.A'- 7 8(2 (О 2Дц (7V
' 6,(6 Не имеется состав пяюшей Для а 'Ки.тбензолз. Поправка рр метазажч к кие
Л’’’ - 7 Д- 6,16 - 0,(, - (J 27
Значения Л * используются затем для определения В и То входящих в урав-
нение (9.11 Гй Для Го:
/ 28 86- 37 139,V* _ ],3547 V2 - О 02076 V‘:1 „рп .V- < 20 (9 11.7)
’ ’( 8, (61,V” - 238,59 мри №>20 (9.118)
Для В
В = В,- ViB, (9 11.9)
'R f 24,79 (Д.885№- 1.3 (73 V’: - 0,0u37,V'3 нри № «S 20 (9.11(0)
' | 530,5'1 - (3 74б\* т.рц У*д>2() (9K.I1)
Вепирнна Ай, определяется суммированием составпяющнх как эго лока-
<пь' в табл ° II Даже если функ'1ц(>пааьн<ая группа может проявиться оолее
'июго раза >: соединении, составляющая ДВ; употребляется только одни раз
Значения В и Т,,, найденные для любою конкретного соединения, далее
сгю.илукутся в уравнении (9 Н б>. по которому рассчитывается вязкость жтд-
остц. В этом уравнении т)д выражено в сантипуазах. Т -- в кельвинах.
гязкос'ь при 25, 55: 95 и 120 °C Й !вестн(дс экспериментальные значения равны
Ти = (8 161) (20,08) + 238,59 - 4<)2,52
Д гя определения В сночата ю V] ащ>е:п„<> i<) ((.(I) находит,я В„
В,,-- 530,60 ((3,7401 (20,(Й) -
Значения -1Я/
Ай (ьеюч) - -117,21 (15 781) (20,08) (90,67
Ай (поправка in apOM.filHiccKiHi петой! 7(,О,6б
(50,4781 (20,08) = 252,90
/? _ 809 /10 199 67 + 252 95 1259.(1
ТАБЛИЦА 9.11. Составляющие для расчета вязкости жидкостей пи Ван-Вельцену, Кардою и Лангенкампу [211]
Структура или фу;; Klimin a.'ii-ua и ... (1C,!|LLIIML|(- Припер \ “ 1 т- 1 Ipi i чей аки с
д 0 ч-Гексан 0,00 377,86 209,21
Изоалканы 1,389- 0,238/V 1 Г, .11 2 Л1егилбуган 5,20 6.89 351.95 189,83
Нчсыщенн >ге углепо породы с двумя ме- тильными группами в изоположении о,.11'1- 0.238.V 15,51 2,3 Димегилбутап 229,29
н-ЛлкенЫ - 0 152—0,042V — 11,91+ + 5,410,V -494+ 4 5.410V* 1-Октен 7.51 446 89 242,11
«- Хтнаднсны - 0 301—0,081.V 1,3 Бутадиен 3,36 211/21 110,15
Изоал кеин 1.237—0,280 V —36,01+ -'-5.4(0V* 2 Метил 2 бут ен 4.81 307,40 18(1,(>х
Июаикадиепы 1,085 -0.322.V —35,01 + -5,410.V* 2 Menu 1,3 бута- диен 4,18 285,89 17 1 ,'20
> |<|еводород с одной двойной СВЯЗЬЮ II двумя мегитьиыми группами в изопото- жении 2 -:>2г, -0.518 V 36,01+ + 5,410.V* 2,3-Цнметл 1 бу- 347,(17 197,7 1 Д.гн -nwOii /п.'.юлли ге.т.цой i рунам СН3 в птончложении те личин пи, ДА на 1 .ЗА,-(1.238.V
Углегодород с двумя двойными связями и ДВУМЯ могильными rpvnuavii в изоиоло- жеипи 2,474—O.560.V 35,01+ + 5.410V* 2,3-Днметид-1,3 бутадиен 323,30 187.57 Го же
Циклонснганы 0,2054- 0.069.V -45,90+ + 2.224.V* «-Бутилцикло- пентан 9.83 52/.3 285,7 ,V С 1b, ие рекомен- дуется для X — 5 и 6
3 971 0,172V -339,67+ 1-23.135/V* Гридсцилцикло пентан 18.87 889,40 392 Г) .V 16
Циклогексаны 1,48 - 272,85+ +25,041/V* Зги.и1икло1ексан 9,48 501,80 279.72 А'<' jy, не рекомен- дуется для V — С и 7
6,517—0,311V - 272,85+ +25 041V* Додецилцикло- гексан 18,92 994,10 392,87 /V 17 1
Алк/ыбс 1 IO.T я Полифеиилы 0,(0 3,055-0,1 и 1 А’ - 5,340+0,815,V 1 10,04 -f-13, ,869V* —; (0,04-1- -f 13 869V* -188,40+ + 9.558A* I' Iv.i 1 1 1 ,и-Тр|феиил 27,44 .л'.3,0У 1008,7 462 58 X ., (о, не рекомен- дуется для /V = 6 и 71. 5 С) X . ... 14 >)
Спирты первичные 10,606- 0,270 V —589,44+ 1 Пентанол 14,23 1113.0 347 12 •»)
вторичные 11,200- O.bO5,V + 70 519V* 497,58 Изопропиловый 12,38 1141,35 321,12 2)
третичные 11,200- 0,605,V 928,83 спирт 2-Метил-2-бе га- 13,42 1699,1 337.19
диолы (поправка) См примечание 057.77 Пропилен гл н копь 22,66 1399,71 423.55 Для ДА исиользеют-
фенолы (поправ — ОН в боковой цепи к аромати- ческом!) кольцу (г.оправка) я-Кистоты 16.17- V - 0.lb 6,7954 0,365V 213 68 213.68 -249,12- н Масляная ки 12,25 665.4(1 322,3(1 ся состав ичощие С1(иръ)и и доб.1вляет- ся V - 2.50 । 7 П .V <' 11, нс рекомеп-
Изокисло । ы 10.71 См примечания + 22,449 V* - 249.12— +22,449V* — 249,12-1- слот а Изомаеляи.1я ки- 12,01 652,02 319.00 дуется для V = 1 и 2 Рассчитать А5 как
£ + 22.449.V* для кислоты с пря- мой цепочкой: рас- считать AV для ки- слоты с прямой це- почкой, ио уменьшить Л V на 0 24 для каж- дой мегильнои груп- пы и изопоюжении
Пром ua'iiue
Ароматические
стые эфиры
Амины
первичные
Кислоты с ароматиче-
ским ядром я структу-
ре (поправка)
(.ложные эфиры
('ложные эфиры с
л рома тн'(еским ядром
в структуре (поправ-
ка)
Кетоны
Кетоны с ароматиче-
ским ядроч н струк-
туре и поправка)
Простые эфиры
4,81 — 188,40 h Н-Ч 558 V’ Фенилуксусная кислоia 22.52 1123,29
4,337— 0.230 V — 149,18+ -г 18.695,V* Эгиловыи эфир валерьяновой ки- 9,73 380,16
— 1 174+ф376А 140,044- 13.860А* Бепзитбензоат 19,21 1133,17
3,265 0,122V 1 17,21+ 15,781,V- Метил п бут ил- 8,51 514,53
2,7 0 760,05+ т 50,478,V- Аоеюфеио(1 12,99 615,02
।\2ОДф O4V — 9.39+ 2,84ЬА- Этилгексплопий 9,97 ГУ75,96
1 1,5- V — 140,04+ + 13,869Л'* Пропил фенило- вый эфир 1 I ,г- 650,83
422,41
284,01
393,31
20 1,51
288.П4
Ес.ш углеводород
Добавляется к тиа
•icHiisiM Д.-V, \В, вы-
жит поправкой т.н1
оp<vi «и о Дира
3.581+0.325V 27>,39+ + 8.744.V* 11ропиламин
7,об 545.01
243,44
Гели углеводород-
ные j руины имею,
изоыч 1 фигурацию,
— 0,16 0 Don аи.тамии 12,91 799,17' и.ш.'ы jь 1, вычислен- ным (печениям длн ам ипа
1,3901-0,-ИИ,\ 25,39+ -,- 8,744 Л ‘ ЭгиЛирон ила м и .1 8,69 603,44 265,53 1 тли углеводородные группы имеют иао- конфигурацию, то см. с носку 5
трети чи ыс 5,2Т 25.39+, ... ... Го же
D ервичивн- с г рут - пой ,\Н2 в аро- мат» четком ядре Го, 04- V 'о я 1 оду иди и 15,01 904,08 356,13 1 • ') Эн ачеи ио \,\‘ не я вляеп я поправкой; для \И используется значение для просто-
вторичный или третичный по крайней мере с одной ароматиче- ской группой, со- единенной с азо- том аминогруппы Нитросоедииения: *) ’) Бевзилфсннламин 21,58 1041,18 411,71 го । ервичио] о амина
1-HII тро 7,812--0,236 V —213,14 + + 18.330А* —213,11+ + I8,33O;V’ — 338,01 1- +25.086Л'- —338.01 + + 25.086А' Нитрометан 8,57 442,82 263,28
2-nntpo 3 нитро 4 нитро; 5 нитро 5,84 5,56 5,36 2-1 lit। ро 2-i ентси 10,48 567,43 296 33 Необходима отмечен- ная алкеновая сос’Л- ВЛЯ Юща я
ароматическое питросоединеиие Галогена вмещенные соединения фториды 7,81'2—0 236 V 1,43 — 213,14+ + 18.330.V’ S 75 Нитробе»аэл 13,01) 728,79 332,23 О поправке на яро матпку см. сноску 6
npodu.mi’Hue
Структура Я.Hl фУШ.ЦийНСЛ Ml.l я группа дм. 1 Пример При меч.п1 иг*
со 1'Д| i н> нпе Л" 1 ° Т„
3.21 - 17,03 Эталхлорид 5,21 319,94 190,08 5,0)
бромиды 4,39 101.97-1- + 5.974Л'* l-Вром 2-метил- пропан 8,15 435,85 2.>5,24 5,0)
йодиды 5.76 -85,32 Иодбснзол 12.36 589,18 0.6)
Особые конфигурации (поправки): (СО)Х -CC1-CCI- - С(В1Ь —СВг— СВ1— CF3, в спиртах C.F,. в других со- етииеииях 1,91—1,459х 0,96 0,50 1,60 —3,93 -3,93 — 26,38 0 81.34— 8Ь,850л - 57,73 341,68 25,55
Альдегиды 3,38 146,45- 2.5,11 .V” Пропионовый Я.11.ДС1ИД (>,38 383,16 217.97
Альдегиды < аромата ческим ядром в струк- туре (поправка) 2,70 —760.63-1- -+.50.178.V* бензойный аль де г ад 13,08 391.19 .333.25
Ангидриды 7<97_0<50Л' -33,50 Пропионовый aii- гидрид 10,79 554,87 301,19
Автадриды с'гарома- тическнм ядром в структуре (поправка) 2,70 —760.65-1- 4-3(1,
13,12+ 1.49W 524,63— Ацетамид 18,10 931,07 385,79
— 7(i0.(k>+
+ .'D, 17X.V"
12,44
близится:.нс, с 1500 данными точками и произведи тщательную статистическую
количественную опенку. Ьотьшпе погрешности часто замечал, сь тзя первых
членов гомологических рядов Этот вопрос очень важен, поскольку в табт 9 12,
,де сравниваются расчетные и экспериментальные значения вязкости многие
проверенные соединения являются именно первыми пленами рядов, .,то может
дай, несколько неправильное представленье о метоле Вап-Вельп.епа и др
Другие корреляция. Предложено также бо.тыиос число других эмпирических
методов определения вязкости жидкостей. Гамбилл [69] сделал обзор мцогих из
них Отбрайт и Лоренд 11 ] псполыовачп коррелирующий параметр 27.,. а дру-
гие авторы в разное время предлагали зависимости, включающее г|д, Т п один
или несколько следующих параметров Ti,, 'l'f. ,М, плотность паров, поверхностное
на*яжсние, скорость звука в.тндерваа.гьсовгкие объемы, давление ларов, реохор
[84. ]8b. 188, 191, 201 1 Большинство этих методов применимо только при тем-
пературах, близких к нормальной точке кппечця
Метод Андраде |8[ для определения вязъистсы в годке плавтенпя исследо-
вали Магссн и Джонсон [|42], которые представили его следующим образом
'1/ --- Р1>г”7'1 2 .-И1 й. где г|г в точке птавтения выражено в сантипуазах, о -
в граммах на кхбипескпн сантиметр, Т — в кельвинах, а М молекулярная
хщеса Андраде, исходя из теоретических соображений считал минимальное зна-
чение [3 равным 0,051 Матсон ц Джонсон нашди. что в действительности зпаче-
рении Существует определенная корреляции между |i и структурными иараме
близки к теоретическим, но увеличиваются, часто па несколько порядков, для
сложных несимметричных структур Например, значения [J для ряда «-алканов
колеблются от 0,058 для метана до 2.78 для пропана, хотя шачеиня |3 для боль-
шинства соединеный вплоть до эйкозана, находятся в пределах от 0 3 до 0,7
Для ряда ассоциированных жидкостей Махин и Ствйрс 1137 [ табулировали
lg 4L - Л'
Значсипя -V, Д', 1" для дссяц| простых полярных жидко, геи даны
в ,абл. 9.13
Некоторые исследования бьыи направлены пи коррелирование приведенной
вязкости жидкости в терминах приведенной температуры. Приведенная вязкость
была ранца 1[т [(те)1 2 'гт!|, а приведенная । см пера i vpa /,7'А. (гп масса моле-
кулы гни— параметр,,,, характеризующие энергию п линейный размер в ре-
зультате применения межмолекулярного потенциала). Обычно приемлемые ре-
зультат^ подучались только Для одноатомных жидкостей, например аргона
| 18 2021. хотя делали, ь попытки применения такого еодходя к жидким металлам
[44] и криогенным жидкостям (ц смесям) 1164]
ТАБЛИЦА 9 12. Сравнение расчетных и экспериментальных значений
вязкости жидкостей
fl родолжение
Циклолснтан
2,2-Дцмегцлпро-
пан
Эга и
1,2-Дибрс>м=тан
],2 ДихлорЭгЗК
Эти.к.вый CrfHpT
Эти-Внет.гг
Эснлбен юл
Брома f .rd
Этилен
Дилгиловьги ),|,ир
ЭI иЛформ it ат
Гептан
Iloi jiciUHO. ть расчета ) ( .> методу
Pau-Lcib
Оррика
Р О ... V. 1 л м л: 1 Кард..'.'
ГТК 11
20 0.72 -36 -- 38 15
20 0 430 -32 2,6
50 0.323 - 28 - 26 -2,3
0,431 —37 -3,5 7,2 —24
0 0.328 .31 -1,2 16 —32
10 0,281 • 26 -0,8 20 — >8
г тп. О.'.'д’о 54 30 2 О
120 0,257 27 -|2 8 2 —3.2
_85 0,162 20 —22 12 11 <
20 1,714 м — 2<» -0,8 18
00 0,995 18 __ 2 а 0 1 -14
120 0.562 —12 -20 -20 -12
0 1,121 19 -41 4.0
40 (1,644 -В -4.0 -11
80 0,417 8.6 - 27 -18
д 1.776 79 27 (>9 | л
40 0,826 . -68 з ,. 38 — 6,1
0,465 —55 5.4 27 -6,0
20 0,458 „ < :*» а о 3 1 —0,6
80 0,246 0,4 0,4 / 2 1.4
140 0 153 4 о ] |
190 0,0998 1'1 34 24
-’() 1.24 - 2.9 - 1 8 В
40 0,535 -1.3 - 1,2 —3 3 7,4
100 0 308 _ 1 .1 1,
НО 0,231 -0,4 -1,2 —4,6 — 0,2
20 0,397) 1,0 27 2,0 11
60 0,269 9 3 32 Ю 19
100 0,199 I 1 36 16 26
1 ьо 0 126 23 58 38 оО
170 0,70 23 -25 4 0 -41
140 0,31 В -27 40 - 23
10(1 6,15 27 -2'2 92 2,4
() 0.289 7 6 6 4.3
20 0 23b 7,6 - 3 0 5,7
60 1) 167 8 4 2 1,1 9,6
100 (f, 1 (« IC 11 8,8 '22
0 6 507 Г", г. -18 -3.3
Об 0,362 ;т '
6,288 2,1 111 - 1.2
-90 л “г 2о 2 ] -17
-16 0,965 0,1 — О л 0.8 1,6
20 0,418 1,2 — 1,9 1.8 4 6
IOO ОД0<) - 1.1 3, 1 -4,4 -4.8
npv<~lniircen:i
I io:*iv-:u!i (v-т , L>r k'i ,><< , >k<(( 1 |00"_
Рекомендации для pjuieia низкости жидкости при инжик температурах.
Рассмотрено четыре метода расчеса вязкости жидкостей по групповым состав
ьязкоетп 1<т различных ж,|дкостсй (обычно простои структуры' Для всех методов
осуждение, поскольку мето,. Ван Всльцепа и до не рекомендуется для перлах
Моодь! Морриса и Ван-Вс.(ыдсна и ,др предполагаю!, чго (gi|/_ является
линейной Фупкняей ( Г тогда как истоды Оррика—Эрбара и Томаса имеют не-
сколько иной жьт, поскольку включают плотность жидкости Ни один из методов
нс надежен для весьма разветвленных структур (методом Ван Всльдена и Др.
Можно обрабатывать линю нзосоедтн'иг,я'1 и дтя неорганических жидкостей (ме-
тодом Томаса можно обрабатывать только соединения, Содержание серу). 11р>,ме-
пимосн всех методов ограничена диапазоном темнерлур от несколько выше
точки замерзания До 71, -- 0,73
['екомендует! я использовать, когда ->т<> возможно, метод Вян-Всльцсна,
1'ардозо и Тангов,кампа для расчета нязкОсТи жнЛкостр при г изКиХ температурах.
I (ei, чючсипе должно быть сделано дня первых членик гохюлоигческнх рндев
Погрешности отличаются значительно, но судя ко широкой проверке [21 [ ] в бо.п.-
шиистве случаев они должны быть пенсе (0 — 15 "f, Fenn с:етод Ван-Вельцена нс
может быть применен, то рекомендуете» метод Морриса пл,] Оррика ц Эрбара
Однако с)цн нс на много точнее метода Томаса.
Для многих ueniecrn значения В и / 0 табу л]][>',ион>а в приложении А. Эти
параметры были определены ко акспернмецта.н.ным данным 12(21. а не расс'.ипы-
в.алпсь но методу Вап-Вельпс'и п др О-< видно что емсиир <>н1к должны полол.'.-
човгться когда зто возможно, в уравнении (9 Ц.'н хоти диапазон их грнмеш'-
Mocni вес же ниже Т, 0,75.
9.12. РАСЧЕТ ВЯЗКОСТИ ЖИДКОСТЕЙ ПРИ ВЫСОКИХ ТЕМПЕРАТУРАХ.
1.,п насыщенных жидкостей при высоких темгератх;.'.
оказал ici,
ВОЗМОЖ-
плотностн ис тренышень:. Так для неполярных газов уравнение (4.6.4) должно
применяться гри приведенных плотностях ниже 3 Такое соотн апепче означает,
(9 (2 ()
Здесь 1|э — / (L Тг': — вязкость газа рп низком (автепш: Например, на
‘’сновании уравнения ('* 4 17)
Г’Г'1 >,,£—000208 - (0.351) (0,00[ [21 - 0 00247
Поскольку
(Г,40.0)1"
5 - д?/’/Ж " (ЮО нОЗ)1-2 (2; О)-3 = С>'031('Й
окоьча,сль»о wcbi-
,t »»^п
Эш.перц\1с!|Та.1|.1|(1е Значение щи, эг.й им'гсратуре [онио 0,085 сП 1136]-
С.1едов.|те«’1Ы1О
0,078-0.087
Погреппккть —------(м)85"-----™--------"
7s ,>лвие(п(я ,9.12.3) - (Ч.12.0, предс.ап.ikio। лу-ипии мек.д раг-кта вязкости
пас ыщепuniх жидкостей при температурах Т. и.70 ,1 вы.не. Он бы;, разработан
iii JiaujjLjx rcu),>(<; ,,i) J4 жидкостям, в dl।к,i.11,л; простых углеводородов,
ii lie Cj,j । ini।[Юк1, проверен Ангоры '.н-года сообщают. ' io средняя погрешность
9-13- ВЯЗКОСТЬ СМЕСЕЙ ЖИДКОСТЕЙ
401
Группа exp (-AS”;Pi явлистс! эквивалентов А. а SH'-R —
эквивалентом В н уравнении (9.10 Р Здесь нелишни Л?', АЧ" и Х3‘ -- согн-
надсждых методов определения количеств этой оперши, но с помощью <и не,эн-
ных качсстпеирых представлений можно состг'ипъ модель смеси
В смеси, состоящей ич компонентов А и В, молекулы А при перемещении
Чсрет энергетический барьер может в1аимодсйС1вовать главным образом с Л,
с В или с какой то комбинацией А и В в зависимости о- локальной копиейi рз-
пни Кроме того, это взаимодействие можно было бы рассматривать как бинарное
стым с точки ipcHiiH наглядного изображения являет1-'*’ двухмерное тройное
взаимодействие, принятое .Макаллистером1) Основная идет такого пзапмогшн-
епшя может бы।ь выражена следующей схемой'
Tie< ь молекула Z проскакипает пли протекает между молекулами X н Y.
где, в случае бинарной смеси, Z, X р \ могут быть Л пли В Если все три яв-
ляются А. взаимодействие будет типа Д-Д А вообще дтя бинарной шшен может
схщестгшв.-ць шесть тиров взаимодействия, т. е А-А-.А. В В В, /Х-В А. В-.А В,
\-Л В. A-В В Пред едашется что значение Vi’ д 1я вязкою п 1апмоде11Стзня
может быть пыряжспо в общем виде как
Л6’ -Й
--I / I "’—I
гдх \ io iг Ito,ice тою
(<) J 3 3)
(ч 13 4)
лол хи ~ Л(Лв \ -
AGbl< у л6в хв - Л(?’ю
(.>1,9), необходимо,
ьзиП модейс гния
'} <дсс1> npiitiiniaeicsi,'ни Идл’ ' Vu)'3ii 11;,д - (2llj | Л1д1 3
видно, что чем больше будет нспользопапо данных тем лучше будет полученная
.Чобс [129] гс.ке проверил большое число корреляций ьязклС'и смеси жид-
уравнения
~= £ Флг еур
У
— а|( /?7) ,| предположил, чк) если
(где — a.v;P7’ и -
компонента с меньшей вя
изменяется с составом
\ П|.|брлгь в Kd4gciBe
Всс сказанное относится к зязкостчм жидких смесей с,р« низки'’ ге.коера-
iVpa.x. По существ' нет Никаких экспериментальных данных п отсутствую!
коррс.1 яки и вязкости жидких смесей npi: высоких температурах {7"г> 0,75)
Можно -олько предположить Чт<> в эюи области подход основании!! на исполь
зопаиип приц|тппа соответственных состоянии, мог бы быть применен гам, где
кюглп 6|,i пегю.:,HicBd।вся корреляции, рассмотренные в разделе 9.12, а приведеи-
iii.ic тем|ц р<| г<[)<!, ди плен нс и фактор апептричностн для смеси были бы определены
по ир<|ГН|лам смешения, гаким как представленные уравнениями (9 7 2)—(9.7.3).
iioHHTiiii остаточной вязкости (см. раздел 9.7)
Рекомендации: аядкость смесей жидкостей. Для определения , д (кои'миерч
।урной вязкости жидких смесей, состоящих in двух компонентов, рекомендуется
при наличии достаточного количества экспериментальных точек и данных |,о
объему смеси иене.тьзовати сравнения (9.13.5) пли (9 |8.91 Если имеется толькс>
один экспериментальная точка при каждой in двух температур можно приме-
ни । ь у ]> а и пей не (9 13 7 г удобной формой для f (т|) / является 'in iji , а х моль
Если не г никчКиХ данных о вязкости л.|Я смеси, '<> применяются урапненис
1 [рсдиоллгдем^е ih>i рсшности мго уу иметь широкий диапазон
гостящих из химически подобны' всшеств, по ДоЛЖ1ц,' быть ме-
Пример 9.|8. PdCC'iH।<iTi, пткосг, /кидю»! смесн эг11.,бе।:,,, и о1ч|3илбец-
юат.| при 25 °C Мольная доля <5einii;irteii3iiaia составляет (),6()G Экспсрнмситаль-
Решение. Примем индексы ЕВ для ятилбен'пата и RR для бепзилбсн-
эоата Данные для чистых компонентов смеси при 25 "С [991. 1]рв = 2,01 сП:
________ О .10 -П - _ , л.« а _ , । гл1 _ . л
1:. 1: 8.-18
4 8| —4.95
1.927
______ (0.606) (178)___________
(0,606)(178) 4 (0,394)(144) - '
((Ш>5) (7,626)
и (кнэрлбсцзоата составляй (1,091) (4,27) 4 66 oil.
ОБОЗНАЧЕНИЯ
11.mb
imbl
11 < i
Глава
ТЕПЛОПРОВОДНОСТЬ
10.1. СОДЕРЖАНИЕ ГЛАВЫ
В этой главе рассматривается теплопроводность газов I жидкостей Теории
теплопроводное,.( газов посвящен раздел [0.2. теории теплопроводности жидко-
стей — раздел 10 8 Методы расчета теиюпроводности газов npii низких давле-
ние обсуждаются в разделе 10.,1, а слияние температуры и давления — в раз-
деле |0.4 и 10 5. Аналогичные темы, относящиеся к жидкости изложены а раз
делах (09—10.11. Теплопроводное:,- смесей газов и смесей жидкостей отведены
ра тделы 10.G, 10.7 „ '0 [2.
В качестве единицы измерении теплопроводности в данно,, главе ист,оль-
зуется кал/(с\- с К и Д зя пересчета т ой единицы в БЕТдфут ч-°Ю се необходимо
умножить на 2И,А а для пересчету в Вт./сч-К) или ,'Iik-'(cm-c-Ki— па 1,186.
10.2. ТЕОРИЯ ТЕПЛОПРОВОДНОСТИ ГАЗОВ
В разделе 9 3 представлена элементарная кинетическая мадс.ъ. в которой
теплопроводность газов была рави i сССцП'З [уравнение (9 3.7) J, где j — средняя
скорость уолеху.ты, А - средняя длина свободного пробега, Cs теплоемкость,
приходящаяся на одну мо-пекулу', ч — число молекул в единице объема (Лпж-
jiocrb) Лпадыипн .ie уравнения были получены для вязкости и коэффнЦ1|СН~ов
диффузии газов. Е двух последних случаях такай элементарная модель дает
приблизительные, ио приемлемые результаты Для теплопроводности она не-
точна. Необходима более детальная трактовка, которая могла бы обнясцить име-
ющийся э(|>фск, нтирокок, спектра скоростей молекул; кроме того, энергия моле»
KV.n.i может проявляться в чвых формах, а нс только как энергия поступательного
движения /l-чя оди,,атомиь|Х ,азов, которые не имеют вращательных или колеба-
тельных степеней свободы, более строгий ацаню дает
(.тщ/гГ)'
Cv_m
щт2Йс,
(!().> I)
или в более удобно?., ,я в1,'1|1слец||(| нидо
। азч.кгфгд!)1 :
(10.2.2)
где а - зсн.точрориносуь, ка.т. (oi с-К); / — температура, К tn ~ масса моле-
кул,,|. Л1 - молекулярная масса, <> — характеристический размер молекулы. А:
интервал сюдкновепшт, безразмерный.
Ч,с>бы получить уравнение (10 2.2) из уравнении (10 2 I), величии., С„ была
принята равной 3А k, где 'i - iincrojunian Больцмана 21ля молекул-твердых сфер
интегра.। столкновений 1. однако обычно он является функцией темпера
туры, и точная завцспзюсть относится к Bj.iop.inному закону межмолекулярных
сид Если выбирается потенциал Леппарда ;2жонса 12-6 [уравнение (4 4,2) [,
то интеграл столкповин,|Г| 1.’;, дастся уравнением (9.4 3).
Fctu уравнение (19.2 [) разделить ,,а уррзненис (9 3 9)
г М
(10.2.3)
При ", ’ Cr‘Cv Rpjin'p'iTi Праидгля будет равен
(10 2 4)
10.3. ТЕПЛОПРОВОДНОСТЬ МНОГОАТОМНЫХ ГАЗОВ
ТС, <5 T.SV.^VillVi К -ill»' ?! li i i H ЧЛСИЫ'.
(IO 3 i)
ira n,n 11'।г।i/jio
.Персию] Тачим образом, с<к luisciHWiny ю анергии pod iTawai'iiwo движения
отдсонЮ! <>r любой внутренней энсргсн ваапмодсйсгвпя [29, S5 ]05, 124, 162,
176 ['ib, Ю<>1, xoin обоснованность атого действия сомнительна [60, 94, 159,
1301. Неизменно аничС|1ие /1г принимается равным 2,5, чтобы уравнение (10 3 1)
можно было свести к сравнению (10.2 3) для одноатомного газа. Значение С’1г
как
74' ;11,|(е.,->)
111
Эпкец выбрал /lllt = 1,0, тем самим уравнение (10 3 2) было сведено ,< виду
(10 3 3)
(10 8.8) не доказана, оссюенно выбор ш.. — 1.0 У(
линг [ь2]. Гпршфельдер [ЬО] и Шефер 11ио[ щшдпе
Сужденными внутренней энергией (остоявиям,1 мо
дельная химическая разновидность. а перенос внтг-
к ы emit ша ( t м ди[ ]л i hi г п) и д Э
влцему результату:
где Л! — молекулярная масса г; — вязкость; р--мольная ндогноегь, D —
коэффициент диффузии
В большинстве ранних теорий величина Р представлялась эквивалентом
коэффициента молекулярной самодиффузцп. а /рц— обратной величиной кри-
терия Шмидта. Ла основании уравнений (9.3’1) ц (И 3 2) можно показать, что
fiut | ,32 и цоити не зависит от температуры Лги такой Формулировке уравне-
ние (10 3 2) принимает вид
Уравнение (10.3.Р) час>о называ'О, модифицированной KcppepTn.iiei'i Эйкена.
Свехла | 180 ] использовал ее в работе, , освященной свойствам га job при высокой
температуре,
Модифицированная корреляция Эйкена [уравнение (10 3.0)] дает более ёц-
сокие значения А, чем его же корреляция в форме (10 3 3), и ра-щнна становится
еще большей, когда Cv превышает значение для одноатомных газов приблизи-
тельно па 3 кал/(мо,ть К). [Обе корреляции сводятся к уравнению (]0 2 3), когда
Сс = 3(г7?.] Обычно экспериментальные значения А .тежат между значениями,
рассчитанными по обеим корреляциям Эйкена, кроме, полярных , азол, когда
уравнения (10.3 3) и 10.3.3) дают значения А, которые слишком высоки
Лиа.(из Мэсоца и Иончика. В работе, опуб.гнкопгнгпой в 1962 г' [105], Мэгон и
Моцчиц применили формальную динамическую теорию Вак-Чепа и УлепЛена
[ 199] и Таксмепа 118) ] для вывода аппроксимационного уравнения теплопровод-
ности Многоатомных газ(1в. В Формализме уравнена» (10 3 1) они нашли
(10 3 6)
(10.3 7)
является сое гавлякчпей ас ii.iocsikoctii.
— число
< тереней свободы для внешнего вращения Ве-чичиим С\.;, - ('.v Сц, a Zroi —
число столкновении (представляет собой ihic.to столкновений, требуемых Для
взаимного обмена кванта энергии црашепця с энергией и0с1-тяте.и>иог<> движе-
ния). [В ура1!нениях (10.3(5) и (10 3.7) пренебрежимо малая величина, учитыва-
ющая соспвляютук) энергии колебание, онкнетм / При ftuwinr значениях
Zrill Уравнения (10.3 6) и (10 3 7) приводят к )|г-_ 2,5 и /ни - -WpD Т|, т. е.
к тому, что ращ.шс использовалось для модифицированной ксфре.щаии Эйкена,
412
Коэффициенты Эйкена как функция
<.) RRRC,
^равцеиие (10.3.8; следует применять
только для неполярных многоатомных моле-
кул. Ключом к его ИСцолъзоваии|0 является
точное определение значения Zr-j. В на
стоящее время сделать зто невозможно, хотя
называемого коэффиписн,а
окиси углерода
хгмечено Выше,
значения ЛЛйт|Сс.. чоторыс лежат мезеду
рассчитанными по корреляции Эйкена и ее
модификации 11а рис. 10.2 показапы тезна-
пветствиц
оторых полярных мо-иеку.т 7—i может уменьшаться с температурой.
Аиалит Масона в Мишина пыл модифицирован Ьрошу f 12] для полярны1*
>в. по прелтоженныи расчетный метод треиусг знания момента инерппи мо-
Ул К тому же гру ,иа -VpD.'p рассматривалась как зависящая иттсмпсрагсры,
тя каждого вида полярньгл молекул нсооходима осэоая коистапта
иеиием. пригодным для определения теплопроводности неполярных многоатом-
некого значения Обычно Zr^. - 1-*-]0 и. по-вцдимому.
Zr.| с другим, оолсс быстро находимым свойством Молекулы не были удачны.
Анализ Ьромди. Ьром.ш [ 14] нанял < сравнения (!().<•> 11. ио преибразопал /|Г и
разложил „ следующим ооразом'
оответствеИим (где 7? — Универсальная газовая постоянная, Гг — число степе-
ней свободы для внешкСк» вращения, а составляющая теплоемкое,,), обуслов.тсн-
,С1Я колебательным движением, с\.ц, — Cv - 5;2/? для линейных молекул и
й <:ь Cv 3R (?ir для (1сл,шсйнйх молекул). Составляющая теплоемкости,
ойуслоплснкая гшутреиштм крашением, С\г была рассчитана Ио величине иоген-
1'М>-11,цпги барьера для внутреннего вращения п приведенного момент,? 1<иорнип
413
Коэффициент а. — Поправка на усиление взаимоде/гсзвия при каждом со-
ударении, обусловленное rro.nsrptib[M характером сталкивающихся молекул За
метив, иго эо; можно было бы лучше выразить в виде функции безразмерной
। руши.т вклюцакицей диполши-п) момент, Бромли тем це менее нагнел удобным
связагн эмпирически а с разпостт.ю между действительной энгропцсй иэрлобразс-
ваипи на едкпиих объема п энтропией парообразования, выраженном •.равнение'',,
Кпстякопского ') Коэффициент пропорциональности эмпирически бы.) найден
равным 3,0-
c'-^3,0lH,(AS€,f/- 8,7о - R In 7S) (10.3 10)
'де р; — n.noiiiocTi. жидкости при нормальной кмиературе кипения, моль.Фм1,
АЗал - тсйетпптс-1Ы1ая эо-гронья парообразования при нормальной температуре
кипения, ьал''(моит> К). R — 1,987 кал.'(моль> К) — универсальная газовая по-
стоянная; Т/, - - нормальная температура кипения, К. Коэффициент а имеет
сдипидм" измерения ка.тЧмоль-К) Типичные значения о/ вода - 0,90, аммиак —
С,5|. метиловый Спирг--0,33 «-пропиловый спирт — 0,21, эастоп — 0,06;
бензол — 0 Значения о* могут быть определены по уравнениям, приведенным
в io 3 а Д5а/, = Л/7аь/7ф — ио уэавнениям, данным в гл 6
R Сомчае -'шиедных молекул предполагается, что энергия колебания пере-
дастся пр диффузионному механизму, а величина Р должна при этом представлять
собой при'-ырно, то же что и группа самодиффузцй Мо£>/т|, значение которой
как отмечалось выше, б.тако к 1,30; для нелинейных молекул значение f> может
бы(ь меньше 1.30. Бромли попыгатся связать f> с группой
1дс I |Г — число Степеней свободь для внутреннего вращения, ап - число
атомов в молекуле Грабтик Бромли для этого тоотношеипя показывает, что
значение |3 постоянно И приблизительно равно 1,30 для У < 0,6, а затем быстро
уменьшлссся до 1,0 при V > 0.85. Эта. корреляция не ив.тяется, однако, удовле
творительной и, по-видимому, следует принять что f> — постоя тная величин,т,
равная пр-|бли,<1пельнг> 1,30
Эмпирически установлено, нм> коэффициент восстает с тем пера т у рой;
для линейных молекул
для нелинейных молекул
‘I акрхт образом, корреляция Бромлц может быть представлена в следующем
тазов
У) для линейных модекул
= 1,3()Сг
3) для нелинейных молекул
Сто) — 3/s R"
(Ю 3 12)
8,75-г R In Tt> [уравнение (6.]7.])|.
1Ж / цплощюво.тност,. при низком давлен!:!; кал (см <. К). г) — вязкости. П.
Wi.TuiaH теплоемкость при постоянном давлении калцмоль-Ю. .11 —
молекулярная масса 7‘г - / --приведенная температура. « коэффициент,
(гредмяе'иый ио ураипению (10 3.10), С|Г -- составляющая теплоемкости, обую
довоенная вну трснипм вращением (находится по ;абт. 10.1). кал'(мол,,• К).
Уравнение (10 3 1 I) и, особенно, уравнение (10 3 12) обнаруживают порази-
тельное сходство с выражением ([0.3.8) и могут рассматриваться как лающие
эмпирический чьтоД определения последнего 'Щека уравнения (10 3 8), который
содержит число столкновений ZIC| т. С.
0.886Сг
для не [ииепных щщекхд
Сравнение полуэ\()1ири'1сской формы (10.3 12) также может служить для
определения теплопроводности нелинейных полярных молекул.
Эмпирические аппроксимации метода Эйкеца. Различные агичры пытались
выразить ХЛГт) простым Способом, задаваясь при Этом целью получить более
высокие значения этого отношения, чем ио корреляции Эйкена [уравнение
(10.3.3) ]. ио п более ппзк ге, чем ло модифицированной корреляции Эйкена [урав
не/иге (10.3,5)! Чтобы всказась характер иолучоццых эмнпрпчсских результатов
некоторые пз них представлены ниже:
К1!।,eiическая теория, оти<>?,оиные газы
Корреляция Эйкена
Модифицированная ыфреляния Эйкена
Стил и Тодос [178]
Другие зависимое!!! аналотчного характера приведены Лили [93], БрокаУ
[0] опубликовал номограмму модифицированной корреляции Эйкена, а Свехла
рассчитал теплоемкости 200 газов при гемператУфзх от 100 до 5000 К. На рис. 10 3
некоторые из этих зав1кикис1ей сравни*
Рис to 3 построен для Диапазона температур 40—[40 °C Эмпирическая зависи-
мости Стила и Тодоса даст промежуточные результаты То же относятся и к ме-
тоду Бромли Хотя Этого нельзя установить по рис. 10 3, безразмерная группа
7.Л1т}Сг, почти не зависит от температуры, изменяясь от 1,40 при 40 °C до ) ,49
при 150'С. такая нечувствительность ЛЛ4/г)С0 к темперам-ре является, в узких
тсмиературньл диапазонах, типичной для большинства веществ--полярных
и неполярных (196) Однако Iрилли (55] указал ка наличие исключений (осо-
бенно водород) и исследовал влияние температуры на 7. И/T]C?tr в более широком
диапазоне температур (см также рис. 10 2).
Расчетный метод Мисика и Тодоса. Все методы, описанные выше, базиропа-
:ись на кинетической теории, а отношение аМ;т]Сь было коррелирующей группой.
vVici'k н Тодос [113, Н4], при ином подходе, предложили эмпирический расчет-
ный метод а, который основывается на методе анализа размерностей. Если пред-
положить
f (M‘T‘r^v,drm (ю.3.13)
го нетрудно доказать с помощью метода анализа размерностей, что
(10-3.11)
где Г определяется иак
7’’6_И’/2
(10.3.15)
Метод Мисика и Тодоса сводится к нахождению наидучшей функциональной
зависимости между X Г и Тг, С/} и Zc. Получено несколько уравнений для различ-
ных типов соединении и для разных диапазонов приведенной температуры.
Ниже представлены уравнения только для углеводородов, поскольку другие
установленные /Мисиком и Тодосом соотношения применимы только в случае
простых молекул и не точны, в основном, для большинства органических сосди-
Для метана, цаф|енов и ароматических углеводородов при Тг < [
U4.45 |0'677-гг-
(10.3.[6)
Для всех других углеводородов и других областей приведенной температуры
X ^(10~G) (|4,527> - 5,14)2'3
(10.3 17)
В уравнениях (10.3.13)—(10.3.17) приняты следующие обозначения: ?-—
теплопроводность газа при низком давлении, кал/(см-с-К), Тс —критическая
)емпсратура. К; Рс — критическое давление, атм; М - молекулярная масса;
(.'„ — мольная теплоемкость при постоянном давлении, кал/(моль-К).
Расчетный метод Роч— Тодоса. В развитие расчетного методе МисцКа —
Юд(>са, рассмотренного выше, Рой и Тодос [150. |51) разделили величину ХГ
ггя две части. Первая из них, относящаяся только к энергии поступательного
движения, была получена по кривой, соответствующей дачным для разреженных
। азор [140]; эта часть изменяется только с Тг. Вторая часть, учитывающая
нзапмныи обмен энергией вращения, колебания и т д., была связана с приведен-
ной температурой и особой константой, определяемой по групповым составля-
ющим Основное уравнение может быть записано в в„де
14 Ряд Р. я др.
XI1 - (АГ,г-[ (ХГ)1пЬ
(10.3 18)
417
ТАБЛИЦА JO.2. Рекомендуемые уравнения для f(Tr) в методе Роя—Тодоса
Вещества
Насыщенные углеводороды J
Олефины
Ацетиленовые углеводороды
Нафтены и ароматические уг-
леводороды
Спирты
Альдегиды, кетоны, простые и
сложные эфиры
Амины и нитрилы
Галогениды
Циклические соединения 2)
_D.I52T, (-J.I9I7; —0,0397®
—0,2357,. -- 1,0657^ (-0,1907®
—0,0687. 1 1,2517;_0,1837®
_O,3G4Tr-i_ 1,501 7 J — 0, [477®
1,00072
—0,0827,. + 1,04572 j- 0,0377®
0,6337^ + 0,3677®
—0,[077г 4- [,3307^—0,2237®
-0,3547,+ 1,50[7; _ 0,1477®
пиперидин
где X — теплопроводность газа при низком давлении, кал'(см с-К); Г —
—Тс— критическая температура, К, М — молекулярная масса;
Рс — критическое давление, атм;
(ХГ)1г = 99,6-|О'6 (е0,0464Гг - е-°'т7г) (ЮЗ 19)
('•Hint = 5/ (Гт)
Соотношения для / (Тг) представлены в табл. 10.2. Константа b — особая
для каждого вещества и определяется по методике групповых составляющих,
рассматриваемой ниже.
Определение постоянной Ь. В дальнейшем наложении метода Роя—Тодоса
будут использоваться следующие типа атомов Углерода:
Н Н Н
НС С С- - С - н н Тип 1 2 3 4
Парафиновые углеводороды | ЛЬ- 10*
Основная группа — метан 0,83
Первое метильное замещение 2,27
Второе метильное замещение 3,62
Третье метильное замещение 4,18
Четвертое и последующие метильные 5,185
замещения
Например, значение Ъ для н-октана равно [0,83 4- 2,27 Ц- 3,62 4- 4,18 I 4- 4 (5,185)] (10-«) 3|,64.10 Изопарафины Сначала определяется значение b для парафина с наиболее длинной прямой цепью углеродных атомов, а затем осуществляются последова- тельные замещения атомов водорода метильными группами Значения ДЬ для таких замещений приведены ниже:
Тип эячегцеи| ЛЬ-10в Тип замещения Ы>- (О'
i 2 -> ] 4,14 1 «- 2 2 5,36 1 «- 2 3 6,58 1 «-3-1 5,12
2<- 2 ->2 6,58 t «- 3 -<• 1 3,86 Ф [ 3 - 1 1 6,38
Тип атома углерода, от которого отходят стрелки, включается в метильное
замещение. Стрелками указаны типы смежных атомов углерода. Чтобы рассчи-
тать значение b для изопарафина, начиная с наиболее длинной прямой цепи
атомов углерода, вводят боковые цепочки с левого конца основной цепи и далее
по часовой стрелке Покажем это на примере 2,2,4-триметилпентана:
н Пентан = (0,83 4-2,27 + 3,62 4-4, |8 4-5, (85) (10's) = (6,085-10^
Метцльные замещения:
& = У Д6-31,925-10-4
Олефины и ацетиленовые углеводороды, Сначала определяется значение b
для соответствующего насыщенного углеводорода, как описаны выше, а затем
вводятся ненасыщенные связи (связь) и применяются следующие составля-
ющие Д&:
Д!>- 10»
Первая двойная связь: 1 1 1 «• 2 2 «-• 2 Вторая двойная связь: — 1,35 —0,77 -0,33
2 « | Любая тройная связь -0,19 -0,94
14*
4(9
неуглсводородов
аначен1|ц
важно заметить, что простые правила,
приведенные выше, неполны и не
охватыпают многие типы углеводо-
родов. Однако нет эксперименталь-
ных данных, которые мог^и бы быть
использованы для получения дополнительных составляющих Aft. В' дей-
ствительности некоторые значения Д&, указанные выше, основаны на таком
незначительном числе данных, что их следовало бы рассматривать как прибли-
зительные. Для 27 углеводородов, исследованных Роем и Тодосом, можно полу-
чить грубую. но часто удовлетворяющую требованиям корреляцию, построив
график зависимости Ъ от молекулярной массы (рис. 10 4). Две точки для аромати-
ческих углеводородов (бензол и толуол) располагаются несколько ниже кривой,
а значение & для пиклопентаиа вообще отклоняется от общей зависимости (Рой
и Родос отметили, что экспериментальные данные для циклопентана вызывают
сомнение.)
Для неуглеводородов значения Ъ сначала определяются по методу группо-
вых составляющих, в котором мысленно синтезируется конечное соединение с по-
мощью системы особых правил и при Этом используются значения Ай для каждой
стадии.
Спирты. «Синтезируется» соответствующий углеводород с такой же угле-
родной структурой и для него рассчитывается значение b одним из рассмотренных
прежде способом. Далее соответствующий атом водорода заменяется гидроксилы
ной группой и значение b корректируется следующим образом:
На метане
4 31
5,25
4 67
4,04
Система обозначений та же, что и раньше. Паирямср, 3«-| показывает, чю
группа —ОН заменяет атом нодорода u 1 типе атомт углерода, который яв-
ляется смежным атому углерода типа 3.
С-С -С - С -♦ С - С — С -он
Эти правила применимы только к алифатическим спиртам, но неполны даже
дли них.
Л.ипны. Определение 6 для аминов аналогично только что описанному
лля спиртов. Сначала «синтезируется» углеводородная часть (с более сложной
структурой), которая в конце концов присоединяется к атому ачота. В случае
первичных аминов соответствующий конечный атом водорода заменяется на
группу — \Н2, при этом учитываются следующие составляющие ДА:
Дополнительные значения Aft для вторичных аминов:
4ft- (О1
Н
СН,—NHa —> СН,- -N-CH, 3,76
Н
—СНа—NHa —> -СН ,-N-CH, 5,00
Наконец, для третичных аминов Рой и Тодос привели три типа коррек-
тпровки значений 6, используемых в случае вторичных аминов:
дь-101
CHS—NH—СН3 —> (СН,),-N
Н СН,
I I
—СНа—N—СН2-----> -CHa-N-CH2—
Н
-CHa-N-Cll,---► -CH2-N-(CH,12
2,95
3,72
3,31
[[осле вычисления значения b для амина указанным выше способом любое
метильное замещение для атома водорода на боковой цепочке увеличивает b
ira 5 135- Ю"1 (т е на ,у же величину, которая указана Для четвертой) ц после-
дующих метильных замещении в случае парафиновых углеводородов) Напри-
-N - СП,- N - СНа - СП,; Ай 5,185 К)'»
421
Нитрилы. Используются только три составляющие Д6 (они основаны на
данных о теплопроводно.тя ацетонитрила, проппонитрила и акрилонитрила':
На метане
СНЭ-СПЭ —> CHS—СНа—CN
6,17
8,10
—СН=СН2 ► _СН=СН—CN
Галогениды. Предложенные составляющие приведены ниже. Порядок заме-
цения должен быть следующим: сначала F, затем С1, далее Вг и, наконец, I.
Лервое галогенное замещение на метане. фтор хлор бром иод Второе и доследующие замещения на метане бром Замещения на этане и последующих членах гомологического >яда углеводородов: 0,29 1,57 1,77 3.07 • 0,43 2,33 3,20
хлор 0,66 3,33
Альдегиды и кетоны. «Синтезируется» углеводородный аналог с тем же чис-
юм углеродных атомов и для него способом, описанным выше, рассчитывается
качение Ь. Затем формируется нужный альдегид или кетон замещением двух
томов водорода па атом кислорода:
—СНа-СНа —> — СН,—СНО
—CHj-CHj-CH,-----► -СНа-СО-С1-1а-
2,20
3,18
Простые эфиры. «Синтезируется» первичный спирт с наиболее длинной це.
ючкой атомов углерода с одной стороны атома кислорода. Этот спирт преобра-
овывается в метиловый эфир:
— СН2ОН— СН2 — О —СН3; Д& = 2,80 Ю'*
Если необходимо, метильная часть расширяется до этила:
- СН2 - О — СН3 > СН3 О СНа СН3; Д* - 4,75 10’5
Хотя Рой и Тодос не предлагали наращивать этильную группу, более слож-
но цепочки можно было бы. по видимому «синтезировать», используя значе-
ня Д6, по.[ученные на основании парафиновых и изопарафиновых составля-
ла
Кислоты и сложные эфиры. «Синтезируется» простой эфир так, чтобы можно
было учесть следующие замещения:
—СН2-О-СН,—
0,35
Циклические соединения. «Синтезируется» кольцо, если возможно, со следу-
ющими составляющими (не замещениями!
Группа ft/>. ] 0»
—сн2— 4,83
—СН= 3.98
—NH- 5,48
\j= 3.98
, 0 4,10
S= 7.97
н значение b определяется как
6г- —8,90 Ю"4
Эти групповые составляющие были получены, исходи из ограниченного
числа данных, и являются усредненными значениями Для многих веществ
Пример 10.1, Рассчитать теплоемкости газообразного нзоиентина при 1 атм и
100СС. Известное значение равно 52' 10‘« кал/(см-с-К) [4]
Решение. Из приложения А имеем: Тс — 460,4 К; Д — 33,4 атм:
Ус = 306 см’/моль, Ть = 301 к Z: = 0,271: 44 - 72,151 .
Сначала нужно определить вязкость изопентана. Используем для этого
корреляцию Райхснберга [уравнение (9 4.21)]. По табл. 9.3 ^п(Сг — (3j X
X (9,04) + 6,47 + 2.67 -= 36,26. Далее
£«<с,
При Тг - (100 + 273)1460,4 = 0,810
_________а*Тг___________
[1 J- 0.3677 (Г, — I)]1'6
(107,85)(0,810)____________
[1 -ь (0,36) (0,810) (0,810 — I)]1'6
мкИ
(Если использовать уравнение Тодоса (9.4.17), то расчетное значение ц будет
равно 88.7 мкП).
Теплоемкость при постоянном дэвлепил может быть найдена по коисташам,
приведенным в приложении А
Г = СРХ'ЛРЛ -i (СО\ ЛРВ) (Г) + (CPI АРС) (Т2) •- (СРУЛРГД (Г1) --
2,275 -l (0.1210)(373) — (6,519-10"')(373)2 4- (1.367 КГ») (373=) -
= 34,5 нал/(моль К)
Значение С° определенное как С — А = 34 5 -- 1,99 — 32,5 кал (моль- К).
Метод Эйкена. По уравнению (10 3.3]
Х = 1Г^ + 4>47)--^,Тр (32-5 I 4-47> '45-2 10’5 с к’
Погрешность ~ -----13.1 %
Модифицированный метод Эйкена, Поскольку изопентан имеет неполярные
молекулы, можно использовать уравнение (10.3.12). Значение а определяется
по уравнению (10.3.101. По методу Тина н Калуга [уравнение (3.1-1.1)]
Рь - = [(0,285) (P‘ °4S)]-1 = 8i7l 10-3 мол,. см3
5900
—— = “эд। = (9,6 кал (моль К)
(АЯС& по приложению А). Следовательно
а = 3.0рь - 8.75 - R (и ТЬ) = (3,0) (8,71 • 10 s) х
X (19,6- 8.75— 1,9871ц 301) = - 0,013
Допчскаем, что а = 0. Это приемлемо, потому что изопентан — неполярное
вещество.
Далее для определения С|г используем табл. 10.1. Хотя и нет точной ана-
логии но примем, что имеются три связи CHS—СН2— и одна связь — СН2—СН2—,
При 3~3 К они дают приближенное значение С-1Г, равное (3) (2,15) — (2.86) —
= 9,31 кал'(моль-К). Тогда по уравнению (10.3.12)
1 (, ,зос. + з.бб - 0,ЗС„ - - 3«) -= X
X [(1.30) (32,5) + 3,66 - (0.3) (9,31) -- (3) (0)] -
= 51.6 10‘“кал, (см с К)
Погрешность — —— ~ 100 — — 0,8%
Метод Мисака— Тодоса. По Уравнению (10.3.15)
г ^М1-'2 (460,4)1'6 (72.15)!'2
--------''
Тогда по уравнению (10 3 17)
> = по-.. (И.^Т,-5,14)/'»С, 1(14,59) (0,813) -5,ItfX (31.5) _
‘ 1 ' Г ’ 2,276
= 53,4 Ю“° кал/(см с-К)
Погрешность — ~
424
A'lemot) Ри- и Тодоса. Используется уравнение (10.3.18). В первую очередь
находим (ХГ)|Г по уравнению (10.3 19) При Г, = 0,810:
₽.Г!„ -w.s «)-•(<'" и',г--.-“/',',г' = да.« «Г610-
Чюбы найти /Xl'linf сначала определяем Ь, «синтезируя* н-бутан и исполь-
зуя рекомендованные значения Д6.
Н Бутан = (0 83 -р2.27 (- 3,62 4-4.18) Ю’»» Ю,9 10’=
ч-Бутан -- (0,83 + 2.27 + 3,62 + 4,18) 10'5= 10,9-10-
Далее я-бутапу придаем вид изопентана (2-метилбутана), для чего необ-
ходимо чамещение типа 1 -.-2—»2. Таким образом
Изопентан -= 10 9 10"5-i-5,36 10'5 = 16.2ь 10"»
Соответствующее уравнение для / (Г,) дано в табл. 10 2 (насыщенные угле-
водороды):
f (Г,) - 0.152Т, + 1,19!7^ - 0,0397^ = — (0,152) (0.810) 4
I- (1,191) (0.810)2 - (0,039) (0,810)’ = 0,638
Следователе о
(ЛГ),,., bf(Tr} = (16 26 10-’) (0,638) = 103,7 1СГ*
По уравнению (10.3.18), используя значение Г, найденное выше при расче-
тах по методу Мисика—Тодоса, имеем
лГ = (Х-Г)[Г 4 (ХГ) |Пt
> _ д^цт7>1,1о-.> = 10_, ям/(а с К|
„ 55,0 — 52 .п_ . 0|,
Погрешность = ——ж 100 = 5,8%
Пример 10.2. Цснольлуя расчетные методы Эйкена, Бромли и Роя—То-
доса определить теплопроводность газообразного ацетона при 1 атМ и темпе-
ТАБЛИЦА 10.3 Экспериментальные и расчетные значения теплопроводности
л |в 10*1- кал/(см-с К)] газообразного ацетона при низком давлении
/.«< 1 Зничнцкя ?, рЯС+ЧЦТЛГГГГ4 ,ге по методу
| Эйкина । Бромли ! Роя — Тодоса
0 22,8 23,3 24,9 24,3
27 27,2 27.1 29 6 28,8
67 34,8 33.4 37,2 36,0
107 42,8 40 2 45 5 44 0
147 51,4 47.4 54,4 52,5
187 00,0 54,9 63.8 62 3
Реще и и е. Метод Эйкена. Из уравнения (10.3.3)
’• (С,+ 4,47)
В табл. 10 3 даны расчетные значения X при ’1 и Cv, определенными по
рис. 10.5 и 10 0, М — 58,08
Метод Бромли. Значение С|Г находится "по табл. 10 1 как 2 , CHS— С—0
1 м
Исходя из табл. 3.12, (•(, =- V-' _ (77,5)-1 _ 0,0129 моль'с№, a AS,, = ;Т'ь=
— 6960/329,4 _ 21,1 кал (моль - К) при Ть — 329,4 К и — 6960 кал\юль.
По 'равнению (10 3 10)
а _ (З.Оро) (ASOi- 8,75—7? М Ть) — (3,0) (0,0129) [2Ы -8 75-
- (1.987) 1п 329,3] =0,032
Тогда из уравнения (10.3 12)
Расчетные значения ?. даны в табл 10.3.
Метод Роя—Тодоса Значение Г определяется по уравнению (10.3.15) при
7^ = 508,1 К; Рс = 40,4 атм, ,4-58.08
г _ Т^М1 2 (508,2)|'ь (58,08)1;: ( 6б7
(46,4)2 8
В уравнении (10.3.19) Т,— Т‘ТС - 7/508,2. п можно вычислить
значения (M’)ir при различных температурах. Чтобы определить (AF)int, на
холим по табл. 10 2 / (7,) = —0.0827,.1,0457® + 0.037Т®. Значения h
рассчитываются методом i р\пповых составляющих-
Стад,,» Д»> |0‘
Метан 0.83
Замещение Н метильной группой СН3 с образованием 2,27
этана
Замещение Н метильной группой СН3 с образованием 3 62
iponaua
Замещение двух атомов водорода атомом кислорода =0 3.18
образованием ацетона
b - 9,90- 10’5
ные значении теплопроводности ацетона:
i — метод Эйкена; 2 — метод Прочли.
j — метод Роя — Тодоса, точками отме-
чены экспериментальные данные
Так, iM образом
(лГ)1п, =9,90 IO"1 х
(-0,0827, -1,0457^ + 0,037?))
Значения ?., рассчитанные из
уравнения (10.3.181, приведены
б табл. Ю 3.
Результаты, полученные по трем
использованным методам, предста-
влены на рис 10 7. В табл 10.3 они
сравниваются с имеющимися в лите-
ратуре экспериментальными данными.
Самый точный расчет обеспечивается
методом Роя — Тодоса.
Обсуждение и рекомендации. В табл. 10.4 сравнивается точность пяти методой
расчета теплопроводности газов. Корреляция Айкена дает удивительно хорошие
результат!,I и обычно более точна, чем модифицированный .метод Эйкена. Однако
497
; ТАБЛИЦА 10.4. Сравнение расчетных и экспериментальных значений теплопроводности чистых газов при давлении
5 около 1 атм
Вещество Т, К Экепсри- । меита.тыюс . значение л Литература калДсм. с. • К) 1 Погрешность расчета *) по методу
Эйкена (уравнение (10 3 3>J МОДИфиЦИ Эйкен а [уравнение (10 -3.5)1 Бромли ура Huett «я [(10.3.11) и <10 3 12)1 Мнсхка п Су рарн eitii't (10.3.1Ь'< и (10.3 17)1 Сурааценве (10 3 18)1
Ацетальдегид
Ацетонитрил
Ацетилен
Аммиак
273 22,8 [14] 2,0 22
300 27,2 1196] —0,2 20
340 34,8 — 4,0 )Т
330 42,8 —6,0 15
420 51,4 —8.0 13
460 60.0 —8,5 12
ЗВ 30,1 [196] 9,6 28
333 34,0 6,7 25
353 37,9 4,7 23
373 42.0 2,9 22
393 46,3 1,3 20
353 29,7 [196] 13 32
373 32,7 I j 31
393 35,8 9,7 29
198 28,1 [14] 4,1 15
273 44,6 3,0 10
323 57,8 — 1,0 13
373 71,1 -3,8 11
213 39.3 [14] 15 26
273 52,9 9,2 • 20
373 76,4 15 29
8,9 6.9 5,9
6,9 3.4
6,4 2,1
5 9 9 4
6В :.. з,9
1С> 7 5
14 5Д
13 3,9
12 2,7
1 1 , 1,6
19 2,7
19 2,7
18 2,9
1.8 -9,2 10
7,5 3,0 5,7
5,8 3,1 2,7
3,9 3,0 1,9
- 3,2
7Д
6 С ч ;«>, t 353 :и,8 [196] — 1 • .. . < ов 9,2
393 39,4 ” — 1 о 5 4 <) 0 0,1
44,| 16 9 3
433 54,0 — 18 2^7 — 1,0 0
'1 5т гаи 273 32,2 58,7 [39] -9,3 । 13
373 — 15 0,0 —3 3 з т
Двуокись углерода 200 ОО 7 [14] 5,4
300 39,8 —2,9 7 9 1 8
473 67,7 2,1 6 8
598 90,4 —4,8 9.4 4 8
1273 195 —13 2.4 —0,1
Тетрахлорметан (че- 273 14,2 [14] 9.3 9 8
тыреххлористый уг- 373 20,5 5,5 15 3 н’2
лерод) 457 26,0 —5,2 16.0 17^
Циклогексан 353 38,9 [196] — 14 7,6 3,1 —0,6 0 5
393 49,2 —8,3 — 18 4,9 0.9
433 61,1 2,6 - 0,6 - -0,8 — 1.0
Дпхлордифторметан 1 273 19,8 33,0 [14] —13 ту 2 9 0,7
373 — 18 — 1 7 6,2
473 46,3 —21 —3,8 3,8
Этилацетат 319 28,8 [ 14] —5,2 17 С Л 2'5
373 38,6 —6,6 17 8,8
457 56,8 —11 12
Этиловый спирт 293 35,8 53,0 14] —7,6 9,7 —2,9
375 —6,7 13 । ।
401 59.4 —7,2 12 —0,5 —1.5
Этилен 273 41,5 [14] —0,5 12 4 0 2,1 0 3
323 54,1 — 1.9 12 5,5 4,1 0,2
66,5 — 1,4 14 8.5 3,0
П родолжение
Погрешко ть расчета ) по методу
Вещество Г. К Эксперн- менталеное значение X, кал,'(см-с> К) Литература Эйкена [уравнен не (10.3.3)1 модифнци рованному Эйкена [уравнение (10.3 5)1 Бромли уравнения 1(10.3.11) и (10 3.12)] Мнсика и Т одсса [уравнения (10.3 16) и (10.3.17)] Роя н Тодоса [уравнение (10 3 18)1
Диэтиловый эфир
н Гексан
Изопропиловый спирт
Вода
Двуокись серы
273 31,0 114] -13 8,3 —2,3
373 53,0 —20 —0,6 —8.7
486 83.9 U96] —23 —1.6 — 8,7
273 26,0 114] — 5.4 19 3 3
373 48.0 [196] — 17 5,0 —бЛ
433 64,9 — 20 2,2 - 6.4
304 36,3 [14] — 19 —1,8 — 15
400 59.7 — 16 4.0 — 4,0
373 56,3 [196] 28 40 — 8,3
413 G5.9 23 35 —9,3
273 19,8 [141 8,6 21 13
— 10
— 1.9
—1,0
1) Пи. решиость — [(р.кч. — ьксп )/акч| ] 100%.
ТАБЛИЦА 10.5. Зиа- |ения X и У для рис, 10,8
Гач 1 vzs- |х|, 1 диаиа-юн К 1 | 1.13 I А I у
Азот 50 250 12,5 14 0 Кислород 300- 1500 1 л к 14.8
250—1500 15,8 15,3 Криптон 100 -700 13 7 21,8
1500 3000 12,5 16 5 Ксенон 150—700 13,3 25.0
Аммиак 200—900 8,5 12,6 Метан 100—300 11,2 1 1 7
Аргон 50—250 12,5 300—1000 8.5 11,0
250—5000 15,4 ISJ МС'НЛОВЫЙ спирт 300—500 5,0 14 Ч
Ацетилен 200 600 7,5 13,5 Пеон 50—250 15,2 10,2
Ацетон 250 500 14 8 250—5000 17,2 1 1,0
Бензол 250—600 2.8 14 2 Окись азота 100—1000 13,2 14,8
Бром 250—350 10,1 23,6 Окись углерода 80—300 12,3 14,2
ч Бутан 250 500 к 14 1 300—1200 1 5 9 15,2
Воздух 50 250 12,4 13 9 Пентан 250—500 5,0 14,1
250—1000 14,7 150 Пропан 200—300 2.7 12,0
1000 1500 17.1 14 5 300—500 it .4 13.7
Водорид 50—250 13,2 Тстрахлорметан (четырех- 250—500 9.4 21,0
250—1000 15.7 1 4 хлористый углерод)
1000 2000 13,7 2 7 Толуол 250 600 6,4 11 6
Гексан 250 1000 14 0 Трсхфтористый бор 250—400 12,4 16,4
Гелий 50—500 17.0 2,5 Фтор 80—600 12,3 13,8
500—5000 15,0 3,0 600—800 18.7 13,8
Гептан 250—600 4,0 14 8 Фреон-11 250—500 7 5 19,0
600—100 6,9 14 9 Фреон-12 250—500 6,8 17,5
Двуокись серы 250—900 9,2 18 5 Фреон-13 250—500 7,5 16,5
Двуокись углерода 200 -700 8.7 15,5 Фреон-21 250—450 6.2 17 5
700—1200 13,3 15 4 Фреон-22 250—500 6,5 16.6
Дейтерий 50—100 12.7 17 3 Фреон-113 250-400 4 7 17,0
100-400 14,5 19 3 Хлор 200-700 10,8 20,1
Диэтнловый эфир 250—500 5,3 14 1 Хлористый водород 200-700 12,2 18,5
Закись азота 200—500 8,4 15 0 Хлорметан 250—700 4 7 15,7
500—1000 11,5 15 5 Этан 200—1000 5 4 12,6
Изобутан 250 500 5,7 14 0 Этилен 200—450 3,9 12,3
Кислород 50—300 12,2 138 Этиловый спирт 250—350 2,0 13,0
,350—500 7.7 15.2
наиболее точной корреляцией является уравнение Роя—Тодоса (10 3 18). Для
определения значении параметра b нужно располагать i рхтпюиыми юставля-
юшими. хотя для углеводородов рис. 10 4 дает приемлемую корреляцию )> как
функции молекулярной ма;сы. Когда эта корреляция неприменима, следует ш-
оии меп-.ше 10% Зз иеоольшим исключением методы Роя —1о
приводят к значениям теплопроводности превышающим наид<
ментально, а уравнение Эйкена (10.3 3) дает в основном занижении
Не следхп слишком верить точности значении погрешности, .ак как
личные мнения о правильности акспернмензальяых значении тепт
‘иные еКеПОрц
найдены данные по теплопровода
ряда мнь>гоато\1Ш,гх газов |1й4]
10.4. ВЛИЯНИЕ ТЕМПЕРАТУРЫ НА ТЕПЛОПРОВОДНОСТЬ ГАЗОВ
ПРИ НИЗКИХ ДАВЛЕНИЯХ
1 ьнлонроволиос-п, юзов чрп низких давлениях увеличивается с теуперату-
рои. В узких темпер<|"урпых диапазонах хавпепхюсть л от Т почти линейна
X К) i-а.т (см с- К-). (. веше-тпа с большими значениями X обычно имеют более
высокие зиачеш-я Р/. РТ
При щади \ температурных днапазонах уравнения, предсывлснные
в 1абл. 10'2 ц сочетании с ураьнсшп-м (гО.3.191 показывают, что значения 1.
возрастаю! зни'тцюлr.fiii быстрее <. температурой, чем получаемые по линейной
Ч!'Ч|Сг)И<>сги (См также рис. ]0.7.) Если имеются данные о теплопроводности
в единственно,й п>чкс при определенной температуре oim могут быть использо-
ваны для обрыною пересчета значения копит,ашы Ь, примснясмои в методе
Роя—Тодоса, п далее /, можно вычислять для широкого температурною диапа-
зоне по зависпмочц 1- ст Тг, приведенной ь эк>х1 методе Другие авторы предпо-
Оу ->ri< и Гсдос 1128] рекомендуют значение ч— 1 "8'5 (кроме циклических
соедпнеиии). а Миссенар 1120] указывает что ’’ зависиз о: температуры. Зави-
симость (Ю.4 ]) при п 1.786 представлена норпхэвыми лилиями в верхней
части рис 'б.'.). Ihieeicn несколько таких jhihhu, поскотьку прошв<>днаи <И. dT
зависит <>> координат выбранной (очки (1.т , Г,).
10.5. ВЛИЯНИЕ ДАВЛЕНИЯ НА ТЕПЛОПРОВОДНОСТЬ ГАЗОВ
Iецлоироводность всех la.iou возрастает с давлением, при шикил ft
умеренных давлениях зто влияние относительно ненелпко Ниже рассматри-
ваюгся три области, в которых влияние давления существенно ра!Лнчнэ.
мои областью Кнудсена, средняя длина свободного пробега могек^-т сопоста-
вима с размерами измерительной ячейки и влияние давления отзывается незна-
чительным. т. е. при давлениях ниже 0,1 му рт. ст. значение А почти пропор-
ционально Р В работах по теплопроводности чаек’ используется понятно 'Щуле-
вое давление», оно относится к значениям, экстраполированным поданным, кото-
}.) г , t 1,786
t Qg рые от1|ося[ся к более высоким
давлениям (свыше нескольких
04 миллиметров ртутного столба).
02 а не к измеренным значениям
в области очень низких Да-
влений.
Низкие дарения К диапа-
зону [Низких давлений отно-
сятся значения Р примерно
от I мм рт. ст. до 10 атм.
Он включает в себя также
область давлений, рассматри-
ваемую в разделах 10.3 и 16.4.
В этом диапазоне теплопровод-
ность возрастает приблизитель-
но па 1 % при увеличении
давления на 1 атм. Таким повы-
шением Л часто пренебрегают
в литературе, и теплопровод-
ностью при низком давлении
называют либо значение X при
1 атм, либо значение X., экстра-
полированное на нулевое да-
вление.
Большинство имеющихся
данных о теплопроводности X
было получено для области
низких Давлений, но переменной величиной, изменяемой в эксспримснтах,
обычно служила температура, а не давление. Вайнес и Беннет [196] и Бай-
нес [194, 195 ] приводят данные о теплопроводности для паров различных органи-
ческих веществ при температурах от 30 до 100 :С в диапазоне давлений 10—
100 мм рт ст. и отмечают, что значения В (определяемые как выраженное в про-
центах возрастание значения л, отнесенного к «нулевому давлению», при повы-
шении давления па I атм) увеличиваются с давлением. Для полярных соедине-
ний В изменяется от 0,5 до 4.3: метиловь^ спирт отличается высокими значе-
ниями В ]0,9 и 4,3 при "9 н 1 Ю 'С, соответственно Для неполярных соединений
значение В меньше 2. Данные как для полярных, так и неполярных соединений
показали, что В уменьшается с повышением температуры. На основе исследова-
ний при давлениях ниже атмосферного, КаццудЮк н Дональд [76] установили,
что влияние давления на теплопроводность Лт. Не. воздуха, CQ2, N2O п СН4
ничтожно мало
Болес обширные данные ио изменению X с давлением в Этой области пред-
ставлены на рис. 10.10. Кривые показывают влияние давления на отношение
Х/а°, где ).с —эна'снис X при низком давлении и той же температуре. Только
для аммиака при Рт ~ 0,3 значение ?- на 8 % выще, чем при низком давлении;
влияние давления в случае этого полярного газа, очевидно, большее при низ-
ких приведенных reMiiepaiypax
Данные, представленные на рис 10.10 показывают, что значение В, выра-
женное в процентах на I атм, в каждом случае меньше 1,0. Более высокие зна-
чении В в немногих случаях, о которых сообщает Вайнес, объясняются близостью
у'СЛОВнн Насыщения.
Высокое давление. \1hoiiic корреляции >енл<)Проводности при высоком дав-
лении основываются на использовании принципа соответствующих состояний,
согласно которому либо Х/7.0, либо наносятся на график как функция при-
веденного давления при постоянной приведенной температуре.
Геплопроводнос| ь при Г и низком давлении обозначается черен — зна-
чение теплопроводности при Тс и Рс- Графики впервые были предложены
(ST
Камингсом и Мейландом [26], а графики Ю.с— Рамсоном [47]J). Такие графики
удобны для обобщения данных по отдельному веществу [27, 91, 92, 112, 177]
Однако, как показали Крамер и Камингс [84], даже для простого ряда этан,
пропан, «-бутан двух параметрон Т, и Р, недостаточно для корреляции отноше-
ния Х.-'/Л Они предлагают использовать Ср в качестве третьего коррелирующего
параметра, но этот метод, кажется, не получил дальнейшего развития
Теплопроводность значительно меняется при небольших изменениях давле-
ния или температуры вблизи критической точки; здесь обнаруживаются резкие
перепады значений К на изотермической кривой при изменении даплепия
плотности) [170]. На рис- 10 11 представлены данные Гилднера для СО2 .
при р( значение (d>.'iiT)p становится все больше по мере приближения к кри-
тической температуре. Это явление объяснить нелегко. Оно может быть обус-
ловлено упорядочением молекул, соответствующим переходной стадщ |Ь4],
или влиянием мелкомасштабной циркуляции, вызываемой миграцией небольших
скоплений молекул [89]. В любом случае при построении обобщенной .зависи-
мости X от давления эти иррегулярности обычно сглаживаются и нс выявляются.
Типичный график, показывающий влияние температуры и давления на
теплопроводность метала, представлен на рис. 10.12 [102]. При высоких давле-
ниях увеличение температуры приводит к уменьшению X, то1да как при давле-
ниях около 1 атм влияние температуры на теплопроводность противоположно.
Большинство корреляций, описывающих влияние давления ца теплопровод-
ность X, использует в высшей степени простую корреляционную методику, пред-
ложенную Варгафтиком [190, 191]. По ней избыточная теплопроводность
J) Иногда используется соотношение Х;Х‘, где Х° — значение X при Тс и низ-
ком давлении.
435
I 120 К [102 1 2 — 200 К I 102 1, 3 — 300 К [1021; 4 — 400 К Ц02 [, 5 — 200 К
[04]. Ь - 205 К |6| ]
X—Х° изображается ца графике в виде функции плотности (или приведенной
плотности), т. е.
Х-Г-/(р) (10.51)
&та методика подобна той, которая излагалась в разделе 9 6 для коррели-
рования вязкости по плотности газов. Она была применена к аммиаку (56, 144],
этапу [18], н-бутзну [17, 84], закиси азота [i431, этилену [128], метан) 119.
102, 127 ], двухатомным газам [115, 165 ], водороду 1164 ], инертным ; азам ] 126]
И двуокиси углерода [771 В такие корреляции температура и давление в явном
виде не входят, но их влияние отважено в параметрах 4* (lOni-Ko влияние
температуры) и цЛщносги р В качестве иллюстрации данные о теплопроводности
метана, представленные па рис 10.12, перенесены в координаты Д — V) _ р
(рис 10 13)1),
Сги-с и Тодое [178] обобщили уравнение (10.5.1) предположив, что / (р)
зависит только от Тс, Vc, М и р. Методом анализа размерностей они полу-
нидсг корреляцию между X_____?.с, Z,, Г н р,, где Г _величина, определяемая
уравнением (10.3.15) По данным для 20 неполярных веществ, вктючая инерт-
ные газы, двухатомные газы, СО, it углеводороды, <>ии вывели корреляцию, пред-
ставленную да рис. Ю 14 Приближенные аналитические выражения для этой
кривой имеют вид
(а — V) = (14.0 10-я|(а°'0!,р'-_1) прирл<0,5 (Ю.5.2)
(X - Х“) Г2’ = (|3, ] [0“®) (а0 6 Рл — 1,069> при 0,5 < lv < 2.0
(10.5.3)
(X —X°)rZ£5 = (2,976 10-Ч)(е''",1рг-(-2,01б) при 2,0<pf <2,8 (10 5.4)
') Розенбаум и Тодос [147] тоже измеряли теплопроводность плотного ме-
тана и сообщают, что наблюдаемое слабое влияние температуры будет, но-види-
мому, иным, чем то, которое отражено в рг. Значительные эффекты температуры
были обнаружены для тстрафтормстапа, и каждая изотерма изображалась на
графике отдельно.
Для полярных веществ, водорода и гелия рис. 10 14 использовать нс следует.
Вообще его -очность вызывае1 сомнение (разброс да иных показывает, что возможны
погрешности, равные ±10—20%) Однако это, по-видимому, лучшая из обоб-
щенных корреляций в настоящее время.
Рекомендации. Для епреледения в случае ж полярных газов следует
исполыовагь рцс 10.14 цлit уравнения (10 5 2)—(10.5 ->) 1<ритнческ1(е константы
могут бить найдены и приложении А или рассчитаны но методам. приведенным
в гл. 2 Предпочтительны значения плотности, найденные экспериментально, но,
когда они нси;да<тнь, их м<жно рассчитать с помощью методов, опнсаднщх
в г.ч. 3. Зависши: / ; при ггйзкцх давлениях можно определить так, как это пока-
зано в разделе '0 3, (очне-сть иомжрамкщ оц?1'итъ трудно Вб.янли критической
точки точность, вероятно, очень мала, а в других областях высокой плотности
Ute.iyt7, по-видимому ожидать погрешностей 10—20%.
Как отмечено выше, pci К) 14 не должен гы-осы,t,лопаться Для определения
тт |ОПроводц(>с1И полярных соединений, водорода и гелия при нисскщ диц.|е-
чощк»ьодн<хти n;U><kUX
10.6. ТЕПЛОПРОВОДНОСТЬ ГАЗОВЫХ СМЕСЕЙ ПРИ низких
ДАВЛЕНИЯХ
Teii;ioi![>cino.inocTb газовой смеси обычно нс является -чиненной функцией
состава Если молекулы компонентов сильно отличаются по полярности, тепло-
проводность смеси превышает значения, получаемые по правилу аддитивности
при выражении состава в мольных долях для неполярных молекул наблюдается
обратная тенденция, и она тем более явно выражена, чем больше разность молеку-
лярных масс пли размерен молекул компонентов [51. 113] Это яепо видно ио
рис К) 15. на котором представлены экспериментальные значения геплоцронод-
носги для четырех систем Система аргон—бензол является типичным примером
неполярной смеси С молекулами различных размеров, а смесь метиловый спирт—
«-тексац характеризуется значительной разницей полярностей компонентов,
Линейные системы бензол— н-гексаи и простой эфир—хлороформ представляют
собой промежуточный случай смесей, в которых определяющее значение имеют
размеры молекул, и смесей, свойства которых определяются полярностью ком- -
понентов
В последние юды опубликовано несколько обюров, обобщающих различные
методы расчета теплопроводности смесей [12, 38, 45, 48 88, 93, ЦО, 111».
121, 157, 163, 169. 185, 1881.
Кроме того, появилось большое число теоретических статей, анализирующий
проблемы, степени аппрокснм.гЦцп и ограничения методов Детально разработав*
теория расчета теплопроводности смесей инертных газов |7, 10, 34, 61, 104, Ю*
109, 122] Наиболее сложной проблемой, однако, является видоизменение кор-
реляции, предназначенной для смесей одноатомных |азов, применительно к мяо-
гоатомным молекулам Предложено много методов такой модификации цо все
опн в основам эмпирические, и большинство из них приводит к кпкоп-либо форме
уравнения Васильевой. * ‘
Уравнение Васильевой. В форме, апп.тогичпой теоретическому соотношению
Дли вязкости [уравнение (9 5.1)], теплоемкость газовой смеси л,п
00 6.1)
где — теплопроводность чистого компонента i; t/„ у, - мольные доли ком-
попсцтов I и /. Atj — параметр (см. ниже).
Это эмпирическое уравнение было предложено Васильевой в 1904 г. [200]
Модификация Мэспна и Саксены, N простив более точное выражение для >т
'‘"'‘умных газов » использовав предложение Гирщфе.тьдера об определении
оз,р(р|1|Ше11та JnKena для смеси многоатомных газов, Мэсоп и Саксена IЮ7 ]
l|i-iu, что -1<? в уравнении (10 6 1) может быть представлено как
(Ю G 2)
ЛГ—молекулярная масса 2-t, — значение теплопроводности для одиоятом-
'< газа к — коэффициент, значение которо|0 близко к единице
.Мэсон и Саксена сначала предложили значение к. равное 1.065. a Toh.ivii
3a\',-,Tit4. чти тоя одноатомных
При подстановке уравнения (10 6.3) в соотношение (10.6.2) п сравнении
с уравнением (9.5.2) видно, нго
где Ф,; — параметр взаимодействия для вязкости газовой смеси. Этот очень
«нтерсснЪ|Гг результат показывает, что теоретическое соотношение для определе-
ния вязкости смеси применимо шкже к *епчопроводностИ. если прости заменить
т| на X. Поскольку передача количества движения и энергии является следствием
различных молскуляплых взаимодействий, уравнение (10 6.4) следует рассма-
тривать только как приближенное [100].
Модификация Мэсона~и Саксеиы уравнения Васильевой (10.6 1) приводит
к использованию зависимостей (10.6 4) и (9.5.2) для определения ^if- Другой
способ перехода состоит в получении теплопроводности одноатомного газа по
уравнению (10 3 19) Тогда
(10.6.5)
где Г определяется уравнением (10.3.15). В этом случае значения Л/, Становятся
функциями приведенных температур Компонентов ( и /. Однако ,’ри таком
подходе не требуется знать вязкости чистых газов. Обе методики иллюстрируются
примером 10.1.
Модификация Линдсея и Бромли. Иепо-'ыуя |азс.вую модель Сюзсрлснда
ЛипД’И] и Бромли [95] предложили следующее уравнение:
где Л - • вязкость чистого газа, Т — температура. К; S — постоянная Сюзер-
Параметр /1,/ получается аналогично, но со всеми индексами в обратном по-
рядке Значение 5 для чисто; о компонента может быть определено путем согласо-
вания уравнения Сюзерленда для вязкости с экспериментальными данными или
рассчитано по какому-либо эмпирическому правилу. Одно из них, принятое Линд-
(10.6.7)
где ТI, —нормальная температура кипения компонента (, К.
Лругие снО'обы определения $; обсуждает Гамбилл [45] Имеются таблицы
значений S для различных соединений (36, 133] 'Хотя эги правила и нс оченЫ
точны, значение относительно нечувствительно к изменениям S, напрцмерг
измерение .$ и-i 20 % меняет расчетное значение приблизительно тольк®
на 1 %. ;
Постоянная взаимодействия Сюзерленда определяется как
(Ш.6.8Х
’) Модель Сюзерленда для вя!Кос|И показывает, что г] пропорциональна
’ (Т + 9)
ф Для Не, П2 и Ne значение S, с-юдует считать равным 79 К [95].
ь
ТЛБЛИЦА 10.6. Изменение параметра q Брокау в зависимости or содержания
легкого компонента в смеси
0,1
0.2
6,3
0.34
0.37
0,39
Молы) .'я Ифжтр д дтя уравне- ния (I0-S 9) । Лоия’тегкЛ, 1 Параметр « > 1 Л и' уравне- |1-я (10 6 9)
П д 0,42 0,8 0,61
0.5 0,46 J О 0 0,69
о/> 0,50 || 0.9и 0/4
0.7 0.55 I ’,0 0,80
441
сами проверили уравнение па 16 бинарных смесях и получили среднюю погреш-
ность 1 9 %. Проверка проводилась па смесях, сосюяши.х из полярных <244-3-,.
Н,О) п неполярных компонентов, по не включала смесей полярных веществ
с полярными. Температуры поменялись от 0 до 80 'С В корреляции (как
И при всех других проверках, упомянутых в атом разделе) использовались экспе-
риментальные значения теплопроводности чистых компонентов
Брокау проверил свой эмпирический метод на 18 неполярных смесях и
нашел, что средняя пси решность составляет около 2,6 % , а максимальная 11,4 %.
Поскольку метод Брокау нс может давать более высоких значений У.т, чем зна-
чения, определяемые ио правилу аддитивности, он неприменим для смесей, со-
держащих полярным компонент
Метод Мэсопа—Саксены не провсря.тся так тщательно, по при сравнении
расчетных и экспериментальных значении теплопроводности 9 бинарных и
5 трехкомпонентных смесей средние погрешности составили 2—3 % [10?]. Хо-
рошее соответствие между экспериментальными данными и рассчитанными по
этому методу значениями было получено для смесей ме,ан—пропан [175].
В ряде работ Г рей с сотрудниками [50—52, 99, 100] показал, что метод Линд-
сея:— Бромли дает для широкого круга смесей погрешность 2 — 4 % Более зна-
чительные погрешности получались, когда одним из компонентов был Н2 или
Не. Лондон и Саксена [183] также указывают, что этот метод обычно надежен
для неполярных смесей.
Опубликованы данные и о других проверках, по они никак пе меняют тех
выводов, которые могут быть сделаны па основании приведенных выше замеча-
ний [28. 36, 53, 58, 70, 123, 134, 161. 182].
Рекомендации, Неполярные смеси Можно применять любой из" трех
описанных методов. По метолу Мэсона—Саксены используется уравнение (10.6 I)
с Aij = Ф(у по соотношению (9.5.2) или е A по уравнениям (10 6.2) и (10.6.5).
По методу Линдсея—Бромли используются уравнения (10 6.1) и (1Ь.6.6)—
(10.6.8), если только значение S; не получено на основании экспериментальных
данных о вязкости Наконец, по мегоду Брокау нужно использовать уравнение
(10 6.9} Для всех методов ,пеобх<;димо знать теплопроводности компонентов смеси,
и вес, кроме ме|ода Брокау и метода Мэсопа—Саксены с уравнением (10.6.5),
требуют наличия данных о вязкостях чистых компонентов. Обычно погрешности
не превышаю! 1—3%
Полярно-неполярные смеси. Можно рекомендовать тс же самые методы,
что ii для неполярных смесей, за исключением эмпирического метода Брокау,
который в этом случае неприменим. Метод Мэсопа—Саксены не был так широко
проверен,как корреляция Линдсея—Бромли Погрешности редко превышают 5 %.
Полярные смеси Применяется метод Линдсея—Бромли; точность его не-
ясна, но по данным Мачека и Гзея [99], которые можно использовать для ориен-
тировки, погрешности редко превышают 5% даже для многокомпонентных смесей.
Пример 10.4. Рассчитать теплопроводность смеси метана И пропана при
1 атм и 95,‘С. если мольная доля метана составляет 0.486 Известное эксперимен-
тальное значение равно 7,61-10”Б кал/(см-с-К) [24, 175].
Решение. Свойства чистых компонентов, необходимые для одного или
для всех методов расчета приведены ниже:
| Метсн | Пропал
Молекулярная масса 16,043 Теплопроводность чистого газа >„ 10,49-Ю"Б кал/(см-с-К) [24, 175| Вязкость чистого газа г|, сП [87] |,32-10“8 Нормальная температура кипения, К 111,7 Cv при 95°C, кал (мэль-К) 11] 7.44 Критическая температура, К 190.6 Критическое давление, атч 45 4 Приведенная |Смнература Tr— Т/Тс 1,03 44.097 6,34-10’5 1 00- 10г 231,1 19,5 369.8 41,9 0,995
Эмпирический чето? Брокаи. По уравнению (10 6.9)
Х,„/. 10* = (0,486) (10,49) 1 (0,514) (6,34) = 8,35
„ ,л. / О 48b 0,314 \- 1
Пи табл 10 6 д,'уя мольпоп Доли метана 0,486 значение у - 0,45 Таким
образом
>т = [(0,45) (8,35) (0,55) (7,84)] (i0’5) = 8,0 10-» ка.т/(см с К)
ПогрешноС1Ь - ~y-gif—- 100 — 4,7%
Метод Ландсея—Боомли. Сначала нужно определить постоянпнс Сюзер-
.тепла Обозначив метан индексом 1 и пропан индексом 2, по уравнениям
(10.6.7) и (10 6.8) получаем
Sj2 - [(167) (347)]’ 3 = 240К
Параметры и /15| определяются по сравнению (10 6 6) Например
1,00 \ 16,043 / J I - 347/368 J ) ’14- 167/368
— 0,61. Тогда по уравнению (Ю.6.1)
/Л L_________(Л______(0,486) (10,40 10-5)
Погрешность —> 100 = 1,496
Метод Мчсона—Саксены. Значения Ф12 и Ф21- могут быть рассчитаны по урав-
нению (9 5.2) пли по уравнениям (Ю.6.2) и (I0.6.5). В последнем случае
И Ч- (1.32/1,00)|/2 (44,097/16,043) 1/4Р
12 8,/2(1 -(6,04,'44,10)'/2 '
Подобным же образом, но поменяв индексы, получаем Ф2] = 0,51. Тогда
ко у равнению (10 6.4)
А12 — Ф^2 = 1,86; А21 = Ф2х — 0,51
Подстановка этих значений в уравнение (10 6.1) дает
, (0,486) (10,49) (10~5) (0,514) (6,34) (Ю-8)
"т (0,486) + (1,86) (0,514) • (0,514) + (0,51) (0,486)
= 7,81 10"* кал,'(см с К)
Погрешность =
Ec.ni Для определения А-,, используются уравнения (10.6 2) и (10.6.5)
знать вяз кости чистых компонентов не требуете я. Сначала по у равнению (10.3.15)
Рассчитываются значения Г ди метана и пропана'
Т''‘М' ‘
Г = — s-------; Г.- 0.7506; Г,,--1.472
По j равнению (|0 6 5)
)!r, } 470 ,(t OtGlMl Ml _ . (0.2112) (lAb
- 1 :—±________________________________________3 50
z,rj 0,750b e(0 0.61) e- (О 24Г?) ~
Потст.ыюпкг- Вт,то значения в ураппепис (10 6 2) с к — 1,0 дает:
.4J3 = 11Н-(3,50)' 2(16.О4 44,Ю)1'1!2 = , fi2
[8(1 Ь 16 04'4-.10)]|/2
Аналогично AS1 = 0 52). Кик и прежде, по ^разнснню (10.6.1)
"г„, =7 8з J0"3 кал (СМ'С'К)
Погрешность с= 7|S^ 100 =2,5%
10.7. ВЛИЯНИЕ ТЕМПЕРАТУРЫ И ДАВЛЕНИЯ НА ТЕПЛОПРОВОДНОСТЬ
ГАЗОВЫХ СМЕСЕЙ
Влияние температуры. Обычно изменение температуры не оказывает заметного
влияния на форму кривых зависимости теплопроводности смеси от состава.
Однако бывают случаи, когда смесь, обнаруживающая отрицательное отклоне-
ние при низких температурах, може, дать положительное отклонение прй более
высоких температурах, здесь «отклонение» следует понимать как отклонение от
прямой, рассчитанной но правилу аддитивности при выражении состава в моль-
ных долях. Такой случай рассматривает Брокау |8] на примере смеси Ns—СО,.
Бели отсутствуют признаки такого аномального поведения, влияние темпе-
ратуры на теплопроводность смеси скрадывается изменением теплопроводностей
чистых компонентов. О таких изменениях говорилось в разделе 10.4, Следова-
тельно, нет необходимости изменять функциональную форму выбранной корреля-
ции для смеси.
Улыбин [|87]
предложил эмпирическое соотношение
/ m (^s) — ’/п (Т}) у.
(10.7.1)
Как показали Саксена и Гапта (161), это соотношение можно с успехом
использовать для смесей легких газов.
Влияние давления. Имеется очень мало экспериментальных данных о тепло-
проводности газовых смесей при высоких давлениях. Кейс (80] исследовал си-
стему азот—двуокись углерода. Камингс и ДР. приводят данные о смесях
этилен—азот ц двуокись углерода—этилен [72], смесей инертных газов (135]
и бинарных смесей, содержащих двуокись углерода, азот и Эган [49]. Розенбаум
и Тодос изучали бинарные смеси метан—двуокись углерода [|48] и метан—
тетрафторметап 114/1
Хося модификация Линдсея и Бромли уравнения Васильевой была предло-.
жена в качестве ьетояа расчета теплопроводности газовых смесей при высоких»
давлениях (раздет )() 5i [49. 70]. наиболее точные результаты обычно полу-з
чакмея с помоыью г'оот1Ю1иени1( Стиля и Тодоса тля чистых компонентов [урав-^
и Н|| (10 ) 4 ] г и р t из ।; ьз г t г г г г т х 41 и и и кем
поиент с (,«пдонрп'j четкими свойствами С помощью преоорловапН1'14 правил.
Прауспина к Inpa;, |аддитивные значения V,. Z. п уравнение (4.2.2) длй
/•-] он:.',а < осавлечч гмпл Н1 /. ( нсмио, ими исключениями эта простая МеТО, .
ДИКл щпегкна Ооссж.та.ыкн возможность использования ДрУг!1' правил ипреДв
.'(спил исев.т(1кр(ыпческпх свойств, но получаемые по чим результаты несколько
мешт точны 1118 I. ицгако дли смеси (Л,—СР) метод с-тпл.ч и I олоса дае, ичень
и г [ \ f [ 1 хц ч м V II । ш । ин хотвнени®
(lb ищ)-(io о й чтобы представить их в виде (X — Xj 1 Z ;-= / (р,. Г, М).
ТАБЛИЦА 10 7 Сравнение расчетных и экспериментальных значений
теплопроводности газовых смесей при высоком давлении
FC I к i t 5 I - £ 2 -’s = — |Н- г,к Д %™ Fi । Н В s2 ра г 1 о I’ I I s: “h 3g -- 1 1 = S5 а.. е ¥
Этилен—двуокись углерода 55,5 315,1 50,0 104.8 155,9 198,1 63,3 137 168 192 49,6 172} 64 144 191 211 4,9 14 10
79,8 315.1 52,1 114,4 155,3 199,9 68,6 151 168 19» 31,6 172] 70 170 195 218 2,0 14 16 J0
Этилен— дзот 67 5 315,1 43.6 101,9 156 5 196,9 64.5 88,5 119 |30 56.3 [72] 66 89 |20 |35 2,3 0,6 0,8 3,7
38,8 315,| 51,1 |02 4 154,9 197,8 67,9 79,5 94,3 |04 58,2 [72] 67 78 95 111 -Б9 1.8 6,7
Азот—двуокись угле- рода 34,1 323,2 19,8 48,8 5|,2 81,0 53,0 58,8 59,8 68,5 49,9 [80] 53 58 59 66 4,4 — 1,3 —3,6
52,9 323,2 20.0 42,7 68,7 84,3 55,6 59,8 67,0 72,1 53,7 [80] 56 63 64 69 — 1,0 5,3 —4,5
Метав—двуокись углерода 75,5 370,8 33,3 172,5 688,6 94,9 121 176 228 90,0 [148] 95,1 126 195 251 0,5 3,9 10
24,3 370,7 35,7 170,8 118,1 682,2 68,4 106 172 229 63,0 1148] 68,8 110 200 254 0,5 3,0 16 11
') Пи (Тшпость _ Црас'1 -экс., )/{ысси 11 («0%
По преобразованным правилам определения пссвдокритических констант
Прауснпад и Ганна значения Tcm, Km, доджиы рассчитываться по пра
виду амктивност», a Ptjn — г,о уравнению рст~ 7,- Например
Аналогично
= (0,755)(190,6) + (0,245) (304,2) =2|8.5К
_ 0,286;
22,895
№H1W)(2'8,51;=52[24
Затем
0,1440
ТТюГ-0'6"
По уравнению (]0.5 3), где Г = (218.5)1'5 (22,895),,: (52,24)2/3 — 0,840,
получаем;
(|3,1 10_!
К~ (0,840) (0,285? + °’ " U
Погрешность - ~|26|7Г;Г^~
10.8 ТЕПЛОПРОВОДНОСТЬ ЖИДКОСТЕЙ
Теплопроводность большинства простых органических Жидкостей в (0—
100 раз больше теплопроводностей газов при низких давлениях и той же темпе-
ратуре. Она мало зависит от давления, а повышение температуры обычно при-
водит к уменьшению теплопроводности. Эти характеристики подобны тем, кото-
рые отмечались для вязкости жидкости, хотя зависимость вязкости от темпера-
туры почти экспоненциальна, а для теплопроводности она слабее и приближается
к дипенной.
Значения Х^для большинства обычных органических жидкостей составляют
(2504-400) 10-е кал'(см-с К) при температурах ниже нормальной точки кипения,
по Для воды, A’Hj и другие сильно полярных соединений соответствующие эна-
ТАБЛИЦА 10 8. Теплопроводность некоторых
жидкостей при I атм
I г,=с 1 I I каj кч с* Ю
Водород -25.J 2а2
Аргон -190 301
н-Гексац 20 291
п-Ксилол 20 325
Нитробензол 20 361
5 ксусиая кислота 20 374
Ацетон 20 385
Хлороформ 20 277
Глицерин 20 693
Вода 20 1 430
Даутерм Л 20 344
Керосин 25 326
NaCI (насыщенный водный рас 20 1 370
твор)
Натрий 300 180 000
Ртуть 100 22 000
Смесь KNO3—NaNO2—NaNO3 150 I 360
нения в 2—3 раза выше. Кроме того, во многих случаях безразмерное соотно-
шение ЛТА//?т] приблизительно постоянно (для неполярных жидкостей) п равно
2—3. так что нысоковязкпе жидкости часто обладают соответственно большей
теплопроводностью. ЖиДкие металлы и кремннйорглническпе соединения имеют
высокие значения Хд. Для жидких металлов X; часго в 100 раз больше, чем для
нормальных органических жидкостей. Теплопроводность тела в твердом состоя-
нии при температуре плавления приблизительно на 20—40 % больше, чем в жид-
ком. Некоторые значения теплопроводности жидкоьтей приведены в табл 10.8
для иллюстрации встречающихся диапазонов Данные о теплопроводности
жидкостей собраны и оценены Джеймисоном и др. [68].
Различие между значениями переносных свойств газовой и жидкой фаз
указывает па особе1(ности механизма передачи Энергии (количества движения
или массы), т е.
-^-^10+100,
В газовой фазе молекулы могут перемещаться О1носительно свободно и пере-
давать количество движения или энергию с помощью «механизма столкновений».
Межмолекулярные силовые поля влияют на значения X, rj и D хотя и заметно,
по не определяющим образом, т, е. силы межмолекулярного взаимодействия
отражаются только в интегралах столкновений и Цд>, которые в действитель-
ности представляют собой отношения интегралов столкновений для реального
силового поля и идеальной системы, в которой молекулы рассматриваются как
жесткие невзаимодействующие сферы. Отклонения значений и О о от единицы
дают грубую количественную опенку нажности нлцяния сил межмолекулярного
взаимодействия на величину коэффициентов переноса в газовой фазе. Уравнения
(9.4.3) для Qa и (11.3.6) для &£> показывают, что значения Й часто близки к еди-
нице. Поэтому считается, что молекулярная модель жестких невзаимодейству-
ющих сфер дает коэффициенты переноса при низком давлении (К г| и О)
') В этом случае ?. — значение теплопроводности Для одноатомной молекулы,
не включающее составляющих, основанных на механизмах переноса внутренней
энергии.
не очень сильно отличающиеся от тех, которые рассчитаны с учетом сил межмо-
ле куля pi (Ого нзапмодействия.
Однако для жидкостей эта (шдасза не оправдывается даже приблизительно.
Тот факт что молекулы находятся на малых расстояниях одна от другой, яв-
ляется причиной значительного усиленья действия межмо.текулчрных сил <»,-
тглк^вапия. Лвижсрле молекул стеснено, и это находит отражение в том, что
коэффициенты диффузии в жндкоеи имен»] пеболп!ине чцачсрия а жидкость
часто моделируется в виде решетки, в которой каждая молекула находится
в ячейке, обрадованно,) соседними молекулами Гр р< дача энергии количества
движения происходит преимущественно г,’резу.чь| ате колебаний молекул в смеж-
ных силовых полях, окружающих каждую молекулv. Шеффи (167) обращает
внимание на образное описание этих процессов, данное i рпном: '.Предстаньте
себе молекулы, связанные междх собой эластичными веревкаw н.'ыяжечне
которых меняется Довольно странным образом: так, что они способствуют появ-
лению сид притяжения Но поскольку молекулы движутся, упругая энср,ия
веревок изменяется п б-та, одари этому может передавайся от одной части ансамбля
к другой, хотя про этом фактически не переносится самими молекулами»1.
Различие механизмов переноса в плотном газе или жидкости и в газаг При
низких давлениях подробно обсуждается Маклафлином 197].
Эти выходящие из употребления теории нс приводят к простым методам
расчета теплопроводности жидкости [184], в инженерной практике нужно поль-
зоваться приближенными (или откровенно эмпирическими) методами.
В последующих разделах рассматриваются только относительно простые
органические жидкости. ,Хоу я др (62 J сделали исчерпывающий обзор, охваты-
вающий теплопроводность элементов, а Юинг и др. [40J и Гамбилл |4б].иссле-
довали, соответственно, расплавленные металлы и смеси расплавленных солей.
Криогенным жидкостям посвгидсны работы Престона к Др. 1137], Мбу и Габ-
бпнеа [120а].
10.9. РАСЧЕТ ТЕПЛОПРОВОДНОСТИ ЧИСТЫХ ЖИДКОСТЕЙ
Существует много методов расчстл теплопроводности чистых жидкостей.
Почти все они эмпирические и только ограничено проверенные, i,o некоторые
могут казаться более точными, чем в действительности. Как было отмечено, нцже
нормальней точки кипения теплопроводность большинства органических непо-
лярных жидкостей составляет (250-Н5О) 10-6 кал/(см-с-К). Учитывая это, не-
трудно разработать различнее схемы определения /.£_ в пределах указанной
ограниченной области.
Многие расчетные методы были проверены, iри лучших из них подробно опи-
саны ниже, другие, принятые во внимание, кратко рассмотрены в конце раздела.
Метод Роббинса и Кингри. Вебер в 188(1 г. предположит, что теплопровод-
ность Ку. пропорциональна произведению СрР*'3, и Этот общий тип корреляции
многократно модифицировался позднее (132, 173. 174, 19] ], Лучшая модифика-
ция, однако, Принадлежит Роббинсу и Кингри [146], которые предложили сле-
дующее соотношение
(10АО
где ?.£ — теплопрополность жидкости. кал/(см-с-К); Тт=* Т/Тс — приведен-
ная температура; Ср — мольная теплоемкость жидкости. кал/(Мо.1ь-К); р —
мольная плотность жидкости, моль'емф
AS* = MlVb!Tb h R 1ч (273/ Tb)
_ Мольная теплота парообразования при нормальной температуре кипе-
ния, Ть — нормальная температура кипения, К-
Зцачения параметров Ц и N берутся из табл 10 9, И тавнент ог молекул*?»-,
ной структуры, a N — от плотности жидкости при 20 ’С. Уравнение (10.9.1Л
относительно просто в использовании, но необходимо зпагь значения
(10.9.2)
ТАБЛИЦА J0.9. Значения Н н N яля уравнения (10.9.t) (Т46а(
Нсразнствлснныс у, Лсводороды:
ihiz-i.bneuHbie
ненасыщенные
циклические
Алкильные группы в разветвлениях угле
eF—
Вг—
-ОН
1 (ито)
Кислсродпые замещения'
1 (трет)
-О (кегоиы, альдегида)
—С—О— (кислоты, сложные эфиры)
—О— (простое эфирьт)
.Замещение на — МН2
Шщ.юсть жидкости. Осм3
7'м р к С-р О1(« Юттут быть получены по экспериментальным данным или раСсчи-
т,ш!,( с помощью методов, описанных ранее в этой книге-
Роббинс и Кингри P.poBCpiMn уравнение (10.9.1) на 70 органических жи ко-
С’ях, используя данные для 142 точек; некоторые из веществ, на которых про-
иодч.тась проверка, и ее результаты представлены ь табл. 19.10. Погрешности
редко превышают 10 %. Эти авторы утверждают, что температурный Диапазон
применимости уравнения (10.9.1) соответствует Тг — 0.44-0.9, по проверка
табл. 10 9 неизменно выполнялась только при значениях Тг приблизительно от
’'А до 0,7. Соединенна, содержащие серу, л неорганические вещества в проверку
!'' u^.wrta.fticb. Во миогпх случаях трудно согласиться с резким изменением
('Указателя степени Л' от нуля До единицы для веществ с плотностью болюче или
15 р«д V. и др. 449
ТАБЛИЦА 10.10. Сравнение расчетных и экспериментальных значений теплопроводности жидкости1)
Соединение г, к Эксперименталь ное значение К- 10*. квл/(сн• С' К) Метод Роббинса и Кингри Метод Сапе и Риде1,,, Мксссиара и Ридсл я погрсш
Н 1 Л "'п-рс.и " несть’)
Пропан 323 187 0 1 0,5 27 18
н-Пентан 293 272 0 1 —1,8 20 17
303 205 -3,0 20 1 /
«• Гексан 293 291 0 1 2,0 12 12
303 282 3,5 12 12
н-Гетаи 273 310 0 1 5 3 0,0 8 9
293 301 3.0 6,9 9,6
33,3 270 1.5 8,5 12
н Октан 293 308 0 1 4,2 3,2 8.8
350 207 2,6 5,2 И
«- Нопан 293 313 0 1 3,8 0 8,3
350 275 -0,7 1,8 11
н-Цекап 314 304 0 1 7,9 • 2,0 9.5
349 284 2,8 — 1,8
2-А1етилпентан 305 259 1 1 1.5 18
322 247 0 19 18
2,3-Диметилбутан 305 322 248 238 2 1 - 2,0 24 23 20 19
2,2,4-Триметилпентан 311 350 231 201 . 3 1 — 1,3 27 23 20 26
Циклогексан 293 297 0 1 12 1 1 3,7
МепмиилЛопсктаи
Бензол
Этилбензол
Этиловый спирт
н-Бутпловый спирт
нОмИЮВЫЙ спирт
отрет-Бутиловый спирт
ж-Крезол
Этиленгликоль
Анилин
Пропионовая кислота
Днхлорметан
311 289 275
293 353
323 ,327
389 272
293 316
353 281
293 394
313 363
,333 339
347 322
293 367
313 352
333 344
293 396
311 383
.311 277
350 255
293 358
353 347
293 609
350 635
290 424
285 413
253 380
273 373
293 353
1 1 1,0 13 14 3,8 4.7
0 1 4,5 - -0,4 — 5 1
2.4 -2.1 -4.0
2,6 0 - 1,8
2 1 3 8 2.2 4,4
3^6 3.2 5.3
- j 1 8,1 15 24
14 19 28
21 21 30
28 22 ,32
-1 1 4 1 5,4 20
5 7 i Т 21
6,7 3,Э 18
_ [ i -19 С П
3’9 — 18 6Д)
5 [ - 2 9 20 --
- 6’4 22 72
2 0 1 1 -3,6 28
13 -8,6 21
0 0 0,3 ’)
6,4
1 0 4,7 —15 10
0 0 — 1,7 -3,4 13
2 0 —4,7 — 1,3 — 6,3
—7,2 — 15 —8.3
—5,4 — 15 —7,9
ерод)
меньше 1 г/см3, часто более падежные результату получаются при ^ = 1,0 даже
для соединений с р> 1 г/см3.
Мени, использующий нормальную температуру кипения. Сато 1101] предпо-
ложил, что при нормальной температуре кипения
(10-9.3)
де тег топроводность жидкости при нормальной температуре кипения;
.11 — молекулярная масса
Для определения X при других температурах нужно сочетать уравнения
(10 9.3) и (10.9.1) так, чтобы исключить члены, связанные с 1/и АЗ*. Когда
это сделано [КН 1, получаем, приняв Л' — 1;
. 2,64 10-= / р у/» ТЬ (Ю.9.4)
д1>/- Срь \ pt,} Т
где индекс b относится к условиям при нормальной точке кипения.
С другой стороны, соотношение между Хд и Т. данное Риделем [145] и най-
денное точным Рахалкаром и др. [1401, а также Мартином ] ЮЗ] имеет вид
Хъ-Л[1 +20/3(1 —7» |2/3
(10.9.5)
По уравнениям (10,9 3) и (10,9,5)
2,64 1Q-3 3 + 20(1 — Тг)2'3
„И1'2 ’ 3-^20 (1 —Тгь)2/3
(10.9.6)
Уразнение (10 9.6) использовалось при определении значений X/, для
•табл. 10 Ц1 При расчете необходимо знать только Т, Те,ТьН М- Погрешности
изменяются в широком интервале. Плохие результаты были получены для угле-
водородов с низкой молекулярной массой и углеводородов с разветвленной цепью.
Обычно предсказываемые значения теплопроводности были более высокие, чем
экспериментальное. Лучшие результаты получались д.чя неугпсводородов.
Метод Мпссеиара. В книге, посвященной теплопроводности, ,Мгссенар [117]
предположил, что
90 106 (Tfcpo)'/2CP0
(10.9.7)
rie Хд0 — теплопроводность при 0 °К, кал^см-с-К), Ть — нормальная темпе-
ра।ура кипения, К, р0 — плотность жидкости при 0 °C, моль'см3, — тепло-
емкость жидкости при постоянном давлении и 0‘С, кал'(молъ-К), М — моле-
кулярная масса Л' — число атомов в молекуле.
Комбинируя уравнения (10.9,7) и (10.9.5), получаем:
(10.9.8)
иным по соотношению ц0 9.7),
1К1:. результаты которой представлены в табл. 10.10
счетные значения Лд превышали экспериментальные,
uuieniut (К) 9.1'1 следует, пожалуй, уменьшить па 10 -
Мисс'снар нре- мелкий позднее значение 84-10”' [116].
Решение. Данные:
i
Метод Роббинса и Кин-'ptt. Г1" law:. |о.З У - 3 н поскольку нлоiно-тъ
жидкости равна (0,(ЖЗ) (153,823) — 1.58 > 1, V - 1'. Кроме -.то по урав-
нению (|0 9.2)
“’‘W*1’’®’»;'’*’.................... 1 '
Затем по уравнению (|0.9.1)
_ (Д.О^ (4,9..) О), (3|ЛЗ) [0 111||3)1/^гж с К)
Погрешность =z-° 1 ~(1^4- 100 - 5 3 „
Метод ( агио -Риделя. По уравнеишо (10.9.6) г'огшо.ш^ Г, - ЗОТГшб 1 -
-0.527 и ТЬ/ - 319.7/556J _ 0,(',29 имеем:
. 2 64 IO'8 3 |- (20) (1 _ (ЛГ.271 - Л
’L ’ (153.84)1-'- 3 1 (20) П (i 029)
- 242 Р)-*5 кал (см с К)
Погрешность — '24§
1<Ю - 1 0
Alci-od Миссенара- Риделя. С'
! _ теп.лон; оводность при 0°С:
O0=(»10-S>U349.7l(0.(.1«i)l «>
Т<)Гда по уравцен но (10.9 8) с 273/7С — 273/556 j - 0.491
= (202 |0-")
Я-. (20) (1- 0,'|91)-
....246 '
И 'икшернментаилшеч значениями гсшюир'шодшш,,i
455
10.10. ВЛИЯНИЕ ТЕМПЕРАТУРЫ НА ТЕПЛОПРОВОДНОСТЬ
ЖИДКОСТЕЙ
стсй уменьшается с температурой ’). Ниже вблизи нормальном точки кипения
это уменьшение дочти линейно и для небольшого температурного дна, аэсци гасю
представляется в следующем виде:
^1 = >£01| ' 'Л,Т~ T»)i
(10 ;0 1)
где ^Ln ~ теплопроводность при температуре 7Д а - иос’оянная данною
вещества, значения которой лежат в пределах ( -0.0005)-ы( -0.002) К' Пр:,
температурах, близких к точке плавления, наклон dl.-<iT может умсныитться
[155[, а вблизи критической точки становится большим 1|45].
Для более широких температурных дисшазодои t;pe,ViO4T;nc:ibuci стлков;.'» ч
предложенная Риделем корреляция, приведенная выше как уравнение (10.9.5)
Хотя она неприменима для воды, глицерина, гликолей, водорода п гелия. Джей,
мисон [05] показал, чго она хороню представляет изменения тептоироводпости *./.
с температурой Т для широкого крута соединений. На рис id.l'O дан график
зависимости теплопроводности жидкого хлортрифтпрмеюна (Г-|3) or -evne.
ратуры в диапазоне от — 120 СС (Т, 0,5) до О °C (Т, =- 0,9) [95 [ Крдзая была
построена по уравнению (|09.5), и экспериментальные данные (на рисунке нс
показаны) имели разброс вокруг этой кривой. Однако для умеренною тидпазоиа
температур уравнение (10. |О I) адекоатрг,
А1|(ссенар [118, 1191 предположил, что если иоользоватт лн1(С,ШУ!О зависи-
мость от Т [уравнение (10.10 1)],то i омаюгцческис ряды будут иметь общую
точку сходимости. Дже.талян [35] и Пуранасамриддхд 1138] сообщают, что
величина является постоянной, 1 де показатели стспети п связан с —
мольным объемом жидкости при 20‘С. Эю соотношение, однако, лиши прибли-
’) При очень высоких давлениях значение dl.ldT часто положительно даже
для неполярных жидкостей [741.
:гых жидкостей сильнее
имеют oo.ice высокие значения [(</ In <1Т]р — и что особенности структуры
сложных молекул ие иметот особого значения. Например, как отмечают Хоррокс
I. Маклафлин |63[. температурные коэффициенты теплопроводности дли о-три.
dicHii.na и п-трнфенпла почты одни ц тс же. Однако |смпературные коэффициенты
>и: для первого вещества вязкость при температуре плавления равна при-
зитетыю 350 nJl а для второю — всего лцшв около 8 мП Ясно, что вяз-
ъ жидкости гораздо оолес чувствительна к температуре и молекулярной
Таким оиразом. теплопроводность Жидкостей обычно Уменьшается с темпе-
чтурои: исключением являются вещества с высокой полярнос-ыо и соединения,
'Держащие несколько i илрок<ильцых групп или несколько аминогрупп,—
пом случае теплопроводность уменьшается с увеличением температуры. Влия-
ли температуры невелико, и простые жидкости более чувствительны к темпера-
. ре. чем сложные сЬтп замечания справедливы для насыщенных жидкостей или
•реохлажденных при давлениях до 30—40 атм. т. е. в пределах этого дпапа-
ша влияние давления на теплопроводность жидкостей невелико (кроме около-
1п'тцчеекои опляети для которой более предпочтительным было бы пользоваться
10.11. ВЛИЯНИЕ ДАВЛЕНИЯ НА ТЕПЛОПРОВОДНОСТЬ
ЖИДКОСТЕЙ
lb'ii врепных давлениях (до oU- •40 азм! влиянием давления па те п-Ло-
.I': । ' II. л"| 1. жидкостей ooi.niffo препеор< ?гают. за исключением оидасти вблизи
Ill Hi l.i .11 точк i. i зе жидкость ведет < геол ди некоторой степени как п |.|ц 1 Г1-1.1 и
i' '1 n. ii дел ю о). Л.|Я оо.чсс низких jCMircparvp чем Т~. результат! Ы КЛЗ'.-
( 1.11 iiii гдгоп Прнлжмена |о] составляют почти вею имеющейся экспери-
I . I. 1 '.1,1.1 II матерца.] ио влиянию давпепия на >.г. с>ги данные пока. !Ывают,
' ! ....(ле।и<т с ляп.'И'иием.
ТАБЛИЦА 10 11 Значения napaMeipa А' в уравнении (Hi.11.2)
I 1W 200
0.8
0,7
0.5
о.ОЗп
0.018
О 01'
0,01 2
0,(08 0.03^
0,020 0.027
0,020 0.1)22
0,0155 0 0|7
(0.038)
0,032
О 025
(0,038)
0.032
0,025
0.020
тиол 1(1. [ t 1 — 0,0205 11 । (zt пепелг,з\ , х pai.iK iir. (1 ' I I 2). । мееч
7/(Рг)- (307 U ' ((1,0205) (15-1)п‘J-521 ю ' п.-икме 1'1
л 521 - r')5 . , ,
Погрет (, . loo . 4 -J ,
10,12. ТЕПЛОПРОВОДНОСТЬ СМЕСЕЙ ЖИДКОСТЕЙ
I L'H.T, ,liinilin:ii|i!i г I.. I ’ 11 • 111 Г1. I I ',11'U'II ui, пн I и • inch в \ ;mi ! к. л leu r, \; i < i .11 < n г< л I
меньше рассчитываемой по правилу .u;iifritni:<’CTn при выражении состава п моль-
ных (или массовых) долях ‘) Значения теплопроводности 5. .. четырех смесей при-
г., л, a nil'', in .'И < л । :, ,ii ',1 iirili ни V : к > ч, 11.а, и1 hi л, ,п 10г ; i I'Meeci I , и I си
11 И 1 Ч И рн 8 I I 1
НО Ullin' С Г,| I |,|| III Х'В'г 11’14 1111,11' и I МЛ Ч'И|||О . 111,1 ... I.. II || 1111,111 ' IIIOC ГН. I'' 1.11'Н
жэтся В 166, 67, 171]
I) Система анилин _ yi«.ycna!i кис.тпт-i может быть псп.нешсиа 142 |; другие
rMLCtJ, Содержащие ОДИН ОСНОВ ЧОЙ и ОДНИ М1СЛОТНЫЙ КЦМ1 lOHC'li г, но вщимому,
иноке Mni'vr (i|,l и, iicMiii'K'h'1.1.
Предложено ми,), о корреляционных
методов расчета теплопроводности
смесей (37, 7? %, 97, 137. 13<). 15'3,
193.-S 204] Из всех предложенных
распетых методов пять ржем.ырп-
ваются ниже Каждый in ни^шн
роко нроверен и далежен ::.'я 'о с-
нпшетва емссеп
Уравнение ПИЛ. Эл ур..ггни1н
-Д1 -?>
где ?., > 7.,: е> — массовая ком-
понента 2, а — константе, смсеи iua-
чення Этой константы G9 систем
даны в работе L661 ,1 находятся в нсс-
дслах приблизительно от 171 до I ('
Значение * — 0 должно приводить
к iuKUfO'icHuio, что теплопровод
юсть A-fj была рассчитана по правилу аддитивности. Поскольку аначе
(ив с обычно неизвестно, часто принимается а — ] При экм погрешности
to превышают, однако, 4 %. Уравнение неприменимо для чно'окомгонеитных
месеЯ,
Уравнение Филиппова, Другое эмпгриче.кпе сшиношеипе было предложено
Советском Сокпе [41, 43]
X ггт — 41
Хз — 7 j
| ta2(l - С)
Оно подобно уравнению Н11Л Здесь а.1» тоже массовая доля «им по пента 2,
С — константа смеси. Если эксиерцмен1альнос значение С неизвестно, ек’
бычпо принимают равным 0,72. Точность уравнения (1'1 12.2) аналогично точ-
ости уравнения (10 12 1) Эю уравнение также пенрш одно для мнотокохп'онент-
ых растворов.
Уравнение Джордана—Коутса. Шрофф [171, [72] после проверки многих
орре.тяций для cMCceii рекомендовал одне, предложенное Джорданом [71 [
,2'7 -|«p(nt,~M -ол/ft, I
А , л2
«'1'2
(10 12.3)
(10 12 4)
де и _ массовая доля. Для получения наиболее тонных результатов можно
ыбрап, значение параметра г Если г - 1, ю, следовательно, определяется
о правилу аддитивности. По мере тою как г делается ппж<’ единицы, значение
тЛонроводности л,,, постепенно становится меньше вн1шсле1пп1го ио пр;ни1лУ
адд, ti:b:-iocth. Наиболее приемлемое значение г, по-видимому, зависит от отно-
шения л2 /-•,. где / 2 > л,. Д-я большинства смесей 1 Х2/Х| 2, и в этом диака-
зоне значение г = —2 обеспечивает достаточную согласованность предсказан-
nt.ix и р а (г ч । о и н и,, х теплопроводностей. Уравнение (10 |2 I) можно легко обоб-
щи 1L. Д.'1>( чти окомчогеитпых смесей
н, = S
/=1
I10 12 о)
> равнение Лц. Ли |‘)2а] предположит, 'По
'.я- Y
~S
(Ю 12 С)
(10 12 7)
(10 12 3)
X; — мольная доля компонента I, Ф; — объемная доля компонента г, V, -
мольный объем чистой жидкости г.
Дтя бинарных систем (кохшонепш I и 2) уравнение (10 12 6) принимай
нид
I Ф(?-2 (Ю 12 <_))
Среднее гармоническое приближение для Х,; было принято вместо среднего
геометрического или арифметического после широкой проверки и сравнения
расчетных и экспериментальных значений Кроме того, било найдено, что
члены V'; в уравнении (l0.l2.fi) можно заменять критическими объемами безвод-
ных Жидких систем без Значительною влияния на результаты.
Обсуждение. .'1и [92а] сравнил точность его метода с уравнениями НЦЛ ц
Фи..пппова для большого числа бинарных жидких смесей (как водных, гак и
безводных) Погрешности всех методов редко превышали 3— I %, если спегемы
ire проявляли минимума Х„, при изменении состава. Ни один расчетный метод
ис может предсказать появления .минимума. Менее широкая проверка, предприня-
ли авторами этой книги, показала, что уравнение Джордана -Коутса и соотно-
j нхг методам Лее методы иллюстрируются примером 10 9.
Пример 10.9. Рассчитать теплопроводность жидкой смеси метилового си нртд ц
бензола при 0 СС, если массовая доля метилового спирта в смеси составляет 0,4,
При этой температуре теплопроводность чистых бензола и метилового спирта
равна 364- 10'6 и 501-10'“ калием-с- К) [66], соответственно. Сравнить рассчитан-
ное значение с определенным экспсрглшнгально. Экспериментальное значеппе
равно 405-10'с кал/(сМ’С’К).
Решение. Уравнение НИЛ. Поскольку \ (метиловый спирт) > ?. (бен-
гол), мешлоиып aiiipi обозначим как Koxn.oneirr 2, По ура(’цени|Э (10 12 I)
501-10-“-364-10-“ 1 (MU “)
При а а 1 значение теплопроводное^ смеси /;п — 399 10'6 кал/(см с- К)
390 _ 405
Погрешность —-------4оЗ-- ’90- —1,5%
Если же, как предположил Джеймнсо j и Хайсцицз [Go] для этой смеси,
0,49 ю
_ 409 |0-6 рал-Чем-с-К)
1 lortieun ость = 4в>, 4°’-' 1(10 -- ) ()",,
' 40о '
Уравнение Филиппова По уравнения (10 12 2) грн С — 0,72
?.т — 364 10-»
501 10-° — 364 )()-«
— (0,72)
lU.-D (1 -0,72)
r,n 395-10"’ к,4.т.'(гм с-К>
— 395 — 405 ... . -
Погрешность =--------—=----- 100 2 м|„
405
Уравнение Джордана—Коутса. Уравнение (10 12.3) при и, = 0,6 и ш2 =
—0,4 Дает.
(364 10-’)° 6 (501 10-’1с 4 ”
= (ор [(13,80) (501 10-’ — 364 К)-11)] —
— (0,5) (13,80) (501 10-’-l 3G4 1 0-с))'"’Ь| -0,9959
л„. 412-10-’ кал/(см-с К)
1 lorpetlll’OCTb — ——777-—— 100 — '1,7%
Соотношение. использующее правило аддитивности. 11рпмсияя уравнение
(10-12 4) с г —2 и составами, выраженными в массовых долях, имеем'
Х“2 = (0,6) (364 1О-6)-2 + (0,4) (501 • 10-®)-2
Лт — 404-10"’ кал.'(см-с-К)
404 — 405
Погрешность —-------------100 — — 0,2%
Уравнение Ли. При 0 ’’С значения мольных объемов чистых жидкостей со-
став.1Я|ОТ V (метиловый спирт) = 39,6 см’/моль и V (бензол) =_ 88,9 см’/моль.
Если массовая доля метилового спирта равна 0.4, io мольная доля составит
0,619, и по уравнению (10.12 8) Ф — 0,420. Значение /.,2 ио уравнению (10 12 7)
Л|2 = 2 [(501 • 10-’)-1 I- (364 10-’)"|]-| 7=422-10-’ кал/(см с К)
Тогда по уравнение (10,12 9)
Х,,г — (0.420)2 (501 10-’) +
42 i0,420) (0,580) (122 IO’’)+
(0,580)2 (364 IO’’) -
- 416 10-’ ьал/(см с 1\)
Теплопроводное
40о
Пять 7 ето юв, и. 1.тюсгрируемые
примером 10 9, применимы также
к водноорганкческим смесям. Напри-
мер, на рис 10.21 показаны экспе-
462
ТХБ.ТИЦА 10 12. Значение для анионов и катионов в уравнении
(10.12.11) [69]
011- 20.934 H* 9.071
F~ 2.0934 Li* -3,489
С1- -5,166 Na* 0,0000
Вг- - 17.445 К* -7,560
I- —27.447 Nllj- -11,63
NO7 - 4,652 Mg2* -9,304
NOj - 6.973 Ca2* - 0,5815
CIO3 -14,181 Sr2fl -3,954
СЮ7 -17,445 Ba2+ —7,676
BrOj -14.ISO Ag* 10.47
COjj- -7.5G0 Zn2* -16,28
SiO?(- —0,300 ( u2+ -16,28
so<- - 2,326 Pb2* —9.304
SOj- 1,163 (_o2+ —11.63
S.O2' 8,141 Al3*- —32,56
CrO’- — 1.163 Tli1*- -43.61
Cr„O=— 15.93
РОГ -20,93
Fe(CN)J- 18,61
Хнетат" -22,91
Оксалат2' -3,489
463
пение, предложенное Ридс.,еч [145] к приперешюе Варсафтикон ц Оспмииины''
1192]
<20"С) о(20'С) 4-^ V п с. (10 12 111
где ?.п — теплопроводность ионного расгнпра при 20 «' н<зi '(си • с-К) >|4 0 —
теплопроводность воды при 20 иал/(сн- е-1\), — киндеи-градн!1 зискгролита,
VGib/л; с; — коэффициент, который является харакгерис-пкси) каж-гп, кона.
Значения с’, приведены в табл. 10 12. Чтобы полтишь о... фи .invi -ix
parvpax, нежно использовать уравнение
/ О (X (г)
;,,(Г),л.₽С!-(I» 12.12)
5Л жключенпсл! Cii.ibr.UX ЪЦС'<,1 и оеног.аиид при В)Л,-)».ич кончен vp-aa-awa
погрешности ypaBi’CHiiii (10 12 II) п ПО 12 12) находятся в трсдслах ±до %
404
Греческие
- параметр полярности п уравнениях (10.3.9) и (10.3. |0); нектон в vl'iift*
пенен (10 Ю-1) параметр в уравнении (10.12.1)
-- ларсчетр а Уравнении (|0.3.9(
теплопроводность, кал,'(см с К), >t— при критической температуре,
но обычно при пианом давлении, ).£ — для жидкого состояния, \п-~
— плогкость. обычно моль/см*; pj — гри нормальной температуре Кипе
ния' рс — в критической точке; р, — 0/Ос — приведенная плотное^..
р(_ — для жидкости а
параметр
- объемная долл
— паразитр изанмодсйствия Для вязкости [уравнение (9 5.5) ]
— параметр в уравнении (10 3.9)
— интеграл столкновений для вязкости ч теплопроводности; Йд—длч
Индексы
вещесгво ведет себя как идеаль-
i, ! — для компонентов (, /
( г — для смеси (/-' взаимодействие)
b — ирн нормаль|1ой температуре кипения
ЛИТЕРАТУРА
I-'. N.
Properties о! Q
Глава 11
КОЭФФИЦИЕНТЫ ДИФФУЗИИ
11,1. СОДЕРЖАНИЕ ГЛАВЫ
В разделе 11.2 кратко обсуждзк>|ся системы отчета, с которыми может быть
связана диффузия и относительно которых может быть определен коэффициент
диффузии Расчету коэффициентов диффузии в бинарных газовых системах „ри
низких давлениях посвящены разделы 11 3 и 11.4, а рекомендации дтя выбора рас-
четного метода даны в разделе 11 5 Влияния давления в температуры на диффу-
зию в газе рассматрива|(!тея в разделах Ц.Ь и 11 7, соответственно, (ворья диф-
фузии жндкостн представлена в разделе 11.9, а методы определения коэффици-
ентов диффузии в бинарных жидких смесях описаны в разделе 11 10. Концентра-
ционная зависимость коэффициентов диффузии в бинарных жидких смесях при-
водится в разделе || J1, а влиянию температуры на диффузицщо в жидкостях
посвящен раздел 11 12
Краткое описание диффузии в MhotokomhOhchtiibiX смесях дано в разделах
11.8 (газы) .1 11.13 (жидкости), диффузия в электролитах рассматривается в раз-
11,2. ОСНОВНЫЕ ПОНЯТИЯ и ОПРЕДЕЛЕНИЯ
Диффузия — sro перенос вещества ,,з одной области в Другую в пределах
одной фазы при отсутствии перемешиванья (механическим способом пли конвек-
цией), Эксперимент ц теория показывают, что диффузия происходи! при наличии
градиента давления (диффузия под давлением), градиента гемпературвт (термиче-
ская диффузия), ||отеи внешних сил. л ^акже । радцента концентрации (молеку-
лярная диффузия). Настоящая глава ограничивается рассмотрением изотермиче-
ской изобарной молекулярной диффузии без градиентов, обусловленных полем
ВцСШНИХ сил.
Даже ири этом <>1 раничепин легко может возникнуть путаница, если не дать
'Ю|Ких Определений диффузионным потокам и диффузионным потенциалам, т. в-
4йх
Рис; И.!, диффузия через поверхность
движущим силам Коэффишк нт дне) -
фузии является константой пропор-
циочаленостм между чотрк...,м и пг-
Диффузионные потоки Летальное
можно найти в книге Лерда, Стнюр-
петому, ц, о приме
клоскокостн отекла
та и Лайтфута (17). Различные их типы позмежны
няются разные плоскости отсчет;! Наиболее очевидная
i;Ci:o,Taiiжча на оборудовании, в котором происходит ,„.T,.Z_..„.
скость обоз,,ачт через RR' на f>iK. Н.1 Предположим, что компонент \
бинарной смеси Диффундирует в левую сторону, а компонент В — в правую
Ес.m скорости дифсузип этих компонентов неоДинатовы, будет происходи г:,
(оЛнор исчерпывание или накс,i.ieinie молекул одного из компонентов по каку.о-
.шбо из сторон RR1. Для сохранения условии изотермической изобарной енстемл
iiMiiitr^n <г /1 (намеренное н иепсдвижной системе отсчета RR") iijiCitcxojii г
в таком случае из-за диффузии и движения объемного потока.
ленпя коэффндиен ,а диффузии в бинарных смесях используется h.toceoc'ti, без
peiy.iL,прующего рольного потока. Fc-ти мольный поток в cmccii |ССМ1к>гентов
А и В обозначить как , о .7д' представляет c</>oi( резу.гьтирукяищн м<>.|ЬЦЫЙ
поток компонента Л через гипотетическую (движущуюся) h.'iOckocti, так, что
сумма молей 4 и В постони га по обе стороны , носкости. Величина J \ может быть
свячаиа с потоками через 7?/?' следующим обратом
1> плоскости отсчета). Х\ -- молннап доля компонента Л у плоскости RR'.
лоджии бы бить присвоены с001ветствуюш.ие символы. Уравнение (ff.2.1) пока-
лывает, что усзул1,1ц(1у1ош.11й поток Компонента Л через n.TocWCib RR’ обуслов-
лен диффузионной с-оставлякядей и состав.,я нищей <>бемкого пи ижа ху (Л Л
Для зквямо.чярпзй i.ptлнзодиффу-дщ \'д Ав - 0 и J'\! -- ,\Л.
Широко используется также плоскость без результирующей объемного
тазика, (к» она менее наглядна, llo определению
(11 22)
а ссои Уц — векторные мольные потоки компонентов А и В, огнсс'сщгые
и плоскости без объемного результирующего потока, to, по определению
'Де 1'д, Ур, — нарцпзаьнм мольные объема компонентов
1 и 1 - обьсм, ирчтадтидийся ин f мо,|Ь смеси Очевидно, чю ес.ц
1 , мь в смеси 1Ь|салЬ||1,|Х газов, то Уд = Уд
вес leoi'liii ||';1Вг'ДЯт i: вовффп гиени диф:|л ши D'XB
‘ b TFrej/p*!. >7)|7Г
где ii'.i'ii'Hi'i. £>'лв itcto менее Be mure гьцо к еосывз зе', 1) X|)
[!лдяя и с сострьа 'lowii'i-; не sh/ki:o дгя газов, e — D^r. 11 ’ имеет
si id 'iriui; д, и) жидких сне ге'! (c\t. разде । 11 °)
11.3. КОЭФФИЦИЕНТЫ ДИФФУЗИИ В БИНАРНЫХ ГАЗОВЫХ
СИСТЕМАХ ПРИ НИЗКИХ ДАВЛЕНИЯХ: ТЕОРЕТИЧЕСКИЙ РАСЧЕТ
ери давлениях от низких до умеренных Как было отмечено раньше в гл. 9 (вяз-
для диффузии (является Функцией гем лера гуры и зависит от выбранного за-
кона мсжмодеку.1яр'|ых си. i в id дно теф::твп>1 егалкиваюшихся молекул), ггав —
'iiipaKTcpHCTH'Tectoe расстояние (оно тоже зависит о* выбранио! о закона mwkmo.ic-
1,02 ||езавцсичс> ог состава межмо.геку-
.'ша'нение /?) может бо-
i fpilHHB /г.
,цого 1 азз.
.2 |(МА -? Мв^аЛ!,^
Потенциал Леннарда Джинст 12-Н. Как было отмечено раньше [уравце-
(9 4 2)), обн1ерасг!рос1раиеииач корреляция, связывающая межмолекуляр-
•»acpi ню взаилюдействця ф дву\ молекул с расстояние^ ' между ними, дается
Значение Qi; табу. skPob.i tf Ы в зависимости от Й7;е дли t>o теница та . кпнарда —
Джонса в неск'ьтьких рекомендуемых иС|ОЧНцках. цалрциер [(0(1, имеются
Также различные аналитические аппроксимации [04, 1(2, (66| [очное сздгцо-
шепце, цредтоженное Нойфсдьдом и др. [166], имеет вид
где
о________________r_ _ 1 ___г____ и
D ~ :р~‘В ехрйТ* ’ ехр/7* схр//Г*
(11 3,6)
С -0,10300;
F- 1,52996:
А 1,06036;
П = (Ш635-,
G = 1,76474:
В = 0,15610
L = (.03587
// = 3,89411
Пример ПЛ. Рассчитать коэффициент диффузии в системе ,\2—СО» при
500 К и 1 атм. Эксч;сримеита.|Ьнос значение, сообщаемое Эллисом ц Ходссном
[63], равно 0,575 си'А'с.
Решение Чтобы применигь уравнение (11 3 2), нужно знать значення
°СО 1 %.’ Фо, ₽N • Испольэ'’!< приложение G и уравнения (11 3 4) и
(11 3.5). )П|сем’ ссо'г = 3,941 A, uN> = 3,798 A; осо _N, = (3,941 +
-ф 3,798) 2 - 3,8695 A; fc0?fe = 195,2 К eN Ог - 71,1 К, =
_ [((95,2) (71 1) |1/2 - I (8 К Тогда 7'* _ fe7/£C0. N - 590 118 - 5,0.
Но уравнен и ю (11 3 6) _ 0,812 Следовательно, располагая шаиенними
Л1со.^ 4>1 u ЯХ, — 1,0 Уравнению (((32) получаем:
,, (/<858 1О-3) (59O:'/J) |(44 I- 28),'(44) (28Д1;-
’ (1) (3,869S)3 (0,842)
Погрешность составляет 11 % Э.щис и Хслссн рекомендует значения
е(-о _ 134 К и <iro _ч< _ 3.660 С этими параметрами про,лека (ывасмре зна-
чение коэффициента диффузии равно о,56 ем'А'с, т- е. бо.ке бти-жос к найден-
ному эрсцеримснгально. Расчеты нечувствительны к шачедиго £дв, но сильно
зависят от внбраи [Ого значения аде- I
Уравнение (11.3. [) получено для разреженных газов, состоящих из непо-;
лпрцых сферических одноатомных молекул, а потенциальная функция в осиов-
>нм эмпирическая, как и комбинационные правила [уравнение (11.3.4) Я
(11 3.5)1 Тем не менее уравнение (1(.3 1) даст хорошие результаты в широком
.цыиазоце температур и представляет собой полезную аппроксимацию значении
Удв 1«2, 83] Общий характер рогрсшностец, которые можно ожидать от этого
метод., выв,! 1Я1ЧСЯ сравнением расчетных и экспериментальных данных
(т.[б.1. 112).
Флаги ФняШим o'TCTouic-TbcrBoM является [О. что расс-[1тга[((г<х‘ (иачени*
Г)дБ относительно нечувствительно к припячому впячекаю Вдв (г даже к форме
ери [in той потенциальной функции. Значения е и о определяют по измерениям
вязкости (следовало бы. конечно, отдать предпочтение значениям найденным
ио данные о дцффуаци, уо последних одень мало). Колес детализированная теория
показывает, что возможно небольшое плцяице состава на D дВ. когда значения
п Л)ц существенно отличаются олцо от другого. В счетаэыюм цсслсдона-
Пц| лого в.тиярпя [23!)] бицгрный коэффициент диффузии был найден равным
6,416- 0.430 смг;с в пределах элстрсмумов состава R другом исследовании
(163] никакого влияний состава нс было замечено для системы метиловый
спирт - - воздух но неэнатительиые отклонения наблюдались для системы хлоро
фору -воздух.
Расчет коэффициентов диффузии ори низких давлениях по данным о вяз-
кости. 1[оско,'|Ы;у уравнения для вязкости газа [уравценне (9 3.9) J и коэффици-
ента диффузии [уравнение (11.3.2)] при низких давлениях основываются на о/цк-й
ц тон Иче теории Чэпмена -Эрскигя, они могут быть использованы для выявле-
ния соотношений между этими двумя свойствами газа.
Коэффикпен । самодиффузци Оду негне определяется следующим образом
мр aD пл
где вя.«кость i| выражена в пуазах. Отношение интегралов С|Одкновснг1Й £2у/£2.о
является слабой функцией кТ'ен приблизительно равно ) .1 при обычных темпера-
турах ')• Это значит, что величина Одд^А почти нс зависит от выбора модели сил
гзаим<1депс1вця и иотенциадыой функции. Кроме тщо, это объясняет, почему
ццитерий Шмцдта для газов гри низки* давлениях почти не зависит от тем-
пературы. Уравнение (I (.3.7), как показано в работах [227, 228], позволяет trpe,i-
сказать надежные значения Одд цс только для цротсых газов, но и Для ИСК
Эга теория связывает 1акже вязкость бинарной смеси с ее сос,авом. Поэтому
экспериментальные данные о нчзкостц в зависимости от состава смесей при ио-
сюянной температуре могут быть использованы как основа для расчета бцна^
него коэффициента диффузия Одв 151, 84, 101, 228]. Вейсман н .М-сон [22/,
228] сравнили результаты, получаемые по этому методу, с очень большим коли-
чеством экспериментальных данных о диффузии и обнаружили превосходное их
совпадение. Значения Одв, полученные с помощью этого метода, фактически
лучше совладают с экспериментальными данными, нем значения, рассчитанные
с помощью уравнения (11.3.1). Как будет показано ниже, уравнение (11.3.1)
иредсказьЕвас! зиаче11ия ©дв. которые обычно па несколько процентов ниже
Вели один или оба компонента газовой смеси являются колярнышг, то ис
пользуется модифицированное соотношение Лсннарда—Джонса, такое кик потен-
циал Штокмайсра. Поэтому необходимо другое пыражеиис для пнтщ рала сюлк-
«ювеппи [лу'ЕШс, чем уравнение (11.3.6)], и згтаченлй параметров потенциала
Леппарда— Джонса уже недостаточно, Врокау 119] предложил альтернативный
м<яоД расчета коэффициентов диффузии в бинарных смесях, содержащих поляр-
ные компоненты. (См. также разделы 9.4 и 10.3) Уравнение (11.3. () вес же не-
го (ьзуется, но интеграл столкновений в нем новый
'ab
T* — *Г/едв
УъГь
') О। ношение соответствует отношению Гиршфсльдера Q(2,2)’,'q<1 |,*1
:Снця которого в зависимости от Т' _ kT/i приведены в работе
где ftp — дипольный момент, дебай; V/, - - мольный объем жидкости при нор-
мальной температуре кипения, см:7мо-'(н, Ть - - нормальных температура ки-
пения, К,
Заметим, иго, кроме определения 'т<,ъ- молифдкатии В|,окау приводит
к иотепипа.ту скннарда—Джонса для смесей, содержащих этин итп оба пспо
-тарных компонента (i‘o__0). Влияние полярности широко езязаио с дппо тлным
моментом; зю допущение, может быть, нс всегда будет достаточным.
Пример И.2. Раее-штатг. козффиднеи г ,п,ффу щи для cmlCh хлорметана ( \ ) и
двуокиси серы (В) при 1 атм и 50 СС Данные, необходимые Для т;ссо-тьзовандя
СООТГЮП1СНИЯ Ьрокау пртведеиы ниже:
Дипольный момент. Дебай
Мольный объем жидкости. с\1Я/Л(ОЛ1|
50,6
249
263"
Решение. По уравнениям (11-3.9) п (11.3.[2)
. (1,94 Ю5) (I.9H „
(50.6) (240) ,J0
. (| .94 103) (1,6)2 _пл,
бв - (43,8) (263) ‘43
б,в = ((0,55) (0.43)]'^ = 0,490
Кроме ток», по уравнениям (Ц 3.[0) и (Ц.ЗдЗ)
=1,18(1 4-1,3 10,55)2] (249) = 409К
ebjk = ] ,18[1 4- 1,3 (0,43)2] (263) = 385К
елЬ,Д = [(409) (385)]'^ = 397 К
1]акг>ьси. но уравнениям (11-3 11) и (113 14)
Г (1,585) (50,6) -и/Э .
"д-(тглрдутоДз)-] ^3'8Г,А
_ Г (1,585) (43.8) , 1/3 so ,
<;1 I I 4- (1,3) (0.43)0- j
фл|, -[(3,86) (3,82)]'/! = 3,84 Л
ц.4. КОЭФФИЦИЕНТЫ ДИФФУЗИИ В БИНАРНЫХ ГАЗОВЫХ
СИСТЕМАХ ПРИ НИЗКИХ ДАВЛЕНИЯХ: ЭМПИРИЧЕСКИЕ КОРРЕЛЯЦИИ
Некоторые методы расчета Рдв D бинарных газовых системах при низких
давлениях сохраняют общую форму уравнения (11.3.2) с константами, опреде-
лимыми па основании экспериментальных данных Сюда относятся уравнения,
предложенные Арнольдом [9], Джиллилелдом [78], Вильке к Ли [243], Слет-
тери и Бердом [199], Вейли [11], Ченом и Отмером [35], Огмсром и Ченом
а также Фуллером, Шеттлером и Гиддингсом [68, 69]. Отклонения зна-
чений Рдн, рассчитанных по этим уравнениям, от экспериментальных данных
обычно составляв! 5— 10 % , хотя иногда отмечаются расхождения и более 20 %.
.Метод Фуллера, Шеттлера <i I иддингса оказывается несколько более точным,
щ. тылом числе данных
Метод Фуллера, Шлеттера и Гиддингса [68, 69] Предложенная AinMpit-ie-
:;:ая корреляция имеет форму уравнения (11-3 2)
10-эт17ГЧ(-Ид - MinMWhr'1’ , л
1,М --
1 Т гя,гр<-|а,с,:<> и i«."j(,4nij<rx, а Р — в физических атмосферах. Чгпбы вы-шс гигь
Чс, (ледусг нспоть;ова|0 j и >, чен и я cijc газлякнии х атомных днффу знойных объ-
' (в, ирнведс1ыых в табд 11 1. Эти составляющие были оаредслеиы с помощью
ivyitсезонного ача-итза 3W эксперимеигаиынчх значений коэффициентов дщффу-
175
ТЛГЗЛИЦА 11 1 Атомные диффузионные объемы, используемые
при определении tto методу Фуллера, Шертлера и Гиддингса1’
и 1 mpymiiijp„ые cocmmi.w щие autfuf узионни,х о6ъ< н
Ц 16,5 (С1) (19,5)
1.98 (5) (17.0)
(N) 5.48 Ароматическое кольцо —20,2 20.2
(5,69) 1 е_сроцикличесцое
КОЛИНО
Диффузионные объемы ля простых t'oicyp, г t
Н2 7 07 СО 18,9
d2 6,76 СО2 26,9
Не 2,88 Ч2О 35,9
нф 17,9 NHS 14.9
О2 16.6 н2о 12.7
20,1 (CF2C12) (111.8У
Аг 16,1 (SF.) (69,7) (37,7)
Kt 22,8 (С)2)
Хе (37,9) (Вг2) (67.2)
(SOJ (41,1)
’> В скоб <ц заключены значения, оси оезппыс только на нескочьк
Зци в 153 бинарных системах Корреляция (11.4.1) не может выделять изомеры.
Нсйн и Феррон [165] установили, «то точность корреляции была низкой для
полярных газовых смесей; именно они предложили эмпирический корректирую-
щий член [( 2[')а3 + ( S1');/'1]2, Учитывавший изменение темпера,уры. По-
добное у । o-niсиис для более общего стукая было предложено также в работе 1188].
Марреро и Мэс.ок 1143] показали, что уравнение (II 4 1) надежно ирц умеренных
и высоких температурах, „о часто неприменимо при низких температурах.
Метод, основанный на использовании принципа соответственных состояний.
Лоско-'ькуОр бшрдЗмерно, если п—kT Р,оп " I'/3 : 3, уравнение
(11 3 11 можно преобразовать, иСцО н.яуя безразмерный коэффициент диффузии,
(11.4.2)
где
Л4дв —
Опредеаепне ne.ni'iiiii Р, ц Тс,ё несколько неопределенно при такой
замене, п безусловных правил их вычисления сформулировать нельзя. Некото-
рые авторы пытались разработать обобщенные корреляции, основанные на ис-
пользовании принципа сошвстсгвенпых состояний 166, 178, 204] Матур и
Тодос |145] использовали уравнение (11 4 2) для коррелирования констант
•ipn высоких давлениях (см ряздез 11.6).
П-5. СРАВНЕНИЕ МЕТОДОВ РАСЧЕТА КОЭФФИЦИЕНТОВ ДИффУЗИИ
В БИНАРНЫХ ГХЗОВЫХ СИСТЕМАХ ПРИ НИЗКИХ ДАВЛЕНИЯХ
Ряд чнс. 1СППЫХ оценок •(редложенных методов расчета коэффициентов диф-
фузии в бинарных 1аз0В(,|Х системах представлен в литературе. Лагг [ 134] из-
мори I значения D.yu лтя 117 систем в воздухе при 25 ''С и сравни । свои экснсри-
ментальные данные с результатами по некоторым упомянутым выше методам рас-
иста £)дн- К лучшим результатам приводили методы Чена—Отмерз и Вильке—
Ли. Первый из них, однако, требует знания критических свойств, поэтому он
не Moi быть применен к более чем половице иеследомнных систем Вильке
ii ,'1и заменили хонстацту 1,858-10-3 в уравнении (11.3.2) величиной 0,00217—
0,00050 [(А1 л -|- ,МЕ) 'МлА7в]'^2. Для этого метода не нужны данные о крити-
ческих свойствах, по необходимы Значения е и п. Чтобы найти эти значения,
Лагг использовал эмпирические правила, предложенные Вильке и Ли для пара-
метров чистых компонентов, т. е.
где Vj, — объемы по Ле Ба (табл. 3.13); То — нормальная температура ки-
пения.
Для воздуха были вь,брань| значения с — 3,617 А и t'k - 97,0 К, не-
сколько отличающееся от приведенных в приложении С- Использование урав-
нении (И 5 1) приводит к результатам, очень похожим на те. которые получа-
ются по правилам Брокау [уравнения (11 3 10) и (11.3 11)], поскольку для систем,
одним чз компонентов которых является воздух, ё = 0 Величины рап и яав
рассчитываются по уравнениям (11.3 4) и (U 3 5). Применение расчетного ме-
тода Вильке—Л,, иллюстрируется примером Ц.З.
Пример fl.3. Рассчитать коэффициент диффузии х-юрнстого аллила (А)
в воздухе (В) при 25 °C и 1 атм. Экспериментальное значение, сообщаемое Лаг-
юм []34|, равно 0,0975 см’/с.
Решение, Используем сначала метод Фуллера, Шегглера п Гиддингса.
Находим цО табл 11 1 значение
Sc (В) = 20,1
Поскольку (А) = 76,53 и М (В) = 28,8, по уравнению (Ц 4 I)
(10-3) (298' ") ((76.53 + 28,8)7(70,53) (28 8))1'2
1 'АВ-------------—,.о —,от; ..V312------------ - С
Теперь воспользуемся модификацией Вильке—Ли уравнения (]] 3 2)
Для воздуха по приложению С находим с (В) — 3,711 А и еД (В) 78,6 К.
Данные по хлористому аллилу в приложении С не приведены . 11о уравнениям
(11.5.1) с Т/, -= 318 К и Vb — 87,5 см3/моль (объем ,ю Ле Ба рассчитал па
основании
Тсгда по
Следовательно
табл- 3.11) имеем;
а (А) - (1,18) (87,5)|/3 = 5,24 А
г/k (А) = (1,15) (318) = 366 К
уравнениям (11.3.4) и (11.3.5)
б/Алв - [(78,6) (366)1* 2 = 170
298
170
Но уравнению (11 36) находим £2/д _ 1,13.
0,00217
ТАБЛИЦА 11 2. Сравнение методов расчета коэффициентов диффузии газов
при низких давлениях
1 1- ное зпа 'Д । 1 — —
1 Фуллера
1 1но;.ет.:- Ви.'ы<с Шеттлнр.
I ЧСС.'ИИ
ДКНГСч
ЗоЗДуХ—ДВ\ ОКПГЬ 276,2 fl 1 1 э 1104 -6 4 _з
углерода 717 > 0 I / 7 [104 -3 з 1
Зоздхх э-иловыи 313 O.I45 L14-1I -10 0 - 8
'ТИрТ
Зоздух—гелии 276,2 0,624 L101 0 з у
317,2 0,765 [101 2 □ .4
346,2 0,902 1104 з 4
Зозду.х—ннексаи 294 0,0800 1-0 (, Q 6
326 0,0930 131 1 и ч
Зоздух — н гептен 294 0,071 |31 [Г) 28 15
Ml 0,0985 131 21 \Т 19
Воздух—вода .313 0,283 |31 18 (। -5
Аммиак— ди этиле- 2.88,3 0,0999 [202 —23 — 16 । ]
<ЫЙ эфир 337,5 (>,137 1202 23 16 7
Аргон—аммиак 254,7 0 1аЭ [201 з 13 26
333 0.253 [201 12 19
Аргон—двуоки<.= 276 2 0.1,33 [104 — 17
глерод.т
Аргон—гелий 276 2 0,046 [104 -1 2 з
288 0,696 |3/ —2 1 .4
298 0 729 1191> 1 з 2
418 1.398 [32 10 -8 7
Аргон—водород 242,2 0,562 [174 —2
295,1 0,83 [230 —9 — 1 —7
448 1,76 [230 -13 —6 9
628 3.21 [230 -15 —8 Ю
«06 4,86 [230 -15 Q 8
958 6,81 [230 -19 -13 11
1069 Р 1Н |230 - 19 — 13 11
Аргон—криптон 273 0,119 |200 1 1 з
Аргон—метан 298 0,202 |32 15 6
Аргон—jjeoii 27,3 0,276 [200 з 6
Аргон—двуокись 263 0,077 [144 24 38 25
Аргон—ксенон 195 0,0518 [321 1 11 2
194,7 0,0508 121 0 12
329 9 0,137 12 -1 2
378 0,178 [32 2 10 5
Двуокись у'1'.iepo 194.8 0,0516 J4J 7 1 16
да —двуокись уг- 312.8 0.125 14 3 5 Ю
лерода
Двуокись vrne,)(i- , ।, > 0 531 I 104 —2 । 6
да- -гелии 298 0,6'2 [1951 -3 0 у
299 0.6И [1951 - 5 2 6
340.2 0,7(45 [104 - 1 2 —4
498 1,414 [195] - 2 0 . 1
Продолжение
Система / к 1 ине зна 1 ' 1 '2SS е (з %; an .j'k-h н ,
них даппь len.ipra
Двуокись углеро- 298 0,167 224 - 9
да—азот 299 0,171 228 11 1 J
Двуокись углеро- 194,8 0,0531 14] —11 А
да—закись азота 312,8 0.128 4 Л --2
Двуокись углеро- 293,2 0,153 225] 3 7 3
да—кислород
Двуокись углеро- 263 0 064 |44 г. 12 27
да—двуокись серы 173 0,195 144 3 21 16
Двуокись углеро 307,2 0,198 |37 -20 - 13 12
да—вода 328 6 0 257 13/ 30 -23 А
352,3 0 245 193 — 14 6 |)
Окись углерода— 194,7 0 109 13 -14 6 13
окись углерода 373 0 323 13 - 2 “-8
Окись углерода— 194,7 0,105 |3 а 0 —8
азот 373 0,318 г. з с
Этан—я-гексац 294 0,0375 |31 37 52 80
Этилен—вода 328.4 0,233 193 у
I елий—бензол 423 0,6[0 19h 8 12 6.
Гелий—я-бутило 423 0,587 195 10 12 2
вый спирт
I елий—этиловын 423 0 821 195 з 7 -5
спирт
Гелий—я-гексил о- 423 0,469 195] 16 19 1
вый'спирт
I елий—метай 298 0,673 [321 3 б 6
Гелий—метиловый 423 1,032 195] 10 ]
спирт
Гелий—пеон 242 2 0,792 174 —6 4
341,2 1,405 ||74 7 з
Гелий—азот 298 0.687 [195 ч
Не индикатор 298 0,130 231 71 i 5
N2 индикатор 298 0.688 231 0 3
Гелий кислород 298 0,720 J95] 2 2
1 елий—я-змило- 423 0,507 [1951 16 18 2
вый спирт
I елий—цзопропи- 423 0,677 195 7 9 -4
ловый спирт
Гелий—и-пропи- 423 0,676 [195] 18 20 -3
ловый спирт
Гелий—вода 307,1 0,902 р.З] — 1 2
352,4 1.121 193] 4
Водород—ацетон 296 0,424 1441 О _ з 17
Водород—аммиак 263 0 57 144 4 1 17
273 0,745 194 — 15 17 -5
298 0,783 144 _ 4 7 6
358 1,093 144 4
47.3 1.86 [44 $ 0
533 2,149 194 2 — 1
Продолжение
с, т. к 1:ое зня- dab'’- (CM*/C)ETS Литера ра«ч>
’SET
Водород—бензол 311,3 0,404 L107] 0
Водород—цикло- 288/ 0,319 [107] - 3
ексан
Водород—метан 288 0,694 [32] -5
Водород—азот 294 0,763 [1941 —у
298 0,784 [144]
358 1,052 [144] —3
573 2,417 [1941 —8
Водород—пипери- 315 0,403 [Ю7[ —2
дин
Водород—пиридин 3 [8 ч 0,437 [Ю7[ —5
Водород дпхокись серы 285,5 473 0.525 1,23 [1441 [1441 -5 0
Водород -тиофен 302 0,400 [Ю7] 0
Водород—вода 307,1 0,915 1,121 [371 — 12
328,5 [193| — 17
Водород—ксенон 341,2 0,751 [174| — 1
Метан—вода 352,3 0,356 [193[ •— 11
Неон—криптон 273 0,223 [200| — 2
Азог—,аммиак 298 0,230 [144] —5
358 0,328 [144] —6
Азот—бензол 311,3 0,102 [107] —4
Дзот—Циклогексан 288,6 0,0731 1Ю7] 1
Азот—пиперидин 315 0,0053 [107] —3
Аил— двуокись 263 0,104] [144] —3
\зот— вода 307,5 0,2561 [1931 — Н
328,9 0,313 —17
349,1 0,3541 [37] - 17
352,1 0,359, |193| -17
Кислород—бензол 311,3 0,101 (107) —9
Кислород—тетра- 296 0,0749 [1441 —5
хлорметан
Кислород—никло- 288,6 0,0746 [Ю7| —7
гексан
Кислород—пипе- 315 0,0953 [Ю7| —7
ридип Кислород—вода 352,3 0,352 [193] -15]
и_
Абсолютное сред-
нее отклонение
480
I(7b,53+28,8);(7b,5J) (28.8)]'' -
Погрешность p.-icicia ио каждому из двух ьассиотрситых ме|одоп состав-
г2.,г>°11.
Позднее Эллиот и Ватте [62] измерили значения коэффициентов диффузии
мпотих углеводородов в воздухе при 25 СС и низком давлении. В этом случае
метод Виднее—Ли тоже давал лушиие результаты, несмотря на ю, чго и дру.
гие методы приводи ти к средним отклонениям в пределах около 4 %. Вычисления
по методу Впльке—Ли проводились так, как описано выше
Оценка метода Фуллера, Шстыера ц Гиддингса [68, Ь9] i,o имеющимся
данным, относящимся к наиболее низким температурам, показала, что урав-
нение (I |.4.1) имеет наименьшую погрешность, хотя методы Впльке—Ли, Чена
Отмера и уравнение (11.3.2) в этом случае также приводили к небольшим погреш-
ностям. Готох и др [82, 83], проверив уравнение (11.3 2) по новым данным для
систем, содержащих Цд, М., 8Ее, СЩС(. С..НЪС1 и предельные углеводороды от
метана до неопентана, нашли его точным.
Экспериментальные данные сравниваются с расчетными по трем методам
в табл. 11.2. За исключением нескольких значений, на которые ссылаются Мэ-
сои и Моичик [ 144], все 114 экспериментальных точек были взяты из оригиналь-
ных источников Не делалось никакой попытки дать оценку степени точности
экспериментальных данных. Из табл 11.2 следует, однако, что расхождение
между результатами различных исследователей составляет иногда несколько про-
центов По двум значениям для системы гелий—азот при 298 К можно судить
о незначительном влиянии состава смеси, которым обычно ц пренебрегают
В табл И 2 включены данные, полученные по четырем разным эксперименталь-
ным методам.
Из табл. 11.2 следует. чк, уравнение Фуллера—Шетглера—Гиддингса даег
результаты, несколько лучшие, чем получаемые to теоретическому уравнению
Среднее отклонение значений, полученных по последнему методу равно 8 %, по
вычисленные значения в среднем на 3,7 ниже Это может приблизительно компен-
сировать ту ошибку, которая часто возникает в завышенных экспериментальных
данных из за невозможности исключения ьоивекнии. Для систем, содержащих
воду, теоретические значения почти всегда на 10 % ниже, что и послужило ос-
нованием для введения в этих случаях в уравненье (11 3.2) эмпирического коэф'
фициента 1,09 Температурные функции, входящие в несколько уравнении,
включенных в таб.ч. 11.2, проверены недостаточно; температурная же функция
теоретическою метода как было указано в предыдущем разделе, оказывается
весьма хорошей.
Рекомендации. 11н основании численной оценки, представленной в табл 11.2.
а также других проверок, описанных выше, можно рекомендовать следующее.
(. Для простых неполярных систем при умеренных температурах исцоль-
Зевать корреляцию Фуллера, Шеттлера и Гиддингса (11.4.1), отклонения дол-
жны быть меньше 5—16 %
2 . В случае систем, содержащих полярные компоненты, применять метод
Брокау [уравнения (11.3.2). (11 3 8)—(11 3 14)]; отклонения полученных зна-
чений обычно меньше 15 % Дипольные моменты многих веществ приведены
в приложении Л.
11.6. ВЛИЯНИЕ ДАВЛЕНИЯ НА ДИФФУЗИЮ В ГАЗАХ
При низких и умеренных давлениях коэффициенты Диффузии в га.тах обратно
пропорциональны давлению н п-и/иостн. Этот экспериментально установленный
фак-т согласуется с теорией [см. уравнения (113.1) и (11.3.2)].
Большая часть экспсримснталынлх данных по /Ы|ффуэш| при высоких Дав-
лениях относится к коэффициентам самодиффузии. Доусон, Курн и Кобайяши
[50] провели особенно широкие иселедозщше коэффициентов самодпффуз|Ш в мс-
16 |>,ГД |>
481
Рис. II 4 Зависимое’». произведения />.
Рис. 11.5. Коэффициенты диффузии в
'Л (C2[I6) =- 148 см3<моль, Zt (CH,) 0,288. 7, (C,I|h) = 0 285. 4 (CHi, -
- 16 0, M — 30,| i,«ee;i:
ГЧ11 = (0 8) (190,6) (0 2) (305 1) —213,6 К
1^,^ = (0,8) (09.0) - (0,2, (1 la) -» 108.8 cm3 'mo.il
Zfrj = (0,8) (0,288) + (0 2) (0 285) = 0,287
O„-<«.287) <82,07,
ли =(0,8) (16.0) -(0 2) (30,1) _ (8.85
18.85
40 - 273
—213Л
(.16
Следовательно, из уравнения (11.6.2)
(10,7 IO-3) (1,46)
(О, (78) (0,779)
11,3 IO-3 см‘,с
Рассчитанное знамение Рдв приблизи)сльро на 30 % выше эксперимен-
тального Конечно, уравнение (1 (.6.2) не было предназначено для бинарных
коэ<|<фи| центов диффузии, но оно даст нр|1б.ти<кепиые. хотя и яцно заг,ыи1е(Н1ые
расчетные значения.
11.7. ВЛИЯНИЕ ТЕМПЕРАТУРЫ НА ДИФФУЗИЮ В ГАЗАХ
При низких давлениях, Когда можно ппимсня,ъ закон идеальных газов,
по уравнению ([[.3 2) нетрудно установить, что
Р ~ сона!
(И.7 2)
Марреро и Масон 1/4-’] «оказали, что л большшыгас случаев веынтина
(0 Io Qp)/(3 1и Т) изменяется г>г 0п- 0,5 Таким образом, Dab меняется про-
порционально T^-t-T- Этот резудыат согласуется с эмпирическими расчет-
ными методами, упомянутыми в раздето И 1 например, п эмпирической корре-
ляции Фуллера, Шетт-тера ц Гиддингса | у равнение (11 I I'] Р Т ,6. Однако
и Широких диапазонах темюратур показатель степени при I изменяется. На
рис. jj.6 представлено прнблпзптсн.ное. изменение этой» показателя в зависи-
мости <>т приведенной гсмпсратуры Он сначала возрастает, а Затем уменьшается.
Это свидетельствует о том, что большинство эчпцрпче» ких методов расчета с ио-
.......... iiuii.i 1.1 irji'h, и |V । j, .. ,ii : г и nniiiricii'i tri. i г .гч । 11 x .ir.'iit.rioin '4 it 11 itxtejllr-
T p it д В I Г прсдпо-
','11,111 I Mil Ci'.'III ox Im I IJ Hill "I CH II II 11II IK II И 'I 'I M I H‘ П; r I V ton,HI ,111 :i 11 in,, II.
11.8. ДИФФУЗИЯ В МНОГОКОМПОНЕНТНЫХ ГАЗОВЫХ СМЕСЯХ
ИесКи.тЬКО ОСНОВНЫХ ПОНЯТИИ, ОТНОСЯЩИХСЯ к диффузии В ЧИОГОКОМГ|ОНСНГ-
иих смесях жидкостей (си раздел 11.13), можно нснользоп.ать также для газовых
смесей. Одной из проблем, связанных с дщффхзией в жидкостях, является то,
что даже Си парные коэффициенты диффузии очей,, часто завися) &| состава. Сле-
довательно, для мно!окох<понснтш>й смеси жидкостей трудно и<мх <и~ь численные
•значения коэффициентов Дш|>фуз)1И, связывающих потоки с концентрационными
градиентами.
мым от состанз. При таком приближении хщогокомпоцепгная диффузия в гаазх
обычно описывается уравнением Стефана -Макспелда
(11 8.1)
где с, — концентрация комтю-тепта t с — концентрация смеси, J ; — иотоки
KOMiioiieiiTOB i и D,, бинарный коэффициент Лиффуэщт в смеси компонентов
। и j; Vx, — (радиент, выраженный в мольных долях компонента i
Уравнение (11.8.1) л топчается от основного тоэотнечпения для бинарно, I диф-
фузии (И 2.5), цс всполь-юнанно в пси обычных бинарных коэффициентов диф-
фузии очень удобно ггрн расчете Марреро и Мэсоц 1142 J обх’у.клтюг хнпТочиелс г
«иле допущения, касающиеся Ураг.пенця (118 1)
Попытки jnpKCHcpiioi и р,1счет.1 потоков в чиогокомгоионтци'Х' системах
о.- чЕУф
(11й 2)
О ((рсзс.тс (1 г ,1
11.9. ДИФФУЗИЯ В ЖИДКОСТЯХ: ТЕОРИЯ
ФФ:
нкщства.
11.10. РАСЧЕТ КОЭФФИЦИЕНТОВ ДИФФУЗИИ В БИНАРНЬ|Х
ЖИДКИХ СМЕСЯХ ПРИ БЕСКОНЕЧНОМ РАЗБАВЛЕНИИ
Рнс- ii н. Сравнение корреляции для коэффициентов диффузии и ноле и Уравнения
•Днпх
лииари н).
>лд\'эдл и Баби |z,i] (1рсдП(1.'К<жи.')И.
Pit- И [ 11 г 1 ipiMeip 1 ЦП Я
рацне-tilH
ТАБЛИЦА [13. Сраниепие экспериментальных и расчетных значений
коэффициентов диффузии воды в органических растворите.'шх
I М
1,18
1,26
0,67
0,60
0,14
О 0024
8.80
2,24
7,18
0.82
1.(53
(к 12
2.53
(5.153
8,64
•5.6 5
об
3,83
1,80
I 20
0 50
О 51
0,55
(1,29
0,26
0,361
0,15
0,00| 0
3,72
0,07
0.3(5
0,71
2,66
1.10
2,88
2,46
3,12
1.00
'Ией и метиловом спир-с rrj,n 30 °C Вязкость метилового спирта при этой тем-
пературе состав.тйог 0 514 сП а модт.иыи <161,04 лтчпичопой кислты при тер-
мальной теМперат>;>е книсиия ране,) |73,8 cm-imo.ib. Молекулярная теса мсти-
,'1<>н<1| с, сиир'а И — 32 01
1-' е ш ев г < По ypspticiHno Щ 15' И с '-О 1.3
[(1.5) (32.04)]1 (303 ?)
(0.514) (173,81° ь
'iia'ieinie
тальных зиакснип коэффициентов дпффуяп, при бесконечном рачбанленпи пр°
ЩО
ii'ini.ic зиа-
Р п
i'll
4I>
бом [уравнением (JI lu.8i ] эти авторы обнаружили, что для указанных растворя-
емых веществ, были (-.еобтодимы различные значения г\ и В в зависимости оттого.
алканом ичи с iiiJitom являлся раствори гель
Эти и другие исследования [72, [36, 226) ясно цоказыпяют, что и широком
диапазоне температур или вязкостей растворителя простые эмпирические кор-
реляции представ.Тс‘Ш1ые выше, неадекватны. Коэффициент диффузии уменьша-
ется пс и|юпор|ц юн ал ыю подрастанию ehbkoci и раствор|иеля, a D i] rJ, где
k называю'
140 с\Л'моль.;За исключением с;п чаев ииз-
приведен-
- - Шайбель -
— Вллте a yens -
—- Гойдин <. Лодп_
корреляция представлена на
одинаковые значе-
Обсуждение и рекомендации кпэффи
циенты диффузии в жидкостях, Водные
растворы неэ зектролитов. Про-
верены методы Вилвке—'Ic-ira, Щай-
бсЗ|я, Гайдука—ЛоДИ, Редди - Чорэспей-
ми к Кинга—Хсу Мао Обнаружено,
что два последних метода менее точны
Резулыгггы расчетов по первым трем
ных растворов все о"|) могут быть сведены
к форме
40 ч
ТАБЛИЦА И 4 Коэффициенты диффузии в водных pacieopax при бесконечном
разбавлении
ТАБЛИЦА И.Ъ. Коэффициенты диффузии в органических жидкостях при бесконечном раабаа.тении
Метилэтилкегоп
Кислород
1,J,4 I рихлярбеп юл
Винилхлорид
Кксуюия кис.нл i
15
Муравьиная кисло.';,
I ||''Тебенвол
Вода
Ьр<>\ [бензол
1 етрахлорметап
Додекан
н Гексан
.Метилэтилкегоп
Пропан
Бензол
Бромоформ
Камфара
Диуокиа. yi.iepo.n
Глицерин
1 Гибснзол
Кислород
I 1ирИД|,Н
.Мочевина
Teipax lopMciai,
20
Бензо.1
1.19 |203| — ‘I ’> ] 7 3 1 -3,4 0
1.85 [190. 191] — 1 1 2 3 4 5 4 5 8 3
2.39 | |‘Ю, 191 j - 2 1 1 ; и г, 4'о 1 3
1.34 [2011 — 18’ — <\О —О । 13 — .
1 77 [2031 Об 6 8 Г, 1 1.3 9.0
2Д2 [ 1 ,> ] 39 зГ .44 61 10
3.31 133] 29 32 59 34
404 [2331 33 .'.1 61 1 1
Ч ( >0 [33 | 13 20 32 ю I,
1331 аб 31 13 8 1 14'
2.91 [(831 0.7 I а [д 17 1 4
4 ,16 [169 | 3) 40 22 ';> 100 ] |
2Д() 1233] 16 6,1 8,7 1(1 19
3,70 [88 [ 8.6 -2,2 (। _> j '*1
2.7.3 [2171 -13 — 1 , а о । ,
4,21 Ц391 — 10 - 2о - 18 f'( 'У 4 3
3 ‘ 4 [о 1 23 5 0 8 3'1" У 1
4 '87 (961 6.0 — 15 22 21
4.21 [,33| —6.9 - 15 1 3 Q
0.98 11101 1,а 4.1 4 1 14 4 ]
0.81 НЮ1 1 2 4.9 4 О | i
1 81 [138] - -4б' — 4! 41 -ю' — Я
0.97 [207] 2 1 О 1 Ь 1 2 I
0,7(1 [1101 ] - 10 — 10 8.5
.< 9 ЦК»] - 1ft (,н —68 — 49
0ю1 [1101 90 8*а ,4'1 90 '9
1.32 [33] — 1 5 12 — 1 о _ у ч [ 7
1,00 1110] -19 — К» -16 — 18' —.8
2 64 Ц23] 1.(1 -З*1 —42 4 5 18
1,10 [ПО] — 17 18 - 18 । 8 —8 2
0.54 [НО] >1(10 70 70 10)
1,24 1124] 24 >10 1 | г
1,50 цзм 2‘) — Я 31 2’1 1 0
о.зэд г,‘.> 16 3,2
0,988 1138] — 48 г.г 53 -19 —38
0,627 Ц38] -44 -11 4! 4 > — 30
ши.
•meopumi
ФФ:
4Ф:
ФФ1
КОЭФФИЦИЕНТОВ
fl.11. КОНЦЕНТРАЦИОННАЯ ЗАВИСИМОСТЬ
ДИФФУЗИИ В БИНАРНЫХ СМЕСЯХ ЖИДКОСТЕЙ
В разделе 1 ] 2 предполагалось, что коэффициент дцЛфузки D дв может быть
пропорционален In o'))to lit art )г. p в Гитарной смет p, — актцпность, x —
мольная дол*)) 11а основании уаавнеипя ( нббса Дюгсма величина |(О hl 6)
to In v) ] будет од|И1аыл1ой нсзагшеимо oi rot'o. для x.ikoio компонента- \
запись; вается.
Рас
Различные солелл жиДых ти показывали, ьак /> хв может пзгиснятьси с мо ть
I г40 ].
Рис. Illi
:,0(i
tl.13. ДИФФУЗИЯ В МНОГОКОМПОНЕНТНЫХ СМЕСЯХ
ЖИДКОСТЕЙ
VHoruxoMiioirerrTHiiiX
-П.л.хс. (u т>
('>,62
З.М
•5,33
динамическую теорию для определен).я тройных коэффициентов диффузии. Хотя
при этом был ,|01'.ти1 нут ।|сю>)<>[ч,;н ycicx, однако снова требовались обшнрюле
данные до актрп.-юстям, мольным объемам и вязкостям пиегых komoouchiob и
смеси, а также кюо:[?<Ьлщ'сл ы дикфезпп индикатора и бинарные коэффициенты
диффузии
деления М1и;го'<о.'и1г1цсп7!1ь:х коэфсрпниектов диффузии Для жидкостей Однако
11.14. ДИФФУЗИЯ В РАСТВОРАХ ЭЛЕКТРОЛИТОВ
Когда соль диссоциирует в растворе, в диффузии участвую, ц<->цы, а не мо.ю
кулы, Однако при отсутствии электрического потенциала диффмзпя ,росгой сочи
рассматривается как молекулярная.
Теория диффузии при низких концентрациях со.кй ра.-вцта хорошо При кон-
центрациях же, нсгрсчаюц1нхся и большинстве промышленных процессов, обычно
приходится 1рцбегать и хчииринеским соотношениям с соответствующими поте
римц общности и точности Йсчсриываюи'ее обсуждение этого вопроса можно
найти в работе |1С7].
Дли разбавленных рас,воров простых co-ien коэффиццсн г диффузии даедя
урпвпенцем Нерпе ,а — Хаскелла
L 'в - Fa ’ 1//Д ы 1/7.2.
।дс — |>оэфф)|Ц|1С|,1 Д|.ффузИ|| при иескоце'1||Ом разбавлении, основ.,ш|ьг,1
на мольной концентрации, см'Фс; Т — температура, К R. — 8.314 Дж.фмоль-К) -
универсальная газовая постоянная; Аф, }.* — предельные (нулевая концентрация)
ионные проводимости. А/1 (см") (В/см) (г-экв/смл) nt, п_ — валентности катиона
n annoi-a. ссютвсклветю', Fa — 95 500 цултм'-экв — число Фарадея.
Значения 7^- и л° Для многих видов попов при 25 СС могут быть найдены
в гибл. 11.6 или в других источниках ,158, )85]. Если необходимы -yia'ieiiun 1.1 п
ТЛБЛИЦ411 6 Предельные значения ионной проводимости в воде при25"’С (91 ]
3.10'10.111 ч а,;"Ь| ,1 Л . [ (СЫ;) (П/СМ) <г экв/см"))
КОф
С1О(
ЦСОй
I-lCOc
5 4
53
09,1
102
у, — средний коэфотщиенt акai:biiociи ионов расаворснного пегцеетва
В бидышшетве civml’b ироизвсдсоис (р 1 , 6.1,, ,ко к I'.oiiuiuc. i<ik
коэфоьииепта диффу.иш г,г> сКГцвкосгям upii бесконечном pa;it>aB.iciini
Рекомендации. ri'jC'ri-
данныс в таб..
Пример 11.10 Опре i< i•
П1111 ] ,5 ( пя <мл. j и воД|>| рпви,| 1, ] 44 r'J ] поз юУ у 3ii<i'ierii|C El A[j npi, I a °C co
(11 11 3|
(11 1>! 4)
где A+. A_ — I1.(<1I1«)CB| .ruipipY^KOtiiii.n 1,0 ОКОН K.TTIiOilOB 1| «1 ГГИоцОП, соответ-
ciuctiiio. г-экв (cmj-c); cooiBCTcrByicwiie Knutieinpaniilt ионов i'-skbA'M5;
ilE r<i/ градиент едсцтричсскаи noTeHtliia.ia
Этог градиент Г|оже каааткся тиюшним. по присутствует в ион нОм расторг
с1<1ЖнЬ|М11 пипами и коррекциями атti’bikiCtIi можно нренебречт.
RT'i.
ОБОЗНАЧЕНИЯ
it Fk
Глава 12
ПОВЕРХНОСТНОЕ НАТЯЖЕНИЕ
12.1. СОДЕРЖАНИЕ ГЛАВЫ
|ДК1
12.2. ВВЕДЕНИЕ
12.3. РАСЧЕТ ПОВЕРХНОСТНОГО НАТЯЖЕНИЯ ЧИСТЫХ ЖИДКОСТЕЙ
По мере того м\ гемдература повышается, поверхностное натяжение жидко-
сти, находящейся в равновесии с собственным рнром, уменьшается и принимай!'
пулевое значение в критической точке |47 | При приведенной температуре, рап-
ной 0,45--O.65, впадения о для бо.тьщпиства органических жидкостей находятся
в предетах от 20 до 40 Дии/с.ч. цо для некоторых жидкостей высокой плотности,
имеющих низкую лшлеку,1Я|>1пто Лиссу (таких как, например, формалин), а >
> 50 дин. см. Ди» нодд о . 72.fi дщрем при 20 'С; для жидких металлов вначс-
< составчают 300—00(1 дкн/сч (например, piyri. пру 20 °C имеет поверхност-
ное натяжение около 176 дшт/см) Новейшие экспериментальные значения по-
верхностного иатч/кегшя различных жидкостей nOc.ie тщательной их оценки со
бра.г Jicnep [2У].
В основном вес приемлемые истоды расчета поверхностного нЗггжеиия ;кг<л-
Корреляция Маилеола— Сагдена Сагден [33| п 1023 ярсдло/кил соотиошй-
tttie. ci'H^iJuaioiiiee nilnepxuocTiK1e натяжение с iuoihoc цгмп жидкости (н п ее
PlK-i'J
ии экспериментальные данные о поверхностном натяжении и
оеднпешш, вычислил их парахоры. Па основании значений
[. При :iciic>b^Toatrirw значении |А], определен-
;оом. поверхностное натяжение выражается в динах на санти-
тод иллюстрирус
римсн гальными
Пример 12.
I 1 .Г1 ГМК К I JI1 JI о
It I тонне (.( < II
Р е ш е ч и
Н чч in; ।
стоя примером 12.1. Расчетные значения гт сравниваются с экеис-
в таол. [2 2.
,,темпе Ягиг-ром [2ч]. равно 2).30 ЛиН'СМ-
с. При 00 ’U плотность жидкости 0.9(2 г/см- Г2М J, ti-ти. с мчегоМ
= 0.912/W.107 — ) ио5-10 2 моль/см-. Температуря оО ’С значн-
|Р] = CIIa -СН(СН,)-+ -СООН = 133,3+ 73,8 = 207,1
Тогда по уравнение (12.3,1)
о -= [(207,1) (1,035 1О'г)|1 = 21,10 дин'см
Погрешность = 2' ’ '^"зе ' 100 = 112%
Поскольку с про порциона гЬпо ([Р] рц)4, уравнение (12.3 1) очець чувстви-
тельно к значениям парахора и плотности жидкости, Удивительно, что расчетные
значении С так точны, как sru показано в табл. [2.2,
Вместо экснернмсвташиых данных о плотностях могут быть использованы
значения, полученные по корреляциям, связывающим р с Т (см гл 3). Еще один
метод, нс рассмотренный в гл 3, был предложен Голдхаммсром [)9] и обсужден
Гамбиллом (17|
Р ( I — Тг \п
+.'-%++) 02.3 2)
MoJib'CM1. Значение показателя стеренп п находится в пределах 0,25—0,3]; Фиш-
тайн [15] приводит следующие значения п:
Ciinpii,i ' 0,25
Углеводороды и простые эфиры I 0,29
Другие органические соединения I 0,31
Подставив соотношение (12 3,2) в уравнение (12.3 1), получаем:
"Д:р|%)4(т"гфГ ,12'3'3)
где 4м iiJMeiiiiCieu между 1,0 и 1,21 Как будет показано позже, другие корреля-
по липеипон ывщпмосчи
5] 4
ТАБЛИЦА 12 I. Структурные составляющие для расчета парахора1»
5 глерод— водород
Н
С11з—
-CHa- CH,-CH(CH5)- CH3—CH2—CH(CH3)— CH3--CH2-CH2-CH(CH3)- CH3-CH(CH3)-CH2- CH3- CH2—C>H(C2116)— CHS—C(CH3)2— CHn-ClI2-C(CH3).— CH5-CH(CII3)-CH(CH5)- CH3-CH(CH3|_C(CH3)3 _ Особые группы —'/00— —соон —он —\н2 —N02 (нитриты) —N03 (нитраты) —СО(\'Н2) — 0 (кетоны) Т|>п атома углерод., четыре атома углерода дать атомов углерода шесть атомов углерода —сно 0 (кроме указанных выше случаев) N (кроме указанных выше случаев) 10.0 •" (33,0 (71,9 173,3 209,5 170,4 207,5 207,9 243,5 139,6 0,3, Я 73,8 29,8 42,5 20,0 71 03 91,7 22,3 20,0 18,5 бб' 20 17,5 40,1
Г CI Вт 10,5 26,1 55,2 68,6 90,3
Дво1гкдя СВЯЗЬ
копен цепи в положении 2, 3 в положении 3, 4 ТРОЙ|ГВЯ связь Замкну Оле кольца. трехчленное четы рехчлегнье ня гнчлеппое игестпчлсчное 19,1 16,3 40,5 12,5 (>,0 3,0 0,8
• ) Г1 МчдифпЦПроиа.шо-Г П||Д< пдтп ij ri .Potih f44l.
’> ь-.ir .. • I.1 0 MC-iii'iini 1|1ачс-цпе госта.. д.? ,
ТАБЛИЦА 12‘2 Сравнение расчетных и экспериментальных 1 > значений
поверхностного натнжения чистых жидкостей
Уксусная кислота
/Ацетон
Aiin.ini i
Бен-юл
Ьензокитрнл
Бромбензол
и Бугаи
Сероуглерод
Тетрах.тормстан (четырех хл о
ристып 'Гдерол)
Хлорбензол
п Крезол
Циклогексан
Циктонерган
Лнэ; иловый sqmp
2,3-Дил,етклбутан
Этилацегат
23,62
24.02
22,34
21.22
42,67
40.50
28.88
26,25
23 67
21,20
,39,37
35.89
31,26
35,82
32,34
]9 69
12,46
32,32
29.35
20 3]
17,86
33,59
30,01
24.06
34,88
29,32
25.24
22,87
20 49
22.61
19,68
17.56
16.20
17,38
15.38
23,97
17 00
14 68
8,0
Ьромлая
СОгилмеркаптаи
Формами I
н Гепглп
Из<>м;-сляная кислота
Ale~iiJi4’('P'tita г
Merit.toni.iii спирт
Фенол
н Прогси.ЮНМ! Criripr
«-ПрС1Т,мбензол
Пиридин
9,1
20 20,14 8 -0,0
40 18.]8 0 7 0,1
60 16,22 3 I 0, 3
80 14.26 6 8 0,8
20 25,04 /2
40 23,20 0,5
60 2'.3о -) 2
0(1 [8.60 3 5
20 24.62 ~ 4,4
30 20,05 - 7.2 4,6
100 [2.90 -7.4 4,3
150 6,30 -8.8 0.4
200 (1,87 14 21
20 22.56 -13
40 20,96 1 Г.
6() 19,41 - 17
40 .39,27 — Ь,7
60 37, ]8 —7 3
100 32,80 -Л«
20 23,7] - 0.6
40 22,(5 ] ,9
60 20.60 - 3 3
90 18,27 -4J)
20 29,98 0,2 -1,1
40 26 83 0,8 - 0,7
60 2'1,68 2.1 -0,1
80 22 53 0.7
10о 20/38 1 9
20 .3? 21 2,8
40 •Зз’ы} -.5 0
60 31,98 -4J
Корреляции, основанные на испилипитании принципа соответственных со-
единиц
Ван дср-Влятие 163]
. ............, ............. , ........... быть скор роли рои а на
с 1 — Брок и Берд [6 I разв]|,|И цдето Бан ,тер В ла ,ьса дтя иецо тнрпых жн„
юстей п :1рсД|’оложтлгг, .по
i0,133a£ — 0 281) 11 — Г,,1
где Рг выражегто R физических атмосферах, Т, — н xeii,винах л ctr _ рюэффп-
т.пент Риделя, представленный в ратле.ге 6 п Одцлио, используя । редпо тоженис
MriAiro татем ,|Оказ,|Ть, что
1'Ч>(1
(12 3.6)
| -6 281
По уравнениям (|2.3 6) ,г (12 3.7) вь|чпс тя.тпсь значения о nei„>.'i>iрш.тх жид-
костей, приведенные в табл. |2 2 Точности их аналогична точности корреляции
Маклеода- Сагдена Однако метод, ссяованнитй на ис-гользсвапи:! пpiini;ini;i coo;
ветственных состояний, неприменим длч соединений с волороднымн связями
(спирты, кислоты) и квантовых жидкостей (IL, lie, No).
Подобная же корреляция была предложена Риделем [48] Позже с целью
Гасли ре 1 „я этой корреляции „а полярные жидкость, Хаким и Др [2] ввел,.
(I2.3.8)
давление, атм' Тс — крнтичсс!
- 0,1574 0,369,4-
m 0,210 - ОфЗвбл -
,Y—факгот цолярц л ц1 Стн.
13,69,\2 0 5|Ог + [,298с-, Y
32,07V - 1,(156щ’-Р 22,()3а>\‘
2 6); <о — фактор апеитричнос, и
либо
констант, плодящие
нений, причем некоторые из них были слабо полярными (Диэтпловыи эфир, диме
многих вешсс-в. а рлсчотрыс поверхностные натяжения <» чувствительны к вы
бранному значению У.
равно 22 68 дпн^'м [29]
') ФунДаМ<'.|Г.|Лт,||Г)ц безразмерной группой является л)';'' RTC [2i,64],
ИО прэпорциопалт-яостк Г RTJP, можно нспольалоагь, л уцпперсальцхю
ТлБ.1ИЦ\ 12.3 Значения X и У для рис. 12.1 (40}
' ТЩ1111Ч1 1 ' 1 ’ । ' йл 1 1 НС; Ill . ' i
\лл И.ЮВ1.1.1 СНИр'. Г.1 111.5 । Mel n.iqxip .гяат 3rt,5 88
1 ч*.1ГОг 56.2 63,5 1 Мсшлэтклкето г 23.6 97
Аг’етол 13 1.4.4 1 1 Нафталин 22.5 16э
\HH3O.T ГЛ 1 138,9 Ингреме । а и 30 139
Анилин 22 0 1'1.8 11 игр. )эта 11 25,4 126,1
Ацеталь 19 ня Окиси, оилен.. 42 8,3
\цста.1ьде| ид ' ; /Я Октан i . . 90
Ancia.Tb.'ioKcirM 23,5 1 2, Паральдегид 22,3 103,8
Ацетамид ], 192.5 Пицерпдигг П4 7 120
Ацетин 23 91 Пиридин 31 138,2
Аиет<иги1р цл 33,5 111 ПрОпиламин 23 ’ 87,2
Лпетогрецон 1» ЮЗ Прииилацс-1 аг 97
Бензил а чин 25 |5t> 11р0!пгловый crirpi 8,2 Ю5Д
Бензол 30 но Пропи-тформца1 24 97
Еепзоцги Рил 19,5 159 Г|рС>1|И0Ниг рил 23 108.5
Ьромбеизол 23,5 145,5 Пропионовая кислота 17 112
Бромзз ан 31,6 90,2 Сероуглерод 35,8 1 17 2
bvni.TOBr.ii’i епггрз 9,6 107,5 Сипильпая кислота 30,6 66
ЬутиропитрИ'г 20.3 ИЗ Тс гр ах лор метан (четырех % 104,5
Гексан 22,7 72.2 хлористый сг-терсы)
Б, ме । |!лаипли!| 20 149 Тгюфеи 35 1 9 |
Дпметилопг.гй эфцр 44 37 Толуол 21 113
Дикгстгглсельф'тт 23,5 158 Триметнламин 21 67 6
1.2-, |ихлорэт;1гг (хлори- 32 120 Трипальмитш| 2 151
стьгп этилен) Трифенилметян 12,5 182,7
Диэт ц.1 амии |6 66 1 риэтпламггг! 20,| 83,9
Диэтиланилягг I, 142,6 5ксуснач кислот 17,1 1 16,5
Лиэтилкетон 20 10| 5Kcycirbiii ЛниДрид 25 129
Диэтиливыи эф гр 27,5 64 Фене-од 2(1 131,2
ДнЭТИЛОКСа.'ЦТТ 20,5 130.8 Фецол 20 Ю8
, (нэгилсульцмг 19.5 Хгцю.тгцг 19 6 183
Закись азота 62,5 0,5 АЛОр 45,5 59,2
Иуоа милацстсл 16.1 103,1 , Хлораль 30 1 13
11зоамило|ц.ггг cpiipr 166,8 Хлорбензол 93 > 132,5
Изобутиланетяг Ю 97.2 п Хлорбромбснзо.т 14 1С2
И 1|)6\'!Ц.ТОВЬГП спирт 103 Хлористый ПГПр'ИПЛ 38,5 93
Изо.часлшгая кислота 11,8 107,4 Хлорметагг пая 53,2
П ИзОцрЗипЛТОЛУ'Щ 12,8 Хлорокись фосфора 26 125,2
Иодэтан 28 113,2 | X юроформ 32 Ю1,3
о Крезол 20 161 п .Хдортол мол 18,7 134
ч-[\рсзол |3 101,2 фпк.тогсксап 12 86,7
п Кремы 1 1,5 160, ,5 Эгиламип 1 I 9 83
•и-Ксцдол 20,5 118 Этилапегат 2/,5 92.4
и-Ксилол 19 117 Этилацетоаиетят 21 1,32
Масляная рг1С.цч.з 14,5 Этилбензол। 14.8 1 - г
Мезитилен 1, 119.6 । -)тил бензол 22 118
Мети.1! и 'иг । г 12 58 Эгнлбмтпрдг 1 . 5 102
,4ч илацет.'п 34 90 9тилизобмти|'а1 2(1.') 93,7
Метилбутприт 25 88 .| Этилмеркаиглгг До «1
Чегплизоб' тпр.гг 24 93.8 | 9т1'.'10ВЬг1Г СППр! 11) 97
Метиловый спирт 1 / 93 Jri'.ini'onrKHiaT 22,6 97
4егнлпроп1цц|а| 29 ЭгилформцЭ I 30,5 88,8
Р с in с н )i о По приложению Л тля эт| .тмеркаитлпа находим Г, _ 49') к,
7ф — 3<)8,2 К Р, -- 54,2 дтм Таким образом. 7,^ 308,2'499 — (i G18. По урав-
нению (12 3.7)
(0 61S) (in г>4.2)_ п
1 - 0 618... |
Другие метлы расчета
Поверхпостнос натяжение коррелируется также с мо. ьнои рефракцией и показа
iC.tcm преломления |61 ], сжимаемостью жидкости (34 [ и вязкостью |8, 39, 41,
52, 62 | Шонхорн [52] развил бо.тее раннюю паек, IКиевского [41 | и показа.'!, чгг,
1Н л .Ttiriertrio зав1гси г иг (1Д — >д,)~', । де >1 вязкость Рамана гг лР- 115|пРед-
,т ожил и линейную зависимое ,ь между |g <д и Г/, д тя различных гомо, юг нческпх
[гидов (О<, — поверхностное натяжение при Tf,).
Для быстрого определения поверхностного патяжеиця угленодородав Ход
деи |22 | предложил номограмму. связывающую о и 'Г Подобная номограмма по
Отмсру и тр. [40 | охватывает более широкий круг вегпесгв (рис. 12 1 и габл. 12 3).
Данные для легких углеводородов н их смесс» коррелировались Порто .43].
Значения поверхностного натяженНЯ нскстоэр'х криогенных жидкостей пргг-
воДя г Cnpov гг Прауспип [54 |; эшг значения коррелируются модпф1|и.ггрг>ьэгцгым
уравнением [12 3 41
(12 3 10)
1 Де '-то и Р устииаи 1ннаются с помощью ме года нацменыдп\ кнадрлтГ1г!. .3। гаченця
о быги олцзкп к |1.'.| но лv'нисс значение о„ часто было несколько больше зиаче-
Рекомендации. Д. я i."hCj\ \ портного натяжсниу , «рг.ггш 'кСкц х Ar'.TW rcfi
ricno.'ib^ciBjTb данные, собранные Яспером 129 [ Два метода Расчета о изложены
в этом ратде.те Расчетные значения и сравнгваготсг| с днсцсрггмептальиыми
пения (12.3.6) и (12 3 7) | При этом необходимо а на о, ,ормл тьпую температуру
KrinciiiiH, критическую гем пер ату pi и крп ошеексе давлен ire 11ог рси’нос ггг обычно
меньше 5 “и
Дтя жидкостей с водородными связями испо.гьзовЗ||, корреляцию Мак
геггда- Сагдена [уравнение (12.3.1)] с ггзра.хиром, определенным но групповым
гоставлятшим, приведенным и табл. |2 | Мсжт-. применять экспериментальные
данные о п.Югиосгях насыщенных жидкостей гг пасыщенпых паров либо с нс-
(колько меньшей тччностыо. подстанлягь модифицированную температурную
12.4. ИЗМЕНЕНИЕ ПОВЕРХНОСТНОГО НХТЯЖЕНИЯ С ТЕМПЕРАТУРОЙ
Поверх Н(И
Ясперу |2<)J прмс*лплены tia рис. ic
тслыия Яспер привод, т значения
12.5. ПОВЕРХНОСТНОЕ НАТЯЖЕНИЕ НЕВОДНЫХ СМЕСЕЙ
— поверхностное нсляжеппе смеси, дин см (PJ — паракор компонента
7; - мо.чьньн. доли номпонек ia i в жидкой и газовой фазах, соответственно;
— плотность ж и ткой смеси, мольгзг, iiv — плотность смеси "аров, hio.ib'CM3
тк.тю гаюшая
n.TOTiiocir, паров н н.\ копнен 1 p<i|i.|"|->, можс; быть опущена, когда эго упрощение
ноэхюжгю, уравнение (12.5 1) может быть icno.Ti.aouaHo для коррелирования по-
верхностных натяжений смесей широкого круга органических жидкостей [5. 16,
24, 36, 48 I с достатсчнг, хорошими ое.ч ул платами Большинство авторов не приме-
няют. однако, общие таблицы (такие как табл 12 I) значений групповых состав-
ляющих для вычисления I?, J а обрабатывают экспериментальные данные мс_о-
дом регрессионного анализа чтобы получить нан-тучшее значение |PJ для каж-
дого компонента смеси. Такая же процедура с уснехо'т используется для систем
верхпосткос натяжение смог и метан - - - пропан при температурах от -- 15 до 90 ГС.
и Давлениях 2 7—102 лм Ним и Мелтоне ПИ также применяли это уравнение
для системы метан нонан при температурах ел —34 до 24 СС и давлениях 1--
100 атм. Некоторые т глаже иные результаты представлены на рнс 12.4. при любой
TCMnepaiypc поверхностное натяжение смеси уменьшается с увеличением давле-
ния, так как большее количество метана растворяется в жидкой фазе Влияние
давления необычно, вместо уменьшения с ростом температуры поверхностное на
тяженце смеси увелинпвается, кроме случаев наиболее низких давлений Это яв
ление иллюстрирует тот факт, что три невысоких температурах метан более рас
творим в нонане и влияние состава жидкости более важно в определении <7,п.
чем влияние температуру
МСТИМ. иго при ПСПОЛЬТ<Т||.| Ш 11
391
исследовал спстсмьг метаи—пептан и метан—декан. Рено и Кзы [4] изучали смеси
азот—бутан (и гептан!, а Лефрансуа и Буржуа [31 ] рассмотрс.ш влияние давле-
ния инер-пых газов па поверхностнее натяжение многих органических жидко-
стей, а также влияние давления и Hi на псвсрмюстпое натяжение жидкого
') В этом I. 1\ ще чокаДп ц о, степени При чаще 61,01 рднен ч'п. а ш
523
-i Ш гр >с< (1 <0.1 Ti
Повсрхпо< ГИ01 ПЛТЯЛСПИС СмСССЙ ЖИЛЫХтСЙ при Т
эксисрнменталып.’хт данным
Корреляция, основанная на исполыованнп принципа соответствепН1.|Х со-
стояния. *> раПнеицС (12.14 имеет малое применение дня смесей, । joe млк у
iiontr|iхнос 1 кые концентрации от.атчаются or концентрации в объеме Для
/, । Q"' следует пРпнят'ь какие тшбудь 'траВт лп смсттгеикя Ряд поиюжпых нра-
Ви.! тио/ко I бы те гюл\1 тс I, на основании сведении, пр, во де типах ц т jt I, либо можно
испод!,топать просите травило аддитивности щи: выражении состава в мольных
долях Ограндяснттая гридерка ;тото мспиа для неполярных смесит показывает,
е.ТЫТОС отРСЛСЛСИНС с.,,
(12.5.2)
Хадден f 22 J рекомендует т —! для болт, тип нет в а смесей 1), ио значительно
лхчтиая сог.тасс:паи||ост|> расчеггцмх и экспериментальных Значений достигается,
если г равно (— I ')-=-(—3) Ур авт тети ,е (12.5. Г) может быть записано также в форме,
иодотмтои х [MHiHeiiiijo (12 5 2', i;pi истюльзоиаини чавтт( ттмостн (12 3 1) чтя цыра-
жения папг''.ср.-i IР, 1 Опг^кля величины. стнп|'япш₽''я к nanv Сннякие пявлпн||як
•l<‘JplT'L 112 а о)
и .ио тын. it.: .о.З) и: mu 1 To нреимущег • nt । ti cpaBiiellHKJ . уравнением (1 з J1
Г1 а эю-трсму 11 ,т: ii II 1 II i.n' । иэавиЛпные значения (о.,, —> о.
I, 1.11 11 ,M J > 1 TP i"l II4 к.1 К В 1AEI ’ It I TII or Bbiopaintujo |Г-,! уравнение
ii'ii и ли '.I.i । и hi III Mil a,4T приводить К 11.(11 и, штвуюшемс предельному анач₽
. 11 II. |,.|(|| 1 j 11 pll " , ГЫЧН НСД TJT 1НДИ JOTEMHIHS
I 1, '! И .1 I I u moi 11 i: <i hi hi
. 'I 1 i 1 1 M 1. 1 1 1 lil ' |l '1 1,11'' .IN a i.i l.'l II. 1.1 IO, 1 1 III 11 I’Kl I I'll 1 ] II 1 pl М 1 ‘ 11| ЯП И 1 Т |) Г
II 1 V .Hi I' III' Ti li 11’ 1 11 т -I 'Kill! Oti । делать оооошспия. и несмотря на го
,11.1 II1, S 11 11 . U|() Koppejinp 11 । н.п п'ые но одной смеси, они же мо-
ll'l'i IT IlMl' h vi'lll i:i и । . i уч; li' .'Illi I ' hl III i. смесв. На рпс 1/ о приведены
.1.111 1 1 .1 т 0 IHlbCpMIC CT1K1M it a ti IHienint ясско. ЛЬКЦХ смесей Вес КрИВЬн свидетсльст-
Hl III 1 < 1 ro'i, что ,<ai ЗцСпМО от x нелинейна но в ра 1лиЧГ|дц степени. Поверх-
III л i Hou Hill H.Ill'HIH' iMl'i II a a' i< Hlll'll'll 1 in очги ЛиНеИНо Зависит од состава.
,1 .1. Ill 1 II cre.'i цитре nil' 1,1 II 11. l'hbo.t и нптробенЗг). я тетрахл<1[гэтан 1 четырех х.то-
1,11 1 1 III II иодород) такая зависимость оесснорно iie.i цнсн на смег ь Диэтилокыи эфир —
1 |(.| rill i предо гзвчя 41 rl|ll hil l! v i ii'iiii.ii: i',i v
Пример 12..1. 1'. и I'M II 1 ;,l 1. iTopi'li XH'i'TH1 11 ’ 11.11' .i, Ki'ii нс смеси hi ли, юн пн i>,i
И бе изо. i.i ioiiri'.ii.' .1 1110,1. 1 IK'lllll н о HOMnotietiTii. при температуре 25 (.
A '<0 мяк и Эндр вводят лиапення пл отностси и поверхностных натя-
JM I l| [I I l hl I 1 । II , IT I'll Ill'll .'. I другие данные оеру |<Ч1 Ii;i Iipti.iii/H. IIU'.I л.
Плотность, г сч4
Поверхностное иляжлию дни сц
Молекулярная масса
Кри। ическаа температура, К
Критическое „явление, атм
Нормальная температура кипения, К
2» 23
78,1 И
562,1
0,7069
16.47
74.123
466,7
0.7996
21,81
76.426
|/'] (бензол) - (Н) 189 6 15 5- 2(>э |
И 'ЛиэтплоцьМ тфир,- (2) ((,11.,-) - (2) (-СП,-) - (-О-)--
- (2) (55 5» + (2) (4(1,0) -- (2(),0> - 211
,U„, - (0 12.3) (7 | 12.3) + (0,577) (78, | (4) 76,426
"У ТбТ2Г|<’'4и’ <2||) <0.вТ7»
--- 22,25 дпч/см
I I1 ’ рСь II" ic 11
22
1H\ly. It'll 111 .ГХПГ выше, It С ПЛОТНОСТЯМИ Mnctbtx
ic г i и 11 ;e' 11111 л itn.ie натяжения 27,5 дни см для
। 'iiirTi>rii jut!!илового эфира, сравнимые с экс
525
Модифицированная корреляция Маклеода—Сагдена. По уравнению (12.5.3)
V, 0.7996 Г (0.423) (]6.47У1/4 (0 577) (28.23)!'4 1
~ 76.426 I 0,7069/74,123 0,8772/78 114 |
<т„; = 22,03 дин см
90 6-3 — 21 8 (
Погрешнее.!, - _ 100 - 3,8%
Хотя уравнение (12 5 .3) иредсказь васт нравильнме значения 4.ц гых компо-
гов. оно неизменно приводит к большим ц()Гре(пкостям. чем уравнение (125 I.
Корреляция, основанная на i.c пользован пи принципа соответственных со
Р /и — (0,42 3) (35.9) — (0,3’7) (48,3) - 43 I гтм
Т,— .0,12,4) (166,7) + ,0,577) (562,1) - 522 К
С, Q (in ян TOBi.i и эфир) = 0 680 и Q (пептон = () о34 имеем'
Q.-r, (0.423) (0,б8()) -|- (0,577) (0.634) - 0 G53
(игла при / ,rt --(25 — 273)522 — 0,571 получаем:
V)-;3 н () — ))11 J днн%м
22 97 -21 81
Погрешность —------О|—81----- ° ~ 5-3%
Соотношенье, основанное на i,iiu>vcK>cat'uu правит аддитивности Для
уравнений (12 5 2) могу, быть выбраны различные .значении г Результаты, гри-
ЕсДСш'Ьц- ниже н.жазьщат юГрешности расчета
ч Поп г 0 % = °i^P [% in (% 0,)|
1ермнД11намические корреляции. Чегцды рисчсгэ, которые рассматривались
ран.,!..е в атом разделе, эмпирические, вес они используют составы, относящиеся
I, обьему жидкости (я иногда и парс), чтобы характеризовать смесь Однако ил
межфазной поверхности состав отличается от состава в обьсмах жидкости и пара
р целесообразно предположить, что в соотношениях для определения (7п поверх-
ностные составы играют более важную роль чем составы в объемах Значение <зт
почти всегда Меньше, чем вычисленное ио правилу аддитивности при выражении
объемных составов и ми .иных долях, это следует воспринимать как свидетельство
того, что компонент пли компоненты с более низкими значениями а концентри-
руются преимущественно на межфазной поверхиос-и. Эберхарт [12] предполагает
что от дается ираипдоу аддитивности при выражении поверхностных составов
в молг.иы1, ДО.|Я\
Как классическая, сяк и статистическая термодинамика примерялись к вы-
воду выражений для о,„ [4 9, (3, И, 25—27, 30. 50 51 53 >). 55, 59] результаты
|) Хансеп и ( ссор 12“] показали. что термг.|дцц 1мпческо? выражение, полу-
черное Шерешевсьцы 1 <33] в использованное Коттоном 110 | является ошибочным.
526
отличаются в некоторых аспектах, по болишинс,во их в конечном с с 1 с приводит
к выражениям, подобным следующему:
RT
где хв — мольная доля компонента ( п объеме жидкости }'В— коэффициент актив-
ности компонента ( в обьеме жидкости ()’? —» I, когда с-> 1), у? коэффициент
активности компонента ( на межфазной поверхности (у, » 1 г> мере ion ,.ак меж’
фазная поверхность становится тождественной поверхности чистого компо |ента
)). А,— удельная площадь поверхности компонента i, см-’/мол!,; а,,, — но-
йерхпосгпое натяжение смеси и компонента < соо’всгссвснио
Значения коэффициентов ак iiiuhoctii обычно подучают но дачным о равнове-
сии пае—жидкость или исходя из какой-либо модели жидкости, как это рассмо-
трено в гл. S Аля межфазной поверхности никакие непосредственные намерения
невозможны, поэтому должна быть принята модель Жидкости ГильДебоапт и
Скотт [26 | трактуют случай «идеальною' межфазной повсрхно<н. (vf- 1), В ТО
время как Эккерт и Прауениь. [131, а также Спроу п Пряу< ниц |55| используют
теорию регулярных растворов для описания фазы. Во всех случаях 4, аппрокси-
мируется как (Viy:<d (ДУ)1'3, где V; — мольный объем чистого компонента а \'о —
число Лвогадро. Спроу и [ [рауспни. успешно применили уравнение (12.5.41 и ряду
различных иецодярных бинарных смесей и точно рассчитали поверхностное на~я-
жеиие о-л. Даже Для полярных смесей был достигнут некоторый успех, хотя
в этом случае для межфазной поверхности использовалось модифицированное вы-
ражение Вильсона для коэффициентов активности и одна эмпирическая константа
была сохранена, чтобы достигалось лучшее <оотпетствие рассчитанных значении
с„, экспериментальным данным
Хотя подход Спроу и Прауснииа более реалистичен, уравнение (|2 5.4)
можно упростить, предположив, что смесь состоит из идеальных жидкостей, i с
yf — 1° - 1 В таком случае можно । оказав. что для бинарных систем эсо урав-
нение принимает вид
где .хд, хв — мооьиые доли компонентов А и В в с,бьеме. жидкости, Л — средняя
площадь поверхности молекул, составляющих смесь. Эта упрощенная иорма тер-
модинамической Корреляции ясно показывает, что значение о171 меньше опреде-
ляемого по правилу адди1ииности при выражении состава и мольных долях.
форму термодинамической корреляции
Решение Обозначим индексом А диэги.рвыи
индексом В —
— 9ft ЯП
1[иеем:
ш Л и) 2 " 1,713-10° см'т' модь по у равнению (12 5 5) полу чаем:
гт,,: = (0,42,3) ([6,47) I- (0 577) (28.23) -
Погрешпоиь _ -'
'1 357111ЦД 1Д4 Значение константы а для уравнения Шишковского (12 6.1) [301
.Ь.цс-егвч | Вещ<'СТ1,п |
I 11 111 I 1 Я 1 II Т Г 1 2,1 i | Диэткльетон 0 г
,. 1 1.1. III1I.I. IIII.III Г1ИИ1 i 26 1 1 .-)ти.1иро|,ионз । I j
1 Ьопр'тУУ.'ЮТЫ п спирт 2fi Лропилаист.чт $ I
МП 1 1 I Валериановая khc.iohi 1 ,
ч-Пиопиламп и 19 I Изоналериановая г.нслота 1 ‘
ИГ 1 II. 1 .11.11.1 |1Ч| 19 I I л Лмиловыи спирт 1 .
II 11 ..!!.!! ' 1 1 . 1 . . . . 0 II !‘><1МИ.Т<|ВЬ|И СИЦрТ 1,7
1 1 <. 1У1.1Г.-1Ч 'l.'lll 1.ЦГ. 1. IT. I T.i) 1 I Ip at । ил а р о; । чоп a i 1.0
II г> V 1 | . |.nil.IK < null 7,0 I н Капроновчя khcjoih i> 7,>
i 1зоиути.ючыи спирт 7.0 । I п'-Геитяьовая кислота II 17
Прочн-тфорчиат I н-Октановая кислота 0,034
,че । и in; г || /• Декановая кислот; 0,0025
женил водньх бинарных смесен в (Нирокпх iin-гервала х KoiiRenipatW
растворенного органического, лешссгва it воднооргаиическпх систем как с низ
рае н'я ур;|ВпС|цге (12.,> j) но Дли важных плотностей и концентрации берутся знп-
чсния характерные для i-оверхпостцО!о с-ЧоЯ, т е. шмоинет (1'П—
Iипотсгпчеекпн мольный обьем поверхностного слоЯ| Значение 1,л определяется
где т17 — м<мьпая до.тЯ компонента j в поверхностном <.тос Значение Г , однако,
выбпрас’ся так мьдьиыц об-аем чистого компонента [ Тогда но \ равнению (12 5 1'.
(12 0 3)
тдс индекс означает воД), а индекс' О — органическое вещество
Чтобы иск почтцн парахор Тамура j лР ввели уравнение (12.J.H, результат
имеет вид
?- . ч&'б4
объемная деля воды п (ювсунклуцом «нас
lllllt Н с> ПРЫЮДИЦ.Я I'pil 1|[>СДЯ<1-'|ОЖС1ШП. 'ПО Между BOiKpXHOCtblO I обьемоч
ное,тс’ tipeoOpaaoHaiiiiii моя.сч быть датчане в виде с.'1еду1ошей системы-
b = В + г
(12 6 8)
(12 6 6)
определяется ио ураппенто (12 6 5' a i| „
Здесь х^., л®— мольные доли даш коды к "испто г.ргаьи'гы. k^t.j вещества
в основном объеме, соответственно, l'w, 1’0 — .м< iыгыс объем ч чис|t,it bo.ti,i н >ii
стого органического вещества, соответственно, — гкдьеръ рос гное натяже-
ние чистой воды и чистого органического вер:егтн:1, -.оотзеп т'ссини Т — темпе] а -
тура. К, а — константа, -мвиеншая от типа и размеров ор, щи"|еских составных
частей:
Жирные кислоты,
спирты
Кетоны
I злогерпроизводныс
жирных кислот
Число а|О\юв углерода
На единицу иеньтпс числа
атомов углерода
умноженное на отношение
мольных объемов г-тлите и-
ПрОИЗКОЩИЦХ « ЦСХО-ТНОЙ
жирной кислоты
кислота
Уксусная кис.кна,
кислота)
1 Ъ (уксусной
кнс.|Ота)
Метод иллюстрируется примером 12 5 Тамури и др [(>()] ы^оверплц метод
па 14 водных сисуевдх п двух системах чщрт—спирт 1 , гюгредшоси, расчета
меньше 10 % при q < 5 и в пределах 2(1 % при д > 5. Метод пеырпменпм для мно-
гокомпонентных смесей
Пример 12.5. Рассчитать роаеухriociное натяжение смеси мтiи.тоЗого crH'pi'i и
воды при 30 “С если мольная доля спирта составляет 0 122 Экспериментальное
значение равно 46 | дин-'см (Ы)].
Р е тв е н и с . При 30'С (индекс О означает метннорый спирт, индекс М —
воду) (т^, = 7118 Д|1п.'см, of) — 21,75 дии-см. 18 см’-'мо.гц,, = 41 смУмоль
и ч ~ I - число атомов уг.дерсда
На основании уравнений ([2 <> 101
% _ (0.878) (18) _ 3 -
фо ”'((),|22) (41)
Тогда но провисшие) ([2.6 6)
В 1g?, (6-'*,50
и ио уравнению (12 6 9)
F= (0,441) (^3) |(21,75) (41Г"3 — (7! 18) (!*<)- '= MI
Следовательно, ио Уравнений (12 6 8)
!, В -р VC - (\5(г - 9.34 0,10
') Для неводных смесей, содержащих п<> шрнщо '-олекуиы, щчол к 'ас
иси.1лге(гггь|м, за искличеннеч юго, что в гаком cnytac у чилясася отношен!
мольного объема растворенного вещества к мс.'п.иому объему растворик’Дя,
Ч W = 10С, 16 =
4G дип/см
гных натяжений бинарных водни-
I 1 ,-iMypbj, Kypaibi п Одаии (уравнения
йсжцо таюке применять для других
Н111ЧЫ Погрешности расчета обычно не
1т. органического компонента в воде низ-
i Шишковского в форме, предложенной
ння
iia i в поверхностном слое
фокрити чссиое давление
Фатура: Т^— нормальная температура
чературв; Ть = Г^Т,,: 7 -псевдо
для поверхности фазы
— для поверхности ф4аы
— ДДТ обммэ Ж<|ДКСЙ ipaJU е — Л''Я