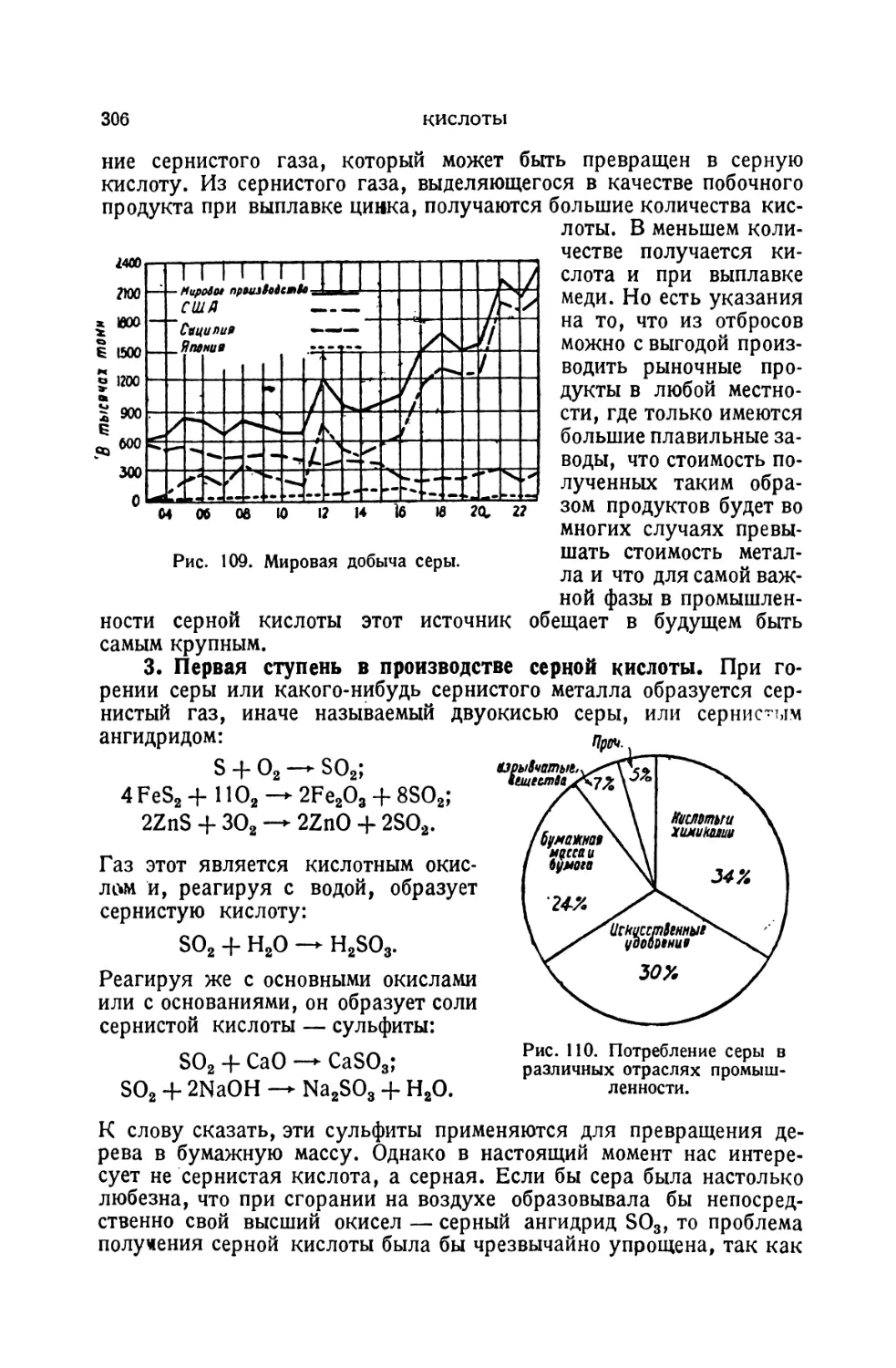
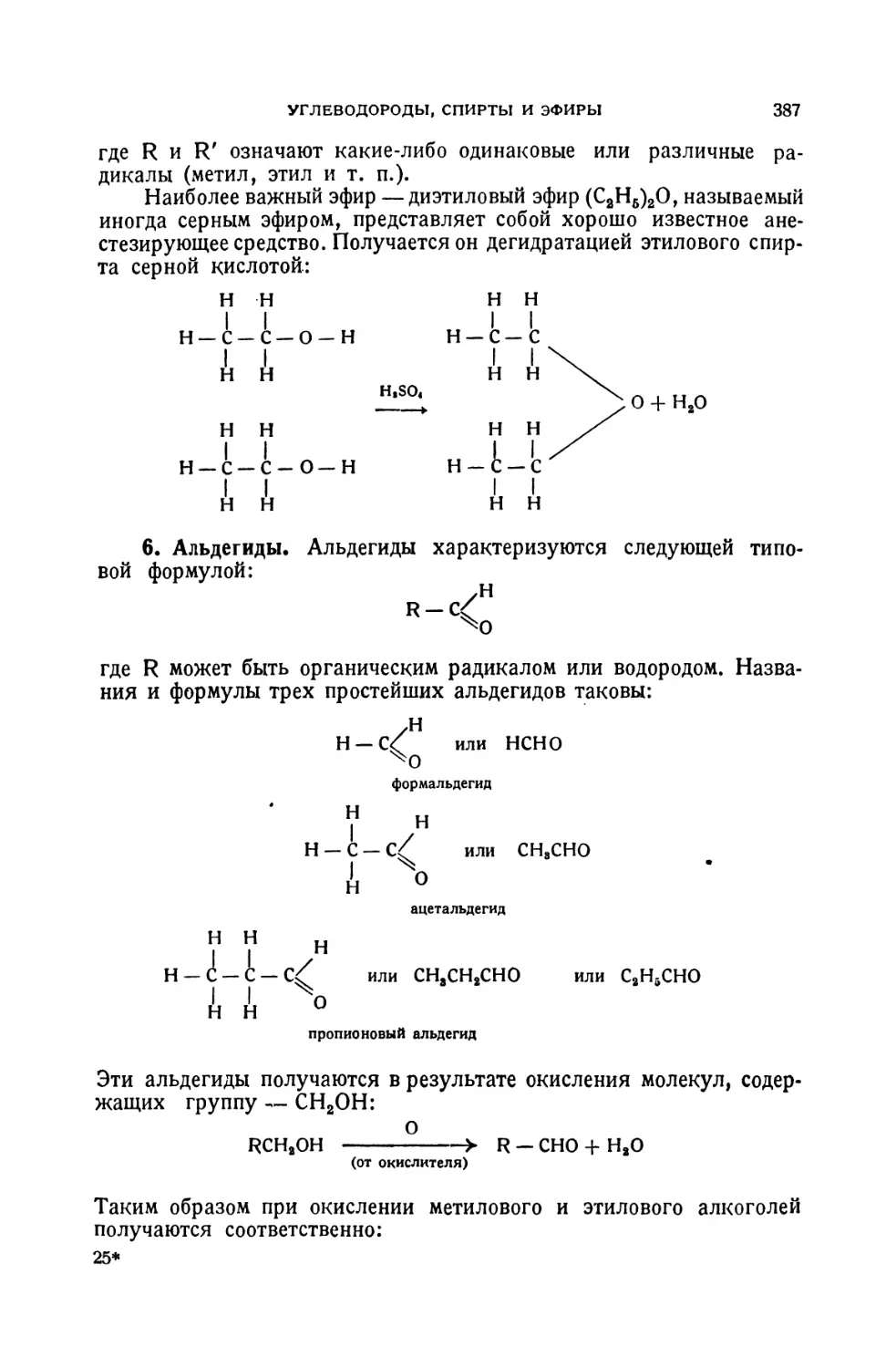
Текст
John A. TIMM
AN INTRODUCTION
TO CHEMISTRY
SECOND EDITION
Me GRAW-HILL BOOK COMPANY, Inc.
NEW YORK and LONDON 19 32
Дж. А. ТИММ
ВВЕДЕНИЕ В ХИМИЮ
Перевод с английского
Б. А. Казанского и А. Ф. Платэ
ПОД РЕДАКЦИЕЙ П. П. КОРЖЕВА
нктп
ОНТИ. ГЛАВНАЯ РЕДАКЦИЯ ХИМИЧЕСКОЙ ЛИТЕРАТУРЫ
МОСКВА • 1935
ХМ—10-5-2
Книга Тимма представляет ввод-
ный курс химии, читанный автором
в колледжах и педагогических инсти-
тутах США.
Задача автора познакомить чита-
телей в живой, популярной форме
как с современными успехами хими-
ческой теории, так и с главнейшими
отраслями химической промышленно-
сти.
Русский перевод имеет целью
познакомить советских педагогов с
развитием методической мысли за
границей, а также дать книгу для
самообразования и пособие для уча-
щихся нехимических вузов и втузов.
ОГЛАВЛЕНИЕ
Стр.
Предисловие к русскому изданию 5 . . . 6
Предисловие автора ко второму изданию . ............................. 8
Предисловие автора к первому изданию ................................. 9
Предисловие Джона Джонстона . . s . ..................................11
Введение..................; • • : •..................................13
Глава I. Природа вещества ................; —
Глава П. Природа газов ............................21
Глава III. Природа жидкостей и твердых тел....................... . 35
Глава IV. Переход из одного состояния в другое........................43
Глава V. Молекулы • • • s i 1 i 2 ............................56
Глава VI. Атомы . . ; з ; ; s ; з s ...........................63
Глава VII. Химическая стенография . ..............................70
Глава VIII. Сущность химических реакций...............................76
Глава IX. Скорость химических реакций ................................83
Глава X. Атмосфера 92
Глава XI. Сущность горения . ; з ; .............................104
Глава XII. Топливо ..................................................114
Глава XIII. Металлы .................................................126
Глава XIV. Железо и сталь . . . .................................140
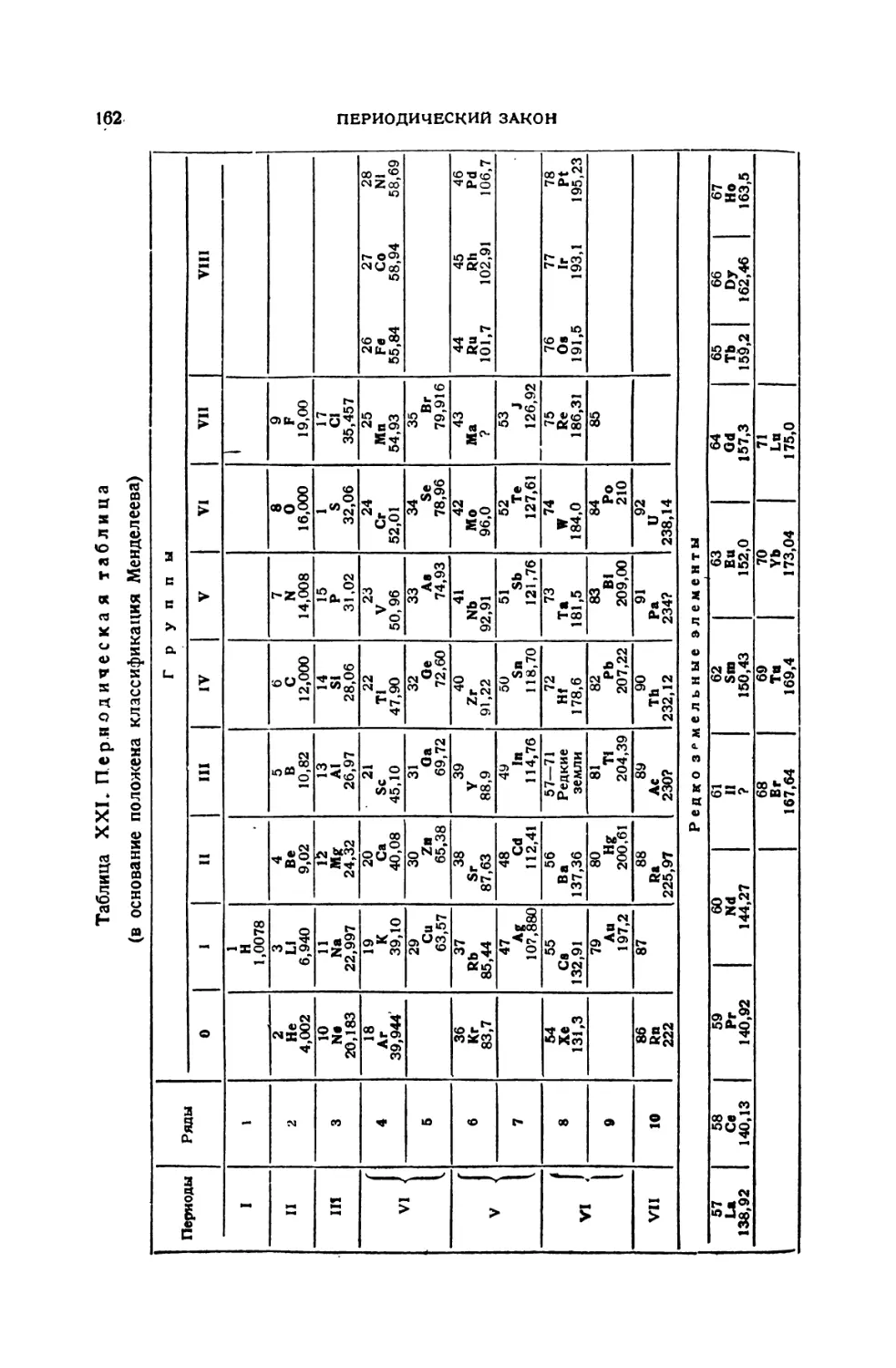
Глава XV. Периодический закон........................................156
Глава XVI. Строение атомов...........................................166
Глава XVII. Планетарные электроны.................................. 178
Глава XVIII. Радиоактивность . ......................................189
Глава XIX. Понятие об энергии .......................................203
Глава XX. Лучистая энергия...........................................215
Глава XXI. Излучение и поглощение лучистой энергии...................232
Глава XXII. Вода . . . ; ; j ] ; । : 241
Глава XXIII. Растворы ; ; ; з с з с § з в s • ;................251
Глава XXIV. Свойства растворов 258
Глава XXV. Электролитическая диссоциация ............................267
Глава XXVI. Электролиты................... . ........................278
Глава XXVII. Реакции электролитов . .................................290
Глава XXVIII. Основная химическая промышленность. Кислоты .... 300
Глава XXIX. Основная химическая промышленность. Щелочи . . . . 316
Глава XXX. Электролиз и отрасли промышленности, основанные на
электролизе............................. .......................... • 324
Глава XXXI. Гальванические элементы ззззззззс::* 333
Глава XXXII. Коллоиды ...............................................345
Глава XXXIII. Керамика и смежные с нею отрасли производства .... 357
Глава XXXIV. Питание растений........................................368
Глава XXXV. Органическая химия. Углеводороды, спирты и эфиры . . 379
Стр.
Глава XXXVI. Органическая химия. Углеводы, жиры и белки . . : ; ; 390
Глава XXXVII. Ограническая химия. Каменноугольный деготь ; j ; ; 405
Приложения...................................................... 415
I. Единицы измерений. . i ; ; । $ j t t t s : . . ; . s ; —
IL Упругость водяных паров sszitiiii;.;.:.; —
111. Валентности наиболее часто встречающихся элементов . 416
IV. Наиболее часто встречающиеся ионы и их названия...........; —
Алфавитный указатель •
ПРЕДИСЛОВИЕ К РУССКОМУ ИЗДАНИЮ
Перевод книги Тимма был предпринят с целью ознакомить широкие круги
работников в области распространения химических знаний — преподавателей сред-
ней и высшей школ, лекторов, руководителей химических кружков и т. д. — с
развитием методической мысли за границей.
Выбор для этой цели книги Тимма не случаен. Уже при весьма поверхностном
ознакомлении с построением книги, с предисловием, нетрудно убедиться, что мы
действительно имеем перед собой новый и оригинальный подход к построению
вводного курса химии для лиц, «главные интересы которых лежат вне химии»
(см. предисловие автора).
Исходя из того, что «методология и философия науки вообще и химии в част-
ности» имеют большую образовательную ценность для учащегося, автор отказы-
вается от традиционного построения элементарного курса химии, в котором она
представляется главным образом как описательная наука. Описательная сторона
химии занимает в книге Тимма второстепенное место, а на первом месте стоит
«философия науки».
Руководимый этим принципом автор силою вещей пришел к созданию курса,
который скорее можно считать введением в физическую химию, чем обычным эле-
ментарным курсом химии, принятым у нас. На современном этапе развития химия
настолько близко соприкасается с физикой, что в настоящее время становится
затруднительным излагать основы химии в описательном духе, который столь харак-
терен для курсов XIX и начала XX вв. Насколько хорошо справился автор со
своей задачей, предоставляется судить читателю.
Книга написана в весьма своеобразном, мы сказали бы, специфически «аме-
риканском» стиле; автор часто прибегает для иллюстрации и оживления материала
к сравнению с долларами, автомобилями и вообще не стесняется в выборе
сравнений. В своем желании приблизиться к читателю автор нередко дает не-
сколько наивную и упрощенную трактовку вопросам, подчас весьма серьезным,
и не свободен от некоторых прямых ошибок.
По своему построению и содержанию книга Тимма не подходит ни к одной
из принятых у нас программ для вводного курса химии. Тем не менее в изве-
стной мере она может быть использована при преподавании, а также как
книга для самообразования.
Желая дать нашему читателю возможно полное представление о типе новой
американской учебной литературы, редакция считала необходимым сохранить об-
щий колорит книги, не подвергая ее какой-либо переработке и внося измене-
ния лишь в тех случаях, где автор допускал явные ошибки. Помимо этого редак-
ция сочла необходимым исключить ряд философских рассуждений автора,
имеющих весьма сомнительную ценность и представляющих странный конгломерат
материалистических и идеалистических, в частности теологических, воззрений.
Исключены также многие сведения экономико-географического характера, которые
не могли бы представить интереса для советского читателя»
ПРЕДИСЛОВИЕ К РУССКОМУ ИЗДАНИЮ 7
Само собою разумеется, что общефилософская концепция автора не могла
не отразиться на книге в целом. Поэтому читатель должен критически отнестись
к рассуждениям автора о цели и содержании науки, об отношении ее к окру-
жающему нас миру и к другим обобщениям философского характера, которые
нельзя было исключить без того, чтобы не была нарушена целостность постро-
ения книги.
В некоторых случаях, где представилось возможным, редакцией сделаны до-
полнения,’ касающиеся химической промышленности СССР, а также имеющие
своей целью привести курс в соответствие с новейшими данными науки. Труд по
редактированию этой книги разделили со мной Я. Л. Гольдфарб и Л. М. Смор-
гонский. Редактор.
ПРЕДИСЛОВИЕ АВТОРА КО ВТОРОМУ ИЗДАНИЮ
Применение первого издания предлагаемой книги в колледжах и педагоги-
ческих институтах различных типов и образцов указало ее автору те пути, кото-
рыми могла бы быть повышена ее общая полезность. Многими высказывалось мне-
ние, что математическое изложение теории могло бы быть менее трудным, а иногда
и совсем опущено без нанесения ущерба важным теоретическим заключениям.
Во втором издании в согласии с этими указаниями так и было сделано в большин-
стве случаев. Лишь иногда, например при объяснении применения х-лучей для
определения строения кристаллов, так нельзя было поступить. К счастью, такие
случаи могли быть совсем опущены без нарушения последовательности изложения
или их можно было оставить лишь для более подготовленных учащихся.
Глава о сплавах, в которой обсуждалось применение диаграмм равновесия
фаз, была опущена как слишком трудная для среднего студента. Данные о составе
и свойствах наиболее часто встречающихся сплавов были включены в главы о
металлах, о железе и о стали. Учение об энергии и ее отношении к химии
было в значительной степени сокращено, причем однако значению этого учения
для современной физической химии было уделено достаточное внимание. Чтобы
дать более полную картину экономического значения химии, была прибавлена
глава о керамической промышленности. Наконец излагаемый материал был по-
полнен новейшими данными, было также прибавлено кое-что по истории химии.
Автор приносит благодарность преподавателям, пользующимся его книгой,
за их сотрудничество, которое выразилось в сообщении желательных по их мнению
изменений, когда рукопись еще только подготовлялась ко второму изданию, а также
и за их указания относительно улучшения первого издания.
Автор сожалеет, что нс было возможности исполнить все указания.
Нью-Хэвен. Коннектикут
Апрель 1932 г.
Джон Арренд Тимм
ПРЕДИСЛОВИЕ АВТОРА К ПЕРВОМУ ИЗДАНИЮ
За последние годы растет число преподавателей, подвергающих подробному
критическому рассмотрению традиционные типы курсов введения в химию с целью
выяснить, не следует ли в конце концов совсем осудить этот тип курсов, принимая
во внимание крайне прискорбное отсутствие интереса к нему со стороны учащихся,
изучающих гуманитарные науки. Эти преподаватели относят возникновение курса
такого типа к середине XIX в., когда химия была по преимуществу описательной
наукой.В то время самым логичным было излагать материал в таком курсе, основы-
ваясь на описательной химии элементов и их соединений. Постепенно сюда вводи-
лись и научные теории, по мере их развития. После того как студенту давалось
количество фактов, достаточное для того, чтобы к ним можно было приложить и те-
орию, последняя излагалась ему без малейшей попытки объяснить, как она возник-
ла. Особые старания прилагались к тому, чтобы обеспечить подготовку учащегося
к курсам по аналитической химии, которые должны были следовать за этим всту-
пительным курсом, для чего постоянно практиковалось составление уравнений
и решение задач как средство научить будущего химика обращаться с орудиями
своей науки, а других учащихся заставить пройти ту школу, которая многими
и до сих пор считается дающей наилучшую умственную сноровку.
Химия между тем развивалась. Собирание фактов стало скорее средством для
достижения цели, чем самой целью. В химию были введены физические методы.
Все большее и большее значение приобретала теоретическая химия. Однако поря-
док изложения элементарного курса с упором на описательную сторону науки
в сущности оставался без изменения.
В настоящее время имеется немало преподавателей, полагающих, что все
виды элементарных курсов в нашей отрасли знания нуждаются в решительном пере-
смотре и что особенно настоятельна нужда в курсе, имеющем в виду в первую оче-
редь учащихся, главные интересы которых лежат вне химии. Что таким учащимся
нужны подобного рода курсы для завершения их образования, признается всеми.
Не подлежит также сомнению и образовательная ценность методологии и филосо-
фии науки вообще, и химии в частности, для учащегося, изучающего, например»
классическую литературу или гуманитарные науки. Что ничего подобного он за-
частую не находит в элементарном курсе химии более или менее традиционного ти-
па, слишком уж ясно видно из результатов преподавания такого курса. Изложение
свойств химических элементов и их соединений одного за другим и постоянная
практика в составлении уравнений и решении задач необходимы и крайне жела-
тельны для учащегося, готовящегося вполне посвятить себя химии, но все это со-
вершенно не должно иметь места в общеобразовательном курсе. Развитие некоторой
Умственной сноровки в обращении с химическими уравнениями для учащегося,
специализирующегося в других областях знания, оказывается только безжалост-
ной тратой времени.
В результате всего сказанного некоторые стали предлагать «общедоступные»
химические курсы. Такие курсы могут быть двух видов: в одном особое внимание
10
ПРЕДИСЛОВИЕ АВТОРА Ц ПЕРВОМУ ИЗДАНИЮ
обращается на приложения химии и совершенно оставляется в стороне философ-
ская сторона дела. Автор этой книги полагает, что такие курсы о чудесах химии
не могут не оказать на учащегося такого же действия, как и пятифунтовый ящик
конфет, съеденных не с благоразумной умеренностью, но со слишком большим
удовольствием, и что хотя в результате таких курсов и может получиться некото-
рая умственная тренировка, размеры ее будут однако совсем ничтожны.
В курсах второго типа на первом месте стоит философия науки, и
последовательность изложения основывается на логическом развитии основных
теорий химии.
Курс, изложению которого посвящена предлагаемая книга, впервые был
прочитан автором в Иэле в 1926 г. С тех пор он был пересмотрен несколько раз.
При изложении предмета автор главным образом имел в виду удовлетворить
следующим требованиям:
во-первых: постараться отметить научный процесс образования и проверки
основных теорий физических наук, а именно процессы собирания и классификации
фактов, анализа или сведения к более простым данным, установления, проверки
или замены одной гипотезы другой, вплоть до открытия общей формулы или закона
природы;
во-вторых: показать, как публикуются результаты исследований, как из
них делаются выводы, как они располагаются в таблицы, наконец как они сво-
дятся в научные монографии или руководства; показать также, как следует поль-
зоваться этой литературой для ознакомления с наукой;
в-третьих: научить прилагать эти теории к разработке естественных богатств,
к проблемам промышленности и к задачам повседневной жизни отдельного чело-
века;
в-четвертых: вести изложение развития теории с исторической точки зрения,
поскольку такое изложение будет допустимо в педагогическом отношении.
Совершенно неизбежно, что многие вопросы физики должны быть включены
в предлагаемую книгу. Говорить что-либо в защиту такого включения автор не бу-
дет, ибо он убежден, что с течением времени первоначальное обучение как физи-
ков, так и химиков практически будет тождественным и что для начинающего
учащегося некоторое знание физики и в настоящее время необходимо для того,
чтобы понимать современную химию. Такого знания нельзя предполагать у уча-
щихся, для которых главным образом и предназначается предлагаемая книга.
В конце концов учащийся, в достаточной степени овладевший излагаемым
в этой книге курсом и желающий приступить к дальнейшему изучению химии, не
окажется в убытке, ибо он познакомится со всеми основными теориями этой отра-
сли знания.
В заключение автор желал бы выразить глубокую благодарность проф.
Юрей в Колумбии и проф. Дзелени, Футу, Харнеду и Сэкстону в Иэле за их ука-
зания, касающиеся различных исправлений в книге, а также докторам Киллеф-
феру и Леонарду за их разрешение воспроизвести некоторые фотографические
снимки. Автор особено благодарен доктору Джону Джонстону из Стальной корпо-
рации (Steel Corporation) США за его помощь и поддержку при организации
курса в Иэле и при составлении книги, а также за время, потраченное им на рас-
смотрение многих иллюстраций и на составление предисловия.
Джон Арренд Тимм
Ныо-Х^вен. Коннектикут
Август 1930 Г.
ПРЕДИСЛОВИЕ ДЖОНА ДЖОНСТОНА
Со времени войны, вероятно, в силу особого значения, которое придавалось
тогда химическим знаниям, стала замечаться все увеличивающаяся неудовлет-
воренность обычным видом вступительного курса в химию, в особенности в тех
случаях, когда он для многих учащихся оказывается единственным курсом по хи-
мии. Считая желательным введение такой научной дисциплины, которая специаль-
но предназначалась бы для значительной группы учащихся, не имеющих кроме
нее никакого другого курса физических наук, факультет колледжа в Иэле около
четырех лет тому назад осуществил такой курс, и с самого своего возникновения он
с каждым годом привлекал все большее число слушателей; так возникла предла-
гаемая книга.
Главной целью ее было познакомить учащегося с предметом в его целом —
с общей философией физических наук и их многообразным отношением к жизни
каждого из нас. Содержание ее обусловливается убеждением в большей образова-
тельной ценности философии любой науки сравнительно с простым ознакомлением
с фактами, входящими в ее состав. Отсюда стремление подчеркнуть, что то, с чем
мы имеем дело в физических науках, есть скорее последовательность находящихся
в определенных отношениях друг к другу явлений, чем груда разрозненных фак-
тов. Другими словами, этот курс преследует цель не столько дать возможность
учащемуся овладеть некоторым количеством подобранных фактов, относящихся к
избранным классам веществ, сколько установить их взаимные отношения и объяс-
нить в простых выражениях некоторые физические и химические явления, ежеднев-
но нам встречающиеся. Предмет химии рассматривается здесь как живое древо с
непрерывно крепнущими корнями и с вновь появляющимися и растущими ветвями,
а не как законченный ряд приведенных в порядок фактов. Ведь нового предстоит
открыть гораздо больше того, что известно в настоящее время, и этот процесс
открытия столь же романтичен и радостен, как исследование новой страны.
При составлении книги имелось ввиду ограничить число рассматриваемых
вопросов с тем, чтобы они могли быть тщательно разобраны в отведенное для этого
время. Для поддержания постоянного интереса к изучаемому предмету в круг
обсуждения привлекаются самые обычные предметы, например автомобиль, спо-
собный иллюстрировать самые разнообразные химические явления и физические
процессы. Желательно, чтобы одновременно практиковалось чтение хорошо сос-
тавленных биографий научных деятелей и книг, трактующих о физической
науке вообще.
Следует надеяться, что, излагая объективные научные выводы, остающиеся
истинными независимо от Нашего желания, мы помогаем учащемуся мыслить более
логически относительно явлений и их отношений. Это может внушить ему идеи,
Далеко не в достаточной степени оцениваемые. Расширяя область знания, мы дви-
жемся вперед при помощи определенного научного метода, который состоит в под-
боре известных экспериментов для решения вопроса, какое из кажущихся возмож-
ными объяснений будет наиболее подходящим в данном случае, и идем от извест-
12 ПРЕДИСЛОВИЕ
ного к неизвестному маленькими тщательно обдуманными шагами. Совершенно
невероятно, чтобы мы могли прогрессировать в нашей власти над миром матери-
альных вещей, не исследуя присущих им возможностей и не учась, как следует
ими пользоваться. Отсюда ясно, что успехи в техническом (промышленном) раз-
витии или в медицине едва ли могут быть сделаны кем-либо иным кроме того, кто
путем обучения и опыта к этому подготовился.
Насколько указанный курс достигает всех этих целей, будет видно впослед-
ствии; очевидно это будет зависеть также и от преподавателя и от того, в какой
мере удастся ему оживить аналогиями и иллюстрациями те голые контуры науки,
которые неизбежны в книге столь сравнительно незначительных размеров. Впрочем
я вполне убежден, что она окажется по меньшей мере правильным шагом вперед
в деле сообщения учащемуся более совершенного взгляда на значение физической
науки.
Джон Джонстон
Руководитель научных исследований
Стальной корпорации, Нью-Йорк
Август 1930 г.
ВВЕДЕНИЕ
Химия представляет собой такую отрасль науки, которая ставит
своей целью изучить материалы, составляющие вселенную.
Она не интересуется формами, которые могут быть им приданы.
Предметы, например стулья, столы, вазы, бутылки или проволоки,
не имеют никакого значения для химии; такие же вещества, как
стекло, шерсть, железо, дерево и глина, т. е. материалы, из которых
состоят предметы, — вот что изучается ею. Химия интересуется
не только составом веществ, но также и их внутренним строе-
нием. Далее, вещества в природе постоянно подвергаются из-
менениям: железо ржавеет, дерево гниет, сахар подвергается бро-
жению, уголь горит, скала из известняка вымывается водою, а
живые существа переваривают пищу и за счет ее строят свой
организм. Химия исследует такие изменения и условия, при ко-
торых они происходят, механизм этих изменений, новые вещества, об-
разующиеся в результате изменений, энергию, освобождаемую или
поглощаемую ими. Химия изучает также способы, посредством кото-
рых эти и подобные им изменения могут быть искусственно вое про-
изведены в лаборатории или в более обширных размерах на хими-
ческом заводе. В результате всех этих исследований химия открыла,
каким образом металлы могут быть извлечены из руд, как истощен-
ные поля могут быть сделаны снова плодородными, как встречаю-
щиеся в природе вещества могут быть превращены в тысячу новых
веществ, и как эти новые вещества будут использованы для питания
людей и лечения больных.
ГЛАВА I
ПРИРОДА ВЕЩЕСТВА
Наука базируется на небольшом числе основных понятий; к
ним относятся понятия материи, энергии, пространства и времени.
Поэтому на следующих страницах мы хорошо познакомимся с зна-
чением этих понятий. Обычно физические науки делятся на физику,
изучающую энергию, и химию, изучающую материю. Но мы никогда
не должны терять из виду, что такое деление искусственно. Материя
всегда обладает энергией, а изменения в материи всегда сопровож-
даются соответствующими измененениями энергии.
1. Представление о материи у примитивного человека. Отно-
шение примитивного человека к материальному миру, окружающему
его, носило почти исключительно практический характер. Вначале
природа в достаточной степени удовлетворяла его нужды, дос-
14
ПРИРОДА ВЕЩЕСТВА
тавляя ему пищу и кров. Постепенно однако он начал при-
способлять много предметов, которые увеличивали его удобства,
или удовлетворяли его эстетические потребности. Оружие и орудия
из камня, топливо из жира животных, краски из окиси железа
и глина—все это издавна человек приспособил к своим потребностям.
Позднее благородные металлы (серебро и золото), встречающиеся
в природе в свободном состоянии, стали употребляться для укра-
шения. Еще позднее человек нашел способ извлекать многие полез-
ные металлы из руд, в которых они находятся в соединении с другими
веществами. Около 3000 лет до н. э. человек научился добывать
медь, свинец, олово, ртуть и железо и открыл ценные сплавы этих
металлов; таковы например бронза — сплав меди и олова, латунь
(медь и цинк), электрум (серебро и золото). Уже в IV в. до н. э.
в Дамаске производились орудия из тонкой стали. В Египте уже
в очень ранние времена мы находим довольно совершенную циви-
лизацию, которая владела многими практическими ремеслами. Еги-
петские жрецы открыли способы дубить кожу, извлекать из растений
лекарства и краски, делать стекло, глиняную посуду и финифть.
Однако хотя египтяне и умели использовать окружающие вещества
для своих нужд, они мало задумывались над их конечной природой.
Они были прежде всего ремесленниками.
2. Философия греков. В Греции впервые были даны намеки
на решение многих проблем, к решению которых наука пришла
значительно позже, вооруженная более убедительным эксперимен-
тальным методом.
В Индии и Вавилонии зародились идеи о конечной природе
материи, и эти идеи имели значительное влияние на греческую
мысль. Философы ионийской школы старались отыскать единое про-
стое вещество, из которого по их понятию состоит весь материаль-
ный мир. Для Фалеса из Милета (580 г. до н. э.) такой первичной
материей была вода, для Анаксимена (умершего в 526 г. до н. э.)
ею был воздух. Позднее Гераклит (502 г. до н. э.) первичным элемен-
том считал огонь. Наконец Эмпедокл (450 г. до н. э.) к этим элемен-
там присоединил еще землю на том основании, что когда зеленое
дерево горит, разве не появляется огонь, не улетучивается дым,
чтобы стать воздухом, не выкипает вода и в золе не остается ли
земля?
Аристотель (384—322 г. до н. э.) был неутомимым собирателем
всевозможных знаний. Его труды — энциклопедия античного (до-
аристотелевского) знания и учености. И действительно, в продолже-
ние мрачных средних веков и вплоть до эпохи возрождения наук
в Европе (XV ст.) труды Аристотеля были единственным подробным
обзором всех имевшихся знаний. Влияние Аристотеля на историю
мировой мысли огромно.
Его теории, касающиеся природы материи, интересны, посколь-
ку они влияли на научную мысль. Но хотя они и принимались
в продолжение столетий, не возбуждая сомнений, все же оказались
ошибочными, когда их стали проверять экспериментально. Аристо-
ПРИРОДА ВЕЩЕСТВА
15
исканию средств
ель признавал четыре элемента — огонь, воздух, воду и землю,
образовавшиеся в силу взаимного действия друг на друга четырех
противоположных качеств — тепла и холода, сухости и влажности.
Огонь горяч и сух; воздух влажен и горяч; вода холодна и влажна;
земля холодна и суха (рис. 1).Эта концепция вследствие ее схемати-
ческой простоты получила признание. Повидимому казалось несу-
щественным то, что ведь и вода иногда может быть горяча. Для Ари-
стотеля она была холодной и влажной;
холодной и влажной оставалась она в про-
должение 2 000 лет *.
3. Алхимики. В III ст. до н. э. Алек-
сандрия заместила Афины, став вторым
интеллектуальным центром древнего мира.
Здесь был основан знаменитый музей с
библиотекой в 400 000 томов, позднее,
в середине VII ст. н. э., разрушенный
арабами. Здесь Эвклид привел в систему
и расширил геометрию. В Александрии мы
встречаем первого крупного специалиста
по анатомии человека — Герофила — и
великих астрономов Гиппарха и Птоломея.
Здесь же алхимия положила начало беси
превратить неблагородные металлы в золе
Искусство подделки благородных металлов процветало в про-
должение столетий в Египте. Такие подделки продавались более
бедным классам, не имевшим средств покупать дорогие благородные
металлы. Благодаря влиянию учения Аристотеля люди стали думать,
что свойства, присущие материи, должны быть более основными, чем
сама материя.
Проблема превращения неблагородного металла в золото —
главный предмет стремления алхимиков — не должна была казаться
неразрешимою, поскольку она заключала в себе удаление из небла-
городного металла свойств, не присущих золоту, и, наоборот, прибав-
ление к нему тех свойств, которые присущи золоту. Много химиче-
ских знаний было получено алхимиками, но они излагались таким
мистическим языком, что истинный смысл их совершенно затемнялся.
С установлением закона сохранения материи, согласно кото-
рому материя вечна, стало очевидностью, что она не может быть ни
создана вновь, ни разрушена. Первичной основной реальностью
стала сама материя, а ее свойства стали рассматриваться как
аттрибуты материи. Материя вечна и существует помимо впечатле-
* Аристотель и его последователи под элементами «вода», «земля» и т. п.
понимали не воду или землю как таковые; этими терминами они обозначали из-
вестную совокупность качеств. Например выражение «данное вещество содержит
воду» следовало понимать не в буквальном смысле слова, а лишь в том смысле,
что данное вещество наделено в большей или меньшей мере известными свойствами
^влажностью» и «холодом»), носителем которых считался абстрактный элемент —
16
ПРИРОДА ВЕЩЕСТВА
ний, производимых ее свойствами на человека через посредство его
пяти чувств.
Как только иго аристотелевского понимания материи было снято,
алхимия—искусство сделалось химией—наукою. Отвлеченные эле-
менты древних философов—огонь, воздух, земля и вода—были вы-
теснены конкретными веществами, которые в горниле научного экспе-
римента заслужили право называться элементами. Правда, многие
вещества, в первые дни науки отнесенные к числу элементов, с тех пор
подверглись разложению, но понятие элемента как вещества, которое
уже не может быть далее разложено и не может быть вновь создано'из
более простых веществ, оставалось вполне ясным и недопускало ни-
каких неправильных толкований. Определение химического соеди-
нения как вещества, в котором известные элементы соединены в опре-
деленном весовом отношении, также не допускало никакой дву-
смысленности в понимании. Таким пониманием природы химиче-
ских элементов мы в значительной степени обязаны взглядам Роберта
Бойля (1627—1691), столь убедительно изложенным в его знаменитом
трактате «Скептик-химик или химико-физические сомнения и пара-
доксы, касающиеся экспериментов, посредством которых невеже-
ственные алхимики обыкновенно стараются доказать, что их соль,
сера и ртуть — истинные принципы вещей».
4. Описание веществ. Если признать, что материя—первичная
основная реальность, то очевидно определить ее мы не сможем, и
придется удовольствоваться описанием ее различных форм— отдель-
ных веществ, пользуясь их свойствами, которые производят впечат-
ление на наши чувства.
Свойство, принадлежащее всем веществам, есть масса. Бла-
годаря тому, что сила притяжения пропорциональна массе, послед-
нюю можно измерить. Мы знаем, что всякие две массы в простран-
стве стремятся двигаться по направлению друг к другу под влия-
нием силы притяжения, прямо пропорциональной произведению их
масс и обратно пропорциональной квадрату расстояния между ними.
Вес какого-либо образца вещества будет мерою этой силы взаимодей-
ствия между массой данного образца и массой земли.
Столь часто даваемое определение, что материя есть то, что имеет
вес, как бы заключает в себе положение, что все материальное обя-
зательно должно иметь вес. В свете современных воззрений это не
будет вполне правильным, так как современному поколению стало
известно, что масса может изменяться, и это изменение не может рас-
сматриваться как признак уничтожения материи или образования
ее из ничего.
Быть может масса является самым важным аттрибутом веще-
ства. Однако когда какой-либо данный образчик вещества взвешен,
то о нем многое еще нужно сказать, прежде чем можно будет согла-
ситься, что описание сделано хотя бы приблизительно полно. Ибо
вещество ведь занимает также пространство; оно может существо-
вать в каком-либо из трех состояний: твердом, жидком или газооб-
разном; оно может быть окрашено или бесцветно; оно может иметь
ПРИРОДА ВЕЩЕСТВА
П
пИ не иметь запаха. Пока мы только начали перечисление свойств
11сществ, но ведь одной из задач химии как раз и является возможно
более полное описание всех известных веществ и классификация
поЛученных сведений, с тем чтобы потом было легко пользоваться
ими. Эти описательные факты столь несметно многочисленны в хи-
мИи, чт° ни один человек не может надеяться когда-либо усвоить
хотя бы даже сравнительно малую часть их. Тем не менее каждый
химик должен знать, где следует искать эти сведения, и, когда пред-
ставится необходимость, должен легко находить их.
5. Виды веществ. Химия имеет дело с составом веществ. Одна
из ее главных функций состоит в анализе или разделении на состав-
ные части различных веществ с целью отыскать, как эти части могут
быть вновь соединены вместе.
Если мы поближе познакомимся с веществом, то мы будем
в состоянии сразу увидеть разницу, позволяющую все вещества
разделить на два класса: вещества разнородные и вещества
однорогие. Большая часть всех образцов веществ, находимых
в природе/разнородна. В куске гранита мы можем различить бес-
цветные кристаллы кварца, белые кристаллы полевого шпата и темно-
коричневые частицы слюды. Разнородный характер куска гранита
может быть легко установлен, так как свойства его не одинаковы
во всей массе, но резко меняются при переходе от одной части к дру-
гой. О каждой части такой смеси, имеющей одни и те же свойства,
говорят как о ф а з е. Таким образом гранит представляет собою
смесь трех твердых фаз: полевого шпата, кварца и слюды. Так как
термином «фаза» придется пользоваться неоднократно, полезно
будет теперь же иллюстрировать его значение еще несколькими при-
мерами. Суспензия кварцевого песка в воде состоит из двух фаз:
твердой фазы — кварца и жидкой фазы — воды *. Холодильная
смесь, которой пользуются при приготовлении мороженого, со-
стоит из трех фаз; две из них твердые — кристаллы льда и кристал-
лы соли, одна жидкая — раствор соли **. Некоторые вещества,
например латунь и сталь, невооруженному глазу могут казаться од-
нородными, но под микроскопом обнаруживается их разнородный
характер.
6. Смеси. Все разнородные формы веществ относятся к классу
смесей. Весовые пропорции различных составных частей смеси или,
Другими словами, состав смеси может быть видоизменен по желанию.
Так возможно приготовить смеси из железа и серы в какой угодно
пропорции: 1 г железа с 99 г серы, 1 г серы с 99 г железа, или в ка-
кой-либо иной пропорции. Это до такой степени ясно, что кому-либо
могло бы показаться удивительным, для чего нужно было упоминать
°б этом. Изменчивость состава и есть как раз то свойство, которое
отличает смеси от чистых веществ, к рассмотрению которых мы
скоро перейдем.
* Строго говоря, здесь не две фазы, а три (третья фаза —пары воды над
сУспензией). Ред.
** Здесь также не три фазы, а четыре (четвертая фаза — пары воды). Ред.
введение в химию.
ПРИРОДА ВЕЩЕСТВА
18
Первый шаг в исследовании смеси — это разделение ее компо-
нентов. Такое разделение можно произвести многими способами.
Твердые компоненты могут быть отделены от жидких посредством
фильтрования, жидкие от твердых — путем перегонки. Два твердых
компонента могут быть разделены друг от друга несколько утоми-
тельным процессом отбора отдельных частиц каждого из них или
один компонент может быть полностью отделен от другого посред-
ством какого-либо подходящего растворителя, в котором один ком-
понент растворим, а другой нерастворим. Можно применять также
и многие другие способы.
7. Растворы. Однородная фаза, состоящая из двух или более
компонентов, называется раствором. Самый обыкновенный вид ра-
створа — это раствор твердого вещества в жидком, хотя существует
еще восемь других видов растворов. Растворы кажутся однородными
даже в весьма сильно увеличивающие микроскопы. В этом отношении
они похожи на чистые вещества. Однако их состав может меняться,
и — в соответствии с изменением в составе — происходит изменение
и в свойствах. Этого не бывает у чистого вещества, свойства которого
вполне определенны при данных температуре и давлении. Например
чистая вода при данных температуре и давлении имеет всегда одну
и ту же плотность. С другой стороны, плотность раствора сахара
в воде при данной температуре и давлении обусловливается также
соотношением между количествами сахара и воды, его растворяющей.
8. Элементы и соединения. Чистые вещества представляют
собой однородные образцы материи постоянного состава, свойства
которых точно определены при данных температуре и давлении.
Для того чтобы твердо установить состав чистых веществ, мы должны
главным образом обращаться к двум особенно полезным для химика
методам — анализу и синтезу. Анализ состоит в разложении вещества
на более простые, с последующим отделением продуктов разложения
друг от друга и идентификацией их. Посредством взвешивания этих
продуктов может быть определен процентный состав исходного
вещества. Синтез сводится к противоположной операции, к получе-
нию сложного вещества из более простых веществ. Воду например
можно разложить на два газа — водород и кислород, — пропустив
через нее электрический ток. Это — анализ воды. Полученные таким
образом водород и кислород могут быть тщательно взвешены,
и таким путем может быть определен состав воды. С другой стороны,
вода может быть синтезирована сжиганием струи газообразного
водорода или в атмосфере чистого кислорода, или в атмосфере воз-
духа, содержащего кислород.
Существует однако известное число чи стых веществ, ко-
торые обычно применяемыми методами не могут быть разложены на
более простые вещества; точно так же не удается и с интезировать их
из более простых веществ. Это и есть элементы*; чи ело известных в на-
• Здесь и в дальнейшем автор часто употребляет слов о «элемент» в смы-
сле «простое вещество». Эти понятия не следует смешивать. Мы говорим, что
сложное вещество состоит из элементов, химии ески связанных между собой.
ПРИРОДА ВЕЩЕСТВА
19
тОяШее вРемя элементов равно 90. Химически соединяясь друг
С дрУгоМ’ они образуют бесчисленное количество комбинаций. Обра-
сованные таким образом вещества называются соединениями. Извест-
но несколько сот тысяч соединений, причем только небольшое коли-
чество их можно найти в природе. Ббльшая часть из них была син-
тезирована химиками в лаборатории.
Создание новых веществ, из которых некоторые могут оказать
громадную услугу человечеству, — одна из наиболее интересных
функций химии. В самом деле, иногда существующие в природе сое-
динения в химической лаборатории или на химическом заводе могут
быть приготовлены дешевле, чем обошлось бы их извлечение из есте-
ственных источников, Синтетическое индиго, которое производится
Баденской анилиновой и содовой фабрикой (Германия), может про-
даваться по 15 центов за фунт. Раньше чем этот искусственный про-
дукт появился на рынке, природное индиго продавалось по 4 долл,
за фунт. В 1897 г. 1000000 акров земли в Индии дали урожай индиго
стоимостью в 20 000 000 долл. В 1914 г. Индия произвела этой кра-
ски только на 300 000 долл. Для индусов это было несчастьем, для
синтетической химии — триумфом.
9. Количество элементов и распространение их в природе.
Было открыто 90 элементов; из них только около одной трети найдено
в сколько-нибудь заметном количестве в природе или вообще оказа-
лось имеющим значение. Сравнительное распространение элементов
в земной коре, морях и атмосфере в процентном отношении может
быть выражено следующими цифрами:
Кислород..... 49,2
Кремний.......25,7
Алюминий .... 7,5
Железо.........4,7
Кальций..........3,4
Натрий...........2,6
Калий............2,4
Магний...........1,9
Водород..........0,9
Титан............0,6
Хлор.............0,2
Фосфор...........0,1
Все остальные элементы вместе составляют остающиеся 0,8%.
Сравнительное распространение какого-либо элемента не указывает
однако на его полезность. Углерод составляет менее 0,1% всей
массы земной коры, морей и атмосферы. Однако если бы не было
совсем этого элемента, на земле не могла бы развиваться никакая
Жизнь, так как это наиболее важный элемент во всех органических
соединениях. С другой стороны, титан, относительно более распро-
страненный, имеет мало применения и в некоторых железных рудах
пРедставляет собою нежелательную примесь.
Ю. Металлы и неметаллы. Элементы в основном могут быть раз-
делены на два класса — металлы и неметаллы. Некоторые металлы,
апРимер железо, олово, цинк или свинец, конечно уже известны
Пеп»,?*® сложное вещество распадается на свои составные части, то элементы
0 ипо ДЯТ в свободное состояние. В этом случае мы говорим об элементе, как
ДеРЖит0Л< eel4ccmec- Так например кислород — газ без запаха и цвета, под-
енном ак>и,иЯ горение, — простое вещество. В воде мы имеем кислород в свя-
г°вори Состоянии (в химическом соединении с водородом) и поэтому должны
2» ** ° нем не как о простом веществе, а как об элементе. Ред.
20
ПРИРОДА ВЕЩЕСТВА
читателю. Основные химические свойства, которыми металлы от-
личаются от неметаллов, будут рассмотрены в одной из следующих
глав.
11. Закон постоянства состава. Когда различные образцы
одного и того же соединения подвергаются анализу с целью опреде-
ления в процентах весовых отношений составляющих их элементов,
то замечается один интересный факт. Не существенно, из какого
источника получено соединение, не существенно также, каким спо*
собой оно получено, лишь бы только оно было свободно от приме-
сей,—его состав оказывается всегда один итот же. Вода из растаявше-
го снега или льда на севере, изреки в тропиках или из океана, если
только она была очищена надлежащим образом, всегда будет состоять
из 11,11% (весовых) элемента водорода и 88,89% элемента кисло-
рода. Это справедливо относительно всякого другого соединения
и формулируется в одном из основных законов химии, в законе по-
стоянства состава: в данном химическом соединении элементы всегда
содержатся в одних и тех же весовых пропорциях. Этот закон имеет
огромное значение, так как он не только весьма упрощает изучение
веществ, но позволяет нам также,как мы увидим в одной из следующих
глав, сделать вывод о их строении.
12. Изменения веществ. Изучение состава веществ — одна
из наиболее важных задач из числа поставленных химией. Однако
химия интересуется также и изменениями, которым подвергаются
вещества. Мы все очень хорошо знакомы с тем фактом, что вещества
постоянно претерпевают изменения. Железо ржавеет, уголь горит,
вода испаряется, наконец все бесчисленные процессы самой жизни
с очевидностью свидетельствуют о подобных изменениях. Всем этим
интересуется химия.
Различие между двумя видами таких изменений становится
ясным, как только мы познакомимся с их характерными чертами.
Некоторые изменения не сопровождаются никаким изменением
в составе веществ, подвергнувшихся превращению. Такие изменения
называются физическими изменениями. Те же, которые сопровож-
даются изменениями в составе реагирующих веществ, называются
химическими изменениями.
Когда вода кипит или лед тает, вещества сохраняют свой состав,
так как лед, вода и пар состоят из водорода и кислорода в одних и
тех же весовых пропорциях. Если серебро накалить докрасна, то
в составе серебра не произойдет никакого изменения. Эти изменения
поэтому будут физическими. С другой стороны, когда электриче-
ский ток проходит через воду, вода разлагается на два газообраз-
ных элемента— водород и кислород. Здесь очевидно произошло изме-
нение в составе. Точно так же, когда железо ржавеет, оно соединяется
с находящимся в воздухе кислородом, образуя ржавчину. Здесь
снова имеет место изменение в составе, которое должно сопрово-.
ждаться исчезновением первоначальных веществ и появлением новых-
13. Закон сохранения материи. Исследованиями отношений
между весом веществ, подвергающихся химическому изменению,
ПРИРОДА ГАЗОВ
21
весом образовавшихся продуктов было установлено основное
^общение величайшей важности, приводящее к очень интересным
уводам. Во всех случаях общий вес продуктов реакции в пределах
тОчности измерений равен весу подвергшихся изменению веществ.
Хотя форма материи и может быть изменена, сама материя не может
ни создана вновь, ни разрушена. Это положение известно под
именем закона сохранения материи.
В заключение полезно будет рассмотреть схему, подводящую
итоги всему сказанному в этой главе о составе веществ.
Таблица 1.
Неоднородные вещества
Однородные
вещества
Смеси
(с изменяющимся соотно-
шением составных частей)
Растворы
(с изменяющимся
соотношением
составных частей)
Соединения
(точно определенного со-
става; могут быть разло-
жены и синтезированы)
Простые вещества
(не поддаются разложе-
нию и не могут быть
синтезированы)
Металлы
Неметаллы
ГЛАВА II
ПРИРОДА ГАЗОВ
В ближайших главах мы рассмотрим современную теорию строе-
ния веществ, получившую свое начало при изучении свойств газов.
Вещество может существовать в одном из трех состояний: в виде газа,
в виде жидкости или в виде твердого тела. Ни одно из этих состоя-
ний нельзя рассматривать как характерное для какого-либо опре-
деленного вещества, так как то состояние, в котором оно в данное
время существует, зависит от внешних условий, температуры и дав-
ления. Например вода при атмосферном давлении и при темпера-
туре ниже 0° С твердое тело, а выше 100° С — газ. Такие
выражения, как «вода — жидкость», «железо — твердое тело» или
«кислород —газ», неточны, если при этом не будут подробно указаны
внешние условия, так как каждое из этих трех веществ может быть
получено в одном из трех состояний. Все вещества,'Которые при обык-
новенной температуре и давлении являются газами, были получены
в Жидком и даже в твердом состоянии; почти все тела, при нормаль-
ных условиях представляющие собою твердые тела или жидкости,
°ыли превращены в газы. Вещества, химически разлагающиеся при
22
ПРИРОДА ГАЗОВ
температурах более низких, чем температура, при которой они
превращаются в пар, при этом не имеются в виду.
В этой главе мы рассмотрим природу газов, исследуя характер-
ные свойства, которыми они обладают, и познакомимся с тем, как по-
строена была кинетическая теория для объяснения присущих га-
зам свойств.
1. Галилей и Торичелли. Приблизительно за 350 лет до н. э.
Аристотель учил, что скорость, с которой тела падают, пропорцио-
нальна их весу. Его учение основывалось на очень поверхностном
наблюдении. Однако в продолжение почти 2 000 лет воззрения Ари-
стотеля не подвергались сомнению. Никому и в голову не приходило
подвергнуть высказанное им положение испытанию посредством
эксперимента, пока наконец Галилей, тогда молодой профессор
пизанского университета, не бросил два шара разного веса с знаме-
нитой наклонной башни в этом городе и не доказал членам факуль-
тета этого старинного учреждения, что Аристотель был неправ, что
он слишком поспешил со своим заключением. Шары падали с одина-
ковой скоростью; они ударялись об землю в один и тот же момент.
Его эксперимент, произведенный в 1591 г., положил начало новому
научному методу в исследовании явлений природы, методу, под-
вергавшему экспериментальной проверке сделанные ранее предпо-
ложения и основывавшему заключения на результатах тщательного
наблюдения.
Галилей был первым, показавшим также, что воздух имеет вес;
он взвешивал бутыль, наполненную воздухом при обыкновенном
давлении, и затем снова взвешивал ее после того, как в нее был
введен воздух под давлением. Это свойство воздуха объясняет, по-
чему земная атмосфера связана с землею, ибо вес — проявление
силы тяжести, действующей между весомым предметом и землею.
Торичелли, ученик Галилея, сделал отсюда такой естественный
вывод: если воздух имеет вес, то он должен оказывать давление на
землю. Он постарался придумать и эксперимент, которым этот вы-
вод мог бы быть подтвержден.
Стеклянная трубка, закрытая с одного конца, длиною около
одного метра, была наполнена ртутью, перевернута и своим открытым
концом погружена в ртуть, находящуюся в неглубоком сосуде.
Ртуть в закрытой трубке при этом понизилась, так что ее поверх-
ность оказалась приблизительно на 30 дюймов, или на 76 см, выше
поверхности ртути в сосуде.
Закрытый конец стеклянной трубки не позволил давлению воз-
духа производить какое-либо действие на поверхность ртути в трубке.
Пространство выше этой поверхности и до закрытого конца трубки
представляло собою почти абсолютную пустоту, если не считать со-
вершенно ничтожного давления, которое оказывало незначительное
количество паров ртути. Давление атмосферы на поверхность ртути
в сосуде поддерживало столб ртути длиною в 76 см и было поэтому
равно весу этого столба ртути, давящего на поверхность, равную
поперечному сечению трубки. Если поперечное сечение трубки рав-
ПРИРОДА ГАЗОВ
23
нялось 1 см\ то объем ртути в столбе был равен 76 см3, а вес ее рав-
нялся этому объему, умноженному на плотность ртути (13,6),
т. е. 1033 г. Этот вес и давит на поверхность в 1 см2. Таким обра-
зом экспериментом Торичелли было доказано, что давление атмо-
сферы равно 1033 г на 1 см2. Этот грубый аппарат был первым
барометром, и при его помощи было показано, что атмосферное
давление не постоянно, но в данном месте всегда колеблется; кроме
того, чем выше над уровнем моря, тем меньше атмосферное дав-
ление. Средняя высота столба ртути, поддерживаемого атмосфер-
ным давлением на уровне моря, равна 76 см, или 760 мм.
Барометр был также первым инструментом, которым могли
быть измерены давления газов. Пользование им (в измененной форме)
сделало возможными опыты Роберта Бойля, относящиеся к исследо-
ванию изменения объема газа при изменении давления, и привело
к установлению закона Бойля.
2. Закон Бойля. В 1662 г. Бойль опубликовал результаты двух
серий опытов, «касающихся измерения силы упругости воздуха при
сжатии его и расширении», на которых основывался его закон. Его
собственное описание первой серии этих опытов будет интересно чи-
тателю, поэтому мы его приводим.
Мы взяли тогда длинную стеклянную трубку, которая правой рукой
была согнута на лампе в нижней своей части таким образом, что часть, загнутая
кверху, оказалась почти параллельной остальной части трубки; при этом от-
верстие более короткого колена сифона (да позволено будетмне назватьтак весь
инструмент) было герметически запаяно, а все колено разделено на дюймы*
(каждый из которых в свою очередь разделен на восемь частей) с помощью
прямого листа бумаги; на нем были нанесены эти деления, и сам он был
тщательно приклеен вдоль колена трубки. Затем, влив столько ртути, сколь-
ко нужно было для того, чтобы заполнить дугу или согнутую часть сифона
до уровня, который в одном колене достигал нижнего края бумаги с делени-
ями, и точно до такой же высоты или горизонтальной линии — в другом, мы
постарались, наклоняя много раз трубку таким образом, чтобы воздух мог
свободно переходить из одного колена в другое мимо ртути (я говорю, мы
постарались), добиться того, чтобы воздух, заключенный в более коротком
цилиндре, был такой же незначительной плотности, как и вне его. Когда это
было сделано, мы начали вливать ртуть в более длинное колено сифона, при-
чем ртуть, производя своим весом давление на воздух, заключенный в корот-
ком колене, постепенно сжимала его; приливание ртути продолжалось до тех
пор, пока воздух в более коротком колене не был сжатием доведен до поло-
вины того пространства, которое он занимал (я говорю занимал, а не напол-
нял) ранее; мы обратили наш взор на более длинное колено стеклянной труб-
ки, к которому также был приклеен лист бумаги, тщательно разделенный на
дюймы и части дюймов, и заметили не без радости и удовлетворения, что
ртуть в этой части трубки была на 29 дюймов выше , чем в другой части...
Воздух в такой степени плотности, в таком состоянии сопротивления, до
которого довела его оказывающая на него давление атмосфера, был способен
уравновешивать и противостоять давлению цилиндра ртути длиною около
29 дюймов, как это мы узнали благодаря опыту Торичелли; в данном слу-
чае тот же воздух, доведенный до степени плотности почти вдвое большей,,
чем ранее, приобретает вдвое большую упругость; это можно заключить из
* Дюйм равен 2,54 см, Рсд,
24
ПРИРОДА ГАЗОВ
того, что он получает способность выдерживать или оказывать сопротив-
ление цилиндру ртути в 29 дюймов в более длинной трубке вместе с атмо-
сферным цилиндром, который оказывал давление на эти 29 дюймов ртути
и который, как мы только что видели из опыта Торичелли, был равного
веса с ним.
Во второй серии опытов Бойль установил отношение объема
газа к давлениям ниже атмосферного. Известное количество воздуха
помещалось над ртутью в длинной и узкой стеклянной трубке. Ниж-
ний открытый конец этой трубки погружался ниже поверхности
ртути, находившейся во второй стеклянной трубке с большим ди-
аметром. Объем помещенного в первой трубке воздуха измерялся
при атмосферном давлении, т. е.
в тот момент, когда уровни ртути
во внутренней и наружной трубках
были одинаковы. Затем внутреннюю
трубку поднимали, понижая таким
образом давление заключенного в
ней воздуха, так что поверхность
ртути во внутренней трубке стояла
теперь выше, чем поверхность ртути
во внешней. Длина столба ртути
между двумя уровнями и была мерою
разницы в давлении между помещен-
ным во внутренней трубке воздухом
и атмосферным. Таким путем Бойль
установил отношение между давле-
нием и объемом газа менее плотного,
чем атмосферный воздух. Результаты
обеих серий опытов сошлись, т. е.
оказалось, что когда давление газа
Роберт Бойль. увеличивалось, его объем уменьшал-
ся и наоборот.
Закон Бойля — вывод, сделанный из результатов произведен-
ных им опытов. Если температура газа остается постоянной, то
давление данной массы газа обратно пропорционально объему, кото-
рый он занимает. Математически этот закон может быть выражен
следующим образом:
где V — объем, Р—давление, к — коэфициент пропорциональ-
ности.
Чтобы выразить то обстоятельство, что речь идет об обратной
пропорциональности, один множитель должен быть взят в виде об-
ратной величины (1/Р).
То же выражение может быть дано в такой форме;
ПРИРОДА ГАЗОВ
25
Роль константы к состоит в том, чтобы установить определен-
ные отношения между величинами двух переменных, выраженных
в определенных единицах. Например объем известного образца
газа может быть равен 10 см3 при давлении в 700 мм. В приложении
к этому примеру отношение, выражаемое законом Бойля, будет та-
ково:
10 см3 — к мм;
к = 700 X 10 мм х см3.
Зная величину константы к, мы можем вычислить объем
данной массы газа при каком угодно давлении и, наоборот, давление
при каком угодно объеме.
Закон Бойля может быть также выражен и иначе — способом,
в некоторых отношениях более удобным. Если — объем извест-
ного газа при давлении Pv a V2 — объем того же газа при давле-
нии Рг, то
Рис. 2. Изменение объ-
ема газа в зависимости
от давления при постоян-
ной температуре.
v1_pi
F.-p»’ (2)
Если различные объемы данной массы га-
за отметить на чертеже против соответствую-
щих давлений, то получается кривая, пока-
занная на рис. 2. Эта кривая ясно указы-
вает, что когда давление приближается к бе-
сконечности, объем приближается к нулю
и наоборот.
3. Термометры. Температура предста-
вляет собою другой фактор, определяю-
щий объем, занимаемый данным газом.
Несколько позже мы будем иметь случай
изучать природу тепловой энергии и вообще
значение понятия температуры. Для на-
стоящих целей будет достаточно опреде-
лить температуру как меру степени нагре-
тости какого-либо тела. Температуры двух тел различны, когда тепло
переходит от одного к другому при соприкосновении их друг с дру-
гом. Изменение температуры какого-либо тела сопровождается
соответствующими изменениями многих его свойств. Объем тела,
цвет и электропроводность тела — только немногие примеры
свойств, изменяющихся под влиянием изменений температуры.
Масса тела может быть единственное свойство, на которое измене-
ния температуры не оказывают влияния. Эти изменения в свойствах
и дают нам средства для измерения температуры. Грубо оценить
температуру какого-либо тела мы можем хотя бы по его цвету: тело
сначала раскаляется докрасна, а затем добела. В оптических пиро-
метрах, измеряющих высокие температуры, используется именно
26
ПРИРОДА ГАЗОВ
Г С А
-212 -100 -373
-194 -90 -363
-176 -80 -353
-158 -70 -343
-140 “60 -333
—122 -50 -323
-104 -40 ’ -зпз
“86 -30 -зоз
-бв -20 -293
-50 -ю т 283
-32 - 0 -273
-И --Ю Г 263
это последнее свойство. Температуры часто измеряют с величайшей
достигаемой в настоящее время точностью, пользуясь тем, что при
нагреваний места соединения двух металлов возникает разность по-
тенциалов, величина которой изменяется с температурой. В самом
же обыкновенном приборе, служащем для измерения температур,
используются изменения объема, связанные с изменениями тем-
пературы.
Мы уже отметили, что Торичелли был первым, придумавшим
прибор для измерения давления. Его учителю, Галилею, принадле-
жит честь изобретения первого термометра. Термометр этот состоял
из стеклянного шара, заключавшего в себе известное количество воз-
духа; он соединялся с концом стеклянной трубки. Другой конец
трубки был погружен в сосуд с водой. Увеличение температуры газа
сопровождалось расширением его объема и
следовательно понижением уровня воды
в трубке. Этот механизм позволял врачу
установить температуру тела своего пациента
по сравнению с температурой собственного
тела. Когда шар находился подмышкой у
врача, уровень воды в трубке указывал на
нормальную температуру. Если же вода
опускалась ниже этого уровня (когда шар
был подмышкой у пациента), это указывало
на лихорадку. Позднее Рей, французский
врач, усовершенствовал этот термометр, пере-
вернув его и наполнив шар водой. Посте-
пенно дошли до современного термометра,
в котором в качестве жидкости используется
ртуть или алкоголь.
4. Шкалы температур. Чтобы с помо-
щью термометра численно охарактеризовать
степень нагретости, необходимо произвольно
зафиксировать две основные точки на его шкале. Эти точки дол-
жны обозначать температуры, легко воспроизводимые в лаборатории.
Такими температурами будут: температура тающего льда и темпера-
тура кипящей воды при атмосферном давлении. Такие зафиксирован-
ные точки впервые были приняты Фаренгейтом для температурной
шкалы, носящей его имя и поныне. На этой шкале градус представ-
ляет собою 1/180 расстояния между двумя определенными точками.
Градусные деления одинаковой длины продолжаются выше и ниже
этих точек. Фаренгейт избрал нулем на своей шкале температуру
смеси льда, воды и соли, — температуру, которая в те времена счи-
талась наинизшей. Эта температура лежала на 32° ниже температуры
замерзания воды.
Таким образом за температуру последней была принята темпера-
тура в 32°, а за температуру кипения воды 212°. В середине XVIII ст.
астроном Цельсий предложил стоградусную шкалу, которая была
принята во всем мире для научных работ. Основные точки опреде-
Рис. 3. Сравнение темпе-
ратурных шкал.
ПРИРОДА ГАЗОВ
27
ляются температурой замерзания и кипения воды и обозначаются
соответственно 0° и 100°. Расстояние между этими точками делится
на сто равных частей, называемых градусами ♦. На рис. 3 сравнива-
ются эти две шкалы.
5. Изменение объема при изменении температуры. После того
как были установлены легко воспроизводимые шкалы темпера-
туры, стало возможным изучение изменений объема газа в зависи-
мости от изменений температуры. Отношение между этими двумя
переменными было впервые изучено французским физиком Шарлем
в 1787 г., а в 1802 г. французом Гей-Люссаком и англичанином
Дальтоном. Они нашли, что все газы расширяются одинаково при
одинаковом повышении температуры. В результате исследований
Гей-Люссака и Дальтона было найдено, что всякий газ при повыше-
нии температуры на Г по стоградусной шкале расширяется на V273
часть своего объема при 0° С. Например объем газа в 273 см3 при 0° С
расширяется на 1 см3, если температура поднимается на Г С: расши-
рение составляет от 273 см3. Очевидно, что отношение объемов
будет не таково, как отношение температур, ибо 273 см3/214 см3
не будет равно 0°/Г. Объем следовательно изменяется не так, как
температура по стоградусной шкале. Если температура одного и
того же количества газа поднимается с 1 до 2°, то снова произойдет
расширение — до объема в 275 см3. Этот процесс может итти и в про-
тивоположном направлении: понижение на 1° в температуре вызовет
сжатие на 1/273 объема при 0° С. Мы не должны упускать из ви-
ду, что при всех этих изменениях давление принимается посто-
янным.
6. Изменение давления в зависимости от температуры. Если
некоторое постоянное количество газа заключено в определенный
объем, то давление этого газа при изменениях температуры меняет-
ся совершенно также. При повышении температуры на Г по стогра-
дусной шкале давление увеличивается на ^73 давления газа того же
объема при 0° С. Охлаждение дает противоположный результат.
, 7. Шкала абсолютной температуры. Если газ при постоянном
давлении будет охлажден до температуры на 273° ниже нуля по сто-
градусной шкале, то объем его уменьшится на 273/273 его объема при
0° С. Другими словами, газ совсем не должен занимать объема. Совер-
шенно так же газ, охлажденный при постоянном объеме до — 273° С,
не должен производить давления **. Таким образом—273°Сэто са-
мая низкая возможная температура; она называется абсолютным
нулем.
• Автор не упоминает об общеизвестной шкале Реомюра, где основные тем-
пературы замерзания и кипения воды обозначаются соответственно 0* и 80°.
Ред.
** Следует отметить, что эти рассуждения справедливы только по отношению
к так называемому «идеальному» газу, в точности подчиняющемуся законам Бойля-
Мариотта и Гей-Люссака.
В действительности же у всех существующих реальных газов наблюдаются
Уклонения от этих законов и поэтому вывод о полном исчезновении объема к реаль-
"Мм газам не приложим (см. стр. 29 и 35). Ред,
28
ПРИРОДА ГАЗОВ
Мы видели, что ни объемы, ни давления не оказываются прямо
пропорциональными температуре по стоградусной шкале. Можно
однако установить такую шкалу температур, которая будет пря-
мо пропорциональна объемам и давлениям. Такая шкала называется
абсолютной шкалой. Прибавив 273° к температуре по стоградусной
шкале, можно перейти от последней к абсолютной, т. е.
t + 273°= Т,
причем t означает температуру по стоградусной шкале, а Т — абсо-
лютную. Сравнение двух шкал (рис. 3), где А шкала абсолютной тем-
пературы, уяснит существующее здесь отношение. Теперь мы можем
выразить посредством абсолютных температур законы, управляю-
щие изменениями объема и давления при изменениях температуры.
Закон Шарля принимает такую формулировку: если давление
какого-либо газа остается постоянным, его объем будет изменяться
прямо пропорционально абсолютной температуре, т. е.
V = /сТ;
(3)
Если сравниваются объемы какого-либо газа при двух различных
температурах, то
Если объем какого-либо газа остается постоянным, его давление
изменяется прямо пропорционально его абсолютной температуре:
Р = кТ;
Рг_7\
(5)
(б)
8. Общее уравнение газообразного состояния. Три переменных—
объем, давление и температура — вполне определяют состояние
какого-либо газа. Мы рассмотрели, как одна из переменных изме-
нялась вместе с другой, в то время как третья переменная оставалась
постоянной. Теперь мы рассмотрим, что получится, когда все три фак-
тора будут переменными. Начнем с такого состояния газа, в котором
объем будет равен Vv давление Рг и абсолютная температура 7\,
и затем приведем его в такое состояние, когда объем будет равен
Vs, давление Ра и его температура Тг. Каково будет отношение между
всеми этими факторами? Переход из одного состояния в другое раз-
ложим на две стадии. Сначала примем постоянной температуру Tlt
давление же повысим до Р2. Объем при Тх и Ра обозначим V. Тогда
V, _ р.
(?)
ПРИРОДА ГАЗОВ
29
(8)
Теперь повысим температуру до Т2. Тогда
YL-I1.
V, т, •
Подставив значение V из уравнения (7) в (8), получим выраже-
ние, известное как общее уравнение газообразного состояния:
v, т, Pt' и
Если пять переменных известны, то шестое может быть получено
подстановкой этих пяти в указанную формулу (9). Разберем на типич-
ном примере, как это может быть сделано.
Задача. 10 л некоторого газа при давлении в 5 am и при температуре
227° С нагреты до температуры 327° С и давление поднято до 12 ат. Каков
будет объем при этих новых условиях?
у, = 10 Л Pi = 5 am t,= 227° С или 7, = 500° А
V, =? Р, = 12 am tt = 327° С или Та = 600 А
Подставим известные величины в уравнение (9):
10 500 12
ТГ= 600 Х5; Г‘=5Л-
9. Нормальные температура и давление. Было найдено удоб-
ным установить нормальные температуру и давление, к которым
можно было бы приводить данные объемы газа. Нуль градусов
по стоградусной шкале или 273° по абсолютной шкале условились
считать нормальной температурой и 760 мм, или 1 ат, нормальным
давлением.
10. Отклонения от газовых законов. Газовые законы, только что
рассмотренные нами, не столь же точны, как например закон постоян-
ства состава или закон сохранения материи. В 1825 г. Депре открыл,
что газы в условиях, близких к тем, при которых наступает их
сжижение, способны сжиматься более, чем это должно было бы иметь
место, согласно закону Бойля. Позднее в результате очень обстоя-
тельных опытов Реньо нашел, что ни один газ не повинуется вполне
точно газовым законам, но что в случаях трудно сжимаемых газов,
например водорода, азота или кислорода, отклонения от законов
ничтожны, за исключением тех случаев, когда действия этих зако-
нов приходится наблюдать при низких температурах или высоких
Давлениях.
11. Развитие кинетической теории газов1. Тот факт, что отно-
шение всех газов к изменениям температуры и давления так порази-
тельно сходно, с самого начала внушал предположение о совершенно
тождественном строении всех газов и вызывал попытки создать прием-
лемые модели этого строения. Теория строения газов, близкая к сов-
ременной, впервые была предложена Бернулли еще в 1738г.*. Позднее,
‘Брэгг, о природе вещей, гл. II (русский перевод).
б * Взгляды на строение вещества, весьма приближающиеся к современным,
Оь,ли высказаны Ломоносовым в 1740 г. Ред.
30
ПРИРОДА ГАЗОВ
к концу девятнадцатого столетия, эта теория была расширена трудами
Клаузиуса и Максвелла. Теперь мы постараемся пойти по следам
этих ученых и вывести теорию из экспериментальных данных.
Приступая к мысленному построению картины, рисующей
нам вид и свойства газа как бы под микроскопом, увеличивающая
способность которого несравненно выше той, какую мы можем иметь
в действительности, рассмотрим прежде всего с качественной стороны
некоторые характерные черты, присущие,как показывают нам лабора-
торные исследования, всем газам. Затем на основании этих экспери-
ментальных данных, постараемся построить мысленно картину
строения газов, которая объяснит нам известные их свойства. Кар-
тина эта будет носить исключительно теоретический характер, и
нам придется проверить ее многими способами, прежде чем мы впол-
не удостоверимся в ее истинности.
Прежде всего следует остановиться на том факте, что отношение
всех газов к изменениям объема, температуры и давления одинаково,
причем совершенно не имеет значения, будут ли они простыми ве-
ществами, соединениями или, как, например, воздух, смесью га-
зообразных веществ. Из этого мы можем вывести, что строение
всех газов вероятно одинаково. Из осторожности мы говорим «ве-
роятно». Быть может в будущем будет найден какой-либо газ,
свойства которого не будут похожи на свойства других газов. Это
мало вероятно, но тем не менее возможно.
Другое свойство, присущее всем газам, — способность диффун-
дировать в пространство, занятое уже другим газом. Это ясно пока-
зывает, что строение газов как бы пористое. Вещество в газообраз-
ном состоянии имеет прежде всего прерывистое строение, т. е. между
частицами, из которых состоит газ, находятся пространства, неза-
полненные газом.
Одна особенность газового давления лучше всего поможет нам
проникнуть в строение газа: газовое давление проявляется равномерно
во всех направлениях. Для того чтобы представить себе механизм,
который мог бы производить такое давление, мы должны выяснить с
помощью нашего опыта, какими способами вообще может быть
осуществлено давление. Затем, рассуждая по аналогии, мы должны
применить эти способы к газам и посмотреть, будет ли объяснено та-
ким образом газовое давление. Быть может наиболее обыкновенной
формой давления является давление некоторого веса на известную
поверхность. Однако такое давление может производиться только
вниз, так как оно обусловливается земным тяготением. Очевидно та-
ким образом нельзя объяснить газовое давление. Давление, произ-
водимое пружиной, действует только в одном направлении, тогда как
газовое давление проявляется одинаково во всех направлениях. Дав-
ление может быть произведено также толчком движущегося предмета.
Теперь мы ближе к правдоподобному объяснению. Представим себе
пространство, в котором миллионы маленьких, невидимых даже и под
микроскопом частиц движутся свеличайшей скоростью во всех напра-
лениях. Их движения в полном смысле слова беспорядочны. Объяснит
ПРИРОДА ГАЗОВ
31
й такая картина строения какого-либо газа его давление? Мы можем
мысленно представить себе частицы, посылающие целый ливень уда-
ров на каждый участок поверхности сосуда, вмещающего в себе газ,
л на каждый предмет, находящийся в сосуде. Если движения этих
частиц в полном смысле слова беспорядочны, то количество их двигаю-
щихся в каком-либо направлении будет совершенно таким же, как и
количество двигающихся в любом другом, и производимое ими дав-
ление будет одинаковым во всех направлениях. Эти частицы назы-
ваются молекулами. Считаясь с теми фактами, что газы способны
диффундировать друг в друга и кроме того расширяться и сжимать- (
ся, мы должны также допустить, что при обыкновенных давлениях )
отдельные молекулы газа отделены друг от друга относительно огром- [
ными пространствами.
Рассмотрим еще одну характерную черту газового давления.
Мы знаем, что повышение температуры какого-либо газа при по-
стоянном объеме сопровождается увеличением его давления. Как
же отразится это увеличение давления при повышении температуры
в данном случае на нашей картине газа? Рассмотрим сначала, от
чего зависит получающееся давление, когда одна газовая молеку-
ла ударяется о какой-либо предмет. Давление обусловливается не
только массой молекулы, но также и скоростью, с которой она дви-
жется. Пушечное ядро ударит сильнее, чем перо, движущееся с той
же скоростью *.
Чтобы объяснить увеличение давления, сопровождающее повы- j
шение температуры, мы должны принять, что при этом увеличится |
или масса или.скорость молекулы (или и та и другая). Так как i
мы знаем, что масса не зависит от изменения температуры, то по-
вышение температуры должно сопровождаться увеличением скорости,
с которой движутся газовые молекулы.
Другое характерное свойство газов, настолько очевидное, что
выводы из него почти никогда не рассматриваются, состоит в том,
что данный образец газа, сохраняющий постоянный объем и постоян-
ную температуру, сохраняет постоянным и свое давление. Могли бы
мы предсказать это, исходя из нашей картины строения газа? Во-
образим себе, что по полу пустой комнаты с величайшей скоростью
во всех направлениях движутся сто мячей. Через короткое время
они конечно остановятся. Почему? Очевидно под влиянием силы
тяжести. Их начальная кинетическая энергия и упругость определят
Как скоро они остановятся. Теннисные мячи пробудут в движении
Дольше, чем деревянные. Почему же молекулы газа не последуют
их примеру? Доказательством того, что они действительно не оста-
навливаются, служит тот факт, что давление газа остается постоян-
ным при постоянных объеме и температуре. Может ли наша картина
строения газов объяснить такое «анормальное» поведение газовых мо-
лекул? Прежде всего мы должны принять, что молекулы любого газа
* Вместе с тем из двух одинаковых ядер, движущихся с различными ско-
ростями, более сильный удар нанесет то, которое движется быстрее. Ред.
32
ПРИРОДА ГАЗОВ
отличаются величайшей упругостью, а отсюда вытекает ряд следствий.
Ударяясь о поверхность, весьма упругое тело сохраняет ту кинети-
ческую энергию, которой оно обладало до удара.
Знаем ли мы из нашего повседневного опыта предмет, который
обладал бы таким же свойством? Даже новый теннисный мяч не бу-
дет отскакивать от неподвижной стены с той же скоростью, с какою
он был брошен, по той причине, что известная доля первоначальной
кинетической энергии теряется в виде тепла или, другими словами,
в виде трения. Чем большей упругостью обладает тело, тем меньше
трение, когда тело сталкивается с другим предметом. Идеально уп-
ругое тело не должно терять ничего из своей кинетической энергии
в виде тепла, когда оно ударяется о другой предмет. Чтобы объ-
яснить давление газа на нашей модели, мы должны принять, что
молекулы газа идеально упруги, что они не могут при ударе терять
какой-либо доли своей кинетической энергии в виде тепла.
Следующий вопрос, на который должна дать ответ наша кар-
тина строения газа, относится к действию силы тяжести на моле-
кулы газов. Действует ли на них сила тяжести, и, если действует,
то почему они не концентрируются вблизи дна сосуда, в котором
они заключены? Если же допустить, что они сосредоточены на дне
сосуда, то почему давление газа не будет больше на дне сосуда, чем
наверху его? Сила тяжести несомненно производит действие на га-
зовые молекулы, но ее действие в сосуде обыкновенной высоты ска-
зывается неизмеримо мало вследствие необычайной скорости,
с которой двигаются молекулы. Было теоретически установлено,
как мы увидим позже, что при 0° по шкале абсолютной температуры
всякое движение этих газовых молекул прекращается, но если тем-
пература поднимется только на 0,001°, у них будет достаточно кине-
тической энергии для того, чтобы оттолкнуться от дна сосуда на
18 см. При температуре, приближающейся к комнатной, их скорость,
едва ли меньшая, чем 1—2 км в секунду, заставит, их отскакивать
на несколько миль в пространство. Хорошо известен факт, что зем-
ная атмосфера имеет высоту около 500 км и что давление, по мере
того как мы поднимаемся в воздух, быстро уменьшается. Если бы
сила тяжести совсем не действовала на земную атмосферу, послед-
няя удалилась бы от земли в пространство.
12. Кинетическая теория и газовые законы. Нарисованной выше
картиной строения газов можно очевидно воспользоваться для того,
чтобы с качественной стороны объяснить характерные свойства газов.
Газовые законы — это количественные описания этих же свойств.
Может ли кинетическая теория строения газов так же хорошо объяс-
нить их свойства и с количественной стороны, как она объясняла
их качественно?
Чтобы истолковать закон Бойля, наша модель должна быть в
состоянии показать, почему одно и то же количество газа в объеме
вдвое меньшем будет производить вдвое большее давление. Вообра-
зите себе некоторый цилиндр А (рис. 4), снабженный поршнем В,
на который можно помещать тяжести и таким образом производить
ПРИРОДА ГАЗОВ
33
Рис. 4. Изменение давления
газа при изменении объема.
давление на газ, заключенный в цилиндре. Газ будет производить
давление на нижнюю сторону поршня, равное давлению силы тя-
жести на верхнюю сторону его. Чтобы лучше представить себе моле-
кулы, вообразим, что весь аппарат микроскопического размера и
что он содержит в себе только 10 молекул. Газ находится под давле-
нием Plf его объем Vv Теперь увеличим вдвое тяжесть на поршне
и таким образом удвоим давление. Новый объем будет равен поло-
вине старого, но число молекул очевидно осталось без изменения.
Мы таким образом удвоили их концентрацию, так как теперь в еди-
нице объема вдвое больше молекул. Отсюда частота столкновений
молекул с нижней стороной поршня удвоится, в результате чего
получится удвоенное давление. Кинетическая теория таким образом
выдвигает постулат: давление, произ-
водимое каким-либо газом при данной
температуре, пропорционально концен-
трации его молекул.
Когда мы рассматриваем законы,
выражающие зависимость изменения
объема или давления какого-либо газа
от абсолютной температуры, мы по-
стоянно должны помнить, что эти за-
коны определяют собой шкалу абсолют-
ной температуры. Эта шкала так по-
строена, что температуры, указываемые
ею, пропорциональны объемам газа
при постоянном давлении или давле-
ниям при постоянном объеме. Теперь
необходимо рассмотреть смысл шкалы
в терминах кинетической теории. Может быть наилучший спо-
соб понять это состоит в рассмотрении изменения давления какого-
либо газа при постоянном объеме в зависимости от изменений его
температуры (абсолютной). Мы уже упоминали о том факте, что дав-
ление р, производимое ударом одной молекулы газа, определяется
ее массой т и ее скоростью v, т. е. пропорционально произведению
этих факторов. Это произведение и есть то, что называется коли-
чеством движения тела:
p<Xmv *.
Общее давление всех молекул Р пропорционально двум факто-
рам — скорости движения каждой молекулы и количеству ударов
/ о стенки сосуда, т. е. .
Р <xmv,
и
РОС/;
абсолютной
. ♦ Знак ос — знак пропорциональности (не смешивать с коэфициентом пропор-
циональности!). В нашей литературе этот знак не принят. Приведенное
выражение читается так: р пропорционально mv. Ред,
3 Введение в химию.
34
ПРИРОДА ГАЗОВ
следовательно
P<xmv xf.
Количество ударов / обусловливается только скоростью моле-
кул:
/сс V.
Поэтому общее давление пропорционально массе одной моле-
кулы, умноженной на квадрат скорости:
Р <х mv х v = mv2.
Так как энергия, которой обладает движущееся тело, т. е.
его кинетическая энергия Е, равна половине произведения массы
тела на квадрат скорости:
Е = Va mv2,
то отсюда следует, что общее давление всех молекул какого-либо
газа пропорционально их кинетической энергии:
Шкала абсолютной температуры установлена так, что ее пока-
зания изменяются прямо пропорционально давлению газа при по-
стоянном объеме. Таким образом абсолютная температура есть
мера кинетической энергии молекул какого-либо газа:
Е&Т.
Идя к этому заключению, мы принимали, что скорость, а следо-
вательно и кинетическая энергия всех молекул данного газа при
данной температуре одинакова. На самом деле это не так. В дейст-
вительности возможны все скорости от нуля до бесконечности, но
средняя* скорость определяется температурой. С помощью стати-
стической механики можно вычислить вероятность известной скоро-
сти какой-либо молекулы, но такое вычисление выведет далеко
за пределы нашей книги.
13. Общие выводы, касающиеся кинетической теории газов.
Суммируем теперь то, что нам известно о кинетической теории в виде
нескольких положений:
1. Газы состоят из мельчайших частиц, называемых молеку-
лами; движение молекул имеет случайный характер; число моле-
кул, движущихся в одном направлении, в среднем равно числу
движущихся в каком-либо другом направлении.
2. Средняя кинетическая энергия молекул пропорциональна
абсолютной температуре.
* Среднюю скорость V можно определить как среднее арифметическое скоро-
стей Vlt Vt...Vn молекул, заключающихся в данном объеме:
v = У, +У, + У,+-+ v„ . Реб.
и
ПРИРОДА ЖИДКОСТЕЙ И ТВЕРДЫХ ТЕЛ 35
3. Давление данной массы любого газа изменяется пропор-
«онально молекулярной концентрации газа.
ЦИ 4. Молекулы в высшей степени упруги, поэтому при столкно
нИи с другими, при постоянной температуре, не происходит ни-
какой потери общего количества кинетической энергии.
К 5. При любом давлении, за исключением очень высоких, объе-
мом самих молекул можно пренебречь по сравнению с пространством
между ними.
14. Отклонения от газовых законов. Мы уже указали, что при
высоких давлениях и низких температурах газы не подчиняются
газовым законам. Объясняя, как можно истолковать в терминах
кинетической теории, например, закон Бойля, мы молчаливо при-
нимали, что, сближая молекулы и увеличивая таким образом дав-
ление мы нисколько не увеличиваем сил притяжения между ними.
Эти силы отчасти имеют характер сил тяготения, отчасти электри-
ческих, отчасти магнитных; их действие становится более заметным
по мере того, как среднее расстояние между молекулами умень-
шается. Поэтому при высоких давлениях, т. е. при больших концен-
трациях молекул, эти силы не могут быть оставлены без внимания,
и в таких случаях поведение газа уклоняется от поведения, требуе-
мого газовыми законами. Далее при высоких давлениях начинает
сказываться и объем самих молекул, являясь уже заметной величиной
в сравнении с пространством между молекулами. Так как объем,
о котором идет речь в газовых законах, относится к свободному
пространству между молекулами, то при высоких давлениях объем
молекул становится другим фактором, вызывающим отклонение.
Мы видели, что необычайно большие скорости, с которыми
молекулы движутся при всех обыкновенных температурах, проти-
водействуют силам взаимного притяжения между ними и застав-
ляют их свободно отталкиваться друг от друга и заполнять весь
сосуд, в котором газ находится. Однако при низких темпера-
турах молекулы движутся относительно медленно. При этих усло-
виях силы межмолекулярного притяжения начинают проявлять
себя — ив результате появляются уклонения от газовых законов.
Гипотетический газ, в котором нет сил притяжения между со-
ставляющими его молекулами и в котором объемом самих молекул
можно пренебречь, называется идеальным газом. Такой газ подчи-
нялся бы газовым законам в точности и без всяких уклонений. Из
известных нам газов ни один не является идеальным, хотя химичес-
ки инертные газы, как, например, гелий, в своем поведении прибли-
жаются к такому состоянию.
ГЛАВА III
ПРИРОДА ЖИДКОСТЕЙ И ТВЕРДЫХ ТЕЛ
ск а^3Учение природы газов привело нас к молекулярно-кинетиче-
н«е ТеоРии их строения. Теперь мы будем продолжать наше изуче-
состояний вещества, исследуя природу твердых тел и жидкостей.
36 ПРИРОДА ЖИДКОСТЕЙ И ТВЕРДЫХ ТЕЛ
1. Характерные черты жидкого состояния *. Как и в случае
газов, удобнее всего проникнуть в природу жидкостей, изучая харак-
терные свойства, общие всем жидкостям. Одним из наиболее ярких
свойств жидкости является то, что данное количество жидкости при
данной температуре занимает определенный объем. Отсюда следует,
что такое количество не заполнит сосуда с большим объемом, как
это имело бы место для газа. В силу этого характерного свойства у
жидкостей наблюдается свободная поверхность и поэтому их легко
отличить от газов. В отличие от твердых тел они не имеют опре-
деленной формы, но растекаются и принимают форму' той части
заключающего их сосуда, которую они занимают. В отличие от га-
зов жидкости относительно мало сжимаемы. Если например давле-
ние на воду в жидком состоянии увеличить от 1 до 10 000 ат, объем
ее станет равным приблизительно */5 ее первоначального объема.
Далее объем жидкости с изменением температуры изменяется только
очень медленно, гораздо меньше, чем объем газов. Подобно газам
жидкости способны диффундировать одна в другую. Наконец все
жидкости испаряются, т. е. они стремятся переходить из жидкого
в газообразное состояние в количествах, зависящих от природы
жидкости и температуры, причем предполагается, что поверх-
ность жидкости свободно соприкасается с находящимся над ней
газом.
2. Строение жидкостей. Говоря о природе газов, мы отме-
тили, что при низких температурах и высоких давлениях явно
обнаруживается взаимное притяжение между молекулами газов,
в результате которого появляются отклонения от газовых законов.
Пока молекулы находятся относительно далеко друг от друга, эта
сила притяжения невелика, так как она быстро уменьшается с увели-
чением расстояния между молекулами. Точно так же, если скорость
молекул велика, они выходят из сферы взаимного действия их друг
на друга во время прохождения одной мимо другой или в момент
действительного столкновения.
Молекулы жидкости гораздо ближе друг к другу, так что дей-
ствие сил притяжения между ними проявляется весьма заметно.
Поэтому-то жидкость и занимает определенный объем. Однако
эти силы недостаточно велики для того, чтобы удерживать молекулы
жидкости на одном месте; на это указывает то обстоятельство, что
жидкости не имеют собственной формы, но принимают форму со-
суда, в котором они находятся.
Предположение, что молекулы жидкости расположены очень
близко друг к другу, подтверждается тем, что сжимаются жидко-
сти необычайно трудно; если же жидкость при постоянном дав-
лении превращается в газ, то происходит громадное увеличение
объема. Так, если один объем воды при 100° С превращается в пар,
то объем ее при испарении увеличивается в 1 700 раз, при неизме-
няющемся конечно давлении.
‘Брэгг, О природе вещей, гл. lllj
ПРИРОДА ЖИДКОСТЕЙ И ТВЕ РДЫХ ТЕЛ
37
3. Испарение. Одно из наиболее интересных свойств жидкостей—
это их стремление испариться. Вода в открытом сосуде быстро испа-
ряется- Найти объяснение этому явлению нетрудно. Вообразим себе,
{jro молекулы в жидкости движутся по разным направлениям с от-
носительно большими скоростями, по очень коротким путям и под
соединенным влиянием кинетической энергии, притягательных сил
между соседними молекулами и действия взаимных столкновений.
Внутри жидкости силы притяжения, действующие на какую-либо
одну молекулу, равны по всем направлениям, так что их равнодей-
ствующая равна нулю. На поверхности жидкости сила, тянущая
молекулу внутрь жидкости, не уравновешивается никакой соответ-
ствующей силой сверху; поэтому для того чтобы молекула могла
оторваться от своих товарищей на поверхности, она должна обла-
дать большей кинетической энергией, чем средняя кинетическая
энергия других молекул. При данной температуре средняя кинети-
ческая энергия молекул данной жидкости всегда одна и та же.
Тем не менее в каждый данный момент часть молекул будет дви-
гаться с большей кинетической энергией, чем средняя, и часть
молекул будет двигаться с меньшей, чем средняя, кинетической
энергией. Молекула может прорваться через поверхность, если
она обладает достаточной кинетической энергией, чтобы побороть
действие притягательных сил, которые стремятся притянуть ее внутрь
жидкости. Раз молекуле удалось вырваться из жидкости, она стано-
вится типичной газовой молекулой и улетает во внешнее пространство.
В открытом сосуде этот процесс продолжается до тех пор, пока вся
жидкость не испарится.
Отрываясь от своих товарищей — молекул — наперекор их
силам притяжения, молекула тратит часть своей кинетической
энергии. В предшествующей главе было обращено внимание на то,
что молекулярная кинетическая энергия есть тепловая энергия.
Поэтому если при испарении теряется часть кинетической энергии
то это имеет своим следствием понижение температуры. Другими
словами, испарение сопровождается охлаждением. Это согласуется
и с нашим опытом. Когда мы умываем лицо или промачиваем ноги,
мы вспоминаем об этом факте. Подобное же охлаждение замечается,
когда газам позволяют расширяться. То обстоятельство, что при
сжатии газы нагреваются, знакомо всем, кому приходилось надувать
автомобильную шину. В этом случае по отношению к газу произ-
водится работа сжатия, и молекулы его получают затраченную на
ЭтУ работу энергию в форме тепловой энергии. Когда газу позволяют
снова расширяться, эта тепловая энергия расходуется, так как газ
Теперь производит работу, расширяясь под атмосферным давлением.
Мы можем таким образом сказать, что при концентрировании молекул
Происходит выделение тепла, а при расширении газа тепло поглощает-
Ся< Если мы приложим это положение к испарению, то будет ясно,
/Го оно представляет собой случай расширения. С ним связано увели-
ение расстояния между молекулами и следовательно поглощение
т$Плд.
38
ПРИРОДА ЖИДКОСТЕЙ И ТВЕРДЫХ ТЕЛ
4. Упругость пара. Если жидкость, находится в закрытом
сосуде, то испарение не должно быть непременно полным. Действи-
тельно, если жидкости достаточно, принимая во внимание простран-
ство над нею, то испарение остановится по достижении известного
предельного содержания паров в пространстве над жидкостью.
Рассмотрим, почему это так. Если сосуд закрыт, молекулы пара раз-
местятся в пространстве над жидкостью. Там они будут накопляться,
по мере того как будет продолжаться испарение, и концентрация
их будет возрастать. Так как это типичные газовые молекулы, то
они будут оказывать давление на стенки и крышку сосуда, все воз-
растающее по мере увеличения их концентрации. Одновременно они
будут сталкиваться с поверхностью жидкости и благодаря притяже-
нию со стороны молекул жидкости проникать внутрь ее. Этот про-
цесс противоположен испарению и носит название
конденсации. Скорость конденсации определяется кон-
центрацией молекул пара, так как очевидно, что чем
больше их в данном объеме, тем чаще они будут стал-
киваться с поверхностью жидкости. Между тем про-
цесс испарения будет итти своим чередом и концентра-
ция молекул пара будет все возрастать. В конце кон-
цов скорости конденсации и испарения сравняются.
Тогда будут иметь место два противоположных про-
цесса, протекающих с одинаковыми скоростями и
в известном смысле слова нейтрализующих действие
L| один другого. Для каждой испаряющейся молекулы
жидкости найдется соответствующая молекула, пере-
ходящая из газа в жидкость. При таких условиях от-
Рис. 5. Из- носительные количества жидкости и паров будут оста-
вления папа" ваться постоянными, ибо сколько молекул каждая фаза
в ни ара. терЯет> СТОлько же она и получает. О такой системе,
в которой два прямо противоположных процесса
протекают с равной скоростью, говорят, что она находится в ди-
намическом равновесии. Давление, производимое молекулами пара,
находящегося в равновесии с жидкостью, называется давлением или
упругостью пара данной жидкости.
Упругость пара какой-либо жидкости может быть измерена
в барометрической трубке (рис. 5). Пространство выше поверхности
ртути в такой трубке, как припомнит читатель, представляет собой
безвоздушное пространство. В это пространство вводится с по-
мощью изогнутой пипетки через открытый конец трубки неболь-
шое количество жидкости, упругость пара которой подлежит изме-
рению. В пространстве над ртутью установится равновесие, и пар
будет производить давление, равное упругости пара. Это давление
будет вызывать понижение уровня ртути в трубке. Разница в уровнях
ртути до и после введения жидкости будет равна давлению пара
В миллиметрах ртутного столба.
5. Зависимость упругости пара от температуры. Мы уже раз-
бирали действие изменений температуры на скорость, с которой
ПРИРОДА ЖИДКОСТЕЙ И ТВЕРДЫХ ТЕЛ
39
движутся газовые молекулы. Увеличение температуры подобным же
образом увеличивает скорость молекул жидкости. Как и можно
было ожидать, в результате этого увеличивается испарение, так
как последнее обусловливается частотой попаданий молекул на
поверхность и их кинетической энергией, а обе эти величины —
функции скорости. В конце концов упругость пара при повышении
температуры также повысится; это случится в силу увеличения кон-
центрации молекул пара, необходимой, чтобы вызвать конденсацию
в размере, соответствующем увеличившемуся, при более высокой
температуре, испарению.
Если мы нанесем на чертеже упругости пара воды для соответ-
ствующих температур, то получится кривая, изображенная на
рис. 6. Каждая точка этой кривой
определяет температуру и давление,
при которых вода в жидком состоя-
нии находится в равновесии со своим
паром. В любой точке вне кривой не
может быть равновесия между двумя
фазами, и только одна из них ока-
жется устойчивой. В любой точке
выше кривой жидкая вода предста-
вит устойчивую фазу; в любой точке
ниже кривой только пар будет устой-
чивым. Например водяной пар при
температуре 20° С не может нахо-
диться под давлением выше 17,5 мм,
т. е. выше нормального давления па-
ра при этой температуре, ибо при
более высоких давлениях водяной
Температура t градуса
Рис. б. Изменение давления
пар вполне сгустится В жидкую воду. пара жидкости в зависимости
Обратно, при этой температуре от температуры.
жидкая вода полностью испарится,
если она будет находиться под давлением, менее чем 17,5 мм.
6. Принцип ван’т Гоффа. Условный метод изображения ди-
намического равновесия может быть иллюстрирован примером,
который мы только что изучили, а именно равновесием системы
жидкость-пар:
водяной пар жидкая вода 4- тепло.
Каждая из стрелок указывает на один из противоположных
процессов. Стрелка, направленная вправо, указывает на процесс
Конденсации, а стрелка, направленная влево, — на процесс ис-
парения. Процесс, который мы отмечаем с помощью стрелки, направ-
ленной вправо, называют прямым процессом, противоположный о б-
Ратным. Прямой процесс, или сгущение, сопровождается выделе-
нием тепловой энергии , а обратный, или испарение, — поглощением
Тепла. Процессы или реакции, при которых выделяется тепло, на-
зываются экзотермическими, а те, при которых тепло поглощается,—
40
ПРИРОДА ЖИДКОСТЕЙ И ТВЕРДЫХ ТЕЛ
эндотермическими. Если одна из двух противоположных реакций
эндотермическая, то другая должна быть экзотермическая, ибо ина-
че будет нарушен закон сохранения энергии.
Можно предсказать результат действия повышения темпера-
туры на равновесную систему, если известно, какая из двух реакций
экзотермическая. Если температура какой-либо системы, находя-
щейся в равновесии, повышается, то установится новое равновесие
при более высокой температуре, при котором реакция, поглощающая
тепло, протекает более полно. Это и есть принцип ван’т Гоффа.
Применяя его к равновесию между какой-либо жидкостью и ее па-
ром, мы находим, что результатом повышения температуры будет
установление нового равновесия, в котором испарение или эндотер--
мическая реакция будет усиливаться, т. е. в новом состоянии равно-
весия в пар будет переходить большее, чем раньше, количество жид-
кости.
7. Степень испарения различных жидкостей. Степень испарения
различных жидкостей при данной температуре очень разнообразна.
Так как упругость пара какой-либо жидкости есть мера ее испаряе-
мости, то удобно пользоваться при сравнении испаряемости жидко-
стей соответствующей таблицей упругости их пара при различных
температурах. Например упругости паров воды, алкоголя и эфи-
ра при 20° соответственно равны 17 мм, 45 мм и 433 мм; эти числа
являются мерой относительных скоростей испарения этих трех ве-
ществ. То обстоятельство, что различные жидкости испаряются в раз-
ной степени при одной и той же температуре, может служить ука-
занием, что сила притяжения между молекулами не одна и та же во
всех случаях. Мы имеем все основания полагать, что кинетическая
энергия молекул всякой жидкости при данной температуре одина-
кова. Отсюда следует, что причиной различной испаряемости жид-
. костей является разница в силах притяжения между молекулами.
8. Твердые тела. Мы видели, что, когда тело находится в газо-
образном состоянии молекулярное движение доминирует над притя-
жением между молекулами. В случае жидкостей силы притяжения
оказывают большее влияние благодаря более тесному расположению
молекул и стремятся помешать молекуле покинуть ее товарищей,
а также стремятся сохранить данное количество жидкости в опре-
деленном объеме. В твердом теле эти притягательные силы преоб-
ладают. Каждая молекула является как бы прикрепленной к своему
месту и не имеет свободы движения между своими соседями ♦.
9. Характерные свойства кристаллического состояния вещества*.
Единственное свойство, отличающее твердые тела от жидкостей
и газов, это жесткость их строения. Однако было бы весьма
неточным определять твердое тело этим термином, так как неко-
торые твердые тела, как, например, графит, представляют собою
идеальный смазочный материал, а из асбеста можно выткать ткань.
* Это не вполне точно, так как и в твердых телах молекулы колеблются
около положений равновесия в относительно небольшом интервале. Ред.
1 Б р э г г, О природе вещей, гл. IV, V и VI. * *
ПРИРОДА ЖИДКОСТЕЙ И ТВЕРДЫХ ТЕЛ 41
С ДРУГ0Й СТ°РОНЫ> такие вещества, как стекло, обладают большей
жесткостью строения, чем жесткость многих твердых тел, и однако
оНи вовсе не твердые тела, а жидкости. Подлинное твердое тело
должно иметь кристаллическое строение, т. е. оно должно быть
правильной геометрической формы и ограничено плоскими поверх»
лостями. Такие вещества, как смола, аморфны, не обладают кристал-
лическим строением формы и должны быть отнесены к жидкостям.
Эти вещества способны течь, правда в весьма малой степени. Кусок
смолы, положенный на плоскую поверхность в теплой комнате,
в течение нескольких недель растечется в форму более или менее со-
вершенного диска.
Кристаллические тела и такие аморфные тела, как стекло,
при нагревании ведут себя совершенно различно. Последние по
мере увеличения температуры постепенно становятся мягче, и их
способность растекаться, их текучесть становится больше. Тогда их
можно признать подлинными жидкостями и можно переливать из
одного сосуда в другой. С другой стороны, истинные твердые тела
мало изменяют свою жесткую структуру при нагревании, и так про-
должается до тех пор, пока не будет достигнута температура их плав-
ления. Тогда без всякого нового повышения температуры твердое
тело переходит с большей или меньшей скоростью в жидкое состоя-
ние, и этот переход продолжается до тех пор, пока все твердое тело
не будет расплавлено.
10. Строение кристаллов. Тот факт, что все истинные твердые
тела характеризуются кристаллической формой, указывает, что ча-
стицы, из которых они состоят, должны быть закреплены относительно
друг друга с известной геометрической правильностью, которой и
обусловливается правильная форма кристалла. Молекулы замерзаю-
щей жидкости не соединяются как-либо случайно. Можно с полной
очевидностью полагать, что характерные свойства частиц, из которых '
состоят сами молекулы, определяют строение кристалла, частью
которого они и являются. Эти частицы называются атомами; мы бу-
дем иметь возможность изучить их свойства и их строение в следую-
щих главах. Сейчас достаточно будет указать, что в атомах имеются
электрические заряды и что размещение этих зарядов опреде-
ляет расположение атомов в кристаллах твердого тела. Совсем не-
давно были усовершенствованы экспериментальные методы, с по-
мощью которых стало возможно изучение расположения атомов
в кристалле. Эти методы используют х-лучи (рентгеновы лучи), и
по этой причине обсуждение их должно быть отложено до одной из
последующих глав, после того как мы будем иметь случай изучить
природу х-лучей. Этот метод анализа кристалла вполне определенно
показывает, что форма кристалла — результат бесчисленного повто-
рения единичных кристаллических ячеек, каждая из которых имеет
ТУ Же форму, что и кристалл, часть которого она составляет *.
п * Это утверждение автора ошибочно: внешняя форма кристалла отнюдь не
лЖна совпадать с формой элементарной ячейки (или элементарного тела). Это
42
ПРИРОДА ЖИДКОСТЕЙ И ТВЕРДЫХ ТЕЛ
11. Получение кристаллов. Кристаллы данного вещества мо-
гут быть приготовлены различными способами, из которых мы упо-
мянем только о двух. Вещество в жидком состоянии можно охла-
дить до его точки замерзания. При этой температуре молекулярное
'•движение уменьшается до такой степени, что притягательные силы
между молекулами берут верх, и молекулы получают возможность
сложиться в твердый кристалл, обладающий строением, свойствен-
ным данному веществу. Этот метод обычно дает в результате массу
маленьких кристаллов, тесно сплетенных друг с другом.
Второй метод, с помощью которого могут быть получены кристал-
лы большей величины и с более совершенной формой, состоит в кри-
сталлизации твердого тела из раствора. Твердое тело растворяется
в каком-либо растворителе при повышенной температуре, достаточ-
ной для того, чтобы дать возможность ему раствориться в данном объ-
еме растворителя и насытить этот объем. Излишек твердого тела
или постороннего нерастворенного вещества должен быть затем
быстро отфильтрован без заметного охлаждения раствора. В раст-
вор может быть внесен в виде затравки один кристаллик, который
и будет действовать как ядро для кристаллизации на нем молекул
растворенного вещества. После этого раствору дают медленно ох-
лаждаться. Количество твердого тела, которое может раствориться
в известном объеме жидкости, обычно уменьшается с понижением
температуры. Раствор, уже насыщенный при повышенной темпера-
туре, при охлаждении становится пересыщенным. Избыток раство-
ренного вещества кристаллизуется, нарастая на внесенном кристал-
лике — затравке. Чем медленнее идет охлаждение, тем больших
размеров и более совершенной формы получаются кристаллы, так
как в этом случае молекулы будут иметь время найти себе место
на поверхности уже образовавшихся кристаллов, вместо того что-
бы образовывать новые кристаллы.
12. Кристаллизационная вода. В весьма многих случаях,
когда твердое тело кристаллизуется из своего водного раствора,
кристаллы содержат молекулы воды в определенном отношении
к молекулам твердого тела. Сернокислая медь или синий купорос,
кристаллизуется например из водного раствора в кристаллах, содер-
жащих 5 молекул воды на каждую молекулу соли. Вода в таком сое-
динении называется кристаллизационной водой. Кристаллы, содер-
жащие кристаллизационную воду, известны под названием кристал-
логидратов. Кристаллы большинства твердых тел, получающиеся
из воды, не содержат кристаллизационной воды. Так например кри-
сталлы поваренной соли, сахара и многих других веществ безводны.
13. Кристаллические формы вещества. Твердое состояние дан-
ного вещества характеризуется одной или, самое большее, пятью
различными кристаллическими формами. Такие вещества, как сера,
карбонат кальция и вода, могут существовать более чем в одной фор-
видно хотя бы из того, что условия роста кристалла весьма отражаются на его
внешней форме, тогда как форма элементарного тела остается (tea изменений. Pro
ПЕРЕХОД ИЗ ОДНОГО СОСТОЯНИЯ В ДРУГОЕ 43
ge, почему они и называются полиморфными. Явление полимор-
физма указывает на то, что некоторые твердые вещества могут об-
разовывать несколько устойчивых кристаллических форм. Однако
каждая из нескольких кристаллических форм полиморфного ве-
щества вполне устойчива только при известных температурах,
так что при определенной температуре одна форма более устойчива,
чем какая-либо другая. Если какой-либо элемент полиморфен, его
различные кристаллические видоизменения носят название аллотро-
пических форм. Например элемент углерод может существовать
в одной из двух аллотропических форм — в форме алмаза или гра-
фита *.
14. Молекулярное движение в твердых телах. Тот факт, что
атомы твердого тела занимают вполне определенные положения
в кристалле, не влечет за собой необходимость вывода, что они не
обладают никакой кинетической энергией. Напротив, у нас имеются
все основания считать, что они находятся в движении. Одно из наи-
более убедительных доказательств, подтверждающих этот взгляд,
заключается в том, что твердые тела испаряются. Нам всем хорошо
известен факт, что некоторые твердые тела, например камфора, мен-
тол, нафталин, имеют запах; э^о служит доказательством того,
что молекулы этих твердых тел действуют на слизистую оболочку
носа. Мы знаем также, что лед и снег при температурах ниже точки
таяния льда постепенно исчезают благодаря испарению. Такие твер-
дые тела, как мрамор и кварц, испаряются, но в столь ничтожной
степени, что измерить величину их испарения невозможно.
Твердое тело, помещенное в закрытый сосуд, приходит в равно-
весие со своим паром, точно так же как и жидкость. Твердые тела
следовательно также имеют давление пара (как их имеют и жид-
кости), и эти давления увеличиваются вместе с температурой.
Стало быть, атомы твердого тела находятся в движении, но это
движение должно быть ограничено для каждого атома определен-
ной областью в кристалле. Вероятно оно больше походит на вибра-
цию вокруг некоторой определенной точки, чем на какое-либо дви-
жение по прямой линии. Так как давление пара твердого тела уве-
личивается при повышении температуры, то интенсивность этой виб-
рации также должна возрастать.
ГЛАВА IV
ПЕРЕХОД ИЗ ОДНОГО СОСТОЯНИЯ В ДРУГОЕ
В двух предшествующих главах мы рассмотрели характерные
свойства и строение газов, жидкостей и твердых тел. Теперь нам
следует рассмотреть, что же происходит, когда вещество переходит
1,3 одного состояния в другое.
* Вопрос о существовании третьей аллотропической формы углерода —
м°рфного углерода —остается пока открытым. Ред.
44
ПЕРЕХОД ИЗ ОДНОГО состояния В ДРУГОЕ
1. Явления замерзания и плавления. Мы видели, что как
твердые тела, так и жидкости обнаруживают некоторую упругость
пара в силу того факта, что и те и другие испаряются; в обоих
случаях эта упругость повышается вместе с повышением темпера-
туры. Если мы нанесем на график упругости паров как жидкой,
так ц твердой фазы одного и того же вещества в зависимости от тем-
пературы, у нас получатся две кривые, подобные изображенным на
рис. 7, где АВ — кривая для твердой фазы, a CD — кривая для жид-
кой. Точка Е, представляющая собой пересечение двух кривых,
имеет особое значение, так как она соответствует температуре, при
которой и твердая и жидкая фазы имеют одну и ту же упругость
Рис. 7. Точка замерзания
жидкости.
Жидкость
Тбердое твдь
г
Рис. 8. Относительная летучесть твер-
дой и жидкой фаз при точке замер-
зания и вблизи нее.
пара. При этой температуре следовательно испаряемость для обеих
фаз одинакова. Это иллюстрируется рис. 8, на котором длина каж-
дой стрелки —мера степени испаряемости каждой фазы. При темпе-
ратуре / обе стрелки одинаковой длины. Степень испарения есть
мера стремления молекул уйти от своих товарищей-молекул через
поверхность во вне лежащее пространство. Обычно молекулы уле-
тучиваются в пространство, содержащее какой-либо газ, но это не
обязательно. Улетучивание может происходить и в какую-либо дру-
гую жидкость или даже в твердое тело. Например бензол плавает
по поверхности воды благодаря его меньшей плотности. При таких
обстоятельствах молекулы воды «испаряются» в слой бензола. Это
процесс растворения молекул воды в слое бензола, но по существу
он имеет ту же природу, что и испарение *.
Стремление молекул жидкости или твердого тела улетучиваться
* Автор несколько упрощает вопрос о процессе растворения жидкости в
жидкости. В то время как природа газа над жидкостью не влияет сколько-ни-
будь заметным образом на процесс испарения, при растворении жидкости в жид-
кости их природа имеет существенное значение. Ред*
ПЕРЕХОД ИЗ ОДНОГО СОСТОЯНИЯ В ДРУГОЕ
45
За пределы поверхности своей фазы называют летучестью *. Так как
испаряемость есть лишь частный случай этого общего явления, то
она может служить мерой летучести. Когда твердая и жидкая фазы
одного и того же вещества имеют одинаковую упругость пара р
при температуре /, то, как показано на рис. 7, молекулы в каждой
фазе имеют одинаковое стремление улетучиваться. Если теперь
вещество в жидкой фазе налить на такое же вещество в твердой
фазе, то будет иметь место условие равновесия двух фаз (рис. 9).
Переход твердой фазы в жидкую называется плавлением, пере-
ход жидкой в твердую фазу — замерзанием. При той температуре,
при которой давления пара для обеих фаз одинаковы, стремления
молекул улетучиться в обеих фазах также одинаковы, и замерзание
имеет место в том же размере, как и плавление. В этом случае мы
имеем другой пример равновесия, так как здесь
два противоположных процесса протекают с оди-
наковой скоростью. При этих условиях относи-
тельные количества жидкости и твердого тела
останутся одинаковыми. Температура, при кото-
рой твердая и жидкая фазы вещества имеют
одинаковое давление пара, называется или точкой
замерзания жидкости, или точкой плавления
твердого тела.
Если твердое тело будет нагрето выше этой
температуры, оно должно расплавиться, так как
Рис. 9. Твердая и
жидкая фазы ве-
щества в равнове-
сии при точке за-
мерзания.
при температурах более высоких, чем / (рис. 7),
упругости пара твердого тела вдоль кривой ЕВ
будут больше, чем упругости пара жидкости на-
кривой ED. При этих температурах у твердого
тела будет больше стремления улетучиться, и оно будет плавиться
в большей степени, чем жидкость замерзать. При температурах
ниже / жидкость оказывается менее устойчивой фазой, так как
стремление улетучиваться у нее больше.
2. Точка кипения жидкости. Прежде чем рассмотреть, что по-
нимается под точкою кипения, зададим вопрос: как можно узнать,
что жидкость кипит? Очевидно узнать это можно по образованию пу-
зырьков пара ниже поверхности жидкости. Эти пузырьки пара могут
быть устойчивы только тогда, когда давление внутри их по крайней
мере равно давлению извне. Внутреннее давление этих пузырьков
Равно давлению пара в жидкости, ибо они представляют собой про-
странство, заключающее в себе пары, находящиеся в равновесии с
окружающей жидкостью. Давление с внешней стороны есть атмосфер-
ное давление, или общее давление газа на поверхность жидкости.
Таким образом жидкость начинает кипет тогда, когда давление
* Здесь словом «летучесть» переведен английский термин escapement tendency,
которого в русской научной литературе еще не имеется общепринятого соот-
ветствующего термина. В дальнейшем этот термин переводится применительно
^смыслу ФРазы: стремление улетучиваться, стремление к улетучиванию и т, п.
46
ПЕРЕХОД ИЗ ОДНОГО СОСТОЯНИЯ В ДРУГОЕ
ее паров станет равным внешнему давлению на ее поверхность.
Температура, при которой это осуществляется, называется точкой
кипения. Точка кипения какой-либо жидкости очевидно функция
общего давления газа на ее поверхность. Последнее положение
придает точке кипения точное значение.
Когда указывается точка кипения, а давление не приводится,
следует подразумевать нормальное давление (760 мм). Точка кипе-
ния может быть отмечена на кривой зависимости между темпера-
турой и давлением пара, если от оси давления провести координату,
отвечающую давлению в 760 мм (рис. 10). Температура Ь, соответ-
ствующая пересечению кривой давления пара с координатой 760 мм,
и будет точкой кипения.
Это объясняет, почему точка кипения воды ниже на вершине
горы, чем на уровне моря. Так как температура, а не кипение, опре-
Рис. 10. Точка кипения
жидкости.
деляет, как скоро сварится карто-
фель, приготовление кушанья на
вершине высокой горы будет очень
скучным процессом. В герметически
закрытом сосуде жидкость никогда
не закипит, так как общее газовое
давление на ее поверхности равно
давлению воздуха плюс давление ее
пара. При таких обстоятельствах
давление пара жидкости никогда не
сможет стать равным общему газо-
вому давлению на ее поверхность.
В автоклавах используется этот факт;
в них могут быть достигнуты более
высокие температуры, чем точка ки-
пения воды при атмосферном да-
влении, и нужное для приготовления
пищи время таким образом сокращается. Один из самых обыкновен-
ных методов очистки жидкости — дестилляция — заключается в ки-
пячении жидкости и сгущении ее паров в приемнике. Большое чис-
ло жидкостей однако химически разлагается при температурах
ниже их точек кипения при атмосферном давлении. Такие вещества
не могут быть очищены посредством дестилляции; в таких случаях
может помочь только понижение давления в дестилляционном аппа-
рате и в результате этого понижение точки кипения жидкости до
температуры ниже той, при которой имеет место разложение.
3. Возгонка. Те твердые тела, у которых при нормальных
температурах упругости пара высоки, обыкновенно могут быть очи-
щены посредством процесса, носящего название возгонки. Твердое
тело нагревают до некоторой температуры ниже его точки плавления,
при этом оно быстро испаряется. Его пары приводятся тогда в со-
прикосновение с холодной поверхностью, на которой имеет место
конденсация вещества в твердое тело. И испарение, и последующая
конденсация замечательны отсутствием образования жидкой фазы.
ПЕРЕХОД ИЗ ОДНОГО СОСТОЯНИЯ В ДРУГОЕ 47
Такие вещества, как иод и хлорная ртуть, обыкновенно очищаются
этим путем.
4. Конденсация паров. Мы знаем, что когда давление паров
какой-либо жидкости изображается на графике как функция тем-
пеоатуры» то получается кривая, каждая точка которой соответст-
вует условию равновесия между жидкой и газообразной фазами ве-
щества. При данной температуре жидкая и газообразная фазы ка-
кого-либо вещества могут быть в равновесии только в том случае,
если пар производит давление, равное упругости паров жидкости
При этой температуре. Если пар все время будет находиться под ббль-
щим давлением, он должен сгуститься вполне; если же пар над жидко-
стью будет под меньшим давлением, жидкость вполне испарится. Сле-
довательно, чтобы сгустить пар, необходимо или увеличить давление
до .размера большего, чем упругость пара жидкости при этой темпе-
ратуре, или охладить его до того момента, пока давление, произво-
димое им при более низкой температуре, не станет больше упруго-
сти, соответствующей более низкой температуре. Например извест-
ное количество водяного пара вводится в сосуд, в котором оно произ-
водит давление в 15 мм при 20°. Если мы определим величину упру-
гости паров воды при 20° по таблице упругостей пара, мы найдем,
что величина этой упругости равна 17,4 мм. Стало быть, взятое коли-
чество пара при 15 мм не будет конденсироваться. Чтобы обратить
его в жидкое состояние, мы должны сжать его, уменьшая его объем
до тех пор, пока давление не станет более 17,4 мм. Если мы будем
поддерживать его давление на уровне выше 17,4 мм, весь пар обра-
тится в жидкость. Пар может быть сгущен также охлаждением его,
скажем, до 10°. При этой температуре наше количество пара будет
производить давление около 14 мм, но это давление будет больше
давления 9,2 мм, давления паров воды при 10°, и потому пар сгустит-
ся. Однако в этом случае сгущение не будет полным, ибо оно прекра-
тится, когда давление пара станет равным 9,2 мм.
Конденсация водяного пара из атмосферы в виде дождя
похожа на только что рассмотренное нами явление. О воздухе, со-
держащем такую концентрацию водяного пара, которая находится
в равновесии с водой в жидком состоянии при этой температуре,
говорят, что он насыщен водяным паром. Концентрация водяного
пара называется абсолютной влажностью воздуха, а отношение аб-
солютной влажности к количеству водяного пара, требуемого для
насыщения воздуха при данной температуре, называется его относи-
тельной влажностью. Последняя обычно выражается в процентах.
Теплый, поднимающийся вверх столб воздуха, почти насыщенный
в°Дяным паром, охлаждается, так как встречает холодные, нисхо-
ДяШие воздушные течения и при подъеме расширяется. При этих
обстоятельствах обычно происходит конденсация водяного пара.
5. Критические явления. Пионером в области сжижения га-
зов был Михаил Фарадей. В 1823 г. он опубликовал результаты ис-
•Иедования, в котором ему удалось с помощью необычайно простого
Ппаоата обратить в жидкость большое количество газообразных
48
ПЕРЕХОД ИЗ ОДНОГО СОСТОЯНИЯ В ДРУГОЕ]
веществ. Его аппарат состоял из перевернутой U-образной трубки,
одно колено которой содержало твердое тело, при нагревании выде-
лявшее газ, подлежащий сжижению, другое колено было погружено
в смесь из льда и воды. Образовавшийся в значительном количестве
при нагревании твердого тела пар развивал в относительно неболь-
шом объеме трубки давление, которое было больше, чем давление
пара при температуре тающего льда, и пар обращался в жидкость.
Таким путем Фарадей обратил в жидкости такие газы, как аммиак,
хлор, двуокись серы, двуокись углерода, сернистый водород. Однако
он не имел успеха в сжижении кислорода, азота, водорода и некото-
рых других газов. Его эксперименты были произведены ранее, чем
были открыты так называемые крити-
ческие явления, и таким образом при-
чины его неуспеха остались ему неяс-
ными. Рассмотрим теперь эти явления.
Постараемся вообразить, как вы-
глядела бы жидкость, находящаяся
в равновесии со своим паром, если бы
мы могли видеть ее молекулы. Моле-
кулы пара переходят из газа в жид-
кость в том же числе, в каком молеку-
лы уходят из жидкости. Теперь попы-
таемся представить себе, что произой-
дет, если температура начала бы под-
ниматься. Молекулы в обеих фазах
двигаются быстрее. Скорость испаре-
ния также возрастает, следовательно,
возрастает концентрация пара и ско-
рость конденсации его. Устанавливает-
ся новое равновесие при более высокой
Михаил Фарадей; температуре, при котором пар более
концентрирован, тогда как жидкость,
несколько расширившаяся вследствие увеличившейся темпера-
туры, стала менее плотной. По мере того как температура ра-
стет, пар становится все более плотным, а жидкость менее
плотной,— и этот процесс продолжается до тех пор, пока плот-
ность пара не станет окончательно равной плотности жидкости.
Другими словами, жидкость и пар при этих условиях отождест-
вляются и поверхность раздела между ними исчезает. Температура,
при которой это происходит, называется критической температурой.
При критической температуре жидкая фаза исчезает. Дальнейшее
нагревание, как и следовало ожидать, только увеличивает произ-
водимое газом давление. Выше своей критической температуры газ
не может быть обращен в жидкость; ниже этой температуры газ
обратится в жидкость, если его давление будет больше, чем дав-
ление пара жидкости при этой же температуре. Изучение состоя-
ния газа при постоянной температуре привело английского фи-
зика Эндрьюса в 1863 г. к открытию и определению критической тем-
ПЕРЕХОД ИЗ ОДНОГО СОСТОЯНИЯ В ДРУГОЕ
49
дературы. Закон Бойля устанавливает, что при постоянной темпе-
ратуре объем какого-либо газа изменяется обратно пропорционально
давлению. Если бы газ вел себя согласно закону Бойля, то кривая,
выражающая зависимость его объема от давления, должна бы была
представлять собою правильную гипер-
болу. Ряд подобных кривых, показанных
па рис. 12, может быть получен, если отме-
тить отношения между давлениями и объ-
емами для воздуха при различных тем-
пературах. Каждая кривая представляет
зависимость изменения объема от измене-
ния давления при постоянной темпера-
туре и называется изотермой. Как пра-
вило, газы подчиняются закону Бойля
при температурах значительно более вы-
соких, чем их критические температуры,
и при не очень высоких давлениях.
Изучение поведения двуокиси угле-
Рис. 11. Прибор Фарадея
для сжижения газов.
рода во время сжатия при различных
температурах, привело Эндрьюса к установлению ряда кривых,
показанных на рис. 13. При 48° кривая представляет собою
почти совершенную гиперболу, так что при этой температуре
двуокись углерода, практически подчиняется закону Бойля.
При 40° на кривой ясно виден перелом, сопровождаемый подъ-
емом, почти вертикальным при более высоких давлениях. В этой
области кривой поведение газообразной двуокиси углерода очень
^ис. 12. Изотермы газов, вы-
ражающие зависимость меж-
ду давлениями и объемами.
Рис. 13. Критическая темпера-
тура двуокиси углерода.
близко к поведению какой-либо жидкости, ибо относительно боль-
шое увеличение давления вызывает только небольшое уменьшение
объема. При обеих отмеченных температурах не замечается никакого
Признака обращения газа в жидкость. Когда же газообразная
Апуокись углерода сжимается при 20°, то в точке А кривой начи-
нается образование жидкой двуокиси углерода. При этом всякая
Попытка увеличить давление приводит к превращению в жидкость
Введение в химию.
50
ПЕРЕХОД ИЗ ОДНОГО СОСТОЯНИЯ В ДРУГОЕ
больших количеств пара с соответствующим уменьшением объема, да-
вление же при этом остается постоянным (линия АВ). Вдоль этой
линии жидкая и паровая фазы находятся в равновесии при давлении,
представляющем собою давление пара двуокиси углерода при 20°. При
достижении точки В весь газ обратится в жидкость, и остаток кривой
изобразит действие повышения давления на объем жидкой двуокиси
углерода. При любой температуре ниже 31,1° сжатие приводит к
превращению газа в жидкость; при любой более высокой темпера-
туре жидкость не образуется. Эга температура в 31,1° следовательно
и будет критической температурой двуокиси углерода. Точки А
и D представляют объемы газообразной двуокиси углерода при 20*
и 10°, которые в жидком состоянии занимают соответственно объемы
В и Е. Таким образом при 10° при сжижении газа будет иметь место
более сильное уменьшение объема, чем при 20°, и разница в плотностях
между жидкостью и паром будет поэтому тем больше, чем ниже темпе-
ратура. При критической температуре точка Сопределяет объем ижид-
кой и парообразной фаз, так как при этой температуре они одинаковы.
Давление как раз достаточное дня того, чтобы обратить газ в жидкость
при его критической температуре, называется критическим давлением.
Таблица критических температур и точек кипения некоторых
часто встречающихся газов указывает на любопытное отношение
между абсолютной температурой кипения при а мкферном давле-
нии и абсолютной критической температурой. Первая почти для
каждого газа составляет приблизительно две трети последней. Те
газы, критические температуры которых лежат выше 20°, или выше
средней комнатной температуры, могут быть обращены в жидкости
при посредстве одного только сжатия, тогда как другие должны быть
сначала охлаждены до температуры ниже их критических температур
и только после этого они могут быть обращены в жидкости давле-
нием. Таблица ясно указывает, почему Фарадей не имел успеха
при сжижении «постоянных» газов.
Таблица П. Физические константы некоторых
важнейших газов
Газ Точка кипения Критическая температура
°C J абс. С ° абс.
Гелий Водород Азот . Окись углерода .... Ки.лород Дьуо сись углерода . . . Аммиак Хлор Двуокись серы -268,5 -253,4 -195,7 -150,0 — 182,9 - 78,3 - 33,5 - 33 . б - 10.0 4,5 20,4 77,3 83,0 90,1 194,7 239,5 239,4 263,0 -:бз о —239 9 —147,1 — 139.0 -118 8 31,1 132,4 144,0 157,2 5.0 33.1 125 9 134,0 154,2 304,1 0 4 417 0 4:0,.;
ПЕРЕХОД ИЗ ОДНОГО СОСТОЯНИЯ В ДРУГОЕ
51
6. Твердая двуокись углерода. Продолжая дело Фарадея-
Тилорье в 1834 г. сумел обратить в твердое состояние газ двуокись
углерода. Пользуясь тем, что теплота при испарении и расширении
поглощается, он постарался превратить жидкую двуокись углерода
в пары, давая ей расширяться от высокого давления до атмосферного.
При этом газ охлаждался так быстро, что часть его обращалась в твер-
дое тело. Он открыл также, что при смешении твердой двуокиси уг-
лерода с эфиром может быть получена охлаждающая смесь, темпера-
тура которой очень низка. К несчастью, придуманный им для сжиже-
ния двуокиси углерода аппарат имел некоторые недостатки, и в ре-
зультате произошло несколько роковых взрывов.
Твердую двуокись углерода можно удобно приготовить, подвя-
зав вокруг выходной трубки цилиндра с жидкой двуокисью углерода
холщевый мешок; выводная трубка наклоняется под таким углом,
что ее конец с вентилем оказывается ниже дна цилиндра. Когд,а вен-
тиль открывается, жидкость с силой вырывается в мешок, испаряясь
и расширяясь при этом. В мешке собирается белое, похожее на снег
твердое тело, температура которого при атмосферном давлении—73°.
При этой температуре может быть без затруднения заморожена
ртуть в сосуде такой формы, чтобы из ртути получилась головка
молотка; золотком можно воспользоваться для того, чтобы вбивать
гвозди. Полученное из двуокиси углерода твердое тело можно дер-
жать в руке в течение короткого времени без каких-либо неприятных
последствий, так как рука слоем газа предохранена от непосредствен-
ного соприкосновения с твердой двуокисью углерода. Однако если
сжать его, можно вызвать болезненное обмораживание.
В продолжение ряда лет это вещество представляло интерес
только для экспериментов на лекциях и для исследовательской ра-
боты и не имело какого бы то ни было практического значения. Од-
нако за последние годы это вещество нашло себе промышленное при-
менение в качестве замораживающего средства. С его помощью
мороженое оказалось весьма выгодным транспортировать из Нью-
Йорка в Кубу в таких количествах, что правительство Кубы было
принуждено наложить эмбарго на ввоз его. Тонны замороженной ры-
бы могут быть отправлены грузом на очень большие расстояния
(без потери времени на повторное замораживание) и могут прибыть
к месту своего назначения в прекрасном состоянии. Двуокись угле-
рода в твердом состоянии, или «сухой лед», вырабатывается в таких
количествах, что ежедневно расходуются тонны этого материала.
Она имеет некоторые преимущества перед льдом в качестве охлаж-
дающего в вагонах-холодильниках. Она не плавится в жидкость,
но возгоняется в газ, имеющий большую плотность и покрывающий
охлаждающее вещество и охлаждаемый предмет непроводящей тепло
оболочкой. При возгонке твердая двуокись углерода поглощает
°чти вдвое больше тепла, чем лед одинакового веса. В силу этих
хйНЫХ свойств не бУДет ничего удивительного, если в будущем «су-
ои лед» станут употреблять в вагонах-холодильниках чаще, чем
и°Ыкновенный лед.
52
ПЕРЕХОД ИЗ ОДНОГО СОСТОЯНИЯ В ДРУГОЕ
7. Сжижение газов. С помощью смеси из эфира и твердой
двуокиси углерода вместо льда Фарадею в 1845 г. удалось обратить в
жидкое состояние такие газы, которые раньше обратить в жидкость
он не мог. Однако его попытки обратить таким способом в жидкое
состояние водород, азот, кислород и окись углерода остались безус-
пешными.
В 1878 г. Кайльете и Пикте, работая независимо один от другого,
первый в Париже, последний в Женеве, сообщили о сжижении кис-
лорода. Кайльете сжимал кислород до 300 ат, в то же время охлаж-
дая его или кипящей двуокисью серы или твердой двуокисью угле-
рода под уменьшенным давлением. Газообразный кислород затем
внезапно расширялся, причем охлаждался до такой степени, что
происходило его сжижение. Таким же путем Кайльете удалось обра-
Рис. 14. Сосуд
Дьюара.
для хранения
тить в жидкое состояние воздух, азот и окись
углерода.
Двумя годами позже Джемс Дьюар придумал
усовершенствованный апЯарат для обращения воз-
духа, кислорода или азота в жидкость в более широ-
ких размерах. Имя Дьюара всегда будет вспоми-
наться исследователями в связи с введенными им
в лабораторную практику сосудами с эвакуирован-
ной оболочкой; в науке они известны под именем
сосудов Дьюара, а среди широкой публики как бу-
’ тылки «термос».
«Пустота» — прекрасный теплоизолятор. И со-
суд Дьюара (рис. 14) представляет собою сосуд
с двойными стенками, у которого из пространства
между стенками выкачан воздух. Стенки изнутри
посеребрены, чтобы помешать потере тепла вслед-
ствие лучеиспускания. Такие сосуды весьма удобны
сжиженных газов, так как тепловая энергия извне
здесь не может достигнуть жидкости и поднять температуру выше
критической. Интересна история изобретения этих сосудов. Во
время последней болезни королевы Виктории Джемсу Дьюару
оказалось необходимым перенести сыворотку из своей лаборатории
во дворец. В продолжение переноса сыворотка должна была оста-
ваться при определенной температуре. Его изобретательность побу-
дила его создать для этой цели первый сосуд описанного типа.
В 1908 г. голландскому физику Камерлинг-Оннесу в Лейденской
криогенной лаборатории удалось обратить в жидкое состояние ге-
лий. Критическая температура гелия только на 5° выше абсолют-
ного нуля. Этот опыт был повторен еще лишь в одной лаборатории,
именно в университете в Торонто в Канаде. С жидким гелием Камер-
линг-бинесу удалось получить температуру в—272,18°, т. е. менее
чем Hing) дин градус выше абсолютного нуля. Наконец в 1926 г.
проф. Кезому, работавшему в лаборатории Камерлинг-Оннеса,
удалось обратить гелий в твердое состояние при—271, 6° под давле-
нием 26 ат.
ПЕРЕХОД ИЗ ОДНОГО СОСТОЯНИЯ В ДРУГОЕ 53
8. Жидкий воздух. Двадцать пять лет тому назад жидкий воз-
дух был новинкой, свойства которой были гвоздем воскресных обоз-
рений в газетах. В настоящее время он приготовляется химической
промышленностью в количестве многих тонн. Около 1907 г. спрос
на сжатый кислород был вызван зарождающейся промышленностью
кислородно-водородной сварки, и жидкий воздух оказался одним
из наиболее экономичных исходных веществ для приготовления чи-
стого сжатого кислорода. Жидкий воздух — это смесь двух жидко-
стей — кислорода и азота *, которые в силу различия их точек
кипения легко могут быть отделены друг от друга. Азот благодаря
своей более низкой точке кипения отгоняется первым, и таким
образом происходит их разделение. Вначале азот был побочным про-
дуктом, находившем очень ограниченное употребление. В настоящее
время существует огромный спрос на этот побочный продукт со сто-
роны промышленности связанного азота, а также для наполнения
электрических лампочек, так как лампочки, наполненные азотом,
обладают особо высокими свойствами. Во время мировой войны был
открыт еще иной способ использования жидкого кислорода. Когда
с кислородом смешивается зернистый древесный уголь и хлопок,
то получается сильное взрывчатое вещество, представляющее опре-
деленные преимущества для некоторых целей. Жидкий кислород
следует держать отдельно от других составных частей смеси не-
посредственно до той поры, когда придется пользоваться им для
взрыва; таким образом устраняется опасность при транспорте и этот
вид сильного взрывчатого вещества можно применять в населенных
местностях.
Жидкий воздух представляет собой почти бесцветную жидкость,
постепенно принимающую нежный голубой оттенок (цвет жидкого
кислорода), по мере того как азот выкипает. Азот кипит при атмос-
ферном давлении при —195,5°, а точка кипения кислорода —182,93°.
Жидкий воздух можно сохранять в продолжение нескольких дней
в сосудах Дьюара. При низкой температуре жидкого воздуха цветы,
яйца, мясо, каучук и многие другие предметы становятся хрупкими,
как стекло.
9. Машины для изготовления жидкого воздуха. В 1895 г. Гэмп-
СОН в Англии и Линде в Германии придумали первые машины для
изготовления жидкого воздуха в большом количестве. Аппарат Гэмп-
сона, задуманный в лабораторных размерах и менее мощный, благо-
даря своей простоте имеет некоторые преимущества. Машина Лин-
Де была гораздо эффективнее и вырабатывала жидкий воздух в бо-
лее широких размерах. Обе машины используют тот факт, что при
расширении газ охлаждается. Этот факт, как читатель припомнит,
обусловливается тем обстоятельством, что при расширении газа мо-
лекулы действуют против сил взаимного притяжения. Совершенно
подобно тому, как при поднятии некоторой массы, т. е. при отрыве
* Жидкий воздух помимо этих двух главных составных частей содержит
еще ряд примесей (см. стр. 99—100). Ред.
54
ПЕРЕХОД ИЗ ОДНОГО СОСТОЯНИЯ В ДРУГОЕ
ее от земли, производится работа, молекулы, взаимно отталкиваясь
друг от друга, затрачивают работу и теряют некоторое количество
своей кинетической энергии. Потеря молекулярной кинетической
энергии естественно в результате дает падение температуры. В ма-
шине, изготовляющей жидкий воздух, последовательные расшире-
ния вызывают последовательно все большее понижение температуры,
пока не будут достигнуты критические температуры кислорода и азо-
та, ниже которых воздух становится жидким при давлении, имею-
щем место в машине. На рис. 15 дана схема лабораторного прибора
гэмпсоновского типа. Воздух, тщательно очищенный от двуокиси
углерода и водяного пара, доводится компрессором до давления
в 200 atri, газ при этом нагревается. Теплота, полученная от сжатия,
теряется в холодильнике, где сжатый газ проходит через спираль-
ную трубку, окруженную холодной проточной водой. Затем охлаж-
денный газ входит в
Рис. 15. Машина для получения жидкого
воздуха.
прибор для ожижения,
где он проходит через
внутреннюю из двух
концентрических спи-
ральных трубок А. При
этом он охлаждается
газами, проходящими в
противоположном на-
правлении через внеш-
нюю спиральную труб-
ку В. Затем через расши-
рительный клапан С га-
зу дается возможность в
камере D расшириться
до еще гораздо более
низкого давления. Охла-
дившийся в результате
этого расширения газ выходит через внешнюю спираль, охлаж-
дая таким образом сжатые газы во внутренней трубке, перед тем
как они войдут в камеру через расширительный клапан. Таким об-
разом каждая последующая часть газа начинает расширяться при все
более низких температурах и охлаждается при расширении до со-
ответственно еще более низкой температуры. В конце концов дости-
гаются температуры, более низкие, чем критические температуры
кислорода и азота, и некоторая часть газа превращается в жидкость
в камере D, из которой она может быть удалена, когда понадобится,
через клапан Е.
10. Искусственное охлаждение. Принципы, на которых по-
строена машина, изготовляющая жидкий воздух, в последние годы
широко использованы при устройстве различных типов домашних
холодильников. Такие холодильники в общем представляют собою
два типа: машины сжатия и машины, основанные на поглощении.
Машины сжатия пользуются каким-либо легко обратимым в жид-
ПЕРЕХОД ИЗ ОДНОГО СОСТОЯНИЯ В ДРУГОЕ
55
кость газом, например аммиаком, двуокисью серы или хлористым
этилом. Критические температуры этих веществ выше комнатной тем-
пературы, так что они могут быть обращены в жидкость одним дав-
лением. На рис. 16 изображена несколько упрощенная машина
Приемник
Рис. 16. Прибор для искусственного
охлаждения компрессионного типа.
Приемник
рис. 17. Машина для охлаждения,
основанная на принципе погло-
щения.
этого типа, состоящая из ком-
прессора, приводимого в дейст-
вие электрическим двигателем,
конденсатора, расширительного
клапана и испарителя, окру-
женного некоторым простран-
ством для охлаждения. Пар
сжимается ходом поршня ком-
прессора слева направо, и теп-
лота, освобождающаяся при
сжатии, уносится в конденсато-
ре потоком воды, циркулирую-
щим вокруг спиральной труб-
ки, через которую проходит
газ. Этого охлаждения доста-
точно, чтобы ббльшую часть
сжатого пара обратить в жид-
кость, собирающуюся в нижнем резервуаре. Затем она получает
возможность испаряться и распространяться по земеевику испа-
рителя и при этом поглощает тепло из окружающего простран-
ства. После этого пар уносится опять
в компрессор, и цикл повторяется.
Машины, основанные на погло-
щении, производят охлаждение за
счет тепла, как это ни звучит пара-
доксально. Работа этих машин осно-
вана на том, что газообразный ам-
миак очень легко растворим в воде.
При нормальной температуре и да-
влении 1 г воды растворяет количе-
ство аммиака равного веса, или 1,2 л.
Так как 1 г воды занимает объем
в 1 см3, то следовательно 1 объем
воды поглощает 1 200 объемов ам-
миака. Однако по мере поднятия
температуры растворимость газа бы-
стро уменьшается. В согласии с эти-
ми фактами и был придуман прибор, удачно заменяющий работа-
ющий от двигателя компрессор. Машина для охлаждения (рис. 17)
состоит из генератора-поглотителя, конденсатора, приемника, рас-
ширительного клапана и испарителя.
В продолжение первой фазы цикла находящаяся в генераторе-
поглотителе вода охлаждается посредством змеевика, помещенного
ВнУтри генератора. Через змеевдк пропускается холодная вода.
56
МОЛЕКУЛЫ
Аммиак, проходя через клапан А, растворяется в воде, находящейся
в генераторе. По окончании поглощения аммиака водой через змее-
вик вместо холодной воды начинают пропускать пар. При темпера-
туре пара аммиак выделяется из раствора, вследствие чего быстро
усиливается давление газа в генераторе и клапан А закрывается,
а клапан В открывается. Сжатый газ охлаждается и обращается в
жидкость в конденсаторе. Жидкий аммиак собирается в приемнике
и затем испаряется через расширительный клапан, распространяясь
по спирали испарителя. Тогда пар в свою очередь выключается,
его заменяет вода, и начинается новый цикл.
Одна из трудностей, встречающихся при устройстве таких
машин, состоит в том, что вода, растворяющая аммиак, ведь так-
же обладает летучестью, а ей никак нельзя позволять войти в виде
пара в конденсатор. На практике этого затруднения избегают,
вводя между генератором и конденсатором ректификатор, в котором
сжижается водяной пар. Другой способ устранить указанное затруд-
нение состоит в том, что вместо воды, пользуются каким-либо не-
летучим абсорбентом. Такие твердые тела, как азотноаммониевая
соль (нитрат аммония) и роданистый аммоний, могут поглотить
значительные количества аммиака; холодильная машина, в которой
применяются эти или другие поглощающие вещества, может со
временем найти техническое применение.
ГЛАВА V
МОЛЕКУЛЫ
Мы видели, что поведение вещества в газообразном состоянии
ясно указывает на то, что его нельзя рассматривать как сплошную
массу, но что оно должно быть составлено из очень мелких частиц—
молекул. В течение некоторого времени дальнейшее поступательное
движение науки, казалось, приостановилось, после того как кинети-
ческая теория Клаузиуса и Максвелла дала такое ясное представление
о строении газов. Однако в последней четверти XIX ст. молекула
постепенно перестала быть гипотетической, было доказано, что она
вполне реальная частица, которая может быть взвешена, объем
которой может быть определен и даже строение ее может быть рас-
крыто. В дальнейшем точность, с которой были сделаны эти изме-
рения, чрезвычайно возросла, так что в настоящее время трудно
найти скептика, еще продолжающего сомневаться в существовании
молекул.
1. Величина молекул. Было установлено, что молекулы чрез-
вычайно малы, меньше самых малых частиц, которые можно было
надеяться рассмотреть в наиболее мощный микроскоп. Многочислен-
ные попытки измерить хотя бы приблизительно диаметр молекулы
привели к результатам, показывающим, что он должен быть меньше
чемЗх 10~8 см., т. е. меньше, чем Зх юообоооо см' ^акая нев<>
МОЛЕКУЛЫ
57
роятно малая величина поражает воображение. Чтобы составить
себе некоторое представление о величине такой частицы, будем
иметь в виду, что молекула углерода, находящаяся на печатной
странице, образует с глазом читателя угол зрения, равный тому
углу, под каким был бы виден с земли находящийся на поверх-
ности луны человек в 1,8 м ростом. Диаметр молекулы в 10000
раз меньше, чем длина коротких световых волн, воспринимаемых
глазом.
Количество молекул в какой-либо видимой частице материи
конечно огромно. Наперсток, наполненный ими, содержит такое ко-
личество молекул, что если бы каждую из них увеличить до разме-
ра апельсина, то все Соединенные Штаты могли бы быть покрыты
слоем их толщиной в 300 м. В сильно разреженном пространстве,
где давление равно только 0,0001 мм, количество молекул в 1 см3
превосходит 2 000 000 000 000. Еще пример: если бы молекулы,
находящиеся в стакане воды, могли быть все перемечены, а затем
вода из стакана смешана с водами всего земного шара, то после
полного смешения стакан воды, взятый из любого источника, все
еще содержал бы 2000 первоначальных молекул.
Молекулы были также и взвешены. Ускользающую молекулу
конечно нельзя захватить щипцами и осторожно поместить на весы,
ибо одна молекула, на наши самые чувствительные весы с чувстви-
тельностью до 0,00001 г произвела бы меньшее действие, чем перо,
положенное на чашку десятитонных весов. Непрямые методы (некото-
рые из них будут рассмотрены позже) дали возможность вычис-
лить с удивительной точностью вес отдельных молекул. Согласно
недавним определениям Милликэна, масса молекулы водорода равна
3,326x10’24 г.
2. Движение молекул. При обычных давлениях молекулы
какого-либо газа находятся друг от друга на больших, сравнительно
с их собственными размерами, расстояниях. Средняя длина их сво-
бодного пробега между двумя столкновениями зависит не только
от расстояния между ними, но и от быстроты их движения, которая,
как мы видели, является функцией температуры. При 0° средняя
скорость молекул кислорода будет около 425 м в секунду или около
1 500 км в час. При таких скоростях столкновения очень часты. Так
количество столкновений какой-либо данной молекулы кислорода
при нормальных температуре и давлении будет около 6 х 10е в секун-
ДУ^Их средний свободный путь между столкновениями — около
3. Определение молекулы. Мы знаем уже, что газы состоят из
невидимых под микроскопом отдельных частиц, которые были наз-
ваны молекулами. Следующее определение может быть будет одним
из наиболее точных определений того, что мы понимаем под молеку-
лой. Это — отдельная субмикроскопическая частица вещества, находя-
щегося в газообразном состоянии. В приложении к жидкому и твердо-
му состоянию вещества термин молекула имеет меньше значения. В
твердом кристалле — этому мы имеем несомненное доказательство—
53
МОЛЕКУЛЫ
структурными единицами служат более мелкие частицы, чем моле-
кулы. В жидком состоянии во многих случаях молекулы вещества
тождественны с молекулами этого же вещества в газообразном состо-
янии. В других случаях, когда молекулы какого-либо газа сгущают-
ся в жидкость, происходит соединение молекул.
Однако до сих пор мы еще ничего не говорили о химическом
характере молекул, мы рассматривали их исключительно как эле-
менты физической структуры газов. Определение, основанное на их
химических свойствах, в некоторых отношениях предпочтительнее,
чем то, которое мы только что привели. Такое определение гласит:
молекула — мельчайшая частица чистого вещества, которая только
может существовать. Возможны следовательно только молекулы
простых веществ и соединений, ибо это единственные виды чи-
стого вещества. Смесь или раствор должны состоять по крайней
мере из двух различных видов молекул. Далее химики установили,
что молекулы какого-либо данного простого вещества или соедине-
ния одинаковы по своим свойствам. Для каждого известного просто-
го вещества или соединения существует, стало быть, особый, отлич-
ный от других «вид» молекул.
Нам уже не раз приходилось пользоваться несколько необычны-
ми аналогиями, для того чтобы выяснить смысл определения моле-
кулы.
Мы могли бы еще в качестве некоторой аналогии группе моле-
кул привести стадо коров, из которых состоит какой-либо данный
газ. Мы можем подразделить такое стадо на более мелкие стада, но
мы не можем поступать так до бесконечности. Когда наш процесс
деления зашел так далеко, что наши «стада» оказались состоящими
только из одной коровы, он должен остановиться, ибо, если мы раз-
делим корову, ее части уже не будут больше коровами, но мясом и
костями. Подобным же образом можно разделить например известное
количество двуокиси углерода на более мелкие и еще более мелкие
части. Однако когда мы попытаемся разделить единственную моле-
кулу двуокиси углерода, мы разобьем ее на составляющие ее атомы
углерода и кислорода, которые уже не будут более частицами двуо-
киси углерода.
4. Соединительные объемы газов. Так как молекулы какого-
либо вещества тождественны, то все они должны иметь одинаковый
вес. Вес этот, как мы уже указывали, чрезвычайно мал и был опре-
делен только относительно недавно. Однако методы определения от-
носительных весов различных родов молекул были известны давно,
и была установлена целая система относительных весов молекул.
Чтобы выяснить методы, которыми могут быть определены относитель-
ные веса молекул, мы должны обратиться к серии опытов, которые
вели в 1805 году Гей-Люссак и Гумбольдт.
Предметом их опытов было исследование объемных соотношений,
в которых соединяются газы, когда они химически взаимодействуют
друг с другом. Когда была изучена реакция, в которой соединяются
два газа — водоро и кислород (с образованием воды), было найдено»
МОЛЕКУЛЫ
59
Амадео Авогадро.
что отношение объемов соединяющихся газов самое простое: 2 л
водорода соединяются с 1 л кислорода. Пораженный простотой этого
отношения, Гей-Люссак произвел ряд опытов подобного же рода
в более широких размерах и с другими газами. Таким образом в
1808 г. он мог установить, что 2 л азота, соединяясь с 1 л кислорода,
образуют 2 л закиси азота; 1 л водорода соединяется с 1 л хлора,
образуя 2 л газообразного хлористого водорода; 1 л азота соединяется
с 3 л водорода, образуя 2 л газообразного аммиака. Было установ-
лено много других подобных же отношений и на основании полу-
ченных результатов Гей-Люссаком было предложено следующее
обобщение: химические реакции между газами происходят в простых
объемных отношениях.
5. Гипотеза Аво:адро. В 1811 г. Амадео Авогадро, профес-
сор физики в Туринском университете, сделал весьма глубокомыс-
ленное предположение, которое ста-
ло основанием для различных мето-
дов определения молекулярных ве-
сов. Гипотеза Авогадро состояла в
том, что равные объемы всех газов при
одинаковых условиях температуры
и давления содержат одинаковое
количество молекул. Эта знаменитая
гипотеза главным образом опиралась
на закон Гей-Люссака. Изученные
Гей-Люссаком химические реации
должны были быть реакциями меж-
ду молекулами. Чтобы между дву-
мя веществами могло иметь место
взаимодействие, должна произойти
встреча их молекул. Раз молекулы
двух родов соприкоснулись, они
могут или соединиться, чтобы создать
более сложную молекулу, или тут
может произойти реакция обмена
с последующим образованием двух
или большего числа новых молекул. Когда мы обращаем вни-
мание на тот факт, что 1 л водорода соединяется в точности с
1 л хлора, мы легко находим объяснение этих пропорций сточки зре-
ния гипотезы Авогадро. Одинаковые объемы водорода и хлора, сое-
диняющиеся с образованием газообразного хлористого водорода,
содержат равные количества молекул. Поэтому ясно, что каждая
молекула водорода комбинируется с соответствующей молекулой
хлора. В общем, если гипотеза Авогадро верна, объемные отношения,
в которых газы соединяются, тождественны с молекулярными от-
ношениями. Так как опыт показывает, что I л азота соединяется с 3 л
водорода, чтобы образовать 2 л газообразного аммиака, то каждая
молекула азота, входящая в реакцию, соединяется с 3 молекулами
водорода, чтобы образовать 2 молекулы аммиака.
60
МОЛЕКУЛЫ
6. Молекулярные веса. Гипотеза Авогадро дает метод для опре-
деления относительных весов молекул газообразных веществ. Из
этой гипотезы следует, что веса равных объемов всех газов должны
быть также весами равных количеств их молекул. Эти веса поэтому
должны относиться друг к другу так же, как и веса единичных моле-
кул этих газообразных веществ. Допустим например, что равные объе-
мы водорода и двуокиси углерода весят относительно 1 и 22 г.
Это веса равных количеств молекул водорода и двуокиси углерода.
Отсюда вытекает, что молекула двуокиси углерода в 22 раза тяже-
лее молекулы водорода. На основании измерений такого рода можно
получить таблицу относительных молекулярных весов. В этой
таблице веса всех молекул будут сопоставлены с весом молекулы
кислорода как со стандартом. По различным основаниям, которые
будут приведены позже, в этой шкале относительных молекулярных
весов, весу молекулы кислорода было приписано число 32. Молеку-
лярный вес какого-либо вещества может в таком случае быть опре-
делен как число, показывающее, во сколько раз одна молекула его тяже-
лее чем 1/32 часть веса молекулы кислорода. Так, вода имеет молеку-
лярный вес 18 — число, указывающее, что молекула воды в 18 раз
тяжелее чем \32 часть молекулы кислорода, или что
вес молекулы роды __ 18
вес молекулы кислорода 32 *
7. Граммолекулярный вес, или моль. Значение молекулярных
весов очевидно само по себе. Вообразим, что какой-либо химик
столкнулся с задачей взвесить равные количества молекул воды
и серной кислоты. Относительные веса их молекул (молекуляр-
ные веса) относятся друг к другу, как 18 к 98; если веса воды
и серной кислоты взяты именно в этом отношении, то они содер-
жат и одинаковые количества молекул этих двух веществ. Так,
18 кг воды и 98 кг серной кислоты, 18 г воды и 98 г серной кислоты,
9 г воды и 49 г серной кислоты, 1 г воды и 98/18 г серной кислоты
И 7 * * * * * * * * * * 18/v8 г воды и 1 г серной кислоты содержат соответственно (в каж-
дом случае) по равному количеству молекул.
Химики избрали весьма удобный вес, содержащий для всех
веществ одно и то же количество молекул. Это — количество како-
го-либо вещества в граммах, число которых равно молекулярному
весу данного вещества; это весовое количество называется граммоле-
кулярным весом. Громоздкое выражение граммолекулярный вес
было сокращено до короткого моль, обозначающего то же самое.
Так, молекулярный вес воды 18 — число, указывающее относитель-
ный, а не какой-либо определенный вес, тогда как моль воды 18 г—
вполне определенный вес, содержащий то же количество молекул
воды, что и моль всякого другого вещества. Повторим еще раз:
моли всех веществ содержат одинаковое количество молекул.
Легко впасть в ошибку, определяя моль как вес одной молекулы
в граммах. Это очевидно не так. Моль серной кислоты — 98 г — коли-
МОЛЕКУЛЫ
81
чество, достаточное для того, чтобы наполнить вместительную чер-
нильницу, несомненно содержит более чем одну молекулу. В дейст-
вительности он содержит 6,06 х 1023 молекул.
8. Граммолекулярный объем. Так как моли всех веществ,
включая сюда конечно и газы, содержат одинаковое число молекул
и так как согласно гипотезе Авогадро одинаковое число молекул
всех газов занимает одинаковый объем при одинаковых температуре
и давлении, то отсюда следует, что моли всех газов занимают одина-
ковый объем при данных температуре и давлении. При 0° и 760 мм
этот объем равен 22,4 л и известен как граммолекулярный, или
молярный объем. Он может быть определен как объем, который при
нормальных условиях займет моль какого-либо газа. Этот объем,
занимаемый при нормальных условиях кислородом, весит 32 г
(моль кислорода); занимаемый аммиаком — 17 г (моль аммиака);
занимаемый двуокисью углерода — 44 г и т. д.
9. Определение молекулярных весов. Знание объема, зани-
маемого граммолекулой газа, дает указание относительно ме-
тода определения молекулярных весов газообразных веществ.
Можно выдуть стеклянный шар емкостью в 22,4 л (несколько
больше, чем мяч для игры в баскетбол), снабженный краном, через
который можно было бы наполнить его газом. Воздух из шара мож-
но затем по возможности совсем удалить с помощью воздушного
насоса, а затем шар можно взвесить. Далее газ, молекулярный вес
которого желают определить, можно ввести в шар при давлении в
760 мм и при 0°. Взвесив шар снова, получим суммарный вес газа и
шара. Разница в весе между шаром в газом и без газа составит вес
22,4 л газа и будет следовательно граммолекулярный весом газа.
Однако шар такой величины был бы слишком велик, чтобы взвеши-
вать его на чувствительных весах, и эксперимент следовало бы про-
водить в комнате, температура которой тщательно поддерживалась
бы на уровне 0°, а давление при 760 мм.
К счастью, стоит лишь получить вес определенного объема
газа при известных температуре и давлении, чтобы вычислить его
молекулярный вес. Решение типичной задачи определения молеку-
лярного веса может служить иллюстрацией применяемого метода.
Задача. Пустой стеклянный шар емкостью в 231 см3 весит 15,3952 г. На-
полненный газом неизвестного молекулярного веса при температуре в 20° С и дав-
лении 753 мм, он весит 16,6329 г. На основании этих данных требуется вычислить
молекулярный вес газа.
Вес шара с газом. . ; . . = 16,6329 а
Вес пустого шара.....= 15,3952 »
Вес газа = 1,2377 а
Если газ такого веса занимает объем в 231 см3 при 20° и 753 мм, то ка-
ков был бы его объем при нормальных условиях?
Vi = 231 сж* h = 20° С (293°А) Р,
У, = ? /,= 0°С(273°А) Р,
231 293 760
У. =273 Х 753 ’
V, = 213 смг =-
62
МОЛЕКУЛЫ
Это вычисление следовало сделать, чтобы можно было сравнить объем, зани-
маемый 1,2377 г газа, с 22,4 л при нормальных температуре и давлении.
Теперь мы должны решить следующую задачу: если 0,213 л газа весят 1,2377г,
каков будет вес 22,4 л?
0,213 22,4
1,2377 х ’
х = 130 г.
10. Число Авогадро. Быть может, читателю будет интересно
узнать, что действительное число молекул в 22,4 л какого-либо гЗза
при нормальных условиях было определено несколькими различ-
ными способами, причем все эти способы дали результаты, нахо-
дящиеся в точном согласии друг с другом. Число молекул какого-
либо газа в молярном объеме (22,4 л) при нормальных условиях, или,
иначе говоря, число молекул в одном моле какого-либо вещества,
названо числом Авогадро. Оно равно 6,062 хЮ23.
Замечательное согласие результатов, полученных весьма раз-
личными методами, может служить превосходным доказательством
ценности предположения Авогадро. Его первоначальная гипотеза
в настоящее время считается законом.
Численные значения числа Авогадро, полученные несколькими
различными исследователями, приводятся в табл. 111.
Таблица III. Значения числа Авогадро, полученные
различными методами
Метод 1 Наблюда- тель Число Авогадро
Толщина масляных пленок Заряженнные эманации из радиоактив- ных элем, е нто ч Падение заряженных масляных капель Броуновское движение Теория излучения Лэнгмюр Резерфорд МиллиКЭН Перрен Планк 6x10” 6,14x10” б.Обх 10” 6.08x10” б,06х Ю”
Такое гигантское количество молекул поражает воображение
Все население мира в 1925 г. было равно 1 750 000 000 человек. Еслй
бы всем жителям земного шара пришлось пересчитать все 6,06 х 10s5
молекул, причем им заплатили бы достаточно хорошо, для того что-
бы эта «интересная» работа показалась им стоящей труда, они без
сомнения с радостью взялись бы за дело; особенно если бы они были
уверены, что можно считать в секунду по одной молекуле. Каждый
отдельный человек должен бы был сосчитать молекулы газа, находя-
щиеся в объеме несколько меньшем, чем 0,001 мм3. На первый
взгляд это кажется легким заработком. И однако, если каждый
проявил бы достаточно упорства, чтобы довести дело до конца,
то потребовалось бы для этого 10 000 000 лет.
11. Дру<ой метод определения молекулярных вессв. Часто
употребляется другой, быть может, более легкий метод о пределе*
АТОМЫ
63
ния молекулярных весов газообразных веществ. Как и ранее описан-
ный метод, он основан на принципе, опирающемся на закон Аво-
гадро, что веса равных объемов каких-либо газов при одинаковых тем-
пературе и давлении будут находиться в том же отношении, как
и молекулярные веса этих газов. Это должно быть верно, так как веса
равных объемов представляют веса равных количеств молекул.
Так, если определены веса равных объемов двух газов (одного извест-
ного молекулярного веса и другого неизвестного), возможно вычис-
лить неизвестный молекулярный вес посредством простой пропор-
ции, так как
вес некоторого объе.-.-а А мол, пес А
вес того же объема X мол. вес к '
Решение задачи может помочь читателю понять этот метод.
Задача. Было найдено, что стеклянный шар, из которого выкачан воз-
зух, весит 15,3952 г. Наполненный кислородом шар г.есит 16,009: г, а наполнены, й
газом X неизвестного молекулярного веса при тех же температуре и давлении
16,2312 г. Каков молекулярный вес X?
Вес шара с кислородом — 16,0094 г
Вес пустого шара =* 15,3950 г
Вес кислорода в шаре =• 0,6142 г
Вес шара с газом X » 16,23121
Вес пустого шара — 15,3952 г
Вес газа X в шаре — 0,83о0 а
Отсюда
0,6142 32
— — (32 =- мол. вес кислорода)
х — 43,65 (мол. вес газа X).
ГЛАВА VI
АТОМЫ
Повидимому в человеческом уме есть нечто такое, что возмущает-
ся при мысли о возможности дойти до предела чего бы то ни было.
Неудовлетворенные открытием невидимых молекул, мы не хотим
согласиться считать эти маленькие «ничтожества» последними мель-
чайшими частицами, но спрашиваем себя, каково может быть их
строение.
1. Состав молекул. Мы знаем, что химическое соединение со-
стоит из двух или большего числа элементов. Отсюда ясно, что эти
элементы должны присутствовать в каком-либо виде в молекулах
соединения. Мы даже знаем, что элементы, из которых состоит дан-
ное соединение, всегда присутствуют в одних и тех же пропорциях
по весу в любом образце его. Читатель вспомнит, что в этом состоит
закон постоянства состава. Мы можем принять, что во всех отдельных
Молекулах данного соединения элементы имеются в точно таких же
отношениях, в каких они были найдены в образце подвергшегося
64
АТОМЫ
анализу соединения. Это указывает на определенное строение,
которое можно себе представить для молекулы данного соединения.
2. Закон кратных отношений. В 1803 г. Дальтон указал на
другую закономерность, пролившую дальнейший свет на природу
строения молекул. Было известно, что некоторые пары элементов,
реагируя друг с другом при различных условиях, могут образовать
более одного соединения. Существуют например три хорошо из-
вестные окисла азота: закись азота, окись азота и двуокись азота.
Эти соединения состоят только из двух элементов, азота и кислоро-
да, но в каждом соединении эти элементы, как показано в табл. IV,
скомбинированы в различных весовых отношениях. На первый взгляд
результаты анализа указывают только на то, что эти элементы комби-
нируются в различных пропорциях в каждом из трех соединений.
Таблица IV
Соединение Состав
азот (%) кислород (%)
Закись азота 63,64 36,36
Окись азота 46,67 53,33
Двуокись азота 30,44 69,57
Однако если на основании этих данных мы вычислим вес кислорода,
соединяющегося в каждом случае с 1 г азота, то выявится интерес-
ный факт (табл. V). Мы сразу заметим, что веса кислорода, соеди-
Таблица V
Соединение Состав
азот (г) кислород (г)
Закись азота 1 0,5716
Окись азота 1 1,143
Двуокись азота 1 2,286
ненного в каждом из трех соединений с 1 г азота, находятся в про-
стом отношении друг к другу, т. е.
0,5716:1,143:2,286 = 1:2:4.
Что это отношение не какое-либо случайное совпадение, но
закон, становится очевидным после рассмотрения еще нескольких
примеров. Например метан, этилен и ацетилен являются тремя
АТОМЫ
65
соединениями элементов углерода и водорода. Вес углерода, сое-
диняющегося с 1 г водорода, в каждом из этих соединений будет
следующий:
Таблица VI
Углеводород Углерод (г) Водород (г)
Метан 3 1
Этилен 6 1
Ацетилен 12 1
Здесь снова веса углерода (3,6 и 12), соединяющиеся с одной ве-
совой частью водорода, находятся в простом отношении (1 : 2 : 4).
Можно сослаться еще на много примеров такого отношения, но и
приведенных достаточно, чтобы мож-
но было считать, что в каждом по-
добном случае можно ожидать соот-
ветственных простых отношений. Это
привело Дальтона к такой форму-
лировке закона кратных отно-
шений: если два элемента соеди-
няются с образованием более чем
одного соединения, то веса одного эле-
мента, соединяющегося с определен-
ным весом другого, находятся между
собой в отношении целых чисел.
Теперь мы можем рассмотреть
теорию строения молекул, основы-
ваясь на законах постоянства соста-
ва и кратных отношений.
3. Атомистическая теория Даль-
тона. В 1803 г. Дальтон для объ-
яснения рассмотренных нами зако- Джон Дальтон.
нов предложил теорию строения мо-
лекул. Он предположил, что элементы состоят из неделимых ча-
стиц, называемых атомами, и что атом какого-либо элемента —
самая мелкая частица этого элемента, которая только может су-
ществовать в молекулах какого-либо из его соединений. Далее он пред-
положил, что существует столько различных видов атомов, сколько
существует различных элементов, и для каждого элемента име-
ется особый вид атомов, что атомы данного элемента тождествен-
ны, в частности имеют одинаковый вес, и наконец, что атомы различ-
ных элементов обладают различными свойствами.
Теперь посмотрим, насколько хорошо эта теория объясняет
законы постоянства состава и кратных отношений. Молекулы ка-
кого-либо данного соединения должны содержать атомы элементов,
5 Введение в химио.
<>б АТОМЫ
из которых состоит соединение. Если каждая из молекул данного сое-
динения построена совершенно одинаковом образом из состав-
ляющих ее элементов и если все атомы данного элемента имеют оди-
наковый вес, то сразу становится ясным, почему весовые отношения
элементов постоянны в каком-либо данном соединении. Теория сле-
довательно объясняет нам совершенно удовлетворительно закон
постоянства состава.
Закон кратных отношений столь же легко объясняется этой тео-
рией. Возьмем гипотетический случай двух элементов X и Y, соеди-
няющихся при различных условиях, с образованием двух различных
соединений. Затем примем, что каждая молекула одного из этих сое-
динений состоит из 1 атома X и 1 атома Y и что каждая молекула
другого соединения содержит 1 атом X и 2 атома Y. В таком случае
количества атомов Y, которые соединились с 1 атомом X, в обоих
соединениях относятся друг к Другу, как 1 относится к 2. Отсюда
следует, что и веса Y также должны находиться в этом же отношении.
В общем должны иметь место целые кратные числа, так как число
атомов различных элементов, составляющих молекулу какого-либо
соединения, обычно бывает небольшим. По одному атому каждого
элемента, 1 атом одного и 2 другого, 1 одного и 3 другого или 2 од-
ного и 3 другого и т. п. — таковы в общем отношения, наблюдаемые
в молекулах соединений, состоящих из двух элементов.
Эта картина етроения молекул, данная атомистической теорией
Цальтона, оказалась чрезвычайно полезной для химии. На ней осно-
зывается наше знание строения материи1 и механизма изменений,
которым она подвергается.
4. Отношение атомов к молекулам. Теперь будет вполне умест-
но воспользоваться тем, что мы узнали до сих пор об атомах и мо-
пекулах, и ясно установить отношение между теми и другими.
Мы узнали,что молекула представляет собою самую маленькую,
какая только может существовать, частицу какого-либо чистого ве-
щества. Так как чистые вещества могут быть или элементами, или
соединениями, то существует столько различных родов молекул,
сколько элементов и соединений. В молекулах какого-либо вещества
находятся атомы элементов, из которых состоит вещество. В каж-
дой молекуле данного вещества всегда имеется то же количество
атомов, что и в любой другой молекуле этого вещества.
В чем же разница между молекулами простого вещества и моле-
кулами соединения? Разница заключается в том, что молекулы про-
стого вещества содержат атомы только одного элемента, тогда как
молекулы соединения должны содержать атомы по крайней мере двух
различных элементов.
Молекула какого-либо простого вещества может содержать толь-
ко один атом этого элемента. В таких случаях молекула и атом тож-
дественны. Такие газообразные элементы, как гелий, аргон и другие
редкие атмосферные газы, моноатомны, т. е. их молекулы состоят из
* Брэгг, О природе вещей, гл. I.
аТомы
67
одного атома. Однако это ни в коем случае не может быть правилом.
так, например, молекулы кислорода, азота, водорода и хлора двух-
атомны; озона — трехатомны и т. п.
5. Молекула кислорода. Интересно между прочим познакомить-
ся с доказательством двухатомности молекулы кислорода. На стр. 58
был описан один из опытов Гей-Люссака, имеющий целью опреде-
лить объемные отношения, в которых соединяются с образованием
воды водород и кислород. Если этот эксперимент провести при
температурах выше 100°, то образующаяся вода будет в газообраз-
ном состоянии и можно будет измерить и сравнить ее объем с объе-
мом водорода и кислорода, из которых она образовалась. Гей-Люс-
сак нашел, что 2 л водорода соединяются с 1 л кислорода и образуют
2 л водяного пара:
2 л
2 л
водорода
кислорода
водяного
пара
Эти результаты, истолкованные с точки зрения гипотезы Аво-
гадро, указывают, что 2 молекулы водорода взаимодействуют с
I молекулой кислорода, образуя 2 молекулы воды. Каждая из 2 мо-
лекул воды, образовавшаяся из 1 молекулы кислорода, должна со-
держать по крайней мере 1 атом кислорода, так как вода есть соеди-
нение кислорода и водорода. Таким образом 1 молекула кислорода
должна содержать 2 атома, для того чтобы при реакции дать 2 атома
кислорода, по одному на каждую из двух молекул воды:
молекулы
водорода
молекула
кислорода
молекулы
воды
6. Атомные веса. Мы видели в предыдущей главе, как может
быть полезна система относительных молекулярных весов. Припом-
ним, что эти относительные молекулярные веса представляют собой
относительные веса молекул, причем вес молекулы кислорода при-
нимается равным 32. Вес какой-либо молекулы равен сумме весов
нтсмов, из которых она состоит. Благодаря методам, которых мы ско-
ро Коснемся, можно получить таблицу относительных атомных весов,
отнесенных к кислороду (вес молекулы кислорода = 32). Таким
°°Разом мы можем определить атомный вес элемента как число,
Убывающее, во сколько раз один атом элемента тяжелее 1/32 веса
У^ЛекУлы кислорода. Так как атомный и молекулярный веса выра-
о?К)тся в одних и тех же единицах, то сумма атомных весов всех
з/»°м<>в в молекуле какого-либо вещества равна молекулярному весу
и!°го вещества;«Таблицу атомных весов элементов можно найти в кон-
че этой книги.
68
АТОМЫ
Так как молекула кислорода содержит 2 атома, то, следователь,
но, атомный вес кислорода равен половине его молекулярного
веса 32, т. е. 16, так что определение атомного веса какого-либо эле-
мента может быть дано по отношению к весу атома кислорода. И то и
другое определение сводится к одному и тому же.
Тех, кто только что познакомился с учением об атомных весах
может смутить возможность сравнения весов атомов с весом опреде-
ленной молекулы. Однако это сравнение вовсе не является странным.
Вполне возможно сравнивать вес яблочных семян с весом самого
яблока как целого, или с весом груши, или даже с весом слона, если
это нам для чего-нибудь необходимо.
7. Определение атомных весов. Попытаемся понять метод, ко-
торым пользуются при определении атомного веса какого-либо эле-
мента. Рассуждение, применяемое здесь, кажется совсем простым,
раз оно понято. Однако ни один из основных вопросов химии не
оказывается столь трудным для понимания начинающего.
В соединении, молекула которого содержит только 1 атом дан-
ного элемента, можно найти только 1 атомный вес этого элемента
в 1 молекулярном весе соединения. К несчастью, нет способа указать
наперед, какие соединения элемента содержат только 1 атом эле-
мента. Если бы можно было каким-либо способом определить веса
элемента, содержащиеся в 1 молекулярном весе разных соединений
этого элемента, то можно было бы быть уверенным, что самый малый
из этих весов и будет истинным атомным весом данного элемента.
Этот параграф нужно перечитать несколько раз, пока его смысл не
станет достаточно ясным, чтобы можно было итти дальше.
Рассмотрим действительный способ определения весового содер-
жания какого-либо элемента в 1 молекулярном весе одного из соеди-
нений этого элемента. В последней главе обсуждались методы опреде-
ления молекулярных весов. Одним из этих методов и следует восполь-
зоваться теперь для определения молекулярного веса соединенения.
Для иллюстрации общего метода возьмем пример, кото-
рый и будем иметь в виду все время, пока будем продвигаться
вперед. Предположим, что нам предстоит задача: определить атомный
вес азота. Мы можем определить молекулярный вес свободного га-
зообразного азота, установив вес этого газа при нормальных усло-
виях в объеме 22,4 л. Результатом этого определения молекулярного
веса будет число равное 28. Оно может равняться и не равняться атом-
ному весу. Если молекулы свободного азота состоят только из 1 атома,
то атомный и молекулярный вес этого элемента один и тот же. Если
же молекулы азота содержат 2 атома азота, то молекулярный вес
будет равен удвоенному атомному весу и т. д. Приготовим какое-
либо газообразное соединение азота, например одно из соединений
азота с кислородом, называемое закисью азота, и тщательнейшим
образом очистим его. Вслед за этим определим молекулярный вес
его; мы найдем, что он будет равен 44. Следующий шаг состоит в том,
чтобы подвергнуть это соединение анализу в лаборйтории и таким
способом определить его процентный состав. Результат анализа
АТОМЫ
69
закиси азота показывает, что она состоит из 36,36% (весовых) кис-
лорода и 63,64% (весовых) азота. На основании этих данных легко
вычислить, сколько приходится на долю азота из молекулярного
веса закиси азота. Умножая 44 (молекулярный вес соединения) на
63,64, т. е. на процентное содержание азота в соединении, и деля
затем на 100, мы узнаем, что 28 весовых единиц из 44 приходится
на долю азота. Если молекула закиси азота содержит только 1 атом
азата, то 28 и будет атомным весом азота. Если она содержит 2 атома,
то 28 будет удвоенным атомным весом и т. д.
Если мы теперь приготовим целую серию соединений азота и та-
ким же образом определим вес азота в молекулярном весе каждого
из них, то ни один из этих весов не может быть меньше атомного веса
азота. В случае таких соединений, молекулы которых содержат
только 1 атом азота, вес азота в молекулярном весе соединения
будет атомным весом азота. В тех же случаях, когда в молекуле на-
ходятся 2 атома азота, вес азота в молекулярном весе будет его
удвоенным атомным весом и т. д. Наименьший из весов, приходящихся
на долю данного элемента в молекулярном весе его соединений, и яв-
ляется его атомным весом. В следующей таблице приведены данные
для такой серии соединений. Мы поместили в эту таблицу только три
соединения, но при действительном определении атомных весов, чем
больше число соединений проанализировано, тем более надежны
результаты.
Таблица VII. Атомный вес азота
Вещество Молеку- лярный вес Азот (%) Вес азота в 1 мо- лекуляр- ном весе
Азот 28 100,00 28
Закись азота .... 44 63,64 28
Окись азота .... 30 46,68 14
Аммиак . ... 17 77,68 14
Теперь мы должны выбрать в качестве атомного веса азота са-
Мь,й малый его вес в 1 молекулярном весе. В молекулярных весах
с°единений, перечисленных в таблице, нельзя найти веса азота мень-
ше 14. Стало быть, этот вес и есть атомный вес азота. Те соединения,
молекулярные веса которых содержат 14 единиц азота, должны за-
ключать в своих молекулах только 1 атом азота. Молекулы свобод-
Ог° азота и закиси азота должны содержать 2 атома азота. Из
Сех известных соединений азота не известно ни одного, молеку-
ЯРНЫЙ вес которого содержит меньше 14 единиц азота.
Вы Атомный вес какого-либо элемента, полученный описанным
способом, неточен в силу ряда причин. Он является произ
еД®нием двух множителей — молекулярного веса и процентного
70
ХИМИЧЕСКАЯ СТЕНОГРАФИЯ
содержания, найденного в результате анализа. Точность его таким
образом обусловливается той точностью, с которой определяются
молекулярные веса и делаются анализы. Процентный состав соеди-
нения можно определить анализом с гораздо большей точностью, чем
молекулярный вес. В последнем случае точность редко превышает
1 %, а это в свою очередь определяет точность найденного атомного
веса. Таким образом придется привести еще некоторые соображе-
ния, чтобы разъяснить, как находится точный атомный вес.
8. Точные атомные веса. Остановимся еще ненадолго на отно-
шениях, в которых атомы азота и кислорода могут соединяться, об-
разуя молекулы окиси азота. Если 1 атом азота соединяется с 1 ато-
мом кислорода в молекулу, то 1 атомный вес азота суммируется
с 1 атомным весом кислорода в молекулярный вес этого соединения.
Подобным же образом молекулярный вес соединения, молекулы ко-
торого содержат 2 атома азота, соединенные с 1 атомом кислорода,
составится из 2 атомных весов азота и 1 атомного веса кислорода.
С другой стороны, если 1 атом азота соединился с 2 атомами кислорода
в молекулу двуокиси, то половина атомного веса азота будет соеди-
нена с атомным весом кислорода. Другими словами, вес азота, сое-
динившийся с 1 атомным весом кислорода в каком-нибудь окисле
азота, должен быть кратным или частью его атомного веса. Теперь
очень просто вычислить вес азота, соединившийся с 1 атомным весом
кислорода (16) на основании анализа окисла. Известно например,
что в закиси азота содержание азота по весу равно 63,64% и кисло-
рода 36,36%. Вес азота, соединившегося с 16 весовыми частями кис-
лорода, может быть получен из следующей пропорции:
63,64 х „
36,36“ 16’ х = 28,016.
Этот вес мы узнали точно, так как он основан на результатах
лабораторного анализа. Этот вес представляет собой некоторое це-
лое число, которое может быть кратным или частью истинного
атомного веса азота. Приблизительный атомный вес азота равен 14.
Таким образом, принимая во внимание все сказанное раньше,
мы видим что 28,016 весовых единиц азота, соединившихся
с 1 атомным весом кислорода в молекулярный вес закиси азота,
представляют собою 2 атомных веса азота. Отсюда точный атомный
вес азота равен половине 28,016, или 14,008.
Методами, подобными тому, с помощью которого мы только что
преодолели все затруднения, и были получены атомные веса элемен-
тов.
ГЛАВА VII
ХИМИЧЕСКАЯ СТЕНОГРАФИЯ
Ученые всегда были большими поклонниками краткости. По-
этому всякое изобретение, сберегающее время, пользовалось их боль-
шой благосклонностью. В далеком и мрачном прошлом зародилась
ХИМИЧЕСКАЯ СТЕНОГРАФИЯ 7V
у вавилонян астрология — мать астрономии. Вавилонские астро
логи верили, что планеты производят таинственное влияние на зем
ные металлы. Позднее греки и римляне связывали металлы с бога
ми и богинями их мифологии. Таким образом металлы, известные
древнему миру, считались посвященными различным богам и боги-
ням. Золото было посвящено солнцу, серебро — луне, медь — Ве-
нере, ртуть — Меркурию, железо — Марсу, олово — Юпитеру и
свинец — Сатурну. В продолжение средних веков алхимики возро-
дили эту связь металлов с планетами и употребляли астрологиче-
ские знаки последних в качестве символов для металлов. Так знак
) (луна) был символом серебра: О (солнце) — золота; $ (Венера) —
меди; (Марс) — железа 2|. (Юпитер) — олова; $ (Сатурн) —
свинца и £ (Меркурий) — ртути.
1. Современные химические символы. Современные химические
символы ввел Иене Якоб Берцелиус (1779—1848). Каждому элементу
был дан символ, обыкновенно состоявший из первой буквы латин-
ского названия элемента; например N — символ для азота (Nitro-
genium), О — для кислорода (Oxygenium) и Н — для водорода
(Hydrogenium). Для тех элементов, названия которых начинаются
с одной и той же буквы, в качестве символа употребляются две буквы.
Так как С — символ углерода (Carboneum), то символы из двух букв
введены для кальция (Са), кадмия (Cd), церия (Се) цезия (Cs), ко-
бальта (Со), хрома (Сг) и т. д.
2. Полное значение символа. Символ играет ббльшую роль, чем
простое сокращение названия элемента, который он выражает. Каж-
дый символ означает 1 атом и 1 атомный вес представляемого им эле-
мента. Так символ О не только просто стоит вместо названия эле-
мента кислорода, но также означает собою 1 атом кислорода и 16 ве-
совых единиц (атомный вес) кислорода.
3. Формулы. Символ означает атом элемента; формула — моле-
кулу простого вещества или соединения. Формула, означающая
молекулу, заключает в себе символы элементов, из которых состоит
вещество, вместе с цифрами, поставленными внизу с правой стороны
каждого символа; цифры указывают число атомов элемента, находя-
щегося в молекуле вещества. Если в молекуле найден только 1 атом
какого-либо элемента, число 1 опускается. Несколько примеров
помогут выяснить применение символов. НеО, как каждый знает,
означает воду. Для химика эта формула — символ молекулы воды,
состоящей из 2 атомов элемента водорода и 1 атома элемента кисло-
рода. Молекула серной кислоты выражается формулой H2SO4,
указывающей, что молекулы этой кислоты состоят из 2 атомов во-
дорода, 1 атома серы и 4 атомов кислорода. Всякое простое
вещество, если оно состоит из молекул, содержит атомы только
одного элемента. И формула молекулы такого вещества будет
содержать лишь символ его атома, но если в молекуле такого веще-
ства больше одного атома (как это чаще всего и бывает), то нижнее
число включается в формулу, чтобы отметить это обстоятельство.
Так, О, есть формула для молекулы несвязанного кислорода, содер-
72
ХИМИЧЕСКАЯ СТЕНОГРАФИЯ
жащей 2 атома этого элемента. Иногда можно встретить формулы,
содержащие скобки, например Ala(SO4)3. В таких случаях число
внизу и направо от скобки указывает, что на него нужно помножить
все выражение, находящееся в скобках. В приведенном примере
молекула содержит 2 атома алюминия, 3 атома серы и 12 атомов кис-
лорода. Основание для включения в некоторые формулы таких ско-
бок будет приведено ниже.
4. Вывод формулы. В последних двух главах разбирались ме-
тоды определения молекулярного и атомного весов. Нашей ближай-
шей задачей будет уяснить себе метод, при помощи которого может
быть определено число различных атомов в одной молекуле веще-
ства. Раз мы будем знать это, формула для вещества готова. Читатель
постоянно должен помнить, что молекулы с составляющими их атома-
ми, невидимы для нас, так что мы фактически не можем сосчитать
атомы, из которых состоит молекула.
Возьмем для примера воду. Вода, как показывает нам анализ,
состоит из 88,89% (весовых) кислорода и 11,11 % (весовых) водорода.
Ее молекулярный вес был определен, и было найдено, что он прибли-
зительно равен 18. Эта величина неточна, так как следует помнить,
что методы для непосредственного определения молекулярных весов
не отличаются большой точностью. Однако известно, что атомные веса
водорода и кислорода соответственно будут равны 1,008 и 16,000.
Зная молекулярный вес и процентное содержание по весу каждого
элемента, легко можно вычислить вес, приходящийся на долю каж-
дого элемента в 1 молекулярном весе вещества:
18x88,89%= 16, вес кислорода в 18 весовых частях воды;
18 х 11,11%=2, вес водорода в 18 весовых частях воды.
Эти результаты настолько неточны, насколько неточен молеку-
лярный вес, с помощью которого они были вычислены. Однако они
представляют веса, или равные атомному весу, или являющиеся
кратными атомному весу. При сравнении этих весов с атомными
весами кислорода и водорода легко можно видеть, что здесь 1 атом-
ный вес кислорода и 2 атомных веса водорода заключаются в 1 моле-
кулярном весе воды. Отсюда молекула воды должна состоять из 1
атома кислорода и 2 атомов водорода. Формула воды следовательно
будет Н2О.
Если молекулярный вес какого-либо вещества неизвестен, то
можно установить самую простую его формулу, исходя из процент-
ного состава и атомных весов входящих в состав его элементов. На-
пример процентный состав сернокислого натрия равен: натрия
32,37%, серы 22,58%, кислорода, 45,05%; атомные веса элементов:
натрия 23, серы 32 и кислорода 16. Процентный состав дает нам
весовые отношения, в которых соединились 3 элемента, но, прежде
чем будет вычислена формула, мы должны обратить этим весовые
отношения в атомные отношения, так как формула должна быть
выражена в числах атомов, а не в весовых единицах. Деление вели-
чины каждого процентного содержания на соответствующий атом-
ХИМИЧЕСКАЯ СТЕНОГРАФИЯ
73
ный вес даст нам числа, выражающие отношения атомов, в которых
соединены элементы;
32,37 . л. . _ 22,58 Л,.ЛК . . 45,05 о Ol .
= 1,41 (натрий); = 0,705 (сера); —— = 2,81 (кислород).
ZO *5^ 10
Основываясь на этих атомных отношениях можно составить
предварительную формулу: Na131S0;705O2;81( но так как атомы не
делятся на части, то такая формула’должна быть соответствующим
образом изменена. Поэтому следующий наш шаг должен состоять
в том, чтобы найти наибольший общий делитель этих трех чисел, и,
разделив на него каждое число, получить наиболее простое числовое
отношение. В данном случае наименьшее число 0,705 будет делите-
лем двух других. Разделив на него, получим:
1,41 . 0,705 2,81
0,705 Л 0,705 0,705 4’
Самая простая формула для сернокислого натрия будет таким
образом Na2SO4, хотя не только эта формула правильна, так как
Na4S2O8 или Na8S4O18 или какая-либо другая формула, в которой
атомы находятся в отношении 2:1:4, также вполне удовлетворяла
бы требованиям. Чтобы установить, какая же из возможных
формул будет правильной, нужно узнать молекулярный вес. В гро-
мадном большинстве случаев самая простая формула является в то
же время и правильной.
5. Точные молекулярные веса. Теперь мы в первый раз сможем
найти молекулярный вес вещества, который будет столь же точен,
как точны атомные веса элементов. Так как молекула состоит только
из атомов, то вес молекулы должен быть равен сумме весов состав-
ляющих ее атомов. Так как атомный и молекулярный веса выража-
ются в одних и тех же единицах (молекула кислорода =32), то атом-
ные веса могут быть сложены друг с другом, и сумма атомных весов
в молекуле вещества и будет его молекулярным весом. Так, молеку-
лярный вес воды есть сумма 2 атомных весов водорода (2х 1,008)
и 1 атомного веса кислорода (1 х 16,000) или 18,016. Молекулярный
вес серной кислоты может быть вычислен из ее формулы таким
Же образом:
2 атомных веса Н (2 х. 1,008)= 2,016
1 атомный вес S (1 X 32,064) = 32,064
4 атомных веса О (4 х 16,000)»= 64,000
Молекулярный вес серной кислоты = 98,080
6. Вывод процентного состава из формулы. Как мы видим, фор-
мула первоначально выводится из результатов химического анализа,
выраженного в виде процентного состава. Но раз уж такая формула
выведена правильно, процентный состав соединения, выражаемый
Формулой, может быть легко вычислен из нее. В случае серной кис-
лоты, о которой была речь в предшествующем параграфе, доля водо-
74
ХИМИЧЕСКАЯ СТЕНОГРАФИЯ
„ 2,01 б 32,064 64,000
рода в этой кислоте равна серы и кислорода . Ум-
ножая полученные числа на 100, получаем процентные соотношения.
7. Валентность. Изучение формул соединений, перечисленных
ниже и полученных с помощью рассмотренных нами методов,
обнаруживает интересные отношения, знание которых будет
весьма ценным. Формулы в первом столбце ясно показывают,
что элементы — хлор, кислород, азот и углерод — обладают
способностью удерживать различное число атомов водорода в соеди-
нении с собой.
НС1 I хлористый водород NaCl II хлористый натрий
нао окись водорода (вода) CaCl, хлористый кальций
NH, азотистый водород (аммиак) А1С1» хлористый алюминий
СН4 углеродистый водород (метан) SnCl* хлористое олово
Кислород может удерживать в химическом соединении вдвое боль-
ше атомов водорода, чем хлор, а атомы азота и углерода — в 3 и 4 ра-
за больше, чем хлор. Способность элемента удерживать в соединении
с собой определенное число атомов другого элемента называется
валентностью. Валентность водорода принята за единицу и на
этом основании может быть определена валентность и других эле-
ментов. Валентность хлора, например, тоже равна единице, так как
один атом хлора соединяется с одним атомом водорода. Кислород
имеет валентность 2, так как он соединяется с 2 одновалентными
атомами водорода; азот на том же основании трехвалентен, угле-
род — четырехвалентен. Не все элементы однако соединяются с водо-
родом. Некоторые металлы например не образуют соединений с во-
дородом. К счастью, эти элементы соединяются с хлором, и так как
последний одновалентен, то их валентность может быть определена
на этом основании. Формулы в столбце II показывают, что натрий
одновалентен, кальций двухвалентен, алюминий трехвалентен и олово
четырехвалентно. Валентность какого-либо элемента следовательно
равна числу атомов водорода или другого одновалентного элемента,
с которыми соединяется 1 атом данного элемента.
8. Вывод формул на основании валентности. Для каждого соеди-
нения формула первоначально должна быть выведена с помощью мето-
дов, которые мы рассмотрели в настоящей главе. Валентность какого-
либо элемента впоследствии может быть выведена, если известны
формулы его соединений. После определения валентности элементов
можно выводить формулы других их соединений. Посмотрим как это
может быть сделано. Мы только что узнали, что валентность каль-
ция равна 2 и что хлор одновалентен. Как вывести формулу их сое-
динения — хлористого кальция — на основании этих данных? Один
атом кальция с его валентностью 2 соединяется с 2 одновалентными
атомами хлора. Формула хлористого кальция очевидно будет СаС12
Другой пример: выведем формулу для окиси алюминия, зная, что
валентность алюминия равна 3, а валентность кислорода—2. В этом
ХИМИЧЕСКАЯ СТЕНОГРАФИЯ
75
Рис. 18. Наглядное изображение
связи между атомами.
случае 2 трехвалентных атома алюминия соединяются с 3 двухва-
лентными атомами кислорода, и следовательно формула будет А1аО8.
В общем правило, которому нужно следовать, состоит в том, что
произведения из валентности каждого из соединяющихся между
собою элементов на число его атомов в обоих случаях должны быть
равны. Так, произведение из валентности алюминия (3) на число его
атомов (2) равно валентности кислорода (2), умноженной на число
атомов кислорода (3). Иногда валентность элементов обозначается
римскими цифрами, поставленными наверху с правой стороны сим-
вола, например Н1, Na1, On, Sniv и т. д. Это полезно при выводе
формул, пока практика пользования такого рода записью не сдела-
ется излишне”!. Таблицу валентностей читатель найдет в конце книги.
9. Элементы с переменной
валентностью. Гр i изложении
закона кратных отношений бы-
ло указано, что в некоторых
случаях два элемента могут
соединяться больше чем в одной
пропорции и образовывать бо-
лее одного соединения. Железо
и хлор например образуют два
соединения: хлорное железо
FeCl3 и хлористое железо FeCla.
В этом и подобных случаях
один из элементов в каждом из
соединений имеет различную ва-
лентность. В нашем примере
железо в хлорном железе трехвалентно, а в хлористом железе двух-
валентно. Поведение железа в этом отношении не ограничивается
только его соединениями с хлором; имеются два ряда соединений,
в одном из них железо двухвалентно, а в другом — трехва-
лентно.
Существует например два окисла железа: FeO и FeaOs; два бро-
мида: FeBra и FeBr3 и т. д.
10. Изображение связи между атомами. Чтобы наглядно изоб-
разить, как элементы соединяются в одно соединение, мы можем
предположить, что каждый атом как бы обладает известным количе-
ством крючков, равным своей валентности, и что, когда атомы соеди-
няются, они удерживают друг друга посредством этих крючков.
Подобное графическое изображение молекул хлористого натрия,
воды и окиси алюминия мы видим на рис. 18.
Связи между атомами, полученные указанным путем, называются
валентными связями. Крючков обычно не изображают, и связь изо-
бражается прямой черточкой:
Na- Cl
.О
Н
Н
76
СУЩНОСТЬ ХИМИЧЕСКИХ РЕАКЦИЙ
Такое графическое изображение соединений атомов друг с дру-
гом носит название формулы строения. В ней число связей, исхо-
дящих от каждого атома, должно быть равно его валентности. Не
следует ни на минуту предполагать, что атомы действительно сцеп-
лены друг с другом какими-либо крючками или связями, о которых
мы только что говорили. Такие связи дают только удобную, вообра-
жаемую модель построения молекулы.
До последнего времени ученые не имели ясного представления
о природе этих связей. Но вместе с ростом знаний о строении
атомов появилась и теория о природе валентности, представляющая
собой величайший интерес и значение. Об этой теории речь будет в
одной из дальнейших глав.
ГЛАВА VIII
СУЩНОСТЬ ХИМИЧЕСКИХ РЕАКЦИЙ
В предшествующих главах мы изучали строение вещества. Теперь
мы подготовлены к тому, чтобы рассмотреть сущность изменений,
которым подвергается вещество. Рассмотренный нами материал изу-
чается как физиками, так и химиками. То, что предстоит изучить нам
теперь, почти исключительно лежит в области химии. Для некоторых
читателей, больше интересующихся практическими приложениями
науки, мир молекул и атомов представляется мало привлекательным.
Они могут получить теперь некоторое утешение в том, что, начиная с
настоящей главы, в нашем изложении будет встречаться больше при-
ложений химии. Однако прежде чем мы будем в состоянии понять
важное значение химических изменений или реакций, нам следует
узнать кое-что об их сущности.
1. Повторение предыдущего. В одной из предыдущих глав
мы имели случай определить химическое изменение как такое, в ко-
тором химический состав веществ, подвергшихся изменению, меняется
с образованием новых веществ. Физические изменения, как мы ука-
зывали, не сопровождаются изменениями в составе веществ. Мы имели
случай изучить некоторые примеры физических изменений: испаре-
ние и сжижение (стр. 36), замерзание и кипение жидкостей и плав-
ление твердых тел (стр. 44), возгонка (стр. 46) — все это примеры
физических изменений. Мы видели, что такие изменения сопровож-
даются изменениями энергии и что в большинстве случаев они обра-
тимы. Мы изучили явление равновесия, получающегося, когда два
физических изменения противоположного характера имеют место
в данной системе в равной степени (стр. 38), и к таким равновесиям
мы применили принцип ван’т Гоффа (стр. 39). Желательно, чтобы
читатель перечитал снова указанные параграфы.
Каждое химическое соединение имеет свой собственный харак-
терный состав, т. е. каждый чистый образец данного химического
соединения состоит из одних и тех же элементов в одних и тех же
весовых отношениях,—это закон постоянства состава (стр. 20). Пусть
сущность химических реакций
77
читатель вспомнит также, что атомная теория объясняет этот закон,
принимая, что каждая молекула данного соединения всегда содержит
одно и то же число одних и тех же атомов (стр. 66). Род атомов,
их число и расположение,—вот что в конечном счете определяет
свойства молекулы. От строения молекул вещества зависит, является
ли вещество твердым телом, жидкостью или газом при комнатной тем-
пературе; строение молекул вещества в известной мере определяет
его давление пара, его точки плавления и кипения, его критическую
температуру, степень его растворимости в различных растворителях,
одним словом, все физические его свойства. Химические свойства
данного вещества также оказываются следствием его строения: на-
пример устойчивость самой молекулы, т. е. устойчива ли она при
комнатной температуре, или может существовать только при более
низкой температуре; не разрушит ли повышение температуры моле-
кул вещества и не приведет ли таким образом к химическому разло-
жению; не окажут ли различные виды лучистой энергии какого-либо
действия на нее или, быть может, такое действие окажет звуковая
волна, как это бывает с молекулами взрывчатых веществ; наконец
будут ли молекулы вещества взаимодействовать с молекулами дру-
гих веществ.
2. Сущность химических реакций. Всякое изменение в строении
молекул вещества дает в результате новый вид молекул и следова-
тельно новое вещество. Изменение в строении молекул чаще всего
связано с изменением в химическом составе. (Бывают однако и такие
химические изменения, когда состав молекул не меняется, а изме-
няется взаимное расположение атомов в молекуле.) Химическое из-
менение, стало быть, является изменением в строении участвую-
щих в нем молекул. Старые молекулы разрушаются, и атомы, из
которых они составлены, располагаются в новом порядке, обра-
зуя новые молекулы. Химическое изменение можно сравнить с
разрушением старых домов и с сооружением новых из старых мате-
риалов.
3. Химические уравнения. В главе VII мы познакомились с хи-
мической стенографией, с химическими символами и формулами.
Теперь нам предстоит познакомиться с более сложной формой хими-
ческой стенографии — с химическим уравнением. Читатель уже
вероятно ранее слыхал об этом «орудии умственной пытки» от тех,
кому приходилось сражаться с элементарной химией; однако не
следует волноваться без оснований, ибо мы будем рассматривать эти
уравнения как большое удобство, значение которого читатель должен
будет признать, и не будем тренировать его в писании их только ради
того, чтобы уметь легко делать это. Такая тренировка необходима
для специалиста-химика, но вовсе ни необходима, ни желательна
для неспециалиста.
Химическое уравнение — это запись химической реакции при
помощи формулы. Оно состоит из формул молекул, входящих
в реакцию, формул, помещающихся слева от знака равенства
или стрелки, указывающей своим концом на находящиеся'справа фор-
78
СУЩНОСТЬ ХИМИЧЕСКИХ РЕАКЦИЙ
мулы молекул образовавшихся продуктов. Перед каждой формулой
ставятся числа, указывающие наименьшее число молекул вещества,
могущих войти в реакцию или образоваться при реакции. Теперь на
примере покажем, как составляют химическое уравнение. Начнем с
одного из тех немногих примеров химических реакций, о которых мы
уже имели случай упоминать раньше — с разложения воды на во-
дород и кислород при посредстве электрического тока. Вода —
единственное исходное вещество, поэтому формулу ее молекулы мы
напишем слева от стрелки:
Н2О —
Если мы забыли формулу воды, можно снова вывести ее из ва-
лентностей водорода (1) и кислорода (2) (стр. 74). Продуктами
реакции будут водород и кислород, молекулы которых двухатомны
(стр. 67); отсюда:
Н2О Н8 О2,
но это не будет равенством, ибо хотя с каждой стороны стрелки здесь
и находится равное число атомов водорода, но кислорода в левой сто-
роне только 1 атом, а в правой — 2. Это нужно исправить, ибо оче-
видно из одного атома нельзя получить двух. Это исправление совер-
шается посредством процесса, известного под именем уравнивания
коэфициентов. Перед формулами коэфициенты ставятся таким обра-
зом, чтобы число атомов каждого вида было одинаковым с каждой
стороны стрелки. Эти числа укажут наименьшее число молекул
каждого вещества, которое входит в реакцию. Если мы поставим
2 впереди формулы Н2О (это будет означать 2 молекулы воды), то
число атомов • кислорода будет равно в обеих частях ра-
венства.
Но теперь не уравнено число атомов водорода; чтобы уравнять
их, мы должны поставить еще 2 впереди Н2, тогда будем иметь:
2Н2О — 2На + О2.
Теперь уравнение закончено и означает, что 2 молекулы воды,
каждая из которых состоит из 2 атомов водорода и 1 атома кислорода,
разлагаются, образуя 2 молекулы водорода, состоящие каждая из
2 атомов водорода, и 1 молекулу кислорода, содержащую 2 атома
кислорода.
Теперь попробуем составить уравнение для несколько более
сложной реакции. Когда металлический алюминий обрабатывается
соляной кислотой, выделяется водород в виде газа, и образуется
соединение — хлористый алюминий. Соляная кислота, как и хлори-
стый алюминий находится в водном растворе; вода не участвует
в реакции и служит только средой, в которой происходит реакция.
Поэтому мы< не должны включать в наше уравнение формулу воды.
Реагирующими веществами являются алюминий и соляная кисло-
СУЩНОСТЬ ХИМИЧЕСКИХ РЕАКЦИЙ
79
та — соединение из водорода (валентность =1) и хлора (валент-
ность-1). А1 + нС1-^
Продуктами будут: водород и соединение из алюминия и хлора:
А14-НС1 -> Н2 + А1С13.
Очень важно вспомнить, что формула хлористого алюминия перво-
начально была выведена из его процентного состава и молекулярного
веса методом, объясненным нами ранее (стр. 72). Мы можем получить
ее самым простым образом из валентностей алюминия (3) и хлора (1).
Во всяком случае формула хлористого алюминия получена не из рас-
смотрения формул реагирующих веществ.
Теперь следует уравнять коэфициенты в уравнении; двойка
впереди НС1 уравняет число атомов водорода:
Al +2НС1 — На + А1С13.
Чтобы уравнять число атомов хлора, мы должны умножить 2НС1 на
3 и А1С13 на 2:
Al + 6НС1 — Н2 + 2А1С13.
Затем, если поставить еще 2 перед А1 и 3 перед Н2, уравнение в окон-
чательном виде напишется так:
2А1 + 6НС1 -> ЗНа 4- 2А1С13.
Мы будем иметь случай изучать и составлять уравнения для мно-
гих химических реакций. Постепенно читатель научится легко со-
ставлять их и интерпретировать их значение. У многих, изучающих
элементарную химию, появляется мысль, что уравнения являются
ничем иным, как химической алгеброй. Уравнения эти нечто гораздо
большее. В алгебре какие угодно два количества могут быть сложены
вместе, но в химии далеко не всякие два вещества будут реагировать
Друг с другом. Каждое химическое уравнение в конечном итоге фор-
мулирует то, что дано в опыте. Никто, даже опытный химик, не
может быть вполне уверен, будут ли два данных вещества реагировать
или нет, до тех пор, пока он иди кто-нибудь другой не пойдет в лабо-
раторию и не докажет на опыте, что реакция пойдет. Далее, если
вещества реагируют, никто не может предсказать с абсолютной несом-
ненностью, каковы будут продукты, до тех пор пока они не будут изо-
лированы и идентифицированы в лаборатории. Конечно изучающий
химию может рискнуть сделать предположение на этот счет, ибо он
знает, что вещества известного рода характерным образом реагируют
Другими веществами, причем образуются харак терные продукты.
После того как перечислены вещества, которые могут участвовать
в I елкции, иногда можно предсказать, будут ли они реагировать и
Каковы будут продукты реакции. В этой книге мы будем иметь
случай изучать некоторые из основных химических реакций. До тех
80
сущность химических РЕАКЦИЙ
пор читатель не должен огорчаться» если он не будет в состоянии пред,
сказать продукты известной реакции.
4. Вычисления, основанные на химических уравнениях. Уравне.
ние весьма полезно для выражения какой-либо химической реакции.
Оно указывает число атомов и молекул, участвующих в реакции
и позволяет вычислить весовые отношения, в которых реагируют
вещества и образуются продукты реакции. Если мы рассмотрим в виде
примера уравнение, выведенное нами для реакции между алюмини-
нием и соляной кислотой:
2А1 + 6НС1 ЗН2 + 2А1С18,
то сразу узнаем, что 2 атома алюминия реагируют с 6 молекулами
соляной кислоты, чтобы образовать 2 молекулы хлористого алюми-
ния и 3 молекулы водорода. Значение этого положения можно рас-
шифровать и таким образом, что 2 моля алюминия реагируют с 6 мо-
лями соляной кислоты, образуя 2 моля хлористого алюминия и 3 моля
водорода. Пользуясь атомными весами участвующих здесь элементов,
мы можем вычислитьвесовые отношениям которых реагируют А1 и НС1
и получаются А1С1, и Н2. Атомные веса этих элементов таковы:
алюминия 27, водорода 1 и хлора 35,5. Вычисления дадут:
2А1 +
27 г — 1 моль
х 2
54 г = 2 моля
6НС1
1 х Н (1) - 1г
1 х С1 (35,5) «= 35,5 г
1 моль = 36,5 г
6 молей — 219 г
> 2А1С13
1 х А1 (27) - 27 г
3 х Cl1 (35,5) - 106,5
1 моль » 133,5 г
2 моля -= 267 г
+ ЗН8
2ХН(1)х“з2г
3 моля = 6 г
Таким образом из уравнения видно, что 54 г алюминия реа-
гируют с 219 г соляной кислоты, образуя 267 г хлористого алю-
миния и б г водорода * *.
На основании этих весовых отношений могут быть решены
задачи такого типа:
Задача. Сколько нужно соляной кислоты и алюминия, чтобы полу-
чить 30 г водорода?
54 г А1 + 219 г НС1 образуют 6 г На;
г А1 + г НС1 образуют 1 г Н8;
- X 30 г А! -ь ™ X 30 г HCI образуют 30 а Н».
Задачи этого рода часто имеют большое практическое значе-
ние в лаборатории химического завода. Мы предлагаем читателю
еще две задачи.
Задача. Дано уравнение
CuSO4 + Zn -> ZnSO4 + Си;
* Легко сообразить, что вместо граммов могут быть непосредственно взяты
другие весовые единицы (килограммы, фунты, тонны), от чего весовые соотношения
реагирующих веществ не изменяются. Ред.
СУЩНОСТЬ ХИМИЧЕСКИХ РЕАКЦИЙ
81
требуется узнать, сколько граммов меди может быть получено из 40 г сернокислой
меди CuSO4. Атомные веса: Cu=64, S=32, 0=16.
* Ответ: 16 г.
Задача. Дано уравнение:
Fe + H2SO4 -> FeSO4 + Н2;
требуется узнать: сколько надо взять тонн серной кислоты, чтобы она про-
реагировала с 8 т железа? Атомные веса: H = l, S=32, 0 = 16, Fe=56.
и Ответ: 14 т.
Часто встречается Другой тип задач, основанный на уравне-
ниях и имеющий в виду объем газа. Чтобы решать задачи этого
типа, следует помнить, что 1 моль какого-либо газа при нор-
мальных условиях температуры и давления будет занимать 22,4 л
(стр. 61).
Задача. Сколько может быть получено литров водорода при нормаль-
ных условиях из 9 г алюминия и соляной кислоты?
2А1 + 6НС1 -> 2А1С13 + ЗН2;
2 х 27 = 54 г А1 образуют 3 х 22,4 л = 67,2 л Н2;
1 Al - 67,2 u
1 г А1 ооразует л Н2;
67 2
9 з А1 образуют х 9 = 11,2 л На.
Еще две задачи этого же типа рекомендуется решить читателю.
Задача. Дано уравнение:
2КС1ОЭ -> 2КС1 + ЗО2;
требуется узнать, сколько литров кислорода при нормальных условиях может быть
получено из 49 г хлорноватокислого калия КС108. Атомные веса: К =39, С1=35,5,
0=16.
Ответ: 13,4 л.
Задача. Дано уравнение:
С 02 С02;
требуется узнать сколько литров двуокиси углерода образуется из 60 г углерода
при температуре 182° и давлении 2 ат. Атомные веса: С=12 и 0=16.
Ответ: 93 л.
5. Виды химических реакций. Химические реакции подразде-
ляются на несколько типичных групп. Самые простые из них —
Реакции соединения, в которых два или более веществ соединя-
ется, образуя какое-либо более сложное вещество. Общее уравне-
ние этого типа
А+Х->АХ.
А и X могут быть или простыми веществами, или соединениями, как
Показывают следующие примеры реакций соединения:
2Н2+О2 —> 2Н2О;
Zn+CI2 — ZnCl2;
СаО+СО2-> СаСО8;
H20+S08 — H2S()4.
Введение в химию.
82 СУЩНОСТЬ ХИМИЧЕСКИХ РЕАКЦИЙ
Вторая типичная группа — реакции разложения — противоположна
первой; эти реакции изображают распад какой-либо более сложной
молекулы на две или более простые молекулы:
АХ — А+Х.
Примеры реакций этого типа:
2Н2О —► 2Н24-О2;
2КС1Оа—» 2КС1+ЗО2;
СаСОд — СаО+СО2.
В третью группу входят реакции, заключающие в себе замещение
одного рода атома другим:
АХ+В —ВХ+А.
Примеры таких реакций:
Zn4-CuSO4 —> ZnSO4-f-Cu;
2А1+6НС1 —- 2А1С13+ЗН2;
2NaBr+Cl2 — 2NaC14-Br2.
Наконец четвертая типичная группа имеет дело с обменом состав-
ными частями реагирующих веществ:
AX+BY -ч. AY4-BX.
Это —реакции двойного разложения. Примеры этого типа реакций:
СаО+2НС1 ->НаО+СаС12;
2NaJ+HgCI2 —*2NaClH-HgJ2;
BaCI24-H2SO4 —*BaSO4-|-2HCI.
Важно уметь отнести данную реакцию к тому или иному классу.
6. Энергия и химические реакции. Каждое химическое пре-
вращение сопровождается изменением энергии. Молекула данного
вещества при данной температуре обладает определенным количе-
ством химической энергии. Когда происходит какая-либо хими-
ческая реакция, новые молекулы образовавшихся продуктов
также оказываются наделенными известным количеством химиче-
ской энергии, которое может быть больше или меньше количества
энергии молекул, из которых они образовались. Если энергия про-
дуктов реакции больше энергии реагирующих веществ, то избыток
энергии во время реакции должен быть получен из какого-либо внеш-
него источника. Обыкновенно в этом случае поглощается тепло из
окружающей среды. Химические реакции, поглощающие энергию,
называются эндотермическими. С другой стороны, если продукты
реакции обладают меньшей энергией, чем реагирующие вещества,
излишек энергии освобождается при реакции. Такие химические
реакции называются экзотермическими. Здесь снова энергия прояв-
ляется в виде тепла. Однако и другие формы энергии могут или по-
глощаться или выделяться при химических реакциях. Некоторые
из этих случаев мы будем изучать в дальнейших главах.
СКОРОСТЬ ХИМИЧЕСКИХ РЕАКЦИИ 83
ГЛАВА IX
СКОРОСТЬ ХИМИЧЕСКИХ РЕАКЦИЙ
1. О механизме химической реакции. Химическое уравнение от-
мечает наименьшее число молекул веществ, принимающих участие
в химической реакции, а также образующихся при этом. Когда реа-
гируют весомые количества веществ, мы имеем дело с процессом,
в котором участвуют миллиарды молекул. Уравнение выражает то,
что можно было бы назвать «единичной реакцией», повторяющейся
почти бесконечное число раз, когда реагирует весомое количество
вещества.
Действительный механизм взаимодействия молекул мало изве-
стен. Было произведено большое количество исследований для раз-
решения этой в высшей степени интересной и важной проблемы;
многое удалось узнать, однако полной картины у нас пока еще нет.
Мы конечно знаем, что реагирующие молекулы, прежде чем они
станут реагировать, должны притти в действительное физическое
соприкосновение. Что они не реагируют каждый раз, когда прихо-
дят в соприкосновение, этому мы имеем много доказательств.Извест-
ные виды молекул совсем не реагируют с некоторыми другими вида-
ми молекул. Во всех остальных случаях только известный процент
столкновений между реагирующими молекулами дает в результате
химическое взаимодействие. Относительно природы химической ак-
тивности предлагалось не мало теорий, предлагается и до сих пор,
но многое еще требуется узнать, прежде чем мы окажемся в состоя-
нии составить себе сколько-нибудь полное представление о меха-
низме химических реакций.
2. Скорость химических реакций. Некоторые, вполне достовер-
ные, сведения о механизме химических реакций были получены при
изучении скорости, с которой происходят реакции. Под скоростью
реакции понимается количество вещества, превращающегося в про-
дукты реакции в единицу времени. Удобнее всего количества выра-
жать числом молей, превращающихся в секунду. Что скорость, е ко-
торой происходят различные реакции, очень меняется, это нам
известно. Взрыв динамита и ржавление жестянки — реакции, про-
текающие с совершенно различными скоростями. Мы увидим также,
что условия, при которых данная реакция протекает, также влияют
на ее скорость.
Обычный метод наблюдения за течением химической реакции
состоит в анализе через определенные промежутки времени реакци-
онной смеси для определения количества реагирующих веществ или
продуктов реакции. Таким путем можно установить скорость, с кото-
рой вещество реагирует или вновь образуется. К несчастью, большин-
ство реакций между неорганическими веществами протекает слишком
быстро, чтобы можно было следить за ними таким путем. Реакции
Между органическими молекулами протекают медленнее, но эти ве-
щества с трудом определяются анализом. Существует однако очень
много реакций, течение которых было прослежено исследователями,
а*
84 СКОРОСТЬ ХИМИЧЕСКИХ РЕАКЦИЙ
Знание факторов, влияющих на скорость реакции, было получено
именно этим путем. Такие сведения оказывают ценную помощь хи-
мику в лаборатории и инженеру на заводе. Рассмотрим вкратце эти
факторы.
3. Концентрация. Мы уже упоминали о том, что частота столкно-
вений между реагирующими молекулами — фактор, влияющий на
скорость реакции. Мы указали также, что не каждое столкновение
между молекулами ведет непременно к химическому взаимодействию.
Но так как эффективные столкновения составляют некоторый сред-
ний процент от общего числа столкновений, то в итоге скорость реак-
ции пропорциональна частоте столкновений. Всякий фактор, влия-
ющий на частоту столкновений, будет влиять и на скорость реакции.
Рассмотрим в виде примера реакцию между двумя газообразными
веществами, смешанными в известном объеме при известной тем-
пературе. При одной и той же температуре средняя кинетиче-
ская энергия каждого рода молекул будет одинаковой. При комнат-
ной температуре их скорость будет порядка нескольких тысяч мет-
ров в секунду. Столкновения между двумя типами молекул будут
происходить огромное число раз в секунду, но только небольшая
часть этих столкновений даст в результате химическое взаимодей-
ствие. В результате этих эффективных столкновений произойдет
реакция, скорость которой будет пропорциональна числу столкнове-
ний. Если мы начнем с определенных концентраций каждого веще-
ства при определенной температуре, то начальная скорость опре-
делится числом столкновений. Попытаемся исследовать, каково
будет действие увеличения концентрации какого-либо одного или
обоих видов молекул на частоту столкновений и на скорость реакции.
Может быть, нам поможет аналогия. Вообразим на минуту, что на
площади в один акр, огороженной крепким забором движутся со-
вершенно беспорядочно 10 красных и 10 синих автомобилей; все эти
автомобили идут с одинаковой скоростью и управляются совершенно
негодными шофферами. Число столкновений красного автомобиля
с синим в единицу времени в среднем будет оставаться одинаковым,
ибо и концентрация каждого рода автомобилей (10 автомобилей на
акре) и их скорость остаются постоянными (при условии, что ма-
шины не страдают от столкновений). *
Если мы удвоим число красных автомобилей, введя добавочно
10 красных машин на поле, но оставим концентрацию синих машин
без изменения, то вследствие этого число красных автомобилей,
которые могут столкнуться с синими на этой площади, удвоится.
Следовательно общее число столкновений в единицу времени будет
вдвое больше. Если мы удвоим также и концентрацию синих автомо-
билей, то число столкновений будет учетверено. Другими словами,
частота столкновений пропорциональна концентрации каждого рода
автомобилей.
Теперь, возвращаясь к нашей реакции между двумя различными
ррдами молекул, которые мы для краткости назовем А и В, начнем
с 1 моля (6,0бх 1028 молекул) каждого вещеста на литр; частота
СКОРОСТЬ ХИМИЧЕСКИХ РЕАКЦИЙ
85
столкновений и скорость реакции будут точно определены этими
концентрациями. Если мы удвоим концентрацию А или В до 2 молей
на литр, то частота столкновений и скорость реакции будут удвоены.
Если мы удвоим концентрацию и А и В, скорость реакции будет
учетверена. Однако по мере протекания реакции, иными словами,
по мере того как реагирующие молекулы заменяются молекулами
продуктов реакции, их концентрация должна становиться все мень-
ше и меньше, и скорость реакции следовательно должна падать.
4. Закон действия масс. В 1867 г. два норвежских химика Гульд-
берг (1836—1902) и Вааге (1833—1900) установили закон действия
масс, состоящий в том, что скорость химической реакции пропорцио-
нальна активной массе реагирующих молекул,. Употребление тер-
мина «активная масса» вызывало немалую путаницу до тех пор, пока
он не был заменен термином «концентрация»; после этого смысл
закона стал ясен. Этот закон естественным образом вытекает из тех
соображений, которые приведены нами в последнем параграфе.
Здесь мы опять сталкиваемся с тем, что многим читателям
кажется только скучным обычаем, именно с математический форму-
лировкой закона. 4
Начнем с простой реакции, в которой 1 молекула А соединяется
с 1 молекулой В, образуя вещества С и D:
А + В —C-f-D.
Скорость этой реакции 7? в любое время течения реакции будет про-
порциональна наличным концентрациям молекул А и В. Обозна-
чим концентрации через Сд и Св соответственно каждому роду мо-
лекул. Тогда:
/?« СА,
R ос Св;
или
7? осСд х Св;
/? = АСд х Св.
Константа к, которой мы воспользовались, чтобы превратить
изменяющееся отношение в уравнение, известна под именем кон-
станты скорости и является величиной, характеризующей данную
реакцию.
Теперь предположим, что 2 молекулы одного вещества Е ре-
агируют с 1 молекулой другого вещества F:
или
2E + F —> G,
E + E + F О.
Чтобы эта реакция могла иметь место, должно произойти столкно-
вение, в котором одновременно сталкиваются 2 молекулы Е и одна F.
86
СКОРОСТЬ ХИМИЧЕСКИХ РЕАКЦИЙ
Концентрация Е в таком случае должна появиться дважды в нашем
уравнении. Скорости реакции:
/? = ЛСеХ Се X Ср,
или
/?=fcC|CF.
В общем, если п молекул X реагируют с т молекул Y
пХЦ-mY —► Q,
то скорость реакции
/? = ЛС£ х С”.
Несколько реальных примеров помогут читателю понять приложение
закона действия масс:
2На +Оа —* 2НаО R = ЛС2а X Со
2СО +Оа —> 2СО2 /?'=VCc2o х С °
4NH3 4- 5Оа — 6Н2О + 4NO R" = к" CN4H3 х С’2
Выводя такие выражения для скорости реакции, мы постоянно
должны помнить, что практически невозможно изменить концентра-
цию реагирующего твердого тела или жидкости, так как вещества,
находящиеся в этих состояниях, несжимаемы. Их концентрация
следовательно остается постоянной и не влияет на скорость реакции.
Например скорость, с которой происходит сожжение угля, про-
порциональна только концентрации кислорода, так как уголь
твердое тело:
С + О2 -> СОа;
R = к х С02.
Изучая в дальнейшем химические реакции, мы будем иметь слу-
чай указать много весьма важных практических приложений закона
действия масс.
б. Влияние температуры. Температура, как мы видели, есть
мера средней кинетической энергии молекул, а следовательно их
скорости, т. е. повышение температуры увеличивает и скорость моле-
кул. Увеличение температуры таким образом увеличит частоту
столкновений молекул друг с другом, когда их концентрация будет
оставаться постоянной. Изменение температуры является средством
для изменения скорости реакции. Действие, производимое тем-
пературой на скорость реакций, изумительно. Хотя в отдельных
случаях оно и неодинаково, в среднем повышение температуры
на 10е удваивает или утраивает скорость реакции. Реакция, кото-
рой требуется при О’ 1 секунда для завершения, закончится в срок
около х/,оао секунды при 100° и в срок около Viooooo секунды при 200°
(табл. VIII). С другой стороны, реакция, заканчивающаяся в 1 секун-
ду при 200°, потребует 10е секунд или немного более 11 дней при 0е.
СКОРОСТЬ ХИМИЧЕСКИХ РЕАКЦИЙ
87
^то весьма удивительно, так как мы знаем (стр. 34), что скорость
движения молекул пропорциональна квадратному корню из абсо-
лютной температуры. Такое небольшое повышение температуры
Таблица VIII. Вл и я н и е температуры на
скорость реакции
Темпера- тура в °C Время в сек. Темпера- тура в °C Время в сек.
0 1,0 60 0,015625
10 0,5 70 0,0078125
20 0,25 80 0,00390625
30 0,125 90 0,001953125
40 0,0625 100 0,0009765625
50 0,03125 200 10’®
не вызывает достаточно большого числа столкновений молекул,
которое могло бы объяснить удвоенную и утроенную скорость.
Мы должны поэтому принять, что повышение температуры не только
увеличивает частоту столкновений, но и учащает такие столкнове-
ния, в результате которых происходит химическое взаимодействие.
Это может обусловливаться отчасти и тем фактом, что, вообще го-
воря, по мере повышения температуры молекулы становятся менее
устойчивыми и, стало быть, более склонными к химической реакции.
6. Действие поверхности. Реакции, происходящие между веще-
ствами в различных фазах, происходят на границе или разделе меж-
ду фазами. Когда например твердое тело реагирует с жидким, сопри-
касаются только молекулы в поверхностных слоях каждой фазы и
только они способны к реагированию. По этой причине всякое уве-
личение поверхности приведет к увеличению скорости реакции.
Измельчение твердого тела сильно увеличивает его поверхность, а
следовательно и его способность реагировать. Размешивание и встря-
хивание производит такое же действие и приводит в соприкоснове-
ние друг с другом свежие слои молекул, до тех пор еще не реагиро-
вавшие. Растворение реагирующих веществ в одном и том же раство-
рителе приводит к молекулярному раздроблению их и таким обра-
зом увеличивает их поверхность в громадной степени. Если просто
смешать вместе кристаллы хлорной ртути и йодистого натрия,
то не произойдет никакой заметной реакции. Если же их истолочь
вместе в ступке, быстро появляется красный цвет иодной ртути, од-
ного из продуктов реакции. Если смешать водные растворы каждого
Из этих веществ, реакция практически происходит мгновенно *.
7. Катализ. Еще в начале последнего столетия, когда химия
чыла почти в младенческом состоянии, химики постепенно начали
* В данном случае увеличение скорости реакции зависит не столько от
Увеличения поверхности реагирующих веществ, сколько от их ионизации. Ред.
88
СКОРОСТЬ ХИМИЧЕСКИХ РЕАКЦИЙ
приходить к сознанию существования нового необъяснимого яв.
ления, которому было предназначено сделаться могущественной си-
лой в химической промышленности. Исследователи стали сообщать о
случаях химических реакций, которые могли протекать гораздо
быстрее в присутствии третьего вещества. Особенно удивительным
во всем этом было то, что эти «третьи вещества», казалось, не прини-
мали никакого деятельного участия в реакции, ибо в конце реакции
они оставались неизмененными. Так, например, в 1822 г. Деберей-
нер сообщил, что платина вызвала сильное самопроизвольное сго-
рание смеси водорода и кислорода при комнатной температуре.
С свойственной ему изобретательностью он придумал аппарат,
в котором при действии цинка на серную кислоту получался водород,
тонкой струей направлявшийся на кусочек губчатой пластины. Пла-
тина вызвала столь энергичное соединение водорода с кислородом
воздуха, что появилось пламя.
В 1835 г. Берцелиус, о котором читатель уже слышал раньше,
как об отце химических символов, предложил название катализа-
тора для этих веществ. В продолжение большей части XIX ст. было
мало известно каким образом катализаторы ускоряют химиче-
скую реакцию, но зато были открыты новые примеры катализа;
некоторые из них имели большое практическое значение. В то время
существовал^ тенденция скрывать за пышным названием глубокое
невежество относительно природы известного явления. Однако
постепенно некоторые факты, касающиеся каталитического дей-
ствия, стали разъясняться. Прежде всего катализаторы были найдены
только для определенных реакций. Далее, вещество, служившее
в качестве катализатора для одной реакции, не обязательно должно
быть, да обыкновенно и не бывает, катализатором для другой. Нако-
нец катализатор очевидно никогда не может вызвать реакции, кото-
рая не идет самостоятельно; он может лишь ускорить реакцию. Ве-
ликий немецкий химик Оствальд действие катализатора в химической
реакции сравнивал с действием масла в механизме. Наконец были
открыты отрицательные катализаторы, понижающие скорость
реакций. Например, если прибавить ацетанилид, противолихорадоч-
ное средство, добываемое из каменноугольной смолы, к перекиси
водорода, хорошо известному антисептику, то скорость, с которой это
последнее вещество разлагается, в значительной степени уменьшится.
Скоро стали различать два вида катализаторов. Контактные ката-
лизаторы,—обычно тонко раздробленные металлы, конденсирующие
молекулы реагирующих веществ на своих поверхностях и таким
образом приводящие их в более тесное соприкосновение. Здесь ката-
литическая сила — функция поверхности и следовательно зависит от
степени раздробления катализатора. Другой вид катализаторов,
которые можно бы назвать переносными катализаторами, образует
промежуточное соединение с одним из реагирующих веществ, а это
соединение в свою очередь реагирует с молекулами другого вещества,
восстановляя катализатор. Эти теории каталитического действия
более подробно будут изложены позже.
СКОРОСТЬ ХИМИЧЕСКИХ РЕАКЦИЙ
89
Многие примеры катализа будут рассмотрены в следующих гла-
вах; среди них можно упомянуть о контактном процессе получения
серной кислоты (стр. 309), о процессе синтеза аммиака (стр. 376),
о процессе окисления аммиака (стр. 315), о синтетическом метаноле,
уксусной кислоте и ацетоне (стр.385), гидрогенизации жиров(стр. 399)
и действии энзим (стр. 402).
8. Фотохимическое действие. Отношение лучистой энергии к не-
которым химическим реакциям очень интересно. Скорость, с которой
протекают некоторые реакции, сильно возрастает, если реагирующие
вещества находятся под действием света. Водород и хлор реагируют
с образованием хлористоводородной кислоты:
Н2 + Cl. 2НС1.
В темноте реакция протекает очень медленно. При действии яр-
кого солнечного света или при свете горящей ленты магния веще-
ства вступают б бурную, сопровождающуюся взрывом реакцию.
Если реакция экзотермическая, то действие света кажется чисто ка-
талитическим — фотокатализ. Небольшое количество света вызы-
вает относительно сильное химическое действие. Реакция водорода
с хлором — одна из реакций этого типа. Однако если реакция эн-
дотермическая, то лучистая энергия накопляется в системе в виде
химической энергии продуктов реакции. Фотосинтез углеводов
растениями из углекислого газа, воздуха и воды может быть приме-
ром этого типа процессов, имеющих громадное значение для чело-
вечества. Было вычислено, что благодаря только этой реакции
132 х Ю18 кал лучистой энергии, доставляемой земле солнцем, еже-
годно накопляется растениями в виде химической энергии. Лучи-
стая энергия делает возможной жизнь на земле и достав-
ляет топливо, служащее источником силы, требуемой современ-
ной цивилизацией. Одна из наиболее известных фотохимических
реакций есть реакция при фотографировании. Здесь молекулы бро-
мистого серебра в эмульсии на фотографической пластинке разла-
гаются на металлическое серебро и бром.
9. Обратимые химические реакции. В предыдущем изложении
мы познакомились с некоторыми физическими изменениями, которые
оказываются обратимыми. Эти обратимые реакции, как припомнит
читатель, приводят к состоянию равновесия, если совершаются
в замкнутой системе. Так, если жидкость находится в закрытом со-
суде, то между жидкой и паровой фазами устанавливается равно-
весие.
Здесь имеются два процесса противоположного характера:
испарение и конденсация; процессы эти протекают с равными скоро-
стями.
Обратимых химических реакций много. Например, когда пар
проходит над нагретым железом, имеет место следующая реакция:
4НаО + 3Fe — Fe9O4 + 4На.
90
СКОРОСТЬ ХИМИЧЕСКИХ РЕАКЦИЙ
С другой стороны, когда водород проходит над нагретой магнитной
окисью железа, образуются железо и водяной пар:
Fe3O4 4- 4На —> 3Fe 4- 4НаО.
Реакция следовательно обратимая. Указанные выше реакции можно
провести, нагревая в трубке железо или окись железа (и то и дру-
гое твердые тела) и проводя через трубку водяной пар или водород.
Таким путем газообразный продукт в каждом случае уносится от
твердого продукта, и обратимость реакции предотвращается. Однако,
если железо и пар нагреваются в запаянной трубке, продукты ре-
акции будут накапливаться и станут реагировать друг с другом.
В конце концов, когда скорость обратной реакции станет равной
скорости прямой, установится равновесие:
4НаО + 3Fe Fe8O4+ 4На.
Рассмотрим механизм установления такого равновесия на дру-
гом примере, в котором все участвующие вещества—газы; пример
этот — разложение и синтез йодистого водорода:
2HJ^Ha + Ja.
Помещенные в запаянную трубку при температуре, скажем около
500°, молекулы чистого йодистого водорода немедленно начинают
разлагаться на молекулы водорода и иода. Скорость, с которой проис-
ходит это разложение, пропорциональна квадрату молекулярной
концентрации йодистого водорода. По мере протекания реакции
концентрация эта уменьшается, так как разложившихся молекул
остается все менее и менее. Поэтому и скорость прямой реакции также
уменьшается. С другой стороны, в начале эксперимента, пока не об-
разовались еще ни молекулы водорода, ни молекулы иода, скорость
обратной реакции равна нулю. Но как только образовалось хоть
немного этих молекул, начинается обратная реакция, и — по мере
того как увеличивается их концентрация — скорость обратной реак-
ции также увеличивается. Наконец скорость обратной реакции ста-
новится равной скорости прямой, и устанавливается равновесие. При
равновесии количества реагирующих веществ остаются постоянными,
ибо молекулы йодистого водорода образуются в том же самом коли-
честве, в каком они разлагаются.
10. Константы равновесия. Таким образом химические равно-
весия характеризуются двумя реакциями противоположного харак-
тера, протекающими с равными скоростями. Ранее (стр. 84) мы узна-
ли, что скорость, с которой проходит реакция при известной тем-
пературе, пропорциональна концентрации веществ, входящих в ре-
акцию. Так, если п молекул А реагирует с т молекул В, образуя
о молекул Сир молекул D:
пА 4- тВ оС 4- pD,
СКОРОСТЬ ХИМИЧЕСКИХ РЕАКЦИЙ 91
т0 скорость, с которой происходит такая реакция, может быть выра-
жена следующим образом (стр. 85):
r = kxCnAxC% (1)
причем г — скорость реакции; Са и Св — концентрации молекул
д и В; к — константа скорости. Если предшествующая реакция об-
ратима, то скорость обратной реакции г' равна
г'= к1 х С°с х С£, (2)
где к' — константа скорости, а Сс и Cd — концентрации, соответ-
ственно, молекул С и D. При равновесии обе скорости равны, т. е
г = г'.
Отсюда из уравнения (2) и уравнения (1) получаем:
к' хС°х С&= к х С" + С"
или •
Сс х _ fc
Сд х с“ к' = ’
Константа К — отношение двух констант скоростей — называется
константой равновесия реакции. Хотя эта константа изменяется
с температурой, но при данной тепературе ее величина остается
неизменной. Если мы изменим концентрацию каких-либо из реаги-
рующих веществ или продуктов реакции, концентрации других из-
меняются таким образом, что отношение
Сс х С{,
СХ X С”
всегда сохранит свое значение.
Знание константы равновесия какой-либо обратимой реакции
очень полезно. Следует обратить внимание, что величины концентра-
ций продуктов реакции помещаются в числителе. Таким образом
чем больше константа равновесия, тем больше процентное содержа-
ние продуктов реакции в равновесной смеси. Величина константы
реакции, посредством которой химик-инженер пытается получить
известные продукты, имеет для него громадное значение. Если эта
величина велика, он будет иметь успех, если мала — его постигнет
неудача.
И. Теорема Ле-Шателье. В одной из предшествующих глав
(стр. 39) читатель познакомился с законом ван’т Гоффа, с помощью
Ноторого возможно предсказать действие температуры на какую-
либо систему, находящуюся в равновесии. Этот закон устанавли-
вает, что если температура повысится, то установится новое рав-
новесие — такое, при котором поглощающий тепло процесс пройдет
92
АТМОСФЕРА
более полно. Закон этот, приложенный к равновесию между жидк0.
стью и ее паром
жидкость + тепло пар,
предсказывает, что чем выше температура, тем больше пр0.
цент пара при равновесии, так как прямой процесс сопровождается
поглощением тепла. Этот закон можно прилагать также и к химц.
ческим равновесиям. Например мы знаем, что разложение аммиака
сопровождается поглощением тепла:
2NHS + тепло N2 + ЗН2.
Таким образом чем выше температура, тем больше будут относитель-
ные количества азота и водорода в равновесной смеси. Одно знание
этого факта могло бы служить указанием химику, что следует рабо-
тать при низких температурах, если он желает синтезировать в ка-
ком-либо количестве аммиак из азота и водорода.
Мы можем смотреть на увеличение температуры, как на извест-
ное воздействие на равновесие системы. Поглощая тепло, си-
стема до некоторой степени пущается этому воздействию, что благо-
приятствует реакции, поглощающей тепло. Великий французский
химик Ле-Шателье, сознавая, что смещение равновесия вследст-
вие изменения температуры есть лишь частный случай влияния
различных факторов на равновесие, обобщил закон ван’т Гоффа
следующим образом: если на систему, находящуюся в равновесии,
производится какое-либо воздействие, то оно благоприятствует той
из двух противоположных реакций, которая его ослабляет. Это и
есть теорема Ле-Шателье. Чтобы иллюстрировать общую приложи-
мость этой теоремы, рассмотрим действие увеличения давления на
равновесие аммиак-азот-водород. Прямая реакция даст в резуль-
тате увеличение числа молекул, ибо 2 молекулы аммиака образуют
1 молекулу азота и 3 молекулы водорода. Следовательно давление
увеличится, так как 4 молекулы окажут вдвое большее давление,
чем 2. С другой стороны, обратная реакция уменьшит давление, так
как число молекул уменьшается. Поэтому с увеличением давления
пойдет обратная реакция. Чем больше давление, тем меньше азота
и водорода и тем больше будет аммиака в равновесной смеси.
Присутствие катализатора повидимому не влияет на равнове-
сие, так как он увеличивает скорости обеих реакций в одинаковой
степени. Следовательно Катализатор не увеличивает своим присут-
ствием выхода какого-либо желаемого вещества, но уменьшает
время, необходимое для установления равновесия, и таким образом
тот же самый выход получается в более короткое время.
* ГЛАВА X
АТМОСФЕРА
Теперь мы перейдем к изучению некоторых видов химических
реакций, имеющих большое практическое значение, именно к сго-
ранию топлива и коррозии металлов. Это приведет нас естественно
АТМОСФЕРА
93
g изучению металлургии вообще, в частности к изучению железа
0 стали. Однако прежде чем мы будем в состоянии изучать горение
0 коррозию, нам следует узнать кое-что о природе атмосферы, так
Как названные процессы включают в себя взаимодействие между
топливом, металлом и кислородом воздуха.
1. Состав атмосферы. Древний и средневековый мир считал,
внешний мир состоит из четырех элементов — огня, воздуха,
земли и воды; из этих же элементов состоит и материя во всех своих
многочисленных проявлениях1. Этот взгляд вел свое начало от
учений древних индусов. Мы снова встречаем его в учениях грече-
ских натурфилософов — Фалеса, Анаксимена, Гераклита и Эм-
педокла. Таких же воззрений держался и Аристотель (385—323
до н. э.), и его авторитет сохранял их жизнеспособность в продолже-
ние 2000 лет. В области натурфилософии древние удовлетворялись
абстрактными обобщениями. Экспериментальное исследование, как
мы понимаем его в настоящее время, фактически началось с того
момента, когда Галилей совершил свой классический опыт на галле-
рее наклонной башни в 1591 г.
Опыты Бойля, результатом которых был знаменитый закон,
носящий его имя, были произведены около 1660 г., т. е. прежде,
чем стал известен состав атмосферы. В 1674 г. английский врач
Майо (Mayow) показал, что, когда горючие вещества сжигались в
воздухе, находящемся в сосуде над поверхностью воды, объем газов
уменьшался и оставался газообразный остаток, не поддерживавший
дальнейшего горения. В 1772 г. Пристли доказал, что часть атмо-
сферы, которая поддерживает горение, составляет около l/s части
воздуха и что она тождественна с открытым им раньше газом, кото-
рому Лавуазье дал имя «кислород».
В настоящее время мы знаем, что воздух состоит из таких
составных частей, которые постоянно встречаются в одних и тех же
пропорциях, и из таких, пропорции которых меняются.
Постоянными составными частями воздуха являются кислород
и азот вместе с группой инертных газов, среди которых преобла-
дает аргон. Изменяющиеся составные части состоят главным образом
из водяного пара, углекислого газа и пыли. Если из данного образца
воздуха удалить непостоянные составные части, то относительные
Количества постоянных составных частей будут следующие:
Таблица IX. Состав воздуха
Составные части По весу По объему
Азот Кислород Аргон и др 75,5 23,2 1.3 78,06 21,00 0,94
* Аррениус, Химия и современная жизнь, гл. I.
94
АТМОСФЕРА
Сначала мы изучим свойства непостоянных составных ластёк, а
затем свойства постоянных.
2. Водяной пар. Водяной пар проникает в атмосферу благодаря
испарению воды. Мы уже имели случай указать в одной из предше-
ствующих глав об условиях, управляющих образованием осадков
в виде дождя, также и о том, что разумеется под «влажностью».
Когда водяной пар конденсируется, он может остаться в воздухе в
форме очень маленьких капелек, которые мы называем облаком,
если они над нами, или туманом, если мы имеем несчастье быть ими
окруженными. Эти маленькие капельки могут вырасти в большие, па-
дающие в виде дождя. Если эти маленькие капельки при падении про-
ходят через очень холодную область, прежде чем достигнуть земли,
образуется град. Если осаждение происходит при температуре ниже 0°,
образуются ледяные кристаллы и в результате снег.
3. Двуокись углерода. Сгорание топлива, которое состоит из
соединений углерода, приводит к выделению в атмосферу ежегодно
буквально сотен тысяч тонн газообразной двуокиси углерода СОа.
Каждая тонна’ сгоревшего углерода дает почти 4 т этого газа. Его
выдыхают также животные и растения. Городской воздух содержит
этого газа больше, чем деревенский. Последний содержит только
около 3,5 ч. на 10 000, тогда как в битком набитых, плохо вентили-
руемых комнатах содержание СО2 иногда превышает 1%.
Этот газ может быть приготовлен разнообразными способами в
лаборатории; наиболее удобна реакция соляной кислоты НС1
с мрамором (углекальциевая соль СаСО8):
СаСО3 + 2НС1 -> СаС12 + Н2О + СО2.
Присутствие этого газа может быть доказано пропусканием его в из-
вестковую воду, т. е. в раствор гидрата окиси кальция Са(ОН)2.
При этом получится белый осадок (нерастворимое вещество) угле-
кальциевой соли:
Са (ОН)2 + СО2 — СаС03 + Н2О.
Двуокисью углерода широко пользуются при приготовлении
некоторых напитков, содержащих этот газ растворенным под давле-
нием. Когда пробка бутылки удаляется и давление падает, газ со
свистом вылетает из раствора. Мы уже упоминали о пользовании
твердой углекислотой как охлаждающим средством. Употребляемый
при хлебопечении порошок, заменяющий дрожжи, представляет
собою смесь химических препаратов, реагирующих с образованием
СО2. Газ, освободившийся в тесте, наполняет его пузырями. Угле-
кислый газ употребляется также для тушения пожаров. Впрочем
огнетушители будут рассмотрены в следующей главе.
4. Пыль. Пыль в атмосфере состоит из очень мелко раздроблен-
ных твердых частиц, например мелкого песка, глины, известняка
и пр., частиц несгоревшего топлива, например черной сажи, обра-
зующейся при сгорании мягкого угля, частиц органического происхо-
ждения, например бактерий, кусочков веществ растительного про-
АТМОСФЕРА
95
^схождения и пр. Частицы пыли в атмосфере до известной степени
могут быть полезными, ибо они служат ядрами, на которых могут
образоваться дождевые капельки. Если бы не было этих частичек,
т0 влага осаждалась бы на твердых поверхностях строений, деревьев
и даже — неприятно и подумать — на нас самих, вместо того чтобы
образовать капли в воздухе. При таких обстоятельствах был бы беспо-
лезен и зонтик. Однако мы все хорошо сознаем, какой вред, а также и
опасность может принести пыль. Минеральная пыль, проникающая
в наши легкие, опасна. У каменщиков, не носящих масок, часто
развивается туберкулез и так называемый силикоз легких. Пыль
в атмосфере понижает количество ультрафиолетовых лучей солнца.
5. Вентиляция. Неприятное состояние, которое приходится
испытывать в переполненной народом и плохо вентилируемой ком-
нате, долгое время приписывалось накоплению продуктов дыхания
и понижению количества кислорода в воздухе. Читатель знает,
каким образом кислород воздуха поглощается гемоглобином крови
в легких и циркуляцией крови разносится по тканям во все части
тела. Здесь происходят химические реакции, в которых кислород
соединяется с различными органическими соединениями. Это и есть
топливо для живой машины. Результат этого химического взаимо-
действия — производство механической работы мускулами, образо-
вание тепла для поддержания температуры тела и образование угле-
кислого газа. Последний переносится через вены назад в легкие,
откуда выдыхается наружу. Количество кислорода и углекислого
газа в вдыхаемом и выдыхаемом воздухе таково:
Таблица X. Состав вдыхаемого и выдыха-
емого воздуха
Составные части Воздух
вдыхаемый (%) выдыхаемый (%)
Кислород 20,94 15,9
Углекислый газ 0,03 3,7
Долгое время считалось, что здесь кроется объяснение неприят-
ного состояния, испытываемого в переполненной людьми комнате. Ко-
личество кислорода в таких комнатах уменьшается, 'причем вдыхание
достаточной порции его становится все труднее. С другой стороны,
двуокись углерода накопляется и действует как ядовитое вещество.
При обмене веществ она является отбросом и поэтому ядовита. Это
рассужДение оказалось ложным, когда было подвергнуто испытанию
опытом. Было найдено, что содержание кислорода может быть сни-
жено до 17%, и при этом все еще нельзя заметить каких-либо вред-
ных действий. Этот процент слишком мал, чтобы поддерживать сго-
рание. В одном опыте группа студентов была заперта в небольшой
06
АТМОСФЕРА
герметически закрытой комнате, и не было замечено никаких дурных
последствий, даже когда содержание кислорода упало ниже 17%,
хотя при этом нельзя было уже зажечь папирос. В переполненных
народом помещениях содержание кислорода редко бывает ниже 20%.
Углекислый газ, как это было показано, не ядовит в концентрациях
до 1%. Содержание этого газа даже в переполненных народом поме-
щениях редко превышает 0,4%. Кислород и углекислый газ таким
образом перестают быть факторами, на которые должно быть обра-
щено главное внимание при рассмотрении вентиляции.
Другое широко распространенное мнение состоит в том, что
в выдыхаемом воздухе* находятся некоторые неуловимые органиче-
ские вещества, ядовитые для живых организмов. Никто однако не
был в состоянии обнаружить их присутствие, так что мы имеем все
основания предполагать, что такие вещества и не существуют.
Почти 50 лет тому назад Германе впервые указал, что причины
неприятного состояния, испытываемого в дурно вентилируемых
комнатах, следует искать в расстройстве факторов, регулирующих
выделение телом излишка тепла. Это выделение производится луче-
испусканием тепла (инфракрасные лучи) кожей и вследствие испаре-
ния воды потовыми железами. Профессор Ли * излагает этот воп-
рос следующим образом:
Рассматривая вентиляцию с наиболее современной точки зрения, мы
должны от химии обратиться к физике. В то же время от легких мы обра-
щаемся к коже. Физиологическая проблема обыкновенной вентиляции пе-
рестала быть химической и легочной и стала физической и кожной.
Нормальная потеря тепла телом может быть задержана, если окру-
жающий воздух становится слишком теплым, что мешает лучеиспусканию
и теплопроводности, или если воздух становится слишком влажным,
препятствует испарению пота; особенно сильный эффект получается в том
случае, когда закрыты оба указанные пути нормальной потери тепла.
Именно это и происходит с людьми, запертыми в плохо вентилируемых
комнатах. От их тел повышается температура воздуха и увеличивается
его влажность. По мере того как это происходит, человеческое тело все с
большим трудом освобождается от избытка тепла; это затруднение все уве-
личивается, и преодолеть его становится все труднее. Нагруженная теплом
кровь посылается в большом количестве к расширенным кожным артериям,
быстро притекая и нагревая кожу; в потовых железах нужно вызвать
видимую деятельность; дыхание должно стать более глубоким. Одним сло-
вом, в действие приводятся все методы самозащиты, на которые способно
человеческое тело. Сначала ощущается только общее чувство неудобства,
проявляющееся в беспокойстве; затем постепенно наступает сонливость,
гнетущее ощущение тепла, головная боль, жажда и еще более тяжелые
ощущения. Наряду с этим появляются лихорадка и другие патологические
явления.
Проблема вентиляции таким образом есть проблема снабжения
движущимся воздухом, уносящим теплую воздушную оболочку,
окружающую тело, и проблема надлежащего содержания водяного
пара. Если количество водяного пара будет слишком велико, испа-
’ Автор книги, изданной в Америке, «Физиологические проблемы вентиля-
ции». Ред.
АТМОСФЕРА
97
Джозеф Пристли.
ение задержится и температура тела повысится; если же это коли-
чество будет слишком низко, испарение окажется чрезмерным и по-
явившееся в результате охлаждение неприятным. Зимой влажность
должна поддерживаться высокой в наших жилищах. Резервуары
с водой в случае воздушного отопления и позади паровых радиаторов
должны быть постоянно наполнены. Летом чем суше воздух, тем
лучше.
6. Кислород. Теперь мы должны рассмотреть постоянные состав-
ные части атмосферы. Пожалуй, кислород из этих элементов имеет
наибольшее значение. Он входит в значительной степени в состав
нашего тела. Без кислорода человек может прожить не больше 5 мин.
Без него никакой огонь не мог бы гореть, никакой металл ржаветь и
никакая органическая материя гнить.
Около половины земного шара состоит
из него.
Кислород был известен еще свыше
1000 лет тому назад у китайцев под на-
званием «йин» как активная составная
часть атмосферы. Леонардо да Винчи был
первым из жителей Запада, упомянувшим
о присутствии в воздухе двух различных
газов. Майо (1662) определил содержание
кислорода в воздухе и подробно обсуждал
его отношение к явлениям сгорания, ржа-
вления, брожения и дыхания. Однако ему
не удалось получить чистого кислорода.
В 1731 г. Гэльс получил кислород нагре-
ванием селитры, но не знал, что этот газ
находится в воздухе. Шведский аптекарь
Шееле получил кислород по крайней мере
из семи различных веществ.
Джозефа Пристли (1733—1804), пастора в Бирмингэме в Англии,
считают первым, получившим кислород, несмотря на то, что этот
газ уже был получен столькими исследователями до него. Пристли
нагревал окись ртути HgO, сосредотачивая на ней солнечные
лучи посредством зажигательного стекла, и нашел, что окись ртути
выделила большое количество какого-то газа. Он нашел, что свеча
горела в этом газе необычайно ярко, а мышь не только не была умер-
щвлена им, но наоборот, сделалась весьма оживленной и подвижной,
вероятно от страха.
Вследствие того, что Пристли симпатизировал идеям Француз-
ской революции, а также вследствие его теологических взглядов,
не согласных со взглядами господствовавшей церкви, толпа сожгла
его дом и лабораторию 14 июля 1791 г. Сам Пристли едва спас
свою жизнь. Позднее он переправился в Америку, чтобы жить
со своими детьми, поселившимися в*Нортумберлэнде в Пенсиль-
вании.
Удобнее всего получать кислород в лаборатории, нагревая
7
Введение в химию.
98
АТМОСФЕРА
смесь хлорноватокислого калия КС1О8 в присутствии двуокиси мар.
ганца МпО2; последняя действует как катализатор:
2КС1О3 -> 2КС1 + ЗО2.
Кислород легко может быть получен также при разложении воды
электрическим током в аппарате, изображенном на рис. 19. Газооб-
разный водород образуется на катоде или отрицательном полюсе,
а кислород на аноде:
2Н2О — 2На 4- О2.
Об его приготовлении в промышленном масштабе из жидкого воздуха
мы уже говорили в одной из предшествующих глав (стр. 53). О хи-
Рис. 19.
Разложе-
ние воды
посредст-
вом элек-
трическо-
го тока.
мических реакциях кислорода нам придется много гово-
рить в следующих главах.
I 7. Азот. Азот был открыт в 1772 г. Резерфордом,
профессором ботаники в Эдинбурге, почти одновременно
с открытием кислорода. Проф. Резерфорд изолировал его
из воздуха, удаляя кислород посредством сжигания та-
ких веществ, как фосфор или углерод, и удалял затем
продукты сгорания — окислы углерода или фосфора.
Этот элемент по объему составляет */, воздуха. Над каж-
дой квадратной милей земной поверхности находится до
20 000 000 т азота.
В нечистом виде он может быть приготовлен в лабо-
ратории удалением кислорода из воздуха. Приготовлен-
ный таким способом, он однако содержит инертные газы
воздуха. Чистый азот наиболее удобно получать нагрева-
нием в сосуде смеси азотистокислого натрия NaNO2
и хлористого аммония NH4CI вместе с небольшим коли-
чеством воды. Реакция двойного разложения, которая
произойдет в первую очередь, даст в результате азо-
тистокислый аммоний NH4NO2:
NH4C1 + NaNOj — NH4NO2 4- NaCl,
который неустойчив и разлагается на азот и воду:
NH4NO2 -> Na -I- 2Н2О.
В промышленном масштабе азот приготовляется путем разгонки
жидкого воздуха.
Азот весьма недеятельный элемент; он трудно вступает в хими-
ческое соединение с другими элементами. Обычно когда азот реаги-
рует с другими элементами, энергия поглощается, так что его соеди-
нения богаты энергией и следовательно очень активны. Практически
все взрывчатые вещества являются соединениями, содержащими
азот. Насколько трудно заставить азот соединиться с другими эле-
ментами, настолько же сильное стремление выйти из соединения он
атмосфера
99
обнаруживает, коль скоро оно получено. Азот в высшей степени «необ-
щительный» элемент.
Свободный азот употребляется для наполнения электрических
Генри Кэвендиш.
лампочек и пространства над ртутью в термометрах для высоких
температур. Он входит в состав весьма
важных соединений. Об этих соедине-
ниях речь будет итти в следующих гла-
вах; к ним относятся азотная кислота,
азотистые удобрения, белковые веще-
ства, азотистые пищевые вещества и
взрывчатые вещества.
8. Инертные, или благородные,
газы атмосферы. В 1799 г. в Англии
лорд Генри Кэвендиш произвел не-
сколько удивительно простых, но весь-
ма важных экспериментов, пользуясь
самым примитивным прибором. Послед-
ний (рис. 20) состоял из двух рюмок и
куска согнутой стеклянной трубки.
Рюмки и трубка наполнялись водой;
в трубку, вытесняя некоторое количе-
ство воды, можно было ввести воздух
или любую смесь газов. Соединенные
с электростатической машиной прово-
лочки, вставлялись затем в оба конца
трубки и сдвигались настолько близко,
насколько это было необходимо для
того, чтобы между ними могли проска-
кивать электрические искры.
С помощью этого аппарата Кэвен-
диш первый доказал, что 2 объема водорода соединяются с 1 объемом
кислорода, образуя воду. Он был также первым, заставившим по-
средством электрической искры азот соеди-
ниться с кислородом воздуха.
Другой опыт Кэвендиша привел к откры-
тию недеятельных газов атмосферы. Этот
опыт особенно интересен для нас. Кэвендиш
вместе с большинством ученых своего вре-
мени был сторонником теории флогисто-
на *. Он считал кислород воздухом, лишен-
ным флогистона, а азот—флогистированным
воздухом. Он пишет:
«Я произвел опыт, чтобы определить, все ли данное количество
флогистированного воздуха атмосферы может быть превращено в азотистую
кислоту, или в нем содержится отличная по природе часть, которая не под-
вергается этому изменению. Предыдущие опыты до известной степени ре-
См. следующую главу. Ред.
7*
100
АТМОСФЕРА
шали этот вопрос, поскольку весь воздух втягивался в трубку, теряя свою
упругость; некоторая же часть оставалась непоглощенной, причем неясно
было, имеет ли она ту же природу, что и остальной воздух, или нет. Поэтому
я уменьшал объем смеси дефлогистированного и простого воздуха совершенно
таким же способом, как я делал это раньше,— до тех пор, пока этот объем не
стал равным только небольшой части исходного. Затем, чтобы разложить по
возможности остававшийся в трубке флогистированный воздух, я прибавил
к нему некоторое количество дефлогистированного воздуха и продолжал
пропускать искры до тех пор, пока их объем не перестал уменьшаться.
Сконденсировав, насколько возможно, таким путем флогистированный
воздух, я втянул в трубку немного раствора серной печени для поглощения
воздуха, лишенного флогистона. После этого остался непоглощенным только
небольшой пузырек воздуха, составлявший не более 1/М9 объема введенного
в трубку дефлогистированного воздуха. Поэтому если здесь и имелось не-
которое количество дефлогистированного воздуха нашей атмосферы, от-
личного от остального и неспособного переходить в азотистую кислоту, то
мы с уверенностью можем заключить, что он составлял не более ‘/и» части
всего объема.
Природа этого остатка, составлявшего 1/1го часть всего объ-
ема, оставалась невыясненной в течение еще 100 лет, т. е. до
1894 г.
В 1887 г. Джон Уильям Стретт, позднее лорд Рэлей, сделался
профессором натуральной философии в Королевском институте. Лорд
Рэлей занимался весьма точными определениями плотности и моле-
кулярного веса некоторых газов, среди которых был и азот. К своему
удивлению он нашел, что плотность азота, полученного из азотисто-
кислого аммония, постоянно была немного менее плотности азота,
полученного из воздуха удалением других известных в то время со-
ставных частей воздуха. Разница была невелика, но все же больше,
чем позволяли пределы точности его опытов. С разочарованием он
сообщил о своих затруднениях Джемсу Дьюару, профессору химии
в Королевском институте, и высказал предположение, что возможно
существует еще какая-то, пока не открытая, составная часть воздуха,
и эта-то часть и является причиной испытываемых им затруднений.
Если такая часть действительно существует, она должна быть уди-
вительно недеятельной, почему она и оставалась неоткрытой. Вместе
они отправились в соседнюю комнату справиться с подлинными за-
писями Кэвендиша и прочитать приведенные нами выше строки.
Остаток, о котором с такой уверенностью сообщил Кэвендиш, полу-
чил при этом новое значение. Они заручились помощью Уильяма
Рамзая, профессора химии университетского колледжа в Лондоне,
и в 1894 г. Рэлеем и Рамзаем был прочитан доклад Британской ассо-
циации об открытии первого газа из семейства инертных газов
атмосферы — аргона.
9. Аргон. Аргон был изолирован Рамзаем удалением кислорода
из воздуха посредством пропускания воздуха над нагретой медью.
Азот затем был удален подобным же способом с помощью накален-
ного докрасна магния, с которым он соединяется, образуя твердый
нитрид.
Аргон находится в воздухе в количестве немного большем, чем
1% (но весу). Плотность его выше, чем плотность азота и кислорода
АТМОСФЕРА
101
ft это дает объяснение результатам, полученным Рэлеем. Наиболее
удивительным его свойством является его химическая инертность.
Его нельзя заставить соединиться с другими элементами. Как мы
увидим дальше, это обусловливается необыкновенной симметрией
строения его атомов. Его название, взятое с греческого языка,
означает «ленивый». В некотором количестве он производится в на-
стоящее время в качестве побочного продукта при сжижении воздуха,
ибо он остается в виде газа, после того как кислород и азот обращены
в жидкое состояние.
Ввиду его инертности и доступности аргоном пользуются для
наполнения электрических лампочек. Лампочки накаливания от
50 до 100 ватт наполняются в настоящее время именно этим газом.
10. Открытие гелия. История открытия гелия и всех его практи-
ческих приложений представляет собой едва ли не самую интересную
страницу в истории открытия элементов. В 1868 г. проф. Жанссен
открыл желтую- линию в спектре солнечной хромосферы, не принад-
лежащую спектру какого-либо известного на земле элемента. В том
же самом году Франкланд и Локьет сделали то же самое открытие
и назвали новый элемент «гелием» (от греческого названия солнца).
Почти 30 лет спустя, в 1890 г. американский химик Гиллебранд
заметил медленное и долго продолжавшееся образование маленьких
пузырьков газа, когда минерал клевеит обрабатывался соляной кис-
лотой в пробирке. Принимая во внимание химическую инертность
газа, Гиллебранд ошибочно заключил, что это был азот. Рамзай,
услышав об экспериментах Гиллебранда, немедленно закупил все
образцы клевеита и подобных ему минералов, которые он мог
достать в Лондоне. Из них он выделил новый инертный газ — ге-
лий. В письме к своей жене он пишет:
Прежде всего поговорим о новостях громаднейшего значения. Я поме-
стил новый газ в эвакуированную трубку и устроил так, что мог наблюдать
его спектр и спектр аргона в одном и том же спектроскопе одновременно.
Газ содержал аргон; в спектре имелась еще великолепная желтая линия,
яркая и блестящая, не совпадающая, но очень близкая к желтой линии
натрия. Я недоумевал, но кое-что начал подозревать. Я рассказал об этом
Круксу, и в субботу утром, когда Гарли, Ши льде и я рассматривали
спектр в темной комнате, пришла телеграмма от Крукса. Он прислал
копию, и ее я вложил в письмо. Вы удивитесь ее содержанию. Гелий —
название, данное линии солнечного спектра. Известно, что она соответ-
ствует какому-то элементу, но самый элемент до сих пор был неизвестен
на земле.
В 1895 г. сообщение об открытии гелия было сделано публично
по случаю поднесения лорду Рэлею фарадеевской медали на годич-
ном собрании Химического общества.
Вскоре Кайзер установил, что этот газ встречается и в воздухе,
но в чрезвычайно малом количестве. Он был найден также во всех
минералах радиоактивных элементов, так как альфа-частицы, вы-
брасываемые радиоактивными элементами, оказываются положитель-
но заряженными атомами гелия; найден он также и в природных га-
зах. Гелий это — газ с атомным весом 4, т. е. самый легкий после
102
АТМОСФЕРА
водорода. Он химически неактивен. Гелий, в силу своей низкой
критической температуры (—268°), наиболее трудно сжижаемый газ.
11. Применение гелия в дирижаблях. Вскоре после того как
вспыхнула мировая война, Р. Б. Мур в Нью-Йорке получил от
своего прежнего учителя Уильяма Рамзая телеграмму следую-
щего содержания:
Я исследовал выходы каменноугольных рудничных газов, имея в виду
гелий для нашего правительства. Повидимому в наших английских выходах
нет никаких следов гелия, но я получаю образцы из Канады и Штатов.
Цель — применить гелий в дирижаблях.
При бомбардировке английских городов в 1914 г. немецкий цеп-
пелин был атакован аэропланами союзников и пробит многими зажи-
гательными снарядами. Несмотря на это он не загорелся. Будь он
наполнен обыкновенным газообразным водородом, это кончилось бы
для него тем, что он загорелся бы и, охваченный пламенем, упал
бы на землю. Нужно сказать, что гелий обладает 92% подъемной
силы водорода и в то же самое время в силу своей химической инерт-
ности абсолютно неспособен к воспламенению. На этом основании
англичане пришли к предположению, что в Германии нашли какой-то
новый источник гелия и наполнили цеппелин этим газом. До того
времени единственный способ получения гелия состоял в действии
кислот на радиоактивные минералы, и в общем из этого источника
было получено не более 280 л гелия. Задача наполнить гелием дири-
жабли вместимостью до 56 000 м3 казалась в то время невозможной.
На конференции по разоружению в Вашингтоне после войны
проф. Муре из Парижа заявил, что «если бы кто-нибудь сказал ему
пять лет тому назад, что гелием будут наполнять дирижабли, он
отнесся бы к этому совершенно так же, как если бы кто-либо ска-
зал ему, что памятник Вашингтону только что собрались покрыть
бриллиантами».
12. Гелий в природных газах. Присутствие этого газа в некото-
рых выходах природных газов в США должно было дать указания
на источник достаточного количества гелия для приведенной выше
цели. В 1909 г. Кэди и Мак Фэрлянд из Канзасского университета
открыли природный газ, содержавший 1% гелия. Перед этим, в
1903 г., происходило бурение колодца в Декстере, в Канзасе, причем
был обнаружен большой источник природного газа. Владелец пригла-
сил множество народа отпраздновать открытие богатого источника.
Газ попробовали зажечь горящей связкой прутьев, но к отчаянию
владельца газ не загорелся. Он содержал слишком высокий про-
цент азота и гелия. С 1914 по 1915 гг. Беррель из Горного бюро
исследовал ресурсы природных газов страны и нашел, что газ нефтя-
ных месторождений около Форта-Уорта содержал около 35% азота
и 0,97% гелия.
Метод выделения гелия из природных газов основан на трудной
сжижаемости гелия. Все составные части природного газа, за исклю-
чением гелия, подвергаются сжижению при очень низкой темпера-
АТМОСФЕРА
103
туре и таким образом удается отделить их от несжиженного гелия.
} Максимальная стоимость гелия при получении его из радиоак-
тивных минералов была 60 долл, за 1 л. Небольшие эксперименталь-
ное заводы, только что построенные, производили его стоимостью
н 30 долл, за 1 000 л. В 1925 г. завод в Петролиа Вильд мог изоли-
ровать гелий стоимостью в 3 долл, за 1 000 л.
Важность применения гелия в дирижаблях не может быть
переоценена. Дирижабли, наполненные водородом, часто испытывали
несчастья, которых они могли бы избежать, если бы были наполнены
Рис. 21. Цистерна для перевозки газообразного гелия.
Гелий находится под давлением в 150 кг на 1 см1 и при атмосферном давлении займет около
600 л1.
гелием. Можно напомнить гибель дирижабля R-38, потерпевшего
крушение и сгоревшего при пробном полете в Гулле, дирижабля
«Рома», упавшего и взорвавшегося в Гэмптон-Род. Оба несчастных
случая сопровождались человеческими жертвами. Величайшая воз-
душная трагедия, гибель британского воздушного корабля R-101
во Франции, еще свежа в нашей памяти. Мур рассказывает о раз-
говоре, который был у него с полковником Воздушной службы ар-
мии Е. И. Холлом, оставшимся в живых при несчастьи. Полковник
Холл сказал: «Если бы контрольная гондола была прикреплена
по-иному и рама не сломалась бы, погибли бы только три или четыре
человека из всего экипажа»*.
13. Криптон, ксенон, неон и радон. Открытие аргона и ге-
лия побудило Рамзая искать другие подобные же газы в воздухе.
♦ Если бы дирижабль был наполнен водородом, а не гелием, то катастрофа
неизбежно сопровождалась бы взрывом водорода, при котором вряд ли кто-либо
из экипажа дирижабля мог бы спастись. Ред.
104 СУЩНОСТЬ ГОРЕНИЯ
В 1898 г. метод, придуманный Дьюаром и заключавшийся в фрак-
ционированной адсорбции смешанных с аргоном газов с помощью
древесного угля при низких температурах, после удаления кисло-
рода и азота воздуха, привел к открытию трех новых элементов —
криптона, ксенона и неона. Еще один элемент, принадлежащий к
группе инертных газов, — радон — образуется в виде газообраз-
ной эманации при распаде радия; из этих четырех газов практиче-
ское применение было найдено для радона и неона. Радоном поль-
зуются при лечении рака (стр. 203), а неоном — в новом способе
освещения реклам и в так называемой неоновой лампе накалива-
ния Пинча.
ГЛАВА XI
СУЩНОСТЬ ГОРЕНИЯ
В этой главе мы будем изучать сущность одной из наиболее важ-
ных химических реакций. Наша современная цивилизация нераз-
рывно связана с развитием машины, которая получает свое питание
из разумного пользования энергией, доставляемой главным образом
двумя источниками — углем и нефтью. Огню не поклоняются боль-
ше, как богу, им пользуются на благо человечества.
1. Теория флогистона. В первой половине XVII ст. в Герма-
нии химиками Бехером и Сталем была развита теория горения, ко-
торой было суждено пользоваться общим признанием в течение более
чем сотни лет. Немногие из принятых в настоящее время теорий жили
столь долго. Теория флогистона считала, что всякое горючее веще-
ство состоит из флогистона и извести*. Когда вещество сгорает, то
огненное начало, флогистон, выделяется в пламени, оставив известь
в виде золы. Вещества, оставлявшие мало золы, считались состоявши-
ми почти из чистого флогистона. Газ водород, не оставлявший пос-
ле сгорания золы, рассматривался как чистый флогистон. Ржавление
или кальцинация (окисление) металлов считались явлениями того же
рода, хотя тогда было хорошо известно, что ржавчина или известь
весили больше, чем металл, из которого они образовались. Сам
Сталь говорил, что «при кальцинации флогистон уходит, но не
уносит с собою какого-либо веса». Постоянно выдвигалось странное
объяснение, что флогистон имеет отрицательный вес, и потому потеря
флогистона металлом увеличивает вес металла.
2. Лавуазье и современная теория горения. Современная теория
горения явилась следствием открытия кислорода в 1774 г. Пристли
и Шееле, а также результатом экспериментального доказательства,
что вещества энергичнее горят в кислороде, чем в воздухе. В ноябре
1772 г., до открытия кислорода, великий французский химик Ла-
вуазье послал во Французскую академию сообщение, в котором он
отметил, что во всякой реакции горения и кальцинации известное
* Здесь термин «известь» следует понимать не в его обычном значении, а как
обозначение негорючего продукта сгорания. Ред.
СУЩНОСТЬ ГОРЕНИЯ
105
Антуан Лоран Лавуазье
количество воздуха соединяется с горящим веществом, и это и объяс-
няет увеличение веса вещества. Такие вещества, как уголь и сера,
невидимому, сгорают вполне и не оставляют золы; ему удалось по-
казать, что продукты сгорания в этом случае являются газами,
которые, будучи собраны, весят больше, чем уголь или сера, из
которых они образовались. Опыты Лавуазье показали далее, что
когда известь некоторых металлов разлагалась под влиянием нагре-
вания, то освобождался какой-то газ. Описывая один из своих
опытов, он говорил:
Я провел превращение глета (окис-
ла свинца) в закрытом сосуде и нашел,
что в тот момент, когда известь превра-
щается в металл, освобождается значи-
тельное количество воздуха, по объему
в тысячу раз большее глета.
Затем Пристли открыл кислород
и вскоре после этого посетил Лавуазье
в Париже, сообщив последнему о своем
открытии. Лавуазье тотчас же оценил
значение вновь открытого газа для
своей теории горения и кальцинации,
хотя сам Пристли до самой своей смерти
в 1804 г. оставался деятельным при-
верженцем теории флогистона. Лаву-
азье был глубоко убежден в необхо-
димости изучать количественную сто-
рону химической реакции так же пол-
но, как и качественную. Главным
образом благодаря ему в химическое
исследование был введен учет взятых и полученных веществ, с по-
мощью чего он установил закон сохранения материи, лежащий
в основе всех химических явлений. Поэтому-то Лавуазье часто на-
зывают «отцом современной химии». С помощью количественного
учета ему совершенно точно удалось доказать, что горение—процесс,
в котором происходит соединение горючего материала с кислородом
воздуха, и что ржавление металлов — подобный же процесс.
В 1793 г., во время Французской революции, Лавуазье погиб,
он был гильотинирован. Как лицо, связанное со старым правитель-
ством (Лавуазье был откупщиком податей), Лавуазье был предан
суду, против него были приведены важные обвинения, и он был
приговорен к смерти.
3. Реакция горения. Наиболее существенной составной частью
топлива, которое мы сжигаем, является углерод.
Углерод образует два соединения с кислородом, т. е. два окисла,
соответствующие его валентностям 2 и 4. Эти окислы — окись угле-
рода СО и двуокись углерода СО2. При избытке углерода образует-
ся окись углерода:
2С О2
2СО.
106
СУЩНОСТЬ ГОРВНИЯ
При избытке кислорода образуется двуокись углерода:
С + О2 = СОа.
В свою очередь окись углерода в присутствии избытка кислорода
сгорает до двуокиси углерода:
2СО + О2 —> 2СОа.
Горение каменного угля, кокса и древесного угля может быть
изображено приведенным выше уравнением, так как содержание
в них углерода значительно выше, чем других элементов *.
Соединения водорода и углерода, так называемые углеводо-
роды, образуют другой класс важных в промышленном отношении
топливных веществ. Самый простой углеводород — газ метан СН4;
этот газ представляет собой наиболее важную составную часть
природного газа, одного из наилучших топливных газов. Он встре-
чается также в болотистых местах, где разлагаются растительные
остатки, в виде болотного газа и в виде рудничного газа камен-
ноугольных копей. При избытке воздуха метан сгорает полностью
с образованием углекислого газа и воды:
СН4 + 2Оа—» СОа 4-2НаО.
В случае недостатка воздуха имеет место неполное сгорание метана,
в результате чего наряду с углекислым газом в большей или мень-
шей степени (в зависимости от условий горения и состава газовой
смеси) образуется окись углерода СО и сажа. Получающаяся высоко-
сортная сажа употребляется в производстве туши, черного лака,
типографских красок, а также в резиновой промышленности.
Нефть и продукты ее перегонки, газолин, керосин и т. д. со-
стоят главным образом из углеводородов. Когда горит это важное
топливо, имеют место реакции, сходные с реакциями горения метана,
т. е. при избытке воздуха все сгорает до СОа и НаО, а при недостатке
воздуха образуются и продукты неполного сгорания в том числе
окись углерода и сажа.
Многие виды топлива состоят из углерода, водорода и кислоро-
да> например дрова и алкоголь. Дрова состоят главным образом
из целлюлозы, простейшая формула которой СвН10О6 **. Формула
винного спирта СаНБОН. При сгорании этих или подобных им ве-
ществ продуктами реакции являются вода и двуокись углерода:
CeHi0O5 4* 6Оа —» 6СОа 4“ 5НаО;
СаН6ОН 4- ЗОа — 2СОа 4- ЗНаО.
• Горючая масса кокса содержит до 97% углерода. Ред.
*♦ Эта простейшая формула выражает только соотношение числа атомов в мо-
лекуле целлюлозы. Вопрос о действительном числе атомов в молекуле еще нельзя
считать разрешенным. Ред,
СУЩНОСТЬ ГОРЕНИЯ
107
Другие неметаллы, например сера и фосфор, горят также лег-
ко; их горение имеет меньшее практическое значение, чем горение
углерода:
S+O2 — SO2;
2S + ЗО2 — 2SO3;
4Р + ЗО8 —» 2Р2О3;
4Р + 5О2 — 2Р2О5.
Однако при сгорании серы, даже в избытке воздуха, практиче-
ски образуется только один продукт — двуокись серы. С другой
стороны, пятиокись фьсфора—главный продукт сгорания фосфора.
Рис. 22. Искусственное вдыхание смеси углекислого газа
с кислородом.
4. Опасность неполного сгорания. Мы узнали, что окись угле-
рода является продуктом неполного сгорания топлива. Этот бесцвет-
ный, не имеющий запаха газ — смертельный яд. При вды-
хании он соединяется с гемоглобином красных кровяных шариков и
приводит к удушью и смерти. Газы, выпускаемые автомобилем, содер-
жат много этого газа. Пустить мотор в небольшом гараже при закры-
тых дверях — самоубийство. Обычно жертва не сознает угрожаю-
щей опасности до тех пор, пока помощь уже оказывается запозда-
лой. Неудачно устроенная или испорченная печь может позволить
этому газу пробраться в жилое помещение в достаточной, чтобы на-
нести вред, концентрации, что особенно опасно после того, как труба
уже была закрыта на ночь. Когда свежий уголь сгребается лопатой
к огню, углекислый газ, образовавшийся в нижних слоях горящего
Угля, переходит в окись углерода при участии верхних слоев раска-
ленного угля:
СО2 + С — 2СО.
Светильный газ большинства городских газовых заводов содержит
высокий процент окиси углерода.
108
СУЩНОСТЬ ГОРЕНИЯ
Для спасения отравившегося требуется вдыхание смеси из
95% кислорода и 5% углекислого газа. Углекислый газ нужен, как
показали опыты, для возбуждения дыхания.
5. Факторы, влияющие на скорость горения. Мы все хорошо
знакомы с тем фактом, что вещества весьма различаются по легкости,
с которой они могут быть зажжены, и по энергии, с какой они горят.
Некоторые вещества, например вода, кирпич и камень, не горят со-
всем. Другие — большинство металлов — могут быть зажжены лишь
с большим трудом. С другой стороны, фосфор следует хранить под
водой, вне соприкосновения с воздухом, иначе он загорится при ком-
натной температуре. В одной из предшествующих глав мы познако-
мились с факторами, вообще влияющими на скорость химических
реакций. То, что было сказано там, мы приложим к изучению реак-
ций горения.
, 6. Температура. Мы видели, что повышение температуры
увеличивает скорость, с которой протекают химические реакции во-
обще. Реакции горения не представляют исключения в этом отно-
шении. Все реакции горения экзотермичны, так что чем быстрее они
протекают, тем более освобождают тепла в единицу времени и тем
выше поэтому окружающая температура. Здесь таким образом имеет
место эффект накопления тепла. Раз огонь возник, трудно погасить
его. Горючие материалы в общем могут безопасно находиться в сопри-
косновении с кислородом воздуха, хотя они соединяются с ним даже
при комнатной температуре, так как при этой температуре реакция
идет так медленно, что за исключением каких-либо чрезвычайных об-
стоятельств освобождаемое тепло удаляется от топлива (благодаря
теплопроводности и излучению) столь же быстро, как и образуется,
и поэтому температура не поднимается. Однако если по какой-либо
причине тепло реакции будет задержано, и его рассеиванию будет
положен предел, температура поднимется, реакция пойдет все быст-
рее и быстрее, выделяя все большее количество тепла, и в результате
может появиться огонь. Самовозгорание смоченных маслом тряпок,
свежескошенного сена или даже угля в плохо вентилируемых уголь-
ных ящиках — явления такого именно происхождения.
Обычно горючее вещество должно быть нагрето, прежде чем оно
загорится. Топливо должно быть нагрето до известной температуры,
прежде чем его соединение с кислородом воздуха пойдет так быстро,
что выделяющейся теплоты будет достаточно для поддержания темпе-
ратуры, при которой реакция пойдет сама собой с выделением света.
Эта температура называется точкой воспламенения ве-
щества или его температурой воспламенения, и до известной степе-
ни обусловливается степенью его измельчения. Если горящее ве-
щество охладить ниже температуры воспламенения, то горение пре-
кращается. Это легко можно доказать простыми опытами с куском
металлической сетки и горелкой Бунзена (рис. 23). Если, держа
сетку на 5—8 см выше горелки, открыть газ и поднести зажженную
спичку к струе газа выше ткани сетки, то газ воспламенится выше
сетки, но не ниже ее. Тепло горящего газа проводится и рассеивается
СУЩНОСТЬ ГОРЕНИЯ
109
сеткой так быстро, что температура газа ниже ткани оказывается
ниже температуры его воспламенения. Если опустить сетку на пла-
Рис. 23.
Рис. 24. Безопасная руд-
ничная лампа Гемфри Дэви.
мя горелки, то выше сетки пламя не появится, хотя несгоревший
газ и будет проходить через нее, что можно доказать, поднося к нему
зажженную спичку.
Рис. 25. Вот что сделал взрыв пыли с величайшим в мире элева-
тором. Гибель шести человек и материальный убыток
в 4 500 000 долл.
по
СУЩНОСТЬ ГОРЕНИЯ
Охлаждающая способность куска металлической сетки была
оценена Гемфри Дэви и использована в его безопасной лампе для
рудокопов (рис. 24). Металлическая сетка позволяет кислороду
воздуха, необходимому для поддержания пламени лампы, свободно
проходить через сетку вокруг лампы, но не допускает нагревания
взрывчатой смеси рудничного газа с воздухом вне лампы до
температуры воспламенения.
7. Поверхность. Горение твердого
происходящая на разделе между двумя
топлива есть реакция,
фазами—между твердым
топливом и газообраз-
ным кислородом. Мы
знаем, что скорость та-
кой реакции пропор-
циональна величине по-
верхности между дву-
мя фазами. Следова-
тельно чем более раз-
дроблено топливо, тем
больше будет быстрота,
с которой оно сгорает.
Котелки и кастрюли,
сделанные из алюминия
или железа, не горят,
но эти металлы в виде
порошка горят легко в
воздухе при температу-
ре бунзеновой горелки.
Огню легче возникнуть
в угле, измельченном
до размеров горошин,
Рис. 26. Сахарная пыль произвела этот взрыв. Ч®** размеров яйца.
Погибло двенадцать человек. Обращенный в поро-
шок уголь должен был
бы давать самый жаркий огонь, если бы он не слеживался и не
представлял таким образом меньшей поверхности для воздуха,
чем более крупный. Однако если обращенный в порошок уголь
продувать через подходящей величины трубку, он может гореть
очень энергично, почти так, как если бы это было газообразное
топливо.
Жидкое топливо горит энергичнее, когда его смешивают с воз-
духом и продувают в виде мелких капелек в камеру горения. В этом
и состоит функция карбюратора в двигателе автомобиля.
Очень мелко раздробленная горючая пыль, взвешенная в возду-
хе, образует с ним взрывчатую смесь; чтобы вызвать взрыв, нужна
только зажженная спичка или электрическая искра. Поверхность
твердых частиц в такой пыли столь велика, что воспламенение ча-
стиц происходит практически мгновенно. Имеются сведения о взры-
вах пыли угля, муки, крахмала, алюминия, бронзы, красящих ве-
СУЩНОСТЬ ГОРЕНИЯ
III
ществ, кожи, пряностей, пробок, твердой резины и даже сухого
молока.
8. Концентрация. Классические опыты Пристли с кислоро-
дом, доказавшие, что вещества легче горят в этом газе, чем в воздухе,
были одними из первых, указавших на влияние концентрации кисло-
рода на быстроту сгорания. Воздух состоит только на одну пятую
из кислорода. Таким образом чистый кислород имеет концентрацию
в пять раз большую, чем в воздухе при том же давлении. Молекулы
кислорода ударяются чаще о поверхность горящего вещества и го-
рение происходит живее. Кусок металлической сетки, не горящий
в воздухе, прекрасно сгорает в чистом кислороде.
Концентрация горючего материала, будь это твердое тело или
жидкость, не может быть изменена. Однако если это будет газ, его
концентрация может быть различна. Здесь снова, как и в общем слу-
чае, чем больше концентрация газа, тем больше скорость реакции
горения. Чтобы зажечь какой-либо газ, мы должны прежде всего
получить способную гореть смесь из газа и воздуха, а затем уже
поднять температуру этой смеси до точки ее воспламенения.
Горючей смесью можно считать такую, горение которой будет
протекать достаточно быстро, с освобождением теплоты, достаточной
для поддержания реакции после того, как будет достигнута точка
воспламенения. Пределы воспламеняемости некоторых смесей газа
и воздуха даются в следующей таблице.
Таблица XI. Пределы воспламенения газов
в воздухе
Газ Низший предел (%) Высший предел (%)
Водород 6,2 71,4
Окись углерода 6,3 71,2
Метан 5,3 13,3
Первая газовая горелка состояла вероятно из металлической
трубки с круглым отверстием. Газ в трубке, ведущей к этой горелке,
содержал так мало воздуха, что не воспламенялся. У отверстия го-
рючий газ смешивался с воздухом и получалась смесь, способная
воспламеняться. Бунзен первый подал мысль смешивать воздух с
газами до их воспламенения. Однако в горелке Бунзена количество
воздуха, поступающего через отверстие у ее основания, недостаточ-
но для того, чтобы образовать воспламеняющуюся смесь в самой
трубке горелки; если бы это было так, то пламя «проскакивало» бы
и горело у основания горелки, как это и бывает часто, если доступ
газа в горелку задержать, так что образуется воспламеняющаяся
смесь с воздухом.
112
СУЩНОСТЬ ГОРЕНИЯ
Обычный городской газ требует примеси несколько более 4
объемов воздуха на каждый объем газа для полного сгорания га-
за, тогда как в бунзеновской горелке получается обратное отноше-
ние. Горелка типа Мекера дает лучшие результаты, так как в ней
удается смешивать большее количество воздуха с газом, и тем не
менее «проскакивание» газа не имеет места; это достигается
вставкой металлической сетки при выходе из горелки и большей ско-
ростью истечения газовоздушной смеси, чем та скорость, с которой
пламя распространяется в обратном направлении.
9. Пламя. Пламя образуется в тех случаях, когда экзотерми-
ческая реакция между газами происходит столь быстро, что они
начинают светиться. Обыкновенный вид, который принимает пламя,
является результатом способа, каким газы смешиваются друг с дру-
гом. Когда горючий газ нужно зажечь, его выпускают в воздух из
соответствующей горелки. При таких обстоятельствах зона, в ко-
торой горючий газ реагирует с кислородом воздуха, отмечается пла-
менем. Когда мы говорим о горящем газе и о воздухе, поддерживаю-
щем горение, мы поступаем так в силу того, что в нашей атмосфере
имеется кислород. Если бы наша атмосфера состояла из светильного
газа, мы должны были бы запасать воздух в газовых баках и сжигать
его в бунзеновских горелках.
Газовое пламя имеет форму конуса, окруженного светящейся
оболочкой. Внутренний темный конус состоит из газа, еще не горя-
щего, еще не пришедшего в соприкосновение с кислородом воздуха.
Светящаяся оболочка отмечает зону, в которой происходят реакции
горения. Это та часть пламени, где температура наиболее высока.
Всякое пламя в большей или меньшей степени светится. Некоторые
же виды пламени, например пламя горящего водорода или окиси
углерода, почти невидимы в яркоосвещенной комнате и дают только
бледный синеватый свет в темной комнате. О таком пламени говорят,
как о «несветящемся». Другой вид пламени светится более ярко,
испуская блестящий желтый свет. Такое пламя непрозрачно и ви-
деть его можно легче. Оно содержит твердые частицы углерода,
накалившиеся добела. Несветящееся пламя очень плохо проводит
тепло. С другой стороны, светящееся пламя хорошо проводит тепло,
в силу того, что в нем взвешены накаленные твердые частицы. Пламя
в газовых печах, которыми пользуются для нагревания комнаты,
должны быть именно этого типа; если же это несветящееся пламя,
то его следует направлять на асбест или огнеупорный кирпич. Ауэ-
ровские газокалильные сетки могут служить примером того, как не-
светящееся пламя может быть использовано для освещения путем
накаливания твердого материала.
В связи с излагаемым интересно вспомнить историю открытия
этих сеток. Около 1880 г. Ауэр фон Вельсбах работал в лаборатории
Бунзена в Гейдельберге над линейными спектрами некоторых редко-
земельных металлов (стр. 233). Он описывает эксперимент, при-
ведший его к изобретению газокалильных сеток следующим
образом:
СУЩНОСТЬ ГОРЕНИЯ
113
Рис. 27.
Огнетуши-
тель.
Случайно мне приходилось пропитывать раствором этих солей бумаж-
ную тесьму и затем сжигать се. Можно было ожидать, что эксперимент
не будет удачен, так как остающийся остаток земель должен был бы, каза-
лось, рассыпаться, после того как тесьма сгорит, но в конце концов опыт
оказался удачным, и земельные элементы сохранили форму тесьмы.
Когда остаток накаливался несветящимся пламенем, он испу-
скал яркий свет. Встречающаяся в продаже газокалильная сетка,
в усовершенствованном виде, состоит из 99% окиси тория и 1% оки-
си церия.
10. Огнетушители. Мы видели, что горение топлива может
происходить лишь при доступе кислорода воздуха и при температуре
не ниже температуры воспламенения топлива. Обратно, если жела-
тельно погасить огонь, то следует помешать каким-
либо способом воздуху притти в соприкосновение
с горящим материалом или снизить температуру ниже
температуры воспламенения. Первый изобретенный
огнетушитель выбрасывал струю воды с углекислым
газом. Вода охлаждала горящее вещество, а тяжелый
углекислый газ как бы покрывал его покровом и за-
щищал от кислорода воздуха. Такой огнетушитель
показан в поперечном сечении на рис. 27. Склянка
А наполнена серной кислотой, а остальной сосуд кон-
центрированным раствором бикарбоната натрия
NaHCO3. Если огнетушитель опрокинуть, реактивы
смешаются, и произойдет следующая реакция:
2NaHCO3 + H2SO4 —> Na2SO4 + 2Н2О + 2СО2.
Огнетушитель более позднего типа наполняется невос-
пламеняющейся жидкостью — четыреххлористым угле-
родом; когда его пускают струей на огонь, он пре-
вращается в пары, образуя очень плотный паровой покров над го-
рящим материалом. Пары этого огнетушителя весьма ядовиты,
так что комната, после того как в ней пользовались огнетушите-
лем, должна быть хорошо проветрена. Другой тип огнетушителя
гасит огонь пеной из пузырьков углекислого газа, образующихся
вследствие смешения растворов бикарбоната натрия и сульфата
алюминия в присутствии небольшого количества солодкового корня,
чтобы сделать пену более стойкой. Недавно на рынке появились
Цилиндры с жидкой двуокисью углерода в качестве огнетушителей.
Их успех при тушении огня обусловливается окутывающим дей-
ствием углекислого газа и интенсивным охлаждающим действием
твердой двуокиси углерода, образующейся при выпускании газа.
Совершив свое дело, углекислый газ полностью улетучивается, не
портя ничего, с чем ему приходятся приходить в соприкосновение.
11. Огнеупорные вещества. Только вещества, состоящие из
элементов, соединившихся с максимальными количествами кисло-
родных атомов, которые они могут удерживать в химическом соеди-
нении, являются абсолютно огнеупорными. Вода и углекислый газ
g
Введение в химию.
114
топливо
не могут гореть, потому что они продукты полного сгорания водород
и соответственно углерода. Песок SiO2 и все получаемые из него
силикаты не горят по той же причине. Эти вещества в форме кирпича
Рис. 28. Огнетушитель гасит огонь покровом из твердой угле-
кислоты.
стекла, строительного камня, цемента, штукатурки и т. п. принад-
лежат к наиболее важным огнеупорным строительным материалам.
Железный остов небоскреба едва ли можно считать способным го-
реть; однако мелкораздробленные частицы железа легко горят в
кислороде и даже в воздухе.
ГЛАВА ХН
ТОПЛИВО
Твердое топливо
1. Происхождение каменного угля. Много тысячелетий тому
назад в позднюю палеозойскую эру, когда климат был влажный и ко-
личество осадков обильное, в топях и болотах пышно произрастала
роскошная растительность, которой предстояло сделаться впослед-
ствии бесценным наследством — каменным углем. Болота постепен-
но заполнялись обломанными сгнившими растениями, смешанными
с пропитывавшей их грязью. В результате образовался торф-
При образовании торфа микроорганизмы и грибки вызывали разло-
жение растительных тканей. Эта деятельность бактерий продолжа-
топливо
115
лась До тех пор, пока болотная вода не делалась слишком кислой
й не останавливала процесса гниения. Торф образуется и теперь,
если имеют место аналогичные условия. Скорость, с которой он
образуется, обусловливается скоростью роста и гниения растений,
рыло вычислено, что в болотах каменноугольной эры в продолжение
столетия отлагалось от 30 до 60 см торфа. В некоторых странах
торф употребляется в качестве топлива.* В частности в СССР, об-
ладающем огромными пространствами торфяников, торф как топ-
ливо имеет большое значение. Ре<9.*
Дальнейшая стадия образования каменного угля предполагает
такого рода сдвиг земной поверхности, что пласты торфа оказываются
под землей и подвергаются давлению. Это приводит к увеличению
плотности, потере воды, углекислого газа, метана и других летучих
веществ и к образованию лишенного воды материала, обладающего
вяжущими свойствами. Постепенно образуется бурый уголь, или
лигнит, за ним следует мягкий, или битуминозный*, уголь и наконец
твердый уголь, или антрацит. Эшли вычислил, что слой в 6 м
растительного материала образует около 1 м торфа и впоследствии
30 см каменного угля. Если торф отлагается по 30 см в столетие, то
потребуется 300 лет, чтобы накопить материал для прослойки камен-
ного угля около 30 см толщиной.
2. Состав и теплотворная способность углей. Химические
реакции, имеющие место в процессе образования каменного угля
из растительного материала, сложны и мало изучены. Помимо угле-
рода угли содержат еще водород, кислород, серу и азот вместе с не-
которыми негорючими минеральными частями, превращающимися
в золу, когда угли сгорают. Таблица ХП дает состав средних об-
разцов различных видов угля и их теплотворную способность.
Таблица XII. Состав и теплотворная способность
твердого топлива
Вещество Углерод Водород Кислород Теплотвор. способ. 1 кг (Кал)
Чистая клетчатка .... 44,5 6,2 49,3 4 200
Дерево 50,0 6,0 44,0 4 103
Торф 60,0 5,9 34,1 5 50J
Лигнит 67,0 5,2 27,8 6 500
Биитумнозный уголь . . 88,4 5,6 6,0 840)
Антрацит 94,1 3,4 2,5 8 800
* Этим термином автор обозначает то, что у нас принято называть камен-
ным углем. Значение термина «битуминозный» однако шире: им обозначается вообще
^який уголь, заключающий битумы, будь то каменный бурый уголь или даже
8» ’ :
116
топливо
Антрацит главным образом употребляется в домашнем быту,
битуминозный же уголь или превращается в кокс или сжигается
для получения энергии. Употребление лигнита в качестве топлива
до сих пор было незначительно. Этот уголь вследствие большого со-
держания в нем влажности рассыпается в порошок, когда попа-
дает на земную поверхность. Однако его можно брикетировать и в
таком виде он становится приемлемым топливом. В Германии неко-
торые виды бурого угля пережигаются в кокс.
3. Запасы каменного угля. Известные мировые запасы камен-
ного угля приведены ниже в таблице. XIII. Мировое потребление
угля кажется настолько громадным, что если судить только по
этой таблице, составляется неверное представление об обеспечен-
ности углем.
Таблица XIII. М и р о в ы е запасы каменного угля
(в миллионах тонн)
Страны Антрацит Битуминоз- ный уголь Лигнит
Сев. и Южн. Америка . . Азия Европа Океания Африка 25000 450000 60000 72 600 13000 2 500000 838 000 760 000 147 000 20000 3 100000 1 120000 40С00 40 000 12000
Угля хватит для всех нас и для детей наших и внуков. Если битуми-
нозного угля станет мало, есть еще громадный запас лигнита, на ко-
тором можно базироваться.
Из всего количества угля, необходимого для добывания энер-
гии на современных паровых установках, немного менее */з теряется
или тратится в руднике, 5% теряется или сжигается при перевозке,
*/8 сжигаются без полезного эффекта на силовой установке и только
3,8% действительно превращаются в полезную энергию.
4. Древесный уголь и кокс. Древесный уголь, очень близкий по
своему составу к чистому углероду, образуется, когда дерево нагре-
вается без доступа воздуха. Составные части дерева частично разла-
гаются при нагревании на такие летучие продукты, как горючие
газы, уксусная кислота, древесный спирт и ацетон. Все это ценные
побочные продукты. Употребление древесного угля как топлива от-
носительно невелико. Он легко загорается, горит без дыма и остав-
ляет мало золы. Пользование им как хорошо адсорбирующим ве-
ществом будет рассмотрено в гл. XXXII.
Когда битуминозный уголь нагревается в закрытой реторте,
он начинает размягчаться при температуре выше 350°, и по мере
того как температура поднимается, выделяет газы и смолистые па-
ры. Остаток после охлаждения затвердевает в черно-серую пористую
массу, называемую коксом. Летучие продукты содержат вещества,
топливо
117
из которых приготовляются удобрения, сильные взрывчатые вещест-
ва, топливо для автомобилей, материалы кровельные и для мостовых
и множество других полезных продуктов наряду с весьма важным
горючим газом.
Сам кокс не только великолепное топливо, но и неоценимое ве-
щество для превращения железных руд в металлическое железо в до
менной печи. Одна седьмая всего угля, до-
бываемого в рудниках США, превращается
в кокс для нужд металлургической про-
мышленности, потребляющей ежегодно до
50 000 000 т этого топлива.
5. Коксовальные печи. До самого
последнего времени большая часть кокса
в США производилась в коксовальных
Рис. 29. Разрез коксоваль-
ной печи, имеющей вид
улья.
печах, имеющих вид улья (рис. 29). Эти
печи наполняются битуминозным углем,
часть которого зажигается, чтобы пре-
вратить остальную часть в кокс Лету-
персом, была введена в
Рис. 30. Разрез печи с улав-
ливанием продуктов коксо-
вания.
чие продукты улетучиваются через отверстие вверху, весело,
хотя и бесполезно, пылая при этом. Печь для коксования с
улавливанием побочных продуктов появилась в Европе около 45
лет тому назад. В Америке печь такого рода, разработанная Г. Коп-
1910 г. В ней ценные побочные продукты
при процессе обжигания угля сберегаются.
Распространение таких печей происхо-
дило в Европе (особенно в Германии) го-
раздо быстрее, чем в США. Когда вспых-
нула война, Германия была снабжена
всем необходимым для производства цен-
ных побочных продуктов лучше, чем ее
противники. В связи с возросшей по-
требностью во взрывчатых веществах во
время войны союзники поспешили со-
орудить коксовальные печи с улавлива-
нием побочных продуктов. В 1915 г.
лишь немногим более 30% всего кокса,
производимого в США, производилось в
таких печах. В настоящее время свы-
ше 80% битуминозного угля, превращае-
мого в кокс, подвергается этой операции
в печах описанной конструкции.
Печь с улавливанием продуктов кок-
сования (рис. 30) состоит из длинной узкой камеры около 9 м
Длиной, от 30 до 60 см шириной и от 1,8 до 4 м высотой. Она
нагревается сжиганием в расположенных по бокам трубах] горючих
смесей из газа и воздуха. Отработанное тепло горящих газов ис-
пользуется на предварительное нагревание воздуха и газа. Темпера-
тура в печи около 1000°. Побочные продукты выводятся в виде паров
118
ТОПЛИВО
через трубу вверху печи. Когда уголь превратился в кокс, откры
ваются оба конца печи и особое приспособление (таран) выталкивает
из нее кокс. Печи расположены рядом в виде батарей (рис. 31), при-
чем численность их колеблется от четырех до сотни.
Рис. 31. Батарея печей с улавливанием продуктов коксования.
Основными побочными продуктами являются: горючий газ, га-
зообразный аммиак и смола. Одна часть горючего газа идет на на-
гревание коксовальных печей, а другая используется для бытовых
нужд. Из газообразного аммиака NHS, обрабатываемого раствором
серной кислоты, получают сульфат аммония — ценное удобрение:
2NH3 + H2SO4 — (NHJ2SO4;
каменноугольная смола служит исходным материалом для полу-
чения большинства наших красящих веществ, медикаментов и
взрывчатых веществ.
Одна тонна битуминозного угля —<
318 м газа
47 л каменноугольной смолы
11 кг серноаммониевой соли
675 кг кокса
Горючие газы
Преимущества газообразного топлива перед твердым вполне
очевидны и состоят в следующем: в большей легкости распределения,
в более активном сгорании, в более совершенной регулировке тем-
пературы и в отсутствии дыма и золы. Устранение вреда от дыма
одно могло бы дать большую экономию. Институт Меллона в Питтс*
топливо
но
бурге вычислил, что ежегодные потери и убытки от дыма в одном
0иттсбурге доходят до 10 000 000 долл.
В США ежегодно сжигается горючих газов почти на биллион
долларов. Это наиболее экономичный способ, каким может быть
получена энергия из наших топливных ресурсов. Рассмотрим теперь
некоторые из этих газов.
6. Каменноугольный газ. Каменноугольный газ получается при
производстве кокса из мягкого угля. На городских газовых заводах
газ является главным продуктом, а кокс — побочным. Газовые ре*
торты этих заводов мало отличаются от печей с улавливанием про-
дуктов коксования. Они состоят из длинных, узких камер овального
сечения. Производственный процесс и получаемые продукты в общем
те же самые, что и в коксовальных печах с улавливанием продуктов
коксования. Прежде чем быть направленным в общегородскую сеть,
газ подвергается очистке. Его состав приведен в табл. XIV.
Таблица XIV. Состав горючих газов
7. Водяной газ. Водяной газ получается пропусканием пара
через раскаленный уголь или кокс. Сначала пропускается ток воз-
духа, в котором топливо энергично загорается и температура подни-
мается:
С 4- О2 —* СО2 4- тепло.
Затем воздух удаляется и пропускается пар:
С 4- Н2О 4- тепло —* СО 4- Н2.
Так как эта реакция эндотермична.то температура падает до тех пор,
пока не становится настолько низкой, что приходится снова пускать
воздух и разогревать уголь, после чего снова вдувать пар и т. д.
Водяной газ горит синим бесцветным пламенем, непригодным для
осветительных целей (исключая ауэровские калильные сетки).
Иногда его смешивают с газами, образующимися при нагревании
До высокой температуры тяжелых остатков от перегонки нефти.
Продукты крэкинга таких нефтяных остатков содержат углево-
дороды, горящие очень ярким пламенем. Водяной газ, смешанный
о этими продуктами, называется карбюрированным водяным газом.
120
топливо
В этом виде или смешанный с каменноугольным газом он широко
применяется под названием светильного газа для отопления и осве-
щения жилищ.
8. Генераторный газ. Генераторный газ образуется продува-
нием воздуха или смеси воздуха и водяного пара через толстый
слой угля. Если пользуются одним воздухом, то имеют место сле-
дующие реакции:
С + О2 —► СО2 + тепло;
СО2 + С 4- тепло —* 2СО.
При первой реакции освобождается тепла больше, чем по-
глощается при второй. Этот избыток тепла, который несут с собой
нагретые газы, должен быть использован непосредственно после их
выхода из генератора, иначе это тепло будет потеряно. В связи с
этим неэкономно пользоваться генераторным газом для домашних
нужд.
Если через уголь продувать и воздух и пар, то образуется так
называемый «полуводяной газ», так как пар реагирует с частью
угля, образуя водяной газ. Так как при продувании воздуха в гене-
ратор вместе с кислородом вводится и азот, то последний содержит-
ся в «воздушном газе» в размере до 50% и в «полуводяном газе»
в размере до 29%. Несмотря на то, что при сгорании генераторного
газа освобождается тепловых единиц меньше, чем при сгорании тако-
го же объема всякого другого промышленного газа, генераторный
газ по стоимости единицы тепла наиболее дешевый газ.
9. Природный газ. Природный газ почти исключительно со-
стоит из углеводородов, из которых метан СН4 составляет 80—90%,
иногда и выше, а этан С2Н6 — до 18%. Обычно, но не всегда, его
находят вместе с нефтью. Свыше 50% употребляемых нами на отоп-
ление и освещение газов приходится на долю этого газа. В 1923 г.
было использовано свыше 30 000 000 000 м3 газа. Западная Вирги-
ния, Оклахома, Пенсильвания, Охайо, Луизиана и Калифорния
доставляют очень большие количества природного газа.
♦ СССР также богат природным газом (районы Баку, Грозный,
Майкоп, Керчь и др.). Использование природного газа получило
свое развитие только при Советской власти. Однако не все еще газо-
вые скважины, дающие миллионы кубических метров газа, исполь-
зуются. На природном газе в Дагестане работает в настоящее время
большой стекольный завод «Дагестанские Огни». Ред.*
10. Ацетилен. Ацетилен представляет собой углеводород
С2Н2, который легко может быть получен действием воды на кар-
бид кальция:
СаС2 + 2Н2О — Са (ОН)2 + С2Н2.
Карбид кальция получается при нагревании извести СаО и кокса
в электрической дуговой печи:
СаО + ЗС — СаС2 + СО.
топливо
121
Прежде ацетилен применялся в велосипедных и автомобильных
фонарях. В настоящее время он широко применяется в смеси с кис-
лородом при сварочных работах и для разрезания стали, а также для
химических синтезов. Ацетилен можно безопасно перевозить в сталь-
ных цилиндрах в растворе ацетона под давлением. Если же под дав^
лением он находится без растворителя, то может быть причиной
опасных взрывов.
Жидкое топливо
11. Нефть. Наряду с каменным углем нефть один из наших
наиболее ценных естественных ресурсов для получения энергии.
Из нее мы добываем энергию, заставляющую двигаться наши автомо-
били, локомотивы и паровые суда. Нефтяными маслами смазываются
Рис. 32. Месторождение нефти Солт-Крик (Уайоминг).
машины во всем мире. Нефть была известна и древним. Битумы
были в употреблении у вавилонян еще за 3 000 лет до н. э. В древ-
нем Вавилоне и Ниневии мозаики и каменные дощечки укреплялись
на месте с помощью битумов. Об употреблении нефти несколько раз
упоминается и в библии. В Америке она была известна индейцам
еще до прихода белых колонистов.
12. Состав и происхождение нефти. Нефть состоит из многих
углеводородов, большинство которых жидкие вещества, раство-
ренные одно в другом. Состав этих углеводородов неодинаков,
в зависимости от месторождения нефти. Физические свойства раз-
личных видов нефти поэтому также до известной степени различ-
ны. В необработанной нефти находятся в большем или меньшем
количестве сернистые соединения, представляющие собой неже-
лательные примеси. О строении различных углеводородов мы
будем иметь случай сказать в одной из следующих глав.
122
топливо
У нас есть основания полагать, что нефть происходит как из жи-
вотных, так и из растений. Остатки по большей части морских ра-
стений и животных, покрытые наслоениями пород, послужили нача-
лом нефтяным углеводородам. Эти углеводороды накапливались
в грязевых породах и в черных глинистых сланцах стоячих вод.
С течением времени они вымывались грунтовыми водами и собирались
в подземных пещерах в отложениях песчаников. Некоторое подтверж-
дение теории происхождения нефти из морских животных и растений
дает опыт Энглера: он получил углеводородные масла, похожие на
сырую нефть, подвергнув перегонке полтонны трески под давлением
в 10 ат.
Природе потребовались сотни тысяч лет, чтобы образовать
нефть так же, как и каменный уголь, а мы потребляем ее в настоящее
время в возбуждающих опасения количествах.
13. Переработка нефти. Ввиду широкого распространения ав-
томобилей США всегда подвергали переработке бблыпую часть
мировой добычи нефти. Мировая добыча сырой нефти дана в таб-
лице XV.
Таблица XV. Добыча нефти в четырех круп-
нейших нефтедобывающих странах
(в тысячах тонн)
Страны 1929 г. 1930 г. 1931 г.
США СССР Венецуэла Мексика 143800 14 100 19 800 6 400 128300 18 400 20 200 5 800 122200 22 300 18500 4 700
Нефть доставляется на поверхность земли из буровых сква-
жин, просверленных через вышележащие пласты вплоть до нефте-
носных песчаников. Глубина скважин может быть от 150 м до 2,5 км.
Если нефть находится под высоким давлением, то из скважины может
забить нефтяной фонтан.
Сырая нефть обыкновенно не подвергается переработке на
месте добычи. Она или перевозится на нефтеналивных судах или пере-
качивается через сеть труб на нефтеперегонный завод. Эти трубы
соединяют заводы на Больших Озерах или на Атлантическом по-
бережье с обширными месторождениями на восток от Скалистых Гор.
Иногда эти расстояния доходят до 1 600 миль (ок. 2 500 км), напри-
мер при перекачке нефти из месторождений в Оклахоме на Атланти-
ческое побережье.
♦ В СССР имеются нефтепроводы Баку—Батум (822 км), Грозный—
Туапсе (618 км), Грозный—Махач-Кала, Армавир—Донбасс. Стро-
ится нефтепровод Гурьев—Орск. Ред. *
На нефтеперегонном заводе сырая нефть подвергается перегонке
в железных перегонных кубах (рис. 34), помещенных в кирпичной
топливо
123
кладке и нагреваемых сжиганием горючих масел. Прежде всего от-
деляются растворенные в нефти газообразные углеводороды, содер-
Рис. 33. Нефтеперегонный завод.
жащие от 1 до 4 атомов углерода в молекуле; таковы например
метан СН4, этан С2Нв, пропан С8Н8 и бутан С4Н10. По мере повы-
шения температуры из куба в холодильник начинают переходить
пары низкокипящих жидкостей. Когда нефть нагревается до 100—
Ректификационнйи колоний
Рис. 34. Горизонтальный нефтеперегонный куб с ректификационными
колонками.
120°, в куб впускают перегретый водяной пар, чтобы понизить темпе-
ратуру кипения и тем самым по возможности предотвратить разло-
жение высококипящих составных частей нефти.
* Первый погон, кипящий до 150°, называется газолиновым дестил-
124
ТОПЛИВО
латом; из него путем дальнейшей разгонки получают различные сор.
та бензина — авиационный бензин, бензин 1-го сорта и т. д. Следую-
щий погон, от 150 до 300°, служит для получения различных сортов
керосина. Остаток после отгонки этих двух фракций называется ма-
зутом. Мазут применяется как топливо или же подвергается даль-
нейшей перегонке с водяным паром с целью выделения из него сма-
зочных масел. Остаток после отгонки смазочных масел — гудрон —
черная смолообразная масса. Он вместе с асфальтовым известняком
идет для мощения. Ред*
Жидкие фракции до продажи обычно подвергаются дальнейшей
очистке.
14. Применение нефтяных продуктов. До появления авто-
мобиля на керосин смотрели как на наиболее важный продукт
перегонки нефти. Газолин был слишком опасен для употребления
в лампах и печах, отапливающихся маслом, так что он оставался без
употребления. Однако с появлением автомобиля положение измени-
лось. Керосин остается еще в употреблении для освещения в кероси-
новых лампах и для сжигания в печах в сельских местностях. Он
употребляется также в тракторах и некоторых видах стационарных
машин внутреннего сгорания. Горючие масла сжигаются в паро-
ходных топках известной конструкции, в двигателях Дизеля и при-
меняются для отопления жилищ. Они могут быть обращены также
в газолин при посредстве крэкинг-процесса, о чем мы будем говорить
позже. Смазочные масла или употребляются прямо как смазочный
материал, или превращаются в смазки, представляющие собой
эмульсии масла и воды. Некоторые из жидких масел содержат в
растворенном виде твердые углеводороды, которые отделяются от
масла вымораживанием. Эти твердые углеводороды называют па-
рафином. Парафин употребляется для производства свечей, вощеной
бумаги и т. д.
15. Крэкицг. Процент бензина, получаемого из сырой нефти,
постоянно повышался. Это отчасти обусловливалось улучшением
методов переработки нефти, но главным образом введением в 1913 г.
процесса Бертона для производства бензина — крэкингом газа или
масел. Масла, кипящие при температурах между 225 и 375°, наг-
реваются в перегонных кубах (рис. 35) под давлением в 4 ат до тем-
пературы в 400°. При этих условиях происходит разложение более
сложных молекул на более простые, соответствующие нижекипя-
щим, более летучим жидкостям.
16. Другие источники получения бензина. Большие коли-
чества легкого бензина получаются из так называемого «жирного»
природного газа. Этот газ содержит пары жидких углеводородов,
которые могут быть выделены из него при сжатии газа. Газо-
лин, получаемый из жирного нефтяного газа, имеет очень вы-
сокие качества. В 1920 г. из этого источника было получено
до 3 800 000 000 л.
Мы упомянули о том, что на известной стадии образования
нефти ее можно найти в пористых сланцевых формациях. Измель-
топливо
125
ценные горючие сланцы можно нагревать в перегонных кубах и при
этом летучие масла отгоняются от твердого материала. Горючие
сланцы представляют собой естественный ресурс, который будет
эксплоатироваться все шире, по мере того как запасы нефти будут
уменьшаться.
17. Другие виды жидкого топлива. Когда запасы нефти бу-
дут исчерпаны, мы должны будем обратиться к другим видам
жидкого и газообразного топлива для наших двигателей внутрен-
Рис. 35. Крэкинг-установка.
него сгорания. Среди них имеются различные виды алкоголей.
Этиловый, или винный, спирт С2Н5ОН получается при брожении
сахаров. Может ли в будущем расти достаточно растений, содержа-
щих сахар, чтобы снабдить алкоголем автомобили и аэропланы?
Это еще подлежит обсуждению. Метиловый, или древесный, алко-
голь СН3ОН получается в качестве побочного продукта при сухой
перегонке дерева. Недавно он был синтезирован из водяного газа
и выпущен на рынок под названием синтетического метанола, произ-
водящегося сейчас в больших количествах. Тогда как водяной газ
образуется из каменного угля, в синтетическом метаноле мы имеем
Моторное топливо, которое может быть получено из природных
Ресурсов, запасы которых еще весьма велики. В Германии Бергиусом
был разработан особый процесс для превращения угля в нефть. Из-
мельченный уголь, смешанный с маслом, нагревается под давлением
около 200 ат при температуре около 450° в атмосфере водорода.
Бергиус указывает, что из 1 т угля было получено 530 л сырой нефти,
123
МЕТАЛЛЫ
давших при перегонке 150 л моторного топлива, 190 л машинного
масла для дизелей и 133 л топливного масла вместе с 280 м3 газа.
За эту работу Бергиус получил нобелевскую премию в 1931 г.
18. Гидрогенизация нефти. Громадный исследовательский ап-
парат германского химического концерна I. G. Farbenindustrie
работал затем над применением процесса Бергиуса к гидро-
генизации сырой нефти и нефтяных остатков; гидрогенизация про-
изводилась газообразным водородом при высоких давлениях и с уча-
стием катализаторов. Для этого процесса были найдены катализа-
торы, удивительно стойкие к отравлению серой.
ГЛАВА XII1
МЕТАЛЛЫ
Химические элементы обычно делят на металлы и неметаллы.
Неметаллические элементы в общем меньше известны каждому,
чем металлы. Правда, каждый знает, что в легких у него имеется кис-
лород, может быть, знает даже, что в его аптечке имеется иод. Он
смутно сознает, что сера означает для него спички, окуривание,
повышение урожайности. Если бы не пришла мировая война, он
никогда не услышал бы о хлоре. Это недостаточное знакомство
с неметаллами обусловливается тем фактом, что свойства свобод-
ных неметаллов не таковы, чтобы сами они могли найти широкое
применение в обыденной жизни. Они важны главным образом как
исходный материал, из которого могут быть приготовлены соеди-
нения, имеющие непосредственное применение. Наоборот, металлы
обладают свойствами, сделавшими их полезными и поэтому хорошо
знакомыми. Железо, медь, цинк, свинец и олово — металлы, для
которых каждый может назвать по крайней мере с полдюжины по-
лезных применений.
Наши человекообразные предки научились пользоваться камня-
ми в качестве орудий много раньше того, как они перестали жить
на верхушках деревьев. Дарвин рассказывает об одной обезьяне,
которая пользовалась камнем, чтобы разбивать орехи, и тщательно
хранила его под соломой своей постели. Первобытный человек от-
крыл, что кремень может быть отесан и что отесанный угол его ста-
новится острым. В продолжение сотен тысяч лет после этого
он довольствовался каменным инструментом и оружием, пока не
научился пользоваться металлами. Некоторые металлы встречаются
в природе в свободном виде лишь в небольших количествах. Между
ними серебро и золото прежде всего привлекли внимание человека.
Еще в такое отдаленное время, как за 5 000 лет до н. э., египтяне
уже готовили ювелирные изделия и посуду из этих драгоценных ме-
таллов с изысканным мастерством. Медь в свободном виде встре-
чается в природе, но в довольном малом количестве. Самый по-
лезный из всех металлов — железо — редко можно найти в свобод-
ном состоянии, Да и то только в метеоритах и в относительно неболь-
МЕТАЛЛЫ
127
тих количествах в Гренландии. Громадное количество металлов
мира заложено ниже поверхности земли в соединении с другими эле-
ментами. Не ранее того, чем человек научился плавить металличе-
ские руды, они начали играть сколько-нибудь существенную роль
в его жизни.
Тот факт, что медь и олово могут быть получены из их окисных
руд посредством сплавления с древесным углем, был известен очень
давно, как и факт, что прибавление небольших количеств олова к
меди дает твердый сплав — бронзу, из которой могут быть сделаны
острые орудия гораздо более высокого качества. Это открытие отме-
чает начало бронзового века в Греции около 5000 лет тому назад.
Весьма удивительно, что металлургия железа была разработана у
греков и римлян почти на 800 лет позже, хотя плавить железные руды
гораздо легче. В Индии искусство плавления железных руд было
разработано уже давно. Около 500 г. н. э. в Китубе, около Дели,
была воздвигнута колонна из чистого железа, высотою в 8 м,
весящая 55 т.
1. Физические свойства металлов. Металлы обладают некото-
рыми общими свойствами, по которым мы научаемся распознавать
их: металлический блеск, непрозрачность, высокая проводимость
электричества и тепла и др. Некоторые другие свойства труднее
распознать при поверхностном наблюдении; как раз они-то и опре-
деляют полезность металла. Эти свойства определяются таким об-
разом. Твердость есть способность вещества сопротивляться про-
никновению в его поверхность другого вещества. Относительная
твердость двух веществ может быть легко определена трением остро-
го конца одного о поверхность другого и наоборот. Более твердое
вещество будет царапать более мягкое. Была установлена произволь-
ная шкала твердости путем выбора десяти минералов различной сте-
пени твердости, с которыми можно было бы сравнивать другие веще-
ства (табл. XVI). Способность вещества сопротивляться разлому
Таблица XVI. Шкала твердости
1. Тальк 2. Каменная соль 3. Кальцит 4. Флуорит 5. Апатит б. Полевой шпат 7. Кварц 8. Топаз 9. Корунд 10. Алмаз
под действием тяжести, достаточной, чтобы вызвать постоянную де-
формацию, будет служить мерой его прочности. Хрупкость практи-
чески является противоположностью прочности. Прочность на раз-
рыв есть сопротивление вещества силе, стремящейся тянуть его в раз-
ные стороны. Тягучесть есть способность вещества вытягиваться в
проволоку. Вещество будет ковким, если ему на наковальне можно
придать какую-нибудь определенную форму.
Свойства чистых металлов часто заметно меняются благодаря
присутствию в них даже небольших примесей. Чистое железо ковко
128
МЕТАЛЛЫ
и тягуче, но когда оно содержит всего только 2% углерода, оно ста-
новится очень хрупким. Электрическая проводимость меди умень-
шается наполовину при следах мышьяка. Когда два или большее
количество металлов сплавляются вместе, получаются сплавы,
свойства которых могут заметно отличаться от свойств, составляю-
щих их металлов.
2. Сходство между горением и образованием ржавчины. Мы
уже указали на сходство между горением и образованием ржавчины.
Образование ржавчины есть соединение металла с кислородом воз-
духа. Образовавшаяся ржавчина таким образом есть окись металла.
Уравнения для реакций ржавления тождественны по форме с уравне-
ниями горения. Если металл может иметь две различные валентности,
его коррозия будет происходить в две стадии. Медь например может
иметь валентность 1 или 2. Поэтому сначала образуется закись меди
СиаО:
4Cu + Оа — 2СиаО,
а затем окись меди СиО:
2СиаО + Оа -> 4СиО.
Эти уравнения имеют совершенно такую же форму, как и уравнения
для горения углерода.
Образование ржавчины вовсе не простой процесс. Все мы знаем,
как вода ускоряет образование ржавчины на железе. Некоторые
из нас могли заметить, что ковкое железо, самая чистая форма про-
мышленного железа, сильнее сопротивляется коррозии, чем чугун
или сталь. Следовательно примесь играет некоторую роль в обра-
зовании ржавчины на металлах. Изучение роли влажности и при-
месей в коррозии металлов следует отложить до одной из последую-
щих глав (гл. XXXI). В данный же момент мы можем считать ту про-
стую схему образования ржавчины, которую мы очертили выше, по
существу правильной.
3. Относительная активность металлов. Все мы замечали,
что металлы ржавеют в очень различной степени. Мы инстинктивно
ассоциируем железо в наших мыслях с ржавчиной, так как степень,
в которой оно может подвергаться коррозии, высока. С другой сто-
роны, медь известна как металл, ржавеющий очень медленно.
Медные сита держатся гораздо дольше, чем железные. Серебро,
золото и платина не ржавеют совсем и поэтому называются «благо-
родными металлами». Большинство из нас сказало бы, что алюми-
ний не ржавеет, однако мы будем удивлены, узнав, что и этот
металл на самом деле ржавеет, или правильнее, окисляется быстрее,
чем железо. Причина того, что он не разъедается совсем в порошок,
как это имеет место с железом, состоит в том, что его окись покры-
вает металл, образуя защитную оболочку, предохраняющую металл
от дальнейшего взаимодействия с кислородом воздуха. Окиси олова,
свинца и цинка действуют таким же образом, но, к несчастью, ржав-
МЕТАЛЛЫ
120
цина наиболее полезного из всех металлов — железа — пориста и
рассыпается на мелкие кусочки, открывая действию воздуха
свежие поверхности.
Благодаря образованию этих предохраняющих оболочек очень
трудно при изучении ржавления металлов расположить их в ряд
по степени их активности. Существуют однако другие реакции, даю-
щие лучшие указания в этом отношении. Например наиболее актив-
ные металлы при комнатной температуре реагируют с водой очень
бурно, иногда со взрывом. Это так называемые щелочные металлы:
натрий Na и калий К. Один атом одновалентного металла заме-
щает в молекуле воды один из двух атомов водорода:
2Na + 2Н2О — 2NaOH + Н2;
2К + 2Н2О — 2КОН 4- Н2.
Гидрат окиси натрия NaOH и гидрат окиси калия КОН, со-
ответственно, представляют собою уже совсем иные продукты Ч
Двухвалентный металл кальций реагирует с водой медленнее:
Са + 2Н2О -* Са (ОН)2 4- Н2.
Магний даже с кипящей водой будет реагировать медленно. Железо,
алюминий, цинк, олово и свинец будут реагировать с водой с замет-
ной скоростью только в том случае, если над накаленным докрасна
металлом будет пропущен водяной пар. В этих случаях образуется
окись металла, например
Zn 4- Н2О ZnO 4”
Медь, серебро, золото и платина не реагируют с водой ни при каких
условиях. Изучение всех этих реакций дает нам грубую меру от-
носительной активности металлов. Мы можем попытаться распо-
ложить их в ряд по степени их активности, поставив на первом
месте натрий и калий, затем кальций и магний, далее группу бо-
лее знакомых металлов и после всех медь, серебро, золото и пла-
тину.
Одной из наилучших реакций для изучения активности метал-
лов является реакция замещения, имеющая’ место в некоторых слу-
чаях, когда металл погружается в водный раствор соединения дру-
гого металла. Например если цинк погрузить в раствор CuSO4
1 Группа ОН называется гидроксильной группой и имеет валентность, рав-
ную единице.
4 В дальнейшем мы будем изучать некоторые группы элементов, находящиеся
в молекулах многих соединений и проявляющие сильную тенденцию оставаться без
Изменения в некоторых реакциях (стр. 272). Молекула сернокислой меди содержит
Такую группу в виде радикала SO4. Такие группы имеют характерные для них ва-
лентности (301=2), приводимые в таблице, помещенной в приложении. Формулы
Уединений, содержащих такие группы, выводятся обычным путем из валентно-
стей. Например:
Cu2SO^ NH’Cl1 (NH4)|PO^
Fei(SO4)2 (NH4)'SO2 ит. д.
g
Введение в химию.
130
МЕТАЛЛЫ
(сернокислой меди), то атом цинка станет на место атома меди,
освобождая его в виде свободной меди:
Zn + CuSO4 —> ZnSO4 + Си.
Однако если кусок меди поместить в раствор растворимого соедине-
ния цинка, то никакой реакции не происходит. Это показывает, что
цинк более активен, чем медь. Производя подобные опыты с другими
парами металлов, возможно качественно определить положение каж-
дого из них в ряду по степени их активности.
4. Электродвижущий ряд (ряд напряжений)
ряд называется электродвижущим рядом метал-
лов (рядом напряжений), так как их порядок
в этом ряду может быть определен с довольно
большой точностью путем измерения электро-
движущей силы гальванических элементов
(XXXI). Включение в группу металлов газа
водорода может возбудить сомнение, по хи-
мически водород ведет себя подобно металлам.
Какой-нибудь металл выше водорода в этом
электродвижущем ряду металлов заменяет
атомы водорода в молекулах кислоты, например
Zn + 2HC1 ZnCl2 + Н2;
2А1 + 3H2SO4 — Al2 (SO4)3 + ЗН2.
металлов. Этот
Электродви-
жущий ряд
металлов
Калий
Натрий
Кальций
Магний
Алюминий
Цинк
Железо
Олово
Свинец
Водород
Медь
Ртуть
Серебро
Золото
Платина
Эти реакции дают удобный способ получения водорода в лабо-
ратории. В общем каждый металл в электродвижущем ряду метал-
лов может вытеснять стоящий ниже металл из соединений послед-
него. Электродвижущий ряд металлов оказывает существенную по-
мощь химику. В общем, чем химически активнее металл, тем меньше
будет он сопротивляться действию атмосферных влияний и хими-
ческих реагентов. Чем более активен свободный металл, тем более
устойчивы его соединения. С другой стороны, чем менее активен
свободный металл, тем легче будут разлагаться его соединения.
5. Металлургия. Руду можно определить как минерал, содер-
жащий металл в достаточном количестве, чтобы сделать выгодным
его получение. Железная руда должна содержать по крайней мере
50% железа, чтобы считаться хорошей рудой. С другой стороны,
целесообразно разрабатывать руды меди или никеля, содержащие
только 2% или даже меньше металла. Металлургия занимается
вопросами извлечения металлов из их руд. Чем болеее активен ме-
талл, тем менее вероятно его нахождение в природе в свободном
или самородном состоянии. Металлы, находящиеся внизу ряда
напряжений, можно найти в самородном состоянии. Золото, се-
ребро, платина и медь — все могут быть найдены в самородном
состоянии; то же можно сказать и относительно ртути, хотя эту
тяжелую жидкость можно найти только случайно там, где она как
МЕТАЛЛЫ
131
бы попалась в западню — в углублениях скал. Более важное зна-
чение имеют окисные руды металлов. Некоторые из них имеют
очень большое значение. Гематит (Fe2O3)—одна из наиболее важных
железных руд. Другие окисные руды: боксит (А12О3.ЗН2О), магнетит
(ре3О4), лимонит (Fe2O3.3H2O) и касситерит (SnO2). Сернистые руды
очень многочисленны, и многие из них весьма важны: сфалерит
(ZnS), свинцовый блеск (PbS), медный блеск (Cu2S), киноварь (HgS)
и аргентит (Ag2S). Из углекислых руд, встречающихся в природе,
сидерит (FeCO3), смитсонит (ZnCO3), церрусит (РЬСО3) и некоторые
карбонаты меди являются единственными, имеющими некоторое
значение рудами. УглекальциеваяГсоль (СаСО3), или кальцит, важ-
на однако как строительный камень (в форме известняка или мрамо-
ра), как плавень в. металлургии и как материал, из которого полу-
чается известь СаО.
Соединения более активных металлов — калия, натрия и маг-
ния, находимые в природе, являются обыкновенно растворимыми
хлористыми металлами или сернокислыми солями. Они находятся
в морской воде'и — в меньшем количестве — в соляных отложениях,
образуемых при высыхании соленых озер.
Так как большинство металлических руд является соединениями
металлов, то задача металлургии заключается в нахождении мето-
дов, посредством которых элементы, соединенные с металлами в их
рудах, могут быть отделены от металлов. Удаление каменистых
материалов, или маточной породы, с которой смешана руда, являет-
ся второй задачей. Металлургу иногда приходится работать с мате-
риалом, 98% которого ему вовсе не нужны, а нужны только 2%.
Обычно для того чтобы помочь удалению маточной породы, в виде
шлака, прибавляется плавень. Если маточная порода имеет кислот-
ный характер, то прибавляется основной плавень и наоборот. Маточ-
ная порода обыкновенно состоит из песка или песчаника (главным
образом SiO2) и горных пород характера силикатов. Поэтому они
имеют обычно кислотные свойства. Силикаты легко плавятся при тем-
пературах плавильных печей, но кремнезем (SiO2) не плавится.
Для удаления кремнезема применяют известняк. При нагревании
он разлагается на известь и двуокись углерода:
СаСО3 -> СаО + СО2.
Обладающая основным характером известь реагирует далее с
Кислотным кремнеземом, образуя легкоплавкий силикат кальция:
СаО + SiO2 — CaSiO3.
Расплавленные силикаты образуют шлак, нерастворимый в рас-
плавленном металле и плавающий сверху металла. Оба жидких
слоя могут быть затем вылиты порознь, так как они находятся на
Различных уровнях.
6. Типичные металлургические операции. Большинство руд
имеет лишь небольшое процентное содержание металла, ради кото-
рого они добываются. Такие руды поэтому прежде всего должны
о*
132
МЕТАЛЛЫ
быть обогащены этим металлом. Руда обыкновенно раздробляется,
размалывается и затем встряхивается с водой, вымывающей более
легкие примеси горных пород. Иногда к взвешенным в воде мелким
размолотым частицам руд прибавляется немного масла, которое при-
липает к частицам руды, но не к маточной породе; затем через эту
смесь продувается воздух. Масло поднимается на поверхность в виде
пены (стр. 351), унося частицы руды с собой. Маточная порода падает
на дно в слой воды. Этот процесс масляно-пенной флотации имеет
особую ценность при обогащении медных руд с низким процентным
содержанием меди.
Если руда представляет собою самородный металл, то после
обогащения требуется несложная обработка, например руда плавится
с соответственным плавнем, как это имеет место .в случае с медью.
Золото и серебро или извлекаются из маточной породы раствором
цианистой соли или амальгамируются 1 посредством промывания
измельченной руды над амальгамированными медными пластин-
ками. Амальгама драгоценных металлов соскабливается с пластин,
и ртуть отгоняется в соответствующей реторте. Если драгоценные
металлы были извлечены раствором цианистой соли, то удаляются
они из раствора прибавлением металлического цинка, замещающего
менее активные благородные металлы.
Если руда будет окисная, кислород обычно удаляется из соеди-
нения с металлом путем нагревания с коксом. Этим способом обра-
батываются например окисные руды железа и олова. Окиси металлов,
стоящих’выше цинка в ряду напряжений, не могут быть обработаны
таким способом, так как эти активные металлы легче соединяются
с кислородом, чем углерод.
Немецкий химик Гольдшмидт для удаления из офисных руд
Кислорода применил вместо углерода алюминий. Алюминий, бу-
дучи нагрет, отнимает кислород из окиси всех металлов, стоящих
ниже его в электродвижущем ряду металлов. Этот сравнительно
дорогой метод, называемый алюминотермией, употребляется для
получения небольших количеств очень чистых, свободных от угле-
рода металлов, например марганца, вольфрама, титана, молибдена
и ванадия, которые затем употребляются для сплавов с железом или
медью. Смесь алюминия и окиси железа употребляется для термитной
сварки. Смесь помещается в тигель с фальшивым дном над желез-
ными частями, подлежащими свариванию вместе. Реакцию вызывают,
воспламеняя смесь посредством запала. Происходит очень энер-
гичная химическая реакция, сопровождающаяся освобождением
больших количеств тепла:
2А1 4~ Fe2O3 ► А1А -f- 2Fe,
при этом достигаются температуры между 3000 и 3500°. Расплавлен-
ное железо стекает через дно тигля в пространство между концами,
которые должны быть соединены, и прочно сваривает их.
1 Сплавы со ртутью называются амальгамами.
Сернистые руды сначала обжигаются, т. е. нагреваются с под-
дуванием воздуха. Сера в них превращается в газ — двуокись
серы, а металл обыкновенно — в окись, например:
2ZnS + ЗО8 -* 2ZnO + 2SO2.
Окиси малоактивных металлов, стоящих ниже меди в электродвижу-
щем ряду металлов, неустойчивы при температуре обжигания;
в этих случаях уже при обжиге получается свободный металл:
HgS + О2 Hg + SO2.
Двуокись серы обычно используется для получения серной кис-
лоты (стр. 306). Окись металла затем воссТановляется коксом или
каким-нибудь другим способом.
Углекислые руды сначала разлагаются нагреванием на окись
металла и двуокись углерода:
FeCO3 — FeO + СО2;
ZnCO3 —* ZnO + СО2.
Окись затем восстанавливается в свободный металл.
Очень активные металлы — калий, натрий, кальций, магний
и алюминий — получаются из своих руд при посредстве электриче-
ского тока.
Принципы, лежащие в основе электрометаллургии, будут рас-
смотрены в гл. XXX.
Металлургия железа и стали имеет такое большое экономиче-
ское значение, что мы посвятим ей всю следующую главу. Металлур-
гия же некоторых более важных металлов, за исключением желе-
за, будет рассмотрена сейчас.
7. Металлургия цинка. Наиболее важная цинковая руда —
сернистая руда, цинковая обманка или сфалерит. Эта руда сначала
обжигается для превращения в окись, а затем, смешанная с мелким
углем, накаливается добела в горизонтальных цилиндрических гли-
няных ретортах. Эти реторты располагаются в ряды, от 4 до 6 реторт
в высоту и около 100 в длину (по обеим сторонам печи), и накали-
ваются генераторным газом. Каждая реторта заключает в себе около
30 кг обжигаемой руды. Реторты соединены с холодильниками, в
Которые перегоняется цинк и в которых пары сгущаются; после
того как печь проработала от 10 до 12 часов, цинк выгружается.
Жидкий металл выливается в формы из чугуна.
Более современный способ заключается в обжигании сернистого
Металла при низких температурах до образования растворимой сер-
Кокислой соли:
ZnS + 2О3 -> ZnSO4.
эта сернокислая соль затем выщелачивается из руды разбавленной
серной кислотой. Через полученный раствор пропускается электри-
ческий ток, в результате чего цинк осаждается на катоде. Хотя этот
134
МЕТАЛЛЫ
способ пока еще распространен меньше, все же при посредстве его
ежегодно получается свыше 100 000 т очень чистого цинка. Еже-
годное производство цинка превышает 1 000 000 т.
Цинк представляет собой синевато-белый металл, плавящийся
при 419° и кипящий при 906°. Металл отличается крайне низкой
тягучестью, а также низкой ковкостью и проводимостью. Однако
если нагреть его от 100 до 150°, он становится более ковким и при-
обретает большую проводимость; если его охладить снова, он мо-
жет быть прокатан в листы. Главным образом он употребляется
при изготовлении латуни, сплава меди и цинка и для оцинкования
железа (стр. 343). Среди других его применений можно упомянуть об
использовании его в сухих элементах, а также в производстве красок
для живописи.
8. Металлургия олова. Наиболее важная руда олова — это окись
олова (SnO2), касситерит или оловянный камень. Приблизитель-
но половина олова добывается в рудниках в Стрейте-Сеттльменте
(Узкие Поселения у Малаккского пролива). За ними в порядке
добычи стоят: Боливия, Голландская Ост-Индия, Южная Африка,
Англия (в Корнуэлле), Китай и Австралия. Немного олова добы-
вается и в США хотя они потребляют до двух третей мировой его
добычи. Руда легко восстанавливается в металл нагреванием с углем:
SnOa + 2С — Sn + 2СО.
Физические свойства олова интересны в том отношении, что оно
встречается в трех твердых, аллотропических формах (стр. 42).
Форма а устойчива при температурах ниже 18°, форма р, или обык-
новенное олово,—при температурах между 18 и 161° и форма у—при
температурах между 161° и точкой его плавления (232°). Переход
p-формы в a-форму при температурах ниже 18° сопровождается
изменением в строении кристаллов, что дает в результате пре-
вращение олова в порошок. В холодных странах предметы, сделан-
ные из олова, часто гибнут от так называемой «оловянной чумы», т. е.
процесса перехода обычной формы олова (Р) в более устойчивую при
низкой температуре порошкообразную а-модификацию. Процесс
распространяется по предмету, постепенно захватывая все большие
участки и «заражая» соседние оловянные предметы. Наиболее час-
то встречающаяся форма олова обладает большой ковкостью и может
быть прокатана в очень тонкие листы, известные под названием фоль-
ги. Олово в широких размерах употребляется для покрытия железа
(производство белой жести). Олово образует много полезных сплавов
с другими металлами. Бронза, сплав из меди и олова, была, быть мо-
жет, первым сплавом, известным человеку. Добывается олова ежегод-
но около 130 000 т.
9. Металлургия свинца. Наиболее важная свинцовая руда
это сернистый свинец (PbS), галенит. Свинец встречается также в виде
углекислой соли — церусита и сернокислой соли — англезита. Не-
редко свинцовые руды содержат серебро, а в некоторых случая*
МЕТАЛЛЫ
135
золото, что делает выгодной плавку руд, которые не имело бы смысла
разрабатывать только из-за содержания в них свинца.
Сернистый свинец сначала концентрируется флотацией; затем
частично обжигается или до окиси или до сульфата (сернокислой
соли):
2PbS + ЗО2 — 2РЬО + 2SO2,
PbS + 2О2 -> PbSO4,
а затем нагревается с большим количеством сернистого свинца:
2РЬО + PbS ЗРЬ + SO2;
PbSO4 + PbS — 2Pb + 2SO2.
Если руда содержит серебро или золото, то эти благородные
металлы окажутся растворенными в свинце в конце процесса. Они
удаляются из этого свинцового раствора по способу Паркса. К рас-
Рис. 36. Вид медеплавильного завода с аэроплана.
Плавленному свинцу прибавляется небольшое количество цинка»
в котором благородные металлы растворимы гораздо более, чем в
свинце. Нерастворимый в свинце цинк с растворенными в нем бла-
городными металлами образует слой, всплывающий поверх свинца.
Этот слой можно удалить, после чего цинк отгоняется от менее
•Летучих благородных металлов.
136
МЕТАЛЛЫ
Рис. 37. Поперечный
разрез конвертора для
меди.
Свинец представляет собой очень мягкий плотный металл. Под
давлением он может быть вытянут в проволоку или трубку. Свинец
мало растяжим. Он применяется в аккумуляторных батареях, при
изготовлении красокдля живописи [свинцовые белилаРЬ3(ОН)2(СО3)2](
в паянии, для покрывания электрических кабелей, в свинцовых
камерах при производстве серной кислоты (стр. 308) и во многих
сплавах (стр. 139).
10. Металлургия меди. Медь главным образом встречается в
сернистых и окисных рудах. Наиболее важные медные руды: халь-
коцит или медный блеск (Cu2S), борнит (3Cu2S. Fe2S3), халькопирит
(Cu2S.Fe2S3), энаргит (3Cu2S.As2S6) и ковеллит (CuS). Куприт (Си2О)—
наиболее важная окисная руда ы обычно находится в слоях, лежа-
щих над сернистыми рудами. Из других медных руд можно указать
еще на малахит [CuCO3.Cu(OH)2], азурит [2CuCO3.Си(ОН)2] и хри-
зоколл (CuSiO3.2Н2О). Небольшие количе-
ства меди встречаются в природе и в само-
родном состоянии.
Сернистые руды сначала измельчаются,
' а затем размалываются в порошок в шаро-
вых мельницах. Далее они концентрируются
с помощью флотации, причем в руде сохра-
няется 95% содержащейся в ней меди и
удаляется около 2/3 пустой породы. Скон-
центрированная руда в дальнейшем частью
обжигается, чтобы удалить часть серы и
превратить встречающееся здесь сернистое
железо в окись; в этой форме оно переходит
в шлак. Из обжигательной печи обожженная
отражательную печь вместе с некоторым ко-
SiO2, для превращения в шлак окиси желе-
за, и извести, чтобы сделать шлак более плавким. Печь нагревает-
ся пламенем путем сжигания нефти или порошкообразного угля.
В этой печи происходит дальнейшее концентрирование меди. Продук-
тами этого концентрирования являются шлак, главным образом
состоящий из силикатов железа и кальция, и продукт первой плавки
«штейн». Он содержит от 42 до 45% меди и от 23 до 25% серы. Рас-
плавленный штейн идет затем в конвертор, изображенный в попереч-
ном сечении на рис. 37. Этот конвертор состоит из оболочки, изготов-
ленной из стальных пластинок, и выложен кирпичами из магнезии
MgO. Он укреплен на больших стальных цапфах, так что его можно
наклонять и выливать из него содержимое. Внутренние размеры
типичного конвертора для меди таковы: 5 м в вышину и 5,5 м в диа-
метре. Нагрузка такого конвертора может достигать 65 т. Через
отверстия в дне конвертора пропускается ток воздуха в продолжение
приблизительно 15 мин.; в это время продолжается обжиг сернис-
той меди. От времени до времени прибавляется штейн и некоторое
количество сырой руды, чтобы помочь образованию шлака; хими-
ческие реакции, происходящие в конверторе, сложны. Железо, на-
руда загружается в
личеством кремнезема
МЕТАЛЛЫ
13?
родящееся в штейне, удаляется в виде силиката в шлаке»
2FeS 4- ЗО2 — 2FeO + 2SO2;
FeO + SiO2 -> FeSiO3.
Сернистая медь превращается в металлическую медь. Вероятно
происходят следующие реакции:
Cu2S 4- Og 2Cu 4~ SO2j
2Cu2S 4- 3O2 — 2Cu2O 4- 2SO2;
Cu2S 4- 2Cua0 — 6Cu 4- S02
Расплавленная медь помещается далее в печь меньшего размера,
в которой воздух снова продувается через металл для удаления по-
следних следов железа. Небольшое количество меди при этом превра-
Рис. 38, Конверторы для меди.
щается в окись. Кислород удаляется процессом, известным под на-
званием «дразнения». Деревянные шесты опускают под повер-
хность расплавленной меди. Дерево обугливается, и образовавшийся
древесный уголь удаляет кислород из окиси меди. Медь затем
отливается в слитки, и в дальнейшем подвергается электролити-
ческой очистке. Такие слитки содержат до 99,3% меди, но
присутствие даже следов мышьяка сильно понижает электропровод-
ность металла, так что эту примесь необходимо удалять. Описание
электролитической очистки меди будет дано в одной из следующих
глав (гл. XXX).
Мировое производство меди составляет свыше 1 000 000 т еже-
138
МЕТАЛЛЫ
годно, причем половина этого количества производится в США.
В силу высокой тягучести и электропроводности меди главное при-
менение она находит при передаче электрического тока. В силу ее
сравнительной химической инертности из нее делаются кипятиль-
ники, трубы, кровельные желоба, главные колеса в машинах. Некото-
рые из ее сплавов имеют большое значение, особенно латунь — сплав
меди и цинка — и бронза — сплав меди и олова.
11. Сплавы. Когда два или большее количество металлов сплав-
ляются вместе и затем затвердевают, получающийся при этом про-
дукт называется сплавом. Сплавы известны еще с древних времен.
Действительно, бронза — сплав меди и олова — имела такое боль-
шое значение в древние времена, что ее именем называют целую эпоху
в развитии человечества.
Изучение структуры сплавов привело к уменью составлять спла-
вы с свойствами, нужными для данного применения. Эта часть метал-
лургии называется физической металлургией. Сплав двух металлов
может представлять собой один из трех описываемых ниже типов или
их комбинацию. Во-первых, если два металла образуют кристаллы,
не растворяющиеся друг в друге, то сплав состоит из смеси чистых
кристаллов каждого компонента. Во-вторых, если компоненты
друг друга растворяют в твердом состоянии, сплав может состоять
из кристаллов, представляющих собою твердые растворы обоих ме-
таллов. Наконец оба металла могут реагировать химически и образо-
вать соединение. Известно много ценных сплавов каждого из этих
типов.
Свинцово-сурьмяные сплавы например относятся к типу смеси.
Одна сурьма слишком хрупка, а свинец слишком мягок для опре-
деленных целей. Типографский металл из свинца и сурьмы, с неболь-
шим количеством олова, обладает твердостью сурьмы, но не имеет
ее хрупкости. К тому же точка плавления у него более низкая. При-
пой — сплав из свинца и олова — естественно, должен иметь низкую
точку плавления. Сплав, содержащий 37% свинца и 63% олова,
имеет самую низкую точку плавления всех сплавов этих металлов
(181°). Этот сплав употребляется в качестве оловянного при-
поя. Несколько больший процент свинца (67%) имеет свин-
цовый припой. Этот последний плавится при более высокой
температуре (ок. 270°), но имеет большую вязкость, необходимую
для соединения очищенных спаев.
Весьма важное применение имеют многие медно-никелевые спла-
вы, относящиеся к типу твердых растворов; из применений этих
сплавов можно упомянуть медные монеты, колпачки винтовочных
пуль (20% Ni) и проволоку высокого электрического сопротивления,
мало меняющуюся под влиянием температуры и употребляющуюся
в электронагревательных приборах и для измерения температуры
(термоэлементы). Некоторые канадские руды содержат сернистые
медь и никель, из которых при плавлении получается сплав этих
металлов, заключающий 67% никеля и 28% меди; остаток в 5% со-
стоит из железа и марганца. Этот сплав называется монель-металл;
МЕТАЛЛЫ
139
Таблица XVII. С о ст а в и применение наиболее известных
сплавов цветных металлов
Название Состав (%) Применения
Алюминиевая латунь . Алюминиевая бронза . . Баббит металл .... Колокольный металл . Латунь Британский металл . . Карболой ....... Константан Дельта металл .... Дуралюминий ..... Немецкое (германское) серебро Зеленое золото .... Бронза Магналий Монель-мета л л .... Нихром Палау Пермаллой Олово (посуда) .... Металл для выделки пуль и дроби .... Серебро (монеты) . . . Серебро (стерлинги) . . Припой Си 71—55; Zn 26-42! Al 1—6 Си 99-89; Al 1—11 Sn 89; Sb 7,3; Си 3,7 Си 75-80; Sn 25—20 Си 73-66: Zn 27-34 Sn 90-85; Sb 5—10; Си 1-3 Углеродистый вольфрам и кобальт Си 60-45; Ni 40—55; МпО—1,4; С 0,1; Fe Си 56—54; Zn 40—44; Fe 0,9-1,3; Мп 0,8-1,4; Pb 0,4—1,8 Al;Cu5-5,5;MgO,5—0,8; Мп 0,5-0,8; Fe; Si Си 55; Zn 25; Ni 20 Au 75; Ag 11-25; Cd 13-0 Си 95-71; Sn 0-11; Pb 0—13; Zn 0,5; Fe 0-1,4 Al 95-70; Mg 5—30 Ni 68; Си 28; Fe 1,9 Ni 80-54; Cr 10-22; Fe 4,8-27 Au 80; Pd 20 Ni 78; Fe 21; Co.0,4; Мп; Си; C; S; Si Sn 89—74; Pb 0—20: Sb 0—7,6; Си 0—3,5; Zn Pb 99; As 1 Ag 90; Си 10 Ag 80; Zn 18; Си 2,5 Pb 67; Sn 33 Морские аппараты, ло- пасти пропеллера и т. д. Прочный, нержавеющий сплав Подшипники Колокола Для холодной обработки; листы, трубы и т. д. Старинная столовая по- суда и т. д. Тверже и светлее, чем олово Размалывающие и режу- щие орудия Электрические, измеряю- щие температуру при- боры. Термопары Морские приборы. Кре- пок, как мягкая сталь, но не легко разъедает- ся Легкий, но большой тя- гучести. Металличес- кие части аэроплана, остов (рама) дирижаб- лей и т. д. Заменяет серебро Ювелирное искусство и Др. Пуговицы, ордена, под- носы, безделушки, литье, части машин. Легкий металл. Научные инструменты, коромыс- ла для весов и т. д. Не ржавеет Сопротивляется корро- зии при высоких тем- пературах. Проволока для электрических на- гревательных прибо- ров Заменяет платину в тиг- лях, посуде и т. д. Телефонные кабели Старинные тарелки, куб- ки, чашки и т. д. Пули и дробь Свинцовый припой
140
ЖЕЛЕЗО И СТАЛЬ
Продолжение табл. XVII
Название Состав (%) Применение
Стеллит Оловянная фольга . . . Тинзель Типографский металл . Металл Вуда Со 80-55; Сг 20-35; W 0-10 Sn 88; РЬ8; Си 4; Sb 0,5 Sn 60; Pb 40 Pb 60 -56; Sn 10-40; Sb 4,5-30 Bi 50; Pb 25; Sn 13: Cd 13 Хирургические инстру- менты Обертка для пищевых продуктов, табака и т. д. Плавится при низкой температуре. Пожар- ные краны в системах автоматических сприн- клеров
он обладает высокой тягучестью и гибкостью и замечательно стоек по
отношению к коррозии.
Сплавы типа твердых растворов многих других металлов имеют
техническое значение. Многие из сплавов с золотом принадлежат
к этому классу. Золотые монеты становятся более твердыми в сплаве
с серебром. Белое золото представляет собой сплав золота с 18%
никеля. Нихром — сплав никеля и хрома — весьма стоек по отно-
шению к коррозии при высоких температурах; применяется главным
образом в электрических нагревательных приборах. Стеллит — сплав
кобальта и хрома —. представляет собой серебристо-белый не ржа-
веющий металл, из которого приготовляют режущие орудия. Он
применяется для хирургических инструментов и т. д.
Как уже отмечено выше, металлы могут химически взаимодейство-
вать друг с другом. Известно несколько сотен соединений метал-
лов друг с другом. Формулы для этих соединений однако нельзя
вывести, основываясь на валентности принимающих в них участие
атомов металлов. Лишь немногие сплавы, представляющие собой ме-
таллические соединения, имеют практическое значение, так как во
многих случаях они тверды, хрупки и обладают очень низкой сте-
пенью прочности и ковкости. Твердость этих сплавов делает их по-
лезными для подшипников металлов, например металл баббит, со-
держащий SbSn и Cu3Sn. Иногда соединения металлов с неметаллами
играют большую роль в сплавах, например в случае CusP в фосфо-
ристой бронзе и Ре8С в стали.
ГЛАВА XIV
ЖЕЛЕЗО И СТАЛЬ
Едва ли нужно убеждать кого-либо в важности железа для на-
шей современной цивилизации. Железо, из которого строят машины,
и уголь, который доставляет энергию, приводящую их в движение, —
ЖЕЛЕЗО И СТАЛЬ 141 .
это два наиболее важных природных ресурса. Без них челове-
чество— хилое создание; с ними производительная сила человечества
возрастает в громадных размерах.
1. Железные руды. Железо по всей вероятности самый распро-
страненный из всех элементов. Сердцевина земли на расстоянии
около 3 200 км от центра, повидимому, представляет собой почти
чистое железо. Такое предположение можно сделать на основа-
нии высокой плотности земли в целом по сравнению с плотностью
земной коры, на основании магнитных свойств земли и на основании
известного состава метеоритов. Среди элементов на земле железо
стоит на четвертом месте по количеству и составляет около 5% зем-
ной коры. Так как человек никогда не проникал в землю на боль-
шую глубину, чем 1,5 мили, то представляется мало вероятным,
чтобы громадный запас железа, лежащий на расстоянии около двух
с лишним тысяч километров ниже земной поверхности, мог когда-
либо быть эксплоатируемым.
Немногие из нас видели когда-нибудь чистое железо. Это — се-
ребристо-белый металл; выставленное на влажный воздух, оно быс-
тро тускнеет, становясь сначала черным, а затем красным. Благодаря
легкости, с которой железо ржавеет, и благодаря тому, что окись же-
леза не защищает его от ржавления, в земной коре можно найти
очень мало самородного железа. Как и можно было ожидать, окисные
железные руды наиболее важны. В Америке больше всего распростра-
нен гематит (иначе красный железняк), или окись железа (Fe2O3).
Самые обширные в мире отложения железной руды — это отложе-
ния гематита в области Верхнего Озера близ Маркетты в Мичигане
и в Дулуте в Миннезоте. Они доставляют свыше 85% железной руды,
потребляемой в США. Эта руда очень высокого достоинства, она
содержит около 56% железа и 24% кислорода и приблизительно на
4/s состоит из Fe2O3.
Остальные окисные железные руды таковы: магнетит (Fe3O4),
черная магнитная окись железа и лимонит (Fe2O3«3H2O), или болот-
ная железная руда. Последняя разрабатывалась в С. Америке в боль-
ших размерах в то время, когда Америка была колонией. Угле-
кислая руда, сидерит (FeCO3) не имеет большого значения в Амери-
ке, но в широких размерах разрабатывается в Англии. Пирит,
или сернистое железо (FeS2) используется главным образом не как
железная руда, а как источник серы (стр. 304).
* В СССР имеются мощные месторождения гематита в Кривом
Роге (Украина), на которых базируется наша южная металлур-
гия.
Магнетит в СССР встречается в больших количествах на Урале
(гора Благодать, гора Высокая, гора Магнитная; вблизи последней
расположен г. Магнитогорск). *
2. Разработка железной руды. В руднике Гелл Рэст, недалеко
от маленького рудничного городка Гиббинг, к северу от Дулута,
человек вырыл величайшую в истории разработки железной руды
шахту. Эта открытая разработка представляет собой гигантское
142
ЖЕЛЕЗО И СТАЛЬ
ущелье глубиной в 100—130 м, шириной более чем в 1 км; оно тянется
в длину свыше 3 км. На дне этого ущелья громадные паровые лопаты,
зачерпывающие сразу 1,5 м3 руды, грузят руду прямо в железно-
дорожные вагоны, каждый из которых вмещает 50 т руды. Рудник
Рис. 39. Открытые разработки железной руды.
Гэлл Рэст — обширнейший железный рудник, но это только один
из 115 рудников месторождения Мезаби. Добраться до руды в дру-
гих месторождениях области Верхнего Озера нельзя методами откры-
той разработки. Для этого в землю пробуравлены глубокие шахты,
от которых к пластам руды ведут галлереи.
3. Доменная печь. Первый шаг в металлургии железа состоит
в нагревании в доменной печи смеси железной руды, кокса и извест-
няка. Доменная печь представляет собой громадное, каминообразное
сооружение вышиной около 30 м с наибольшим диаметром 9 м.
Главные части ее изображены на рис. 41. Нагрузка поднимается на-
верх печи с помощью пары вагонеток, бегущих кверху по наклонной
железной дороге. Нагрузка состоит из руды, кокса и известняка
в пропорции 2 т руды на 1 т кокса и х/4 т известняка. Наверху
печи находится два люка, имеющие форму опрокинутых конусов.
Нагрузка падает на верхний конус, который затем опускается,
чтобы дать возможность материалам нагрузки упасть на нижний
конус. Верхний конус затем поднимается, закрывая верхушку
печи, а нижний конус опускается, давая возможность нагрузке
упасть в печь. Труба и вся печь заполняются твердыми материала-
ми загрузки. Расплавленный металл и шлак стекают каплями с твер-
дых материалов в нижнюю часть печи, называемую горном. Нагре-
тый воздух вдувается через ряд трубок, называемых фурмами, вхо-
дящих в печь в нижней ее части. Образовавшиеся газы оставляют
печь через спускные клапаны наверху печи. Печь покрыта сна-
ЖЕЛЕЗО И СТАЛЬ
143
ружи металлическим кожухом, изнутри выложена огнеупорным кир-
пичом.
Доменная печь выполняет две функции: превращает руду в ме-
талл (чугун) и удаляет маточную породу в виде шлака. Кокс прибав-
ляется к руде, чтобы выполнить первую функцию, а известняк, что-
Рис. 40. Нагрузка судна для перевозки руды.
бы выполнить вторую. Посмотрим, какие процессы происходят в дом-
не. На уровне фурм кокс горит сильно, образуя при избытке
воздуха двуокись углерода; температура на уровне фурм достигает
2 000°:
с + О2 —> СО2.
Двуокись углерода, по мере прохождения через находящиеся наверху
слои раскаленного кокса, превращается в окись углерода:
С 4- СО2 -> 2СО.
Руда таким образом омывается этим газом, превращающим ее в ме-
таллическое железо:
Fe2O3 + ЗСО —> 2Fe Ч-ЗСО2.
Металл в жидком состоянии стекает каплями вниз в горн, из кото-
рого время от времени выпускается через выпускное отверстие.
Руда содержит маточную, «пустую» породу, в состав которой
Входят легкоплавкие силикаты и менее плавкий кремнезем (SiOg).
Плавень — известняк — прибавляется для того, чтобы перевести крем-
fJJ
ЖЕЛЕЗО И СТАЛЬ
220 С
ГОРЯЧЕЕ
ДУТЬЕ
ОТВЕРСТИЕ Д
УДАЛЕНИЯ ЧУГУНА
ОТВЕРСТИЕ
Д! УДАЛЕНИЯ ШЛАКА
480°С
ПРОЦЕСС ПЛАВКИ
2000 С
ГОРЯЧЕЕ
ДУТЬЕ
ПРОЦЕСС
ВОССТАНОВЛЕНИЯ
ВЫТЯЖНОЕ
ОТВЕРСТИЕ
ПРОЦЕСС ПОГЛОЩЕ
НИЯ ТЕПЛА
Ж
РАСПЛАВЛЕННЫЙ
ШЛАК
Рис. 41. Доменная печь в разрезе.
КОКС—
РУДА
ИЗВЕСТНЯК
200 С
€ tip <1<Q
ТРУБА Д[ ОТВОДА
КОЛОШНИКОВЫХ ГА-
ЗОВ В РЕ гЕНЕ РА -
ТОРЫ
ПРОЦЕСС
СЖИГАНИЯ
СМОТРОВОЕ
ОТВЕРСТИЕ
РАСПЛАВЛЕННЫЙ
ЧУГУН
ЖЕЛЕЗО И СТАЛЬ
145
незем в легкоплавкий силикат кальция. В печи, приблизительно на
половине высоты ее, известняк разлагается на известь и двуокись
углерода:
СаСО3 — СаО + СО2.
Ниже известь соединяется с кремнеземом, образуя силикат кальция:
СаО + SiO2 —► CaSiO3.
Этот последний, вместе с уже расплавленными силикатами маточной
породы, стекает в горн и всплывает в виде шлака поверх расплав-
ленного металла. Он выливается через отверстие для выпуска шлака.
Рис. 42. Доменные печи и кауперы.
4. Продукты, получаемые в доменной печи. В доменной печи
образуются продукты трех родов: колошниковые газы, шлаки и
чугун.
Газы благодаря своей высокой температуре и содержанию в них
окиси углерода представляют собой значительную тепловую ценность.
Часть этих газов сжигается в раскаленных нагревательных печах,
так называемых кауперах, служащих для предварительного на-
грева вдуваемого в домну воздуха и по величине не уступающих до-
менной печи. Каждая доменная печь имеет четыре каупера, внутри
выложенных в клетку огнеупорными кирпичами. Смесь образую-
щегося в доменной печи газа и воздуха сжигается в одной из наг-
ревательных печей для накаливания находящейся в ней кирпичной
Кладки, тогда как свежий воздух для доменной печи нагревается в
это время в других нагревательных печах, проходя через нагретые
ранее печи. Каждые полчаса газ и воздух переключаются, так что
Ю Введение в химию.
146
ЖЕЛЕЗО И СТАЛЬ
вновь нагретые печи могут теперь нагревать вдуваемый воздух, а в
это время печи, охладившиеся за прошедшие полчаса, могут снова
быть нагреты сорящим газом. Не весь газ используется в нагре-
вательных печах. Часть сжигается для обслуживания всего завода
и для производства стали.
Рис. 43. Как нагревается вдуваемый воздух.
7 — доменная печь; 2 — печь для нагоевания воздуха; 3 — тяга открыта; 4 — тяга закрыта;
5 — труба для отвода горячего газа; о — горячий газ; 7 — пылеуловитель; 8 — пыль; 9 — хо-
лодное дутье для воздуходувок; 10— горячее дутье; 11 — отверстие для удаления железа:
Т2 — часть газа, идущая к нагревательным печам; 13 — часть газа, идущая к паровым котлам
- Шлак состоит главным образом из силикатов кальция, магния,
алюминия и железа. Отчасти он употребляется в цементном производ-
стве, а также в смеси со смолой при мощении улиц.
Металлический продукт носит название чугуна. Он содержит
от 2 до 4,5% углерода, от 0,7 до 3% кремния, от 0,1 до 0,3% серы,
от 0 до 0,1% фосфора и от 0,5 до 1% марганца. Свыше трех четвертей
чугуна, получаемого в доменных печах в США, идут на переработку
в сталь. Остаток отливается в слитки, называемые болванками, каж-
дый весом около 70 кг. Чугун тверд и хрупок; его ковкость и тягу-
честь низки, сопротивление сжатию высоко. Точка плавления
чугуна ниже точки плавления чистого железа благодаря заключаю-
щимся в нем примесям, и он легко может быть отлит в сложные формы.
Ковать чугун нельзя. В настоящее время получил широкое приме-
нение так называемый ковкий чугун, получаемый из обычного чугуна
путем специальной обработки.
ЖЕЛЕЗО И СТАЛЬ
147
Доменная печь действует непрерывно до тех пор, пока не станет
необходимой починка внутренней огнеупорной кладки.Некоторые
печи были в непрерывном действии по несколько лет. Современная
средняя печь дает ежедневно свыше 1 000 т чугуна и от 400 до 500 т
шлака.
* Выплавка чугуна в Советском Союзе за 1934 г. составила
10 млн. т. Ред. *
5. Ковкое железо. До введения доменных печей ковкое железо
получалось в небольших количествах одновременным нагреванием бо-
лотной железной руды и древесного угля. Шлак выбивался молотом,
а железо от времени до времени повторно нагревалось в кричных
горнах. Это нагревание давало железо более чистое, чем чугун, и по
этой причине ковкое. Однако с введением доменной печи железо
стало вырабатываться в больших количествах, но в форме чугуна,
не поддающегося ковке, так как высокий процент в нем углерода
делал его хрупким.
В 1784 г. англичанин Генри Корт изобрел пуддлинговую печь
для превращения чугуна в ковкое железо. Эта печь состоит из
печного пода, топочной решетки сзади низкой перегородки,
где и располагается огонь, и сводчатой крыши, отражающей пламя
вниз на под. В печь загружается около 200 кг расплавленного чугуна,
с низким содержанием серы и фосфора и некоторым количеством оки-
си железа в виде руды или заржавленного железного лома. Послед-
ний действует как окисляющий агент, окисляя углерод чугуна
в окись углерода, превращающуюся далее при горении в двуокись,
которая появляется в виде пузырей на поверхности железа:
Fe2O3 + ЗС —► 2Fe + ЗСО;
2СО + О2 —► 2СО2.
Кремний и марганец при этом окисляются подобным же образом, но
продукты окисления в этом случае тверды и образуют шлак. По мере
того как чистота железа увеличивается, его точка плавления повы-
шается до тех пор, пока оно не отвердеет частично в тестообразную
массу. Эта масса формуется в несколько шаров, каждый весом
около 70 кг. Шары удаляются из печи вместе с шлаком и сжимаются
Между тисками «сжимателя», чтобы выдавить насколько возможно
Шлак. Такое железо твердо, крепко и не ржавеет так легко, как
сталь или чугун. Большая часть ковкого железа употребляется прямо
на выделку цепей, якорей, болтов, но некоторое количество перера-
батывается в сталь.
Изобретение пуддлинговой печи повело к пользованию желе-
зом в более обширных размерах. Якорные канаты были заме-
нены якорными цепями из ковкого железа. Деревянные трубы
Перестали подводить воду и газ к городам. Деревянные рельсы, по
которым подталкивались повозки с древесным углем, постепенно были
заменены рельсами из ковкого железа. Небольшие количества стали
Производились с помощью дорогого процесса цементации, состоящего
10«
148
ЖЕЛЕЗО И СТАЛЬ
в накаливании в продолжение нескольких дней в закрытой реторте
ковкого железа и древесного угля. Этим путем углерод медленно пр0.
никал в железо и в результате получалась сталь очень высокого ка-
чества. Такие образцы стали производятся и в настоящее время и
применяются для выделки ножей, напильников, острых инструмен-
тов, ружейных стволов и др., но для пользования в широком мас-
штабе они чересчур дороги. Промышленники и железнодорожники
в середине XIX ст. буквально вопили о необходимости дешевой стали.
6. Сталь. Высокий процент углерода в чугуне является причи-
ной его твердости и хрупкости. Следы фосфора делают железо очень
хрупким в холодном состоянии, а небольшое количество серы дает
тот же эффект в нагретом металле. Полное удаление этих примесей
дает в результате мягкий, гибкий продукт высокой ковкости, но об-
ладающий невысоким сопротивлением разрыву и неспособный пре-
вратиться в режущее лезвее. Сталь представляет собой железо, со-
держащее от 0,5 до 1,5% углерода; этого достаточно, чтобы увели-
чить твердость и тягучесть чистого железа, но не достаточно, чтобы
железо сделалось настолько хрупким, чтобы его нельзя было обра-
батывать с помощью машин.
7. Бессемерование. В 1855 г. Генри Бессемер изобрел для произ-
водства стали конвертор, носящий его имя, и этим произвел револю-
цию в железной и стальной промышленности. Конвертор Бессе-
мера (рис. 44) представляет собою грушеобразный стальной сосуд
Рис. 44. Конвертор Бессемера.
1 — расплавленная сталь! 2 — обкладка; 3 — место, в котором дно конвертора может быть
отделено; 4 — дно, пронизанное отверстиями; металл удерживается током воздуха.
от 4 до 7 м вышиною и от 3,5 до 5,5 м в диаметре. Он выложен внутри
содержащими кремний огнеупорными кирпичами шириной от 50
до 75 см, скрепленными огнеупорной глиной. Эта обкладка имее?
ЖЕЛЕЗО И СТАЛЬ
149
Кислые свойства, поскольку она содержит значительное количество
окиси SiO2. Конвертор укреплен на цапфах таким образом, что мо-
^ет быть опрокинут, и содержимое его вылито. Одна из цапф
ролая, чтобы через нее можно было вдувать воздух в конвертор
через 15 фурм, находящихся на дне. Каждая фурма имеет до 75
в длину и 15 см в диаметре и в ней находятся 8 отверстий диамет-
ром 1,4 см, через которые воздух входит в загружаемый материал.
Расплавленный чугун выпускается из доменной печи через каж-
дые 4 часа и течет в ряд огромных ковшей, которые подводят его к
миксеру — большому резервуару, откуда расплавленный металл
от времени до времени перегружается в конвертор Бессемера. Одна
загрузка, т. е. приблизительно 20 т расплавленного чугуна, выли-
вается из ковша в верхнюю часть горизонтально расположенного
конвертора, предварительно разогретого. Затем пускают через
фурмы воздух и приводят конвертор в вертикальное положение.
Примеси — углерод, кремний и марганец — бурно сгорают при про-
дувании воздуха, причем это сгорание значительно повышает тем-
пературу металла в конверторе. Кремний и марганец сгорают пер-
выми, за ними следует углерод. Сначала пламя имеет оранжево-
желтый цвет с 'шним оттенком, затем, когда остается один углерод,
пламя становится ярче и сопровождается дождем искр. Наконец
пламя исчезает, и так как точка плавления железа повышается по
мере удаления примесей, а другого источника теплоты, кроме
горения этих примесей, не имеется, то металл должен быть вылит,
иначе он затвердеет в конверторе. Дутье продолжается от 10 до
15 минут. Так как в конверторе теперь почти чистое железо, то к нему
прибавляется достаточное количество углерода в форме зеркального
чугуна, т. е. сплава железа с большим содержанием углерода,
марганца и кремния, чтобы получить сталь желаемых свойств. Мар-
ганец удаляет из железа весь химически соединенный с ним кис-
лород, а кремний соединяется с кислородом, попавшим в металл
в виде воздушных пузырей.
Содержимое конвертора выливается затем в ковш, который
ставится в известное положение над рядом форм — изложниц. Проб-
ка в дне ковша открывается, и расплавленная сталь льется в излож-
ницы. Стальные слитки, каждый весом от 450 до 3 500 кг, кладутся
затем в томильный колодезь, где их выдерживают при постоянной вы-
сокой температуре, чтобы уменьшить напряжения в металле, разви-
вающиеся, когда он твердеет в форме.
В конверторе Бессемера получается сталь, годная для рельсов
и для стальных конструкций. Бессемерование обходится несколько
Дешевле, чем процесс на открытом печном поду (см. ниже), но получае-
мая сталь ниже сортом. Причин этому несколько. Прежде всего дутье
столь кратковременно, что регулировка его продолжительности с по-
мощью химического анализа металла невозможна. Состав образовав-
шегося продукта нельзя следовательно регулировать с точностью, что
возможно при процессе на открытом печном поду. Точно так же
нельзя при бессемеровании удалить фосфор из чугуна. Фосфор во
150
ЖЕЛЕЗО И СТАЛЬ
время дутья окисляется, но он не входит в шлак. Он снова восставав,
ливается в свободный фосфор прибавлением углерода, после того
как дутье закончено. По этой причине бессемерованию может
подвергаться только такой чугун, содержание фосфора в котором
очень низко. Это вызывает необходимость для плавки в доменной
печи, употреблять руду с низким содержанием фосфора, что обхо-
дится дороже.
Рис. 45. Печь Сименса-Мартена.
lt 7 - - ггз; 2, 2 — воздух; 3, 4, 5, 6 — кирпичная кладка в клетку; 7 — расплавленная сталь;
8 — обкладка; 9 — к вытяжной трубе; 10 — тяга.
Введение бессемерования для производства стали вызвало гро-
мадное расширение железной промышленности. Теперь стала до-
ступна дешевая сталь. Железные дороги воспользовались этим,
и километр за километром стали открываться новые железнодорож-
ные пути. Открылись буквально тысячи новых применений стали.
Приблизительно до 1876 г. вся сталь в США производилась в кон-
верторах с кислой обкладкой. Большие количества железной руды
с слишком высоким содержанием фосфора оставались неподходящими
для этого процесса. Затем появился процесс на основном открытом
печном поду, и эти руды тотчас же стали годными для переработки.
8. Способ открытого пода. В 1856 г., вскоре после открытия
конвертора Бессемером, братья Сименс в Англии разработали
нагреваемую газом печь с открытым подом для производства
стали из чугуна. В 1864 г. братья Мартен соорудили на Сирейльских
железоделательных заводах во Франции печь братьев Сименс, введя в
нее принцип нагревания газом с регенерацией тепла. Такая печь
изображена на рис. 45 и 46. Эти печи сооружаются из стали и кир-
ЖЕЛЕЗО И СТАЛЬ
151
пича и располагаются по несколько в ряд. Каждая содержит неглу-
бокий, овальной формы чан или открытый печной под, приблизи-
тельно в 12 лг длиной, 4,5 м шириной и 0,7 м глубиной, способный
выдержать нагрузку в 75 т. Под имеет основную обкладку из маг-
незита (MgCO3) или доломита (MgCO3-CaCO3). Эти карбонаты раз-
лагаются при нагревании в печи на соответствующие окислы:
MgCO3 -> MgO + СО2.
СаСО3 -> СаО + СО2.
Рис. 46. Поперечный разрез печи Сименса-Мартена.
Оба они, как окислы металлов, являются основными окислами. Го-
рючий газ (естественный или генераторный) и воздух пропускаются
через отдельные трубы над нагретыми кирпичами, выложенными в
шахматном порядке, и оттуда через отверстия в печь. Здесь проис-
ходит горение, и пламя как из гигантской паяльной горелки разве-
вается над металлом. Горячие газы выходят через отверстия на
другую сторону печи, где они нагревают другие ряды кирпичей, вы-
ложенных в шахматном порядке. Приблизительно через каждые
полчаса газы направляются в обратную сторону. Газы и воздух
теперь проходят над свеженагретыми кирпичами и, оставив печь,
нагревают охладившиеся на противоположной стороне кирпичи.
Таким образом газы все время подогреваются чем достигается
значительная экономия в топливе.
Загрузка состоит из чугуна, заржавленного стального лома, же-
лезной руды и известняка. Сначала известняк, затем железный лом
и наконец чугун механически загружают на под через дверь, нахо-
дящуюся позади печи. Расплавленный чугун выливается из ковша
152
ЖЕЛЕЗО И СТАЛЬ
в печь через дверцу на передней стороне печи. Теплота горящих
газов поддерживает чугун в расплавленном состоянии и разлагает
известковый плавень:
СаСО3 — СаО + СО2.
Затем прибавляется руда и очень сильный поток воздуха раздувает
пламя. Кислород этого воздуха вместе с кислородом окисной руды
окисляют примеси:
3C + Fe2O8 —>3CO + 2Fe;
6Р + 5Fe3O3 -> ЗР2О6 + WFe;
3S +2Fe2O3 3SO2 + 4Fe;
3Mn + Fe2O3 —* 3MnO + 2Fe;
3Si + 2Fe2O3 -> 3SiO2 + 4Fe.
Окислы углерода и серы, образовавшиеся таким способом, удаляются
в виде газов. Остающиеся окислы реагируют друг с другом и с из-
вестью плавня,образуя шлак:
ЗСаО -]- Р2О3 ► Са3 (РО4)2;
СаО + SiO2 —► CaSiO3;
MnO 4- SiO2 —► MnSiO3.
Этим способом все примеси, включая и фосфор, который нельзя было
удалить в конверторе Бессемера, удаляются из расплавленного ме-
талла. После этого из печи берется образец металла; ему дают затвер-
деть и отмечают, каков он в изломе. К концу процесса пробы посы-
лаются в химическую лабораторию для ускоренного анализа. На
основании этих анализов можно вычислить, какое количество зер-
кального чугуна следует прибавить к нагрузке. Прибавляется также
в небольшом количестве алюминий, чтобы удалить кислород из
окисла железа, который мог образоваться. Затем печь опоражни-
вается (рис. 47). Нагревание продолжается от 8 до 12 часов. Расплав-
ленная сталь отливается в слитки и помещается в томильные колод-
цы, как это имеет место и в случае стали Бессемера.
Процесс на основном открытом иоду имеет следующие преимуще-
ства перед бессемерованием:
1. Более точное регулирование температуры благодаря приме-
нению внешнего источника нагревания.
2. Возможность использования чугуна из более низкосорт-
ных руд.
3. Бозможность более точного определения и регулирования
состава металла.
4. Железный лом и железная руда могут быть превращены
в сталь при меньшей затрате чугуна, т. е. при меньшем числе домен-
ных печей для производства того же количества стали.
ЖЕЛЕЗО И СТАЛЬ
153
В настоящее время основная часть выплавляемой стали произво-
дится в печах открытого пода.
9. Прокатный стан* Превращение стальных слитков, оставлен-
ных нами в колодцах, в законченные продукты не имеет никакого
отношения к химии. Тем не менее мы укажем кратко, как это делается.
Накаленные докрасна слитки пропускаются между тяжелыми сталь-
Рис. 47. Опоражнивание печи открытого пода.
ными валами мощного обжимного стана — блюминга, подобно
тому как сырые простыни пропускаются через машину для выжима-
ния белья. Это уменьшает ширину и толщину слитков, но значитель-
но увеличивает их длину. Получающаяся в результате полоса пря-
моугольного сечения называется крицей. Далее, на обычном про-
катном стане крицы прокатываются в листовые полосы и наконец
на листовом прокатном стане — в листы стали. Железные балки,
употребляемые для строительных целей, и железнодорожные рельсы
также прокатываются из стальных полос соответствующего сечения.
10. Электрическая печь. Высший сорт стали производится
в настоящее время в электрической печи (рис. 48). Такими печами
пользуются обычно для того, чтобы еще более повысить качество
бессемеровской или полученной на открытом поду стали. В них полу-
чается более плотная сталь, свободная от полостей, образующихся
при дутье благодаря поглощенным газам.
11. Сложные (качественные) стали. Появление автомобиля
дало резко выраженный толчок производству стальных сплавов.
154
ЖЕЛЕЗО И СТАЛЬ
Таблица XV1I1. Состав и применение более известных содер<
ж ащих железо сплавов
Название Состав (%) Применения
Железо кислотоупорное f Железо стойкое к щело- чам Стальные сплавы: Хромовая сталь . . . Хромо-вольфрамовая сталь Хромо-ванадиевая . . Марганцевая . . . . Молибденовая .... Никелевая Хромо-никелевая . . Ауэровский металл . . Дурирон Fe 86; Сг 13 Fe 95; Ni 5 Cr<3 G 0,25—1; W 5—25; Cr 2-10; V 0,25 C 0,25-1; Cr 0,8—1,1; V 6,15 Mn 6—15 Mo 0,3—3 Ni 3-4 Ni 25 Ni 30—40 Ni 36 Ni 46 Ni 1—4; Cr 0,45-2 Fe 35; Ce 35; La 24; Yb 3; Cr 2 Fe; Si 14—15; Mn 2—2,5; CO,8—1,3; SO,05-0,2; P 0,05-1 Снаряды, напильники, клещи для дробления камней, шарикоподшип- ники, сейфы, броневые плиты । Сталь для быстроре- жущих инструментов Зубчатые колеса и оси Железн одорожные рельсовые закругления, железнод. стрелки, паро- вые лопаты Оси (Большая растяжи- мость, сопротивляемость коррозии.). Проволочные кабели, передаточные и коленчатые валы, мосто- вые фермы и т. д. Электрические реос- таты Нержавеющая сталь для насосов, клапанов и т. д. Нержавеющая сталь для маятников стенных часов, для чашек весов и т. д. Платинит. Одинаковый со стеклом коэфициент расширения. Металличе- ские печати Броневые плиты Дающий искры сплав. Газовые зажигалки, па- пиросные зажигалки и т. д. Сплав, стойкий к дей- ствию кислот 1
Металлы, которые до тех пор даже химикам были известны только по
названиям, стали входить в состав сплавов со сталью. В результате
появились высококачественные стали, которые служат не только
для производства частей автомобильных машин, но и для произвол-
ЖЕЛЕЗО И СТАЛЬ
155
ства инструментов, применяемых на быстродвижущихся станках.
Инструментальная сталь закаливается накаливанием докрасна и по-
следующим быстрым охлаждением в масле или в воде. Однако если
она снова нагреется до слишком высокой температуры благодаря
трению, которое развивается, когда сделанный из нее инструмент
применяется на быстрорежущем станке, она снова размягчается и те-
ряет свои режущие свойства. Необходимость работать, избегая на-
гревания, понижала быстроту работы станков. Случайное открытие
Мешета в 1868 г., которое заключалось в том, что сталь, содержащая
Рис. 48. Электрическая печь для получения стали.
вольфрам, не нуждается в охлаждении для того, чтобы стать твердой,
привело в 1890 г. Тайлора к получению быстрорежущих инструмен-
тальных сталей и революционизировало практику машиностроения.
Вскоре были найдены и другие металлы, придающие стали многие
ценные свойства. Так, марганец повышает крепость стали. Он уда-
ляет также кислород, делающий сталь менее прочной, и серу, при-
дающую ей хрупкость. Никель повышает крепость стали, не повышая
ее хрупкости. Хром в небольших количествах делает сталь более
твердой и повышает ее сопротивляемость удару. В больших
количествах этот элемент повышает ее стойкость к коррозии: нержа-
веющая сталь содержит хром. Даже такой металл, как сталь, может
«утомиться» и ломаться при повторяющихся ударах. Эта склонность
к утомлению в значительной степени снижается в присутствии ва-
надия. Ванадиевая сталь стала знаменитой благодаря автомобилям
Форда. Молибденовые стали более тверды, стойки к нагреванию и т. д.
156
ПЕРИОДИЧЕСКИЙ ЗАКОН
Чтобы дать некоторое представление о применении стальных
сплавов, укажу, что с мая по декабрь 1918 г. в США было полу-
чено 21000000 кг вольфрамовой стали, содержащей до 3 600000 кг
вольфрама.
ГЛАВА XV
ПЕРИОДИЧЕСКИЙ ЗАКОН
92 вида атомов, принадлежащих такому же числу элементов, явля-
ются теми камнями, из которых построена вселенная. Комбинации
этих атомов дали в результате множество веществ, из которых со-
стоит материальный мир. И хотя мы видим с некоторым удовлетво-
рением, что труды химиков необычайно упростили изучение материи,
сведя его от изучения полумиллиона или даже большего количества
соединений к изучению комбинаций всего 92 элементов, чувство удов-
летворения все же смешивается в большей или меньшей степени
с чувством разочарования, так как, сознательно или бессознательно,
мы недовольны что число элементов так велико и чувствуем, что
в изучении материи мы еще не достигли конечных основ. Если атомы
различных элементов состоят из некоторой более основной частицы
или частиц, тогда одним из путей изучения проблемы строения атомов
будет отыскание связи между атомами, ибо если такая связь суще-
ствует, то она должна свидетельствовать и о связи в строении атомов.
Одному из наиболее важных видов связей такого рода и посвящена
настоящая глава.
1. Краткая история определений атомного веса. Мы не задаемся
целью исторически проследить наше современное понимание при-
роды строения молекул, так как подобная попытка сделала бы
наше изложение неясным. Слишком много ложных теорий было пред-
ложено, прежде чем была ясно понята истинная природа отноше-
ний между молекулами и атомами. Как мы видели, определение атом-
ного веса заключает в себе две отличные одна от другой задачи: одна—
аналитическая — состоит в установлении весовых отношений, в ка-
ких соединяются элементы; другая заключается в определении моле-
кулярного веса; решение ее связано с применением гипотезы Аво-
гадро. Опубликование Дальтоном в 1808 г. его атомистической теории
имело последствием попытки со стороны некоторых исследователей
вычислить атомные веса. Эти попытки однако оказались неудач-
ными, с одной стороны, вследствие недостатка точных аналитических
методов, а с другой — благодаря тем сомнениям, которыми была
встречена гипотеза Авогадро после ее опубликования в 1811 г. Одним
из первых химиков, попытавшихся установить атомные веса, был
Берцелиус, о котором мы слышали ранее в связи с введением им
химических символов. Еще в 1810 г. он сообщил об определениях
соединительных весов и после работы, продолжавшейся немного более
10 лет, он определил соединительные веса не менее 50 элементов, при-
готовив, очистив и произведя анализ не менее 2000 их соединений.
ПЕРИОДИЧЕСКИЙ ЗАКОН
157
Если мы остановимся на минуту и вспомним, что аналитические ме-
тоды в то время не только были грубы, но часто просто отсутствовали,
то мы будем в состоянии хотя бы в малой степени представить себе
грандиозность его работы. Сделав несколько смелых допущений,
которые оправдались в некоторых, но не во всех случаях, он счел
возможным превратить соединительные веса в атомные. Сравнение
некоторых атомных весов, опубликованных им в 1826 г., с весами
Интернациональной таблицы атомных весов 1929 г. указывает на
поразительную точность полученных им результатов.
Таблица XIX
Элемент Берцелиус (1826) Интернацио- нальная таблица
Хлор Свинец Азот Калий Серебро Сера 35,41 207,12 14,05 39,19 108,12 32,18 35.457 207,20 14,008 39,096 107,880 32,064
Дело Берцелиуса было продолжено бельгийским химиком Жаном
Сервэ Стасом (1813—1891). Достигнутые им результаты расценива- ।
лись так: «Он усовершенствовал процессы количественного превра- {
щения до степени, никогда не достигнутой ранее, работая с прекрасно ।
очищенными веществами, применяя исключительно большие весовые
количества вещества, производя взвешивания на весах непревзой-
денной точности и соблюдая во всей своей работе необыкновенную
тщательность». Американский химик Теодор Уильям Ричардс
(1868—1928) начал работу с той стадии, на которой Стас оставил
ее и определил атомные веса не менее чем 22 элементов величайшей
степенью точности. За эту работу ему была присуждена в 1914 г.
нобелевская премия по химии.
Таблица атомных весов может быть принята с признательностью
за настойчивый, прилежный труд людей, установивших ее, и за-
тем может быть использована как основание для всех химиче-
ских вычислений. Большинство химиков, считавших, что у них нет
времени исследовать скрытое значение этой таблицы, действительно
было благодарно за установление таблицы и... обратилось к своей ра-
боте. Лишь немногие остановили на ней свое внимание, желая вы-
яснить, какие можно вывести из нее следствия.
2. Джон Ньюлэндс. В 1866 г. молодой англичанин Джон Нью-
лэндс прочитал доклад в Английском химическом обществе, в кото-
158
ПЕРИОДИЧЕСКИЙ ЗАКОН
ром он сообщил о зародыше открытия, впоследствии оказавшегося
замечательным. Он открыл, что если известные в то время элементы
расположить в порядке увеличения их атомных весов, то выявляется
поразительная периодичность. Это делается совершенно очевидным,
если следовать приведенному им примеру. Приводим список эле-
ментов, расположенных в порядке их атомных весов:
водород!; литий! 7; бериллий 9; бор 11; углерод 12; азот 14; кислород 16;
фтор 19; натрий 23; магний 24; алюминий 27; кремний 28; фосфор 31; сера 32;
Эти элементы умышленно расположены по 7 элементов в ряд для того,
чтобы наиболее резко подчеркнуть особенно существенную сторону
открытия Ньюлэндса. Обратимся в виде примера к элементам литию
и натрию, находящимся в одном вертикальном столбце. Эти два
элемента в химическом отношении являются активными металлами,
так как они соединяются с неметаллами с выделением сравнительно
большого количества энергии. Формулы соединений, образуемых
этими элементами с другими элементами, поразительно сходны; на-
пример формулы их хлоридов будут LiCl и NaCl, а их окисей Li2O
и Na2O. Другими словами, у обоих элементов одна и та же валент-
ность, хотя в общем стл элементы не тождественны по своим физиче-
ским свойствам, и по тому, как они ведут себя химически, они также
похожи друг на друга, как «две горе ш шы в одном стручке».
Точно так же бериллий и магний, бор и алюминий, углерод и крем-
ний, азот и фосфор, кислород и сера оказываются парами весьма
родственных элементов. Мы находим таким образом любопытную пе-
риодичность или повторение свойств вместо их непрерывного измене-
ния. Гексли приводит аналогию, сравнивая последовательность
элементов с буквами алфавита. Он располагает буквы так, что они
следуют друг за другом не в таком порядке: а, б, в, г, д, е, ж, з
и т. д., а в таком: а, б, в, г, д, е, ж, з, А, Б, В, Г, Д, Е, Ж, 3
и т д., причем а и А, б и Б, в и В и т. д. очень похожи друг на дру-
га. Сходство этой последовательности с последовательностью то-
нов в музыкальной гамме дали Ньюлэндсу повод назвать ее з а к о-
ном октав.
Легко можно представить себе то одобрение, с которым должно
было бы быть принято это сообщение Ньюлэндса, вскрывающее от-
ношения между атомами. На самом же деле оно не только не встретило
сочувствия, но ученые члены Английского химического общества
унизились до насмешек: проф. Дж. Е. Фостер спросил в шутку, не
рассматривал ли Ньюлэндс элементы, располагая их по порядку
их начальных букв, и намекнул, что таким методом чего доброго
можно открыть еще более поразительный ряд сходств. Ньюлэндсу
было отказано в опубликовании обществом его доклада, хотя его
идеи уже были опубликованы ранее в журнале Chemical News.
С тонкого льда умозрений Ньюлэндс удалился в сравнительно безо-
пасную область сахарной промышленности. Однако в 1882 г. Королев-
ское общество присудило ему медаль Дэви за его открытие периодич-
ности элементов.
ПЕРИОДИЧЕСКИЙ ЗАКОН
159
3. Дмитрий Иванович Менделеев. 7 февраля 1834 г. в Тоболь-
ске в Сибири родился Дмитрий Иванович Менделеев, самый младший
в многочисленной семье. Ему было предназначено вновь открыть ука-
занные Ньюлэндсом отношения и с помощью этого открытия сделать
несколько поразительных предсказаний, которые с удивительной
точностью осуществились. В 1869 г. Мен-
делеев опубликовал предварительное со-
общение о классификации элементов, при-
чем к этой классификации он пришел
путем, сходным с путем Ньюлэндса. За
этой статьей последовала в августе 1871 г.
вторая статья, в которой действительность
и ценность его классификации были пока-
заны с такой силой, что классификация
эта привлекла, как она того и заслужива-
ла, серьезное внимание химиков во всем
мире. В этой статье он сделал смелое пред-
сказание, что с течением времени будут
открыты три элемента и дополнил это
предсказание указанием, каковы будут
их атомные веса и свойства. Эти предска
заниябыли сделаны В 1871 Г. Не прошло Дмитрий Иванович
и 25 лет, как элементы были открыты, и их Менделеев
свойства совпали с предсказанными. Как
близко предсказания Менделеева сходятся с действительными свой-
ствами для одного из этих элементов, можно видеть из следующей
таблицы:
Таблица XX
Характерные свойства Экасилиций, предсказан- ный Менде- леевым (1879) Германий, открытый Винклером (1887)
Атомный вес Плотность металла . • . Формула окиси Формула хлорида .... Точка кипения хлорида . 72 5,5 EsO, EsCl4 ниже 100° 72,5 5,47 GeOa GeCl, 86°
Менделеев пишет в своих «Основах химии)1.
Писавши в 1871 г. статью о приложении периодического закона к опре-
делению свойств еще неоткрытых элементов, я не думал, что доживу до
оправдания этого следствия периодического закона, но действительность
ответила иначе; Описаны были мною три элемента — экабор, экаалюми-
1 Менделеев, Основы химии, гл. 15.*
160
ПЕРИОДИЧЕСКИЙ ЗАКОН
ний и экасилиций; не прошло двадцати лет, как я имел величайшую радость
видеть все три открытыми и получившими свои имена от трех стран, где
найдены редкие минералы их содержащие и где сделано их открытие —
Галлии, Скандинавии и Германии.
Осуществление его предсказаний вместе с его мастерским из-
ложением периодического закона привело к всеобщему признанию
теории периодичности элементов.
4. Периодическая таблица. Современная периодическая таблица,
основанная на оригинальной системе Менделеева, приводится на
стр. 162. Эта таблица становится современной благодаря включению
в нее тех элементов, которые были открыты после опубликования
Менделеевым первой таблицы в 1871 г. Нулевая группа, которой не
было в первоначальной таблице, прибавлена, чтобы поместить в таб-
лицу химически недеятельные газы, открытые Рамзаем и другими
в продолжение последнего десятилетия XIX ст. Весьма рекомен-
дуется рассмотреть эту таблицу подробнее и внимательнее, чтобы
уяснить ее пользу, а впоследствии и ее значение.
Элементы расположены в горизонтальных рядах или сериях
слева направо в порядке возрастания атомных весов и распреде-
лены между девятью вертикальными столбцами или группами. Эле-
менты в одной вертикальной группе обнаруживают определенно
сходные физические и химические свойства. По причинам, которые
станут ясными позже, водород, элемент с самым низким атомным ве-
сом, является единственным членом 1-го ряда и помещен в группе I.
Затем во 2-м и 3-м рядах следуют 16 элементов, по 8 в каждом ряду.
Ни один элемент этих рядов не находится в группе VIII. В каждой
группе 3-го ряда элемент естественно приходится под сходным эле-
ментом 2-го ряда. До сих пор все просто, но со следующих рядов
начинаются затруднения. Аргон, калий и кальций, первые три эле-
мента 4-го ряда, еще хорошо находят свое место под неоном, натрием
и магнием, но скандий мы принуждены поместить под алюминием
в группе III с некоторыми оговорками, так как его свойства не схо-
дятся со свойствами алюминия так близко, как это было бы жела-
тельно, Символ скандия помещен левее символа алюминия, чтобы
обозначить эту разницу. Следующие четыре элемента 4-го ряда
(Ti, V, Сг и Мп) обнаруживают тот же недостаток близкого сходства;
их символы помещены подобным же образом левее символов элемен-
тов, находящихся в каждой группе над ними. За марганцем в 4-м
ряду следуют три элемента — железо, кобальт и никель, — очень
тесно связанные друг с другом; настолько тесно, что это оправдывает
включение их в одну и ту же группу. Они не принадлежат к группе О,
где находятся недеятельные газы, но они и не подходят к какой-либо
другой из остальных групп. Поэтому Менделеев поместил их вместе
в rpynjiy VIII в конце ряда.
5-й ряд не начинается с недеятельного газа и в этом ряду нет
элементов,которые относились бы к группе VIII. 6-й ряд начинается
с недеятельного газа, криптона, а также содержит 3 элемента, отно-
сящиеся к группе VIII. Ряд 7-й похож на 5-й ряд, а 8-й ряд сходится
ПЕРИОДИЧЕСКИЙ ЗАКОН
161
с б-л с одним важным исключением по отношению к 8-му ряду. В 8-м
ряду есть серия из 15 элементов, начинающаяся с лантана и кончаю-
щаяся лютецием и известная под названием редкоземельных элемен-
тов. Все эти элементы по своим химическим свойствам и по формулам
соответствующих соединений настолько похожи друг на друга,
что помещаются на одном и том же месте в таблице — в группе
1Пив8-м ряду. 9-й и 10-й ряды похожи соответственно на 7-й и
8-й ряды, кроме того 10-й ряд оканчивается в группе VI ураном —
«•элементом самого большого, какой только известен, атомного веса.
5. Польза таблицы. Мы только что вкратце рассказали, как
расположены элементы в периодической таблице. Теперь попытаемся
посмотреть на отношения между элементами, обнаруживаемые табли-
цей. В таблице мы находим ярко проходящую перед нами любопытную
периодичность элементов. В каждой группе элементы сходны по своим
свойствам. Металлы в общем находятся в группах с более низкими
нумерами, в левой половине таблицы, а неметаллы — в группах,
с более высокими нумерами. Если мы проследим характер элементов
по рядам, то нам невольно придет в голову мысль о качании маят-
ника. Например в 3-м ряду, первый элемент неон представляет
собой недеятельный газ. Следующий элемент — натрий — активный
металл. Затем следует менее активный металл магний, еще менее
активный металл алюминий, неактивный неметалл кремний, более
активный неметалл фосфор, еще более активный неметалл сера
и самый активный неметалл этого ряда — хлор. Во всякой группе
с повышением атомного веса металлические свойства элементов воз-
растают, а неметаллические падают. В группе II например бериллий
представляет собою наименее активный, а радий наиболее активный
металлы. Как и можно было ожидать, группы в середине таблицы
содержат неметаллы наверху и металлы внизу. В группе IV напри-
мер углерод и кремний — неметаллы, тогда как олово и свинец
металлы. Линия, проведенная из верхнего левого угла к нижнему
правому периодической таблицы, довольно резко отделяет металлы
от неметаллов при условии, если мы оставим в стороне элементы
группы VIII, которые все являются металлами. Такая же оговорка
необходима и в отношении группы 0, элементы которой не являются
металлами. Когда позже мы будем иметь удобный случай рассмотреть
строение атомов и теорию электролитической диссоциации, ценность
периодической таблицы станет еще яснее.
6. Периодическая таблица и валентность. Одно из наиболее убе-
дительных доказательств периодичности свойств элементов заклю-
чается в том, что элементы одной и той же группы в общем имеют ту
Же валентность. Элементы нулевой группы имеют валентность равную
О, так как их атомы не обнаруживают склонности соединяться с атома-
ми других элементов. Элементы группы I имеют валентность, равуню
единице; элементы группы II — валентность, равную двум; группы
III — валентность, равную трем; группы IV — валентностьравуню
четырем. Элементы группы V имеют валентность, равную трем,
Когда они соединяются с металлами, и равную трем и пяти, когда
11 Введение в химию.
Таблица XXL Г! ер ио д иче с к а я таблица
(в основание положена классификация Менделеева)
Периоды Ряды Группы
0 1 ' II III IV 1 v VI VII VIII
I 1 1 н 1,0078
II 2 2 Не 4,002 3 Li 6,940 4 Be 9,02 5 В 10,82 6 c 12,000 7 N 14,008 8 0 16,000 9 F 19,00
1И 3 10 No 20,183 11 Na 22,997 12 МЯ 24,32 13 Al 26,97 14 Si 28,06 15 P 31,02 1 s 32,06 17 Cl 35,457
VI { 4 18 Аг 39,944' 19 К 39,10 20 Са 40,08 21 Sc 45,10 22 Ti 47,90 23 V 50,96 24 Cr 52,01 25 Mn 54,93 26 27 28 Fe Co Ni 55,84 58,94 58,69
5 29 Си 63,57 30 Zn 65,38 31 Ga 69,72 32 Ge 72,60 33 As 74,93 34 Se 78,96 35 Br 79,916
V < 1 6 36 Кг 83,7 37 Rb 85,44 38 Sr 87,63 39 Y 88,9 40 Zr 91,22 41 Nb 92,91 42 Mo 96,0 43 Ma ? 44 45 46 Ru Rh Pd 101,7 102,91 106,7
7 47 107,880 48 Cd 112,41 49 In 114,76 50 Sn 118,70 51 Sb 121,76 52 Те 127,61 53 J 126,92
VI - 8 54 Хе 131,3 55 Св 132,91 56 Ba 137,36 57—71 Редкие земли 72 Hf 178,6 73 Ta 181,5 74 W 184,0 75 Re 186,31 76 77 78 Os Ir Pt 191,5 193,1 195,23
9 79 Аи 197,2 80 Hgf 200,61 81 Ti 204,39 82 Pb 207,22 83 Bi 209,00 84 Po 210 85
VII 10 86 Rn 222 87 88 Ra 225,97 89 Ac 230? 90 Th 232,12 91 Pa 234? 92 U 238,14
Редкоземельные элементы
57 La 138,92 58 Ce 140,13 59 Pr 140,92 60 Nd 144,27 61 11 ? 62 Sm 150,43 63 Eu 152,0 64 Gd 157,3 65 Tb 159,2 66 Dy 162,46 67 Ho 163,5
68 69 70 71
Br Tn Yb Ln
167,64 169,4 173,04 175,0
ПЕРИОДИЧЕСКИЙ ЗАКОН
ПЕРИОДИЧЕСКИЙ ЗАКОН
163
соединяются с кислородом. Элементы группы VI имеют валентность,
равную двум, когда соединяются с металлами, и равную четырем
шести в своих соединениях с кислородом. Элементы группы VII
одновалентны в своих соединениях с металлами и одно-,трех-, пяти-
и семивалентны, когда соединяются с кислородом. Металлы группы
VIII двух- или трехвалентны. Знание характерных валентностей
группы периодической таблицы является большим сбережением
умственного труда, так как валентность какого-либо отдельного эле-
мента легко может быть определена по группе, в которой он находит-
ся в таблице.
7. Предсказания Менделеева. До сих пор мы еще не привели тех
соображений Менделеева, в силу которых он оказался способным
предсказать неизвестные еще свойства элементов. Мы надеемся,что
читатель уже предвидит эти соображения. В 1871 г. элементы скан-
дий, галлий и германий еще не были известны. В связи с этим при
составлении таблицы Менделеев нашел, что за кальцием следует
титан. Это заставило поставить титан в группу III, но, свойства его
ясно показывали, что он относится к группе IV. Это принудило оста-
вить пустое место в группе III, что сразу внушило Менделееву мысль
о существовании какого-то неизвестного еще элемента. Подобным же
образом в его первоначальной таблице появились пустые места, за-
нимаемые теперь элементами галлием и германием. Свойства какого-
либо элемента могут быть предсказаны с некоторой степенью досто-
верности на основании положения элемента в периодической таблице;
на этом-то основании Менделеев и оказался в состоянии предсказать
свойства неизвестных элементов, которые должны были занять
пустые места в его таблице.
Менделеев назвал элемент, который должен был поместиться
в группе III в 4-м ряду его таблицы, экабором (эка на санскритском
языке значит один). Атомный вес этого элемента должен находиться
между атомным весом алюминия и галлия и между атомными весами
кальция и титана. Если взять среднюю величину от атомных весов
этих четырех элементов, то получится число, близко подходящее
К действительному атомному весу менделеевского экабора:
-L (26,97 4- 69,72 + 40,07 + 47,90) = 46,19.
После того как был открыт скандий, определение его атомного веса
Дало величину 45,10, так что указанный выше способ дал хорошее
Приближение. Во время предсказаний Менделеева галлий также был
Неизвестен, так что атомный вес, указанный им для экабора был сред-
ней величиной атомных весов кальция и титана или -у (40-J-48)=44.
Зная, что валентность элементов группы III равна трем, Менде-
леев не нашел затруднений в выводе формул соединений, которые
Qro элемент экабор мог образовать с другими элементами. Так как
эНабор имел валентность три, то формулы для его хлорида и окиси
^ответственно должны были быть EkCls и ЕкаО8.
11%
164
ПЕРИОДИЧЕСКИЙ ЗАКОН
8. Отклонения в периодической таблице. На основании сказан-
ного можно предположить, что периодическая таблица все химиче-
ские факты представляет в удобной, сконцентрированной форме.
К сожалению, это не так. В таблице обнаруживаются весьма важные
непоследовательности. Например каждая группа, за исключением
групп 0 и VIII, разделена на подгруппы, начиная с элемента скан-
дия в группе II в 4-м ряду. Эти подгруппы разделяются далеко не
удовлетворительно, так как две подгруппы какой-либо группы мо-
гут содержать элементы, очень сходные между собой; с другой сто-
роны, между элементами одной подгруппы может и не быть тесного
сходства.
Когда наш воображаемый маятник, отмечающий, по мере того
как он качается, периодическое повторение элементов со сходными
свойствами, делает два первых своих взмаха он отмечает два периода,
каждый из 8 элементов. При следующем взмахе он до своего возвра-
щения описывает дугу с большим протяжением, включающую
18 элементов 4-го и 5-го рядов. При ближайшем взмахе он снова про-
бегает период в 18 элементов б-го 7-рядов. Затем дуга снова становит-
ся больше для ближайшего периода, включающего элементы 8-го
и 9-го рядов и состоящего из 32 элементов. 10-й период неполон, ибо он
внезапно прерывается на уране и содержит только 7 элементов. Сам
Менделеев указывал и на другой способ группировки элементов по
периодам вместо рядов. Этот порядок, вызвавший недавно некоторое
сочувствие, показан на таблице XXII с изменениями, сделанными
Томсеном и Бором. В этой таблице есть многое, за что следует по-
хвалить ее, как это станет ясным при чтении следующих глав.
Другая непоследовательность в периодической таблице обна-
руживается в том, что некоторые элементы приходилось поместить
на подходящие места в таблице по свойствам этих элементов, а не
по последовательности их атомных весов. Так, атомный вес иода
ниже атомного веса теллура, и однако иод стоит в группе VII,
а теллур в группе VI. Подобным же образом, казалось, должны
быть переставлены аргон и калий, кобальт и никель. В то время,
когда таблица предлагалась впервые, атомные веса индия, урана,
церия, итрия и других не позволяли поставить эти элементы на
подходящие места в таблице. Менделеев указал, что атомные веса
этих элементов были определены неправильно; более поздние и бо-
лее точные определения подтвердили это указание. Любопытно
однако, что в таком неприемлемом для таблицы положении остаются
три пары элементов, атомные веса которых были определены с вели-
чайшей точностью: аргон и калий; иод и теллур; никель и кобальт.
Таким образом в этих случаях основной принцип, по которому эле-
менты были расположены в таблице, должен был быть принесен
в жертву, чтобы избежать очевидной неправильности в расстановке
элементов. Это невольно наводит на мысль, что может существовать
еще какое-то свойство атомов, более основное, чем их вес. В следую-
щей главе мы увидим, что это за свойство.
9. Взаимная связь между атомами. При изучении периоди-
ПЕРИОДИЧЕСКИЙ ЗАКОН
165
Таблица XXII. Периоди ческая таблица Томсена-Бора
1 2 3 4 5 6 7
5 В —13 А1 — 31 Ga — 49 In — 81 П
6 С -14 S1 — 32 Ge —50 Sn — 82 Pb
7 N —15 P — 33 As —51 Sb — 83 Bi
8 0 —16 S — 34 Se —52 Те — 84 Po
1 H — 9 F -17 Cl — 35 Br —53 J - 85 —
2 He —10 Ne—18 Ar — 36 Kr -54 Xe — 86 Rn
ческой таблицы элементов все время находишься под впечат-
лением поразительной взаимной связи между атомами. Очевидно
должен существовать какой-то вид взаимоотношений между атома-
ми, иначе периодичность элементов следует рассматривать как чи-
стейшую случайность. Однако если попробовать вычислить вероят-
ность такого случайного совпадения, то оказывается, что она так
непостижимо мала, что практически невозможна. Неизбежно при-
дется сделать заключение, что атомы не последние частицы материи,
и что существуют один или несколько видов более мелких частиц,
из которых построены различные атомы. По мере того как мы глубже
будем проникать в строение материи, мы увидим величественную
простоту. Полмиллиона различных молекул состоят из 92 видов
атомов, а каждый из атомов в свою очередь состоит из немногих,
более простых частиц.
166
СТРОЕНИЕ АТОМОВ
ГЛАВА XVI
СТРОЕНИЕ АТОМОВ
Конец XIX ст. характеризуется замечательными открытиями
в области физики, которым было предназначено нарушить самодо-
вольство как физиков, так и химиков. Для химика молекулы Аво-
гадро и неизменные атомы Дальтона давали удовлетворительную
модель строения вещества и изменений, которым оно подвергается.
Эти структурные единицы были взвешены, и судьба их была просле-
жена во многих реакциях. Атомы были приведены в систему Менде-
леевым. В физике были установлены и проверены принципы меха-
ники. Волнообразная теория света была проверена опытами Юнга
и Френеля, и теория электромагнитного характера этих волн была
экспериментально проверена Герцом. Физики думали, что все вели-
кие открытия уже сделаны, и все, что остается, — это более точные
измерения известных явлений, искание большего количества знаков
в десятичных дробях.
В последнее десятилетие XIX ст. был открыт электрон, частица
электричества почти в 2 000 раз более легкая, чем самый легкий
атом, и были изучены его свойства. В конце 1895 г. проф. Рентген
объявил о своем открытии х-лучей. В следующем году Беккерелю
удалось при изучении некоторых минералов обнаружить радиоак-
тивность. Встретилось явление, объяснение которого должно было
вызвать крушение неизменных атомов Дальтона. В 1906 г. Эйн-
штейн указал на соотношение между материей и энергией, которое
сразу навело на мысль о возможном превращении первой в послед-
нюю. Наконец, начиная с 1900 г., был открыт ряд явлений, относя-
щихся к взаимодействию света и материи; эти явления с несомнен-
ностью внушили представление о том, что свет скорее поток ато-
мов или квантов энергии, чем волнообразное движение. Так, на про-
тяжении менее чем двух десятилетий были сделаны открытия, кото-
рые должны были глубоко видоизменить основные теории физиче-
ских наук ив то же время настойчиво требовали от науки объяс-
нений в соответствующих областях.
Нашим знанием молекулярного строения вещества мы обязаны
главным образом физику, тогда как химик открыл атомистическую
природу молекулярного строения. То, что сделано химиком Мен-
делеевым, несомненно указало путь к раскрытию строения атома.
И однако в нашем знании этого строения наибольшее доверие мы
должны оказать физику. В своих основах физика представляет
собой науку, изучающую энергию, а химия — науку, изучающую
материю. Но ведь не может быть материи без энергии, и нет энергии,
если она не соединена каким-то образом с материей. Таким образом
нет ничего удивительного, что многое из нашего знания природы
энергии было получено из изучения материи и наоборот. Проблемы
химика и физика не разнородны. До начала настоящего столетия
физик главным образом интересовался частицами материи размера
молекулы и больше, тогда как химик рассматривал проблемы стро-
СТРОЕНИЕ АТОМОВ
167
ения молекул. Когда физиками были открыты частицы меньшего
размера, чем атомы, со стороны химиков было вполне естественно
признать их относящимися к своей области. Результатом было то, что
физики и химики соединили свои силы в изучении проблемы строения
атомов.
1. Прохождение электричества через газы. Как мы только что
указали, физики были пионерами в открытии частиц меньших, чем
атомы. К открытию этих частиц привело изучение проводимости
электричества газами. Газы при обык-
новенных давлениях чрезвычайно
- — J*___ плохие проводники электричества,
/| I । что с практической точки зрения
у * * J оказывается весьма удобным, ибо
в противном случае прохождение
Рис. 49. Катодная трубка. электрического тока через неизоли-
рованные металлические проволоки
было бы очень неэкономичным процессом. Чтобы заставить искру
проскочить между металлическими остриями, требуется высокое
напряжение, и острия эти должны во всяком случае находиться
довольно близко друг к другу. Всякий, кто имеет какое-нибудь
представление об устройстве запала в автомобиле, знаком с ин-
дукционной катушкой для получения необходимого вольтажа.
При атмосферном давлении воздух и газы в общем плохие про-
водники, но при высоком напряжении их проводимость увеличи-
вается, и тем больше, чем больше понижается давление, пока не до-
стигнет максимума понижения, после чего (при более низких давле-
ниях) проводимость снова умень-
шается. Прибор для проведения ис-
следований проводимости газов при
низких давлениях очень прост. Он
состоит из трубки (рис. 49), в которую
впаяны два металлических электрода
и которая снабжена боковым ответ-
влением, соединяющим ее с воздуш-
ным насосом. Если электроды соеди-
нены с вторичной обмоткой соответ-
ственной индукционной катушки, разряд будет иметь место по-
чти одновременно с тем, как начнет действовать воздушный насос.
Вначале разряд будет сопровождаться тихим треском и иметь
вид узких мерцающих линий между отдельными точками на
обоих электродах. Но по мере того как воздух будет выкачиваться,
разряд будет расширяться, пока не наполнит всей трубки. Бле-
стящее сияние покроет поверхность катода или отрицательного элек-
трода, около которого находится так называемое круксово темное
пространство. Блестящий цилиндр, называемый пучком положитель-
ных лучей (рис. 50), простирается от положительного электрода, или
анода, до фарадеева темного пространства. Пучок положительных лу-
чей обыкновенно разбивается на перемежающиеся более свет-
Рис. 50. Разряд в катодной трубке.
/ — пучок положительных лучей; 2
фарадеево темное пространство; J —
круксово темное пространство.
168
СТРОЕНИЕ АТОМОВ
лые и более темные слои, перпендикулярные к направлению раз-
ряда; эти слои расширяются, по мере того как давление воздуха
уменьшается.
Если давление понизится до порядка 0,001 мм, то пучок поло-
жительных лучей становится слабым и незаметным, а круксово темное
пространство увеличивается в объеме, пока не займет большую часть
пространства внутри трубки. Стеклянная стенка трубки, противо-
положная катоду, флуоресцирует зеленоватым светом. Некоторые
минералы, помещенные внутри круксова темного пространства, флу-
оресцируют светом характерной для них окраски. Темное простран-
ство пересекается лучами, которые называются катодными лучами.
Они проходят под прямыми углами к поверхности катода, незави-
симо от положения анода. Лучи эти можно слабо различить в виде
полос голубоватого света при пересечении ими круксова темного
пространства. Когда они доходят до стекла, появляется зеленоватая
флуоресценция. Эти лучи впервые были открыты Плюккером в
1859 г. и их свойства несколько лет позже были описаны Гитторфом.
Открытие природы этих катодных лучей дало науке первую возмож-
ность проникнуть в природу строения атома.
2. Природа катодных лучей. Природа этих лучей не сразу стала
очевидной. С первого взгляда они казались световыми. Но поспеш-
ные суждения в науке никогда не бывают надежными. Ведь свет
этих лучей мог быть вторичным действием, вызванным каким-либо
более основным явлением. В 1869 г. Гитторф между катодом, источ-
ником лучей, и стеклом помещал различные преграды и наблюдал
на стекле отчетливую тень их. Шесть лет спустя Гольдштейн под-
твердил эти результаты и заключил, что лучи эти были световые.
Однако в 1879 Уильям Крукс пропустил катодные лучи между по-
люсами электромагнита и заметил, что их прежнее прямолинейное
направление искривлялось. Для физика это было изумительным и
могло означать только одно: эти лучи представляют собою какую-то
материю, заряженную электрически. Свет никогда не ведет себя таким
образом. Объяснение этого явления, выдвинутое Круксом, оказалось
совершенно ошибочным. Он решил, что нашел четвертое состояние
материи, и предположил, что катодные лучи — лучистая материя.
3. Работы Дж. Дж. Томсона. Арена для выдающегося исследо-
вания Дж. Дж. Томсона, директора Лаборатории эксперименталь-
ной физики имени Кэвендиша в Кэмбридже, была подготовлена. Ему,
преемнику Кларка Максвелла и Рэлея, в возрасте 28 лет выпало
на долю объединить группу блестящих молодых физиков, которые
должны были под его руководством раскрыть тайны атома. Он от-
крыл, что катодные лучи могут отклоняться как в электрическом,
так и в магнитном поле, и что отклонение лучей происходит в сто-
рону положительно заряженной пластинки. Отсюда последовал вы-
вод, что они должны быть заряжены отрицательно. Затем, в апреле
1897 г., он доложил Королевскому обществу результаты своей двад-
цатилетней работы. Он показал, что катодные лучи состоят из ча-
стиц отрицательного электричества более легких, чем атом водорода.
СТРОЕНИЕ АТОМОВ
169
Он открыл существование частицы материи более легкой, чем самый
легкий из атомов Дальтона.
Посредством измерения отклонений, производимых магнитным
и электрическим полями известной силы, он получил возможность
вычислить не только скорость, с которой двигались эти частицы, но
и отношение их заряда е к массе их т. Найденное отношение е/т
оказалось равным 1,768 хЮ’ электромагнитных единиц на грамм.
Полученная величина для elm не зависела ни от металла, из ко-
торого сделан катод, ни от природы газа в трубке. Это доказывает,
что природа частиц отрицательного электричества при различных
металлических электродах одна и та же. Было также открыто уче-
ником Томсона Резерфордом, что е/т для бета-частиц, испускаемых
радиоактивными элементами, было тождественно с е/т для частиц
катодных лучей. Было найдено, что частицы того же рода испу-
скаются раскаленными металлическими нитями и окисями металлов, а
также при освещении металлов х-лучами. Во всех этих случаях
измеренное е/т было тождественно в пределах экспериментальных
ошибок, как это показано в табл. XXIII. Таким образом начали
накопляться строгие доказательства, с очевидностью свидетельство-
вавшие о том, что эти частицы должны находиться во всякой материи
и что, каков бы ни был их источник, сами они тождествены. Дж.
Джонстон Стоней еще в 1891 г. предложил название электрон для
«естественной единицы электричества». Это было еще до открытия
частиц в катодных лучах. Этот термин и был принят для этих частиц.
ТаблицаXXIII. Отношение elm, определенное
различными способами
Наблюдатели Источник частиц Эл.-магн. ед. (на грамм)
Классен Классен Вольтц Катодные лучи Нагретая окись кальция f-лучи из радия 1,774х 107 1,776х107 1,7б7х107
Хотя отношение заряда к массе е/т электрона н не дает нам
ни точных величин заряда, ни точной величины массы, тем не менее
оно весьма важно. Отношение е/т было установлено и для различ-
ных других заряженных частиц. Самая малая из них — ион водорода,
положительно заряженный атом водорода, который можно обнару-
жить в водных растворах всех кислот. Было найдено, что его е/т дт-
вечает 9649,4 электромагнитных единиц на грамм, что в 1830 раз
меньше чем 1,768х107, т. е. отношение е/т для электрона. Из этого
сравнения можно сделать два заключения: или заряд электрона при-
170
СТРОЕНИЕ АТОМОВ
близительно в 1830 раз больше, чем заряд иона водорода, причем
оба весят одинаково, или оба заряжены одинаково, но электрон
приблизительно в 1830 раз легче атома водорода. Если бы оказа-
лось справедливым последнее, в таком случае была бы найдена ча-
стица материи более легкая, чем самый легкий атом. Единственный
способ открыть, какая из двух альтернатив правильна, —это опре-
делить непосредственно массу электрона или же определить его за-
ряд и, поставив последний вместо е в отношении е/т, вычислить
массу.
4. Определение заряда электрона. Заряд электрона впервые был
определен Таунсендом в 1897 г. и независимо от него К. Т. Р. Уиль-
соном. Оба работали в лаборатории имени Кэвендиша в Кембридже,
директором которой был Томсон. Наиболее точные определения
заряда электрона были сделаны Робертом Эндрьюсом Милликэном.
За эту работу, начатую в университете в Чикаго в 1909 г., он полу-
чил нобелевскую премию по физике. Милликэн вычислил величину
заряда на заряженных электричеством капельках масла по данным,
полученным измерением скоростей их падения под влиянием силы
тяжести и поднятия между заряженными латунными пластинками.
Он нашел, что заряд на каждой капельке должен быть равен или за-
ряду электрона или кратному целому его. Если например заряд на
капельке состоит из 9 электронов, он очевидно должен быть в 9 раз
больше, чем заряд 1 электрона. Если взять наибольший общий мно-
житель величин зарядов на многих масляных капельках, то можно
получить величину заряда 1 электрона. Эта величина могла бы ко-
нечно быть зарядом 2 или даже 3 электронов при условии, что не
изучались капельки с зарядами менее 2 или 3 электронов, но прибли-
зительная величина е, полученная другими методами, во всяком
случае согласуется с величиной, найденной Милликэном. Вычислен-
ная им с наибольшей точностью величина заряда электрона равна
4,774хЮ*10 электростатических единиц.
Крайне важной чертой этих экспериментов было то, что хотя
заряд на капельке мог быть или положительным или отрицательным,
однако независимо от своего знака, по величине он был целым, крат-
ным заряда одного электрона. Это было убедительным доказательством
того, что положительное электричество также состоит из единичных
зарядов, равных по величине заряду одного электрона. Следователь-
но, по всей вероятности, существуют как отрицательные электроны,
так и соответствующие им положительно заряженные частицы.
Об этих положительно заряженных частицах или протонах, как
их иногда называют, будет сказано подробнее в одном из следующих
параграфов.
5. Вычисление массы электрона. Мы знаем, что е/т— отношение
заряда электрона к его массе — равно 1,768 Х107 электромаг-
нитных единиц на грамм. Так как в настоящее время е определено,
то можно вычислить массу электрона т:
е/ п —1,768 х 107 эл.-магн. ед. на 1 г =5,304 х 1017 эл.-стат. ед. на 1
СТРОЕНИЕ АТОМОВ
171
е=4,774х1010 эл.-стат. ед.
Отсюда
4,774 х 10 —40 эл.-стат. ед. - о„. ,Л1, , _
— ---------—------------- 5,304 х 1017 эл.-стат. ед. на 1 г;
4 774 v 10“ 10
"° Шхц.' =0'9001 * |,г'л
т = 9,001 х 10-“ г.
Масса атома водорода (1,650 х 10—24 г) до открытия электрона
была наименьшей известной массой. Электрон легче в 1,833
раза. Тысяча миллионов миллионов миллионов миллионов элект-
ронов весят немного более одного грамма.
Допустив некоторые предположения, возможно вычислить вели-
чину радиуса электрона; она будет равна2х 10~13 см. Это меньше
радиуса атома почти в 50 000 раз. Это вычисление сделано на основа-
нии предположения, что электрон по своему виду шарообразен.
Относительно существования электронов в любом веществе больше
не может быть никаких сомнений. Проводимость электричества га-
зами, растворами, металлами, происхождение х-лучей, различные
оптические явления и многие другие физические и химические явле-
ния указывают на их существование.
6. Положительно заряженные частицы, или протоны. Откры-
тие электронов в катодной трубке естественно привело к поискам
лучей,исходящих из анода, которые могли бы состоять из положитель-
но заряженных частиц. При умеренно низких давлениях (порядка
0,1 мм) в круксовой трубке замечается яркая оболочка фиолетового
цвета, окружающая катод, но не касающаяся его. По мере того как
давление уменьшается, внутренняя поверхность оболочки отодви-
гается от катода, пока — при очень малых давлениях — между ка-
тодом и внутренней оболочкой с фиолетовым цветом не получится
расстояние приблизительно в 2 см. Одновременно из внутренней по-
верхности оболочки начинают исходить по направлению к катоду
лучи оранжевого цвета; по мере приближения их к катоду яркость
их становится более сильной. Что эти лучи возникают в оболочке и
движутся по направлению к катоду, может быть доказано, если между
внутренней поверхностью оболочки и катодом поместить какой-ни-
будь предмет. Отчетливая определенная тень предмета будет брошена
на поверхность катода. То, что эти лучи движутся по направлению
к катоду, сразу наводит на мысль, что -они могли бы состоять из поло-
жительно заряженных частиц, похожих по своей природе на элек-
троны, но с противоположным зарядом.
В 1886 г. немецкому физику Гольдштейну, который пользовался
катодом с отверстиями в виде цилиндрической трубки или канала,
удалось получить пучок этих положительных лучей позади катода
(рис. 51). Лучи, пройдя через канал, могут продвинуться на несколь-
ко сантиметров в пространство позади катода. Эти лучи известны
под названием каналовых. Их исследовали так же, как были иссле-
дованы катодные лучи, т. е. способом отклонения посредством магнит-
172
СТРОЕНИЕ АТОМОВ
ного и электрического полей. Скорость частиц, из которых состоят
каналовые лучи, во много раз меньше скорости электронов катодных
лучей. Отношение их заряда к массе (е/т) значительно меньше и из-
меняется в зависимости от природы газа, находящегося в трубке.
Когда в трубке находится водород, частицы несут положительные
заряды, каждый из которых равен по величине (но не по знаку)
заряду электрона. Масса же каждой частицы, несущей положитель-
ный заряд, равна массе атома водорода. В случае других газов, из
частиц которых состоят каналовые лучи, соответственные атомы} этих
газов несут один положительный заряд или более. Ни в каком слу-
чае нельзя было изолировать единичный положительный заряд, свя-
занный с массой меньшей, чем масса атома водорода *. Совершенно
очевидно, как мы увидим в следующей главе, что нейтральный атом
водорода состоит только из одного
протона и одного электрона. Таким
образом протон можно рассматри-
вать как атом водорода, лишенный
своего электрона.
7. Сравнение электрона с прото-
ном. Постараемся теперь суммиро-
вать то, что мы узнали об элект-
роне и протоне. Электрон предста-
вляет собой единичный заряд отри-
цательного электричества (4,774 X
X 10-10эл.-ст. ед.) с массой (9,001 х 10-28 г), приблизительно в 1 800
раз меньшей, чем масса атома водорода. Радиус его порядка
2хЮ-18 см или приблизительно в 50 000 раз меньше радиуса наи-
меньшего атома (водорода). Протон имеет единичный заряд поло-
жительного электричества, равный по количеству заряду электрона,
но с противоположным знаком. Так как атом водорода состоит только
из одного электрона и одного протона, ясно, что масса протона прак-
тически равна массе атома водорода и следовательно приблизитель-
но в 1 800 раз более массы электрона. Радиус протона вероятно
не более 10-18 см,что приблизительно в 1 800 раз меньше величины
радиуса электрона. Протон таким образом в 1 800 раз тяжелее, но
в 1 800 раз меньше по размерам, чем электрон.
8. Работы Мозелея. Рассмотрим теперь вопрос о числе положи-
тельных и отрицательных зарядов в атоме какого-либо данного
элемента. В окопах Галлиполи, летом 1915 г., нашел мгновенную
смерть от пули Мозелей, один из самых блестящих молодых англий-
ских физиков. Незадолго до смерти в возрасте 27 лет он завершил
исследование, которое является одним из самых важных за пос-
ледние истекшие полвека.
Если поток катодных лучей расположить так, чтобы он попал
на какое-либо препятствие, останавливающее электроны, то воз-
“ В 1933 г, было доказано существование частиц, имеющих ту же массу, что
и электрон, но заряженных положительно, так называемых позитронов. Абсолют-
ная величина заряда позитрона равна заряду электрона. Ред.
СТРОЕНИЕ АТОМОВ
173
никают х-лучи (лучи Рентгена) с частотами (частотами колебаний
излучения в секунду), характерными для того элемента, из ко-
торого состоит препятствие. Мозелей пользовался препятствиями
или антикатодами из большинства известных элементов и измерял
частоты х-лучей, испускаемых в каждом случае. Если элементы рас-
положены в порядке увеличивающейся частоты характерных х-лу-
чей, испускаемых ими, то они образуют ряд, в котором последова-
тельность элементов будет та же, что и последовательность их в пе-
риодической системе. Мозелей указал для каждого из известных
элементов атомное порядковое число, обозначающее место элемента
в этом ряду. Эти атомные порядковые числа приведены в табли-
це, помещенной в гл. XV (стр. 162) вместе с соответствующими'
атомными весами. Последовательность, в которой следуют эле-
менты, расположенные в порядке возрастания их атомных
весов, отвечает порядку возрастания атомных
чисел, за исключением аргона и калия, ко- -
бальта и никеля, теллура и иода; в этих слу-
чаях порядок должен быть обратный. Сле-
дует напомнить, что эти исключения вызывали
затруднения в связи с проблемой отыскания
надлежащих мест для элементов, входящих
в периодическую таблицу (стр. 163). Порядок
их атомных весов должен был быть обратным,
чтобы, руководствуясь свойствами этих элемен-
тов, Поместить их в подходящие для них группы
таблицы. Однако порядок атомных чисел ставит
каждый элемент на подобающее ему место. На
рис. 52 показан ряд фотографических снимков
33
34
33
37
Зв
At
5е
Sr
Sr
Рис. 52. Спектры х-лу-
чей.
Ab
с соответствующих линий в рентгеновых спектрах ряда элемен-
тов от атомного числа 33 до числа 38. Спектр криптона —газа с атом-
ным порядковым числом 36 — не включен сюда, так как очевидно,
что для него нельзя найти никакого антикатода. Положение линий
по горизонтальной оси фотографического снимка соответствует
частоте колебаний линии. Мозелей нашел, что квадратный корень
из частоты колебаний характерной линии в спектрах элементов
изменяется прямо пропорционально атомным порядковым числам
соответствующих элементов. Таким образом, если нанести квад-
ратный корень из этих частот на график по отношению к атом-
ным числам соответствующих элементов, получается почти прямая
линия, указывающая на прямую пропорциональность (рис. 53).
Значение атомных порядковых чисел Мозелея заключается в том,
что частота колебаний световых лучей, испускаемых атомами ка-
кого-либо данного элемента, определяется строением этих атомов,
т. е. расположением и числом электронов, входящих в состав каждо-
го атома. Атомное число какого-либо элемента должно быть связано
известным образом со строением его атомов. Еще раньше работ Мо-
зелея голландский физик ван-ден-Брок пришел к мысли, что коли-
чество электронов в атоме какого-либо элемента равно его порядко-
174
СТРОЕНИЕ АТОМОВ
вому числу в ряду элементов, расположенных по их атомному весу.
Позднее, на основании работ Резерфорда о рассеивании альфа-
частиц из радиоактивных элементов и теории Бора о строении атомов,
стало ясно, что атомное число какого-либо элемента равно числу
положительных зарядов ядра его атома и также числу электронов,
расположенных вне ядра.
9. Нуклеарный атом по Резерфорду. Одной из самых ранних
моделей строения атомов была модель, предложенная лордом Кельви-
ном и развитая Дж. Дж. Томсоном. Она представляла атом со-
стоящим из положительного электричества, в котором электроны
вращались по круговым концентрическим орбитам различных радиу-
сов. В 1911 г. Резерфорд доказал, что эта картина была неправильна
и что положительное электричество всякого атома сконцентрировано
в чрезвычайно малом ядре в центре атома, вокруг которого вращаются
Рис. 53. Атэмные числа, как
функция частот колебаний х-лу-
чей.
электроны. Его метод исследования
состоял в применении альфа-частиц,
испускаемых каким-либо радиоактив-
ным элементом. Каждая из этих частиц
заряжена положительно количеством
электричества, равным заряду 2 прото-
нов. Их масса приблизительно в 4 раза
тяжелее массы протона и следовательно
приблизительно в 7 300 раз тяжелее
массы электрона. Такие частицы вы-
брасываются с необыкновенными скоро-
стями атомами некоторых радиоактив-
ных элементов. Поток этих частиц пропу-
скался через маленькое отверстие в хо-
рошо эвакуированной камере и падал
на экран из сернистого цинка. По мере
того как это вещество под влиянием
бомбардировки альфа-лучей флуорес-
цировало, на экране появлялось блестящее пятно, края которого
отчетливо обозначались. Затем над отверстием помещалась тонкая
металлическая пластинка известной плотности так, чтобы поток
альфа-частиц для достижения экрана должен был пройти через пла-
стинку. В силу своей большой скорости и благодаря существованию
промежутков между атомами и внутри атомов металла, из ко-
торого была сделана пластинка, альфа-частицы проходили через
нее легко. Однако светлое пятно на экране из сернистого цинка уже
не было видно отчетливо; оно расширялось настолько, что запол-
няло большую часть площади экрана. Иногда можно было открыть
мгновенные вспышки света на некотором расстоянии от главного
светлого пятна. Это указывало на то, что, проходя через металличе-
скую пластинку, альфа-частицы допускали многочисленные откло-
нения от своего первоначального прямолинейного пути. Действи-
тельно, в некоторых случаях отклонение оказывалось настолько
большим, что какая-либо случайная частица могла, отскочив от пла-
СТРОЕНИЕ АТОМОВ
175
стинки, остаться на той же стороне, с какой она неслась к пластинке.
Прилагая теорию вероятности к анализу этих отклонений, можно
было удостовериться, что более значительные отклонения, когда
направление пути частицы изменялось в обратную строну, обуслов-
ливались отталкивательным действием зарядов положительного
электричества, сконцентрированного в необычайно малых объемах.
Это и были ядра атомов. Рис. 54 помогает нам мысленно построить
механизм этих отклонений. Первая и третья альфа-частицы прибли-
жаются достаточно близко к электронам, чтобы быть притянутыми
ими и вследствие этого получить изменение своего пути. Вторая аль-
фа-частица, приближаясь к ядру атома, с силой отталкивается и обна-
руживается на той же стороне металлической пластинки. Произво-
дя дальнейшие опыты, Резерфорд был в состоянии показать, что диа-
метры ядер атомов были порядка от
Ю-1’ до 10-ls см. Ему* удалось так- - —
же, прилагая теорию вероятности 7* -
к наблюдаемому рассеиванию альфа- •' *.
частиц, вычислить количество поло- —X
жительных зарядов в ядрах атомов *2 I
металла. По отношению к каждому 4°— -
металлу, из которого были сделаны — —
различные пластинки, было найдено, «. •- ••
что положительный заряд ядра onto- Рис. 54. пР ,хожд..ше а- истиц
ма металла должен быть равен чеРез тонкий слой металла.
атомному порядковому числу металла.
10. Прохождение альфа-частиц через воздух. Отвечающие дей-
ствительности фотографические снимки с путей альфа-частиц че-
рез воздух были получены благодаря остроумному способу, пред-
ложенному К. Т. Р. Уильсоном. Какая-нибудь альфа-частица, про-
ходя через воздух, в действительности проходит через те атомы газа,
которые лежат на ее пути. Во время этого прохождения она часто
приводит в колебание атом, освобождает электрон, оставляя таким
образом за собой заряженные атомы или ионы или, как говорят, иони-
зируя воздух на своем пути. Если газ пересыщен водяным паром,
эти ионы действуют как центры, на которых сгущаются пары воды
в виде маленьких капелек. Путь альфа-частицы определяется таким
образом нитью тумана, которую она оставляет за собой. Осветив
камеру, можно зафиксировать эту нить тумана на фотопластинке.
Пути представляют собой почти прямые линии; некоторые имеют
длину 7 см. Однако близко к концу пути, когда быстрота движения
частицы значительно уменьшается, можно было найти отклонения
от прямой линии. Под конец скорость движения альфа-частиц
становится настолько медленной, что частица перестает ионизировать
атомы, через которые она проходит, никакого сгущения влаги уже
не наблюдается, и пути альфа-частиц нельзя больше фотографиро-
♦ Точнее, его ученику Чэдвику. Ред.
176
СТРОЕНИЕ АТОМОВ
вать. Было вычислено, что, проходя в воздухе 7 см при нормаль-
ном давлении, альфа-частица проходит приблизительно через
130 000 молекул. Мы имеем следовательно убедительное доказатель-
ство того, что положительное электричество какого-либо атома не
распределено по целому атому, но сконцентрировано в очень малом
объеме — в центре атома.
11. Число планетарных электронов. До сих пор мы узнали,
что число единичных положительных зарядов в ядре какого-либо
атома равно его порядковому числу, что объем ядра чрезвычайно
мал, что оно действует подобно солнцу, около которого вращаются
планетарные электроны. Так как атомы элемента, не находящегося
в химическом соединении, электрически нейтральны, то число этих
планетарных электронов должно быть равно положительному за-
ряду в ядре, а следовательно атомному порядковому числу эле-
мента.
12. Строение атома водорода. Теперь мы можем рассмотреть
строение самого простого из атомов — атома водорода. Порядковое
число этого элемента равно единице и таков же практически его атом-
ный вес. Таким образом атом водорода должен состоять из един-
ственного протона в качестве ядра и единственного планетарного
электрона. Так как протон приблизительно в 1 800 раз тяжелее
электрона, то вся масса атома практически сводится к протону. Да.-
лее мы знаем, что относительно бо’лее тяжелый протон имеет в 1 800
раз меньший объем, чем объем электрона. Эти две частицы представ-
ляют собой всю материю, находящуюся в атоме водорода. Радиус
атома водорода — порядка 10-8 см, а это приблизительно в 50 000
раз больше радиуса электрона (2х 10-13 см) и в 100000000 раз боль-
ше радиуса протона. Другими словами, атом водорода главным
образом состоит из одной относительно незначительной частицы отри-
цательного электричества, вращающейся на некотором расстоянии
вокруг еще более ничтожного ядра, заряженного положительным
электричеством. Если бы атом водорода был увеличен до такого раз-
мера, что расстояние между его электроном и его протоном имело бы
размер порядка расстояния между Нью-Йорком и Филадельфией (ок.
150 км), тогда при том же масштабе его электрон был бы величиной
в 3-метровый шар, вращающийся вокруг ядра-протона размера
средней дробинки.
13. Атом гелия. Гелий—следующий за водородом элемент, сле-
довательно порядковое число гелия будет равно 2. Это пока-
зывает, что в каждом его атоме находятся 2 планетарных электрона
и что заряд на его ядре будет 4-2, иными словами, этот заряд равен
заряду двух протонов. Его атомный вес, равный 4, указывает, что
он в 4 раза тяжелее атома водорода. Как мы знаем, практически вес
какого-либо атома сводится к весу находящихся в нем протонов, так
как протон приблизительно в 1800 раз тяжелее электрона. Так как
вес атома водорода практически равен весу 1 протона, а атом гелия
в 4 раза тяжелее атома водорода, то атом гелия должен содер-
жать 4 протона. Однако 4 протона дали бы заряд 4-4 в ядре, между
СТРОЕНИЕ АТОМОВ
177
тем как порядковое число гелия указывает на заряд 4-2. Этот оче-
видный парадокс может быть объяснен тем, что ядро атома гелия
содержит электроны. Если каждое ядро содержит 2 электрона и
4 протона, то его положительный заряд будет 2, что согласуется с
порядковым числом гелия и с тем, что его атомный вес в 4 раза тя-
желее атома водорода. Мы таким образом должны представить се-
бе атом гелия состоящим из 2 планетарных электронов, вращаю-
щихся вокруг ядра, в состав которого входит 4 протона и 2 элек-
трона *.
14. Другие атомы. В общем порядковое число какого-либо
элемента указывает на число его планетарных электронов и величину
заряда его ядра. Например элемент алюминий имеет атомное по-
рядковое число 13. Его атом состоит следовательно из 13 (порядко-
вое число) планетарных электронов и из ядра с положительным за-
рядом 13 (порядковое число).
15. Расположение планетарных электронов. Не может быть
сомнения в том, что планетарные электроны расположены в атоме
в известном порядке. Что касается самого порядка такого располо-
жения, то на этот счет мы имеем мало определенных данных; то,
что кажется ясным, может все же быть истолковано несколькими
различными путями. При разрешении этой проблемы пользовались
двумя методами. Метод, основанный на химических данных, глав-
ным образом развитый Дж. Н. Льюисом и Ирвингом Лэнгмьюром,
дал очень правдоподобное объяснение таких явлений, как перио-
дичность элементов и валентность. Физики, с другой стороны, раз-
вили теорию расположения планетарных электронов, основанную
на таких данных, как природа света, испускаемого излучающими
атомами. В следующей главе мы постараемся изучить картину строе-
ния атома, предложенную химиками, и отложим обсуждение точки
зрения физиков до тех пор, пока не познакомимся с природой лучи-
стой энергии.
♦ В настоящее время (1934 г.) помимо электронов и протонов известны еще
другие частицы, которые по крайней мере формально можно было бы рассматривать
как структурные элементы атома. Это—уже упоминавшиеся раньше (см. примеча-
ние на стр. 172) позитроны (открыты в 1932 г. Андерсеном, Блеккеттом и Оккиа-
лиани) и нейтроны (открыты в 1932 г. Иреной Кюри и Жолио и Чэдвиком). Ней-
троны — частицы, лишенные вовсе электрического заряда и имеющие массу,
равную массе протона.
Эти открытия заставили пересмотреть прежние взгляды на строение ядра
атома. Относительно строения ядра атома гелия например могут быть с формаль-
ной точки зрения высказаны следующие предположения:
1. Ядро состоит из 4 протонов и 2 электронов (первоначальная гипотеза).
2. Ядро состоит из 4 нейтронов и 2 позитронов.
3. Ядро состоит из 2 нейтронов и 2 протонов.
Какое из этих предположений соответствует действительности — вопрос
нерешенный. Впрочем имеются весьма веские соображения, говорящие против
первой из высказанных гипотез; ряд авторов высказывается за то, что в ядре нет
электронов. Ред.
12 Введение в химию.
178
ПЛАНЕТАРНЫЕ ЭЛЕКТРОНЫ
ГЛАВА XVII
ПЛАНЕТАРНЫЕ ЭЛЕКТРОНЫ
Физики и химики всегда были согласны относительно величины
заряда ядра какого-либо атома и числа его планетарных электронов.
Примерно вплоть до 1925 г. несогласие сводилось к тому, как ведут
себя планетарные электроны. Химики и физики решали проблему
о строении атомов различными путями; первые — изучением хими-
ческого поведения и особенно валентностей элементов,.последние —
рассмотрением природы света, испускаемого светящимися парами
элементов. Эти различные пути приводили прежде всего к различ-
ным изображениям одних и тех же атомов. Чтобы объяснить химиче-
ские свойства и активность какого-либо элемента в частности его
валентность, химики находили нужным предполагать, что планетар-
ные электроны или закреплены в пространстве вокруг ядра или
колеблются около неподвижных в отношении ядра точек. Физики
справедливо указывали, что такое строение атомов было бы дина-
мически непрочно и наверное привело бы к разрушению его,
так как электроны упали бы на ядро, и это падение, поскольку тут
принимает участие материя, вызвало бы губительные последствия.
Физики создали динамическую модель, по которой электроны вра-
щаются по круговым и элиптическим орбитам вокруг ядра. В послед-
ние годы, по мере того как химики все более овладевали физикой,
динамическая модель физиков становилась общепринятой. Однако
в продолжение немногих самых последних лет физики отклонили
все механические модели строения атома и развили новую механику,
совсем не дающую никакой картины строения атома, но объясняю-
щую его свойства в терминах математических функций, пока еще
не имеющих физического значения.
Таким образом в настоящее время существуют три пути интер-
претации строения атома. Первый — статическая модель химиков.
Относительно этого пути каждый согласится, что его недостаточно
для объяснения всех свойств атома. Однако благодаря его простоте
им широко пользуются химики, да в некоторых случаях и физики,—
для того чтобы наглядно представить некоторые характерные свой-
ства атомов. Второй путь — динамическая модель физиков, которой
пользуются, чтобы объяснить многие из оптических свойств атомов.
Наконец третий путь — наиболее современный метод исследования
поведения электронов — волновая механика. В настоящей главе
мы рассмотрим статическую модель атома, которая для поставлен-
ных нами в этой книге целей будет весьма полезной. Следует однако
постоянно помнить, что пользоваться этой моделью нужно с ого-
ворками. Динамическую модель мы рассмотрим в одной из даль-
нейших глав. Волновую механику мы совсем не можем рассматри-
вать, так как связанные с ней математика и физика всецело на-
ходятся за пределами целей, преследуемых элементарным руко-
водством.
ПЛАНЕТАРНЫЕ ЭЛЕКТРОНЫ
179
Ирвинг Лэнгмьюр.
1. Теория Льюиса-Лэнгмьюра. Химическая теория располо-
жения элементарных электронов первоначально была развита Кос-
селем в 1916 г. и Дж. Н. Льюисом в том же году. В 1919 г. она была
значительно расширена и видоизменена Ирвингом Лэнгмьюром.
Главным образом она основана на периодической системе и на валент-
ностях элементов в группах этой системы.
Благодаря Дж. Дж. Томсону получило впервые признание
предположение, что планетарные электроны расположены на сфери-
ческих оболочках вокруг ядра. С по-
мощью математического анализа ему
удалось показать, что есть предел
числу электронов, которые могут
поместиться на поверхности одной
сферической оболочки с ядром ка-
кого-либо данного положительного
заряда в центре. Когда это число
превзойдено, то электроны сами пере-
распределяются вновь на оболочках.
Путеводная нить к числу электронов,
которые может удержать данная обо-
лочка, дается строением химически
недеятельных газов нулевой группы
периодической системы и валентно-
стями элементов.
Единственный электрон атома
водорода находится на самой близ-
кой к ядру оболочке. Два электрона атома гелия находятся так-
же на той же оболочке. Гелий является одним из элементов ну-
левой группы, все элементы которой абсолютно недеятельны хими-
чески, т. е. они не выказывают никакой склонности к образованию
соединений с
Рис. 55. Атом
аргона.
другими элементами. Это свидетельствует о необыкно-
венной устойчивости атомного строения; таким
образом 2 электрона в оболочке атома гелия пред-
полагаются завершающими норму этой оболочки.
Атом лития (атомный номер 3) содержит 3 плане-
тарных электрона, из которых 2 помещаются на
внутренней оболочке и 1 на второй. Атомы осталь-
ных элементов второго периода (см. периодическую
систему) — бериллий (атомный номер 4), бор (5),
углерод (6), азот (7), кислород (8), фтор (9) и неон
(10) — имеют (каждый из них) 2 электрона во
внутренней оболочке и, соответственно, Be—2, В—3, С—4, N—5,
О—6, F—7 и Ne—8 электронов во второй оболочке. Неон, по-
следний элемент этого периода, является другим недеятельным
Элементом нулевой группы, следовательно 8 электронов его вто-
рой оболочки должны быть нормой для этой второй оболочки.
В следующем периоде, содержащем в себе элементы от натрия (атом-
ный номер 11) до аргона (18), атомы каждого элемента состоят из
12*
180
ПЛАНЕТАРНЫЕ ЭЛЕКТРОНЫ
2 электронов в первой и 8 электронов во второй оболочках с электро,
нами в третьей оболочке от 1 у натрия и до 8 у аргона. Снова 8 элек-
тронов оказываются нормой для третьей оболочки, так как аргон —
инертный газ нулевой группы. Если бы 8 электронов второй и 8
электронов третьей оболочек должны были образовать наиболее сим-
метрическое расположение в пространстве, они заняли бы углы вооб-
ражаемых кубов. Таким образом электроны атома аргона можно бы
было вообразить сгруппированными так, как это.изображено на рис. 55
Таблица XXIV. Строение атомов элементов 1,2 и 3 периодов
Следует напомнить, что на этом чертеже расстояния между
электронами и между электронами и ядром изображены не по мас-
штабу. Если придерживаться масштаба, равняясь по электронам, то
сторона, изображенная ближе всего к нам, должна была бы содер-
жать сотни метров от одного электрона до другого, а ядро пришлось
бы отыскивать с помощью микроскопа. Табл. XXIV показывает
строение атомов элементов первого, второго и третьего периодов.
Четвертый период будет первым длинным периодом и содержит
ПЛАНЕТАРНЫЕ ЭЛЕКТРОНЫ
181
18 элементов. Расположение электронов на четвертой оболочке свя-
зано с затруднениями, с которыми можно будет справиться легче, по-
сле того как мы попытаемся разъяснить механизм, с помощью кото-
рого атомы соединяются и удерживаются в молекулах соединений.
2. Образование химического соеди-
Ne(t) ci(t)
Рис. 56.
нения. Атомы инертных газов нулевой
группы не образуют никаких соедине-
ний с атомами других элементов. Это
обусловливается, как полагают, на-
столько устойчивым расположением
планетарных электронов в атомах этих
газов, что для них не получается ника-
кого выигрыша ни от потерь, ни от при-
бавления лишних электронов. Каждая сболочка этих атомов,
содержащая электроны, содержит их нормальное количество. С дру-
гой стороны, внешние сболочки атомов всех других элементов не-
полны, и предполагается, что этот факт дает объяснение химической
активности этих элементов. Соединяясь с другими атомами, атомы
этих элементов стремятся получить устойчивое расположение элект-
ронов, характерное для
недеятельных газов ну-
левой группы. Это и до-
стигается прибавлением,
потерей или образованием
общих электронов. Попро-
буем например предста-
вить наглядно, что проис-
ходит, когда элемент на-
трий соединяется с элемен-
том хлором, образуя хло-
ристый натрий. Это хими-
ческое изменение состоит
в соединении 1 атома на-
трия с 1 атомом хлора. На
рис. 56 показано строение
реагирующих атомов. Оба
эти атома нейтральны (±)
электрически, так как чи-
сло планетарных электро-
нов равно чистому заряду
в ядре в обоих случаях.
Однако ни в том, ни в другом случае внешняя оболочка не
содержит полного нормального числа электронов. Чтобы полу-
чить устойчивое расположение электронов одного из недеятель-
ных газов нулевой группы, атом натрия должен был бы или
потерять 1 электрон и таким образом уподобиться неону или при-
обрести 7 электронов и уподобиться аргону (рис. 57). Подобным же
образом атом хлора, приобретая I электрон, уподобился бы недеЯ’
182
ПЛАНЕТАРНЫЕ ЭЛЕКТРОНЫ
тельному газу аргону, а теряя 7 электронов, стал бы похожим на
неон (рис. 57). Можно вообразить следовательно, что атомам натрия
и хлора как бы предназначено итти навстречу нуждам друг друга,
ибо, отдавая 1 электрон из своей внешней оболочки атому хлора,
атом натрия приобре-
тает устойчивое рас-
положение
нов атома
электрон,
мый таким
хлором,
единственное пустое
пространство на вне-
шней оболочке атома
хлора. Теряя 1 эле-
ктрон, атом натрия
приобретает единич-
ный положительный
заряд, так как этот
атом теперь содержит
только 10 электро-
нов, а заряд его ядра
остается равным 4-11.
С другой стороны,
атом хлора, приобре-
заряженным, так как
Нейтральный атам
ейободшго хлора
Нейтральный атам
Мойного катрш
Нейтялыии молекула ллюиапого натра,
истишал из положительно зараженном
атома натрия и отрииательно зарохеа-
юга атома лларя, еоеОиненных Орце с top-
им алой тюпроатитпаши аритяжемя
Рис. 58.
электро-
неона, а
получае-
способом
заполнит
фтор
тая 1 электрон, становится отрицательно
теперь у него 18 планетарных электронов и заряд 4-17 в ядре.
Два атома соединяются в силу электростатического притяжения
между противоположными зарядами. Механизм соединения 2 атомов
изображен на рис. 58.
3. Строение атомов и валентность. Теперь мы в состоянии
рассмотреть вопрос о природе валентности, так как всякое предпо-
ложение относительно того, как атомы
соединяются друг с другом, должно
быть в состоянии объяснить и их ва-
лентность или способность соединяться
в определенных количественных отно-
шениях. Когда валентность рассматри-
валась выше, мы узнали, что 1 атом
натрия соединяется с 1 атомом хлора
и следовательно каждый элемент был
одновалентен. Соединение этих атомов
узнали в предшествующем параграфе, потерей атомом натрия 1 эле^
ктрона и получением этого электрона атомом хлора. Каждый
атом становится заряженным единичным зарядом электричества
в силу перенесения одного электрона от одного нейтрального
атома к другому. Таким образом валентность какого-либо эле-
мента в соединении равна электрическому заряду атома этого
Магма
Рис. 59.
обусловливается, как мы
ПЛАНЕТАРНЫЕ ЭЛЕКТРОНЫ
183
фтор (-1)‘
Намой
элемента. Рассмотрим еще несколько примеров этого же рода.
Атомы магния двухвалентны, а атомы фтора одновалентны. Строение
нейтральных атомов этих элементов до соединения представлено
на рис. 59.
Каждый атом магния имеет 2 электрона
на своей внешней оболочке, которые он мо-
жет потерять, и каждый атом фтора имеет
на своей внешней оболочке только одно
свободное место, которое может быть запол-
нено (рис. 59). Таким образом 1 атом маг-
ния отдаст по 1 электрону каждому из 2
атомов фтора (рис. 60).
Еще один пример: в молекуле сернистого натрия 2 атома однова-
летного натрия соединяются с 1 двухвалентным атомом серы. Соеди-
нение этих атомов изображено на рис. 61.
В общем когда атомы металлов соединяются с атомами неметал-
лов, происходит перенесение электронов с атомов металла на атомы
неметалла. Атомы металла следовательно остаются полржительно
заряженными, а атомы неметалла приобретают отрицательный заряд.
Валентная «связь» в таких случаях есть связь электростатического
фторМ)>
Рис. 60.
притяжения между противо-
положно заряженными ато-
мами. Валентные связи этого
рода называются поляр-
ными.
В каждом из трех рас-
смотренных нами примеров
металл соединяется с неме-
таллом, причем атомы метал-
ла теряют электроны, кото-
рые приобретаются атомами
неметаллов. Следует напом-
нить, что металлы находятся
в группах периодической си-
стемы с более низкими нуме-
рами и поэтому число эле-
ктронов на внешних оболоч-
ках их атомов в общем мень-
ше половины нормы электро- Рис- 61.
нов для оболочки инертного
газа (табл. XXIV). Будет логично ожидать, что атомы металлов
станут стремиться скорее опустошить свои внешние оболочки,
уступая электроны атомам, с которыми они соединяются, чем
пополнить эту оболочку, приобретая дополнительные электроны.
Теряя электроны, атомы металлов станут положительно заряжен-
ными, другими словами, будут обнаруживать положительную вален-
тность. Величина этого положительного заряда (валентности) бу-
дет равна числу электронов, потерянных с внешней оболочки. Так,
184
ПЛАНЕТАРНЫЕ ЭЛЕКТРОНЫ
атомы не находящихся в соединении элементов в группе I перио-
дической системы имеют по I электрону на своих внешних оболоч-
ках; когда этот электрон при соединении с другими атомами теряется,
то и атомы приобретают единичный положительный заряд, другими
словами, положительную валентность -|-1. Подобным же образом ме-
таллы группы 11 обнаруживают валентность -|-2, так как их атомы те-
ряют 2 электрона со своих внешних оболочек, когда соединяются
с атомами других элементов, и так далее для других групп
металлов.
Неметаллы, с другой стороны, находятся в группах с более вы-
сокими номерами. Поэтому внешние оболочки их атомов содержат
почти все, приходящееся на долю этих оболочек, нормальное коли-
чество электронов. Стало быть, когда атомы неметаллов соединяются
с атомами металлов, существует большее стремление скорее приобре-
сти, чем потерять электроны. При таких обстоятельствах атомы не-
Рис. 62. Неполярная связь.
цательную валентность. Отрицательная валентность неметалла
равна числу электронов, которые атом неметалла должен получить,
чтобы пополнить норму электронов своей внешней оболочки. Отсюда
характерная валентность неметаллов группы IV будет —4; группы
V —3; группы VI —2; группы VII —1.
В общем металлы не соединяются друг с другом, точно так же
как и неметаллы не соединяются с другими неметаллами. Когда такие
соединения все же образуются, электроны по всей вероятности не
переходят от одного рода атомов к другому, но здесь возможно имеет
место другой, отличный от рассмотренного нами вид соединения.
4. Неполярные связи. Во многих случаях при соединении ато-
мов не происходит действительного перехода электронов. Напри-
мер когда металлы или неметаллы соединяются с кислородом или
когда неметаллы соединяются друг с другом, то участвующие в этих
реакциях атомы достигают устойчивого строения одного из недея-
тельных элементов в силу образования общих пар электронов атомами
соединяющихся элементов. Этот вид соединения легче изобразить,
4ем описать. В качестве примера рассмотрим строение молекулы
свободного хлора, содержащего 2 атома хлора. Эти 2 атома сое-
динены парой общих электронов, по одному от обоих отдельных ато-
мов, как это изображено на рис. 62. Электроны каждого из атомов
хлора изображены по разному не потому, что они как-либо отли-
ПЛАНЕТАРНЫЕ ЭЛЕКТРОНЫ
185
чаются друг от друга, но для того лишь, чтобы можно было
нагляднее изобразить электроны, принадлежащие каждому атому.
Атомы, связанные таким способом, остаются электрически нейтраль-
ными, так как ни тот ни другой не потеряли ни одного электрона.
Такая связь называется ковалентной, или неполярной. Подобные
связи встречаются в окисях металлов и неметаллов, например
в окиси алюминия и в двуокиси углерода (рис. 63).
Возможно, что в молекулах, в которых ковалентными свя-
зями соединяются разнородные атомы, общие пары электронов
ближе к одному атому, чем к другому, принимая во внимание вели-
чины положительных зарядов на
различных ядрах. Когда металлы
или неметаллы соединяются с ки-
слородом, весьма возможно, что
общие пары электронов ближе к
ядрам кислорода, чем к ядрам
других атомов. Таким образом ато-
мы кислорода в таких соединениях
более отрицательны, чем атомы
металлов или неметаллов, с ко-
торыми атомы кислорода соеди-
няются; наоборот, другие атомы
более положительны, чем атомы
кислорода. >
Валентность какого-либо эле-
мента в молекулах, в которых
атомы соединены ковалентными
связями, равна числу пар элек-
тронов, общих у этого элемен-
та с атомами других элементов.
В окиси алюминия например ва-
лентность атомов кислорода будет
2 и валентность атомов алюминия
О(-) / W)
Нейтральные,иетдиненнш ip ft с другом
атомы кислорода и алюминия
p(t) 0(»)
Молекула окиси алюминия
0(1) СС-) 011)
Нейтральноюсочиненные друге
другом атомы углерооа о кислорода
ftaaeiupiadtyokuw углерода
Рис. 63. Ковалентные связи в мо-
лекулах металлических и неметал-
лических о КИСЛОВ.
3. В двуокиси углерода атомы
углерода четырехвалентны, а атомы кислорода двухвалентны.
Теперь постараемся суммировать то, что мы узнали до сих пор
о сущности валентности:
1. Валентность какого-либо элемента в соединении равна
электрическому заряду его атомов.
2. Валентность какого-либо не находящегося в химическом
соединении элемента равна нулю, так как его атомы электрически
нейтральны.
3. Валентность металла, находящегося в соединении с неметал-
лами, всегда положительна.
4. Валентность неметалла, когда он соединен с металлами,
отрицательна, когда же он соединен с кислородом, положительна.
5. Валентность находящегося в соединении кислорода всегда
отрицательна.
6. Положительная валентность какого-либо элемента равна
186
ПЛАНЕТАРНЫЕ ЭЛЕКТРОНЫ
числу электронов, теряемых его атомами с их внешних оболочек,
когда они соединяются с атомами других элементов.
7. Отрицательная валентность какого-либо элемента равна
числу электронов, приобретаемых его атомами для пополнения
нормы электронов их внешних оболочек.
8. Молекулы химических соединений, состоящие из нескольких
элементов, электрически нейтральны.
Последнее положение особенно полезно при составлении формул
соединения на основании валентностей элементов, из которых со-
ставлено соединение. Формула в громадном большинстве случаев
будет состоять из наименьшего числа положительно и отрицательно
заряженных атомов, необходимых для получения нейтральной мо-
лекулы.
5. Большие периоды. Теперь мы в состоянии рассмотреть остаю-
щиеся периоды периодической системы. Четвертый и пятый периоды
содержат 18 элементов, шестой 32, седьмой неполон — он содержит
только б элементов. Казалось бы, это могло указывать на то,
что внешние оболочки атомов элементов четвертого и пятого периодов
могут содержать по 18 электронов, а шестого 32. Однако при та-
ком предположении было бы чрезвычайно трудно объяснить валент-
ности этих элементов. Бор и Томсон указали путь для выхода из
этого затруднения, предполагая, что увеличение заряда в ядре
элементов с более высоким атомным числом сопровождается увели-
чением способности удерживать больше электроно^на внутренних
оболочках, так что на внешней оболочке никогда не должно нахо-
диться более обычного максимума (8). Табл. XXV показывает рас-
пределение электронов на различных оболочках атомов недеятель-
ных газов. В каждом случае 8 электронов оказываются макси-
мумом для внешней оболочки.
Таблица XXV. Распределение планетарных электро-
нов в атомах недеятельных газов
Элемент Оболочки
1-я 2-я 3-я 4-я 5-я 6-я t
Гелий 2
Неон 2 8 — — — —.
Аргон 2 8 8 — — —
Криптон 2 8 18 8 — —
Ксенон 2 8 18 18 8 —
Радон 2 8 18 32 18 8
Чтобы наглядно показать, как предположение Бора и Томсона
могло бы на деле разрешить трудности, о которых шла речь, рас-
смотрим строение атома цинка, валентность которого равна 2, а атом-
ный номер 30. Три внутренних оболочки его атома должны бы со-
ПЛАНЕТАРНЫЕ ЭЛЕКТРОНЫ
187
ответст венно содержать 2,8 и 8 электронов, и если бы все из оста-
ющихся электронов были помещены на четвертую оболочку, то н»
ней оказалось бы 12 электронов (рис. 64). При таком, предположении
было бы чрезвычайно трудно объяснить валентность цинка (+2).
Если однако принять строение, показанное на рис. 65, то такая
валентность легко объясняется.
В длинных периодах встречается большой процент элементов с
переменной валентностью (стр. 75). Переменная валентность этих
элементов сначала доставляла затруднения. Однако если можно поме-
стить вызывающие затруднения электроны во внутренние оболочки,
то почти всякая валентность может быть объяснена. Например у
железа две валентности: +2 и +3. Оболочки его атомов поэтому
мог\т иметь какой-либо из двух видов, именно 2, 8, 14, 2 для двух-
валентного железа и 2, 8, 13, 3 для трехвалентного. В солях железа,
Рис. 64. Рис. 65.
в которых валентность железа +2, остаются 2, 8 и 14 электронов в
первых трех оболочках его атомов, тогда как в солях, в которых
железо трехвалентно, его атомы будут содержать в этих оболоч-
ках 2, 8 и 13 электронов.
6. Резюме. Для нас будет полезно, прежде чем мы закончим на-
стоящую главу, кратко суммировать то, что мы узнали относительно
теории строения атома. В центре каждого атома находится ядро,
несущее положительный заряд электричества, равный порядко-
вому числу элемента. Ядро состоит из протонов, численно равных
атомному весу, и из электронов ядра, численно равных разнице
между атомным весом и порядковым числом. Практически вес атома
сводится к весу протонов, содержащихся в ядре. Положительный за
ряд ядра определяет элемент, которому принадлежит атом. Ядро
остается неизменным при всяком химическом изменении, в котором
принимает участие атом. Ядро окружено планетарными электро-
нами, в свободном атоме численно равными заряду ядра. Эти
атомы расположены, согласно льюис-лэнгмьюровской теории, на
концентрических оболочках вокруг ядра. Число электронов на
внешней оболочке определяет валентность и вообще химический
характер и способность к реакциям элемента.
7. Окисление-восстановление. Большинство реакций (горение,
ржавление и реакции, связанные с процессами в металлургии), со-
провождается изменениями валентности входящих в них элементов.
188
ПЛАНЕТАРНЫЕ ЭЛЕКТРОНЫ
Такие реакции называются реакциями окисления-восстановления.
Рассмотрим следующие примеры:
С° + О2~*-С+4О2-2; (I)
4Fe° + ЗО2 — 2Fe2+3 О3"2; (2)
Fe2+3O3+2 + ЗС° —* 2Fe°+ЗС+2О-2; (3)
Zn0 + Cu+2SO4_2-*Zn+2SO4~2 + Cu0. (4)
В каждом случае валентность у одного из элементов увеличи
лась, у другого же она уменьшилась. Увеличение валентности и есть
окисление, уменьшение ее — восстановление. Так, в уравнении (1)
углерод окисляется
С° —>С+4, (окисление)
а атомы кислорода восстановлены:
0° —► 0“2. (восстановление)
В уравнении (2) железо окисляется, а кислород восстановляется:
Fe° —► Fe+3; (окисление)
О0—* О-2. (восстановление)
В уравнении (3) углерод окисляется, а железо восстановляется:
С° —> С+2; (окисление)
Fe+ 3 —► Fe°. (восстановление)
Атомы кислорода в этой реакции ни окисляются, ни восстановляются,
так как их валентность не изменяется. В уравнении (4) цинк оки-
сляется, а медь восстановляется. Валентность группы S04 остается
неизменной:
Zn° —* Zn*2; (окисление)
Cu+ 2 —” Си0. (восстановление)
Так как валентность какого-либо элемента есть электрический
заряд его атома, то рассматриваемые нами изменения валентности
должны представлять собой изменения в электрических зарядах
атомов элементов, принимающих здесь участие. Алгебраическое уве-
личение валентности может быть вызвано только потерей электро-
нов, уменьшение валентности обусловливается приобретением элек-
тронов. Таким образом окисление вызывает потерю электронов, вос-
становление — приобретение электронов атомами элементов, участ-
вующих в реакции. Возвращаясь к уравнению (1), мы видим, что
каждый атом углерода теряет 4 электрона:
С° —♦ С*4, (потеря 4е)
РАДИОАКТИВНОСТЬ
189
тогда как каждый атом кислорода приобретает два:
О —* О 2. (приобретение 2 е)
Очевидно потерянные атомами углерода электроны приобретены
атомами кислорода. Четырех электронов с атома углерода доста-
точно, чтобы восстановить 2 атома кислорода, каждый из которых
приобретает 2 электрона. Так как электроны, теряемые атомами
окисляемого элемента, приобретаются атомами восстанавливающе-
гося элемента, то это обстоятельство указывает здесь на способ
подбирания коэфициентов в реакциях окисления-восстановления.
Например в уравнении:
Fe2+3O3-2 + ЗС°— 2Fe° + ЗС+2О~2
Fe+3 —► Fe°; (приобретение Зе)
С°—* С+2. (потеря 2е)
Два атома железа таким образом окисляют 3 атома углерода. Отно-
шение это приводит таким образом к уравнению
Fe2O3 + ЗС —» 2Fe + ЗСО.
В таких реакциях окислитель, как показывает его название,
есть вещество, производящее окисление окисляемого элемента. Оче-
видно, что это вещество'Должно содержать в своей молекуле элемент,
способный восстанавливаться. В уравнении (3) окись железа — оки-
слитель, так как его молекула содержит атомы железа, которые,
восстанавливаясь, окисляют атомы углерода. Восстановитель
должен быть веществом, содержащим окисляющийся элемент. В ре-
акции (3) углерод есть восстановитель.
С реакциями окисления-восстановления, которые, как мы ви-
дели, имеют место в явлениях горения, ржавления, в металлурги-
ческих процессах, мы встретимся еще много раз в дальнейшем
изложении.
ГЛАВА XVIII
РАДИОАКТИВНОСТЬ
В последнее десятилетие XIX ст. были сделаны открытия, ко-
торым было предназначено поколебать некоторые из самых основных
понятий физических наук. В этом десятилетии положено было на-
чало новой физики. Составившее эпоху открытие Круксом и Томсо-
ном электрона в катодных лучах круксовых трубок, открытие
х-лучей Рентгеном, наконец открытие радиоактивности Беккере-
лем, — все это произошло в продолжение указанного периода. В
1896 г. открытие радиоактивности обнаружило явление, которое
должно было ниспровергнуть наши взгляды на неизменяемость хими-
ческих элементов и в сильнейшей мере расширить представления
о вселенной.
190
РАДИОАКТИВНОСТЬ
1. Открытие радиоактивности. В 1895 г. проф. Рентген, ис-
следуя флуоресценцию стеклянной стенки круксовых трубок под
влиянием катодных лучей, открыл новый вид излучения — х-лучи.
Он нашел, что эти лучи обладают способностью проникать через ма-
терию, не пропускающую видимого света. Эту способность легко
можно было обнаружить, завертывая фотографическую пластинку
в непроницаемую для света черную бумагу и помещая ее вблизи флу-
оресцирующей стенки круксовой трубки. После проявления пла-
стинки можно было установить, что лучи проникали через бумагу.
В то время было хорошо известно, что некоторые природные ве-
щества флуоресцируют, т. е. имеют способность поглощать свет и
Рис. 66. Радиоактивная руда сама себя фотографирует через
светонепроницаемую бумагу.
вновь испускать его, но уже измененным по цвету, причем этот цвет
характерен для флуоресцирующего вещества, но не для света, которым
вызывалась флуоресценция. У французского физика Анри Бекке-
реля зародилась мысль, что испускание х-лучей по всей вероятности
характерно для всякой флуоресценции, и он предпринял ряд опытов,
похожих на те, которые помогли Рентгену открыть х-лучи. Флуо-
ресцирующие вещества помещались на непрозрачной обертке фото-
графических пластинок с целью испытать, будут ли они испускать
х-лучи. Результаты были отрицательными, т. е. фотографические
пластинки остались неизмененными, за исключением одного случая.
По счастливой случайности Беккерель включил в свои опыты неко-
торые соединения элемента урана, флуоресцирующие прекрасным
зеленовато-желтым светом. Соединения урана, в отличие от дру-
гих испытуемых веществ, подействовали на фотографическую пла-
стинку. Это привело Беккереля к предположению, что элемент
уран испускает лучи, или тождественные с х-лучами или весьма сход-
ные с ними.
РАДИОАКТИВНОСТЬ
191
Мария Склодовская-Юср f.
Он нашел, что подобно х-лучам эти лучи обладают способностью
делать воздух проводником электричества. Эту способность можно
легко продемонстрировать при помощи электроскопа с золотыми
листочками. Заряженные электричеством два золотых листка этого
прибора отталкивают друг друга и вследствие этого расходятся.
Когда уран или какое-либо из его соединений помещают близко к за-
ряженному электроскопу, то его листки медленно спадают, указы-
вая, что электроскоп разрядился вследствие утечки заряда через
окружающий воздух, ставший проводником электричества под
влиянием лучей, исходящих из урана. Быстротой разряда электро-
скопа можно пользоваться как количественной мерой интенсивности
испускаемых лучей, а следовательно и степени активности их источ-
ника. Эти открытия Беккереля по-
служили началом изучения радио-
активности.
2. Пьер и Мария Кюри. 7 ноября
1867 г. в Варшаве, родилась Мария
Склодовская, которой выпало на
долю сделаться величайшей женщи-
ной своего поколения. Ее отец, д-р
Склодовский, преподаватель мест-
ной гимназии, был ее единственным
учителем, пока она, побуждаемая не-
навистью к царскому режиму, не
покинула домашнего очага, где про-
вела детство, и не отправилась
учиться в Краков, старинную сто-
лицу Польши, в то время находив-
шуюся под властью Австрии. Скоро
она переехала в Париж, для того
чтобы учиться в Сорбонне. Там она встретилась с пионером в обла-
сти цветной фотографии Габриэлем Липпманом, для которого мыла
склянки и стаканы, получая за это вознаграждение, позволяющее
ей нанимать в трущобах Парижа комнату на четвертом эта-
же. Она питалась хлебом и водой и довела свои ежедневные
расходы до десяти центов. Вскоре Липпман заметил ее вы-
дающиеся способности и устроил ее к своему наиболее обещаю-
щему ученику Пьеру Кюри. В 1895 г. Мария и Пьер Кюри всту-
пили в брак.
В 1897 г. М. Кюри предприняла исследование незадолго до
того открытого яцления радиоактивности. Эти работы и сделали ее
знаменитой. Заменив электроскоп электрометром, она придумала
очень надежный способ измерения интенсивности лучей, испускае-
мых радиоактивными веществами. Она нашла, что радиоактивность
соединений урана оставалась постоянной в продолжение долгого
времени, что она проявлялась у всех соединений урана и что в соеди-
нениях урана активность была пропорциональна количеству
урана в соединении. На основании полученных результатов она
192
РАДИОАКТИВНОСТЬ
вывела заключение, что радиоактивность есть свойство атомов урана,
а не других атомов в молекулах соединений урана.
После этого М. Кюри занялась систематическим исследованием
других элементов с целью определить, проявляет ли какой-нибудь
из них радиоактивные свойства. Это исследование привело к откры-
тию, что из всех известных в то время элементов только непохожий
на уран торий обладает этим замечательным свойством. Сравнение
свойств этих двух элементов обнаружило, что они похожи друг на
друга только своей радиоактивностью и тем, что они являются эле-
ментами с наибольшими атомными весами. Оказалось, что последнее
обстоятельство, как мы это увидим позднее, имеет очень большое
значение.
3. Открытие полония и радия. В высшей степени изумитель-
ный факт был обнаружен дальнейшим открытием М. Кюри, кото-
рое она описывает следующим образом:
В моих исследованиях весьма большого количества химических ве-
ществ я изучала не только чистые элементы и их соединения, но также и
природные продукты — руды и минералы; тут-то я и столкнулась с совер-
шенно неожиданными фактами. Я ожидала, что все минералы, содержащие
уран и торий, — а очень часто одни и те же минералы содержат оба
эти элемента, — будут радиоактивными, но с моей точки зрения ни один из
них не должен был обладать такою большой радиоактивностью, какая на-
блюдается у чистых окисей урана или тория. Мне удалось найти совершенно
иное! Я нашла несколько минералов, радиоактивность которых была боль-
ше радиоактивности окисей тория и урана; так, для одного образца смоляной
обманки радиоактивность была в 4 раза больше. Чтобы объяснить это ненор-
мальное поведение минералов, я сделала предположение, что в этих мине-
ралах содержатся какие-то новые элементы с радиоактивностью, гораздо
более значительной, чем радиоактивность урана и тория, и что эти новые
элементы могут находиться в минералах только в очень малых количествах,
так как их нельзя открыть при анализе минералов. Эта гипотеза подтвер-
дилась открытием полония и радия проф. Кюри и мной.
Проф. Кюри и я начали тогда общую работу для выделения нового
элемента. В нашей работе мы руководились химическим анализом минерала
и измерениями радиоактивности. Так как при анализе обнаружилось, что
некоторые продукты оказывались все более и более радиоактивными, то мы
заключили* что наши усилия в изолировании нового элемента идут успеш-
но, и в продолжение 1898 г. мы смогли установить существование по край-
ней мере двух новых радиоактивных элементов; один из них, выделявшийся
вместе с висмутом, получил название полония, другой, выделявшийся вме-
сте с барием, был назван радием.
Смоляная обманка, из которой супруги Кюри выделили радий
и полоний, содержала около 60% урана. Отношение в таких рудах
радия к урану составляет 3,4 ч. радия на каждые 1Q ООО 000 ч. урана.
Одна тонна руды содержит около 0,2 г радия. Srro дает некоторое
представление о задаче, выполнение которой взяли на себя супруги
Кюри. Австрийское правительство щедро предоставило им тонну остат-
ков смоляной обманки, из которой был извлечен уран; воспользо-
вавшись денежной помощью, оказанной им некоторыми научными
обществами и друзьями, интересовавшимися их работой, супругам
Кюри удалось выделить из этих остатков 0,1 г совершенно чистого
РАДИОАКТИВНОСТЬ |03
хлористого радия, в результате чрезвычайно продолжительной рабо-
ты. Этот образец послужил для определения атомного веса радия и
фотографирования его спектра.
В 1903 г. М. Кюри получила степень доктора физических наук
за свою диссертацию об открытии радия и через несколько месяцев
после этого разделила со своим мужем и Беккерелем нобелевскую пре-
мию. В 1906 г. ее муж был раздавлен проезжавшим фургоном при пере-
ходе улицы Дофина в Париже. Этот удар едва не стоил ей жизни. Хотя
и медленно, но все же она оправилась от постигшего ее несчастья
и посвятила остаток жизни своим двум детям и работе. В 1910 г.
ей удалось получить радий в виде свободного элемента, а в следую-
щем году ей-опять была присуждена нобелевская премия; она была
первой, получившей это отличие во второй раз.
4. Свойства радия. Открытие радия обнаружило группу един-
ственных в истории науки явлений. Его громадная радиоактивность,
превышающая активность урана приблизительно в 3 000000 раз,
сразу привлекла всеобщий интерес. Радий — элемент, способный вы-
делять энергию в форме света и тепла вне. зависимости от внешних
условий. При высоких температурах и при температуре жидкого
водорода его активность остается одной и той же. Он испускает лучи,
которые могут проходить через светонепроницаемую бумагу и даюг
возможность производить фотографические снимки внутреннего
строения непрозрачных предметов; он делает также воздух провод-
ником электричества. Поэтому нет ничего удивительного, что откры-
тие радия возбудило и поддерживало общий интерес, как никакое
другое научное открытие.
5. Открытие других радиоактивных элементов. Открытие дру-
гих радиоактивных элементов было прямым результатом исследова-
ний, вызванных открытием Беккереля и супругов Кюри. В 1899 г.
Дебьерн, работавший в лаборатории М. Кюри, открыл актиний.
В 1901 г. Гофман и Штраус открыли радиоактйвную форму свинца.
В 1900 г. Резерфорд открыл радиоактивный газ, сопутствовавший сое-
динениям тория, и в том же году Дорн показал, что подобный же
газ может быть получен из радия. В 1907 г. Болтвуд открыл ионий
в урановых минералах. Вскоре многие другие радиоактивные эле-
менты пополнили этот список.
6. Природа радиоактивности. В течение этого периода откры-
тий подвергались исследованию лучи, испускаемые радиоактивными
элементами. Большая часть этих исследований произведена была Эр-
нестом Резерфордом в Манчестерском университете. Были найдены
три вида излучения: альфа- и бета-частицы и гамма-лучи; свойства
их могут быть вкратце охарактеризованы следующим образом.
Альфа-частицы представляют собой ядра атомов гелия,
следовательно состоят из 4 протонов и 2 ядерных электронов. Поэтому
они несут положительный заряд, равный заряду 2 протонов. Благо-
даря этому заряду масса частицы и величина заряда могут быть опре-
делены способами, аналогичными тем, которыми пользовался Томсон
и другие при определении массы и заряда электрона. Поток альфа-
13 Введение в химию.
194
РАДИОАКТИВНОСТЬ
частиц отклоняется от своего прямолинейного пути к отрицательно
заряженной пластинке конденсатора. Четыре протона частицы де-
лают ее в 4 раза тяжелее атома водорода. Такие частицы испускаются
атомами некоторых радиоактивных элементов и движутся с гро-
мадными скоростями, иногда равными 1/м скорости света. Благодаря
такой скорости альфа-частицы пролетают в воздухе при нормальном
давлении расстояния от 2,6 до 8,6 см, вышибая электроны у многих
из тех 200 000 атомов азота и кислорода, мимо которых в среднем
каждая частица пролетает, пока не истощится ее энергия. Резерфор-
ду удалось показать, что после того, как какая-либо альфа-ча-
стица присоединит 2 недостающих электрона, она делается типич-
ным нейтральным атомом гелия, а 2 электрона становятся плане-
тарными электронами в атомной
структуре гелия.
Резерфорду удалось также со-
считать число альфа-частиц, выпу-
скаемых данным количеством радия
в данный промежуток времени, устра-
ивая так, чтобы известная часть всех
выпускаемых частиц ударялась о
флуоресцирующий экран. Частицы
эти легко сосчитать по вспышкам
света, так как каждая альфа-частица,
ударяясь об экран, дает световую
вспышку. Затем, измерив объем, за-
нимаемый всем числом атомов гелия,
легко вычислить число атомов, в дан-
ном случае молекул гелия (так как
молекула гелия одноатомна), содер-
жащееся в 1 см? при нормальных
условиях. Резерфорд нашел, что их
число равно 2,75 х 10х*. Если вспомнить закон Авогадро, то будет
ясно, что это число должно быть также равно числу молекул какого-
либо газа в 1 см? при нормальных условиях. Мы можем в таком слу-
чае получить число Авогадро, т. е. .число молекул в 22,4 л какого-
либо газа или в 1 моле какого-либо вещества, умножая на 22 400 или
на 2,24х Ю4. Это даст 6,16 x1g23, что находится в превосходном
согласии с результатом Милликэна (6,06х10аз), полученным иным
способом.
Бета-частицы — это электроны, испускаемые атомами
известных радиоактивных элементов с необыкновенно большими ско-
ростями. Эти скорости в некоторых случаях превышают */10 скорости
света. Они также выбивают электроны из атомов газов, через которые»
они проходят, делая таким образом эти атомы проводниками электри-
чества. Так как бета-частицы заряжены отрицательно, то поток их
будет отклоняться электрическим полем в сторону положительной
пластинки конденсатора. Количественным изучением этого откло-
нения была установлена тождественность бета-частиц с электронами.
РАДИОАКТИВНОСТЬ
195
Гамм а-л учи находятся в связи с испусканием бета-частиц. Эти
лучи очень похожи на х-лучи и состоят из световых лучей с очень
короткой длиной волн, вследствие чего им присуща в необычайной
степени способность проникать сквозь материю. Они главным обра-
зом и действуют на фотографические пластинки, завернутые в непро-
ницаемую для обычного света бумагу. Только половина потока
гамма-лучей поглощается слоем свинца толщиной в 2,5 см. Эти
лучи отличаются от видимого света лишь длиной волны; длина
их волн в 1000 раз меньше самой короткой волны видимого
света. Они движутся со скоростью света и не отклоняются магнит-
ным и электрическим полями.
7. Теория радиоактивного распада Резерфорда-Содди. Чтобы
объяснить источник этих излучений, Резерфорд и Содди в 1902 г.
предложили свою теорию радиоактивного распада, которая в свете
принятых научных положений того времени имела характер револю-
ционной теории. Эту теорию они формулировали следующим
образом.
Атомы радиоактивных элементов распадаются, давая новый элемент,
который может распадаться подобно исходному элементу, но может и не
распадаться. Атомы, появившиеся в результате распада исходного элемен-
та, обладают свойствами, отличными от его свойств. Это распадение сопро-
вождается испусканием частиц и излучениями, которые указывают на сте-
пень распада.
Теория неизменяемости элементов была ниспровергнута одним
ударом. В свое время взгляд на неизменяемость элементов был
выражен Кларком Максвеллом перед Британской ассоциацией
(в 1,873 г.) следующим образом:
Существуют, как мы знаем, естественные причины, стремящиеся изме-
нить, если не совсем разрушить, весь порядок и все величины на земле и
во всей солнечной системе. Но хотя на протяжении веков в пространстве
происходили и могут еше произойти катастрофы, хотя древние системы
могут разрушиться, а новые возникнуть на их развалинах, молекулы
(атомы), из которых созданы эти системы, — основные атомы вселенной, —
остаются целыми и невредимыми.
И однако теория распада, принимающая, что атомы радиоактив-
ных элементов постоянно изменяются, давая другие атомы, была
доказана и сейчас не вызывает даже и тени сомнения.
8. Радиоактивные превращения. Теория распада дает целую
семью элементов, начиная с главы семейной линии, за которым сле-
дует его отпрыск, аза отпрыском потомство этого отпрыска и т. д.,
вниз по семейному дереву. Такая семья радиоактивных элементов
возглавляется элементом ураном. Атом этого элемента характерным
для него образом выделяет альфа-частицу и превращается в новый
элемент — уран XI, который в свою очередь выбрасывает бета-ча-
стицу и становится ураном Х2 и т. д. Эти частицы выделяются
из ядра атома, как это становится очевидным, если проанализировать
эти изменения. Атомный вес урана 238, а порядковое число его 92.
Следовательно ядро урана состоит из 238 протонов и 146 электронов
с зарядом ядра 4-92. Вокруг этого ядра в нейтральном атоме урана
13*
196
РАДИОАКТИВНОСТЬ
•2
*£>
Ядро атом орано Яльфо - частш Ядро отто
или ядро гиш аринам
*92
*90
Рис. 67.
вращаются 92 планетарных электрона, не принимающих участия
в рассматриваемых радиоактивных изменениях. Концентрация та-
кого количества протонов и электронов внутри ядра приводит к не-
устойчивости и стремлению перейти в более устойчивое состояние
через потерю альфа-частицы.
Выбрасывание этой частицы
из ядра атома урана изобра-
жено на рис. 67.
То, что осталось от ядра ура-
на после потери альфа-частицы,
оказывается ядром другого эле-
мента с атомным весом 234
(234 протона) и порядковым числом 90 (чистый заряд ядра). Так
как заряд ядра определяет элемент, которому принадлежит атом,
то изменение в этом заряде с 4-92 на 4*90 означает превраще-
ние одного элемента в другой. Этот новый элемент в свою оче-
редь радиоактивен и способен
рис. 68).
Новый элемент, полученный
таким путем, имеет такой же атом-
ный вес, как и XI, так как вес по-
терянной бета-частицы (электрона)
не влияет на атомный вес, но по-
рядковое число его 91. Следует
все время помнить, что заряд ядра или порядковое число
ляют число и порядок планетарных электронов, а следовательно и
химические свойства соответствующего элемента. Атомы с различ-
ными зарядами ядер будут атомами различных элементов. Полная
родословная семейства урана приводится в табл. XXVI. В каждом
случае потеря одной альфа-частицы имеет своим последствием обра-
зование нового элемента с атомным весом на 4 единицы меньше пре-
дыдущего и с порядковым числом, меньшим на 2. С другой стороны,
потеря бета-частицы не сопровождается никаким изменением в атом-
ном весе, порядковое же число при потере бета-частицы увеличи-
вается на единицу. Следует отметить, что сам радий является одним
из потомков урана, а нерадиоактивный элемент свинец оказывается
последним членом семейства.
Радиоактивные элементы представляют собой элементы с самыми
высокими атомными весами и порядковыми числами, а потому са-
мыми сложными атомами. Совместное пребывание такого большого
количества электронов и протонов в одном ядре приводит к неустой-
чивости в системе, в которой имеется напряжение. Это напряжение,
падает благодаря потере электронов или ядер гелия до тех пор, по-
ка не останется атом с устойчивым ядром. В рассматриваемом нами
ряде таким атомом будет атом свинца. В двух других рядах радио-
активных элементов, т. е. ториевом и актиниевом, свинец также
оказывается конечным членом ряда.
9. Скорость радиоактивного pacHaflaf Испускание электронов,
выбрасывать бета-частицу (см.
♦fiO «01
Ядро ато-
ма ЦП
Blma-vetmuin
или ментрви
Рис. 68.
Ядро атом
опреде-
РАДИО АКТИВН ОСТЬ
197
Таблица XXVI. Ряд урановых радиоактивных элементов
Элемент Атомный вес Электро- ны (ядра) Порядко- вое число Испускае- мая ча- стица Время полу- распада
Уран 1 . . . . 238 146 92 альфа бхЮ9 лет
Уран XI .... 234 144 90 бета 24,6 дней
Уран Х2 .... 234 143 91 бета 69 сек.
Уран 2 234 142 92 альфа 2x10° лет
Ионий ...... 230 140 90 альфа 69 000 лет
Радий 226 138 88 альфа 1 690 лет
Радон 222 136 86 альфа 3,85 дней
Радий А .... 218 134 84 альфа 3,0 мин.
Радий В .... 214 132 82 бета 27 мин.
Радий С 214 131 83 бета V ОЛ llffVY
Радий С' .... 214 130 84 альфа ? ZU мин.
Радий D .... 210 128 82 бета 16,5 лет
Радий Е .... 210 127 83 бета 5 дней
Полоний .... 210 126 84 альфа 136 дней
Свинец 205 124 82 не радиоактивен
сопровождающее распад радиоактивного элемента, позволяет изме-
рить скорость, с которой происходит распад. Количественное изу-
чение скорости радиоактивного распада показало, что число распа-
дающихся в единицу времени атомов во всех случаях пропорционально
всему числу атомов данного радиоактивного элемента. Кроме того
эта скорость пропорциональна характерной тенденции атомов дан-
ного радиоактивного элемента подвергаться распаду. Мы видели
например, что атомы радия проявляют активность в 3 000 000 раз
бблыпую, чем атомы урана. Этот последний фактор различен для
каждого радиоактивного элемента; он велик для элементов, имеющих
ббльшое стремление к распаду, и мал для элементов, радиоактивность
которых незначительна.
Так как скорость распада вариирует, то отсюда следует, что
в определенный промежуток времени определенная часть всего числа
атомов данного радиоактивного элемента будет подвергаться рас-
паду. Предположим, например, что в случае какого-либо гипоте-
тического радиоактивного элемента часть всего числа имеющихся
атомов его ежедневно распадается. К концу первого дня х/4 часть
числа имевшихся вначале атомов подвергнется распаду и оста-
нутся */4. К концу второго дня */. остававшихся 8/4 подвергнется
распадению, и останутся ’/« от 3/4 или ®/1в первоначального числа ато-
мов. Очевидно потребуется бесконечное время, чтобы при таких
обстоятельствах все атомы распались. Жизнь каждого радиоактив-
ного элемента равна поэтому бесконечности и по этой причине ее
нельзя выразить какой-нибудь определенной величиной. Однако вре-
мя, необходимое для распадения половины определенного числа ато-
198
РАДИОАКТИВНОСТЬ
мов данного элемента легко может быть вычислено; оно является
характерной величиной для каждого радиоактивного элемента. Этот
период полураспада, как он называется, и будет мерой активности
элемента, так как чем короче этот период, тем больше будет часть
всего числа атомов, подвергающихся изменению в данный промежу-
ток времени х. Так, радий с периодом полураспада в 1 690 лет при-
близительно в 3 000 000 раз активнее урана, период полураспада
которого равен 5x10® лет. Радон—радиоактивный газ, в который
превращаются после своего распада атомы радия, период полу-
распада его 3,85 дня. Поэтому потребуется лишь очень небольшое
число атомов радона, для того чтобы получить ту же степень актив-
ности альфа-лучей, которую обнаруживает сравнительно гораздо
большее число атомов радия.
10. Радиоактивное равновесие. Дан-
ное количество радия распадается,
образуя радон, со скоростью, которая
остается практически постоянной в про-
должение нескольких месяцев; это по-
стоянство скорости обусловливается
сравнительно долгой жизнью радия.
Атомы радона после своего образования
начинают распадаться, образуя радий
А со скоростью, пропорциональной чис-
лу наличных атомов радона и их стре-
млению к распаду. Сначала, пока об-
Рис. 69. Аналогия с радио- разовалось только немного атомов ра-
активным равновесием. дона, эта скорость невелика, цо по
мере того как из радия образуется все
больше и больше атомов радона, число атомов последнего, распадаю-
щихся в единицу времени, становится все ббльшим и большим. Нако-
нец скорость, с которой атомы радона распадаются, будет равна
скорости, с которой они образуются из радия, и тогда количество
радона станет постоянным. Если мы начнем с долговечного патри-
арха ряда — самого урана, то с течением времени все продукты его
распада придут в подобное же равновесие, в котором каждый член
ряда распадается столь же быстро, в том же количестве, как и
образуется. Когда такое равновесие установилось, количество каж-
дого наличного элемента будет обратно пропорционально его харак-
терному стремлению распасться.
Чтобы объяснить сущность радиоактивного равновесия поль-
зовались нередко следующей аналогией. На рис. 69 показан ряд
приемников, помещенных на различных уровнях, с отверстиями
различных размеров в нижней части их. Струя воды вливается с по-
стоянной скоростью в самый верхний сосуд через маленькое отвер-
стие в основании большого резервуара. С течением времени вода
1 Периоды "полураспада элементов ряда урана можно найти в последнем
столбце табд. XXVI.
РАДИОАКТИВНОСТЬ
199
накопится в каждом из приемников и в каждом будет доходить до
постоянного уровня. При таких условиях скорость, с которой вода
вливается в данный приемник, будет равна скорости, с которой она
выливается. Чем меньше отверстие, тем больше будет высота воды
в данном приемнике. Если мы уподобим ряд приемников ряду ра-
диоактивных элементов, допуская, что высота воды в каждом соот-
ветствует количеству каждого элемента при равновесии и что размер
отверстий соотретствует различным наклонностям различных эле-
ментов к распаду, то наша аналогия станет ясной.
11. Возраст земли. В ряду радиоактивных элементов, нахо-
дящихся в равновесии, количества каждого элемента остаются
постоянными, так как сколько его вновь образуется, столько же его
и распадается. Последний элемент в ряду однако не распадается —
поэтому он увеличивается в количестве со скоростью вполне постоян-
ной. Такой элемент соответствует приемнику, у которого нет отвер-
стия для вытекания воды. В 1905 г. Болтвуд указал на то, что в ми-
нералах, содержащих уран, постоянно находится свинец; отсюда
он заключил, что этот элемент является конечным членом уранового
ряда. Так как свинец в этих минералах накоплялся при постоянной
скорости в продолжение веков, то Болтвуд смог вычислить, сколько
времени потребовалось на то, чтобы из находящегося в минерале
количества урана получилось имеющееся в том же минерале коли-
чество свинца, и таким образом определить возраст минерала. Он
нашел, что возраст некоторых минералов равен 1 640 000 000 лет.
Геологи при определении возраста земли всегда указывали на мил-
лионы лет, но до вычислений Болтвуда не имелось метода для более
или менее точного определения столь почтенного возраста земли.
12. Изотопы. Вскоре после того как Болтвуд открыл радиоак-
тивный элемент ионий, ему оказалось нужным выделить из смеси
этого элемента с торием составные части смеси. Он старался
произвести выделение различными способами, но попытки были
совершенно безуспешны. Он заключил, что хотя атомные веса у этих
элементов различны, но во всех других отношениях они тождествен-
ны. Раз эти элементы оказались в смеси, их разделение, в силу тож-
дественности их химических свойств, стало невозможным. Вскоре
было найдено, что в радиоактивных минералах свинец, сходный с
обыкновенным свинцом во всех отношениях, обладает более низким
атомным весом.
Еще в 1886 г. Уильям Крукс сделал вызвавшее удивление со-
общение в Химическом общестее Британской ассоциации в Бирмин-
геме, в котором он указал, что атомы какого-либо данного элемента
могут не все иметь одинаковый вес, хотя их свойства во всех других
отношениях будут тождественными. Он сказал:
, Я представляю себе дело таким образом: когда мы говорим, на-
пример, об атомном весе кальция, что он равен 40, в действительности мы
выражаем факт, что, в то время как большинство атомов кальция имеет
действительно атомный вес 40, существует не мало атомов кальция, имею-
щих атомный вес 39 или 41, меньшее число их — 38 или 42 и т. д... Это
200
РАДИОАКТИВНОСТЬ
может казаться смелой спекуляцией, но я не думаю, чтобы химия была не
в силах испытать, насколько такое предположение приемлемо.
Такое представление противоречило принятой повсюду атомной
теории Дальтона, но, как мы видели, изучение радиоактивности
дало первое доказательство правильности пророчества Крукса; Содди
предложил назвать изотопами те атомы одного и того же элемента,
которые отличаются по атом-
♦8* ному весу, но тождественны
по химическим свойствам.
'~7 Если мы обратимся к
табл. XXVI на стр. 197, мы най-
дем, что радий В, радий D и
свинец имеют одни и те же по-
рядковые числа. Следовательно
Лдийв । PMD
Рис. 70.
они являются атомами одного и того же элемента, хотя их атом-
ные веса различны. По химическим свойствам они должны быть тож-
дественны. Тем не менее число протонов в каждом виде атома дол-
жно быть различно (рис. 70).
Так как строение ядра определяет радиоактивность, то эти
атомы обнаруживают различное стремление к распаду или, как в
случае свинца, совсем не подвергаются ему.
Таблица XXVII. Изотопы некоторых наибо-
лее часто встречающихся элементов
Элементы Атомные веса Изотопы
Бор 10,82 10; И
Кальций 40,08 40; 44
Хлор 35,457 35; 37; 39
Медь 63,57 63; 65
Водород ..... 1,008 I; 2
Желёзо 55,84' 54; 56
Магний ..... 24,32 24; 25; 26
Калий 39,10 39; 41
Кремний 28,06 28; 29; 30
Серебро 107,88 107; 109
Олово ...... 118,70 112; 114; 115;
116; 117; 118;
119; 120; 121;
122; 124
Кислород .... 16.000 16, 17; 18
Углерод 12,000 12; 13
Азот 14,008 14; 15
13. Дробные атомные веса. Вскоре после того было открыто,
что многие из нерадиоактивных элементов представляют собою смеси
изотопов, и в промежуток времени с 1919 по 1924 г. до 53 таких эле-
ментов было исследовано с целью определить, состоят они или не
состоят из смесей изотопных атомов. Было найдено, что элемент
РАДИОАКТИВНОСТЬ
201
хлор например состоит из смеси 2 изотопов, одного с атомным весом
35, а другого с атомным весом 37. Эти два вида атомов хлора в при-
роде были найдены в смеси в одних и тех же отношениях во всех об-
разцах этого элемента, так что атомный вес хлора 35,46 представ-
ляет статистическую среднюю величину из атомных весов 2 изото-
пов. В табл. XXVII перечислены изотопы, из которых состоят не-
которые из наиболее часто встречающихся элементов. В каждом
случае атомный вес изотопа в пределах точности, с которой произво-
дились определения, есть целое число.
В 1815—1816 гг. лондонский врач, Уильям Проут, опублико-
вал гипотезу, которая дает право считать его, более чем кого-либо,
другого, пророком в химии. Просматривая атомные веса элементов,
уже определенные в его время, он был поражен тем, что большинство
из них в пределах точности, с какой они могли быть определены в то
время, представляли собой кратные числа от атомного веса самого
легкого элемента водорода. Вследствие этого он пришел к заключению,
что это обстоятельство не может быть простым совпадением и что
атомы всех элементов являются лишь агрегатом первоначальных
атомов водорода. -Атом кислорода например он рассматривал, как
состоящий из 16 атомов водорода, так как его атомный вес равен 16.
Однако на основании этой гипотезы трудно было объяснить такой
аномальный атомный вес, как вес хлора (35,5); едва ли можно было
найти еще атомный вес, который был бы дальше от целого числа.
Или атомные веса хлора и других элементов, выраженные дробными
числами, ошибочны, или ошибочна гипотеза Проута! Хотя это и
может показаться парадоксальным, но и то и другое верно. Пять-
десят лет позже Стас из Гента, о котором мы упоминали уже в связи
с точными определениями атомных весов, нашел так много дробных
атомных весов, что пришел к заключению: «Я пришел к решитель-
ному убеждению, к полной несомненности, что закон Проута есть
ничто иное, как иллюзия». В настоящее время знание строения ато-
мов и изотопов ясно указывает, что предположение Проута в своей
основе было правильным.
14. Энергия радиоактивных элементов. Энергия, связанная
с альфа- и бета-частицами и гамма-лучами, огромна, если принять
во внимание необыкновенно малые количества радиоактивных эле-
ментов, освобождающих ее при своем распаде. Когда эти эманации
сталкиваются с атомами материи, их энергия превращается в теп-
лоту. Теплоты, получаемой в течение часа этим путем из 1 г радия,
достаточно, чтобы поднять температуру 1 г воды с точки замерзания
до точки кипения. Эта энергия выделяется с практически постоянной
скоростью в продолжение длинного ряда лет. Через 1 690 лет будет
освобождена только половина той энергии, которая должна быть вы-
делена окончательно данным образцом радия.
Вопрос об источнике этой энергии долгое время после ее откры-
тия был весьма трудным вопросом. Казалось, что тут опровергался
закон сохранения энергии, ибо здесь происходило освобождение
энергии, происходящей из неизвестного источника. Когда на-
202
РАДИОАКТИВНОСТЬ
чали лучше понимать строение атома, стало ясно, что источником
здесь является новая форма потенциальной энергии—внутриатомная
энергия. Атомы обладают энергией в силу способа, которым электро-
ны и протоны располагаются в них. Атомная структура радиоактив-
ных элементов неустойчива, и вследствие этой неустойчивости проис-
ходит испускание альфа- и бета-частиц, несущих с собой часть вну-
триатомной энергии тех атомов, из которых они выделяются.
15. Искусственное разложение элементов. Радиоактивные эле-
менты распадаются, и не было найдено никакого средства остановить
распад или даже повлиять на его скорость. Поэтому казалось бы
невозможным вызвать распад атома какого-либо нерадиоактивного
элемента, так как в таком случае нужно было бы открыть средство
для изменения заряда его ядра, ибо именно заряд определяет эле-
мент, которому принадлежит атом. Если бы можно было удалить из
ядра какого-либо атома протон, то в результате получился бы новый
элемент. Недавно это действительно было осуществлено в нескольких
случаях Резерфордом. Бомбардируя атомы газообразного азота
альфа-частицами из радиоактивного источника, он сумел вытолкнуть
протоны, или ядра водорода, в свободном виде из ядер азота. Таким
способом он сумел также освободить водород из атомов бора, фтора,
натрия, алюминия и фосфора. Распад этот происходил однако лишь
в очень незначительной степени. На каждые 1 000 000 альфа-частиц,
бомбардирующих элемент, освобождались только 2 протона.
В мае 1924 г. Адольф Мите в Берлине опубликовал сообщение
о том, что он нашел следы золота (8,2 х 10-5 г) в ртути кварцево-ртут-
ной лампы Иенике. Было указано, что это изменение произвел элек-
трический ток, пропущенный через чистые пары ртути. Однако
результат этот не удалось получить вторично, хотя некоторые дру-
гие ученые произвели ряд аналогичных опытов.
16. Промышленное получение радия. Радий навсегда останется
редким и дорогим элементом. Сам уран встречается в природе в ко-
личестве, далеком от изобилия, хотя и широко рассеян в земной ко-
ре. Так как радий представляет собой один из продуктов распада
урана, то эти два элемента встречаются в минералах вместе, и радий
распространен также широко, но в чрезвычайно малых количествах.
Отношение радия к урану в каком-либо старом минерале никогда
не может превысить отношения 1 к 3 000 000, так как таково от-
ношение этих двух элементов в радиоактивном равновесии. Уран
не встречается в природе в свободном состоянии; самая чистая форма
его — окись U3O8 (смоляная обманка), содержащая около 85% ура-
на. Каждые 3,9 т такой высокоценной руды содержат лишь 1 г радия.
До 1913 г. главными источниками радия были: смоляная обманка—
нечистая урановая руда из Иоахимсталя в Чехословакии и аутунит—
фосфорнокислая соль урана и кальция из Португалии. С 1913 г.
приблизительно до 1925 г. отложения карнотита (ванадиево-ураново-
калиевой соли из Колорадо и Ута) обрабатывались благодаря содер-
жанию в них радия Образцовой химической кампанией в Питтсбурге.
Из этих американских отложений было извлечено свыше 160 г радия.
ПОНЯТИЕ ОБ ЭНЕРГИИ
203
В 1929 г. началось получение радия из богатых содержащих радий
руд в Бельгийском Конго; практически эти руды доставляют весь
добываемый в настоящее время радий. В продолжение лета 1931 г.
были открыты залежи смоляной обманки в отдаленных областях
Канады; повидимому они достаточно богаты,чтобы нарушить бельгий-
скую монополию. До самого последнего времени всего было извле-
чено только 600 г радия.
Дать какое-либо подробное описание способов, употребляемых
для получения радия из его руд, не является целью настоящей книги,
но следующие данные все же помогут составить некоторое пред-
ставление, почему процесс добывания радия так дорог. Карнотит,
из которого извлекается радий в Америке, в среднем дает немного
менее 1% окиси урана. Приблизительно из 2 000 т этого минерала
и горной породы, находящейся в смеси с ним, можно получить лишь
1 г чистого бромистого радия. Ручной сортировкой этого огромного
количества материала получается около 500 т измельченной руды,
содержащей около 0,003 г радия на тонну. Химические препараты,
требующиеся при извлечении 1 г радия, берут в количестве от 450
до 500 т вместе с приблизительно 10 000 т дестиллированной воды
и 1000 т угля. Завод с числом рабочих в 300 человек может получить
1 г радия в месяц. Не приходится удивляться, что 1 г радия стоит
около 60 000 долл. *
17. Применение радия. Наибольшее количество радия исполь-
зуется для лечения болезней, в частности для лечения рака. Броми-
стый радий, а также радон — радиоактивный газ, который являет-
ся одним из продуктов распада радия, — дают эманации, задер-
живающие рост раковых клеток и, как полагают, усиливающие
рост здоровой ткани. Радий не является все же единственным сред-
ством для лечения рака и не заменил собою хирургии. Смешан-
ный с особым видом фосфоресцирующего сернистого цинка он при-
бавляется к светящимся краскам для изображения цифр на карман-
ных часах и на других инструментах. От 10 до 25 ч. радия на
1 000 000 ч. краски дают блеск, видимый в темной комнате.
ГЛАВА XIX
ПОНЯТИЕ ОБ ЭНЕРГИИ
Прогресс, достигнутый человеком в борьбе с окружающей его
природой, был отмечен увеличением господства его над веществом,
из которого состоит его окружение. Отдельные эры, отмечающие
этот прогресс, имеют названия тех веществ, овладение которыми дало
человеку новое могущество. Он прошел через каменный век, брон-,
зовый век, железный век, наконец через стальной век. Параллельно,
но значительно медленнее человек научился использовывать силы
природы и эксплоатировать огромные природные запасы энергии
для облегчения своего труда. Так, например, человек научился
204
ПОНЯТИЕ ОБ ЭНЕРГИИ
использовывать тепловую энергию огня и силу ветра. Самая жизнь его
постоянно находилась в зависимости от лучистой энергии, приходив-
шей на землю от солнца; эта энергия запасалась в виде химической
энергии в тканях растений, служивших ему пищей, наконец станови-
лась энергией процессов его собственной жизни, когда пища сжига-
лась в его теле. Наш нынешний век в такой же мере век энергии,
как и стали.
1. Понятие об энергии. История развития понятия энергии
в высшей степени интересна. Вещество представляет собой нечто
такое, чего мы не можем не заметить, так как оно производит несом-
ненное впечатление на наши чувства. Слругой стороны, энергия —
блуждающий огонек. Она появляется, на наших глазах меняет свою
форму и затем как будто бы совершенно исчезает. К ней нельзя приме-
нить никакого простого инструмента вроде весов, чтобы измерить ее
количество, и таким образом нет ничего удивительного в том, что
установление закона сохранения энергии отсрочилось до половины
XIX ст., а вместе с ним и установление понятия энергии, как одного
из основных понятий физических наук. В следующих параграфах
мы изложим историю установления этого важного понятия.
2. Теория флогистона. Первую попытку определить энергию
как физическую сущность следует видеть в теории флогистона,
старавшейся объяснить сущность горения. Эта теория разраба-
тывалась в продолжение XVII ст. немецким химиком Иоган-
ном Иоахимом Бехером и немецким физиком Георгом Эрнстом Ста-
лем. Согласно этой теории, когда вещество сгорает, флогистон исче-
зает. Такое представление опередило более чем на столетие современ-
ное понятие об энергии. Однако с появлением весов появилась
тенденция всюду видеть только вещество. У всего, что не могло быть
взвешено, отрицалось право на независимое существование, и на
него смотрели исключительно, как на свойство вещества. В связи
с этим у защитников теории флогистона возникла попытка наделить
горение атрибутами вещества; попытка эта оказалась гибельной для
теории.
3. Теория теплорода. Между тем изучение явлений теплоты
вызвало интересные последствия, приведшие в конце концов к сов-
ременному понятию энергии. Хорошо известное стремление предме-
тов, соприкасающихся друг с другом, принимать одну и ту же
температуру дало в результате представление о теплоте, как о жид-
кости, перетекающей от более теплого тела к более холодному. Этой
жидкости было Дано название «теплорода». Вскоре было доказано,
что эта жидкость не имеет веса, так как теплый предмет весит не боль-
ше, чем холодный. Еще в 1829 г. теория теплоты, как жидкости,
была принята повсюду. В «Химии» Генри (изд. 1829 г.) мы
читаем:
Всего лучше объясняет тепловые явления теория, которая при-
нимает существование крайне тонкой жидкости, такой утонченной природы,
что она не обладает никаким ощутительным весом и способна проникать
между частицами наиболее плотных и твердых тел. К этой жидкости, точно
так же, как и к вызываемому ею ощущению, прежде прилагалось название
ПОНЯТИЕ ОБ ЭНЕРГИЙ
205
теплоты. Название «теплород», впервые предложенное Лавуазье, теперь часто
принимается, чтобы обозначить причину теплоты.
4. Измерение тепла. Применение весов при изучении химиче-
ских изменений привело к открытию закона сохранения веса веществ.
При определении количества вещества, претерпевающего изменения,
и количества вещества образующегося, оказалось, что оба эти коли-
чества равны друг другу. Совершенно аналогично, пооле того как
были разработаны методы измерения количеств тепла, заключающих-
ся в веществах, получился закон сохранения количества энер-
гии. Количество тепла, заключающееся в каком-либо теле, опре-
делить значительно труднее, чем количество вещества, так как
тепло в отличие от вещества взвешивать нельзя. Однако можно вос-
пользоваться в качестве меры для измерения тепла изменением
температуры, которая является внешним признаком прибавления
или отнятия тепла.
Джозеф Блек (1728—1799), профессор химии в Глазго и Эдин-
бурге, первый разработал методику, посредством которой можно
было измерять количество тепла. Он первый разработал понятие о
теплоемкости или удельной теплоте и о том, что мы теперь называем
скрытой теплотой. Один из простейших опытов Блека состоял в сме-
шении ртути при 150 и воды при 100° в равных количествах. Оказа-
лось, что температура полученной смеси равняется 120, а не 125°, как
это можно было ожидать. Блек считал, что ртуть отдает свое тепло
воде и что следовательно количество тепла, потеря которого пони-
жает температуру ртути на 30°, повышает температуру одинаковой
массы воды лишь на 20°. Из этого можно было сделать только одно
заключение — именно, что для повышения температуры одинако-
вых масс различных веществ на одно и то же количество градусов
необходимы разные количества тепла.
Три фактора определяют количество тепла, выделяемое или по-
глощаемое при охлаждении или нагревании какого-нибудь вещества:
природа вещества, количество вещества и изменение температуры.
Для того чтобы определить единицу измерения тепла, мы должны
выбрать определенное весовое количество какого-нибудь вещества
и определенное изменение температуры. Калория (единица измере-
ния тепла) определяется как количество тепла, необходимое для по-
вышения температуры 1 г чистой воды на 1° С, и является обще-
принятой единицей измерения в науке.
Теплоемкостью какого-нибудь вещества называется отношение
количества тепла, необходимого для повышения температуры опре-
деленного весового количества этого вещества на ГС, к тому коли-
честву тепла, которое необходимо для повышения температуры на
Г С равной массы воды. Это, естественно, все равно, что сказать, что
теплоемкость вещества равна количеству калорий тепла, которое
необходимо для того, чтобы поднять температуру 1 г этого вещества
на Г С.
Блек также обнаружил, что в случае плавления твердого веще-
ства или испарения жидкого поглощается относительно большое
206
ПОНЯТИЕ ОБ ЭНЕРГИИ
количество тепла без соответствующего изменения температуры.
Это же количество тепла выделяется обратно при обратных
процессах. В одном случае тепло это называется скрытой теплотой
плавления, а в другом — скрытой теплотой парообразования. В на-
стоящее время часто опускают слово «скрытая» и просто говорят
о теплоте плавления и теплоте парообразования. Первая представ-
ляет количество тепла, которое поглощается при плавлении 1 г ка-
кого-нибудь вещества, а вторая — количество тепла, поглощаемое
при превращении в парообразное состояние 1 г какой-нибудь жид-
кости.
5. Тепло, выделяющееся при трении. Теория теплорода очень
хорошо объясняла переход тепла от одного тела к другому, но не
в состоянии была объяснить природу тепла, выделяющегося при тре-
нии, или, иными словами, выделяющегося в результате механи-
ческих воздействий. Среди первых экспериментов, касающихся
тепла, получаемого в результате механической работы,необходимо
упомянуть об опытах Румфорда в начале XIX ст. Он наблюдал свер-
ление пушек, причем сверла приводились во вращение лошадьми.
В одном случае, как им указывается, работа, выполняемая одной
лошадью в течение 140мин., повысила температуру 19 фунтов (8,62 кг)
воды, пушки, сверла и всего оборудования для сверления до тем-
пературы кипения воды. Единственным изменением в самих материа-
лах, которое можно было наблюдать, являлось превращение мас-
сивного железа пушки в мелкое железо стружек. Сторонники теории
теплорода объясняли это явление следующим образом: если тепло-
емкость стружек меньше теплоемкости массивного железа, то выделе-
нием определенного количества калорий, вызванным сверлением,
можно объяснить повышение температуры. Румфорд определил
теплоемкость массивной бронзы и бронзовых стружек и нашел, что
обе величины одинаковы, в результате чего от теории теплорода
пришлось отказаться.
Другой, еще более убедительный эксперимент был осуществлен
Гемфри Дэви в Королевском институте в Лондоне, в том институте,
который был основан Румфордом в 1799 г. Королевский институт
был первым исследовательским институтом этого рода в мире, а
Гемфри Дэви его первым директором. Дэви сконструировал прибор,
в котором было осуществлено трение двух кусков льда в камере,
температура которой поддерживалась при 0°. При этом выделялось
тепло, что было заметно по тому, что куски льда таяли. Этот
факт был еще более разительным опровержением теории те-
плорода.
В 1847 г. перед Британской ассоциацией предстал молодой
пивовар из Манчестера по имени Джоуль. Он повторил опыты Рум-
форда, но в несколько измененном виде. Он поставил опыты механи-
ческого размешивания воды с помощью падающих грузов. Механи-
ческая работа, выполняемая таким грузом, равняется произведению
веса этого груза на то расстояние, на которое груз падает. Получен-
ное таким образом повышение температуры известной массы воды
ПОНЯТИЕ ОБ ЭНЕРГИИ
207
дало возможность вычислить количество выделившегося тепла (в ка-
лориях). Джоуль нашел, что всегда для повышения температуры
1 фунта воды на 1° С необходимо затратить 772 футо-фунтов механи-
ческой работы. Выражая тоже самое в граммах, сантиметрах и ка-
лориях, мы можем сказать, что для получения 1 кал необходи-
мо затратить 42 650 г-см механической работы. Это и является обще-
известным механическим коэффициентом тепла. Джоуль сумел также
доказать существование аналогичной зависимости между энергией,
затрачиваемой электрическим током, и количеством тепла, которое
этот ток выделяет. Работа Джоуля прошла бы незамеченной, если
бы не замечания Уильяма Томсона (лорда Кельвина), который,
после того как Джоуль зачитал свою работу, мастерски подчеркнул
все значение полученных им результатов.
6. Закон сохранения энергии. Через два года германский фи-
зик Гельмгольц впервые сформулировал «закон сохранения силы»,
который позднее, по предложению лорда Кельвина, был изменен
в «закон сохранения энергии». Этот закон гласит, что энергия не мо-
жет ни создаваться, ни разрушаться, но что она может переходить
из одной формы в другую. Этот закон может быть выражен и следу-
ющим образом: энергия мира постоянна.
7. Виды энергии. Мы можем воспринимать энергию только
тогда, когда она переходит из одного вида в другой, или когда
она изменяется количественно. Обычно изменения энергии сопрово-
ждаются движением тел, благодаря чему мы и узнаем об этих изме-
нениях. Падение воды, переход тепла от более теплого тела к более
холодному, расширение пара в цилиндре паровой машины, падение
груза, полет птицы — все это примеры превращения энергии, о ко-
тором мы судим по движению тел. Пока тела находятся в состоянии
покоя, мы не обнаруживаем существования энергии. Энергия камен-
ного валуна на выступе горы не дает нам никакого доказатель-
ства о своем существовании. Мы никогда не подозревали бы о
существовании энергии заключающейся в каменном угле, если бы
этот уголь никогда не был сожжен, хотя конечно мы можем подо-
зревать о существовании энергии по аналогии. Например, мы виде-
ли падение аналогичного валуна и видели, как горит уголь. Отсюда
мы можем предположить о существовании энергии в неподвижном
валуне и в куске угля. Энергия, обязанная своим происхождением
движению тел, называется кинетической энергией, тогда как энер-
гия, которая не привела еще тела в движение, называется потен-
циальной энергией.
Различают несколько форм кинетической энергии. Энергия дви-
жения тел— твердых, жидких или газообразных — называется ме-
ханической энергией; энергия движущихся молекул — тепловой
энергией; энергия движущихся электронов — электромагнитной
энергией.
Хорошо известно, что два тела, разделенные пространством,
стремятся двигаться по направлению друг к другу. Это стремление
называется гравитационной силой (силой притяжения). Причины
208
ПОНЯТИЕ ОБ ЭНЕРГИИ
этого явления неизвестны. Человек стремится объяснить' это влия-
ние или действие на расстоянии предположением, что какая-то сила
толкает эти два тела по направлению друг к другу, так как чело-
век знаком с фактом, что для того, чтобы привести тело в движение,
необходимо его толкнуть. Фактор, вызывающий приложение силы
тяжести, должен нам дать доказательства своего существования.
Применяя понятие о силе для объяснения действия притяжения,
мы повинны лишь в том, что придумываем понятие для того, чтобы
представить себе механизм процесса. Стремление электрически за-
ряженных тел притягиваться или отталкиваться в зависимости от
того, различны ли их заряды (один положительный, а другой отрица-
тельный) или же одинаковы (оба положительны или оба отрица-
тельны), является другим общеизвестным примером действия на
расстоянии, так же как и стремление разных полюсов двух магнитов
притягиваться, а одинаковых отталкиваться. Эти три силы — гра-
витационная сила, сила электростатического притяжения или оттал-
кивания и сила магнитного притяжения или отталкивания — изме-
няются обратно пропорционально квадрату расстояния между
принимающими участие в этом явлении телами.
Вследствие наличия гравитационной силы (силы притяжения),
для того чтобы отдалить два тела друг от друга, необходимо затра-
тить работу, иными словами, необходимо к этим телам приложить
энергию. Эта энергия сообщается обоим телам по мере удаления их
друг от друга. Когда же тела придут наконец в состояние покоя,
они будут обладать энергией, зависящей от их относительного по-
ложения по отношению друг к другу. Такая энергия и называется
потенциальной энергией. Количество потенциальной энергии, полу-
чаемой обоими телами, как раз равно количеству энергии, затрачен-
ному при удалении обоих тел друг от друга. Вес тела является
мерилом гравитационного притяжения, существующего между телом
и землей. Совершенно ясно, что количество потенциальной энер-
гии, которым обладает тело вследствие силы тяжести, определяется
весом тела и той высотой, на которую оно было поднято. Необхо-
димо затратить одинаковое количество энергии как для того, чтобы
поднять груз в 1 кг на высоту в 10 м, так и для того, чтобы поднять
груз в 10 кг на высоту 1 м, причем как тот, так и другой грузы при-
обретут в результате этого процесса одно и то же количество потен-
циальной энергии.
Потенциальная энергия, приобретенная грузом, поднятым на
определенную высоту, может быть выделена обратно в виде механи-
ческой энергии, если грузу дать упасть обратно на землю. Количе-
ство механической энергии, которым груз будет обладать в момент
перед тем как удариться о землю, будет как раз равно первона-
чальной потенциальной энергии
Таким же образом, если удалять друг от друга два тела,
стремящихся притягиваться под действием их электрических за-
рядов, или приближать два тела, отталкивающих друг друга, эти
тела приобретают потенциальную энергию. Потенциальная энергия
ПОНЯТИЕ ОБ ЭНЕРГИИ
209
Может также образоваться из механической энергии в том случае, если
производится работа против магнитных сил.
Силы внутримолекулярного притяжения изучены еще недоста-
точно. Однако кажется весьма вероятным, что силы эти частично
являются гравитационными силами, частично электростатическими,
а частично магнитными. Какова бы ни была их природа, они делают
возможным то, что молекулы обладают потенциальной энергией
в количестве, которое увеличивается при удалении молекул друг
от друга и уменьшается при их приближении. Расширяющийся газ
поглощает тепловую энергию, превращая ее в потенциальную.
Этим фактом пользуются в холодильных установках, которые были
нами рассмотрены в одной из предыдущих глав. По тем же причинам
энергия поглощается при испарении какой-нибудь жидкости, так
как этот процесс предполагает отделение испаряющихся молекул
от остальных молекул. Поглощаемая при этом теплота будет
теплотой парообразования. Естественно, что при обратных изме-
нениях потенциальная энергия выделяется в одной из форм ки-
нетической энергии.
8. Химическая энергия. Относительное положение атомов вну-
три молекулы какого-нибудь вещества является причиной еще одной
формы потенциальной энергии — химической или внутренней энер-
гии. Эта форма потенциальной энергии по существу вероятно элект-
рического порядка, так как она зависит от распределения электро-
нов и протонов внутри атомов. Каждое чистое вещество обладает
своей долей этой энергии, хотя одни вещества обладают большим
количеством ее, чем другие. В том случае, когда имеет место хими-
ческая реакция, количество выделившейся тепловой, световой,
электрической или какой-либо иной формы энергии представляет
как раз разность между количеством химической энергии, которым
обладают продукты реакции, и тем количеством химической энер-
гии, которым обладали исходные вещества. Когда водород реаги-
рует с кислородом и образует воду, то выделяется тепло. Следова-
тельно количества водорода и кислорода, вступившие в реакцию,
обладали ббльшим запасом химической энергии, чем образовавшаяся
вода. При разложении воды электрическим током поглощается
электрическая энергия, которая сохраняется в виде химической
энергии образовавшихся молекул водорода и кислорода. При раз-
ложении 1 моля вбды количество израсходованной электрической
энергии как раз эквивалентно количеству тепловой энергии, вы-
деляющейся при образовании 1 моля воды из элементов, как того
и требует закон сохранения энергии. Так, при образовании 1 моля
жидкой воды из водорода и кислорода выделяется 68 330 кал
тепловой энергии и соответственно 285 619 джоулей электрической
энергии поглощаются при разложении 1 моля воды на водород и
кислород. Так как 1 кал эквивалентна 4,18 джоуля, то эти два коли-
чества энергии равноценны.
До сих пор мы не имеем верного метода для измерения общего
количества химической или внутренней энергии, которой обладает
14 Введение в химию.
210
ПОНЯТИЕ OB ЭНЕРГИИ
какое-нибудь вещество. Все, что мы можем измерить, —
это разности внутренней энергии по количеству той энергии,
которая выделяется или поглощается при химическом изменении
вещества.
9. Внутриатомная энергия. Исследование явления радиоак-
тивности выявило внутри атомов элементов огромные запасы потен-
циальной энергии, количество которой мы за последнее время на-
учились определять. В принципе относительности, предложенном
Эйнштейном в 1905 г., заложено понятие об эквивалентности массы и
энергии. В том случае, когда тело приобретает или теряет массу,
одновременно теряется или приобретается и соответствующее ко-
личество энергии. Согласно этому революционизирующему понятию
масса и энергия просто различные стороны одного и того же объек-
та. Оказывается, что 1 г эквивалентен 9 х 1020 эргам. Если бы нам
удалось соединить вместе 4 грамматома водорода (атомный вес 1,008)
и получить при этом 1 грамматом гелия (атомный вес 4,000), то
0,032 г массы были бы потеряны системой в виде энергии. Это было
бы эквивалентно выделению Зх Ю19 эргов или 7Х1011 кал. Следова-
тельно мы могли бы получить 700 000 000 000 кал из 4 г водорода
в том случае, если бы из последнего образовался гелий. При сжи-
гании 4 г водорода с образованием воды выделяется только
136660 кал. Это дает нам некоторое представление о величине внут-
риатомной энергии сравнительно с химической энергией. К сожа-
лению, до сих пор нам еще не удалось начать эксплоатацию этого
огромнейшего запаса энергии.
10. Особенность тепловой энергии. В 1686 г. Исаак Ньютон
в своих знаменитых «Началах» дал три закона движения, из которых
первый гласит, что тело продолжает пребывать в состоянии покоя
или равномерного движения по прямой линии до тех пор, пока на
него не подействует какая-нибудь внешняя сила. Если бы какое-
нибудь тело можно было заставить двигаться с определенным запасом
механической энергии на таком расстоянии от других тел, что силой
притяжения можно было бы пренебречь, то это тело двигалось бы не-
прерывно с постоянной скоростью в том направлении, в котором оно
было пущено. Однако на нашей земле тела, находящиеся в движении,
не движутся бесконечно долго, а довольно быстро приходят в состоя-
ние покоя. Мяч, брошенный вверх, рано или поздно (и скорее рано,
чем поздно) упадет обратно на землю. Поезд не может находиться в
движении после того, как израсходован весь уголь, а автомобиль
после того, как опустел бензиновый бак. По закону сохранения
энергии та энергия, которая заставила двигаться мяч, поезд или
автомобиль, не могла исчезнуть. Куда же она делась? Она коли-
чественно превратилась в теплоту. Тело не может двигаться на земле,
не встречая на своем пути других тел. В результате этого имеет место
трение или превращение энергии в теплоту. Энергию необходимо
было затратить на то, чтобы придать автомобилю первоначальную
скорость, и если бы не было трения, то, придя раз в движение,
при неизменных условиях автомобиль продолжал бы двигаться не-
ПОНЯТИЕ ОБ ЭНЕРГИИ
211
прерывно и его нельзя было бы не только остановить, но даже и
управлять им. Энергия может сохраняться в течение любого периода
времени в одной из потенциальных форм, но в том случае, когда
потенциальная энергия выделилась в одной из форм кинетической
энергии, рано или поздно она превращается количественно в теплоту.
Химическая энергия, выделившаяся при сжигании угля под котлом
паровоза, превращается сперва в теплоту, которая в свою очередь
лишь частично превращается в механическую энергию поезда. Од-
нако как только она принимает эту форму, она снова затем превра-
щается в теплоту при движении поезда. Потенциальная энергия
высоко расположенного ручья превращается в теплоту при падении
воды или же может быть частично превращена с помощью турбин
и генераторов гидроэлектрической станции в электрическую энергию,
но в этой форме кинетической энергии она существует недолго, так
как при передаче ее по металлическим проводам, при превращении
ее в механическую энергию с помощью электромоторов, или в
свет с помощью электрических лампочек постепенно завершается
переход ее в теплоту. Так как все вещества являются проводниками
тепла, то выделяющееся тепло вскоре рассеивается в окружающей
среде до тех пор, пока не будет достигнут общий температурный уро-
вень. Вся земля служит как бы резервуаром тепла, находящимся
при более или менее равномерной температуре.
11. Способность теплоты превращаться в другие формы энер-
гии. Если какое-либо тело имеет температуру окружающей среды,
то его тепловая энергия не может переходить в другие формы энер-
гии и следовательно не может быть применена для выполнения ра-
боты. В земле имеются запасы огромного количества энергии в фор-
ме теплоты, которой было бы достаточно для выполнения работы
всех машин в течение столетий; однако запасы эти должны оставаться
неиспользованными. Если когда-нибудь была бы изобретена машина,
которая могла бы работать на этом огромном запасе энергии, то проб-
лема вечного движения практически была бы разрешена. Такая машина
не противоречила бы закону сохранения энергии, так как она исполь-
зовала бы энергию, в существовании которой никакого сомнения быть
не может, однако она противоречила бы так называемому второму за-
кону термодинамики, закону доступности тепловой энергии. Мы
могли бы вообразить, что такая машина установлена на океанском
пароходе и черпает энергию для вращения лопастей пропеллера
из почти бесконечного запаса тепловой энергии океана, причем вода
от этого охлаждается на весьма незначительную величину. Затем
эта энергия возвращалась бы обратно океану в результате трения,
которое развивается между судном и водой, по которой оно идет.
Однако такая машина никогда не была построена и закон доступ-
ности тепловой энергии говорит нам, что она никогда не сможет быть
построена. Когда этот закон был впервые предложен, был сделан
целый ряд попыток его опровергнуть, причем все эти попытки, без
исключения, оказались безуспешными. Сперва этот закон выражал
только результаты опыта без всяких объяснений того, почему такие
14*
212
ПОНЯТИЕ ОБ ЭНЕРГИИ
машины реализованы быть не могут. Современные понятия о харак-
тере тепловой энергии дали эти объяснения.
12. Природа тепловой энергии. Читатель помнит, что изу-
чение природы давл ения газов привело к молекулярно-кинетической
теории. Согласно этой теории газы состоят из молекул, которые дви-
жутся таким беспорядоч ным образом, что количество молекул, дви-
жущихся в одном направлении, в среднем равно количеству движу-
щихся в противоположном направлении. В случае жидкостей то же
самое состояние беспорядочного движения молекул должно сущест-
вовать внутри жидкости, где силы внутримолекулярного притяже-
ния, действующие на одну молекулу, одинаковы со всех сторон и
следовательно уравновешивают друг друга. В твердых телах моле-
кулярное движение на заметные расстояния по прямой линии ко-
нечно невозможно, так как атомы или молекулы занимают фикси-
рованное положение в кристаллической решетке. Однако даже и
при этих условиях атомы или молекулы твердого вещества вибри-
руют около этих фиксированных точек кристаллической структуры.
Читатель также помнит, что беспорядочное движение молекул остает-
ся неизменным, если только температура постоянна. Это хаотическое,
беспорядочное движение молекул и воспринимается нами как те-
пловая энергия.
13. Температура. Различные термометрические шкалы, как-
то шкалы Фаренгейта, Цельсия и Реомюра были разработаны для
измерения температуры задолго до того, как была полностью понята
природа тепловой энергии. Все три шкалы определялись при помощи
свойств одного только вещества — воды. Например 0° шкалы Цель-
сия определялся как температура, при которой леди вода находятся
в равновесии, а Ю0° С—как температура кипящей воды при давлении
в 1 ат. Свойство тел расширяться при повышении температуры
было широко применено в приборах для ее измерения. Особенно
для этой цели подходит ртуть, так как расширение ее весьма одно-
образно в широких температурных пределах. Обыкновенный ртут-
ный термометр можно прокалибрировать, погрузив его сперва в за-
мерзающую, а затем в кипящую воду для определения на шкале
соответственно точек 0° С и 100° С. Затем интервал между этими
двумя точками делится на 100 равных частей, каждая из кото-
рых соответствует 1°С. Деления такой же величины отклады-
вают выше метки соответствующей 100°, и ниже метки, соответст-
вующей 0°. Температуры ниже 0° обозначают отрицательной
величиной.
Современная теория тепловой энергии рассматривает темпе-
ратуру как меру интенсивности молекулярного движения, другими
словами, как меру кинетической энергии молекул. Если это так, то
хотя и не может быть высшего предела температуры, до которой ве-
щество может быть нагрето, однако должен быть низший предел,
так как не может быть никакой температуры, если движение молекул
вещества прекращается. Такое вещество не будет обладать тепловой
энергией, следовательно будет абсолютно холодным. Эта темпера-
ПОНЯТИЕ ОБ ЭНЕРГИИ
213
тура и обозначается нулем по абсолютной или термодинамической
шкале.
Самым непосредственным доказательством, которое мы имеем
о молекулярном движении, является давление газов. Следовательно
это давление может служить одним из наиболее точных методов из-
мерения температуры. Исходя из термических соображений, было
показано, что при охлаждении газа до —273° давление, а следова-
тельно и всякое молекулярное движение, должно исчезнуть. Эта тем-
пература соответствует нулю градусов абсолютной или термодинами-
ческой шкалы. Температуру, выраженную в градусах Цельсия,
легко превратить в абсолютную температуру, прибавив к первой
273°.
При одинаковой температуре средняя кинетическая энергия
индивидуальных молекул всех газов одинакова. Это должно быть
так, потому что при смешении двух газов, находящихся при одной
и той же температуре, не происходит изменения в средней кинети-
ческой энергии каждого рода молекул.
Температура по абсолютной шкале температуры согласно опре-
делению прямо пропорциональна давлению, которое оказывает
определенное количество газа в определенном объеме. Давление в
свою очередь пропорционально общей кинетической энергии моле-
кул газа. Для определенного количества газа общая молекулярная
кинетическая энергия пропорциональна средней кинетической энер-
гии индивидуальных молекул. Отсюда следует, что средняя кинети-
ческая энергия молекул газа прямо пропорциональна абсолютной
температуре. А так как масса определенной молекулы очевидная
константа, то квадрат ее скорости должен быть прямо пропорцио-
нален абсолютной температуре.
14. Превращение механической энергии в тепловую. Теперь
мы в состоянии рассмотреть причину, почему все другие формы
кинетической энергии постепенно деградируют в тепловую и почему
тепловая энергия тела, находящегося при той же температуре,
что и окружающая среда, не может быть обратно превращена в дру-
гие формы энергии. Всякая иная форма кинетической энергии будет
направленной энергией. Твердое движущееся тело, жидкость, те-
кущая по трубе, электроны, передвигающиеся по проводу, — все это
примеры кинетической энергии, имеющей направление. Тепловая же
энергия—движение молекул — беспорядочна ине имеет направле-
ния. Механизм превращения механической энергии в тепловую состоит
в превращении направленного движения тела в некоординированное
движение составляющих предмет молекул. Масса воды в состоянии
покоя в соответствующем сосуде состоит из миллиардов и миллиар-
дов молекул, движение которых характеризуется средней кинети-
ческой энергией, которая и определяет температуру воды. Если
этой воде дать стеаь по сифону в расположенный ниже сосуд, то
определенное количество механической энергии прибавится к неко-
ординированной тепловой энергии молекул. По мере того как во-
да течет по сифону, между водой и стенками трубки разви-
214
ПОНЯТИЕ ОБ ЭНЕРГИИ
вается трение, и часть направленной механической энергии всей
массы молекул ьоды теряется, превращаясь в тепло. Остаток меха,
нической энергии падающей воды превращается в тепловую, когда
вода приходит в состояние покоя в нижнем сосуде. Температура
воды, сифонной трубки и нижнего сосуда несколько повысится в ре.
зультате образовавшейся тепловой энергии за счет механической
энергии падающей воды.
15. Доступность тепловой энергии. В том случае, если тем-
пература какого-нибудь тела выше температуры окружающей сре-
ды, часть ее тепловой энергии может быть превращена в другие
формы энергии. Тепло обычно переходит непосредственно от более
теплого тела к окружающей среде до тех пор, пока температура
их не сравняется; одновременно при этом не образуется другой
формы энергии. Можно однако тепловую энергию направить в со-
ответствующую машину таким образом, чтобы тепловая энергия,
удаление которой сравнивает температуру тела с температурой окру-
жающей среды, превращалась бы в механическую энергию. Для
того чтобы использовать всю тепловую энергию тела, температура
его должна была бы быть понижена до абсолютного нуля. Такая
машина пока еще не сконструирована. Самым лучшим результатом,
на достижение которого мы можем надеяться, является количествен-
ное превращение в механическую энергию того тепла, которое вы-
деляется при понижении температуры тела до температуры окру-
жающей среды. Если мы рассмотрим случай охлаждения какого-
нибудь тела без изменения его состояния, от 100 до 0° С, т. е. от 373
до 273 А, то только 100/з7з первоначального количества тепловой
энергии может быть при этом превращено в механическую энергию.
Тепловая машина, которая может использовать максимальное ко-
личество тепла, выделившегося при этом охлаждении, смогла бы
превратить только 27% тепловой энергии нагретого тела в полезную
работу. Чем выше первоначальная температура нагретого тела и
чем холоднее окружающая среда, тем больше тот коэфициент полез-
ного действия, с которым тепловая энергия может быть превращена
тепловой машиной в механическую энергию. По этой причине паро-
вые котлы, работающие на ртути, обладают более высоким коэфи-
циентом полезного действия по сравнению с теми, которые исполь-
зуют тепловую энергию водяного пара.
Если температура тела равна температуре окружающей среды,
то тепловая энергия, которой еще обладает тело, не может быть
использована для полезной работы, т. е. она не может быть превра-
щена в другие формы энергии. Если бы можно было разработать
процесс, по которому можно было бы заставить все молекулы
тела двигаться по одному только направлению, то в результате
было бы достигнуто полное превращение тепловой энергии в ме-
ханическую и притом в количестве, равном общему количеству
кинетической энергии индивидуальных молекул. Никому однако
до сих пор это не удалось. Конечно имеется всегда шанс за то,
что если молекулы предоставить самим себе на достаточно дли-
ЛУЧИСТАЯ ЭНЕРГИЯ
215
тельный срок, то в некоторый момент может оказаться, что все моле-
кулы будут двигаться в одном и том же направлении, так как их дви-
жение случайно, и такой шанс согласно теории вероятностей не ис-
ключен. Однако этот шанс настолько незначителен, принимая во
внимание те миллиарды молекул, которые содержатся в теле,
обладающем некоторым размером, что следует сказать, что он вооб-
ще маловероятен.
ГЛАВА XX
ЛУЧИСТАЯ ЭНЕРГИЯ
В течение миллионов лет солнце излучает в пространство поток
энергии, небольшая часть которой сделала возможной жизнь на на-
шей планете. Полное объяснение того, каким образом такая энер-
гия, как лучистая, может передаваться через почти абсолютную
пустоту междузвездного пространства, нам еще неизвестно, но ис-
тория борьбы ученых за объяснение не только способа переда-
чи лучистой энергии, но и ее происхождения и последующего
поглощения веществами, чрезвычайно интересный объект для из-
учения.
1. Соперничающие теории. В 1675 г. Исаак Ньютон (1642—
1717) прочитал доклад в Королевском обществе о «гипотезе, объяс-
няющей свойства света», в которой он предположил существование
«эфирной среды, примерно такого же состава, что и воздух, но толь-
ко более редкой, утонченной и упругой». Далее он предположил, что
свет состоит из быстро движущихся маленьких телец (корпускул),
испускаемых светящимися телами, которые после этого испускания
двигаются все с большей и большей скоростью до тех пор, пока
сопротивление «эфирной» среды, через которую они проходят, не
сравняется с движущей их силой. После этого они начинают двигать-
ся с постоянной скоростью, так же как это делают падающие в во-
де тела, после того как сопротивление воды в известный момент сде-
лается равным ускорению, сообщаемому телу силой тяжести.
Через 30 лет Ньютон опубликовал свою классическую работу
«Оптика», в которой он снова защищал корпускулярную теорию
света.
В 1690 г. голландский физик Гюйгенс в своем «Трактате о свете»
впервые предложил волновую теорию распространения света. В
этом трактате он проводит сравнение между распространением света
и распространением звука и предполагает, что свет, так же как и
звук, распространяется путем сферических волн, весьма похожих
на те волны, которые образуются в том случае, если в воду бросить
камень. Однако авторитет Ньютона был настолько велик, что до-
стоинства, которыми обладала волновая теория, остались невыяв-
ленными и в течение следующей сотни лет общепринятой теорией
света была корпускулярная теория.
Волны однако обладают некоторыми свойствами, которыми кор-
216
ЛУЧИСТАЯ ЭНЕРГИЯ
пускулы не обладают, и следовательно если свет представляет яв-
ление, обладающее волновым характером, то, казалось бы, нетрудно
доказать его волновую природу. Всем на-
пример известно, что водяные волны обхо-
5
дят такое препятствие на своем пути, ка-
ким является например волнорез. Каждая
Рис. 71. Расположение экра-
нов для получения рисунка
интерференции.
движущаяся частица воды сама становится
центром колебаний, в результате чего
возникает ряд волн. Эти волны распростра-
няются кругами по поверхности воды.
Таким образом когда волны подходят
к краю препятствия, в воде возникают новые волны, которые
частично обходят это препятствие. Это свойство волн было известно
как Ньютону, так и Гюйгенсу, но ни тому ни другому не уда-
лось доказать, что свет отклоняется или преломляется таким же
образом. И только тогда, когда через 100 лет Томас Юнг открыл
явления дифракции и интерференции, а французский инженер Фре-
нель блестяще объяснил эти явления с помощью волновой теории,
последняя вступила в свои права, и корпускулярная теория была
оставлена.
В 1802 г. Томас Юнг (1773—1829) поставил опыт, послуживший
блестящей иллюстрацией к явлению интерференции. Три экрана
друг другу, как это показано на
оыли поставлены параллельно
рис. 71. Луч света проходит
через щель S в первом экране,
далее проходит через две щели
А и В во втором экране, нахо-
дящиеся на равном расстоянии
от S, и падает на третий экран.
При этих условиях на третьем
экране появляются чередую-
щиеся светлые и темные зоны,
которые образуют то, что назы-
вается узором интерференции.
Объяснение опыта Юнга дано на
рис. 72. Мы имеем дело с ди-
Рис. 72. Интерференция лучей света.
фракцией волн у краев щелей, причем образуется два ряда волн со
щелью в центре каждого ряда. При этих условиях на некоторых ли-
ниях гребни и провалы обоих рядов волн будут в точности совпа-
дать, в результате чего произойдет удвоение интенсивности света
по этим линиям. С другой стороны, по другим линиям гребни волн
от одной щели будут совпадать с провалами волн от другой. При
этом произойдет полная нейтрализация и по этим линиям не будет
никакого света. Между теми линиями, где интенсивность света мак-
симальна, и теми, где она минимальна, происходит падение в силе
света от наиболее ярких линий до линий полной темноты. Если по-
перек этих линий поставить экран, то можно будет заметить рисунок
интерференции.
ЛУЧИСТАЯ ЭНЕРГИЯ
217
Явления интерференции и дифракции несомненно говорят
в пользу правильности волновой теории. После работ Юнга и Френ-
келя эти доказательства показались настолько убедительными, что
волновая теория оказалась общепринятой. Время от времени, в те-
чение XIX ст. открывались все новые и новые факты, которые все
как будто подтверждали ее правильность.
2. Свойства света и волновая теория. Рассмотрим теперь, каким
же образом свойства света могут быть объяснены при помощи
волновой теории. Каждую
волну можно характеризо-
вать ее длиной (рис. 73), ам-
плитудой и скоростью, с ко-
торой она распространяется.
Длина волны светового луча
определяет его цвети обо-
значается греческой буквой
лямбда (X). Амплитуда ха-
к-------Л -----------»1
Рис. 73- Длина волны и амплитуда.
растеризует его интенсивность, т. е. его яркость. Свет распростра-
няется в пустоте со скоростью равной 2,9986 х 1010 см/сек. Это
примерно соответствует 300 000 км)сек.
Оливер Лодж дает такую яркую картину всей огромности
этой скорости, что мы позволим себе здесь его процитировать.
Вообразите нитку, которой по экватору опоясан земной шар и которая
проходит через все континенты и океаны; если эту нитку вытянуть в прямую
линию, то мы получим расстояние, которое свет преодолевает в одну седьмую
секунды. Чтобы получить расстояние, проходимое светом за одну секунду,
пришлось бы эту нитку обернуть семь раз вокруг земного шара и затем
вытянуть в прямую линию; этакая нитка почти достигла бы луны. Свет
от луны достигает земли черетюдну с четвертью секунды; от солнца через
восемь минут; от звезд, даже наиболее ярких, через года и даже через сто-
летия; некоторые же тусклые и дальние звезды, видимые через большие
телескопы, мы видим в том состоянии, в котором они были сотни тысяч лет
назад... Вот насколько огромен масштаб мира!
Среда, через которую свет распространяется, как и можно было
ожидать, влияет на его скорость. Скорость света в воздухе лишь не-
многим менее скорости в пустоте, но скорость его в воде равна лишь
3/4 скорости в воздухе.
Частота (v) колебаний определяется как число волн, прохо-
дящих через определенную точку в секунду. Она представляет собой
функцию, зависящую от длины волны к и скорости с, с которой эта
волна распространяется. Число волн в секунду (частота) равно
расстоянию, проходимому в секунду (скорости) и деленному на длину
волны:
Таким образом частота — функция, обратная длине волны.
218
ЛУЧИСТАЯ ЭНЕРГИЯ
3. Мировой эфир. Несомненно перед вами уже вставал вопрос
о природе той среды, волновым движением которой является свет.
Свет распространяется в пустоте межзвездного пространства с боль-
шей легкостью, чем через любую материальную среду. Что это за неу-
ловимое нечто, наполняющее все пространство и служащее средой
для распространения лучистой энергии, но не обладающее свой-
ствами известных нам веществ? Никто этого не знает. Физики уже
давно называют эту среду «мировым эфиром», но необходимо всегда
помнить, что назвать неизвестное, это еще не значит доказать су-
ществование названного. Те, которые верят в существование эфира,
предполагают, что он заполняет все пространство — не только
пространство между небесными телами, но и между теми мельчай-
шими частицами, из которых состоит вещество. Однако все попытки
доказать его существование терпели неудачу. Знаменитый опыт
Майкельсона-Морлея, целью которого было определить, увлекается
ли часть эфира при вращении земли или нет, не дал никаких
указаний на увлечение эфира. Эйнштейн в своей теории относитель-
ности предполагает, что эфир не существует, так как ни один опыт
не доказал его существование. Как бы там ни было, понятие об эфи-
ре оказалось весьма полезным в деле представления механизма
распространения света.
4. Электромагнитная природа света. Рассмотрим теперь кратко
другое направление исследований, которые впервые были пред-
приняты Майкелем Фарадеем более 100 лет тому назад и тогда
казались мало связанными с явлением света, хотя в дальнейшем
этим исследованиям было суждено разъяснить с новой стороны при-
роду световых волн. Фарадею первому принадлежит заслуга в уста-
новлении связи между электрическими зарядами и магнитными по-
люсами. Его экспериментальная ^бота была превосходной, но
познания в математике недостаточны. В результате этого его объяс-
нения — скорее механические картины, чем математические урав-
нения. Примерно в 1865 г. Джемс Кларк Максвелл, профессор фи-
зики в Кембридже, подверг работу Фарадея тщательному и мастер-
скому математическому анализу, в результате которого выявилась
поразительная аналогия между светом, с одной стороны, и электро-
магнитным полем — с другой. Ему удалось доказать, что скорость,
с которой электромагнитные волны распространяются в простран-
стве, равна скорости света и что световые волны по своей природе
являются электромагнитными. Вместе с другими это доказал экспе-
риментально в 1877 г. великий германский физик Генрих Герц,
показавший, что при разряде заряженного конденсатора разряд
по своему характеру оказывается колебательным и что при этих
условиях возникают некоторые электромагнитные явления, распро-
страняющиеся в окружающем эфире со скоростью света. Далее
он доказал, что эти электромагнитные явления волнового характера,
так как они обладают свойствами дифракции и интерференции.
Таким образом к концу XIX ст. ученые считали, что механизм
распространения света окончательно разрешен. Мы увидим, что
ЛУЧИСТАЯ ЭНЕРГИЯ
219
в дальнейшем их самонадеянности был нанесен решительный
удар.
5. Преломление. Когда луч монохроматического света, т. е.
одноцветного света, проходит через какую-нибудь поверхность в дру-
гую среду, направление его пути изменяется.
Это зависит от того, что скорость его при
прохождении из одной среды в другую из-
меняется. Явление это называется преломле-
нием (рефракцией). Углом падения называ-
ется угол, образуемый направлением падаю-
щего луча с нормалью (перпендикуляром)
к поверхности (^/АВС на рис. 74). Угол,
образуемый преломленным лучом и норма-
лью, называется углом преломления (^EBF
на рис. 74).
При прохождении луча света через сте-
клянную пластинку, преломление происхо- Рис. 74. Преломление
дит на обоих поверхностях, как это пока- лучей у поверхности,
зано на рис. 75.
Угол преломления для одного и того же угла падения и для од-
ной и той же среды неодинаков для различных цветов. Например
красный свет отклоняется стеклом от своего первоначального пути
в воздухе менее, чем фиолетовый свет. Белый свет, например солнеч-
ный или свет от электрической дуги, содержит свет всех цветов,
Когда белый свет из воздуха поступает в стекло, различные цвета
преломляются по разному и получается полоска вроде радуги,
Рис. 75. Преломление лучей
у двух поверхностей.
Рис. 76. Дисперсия.
называемая спектром. Красный свет отклоняется менее всего, затем
идет оранжевый, желтый, зеленый, синий и наконец фиолетовый
(рис. 76). Это явление называется дисперсией.
Вам несомненно известно применение призмы для разложения
белого света. Если через такую призму пропустить луч монохромати-
ческого (одноцветного) света, то направление его пути изменяется
у каждой поверхности, как это видно из рис. 77. При пропускании
220
ЛУЧИСТАЯ ЭНЕРГИЯ
луча белого света через такую призму происходит дисперсия на каж-
дой поверхности, в результате чего получается явление, показанное
на рис. 78.
Применение такой призмы в приборе, называемом спектро-
скопом, для определения, из каких лучей состоит луч белого света,
будет рассмотрено в следующей главе.
6. Видимый спектр. Длина волны света определенного цвета
может быть измерена несколькими различными путями, рассматри-
вать которые мы здесь не будем. Эту длину можно затем выразить
Рис. 77. Путь светового луча
в призме.
Рис. 78. Дисперсия солнечного
луча призмой.
в любой удобной единице длины, например в сантиметрах, миллимет-
рах, футах и т. п. Одной из единиц, чаще всего применяемой в спек-
О
троскопии, является единица Ангстрема (А). Эта единица равна
10"7 8 см. Частоту света можно вычислить, разделив соответствующую
длину волны на скорость света. Человеческий глаз чувствителен
только к свету в очень узком интервале длин волны. Длины волн
О
цветов видимого спектра расположены все в пределах между 4000 А
(=4хЮ-8 см) для наиболее короткой волны видимого фиолетового
света и 8000 А (=8х Ю-8 см) для наиболее длинной волны видимого
красного света.
Таблица XXVIII. Д л и н ы волн цветов видимого спектра
Цвет ° А Цвет А
Красный Оранжевый Желтый СЛ О -4 со ел ел ООО ООО 1 1 1 ел ел о —J со сл сл О О Зеленый Синий Фиолетовый 5750—4900 4900—4550 4 550—3950
7. Полный спектр электрома нчтных волн. Однако цвет света
не является природным свойством самого света, а только психоло-
гическим признаком света, падающего на глазное яблоко, откуда
он как бы по «телеграфу» передается оптическим нервом в мозг.
ЛУЧИСТАЯ ЭНЕРГИЯ
221
Мы уже видели, что природа видимого света в основном та же, что
и природа электромагнитных излучений Герца. Однако эти герцов-
ские волны не производят впечатления света на наши зрительные
нервы. Видимый свет лишь небольшая часть излучений вообще.
Существуют электромагнитные волны, которые длиннее волны крас-
ного света, обладающего максимальной длиной волны из числа види-
мых нашим глазом лучей, и волны, которые короче самых коротких
волн, — фиолетового света. Такой источник света, который излу-
чал бы световую энергию с волнами всех длин неизвестен, но
если бы даже такой источник света и был найден, то нам не известна
такая призма, которая смогла бы разложить такой свет и дать полный
электромагнитный спектр. Однако для поставленной нами цели
целесообразно построить такой гипотетический спектр и разбить
его на зоны, как это сделано на рис. 79.
Рис. 79. Полный электромагнитный спектр длины волн
(в единицах Ангстрема).
Великие пионеры в деле изучения оптики, Ньютон и Гюйгенс,
знали только световую энергию относительно незначительной по-
лоски с длинами волн, составляющими видимый свет. Вскоре однако
было обнаружено, что фотопластинка чувствительна и к лучам с бо-
лее короткой длиной волны, чем фиолетовые. Эти лучи были названы
ультрафиолетовыми. В предыдущих главах мы уже упоминали об
открытии рентгеновых и гамма-лучей с еще меньшей длиной волны,
чем в случае ультрафиолетовых лучей. Недавно Милликэн обнаружил
лучи с еще меньшей длиной волны, чем гамма-лучи. Эти так назы-
ваемые космические лучи обладают громадной проникающей спо-
собностью и могут проникнуть на глубину воды до 60 м и пройти
через 5 м свинца, тогда как гамма-лучи максимальной частоты обла-
дают проникающей способностью равной 5—7,5 см свинца. Эти лучи
образуются где-то в пространстве и обладают такой незначительной
интенсивностью, что при достижении ими земли для их открытия
требуются чрезвычайно точные инструменты. Оказывается, что солн-
це не имеет никакого отношения к их образованию, так как их ин-
тенсивность одинакова как в полдень, так и в полночь. Милликэн
и Камерон предложили теорию, частично основанную на некоторых
222
ЛУЧИСТАЯ ЭНЕРГИЯ
опытных данных, согласно которой эти лучи испускаются при син-
тезе атомов таких элементов, как гелий, кислород и кремний, из сво-
бодных электронов и протонов в необъятном межзвездном простран-
стве.
Уже в самом начале зарождения оптики была открыта область
инфракрасных лучей в ряду тепловых волн. Эти лучи легко погло-
щаются материей и превращаются в тепловое движение молекул.
Если держать термометр в области, находящейся сейчас же за крас-
ными лучами видимого спектра, он зарегистрирует повышение тем-
пературы, хотя эта область на экране и будет совершенно темной.
Эти лучи не действуют на обычную фотопластинку, что и следовало
ожидать, так как уже красные лучи видимого спектра не влияют
или почти не влияют на фотографическую пластинку, и красный свет
можно применить в качестве «безопасного» света при проявлении.
Однако применяя некоторые органические красители, можно сде-
лать эмульсию фотографической пластинки чувствительной к свету
в области красных и инфракрасных лучей. Это открытие принесло
большую пользу в деле аэросъемки во время мировой войны, так
как преобладающими цветами земной поверхности являются красные
и коричневые тона. За областью инфракрасных лучей находятся
волны еще большей длины, именно волны Герца, применяющиеся
в радиотехнике. Эти волны являются гигантами среди остальных
электромагнитных волн, причем некоторые из них достигают длины
в сотни и тысячи метров.
8. Химия и лучистая энергия. Читатель, быть может, удив-
ляется, что в курсе химии мы уделяем так много места изучению
лучистой энергии. Не следует однако забывать, что нет такой обла-
сти спектра, за исключением космических лучей и лучей Герца,
которая не применялась бы к исследованию вещества и его реакций.
Структура твердых веществ стала ясной после исследования их с по-
мощью рентгеновых лучей. Строение атома было исследовано с по-
мощью того света, который атом выделяет или поглощает. При це-
лом ряде химических реакций происходит поглощение лучистой
энергии. Примером подобного рода фотохимической реакции являет-
ся восстановление бромистого серебра фотографической пластинки
в металлическое серебро. При синтезе сахаров, осуществляемом
растениями из углекислого газа воздуха и воды, содержащейся в
почве, необходимо поглощение лучистой энергии солнечных лучей.
Только благодаря этой реакции возможно существование раститель-
ной и животной жизни на земле. Кроме того, принимая во внима-
ние растительное происхождение каменного угля, эта реакция дает
энергию, которая делает возможной нашу современную цивили-
зацию. Жан Перрен, известный французский физик, выдвинул
теорию, по которой все химические реакции по существу реакции
фотохимические. Но, как заметил один из его соотечественников,
«нет такого обобщения, которое было бы правильным и даже это
обобщение неправильно». Все же, хотя теория Перрена и не во
всех случаях оказалась правильной, это был весьма важный шаг
ЛУЧИСТАЯ ЭНЕРГИЯ
223
в направлении разрешения проблемы химической реакционной спо-
собности.
9. Виды спектров. Если свет, испускаемый различными све-
тящимися телами, исследовать с помощью призмы или дифракцион-
ной решетки, то можно обнаружить три типа спектров. Свет от рас-
каленного твердого вещества, например от лампочки накаливания
или от вольтовой дуги, дает сплошной спектр, состоящий из непрерыв-
ной цветной полосы от фиолетовой до красной части видимого спек-
тра, которая продолжается и в область ультрафиолетовых и инфра-
красных лучей. Раскаленные жидкости, например расплавленные
металлы, дают тот же тип спектра. Однако при свечении газов,
которое происходит или в результате высокой температуры, или
при пропускании электрического разряда, мы имеем дело с другим
типом спектра. В этих случаях спектр состоит из ряда ярких линий
разделенных темными областями. Цвет этих линий характерен
для тех элементов, из которых состоит газ. Такой спектр называется
линейным. Изучение этих спектров оказалось чрезвычайно полез-
ным для выяснения строения атома, как мы это увидим в следующей
главе. Третий тип спектра получается при пропускании света, излу-
чаемого накаленным твердым телом, через нагретый газ. Он состоит
из непрерывного спектра, поверх которого нанесены узкие темные
линии. Эти линии указывают на поглощение нагретым газом света
с длинами волн, соответствующими положению темных линий не-
прерывного спектра нагретого источника. Такой спектр называется
спектром поглощения, причем и в этом случае спектр поглощения
элемента оказывается характерным для данного элемента. Положе-
ние темных линий соответствует положению ярких линий на ли-
нейном спектре. Другими словами, светящийся газ испускает свет
с теми же длинами волн, как и те, которые он поглощает, если через
него пропускать луч белого света. Более подробно линейный спектр
и спектр поглощения будут рассмотрены в следующей главе.
10. Испускание лучистой энергии как функция температуры.
Мы уже видели, что различие между видимым светом и лучистой
тепловой энергией или инфракрасными лучами заключается только
в различной длине волн, а не в самой природе лучей. В том случае
когда лучистая энергия, независимо от того, принадлежит ли она
к видимой или невидимой части спектра, поглощается непрозрач-
ным телом, эта энергия превращается в тепло, т. е. в движение мо-
лекул. Если свет в видимой части спектра мы можем определять
не только по тепловому эффекту, но и при помощи нашего органа
зрения, то о существовании инфракрасных лучей мы можем судить
лишь по тому тепловому ощущению, которое они производят, когда
касаются поверхности нашего тела.
Если твердое тело нагреть до температуры выше температуры
окружающей среды, то оно начинает испускать лучистую энергию
в виде инфракрасных лучей с большей скоростью, чем та, с которой
эти лучи падают на него из о кружающей среды. По мере повышения
температуры тело испускает лучи все с меньшей и меньшей длиной
224
ЛУЧИСТАЯ ЭНЕРГИЯ
волны до тех пор, пока при 500—600° оно не накалится докрасна,
т. е. часть испускаемого им света будет обладать настолько малой
длиной волны, что расположится уже в красной части видимого спект-
ра. При еще более высокой температуре происходит излучение всех
цветов видимого спектра, так что тело доходит до белого каления.
Одновременно чрезвычайно возрастает интенсивность излучения
в области инфракрасных лучей, так что твердые тела, раскаленные
добела, испускают даже больше энергии в виде невидимого теплово-
го излучения, чем в форме видимого света. Твердые тела при темпе-
ратуре вольтовой дуги излучают не только инфракрасные и види-
мые лучи, но и ультрафиолетовые.
Астрономы определяют температуру звезды по тому, насколько
далеко свет от такой звезды заходит в область ультрафиолетовых
лучей. Относительно холодные звезды — красного цвета, более
горячие — синего. Для каждой температуры существует такая дли-
на волны, интенсивность излучения которой максимальна. По ме-
ре повышения температуры длина волны максимальной интенсив-
ности все уменьшается, переходя от инфракрасных и красных лу-
чей к фиолетовой части видимого спектра. Солнечный свет дости-
гает максимальной интенсивности где-то между областями желто-
го и зеленого цветов. Это указывает на то, что на поверхности солнца
температура равняется примерно б 500°; по сравнению с рядом дру-
гих звезд эта температура не очень высока. Она все же значительно
выше, чем та максимальная температура, которая была достигнута
на земле и которая равна примерно 3 500°. Весьма характерно, что
наши глаза наиболее чувствительны к свету с длиной волны, которая
соответствует максимальной интенсивности солнечного света.
И. Ультрафиолетовые лучи. Ультрафиолетовые лучи извест-
ны, хотя бы по имени, каждому. В газетах и журналах часто встре-
чаются указания на ту пользу, которую эти лучи оказывают в деле
предупреждения рахита. Особенно богат этими важными для здо-
ровья лучами солнечный свет. Загар, образующийся на нашей коже,
еще важнее для нашего здоровья, чем для нашего вида. Оконное
стекло не пропускает ультрафиолетовых лучей, так что зимой,
когда большую часть времени мы проводим в помещении, мы
лишены этих лучей. За последнее время появились новые виды
оконного стекла, которые в большей или меньшей степени пропускают
эти лучи. Кроме того в продаже появились уже ультрафиолетовые
лампы для домашнего обихода. Итак, очень многие знают о том,
какую пользу приносят ультрафиолетовые лучи, но лишь немногим
знакома природа этих лучей и те опасности, которые связаны с их
применением.
Ультрафиолетовой областью спектра более или менее произ-
вольно считается та область лучей, длина волны которых лежит
между 135 и 4000 А. Излучения в этой области влияют на химические
вещества фотографической пластинки еще более сильно, чем види-
мый свет, и поэтому легко могут быть фотографируемы. Некоторые
ЛУЧИСТАЯ ЭНЕРГИЯ
225
химические вещества, например бариевая соль платиноцианисто-
водородной кислоты, будучи подвергнуты действию ультрафиоле-
товых лучей, сильно флуоресцируют. Эти вещества поглощают лу-
чистую энергию ультрафиолетовых лучей и выделяют часть ее в ви-
де волн такой длины, что они становятся для нас видимыми. Флуорес-
цирующий экран, покрытый бариевой солью платиноцианистово-
дородной кислоты светится ярким зеленоватым, флуоресцирующим
светом при освещении его ультрафиолетовыми лучами. Лучи средней
части ультрафиолетовой области легко поглощаются даже тонкими
слоями воздуха, так что изучать их можно лишь в вакууме. Лучи
по краям этой области уже не так легко поглощаются атмосферой.
Вследствие того что воздух поглощает ультрафиолетовые лучи, ин-
тенсивность этих лучей гораздо больше на вершинах гор, чем на
уровне моря.
Как было сказано выше, обыкновенное оконное стекло почти
целиком поглощает ультрафиолетовые лучи. Кварцевое же стекло
пропускает эти лучи. Это стекло получается сплавлением чистых
кристаллов кварца SiO2. Вследствие того, что для сплавления
требуется высокая температура, этот вид стекла стоит очень дорого.
В настоящее время изобретены различные, менее дорогие, суррогаты
кварцевого стекла.
В свежеизготовленном виде большая часть этих стекол более
или менее пропускает ультрафиолетовые лучи с большей длиной
волны, однако эта способность стекла обычно быстро утрачивается,
так как в результате действия лучей в стекле происходят изменения
физического и химического порядка.
Так как раскаленные вещества испускают свет, богатый ультра-
фиолетовыми лучами, то электрические дуговые лампы могут служить
источником такого рода лучей. Газы при низких давлениях при
пропускании через них электрического разряда также испускают
ультрафиолетовые лучи. Наиболее извертна из таких ламп ртутная
лампа. Она состоит из небольшого количества жидкой ртути, нахо-
дящейся в кварцевой трубке, по обеим сторонам которой впаяны
электроды. При высокой температуре, возникшей при прохождении
через трубку тока, ртуть частично испаряется, и свет, испускае-
мый светящимися парами ртути, является богатейшим источником
ультрафиолетовых лучей.
Ультрафиолетовый свет, падая на вещество, вызывает во многих
случаях — помимо обычного теплового эффекта — и химические
изменения. Это фотохимическое действие ультрафиолетового света
особенно велико в случае органических соединений, молекулы ко-
торых обычно весьма сложны. При кратковременном действии уль-
трафиолетовых лучей на такие соединения происходят только незна-
чительные изменения, длительное же действие вызывает глубокий
распад молекул вещества. Это особенно имеет место в том случае,
когда органические вещества подвергаются действию ультрафиоле-
товых лучей в присутствии кислорода воздуха. По этой причине
живой организм весьма чувствителен к действию ультрафиолетовых
15 Введение в химию.
226
ЛУЧИСТАЯ ЭНЕРГИЯ
лучей. Микроскопические животные организмы, например бактерии,
вызывающие различные болезни, предоставляют действию лучей
относительно большую поверхность, чем высшие организмы. Этой
ведет к тому, что действие лучей в течение такого периода времени,
который для человека может оказаться даже полезным, будет смер-
тельным для бактерий, вследствие разрушения тех соединений, из
которых состоят их ткани. На многих городских водопроводных
станциях применяют ультрафиолетовый свет для уничтожения вре-
доносных бактерий в водопроводной воде. Организмы, живущие
в темноте, например бактерии, особенно чувствительны к действию
ультрафиолетовых лучей. В табл. XXIX указано время в секундах,
необходимое для умерщвления различных бактерий ультрафиоле-
товыми лучами.
Таблица XXIX. Время, необходимое для умерщвления микро-
организмов
(на расстоянии 200 мм от кварцево-ртутной лампы при 66 V и 3,5 А)
Микроорганизмы Время (в сек.) Микроорганизмы Время (в сек.)
Бацилла холеры . . . » тифа . . . » дезинтерии . » Coli . . . 13 18 17 16 Pneumobacillus .... В. tetanus Paramaecia Дрожжи 21 40 180 больше 300
Ультрафиолетовый свет умеренной интенси вности действует
стимулирующе на человеческие ткани, длительное же действие этих
лучей оказывает вредное действие. Коричневый пигмент, образую-
щийся в коже в результате действия солнечных лучей, служит за-
щитным механизмом, вырабатываемым нашим организмом" против
слишком интенсивного действия ультрафиолетовых лучей на нежные
ткани, лежащие непосредственно под кожей. Ультрафиолетовые
лучи действуют чрезвычайно раздражающим образом на глаза.
Действие этих лучей даже при умеренной интенсивности в течение
даже нескольких минут вызывает серьезное и болезненное воспа-
ление, последствия которого могут ощущаться годами. Более дли-
тельное действие ультрафиолетовых лучей ведет к слепоте. Поэтому
в комнате, в которой происходит излучение ультрафиолетового света,
необходимо носить предохранительные очки.
Влияние ультрафиолетовых лучей однако не всегда оказывается
вредным. Ведь нельзя забывать, что слишком большая порция даже
хорошего всегда вредна. Рахит всегда был одной из неприят-
нейших детских болезней. Рахит возникает в результате дефекта
того механизма, с помощью которого организм контролирует разви-
тие костей. Рахитичные дети страдают запоздалым и ненормальным
развитием костей, что ведет к искривлению костей и неправиль-
ЛУЧИСТАЯ ЭНЕРГИЯ
227
ному развитию зубов. Эта болезнь известна лишь в умеренных зо-
нах: ни в арктическом, ни в тропическом климате случаев этой бо-
лезни не было обнаружено. В течение последних нескольких столе-
тий считалось, что солнце является предупредительным средством
против этой болезни, поэтому дети, которые живут в тропическом
климате и совсем не носят одежды или носят ее очень мало,
рахитом не страдают. В умеренной же зоне во время длинных зимних
месяцев дети большую часть времени проводят в помещении и отго-
рожены оконным стеклом от ультрафиолетового света солнца. Кро-
ме того эти месяцы — наиболее темные месяцы в году, поэтому рахит
развивается почти исключительно в зимнее время. Прекрасной ил-
люстрацией эффективности солнечного света в деле предупрежде-
ния этой болезни послужило исследование рахита у индусских де-
тей, проведенное Хетчинсоном и Шолем. Оказалось, что дети трудя-
щихся, которые бегают голыми
по улицам, никогда не заболевают
рахитом, но что дети высших
каст Индии обычно страдают тя-
желым рахитом вследствие того,
что их матери должны вести за-
творнический образ жизни из-за
религиозных обычаев. Это ведет
к тому, что и дети находятся
вместе со своими матерями в тем-
ных комнатах.
12. Лучи Рентгена. Мы уже
говорили об открытии этих лу-
Рис. 80. Рентгеновская трубка Ку-
лиджа.
чей Рентгеном в 1895 г. Эти лучи .обладают еще меньшей длиной
волны, чем ультрафиолетовые лучи. Они занимают область в общем
О
спектре, расположенную между 0,06 и 100 А, и появляются всегда
в тех случаях, когда неожиданно прерывается быстрое движение
электронов вследствие столкновения их с каким-либо телом. На
рис. 80 схематически изображена современная рентгеновская
трубка кулиджевского типа. Она состоит из нити F, нагреваемой
электрическим током от низковольтной батареи А, причем эта
нить служит источником потока электронов. Мишень (антикатод)
Т делается из очень плотного металла с высокой температурой
плавления, например из вольфрама. Между мишенью и нитью
поддерживается высоковольтная разность потенциалов посредством
батареи В, причем антикатод является положительно заряженным по
отношению к нити. В таком электрическом поле электроны, излу-
чаемые нитью, достигают весьма большой скорости. В момент столк-
новения их с антикатодом образуются рентгеновы лучи.
Применение рентгеновых лучей в фотографии общеизвестно.
Лучи эти обладают способностью проникать через вещества, непро-
ницаемые для видимого света. Эта проникающая способность быстро
возрастает по мере уменьшения длины волны. В свою очередь дли-
на волны рентгеновых лучей, образующихся в приборе Кулиджа,
15*
228
ЛУЧИСТАЯ ЭНЕРГИЯ
уменьшается по мере возрастания той внезапности, с которой прио-
станавливается движение электронов при ударе об антикатод.
Эту внезапность остановки можно увеличить посредством увеличе-
ния скорости электронов, что достигается увеличением разности
потенциалов между нитью и антикатодом и применением для анти-
катода более плотных металлов.
Применение рентгеновых лучей во всех областях врачебной
практики хорошо известно, но применение их металлургами для
исследования физической структуры металлов и сплавов гораздо
менее известно в широких кругах. Кроме применения их для иссле-
дований в медицине рентгеновы лучи применяются также и для ле-
чения некоторых кожных заболеваний. Однако в случае такого при-
менения нужна особая осторожность, так как если пациента под-
вергнуть чрезмерному действию рентгеновых лучей, то это может
повести к образованию чрезвычайно болезненных и медленно
заживающих язв, похожих на ожоги гамма-лучами радиоактивных
элементов.
13. Лучи Рентгена и строение кристаллов *. В одной из пре-
дыдущих глав, при рассмотрении природы твердых веществ, мы
обещали разобрать метод, применяемый для исследования струк-
туры кристаллов. Теперь мы уже имеем возможность разобраться
в этом важном и интресном методе. Мы уже видели, что если
свет на своем пути встречает какой-нибудь предмет, то могут про-
изойти три явления: свет может отразиться от поверхности пред-
мета; он может пройти через предмет, наконец может этим пред-
метом поглотиться, причем в этом случае энергия его превра-
тится в тепло. Обычно все эти три явления протекают одновременно.
Мы видим предмет в результате тех изменений, которые он оказы-
.вает на свет, исходящий от какого-нибудь источника освещения.
Эти изменения оказывают известное влияние на наш глаз, причем
влияние это интерпретируется нашим мозгом. Если размеры пред-
мета очень малы, то мы можем и не увидеть его, так как влияние,
оказываемое им на световые волны, падающие на него, будет очень
незначительно. Риф например оказывает влияние на гигантскую
океанскую волну, но устричная раковина не оказывает на нее ника-
кого влияния. Это как раз и является причиной того, почему мы
не видим отдельных молекул. Волны видимого света являются как
бы гигантскими океанскими волнами по отношению к молекулярным
«устричным раковинам»; последние не оказывают на эти волны ни-
какого влияния. Для того чтобы увидеть какую-нибудь частицу,
даже в самый сильный микроскоп, диаметр ее должен быть больше
длины волны видимого света. Микроскопы оказывают огромную по-
мощь нашему зрению, так как они чрезвычайно увеличивают пред-
меты, которые не видны невооруженному глазу, однако микроскопы
не могут нам помочь увидеть молекулы, диаметр которых примерно
в 10 000 раз меньше наиболее короткой из видимых световых волн.
♦Брэгг, О природе вещей, гл. IV.
ЛУЧИСТАЯ ЭНЕРГИЯ
229
Поэтому молекулы всегда должны оставаться невидимыми для нашего
глаза.
Таким образом попытки увидеть молекулы и атомы, лежащие
в основе кристаллического строения твердого вещества, совершенно
бесполезны. Однако рентгеновские лучи дают нам метод, с помощью
которого мы можем определить относительное положение молекул
и атомов. Длины волн рентгеновских лучей примерно порядка 10-8 см,
т. е. приблизительно в 10 000 раз короче длин волн видимого света.
Они представляют собой как бы мелкую зыбь в океане эфира, если
продолжать наше сравнение. Величина их примерно того же
порядка, что и диаметры атомов. Отсюда следует, что группа атомов
или молекул, лежащих в одной плоскости, может отразить рентге-
нов луч, и это отражение может быть сфотографировано.
Рис. 81. Пучок рентгеновских лучей,
направленный на плоскость кри-
сталла.
Рис. 82. Интерференция пучков
рентгеновских лучей, отраженных
от различных плоскостей кристаллов.
Теперь попытаемся разобраться в методе, разработанном Уилья-
мом Брэггом и его сыном. Рассмотрим пучок рентгеновых лучей,
направленных по линии АВ под углом 0 к поверхности кристалла
(рис. 81).
Ряд атомов XX, расположенных на поверхности, показан на
рисунке. Гребни каждой волны в пучке рентгеновых лучей изобра-
жены прямой WW и линиями ей параллельными. Большая часть
рентгеновых лучей пройдет дальше первой плоскости, небольшая же
часть их отразится в направлении CD. Этот отраженный луч будет
во всем походить на первоначальный, так как длина волны его будет
та же самая, отличаться же он будет лишь своей меньшей интенсив-
ностью. На рис. 82 изображены также плоскости, параллельные по-
верхности и находящиеся под XX. Каждая из этих плоскостей отразит
также по пучку рентгеновых лучей, гребни которых изображены
на рисунке в виде уу и zz. В общем гребни волн, отраженных от
YY и ZZ, не совпадут с гребнями волн, отраженных от XX. Между
ними будет происходить более или менее значительная интерферен-
ция, в результате которой ceej совсем не отразится или же отразит-
ся очень мало. Изменяя угол 0, мы тем самым изменяем относи-
тельное положение лучей, отраженных от каждой плоскости.
При некотором угле 0 волны, идущие от всех плоскостей, сов-
падут друг с другом. В этом случае мы получим отражение
230
ЛУЧИСТАЯ ЭНЕРГИЯ
с максимальной интенсивностью. Если же угол будет таким, что про-
изойдет синхронизация различных волн, отраженных от параллель-
ных кристаллических плоскостей, то, зная длину волны применяемых
рентгеновых лучей, можно вычислить расстояние между кристалли-
ческими плоскостями. Рассмотрим теперь, как это можно сделать.
На рис. 83 к — это длина волны пучка монохроматических
рентгеновых лучей, падающих по прямым АВ, А'В', А"В” и т. д.
Эти лучи отражаются от плоскостей кристалла рр, р'р' р"р"
по прямой ВС. Угол 0 таков, при котором гребни лучей,
отраженных от всех плоскостей, при своем совпадении дают
максимальное отражение. Продолжаем прямую А'В' до плоско-
Рис. 83. Зависимость между длиной волны рентгеновских
лучей и расстоянием между плоскостями кристалла.
сти р"р”, проводим прямую в BD перпендикулярно плоскостям
кристалла, и строим прямую BN, перпендикулярную прямой B'D.
Угол NBD равен углу 0, так как стороны их взаимно перпендику-
лярны. АВС и А'В'С — это расстояния, проходимые светом, отра-
женным соответственно от плоскостей рр и р'р'. А'В'С должно быть
больше АВС или на одну длину волны, или же на целое число, умно-
женное на длину волны к, для того чтобы гребень волны от р'р'
совпал бы с гребнем волны от рр. Это можно выразить следующим
уравнением:
п\ = А'В'С — АВС (где п — целое число);
с другой стороны
А'В'С — АВС = В'В — B'N,
но
В'В = B'D,
откуда
пк = А'В'С — АВС = B'D - B'N = ND.
В свою очередь
1 Из тригонометрии известно, что синус острого угла в прямоугольном тре-
угольнике равен отношению противолежащей стороны к гипотенузе.
ЛУЧИСТАЯ ЭНЕРГИЯ
231
где d—расстояние между плоскостями кристалла;
ND = 2d sin 0,
ИЛИ
откуда
неизвестных ве-
d — расстояние
Рис. 84. Кристаллы хло-
ристого натрия.
лк—2d sin 0.
К сожалению, в этом уравнении мы имеем две
личины: к — длину волны рентгеновых лучей и
между плоскостями кристалла. К счастью, расстояние между
плоскостями кристалла легко может быть вычислено по друго-
му методу для кристалла, структура которого настолько проста,
что расположение атомов в ячейках совершенно очевидно. Кристалл
например поваренной соли (хлористого на-
трия) является кубом, что указывает на
такое расположение атомов натрия и хлора
в первичных ячейках кристалла, какое по-
казано на рис. 84. На этом рисунке видно,
что атом хлора в центре одновременно явля-
ется угловым в каждом из восьми показан-
ных кубов. Аналогично, каждый атом на-
трия или хлора внутри кристалла может
быть отнесен к одному из восьми кубов. При
большом числе атомов хлора и натрия в кри-
сталле соли имеется столько первичных ку-
бов, сколько в нем атомов натрия и хлора.
Если нам известен вес 1 см3 соли, т. е. удель-
ный вес соли, и мы знаем, сколько молекул
находится в таком кубе, то легко вычислить
число кубических первичных ячеек, находящихся в кристалле соли,
объем которого равен 1 см3. Удельный вес соли равен 2,163; по-
этому 2,163 г—вес 1 см3 соли. Кроме того мы знаем, что граммолекула
любого вещества состоит из 6,06 х 1023 молекул. Граммолекула соли
равняется 58,455 г. Следовательно одна молекула соли весит
58,455 — о 645 у Ю'23 г
6,06 х ю»— у’04 х и
Отсюда следует, что в 1 см3 соли содержится
С,М32,х .0-= 2'242 Х 10”
или вдвое большее число атомов натрия и хлора. Следовательно
1 см3 соли будет состоять из 4,484хЮ22 первичных кубических
ячеек. Таким образом объем каждой первичной ячейки равен:
—________— о 23 х 10~23 сл3
Если расстояние между кристаллическими плоскостями равно d,
то объем первичной ячейки будет d3. Отсюда
d3 = 2,23 х 10“23C4t3;
d =2,814 х Ю“8сл<.
232 ИЗЛУЧЕНИЕ И ПОГЛОЩЕНИЕ ЛУЧИСТОЙ ЭНЕРГИИ
Если мы для данного кристалла знаем d, то длину волны рентгеновых
лучей можно определить на основании выведенной нами выше фор-
мулы:
= 2d sin 0.
Применяя длину волны какого-нибудь пучка монохроматиче-
ских рентгеновых лучей, которая была таким образом определена,
мы можем, пользуясь той же формулой, определить расстояние меж-
ду кристаллическими плоскостями других кристаллов. Повторяя
эту операцию со всех сторон кристалла, можно определить расстоя-
ния между всеми возможными группами параллельных плоскостей.
Изучение результатов, полученных при такого рода определениях,
дает возможность, при соответствующем опыте, построить модель,
показывающую положение каждого атома в кристалле Ч
ГЛАВА XXI
ИЗЛУЧЕНИЕ И ПОГЛОЩЕНИЕ ЛУЧИСТОЙ ЭНЕРГИИ
Отношение физиков к своей отрасли науки в конце XIX ст.
было прекрасно высказано проф. Милликеном в его первой лекции
в Иэльском университете в 1926 г. на тему «Эволюция в науке и
религии».
Часть этой лекции касается как раз вопроса, разбираемого в
настоящей главе:
Что же мы знаем о природе явления, названного нами лучистой энер-
гией, явления, посредством которого звездные массы рассеиваются в про-
странстве? Словом, что представляет собой сейчас мировой эфир с точки
зрения физиков XIX века?
С физической стороны мировой эфир в 1890 г. обозначал физику элек-
тромагнитных волн и в настоящее время он обозначает абсолютно то же
самое. Электромагнитные волны четко и безусловно определяются с по-
мощью некоторых наблюденных свойств. Во-первых, электромагнитные
волны распространяются в пространстве со скоростью, которая может быть
точно измерена и которая равняется скорости света, т. е. 300 000 км в се-
кунду. Во-вторых, все эти волны обладают определенной периодичностью,
или частотой, которая может быть точно измерена и которая, будучи раз-
делена на скорость света, дает длину волны. В-третьих, эти волны обладают
еще одним свойством, которое может быть измерено и которое характери-
зуется словами «состояние поляризации», причем точное определение этого
понятия здесь можно и не давать. Отметим только, что все эти свойства совер-
шенно независимы от различных теорий, касающихся вопроса о природе
электромагнитных волн.
Мы можем получать и изучать электромагнитные волны самых раз-
нообразных частот: чрезвычайно длинные радиоволны, длина которых
измеряется километрами, затем тепловые волны, световые волны с длиной
волны порядка 5/1000 мм, потом ультрафиолетовые лучи, рентгеновы
лучи, частота которых в 10 000 раз меньше частоты обычного света, далее
1 Экпериментальная работа Брэггов прекрасно изложена самим Уильямом
Брэггом в его увлекательной книжке «О природе вещей», которую каждому
следует прочесть.
ИЗЛУЧЕНИЕ И ПОГЛОЩЕНИЕ ЛУЧИСТОЙ ЭНЕРГИИ
233
гамма-лучи и наконец космические лучи, частота которых в 1000 раз меньше
частоты рентгеновых лучей. Из всего этого видно, что физика эфира не
является туманным комплексом идей, что она имеет дело с эксперименталь-
ными фактами, которые могут быть точно измерены, действительность
которых вне всякого сомнения, которые наконец совершенно независимы
от всяких спекуляций и теорий...
До 1900 г. все явления, связанные с волнами эфира, как будто бы точно
соответствовали такого рода волновой теории. Успехи ее были весьма зна-
чиЛльны. Она объясняла такие красивые несложные явления, как окрашен-
ность мыльных пузырей и наиболее сложные явления интерференции. До
1900 г. эта теория не терпела никаких поражений. В течение первых 15 лет
этого столетия однако был открыт ряд новых явлений, которые уже нельзя
было объяснить, пользуясь понятиями физики эфира XIX века.
Целью этой главы и является рассмотрение некоторых из этих
явлений и тех способов, с помощью которых физики пытаются их
объяснить.
Сперва нам придется вернуться примерно к середине прошлого
столетия, когда были открыты и впервые исследованы спектры по-
глощения и линейные спектры.
1. Изобретение спектроскопа. Два ученых работали вместе
в скромной лаборатории Гейдельбергского университета. Один из
них был Роберт Вильгельм Бун-
зен, профессор химии, имя которого
нами всегда ассоциируется с бун-
зеновской горелкой, и Кирхгофф,
профессор физики. Фраунгофер в
то время открыл уже темные ли-
нии в солнечном спектре, носящие
теперь его имя. Бунзен работал
над применением окрашенного
пламени в качественном анализе.
Рис. 85. Принцип устройства
спектроскопа.
Опыты эти могут быть осуществлены в лаборатории весьма просто.
Смачивают чистую платиновую проволоку, конец которой обра-
зует петлю. Петлю погружают в соль какого-нибудь металла,
после чего проволоку вносят в пламя бунзеновской горелки. Соль
металла испаряется при температуре пламени и частично раз-
лагается. Образующиеся атомы металла начинают испускать свет
характерного цвета, который может быть использован для опреде-
ления металла, например пламя натрия желтого цвета, калия — фио-
летового, стронция — красного и т. д. Окраска фейерверков как раз
и зависит от присутствия таких металлических солей в порошко-
образных смесях. Бунзен уже пользовался призмой для анализа
света, получаемого от такого рода пламени, на составляющие цвета,
т. е. он уже применял полосатые спектры светящихся металличе-
ских паров для идентификации металла. Когда в 1854 г. Кирхгофф
приехал в Гейдельберг в качестве профессора физики, они вдвоем
изобрели спектроскоп, с помощью которого луч света можно было
разложить на составные цвета. Схема этого инструмента пока-
зана на рис. 85. Коллиматор С состоит из щели, с одной стороны,
и линзы для получения пучка параллельных лучей — с другой.
234
ИЗЛУЧЕНИЕ И ПОГЛОЩЕНИЕ ЛУЧИЬГОЙ ЭНЕРГИИ
Свет по выходе из коллиматора разлагается призмой Р на составные
цвета, причем каждый цвет с помощью линзы в трубе Т собирается
в фокусе таким образом, что его можно видеть в окуляр в виде изоб-
ражения щели на темном фоне. В окуляре, в том месте, где получается
спектр, помещается шкала, градуированная в длинах волн. Это
дает возможность наблюдателю знать длину волны каждого цвета
в линейном спектре элемента.
2. Применение спектроскопа. Спектроскоп дает возможность
определять такие малые количества элемента, что применение его
может дать благоприятные результаты даже в тех случаях, когда
химический анализ применен быть не может. Бунзен и Кирхгофф
первые установили, что каждый элемент в виде светящихся паров
дает характерный линейный спектр. В 1860 г. Бунзен сообщил
об открытии нового элемента, названного им цезием (от латинского
caesius — небесно-голубой) вследствие двух красивых голубых ли-
ний в его спектре. Он обнаружил присутствие этого элемента (с по-
мощью спектроскопа) в воде некоторых источников в Дюркгейме.
Концентрация цезия в этой воде была настолько незначительной,
что Бунзену удалось выделить только 17 г хлористого цезия из
40 m воды. В следующем году он открыл рубидий (rubidus — темно-
красный), в виде следов содержавшийся в минерале петалите. Затем
спектроскоп был направлен на звезды и изучен их состав. С помощью
этого же инструмента можно вычислить скорость движения звезд
относительно земли, но рассмотрение этого вопроса завело бы нас
слишком далеко. Об открытии с помощью спектроскопа нового эле-
мента гелия на солнце, за 40 лет до того, как присутствие его было
обнаружено на земле, уже сказано в одной из предыдущих глав.
Легче всего получить спектр газообразного элемента, пропу-
ская высоковольтный ток через стеклянную или кварцевую трубку,
в которой находится газ при очень низком давлении. Такие трубки
нашли за последнее время применение для реклам и вывесок, причем
буквы состоят из трубок, содержащих газ, через который можно
пропускать электрический ток. Особенно красивы трубки, напол-
ненные неоном; они светятся ярким красным светом.
3. Спектр водорода. Линейный спектр элемента водорода,
как и следовало ожидать, наиболее прост сравнительно со спектрами
других элементов. Его легко можно исследовать, наблюдая в спект-
роскопе свет, испускаемый светящимся газом. Он состоит из трех
линий: красной, голубой и фиолетовой. Если спектр водорода фото-
графировать с помощью пластинок, чувствительных к инфракрас-
ным лучам, можно обнаружить много других ярких линий в области
инфракрасных и ультрафиолетовых лучей. Полный спектр водорода
изображен на рис. 86. Линии сгруппированы как бы в трех отдель-
ных группах или рядах, причем по мере приближения к предельной
длине ^волны, отмеченной на рисунке (в каждом случае) пунктирной
линией, они располагаются теснее и теснее друг к другу.
Различные длины волн света, соответствующие ярким линиям
спектра водорода, обязаны своим происхождением какому-то меха-
ИЗЛУЧЕНИЕ И ПОГЛОЩЕНИЕ ЛУЧИСТОЙ ЭНЕРГИИ
235
низму, связанному со структурой атома водорода. Эти линии можно
сравнить с музыкальной струной, принадлежащей какому-то скры-
тому музыкальному инструменту. Имеет ли физик возможность
описать строение этого инструмента, анализируя частоты звуковых
волн, которые он испускает? Возможно ли для физиков построить
воображаемую модель водородного атома, анализируя частоты света,
которые он испускает? Одним из больших триумфов современной фи-
зики явилась возможность дать
положительный ответ на этот во-
прос.
4. Еще о планетарных элек-
тронах. В связи с открытием
электрона, а также в связи с эле-
ктромагнитной теорией света,пред-
ложенной Кларком Максвеллом, у
Г. А. Лоренца возникла мысль,
Рис. 86. Спектр водорода.
что электроны, находящиеся внутри атома, возможно служат в ка-
честве вибраторов и дают начало электромагнитным волнам свето-
вой энергии, пободно тому как вибрирующий камертон дает начало
звуковым волнам. Эти электроны могли бы также поглощать све-
товую энергию некоторых частот, вибрирующих в тон или резони-
рующих с их световой энергией, аналогично с камертоном, приходя-
щим в состояние колебания от движения звуковых волн.
Мы уже видели, что химики разработали теорию строения ато-
ма, по которой планетарные электроны занимают неподвижное по-
ложение в пространстве вокруг ядра. Физики же всегда указывали
на то, что такая система не могла бы существовать, так как неподвиж-
ный электрон несомненно упал бы на ядро вследствие притяжения
разноименных зарядов.
Электрон, вращающийся вокруг ядра, так же как и земля,
вращающаяся вокруг солнца, являлся бы гораздо более правдо-
подобной системой, так как центробежная сила движения его по ор-
бите уравновешивала бы силу электростатического притяжения
ядра. Однако тело, электрически заряженное, каким является элект-
рон, при движении по круговому или эллиптическому пути должно
непрерывно излучать в пространство энергию, согласно класси-
ческой теории электродинамики. Электромагнитные волны излу-
чаются во всех тех случаях, когда изменяется или скорость, или
направление, или и то и другое движущегося электрона. Электрон,
движущийся по орбите вокруг ядра, непрерывно изменяет свое на-
правление. Согласно классической теории, чтобы не излучать энер-
гии, электрон должен или находиться в состоянии покоя, или дви-
гаться равномерно и прямолинейно. Энергию, которую вращаю-
щийся электрон будет таким образом излучать, следует отнять
от его энергии движения, и в результате такой электрон все время
замедлял бы свое движение, а следовательно двигался бы по орбите,
все ближе и ближе расположенной к ядру. При этих условиях он
в конце концов упал бы в ядро. Кроме того в процессе вращения ча-
236
ИЗЛУЧЕНИЕ И ПОГЛОЩЕНИЕ ЛУЧИСТОЙ ЭНЕРГИИ
стота излучаемых световых волн должна была бы постепенно умень-
шаться, тогда как спектр элемента состоит из ярких линий с совер-
шенно определенными частотами. Таким образом с точки зрения клас-
сической теории электродинамики представления о строении атома
как химиков, так и физиков оказываются невозможными. Следо-
вательно представления эти или ошибочны, или классическая тео-
рия электродинамики, до сих пор прекрасно объяснявшая все из-
вестные факты, должна быть оставлена.
5. Теория квантов. В конце прошлого столетия было открыто
еще одно явление, опрокинувшее ряд укоренившихся понятий, —
излучение абсолютно черного тела. Абсолютно черным телом назы-
вается такое тело, которое поглощает все частоты лучистой энер-
гии, им получаемые. Кирхгофф показал, что наибольшим прибли-
жением к абсолютно черному телу могут служить внутренние стен-
ки непрозрачной оболочки, окружающей замкнутое пространство,
поддерживаемое при постоянной температуре. Пространство внутри
такой оболочки пересекается волнами широкого предела частот.
Были поставлены опыты, чтобы определить распределение энергии
в этом пределе частот. Основываясь на классической теории, физики
ожидали, что интенсивность будет максимальной для волн наивыс-
ших частот. На самом же деле оказалось, что наиболее длинные
волны (наименьшие частоты) обладают малым количеством энергии,
но что по мере увеличения частоты энергия повышалась, достигала
максимума, после чего опять приближалась к нулю при наиболее
коротких волнах. А эти волны как раз и должны были обладать
максимальной интенсивностью. Опять что-то было неладное в клас-
сической теории.
В 1900 г. Макс Планк после тщательного исследования и мате-
матического анализа этих поразительных результатов смело пред-
ложил теорию, которая во многих отношениях противоречила поня-
тиям классической механики. Он утверждал, что наблюдаемый ха-
рактер излучения абсолютно черного тела может быть объяснен
только в том случае, если планетарные электроны не излучают энер-
гии при своем вращении, а накапливают ее и отдают только тогда,
когда она достигнет величины кратной йу, где й — константа, а
> — частота излучаемой лучистой энергии. Другими словами, Планк
постулировал, что энергия не излучается атомом в виде непрерывного
потока, как, например, звук вибрирующего камертона, а испускается
индивидуальными пачками или квантами. Таким образом опять,
после векового забвения, выплыла корпускулярная теория Ньютона.
В 1905 г. Эйнштейн расширил эту теорию. Он предложил тео-
рию, по которой атомы не только поглощают и выделяют свет опре-
деленными и конечными количествами, но что эти кванты световой
энергии сохраняют свою сущность при прохождении через простран-
ство^ В это время он не имел еще достаточных доказательств в пользу
своей теории, но он надеялся на то, что со временем эти доказатель-
ства накопятся и докажут справедливость его теории. Так это и слу-
чилось.
t ИЗЛУЧЕНИЕ И ПОГЛОЩЕНИЕ ЛУЧИСТОЙ ЭНЕРГ ИИ
237
Рис. 87. Электроны, выби-
ваемые рентгеновскими лу-
чами из металла.
6. Фотоэлектрический эффект. В 1889 г. Герц открыл, что
при падении света на поверхность металла, последний выделяет
электроны. Только по прошествии нескольких лет удалось опреде-
лить сущность этого явления. Оказалось, что скорости, с которыми
передвигаются эти электроны, различны — до достижения опре-
деленной максимальной скорости. Было логично предсказать, что
эта максимальная скорость определяется интенсивностью того света,
который освещает металл. Однако опыт показал, что скорость эта
не зависит от интенсивности, но что она находится в прямой зависи-
мости от частоты колебаний света, вызывающего испускание электро-
нов. Зависимость эта оказалась довольно неожиданной. Дарроу го-
ворит, что «это весьма странно: выходит так, как будто бы волны,
ударяющие о берег, увеличивались бы вдвое по своей высоте и эти
мощные новые волны всколыхнули бы в
четыре раза больше галек, но ни одну из
них не смогли бы двинуть дальше, или
поколебать сильнее, чем это сделали на-
чальные, слабые волны с теми гальками,
которые они приводили в движение».
Максимальная энергия выделения
£шах изменяется вместе с изменением ча-
стоты v по уравнению
£max=b— Р,
где h — константа Планка, а Р — кон-
станта, характерная для освещаемого ме-
талла. Константа Р по всей вероятности
равна той энергии, которую электрон
должен затратить при своем отделе-
нии от атомов металла. Величина константы й, полученная Милли-
кэном для фотоэлектронов натрия и лития, равна 6,57хЮ-27. Это
прекрасно согласуется с величиной, полученной Планком для кон-
станты из теории квантов на основании изучения излучения абсолют-
но черного тела.
Явление, диаметрально противоположное фотоэлектрическому
эффекту, происходит в том случае, когда поток электронов ударяется
о металлическую поверхность. В этом случае излучается свет, частота
которого пропорциональна скорости электронов, а интенсивность
его — числу их.
Для иллюстрации сущности этих явлений мы можем поставить
опыт, в котором рентгеновы лучи выделяются потоком электронов
(рис. 87). Каждый электрон дает начало одному кванту энергии,
частота которой пропорциональна его скорости. Общее количество
выделившихся квантов, а следовательно и интенсивность света,
будет равняться количеству электронов, попавших в цель. Эти кван-
ты рентгеновых лучей теперь будут распространяться в простран-
стве со скоростью света. Некоторым из них дают упасть на металли-
ческую пластинку. Попадая на металл, они выбивают электроны
238
ИЗЛУЧЕНИЕ И ПОГЛОЩЕНИЕ ЛУЧИСТОЙ ЭНЕРГИИ
из атомов металла в количестве, равном количеству световых
квант, попадающих на металл и обладающих скоростями, рав-
ными скоростям тех начальных электронов, которые дали начало
рентгеновым лучам. Проф. А. Г. Комптон приводит следующий
рассказ, находящийся б поразительной аналогии с этими опытными
результатами:
Поразительную природу этого явления можно иллюстрировать случаем,
который имел место со мной, когда я был мальчиком. Во время летних
каникул отец проживал со всей семьей на берегу одного озера в северном
Мичигане. Мой старший брат вместе с другими мальчиками старшего воз-
раста построил на расстоянии около 800 м от лагеря, в том месте, где вода
была очень глубока, мостки для ныряния. Нас, младших сыновей, мать не пус-
кала туда плавать, опасаясь несчастного случая. Поэтому мы построили свои
мостки для ныряния в мелкой воде, у самого лагеря. Как-то раз в июле,
в жаркий безветренный день, мой брат прыгнул в воду в глубоком месте со
своих мостков. Естественно, что по озеру в результате прыжка пошли круги.
Понятно, что когда эти круги достигли того места, где плавал я, на расстоя-
нии полумили, эти круги были настолько малы, что их трудно было заметить;
Представьте же себе мое удивление, когда эти незначительные круги, дойдя
до меня, в то время как я плавал под нашими мостками, вдруг подняли меня
из воды и посадили на мостики.
Является ли это невероятным? Если невероятно, что волна воды
могла это сделать, то также невероятно и то, чтобы волна эфира, получив-
шая свое начало при ударе электрона о металлическую пластинку рентгеновой
трубки, могла бы выбить электрон из второго куска металла со скоростью,
равной скорости первого электрона.
Уильям Брэгг приводит другую аналогию. Предположим, что
около дюжины досок бросают в океан с высоты в 100 м. При этом
возникает ряд волн, которые распространяются по всем направле-
ниям. Предположим далее, что на расстоянии около 1 км от этого
места плывет другая доска того же размера. Когда волны, образовав-
шиеся от падения первых досок, достигнут этой доски, она подпрыг-
нет на 100 м в воздух. Такой результат кажется абсурдным, если мы
попытаемся его объяснить с помощью волнового механизма, но он
становится вполне логичным, если мы предположим, что энергия,
выделившаяся при падении в воду каждой доски, сохранилась в виде
отдельной единицы при движении ее от центра волнения. Когда такой
комок энергии ударился о доску, плавающую на поверхности, то
энергии оказалось как раз достаточно для того, чтобы поднять эту
доску на ту же высоту в воздух, с которой упала первая доска.
7. Теория Бора. Мы подошли теперь к работе молодого физика
Нильса Бора из Копенгагена, который в 1913 г. предложил теорию,
объясняющую выделения и поглощения света водородным атомом. Он
предположил, что количество энергии йу, которой обладает световой
квант с частотой у, соответствующей линии спектра водорода, рав-
но разности между двумя количествами потенциальной энергии Е'
и Е, как это видно из следующего уравнения:
йу = Е'—Е.
На основании этого уравнения Бор приступил к объяснению
поведения электрона в атоме водорода при поглощении или выделе-
ИЗЛУЧЕНИЕ И ПОГЛОЩЕНИЕ ЛУЧИСТОЙ ЭНЕРГИИ
239
нии им кванта энергии. Он постулировал, что электрон может вра-
щаться вокруг ядра только по определенным орбитам. По другим
орбитам он вращаться не может. Эти установленные орбиты пока-
заны на рис. 88. Электрон, находящийся на одной из этих орбит,
обладает количеством потенциальной энергии, характерным дня этой
орбиты. Эти орбитные энергии обозначены на рисунке Ео, Eit Е2,
Е3, Et, Е&..., Eqq. Количество энергии, которой обладает электрон,
возрастает по мере того как элект-
рон передвигается с внутренней ор-
биты на внешнюю, так как если про-
тивоположно заряженные частицы
удаляются друг от друга, то энергия
поглощается. Когда электрон нахо-
дится на самой внутренней орбите,
он не может испускать лучистой
энергии. Это и будет нормальным со-
стоянием атома. Если же атом воз-
бужден в результате действия внеш-
него источника энергии, например
действия электрического разряда или
света соответствующей частоты, то
электрон Может поглотить квант
энергии, перескочив на одну из
внешних орбит. Этот процесс по-
глощения математически
Рис. 88. Энергетические уровни
в атоме водорода.
можно выразить следующим образом:
Ео 4- йу = Е\ (с орбиты 0 на орбиту 1)
Ео 4- йу' = Е2 (с орбиты 0 на орбиту 2)
Ех4~ йу" = Е2 (с орбиты 1 на орбиту 2)ит. д.
На всех орбитах, за исключением самой внутренней, электрон на-
ходится в возбужденном состоянии и может выделить квант лучи-
стой энергии, совершив обратный процесс и перескочив обратно йа
одну из внутренних орбит:
Е2 = Е1 + 1п" (с 2 на 1)
Е2 = Ео 4- йу' (с 2 на 0)
Er = Eg -j- йу (с 1 на 0) и т. д.
Свет, излучаемый при перескоке электрона с одной орбиты на другую,
обладает определенной частотой и соответствует одной из линий
спектра водорода. Например прыжок с орбиты 1 на орбиту 0 соот-
ветствует излучению ультрафиолетового света с частотой, соответ-
ствующей линии (7 на рис. 86) спектра водорода. Перескок с орби-
ты 2 на 1 дает красную линию (4 на пис. 86) и т. д. Самая внешняя
орбита, на которой электрон обладает энергией Е<х>, соответствует
тому максимальному содержанию энергии, которым электрон может
обладать, оставаясь в то же время в пределах атома. Если он погло-
тит еще большее количество энергии, то он освободится от влияния
положительного ядра и вылетит из водородного атома.
240
ИЗЛУЧЕНИЕ И ПОГЛОЩЕНИЕ ЛУЧИСТОЙ ЭНЕРГИИ
В дальнейшем теория Бора была несколько изменена, но основные
ее черты остались без изменения. Сам Бор расширил ее, включив
в нее атом гелия, другие же ученые распространили ее и на атомную
структуру других элементов. Мы еще совершенно не уверены в том,
что всё эти теории правильны, так как доказательство строения ато-
мов не может быть получено в результате математического анализа
их спектральных линий. Однако имеется достаточное количество до-
казательств того, что только электроны, находящиеся на внешних
орбитах атома, — валентные электроны принимают участие в вы-
делении и поглощении лучистой энергии. Следует отметить, что рас-
положение электронов на различных энергетических уровнях в ос-
новном то же самое, что и их расположение на оболочках в случае
атома типа Льюиса-Лэнгмьюра.
8. Теория квантов в противовес волновой теории. Теория квантов
снова возбудила старый спор между волновой и корпускулярной
теориями света. Явления интерференции и дифракции как будто
служат доказательством того, что свет должен состоять из волн. Та-
кие явления, как излучение абсолютно черного тела и фотоэлектри-
ческий эффект, доказывают вне всякого сомнения, что свет состоит
из корпускул. За последние 10 лет этот парадокс был одной из основ-
ных проблем, которую должны были разрешить физики.
Французский физик де-Бройль задал себе несколько лет тому
назад вопрос, который в то время казался абсурдным. Если
свет частично обладает свойствами волнового движения, а частично
свойствами потока корпускул, или световых квант, то не вероятно ли
то, что и поток электронов, в катодных лучах например, также об-
ладает свойствами волнового движения. На этот вопрос попытались
ответить экспериментально Дэвисон и Джермер из Нью-Йорка,
с одной стороны, и Дж. П. Томсон, сын Дж. Дж. Томсона, из Абер-
дина — с другой. Мы видели, что рентгеновы лучи подвергаются
дифракции под действием правильно расположенных атомов кри-
сталла твердого вещества. Если рентгеновы лучи пропускать через
массу измельченных кристаллов и дать им удариться о фотографи-
ческую пластинку, то получается фотография, на которой видны
концентрические, попеременно светлые и темные, кольца. Эти кольца
служат убедительным доказательством того, что рентгеновы лучи
подвергаются дифракции и следовательно состоят из волн. Когда
рентгеновы лучи были заменены потоком электронов, была получена
аналогичная фотография. Не достаточно ли это убедительное доказа-
тельство того, что электроны также представляют собой волны.
В связи с этим А. Г. Комптон рассказывает следующую историю;
Большинству из вас известно, что Дж. Дж. Томсон, знаменитый про-
фессор физики в Кембридже, в значительной степени способствовал доказа-
тельству того, что катодные лучи являются электрически заряженными части-
цами. Около года тому назад мы с женой были в гостях у сэра Джозефа
и лэди Томсон и встретили там их сына Дж. П. Томсона, который приехал
из Абердина на воскресенье (уик-энд)} При нем была эта фотография, по-
казывающая ‘ дифракцию катодных лучей кристаллами золота. Это был
воистину драматический случай, когда этот великий ученый, затративший
ВОДА
241
свои лучшие годы на то, чтобы доказать, что электроны не что иное как
заряженные частицы, был полон энтузиазма по отношению к успехам своего
сына, нашедшего столь поразительные доказательства тому, что движу-
щиеся электроны — волны.
За последние годы де-Бройль во Франции, Шредингер и Гей-
зенберг в Германии, Дирак в Англии, Бор в Дании и Дюэн и Слетер
в США разработали такую систему механики, с помощью кото-
рой динамику частицы, например электрона, можно выразить,
пользуясь понятием о распространении потока волн. Эта теория
настолько связана с высшей математикой, что ее пока еще нельзя
отобразить в виде некоторой механической картины. Однако весьма
возможно, что из этой массы высокоматематических рассуждений,
в которые в настоящее время погружены физики, возникнет такая
картина строения атома, которая сможет быть оценена любым из нас.
9. Теория квантов и химические реакции. В 1905 г. Эйнштейн
впервые предложил современную теорию механизма поглощения лу-
чистой энергии химическими реакциями, основанную на теории кван-
тов. Эта теория была развита и расширена втечение 1912—1916гг.
Он постулировал, что в первой стадии фотохимической реакции
каждая реагирующая молекула поглощает квант энергии hv с ча-
стотой у, характерной для поглощающей молекулы. В последователь-
ных стадиях эти активированные молекулы вступают в химическую
реакцию, при которой их энергия активации и накапливается в моле-
кулах самих продуктов, как в случае эндотермической реакции,
или же переходит к другим молекулам в экзотермических фотоката-
литических реакциях. В случае реакции между водородом и хлором,
как и в случае многих других реакций того же типа, квант энергии
может вызвать так называемую цепную реакцию, так как он служит
для последовательного активирования одной молекулы за другой.
Это можно иллюстрировать следующими уравнениями, в которых
активированные атомы, * т. е. атомы, поглотившие квант энергии,
изображены со значком
С12 + йу = СГ -f-Cl,
СГН2 =НС1 + Н',
Н' +С12 = НС1 + С1' и т. д.
ГЛАВА XXII
ВОДА
Среди химических реакций, изученных нами, до сих пор мы со-
вершенно не встречали еще реакций между веществами, находящи-
мися в растворе. Однако эти виды реакций являются одними из наи-
более важных среди других химических реакций. Нам придется
посвятить некоторое время изучению растворов и тех реакций, кото-
рые в них протекают. К наиболее важному классу растворов при-
надлежат те растворы, в которых растворителем служит вода. Ввиду
16 Введение в химию.
242
ВОДА
важности этого соединения будет целесообразно прежде всего рас-
смотреть некоторые из его свойств.
1. Нахождение в природе. Вода—наиболее распространенное из
всех соединений. Она покрывает три четверти земной поверхности в
жидком виде или в виде льда. Пары ее всегда находятся в атмосфере.
Даже сухая земля, за исключением земли пустынь, содержит воду.
Земная кора содержит около 9% (весовых) воды. Человеческое тело
было кем-то цинично описано как «шесть килограммов золы и восемь
ведер воды». Наш организм в день выделяет приблизительно 3 кг во-
ды. Температура тела регулируется испарением воды с поверхности
кожи. Без воды мы можем прожить только очень ограниченное время.
2. Состав и свойства воды. В древние и средние века вода счи-
талась одним из четырех элементов (стр. 15), .и лишь после того
как Пристли в 1774 г. (стр. 97) открыл кислород, была понята истин-
ная природа воды как соединения водорода с кислородом. Кэвен-
диш с помощью той же простой аппаратуры, с которой ему удалось
открыть, что кислород и азот воздуха соединяются друг с другом
под действием электрической искры (стр. 99), показал, что 2 объема
водорода соединяются с 1 объемом кислорода и образуют воду
(стр. 59). Это было около 1795 г. При пропускании постоянного
электрического тока происходит обратное явление, т. е. вода разла-
гается, образуя на каждый объем кислорода 2 объема водорода.
В 1820 г. Берцелиус впервые тщательно определил те весовые соот-
ношения, в которые вступают эти два газа, образуя воду. В 1895 г.
американский ученый Морлей (1838—1923) произвел чрезвычайно
точное определение состава воды. Оказалось, что в воде водород
и кислород находятся в отношении 1 : 7,9375 (по весу)*.
Ввиду той относительной легкости, с которой вода может быть
подвергнута очистке, а также ввиду ее доступности, некоторые
физические свойства воды были выбраны для определения ряда физи-
ческих констант. Температура плавления воды (льда) и температура
ее кипения при давлении в 760 мм соответственно равны 0 и 100° С.
Тепловая единица (калория) является количеством тепла, необхо-
димым для повышения температуры 1 г воды на ГС. Плотность воды
ведет себя аномально по отношению к изменению температуры,
так как она постепенно увеличивается по мере понижения темпера-
туры, пока последняя не достигнет 4° С. Затем, при дальнейшем ох-
лаждении, плотность воды уменьшается. При замерзании воды про-
исходит не сжатие, а расширение, так как лед обладает меньшей
плотностью, чем вода. Это аномальное поведение полезно для нас,
♦ Исследованиями последнего времени было установлено, что в обыкновен-
ной воде содержится примесь так называемой «тяжелой» воды, в состав которой
входит изотоп водорода с атомным весом 2, для которого в настоящее время уста-
новлен особый символ D (дейтон, дейтерий). Тяжелая вода накопляется в остатке
после длительного электролиза, при котором в первую очередь на электродах
выделяется легкий изотоп водорода с атомным весом 1.
Тяжелая вода при 760 мм кипит при 101,4°, удельный вес ее при 25° равен
1,1056, точка замерзания ее 4-3,8°. Ред.
ВОДА
243
с одной стороны, и неудобно — с другой. Вследствие своей меньшей
плотности лед в воде плавает. Ледяной покров, образующийся на
поверхности прудов и озер в холодную погоду, является плохим про-
водником тепла, так что вода под этим покровом редко достигает тем-
пературы замерзания. Живые существа, находящиеся в воде, несом-
ненно весьма ценят это внимательное отношение воды. С другой сто-
роны, когда вода в наших трубах или в радиаторах автомобилей
замерзает, то мы предпочли бы, чтобы она вела себя более нормаль-
но и при замерзании сжималась бы, а не расширялась.
Воду часто называют, и с.некоторым правом, «универсальным
растворителем», принимая во внимание то число веществ, кото-
рые в ней растворимы. Ввиду того что вода такой хороший раствори-
тель, она редко встречается в чистом виде в природе. Почти немед-
ленно после своего образования из водных паров в виде дождя она
начинает растворять некоторые газы из воздуха. По мере просачи-
вания воды через почву и различные породы в ней растворяется все
большее и большее количество веществ. То громадное количество
растворимых веществ, которое содержит морская вода, служит
самым веским доказательством растворяющей способности воды.
3. Роль воды в природе. В природе вода непрерывно совершает
цикл, имеющий огромнейшее значение в экономике естественных
процессов. Солнечные лучи, падающие на водохранилища, частично
поглощаются в виде тепловой энергии, частично же поглощаются
молекулами, испаряющимися с поверхности. Эти молекулы диффун-
дируют во все части атмосферы. Когда же метеорологические усло-
вия таковы, что какая-нибудь одна область атмосферы становится
пересыщенной водяными парами, последние осаждаются в виде жид-
кой воды (стр. 43 ). Такого рода осаждение мы называем дождем,
если капли достаточно велики и быстро падают на землю, и облаком
или туманом, если они настолько малы, что остаются в суспенди-
рованном состоянии. Количество водяных паров в атмосфере иногда
бывает огромным. Кубический километр воздуха, насыщенный во-
дяным паром при 35°, выделяет 38 000 000 л воды при охлаждении
до 0°. Дождь при падении своем на землю растворяет углекислоту,
кислород и азот, содержащиеся в воздухе. Действие дождевой воды
в качестве растворителя продолжается и после того, как она упадет
на земную поверхность. Некоторые плохо растворимые сульфаты,
например гипс CaSO4, выщелачиваются из почвы. Нерастворимые
известковые отложения СаСО3 превращаются в растворимый бикар-
бонат кальция под действием воды и углекислоты, содержащейся
в естественной воде:
СаСО3 -|- Н2О СО2 —► Са (НСО3)2.
Полевой шпат (KAlSi3O8) — важный минерал, одна из составных
частей гранита — медленно превращается в глину (H4Al2Si2O9):
2KAlSi3O8 + 2Н3О + СО3 — H4Al2Si2O9 + 4SiO2 -f- K2CO3.
16*
244
ВОДА
Помимо своего действия в качестве растворителя и химического
агента вода оказывает и механическое действие, размельчая боль-
шие камни на все меньшие и меньшие частицы. Небольшая тре-
щина в породе расширяется при замерзании в ней воды; малень-
кие частицы отламываются от поверхности больших камней под
действием проточной воды, растворимые минералы выщелачивают-
ся и постепенно какая-нибудь голая скала превращается в пло-
дородную почву. Водой уносятся мелкораздробленные частицы
почвы в суспендированном состоянии; в воде содержатся также
и бактерии, существующие везде, где только имеется живот-
ная и растительная жизнь. Унося в*се эти вещества в растворе или
в суспендированном состоянии, вода течет по земле или проходит
через ее слои, собирается в ручьи, впадающие
в реки, последние же текут к морям. Суспенди-
рованный материал осаждается вдоль русла
рек и в больших количествах отлагается в
дельтах рек при впадении их в моря.
4. Состав естественных вод. Относительные
количества веществ, удерживаемых в растворе
естественными водами различного типа, пока-
заны на рис. 89. Дождевая вода содержит в сус-
пензии некоторое количество пыли и немного
бактерий, а в растворе—газы: углекислый газ
СО2, двуокись серы SO2, аммиак NH3, азот
N2 и кислород О2. Состав ключевой воды за-
Рис. 89. Относитель-
ные количества ве-
ществ, растворенных
в естественных водах.
висит от химической природы почвы и тех по-
род, с которыми вода приходит в соприкосно-
вение. Обычно она содержит в растворе кар-
бонаты и сульфаты кальция, магния,натрия, ка-
лия, железа и алюминия, а в виде суспензий —
окислы кремния, железа и алюминия. Вода в реках и озерах содер-
жит все эти минеральные вещества; кроме того, она еще склонна
содержать органические примеси, образовавшиеся при разложении
растительных продуктов, а также поступившие сюда из сточных вод.
Обычно везде, где имеются органические вещества, можно найти
и бактерии; некоторые из них вызывают болезни. Морская вода со-
держит в увеличенном количестве растворимые вещества, выщело-
ченные водой из почвы. Среднее содержание солей во всех океанах
равно примерно 3,5%. Эти растворенные соли содержат металлы:
натрий, кальций, магний и калий в виде их соединений со следую-
щими неметаллами и отрицательными радикалами—хлором, группой
SO4 (сульфаты), группой СО3 (карбонаты) и бромом. В одной из
последующих глав мы узнаем, что молекулы солей диссоциируют
на положительную и отрицательную части при растворении их
в воде и что эти электрически заряженные частицы называются
ионами.
Средний анализ солей, содержащихся в воде Атлантического
океана, дает такие результаты (табл. XXX).
ВОДА
245
Таблица XXX. Анализ солей морской воды
Ионы о/ /о Ионы %
Хлор СП Натрий Na+ Сульфат SO<= .... Магний Mg++ .... 55,29 30,59 7,69 3,73 Кальций Са+* .... Калий К+ Карбонат СОа— . . . Бром Вг 1,20 1,11 0,21 0,19
Морскую воду можно приготовить искусственно, растворив в воде
такую смесь солей:
NaCl......... 77,76% K2SO4........2,47 %
MgCla.........10,88% СаСО,........0,34%
MgSO,.........4,74% MgBr2........0,22%
CaSO,........3,60%
5. Значение примесей в естественных водах. В больших количе-
ствах человек применяет воду для трех целей: питья, мытья и полу-
чения пара в паровых котлах. Некоторые примеси делают воду не-
пригодной для этих целей. Естественно, что в питьевой воде должны
отсутствовать вредоносные бактерии, в большей или меньшей сте-
пени должны отсутствовать органические соединения, образующиеся
в результате распада растительных и животных продуктов. В ней
не должно быть также некоторых водорослей, которые хотя и не опас-
ны для здоровья, но делают воду неприятной на вкус. Вода, в кото-
рой содержится довольно значительное количество растворенных
минеральных веществ, в частности солей кальция и магния, назы-
вается «жесткой» водой и непригодна для стирки и применения в па-
ровых котлах.
Мыла, применяемые для стирки, представляют собой натриевые
или калиевые соли некоторых органических соединений, известных
под названием жирных кислот (стр. 399). Формула типичного мыла,
олеата натрия, будет NaC18H33O2. Мыла реагируют с растворимыми
соединениями кальция и магния, которые содержатся в жесткой
воде, и образуют уже нерастворимые кальциевые или магниевые
соли жирных кислот, входящих в состав мыла. В данном случае мы
имеем реакцию двойного обмена, например:
2NaC18H33O2 -J- CaSO4 * Са (С,8Н33О<>)2 -}- Na2SO4.
Эти нерастворимые соединения уже не могут дать пены с водой и пред-
ставляют собой потерянное мыло. Соединения кальция и магния
нежелательны и в воде для паровых котлов. Когда жесткая вода
в котле испаряетЛ, эти соединения отлагаются в виде твердой, не-
теплопроводной накипи в трубаХфПарового котла (рис. 90). Такая на-
кипь не только понижает производительность котла,но и делает работу
246
ВОДА
Рис. 90. Накипь от жесткой воды,
образовавшаяся в трубе.
с таким котлом опасной для жизни. В результате длительной работы
может произойти местный перегрев и разрыв труб паровых котлов.
Накипь толщиной в 6,5 мм (1/4 дюйма) увеличивает расход
топлива на 50%. Смягчение жесткой воды и очистка питьевой
воды являются проблемами, в
разрешении которых хими-
ки сыграли немаловажную
роль.
6. Смягчение воды. Жест-
кая вода подразделяется на во-
ду с временной и постоянной
жесткостью. Воду с временной
жесткостью можно смягчить
одним только нагреванием. В та-
кой воде содержатся бикарбо-
наты кальция и магния. При
нагревании растворимые бикар-
бонаты разлагаются, переходя
в нерастворимые карбонаты,
которые оседают на дно и мо-
гут быть оттуда удалены:
Са (НСО8)2 — СаСО8 + Н2О + СО2.
В воде с постоянной жесткостью содержатся сульфаты этих металлов,
которые не могут быть удалены одним лишь нагреванием, однако
такая вода может быть смягчена химическими методами.
Английский химик Томас Кларк первый предложил для смягче-
ния воды с временной жесткостью применять известь СаО. Этот
реактив превращает растворимые бикарбонаты в нерастворимые
карбонаты:
Са (НСО3)2 + СаО -* 2СаСО3 + Н2О.
Позднее Портер предложил применение соды Na2CO8 для удаления
«постоянной» жесткости, вызываемой сульфатом кальция CaSO4.
При такой обработке кальций выпадает в осадок в виде карбоната:
CaSO4 + Na2CO8 -> СаСО3 + Na2SO4.
Соединение этих двух методов, так называемый метод Портер-Кларка,
или содово-известковый, применяется для смягчения миллиардов
тонн воды в год.
Примерно в 1910 г. Роберт Ганс ввел так называемый пермути-
товый способ смягчения воды. При этом применяется соединение,
похожее на минералы определенного класса, встречаемые в природе
и называемые цеолитами. Молекула этого искусственного цеолита
имеет следующее строение;
ВОДА
247
«««•MtiaMiwwivweMrvnnrmaaBeaimmtavvttitviiivMaia
н-о о-н
\i —О - А)/
Н-О^ I \ — Na
О
Н-0 | О— Na
\i - О - д/
н-р/\}-Н
Чтобы не писать каждый раз эту сложную структурную формулу,
мы обозначим через Ze ту часть молекулы, которая окружена пунктир-
ной линией. Валентность этой части равна 2, так как она соединяется
с 2 одновалентыми атомами натрия. Когда жесткую воду фильтруют
через слой этого нерастворимого соединения, имеют место следующие
реакции:
Na2Ze 4- Са (НСО3)8 — 2NaHCO3 + CaZe;
Na2Ze 4- CaSO4 —► Na2SO4 4- CaZe.
Когда такой пермутитовый фильтр отработается в результате пол-
ного превращения в кальциевое или магниевое производное, снизу
в него пускается раствор поваренной соли NaCl, что ведет к обрат-
ному получению первоначального соединения:
CaZe 4- 2NaCl — СаС12 4- Na2Ze.
При пермутитовом процессе жесткость воды становится равной нулю.
7. Питьевая вода. Чистая и прозрачная вода не всегда годится
для питья. Присутствие вредных, вызывающих болезнь, бактерий
может быть обнаружено лишь с помощью микроскопа. Единствен-
ный верный способ определения пригодности данных водяных запа-
сов для питья — это химический и бактериологический анализ.
Наиболее обычными болезнями, заражение которыми в США
происходит посредством воды, являются тиф, паратиф, холера и де-
зинтерия. Все эти бактерии попадают в воду вместе со сточными
водами. Присутствие сточных вод в воде достаточная причина для
того, чтобы сделать ее непригодной для питья. В «свежих» сточных
водах всегда присутствует группа азотистых органических веществ,
называемых альбуминоидами. Азот этих соединений может быть опре-
делен посредством химического анализа в виде «альбуминоидного
аммиака». Загрязнение питьевой воды свежими сточными водами
принадлежит к наиболее опасному виду загрязнений. Эти органиче-
ские азотистые соединения постепенно, под действием особых нитри-
фицирующих бактерий, превращаются сперва в нитриты, а затем
в нитраты. Присутствие нитритов и нитратов указывает на то, что
загрязнение принадлежит к более старому и следовательно менее
248
ВОДА
опасному типу. Но все же .в хорошей питьевой воде должно содер-
жаться менее х/100 ч. нитритного азота на 1 000 000 ч. воды. В прес-
ной воде почти не содержится поваренной соли, а так как соль по-
падает в воду главным образом из человеческих экскрементов, то ее
присутствие указывает на опасное загрязнение.
Бактериологический анализ воды непосредственно определяет
присутствие бактерий в воде, а потому, пожалуй, и более надежен,
чем химический анализ. Однако бактериолог не теряет времени в
поисках под микроскопом бактерий, вызывающих болезнь. Он ищет
другой класс бактерий, который непременно содержится в больших
количествах в экскрементах как человека, так и высших животных,—
бактерии коли (В. Со И). Эти бактерии безвредны, но присутствие
их указывает на свежие сточные воды. Содержание их не должно
превышать 1 на 50 см3 воды.
8. Очистка питьевой воды. Абсолютно чистая вода может быть
получена только дестилляцией. Однако осуществление такого про-
цесса в большом мас-
штабе было бы слишком
дорогим, хотя океан-
ские пароходы для по-
лучения питьевой воды
для своих нужд обычно
подвергают дестилля-
ции морскую воду. Ки-
пячение воды в течение
10 минут убивает все
бактерии, однако при
Рис. 91. Разрез фильтровального слоя. кипячении удаляются
все растворенные газы
из воды и она приобретает характерный пресный вкус.
Очистка воды с целью применения ее в качестве питьевой осу-
ществляется в большом масштабе фильтрованием через песок и хими-
ческой дезинфекцией. Ни тот, ни другой метод не удаляет в сколько-
нибудь заметной степени растворенные в воде примеси, но ведь эти
примеси не делают воду непригодной для питья. Вызывающие бо-
лезни бактерии находятся во взвешенном состоянии и могут быть
удалены фильтрованием или убиты химической дезинфекцией.
Песочные фильтры городских водоочистительных станций бывают
двух типов — медленного и быстрого. Разрез части медленного филь-
тра показан на рис. 91. Вода медленно просачивается через слой
фильтра, причем песок, грязь и большая часть бактерий фильтром
удерживаются. На поверхности фильтра выращивают особый вид
водяных растений — альг, — способствующих удалению бактерий.
Очищенная вода вытекает через систему сточных труб, сделанных
из пористого материала и расположенных на дне фильтра. Этот метод
весьма эффективен, однако недостатком его является медленность
в работе. За последнее время во многих городах установлены более
быстрые методы фильтрации. Фильтровальный слой делается не та-
ВОДА
249
ким глубоким, причем применяется более грубый гравий. Прежде
чем пропускать воду через фильтр, ей дают отстояться в отстойных
бассейнах, причем для того чтобы ускорить осаждение суспендиро-
ванного вещества, прибавляют коагулирующий реактив, например
сульфат алюминия. Последний образует в воде желатинообразную
массу, к которой пристает суспендированное вещество. Затем на
поверхности фильтра образуется пленка, которая способствует уда-
лению бактерий. Для удаления бактерий быстрый тип фильтра
менее эффективен, чем медленный, но окраску и взвешенные приме-
си он удаляет почти полностью. Большим преимуществом этого спо-
соба является то, что работать можно при большой скорости фильтра-
ции, равной 1 400 000 000 л в сутки на 1 га поверхности фильтра.
Эта скорость примерно в 30—50 раз превышает скорость медленной
фильтрации; такого рода фильтры нуждаются в меньшей площади
и могут быть расположены ближе к потребителю.
9. Химические методы очистки воды. В настоящее время более
половины населения США пользуется хлорированной водой. Обы-
вателю стало известно о существовании элемента хлора только после
того, как он был применен немцами в качестве отравляющего ве-
щества в мировую войну. Однако химикам он известен уже с 1774 г.,
когда Шееле (стр. 97) открыл его в виде индивидуального вещесгва.
Уже в 1896 г. применение некоторых соединений хлора, именно
гипохлоритов, было введено в Англии для дезинфекции питьевой воды.
Применение для этой цели белильной извести и гипохлорита кальция
было начато в Америке в 1908 г. Электролитический метод получе-
ния едкого натра (стр. 426), при котором в качестве побочного про-
дукта получается хлор, сделал последний доступным в больших
количествах и по относительно низкой цене. Хлор легко сжижается
под сравнительно небольшим давлением и может храниться и транс-
портироваться в жидком виде в стальных бомбах. Жидкий хлор
для уничтожения бактерий в питьевой воде был применен в Америке
впервые в 1913 г. Процесс этот весьма несложный и почти автомати-
ческий, в то же время это наиболее дешевый, а в некоторых отноше-
ниях и наиболее удовлетворительный метод уничтожения бактерий
в питьевой воде. Для полной стерилизации требуется не более 0,7 ч.
хлора на 1 000 000 ч. воды. Хлор действует как непосредственный
яд на бактериальные клетки.
10. Результаты очистки. Влияние фильтрования и хлориро-
вания на уменьшение смертности от тифа оказалось поразительным.
Только в городе Лауренс фильтрование понизило смертность с
114 до 25 человек на 100 000 населения. Хлорирование снизило на 75%
смертность от этой болезни во многих городах.
Многие химики принадлежат к сторонникам суперхлорирования
воды. При этом методе унитожаются не только все бактерии, но и все
органические примеси, которые при неполном хлорировании могут
оказаться источником питания бактерий. Избыточный хлор может
быть затем удален процессом дехлорирования, разработанным для
этой цели. Сторонники этого метода указывают на серьезную эпиде-
250
ВОДА
мию брюшного тифа в Ганновере (Германия) в 1926 г., когда умерло
около 1800 человек и болело более 60 000. Источником воды для
города служили колодцы, вода из которых до употребления подвер-
галась фильтрованию и хлорированию. В результате сильного дождя,
небольшая речка вышла из берегов и часть ее воды попала в эти
колодцы. В течение 2г/2 часов эта вода, содержавшая органических
примесей в 6 раз более нормы, подавалась насосами в водопроводную
систему. Количество хлора оказалось недостаточным — ив резуль-
тате началась эпидемия.
11. Контролирование вкуса питьевой воды. Вода может быть
совершенно безвредной для питьевых целей и все же из-за неприят-
ного вкуса население может предпочесть такой воде речную воду,
опасную для здоровья. Весьма трудно убедить потребителя воды,
что вкус и прозрачность питьевой воды еще не окончательные кри-
терии ее пригодности. Некоторые виды водных растений, которые
появляются в водных резервуарах в определенные времена года,
придают воде рыбный или затхлый вкус. Рост этих организмов
можно приостановить прибавлением к воде небольших количеств
сульфата меди. Количества от 1 до 4 ч. на 1 000 000 ч. воды уже пре-
пятствует их развитию. Нет никаких данных для того, чтобы считать,
что такая малая концентрация сульфата меди вредна для здоровья
потребителя. Если в воде содержатся фабричные сточные воды и та-
кая вода подвергается хлорированию, то могут образоваться веще-
ства, неприятные на вкус, удаление которых весьма затруднительно.
12. Химические свойства воды. Вода — весьма стойкое соедине-
ние, т. е. молекулы ее довольно трудно распадаются на составляю-
щие их элементы даже при высокой температуре. Это разложение
представляет обратимую реакцию, так как водород и кислород
легко вступают в соединение:
2Н2О + тепло 2Н2 -J- О2.
Для любой температуры имеется свое состояние равновесия. Напри-
мер при такой высокой температуре, как 2000°, диссоциировано
только 1,8% молекул воды. Так как диссоциация воды — реакция
эндотермическая, то повышение температуры согласно закону ван’т
Гоффа увеличивает диссоциацию.
В одной из предыдущих глав (стр. 131) мы определяли основной
окисел как окись металла, а кислотный окисел как окись неметалла.
Вода реагирует с обоими типами окислов. Соединяясь с основными
окислами она образует основания или гидраты окисей соответствую-
щих металлов1.
Такого типа реакцию представляет например гашение извести:
СаО 4- Н2О Са (ОН)2.
Основания принадлежат к весьма важному классу химических соеди-
нений, свойства которых будут рассмотрены в одной из последую,
щих глав (стр. 289). ’
1 Валентность гидроксильной группы ОН равна —1.
РАСТВОРЫ
251
Соединяясь с окислами неметаллов или с кислотными окислами,
вода образует кислоты. Последние представляют собой соединения
водорода с неметаллом или с отрицательной группой, в которую
входят атомы неметалла и кислорода. Все кислоты, образовавшиеся
соединением кислотных окислов с водой, содержат кислород, напри-
мер
СО2 +Н2О —> Н2СО3;
SO2 +Н2О — H2SO3;
SO3 +Н2О —► H2SO4;
Р2О5 + ЗН2О —2Н3РО4.
Кислоты принадлежат также к весьма важному классу соединений;
в некотором роде они как бы химические противоположности основа-
ний. Подробно их свойства будут рассмотрены позднее.
ГЛАВА XXIII
РАСТВОРЫ
В одной из предыдущих глав мы узнали, что имеется четыре рода
веществ: элементы, соединения, растворы и смеси (стр. 17—18). •
О природе элементов и соединений мы уже много говорили.
О смесях многого не скажешь. Теперь нам остается рассмотреть
только растворы, играющие в химии весьма важную роль.
1. Характеристика растворов. Раствор можно определить как
вещество, гомогенное (однородное) по характеру и могущее
обладать различным составом. Мы знаем, что химическое соединение
также гомогенно, но что элементы, его составляющие, входят в него в
определенных весовых отношениях. Растворы же могут быть пригото-
влены из данных составных частей в любых отношениях, в пределах
их растворимости. При 20° в 1 л воды растворяется например около
2 000 г сахара. Это и будет пределом растворимости сахара в воде
при данной температуре. Но до достижения этого предела можно
приготовить растворы, содержащие любые отношения сахара и воды.
Состав раствора, как и состав смеси, может изменяться, однако
в отличие от смеси раствор однороден, гомогенен.
Если крупнозернистый песок взболтать в воде, то частицы его
быстро осядут на дно. В случае же более мелких частиц оседание их
происходит медленнее. Можно песок измельчить до такой степени,
что после взмучивания частицы останутся во взвешенном состоянии
в течение некоторого времени; такая суспензия невооруженному
глазу будет даже казаться гомогенной. Однако если через такую
суспензию пропустить яркий пучок света, то он отразится от взве-
шенных частиц и обнаружится настоящий гетерогенный характер,
такой суспензии. Взвешенные частицы в истинном растворе не про-
являют стремления к осаждению, так же как не проявляют ЭТОГО
252
РАСТВОРЫ
стремления молекулы газа — и по той же причине, ибо частицы эти
обладают размерами молекул и даже еще меньшими размерами.
Поэтому скорость их в результате теплового движения (стр. 212)
очень велика и поддерживает их равномерно распределенными в той
среде, в которой они взвешены. То, что было нами сказано о причи-
нах, заставляющих молекулы газа оставаться в суспензии, если мож-
но так выразиться (стр. 32), применимо также и к суспендиро-
ванным частицам истинного раствора.
За последние 25 лет тщательному изучению был подвергнут
класс суспензий, в котором каждая суспендированная частица со-
стоит из сотен молекул. Частицы такого размера слишком велики,
чтобы находиться в истинно растворенном состоянии, но в то же время
они и слишком малы, чтобы быть видимыми в микроскоп. Поэтому
эти суспензии кажутся под микроскопом гомогенными; если же через
них пропустить сильный луч света, то мелкие световые точки укажут
на те места, где эти частицы отражают свет. Частицы же молекуляр-
ных размеров в истинных растворах слишком малы и такого явле-
ния не обнаруживают. Суспензии многомолекулярных агрегатов,
которые однако слишком малы, чтобы быть различимыми в микро-
скоп, относятся к так называемым коллоидальным растворам. Рас-
смотрению последних будет посвящена одна из последующих глав.
В истинных растворах мы имеем, с одной стороны, растворенное
вещество, а с другой — среду, в которой это вещество растворено
и которая называется растворителем. Обычно, но не всегда, довольно
легко определить, какое вещество растворитель и какое — раство-
ренное вещество. В случае раствора сахара и воды ясно, что сахар
растворенное вещество, а вода растворитель. Обычно растворителем
бывает тот компонент, который в чистом виде существует в том
же состоянии, в котором находится и полученный раствор. Чистая
вода представляет собой жидкость, раствор сахара в воде тоже жид-
кость, следовательно вода и будет растворителем. В тех же случаях,
когда чистые компоненты находились и до их растворения в том же
состоянии, выбор растворителя и растворенного вещества произво-
лен. Спирт и вода являются жидкостями, растворяющимися друг в
друге во всех пропорциях. В таких случаях тот компонент, который
находится в избытке, обычно считается растворителем, однако по
существу такое разделение совершенно несущественно.
2. Типы растворов. Наиболее обычным типом раствора является
раствор твердого вещества в жидком растворителе. Кроме этого су-
ществует еще 8 других типов растворов. Вещество в любом из трех
состояний материи может быть как растворителем, так и растворен-
ным веществом. Отсюда и получается 9 типов растворов, соответ-
ствующих 9 возможным комбинациям.
3. Скорость растворения. Рассмотрим сперва наиболее важный
тип раствора—раствор твердого вещества в жидкости. Если твердое
вещество погрузить в жидкость, в которой это вещество растворимо,
то оно начинает переходить в раствор со скоростью, обусловливаемой
различными факторами. Попытаемся представить себе механизм этого
РАСТВОРЫ
253
Таблица XXXI. Типы растворов
Растворенное вещество Растворитель Пример
Газ » » Жидкость » Твердое тело » » » » Газ Жидкость Твердое тело Газ Жидкость Твердое тело Газ Жидкость Твердое тело Воздух Углекислый газ в воде Водород в палладии Водяные пары в воздухе Спирт и вода Ртуть в золоте Пары иода в воздухе Сахар в воде Серебро в свинце
процесса и для этого рассмотрим конкретный случай растворения са-
хара в воде. Когда мы изучали природу тепла, то узнали, что моле-
кулы твердого вещества вибрируют около своего среднего полож.'ния
в кристаллической решетке, причем за меру кинетической энергии
принимали абсолютную температуру тела (стр. 212). Это явление
и будет причиной стремления твердых молекул удалиться от поверх-
ности. Этому стремлению противодействуют силы внутримолеку-
лярного притяжения. Так как в твердых телах последние силы до-
вольно значительны, то тенденция молекул удалиться в общем будет
очень незначительна. До сих пор мы рассматривали эту тенденцию
только в связи с испарением, т. е. с переходом в газовую фазу. В этой
фазе молекулы находятся так далеко друг от друга, что между ними
и поверхностью жидкости или твердого вещества, с которым газ на-
ходится в соприкосновении, почти не действуют силы взаимного
притяжения. Молекулы твердого вещества или жидкости поэтому
улетучиваются в газ почти с такой же скоростью, с которой они уле-
тучиваются в пустоту. Если же твердое вещество погружено в жид-
кость, то скорость улетучивания его молекул — в этом случае ско-
рость растворения — в известной степени определяется силами при-
тяжения, существующими между молекулами жидкости и молеку-
лами твердого тела, так как молекулы жидкости находятся в гораздо
более концентрированном состоянии, чем молекулы газа. Так как
силовое поле, окружающее определенный вид молекул, характерно
для этого вида и так как это поле не одно и то же для всех видов мо-
лекул, то отсюда следует, что скорость растворения твердого веще-
ства в жидкости зависит как от природы молекул твердого тела,
так и от природы молекул жидкости. Так как кинетическая энергия
молекул твердого тела определяется его температурой, то повышение
температуры будет способствовать увеличению тенденции молекул
к улетучиванию, а следовательно и увеличению скорости растворения.
Если же температура остается постоянной, то скорость растворения
определенного твердого вещества в определенной жидкости на еди-
ницу площади соприкосновения между двумя фазами будет также
254
РАСТВОРЫ
Рис. 29. Сходство меж-
ду испарением и раство-
рением, конденсацией и
кристаллизацией.
вполне определенной величиной. Но так же как общая скорость
испарения увеличивается с увеличением поверхности жидкости, так
и общая скорость растворения будет функцией площади соприкос-
новения. Твердое вещество растворяется гораздо быстрее в том слу-
чае, если оно находится в мелкораздробленном состоянии. В лабора-
тории мы всегда экономим время, измельчая крупные кристаллы
твердого тела, подлежащего растворению в жидкости.
4. Равновесие в растворе. Мы уже знаем, что испарение яв-
ляется обратимым процессом и что между парами и жидкостью уста-
навливается состояние равновесия, когда скорость конденсации ста-
новится равной скорости испарения (стр. 38). Растворение твердого
вещества в жидкости также обратимый процесс. Не только молекулы
твердого вещества переходят в жидкость и тем самым растворяются,
но и растворенные молекулы твердого веще-
ства, ударяясь о поверхность еще нераство-
рившихся кристаллов, входят в их струк-
туру. Скорость, с которой растворенные мо-
лекулы ударяются о поверхность нераство-
рившихся кристаллов,—функция их кон-
центрации. По мере увеличения последней
ввиду растворения все большего и большего
количества твердого вещества, скорость кри-
сталлизации также увеличивается. Когда
обе скорости станут равными, устанавливает-
ся равновесие:
твердое вещество (нерастворенное)
t=p твердое вещество (растворенное).
Тогда в течение определенного интервала
времени количества молекул, растворяю-
щихся и кристаллизующихся, равны друг
другу. В этом случае раствор называется
насыщенным. Насыщенный раствор — это
такой раствор, в котором находится в равновесии вещество, раст-
воренное и не растворенное. Из рис. 92 легко усмотреть сходство ме-
жду испарением и растворением, конденсацией и кристаллизацией,
а также сходство между газом, насыщенным паром и насыщенным
раствором. Изучите как следует этот рисунок и в случае необхо-
димости перечитайте гл. III, § 3 и 4.
5. Концентрация растворов. Единственным способом добиться
того, что раствор окажется насыщенным по отношению к опреде-
ленному твердому веществу, будет прибавление этого вещества в та-
ком количестве, чтобы часть его осталась нерастворенной. Однако
во многих случаях совершенно нет необходимости, а иногда даже и
нежелательно пользоваться насыщенным раствором. Для некоторых
целей гораздо более пригодны разбавленные растворы. Во всяком
случае при применении какого-нибудь раствора в химическом опыте
всегда желательно указывать его концентрацию. Часто бывает уже
достаточно указание на то, что раствор разбавленный или концен-
РАСТВОРЫ
-Jj
трированный. Концентрацию раствора можно выразить количест-
венно различным образом, например в виде весового количества
растворенного вещества в определенном весовом или объемном коли-
честве растворителя. Другой метод выражения концентраций, кото-
рый обладает определенными преимуществами с точки зрения хими-
ка, состоит в указании количества молей растворенного вещества
в 1 л раствора. Молярный раствор — это такой раствор, в котором
1 моль вещества содержится в 1 л раствора. Чтобы приготовить
например молярный раствор сахара в воде, поступают следующим
образом. Один моль сахара, т. е. 342 г (молекулярный вес С12Н22Ои =
342), вводят в однолитровую мерную колбу (рис. 93), на горлыш-
ке которой чертой отмечен объем, точно равный 1 л. Затем добавляют
достаточное количество воды, чтобы сахар растворился, и
наконец, раствор доводят до метки.
Таким образом 1 моль сахара окажется растворен-
ным в 1 л раствора, а не в 1 л воды. Так как моли или
граммолекулы всех веществ состоят из одного и того же
числа молекул» то молекулярная концентрация всех мо- И
лярных растворов будет одна и та же. Молярность ра- / \
створа равняется числу молей вещества, растворенных / \
в 1 л раствора; 0,5 М раствор содержит 0,5 моля на литр, f )
а 0,3456 М раствор — 0,3456 молей на литр. Растворы \ /
одной и той же молярности обладают одной и той же мо- Рис# 93
лярной концентрацией. Мерная
6. Растворимость. Растворимость какого-нибудь твер- колба.
дого вещества в определенном растворителе равна концен-
трации насыщенного раствора этого вещества при определенной тем-
пературе. Концентрация, как мы видели, определяется условиями
равновесия между растворенным и нерастворенным вещестом. При
изучении влияния изменения температуры на упругость паров жид-
кости был применен закон ван’т Гоффа (стр. 39). Тот хорошо извест-
ный факт, что растворимость твердого вещества в жидкости боль-
шей частью увеличивается с повышением температуры, также может
быть предсказан этим законом. При растворении твердого веще-
ства молекулы его диффундируют до тех пор, пока они не займут
весь объем растворителя. Этот процесс является процессом расшире-
ния, и следовательно мы можем ожидать, что определенная часть
теплового движения молекул твердого вещества перейдет в потен-
циальную энергию (стр. 211). В общем мы видим, что это действитель-
но так, потому что растворение твердого вещества в жидкости обычно
(но не всегда) является реакцией эндотермической:
нерастворенное твердое вещество 4- тепло
qrt растворенное твердое вещество.
Так как при повышении температуры равновесие сдвинется та-
ким образом, что эндотермическая реакция пойдет дальше к своему
завершению, то при установлении нового равновесия при более
высокой температуре (закон ван’т Гоффа) мы должны ожидать, что
концентрация твердого вещества в растворе, а следовательно и его
256
РАСТВОРЫ
растворимость увеличатся. На рис. 94 показаны растворимости
различных твердых веществ в зависимости от температуры. Сле-
дует отметить кривую растворимости поваренной соли NaCl ввиду
того малого влияния, которое оказывает даже значительное повы-
шение температуры на ее растворимость.
7. Пересыщенные растворы. Когда раствору, насыщенному при
высокой температуре, дают охладиться, то избыток растворенного
вещества обычно, но не всегда, выкристаллизовывается из раствора,
так как при охлаждении растворимость уменьшается. Если в растворе
находятся нерастворенные кристаллы или даже отдельные пылинки,
то они служат при охлаждении раствора центрами кристаллизации.
Если же тщательным фильтрованием отделить от горячего насыщен-
0 Ю 20 5» 40-50 «о »« м°с
Тешератцм
Рис. 94. Влияние темпера-
туры на растворимость твер-
дого вещества в жидкости.
ного раствора все нерастворенные твер-
дые частицы, то часто при охлаждении
избыточное количество растворенного ве-
щества не выкристаллизовывается. Такие
растворы называются пересыщенными.
Если к такому раствору прибавить пылин-
ку или кристалл растворенного вещества,
то немедленно начинается кристаллизация
избыточного количества растворенного ве-
щества. С аналогичными явлениями нам
уже приходилось иметь дело. Воздух
например может стать пересыщенным во-
дяными парами, если в нем отсутствуют
взвешенные пылинки. Многие чистые
жидкости могут быть охлаждены при ана-
логичных условиях ниже температуры их
замерзания.
8. Растворы газов в жидкостях. Ра-
створы газов в жидкостях, хотя и менее
распространены, чем тот тип растворов, который мы только что
рассмотрели, все же имеют определенное значение. Если бы кисло-
род в определенном количестве не растворялся в, воде, рыбы не
могли бы жить. Углекислый газ в естественных водах играет важную
роль в образовании почвы и освежает нас в газированной воде.
Молекулы газа, находящиеся в закрытом сосуде над поверх-
ностью жидкости, будут бомбардировать поверхность жидкости и
растворяться в ней со скоростью, пропорциональной их концентра-
ции и температуре. Растворенные молекулы газа будут диффунди-
ровать через весь объем жидкости. От времени до времени они будут
ударяться о поверхность жидкости и опять улетучиваться в газовую
фазу. По мере того как — в результате растворения — концентрация
их в жидкости будет увеличиваться, скорость их улетучивания из
раствора также будет увеличиваться до тех пор, пока она не срав-
няется со скоростью растворения. Тогда установится состояние рав-
новесия и жидкость будет насыщена газом:
газ газ (растворенный).
РАСТВОРЫ
257
Весовое количество газа, растворенного в данном объеме жидкости,
прямо пропорционально давлению газа (закон Генри). Объем же рас-
творенного газа не зависит от давления. Рассмотрим, почему имеет
место такое явление. Давление газа определяется его концентрацией
при определенной температуре и в свою очередь определяет ту ско-
рость, с которой молекулы газа ударяются о поверхность жидкости и
в ней растворяются. При состоянии равновесия чем больше давление
газа над жидкость^), тем больше и количество молекул газа, раство-
ренных в определенном объеме этой жидкости. Однако при давлении
в 2 раза большем в одном и том же объеме газа будет содержаться
в 2 раза больше молекул. Поэтому при давлении в 2 раза большем
растворится в 2 раза большее количество молекул, занимающее
тот же объем. Закону Генри подчиняются такие плохо растворимые
газы, как кислород или азот, но ему плохо подчиняются хорошо рас-
творимые газы, например аммиак.
Растворы газов в жидкостях следует хранить в герметически
закупоренных склянках. В противном случае нельзя поддерживать
давление газа над поверхностью жидкости. По мере того как газ
диффундирует из горла открытой склянки, давление его падает и
растворенные молекулы газа начинают выходить из раствора. Содо-
вая вода содержит углекислый газ, растворенный в воде под большим
давлением. Чтобы поддерживать эту высокую концентрацию газа
в растворе, бутылки должны §ыть хорошо закупорены. При отку-
поривании такой бутылки давление падает и избыток углекислого
газа с шипением выходит из раствора.
При растворении газа в жидкости выделяется тепло, так как мо-
лекулы газа сближаются друг с другом. В результате же повышения
температуры растворимость газа в жидкости уменьшается:
газ (нерастворенный) газ (растворенный) + тепло.
9. Растворы одной жидкости в другой. Некоторые жидкости
взаимно растворяются друг в друге в любых пропорциях; в качестве
примера таких жидкостей можно указать на спирт и воду. Другие
жидкости смешиваются друг с другом лишь до известного предела,
например эфир и вода. Если эфир и воду взболтать друг с другом и
дать отстояться, то они образуют два жидких слоя, причем верхний
слой представляет насыщенный раствор воды в эфире, а нижний —
насыщенный раствор эфира в воде. В большинстве подобных случаев
с повышением температуры растворимость одного компонента
в другом увеличивается до тех пор, пока не будет достигнута темпе-
ратура, при которой обе жидкости становятся растворимыми друг
в друге во всех пропорциях.
10. Другие типы растворов. Остальных типов растворов, менее
важных для наших целей, мы коснемся лишь вкратце. Газы рас-
творяются друг в друге во всех пропорциях, как это и следовало
ожидать, исходя из строения газов. Примеры растворов газов
в твердом веществе очень редки. Растворимость газа в твердом веще-
17 Введение в химию.
258
СВОЙСТВА РАСТВОРОВ
стве определяется, как правило, теми же факторами которые опре-
деляют и растворимость газа в жидкости. Растворы одного твердого
тела в другом составляют гораздо более важную группу растворов,
так как в этот класс входит большинство сплавов.
ГЛАВА XXIV
СВОЙСТВА РАСТВОРОВ
Присутствие растворенного вещества может оказать заметное
влияние на свойства растворителя. Теоретически в том случае,
когда два вещества создают вокруг своих молекул одинаковое си-
ловое поле, никакое изменение энергии при растворении одного
вещества в другом не должно иметь места. Свойства такого идеаль-
ного раствора должны были бы быть аддитивными по отношению
к свойствам его компонентов, т. е. свойства растворов должны
были бы быть равны сумме свойств компонентов. На прак-
тике такие случаи не известны, если не считать случаев изотопов
(стр. 199). Силовые поля различных молекул растворенного веще-
ства и растворителя вызывают изменения тех свойств, которыми
эти вещества обладают в чистом состоянии.
Мы уже видели, что поведение газов тем ближе к поведению
идеального газа, о котором говорится в газовых законах, чем мень-
ше концентрация их молекул (стр. 35). Точно так же и растворы тем
ближе по своим свойствам к идеальным растворам, чем более увели-
чивается разбавление растворителя,и только весьма разбавленные
растворы подчиняются тем законам, которые мы сейчас рассмотрим.
1. Электрические свойства растворов. Хотя чистая вода принад-
лежит к числу чрезвычайно плохих проводников электричества, од-
нако водные растворы определенного класса соединений, называе-
мых электролитами, проводят электрический ток. Эти вещества
представляют собой кислоты, основания или соли и по природе
своей они обычно являются неорганическими соединениями. Со-
стояние этих веществ в водном растворе, обусловливающее их элек-
тропроводность, представляет значительный интерес и имеет огром-
ное значение в химии. Это состояние мы рассмотрим подробнее в ряде
следующих глав. К неэлектролитам принадлежат главным образом
органические вещества, например различные углеводороды, спирты
и сахара. Растворы этих веществ обладают определенными законо-
мерностями, которые и будут рассмотрены нами сейчас.
2. Давление паров растворов. Растворение какого-нибудь веще-
ства в определенном растворителе вызывает как бы разбавление
этого растворителя. Молекулы воды менее концентрированы в вод-
ном растворе сахара, чем в чистой воде. Следовательно и на поверх-
ности раствора концентрация молекул растворителя будет ниже, чем
концентрация их на поверхности чистого растворителя. Отсюда
следует, что испарение молекул растворителя из раствора будет
СВОЙСТВА РАСТВОРОВ
259
протекать медленнее, чем испарение их из чистого растворителя. Но
так как скорость испарения определяет давление паров (стр. 38),
то очевидно, что растворение какого-нибудь вещества в растворителе
понижает давление паров этого растворителя.
Закон, определяющий, насколько понижается давление паров
растворов, лучше всего формулировать, пользуясь понятием моляр-
ных дробей. Молярная дробь растворенного вещества равна количе-
ству молей растворенного вещества, деленному на общее количе-
ство молей в растворе, т. е. молей растворенного вещества и молей
растворителя. И аналогично, молярная дробь растворителя равна
количеству молей растворителя, деленному на общее количество
молей растворенного вещества и растворителя. Если через N мы обо-
значим количество молей растворенного вещества, а через N' —коли-
чество молей растворителя, то молярная дробь растворенного веще-
ства будет равна
N
N + N' ~ Х>
а молярная дробь растворителя будет равна
Вообще говоря, так как сумма обеих молекулярных дробей
должна равняться 1, то если мы обозначим через х молярную дробь
растворенного вещества, молярная дробь растворителя будет равна
1—х.
Из всего сказанного следует, что давление паров р какого-
нибудь раствора должно равняться давлению паров чистого раство-
рителя р0, умноженному на молярную дробь растворителя:
N'
P = PoN + NT = Ml~X)' (1)
Это так называемый закон Рауля, который строго применим к раз-
бавленным растворам неэлектролитов. Электролиты в водном раст-
воре вызывают ненормально высокое понижение упругости паров.
Чтобы вычислить давление паров рассмотренного нами раствора
при любой температуре, мы просто должны посмотреть в таблицу
упругости паров чистой воды (см. приложение, стр. 415), найти там
упругость паров при интересующей нас температуре и умножить
ее на молярную дробь.
Для того чтобы пояснить применение этого закона, вычислим
в качестве примера давление паров при 20° раствора в котором
Vio моля сахара растворена в 1 000 г воды. Сперва мы должны вы-
числить, какое количество молей воды содержится в 1 000 г. Так как
1 моль воды равен 18 г, то 1000 г будут равны
юоо
——— = 55,5 молей.
17*
260
СВОЙСТВА РАСТВОРОВ
Следовательно молярная дробь для воды будет равна:
55’5 =0,9982.
0,1 +
Упругость паров чистой воды при 20° равна 17,54 мм, следова-
тельно давление паров раствора будет равно
р = 17,54 мм х 0,9982 = 17,51 мм.
Уравнение (1) можно преобразовать следующим образом:
Р = Ро(1—х), (1)
Р = Ро - Ра*,
Ро-Р = Рох, (2)
или
Др = рох.
водяных паров двух
водных растворов.
Из уравнения (2), принимая во внимание, что р величина постоян-
ная, видно, что понижение давления паров (р0—р или Др) пропор-
ционально молярной дроби растворенного вещества (х). Это другой,
более общепринятый способ выражения закона
Рауля.
На основании уравнения (2) можно следую-
щим образом вычислить понижение давления
паров, которое будет иметь место в результате
растворения 0,1 моля вещества в 1000 г воды
при 20°:
Др = 17,54 ^ЖХ^^ ;
Др = 17,54 мм X 0,0018;
Др = 0,0316 мм.
На рис. 95 изображены три кривые давле-
ния паров чистой воды и двух растворов, в од-
ном из которых молярная дробь растворенного
вещества, неэлектролита, равна 0,1, а в другом 0,2, в зависимости от
температуры.
При какой-нибудь температуре t давление паров воды р будет
больше давления паров раствора р0;1, Для которого молярная дробь
растворенного вещества равна 0,1,’ а эта упругость паров в свою
очередь будет больше упругости паров р02 раствора, для которого
молярная дробь растворенного вещества равна 0,2. Что пониже-
ние давления паров чистой воды пропорционально молярной дроби
растворенного вещества, видно из следующего равенства:
Р —Po.i
Р — Ро.а 0>2
Данные опытов для давления паров неэлектролитов в разбавленных
растворах согласуются с законом Рауля. Это видно из типичного
примера, приведенного в табл. XXXII.
СВОЙСТВА РАСТВОРОВ
261
Таблица XXXII. Понижение давления паров рас-
творов маннита
(в воде при 20°, р = 17,51 мм)
Концентрация (моли на 1 000 г воды) Понижение давления паров Отклонение от закона Рауля (%)
наблюдае- мое вычисленное на основании закона Рауля
0,0984 0,0307 0,0311 +1.3
0,1977 0,0614 0,0622 +1,3
0,2962 0,0922 0,0931 + 1,0
0,3945 0,1227 0,1239 + 1.0
0,4938 0,1536 0,1547 + 0,7
0,5944 0,1810 0,1858 -0.1
0,6934 0,2162 0,2164 +0,1
0,7927 0,2478 0,2469 -0,3
0,8922 0,2792 0,2775 -0,7
0,9908 0,3096 0,3076 -0,6
3. Температура замерзания растворов. Известно, что морская
вода замерзает при более низкой температуре, чем пресная, в что
в зимние месяцы приходится растворять спирт в той воде, которая
служит для охлаждения, автомобильного мотора. Отсюда следует, чте
растворенные вещества должны понижать температуру замерзания
жидкостей. Чтобы понять, какие причины вызывают это явление,
вспомним зависимость, существующую между температурой замер-
зания жидкости и давлением ее паров (стр. 44). Температура за-
мерзания жидкости — это температура, при которой давление ее
паров равно давлению паров того твердого тела, которое образуется
в результате замерзания данной жидкости. При охлаждении раз-
бавленного раствора сахара в воде кристаллы льда появятся лишь
тогда, когда давление паров раствора сделается равным давлению
паров льда. На рис. 96 даны кривые давления паров воды и двух
растворов, в которых молярная дробь равна соответственно 0,1 и 0,2,
в зависимости от температуры (аналогичные изображенным на рис 95);
кроме того дана кривая давления паров льда. Температуры, при ко-
торых кривая давления паров льда пересекает кривые давления па-
ров воды и обоих растворов, как раз и будут температурами замер-
зания последних. Температура замерзания /0)1 раствора, молярная
дробь которого равна 0,1, будет ниже температуры замерзания воды /,
а температура замерзания более концентрированного раствора, /0 2 - -
ниже температуры замерзания менее концентрированного Здесь
мы опять имеем:
/ - /о.2 _ 03
/ - /о,2 " 0,2 ’
262
СВОЙСТВА РАСТВОРОВ
иными словами, понижение температуры замерзания (депрессия)
пропорционально молярной дроби растворенного вещества'.
Щ = fo~ f — Гх,
Рис. 96. Точки замерзания и точки ки-
пения воды и двух водных растворов.
где /0 — температура замерзания чистого растворителя, / — темпе-
ратура замерзания раствора, Д/ — понижение температуры замер-
зания, х — молярная дробь растворенного вещества и F — так на-
зываемая константа температуры замерзания, связывающая пони-
жение температуры замерзания с молярной дробью и имеющая для
каждого растворителя характерную величину. Для водных растворов
величина ее равна 103,2°. Для того чтобы вычислить температуру
замерзания раствора, в ко-
тором 0,1 моля вещества
растворено в 1000 г воды,
можно просто подставить в
наше уравнение соответству-
ющие цифры. Мы уже вычи-
. слили, что молярная дробь
растворенного вещества в
случае такого раствора равна
0,0018, откуда имеем:
Д/ = 103,2° х 0,0018=0,186°.
На это уравнение рас-
пространяются те же ограни-
чения, о которых мы уже го-
ворили в связи с законом
Рауля: концентрированные
растворы и растворы элект-
ролитов дают аномальные
результаты.
4. Температура кипения растворов. Температурой кипения
жидкости называется та температура, при которой давление паров
жидкости становится равным общему давлению газа на ее поверх-
ности (стр. 45). На рис. 96 координата, соответствующая давлению
в 760 мм, изображена пунктирной линией. Она выражает среднее
барометрическое давление. Температуры, соответствующие точкам
пересечения кривых давления паров с этой координатой, как раз
и будут температурами кипения в каждом отдельном случае. Темпе-
ратура кипения воды Ьо ниже температуры кипения раствора &0)1,
молярная дробь растворенного вещества которого равна 0,1, а эта
температура в свою очередь ниже температуры кипения более кон-
центрированного раствора b0>a, молярная дробь растворенного веще-
ства которого равна 0,2. Таким образом растворенное твердое веще-
ство повышает температуру кипения жидкости, и в данном случае
СВОЙСТВА РАСТВОРОВ
263
опять повышение температуры кипения пропорционально молярной
дроби растворенного вещества:
ь^-ь 0,1
&Ь = Ь — Ь0 = Вх,
где Ьо — температура кипения чистого растворителя, b — темпера-
тура кипения раствора, Д& — повышение температуры кипения,
х — молярная дробь растворенного вещества и В — константа тем-
пературы кипения, характерная для каждого растворителя. В слу-
чае воды В=29,26°. На основании этого уравнения мы можем вычи-
слить повышение температуры кипения воды, вызванное растворе
нием 0,1 моля сахара в 1000 г воды. Молярная дробь растворенного
вещества будет равна 0,0018, а отсюда следует, что
0 = 29,26° х 0,0018 = 0,052°.
Такой раствор будет кипеть при 100,052° С (давление 760 мм}.
5. Молярная дробь и молекулярная концентрация. В очень
разбавленных растворах молярная дробь растворенного вещества
почти пропорциональна его молекулярной концентрации. Например
если мы сравним молярные дроби и молекулярные концентрации
(в молях на 1000 г растворителя) двух растворов, в одном из кото-
рых в 1000 г воды содержится 0,1 моля, а в другом 0,2 моля раство-
ренного вещества, то увидим, что молярные дроби растворенного ве-
щества будут равны 0,1/(0,14-55,5) и 0,2/(0,2-j-55,5), а молекуляр-
ные концентрации будут равны 0,1 и 0,2. Так как 0,1 и 0,2 очень
малы по сравнению с 55,5, то не будет большой ошибки, если мы бу-
дем считать молярные дроби равными 0,1/55,5 и 0,2/55,5. В этом
случае:
0,1 0,2
55,5 : 55,5 - °>* : °’2’
иными словами, молярные дроби пропорциональны молекуляр-
ным концентрациям в весьма разбавленных растворах. Поэтому мы
допустим лишь очень незначительную ошибку, если скажем, что в
очень разбавленных растворах понижение давления паров, пониже-
ние температуры замерзания и повышение температуры кипячения
пропорциональны не только молярной дроби растворенного вещества,
но и его молекулярной концентрации.
6. Молекулярный вес вещества в растворе. Влияние, оказываемое
нелетучим растворенным веществом в разбавленном растворе на дав-
ление паров и на температуры кипения и замерзания жидкости, в ко-
торой это вещество растворено, зависит только от его молекулярной
концентрации, но не зависит от химического состава. Поэтому раз-
ные вещества равной молекулярной концентрации в одном и том
же растворителе должны в одинаковой степени уменьшать давление
паров, понижать температуру замерзания и повышать температуру
сипения этого растворителя. Например 1 моль сахара или глицерина
264
СВОЙСТВА РАСТВОРОВ
в 1000 г воды понижает давление паров воды на 0,31 мм, температуру
замерзания на 1,86° и повышает ее температуру кипения на 0,515°.
1 моль любого другого неэлектролита в том же количестве воды вы-
зовет аналогичные результаты. Зная это, мы имеем метод, на осно-
вании которого можно вычислить молекулярный вес растворенного
вещества. Рассмотрим например чаще всего применяемый криоско-
пический метод определения молекулярного веса, для чего восполь-
зуемся понижением температуры замерзания (депрессией).
Мы знаем, что 1 моль неэлектролита, растворенный в 1000 г
воды, понижает температру ее замерзания на 1,86°. Таким образом
достаточно растворить известное весовое количество того вещества,
молекулярный вес которого мы хотим определить, в определенном
весовом количестве воды и на основании замеченного понижения
температуры замерзания вычислить, какое количество этого веще-
ства следует растворить в 1000 г воды, чтобы понизить температуру
ее замерзания на 1,86°. Это весовое количество как раз и будет грам-
молекулой данного вещества. Например 8,55 г тростникового сахара,
при растворении их в 100 г воды, понижают температуру замерзания
юследней на 0,465°; так как
8,55 г сахара _ 85,5 г сахара
100 г воды — 1000 г воды ’
ТО
85,5 г _ хг
(М65~° “ 1786° ’
и вообще
вес растворенного вещества в 1000 г воды молекуляон. вес растворен, вещества,
наблюдаемое понижение темп, замерзания 1,86°
Вычисления в случае эбулиоскопического метода (с применением
температуры кипения) совершеннно одинаковы за исключением того,
что повышение температуры кипения на 1 моль равно 0,515°. Можно
пользоваться также и другими растворителями помимо воды, если
только известны для них молярное повышение температуры кипения
и молярная депрессия температуры замерзания. Определение моле-
кулярного веса методом депрессии давления паров осуществляется
редко ввиду относительно большей трудности, с которой делаются
измерения давления паров. Многие вещества разлагаются ниже той
температуры, при которой их можно испарить. Молекулярный вес
таких веществ нельзя определять по методу измерения газовых плот-
ностей. К счастью, методы растворения дают нам удобный способ
для определения молекулярных весов.
7. Осмотическое давление. Явление осмоса имеет чрезвычайно
большое значение в природе, хотя сущность этого явления редко
понятна учащимся. Мы уже указали на то, что при одной и той же
температуре тенденция жидкости к улетучиванию понижается при
растворении в ней какого-нибудь вещества. Это объясняется раз-
бавлением молекул растворителя молекулами растворенного ве-
СВОЙСТВА РАСТВОРОВ
265
А
вода спхго*
Рис. 97.
щества. Если мы под колокол поставим два стакана, в один из кото-
рых налита вода, а в другой раствор сахара в воде (рис. 97), то чи-
стая вода будет испаряться быстрее, чем вода из раствора. Если бы
под колоколом был только один стакан с водой, то объем над ним
вскоре насытился бы водяными парами, которые оказывали бы дав-
ление, равное давлению паров чистой воды при этой температуре.
Но концентрация водяных паров, достаточная для того, чтобы на-
сытить объем над чистой водой, сделает объем над раствором сахара
в воде пересыщенным водяными парами по отношению к послед-
нему. Следовательно до тех пор, пока еще будет иметься вода в ста-
кане с чистой водой, водяные пары будут конденсироваться в раствор
сахара с большей скоростью, чем они из него будут испаряться. Таким
образом при одной и той же температуре чи-
стая вода никогда не сможет быть в равнове-
сии с водой в растворе вследствие различия
в тенденции к улетучиванию в обоих слу-
чаях. Имеются два способа, с помощью ко-
торых тенденция воды в растворе к улетучи-
ванию может быть увеличена: посредством
повышения температуры или повышения
давления на жидкость. Повышение темпе-
ратуры поведет к усилению молекулярных
движений, а следовательно к увеличению
тенденции к улетучиванию. Если температуру чистой воды поддер-
живать постоянной, а температуру раствора сахара повышать до
тех пор, пока тенденция молекул воды к улетучиванию из раст-
вора при более высокой температуре не сравняется с тенденцией
к их улетучиванию из воды при более низкой температуре, то обе
жидкости будут находиться в состоянии равновесия. При увели-
чении давления на жидкость молекулы последней концентрируются,
так как они скопляются в меньшем объеме. Повышение концент-
рации ведет к увеличению тенденции к улетучиванию. Если дав-
ление на раствор увеличить до такой степени, чтобы концентрация
молекул воды в нем стала бы равной концентрации молекул в чис-
той воде при обыкновенном давлении, то опять-таки обе жидкости
будут находиться в состоянии равновесия. Разность давлений, необ-
ходимая для того, чтобы установить равновесие между чистым
растворителем и раствором, называется осмотическим давлением
раствора.
Чтобы получить более ясное представление о том, что такое
осмотическое давление, рассмотрим случай, в котором чистая вода
и водный раствор сахара разделены друг от друга полупроница-
емой перегородкой, через которую могут свободно диффундировать
молекулы воды, но не могут диффундировать молекулы сахара.
Такая полупроницаемая перегородка может быть получена, если в
порах глиняной колбы отложить осадок ферроцианида меди. Затем
такую колбу наполняют раствором сахара, закупоривают резиновой
пробкой, через отверстие которой проходит длинная стеклянная труб-
266
СВОЙСТВА РАСТВОРОВ
ка, и погружают колбу в стакан с чистой водой (рис. 98,а). Рассмотрим
теперь, чго происходит по обе стороны мембраны в одной из пор кол-
бы (рис. 98, Ь). Молекулы воды более разбавлены со стороны раствора
и поэтому диффундируют с большей скоростью в раствор, чем из него.
В результате этого уровень раствора повышается, что будет заметно
в стеклянной трубке, и в конце концов раствор пойдет через край
трубки. Такая неравномерная диффузия через полупроницаемую
Рис. 98. Осмотическое
давление.
перегородку называется осмосом.
8. Измерение осмотического давления.
Если колбу, содержащую раствор, осмотиче-
ское давление которого должно быть изме-
рено, соединить с прибором, указывающим
давление, так чтобы раствор не имел воз-
можности расширяться, то осмос воды в ра-
створ будет увеличивать концентрацию мо-
лекул воды в растворе, а следовательно и да-
вление. Когда давление в колбе возрастет
настолько, что молекулы воды в растворе бу-
дут так же концентрированы, как и молекулы
в чистой воде вне колбы, скорости диффузии
воды в обоих направлениях сравняются. Это
давление и будет осмотическим давлением
раствора. Величины осмотического давления
растворов очень значительны, например ос-
мотическое давление молярного раствора сахара превышает 20 ат.
Неудивительно, что исследователям трудно приготовить такие по-
лупроницаемые перегородки, которые могли бы противостоять та-
ким давлениям.
Ранние работы Пфеффера в этой области в 1877 г. показали, что
осмотическое давление раствора приблизительно пропорционально
молекулярной концентрации растворенного вещества. Голландский
химик ван’т Гофф нашел, что молярный раствор сахара оказывает
осмотическое давление, равное давлению газа этой же молекуляр-
ной концентрации и при той же температуре. Он указал на то, что
закон Авогадро может быть также применен и к разбавленным ра-
створам: равные объемы растворов, обладающие одинаковым осмо-
тическим давлением, при одной и той же температуре содержат
одинаковое число молекул.
Мы уже упоминали о том, что осмос — весьма важное явление
в природе. Вода потому поступает в корни растений, что внутри
корней обычно имеется более концентрированный раствор, чем
в грунтовых водах. Отсюда следует, что мы можем убить ненужные
нам растения, посыпав соли вокруг их корней. Наша кровь содержит
красные кровяные тельца, стенки которых являются полупроница-
емыми перегородками. К нашему счастью, растворы с обеих сторон
этих стенок изотоничны, т. е. обладают одинаковым осмотическим
давлением. Если бы в нашу кровеносную систему сделать вливание
чистой воды, то жидкость, в которой кровяные тельца плавают, ока-
ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ 267
залась бы разбавленной и вода поступала бы в них с большей ско-
ростью, чем из них выходила. В результате возникшего давления
стенки скоро лопнули бы. Вливание слишком концентрированного
раствора оказало бы противоположный эффект. Отсюда следует, что
раствор, вливаемый в кровь, должен быть изотоничен с последней.
ГЛАВА XXV
ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ
В предыдущей главе (стр. 258) мы упомянули о том, что раство-
ренные вещества в зависимости от того, проводят их растворы элек-
трический ток или нет, разделяются на электролиты и неэлектроли-
ты. Было также сказано, что понижение давления паров и темпера-
туры замерзания и повышение температуры кипения растворов элек-
тролитов в воде не пропорциональны их молярной дроби в противо-
положность неэлектролитам. В этой главе мы рассмотрим причины
электропроводности и аномального поведения электролитов.
1. Электропроводность. Как это наверно известно большинству
из вас, вещества могут быть разделены на проводники и изоляторы
в зависимости от того, проводят они электрический ток или
нет. Идеального изолятора, т. е. такого изолятора, электропровод-
ность которого равна нулю, не существует. Однако такие вещества,
как стекло, резина или бакелит, являются хорошими изоляторами.
Проводники могут быть разбиты на два класса. К первому классу
принадлежат металлы, ко второму — растворы электролитов. При
прохождении тока через металл никаких химических изменений не
происходит. При прохождении же тока через раствор электролита
имеют место химические изменения. Электрический ток при про-
хождении через металл просто состоит из потока электронов, кото-
рые текут по проводнику так же, как вода течет по трубе. С другой
стороны, при прохождении тока через электролит на электродах,
через которые ток входит и выходит из раствора, происходят химиче-
ские изменения. Сущность этого вида проводимости мы и попытаемся
объяснить в этой главе. Однако прежде чем приступить к такому
объяснению, нам нужно познакомиться с теми единицами измере-
ния, в которых выражаются различные факторы электрического
тока.
2. Электрический ток. Всякий знает, что электрический ток
может быть получен, если соединить два полюса батареи или гене-
ратора замкнутой цепью проводников. Мы можем сравнить такую
систему с замкнутой системой труб, наполненных водой, которые
соединяют входную и выходную трубы насоса (рис. 99). Вода с по-
мощью насоса приводится в движение и течет из выходного отвер-
стия, или со стороны высокого давления, к входному отверстию,
или к стороне низкого давления. Путь, по которому вода течет, опре-
деляется стенками труб, а скорость течения определяется разностью
268
ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ
давлений между обеими сторонами насоса и диаметром трубы. Чем
этот диаметр больше, тем меньшее сопротивление будет оказывать
труба току воды. Если в трубопровод включить вентиль, то посред-
ством него можно при желании создать такое большое сопротив-
ление, что ток воды прекратится.
При сравнении обеих систем мы видим, что металлические про-
волоки соответствуют трубам. Мы уже знаем, что атомы металлов
содержат весьма подвижные электроны. Они-то и составляют «воду»
этих электрических «труб». Изоляция вокруг проволоки соответст-
вует металлу водяных труб, так как она определяет путь тока. Ба-
тарея служит «электронным насосом», так как она устанавливает
разность в электриче-
ском давлении, так на-
зываемую разность по-
тенциалов. В результа-
те чего получается эта
разность, мы увидим в
одной из последующих
глав (стр. 333). Поток
электронов течет от по-
люса с высоким потен-
циалом (отрицательно-
го) к полюсу с низким
потенциалом (положи-
тельному). Скорость это-
Рис. 99. Аналогия между электрическим током
и током воды.
Huntpamp
го потока определяется
разностью потенциалов или электродвижущей силой Е бата-
реи и сопротивлением R цепи. Естественно, что она должна
быть прямо пропорциональна электродвижущей силе и обратно про-
порциональна сопротивлению. Это и будет известным законом Ома,
который выражается математически следующим образом:
1 ==
Е
К
3. Единицы измерения электричества. Теперь мы можем рас-
смотреть те единицы измерения, в которых все эти факторы могут
быть выражены. Единицей измерения количества электричества есте-
ственно является заряд одного электрона (4,774 х Ю-10 эл.-стат. ед.)
(стр. 170), но еще задолго до того, как был открыт электрон, была
введена более практическая единица измерения кулон. Кулон — это
то количество электричества, которое при пропускании электри-
ческого тока через водный раствор серебряной соли отлагает на
катоде 0,00118 г серебра. Почему кулон определяется именно таким
образом, нам станет ясно при изучении закона Фарадея в одном из
последующих параграфов этой главы. Кулон электричества в при-
веденном нами выше сравнении аналогичен литру воды.
Поток воды можно измерять в единицах количества воды, проте-
кающей через определенное место системы в единицу времени, на-
ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ
269
пример в литрах в секунду. Аналогично, силу тока электриче-
ства по проволоке можно измерять количеством кулонов в секунду.
Здесь мы уже имеем единицу, называемую ампером, для измерения
силы тока, которая определяется как сила тока в 1 кулон в секунду:
ампер =
кулон
секунда
Ток в 1 ампер течет со скоростью 1 кулона в секунду. Прибор для из-
мерения силы тока называется амперметром и вводится в электри-
ческую цепь таким образом, чтобы весь ток проходил через него
(рис. 99). Единица измерения электродвижущей силы называется
вольтом и определяется в терминах электродвижущей силы стандарт-
ного элемента Вестона, электродвижущая сила которого при 20° С
равна 1,0183 вольта. Вольт можно определить как 1/1,0183 часть
электродвижущей силы элемента Вестона. Единица сопротивления—
ом, который определяется, как сопротивление столба ртути, сечение
которого равно 1 мм2, а вес 14,4 г при 0° С. Длина этого столба при
этих условиях равна 106,3 см.
Определив единицы измерения силы тока, электродвижущей
силы и сопротивления, мы может показать с помощью закона Ома,
какая между ними существует зависимость:
вольт
$ ампер = ———
Электродвижущая сила, равная 1 вольту, при прохождении тока
через сопротивление, равное 1 ому, возбудит силу тока, равную 1
амперу. Совершенно ясно, что, зная два из этих факторов, мы можем
вычислить третий на основании только что приведенной зависимости
между ними.
Теперь нам остается определить еще две дополнительные еди-
ницы, предназначенные для измерения электрической энергии и элек-
трической мощности. Мы уже знаем, что всякая форма энер-
гии является произведением двух факторов: фактора емкости
и фактора интенсивности. Кулон в качестве меры количества элек-
тричества и вольт в качестве меры электродвижущей силы — как
раз и будут единицами емкости и интенсивности. Их произведение
даст нам единицу электрической энергии — джоуль:
1 джоуль = 1 кулон х 1 вольт.
Мощность определяется как скорость, с которой может подаваться
энергия. За единицу электрической мощности принят ватт, равный
1 джоулю в секунду:
, 1 джоуль
1 ватт = :------ •
1 секунда
Динамомашина мощностью в 1 киловатт может давать 1000 джоу-
270
ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ
лей электрической энергии в секунду. Но ватт равен также произве-
дению ампера на вольт, так как
ватт =
джоуль
секунда
кулон х вольт
секунда
= ампер х вольт.
Когда мы покупаем электрическую энергию для домашних целей,
счета выписываются нам обычно в киловатт-часах. Это тоже единица
измерения электрической энергии, как мы увидим, связав ее с джо-
улем:
1000 джоулей 3600 000 джоулей
киловатт х час =------------X час ---------------1---X час =
секунда час
= 3 600 000 джоулей.
4. Электролиз. В 1800 г. итальянский физик Вольта построил
свой «вольтов столб» — первый электрический элемент. Это открытие
сделало возможным исследование электрического тока, так как дало
удобный метод для его получения. Вскоре с помощью электрического
тока было осуществлено разложение воды на водород и кислород
В 1807 г. Гемфри Дэви, о котором мы уже упоминали ранее (стр. 206),
осуществил впервые один из упомянутых опытов электролиза, полу
чив впервые же с помощью электрического тока натрий и калий.
Прохождение постоянного электрического тока через электро-
лит сопровождается химическими изменениями, происходящими
на каждом электроде. На отрицательном электроде, или катоде,
выделяется металл или водород. Металл обычно покрывает электрод
тонким слоем, а водород выделяется в виде пузырьков газа. На поло-
жительном полюсе, или на аноде, выделяются неметаллы, например
кислород, хлор или иод. Выделившиеся на электродах вещества
могут вызвать дальнейшие химические изменения, но в них мы пока
не заинтересованы. Сейчас нас интересует главным образом вопрос о
том, чем же проводится ток через электролит. Нам хотелось бы отве-
тить на такой вопрос: «почему водный раствор соли проводит элек-
трический ток, а раствор сахара его не проводит?»
Майкель Фарадей первый открыл ту основную зависимость,
которая существует между количеством электричества и вызывае-
мым им химическим действием. Эта зависимость выражена в двух
законах:
1. Количество веществ, выделившихся в свободном состоянии
на электродах, пропорционально количеству протекшего электри-
чества.
2. Одно и то же количество электричества выделяет различ-
ные вещества в весовых количествах, пропорциональных их хи-
мическим эквивалентам.
Первый закон не нуждается в особых пояснениях. Если напри-
мер 1 кулон электричества выделяет 0,00118 г серебра, то 2 кулона
выделят количество серебра в 2 раза большее и т. д. Второй зак<М5
менее очевиден. Во-первых, мы должны определить, что подразуме-
вается под словом химический эквивалент. Химический эквивалент
электролитическая диссоциация
27i
равен атомному весу элемента, деленному на его валентность. Так,
107 88
например,----р— весовых частей серебра (атомный вес = 107,88;
63,57 . ,
валентность=1) эквивалентны—--------- весовым частям меди (атом-
16
ный вес = 63,57; валентность = 2), —л— весовым частям кислорода
4
197,2
3
или
весовым частям трехвалентного золота. Рассмотрим опыт,
который мог бы быть осуществлен Фарадеем и который пояснит нам
значение его второго’ закона. Три
йены последовательно с источни-
ком постоянного тока (рис. 100).
При такого рода соединении одно
и то же количество электричества
должно пройти через каждую ван-
ну. В первой ванне имеется раст-
вор нитрата серебра AgNO3, во
втором — раствор сульфата меди
CuSO4, в третьем — раствор хло-
рида золота АиС13. Нами нарочно
взяты соли одновалентного Ag,
двухвалентного Си и трехвалент-
ного Au, чтобы лучше иллюстри-
ровать закон Фарадея. В каждом
случае металл будет отлагаться н;
будет определить, взвесив электроды до и после электролиза, причем
увеличение в весе будет равняться весу металла, отложившегося
на электроде в результате пропускания тока при электролизе. В ре-
зультате одного опыта было найдено, что при пропускании через 3
ванны 4825 кулонов электричества отложилось 5,394 г серебра,
1,589 г меди и 3,29 г золота. Эти весовые количества химически экви-
валентны друг другу, так как они находятся между собой в тех же
отношениях, что и химические эквиваленты металлов, как это видно
из табл. XXXIII.
электролитических ванны соеди-
Рис. 100. Опыт, иллюстрирующий
закон Фарадея.
катоде, и вес его легко можно
Таблица XXXIII
Металл । Количество металла (ь г), отложившееся при прохождении 4825 ку- лонов 1 Хими- ческие эквива- ленты
Серебро • • • • 5,394 107,88
Медь 1,589 31,785
Золото 3,290 65,7
272
ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ
Отсюда следует, что:
5,394 = 107,88 . 5,394 _ 107,88 . 1,589 _ 31,785
1,589 — 31,785 ’ 3,29 ~ 65,7 ’ 3,29 “ 65,7 '
Из этого закона следует, что должно существовать такое коли-
чество электричества, которое отложит граммэквивалентное коли-
чество любого элемента. Это количество мы можем вычислить на
основании приведенных выше результатов. Если 4825 кулонов отла-
гают 5,394 г серебра, то сколько кулонов отложат 107,88 г? Приме-
няя первый закон Фарадея, получаем:
5,394 = 107,88
4825 - х
Решая это уравнение, получаем:
х = 96500 кулонов = 1 фарадей.
Это то количество электричества, которое при электролизе выделяет
граммэквивалентное количество любого элемента и которое назы-
вается фарадеем.
Прежде чем приступить к изучению общепринятой в настоящее
время теории, касающейся природы электрической проводимости,
рассмотрим с некоторых других сторон поведение электролитов так,
чтобы мы могли лучше понять, каким образом эта теория была выве-
дена из имевшихся и известных фактов.
5. Реакции электролитов. Химические реакции, которые имеют
место между электролитами в водном растворе, по большей части
характеризуются большой скоростью, с которой они протекают и
тем простым типом реакций, которые имеют место. Эти реакции про-
текают почти мгновенно по сравнению с аналогичными реакциями,
протекающими между неэлектролитами. Например при смешении
растворов нитрата серебра AgNO3 и хлорида натрия NaCl немед-
ленно появляется белый осадок нерастворимого соединения — хло-
рида серебра AgCl:
AgNO3 + NaCl = AgCl + NaNO3.
Такая скорость наводит на мысль о том, что или связи между атомами
в молекулах реагирующих веществ очень слабы, или эти молекулы
в водном растворе уже разбиты на некоторые обломки и эти обломки
могут мгновенно реагировать друг с другом. В сухом состоянии нит-
рат серебра и хлорид натрия не реагируют друг с другом со сколь-
ко-нибудь заметной скоростью.
Далее большинство реакций между электролитами в водном
растворе — реакции двойного разложения (стр. 82). Из сотен реак-
ций, которые можно было бы привести для того, чтобы иллюстри-
ровать этот факт, следующие реакции пожалуй наиболее типичны:
NaOH + НС1 = NaCl + Н2О;
2NaCl + Pb(NO3)2 = 2NaNO3 + PbCI2;
ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ
273
CuSO4 + Na2S = Na2SO4 + CuS;
Al (NO3)3 + 3NH4OH . Al (OH)3 + 3NH4NO3.
Такая тенденция к реакциям обменного разложения указывает на то,
что в молекуле каждого электролита существует связь, которая раз-
рывается или до реакции или во время реакции с другими электро-
литами. Далее, некоторые группы атомов, например гидроксильная
ОН, нитратная NO3, сульфатная SO4 и аммонийная NH4, остаются
при таких реакциях без изменения, как будто валентные связи, удер-
живающие вместе атомы этих групп, совершенно другого рода и более
прочны, чем те валентные связи, по которым происходит распад
молекулы. Все эти данные имеют особо важное значение при
разборе любой теории, касающейся состояния молекул электроли-
тов в водном растворе.
6. Молекулярные свойства водных растворов электролитов. Те-
перь мы можем рассмотреть более подробно тот упомянутый нами
ранее факт (стр. 259), что растворы электролитов не подчиняются за-
кону Рауля о понижении давления паров, законам, касающимся
понижения точки замерзания и повышения точки кипения (стр. 262).
Мы уже знаем, что существуют следующие законы для понижения
давления пара и точки замерзания и для повышения точки кипения,
которые вызываются неэлектролитами в разбавленном растворе:
ДР = Ро— Р = Р<*,
Д& = b —Ьо = Вх,
где Ро> /о и &0 — соответственно давление пара, точка замерзания
и точка кипения чистого растворителя; р, f и b — соответствующие
константы раствора их — молярная дробь растворенного вещества.
Молярная дробь растворенного вещества х равна, как вы помните,
количеству молей растворенного вещества N, деленному на общее
количество имеющихся молей, т. е. на сумму молей растворителя
N' и растворенного вещества N:
N
М SS —— :
N' + N
В гл. XXIV мы вычислили на основании этих уравнений|
чему равны Др, Д/ и Д& для раствора, содержащего 0,1 моля
неэлектролита в 1000 г (1000/18—55,5 молей) воды. Вычисленные
величины сравниваются в двух первых столбцах табл. XXXIV
с величинами, полученными на основании опыта для растворов са*
хара (маннита) в воде. Как видно из таблицы, наблюдаемые величины
прекрасно согласуются с величинами, вычисленными на основании
этих уравнений. Другими словами, в каждом случае выявившийся
эффект пропорционален молярной дроби растворенного вещества
в растворе маннита.
18 Введение в химию.
274
электролитическая диссоциация
Таблица XXXIV. Свойства водных растворов1 маннита
(неэлектролита) и хлористого калия (электролита)
Свойства Вычислен- ное Наблюден- ное для раствора маннита Наблюден- ное для раствора КС1
Понижение давления пара при 20° в мм Повышение точки кипения в °C . . Понижение точки замерзании в°С . 0.0316 0,052 0,186 0,0311 0,050 0,186 0,0574 0,098 0,345
С другой стороны, если приготовить раствор хлористого калия,
типичного электролита, той же молярной концентрации, то все упо-
мянутые изменения будут больше, чем они должны были бы быть
на основании законов о растворах. Молярные дроби маннита и хло-
ристого калия одинаковы, следовательно эти растворы должны были
бы показать например одинаковое понижение давления пара. На са-
мом же деле наблюдаемая величина для хлористого калия почти
в 2 раза превышает соответственную величину для маннита. То же
самое имеет место и в случае наблюдаемых величин понижения точки
замерзания и повышения точки кипения. В некоторых случаях, как
в рассматриваемом нами примере, наблюдаемые величины почти
в 2 раза больше вычисленных на основании законов о растворах; в
других случаях они почти в 3 раза больше, а иногда бывают даже
почти в 4 или в 5 раз больше.
Теперь мы уже подготовлены к тому, чтобы познакомиться с
общепринятой в настоящее время теорией, касающейся состояния
электролитов в водном растворе.
7. Теория ионизации, или электролитической диссоциации. Эта
теория впервые четко была сформулирована в 1887 г. швед-
ским химиком Сванте Аррениусом. Прежде чем ее изложить, мы
подытожим все те факты, которые нам известны относительно пове-
дения водных растворов электролитов и неэлектролитов. Все эти
факты были известны Аррениусу, так как работы Фарадея, ван’т
Гоффа и других над растворами были произведены до того как Ар-
рениус предложил свою теорию. На этих фактах главным образом
и была основана его теория.
1. Некоторые вещества — именно кислоты, основания и соли —
при растворении их в воде или в расплавленном состоянии прово-
дят электрический ток. Эти вещества были названы Фарадеем элек-
тролитами.
* В каждом растворе содержится 0,1 моля растворенного вещества в UOOO а
воды.
ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ
275
Сванте Аррениус. •
2. Количество электричества, необходимое для выделения опре-
деленного количества какого-нибудь элемента пропорционально его
валентности. Это вытекает из второго закона Фарадея.
3. Реакции между электролитами в водном растворе отличают-
ся своей скоростью и простотой. Имеется определенное указание
на то, что или имеет место фактическая диссоциация их молекул
на меньшие частицы, или же в их молекулярном строении имеется
весьма слабая связь.
4. Водные растворы электролитов не подчиняются законам о
растворах. Электролиты вызывают ненормально большое понижение
давления пара и точки замерзания и ненормально большое повы-
шение точки кипения воды.
Чтобы объяснить все эти известные
факты, Аррениус постулировал, что
молекулы электролитов фактически
диссоциированы в водном растворе на
атомы или группы атомов, названные
им ионами х. Эти ионы являются эле-
ктрически заряженными и от них за-
висит электропроводность водных ра-
створов электролитов.
На минуту остановимся и посмот-
рим, каким образом эти постулаты объ-
ясняют уже известное поведение элект-
ролитов. То, что молекулы электролитов
диссоциированы на атомы или группы
атомов,ясно видно из сущности реакций,
протекающих между ними, и из того фак-
та, что электролиты вызывают ненор-
мально большую депрессию давления па-
ров и точки замерзания и ненормально
большое повышение точки кипения. Мы
уже видели, что 0,1 моля хлористого ка-
лия понижает точку замерзания почти в 2 раза сильнее чем 0,1 моля та-
кого неэлектролита, как маннит, в том же количестве воды. Аррениус
предположил, что одно и то же количество молекул хлористого
натрия может вызвать такой двойной эффект только в том случае,
если эти молекулы диссоциированы и если каждая молекула распа-
лась на две частицы или два иона. В этом случае в растворе хлористого
калия будет при том же числе молекул в 2 раза больше частиц
по сравнению с числом молекул в растворе неэлектролита маннита.
Так как влияние, оказываемое растворенными частицами на давле-
ние паров, точку замерзания и точку кипения, не зависит от природы
этих частиц, то естественно, что в случае раствора хлористого калия
оно будет в 2 раза больше.
1 Термин этот был впервые применен Фарадеем, но имел несколько иное зна-
чение.
18*
276 ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ
Что ионы электрически заряжены также легко показать. Во-
первых, электрический ток проводят только те растворы, в которых
ненормальное понижение давления пара и пр. указывает на диссо-
циацию молекул растворенного вещества. Присутствие ионов являет-
ся как бы необходимым для того, чтобы раствор проводил электри-
ческий ток. Кроме того опыты показывают, что металлические ионы
двигаются по направлению к отрицательному полюсу, или катоду,
а неметаллические ионы двигаются по направлению к аноду, так как
металлические ионы разряжаются на катоде, где они выделяются
в виде свободных металлов, а неметаллы — на аноде. Эти факты не
только указывают на то, что ионы несут электрические заряды,
но и на то, что заряд металлических ионов положительный, а неме-
таллических ионов — отрицательный.
8. Заряд иона. Второй закон Фарадея позволяет нам опреде-
лить величину заряда иона. Мы уже знаем, что количество электри-
чества, равное 96 500 кулонам, или 1 фарадею (F), выделяет 1
граммэквивалент элемента, нейтрализуя заряд его ионов на том
электроде, на котором происходит разряжение. 1 фарадей например
может разрядить 107,88 г ионов серебра, 31,785 г ионов меди и 65,7 г
ионов золота (стр. 276), как это видно из табл. XXXV.
Таблица XXXV
Металл Валентность Граммэкви ва- лент = грамматом валентность Количество электри- чества, не- обх. для выделения 1 грамм- эквивалента Атомный вес Количество электриче- ства, необх. для выде- ления 1 грамм- атома
Серебро 1 107,88 1 F 107,88 1 F
Медь 2 31,785 1 F 63,57 2 F
Золото 3 65,7 1 F 197,2 3 F
Зная, что граммэквивалент равен грамматому, деленному на
валентность, легко найти, что для выделения 1 грамматома однова-
лентного металла, например серебра, требуется 1 фарадей; двух-
валентного металла, например меди, 2 фарадея; трехвалентного ме-
талла, например золота, 3 фарадея. Та же зависимость имеется и
между неметаллическими ионами. Так как грамматомы всех эле-
ментов Содержат одинаковое количество атомов, то отсюда следует,
что для того, чтобы разрядить двухвалентный ион, требуется в 2 ра-
за больше электричества, а для того, чтобы разрядить трехвалентный
ион, —в 3 раза больше, чем в случае одновалентного иона. Следова-
тельно величина заряда иона пропорциональна его валентности. На
этом основании мы изображаем ион серебра символом Ag+, ион меди
ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ
277
Cu++, ион золота Аи+ ++, йон хлора СГ, сульфат-ион SOr
и т. д.
9. Источник, из которого берутся заряды ионов. Для тех, кто
помнит, что было сказано в одной из предыдущих глав о структуре
атома и о положительной и отрицательной валентности, не будет не-
ожиданным тот факт,что ионы, на которые диссоциируют электролиты,
оказываются электрически заряженными. Но не следует забывать,
что когда Аррениус впервые излагал свою теорию, электрон еще
не был открыт и происхождение заряда ионов не было вполне понято.
Теперь мы знаем, что атомы например хлористого калия несут за-
ряды уже в кристаллах
этого вещества вслед-
•ствие перехода электро-
на с внешней орбиты
атома калия на внеш-
нюю орбиту атома хлора
'(рис. 101). Хлористый
калий в кристалле уже
полностьюионизирован.
Но ионы эти настолько
прочно связаны друг
К+ сг
с другом силами меж- им«сл«₽ 'Хлю-иш
ионного притяжения в рис. ю1.
кристаллической решет-
ке, что они не могут
двигаться. Поэтому электропроводность кристалла очень низка.
Однако в процессе растворения или расплавления происходит распад
кристалла, в результате которого ионы приобретают ту подвиж-
ность, которая необходима для электропроводности.
10. Теоретические выводы. Теперь мы можем собрать воедино
различные положения теории электролитической диссоциации, рас-
смотренные нами уже в предыдущих параграфах.
1. Молекулы электролитов в водном растворе диссоциированы
на электрически заряженные атомы или группы атомов, называ-
емые ионами.
2. Металлические ионы заряжены положительно, неметалли-
ческие отрицательно.
3. Заряд иона пропорционален его валентности.
В заключение этой главы читателю будет интересно познакомить-
ся со следующей выдержкой из речи Аррениуса, произнесенной им
в Чикагской секции Американского химического общества, в которой
он весьма остроумно говорит о том приеме, который был оказан
его теории.
Я пришел к моему профессору Клеве, которого я глубоко уважаю,
и сказал: «У меня имеется новая теория электропроводности, объясняющая
происхождение химических реакций». Он сказал: «Это весьма интересно»
и затем добавил: «прощайте». Позднее, когда ему пришлось формулировать
основания для получения мною нобелевской премии за эту работу, он мне
объяснил, что ему было прекрасно известно о существовании огромного
27S
ЭЛЕКТРОЛИТЫ
количества теорий, которые почти все наверняка были ошибочны, так как
z по истечении короткого времени они все исчезали, и поэтому, применяя
статистический метод мышления, он заключил, что и моя теория вряд ли
долго просуществует. (Смех).
Я остался не совсем доволен его мнением и тогда же подумал, что за
границей имеется много выдающихся ученых, которые, может быть, иначе
на это посмотрят; моя теория могла бы на них подействовать. Тогда я на-
писал Клаузиусу и спросил его: «Что вы об этом думаете?» Я написал
Оствальду, он работал в той же области. Я написал Томсону. От большинства
этих ученых я получил весьма дружественные ответы и все они были очень ра-
ды со мной познакомиться ит. д., но дальше ничего не было. (Смех). Един-
ственным исключением оказался Оствальд, который рассказывал, как он
в один и тот же день получил мою диссертацию, зубную боль и хорошень-
кую дочку, и что всего этого было слишком много в один день, причем хуже
всего было дело с диссертацией, так как остальные обе развивались вполне
нормально. Но эта объемистая диссертация была очень тяжела для него,
и, по его словам, имелись указания на то, что в некоторых своих частях она
была не совсем в порядке. В ней имелись кое-какие неизвестные выражения
и сангвинические мысли, но в конце концов он пришел к заключению,
что, пожалуй, следует посмотреть, правильна ли она... Затем он сам приехал
ко мне и мы разговорились и провели вместе несколько очень приятных
дней
Затем Оствальд конечно посетил моего дорогого друга и учителя Клеве.
Однажды Оствальд разговаривал спим в лаборатории. Я пришел несколько
позднее. Меня не ждали, и я услышал, как Клеве сказал’. «Вы верите в то,
что хлористый натрий распадается на натрий и хлор?» «В этом стакане у меня
имеется раствор хлористого натрия: верите вы в то, что здесь имеются нат-
рий и хлор?» «Разве они так выглядят?» «О, да», сказал Оствальд, «несом-
ненно в этой идее имеется доля истины». Тут я вошел, и разговор оборвался.
Я об этом весьма пожалел.
ГЛАВА XXVI
ЭЛЕКТРОЛИТЫ
Теория электролитической диссоциации в том виде, в каком
она была предложена Аррениусом, остается и до сих пор в своих
основных чертах общепринятой теорией. Однако более поздние ис-
следования привели к изменению некоторых его положений. Этих
изменений мы и коснемся в этой главе.
Мы уже знаем, что определенное число молекул хлористого ка-
лия понижает давление пара и точку замерзания и повышает точку
кипения воды почти в 2 раза сильнее, чем то же число молекул
неэлектролита, растворенное в одинаковом количестве воды. В дан-
ном случае слово почти имеет большое значение и причинило Арре-
ниусу немало хлопот. Если мы предположим, что каждая молекула
хлористого натрия диссоциирует на 2 иона, то мы должны ожидать,
что оказываемое ими влияние на физическое свойство воды будет
в 2 раза сильнее по сравнению с неэлектролитом. Мы же наблюдаем
почти удвоенное действие.
1. Ионцое равновесие. Аррениус дал этому следующее объясне-
ние. Он предположил ,что не все молекулы диссоциированы, так
как ионизация является обратимой реакцией, в результате которой
ЭЛЕКТРОЛИТЫ
279
устанавливается равновесие между молекулами и ионами. По мнению
Аррениуса, равновесие в этом случае устанавливается следующим
образом. По мере растворения молекул например хлористого калия
в воде они начинают диссоциировать на ионы со скоростью, про-
порциональной их концентрации:
КС1 К+ + СГ.
Вначале скорость эта максимальна, но по мере того как диссоции-
рует все большее и большее количество молекул, скорость диссоци-
ации оставшихся молекул уменьшается. С другой стороны, ионы
К+ и С1“ тотчас же после своего образования начинают соединяться
друг с другом, образуя опять молекулы KCI
К + + CI “ КС1
со скоростью, в свою очередь пропорциональной их концентрации.
В самом начале растворения скорость этой обратной реакции равна
нулю, так как в растворе еще не имеется ионов, но она возрастает
по мере роста концентрации ионов вследствие непрерывной диссо-
циации молекул КС1. В конце концов скорости обеих реакций стано-
вятся равными, в результате устанавливается химическое равнове-
сие. При состоянии равновесия относительные количества недиссо-
циированных молекул и ионов остаются постоянными:
КС1 К + + С1".
Относительная склонность молекул какого-нибудь электролита
к диссоциации, а ионов к обратному соединению друг с другом, опре-
деляет относительные количества недиссоциированных молекул и
ионов в состоянии равновесия. Если молекулы обладают большей
тенденцией к диссоциации, чем ионы к соединению в молекулы, то в
состоянии равновесия в растворе будет больше ионов и меньше мо-
лекул и наоборот. В случае хлористого калия тенденция молекул
к диссоциации такова, что 85% всего вещества находится в виде
ионов и только 15% в виде недиссоциированных молекул. Такова
была та первоначальная картина, которая была предложена Арре-
ниусом. Исследуем несколько глубже эту гиппотезу и посмотрим,
почему ее пришлось несколько видоизменить.
2. Сильные и слабые электролиты. Мы уже знаем, что поведение
веществ, растворенных в воде, указывает на резкое различие, су-
ществующее между двумя классами соединений: электролитами и не-
электролитами. Но и среди электролитов согласно теории Арре-
ниуса степень диссоциации на ионы бывает различна (табл. XXXVI).
Грубо мы можем разбить электролиты на два класса: сильно
ионизированные, сильные электролиты, и слабо ионизированные,
слабые электролиты.
Весьма вероятно, что природа валентных связей между атомами
молекулы предрешает вопрос не только о том, будет ли данная моле-
кула диссоциировать, но и степень ионизации, в том случае когда
280
ЭЛЕКТРОЛИТЫ
Таблица XXXVI. Кажущаяся диссоциированной
часть в 0,растворе при 18°
Электролиты Ионизация Часть, ка- жущаяся диссоци- ированной
Соляная кислота HCIZ^ H++C1- 0,92
Азотная кислота HNO8^ H++NO,- 0,92
Серная кислота h2so4^ 2H*+SO4= 0,61
Фосфорная кислота Н3РО4^ h++hpo4 - 0,27
Уксусная кислота нсоасн8 h++co2ch3- 0,013
Угольная кислота Н2СО3^ Н + + НСО,- 0,0017
Сероводород HaSZ± H ++HS- 0,0007
Едкий натр NaOH^ Na + +OH- 0,91
Едкое кали KOH«=± k*oh- 0,91
Гидрат окиси бария Ba(OH)2T=± Ba + ++2OH- 0,77
Водный аммиак NH4OH^ NH.+ + OH' 0,013
Хлористый калий KC1Z=± K*+ci- 0,86
Хлористый натрий NaC17=? Na ++Cl~ 0,84
Азотнокислый натрий NaNO3 Na + 4-NO,- 0,83
Азотнокислый калий KNOg^ k++no8- 0,83
Сернокислый цинк ZnSO4T=i: Zn+4-SO. 0,40
Сернокислая медь CuSO4 z=± Cu+ + +SO4= 0,40
Хлорная ртуть HgCla^ Hg+*+2Cl- 0,01
последняя имеет место. Валентные связи в молекулах неэлектролитов
принадлежат к типу ковалентных, неполярных связей, т. е. эти связи
состоят из общих пар электронов. В мо-
лекулах же электролитов существует
по крайней мере одна полярная связь
в каждой молекуле, т. е. такая, кото-
рая получается в результате действи-
тельного перехода электрона от одного
атома к другому (рис. 102). Такая
полярная связь соединяет две проти-
воположно заряженные части молекулы
электролита. Части эти и являются
ионами.
3. Константа диссоциации. Ион-
ное равновесие — это один из видов
химического равновесия. Следователь-
но мы можем вывести константу для
Рис. 102. Полярные и непо- состояния равновесия между электро-
лярные связи, литом и его ионами совершенно так же,
как это было уже объяснено в гл. IX.
Рассмотрим сперва случай, при котором молекула электролита
Ая Хст диссоциирует на ионы п А* и /пХ“:
АяХотт^ пА+ +тХ ".
ЭЛЕКТРОЛИТЫ
281
В этом случае при состоянии равновесия мы будем иметь;
С Л . pffl
Л + X сх-
Ад Х/д
В данном случае константа К называется константой диссоциации.
Для того чтобы понять, каким образом такая константа вычис-
ляется в действительности, рассмотрим характерный пример. Мы
знаем, что молекулы хлористого калия в 0,1 М растворе диссоции-
рованы по Аррениусу на 85%. Следовательно в таком растворе кон-
центрация молекул хлористого калия равна
СКС1 =0,1 х 15% =0,015 молей на литр,
а концентрация каждого из ионов равна
Ск+ = Сс1_ =0,1 х 85% =0,085 молей на литр.
Отсюда путем подстановки мы получаем:
0,085 х 0,085 л лоо „
------------- 0,482 =ККС1.
Если такого рода равновесие действительно существует в вод-
ных растворах хлористого калия и других электролитов, то вычис-
ленные константы равновесия в растворах различных концентраций
действительно должны быть величинами постоянными. Если же такое
равновесие не существует, то все эти вычисленные величины ока-
жутся разными, и в этом случае вообще не было бы никакого смысла
вычислять эти величины. Таким образом мы имеем возможность про-
верить теорию Аррениуса.
4. Концентрация раствора. По мере увеличения разбавления
раствора электролита степень ионизации его молекул возрастает,
как это видно из табл. XXXVII.
Таблица XXXVII
Электролит Концен- трация Диссоци- ированная часть
КС1 1 М 0,756
КС1 0,1 М 0,862
КС1 0,01 М 0,942
НСОаСН8 0,1 М 0,0132
НСОаСН8 0,01 М 0,0410
Посмотрим, чего же мы можем ожидать из рассмотрения закона
действующих масс в его применении к тем скоростям, с которыми
происходит диссоциация молекул и соединение ионов в молекулы. Как
мы видим, скорость диссоциации пропорциональна первой степени
282
ЭЛЕКТРОЛИТЫ
концентрации,тогда как скорость обратной реакции пропорциональна
квадрату или даже более высокой степени концентрации. Следователь-
но должно ожидать, что увеличение концентрации в большей степени
увеличит скорость обратной реакции, чем скорость диссоциации.
Таким образом при увеличении концентрации раствора равновесие
сдвигается так, что уже меньшее количество ионов находится в рав-
новесии с большим количеством недиссоциированных молекул. И на-
оборот, при разбавлении раствора электролита, скорость реакции дис-
социации уменьшается в меньшей степени, чем скорость перехода
ионов в молекулы, так что в более разбавленном растворе дис-
социирует большее количество молекул.
В связи с этим интересно посмотреть, насколько уравнение,
служащее для определения константы диссоциации, пригодно при
измерении концентрации электролита. Мы имеем все необходимые
данные в предыдущей таблице как для сильного электролита КС1,
таки для слабого НСО2СН3 — уксусная кислота. Рассмотрим сперва
случай слабого электролита — уксусной кислоты, диссоциирующей
на водород- и ацетат-ионы:
НСО,СН, Н+ + со2сн3-.
Уравнение для константы диссоциации этой кислоты имеет следую-
щий вид:
Сн + Ссо.сн,— 17
Р к»
СнСО.СНз
В 0,1 М растворе концентрация водород-и ацетат-ионов равна
0,1 х 0,0132, а концентрация недиссоциированных молекул
0,1x0,9868. Подставляя, мы получаем следующую величину для
константы диссоциации:
0,00132 х 0,00132
0,09868
= 0,0000176.
Аналогично, для 0,01 М раствора имеем следующую величину
константы диссоциации:
0,000410 х 0,000410 n nnnni-r
----------------=0,0000175.
Эти две величины, вычисленные нами для константы диссоциации,
прекрасно согласуются между собой, согласуются они и с величи-
нами, вычисленными для других концентраций растворов уксусной
кислоты. Таким образом диссоциация уксусной кислоты, типичного
слабого электролита, подчиняется закону действующих масс.
В случае же растворов хлористого калия мы имеем совершенно
иную картину. На основании данных, взятых из предыдущей таблицы,
мы можем вычислить константы диссоциации для следующих рас-
творов хлористого калия: 1 М, 0,1 Ми 0,01 М.
ЭЛЕКТРОЛИТЫ
283
Для 1 М раствора КС1 имеем:
0,756 х 0,756 Q
0,244 “
Для 0,1 М КС1:
0,0862 х 0,0862 п сое
----6ТЙ38----=0’536-
Для 0,01 М KCI:
0,00942 х 0,00942 п .„
0,00058
Здесь мы уже имеем «константу» диссоциации, которая совсем не
является константой. Изменение константы диссоциации характерно
не только для хлористого калия, но и для любого другого сильного
электролита и указывает на то, что закон действующих масс не может
быть применен к равновесию между молекулами сильных электро-
литов и их ионами, если только такое равновесие действительно суще-
ствует. Закон действующих масс (стр. 85), на котором основаны вы-
ражения для скорости и констант равновесия, может быть строго
применен только к реакциям таких веществ, между молекулами кото-
рых не существует заметных сил притяжения. Это в некотором роде
ограничительный закон, который может быть применен лишь в иде-
альных условиях. Мы уже встретились с аналогичным случаем при
изучении газовых законов и узнали, что эти законы строго применимы
только к гипотетическим идеальным газам (стр. 35). Причина ано-
мального поведения сильных электролитов заключается в том, что
силы межионного притяжения в таких растворах весьма значи-
тельны вследствие относительно высоких концентраций в них ионов.
В растворах сильных электролитов концентрация ионов значительна,
и среднее расстояние между ними соответственно мало. Так как ионы
электрически заряжены, то силы притяжения или отталкивания,
действующие между ними, очевидно должны быть значительными. При
таких условиях естественно можно ожидать заметных отклонений от
такого ограничительного закона, каким является-закон действую-
щих масс, и мы действительно видим, что это имеет место. С другой
стороны, в растворах слабых электролитов концентрация ионов не-
значительна, и следовательно ионы находятся на относительно боль-
ших расстояниях друг от друга, так что силы межионного 'при-
тяжения и отталкивания невелики. При таких условиях отклонения
от ограничительного закона незначительны, и константы равновесия
имеют одну и ту же величину в широких пределах концентраций.
5. Состояние, в котором находятся сильные электролиты в рас-
творе. Таким образом в случае слабых электролитов теория Арре-
ниуса вполне согласуется с экспериментальными данными, для
случая же сильных электролитов эта теория должна быть в значи-
тельной степени видоизменена. Благодаря работам Брэггов над
структурой кристаллов (стр.228) стало ясно, что сильные электролиты
полностью ионизированы уже в кристаллическом состоянии, т. е.
что они состоят скорее из заряженных ионов, чем из нейтральных
284
ЭЛЕКТРОЛИТЫ
молекул. Это видно из строения кристалла хлористого натрия,
изображенного на рис. 103. Таким образом вполне логично предпо-
ложить, что когда кристаллы сильного электролита растворяются в
воде, ионы переходят в раствор один за другим, а не в виде ней-
тральных молекул. Это приводит к заключению, что молекулы
сильного электролита в водном растворе диссоциированы нацело.
Конечно картина эта весьма проста и все же она несколько
нас поражает. Как сможем мы объяснить тот факт, что понижение
точки замерзания, вызываемое 0,1 моля хлористого калия, почти
в 2 раза больше, чем вызываемое 0,1 моля сахара в растворе той же
концентрации, но все же меньше чем в 2 раза, если полная диссоциа-
ция хлористого калия должна привести к удвоенному количеству
ионов по сравнению с числом молекул? Совсем недавно Дебай и Хюк-
кель указали на то, что это отклонение может быть объяснено тем,
что оно зависит от электрических сил, дей-
• ОвС/’ ствующих между ионами. Они показали, что
Рис. 103. Кристалл хло-
ристого натрия.
«активность», или кажущаяся концентрация
иона, связана с плотностью его «ионной ат-
мосферы», т. е. с ионами, его окружающими.
Происхождение этой теории отличается та-
кой математической сложностью, что разбор
ее совершенно невозможен в нашей книге.
Она неполна во многих отношениях, и все
же успех теории оказался настолько значи-
тельным, что дает уверенность в ее суще-
ственных достоинствах. Мы всегда должны
помнить, что когда мы говорим о «проценте
диссоциации» сильного электролита, то под
этим мы подразумеваем «кажущийся про-
цент ионизации», так как молекулы силь-
ного электролита по всей вероятности диссоциированы нацело.
6. Природа растворителя. До сих пор мы рассматривали дис-
социацию веществ только в их водных растворах. Действительно,
вода — наилучшая среда для диссоциации, но все же имеются и дру-
гие растворители, в которых также происходит диссоциация электро-
литов. Среди таких растворителей следует упомянуть жидкий аммиак
и жидкий сернистый ангидрид. Диссоциирующая способность среды
каким-то образом связана с ее диэлектрической постоянной, которую
грубо можно определить как меру способности среды удерживать
две суспендированные в. ней электрически заряженные частицы вдали
друг от друга. Из всех обычных растворителей вода обладает наивыс-
шей диэлектрической постоянной. С другой стороны, диэлектриче-
ские постоянные таких растворителей, как бензол, толуол или эфир,
в которых диссоциация не происходит в заметной степени, весьма
малы.
7. Ионы и их названия. Теперь мы познакомим читателя с не-
которыми из наиболее распространенных ионов. В отличие от того,
как даются имена людям, в номенклатуре ионов имеется некоторая
ЭЛЕКТРОЛИТЫ
285
система. Сперва мы познакомим читателя с этими ионами, а затем
уЯ<е посмотрим, откуда происходят их названия.
Правила для наименования ионов немногочисленны и их легко
усвоить. Вот эти правила:
1. При наименовании электролита сперва называется положи-
тельный ион, а затем отрицательный.
2. Для названия положительного иона берется название свобод-
ного металла, если металл обладает постоянной валентностью. Если
же он обладает переменной валентностью, то это также упоминается.
Например в молекуле хлористого железа FeCla железо двухвалентно,
мы его обозначаем как ион железа (II), или двухвалентный ион же-
леза. В случае FeCl3, где железо трехвалентно, мы говорим: ион же-
леза (Ш), или трехвалентный ион железа.
3. Для отрицательных ионов в соединениях, не содержащих
кислорода, берется окончание ид: хлорид-ион, роданид-ион. Для
Таблица XXXVIII. Наиболее часто встречающиеся ионы и их
названия
Положительные ионы
Отрицательные ионы
Одновалентные
Н + ион водорода
Na + ион натрия
К + ион калия
Ag+ ион серебра
Cu+ ион меди (I)
Hg+ ион ртути (I)
nh4+ ион аммония
Са + + ион кальция
Ва + + ион бария
Mg+ + ион магния
Zn + + ион цинка
Pb+ + ион свинца
Cu+ + ион меди (II)
Hg+ + ион ртути (II)
Fe+ + ион железа (II)
Sn+ + ион олова (II)
А1 + + + ион алюминия
Fe+ + + ион железа (III)
ОНгидроксил-ион
С1 хлорид-ион
Вг" бромид-ион
J" иодид-ион
NOa” ни трит-ион
NOa“ нитрат-ион
С1О8” хлорат-ион
СО2СН8“ ацетат-ион
Двухвалентные
S= сульфид-ион
SO3= сульфит-ион
SO4= сульфат-ион
СО8= карбонат-ион
SiOa” сили кат-ион
Трехвалентные
РО4= фосфат-ион
Четырехвалетные
Sn + + + + ион олова (IV) |
286
ЭЛЕКТРОЛИТЬЦ
0^ица1тлы№зарй-
шпы плова иттый то/-иен
кислородсодержащих ионов, в том случае если существует один толь-
ко ион, содержащий данный неметалл и кислород, применяется окон-
чание ат. Если существуют два такого рода иона, то название иона
с меньшим содержанием кислорода оканчивается на ат, а с большим
содержанием кислорода — на ат. . Например SO3=—сульфиги-ион;
SO4=— сульфат-ион. Эти правила имеют общее применение, кроме
того существует еще номенклатура для кислот, которую мы рассмот-
рим при обсуждении этого класса соединений.
8. Свойства ионов. В теории электролитической диссоциации,
в то время когда она была предложена, наиболее непонятным для
химиков казалось то, каким образом молекулы могут разлагаться
на атомы металлов и неметаллов, причем эти продукты не обладают
теми характерными свойствами, кото-
рыми они, казалось бы, должны были
обладать. Например если молекулы по-
варенной соли (хлористого натрия) раз-
лагаются на атомы натрия и хлора, как
это утверждает Аррениус, то почему же
натрий не реагирует бурно с водой
с выделением водорода и с образова-
нием едкого натра (стр. 129), почему
раствор не обладает токсичными свой-
ствами и неприятным запахом хлора.
В ответ необходимо сказать, что ион
натрия совершенно иное вещество по
сравнению с нейтральным атомом ме-
таллического натрия и что хлорид-ион
обладает рядом свойств, совершенно от-
личных от свойств нейтрального ато-
ма хлора в молекуле свободного хло-
ра. Это совершенно ясно видно из приводимого наглядного изобра-
жения атомов (рис. 104), хотя не следует забывать, что в то
время, когда теория электролитической диссоциации была впервые
предложена, еще не существовало и понятия об атомной структуре.
Переход электрона от атома натрия к атому хлора, имевший место при
первоначальном соединении этих атомов с образованием молекул
хлористого натрия, в результате привел к образованию заряжен-
ных атомов или ионов этих двух элементов. Свойства же этих заря-
женных атомов весьма отличны от свойств первоначальных ней-
тральных атомов.
Каждый ион, с которым мы познакомились, характеризуется осо-
быми, присущими ему свойствами. Свойства водного раствора какого-
нибудь электролита зависят от свойств тех ионов, на которые он дис-
социирует, и тех недиссоциированных молекул, которые находятся
в равновесии с этими ионами. Но так как большинство электролитов
в сильной степени диссоциировано, то свойства этого относительно
небольшого количества недиссоциированных молекул не играют
такой роли, какую играют свойства ионов. Коль скоро нам это извест-
Нейтринный. яинжителым згре-
атаи fiainpu» веяный ион нвтца
Рис. 104.
ЭЛЕКТРОЛИТЫ
287
но, тем самым облегчается и изучение водных растворов электроли- I
тов, так как мы можем ограничиться изучением только свойств ионов
и не касаться свойств молекул, образующих э*ги ионы. Нитрат-
ион например обладает одними и теми же свойствами независимо от
того, образовался ли он в результате растворения нитрата натрия,
кальция или любого иного нитрата в воде. Совершенно так же ион '
натрия будет обладать одинаковыми свойствами в водных растворах
хлорида натрия, иодида натрия, сульфата натрия или любой другой
натриевой соли.
9. Кислоты. Теперь мы приступим к рассмотрению тех трех ти-
пов веществ, которые являются электролитами в водном растворе —
кислот, оснований и солей. Кислоту обычно определяют как электро-
лит, который при диссоциации образует в водном растворе ионы во-
дорода. Таким образом свойства, которыми обладают водные раство-
ры всех кислот оказываются, собственно говоря, свойствами иона1
водорода Н+. Формулу кислот легко отличить от формул других
соединений, так как в них положительным радикалом всегда яв-
ляется водород, к которому присоединен какой-нибудь отрица-
тельный радикал, отличный от ОН. Формулы большинства кислот
можно составить, пользуясь таблицей ионов (§ 7 этой главы). Для
этого следует взять в каждом случае в качестве положительного
радикала водород и к нему один за другим добавлять отрицательные
радикалы. Полученные таким образом формулы кислот приведены
в табл. XXXIX.
Таблица XXXIX. Наиболее часто встречающиеся
кислоты
Формула Название (по ради- калам) Название кислоты
НС1 НВг HJ hno2 HNO3 HCld3 НСО2СН3 H2S H2SO8 H2SO4 Н2СО3 H2SiOa н8ро4 Хлорид водорода Бромид водорода Иодид водорода Нитрит водорода Нитрат водорода Хлорат водорода Ацетат водорода Сульфид водорода Сульфит водорода Сульфат водорода Карбонат водорода Силикат водорода Фосфат водорода Хлористоводородная Бромистоводородная Иодистоводородная Азотистая Азотная Хлорноватая Уксусная Сероводородная Сернистая Серная Угольная Кремневая Фосфорная
1 Вероятно этот ион в водном растворе гидратирован и его следовало бы
писать Н + .НаО или Н8О + , но для обычных целей гидратационной водой можно
пренебречь.
288
ЭЛЕКТРОЛИТЫ
Номенклатура, применяемая для названий кислот, такова: если
отрицательный ион кислоты не содержит кислорода, то название
кислоты оканчивается на водородная. Например НС1, HBr, H2S —
будут называться соответственно: хлористоводородная (соляная), бро-
мистоводородная, сероводородная кислота. Название отрицательного
иона предопределяет название кислоты в том случае, когда послед-
няя содержит кислород. Если название иона оканчивается на ат,
то название кислоты оканчивается на ноя. Например H2SO4, назва-
ние отрицательного иона которой (SO4= — сульфат) оканчивается на
ат, будет называться серная (сульфатная) кислота. Если же название
иона оканчивается на нт, то окончание в названии кислоты будет
истая: H2SO3 — сернистая (сульфитная) кислота.
10. Ионизация кислот. Кислоты иногда классифицируют по
числу могущих ионизировать атомов водорода, содержащихся в их
молекуле, причем в этом случае они называются одноосновными,
двухосновными, трехосновными и т. д. Такие кислоты, как азотная
или хлористоводородная, будут одноосновными и могут диссоцииро-
вать только одним путем:
НС1 77 Н+4- CI-;
HN03HH+ 4-NO3~.
Уксусная кислота, в молекуле которой имеется 4 атома водорода
все же одноосновна, так как только 1 из этих атомов может пре-
вратиться в ион:
нсо2сн8 тх н+ +соасн8-.
Серная и угольная кислота — двухосновны и диссоциируют в две
стадии:
H2SO4 7ZL Н++ HSO4~ ;
HSO4- Z±H++SO4=;
Н2СО3 71 н* + нсо3- ;
НСО3" 77Н++С03=.
Трехосновная кислота, например фосфорная, диссоциирует в три
стадии:
Н8РО4 71 Н*+ Н2РО4";
НаРО4- 77 Н* + НРО4=;
НРО4= Т1Н + + РО4=.
Так как свойствами общими для всех кислот являются свойства
водородного иона, то сила кислоты зависит от степени диссоциации
ее молекул. Самые сильные кислоты, соляная и азотная, вероятно
целиком диссоциированы, но силы межионного притяжения та-
ковы, что кажущаяся степень ионизации равна примерно 92% в
0,1 М растворе. Многоосновные кислоты, как правило, слабее одно-
основных. Первая стадия их диссоциации, так называемая первич-
ная диссоциация, протекает более полно, чем последующие стадии.
ЭЛЕКТРОЛИТЫ
289
В случае серной кислоты первичная диссоциация на Н+ и HSO4~ фак-
тически происходит нацело, тогда как вторичная диссоциация HSO4~
на Н+ и S04= протекает в значительно менылей степени. Первичная
диссоциация угольной кислоты протекает только на 0,17%, тогда
как вторичная диссоциация чрезвычайно мала. Таким образом ра-
створы угольной кислоты содержат ионы водорода в очень слабой
концентрации, поэтому они слабо кислые.
11. Основания. Основанием называется электролит, который
при растворении в воде диссоциирует с образованием гидроксильных
ионов ОН-. Молекулы оснований состоят из какого-нибудь положи-
тельного радикала, за исключением водорода, и гидроксила
(табл. XL).
Таблица XL. Наиболее распространенные основания
Формула Название Кажущаяся диссоциа- ция 0,1 N раствора (в %)
NaOH Едкий натр 91
КОН Едкое кали 91
ЫН4ОН Гидрат окиси аммония 1,3
Ва(ОН)2 Гидрат окиси бария 77
Са(ОН), Гидрат окиси кальция • 90 в 0,015 N растворе
• Все основания — гидроокиси металлов, но так как большинство их, за
исключением приведенных выше, практически нерастворимы в воде,
то применять их в качестве оснований затруднительно. Основания
могут быть одногидроксильными, двугидроксильными и трехги-
дроксильными, в зависимости от числа групп ОН-, образующихся при
диссоциации их молекулы. Так же как и в случае многоосновных
кислот, многогидроксильные основания диссоциируют в несколько
стадий.
Так как свойствами общими для всех оснований являются свой-
ства иона ОН", то степень диссоциации основания определяет силу
основных (щелочных) свойств его раствора. Едкий натр и едкое кали —
самые сильные из наиболее употребительных оснований и вероятно
। диссоциированы нацело, хотя их кажущаяся диссоциация равна
примерно 90%. Гидрат окиси аммония — слабое основание.
12. Соли. Солью называется такой электролит, который при
растворении в воде диссоциирует и образует положительный ион,
отличный от водорода, и отрицательный ион, отличный от гидро-
ксила. Формулы некоторых типичных солей приведены в табл. XLI.
Так как не имеется такого иона, который был бы общим для
водных растворов всех солей, то последние не обладают общими
свойствами. Как правило, соли сильно диссоциированы. Чем меньше
валентность тех ионов, на которые данная соль диссоциирует, тем
больше степень ее диссоциации.
19 Введение в химию.
290
РЕАКЦИИ ЭЛЕКТРОЛИТОВ
Таблица XLI. Некоторые типичные соли
Формула Название Кажущаяся дис- социация в O,1N растворе (в %)
NaCl Хлорид натрия 84
КС1 Хлорид калия 86
NH4C1 Хлорид аммония 85
Na NO, Нитрат натрия 83
KNO3 Нитрат калия 83
ксю8 Хлорат калия 83
NaCO2CH8 Ацетат натрия 79
BaCI, Хлорид бария 76
Ag,SO, Сульфат серебра 70
CuSO, Сульфат меди (II) 40
ZnSO, Сульфат цинка 40
. Хлорид ртути (II) 1
ГЛАВА XXVII
РЕАКЦИИ ЭЛЕКТРОЛИТОВ
1. Диссоциация воды. До сих пор мы рассматривали диссоциацию
только растворенного в воде* вещества и ничего не говорили о воз-
можной диссоциации самого растворителя — воды. Если вода диссо-
циирует, то абсолютно чистая вода должна была бы проводить элект-
рический ток. Это так и есть, хотя электропроводность ее чрезвы-
чайно мала. На основании электропроводности чистой воды мы мо-
жем вычислить степень диссоциации молекул воды на водородные
и гидроксильные ионы:
НОН -> Н++ОН".
Эта диссоциация равна примерно 0,00001% при 18°. На основании
этой величины можно вычислить константу диссоциации для воды:
Сн -I- X Сон - _ „
Снон
Одна граммолекула воды (18 г) будет состоять из 0,0000001
(1 х 10-7) молей (граммионов) водородных ионов,такого же количества
гидроксильных ионов и из 0,9999999 молей недиссоциированных
молекул воды. Последняя величина настолько близка к единице,
что мы можем принять ее равной единице. В таком случае
Сн+ х ^он- ~ К
или
(1 X 10“ 7) X (1 X 10“ 7) = 10“14 == к.
РЕАКЦИИ ЭЛЕКТРОЛИТОВ
291
Эта величина произведения концентрации водородных и гидро-
ксильных ионов должна оставаться постоянной независимо от того,
рассматриваем ли мы ионы Н+ и ОН- чистой воды или водного раство-
ра. Следовательно для раствора сильной кислоты, в котором кон-
центрация водородных ионов равна 1 молю Н+ (граммиону) на
литр, можно следующим образом вычислить концентрацию ги-
дроксильных ионов:
1 ХСОН_ = 1 х Ю“14,
откуда
Сон_ = 1 х Ю-14 молей на литр.
В растворе сильного основания, в котором концентрация гидроксиль-
ных ионов равна 1 молю (граммиону) на литр, концентрация водо-
родных ионов будет равняться 10-14 молей (граммионов) на литр.
Растворы, в которых концентрации водородных и гидроксиль-
ных ионов равны друг другу, т. е. каждая концентрация равна 10-7 мо-
лей на литр, называются нейтральными растворами. Приведенная
ниже таблица весьма удобно выражает зависимость между концентра-
циями водородных и гидроксильных ионов в водных растворах.
Таблица XLII. Зависимость между Н+ и ОН
Концентрация Н+ (моли на литр) Концентрация ОН (моли на литр) ^н+х^он“ pH Характер реакции
1 = 10° 10-14 10-14 0
10-1 Ю-13 10—1* 1
10-’ 10-12 10-14 2
10-8 10-и 10-1* 3 Кислая
10—* 10-1° 10 1* 4
10-® 10—• 10-1* 5
10-® 10-® 10-1* 6
10-’ 10-7 10-1* 7 Нейтральная
10-® 10-® 10-1* 8
10-’ . 10-2 * * 5 * 10-1* 9
10-10 10-* 10-1* 10
10-и 10“8 10-1* 11 Щелочная
10-12 10-’ 10-1* 12
10“13 10-1 10-1* 13
10-14 1=10° 10-1* 14
2. Концентрация водородных ионов. Вероятно четвертый
столбец, с заголовком pH, поставил читателя втупик. Здесь мы
имеем дело с методом выражения концентрации водородных ионов,
который за последнее время нашел широкое применение вследствие
19*
292
РЕАКЦИИ ЭЛЕКТРОЛИТОВ
его простоты и удобства. Кислотность раствора, выраженная в pH,
равна логарифму величины, обратной концентрации водорода:
о . 1
pH = log -— .
lh+
Таким образом в случае раствора, концентрация водородных ионов
которого равна 10-7, pH будет равно 7, так как
pH = logIy=-, = log!0+’=7.
Это и будет величина pH для нейтрального раствора. При рассмотре-
нии предыдущей таблицы становится совершенно ясным, что раствор,
для которого pH больше 7, будет щелочным, а раствор, для которого
pH меньше 7, — кислым. Так как мы имеем дело с логарифмической
шкалой, то очевидно, что раствор с рН=6 обладает концентрацией
водородных ионов в 10 раз большей, чем раствор с рН=7. Кроме
того, если нам известна концентрация водородных ионов, мы легко
можем вычислить концентрацию гидроксильных ионов, так что pH
раствора дает нам все данные, касающиеся как концентрации водо-
родных ионов, так и концентрации гидроксильных ионов. Напри-
мер в растворе с рН=5 концентрация водородных ионов равна 10"s,
а концентрация гидроксильных ионов 10-9, так как произведение
Сн+ X Сон- всегда равно 10-14.
Кислотность раствора часто является весьма важным фактором
не только в химическом исследовании, но и во многих промышлен-
ных операциях. В настоящее время не только химики, но и бактерио-
логи, биологи, физиологи и патологи говорят о pH тех растворов,
в которых они заинтересованы. Даже земледельцы, бумагопромыш-
ленники, сахарники, медицинские работники свободно говорят о pH,
так как они знают, что этот фактор играет важную роль в определении
качеств их продукции, роста растений и бактерий, в диагнозе болез-
ней и т. д.
3. Определение pH. Индикаторы. pH раствора можно опре-
делить двумя способами: электрометрическим титрованием и при-
менением индикаторов. Первый метод более сложен, но в то же время
и более точен. Теоретические рассуждения, на которых он основан,
лежат вне сферы этой книги. Второй же метод весьма прост в приме-
нении и легко понятен. Существуют такие окрашенные органиче-
ские вещества, окраска которых не только меняет свой оттенок при
изменении pH раствора, но при некоторой определенной величине pH
совершенно изменяется. Такие вещества называются индикаторами.
Простейший из этих индикаторов лакмус, синий в растворах, более
щелочных, чем при рН=7, и красный — в более кислых, чем при
рН=7. Лакмусовые бумажки, часто применяемые для грубого
определения кислотности раствора, обычно приготовляют следую-
щим образом. Полоски фильтровальной бумаги окунают в концентри-
рованный раствор лакмуса и затем эти полоски высушивают. Лакму-
совая бумажка приобретает слабую розовую окраску в слабом кис-
РЕАКЦИИ ЭЛЕКТРОЛИТОВ
293
лом растворе и более яркую красную окраску в более кислом растворе.
Аналогично голубой цвет указывает на слабый щелочной раствор,
а темносиний на сильный щелочной раствор. Однако лакмусовая
бумажка в лучшем случае может служить лишь грубым количествен-
ным способом определения pH раствора. Существуют другие инди-
каторы, более чувствительные к незначительным изменениям pH,
хотя и не известен такой индикатор, который был бы одинаково
чувствителен в широких пределах величин pH. Поэтому в пределах
от, скажем, рН=0,2 до рН=9,8 следует пользоваться серией инди-
каторов, указанных в табл. XL III.
Таблица XLIH. Таблица индикаторов
Название Изменение окраски по мере увеличения pH Предел чувстви- тельности (в pH)
Кислая крезоловая красная Метакрезоловая пурпурная . Бромфеноловая голубая • . Бромкрезоловая зеленая . . . Хлорфеноловая красная • . . Бромтимоловая голубая . . . Феноловая красная Крезоловая красная • • • . . Тимоловая голубая Крезолфталеин ....... | от красного до желтого | от желтого до синего { от желтого до красного . от желтого до синего j> от желтого до красного | от желтого до синего от бесцветн. до красного 0.2-1,8 1,2-2,8 3,0-4,6 4,0—5,6 4,8-6,4 6,0-7,6 6,8-8,4 7,2-8,8 8,0-9,6 8,2-9,8
Из каждого индикатора приготовляются образцы стандартной ок-
раски при концентрациях водородных ионов, соответствующих
каждой 0,1 pH в пределах чувствительности данного индикатора.
К пробе раствора, pH которого хотят определить, добавляют такое
количество индикатора, чтобы концентрация его была бы такой же,
как и в стандартных образцах. Затем окраску раствора сравнивают
с окраской одного из стандартных образцов. В этом случае pH этого
образца как раз и будет соответствовать pH раствора.
4. Нейтрализация. Если смешать раствор кислоты и раствор
основания, то протекает весьма важная реакция. В качестве иллю-
страции расмотрим характерный пример — реакцию, протекающую
между таким основанием, как едкий натр, и хлористоводородной
кислотой.
В каждом из растворов этих веществ до смешения молекулы на-
цело диссоциированы, так как NaOH и НС1 являются сильными
электролитами:
NaOH —Na+ +ОН";
HCI — Cl‘+H + .
294
РЕАКЦИИ ЭЛЕКТРОЛИТОВ
После смешения обоих растворов ионы натрия встретят ионы хлора,
а ионы водорода — гидроксильные ионы. При встрече ионов хлора
и натрия не произойдет образования молекулы хлористого натрия,
так как это вещество сильный электролит и поэтому нацело диссо-
циировано. При встрече же водородных и гидроксильных ионов об-
разуются недиссоциированные молекулы воды:
NaOH — Na+
+
НС1 — Cl-
t
NaCl
+ OH-
+
+ H+
b
HOH
Мы уже знаем, что равновесие между молекулами воды и образую-
щимися ионами таково, что диссоциирована только 0,00001% всех
молекул. Следовательно, соединение ионов Н+ и ОН" протекает
практически нацело, и к концу реакции мы имеем следующее поло-
жение:
Na+
+
С1-
+ ОН-
+
+ Н+
I
нон
Хотя при реакции нейтрализации и не образовалось молекул хло-
ристого натрия, однако раствор, полученный в результате полной
нейтрализации, идентичен с раствором, полученным растворением
твердого хлористого натрия в воде.
Главная реакция, имеющая место при смешении растворов
сильной кислоты и сильного основания, будет реакцией соединения
водородных ионов кислоты с гидроксильными ионами основания,
приводящей к образованию недиссоциированных молекул воды:
Н+ +ОН"-^Н2О.
Лучшим доказательством в пользу такого предположения будет
то, что тепло, выделяющееся при нейтрализации 1 моля сильной од-
ноосновной кислоты 1 молем сильной одногидроксильной щелочи, во
всех случаях окажется одинаковым и равным 13 700 кал. Так, мы
имеем:
NaOH + НС1 — NaCl
КОН +НС1 -+КС1
NaOH + HJ Na J
NaOH + HNO3 NaNO3
4- H2O 4-13 700 кал;
|- H2O + 13 700 кал;
+ H2O + 13 700 кал;
4-H2O-J- 13 700 кал.
Образование всегда одного и того же количества теплоты нейтра-
лизации может быть объяснено только в том случае, если молекулы
как реагирующих кислоты и основания, так и образующейся при
РЕАКЦИИ ЭЛЕКТРОЛИТОВ
295
этом соли нацело диссоциированы. В этом случае единственной
реакцией, которая имеет место в каждом случае, будет образование
1 моля воды из ее ионов:
Н+ + ОН" — Н2О + 13700 кал.
В том же случае, когда в реакции нейтрализации принимают участие
слабые кислоты или слабые основания, последние до нейтрализации
находятся главным образом в виде недиссоциированных молекул.
Следовательно в этом случае в теплоту нейтрализации будет входить
не только теплота образования воды из ее ионов, но и теплота диссо-
циации молекул слабого электролита на ионы; поэтому
она уже не будет равна 13 700 кал.
5. Ацидиметрия и алкалиметрия. Если нам нужно оп-
ределить точное количество кислоты или основания, нахо-
дящихся в растворе, то это легко осуществить с помощью
реакции нейтрализации. Для этого в стакан берут опре-
деленное количество раствора неизвестной концентрации
и добавляют несколько капель подходящего индикатора.
Затем в том случае, если раствор содержит основание,
К нему по каплям прибавляют из градуированной труб-
ки, называемой бюреткой (рис. 105), раствор кислоты
определенной концентрации до тех пор, пока не начнет
изменяться окраска индикатора, указывающая на то, что
раствор стал нейтральным. Этот процесс называется mum-
рованием. Затем по шкале бюретки отмечают объем ра- Рис. 105.
створа кислоты, пошедшей на нейтрализацию щелочи, и Бюретка,
на основании этого объема и известной концентрации ра-
створа кислоты вычисляют концентрацию раствора щелочи. Если
же неизвестный нам раствор — раствор кислоты, то к нему при-
ливают раствор основания определенной концентрации. Теперь
(прежде чем показать, как производятся титрование и необходимые
вычисления) мы остановимся на том, как приготовляются стандар-
тные растворы.
6. Стандартные (титрованные) растворы. Один моль одногидро-
ксильного основания может нейтр ализовать 1 моль одноосновной кис-
лоты. Аналогично, 1 моль двухгидроксильного основания может ней-
трализовать 1 моль двухосновной кислоты. Но для нейтрализации 1мо
ля двухосновной кислоты требуется 2 моля одногидроксильного
основания и т. д., как это видно из следующих уравнений:
НС1 -J-NaOH —>-NaCl + Н2О;
H2SO4 + Са (ОН)2 -* CaSO4 + 2Н2О;
2НС1 +Са(ОН)2-> СаС12 +2Н2О;
H2SO4 + 2NaOH — Na2SO4 + 2Н2О.
По этой причине, если какого-нибудь объема молярного раствора
одноосновной кислоты как раз достаточно для нейтрализации та-
296
РЕАКЦИИ ЭЛЕКТРОЛИТОВ
кого же объема одногидроксильной щелочи, то требуется 2 объема мо-
лярного раствора одноосновной кислоты для нейтрализации I объема
молярного раствора двухгидроксильной щелочи. Поэтому гораздо
удобнее выражать концентрации стандартных (титрованных) раство-
ров кислот и щелочей в терминах не молярности, а нормальности.
Нормальный раствор кислоты или основания содержит в I л ра-
створа такое весовое количество растворенного вещества, которое
равно его граммолекулярному весу, деленному на число образую-
щихся при диссоциации водородных атомов — в случае кислоты —
или гидроксильных групп — в случае основания. Нормальные
растворы всех одноосновных кислот и одногидроксильных щелочей
содержат 1 моль растворенного вещества в литре раствора; нормаль-
ные растворы двухосновных кислот и двухгидроксильных щелочей
содержат х/2 моля в литре, а трехосновных кислот и трехгидроксиль-
ных щелочей 1/3 моля в литре. Отсюда следует, что равные объемы
растворов какой-нибудь кислоты и какого-нибудь основания одной и
той же нормальности вполне нейтрализуют друг друга.
Рассмотрим теперь в качестве примера какой-либо случай титро-
вания. Для нейтрализации 25 см3 раствора серной кислоты неиз-
вестной концентрации пошло 30 см3 однонормального (1N) раствора
едкого натра. Какое весовое количество серной кислоты содержится
в этих 25 см3 раствора? Объемы этих растворов будут обратно про-
порциональны их нормальностям, так как чем больше объем раство-
ра, затраченного на нейтрализацию, тем меньше его нормальность.
Отсюда следует, что
30 = xN.
25 ~ 1№
e/8 N — нормальность данного раствора серной кислоты.
В однонормальном растворе серной кислоты содержится % моля
(98/2 г) в литре. ®/5 N раствор будет содержать ®/6Х 98/2 = 58,8 г в
литре, а в 25 см3
— X 58,8 =1,47 г.
Титрование раствора кислоты или основания дает нам общее ко-
личество кислоты или основания, т. е. сумму недиссоциированных
молекул и ионов, находящихся в растворе, но не дает нам никаких
данных относительно фактической концентрации водородных ионов.
Эта последняя может быть проделана с помощью одного из тех двух
методов, которые были указаны в § 2 этой главы.
7. Кислые и основные соли. Мы уже говорили о том, что много-
основные кислоты и многоатомные щелочи диссоциируют не сразу,
а в йесколько стадий, и что первичная диссоциация (первая стадия)
протекает наиболее полно. Прибавление 1 моля едкого натра одно-
гидроксильной щелочи к 1 молю серной кислоты (двухосновной) ведет
к нейтрализации гидроксильными ионами основания только водород-
РЕАКЦИИ ЭЛЕКТРОЛИТОВ
297
ных ионов, полученных от первичной диссоциации:
H2SO4->H+ +HSO/
+ +
NaOH OH'+Na--
и t
НОН NaHSO4
Если, полученный раствор выпарить досуха, то получим в твердом
виде кислую соль вследствие завершения следующей реакции:
HSO4" + Na+ — NaHSO4.
Такое соединение называется кислой солью, потому что оно частично
является солью, сульфатом натрия, а частично кислотой. При ра-
створении в воде это соединение диссоциирует в две стадии:
NaHSO4 Na+ + HSO4“ (диссоциация соли)
HSO4" Н+ + SO4= (диссоциация кислоты)
Такую кислоту можно превратить в среднюю соль с помощью
еще 1 моля едкого натра:
NaHS04Z2H+ + Na+4-SO4=
NaOH — ОН" + Na
НОН Na2SO4
Нам еще придется познакомиться в последующих главах с несколь-
кими весьма важными кислыми солями, в частности с кислым фосфа-
том кальция — суперфосфатом, ценным удобрением, и с хорошо
известным бикарбонатом натрия NaHCO3.
Основные соли могут быть получены аналогично при обработке
моногидроксильной щелочи равным количеством молей кислоты
низшей основности.
8. Гидролиз. При растворении некоторых средних солей в воде
происходит изменение в концентрации водородных ионов, т. е.
полученный раствор не будет нейтральным, а будет щелочным или
кислым. Сперва такое явление покажется нам удивительным, так как
средняя соль не может образовать при ионизации ни водородных,
ни гидроксильных ионов. Однако нам все станет вполне ясным, если
мы рассмотрим следующие типичные примеры. При растворении
ацетата натрия в воде оказывается, что получившийся раствор обла-
дает слегка щелочной реакцией, т. е. в нем содержится избыток гид-
роксильных ионов по сравнению с водородными. При растворении
298
РЕАКЦИИ ЭЛЕКТРОЛИТОВ
этой соли в воде устанавливается следующее равновесие:
NaCO2CH3—- Na+ + СО3СН-
+ +
НОН ^ГОН- +н +
i
NaOH НСО2СН,
Соединение ионов натрия и гидроксильных ионов совершенно не
имеет места, так как едкий натр, как сильное основание, нацело дис-
социирован. Уксусная же кислота является слабой кислотой, т. е.
она только слегка диссоциирована. По этой причине водородные
ионы исчезают из раствора, так как они соединяются с ацетат-иона-
ми, образуя молекулы уксусной кислоты. Это понижение концентра-
ции водородных ионов должно повести к соответственному увели-
чению концентрации гидроксильных ионов, так как произведение
концентраций этих ионов в водном растворе должно всегда рав-
няться Ю"14. Вследствие этого раствор становится щелочным. Та-
ким же образом ведут себя все соли слабых кислот.
С другой стороны, водные растворы солей слабых оснований
обладают кислой реакцией. В водном растворе хлорного желез;',
(соли такого именно типа) мы имеем следующее равновесие:
FeCI3 -* Fe+ + + 4-ЗСГ
+ +
ЗНОН ЗОН- + зн*
jt I
Fe (ОН)3 + ЗНС1
Так как гидрат окиси железа слабое основание, то гидроксильные
ионы соединяются с ионами железа, образуя большое количество
недиссоциированных молекул. В результате этого концентрация водо-
родных ионов повышается, и раствор становится кислым.
Соли сильного основания и сильной кислоты образуют при
растворениичв воде нейтральные растворы, так как ни водородные,
ни гидроксильные ионы воды не связываются в недиссоциирующие
молекулы. Например в случае хлористого натрия мы имеем:
NaClNa+ + С1"
+ +
НОН "=г ОН“4-Н*
t t
NaOH НС1
Ввиду того что молекулы сильных оснований и сильных кислот на-
цело диссоциированы, такие молекулы и не будут образовываться.
Только что рассмотренные нами реакции, в которых понижается
концентрация или водородных, или гидроксильных ионов воды при,
растворении в ней соли, называются реакциями гидролиза..
РЕАКЦИИ ЭЛЕКТРОЛИТОВ
29£
9. Реакции осаждения. Мы знаем, что при реакции нейтрализа-
ции происходит соединение водородных и гидроксильных ионов с об-
разованием недиссоциированных молекул воды. Другой реакцией,
протекающей между ионами, является соединение ионов с образо-
ванием вещества, растворимость которого в воде настолько мала, что
практически его можно считать нерастворимым. Например при сме-
шении раствора, содержащего ион бария, и раствора, содержащего
сульфат-ион, всегда из раствора выделяется осадок нерастворимого
сульфата бария:
Ва++ + SO4= -* BaSO4
Смешение растворов хлористого бария и сернокислого натрия ведет
к образованию этого осадка:
ВаС12"^ Ва++4-2СГ
Na2SO4 SO4= + 2Na*
| t
BaSO4 2NaCl
Ион бария и сульфат-ион удаляются из раствора, так как немедленно
после того как они соединятся друг с другом с образованием молекул
сульфата бария и последние из раствора выкристаллизовываются.
Та же самая реакция имеет место и при смешении любой бариевой
соли с любым сульфатом.
Как правило, при смешении растворов таких ионов, которые
соединяются друг с другом с образованием молекул вещества, не-
растворимого в воде, вещество это выпадает в осадок. Ниже пе-
речислены соли, растворимые в воде, а также соли, практически
в воде не растворимые.
1. Все нитраты и хлораты растворимы. I
2. Все калиевые, натриевые и аммонийные соли растворимы. i
3. Все хлориды растворимы, за исключением хлоридов серебра,
свинца и закисной ртути.
4. Все сульфаты растворимы, за исключением сульфата бария.
5. Все карбонаты и фосфаты нерастворимы, за исключением
карбонатов, фосфатов натрия, калия и аммония.
б. Все сульфиды нерастворимы, за исключением сульфидов нат-
рия, калия, аммония, кальция и бария.
Для того чтобы получить одну из этих нерастворимых солей,
достаточно смешать два электролита, из которых один содержит
положительный, а другой отрицательный ион нерастворимой соли.
10. Аналитическая химия. Реакции осаждения лежат в основе
огромного количества реакций, применяемых химиком-аналитиком
не только для того, чтобы определить, какие ионы присутствуют
в растворе (качественный анализ), но и для того, чтобы узнать, какое
количество определенного иона в нем содержится (количественный
анализ). Характерные осадки, образуемые положительным ионом
300
кислоты
в растворе при прибавлении к нему растворов, содержащих отрица-
тельные ионы (и наоборот), служат основой для качественных реак-
ций на присутствие какого-нибудь иона. Если некоторые из этих осад-
ков обладают характерной окраской, то идентификация иона тем
самым облегчается. Например ион серебра Ag+ при прибавлении
раствора, содержащего хлорид-ион С1“ образует белый осадок хло-
ристого серебра AgCl, растворимый в водном аммиаке. Этот ион
образует красный осадок хромата серебра Ag2CrO4 с любым хрома-
том, черный осадок сульфида серебра Ag2S с любым сульфидом и т. д.
Можно разработать такую методику качественного анализа, с по-
мощью которой можно будет определить присутствие любого 'иона
в растворе, содержащем и другие ионы.
В количественном анализе можно определить количество какого-
нибудь иона, находящегося в растворе, осадив его в виде одного из
его нерастворимых соединений. Осадок тщательно отфильтровы-
вают от раствора, промывают, сушат и взвешивают. По весу осадка
можно вычислить весовое количество данного иона.
ГЛАВА XXVIII
ОСНОВНАЯ ХИМИЧЕСКАЯ ПРОМЫШЛЕННОСТЬ.
КИСЛОТЫ
В ряде книг для широкой публики так много было написано
о наиболее эффектных отраслях химической промышленности,
например анилокрасочной, парфюмерной, фармацевтической и взрыв-
чатых веществ, что публика совершенно потеряла из виду менее
эффектную отрасль химической промышленности, но значительно
более фундаментальную и важную с экономической точки зрения —
отрасль, производящую химикалии, занимающие на рынке первое
место. Мы имеем в виду основную химическую промышленность.
Дамские духи, искусственный шелк, окрашенный в цвета, рядом с ко-
торыми античный пурпур римских консулов кажется тусклым и
выцветшим, — все эти и многие другие достижения химиков кажутся
более.привлекательными для широкого читателя, чем соль,серная кис-
лота, сода и известь. Однако без продукции основной химической про-
мышленности производство всех перечисленных изумительных про-
дуктов было бы невозможно.
Сырьем для основной химической промышленности служат весьма
немногочисленные материалы, которые широко распространены
в природе, именно соль, сера, известняк, каменный уголь, фосфориты,
селитра и калийные соли, а также азот и кислород воздуха. Из этого
сырья получаются наиболее важные кислоты — серная, азотная и
соляная, и щелочи — известь, сода, едкий натр и едкое кали. Так как
в любой отрасли химической промышленности применяется по край-
ней мере один, а в большинстве случаев несколько из упомянутых
кислоты
301
выше продуктов, то нам будет интересно рассмотреть методы их
получения и их экономическое значение.
1. Значение серной кислоты. Вся важность производства сер-
ной кислоты видна уже хотя бы из того, что в США ее годовая про-
дукция равна 7 000000 m, а стоимость этой продукции 75 000 000 долл.
Серная кислота обеспечивает фермеру повышение урожайности, она
дает горному и гражданскому инженерам те взрывчатые вещества,
без которых нельзя было бы добывать металлы, строить мосты,
дороги и туннели. Без серной кислоты невозможна была бы вся
наша современная цивилизация с ее автомобилями, железными до-
рогами и аэропланами, телефоном и радио. Без взрывчатых веществ в
значительной степени была бы затруднена добыча угля, без серной
кислоты пришлось бы разрабатывать новые методы очистки бензина и
смазочных масел. Кроме того без серной кислоты нам пришлось бы
лишиться целого ряда веществ, которые мы считаем более или менее
необходимыми. Среди этих веществ следует упомянуть целлулоид, ис-
кусственные шелк и кожу, лаки и многие из наших красок и лекарств.
Принимая во внимание, что серная кислота участвует во мно-
жестве различных процессов и в больших количествах и что
лишь небольшие запасы ее хранятся на складах, считается, что
рынок серной кислоты является лучшим барометром экономическо-
го благосостояния страны, чем рынок железа и стали.
2. Сырье для производства серной кислоты. Из трех элементов,
из которых состоит молекула серной кислоты, два имеются прак-
тически везде, так как водород получается из воды, а кислород из
воздуха. Третий же элемент, сера, не столь общедоступен, как первые
два, и стоимость ее и определяет стоимость серной кислоты. Сера
встречается в различных местностях или в виде свободной серы, или
в виде различных сернистых минералов. Первым сырьем для получе-
ния серной кислоты служила сера вулканического происхождения,
встречающаяся на острове Сицилия. До 1900 г. вся сера, потребляв-
шаяся во всем мире, получалась из Сицилии. Она встречается там
в пористой породе, содержащей более 40% свободной серы. До самого
последнего времени для выплавки серы из этой породы применялись
крайне примитивные методы. Руда нагромождалась в кучи, и часть
серы сжигалась для того, чтобы расплавить остальную часть. Совер-
шенно ясно, что при таком методе выход серы был очень низким.
Жидкой сере давали затвердеть в деревянных формах; в продажу
она поступала под названием черенковой, штыковой
серы. Сера высокой степени чистоты получается дестилляцией из
глиняных реторт. Сперва пары серы конденсируются в холодной
конденсационной камере в виде мелкого кристаллического порошка.
Этот порошок поступает в продажу под названием серного
цвета. После того как камера нагреется, пары конденси-
руются в жидкость, которую отливают в формы.
Мировая монополия, которой Сицилия пользовалась на серном
рынке, имела настолько большое значение в начале XIX ст., что когда
неаполитанский король передал эту монополию одной французской
302
кислоты
фирме в Марселе, нависла угроза войны из-за серы между Францией
и Англией, и эта монополия была отнята у Франции.
В 1865 г. в Америке, в штате Луизиана, при разведочном бурении
на нефть геологи нашли залежи серы примерно на глубине 500 футов
(150 м) под слоем плывунов. Экономическое значение этого открытия
было тотчас же признано, причем сейчас же был сделан ряд попыток
добывать эту серу; все они однако оказались безуспешными. Была
сделана попытка соорудить шахты до залежей серы, чтобы сделать
возможной их разработку. Однако когда была достигнута глубина
несколько большая 100 футов (30 м), через пролом в креплении
шахты стало поступать такое количество ядовитого сероводорода,
что проект этот пришлось оставить. В 1852 г. в Гайлдорфе (Вюр-
темберг) родился Герман Фраш, который впоследствии разработал
метод поднятия этой серы на поверхность. В возрасте 16 лет он
эмигрировал в Америку, где стал работать фармацевтом. Он вскоре
заинтересовался проблемой очистки нефти и за период в 15 лет его
изобретения принесли как ему, так и его сотрудникам целое состоя-
ние. Около 1890 г. ему пришла мысль пробурить скважину до слоя,
содержащего серу, расплавить под землей серу посредством перег-
ретой воды и выкачать жидкую серу на поверхность. Так как тем-
пература плавления серы (115°) лежит выше температуры кипения
воды при атмосферном давлении (100°), то последнюю пришлось
нагревать под давлением, для того чтобы достигнуть температуры,
достаточной для расплавления серы. Фраш пробурил скважину,
опустил в нее трубу диаметром в 10 дюймов (25,4 см) вплоть до
залежей серы и затем продолжал бурение через слой серы с буром
в 9 дюймов (22,86 см). Внутри этой обсадной трубы было еще две
трубы с диаметрами равными 6 и 3 дюймам (15,2 и 7,62 см). Перег-
ретая вода при 168° подавалась вниз с помощью насоса по кольце-
вому пространству между обеими трубами, а расплавленная сера
должна была откачиваться через трехдюймовую трубу (7,62 см).
Как был произведен первый опыт, лучше всего рассказать словами
самого Фраша<
Когда все было готово для производства первого опыта, который мог
иметь или крупный успех, или крупную неудачу, мы подняли давление пара
в котлах и без всяких приключений погнали перегретую воду в грунт.
Если бы хотя на мгновение необходимая высокая температура упала ниже
точки плавления серы, это означало бы неудачу, а поэтому все внимание
было устремлено на эту первую попытку.
После того как перегретая вода поступала в землю в течение уже
24 часов, я решил, что должно было расплавиться достаточное количество
материала и что можно уже добыть серу. Насос, включенный в линию серы,
был пушен в ход, и увеличивающееся напряжение машины показывало,
что производится работа. Машина шла все медленнее и медленнее, пар
все поддавали, и вдруг рабочий у напорной трубы прокричал изо всей
силы: «Идет! Идет!» На полированном стержне появилась жидкость, и когда
я его вытер, то увидел, что палец мой покрыт серой. Через 5 минут прием-
ники, находящиеся под давлением, были открыты, и красивые потоки зо-
лотистой жидкости потекли в приготовленные нами бочки. Через 15 минут
мы увидели, что приготовленных 40 бочек уже недостаточно. Быстро мы сдела-
ли насыпи, обшили их досками и стали в эти резервуары принимать потоки
кислоты
303
серы; с этого дня мы уже никогда не принимали серу в специальные сосуды
или формы.
Когда солнце зашло, мы остановили насос, чтобы сохранить жидкую
серу внизу до тех пор, пока мы не приготовимся принять новые порции ее
утром. Надо было сперва убрать материал, уже имеющийся на поверхности,
и нашлось много охотников, которые очистили нам площадку для завтраш-
него дня. Когда все было закончено, вся сера собрана в одну кучу и рабо-
чие ушли, я, оставшись наедине, наслаждался успехом. Я влез на кучу
серы и уселся на самый верх ее. Мне было приятно слышать слабый треск,
вызываемый сжатием теплой серы, это походило как бы на приветствие сни-
зу, как бы в доказательство того, что я достиг цели... Мы расплавили мине-
рал под землей и доставили его на поверхность в жидком виде. Мы пока-
зали, что это может быть осуществлено.
Особенно приятно это было еще потому, что критика моего предло-
жения со стороны технических журналов и всех тех, кто слышал о моих пла-
нах, по отношению ко мне была очень неблагоприятна. Каждый из выра-
жавших свое мнение казался убежденным в том, что осуществить эти планы
невозможно; одно хорошо известное лицо предлагало даже съесть каждую
унцию серы, которую мне удалось бы выкачать. Хорошей иллюстрацией к то-
му общественному мнению, которое существовало по этому вопросу, может
служить замечание парнишки, отвозившего меня на станцию на утро после
нашего первого опыта. Он сказал: «Действительно вам удалось выкачать
серу, но в это никто не верил, кроме старика плотника, да и то про него
говорят, что он полоумный».
Позднее, когда выяснилось, что пары серы слишком быстро
разъедают непосредственно действующие насосы, процесс этот был
изменен (рис. 106). В жидкую серу вдувается воздух, который вме-
сте с серой образует пену, а пену эту легко поднять на поверхность.
По трубам сера поступает в гигантские резервуары (рис. 107), длина
которых 250 фт. (75 м), ширина 150 фт. (45 м) и высота 60 фт. (18 л<),
в которых она и застывает. Когда такой резервуар наполнится серой,
стенки его разбивают (рис. 108) и серу с помощью динамита взры-
вают, причем получаются куски годные уже к перевозке. Сера полу-
чается замечательной чистоты, обычно превышающей 99,5%.
Серные скважины бурят на расстоянии 50—100 фт. (15—30 м)
друг от друга и дают они в среднем около 400—500 т в сутки. Общая
добыча серы по этому процессу в штатах Луизиана и Техас равна
примерно 2 000 000 т в год и ограничена эта добыча только спросом
на серу.
Ко времени развития процесса Фраша серная промышленность
в Сицилии находилась под контролем английского капитала в лице
Англо-сицилийской серной компании. Успех этой компании был
настолько велик, что она платила 50%-ный дивиденд по своим обык-
новенным акциям и откладывала большие суммы ежегодно на вся-
кие непредвиденные случайности. Фраш вскоре нашел, что он в со-
стоянии продавать свою серу в Сицилии по более низкой цене, чем
она может быть там добыта. Он поехал в Англию для деловых перего-
воров, но был встречен там «с полным отсутствием энтузиазма по
отношению к этой американской чепухе». Ему было сказано, чтобы
он шел своей дорогой, а что они пойдут своей. Он так и сделал и в
результате Англо-сицилийская серная компания обанкротилась
и при этом потеряла 285 000 фн. стерлингов. Вскоре правительство
304
кислоты
образовало трест, в который вошли все силицийские серные руд-
ники и который успешно работает с 1906 г., правда, главным об-
разом потому, что Фраш согласился продавать свою серу на евро-
пейских рынках по такой цене, чтобы с ней могла конкурировать
сицилийская сера. Как изменялась добыча серы, получаемой из раз-
личных источников, показано на рис. 109.
*
входное отВерстие-
выходное отВерстив
входное отВерстив
входное отверстие*
Воздух
Серо и Воздух.
Горячая Вода
Горячая Вода
Примечание. Горизонтальные ।
размеры сильно
уВеличены.чтоВы
показать оетаяи
Деталь системы
Дно скВожины
Рис. 106- Метод Фраша.
Попутно приводим не лишенную интереса диаграмму потребле-
ния серы в различных отраслях промышленности (рис. 110). В 1930 г.
в США было добыто 2 525 000 т серы по цене 18 долл. 1 т.
В качестве сырья для производства серной кислоты служат
также сернистые минералы. Наиболее важен из них пирит FeS2.
Мы уже видели, что при обжиге сернистых руд происходит выделе-
кислоты
305
Рис. 107. Жидкая сера поступает в резервуар.
Рис. 108. «Гора» серы добытой по методу Фраша.
20 Взедение в химию.
306
кислоты
ние сернистого газа, который может быть превращен в серную
кислоту. Из сернистого газа, выделяющегося в качестве побочного
продукта при выплавке цинка, получаются большие количества кис-
лоты. В меньшем коли-
Рис. 109. Мировая добыча серы.
Рис. ПО. Потребление серы в
различных отраслях промыш-
ленности.
честве получается ки-
слота и при выплавке
меди. Но есть указания
на то, что из отбросов
можно с выгодой произ-
водить рыночные про-
дукты в любой местно-
сти, где только имеются
большие плавильные за-
воды, что стоимость по-
лученных таким обра-
зом продуктов будет во
многих случаях превы-
шать стоимость метал-
ла и что для самой важ-
ной фазы в промышлен-
ности серной кислоты этот источник обещает в будущем быть
самым крупным.
3. Первая ступень в производстве серной кислоты. При го-
рении серы или какого-нибудь сернистого металла образуется сер-
нистый газ, иначе называемый двуокисью серы, или сернистым
ангидридом:
S + О2 —* SO2;
4 FeS2 -f- 11О2 —«• 2Fe2O3 4- 8SO2;
2ZnS + 3O2 — 2ZnO 4- 2SO2.
Газ этот является кислотным окис-
лим и, реагируя с водой, образует
сернистую кислоту:
SO2 -f- Н2О —► H2SO3.
Реагируя же с основными окислами
или с основаниями, он образует соли
сернистой кислоты — сульфиты:
SO2 4- СаО — CaSO3;
SO2 + 2NaOH —- Na2SO3 4- H2O.
К слову сказать, эти сульфиты применяются для превращения де-
рева в бумажную массу. Однако в настоящий момент нас интере-
сует не сернистая кислота, а серная. Если бы сера была настолько
любезна, что при сгорании на воздухе образовывала бы непосред-
ственно свой высший окисел — серный ангидрид SO3, то проблема
получения серной кислоты была бы чрезвычайно упрощена, так как
кислоты
307
серный ангидрид соединяется непосредственно с водой, образуя
серную кислоту:
SO3 + Н2О -» H2SO4.
Но, к сожалению, это не имеет места. Наиболее трудная проблема
в производстве серной кислоты — это превращение легко получаемого
сернистого ангидрида в серный ангидрид или серную кислоту. Эта
проблема сводится к присоединению к молекуле сернистого ангид-
рида третьего атома кислорода.
4. Камерный процесс. В более старом из двух существующих
методов технического получения серной кислоты, в камерном про-
цессе, в качестве окислителя для повышения валентности серы с +4
в сернистом ангидриде до + 6 в серном ангидриде и в серной кислоте,
Рис. 111. Камерный процесс.
применяется один из окислов азота. Протекающие при этом реакции
в точности неизвестны, однако по всей вероятности имеет место
образование сложного промежуточного продукта. Для наших целей
достаточно ограничиться следующей упрощенной схедой имеющих
место реакций:
SO2 + NO2 — SO3 + NO;
SO3 + H2O — H2SO4.
В присутствии избытка воздуха окись азота NO опять переходит
в двуокись:
2NO + О2 — 2NOa.
Таким образом окислы азота могут служить непрерывно в каче-
стве передатчиков кислорода (стр. 88). Реакции эти протекают одно-
временно так, что в процессе работы выделить SO3 нельзя. Реакции
20*
308
КИСЛОТЫ
эти осуществляются в больших свинцовых камерах, длина которых
50—150 фт. (15—45 м), высота 16—26 фт. (4,8—7,8 м) и ширина 20—
30 фт. (6—,9 м). Обычно последовательно соединяется от трех до шести
таких камер. Материалом для камер служит свинец, потому что на
него не действует разбавленная серная кислота. Перед камерами
помещают башню Гловера а за ними башню Гей-Люссака (рис. 111).
Окислы азота от конца системы (от башни Гей-Люссака) поступают
в ее начало (в башню Гловера), в виде их соединения с концентри-
рованной серной кислотой, в виде так называемой нитрозилсерной
кислоты [H(NO)SOJ. Нитрозилсерная кислота в верхней части
башни Гловера смешивается с разбавленной серной кислотой, по-
ступающей из камер, — при этом мы сразу же убиваем двух зайцев.
Вода, разбавляющая камерную кислоту, служит для выделения из
нитрозилсерной кислоты окислов азота:
Н2О + 2H(NO)SO4 —\2H2SO4 + NO2 + NO,
причем тем самым концентрируется кислота и окислы азота выде-
ляются в самом начале процесса. Сернистый газ, образовавшийся
при сжигании серы или FeS2, поступает из печей в нижнюю часть
башни Гловера в смеси с достаточным количеством NO2, чтобы вос-
полнить небольшие потери окислов азота, которые имеют место во
время процесса. Эта двуокись азота получается или в небольших
открытых сосудах при действии серной кислоты на чилийскую се-
литру NaNO3:
2NaNO3 + H2SO4 -* Na2SO4 + 2HNO3,
2HNO3 + SO2 -* H2SO4 + 2NO2,
или же окислением газообразного аммиака NH3 при пропускании
смеси его с воздухом над нагретым платиновым катализатором
(стр. 315):
4NH3 + 5О2 -> 4NO + 6Н2О;
2NO + О2 — 2NO2.
Некоторое количество серной кислоты образуется уже в башне
Гловера, так как там имеются SO2, NO2 и Н2О. Но ббльшая часть
сернистого газа и окислов азота выходит из верхней части башни
Гловера и поступает в камеры. Здесь газы встречают водяной пар
или распыленную воду, которая подается инжекторами, располо-
женными в верхней части камер. При этом образуется разбавленная
серная кислота (камерная кислота), которая собирается в нижней
части камер. Это примерно 62%-ная серная кислота. Такую раз-
бавленную кислоту можно или применять непосредственно, например
в производстве таких удобрений, как суперфосфат (стр. 311), или же
ее можно концентрировать. Часть кислоты поступает обратно в вер-
хнюю часть башни Гловера, где происходят реакции, ведущие к уве-
личению ее концентрации, как это было уже сказано выше.
Неокислившийся сернистый газ, которого должно быть ми-
исислоты
309
нимальное количество, вместе со всеми окислами азота при вы-
ходе из последней камеры поступает в башню Гей-Люссака. Наз-
начение этой башни состоит в том, чтобы поглощать окислы азо-
та, так чтобы; их можно было снова возвратить в башню Гловера
в начале нового цикла. Для этой цели некоторое количество кон-
центрированной кислоты подают с нижней части башни Гловера
в верхнюю часть башни Гей-Люссака. Эта кислота реагирует с окис-
лами азота, образуя нитрозилсерную кислоту:
2H2SO4 + NO + NO2 — 2HNOSO4 + Н2О.
Нитрозилсерная кислота поступает в башню Гловера, где выделяет
окислы азота при реакции с водой.
5. Контактный процесс. Начиная с 1765 г., когда серная
кислота была впервые получена в больших стеклянных сосудах,
камерный процесс давал дешевую, разбавленную серную кислоту
умеренной чистоты. Когда в результате производства новых взрыв-
чатых веществ — нитроглицерина и нитроцеллюлозы — возникла
потребность в очень концентрированной серной кислоте, пришлось
применить весьма дорогой процесс для концентрирования камерной
кислоты. Примерно в 1900 г. в производственном масштабе был
впервые осуществлен контактный процесс. Этот процесс дает воз-
можность получать серную кислоту любой концентрации и высокой
чистоты. Название процесса происходит от того, что в нем в качестве
контактного катализатора применяется платина.
Реакция между сернистым газом и кислородом, ведущая к об-
разованию серного ангидрида, обратима и поэтому не протекает до
конца, а доходит до состояния равновесия:
2SO2 + О2 2SO3 + тепло.
Так как прямая реакция экзотермична, то при повышении темпера-
туры устанавливается новое равновесие, при котором уже будет
меньше SO3 и больше SO2, т. е. повышение температуры способст-
вует эндотермической, в данном случае обратной, реакции и пони-
жает выход SO3. Теоретически чем ниже температура, тем больше
выход SO3 при равновесии. Но, с другой стороны, повышение тем-
пературы увеличивает скорость всех химических реакций (стр. 86),
и следовательно время, необходимое для того", чтобы установилось
равновесие, уменьшается по мере повышения температуры. При ком-
натной температуре условия равновесия таковы, что превращение
SO2 в SO3 практически оказывается полным, но при этой темпера-
туре для достижения-такого выхода потребовалась бы вечность.
Неудобство экзотермических реакций, состоит в том, что с
повышением температуры быстрее устанавливается равновесие,
но в то же время меньше получается желаемых продуктов. Вот
тут-то и удобно применить катализатор. Катализаторы увеличивают
скорость как прямой, так и обратной реакции в одинаковой степени,
так что они не влияют на состояние равновесия, но чрезвычайно
сокращают время, необходимое для того, чтобы установилось рав-
310
кислоты
новесие. В результате этого можно воспользоваться процессом при
тех низких температурах, при которых выхода бывают значительны.
Если смесь воздуха и сернистого газа пропускать над мелко
раздробленной платиной или ванадием, состояние равновесия дости-
гается при 400° в течение нескольких секунд. При этой температуре
на практике достигается превращение SO2 в SO3 на 98% или даже
больше. Так как катализатор весьма легко отравляется примесями,
которые могут содержаться в сернистом газе, газ этот лучше полу-
чать из свободной серы, а не из пирита. Во всяком случае до поступ-
ления в каталитическую камеру газ подвергают тщательной очистке.
После прохождения над катализатором газы состоят главным обра-
зом из паров SO8 и избытка воздуха. Такие газы пропускают через
97%-ную серную кислоту, причем SO3 реагирует с имеющимися в
кислоте 3% воды, образуя серную кислоту:
SO3 + Н2О -> H2SO4.
В результате получается практически 100%-ная H2S04. Часть
этой кислоты поступает в продажу, часть же разбавляют водой
до 97%-ной кислоты, которая снова поступает в абсорбционные
башни, где и происходит поглощение SO3. Вероятно читатель удив-
ляется, почему SO3 не пропускают прямо в воду. Ведь, казалось
бы, это гораздо проще, чем пропускать его в 97%-ную кислоту.
Причина этого кроется в том, что пары SO3 неполно поглощаются
чистой водой, поглощение же их концентрированной кислотой про-
ходит нацело.
Серный ангидрид растворим в чистой серной кислоте. Такие
растворы называются дымящей серной кислотой,
или олеумом, и находят широкое применение при нитрова-
нии органических соединений (стр. 408).
Преимущество контактного процесса по сравнению с камер-
ным состоит в том, что можно получить непосредственно, без до-
рого стоящего концентрирования, весьма чистую кислоту любой
концентрации. Однако первоначальные затраты на контактную
установку, принимая во внимание стоимость платины, несколько
удорожают контактную кислоту. Поэтому для таких целей, как
производство удобрений, вполне пригодна и применяется до сих
пор камерная кислота. Для целей же нитрования необходима кон-
тактная кислота.
6. Свойства серной кислоты. Чистая серная кислота пред-
ставляет собой тяжелую маслянистую жидкость. Молекулы ее,
стойкие при обыкновенной температуре, начинают слегка разла-
гаться на воду и SO3 при 150—180°. При 330° кислота кипит. В вод-
ном растворе диссоциация ее на ионы протекает в две стадии, так
как серная кислота — кислота двухосновная. Первичная диссоциа-
ция в разбавленном растворе протекает нацело:
H2SO4 — Н+ + HSO4“,
кислоты
311
но ион HSO4" диссоциирует лишь частично:
HSO4~ ZZ Н + + SO4=.
Серная кислота реагирует с водой, образуя несколько гидратов,
причем выделяется большое количество тепла. По этой причине
нельзя прибавлять воду к концентрированной серной кислоте
или же выливать горячую кислоту в раковину. Поэтому же
концентрированная серная кислота служит хорошим обезвожи-
вающим средством. Она может отнимать элементы воды у мо-
лекул органических соединений. Это свойство весьма полезно
для ряда химических операций, но оно же служит причиной и тя-
желых ожогов, когда концентрированная серная кислота прихо-
дит в соприкосновение с нашей кожей.
7. Применение серной кислоты. Серная кислота представ-
ляет собой умеренно сильную, стойкую и нелетучую кислоту. Та-
кая кислота будет реагировать с солями более летучих кислот.
При нагревании концентрированной серной кислоты например с
хлористым натрием (поваренной солью) образуется кислый суль-
фат натрия и выделяется хлористоводородная кислота:
NaCl + HaSO4 -> NaHSO4 + НС1.
Это как раз и есть тот способ, который в промышленности
применяется для получения соляной (хлористоводородной) кислоты.
Аналогичным образом получаются азотная, фосфорная и другие
кислоты:
NaNOs + H2SO4 -> NaHSO4 + HNO3;
Ca3 (PO4)2 + 3H2SO4 3CaSO4 + 2H3PO4.
Растворимые фосфаты — необходимая составная часть всех
смешанных полных удобрений. При обработке нерастворимого фос-
фата кальция, который в природе встречается в виде фосфоритов,
разбавленной серной кислотой образуется растворимая кислая соль:
Са3 (РО4)2 + 2H2SO4 — 2CaSO4 4- Са (Н2РО4)2.
Огромнейшие количества камерной кислоты применяются для
этой цели в производстве так называемого «суперфосфата».
Газообразный аммиак NH3 реагирует с разбавленной серной
кислотой, образуя сульфат аммония:
2NH3 + H2SO4 -* (NH4)2SO4.
В виде удобрений мы должны давать нашим сельскохозяйствен-
ным культурам растворимые азотсодержащие соли; однако ясно,
что такой газ, как аммиак, для этой цели оказался бы бесполезным.
Поэтому необходимо его превратить в твердый сульфат аммония,
растворимую в воде соль. Этот процесс имеет громадное экономи-
ческое значение как для промышленности искуоственных удобре-
ний, так и для сельского хозяйства.
312
КИСЛОТЫ
Применение серной кислоты для травления стали основано
на ее кислотных свойствах. При покрытии железа оловом или цин-
ком, т. е. при производстве белой жести или оцинкованного же-
леза, на поверхности железа не должно быть ржавчины, в про-
тивном случае металлическое покрытие не пристает. Так как же-
лезная ржавчина принадлежит к обычным основным окислам, то
она будет реагировать с такой кислотой, как серная, образуя в этом
случае растворимую соль — сульфат окисного железа:
Ре2О3 3H2SO4 > Fe? (SO4)3 ЗН2О.
Поэтому листовую сталь или железо погружают сперва в кислот-
ную ванну с разбавленной серной кислотой, а уже затем в тот рас-
плавленный металл, которым хотят железо покрыть.
До сих пор мы рассматривали те применения серной кислоты,
которые зависят от ее кислотных свойств и от того, что она неле-
туча. Но применение серной кислоты в качестве дегидратирующего
(водуотнимающего) средства также имеет большое значение. Если
глицерин, целлюлозу, некоторые углеводороды подвергнуть дей-
ствию концентрированной азотной кислоты, то при этом протекают
реакции, в результате которых от реагирующих веществ отнимаются
элементы воды и образуются взрывчатые вещества и другие про-
дукты. Типичны следующие реакции:
С3Н5(ОН)3 + 3HNO3 — C3H5(ONO2)3 + ЗН2О;
глицерин < тринитроглицерин
С6Н7О2 (ОН)3 + 3HNO3 — CeH7O2 (ONO2)3 + ЗН2О;
целлюлоза тринитроцеллюлоза
С,Н8 + 3HNO3 —< С7Н5 (NO2)3 + ЗН2О.
толуол тринитротолуол
В отличие от реакций, протекающих между электролитами, эти
реакции протекают очень медленно. Однако прибавление концент-
рированной серной кислоты чрезвычайно ускоряет реакцию, так как
вследствие своих дегидратирующих свойств она способствует отня-
тию воды от реагирующих веществ. В результате подобных реакций
получаются не только взрывчатые вещества, но и те материалы,
из которых делаются целлулоид, искусственная слоновая кость,
искусственная кожа и современные быстро сохнущие лаки (стр. 397).
8. Значение азотной кислоты. Абсолютная необходимость
взрывчатых веществ в горном и инженерном деле, важность лаков
в автомобильной промышленности и целлулоида, представляющего
собой пироксилиновую пластическую массу (стр. 397), в кинемато-
графической промышленности, — все это делает азотную кислоту
Одним из важных факторов нашей промышленности.
9. Химия соединений азота. Химия соединений азота не-
сколько сложна, ввиду того что азот обладает в различных соеди-
нениях различной валентностью. Типовые соединения, в кото-
рых встречается азот, и различные валентности его приведены
в табл. XL IV.
кислоты
313
Таблица XLIV. Сводка по химии азота
Валент- ность Гидрид, i? ись или свободный азот Основание или кислота Соль
-3 0 +1 +2 +3 +4 +5 NH3 N, N2O NO {NAP no2 [N,O6]‘ НОН аммиак ► свободный азот закись азота или веселящий газ окись азота НОН азотистый > ангидрид двуокись азота НОН азотный ► ангидрид НС1 NH4OH ► гидрат оки- си аммония | NaOH HNOa > азотистая кислота NaOH HNO3 > азотная кислота NH,C1 хлористый аммоний NaNOa нитрит натрия NaNO8 нитрат натрия
Аммиак и аммонийные соединения содержат азот в низшей
степени окисления (валентность=—3). Сам аммиак NH3 представ-
ляет собой газ с характерным запахом. В промышленном масштабе
он получается или как побочный продукт при сухой перегонке ка-
менного угля (стр. 118), или же синтетически из атмосферного азота
(стр. 375), или в меньшей степени, по цианамидному способу. Так как
его критическая температура лежит вблизи комнатной, то он легко
сжижается и вследствие этого широко применяется для искусствен-
ного охлаждения (стр. 54). При действии на него воды он образует
слабое, нестойкое основание — гидрат окиси аммония:
NH3 -J- НОН NH4OH NH4+ + ОН-,
водный раствор которого известен в продаже под названием вод-
ного аммиака или нашатырного спирта. Если на аммиак или на
раствор гидрата окиси аммония действовать кислотой, то образуется
соответствующая аммонийная соль:
NH3 + НС1 — N Н4С1;
NH4OH + НС1 -* NH4C1 + Н2О;
2NH3 + H2SO4 (NH4)2SO4;
2NH4OH 4- H2SO4 (NH4)2SO4 + 2H2O и т. д.
Свободный азот N2, как нам известно, инертный газ, лишь с
большим трудом соединяющийся с другими элементами.
1 В скобках нестойкие соединения.
Л4
кислоты
Закись азота N2O, более известная под названием веселящего
газа, широко применяется в качестве анестезирующего средства
при несерьезных операциях, а также зубными врачами. Получают
ее нагреванием нитрата аммония:
NH4NO3—> N2O + 2H2O.
Закись азота легко сжижается и нагнетается под давлением в не-
большие стальные цилиндры.
Окись азота NO — бесцветный газ, получаемый в технике
или при пропускании электрической дуги через воздух (стр. 372)
N2 + О2 — 2NO,
или же при пропускании смеси аммиака и воздуха над нагретым
платиновым катализатором:
4NH3 + 5О2 -> 4NO 4- 6Н2О.
Этот окисел сам по себе не имеет большого значения, но служит
весьма важным промежуточным продуктом при получении азотной
кислоты.
Соединения, в которых валентность азота равна 4- 3, не имеют
особого значения, хотя нитриты и применяются для получения раз-
личных азокрасителей.
Двуокись азота NO2 — красновато-бурый газ, образующийся
при действии кислорода воздуха на окись азота:
2NO 4- О2 —► 2NO2.
Двуокись азота — важный промежуточный продукт при получении
азотной кислоты.
После этого краткого обзора химии соединений азота мы мо-
жем заняться рассмотрением получения и свойств самой азотной
кислоты. Значение азотистых соединений и фиксации атмосферного
азота для производства удобрений будет рассмотрено в одной
из последующих глав (стр. 377).
10. Получение азотной кислоты из селитры. Почти вся азот-
ная кислота, производимая в США, получается действием серной
кислоты на чилийскую селитру. Азотнокислый натрий, или чилий-
ская селитра, встречается в пустынной безводной области, которая
тянется в Чили параллельно берегу Тихого океана. Отложения,
находящиеся там и содержащие нитрат натрия, называются калише.
Залежи эти простираются в длину на 400 миль (650 км^ а в ширину
на 3—30 миль (5—50 км). С 1830 г. и почти до самого последнего
времени чилийская селитра была единственным источником полу-
чения азотной кислоты. Что, пожалуй, важнее, это то, что залежи
эти представляют собой бесценный источник азотистой пищи расте-
ний (стр. 370).
Если сухой нитрат натрия нагревать с концентрированной сер-
ной кислотой, то протекает следующая реакция:
NaNO3 4- H2SO4 — NaHSO4 4- HN03.
кислоты
315
Азотная кислота отгоняется от реакционной смеси и конденсируется
с помощью системы воздушных и водяных холодильников.
И. Азотная кислота из окислов азота. При фиксации атмос-
ферного азота с помощью вольтовой дуги воздух пропускают через
гигантские электрические дуги, где протекает следующая реакция:
N2 + О2 —> 2NO.
По охлаждении окись азота присоединяет еще кислород и образует
двуокись:
2NO + О2 — 2NO2.
Этот газ пропускают через поглотительные башни, где он встречает
ток воды или слабой азотной кислоты, которая медленно прохо-
дит через кварцевую набивку башни. При этом происходит тес-
ное соприкосновение газа и воды и протекает следующая реакция:
3NO2 + Н2О — 2HNO3 + NO.
Как видно из уравнения, две трети NO2 превращаются в азотную
кислоту, а одна треть восстанавливается в NO. Эту последнюю
Рис. 112. Платиновая сетка для окисления
аммиака.
можно опять окислить в
NO2, смешав ее с возду-
хом, и процесс поглоще-
ния повторить в следую-
щей башне и т. д.
Этот метод не прина-
длежит к числу основных
методов фиксации азота,
и этим путем получается
лишь незначительное ко-
личество азотной кислоты.
12. Азотная кислота
из аммиака. Аммиак NH3
является побочным про-
дуктом перегонки камен-
ного угля, но может быть
получен и синтетически
из азота воздуха по ме-
тоду синтетического ам-
миака (метод Габера) или же по цианамидному методу. Превра-
щение аммиака в азотную кислоту имеет первостепенное значение
во время войны, так как страна, владеющая этим методом, не должна
иметь запасов чилийской селитры на случай войны. Если бы Герма-
ния не умела превращать азот воздуха в аммиак и затем в азотную
кислоту, последняя война окончилась бы значительно раньше.
Если смесь аммиака и воздуха пропустить над соответствую-
щим катализатором при 500—600°, то имеет место следующая реак-
ция:
4NO + 6H3O.
4NH3 4- 5О2
316 ЩЕЛОЧИ
Катализатором служит платиновая сетка из трех или четырех слоев
(рис. 112). Полученную таким образом окись азота превращают в
азотную кислоту методом, который был описан в предыдущем
параграфе.
Цена азотной кислоты, полученной по этому методу, уже доста-
точно низка для того, чтобы конкурировать с азотной кислотой из
чилийской селитры.
13. Соляная кислота. Эта кислота представляет собой раствор
бесцветного газа — хлористого водорода, прекрасно растворимого
в воде. Наиболее часто применяемая техническая соляная кислота
(уд. вес 1,19) содержит 37,2% хлористого водорода в водном растворе.
Получается хлористый водород при нагревании смеси сухой камен-
ной соли и серной кислоты.
Реакция протекает в две стадии:
NaCl + H2SO4 — NaHSO4 + HCI;
NaHSO4 + NaCl Na2SO4 + HCI.
Для второй реакции требуется более высокая температура.
ГЛАВА XXIX
ОСНОВНАЯ химическая промышленность.
ЩЕЛОЧИ
Пожалуй, покажется парадоксальным то, что один из трех глав-
ных щелочных продуктов вовсе не щелочь, а представляет собой соль.
Мы имеем в виду соду, или карбонат натрия Na2CO3. Другой про-
дукт, применяемый в огромном количестве, является основным окис-
лом, известью СаО. Третий же продукт — щелочь, каустическая
сода, или едкий натр NaOH. Из этих трех продуктов наиболее ще-
лочным является едкий натр. Это одно из самых сильных оснований,
которое диссоциирует по следующему уравнению:
NaOH—> Na + 4-ОН-.
При нейтрализации его какой-нибудь кислотой это основание об-
разует соответствующую натриевую соль:
NaOH + HCI -* NaCl + Н2О;
2NaOH 4- H2SO4 -> Na2SO4 + 2H2O и т. д.
Известь (основной окисел), реагируя с водой, образует основание —
гидрат окиси кальция:
СаО 4- Н2О —► Са (ОН)2 4- тепло.
Этот процесс известен под названием гашения извести и сильно
экзотермичен. Сухой продукт, получаемый при этом, называется
гашеной известью; он плохо растворим в воде, и насыщенный рас-
твор его называется известковой водой. В таком разбавленном рас-
ЩЕЛОЧИ
317
творе гидрат окиси кальция почти нацело диссоциирован на ионы
гя++ и ОН":
е Са (ОН)2 —* Са++4-ОН'.
Суспензия гидрата окиси кальция в его насыщенном водном рас-
творе (известковое молоко) широко применяется для нейтрализации
кислот. По мере реагирования части, находящейся в растворе,
растворяется свежее количество гидрата окиси кальция:
Са (ОН)2 + 2НС1 СаС12 + 2Н2О;
Са (ОН2) + H2SO4 -* CaSO4 + 2Н2О и т. д.
Сода Na2CO3 представляет собой соль сильного основания NaOH
и слабой кислоты Н2СО3 и подвергается в водном растворе гидро-
лизу:
Na2CO3 —< 2Na+ 4-С037
+ +
2НОН^2ОН' + 2Н*
t It
2NaOH Н.СО,
Карбонат-ионы, на которые диссоциируют молекулы соды, удаляют
водородные ионы из раствора в виде мало диссоциированных мо-
лекул слабой угольной кислоты. Следовательно в водных раство-
рах соды имеется избыток ионов ОН", поэтому растворы имеют
щелочную реакцию.
Растворы карбоната натрия реагируют с кислотами, образуя нат-
риевые соли этих кислот и нестойкую угольную кислоту, которая в
свою очередь разлагается в значительной степени на Н2О и ГО2:
Na2CO3 + 2НС1 — 2NaCl 4- Н2СО3 Н2О 4- СО2;
Na2CO3 4- H2SO4 —> Na2SO4 + Н2СО3 Н2О 4- СО2 и т. д.
1. Производство извести. Известь получается из известняка
(СаСО3). Минерал этот весьма широко распространен в природе; он
главным образом морского происхождения, так
как состоит из раковин и скелетов морских живот-
ных. Для получения извести известняк, измельчен-
ный на дробилках, подают в верхнюю часть вер-
тикальных печей для обжига, представляющих
собой вертикальные цилиндрические печи, выло-
женные огнеупорным кирпичом (рис. 113). Темпе-
ратура, необходимая для разложения известняка
СаСО3 ZZ СаО 4- СО2,
Достигается сжиганием каменного угля, кокса,
Дерева, светильного газа или жидкого топлива.
Для удаления углекислого газа из извести под-
держивают хорошую тягу. Состояние равновесия
Рис. 113. Печь для
обжига известняка.
318
ЩЕЛОЧИ
определяется только концентрацией СО2, так как известняк и из-
весть — вещества твердые. Поэтому давление СО2 поддерживают
возможно более низким, чтобы избежать обратной реакции. Про-
цесс этот непрерывен, так как известь выгружается время от времени
из нижней части печи (без перерывов в работе).
2. Потребление извести. Известь широко применяется в строи
тельных работах, а также в производстве стекла, песчано-извест-
ковых кирпичей и красок, растворяющихся в холодной воде.
Известковый раствор для скрепления друг с другом кирпичей,
черепицы и камней приготовляют следующим образом: 1 ч. гаше-
ной извести смешивают с 3—4 ч. песка и достаточным количеством во-
ды, чтобы образовалась паста. При схватывании известковый раствор
сперва теряет воду вследствие испарения, причем образуется по-
ристый, несколько рассыпчатый материал, который постепенно за-
твердевает, по мере того как гашеная известь присоединяет СО2 из
воздуха: >
Са (ОН)2 СО2 ► СаСО3 Н2О
и переходит в кристаллический СаСО3.
Портланд-цемент, который в настоящее время считается наря-
ду с железом и сталью нашим наиболее важным строительным мате-
риалом, получают при совместном нагревании известняка и глины,
соединения, состоящего из описей алюминия и кремния, в горизон-
тальной вращающейся обжигательной печи до шлакования и даже,
частично, сплавления материала. Затем всю эту массу перемалы-
вают и упаковывают; при употреблении ее смешивают с песком, мел-
ким камнем и водой. Наиболее важными составными частями порт-
ланд-цемента являются следующие окислы: кальция (известь), крем-
ния (кремнезем) и алюминия (глинозем).
Таблица XLV. Состав портланд-цемента
Состав Средний % Состав Средний %
Кремнезем SiO2 . . . . Глинозем А12О3 . . . Известь СаО 22,0 7,5 62,0 Окись железа FeaO3 . Магнезия MgO .... Разное 2,5 2,5 1,5
Обыкновенное стекло получ ается при нагревании соды Na3CO3,
извести СаО и песка SiO2. Известковый раствор для побелки —
•- простая суспензия гашеной извести в воде.
Известь широко применяется и в сельском хозяйстве. Слишком
кислые почвы нейтрализуют гашеной известью. При распылении
сухой гашеной извести или ее суспензий и различных смесей с из-
вестью гибнут насекомые и их личинки. Известь, обработанная раз-
личными веществами, дает инсектисиды, фунгисиды и яды. Среди
этих средств следует упомянуть об арсенате кальция, применяемом
ЩЕЛОЧИ
319
в больших количествах на хлопковых плантациях для борьбы с хлоп-
ковым долгоносиком.
Кроме того известь находит значительное применение в хи-
мической промышленности. Мы уже говорили о ее применении в ка-
честве флюса в металлургии. При производстве смазочных масел
кальциевые мыла, образующиеся при обработке жиров известью,
применяются для стабилизации эмульсий масла и воды (стр. 356).
При старом способе получения едкого натра известь обрабаты-
вают содой (стр. 323).
Если SO2 пропускать через раствор гашеной извести, то обра-
зуются сульфиты кальция:
Са (ОН)2 + 2SOa -> Са (HSO3)2.
Они служат для растворения лигнина, цементирующего в древесине
волокна целлюлозы, и для превращения последней в бумажную
массу (стр. 396). При пропускании газообразного хлора над сухой
гашеной известью образуется белильная известь:
Са (ОН)2 + С12 — СаОС12 + Н2О.
При нагревании извести и угля в электрической печи образуется
карбид кальция:
СаО + ЗС —- СаС2 + СО.
Из него могут быть получены ацетилен (стр. 384), уксусная кислота
и много других органических соединений. Карбид кальция служит
также основой цианамидного процесса фиксации азота воздуха.
Применение извести для смягчения воды упоминалось нами уже
ранее.
3. Значение и применение соды. Кальцинированная сода —
торговое название безводного карбоната натрия. При кристаллиза-
ции из водных растворов ниже 35° карбонат натрия выпадает в виде
кристаллогидрата Na2C03.10H20. Этот продукт обычно называется
кристаллической содой. При температуре выше 35° кристаллы содер-
жат меньше кристаллизационной воды Na2CO3. Н2О. Этот моно-
гидрат применяется в порошках для стирки.
4. История производства соды. Мыло получается при об-
работке животных или растительных жиров щелочью, т. е. каусти-
ческой содой NaOH, едким кали КОН, содой Na2CO3 или пота-
шом К2СО3. Впервые мыло было получено галлами из древесной
золы и козьего сала. Знакомы ли были они с очищающими свойствами
мыла и применяли ли они его с этой целью—нам неизвестно. Однако
вскоре им удалось открыть, что если этим сырым мылом смазывать
бороды, то последние становятся яркорыжими, а так как это спо-
собствовало поднятию их воинской доблести, то это свойство мыла
ими весьма ценилось. От них искусство мыловарения переняли рим-
ляне.
Поташ К2СО3, как видно из его названия (pot—горшок; ash —
зола), получался выщелачиванием водой древесной золы из-под
горшков с едой на очагах. Из щелочей поташ первый стал известным
320
ЩЕЛОЧ1
человеку. Еще до того как бы то открыто его применение в мылова-
рении, было известно, что он необходим при изготовлении стекла,
впервые появившегося в Египте около 5000 лет тому назад. Плиний
приписывает честь открытия стекла финикийским морякам, которые
пристали к берегам реки Бела в Сирии и так как берег был песчаным
и камней не было, поставили свои горшки с пищей на куски нату-
ральной соды Na2CO3, которая была грузом на их корабле, и раз-
вели огонь на песке, чтобы сварить себе пищу. Здесь-то впервые ока-
зались собранными все составные части, необходимые для производ-
ства стекла, а тепло, которое давал огонь, доделало все остальное.
В средние века стекольные заводы Франции и Богемии работали
на соде, импортировавшейся арабами в виде натуральной соды,
залежи которой встречались в пустынных местах в Средней Азии,
а также на «барилле» из Испании, представлявшей собой соду из
золы морских растений. Незадолго до Французской революции,
после того как Англия отрезала Францию от источников бариллы,
Французская академия наук предложила премию в 2400 ливров
за нахождение процесса получения соды из поваренной соли. Эту
проблему разрешил Николя Леблан, но премия так и не была при-
суждена никому.
5. Способ Леблана. В это время (1775) Леблан был врачом
герцога Орлеанского. Побуждаемый высокой премией, он разработал
следующий способ. Сперва соль обрабатывалась концентрированной
серной кислотой и превращалась в сульфат натрия:
2NaCl + H2SO4 Na2SO4 + 2НС1.
Хлористый водород был ценным побочным продуктом этой реакции.
Затем сульфат натрия смешивали с коксом и известняком и смесь
нагревали во вращающейся печи, причем имели место следующие
реакции:
Na2SO4 4- 2С —* Na2S + 2СО2;
Na2S СаСО3 ► Na2CO2 -J- CaS.
Соду выщелачивали водой, а менее растворимые продукты в рас-
твор не переходили. Леблан настолько тщательно разработал свой
способ, что он сразу оказался успешным. В 1789 г. благодаря финан-
совой помощи герцога был пущен завод в Сен-Дени. Так как Испа-
ния находилась в состоянии войны, то цены на бариллу бешено
е росли и успех казался обеспеченным. Однако б ноября 1793 г. гер-
цог Орлеанский был гильотинирован, содовый завод конфискован,
а патенты Леблана аннулированы. Все это довершила смерть люби-
мой дочери Леблана и он покончил жизнь самоубийством. В год его
смерти (1806) в Париже был пущен завод, работавший по его способу,
а через год стекольный завод в Сен-Гобен применял уже его соду
для производства оконного стекла. В течение следующих 75 лет спо-
соб Леблана получил широкое развитие и превратился в огромную
ЩЕЛОЧИ
321
отрасль промышленности, распространившись в Германии, Австрии
и Англии. Но в Англии же господству этого способа был нанесен
удар более дешевым способом Сольвея.
6. Способ Сольвея. Эрнест Сольвей (род. 1838) происходил
из Брабанта (Бельгия), где отец его занимался очисткой соли.
Детство его было проведено в «атмосфере» этого продукта, послу-
жившего сырьем для его способа. В I860 г. он уехал в Шаарбек, что-
бы помогать своему дяде, бывшему директором небольшого газо-
вого завода в этом городе. Здесь ему пришлось столкнуться с побоч-
ным продуктом газового производства — аммиаком NH3, который
был вторым 'Веществом, необходимым для работы по его способу.
Через год он взял патент на этот способ, по которому в настоящее
время и производится, можно сказать, вся сода.
Насыщенный раствор поваренной соли NaCl насыщают еще
аммиаком и углекислым газом в поглотительных башнях. При этом
протекают следующие реакции:
NH3 + Н2О ZT NH40H;
СО2 Н2О —- H3CO3j
NH.OH + Н2СО3 NH.HCO, + Н2О;
бикарбонат
аммония
NH4HCO3 + NaCl -> NaHCO3 + NH4C1.
бикарбонат
натрия
Условия поддерживаются такими, чтобы бикарбонат натрия
выпадал в осадок. Этот осадок отфильтровывают от маточника
на вращающихся вакуумфильтрах. Часть его продается в виде
£ бикарбоната натрия NaHCO3 и идет главным образом на произ-
водство порошков для печения хлеба. Большая же часть бикарбо-
ната натрия превращается в нормальный карбонат Na2CO3 прока-
ливанием в закрытых печах:
2NaHCO3 — Na2CO3 + Н2О + СО2.
Для успешного осуществления этого способа необходима регенера-
ция аммиака, находящегося в растворе в виде хлористого аммония.
Для этого последний обрабатывают известковым молоком, причем
выделяется газообразный аммиак:
Са (ОН)2 + 2NH4C1 2NH3 ф- 2Н2О + СаС12,
который опять может быть пущен в дело. Регенерация аммиака
почти количественная. Преимущества способа Сольвея по сравне-
нию со способом Леблана вполне очевидны: он требует меньше
топлива и дает меньшие потери материалов. Единственным по-
бочным продуктом при этом процессе получается хлористый каль-
ций, который вследствие своей гигроскопичности широко применяется
для поливки дорог (дорога долго остается влажной и не пылит),
для уничтожения сорняков и для сушки.
21 Введение в химию.
322
ЩЕЛОЧИ
7. Каустическая сода. Из трех упомянутых выше продуктов,
употребляемых в качестве щелочей, едкий натр (гидрат окиси натрия)
наиболее сильная щелочь. Это—хорошо растворимое, активное ос-
нование, водные растворы которого могут быть получены с высокой
концентрацией ионов ОН~.
Рис. 114. Схема использования и переработки соли.
Мыло получают нагреванием жиров животного или раститель-
ного происхождения с концентрированными растворами каустиче-
:кой соды (стр. 399). Большие количества щелочи применяются для
очистки различных погонов сырой нефти. Дурно пахнущие серии-
ЩЕЛОЧИ
323
стые соединения удаляют из бензина, промывая последний раство-
ром одного из окислов свинца в крепкой щелочи. Избыток серной
кислоты, примененной для удаления смолообразующих компонентов
бензина, также нейтрализуется щелочью. Аналогичным образом
очищаются керосин и смазочные масла. Текстильная промышленность
применяет едкий натр как для обработки естественных волокон,
так и для получения искусственных. Растворы едкого натра при-
меняются для придачи блеска хлопковым волокнам; этот процесс
называется мерсеризацией. Вискозный способ (стр. 398), по которому
получается большая часть искусственного волокна, основан на об-
работке целлюлозы едким натром и сероуглеродом.
8. Производство едкого натра. В настоящее время для полу-
чения едкого натра применяются два способа: химический и электро-
литический. Химический процесс более старый и сводится к обра-
ботке соды гашеной известью:
Na2CO3 + Са(ОН)2 СаСО3 + 2NaOH.
Реакция протекает в растворе и в результате образуется нераст-
воримый карбонат кальция.
Электролитический процесс заключается в электролизе раствора
поваренной соли. При этом помимо едкого натра получаются хлор
и водород. Газообразный водород образуется на катоде, газообраз-
ный хлор на аноде. Раствор едкого натра образуется в катодном от-
делении электролитической ванны. Механизм образования этих про-
дуктов будет рассмотрен в следующей главе. Около 25% всего едкого
натра получается именно по этому способу. •
9. Хлор. Хлор не есть щелочь, но так как он образуется
в качестве побочного продукта при электролитическом способе по-
лучения едкого натра и оказывается весьма полезным продуктом,
то целесообразно будет вкратце остановиться на его применениях.
Два свойства хлора делают его очень полезным. Влажный хлор—
прекрасное белящее средство и кроме того прекрасное дезинфеци-
рующее средство. Хлор главным образом применяется для беления
бумажной массы, текстильных изделий и пищевых продуктов и для
обработки питьевой воды.
Хлор завоевал незавидную славу во время мировой войны.
Однако то свойство хлора, которое делает его столь опасным в вы-
сокой концентрации, делает его весьма полезным в более разбав-
ленном состоянии. Некоторые из вас вероятно слыхали о при-
менении хлора при прастудах, которое получило свое развитие
тогда, когда выяснилось, что ни один человек из работавших в Эдж-
вудском арсенале во время войны, где производилось большое
Количество хлора, не болел инфлуэнцией. Хлор входит в состав таких
антисептических средств, как, например, хлорамины, хлороформ —
анестезирующее средство, а четыреххлористый углерод — раство-
ритель при сухой чистке.
г24
ЭЛЕКТРОЛИЗ
ГЛАВА XXX
ЭЛЕКТРОЛИЗ И ОТРАСЛИ ПРОМЫШЛЕННОСТИ, ОСНОВАННЫЕ
НА ЭЛЕКТРОЛИЗЕ
1. Опять о ряде напряжений. В одной из предыдущих глав
(стр. 130) было сказано, что все металлы можно расположить в ряд
в зависимости от их относительной активности и на основании реак-
ции замещения следующего типа:
Zn 4~ CuSO4 —* ZnSO4 + Си.
Для осуществления такой реакции кусок металлического цинка по-
гружают в водный раствор сульфата меди. Из теории диссоциации
мы знаем, что сульфат меди в водном растворе почти нацело диссо-
циирован, так что та реакция, которая имеет место, должна проте-
кать между нейтральными атомами цинка и ионом меди или сульфат-
ионом. Кроме того из приведенного выше уравнения видно, что об-
разуется сульфат цинка; юднако мы знаем, что молекулы этой соли
в растворе также в значительной степени диссоциированы. Таким
образом эту-реакцию можно было бы точнее изобразить следующим
образом:
Zn° + Cu++ +SO4= — Zn+ + + SO4= + Cu°.
Так как сульфат-ион имеется в обеих частях уравнения, то из этого
следует, что он не принимает участия в реакции. Следовательно
происходящие изменения можно выразить таким простым уравне-
нием:
Zp°-|-Cu++ Zn++ + Cu°.
Совершенно очевидно, что это — реакция окисления-восстановления
(стр. 187) и что имеет место переход 2 электронов от атома цинка
к иону меди:
Zn°-> Zn+++20;
Cu++ + 20 — Cu°.
Нейтральные атомы более активного металла отдают свои элек
троны ионам менее активного металла. Чем активнее металл, тем
больше у его нейтральных атомов тенденция к отдаче электронов
и к превращению в ионы и тем меньше тенденция его ионов к приоб-
ретению электронов и превращению в нейтральные атомы. Эта отно-
сительная тенденция металлов ряда напряжений к отдаче электро-
нов и превращению в ионы, а также тенденция их ионов к приобре-
тению электронов в результате обратного процесса указаны в табл.
XLVI относительной длиной соответствующих стрелок.
2. Разряд ионов. В явлении электролиза нас интересует как
ионы, находящиеся в растворе, разряжаются на электродах. На
катоде разряжается положительный и эн (катион), а на аноде—
отрицательный (анион). Электроды соединены с каким-нибудь
источником постоянного тока, который служит в качестве элек
ЭЛЕКТРОЛИЗ
325
Таблица XLVI. Ряд напряжений металлов
к К + +10 . Mn + 1 1
гча 7—** гм a* ~r 1 0
Са Ca+ + +20
A’g - " Mg+ + +2Q
Al A1+ + + + 3 Q
Zn <=+ Zn+ + 4-20
Fc —— Fe + + +20
Sn Sn + + + 2 (2)
Pb ; -t Fb + + 4-2©
Ha t 2H + 4-2 0
Cu Cu + + +2©
Hg Hg+ + 4-20
Ag — Ag+ +10
Au Au+ +1©
тронного насоса, всасывая поток электронов через отрица-
тельный полюс. Источником постоянного тока может служить
ряд гальванических элементов, аккумуляторная батарея или же
генератор постоянного тока. Катод в электролитиче- +
ской ванне соединяют с отрицательным полюсом источ-
ника тока, а анод ванны — с положительным полюсом J ]|
(рис. 115). Таким образом электроны накачиваются +||
в катод и выкачиваются из анода ванны. При этих
условиях катод становится заряженным отрицательно,
а анод положительно. Под влиянием этих заряженных
электродов положительные ионы в растворе будут пере- г I- В?
двигаться к катоду, а отрицательные к аноду*. Как на ’ 4
одном, так и на другом электроде происходит разряд
ионов, но так как то, что происходит на аноде, более
или менее независимо от того, что происходит на
катоде, мы можем рассмотреть каждый процесс в от-
Рис. 115.
Электроли-
тическая
ванна.
дельности.
При рассмотрении механизма электролиза нельзя забывать,
что помимо ионов электролита, во всех водных растворах имеются
также и ионы воды (Н+ и ОН-). Эти ионы в электрическом поле
передвигаются совершенно так же, как и ионы электролита: ионы
водорода двигаются по направлению к катоду, а гидроксильные
ионы — к аноду. Обычно на катоде одновременно готовы разрядиться
два иона — положительный ион электролита и ион водорода из воды.
Который из них разрядится, это зависит от их относительного поло-
жения в ряду напряжений металлов. Ион каждого из металлов, сле-
дующих за водородом, разряжается легче (точнее, может быть раз-
ряжен при меньшем вольтаже), чем ион водорода. Таким образом,
если положительный ион электролита будет ионом меди, ртути,
серебра или золота, то он разрядится ранее иона водорода. С другой
стороны, ион более активного металла разрядить труднее, чем ион
326
ЭЛЕКТРОЛИЗ
водорода; в этом случае разрядится ион водорода. Действительный
механизм разряжения положительного иона заключается в приобре-
тении от катода некоторого количества электронов, равного положи-
тельному заряду иона, что в результате ведет к образованию ней-
трального атома свободного металла. Вообще
Хп+ 4-п©->Х°
или, в конкретных случаях:
Ag+ + 10 —Ag°;
Cu++ +20-*Cu°;
Au+ + + + 30 —- Au°.
Нейтральные атомы металлов, не взаимодействующие с водой, обычно
образуют слой металла на катоде. Когда происходит разряжение
иона водорода, первая стадия протекает совершенно аналогично:
Н+4-10^Н°,
но так как нейтральные атомы водорода обладают сильно выражен-
ной склонностью соединяться попарно с образованием стойкой двух-
атомной молекулы газообразного водорода, то следующую стадию
можно изобразить так:
* 2Н° — Н2,
причем газ выделяется из раствора в виде мелких пузырьков на по-
верхности катода. При таком разряжении ионов водорода равно-
весие между недиссоциированными молекулами воды и водородными
и гидроксильными ионами нарушается: по мере разряжения ионов
водорода диссоциирует все большее и большее количество молекул
воды:
НОН —>Н+4-0Н~.
Это приводит к увеличению концентрации гидроксильных ионов,
так что раствор около катода становится более щелочным.
К аноду передвигаются отрицательные ионы электролита и гид-
роксильные ионы воды. Если отрицательный ион не содержит кисло-
рода, как, например, в случае хлор-(С1"), бром-(Вг"), иод-^-)
и сульфид-(5=)ионов, то разряжается именно этот ион, а не гидрок-
сильный. В этом случае процесс разряжения сводится к переходу
электронов от иона к электроду:
Ci- — С1°+ 10
2С1° — С12
Вг- — Br°+ 1©
2Вг°—* Вг2
j- — j° + ie
2 J° — J.
S= — S° + 20
ЭЛЕКТРОЛИЗ
327
причем иногда за этим следует соединение полученных нейтраль-
ных атомов попарно, с образованием двухатомных молекул.
Если же отрицательный ион электролита содержит кислород,
как, например, в случае сульфат-(8О4=) и нитрат-(МО3“) ионов, то
на аноде выделяется газообразный кислород, и раствор становится
кислым. Действительный механизм образования этих продуктов не-
известен, но наиболее простым объяснением будет предположение,
что в этих случаях гидроксильный ион воды легче разряжается, чем
сульфат- или нитрат-ионы. Изменения, имеющие место при разря-
жении этого иона, можно изобразить следующим образом:
он- -> он« +10.
Нейтральный радикал ОН нестоек и разлагается следующим образом:
4ОН — 2Н2О + О2.
Таким образом разряжение гидроксильных ионов оказывается при-
чиной выделения кислорода и увеличения концентрации водэродных
ионов, которое происходит вследствие диссоциации молекул воды по
мере разряда гидроксильных ионов.
3. Типичные случаи электролиза. Рассмотрим теперь электролиз
растворов некоторых типичных электролитов, чтобы показать при-
менение изложенных выше фактов относительно разряда ионов.
В растворе хлорной меди имеет место следующее равновесие:
CuCl2qz±Cu++ 4-2С1-.
Кроме этих ионов в растворе имеются также ионы воды. Если через
такой раствор пропускать постоянный ток, то ионы меди и водорода
будут передвигаться по направлению к катоду, а хлор-ионы и гидрок-
сил-ионы — к аноду. На катоде ион меди будет разряжаться легче,
чем ион водорода:
Си++ + 20 —>• Си0,
и нейтральные атомы металлической меди будут образовывать слой
металла на полюсе. На аноде будут разряжаться хлор-ионы:
С1- С1°+ 10
2С1° С12,
образуя газообразный хлор С1а, который будет выделяться на аноде
в виде пузырьков.
Если же мы подвергнем электролизу раствор сульфата натрия
Na2SO4, то ионы водорода из воды будут гораздо легче разряжаться,
чем ионы натрия:
Н+ + Ю —н°,
2Н° Н2,
а гидроксил-ионы легче сульфат-ионов:
ОН- ОН0 + 10;
4ОН° 2Н2О 4- О2.
328
ЭЛЕКТРОЛИЗ
В этом случае не разряжается ни один из ионов электролита.
4. Электропроводность. Из всего сказанного выше становится
совершенно очевидным, что электрический ток проходит через раствор
совершенно иначе, чем через металлический проводник. Эффект
однако один и тот же, так как электроны удаляются с катода в ре-
зультате разряда положительных ионов, в то время как другие элек-
троны переносятся на анод отрицательными ионами. При прохожде-
нии тока через металлический проводчик по металлу передвигается
непрерывный поток электронов. Следует также отметить, что при раз-
ряде отрицательных ионов на аноде имеет место окисление, или от-
дача электронов, а при приобретении положительными ионами
электронов у катода имеет место восстановление.
5. Электролитический едкий натр. В предыдущей главе мы
узнали, что одним из важных технических методов получения едкого
натра является электролиз водных растворов поваренной соли. Те-
перь мы уже в состоянии понять механизм этого процесса. Хлори-
стый натрий диссоциирует следующим образом:
NaCl —Na++ С1~.
На катоде разряжаются ионы водорода:
н+ + ie -> н°,
2Н° -> На,
причем ионы натрия остаются в растворе. По мере разряжения ионов
водорода диссоциирует все большее количество молекул воды:
НОН — Н+ +он-,
и вокруг катода возрастает концентрация гидроксильных ионов.
Ионы натрия и гидроксильные ионы образуют вокруг катода водный
раствор едкого натра, который, если его удалить из электролитиче-
ской ванны и выпарить досуха, дает твердый едкий натр. Таким об-
разом в числе образующихся продуктов мы имеем водород и едкий
натр. На аноде разряжается хлор-ион в виде газообразного хлора:
С1- С1° + 10;
2С1° — С12.
Этот газ частично растворим в воде, и если не принять предосторож-
ностей, то он продиффундирует через раствор электролита и проре-
агирует с раствором едкого натра:
С12 + 2NaOH — NaCl + NaClO + Н2О.
Чтобы избежать этого, применяются специальные электролитиче-
ские ванны, в которых, в том случае если желательно в качестве од-
ного из продуктов получать едкий натр, смешение продуктов, обра-
зующихся около каждого электрода, затруднено. Однако гипохло-
рит натрия NaClO, образующийся в результате призведенной выше
реакции, является ценным антисептическим средством (известным
ЭЛЕКТРОЛИЗ
329
в продаже под названием «зонита»). При электролизе NaCl он полу-
чается по дешевой цене, если не препятствовать смешению растворов.
6. Электрометаллургия. Процесс, посредством которого металл
извлекается из его руды, — процесс восстановительный. Мы уже
видели (стр. 132), что для этого восстановления применяется в каче-
стве восстановителя чаще всего кокс. Однако кокс нельзя применять
для восстановления окислов весьма активных металлов, стоящих в
ряду напряжений до цинка. Учитывая, что при электролизе на ка-
тоде происходит восстановление, можно использовать этот процесс
для восстановления ионов этих активных металлов до нейтрального
состояния, конечно в том случае, если
вольтаж достаточно высок (стр. 270).
Однако это нельзя осуществить в
водном растворе, так как в этом слу-
чае вместо иона более активного
металла будет разряжаться менее
активный ион водорода. К счастью,
электролиз можно осуществить и в
отсутствии воды, пропуская ток че-
рез расплавленный электролит. Рас-
плавление, так же как и растворе-
ние, делает подвижными ионы, кото-
рые были до этого неподвижны в
твердом кристалле, и дает им воз-
можность передвигаться в электро-
статическом поле.
Вас несомненно заинтересует Гемфри Дэви
история электрометаллургии. Откры-
тие вольтова или гальванического элемента, сделанное италь-
янским физиком Вольтой около 1800 г., впервые дало возможность
получить и изучить электрический ток. Гемфри Дэви (стр. 206),
который в это время был секретарем Королевского общества, вскоре
начал экспериментировать в Королевском институте с самым боль-
шим в мире, по тому времени, вольтовым столбом. В 1807 г. он опубли-
ковал сообщение о том, что им получен металлический натрий и калий
разложением расплавленных гидроокисей натрия и калия. Интересно
привести его собственные слова, характеризующие это открытие,
сделавшее эпоху:
При этих условиях вскоре началась бурная реакция. Поташ начал
плавиться в обеих точках электризации. На верхней поверхности было за-
метно бурное вскипание, на нижней, или отрицательной поверхности,
не происходило выделения упругой жидкости, но появились маленькие
глобулы (шарики) с металлическим блеском и по виду чрезвычайно похо-
жие на капельки ртути. Некоторые из этих глобул, немедленно по их обра-
зовании, загорались со взрывом и с ярким пламенем, другие же не изменя-
лись и только блекли и затем покрывались белой'пленкой, образующейся
на их поверхности. Эти глобулы, как показали многочисленные опыты, ока-
зались тем самым веществом, которое я искал, особая горючая первопри-
чина, основа поташа.
330
ЭЛЕКТРОЛИЗ
Через год Дэви удалось с помощью того же метода впервые
получить элементы барий, кальций и магний.
В настоящее время с помощью тех же в основном методов, кото-
рыми 100 лет тому назад пользовался Дэви, получаются в промыш-
ленном масштабе натрий и магний.
7. Алюминий. Дэви однако не удалось выделить чистый алюми-
ний. Этот элемент был впервые изолирован в 1827 г. восстановлением
хлористого алюминия металлическим калием:
А1С13 + ЗК 3KCI А1.
В 1854 г. Анри Сент-Клер-Девиль, пользуясь финансовой под-
держкой Луи-Наполеона, наладил получение алюминия в производ-
ственном масштабе, применяя для восстановления хлористого алю-
миния металлический натрий, получаемый им электролитически.
Сперва (в 1855 г.) алюминий продавался по цене 90 долл, за фунт
(454г), но в 1886 г. цена его упала до 12 долл., и годовое производство
достигло 5 000 фн. В то время алюминий применялся дня изготовления
ювелирных изделий. Поль Эру, который позднее разработал способ,
по которому алюминий получается и в наше время, рассказывает
следующий любопытный случай:
В то время у меня был друг, ставший впоследствии моим партнером,
и мы оба буквально были без гроша в кармане. Мы уже заложили все, что—
только можно было заложить. Вдруг моему партнеру пришла в голову бле-
стящая мысль. Он принес из дому алюминиевый стержень длиной около
6 дм, который его семья ценила чрезвычайно высоко, как память от Сен-
Клер-Девиля. Когда мы показали этот стержень ростовщику, он сказал —
«Что это такое, серебрянный слиток?»
Мы сказали: «Нет, это нечто лучшее, это алюминий». «Алюминий» —
сказал он, —«что это такое?»
Затем он прикинул его на руке и сказал: «Что это такое, он вероятно
внутри полый?»
Мы ответили: «Нет, это алюминий и он стоит 120 франков за кило-
грамм».
Немного подумав, он сказал: «Ладно, я дам вам за него 2 франка».
В 1886 г. два молодых человека совершенно независимо друг от
друга, один во Франции (Эру), другой в США (Холл) открыли
один и тот же способ электролитического производства алюминия.
Чарльз Мартин Холл, американец, был 22 лет от роду и только год
как получил свой диплом в Оберлине. Эру было примерно столько же
лет. Способ их заключи ся в растворении очищенного минерала бок-
сита (А12О3) в расплавл ином грио те (Na3AlF6) и в пропускании
черзз плав тока достаточн > сысского напряжения, чтобы восстановить
алюминий на катоде (рис. 116). В 1888 г. в Кенсингтоне, около Питтс-
бурга уже работал маленький завод по этому способу. Вначале
завод этот производил алюминий по цене 2 долл, за фунт. Вскоре на
Ниагарском водопаде были пущены большие заводы и цена на алюми-
ний упала. В настоящее время его рыночная цена около 20 центов
за фунт. В результате таких низких цен алюминий нашел целый ряд
применений, начиная от прозаических кастрюль и сковородок и до,
ребер мощных дирижаблей.
ЭЛЕКТРОЛИЗ
331
8. Электрорафинировка металлов. Некоторые металлы, в част*
пости медь, требуются в больших количествах и в весьма чистом
состоянии. Электрический ток во многих случаях дает нам возмож-
Рис. 116. Ванны для электролитического получения алюминия.
чма Си
Си
Ли
Рис. 117. Электрора-
финировка меди.
Си^—
Zn*-±
—
ность осуществить необходимое рафинирование. Чрезвычайно чистая
медь требуется в больших количествах для электрических проводов,
так как даже следы примесей заметно уменьшают проводимость
меди. Электролитическая ванна для электрорафинирования меди
состоит из одного электрода из чистой меди, который служит катодом,
и из медной болванки, служащей анодом,
причем оба электрода погружены в раствор
сульфата меди'(рис. 117). Применяется по-
стоянный ток низкого напряжения (0,4 воль-
та). До сих пор мы рассматривали только
электроды, состоящие из инертного мате-
риала, например из угля или платины. При
применении таких электродов ионы разря-
жаются на каждом электроде. При примене-
нии же в качестве анода металлов более
активных, чем платина, нейтральные атомы
этих металлов могут превратиться в ионы,
оставив свои электроны на электроде. Среди
примесей в меди имеются более активные ме-
таллы, например цинк, и менее активные, например серебро изолото.
Когда пускается ток, сульфат-ионы электролита и ОН-ионы воды
передвигаются по направлению к аноду. Если бы анод был инерт-
ным, то ОН-ионы на нем разрядились бы; в даном же случае, вместо
этого, нейтральные атомы анода превращаются в ионы. Чем активнее
332
ЭЛЕКТРОЛИЗ
металл, тем легче он ионизирует (стр. 324), так что из четырех метал-
лов— цинка, меди, серебра и золота — цинк будет ионизировать
при наиболее низком вольтаже:
Zn° — Zn++ + 20.
Таким образом весь цинк переходит в раствор в виде ионов цинка.
Но атомов цинка настолько мало по сранению с атомами меди, что
последние также превращаются в ионы:
Си0 — Си + + +20.
Рис. 118. Ванны для электрорафинировки меди.
Для превращения серебра и золота в ионы требуется более высокое
напряжение, так что эти металлы остаются в виде нейтральных ато-
мов и падают на дно ванны в виде шлама, который естественно
является ценным побочным продуктом этого процесса.
Три положительных иона — цинка, водорода и меди — пере-
двигаются по направлению к катоду. Из всех этих ионов ион меди
разряжается при наименьшем вольтаже. Поэтому на катоде, пред-
ставляющем пластину из чистой меди, выделяется только одна медь:
Си++ +20 — Си0.
9. Гальванопластика и электротипия. Электрический ток ши-
роко применяется для покрытия металлов гальваническим способом.
Тот предмет, который хотят покрыть металлом, делают катодом и по-
гружают его в электролит, содержащий ионы того металла, слой
которого хотят нанести. Эти ионы при своем разряжении образуют
слой металла на катоде. Конечно гальванопластика невозможна для
очень активных металлов, но так как слой металла обычно должен
служить для предохранения, то покрытие активным металлом при-
ГАЛЬВАНИЧЕСКИЕ ЭЛЕМЕНТЫ
333
несло бы мало пользы. В гальванопластике чаще всего применяются
никель, хром, медь, серебро и золото.
Электротипия — один из видов гальванопластики. Для печата-
ния книги текст сперва набирается на монотипе или линотипе из
мягкого типографского металла. Для большого числа оттисков приме-
нять этот шрифт ввиду его мягкости нельзя, так что с такой матрицы
делают восковой слепок, покрывают его графитом, чтобы сделать
поверхность электропроводной, и погружают слепок вместо катода
в раствор сульфата меди. Затем с помощью электрического тока от-
лагают на нем слой меди толщиной в 0,006 дюймов (0,15 мм), вос-
ковой слепок удаляют, а медный футляр укрепляют, наливая в него
расплавленный типографский металл.
ГЛАВА XXXI
ГАЛЬВАНИЧЕСКИЕ ЭЛЕМЕНТЫ
Все химические реакции сопровождаются энергетическими изме-
нениями. Мы уже знаем (стр. 82), что химическая реакция может
быть или экзотермической, или эндотермической, т. е. при реакции
либо выделяется, либо поглощается энергия. В большинстве случаев
при химических реакциях происходит выделение энергии в виде теп-
ла. Однако это не всегда так. Мы уже знаем, что при некоторых хи-
мических реакциях может накапливаться лучистая энергия (стр. 89),
а недавно узнали (стр. 324), что при других реакциях может погло-
щаться электрическая энергия. Определенный тип экзотермических
реакций можно осуществлять таким образом, чтобы при них вместо
тепловой выделялась бы электрическая энергия. Этот тип реакций
и лежит в основе всех гальванических элементов.
1. Реакции окисления-восстановления как источник электриче-
ской энер ии. Реакции окисления-восстановления, как читатель ве-
роятно помнит, заключаются в переходе электронов от атомов того
элемента, который окисляется, к атомам элемента восстанавливаемого.
В свое время был подробно разобран ряд примеров такого рода
(стр. 187); несомненно будет полезно вспомнить эти примеры еще раз.
Простейшим случаем реакции окисления-восстановления яв-
ляется прямое соединение двух элементов. В большинстве случаев
при такой реакции выделяется энергия, которая может быть исполь-
зована в качестве источника электрической энергии. Рассмотрим в ка-
честве типовой реакцию, протекающую между цинком и хлором,
в результате которой образуется хлористый цинк:
Zn -ф С12 —► ZnCI2.
Происходящие при этом изменения валентности, а также и переход
электронов, их обусловливающий, можно изобразить следующим
образом:
Zn° -*Zn+24-20;
Cl2 + 20. — 2С1-.
334
ГАЛЬВАНИЧЕСКИЕ ЭЛЕМЕНТЫ
Атомы цинка окисляются, а атомы хлора восстанавливаются. По-
стараемся себе представить механизм такой реакции. Мы погрузили
полоску металлического цинка в раствор газообразного хлора
в воде. В данном случае мы имеем дело с реакцией, которая будет
протекать на границе двух фаз, т. е. на поверхности цинка. Мы можем
вообразить, что молекулы хлора, состоящие каждая из 2 атомов, уда-
ряются о поверхность цинка. Часто при таких ударах 2 электрона
переходят от нейтрального атома цинка к паре атомов молекулы
хлора. Эти атомы превращаются в ионы хлора С1“, и аналогич-
но— атом цинка переходит в раствор в виде иона цинка Zn+ + .
Все, что требуется для этой реакции — это переход электронов от
атома цинка к атомам хлора. Если при этом переходе электронов
атомы находятся в физическом контакте друг с другом, то выделя-
ющаяся энергия принимает форму тепла. Но переход этот может быть
Рис. 119. Схема гальвани-
осуществлен и другим путем. Можно сде-
лать гальванический элемент, в котором
реагирующие атомы не будут находиться
в физическом контакте, а будут соединены
металлическим проводником, по которому
можно посылать электроны от цинка
к хлору.
Такой элемент даожно построить сле-
дующим образом. Два стакана наполняют
раствором такого электролита, который
не реагирует ни с цинком, ни с хлором;
вполне подойдет для этой цели хлористый
ческого элемента. натрий. Растворы в стаканах соединены
друг с другом с помощью перевернутой
U-образной трубки, наполненной тем же раствором (рис. 119). За-
тем один из растворов насыщается газообразным хлором, а в другой
погружается цинковый электрод. Угольный электрод, погружен-
ный в раствор, насыщенный газообразным хлором, заканчивает
оборудование элемента. Цинковый стержень и хлор отделены
друг от друга, но они все же вступят в реакцию, если оба электрода
соединить проволокой.
Вам вероятно непонятна роль перевернутой U-образной трубки.
Назначение ее состоит в том, чтобы препятствовать переходу (диф-
фундированию) молекул хлора в раствор, окружающий цинковый
электрод, и в то же время давать возможность ионам соли передви-
гаться в электрическом поле электродов. Так как электроны уходят
из цинкового полюса (отрицательного полюса элемента), то этот
полюс становится более положительным. Поэтому хлор-ионы раствора
передвигаются по направлению к этому полюсу. С другой стороны,
угольный полюс становится более отрицательным, так как по про-
волоке к нему текут электроны, поэтому ионы натрия раствора пере-
двигаются по направлению к этому полюсу.
2. Равновесие между металлом него ионами в растворе. Реакция
замещения является реакцией окисления-восстановления, поэтому
ГАЛЬВАНИЧЕСКИЕ ЭЛЕМЕНТЫ
335
она может быть использована в качестве источника электрической
энергии. Реакция между металлическим цинком и ионами меди:
Zn 4- Cu+ + —► Zn* + 4- Си
лежит в основе одного важного элемента, элемента Даниэля. Сухой
элемент также принадлежит к подобному типу. Чтобы понять меха-
низм действия таких элементов, мы должны посмотреть, что происхо-
дит при погружении металла, например цинка, в раствор, содержа-
щий его ионы (рис. 120). Здесь мы имеем дело с двумя противополож-
ными тенденциями: с тенденцией нейтральных атомов металличе-
ского цинка перейти в раствор в виде ионов цинка, оставив на ме-
талле электроны;
Zn° —* Zn** 4-2©,
и с тенденцией ионов цинка приобрести электроны от металлической
пластинки и превратиться в нейтральные атомы свободного металла:
Zn* + 4-2© ->Zn°.
Первая реакция — реакция образования ионов цинка из нейтраль-
ных атомов цинка — зависит от свойства, присущего атомам цинка,
которое Нернст назвал электролитической упру-
гостью растворения. Величина упругости раство-
рения характерна для каждого металла; чем
активнее металл, тем больше эта величина. В эле-
ктродвижущем ряде металлов те металлы, кото-
рые обладают максимальной упругостью раство-
рения, расположены в начале рядй, обладающие
же минимальной — в конце ряда. Когда ней-
тральные металлические атомы переходят в раст-
Рис. 120. Элект-
родный потенциал
цинка.
вор в виде положительно заряженных ионов, они
оставляют электроны на том металле, который
растворяется. Металл делается более отрицатель-
ным, а раствор более положительным. Это ведет
к притяжению всех положительных ионов раствора
к металлу и оказывает важное влияние на равновесие, как мы это
увидим в следующем параграфе.
Рассмотрим случай, когда полоска металлического цинка по-
гружена в раствор, содержащий ионы цинка, например в раствор
хлористого цинка. Ионы эти двигаются беспорядочно, в зависимости
от теплового движения, которое в свою очередь является функцией
температуры. При данной температуре скорость, с которой они бом-
бардируют нейтральную полоску цинка, пропорциональна их кон-
центрации. При соприкосновении иона цинка с поверхностью ме-
таллического цинка ион имеет возможность приобрести электроны
и превратиться в нейтральный атом цинка, направив в обратную
сторону реакцию, рассмотренную нами выше:
Zn++4-2© —* Zn°.
336 ГАЛЬВАНИЧЕСКИЕ ЭЛЕМЕНТЫ
Скорость, с которой это происходит, не только пропорциональна
концентрации ионов, но и электростатическим силам притяжения
между ионами цинка и цинковым электродом, который теперь за-
ряжен отрицательно вследствие происходящего растворения атомов
цинка (в виде ионов). Таким образом, подводя итоги, мы можем ска-
зать, что скорость rit с которой атомы металлического цинка превра-
щаются в ионы
Zn°—* Zn++ 4-2©,
пропорциональна электролитической упругости растворения цинка:
rt электролитической упругости растворения,
тогда как скорость rd, с которой ионы цинка отлагаются на металле
в виде нейтральных атомов
Zn++ 4- 2© —> Zn°,
пропорциональна концентрации ионов цинка и величине электро-
статических сил, действующих между ионами и отрицательно заря-
женным полюсом. В том случае, когда
П = rd,
т. е. когда упругость растворения уравновесит стремление ионов
выделиться из раствора, установится равновесие:
Zn°^=t Zn++ 4-2©.
Электролитическая упругость растворения цинка настолько велика,
что нельзя приготовить такого раствора ионов цинка в воде, концен-
трация которых была бы ей равна. Поэтому при погружении метал-
лического цинка в раствор Zn++ нейтральные атомы всегда будут
превращаться в ионы с большей скоростью, чем та, с которой ионы
цинка будут разряжаться на металле. Поэтому металл будет посте-
пенно становиться все более и более отрицательным по отношению
к раствору, и так до тех пор, пока силы электростатического притя-
жения между отрицательно заряженным металлом и положительно
заряженными ионами цинка в растворе не увеличатся настолько, что
скорости эти сравняются. При состоянии равновесия, в случае цинка
и других активных металлов, металл бывает отрицательно заряжен-
ным по отношению к раствору.
С другой стороны, если такой неактивный металл, как, напри-
мер, медь, погрузить в раствор с умеренной концентрацией ионов
меди, электролитическая упругость растворения этого неактивного
металла будет настолько мала, по сравнению с концентрацией ионов
и стремлением их выделиться из раствора, чго ионы меди начнут
отлагаться с большей скоростью на металле
Си + + 4-2© — Си®,
ГАЛЬВАНИЧЕСКИЕ ЭЛЕМ ЕНТЫ
337
чем нейтральные атомы меди превращаться в ионы:
Си0—*• Си + + +20.
Это поведет к тому, что металл зарядится положительно по отноше-
нию к раствору и будет стремиться отталкивать ионы. При состо-
янии равновесия мы имеем в данном случае:
Cu°^Cu + + +2Q,
так как здесь электростатические силы будут силами отталкивания,
работающими против концентрации ионов. При равновесии металл
заряжен положительно по отношению к раствору.
Во всех случаях электростатические силы возрастают настолько
быстро после погружения металла в раствор его ионов, что равнове-
сие устанавливается еще до отделения заметного количества металла
от пластинки или осаждения значительного количества металла на
пластинке.
3. Электродные потенциалы и электродвижущий ряд. Мы уже
показали качественно, что при установлении равновесия между
металлическим цинком и ионами цинка металл заряжен отрицатель-
но по отношению к раствору. Проблема количественного измерения
имеющейся здесь разности потенциалов затрудняется практической
невозможностью присоединить раствор к вольтметру, не погружая
в него металлического проводника. А в этом случае установится
разность потенциалов между этим проводником и ионами раствора,
так что напряжение, указываемое вольтметром, будет зависеть от
двух разностей потенциалов: разности потенциалов металлического
цинка в контакте с ионами цинка и металлического проводника в
контакте с тем же раствором.
Для избежания этого затруднения, электродные потенциалы
металлов измеряются с помощью так называемого водородного элек-
трода. Последний состоит из платинового электрода с весьма губча-
той поверхностью, насыщенной газообразным водородом при давле-
нии в 1 ат, и погруженного в раствор, нормальный по отношению
к ионам водорода х. Платиновый полюс, насыщенный таким образом
водородом, является в основном водородным электродом. Этот элек-
трод находится в равновесии с ионами водорода раствора. Разность
потенциалов между таким электродом и раствором принимается
условно равной нулю. Для того чтобы измерить электродный
потенциал какого-нибудь другого электрода, собирают гальваниче-
ский элемент, в котором этот электрод будет одной половиной элемен-
та, а водородный электрод — другой. Например, когда хотят опре-
делить электродный потенциал цинкового электрода, применяют
элемент вроде изображенного на рис. 121. В таком элементе в трех
1 Такие растворы содержат 1 граммион водородных ионов на литр. Вообще
нормальный раствор иона содержит в литре раствора такое весовое количество
иона, которое равно атомному весу, деленному на валентность иона.
22 Введение в химию.
338
ГАЛЬВАНИЧЕСКИЕ ЭЛЕМЕНТЫ
местах имеется разность потенциалов: между каждым из метал-
лов и соответствующим ему раствором и между обоими растворами.
Вот эти-то три величины и определяют разность потенциалов самого
элемента. Из этих трех разностей потенциалов разность между раство-
рами может быть сведена к минимуму, если в U-образной трубке,
служащей сифоном и соединяющей оба раствора, применять раствор
хлористого калия. Электродный потенциал водородного электрода
принимается равным нулю, так что вся электродвижущая сила эле-
мента, т. е. разность потенциалов между цинковым электродом и водо-
родным, измеряемая вольтметром, зависит от электродного потен-
циала цинка. Если измерить разность потенциалов такого элемента,
то окажется, что она равна 0,75 вольта.
Рис. 121. Измерения элек-
тродного потенциала цинка
с помощью водородного
электрода.
Это и будет электродным потенциалом
цинкового электрода в растворе ионов
цинка нормальной концентрации. В слу-
чае металлов более активных, чем водо-
род, т. е. с большей упругостью раство-
рения, металл окажется отрицательным по
отношению к раствору, и электродный по-
тенциал будет иметь знак минус. Для ме-
таллов, менее активных, чем водород, ве-
личина электродного потенциала будет
положительной.
Электродвижущий ряд металлов по-
лучается, если расположить металлы в по-
рядке, определяемом их электродными
потенциалами, причем металлы с наиболее отрицательными электрод-
ными потенциалами следует расположить первыми, а металлы с наи-
более положительными электродными потенциалами — последними.
Таблица LXVII. Электродные потенциалы металлов по отно-
шению к нормальным растворам их ионов
Металл Ион Потенциал i (вольты) Металл Ион Потенциал (вольты)
К к+ -2,92 Sn Sn+ + —0,14
Na Na + -2,72 Pb Pb+ + -0,13
Са Са + + -2,5 (?) H, H + 0,00
Mg Mg+ + -1,55 Cu Cu + + +0,39
Al А1 + + + -1,34 Hg Hg+ +0,79
Zn Zn+ + -0,75 Ag Ag + +0,80
Fe Fe+ + -0,44 Au Au + + 1,5 (?)
Пользуясь этими электродными потенциалами, можно вычи-
слить разность потенциалов элементов, состоящих из любых двух
электродов в нормальном растворе их ионов. Сейчас мы рассмотрим
несколько элементов такого типа.
ГАЛЬВАНИЧЕСКИЕ ЭЛЕМЕНТЫ
339
4. Элемент Даниэля или гравитационный элемент. В этом эле-
менте в качестве источника электрической энергии использована
реакция замещения, протекающая между металлическим цинком
и ионами меди:
Zn° 4- Cu*+ —Zn++ + Си0.
Он состоит, в основном, из цинкового и медного электродов, находя-
щихся в растворах их ионов, как это схематически показано на
рис. 122. Если в растворах мы имеем нормальные концентрации ио-
нов цинка и меди, то разность потенциалов элемента будет равна
разности обоих электродных потенциалов, т. е. +0,39—(—0,75)=
= 1,14 вольта. Однако величина эта может быть еще увеличена в слу-
чае применения весьма разбавленного раствора ионов цинка, чтобы
Рис. 122. Схема элемента Даниэля.
Рис. 123. Гравитационный элемент.
сделать цинковый электрод возможно более отрицательным по отно-
шению к своему раствору, а также в случае применения насыщенного
раствора сульфата меди, чтобы достигнуть высокой концентрации
ионов меди, и сделать медный электрод возможно более положи-
тельным.
В гравитационном элементе медный полюс погружен на дно со-
суда (рис. 123) с раствором сульфата меди, который поддерживается
насыщенным благодаря присутствию нерастворенных кристаллов
соли. Цинковый электрод подвешен над раствором сульфата меди
в разбавленном растворе сульфата цинка, который располагается
над раствором сульфата меди вследствие своей меньшей плотности.
Когда оба полюса соединены проводом электроны передвигаются
от цинка к меди, т. е. от более отрицательного к более положитель-
ному полюсу. Как только электроны оставляют цинковый электрод,
равновесие между атомами металлического цинка и ионами цинка
Zn° z±Zn++ +2©
нарушается, в результате чего большее количество атомов цинка
превращается в ионы, причем электроны остаются на электроде. По
мере притока электронов к медному электроду равновесие между
22*
340
ГАЛЬВАНИЧЕСКИЕ ЭЛЕМЕНТЫ
Рис. 124. Концентрацион-
ный элемент.
нейтральными атомами меди и ионами меди
Си® -> Си++ 4-2©
также нарушается. Так как медный электрод приобретает электро-
ны, то он становится все более отрицательным и на нем разряжаются
ионы меди, приобретая от него электроны.
Таким образом протекают две реакции, поддерживающие поток
электронов. На отрицательном полюсе:
Zn» —Zn+ + 4-2©,
а на положительном полюсе:
2©4-Си++ — Си®.
Таким образом процесс, протекающий в элементе, можно выразить
следующей схемой:
Zn° 4- Cu++ —> Zn++ 4- Си®.
Так как концентрация ионов цинка вокруг цинкового полюса воз-
растает по мере протекания реакции в элементе, то цинковый электрод
становится менее отрицательным и разность потенциалов элемента
уменьшается.
5. Концентрационные элементы. Так
как электродный потенциал какого-нибудь
металла в контакте с его ионами зависит
от концентрации ионов, то можно по-
строить гальванический элемент, в кото-
ром электроды сделаны из одного и того же
металла, а растворы состоят из одних и
тех же ионов, но разных концентраций.
Такой концентрационный элемент изо-
бражен на рис. 124. Оба полюса сде-
ланы из активного металла — цинка и по-
этому по отношению к своим растворам они
отрицательны. Однако чем разбавленнее
раствор ионов цинка, тем отрицательнее будет металл при состоянии
равновесия. В результате этого цинковая пластина в разбавленном
растворе будет отрицательной по отношению к цинку, находящемуся
в более концентрированном растворе. Если оба полюса соединить
проводом, то электроны начнут передвигаться по проводу от цинко-
вой пластинки в разбавленном растворе к цинковой пластинке в кон-
центрированном растворе. По мере того как электроны по проводу
уходят от отрицательно заряженной цинковой пластинки, нейтраль-
ные атомы цинка превращаются в ионы и оставляют свои электроны
на пластинке:
Zn» — Zn++ 4-2©.
По мере же того как положительный полюс приобретает электроны,
ионы цинка концентрированного раствора также приобретают эле-
ГАЛЬВАНИЧЕСКИЕ ЭЛЕМЕНТЫ
341
ктроны, превращаясь в нейтральные атомы цинка и образуя слой
металлаз
Zn++ + 2© —+ Zn°.
Отрицательные ионы электролита (S04= на рис. 124) передвигаются
по направлению к тому полюсу, который теряет электроны (отри-
цательный полюс элемента), т. е. из более концентрированного к бо-
лее разбавленному раствору. Таким образом по мере передвижения
электронов концентрированный раствор становится более разбавлен-
ным, а разбавленный — более концентрированным. В результате
этого разность потенциалов между полюсами уменьшается до тех
пор, пока наконец концентрации обоих растворов сравняются,
разность потенциалов станет равной нулю и ток прекратится.
Такие элементы дают ток слишком малого напряжения, чтобы
они могли иметь какое-нибудь практическое значение.
6. Сухой элемент. Из гальванических элементов в настоящее
время наиболее широкое применение имеет так называемый «сухой»
элемент. Он получил свое развитие от элемента Лекланше, изобре-
тенного в 1868 г. Источником тока у этого элемента служит следую-
щая реакция замещения:
Zn + 2NH4+ — Zn++ 4-2NH4°;
2NH4o—«- 2NH34-Ha.
Ионы аммония нейтрализуются электронами, полученными от ней-
тральных атомов цинка. Нестойкий нейтральный аммониевый ра-
дикал распадается на аммиак и водород. Если в раствор хлористого
аммония погрузить один цинковый и один угольный электроды, и
электроды эти соединить проводом, то электроны будут течь по этому
проводу от цинка к углю. У цинкового электрода нейтральные атомы
цинка переходят в раствор в виде ионов, причем каждый из них ос-
тавляет на полюсе два электрона:
Zn —► Zn++ + 2©.
На угольном электроде разряжаются ионы аммония:
NH4* +1©-* nh4°,
немедленно же разлагающиеся:
2NH4° — 2NH3 + Н2.
Образовавшийся аммиак переходит в раствор в виде гидрата окиси
аммония:
NH3 + НОН — NH4OH,
газообразный же водород, почти нерастворимый в воде, выделяется
из раствора на угольном электроде в виде пузырьков. Этот газ как бы
изолирует электрод от раствора, создавая электрическое сопротив-
ление и нарушая тем самым активность элемента. В этих случаях
говорят, что элемент поляризуется. Чтобы удалить эту пленку газо-
342
ГАЛЬВАНИЧЕСКИЕ ЭЛЕМЕНТЫ
образного водорода, прибавляют деполяризатор, которым в данном
случае является окислитель — двуокись марганца, нерастворимое
твердое черное вещество. Угольный электрод помещают в пористый
сосуд, а пространство вокруг него набивают окислителем. Последний
окисляет водород в воду:
МпО2 + Н2 —► Н2О + МпО.
Так как это реакция между твердым веществом и газом, то проте-
кает она медленно, и элемент Лекланше лучше всего приспособлен
для прерывного действия, например для звонков и т. п.
Сухой элемент был изобретен Гасснером в 1888 г. и по сути дела
является мокрым, так как никакая реакция не была бы возможной,
если бы хлористый аммоний не был в ра-
створе. Основные его части показаны на
рис. 125. Элемент состоит из цинкового со-
суда, который одновременно служит и от-
рицательным полюсом элемента, и из по-
ложительного электрода (угольный стер-
жень), вокруг последнего имеется спресо-
ванная смесь, состоящая из графита и
хорошо измельченной двуокиси марганца.
Мешок из бумажной материи, содержащий
деполяризующую смесь, окружает уголь-
ный электрод, а пространство между ним
и цинковым сосудом наполнено пасто-
образной смесью из муки и хлористого
аммония. Элемент залит воском. Дей-
ствие его идентично действию элемента Лекланше.
7. Гальванические пары. Мы уже видели, что металлы, более ак-
тивные, чем водород, могут вступать в реакцию с ионами водорода
в растворах кислот, разряжая их и выделяя в виде газообразного
водорода. В случае цинка например мы имеем следующую реакцию:
Y/ольмый злоктооб
воскойая
пробка
Секция су-
лого зле
мента ти-
па мешочка
Цинков
злекдщо
Мучнао
масса
Мешокчз
хлопчато-
бумажной
ткани
Рис. 125. Сухой элемент.
Zn°-J-2Н+—> Zn+++ Н2.
Один из простейших элементов, основанных на этой реакции, состоит
из двух металлов, погруженных в раствор кислоты. Более активный
из этих металлов служит отрицательным полюсом элемента, менее
активный — положительным. Если металлы не соединены друг
с другом и в ряду напряжений стоят перед водородом, то они будут
непосредственно реагировать с кислотой, причем на их поверхности
будет выделяться водород. Если же они соединены посредством про-
водника, то более активный металл будет переходить в раствор
в виде ионов, а на менее активном будут разряжаться ионы водорода.
В случае элемента, состоящего например из цинкового и медного
электродов в растворе серной кислоты, цинк образует ионы, отдавая
электроны
Zn° —*Zn+ + 4-20,
ГАЛЬВАНИЧЕСКИЕ ЭЛЕМЕНТЫ
343
которые по проводу потекут к медному электроду; здесь ионы водо-
рода кислоты, приобретая электроны, будут разряжаться и выде-
ляться в виде газообразного водорода:
2Н+ 4-2© -* Н2.
Та стойкость, с которой железо, за-
щищенное металлическим покрытием, про-
тивостоит коррозии, в значительной мере
определяется относительной активностью
защищающего металла и железа. В оцин-
кованном железе, где в качестве покрытия
служит цинк, стоит только поцарапать его
так, чтобы обнажилось железо, как при
попадании дождевой воды образуется
гальванический элемент (рис. 126). Дож-
Оцинкованное железо
Месть
девая вода содержит угольную кислоту, а
следовательно и водородные ионы. Так как
цинк более активен, чем железо, то он пе-
реходит в раствор в виде ионов цинка, соединяющихся с карбо-
нат-ионами угольной кислоты, образуя нерастворимый карбонат
цинка. Этим предотвращается дальнейшая коррозия цинка. Ионы
водорода выделяются на железе. В случае же белой жести
(рис. 126) мы имеем другое положение: железо более активно, чем
защищающее его олово. Поэтому если в этом случае покрытие
________* поцарапать и обнажить железо, то последнее оки-
сляется, переходя в ионное состояние, и водород
выделяется на олове. Таким образом железо,
покрытое оловом, весьма быстро ржавеет.
Что чистое железо корродирует значительно
труднее, чем чугун или сталь, по всей вероятности
зависит от примесей, присутствующих в последних
Рис. 127. Схема
зарядки и разряда
аккумулятора.
и порождающих электролитическое действие, а
тем самым и ускоряющих окисление железа.
8. Аккуму г. я горы. Аккумулятором называется
такой элемент, который может накапливать эле-
ктрическую энергию, получаемую им от какого-
нибудь внешнего источника, в виде химической
энергии, и отдавать обратно эту энергию, когда
это понадобится. Работа его слагается из двух
процессов: зарядки, при которой электрическая
энергия дается аккумулятору за счет внешнего
источника и накапливается в виде химической
энергии, и разрядки, при которой аккуму-
лятор действует как гальванический элемент. Так как в настоящее
время наиболее широкое применение имеет свинцовый аккумулятор,
то мы и возьмем его в качестве примера работы аккумулятора вообще.
Зарядка представляет собой электролиз. Оба полюса незаряжен-
ного аккумулятора состоят в основном из нерастворимого сульфата
344
ГАЛЬВАНИЧЕСКИЕ ЭЛЕМЕНТЫ
свинца; они погружены в слабый раствор серной кислоты. Тот по-
люс, который должен быть отрицательным в заряженной батарее,
соединяют с отрицательным полюсом источника постоянного тока,
вольтаж которого должен быть выше, чем вольтаж полностью заря-
женного аккумулятора; положительный же полюс аккумулятора
соединяют с положительным полюсом источника тока (рис. 127).
При зарядке протекает следующая реакция:
Е + 2Pb (SO4)2 + 2НгО -> Pb + PbO2 + 2H2SO4. (1)
Эта реакция поглощает электрическую энергию и накапливает ее в
виде химической энергии. Механизм этой реакции до сих пор еще не
вполне объяснен, однако приводимый ниже механизм реакции неви-
димому наиболее прост и логичен. На отрицательном полюсе,
PbSO4 + 2© Pb° + SO4= (2)
свинец восстанавливается до свободного металла, а сульфат-ионы
переходят в раствор. С другой стороны, каждый атом двухвалент-
ного свинца в сульфате свинца отдает на положительном полюсе
еще 2 электрона, становится четырехвалентным и соединяется еще
с 1 сульфат-ионом:
Pb+2SO4 + SO4= -> Pb+4 (SO4)2 + 20. (3)
Образовавшийся персульфат свинца — соль чрезвычайно слабого
основания и поэтому целиком гидролизуется (стр. 297) с образованием
нерастворимой двуокиси свинца:
Pb(SO4)2 + 2H2O — PbO2 + 2H2SO4. (4)
Суммируя уравнения (2), (3) и (4), получим полное уравнение реак-
ции, протекающей при зарядке (1). Заряженный аккумулятор имеет
в качестве отрицательного полюса металлический свинец, а в каче-
стве положительного — двуокись свинца. Так как одним из продуктов
этого процесса является серная кислота, то электролит становится
более концентрированным, следовательно плотность его возрастает,
так что зарядку можно контролировать, измеряя плотность электро-
лита.
Заряженный аккумулятор работает как типичный гальваниче-
ский элемент, когда этот последний дает электрическую энергию.
Реакция, имеющая место при работе аккумулятора, будет как раз
обратной реакции (1):
Pb -J- РЬОа + 2H2SO4 2PbSO4 + 2Н2О + Е. (5)
В данном случае точно неизвестно, что происходит на каждом полюсе.
Указанный ниже механизм реакции дрост, но возможно, что он и не
соответствует действительности.
На отрицательном полюсе:
РЬ° -> РЬ + + +20;
Pb+++SO4= — PbSO4.
коллоиды
345
На положительном полюсе:
2Н+ +2Q — 2Н°;
2Н° 4- РЬО2 — РЬО + Н2О;
Р -> РЬО 4- H2SO4 -> PbSO4 + Н2О.
На обоих электродах образуется сульфат свинца и часть сер-
ной кислоты из раствора уходит.
ГЛАВА XXXII
КОЛЛОИДЫ
Примерно в середине прошлого века Томас Грэм, профессор
химии в университетском колледже в Лондоне, занимался исследова-
нием диффузии растворенных веществ через поры пергаментной бу-
маги и животных мембран. Он нашел, что определенный класс ве-
ществ, например соль и сахар, диффундируют через такие мембраны
тогда как такие вещества, как желатина, клей и т. п., этой спо-
собностью не обладают. Вещества первого рода обычно кристалли-
ческого характера, тогда как вещества второго рода обычно аморфны.
Он предложил для веществ первого рода название «кристаллоиды»,
а для веществ второго рода название «коллоиды» (что значит
по-гречески «клееподобные»).
Классификация Грэма была основана на тех свойствах, которые
он принимал за основные. Соль например была всегда кристаллоидом
и никогда не была коллоидом. Со времен Грэма термин «коллоидный»
принял несколько другое значение. Теперь этот термин относится
скорее к состоянию агрегаций частиц, из которых состоит вещество,
чем к неотъемлемому свойству самого вещества.
1. Коллоидальное состояние. Если бы мы стали растирать и из-
мельчать те относительно грубые кристаллы, из которых обычно
состоят твердые вещества, то частицы становились бы все меньше
и меньше, пока нам, для того чтобы их рассмотреть, не потребовалась
бы лупа или даже сильный микроскоп. Теоретически мы могли бы
продолжать этот процесс раздробления до тех пор, пока каждая
индивидуальная частица не состояла бы из одной молекулы. Дальше
мы уже итти не могли бы, не разлагая химически вещество. Предел
видимости в микроскоп лежит около 0,0005 мм, или, пользуясь мень-
шей единицей измерения, микроном \ который часто применяется
для выражения микроскопических размеров, 0,5 р. Частицы с таким
диаметром примерно в 1 000 раз больше самых больших молекул
и примерно в 500 000 раз больше атома водорода; между частицами
диаметром 0,5 м и молекулами лежат частицы разнообразных раз-
меров. Такие частицы, состоящие из агрегатов молекул, и являются
1 Микрон равен 10-’ (0,001) мм, а миллимикрон, 10-« (0,000001) мм.
Микрон обозначается ц, миллимикрон — тц.
346
КОЛЛОИДЫ
коллоидными. Они лежат в «сумеречной зоне материи», как сказал
Финдлей.
Частицы коллоидных размеров играют важную роль в различных
областях деятельности человека. Из важных промышленных про-
блем, в которых имеют значение коллоиды, можно упомянуть в каче-
стве примера о следующих: очистка воды и очистка сточных вод;
смазка, флотация руд; адсорбенты; дубление; крашение; кирпич;
керамика; стекло и фарфор; каучук; молоко и молочные продукты;
хлебопечение; краски, лаки и пигменты; огнетушители; фотография;
осаждение тумана и дыма и т. д. Некоторых из этих применений кол-
лоидной химии нам еще придется коснуться в этой главе. Что живой
организм построен из тканей, структура которых состоит из частиц
коллоидных размеров, служит указанием на то, что коллоиды играют
важную роль в качестве среды, где протекают жизненные процессы.
2. Типы коллоидных систем. Банкрофт указал на то, что коллоид-
ная химия является наукой о пузырьках, каплях, зернах, нитях
и пленках. Пузырьки газа, капли жидкости, зерна твердого тела —
все эти агрегаты молекул могут иметь коллоидные размеры.
Исследование поведения всех этих тел и относится к области коллоид-
ной химии. Мы знаем, что в истинном растворе частицы растворен-
ного вещества обладают молекулярными или даже еще меньшими
размерами. В коллоидном растворе частицы коллоидных размеров
диспергированы в твердой, жидкой или газообразной среде. Таким
образом, так же как и в случае истинных растворов, мы имеем 9 ком-
бинаций, из которых однако одна невозможна как тип коллоидного
раствора, так как все газы образуют друг с другом истинные раство-
ры. Из всех типов, приведенных в табл. XLV111, наибольший интерес
для нас представляют туманы, дымы, эмульсии и коллоидальные
зерна в жидкости.
Таблица XLVIII. Типы коллоидальных систем
Диспергированная фаза Диспергирующая фаза Пример
Пузырьки газа Капельки жидкости Зерна твердого веще- ства < в газе в жидкости в твердом веществе в газе в жидкости в твердом веществе в газе в жидкости в твердом веществе Невозможен Пена Воздух в некоторых пористых минералах Туман Эмульсия Вода в коровьем масле Дым Коллоидальное золото в воде Натрий в голубых кри- сталлах соли
3. Распознавание коллоидного раствора. Коллоидный раствор
можно отличить от истинною раствора посредством одного явления,
коллоиды
зп
известного под названием эффекта Тиндаля. Читателю вероятно
приходилось видеть, как путь светового пучка в темной комнате очер-
чен отражением света от коллоидных частиц пыли, находящихся
в воздухе. В равномерно освещенной комнате этих пылинок не видно.
Если бы в воздухе комнаты совершенно не было пыли, то мы не
могли бы видеть путь света, так как молекулы воздуха слишком малы,
чтобы давать видимое отражение. Воздух, свободный от пыли, яв-
ляется истинным раствором, так как в нем не содержится никаких
частиц, размер которых был бы больше одной молекулы составляю-
щих воздух газов. Если сильный пучок света пропускать через
истинный раствор, то путь его проследить нельзя. С другой стороны,
при тех же условиях путь светового пучка будет ясно очерчен
в коллоидном растворе, так как каждая коллоидная ча-
стица отражает свет.
Под сильным микроскопом коллоидные растворы вы- Т ’
глядят такими же гомогенными, как и истинные растворы, I
так как суспендированные частицы коллоида слишком малы, Г
чтобы быть видимыми. Однако, сочетая эффект Тиндаля с I
действием сильного микроскопа, Зидентопфи Жигмонди вве- в
ли в 1903 г. применение ультрамикроскопа, с помощью ко- i
торого можно обнаружить присутствие частиц, размер кото- у
рых не больше 10-в см. Такие частицы __________ft_____а
только в 100 раз больше молекулы водо-
рода. В ультрамикроскопе (рис. 128) ин-
тенсивный пучок света — сперва с помо-
щью линзы — фокусируется под прямым
углом к оси микроскопа на какую-нибудь
точку коллоидного раствора. Затем на эту же точку фокусируют и
микроскоп. Применяя вместо видимого света ультрафиолетовые
лучи, можно сфотографировать отражение света от еще более мел-
ких частиц, так как чем короче длина волны света; тем сильнее
отражение.
4. Броуновское движение. В ультрамикроскопе коллоидные ча-
стицы выглядят в виде маленьких световых точек, находящихся
в непрерывном движении. Это движение было впервые обнаружено
одним шотландским ботаником доктором Робертом Броуном, храни-
телем ботанического отдела Британского музея. Он в следующих
словах говорит о своем открытии:
Рис. 128. Схема ультрами-
кроскопа.
Мельчайшие частички твердой материи, полученные из органических
или неорганических веществ, при суспендировании их в чистой воде или
в других водных жидкостях, находятся в движении, объяснить которое
я не могу и которое по своей беспорядочности и кажущейся независи-
мости чрезвычайно похоже на несколько менее быстрые движения неко-
торых простейших инфузорий. Эти мельчайшие движущиеся частицы обла-
дают как будто сферической, или почти сферической формой; диаметр их
лежит между 0,0013—0,0008 мм (приблизительно). Другие частицы зна-
чительно больших и разнообразных размеров, такой же или совершенно
иной формы, в аналогичных условиях находятся в аналогичном дви-
жении.
348
КОЛЛОИДЫ
Причина броуновского движения долгое время оставалась не-
известной, но с развитием кинетической теории тепла стало понят-
ным, что в этом явлении мы имеем еще один пример такого же непре-
рывного движения, как и в случае самих молекул. Классические
опыты Жана Перрена, директора лаборатории физической химии
Парижского университета, количественно доказали правильность
этой гипотезы. Посредством процесса фракционного центрифугиро-
вания ему удалось получить коллоидный раствор гуммигута в воде,
в котором взвешенные частицы были все одинакового размера. Этот
размер можно было непосредственно установить под микроскопом,
а зная их плотность, можно было вычислить и массу частиц. Прямым
наблюдением ему удалось определить их скорость, а следовательно
и кинетическую энергию. Результаты его вычислений оказались
потрясающими. Оказалось, что средняя кинетическая энергия ча-
стиц, масса которых колебалась в широких пределах (масса самой
тяжелой была в 60 000 раз больше, чем масса самой легкой), соответ-
ствовала кинетической энергии молекул газа при той же температуре.
Его небольшие частицы были примерно в 10й раз тяжелее молекулы
водорода. Кинетическая же энергия их одинакова.
5. Приготовление коллоидных растворов. Методы, с помощью
которых могут быть получены коллоидные растворы, можно для
удобства разбить на две группы. К первой группе принадлежат спо-
собы, с помощью которых грубые частицы измельчаются до коллоид-
ных размеров; такого рода способы называются пептизацией.
Ко второй группе принадлежат способы, с помощью которых коллоид-
ные частицы создаются из отдельных молекул, причем такие способы
называются коагуляцией*.
Наиболее очевидным методом пептизации твердого вещества яв-
ляется растирание, но до последнего времени этот способ не имел
практического значения. Однако за последние 10 лет были изобре-
тены коллоидные мельницы (рис. 129), посредством которых твердые
частицы можно измельчить до коллоидных размеров. Эти мельницы
оказались весьма важными в практическом отношении для изготовле-
ния различных красок, коллоидального топлива, которое течет по
* Автор объединяет под термином «пептизация» все методы получения
коллоидных растворов путем перехода от более крупных частиц к более мел-
ким, относя сюда механическое размельчение, взбалтывание и т. д. Это не со-
ответствует общепринятому значению термина «пептизация», которым обозна-
чается процесс перевода твердого тела (осадка) в коллоидный раствор с по-
мощью небольших количеств подходяще выбранного химического реактива.
Так, например с помощью небольшого количества щелочи можно перевести в
коллоидный раствор большое (сравнительно со щелочью) количество осадка оло-
вянной кислоты; другим примером может служить пептизация сернистой меди
сероводородом.
Точно так же термин «коагуляция» употребляется обычно для обозначе-
ния процесса укрупнения коллоидальных частиц.
Поэтому для обозначения этих двух прямо противоположных направлений
получения коллоидных растворов лучше употреблять термины «дисперсионный
метод» (дисперсия значит рассеяние), частным случаем которого является пеп-
тизация, и «конденсационный метод». Ред.
КОЛЛОИДЫ
349
трубам, как жидкость, наполнителей для бумаги и резины и в целом
ряде других отраслей промышленности. С помощью коллоидной мель-
ницы могут быть получены даже частицы с диаметром равным только
0,01 ц.
Методом, аналогичным растиранию и могущим быть примененным
для приготовления эмульсий, является взбалтывание. Это ведет
к тому, что одна из жидкостей разбивается на все меньшие и меньшие
капельки, суспендированные в другой жидкости. Так как две ма-
ленькие капельки менее стойки, чем одна большая, то эти капельки
обладают значительной тенденцией соединиться друг с другом, как
Рис. 129. Коллоидная мельница.
только прекращается взбалтывание. Этого можно избежать прибав-
лением эмульгатора, который образует пленку вокруг капелек дис-
пергированной фазы. Приготовление стойкого соуса (майонез) может
служить примером применения такого рода эмульгатора (рис. 130).
Масло для салата, для которого служит какой-нибудь жидкий жир,
например хлопковое масло (стр. 399), диспергируют в уксусе (разбав-
ленный раствор уксусной кислоты в воде) путем взбалтывания, еще
лучше взбивания.
В качестве эмульгатора прибавляют содержимое яйца, которое
обволакивает капельки масла и препятствует их соединению друг
с другом.
Вещества, первоначально названные Грэмом коллоидами, на-
пример клей, желатина, пептизируются, если их поместить в соответ-
ствующую пептизирующую среду; при этом следовательно полу-
чается не истинный раствор, а коллоидный.
Методы коагуляции, состоящие в образовании коллоидных
частиц из молекул, зависят, вообще говоря, от быстрого образования
350
коллоиды
соединений, не растворимых в той среде, в которой протекает реакция.
Мы уже указывали (стр. 42) на то, что для образования из раствора
больших кристаллов раствор должен быть только слегка пересы-
щенным так, чтобы молекулы, выходящие из раствора, имели
возможность принять участие в построении уже имеющихся кристал-
лов, а не образовывали бы новые кристаллы. И наоборот, кристаллы,
образующиеся из чрезвычайно пересыщенного раствора вследствие
быстрой кристаллизации весьма малы. Когда в результате химиче-
ской реакции, протекающей между электролитами, получается нера-
створимое соединение, то это ведет к образованию осадка, т. е. к
почти мгновенной кристаллизации. При этих условиях часто кри-
сталлы получаются весьма мелкими. Осадки некоторых веществ
Рис. 130. Майонез (соус), полученный обыкновенным сбиванием
и на коллоидной мельнице (под микроскопом).
обладают коллоидными размерами и потому остаются 'взвешенными
в жидкости. Например при реакции между сероводородом и гидро-
окисью трехвалентного мышьяка получается коллоидный раствор
трехсернистого мышьяка:
3H2S + 2As (ОН)3 — As2S8 + ЗН2О,
частицы которого настолько малы, что они легко проходят через
поры фильтровальной бумаги. Можно получить также коллоидный
раствор гидрата окиси железа гидролизом хлорного железа:
FeCl3 + ЗНОН Fe (ОН)3 + ЗНС1.
Коллоидные растворы неактивного металла могут быть легко
получены обработкой раствора, содержащего ион этого металла,
каким-нибудь восстановителем. Восстановитель отдает свои электро-
ны ионам металла и восстанавливает их до нейтральных атомов ме-
талла. Разбавленные растворы хлорного золота легко восстанавли-
ваются с образованием суспензий коллоидных частиц металлического
золота растворами таннина, который представляет собой слабый
восстановитель.
коллоиды
351
6. Адсорбция. Некоторые из наиболее важных свойств коллоид-
ных частиц зависят от той огромной поверхности, которой обладают
эти частицы по сравнению с их массой. По мере того как какое-
нибудь определенное количество материала все более и более раз-
дробляется, его суммарная поверхность быстро возрастает. Это
видно из табл. XL IX.
Таблица XLIX. Прогрессивное раздроблен'ие куба
Длина ребра Число кубов Общая по- верхность Длина ребра Число кубов Общая по- верхность
1 см 1 мм 0,1 » 0,01 » 1 и 1 1000 1x10е 1 х 10® 1 х 101а б см2 60 » 600 » 6000 » 6 м2 0,1 н 0,01 » 1 Ш|1 0,1 » 1 X 101® 1x10“ 1 х 1021 1Х1021 60 м2 600 » 6000 » 60000 »
Молекулы на поверхности находятся в исключительном поло-
жении. В отличие от молекул, находящихся внутри, они не окружены
со всех сторон другими молекулами. Силы межмолекулярного при-
тяжения неуравновешены на поверхностной стороне этих молекул.
Поэтому-то они и обладают способностью удерживать на своей поверх-
ности молекулы других веществ. Это и называется «адсорбцией».
Лэнгмьюр предложил теорию, согласно которой вещества, погло-
щаемые таким образом на поверхности, лежат слоем, толщина кото-
рого не превышает одной молекулы. Весьма пористые вещества, как
например древесный уголь, силикагель или фуллерова земля, яв-
ляются хорошими адсорбентами благодаря их относительно большой
поверхности. Применение древесного угля для адсорбции крася-
щего вещества из растворов сахара общеизвестно, а его способность
конденсировать на своей поверхности газы спасла не одну жизнь
во время мировой войны. Весьма ценно для нас то, что адсорбция —
процесс избирательный. Активированный уголь в противогазах
в значительной степени поглощает ядовитые газы, но пропускает
почти все молекулы кислорода и азота. Вообще, чем легче газ кон-
денсируется, тем сильнее он поглощается, что и следовало ожидать,
так как силы межмолекулярного притяжения сильнее именно у
этих газов. Фуллерова (инфузорная) земля находит широкое приме-
нение для обесцвечивания специальных нефтяных продуктов, напри-
мер при производстве белого вазелина. Хлопковое масло, будучи
обесцвечено этим адсорбентом, представляет собой масло для салата
лучшего качества. Активность катализаторов также в значительной
степени зависит от площади их поверхности, что указывает на то,
что адсорбция играет важную роль в каталитических явлениях.
Одно из наиболее важных применений адсорбции — флотация
руд в металлургии (стр. 132). Для этого низкосортную, например
сернистую, руду хорошо измельчают и взбалтывают с помощью тока
352
КОЛЛОИДЫ
воздуха с водой, к которой прибавлено небольшое количество деше-
вого соснового масла. Масло адсорбируется сернистой рудой, а вода —
пустой породой. Смазанный маслом минерал подымается на поверх-
ность пузырьками воздуха, обволокнутыми маслом. Пустая порода
садится на дно. В США с помощью этого процесса концентри-
руется около 60 000 000 т руды в год.
Адсорбция имеет место и при крашении текстильных волокон
красителем. Бумажные волокна поглощают красители труднее, чем
шелк и шерсть, так что часто при крашении применяются протравы.
Для этого на бумажных волокнах отлагают коллоидальный гидрат
Рис. 131. Флотационные машины для концентрирования
медных руд.
окиси алюминия, погружая ткань в раствор алюминиевой соли, кото-
рая гидролизуется в гидроокись водяным паром. Затем уже коллои-
дальная протрава поглощает краситель.
7. Заряды коллоидных частиц. Между коллоидными частицами ди-
спергированной фазы и диспергирующей средой существует разность
потенциалов, т. е. некоторые типы коллоидных частиц более отри-
цательны, а другие более положительны, чем та среда, в которой они
суспендированы. По всей вероятности это вызывается избирательным
поглощением поверхностью коллоидов ионов, которые всегда суще-
ствуют в известном количестве в растворах. Наличие таких зарядов
легко можно показать, погрузив в коллоидный раствор электроды,
к которым приложена извне электродвижущая сила. При этих
условиях коллоидные частицы ведут себя подобно ионам. Если они
заряжены положительно, то передвигаются по направлению к ка-
тоду, если же отрицательно — то к аноду. Это передвижение коллоид-
ных частиц называется катафорезом. Вообще говоря, коллоидные
коллоиды
353
Ф. Дж. Коттрель.
частицы окисей и гидроокисей стремятся адсорбировать положи-
тельные ионы и поэтому становятся заряженными положительно.
Коллоидные же металлы и сульфиды стремятся приобрести отрица-
тельный заряд.
То, что все частицы данного коллоидного раствора обладают
одним и тем же зарядом, заставляет их отталкиваться друг от друга
и тем самым препятствует коагуляции в большие частицы, которые
скорее осели бы на дно. Это явление, а также броуновское движение
являются теми двумя факторами, благодаря которым главным обра-
зом коллоидные частицы и остаются во взвешенном состоянии. По
этой причине все то, что уничтожает заряды коллоидных частиц,
одновременно будет вызывать их коа-
гуляцию в более крупные частицы, а
следовательно и осаждение коллоида.
Ионы с противоположным зарядом, осо-
бенно в том случае, если они обладают
высокой валентностью, способствуют
осаждению коллоидов. Так, например,
положительно заряженный коллоид ги-
драта окиси железа быстро коагули-
рует при прибавлении раствора раство-
римого фосфата, содержащего ион РО4^,
а отрицательно заряженный коллоид
трехсернистого мышьяка коагулируется
раствором, содержащим ионы А1+ + + .
Как и следовало ожидать, два противо
положив заряженных коллоида осажд ь
ют друг друга; в качестве примера назо-
вем коллоидные растворы гидроокиси
железа и трехсернистого мышьяка. Для
того чтобы коллоид стабилизировать, необходимо удалить ионы из
диспергирующей сред л. Достигается это посредством диализа — про-
цесса, открытого Грэмом. Для этого коллоидный раствор помещают
в пергаментный мешочек, в свою очередь висящий в чистой воде.
В коллоид медленно добавляют воду. Ионы при этом диффундируют
через поры пергамента, коллоид (ые же частицы вслед :твие их
размера диффундировать не могут. •
Образование дельт у устьев рек при впадении их в море может
быть объяснено осаждением коллоидных частиц глины и песка из
пресной речной воды, вызванным ионами солей, содержащихся
в морской воде.
8. Осаждение в аппаратах Коттреля. Коллоидные частицы
пыли и тумана, суспендированные в воздухе, также обладают элек-
трическим зарядом. Такие взвешенные частицы, выходящие из вы-
тяжных труб химических заводов, не только составляют во многих
случаях потерю дорого стоящего продукта, но в некоторых случаях
губительно действуют на окружающую растительность и опасны для
здоровья окрестных жителей. Администрация металлургических за-
23 Введение в химию.
354 КОЛЛОИДЫ
водов, работающих на сернистых металлах (например медеплавиль-
ные и свинцовые заводы), а также сернокислотных установок часто
привлекалась к судебной ответственности; в некоторых же случаях
такие заводы приходилось даже закрывать вследствие вызываемой
ими гибели лесных массивов. Все это продолжалось до тех пор, пока
американский химик Коттрель не разработал способ электроосаж-
дения паров и дымов. Для этого отходящие газы пропускаются
Рис. 132. Аппарат Коттрелл:
между двумя электродами, причем площадь одного обычно бы-
вает значительной, а другой представляет собой проволо-
ку, на которой имеется много асбестовых волокон или кристал-
лов слюды. Большой электрод несет заряд, противоположный заряду
взвешенных частиц. Последние передвигаются по направлению к
электроду, разряжаются и сейчас же коагулируют в большие зерна.
Осаждение протекает практически нацело. С помощью этого изобре-
тения мы не только избавились от неприятных последствий, но и из-
влечение из отходящих газов ценных продуктов более чем окупило
стоимость этого осаждения.
к
'Site
коллоиды
Й*-;
«
Рис. 133. Результат действия аппарата Коттреля: а — аппарат
выключен, в — действует.
9. Защита коллоидных частиц. Мы уже упоминали о применении
эмульгатора при стабилизации эмульсий. Эмульгатор распола-
гается на границе между капельками жидкости диспергированной
фазы и той жидкой средой, в которой они суспендированы. Это пре-
пятствует соединению коллоидных капелек друг с другом и делает
эмульсию более устойчивой. Адсорбция коллоидными частицами
23*
зев
коллоиды
такой защитной пленки одно из их наиболее ценных свойств, так
как она чрезвычайно увеличивает их стойкость.
Эмульсии капелек масла в воде и капелек воды в масле имеют
практическое значение в качестве смазок. Интересно применение
в качестве эмульгаторов для этих эмульсий различного вида мыл,
так как тип мыла определяет, какая из двух фаз — вода или масло —
будет диспергированной фазой. Натриевое мыло (стр. 399) диспер-
гирует масло в воде, кальциевое же или алюминиевое мыло действует
как раз наоборот.
Коллоидные растворы какого-нибудь твердого вещества часто
делаются более стойкими при прибавлении третьего вещества, в дан-
ном случае стабилизатора, действие которого аналогично действию
эмульгатора. Коллоидные суспензии глины в воде широко приме-
няются в керамической промышленности при производстве всякого
рода глиняных изделий и кирпичей. Ачесон, американский химик,
открывший секрет производства шлифующего материала карборунда
и искусственного графита в электрической печи, нашел, что прибав-
ление таннина к суспензиям глины делает их более пластичными
и что кирпичи, сделанные из такого сырья, оказываются значительно
прочнее.
Ачесону удалось использовать стабилизирующее действие тан-
нина еще и другим способом. Если искусственный графит, который
получался им из каменного угля, взбалтывать с разбавленным раство-
ром таннина, то он диспергирует в воде в виде коллоидных частиц
и не проявляет стремления к осаждению. Такие коллоидные суспен-
зии «стабилизированного графита Ачесона» называются «аквадаг»
(слово «dag» происходит от начальных букв слов «Deflocculated
Acheson Graphite») и являются важным смазочным материалом.
10. Оптические свойства коллоидных растворов. Вероятно всем
хорошо известна красивая окраска тонких масляных пленок, или
мыльной воды в мыльных пузырях. Эта окраска зависит от отраже-
ния белого света от обоих поверхностей пленки. Угол, под которым
свет падает на эти поверхности, может быть таким, что гребень волн
с определенной длиной, отражающийся от одной поверхности, может
соответствовать провалу волн той же длины волны, отражающейся
от другой поверхности пленки. Это привело бы к интерференции
волн, так что цвета, соответствующие этим волнам, отсутствовали бы
в отраженном луче. В результате такой луч был бы уже не белым
светом, а состоял бы лишь из дополнительного цвета. По этой при-
чине многие эмульсии обладают красивой окраской. Голубая окраска
некоторых птичьих перьев или голубые глаза не являются следствием
наличия пигмента, а следствием как раз рассмотренного нами явле-
ния. И в случае перьев, и в случае голубых глаз мы имеем дело со
структурой из многих коллоидальных пузырьков воздуха, суспен-
дированных в твердой среде. Они рассеивают голубой свет, но про-
пускают красный, который и поглощается темным фоном.
Коллоидные растворы металлов часто обладают интенсивной
окраской. Коллоидные растворы золота бывают от красного до
КЕРАМИКА И СМЕЖНЫЕ ПРОИЗВОДСТВА
357
эти незначительны, назы-
Рис. 134. Схематическое изо-
бражение структуры геля.
фиолетового цвета, в зависимости от размера частиц. Это зависит
от избирательного отражения — явления слишком сложного, чтобы
мы могли разобрать его здесь.
11. Гели. Коллоидные растворы могут быть разбиты на два
класса, в зависимости от величины сил притяжения, действующих
между коллоидными частицами диспергированной фазы и средой.
Коллоидные растворы, в которых силы
ваются лиофобными коллоидами, те же
растворы, где эти силы значительны,—
лиофильными коллоидами. Суспензии
лиофобных коллоидов, например кол-
лоидные металлы, сульфиды или гидро-
окиси, характеризуются тем, что вяз-
кость их лишь немногим отличается от
вязкости среды, и тем, что они чрезвы-
чайно чувствительны к коагуляции эле-
ктролитами (стр. 352). С другой сторо-
ны, суспензии лиофильных коллоидов,
как правило, значительно более вязки,
чем чистая среда, в которой они су-
спендированы, и обладают заметной
тенденцией превратиться при охлаждении в гель. К этому типу при-
надлежат такие вещества, как желатина и агар-агар. Гель образуется
вероятно вследствие соединения друг с другом коллоидных частйЦ,
образующих сетку из цепочек, в которой оказывается как бызакЛЮ*
ченной та жидкая среда, где они суспендированы (рис. 134).
ГЛАВА XXXIII
КЕРАМИКА И СМЕЖНЫЕ ПРОИЗВОДСТВА
В почве и в различных породах находится много полезных мате-
риалов. Среди них имеются металлические руды, из которых полу-
чаются металлы, затем несколько неметаллов, также чрезвычайно
полезных, в частности каменный уголь — наше богатейшее ИЙС“
ледство, — и сера для серной кислоты. На приносимую ими полЙ^
мы уже неоднократно указывали. Кроме того имеется один неметалл»
не встречающийся в природе в свободном состоянии, но входящий в cd-
став весьма ценных для человека соединений. Мы имеем в виду креМ-
ний, занимающий второе место по своей распространенности в зеМ-
ной коре. Без кремния у нас не было бы стекла, кирпича, фарфора»
портланд-цемента и много другого, необходимого для нашей совре-
менной цивилизации. В этой главе мы рассмотрим примеНенЙё
кремния.
1. Окись кремния. Основным соединением кремния является егб
окись SiOj, известная под названием кварца, горного хрустаЛЯ
и кремнезема. Его бесцветные кристаллы в виде гексагональных
КЕРАМИКА И СМЕЖНЫЕ ПРОИЗВОДСТВА
кристаллов прозрачнее самого чистого стекла. Вследствие его высокой
точки плавления (1770°) до самого последнего времени (см.§ 9) его
не удавалось сплавить в прозрачное стекло. После полевого шта-
та, он. принадлежит к числу самык распространенных ми-
нералов земной коры. Бесцветные кристаллы в песке представ-
ляют собой кварц. Песчаник в основном также состоит из кварца.
Многие драгоценные и самоцветные камни, например аметист, опал,
оникс и агат, состояг из загрязненного примесями кремнезема. В виде
эдэданя SiO2 был в руках первобытного человека первым орудием
с острыми краями. Скелетная структура некоторых водных микро-
организмов, диатомей, состоит из этого окисла. Этот скелет дает нам
йЬвмнезем в одной из наиболее раздробленных форм, в виде диато-
мрйой земли, которую Нобель применил в качестве адсорбента для
нЬ^роФлицерина, чтобы получить динамит.
В химическом отношении окись кремния — кислотный окисел,
ик&к таковой может реагировать с металлическими или основными
о числами (при сплавлении с ними), с образованием силикатов метал-
ла! Так, например, известь реагирует с кремнеземом и образует си-
лцкАт кальция:
СаО 4- SiOa —* CaSiO3;
окись алюминия образует силикат алюминия:
- ч. А1аО3 4- 3SiOa А1а (SiO3)3.
г: ".
Нередко кремнезем сочетается с основными окислами в различных
о^Нфошениях, образуя полисиликаты. Такие полисиликаты часто
встречаются в природе. При сплавлении кремнезем реагирует также
й'Ж, карбонатами, причем выделяется углекислый газ и образуется
силикат соответствующего металла. При сплавлении песка с содой
образуется растворимое стекло — силикат натрия, растворимый
в воде:
NaaCO3 4- SiOa — NaaSiO3 4- СОа.
Если водному раствору этого вещества дать испариться, то получа-
ется стеклообразный остаток. Он находит себе применение для склеи-
вмиЯ битого стекла или фарфора, для заполнения пор яичной скор-
тш и при изготовлении огнеупорных тканей. Если жидкое стекло
(йдещать с мелом или окисью цинка, то оно образует.быстро схваты-
вающий и очень прочный цемент.
Тф'З? Долевой шпат и глина. Полевые шпаты, наиболее распростра-
нение минералы в земной коре, представляют собой смешанные си-
ликаты или калия и алюминия, или натрия и алюминия (например
lj$£|Si30g). Они встречаются во всех гранитных породах. Калийный
н®4ево11 шпат начинает плавиться при 1270°. При охлаждении рас-
Ляаиленного полевого шпата последний затвердевает в очень твердое,
почти прозрачное стекло. Хотя оно и нерастворимо в воде, однако
^Мически все же нестойко и выветривается под действием естествен-
Мни ’ ’ " • - - •
КЕРАМИКА И СМЕЖНЫЕ ПРОИЗВОДСТВА
359
ных вод, содержащих углекислоту. В результате получается глина
и карбонат натрия или калия:
2KAlSi3Os + 2Н2О + СО2 -* H4Al2Si2O, + 4SiOa + К2СО3.
глина
Глину или, лучше, каолин можно рассматривать как соединение,
состоящее из окислов алюминия, водорода и кремния (А12О3.2Н2О.
.2SiO2). Глина обычно представляет собой сложную смесь каолина,
кремнезема, слюды, окиси железа и органических примесей. Чистый
каолин плавится при довольно высокой температуре (1755°), но, как
и следовало ожидать, примеси понижают его точку плавления.
Мы уже указывали (стр. 356) на то, что глина образует чрезвы-
чайно пластичные коллоидные суспензии в воде. Органические ве-
щества, например таннин или отвар из сена или соломы, стабилизи-
руют эти суспензии и делают их более пластичными.
3. Гончарные изделия и кирпичи. Точно не известно, когда чело-
век впервые стал изготовлять из глины предметы обихода и укра-
шения, но вероятно это произошло в середине каменного века. Пер-
воначально глину месили с водой и тем самым делали ее пластичной,
руками придавали ей соответствующую форму и сушили на солнце.
Позднее появилась глина, обожженная на огне. В настоящее время
гончарные изделия изготовляются примерно таким же способом, но
только тщательно регулируются состав глины и температура обжига.
Кроме того для повышения механической прочности изделий к глине
примешивают другие вещества. Для того чтобы закрыть поры, по-
верхность изделий глазируется.
Из примесей, прибавляемых к глине, самыми важными являются
полевой шпат и кварц. Так как полевой шпат плавится при сравни-
тельно более низких температурах, то прибавление его к глине ведет
к понижению температуры обжига. Кроме того при охлаждении поле-
вой шпат застывает в твердое стекло, которое прекрасно связывает
всю глиняную массу. Кварц уменьшает усадку смеси при сушке и по-
следующем обжиге, а также увеличивает жесткость изделий при об-
жиге, так что формованные изделия сохраняют свою первоначаль-
ную форму. Состав типичного американского глиняного изделия та-
ков: 49,3% глины, 13,4% полевого шпата и 35,3% кварца. Для фар-
фора применяется высокосортный каолин.
После формовки изделия сушат и затем помещают в печь для
обжига. Для глиняных изделий температуру печи поддерживают
около 1270°, для более стекловидного фарфора — от 1350 до 1400°
и даже выше. При обжиге вода улетучивается, причем не только вода,
на которой была замешана глина, но и вода, входящая в состав моле-
кул глины. Вследствие потери воды глина становится пористой. По-
сле потери воды она превращается в силикат алюминия, в которому
3 молекулы окиси алюминия соединены с 2 молекулами кремнезема
(3Al2O3.2SiO2). Полевой шпат плавится и начинает растворять крем-
незем, вся масса уменьшается в объеме, что ведет к соответствующему
уменьшению пористости. Чем выше температура печи, тем лучше
360 КЕРАМИКА И СМЕЖНЫЕ ПРОИЗВОДСТВА
происходит сплавление и тем больше получается при последующем
охлаждении стекловидного материала. Прозрачность фарфора как раз
и зависит от высокого содержания в нем этого стекла.
Наконец изделие можно глазуровать, т. е. покрывать его стекло-
видной пленкой. Для получения одного из самых дешевых видов
глазури в обжиговую печь бросают поваренную соль, которая
вступает в реакцию с частью кремнезема, находящегося в из-
делии, образуя глазурь из силиката натрия. Для получения лучших
глазурей изделия после обжига покрывают слоем смеси, состоящей
из полевого шпата, окиси свинца и кварцевого песка, или же слоем
смешанного силиката свинца и бора. Затем изделие подвергается вто-
ричному обжигу. Окислы металлов прибавляют для получения окра-
шенных глазурей.
Кирпичи делаются совершенно так же, как и глиняные изделия,
но только для их изготовления можно применять менее чистые гли-
ны. Красный цвет обыкновенного кирпича зависит от примеси окиси
железа.
4. Известковый раствор. Когда человек впервые начал строить
из кирпича и камня, ему понадобилось какое-нибудь связующее веще-
ство. Ассирийцы и вавилоняне применяли влажную глину, которая
при высыхании затвердевала. Так же поступали и строители в древ-
нем Египте. Позднее египтяне, накаливая минеральный гипс
CaSO4.2H2O, открыли жженый гипс. Гипс (минерал) при нагре-
вании теряет часть кристаллизационной воды
2CaSO4-2H2O (CaSO4)2-H2O + ЗН2О,
причем в результате получается жженый гипс. Это обезвоживание
представляет собой обратимый процесс, так как жженый гипс легко
опять присоединяет воду и превращается в массу переплетенных
между собой кристаллов гипса. Для скрепления камней, применяв-
шихся при постройке пирамид, жженый гипс смешивался с песком.
Вслед за этим была открыта известь. Это открытие вероятно принад-
лежит грекам, нагревавшим известняк:
СаСО3 —► СаО + СО2.
Как вы вероятно помните, известь соединяется с водой, причем вы-
деляется тепло и образуется гашеная известь, или гидрат окиси
кальция:
СаО + Н2О-* Са (0Н)2.
Если эту последнюю смешать с песком и водой, то как раз и обра-
зуется тот известковый раствор, которым мы связываем кирпичи
и в настоящее время. Этот известковый раствор сперва схватывает
вследствие потери воды, а затем вследствие медленной реакции,
протекающей между гашеной известью и углекислотой воздуха:
Са (ОН)2 -|- СО2 * СаСО3 -J- Н2О,
КЕРАМИКА И СМЕЖНЫЕ ПРОИЗВОДСТВА
361
5. Цемент. Недостатком известкового раствора является то, что
он не может схватывать под водой. И вот римляне начали применять
гидравлический цемент, получавшийся при смешении извести
и песка с вулканическим пеплом, так называемым пуццолана. Такой
цемент успешно может выдерживать действие как пресной, так и со-
леной воды. Многие строения, при постройке которых применялись
пуццолановые цементы, дожили до наших дней почти в полной
сохранности. Однако после падения Рима искусство изготовления
этих цементов было утрачено.
В 1756 г. британский парламент поручил инж. Джону Смитону
построить каменный маяк в Эддистоне на открытых скалах Ламанша,
для замены деревянных строений, которые под действием ветра и волн
оказались весьма недолговечными. Основной его задачей было найти
такой цемент для фундамента маяка, который затвердевал бы под
водой. После ряда опытов ему удалось разрешить эту задачу. Под-
вергая обжигу глинистый известняк, найденный им около Корнуолла,
и смешивая его с пуццоланной, он получил прекрасный гидравличе-
ский цемент. Однако ввиду редкости пуццоланы этот цемент не на-
шел широкого распространения, но открытие Смитона заставило
продолжать поиски других залежей глинистого известняка, которые
для того, чтобы схватывать под водой, уже не нуждались бы в при-
меси пуццоланы.
В 1824 г. Джозеф Аспдин, английский каменщик, взял патент
на производство цемента нагреванием смеси известняка и глины. Он
назвал этот материал портланд-цементом, как как после схватыва-
ния он был похож на один английский строительный камень, назы-
ваемый портландским камнем. Этот материал и является нашим
современным цементом. Необходимое для его производства сырье —
известняк (СаСО3) и глина (H4Al2Si2O9) — весьма распространено
в природе и встречается во многих местах в виде больших залежей.
Это сырье в основном состоит из трех окислов: извести- СаО, гли-
нозема А12О3 и кремнезема SiO2. Окислы эти для получения цемен-
та должны быть хорошо смешаны в соответственных пропорциях.
Предельное содержание отдельных окислов для получения хорошего
цемента приведено в табличке.
Материал Предель- ные ко- личества (В %) Среднее содер- жание (в %) Материал Предель- ные ко- личества (В %) Среднее содер- жание (в %)
Известь СаО 60—64,5 62,0 Магнезия MgO 1-4,0 2,5
Кремнезем SiO2 20—24, С 22,0 Окись железа FeeO3 .... 2—4,0 2,5
Глинозем AlgO 5—9,0 7,5 Сеяный ангидрид 1 — 1,75 1,5
362
КЕРАМИКА И СМЕЖНЫЕ ПРОИЗВОДСТВА
Такую смесь во влажном или сухом состоянии обжигают в боль-
ших вращающихся наклонных печах, диаметр которых около 3 м,
а длина 60—65 м. Печь нагревается распыленным углем, газом или
нефтью, причем топливо вдувается в нижнюю часть печи с помощью
сжатого воздуха и образует пламя длиной до 12 м. Производите-
льность таких печей равна 1000—1500 бочкам цемента в день. Смесь
загружается в верхнюю часть вращающейся печи и гребками, вде-
ланными в стенки, постепенно подается в нижнюю, горячую часть
печи. Сперва смесь высушивается, затем из известняка выделяется
углекислый газ, наконец при температуре около 1425° имеют место
химические реакции, в результате которых из трех окислов, кото-
рые при этом частично сплавляются, образуются новые соедине-
ния. Наиболее желательно образование трехкальциевого силиката
3CaO.SiO2. Клинкер разгружают из нижней части печи, добавляют
для лучшего схватывания 2—3% гипса, после чего всю массу измель-
чают на мельницах и упаковывают.
Цемент, при смешении его с песком и водой, образует пласти-
ческую массу, которая схватывает через несколько часов, после
чего она постепенно затвердевает. Оба эти процесса весьма сложны;
вода при этом вступает в химическую реакцию с силикатами и алюми-
натами цемента, образуя при схватывании цемента желатинообраз-
ный коллоидальный материал. Это особенно касается трехкальцие-
вого силиката — наиболее важной цементирующей составной части.
Со временем этот желатинообразный материал частично кристалли-
зуется. В США в настоящее время производится более половины
всего цемента, получаемого в мире, т. е. примерно 200000000 бочек
(баррелей), стоимость которых составляет около 300 000 000 долл.
6. Стекло. Польза, которую приносит кремний, не ограничи-
вается тем, что мы до сих пор рассказали. Гончарные изделия и
цемент конечно для нас очень важны, но и стекло не менее необ-
ходимо. Без стекла не были бы изобретены микроскоп и телескоп.
Астрономия как наука никогда не родилась бы из астрологии.
Борьба с бактериями, вызывающими болезни, даже не была бы на-
чата, так как никогда не было бы открыто существование этих бакте-
рий. Самые ужасные болезни все еще господствовали бы у нас.
Вообще говоря, наука не смогла бы развиться даже до первого приб-
лижения к ее настоящему положению, если бы у нас не было стек-
ла. Огромное количество людей ходило бы полуслепыми, так как не
было бы стекол, помогающих их зрению. Ночью мы могли бы осве-
щаться только свечами, и не было бы окон, защищающих нас от зим-
них холодов и непогоды.
Точно неизвестно, где и когда впервые было открыто стекло.
Во всяком случае стеклянные предметы, состав стекла которых тог
же, что и состав современного бутылочного стекла, были найдены в
египетских могилах, отнесенных по времени к 3500 г. до н. э. За
1150 лет до н. э. в Египте процветала стекольная промышленность.
В Риме эта отрасль промышленности впервые приобрела значение
при власти цезарей. После падения Римской империи искусство
КЕРАМИКА И СМЕЖНЫЕ ПРОИЗВОДСТВА 363
приготовления стекла было забыто европейцами и перешло на восток
В Европу оно возвратилось в средние века. В эпоху Возрождения
прославилось венецианское стекло достигшее совершенства в XVI и
XVII ст. Одновременно производство стекла стало развиваться во
Франции и в Богемии. В XVIII ст. во Франции было открыто искус-
ство отливки зеркального стекла, и стекольный завод в Сент-Гобене
прославился блаАщаря своему искусному изготовлению зеркального
стекла.
В средние века и, пожалуй, почти до самого последнего времени
производство стекла было основано скорее на традиционных рецеп-
тах, чем на точных научных знаниях. До 80-х годов прошлого сто-
летия хотя и был открыт особый сорт стекла, так называемый флинт-
гласе (т. е. стекло, содержащее свинец), однако не было никаких си-
стематических исследований, касающихся изменений, вызываемых
прибавлением других компонентов к стандартной смеси, состоящей
из песка и извести, с прибавкой соды или поташа. Как и во многих
других областях, пионером в деле развития технологии стекла ока-
зался Фарадей, но производители стекла почти не обратили внима-
ния на его исследования. Развитию технологии стекла до ее настоя-
щего положения мы обязаны главным образом Шотту и Аббе в Иене
(Германия) и Ю. С. Сюлливану (США).
7. Состав и производство стекла. Стекло в основном состоит из
трех окислов: извести СаО, кремнезема SiO2 и окиси натрия
Na2O. Эти компоненты получаются из основных сырых материалов
стекольной промышленности: известняка СаСО3, белого песка
SiO2 и кальцинированной соды Na2CO3. Смесь этих компонентов
нагревают в тигле из огнеупорного кирпича до температуры
выше 1260 °. Материалы постепенно плавятся и из карбонатов под
действием нагревания и кремнезема выделяется углекислый газ.
При этом образуются силикаты натрия и кальция, из которых наи-
более важно, с точки зрения производства стекла, соединение
Na2O.3CaO.6SiO2. Это соединение отличается своей низкой темпера-
турой плавления, большой вязкостью и трудностью, с которой оно
кристаллизуется при охлаждении до температур, лежащих ниже
точки плавления. При охлаждении стеклянного плава кристаллы
не образуются. Вся масса остается жидкой, но вязкость ее возрастает
по мере-понижения температуры до тех пор, при вся масса не
станет столь же твердой, как и кристаллическое вещество.
Обыкновенная смесь, состоящая из песка, извести и соды, при-
меняется для изготовления оконного или бутылочного стекла. Если
применяется не чистый песок, то получается окрашенное стекло.
Песок, содержащий окислы железа, являющиеся весьма обычной
примесью, окрашивает стекло в зеленый цвет вследствие образова-
ния силиката закиси железа. Присутствие последнего объясняет
дивный цвет старого бутылочного стекла. Прибавление небольшого
количества двуокиси марганца уничтожает зеленое окрашивание.
Оконное стекло имеет тот же состав, что и бутылочное, только
при его изготовлении часть соды заменяется сульфатом натрия, что
364
КЕРАМИКА И СМЕЖНЫЕ ПР ОИЗВОДСТВА
увеличивает прочность стекла. Материалы плавят в больших прямо-
угольных резервуарах, работающих непрерывно, причем в каждом
резервуаре выплавляется в сутки от 600 до 1 000 т стекла. При
приготовлении оконного стекла в расплавленную массу опускают
Рис. 135 Вытягивание цилиндров оконного стекла из
расплавленной массы.
трубу и с помощью сжатого воздуха выдувают полые сосуды (холявы),
имеющие около 2 фт. (60 см) в диаметре. Затем эти сосуды вытягивают
в полые цилиндры длиной около 40 фт. (12 м) путем поднятия труб
вверх от расплавленной массы. Дно каждого цилиндра обрезают,
после чего цилиндр разрезают на секции с помощью проволок,
(нагретых электрическим током, и каждую секцию разрезают про-
дольно пополам посредством нагретых стержней. Эти половинки
КЕРАМИКА И СМЕЖНЫЕ ПРОИЗВОДСТВА
365
помещают в печь, где дают им развернуться («разводят» их), пре-
вращая в плоский листы оконного стекла.
Рис. 136. Опускание цилиндроа в люльки.'
Рис. 137 Гигантские стальные валы раскатывают листы
зеркального стекла.
Для получения зеркального стекла расплавленную стеклянную
массу выливают на стальной стол, где большим стальным катком
раскатывают ее в плоские листы. Эти листы подвергают сперва шли-
фовке, а затем полируют окисью железа.
366
КЕРАМИКА И СМЕЖНЫЕ ПРОИЗВОДСТВА
8. Стекло с малым коэфициентом расширения. Конечно всякий
знает, что стекло — материал хрупкий, но воспоминание о многих
студентах, пытавшихся в лаборатории кипятить воду в бутылках,
заставляет нас подозревать, что имеются люди, которые не знают,
что обыкновенное стекло, подвергнутое внезапному охлаждению
или нагреванию, лопается. Однако в настоящее время мы безнаказан-
но пользуемся даже стеклянными кастрюлями. Честь изготовления
стекла с малым коэфициентом расширения, которое как раз и приме-
няется для изготовления этих кастрюль, принадлежит Ю. С. Сюлли-
вану и его сотрудникам на заводе Corning Glass Works в США.
Это стекло при одном и том же повышении температуры расширяется
в тди раза меньше обычного. Поэтому при неравномерном нагревании
у -Такого стекла меньше шансов треснуть. Отто Шотт, великий пионер
технологии стекла в Иене, нашел, что прибавление борной кислоты
к смеси, в которой относительно меньшее количество соды, понижает
коэфицйент расширения стекгЙЬ Стекло «Ругех», получаемое на
заводе Corning Glass Works, содержит 12% окиси бора В2О3 и 81%
кремнезема.
9. Плавленый кремнезем. Кварц, — встречающася в природе
кристаллическая форма кремнезема,—может быть расплавлен в элек-
трической печи. По охлаждении этот чистый кремнеземный плав так
же трудно кристаллизуется, как и плавы силикатного стекла. Он
образует стекло, получить которое в прозрачном виде до самого по-
следнего времени было очень затруднительно. Благодаря работам
Берри и его сотрудников из General Electric Со мы теперь можем
иметь плавленый кремнезем более прозрачный, чем стекло. Его де-
лают, тщательно регулируя давление в электрической печи так, чтобы
удалить пузырьки воздуха. Коэфициент расширения стекла из сплав-
ленного кремнезема настолько незначителен (5,5 х Ю~7,т. е. в 10 раз
меньше, чем для обыкновенного стекла), что такое кварцевое стекло
может быть нагрето докрасна и затем погружено в воду, причем
стекло не изменяется. Кроме того это стекло пропускает ультрафио-
летовые лучи, что является весьма ценным свойством (стр. 224).
Хотя сплавленный кремнезем все еще довольно дорог, он уже нашел
себе ряд применений.
10. Цветное стекло. - Цветные стекла могут быть получены
различными способами. Например красное стекло было впервые по-
лучено следующим образом: применявшийся для получения стекла
песок был полит солью золота, в результате чего стекло после ох-
лаждения приобрело желтый цвет. Если такое стекло нагреть в коп-
тящем пламени и снова охладить, то получится стекло, окрашенное
в красивый красно-рубиновый цвет. Эту окраску ему придают кол-
лоидные частицы золота (стр. 356). В последнее время для этой цели
дорогое золото заменено было более дешевым селеном—элементом,
напоминающим серу и получаемым в виде отброса при рафинировке
меди. В случае применения селена известь заменяют окисью цинка,
кроме того добавляют сернистый кадмий и древесный уголь. Оранже-
вое стекло может быть получено также прибавлением селена, если
КЕРАМИКА И СМЕЖНЫЕ ПРОИЗВОДСТВА
367
вместо окиси цинка применять известь. Розовое или пурпуровое
стекло содержит силикаты никеля или марганца. Янтарное или жел-
тое стекло содержит коллоидальные серу и уголь. Такого рода стекло
непрозрачно для световых волн с более короткой длиной волны, т. е.
для волн, которым принадлежит наиболее активная роль при разло-
жении светочувствительных веществ. Поэтому в качестве сосудов для
светочувствительных веществ применяют склянки из янтарного или
коричневого стекла. Зеленый цвет стекла зависит от силикатов железа.
Синее стекло содержит окись кобальта. Черное стекло на самом деле
нечто иное, как очень темное синее кобальтовое стекло. Белое непро-
зрачное стекло получают при прибавления какой-нибудь фтористой
соли и полевого шпата.
И. Карбид кремния. Прежде чем закончить эту главу, в которой
описывается польза, получаемая от кремния, рассмотрим еще не-
сколько продуктов, содержащих этот элемент и получаемых в элек-
трической печи при высокой температуре.
В 1885 г. Е. А. Ачесон, сотрудник Эдисоновской лаборатории,
поместил в железный тигель смесь глины и древесного угля, опустил
в смесь угольный электрод и присоединил электрод и тигель к динамо-
машине. Когда через некоторое время он вынул электрод, то к своему
великому удивлению увидел, что он усыпан красивыми играющими
на свету кристаллами синего и черного цвета. Пораженный их кра-
сотой, он их продал сперва как драгоценные камни по цене 1240 долл,
за килограмм. Позднее, обратив внимание на их удивительную твер-
дость, он продавал их уже тоннами по цене около 22 центов за кило-
грамм и заработал еще больше денег. Оказалось, что им был открыт
карбид кремния CSi — один из наиболее полезных шлифующих
материалов. В настоящее время он производится партиями по 10 т
в больших электрических печах у Ниагарского водопада. Каждая
печь представляет собой прямоугольный кирпичный резервуар дли-
ной около 15 фт. (4,5 м) и шириной и глубиной в 7 фт. (2,1 м). С обоих
концов ящика имеются большие угольные электроды. В печь загру-
жают смесь кокса и песка, к которой прибавляют древесные опил-
ки, чтобы масса стала пористой, и соль, служащую флюсом. Сопро-
тивление, которое эта масса оказывает прохождению электрического
тока, вызывает ту высокую температуру, которая необходима для
течения реакции:
SiO8 + ЗС — SiC + 2СО.
По своей твердости карборунд уступает только алмазу; шлифовка
металлов при помощи карборунда происходит быстрее и обходится
дешевле, чем при применении природного шлифующего вещества —
наждака (А12О3). Карбид кремния — также прекрасный огнеупор-
ный материал, особенно после перекристаллизации.
12. Свободный кремний. Кремний, который так полезен в сое-
динении с другими элементами, до последнего времени мог быть
получен в свободном состоянии только с помощью дорогих ме-
тодов. При цене, равной 100 долл, за 30 г, применение его естествен-
368
ПИТАНИЕ РАСТЕНИЙ
но было весьма ограничено. В настоящее время он получается в боль-
ших масштабах в электрических дуговых печах мощностью в 4000 л.с.
нагреванием смеси кремнеземной породы и кокса:
SiO2 + 2С — Si + 2СО.
Теперь цена его 22 цента за килограмм. Как только кремний
подешевел, он нашел себе широкое применение. Сталь с содержанием
4% кремния называется нестареющей и применяется для электри-
ческих трансформаторов. Сплавы кремния с алюминием, содержа-
щие от 8 до 15% кремния, и сплавы кремния с медью приобретают
за последнее время большое значение. Во время мировой войны ты-
сячи тонн кремния были употреблены для получения водорода дей-
ствием кремния на раствор едкого натра. Этим водородом напол-
нялись воздушные шары и дирижабли.
ГЛАВА XXXIV
ПИТАНИЕ РАСТЕНИЙ
С этой главы мы начинаем изучение органических соединений
как тех, из которых состоят растительные и животные ткани, так
и тех многочисленных органических соединений, которые были по-
лучены синтетически в лаборатории. Пожалуй, наиболее логично
будет начать это изучение с рассмотрения того, как питаются расте-
ния, затем — какие соединения образуются из этой пищи, в их
тканях и отсюда перейти к питанию животных. В заключение не-
обходимо будет остановиться на синтезах органической химии, так
как даже такой краткий обзор органической химии, как в настоящей
книге, будет неполным без рассмотрения этой области.
1. Происхождение и состав почвы. Силы природы работают не-
прерывно. Самые твердые породы в конце концов поддаются разру-
шающему действию атмосферы и проточной воды, той самой воды,
которая, расширяясь при замерзании, делает маленькие трещины
большими и разрушает большие валуны, образуя из них мелкие пес-
чинки. О химическом действии воды, насыщенной углекислым га-
зом воздуха, на известняк мы говорили выше (стр. 243):
СаСО3 + Н2О + СО2 -> Са (НСО3)2 + Н2О.
Аналогичная реакция, хотя и значительно более медленная, имеет
место и в случае полевого шпата — составной части всех гранитов,
причем происходит превращение его в глину:
2KA1S=3O8 + 2Н2О + СО2 -* H4Al2Si2O3 + 4SiO2 + КаСО3.
полевой шпат глина
Корни растений также играют важную роль в образовании почвы.
Основную массу почвы составляют песок, глина и гумус.
Песок состоит главным образом из мелких кристаллов кварца —
ПИТАНИЕ РАСТЕНИЙ
369
окиси кремния SiO2. Глина представляет собой гидратированный
силикат алюминия H4Al2Si2O9. Гумус (перегной) — органиче-
ского происхождения и образуется при разложении животного и ра-
стительного вещества. Кроме этих веществ в почве встречаются сое-
динения натрия, калия, кальция, магния и железа, а также сульфаты,
хлориды, нитраты и фосфаты. Вот из этой-то среды, а также из
атмосферы берут пищу растения, следовательно и мы.
2. Пища растений. Химический анализ растений дает нам
некоторые указания относительно их потребности в пище. Во-пер-
вых, большой процент растительных тканей составляет вода. В сухих
растительных тканях 90—98% составляет горючее, т. е. органиче-
ское вещество, и от 2 до 10% остается в виде золы (минеральные ве-
щества). Полный анализ показывает, что в состав растительных тка-
ней входят следующие элементы: калий, фосфор, железо, кальций,
магний, кремний, азот, водород, кислород, углерод и некоторые дру-
гие. Почти все элементы, встречающиеся в почве, находятся и в ра-
стительных тканях. Однако их относительные количества весьма
различны. Опыты, поставленные с выращиванием растений в почвах,
в которых отсутствовали один или несколько из этих элементов,
вскоре показали, какие из них необходимы для произрастания расте-
ний. Оказалось, что необходимы углерод, водород, кислород, азот,
сера, фосфор, магний, железо и кальций. Из них углерод, водород и
кислород получаются за счет углекислого газа воздуха и воды почвы.
Практически во всех почвах не содержится азота минерального
происхождения. Этот элемент должен получаться за счет органиче-
ского вещества перегноя. Все другие необходимые элементы происхо-
дят из минералов почвы.
Если мы рассмотрим более внимательно природу органических
соединений, входящих в состав растений, с целью выяснения вопроса,
почему необходимы перечисленные выше элементы то увидим, что
большинство соединений может быть разбито на три класса: угле-
воды, в число которых входят сахара, крахмалы и целлюлоза, жиры
и белки. Углеводы и жиры состоят из углерода, водорода и кисло-
рода, а в состав белков кроме этих трех элементов входят также азот
и сера. Некоторые элементы в ядре растительных клеток содержат
фосфор, а чрезвычайно важное соединение, хлорофил (зеленое кра-
сящее вещество листьев), служащий как бы тем звеном, с помощью
которого лучистая энергия солнца может быть усвоена всеми живы-
ми организмами, содержит магний. Калий безусловно необходим
растениям, и однако он не входит в состав органических веществ,
из которых состоят растения. Он как будто способствует каким-то
образом синтезу крахмалов и сахаров и способствует большей
устойчивости растения по отношению к заболеванием. Потреб-
ность в железе каким-то образом связана с синтезом хлорофила,
а кальций каким-то непонятным образом способствует образова-
нию материала, из которого состоят клеточные стенки или древесные
волокна.
Обыкновенная почва дает растениям все эти элементы в коли-
24 Введение в химию.
370
ПИТАНИЕ РАСТЕНИЙ
честве, достаточном для удовлетворения их потребностей, за исклю-
чением трех: азота, фосфора и калия. Эти три извлекаются уро-
жаями из почвы с большей скоростью, чем пополняются приро-
дой. Поэтому для того чтобы почва оставалась плодородной, эти
элементы необходимо к ней добавлять. Этому требованию удовлет-
воряет промышленность искусственных удобрений.
3. Источники азота. Если мы учтем, что в атмосфере земли со-
держится около 4 000 000 000 000 000 т азота, то может показаться
странным, что Уильям Крукс в речи перед Британской ассоциацией
в 1898 г. счел нужным указать, что если не будут открыты способы
для того, чтобы развить промышленность, которая дала бы нам азот
в усвояемой форме, то пшеничные поля во всем мире вскоре будут
пустынны, и кавказская раса, питающаяся пшеницей, будет «вытес-
нена из жизни теми расами, для которых пшеничный хлеб не является
основой существования». В словах «в усвояемой форме» лежит весь
секрет бесполезности азота воздуха, как пищи для растений. Мы мог-
ли бы переиначить старую поговорку с точки зрения нужд растений:
«Азот, кругом азот, но ничего нельзя съесть». Ибо азот в воздухе нахо-
дится в свободном состоянии, а растение должно получать свою пищу
в виде раствора через корни. Таким образом задача получения азота
в форме,усвояемой растениями, состоит в нахождении источников
растворимых соединений азота или в фиксации азота воздуха, т. е.
в сочетании его с другими элементами в виде растворимых соединений.
Ценность навоза в качестве удобрений известна уже по крайней
мере 2000 лет. Навоз животных содержит много белков и аналогич-
ных им соединений, которые все содержат азот. Пожалуй, наиболь-
шее количество азота возвращается обратно в почву именно при удоб-
рении ее навозом. Однако необходимо помнить, что таким путем мы
возвращаем почве только часть того азота, который был извлечен
из нее снятым урожаем. Земледелец, который аккуратно возвращает
на поле навоз своего скота, сохраняет только ту долю азота, которая
этим скотом не усваивается. Большая же часть азота уходит вместе
с теми овощами и мясом, которые он продает или съедает вместе со
своей семьей.
Другой источник азота — отбросы некоторых отраслей про-
мышленности. Такие отбросы, как рыбные, сушеная кровь, отбросы
боен, мука из хлопкового жмыха, находят себе применение в каче-
стве удобрений, но содержание азота в этих материалах незначи-
тельно.
Самые важные мировые естественные запасы связанного азота,
залежи нитрата натрия, так называемой чилийской селитры, нахо-
дятся на узкой полоске бесплодного плато вдоль берега Чили.
Нитрат натрия выщелачивают из породы, называемой калише, и
водный раствор выпаривают. Вывоз этого продукта начался около
100 лет тому назад и достиг в 1928 г. почти 3000 000 m. Подсчеты по-
казали, что при современном темпе потребления этих запасов хватит
по крайней мере еще на 100 лет.
В одной из предыдущих глав мы уже указывали на то, что имеется
ПИТАНИЕ РАСТЕНИЙ
371
еще одно ценное азотистое удобрение, которое получается в качестве
побочного продукта при перегонке каменного угля с целью получе-
ния кокса (стр. 118). Этот газообразный продукт, аммиак NH3,
обрабатывают серной кислотой (стр. 311) и превращают в сульфат
аммония — растворимое в воде твердое вещество, широко применяе-
мое в качестве удобрения. В США в 1928 г. получено около
200 000 т связанного азота в виде сульфата аммония.
4. Фиксация азота. Все эти естественные источники связанного
азота были хорошо известны Уильяму Круксу, когда он в 1898 г.
делал свое знаменитое предсказание. Он знал и о том, как возрастает
население, потребляющее пшеницу, знал какой максимальный
урожай может быть получен с 1 га при интенсивном удобрении.
С'тех пор площадь, занятая под пшеницу, значительно возросла: с
200 000 000 акров (80 000 000 га) в 1890 г. до почти 300 000 000 акров
(120 000 000 га) в настоящее время. Эта площадь уже близка к воз-
можному пределу. Средний урожай с акра также значительно уве-
личился главным образом благодаря усиленному применению удоб-
рений. Незначительный средний урожай с акра в США, равный 15
бушелям*, по сравнению с 35 бушелями в Германии объясняется тем,
что в США на 1 акр расходуется в среднем 28 фн. (12,5 кг)
удобрений, а в Европе 200 фн. (90 кг). Если бы средний мировой уро-
жай можно было повысить до 20 бушелей с акра, то можно было бы
прокормить миллиард человек, считая по 6 бушелей в год на чело-
века. Но такое увеличение урожая могло бы произойти только при
росте применяющихся удобрений, и Уильям Крукс как раз и задавал
вопрос о том, откуда они смогут быть получены. Единственным воз-
можным путем являлось развитие экономических методов фиксации
атмосферного азота. Как сказал Крукс, «фиксация атмосферного
азота явится одним из величайших открытий, которое только дожи-
дается изобретательности химиков». Задача эта оказалась не из лег-
ких, так как свободный азот чрезвычайно инертный газ. Вследствие
его химической инертности, соединение его с другими элементами
затруднительно и обычно требует поглощения относительно боль-
ших количеств энергии. Все же задача эта была разрешена и возмож-
ная гибель человечества от голодной смерти перестала быть реаль-
ной угрозой.
5. Бактерии, фиксирующие азот. Если бы инженеры-химики
могли последовать примеру некоторых низших организмов, нахо-
дящихся в почве и в клубеньках корней некоторых растений, реше-
ние задачи фиксации азота не было бы столь затруднительным. Эти
бактерии, фиксирующие азот, могут осуществить при атмосферном
давлении и низкой температуре то, для чего человеку требуется воль-
това дуга, высокое давление и сложная аппаратура. Некоторые
из этих бактерий находятся в клубеньках таких бобовых растений,
как, например, клевер, горох и др. Выращивая эти расте-
ния и затем запахивая их в землю, мы тем самым обогащаем почву
* 1 бушель = 36,37 л. Ред.
24*
372
ПИТАНИЕ РАСТЕНИЙ
связанным азотом. Эти бактерии сделали возможными растительную
и животную жизнь на земле, так как они служат единственным звеном
между атмосферным азотом и азотом белков растительных и живот-
ных тканей. Каким образом они осуществляют фиксацию азота, до
сих пор еще не известно, но вероятно станет известным в ближайшем
будущем.
6. Дуговой процесс. Теперь мы перейдем к рассмотрению пер-
вого успешного метода фиксации атмосферного азота. Около 1790 г.
Кэвендишу (стр. 99) удалось осуществить соединение азота и кисло-
рода воздуха с помощью электрической искры. Несколько позднее
(1800) Гемфри Дэви осуществил ту же реакцию, пропуская воздух
над проволокой, нагретой электрическим током. Более 100 лет эти
открытия не находили практического применения. В 1902 г. два
американца Брэдли и Левджой сделали первую попытку осуществить
связывание азота с помощью дугового процесса на Ниагарском водо-
паде, но успеха они не имели. В 1903 г. два норвежца Биркеланд и
Эйде осуществили этот процесс на практике. Для более тесного
контакта между дугой и проходящим через нее воздухом применяемая
ими вольтова дуга помещалась между двумя сильными электрома-
гнитами, питаемыми переменным током. Вольтова дуга под влия-
нием переменного силового поля магнитов испытывала различ-
ное отклонение и колебалась в дискообразном пространстве печи,
образуя светящийся диск, что достигалось применением элект-
ромагнита. При этих условиях имеет место следующая реакция,
которая приводит к образованию газообразной окиси азота:
N2 + О2 + тепло 2NO.
Как мы уже указывали, реакция эта обратимая, следовательно не
доходит до конца, а достигает лишь состояния равновесия. Мы
опять можем применить теорему ван’т Гоффа (стр. 91) для выясне-
ния того, как изменение температуры влияет на это равновесие, а
следовательно и на выход окиси азота. Так как прямая реакция эн-
дотермична, то повышение температуры должно повести к сдвигу
равновесия в пользу прямой реакции. Другими словами, чем выше
температура, тем больше в равновесной смеси должно содержаться
окиси азота, так как последняя — продукт прямой реакции. В табл. L
дан выход окиси азота при различных состояниях равновесия в за-
висимости от температуры.
Таблица L
Темпера- тура (в°С) Содержание NO в газовой смеси (в объемных %) Темпера- тура (в°С) Содержание NO в газовой смеси (в объемных %)
1538 0,37 2307 2,05
1604 0,42 2402 2,23
1760 . 0,64 2927 5,00
ПИТАНИЕ РАСТЕНИЙ
373
На основании этих данных совершенно очевидно, что выход во
всех случаях незначителен, но что он увеличивается с повышением
температуры, как это и следует по теореме ван’т Гоффа. Из этого
становится совершенно ясным, почему для того, чтобы получить за-
метные выхода окиси азота, приходится применять высокую темпе-
ратуру вольтовой дуги.
Другое преимущество применения высокой температуры заклю-
чается в том, что скорость химической реакции возрастает с повы-
шением температуры (стр. 86). Вследствие этого время, необходимое
для установления равновесия, уменьшается при повышении темпера-
туры, как это видно из табл. LI.
Таблица LI
Температура (в °C) Время, необходимое для достижения равно- весия
1000 82 дня
1500 1,25 дня
2100 5 сек.
2500 0,01 сек.
Следующей ступенью этого процесса является реакция:
2NO 4- О2 2NOa 4- тепло.
Другими словами, после того как смесь газов выходит из вольтовой
дуги, продукт первой реакции соединяется еще с некоторым коли-
чеством кислорода, образуя другой газ — двуокись азота. Эта реак-
ция также обратима, но в этом случае прямая реакция экзотермич-
на, а поэтому ей благоприятствует низкая температура. Вследствие
этого газы после вольтовой дуги быстро охлаждают как для того,
чтобы создать условия наиболее благоприятные для второй реакции,
так и для того, чтобы помешать быстрому обратному течению пер-вой.
Чем ниже температура, тем меньше выход окиси азота в первой реак-
ции. Поэтому, как только газовая смесь выходит из области дей-
ствия высокой температуры вольтовой дуги, равновесие сдвигается
в пользу обратной реакции, т. е. окись азота начинает, разлагаться
на азот и кислород. Кроме того, как указано было раньше (стр. 86),
при понижении температуры сильно замедляется скорость химиче-
ских реакций. Поэтому, чтобы еще более замедлить процесс распа-
да NO, смесь быстро охлаждают.
Газообразную двуокись азота поглощают водой — образуется
азотная кислота (стр. 315):
3NO2 4- Н2О — 2HNO3 4- NO,
которую обычно нейтрализуют гашеной известью:
Са (ОН)г 4- 2HNO3 Са (NO3)2 + 2НгО.
374
ПИТАНИЕ РАСТЕНИЙ
После выпаривания получают твердый нитрат кальция — ценное
удобрение.
При дуговом процессе требуется около 65 000 квт-ч электриче-
ской энергии на тонну связанного азота. Коэфициент использования
электрической энергии очень низок; поэтому метод этот может кон-
курировать с другими методами фиксации азота только там, где
имеется дешевая гидроэлектрическая энергия. В настоящее время
менее 6% всего мирового производства связанного азота падает на
дуговой метод. Довольно успешным этот метод оказался в Норвегии,
в частности в Ноттодене и в других частях Телемаркского округа,
где Ряньканский водопад дает дешевую электрическую энергию.
Хотя 85% всего азота, связанного по дуговому процессу, падает на
этот округ, однако и здесь ряд предприятий постепенно переходит
на работу по более экономичному методу Габера.
7. Цианамидный процесс. В 1895 г. два немца, Франк и Каро,
открыли ряд реакций, легших в основу успешного процесса фикса-
ции азота. Если известь нагревать вместе с коксом в электрической
печи, то в результате реации получается карбид кальция:
СаО + ЗС — СаС2 + СО.
Если это вещество в электрических печах при 1000° привести в со-
прикосновение с азотом, полученным фракционированием жидкого
воздуха, то в результате экзотермической реакции происходит фикса-
ция азота и образование цианамида кальция CaCN2:
СаС2 + N2 —> CaCN2 + С + тепло.
Количества тепла, выделяющегося при этой реакции после ее начала,
вполне достаточно для течения реакции без применения внешнего
источника тепла. Полученный продукт может быть непосредственно
использован в качестве удобрения, хотя он и обладает некоторыми
нежелательными свойствами. Кроме того он может быть превращен
в аммиак, если его подвергнуть действию водяного пара под давле-
нием:
CaCN2 + ЗН2О -> 2NH3 + СаСО3.
Первый завод, работавший по этому методу, был пущен в Италии
в 1905 г., а вскоре вслед за этим и в Германии. В 1915 г. в девяти
странах было всего около 15 заводов с общей производительностью
в 300 000 т. К концу мировой войны это количество возросло до 35 за-
водов с производительностью 1 625 000 т цианамида.
При этом методе требуется 15 000 квт-ч на тонну связанного азота.
Квалифицированной рабочей силы не требуется.
Что же касается метода синтетического аммиака, то он уже
давно вышел из стадии опытной разработки. Ввиду того что он пот-,
ребляет энергии меньше, в будущем этот метод несомненно заменит
более дорогой цианамидный метод. По этой причине новые цианамид-
ные заводы не строятся, хотя ббльшая часть существующих заводов
продолжает работать.
ПИТАНИЕ РАСТЕНИЙ
375
8. Габеровский процесс получения синтетического аммиака. Уже
давно было известно, что если пропускать газообразную смесь азота
и водорода через нагретые трубки, то образуется небольшое коли-
чество аммиака. Однако, только начиная с 1905 г., после того как
два немецких физико-химика, Нернст и Габер, подвергли системати-
ческому исследованию равновесие
N2 + ЗН2 2NH3 -|- тепло
и особенно влияние катализаторов на скорость, с которой устанавли-
вается равновесие, эта реакция смогла лечь в основу процесса фик-
сации азота.
Условия, при которых эта реакция сможет дать оптимальный
выход аммиака, могут быть предсказаны на основании закона Ле-
шателье. Если в данной системе, находящейся в устойчивом равнове-
сии, мы изменим одно из условий (например температуру, давление,
концентрацию), то система оказывает этому Изменению возможное
противодействие и стремится ослабить влияние изменения.
Закон ван’т Гоффа, касающийся влияния температурных изме-
нений на состояние равновесия,—естественное следствие этой теоре-
мы. Течение реакции, поглощающей тепло, будет облегчено повышен-
ной температурой. Повышенное давление также может быть приме-
нено для того, чтобы сдвинуть равновесие. В последнем случае, если
мы имеем реакцию, ведущую к уменьшению объема системы, она
будет облегчена повышенным давлением. Попробуем применить
эту теорему к равновесию аммиака.
Так как обратная реакция эндотермична, то в результате по-
вышения температуры уменьшится выход аммиака, так как усло-
вия будут более благоприятны для разложения его на водород и азот.
Следовательно чем ниже температура, тем выше выход аммиака при
определенном давлении. На опыте это действительно имеет место,
как можно видеть из табл. LI I.
Таблица LII. Выход аммиака
(в процентах)
Темпера- тура (СС) Давление в ат
1 100 _ 200 300 60Э 1000
200 15,3 80,6 85,5 89,9 95,4 98,3
300 2,2 52,1 62,8 71,0 84,2 92,6
400 0,44 25,1 36,3 47,0 65,2 79,8
500 0,129 10,4 17,6 26,4 42,15 57,5
600 0,049 4,5 8,25 13,8 23,1 31,4
700 0,022 2,14 4,10 7,25 12,6 12,9
800 0,012 1,15 2,24
900 0,007 0,68 1,34
1000 0,004 0,44 0,87
376
ПИТАНИЕ РАСТЕНИЙ
На основании этих данных можно было бы предположить, что
для работы в производственном масштабе следует вести реакцию
при очень низкой температуре. На самом же деле это не так,кввиду
того что при низких температурах очень медленно достигается со-
стояние равновесия. Следовательно надо выбирать такую темпера-
туру, при которой получается удовлетворительный выход аммиака
в сравнительно небольшой отрезок времени.
Так как 1 моль азота и 3 моля водорода соединяются друг с дру-
гом, образуя 2 моля аммиака, то при прямой реакции имеет место
уменьшение объема с 4 до 2. Следовательно такой реакции будет бла-
гоприятствовать повышенное давление, как это и видно из таблицы.
Таким образом заводы синтетического аммиака проектируют на ра-
боту при высоких давлениях. На практике применяют давления
от 100 до 1000 ат. Чем выше давление, тем дороже соответствующая
аппаратура, однако тем выше и выход аммиака.
Пожалуй, наиболее важной частью завода синтетического аммиа-
ка является катализатор, без которого нельзя было бы достигнуть
соединения азота и водорода в большом масштабе. Как вы вероятно
помните, катализатор представляет собой вещество, которое уско-
ряет химическую реакцию, само же не претерпевает при этом изме-
нений (стр. 87). Влияние катализатора на обратимую реакцию за-
мечательно тем, что он увеличивает в одинаковой степени как ско-
рость прямой, так и скорость обратной реакции. Таким образом
катализатор не изменяет состояния равновесия, т. е. не изменяет
выход аммиака, но зато значительно сокращает время, потребное
для установления равновесия. Если мы примем во внимание то
обстоятельство, что смесь водорода и азота, пропускаемая над ката-
лизатором, может оставаться в соприкосновении с ним в течение
только короткого промежутка времени, то мы поймем, что фактор
времени действительно имеет большое значение. На практике время
контактирования газовой смеси с катализатором обычно бывает недо-
статочным для достижения состояния равновесия, так что макси-
мальный выход аммиака никогда не достигается. Однако чем актив-
нее катализатор, тем ближе выход аммиака к теоретическому. Поэ-
тому поиски катализаторов для этого процесса были весьма
многочисленны. Огромная работа в этом направлении была про-
ведена в лабораториях гигантского химического треста в Герма-
нии И. Г. в Оппау рядом исследователей, в частности Бошем, Мит-
ташом и их сотрудниками. В США большую работу провела
Исследовательская лаборатория связанного азота. В настоящее время
наиболее широкое применение имеет железный катализатор, к ко-
торому в качестве промоторов* прибавлены окислы алюминия и
калия.
Кроме того пришлось разрешить еще целый ряд вопросов, в част-
ности вопросы о дешевом получении водорода и азота в достаточно
♦ Промоторами называются примеси, усиливающие действие катализато-
ра. Ред.
ПИТАНИЕ РАСТЕНИЙ
377
чистом состоянии, чтобы не «отравлять» катализатор. Интересую-
щихся этими вопросами мы должны отослать к другим источникам
информации.
9. Современное состояние вопроса о фиксации азота. Несом-
ненно, что из всех методов фиксации атмосферного азота процесс
получения синтетического аммиака подает больше всего надежд.
Потребление энергии при этом методе наименьшее — 4000 квт-ч
на тонну фиксированного азота. Характер изменений, которые пре-
терпело мировое производство связанного азота с 1910 г., видно
из табл. LI1I.
Таблица LIII. Производство связанного азота
(в процентах)
1913 1924 1926
N (фиксированный) 7.1 38,8 50,1
N (газ коксовых печей) 36,7 36,5 20,6
N (чилийская селитра) 56,2 34,7 29,3
Ф. Габер
Производство синтетического аммиака получило настолько
широкое распространение и сделало такие успехи, что по этому
методу аммиак может быть получен по цене не выше, а может быть
даже и ниже, чем аммиак из газов коксовых печей. Азотная же
кислота, полученная окислением такого аммиака по методу Габера
(стр. 315), может конкурировать с азот-
ной кислотой, полученной из чилий-
ской селитры.
Таким образом мы вполне уверен-
но можем сказать, что азотная проблема
разрешена. Теперь обратимся к другим
двум элементам, необходимым для удо-
брения полей,— калию и фосфору.
10. Калий. Полевой шпат, входя-
щий в состав всех гранитных пород,
является соединением калия, но, к со-
жалению, он нерастворим в воде. Этот
минерал широко распространен в при-
роде, но вследствие своей нераствори-
мости в воде он бесполезен в деле
питания растений. Естественные воды,
содержащие растворенную'углекислоту, постепенно переводят поле-
вой шпат в растворимые калиевые соединения, но процесс этот
протекает слишком медленно для того, чтобы возвратить почве
калий с той же скоростью, с какой он извлекается из почвы уро-
жаями. Растворимые соединения калия, образующиеся из поле-
вого шпата, находят в конце концов дорогу в океан, и хотя общее
378
ПИТАНИЕ РАСТЕНИЙ
количество таких соединений в морской воде и очень велико, все же
концентрация, их по сравнению с концентрацией других солей на-
столько ничтожна, что извлечение их с целью применения в качестве
удобрений невозможно. Однако то, что невозможно для человека,
то в некоторых местах земли сделано в большом масштабе приро-
дой. Случается, что участок океана отделяется геологическим подъ-
емом дна океана. В результате образуется соленое озеро. Если
в такое озеро из окружающей почвы поступает меньшее количество
воды, чем ее теряется в результате испарения, то соли в таком
озере постепенно концентрируются, пока наконец они не начнут
последовательно выкристаллизовываться из раствора. Такие соле-
вые отложения встречаются в Стассфурте, в Германии, причем
расположены они слоями, как
это изображено на рис. 138.
Калий встречается в них в ви-
де сильвина (КС1) и карналлита
(KCl.MgCl2.6H2O). Эти залежи,
а также залежи в Эльзасе соз-
дали Германии монопольное поло-
жение на мировом калийном рын-
ке, продолжавшееся вплоть до
конца мировой войны, в резуль-
тате которой Франция получила
Эльзас и Германия потеряла свое
исключительное положение. Во
время войны США испытывали
чрезвычайную нужду в калии,
цены на который поднялись с 40
Рис. 138. Схематический разрез стасс- до 400 долл, за тонну. При этих
фуртских солевых залежей. условиях были использованы все
возможные источники калия в
стране. Соли калия получались из древесной золы, из пыли цемент-
ных и доменных печей, из сахарной свеклы, на которую в этой
стране в год расходуется до 18 000 т калия, из озера Сирль
и других щелочных озер, из минерала алунита, представляющего
собой плохо растворимое соединение калия, и даже из кельпа —
гигантских водорослей, произрастающих на берегу океана в Кали-
форнии. В результате этих мероприятий в 1917 г. в стране было
добыто 32573 т калия, что соответствовало примерно месячному
потреблению.
Перспектива полного освобождения США от иностранных
источников калия не очень обнадеживающа, хотя и были открыты
новые залежи калия в штате Иллионойс.
* Крупнейшие в мире залежи растворимых калийных солей на-
ходятся на территории СССР (Соликамск).
В Соликамских месторождениях калия по приблизительному
подсчету находится 16 млрд, т (в пересчете на К2О). Кроме того
богатые калийные месторождения недавно открыты в Средней Азии.
УГЛЕВОДОРОДЫ, СПИРТЫ И ЭФИРЫ
379
Таким образом Советский союз калийными удобрениями обеспечен
гораздо лучше, чем все другие страны, а в ближайшее время СССР
сможет стать крупным экспортером калийных соединений *.
11. Фосфаты. Источником для получения растворимых соеди-
нений фосфора служат фосфориты и апатиты: в состав тех и других
входит фосфат кальция Са3(РО4)2. Залежи фосфоритов имеются почти
во всех странах света. В США — в штатах Южная Каролина, Фло-
рида и Теннеси.
♦ Имеющие крупнейшее промышленное значение залежи высо-
косортных апатитов были найдены в 1923 г. в СССР (Хибиногор-
ские апатиты).
Хибинские апатитовые месторождения представляют самые боль-
шие в мире скопления апатитов, запасы которых свыше миллиарда
тонн. Хибинские апатиты являются не только мощной базой для
развития промышленности фосфорных удобрений, но благодаря своим
высоким качествам служат предметом экспорта и завоевали себе
прочное место на мировом рынке *.
Апатиты и фосфориты нерастворимы в воде. Поэтому их (после
измельчения) обрабатывают разбавленной серной кислотой и превра-
щают в растворимые кислые фосфаты кальция, в так называемый су-
перфосфат. Последний может быть непосредственно усвоен расте-
ниями:
Са3 (РО4)2 4- 2H2SO4 Са (Н2РО4)2 + 2CaSO4.
12. Концентрированные удобрения. В настоящее время в про-
мышленности удобрений существует тенденция производить такие
соединения, которые содержали бы минимальное весовое количе-
ство элементов, бесполезных для питания растений. Таким образом
получается экономия на перевозке инертных материалов. Если мы
обратим внимание на то, что чилийская селитра содержит только
16% азота, цианамид — 22%, а сульфат аммония — 21%, то наМ
станут совершенно ясными все преимущества таких веществ, как
нитрат калия, в котором 60% по весу служит питанием для расте-
ний, или двуаммонийная фосфорнокислая соль, содержащая 66%,
или смешанный фосфат калия и аммония, содержащий 84% полезных
составных частей. Последнее соединение содержит все три элемента,
в которых нуждаются растения и которые им должны дать удобре-
ния. В настоящее время такие концентрированные удобрения
появляются на рынке.
ГЛАВА XXXV
ОРГАНИЧЕСКАЯ ХИМИЯ
УГЛЕВОДОРОДЫ, СЦИРТЫ И ЭФИРЫ
В предыдущей главе нами была рассмотрена проблема питания
растений. Теперь мы займемся теми соединениями, из которых ра-
стения создают свои ткани. Это приведет нас в область органической
химии, т. е. химии соединений углерода, так как все органические
соединения содержат этот элемент. Атомы углерода обладают свой-
380
ОРГАНИЧЕСКАЯ ХИМИЯ
ством непосредственно соединяться друг с другом, образуя длинные
цепи или циклы. Этим характерным свойством атомов углерода не
только объясняется существование многочисленных соединений уг-
лерода, встречающихся в живых организмах, но также и тех «органи-
ческих» соединений, которые были впервые синтезированы в лаборато-
риях. Известно около 250000 соединений углерода. Это примерно пре-
вышает в 10 раз общее количество соединений всех других элементов.
Раньше, даже примерно 100 лет тому назад, среди химиков господ-
ствовало твердое убеждение, что такие соединения могут быть обра-
зованы только в живой ткани с помощью особой жизненной силы.
Однако это убеждение было разрушено после того как в 1828 г. не-
мецкий химик Велер синтезировал в своей лаборатории мочевину —
продукт животного обмена — путем нагревания цианата аммония.
С тех пор в лабораториях всего мира было осуществлено громадное
число синтезов органических соединений, и в настоящее время полу-
чаются синтетически тысячи тонн органических соединений.
1. Углеводороды. Простейший класс органических соединений—
углеводороды—соединения, молекулы которых состоят только из
углерода и водорода. В настоящее время известно несколько тысяч
углеводородов, из которых важнейшими являются алифатические
и ароматические углеводороды. Молекулы алифатических углеводо-
родов состоят из цепей углеродных атомов, тогда как молекулы аро-
матических углеводородов состоят из одного или большего числа
колец углеродных атомов. Бдльшая часть ароматических углеводо-
родов получается из каменноугольного дегтя (стр. 118), значительное
число их в настоящее время служит тем сырьем, из которого полу-
чаются красители, фармацевтические препараты и взрывчатые ве-
щества. Всех этих веществ мы коснемся в последней главе этой кни-
ги. Большую часть соединений, встречающихся в растительных
и животных тканях, составляют производные алифатических уг-
леводородов. Поэтому при рассмотрении обмена в растениях мы
главным образом заинтересован^ в этих соединениях. Алифатические
углеводороды подразделяются на три ряда: парафийовые, олефино-
вые и ацетиленовые углеводороды. К изучению их мы и приступим.
2. Парафиновые углеводороды. Молекулы углеводородов пара-
финового ряда отвечают общей формуле €„14^+2. Формулы индиви-
Таблица LIV. Некоторые парафиновые
углеводороды
сн4. метан т. к. — 164°
С.Н., этан т. к. — 90°
Сэнв, пропан т. к. — 38°
С4Н10, бутан т. К. + 1°
пентан т. к. + 37°
С«Н14, гексан T. К. + 69°
С7Н1в. гептан Т. К. + 98°
пентадекан т. пл. 4- 10°; т. к. 271°
CieHs4, гексадекан т. пл. -j- 18°; т. к. 287°
CssH72, пентатриаконтан т. пл. 74,7°
УГЛЕВОДОРОДЫ, СПИРТЫ И ЭФИРЫ
381
дуальных углеводородов этого ряда могут быть получены, если
в этой ‘общей формуле п заменить на какое-нибудь целое число.
Формулы, названия и физические свойства нескольких первых и не-
скольких высших членов этого ряда даны в табл. LIV.
При комнатной температуре (20° С) первые четыре члена этого
ряда — газы, от СБН12 до С1вН32—жидкости, а парафины,содержащие
в молекуле более 16 атомов углерода,—твердые вещества.
Вероятно кажется удивительным, что четырехвалентный углерод
и одновалентный водород могут образовать такое большое количество
соединений. Однако изучение структурных формул (стр. 76) этих
соединений пояснит нам, почему это оказывается возможным. Каж-
дый атом углерода в этих формулах мы должны изобразить следую-
щим образом:
I
— С-
I
причем четыре черточки соответствуют валентностям атома углеро-
да, которых всего 4. Каждый одновалентный атом водорода мы долж-
ны изобразить следующим образом:
н —
Следовательно структурная формула метана будет такова:
н
I
н-с —н
I
н
Этан с эмпирической формулой С2Н6, имеет следующую структуру:
н н
Н — (2 — Н
Одна из валентностей служит связью между 2 атомами углерода.
Структурная формула пропана С3Н8 будет такова:
н н н
I I I
н—с—с-с—н
Если мы рассмотрим формулу бутана С4Н10, то увидим, что могут
существовать две возможные структуры:
н н н н
1111
н-с-с-с-с — н
1111
н н н н
(О
н н н
Н — — с — k — н
и н | н
н- с —н
Н (2)
382
ОРГАНИЧЕСКАЯ ХИМИЯ
Эти формулы изображают молекулы двух различных веществ, так
как они хотя и состоят из одного и того же числа одинаковых атомов,
но атомы эти соединены друг с другом различным образом. Вещества,
имеющие одинаковую эмпирическую формулу, но разное строение,
называются изомерами. Оба изомерных бутана, соответствующие
приведенным выше формулам, весьма похожи друг на друга, но не
идентичны по своим химическим свойствам. Физические свойства
их также различны. Например нормальный бутан (1) обладает более
высокой температурой кипения, чем изобутан (2).
Существуют три изомерных пентана:
н
I
н —с- н
н | н
Н — С — с — с-н
н-с-н
I
н
Мы уже упоминали выше о том, что эти углеводороды входят в
состав нефти, и что метан является составной частью натурального
газа (стр. 120 и 123), а также и о том, какое они находят примене-
ние. Все парафины горючи и сгорают нацело в углекислоту и во-
ду, а в случае недостатка кислорода — с образованием воды и сажи
или окиси углерода (стр. 105). Парафиновые углеводороды с трудом,
лишь при определенных условиях, реагируют с кислотами и щело-
чами; практически они нерастворимы в воде, причем та незначитель-
ная часть, которая в воде растворяется, при этом не ионизирует,
т. е. не образует ионов водорода, так как атомы водорода соеди-
нены с углеродом неполярной связью. Таким образом парафины не
являются кислотами. При действии хлора на парафины образуется
целый ряд продуктов, в которых атомы хлора полностью или части-
чно замещают атомы водорода. Метан например может быть прев-
ращен в один из следующих четырех продуктов:
СН4 + С1а СН3С1 + НС1;
метил-хлорид
СН8С1 + С12 -* СН2С12 + НС1;
УГЛЕВОДОРОДЫ, СПИРТЫ И ЭФИРЫ
383
СН2С12 + С12 -* СНС13 + НС1;
хлороформ
СНС13 + С12 — СС14 + НС1.
четыреххлористый
углерод
Метил-хлорид применяется в комнатных холодильниках, а также
для целей местной анестезии, хлороформ— хорошо известное общее
анестезирующее средство, а четыреххлористый углерод — ценный
растворитель для различных жиров, применяемый при сухой чистке.
Кроме того он находит себе применение в огнетушителях.
3. Непредельные углеводороды. Углеводороды олефинового и
ацетиленового рядов характеризуются наличием одной или несколь-
ких, соответственно, двойных или тройных связей между атомами
углерода, входящими в их молекулы. Так, например, структурная
формула этилена С2 Н4 — первого члена олефинового ряда — содер-
жит одну двойную связь:
н—с=с—н
Ацетилен С2Н2 — первый член ацетиленового ряда — обладает
одной тройной связью:
Н — с=с— н.
Соединения, обладающие двойными или тройными связями, назы-
ваются непредельными или ненасыщенными. Чтобы связать два
атома углерода достаточно простой связи. Многократные связи
изображают валентности, которые не выполняют полностью
своего назначения. Благодаря присутствию кратной связи молекулы
ненасыщенных соединений обладают способностью присоединять
разные атомы, например атомы хлора или водорода. Если например
на этилен или ацетилен действовать хлором, то происходит присо-
единение хлора по месту двойной связи:
нх /н
)С = С< + С1 — С1
н/ \н
этилен молекула
хлора
н н
I I
н-с-с-н
I I
С1 С1
С1 С1
Н — С = С — Н + С1- CI —> н —с = с— н
ацетилен
CI С1
н — с = d — н + Cl — Cl —►
Cl Cl
I I.
н-с —с— H
I I
Cl Cl
384 органическая химия
Этилен может быть получен отщеплением элементов воды от этило-
вого спирта:
НН НН
II II
н — с - с — н —* н — с = с — н + Н„о
I I
н о
I
н
этиловой
спирт
Такая дегидратация имеет место при пропускании паров спирта над
катализатором, например над пористым каолином. Во время миро-
вой войны этилен применялся для получения горчичного газа (ип-
рита), причем были разработаны способы для получения его в
большом масштабе и по низкой себестоимости. После войны выяс-
нилось, что этилен может заменить ацетилен при сварке, причем
работа с ним гораздо безопаснее. В настоящее время ; этилен
широко применяется для придания соответствующего цвета зеле-
ным апельсинам и лимонам. Цитрусовые фрукты созревают до
того, как их кожа теряет свою зеленую окраску. В таком виде
их удобно транспортировать, причем они не портятся, а затем по
прибытии их по назначению им придают соответствующую окраску
с помощью газообразного этилена. Даже при такой ничтожной
концентрации, как 1 ч. этилена на 3 000 ч. воздуха, 25 куб. фт.
(0,7 м3) этого газа достаточно, чтобы вагон апельсинов в течение
5 дней приобрел соответствующую окраску. Этилен находит также
применение в медицине в качестве общего анестезирующего средства.
Большой интерес представляет история открытия применения этиле-
на для этой цели. В 1908 г. цветочный торговец в Чикаго обнаружил,
что гвоздика при помещении ее в один из углов его теплицы быстро
закрывала свои лепестки и как бы засыпала. Он пригласил на кон-
сультацию ботаника Крокера из чикагского университета. Послед-
ний обнаружил, что все это происходило в результате того, что газо-
вая труба дала течь, и просачивался светильный газ. Так как све-
тильный газ состоит из смеси различных веществ (стр. 118), то Крокер
исследовал действие всех этих составных частей на гвоздику и об-
наружил, что действующим началом в данном случае был этилен.
Позднее, уже в 1922 г., проф. Лекхардт, также из чикагского универ-
ситета, в сотрудничестве с Картером нашел, что крысы, подвергну-
тые действию воздуха, содержащего 80% этилена, сворачивались
клубочком и засыпали. Таким образом были открыты анестезирую-
щие свойства этилена.
Ацетилен получают в больших количествах при действии воды
на карбид кальция СаС2:
/С НОН /ОН С- Н
Са<|||+ ^Са< +Ш
х нон +н с-н
УГЛЕВОДОРОДЫ, СПИРТЫ И ЭФИРЫ
385
Он широко применяется для ацетиленовой сварки и резки, а так-
же для синтеза таких важных органических соединений, как ук-
сусная кислота (§ 8) и ацетон (§ 7).
4. Алкоголи (спирты). Алкоголи можно рассматривать как
соединения, получающиеся в результате замещения одного или боль-
шего числа водородных атомов углеводорода гидроксильными груп-
пами ОН. Простейшие и наиболее важные алкоголи являются про-
изводными парафиновых углеводородов. Если мы от углеводорода
отнимем 1 атом водорода, то получим одновалентную группу, или
радикал. Такое соединение радикала с группой ОН и представляет
собою алкоголь (табл. LV).
Таблица LV. Типичные алкоголи
Углеводород Одновалентный ра- дикал Соответству юти й алкоголь
СН4 метан С2Нв этан С3Н8 пропан С4Н10 бутан СН3 метил С2Н5 этил С3Н7 пропил С4Н9 бутил СН3ОН метиловый С2Н6ОН этиловый С3Н7ОН пропиловый С4Н9ОН бутиловый
Название радикала производят от соответствующего углево-
дорода заменой окончания ан на ил.
Наиболее важны в этом ряду первые два алкоголя — метило-
вый и этиловый. Оба они имеют целый ряд других названий. Мети-
ловый алкоголь обычно известен под названием древесного спирта.
За последнее время он появился на рынке под названием метанола.
Этиловый алкоголь известен обычно как винный спирт или этанол.
Метиловый алкоголь до последнего времени получался исклю-
чительно в качестве побочного продукта при сухой перегонке де-
рева (стр. 116). В 1923 г. в Германии был разработан синтез метило-
вого спирта из водяного газа (стр. 119 и 125). Водяной газ, представ-
ляющий собой смесь окиси углерода и водорода, приводят в соприкос-
новение с соответствующим катализатором при температуре около
400° и под давлением в 50 ат или выше; синтез метилового спирта
протекает по уравнению:
СО + 2Н2 — СН3ОН.
В качестве катализаторов чаще всего применяют смеси окислов
цинка и хрома или цинка и меди.
Метиловый алкоголь применяется в качестве растворителя
для смол и камедей при производстве лаков и шеллака, для полу-
чения формальдегида (стр. 388) и в качестве добавки для денатури-
рования этилового спирта, делая последний непригодным для внут-
реннего употребления. Метиловый алкоголь является сильным
ядом при внутреннем употреблении, вызывая слепоту и смерть.
25 Введение в химию.
386
ОРГАНИЧЕСКАЯ ХИМИЯ
Этиловый алкоголь, иначе называемый винным спиртом С2Н5ОН,
получается брожением сахаров. В США наиболее важным сырьем
являются меласса тростникового сахара и кукуруза (в СССР — кар-
тофель). Мелассу разбавляют водой, слегка подкисляют и затем при-
бавляют чистую культуру дрожжей, в результате чего протекает
следующая реакция:
С6Н12О6 — 2С2Н5ОН -ь 2СО2.
сахар
По окончании брожения перебродившую жидкость подвергают
перегонке. Дестиллат подвергают повторной многократной перегон-
ке, после чего получают чистый 95%-ный спирт, который и посту-
пает в продажу.
Область промышленного применения этилового алкоголя на-
столько велика и разнообразна, что мы можем коснуться здесь только
некоторых из них. Прежде всего этиловый спирт — ценный раство-
ритель при получении лаков, шеллаков, эмалей и пироксилиновых
пластических масс (стр. 397). Более 4000 различных лекарств гото-
вятся на этиловом спирте. Он применяется в качестве противоза-
мерзающего компонента в автомобильных радиаторах, в качестве
моторного топлива, при изготовлении вкусовых экстрактов, при
производстве красителей и искусственного шелка, для получения
этилена и эфира и т. д.
О том, какой физиологический эффект оказывает винный спирт
при внутреннем употреблении, вероятно читателю известно.
Существуют также алкоголи, которые содержат в молекуле бо-
лее одной группы ОН. К таким многоатомным алкоголям принадле-
жит например глицерин С8Н6(ОН)3 или
н н н
I I I
Н—с—с-с—н
Глицерин получается в качестве побочного продукта при производ-
стве мыла (стр. 399 и применяется главным образом для получения
нитроглицерина и динамита (стр. 390), а также применяется в кос-
метике.
5. Эфиры. Эфиром называется такое органическое соединение,
молекулы которого содержат два органических радикала, например
метил, этил или пропил и т. п., соединенных друг с другом через атом
кислорода. Типовая формула эфира такова:
R\
>0
УГЛЕВОДОРОДЫ, СПИРТЫ И ЭФИРЫ
387
где R и R' означают какие-либо одинаковые или различные ра-
дикалы (метил, этил и т. п.).
Наиболее важный эфир — диэтиловый эфир (СаН8)2О, называемый
иногда серным эфиром, представляет собой хорошо известное ане-
стезирующее средство. Получается он дегидратацией этилового спир-
та серной кислотой:
н н
н—с-с—о-Н
I I
н н
н н
н-с-с-О-Н
6. Альдегиды. Альдегиды характеризуются следующей типо-
вой формулой:
р__С/Н
R %
где R может быть органическим радикалом или водородом. Назва-
ния и формулы трех простейших альдегидов таковы:
или НСНО
формальдегид
или СН8СНО
ацетальдегид
или СНаСН2СНО
или
СаН6СНО
пропионовый альдегид
Эти альдегиды получаются в результате окисления молекул, содер-
жащих группу — СН2ОН:
о
RCHaOH---------------> R — СНО + НаО
(от окислителя)
Таким образом при окислении метилового и этилового алкоголей
получаются соответственно:
25*
388
ОРГАНИЧЕСКАЯ ХИМИЯ
Н
н - (i — он
I
н
н н
I I
н - с - с - он
I I
н н
н
н-с/ + нао
о
' /
н — с - с< + Н,0
Формальдегид представляет собой газ и при растворении в воде дает
хорошо известное антисептическое и дезинфицирующее средство —
формалин. Если его обработать фенолом, который иначе называется
карболовой кислотой (стр. 407), то образуется синтетическая смола —
бакелит. Формальдегид находит широкое применение в производ-
стве красителей и лекарственных препаратов.
7. Кетоны. Молекулы кетонов характеризуются следующей
общей формулой:
R.
>с =о,
Rr/
в которой R и R' могут быть любыми органическими радикалами.
Наиболее важным из этих соединений является диметилкетон, или
ацетон СН3СОСН3. Он широко применяется в качестве раствори-
теля.
*8. Органические кислоты. Все органические кислоты содержат
группу —СООН:
,о-н
В этой’формуле R может быть водородом или любым органическим
радикалом. Некоторые из наиболее простых органических кислот
приведены ниже:
.о - н
Н - С< или НСООН
^0
муравьиная кислота
У о-н
Н — С - с/ или СНЭСООН
уксусная кислота
7 I* о— н
н - С - С - или C,HSCOOH
н н °
пропионовая кислота
УГЛЕВОДОРОДЫ, СПИРТЫ И ЭФИРЫ
389
Эти кислоты получаются в результате окисления альдегидов;
уН О /О - н
н - с/----------------► н - с/
(от окислителя)
формальдегид муравыш-я кислота
1/0 1
Н — С - С</---------► н - с —
н 0 н 0
ацетальдегид уксусная кислота
Эти кислоты в водном растворе диссоциируют, образуя водородные
ионы за счет группы —СООН, причем другой ион представляет
собой остаток молекулы:
.о— н уО~
Н-С<---------------► Н — с/ +н +
X) ч----------
формиат-ион
ацетат-ион
+ н*
Следовательно органические кислоты могут вступать в реакцию
нейтрализации с основаниями, образуя при этом соли:
HCOOjH + Na|OH — HCOO|Na + На0
муравьинокис-
лый натрий
СН8СОо’|Н + Na|oH — CH3COo!Na + Н20
уксуснокислый
натрий
9. Сложные эфиры. При реакции алкоголя с кислотой обра-
зуется сложный эфир. Так, например, этиловый спирт и хлористо-
водородная кислота образуют этилхлорид:
C8HjOH + НС1 — С2Н6С1 + Н80.
Этот тип реакции называется этерификацией и по крайней мере
формально, аналогичен реакции нейтрализации, протекающей меж-
ду основанием и кислотой с образованием соли и воды:
NaOH + НС1 — NaCl + На0.
Однако между этими двумя типами реакций имеется весьма сущест-
венная разница. Нейтрализация — это реакция, протекающая меж-
ду веществами, каждое из которых является электролитом и следо-
вательно диссоциировано на ионы. Поэтому эта реакция протекает
почти мгновенно. Что касается этерификации, то так как алкоголь
390
ОРГАНИЧЕСКАЯ ХИМИЯ
неэлектролит, реакция требует нагревания в течение многих часов,
для того чтобы получился заметный выход сложного эфира.
Кислота, реагирующая с алкоголем, может быть органической,
например уксусная кислота, или неорганической, например
хлористоводородная кислота, причем в обоих случаях образуется
сложный эфир.
Так, например, уксусная кислота и этиловый алкоголь образуют
сложный эфир — этилацетат:
СН3СООН + С2НБОН -и СН3СООС2Н5 4 Н20.
Сложные эфиры органических кислот большей частью представляют
собою жидкости, обладающие приятным запахом. Многие из них
входят в состав фруктов и цветов. Некоторые сложные эфиры являют-
ся весьма ценными органическими растворителями.
Весьма важное значение имеют некоторые сложные эфиры мно-
гоатомных алкоголей. При обработке глицерина смесью азотной и
серной кислот получается тринитрат глицерина, или нитроглице-
рин,— хорошо известное взрывчатое вещество:
С3Н6 (0Н)3 + 3HN03 С3Н6 (ONO2)3 + ЗН2О.
глицерин тринитрат
глицерина
Серная кислота в этом случае служит дегидратирующим средством
(стр. 312). Полученное вещество представляет собой жидкость, ра-
ботать с которой весьма затруднительно ввиду ее взрывчатости.
Если нитроглицерин смешать с таким пористым веществом, как на-
пример, древесные опилки или инфузорная земля, то он пропиты-
вает это вещество, и из этой массы можно изготовить стержни. В
этом виде нитроглицерин известен под названием динамита.
ГЛАВА XXXVI
ОРГАНИЧЕСКАЯ ХИМИЯ
УГЛЕВОДЫ, ЖИРЫ И БЕЛКИ
Мы довольно бесцеремонно и быстро провели читателя по неко-
торым основным типам органических соединений, чтобы показать
ему хотя бы частично всю сложность тех веществ, из которых состоят
живые организмы. Кроме того некоторое знакомство с этими вещест-
вами необходимо и для того, чтобы перейти к проблемам питания.
Если мы обратимся к простейшим жизненным формам, существую-,
щим в виде одноклеточных организмов и видимым лишь под ми-
кроскопом, с целью определения тех соединений, из которых
они состоят, то заметим, что все эти соединения весьма сложны,
как и соединения, входящие в состав высших организмов. Вопрос
о том, каким образом эти соединения образовались из неорганиче-
ской материи, представляет такую же загадку для химика, какую
происхождение жизни — для биолога. Нигде в природе химики не
УГЛЕВОДЫ, ЖИРЫ И 6ЕЛКИ
391
встречаются с синтезом даже простейших органических веществ
из неорганических соединений, за исключением клеток живых орга-
низмов. Протоплазма, та физическая среда, в которой протекают
жизненные процессы, в основном состоит из смеси таких сложных
веществ, как углеводы, жиры и белки, причем молекулы этих веществ
образуют системы, в которых важную роль играют коллоидальные
агрегаты. Мы попытаемся здесь дать некоторое представление о
химической природе этих типов веществ и их значении как в ка-
честве сырья для некоторых химических отраслей промышленности,
так и в качестве тех питательных веществ, из которых черпается
энергия для наших собственных жизненных процессов.
1. Фотосинтез. В зеленых листьях растений находятся малень-
кие круглые тельца, диаметр которых равен примерно 0,002 мм и
которые называются хлоропластами. Для живых организмов эти
тельца являются самыми важными телами на земле, так как внутри
их, каким-то неизвестным нам образом происходит превращение лу-
чистой энергии солнца, накапливаемой там в виде химической энер-
гии. Если бы навсегда остановилась работа этих телец, на земле
вскоре прекратилась бы всякая жизнь *. Внутри их находится ве-
щество — хлорофил, которое по всей вероятности представляет
смесь четырех сложных соединений, находящихся в коллоидном
растворе вместе с жирами, восками и минеральными солями. Ниже
даны названия этих четырех соединений, их эмпирические формулы
и процентное содержание в хлорофиле:
Хлорофил A (C55H72O5N4Mg)......................61 %
Хлорофил В (C55H70O,N4Mg)......................22 %
Ксантофил (С40Н5,О2)...........................10 %
Каротин (С10Н6в)...............................5,9%
Большое число атомов в формулах этих веществ служит указа-
нием на сложную структуру их молекул. Мы знаем очень мало о струк-
туре этих соединений; интересно лишь отметить, что хлорофильные
пигменты связаны с гематином, производным гемоглобина, входя-
щего в состав крови животных. Атом железа в молекулах гематина
соответствует атому магния в хлорофиле.
Основная пища растений — углекислый газ и вода. Эти послед-
ние каким-то образом в хлоропластах превращаются в углеводы,
в молекулах которых накапливается солнечная энергия в виде хими-
ческой энергии. При этом процессе выделяется кислород. Механизм,
по которому осуществляется синтез углеводов, неизвестен, однако
имеются некоторые указания на то, что он может протекать следую-
щим образом. Сперва углекислый газ и вода соединяются друг с дру-
гом, образуя формальдегид и кислород:
СО2 + Н2О НСНО + О2.
* Такое утверждение неточно; оно справедливо лишь по отношению к вы-
сокоорганизованным живым существам. Известны микроорганизмы, способные
синтезировать органические вещества из неорганических без помощи света. Ред.
392
ОРГАНИЧЕСКАЯ ХИМИЯ
Осуществить эту реакцию в лабораторных условиях очень трудно,
однако Бэли удалось получить некоторое количество формальдегида,
подвергая реагирующие вещества действию ультрафиолетовых лу-
чей. В дальнейшем 6 молекул формальдегида могут вступить в реак-
цию конденсации с образованием глюкозы, одного из простейших
углеводов, представляющей собой сахар:
6НСНО -* СвН12Ов.
глюкоза
Эту реакцию уже гораздо легче осуществить в лабораторных усло-
виях. Наконец несколько молекул глюкозы (сколько, пока еще точ-
но неизвестно) могут соединиться друг с другом с отщеплением
элементов воды, причем в результате образуется или крахмал, кото-
рый является как бы запасной пищей растений, или целлюлоза —
то соединение, из которого состоят в основном клеточные стенки
растительных тканей и которая придает им жесткость:
хСвН12Ов ► (СвН10О6)х хН2О
крахмал или
целлюлоза
Крахмал и целлюлоза имеют одинаковые простейшие формулы, но
различную структуру.
2. Строение углеводов. Углеводами называются органические
соединения, в состав которых входят следующие элементы: угле-
род, водород и кислород. Кроме того атомы водорода и кислорода,
входящие в состав большинства углеводов, находятся в том же отно-
шении, как и в молекуле воды, т. е. в отношении 2:1. Общая фор-
мула углеводов следующая СхН2уОу*; простейшим углеводом, исходя
из формальных соображений, можно считать формальдегид СН2О.
Углеводы, встречающиееся в природе, разделяются на сахара, дек-
стрины, крахмалы и целлюлозу. Структурная формула одного из
простейших сахаров, глюкозы, указывает на то, что она явля-
ется пятиатомным алкоголем и одновременно альдегидом:
1 н 1 : Н-С-О-Нi Н-С-О-Н| | i пятиатомный алкоголь Н-С-О-Нi 1 н — с — С — Н ! 1 i Д—С-О— Н ! Н — С = 0 i альдегидная группа Н — С = 0
глюкоза
♦ Название «углеводы» устарело. Известны вещества, являющиеся по строе-
нию и свойствам углеводами и имеющие состав CeH12O5. С другой стороны, уксус-
ная кислота CsH4Ot, содержащая водород и кислород в той же пропорции, что
и углеводы, все же не углевод. Тем не менее название «углеводы» не заменено еще
другим. Ред.
УГЛЕВОДь!, ЖИРЫ И БЕЛКИ
393
К несколько иному типу сахаров принадлежит изомер глюкозы —
фруктоза. Структурная формула этого сахара:
кетонная группа
фруктоза
Формула указывает на то, что он является многоатомным алкого-
лем и одновременно кетоном. Эти сахара существуют и в другой фор-
ме, получаемой при молекулярной перегруппировке, приведен-
ной ниже. В каждом отдельном случае атом водорода переходит
от гидроксильной группы пятого углеродного атома (считая и угле-
род карбонильной группы) к группе СО, в результате чего обра-
зуется кислородный мостик между этими двумя атомами:
альдегидная форма
лактонная форма
Более сложные сахара получаются в результате конденсации
двух или большего числа более простых молекул сахара с отщепле-
нием при этом воды. Сахароза например, или обыкновенный
394
органическая ХИМИЯ
тростниковый сахар, — продукт конденсации глюкозы и
фруктозы:
н
I
н — с-о— н
I
н-с-----
I
н —с—о-н
н-С-О-н
I С
Н —С—О-Н |
н
I
н-о-с-н
I
I----с—н
I Н — О — С— н
О I
I н-о-с-н
н-о-с-н
сахароза
Крахмал и целлюлоза вероятно образуются в результате ана-
логичной конденсации молекул глюкозы. В настоящее время имеет-
ся несколько различных формул, которые были предложены для
изображения молекул этих двух веществ, однако все эти формулы
представляют только попытку найти истинную формулу. Применяя
только эмпирические формулы, мы можем изобразить синтез целлю-
лозы или крахмала из глюкозы следующим образом:
хС6Н12О6 ч—(CeH10O5)x -f- хН2О.
Все реакции, представляющие образование более сложных угле-
водов из более простых с отщеплением при этом воды, являются ре-
акциями обратимыми. Сахароза, например, легко подвергается гидро-
лизу, распадаясь на глюкозу и фруктозу. Крахмал и целлюлоза с по-
мощью гидролиза могут быть количественно превращены обратно
в глюкозу. Такого рода изменение претерпевают крахмалы в на
шем организме при пищеварении. Целлюлоза же нами не перевари-
вается. Если же древесные опилки (состоящие в основном из цел-
люлозы) нагревать с концентрированным раствором соляной кис-
лоты, то они превращаются в переваримые сахара, которые успеш-
шно применялись для кормления животных
3. Сахарная промышленность. Единственный сахар, знакомый
обывателю, — это тот сахар, который химики называют сахарозой.
Как читателю вероятно известно, он извлекается из сахарного трост-
ника или сахарной свеклы. Продукция сахара из этих двух источ-
ников в 1924/25 г. достигла почти 25 000 000 т. Распределение этой
продукции по отдельным странам дано в табл. LVI.
Описание методов культивирования и уборки сахарного трост-
ника и сахарной свеклы выходит за пределы данной книги. Для то-
го, чтобы из тростника или свеклы извлечь сахар, тростник сперва
пропускают между валами, а свеклу с помощью вращающихся
ножей режут на тонкие ломтики. Затем сахар извлекают водой,
УГЛЕВОДЫ, ЖИРЫ И БЕЛКИ
395
Таблица LVI. Продукция сахара
Страна Тонны сахара Источник
Куба США и их колонии .... Британская Индия .... Ява Германия Чехословакия Франция Бразилия Польша Япония и Формоза .... 5100 000 0 7^7 QQ7 / 1 783 652 2 757 837 | g74158 2 537 000 1 977 490 1600 000 1460 000 830 000 500 000 495 000 460 000 тростник » свекла тростник « свекла « « тростник свекла тростник
понижают кислотность полученного раствора, некоторую часть
примесей осаждают известью. Сахарный раствор упаривается в
эвапораторах и вакуумных чанах. При этом сахар кристаллизуется.
В западном полушарии источником получения сахаров служит
кукуруза. Зерно кукурузы состоит из трех частей: шелухи, зародыша
и белого тела, кото-рое состоит главным образом из крахмала и со-
ставляет более половины веса зерна. При нагревании его с очень
разбавленной кислотой крахмал гидролизуется, образуя ряд продук-
тов, среди которых имеются декстрины, применяемые в качестве
клея для почтовых марок и конвертов, и зерновая патока, состоя-
щая из смеси двух сахаров — мальтозы (45%) и глюкозы (20%) —
и декстрина (35%). Маисовый крахмал можно посредством гидро-
лиза превратить количественно в глюкозу, которая находит широкое
применение в кондитерской промышленности. Она обладает тем
преимуществом по сравнению с тростниковым сахаром, что весьма
трудно кристаллизуется.
4. Целлюлозная промышленность. Целлюлоза является тем
углеводом, который образует клеточные стенки и древесную струк-
туру растений. Хлопок представляет собой почти чистую целлюлозу.
Эмпирическая формула ее (С6Н10О6)х ничего не говорит нам о ее
строении, а следовательно и химических свойствах. Для молекулы
целлюлозы был предложен целый ряд структурных формул, но ни
одна из них не считается еще общепринятой. Все сходятся в том,
что целлюлоза образовалась в результате конденсации нескольких
молекул глюкозы:
xCeH12O6 (CeH10Os) х + хН2О,
так как целлюлозу можно подвергнуть гидролизу и нацело превра- •
тить обратно в глюкозу. Кроме того все структурные формулы схо-
дятся на том, что в молекуле целлюлозы на каждую группу СвН10О5
имеются три группы ОН. Таким образом целлюллоза ведет себя как
396
ОРГАНИЧЕСКАЯ ХИМИЯ
многоатомный, точнее трехатомный, алкоголь, и мы можем это отме-
тить, написав ее формулу следующим образом:
[С6Н7О2 (ОН)3]Х.
Целый ряд отраслей промышленности применяет целлюлозу, не
подвергая ее химическим изменениям. Среди них необходимо упомя-
нуть текстильную и деревообделочную промышленность. При по-
лучении бумаги из древесины химия требуется только для того,
чтобы освободить целлюлозу от тех примесей, которые вместе с ней
входят в состав древесины. Среди этих примесей самая важная
лигнин. В бумажном производстве дерево, обычно ель и сосна,
превращается с помощью особой машины в стружки, которые в те-
чение нескольких часов обрабатываются под давлением раствором
бисульфита натрия NaHSO3 или кальция Ca(HSO3)2. При такой
обработке лигнин растворяется, и полученная бумажная масса со-
стоит из волокон почти чистой целлюлозы. Эту бумажную массу
отбеливают хлором, прибавляют проклеивающие вещества, напри-
мер клей или канифоль, для того чтобы на готовой бумаге не рас-
плывались чернила, а затем всю эту массу на бумажной машине по-
средством механического' процесса превращают в бумагу. Бумага
из льняной или бумажной тряпки лучше, чем бумага из древесной
массы, и прочнее ее. В США газеты и журналы чрезвычайно интен-
сивно истребляют леса. Например одна из нью-йоркских газет по-
требляет почти 2000 акров (800 га) леса в год.
5. Эфиры целлюлозы. Некоторые другие отрасли промышлен-
ности применяют целлюлозу в качестве сырья, но в процессе произ-
водства готовой продукции изменяют ее химическую природу. Мы
уже указывали на то, что целлюлоза может функционировать как
алкоголь, следовательно при обработке кислотами она может быть
превращена в сложные эфиры. Наиболее важными из них являются
нитраты целлюлозы, получаемые при обработке целлюлозы смесью
концентрированных азотной и серной кислот:
[CeH7O2 (ОН)3] х+ 3xHNO3 — [CeH7O2 (NO3)3] х + Н2О.
целлюлоза нитрат целлюлозы
Нитрат целлюлозы является хорошо известным взрывчатым ве-
ществом, называемым нитроцеллюлозой. Это вещество не
растворимо в воде, но растворимо в смеси эфира и спирта.
Такой раствор называется коллодием. Существует предание,
что Альфред Нобель, шведский химик, как-то, работая в лабо-
ратории, порезал себе палец. Он помазал порез этим эфирно-
спиртовым раствором, и в то время, как растворитель испарялся,
ему пришла в голову мысль использовать это вещество в ка-
честве абсорбента для жидкого сильно взрывчатого вещества
нитроглицерина. Когда он смешал раствор коллодия с нитро-
глицерином, образовалась желатинообразная масса. Это и было
открытием гремучего студня, первого в ряду сильнейших взрыв-
чатых веществ, которые настолько мало чувствительны к удару,
УГЛЕВОДЫ, ЖИРЫ И БЕЛКИ
397
что ими можно выстрелить из пушки без всякой опасности для стре-
ляющих. Все это произошло в 1878 г. Нобель на этом открытии
составил себе состояние, часть которого, согласно его посмертной
воле, пошла на установление фонда, из которого ежегодно при-
суждаются премии, носящие его имя, тем, которые сделали выдаю-
щиеся открытия в области медицины, химии и физики, кто создал
лучшие художественные произведения, и тем, кто сделал значитель-
ные вложения в дело поддержания всеобщего мира.
Если целлюлозу обрабатывать в более мягких условиях сме-
сью азотной и серной кислот, получается смесь моно- и динитратов
целлюлозы:
[СвН7О2 (ОН)3]Х + 2xHNO3 — [СвН7О2 (ОН) (NO3)2] х + 2хН2О;
[СвН7О2 (ОН),] х + xHNO3 -> [С6Н7О2 (ОН), (NO3)], + хН2О.
Смесь эта называется пироксилином. Он чрезвычайно
легко воспламеняется и сгорает с большой быстротой без взрыва,
но взрывает с большой силой от взрыва других веществ (дето-
нация). Из него получается целый ряд полезных материалов.
В 1870 г. Д. У. Хиятт в поисках вещества, которое могло бы за-
менить слоновую кость для изготовления биллиардных шаров, от-
крыл целлулоид. Этот материал получается при формовке пирок-
силина с половинным (по весу) количеством камфоры вместе со спир-
том; после этого смесь в формах подвергают действию нагревания и
давления. Хиятт начал производство этого вещества в Ньюарке (штат
Нью-Йорк). Целлулоид идет главным образом на изготовление плен-
ки, применяемой в фотографии и в кинематографии.
От целлулоида берет свое начало целый ряд так называемых
пироксилиновых пластических масс. Материал этот мо-
жет быть окрашен целым рядом красителей, кроме того его можно
сделать прозрачным посредством отбелки, или же непрозрачным,
прибавляя к нему окислы или хлориды некоторых металлов. Из
целлулоида делается целый ряд искусственных материалов, идущих
на имитации под слоновую кость, черепаховый щит, кораллы, янтарь
и многие другие натуральные продукты. В настоящее время изго-
товляюг медленнно горящий и трудно воспламеняемый целлулоид для
безопасной пленки, причем вместо нитрата целлюлозы применяется
ее ацетат.
Другое применение пироксилин находит себе в производстве
искусственной кожи. Для этого ткань пропитывается раствором
пироксилина в касторовом масле.
Новые лаки и лакокраски для автомобилей представляют со-
бой пироксилин, коллоидально диспергированный в таком раство-
рителе, как, например, бутилацетат, или в смеси этил- и амилацета-
тов. В качестве пластификатора применяется камфора, кроме того
добавляются светоустойчивые и светонепроницаемые пигменты, а
также смолы, чтобы придать готовой, покрытой лаком поверхности
блеск и прочность.
ОРГАНИЧЕСКАЯ ХИМИЯ
6. Искусственный шелк. Искусственный шелк, иначе назы-
ваемый искусственным волокном, также является производным цел-
люлозы. В настоящее время существуют четыре метода, по которым
получается этот весьма важный текстильный фабрикат. В 1889 г.
на Парижской выставке появились первые образцы искусствен-
ного шелка. Получен этот шелк был по нитратному методу, откры-
тому де-Шардоннэ. При работе по этому методу раствор нитроцел-
люлозы продавливается через мелкие отверстия в раствор сернистого
кальция. При этом происходит отщепление нитрогрупп и в осадке
остается почти чистая исходная целлюлоза в виде искусственного
волокна, обладающего блеском шелка.
В настоящее время более 80% всего искусственного волокна
делается по вискозному методу, открытому в 1892 г. двумя англий-
скими химиками, Кроссом и Бивэном. По этому методу хлопок или
древесную массу обрабатывают концентрированным раствором едко-
го натра и сероуглеродом, причем целлюлоза превращается в раст-
воримый в воде ксантогенат целлюлозы, раствор которой в разбав-
ленной щелочи называется вискозой. Из этого раствора целлюлозу
осаждают в виде блестящего целлюлозного волокна при помощи
раствора серной кислоты.
7. Жиры. Жиры принадлежат к другому важному классу ор-
ганических соединений, встречающихся в живых организмах. Все
жиры представляют собой смеси сложных эфиров трехатомного спирта
глицерина и какой-нибудь жирной кислоты, т. е. органической кис-
лоты, имеющей в своем составе группу СООН, но со значительно
большим молекулярным весом. Наибольшее значение имеют сле-
дующие жирные кислоты:
Предельные жирные кислоты
С15Н31СООН пальмитиновая кислота
С17Н36СООН стеариновая кислота
Непредельные жирные кислоты
С17Н33СООН олеиновая кислота
с17н31соон линолевая кислота
Жир можно синтезировать с помощью реакции этерификации, проте-
кающей между глицерином и жирной кислотой (стр. 390):
С3НБ (ОН), + ЗС17Н35СООН — (С17Н36СОО)3С3Н5 + ЗНОН.
глицерин стеариновая кислота стеарин
Жиры, в которых преобладают сложные эфиры предельных жирных
кислот, представляют собой твердые вещества, тогда как в жидких
жирах, например хлопковом или оливковом масле, в большем коли-
честве содержатся эфиры, происходящие от жирных кислот, в мо-
лекулах которых имеются двойные связи, т. е. от непредельных жир-
ных кислот. Обычно все жиры, встречающиеся в природе, представ-
ляют собой смеси твердых и жидких жиров. Говяжье сало, например,
УГЛЕВОДЫ, ЖИРЫ И БЕЛКИ
399
состоит на 3/4 из стеарина и пальмитина и на 1/i из олеина. Свиное
сало на 40% состоит из пальмитина и стеарина и на 60% из олеина.
Коровье масло представляет эмульсию, содержащую 14% воды,
затем пальмитин, стеарин и олеин и кроме того еще 8% бутирина
(С3Н,СОО)3С3Н5. Хлопковое и оливковое масла содержат 75% олеи-
на, непредельного жидкого жира. Льняное масло, широко применяю-
щееся в лакокрасочной промышленности, содержит линолеин, слож-
ный эфир глицерина и линолевой кислоты. Эта кислота обладает еще
более непредельным характером, чем олеиновая.
8. Гидрогенизация жиров. Превращение жидких непредель-
ных жиров в твердые предельные является предметом весьма
важной отрасли промышленности. Осуществить это превращение
можно посредством присоединения водорода по месту двойных свя-
зей в молекулах непредельных жиров, применяя для этого в каче-
стве катализатора мелкораздробленный никель, например
[СН, (СН2), CH = СН (СН2)7 СОО], с,н,
олеин, жидкий жир
[СН, (СН2), СН2 СН2 (СН2), СОО], с, н,
стеарин, твердый жир
Этот процесс гидрирования двойных связей с применением никеля
в качестве катализатора был разработан французским химиком По-
лем Сабатье, за что он получил в 1912 г. нобелевскую премию. По-
средством этого процесса такие жидкие жиры, как хлопковое мас-
ло, подвергаются частичной гидрогенизации и превращаются в по-
лутвердые растительные жировые продукты, пользующиеся в настоя-
щее время большим распространением. В результате полной гидро-
генизации получается твердый, хрупкий продукт. Гидрогенизирован-
ные жиры находят широкое применение в производстве мыла.
9. Мыло. Мылом называется соль жирной кислоты. Для
получения мыла жир обрабатывают едким натром или едким кали:
(С17Н35СОО)3С3Н5 + 3NaOH — 3C17H85COONa + С3Н6 (ОН)3
стеарин, жир стеарат натрия, глицерин
мыло
В качестве побочного продукта всегда получается глицерин. Для
стирки применяется как натриевое, так и калиевое мыло. Мыла не-
которых тяжелых металлов применяются в качестве эмульгаторов
при получении смазочных продуктов (стр. 356).
10. Белки. Белки, иначе называемые протеинами, обладают
более сложными молекулами, чем углеводы или жиры. Прежде чем
перейти к рассмотрению их строения, мы должны познакомиться
с двумя более простыми классами веществ, производными которых
и являются белки, а именно с аминами и амидами. Оба эти класса
400
ОРГАНИЧЕСКАЯ ХИМИЯ
веществ — производные аммиака NH3. Аминогруппа — NH2, вхо-
дящая в состав их молекул, — группа одновалентная, получаемая
из молекулы аммиака отнятием от последней одного водородного
атома. Амином называется вещество, в котором эта группа соеди-
нена с органическим радикалом, как, например, метил, этил, пропил
и т. д. Метиламин можно получить при взаимодействии аммиака
с метилхлоридом:
СН3С1 + NH3—> CH3NH2 + НС1.
Амиды являются производными органических кислот. В молекуле
амида аминогруппа заменяет группу ОН-кислоты:
СН3СООН CH3CONH3
уксусная кислота ацетамид
Амиды могут быть получены из соответствующей кислоты и аммиака.
Сначала получается аммонийная соль кислоты:
R СООН + NH3 — R COONH4,
которая при нагревании дает амид:
R COONH4 — R CONH2 + Н2О.
Таблица LVII. Аминокислоты, полученные при гидролизе
белков
CHBNHBCOOH
глицин
CHaCHNHsCOOH
аланин
(CH8)BCHCHNHBCOOH
валин
(CH8)BCHCHBCHNHBCOOH
лейцин
CeH6CHBCHNHBCOOH
фенилаланин
HOCe^CH.CHNHjCOOH
тирозин
CHBOHCHNHBCOOH
серин
SCHBCHNHBCOOH
^CH,CHNH,COOH
цистин
НВС —СН8
н,с ^нсоон
N
14
пролин
COOHCHBCHNHBCOOH
- аспарагиновая кислота
COOHCHBCHBCHNHBCOOH
глутаминовая кислота
CHBNHBCHBCHBCHNHBCOOH
орнитин
NHBC (= NH) NHCHBCHBCHBCHNHBCOOH
аргинин
CHbNHbCH8CHbCH2CHNHbCOOH
лизин
НС = С - CHBCHNHtCOOH
I I
HN N гистидин
\//
С
I
н
н
к
//\
НС С —С —CH.CHNH.COOH
НС С (Ун триптофан
УГЛЕВОДЫ, ЖИРЫ И БЕЛКИ
401
При гидролизе белков получается смесь различных аминокис-
лот — веществ, которые одновременно являются и аминами и кисло-
тами. Простейшим соединением такого рода будет глицин, или ами-
ноуксусная кислота:
СН2ЫН2СООН.
Более или менее полный перечень аминокислот, выделенных при
гидролизе белков, дан в табл. LVII.
Вряд ли нужно указывать на то, что формулы эти не следует
запоминать. Ни один белок не дает всех этих кислот. В табл. LVIII
показано в процентах количество различных аминокислот, полу-
чаемых при гидролизе четырех типичных белков.
Таблица LVIII. Количества различных аминокислот, полу-
чаемых при гидролизе различных протеинов*
Казеин Желатин Глиадин Цеин
Глицин 0,45 . 25,50 0,00 0.00
Аланин 1,85 8,70 2,00 13,39
Валин 7,93 1,00 3,34 1,88
Лейцин 9,70 7,10 6,62 19,55
Пролин 7,63 9,50 13,32 9,04
Оксипролин 0,23 14,10 ? ?
Фенилаланин 3,88 1,40 2,35 6,55
Глутаминовая кислота . Оксиглутаминовая кис- 21,77 5,80 43,66 26,17
лота 10,50 0,00 2,40 2,50
Аспарагиновая кислота . 4,10 3,50 0,58 1,80
Серин 0,50 0,40 0,13 1,02
Тирозин 6,50 0,01 3,50 3,55
Цистин 0,50 0,31 2,32 0,85
Гистидин 2,84 0,90 3,35 0.82
Аргинин 3,81 8,22 3,14 1.82
Лизин 7,62 5,92 0,92 0 00
Триптофан 2,20 0,00 1,14 0,00
Аммиак • 1,61 0,49 5,22 3,64
93,62 92,85 93,89 92,58
Всеми нашими знаниями о том, как эти аминокислоты связаны
друг с другом в молекуле белка, мы обязаны главным образом вели-
кому германскому химику Эмилю Фишеру. Амин реагирует с органи-
ческой кислотой совершенно так же, как и аммиак, и при этом обра-
зуется замещенный амид:
СН3С00Н -J- HNHCH8 CH3CONHCH8 4- Н2О.
уксусная кислота . метиламин метилацетамид
* Шерман, Химия пищи и пищевых продуктов (русский перевод).
26 Введение в химию.
402
ОРГАНИЧЕСКАЯ ХИМИЯ
Так как аминокислота одновременно является и амином и
кислотой, то две молекулы ее могут вступить в реакцию друг с дру-
гом согласно приведенной выше схеме, причем одна аминокислота
в данном случае будет как бы только кислотой, а другая — только
амином:
CH2NH2COOH + HNHCH2COOH -* CH2NH2CONHCH2COOH + H2O.
глицин в качестве глицин в качестве глицилглицин
кислоты амина
Таким путем могут образоваться длинные цепи, в которых аминокис-
лоты связаны друг с другом через аминогруппы. Эмиль Фишер со-
единял друг с другом от 7 до 19 молекул аминокислот и получил
синтетические полипептиды, близко напоминающие простейшие
протеины — пептоны.
Химия пищи и питания1
11. Энзимы и пищеварение. Переваривание пищи в организме
животных осуществляется с помощью секреций рта, желудка и
кишок. Эти выделения, или секреции, содержат энзимы — органи е-
ские катализаторы (как кто-то их удачно назвал), разлагающие
сложные нерастворимые молекулы нашей пищи на более простые,
растворимые вещества, из которых или могут быть построены ткани
нашего организма, или же они могут быть окислены для того, чтобы
дать энергию, необходимую для жизненных процессов. Наибольшее
значение имеют пищеварительные энзимы, приведенные в табл.
ЫХ.
Таблица LIX. Г л а в ные пищеварительные энзимы
Действие Энзимы Где встречаются Превращают
Действуют на углеводы Действуют на жиры Действуют | на белки \ Птиалин Амилопсин Инвертаза Мальтаза Лактоза Липазы Пепсин Трипсин Слюна Поджелудочная же- леза Кишечник » » Желудок и подже- лудочная железа Желудок Кишечник Крахмал в мальтозу » » » Сахарозу в глюкозу и фруктозу Мальтозу в глюкозу Лактозу в глюкозу и галактозу Жиры в жирные кис- лоты и глицерин Протеины в пептоны Протеины в пептоны и аминокислоты
При пищеварении углеводы, состоящие главным образом из
крахмала, превращаются посредством гидролиза в простые сахара.
1 Шерман, Химия пищи и пищевых продуктов.
УГЛЕВОДЫ, ЖИРЫ И БЕЛКИ
403
Совместное действие птиалина, амилопсина и мальтазы приводит к
количественному гидролизу крахмала в глюкозу. Сахара накапли-
ваются в печени, откуда время от времени выделяются в небольших
количествах в кровь, которая разносит их по тканям. Содержание
глюкозы в крови никогда не превышает 0,1%, за исключением крови
больных диабетом (сахарной болезнью). В тканях происходит окис-
ление глюкозы в углекислоту и воду. Углеводы могут быть также
превращены в организме в жиры.
Жиры разлагаются липазами на жирные кислоты и глицерин,
которые при прохождении через стенки кишечника опять соединя-
ются друг с другом и поступают в лимфатическую систему, а затем
в кровь. В тканях они либо окисляются, либо откладываются про
оапас (в жировой ткани).
Протеины (белки) при гидролизе распадаются на растворимые
пептоны и на аминокислоты и в таком виде распределяются в орга-
низме, чтобы затем в результате рекомбинации образовать белки
тканей или окислиться при работе мускулов.
12. Калорийность продуктов питания. Одним из простейших
методов измерения той энергии, которую наш организм может
получить в результате окисления различных пищевых продуктов,
является сожжение этих продуктов в калориметре и определение
количества выделившихся при этом калорий. Результаты такого
рода определений приведены в табл. LX.
Таблица LX. Теплоты горения и примерный состав типовых
элементов пищи*
Вещество Теплота горения Кал/г Углерод (%) Водород (%) Кислород (%) Азот (%) Сера (%)
Глюкоза 3,75 40,0 6,7 5,33
Сахароза .... 3,96 42,1 6,4 51,5 — —
Крахмал .... 4,22 44,4 6,2 49,4 — —
Коровье масло . . 9,30 75,0 11,7 13,3 — —
Альбумин .... 5,80 52,5 7,0 23,0 16,0 1,5
Углекислота и вода, продукты сгорания жиров и углеводов,
одинаковы как в нашем организме, так и в калориметре. Следова-
тельно и выделяемая энергия в обоих случаях будет одинако-
вой. Что же касается белков, то в калориметре при сгорании они
дают углекислоту, воду и свободный азот, а в нашем организме азот
выделяется в виде мочевины и других органических соединений.
Следовательно организм получает меньше энергии при окислении
белков, чем ее выделяется при полном сгорании в калориметре. Дей-
ствительная потеря равна примерно 1,3 Кал на грамм белка, так что
* Шерман, Химия пищи и пищевых продуктов. Q
26*
404
ОРГАНИЧЕСКАЯ ХИМИЯ
средняя энергия, которую организм получает от 1 г белка, равняется
4,35 Кал. Шерман * приводит следующие данные примерной физиоло-
гической калорийности (считая на грамм) составных частей пищи:
Углеводы...................... 4 Кал
Жиры.......................... 9 »
Белки......................... 4 »
Средняя потребность в энергии зависит от веса тела и от ра-
боты, выполняемой организмом. В среднем для человека требуется
около 2 200 Кал в день, если он не занят напряженной физичес-
кой работой, и до 3000 Кал при тяжелой физической работе.
13. Витамины. До начала этого столетия ученые считали, что по-
требности животных в питании удовлетворяются достаточным коли-
чеством жиров, углеводов и белков, а также небольшим количеством
неорганических соединений. Тогда, так же как и в настоящее время,
считалось, что молоко содержит все эти необходимые питательные
составные части. В 1906 г. Гопкинс из кембриджского университета
показал, что если молодых крыс кормить смесью чистых жиров,
углеводов и белков, с добавлением минеральных солей, сохраняя
соотношения всех этих составных частей пищи такими же, как и
в молоке, то рост животных прекращается и они вскоре умирают.
Если же кроме того крысам давать еще немного молока, то рост сно-
ва возобновляется. Следовательно в молоке содержится еще какой-
то пищевой фактор, на который до тех пор не было обращено должно-
го внимания. В 1912 г. аналогичные результаты получили Осборн
и Мендель в Иэле. Одновременно было выяснено, что восточная бо-
лезнь берибери обусловливается тем, что люди питаются очищенным
рисом, который уже не содержит какого-то вещества, удаляемого
при очистке. Функ предложил назвать витаминами те питательные
средства, отсутствие которых вызывает «болезни недостатка» или
препятствует нормальному росту. В настоящее время считается
установленным существование следующих витаминов, хотя химичес-
кое строение ни одного из них еще не установлено.
Витамин А. Антиофталмический и антиинфекционный вита-
мин. Он растворим в жирах, и его содержит рыбий жир, итальянская
капуста брокколи, морковь, салат, шпинат, томаты, коровье масло,
молоко, яичный желток и сыр. Действие его исчезает при нагревании.
Отсутствие его препятствует нормальному росту, понижает сопротив-
ляемость организма к инфекции, ведет к заболеваниям глаз и затем
к смерти.
Витамин В. Противоневрический витамин (и против берибери).
Содержится главным образом в дрожжах, целых злаках и в яичном
желтке. Отсутствие этого витамина ведет к заболеванию берибери.
При замене полированного риса неполированным в питании скаутов
на Филиппинах удалось понизить смертность от берибери с 100%
в 1910 г. до 0 в 1913 г.
Витамин С. Противоцынготный витамин. Находится в капу-
* Шерман, Химия пиши и пищевых продуктов.
КАМЕННОУГОЛЬНЫЙ ДЕГОТЬ
405
сте, салате, шпинате, помидорах, апельсинах и лимонах. Предотвра-
щает заболеваемость цингой.
Витамин D. Противорахитный витамин. Содержится в ры-
бьем жире трески и яичном желтке. Предотвращает заболевание
рахитом, регулируя усвоение костеобразующих элементов — каль-
ция и фосфора. Влияние, аналогичное действию этого витамина,
оказывают ультрафиолетовые лучи солнечного света.
Витамин Е. Антистерильный витамин (витамин против бес-
плодия). Содержится в росгках пшеницы и в салате. Предотвращает
бесплодие самцов и отсутствие плацентной функции самок.
Витамин G. Противопеллагрический витамин. Предотвра-
щает заболевания пеллагрой и содержится в дрожжах, печени, поч-
ках и в постном мясе.
14. Правильное применение пищевых продуктов. В заключе-
ние мы даем следующие два простых правила Шермана, касающиеся
того, каким образом лучше всего расходовать деньги при покупке
пищевых продуктов.
1. По крайней мере следует столько же тратить на молоко
(в •цщ числе и на сливки и сыр, в случае их применения), сколько
и на мясо, птицу, рыбу.
2. По крайней мере столько же следует тратить на фрукты
и овощи, сколько на мясо, птицу и рыбу.
ГЛАВА XXXVII
ОРГАНИЧЕСКАЯ ХИМИЯ
К’МЕННОУГОЛЬНЫЙ ДЕГОТЬ
Мы уже указывали на то, что имеется два основных класса угле-
водородов: алифатические, или цепные, углеводороды и циклические
углеводороды. Особенное значение имеет группа циклических уг-
леводородов, называемых ароматическими. Первый класс угле-
водородов и их производные мы уже рассмотрели, сейчас мы кратко
остановимся на ароматических углеводородах.
1. Ароматические углеводороды. Эмпирическая формула про-
стейшего ароматического углеводорода — бензола СвНв. Реакции
его указывают на то, что он обладает симметричным строением
т. е. все атомы углерода в молекуле бензола равноценны и с каждым,
из них связано по одному атому водорода. Структурная формула
бензола такова:
н
I
с
н—с с—н
। н
н—с С—н
I
н
406
ОРГАНИЧЕСКАЯ ХИМИЯ
Чтобы сэкономить время для изображения его структуры, химики
обычно пишут просто шестиугольник:
Производные бензола, в которых один или больше водородных ато-
мов замещены другими атомами или группами, обычно изображаются
в виде шестиугольника, причем замещающая группа или группы на-
ходятся у одного или нескольких его вершин. Например хлорбен-
зол СвН6С1, точная структурная формула которого будет
С1
I
н —с^с—н
н-с^ с-н
А
просто изображается следующим образом:
С1
Толуол СвН6СН3 является важным углеводородом, производ-
ным бензола. В его молекуле вместо одного из водородных атомов
бензола находится метильная группа:
или
Нафталин С10Н8 и антрацен С14Н10 — это углеводороды, в мо-
лекулах которых имеется более Чем одно бензольное кольцо:
КАМЕННОУГОЛЬНЫЙ ДЕГОТЬ
407
или
нафталин
ИЛИ
/\/\/\
I I I
\/\/\/
антрацен
2. Производные ароматических углеводородов. Если арома-
тические углеводороды подвергнуть действию хлора, то имеют место
реакции замещения, например
хлорбензол
При обработке хлорбензола гашеной известью в соответствующих
условиях образуется оксибензол:
Са (ОН),
фенол
(карболовая кислота)
Это вещество вам хорошо известно как ароматическое и дезинфе-
цирующее средство, называемое карболовой кислотой; химикам оно
известно под названием фенол. Большие количества этого соеди-
нения применяются при производстве лекарственных препаратов,
красителей и взрывчатых веществ. Оно применяется также для
получения синтетической смолы, бакелита, для чего его конденси-
руют с формальдегидом.
408
ОРГАНИЧЕСКАЯ ХИМИЯ
Если хлорбензол нагревать с аммиаком под давлением, то по-
лучается анилин, который служит сырьем для изготовления целого
ряда красителей и лекарств:
ын,
Весьма важная реакция имеет место при обработке ароматического
углеводорода смесью концентрированных азотной и серной кислот.
Чтобы яснее разобраться в 'Протекающей при этом реакции, мы
воспользуемся структурной формулой азотной кислоты:
н
I
/с\
Н—С с—н 7/0
| II + Н —О —N< H.so4
Н — С С —Н ^0-------*
/ азотная кислота
I
н
бензол
нитробензол
Нитрогруппа — N02 замещает водородный атом бензола, а вода
удаляется в результате обезвоживающего действия концентрирован-
ной серной кислоты. При соответствующих условиях в молекулу
бензола вместо атомов водорода удается ввести 2 и даже 3 нитро-
группы:
/\ /х2
I + 2HNO3 -------у II + нао
\/
динитробензол
Как мы увидим далее, реакция эта имеет большое значение при
производстве взрывчатых веществ.
Хорошо известны также альдегиды, кислоты, кетоны и сложные
эфиры — производные ароматических углеводородов.
3. Каменноугольный деготь. Если каменный уголь подвергать
нагреванию в реторте без доступа воздуха (стр. 117), то в числе отго-
няющихся продуктов получается каменноугольный деготь — черная,
плохо пахнущая и чрезвычайно вязкая жидкость. Из этого непривле-
кательного вещества химикам удалось получить красители, соперни-
чающие с цветами радуги, и духи, не уступающие наиболее тонким
запахам цветов. Из этого же дегтя изготовляются лекарства, облегча-
ющие страдания людей, вылечивающие их от болезней, а также
КАМЕННОУГОЛЬНЫЙ ДЕГОТЬ
409
взрывчатые вещества, приносящие пользу человеку в мирное время
и страдания во время войны.
При перегонке каменноугольного дегтя получают 8 важных
«сырых продуктов» и кроме того в реторте остается пек. Этими «сы-
рыми продуктами» являются бензол, толуол, ксилол, нафталин,
антрацен, фенантрен, фенол и крезол. Некоторые из этих веществ
были нами уже рассмотрены выше, другие же тесно с ними связаны
(табл. LX).
Таблица LX. Продукты, получаемые из каменноугольной
смолы
три изомерных ксилола
Все эти вещества служат сырьем для следующих отраслей про-
мышленности: апилинокрасочной, фармацевтической и взрывчатых
веществ. Некоторые из этих веществ применяются и сами по себе.
Бензол применяется в качестве жидкого топлива и как раствори-
тель. Нафталин служит для предохранения шерстяных вещей от
моли. Антисептические свойства фенола, иначе называемого кар-
боловой кислотой, общеизвестны. Крезолы составляют креозотовое
масло, широко применяемое для предохранения дерева от гниения и
в качестве антисептика.
4. Анилинокрасочная промышленность. Примерно до середины
прошлого столетия для окраски текстильных изделий пользовались
красителями исключительно растительного или животного происхож-
дения. С этой целью применялись: кампешевое дерево для черной
краски, кошениль, получаемая из некоторых насекомых, и ализарин
из корней растения марены—для красной краски, а индиго — для
синей, античный пурпур из некоторых моллюсков — для фиолетовой
красок. Синтетические красители не были еще известны. Правда,
в 1771 г. Вульфе получил окислением индиго желтое красящее ве-
щество, пикриновую кислоту, а в 1834 г. Рунге удалось получить
из фенола еще один желтый краситель — аурин, но эти красители
не имели большого значения. Но вот в 1856 г. Уильям Перкин, ученик
410
ОРГАНИЧЕСКАЯ ХИМИЯ
знаменитого химика-органика Гофмана, впервые получил синтети-
чески мовеин — красивый пурпуровый краситель, причем произош-
ло это случайно, при попытке превратить анилин в хинин. Если бы
Перкин для этой цели применял чистый анилин, то сделать это откры-
тие ему бы не удалось. К счастью, применявшийся им анилин содер-
жал примесь толуидина. Обработка этой смеси окислителем, бихро-
матом калия, и ведет к синтезу мовеина:
N
NH,
СН,
В это время светильный газ, получаемый сухой перегонкой камен-
ного угля (стр. 119), уже имел широкое распространение, так что
каменноугольный деготь был продуктом доступным. Были также
разработаны методы превращения в анилин бензола, выделяемого
из этого дегтя. Почва для развития промышленности синтетических
красителей была подготовлена. Открытие Перкина настолько стиму-
лировало дальнейшие исследования, что вскоре был синтезирован
целый ряд новых красящих веществ. Особенно исследовательская
работа в этом направлении развернулась в Германии. Медленно,
но верно развивалась в этой стране гигантская промышленность
органических красителей, которая стала настолько мощной, что
фактически Германия оказалась монополистом в этой области,
удаляя с своего пути конкурентов.
Это был период быстрого развития органической химии. Длинный
ряд естественных продуктов был подвергнут анализу, и было опре-
делено строение их молекул. А раз стали известными их структурные
формулы, то вскоре были разработаны и методы, с помощью которых
они могли быть синтезированы. Через 10 лет после того как им был
открыт мовеин, Перкин синтезировал ализарин — естественное кра-
сящее вещество, экстрагируемое из корней растения марены. Гребе
и Либерман доказали в 1868 г., что ализарин является производным
антрацена:
о
II
с он
/VWh
о
ализарин
КАМЕННОУГОЛЬНЫЙ ДЕГОТЬ 411
В 1869 г. было начато производство этого красителя из антрацена
в промышленном масштабе, и культивирование марены, под ко-
торую в одной только Франции возделывалось 50 000 акров земли,
было обречено на гибель. В 1870 г. из корней марены было экстра-
гировано 750 т этого красящего вещества. В настоящее же время еже-
годно на химических заводах синтезируется более 2000 m ализарина,
а марена почти ботаническая редкость.
Та же участь ожидает и индиговые поля в Индии. Германский
химик Адольф Байер посвятил 20 лет проблеме выяснения строения
молекулы индиго:
NH NH
Это ему удалось в 1884 г.; вскоре за этим последовал синтез индиго
в лаборатории. Однако лабораторный метод оказался слишком до-
рогим для того, чтобы получать этот краситель в промышленном мас-
штабе и чтобы он мог конкурировать с естественным продуктом.
Баденская анилиновая и содовая фабрика потратила 5 000 000 долл,
и более 17 лет исследовательской работы, прежде чем был разра-
ботан успешный метод, который можно было применить в промышлен
ном масштабе. А затем-то и началось самое интересное. В 1897 г.
в Индии 1 000 000 акров земли было занято под культуру индиго-
носных растений, ежегодно дававших на 20 000 000 долл, индиго,
в 1914 г. продукция естественного индиго в Индии составляла толь-
ко 300 000 долл. Германия обладала монополией, равнявшейся 96%
мирового производства этого красителя.
* До сих пор в СССР индиго было импортное. В данное время
налажено его производство и в конце 1935 г. мы будем обеспечены
собственным индиго.*
В 1909 г. Фридлендеру удалось установить строение античного
пурпура, причем оказалось, как это ни странно, что он еще 5 лет
тому назад был получен синтетически Заксом, но был отвергнут как
низкосортный краситель. Античный пурпур оказался дибром*
индиго.
В настоящее время анилинокрасочная промышленность превра-
щает сырые продукты каменноугольного дегтя в 300 или больше
промежуточных продуктов, из которых получается более 1000 раз-
личных красителей. Чтобы дать хотя некоторое понятие о различных
стадиях производства красителей, мы рассмотрим получение одного
черного красителя, который находит широкое применение для кра-
шения чулочного товара:
412
ОРГАНИЧЕСКАЯ ХИМИЯ
/\/\
NHa
фенилендиамин
SO8H
ho^J^Jsc^h
на фтал и нт рп сульфо-
кислота
ф
SOaHNO,
/\/\
ho.s^J^Jso.h
нитрэнафталинтрисульфо-
кислота
ф
НО NH,
Н-кислота
Из этих промежуточных продуктов синтезируется молекула
красителя:
5. Взрывчатые вещества. Все наши современные взрывчатые
вещества, за исключением нитроглицерина и нитроцеллюлозы, яв-
ляются производными все тех же веществ, которые входят в состав
каменноугольной смолы. Нитрование толуола и фенола дает нам два
наиболее важных взрывчатых вещества— тринитротолуол (Т. N. Т.)
и пикриновую кислоту:
КАМЕННОУГОЛЬНЫЙ ДЕГОТЬ
413
СН;
HNO4
СНз
NO У4) NO,
ОН
ОН
NO2|/X.NO2
H.SO,
толуол
NOa
тринитротолуол
фенол
NO,
пикриновая
кислота
Тот факт, что взрывчатые вещества не только могут быть по-
лучены из того же сырья, которое применяется для изготовления
красителей, но и с помощью тех же реакций и в той же аппаратуре,
дает возможность анилинокрасочному заводу легко переключиться
в случае войны на производство взрывчатых веществ. Монополь-
ное положение, которым Германия обладала до войны в анилино-
красочной промышленности, послужило ей весьма на пользу во вре-
мя мировой войны.
6. Химия и медицина. Перечень тех заслуг, которые имеет
химия перед человечеством, будет неполным, если мы не скажем,
хотя бы кратко, о той пользе, которую химия оказала медицине.
Рассмотрение списка тех лекарств и медикаментов, которые приме-
няли врачи XVII и XVIII стст., сейчас приводит нас в ужас. Одна
мысль об ампутации ноги или о вскрытии брюшной полости без ане-
стезирующих и антисептических средств заставляет нас благода-
рить судьбу за то, что мы, к счастью, живет уже в XX ст. и выразить
всю нашу признательность тем химикам, которые дали нам возмож-
ность спать в полном неведении относительно того, каким исследо-
ваниям предается хирург над нашими внутренностями, и просы-
паться с приятной мыслью, что антисептические средства гаранти-
руют нас от заражения крови. В настоящей книге мы имеем воз-
можность коснуться лишь весьма кратко всего того, что сделано в
этой области.
Что касается анестезирующих средств, то мы должны упомянуть
об открытии закиси азота, «веселящего газа», сделанном Гемфри
Дэви (стр.314),и об открытии хлороформа Либихом в 1832г. Открытие
эфира было сделано в 1544 г. Валериусом Кордусом, но применен
эфир с целью вызвать анестезию впервые был лишь в 1842 г. американ-
ским врачом Крауфордом В. Лонгом, удалившим под эфиром у одного
пациента опухоль. Об открытии анестезирующих свойств этилена
было уже сказано выше (стр. 384).
Кокаин, растительный алкалоид, применялся, начиная с 1884 г.,
в качестве местного наркоза. Однако синтетические препараты,
как, например, новокаин
NH.
:OOCH,CH,N (С,Н5),
414
ОРГАНИЧЕСКАЯ ХИМИЯ
значительно лучше в том отношении, что они менее токсичны, к ним
не так легко привыкают, кроме того они дешевле.
Опий — одно из натуральных веществ, обладающее снотворным
действием. Но вероятно читателю известна та опасность, которой че-
ловек подвергается при его применении. В настоящее время синтези-
рован целый ряд снотворных препаратов, имеющихся в продаже,
причем их употребление не вызывает вредной привычки. Среди та-
ких препаратов упомянем хотя бы веронал, сульфоналы, люминал
и др.
Практически все жаропонижающие и антисептические средст-
ва — синтетические препараты, производные углеводородов каменно-
угольного дегтя.
Многие химические препараты были разработаны специально
для борьбы с определенными заболеваниями. Среди них следует
упомянуть холмугровое масло и его производные, как средство про-
тив проказы, четыреххлористый углерод — против клещей и сальвар-
сан как средство для лечения сифилиса.
Кроме того химиками-органиками был исследован ряд выделе-
ний желез внутренней секреции с целью определения их структуры,
а химиками-физиологами — с целью определения их роли в обмене
веществ организма. Из числа этих так называемых гормонов следует
упомянуть об адреналине, секреции надпочечной железы, который
был синтезирован и сейчас изготовляется в большом масштабе:
он
QOH
OiOHCHjNHCH,
В случае надобности это вещество секретируется в кровь и вызывает
сужение кровеносных сосудов, что ведет к увеличению давления
крови. При введении под кожу небольших количеств чистого адре-
налина стенки артерий настолько сужаются, что кровь из них изго-
няется и тем самым становится возможной «бескровная хирургия».
Не так давно было доказано, что гормон щитовидной железы, тироин,
обладает следующим строением:
J___н j____н
НО<^ О — /у CH*CHNHtCOOH.
J Н J н
Инсулин, гормон поджелудочной железы, все еще является объектом
исследования, и строение его пока не определено. Однако химики
сделали возможным экстрагирование его в чистом виде в активной
форме и применение его при лечении диабета (сахарной болезни).
ПРИЛОЖЕНИЯ
I. Единицы измерений
Длина
1 м = 100 см = 1000 мм = 10е и
1 |л == 10-8 мм = 10-в м
1 гп}к= 10-6 мм
1А = 10~8 см = 10~7 мм
1 миля = 1609,35 м
1 фут » 0,3048 м = 30,48 см
1 дюйм = 2,54 см = 25,40 мм
Вес
1г = вес 1 см3 воды при 4® С
1 кг = 1000 г
1 англ, фунт = 0,4536 кг = 453,6 г
Объзм
1 л == 1000 см*
1 кб. фут = 28,32 л
j кб. дюйм = 16,38 см*
Температура
t — температура (в градусах) по
шкале Цельсия; Т — температура
по абсолютной шкале; F — тем-
пература по шкале Фаренгейта
t + 273° = Т
t = ‘/e(F-32o)
F = 1,814-32°
II. Упругость водяных паров
Темп-ра (°C) Давление (мм) Темп-ра (°C) Давление (леи)
0 4,57 18 15,33
1 4,91 19 16,32
2 5,27 20 17,36
3 5,66 21 18,47
4 6,07 22 19,63
5 6,51 23 20,86
6 6,97 24 22,15
7 7,47 25 23,52
’ 8 7,99 26 24,96
9 8,55 27 26,47
10 9,14 28 28,07
11 9,77 29 29,74
12 10,43 30 31,51
13 11,14 31 33,37
14 11,88 32 35,32
15 12,67 33 37,37
16 13,51 34 39,52
17 14,40 100 760,00
416
III. Валентности наиболее часто встречающихся элементов
Металлы H еметаллы
Na +1 Cl — 1, + 1, + 3, + 5 и + 7
К +1 J — 1
Н + 1 0 — 2
Ag + 1 s — 2, 4-4и + б
Са + 2 N — 3, 3 и + 5
Mg + 2 P — 3, +Зи + 5
Zn + 2 C — 4, + 2и + 4
Pb + 2 Si + 4
Al + 3
Hg + 1 и + 2
Cu + 1 и + 2
Fe + 2 и + 3
Sn -f" 2 и + 4
IV. Наиболее часто встречающиеся ионы и их названия
Положительные ионы Отрицательные ионы
Валентность» I
Н + водород он- гидроксил-ион
Na+ натрий С1- хлор-ион
К+ цалий Вг“ бром-ион
Ag+ серебро J- иод-ион
Cu+ медь I no2- нитрит-ион
Hg+ ртуть I NO,- нитрат-ион
NH*+ аммоний сю3- хлорат-ион
СН3С00- ацетат-ион
Валентность^2
Са + + кальций S= _ сульфид-ион
Ва + * барий SO3“ сульфит-ион
Mg+ + магний so4= сульфат-ион
Zn+ + цинк СО31 карбонат-ион
Pb+ + свинец SiO8~ си ликат-ион
Cu+ + медь II
Hg+ + ртуть II
Fe+ + железо II
Sn+ + олово II
Валент н о с т ь » 3
А1+ + + Fe+ + + алюминий I РО4— железо III | фосфат-ион
Валентность=4
Sn++++ олово IV |
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
Абсолютная температура 27, 34, 213
Абсолютный нуль 215
Авогадро 59
Авогадро гипотеза 59
— число 62
Адсорбенты 351
Адсорбция 351
— древесного угля 351
Адреналин 414
Азот 98
Азота атомный вес 68—70
— источники 370
— соединения 312—314
— фиксация 371—379
----бактериями 371
Азотная кислота 312
----из аммиака 315
----из селитры 314
Аккумуляторы 343
Активность 284
Ализарин 410
Алкалиметрия 295
Алкоголи (спирты) 385—387
Алкоголь метиловый 385
— этиловый 385, 386
Аллотропия 43
Алхимия 15
Алюминий 330
Алюминотермия 132
Альдегиды 387
Альфа-частицы 175, 193
Альфа-частицы прохождение через воз-
дух 175
Амальгамы 132
Амиды 400
Амины 400
Аминокислоты 400
Аммиак 313, 321, 374, 375—377
— при процессе Сольвея 321
Аммоний сульфат 118, 311, 371
— бикарбонат 321
Ампер 269
Анализ 18
Ангстрем 220
Анестезия 413
Анилин 412
Антрацит 115
Аргон 100
Аристотель 14
Ароматические углеводороды 405
Аррениус 274
Аспдин 360
Атмосфера 92
Атом возбужденный 239
— нуклеарный 170
Атома распад 195
— строение 166—177, 182
Атомы 41, 63—70
Атомная теория 65
— энергия 202
Атомное порядковое число 173
Атомный вес 68—70
Ацетальдегид 387
Ацетон 388
Ацидиметрия 295
Ачесон 356, 367
Бакелит 388, 407
Бактерии, фиксирующие азот 371
Банкрофт 346
Барометр 23
Безопасная лампа 110
Беккерель 189
Белильная известь 318
Белки 399
Белков гидролиз 400
Бензол 405
Берцелиус 71, 88, 156
Бессемерование^ 148
Бета-частицы 193
Бехер 104
Бикарбонат кальция 243, 246, 247
— магния 246
— натрия 243, 246
Биркеланда и Эйде процесс 372
Бисульфит кальция 396
— натрия 396
Благородные газы 99
Блек 205—206
Блюминг 153
Бойль 16, 23
Бойля закон 23
Боксит 330
Болотный газ 106
Болтвуд 193, 199
Бор 238
де-Бройль 240
Бромистоводородная, кислота 287—288
Бронза 127, 138, 139
Броуновское движение 347
Брэгг 229
Бумага 306, 396
Бунзен 233
Бюретка 295
27 Введение в химию
418
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
Вааге 85
Валентность 74, 182
— и периодическая таблица 161
— и строение атома 189
— отрицательная 184
— положительная 183
Валентные связи полярные 183
---неполярные (ковалентные) 184.
Вант-Гофф 39, 91, 372, 375
Ванг-Гоффа принцип 39
Ватт 269
Величина молекул 56
Вентиляция 95
Веселяший газ 313
Вещества взрывчатые 412
— огнеупорные 113
— одйородные 17
— разнородные 17
Видимый спектр 220
Виды спектров 223
— химических реакций 81
— энергии 207
Винный спирт 385
Вискоза 398
Витамины 404
Влажность 94
Вода 241—251
— жесткая 245
— кристаллизационная 42
—’•питьевая 247
— природная 243
Водород 242
— строение атома 176
Водородный электрод 337
Водородных ионов концентрация 291
Водяной газ 119
— пар 94
Воды диссоциация 290
— действие на соли 296
— разложение 78
— реакция 250
смягчение 246
— фильтрование 248
— хлорирование 249
Возгонка 46
Воздух 53, 97—104
Волновая теория 215—218
Вольт 269
Вольта 270, 329
Временная жесткость 246
Вывод процентного состава вещества 73
Вывод формулы 72
---на основании валентности 74
Выделение света 238
Вычисления веса 80
— объема 81
— основанные на газовых законах 29
— основанные на химических уравне-
ниях 80
Газ болотный 106
— веселящий 313
— водяной 119
— генераторный 120
— горчичный 384
— идеальный 35
— каменноугольный 119
— природный 120
— рудничный 106
Газа объем 81
Газовые законы 32
Газолин 123, 124
Газообразное топливо 118—121
Г азы z1
— благородные 99
— горючие 118—121
— инертные 99
Галилей 22, 26
Гальванические пары 342
— элементы 333—343
Гальванопластика 332
Гамма-лучи 193, 195
Гашеная известь 316
Гей-Люссак 27, 58
Г елий 102
Гелия строение атома 176
Гель 357
Гельмгольц 207
Гематит 141
Генераторный газ 120
Геру 330
Герц 218
Гидрат окиси кальция 316
Гидрогенизация жиров 399
— нефти 126
Гидролиз 297
— оелков 401
Гипотеза Авогадро 66
Гипохлорит натрия 328
Глазурь 360
Глина 358—359
Глицерин 386, 398, 399
Глюкоза 392, 393, 395
Гончарные изделия 359
Гопкинс 404
Горение 104
Г ормоны 114
Горчичный газ 384
Горючие газы 118—121
— сланцы 125
Гравитационный элемент 339
Граммолекулярный вес 60
— объем 61
Г рем 345
Гульдберг 85
Гэмпсон 53
Гюйгенс 215 *
Давление критическое 50
— нормальное 29
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
Давление осмотическое 264
— пара 38
— паров растворов 258
Дальтон 27, 28, 65
Даниэля элемент 339
Движение ионов 276, 327
— броуновское 347
— молекул 43, 57, 208
Двойная связь 383
Двуокись марганца 98
— углерода 94
--- твердая 51
Де-Бройль 240, 340
Деви 110, 206, 270, 329, 330
Девиль 330
Деготь каменноугольный 118, 405, 408
Деполяризатор 342
Действие воды на соли 383
Депрессия 262
Дестилляция воды 248
Джоуль 269
Джоуль 207
Диализ 353
Динамит 358, 390
Динамическое равновесие 38
Дисперсия света 219
Диссоциация воды 290
— в растворах 275
— электролитическая 267
— электролитов 355
Дифракция света 216
Диффузия 30
Доменная печь 142—145
Древесный спирт 385
— уголь 116
Дробь молярная 259, 273
Дуговой процесс 315, 372
Дымы 346
Дьюар 52, 103
Едкий натр 289, 316, 322, 326
Едкое кали 289
Железо 140—147
— ковкое 147
— оцинкованное 343
— руды 141
Жесткая вода 245
Жесткость временная £46
— постоянная 246
Жесть белая 343
Жидкие масла 124
Жидкий воздух 53
Жидкое топливо 121—126
Жидкости 35—40
Жиров гидрогенизация 399
Жиры 398—399
— в пищеварении 403
Закон Авогадро 53
— Бойля 23
Закон Вант-Гоффа 39, 91, 372, 375
— Гей-Люссака 59
— Генри 257
— действия масс 85—86
— кратных отношений 64—65
— Ле-Шателье 91—92, 375
— октав 157
— периодический 156—165
— постоянства состава 20
— Рауля 259, 260, 273
— сохранения энергии 207
-----материи 20
— Фарадея 270, 276
Законы газовые 32
Замерзание 44, 45
Заряд иона 276
— электрона 170
Зеркальное стекло 315
Идеальный газ 35
Известь 317—319
— белильная 319
Известковая вода 316
Известковый ратвор 318, 360
Известняк 131, 317
Изменение веществ 20
— тепла 205
Изомеры 382
Изотермы 49
Изотопы 199
Индиго 411
Индикаторов таблица 293
Индикаторы 292
Инертные газы 99
Инжектор 302
Ионизация 274
— кислот 288
Ионов активность 234
— движения 276, 327
— номенклатура 285
— равновесие 109, 278
— свойства 286
Ионы 244
Искусственное охлаждение 54
Искусственный шелк 398
Испарение 36—37
Источники азота 370
Калий 337
Калорийность продуктов питания 403
Калория 205
Кальций 330
— бикарбонат 243
— бисульфит 396
— гидрат окиси 317
— карбид 120, 374, 384
— карбонат 131, 317
— нитрат 374
— силикат 131, 358
— фосфат 311, ^79
27*
42о
ПРеДМеТнЫй указатель
Кальций хлорид 382
— цианамид 374
Кальцит 131
Каменного угля запасы 116
Каменноугольный газ 119
— деготь 405, 118, 408, 409
Каменный уголь 114
Камерный процесс 307
Каолин 359
Карбид кальция 120, 374, 384
— кремния 367
Карболовая кислота 388, 407
Карбонат кальция 131, 317
— магния (доломит) 151
Карборунд 367
Карналлит 378
Касситерит 131
Катализ 87—89, 92
Катализаторы 88
— контактные 88
— отрицательные 88
— переносные 88
Катафорез 352
Катод 327
Катодные лучи 168
Каустическая сода 316, 322
Квантовая теория 236, 340
Кварц 358
Кварцевое стекло 235, 236
Кельп 378
Кельвин 207
Кетоны 338
Керамика 357
Керосин 124
Кинетическая теория газов 29—35
— энергия 207
Киноварь 131
Кирпичи 359
Кирхгофф 233
Кислород 97
Кислорода молекула 67
Кислот ионизация 288
---постепенная 288
— классификация 288
— номенклатура 288
— основность 288
— сила 288
Кислота азотная 287, 288, 312, 314, 316
— азотистая 287
— бромистоводородная 287
— иодистоводородная 287
— карболовая 407
— муравьиная 389
— олеиновая 398
— пикриновая 409
— серная 287, 288, 301—312
— сернистая 287, 306
— соляная 288, 316
— стеариновая 398
— угольная 287, 288
Кислота уксусная 282, 287, 389
— фосфорная 287, 301
— хлорноватая 287
Кислоты 251, 287—289, 300—31
— органические 388
Кислые соли 290
Классификация кислот 288
Коагуляция 348
Ковалентные связи 280
Ковкое железо 147
Кокс 116—118
— в доменном процессе 142
Коксовальные печи 117
Количество элементов 19
Коллоидная мельница 349
Коллоиды 343—357
Комптон 238
— равновесия 90
• Конвертор 136, 148
Конденсация 38
— паров 47
Константа диссоциации 280
— равновесия 90
— скорости 91
Контактные катализаторы 88
Контактный процесс 309—311
Концентрационный элемент 340
Концентрация 84, 111
— водородных ионов 291
— молекул и давление 33
Концентрированные удобрения 37 <
Корпускулярная теория света 21
Коррозия металлов 128, 343
Коттрель 353
Коэфициентов уравнивание 72
Крахмал 392, 402
Крекинг 124
Кремневая кислота 287
Кремнезем плавленый 366
Кремний 357, 367
Кремния окись 354
Криолит 330
Криптон 103
Кристаллизационная вода 42
Кристаллов получение 42
— структура 41, 228—232
Кристаллы 41, 49
Критическое давление 50
Крукс 101, 168, 199, 370
Ксенон 103
Кулидж 227
Кулон 268
Кюри Мария 191
Кюри Пьер 191
Лавуазье 104
Лаки 397
Лакмус 292
Лампа безопасная 110
Латунь 139
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
421
Леблана способ 320
Лед сухой 51
Летучесть 45
Ле-Шателье 92
Ле-Шателье теорема 92
Ли 96
Лигнин 396
Лигнит 115
Лиман 239
Линде 53
Лиофильные коллоиды 357
Лиофобные коллоиды 357
Лоренц 235
Лучи катодные 168
— Рентгена 227, 228
Лучистая энергия 215—232
Лучистой энергии поглощение 232—241
Льюис 179
Лэнгмьюр 179
Магнетиз 151
Магнетит 141
Магний 129, 330
Магния карбонат 151
Максвелл j0, 56, 218, 235
Мальтоза 395
Марганец 147
Марганца двуокись 98
Масло коровье 399
Масса 16
— электрона 170
Маточная порода 131
Машины для изготовления жидкого воз-
духа 53
---искусственного охлаждения 54
Медь 136—138
Мельница коллоидная 349
Менделеев 159
Мендель 404
Металлов коррозия 128, 343
— относительная активность 128
— ряд напряжений 324, 130, 337
— физические свойства 127
— электрорафинировка 331
Металлургия 130
Металлы 19, 126, 140
— щелочные 129
Метан 106, 123, 381
Метанол 385
Метиловый спирт 385
Метил-хлорид 382
Микрон 345
Милликэн 62, 170, 232, 237
Миллимикрон 345
Мировой эфир 218
Мозлей 172
Молекул величина 56
— движение 57, 208
Молекул концентрация и давление 33
— определение 57
7**
Молекул состав 63
Молекулы 31, 56—63
Молекулярное движение в твердых те-
лах 43
Молекулярный вес 59, 61, 62, 73, 263
Молоко 404
Моль 60
Молярная дробь 259, 273
Молярный раствор 255
Муравьиная кислота 389
Мыло 245, 356, 399
Названия ионов 255
Накипь 245
Насыщенный раствор 254
Натрий 129, 329
— едкий 316, 323, 328
— металлический 329
— хлористый 328
Натрия ацетат 321
— бисульфит 396
— гипохлорит 328
Нафталин 406
Нейтрализации теплота 295
Нейтрализация 293—295
Нейтральные растворы 291
Неметаллы 19, 107, 126, 270
Неон 103
Неполное сгорание 107
Неполярные связи 184, 185, 280
Непредельные углеводороды 383
Нефти гидрогенизация 126
— переработка 122
Нефть 121
Неэлектролиты 258
Нитрат кальция 374
Нитробензол 408
Нитроглицерин 312, 390, 412
Нитрозилеерная кислота 308
Нитроцеллюлоза 312, 396, 412
Нобель 358, 396
Номенклатура кислот 288
Нормальная температура 29
Нормальное давление 29
Нуклеарный атом 174
Ньюлэндс 158
Ньютон 210, 215
Обратимые реакции 89
Общее уравнение газообразного со-
стояния 28
Объем граммолекулы 61
Огнетушители 113
Огнеупорные вещества 113
Окисление-восстановление 187—189,
333, 334
Окислитель 189
Окись углерода 105
— кремния 357
Оконное стекло 365
Олеум 310
422
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
Олефины 380, 383
Олово 134
Ом 269
Определение атомного веса 68—70
— молекулярных весов 61
Орбиты электронов 239
Органические кислоты 288
Осаждение в аппаратах Коттрелл 353
Осборн 404
Осмотическое давление 264
Основание слабое 289
— сильное 289
Оснований гидроксильность 289
— ионизация 289
Основания 250, 372
Основная химическая промышленность
300—323
Основность кислот 288
Основные соли 296
Отклонения в периодической таблице
164
— от газовых законов 29
Открытие радиоактивности 190
— радия 192
Относительная активность металлов 126
Отрицательная валентность 184
Отрицательные катализаторы 88
Охлаждение искусственное 54—56
— — компрессорами 54—55
---по принципу поглощения 55
Оцинкованное железо 343
Очистка питьевой воды 248
Пар водяной 99
Пара давление 38
— конденсация 47
— упругость 38
Парафин 124
Парафиновые углеводороды 380
Паркса способ 135
Пары жидкости 47
Пары гальванические 342
pH 292
Пепсин 402
Пептизация 348
Перегной 369
Перегонка каменноугольного дегтя 409
— фракционированная 123
Переносные катализаторы 118
Переработка нефти 122
Пересыщенные растворы 256
Пермутит 247
Период полураспада 198
Периодическая таблица 15Э—1 65
--- и валентность 161
---Томсона-Бора 165
Периоды длинные 186
Перрен 348
Печи доменные 142
— коксовальные 117
Печи открытого пара 150
— отражательные 147
— электрические 153
Пигмент 228
Пикриновая кислота 409
Пирит 141
Пироксилин 397
Питание растений 368
Питьевая вода 347
Пища 402
Плавень 131
Плавление 44, 45
Плавления точка 44
Плавленый кремнезем 366
Пламя 112
Планк 236
Планка константа 237
Планетарные электроны 178, 236
Пластические массы 397
Платина 310, 316
Поглощение энергии 232, 241
Полевой шпат $58
Полиморфизм 43
Полный спектр электромагнитных волн
220
Положительная валентность 183
Полоний 192
Поляризация элемента 341
Полярные связи 183
Порода маточная 131
Портланд-цемент 318
Постоянная жесткость 246
Постоянство состава 20
Потенциальная энергия 207
Почва 368
Превращение сахара 394
Преломление света 219
Применения гелия 102
— радия 203
Принцип Вант-Гоффа 39
Припой свинцовый 138, 139
Природная вода 243
Природный газ 120
Пристли 97
Производство стекла 363
Протеин 399
Протоны 171
Протоплазма 391
Протравы 352
Процесс Габера 292, 375
— дуговой 372
— камерный 307—309
— Фраша 303
— цианамидный 374
Прохождение электричества через га-
зы 167
Пыль 94, 95
Равновесие 38, 89
— динамическое 38
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
423
Равновесие ионов 278
--- в растворе 254
— радиоактивное 198
— химическое 89
Радиоактивность 190—203
Радиоактивная энергия 201
Радиоактивные превращения 195
Радиоактивный распад 196
Радия открытие 192
— получение 202
— применение 203
— свойства 193
Радон 103, 198, 203
Разложение воды 78
— элементов 202
Размеры электрона 71
Разработка железной руды 141
Рамзай 100
Распад атома 195
Распространение элементов 18
Раствор известковый 318, 360
— молярный 255
— насыщенный 254
— нормальный 296
Раствора ионизация 275
Растворенное вещество 252
Растворимое стекло 358
Растворимость 255
Растворитель 252
Растворов температура замерзания 261
--- кипения 262
— типы 253
Растворы 18, 251—258
— газов в жидкости 256
— нейтральные 291
— одной жидкости в другой 257
— пересыщенные 256
— стандартные (титрованные) 295
Реакции воды 250
— горения 105
— двойного разложения 82
— обратимые 89
— осаждения 289
— разложения 82
— соединения 81
— экзотермические 82
— электролитов 290—300
— эндотермические 82
Резерфорд 174
Рентген 189, 227
Ржавчина 128
Ричардс 154
Ртуть 22, 26, 132, 133
Руд флотация 351
Руда 130
Рудничный газ 106
Руды железные 141
Румфорд 207
Рмей Ю0
Ряд напряжений металлов 130, 324, 337
Сабатье 399
Сальварсан 414
Сахар 392—395
Сахар тростниковый 394
Сахара превращение 394
Сахарная промышленность 394
Сахароза 393
Света дисперсия 219
— дифракция 216
— интерференция 216
— корпускулярная теория 215
— преломление 219
Свойства ионов 86
— радия 193
Свинец 134
Свинцовый аккумулятор 243
Связь двойная 383
— ковалентная 185, 280
— между атомами в молекуле 75
— неполярная 184, 280
— полярная 183
— тройная 383
Сгорание неполное 107
Селитра чилийская 314, 370, 377
Сера 301
— черенковая 301
Серная кислота 287, 301
Сернистая кислота 287, 306
Серный цвет 301
Сероводородная кислота 287, 288
Сероуглерод 398
Сжижение газов 52
Сила кислот 288
Силикагель 351
Силикат кальция 131
Сильное основание 289
Символы химические 71 л
Синтез 18
Скорость испарения 38
— радиоактивного распада 196
— реакции 83—92
Скрытая теплота парообразования 206
--- плавления 206
Слабое основание 289
Слабые электролиты 279, 282
Сланцы горючие 125
Смеси 17
Смола каменноугольная, см. каменно-
угольная смола
Смягчение воды 246
Сода 316, 317, 319—321, 363
— каустическая 322
Содди 195
Соединения азота 312—314
Соединительные объемы газов 58
Соли 289
— кислые 296
Соли основные 296
Соль поваренная 322, 328
Соляная кислота 316
424
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
Состав молекул 63
— стекла 363
— углей 115
Сохранение энергии (закон) 207
Спектр видимый 220
— водорода 234
— • испускания 223
— поглощения 223
— электромагнитных волн 220
Спектроскоп 233
Спирт древесный 385
— винный 385
— метиловый 385
— этиловый 386
Спирты 385—386
Сплавы 138—140
— содержащие железо 154
— цветных металлов 139
Способ Леблана 320
— открытого пода 150
— Паркса 135
— Сольвея 321
Стали бессемерование 148
С таль Ю4
Сталь 148—156
Стандартные (титрованные) растворы
295
Стекла состав 363
— производство 363
Стекло 362—367
— зеркальное 365
— кварцевое 225, 366
— оконное 363
— «ругех» 366
— растворимое 358
— цветное 366
Строение адгома и валентность 166, 182
Строение кристаллов 41, 228—232
Сухой лед 51
Сухой элемент 341
Таблица индикаторов 293
Твердое топливо 114—118
Тведрости шкала 127
Твердые тела 40—43
Температура 108, 212, 276
— абсолютная 27, 34
— замерзания растворов 261
— кипения растворов 262
— нормальная 24, 29
Температурные шкалы 26, 276
Теория Бора 238—240
— квантов 236, 240
— Лыоиса-Лэнгмьюра 178
— радиоактивного распада 105
— теплорода 204
— флогистона 204
Теория электролитической диссоциации
274—276
Теорема Ле-Шателье 92
Теплоемкость 205
Теплота 204
— нейтрализации 295
— скрытая парообразования 206
--- плавления 206
Теплотворная способность углей 11:
Термометры 25
Тиндаля эффект 347
Типы растворов 252—253
Томсон 168
Топливо 114—126
— газообразное 118—121
— жидкое 121—126
— твердое 114—118
Торичелли 22, 26
Торф 114, 134
Точка воспламенения 108
— замерзания 45
— кипения 45
— плавления 44, 45
Тринитрат глицерина 312, 390
Тройная связь 383
Тростниковый сахар 294
Туманы 346
Углеводороды 106, 121, 380—385
— ароматические 405
— ацетиленового ряда 383
— ненасыщенные 383
— непредельные 383
— олефиновые 383
— парафиновые 380
Углеводы 390—397
Углерод 105
— как восстановитель 143, 189
— четыреххлористый 113, 383
Углерода двуокись 94, 105
— окись 105
Углей состав 145
— теплотворная способность 115
Уголь 115—117
— битуминозный 115—117
— древесный 116
— каменный 116
Угольная кислота 287
Удобрения концентрированные 379
— фосфатные 311, 379
Уксусная кислота 282, 287, 389
Уксуснокислый натрий 389
Ультрафиолетовые лучи 224—227
Упругость пара 38
Уравнения химические
и валентность 77, 78
Уровни энергетические 238
Уравнивание коэфициентов 78
Фазы 17
Фарадей 47,48, 218, 270, 271, 276
Фарадея законы 270, 276
Фарфор 359
Фенол 388, 407
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
425
Физические изменения 20
Физические свойства металлов 127
Фиксация азота 371—379
Фильтрование воды 248
Флогистон 104, 204
Флотация 132
— руд 351
Формальдегид 387, 288, 392
Формул вывод 72
Формулы 71
Формулы строения 75
Фосфат кальция 341, 379
Фосфатные удобрения 311, 379
Фосфаты 379
Фосфорная кислота 287, 311
Фотография 89, 222
Фотосинтез 89, 391
Фотохимическая реакция 89, 241, 391
Фотоэлектрический эффект 237
Фраш 302
Фраша процесс 303
Френель 216
Фруктоза 393
Халькопирит 136
Халькоцит 136
Химическая энергия 209
Химические реакции 76—92
— символы 76
— уравнения 77
— явления 20
Химических реакций виды 81
---обратимость 89
---скорость 83—92
Химическое равновесие 90
Хлор 323
Хлорид кальция 321, 322,
— натрия 322
Хлорирование воды 249
Хлоропласты 391
Хлорофилл 391
Хлороформ 383
Холмугровое масло 414
Холл 330
Целлулоид 397
Целлюлоза 395
Целлюлозы эфиры 396
Цемент 318, 361
Цианамид кальция 374
Цианамидный процесс 374
Цветное стекло 366
Цинк 133
Четыреххлористый углерод 113, 383,
414
Чилийская селитра 314, 370, 374
Число Авогадро 62
Чугун 145
Шееле 97
Шелк искусственный 398
Шкала твердости 127
Шкалы температурные 26, 27
Шлак 131, 145, 146, 152
Щелочи 316—323, 374, 410, 418
Щелочноземельные металлы 164»
Щелочные металлы 129, 164, 427
Экзотермические реакции 82
Электрическая печь 153
Электрическая упругость растворе*
ния 335
Электрические единицы измерения 268
Электрический потенциал 268
— ток 267
Электрод водородный 337
Электродвижущий ряд 332
Электродвижущий ряд металлов
130, 337, 338
Электродные потенциалы 337
Электролиз 270—272, 324—333
— воды 78, 98
Электролитическая диссоциация
267-278
Электролиты 258, 278—290
— сильные 279, 282, 283
— слабые 279, 283
Электрометаллургия 329
Электрон 166, 169—171
— планетарный 178, 236
Электрона заряд 170
— масса 170
— размеры 171
Электронные орбиты 239
Электронный потенциал 337
Электропроводность 267
Электрорафинирование меди 331
— металлов 3з1
Электротипия 332, 333
Электрохимический элемент 333
Элемент гальванический 333—343
— гравитационный 339
— Даниеля 339
— концентрационный 340
— Лекланше 341
— сухой 341
Элементы 16, 18
— с переменной валентностью 75
Эмульсии 346, 349, 355
Эндотермические реакции 82
Эндрьюс 49
Энергии виды 207
— закон сохранения и химические
реакции 82
— сохранение 207
Энергия 203—215
— внутриатомная 210
— кинетическая 207
426 ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
— лучистая 216—241 — потенциальная 207 — радиоактивных элементов 201 — тепловая 210 — химическая 209 Энзимы 402 Этанол 385 Этилен 384 Этиловый алкоголь (спирт) 385, 86 Эйнштейн 236 Эмульсии 346, 349, 355 Эфир мировой 218 Эфиры простые 386 — сложные 389 — целлюлозы 396 Эффект Тиндаля 347 — фотоэлектрический 237 Юнг 281 Явления критические 47
МЕЖДУНАРОДНЫЕ АТОМНЫЕ ВЕСА 1935 W
N 14,008 Натрий Na 22,997
Алюминий .••••• А1 26,97 Неодим Nd 144,27
Аргон Аг 39,944 Неон Ne 20,183
Барий В 137,36 Ni 58,69
Бериллий Вс 9,02 Ниобий Nb 92,91
Бор В 10,82 Олово Sn 118,70
Бром . В: 79,916 Осмий Os 191,5
Ванадий V 50,95 Палладий ...... Pd 106,7
Висмут . . Bi 209,00 Платина Pt 195,23
Водород Н 1,0078 Празеодим Pr 140,92
Вольфрам • ••••• W 184,0 Радий Ra 225,97
i Gd 157,3 Радон Rn 222,0
Галлий • •••••. Ga 69,72 Рений Re 186,31
Гафний ....... Hf 178,6 Родий Rh 102,91
Гелий Не 4,002 Ртуть • Hg 200,61
Германий G< 72,60 Рубидий Rb 85,44
Гольмий Но 163,5 Рутений , Ru 101,7
Диспрозий Dy 162,46 Самарий Sa 105,43
Европий • Eu 152,0 Свинец • Pb 207,22
Железо Fe 55,84 Селен Se 78,96
Золото Au 197,2 Сера • • • ; • . S 32,06
Индий In 114,76 Серебро ; : ; р ; Ag 107,880
Иод . J 126,92 Скандий ; i ; ; ; Sc 45,10
Иридий Ir 193,1 Стронций Sr 87,63
Иттербий Yb 173;04 Сурьма 1 5 ? • • Sb 121,76
Иттрий . Yt 88,92 Таллий ; ; . ; . Tl 204,39
Кадмий Cd 112,41 Тантал . ; . s . Ta 181,4
Калий К 39,10 Теллур . . ; ; . Те 127,61
Кальций Ca 40,08 Тербий . ; $ ; Tb 159,2
Кислород 0 16,00 Титан . ; s . . Ti 47,90
Кобальт Co 58,94 Торий i ; ; ; , Tb 232,12
Кремний Si 28,06 Туллий ; 5 i 5 1 Tu 169,4
Криптон Kr 83,7 Углерод ; . ; . G 12,00
Ксенон Xe 131,3 Уран U 238,14
Лантан La 138,92 Фосфор . . . ; . P 31,02
Литий Li 6,940 Фтор . : ; ; . . F 19,00
Лютеций Lu 175,0 Хлор • •••,. . Cl 35,45
Магний Mg 24,32 Хром • . ; . . . Cr 52,01
Марганец Mn 54,93 Цезий ; ; ; . . Cs 132,9
Медь Cu 63,57 Церий . . i . . Ge 140,13
Молибден Mo 96,0 Цинк Zn 65,38
Мышьяк As 74,93 Цирконий ; 2 . ; Zr 91,22
Эрбий . . ; ; . Er 167,64
Ведущий редактор Е. С. Чепракма. Техн, редактор П. В. Грацианов. Сдано в набор 25/1 1935 г.ГРХЛ № 740.
Подписано к печати 17/V* 1935 г. Форнат бумаги 62 х 94Х/1А. Бум. п. 13e/s. Уч. авторских лист. 31,55.
Уполн. Главлита В-16689. Тираж 5000 экз. Инд. ХМ—10-5-2. Заказ 510.
1-я Образцовая тип. Огива РСФСР треста «Полиграфкнига». Москва, Валовая, 28.
Отпечатано с матриц в 1-й Журн. тип. ОНТИ. Москва, Денисовский, 30. Зак. 1357.
Замеченные опечатки
в книге Д. Тимма «Введение в химию»
Стр. Строка Напечатано Следует
61 1—3 сн. А Р1 = 753 мм
Pi р2 = 760 мм
= 213 см* = Va = 213 см* = 0,213 л
75 Гис. 18 В верхней левой части рисунка в одном из кружков не имеется обозначения Н
86 18 сн. R = k\Co2 R = k\COi
162 табл. XXI, 1 16
разряд, 3 в S S
группе VI 32,06 32,06
180 табл. XXIV На рисунке, изображаю- щем структуру алюминия, на внешнем кубе показано 4 электрона (по углам куба) На внешнем кубе должно быть 3 электрона (анало гично изображенной выше структуре бора)
188 5 св. Fe2+3O8+2 Ре2+3ОГ2
231 И сн. 58,455 58,455
6,06X102 6,О6ХЮ23
254 рис. рис. 29 рис. 92
296 8 сн. проделана определена
299 14 » сульфата бария сульфатов бария и свинца
358 3 св. штата шпата
369 22—23 св. В перечислении элементов, пропущен калий. необходимых для растений,
Всего отмечено 14 опечаток; из них 4 — редакторских исправления,
3 — издательских и 7 типографских опечаток.
Зак. 1-57