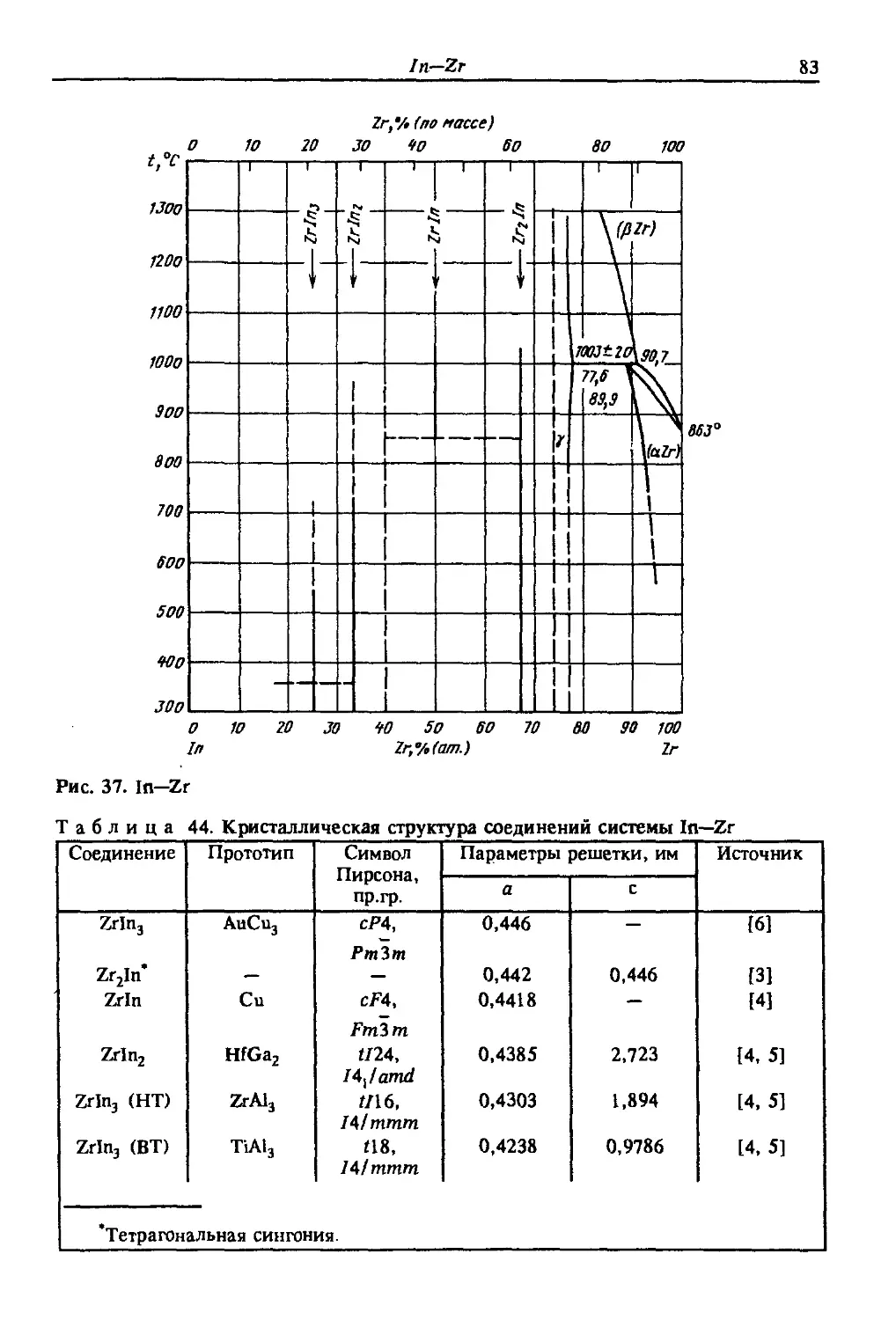
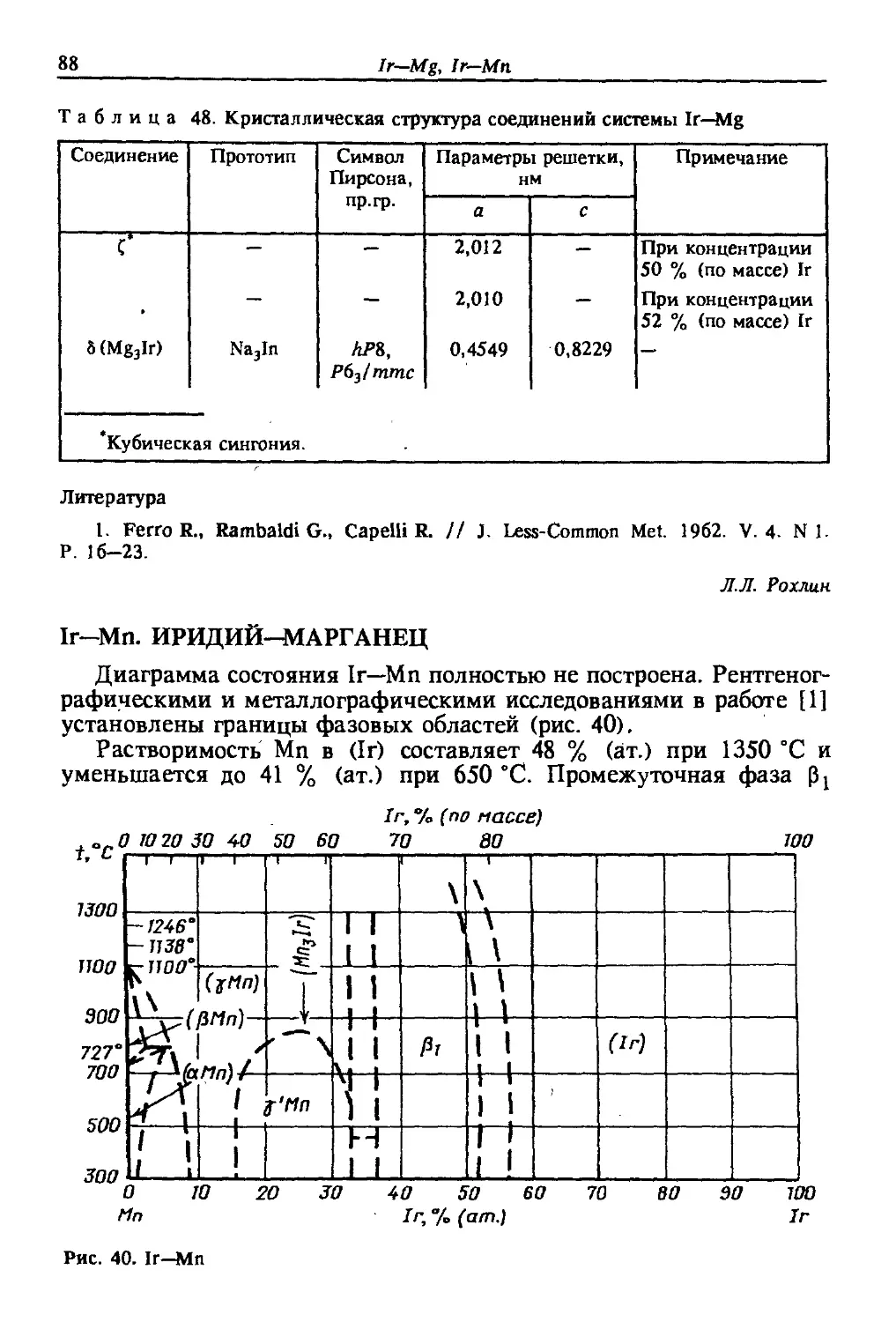
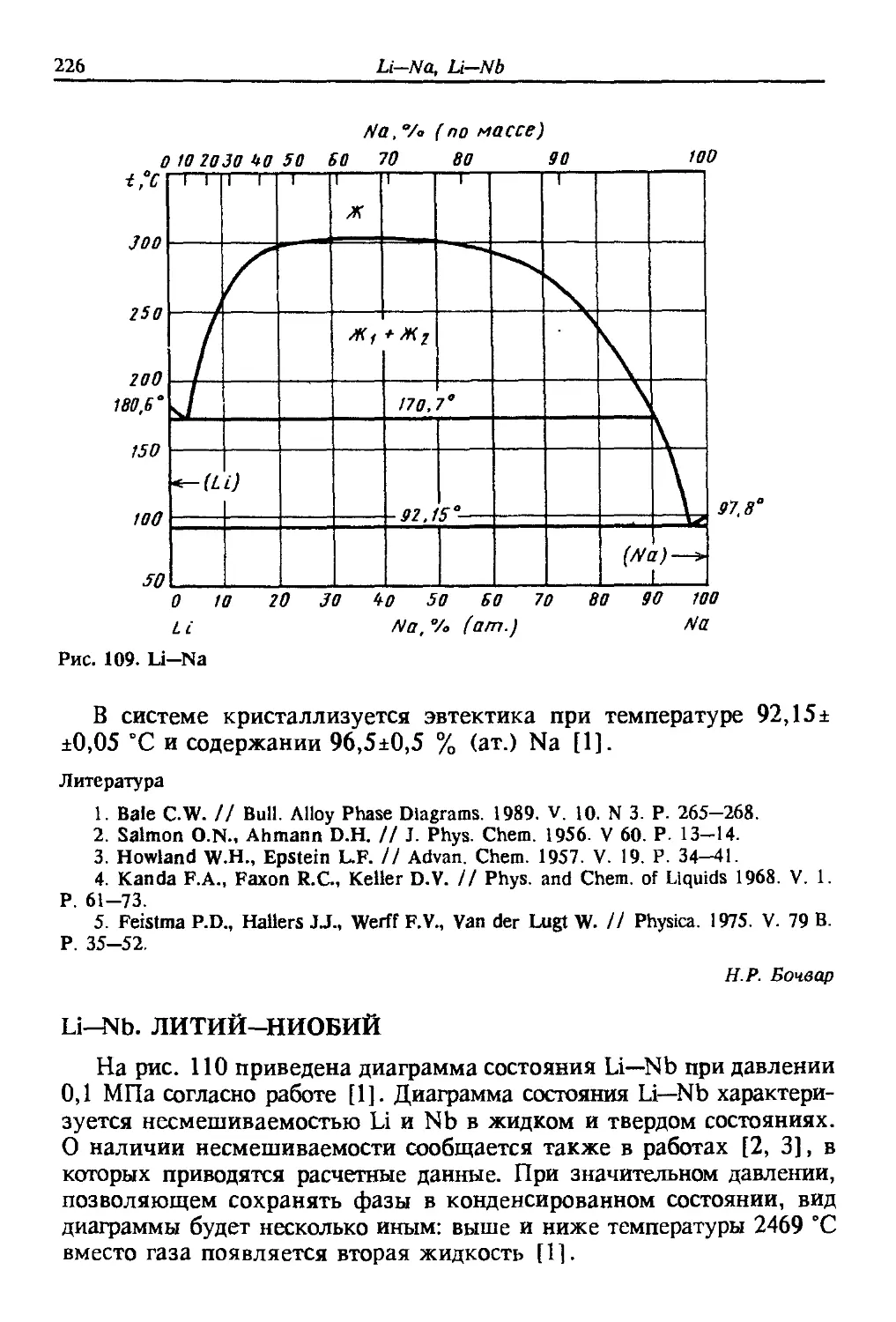
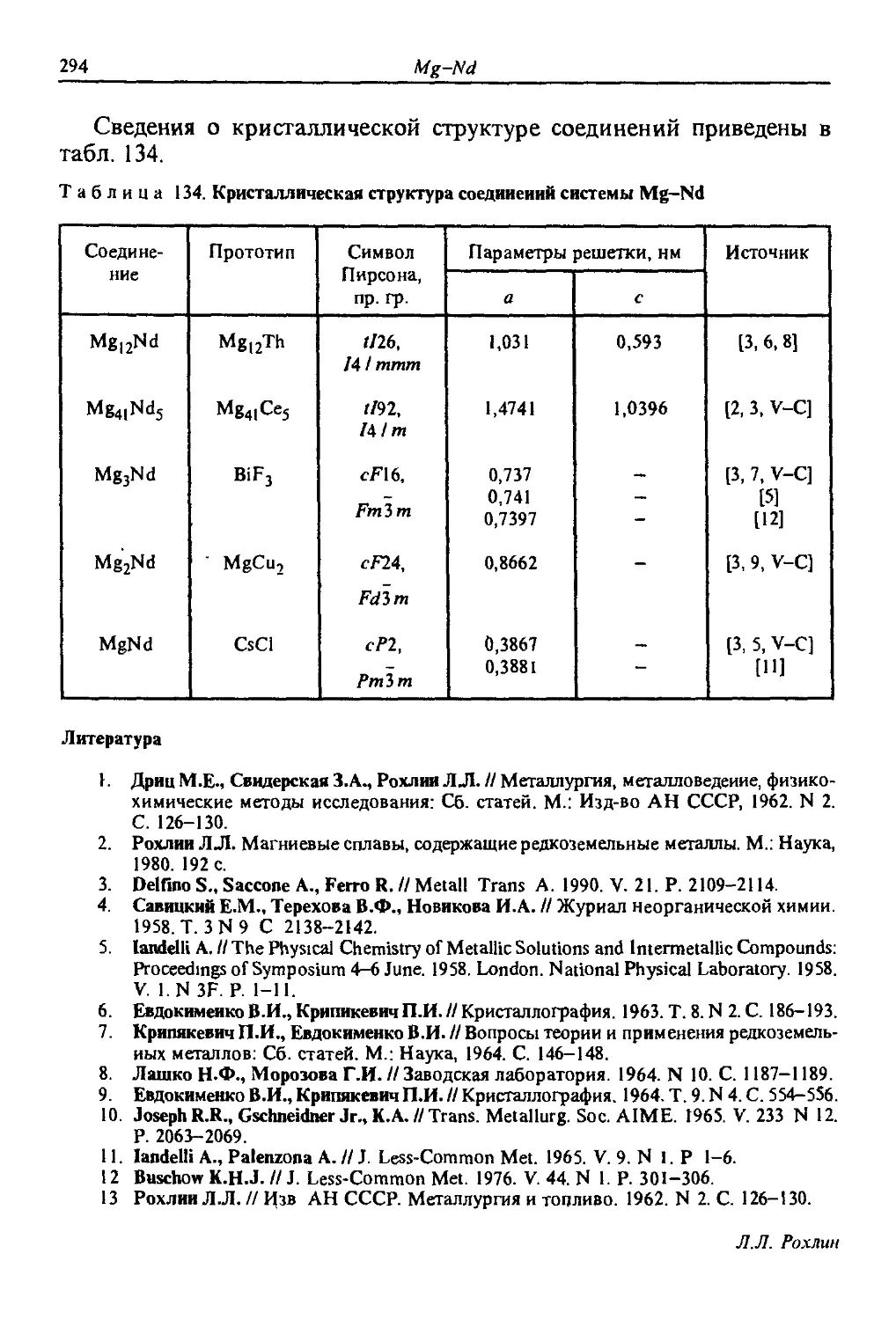
Автор: Лякишев Н.П.
Теги: металлургия металловедение физика инженерия инженерное дело издательство машиностроение
ISBN: 5-217-02843-2
Год: 1996
Текст
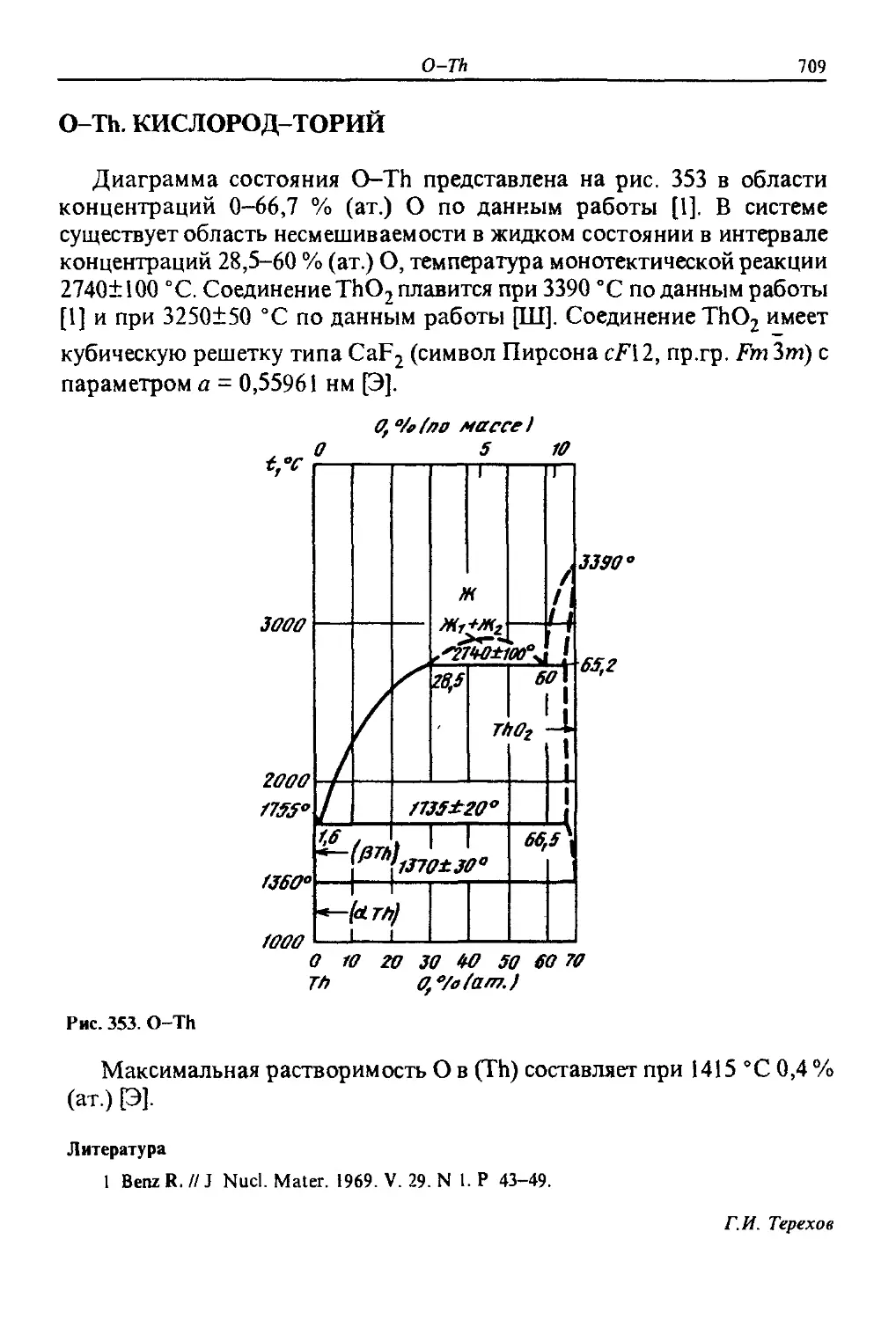
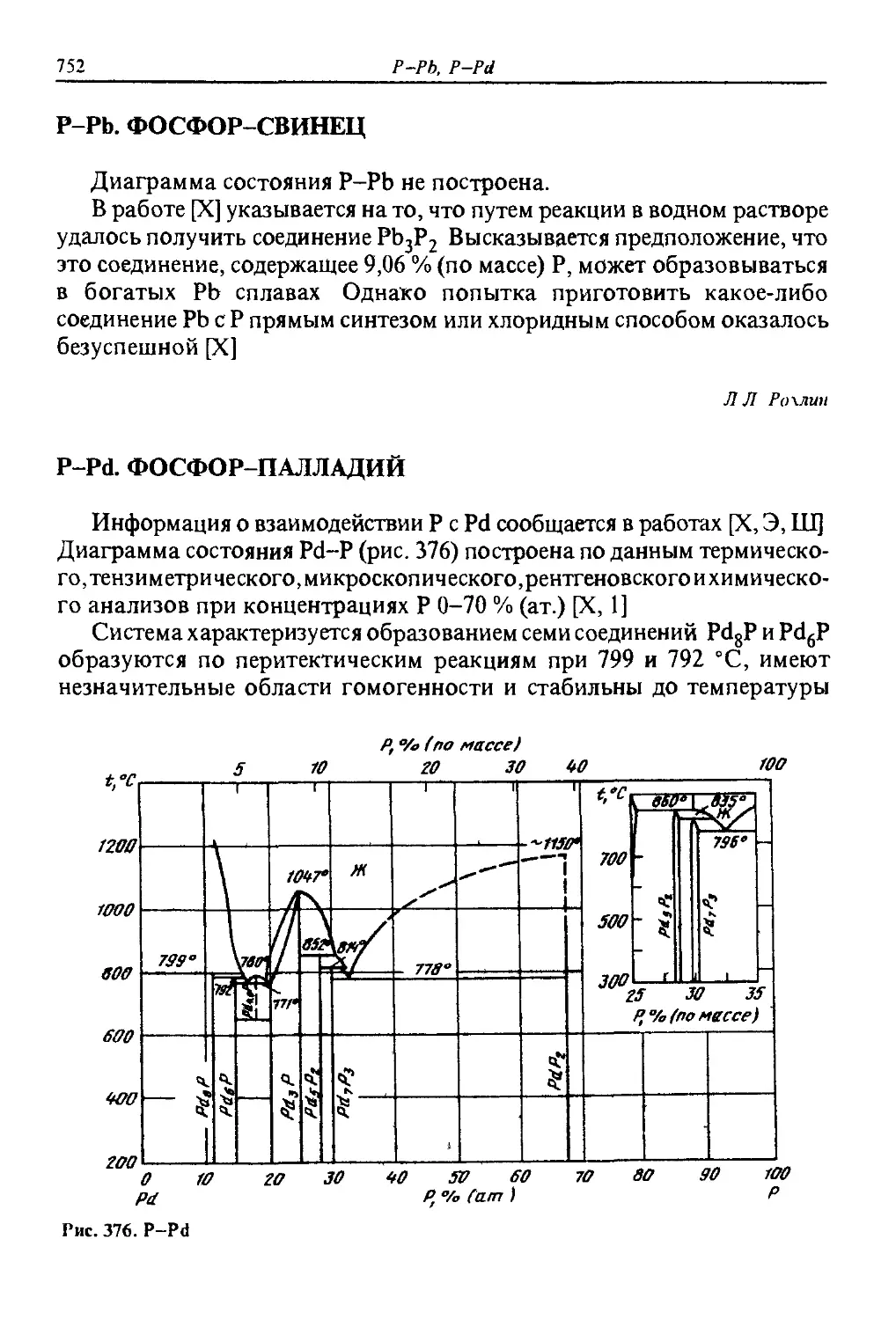
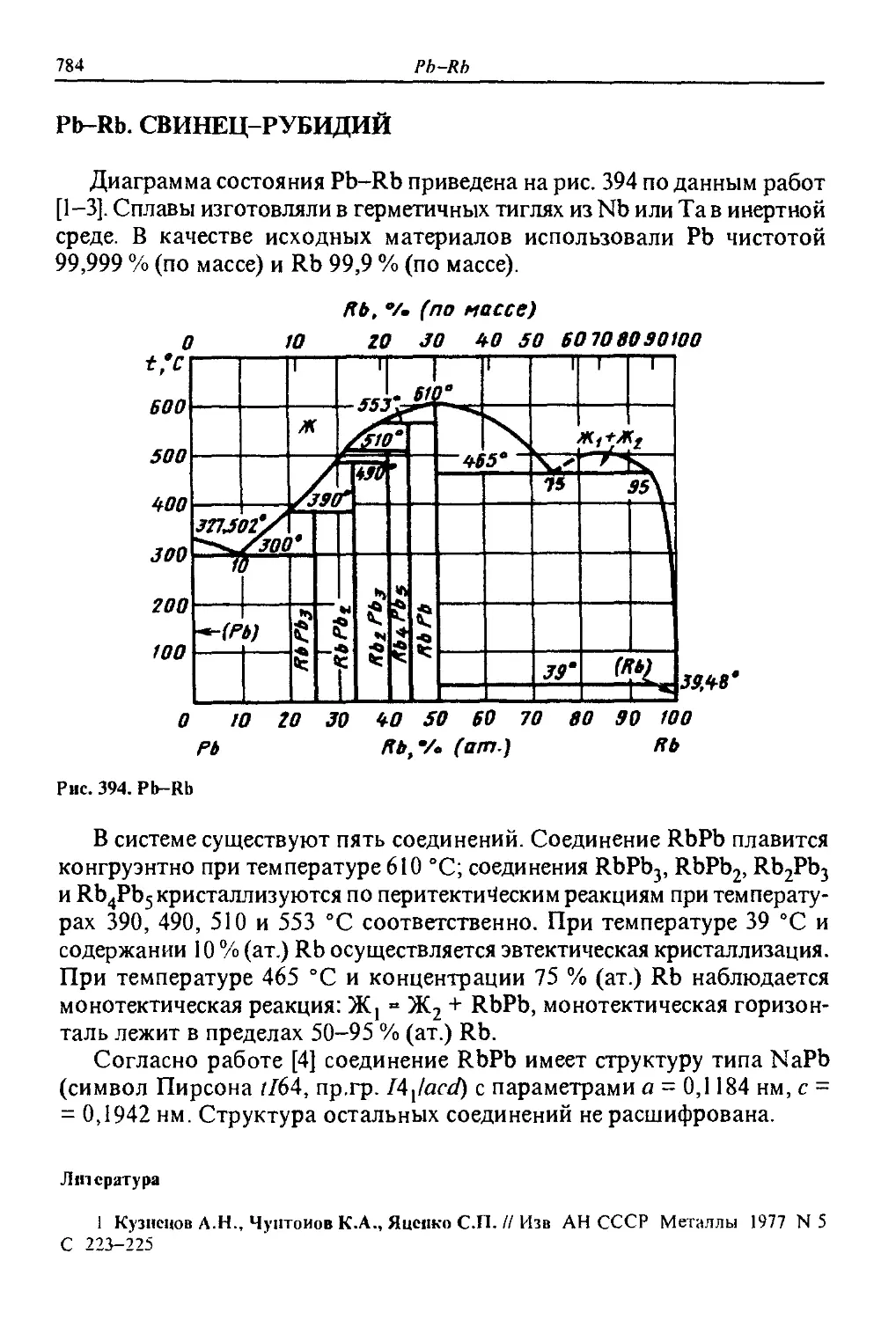
ДИАГРАММЫ
СОСТОЯНИЯ
двойных
металлических
систем
ТОМ 3 КНИГА 1
Под общей редакцией
академика РАН Н.П. Лякишева
МОСКВА
МАШИНОСТРОЕНИЕ
2001
диаграммы
состояния
двойных
металлических
систем
Справочник в трех томах
Редакционный совет:
акад. РАН Н.П. Лякишев
(главный редактор издания),
акад. РАН О.А. Банных
(зам. гл. ред.),
д-р техн. наук Л.Л. Рохлин
(зам. гл. ред.),
канд. техн. наук СП. Алисова,
канд. техн. наук Н.Р. Бочвар,
канд. техн. наук П.Б. Будберг,
канд. техн. наук Т.В. Добаткина,
канд. техн. наук Е.В. Лысова,
д-р техн. наук В.П. Полякова,
д-р техн. наук К.Б. Поварова,
д-р техн. наук М.А. Тылкина,
д-р хим. наук Л.Е. Шелимова,
д-р техн. наук Е.Н. Шефтель
МОСКВА
МАШИНОСТРОЕНИЕ
2001
УДК 669.017.11
ББК 34.2
Д44
р<; ; ^ И Издание осуществлено при поддержке
Российского фонда фундаментальных
исследований по проекту 98-03-46017
Диаграммы состояния двойных металлических систем:
Д44 Справочник: В 3 т.: Т. 3. Кн. I / Под общ. ред. Н.П. Лякишева. -
М.: Машиностроение, 2001. - 872 с: ил.
Приведены критически рассмотренные и обобщенные сведения о диаграммах
состояния двойных металлических систем, знание которых необходимо для
выбора и разработки промышленных металлических материалов, технологии их
производства и практического использования. Содержатся сведения об образующих-
образующихся в системах соединениях и их кристаллических структурах, типах и
температурах фазовых превращений, взаимных растворимостях компонентов друг
в друге и изменении их с температурой.
Для инженерно-технических работников научно-исследовательских инсти-
институтов и промышленных предприятий металлургии, машиностроения и других
отраслей промышленности, а также для профессорско-преподавательского сос-
состава и студентов высших учебных заведений.
ISBN 5-217-02843-2(Т. 3) 5БК 34.2
ISBN 5-217-02687-1
© Н.П. Лякишев, О.А. Банных,
Л.Л. Рохлин и др., 1999
© Издательство "Машиностроение", 1999
© Издательство "Машиностроение", 2001
ПРЕДИСЛОВИЕ
Третий том справочника "Диаграммы состояния двойных металличес-
металлических систем" включает описание равновесных диаграмм состояния
от In-Ir до Zn-Zr. Он составлен на основании оценки и обобщения
имеющихся литературных данных.
При описании кристаллических решеток интерметаллических фаз
указываетя символ Пирсона, который состоит из строчной буквы,
обозначающей сингонию решетки, прописной буквы, характеризующей
решетку по классификации Бравэ, и цифры, дающей число атомов в
элементарной ячейке. В таблице приводятся возможные типы решеток
Бравэ в символах Пирсона согласно справочнику [II].
Таблица. Тппы кристаллических решеток в символах Пирсона
Символ Пирсона
аР
тР
тС
иР
оС
oF
о/
IP
II
hP
hR
сР
cF
cl
Система
Триклинная (анортическая)
Моноклинная
Моноклинная базоцентрированная
Ромбическая
Ромбическая базоцентрированная
Ромбическая гранецентрированная
Ромбическая объемно-центрированная
Тетрагональная
Тетрагональная объемно-центрированная
Гексагональная
Ромбоэдрическая
Кубическая
Кубическая гранецентрированная
Кубическая объемно-центрированная
Символ
решетки
Р
Р
С
Р
С
F
I
Р
I
Р
R
Р
F
1
Предисловие
При описании кристаллических структур также использовали
следующие обозначения:
ОЦК - объемно-центрированная кубическая структура;
ГЦК - гранецентрированная кубическая структура;
ГПУ- гексагональная плотноупакованная структура;
ДГПУ - двойная гексагональная плотноупакованная структура.
Следует обратить внимание на ряд обозначений, введенных в текст
справочника:
Ограниченные твердые растворы на основе чистых компонентов,
аллотропических форм чистых компонентов или соединений обозначают-
обозначаются соответствующими символами и заключаются в круглые скобки,
например, (V), (aTh), (Si3Ni4).
Неограниченные твердые растворы между двумя компонентами
обозначаются символами соответствующих компонентов и заключа-
заключаются в круглые скобки, например, (РРг, Tm), (pPr, pTb), (Pt, Rh).
Если чистый компонент или соединение существуют в двух модифика-
модификациях, то высокотемпературная модификация обозначается греческой
буквой р или (ВТ): pZr, pPdSm или Ni3Sn(BT), а низкотемпературная
модификация обозначается греческой буквой а или (НТ): aZr, aPdSm или
Ni3Sb(HT).
Если чистый компонент или соединение существуют в трех модифика-
модификациях, то высокотемпературная, среднетемпературная и низкотемпера-
низкотемпературная модификации обозначаются соответственно греческими буквами
Y, P, a или (ВТ), (СТ), (НТ): ySm, pSm, aSm, yPt3Pu, pPt3Pu, aPt3Pu или
ZrO2(BT), ZrO2(CT), ZrO2(HT).
На диаграммах состояния указаны принятые в настоящее время
наиболее достоверные значения температур плавления и температур
полиморфных превращений чистых металлов. Значения этих температур
указаны по Бюллетеню фазовых диаграмм сплавов [В].
Для указания повторяющихся ссылок на литературу, используемую
во многих описаниях диаграмм состояния, применены следующие
сокращения:
[X] - Хансен М., Андерко К. Структуры двойных сплавов. М.:
Металлургия, 1962. Т. 1, 2. 1188 с.
Р] - Эллиот Р.П. Структуры двойных сплавов. М.: Металлур-
Металлургия, 1970. Т.1. 456 с. Т.2. 472 с.
[III] - Шанк Ф.А. Структуры двойных сплавов. М.: Металлургия,
1973.760 с.
[М] - Massalski T.B. (Editor-in-Chief). Binary Alloys Phase Diag-
Diagrams. Ohio: American Society for Metals Metals Park, 1986,
1987. V. 1,2. 2224 p.
[M2] - Второе издание [М].
Предисловие
[Р] - Pearson W.B. A Handbook of Lattice Spacings and Structures
of Metals and Alloys. Oxford, London, Edinburg, New York,
Toronto, Sydney, Paris, Braunschweig: Pergamon Press, 1967.
1448 p.
[P] - Пирсон У. Кристаллохимия и физика металлов и сплавов.
М.: Мир, 1977. Т. 1. 420 с. Т. 2. 470 с.
[V-C] - Villars P., Calvert L.D. Pearsons Handbook of Crystallogra-
phic Data for Intermetallic Phases. Ohio: Metals Park, 1985.
V. 1,2,3.
[V-C2] - Второе издание [V-C].
[В] - Bulletin of Alloy Phase Diagrams. 1986. V. 7. № 6. P. 601-602.
In-Ir. ИНДЙЙ-ИРИДИЙ
Получение сплавов в этой системе сталкивается с трудностями из-
за значительного различия температуры плавления и летучести
компонентов. Тем не менее согласно работе [1] удалось получить
соединение Inlr3, которое находилось в равновесии с богатым In
расплавом и фазой примерного состава In3lr2. Соединение Inlr3 имеет
тетрагональную ячейку с а = 0,699 нм, с - 0,720 нм со структурой,
изотропной структуре соединения CoGa3, символ Пирсона tPlfi, пр.
гр. Р4п2. Структура фазы In3lr2, состав расплава и температура,
вероятно, перитектической реакции ее образования не установлены.
Литература
1. Schubert К., Lukas H.L., Meissner H.Y., Bhan S. // Z. Mettalkunde. 1959. Bd. 50.
N 9. S. 534-540.
A.C. Адамова
In—К. ИНДИЙ—КАЛИЙ
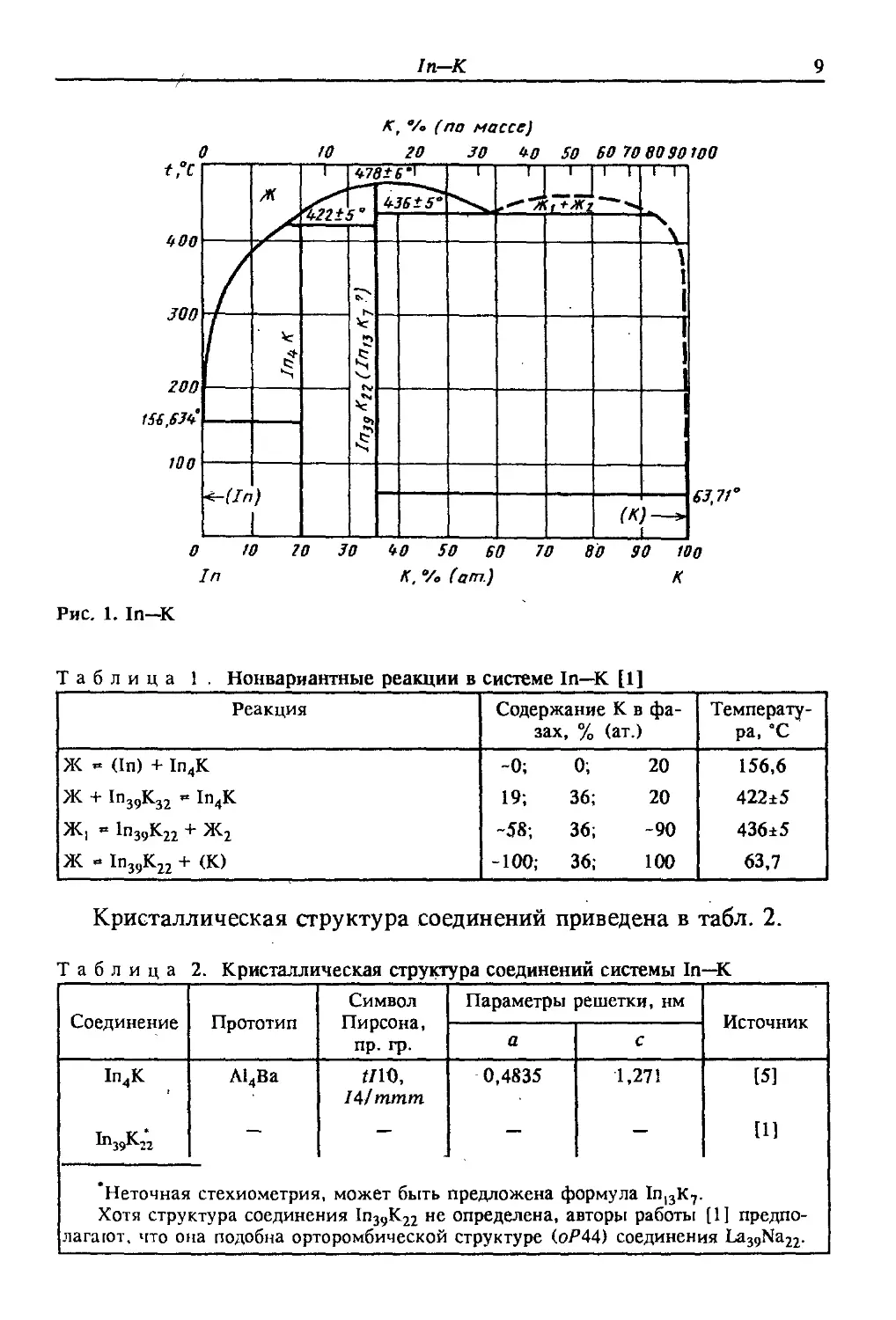
Диаграмма состояния In—К (рис. 1) [1] построена в результате
обобщения данных работ [2—4].
Сплавы получали в инертной среде сплавлением компонентов в
герметичных контейнерах из Та [1]. Чистота исходных металлов:
99,99-99,999 % (по массе) In [3, 4] и 99,99-99,8 % (по массе) К.
Исследования выполняли методами термического [2, 3, 4], резис-
тометрического [4] и рентгеноструктурного [5] анализов, измерени-
измерением плотности и атомного объема сплавов [2].
Установлено образование двух соединений: In39K22(In13K7) и
1п4К. Соединение In3gK22 плавится конгруэнтно при 478 ± 6 °С,
а соединение 1п4К образуется по перитектической реакции при
422 ± 5 "С. Нонвариантные реакции в системе приведены в
табл. 1.
In-K
t,'c
U 00
300
zoo
К, V. (по массе)
10 20 30 <Ю SO ВО 70 80SO 100
100
(
1
ж
у
V:
1
—ч
1
i-3S±5'
1
1 1
1
(К)—*
f
{3,71°
0 10 70 30 <fO SO SO 70 80 SO 100
In K. % (am.) К
Рис. 1. In—К
Таблица 1 . Нонвариантные реакции в системе In—К [1]
Ж
ж
ж,
ж
Реакция
» (In) + In4K
39 32 ** 1^4
** аП391\.22 "г ЛЧ2
- 1п39К22 + (К)
Содержание К в
зах, % (ат.)
-0; 0,
19; 36;
-58; 36;
-100; 36;
фа-
20
20
-90
100
Температу-
Температура, °С
156,6
422 ±5
436±5
63,7
Кристаллическая структура соединений приведена в табл. 2.
Таблица 2. Кристаллическая структура соединений системы In—К
Соединение
1п4К
1п39К,*2
Прототип
А14Ва
Символ
Пирсона,
пр. гр.
ШО,
/4/mmm
Неточная стехиометрия, может быть
Хотя структура соединения 1п39К22 не
лагают, что она подобна орторомбической
Параметры решетки, нм
а
0,4835
с
1,271
Источник
[5]
[1]
предложена формула 1п13К7.
определена, авторы работы [1] предпо-
структуре (&Р44) соединения La39Na22.
10 In-K, In—Kr, In-La
Литература
1. Pelton A.D., Larose S. // Bull. Alloy Phase Diagrams. 1990. V. 11. N 3.
P. 232-236.
2. Thflmmel R., Klemm W. // Z. Anorg. All. Chem. 1970. Bd. 376. S. 44-63.
3. Яценко СП., Чугунов К.А., Бушманов В.Д., Диева В.Н. // Структура фаз,
фазовые превращения и диаграммы состояния металлических систем: Сб. статей. М.:
Наука, 1974. С. 198-201.
4. Meijer J.A., Geertsma W., Van der Lugt W. // J. Phys. F. Met. Phys. 1985. V. 15.
P. 899-910.
5. Bruzzone G. // Acta Crystallogr. B. 1969. V. 25. P. 1206-1207.
. A.C. Адамова
In—Кг. ИНДИЙ—КРИПТОН
Диаграмма состояния In—Кг не построена. Растворимость Кг в
жидком In при 1000 °С составляет 10,9-10~10 % (ат.), при
1300 "С - 3,9- 10"* % (ат.) [1].
Литература
1. Johnson G.W. // Phil. Mag. 1961. V. 6. P. 943-946.
Л. Л. Зусман
In-La. ИНДИЙ-ЛАНТАН
Диаграмма состояния In—La построена в работе [1] (рис. 2).
Сплавы изготовляли плавлением из компонентов в дуговой печи.
При исследовании использовали La чистотой 99,9 % (по массе) и
In чистотой 99,999 % (по массе).
Исследование выполняли методами микроструктурного, рентгено-
структурного и дифференциального термического анализов.
Установлено образование семи соединений, из которых Laln3,
La3ln5 и Lain плавятся конгруэнтно при 1140, 1185 и 1125 °С соот-
соответственно; Laln2, La2ln и La3ln образуются по перитектическим
реакциям при 1153, 955 и 816 °С соответственно. Соединение Lalnx
(состав точно не установлен) предположительно образуется при
1073 °С по перитектоидной реакции, а затем распадается при 905 °С
в результате эвтектоидного превращения.
In—La
11
t °c
1200
1100
1000
918°
300
865°
800
La)-
700
600
500
400
370°
300
200
100
7
J
i
го
1
1
'816°
4/7*2°
702°
*- (ocLa)
I
ж
/
/
In, °/c (no нассеУ
40 60
f
(
112.
955°
1
1
Ю73°\
1
п
п
п
1
I
I
с
I
'53°
си
80
1
iff0
\
155°
A
100
\
\
\
п) -»
156,834°
О 10 20 J0 40 50 60 70 SO SO 100
La In,°A(am.) In
Рис. 2. In-La
12
In—La
Растворимость La в In практически отсутствует. Высокотемпера-
Высокотемпературная модификация (yLa) растворяет до 10 % (ат.) In при 742 °С,
(pLa) содержит в твердом растворе -3 % (ат.) In при 702 °С (тем-
(температура эвтектоидного превращения), при 500 "С растворимость
практически отсутствует.
Нонвариантные реакции в системе In—К приведены в табл. 3 по
данным работы [1], а кристаллическая структура соединений — в
табл. 4 по данным работ [V-C, 2].
Таблица 3. Нонвариантные реакции в системе In—La [I]
Реакция
Ж - (vLa) + La3ln
(yLa) - (PLa) + La3ln
(PLa) - (aLa) + La3ln
Ж + La2ln * La3ln
Ж + Lain <• La2ln
Ж = Lain + La3ln5
Lain + La3ln5 «• Lain,,
Lalnx «• Lain + La3ln5
Ж + La3ln5 «• Laln2
Ж <• Laln2 + Laln3
Ж « Laln3 + (In)
Содержание In в
% (ат.)
14;
8;
-0;
-19;
-32;
-54;
50;
-;
-67;
71;
-100;
-10;
3;
-0;
-33,33;
50;
50;
62-64;
50;
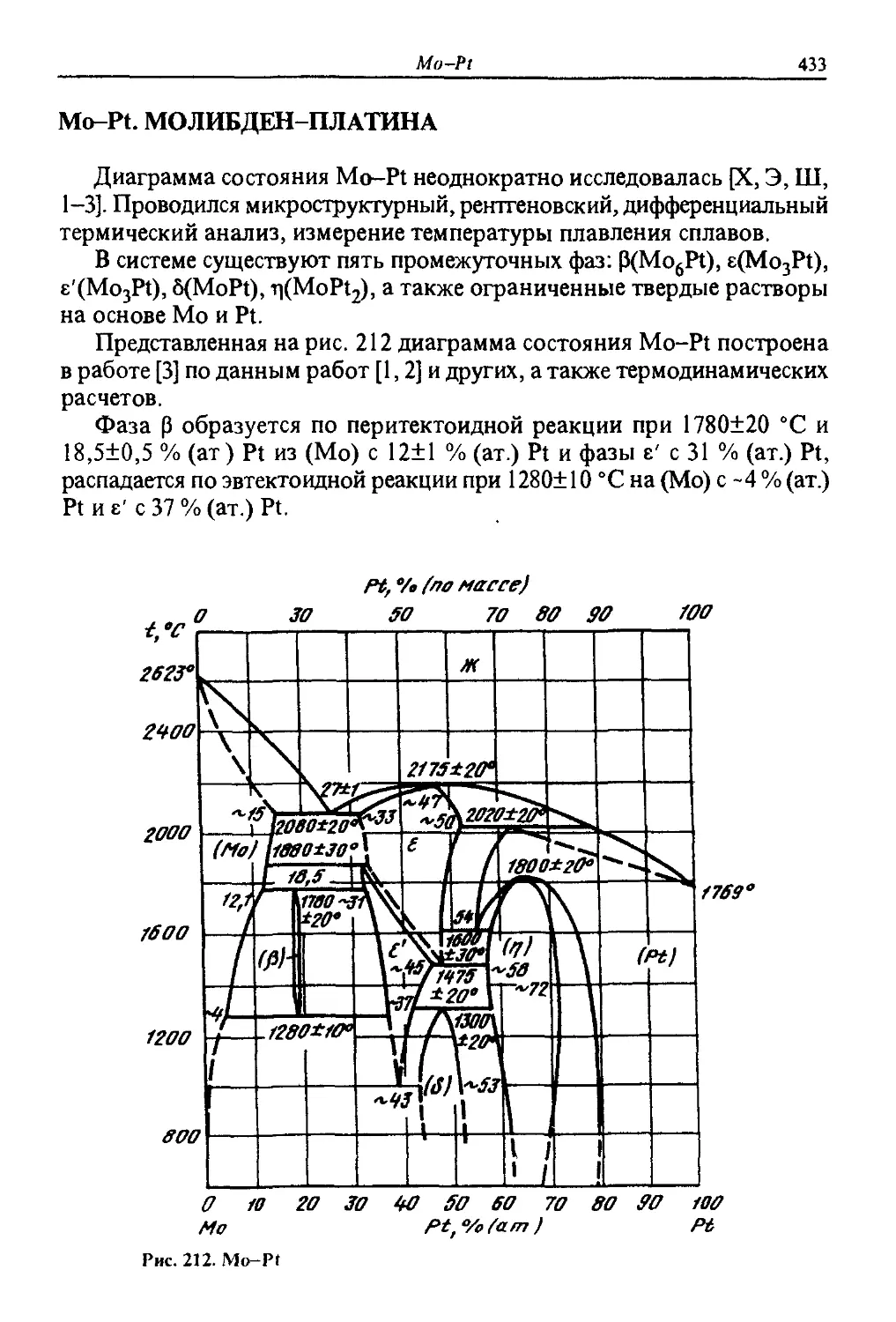
-64;
66,66;
66,66;
фазах,
25
25
25
25
-33,33
62-65
-
-62-63
66,66
75
-100
Темпера-
Температура, °С
742
702
310
816
955
1086
1073
905
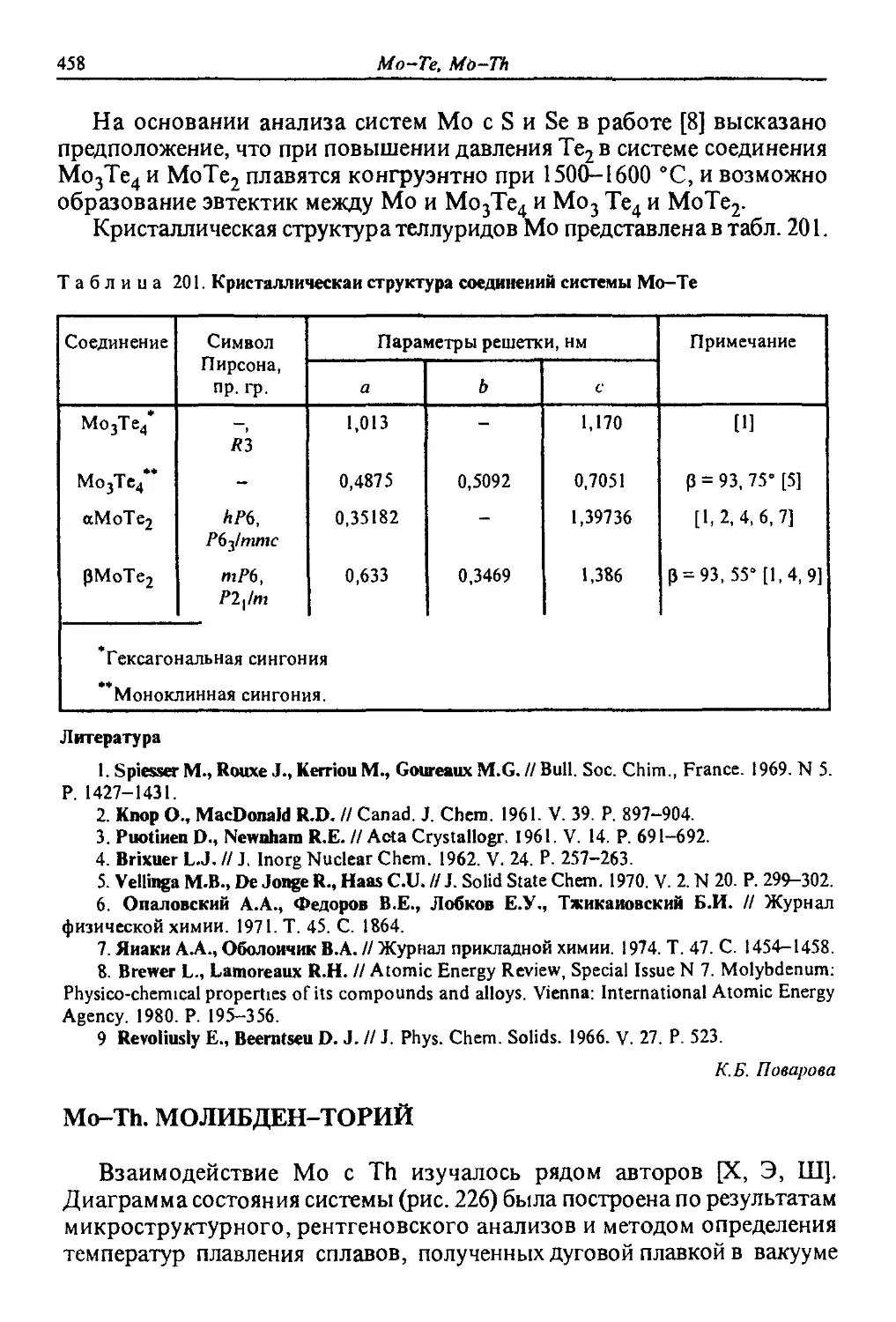
1153
1120
155
Таблица 4. Кристаллическая структура соединений системы In—La [V-C, 2]
Соединение
La3ln
La2ln
Lain
La3ln5
Прототип
AuCu3
In№2
CsCl
Pd5Pu3
Символ
Пирсона,
пр. гр.
сР4,
Рпвт
hPb,
РЬъ1ттс
сР2,
РтЪт
оС32,
Стст
Параметры решетки, нм
а
0,50854
0,5636
0,3985
1,0313
*
-
—
—
0,8350
с
-
0,7065
—
1,0550
In—La, In—Li
13
Соединение
Laln2
Laln3
Прототип
Hg2K
AuCu3
Символ
Пирсона,
пр. гр.
Imma
сР4,
РтЗт
Параметры решетки, нм
а
0,4759
0,47321
b
0,7695
-
с
0,9092
-
Литература
1. McMasters O.D., Gschneidner, Jr., K.A. // J. Less-Common Met. 1974. V. 38.
N 2-3. P. 137-148.
2. Е.И. Гладышевский, О.И. Бодаю Кристаллохимия интерметаллических соедине-
соединений редкоземельных металлов. Львов. Вища школа. 1982. 255 с.
А.С. Адамова
In—Li. ИНДИЙ—ЛИТИЙ
Сплавы In с Li получены в инертной среде в стальных тиглях из
In чистотой 99,99—99,999 % (по массе) и Li чистотой 99,9—99,99 %
(по массе).
Диаграмма состояния In—Li (рис. 3) построена в работе [1] на
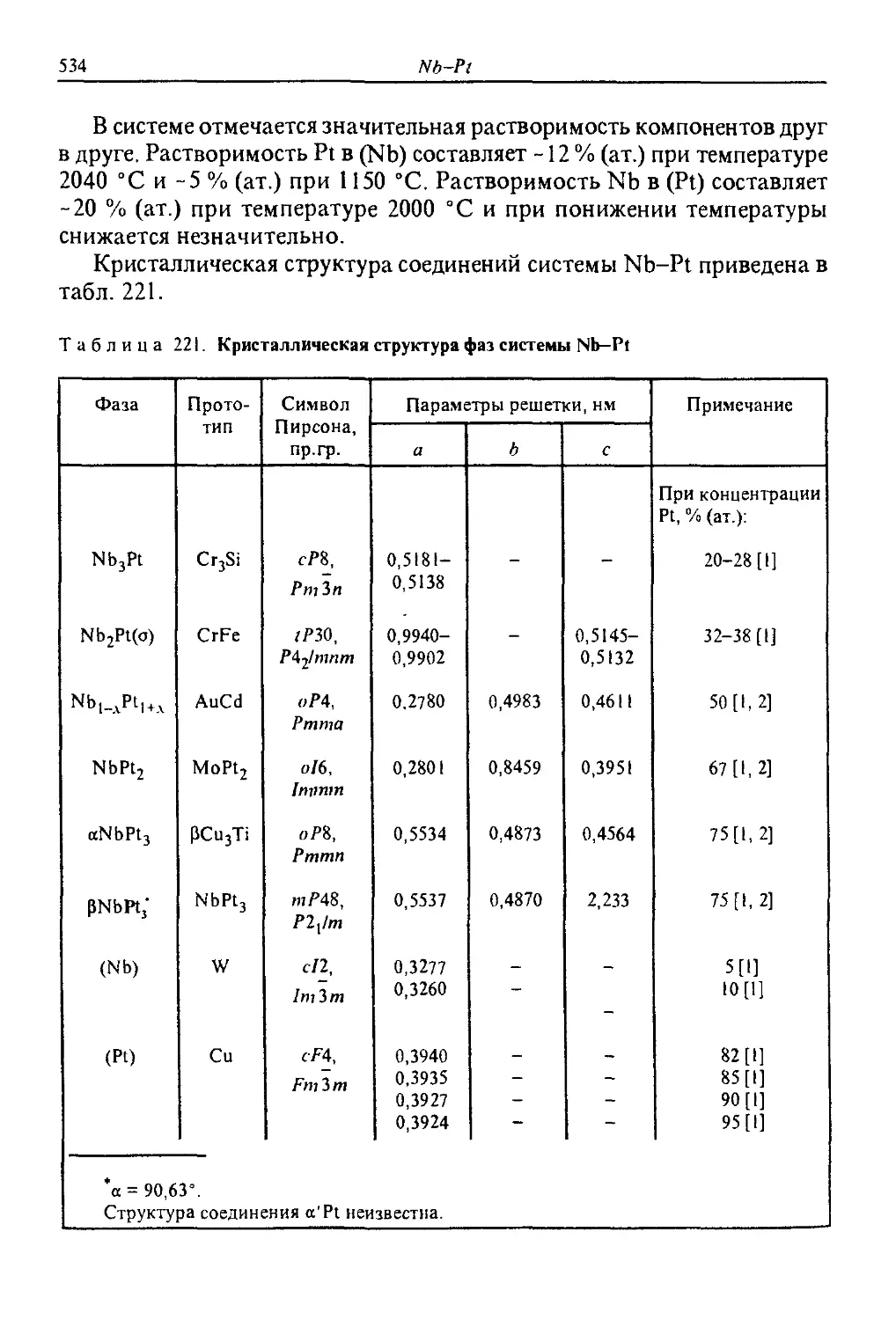
основании результатов термического, рентгеновского анализов.
Li, % (па пассе)
О S 10 20 30 50 100
I8O,S°
0 W ZO 30 90 50 SO 70 вО 90 WO
In Li,%(am.) Li
Л. Tn-!.J
14
В системе образуются несколько соединений. Соединение Inli
плавится конгруэнтно при 632 ± 5 °С, соединение In3lii3 образуется
по перитектической реакции при 400 ± 10 °С, соединения 1п41л5,
In2li3, InLi2, Inli3 образуются в твердом состоянии в результате
превращений Inli. Область гомогенности Inli при 470 °С составляет
46—72 % (ат.) Ii, при 20 "С 49—51 % (ат.) Ii. Кристаллическая
структура соединений приведена в табл. 5. Структура соединения
неизвестна. Со стороны In существует перитектика при 159 ± 7 °С,
со стороны Ii — эвтектика при температуре 179 °С и концентрации
99,8 % (ат.) Ii. Максимальная растворимость Ii в In составляет
1,5 % (ат.). Нет данных о растворимости In в жидком Ii.
Таблица
Соединение
Inli
In«Iis
Inli-
InjUB
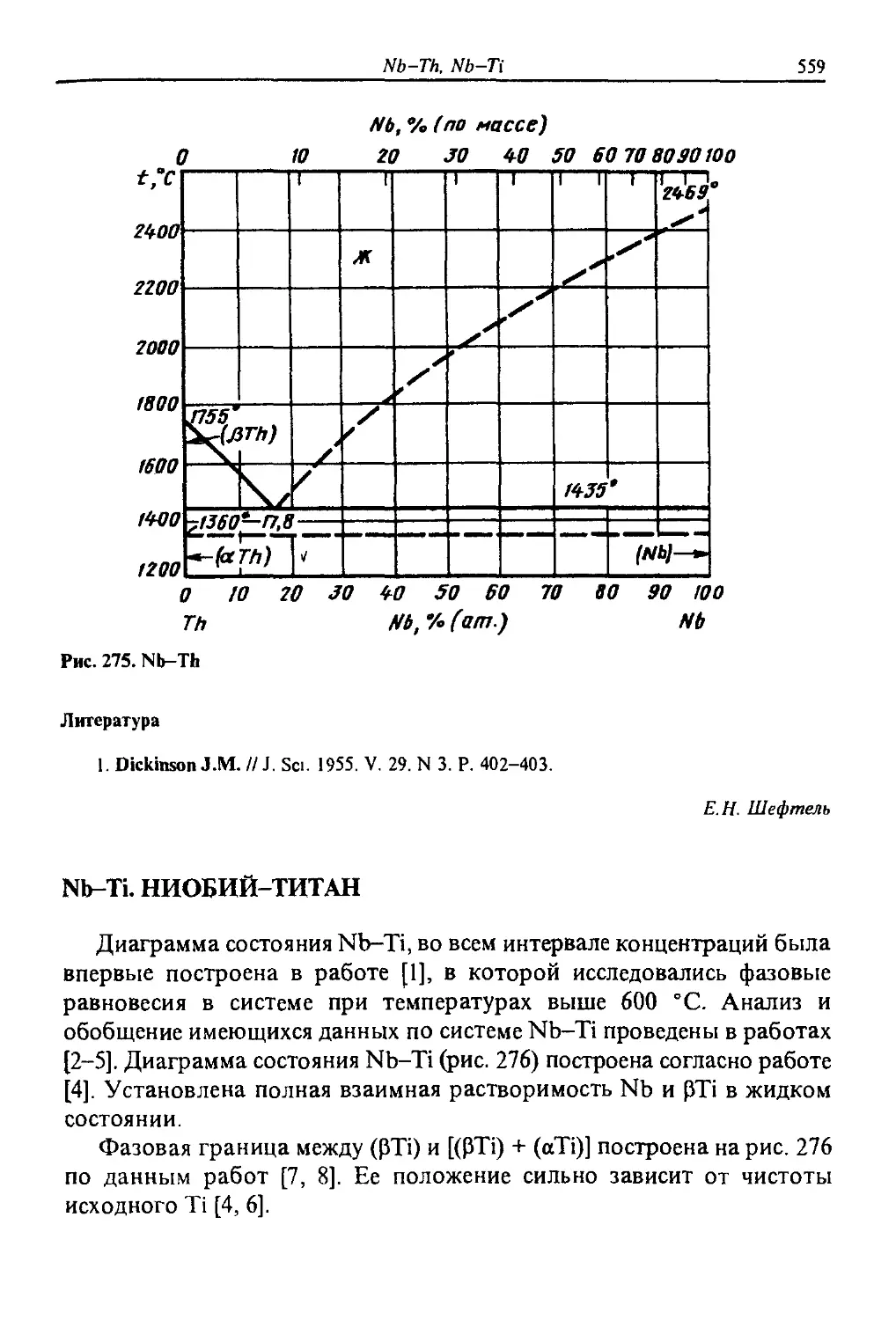
5. Кристаллическая структура соединений системы In—Li
Прототип
№Л1
La4lis
BijTe,
ЬаЬЦ
IrijLiu
Символ
Пирсона,
пр. гр.
сЛ6,
F<Bm
hP9,
PSm\
HR5.
Ют
оСП,
Стоп
CF12S,
Fd3m
Параметры решетки, нм
а
0.67862*
0,67890
0,67926**
0,67666***
0,478
0,4748
0,4763
1.3556
*При концентрации 47,26 % (ат.) Li, после
**При концентрации 48,1 % (ат.) Ы при 25
***При концентрации 55,1 % (ат.) Li, после
Ь
-
_
—
-
—
1.0017
—
с
-
—
0,888
1,4740
0,4735
—
отжига при 480 'С.
•с.
отжига при 190 'С.
Источник
[2]
[2]
[2]
[2]
[3]
[4]
[5]
[5]
Литература
1. Sangster J., Репоп A.D. // J. Phase Equilibria. 1991. V. 12. N. I. P. 37-41.
2. Alexander WJL, Catvent LJX, Gamble R.H., Schinkel K. // Can. J. Chem. 1976.
V. 54. N 7. P. 1052-1060.
3. SiOhr J., MOUer W, Schafer H. // Ada CrystaUogr. A. 1981. V. 37. P. 185.
4. Stthr J, SchaTer H. // Z. Naturforsch. B. 1979. Bd. 34. N 5. S. 653-656.
5. StfihrJ., MuUerW^ Schafer H. // Z. Naturforsch. B. 1978. Bd. 33. N12.
S. 1434—1437.
A.C. Адамова
/И-itt
IS
In-Lu. ИНДИЙ—ЛЮТЕЦИЙ
Диаграмма состояния In—Lu (рис. 4) построена в работе [1] и
скорректирована в области сплавов, богатых La с учетом представле-
представлений о Lu как о мономорфном металле [2].
Сплавы изготовляли длительным D00 ч) отжигом шихты, состоя-
состоящей из навесок чистых металлов, в герметично заваренных тиглях
из Та. При исследовании использовали Lu чистотой 99,9 % (по
массе) и In чистотой 99,999 % (по массе).
Исследование выполняли методами микроскопического, рентгено-
структурного и дифференциального термического анализов.
Соединения In3Lu, In5Lu3 и 1пЛл5 образуются с открытым макси-
максимумом при температурах 960, 950 и 1290 "С соответственно, InLu2
и InLu — при 1190 и 1080 °С по перитектическим реакциям. Все
двойные соединения, кроме In3Lu5 обладают узкими областями
гомогенности, отвечающими идеальной стехиометрии. Область сущес-
существования фазы In3Lu5 при понижении температуры от точки плавле-
плавления сначала увеличивается (максимум отвечает температуре
1080 °С), а затем уменьшается и при температуре ниже 800 "С она
становится практически постоянной (около 37 — 40 % (ат.) In).
Кристаллическая структура соединений системы [V-C, 3] приведена
в табл. 6. Структура соединений InLu и In5Lu3 не установлена.
Таблица
Соединение
InLu2
In3Lu5
IrijLu
6. Кристаллическая структура соединений системы In—Lu
Прототип
In№2
Si3Mn5
AuCu3
Символ
Пирсона,
пр. гр.
hP4,
Pbjlmmc
API 6,
Pd-Jmcm
cP4,
РтЪт
Параметры решетки, нм
а
0,5239
0,8800
0,4544
Ь
—
—
—
с
0,6569
0,6486
—
Растворимость In в Lu при температуре 1020 "С составляет -9 %
(ат.) и резко падает с понижением температуры, становясь практи-
практически незаметной при температуре около 800 "С. Растворимость Lu
в In исчезающе мала.
Литература
1. Yatsenko S.P., Semyannikov A.A., Shafcarov И.О., Fedorova E.G. // J. Less-
Common Met. 1983. V. 90. N 1. P. 95-108.
2. Gschneidner, Jr., K.A., Caldenvood F.W. // Handbook on te Physics and Chemis-
Chemistry of Rare Earths. Amsterdam. New York. Oxford. Tokyo: North-Holland Physics Publi-
Publishing Co., 1986. V. 8. Chap. 54. P. 1—161.
3 Е.И. Гладышевский, О.И. Бодак. Кристаллохимия интерметалли>сасих соенине-
ний редкоземельных металлов. Львов: Вища школа. 1982. 255 с.
Е.И. Гладышевский. О.И. Иодак. В.К. Печорский, А.С. Адамова
16
In—Lu
t,°c
reej°
1600
1500
noo
uoo
noo
1100
1000
900
800
700
600
500
400
300
200
100
Рис. 4.
0
\\
\
(Lu)
/
I
i
\
i
In, % (no массе)
20 40 BO 80 100
I
\/
\ 1/
1170°
1020°
0 10 20 J6
Lu
In—Lu
11
1290'
¦I
<
X
-Д/ЛЯ/7
/
/
/
1
ж
\
f\
\
920° ¦
90 50 6L
\
950°
is
1
i
96
' 70
0°
i
4
156°
\
\
\
1
80 90 WL
In
1
In—Mg
17
In-Mg. ИНДИЙ-МАГНИЙ
Диаграмма состояния In—Mg приведена на рис. 5. При кристал-
кристаллизации в системе имеет место образование фаз р и (In) по перитек-
тическим реакциям:
Ж + (Mg) - р при температуре 484 "С и концентрации -25 %
(ат.) In в жидкости;
Ж + р » (In) при температуре 160,2 "С и концентрации -97 %
(ат.) In в жидкости.
При охлаждении фаза р претерпевает упорядочение с образовани-
образованием фаз Р' и Р". Фаза Р' образуется при температуре 356 "С [1]
C55 °С [2]) и концентрации 29 % (ат.) In, а фаза Р" при темпера-
температуре 338 °С и концентрации 46 % (ат.) In [1] D7 % (ат.) In [2]).
Кроме указанных фаз, в системе образуется еще четыре фазы: р.,
Р2> Рз и Y'.
Фаза у' образуется при 114 °С по перитектоидной реакции Р" +
+ Р -Y' [3].
Фаза р2 образуется с открытым максимумом при температуре
298 "С, фазы Р] и р3 — по перитектоидным реакциям:
Р + Р' •» Pi (температура не установлена) ир' + р2»»р3 (при
210 °С). Характер этих превращений указан на диаграмме с учетом
данных работы [4], в которой диаграмма исследовалась при концен-
концентрациях In от 100 до 70 % (ат.), и по данным работ [1, 2], в кото-
которых исследовались сплавы при концентрации In менее 70 % (ат.).
1л,'А (по косее)
„ от го зо w so во уо so so too
t°c
600
500
100
300
200
100
Мд
Рис. 5. In-Mg
1 1 1
\
<*,
/
/
i
>
2!
t
JSl" fl
I 1
A
Я
331°
\
\
\
T
го зо
to so so 70 ее so too
1л, a/i>(ajn.) In
18
In-Mg
Согласно работе [1] при 327 °С и 25 % (ат.) In осуществляется
эвтектоидное превращение Р * (Mg) + рг При температуре 308 "С
происходит эвтектоидное превращение Р « Р' + Р". В фазе Р' содер-
содержится 36 % (ат.) In, в фазе Р" — 40 % (ат.) In. Твердый раствор на
основе фазы р' распадается с понижением температуры по эвтекто-
идным реакциям: Р' « Р2(+ Р" при 276 °С и р' « pt + р, при 200 °С.
Состав фазы Pj соответствует формуле Mg3ln; фазы р3 — Mg5ln2;
Р2 — Mg2ln, что согласуется с данными работы [5]. Имеются также
сведения об образовании в системе фазы Mg,In5 [5], которая ранее
обозначалась как фаза Mgln, (или Mgln3). Образование фазы Mg2ln5
противоречит результатам более поздней работы [3].
Кристаллическая структура соединений приведена в табл. 7.
Максимальная растворимость Mg в твердом (In) составляет -2 %
(ат.) [Ш]. Растворимость In в твердом (Mg) при температуре 484 "С
равна 19,4 % (ат.), при температуре 327 °С — 18,7 % (ат.), при
температуре 200 °С — 13,9 % (ат.).
Т а б л и ц а 7. Кристаллическая структура соединений системы In—Mg
Соспинрнир
Р'
Р"
Y'
pi
P3(Mg5In2)>>
р*"
Прототип
Cu3Au
CuAu
Cu3Au
-
—
-
-
Символ
Пирсона,
пр. гр.
сР4,
РтЗт
tPl,
Р4/ттт
сР4,
РтЗт
-
—
-
-
Параметры решетки, нм
а
—
0,4610-
0,4633
0,6348
0,827
1,425
-
Ь
—
-
—
0,737
-
'Гексагональная сингония; параметры решетки указань
24.4JX, (ат.) In.
"Ромбическая сингония.
Неупорядоченная
Г1ДК структура.
с
—
3,117
0,342
0,618
-
Источник
[2,5]
[2.5]
[31
[4]
[Ш]
[4]
[4]
г при концентрации
Литература
1. Feschotte P. // J. Less-Common Met. 1976. V. 46. N 1. P. 51-54.
2. Pikwick K.M., Alexander W.A., Gamble R.H. // Can. J. Chem. 1969. V. 47 N 18.
P. 3417-3427.
3. Hiraga K., Koiwa M., Hirabayashi M. // J. Less-Common Met. 1968. V. 15. N 2.
P. 109-119.
4. Watanabe Yousuke // Acta Metall. 1975. V. 23. N 6. P. 691-696.
5. Schubert K., Gauzzi F., Frank K. // Z. Metallkunde. 1963. Bd. 54. N 7.
S. 422-429.
Л.Л. Рохлин
In-Mn
19
In-Mn. ИНДИЙ-МАРГАНЕЦ
Диаграмма состояния In—Mn изучена методами термического [1,
2], металлографического [2], рентгенографического [2] и магнитного
анализов [1]. В основу построения диаграммы состояния In—Mn
(рис.6) [3] положены данные работы [1].
О
t,°c
/200
WOO
600
600
400
200
/S6,6Jt°
20
Mn, % (по пассе)
60
во юо
1
1
-~—"
1
ж
*-—
1
370°
i
6
1 I
1
//7?°
At»")
\(pHn)
\
(ОС
\
-tfMn)
me°
1100°
727°
70
20 JO
In
Рис. 6. In—Mn
SO 60
Mn,%(am.)
70 80
SO 100
tfn
Установлено образование соединения InMn3 по перитектической
реакции при 910 "С, а также нонвариантные реакции, связанные с
полиморфным превращением Мп.
Растворимость In в фМп) составляет -14 % (ат.) при темпера-
температуре 800 °С [2]. Соединение InMn3 имеет магнитное превращение
Таблица 8. Нонвариантные
Реакция
Ж + (вМп) - (уМп)
(уМп) - Ж+ (PMn)
Ж + @Мп) - InMrij
(PMn) - (аМп) + 1пМп3
Ж в (In) + InMnj
реакции в системе
Содержание
зах, %
-95; -98;
-88; -72;
ln-Mn
Mn в фа-
(ат.)
-96,5
-92
-52; -87,5; 75
-79
-90; -97;
-100; -100
75
75
Темпера-
Температура, "С
1172
1020
910
635
156,6
Источ-
Источник
[2]
[1)
[1]
[2]
11]
13]
20 In-Mn, In-Mo
в области температур от —173 до 130 °С [3]. Нонвариантные реакции
приведены в табл. 8.
Соединение InMn3 имеет структуру типа Cu5Zn8 (символ Пирсона
сР52, пр. гр. Р43т), параметр решетки а = 0,9420 нм [4] или а =
= 0,9435 нм [2].
В работе [5] указывается на образование метастабильных фаз в
области (бМп) при концентрациях 86 и 88 % (ат.) Мп в результате
резкой закалки со скоростью 107 — 108 °С/с. Фаза с 86 % (ат.) Мп
имеет структуру типа W (символ Пирсона с/2, пр. гр. Imbm), пара-
параметр решетки а = 0,3015 нм.
Литература
1. Корр W.U., Romer О., Wachtel Е. // Z. Metallkunde. 1968. Bd. 59. S. 917-923.
2. Zwicker U. // Z. Metallkunde. 1950. Bd. 41. S. 399-401.
3. Okamoto H. // Bull. Alloy Phase Diagrams. 1990. V. 11. N 3. P. 303-306.
4. Brandon J.K., Kim H.S., Pearson W.B. // Acta Crystallogr. 1979. V. 35. N 9.
P. 1937-1944.
5. Гудзенко В.Н., Полеся А.Ф. // Изв. АН СССР. Металлы. 1975. Т. 5.
С. 192-195.
А.С- Адамова
In—Мо. ИНДИЙ—МОЛИБДЕН
Диаграмма состояния In—Мо не построена. По данным работы [1],
сплав Мо с содержанием 0,03—0,02 % (ат.) In, приготовленный
спеканием в водороде при температуре 2Q40 "С, имел однофазное
строение после прокатки спеченных штабиков при 1250 °С и отжига
при 1100 "С в течение 0,5 ч. В работах [2, 3] изучена растворимость
Мо в жидком In при температурах 327—967 °С. В работе [4] расчет-
расчетным путем с использованием экспериментальных данных [1—3] и
термодинамических характеристик системы определены следующие
значения растворимости Мо в расплаве In, находящегося в равнове-
равновесии с газовой фазой при давлении 0,1 МПа:
Температура, "С 157 727 2093
Растворимость Мо, % (ат.) Ю~7 0,036 14,0
Литература
1. Bruckhart W.L., La Chance M.H., Craighead СМ., Jaffer R.I. // Trans. ASM.
1953. V. 45. P. 286-313.
2. Диева Е.Н. // Тр. ин-та химии. Уральский научный центр АН СССР. 1974.
Т. 29. С. 105-110.
3. Яценко СП., Диева Е.Н. // Журнал физической химии. 1973. Т. 47. С. 2948.
4. Brewer L., Lamoreaux R.H. // Atomic Energy Rewiew. Special Issue N 7. Molybde-
Molybdenum: Physico-Chemical Properties of its Compounds and Alloys. Vienna: International
Atomic Energy Agency. 1980. P. 261—262.
K.lj. Ппоарооа
In-N, In~Na
21
In-N. ИНДИЙ-АЗОТ
Диаграмма состояния In—N не построена.
В справочниках [X, Ш] сообщается, что установлено образование
соединения InN со структурой вюрцита, а = 0,353, с = 0,570 нм
(символ Пирсона hP4, пр. гр. Рб^тс).
В.Н. Кузнецов
In-Na. ИНДИЙ-НАТРИЙ
Сплавы In с Na получены в стеклянных ампулах, заполненных
Аг, из In чистотой 99,99 % (по массе) и Na, рафинированного от
примесей дистилляцией в высоком вакууме [1] или Na чистотой
99,99 % (по массе).
Диаграмма состояния In—Na (рис. 7) построена на основании
данных термического и рентгеновского анализов, измерения плотнос-
плотности и магнитной восприимчивости сплавов, а также термодинамичес-
термодинамических данных [1, 2, 3].
In с Na образуют соединения: In8Na5, плавящееся конгруэнтно
при 441 ± 2 "С, InNa, образующееся по перитектической реакции
при 345 ± 4 °С, и InNa3, существующее в интервале температур
286—160 °С. Кристаллическая структура определена у InNa: прототип
NaTl, символ Пирсона еР16, пр. гр. Fdbm, a - 0,731 нм [4].
Растворимость In в Na при эвтектической температуре 96 °С
составляет 0,4 % (ат.), при температуре 110 "С — 0,5—0,6 % (ат.)
[5,6].
Нонвариантные реакции в системе приведены в табл. 9 по данным
работы [3].
Та
Ж
Ж
Ж
блица 9- Нонвариантные
Реакция
+ In8Na5* « (In)
+ IngNa3 <• InNa
+ InNa - In N83"
InNa3 - InNa + Ж
Ж
» InNa + (PNa)
реакции в системе
In-ЧЧа
Содержание Na
зах, % (ат
2,5;
60;
78.;
75;
99,6;
38,5;
38,5;
50;
50;
50;
'Формула соединения IngNa5 точно не установлена, может
геновский анализ дает формулу IngNa3.
"Формула соединения точно не установлена.
в фа-
)
3,2
50
75
98
100
быть и
Температу-
Температура, °С
160±5
345±4
286
160
96±0,5
In3Na2. Рент-
22
In-Na, In—Nb
t°c
«00
300
200
15S,B3f°
100
0
In
Рис. 7. In—Na
Литература
Na, °/o (по массе)
10 20 30 W 50607030/00
J
2,5/
У
T
/
160±5°
in)
\
M1
1
±2°
%
lot
Ж
,60
9°~
I l
rg
^4
f1 j 160°
г
96±0,S°
(fWa)
i i i
\
\
99,6
97,86°
10
20 3D
40 50 60
Na,'/.(am.)
70 80 90
WO
Na
1. Thummel R., Klemm W. // Z. Anorg. All. Chem. 1970. Bd. 376. N 1. S. 44-63.
2. Яценко СП., Мелехов Л.З. // Изв. АН СССР. Металлы. 1980. № 5. С. 233-
236.
3. Larose S., Pelton A.D. // J. Phase Equilibria. 1991. V. 12. N 3. P. 371-376.
4. Zintl E., Neumayr S. // Z. Phys. Chem. 1933. Bd. 20. S. 272—275.
5. Davies H.A. // Trans. AIME. 1967. V. 239. P. 928-929.
6. Lamprecht G.J., Crowther P. // J. Inorg. Nucl. Chem. 1969. V. 31. P. 925—931.
A.C. Адамова
In—Nb. ИНДИЙ—НИОБИЙ
Систему исследовали методом дифференциального термического,
рентгеновского и металлографического анализов. При исследовании
использовали порошковые In чистотой 99,999 % (по массе) и Nb
чистотой 99,89 % (по массе). На диаграмме (рис. 8) присутствуют
два инконгруэнтно плавящихся соединения: фаза е (при 1007 °С) и
NbJn (при 475 °С). При температуре 390 "С фаза е, содержащая
90 /0 (ат.) Nb, распадается по эвтектоидной реакции на (Nb) и
Nb3ln. Эвтектическая реакция Ж » (In) + Nb3ln при температуре
In-Nb
23
20
Nb, °/o (no массе)
ЬО BO
80
100
г'too
2200
2000
1800
tsoo
IWO
1200
1000
800
BOO
400
200
156,63 Ь°
/-
/
У
¦1Ь2°
—Aл)
I
/
Ж
/
Ь75
I
/
1001
1
/
f
•
/
(
у
/
1
1
In 1
Г
1
г
391
1_
V6)
Т
>
0
In
10
20
JO
ЬО SO
Nb. °/o
SO
(am.)
70
80
SO
100
/V6
Рис. 8. In—Nb
142 °C вырождена. Область гомогенности Nb3ln заключена между 75
и 85 % (ат.) Nb при температуре 20 °С. Взаимная растворимость In
и Nb в твердом состоянии незначительна.
Соединение Nb3ln имеет кубическую структуру типа p\V (символ
Пирсона с/2, пр. гр. /m3m), параметр решетки а = 0,5293 нм при
концентрации 75 % (ат.) Nb и а = 0,5288 нм при концентрации
85 % (ат.) Nb [Ш].
Литература
1. Villars P., Girgis К. // Z. Metallkunde. 1982. Bd. 73. N 3. S. 169-171.
Е.Н. Шефтель
24
In-Nd
In-Nd. ИНДИЙ-НЕОДИМ
Диаграмма состояния In—Nd построена в работе {1] и приведена
на рис. 9.
Сплавы изготовляли длительным D00 ч) отжигом шихты, состоя-
состоящей из навесок чистых металлов, Nd чистотой 99,9 % (по массе) и
In чистотой 99,999 % (по массе) в герметично заваренных тиглях из
Та.
Исследование выполняли методами дифференциального термичес-
термического, микроскопического и рентгеноструктурного анализов.
Соединения In3Nd, In5NcU и InNd образуются с открытым макси-
максимумом при 1220, 1190 и 1230 °С соответственно. Соединения InNd2
In, % (по пассе)
t°c
1300
1200
1100
1021°
1000
900
563°
800
700
600
500
400
300
200
100
1
-ifiNd)-
ч
\_\
/
/
S930°
/ 880'
по°
*— (aNd)
20
1070°
А
/
¦>
f
/
1
i
Ж
12
7
{
\
\
\
10°
V
1130°
60
1
10°
1220°
1150°
во
1
\
\
too
1
\
\
\
~156°
(In) -»
1
156,63V
0 10 20 30 40 SO 60
Nd In,%hm.)
70
30 90 100
In
Рис. 9. In—Nd
In-Ш
25
и InNd3 образуются по перитектическим реакциям при 1070 и
930 °С. Растворимость Nd в In практически отсутствует. Высокотем-
Высокотемпературная модификация (PNd) растворяет до 12 % (ат.) In при
эвтектической температуре 880 °С. Этот твердый раствор затем
эвтектоидно распадается при температуре 740 "С и концентрации
10 % (ат.) In на (aNd) и соединение InNd3; растворимость In в
(aNd) при этом составляет 5 % (ат.). При температуре 500 °С рас-
растворимость In в (aNd) практически отсутствует. Все двойные соеди-
соединения, кроме InNd обладают узкими областями гомогенности, отве-
отвечающими идеальной стехиометрии. Область гомогенности фазы InNd
при понижении температуры\от точки плавления сначала увеличива-
увеличивается (максимум отвечает температуре 1070 °С), а затем сокращается,
и при температуре ниже 800 °С становится практически постоянной
в интервале концентраций 47—50 % (ат.) In.,
Нонвариантные реакции в системе приведены в табл. 10 по дан-
данным работы [1]. Кристаллическая структура соединений дана в
табл. 11.
Та
Ж
блица
- (PNd)
10. Нонвариантные
Реакция
*• InNd3
(PNd) - (aNd) + InNd,
Ж
Ж
Ж
ж
ж
+ InNd2 .
+ InNd -
» InNd +
» In5Nd3
» In3Nd -t
InNd3
InNd2
In5Nd3
+ In3Nd
- (In)
реакции в системе In—Nd
Содержание Nd в фа-
фазах, % (ат.)
15;
Ю;
-21;
-32;
55;
65;
-100;
12;
5; :
-33,33;
42,5;
50;
-62;
75;
25
25 .
25
-33,33
-62
75
-100
Температу-
' ра, °С
880
740
930
1070
ИЗО
1150
-156
Таблица
[V-C, 2]
Соединение
InNdj
InNd2
In5Nd3
In3Nd
11. Кристаллическая структура соединений системы In-^d
Прототип
AuCu3
InNij
Pd5Pu3
AuCu
Символ
Пирсона,
пр. гр.
сЯ4,
' РтЪт
hP6,
Р6г/тгпс
осъг,
Стст
СР4,
РтЪт
Параметры решетки, нм
а .
0,49296
0,5505
1,008
0,46530
Ь
—
—
0,8155
—
с
—
0,6868
1,044
—
26
Jn-Nd, Jn-Ni
Литература
1. Yatsenko S.P., Semyannikov A.A., Shakarov H.O., Fedorova E.G. // J. Less-
Common Met. 1983. V. 90. N 1. P. 95—108.
/ 2. Е.И. Гладышевский, О.И. Бодаю Кристаллохимия интерметаллических соедине-
соединений редкоземельных металлов. Львов: Вища школа. 1982. 255 с.
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
In-Ni. ИНДИЙ-НИКЕЛЬ
На рис. 10 представлена диаграмма состояния In—Ni, построенная
в основном по результатам работы [1] и дополненная данными работ
[2, 3]. Граница твердого раствора In в Ni проведена по данным
работы [X].
В системе In—Ni установлено существование восьми промежуточ-
промежуточных фаз: Ni3ln, Ni2ln, e, e' (Ni13ln9), Niln, р, Nbln3 и Ni3ln7, из
которых только фазы р, е, е' обладают заметной областью гомоген-
гомогенности. Согласно работе [1], при температуре 900 °С фаза е гомогенна
t°c
0 10 20 30 U0
In, °/o (no массе)
50 ВО 70 80
100
л
\
~1к
ч
,\
t
\910°X6JL'
/
(
I
Г
с
66S
i
1
918°te?
f
,-V
Т7.0
С;
Ц860*
/
' С
у
5,
ж
i
950°
Л/
V
56
770°
1
\
\
\
\
\
~156°
(Ш)
1200
WOO
800
В00
400
200
О 10 20 30 40 50 SO 70 80 90 100
Ni In, °/c (am.) In
Рис. 10. In-Ni
In-Ni
27
в области концентраций 31—42 % (ат.) In, фаза Р — в области кон-
концентраций 52—57 % (ат.) In. Соединения Ni3ln, Ni2ln, e'(Ni13In9),
Niln образуются по перитектоидным реакциям при температурах 842,
665, 876 и 860 °С соответственно. Фазы ей р плавятся конгруэнтно
соответственно при -970 и 950 °С, а при температурах 482 и 770 "С
эвтектоидно распадаются на смеси фаз №21п + е' и Niln + Ni2ln3.
Сплавы с -14,6—31 % (ат.) In и 42—51 % (ат.) In кристаллизуются
с образованием эвтектик (Ni) + е и р + е. Эвтектика между твердым
раствором на основе Ni и фазой е кристаллизуется при температуре
910 °С [1, 2] и содержании 26,5 % (ат.) In [3], между фазами е и
Р - при 876 "С [1,3] и 46,6 % (ат.) In [3].
По данным работ [2, 4, 5], в системе In—Ni отсутствует соедине-
соединение №21п. По данным работы [4], фаза е при температуре -540 °С
распадается по эвтектоидной реакции е » №31п + е', а фаза е' при
температуре -425 °С претерпевает эвтектоидное превращение: е' <*
*» №3In + Niln. Эти данные не были приняты во внимание при по-
построении диаграммы на рис. 10.
Растворимость In в твердом Ni с понижением температуры замет-
заметно уменьшается, значения растворимости In в (Ni) при различных
температурах приведены ниже.
Температура, °С 908 883 830 740 630 600 400
Растворимость In, % (по массе) .. 21,05 24,75 14,53 9,33 4,96 9,33 1,55
Источник [1] [X] [X] [X] [X] [1] [X]
Кристаллическая структура соединений приведена в табл. 12.
Таблица
Соединение
Ni3ln
e(Ni2In)
e'(Nil3In9)
N'iln
•та
12. Кристаллическая
Прототип
Ni3Sn
Ni2ln
NiCGa9
CoSn
CsCl
Символ
Пирсона,
пр. гр.
Ш,
Р63/ттс
ЛР6,
Р6ъ/ттс
hP6,
РЫттт
сР2,
Ртгт
структура соединений
системы In—Ni
Параметры решетки, нм
а
0,553
0,4179
0,4186
0,420
0,732*
0,737"
1,4646*"
0,454
0,520
0,521
0,309
b
—
0,417*
0,420"
0,8329*"
-
—
с
0,425
0,5131
0,5163
0,508
0,527*
0,522"
0,8977*"
0,434
0,434
0,435
—
Источник
[2]
[X]
[X]
[4]
[4]
[4]
[7]
[2]
[5]
[X]
[2]
28
In-Ni, In-0
Соединение
Ni2ln3
Ni3ln7
*B - 90,8
В - 90°
В = 35
Прототип
Ni2Al3
Cu5Zng
Символ
Пирсона,
пр. гр.
hP5,
P3ml
с/52,
/43m
Параметры решетки, нм
а
0,439
0,439
0,918
-
с
0,520
0,529
°, при концентрации 36,2 % (ат.) In.
при концентрации 41,1 % (ат.) In.
35°, при концентрации 42 % <ат.) In.
Источник
[2]
[5]
[2]
Литература
1. Best K.J., GOdecke Т. // Z. Metallkunde. 1969. Bd. 60. N 8. S. 659-661.
2. Hellner E. // Z. Metallkunde. 1950. Bd. 41. S. 401-406.
3. Levingston J.D. // Met. Trans. 1972. V.3. N 12. P. 3173-3176.
4. Винокурова Г.А., Гейдерих В.А., Герасимов Я.И. // Доклады АН СССР. 1973.
Т. 211. № 3. С. 620-623.
5. Баранова Р.В. // Кристаллография. 1965. Т. 10. С. 32—36, 614-621.
6. Pearson W.B., Thompson L.T. // Canad. J. Phys. 1957. V. 35. N 4. P. 349-357.
7. Ellner M., Bhan S., Schubert K. // J. Less-Common Met. 1969. V. 19. P. 245-
252.
H.P. Абрукина
In-O. ИНДИЙ—КИСЛОРОД
При взаимодействии In с О установлено образование соединений
In2O, InO и 1п2О3 с содержанием О — 6,52, 12,24 и 17,3 % (по
массе).
Соединение 1п2О3 является наиболее устойчивым оксидом и имеет
две модификации с ОЦК и ромбоэдрической структурой. 1п2О3 с
ромбоэдрической структурой типа корунда получен гидротермичес-
гидротермическим методом и, по-видимому, является метастабильной формой,
образующейся при высоких давлениях [1] (параметры решетки в
гексагональной сингонии: а = 0,549 нм, с = 1,452 нм, символ Пирсона
W10, пр. гр. R3c [3]). Кубическая модификация 1п2О3изоструктур-
на Мп2О3 (символ Пирсона с/80, пр. гр. /аЗ) а = 1,012 нм [3]. В
работе [2] показано увеличение параметра решетки ОЦК-модифика-
ции 1п2О3 от 1,0119 нм при 30 °С до 1,0199 нм при 968 "С.
Литература
1. Литвин Б.Н., Иванова Л.И. // Кристаллография. 1969. Т. 14. С. 1122.
2. Kunda K.D., АН S.Z. // J. Appl. Crystallogr. 1970. V. 3. P. 543.
3. Вол А.Е., Каган И.К. Строение и свойства двойных металлических систем. М.:
Наука, 1976. Т. 3. 815 с.
СП. Алисова
In-Os, In-P 29
In-Os. ИНДИЙ-ОСМИЙ
Диаграмма состояния In—Os не изучена. In и Os не взаимодей-
взаимодействуют в жидком состоянии. Прогнозирование фаз с использованием
ЭВМ, основывающееся на электронном строении свободных атомов
элементов, позволило предположить образование соединений: In3Os,
In2Os, InOs, InOs2 (вероятно, со структурой фаз Лавеса) [1].
Литература
1. Вол А.Е., Каган И.К. Строение и свойства двойных металлических систем. М.:
Наука, 1976. Т. 3. 815 с.
СП. Алисова
In—Р. ИНДИЙ-ФОСФОР
Сплавы In с Р могут быть получены как прямым синтезом компо-
компонентов, так и косвенными методами. Фосфид InP получали взаимо-
взаимодействием 1п2О3 и РН3, 1пС13 и РН3, а также взаимодействием
металлического In и РН3.
Фазовые равновесия в системе In—P представлены на рис. 11 по
данным работы [1] при давлении 0,1 МПа; штриховой линией обоз-
обозначен участок ликвидуса, отвечающего большему давлению пара: от
0,1 до 1,6 МПа (давление пара InP при температуре 1062 °С). При
температуре -156,4 °С кристаллизуется вырожденная эвтектика
InP + (In); растворимость Р в (In) составляет менее 10~3 % (ат.).
InP имеет кубическую структуру типа сфалерита (символ Пирсона
cFS, пр. гр. FA3m) а = 0,586—0,588 нм [2]. При давлении 13 ГПа
установлено существование метастабильной модификации InP со
структурой типа NaCl (символ Пирсона cF%, пр. гр. Fm3m), a -
= 0,531 нм, обладающей металлической проводимостью [3].
Литература
1. Tmar M., Gabriel A., Chatillon С, Ansara I. // J. Cryst. Growth. 1984. V. 68. N 2.
P. 557-580.
2. Minomura S., Driscamer G. // J. Phys. Chem. Solids. 1962. V. 23. P. 451.
3. Вол А.Е., Каган И.К. Строение и свойства двойных металлических систем. М.:
Наука, 1976. Т. 3. 815 с.
В.Н. Кузнецов
30
ln—P
Р, % (по массе)
0 10 20 30 40 50 50 70 В0100
ъ, С
1400
1300
1200
1100
1000
900
600
700
600
500
400
300
гоо
156,634°
100
0
/
/
-«—л
ж
ж+
Та)
\
\
1
InP
1
—-1
1023°
1062°
Ж + Га
)
1 \
3
'ПР+Г
JnD -i-A
\
(Л
г
\ 1
277°
о
Рис.
11.
0
In
In—Р
10
20
30
40
Р,
50 60
% (am.)
70 80
90 100
Р
In-Pb, In-Pd
31
In-Pb. ИНДИЙ-СВИНЕЦ
Результаты исследования системы In—РЬ (рис. 12) обсуждаются
в работах [X, 1, 2]. При температурах 159 и 178 °С протекают
перитектические реакции образования твердого раствора (In) и
промежуточной фазы а: Ж + а * (In) и Ж + (РЬ) * а. На кривой
ликвидуса при концентрации -2 % (ат.) РЬ имеется минимум при
температуре 156 °С.
D ID 20 10 40
Рв,%(по пассе)
50 Б0 70
90
100
J00
2S0
200
ISO
100
so
",7ТГ
27М
(ре)
327,502'
D К
Ш
) 20
10
40 SO ВО
Рв°/. (am.)
то
80
90
100
РВ
Рис. 12. In—РЬ
Фазовые границы областей в твердом состоянии проведены по
данным работы [3] на основании рентгеновских исследований и
измерения сверхпроводящих свойств. В работе [4] выполнен термоди-
термодинамический расчет, хорошо описывающий диаграмму плавления, но
не согласующийся с данными работы [2] относительно твердого
состояния.
Литература
1. Nabot J., Ansara I. // Bull. Alloy Phase Diagrams. 1987. V. 8. N 3. P. 246—255.
2. Вол А.Е., Каган И.К. Строение и свойства двойных металлических систем. М/
Наука. 1976. 815 с.
3. Nembach Е. // Trans. A1ME. 1969. V. 245. N 1. Р. 131-132.
4. Lukas H.L., Henig E. Fh., Zimmerman В. // Calnhad. 1977 VI N 3
P. 225-236.
В.И. Кузнецов
In-Pd. ИНДИЙ-ПАЛЛАДИЙ
Сведения по исследованию взаимодействия In с Pd представлены
достаточно подробно в справочной литературе [X, Э, 1].
32
In—Pd
Диаграмма состояния In—Pd построена на основании данных
микроструктурного, рентгеноструктурного и термического анализов
[Э] и показана на рис. 13.
В системе установлено существование ограниченного твердого
раствора на основе Pd B1,2 % (ат.) In) и образование пяти соедине-
соединений: Pd3ln, Pd2ln, Pdln, Pd2ln3 и Pdln3. Соединение Pdln имеет
широкую область гомогенности и стабильно в широком интервале
температур. Уникальной особенностью этого соединения, обладающе-
обладающего кристаллической структурой р-латуни, является его специфичес-
специфическая окраска, связанная с изменением порога поглощения при легиро-
легировании Pdln [2].
Соединения Pd2ln и Pdln плавятся конгруэнтно при 1323 и
1285 "С. При этом максимум на кривой ликвидуса при 1285 °С
отвечает содержанию 54 % (ат.) In. Температура плавления соедине-
соединения Pdln при стехиометрическом составе составляет 1265 "С. Соеди-
Соединение Pd2ln существует в двух модификациях: высокотемпературной
pPd2In и низкотемпературной aPd2In. pPd2In образуется конгруэнтно
при 1323 °С и при 935 °С распадается на Pdln и aPd2In по эвтекто-
идной реакции; aPd2In образуется из pPd2In и Pd3ln при 1066 °С по
перитектоидной реакции.
Соединения Pd3ln, Pd2ln3 и Pdln3 образуются по перитектическим
реакциям при температурах 1365, 709 и 664 °С соответственно. При
температуре 155 °С кристаллизуется вырожденная эвтектика (In) +
Pdln
3.
3
Кристаллическая структура соединений приведена в табл. 13.
Таблица
Соединение
Pd3ln*
Pd2ln
Pdln
Pd2ln3
Pdln3
Pd5ln3
13. Кристаллическая
Прототип
—
Co2Si
CsCl
Ni2Al3
Cu5Zn8
Rh5Ge3
Символ
Пирсона,
пр. гр.
—
оЯ12,
Рпта
сР2,
РтЪт
hP5,
РЪт\
с/52,
/43т
оР 16,
РЬат
Тетрагональная сингония.
структура соединений
системы In—Pd
Параметры решетки, нм
а
0,406
0,822
0,325
0,452
0,942
1,100
*
—
0,560
—
—
—
0,559
с
0,379
0,421
-
0,549
-
0,423
Источник
[X]
[3]
[X]
[X]
[3]
[3]
In-Pd
33
t, L
1500
1900
1300
1200
1100
1000
goo
800
700
600
500
300
200
156,63 ?"
100
0 70 20
/
/
/
LZ
155"
'n)
¦1
\
Ж
1
In
Pd, 'A (no nacce)
70 tO 50 60
1 1
f
664U /
/
I
//277
(
106S°-
S35°
ft
I
|
1J2J"
u
70
I
- a
V/
во
С;
Г
?— /i365'
\^80
130V
(f
SO 100
1555°
3
3
d)
О 10 20 30 fO 50 SO 70 80 So 100
In Pd,%(am.) Pet
Рис. 13. In-Pd
Литература
1. Вол А.Е., Каган И.К. Строение и свойства двойных металлических систем. М.:
Наука, 1976. Т. 3. 815 с.
2. Благородные металлы: Справочник / Под ред. ЕМ. Савицкого. М.: Металлур-
Металлургия, 1984. 592 с.
3. Schubert К., Lukas H.L., Meissner H.G., Bhan S. // Z. Metallkunde. 1959.
Bd. 50. S. 534-540.
АЛ. Татаркина
34
In—Pm
In-Pm. ИНДИЙ-ПРОМЕТИЙ
На рис. 14 приведена расчетная диаграмма состояния In—Pm,
построенная в работе [1] на основе общих закономерностей в строе-
строении диаграмм состояния двойных систем In с редкоземельными
металлами.
20
In, % (по пассе)
ЬО SO
80
100
200
100
о w го зо ьо so eo 70 во so wo
Pm In, °/o (am) In
Рис. 14. In—Pm
Литература
1. Delfino S., Saccone A., Ferro R. // J. Less-Common Met. 1984. V. 102. N 2.
P. 289-310.
Н.П. Абрукина
In-Pr
35
In-Pr. ИНДИЙ—ПРАЗЕОДИМ
Диаграмма состояния In—Pr, построенная в работе [1] и позднее
уточненная в работах [2, 3], приведена на рис. 15.
°с
20
Int%(no массе)
W 60
80
100
1200
ПОО
1000
9Л°
900
BOO
795°
700
600
500
too
JOO
200
100
V
V
/
70B°
Pr)
\
\
Ж
/
-767°
i
i I
фРПл
1017°
1091°
txPrln
1iTt°
I
1213°
\
1
\
\
V
\
\
I
1
(In) -*
I
0 10
Pr
20 30
50 60
In,'/, (am.)
70
156,634°
80 90 100
In
Рис. 15. In—Pr
36
ln—Pr
При исследовании использовали Рг чистотой 99,9 % (по массе) и
In чистотой 99,999 % (по массе).
Исследование выполняли методами дифференциального термичес-
термического, микроскопического и рентгеноструктурного анализов.
Соединения Prln3, P^In, и Prln образуются с открытым максиму-
максимумом при температурах 1213, 1195 и 1186 °С соответственно, a Pr3ln
и Pr2ln — в результате перитектических реакций при температурах
767 и 1017 °С. Соединение Prln при температуре 1091 °С претерпева-
претерпевает полиморфное превращение. В работе [4] сообщено о соединении
Pr3ln5, которое не указано на диаграмме состояния.
Нонвариантные реакции в системе In—Рг и кристаллическая
структура соединений приведены в табл. 14 и 15 по данным работ
[1-3].
Таблица 14. Нонвариантные реакции в системе In—Рг
ж
ж
ж
ж
ж
ж
Реакция
- (<*Pr) + Pr3ln
+ Pr2ln » Pr3ln
+ oPrln » Pr2ln
- pPrln + Pr2ln3
- Pr2ln3 + Prln3
- Prln3 + (In)
Содержание In в фа-
фазах, % (ат.)
6;
И;
34;
55;
66;
-100;
0;
33,33;
50;
50;
60;
75;
25
25
33,33
60
75
100
Температу-
Температура, °С
708
767
1017
1114
1145
156
Таблица
Соединение
Рг31п
Рг21п
PPrln
Рг31п5
Prln3
15. Кристаллическая структура соединений системы In—Рг
Прототип
AuCu3
InNi2
CsCl
Pd5Pu3
AuCuj
Символ
Пирсона,
пр. гр.
сРА,
РтЗт
АЯ6,
Р6}/ттс
сР2,
РтЪт
оС32,
Стст
сРА,
РтЪт
Параметры решетки, нм
а
0,49636
0,5534
0,3955
1,0147
0,46707
b
—
—
—
0,8208
-
с
—
0,6893
—
1,0430
-
Литература
1. Iandelli A. // Atti Acad. Naz. Line. Rend. С. Sci. Fiz. Mat. Nat. 1947. V. 2.
P. 327-334.
2. McMasters O.D., Gschneidner, Jr., K.A. // J. Less-Common Met. 1976. V. 44.
P. 281—289.
3. Delfino S., Saccone R., Ferro R. // J. Less-Common Met. 1979. V. 65. P. 181.
4. Delfino S., Saccone R., Mazzone D., Ferro R. // J. Less-Common Met. 1981. V. 81.
P. 45—53.
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
In—Pt
37
In—Pt. ИНДИЙ-41ЛАТИНА
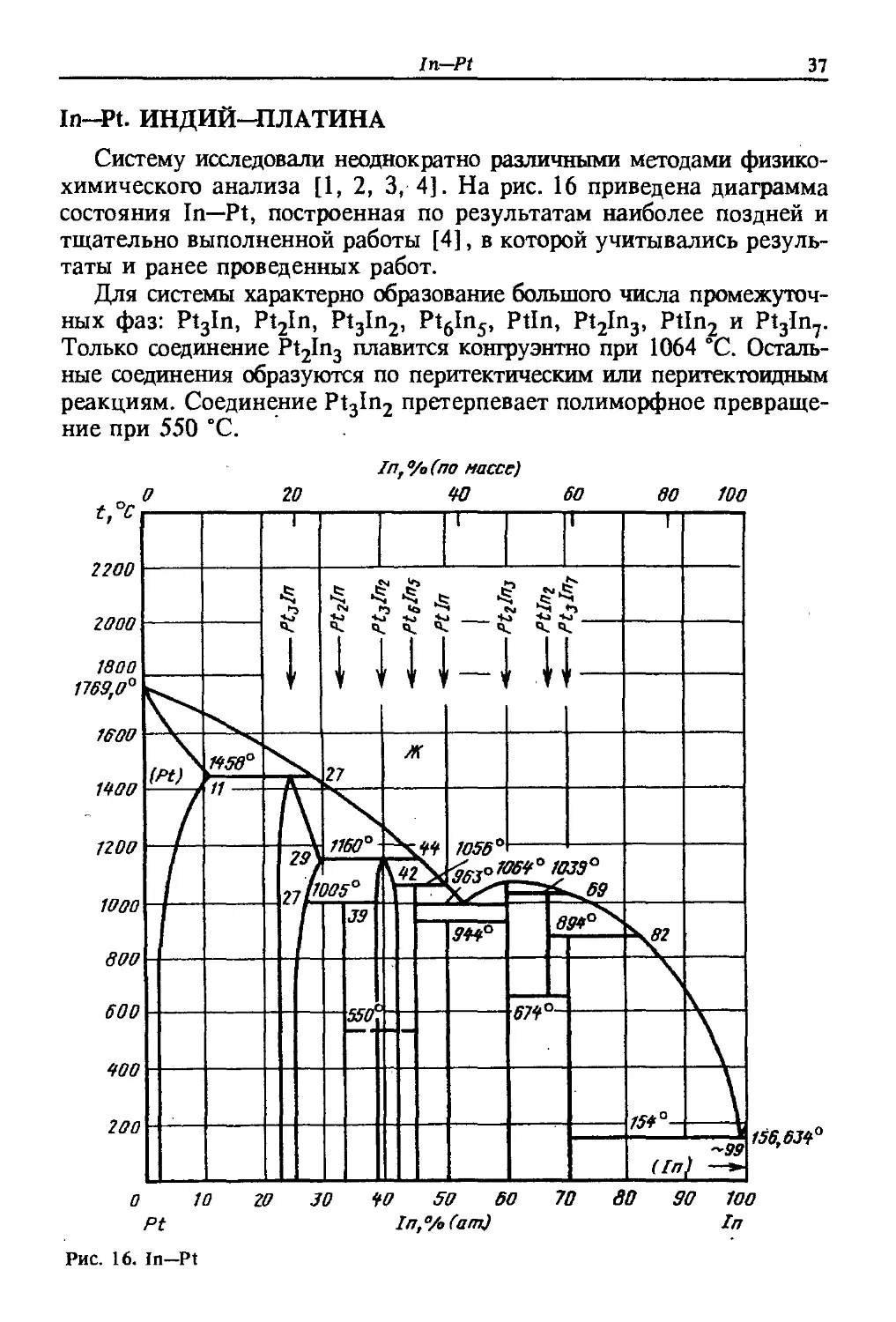
Систему исследовали неоднократно различными методами физико-
химического анализа [1, 2, 3, 4]. На рис. 16 приведена диаграмма
состояния In—Pt, построенная по результатам наиболее поздней и
тщательно выполненной работы [4], в которой учитывались резуль-
результаты и ранее проведенных работ.
Для системы характерно образование большого числа промежуточ-
промежуточных фаз: Pt3ln, Pt2ln, Pt3ln2, Pt6ln5, Ptln, Pt2ln3, Ptln2 и Pt3ln7.
Только соединение Pt2ln3 плавится конгруэнтно при 1064 "С. Осталь-
Остальные соединения образуются по перитектическим или перитектоидным
реакциям. Соединение Pt3ln2 претерпевает полиморфное превраще-
превращение при 550 "С.
20
1п,°/в(по массе)
60
во 100
2200
2000
1800
1769,0°
16-00
1400
1200
1000
800
600
too
200
(Pt)
1
1
1
1
К.
П5в° ^
I
»11
Г4?7
\Ч
\ //«7°
1
550?-т
ll
Ж
|
|
i
1056°
? •»«
', 1
t т
ж° а
?
67$°-
1
|-
US°
5*oS
1
4
15*°
v
3
(In) ^-t
156,63*°
Рис.
0
16.
10
Pt
In-Pt
20
30
40 50 60
In,"/o(am)
70
SO
90
100
In
38
In—Pt
Нонвариантные реакции в системе In—Pt, по данным работы [4],
и кристаллическая структура соединений приведены в табл. 16 и 17.
Структуры соединений Pt6ln5 и Ptin не приводятся.
Таблица 16. Нонвариантные
Реакция
Ж + (Pt) - Pt3ln
Ж + Pt3ln •• Pt3ln2
Pt3ln + Pt3ln2 - Pt2ln
Ж + Pt3ln2 - Pt6ln5
Ж «• Ptjliij + Pt2ln3
Pteln5 + Pt2ln3 •• Ptin
Ж + Pt2ln3 * Ptln2
Ptln2 •• Pt2ln3 + Ptjin,
Ж + Ptln2 - Ptjin,
Ж - Ptjln7 + (In)
реакции в системе
In—Pt
Содержание In
зах, % (ат
27;
44;
27;
49;
53;
45;
69;
66,66;
82;
-99;
И;
29;
39;
42;
45;
60;
60;
60;
66,66;
70,
в фа-
)
25
40
33,33
45
60
50
66,66
70
70
-100
Температу-
Температура, °С
1458
1160
1005
1056
963
944
1039
674
894
154
Максимальная растворимость In в твердом растворе (Pt) составля-
составляет 11 % (ат.), что согласуется с данными работы [1].
Таблица 17. Кристаллическая структура соединений системы In—Pt
Соединение
Ptjin
Pt2ln
Pt3In2(BT)
Pt3In2(HT)
Ptjhl,
Ptln2
PtsW
Прототип
CujAu
Pt5Ga3
Pt3Tl2
NiAs
Al3Ni2
CaF2
Ir2Sn7
Символ
Пирсона,
пр. гр.
сР4,
Prrilm
оС16,
Сттт
hP20,
Р31с
Л/Ч,
РЬъ1ттс
hP5,
РЪт\
сП2,
Frribm
—
Кубическая сингония.
Параметры решетки, нм
а
0,3992
0,818
0,5575
0,435
0,453
0,6366
0,9435
6
—
0,781
—
—
—
—
—
с
—
0,408
1,3657
0,555
0,551
—
—
Источник
[4]
[4]
[3]
[31
[4]
[4]
[41
Inr-Pt, lrt^-Pu 39
В работе [3] в области концентраций между 40 и 45 % (ат.) In
установлено образование фазы, которой дается формула Pt13ln9-
Фаза же с формулой Pt6ln5, которая соответствует этой области
концентраций, не указана в работе [3]. Фаза Ptln в работе [3] не
наблюдалась. Отличие диаграммы состояния в работе [3] от постро-
построенной в работе [4] состояло также в том, что ни одно из соединений
не давало открытого максимума. В системе по данным работы [3]
имела место лишь одна эвтектическая реакция со стороны In.
Литература
1. Металловедение платиновых металлов / Е.М. Савицкий, В.П. Полякова,
Н.Б. Горина и др. М.: Металлургия. 1975. 423 с.
2. Harris I.R., Norman M, Bryant A.W. // J. Less-Common Met 1968. V. 16. P. 427.
3. Jain K.C., Bhan S. // Trans. Ind. Inst. Met. 1973. V. 25. N 3. P. 100-102.
4. Guex P., Feschotte P. // J. Less-Common Met, 1976. V. 46. N 1. P. 101406.
Л.Л. Рохлин
In-Pu. ИНДИЙ-ПЛУТОНИЙ
Исследованию и анализу диаграммы состояния In—Pu посвящен
ряд работ [1—5]. Наиболее полное ее исследование с использованием
микроструктурного, рентгеновского, рентгеноструктурного и дилато-
дилатометрического анализов проведено в работе [1] (рис. 17).
Установлено, что In и Pu полностью взаиморастворимы в жидком
состоянии. В системе образуются пять соединений, из которых
Puln@) и Ри1п3(к) плавятся конгруэнтно при 1145 [1] и 1225 °С [1,
2], а соединения Pu3ln(p), Pu3lnir(ft и фаза л образуются по пери-
тектическим реакциям при 962, 1080 и 1119 "С соответственно [1].
При температуре 1064 °С [1], A068 °С [2]) и концентрации 59 %
(ат.) In в системе кристаллизуется эвтектика Puln + Pu3ln5. При
температуре 863 °С [1] фаза ц распадается на Pu3ln и Puln.
Имеются определенные расхождения в строении диаграммы состо-
состояния In—Pu по данным работ [1,3] в области сплавов, богатых Pu,
а также в значениях растворимости In в Pu. По данным работы [1]
перитектическая реакция Ж + Pu3ln «* (ePu) в системе протекает при
676 °С, а при 527 °С в системе имеет место перитектоидная реакция
(ePu) + Pu3ln «* (бРи). Характер фазового превращения, связанного
с модификацией (б'Ри) не установлен. Предположительно строение
в богатой Pu частью диаграммы показано на вставке рис. 17. По
данным работы [3] соединение Pu3ln претерпевает полиморфное
превращение при температуре 678 °С, а при температурах 666 и
550 °С в системе имеют место соответствующие перитектическая и
перитектоидная реакции.
4Q
In-Pu
In, % (no массе)
«0 60
1600 —
По данным работы [1], растворимость In в (ePu) составляет
<; 1,5 % (ат.), в (SPu) 2 % (ат.) при температурах 676 и 527 °С,
соответственно. По данным работы [3] растворимость In в (ePu) при
664 "С равна -1,8 % (ат.), а при 550 °С ~4 % (ат.). Растворимость
In в жидком Ри при 803 °С составляет 2,7 ± 0,2 % (ат.) [2]. Данные
работы [3] в отношении растворимости In в (бРи) являются, по-
видимому, завышенными.
Кристаллическая структура соединений приведена в
табл. 18. Структура фаз г\ и / (Pu3ln5) не приводится.
In—Pu, In—Rb
41
Таблица 18. Кристаллическая структура соединений системы In—Pu
Соединение
PUjIn
Puln
Puln3
Прототип
AuCuj
AuCu
AuCuj
Символ
Пирсона,
пр. гр.
сРА,
РтЪт
сРА,
РА/ттт
сРА,
РгпЗт
*'При концентрации -24 % (ат.) In.
*2При концентрации -28 % (ат.) In.
*3При концентрации 75 % (ат.) In.
*4При концентрации 74 % (ат.) In.
Параметры решетки, нм
а
0,4705*'
0.4722*2
0,4702
0,4705
0,4811
0,338
, 0,4607
0,46096*'
0,46185м
с
0,4538
0,455
Источник
[1]
[1]
[2]
[3]
[1]
[5]
[2]
[1]
[1]
Литература
1. Coffinberry A.S., Waldrom M.B. // Review of the Physical Metallurgy of Plutonium
of Metallurgy and Fuels. London, New York: Progress of Nuclear Energy, 1956. V. 1.
Ser. 5. P. 354-410.
2. Бочвар А.А., Конобеевский СТ., Кутайцев В.И. и др. // Тр. 2-й международ-
международной конференции по мирному использованию атомной энергии. Женева. 1958.
Доклады советских ученых. Ядерное горючее и реакторные материалы. М.: Атомиздат,
1959. С. 376-395.
3. Schnonfield F.N. The Metal Plutonium. Chikago: Univ. Press, 1961. 240 p.
4 Вол А.Е., Каган И.К. Строение и свойства двойных металлических систем. М.:
Наука, 1976. Т. 3. 815 с.
5. HocheidB., Tanon A., Despres J. // J. Nucl. Mater. 1965. V. 15. N 3.
P. 241-245.
Н.П. Абрукина
In-Rb. ИНДИЙ-РУБИДИЙ
Сплавы системы In—Rb были получены плавлением в инертной
среде в герметичных тиглях из Nb компонентов In чистотой 99,99 %
(по массе) и дистиллированного в вакууме Rb [1} или In чистотой
99,999 % (по массе) и Rb чистотой 99,999 % (по массе) [2].
На основании данных работ [1, 2], в которых использовались
методы рентгеновского и термического анализов и измерения плот-
плотности сплавов, в работе [3] построена диаграмма состояния In—Rb
(рис. 18).
В жидком состоянии при концентрациях -45—90 % (ат.) Rb
существует область несмешиваемости. Максимальная точка на кривой
42
Jn-Rb
t,°c
GOO
ЧОП
WO
JOO
700
too
0
s
/
1
\
to
-e—ffn)
20
i
Rb,',
JO
1
'а (по пассе)
+0 SO 60
1
Ж
/
'2°
¦f.
1
I
70
во
II III
- 625°
Ж, +Ж.
SZ2° N
so too
A
\
\
\
\
(Rb) —»-
о го го зо *о во 60 70 во so too
In Rb, %(am.) f?6
Рис. 18. In-Sb
расслаивания соответствует температуре 625 ± 75 °C и концентрации
-65 % (ат.) Rb. В системе образуются три соединения: In4Rb, In3Rb2
и In5Rb4 (или InjjRbg), два первых — по перитектическим реакциям
и последнее — по синтектической реакция. Формула соединения
In5Rb4 была установлена на основании анализа продолжительности
эвтектических остановок при термическом анализе сплавов со сторо-
стороны Rb.
Нонвариантные реакции в системе In—Rb приведены в табл. 19 по
данным работы [3].
Таблица 19. Нонвариантные реакции в системе In—Rb
Ж -
ж +
ж +
ж, +
ж -
Реакция
(In) + In4Rb
In3Rb2 » In4Rb
In5Rb4 - 1пзйЬ2
Ж2 - In5Rb4
In5Rb4 + (Rb)
Содержание Rb в фа-
фазах, % (ат.)
-0; 0;
-19; 40;
-30; 44,4;
-43; -92;
-100; 44,4;
20
20
40
44,4
100
Температу-
Температура, °С
156,6
452±25
490±10
522±30
-39,43
In-Rb, In-Rh
43
Определена кристаллическая структура соединения In4Rb: прото-
прототип ALBa (символ Пирсона г/10, пр. гр. 14/ттт), а = 0,4914 нм, с =
= 1,282 нм [4].
Соединение In3Rb2 имеет структуру, подобную In3Cs2 (пр. гр.
/4т2) [5].
Литература
1. Thummel R., Klemm W. // Z. Anorg. All. Chem. 1970. Bd. 376. N 1. S. 44-51.
2. Яценко СП., Чунтонов К.А., Бушманов В.Д., Диева Э.Н. // Структура фаз,
фазовые превращения и диаграммы состояния металлических систем. Сб. статей. М.:
Наука, 1974. С. 198-201.
3. Larose S., Pelton A.D. // J. Phase Equilibria. 1991. V. 12. N 3. P. 377-379.
4. Bruzzone G. // Acta Crystallogr. B. 1969. 25. P. 1206-1207.
5. Yatsenko S.P., Tschuntonov K.A., Orlow A.N. et aL // J. Less-Common Met. 1985.
V. 108. P. 339-343.
A.C. Адамова
In-Rh. ИНДИЙ-РОДИЙ
О взаимодействии компонентов системы In—Rh имеются ограни-
ограниченные сведения. В системе In—Rh обнаружено два соединения:
In3Rh и InRh. В интервале температур 200—500"С соединение In3Rh
находится в равновесии с соединением InRh и твердым раствором Rh
в In. Предполагается существование области несмешиваемости в
жидком состоянии.
Кристаллическая структура соединений системы приведена
в табл. 20.
Таблица 20. Кристаллическая структура соединений системы In—Rh
Соединение
In3Rh
InRh
Прототип
CoGaj
CsCl
Символ
Пирсона,
пр. гр.
tPl6,
Р4п2
сР2,
РтЪт
Параметры
а
0,701
0,320
решетки, нм
с
0,715
—
Источник
[1]
[2]
Литература
1. Schubert К., Lukas H.L., Meissner H.G., Bhan S. // Z. Metallkunde. 1959.
Bd. 50. S. 534-540.
2. Вол А.Е., Каган И.К. Строение и свойства двойных металлических систем. М.:
Наука, 1976. Т. 3. 815 с.
А. Л. Татаркина
44
In—Ru, Jn—S
In-Ru. ИНДИЙ^»УТЕНИЙ
Сведения об исследовании диаграммы состояния In—Ru ограни-
ограниченны. Проведено рентгеновское изучение сплавов Ru с 10, 25, 40,
50, 67, 75, 90 % (ат.) In [1]. Установлена незначительная раствори-
растворимость компонентов в твердом состоянии. В системе обнаружено
существование двух соединений: Ruin, и Ru3ln. Соединение Ru3ln
нестабильно и распадается на Ruln3 и Ru.
Кристаллическая структура соединений приведена в табл. 21 по
данным работы [1].
Таблица 21. Кристаллическая структура соединений системы In—Ru
Соединение
Ruln3
Ru3ln
Прототип
CoGa3
Символ
Пирсона,
пр. гр.
«46,
Р4п2
Параметры решетки, нм
а
0,699(8)
0,297A)
с
0,724@)
0,468(9)
Литература
l.HolleckH., NowotnyH., Benesowsky F. // Monatsch. Chem. 1964. Bd. 95.
S. 1386-1390.
А.Л. Татаркина
In-S. ИНДИЙ-СЕРА
Сплавы системы In—S исследованы в работе [1] в интервале
концентраций от 0 до 70 % (ат.) S методами микроструктурного,
рентгеновского и дифференциального термического анализов. Сплавы
готовили нагревом смесей компонентов в эвакуированных кварцевых
ампулах. При исследовании использовали In чистотой 99,999 % (по
массе) и кристаллическую S чистотой 99,999 % (по массе).
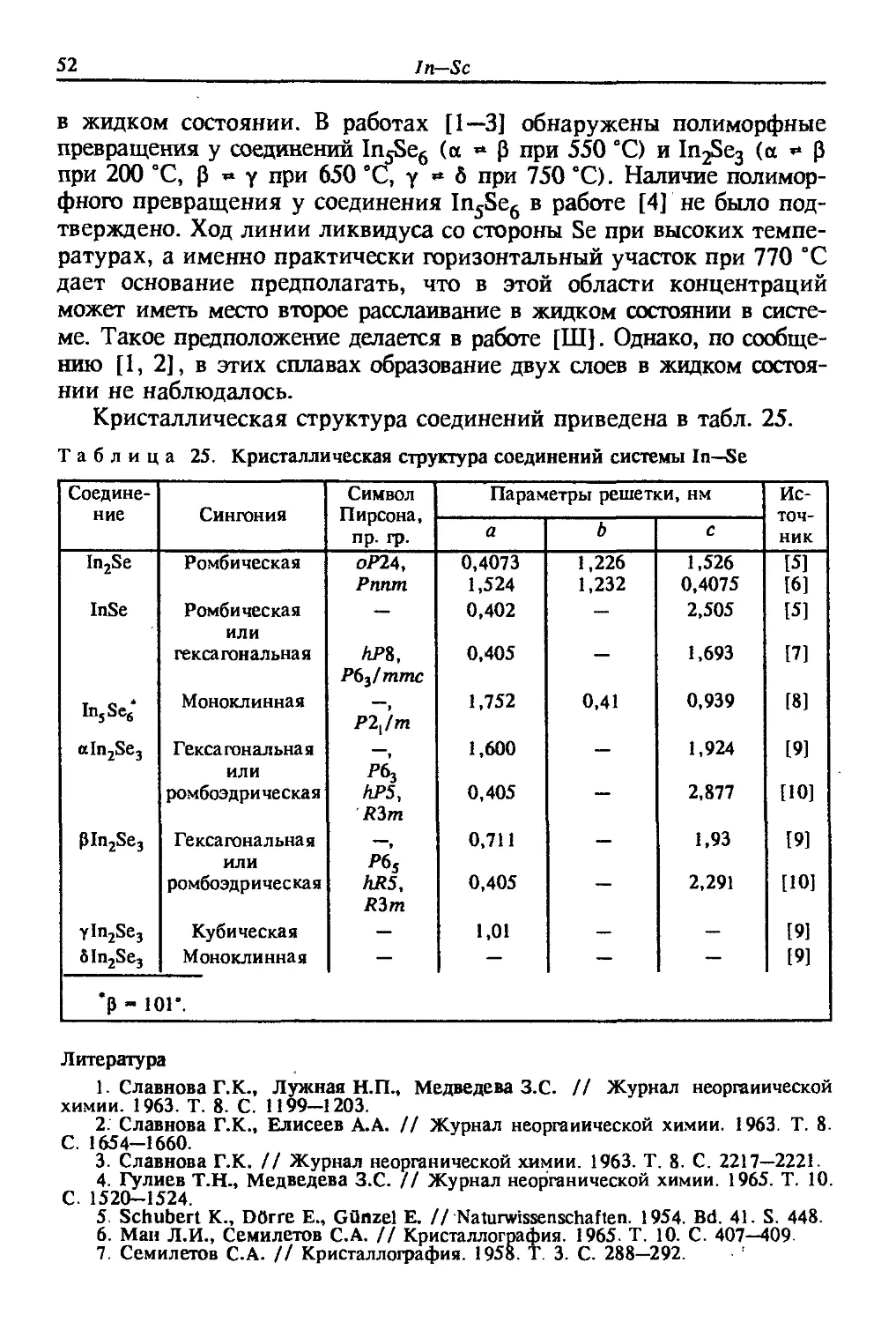
Диаграмма состояния In—S по данным работы [1] приведена на
рис. 19. В системе обнаружено четыре соединения: InS, In6S7, In2 gS4
и In2S3. Соединения InS и In2S3 существуют в двух модификациях:
высокотемпературной InS (ВТ), In2S3(BT) и низкотемпературной
InS(HT), In2S3(HT). Соединения InS (ВТ), In6S7 и In28S4 образуются
по перитектическим реакциям соответственно при температурах 683,
780 и 853 °С. Соединение In2S3(BT) плавится конгруэнтно при
1090 °С. В области сплавов, богатых In, имеет место расслаивание в
жидком состоянии. Критическая точка на кривой расслаивания
находится при температуре 751 °С. Температура монотектического
превращения составляет 638 °С. В работе [2] проводился рентге-
рентгеновский анализ сплавов в области концентраций от 0 до 60 % (ат.)
In-S
45
0 2 5
t°C
1000
90O
80O
7OO
6OO
500
40O
JOO
200
WO
A.6
f
156,634°
I
t,°C
— 680 -
670 -
660 -
650
S, "/„ (no массе)
W 2O JO
ж 1 603°
/lnS(8T)
/ 660°
659°
«¦» 46 48 50 52
S, 7. Cam.)
1°
+ Ж z
638°
Ж
InS(BT)/
J7.6
0 10 20 JO
In S.
Рис. 19. In-S
|
48.8
tOPO)
1
1
1
1
1
1853'
I/
13°-
40 SO
°/o Cam.)
In2S3(Bl
750°
414°
V
;
SO 7O
In. Данные этой работы подтвердили существование соединений InS,
IrigSy и In2S3. Кроме перечисленных выше соединений в системе In—S
обнаружены также соединения InjS, [3, 4], In4S5 {5], In3S5 [6]. Эти
соединения не нанесены на диаграмму (см. рис. 19). Кристаллическая
структура соединений приведена в табл. 22.
46
In—S, In—Sb
Таблица
Соединение
InS(HT)
InS(BT)
In6S7
In5S6
In4Ss
In3S4
In2S3(HT)
In2S3(BT)
In2S3(BT)
In3S5
22. Кристаллическая структура соединений системы In—S
Сингония
Гексаго-
Гексагональная
Ромбическая
Моноклинная
Моноклинная
Моноклинная
Гексаго-
Гексагональная
Кубическая
Кубическая
Тетрагональ-
Тетрагональная
Гексагональ-
Гексагональная
Символ
Пирсона,
пр. гр.
oPS,
Рппт
—
тР26,
pijm
—
—
—
-
-
J4jamd
—
Параметры решетки, нм
а
0,3944
0,3940
—
0,9090
0,910
0,9098
0,986
0,537
1,072
0,7623
0,761
0,759
Ь
0,4447
0,4443
—
0,3887
0,388
0,3879
—
-
-
—
с
1,0648
1,0642
—
1,7705
1,769
1,7676
2,03
-
—
3,236
3,224
2,03
Примеча-
Примечание
[2]
[5]
[1]
Р - 108,2°
[2]
Р - 108,9"
[4]
Р - 108,15"
[2]
[6]
[8]
[8]
191
[10]
[б]
Литература
1. Hahn H., Klinger W. // Z. Anorg. All. Chem. 1949. Bd. 260. S. 97-109:
2. Stubbs M.F., Schufle J.A., Thompson A.J. et al. // J. Amer. Chem. Soc. 1952.
V. 74. N 6. P. 1441-1443.
3. Schubert K., DOrre E., Gunzel E. // Naturwissenschaften. 1954. Bd. 41. S. 448.
4. Goodyear J., Steigmann G.A. // Proc. Phys. Soc. 1961. V. 78. P. 491-495.
5. Klanberg F., Spanday H. // J. Inorg. Chem. 1961. V. 19. P. 180-182.
6. King G.S.D. // Acte Crystallogr. 1962. V. 15. P. 512.
7. Daffin W.J., Hogg J.H. // Acta Crystallogr. 1966. V. 20. P. 566-569.
8. Елисеев А.А., Гулиев Т.Н., Короткова И.П. // Изв. АН СССР. Неорганические
материалы. 1966. Т. 2. № 3. С. 574.
9. Заргарова М.И., Гамидов Р.С. // Изв. АН СССР. Неорганические материалы.
1967. Т. 3. С. 1085.
10. Godecke Т., Schubert К. // Z. Metallkunde. 1985. Bd. 76. N 5. S. 358-364.
Н.И. Никитина
In-Sb. ИНДИЙ-СУРЬМА
В системе In—Sb установлено существование только одного соеди-
соединения InSb [1, 2, 3]. На рис. 20 приведена диаграмма состояния
системы по данным работы [1], выполненной методами микрострук-
микроструктурного, рентгеновского и термического анализов. В системе образу-
образуются две эвтектики: (In) + InSb при температуре 155 "С и содержа-
In-Sb
47
0
t,°c
700
600
500
too
300
ZOO
100
/
I
0.66
—f1
Si, % (no массе)
20 10 60 80 WO
\
n)
I
155°
\ 1
\\
1
525
—
1
68.3
4.
1
630,755°
0 10 20 JO to 50 BO 70 80 90 WO
In Sb,%(am.) Sb
Рис. 20. In-Sb
нии 0,66 % (ат.) Sb и InSb + (Sb) при 494 °C и 68,3 % (ат.) Sb.
Температура образования эвтектики в сплавах, богатых In, и незна-
незначительное содержание в ней Sb подтверждается в работах [2, 4].
Эвтектика в сплавах, богатых Sb, по данным работы [2] образуется
при температуре 505 °С и содержит 70,4 % (ат.) Sb. Температура
плавления соединения InSb по данным различных авторов составляет
525 °С [1], 540 'С [3],530°С [5].
Стабильная при обычных условиях модификация соединения InSb
имеет структуру типа сфалерита (символ Пирсона сЛ$, пр. гр.
РЛЗт), а - 0,6476 нм [1], а = 0,64787 нм [6], а = 0,64796 нм [7].
Соединение InSb имеет ряд нестабильных модификаций. В работе [8]
в поликристаллических пленках, полученных испарением в вакууме,
обнаружена модификация со структурой типа вюрцита (символ
Пирсона hPA, пр. гр. Рб^тс), а = 0,457 нм, с = 0,447 нм. Метаста-
бильная фаза, обнаруженная в тонких пленках быстрозакаленных
сплавов, имеет кубическую сингонию, а = 0,305 нм [9]. В работе
[10] с использованием методики закалки под давлением сплавов,
48 In-Sb, In-Sc
находящихся по своему составу в области соединения InSb, получено
шесть промежуточных фаз. Соединение InSb при давлении 3—4 ГПа
и температуре 120—200 °С превращается в ромбическую фазу, с
параметрами а = 0,585 нм, Ъ = 0,299 нм, с = 0,3117 нм. Тетрагональ-
Тетрагональная фаза типа pSn (символ Пирсона ШЛ, пр. гр. IAl/amd) с пара-
параметрами а = 0,5842 нм, с = 0,3184 нм получается при давлении 7 ГПа
и температуре 350 °С [10].
Литература
1. Погодин С.А., Дубинский С.А. // Изв. сектора физико-химического анализа.
1949. Т. 17. С. 204-208.
2. Liu T.S., Peretti E.A. // Trans. ASM. 1952. V. 44. P. 539-545.
3. Семилетов С.А., Розсивал М. // Кристаллография. 1957. Т. 2. С. 287—288.
4. Giesecke G., Pfister Н. // Acta Crystallogr. 1958. V. П. P. 369-371.
5. Глазов В.М., Петров Д.А. // Изв. АН СССР. Отделение технических наук.
1958. № 4. С. 125-129.
6. Hall R.N. // J. Elektrochem. Soc. 1963. V. 110. P. 385-388.
7. Jordan C.B. // J. Phys. Chem. 1963. V. 39. P. 1613-1614.
8. Озолиньш Г.В., Аверкиева Г.К., Горюнова Н.А. и др. // Кристаллография.
1963. Т. 8. С. 272.
9. Никитина В.К., Бабицина А.А., Лобанова Ю.К. // Изв. АН СССР. Неоргани-
Неорганические материалы. 1967. Т. 3. С. 311—314.
10. Дегтярева В.Ф., Беляш И.Т., Чинеико Г.В. // Физика твердого тела. 1983.
Т. 25. № 10. С. 2968-2974.
Н.И. Никитина
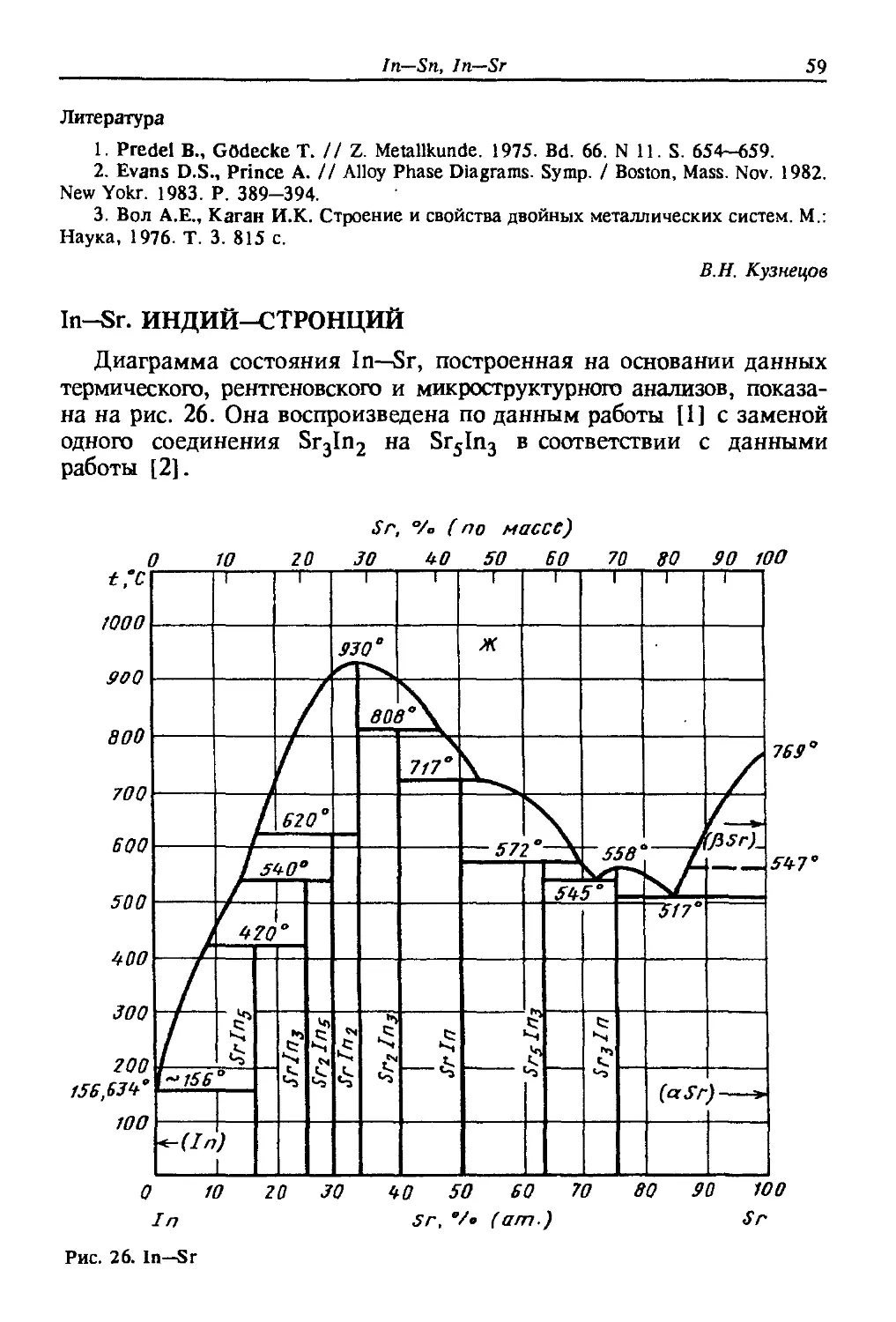
In-Sc. ИНДИЙ-СКАНДИЙ
Диаграмма состояния In—Sc (рис. 21) построена в работе [1].
Сплавы изготовляли длительным D00 ч) отжигом шихты, состоя-
состоящей из навесок чистых металлов, в герметично заваренных тиглях
из Та.
При исследовании использовали Sc чистотой 99~,8 % (по массе) и
In чистотой 99,999 % (по массе).
Исследование выполняли методами дифференциального термичес-
термического, микроскопического и рентгеноструктурного анализов.
Лишь одно из шести обнаруженных двойных соединений Sc2ln
образуется с открытым максимумом при 1420 °С. Все остальные — в
результате перитектических реакций. Все двойные соединения, кроме
Sc5ln3 обладают узкими областями гомогенности. Область существо-
существования фазы Sc5ln3 при понижении температуры от точки плавления
сначала увеличивается (максимум отвечает температуре 1120 °С и
почти совпадает с эквиатомным составом), а затем уменьшается и
при температурах ниже 900 °С становится практически постоянной
(около 38—39 % (ат.) In). Кристаллическая структура соединений и
In-Sc
49
f ОП
t, L
15»°
1500
1100
1337°
1300
1200
i inn
1000
900
BOO
700
600
500
too
300
200
100
9
\
\
(flSc)\
\
-(aSc)
I
/
\irro
r
¦
0°
m
In, % (no пассе)
20
A
i b
\
'20°
13J0°\
\
\
/
V
Ц
I
Jl
1
ill
1
1
J
|
i
1
1
1
i!
I
\
1t20°\
950°
90
CO
Ж
\
\
\9W°
k
\
60
\
i
4
L
\
~15S°
40 100
I
\
\
\
\
(In) -*.
Рис.
0 10
Sc
21. In-Sc
20
30
W 50
In, % (am.)
SO
70
SO
90
100
In
нонвариантные реакции в системе In—Sc no данным работы [1]
представлены в табл. 23 и 24. Структура соединений Scln, Sc5ln3 и
SC3I11J неизвестна.
50
In—Sc
Та
Ж
блица 23. Нонвариантные реакции в
Реакция
- (pSc) + Sc3ln
(PSc) - (aSc) + Sc3ln
Ж
Ж
ж
ж
ж
ж
+ Sc2ln - Sc3ln
+ Sc2ln - Sc5ln3
+ Sc5ln3 - Scin
+ Scin - Sc3ln5
+ Sc3ln, - Scln3
- Scin, + (In)
системе
In-Sc
Содержание In
зах, % (ат
23;
-17;
24;
-45;
60;
-71;
-77;
-100;
'Температура этого превращения скорректирована
температурой плавления In.
20;
15;
-33,3;
33,3;
-49;
50;
-62;
75;
в фа-
25
25
25
40
50
-62;
75
-100
в соответствии
Температу-
Температура, 'С
1320
1100
1340
1330
1120
950
910
-156*
с принятой
Растворимость Sc в In практически отсутствует. Высокотемпера-
Высокотемпературная модификация (PSc) растворяет до 20 % (ат.) In (максимально
при эвтектической температуре 1.320 °С). Этот твердый раствор
эвтектоидно распадается при температуре 1100 °С на (aSc) и Sc3ln.
Растворимость In в (aSc) при температуре 1100 "С составляет 15 %
(ат.), при понижении температуры растворимость падает и уже при
800 °С становится незаметной.
Таблица 24. Кристаллическая структура соединений системы In—Sc
Соединение
Sc3ln
Sc2ln
Scln3
Прототип
Mg3Cd
(Ni3Sn)
Ni2ln
AuCu3
Символ
Пирсона,
пр. гр.
Ш,
РЬъ1ттс
hP6,
РЬг1ттс
сР4,
Ртгт
Параметры решетки, нм
а
0,643
0,502
0,446
с
0,517
0,625
Литература
1. Yatsenko S.P., Semyannikov A.A., Shakarov H.O., Fedorova E.G. // J. Less-
Common Met. 1983. V. 90. N 1. P. 95-108.
A.C. Адамова
In-Se
51
In-Se. ИНДИЙ-СЕЛЕН
На рис. 22 приведена диаграмма состояния In—Se, построенная по
данным работ [1—3]. Исследования проводили методами дифферен-
дифференциального термического, микроструктурного и рентгеновского анали-
анализов и методом измерения микротвердости. Сплавы синтезировали в
эвакуированных кварцевых ампулах с использованием In и элемен-
элементарного Se чистотой выше 99,9 % (по массе).
В системе установлено существование четырех соединений: In2Se,
InSe, In5Se6 и I^Se,. Соединения InSe и In2Se3 плавятся конгруэнтно
при температурах 660 и 900 °С соответственно. Соединения In2Se и
In^Seg образуются по перитектическим реакциям соответственно при
540 и 660 °С. Твердые растворы на основе In и Se практически
отсутствуют. Оба эти компонента образуют вырожденные эвтектики:
(In) + IiuSe при температуре 156 "С и (Se) + pin2Se3 при температу-
температуре 219 °С. Значение последней температуры указано более низким,
чем в оригинальных работах B25 °С), в соответствии с принятой
более низкой (на 6 °С) температурой плавления Se, равной
221 °С. В области сплавов, богатых In, имеет место несмешиваемость
t,°c
900
80О
700
воо
5О0
ЬОО
300
200
156,654"
too
10
го
se, °/o (no массе)
Зо ьО 50
60 70 80 90 100
/
/
1
—/¦
j
I
52
-156°
Jin,
I
I
Ж -
plns
\
к
/5
I
9t
1
660°
660°
ЬО'
4"
/
L
1
70°
\"
\
Г
I
n25e3
770
75
-620°
-sso'
219°
0'
650"
200°
1
\
\
\
1
1
1
1
1
221'
О
In
10
20 30
о 50 6О
Se. °/o (am.)
70
30 90
WO
Se
Рис. 22. In-Se
52
In-Sc
в жидком состоянии. В работах [1—3] обнаружены полиморфные
превращения у соединений In^eg (а « р при 550 °С) и In2Se3 (о "Р
при 200 °С, р « у при 650 °С, у «* б при 750 °С). Наличие полимор-
полиморфного превращения у соединения In5Se6 в работе [4] не было под-
подтверждено. Ход линии ликвидуса со стороны Se при высоких темпе-
температурах, а именно практически горизонтальный участок при 770 °С
дает основание предполагать, что в этой области концентраций
может иметь место второе расслаивание в жидком состоянии в систе-
системе. Такое предположение делается в работе [Ш]. Однако, по сообще-
сообщению [1, 2], в этих сплавах образование двух слоев в жидком состоя-
состоянии не наблюдалось.
Кристаллическая структура соединений приведена в табл. 25.
Таблиц
Соедине-
Соединение
In2Se
InSe
In5Se6*
<xIn2Se3
pin2Se3
Yln2Se3
5In2Se3
a 25. Кристаллическая структура соединений системы In—Se
Сингония
Ромбическая
Ромбическая
или
гексагональная
Моноклинная
Гексагональная
или
ромбоэдрическая
Гексагональная
или
ромбоэдрическая
Кубическая
Моноклинная
*p - \ov.
Символ
Пирсона,
пр. гр.
оР24,
Рппт
—
ЛЯ8,
Р63/ттс
Pljm
—,
Р63
hPS,
Rim
Ябс
hR5,
Rim
—
Параметры решетки, нм
а
0,4073
1,524
0,402
0,405
1,752
1,600
0,405
0,711
0,405
1,01
—
Ь
1,226
1,232
—
—
0,41
—
—
—
—
-
с
1,526
0,4075
2,505
1,693
0,939
1,924
2,877
1,93
2,291
—
—
Ис-
точ-
точник
[5]
[6]
[5]
[7]
[8]
[9]
[Ю]
[9]
[Ю]
[9]
[9]
Литература
1. Славнова Г.К., Лужная Н.П., Медведева З.С. // Журнал неорганической
химии. 1963. Т. 8. С. 1199-1203.
2. Славнова Г.К., Елисеев А.А. // Журнал неорганической химии. 1963. Т. 8.
С. 1654-1660.
3. Славнова Г.К. // Журнал неорганической химии. 1963. Т. 8. С. 2217-2221.
4. Гулиев Т.Н., Медведева З.С. // Журнал неорганической химии. 1965. Т. 10.
С. 1520-1524.
5. Schubert К., DOrre E., GOnzel Е. // Naturwissenschaften. 1954. Bd. 41. S. 448.
6. Man Л.И., Семилетов С.А. // Кристаллография. 1965. Т. 10. С. 407—409.
7. Семилетов С.А. // Кристаллография. 1958. Т. 3. С. 288-292.
In— Se, Гп-Si
53
8. Елисеев А.А., ГулиевТ.Н., Корогеова И.П. // Изв. АН СССР. Неорганические
материалы. 1966. Т. 2. С. 574.
9. Семилетов С.А. // Физика твердого тела. 1961. Т. 3. С. 746—753.
10. Osamura К., Murakami Y., Tommie Y. // J. Phys. Soc. Japan. 1966. V. 21.
P. 1848.
Н.И. Никитина
In-Si. ИНДИЙ-КРЕМНИЙ
Диаграмма состояния системы In—Si (рис. 23) принадлежит к
простому эвтектическому типу [X, Э]. Эвтектика сильно смещена к
In как по составу, так и по температуре. Форма кривой ликвидуса
ю
Si, % (по пассе)
20 30 40 SO SO 70 8090100
1400
1300
200
100
TS6,S54°
(Si)
20
30
40 SO ВО
Si,"/- (am.)
70
80
90
100
Si
Рис. 23. In—Si
54 In—Si, Jn-Sm
указывает на сильное положительное отклонение от идеальности.
Рассчитанная концентрация Si в эвтектике составляет 2- 10"8 %
(ат.), а температура эвтектики на 1 • 10~7 °С ниже температуры
плавления In [Э].
Растворимость In в твердом Si имеет ретроградный характер.
Согласно приведенным в работе [1] расчетам максимальное значение
растворимости In в твердом Si при температуре 1327 °С составляет
0,004 % (ат.), при понижении температуры растворимость снижается
до 6- 10 % (ат.) при 627 °С и, по-видимому, заметно превышает
растворимость Si в In.
Литература
1. Козловская В.М., Рубинштейн Р.Н. // Физика твердого тела. 1961. Т. 3. № 11.
С. 3354-3362.
В.Н. Кузнецов
In-Sm. ИНДИЙ-САМАРИЙ
Диаграмма состояния In—Sm построена в работах [1,2] (рис. 24).
Сплавы изготовляли длительным D00 ч) отжигом шихты, состоя-
состоящей из навесок чистых металлов, в герметично заваренных тиглях
из Та. В качестве исходных материалов использовали Sm чистотой
99,9 % (по массе) и In чистотой 99,999 % (по массе). Исследование
выполняли методами дифференциального термического, микроскопи-
микроскопического и рентгеноструктурного анализов.
В системе обнаружено пять двойных соединений, из которых
Smln3, Sm3ln5 и Smln образуются с открытым максимумом при 1120,
1110 и 1230 °С соответственно, a Sm,In и Sm3ln — в результате
перитектических реакций при 1080 и 1010 °С. Все двойные соедине-
соединения, кроме Smln, обладают узкими областями гомогенности, отвеча-
отвечающими идеальной стехиометрии. Область гомогенности фазы экви-
атомного состава при температуре 1080 °С составляет -45—50 %
(ат.) In, а при температуре ниже 900 °С становится практически
постоянной (около 48—50 % (ат.) In).
Нонвариантные реакции в системе In—Sm представлены в табл. 26
по данным работ [1,2].
Растворимость Sm в In практически отсутствует. Высокотемпера-
Высокотемпературная модификация (ySm) растворяет до 14 % (ат.) In (максималь-
(максимальная растворимость при эвтектической температуре 890 °С). Твердый
раствор на основе (ySm) эвтектоидно распадается при 800 "С, образуя
твердый раствор (pSm) с 5 % (ат.) In. При понижении температуры
растворимость In в (aSm) падает, при 600 °С становится исчезающе
малой.
In—Sm
55
t
t °r
lt <¦
1JO0
1200
1100
1074°
1000
922°
900
(/3Sm)-
800
7Jt°
700
600
500
100
300
200
100
?
lfSW\
/
i
?—^
f 890
800°
in)
i
\
W
i
/
1O10
-\
4
i
r
/
wet
to
I
к
С
12.
/ 1
I
\
\
(no nacce)
' SO
T
10°
\
1080°
1
1
1
i
11
10°
\
10S0'
I
I
im
7°
во
1
\
100
\
\
(In) ^
О 10 20 JO W SO SO 70 80 90 100
Sm In,°/i(am.) ' In
Рис. 24. In—Sm
56
In—Sm
Таблица 26. Нонвариантные реакции в системе In—Sm
Реакция
Ж - (ySm) + Sm3ln
(YSm) - (PSm) + Sm3ln
Ж + Sm-jln - Sm3ln
Ж + Smln - Sm2ln
Ж - Smln + Sm3ln5
Ж - Sm3ln5 + Smln3
Ж - Smln, + (In)
Содержание In в фа-
фазах, % (ат.)
17;
-9;
-24;
-32;
60;
67;
-100;
14;
5;
-33,3;
-44;
50;
62,5;
75;
25
25
25
33,3
62,5
75
100
Температу-
Температура, X
890
800
1010
1080
1080
1060
-156
Кристаллическая структура соединений приведена в табл. 27 по
данным работы [3].
Таблица
f ОРТТИНРНИР
Sm3ln
Sm2ln
Smln
Sm3ln5
Smln3
27. Кристаллическая структура соединений системы In—Sm
Прототип
AuCu3
Ni2ln
CsCl
Pd5Pu5
AuCu3
Символ
Пирсона,
пр. гр.
сР4,
РтЗт
hP6,
РЬъ1ттс
сР2,
РтЗт
ОС32,
Стст
сРА,
РтЗт
Параметры решетки, нм
а
0,4900
0,5454
0,3185
1,001
0,4627
Ь
—
—
0,8135
-
с
—
0,6986
—
1,039
-
Литература
1. Е.И. Гладышевский, О.И. Бодак. Кристаллохимия интерметаллических соедине-
соединений редкоземельных металлов. Львов: Вища школа, 1983. 255 с.
2. Saccone A., Delfino S., Ferro R. // J. Less-Common Met. 1982. V. 84. N 2.
P. 281-289.
3. Yatsenko S.P., Semyannikov A.A., Shakarov H.O., Fedorova E.G. // J. Less-
Common Met. 1983. V. 90. N 1. P. 95-108.
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
In—Sn
57
In-Sn. ИНДИЙ - ОЛОВО
Хотя диаграмма состояния In—Sn изучалась неоднократно [X, Э,
1,2], основные ее особенности установлены недостаточно надежно,
результаты различных работ заметно отличаются друг от друга,
особенно в области составов, богатых Sn. На рис. 25 представлен
вариант диаграммы состояния, построенной, в основном, по резуль-
результатам работы [2]. Исследования проводили методами дифференци-
дифференциального термического и рентгенофазового анализов, а также исполь-
использовали метод испытаний на растяжение для точного определения
температуры солидуса.
?¦ °Г
t, L
260
240
220
200
180
160
140
120
100
BO
60
20
9 Iff
i
4*
-(in)-
2O 30 4L
I
0,0°
12,0
0
P
/
/
/
\
Sn, % (no nacce)
1 5O 6O 7O 80 96
T
ж
1
/
/
1
/
119°-
/
1
> 700
222,6°
98,5
A
7?
A I
1
\
1
1
1
I
1
|
I
\lSn)
1
231,9681°
99,0
10 20 30
In
#0 5O BO
Sn,°/o(am.)
7O
90 100
Sn
Рис. 25. In—Sn
58
In-Sn
Можно считать установленным наличие ограниченной области
твердых растворов на основе In и двух промежуточных фаз: р, имею-
имеющей ГЦК-структу.ру с с/а < 1 (по другим данным — ОЦТ с с/а > 1)
и у, имеющей по большинству результатов простую гексагональную
решетку. В отношении положения границы растворимости In в Sn
имеются противоречия. Согласно работе [1] растворимость носит
ретроградный характер. Максимальное значение растворимости
составляет 6,5 % (ат.) In при 190 °С. С увеличением температуры
растворимость In в Sn уменьшается до 0,8 % (ат.) при температуре
224 "С. С понижением температуры (ниже 190 °С) растворимость In
в Sn также снижается, составляя 4,9 % (ат.) при 120 °С и 3,8 %
(ат.) при 60 °С. Согласно другим исследованиям предполагается, что
растворимость In в твердом Sn с понижением температуры непрерыв-
непрерывно увеличивается [Ш].
Положение нонвариантных точек определено достаточно точно и
приведено в табл. 28.
Таблица 28. Нонвариантные реакции в системе In—Sn
Реакция
(In) + Ж - р
Ж-р + у
Ж + (Sn) - Y
Содержание Sn в фа-
фазах, % (ат.)
11,5; 14,0; 12,0
47,0; 44,2; 76,5
95,2; 99,0; 98,5
Температу-
Температура, °С
140
119
222,6
В работе [2] получено аналитическое описание всех линий ликви-
ликвидуса и солидуса, кроме солидуса (Sn).
Данные по кристаллической структуре фаз Р и y по результатам
различных работ собраны в работе [3] и приведены в табл. 29.
Таблица 29. Кристаллическая структура соединений системы In—Sn
Соединение
¦та
Y
Сингония
Тетрагональная
(гранецентрированная
решетка)
Тетрагональная
(объемно центриро-
центрированная решетка)
Гексагональная
'Значения параметров решетки г
ний при увеличении содержания Sn
Параметры решетки, нм
а
0,486-0,493
0,34375-0,34811
0,32160-0,32215
с
0,446-0,436
0,44695-0,43668
0,29977-0,30001
1риводятся в области существования соедине-
In-Sn, In—Sr
59
Литература
1. Predel В., GOdecke Т. // Z. Metallkunde. 1975. Bd. 66. N 11. S. 654-659.
2. Evans D.S., Prince A. // Alloy Phase Diagrams. Symp. / Boston, Mass. Nov. 1982.
NewYokr. 1983. P. 389-394.
3. Вол А.Е., Каган И.К. Строение и свойства двойных металлических систем. М.:
Наука, 1976. Т. 3. 815 с.
В.Н. Кузнецов
In-Sr. ИНДИЙ-СТРОНЦИЙ
Диаграмма состояния In—Sr, построенная на основании данных
термического, рентгеновского и микроструктурного анализов, показа-
показана на рис. 26. Она воспроизведена по данным работы [1] с заменой
одного соединения Sr3ln2 на Sr5ln3 в соответствии с данными
работы [2].
Sr, "/- (по массе)
О 10 20 30 ЬО 50 БО 70 80 90 100
t"c
/000
900
BOO
700
600
500
40О
300
200
10О
Г
f
1
1
/
/
620°
f—
420
-|
5Б°
}
О
1
930°
ВО,
i
?\
717"
$
ч
1
ж
\
— 571
1
48 •
1
и
Ы/
(aSr
1
/
/iSr)
\ ^
7В9"
10 20 30
In
Рис. 26. In-Sr
40
Sr,
50
V.
БО
(am
¦)
70
80
90
100
Sr
60
In—Sr, In—Та
В системе существует восемь интерметаллических соединений, из
которых лишь Srln2 и Sr3ln плавятся конгруэнтно при температурах
соответственно 930 и 558 °С, a Srln5, Srln3, Sr2ln5, Sr2ln3, Srln и
Sr5ln3 образуются по перитектическим реакциям соответственно при
температурах 420, 540, 620, 808, 717 и 572 °С. Эвтектика, богатая Sr,
кристаллизуется при температуре 517 °С и содержании 84,5 % (ат.)
Sr. Эвтектика, состоящая из Sr5ln3 и Sr3ln кристаллизуется при
температуре 545 "С и содержании 72,7 % (ат.) Sr. Co стороны In при
156 ° С образуется вырожденная эвтектика.
Кристаллическая структура соединений системы In—Sr приведена
в табл. 30. Структура соединений Sr2ln5 и Sr2ln3 не установлена.
Таблица 30. Кристаллическая структура соединений системы In—Sr
Соединение
Srb5*
Srln,
Srln2
Srln"
Sr5ln3
Sr3ln*"
Прототип
-
SnNi,
Caln2
—
Cr5B3
-
Символ
Пирсона,
пр. гр.
-
ЛЯ8,
РЬъ1ттс
hP6,
РЬъ1ттс
—
tm,
14/тст
-
'Гексагональная сингония.
"Ромбическая сингония.
'"Кубическая сингония.
Параметры решетки, нм
а
0,5937
0,6769
0,5000
0,409
0,8738
0,8360
Ь
-
-
—
0,518
—
-
с
0,4827
0,5481
0,8021
1,100
1,6442
-
Источник
[11
[1.2]
[1,2]
[1]
[3]
[1]
Литература
1. Bruzzone G. // J. Less-Common Met. 1966. V. 11. N 4. P. 249-258.
2. Bruzzone G., Merlo F. // J. Less-Common Met. 1982. V. 85. N 2. P. 285-306.
3. Bruzzone G., Franceschi R. // J. Less-Common Met. 1978. V. 60. N 1. P. 59-63.
Л.Л. Зусман
In—Та. ИНДИЙ—ТАНТАЛ
Согласно последним имеющимся данным [1,2] взаимодействие In
и Та в твердой и жидкой фазах практически отсутствует. Попытка
авторов работы [1] получить сплавы In с Та спеканием In и Та при
700 °С в течение трех месяцев успехом не увенчалась. По данным
In—Та, ln—ТЬ
61
прямых измерений, выполненных при температурах E00—1000 °С)
в работе [3], растворимость Та в In подчиняется уравнению
lgx = 0,2 - 4000/7,
где х — концентрация Та, % (ат.), Т — температура, К. Экстраполя-
Экстраполяция к температуре плавления In дает величину растворимости Та в
In Ю-9 % (ат.).
Литература
1. Villars P., Girgis К. // Z. Metallkunde. 1982. Bd. 73. N 3. S. 167-171.
2. Okamoto H. // Bull. Alloy Phase Diagrams. 1988. V. 9. N 1. P. 56-58.
3. Диева Э.Н. // Физические исследования жидких металлов и сплавов: Сб.
статей. Свердловск: Уральский научный центр АН СССР, 1974, С. 105-110.
В.Н. Кузнецов
In-Tb. ИНДИЙ—ТЕРБИЙ
Диаграмма состояния (рис. 27) In—Tb построена в работе [1].
Сплавы изготовляли длительным D00 ч) отжигом шихты, состоя-
состоящей из навесок чистых металлов, в герметично заваренных тиглях
из Та. В качестве исходных компонентов использовали Tb чистотой
99,9 % (по массе) и In чистотой 99,999 % (по массе). Исследование
выполняли методами дифференциального термического, микроскопи-
микроскопического и рентгеноструктурного анализов.
Четыре из пяти обнаруженных двойных соединений — ТЫп3,
Tb3ln5, ТЫп и ТЬ21п — образуются с открытым максимумом при
температурах 1140, 1140, 1260 и 1180 °С соответственно, Tb5ln3 —
в результате перитектической реакции при 1190 °С.
Нонвариантные реакции в системе In—Tb представлены в табл. 31
в соответствии с диаграммой состояния, данной в работе [1].
Таблица 31. Нонвариантные реакции в системе In—Tb
Реакция
Ж - (РТЬ) +ТЬ21п
(РТЬ) - (ctTb) + Tb2ln
Ж » Tt^In + Tb5ln3
Ж + ТЫп » Tbsln3
Ж » ТЫп + ТЬ31п5
Ж » Tb3lns + ТЬ1п3
Ж » ТЫп3 + (In)
Содержание In
зах, % (ат
20;
-15;
-35;
-37;
-55;
-66;
-100;
17;
Ю;
33,33;
45;
50;
62,5;
75;
в фа-
•)
33,33
33,33
37,5
37,5
62,5
75
100
Температу-
Температура, "С
1040
970
-1150
1190
1120
1110
-156
62
In-Tb
z, с
14-00
1356°
}J00
1269°
1200
1100
1000
SOO
800
TOO
600
500
too
300
200
WO
9
\
\
(в.ГЬ)\
/
/
/
/
/
20
1
\-(/}Г6)
v\ 1
\
V
I I
\ \
1RI
A
AOfOa
970°
К
In, %
40
. 1
¦S
(по пассе)
60
\
126
190°\
¦7150^
I
0°
К
V
¦1120°
1
f
|
\
4*0°
TV
1/10°
1
¦
0°
80
I
\
100
\
\
A
0 10 20 JO 40 50 60 70 80 90 100
Tb In,"/, (am.) " In
Рис. 27. In-Tb
In—Tb
63
Растворимость Tb в In практически отсутствует. Высокотемпера-
Высокотемпературная модификация фТЬ) растворяет до 17 % (ат.) In при эвтекти-
эвтектической температуре. Низкотемпературная модификация (аТЬ) рас-
растворяет до 10 % (ат.) In при эвтектоидной температуре 970 "С. С
понижением температуры растворимость In в (аТЬ) резко падает и
при 700 °С становится практически равной нулю. Все двойные соеди-
соединения, кроме ТЫп, обладают узкими областями гомогенности. Об-
Область существования фазы эквиатомного состава при понижении
температуры от точки плавления сначала увеличивается (максимум
отвечает температуре 1190 °С), а затем уменьшается и при темпера-
температурах ниже 900 "С становится практически постоянной (около
48-50 % (ат.) In).
Кристаллическая структура соединений приведена в табл. 32 по
данным работ [ 1, 2].
Таблица 32. Кристаллическая структура соединений системы In—Tb
Соединение
Tb2ln
Tb5ln3
ТЫп*
ТЬз1п5
ТЫп3
Прототип
Ni2ln
W5Si3
-
PdjPuj
AuCu3
Символ
Пирсона,
пр. гр.
hP6,
РЬъ1ттс
г/32,
14/тст
-
оС32,
Стоп
сРЛ,
РтЗт
'Тетрагональная сингония.
Параметры решетки, нм
а
0,5367
1,2238
-0,96
0,987
0,45878
*
—
—
-
0,802
—
с
0,6707
0,6010
-0,84
1,028
—
Литература
1. Yatsenko S.P., Semyannikov A.A., Shakarov H.O., Fedorova E.G. // J. Less-
Common Met. 1983. V. 90. N 1. P. 95-108.
2. Гладышевский Е.И., Бодак О.И. Кристаллохимия интерметаллических соедине-
соединений редкоземельных металлов. Львов: Вища школа. 1982. 255 с.
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
64
In~Te
In-Te. ИНДИЙ-ТЕЛЛУР
Диаграмма состояния In—Те описана в работах [X, Ш, Э]. Уста-
Установлено, что взаимодействие In и Те характеризуется ограниченной
смешиваемостью компонентов в жидком состоянии с монотектикой
при температуре 423 °С и содержании 28 % (ат.) Те и образованием
ряда соединений я твердом состоянии, относительно которых в лите-
литературе имеются расхождения. На рис. 28 представлена диаграмма
состояния системы, построенная в основном по данным работы [1] с
дополнениями и уточнениями по данным работ [2, 3, 4].
В системе In—Те установлено образование следующих соединений:
In2Te, InTe, In3Te4, 1п2Те3 (аир модификации), 1п3Те5 , (а и р
модификации), 1п2Те5. Соединения InTe и 1п2Те3 плавятся конгруэн-
конгруэнтно при температурах 696 и 667 °С соответственно, соединения
In2Te, In3Te4, In3Te5 и 1п2Те5 образуются по перитектическим
реакциям соответственно при температурах 462, 650, 625 и 467 °С.
По данным работ [2, 3, 5] соединение 1п2Те3 обладает определенной
Те, % f по массе)
О 10 ZO J0 40 SO ВО 70 80 30 100
t'C
800
700
BOO
500
400
300
156,634°
200
too
1
I
160
I i
1
1 /sg0
li
In 0,5 1
Te,%(am)/
/ '
1
Г J
423°
160°
4
\
/
\32/ 4
VI
28
ft
I
69
/649
ft
Ж
I
i°C
600
500
\S50"l>bl
600 ¦
!-:
-
kOO
i
— /\
600 \
<\
f-'
ь
\ Те, 7
b67~ V
UP
' to
\t
ft
S25°
467'
~UP
60
,fam.)
1
[теТ
Ш, 57
0
In
10 20 JO
40 50 60
Те.'/<>(am.)
70
80 90
100
Те
Рис. 28. In-Te
Гп-Те
65
областью гомогенности: низкотемпературная модификация а1п2Те3
отвечает содержанию 59,75—59,94 % (ат.) Те, а высокотемператур-
высокотемпературная модификация pin2Te3 — 59,5—60 % (ат.) Те. Полиморфное
превращение pin2Te3 *» aIn2Te3 в зависимости от состава проходит
в интервале температур 600—625 °С так, как это показано на вставке
справа. Указанные температуры на 5 °С ниже приведенных в работе
[2] в соответствии с принятой температурой перитектического пре-
превращения 625 "С. По данным работы [6] полиморфное превращение
1п2Те3 происходит в интервале температур 520—620 °С, по данным
работы [7] — при 617 + 5 °С. По данным работ [6, 8] соединение
InTe также претерпевает полиморфное превращение: при 167 °С [8]
и при (—173)—(—A43) °С при охлаждении и при (—133)—(—103) "С
при нагреве [6].
В системе имеет место при 160 "С перитектическая реакция
образования твердого раствора Те в In (вставка слева на рис. 28) [I].
Основным расхождением между данными различных авторов
является определение составов соединений, образующихся по пери-
тектическим реакциям при 462 °С Aп2Те или 1п9Те7) и при 625 "С
Aп4Те7 или 1п3Те5). Соединение ЫдТе- было установлено лишь в
двух работах [1, 9]. Соединение же 1п2Те получено и хорошо иссле-
исследовано в большем числе работ [X, 10, 11, 12]. Кроме того, формула
1п9Те7 не подтверждена исследованиями кристаллической структуры,
а кристаллическая решетка 1п2Те установлена. Соединение 1п4Те7
было обнаружено в работе [15], однако кристаллическая структура
его не определялась. По данным работы [2] сплав, соответствующий
соединению 1п4Те7, является двухфазным. В работах [1, Ш] для
этого соединения принята формула 1п3Те5.
Кристаллическая структура соединений приведена в табл. 33.
Таблица 33. Кристаллическая структура соединений системы In—Те
Соединение
1п2Те*'
InTe
In3Te;2
pln2Te3
а!а,Те3'3
Прототип
—
TISe
-
ZnS
—
Символ
Пирсона,
пр. гр.
—
//16,
/4/ тст
-
—
Параметры решетки, нм
а
0,446
0,445
0,844
0,8437
0,427
0,614-0,617
0,616
0,6158
1,850
1,840
b
1,2615
1,258
-
—
—
с
1,539
1,536
0,717
0,7134
4,09 ,
—
—
Источник
[И]
[12]
[12]
[13]
[Р]
[6]
[12]
[14, 16]
[6]
[15]
66
In-Te
Соединение
Р1п,Те5'2
**"
Прототип
-
-
-
Символ
Пирсона,
пр. гр.
-
-
-
Параметры решетки, нм
а
0,4359
1,3078
1,327
0,438
1,840
''Ромбическая сингония.
'^Гексагональная сингония.
'^Кубическая сингония (упорядоченная ГЦК)
*4Тетрагональная сингония.
''Моноклинная сингония, р - 92,05° [11], A
Ъ
1,3078
-
-
1,611
1,612
с
0,6165
0,6165
0,356
1,337
1,336
-91,49° [12].
Источник
[7]
[71
[1]
[И]
[12]
Литература
1. Grochowski E.G., Mason D.R., Schmitt G.A., Smith P.H. // J. Phys. Chem. Solids.
1964. V. 25. N 6. P. 551-558.
2. Палатник Л.С., Атращенко Л.В., Гальчииецкий Л.П., Кошкин В.М. 11 Докла-
Доклады АН СССР. 1965. Т. 165. С. 809-812.
3. Гальчинецкий Л.П., Атращенко Л.В., Кошкин В.М., Сысоев Л.А. // Изв. АН
СССР. Неорганические материалы. 1970. Т. 6. № 5. С. 860-863.
4. Вол А.Е., Каган И.К. Строение и свойства двойных металлических систем. М.:
Наука, 1976. Т. 3. 815 с.
5. Holmes P.J., Jennings I.C., Parrott J.E. // J. Phys. Chem. Solids. 1962. V. 23.
P. 1-5.
6. Заславский А.И., Сергеева В.М. // Физика металлов и металловедение. 1960.
Т. 2. С. 2872—2880.
7. Gasson D.B. // International Conference on Semiconductor Physics. Prague. 1960.
New York: Academic Press Inc, 1961. P. 1032-1036.
8. Wright H.C., Brice J.C. // Nature. 1959. V. 183. N 4659. P. 27-28.
9. Mason D.R., Cook J.S. // J. Appl. Phys. 1961. V. 32. N 3. P. 475-477.
10. Klemm W., Vodel N.U. // Z. Anorg. All. Chem. 1934: Bd. 219. S. 45.
11. Schubert K., DOrre E., Giinzel E. // Naturwissenschaften. 1954. Bd. 41. S. 448.
12. Герасимов Я.И., Аббасов Ф.С., Никольская А.В. // Доклады АН СССР. 1962.
Т. 147. С. 835-838.
13. Schubert К., DOrre E., Kluge M. II Z. MettaUkunde. 1955. Bd. 46. N3.
S. 216-224.
14. Wooley J.C, Ray B. // J. Phys. Chem. Solids. 1960. V. 15. N 1. P. 27-32.
15. Inuzuka H., Sugaike S. // Proc. Japan. Acad. 1954. V. 30. N 5. P. 383.
16. Wooley J.C, Pamplin B.R. // J. Elecrochem. Soc. 1961. V. 108. P. 874-879.
Н.П. Абрукина
fn—Th
67
In—Th. ИНДИЙ—ТОРИЙ
На рис. 29 представлена диаграмма состояния In—Th по данным
работы [1]. Исследование выполнено методами микроструктурного,
рентгеновского и дифференциального термического анализов. При
исследовании использовали In чистотой 99,999 % (по массе) и Th
чистотой 99,5 % (по массе). В сплавах системы In—Th найдено
четыре химических соединения: In3Th, In5Th3, InTh и InTh2. Соеди-
Соединения In3Th, I%Th3 и InTh плавятся конгруэнтно при температурах
соответственно 1310, 1335 и 1280 "С, соединение InTh2 образуется по
перитектической реакции при ИЗО °С.
о
20
Th, % (по массе)
60 ВО
90
100
t,°C
1700
1600
1500
1400
1300
1200
1100
1000
900
BOO
700
200
156,634
то
о
0 10
In
Рис. 29. In-Th
/
I
1
/
\
155°
I
I
1310°
с
с?
—м
гг
133
si
7Ь°
i
Ж
5°
1265°
'80°
1
Ч
1130° N
/
/
/
Л
А
Г
1
1
1
(olTh)
\
\
\
\
\
\
\
—V
1
1
1755
.(PTh)
1360
20 30
4<-0 50 60 70
Th, % (am.)
90 1O0
Th
68
In-Th
Сплавы, богатые Th, подробно изучались в работе [2] методами
рентгеновского и металлографического анализов. Для приготовления
сплавов использовали электролитические In и Th высокой чистоты.
Нонвариантные реакции в системе In—Th показаны в табл. 34.
Та
Ж
Ж
Ж
Ж
Ж
блица 34. Нонвариантные реакции в системе In—Th
Реакция
- (In) + In3Th
« In3Th + In5Th3
« In5Th3 + InTh
+ InTh » InTh2
- InTh2 + (aTh)
Содержание
-1;
31,5;
48,5;
72;
74;
82;
Th в фазах,
. -0;
25;
37,5;
50;
66,67;
66,67;
% (ат.)
25
37,5
50
66,67
90
90,8
Темпера-
Температура, °С
155
1275
1265
ИЗО
1095
1160
Источник
[1]
[1]
[1]
[1]
[1]
[2]
Растворимость In в (aTh), по данным работы [2], при 1160 °С
составляет 9,2 % (ат.) и при 800 °С — 1,7 % (ат.).
Кристаллическая структура соединений системы In—Th приведена
в табл. 35.
Таблица 35. Кристаллическая структура соединений системы In—Th
Соедине-
Соединение
ln3Th
In5Th3
InTh
InTh2
Прототип
AuCu3
PdjPu3
InTh
CuAl2
Символ
Пирсона,
пр.гр
сРЛ,
РтЗт
осъг.
Стоп
оР24,
РЬст
Ш2,
И/тст
Параметры решетки, нм
а
0,4701
0,4695
1,0193
1,0806
0,778
0,7787
Ь
—
0,8205
0,9954
—
с
—
1,0374
0,652
0,6113
0,6113
Источник
[1]
[3]
[1]
[1]
[1]
[2]
Литература
1. Palenzona A., Manfrinetti P., Cirafici S. // J. Less-Common Met. 1984. V. 97. N 1.
P. 231-236.
2. Murray J.R. // J. Less-Common Met. 1959. V. 11. P. 314-320.
3. Ferro R. // Acta Crystallogr. 1958. V. 11. P. 737-738.
Н.И. Никитина
In-Ti
69
In—Ti. ИНДИЙ—ТИТАН
Диаграмму состояния In—Ti исследовали в работах [1—3]. Анализ
и обобщение результатов этих работ позволили представить диаграм-
диаграмму состояния системы In—Ti в виде, приведенном на рис. 30 [М].
1100
1000
800
600
100
700
О 10 20 30 40 SO
In, % (по пассе)
60 70 80
90
too
' 1 '
fro /
882°
fS5D°(
i i
V
Ttjl
i
n
1
?
с
1
7
I
96"
(I
\"
\
156.634°
0
П
10
го
40 SO 60
In, % (am)
70
80
90
too
In
Рис. 30. In—Ti
In, растворяясь в Ti, снижает температуру его полиморфного
превращения. Эвтектоидный распад ОТО на (aTi) + Ti3ln протекает
при температуре -850 °С, эвтектоидная точка расположена при
содержании 12 % (ат.) In, растворимость In в (aTi) при этой темпе-
температуре достигает 10 % (ат.). Условия образования соединения Ti3ln
не установлены. Другое соединение Ti3ln4, обнаруженное в сплавах
системы, образуется по перитектической реакции при температуре
796 °С. Со стороны In при 156 °С кристаллизуется вырожденная
эвтектика.
Кристаллическая структура соединений по данным работы [3]
приведена в табл. 36.
70
In—Ti, In-Tl
Таблица 36. Кристаллическая структура соединений системы In—Ti
Соединение
Ti3ln
Ti3ln;
Прототип
Ni3Sn
Тетрагональная сннгония.
Символ Пирсо-
Пирсона, пр.гр.
ЛР8,
Рвг/ттс
Параметры решетки, нм
а
0,592
0,998
с
0,478
0,298
Литература
1. Anderko К. // Z.Metallkunde. 1958. Bd. 49. N 4. S. 165-172.
2. Johnson R.G., Prosen R.J. // Trans. AIME. 1962. V. 244. P. 397-398.
3. Raman Ar, Schubert K. // Z. Metallkunde. 1965. Bd. 56. N 1. S. 44-52.
П.Б. Будберг
In-Tl. ИНДИЙ-ТАЛЛИЙ
Система In—Tl была исследована методами терминеского, метал-
металлографического, рентгеновского анализов и методом измерения
электросопротивления [1—5].
В системе установлено наличие следующих фаз: (In) — твердый
раствор Т1 в In; a — промежуточная фаза, образующаяся в результа-
результате перитектической реакции между жидкостью и твердым раствором
(рТ1); (аТ1) — твердый раствор. На рис. 31 приведена диаграмма
состояния системы по данным работы [5], в которой она была по-
построена по результатам собственных исследований и предыдущих
работ. Кривая ликвидуса в сплавах, богатых In, характеризуется
плоским минимумом при температуре -154 °С и содержании -12 %
(ат.) Т1. Нонвариантное перитектическое превращение Ж + «" (In)
протекает при температуре -155 "С [5]. Нонвариантные реакции
приведены в табл. 37.
Таблица 37. Нонвариантные реакции в системе In—Tl
Реакция
Ж + а - (In)
Ж + (РТ1) » а
(рТ1) - (aTl) + а
Содержание
-16;
40;
39;
82,5;
80;
Т1 в ф
-19;
56;
61;
87.5;
83,2;
азах, % (ат.)
-17,5
43
44
59,9
64
Температура,
°С
155
171,5
171,5
30
-8
Источник
[5]
[5]
[4]
[5]
[4]
In-Tl
71
t.C
го
Tl.°/*fno массе)
6O
SO
too
ЬОО -
soo
2O0
WO
t.'c
155 -
150
15Б. БЭЧ
(Tn)
Ж
755
15 Ь°
I
о
л
I
I
I
I
I
a
О
In
Ю ZO SO
Те, °/о Cam.)
1O
2O JO
4 0 5 О БО
Tl,°/o f arrr.)
8O
SO
ЮО
ГС
Рис. 31. In-Tl
В системе In—T1 обнаружено существоварие только одной фазы а
со структурой типа Си (символ Пирсона C.F4, пр.гр. FmZm), с пара-
параметром а = 0,4745—0,4797 нм, увеличивающимся с ростом содер-
содержания Т1 [6].
Влияние давления на строение сплавов In с TI изучали в работах
[4, 5, 7]. Согласно работе [5] модификация Т1, стабильная при
высоком давлении, имеет ГЦК структуру. Тройная точка существова-
существования трех аллотропических форм Т1 отвечает давлению 3,85 ГПа и
температуре 162 °С.
Литература
1. Valenliner S. // Z. Metallkunde. 1940. Bd. 32. S. 244^-248.
2. Guttman L. // Trans. AIME. 1950. V. 188. P. 1472-1477.
3. Raynor G.V., Graham J. // Trans. Faraday Soc. 1958. V. 54. P. 161-173.
4. Kaufman L. // Acta Metall. 1961. V. 9. P. 896-897.
5. Meyerhoff R.W., Smith J.F. // Acta Metall. 1963. V. 11. N 6. P. 529-536.
6. Adler P.N., Margolin H. // Acta Mefall. 1961. V. 9. P. 896-897, // Trans. AIME.
1964. V. 230. P. 1048-1052.
7. Merrian M.F., Hagen J., Luo H.L. // Phus. Rev. 1967. V. 154. N 2. P. 424—435.
Н.И. Никитина
72
In—Tm
In—Tm. ИНДИЙ—ТУЛИЙ
Диаграмма состояния In—Tm (рис. 32) построена в работе [1].
Сплавы изготовляли длительным D00 ч) отжигом шихты, состоя-
состоящей из навесок чистых металлов, в герметично заваренных тиглях
из Та. При исследовании использовали Tm чистотой 99,9 % (по
массе) и In чистотой 99,999 % (по массе).
Исследование выполняли методами дифференциального термиче-
термического, микроскопического и рентгеноструктурного анализов.
t°r
1595°
1500
ftOO
1300
1200
1100
1000
900
в 00
100
600
500
«00
300
200
100
7
\
\Ч
V
V
1
1
i
\
Г Tm) \
10
/
/
1
А
V
V;
20
\
\поо°
1
tr*o°
1020°
\
12П
In, % (по массе)
40 60
I
¦
ЕЙ
/
/
j2m°
\
\/
-1010° i
~61
I
I
ж
030°
~вв
~99
1
1
\
1
106
0°
0°
-¦V.
во
1
\
N
156°
то
\
\
\
(In) —*
156,63*"
О 10
Тт
20
30
*0 50 60
In, % (am.)
70
вО 90 100
In
Рис. 32. In—Tm
In—Тт.
73
В работе [1] диаграмма состояния In—Tm построена с учетом
полиморфного превращения Tm, высказано предположение об эвтек-
тоидном распаде при 1020 °С твердого раствора на основе рТт.
В настоящее время доказано отсутствие полиморфизма в Tm [2, 3].
Поскольку авторы работы [1] экспериментально установили сущес-
существование двух горизонталей при 1140 и 1020 °С, а также линии
солидуса твердого раствора, на рис. 588 штриховой линией намечено
возможное строение диаграммы состояния In—Tm в области, богатой
Тт.
В системе In—Tm установлено существование пяти соединений:
Tmlnj, Tm3ln5 и Tm5ln3, плавящихся конгруэнтно при 1060, 1030 и
1270 С соответственно, и Tmln и Tm^In, образующихся по перитек-
тическим реакциям при 1210 и 1200 "С соответственно. Все соедине-
соединения, кроме Tm5ln3, обладают узкими областями гомогенности, отве-
отвечающими идеальной стехиометрии. Область гомогенности Tm5ln3 при
понижении температуры от точки плавления сначала увеличивается
до -44 % (ат.) In при 1210 °С, а затем уменьшается, становясь при
температурах ниже 1000 °С практически постоянной C7—40 %
(ат.) In).
Достоверно установлено существование трех эвтектических равно-
равновесий в системе In—Tm:
Ж * Tmln + Tmjn5 при -1010 °С и -61 % (ат.) In;
Ж * Tmln3 + Tm3ln5 при 990 °С и -68 % (ат.) In;
Ж * Tmln3 + (In) при -156 °С и -100 % (ат.) In.
Температура последнего вырожденного эвтектического равновесия
скорректирована в соответствии с температурой плавления In, у
авторов работы [1] она равна 160 °С.
Растворимости Tm в In практически не существует. Растворимость
In в (Tm) при температуре 1020 °С составляет -10 % (ат.) In, затем
уменьшается, становясь незаметной при температуре 800 "С.
Кристаллическая структура соединений приведена в табл. 38 по
данным авторов работы [4]. Структура соединения Tm3ln5 не уста-
установлена.
Таблица 38. Кристаллическая структура соединений системы 1п~Тт
Соединение
Тш21п
Тш51п3
Tmln
Tmln3
Прототип
Ni2ln
SijMrij
CsCl
AuCu3
Символ Пирсо-
Пирсона, пр.гр.
hP6,
Pbj/mmc
hPl6,
P63/mcm
cP2,
Ptribm
cP4,
Pmlm
Параметры решетки, нм
a
0,5274
0,8856
0,3729
0,4548
с
0,6621
0,6533
74
In—Tm, In—V
Литература
1. Yatsenko S.P., Semyannikov A.A., Shakarov H.O., Fedorova KG. // J. Less-
Common Met. 1983. V. 90. N 1. P. 95—108.
2. Gschneidner, Jr., K.A. // J. Less-Common Met. 1985. V. 114. N 1. P. 29—42.
3. Spedding F.H., Sandeen В., Beaudry B.J. // J. Less-Common Met. 1973. V. 31.
P. 1-13.
4. Гладышевский Е.И., Бодак О.И. Кристаллохимия интерметаллических соедине-
соединений редкоземельных металлов. Львов: Вища школа, 1982. 255 с.
А.С. Адамова
In—V. ИНДИЙ—ВАНАДИЙ
Диаграмма состояния In—V впервые была построена в работе [1],
в которой показано, что в системе существует расслаивание в жидком
состоянии. Предполагаемая температура монотектической реакции
-1900 °С. Соединение V3In, о существовании которого сообщалось в
работе [2], при атмосферном давлении не образуется. Высказано
предположение, что оно может быть получено при высоком гидроста-
гидростатическом давлении.
Термодинамический расчет диаграммы состояния в модели регу-
регулярных растворов с оценкой параметров взаимодействия по методу
[3] сделан в работе [4]. Результаты термодинамического расчета
хорошо согласуются с диаграммой состояния, данной в работе [1].
На рис. 33 представлена диаграмма состояния, построенная в
работе [4] на основе обобщения экспериментальных [1] и расчетных
Ъ с
2500
2000
1500
1000
500
10
V, % (по массе)
O SO 40 SO SO 70 80 ЭО 100
\j
11,5
156,634°
-*— (In)
Ж
1
21
Жт
t
80°
— —
tof 7
N
N.
89,
1
.7970°
0 \9JT5
r
\
о
In
Рис. 33. In-V
10
20
30
40 50 ВО
К % (am.)
70
во
ЭО
100
V
In-V, In-Y 75
данных. Подтверждена широкая область расслаивания в жидком
состоянии, определена температура монотектической реакции
1877 °С. Установлено, что критическая температура на куполе
расслаивания соответствует температуре 2850 "С при содержании
50 % (ат.) V.
Литература
1. Свечников В.Н., Пан В.М., Латышева В.И. // Металлофизика. 1970. Вып. 27.
С 175-177.
2. Савицкий Е.М., Барон В.В., Ефимов Ю.В. // Доклады АН СССР. 1966. Т. 171.
С. 331-332.
3. Miedema A.R., Niessen A.K. // Calphad. 1983. V. 7. P. 27-36.
4. Smith J.F., Lee K.J. // Bull. Alloy Phase Diagrams. 1985. V. 6. N 1. P. 66-68.
Л.Е. Шелимова
In-Y. ИНДИЙ-41ТТРИЙ
Диаграмма состояния In—Y построена в работе [1] (рис. 34).
Сплавы изготовляли длительным D00 ч) отжигом шихты, состоя-
состоящей из навесок чистых металлов, в герметично заваренных тиглях
из Та. В качестве исходных компонентов использовали Y чистотой
9,9 % (по массе) и In чистотой 99,999 % (по массе).
Исследование выполняли методами дифференциального термичес-
термического, микроскопического и рентгеноструктурного анализов.
Три из пяти обнаруженных двойных соединений — Y5In3, УЛп5
и YIn3 образуются с открытым максимумом при температурах 1340,
1140 и 1110 °С, а два соединения, Y2In и Yin, — в результате пери-
тектических реакций при температурах 1330 и 1220 °С соответ-
соответственно.
Все соединения, кроме Y5In3, обладают узкими областями гомо-
гомогенности. Область существования фазы Y5In3 при понижении темпе-
температуры от точки плавления сначала увеличивается, достигая макси-
максимальной протяженности при температуре 1220 °С, а затем уменьша-
уменьшается и при температуре ниже 900 °С ее протяженность практически
не меняется (около 37—38 % (ат.) In). ;
Нонвариантные реакции в системе In—Y представлены в табл. 39
в соответствии с данными работы [1].
Температура последнего, вырожденного эвтектического равновесия
скорректирована в соответствии с принятым значением температуры
плавления In (у авторов работы [1] эвтектическая температура
160 "О.
Растворимость Y в (In) практически отсутствует. При эвтектичес-
эвтектической температуре 1060 °С (pY) содержит в твердом растворе 15 %
(ат.) In.
76
In-Y
20
1п,°/о(по массе)
10 60
80
100
t,°C
1522°
Ю8°
1400
1J00
1200
1700
WOO
900
BOO
700
600
500
400
300
200
too
О 10 20 30 fO 50 ВО 70 80 90 100
Y In, "Afam.) In
Рис. 34. In-Y
§4
г
AxKH-
1
1330
/
/
1060°
7030°
1
о
\
13tl
1
\
!
7°
V
/
V
1090°
T
f\
1081
i
V
4
i
V
?°
4
\
I
(In)-*\
156.631°
In-Y
77
Таб
УК **
(PY)
Ж +
Ж +
Ж »
МУ-
ж »
лица 39. Нонвариантные реакции в системе
Реакция
(PY) + Y2In
» (aY) + Y2In
Y5In3 « Y2In
Y5In3 « Yin
Yin + Y3Inj
Y3In5 + YIn3
YIn3 + (In)
Содержание In в фазах,
18;
13;
-32;
52;
56;
68;
-100;
15;
8;
37,5;
47;
50;
62,5;
75;
In-Y
% (ат.)
33,33
33,33
33,33
50
62,5
75
100
Температура, °С
1060
1030
1330
1220
1090
1080
-156
Растворимость In в (aY) при эвтектоидной температуре 1030 °С
составляет 8 % (ат.), при понижении температуры растворимость
уменьшается и становится незначительной при 900 "С.
Кристаллическая структура соединений приведена в табл. 40 по
данным работы [2].
Таблица 40. Кристаллическая структура соединений системы In—Y
Соединение
Y2In
YsIn3
Yin
Y3Ins
YIn3
Прототип
Ni2ln
Mn5Si3
CsCl
Pd5Pu3
AuCu3
Символ
Пирсона,
пр.гр.
hP6,
РЬъ1ттс
№16,
P63/mcm
cPl,
РтЪт
OC32,
Cmcm
cP4,
РтЗт
Параметры решетки, нм
а
0,5365
0,8971
0,3806
0,988
0,4579
*
—
—
—
0,804
—
с
0,6778
0,6745
—
1,029
—
Литература
1. Yatsenko S.P., Semyannikov A.A., Shakarov H.O., Fedorova E.G. // J. Less-
Common Met. 1983 V. 90. N 1. P. 95—108.
2. Гладышевский Е.И., Бодак О.И. Кристаллохимия интерметаллических соедине-
соединений редкоземельных металлов. Львов: Вища школа, 1982. 255 с.
Е.И. Гладышевский, О.И. Бодак, В.К Печарский
78
In-Yb
In-Yb. ИНДИЙ-ИТТЕРБИЙ
Диаграмма состояния In—Yb построена в работе [1] и приведена
на рис. 35.
Методы получения сплавов и чистота компонентов не описаны.
Исследование выполнено методами дифференциального термического,
микроскопического и рентгеноструктурного анализов.
поо
ttoo
1000
900
ПК
800
793°
Yb)^f
600
500
fOO
300
200
WO
0
613°
\
20
i
1
810^^
0° У
690°
in,
]
/
/
/
"/fffno tiaece)
1
ж
/Об/"
/
820° 1
\
675°
60
I
\ 890
s
1
\
\
бзо°
80
\
\
\
"V
100
\
\
151°
a
n) -*•
1S6,63f°
О 10 10 30 40 50 60 70 вО 90 700
Yb In,'A(am.) In
Рис. 35. In-Yb
In-Yb
79
Два из пяти обнаруженных двойных соединений — Ybln2 и Ybln
образуются с открытым максимумом при температурах 890 и 1067 °С
соответственно, а три соединения, Yb5ln2, Yb2ln и Ybln3, — в резуль-
результате перитектических реакций при температурах 810, 820 и 630 °С
соответственно.
Достоверно установленные нонвариантные реакции в системе
In—Yb представлены в табл. 41 по данным работы [1].
la
блица 41. Нонвариантные реакции в системе
Реакция
(pYb) » (<xYb) + Ж
Ж
Ж
Ж
Ж
ж
Ж
» (aYb) + Yb5ln2
+ Yb2ln » Yb5ln2
+ Ybln » Yb2ln
» Ybln + Ybln2
+ Ybln2 » Ybln3
» Ybln3 + (In)
Содержание In в фазах,
-3;
12;
27;
30;
64;
86;
-100;
-2;
-1;
33,33;
46;
50;
66,64;
75;
In-Yb
% (ат.)
-7,5
28,6
28,6
33,33
60,64
75
100
Температура, °С
750
690
810
820
875
630
-154
Растворимости Yb в (In) практически нет. В (pYb) растворяется
-3 % (ат.) In при 750 °С, в (aYb) при этой же температуре -2 %
(ат.) In; при понижении температуры растворимость In в (aY) умень-
уменьшается и становится незаметной при 600 "С.
Все соединения, кроме Ybln, обладают узкими областями гомоген-
гомогенности. Область твердого раствора на основе фазы Ybln при пониже-
понижении температуры от точки плавления до 820 °С увеличивается, затем
уменьшается и при температуре ниже 600 "С становится практически
постоянной в пределах около 49—50 % (ат.) In. У соединения Yb2ln
найдено полиморфное превращение при температуре 675 °С с по-
помощью метода дифференциального термического анализа, не под-
подтвержденное другими методами. На диаграмме состояния это превра-
превращение намечено штриховой линией.
Кристаллическая структура соединений приведена в табл. 42 по
данным работ [1,2].
80
In—Yb, In-Zn
Таблица 42. Кристаллическая структура соединений системы In—Yb
Соеди-
Соединение
Ybjln2
Yb2ln
Ybln
Ybln2
Ybln3
Прото-
Прототип
-
Co2Si
CsCl
Caln2
AuCu3
Символ
Пирсона,
пр.гр.
—,
ДЗс
оРП,
Рпта
сР2,
Ртгт
hP6,
Р63/ттс
сРА,
РтЪт
Параметры решетки,
а
0,947
0,7072
0,38204-0,38076
0,38124-0,38071
0,48908
0,46145
Ь
—
0,5340
—
—
—
-
нм
с
5,405
0,9866
—
—
0,76406
-
Примечание
—
—
Отжиг при тем-
температуре 800 "С
Отжиг при тем-
температуре 300 "С
—
-
Литература
1. McMasters O.D., Nipper C.L., Gschneidner, Jr.,K.A. // J. Less-Common Met.
1971. V. 23. N3. P. 253-262.
2. Гладышевский Е.И., Бодак О.И. Кристаллохимия интерметаллических соедине-
соединений редкоземельных металлов. Львов: Вища школа, 1982. 255 с.
А. С. Адамова
In-Zn. ИНДИЙ-ЦИНК
Диаграмма состояния In—Zn исследована в работах [1—8] метода-
методами термического, микроструктурного, рентгеновского и термодинами-
термодинамического анализов. Она представляет собой диаграмму эвтектического
типа с небольшой взаимной растворимостью компонентов в твердом
состоянии. Данные различных авторов отличаются положением
эвтектической точки в системе и величиной взаимной растворимости
металлов в твердом состоянии.
На рис. 36 приведена обобщенная диаграмма состояния системы
In—Zn, построенная в работе [9] с учетом всех литературных экспе-
экспериментальных данных, а также термодинамических расчетов. По
данным работы [9], эвтектика в данной системе кристаллизуется при
температуре 143,5 °С и содержании Zn в эвтектической точке 3,8 %
(ат.) или 2,2 % (по массе). Максимальная растворимость Zn в (In)
при эвтектической температуре равна 2,06 % (ат.), максимальная
растворимость In в (Zn) предположительно составляет 0,12 % (ат.)
[9]. Твердые растворы (In) и (Zn) имеют соответственно тетраго-
тетрагональную и ГПУ решетки.
In—Zn
81
Zn, % (no массе)
20 40
BO
BO 100
400
3S0
300
250
200
756,634°
150
100
/
In)
i- Ж
.
n)
U3Л
——
4
"
(Zn
13,58'
0 Ю 20 30 40 50 SO 10 80 90 Ю0
In 277,% (am.) In
Рис. 36. In—Zn
Сведения о температуре эвтектики и содержании Zn в эвтектике
приведены в табл. 43.
Таблица 43. Концентрацией температура эвтектики в системе In—Zn
Содержание Zn в эвтекти-
эвтектике, % (по массе)
-4,0
4,27
2,8
2,0
1,8±0,1
2,2
Температура эвтектики, °С
143,5
141,5
143,5
-
144±1
143,5
Источник
[1]
[2]
[3]
[5]
[6]
[8]
Растворимость Zn в (In) находится в пределах 0,2 [6] — 1,2 % (по
массе) [3], а растворимость In в (Zn) — < 0,1 [3] — 3,12 % (по
массе) [2].
По данным работы [9] в системе In—Zn присутствует промежу-
промежуточная фаза InZn8, кристаллическая структура которой отлична от
структур Zn и In.
82 In-Zn, In-Zr
Литература
1. Wilson C.L., Peretti E.A. // Ind. Eng. Chem. 1936. V. 28. P. 204-205.
2. Valentiner S. // Z. Metallkunde. 1943. Bd. 35. S. 250-253.
3. Rhines E.N., Grode A.H. // Trans. AIME. 1950. V. 188. P. 890-891.
4. Carapella S.C., Peretti E.A. // Trans. AIME. 1950. V. 188. P. 890—891.
5. Svirbely W.J., Selis S.M. // J. Amer. Chem. Soc. 1953. V. 75. P. 1532-1535.
6. Oelsen W., Zflhlke P. // Archie Eisenhiittenwesen. 1956. Bd. 27. S. 743—752.
7. Марченко Л.А., Терехова Л.С. // Вестник Харьковского политехнического
института. 1968. № 32. С. 24.
8. Nishimura G.S., Fidler R.S., Taylor R.M., Smith R.W. // Can. Met. Quart. 1969.
V. 8. P. 319-322.
9. Dutkiewicz J., Zakulski W. // Bull. Alloy Phase Diagrams. 1984. V. 5. N 3.
P. 284-289.
Н.П. Абрукина
In-Zr. ИНДИЙ-ЦИРКОНИЙ
Строение сплавов системы In—Zr в области концентраций 0—26 %
(ат.) In и интервале температур 550—1300 °С исследовали в работе
[1]. Сплавы готовили дуговой плавкой из йодидного Zr чистотой
99,95 % и In чистотой 99,99 %, исследовали металлографическим
методом.
Диаграмма состояния In—Zr приведена на рис. 37 в соответствии
с данными работы [1] в области концентраций 74—100 % (ат.) Zr. In
повышает температуру превращения. «Zr » PZr. При температуре
1003±20 °С происходит перитектоидная реакция (pZr) + у » (aZr)
(у — это фаза на основе соединения Zr3ln). Растворимость In в (PZr)
при температуре перитектоидной реакции равна 9,3 % (ат.), макси-
максимальная растворимость в (aZr) — 10,1 % (ат.). Даже незначительное
количество примесей приводит к появлению трехфазной области
(aZr) + (PZr) + у вместо перитектоидной горизонтали. Фаза на основе
Zr3ln имеет область гомогенности 77,6—73,9 % (ат.) Zr [1], согласно
данным работы [2] сплав, содержащий 72 % (ат.) Zr, также нахо-
находится в пределах области гомогенности после отжига при 800 °С в
течение 65 ч. По-видимому, фаза на основе Zr^In плавится конгруэн-
конгруэнтно и с твердым раствором на основе pZr образует эвтектику при
концентрации -79—78 % (ат.) Zr. В системе найдены также соедине-
соединения Zr2ln, Zrln2, Zrln и Zrln3 13—5].
Соединение Zrln было обнаружено в сплаве эквиатомного состава
после отжига при 920 °С, а в сплаве, содержащем 55 % (ат.) Zr и
45 % (ат.) In, после отжига при 700 °С в равновесии находились
Zr2ln и Zrln2. Поэтому был сделан вывод о существовании Zrln
только при высоких температурах. Не исключается возможность
стабилизации Zrln примесями, например, О [4].
Кристаллическая структура соединений приведена в табл. 44.
In-Zr
83
0
10
21
-Zrin
\
—
Zr,'/, (no пассе)
30 10 SO
-Zrin
\
_i
и
_i
i
->
4
I
—
i
(¦
f
:
\
—
80
X
\
1
mat го
100
1
zr)
90,7
7%K
\hzr)
\
\
вез"
t,V
1300
1200
1100
1000
900
800
700
600
500
WO
300
0 10 20 30 tO 50 SO 10 вО 90 100
In Zr,'/.(am.) Ir
Рис. 37. In—Zr
Таблица 44. Кристаллическая структура соединений системы In—Zr
Соединение
Zrln3
Zr2ln*
Zrin
Zrln2
Zrln3 (HT)
Zrln3 (ВТ)
Прототип
AttCiij
—
Си
HfGa2
ZrAl3
TiAlj
Символ
Пирсона,
пр.гр.
сР4,
РтЪт
—
cFA,
Fm3m
tB4.
IAjamd
(/16,
/4/mmm
H8,
] 4/mmm
'Тетрагональная сингония.
Параметры
a
0,446
0,442
0,4418
0,4385
0,4303
0,4238
эешетки, им
с
—
0,446
-
2,723
1,894
0,9786
Источник
[6]
[3]
[4]
[4,5]
[4,5]
[4,5]
84 In-Zr, [r—La
Согласно анализу [7] с использованием уравнений Гильдеб-
ранда — Мотта предположено существование в системе In—Zr области
несмешиваемости в жидком состоянии.
Литература
1. Betterton J.O., Noyce W.K. // Trans. AIME. 1958. V. 212. P. 340-342.
2. Anderko К. // Z. Metallkunde. 1949. Bd. 49. N 4. S. 165-172.
3. Schubert K., Meissner H.G., Raman A., Rossteutscher A. // Naturwissenschaften.
1964. Bd. 51. N 12. S. 287.
4. Raman A., Schubert K. // Z. Metallkunde. 1965. Bd. 56. N 1. S. 44-52.
5. Schubert K., Frank K., Gohle R. u a. // Naturwissenschaften. 1963. Bd. 50. N 2.
S. 41.
6. Schubert K., Meissner H.G., PStzschke M. et al. // Naturwissenschaften. 1962.
Bd. 49. N 3. S. 57.
7. Dasarathy С // Trans AIME. 1969. V. 245. N 9. P. 2015-2019.
JI.A. Третьяченко
Ir-K. ИРИДИЙ-КАЛИЙ
Диаграмма состояния Ir—К не построена.
Имеются сведения о том, что при выдержке проволоки из Ir
диаметром 4 мм в расплавленном К при температурах 110 и 260 "С
в течение 6 ч никакого взаимодействия между Ir и К не обнаружено.
Литература
1. Вол А.Е., Каган И.К. Строение и свойства двойных металлических систем. М.:
Наука, 1976, Т.З. 815 с.
А. С. Адамова
Ir-La. ИРИДИЙ-ЛАНТАН
Диаграмма состояния (рис. 38) построена на основании данных
дифференциального термического анализа и измерения температуры
плавления с помощью оптического пирометра, микроструктурного и
рентгеноструктурного анализов [1]. Диаграмма состояния Ir—La
характеризуется образованием десяти соединений и малой взаимной
растворимостью компонентов друг в друге. Диаграмма состояния
системы в интервале концентраций 0—50 % (ат.) Ir построена на
основании термического анализа. Обнаруженные в этой области
соединения IrLa^i IrL^, IrgLa^, 1г2Ьаз и 1^1л образуются по перитек-
тическим реакциям при температурах 820, 1000, 1140, 1165 и
1180 °С соответственно и имеют узкие области гомогенности.
Соединение Ir2La образуется, вероятно, конгруэнтно при темпера-
температуре -2520 "С.
Установлено эвтектическое взаимодействие Ж « (pLa) + IrLa4 при
температуре 730 °С и содержании 93 % (ат.) La.
Ir-La
85
W
La,% (no массе)
20 30 40 50 60 70 60 90 100
2500
2000
1500 p
/000
500
¦24W-
ч
\
1
1
1 -
i *•
и"
!
1 О
*- -а
ч
fcy
1
2520°
\
\
\
.л
1
1165"
К
\
1140°
к
ж
I
1000°
t
730" 93±2
91в°
OSS"
О 10 20 30 40 50 ВО 70 80 90 100
Ir la,%(am) ia
Рис. 38. Ir-La
Кристаллическая структура установлена только для соединений
Ir3La, Ir7La2, Ir5La, Ir2La и приведена в табл. 45.
Таблица 45. Кристаллическая структура соединений системы Ir—La
Соединение
Ir3La
Ir7La2
Ir5La
Ir2La
Прототип
NijPu
Ni7Ce2
Cu5Ca
Cu2Mg
Символ
Пирсона,
np.rp.
—,
Ют
W36,
Р63/ттс
hP6,
P6/mmm
cF24,
FcfS m
Параметры
a
0,5370 C)
0,538 (r)
0,5399 C)
0,7686
решетки, нм
с
2,634 (I)
2,582 B)
0,4203 C)
—
Источник
[1,2]
[1,2]
[1,2]
[3]
Литература
1. Дмитриева В.Н., Воробьев В.Д., Вареха Л.М. и др. // Металлофизика. 1974.
Вып. 52. С. 121-123.
2. Воробьев В.Д., Мельникова В.А. // Кристаллография. 1974. Т.19. № 3.
С 642-643.
3. Compton V.B., Matlhias B.T. // Acta Crystallogr. 1959. V. 12. P. 651-654.
В. П. Полякова
86
Ir-Li, Ir-Lu
Ir-Li. ИРИДИЙ-ЛИТИЙ
Диаграмма состояния Ir—Li не изучена.
В работе [1] синтезировали отдельные химические соединения Ir
с Li, и с помощью рентгеновского и нейтронографического анализов
была изучена их структура.
Кристаллическая структура синтезированных соединений Ir с 1л,
по данным работы [1], представлена в табл. 46. Оба соединения
имеют область гомогенности.
Таблица 46. Кристаллическая структура соединений системы Ir—Li
Соединение
IrLi
Ir3Li
Прототип
RhLi
Символ
Пирсона,
пр.гр.
hP2,
Р6т2
о/8,
1тт2
Параметры решетки, нм
а
0,26490-
0,26505
0,26724-
0,26722
Ь
0,86969-
0,86933
с
0,43968-
0,43989
0,46706-
0,46700
Литература
1. Donkersloot H.C., Van Vucht J.H.N // J. Less-Common Met. 1976. V. 50. N 2.
P. 279-282.
Л.Л. Зусман
Ir-Lu. ИРИДИЙ-ЛЮТЕЦИЙ
Фазовые равновесия в системе не исследовались. Известно о
существовании в системе соединений: Lulr, Lulr2 и LuAt2 [I, 2, Ш].
Их кристаллическая структура представлена в табл. 47.
Таблица 47. Кристаллическая структура соединений системы Ir—Li
Соедине-
Соединение
Lulr2
Lulr
Lu5lr2'
Прототип
MgCu2
CsCl
Символ
Пирсона,
пр.гр.
CF24,
Fd3m
сР2,
РтЪт
—
Моноклинная сингония, Р ~ 96
Параметры решетки, нм
а
0,7462
0,3332
1,5062
Ь
—
—
0,6279
с
—
—
0,7073
,94°.
Источник
[1,Ш]
[1,Ш]
[1,2]
Ir—Lu, Ir—Mg
87
Литература
1. Благородные металлы: Справочник / Под ред. Е.М. Савицкого. М.: Металлур-
Металлургия. 1984. 592 с.
2. Le Roy J., Paccard D., Moreau J.-M. // Less-Common Met. 1980. V. 72. N 1.
P. 11-15.
В.П. Полякова
Ir-Mg. ИРИДИЙ-МАГНИЙ
В работе [1] методами термического, рентгеновского и микрос-
микроструктурного анализов исследовали диаграмму состояния Ir—Mg со
стороны Mg — до 75 % (по массе) 1г. Термический анализ сплавов
проводился лишь до концентраций 1г 16 % (по массе). Со стороны
Mg диаграмма состояния (рис. 39) характеризуется эвтектическим
превращением, протекающим при 615 °С. Концентрация эвтектичес-
эвтектической точки, установленная экстраполяцией кривой ликвидуса до
эвтектической горизонтали, составляет около 20,7 % (по массе) Ir
или 3,2 % (ат.) 1г. Растворимость Ir в твердом Mg не превышает
1,4 % (по массе) или 0,18 % (ат.) [Ш].
В системе Ir—Mg установлено образование двух промежуточных
фаз: С при концентрациях около 50 % (по массе) Ir и б при 72,5 %
(по массе) Ir, отвечающей формуле Mg3lr. Высказывается также
предположение о возможности образования фазы с формулой Mg4lr.
Кристаллическая структура соединений приведена в табл. 48 по
данным работы [1].
t,'c
650°
BtO
620
BOO
0,5
Ir,'/ofam.)
г
580
1
\
1
\
\
\
1
"^—(на)
\
\
i
615°
Ж
Ч
/
10,1
0
¦10 15 20
1г,% (по пассе)
25
Рис. 39. Ir-Mg
88
Ir—Mg, Ir—Mn
Таблица 48. Кристаллическая структура соединений системы Ir—Mg
Соединение
С*
8 (Mg3lr)
Прототип
Na3ln
'Кубическая сингония.
Символ
Пирсона,
пр.гр.
ЛР8,
РЬ31ттс
Параметры решетки,
нм
а
2,012
2,010
0,4549
с
0,8229
Примечание
При концентрации
50 % (по массе) Ir
При концентрации
52 % (по массе) Ir
Литература
1. FerroR., Rambaldi G., Capelli R. // J. Less-Common Met. 1962. V. 4. N 1.
P. 16-23.
Л.Л. Рохлин.
Ir-Mn. ИРИДИЙЫМАРГАНЕЦ
Диаграмма состояния Ir—Mn полностью не построена. Рентгеног-
Рентгенографическими и металлографическими исследованиями в работе [1]
установлены границы фазовых областей (рис. 40).
Растворимость Мп в (Ir) составляет 48 % (ат.) при 1350 °С и
уменьшается до 41 % (ат.) при 650 °С. Промежуточная фаза pj
.0 1020 30 40 50 60
Ir, % (по пассе)
70 80
1300
1100
300
727°
700
500
300
О Ю 20 30 40 50 ВО
Мп Ir, % (am.)
70
ВО
ЭО
100
1 Г
-1246°
- пзв°
г 1100°
; 1
i i
(тип)
Мп) /
1
1
1
1
Г'Мп
_]
п
1
]
\
И
\
\
Рг
\
\
\
\ \
\ \
1 •
1 1
1
1
1
1
1
(ir)
100
Ir
Рис. 40. Ir—Mn
Ir—Mn, Ir—Mo
89
существует в интервале концентраций -50—64 % (ат.) Мп. При
температуре выше 940 °С, по данным металлографических исследо-
исследований, существует высокотемпературная модификация, вероятно, со
структурой типа CsCl.
Максимальная растворимость 1г в (уМп) составляет 32,5 % (ат.)
в (рМп) -2,5 % (ат.) и в (аМп) -4,5 % (ат.). В твердом растворе на
основе уМп при температуре ниже 900 °С вблизи состава Mn3lr
происходит упорядочение с образованием фазы у'Мп.
Кристаллическая структура промежуточных фаз представлена в
табл. 49.
Таблица 49. Кристаллическая структура соединений системы In—Мп
Соедине-
Соединение
р;
у'
Прото-
Прототип
AuCu3
Тетрагональная
Символ
Пирсона,
пр.гр.
сР4,
РтЪт
сингония.
Параметры решет-
решетки, нм
а
0,273
0,3776
0,3794
с
0,370
Примечание
При концентрации 50 % (ат.)
Мп [1]
При концентрации 79,4 %
(ат.) Мп, отжиг при 500 "С
[1]
При концентрации 70 % (ат.)
Мп, отжиг при 500 "С [1]
Литература
1. Raub E., Mahler W. // Z. Metallkunde. 1955. Bd. 46. S. 282-290.
2. Вол А.Е., Каган И.К. Строение и свойства двойных металлических систем. М.:
Наука, 1976. Т.З. 815 с.
А.Л. Татаркина
Ir-Мо. ИРИДИЙ-МОЛИБДЕН
Диаграмма состояния (рис. 41) построена на основании данных
микроструктурного, рентгеновского, микрорентгеноспектрального
анализов, измерения твердости и определения температуры плавле-
плавления. Сплавы выплавляли из Ir и Мо чистотой * 99,9 % (по массе)
[1—8]. В системе существуют четыре промежуточные фазы: Molr3,
е, о и Мо31г, а также области твердых растворов на основе иридия
(Ir) и молибдена (Мо). При температуре 1610±10 °С фаза е претер-
претерпевает упорядочение е » Molr.
90
lr-Mo
t°C 0 10 20 30 40 SO
2800
2SOO
2400
2447'
1200
О
Mo
Рис. 41. Ir—Mo
Нонвариантные реакции в системе Ir—Mo представлены в табл. 50
по результатам работ [1—8].
Таблица 50. Нонвариантные реакции
Реакция
Ж + (Мо) - Мо31г
Ж + Мо31г - о
о « Мо31г + с
Ж « о + с
с « Mo3lr + Molr
с « Molr + Molr3
Ж + Molr3 « с
Ж + (Ir) - Molr3
Содержание
30;
30,5;
29;
31;
43;
-56;
58;
-67;
в системе
Ir в фазах,
16;
25;
25;
29;
25;
51;
-63;
78;
Ir-Mo
% (ат.)
25
29
38
37
49
-66
60
75
Температура, °С
2110±10
2095±15
1975±5
2080±5
-1400
-1420
2270
2300
Граница растворимости Ir в (Мо) в интервале температур 1327—
2109 °С может быть описана уравнением
In* = -5,9 + 0,81пГ - 5380/7,
где х — атомная доля Ir; T — температура, К.
Ir-Mo
91
Растворимость Мо в (Ir) изменяется с температурой. Богатая Мо
граница фазы е может быть описана уравнением:
1пх = —1,37+(—900/Г) б интервале температур A400 ± 100 —
- 2080 ± 5) °С;
богатая Ir граница фазы е:
Ых = —0,38 — 330/7 в интервале температур A427 ± 100 —
— 2270 ± 20) °С.
Кристаллическая структура соединений приведена в табл. 51.
Таблица 51. Кристаллическая структура соединений системы Ir—Мо
Соедине-
Соединение
Mo3lr
а (Мо71г3)
Е
Molr
Molr3
Прото-
Прототип
Cr3Si
oFeCr
Mg
P'AuCd
SnNi3
Символ
Пирсона,
пр.гр.
сРЪ,
Pmin
tP30,
Р42/тпт
hP2,
Р6г/ттс
оЯ4,
Рпта
hPS,
Р63/ттс
Параметры решет-
решетки, нм
а
0,49790
0,49680
0,9631
0,964
0,2784
0,2770
0,2770
0,2749
0,2745
0,4429
0,5487
с
0,4957
0,496
0,4482
0,4450
0,4424
0,4389
0,4383
0,2752
0,4385
Примечание
При концентрации Ir, %
(ат.):
22 [4]
25 [4]
28 [2, 4, 9, 10]
29 [2, 4, 9, 10]
38 [2, 4, 9, 10)
45 [2, 4, 9, 10)
51 [2, 4, 9, 10]
70 [2, 4, 9, 10]
75 [2, 4, 9, 10]
[4]
[6]
Литература
1. Raub Е. // Z. Metailkunde. 1954. Bd. 45. S. 23-30.
2. Knapton A.G. // J. Inst. Mel. 1958-1959. V. 87. P. 28-32.
3. Raub E. // J. Less-Common Met. 1959. V. 1. P. 3-18.
4. Michalik S.J., Brophy J.H. // Trans. AIME. 1963. V. 227. P. 1047-1053.
5. Raub E. // Z. Metallkunde. 1964. Bd. 55. N 4. S. 195-199.
6. Giessen B.C., Jaehnigen U., Grant N.J. // J. Less-Common Met. 1966. V. 10.
P. 147-150.
7. Knapton A.G. // Constitution of Binary Alloys. Ohio: Metal Park, 1973. P. 312; 365.
8. Brewer L,, Lamoreaux R.H. // Atomic Energy Rewiew, Issue N 7. Molybdenum:
Physico-Chemical Properties of its Compounds and Alloys. Vienna: International Atomic
Energy Agency, 1980. P. 195—356.
9. Brucl C.E. // Monatsh. Chem. 1972. Bd. 103. P. 820-830.
10. Spooner F.J., Wilson C.G. // Acta Crystallogr. 1964. V. 17. P. 1533-1538.
К.Б. Поварова
92 Ir—N, Ir—Na, Ii^-Nb
Ir-ЧЧ. ИРИДИЙ-АЗОТ
Диаграмма состояния Ir—N не построена. Ir, по-видимому, не
соединяется с N и не растворяет его, так как при нагреве Ir в N2 без
примеси О2 при 1500—2150 °С не обнаружены потери массы. Не
наблюдается поглощения N и при нагреве тонкоизмельченного Ir на
воздухе при 900—1040 "С [1].
Литература
1. Вол А.Е., Каган И.К. Строение и свойства двойных металлических систем. М.:
Наука, 1976. Т.З. 815 с.
А.С. Адамова
Ir-Na. ИРИДИЙ-НАТРИЙ
Диаграмма состояния Ir—Na не построена. Есть сведения, что Ir
в виде проволоки диаметром 4 мм не реагирует с жидким Na при
нагреве в течение 6 ч при температурах 150 и 300 °С [1].
Результаты прогноза образования химических соединений при
помощи расчета на ЭВМ указывают на то, что в системе Ir—Na
должны существовать соединения Ir3Na, Ir2Na, IrNa, IrNa2 и IrNa3
[2-5].
Литература
1. Вол А.Е., Каган И.К. Строение и свойства двойных металлических систем. М.:
Наука, 1976. Т.З. 815 с.
2. Савицкий Е.М., Девингталь Ю.В., Грибуля В.Б. // Доклады АН СССР. 1968.
Т.183. № 5. С. 1110-1112.
3. Савицкий Е.М., Девингталь Ю.В., Грибуля В.Б. // Доклады АН СССР. 1969.
Т. 185. №3. С. 561-563.
4. Савицкий Е.М., Грибуля В.Б. // Доклады АН СССР. 1970. Т.190. № 5.
С. 1147-1150.
5. Савицкий Е.М., Грибуля В.Б. // Доклады АН СССР. 1972. Т.206. № 4.
С. 848-851.
А.С. Адамова
Ir-Nb. ИРИДИЙ—НИОБИЙ
Диаграмма состояния Ir—Nb (рис. 42) построена по данным метал-
металлографического и рентгеновского анализов сплавов, приготовленных
из Nb чистотой 99,8 % (по массе) и Ir чистотой 99,9 % по массе [1].
Температура солидуса в некоторых случаях определена с,помощью
оптического пирометра.
В системе Ir—Nb образуются пять промежуточных фаз: Nb3lr, a,
etj, а? и Nblr3. Температуры плавления Nb,Ir и Nblr3 — около 2130
и 2440 °С соответственно. Фазы а, а1? а2 образуются по перитекти-
ческим реакциям соответственно при -2060, -1900 и -1985 °С.
Эвтектические реакции Ж •* (Nb) + Nb3lr, Ж « а + at, Ж •» Nblr3 +
+ (Ir) протекают при температурах 2110, 1840 и 2400 °С соответ-
соответственно.
93
t~C
2500
2400
2300
2200
2100
2000
1900
1800
1700
1600
1500
1400
Ir, % (no массе)
0 10 20 SO 40 50 60 70 75 80 85 30 95 100
>2489
^\
\
\
о
\
\
«?*
112 2U
(Nb) Ц
Zl
1
\
29)
»
-206С
S3
J
\
Hi
а
Ж
>
/
1
1
vX
45 52
а,--
•
«Z
/
j
\
I \2400"
f 80k \84
\
Г
1
1
1
1
1
1
1
(Ir)
0 10 20 30 40 50 SO 70 80 90 100
Nb Ir,%(am.) Ir
Рис. 42. Ir-Nb
Кристаллическая структура соединений по данным работы [1]
представлена в табл. 52.
Твердый раствор на основе Nb в зависимости от содержания в нем
Ir имеет следующие параметры решетки [2]:
Содержание Ir, % (ат.). .
Параметр решетки а, нм.
0 4,8 7,2
0,3301 0,3285 0,3273
Твердый раствор на основе Ir в зависимости от содержания в нем
Nb имеет следующие параметры решетки [2]:
Содержание Nb, % (ат.).
Параметр решетки а, нм.
0 5 10,3
0,3839 0,3850 0,3862
94
Ir-Nb, Ir-Nd
Таблица 52. Кристаллическая структура соединений системы Ir—Nb
Соеди-
Соединение
Nbjlr
а
«1
«2
Nblr3
Прото-
Прототип
Cr3Si
aFeCr
AuCu
—
CujAu
Символ
Пирсона,
пр.гр.
сРЬ,
РтЗп
tP3O,
Р42/тпт
tP2,
Р4/тпт
Ртст
сР4,
РтЗт
Ромбическая сингония.
Параметры решетки, нм
а
0,51323C)
0,98888D)
0,4027B)
0,2823A)
0,3889B)
Ь
—
—
—
0,4818B)
с
—
0,5065B)
0,3863B)
1,3619
Примечание
При концентрации
Ir, % (ат.): 25
34,9
52,5
—
75
Литература
1. Giessen B.C., Koch R., Grant N.J. // Trans. AIME. 1964. V. 230. P. 1268-1273.
2. Giessen B.C., Grant N.J. // Acta Crystallogr. 1964. V. 17. P. 615-616.
EM. Шефтель
ir-m иридий^еодим
Диаграмма состояния системы не построена. Исходя из анализа
известных диаграмм состояния Ir с РЗМ, следует ожидать малой
взаимной растворимости компонентов друг в друге и образования в
системе семи — девяти промежуточных фаз. Известно о существова-
существовании в системе соединений Ndlr, [2] и Nd5lr2 [3] и предполагается
существование соединения Nd7Lr3 И] •
Кристаллическая структура соединений системы Ir—Nd приведена
в табл. 53.
Таблица 53. Кристаллическая структура соединений системы Ir—Nd
Соедине-
Соединение
Ndlr2
Nd5lr2*
Nd7lr3
*P - 96,
Прототип
MgCu2
MgjC2
Th7Fe3
7°.
Символ
Пирсона,
пр.гр.
с/24,
Fd3m
—
hP20,
P63mc
Параметры решетки, нм
а
0,7605
1,6413
Ь
-
0,6584
с
-
0,7309
Источник
[2]
[3]
[4]
Ir-Nd, /r-M 95
Литература
1. Благородные металлы: Справочник / Под ред. Е.М. Савицкого. М.: Металлур-
Металлургия. 1984. 592 с.
2. Compton V.B., Matthias B.T. // Acta Crystallogr. 1959. V. 12. N 7. P. 651-654.
3. Le Roy J., Paccard D., Moreau J.-M. // Less-Common Met. 1980. V. 72. N 1.
P. 11-15.
4. Olcese G.L. // J. Less-Common Met. 1973. V. 33. N 1. P. 71-81.
В.П. Полякова
Ir-Ni. ИРИДИЙ-НИКЕЛЬ
Методами рентгеновского анализа, измерения магнитной воспри-
восприимчивости, электронной теплоемкости и температуры Дебая сплавов
установлено, что Ir и Ni обладают неограниченной растворимостью
в жидком и твердом состояниях [1, 2]. Сплавы системы Ir—Ni во
всем интервале составов имеют ГЦК структуру [1]. Параметры
решетки сплавов с 50 и 75 % (ат.) Ir, отожженных при 800 °С в
течение 7,5 месяцев, составляют а = 0,3711 нм и а = 0,3785 нм
соответственно [2].
В работе [3] при исследовании системы Ir—Ni методом диффузи-
диффузионных слоев было обнаружено явление упорядочения в твердом
состоянии с образованием трех фаз: Ni3lr, Nilr, Nilr3 (рис. 43).
Диффузионную пару получали специальным методом сварки с ис-
использованием кратковременно действующих давлений и отжигали
при 80—1300 °С. Образцы после отжига исследовали методами мик-
микроструктурного, рентгенофазового и микрорентгеноспектрального
анализов.
Литература
1. Bucher E., Brinkman W.F., Maita J.P., Cooper A.S. // Phys. Rev. 1970. V. 1.
P. 274-277.
2. Raub E., Roschel E. // Z. Metallkunde. 1970. Bd. 61. S. 113-115.
3. Архангельская О.В., Куприна В.В., Полкопина О.Ф. Диаграммы состояния в
материаловедении: Сб. статей. Киев: Наукова Думка, 1984. С. 106—111.
А.Л. Татаркина
96
Ir-Ni
Ir. '
0 2O 40 60
t, С
24OO
23OO
22OO
210O
20O0
19OO
Г8ОО
17OO
1SO0
15OO
1400
13OO
7200
1100
WOO
9OO
800
Рис. 43.
i
/
455
1
/
О
J
j
1
\
W
1 1
Ж
/
0 Ю 2О SO 4
Nl
Ir-Ni
Vo (по массе)
80
4
У
(NL
1
У
s
У
ir)
/
II
n
II
jj
j
1
90 100
I
/
I
I \
I i
г
у
/
/
0 5O БО 7О 80 90 WO
Ir, V» fam.) Ir
Ir-O, Ir-Os 97
Ir-O. ИРИДИЙ^СИСЛОРОД
В системе Ir—О существует одно соединение в твердом состоя-
состоянии — 1гО2 [1]. Его образование наблюдалось при окислении Ir при
температурах выше 600 °С. Образование пленки 1гО2 на Ir при
нагреве до 550 "С наблюдалось после выдержки в течение 18 ч, при
нагреве до 600 °С — через 45 мин, а при нагреве до 700 "С — через
90 с. При нагреве соединение 1гО2 разлагается: после отжига при 750
и 850 °С наряду с линиями оксида на рентгенограммах обнаружены
также линии Ir, а после отжига при 900 °С — только линии Ir [2].
В работе [1] показано, что при нагреве Ir и 1гО2 в токе О2 при
1130—1150 °С происходит их улетучивание с образованием газообраз-
газообразного 1гО3, который устойчив до 1700 "С. При нагреве Ir в токе О2
возможно также образование газообразного оксида 1г2О3 [2].
Соединение 1гО2 имеет структуру типа ТЮ2 (символ Пирсона tP6,
пр.гр. Р421тпт, параметры решетки а = 0,450 нм, с = 0,315 нм [3],
а = 0,4983 нм, с = 0,3154 нм [4].
Литература
1. Schafer H., Heitland H.J. // Z. Anorg. All. Chem. 1960. Bd. 304. S. 249-265.
2. Вол А.Е., Каган И.К. Строение и свойства двойных металлических систем. М.:
Наука, 1976. Т.З. 815 с.
3. Schneider SUL, Waring J.L., TresslerR-E. // J. Res. Natl. Bur. Siandards A. 1965.
V. 69. P. 245. i
JI.E. Шелимова
Ir-Os. ИРИДИЙ-ОСМИЙ
Диаграмма состояния Ir—Os (рис. 44) построена в работе [1] на
основании данных металлографического, пирометрического и качес-
качественного рентгенофазового анализов.
Сплавы выплавляли в дуговой печи из исходных компонентов Ir
и Os чистотой 99,8 % (по массе). Диаграмма состояния является
системой простого перитектического типа с широкими областями
твердых растворов на основе компонентов. Перитектичесхая реакция
протекает при 266О±35 °С. Взаимная растворимость компонентов
мало изменяется с температурой. При 2200 °С растворимость Os в
(Ir) и Ir в (Os) составляет 42 и 36 % (ат.) соответственно. По дан-
данным работы [2], растворимость Ir в (Os) значительно меньше.
Литература
1. Reiswig R.D., Dickinson JM. II Trans. AIME. 1964. V. 230. P. 469—472.
2. Geballe Т.Н., Matthias B.T., Compton V.B. et all. // Phys. Rev. 1963. V. 129.
P. 182-183.
JI.E. Шелимова
98
Ir-Os
а го
t °с
28OO
26OO
24-О О
2ООО
fffoO
16 О О
f4OO
f2OO
tooo
(Ir)
-<
OS. ',
'<. Cnc
4О 6О
TSO ±
^/
/
/
I
1
\
80 10
у
(
9s)
7ОЗЗ'
—'"?
О 1O 2O JO UO SO SO 7O 8O SO tOO
In Os, a/° farn) OS
Рис. 44. Ir-Os
Ir~P
99
Ir-P. ИРИДИЙ-ФОСФОР
Диаграмма состояния 1г—Р (рис. 45) построена с помощью методов
рентгеновского анализа, измерения упругости пара и высокотем-
высокотемпературной металлографии [1, 2].
Р, % (по пассе)
10 20
30 40 50 SO S0100
2447°
2000
1500
1000
500
ч
\
\
\
\
Or)
\
\
\
\
1262"
Ж
С
1
-•
i
!
1
Г
1
1
О /0 20 30 40 SO SO 70 80 30 ЮО
Ir P,"U(am.) P
Рис. 45. Ir—P
В системе установлено существование трех фосфидов: 1г2Р, 1гР2
и 1гР3. Соединение 1г2Р плавится конгруэнтно при температуре
между 1310 и 1360 "С [1], образует с (Ir) эвтектику при содержании
24 % (ат.) Р и температуре 1262 "С [2]. Соединение 1гР2 устойчиво
до 1230 °С. Соединения Ir с Р получали под давлением прямым
синтезом при нагреве до 1100 °С порошков Ir с красным Р в эвакуи-
эвакуированных и запаянных ампулах [4, 5]. Кристаллическая структура
фосфидов Ir представлена в табл. 54.
100
Ir-P, Ir-Pa, lr-Pb
Таблица 54. Кристаллическая структура соединений системы Ir-P
Соеди-
Соединение
Ir2P
1гР2
1гР3
Прото-
Прототип
CaF2
RhP2
CoAsj
Символ
Пирсона,
пр.гр.
сП 2,
Fm3m
тР\2,
РУс
с/32,
1пв
Параметры решетки, нм
а
0,5546
0,5543
0,5546
0,55457
0,55453
0,8015
0,80151
Ь
0,57906
0,57915
с
0,58500
0,58494
Примечание
U1
{5]
При концентрации
34,2 % (ат.) Р {41
р-111,600° F1
Р - 111,575° {71
15]
[8]
Литература
1. SaffgeK.H., Heimbrecht M., Biltz W. // Z. Anorg. All. Chem. 1940. Bet. 243.
S. 297-306.
2. Reinacher G. // Rev. Met. (Paris). 1957. V. 54. P. 321-336.
3. Okamoto H. // Bull. Alloy Phase Diagrams. 1990. V. 11. N 4. P. 413-415.
4. Zumbusch M. // Z. Anorg. All. Chem. 1940. Bd. 243. S. 322-329.
5. Rundguist S. // Nature. 1960. V. 185. P. 31-32.
6. Rundguist S. // Acta Chem. Scand. 1961. V. 15. P. 451-^»53.
7. Kjekshus A. // Acta Chem. Scand. 1971. V. 25. N 2. P. 411—422.
8. Rundguist S., Ersson N.O. // Arkiv Kemi. 1969. Bd. 30. N 1-2. S. 103-104.
A.C. Адамова
Ir-4>a. ИРИДИЙ-ПРОТАКТИНИЙ
Диаграмма состояния Ir—Pa не построена. По результатам про-
прогноза химических соединений с помощью ЭВМ в системе Ir—Pa
предположили существование соединений 1г5Ра и 1г2Ра со структура-
структурами типа фаз Лавеса, а также соединений Ir3Pa, IrPa и 1гРа3 [1].
Литература
1. Savitskii E.M., Gribulya V.B. Application of Computer Technigues in the Predicting
of Inorganic Compounds. New Delhi: Oxoman Press Pyt. Ltd, 1985. 206 p.
А.Л. Татаркина
Ir-РЪ. ИРИДИЙ-СВИНЕЦ
Диаграмма состояния Ir—Pb не построена. Известно, что в этой
системе по перитектической реакции образуется соединение IrPb.
Соединение IrPb имеет гексагональную структуру типа NiAs (символ
Пирсона hP4, пр.гр. РЬ^/ттс) с параметрами а = 0,3993 нм, с =
= 0,5566 нм [1].
Ir-Pb, Ir-Pd
101
Результаты прогноза химических соединений с помощью ЭВМ
указывают на возможность существования соединений Ir3Pb, Ir2Pb
и IrPb2 со структурами типа фаз Лавеса, а также соединений Ir3Pb,
IrPb и IrPb3 [2].
Литература
1. Pfisterer H., Schubert К. // Z. Metallkunde. 1950. Bd. 41. S. 358-367.
2. Savitskii E.M., Gribulya V.B. Application of Computer Technigues in the Predicting
of Inorganic Compounds. New Delhi: Oxoman Press Pyt. Ltd, 1985. 206 p.
А.Л. Татаркина
Ir—Pd. ИРИДИЙ—ПАЛЛАДИЙ
t °c
2000
J5SS°
rsoo
WOO
500
9
(Pi
/
0
/
ж
У
20
^^
Ir, '/.(am.)
to
78
I
/
JT60°
SO
1
во
1
J
/
/
WO
7
/
! (Ir)
\
\
\
\
\
О Г0 20, JO
Рис. 46. Ir-Pd
SO GO 70 SO SO 700
г, *А Ого пассе) Ir
102 Ir-Pd, Гг-Рт
Система Ir—Pd исследована неоднократно [1—5], однако при этом
построены разные диаграммы состояния.
По мнению авторов работ [1, 2], Ir с Pd при кристаллизации
образуют непрерывный ряд твердых растворов. При понижении
температуры происходит распад твердых растворов на два. Критичес-
Критическая точка распада отвечает температуре 1480 °С и концентрации
50,45 % (ат.) Ir. Растворимость Ir в (Pd) при 700 °С составляет
~3 % (ат.) и Pd в (Ir) - 6 % (ат.).
По мнению авторов работ [3, 4], диаграмма состояния Ir—Pd
является системой перитектического типа с двумя ограниченными
твердыми растворами (рис. 46). Температура перитектической реак-
реакции Ж + (Ir) « (Pd) равна 1760±25 °С, твердый раствор на основе Pd
содержит 38 % (по массе) или 27 % (ат.) Ir, твердый раствор на
основе Ir — 17 % (по массе) или 25 % (ат.) Pd. С понижением
температуры растворимость Pd в (Ir) и Ir в (Pd) довольно резко
падает, двухфазная область (Pd) + (Ir) простирается при 700 "С от
5 до 91 % (по массе) Ir.
Литература
1. Немилов В.А., Видусова Т.А. // Известия сектора платины. 1950. Т.25.
С. 142-148.
2. Raub E., ROschel Е. // Z. Metallkunde. 1964. Bd. 55. N 6. S. 320-321.
3. Тылкина М.А., Полякова В.П., Савицкий Е.М. // Журнал неорганической
химии. 1962. Т.7. Вып.6. С 1471-1473.
4. Савицкий Е.М., Полякова В.П., Тылкина М.А. Сплавы палладия. М.: Наука,
1967. 216 с.
В. П. Полякова
Ir-Pm. ИРИДИЙ-ПРОМЕТИЙ
Диаграмма состояния Ir—Pm не построена. На основании прогноза
интерметаллических соединений с помощью ЭВМ в системе следует
ожидать наличие соединений Ir5Pm, Ir2Pm, IrPm2, IrPm5 со структу-
структурами типа фаз Лавеса, а также Ir3Pm, IrPm и 1гРт3 [1].
Литература
1. Savitskii E.M., Gribylya V.B. // Application of Computer Technigues in the Predic-
Predicting of Inorganic Compounds. New Delhi: Oxoman Press Pyt. Ltd., 1985. 206 p.
B.IJ. Полякова
lr—Pr
103
Ir-Pr. ИРИДИЙ—ПРАЗЕОДИМ
Полная диаграмма состоя- , о_ °
ния неизвестна. Имеются дан-
данные, что 1г снижает темпера- о7,„
туру плавления и температуру „ .
полиморфного превращения
Рг, а при температуре 729 °С
и содержании 12,1 % (ат.) Ir в
системе наблюдается эвтекти-
ческая реакция Ж « (осРг) +
+ Pr5lr2 (рис. 47) [1]. Извес-
тно о существовании в системе
Ir—Pr кроме Pi*5*r2 еще двух
соединений: Prlr2 и Pr7lr3.
Кристаллическая структура
соединений приведена в
табл. 55.
Ir, % (по пассе)
10 20 30
воо
soo
о г
Рг
б в ю гг
Ir,'/a(am.)
Рис- 47- 1г-р
Таблица 55. Кристаллическая структура соединений системы Ir—Рг
Соедине-
Соединение
Pr5lr2-
Ndlr2
Nd7lr3
Прототип
м?5с2
MgCu2
Th7Fe3
*р = 96,6°.
Символ
Пирсона,
пр.гр.
С2/с
FdZm
hP20,
Р63тс
Параметры решетки, нм
а
1,6538
0,7621
1,0043
Ь
0,6610
—
с
0,7329
—
0,6312
Источник
[2]
[3]
[4]
Литература
1. Griffin R.B., Gschneider, Jr.,K.A. // Melall. Trans. 1971. V. 2. N9.
P. 2517-2531.
2. Le Roy J., Paccard D., Moreau J.—M. // J. Less-Common Met. 1980. V. 72. N 1.
P. 11-15.
3. Compton V.B., Matthias B.T. // Acta Crystailogr. 1959. N 12. P. 651-654.
4. Olcese G.L. // J. Less-Common Met. 1973. V. 33. N 1. P. 71-81.
В.П. Полякова
104
Ir—Pt
lr-P\. ИРИДИЙ-ПЛАТИНА
Первое систематическое исследование системы Pt—1г было прове-
проведено в работе [1] методом микроструктурного анализа и измерения
свойств. По результатам работы сделано заключение об образовании
непрерывных растворов в системе Pt—1г.
Диаграмма состояния Pt—1г (рис. 48) построена на основании
результатов микроструктурного, рентгеноструктурного и дилатомет-
дилатометрического анализов [2].
Сплавы системы Pt—Ir кристаллизуются с образованием непрерыв-
непрерывного ряда твердого раствора (Pt, Ir). При понижении температуры
происходит его распад.на два твердых раствора at и а2. Максималь-
Максимальная критическая температура распада твердого раствора отвечает
975 °С при содержании 50 % (ат.) Ir, пределы двухфазной области
при 700 °С — 7 и 99 % (ат.) Ir. Сплавы Ir с Pt имеют ГЦК структуру
типа Си (символ Пирсона cFA, пр.гр. Fnilm) [3]. Установлено
го
Ir, % (по массе)
40 60
80
100
2400
2200
2000
1800
1600
ftOO
1200
WOO
800
бао
0 10
ft
Рис. 4& Ir—Pt
IIII 1
1769'
1
i
—¦—
Ж
—- —
<**
+ «i
(Pt,
ir)
«II 16s
Z447'
v —
\
Z0 JO 40 SO 60 70 80 SO WO
Ir, '/• (am) Ir
Ir—Pt, Ii^-Pu
105
также, что равновесное состояние в системе Pt—Ir в области сущес-
существования двух фаз не достигается даже при выдержке в течение
одного года [3].
В работе [4] изучены термодинамические свойства и параметры
ГЦК решетки сплавов Ir с Pt. Из концентрационных зависимостей
парциальных термодинамических потенциалов Гиббса, энтальпии и
энтропии Ir в области 55—90 % (ат.) Ir сделан вывод о наличии
купола распада в этой системе при температурах выше 1300 °С.
Параметры кристаллической решетки твердых растворов (Pt, Ir)
изменяются с отрицательным отклонением от правила Вегарда в
интервале концентраций 0—65 % (ат.) Ir в положительную сторону
[4].
Литература
1. Немилов В.А. // Известия сектора платины. 1929. Т.7. С. 13—20.
2. Raub E., Plate W. // Z. Metallkunde. 1956. Bd. 47. N 10. S. 688-693.
3. Raub E., Plate W. // Z. Metallkunde. 1957. Bd. 48. N 10. S. 529-^539.
4. Tripathi S.N., Chandrasckhariah M.S. // J. Less-Common Met. 1983. V. 91. N 2.
P. 251-260.
В.П. Полякова
Ir—Pu. ИРИДИЙ—ПЛУТОНИЙ
Диаграмма состояния Ir—Pu не построена. По результатам рентге-
рентгеновского анализа в системе Ir—Pu установлено существование трех
соединений: Pulr2, -Pu5lr3, ~Pu5Ir4 [1]. В справочнике [Ш] наибо-
наиболее богатому Pu соединению приписана формула Pu3lr.
Определена кристаллическая структура соединений Pulr2 и Pu5lr3,
сведения по структуре приведены в табл. 56.
Таблица 56. Кристаллическая структура соединений системы Ir—Pu
Соединение
Pulr2
Рц51г3
Прототип
MgCu2
W5Si3
Символ
Пирсона,
пр.гр.
cF24,
Fdlm
tm,
/4/(mem)
*При концентрации 37,1 % (ат.) Ir.
При концентрации 40,1 % (ат.) Ir
Параметры решетки, нм
а
0,7512-0,7528
1,1012*
1,1015"
с
0,5727*
0,5621"
Источник
[1]
[2]
[2]
Литература
1: Кутайцев В.И., Чеботарев Н.Т., Андрианов М.А. и др. // Атомная энергия.
1967. Т.23. № 6. С. 511-519.
2. CromerD. // Acta Crystallogr. В. 1974. V. 33. N 6. P. 1966-1977.
АЛ. Татаркина
106 Ir-Ra, Ir-Rb, Ir-Re
Ir-*a. ИРИДИЙ-РАДИЙ
Диаграмма состояния Ir—Ra не построена. По результатам прогно-
прогнозирования химических соединений с помощью ЭВМ в системе Ir—Ra
предположительно существуют соединения Ir5Ra, Ir2Ra и IrRa5 со
структурами типа фаз Лавеса, а также соединения Ir3Ra, IrRa, IrRa,
HlrRa3 [1].
Литература
1. Savitskii E.M., Gribulya V.B. Application of Computer Technigues in the Predicting
of Inorganic Compounds. New Delhi: Oxoman Press Pyt. Ltd., 1985. 206 p.
А.Л. Татаркина
Ir-Rb. ИРИДИЙ-РУБИДИЙ
Данные о взаимодействии Ir с Rb в литературе отсутствуют.
Результаты прогноза химических соединений с помощью ЭВМ указы-
указывают на возможность существования в системе Ir—Rb химических
соединений Ir2Rb и IrRb2 со структурами типа фаз Лавеса, а также
соединений Ir3Rb, IrRb [1].
Литература
1. Savitskii E.M., Gribulya V.B. Application of Computer Technigyes in the Predicting
of Inorganic Compounds. New Delhi: Oxoman Press Put. Ltd, 1985. 206 p.
В.П. Полякова
Ir-Re. ИРИДИЙ-4>ЕНИЙ
Диаграмма состояния системы Ir—Re построена на основе изуче-
изучения системы методами рентгеновского и металлографического анали-
анализов, а также измерения температуры плавления с помощью оптичес-
оптического пирометра, твердости и микротвердости фаз. Чистота исходных
металлов Ir и Re равна 99,8 % по массе [1].
Система Ir—Re является диаграммой перитектического типа с
двумя ограниченными твердыми растворами (рис. 49). Химических
соединений в системе не обнаружено. При температуре 2800±25 °С
имеет место перитектическая реакция Ж + (Re) •* (Ir). Сплавы в
области (Ir) обладают ГЦК решеткой с параметром а, уменьшаю-
уменьшающимся от 0,38312 нм для Ir до 0,365 нм для сплава Ir с 28 % Re.
Растворимость Re в (Ir) при перитектической температуре составляет
Ir—Re, Ir—Rh
107
3000
2800
2600
2W
2Ш
2200
2000
1800
1600
U/00
1200
10
Re, °/o (по массе)
20 JO 40 SO SO 70 80 90 100
1000
(Ir)
I
7^'
у
-,-
n
I
i-
zeoot25'^,
i6
i
1
1
i
i
*e)
0 10
Ir
20 JO «0 50 60 70 80 90 100
He,"/' ( am.) Re
Рис. 49. Ir-*e
-36 % (ат.) и снижается до 28 % (ат.) при 1000 °С. Растворимость
Ir в (Re) при перитектической температуре равна -44 % (ат.) и
снижается до -38 % (ат.) при 1000 °С.
Литература
1. Тылкина М.А., Цыганова И.А., Савицкий Е.М. // Журнал неорганической
химии. 1962. Т.7. Вып.8. С. 1917-1927.
МЛ. Тылкина
Ir-«h. ИРИДИЙ-РОДИЙ
Диаграмма состояния Ir—Rh (рис. 50) построена с помощью мето-
методов измерения температуры солидуса, микроструктурного и рентге-
рентгеновского анализов [1]. Ir и Rh неограниченно растворимы друг в
друге в жидком состоянии. При кристаллизации сплавы образуют
108
Ir—Rh, Ir—Ru.
a
Rh,%(am.)
20 40
eo
80 100
t,°C
2600
2500
2400
2300
2200
2100
2000
1900
0 10 20 30 40 SO BO TO 80 90 100
Ir Kh,% (по массе) Kh
Рис. 50. Ir-Kh
24i7°
4,
s 4,
\
1
ч
ж
1
1
1363°
непрерывный ряд твердых растворов [1, 2]. В работе [2] высказано
предположение о разрыве растворимости в твердом состоянии. Одна-
Однако учитывая физико-химические константы Ir и Rh и их положение
в Периодической системе, следует ожидать, что равновесие при
низких температурах в этой системе будет труднодостижимо [2].
Литература
1. Благородные металлы: Справочник / Под ред. Е.М. Савицкого. М.: Металлур-
Металлургия, 1984. 592 с.
2. Raub Е. // J. Less-Common Met. 1958. V. 1. N 1. P. 3-7.
В. П. Полякова
Ir—Ru. ИРИДИЙ—РУТЕНИЙ
Диаграмма состояния Ir—Ru (рис. 51) построена на основании
результатов микроструктурного и рентгеновского анализов, измере-
измерения температуры плавления сплавов во всем интервале концентраций
[1]. Она представляет собой диаграмму перитектического типа с
широкими областями твердых растворов на основе исходных компо-
компонентов. Температура перитектической реакции Ж + (Ir) »• (Ru) равна
2350 °С [1] или 2395 °С [2]. Двухфазная область существует в
Ir-Ru
109
t,°c
2500
2900
2300
2200
2100
2000
1900
WOO
1700
1600
7500
Ru
Рис. 51. Ir—Ru
20
/r,% (по массе)
60 BO
SO
100
Г
(Re)
1
___
I
Ж
\_+—'
12350 \
1
|
1
i
Ur)
/G
J(?
<Й> ВО
Ir,Vo (am.)
70 BO
90 100
Ir
интервале концентраций 42—53 % (ат.) Ir [1] или 48—54 % (ат.) Ir
[3] при 2000 °С. По данным работы [2], растворимость Ir в (Ru) при
перитектической температуре составляет 49 % (ат.), Rub (Ir) —
45 % (ат.).
Литература
1. Рошан Н.Р., Полякова В.П., Савицкий Е.М. // Новые методы построения
диаграмм состояния: Сб. статей. М.: Наука, 1972. С. 89—92.
2. Еременко В.Н., Хоружая В.Г., ШтепаТ.Д. // Металлы. 1988. № 1. С. 197—202.
3. Raub Е. // Z. Metallkunde. 1964. Bd, 55. N 6. S. 316-319.
В. Я. Полякова
по
Ir-S, IrSb
lr-S. ИРИДИЙ-СЕРА
Диаграмма состояния Ir—S не построена. В системе Ir—S установ-
установлено существование соединений: IrS, Ir2S3, IrS2, Ir3S8 и IrS3. Методы
получения и свойства сульфидов Ir описаны в работе [1]. Кристалли-
Кристаллическая структура соединений системы Ir—S приведена в табл. 57.
Таблица 57. Кристаллическая структура соединений системы Ir—S
Соедине-
Соединение
Ir2S3
IrS2
IrS2'
Ir,S8"
Прототип
Rh2S3
IrSe2
FeS2
RhjSeg
Символ
Пирсона,
пр.гр.
оР20,
РЬсп
оР24,
Рпта
сР\2,
РаЗ
АЯП,
ЛЗ
Параметры решетки, нм
а
0,8465
1,978
0,568
0,5596
Ь
0,6011
0,5624
—
-
с
0,6149
0,3565
—
-
*При давлении 6 ГПа и температуре 1500 °С.
"а = 90,2°.
Источник
12]
[3]
[V-C]
[V-C]
Литература
1. Самсонов Г.В., Дроздова СВ. Сульфиды. М.: Металлургия, 1972. 304 с.
2. Parthe E., Hohneke D., Hulliger F. // Acta Crystallogr. 1967: V. 23. N 4.
P. 832-835.
3. Hulliger F. // Nature. 1964. Bd. 204. S. 644-646.
Ю.Б. Кузьма
IrSb. ИРИДИЙ-СУРЬМА
Диаграмма состояния Ir—Sb в области концентраций 50—100 %
(ат.) Sb (рис. 52) построена на основании результатов термического,
металлографического и рентгеновского анализов [1—5]. Сплавы
готовили сплавлением компонентов в кварцевых ампулах в атмосфе-
атмосфере аргона. На основании данных работ [1—2] построена кривая
ликвидуса со стороны Sb. Установлено, что при температуре 619 "С
со стороны Sb наблюдается вырожденная эвтектика. Соединение IrSb3
образуется по перитектической реакции [1, 2, 4, 5] при 900 °С [1,
2] или, что более достоверно, при -1100 °С [4, 5]. В исследованной
области концентраций обнаружено три соединения, структура кото-
которых приведена в табл. 58.
Ir^Sb
111
t, С
1300
noo
1100
1000
300
воо
700
600
500
taa
0
—
-
-
to
I
Э
¦ >i;
\
Si, % (по массе)
60 во
\
i
-1100°
1
\
V
\
631
Б1Э"
10
Ж
0 50
Ir
60 70 dO
Si,%(am.)
90
tOO
Sb
Рис. 52. Ir-Sb
Таблица 58. Кристаллическая структура соединений системы Ir—Sb
Соедине-
Соединение
IrSb
IrSb2*
IrSb3
*P - \\i
Прототип
NiAs
CoSb2
CoAs3
Символ
Пирсона,
пр.гр.
HP4,
P63/mmc
mP\2,
P2{lc
c/32,
Параметры решетки, нм
a
0,3978
0,648
0,9248
—
0,653
—
с
0,5521
0,668
—
Источник
[3]
[6]
[4,5]
112
Ir-Sb, Ir-Sc, Ir-Se
Литература
1. Кузьмин Р.Н., Жданов Г.С., Журавлев Н.Н. // Кристаллография. 1957. Т.2.
№ 1. С. 48-50.
2. Журавлев Н.Н., Жданов Г.С., Кузьмин Р.Н. // Кристаллография. 1960. Т.5.
№ 4. С. 553-562.
3. Кузьмин Р.Н. // Кристаллография. 1958. Т.З. № 3. С. 366-367.
4. Kjekshus A., Pedersen G. // Acta Crystallogr. 1964. V. 14. N 10. P. 1065-1070.
5. Kjekshus A. // Acta Chem. Scand. 1961. V. 15. P. 678-681.
6. Жданов Г.С., Кузьмин Р.Н. // Кристаллография. 1961. Т.6. № 6. С. 872-881.
В.П. Полякова
irSc. ИРИДИЙ-СКАНДИЙ
Диаграмма состояния Ir—Sc не построена. В литературе имеются
данные о существовании трех соединений: Sclr2, Sclr и Scjjlr4. Крис-
Кристаллическая структура соединений приведена в табл. 59.
Таблица 59. Кристаллическая структура соединений системы Ir—Sc
Соединение
Sclr2
Sclr
>
Sc,,Ir4
Прототип
MgCu2
CsCl
Sc,,Ir4
Символ Пирсона,
пр.гр.
cF24,
Fd3m
cP2,
РтЗт
cF\W,
Fm3m
Параметр решетки
а, нм
0,7348
0,3206
1,3350
Источник
[1]
[2]
[3]
Литература
1. Compton V.B., Matlhias B.T. // Acta Crystallogr. 1959. V. 12. N 7. P. 651-654.
2. Aldred A.T. // Trans. AME. 1962. V. 224. N 5. P. 1082-1083.
3. Chabot В., Cenzual K., Parthe E. // Acta Crystallogr. 1980. V. 36. N 1. P. 7-11.
В.П. Полякова
Ir-^Se. ИРИДИЙ-СЕЛЕН
Диаграмма состояния Ir—Se не установлена. Прямым взаимодей-
взаимодействием или химическими методами получены соединения Ir2Se3, IrSe2
и IrSe3. Кристаллическая структура соединений приведена в
табл. 60.
Ir-Se, Ir-Si
Таблица 60. Кристаллическая структура соединений системы Ir—Se
113
Соедине-
Соединение
IrSe3
IrSe3**
Прототип
IrSe2
FeS2
Символ
Пирсона,
пр.гр.
оЯ24,
Рпта
сЯ12,
РаЪ
Р\
Параметры решетки, нм
а
2,094
—
0,8405
b
0,374
—
0,8405
с
0,593
—
1,0236
Источник
[Э]
[1]
[V-C]
'Высказано предположение, что диселенид Ir нестехиометричен и имеет состав
-IrSe, 9.
Триклинная псевдогексагональная сингония, о = р ~ у ~ 90,2°.
Литература
1. Вол А.Е., Каган И.К. Строение и свойства двойных металлических систем. М.:
Наука, 1976. Т.З. 815 с.
Ю.Б. Кузьма
lr-Su ИРИДИЙ—КРЕМНИЙ
Диаграмма состояния Ir—Si не построена. На рис. 53 схематично
показано положение фазовых областей в системе. Имеются данные
о существовании семи соединений: Ir3Si, Ir^Si, Ir3Si2, IrSi, Ir2Si3, IrSi2
и IrSi3 [2-4].
Таблица 61. Кристаллическая
Соедине-
Соединение
Ir3Sf
Ir2Si"
lr3Si2
IrSi
IrSij
Прототип
U3Si
6Ni2Si
Ni2ln
MnP
AsNa3
Символ
Пирсона,
пр.гр.
Ш6,
/4/mcm
—
hPb,
Р6г/ттс
oP&,
Рпта
hP4,
РЬъ/ттс
*B сплаве, содержащем 16,7 %
"Ромбическая сингония.
структура соединении системы Ir—Si
Параметры решетки, нм
а
0,5222
0,7615
0,3963
0,5558
0,3978
_
0,5284
_
0,3211
_
с
0,7954
0,3989
0,5126
0,6273
0,5521
(ат.) Si.
Источник
[2]
[2]
[2, 4]
[1J
[3]
114
Ir-Si
t.'C°
1700
1600
1500
1400
1300
1200
1100
1000
900
воо
700
600
500
Si, % (no mxcce)
10
20
3D 40 SO SO TOO
\
\
1
1
Ж
/
>
I
/ 7470
-Э.5
I г)
lr3
r2Si
1
T
Ir
Si
Irz.
p
i
- !
2
IrSij
1
1
1
E0
——
0
Ir
10
20
30
40 50 BO
Si,% (am.)
TO
во
90
100
Si
Рис. 53. Ir-Si
Предполагается, что температура плавления большинства соедине-
соединений выше 1340 °С [4]. Отмечается, что соединение IroSi2 в интервале
температур 700—500 °С распадается на Ir2Si и IrSi [2]. Установлена
эвтектическая реакция Ж * (Ir) + Ir3Si при температуре 1470 °С и
концентрации 9,5 % (ат.) Si [5]. Кристаллическая структура инди-
индицированных фаз приведена в табл. 61.
Литература
1. Korst W.L., Finnie L.K., Searcy A.W. // J. Phys. Chem. 1957. V. 61. N 11.
P. 1541-1543.
2. Bhan S., Schubert K. // Z. Metallkunde. 1960. Bd. 51. N 6. S 327-339.
3. Schubert K., Bhan S., Burkhardt W. // Naturwissenschaften. 1960. Bd. 47.
S. 303-307.
4. Finnie L.K. // J. Less-Common Met. 1962. V. 4. N 1. P. 24-34.
5. Reinacher G. // Metall. 1965. Bd. 19. N 7- S. 707-711.
В.П. Полякова
Ir—Sm, Ir—Sn
115
lr-Sm. ИРИДИЙ-САМАРИЙ
Диаграмма состояния системы не опубликована. Известно о су-
существовании в системе соединений Smlr2 и Sm5lr2 [1—5]. Кристалли-
Кристаллическая структура соединений приведена в табл. 62.
Таблица 62. Кристаллическая структура соединений системы Ir—Sm
Соедине-
Соединение
Smlr2
Smjl^*
Прототип
MgCu2
Мп5С2
*Р - 96,7°.
Символ
Пирсона,
пр.гр.
с/24,
Fd3m
mC28,
C2lc
Параметры решетки, нм
а
0,7557
1,6144
Ь
0,6522
с
0,7264
Источник
[1, 3, 4,
5]
[2]
Литература
1. Благородные металлы: Справочник / Под ред. Е.М. Савицкого. М.: Металлур-
Металлургия, 1984. 592 с.
2. Le Roy J., Paccard D., Moreau J.-M. II J. Less-Common Met. 1980. V. 72. N 1.
P. 11-15.
3. Bozorth R.M., Matthias B.T., Suhl H. et ai. // Phus. Rev. 1959. V. 15. N 6.
P. 1595-1596.
4. Теслюк Ю.М. Металлические соединения со структурами фаз Лавеса. М.:
Наука, 1969. 29 с.
5. Lewy R.M. // J. Appl. Phys. 1970. V. 41. N 3. P. 902-904-
B.TJ. Полякова
Ir-Sn. ИРИДИЙ-ОЛОВО
Диаграмма состояния не построена. Имеются данные о существо-
существовании твердого раствора на основе Ir и четырех соединений: IrSn2,
lrSn3, Ir3Sn7 и -IrSn C8,07 % (по массе) Sn). Высказано предполо-
предположение, что соединение IrSn3 идентично соединению Ir3Sn7. Установ-
Установлено отсутствие растворимости Ir в жидком Sn [X, 2]. Кристалличес-
Кристаллическая структура промежуточных фаз приведена в табл. 63.
116
Ir-Sn, lr—Sr
Таблица 63. Кристаллическая структура соединений системы Ir—Sn
Соединение
IrSn2
Ir3Sn7'
IrSn
Прототип
CaF2
RujSn,
NiAs
'Кубическая сингония.
Символ
Пирсона,
пр.гр.
с Л 2,
РтЗт
-
hP4,
РЬъ/ттс
Параметры
а
0,634
0,9360
0,3988
эешетки, нм
с
— '
-
0,5567
Источник
[1]
[2]
[X]
Литература
1. Hamilton D.C., Raub Ch.J., Matthias B.T. et all. // J. Phys. Chem. Solids. 1965.
V. 26. N 3. P. 665-666.
2. Вол А.Е., Каган И.К. Строение и свойства двойных металлических систем. М.:
Наука, 1976. Т.З. 815 с.
В. П. Полякова
Ir-Sr. ИРИДИЙ-СТРОНЦИЙ
Диаграмма Ir—Sr не построена. Методами микроструктурного и
рентгеновского анализов обнаружено конгруэнтно плавящееся соеди-
соединение Srlr2, а также еще две промежуточные фазы с меньшим содер-
содержанием Sr, которые образуются по перитектическим реакциям или
в результате превращения в твердом состоянии [1]. По результатам
работы [1] возможно образование соединения Srlr3, соединение Srlr5
не существует. Однако в работе [3] вновь указывается на вероят-
вероятность существования соединений ~Sr2Ir7 и Srlr5, структура которых
пока не индицирована. Структура соединения Srlr2 относится к типу
MgCu2 (символ Пирсона cF24, пр.гр. Fdbm), параметр решетки а =
= 0,7849 нм [1], а = 0,7700 нм [2].
Литература.
1. Naumann Т., Kniepmeyer М. // Z. Anorg. All. Chem. 1957. Bd 290. S. 191-204.
2. Wood E.A., Compton V.B. // Acta Crystallogr. 1958. V. Hi P. 429—433.
3. Bruzzone G., Merlo F. // J. Less-Common Met. 1962. V. 85. N 2. P. 285-306.
В.П. Полякова
Ir-Ta
117
Ir-Ta. ИРИДИЙ-ТАНТАЛ
Предположительная диаграмма состояния Ir—Та построена на
основании данных металлографического и рентгеновского анализов
сплавов высокой чистоты, полученных методом дуговой плавки [I].
Система Ir—Та характеризуется наличием ограниченных твердых
растворов на основе исходных компонентов и образованием четырех
промежуточных фаз: Talr3, а,, а2 и о (на основе Та31г). Соединение
Та1г3 плавится конгруэнтно при температуре -2450 "С, обладает
областью гомогенности -25—33 % (ат.) Та при 2120 °С. Соединение
Ta3lr (фаза о) и фаза at образуются по перитектическим реакциям
при температурах соответственно 2475 и 2120 °С; <х2 образуется по
перитектоидной реакции при 1860 °С. Область гомогенности фазы о
составляет -59-85 % (ат.) Та при 1950 °С; -65-83 % (ат.) Та при
1400 °С. Границы существования фаз оса и а2 требуют уточнения.
Перитектический характер образования твердых растворов на
основе Ir при температуре 2380 °С вызывает сомнения, так как
данная температура и температура плавления Ir, определенная в
работе [1] B357+25) °С, ниже установленной температуры плавле-
плавления чистого металла 2447 °С.
10
Га,% (по пассе)
30 40 SO ВО 10 вО 30 100
3000
гвоо
2600
2**7°
2*00
2200
2000
.1800
7600
1100
3020°
О 70 20 JO #0 50 SO 70 вО SO ЮО
Ir Ta,a/o(am.) Га
Рис. 54. Ir—Та
118
Ir-Ta, Ir-Tb
На диаграмме состояния системы Ir—Та, приведенной на рис. 54,
в соответствии с принятой температурой плавления Ir скорректирова-
скорректирована часть ее от 0 до 25 % (ат.) Та по температурам образования
твердого раствора (Ir) и Talr3, остальная часть дана в соответствии
с данными работы [1].
Растворимость Та в (Ir) при температуре 2380 "С составляет
-16 % (ат.), Ir в (Та) при температуре 2475 °С -7,2 % (ат.). С
понижением температуры растворимость компонентов друг в друге
уменьшается.
В системе Ir—Та наблюдается единственная эвтектическая реакция
при 1950±15 °С между фазами ctj и о.
Кристаллическая структура соединений приведена в табл. 64.
Таблица 64. Кристаллическая структура соединений системы 1г—Та
Соедине-
Соединение
Talr3
«i
аГ
о
Прото-
Прототип
Cu3Au
—
-
FeCr
Символ
Пирсона,
пр.гр.
сР4,
РтЪт
Ртст
-
tP30,
Р42/тпт
Ромбическая сингония.
Тетрагональная сингония
Параметры решетки, нм
а
0,3886
0,3907
0,2830
0,3988
0,9888
0,9968
Ь
I
0,4803
-
-
с
1,3661
0,3859
0,5121
0,5197
Примечание
При концентрации
Та, % (ат.):
25 [1]
30 [1]
43 [1,2]
41 [1]
70 [1]
80 [1]
Литература
1. Ferguson W.H., Giessen B.C., Grant N.J. // Trans. АШЕ. 1963. V. 227.
P. 1401-1406.
2. Giessen B.C., Grant N.I. // Acta Crystallogr. 1964. V. 17. P. 615-616.
В.П. Полякова
Ir—Tb. ИРИДИЙ—ТЕРБИЙ
Диаграмма состояния не опубликована. Указывается на существо-
существование в системе нескольких соединений, их кристаллические струк-
структуры представлены в табл. 65.
Ir—Tb, /r—Тс, /г—Те
119
Г а б л и ц г
Соедине-
Соединение
Ir2Tb
2 5
IrTbj
1г„ТЬ6<
*р - 96,
65. Кристаллическая
Прототип
MgCu2
Мп5С2
Fe3C
Ir"Y"
73°.
Символ
Пирсона,
пр.гр.
cF24,
Fd3m
mC28,
С2/с
оР16,
Рпта
—
структура соединении системы Ir—Tb
Параметры решетки, нм
а
0,7532
1,5749
0,72170
—
-
0,6462
0,9318
—
с
—
0,7208
0,6361
—
Источник
[1.3]
[2]
13]
[3]
Литература
1. Благородные металлы: Справочник / Под ред. Е.М. Савицкого. М.: Металлур-
Металлургия. 1984. 592 с.
2. Le Hoy J., Paccard D., Moreau J.-M. // J. Less-Common Met. 1980. V. 72. N 1.
P. 11-15.
3. Гладышевский Е.И., Бодак О.И. Кристаллохимия интерметаллических соедине-
соединений редкоземельных металлов. Львов: Вища школа, 1982. 255 с.
В.П. Полякова
Ir-Тс. ИРИДИЙ—ТЕХНЕЦИЙ
Микроструктурным исследованием сплавов, отожженных при
температуре 1050 °С, установлена растворимость Ir в Тс, равная
-70 % (ат.), Тс в Ir — менее 25 % (ат.); сплав с 25 % (ат.) Тс
двухфазный. Промежуточных фаз в сплавах не обнаружено. Предпо-
Предполагается равновесие твердых растворов на основе компонентов [1].
Литература
1. Darby J.B., Norton L.J., Downey J.W. // Less-Common Met. 1963. N 5.
P. 397-402.
А.Л. Татаркина
Ir-Te. ИРИДИЙ-ТЕЛЛУР
Диаграмма состояния Ir—Те не построена. Методом рентгенострук-
турного анализа девяти сплавов в работе [1] установлено существо-
существование двух теллуридов: 1гТе2, находящегося в равновесии с Ir, и
1г3Те8, находящегося в равновесии с Те и, по-видимому, обладающе-
обладающего некоторой областью гомогенности.
120
Ir-Te, Ir-Th
В работе [2] указывается на существование двух соединений:
1гТе2+х и IrTe.
Кристаллическая структура теллуридов приведена в табл. 66.
Таблица 66. Кристаллическая структура соединений системы 1г—Те
Соединение
IrTe
IrTe2
Прототип
NiAs
Cdl2
FeS2
FeS2
Символ
Пирсона,
пр.гр.
hP4,
РЬ^/mmc
hP3,
P3ml
с/Ч 2,
P\
-
Параметры
a
, 0,3930
0,3930
0,6411
0,6414
решетки, нм
с
0,5686
.0,5393
—
-
Источник
[2]
[И ,
[2]
[1]
Литература
1. Hochinge E.F., White J.G. // J. Phys. Chem. 1960. V.-64. P.'1042-1045.
2. Groeneveld Meijer O.J. // Am. Mineral. 1955. V. 40. P. 646-648.
M.A. Тылкина
It-Th. ИРИДИЙ—ТОРИЙ
Система Ir—Th исследована в ряде работ [Э, Ш, 1, 2], результаты
которых практически совпадает. Диаграмма состояния Ir-^-Th в
интервале температур 1000—1500 °С представлена на рис. 55 по
данным работы [1]. Исследование проводилось методами дифферен-
дифференциального термического, рентгеноструктурного и микроструктурного
анализов. Сплавы изготовляли методом дуговой плавки из металлов
высокой чистоты.
Установлено образование шести соединений (в скобках указано
содержание Th, % (по массе)): Ir5Th A9,43), Ir3Th B8,69),
Ir2Th C7,64), IrTh E4,69), IrxTh F4,42), Ir3Th7 G3,8).
Соединения IrTh, Ir3Th7 и, по-видимому, Ir5Th плавятся конгру-
конгруэнтно при температурах > 1500 °С. Остальные образуются по пери-
тектическим реакциям.
Соединение Ir^Th нестабильно и распадается эвтектоидно на IrTh
и Ir3Th7 при температуре несколько ниже 1462 °С. ,
В системе существуют четыре эвтектических равновесия
(табл. 67).
Ir-Th
121
/rUO
1100
?UUU
ioUU
1600
1400
1200
WOO
\
\
\
\
\
\
\
m
I
f
/
jLT"
-1
9
ZO
1
I
1
J
Щ%(т пассе)
JO W 50 60
1
1
i
j
V
1
: ,«? ^
1 4 S
\ I J
ж
N /
мг±12°
w
4
1
\
1337±1
BO
90 100
1
/
\/ "
?°v—
(a.T
17SS°
1360°
0 10 20 3D 40 50 60 70 80 90 100
Ir ГЬ,«/в(ат.) Tfi
Рис. 55. Ir-Th
122
Ir-Th
Таблица 67. Нонвариантные равновесия в системе
Реакция
Ж » (Ir) + Ir5Th
Ж » Ir2Th + IrTh
Ж - Irjh + Ir3Th,
Ж « Ir3Th7+ (aTh)
Содержание Th в жидкой
фазе, % (ат.)
10
43
65
85
Ir-Th
Температура, °С
Выше 1500
Выше 1500
1462±12
1337±12
Растворимость Ir в Th незначительна.
Кристаллические структуры некоторых соединений приведены в
табл. 68 по данным работ [1, 2].
Таблица 68. Кристаллическая структура соединений системы Ir—Th
Соединение
Ir5Th
Ir2Th
IrTh
Ir3Th7
Прототип
CaCu5
MgCu2
CrB
Th7Fe3
Символ
Пирсона,
пр. гр.
W6,
РЬ/ттт
oF48,
Fddd
oC8,
Cmcm
hPTO,
Р6гтс
Параметры решетки,
a
0,5315
0,7650-0,7666
0,3894
1,0076
b
-
-
1,113
-
HM
С
0,4288
-
0,4266
0,6296
Структура соединений Ir3Th, IrThx неизвестна.
Литература
1. Thompson J.R.// J. Less-Common Met. 1964. V. 6. N 1. P.3-10.
2. Благородные металлы: Справочник / Под ред. ЕМ. Савицкого. М.: Металлур-
Металлургия, 1984. 592 с.
М.А. Тылкина
Ir-Ti
123
Ir-Ti. ИРИДИЙ—ТИТАН
Диаграмма состояния Ir—Ti. исследована в работах [1—4] и в
обобщенном виде, по данным этих исследований, представлена на
рис. 56. Ir несколько снижает температуру начала плавления спла-
сплавов. При температуре 1468 °С и содержании 17 % (ат.) Ir кристалли-
кристаллизуется эвтектика ((JTi) + Ti3lr. Максимальное содержание Ir в (PTi)
наблюдается при эвтектической температуре и составляет -15 %
(ат.).
При температуре 720 °С и 5 % (ат.) Ir протекает эвтектоидная
реакция (pTi) * (aTi) + Ti3lr. Максимальная растворимость Ir в (aTi)
-1 % (ат.).
Соединение Ti3lr образуется по перитектической реакции Ж +
+ pTilr * Ti3lr при 1515 °С, перитектическая точка расположена при
27 % (ат.) Ir, установлена некоторая область гомогенности этого
соединения, которая мало зависит от температуры.
Соединение Tilr плавится с открытым максимумом при темпера-
температуре 2130 °С и в процессе охлаждения претерпевает полиморфное
превращение, сопровождающееся упорядочением. Высокотемператур-
Высокотемпературная модификация соединения (PTilr) гомогенна в интервале концен-
концентраций 41—45 % (ат.) Ir, а низкотемпературная модификация
(aTilr) — в интервале концентраций 39—55 % (ат.) Ir.
Ir, Ъ (по массе)
о Ю2030 4/7 50 SO Ю 80 90'
2500,
2000
1500
WOO
500
О 10 20 30 W 50 ВО 10 80 90 100
Ti 1г,'л(ат.) Ir
Рис. 56. Ir-Ti
124
Ir-Ti, Ir-Tl
Соединение Tilr3 образуется по перитектической реакции при
температуре -2125 °С и концентрации -77 % (ат.) Ir.
Максимальная растворимость Ti в (Ir) достигает 11% (ат.) при
перитектической температуре.
Сведения о кристаллической структуре соединений приведены в
табл. 69 по данным работ [1, 2].
Таблица 69. Кристаллическая структура соединений системы Ir—Ti
Соединение
Tijlr
Tilr3
aTilr
Прототип
Cr3Si
AuCu3
CsCl
Символ Пирсона,
пр.гр.
cP&,
РтЪп
cP4,
РтЗт
cP2,
РтЪт
Параметр решетки
а, нм
0,5002
0,3845
-
Литература
1. Еременко В.Н., Штепа Т.Д., Гриценко Э.И. // Новые исследования титановых
сплавов: Сб. статей. М.: Наука, 1965. С. 25-29.
2. Еременко В.Н., Штепа Т.Д. // Изв. АН СССР. Металлы. 1970. №6.
С. 198-203.
3. Yeremenko W.N., Stepa T.D. // CoIIog. Int. Centr. Nat. Rech. Sci. 1972. N 205.
P. 403-413.
4. Штепа Т.Д. // Физика и химия конденсированных фаз, сверхтвердых матери-
материалов и их границ разделов: Сб. статей. Киев: Наукова Думка, 1975. С. 175—191.
П.Б. Будберг
Ir-Tl. ИРИДИЙ-ТАЛЛИЙ
В работе [1] по результатам прогнозирования химических соеди-
соединений с помощью ЭВМ указано на возможность существования в
системе 1г—Т1 соединения 1г2Т1 со структурой фазы Лавеса, а также
соединений 1гТ12> 1г3ТГ, IrTl, IrTl2 и 1гТ13.
Литература
1. Савицкий Е.М., Грибуля В.Б. Прогнозирование неорганических соединений с
помощью ЭВМ. М.: Наука, 1977. 187 с.
АЛ. Татаркина
Ir-Tm, Ir-U
125
Ir-Tm. ИРИДИЙ-ТУЛИЙ
Диаграмма состояния системы неизвестна. В работе [1] указыва-
указывается на существование в системе трех промежуточных фаз: Ir2Tm,
IrTm, Ir2Tm5, кристаллическая структура которых представлена в
табл. 70 по данным работы [1].
Таблица 70. Кристаллическая структура соединений системы Ir—Tm
Соединение
1г2Тт
IrTm
1г2Тт/
*Р - 97,01
Прототип
MgCu2
CsCl
Mn5C2
Символ
Пирсона,
пр.гр.
с/24,
Fd3m
сР2,
РтЪт
тС28,
С2/с
Параметры решетки, нм
а
0,7460
0,3352
1,5263
Ь
—
—
0,6345
с
—
—
0,7141
Литература
1. Благородные металлы: Справочник / Под ред. Е.М. Савицкого. М.: Металлур-
Металлургия, 1984. 592 с.
В.П. Полякова
Ir-U. ИРИДИЙ—УРАН
Диаграмма состояния Ir—U представлена на рис. 57 по данным
работ [1, 2]. Исследование [1] проведено методами термического,
микроструктурного, рентгеновского анализов. Сплавы выплавляли в
индукционной печи в тиглях из ВеО (до 6 % (ат.) Ir) и в дуговых
печах (более 6 % (ат.) Ir) из металлов: Ir чистотой 99,5 % (по
массе) и U чистотой 99,9 % (по массе).
В системе образуются несколько соединений. Два соединения Ulr
и Шг3 плавятся конгруэнтно при температурах 1470 и >2000 "С.
Три соединения U3Ir, U3Ir2 и Шг2 образуются по перитектичес-
ким реакциям при температурах 945, 1121 и >1850 °С, соответствен-
соответственно. В справочнике [М] указывается на существование еще одного
соединения — U2Ir, образующегося по перитектоидной реакции при
температуре 775 °С. Это соединение показано на рис. 57 штриховой
линией.
126
Ir-U
a
Ir, % (по пассе)
О 10 20 30 40 50 60 70 80 30 100
2300
2100
7900
7700
7500
7500
7700
300
77S°
700
SS81
(ftU)
500
1135°
%
1
314°
758°
-681°
565'
1
I
ж
/
i
345°
838°
775°
T~
1
1 (V
j -*
1
i
i
1
1470°.
t
1
1
i
1121°
a
i
1
1
I
1
t
у
г™
ц UbW
к
ч
2
Л
\
000°
1
/
(Ir
2447°
/
1 \
/1
1
т° j
\
0 10 20 30 40 SO Б0 10 80 30 100
U Ir,'/-(am.) Ir
Рис. 57. Ir—U
Ir-U, Ir-V
127
Соединение U3Ir стабильно в интервале температур 945—758 °С
и эвтектоидно распадается при температуре 758 °С на (yU) и (ocU2Ir).
Соединение U3Ir2 имеет две полиморфные модификации: высоко-
высокотемпературную pU3Ir2 и низкотемпературную aU3Ir2, температура
перехода составляет 898 °С.
В системе образуются три эвтектики: (Ir) + UIr3 при температуре
1950 "С; Шг2 + Ulr при 1450 °С и U3Ir + (YU) при 914 °С.
Растворимость \] в (Ir) составляет примерно 3 % (ат.) при темпе-
температуре 1950 "С, а растворимость Ir в (yU), (PU) и (aU) соответствен-
соответственно равна 5,5; 0,4 и <0,3 % (ат.).
Кристаллическая структура двух соединений приведена в табл. 71.
Таблица 71. Кристаллическая структура соединений системы Ir—U
Соединение
UIr2
UIr3
Прототип
MgCu2
Cu3Au
Символ Пирсона,
пр.гр.
с/24,
Fd3m
сР4,
РтЪт
Параметр решетки
а, нм
0,74939
0,4023
Литература
1. Park J.H., Mullen L.R. // J. Res. Nat. Standarts. 1968. V. 72. A. N 1. P. 19-25.
2. Благородные металлы: Справочник / Под ред. Е.М. Савицкого. М.: Металлур-
Металлургия, 1984. 592 с.
А.Л. Татаркина, М.А. Тылкина
Ir—V. ИРИДИЙ—ВАНАДИЙ
Исследование характера взаимодействия компонентов в системе
Ir—V проводилось в ряде работ [Э, Ш]. Ориентировочная диаграмма
состояния системы Ir—V представлена на рис. 58 по данным работы
[ 1 ]. Сплавы приготовляли методом дуговой плавки в инертной атмо-
атмосфере из металлов: V — чистотой 99,8 % (по массе) и Ir — чистотой
99,9 % (по массе) с последующей термической обработкой. Исследо-
Исследования проведены методами микроструктурного и рентгеноструктурно-
го анализов. В системе установлены значительные области взаимной
растворимости компонентов и существование четырех соединений:
V3Ir, VIr (Vj^Irpir, VIr3.
128
Ir-V
ги-оо
2200
2000
1910°
1800
1600
№0
1200
Ir, % (по массе)
010 2030 ШЗ 50 SO 70 80 90
wo
WOO
1 1
*-(v)
1
1900°
/
/
/
/
\
\
I
I I
19.
•o°—
2Ц. 5 ^^
К
39 \
jlr j
1
Ж
1850'
II
!
и;
Ilk
VIr
ii
¦.I
¦и
\
r
i
1 VI i
1
1
j
A
i
i
i
¦
|
* 1
|
1
I
/
i
1
I
\
i
1
1
\
1
1
о io го
у
tO SO 60 70 80 90 100
Ir.°/o (am.) Ir
Рис. 58. Ir-V
Все соединения имеют области гомогенности, протяженность
которых при температуре 1800 "С приведена ниже:
Соединение.
Ir, % (ат.). .
V3Ir
24,5-39
VIr
50-51,5
52-59,5
63-77,5
Соединение V3Ir плавится конгруэнтно при температуре
1930±30 °С. Остальные три соединения образуются по перйтектичес-
ким реакциям. Температура образования их точно не установлена:
для VIr она составляет выше 1880 °С, для (Vj^Irpir — выше
1900 °С, для VIr3 - выше 2000 "С.
В системе имеют место два эвтектических превращения:
Ж - (V) + V3Ir при 1900±30 °С и 23 % (ат.) Ir;
Ж - V3Ir + VIr при 1850±30 °С и 45 % (ат.) Ir.
Максимальная растворимость Ir в (V) равна 21,5±1 % (ат.)
Ir при температуре 1900±50 "С, а V в (Ir) - 19 % (ат.) V
при 2100 °С. С понижением температуры взаимная растворимость
уменьшается.
Кристаллическая структура соединений приведена в табл. 72.
Ir-V, Ir-W
Таблица 72. Кристаллическая структура соединений системы 1г—V [1]
129
Соединение
V3Ir
VIr
<vi-A>Ir*
VIr3
*0,04 < x -
Прототип
Cr3O
VIr
AuCu
AuCu3
: 0,19.
Символ
Пирсона,
пр.гр.
oC 16,
Ama2
oC8,
Cttwxvx
tP4,
P4/mmm
cP4,
Pnilm
Параметры решетки, нм
a
0,4786
0,4794
0,4798
0,5791
0,3887
0,3856
0,3807
0,3812
b
0,6756
—
-
с
-
0,2796
0,3654
0,3717
-
Содержа-
Содержание Ir, %
(ат.)
25
33
40
50
52
S9,5
69,5
75,0
Литература
1. Giessen B.C., Dangel P.N., Grant N.Y. // J. Less-Common Met. 1967. V. 13. N 1.
P. 62-70.
А.Л. Татаркина-
Ir-W. ИРИДИЙ—ВОЛЬФРАМ
Диаграмма состояния Ir—W во всем интервале концентраций
построена в работах [1, 2] и представлена на рис. 59 по данным
работы [1J. Основные результаты обеих работ хорошо согласуются
между собой. Имеют место некоторые различия в температурах
реакций, а также в характере протекания реакции между твердым
раствором (Ir) и фазой р. В системе установлено образование двух
соединений р и o(IrW3).
Фаза р кристаллизуется из расплава при температуре 2494 °С и
концентрации 58 % (ат.) W [1] (по данным работы [2], температура
его образования составляет 2800+25 °С при концентрации -50 %
(ат.) W) и имеет широкий интервал гомогенности при температуре
2300—2400 °С, равный -22—66 % (ат.) W [1J, который сужается до
-22—57 % (ат.) W при температуре -1810 °С и далее до -22—52 %
(ат.) W при температуре -1400 °С [1]. Фаза о образуется по пери-
тектической реакции при температуре 2545±25 "С и концентрации
75,3 % (ат.) W [1] (по данным работы [2], при 2800 °С) и существу-
существует в очень узком интервале концентраций 69—71 % (ат.) [2]. Фаза
а распадается по эвтектоидной реакции при температуре 1813 °С и
концентрации 75 % (ат.) W [1] (по работе [2], при 1850 "С и 70 %
130
Ir-W
W.%(ne массе)
10 20 30 40 50 SO 10 80 90 WO
t.'C
5200
2800
2400
2000
1600
1200
гччт
и
23
1
I
f ,
09 ±25°
' ~2Z
i iff!
' !
i
2?.
-58
1
1
if
2i6i±i
T
7 -
1813±Z0°
\
б
i
/
I
/
//
//
/
C-90,1
\M
\
\
is
\
0 10 20 30 tO 50 SO 10 SO SO 100
lr W,%{am.) W
Рис. 59. Ir-W
(ат.) W). При температуре 2464 °C и концентрации -70 % (ат.) W
[1] (или 2700 "С и 63 % (ат.) W [2]) кристаллизуется эвтектика Р +
+ о. При температуре 2309 "С и концентрации -21 % (ат.) W [1]
осуществляется эвтектическое превращение Ж « (Ir) + р. По данным
работы [2], при температуре 2500 °С и концентрации 22 % (ат.) W
кристаллизуется по перитектической реакции из расплава и фазы р
твердый раствор на основе Ir.
Растворимость W в (Ir) с понижением температуры понижается и
составляет 19,8; 13,7; 12,6 и 11,5 % (ат.) W при температурах 1800,
1300, 1100 й 900 "С. Растворимость Ir в (W) составляет -6, -3 и
-1 % (ат.) Ir при температурах 2800, 2000 и 1000 "С [2] или -10,
-4, -2 % (ат.) Ir при температурах 2540, 1810 и 1400 °С [1].
Предполагают (рис. 59) образование фаз е и б при перикристал-
лизации фазы р. Фаза р имеет гексагональную плотноупакованную
решетку с параметрами а = 0,2736-0,2742 нм, с = 0,4378-0,4389 нм
для сплава с 22 % (ат.) W и а = 0,2762-0,2774 нм, с = 0,4447-
0,4468 нм для сплава с 50 % (ат.) W [2]. Фаза о имеет структуру
типа PU (символ Пирсона tP3O, пр.гр. РА2/тпт), параметры решетки
а = 0,967*0,970 нм, с = 0,497-0,501 нм [2].
Ir-W, lr—Y, Ir—Yb
131
Литература
1. Rapperporl E.J., Smith M.F. // Techn. Rept. WADD-TR-60—132. Part II
(AD287548). 1962. P. 27-41.
2. Тылкина М.А., Полякова В.П., Шехтман В.Ш, // Журнал неорганической
химии. 1963. Т.8. № П. С. 2549-2555.
К. Б. Поварова
Ir-Y. ИРИДИЙ-ИТТРИЙ
Известно о существовании в системе трех соединений, кристалли-
кристаллические структуры которых приведены в табл. 73.
Таблица 73. Кристаллическая структура соединений системы Ir—Y
Соедине-
Соединение
lr2Y
it2y;
IrY3
Прототип
Cu2Mg
Mn5C2
Fe3C
*P = 96,64".
Символ
Пирсона,
пр.гр.
cF24,
Fdlm
mC28,
C2/e
ОЯ16,
Pnma
Параметры решетки, нм
a
0,7500-
-0,7520
1,5698
0,7237
6
¦ —
0,6481
0,9297
с
—
0,7245
0,6400
Источник
[1]
[2]
[3]
Литература
1. Compton V.B., Manias В. // Acta Crystallogr. 1959. V. 12. P. 651-654.
2. Le Roy J., Paccard D., Moreau J.—M. // J. Less-Common Met. 1980. V: 72. N 1.
P. 11-15.
3. Благородные металлы: Справочник / Под ред. Е.М. Савицкого. М.: Металлур-
Металлургия, 1984. 592 с.
В.П. Полякова
Ir—Yb. ИРИДИЙ—ИТТЕРБИЙ
Известно о существовании Лавес-фазы Ir2Yb со структурой типа
MgCu2 (символ Пирсона cF2A, пр.гр. Fdbm), a = 0,7477 нм [1].
Литература
1. Благородные металлы. Справочник / Под ред. Е.М: Савицкого: М.: Металлур-
Металлургия, 1984. 592 с.
В. П. Полякова
132 Ir-Zn, Ir-Zr
Ir-Zn. ИРИДИЙ-ЦИНК
Сведений о строении сплавов Ir с Zn в литературе обнаружить не
удалось. В работе [1] установлено, что при выдержке прутка Ir
диаметром 4 мм в расплавленном Zn при температурах 470 и 620 °О,
в течение 6 ч происходит проникновение Zn в Ir по границам зерен*
и растворение Ir в Zn. Потери Ir при температуре 620 °С составили
0,04 г/(см2-ч) [2].
Литература
1 Rhus D.W., Price E.G. // Metal Ind 1964 V 105 N 8 P 243-245
2 Вол А.Е., Каган И.К. Строение и свойства двойных металлических систем М
Наука, 1976, ТЗ 815 с
М А Тылкина
Ir—Zr. ИРИДИЙ-ЦИРКОНИЙ
Исследование диаграммы состояния системы Ir—Zr проведено в
работах [1—7]. Диаграмма состояния системы приведена на рис. 60
по данным работы [6]. Исследование выполнено на сплавах, приго-
приготовленных дуговой плавкой из иодидного Zr и Ir чистотой 99,9 %
(Ir вводили в виде лигатуры) методами микроскопического, рентге-
рентгеновского (в том числе и высокотемпературного) и дифференциально-
дифференциального термического анализов. Установлено существование шести соеди-
соединений: Zrlr3, Zrlr2, Zrlr, Zr5lr3, Zr2lr, Zr3lr.
Соединение Zrlr3 плавится конгруэнтно при температуре 2280 °С,
при субсолидусных температурах область гомогенности лежит в
интервале концентраций 19—27 % (ат.) Zr, при температуре 1700 °С
она сужается до 4 % (ат.). Соединение Zrlr2 образуется по перитек-
тической реакции при температуре 2085 °С. Соединение Zrlr плавит-
плавится с открытым максимумом при температуре 2050 °С, имеет область
гомогенности протяженностью 6 % (ат.) при температуре 1870 °С.
В интервале температур 900—950 "С соединение Zrlr претерпевает
превращение. Соединения Zr5lr3, Zr2lr и Zr,Ir образуются по пери-
тектическим реакциям при температурах 1730, 1340 и 1305 "С соот-
соответственно; при этом Zrlr существует в двух модификациях.
Установлено существование трех эвтектических превращений:
Ж - (Ir) + Zrlr, при 2120 °С и -13 % (ат.) Zr;
Ж - Zrlr2 + Zrlr при 1870 "С и -42 % (ат.) Zr;
Ж « (pZr) + Zr3lr при 1240 °С и 82 % (ат.) Zr.
В (Ir) при эвтектической температуре 2120 "С растворяется около
7 % (ат.) Zr. В (pZr) при температуре 1240 °С растворяется около
Ir—Zr
133
TrS/el/io нассе)
ю га зо vo so
7& во за/во
гэоо
2300
2700
1300
BBJ°
700
О 10 20 10 10 50 80 -78 80 90 100
If Zr,°/o(am) Zr
Рис 60 Ir—Zr
134
Ir-Zr
5 % (ат.) Ir. Ir понижает температуру превращения (aZr) « (Р&)
до 775 °C — температуры эвтектоидной реакции (pZr) « (aZr) + ZrJr,
Эвтектоидная точка расположена между 3 и 4 % (ат.) Ir. В (aZr)
растворимость Ir менее 1 % (ат.).
При закалке из области (p"Zr) наблюдали образование метаста-
бильных фаз а' (в сплаве с 1 % (ат.) Ir), ш B—4 % (ат.) Ir) и р
[151.
Кристаллическая структура соединений приведена в табл. 74.
Таблица
Соединение
Zrlr3
Zrlr2
Zrlr(BT)
Zr,lr3
Zr2lr
Zr3lr
74. Кристаллическая структура соединений системы Ir—Zr
Прототип
AujCu
MgCu2
CsCl
M^Sij
CuAl2
eVjS
или
1Ш
'При температуре 1050
Символ
Пирсона,
пр.гр.
сР4,
?сП4,
Fdbm
сР2,
РтЪт
№6,
РЬ^тст
—
_
142m
•с.
Параметры
а
0,3943
0,7359
0,3318*
0,7930
0,802
0,651
1,0788
1.078
эешетки, нм
с
-
—
1,7010
0,550
0,559
0,5662
0,562
Источник
[8]
[9]
[Ю]
[121
[4. И]
[41
[14]
[13]
Литература
1. Еременко В.Н., Штепа Т.Д., Семенова Е.Л. // Металлофизика. 1974. № 52.
С. 112-116.
2. Еременко В.Н., Семенова Е.Л., Штепа Т.Д. // Сплавы благородных металлов:
Сб. статей. М.: Наука, 1977. С. 109-111.
3. Еременко В.Н., Семенова Е.Л., Штепа Т.Д. // Изв. АН СССР. Металлы. 1978.
№ 2. С. 200-203.
4. Еременко В.Н., Семенова Е.Л., Штепа Т.Д. // Изв. АН СССР. Металлы. 1980.
№ 5. С. 237-241.
5. Семенова Е.Л. // Получение и исследование свойств новых материалов: Сб.
статей. Киев: Наукова Думка, 1978. С. 40—45. .
6. Еременко В.Н., Семенова Е.Л., Хоружая В.Г., Штепа Т.Д. // Физическая
химия неорганических материалов: Сб. статей. Киев: Наукова Думка, 1988.
С. 256-324.
7. Куприна В.В., Курячая Г.И. // Вестник Моск. ун-та. Химия. 1974. № 3.
С. 371-373.
Ir-Zr, K-La, К—Li 135
8. Dwight A.E., Beck P.A. // Trans. AIME. 1959. V. 215. N 12. P. 976-979.
9. Dwight A.E. // Trans. ASM. 1961. V. 53. P. 479-500.
10. Еременко В.Н., Семенова Е.Л., Штепа Т.Д., Кудрявцев Ю.В. // Доклады АН
УССР. Сер. А. 1978. № 10. С. 945-947.
11. Biswas Т.К., Schubert К. // Z. Metallkunde. 1967. Bd. 58. N 8. S. 558-559.
12. Cenzual К., Parthe E. // Acta Crystallogr. С 1986. V. 42. N 9. P. 1101-1105.
13. Schubert K., Raman A., Rossteutscher W. // Naturwissenschaften. 1964. Bd. 51.
N 21. S. 506-507.
14. Cenzual K., Parthe E. // Acta Crystallogr. С 1985. V. 41. N 6. P. 820-825.
15. Коломиец Л.А., Семенова Е.Л., Скороход В.В. и др. // Доклады АН УССР.
Сер. А. 1978. № 10. С. 947-950.
Л.А. Третьяченко
K-La. КАЛИЙ-ЛАНТАН
Экспериментальные исследования по изучению характера взаимо-
взаимодействия К с La отсутствуют. По данным прогнозирования соедине-
соединений с использованием ЭВМ, указывается на возможность образования
в системе К—La трех соединений: KLa, K2La, K3La [ 1 ].
Литература
1. Савицкий Е.М., Грибуля В.Б. Прогнозирование неорганических соединений с
помощью ЭВМ. М.: Наука, 1977. 187 с.
М.А. Тылкина
K-Li. КАЛИЙ-ЛИТИЙ
Сплавы К с Li синтезировали в молибденовых тиглях в вакууме,
используя Li и К с содержанием кислорода соответственно 0,0062 и
0,0051 % (по массе) [1].
Установлено, что К и 1л полностью не смешиваются друг с другом
в твердом состоянии и весьма ограниченно в жидком [ 1, 2].
Растворимость К в Li в интервале температур 197—527 °С подчи-
подчиняется ¦ зависимости
Igx = -1,25 - 1362/Г,
где х — концентрация К, % (ат.), Т — температура, К.
Растворимость Li в К в интервале температур 77—417 °С подчиня-
подчиняется зависимости
Igx = 0,84 - 1838/71,
где х — концентрация 1л, % (ат.).
136 K-U, К-1м
Взаимная растворимость' К и Li приведена ниже:
Температура, °С 321 427
Растворимость, % (ат.):
Li 5,6- КГ3; 1,3- 10~2 1,6- ИГ2; 2- КГ2
К 2,9- КГ4; 1,8- КГ4 6,4- 10"*; 3,4- КГ*
Источник [1]; [2] [1]; [2]
Температура, "С 538 666
Растворимость, % (ат.):
Li 3,8- КГ2; 6- i(T2 -
К 1,2- КГ3; 1,3- КГ3 2- КГ3; 4,7- КГ2
Источник [1]; [2] [1]; [2]
Исходя из данных по взаимной растворимости, в работе [I]
рассчитано, что полная взаимная растворимость К и 1л возможна при
температурах выше 997 °С.
Литература
1. Smith F.J. // J. Less-Common Met. 1974/ V. 35. N 1. P. 147-151.
2. Moffatt W.G. // Handbook of Binary Phase Diagrams. New York: Business Growth
Services. General Electric Co. Schenectady 1976, 1977. V. 1, 2. 658 p.
Л.Л. Зусман
K-Lu. КАЛИЙ-ЛЮТЕЦИЙ
Сведения по экспериментальному исследованию системы К—Lu
отсутствуют. По данным прогнозирования соединений в двойных
системах с помощью ЭВМ указывается на возможность образо-
образования в системе К—Lu четырех соединений: KLu, K2Lu, K3Lu
и KLu3 [1].
Литература
1. Савицкий Е.М., Грибуля В.Б. Прогнозирование неорганических соединений с
помощью ЭВМ. М.: Наука. 1977. 187 с.
М.А. Тылкина
K-Mg
137
К—Mg. КАЛИЙ-МАГНИЙ
Обзор исследований диаграммы состояния К—Mg проведен в
работах [X, 1,2]. Диаграмма состояния К—Mg приведена на рис. 61
по данным работ [1, 2]. Система К—Mg характеризуется почти
полной несмешиваемостью компонентов в жидком состоянии с незна-
незначительной растворимостью К в жидком Mg. Растворимость компонен-
компонентов друг в друге в твердом состоянии практически отсутствует.
Температура монотектического превращения F50 °С) практически
совпадает с температурой плавления Mg. Температура эвтектического
превращения F3,2 °С) практически совпадает с температурой плав-
плавления К. Промежуточных фаз в системе не обнаружено. Раствори-
Растворимость Mg в (К) составляет 0,6 % (по массе) или 0,95 % (ат.) при
температуре монотектики. Растворимость К в (Mg) менее 0,01 % (по
массе) или 0,22 % (ат.) при температуре эвтектики 63,2 С.°
t.'c
800
700
600
500
иво
300
ZOO
too
ез,71
tO 20 30 4>ff
50
Мд, V. Cam )
SO 70
BO
90
100
—Ж
0.6
t t
>-ж2
1
Б50'
О
к
10
20
SO
Ь0
50 ВО Те
% (по массе)
80
90
100
Рис. 61. K-Mg
Литература
1 Pelton A.D. // Bull Alloy Phase Diagrams 1985 V. 6. N 1. P. 39—41, 95, 96.
2. Klemm W., Kunze D. // Alkali Metals. London. Chemical Society Spec. Publ. 1967
P 3-22
Л.Л. Рохлин
138 К-Мп, К-Мо, K-N
К—Мп. КАЛИЙ-^МАРГАНЕЦ
Диаграмма состояния системы не построена. По данным прогнози-
прогнозирования соединений с помощью ЭВМ указывается на возможность
образования двух соединений: К2Мп и КМп2 со структурой типа
фазы Лавеса [1].
Литература
1. Савицкий Е.М., Грибуля В.Б. Прогнозирование неорганических соединений с
помощью ЭВМ. М.: Наука, 1977. 187 с.
М.А. Тылкина
К-Мо. КАЛИЙ-МОЛИБДЕН
Диаграмма состояния К—Мо не построена. Данные о характере
взаимодействия К и Мо приведены в работах [Ш, 1—4]. По данным
работы [2], при температурах до 900 °С Мо не растворяется в жид-
жидком К. По данным работы [31, растворимость Мо в жидком К состав-
составляет от 0,02 до 0,5 % (ат.) Мо. В работе [Ш] сообщается, что рас-
растворимость Мо в жидком К, содержащем менее 0,07 % (ат.) приме-
примесей, составляет менее 4Х10 % (ат.) Мо. В обзоре [4] сообщается,
что в жидком К растворяется менее 8,12x10"* % (ат.) Мо при темпе-
температуре 1205 °С. В работе [1] предложено выражение для линии
ликвидуса Мо: \пх = —33870- Т~х + 2,21, где х — концентрация Мо,
% (ат.), Г — температура, К. Растворимость Мо в К может быть
оценена как 101 % (ат.) Мо при температуре 63 "С и 1,4*10~7 %
(ат.) Мо при 1227 "С. Растворимость К в Мо предельно мала и кон-
контролируется наличием дефектов.
Литература
1. Brewer L., Lamoreaux R.H. // Atomic Energy Review. Special. Issue N 7. Molibde-
num: Physico-Chemical Properties of its Compounds and Alloys. Vienna: International
Atomic Energy Agency, 1980. P. 195—356.
2. Willhelm С // Mater. Design Eng. 1963. V. 58. N 6. P. 97-108.
3. Distefano J.R., Litman A.P. // Corrosion. 1964. V. 20. P. 392.
4. Вол А.Е., Каган И.К. Строение и свойства двойных металлических систем. М.'.
Наука, 1979. Т.4. 576 с.
КБ. Поварова
K-N. КАЛИЙ-АЗОТ
Диаграмма состояния системы К—N не построена. Предполагается,
что растворимость N в жидком К незначительна [1].
Установлено существование двух нитридов К: K3N [10,67 % (по
массе) N] и KN3 151,80 % (по массе) N].
K-N, K-Na
139
K3N можно получить нагревом гидрида К (КН) в струе N; синтез
KN3 осуществляется пропусканием закиси N(N2O) над расплавлен-
расплавленным амидом К (KNH2).
K3N плавится при температуре 343 °С и разлагается при 355 °С.
Соединение KN3 плавится при температуре 387 °С; оно имеет тетра-
тетрагональную решетку, изотипную с KHF2 (пр.гр. 14/тст), параметры
решетки а = 0,6106 нм, с = 0,7070 нм. При увеличении давления до
0,33 ГПа температура плавления KN3 повышается до 396 °С [1, 2].
Литература
1. Barker M.G. // Handbook of Thermodynamic and Transport Properties of Alkali
Metals. Oxford: Blackwell Scientific Publications. 1985. P. 897—899.
2. Вол А.Е. Строение и свойства двойных металлических систем. М.: Физматгиз,
1959. Т. 1. 756 с.
Л. Л. Зусман
K-Na. КАЛИЙ—НАТРИЙ
Сплавы Na и К получали в вакуумированных стеклянных ампу-
ампулах под слоем нефти, осаждением из газовой фазы на подложку,
взаимодействием расплавленного Na с жидким едким К при темпера-
температурах 400—450 °С, взаимодействием паров Na с жидким хлоридом К
при температурах 850—900 °С [1].
Наиболее точно диаграмма состояния системы К—Na была изучена
методом термического анализа в работе [2], в которой сплавы К с Na
Na,%(no массе)
0 10 20 30 <t0 50 60 70 80 90 100
t,°C
100
80
S3.?!'
60
10
20
0
-го
-40
-60
к.
\
г
/
\
ч
\
Ж
с
3
.1
1
/
\
J
/
-97.8°.
/
7.07°
0
о
к
Рис. 62. K-Na
10 20 30
40 50 60
ыа,%{ат.)
70
80 90 100
Na
140 K-Na, K-Nb
[К чистотой 99,99 % (по массе) и Na чистотой 99,9 % (по массе)]
получали в никелевых тиглях в атмосфере Аг (рис. 62).
В системе образуется соединение KNa2 по перитектической реак-
реакции при температуре 7,07 °С. Эвтектическое превращение Ж •* (К) +
+ KNa2 происходит при температуре —13,4 °С и концентрации
31,93 % (ат.) Na.
Максимальная растворимость Na в (К) (при эвтектической темпе-
температуре) составляет 4,6±0,3 % (ат.). Максимальная растворимость К
в (Na) (при температуре перитектики) равна 0,8±0,1 % (ат.).
Соединение KNa2 обладает структурой типа MgZn2 (символ
Пирсона ЛР60, пр.гр. Рб3/(ттс) с параметрами решетки а =
= 0,750 нм, с = 1,230 нм при температуре —10 "С [3].
Согласно работе [4] при давлении 3,5 ГПа температура эвтекти-
эвтектической и перитектической реакций становится одинаковой, равной
72 °С. При давлении 5,0 ГПа кривая ликвидуса сплавов в области
концентраций 55—80 % (ат.) К проходит через максимум, что указы-
указывает на образование соединения K2Na.
Литература
1. Вол А.Е., Каган И.К. Строение и свойства двойных металлических систем. М.:
Наука, 1979. Т.4. С. 576.
2. Ott J.B., Goates J.R., Anderson D.R., Hall H.T. // Trans. Faraday Soc. 1969.
V. 65. P. 2870-2876.
3. Laves F., Wallbaum H.J. // Z. Anorg. All. Chem. 1942. Bd. 250. S. 110-116.
4. Anderson D.R., Ott J.B., Goates J.R., Hall H.T. // J. Phys. Chem. 1971. V. 54.
N 2. P. 234-239.
Л.Л. Зусман
K-Nb. КАЛИЙ-НИОБИЙ
По данным работы [1], при температурах до 900 °С Nb не взаи-
взаимодействует с расплавленным К. Согласно справочнику [Ш] при
температурах ниже 1200 °С растворимость Nb в жидком К составляет
менее 0,002 % (по массе).
Согласно работам [2, 3] растворимость Nb в расплавленном К
возрастает по мере увеличения в К неметаллических примесей.
Например, в К с примесью кислорода 0,0025 % после выдержки в
течение 48 ч при температурах 400 и 600 "С растворимость Nb
составила соответственно 0,0020 и 0,0016 % (по массе), а при увели-
увеличении содержания кислорода в К до 0,0530 % (по массе) раствори-
растворимость Nb при тех же условиях возросла до 0,075 и 0,093 % [2].
По данным работы [3], с повышением содержания кислорода в К от
менее 0,0001 до 1,9 % (ат.) растворимость Nb возрастает от 0,005 до
1,34 % (ат.) (длительность выдержки Nb в расплавленном К в этом
К-ЫЬ, K-Nd, K-Ni 141
случае составила 500 ч). Согласно работе [4] растворимость Nb в
расплавленном К, содержащем G—11) Ю" % кислорода, после
выдержки в течение 1 ч при температуре 1225 °С составила
(9-28) Ю-4 %.
Литература
1. Wiilhelm С. II Mater. Design Eng. 1963. V. 58. N 6. P. 97-108.
2. Distefano J.R., Litraan A.P. // Corrosion. 1964. V. 20. N 12. P. 392-403.
3. Klueh R.L. // Corrosion. 1969. V. 25. N 10. P. 416-425.
4. Gienell W.S., Teitel R.J. // Trans. Amer. Nucl. Soc. 1965. V. 8. N 2. P. 393—401.
Л.Л. Зусман
K-Nd. КАЛИЙ-НЕОДИМ
Экспериментальные данные о характере взаимодействия К с Nd
отсутствуют. Прогнозирование существования химических соедине-
соединений с помощью ЭВМ, проведенное в работе [1], указывает на воз-
возможность образования в системе К—Nd пяти соединений: KNd,
K2Nd, KNd2, K3Nd, KNd3.
Литература
1. Савицкий Е.М., Грибуля В.Б. Прогнозирование неорганических соединений с
помощью ЭВМ. М.: Наука, 1977- 192 с.
М.А. Тылкина
K-Ni. КАЛИЙ-НИКЕЛЬ
По данным работы [1], при температурах до 900 °С № не взаимо-
взаимодействует с расплавленным К.
Согласно справочнику [Ш] растворимость Ni в расплавленном К
в интервале температур 670^1055 °С приведена ниже:
Температура, "С 670 760 870 985 1055
Растворимость Ni- 10~~*i
% (по массе) 5,5 6,5 19 25 58
% (ат) 3,7 4,3 13 17 39
В работе [2] Ni чистотой 99,97 % (по массе) выдерживался в
расплавленном К в течение 3 ч, а затем подвергался центрифугиро-
центрифугированию в течение 4 ч для отделения частиц Ni, не растворившихся в
К. Согласно работе [3] растворимость Ni в К при температурах 925
и 1000 °С составляет 2Х10 и 4Х10 % (по массе) соответственно.
Литература
1. Wiilhelm С. // Mater. Design Eng. 1963. V. 58. N 6. P. 97-108.
2. Ginell W.S., Teitel R.J. // Trans. Amer. Nucl. Soc. 1965. V. 8. N 2. P. 393-401.
ЛЛ. Зусман
142 K-Np, K-0
K-Np. КАЛИЙ-НЕПТУНИЙ
Экспериментальные данные о характере взаимодействия К с Np
отсутствуют. Прогнозирование существования химических соедине-
соединений с помощью ЭВМ, проведенное в работе [1], указывает на воз-
возможность образования в системе К—Np четырех соединений: KNp,
K2Np, K3Np, KNp3.
Литература
1. Савицкий Е.М., Грибуля В.Б. Прогнозирование неорганических соединений с
помощью ЭВМ. М.: Наука, 1977. 192 с.
М.А. Тылкина
К-О. КАЛИЙ-КИСЛОРОД
Взаимодействие К с кислородом в боксе в атмосфере Аг, используя
К с примесью Na не более 50*10 % (по массе) и спектрально-
чистый кислород, проведено в работе [1].
Диаграмма состояния системы К—О не построена, однако в этой
системе методами термического, рентгеновского анализов и
измерением магнитных свойств установлено существование пяти
соединений — оксидов: с содержанием О в % (по массе): К2О
A6,99), К2О2 B1,04), К2О3 C8,03), КО2 D5,0) и К2О4 E5,1)
[2-5].
В интервале температур 70—402 °С растворимость О в жидком К
рассчитывается по уравнению [1]
Igx = 3,9702 - 420,4/Г,
где х — концентрация 0- 10, % (ат.), Т — температура, К.
Температура плавления оксидов калия К2О2, К2О3, КО2 — 490,
430 и 380 "С соответственно. Озонид калия КО3 самопроизвольно
распадается при комнатной температуре по реакции 2КО3 - 2КО2 +
+ О2. Соединение КО2 в интервале температур 60—100 °С имеет
полиморфное превращение [4].
Кристаллическая структура оксидов в системе К—О представлена
в табл. 75.
K-O, K-Os, К-Р
143
Таблица 75. Кристаллическая структура соединений системы К—О
Соедине-
Соединение
К2О*
аКО2
рко2
ко3"
Прототип
—
СаС2
NaO2
Символ
Пирсона,
пр.гр.
Стса
tlb,
14/ ттт
-
Н/ттс
Ромбическая сингония.
"Тетрагональная сингония.
Параметры решетки, нм
а
0,6736
0,5704
0,6090
0,8597
b
0,7001
-
-
с
0,6479
0,6699
—
0,7080
Источник
12]
[3]
[4]
[5]
Литература
1. Krishnamurthy D., Thiruvendasami A., Bhal N.B., Malhews С.К. // J. Less-
Common Met. 1987. V. 135. N 2. P. 285-292.
2. Foppe H. // Z. Anorg All. Chem. 1957. Bd. 291. S. 12-19.
3. Abrahams S.C., Kalnajs J. // Acta Crystallogr. 1955. V. 8. P. 503-509.
4. Carter G.F., Margrave J.L., Templeton D.H. // Acta Crystallogr. 1952. V. 5.
P. 851-858.
5. Azaroff L.V., Corvin I. // Proc. Nation. Acad. Sci. (US) 1963. V. 49. P. 1-12.
Л.Л. Зусман
K-Os. КАЛИЙ-ОСМИЙ
Экспериментальные данные о характере взаимодействия К с Os
отсутствуют. Прогнозирование существования химических соедине-
соединений с помощью ЭВМ, проведенное в работе [1], указывает на воз-
возможность образования в системе двух соединений: KOs2 со структу-
структурой фазы Лавеса и KOs.
Литература
1. Савицкий Е.М., Грибуля В.Б. // Прогнозирование неорганических соединений
с помощью ЭВМ. М.: Наука, 1977. 192 с.
М.А. Тылкина
К—Р. КАЛИЙ-ФОСФОР
Диаграмма состояния К—Р не построена. В системе К—Р установ-
установлено существование четырех химических соединений — фосфидов с
содержанием Р в % (по массе): К3Р B0,89), К,Р5 F6,45), КР5
G9,85) и КР15 (92,25) [1-4].
144 К-Р, К-Ра, К-РЬ
Соединение К3Р было получено в виде кристаллов действием
паров Р на расплавленный К при температуре 700 "С [1]. Фосфид
KjP имеет структуру типа AsNa3 (символ Пирсона ЛР8, пр.гр.
Pb^lmmc) с параметрами решетки а = 0,5691 нм, с = 0,1005 нм [1].
Фосфид К2Р5 приготовлен путем взаимодействия К со свежедис-
свежедистиллированным Р в вакууме с последующей отгонкой избытка К при
температуре 400—430 "С [2].
Действием избытка К2Р5 на раствор К в жидком аммиаке с после-
последующей отгонкой аммиака при температуре 180 °С получен фосфид
КР5 13].
Фосфид КР15 в виде плоских иглообразных кристаллов приготов-
приготовлен осаждением при температурах 300—320 "С из газовой фазы,
полученной нагреванием смеси К2Р5 с 5—20 % (ат.) К в кварцевой
ампуле [4]. Фосфид КР15 имеет триклинную структуру (пр.гр. рТ;
четыре формульные единицы в элементарной ячейке) с параметрами
решетки а = 2,374 нм, Ъ = 0,969 нм, с = 0,721 нм, а = 116,7*, р =
= 97,5°, у = 90° [4].
Литература
1. Gnutzmann С, Dorn W., Klemm. // Z. Anorg. AH. Chem. 1961. Bd. 309.
S. 210-221. i
2. Bossuet R. // Compt. Rend. Acad. Sci. Paris. 1912. V. 154. P. 209—219.
3. Hugot С // Compt. Rend. Acad. Sci. Paris. 1895. V. 121. P. 207-216.
4. Schnering H.G., Schmidt H.S. // Angew. Chemie (Internet, edition). 1967. Bd. 6.
S. 356-364.
Л.Л. Зусман
K-J»a. КАЛИЙ-ПРОТАКТИНИЙ
Экспериментальные данные о характере взаимодействия К с Ра
отсутствуют. Прогнозирование возможности существования химичес-
химических соединений с помощью ЭВМ, проведенное в работе [1], указыва-
указывает, что в системе К—Ра соединения не образуются.
Литература
1. Савицкий Е.М., Грибу ля В.Б. Прогнозирование неорганических соединений с
помощью ЭВМ. М.: Наука, 1977. 192 с.
М.А. Тылкина
К—РЬ. КАЛИЙ-СВИНЕЦ
Сплавы К с РЬ получали из компонентов в тиглях из Fe в среде
Аг. Диаграмма состояния К—РЬ (рис. 63) построена в работе [1] по
данным термического анализа.
K-Pb
145
Рв,°/о(по массе)
Рис. 63. K-Pb
„010 3040 SO ВО 10 IS ВО 65
700
SOO
500
400
300
200
100
100
ттт
г
J
/
/
— (к)
ж
sz"
/
/
ч
> г
STO'
и
-1
\
\
ЗЯГ
i
\
\
79Z''
t
с
327,502°
274'-
(п
V
•5/
—
20 30
40 SO BO
P8,'U(am.\
10 SO
30
100
PS
В системе К—Pb обнаружено четыре соединения, из которых КРЬ
плавится конгруэнтно при температуре 570 "С, остальные К2РЬ3,
КРЬ2 и КРЬ4 кристаллизуются по перитектическим реакциям при
температурах соответственно 372, 338 и 292 °С. Сплав эвтектическо-
эвтектического состава, богатый РЬ, содержит при температуре 274 "С -91 %
(ат.) РЬ, состав эвтектики на основе К (при температуре 52 °С)
точно не установлен.
Кристаллические структуры некоторых соединений приведены в
табл. 76.
Таблица 76. Кристаллическая структура соединений системы
Соединение
КРЬ
КРЬ2
крь;
Прототип
NaPb
MgZn2
Кубическая сингония.
Символ
Пирсона,
пр.гр.
f/64,
/4,/acrf
API 2,
РЬъ1ттс
Параметры
а
1,150
0,666
1,231
)ешетки, нм
с
1,876
1,076
Источник
[2]
[3]
[3]
146 K-Pb, K-Pd, K-Po, K-Pr
Литература
1. Шойхет Д.Н., Морачевский А.Г., Алабышев А.Ф. // Журнал неорганической
химии. I959.T.4- № 7. С. 1616-1619.
2. Hewaidy I.F., Busmamm E., Klenn W. // Z. Anorg. All. Chem. 1964. Bd. 328. N 2.
S. 283-293.
3. Gilde O. // Z. Anorg. All. Chem. 1956. Bd. 284. N 1. S. 142-146.
Л.Л. Зусман
К—Pd. КАЛИЙ—ПАЛЛАДИЙ
Экспериментальные данные о характере взаимодействия К с Pd
отсутствуют. Прогнозирование существования химических соедине-
соединений с помощью ЭВМ, проведенное в работе [1], указывает на воз-
возможность образования в системе К—Pd двух соединений: KPd2 (фаза
Лавеса) и KPd.
Литература
1. Савицкий Е.М., Грибуля В.Б. Прогнозирование неорганических соединений с
помощью ЭВМ. М: Наука, 1977. 192 с.
М.А. Тылкина
К-Ро. КАЛИЙ-ПОЛОНИЙ
Экспериментальные данные о характере взаимодействия К с Ро
отсутствуют. Прогнозирование существования химических соедине-
соединений с помощью ЭВМ, проведенное в работе [1], указывает на воз-
возможность образования в системе К—Ро четырех соединений: КРо,
К2Ро, КРо2, КРо3.
Литература
1. Савицкий Е.М., Грибуля В.Б. Прогнозирование неорганических соединений с
помощью ЭВМ. М.. Наука, 1977. 192 с
М.А. Тылкина
К-Pr. КАЛИЙ— ПРАЗЕОДИМ
Экспериментальные данные о характере взаимодействия К с Рг
отсутствуют. Прогнозирование существования химических соедине-
соединений с помощью ЭВМ, проведенное в работе [1], указывает на воз-
возможность образования в системе К—Рг пяти соединений: КРг, К2Рг,
КРг2, К3Рг, КРг3.
Литература
1. Савицкий Е.М., Грибуля В.Б. Прогнозирование неорганических соединений с
помощью ЭВМ. М.: Наука, 1977. 192 С.
М.А. Тылкина
K-Pt, K-Pu, K-Ra, K-Rb 147
K-Pt. КАЛИЙ-ПЛАТИНА
Согласно работе [1], взаимодействие Pt с расплавленным К начи-
начинается при температуре 400 °С. С повышением температуры скорость
растворения Pt в жидком К возрастает, достигая 0,0254 мм в год при
температуре 600 "С. Экспериментальные данные об образовании
соединений в системе отсутствуют.
Литература
I. Willhelm С. // Mater. Design Eng. 1963. V. 58. N 6. P. 97-108.
Л.Л. Зусман
K-Pu. КАЛИЙ—ПЛУТОНИЙ
Установлено, что К не смешивается с Ри ни в твердом, ни в
жидком состояниях [ 1 ].
Литература
1. Вол А.Е., Каган И.К. Строение и свойства двойных металлических систем. М.:
Наука, 1979. Т.4. 576 с.
Л.Л. Зусман
К-Ra. КАЛИЙ—РАДИЙ
Экспериментальные данные о характере взаимодействия К с Ra
отсутствуют. Прогнозирование возможности существования химичес-
химических соединений с помощью ЭВМ, проведенное в работе [1], указыва-
указывает на отсутствие соединений в системе К—Ra.
Литература
1. Савицкий Е.М., Грибуля В.Б. Прогнозирование неорганических соединений с
помощью ЭВМ. М.: Наука, 1977. 192 с.
М.А. Тылкина
K-Rb. КАЛИЙ-^РУБИДИЙ
Диаграмма состояния К—Rb, изученная методами термического,
микроструктурного и рентгеновского анализов, приведена на рис. 64
[1]. Сплавы К с Rb получены в никелевых тиглях в среде Аг из К
чистотой 99,99 % (по массе) и Rb чистотой 99,98 % (по массе).
Установлено, что К полностью смешивается с Rb в жидком и
твердом состояниях, причем минимальная температура затвердевания
сплавов этой системы составляет 34,2 °С [при содержании Rb 67 %
(ат.)].
При низких температурах в системе К—Rb возможно образование
химического соединения KRb2, однако при увеличении давления до
148
K-Rb, K-Re
Рис. 64.
K-Rb
RB,% (no массе)
О 10 20 30 40 50 ВО Ю 80
30
wo
10
so
50
40
55,7?
\
1
N
(кМ
1
ж
J4,2"
1
39,32'
10 20 30
40 50 SO 70
RB,°/.(am.)
BO 30
100
RB
1,0 ГПа во всем диапазоне концентраций и температур должен
существовать лишь твердый раствор [1, 2].
Литература
1. Goates J.R., Ott J.B., Delawarde E. // Trans. Faraday Soc. 1977. V. 67. N8.
P. 1612-1616.
2. Soma Т., Hosaka K., Kogaya H.—M. // Phys. Status Solidi. B. 1986. V. 37. N 2.
P. K111-K114.
Л.Л. Зусман
K-4le. КАЛИЙ-РЕНИЙ
Система К—Re исследована в работе [1] методом пламенной
фотометрии, заключающейся в регистрации эмиссионных спектров,
возникающих в высокотемпературных пламенах с температурой
порядка 1830—1840 "С.
Установлено образование одного соединения K2Re. Прогнозирова-
Прогнозирование существования химических соединений с помощью ЭВМ, прове-
проведенное в работе [2], указывает на возможность образования в систе-
системе К—Re трех соединений: KRe2 (фаза Лавеса), KRe и K2Re.
Литература
1. Гукова Ю.Я., Ермолаев М.И. // Общие закономерности в строении диаграмм
состояния металлических систем: Сб. статей. М.: Наука, 1973. С. 135—139.
2. Савицкий Е.М., Грибуля В.Б. Прогнозирование неорганических соединений с
помощью ЭВМ. М.: Наука, 1977. 192 с.
М. А. Тылкина
K-Rh, K-Ru, K-S 149
K-Bh. КАЛИЙ-РОДИЙ
Экспериментальные данные о характере взаимодействия К с Rh
отсутствуют. Прогнозирование существования химических соедине-
соединений, проведенное в работе [1], указывает на возможность образо-
образования в системе К—Rh трех соединений: KRh, (фаза Лавеса), KRh и
K2Rh.
Литература
1. Савицкий Е.М., Грибуля В.Б. Прогнозирование неорганических соединений с
помощью ЭВМ. М.: Наука, 1977. 192 с.
МЛ. Тылкина
K-Ru. КАЛИЙ^РУТЕНИЙ
Исследование сплавов системы К—Ru проведено в работе [1] в
основном методом дифференциального термического анализа, а
также металлографическим и рентгеновским методами. Использова-
Использование последних двух ограничивала химическая активность К и его
сплавов. Установлено отсутствие соединений в системе, а также
незначительные взаимные растворимости Ru и К.
Литература
1. Loebich О., Raub Ch.J. // Platinum Metals Review. 1981. V. 25. N 3. P. 113-120.
T.B. Добаткина
K-S. КАЛИЙ-СЕРА
Диаграмма состояния К—S, изученная методами термического,
микроструктурного и рентгеновского анализов, приведена на рис. 65
[1—3]. В системе образуются шесть соединений. Реакция взаимодей-
взаимодействия К с S начинается при слабом нагреве, сопровождается значи-
значительным выделением теплоты и приводит к образованию наиболее
высокотемпературного из сульфидов К — K2S [1]. Сульфиды K2S2 и
K2S4 получены взаимодействием К с S в жидком NH3; K2S3 и
K2S5 — присадкой S к раствору K2S в абсолютном спирте с последую-
последующим отделением нерастворимого продукта; K2S6 — плавкой K2S5 с S
в вакууме [2].
К и S обладают ограниченной растворимостью в жидком состоянии
и отсутствием взаимной растворимости в твердом состоянии. Область
несмешиваемости жидких К и S при температуре 188 °С имеет место
при содержании S от 73 до 99 % (по массе). Сульфиды [в скобках
указано содержание S в % (по массе)] K2S B9,07); K2S3 E5,15);
K2S5 F7,21) и K,S6 G1,1) плавятся конгруэнтно при температурах
840, 279, 211 и 196 °С соответственно, сульфиды K2S2 D5,05) и K2S4
150
K-S
30 40 50 ВО 70 30 90 100
900
800
700
BOO
500
400
300
200
too
63,71
0
К
Рис. 65. K-5
i
1
1
1
1
I
f
/
/
/
/
K)~
84,
/
1
0°
\
\
500°
«
¦ч
-r
\
\
\
250'Ъ
>TOC
V.
П
211'
Ж
1
¦ /
79S"
! J——
ж,+
(s
жг
-183°
У 115,22'
JO 20 30 40 SO BO 70 80 90 100
S°[a (no массе). S
F2,12) образуются по перитектическим реакциям при 500 и 145 "С
соответственно. Сульфид K2S6 образует с S вырожденную эвтектику.
По данным работ [4, 5], K2S при температуре 146 °С переходит
в новую структурную модификацию. Кристаллическая структура
некоторых соединений приведена в табл. 77.
Таблица 77. Кристаллическая структура соединений системы К—S
Соедине-
Соединение
K2S
K»S2
K2S3
Прототип
CaF2
Na2O2
—
Символ
Пирсона,
пр.гр.
с Л 2,
Fm3m
—,
Р62т
Стс2,
Параметры решетки, нм
а
0,7391
0,849
0,7309
Ь
—
—
0,9914
с
—
0,584
0,7473
Источник
[4]
[6]
[7)
K-S, K-Sb
151
Литература
1. Thomas J., Rule A. // J. Chem. Soc. 1917. V. 111. N 7. P. 1163-1169.
2. Feher P., Berthold H.J. // Z. Anorg. All. Chem. 1953. Bd. 274. S. 223-230.
3. Pearson T.G., Robinson P.L. // J. Chem. Soc. 1931. N 12. P. 1304-1311.
4. Zintl E., Harder В., Dauth B. // Z. Elektrochem. 1934. Bd. 40. S. 588—597.
5. Bridgman P.W. // Proc. Amer. Acad. Arts. Sci. 1915. V. 15. P. 55-64.
6. FoppI H., Busmann E., Prorath P.—K. // Z. Anorg. All. Chem. 1962. Bd 314
S. 12-21.
7. BOttcher P. // Z. Anorg. All. Chem. 1977. Bd. 432. P. 166—177.
Л.Л. Зусман
K^Sb. КАЛИЙ-СУРЬМА
На рис. 66 приведена диаграмма состояния К—Sb, построенная на
основании данных термического и рентгеновского анализов в работе
[1].
В системе К—Sb установлено существование четырех химических
соединений, из которых три — K3Sb, KSb и KSb2 — плавятся конгру-
конгруэнтно при температурах 812, 610 и 411 °С соответственно, а соедине-
соединение K5Sb4 образуется по перитектической реакции при 507 "С. Со
стороны К при температуре 63 "С имеется вырожденная эвтектика,
1
, On
t, L
воо
700
600
SOD
too
300
100
6J,7!
HO 20
1 1
/
/
!
30 <Ю
1 1
/
/
/
\l
50
l
811°
f
/
Й
>?
\
Sb,/o (no naccej
60 TO 80 85
!
\
№o\
1
SI
E07е
f
й
¦8
i
9°
337°
l
Ж
w
S3
ы
30
1
/
/
1
95
1
W7°
(SI
TOO
630,755°
10
го за
u 50 60
Sb,%(am.)
70 80 90
WO
Sb
Рис. 66. K-Sb
152 K—Sb, K-Sc, K-Se
три других сплава эвтектического состава содержат 41, 63 и 68 %
(ат.) к при температурах соответственно 460, 397 и 407 "С.
K3Sb имеет структуру типа Na3As (символ Пирсона hP8, пр.гр.
РЬ3/ттс) с параметрами решетки а = 0,6024 нм и b = 1,0639 нм [2].
Соединение KSb кристаллизуется в структуре типа LjAs (символ
Пирсона т/>16, пр.гр. Р2х1с) с параметрами решетки: а = 0,718 нм,
6 = 0,697 нм, с= 1,340 нм, р = 115,1° [3].
Литература
1 Dorn F.W., Klemm W. // Z. Anorg All. Chem. 1961. Bd. 309 S. 189-203.
2. Gerassimov J.L., Voronin G.F., Nguen Thak Shin// J Chem Thermodyn 1969
V 1 N6 P 425-430.
3. Busmann E., Lohmeyer S. // Z. Anorg. All Chem. 1961. Bd. 312, N 2 S. 53—59.
Л.Л. Зусман
К—Sc КАЛИЙ-СКАНДИЙ
Экспериментальные данные о характере взаимодействия К с Sc
отсутствуют. В работе [1] по результатам прогнозирования химичес-
химических соединений с использованием ЭВМ указывается на возможность
образования в системе К—Sc трех соединений: KSc, K2Sc и K3Sc.
Литература
1. Савицкий Е.М., Грибу ля В.Б. // Прогнозирование неорганических соединений
с помощью ЭВМ М • Наука, 1977. 192 с
М.А. Тылкина
K-Se. КАЛИЙ-СЕЛЕН
Диаграмма состояния К—Se, построенная на основании данных
термического, сканирующего калориметрического и рентгеновского
анализов, приведена на рис. 67 по данным работ [1—4]. Сплавы К с
Se получали из компонентов в инертной среде [1]. Селенид K2Se
может быть получен также восстановлением селената или селенита
К углеродом, окисью углерода или водородом [2].
К и Se обладают ограниченной смешиваемостью в жидком состоя-
состоянии (область несмешиваемости при 220 "С от -77 до 99 % (ат.) Se)
и практически нерастворимы друг в друге в твердом состоянии.
При кристаллизации в системе К—Se образуется пять химических
соединений. Два из них, K2Se и K2Se3, плавятся конгруэнтно при
температурах -800 и -375 °С соответственно (причем K,Se имеет
область гомогенности 33,3—37,5 % (ат.) Se. Соединения K2Se2, K2Se4
и K2Ser образуются по перитектическим реакциям при температурах
-430, -210 и 195 °С соответственно. Предполагается, что со стороны
К существует вырожденная эвтектика; два других эвтектических
K-Se
153
вов
100
600
500
400
300
200
100
8}JI°
Se, % (no массе)
30 SO 60 10 SO
90
100
/
/
/
/
/
I—'
/
/
/
/
/
1
f
63°
/
1
\\
1
to
1
100
\
\
\
\
'7 \
-360'
1 ¦
v
57
—|
\
a
•W. i
ж
I
P
SI
1
no
' \
•¦
- m, ¦ -j
(Si
/0 ^0 30 tO 50 60 10 80 90 100
К Se.%(am) Se
Рис. 67. K-Se
сплава содержат 57 % (ат.) Se (при -360 °C) и 77 % (ат.) Se (при
163 'С).
Согласно работе 15] соединение KjSe имеет ГЦК решетку, изо-
изоморфную CaF2 (символ Пирсона cFl2, пр.гр. Fmbm) с параметром
а = 0,7676 нм. Соединение K2Se3 обладает ромбической синтонией
(пр.гр. Стс2), параметры рещетки а = 0,7692 нм, b = 1,0410 нм, с =
= 0,7717 нм [б].
Литература
1. Klemm W., Sodoman H., Langmesser P. // Z. Anorg. All. Chem. 1939. Bd. 241.
N 8. S. 281-287.
2. Самсонов Г.В. // Халькогениды: Сб. статей. Киев: Наукова Думка, 1967. С.
3-5.
3. Sheiba M., Tausend A., Wobig D. // Thermochim. Acta. 1979. V. 29. N, 2.
P. 265-268.
4. Sheiba M., Wobig D. // Z Phus. Chem. 1980. Bd. 119. N 1. S. 23-32.
5. Zintl E., Harder A., Dauth B. // Z Elektrochem. 1934 Bd. 40. N 7. S. 593.
6. BOttcher P. // Z. Anorg. All. Chem. 1977. Bd. 432. N 5. S. Д 66-174.
JI.JI. Зусман
154
K-Si, K-Sm
K-Si. КАЛИЙ-^СРЕМНИЙ
Диаграмма состояния К—Si не построена. В работе [1] было полу-
получено эквиатомное соединение KSi D1,8 % Si, по массе) сплавлением
К с Si в инертной среде при нагреве до температуры 650 °С. При
длительном нагреве в вакууме или в Аг это соединение разлагается
с образованием промежуточных фаз, состав которых отвечает KSi8
(85,18 % Si, по массе), KSi6 (81,16 % Si, по массе) [2], K6Si46
(84,63 % Si, по массе) [3]. Соединение, состав которого по химичес-
химическому анализу отвечает KgSi^, получается термическим разложением
силицида KSi в вакууме или в Аг в интервале температур
330-500 "С.
Кристаллическая структура соединений приведена в табл. 78.
Таблица 78. Кристаллическая структура соединений системы К—Si
Соединение
KSi
¦
KSi6'
..
146
'Кубическая
Прототип
GeK
—
—
сингония.
Символ
Пирсона, пр.гр.
сР64,
Я43т
—
—,
РтЗп
Параметр
решетки а, нм
1.262
1,34
1,028
Источник
[2,4]
[2]
[3]
Литература
1. Hohmann Е. // Z. Anorg. АИ. Chem. 1948. Bd. 257. N 4. S. 113-119.
2. Schafer R., Klemm W. // Z. Anorg. All. Chem. 1961. Bd. 312. N 3. S. 214-220.
3. Hagenmuller P., Naslain R., Rauchard M., Croc C. // Alkali Metals. London. 1967.
P. 207-221.
4. Busmann E. // Naturwissenshaften. 1960. Bd. 47. N 3. S. 82-86.
Л.Л. Зусман
K-Sm. КАЛИЙ-САМАРИЙ
Экспериментальные данные о характере взаимодействия К с Sm
отсутствуют. В работе [1] по результатам прогнозирования химичес-
химических соединений с помощью ЭВМ указывается на возможность образо-
образования в системе К—Sm пяти соединений: KSm, K2Sm, KSm2, K3Sm,
KSnij.
Литература
1. Савицкий Е.М., Грибуля В.Б. Прогнозирование неорганических соединений с
помощью ЭВМ. М.: Наука, 1977. 192 с.
М.А. Тылкина
K-Sn
155
K-Sn. КАЛИЙ-ОЛОВО
Диаграмма состояния К—Sn, изученная методами термического и
рентгеновского анализов в работе [1], приведена на рис. 68. Сплавы
К с Sn (К - ? примесей s 0,04 %; Sn - ? примесей s 5- 1<Г* %)
йЬлучены из компонентов в среде Аг в герметизированных
тиглях из Мо.
Sn,% (по пассе)
. 0 Ю 20 30 40 50 ВО 70 80 90 100
700
500
300
Ю0
1 1
J
f
1
1
1
1 >
ж
f
— (к)
I
t
'
=
/
/
535'
KSn
1 ft
/740'
-^
1
BOO'
1
\
\
1
-*
231.9681'
0 W 20 30 40 SO 60 70 80 90 100
К Sn,%(am.) Sn
Рис 68. K-Sn
В системе имеется единственное конгруэнтно плавящееся при
температуре 860 °С химическое соединение I^Sn,. Остальные четыре
химических соединения K2Sn, KSn, KSn2 и KSn4 образуются по
псритектическим реакциям при температурах соответственно 535,
740, 710 и 600 °С.
Соединение KSn индицировано в предположении тетрагональной
элементарной ячейки типа NaPb (символ Пирсона 1/64, пр.гр.
/4j/(acrf), а = 1,142 нм, с = 1,857 нм [2]). По данным работы [3]
соединение K2Sn3 кристаллизуется в одну из двух пространственных
групп РА/тсс или Р4сс тетрагональной элементарной ячейки, пара-
параметры кристаллической решетки а = 0,703 нм, с = 1,236 нм.
156 K-Sn, K-Sr, K-Ta
Литература
1 Дриц М-Е., Фридман А.С., Зусман Л.Л., Кустков В.А. // Фазовые равновесия
в металлических сплавах Сб статей М Наука, IS81 С 176—178
2. Hewaidy I.F., BuSmann E., Klemm W. // Z Anorg AH Chem 1964 Bd 328
S. 283-293
3 Дриц М.Е., Сизов р.А., Фридман А.С. и др // Тезисы докладов I Всесоюзной
конференции по химии и технологии редких и щелочных элементов. Апатиты 1988
С 140
Л Л Зусман
K-Sr. КАЛИЙ-СТРОНЦИЙ
К и Sr полностью не смешиваются в жидком и твердом
состояниях [1].
Литература
1 Klemm W., Kunze D. // Proc Int Symp on Alkali Metals. London- Chem Soc
Special Publ, 1967 N 22 P 3-22
Л Л Зусман
K-Ta. КАЛИЙ-ТАНТАЛ
К не смешивается с Та в твердом и жидком состояниях. Раствори-
Растворимость Та в жидком К (содержание О2 менее 2- Ю~3 "%) в интервале
температур 400—1330 °С составляет 3- Г0~5—6- 10"^ % (по массе)
[1, 2]. Растворимость Та в жидком К заметно возрастает в
случае его загрязнения неметаллическими примесями, особенно
О2 [3].
На рис. 69 приведена предполагаемая диаграмма состояния К—Та
[4]. Характер нонвариантных равновесий не установлен. Температу-
Температуры нонвариантнцх равновесий совпадают с температурами плавления
и кипедия К.
Литература
1 GmeH W.S., Teitel RX // Trans Amef Nuel .Soc 1965 N 8 P 393-396
2, Stecura S. // Corrosiomby. Liquid Metals New York, London Plenum Press, 1970
P 601-611 ,
3 Klueh R.L. // Corrosion 1969 V 25 N 2 P 416^-422
4 Garg S.P., ^Venkatrarnan M., Knshnamurthy N. ]l/• Bull Alloy Pha"se Diagrams
1990 V 6 N 1 P 12-.13 ' •
ТВ Добаткина
K-Ta, K-Tb
157
t,'C
1000
m
К, % (по массе)
20 40 SO 100
Рис. 69. К-Та
-200
—
(Та)
(Га)*
(Та)
аз
*Ж
759'
(к
—
63,7/°
О Ю 20 30 40 50 SO 10 80 90 100
la K,%(am) К
K-Tb. КАЛИЙ-ТЕРБИЙ
Экспериментальные данные о характере взаимодействия К с ТЬ
отсутствуют. В работе [2] по результатам прогнозирования химичес-
химических соединений с помощью ЭВМ указывается на возможность образо-
образования в системе К—ТЬ пяти соединений: КТЬ, К,ТЬ, КТЬ„ К,ТЬ,
КТЬ3.
Литература
1 Савицкий Е.М., Грибуля В.Б. Прогнозирование неорганических соединений с
помощью ЭВМ М Наука, 1977 192 с
М А Тылкина
158
К-Те
К—Те. КАЛИЙ—ТЕЛЛУР
Обобщенная диаграмма состояния системы К—Те, построенная по
данным работ [1, 2] и включающая некоторые результаты ранее
проведенных исследований, представлена на рис. 70.
Те, % (по пассе)
от го зо to so 60 70 so so wo
t,°c
воо
700
600
500
WO
300
ZOO
WO
63,7f
0 JO 20 30 fO 50 60 70 60 90 J00
К Те, % (am.) Те
Рис. 70. К-Те
В системе установлено существование трех соединений К2Те, КТе
и К2Те3, плавящихся конгруэнтно при температурах 900±100, 453+5
и 429+5 "С соответственно. Следует отметить, что температура
плавления К2Те установлена методом экстраполирования. Взаимная
растворимость компонентов К в Те и Те в К ничтожно мала.
В системе имеет место образование трех эвтектик. Нонвариантные
равновесия в системе приведены в табл. 79.
Таблица 79. Нонвариантные равновесия в системе К—Те
! i
1
1 i
t
?8?t
i
\
3~I^
frdtS0
3902
¦ "ft
i
53+6a
\ W
ss
9±5°
i
ж
\
V
/
/
220°
(n
^~
¦) -*¦
Реакция
Ж - (Те) + К2Те3
Ж « К2Те3 + КТе
Ж - КТе + ?
Содержание Те в жидкой
фазе, % (ат.)
-79
55
49,5
Температура, °С
220
390±5
448±5
K-Te, K-Th
159
Характер превращения при 484±10 °С не установлен. Предпола-
Предполагается либо полиморфное превращение К2Те при этой температуре,
либо перитектическая реакция образования неустановленного соеди-
соединения, расположенного между К Те и К2Те.
Предполагается, что температура эвтектики между (К) и К2Те по
аналогии с другими подобными системами Те практически совпадает
с температурой плавления К и указывается на диаграмме состояния,
равной 63,71 "С. Эта часть системы требует дополнительного
изучения.
Кристаллическая структура соединений приведена в табл. 80.
Таблица 80. Кристаллическая структура соединений системы К—Те [2]
Соединение
К2Те
К2Те3
Прототип
CaF2
Символ
Пирсона,
пр.гр.
сЯ2,
Fnilrn
оР20,
Рпта
Параметры решетки, нм
а
0,8168-0,8164
1,5938E)
Ь
1,0097E)
с
0,4683C)
Структура соединения КТе не установлена.
Литература
1. Petric A., Pelton A.D., Saboungi M.L. // J. Chem. Phys. 1988. V. 85.
P. 5070-5077.
' 2. Petric A., Pelton A.D. // Bull. Alloy Phase Diagrams. 1990. V. 11. N 3.
P. 443-447.
M.A. Тылкина
K-Th. КАЛИЙ-ТОРИЙ
Экспериментальные данные о характере взаимодействия К с Th
отсутствуют. В работе [1] по результатам прогнозирования химичес-
химических соединений с помощью ЭВМ указывается на возможность образо-
образования в системе К—Th пяти соединений: KTh, K2Th, KTh2, K3Th,
KTh3.
Литература
1. Савицкий Е.М., Грибуля В.Б. Прогнозирование неорганических соединений с
помощью ЭВМ. М.. Наука, 1977. 192 с.
М.А. Тылкина
160
K-Ti, K-Tl
K-Ti. КАЛИЙ-ТИТАН
На рис. 71 приведена по данным работы [1] предполагаемая
диаграмма состояния системы К—Ti.
10 20 30
Ti, % (по массе)
40 50 ВО 10
80
90
100
t'c
1600
1600
ПВО
1200
1000
воо
600
400
200
О
-200
0
К
Рис. 71. К—Ti
1
-
1 1 1 1
-759°
^0000
-
63 71°
f
3
1
1
\
Газ*
Газ*
1
Ж
W
Газ* (<*Tl)
хП)
1
1
1
(г
(«1
1670°
882°
10 10 30 Ьп 50 ВО W 80 90 100
Tt,%(an) Tt
К не смешивается с Ti в твердом и жидком состояниях. Согласно
работе [2], растворимость Ti в чистом К (содержание О2 менее
2хЮ~3 % (по массе)) в интервале температур 750—1070 °С состав-
составляет менее 4x10 % (по массе). С ростом загрязнения К неметал-
неметаллическими примесями растворимость в нем Ti заметно возрастает
[3].
Литература
1 Bale C.W. // Bull Alloy Phase Diagrams V 10 N 2 P 134-135
2 Stecura S. // Corrosion by Liquid Metals New-York, London Plenum Press, 1970
P 601-611
3 Klueh R.L. // Corrosion 1969 V 25 N 2 P 416-422
ТВ Добаткина
K-TI. КАЛИЙ-ТАЛЛИЙ
На рис. 72 приведена диаграмма состояния К—Т1, построенная по
данным термического, рентгеновского анализов, измерения плотности
и атомного объема [1]. Сплавы К с Т1 были приготовлены сплавлени-
сплавлением компонентов в инертной атмосфере [К, очищенный от окисной
K~Tl, K~U
161
t.'c
/Г, % (по массе)
10 Z0 30 40 5060 80 100
230'
200
WO
зоь
\(ATi)
\
V—
г
I
ж
V
/8
1
t
vizo° '
4
1
¦^
-joi.
1 1
\
\
(*)
\ 1
\
Y
-99
40
K,
50
SO
(am)
70
80
SO
too
TL
'Рис. 72. K-Tl
яленки и рафинированный от примесей дистилляцией в высоком
вакууме; Т1 чистотой 99 % (по массе)].
Т1 понижает температуру плавления К приблизительно до 60 °С.
В системе образуются три химических соединения: КТ1, К4Т15 и
К5Т18. Соединение К4Т15 плавится конгруэнтно при 320 "С, соедине-
соединения КТ1 и К5Т18 образуются по перитектическим реакциям при 268
В системе существуют две эвтектики: (К) + КТ1 с содержанием
~1 % (ат.) Т1 при температуре -60 °С и (Т1) + К5Т18 с содержанием
18 % (ат.) К при 172 °С.
Литература
1. Thummel R., Klemm W. // Z Anorg All Chem 1970 Bd 376 S 44-63
Л Л Зусман
К—U. КАЛИЙ-УРАН
Экспериментальные данные о характере взаимодействия К с U
отсутствуют. В работе [1] по результатам прогнозирования химичес-
химических соединений с помощью ЭВМ указывается на возможность образо-
образования в системе К—U двух соединений K2U и K3U.
162
Литература
К—U, K-V
1. Савицкий Е.М., Грибуля В.Б. Прогнозирование неорганических соединений с
помощью ЭВМ. М: Наука, 1977. 192 с.
М.А. Тылкина
K-V. КАЛИЙ^АНАДИЙ
На рис. 73 представлена по данным работы [1] предполагаемая
диаграмма состояния К—V, рассчитанная для системы при возмож-
возможности свободного испарения компонентов при общем давлении
0,1 МПа.
У, "/. (по массе)
О tO 20 30 ЬО 50 ВО 70 80 90 100
t."c
3000
1500
WOO
759°
500
t
I
63.71°
1 1
Газ
v>
1
-
¦
Газ
Ж*
1
—i -
*¦(*)
iv)
Гаг
i
———¦
1
(\/
—
IS W'
К
Рис. 73. К—V
10 70 30 40 SO ВО
V, '/<. (am.)
70 80 90
too
V
К и V практически нерастворимы друг в друге как в жидком, так
и в твердом состояниях. Температуры фазовых превращений совпа-
совпадают с температурами плавления V и К и температурой кипения К.
Литература
1. Smith J.F., Lee K.J. // Bull. Alloy Phase Diagrams. 1988. V. 9. N 4. P. 469—474.
T.B. Добаткина
К— Yb, K-Zn
163
K-Yb. КАЛИЙ-ИТТЕРБИЙ
Экспериментальные данные о характере взаимодействия К с Yb
отсутствуют. В работе [1] по результатам прогнозирования химичес-
химических соединений с помощью ЭВМ указывается на возможность образо-
образования в системе К—Yb четырех соединений: KYb, K2Yb, K3Yb, KYb3.
Литература
1. Савицкий Е.М., Грибуля В.Б. // Прогнозирование неорганических соединений
с помощью ЭВМ. М.: Наука, 1977. 192 с.
М.А. Тылкина
K-Zn. КАЛИЙ-ЦИНК
На рис. 74 приведена диаграмма состояния К—Zn согласно работе
[1], включающая результаты ранее приведенных работ [X].
Zn, % (по массе)
„ О 10 20 30 40 50 60 70 80 90 100
г. С
воо
500
400
300
200
100 ~
т
т-Ж
1<г
1
1 (
I
'1 '
S9Z±S"
Ж+/
'Zn13
1 ,
ж,+>
\
г-
\
Gп
"О
С
1
419,$во
0
к
Рис. 74.
10
K-Zn
20
30
40
Zn,
SO SO
°lо (arn-l .
TO
80
90
100
Zn
Установлено наличие в системе К—Zn широкой области несмеши-
несмешиваемости в жидком состоянии и образование в результате реакции
двух несмешивающихся жидкостей, состоящих практически из чис-
чистых металлов, и химического соединения KZn13 [95,6 % (по массе)
Zn], вступающего в эвтектические реакции с исходными металлами.
164
K-Zn, K-Zr
По мнению авторов работы [2], в системе К—Zn должно существо-
существовать также соединение KZn4 [87,0 % (по массе) Zn].
Соединение KZn3 обладает структурой типа NaZn13 (сим-
(символ Пирсона C.F112, пр.гр. Fm3c) с параметром решетки а =
= 1,236 нм [3].
Литература
1. Pelton A.D. // Bull. Alloy Phase Diagrams. 1987 V. 8. N 6. P. 548-549.
2. Watt G.W., Gentile P.S. // J. Amer. Chem. Soc. 1955. V. 77. N 12. P 5462-5467.
T.B. Добаткина
К—Zr. КАЛИЙ—ЦИРКОНИЙ
На рис. 75 приведена предполагаемая диаграмма состояния К—Zr,
построенная по данным работы [1]. К не смешивается с Zr в твердом
и жидком состояниях. Растворимость Zr в К, содержащим
2x10~3 О % (по массе), в интервале температур 750—1070 "С состав-
составляет менее 10~3 % (по массе) [2]. С увеличением содержания
неметаллических примесей в К растворимость Zr в нем заметно
возрастает [3].
О 10 SO 50 SO 10 80 90 WO
1500
Рис. 75. К—Zr
1000
soo
1
l759'
63.71'
*r-IK>
i
i
1
Газ *M
Газ
+ {№
газ + («2г)
Ж*
(«Zr)
i
1
I*"
1855°
Zr)-*
lr)-*
ТО 20 SO 40 50 SO 70 80
90 ЮО
Zr
Литература
1. Bale C.W. // Bull. Alloy Phase Diagrams. 1989. V. 10. N 3. P. 269-270.
2. Stecura S. // Corrosion by Liquid Metals. New York, London: Plenum Press, 1970.
P. 601-611.
3. Klueh R.L, // Corrosion. 1969. V. 25. N 2. P. 416—422.
T.B. Добаткина
La—Lu
165
La—Lu. ЛАНТАН—ЛЮТЕЦИЙ
Диаграмма состояния La—Lu экспериментально не построена,
имеются только сведения о кристаллической структуре сплавов La с
55—80 % (ат.) Lu [1, 3]. Однако La и Lu изоэлектронны, имея в
металлическом состоянии три коллективизированных валентных
5d^6s2 электрона. Их плотные гексагональные структуры имеют
близкие параметры решетки (табл. 81 [1, 2]), атомные радиусы
отличаются на 8,3 % [1, 2].
Таблица 81. Кристаллическая структура и полиморфные превращения
элементов системы La—Lu
Атом-
Атомный
номер,
элемент
57, La
71, Lu
Модифи-
Модификация
aLa
PLa
yLa
Прототип,
структура
«La, ДГПУ
Си, ГЦК
W, ОЦК
Mg, ГПУ
Параметры решет-
решетки, нм
а
0,37740
0,5303
0,426
0,35052
с
1,2171
0,55494
Темпера-
Температура пре-
превращений,
¦с
310
865
918'
1663
1790
Реакция
«La <* pLa
PLa » yLa
yLa -Ж
Ж »Lu
Жту - ЖОцК
Благодаря близости электронно-кристаллического строения и
атомных радиусов, находящихся в пределах критерия Юм-Розери
A5 %) между La и Lu, так же как в системах La—Gd, La—Y, должны
образовываться непрерывные ряды растворов с плотной гексагональ-
гексагональной структурой, непрерывно Переходящей от ДГПУ структуры aLa
к ГПУ структуре Lu по механизму дефектов укладки. Вследствие
большого различия температур плавления La (918 °С) и Lu A663 °С)
их сплавы должны кристаллизоваться по перитектической реакции
аналогично сплавам системы Nd—Er.
Предлагаемая диаграмма приведена на рис. 76. В приближении
идеальных растворов линии, соединяющие температуры плавления
(918 и 1663 °С) и превращений (865 и 1790 °С) [2], пересекаются в
перитектической точке с координатами 1150 °С, 30 % (ат.) Lu.
Высокотемпературные ОЦК растворы при температуре 850 "С распа-
распадаются по эвтектоидной реакции на ГЦК (PLa) и твердые растворы
на основе ДГПУ (aLa).
Ниже температуры 700 "С при -60 % (ат.) Lu из твердых раство-
растворов с плотной гексагональной структурой возникает промежуточная
фаза б типа (aSm), купол которой разделяет области ДГПУ и ГПУ
растворов.
166
La-Lu
t°c
с, с
1700
WOO
1500
1100
1300
1200
1100
1000
316°
900
665°
BOO
700
600
500
100
300
200
100
7 to 20
—г
%
(PL
U-
(alo
I
/
/
V
a)
i
/
t
)
JO
i
/1
'/
350°
ii/,% (по массе)
10 50 SO 70
1
/'
W'/o
/
i
1
Ж
У
i
У
0
1
У
/
(aLa,Lu)
1
~T
1
1
1
~7OOC
*~ S
s-
80
1
\
\
\
\
\
so too
t
' /
(I
/
u)
1790°
1663°
0 10 20 30 40 50 60 70 80 90 100
La Lu,°/o(am.) Lu
Рис. 76. La—Lu
La—Lu, La—Mg
167
Литература
1 Gschneidner, Jr., K.A., Calderwood F.W. // Handbook on the Physics and Chemis-
Chemistry of Rare Earths. Amsterdam. New York. Oxford. Tokyo: North-Holland Physics Publis-
Publishing Co , 1986 V. 8. Ch. 54. P. I-161.
2. Григорович В.К., Григорович К.В. // Строение и свойства металлических и
шлаковых расплавов: Сб статей. Челябинск: ЧПИ, 1990. Т.2. 4.2. С. 250-252.
3 Anderson G.S., Legvold S., Spedding F.H. // Phys. Rev. 1958. V. 109. P. 243.
B.K. Григорович
LaHVIg. ЛАНТАН—МАГНИЙ
В системе La—Mg (рис. 77) образуются четыре соединения: MgLa,
Mg2La, Mg^La и Mg17La2 И— И]. Соединение Mg3La плавится кон-
конгруэнтно при температуре 798 °С [5], остальные соединения плавятся
инконгруэнтно. Предполагалось, что ближайшее к Mg соединение
имеет формулу MggLa [X, 10, 12, 13]. Однако согласно рентгенов-
рентгеновским исследованиям для него была принята формула Mg17La2 [6, 9].
Установленные в первых работах Каннери [X, 12] несмешиваемость
Mg и La в жидком состоянии в области концентраций 23—50 %
(ат.) Mg и образование соединения MgLa4 в более поздних исследова-
исследованиях не подтвердились [5, 11, 14]. Для соединения Mg3La характерна
некоторая область гомогенности со стороны Mg, уменьшающаяся с
понижением температуры.
Ид, % (am.)
0 10 йО S0 60 70 SO 90
100
(/31 а).
ТОО
О W 20 30 hO 50 60 70 вО 90 100
La Мд, °/« (ho массе) Мд
Рис. 77. La—Mg
168 La-Mg
Co стороны La в системе имеет место эвтектоидное превращение,
протекающее при температуре 546 "С [11] E44 °С [14]). Раствори-
Растворимость Mg в (pLa), определенная рентгеновским методом при темпера-
температуре 544 "С, составляет 1,8 % [9,4 % (ат.)] и при 300 "С - -0,14 %
(по массе) [-0,8 % (ат.)] [14]. Эвтектоид (p"La) + MgLa содержит
3,7 % (по массе) [18 % (ат.) Mg] [11]. Максимальная растворимость
Mg в (yLa) составляет 6,7 % [29 % (ат.)] [11]. В эвтектике со сторо-
стороны La содержится 8,6 % (по массе) [35 % (ат.)] Mg [11]. Темпера-
Температуры превращений со стороны La, а также температуры образования
соединений MgLa и Mg2La из жидкой фазы и распада соединения
Mg2La указаны на диаграмме согласно данным работы [11]. В более
ранней работе [5] для температуры эвтектического превращения Ж *
•» (у La) + MgLa приводится значение 695 °С и для температур пери-
тектических превращений образования соединений MgLa и Mg2La —
745 и 775 °С. Приведенные температуры близки к температурам,
указанным в работе [11]. Для температуры эвтектоидного распада
соединения Mg2La в работе [5] приводится более низкое значение
626 °С, чем указано в работе [11].
В недавно опубликованной работе [18] сообщается об еще двух
фазах, образующихся в системе Mg12La (II) и Mg41La5. Фазы с
аналогичными формулами встречаются в сплавах Mg с другими
редкоземельными металлами цериевой подгруппы. Согласно работе
[18], промежуточная фаза Mg3La плавится конгруэнтно при темпера-
температуре 790 "С, а фазы Mg12La (II), Mg17La2 и Mg41La5 — инконгруэнтно
при температурах 660, 666 и 672 °С соответственно. Эвтектика
(Mg) + Mg12La (II), согласно работе [18], содержит 15,4 % (по
массе) La или 3,1 % (ат.) La, что согласуется с другими работами. В
работе [19] упоминается также фаза Mg12La с решеткой типа
ThMn12, которая рассматривается как метастабильная. Результаты
работы [18] не учтены при построении диаграммы состояния La—Mg,
так как объем представленной информации слишком мал, чтобы
оценить их надежность.
Растворимость La в (Mg) определялась в ряде исследований. Было
установлено, что она мала, но значения, полученные различными
исследователями, существенно отличались между собой. Так, раство-
растворимость La в (Mg) составила 3,0 % (по массе) при температуре
609 °С [15], 1,6 % (по массе) при 571 °С [16], 0,8 % (по массе) при
616 °С [12] и 0,4 % (по массе) при 575 "С [17]. При построении
диаграммы состояния, показанной на рис. 77, были использованы
значения растворимости La в (Mg) по данным работ [10, 14].
La-Mg
169
Эти значения приведены ниже:
Температура, °С 612 600 580 540 500 400 300
Растворимость La:
% (по массе) 0,23 0,22 0,16 0,14 0,03 0,01 0,01
% (ат.) 0,042 0,039 0,029 0,024 0,005 0,002 0,002
Кристаллическая структура соединений представлена в табл. 82.
Таблица 82. Кристаллическая структура соединений системы La-Mg
Соединение
MgLa
Mg2La
MgjLa
Mg4]La5
Mg17La2
Mg|2La(II)*
Прототип
CsCl
MgCu2
BiF3
Mg4,Ce5
Th2Ni17
Mg12Ce
Символ
Пирсона,
пр.гр.
cP2,
РтЪт
cFIA,
Fd3m
cFl6,
Fm3m
tI92,
I4/m
ЛР38,
Р6ъ/тте
—
Ромбоэдрическая сингония.
Параметры
a
0,3963
0,3965
0,879
0,8787
0,7478
0,7509
0,7467
—
1,038
1,036
—
эешетки, нм
с
—
—
-
—
1,027
1,024
—
Источник
[4]
[3]
[2]
[4]
[1]
[4]
[8]
[19]
[6]
[7]
[19]
Литература
1. Rossi A., Iandelli A. // Atti Accad. Naz. Line. Rend. С. Sci. 1934. V 19. N 6.
P. 415-420
2. Laves F. // Naturwissenschaften. 1943. Bd. 31. N 7/8. S. 96.
3. Nowotny H. // 2. Metallkunde. 1942. Bd. 34. NILS. 247-253.
4. Iandelli A. // Physical Chemistry of Metallic Solutions and Intermetallic Compounds.
Proceed Symp. Nat. Phys. Lab. 4-6th June 1958. London: 1959. V. 1. P. 3F.
5. Vogel R., Heuman Th. // Metallforschung. 1947. Bd. 2. N 1. S. 1-8.
6. Гладышевский Е.И., Крипякевич П.И., Черкашин Е.Е. и др. // Редкоземель-
Редкоземельные элементы. М.- Наука, 1963. С. 67—70.
7- Евдокименко В.И., Крипякевич П.И. // Кристаллография. 1963. Т.8 № 2.
С.186-193
8. Buschow K.H.J. // J Less-Common Met 1976. V. 44. N 1. P. 301-306
9. Yojma S., Kayatio H. // J. Less-Common Met. V. 55. N 1. P. 139—141.
10 Рохлин Л.Л. Магниевые сплавы,, содержащие редкоземельные металлы. М.:
Наука, 1980. 192 с
170
La-Ms,
11. Manfrinetti P., Gschneidner, Jr., K.A. // J. Less-Common Met. 1986 V. 123 N I
2. P. 267-275.
12. Canneri G. // Metallurgia Ital. 1931. V. 23. P. 810-813.
13. Park J.J., Wyman L.L. // Nat. Bur. Stand. Rep. WADC-TR-57-504. 1957. P. 33.
14. Joseph R.R., Gschneidner, Jr., K.A. // Trans. AIME. 1965. V. 233. N 12
P. 2063-2069.
15. Рохлин Л.Л., Вочвар H.P. // Изв. АН СССР. Металлы. 1972. №2
С. 193-197.
16. Weibke F., Schmidt W. // Z. Elektrochemie. 1940- Bd. 46. N 6. S. 357—364.
17. Терехова В.Ф., Савицкий Е.М. // Сплавы редких металлов. М.: Металлургиз-
дат, I960. С. 189-201.
18. Chai Liang, Lin Haichun, Yen Yu-pu // Proceed. 5th Nat. Symp. Phase Diagr,
Wuhan. Nov. 18-21, 1988. Dig. (Wuhan, 1988). P. 15.
Л.Л. Рохлин
La—Mn. ЛАНТАН-МАРГАНЕЦ
Система La—Mn исследована в ряде работ [1—3], результаты
которых практически совпадают. На рис. 78 приведена обобщенная
диаграмма состояния системы La—Mn по данным работ [1, 2] с
учетом ряда уточнений по температурам реакций, протекающих в
системе. Диаграмма состояния в работе [1] построена методами
термического, микроструктурного и рентгеноструктурного анализов
с использованием металлов: La чистотой 99,5 % (по массе), Мп
чистотой 99,8 % (по массе).
Мп, У о ( по массе)
О tO 20 30 40 SO @ 70 80 90100
1200
1000
918'
865°
800
600
U 0 0
JfO'
200
+-(*
-п
iLa)
Ж
[у
1
f 1081'
**^~S0
701°
1
1
~w J
(r
(J3M
[ctM
У
ЧпГ
'п)~*
__.
№6*
1138°
1100°
727°
Рис.
78.
0
La
La-Mn
10
20
JO
UO
Mn.
50 SO
*/• (am)
70
BO
90
100
Mn
La—Mn, La—Mo 171
Система La—Mn характеризуется отсутствием соединений. Темпе-
Температуры эвтектической и монотектической реакций равны 701 и
1081 °С соответственно, а содержание Мп в эвтектике -17 % (ат.).
Взаимная растворимость La и Мп ничтожно мала. Параметр
решетки (аМп) увеличивается с возрастанием содержания La от
0,8912 до 0,8921.
Литература
1 Palenzona A., CiraficI S. // Bull. AUoy Phase Diagrams. 1990. V. II. N 5.
P. 491-493.
2. Rolla L., Iandelli A. // Ber Dtsch. Chem. Ges. 1942. Bd. 75. S. 2091-2095.
3. Gschneidner, Jr., K.A., Calderwood F.W. // Handbook on the Physics and Chemis-
Chemistry of Rare Earth. Amsterdam. New York. Oxford. Tokyo: North-Holland Physics Publishing
Co., 1986 V. 8 Ch. 54. P 1-161.
M. А. Тылкина
La-Mo. ЛАНТАН-МОЛИБДЕН
Диаграмма состояния не построена. В работе [1] установлено, что
в Мо растворяется менее 0,07 % (ат.) La; в работе [2] высказано
мнение, что эта система должна быть подобна системе Мо—Се, в
которой отсутствуют интерметаллические фазы. В работе [3] на
-основании данных о термодинамических свойствах компонентов
рассчитано, что в системе должна быть несмешиваемость в жидком
состоянии. Расчетная температура монотектики 2547 °С, содержание
La в твердом растворе на основе Мо, монотектической точке и насы-
насыщенном Мо расплаве составляет 0,13; 4,0±1 и 79±4 % (ат.) соответ-
соответственно. Расчетные температура и содержание Мо в эвтектике (Мо) +
+ (La) равны 928 "С и 9- 10~2 % (ат.). Растворимость La в (Мо)
составляет ~10~2 % (ат.) при 627 "С; при более низких температу-
температурах она контролируется дефектами; рассчитано, что растворимость
Мо в (La) ниже 10~2 % (ат.).
Литература
1 Савицкий Е.М., Барон В.В., Тао Тзу Цун // Изв. АН СССР. Отделение
технических наук. Металлургия и топливо. 1962. № 1. С. 156—159.
2. Гшнейднер К.А. Сплавы редкоземельных металлов: Пер. с англ. / Под ред.
,Е.М. Савицкого. М . Мир, 1965. 427 с.
3 Brewer L., Lamoreaux R.H. // Atomic Energy Review. Special Issue N 7. Molyb-
Molybdenum Physico-Chemical Properties of its Compounds and Alloys. Vienna: International
Atomic Energy Agency 1980 P. 195—356
К.Б. Поварова
172 La-N, La-Na, La-Nb
La—N. ЛАНТАН—АЗОТ
Диаграмма состояния La—N не построена. Установлено образова-
образование соединения LaN [9,16 % (по массе) N] с решеткой типа NaCl
[X, Э, Ш], а = 0,5302 нм [1], что согласуется с данными работы [2].
В работе [3] указывается на существование соединения La^ (стехи-
(стехиометрия точно не определена) с ромбической решеткой, а = 0,532 нм,
Ъ = 0,530 нм, с = 0,525 нм.
Литература
1. Лютан М.Д., Самсонов Г.Б. // Украинский химический журнал. 1963. Т.29.
q 251 255
2. Von Esser U., Klemm W. // Z. Anorg. All Chem. 1962. Bd. 317. S. 25-34.
3. Гшнейднер К.А. Сплавы редкоземельных металлов: Пер. с англ / Под ред.
Е.М. Савицкого. М.: Мир, 1965. 427 с.
Л.Л. Рохлин
La—Na. ЛАНТАН^АТРИЙ
В работе [1] была сделана попытка исследовать систему La—Na
методами микроскопического и термического анализов. Ввиду значи-
значительных экспериментальных трудностей достаточно определенные
результаты не получены. Высказано предположение, что в сплавах
системы может существовать область несмешиваемости.
Литература
1. MSssenhausen W. // Z. Metallkunde. 1952. Bd. 43. N 2. S. 53-54.
Л.Л. Рохлин
La-Nb. ЛАНТАН^ШОБИЙ
Диаграмма состояния La—Nb приведена на рис. 79.
Часть системы La—Nb от 0 до 40 % (ат.) La исследована методами
металлографического и рентгеноструктурного анализов также изме-
измерением твердости и электросопротивления. Сплавы выплавляли
в дуговой печи с использованием La, Nb чистотой 99 % (по массе).
Nb повышает температуру плавления La на 5—7 "С, но не ока-
оказывает влияния на Р - упревращение. Монотектика при темпе-
температуре 2400 "С практически вырождена. Содержание Nb в ней со-
составляет 99,8 % (по массе) Nb. Промежуточные фазы не образуются
[1]. Растворимость La в Nb при комнатной температуре —
около 0,3 % (ат.) [Э]. Построенная в работе [2] расчетным
La-Nb
173
l°C°
2400
2200
2000
1800
1S0O
1400
поо
moo
918"
865'
800
cnn
Ж
i
/
/
/
I
1
J
1
20
i
/
/
/
¦
/
/
1
-*
(ЦШ)
w
Nb,"U(am
SO
Ж2
925°
)
24
80
00'
90
1Mb)
IOC
\
99.8
—*¦
24Б9'
0 10 20 30 40 50 SO 70 80 30 WO
la Nb,% (по пассе) Nb
Рис. 79. La-Nb
174
Lar-Nb, La-Nd
путем диаграмма (в приближении регулярных растворов) обна-
обнаруживает хорошее совпадение с имеющимися экспериментальны-
экспериментальными данными.
Литература
1. Гшневднер К.А. // Сплавы редкоземельных металлов: Перс, с англ. / Под ред
Е М. Савицкого. М : Мир, 1965. 427 с.
2. Ding D., Zhand D // J. Cent-South Inst. Min. Metall. 1985. N 3. P. 64-69.
E.H. Шефтель
La-^Sd. ЛАЛТАН^НЕОДИМ
Диаграмма состояния системы La—Nd приведена на рис. 80 по
данным работы [1]. Высокотемпературные модификации компонентов
(yLa) и (PNd) образуют непрерывный ряд твердых растворов. При
температуре 825 °С происходит эвтектоидный распад: (yLa, PNd) *
* (pLa) + (aLa, aNd). При температурах ниже 310 °С растворимость
модификаций (aLa) и (aNd) становится взаимно неограниченной.
По данным работ [1, 2], все сплавы из этой системы кристаллизу-
кристаллизуются в гексагональной сингонии, а параметры решетки а и с изменя-
изменяются от 0,3667 до 0,3783 нм и от 1,1825 до 1,220 нм соответственно
при увеличении содержания La от 0 до 100 % (ат.).
ПВО
1000
800
600
100
200
10
го зо
Nd,,%("" массе)
40 50 ВО
80
90 100
918°
865° _
/'
/-<
*-
310°
*)
/
/
— —
А
/
/
¦клана
— —
-8
(a La,
Ж
-
?5>
У
а на)
___
'—
1011°
Рис.
80.
10
La
La-Nd
го
J0
so so
Nd,%(am)
10 SO
90
W0
Hi
La-Nd. La-Ni 175
Литература
1 Гшнейдиер К.А. Сплавы редкоземельных металлов: Пер. с англ / Под ред
Е.М Савицкого. М.: Мир, 1965. 427 с.
2. Gschneidner, Jr., K.A., Caldenvood F.W. // Bull. АПоу Phase Diagrams. 1982
V. 2. N 4. P 452-453.
E И. Гладышевский, О.И. Бодак, В.К. Печорский
La-Ni. ЛАНТАН^ШКЕЛЬ
Диаграмма состояния La—№ описана в справочнике [X]. Указыва-
Указывается на образование следующих соединений: La3Ni, LaNi, LaNi2,
LaNi3, ~La№4 и LaNi5. В работе [1] было уточнено строение диаг-
диаграммы состояния La—Ni в интервале концентраций 50-453,3 % (ат.)
Ni. Сплавы изготовляли из металлов высокой чистоты в дуговой печи
в атмосфере Аг, затем отжигали завернутыми в фольгу из Та в
кварцевых ампулах и атмосфере Не при температурах 660—1000 °С
в течение 10—21 суток. Сплавы, содержащие 66—69,5 % (ат.) Ni,
отжигали при 750 °С 2 ч и закаливали в ледяной воде.
В исследованной области концентраций было установлено шесть
соединений LaNi, LaNi! 5i, LaNi2286, LaNi3, La2Nij и LaNi5. Соеди-
Соединение LaNi2, о котором сообщается в работах [X, 2], не существует
в равновесных условиях, а является метастабильной фазой. В равно-
равновесных условиях это соединение может быть стабилизировано приме-
примесями.
На рис. 81 приведена диаграмма состояния La—Ni согласно дан-
данным работы [1] в области концентраций 50—83,3 % (ат.) Ni. Часть
диаграммы состояния выше температуры 1100 °С и при содержании
от 83 до 100 % (ат.) Ni приведена по данным работы [2]. Часть
диаграммы от 0 до 45 % (ат.) Ni приведена по данным работы [X],
однако температуры плавления соединения La3№ и температуры
плавления эвтектик скорректированы.
Соединения La3Ni, LaNi и LaNi, плавятся конгруэнтно при темпе-
температурах -620, 715 [1] и 1350 "С [2]. Соединения LaNi151, LaNi2286,
LaNi3 и La2№7 образуются по перитектическим реакциям при темпе-
температурах 688 ±3 [1] F90 [2]), 714±5 [1] G95± [2]), 811±3 [1] (975
[X], 955 [2]), 1014+4 °С [1] (995 °С [2]) соответственно.
Соединение La2Ni7 претерпевает полиморфное превращение при
температуре 976 °С: pLa2Ni7 * aLa2Ni7.
В системе кристаллизуются четыре эвтектики:
(PLa) + La3Ni при -600 °С и -17 % (ат.) № [X];
La3Ni + LaNi при 517 °С [1] и -31 % (ат.) № [X];
LaNi + LaNit 51 при 675 °С [1] F70 "С [2]) и 57,7 % (ат.) Ni [1];
LaNi5 + (Ni)'npn 1270 "С и 93 % (ат.) Ni [2].
176
La-Ni
1Ь0О\
1200
1000
865
800
400
zoo
310'
0 10
La
Рис. 81. La—Ni
Ni, % (no массе)
10 20 JO Ц0 SO 60 70 80 90100
918°,,,
^(Па
\
\
-600°
1
ч
\
1
•*>
1
-620°
\
J-
1
%
*«.
t
ж
11
,- n
—T^t
S7,7
t— *r -I
;¦ .ii -^
J -j -j
I
i
1
1
J
/ 714°
688°
w
/
/
/
r
976'
811'
^1350°
V
«3*
¦%
"в -
i r-
№SS'
/
/
93
(Nl)-*
20 30 ЬО 50 60
Ni,°/. (am.)
70
80
90
too
Ni
что
В работе [З] исследовали растворимость La в Ni; установили, что
при 1050 "С растворимость La в (Ni) составляет 0,346 % (по массе),
при 1020 °С —0,309 (по массе), при 950 °С —0,380 % (по массе).
Соединение LaNi2j286 ймеет тетрагональную структуру [1].
Соединение LaNi5 обладает гексагональной решеткой типа СаСи5
(символ Пирсона hPb, пр.гр. Рб/ттт), а = 0,4962 нм, с = 0,4008 нм.
Литература
1. Zhang Deyuan, Tang Jinlce, Gschneidner, Jr., K.A. // J. Less-Common Met. 1991
V. 169. N 1. P. 45-53.
2. Buschow K.H.J., van Mai H.H. // j. Less-Common Met. 1973. V. 29. P. 203.
3. Xingkang, Wang Zhigum, Liu Guoquan, Zhang Weijing, Pan Shuning // Proc.
61h, Nat. Symp. phase Diagr., Shenyang, Nov. 20—24. 1990. P. 125—126.
СМ. Алисова
La—O, La-Os
177
La-O. ЛАНТАН-КИСЛОРОД
В исследовании [1] при температурах 450—550 °С и низком
парциальном давлении О2 разложением нитрата La и гидроокиси La
получено соединение La2O3 с ОЦК структурой типа Мп2О3 (символ
Пирсона с/80, пр.гр. 1аЪ), а- 1,136 нм. При температуре 550 °С это
соединение имеет гексагональную структуру с параметрами а =
«¦ 0,393 нм, с = 0,612 нм [X]. Дискутируется вопрос об обратимости
Превращения ОЦК в гексагональную структуру и существовании
двух модификаций до температуры 500 °С. Температура плавления
ia2O3 составляет 2210 "С. Сообщается также о существовании оксида
LaO со структурой типа NaCl (символ Пирсона cF%, пр.гр. FmZm),
а = 0,524 нм [X], что не подтверждено в работе [2].
Литература
I Глушкова В.Е., Келер Е.К. // Доклады АН СССР. T.I52. № 3. С. 6II-4II.
2. Гшнейднер К.А. Сплавы редкоземельных металлов. Пер. с англ. / Под ред. Е.Ц.
Савицкого. М.: Мир, 1965. 427 с.
СМ. Алисова
La-Os. ЛАНТАН-ОСМИЙ
Диаграмма состояния La—Os не построена. В системе установлено
существование двух соединений LaOs2 и La3Os. Соединение LaOs2
полиморфно и под влиянием температуры -1000 "С и давления
порядка 7 ГПа изменяет тип кристаллической структуры [1].
В табл. 83 приведена кристаллическая структура соединений [1, 2].
Таблица 83. Кристаллическая структура соединений системы La—Os
Соедине-
v ние
LaOs2
LaOs2
La3Os
Прототип
MgCu2
MgZn2
Fe3C
Символ
Пирсона,
пр.гр.
cF24,
Fdbm
hPl2,
РЬъ1ттс
oPlb,
Pnma
Параметры решетки, нм
a
0,7743
0,5419
0,7530
b
0,9919
с
0,9083
0,6597
Источник
[1]
[1]
[2]
Литература
1. Cannon J.F., Robertson D.L., Tracy Hall H. // J. Less-Common Met. 1973. V. 31.
N 1. P. 174-176.
2. Благородные металлы: Справочник / Под ред Е.М. Савицкого. М : Металлур-
Металлургия, 1984. 592 с
Е.И Гладышевскчй, О.И. Бодак, В.К. Печорский
178 Lar-P, La-Pb
La-P. ЛАНТАН-ФОСФОР
В системе La—P образуется фосфид LaP, обладающий решеткой
типа NaCl (символ Пирсона cF%, пр.гр. FmZm) с параметром а =
= 0,6025 нм [X] или а = 0,6016 нм [1].
Литература
1 Самсонова Г.В., Ендржеевская С.Н. // Журнал неорганической химии 1963
Т.ЗЗ. С. 2803-2804.
Л. Л. Рохлин
La—Pb. ЛАНТАН-СВИНЕЦ
Диаграмма состояния La—Pb (рис. 82) [X, 1, 2] построена с
применением методов дифференциального термического и рентгено-
структурного анализов.
Взаимная растворимость компонентов в твердом состоянии прак-
практически отсутствует. В системе образуются три соединения. Все
соединения: La2Pb [42,72 % (по массе) Pb], LaPb [59,86 %
(по массе) Pb] и LaPb3 [81,73 % (по массе) Pb] образуются
из расплава при температурах 1318, 1246 и 1090 °С соответ-
соответственно.
В системе происходят четыре эвтектические превращения
(табл. 84).
Т а б
Ж »
Ж »
Ж »
Ж »
лица 84 Нонвариантные реакции в системе La—Pb
Реакция
La2Pb + (la)
La2Pb + LaPb
LaPb + LaPb3
LaPb3 + (Pb)
Содержание Pb в
эвтектике, % (ат.)
14
38
63
-99
Температура, °С
776
1044
962
327
В ряде работ было установлено образование соединений другого
стехиометрического состава и определена их кристаллическая струк-
структура. В табл. 85 приведена кристаллическая структура известных
двойных фаз в этой системе по данным работ [V-C, 3].
La-РЬ
179
Рис. 82.
La-Pb
t,°c
1*00
1300
1200
1100
1000
318°
900
815°
воо
700
600
500
400
300
310'
гоо
20
Pb, % (no nacre)
40 60
во
100
Ж
1
J
-14
— Г/3
*-(a
to)
La)
/
/
776°
--,
\
л
1
y/J/
\
\
t
r
1
itm°
38
296°
N
962°
\
v
63
i
с
1
Й7Я7°
4
\
\
327°
(
\
\
\
\
^
327,502°
0 10 20 30 *0 SO 60 70 80 SO /00
Lo Pb,'/b(om.) Pb
Таблица 85. Кристаллическая структура соединений системы La—Pb
Соединение
La5Pb3
La3Pb4
La5Pb4
LaPbj
Прототип
MrijSij
P4Tha
Sm5Ge4
АиСиа
Символ
Пирсона,
пр.гр.
ЛР16,
РЬъ1тст
с/28,
/43d
оРЪЬ,
Рпта
сРА,
РтЪт
Параметры решетки, нм
а
0,9528
0,98188
0,8538
0,4906
Ь
1,631
с
0,6993
0,8674
180
La-Pb, La-Pd, La-Pm
Литература
1. Canneri G. // Metallurgia Ital. 1931. V. 23. P. 805-S06.
2 Vogel R., Heumann T. // Z. Metallkunde. 1943. Bd. 35. S. 29—42.
3. Гладышевский Е.И., Бодак О.И. Кристаллохимия интерметаллических соедине-
соединений редкоземельных металлов Львов: Вища школа, 1982. С. 255.
Е.И. Гладышевский, О И. Бодак, В К. Печарский
La-Pd. ЛАНТАН-ПАЛЛАДИЙ
Диаграмма состояния La—Pd не исследована. В табл. 86 собраны
сведения о структуре четырех известных двойных фаз [V-C].
Таблица
Соединение
LaPd3
La3Pd4
LaPd
La7Pd3
86. Кристаллическая структура соединении системы La—Pd
Прототип
AuCu3 '
Pll3Pd4
CrB
Th7Fe3
Символ
Пирсона,
пр.гр.
сРА,
РтЪт
ЛЯ14,
Rb
оС8,
Стст
hP20,
Р6ътс
Параметры решетки, нм
а
0,4224
1,3860
0,3945
1,0387
Ь
—
—
1,1032
с
-
0,5848
0,4660
0,6552
Е.И Гладышевский, О.И. Бодак, В.К Печарский.
La4Pm. ЛАНТАН-ПРОМЕТИЙ
Диаграмма состояния La—Pm экспериментально не построена [1].
Однако La и Pm близко расположены друг к другу в периодической
системе, имеют в металлическом состоянии идентичное электронное
строение с тремя коллективизированными валентными 5dl6s элек-
электронами, одинаковые низкотемпературные ДГПУ а-модификации и
одинаковые высокотемпературные ОЦК модификации с близкими
постоянными решеток (табл. 87). Их атомные радиусы отличаются
всего на 3,8 % [1,2].
La—Pm
181
Таблица 87. Кристаллическая структура и полиморфные превращения
элементов системы La—Pm [1]
Атомный
номер,
элемент
57, La
61, Pm
Модифи-
Модификация
«La
PLa
yLa
«Pm
PPm
Прототип,
структура
«La, ДГПУ
Си, ГЦК
W, ОЦК
«La, ДГПУ
W, ОЦК
Параметры решет-
решетки, им
a
0,37740
0,5303
0,426
1,165
с
1,2171
0,1811
Темпера-
Температура пре-
превращений,
°С
310
865
918
890
104
Реакция
«La » pLa
pLa •« yLa
YLa »Ж
aPm •« PPm
PPm -Ж
t°c
two
1000
ж
300
в65г
воо
7P0
600
500
too
310
300
200
100
Pm,% (no пассе)
0 JO 20 30 4D 50 BO 70 80 90 100
' -^ '=*" 890"
1
- -
(PLa
1
_. —
-^
/
...
/
/
/
/
/
——
i
-. —
/
/
/
Ж
*-—"
(jLa,pPm)
—h
/
¦55-
(ocLa,aPm)
1
"HI
1
— —
— -
w
го зо
La
Рис. 83. La—Pm
O 50 SO
Рту°/о(а/п.)
70 80
90 100
Pm
182 La—Pm, La-Po, La-Pr
Близость электронного и кристаллического строения позволяет
предположить, что La с Рт образуют непрерывные ряды ДГПУ твер-
твердых растворов при температуре ниже 310—890 °С и непрерывные
ряды ОЦК растворов при высоких температурах. Близость атомных
радиусов указывает на большую растворимость Рт в (PLa). Вслед-
Вследствие близости строения и малой разницы атомных радиусов раство-
растворы между La и Рт должны быть почти идеальными, поэтому линии
ликвидуса и солидуса на предполагаемом варианте диаграммы состоя-
состояния La—Pm (рис. 83) практически сливаются в одну общую прямую,
соединяющую их температуры плавления с узкой двухфазной об-
областью между ними. Предполагается, что высокотемпературные ОЦК
твердые растворы при охлаждении испытывают, так же как в систе-
системах La—Nd и Се—Рг, эвтектоидный распад на ГЦК и ДГПУ твердые
растворы. Ориентировочные предельные растворимости и эвтектоид-
ная температура указаны на рис. 83. Предполагаемое эвтектоидное
равновесие изображено штриховыми линиями.
Литература
1. Gschneidner, Jr., К.A., Calderwood F.W. // Handbook on the Physics and Chemis-
Chemistry of Rare Earths Amsterdam. New York. Oxford Tokyo: North-Holland Physics Publis-
Publishing Co. 1986. V. 8. Ch. 54. P. 1-161.
2. Григорович В.К., Григорович К.В. // Строение и свойства металлических и
шлаковых расплавов' Тезисы докладов на VII Всесоюзной конференции. Челябинск:
ЧПИ, 1990 Т.2. № 2. С. 250-252.
В К Григорович
La-Po. ЛАНТАН-ПОЛОНИЙ
При взаимодействии паров Ро с металлическим La получены
продукты реакции с атомным отношением 0,1:2 и 2:2. Первый из
продуктов плавится при температуре > 1620±50 "С. Выражается,
однако, сомнение в надежности полученных результатов [Ш, 1].
Литература
1. Kerschner C.J., Steinmeyer R.H. // US At Energy Comm. MIM-1163 1963.
P F1-F6.
Л.Л Рохлин
La—Pr. ЛАНТАН—ПРАЗЕОДИМ
Диаграмма состояний La—Рг экспериментально не построена [1].
Однако La и Рг в периодической системе расположены почти рядом
E7La и 59Рг), имеют в металлическом состоянии идентичное элек-
электронное строение с тремя валентными коллективизированными
электронами 5dxbs2, имеют одинаковые структуры ДГПУ для низко-
La-Pr
183
температурных модификаций La и Pr и ОЦК высокотемпературных
фаз с близкими постоянными решетки (табл. 88 [1, 2]). Их атомные
радиусы отличаются всего на 2,8 %.
Таблица 88. Кристаллическая структура и полиморфные превращения
элементов системы La—Pr
Атомный
номер,
элемент
57, La
59, Pr
Модифи-
Модификация
aLa
E La
YLa
aPr
PPr
Прототип,
структура
aLa, ДГПУ
Си, ГЦК
W, ОЦК
«U, ДГПУ
W, ОЦК
Параметры решетки,
нм
а
0,37740
0,5303
0,426
1,18326
0,413
с
1,217!
1,18279
Темпера-
Температура пре-
превращений,
°С
310
865
918
795
931
Реакция
aLa -« pLa
PLa ¦« yLa
YLa »Ж
aPr » PPr
PPr »Ж
На этом основании можно считать, что La и Рг должны образовы-
образовывать друг с другом непрерывные ряды ДГПУ твердых растворов при
низких температурах и непрерывные ряды ОЦК растворов при
высоких температурах. Вследствие близости строения La и Рг образу-
образуют друг с другом идеальные растворы, поэтому на предлагаемой
диаграмме состояния La—Рг (рис. 84) линии ликвидуса и солидуса
сливаются в одну общую прямую, соединяющую их температу-
температуры плавления с очень узкой двухфазной областью между ними.
На основе ГЦК структуры (PLa) вследствие близости атомных радиу-
радиусов La и Рг образуется широкая область твердых растворов. Высоко-
Высокотемпературные ОЦК растворы при понижении температуры распада-
распадаются на ГЦК и ДГПУ растворы, содержащие приблизительно до
30 % (ат.) Рг и до 60 % (ат.) La соответственно. Температура эвтек-
тоидного распада отвечает приблизительно 770 °С. Эвтектоидное
равновесие показано условно штриховыми линиями.
Литература
1. Gschneidner, Jr., K.A., Calderwood F.W. // Handbook on the Physics and Chemis-
Chemistry of Rare Eartha. Amsterdam. New York. Oxford. Tokyo: North-Holland Physics Publis-
Publishing Co. 1986. V 8. Ch. 54. P. 1-161.
2 Григорович В.К., Григорович К.В. // Строение и свойства металлических и
шлаковых расплавов: Тезисы докладов на VII Всесоюзной конференции. Челябинск:
ЧПИ, 1990. Т.2. № 2. С. 250-252.
В.К. Григорович
184
La—Pr, La-Pt
t,°c
moo
1300
1200
noo
1000
918°
865°
800
700
600
500
bOO
300°
200
WO
Pr , °/o (no массе)
1 10 10 30 40 50 E0 TO »0 90 100
1
и-
La)
/
/
/
\
rv
?¦
/
/
•
1
770'
/
/
i
(Па
\
,flPr
I
I
J
{a La
ocPr
)
)
1
931'
795°
0 W 20 JO 40 50 60 TO 80 90 100
L a Pr, У. (am) Pr
Рис. 84. La—Pr
La—Pt. ЛАНТАН—ПЛАТИНА
Диаграмма состояния La—Pt исследована в работе [1]лишь частич-
частично, со стороны Pt (рис. 85). Сплавы выплавляли в дуговой печи в
атмосфере очищенного Не на медном охлаждаемом водой поду с
нерасходуемым вольфрамовым электродом при давлении 27 000 Па.
Отжиг проводили в вакууме при температуре 1200 °С в течение 5 ч
La—Pt
185
и при температуре 1000 °С в
течение 30 ч. Исследование
выполняли методами диф- *V
ференциального термическо- гооо
го, микроскопического и
рентгеновского анализов.
Установлено, что соеди- юоо
нение LaPt5 образуется из
расплава при температуре
-1860 "С. Эвтектика, содер- то
жащая 5 % (ат.) La, крис-
кристаллизуется при температу-
температуре 1640 °С.
В ряде работ установлено
существование в этой си-
системе семи соединений.
Кристаллическая структура
этих соединений приведена Рис. 85; La—Pt
в табл. 89 по данным [V-C].
La,% (по массе)
1 В в 10
t*go
ПВО
1
O59"
/
1
Ж
№
Wtrf
.а
1
J
О
Pt
б 12
La,'/. Cam)
16
Таблица
Соединение
La7Pt3
La3Pt2
LaPt
La3Pt4
LaPt2
LaPt3
LaPt5
89. Кристаллическая структура соединении системы La-4>t
Прототип
Th7Fe3
Er3Ni2
CrB
Pu3Pd4
MgCu2
AuCu3
CaCu5
Символ
Пирсона,
пргр
ЛР20,
Я63тс
ЛЛ15,
ЯЗ
оС8,
Стст
ЛЛ14,
ЯЗ
cF24,
Fdbm
сР4,
РтЗт
hP6,
РЬ/ттт
Параметры решетки, нм
а
0,4560
0,9096
0,3974
1,3838
0,7781
0,40745
0,5386
—
—
1,1042
—
—
—
с
0,8263
1,7303
0,4555
0,5814
—
—
0,4378
Литература
1 Воронова Л.И., Полякова В.П., Савицкий Е.М. // Изв АН СССР Металлы
1983 № 4 С 176-179
ЕЙ Гладышгвский, О И Бодак, В К. Печарский
186
La—Pu
La—Pu. ЛАНТАН—ПЛУТОНИЙ
Диаграмма состояния системы La—Pu приведена в работах [Э, 1]
и представлена на рис. 86 по данным работы [1].
Синтез сплавов осуществляли в индукционной печи во взвешен-
взвешенном состоянии. Отжиг проводили в эвакуированных кварцевых
ампулах (сплавы дополнительно изолировались фольгой из Та)
при температуре 800 °С с последующей закалкой в холодной воде.
В качестве исходных компонентов использовали La и Pu чистотой
99,9 % (по массе). Исследование выполняли методами микроскопи-
микроскопического, рентгеновского и термического анализов.
10
20
La, % (по пассе)
30 40 50
SO 70 80 30 100
0 10 20 30 40 SO SO 70 80 30 100
Pu La,'A (am.) La
Рис. 86. La-Pu
La-Pu, La-Re
187
В системе обнаружена широкая область несмешиваемости жидких
La и Ри, существующая в интервале температур 850-1200 °С. Рас-
Растворимость Ри максимальна для у-модификации La и составляет
20 % (ат.), в фЬа) — 19 % (ат.) при температуре 835 "С; с пониже-
понижением температуры она резко уменьшается. La практически нераство-
нерастворим в твердом Ри.
Литература
1 Ellinger F.H., Land C.C., Jonson K.A. // Trans. AIME. 1967. V. 239. N 6.
P 895-898.
Е.И. Гладьииевский, О.И. Еодак, В.К. Печарский
La-Re. ЛАНТАН-РЕНИЙ
Система исследована в работе [1] во всем интервале концентра-
концентраций методами рентгеноструктурного, микроструктурного анализов и
измерением микротвердости. При исследовании использованы метал-
металлы: Re чистотой 99,96 % (по массе) и La чистотой 99,54 % (по
массе). Все сплавы приготовляли плавлением в дуговой печи в атмо-
La, '/.(по пассе)
0 10 20 30 40 SO ВО ТО ВО 90 Ю0
3600
5200
2800
Рис. 87. La-4le
2400
2000
WOO
1200
800
400
1
1
I
"•—
Ж,"
зт'
Re)
- —
1
(ке,
— —
- —
I
(iLa)
(PLa)
\
\
—t-
1
. 1
1
t
—
Re
Ю 20 30
40 50 SO
La,°U(am.)
10
¦4L ^^ 91В'
865°
80 30 100
ш
188 Lar-Re, La-Rh
сфере Аг. Кроме того, сплавы с содержанием Re до 38 % (по массе)
готовились также методом порошковой металлургии. Re и La прессо-
прессовали в таблетки и спекали в вакууме при температуре 1800 °С в
течение 45 мин с предварительными выдержками при температуре
850, 1000 и 1500 "С в течение 60, 45 и 45 мин. Схематическая диаг-
диаграмма состояния системы представлена на рис. 87 по данным работы
[1]. Re и La не взаимодействуют друг с другом во всем интервале
концентраций, образуя области несмешиваемости в жидком и твер-
твердом состояниях.
Литература
1 Бадаева Т.А., Дашевская Л.И. // Диаграммы состояния металлических систем:
Сб статей М Наука, 1968 С 218—221
МА Тылкина
La—Rh. ЛАНТАН—РОДИЙ
Диаграмма состояния системы La—Rh приведена на рис. 88 по
данным работы [1]. В системе образуются восемь соединений.
Соединения La3Rh и La2Rh7 плавятся конгруэнтно при температу-
температурах 840 и 1600 "С соответственно.
Пять соединений образуются по перитектическим реакциям:
Ж + La5Rh4 * ^4Rh3 ПРИ 1030 °С>
Ж + LaRh « La5Rh4 при 1100 °С,
Ж + LaRh2 « LaRh при 1280 "С,
Ж + LaRh3 - LaRh2 при 1395 °С,
Ж + La2Rh7 « LaRh3 при 1440 "С.
Соединение La5Rh3 образуется по перитектоидной реакции:
La3Rh + La4Rh3 •* La5Rh3 при температуре 750 "С.
Соединение La2Rh7 претерпевает полиморфное превращение при
температуре 1295 °С и эвтектоидно распадается при температуре
1205 °С: La2Rh7 « LaRh3 + (Rh).
Соединение LaRh2 имеет полиморфное превращение при темпера-
температуре 1240 "С, a LaRh3 - при температуре 1040 "С.
В табл. 90 приведена структура известных фаз системы La—Rh
[V-C].
La-Rh
189
t °г
то
то
1500
то
1300
1200
1100
1000
9N°
900
в65°
воо
100
600
0
— \
Г La)-
\/
695°
<
t
t;
1
0
¦>
)
84
Л
0°
р>
_7
-1
/
!т
1 10*
I
I
ни,»/,
to
и
\
10°
0°
ТГ
(по массе)
L
3
ж
Т39Р
- 1280
W
1 1
¦
3
...
Л
¦м
1
VI
\
поь
—
-
-
—
80
1
/
1
12$
100
1
5°
1
1205°
1963°
О 10 20 30 fO SO SO W 80 90 100
La Rh^/ofam.) Rh
рис. 88. La-Rh
190
La—Rh, La—Ru
Таблица
Соединение
La3Rh*
La7Rh3
La4Rh3
La5Rh4
LaRh
URh2
LaRhj(BT)
LaRh3 (HT)
La2Rh7 (ВТ)
U2Rh7 (HT)
90. Кристаллическая структура соединений системы La—Rh
Прототип
—
Th7Fe3
P4Th3
Sm5Ge4
CrB
MgCu2
PuNi3
CeNij
Er2Co7
Ce2Ni7
'Ромбическая сингония
Символ
Пирсона,
пр.гр.
—
ЛЯ20,
P63mc
с/28.
/43d
0ЯЗ6,
Pnma
0C8,
Стоп
cf24,
Fdim
—,
R3m
ЛЯ24,
P63/mmc
АЛ18,
hP36,
P63/mmc
Параметры решетки, нм
a
1,501
1,0192
0,8922
0,7597
0,3968
0,7628
0,5326
0,5305
0,5333
0,5296
1,334
—
—
1,509
1,1144
—
—
—
-
-
с
1,050
0,6498
-
0,7735
0,4245
-
2,646
1,759
3,946
2,613
Литература
1 Singh P.P., Raman A. // Trans AIME 1969. V. 245 N 7. P. 1561-1568
EH. Гладышевский, О.И. Бодак, В.К. Печарский
La—Ru. ЛАНТАН-РУТЕНИЙ
Исследования характера взаимодействия La и Ru и структуры
образующихся фаз приведены в ряде работ [1—5}.
Диаграмма состояния La—Ru построена методами рентгенострук-
турного, металлографического и дифференциального термического
анализов в интервале концентраций от 0 до 66,7 % (ат.) Ru и пред-
представлена на рис. 89 по данным работы [ 1 ] и обзорной работы [2].
В системе образуются пять соединений: La3Ru, La5^u2> La7Ru3,
LaRux и LaRu2.
Lar-Ru
191
t.°C
2000
1600
1100
918°
865°
800
О
La
Рис. 89. La—Ru
Ru, % (no пассе)
О ГО 20 30 to SO 60
70 60 90 100
I
a)
mn
1
ts
1 SI
5°
I
ill \
84
5° (
760°
1
Ж
/
/
86
l
/
0°
\
\
s
I
1
i
/
file
ГО 20 30 40 50 ВО 70 80 30 100
Щ"/о(ат) Ru
Из них лишь одно соединение La5Ru2 плавится конгруэнтно при
температуре 845 "С, остальные образуются по перитектическим
реакциям. Установлено существование двух эвтектик. Нонвари-
антные равновесия в системе представлены в табл. 91.
Та
Ж
Ж
Ж
Ж
Ж
Ж
Ж
блица 91. Нонвариантные реакции в системе
Реакция
- (PLa) + La3Ru
+ La5Ru2 « La3Ru
- La5Ru2
+ La5Ru2 <• La7Ru3
» La7Ru3 + LaRu2
+ LaRu2 » LaRux
+ (Ru) « LaRu2
Содержание Ru в фазах,
15;
23;
—;
32;
35;
36;
53;
-;
28,6;
28,6;
28,6;
30;
66,7;
100;
La-Ru [2]
% (ат.)
25
25
—
30
37
37
66,7
Температура, "С
675
790
845
825
760
800
1400
Данные по кристаллическим структурам соединений представлены
в табл. 92. Следует отметить, что соединение LaRu^, по данным
работы [1], подобно соединению Y44Ru25, по данным работы [3],
соответствует стехиометрическому составу La5Ru3. В работе [3]
указывается на полиморфизм соединения LaRu3, но температура
полиморфного превращения не установлена.
192
La-Ru, Lar-S
Таблица 92. Кристаллическая структура соединений системы La—Ru
Соедине-
Соединение
La3Ru
La5Ru2
La7Ru3
LaRu^
LaRu2
Прототип
Fe3C
Mn5C2
Sr7Pt3
_
MgCu2
Символ
Пирсона,
пр.гр.
oPlb,
Рпта
mC28,
С2/с
оР40,
Рпта
—
cF24,
Fdlm
Параметры решетки, нм
а
0,7466
0,7470
0,7468
1,6806*'
1.6792*2
1.6790*3
0,7422
1,9134м
0,7708
0,7763
0,7702
*'p = 95,86°.
*2p = 95,79°.
*3P = 95,79°.
*4При концентрации -37 % (ат.) Ru.
Ь
1,0039
1,0144
1,0032
0,6693*'
0.670*2
0.6672*3
,2,3562
1,600м
•• • -
с
0,6578
0,6601
0,6555
0,7444*'
0.7424*2
0.7422*3
0,6732
1,600м
-
Источник
[1]
[3]
[4]
[1]
[3]
[4]
[1]
[1]
[1]
[3]
[5]
Литература
1. Palenzona А., Сапера F. // J. Less-Common Met. 1990. V. 157. P. 307-313.
2. Okamoto H. // J. Phase Equilibria. 1991. V. 12. N 12. P. 247-248.
3. Sharifrazi P., Mohanty R.C., Ramam A. // Z. Metallkunde. 1984. Bd. 74. N 10;
S. 801-805.
4. Palenzona A. // J. Less-Common Met. 1979. V. 66. P. 27—33.
5. Compton V.B., Matthias B.T. // Acta Crystallogr. 1959. V. 12. P. 651-654.
M.A. Тылкина
La-S. ЛАНТАН-СЕРА
Исследование взаимодействия La и S проводилось в ряде работ,
результаты их несколько противоречивы и обобщены в справочниках
[X, Э, Ш, М] и работе [1]. Схематическая диаграмма состояния,
системы La—S представлена на рис. 90 по данным справочника [М].
В системе образуются четыре соединения: LaS, La3S4, La2S3 »
LaS,.
Соединение LaS образуется из расплава при температуре 2175 °С
[М] или -2200 °С [Э].
Температура плавления La2S4 равна 2115 °С [М] или 2100 °С по
данным работы [3]. По данным работы [4], она находится в интерва-
интервале температур 1800—2000 °С.
Lt*S
193
0
t,"C
2000
WOO
1200
918"
865°
800
wo
310°
A
у La
ж
у/
S, % (no массе)
10
2175
1710°,
«3
.__
20
\ 2115
\)
-59.
30
о
-
к
1 IBS
~1
_|
J
*1
CM
о
W
I
3"
0
La
Рис. 90. La—S
10
20
30
40
S,%(am)
50
SO
70
80
Соединение La2S>3> по данным работ [1, Э], существует в трех
модификациях а, р и у (что, однако, не отражено на предлагаемой
схематической диаграмме состояния). Модификация pLa2S3 стабильна
в интервале температур от 650 °С до 1300±100 °С, а у^аг^з ~ от
1300+100 °С до температуры плавления. В работе [5] указывается,
что La3S4 и у^г^З образуют непрерывный ряд твердых раство-
растворов.
Соединение LaS2 образуется, по-видимому, по перитектической
реакции при температуре -1650 °С [М, Э]. По данным работы [1],
при температуре 620 "С LaS2 разлагается с образованием La2S3
и S. В работе [6] указывается на существование соединения
La5S7.
Методы получения соединений в системе La—S подробно описаны
в работе [1].
Кристаллическая структура соединений системы La—S приведена
в табл. 93.
194
La-S. La-Sb
Таблица
Соединение
LaS
La3S4
«La.Sj*
pLajS,"
YLa2S3
L.S,"*
93. Кристаллическая структура соединений системы La—S
Прототип
NaCl
ThjP4
-
-
Th3P4
-
—
^Ромбическая сингония.
"Кубическая сингония.
Символ
Пирсона,
пр.гр.
сП,
Fnilrn
cm,
/43d
-
-
с/28.
/43d
-
—
Тетрагональная сингония.
Параметры i
а
0,586
0,584
0,8748
0,8730
-
2,046
0,8723
0,4147
0,4147
)ешетки, нм
с
—
—
—
-
-
—
0,8176
0,8176
Источник
[2]
[3]
[1,5]
[6]
[1]
[1]
[1]
[1]
[1. 6]
Литература
1. Самсонов Г.В., Дроздова СВ. Сульфиды. М.: Металлургия, 1972. 304 с.
2. Журавлев Н.Н., Степанова А.А., Шебатинов М.И. // Кристаллография. 1964
Т.2. С. 116-117.
3. Жузе В.П., Голубков А.В., Гончарова Е.В. и др. // Физика твердого тела. 1964»
Т.6. С. 257-267.
4. Guittard М. // Compt. Rend. 1965. V. 261. N 10. P. 2109-2112.
5. Picon M., Flahaut J. // Compt. Rend. 1956. V. 243. N 24. P. 2074-2076.
6. Besanson P. // Compt. Rend. 1968. V. 267 С. Р. 1130-1132.
M.A. Тылкина
La-Sb. ЛАНТАН-СУРЬМА
Диаграмма состояния системы La—Sb, приведенная на рис. 91»,
исследована методами термического и микроскопического анализов
в работе [1].
В системе установлено существование четырех соединений: La2Sb,
La3Sb2, LaSb и LaSb2. Однако в работе [2] уточнен состав соединения
La3Sb2 и ему приписана формула La4Sb,. Соединение La4Sb3 плавит-
плавится конгруэнтно при температуре 1690 °С, остальные соединения
La2Sb, LaSb и LaSb2 образуются по перитектическим реакциям при
температурах: 1425, 1540 и 1110 °С соответственно. В системе обра-
La^Sb
195
10
Sb, '/о (по массе)
20 30 40 50 60 70 60 90 100
1800
1700
WOO
1500
1W0
1300
1200
1100
1000V
918°
900
865°
300
700
500
500
0 10 ZO 30 40 50 ВО 70 вО 90 100
La Sb°/o(am.) Sb
Рис. 91. La-Sb
/7
V
m
/
/
/
1
/
/
8*5°
/
/
25°
?
-J
1
'690°
S
%
<a
1
\
Л
s
1110
I
\
N
о
CO
О
1
\
\
1
\
\
630°
(s
1
\
\
\
630,755°
зуется две эвтектики: (La) + La2Sb при температуре 845 °C и
LaSb2 + (Sb) при температуре 630 °C. В работе [3] сообщается о
существовании соединения La5Sb3. На рисунке соединение не
указано.
Кристаллическая структура соединений приведена в табл. 94.
196
La—Sb, La—Sc
Таблиц!
Соедине-
Соединение
La2Sb*
La4Sb3
LaSb
LaSb2**
La5Sb3
i 94. Кристаллическая
Прототип
—
Gd4Bi3
NaCl
-
Mn5Si,
Символ
Пирсона,
пр.гр.
—
—
сП,
Fm3m
-
hPl6,
РЬъ1тст
^Тетрагональная сингония.
"Ромбическая сингония.
структура соединений системы La—Sb
Параметры решетки, нм
а
0,4626
0,963
0,6488
0,6314
0,942
-
-
—
0,6175
с
1,806
-
—
1,856
0,662
Источник
[4]
[2]
[5]
[6]
[3]
Литература
1. Vogel R., Klose H. // Z. Metallkunde. 1954. Bd. 45. S. 633-638.
2. Gambino R.J. // J. Less-Common Met. 1967. V. 12. P. 344-353.
3. Rieger W., Parthe E. // Acta Crystallogr. B. 1968. V. 24. P. 456-458.
4. Stassen W.H., Sato M., Calvert L.D. // Acta Crystallogr. 1970. V. 26. N 10,
P. 1534-1540.
5. Iandelli A., Botti E. // Atti Accad. Naz. Line. Rend. С Sci. Fiz. Mat. Nat. 1964.
V. 37. P. 160-164.
6. Wang R., Steinfink H. // Inorg. Chem. 1967. V. 6. P. 1685-1692.
Н.И. Никитина
La-Sc. ЛАНТАН-СКАНДИЙ
Диаграмма состояния La—Sc (рис. 92) приведена в работе [1].
Система характеризуется неограниченной взаимной растворимостью
компонентов в жидком состоянии и ограниченной — в твердом.
Соединения в системе отсутствуют.
При температуре 750 °С твердый раствор на основе высокотемпе-
высокотемпературных модификаций компонентов распадается по эвтектоидной
реакции на смесь (pLa) + (aSc). При температуре 233 °С (pLa) пре-
претерпевает'также эвтектоидное превращение (pLa) •* (aLa) + (aSc).
Растворимость Sc в (pLa) при температуре -720 °С составляет 16 %
(ат.), a La в (aSc) при этой же температуре — 15 % (ат.).
Структура твердого раствора на основе (aLa) (от 0 до 12 % (ат.)
Sc) принадлежит к типу Мп (символ Пирсона ЛР4, пр.гр. Рб3/ттс).
(pLa) @—16 % (ат.) Sc) обладает структурой типа Си.
с
t, с
МО
1200
WOO
865°
BOO
спп
ьоо
310°
200
j
'918°
-{fiLL
>) J
Чб
12№ -
[aLa)i
LarSc, I
м-Se
Sc,"/o (no массе)
20 40
900^^
Ж
-•^?* ' 1 ^'
У
1
197
ВО 80 100
7
233'
I
SO"
85
/
f
Л
y'33J1
У
[dSc)
Рис.
0 10
La
92. La-Sc
20
30
40
Sc,
SO 60
°/o (am)
70
80
90
100
SC
Твердый раствор на основе (aSc) (95—100 % (ат.) Sc) кристалли-
кристаллизуется в структуре типа Mg. Твердый раствор, существующий между
высокотемпературными полиморфными модификациями редкоземель-
редкоземельных металлов, непрерывен и относится к типу W.
Литература
1. Наумкин О.П., Терехова В.Ф., Савицкий Е.М. II Изв. АН СССР. Металлы.
1970. № 4. С. 147-151.
Е.И. Гладышевский, О.И. Бодак, В.К Печорский
La-Se. ЛАНТАН-СЕЛЕН
Диаграмма состояния La—Se не построена. Установлено образова-
образование шести соединений: LaSe, La3Se4, La2Se3, La^&j' La2Se4, L^S^
[Э, M]. Соединение LaSe образуется конгруэнтно при температуре
~1980±20 °С, соединение La3Se4 — конгруэнтно при температуре
-1800 °С и существует в двух полиморфных модификациях; соедине-
соединения La4Se7, LaSe2 (La,Se4 [Э]), Ьаз^е7 образуются инконгруэнтно
при температурах -1450, -1240, -1080 °С соответственно. Соедине-
Соединения La2Se3 и La3Se4 образуют непрерывные ряды твердых растворов.
198
Lct-Se, Let-Si
Соединение La2Se4 имеет область гомогенности, простирающуюся до;
состава La2Se3 6.
Кристаллическая структура некоторых соединений представлена
в табл. 95.
Таблица 95. Кристаллическая структура соединений системы La—Se
Соединение
LaSe
U3Se4
La2Se3
La^Se;
Прототип
NaCl
Th3P4
Th3P4
—
Символ
Пирсона,
пр.гр.
сП,
Fmbm
с/28,
/43d
с/28,
/43d
'Тетрагональная сингония.
Параметры
а
0,600
0,606
0,9055
0,905
0,849
>ешетки, нм
с
—
-
-
0,856
Источник
[1]
[Э]
[М]
[М]
[Э]
Литература
1. Жузе В.П., Голубков А.В., Гончарова Е.В., Сергеева В.М. // Физика твердого
тела. 1964. Т.6. № 1. С. 257-267.
Л.Л. Рохлин
La-Si. ЛАНТАН—КРЕМНИЙ
Диаграмма состояния La—Si не построена. Отдельные сведения о
составах и структурах двойных интерметаллических соединений
приведены в справочниках [X, Э, Ш].
Кристаллографические характеристики известных двойных фаз по
данным работы [1] приведены в табл. 96.
Таблица 96. Кристаллическая структура соединений системы La—Si [I]
Соединение
La5Si3
La3Si2
Прототип
Cr5B3
U3Si2
Символ
Пирсона,
пр.гр.
Г/32,
/4/mcm
tPIO,
P4/mbm
Параметры решетки, нм
а
0,7593
0,787
Ь
-
с
1,404
0,450
La^-Si, L&Sm
199
Соединение
La5Si4
LaSi
LaSi2
LaSi,,65
Прототип
Zr5Si4
FeB
ThSi2
GdSi2
Символ
Пирсона,
пр.гр.
№36,
Я4,2,2,
оР&,
Рпта
Ш2,
Inland
Imma
Параметры решетки, нм
а
0,804
0,838
0,4322
0,4270
Ь
—
0,399
—
0,4170
с
1,543
0,602
1,386
1,405
Литература
1. Гладышевский Е.И., Бодак О.И. Кристаллохимия интерметаллических соедине-
соединений редкоземельных металлов. Львов: Вища школа, 1982. 255 с.
Е.И. Гладышевский, О.И. Бодак, В.К. Печорский
La-Sm. ЛАНТАН-САМАРИЙ
Диаграмма состояния La—Sm экспериментально не построена [1].
Однако La и Sm близко расположены друг от друга в периодической
системе E7 La и 62 Sm), имеют в металлическом состоянии идентич-
идентичное электронное строение с тремя коллективизированными валентны-
валентными 5dl6s электронами, а также близкие плотноупакованные гекса-
гексагональные модификации ДГПУ (aLa) и ГПУ (pSm) и одинаковые
ОЦК высокотемпературные модификации (yLa) и (ySm). Их атомные
радиусы различаются всего на 4,2 %. Кристаллическая структура La
и Sm приведена в табл. 97 [1].
Таблица 97. Кристаллическая структура и полиморфные превращения
элементов системы La—Sm [I]
Атомный
номер,
элемент
57, La
62, Sm
Модифи-
Модификация
aha
pu
yLa
aSm
PSm
YSm
*Ромбоэдрическа5
Прототип,
структура
aha, ДГПУ
Си, ГЦК
W, ОЦК
aSm*
Mg, ГПУ
W, ОЦК
I СИНГОНИЯ.
Параметры решетки,
нм
a
0,37740
0,5303
0,426
0,36290
0,36630
0,410
с
1,2171
2,6207
, 0,58448
Темпера-
Температура пре-
превращений,
°С
310
865
918
734
922
1074
Реакция
aha « pLa
PLa - YLa
YLa-Ж
aSm >• pStn
PSm •¦ YSm
YSm -Ж
200
La—Sm
Sm. '/. (по массе) Рис. 93. La-^Sm
0 10 20 30 40 50 SO 70 SO 90 100
1400
1300
1200
1100
1000
918°
8S5
800
700
BOO
500
400
300
200
100
0
I
— —
(P
У
i
——
—'—J
La)
I
bT
I
/
1
у
I
, —
/
(a
10 20 30 «
La
I
—¦ ¦
830'
1
1
(
la,J3
i
~—•
-50.
Sm)
I
Ж
-
•m)
—-
1
I
j
1
!
!
j
(ceSmd
1074°
922'
734'
0 SO BO 70 80 90 100
Sm, '/• (am.) Sm
Можно предположить, что между (yLa) и (ySm) при высоки*
температурах должны образовываться непрерывные ряды твердых
растворов. Между гексагональными структурами ДШУ (aLa) и ГПУ1
(pSm) также должны образовываться непрерывные ряды растворов"*
Вследствие близости атомных радиусов в ГЦК структуре (pLa) может
растворяться достаточно большое количество Sm. Вследствие близкого
электронного и кристаллического строения растворы между La и Sm
близки к идеальным, поэтому на диаграмме состояния La—Sifl
(рис. 93) линии ликвидуса и солидуса практически сливаются я
прямую, соединяющую их температуры плавления с узкой двухфаЗ"
ной областью между ними. При понижении температуры ОЦК твер->
La—Sm, La—Sn
201
дые растворы в этой системе должны испытывать, так же как в
системах La—Nd и La—Gd, эвтектоидный распад при температуре
около 830 °С. Предельные растворимости составляют приблизительно
25 % (ат.) Sm в (pLa) и 50 % (ат.) La в (pSm). В (aSm) может
растворяться до 10—20 % (ат.) La. Эвтектоидное равновесие в систе-
системе La—Sm условно показано штриховыми линиями.
Литература
1. Gschneidner, Jr., K.A., Calderwood F.W. // Handbook on the Physics and Chemis-
Chemistry of Rare Earths. Amsterdam. New York. Oxford. Tokyo: North-Holland Physics Publis-
Publishing Co., 1986. V. 8. Ch. 54. P. 1-161.
B.K. Григорович
La-Sn. ЛАНТАН-ОЛОВО
Диаграмма состояния La—Sn приведена на рис. 94 согласно спра-
справочнику [X] и скорректирована относительно температур политерми-
политермического превращения La.
Диаграмма La—Sn построена методами дифференциального терми-
термического и рентгеноструктурного анализов.
Взаимная растворимость компонентов в твердом состоянии прак-
практически отсутствует.
Все три соединения, приведенные на диаграмме, La2Sn, La2Sn3 и
LaSn3, образуются из расплава при температурах 1420, 1187 и
1135 °С соответственно.
В системе кристаллизуются четыре эвтектики:
Ж » LaSn3 + (Sn) при 219 °С и -99 % (ат.) Sn;
Ж » LaSn3 + La2Sn3 при 1108 °С и -68 % (ат.) Sn;
Ж » La2Sn + La2Sn3 при 1142 °С и -57 % (ат.) Sn;
Ж * La2Sn + (PLa) при 716 °С и -10 % (ат.) Sn.
Кристаллическая структура известных двойных фаз по данным
справочника [V-C] приведена в табл. 98.
Таблица
Соединение
La3Sn
La5Sn3
La5Sn3
La5Sn4
98. Кристаллическая структура соединении системы La—Sn
Прототип
AuCu3
W5Si3
Mn5Si3
Sm5Ge4
Символ
Пирсона,
пр.гр.
сР4,
РтЗт
</32,
/4/тст
hPl6,
Р63/тст
оРЗб,
Рпта
Параметры решетки, нм
а
0,5125
' 1,2749
0,9416
0,8448
Ь
—
—
—
1,626
с
—
6,343
0,6926
0,8604
202
La—Sn
Соединение
La3Sns
LaSn3
Прототип
Pu3Pdj
AuCu3
Символ
Пирсона,
пр.гр.
осгг,
Стст
сР4,
РтЗт
Параметры решетки, нм
а
1,035
0,47694
Ь
0,829
с
1,064 "
0
поо
1300
поо
1100
1000
91в°
300
865°
воо
ТОО
60Л
500
too
310°
300
200
too
/
/
/
1
— Ш
о
a)
«_ (a La)
20
/
1
716°
r"
Sn,'/, (па пассе)
*0 SO
T
20°
\
тг°
I,
\
V
1
m°
4 1135
1108
7
\
во
ж
0
\
\
too
\
\
\
\
\
\
I
— ¦ v
213° i
. ~99
"я)-*
Рис. 94.
La—Sn
L 231,9681°
О 10 20 JO 10 50 iO 70 вв 30 100
La Sn,y>(am.) Sn
Е.И. Гладьииевский, О.И. Бодак, В.К. Печарский
La—Sr, La—Та
203
La-Sr. ЛАНТАН-СТРОНЦИЙ
Экспериментальные данные о характере взаимодействия La и Sr
отсутствуют. На основании результатов прогнозирования соединений
с использованием ЭВМ можно предположить возможность образова-
образования в системе La—Sr двух фаз: LaSr типа СеС1 и LaSr5 типа СаСи5
Литература
1 Савицкий Е.М., Грибуля В.Б. Прогнозирование неорганических соединений с
помощью ЭВМ. М.: Наука, 1977. 192 с.
М.А. Тылкина
La-Ta. ЛАНТАН—ТАНТАЛ
Диаграмма состояния La—Та не построена. В системе образуется
широкая область расслоения в жидком состоянии, от 0 до -84 %
(ат.) La. Соединений в системе не обнаружено [Э]. Растворимость Та
в жидком La определена в работе [1].Участок диаграммы состояния
La—Та при очень малых количествах Та приведен на рис. 95 согласно
справочнику [М].
t,°c
woo
1600
1200
865'
воо
too
о
La
рис. 95. La-Ta
0,02
Га, % (по массе)
о,0Н
*?(На)
(pLa)
(
Ж
/
/
(flLa
/
Ж * (Га)
)НТа)
/
0,01
0,02 0,03
Та,°А(ат.)
0,01 0,05
204
La—Та, La—Tb
Для исследования использовали La чистотой 99,8 % (по массе) и
Та чистотой 99,9 % (по массе).
Навески La заваривали в толстостенные тигли из Та, отжигали в
индукционной печи в вакууме при температурах 1355—2083 "С на
протяжении 1 ч и закаливали, сбрасывая в охлаждаемый водой
медный приемник. Содержание Та в закаленном расплаве определяли
с помощью химического анализа (точность не хуже 5 %).
Растворимость Та в La при температуре 1355 "С составляет
0,02 % (ат.); при 1812 °С - 0,0384 % (ат.); при 2013 °С - 0,0491 %
(ат.).
Литература •
1. Dennison D.H., Tschetter M.G., Gschneidner K.A. // J. Less-Common Met. 1966.
V. 11. N6. P.423^35.
Е.И. Гладышевский, ОИ. Бодак, В.К. Печорский.
La-Tb. ЛАНТАН—ТЕРБИЙ
Диаграмма состояния La—Tb экспериментально не построена.
Однако La и ТЬ имеют идентичное электронное строение с тремя
коллективизированными валентными электронами 5dl6s2, близкими
плотноупакованными ДГПУ и ГПУ структурами при низких темпе-
температурах и одинаковыми ОЦК высокотемпературными структурами по
сравнению с мало отличающимися постоянными решеток. Атомные
радиусы La и ТЬ отличаются на 5,4 %.
Кристаллическая структура La и ТЬ приведена в табл. 99 по
данным работы [1].
На основании близости электронного и кристаллического строения
можно предположить, что La с ТЬ образуют непрерывные ряды
высокотемпературных ОЦК растворов и непрерывные ряды плотных
гексагональных растворов при повышенных температурах. Вследствие-
близости атомных радиусов в ГЦК (pLa) растворяется значительное
Таблица 99. Кристаллическая структура и полиморфные превращения
элементов системы La—Tb
Атомный
номер,
элемент
57, La
62, ТЬ
Модифи-
Модификация
aLa
PLa
YLa
aTb
рть
Прототип,
структура
«La, ДГПУ
Си, ГЦК
W, ОЦК
Mg, ГПУ
W, ОЦК
Параметры решетки,
нм
а
0,37740
0,5303
0,426
0,36055
0,402
с
1,2171
0,56966
Темпера-
Температура пре-
превращений,
°С
310
865
918
1289
1356
Реакция
oLa » PLa
pLa » yLa
YLa -Ж
aTb - pTb
рть -ж
La-Tb
205
Tb
о to го jo «я
'400
mo
I20O
1100
woo
$18°
865°
800
700
600
500
400
J10°
200
WO
i
iflLa
(
Г La,.
1
1
13 Tb)
^<\
-8J0
1 i
f /
z_
aia)
ж
''
Vo (по массе)
SO BO 70 BO
1
1
(crtat o(Tb)
1
1
1
1
1
-75
/1
/1
1
j
\<
1
1
1
1
<
0
V
\\
' \
0 W 20 JO 40 50 BO 70
La Tb, % (am )
Рис. 96. La-Tb
i
i_
90 100
1
(o
1
1
¦ть)
1356°
1289°
80 SO WO
Tb
количество Tb. Представленная диаграмма La—Tb (рис. 96) построена
гипотетически и характеризуется, как и близкие к ней диаграммы
La—Gd и La—Y, наличием эвтектоидного распада высокотемператур-
высокотемпературных ОЦК твердых растворов на низкотемпературные растворы на
основе ГЦК (pLa) и ГПУ (аТЬ). Эксперименты, проведенные в
работе [1], показали, что сплавы La с 20, 40, 50 % (ат.) ТЬ имеют
ДШУ структуру, сплавы ТЬ с 15 % (ат.) La и менее — ГПУ структу-
структуру, а в сплавах с 75 и 80 % (ат.) ТЬ найдены линии aSm. Это под-
подтверждает предполагаемую на рис. 96 диаграмму состояния La—Tb.
206
Lar-Tb, Lar-Te
Вследствие большого различия атомных радиусов E,4 %) раство-
растворы значительно отклоняются от идеальных и между ликвидусом и
солидусом образуются широкие двухфазные области. Кривые эвтекто-
идного распада и образования промежуточной фазы изображены
штриховыми линиями условно.
Литература
1. Gschneidner, Jr., K.A., Calderwood F.W. // Handbook on the Physics and Chemis-
Chemistry of Rare Earths. Amsterdam. New York. Oxford. Tokyo: North-Holland Physics Publis-
Publishing Co , 1986. V. 8 Ch. 54. P. 1-161.
B.K. Григорович
La—Те. ЛАНТАН—ТЕЛЛУР
Сплавы системы La—Те изучали в работах [1—5]. На рис. 97
приведена диаграмма состояния системы по данным работы [3]. Для.
приготовления сплавов использовали La чистотой 99,0 % (по массе)
и Те чистотой 99,99 % (по массе). Исследование проводили методами
дифференциального термического и рентгеновского анализов.
Согласно работе [3] в системе существуют следующие фазы:
LaTe, La3_JCTe4, LaTe17±JC, LaTe^, La,!^, LaTe^. Фаза LaTe(a)
имеет узкую область' гомогенности. Область гомогенности фазы
1-аз-лТеФ) простирается от соединения La3Te4 до соединения La2Te3.
Фаза LaTel7 (у) имеет область гомогенности в интервале концен-
концентраций 61,tf-64,0 % (ат.) Те (или от LaTe16 до LaTe178). Область
гомогенности фазы LaTe2_JCF) находится в интервале концентраций
64,0-66,5 % (ат.) Те (или от LaTej 8 до LaTe2). Фаза La2Te5Ke)
имеет узкую область гомогенности при концентрациях 70,9—71,4 %
(ат.) Те. Область гомогенности фазы 1^Те3_х(ц) простирается от 71,4
до 75,0 % (ат.) Те (или от LaTe2 55 до LaTe3). В сплавах, богатых
La, при температуре 895 °С образуется эвтектика. В сплавах, богатых
Те, при 455 °С имеет место перитектическое равновесие.
Кристаллическая структура соединений приведена в табл. 100.
Таблица 100. Кристаллическая структура соединений системы La—Те
Соедине-
Соединение
LaTe
Ьа3-,Те4
ЬаТе;7_„
LaTe2
Прото-
Прототип
NaCl
Th3P4
Cu2Sb
Символ
Пирсона,
пр.гр.
cF&,
Fmbrn
с/28,
/43d
tP6,
P4/nm
Параметры решетки, нм
а
0,3218
0,6422
0,9634-0,9627
0,9628-0,9619
0,4622
0,4552
0,453
0,452-0,456
Ь
0,4497
с
0,9142
0,9178
0,911
0,92-0,917"
Источ-
Источник
[4,5]
[3]
[6]
[4]
[3]
[3]
[4,5]
[7]
La-Te
207
Соедине-
Соединение
LaTe5"'
LaTe-
LaTe3"
Прото-
Прототип
-
Символ
Пирсона,
пр.ф.
ВттЬ
Параметры решетки, нм
а
0,4397
0,4405
0,4407
0,441
^Ромбическая сингония.
"Для составов LaTe, 9—LaTe2.
"'Тетрагональная сингония.
Ь
0,441
с
2,593
2,59
2,6114
2,614
Источ-
Источник
[3]
[3]
[5]
[4]
Рис. 97.
La-Te
20
Те, % (по массе)
40 ВО
80
t.'C
tsoo
1600
то
1200
WOO
918"
ess'
800
600
400
3H"
200
100
/
у
1-ти
—
iLa)
1
Ж
895
11
у
^-
о
1
Wfl' » „V
у^
а
?\ г'
ill
1230°
\
1
8 Г
1
1
V
1
1
1
?
t
1
\
ИЗ'
781°
455'
(Те
\
-Л
\
\
1
1
1
Г
Ю 20 30 10 50
La Te.%(a
SO 10 80 90 100
¦mj Те
208
La-Te, La-Th
Литература
1. Елисеев А.А., Ярембаш Е.И., Кузнецов В.Г. и др. // Журнал неорганической
химии. 1964. Т 9. С. 876-882.
2. Ярембаш Е.И., Вигилева B.C., Елисеев А.А. и др. // Изв АН СССР. Серия,
физическая 1964 Т.28. № 8. С. 1306-1309.
3. Елисеев А.А., Ярембаш Е.И., Кузнецов В.Г. и др. // Изв АН СССР. Неоргани-
Неорганические материалы. 1965 Т.1. № 7. С. 1027—1038.
4. Haasc D.I., Steinfink H., Weiss E.J. // Rare Earth Research (Proceed, of the
Fourth Conference 1964). 1965. V. 2. P. 534-544.
5 Ramsey Т.Н., Steinfink H., Weiss E.J. // Rare Earth Research (Proceed, of the
Third Conference 1963). 1964. V. 2. P. 303-304
6 PardoMP., FlahautJ., Damange L. // Compt. Rend 1963 V. 256 P 1793-1796.
7. Pardo M.P., Flahaut J., Domange L. // Compt. Rend. 1963. V. 256 P. 953-955.
НИ Никитина
La—Th. ЛАНТАН—ТОРИЙ
В системе La—Th установлена непрерывная взаимная раствори-
растворимость компонентов во всем интервале концентраций [Э, X, 1].
На рис. 98 приведен вариант диаграммы состояния согласно спра-
справочнику [М].
0
t,°c
1800
1S00
1400
поо
W00
воо
600
400
too
J7SS
1
1
О
La
20
ч
(aTh.flLa)
0 10 20 30 4
Th
Литература
•/• (по массе)
40
i
m
90
80
(j3 n, /la)
100
¦— -
(«La) 1
Рис. 98. La-Th
SIS'
8SS'
310'
0 50 SO 70 SO 90 100
La,'/' (am) La
1 Бадаева Т.А. // Диаграммы состояния металлических систем Сб науч трудов.
М Наука 1971 С 13-19.
Я И Гладышевский, О.И Бодак, В К Печарский
La-Ti
209
La-Ti. ЛАНТАН-ТИТАН
Результаты ряда исследований характера взаимодействия La и Ti
обобщены в справочниках [X, Э, Ш, М]. На рис. 99 представлена
диаграмма состояния системы La—Ti согласно справочнику [М].
Соединения в системе не обнаружены.
20
1600
1200
1000
882'
800
SOD
1*00
0
п
Рис. 99. La-Ti
La, °/° (по массе)
60 80
100
&"/
г
t—
\-
п)
Тс)
1
ж, *¦
~15
жг
¦50°-
9вП°
-900"
-825°
I
I
1
\
\
\
i
(Г La)
(flLa)-*.
918°
865°
10 20 JO U 0 50 SO 70 80 90 100
La,°/o(am) La
В системе протекают следующие нонвариантные реакции:
монотектическая Ж * (CTi) + Ж2 при 1550 "С;
перитектическая (CTi) + Ж * (yLa) при 960 °С;
перитектоидная (CTi) + (yLa) « (aTi) при 900 °С;
эвтектоидная (yLa) •* (aTi) + (pLa) при 825 °С.
Растворимость La в (Ti), по данным справочника [Ш], при темпе-
температуре 600 °С равна 0,5 % (ат.) и значительно меньше по данным
работы [1] : 0,53 % (ат.) La при температуре 903 °С и 0,07 % (ат.)
La при 772 °С [1, Э].
Литература
1 Гшнейднер К.А. Сплавы редкоземельных металлов Пер с англ / Под ред
Ь М Савицкого М Мир, 1965 427 с
Е И Гладышевский, О И Ьодак, В К Печарский
210
La-TI
La—Tl. ЛАНТАН—ТАЛЛИЙ
Диаграмма состояния La—Tl представлена на рис. 100 по данным
работы [1]. Сплавы готовили нагревом компонентов в тиглях из Та
в индукционной печи в атмосфере Аг и отжигали при температуре
500 °С в течение 500 ч. В качестве исходных компонентов использо-
использовали La чистотой 99,9 % (по массе) и Т1 чистотой 99,99 %
(по массе). Исследование выполняли методами дифференциального
термического, микроскопического, микрорентгеноспектрального и
рентгеноструктурного анализов.
В системе установлено существование шести соединений.
Растворимость La в (Т1) практически отсутствует. Растворимость
Т1 в (pLa) при температуре 640 °С равна ~2 % (ат.), а в
(YLa) при 655 °С - -10 % (ат.).
77, % (по массе)
О 20 40 60 ВО W0
/ZOO
1100
1000
900
865°
800
700
BOO
500
400
300
200
too
La
Рис. 100. La-TI
918°
\
i
310°
—r»
\ У
La)
895°
/
_?
N-
1
/
A
!i
M' jl
II
Г^ I i
1
1
12t
/i
' 1
V
I 1
1 1
j 1
1
i
I i
1 1
! I
'0°
\l
1100'
I
I
1120°
"ТЧ
jj
I
I
I
I
I
jl
i|
Hi
Jn
!
|j
1
ж
/045°
/
T°~
r
«a
30
\
\
\
3°
(ЛП)-*
235°
(an)
230°
/0 20
JO
,0 SO 60
П."/» (a/n)
70 80 90
100
La-Tl
211
Соединения LaTl, La3Tl5 и LaTl3 образуются из расплава. При
температуре 1040 °С соединение La3TI5 претерпевает полиморфное
превращение.
Соединения La2Tl и La5Tl3 образуются по перитектическим реак-
реакциям, a La3Tl образуется по перитектоидной реакции. Предполагает-
Предполагается, что соединения La2Tl, La5Tl3, LaTl и La3Tl5 имеют области гомо-
гомогенности.
В системе существуют четыре эвтектических равновесия.
Моновариантные и нонвариантные равновесия в системе приведе-
приведены в табл. 101.
Кристаллографическая структура известных двойных фаз по
данным работ [V-C, 2] приведена в табл. 102.
Структура соединения La2Tl неизвестна.
Таблица 101 Реакции
Реакция
Ж - LaTl
Ж » U3T15
Ж - LaT!3
Ж + La5T!3 - U2T1
(уLa) + La2Tl » La3Tl
Ж - (yLa> + La2Tl
Ж - LaTl + La3Tl3
Ж » U3T15 + LaTl3
Ж » LaTl3 + (PT1)
Ж + LaT! - La5Tl3
(yLa) - (pLa) + La,T!
в системе
La-Tl [1]
Содержание Т1 в фазах,
—;
—;
—;
~28;
25;
17,5
58;
70;
>99,5
~33;
10,
50;
62,5;
75;
37,5
-9,0
11;
50;
62,5
75;
-43;
1,9;
% (ат.)
-
—
—
33,3
33.3
33,3
62,5
75
-100
37,5
25
Температура, °С
1220
1120
1060
895
645
655
1100
1045
303
950
640
Таблица 102 Кристаллическая структура соединений системы La—T1
Соедине-
Соединение
La3Tl
U5T13
LaTl
La3Tlj
LaTl,
Прототип
AuCu3
W5Si3
CsCl
Pu3Pd5
AuCu3
Символ
Пирсона
пр.гр.
cP4,
РтЗт
tm,
H/mcm
cP2,
РтЗт
oC32,
Cmcm
cPA,
РтЪт
Параметры решетки, нм
а
0,506
1,2798
0,3986
1,039
0,4803
Ь
—
—
—
0,840
—
с
-
0,6347
-
1,076
-
Источник
[2]
[1]
[2]
[U
[1]
212
La—Tl, La—Tm
Литература
1. Delfino S., Saccone A., Cocciamani G., Ferro R. // Z. Metallkunde. 1985. Bd. 76.
N 1. S. 7-10.
2 Гладышевский Е.И., Бодак О.И. Кристаллохимия интерметаллических соедине-
соединений редкоземельных металлов. Львов. Вища школа, 1982. 255 с.
Е.И. Гладышевский, О.И. Бодак, В.К. Печорский
La-Tm. ЛАНТАН-ТУЛИЙ
Фазовая диаграмма La—Tm экспериментально не построена [1].
Однако в металлическом состоянии La и Тт изоэлектронны, имеют
три коллективизированных валентных 5dlbs2 электрона. Их плотные
гексагональные структуры обладают близкими параметрами решетки,
а атомные радиусы отличаются на 7,6 %. Кристаллическая структура
La и Тт приведена в табл. 103 [1, 2].
Таблица 103 Кристаллическая структура и полиморфные превращения
элементов системы La—Tm
Атом-
Атомный но-
номер,
элемент
57, La
69, Ttn
Моди-
фи-
фикация
aLa
pLa
YLa
Прототип,
структура
aLa, ДГПУ
Си, ГЦК
W, ОЦК
Mg, ГПУ
Параметры ре-
решетки, ИМ
а
0,37740
0,5303
0,426
0,35375
с
1,2171
0,55040
Темпера-
Температура пре-
враще-
вращений, X
310
865
918
1655
Реакция
aLa - pLa
PLa » yLa
YLa -Ж
ЖгпУ "
" жоцк
Источ-
Источник
[1]
Ш
[1]
[2]
Благодаря близости электронно-кристаллического строения и
атомных радиусов, находящихся в пределах критерия Юм-Розери
A5 %), между La и Тт при высоких температурах (выше 735 °С),
так же как в системе La—Gd, образуются непрерывные ряды раство-
растворов с плотной гексагональной структурой, непрерывно переходящей
от ДГПУ структуры aLa к ГПУ структуре Но по механизму дефектов
укладки. Вследствие большого различия температур плавления La
(918 °С) и Тт A545 °С) их сплавы должны кристаллизоваться по
перитектической реакции аналогично сплавам системы Nd—Ег. В
приближении идеальных растворов линии, соединяющие температуры
плавления (918; 1545 °С) и превращения (865; 1655 °С) La и Тт,
учитывая изменения ближнего порядка Тт : Жгпу «* ЖОцк при
1655 °С [2], пересекаются в перитектической точке с координатами
ИЗО "С, 35 % (ат.) Тт. Предлагаемая диаграмма состояния системы
La—Tm представлена на рис. 101. Высокотемпературные ОЦК раство-
La—Tm
213
hie 101-
T
t,°c
1600
1500
1100
1300
1200
1100
1000
918°
SOO
865°
800
(P La)-
600
500
too
310°
300
200
100
7 10
I
/^
20
l
\~850°
I
I
f
и
(ale
/
30
I
y*
/
Y
i
i
;
Tmt°/o (no массе)
10 50 60 W
I
^—
/
A
77
II
11
/1
T
1 I
1 1
N
1
1
IT
1
/>'
/(CO.
0%
)\
1
1
I
1
1
i
1
1
1
У
1/30°
u,Tm)
i
1
80
1
90
1
/fit
/
У
(Тт)
100
•
7
16SS°
О 10 20 JO 40 50 60 70 80 30 100
La Tm,%(a/n. тт
ры, как в аналогичной системе La—Gd, должны при температуре
~850 "С распадаться по эвтектоидной реакции на ГЦК растворы на
Основе CLa и ДГПУ растворы на основе aLa. Ниже температуры
735 °С при -40 % (ат.) Тт из плотных гексагональных растворов
возникает, как в системе La—Но и др., промежуточная фаза б типа
aSm, купол которой разделяет области ДГПУ и ГПУ растворов.
214 La—Ttn, Lct-U, La-V
Литература
1. Gschneidner, Jr., K.A., Calderwood F.W. // Handbook on the Physics and Chemis-
Chemistry of Rare Earths. Amsterdam. New York. Oxford. Tokyo: North-Holland Physics Publis-
Publishing Co., 1986.V. 8. Ch. 54. P. 1-161.
2. Григорович В.К., Григорович К.В. // Строение и свойства металлических и
шлаковых расплавов: Тезисы докладов на VII Всесоюзной конференции. Челябинск:
ЧПИ, 1990. Т.2. № 2. С. 250-252.
В.К, Григорович
La-U. ЛАНТАН-УРАН
Диаграмма состояния системы не построена. В системе La—U
отмечено существование области расслоения в жидком состоянии [Э,
Ш, 1, 2]. Методом химического анализа установлена незначительная
взаимная растворимость компонентов. Так, растворимость La в (U)
при температуре 1225 °С составляет 1,43 % (ат.), а при 1150 °С —
1,31 % (ат.). Растворимость U в (La) при этих же температурах
равна 0,46 % (ат.) и 0,35 % (ат.) [2]. По данным, приведенным в
справочнике [Ш], растворимость La в жидком U при температуре
1250 °С составляет 1,53 % (ат.), а при 1150 °С - 1,30 % (ат.).
Растворимость U в жидком La равна 0,59 и 0,18 % (ат.) при темпе-
температурах 1250 и 1000 "С соответственно.
Литература
1. Иванов О.С. // Диаграммы состояния металлических систем: Сб. статей. М.:
Наука, 1971. С. 5-13.
2. Haefling J.F., Daane A.H. // Trans. AIME. 1959. V. 125. Р. 336-338.
Е.И. Гладышевскип, Off. Бодак, В.К. Печарский
La—V. ЛАНТАН—ВАНАДИЙ
Диаграмма состояния системы La—V построена в работах [1, Э]
и представлена на рис. 102 в обобщенном виде с учетом полиморфиз-
полиморфизма La и расчетных данных по системе, полученных в работе [2].
В работе [1] использовали La — чистотой 98,5 % (по массе) и V —
чистотой 99,3 % (по массе). Исследование выполняли методами
дифференциального термического и микроструктурного анализов.
Соединения в системе не образуются. В системе La—V существует
широкая область расслоения в жидком состоянии. Температура
монотектической реакции Ж1 •* Ж2 + (V) равна 1903 "С [2] A680 °С
[1]). При температуре 918,7 °С [2] (890 °С [1]) осуществляется
перитектическое превращение Ж + (V) » (yLa). По эвтектоидной
реакции при температуре 864,5 °С [2] G00 °С [1]) (уLa) распадается
с образованием (CLa) и V.
La-V, La-W
215
20
</0
La,°A(na массе)
60 SO
WO
1910°
1800
WOO
mo
1200
1000
800
boo
100
200
0,15
i
Щ7°
86*,5°
1903°
\
B7,5-9B.6 \_
\
~9B,6 '
-98,8 s\
(PLa)-I
918°
*¦(*
885°
0 10
V
Рис. 102. La-V
20 30 tO SO SO 70 80 SO 100
La,%(am.) La
Литература
1. Савицкий Е.М., Барон В.В., Ефимов Ю.В. // Тр. Ин-та металлургии
им. А.А. Байкова АН СССР. I960. № 5. С. 166-173.
2. Smith J.F., Lee K.J., Martin D.M. // Calphad. 1988. V. 12. N 1. P. 89-96.
Е.И. Гладышевский, О. И. Бодак, В.К. Печарский
La—W. ЛАНТАН—ВОЛЬФРАМ
Диаграмма состояния La—W приведена на рис. 103 в узкой кон-
концентрационной области от 0 до 0,05 % (ат.) W по данным обзорной
работы [1]. Диаграмма состояния эвтектоидного типа, промежуточ-
промежуточных фаз не обнаружено. Температура эвтектики (yLa) + (W) практи-
практически совпадает с температурой плавления La, а концентрация La в
ней приближается к 100 % (ат.) [2].
Растворимость W чистотой 99,9 % (по массе) в (La) чистотой
99,8 % (по массе), по данным работы [2], при различных температу-
температурах приведена ниже:
Температура, °С 1496 1650 1747 1940 2066
Растворимость W, % (ат.).. .. 0,0011 0,0052 0,0086 0,0250 0,0494
216
La-W, Lar-Y
0,01
W, % (no ftacce)
0,02 0,03 0,01 0,05
0,06
(
¦*~(ata)
i
I
Ж
_—
865"
1 1
————
1
и.
t,'c
1600
918°
600
0 0,01 0,02 0,03 0,04 0,05
La W, % (am.)
Рис. 103. La-W
Растворимость W в жидком La может быть описана уравнением
1ше = —11,659- Ю~3Т~1 + 1,692, гдех- атомная доля W; Т — темпе-
температура, К. Рассчитанная по этому уравнению растворимость W в
жидком La при температуре его плавления (918 °С) составляет
8- 10~7 (ат.) [2].
Литература
1. Pandian S., Nagender Naidu S.V., Rama Rao P. // J. Alloy Diagrams. 1988. V. 4.
N 2. P. 73-116.
2. Dennison D.H., Tschetter M.J., Gschneidner K.A. // J. Less-Common Met. 1966.
V. 11. N 6 P. 423-435.
К.Б. Поварова
La-Y. ЛАНТАН—ИТТРИЙ
Диаграмма состояния La—Y приведена на рис. 104 по данным
работы [ 1 ]. Исследование выполнено методами дифференциального
термического, микроскопического и рентгеноструктурного анализов.
Высокотемпературные модификации компонентов yLa и CY обра-
образуют непрерывный ряд твердых растворов. При температуре 861 °С
происходит его эвтектоидный распад по реакции (yLa, pY) »* (CLa) *
+ (aLa, aY). При температуре 735 °C твердый раствор (aLa, aY)
распадается с образованием фазы 5. По данным работы [2] фаза 5
принадлежит к структурному типу aSm (символ Пирсона W?3, пр.гр.
i?3m) с параметрами а = 0,3699; с = 2,670 нм.
La-Y, Lar-Yb, Lar-Zn
217
20
V, */• (no массе)
40 SO
80
WO
918'
/
1
f
310°
¦(JiLa
i
<La
-ffi-a
7
)
(a La)
/
1
1
1
1
i
ж
^—
(«La
-7J5'
1
/1
I
1
<*Y)
i
(aY)
'SI2'
'478°
№00
1200
WOO
800
600
200
0 tO 20 JO 40 SO 60 TO 80 90 100
La У. '/<¦ (am) Г
Рис. 104. La—Y
Литература
1. Spedding F.H., Valletta R.M., Daane A.H. // Trans. ASM. 1962. V. 55. P. 483.
2 Гладышевский Е.И., Бодак О.И. Кристаллохимия интерметаллических соедине-
соединений редкоземельных металлов. Львов: Вища школа, 1982. 253 с.
Е.И. Гладышевский, О.И. Бодак, В.К. Печорский
La-Yb. ЛАНТАН-ИТТЕРБИЙ
Диаграмма состояния La—Yb не построена. По данным справочни-
справочника [Ш] двойные соединения в системе отсутствуют, наблюдается
несмешиваемость компонентов в жидком состоянии и практически
отсутствует взаимная растворимость компонентов в твердом
состоянии.
Е.И. Гладышевский, О.И. Бодак, В.К. Печорский
La-Zn. ЛАНТАН-ЦИНК
Сведения о взаимодействии La с Zn приведены в справочниках
[X, Э, Ш], диаграмма состояния La—Zn (рис. 105) построена по
данным справочника [X] с корректировкой на полиморфизм La [1].
218
La-Zn
t°c
1100
woo
$w°
900
865°
BOO
700
600
500
'tOO
310°
JOO
Znt°/o (по пассе)
О 5 10 15 20 25 30 10 50 SO 70 SO 700
h"
1
1 n\
La)
\
\
*- (/3La)\
i
A
J
V
ij —
I
r
/
/
S3
1 1 1
t
ei
4°
5°
57 7
-LaZr
s
Bt
л
60°
1
ч
i
1
S° A
p>7Y
_ 1 Y. _
7в2°
1
tp
4
872
(
1
ч
\
12П
(Zn)\
«19,58°
О 10 20 J0 40 50 60 70 80 90 100
La 7n,°/o(am.) In
Рис. 105. La—Zn
Взаимная растворимость компонентов в твердом состоянии прак-
практически отсутствует. В системе образуются пять соединений. Соеди-
Соединения LaZn, LaZn2 и LaZn5 образуются из расплава при температу-
температурах 815, 855 и 974 °С соответственно. Соединения LaZn4 и LaZn13
кристаллизуются по перитектическим реакциям, образование (Zn)
также предполагается по перитектической реакции:
Ж + LaZn5 ** LaZn4 при температуре 872 "С,
Ж + LaZn5 *• LaZn13 при температуре 840 "С,
Ж + LaZn13 •* (Zn) при температуре 421 °С.
В системе протекают три эвтектические реакции, приведенные
ниже.
Ж » LaZn + (pLa) при концентрации 23 % (ат.) Zn и темпера-
температуре 530 "С,
Ж » LaZn + LaZn2 при концентрации 57 % (ат.) Zn и темпера-
температуре 760 "С,
Ж » LaZn2 + LaZn4 при концентрации 74 % (ат.) Zn и темпера-
температуре 782 °С.
В справочнике [Ш] указано на образование соединений LaZn5 25
и LaZn7. Кроме соединений, найденных при изучении диаграммы
La—Zn, La—Zr
219
состояния, в работах [V-C, 2] сообщается о существовании других
рройных фаз. Кристаллографическая структура соединений приведена
^б. 104.
Таблица
Соединение
LaZn
LaZn2
^ LaZn4
LaZn5
LaZn,3
La3Zn22
La2Zn17
La2Znl7
LaZn,,
104 Кристаллическая структура соединений системы La—Zn
Прототип
CsCl
KHg2
—
CaCu5
NaZn13
Ce3Zn22
Th2Zn17
Th2Ni17
NaZn,,
Символ
Пирсона
np.rp.
cP2,
Pniim
—,
Imma
—,
Cmcm
hP6,
Pblmmm
cF\\2,
Fm3c
—,
/4,/amrf
ЛЯ19,
R3m
ЛЯ38,
P&j/mmc
/748,
/4,/amrf
Параметры решетки, нм
a
0,3760
0,4677
0,633
0,5427
1,2096
0,897
0,9131
0,9135
1,0686
b
—
0,761
1,029
—
-
—
—
с
—
0,755
0,611
0,4225
—
2,148
1,3334
0,8896
0,6881
Литература
1. Gschneidner, Jr., K.A., Calderwood F.W. // Handbook on the Physics and Chemis-
jfcy of Rare Earths Amsterdam. New York. Oxford. Tokyo: North-Holland Physics Publis-
Publishing Co., 1986 V. 8. Ch. 54. P 1-161.
, 2. Гладышевский Е.И., Бодак О.И. Кристаллизация интерметаллических соедине-
соединений редкоземельных металлов. Львов Вища школа, 1982. 255 с.
ЕЙ. Гладышевский., О.И. Бодак, В.К. Л е чаре кип
la-Zr. ЛАНТАН-ЦИРКОНИЙ
Диаграмма состояния La—Zr не построена. По данным металлогра-
металлографического анализа в системе имеется область расслоения в жидком
состоянии [ 1 ]. Соединения в системе отсутствуют [2].
Литература
1 Спеддинг Ф.Х., Даан А.Х. Редкоземельные металлы. М : Металлургия, 1965.
«10 с.
2. Гшнейднер К.А. Сплавы редкоземельных металлов- Пер. с англ / Под ред.
Е.М. Савицкого М . Мир, 1965 427 с
Е И Гладышевский, О И Бодак, В К Печорский
220
La—Lu, Li—Ug
Li-Lu. ЛИТИЙ-ЛЮТЕЦИЙ
Диаграмма состояния 1л—Lu не построена. На основании прогноза
с помощью ЭВМ в системе Ii—Lu следует ожидать образования следу-
следующих соединений: Li3Lu, LiLu3, Li2Lu, LiLu2, LiLu [1].
Литература
1. Савицкий Е.М., Грибуля В.Б. Прогнозирование неорганических соединений с
помощью ЭВМ. М.: Наука, 1977. 194 с.
В.П. Полякова
Li—Mg. ЛИТИЙ—МАГНИЙ
Диаграмма состояния Li—Mg, исследованная в работах [1—3],
подтверждена результатами более поздних экспериментальных работ
[4, 5] и термодинамическими расчетами [6]. Подробный анализ всех
опубликованных работ проведен в работе [7]. На рис. 106 приведена
диаграмма состояния Li—Mg, построенная в работе [7] по хорошо
согласующимся данным работ [1—5]. В работах [1—5] при исследова-
исследовании использованы методы термического, металлографического,
микрорентгеноспектрального и дилатометрического анализов, а также
t,L
600
SOO
soo
200
100
20 30 40
180,6'
f
SO 6t
у
У
/,
у
-
Mj,'/. (по массе)
10
ж
у
(Li)
^ \
90
?'
}/p75ti
95
1
\
i
I
I
m
650'
(Mg)
го so
40 !0 60
Mg, % (am.)
70
SO
90 WO
Рис. 106. Li-Mg
Li-Mg 22U
измерения электросопротивления. Чистота исходных материалов
составляла 99,99 % (по массе) Mg и 99,99 % (по массе) 1л по дан-
данным работы [3]; 99,8 % (по массе) Mg и 99,9 % (по массе) 1л по
данным работы [5] и 99 % (по массе) 1л, содержащего 0,76 % (по
массе) Na и К по данным работы [1]. Как было показано в работе
[7], чистота материалов не оказывала влияния на температуру
ликвидуса и солидуса системы.
Система Li—Mg характеризуется наличием широких областей
твердых растворов (Li) и (Mg), максимума на кривой ликвидуса при
температуре 592 °С и содержании 70 % (ат.) Mg [4], эвтектического
равновесия Ж * (Mg) + Aл) при 588 °С и 77 % (ат.) Mg [3].
Данные растворимости 1л в (Mg), определенные методами метал-
металлографического [2] и рентгеновского [8] анализов, находятся в
хорошем соответствии с данными, полученными методами микрбрен-
тгеноспектрального и дилатометрического анализов [5]. При темпе-
температурах 200—400 °С растворимость Li в (Mg) практически постоянна
и составляет 18,0±0,1 % (ат.). Данные по растворимости Mg в Aл),
определенные металлографическим анализом в работах [3, 9], согла-
согласуются с данными, полученными методом измерения электросопро-
электросопротивления [5]. При температурах 200—400 °С граница растворимости
Mg в (Li) проходит при 30,1 % (ат.) Li. Выше температуры 500 °С
граница несколько смещается в сторону увеличения содержания Li
[3, 9]. Наличие максимума на кривой ликвидуса привело к предпо-
предположению в ранних работах о существовании промежуточной фазы на
базе соединения Ii2Mg, или LiMg2, что не подтвердилось в последую-
последующих исследованиях [7]. Значения параметров решетки (Mg) а и с
уменьшаются по мере легирования его 1л и составляют 0,31918 и
0,51319 нм, соответственно при 18,4 % (ат.) 1л [10]. Параметр
объемно центрированной решетки (Li) в интервале концентраций
100—30 % (ат.) Ы изменяется по кривой с минимумом. Значения
параметра решетки а следующие: 0,3510 нм при 100 % (ат.) 1л;
0,3492 нм при 57 % (ат.) 1л; 0,3517 нм при 30 % (ат.) 1л [10].
Литература
1. Grabe G., Zeppelin H.B., Bumm H. // Z. Elektrochemie. 1934. Bd. 40.
S. 160-164.
2. Hume-Rothery W., Raynor G.V., Butcher E. // J. Inst. Met. 1945. V. 71.
P. 589-601.
3. Freeth W.E., Raynor G.V. // J. Inst. Met. 1953-1954. V. 82. P. 575-580.
4. Feitsma P.D., Lee Т., Van Der Lugt W. // Physica. 1978. V. 93. N 1. P. 52-58.
5. Schumann E., Geifller I.K. // Giessereiforschung. 1980. Bd. 32. N 4. S. 163-164.
6. Saboungi M.L., Hsu C.C. // Calphad. 1977. V. 1. N 3. P. 237-251.
7. Nayeb-Hashemi A.A., Clark J.B., Pelton A.D. // Bull. Alloy Phase Diagrams. 1984.
V. 5. N 4. P. 365-374.
8. Hofmann W. // Z. Metallkunde. 1936. Bd. 28. S. 160-163.
9. Catterall J.A. // Nature. 1952. Bd 162. S. 336.
10. Herbstein F.H., Averbach B.L. // Acia Meiall. 1956. V. 4. P. 407-^20.
И.Р. Бочвар
222
Li-Mn
Li-Mn. ЛИТИЙ-МАРГАНЕЦ
Диаграмма состояния Ii—Мп, приведенная на рис. 107, построена
по данным термического, металлографического и химического анали-
анализов в работе [1]. Для исследования использовали электролитический
Мп чистотой 99,9 % (по массе) и Ii чистотой 99,9 % (по массе).
Диаграмма состояния Ii—Мп характеризуется наличием области
несмешиваемости в жидком состоянии. В твердом состоянии в равно-
равновесии находятся (Li) и (Мп). Монотектическая реакция Ж2 * Ж] +
+ (Мп) существует при температуре ~1240 °С. Содержание Мп в
жидкости состава Ж2 составляет 98,7 % (ат.), в жидкости состава
Ж1 0,4 % (ат.). При температуре -180 "С (температура плавле-
плавления Ii) наблюдается еще одно нонвариантное равновесие, однако тип
0
t"c
1300
1200
поо
1000
900
800
700
600
500
МО
300
200
180,6"
100
0.5
1
/
/
/
/
1.0
1
/
2.0
г
Ж
J
/
Мп.
3.0
i
/-
/
V. (т
1 i
/
I
1 массе)
99.1
Ж^
I
жг
1
1
1
1
1
1-,
~ПЬО° ~9в,вГ
(Гм
1
99.9
1
¦я «к —
\
IOt
¦хм>
\FМп)
1
JiMn
(a Mi
v
\
\
1
\.
1
1
¦
1138'
100°
727°
О 0,1 0.2 0.3 0,4 98,0 98,5 99,0 99.5 100
Li Mn. "U (ат.) Мп
Рис. 107. Li—МП
Li-Mn, Li—Mo 223
1100
0,3
вляет
1100
0,27
1000
0,279
1000
0.201
900
0,213
900
0,155
800
0,19
800
0,121
его не, установлен (эвтектический или перитектический). Не установ-
установлен характер нонвариантных равновесий, связанных с полиморфными
превращениями Мп. Температуры нонвариантных равновесий, полу-
полученных в работе [1], приведены в соответствии с принятыми темпе-
температурами плавления чистых элементов.
Растворимость Ii в (Мп) уменьшается с понижением температуры
и составляет:
Температура, "С 1200
Растворимость Li, % (ат.) 0,339
Растворимость Мп в жидком Ii составляет:
Температура, "С 1200
Растворимость Мп, % (ат.) 0,336
Растворимость Мп в (Ii) практически отсутствует.
Авторы работы [2], используя субрегулярную модель растворов,
рассчитали линию ликвидуса со стороны Ii в интервале температур
1000-400 °С.
Литература
1. Obinatal., TakeuchHf,, Kurichara К., Watanabe M. // Metall. 1965. Bd. 19. N 1.
S. 21-35.
2. Кузин А.Н., Люблинский И.Е., Бескоровайный Н.М. // Расчеты и экспери-
экспериментальные методы построения диаграмм состояния: Сб. статей. М.: Наука, 1985.
С. 113-118.
Н.Р. Бочвар
Li-Mo. ЛИТИЙ-МОЛИБДЕН
Диаграмма состояния Ii—Мо не построена. Данные авторов раз-
различных работ хорошо согласуются между собой относительно отсут-
отсутствия в системе промежуточных фаз и незначительной взаимной
растворимости компонентов друг в друге [Ш, 1, 2, 3]. Эксперимен-
Экспериментальные данные, оценивающие растворимость Мо в жидком Ii,
отличаются на несколько порядков. Согласно работе [1] раствори-
растворимость Мо в Ii меняется от 3,7- 10~5 % (ат.) при температуре 675 °С
до 1,1- 10" % (ат.) при температуре 925 °С. По данным работы [2]
растворимость Мо в жидком Ii при температуре 1000 °С составляет
-7,2- 10 % (ат.); при температуре 860 °С в жидком Ii растворяет-
растворяется 1-10~~3% (ат.) Мо [Ш]. На основании термодинамических
расчетов растворимость Мо в жидком Li может быть определена
равной 10~26 % (ат.) при температуре 181 °С и 7- 10"8 % (ат.) при
температуре 1324 °С [3].
224
U-Mo, U—N
Литература
1. Leavenworth H.W., Cleary R.E. // Acta Metall. 1961. V. 9. P. 519-520.
2. Бычков Ю.Ф., Розанов А.Н., Яковлева Б.Б. // Атомная энергия. 1959. Т.7.
С. 531-536.
3. Brewer L., Lamoreaux R.H. // Atomic Ehergy Review. Special Issue N 7 Molibde-
num: Physico-Chemicai Properties of its Compounds and Alloys. Vienna: International
Atomic Energy Agency, 1980. P. 195—356.
К.Б. Поварова
Li-N. ЛИТИЙ-АЗОТ
На рис. 108 приведена диаграмма состояния Ii—N, построенная в
работе [1] по данным термического анализа. Сплавы готовили плав-
плавлением в тиглях из Fe металлического Ii чистотой 97,85 % (по
массе) и нитрида Li. Нитрид Li получали путем пропускания азота,
очищенного от кислорода, над металлическим Li до полного насыще-
насыщения. Температура плавления 1л$Ы была определена равной 815 °С,
однако ввиду присутствия примеси Fe в сплавах, особенно богатых
нитридом, точность определения температуры вызывает сомнение.
При температуре 185 °С имеет место нонвариантное равновесие,
однако тип его не установлен (исходя из полученных значений
температур, по-видимому, перитектический). Растворимость N в
го
го
t'c
800
N,°/t(nonecct)
JO
40
Рис. 108. Li—N
Li-N, Li-Na 225
жидком Li, определенная методом химического анализа [Э], приведе-
приведена ниже:
Температура, °С 450 400 350 300 250
Растворимость N:
% (ат.) 0,65 0,6 0,59 0,08 0,02
% (по массе) 1,31 1,21 1,19 0,16 0,04
Соединение Li3N имеет гексагональную структуру (символ Пирсо-
Пирсона hP4, пр.гр. РЫттт), параметрами решетки а = 0,3665 нм, с =
= 0,3892 нм) [Э]. Также сообщается о возможности получения LiN3
в результате химической реакции.
Литература
1 Большаков К.А., Федоров П.И., Степина А.А. // Изв. вузов. Цветная металлур-
металлургия. 1959. № 4. С. 52-53.
2. Hofman-Bang N. // Acta Chem. Scand. 1957. N 11. P. P. 581-582.
H.P. Бочвар
Li-Na. ЛИТИЙ-НАТРИЙ
Диаграмма состояния Ii—Na (рис. 109) построена в работе [1] на
основании обобщения данных различных исследований [2—3]. В
работах [2, 3] были использованы методы термического и химическо-
химического анализов, в работе [4] применен метод измерения плотности и в
работе [5] — метод измерения электросопротивления. Система харак-
характеризуется отсутствием промежуточных фаз и наличием широкой
области несмешиваемости в жидком состоянии. Температура моно-
тектической реакции Ж1 «* Ж2 + (Ii) и содержание Na в монотектике
по данным различных исследователей приведены ниже:
Температура, °С Tfl 170,6 170 169,9
Содержание Na в Ж,, % (ат.) 3,8 3,4 3,42 3,4
Содержание Na в Ж2, % (ат.) 86,9 91,6 87,87 90,2
Источник [2] [3] [4] [5]
Анализируя полученные данные, автор работы [1] установил
температуру монотектики, равную 170,7 °С, и содержание в ней
3,4 % (ат.) Na.
Температура и содержание Na, отвечающие критической точке на
кривой расслаивания, приведены ниже:
Температура, °С 380 442±1 306±1 303±2
Содержание Na, % (ат.) 35 40,3 35 35,7
Источник [2] [3] [4] [5]
226
Li-Na, Li-Nb
DW2030U0 5D
Na.°/o (no массе)
SO 70 80 90
100
1 1
/
4.1
*-(L
7
0
i
m- —i
I
Ж
/ff,
1
.*,
/7ff,
1
s
\
\
(Aft
\
\
300
^5ff
/JO
100
SO
О 10 20 JO <Ю 50 SO 70 80 90 100
L i Na, % (am.) /Va
Рис. 109. Li-Na
S7,8°
В системе кристаллизуется эвтектика при температуре 92,15±
±0,05 °С и содержании 96,5±0,5 % (ат.) Na [1].
Литература
1. Bale C.W. // Bull. Alloy Phase Diagrams. 1989. V. 10. N 3. P. 265-268.
2. Salmon O.N., Ahmann D.H. // J. Phys. Chem. 1956. V 60. P. 13-14.
3. Howland W.H., Epstein L.F. // Advan. Chem. 1957. V. 19. P. 34-41.
4. Kanda F.A., Faxon R.C., Keller D.V. // Phys. and Chem. of Liquids 1968. V. 1.
P. 61-73.
5. Feistma P.D., Hallers JJ., Werff F.V., Van der Lugt W. // Physica. 1975. V. 79 B.
P. 35-52.
H.P. Бочвар
U-НЪ. ЛИТИЙ—НИОБИЙ
На рис. 110 приведена диаграмма состояния Li—Nb при давлении
0,1 МПа согласно работе [1]. Диаграмма состояния Li—Nb характери-
характеризуется несмешиваемостью Li и Nb в жидком и твердом состояниях.
О наличии несмешиваемости сообщается также в работах [2, 3], в
которых приводятся расчетные данные. При значительном давлении,
позволяющем сохранять фазы в конденсированном состоянии, вид
диаграммы будет несколько иным: выше и ниже температуры 2469 °С
вместо газа появляется вторая жидкость [ 1 ].
U-Nb
227
N8, % (по массе)
foc 0 30 50 SO TO 80 90 95
4500
4000
3S00
3000
2S00
2000
1500
1342°
WOO
500
180.8°
Газ
/
fii)
/
Li
Рис. 110. Li-Nb
Ж+(НВ)
Газ* Ж
13+(NS
1. 1
)
wo
1 1 ¦
¦•——¦
4744'
2469°
(MB)—*
0 20 30 40 SO 60 70 80 30 100
N8,% (am | HB
Растворимость Nb в жидком Li изучалась в работе [4], расплав li
в тигле из Nb выдерживался в течение 100 ч при температуре
1000 "С в атмосфере Аг и затем быстро охлаждался. В этом случае
растворимость Nb в 1л составила <7,5х10~5 % (ат.) [<10~4 % (по
массе) ]. Несколько меньшие значения растворимости Nb в жидком
Li сообщаются в справочнике [Ш] и приведены ниже:
Температура, °С
Растворимость Nb,
Растворимость Nb,
7
/о
%
(ат.)
(по массе)
502
2,2x1О
<Зх10-3
737
6x1О
8x1 (Г3
1000
6,7x10-
9x10~2
Литература
1. Smith J.F., Lee KJ. // BuII.AIIoy Phase Diagrams. 1988. V. 9. N 4. P. 474-478.
2. Savictski E.M., Efimov Yu.V. // RIanseeber. Pulvermet. 1969. N 17. S. 103-109.
3. De Boer F.R., Boom R., Miedema AR. /7 Physica. 1980. V. 101 B. P. 294-315.
4. Niessen A.K., de Boer F.R., Boom R. el al. /7 Calphad. 1983. V. 7. P. 51—70.
5. Бычков Ю.Ф., Розанов А.Н., Яковлев В.Б. // Атомная энергия. 1953. Т.7. № 4.
С. 531-536.
Н.Р. Боявар
228
Li-Nd, U-Ni
Li-Nd. ЛИТИЙ-НЕОДИМ
Диаграмма состояния La—Nd не построена. По данным прогноза
с помощью ЭВМ в системе li—Nd можно ожидать существования
следующих соединений: Li,Nd, IiNd,, Ii,Nd (фаза Лавеса), LiNd, и
LiNd [1].
Литература
1 Савицкий Е.М., Грибуля В.Б. Прогнозирование неорганических соединений с
помощью ЭВМ. М.: Наука, 1977. 194 с.
i. ЛИТИЙ—НИКЕЛЬ
Б.П. Полякова
Диаграмма состояния Li—Ni (рис. Ill) является диаграммой
монотектического типа без промежуточных фаз [Ml]. Температура
монотектической реакции выше 1200 °С. Растворимость Ni в жидком
Li, согласно справочнику [Ш], приведена ниже:
Температура, °С 827 600 540
Растворимость Ni, % (ат.) 0,192 0,0078 0,0071
Растворимость Ni, % (по массе) 1,63 0,066 0,060
1155°
0 20 40 SO 60
tfC
/600
1100
1200
WOO
800
600
WO
200
ЩВ°
0
I 1 T
Ф
с
w
1
Ni,%(no массе)
90 90
1
Ж]1
ж,+жг
1200°
***
ч
wo
\
i
\
1
i
i
I
i
1
1
1
1
—\
i
10
20 30
10 50 60
Ni,%(am)
10 80 90 100
Рис. HI. Li-Ni
Li~Ni, 1Л-О, U-P, Li-РЬ 229
В работе [ 1 ] приведены расчетные данные по растворимости Ni в
жидком 1л.
Литература
1. Кузин А.Н., Люблинский И.Е., Бескоровайный Н.М. // Расчеты и эксперимен-
экспериментальные методы построения диаграмм состояния: Сб. статей. М.: Наука, 1985.
С. 113-118.
HP. Бочвар
Li-O. ЛИТИЙ—КИСЛОРОД
Исследования взаимодействия 1л с кислородом достаточно полно
обобщены в справочниках [Э, Ш]. 1л образует с кислородом три
соединения: Li2O, li2O2 и 1лО2. Относительно последнего соединения
1лО2 выражается сомнение, является ли оно стабильным, так как его
можно получить лишь в строго контролируемых условиях [Э]. Ii2O
имеет температуру плавления более 1700 °С и температуру диссоциа-
диссоциации 1200 "С при давлении 0,079 МПа. Ii2O2 диссоциирует при темпе-
температуре 440 °С в токе Аг [Ш].
Li2O имеет ГЦК кристаллическую структуру типа CaF2 (символ
Пирсона cFl2, пр.гр. Fmbrn), наиболее точное значение параметра
решетки а = 0,46114 нм при температуре 25 °С [Ш]. В отношении
кристаллической решетки 1л2О2 имеются разногласия. Для него
указываются следующие типы решеток: тетрагональная с 8 формуль-
формульными единицами в элементарной ячейке, а = 0,549 нм, с = 0,776 нм
[Э], гексагональная с параметрами решетки а = 0,6305 нм, с =
= 0,7710 нм [Ш] или гексагональная с параметрами решетки а =
- 0,3142 нм, с - 0,7650 нм [Ш].
Л.Л. Рохлин
Li-P. ЛИТИЙ-ФОСФОР
Диаграмма состояния Li—Р не построена. Li образует с Р два
соединения: LiP и Li3P [Э]. Соединение 1л3Р имеет гексагональную
структуру с параметрами решетки а = 0,4273 нм, с = 0,7594 нм [Э].
Л.л. Рохлин
Li-Pb. ЛИТИЙ-СВИНЕЦ
Представленная на рис. 112 диаграмма состояния Li—Pb приведена
по данным справочника [X], в котором обобщены результаты работ,
выполненных с использованием термического анализа и измерения
удельного электросопротивления. Система характеризуется наличием
пяти соединений: Li4Pb, Ii10Pb3, U3Pb, Ii5Pb2 и LiPb, из которых
230
U-Pb
+0 60 80 90 92
t С
800
780,6°
/
I
\-17Г°
f
t
/
-65O°L
— (Li)
I
И!
'26°
7T\«
1
¦I
jl
!
ii
Pb, % (iro пассе)
9* 96 98 99
•
1
к
,6*2°
К
1
1
1
1
1
1
—г
1
«о
Ж
23S°
2t
9°
too
^-7
(Pb) —J
327,SO2°
JO
SO 6O
Pb,°Mam.)
70
SO
9O
too
P6
О ТО 2
Li
Рис. 112 Li-Pb
Ii10Pb3 и IiPb образуются конгруэнтно при температурах 726 и
482 "С соответственно. Соединение IiPb претерпевает полиморфное
превращение в интервале температур 186—214 "С. Предполагается,
что соединения Li10Pb3 и LiPb имеют заметные области гомогенности.
Соединения Li4Pb, Li3Pb и Li5Pb2 образуются по перитектическим
реакциям при температурах -650, 658, 642 °С и не имеют областей
гомогенности. Указывается также, что соединению Li10Pb3 может
соответствовать формула Li7Pb2 [X]. В работе [1] высказано предпо-
предположение о существовании в системе еще одной промежуточной фазы
между Li4Pb и Li7Pb2. Рентгеноструктурным анализом в работах
[2—4] были подтверждены составы соединений Li7Pb2, Li3Pb и IiPb.
Соединениям Li4Pb и Li5Pb2 были приписаны формулы Ы22РЬ5 и
Li8Pb3 [2—5]. В системе наблюдаются три эвтектических взаимодей-
взаимодействия при температурах 177, 464 и 235 °С.
Растворимость Li в (РЬ) при различных температурах приведена
ниже:
Температура, "С. 235 212
Растворимость Li [6]:
% (ат.) 3,2 2,0
% (по массе) 0,11 0,07
200
170
120
1,0
0,03
20
U-Pb, Li-Pd
231
Растворимость Li [7]:
% (ат.) 3,0
% (по массе) 0,09
- 2,1 1,8
- 0,07 0,06
1,2 0,35
0,04 0,01
Сведения о кристаллической структуре соединений системы Ii—Pb
приведены в табл. 105.
Таблица 105. Кристаллическая структура соединений системы Li—Pb
Соедине-
Соединение
Li22Pb5
Li7Pb2
Li3Pb
Li8Pb3
LiPb (ВТ)
LiPb (HT)"
Прото-
Прототип
Li22Pb5
Li7Pb2
Li8Pb3
CsCl
—
Символ
Пирсона,
пр.гр.
CF432,
F23
hPi,
РЬъ1ттс
i
Fmim
mC22,
C/2m
cP2,
Pmlm
—,
R3m
'Ромбоэдрическая сингонж
Параметры решетки, нм
a
2,008
0,4751
0,6687
0,824
0,3563
0,3542
b
—
0,4757
—
—
с
—
0,8589
—
1,103
—
—
i.
Примечание
[4]
[2,4]
[2,4]
P - 104,5°
[4,5]
При температуре 220 °C
[3, 4]
P = 89,5°, при темпера-
температуре 20 °C
Литература
1. Veleckis E. // J. Less-Common Met. 1980. V. 73. N 1. P. 49-60.
2. Zalkin A., Ramsey WJ. // J. Phys. Chem. 1956. V. 60. N 2. P. 234—236.
3. Zalkin A., Ramsey WJ. // J. Phys. Chem. 1957. V. 61. N 10. P. 1413-1416.
4. Zalkin A., Ramsey WJ. // J. Phys. Chem. 1958. V. 62. N 6. P. 689-693.
5. Zalkin A., Ramsey WJ., Templeton D.H. // J. Phys. Chem. 1956. V. 60. N 9.
P. 1275-1277.
6. Grube G., Kleiber H. // Z. Eleclrochemie. 1934. Bd. 40. S. 111-112.
7. Погодин С.А., Шпичинецкий Е.С. // Изв. сектора физико-химического
анализа. 1947. № 15. С. 88—95.
Л.Л. Рохлин
Li-Pd. ЛИТИЙ-ЛАЛЛАДИЙ
Диаграмма состояния Li—Pd (рис. 113) построена на основании
данных дифференциального термического, микро- и рентгенострук-
турного анализов, измерения магнитных свойств [1]. В системе
232
Li-Pd
Pd,%(no пассе)
30 95
Рис.
0
и
113
10
Li—Pd
20
30
40
50 SO
Pd.%(am)
10
SO
SO
100
Pt
подтверждено существование восьми соединений: Ii5Pd, I^is^^a*
Li3Pd, Li2Pd, Li3Pd2, LiPd, IiPd2, IiPdr Однако существование
соединений Li5Pd и Li3Pd не было подтверждено рентгенографически.
Предполагается, что фазы IiPd7 и IiPd2 образуются конгруэнтно
непосредственно из расплава при температурах -1500 и -950 °С
соответственно и имеют значительные области гомогенности. Соеди-
Соединение Ii3Pd2 образуется по перитектоидной реакции при температуре
552 "С, существует в интервале температур и при 150 °С претерпева-
претерпевает распад на Ii2Pd и LiPd. Соединения IiPd, Ii2Pd, Ii3Pd, Li15Pd4 и
Li5Pd образуются по перитектическим реакциям при температурах
-650, 565, 404, 260 и 182 °С соответственно.
В системе предполагается существование трех эвтектик: (Pd) +
+ LiPd7 при температуре 1425 °С, IiPd7 + IiPd2 при 930 °С и (U) +
+ Li5Pd при 145 °С.
Отмечается, что растворимость U в (Pd) превышает 5 % (ат.)
[-1 % (по массе)]. Параметр решетки (Pd) меняется от а =
= 0,38905 нм при 100 % (ат.) Pd до а = 0,3878 нм при 94 %
(ат.) Pd [1].
Сведения о кристаллической структуре соединений приведены в
табл. 106.
Li-Pd
233
Таблица 106. Кристаллическая структура соединений системы Li—Pd
Соедине-
Соединение
ЦРеГ
Lil5Pd4 .
Li3Pd
Li2Pd
Li3Pd2
LiPd
LiPd2
LiPd7
*9>x
"Для
'"Для
Прото-
Прототип
Cu]5Si4
BiF3
A1B2
CsCI
LiRh
-
LiPt7
Символ
Пирсона,
пр.гр.
с/76,
/43d
сП6,
Fnibm
Р(\ 1 уп уп (•
m\j/ iiLiiLl*
сР2,
РтЪт
hP2,
Р6
hP,
cF32,
Fnibm
г 5, на рисунке это
Параметры
нм
а
1,9009
1,9347
1,0697
1,0676
0,6187
0,4241
0,4222
0,42267
0,4230
0,2972
0,2986
0,2971
0,2767"
0,2777"
0,27406"
0,2747
0,2749"*
0,27673
0,2751
0,3836
0,7713—
-0,7730
0,7741
0,7660
решетки,
с
—
-
-
—
0,2740
0,2724
0,27319
0,2738
—
-
—
0,4149
0,4132
0,4280
0,4130
0,4259
0,41306
0,4227
0,4336
-
—
соединение обозначено
состава LiPd с избытком Li.
состава LiPd с избытком Pd.
Примечание
Для состава LixPd1+ [2]
Для состава LixPd,_ [2]
[1]
Отжиг при 600 "С [2]
Отжиг при 600 "С [2]
Отжиг при ПО 'С [1]
Отжиг при 320-430 °С [1]
Отжиг при 600 °С [2]
[3]
Отжиг при 320 °С [1]
[3]
[4]
Отжиг при 320 °С [1]
Отжиг при ПО *С [1]
[2]
Отжиг при 600 °С [4]
Отжиг при 480 'С [1]
Закалка от температуры
800 °С 12]
[4]
Отжиг при 600 'С [1]
Отжиг при 600 °С [1]
[1]
[2]
как Li5Pd.
234 Li~Pd, U-Pr, Li-Pt
В работе [2] указывается на возможность перехода структуры
типа LiRh в структуру типа CsCl. После закалки от температуры
800 °С параметр решетки а соединения LiPd со структурой типа CsCl
равен 0,2977 нм.
Литература
1. Loebich О., Raub Ch. // J. Less-Common Met. 1977. V. 55. N 1. P. 67-76.
2. Van Vucht J.H.N., Buschow K.H.J. Hi. Less-Common Met. 1976. V. 48. N 2.
P. 345-347.
3. Ferro R., Capelli R., Delfino S., Centino G. // Atti Acad. Nas. Line. Rend. С Sci.
Fiz. Mat. Nat. 1968. V. 45. N 6. P. 564-566.
4. Nacken В., Bronger W. // J. Less-Common Met. 1977. V 52. N 2. P. 323.
В.П. Полякова
Li-Pr. ЛИТИЙМ1РАЗЕОДИМ
Диаграмма состояния li—Pr не построена. По данным работы [1]
в системе li—Pr можно ожидать образования следующих соединений:
lijPr, LiPr3, Li2Pr (фаза Лавеса), LiPr2, IiPr.
Литература
1. Савицкий Е.М., Грибуля В.Б. Прогнозирование неорганических соединений с
помощью ЭВМ. М.: Наука, 1977. 194 с.
В.П. Полякова
Li-Pt. ЛИТИЙ-ПЛАТИНА
Диаграмма состояния li—Pt (рис. 114) в интервале концентраций
0—40 % (ат). Pt построена в работе [1] на основании результатов
дифференциального термического и рентгеновского анализов. Кроме
того, в данной работе изучены литые сплавы, содержащие 65—100 %
(ат.) Pt. По данным работ [1—4] в системе может существовать семь
соединений. Кроме трех богатых li соединений Ii9Pt, Li5Pt и Li15Pt4,
характер образования которых остается невыясненным [1], в системе
по перитектической реакции при температуре 955 °С образуется
соединение Li2Pt [ 1, 3]. В платиновой части системы образуются
соединения LiPt [5], IiPt2 [I, 2], LiPt7 [1, 4, 6]. Соединение LiPt,
возможно, образуется по перитектической реакции при температуре
1032 °С [1]. По данным работы [1] область гомогенности соединения
LiPt2 находится в пределах 66—73 % (ат.) Pt, LiPt7 — в пределах
57,5—88 % (ат.) Pt, твердого раствора (Pt) в пределах -98—100 %
(ат.) Pt при температуре 600 "С. Растворимость Li в (Pt) при темпе-
температурах 1600 и 600 °С составляет 6 % (ат.) и 1,8 % (ат.) соответ-
соответственно [11.
Кристаллическая структура промежуточных фаз приведена в
табл. 107.
Структура соединений Li9Pt, Li5Pt, Li]5Pt4 неизвестна.
Li~Pt
235
t,°C
1000
Pt,%(/mnaccel
0 SO 10 80 90
SO
Li
Рис. 114. Li—Pt
T а б л и ц а 107. Кристаллическая структура соединений системы Li—Pt
Соедине-
Соединение
Li2Pt
LiPt
LiPt2
LiPt7
Прототип
A1B2
LiRh
Cu2Mg
MgPt7
Символ
Пирсона,
пр.гр.
hP3,
РЫттт
hP2,
рЪ
cFIA,
Fd3m
сП2,
Fmim
Параметры решетки, нм
а
0,4200
0,4180
0,2728
0,76781-0,76932
0,760
0,77577-0,77632
0,7725
0,7758
с
0,2655
0,2661
0,4226
Источник
[3]
[5]
[5]
[1]
[2]
[1,7]
[4]
[6]
Литература
1. Loebich О., Raub Ch.J. // J. Less-Common Met. 1980. V. 70 N 1. P. 47—55.
2. Nash СР., Bovdeu F.M., Whittig L.D. // J. Am. Chem. Soc. 1960. V. 82. N 23.
P 6203-6204.
236
Li-Pt, U-Pu, Li-Rb
3. Ferro R., Capelli R., Delfino S., Centino G. // Atti Accad. Naz. Line. Rend. Sci.
Fiz. Mat. Nat. 1968-1969. V 45. N 6. P. 564-566.
4. Bronger W., Kleissen G., Miiller P. // J. Less-Common Met. 1985. V. 109. N 1.
P. L1-L2.
5. Bronger W., Nacken В., Ploog K. // J. Less-Common Met. 1975. V. 43. N 1.
P. 143-145.
6. Bronger W., Klemm W. // Z. Anorg. All. Chem. 1962. Bd. 319. N 1. S. 58-64.
7. Sangster J., Pelton A.D. // J. Phase Equilibria 1991. V. 12. N 6. P. 678-681.
В.П. Полякова
Li—Pu. ЛИТИЙ—ПЛУТОНИЙ
Попытки получить сплавы li с Pu показали, что Li и Pu не сме-
смешиваются в жидком и твердом состояниях [Э].
По данным прогноза неорганических соединений с помощью ЭВМ,
в системе возможно образование соединений: Li3Pu, LiPu3, Li2Pu
(фаза Лавеса) и LiPu [1].
Литература
1. Савицкий Е.М., Грибуля В.Б. Прогнозирование неорганических соединений с
помощью ЭВМ. М.: Наука, 1977. 194 с.
Л.Л. Рохлин, В.П. Полякова
Li-Rb. ЛИТИЙ-Ч>УБИДИЙ
Согласно экспериментальным данным работы [1] и теоретичес-
теоретическому расчету, проведенному в работе [2], Li и Rb не смешиваются
О 3050 60 70 80
, "/. (по массе)
90 95
too
t.CWA I I II I I—I 1 П 1
1200
10OO
8OO
600
ЬОО
2V0
и i 1 И
1
1
j
1
/
|
180.6
(Li
"о
о
"¦¦¦»—
i
ж
ж,
(Li)
г-газ
1 Жг
<-ж
газ
—¦-,
***"''¦¦"¦
*\
\
39Л81
688
О
Li
Рис. 115.
Ю
Li-Rb
20
SO
40
ffb.
SO 60
"/о fam.)
7O
80
9O
100
Kb
Li—Rb, Li—Re, Li—Rh 237
друг с другом в жидком и твердом состояниях. Диаграмма состояния
li—¦Rb (рис. 115) рассчитана при давлении 0,1 МПа, с учетом незна-
незначительной взаимной растворимости компонентов в жидкой фазе, и
аналогично с системой Li—Cs [3]. Однако по прогнозу, проведенному
с помощью ЭВМ, в системе Li—Rb можно ожидать образования соеди-
соединений LiRb3, Li2Rb и LiRb [4].
Литература
1. B6hm В., Klemm W. // Z. Anorg. All. Chem. 1939. Bd. 243. S. 69-85.
2 Tanigawa S., Doyama M. // Phys. Status Solidi (b). 1973. V. 60. N 1.
P K35-K36
3. Bale C.W. // Bull. Alloy Phase Diagrams. 1989. V. 10. N 3. P. 268-269.
4. Савицкий Е.М., Грибуля В.Б. Прогнозирование неорганических соединений с
помощью ЭВМ. М . Наука, 1977. 194 с.
Л. Л. Зусман
U—Re. ЛИТИЙ—РЕНИЙ
Диаграмма состояния Li—Re не построена. Из водного раствора
получено соединение, являющееся, по-видимому, гидратом соедине-
соединения LiRe [X]. На основании прогноза с помощью ЭВМ в системе
Li—Re следует ожидать образования следующих соединений: Ii3Re,
li2Re, LiRe2 и LiRe [1]. Растворимость Re в жидком Li увеличивает-
увеличивается от 0,6- 10" до 1,7- 10" % (по массе) при повышении темпера-
температуры от 1202 до 1602 "С [2].
Литература
1. Савицкий Е.М., Грибуля В.Б. Прогнозирование неорганических соединений с
помощью ЭВМ. М.. Наука, 1977- 194 с.
2. Sangster J., Pelton A.D. // J. Phase Equilibria. 1991. V. 12. N. 6. P. 681.
В.П. Полякова
Li—Rh. ЛИТИЙ—РОДИЙ
На рис. 116 приведена предполагаемая диаграмма состояния
Li—Rh, построенная в работе [1] по данным [2—5].
В системе образуются соединения IiRh и LjRh3, которые плавятся
конгруэнтно. Температуры плавления соединений точно не уста-
установлены; для соединения IiRh температура плавления предполагает-
предполагается равной 1890 °С или выше [2]. Указанные соединения участвуют
в трех эвтектических превращениях. Эвтектика (Li) + IiRh кристал-
кристаллизуется при температуре 180,1 °С и содержании Rh, равном 0,1 %
(ат.). Температуры плавления и состав двух других эвтектик не
установлены. Растворимость Li в (Rh) и Rh в (Ii) очень мала.
Сведения о кристаллической структуре соединений приведены в
табл. 108.
238
U-Rh
ffh.V»(no массе)
030506070 80 90 100
t;c
2000
woo
1600
№00
1200
1000
800
too
400
200
I
Рис. 116. Li-Rh
1 T 1
4
1
\H
1
Ж
/
/
1
1B0.S'
¦Ш)
/
100,1
i
<
, ^
T
1 10 20 JO 40 SO SO 70
Li Kh.V.fam.)
г
_
196.
*
——
80 90 100
Hh
Таблица 108. Кристаллическая структура соединений системы Li—Rh
Соедине-
Соединение
liRh
LiRhj
Прототип
LiRh
Ltfr3
Символ
Пирсона,
пр.гр.
hP2,
Р6
о/8,
ImmZ
Параметры решетки, нм
а
0,26520
0,2649
0,266
0,26586
Ь
0,86023
с
0,43594
0,4357
0,435
0,46570
Источник
Ш
[4]
[5]
[3]
Литература
1. Sangster J., Pelton A.D. // J. Phase Equilibria. 1991. V. 12. N. 6. P. 682-684.
2. Wheat H.G., Cheng C.-Y., Bayuzick R.J. et al. // J Less-Common Mel. 1978.
V. 58 N. 1. P P13-P19.
3 Donkersloot H.C., van Vucht J.H.N. // J Less-Common Met. 1976. V. 50. N 2
P 279-282.
4 Sidnu S.S., Anderson K.D., Zauberis D.D. // Acta Crystallogr 1965. V. 18.
P. 906-907.
5. Farr J.D. // J Inorg. Nuclear Chem. 1960. V. 14. N 3—4. P. 202-207.
T.B. Добаткина
Li—Ru, U—S, Li—Sb, Li—Se 239
Li—Ru. ЛИТИЙ—РУТЕНИЙ
Диаграмма состояния Li—Ru не построена. Авторы работы [1],
принимая во внимание результаты исследований [2] и данные по
двойным системам 11—Rh, Li—Ir, li—Os, делают вывод о существова-
существовании по крайней мере одного соединения в системе li—Ru и очень
маленькой растворимости li в (Ru).
Литература
1. Sangster J., Pelton A.D. // J. Phase Equilibria. 1991. V. 12. N 6. P. 685.
2. Loebich O., Raub C.J. // Platinum Metals Review. 1981. V. 25. N 3 P. 113-120.
T.B. Добаткина
US. ЛИТИЙ-СЕРА
Диаграмма состояния Li—S не построена. li образует с S сульфид
Li2S, температура плавления которого 975 °С [Э]. Соединение Li2S
имеет кристаллическую структуру типа CaF2 (символ Пирсона cF\2,
пр.гр. Fm3m) с параметрами решетки а = 0,5720 нм [П].
Л.Л. Рохлин
Li-Sb. ЛИТИЙ-СУРЬМА
Диаграмма состояния Li—Sb не построена. В системе образуется
соединение Ii3Sb. Соединение Ii3Sb имеет две модификации. Низко-
Низкотемпературная модификация Li3Sb устойчива до температуры не
ниже 650 °С и имеет кубическую структуру типа BiF3 (символ
Пирсона C.F16, пр.гр. РтЗт) с параметром решетки а = 0,6572 нм.
Высокотемпературная модификация, устойчивая при более высоких
температурах, имеет гексагональную структуру типа Na3As (символ
Пирсона /lP8, пр.гр. Pf>3/mmc) с параметрами решетки а = 0,4710 нм,
с = 0,8326 нм [X]. Указывается, что температура плавления li3Sb
находится между 1150 и 1300 "С или несколько выше 950 °С (по
данным двух разных работ) [X].
Л.Л. Рохлин
Li-Se. ЛИТИЙ-СЕЛЕН
Диаграмма состояния li—Se не построена. В системе образуется
соединение Li2Se. Соединение Ii2Se [85,05 % (по массе) Se] имеет
кубическую структуру типа флюорита CaF2 (символ Пирсона сР12,
пр.гр. Ftnbm) с параметром решетки а = 0,6017 нм [X].
Л. Л. Рохлин
240
Li-Si
Li-Si. ЛИТИЙ—КРЕМНИЙ
В основу построения обобщенной авторами работы {1] диаграммы
состояния Ы—Si (рис. 117) положены, главным образом, проведенные
ими термодинамические расчеты и близко совпадающие с ними
экспериментальные данные, полученные в работе [2].
Система характеризуется наличием четырех соединений Li22Sil5
[18,5 % (ат.) Si], Li13Si4 [23,5 % (ат.) Si], Ii7Si3[10,0 % (ат.) Si] и
Li,2Si7[36,8 % (ат.) Si] [1—3]. Из них соединение Li13Si4 и Ii7Si3
плавится конгруэнтно при температурах 722 и 752 °С. Два других
соединения образуются по перитектическим реакциям Ж + Iij.3SL, *
* Li22Si15 и Ж + Li7Si3 * Li12Si7 при температурах 628 ±3 и 648 "С и
содержании в жидкой фазе 15,2 и 39,2 % (ат.) Si соответственно
[1,21.
Соединение Li22Si,5, как наиболее богатое Li, было впервые
установлено авторами работы [4] и его состав был подтвержден в
ряде исследований, указанных в работе [1]. Однако авторы работ
[5—7] для наиболее богатого Li и инконгруэнтно плавящегося при
температуре 633+5 [5], 635 [6] и 640 °С [7] соединения приняли
формулу Li4Si или Li15Si4. В работе [6] было также установлено, что
соединение Li4Si имеет две модификации р и (У и существует в
узком интервале гомогенности 19,2—20,1 % (ат.) Si с температурами
аллотропического превращения 517 и 540 °С, соответствующих
оя/гозо «о so
t, с
1*00
7ZOO
1ООО
800
BOO
zoo
ieo,e°
1 1 1
/
f
¦ 1
а
^3
0,00*
во
1
/Ж
г
ад
71
Si,'/, (по массе,
> во
1
$2°
¦•з
в*
1
ж
-/
tJ,0
96
***
592°
1ОО
Рис.
О
и
117.
ТО
Li-Si
го
JO
ЧО 50 60
Si,y.(am.)
70
80
SO
100
SI
Li-Si
241
границам, богатым Li и Si. Полиморфизм этого соединения в даль-
дальнейшем не подтвердился [1]. Авторами работы [1] отмечается, что
соединение, имеющее формулу li4Si или Ii15Si4, может существовать
в ограниченном температурном интервале или может быть стабили-
стабилизировано примесями.
Соединение Li7Si3, которое было установлено в работах [3, 8],
ранее рассматривалось авторами работ [5, 6, 9] как Li2Si с темпера-
температурами плавления 750±10 [9], 752±5 [5] и 760 "С [6]. Эти темпера-
температуры близки к температурам 754±3 и 752 °С, указанным в работах
[2, 1] соответственно для соединения Li7Si3. Соединение Li12Si7
впервые было идентифицировано авторами работы [10] и подтвер-
подтверждено в работах [2, 3], хотя ранее о нем сообщалось, как о соедине-
соединении Li13Si7 [11]. Существование соединения Ii3Si, о котором сообща-
сообщалось в справочнике [X], не подтвердилось в работе [7]. В системе
имеют место три эвтектических равновесия Ж >* (pii) + U22Si\5 ПРИ
температуре, близкой к температуре плавления (Li), и содержит
0,004 % (ат.) Si; Ж * Li^Si.* Li7Si3 при 709 °С и 25,1 % (ат.) Si и
Ж - Li12Si7 + (Si) при 592 °С и 43,0 % (ат.) Si [1,2].
Растворимость Li в (Si), по данным работы [7], при температуре
650 "С составляет 1,2 % (ат.) Li, а поданным работы [9] приведена
ниже:
Температура, X 1382 1333 1283 1185 987 790 592
Растворимость Li, % (ат) 0,056 0,086 0,105 0,13 0,10 0,045 0,009
По расчетным данным работы [1], растворимость Li в Si достигает
максимального значения 0,13 % (ат.) при температуре около
1200 "С, а при температуре эвтектики 592 °С она равна 0,013 %
(ат.).
Сведения о кристаллической структуре соединений представлены
в табл. 109.
Таблица 109. Кристаллическая структура соединений системы Li—Si
Соедине-
Соединение
Li22Si15
Li13Si4
Li7Si3
Li|2Si7
Прототип
Li22pb,5
Символ
Пирсона,
пр.гр.
сР432,
/•23
оР34,
РЬат
hPl,
КЗ/и
оР152,
Рпта
Параметры решетки, нм
а
0,799
0,4435
0,8610
b
1,521
1,9738
с
0,499
1,8134
1,4341
Источник
[4]
[12]
[81
[10]
242 Li-Sn
Литература
1. Okamoto H. // Bull. Alloy Phase Diagrams. 1990. V. 11. N 3. P. 306-312.
2. Van der Marel C, Vinke G.J.B., Van der Lugt W. // Silid State Commun. 1985.
V. 54. N 11. P. 917-919.
3. Wemn C.J., Huggins R.A. // J. Solid State Chem. 1981. V. 37. N 3. P. 271-278.
4. Гладышевский Е.И., Олексив Г.И., Крипякевич П.И. // Кристаллография.
1964. Т.9. № 3. С. 338-341.
5 Bohm Н. // Z. Metallkunde. 1959. Bd. 50. N 1. S. 44-46.
6. Федоров П.И., Иоффе А.А. // Изв. вузов. Цветная металлургия. 1962. № 1.
С. 127-131.
7. Obinata I., Takeuchi Y., Kurihara К., Watanabe M. // J. Japan. Inst. Metals. 1964.
V. 28. N 9. P. 568-576.
8. Von Schnering H.G., Nesper R., Tebbe K.F., Curda J. // Z. Metallkunde. 1980.
Bd. 71. N6. S. 357-367.
9. Pell E.M. // J. Phys. Chem. Solids. 1957. V. 3. N 1/2. P. 77-81.
10. Von Schnering H.G., Nesper R., Curda J., Tebbe K.F. // Angew. Chem. Int.
Edition. 1980. Bd. 19. N 12. S. 1033-1034.
11. Schafer H., Axel H., Weiss A. // Z. Naturforsch. B. 1965. Bd. 20. N 12. S. 1302.
12 Frank V., Muller W., Scchafer H. // Z. Naturforsch B. 1975. Bd. 30. N 1.
S. 10-13.
E.B. Лысова
Li-Sn. ЛИТИЙ-ОЛОВО
В справочнике [X] представлена диаграмма состояния Li—Sn,
которая в основном базируется на данных работы [1]. В этой работе
путем тщательного термического анализа и измерения удельного
электросопротивления установлено шесть соединений Li4Sn, Ii7Sn2,
Li5Sn2, Li2Sn, liSn и IiSn2. Для фаз Li7Sn2 и IiSn были установлены
небольшие области гомогенности. В дальнейшем формулы соединений
Li4Sn, LiSn2 и Li2Sn были уточнены и записаны как Li22Sn5 [2],
Li2Sn5 [3] и Li7Sn3 [4] соответственно. В работе [5] при изучении
диаграммы в области концентраций между Li7Sn2 и LirSn2 было
установлено существование соединения Li13Sn5, а также были уточ-
уточнены температуры имеющихся в этой области концентраций нонва-
риантных превращений. Приведенная на рис. 118 диаграмма состоя-
состояния Li—Sn построена по данным справочника [X] с корректировкой
ее в соответствии с результатами работ [1—5].
Растворимость Li в (Sn) при температуре 200 °С меньше 0,1 %
(ат.) [X].
Соединение Ii22Sn5 имеет кубическую структуру (символ Пирсона
cF32, пр.гр. /23) с параметром решетки а= 1,978 нм [Ш, 2]. Крис-
Кристаллическая структура соединений U2Sn4 тетрагональная, изомор-
изоморфная Mn2Hg5 (символ Пирсона tPlA, пр.гр. PA/mbm) с параметрами
решетки а = 1,0274 нм, с = 0,3125 нм [3].
Li~Sn, Li-Sr
243
omosow
Sn, "/. (no массе)
80 SO 9Z Sb 96 98
too
900
700
500
300
180,6
100
231,9681'
Рис.
0
Li
118.
10
USn
20
30
4-0
Sn,
SO
"/.
60
(am.)
70
80
90
100
Sn
Литература
1. Grube G., Meyer E. // J. Electrochemie. 1934. Bd 40. S. 771-777.
2. Гладышевский Е.И., Олексив Г.И., Крипякевич П.И. // Кристаллография.
1964. Т.9. № 3. С. 338-341.
3. HansenD.A., Chang ZJ. // Acta Crystallogr. В. 1969. V. 25. N 11. P. 2392-2395.
4. Mailer W. // Z. Naterforsch. B. 1974. Bd. 29. S. 304-306.
5. Bacley D.M., Skelton W.H., Smith J.F. // J. Less-Common Met. 1979. V. 64. N 2.
P. 233-239.
Л.Л. Рохлин
USt. ЛИТИЙ-СТРОНЦИЙ
Диаграмма состояния Li—Sr, представленная на рис. 119, приведе-
приведена по данным работы [1], в которой она изучена с помощью диффе-
дифференциального термического и рентгеноструктурного анализов. В связи
с тем, что Sr имеет две (Р * а), а не три E <« у " Р) полиморфные
модификации как указано в [1], область, богатая Sr, на рис. 675
несколько изменена. Однако характер фазовых превращений в этой
области требует уточнения. В системе установлено образование
244
Li-Sr
02050 70 80
Sr, "/» (no массе)
90 9Z 9Ь 96 98
100
769'
547'
600
20O
I8o,6"
0 tO 20 JO 4O 50 60 70 80 9O 100
Li Sr, °/o (am ) Sr
Рис. 119. Li-Sr
соединений Li23Sr6, Li2Sr3, LiSr7 и liSr8. Соединение LiSr8 претерпе-
претерпевает полиморфное превращение aliSr8 «* piiSr8, температура которо-
которого не установлена, но близка к температуре 198 °С. Соединение LiSr7
плавится конгруэнтно при температуре 584 °С. Соединения Li23Sr6,
Ii2Sr3 и piiSr8 образуются по перитектическим реакциям при темпе-
температурах 152, 198 и 496 °С соответственно. При температурах 530 и
515 °С в системе имеют место нонвариантные кататектические
превращения, в результате которых соединения liSr7 и (pSr) соответ-
соответственно распадаются с образованием жидкой фазы. В работе [2]
построена обобщенная диаграмма состояния Ii—Sr, на которой отсут-
отсутствуют превращения, связанные с образованием соединений IiSr7 и
LiSr8 (линия ликвидуса плавно поднимается от температуры 198 °С
до температуры плавления Sr, равной 769 °С).
Растворимость Sr в (Li) при эвтектической температуре 134 °С
определена равной 2 % (ат.).
Сведения о кристаллической структуре соединений приведены в
табл. 110.
Li—Sr, Li—Та
245
T а б лица НО. Кристаллическая структура соединений системы Li—Sr
Соединение
Li23Sr6
Li2Sr3
LiSr7*
pLiSrg* *
aLiSrg*
Прототип
Mn23Th6
Al2Zr3
-
—
-
Символ
Пирсона,
пр.гр.
сЛ16,
Fm3m
tP2O,
РАг1тпт
и
—
—
'Тетрагональная сингония.
"Гексагональная сингония.
Параметры
а
1,488
1,505
0,963
0,761
0,431
0,616
решетки, нм
с
—
0,855
0,650
1,385
0,886
Источник
[1, 3]
[4]
[1,2, 3]
[1,2]
[1,2]
[1,2]
Литература
1 Wang F.E., Kanda F.A., King A.J. // J. Phys. Chem. 1962 V. 66. N 11.
P 2138-2142.
2 Bale C.W. // Bull Alloy Phase Diagrams 1989 V. 10. N 3. P. 278-280.
3 Wang RE., KingA.J., Kanda F.A. // J Phey. Chem. 1962. V 66. N 11.
P 2142-2145
4 Крипякевич П.И., Олексив Г.И. // Доклады АН УССР 1963 №11.
С 1489-1491.
Л Л. Рохлин
Li-Ta. ЛИТИЙ-ТАНТАЛ
В работе [1] построена предполагаемая диаграмма состояния
Li—Та на основании имеющихся результатов по другим системам Та
— щелочные металлы. Температуры трех нонвариантных равновесий,
в которых участвуют фазы (Та), (ali), (pii) или (Та), (pli), Ж, или
(Та), Ж, Газ, характер которых не установлен, приняты равными
температурам фазовых превращений чистого Ii.
Определена растворимость Та в жидком Ii, которая составляет
0,000076 % (ат.) [19- КГ4 % (по массе)] при температуре 727 "С
и 0,00705 % (ат.) [0,185 % (по массе)] при 1004 "С. Растворимость
определялась анализом расплавов после выдержки в течение
24-100 ч [Ш].
В работе [2] на основании термодинамических данных теоретичес-
теоретически рассчитана линия ликвидуса в системе Li—Та. В соответствии с
проведенным расчетом растворимость Та в жидком Li оказалась
меньше, чем указано выше: около 10~9 % (ат.) при температуре
700 °С и около 10 % (ат.) при 1000 °С.
246
Li-Ta, Li-Te, Li-Ti
Литература
1. Garg S.P., Venkatraman M., Krishnamurthy N. // Bull. Alloy Phase Diagrams
1990. V. 6. N 1. P. 8-9.
2. Кузин А.Н., Люблинский И.Е., Бескоровайный Н.М. // Расчеты и эксперимен-
экспериментальные методы построения диаграмм состояния. Сб статей. М: Наука, 198S
С 113-118.
Л.Л. Рохлин.
Li—Те. ЛИТИЙ—ТЕЛЛУР
Диаграмма состояния Li—Те не построена. В системе образуется
соединение Li2Te [90,19 % (по массе) Те], которое имеет кубичес-
кубическую структуру типа CaF2 (символ Пирсона cFl2, пр.гр. Fmbm) с
параметром решетки а = 0,6517 нм [X].
Л.Л. Рохлин
Li—Ti. ЛИТИЙ—ТИТАН
Диаграмма состояния Li—Ti (рис. 120) приведена в справочнике
[М]. При температуре -882 °С протекает вырожденная перитекти-
ческая реакция Ж + (ETi) «* (aTi). При температурах выше 1327 "С
наблюдается равновесие газообразного Li с @Ti). Растворимость Li
в жидком Ti не превышает 0,038 % (ат.). Растворимость Ti в жидком
Li чрезвычайно мала и, по данным работы [1], составляет 0,0002 %
?°С°О 30 4050 60
2000
70
Ti ,96 (по массе)
80 85 30
95
100
1800
1600
1*00
1200
1000
800
600
400
ZOO
Г Т
^Ч- ni
IB 0,6'
1 1
1
1
!
Гаэ+fr
i
m)
Ж+(рп)
Ж+fxTl)
(рп
(осП)-^
10
20 SO
1670'
882°
U
Рис. 120. Li-Ti
50 ВО
Tt.1t (am)
70
80
90
100
п
Li-Ti, Li~Tl
247
(ат.) при температуре 925 °С. В работе [2] с использованием модели
субрегулярных растворов рассчитана кривая ликвидуса системы
Li—Ti. Уравнение кривой имеет вид In* = 4,68 —
_ 18,39*1000/7" для («ТО и ltuc - 4,23 - 17,86x1000/7" для (pTi), ще
х — атомная доля, Li, a T — температура, К. Растворимость Li в (Ti)
возрастает от 0,0007 % (ат.) при температуре 300 °С до 0,029 %
(ат.) при 1050 °С [3].
Литература
1 Leavenworth H.W., Crearly R.E. // Acta Metall. 1961. V. 9. N 5. P. 519-521.
2 Кузин А.Н., Люблинский И.Е., Бескоровайный Н.М. // Расчеты и эксперимен-
экспериментальные методы построения диаграмм состояния. Сб. статей. М.- Наука 1985
С 113-118.
3 Пекарев А.И., Савицкий Е.М., Тылкина М.А. // Тр. Ин-та металлургии
им А А Байкова АН СССР. 1963. Т.12 С. 198—201.
Li-Tl. ЛИТИЙ—ТАЛЛИЙ
СП. Алисова
TL,"/o (по массе)
О 50 70 80 90 92 94- 96 98
500
иоо
300
го о
180 6"
100
38.5
(It TI)
\
\
ж
\
ги"
202°
too
ч/
84.8
зои
98
(ДП)
230
•TI)
о ю го so ьо so во 70 so зо юо
Ll Tl,°/ofam) TC
Рис. 121. Li-TI
248
Li-Tl, Li-U, U—V
На рис. 121 представлена диаграмма состояния Li—T1, построенная
в справочнике [X] по данным работы [1], выполненной с помощью
тщательно проведенных термического и терморезистометрического
анализов. В системе образуется пять соединений: Li4Tl, Li3Tl, LJ5TI2,
Ii2Tl, LiTl. Соединение LiTl имеет значительную область гомогеннос-
гомогенности. Соединение LiTl обладает структурой типа CsCl (символ Пирсона
сР2, пр.гр. РтЪт) с параметром решетки а = 0,3431 нм при макси-
максимальном содержании 50,3 % (ат.) Т1 [X].
Литература
1. Grube G., Schaufler G. // Z. Elektrochemie. 1934. Bd. 40. S. 593-600.
Л.Л. Рохлин
Li-U. ЛИТИЙ-УРАН
Диаграмма состояния Li—U не построена. В работе [1] определена
растворимость U в жидком Ii при температурах 700—1000 °С по
данным химического анализа
быстроохлажденных расплавов
после выдержки их при этих
температурах. Результаты ис-
исследования приведены на
рис. 122.
t,°c
1000
0,0005
U,%(am.)
О,ОО1О ЦООТ5
SOO
во О
7ОО
1
1
ж
Литература
1. Бычков Ю.Ф., Розанов А.Н.,
Яковлева В.Б. // Атомная энергия.
1959. Т.7. № 6. С. 531-536.
Л.Л. Рохлин
О
Li
0,0 г
а,
о,о*
(по пассе)
О,ОВ
Рис. 122. Li-U
Li—V. ЛИТИЙ—ВАНАДИЙ
На рис. 123 приведена диаграмма состояния Ii—V, согласно работе
[1]. Диаграмма рассчитана для давления 0,1 МПа. При значительном
давлении, позволяющем сохранять фазы в конденсированном состоя-
состоянии, вид диаграммы будет несколько иной: при температуре 1910 °С
вместо газа появится вторая жидкость.
Li-V, U-W
249
0 20 40 SO 70
V, V* (по массе)
80 9О 95
WO
J000\
zsoo
i
zooo
/500
1342°
1000
soo
>80,S'
0 JO го JO ЬО 50 60 70 80 90 WO
Li V,'/ofam.) V
Рис. 123. Li—V
TTTT
Газ
¦*—AС)
^¦т—
.———
—1—
- '
газ
газ *
Ж+(
—1—
1
*¦ ж
V)
1
- -
(У)
—*
3409'
1910°
Литература
I. Smith J.P., Lee K.J. // Bull. Alloy Phase Diagrams. 1988. V. 9. N 4. P. 474-478.
T.B. Добаткина
Li-W. ЛИТИЙ-ВОЛЬФРАМ
Сведения о системе Ii—W очень ограниченны. В жидком Li при
температуре 716 °С растворяется 0,00396 % (ат.) W [Ш].На основа-
основании расчетов, проведенных в работе [1], растворимость W в жидком
Li в интервале температур 650—1150 "С составляет lJxlO"1—
4,Зх10~6 % (ат.) соответственно. Растворимость Li в (W) также
очень мала [2].
Литература
1. Кузин А.Н., Люблинский И.К., Бескоровайный Н.М. // Расчеты и экспери-
экспериментальные методы построения диаграмм состояния. Сб. статей. М.: Наука, 1985.
С 113-116.
2 Sangster J., Pelton A.D. // J. Phase Equilibria. 1991. V. 12. N 2. P. 203.
Л.Л. Зусман
250
Li-Zn
U-Zn. ЛИТИЙ-ЦИНК
Диаграмма состояния li—Zn, построенная в справочнике [X] на
основании данных термического, рентгеновского анализов и измере-
измерения удельного электросопротивления [1—3], в дальнейшем не претер-
претерпела существенных изменений [4—7]. В системе li—Zn имеется пять
низкотемпературных фаз IiZn, aIi2Zn3, LiZn2, aIi2Zn5, aIiZn4 и три
высокотемпературные фазы pU2Zn3, pii2Zn5, piiZn4. Однако рентге-
рентгенографические исследования пока подтвердили существование лишь
пяти фаз: LiZn, aLi2Zn3, IiZn2, ali2Zn5, aliZn4 [X, 2, 3, 5, 7].
Формула соединения LiZn4 принята произвольно [4]; авторы работы
[4] предполагают также, что соединению Li2Zn5 лучше соответствует
формула Li3Zn8. На рис. 124 приведена диаграмма состояния Li—Zn
[4]. При ее построении авторами работы [4] были учтены данные
работы [6] о растворимости Zn в Li при температуре 150 "С, а также
принято отличное от указанного в справочнике [X] обозначение
соединений. В остальном диаграмма состояния (см. рис. 124) подобна
приведенной в справочнике [X]. Соединение pii2Zn3 плавится кон-
конгруэнтно при температуре 520 "С, соединения piiZn4, pii2Zn3 обра-
образуются в результате перитектических реакций при температурах 481
и 502 °С соответственно. Остальные соединения образуются в твердом
состоянии по различным реакциям. Все соединения имеют области
гомогенности. Для соединений pii2Zn3 и piiZn4 области гомогенности
t,°Cr
500
ого to
Zn, % (па пассе)
90
too
Щ5в°
JO
Li
Рис. 124. Li—Zn
го
30
SO 60 70
Zn,°/o(a/n.)
80
SO TOO
Zn
Li-Zn
251
довольно широкие. Сведения о нонвариантных реакциях, в которых
принимают участие указанные выше фазы, приведены в табл. 111.
Максимальная растворимость Zn в (Li) составляет 1,5 % (ат.) [4].
Растворимость Li в (Zn) при температуре 150 "С равна 1 % (ат.).
Сведения о кристаллической структуре соединений приведены в
табл. 112.
Таблица 111. Нонвариантные реакции
Реакция
Ж - (Li) + PLi2Zn3
pLi2Zn3 - (Li) + LiZn
pLi2Zn3 » LiZn + aLi2Zn3
<xLi2Zn3 + <xLi2Zn5 - LiZn2
pLi2Zn3 » <xLi2Zn3 + <xLi2Zn3
pLi2Zn3 + pLi2Zn5 - aLi2Zn5
pLi2Zn3 + Ж - pLi2Zn5
pLi2Zn5 » aLi2Zn5 + aLiZn4
PLi2Zn5 + pLiZn4 - aLiZn4
pLi2Zn5 + Ж - pLiZn4
pLiZn4 - aLiZn4 + (Zn)
Ж - pLiZn4 + (Zn)
Содержание
4,5
-50
-56
-61
-62
-64
67
-73
-74
74
-88
96
в системе
Li-Zn [4J
Zn в фазах, % (ат.)
1,5
1.5
-55
-71
-61
-71
73
-72
-79
80
-84
92
-50
-50
-58
66,7
-70
-70
71
78
-77
76
-99
99
Температура, "С
161±3
-160
-160
93
161
268
502
168
245
481
65
403
Таблица 112. Кристаллическая структура соединений системы Li—Zn
Соединение
LiZn
aLi2Zn3"
aLi2Zn5*2
PLiZn4>:
aLiZn4'
Прототип
NaTl
-
-
—
—
Символ
Пирсона,
пр.гр.
аП6,
Fdlm
-
-
hPl,
/>63/mmc
''Кубическая сингония.
*2Гексагональная сингония.
Параметры решетки, нм
а
0,6221 E)
0,6232
0,427
0,4371
0,278 (8)
0,279
с
—
-
0,2515
0,439 D)
Источник
[3]
[71
[XI
[21
[2,51
[51
252
Li-Zn, Li-Zr
Литература
1. Grube G., Vosskuhler H. // Z. Anorg. All. Chem. 1933. Bd. 215. S. 211—214.
2. Zintl E., Schneider A. // Z. Elektrochemie. 1935. Bd. 41. S. 764—767.
3. Zintl E., Braver G, // Z. physik Chemie. 1933. Bd. 20. S. 251.
4. Pelton A.D. // J. Phase Equilibria. 1991. V. 12. N 1. P. 42—45.
5. Schonemann H., Schuster H.-U. // Rev. Chemie. Minerale. 1976 V. 13. P. 32—40.
6. Farrar R.A., King H.W. // Metallography. 1968. V. 1. P. 79—90.
7. Ferro R. // Atti Accad. Naz. Line. Rend. С Sci. Fis. Mat. Nat 1966 V 41
P. 348-350.
Li—Zr. ЛИТИЙ^ИРКОНИЙ
t,°c
О JO 50 BO 70 80
Zr, % (no пасхе)
90 95
Л. Л. Зусман, Т.В. Добаткина
100
1500
1342'
1000
500
18О,в"
°0
U
Рис. 125. Li—Zr
*- (и)
1
1 Газ'+Ж '
Газ
Ж*
Ж+
(filr)
"р Zr}
aZr)
(
liZr)
(aTr)
1555°
863'
10
20 30
40 50 ВО
Zr, % (am.)
70
во 90
100
lr
Диаграмма состояния Li—Zr не построена. Опубликованы только
результаты исследования растворимости Zr в жидком Li. Для опреде-
определения растворимости Zr в жидком Li последний выдерживали в
тиглях из Zr в среде Аг [1] или в условиях вибрации в течение 100 ч
[Э]. В работе [1] использовали дистиллированный Li. Полученные
значения растворимости приведены ниже:
Температура,
°С 1200 1100 1000 966 800 760 700 699 480
Растворимость,
Zr:
% (ат.). . . 0,023 0,0091 0,0023 0,0019 0,00076 0,076 <0,00076 0,0005 0,00076
% (по мас-
массе) 0,30 0,12 0,03 0,025 0,01 1,0 <0,01 0,0065 0,01
Источник. . [1] [1] [1] [Ш] [1] [Э] [1] [Ш] [Э]
Li-Zr, Lr—Mo
253
С помощью модели субрегулярных растворов в работе [2] получе-
получено уравнение линии ликвидуса \пх = 2,53 — \Ь,5%*\$П (х — моль-
мольная доля Zr).
Согласно данным работы [3] Zr с Li не образует интерметалличес-
интерметаллических соединений и не растворяется в нем.
На рис. 125 приведена схема диаграммы состояния Li—Zr (без
соблюдения масштаба) по аналогии с системой Ii—Ti [4].
Литература
1. Бычков Ю.Ф., Розанов А.Н., Яковлева В.Б. // Атомная энергия. 1959. Т.7.
№ б. С. 531-536.
2. Кузин А.Н., Люблинский И.Е., Бескоровайный Н.М. // Расчеты и эксперимен-
экспериментальные методы построения диаграмм состояния: Сб. статей. М.: Наука, 1985.
С. 113-118.
3. Weeks J.R. // Trans. ASM. 1965. V. 58. P. 302-322.
4. Moffatt W.G. Handbook of Binary Phase Diagrams. New York: General Electric Co.
Schenectady. 1976. 1977. V. I, 2. 658 p.
Л.А. Трешьяченко
Lr-Mo. ЛОУРЕНСИЙЫУЮЛИБДЕН
На рис. 126 приведена схема диаграммы состояния Lr—Mo, кото-
которая построена на основании расчета в работе [1]. Показано сущес-
существование эвтектики при температуре 1387 °С и концентрации 12 %
(ат.) Мо.
По, '/<• (по массе)
ZO ЭО -ЬО
So
во то во
2SOO
2ООО
WOO
¦/
7Z
Lr)
Ж
T3S7"
(Мо
zezs~
—
\
о го
Lr
Рис. 126. Lr—Mo
so во
Mo.'U (am.)
ТОО
по
254
Lr—Mo, Lu—Mg
Литература
1. Brewer L., Lamoreaux R.H. // Atomic Ehergy Review. Special Issue N 7.: Molib-
denunr Physico-Chemical Properties of ils Compounds and Alloys. Vienna: International
Atomic Energy Agency, 1980. P. 195-356.
T.B. Добаткина
Lu-Mg. ЛЮТЕЦИЙ-МАГНИЙ
На рис. 127 приведена диаграмма состояния Lu—Mg, построенная
в работе [1] с использованием экспериментальных данных работ
[2—5]. В системе образуются три соединения, формулы которых
установлены на основании рентгенографических исследований: MgLu,
Mg2Lu и Mg24Lu5. Co стороны Lu в системе установлено существова-
существование перитектического превращения при температуре 671 "С с образо-
образованием соединения MgLu [2]. Характер превращения при этой темпе-
температуре требует экспериментального уточнения в связи с отсутствием
полиморфизма у Lu [6]. Со стороны Mg в системе имеет место
эвтектическое превращение Ж [-50 % (по массе)] * (Mg) + Р (неиз-
(неизвестного состава) при температуре 616 °С; эвтектоидное превращение
протекает при температуре 538 °С [1,3].
Растворимость Mg в (Lu) при температуре -600 °С составляет
11,5 % (ат.) и уменьшается до -3 % (ат.) с понижением температу-
t°c
1100
800
500
200
7 20 40 50 SO 70
I I
\V\
l|l
ill
111
II
I !
a> 1
J
\
\
\
\
I
1
-J If I
+HgLu
I
3 -
|
80
Mg,V.(am.)
30
i
'I
S
¦>'
1
f
538° -
— ] ^
Ж
Ж+(Мд)
\
(Mg)+MgittLu5
J
\
(ft
\
ч
100
In)
650°
0 10 20 10 MO SO 60 70 80 90 100
Lu Нд,'/Ь (па пассе) Mg
Рис. 127. Lu—Mg
Lu—Mg, Lu—Mn
255
ры до 350 °С [4]. Растворимость Lu в (Mg) при разных температурах
приведена ниже:
Температура, °С
Растворимость, % (ат.).
Источник
538 500 400 300
8,80 6,95 4,43 3,27
[1,3] [1,3] [1,3] [1,3]
Сведения о кристаллической структуре приведены в табл. 113.
Таблица ПЗ. Кристаллическая структура соединений системы Lu—Mg
Соединение
MgLu
MgLu2
Mg24Lu5
Прототип
CsCl
MgZn2
Ti5Re24
Символ
Пирсона,
пр.гр.
сР2,
РтЗт
hP\2,
РЬъ1ттс
-
Параметры
а
0,3727
0,3700
0,596
1,1185
>ешетки, нм
с
—
0,971
-
Источник
[2]
[7]
[5]
[5]
Литература
1 Рохлин Л.Л. Магниевые сплавы, содержащие редкоземельные металлы. М.:
Наука, 1980. 192 с.
2. Miller A.E., Daane A.H. // Trans. AIME. 1964. V. 230. N 4. P. 568-572.
3. Рохлин Л.Л. // Изв. вузов. Цветная металлургия. 1977. № 6. С. 142—144.
4. Joseph R.R., Gschneidner, Jr., K.A. // Trans. AIME. 1965. V. 233. № 12.
P. 2063-2069.
5. Крипякевич П.И., Евдокименко В.И, Гладышевский Е.И. // Кристаллография.
1964. Т.9. № 3. С. 410-411.
6. Gschneidner, Jr., K.A., Calderwood F.W. // Handbook of the Physics and Chemis-
Chemistry of Rare Earths. Amsterdam, New York, Oxford, Tokyo: North-Holland Physics Publis-
Publishing Co., 1986. V. 8. Chap. 54. P. 1-161.
7. Krypiakewytsch P.I., Evdokimenko V.I. // Z. Anorg. All Chem. 1967. Bd. 355.
N 1/2. S. 104-112.
Л.Л. Рохлин
Lu-^VIn. ЛЮТЕЦИЙ—МАРГАНЕЦ
Диаграмма состояния Lu—Mn не построена. Методом рентгено-
структурного анализа установлено образование соединений LuMn2
(фаза Лавеса) и LuMn5.
Соединение LuMn2 имеет структуру типа MgZn2 (символ Пирсона
hP2, пр.гр. Pb^l ттс) с параметрами решетки а = 0,5203 нм; с =
= 0,8517 нм. Соединение LuMn5 имеет структуру собственного типа
(символ Пирсона hPM, пр.гр. Pd^lmc) с параметрами решетки а =
= 0,5186 нм; с = 0,8566 нм [V-C].
Е.И. Гладышевский, О И. Бодак, В.К Пекарский
256
Lu-Mo, Lu-N, Lu-Nd
Lu—Mo. ЛЮТЕЦИЙ—МОЛИБДЕН
Диаграмма состояния не построена. На основании рентгеновского
исследования сплавов системы Lu—Mo, изготовленных дуговой плав-
плавкой, сообщается об отсутствии в системе промежуточных фаз [Ш].
Согласно проведенному в работе [1] расчету в системе можно ожи-
ожидать образование эвтектики при температуре 1545 °С и содержании
Мо9 % (ат.).
Литература
1. Brewer L., Lamoreaux R.H. // Atomic Energy Review. Special Issue N 7. Molibde-
num: Physico-chemical Properties of its Compounds and Alloys. Vienna: International Atomic
Energy Agency, 1980. P. 195-356.
КБ. Поварова
Lu-^Ч. ЛЮТЕЦИЙ—АЗОТ
Диаграмма состояния Lu—N не построена. Нитрид LuN обладает
структурой типа NaCl (символ Пирсона cF%, пр.гр. FmZm) с пара-
параметром решетки а - 0,4766 нм [Э]. Сообщается о синтезе нитрида
Lu2N3 со структурой типа Мп2О3 (символ Пирсона с/80, пр.гр. /аЗ)
и параметром решетки а - 1,032 нм [1].
Литература
1. KiefferR., Ettmayer P., Pajakoff S. // Monatsh. Chem. 1972. Bd. 103. N 5.
S. 1285-1298.
Ю.Б. Кузьма
Lu-^Jd. ЛЮТЕЦИЙ—НЕОДИМ
Диаграмма состояния Lu—Nd экспериментально не построена [1,
М]. Однако Nd и Lu в металлическом состоянии имеют идентичное
электронное строение (bp^—Sc^bs2) и близкие параметры плотных
гексагональных решеток. Их атомные радиусы отличаются на 5 %.
В табл. 114 приведена кристаллическая структура элементов системы
Lu-Nd.
Таблица 114. Кристаллическая структура и полиморфные превращения
элементов системы Lu—Nd
Атом-
Атомный
номер,
элемент
60, Nd
71, Lu
Моди-
фи-
фикация
aNd
pNd
Прототип,
структура
aLa, ДГПУ
W, ОЦК
Mg, ГПУ
Параметры ре-
решетки, нм
а
0,36582
0,413
0,35052
с
1,17966
0,55494
Темпе-
Температура
превра-
превращений,
•с
1021
863
1663
1790
Реакция
Ж - pNd
aNd - pNd
Ж - Lu
Жгпу « Ж0Ц1С
Источ-
Источник
[1]
[1]
[1]
[2]
Lu-Nd
257
±;c
Lu, °/° (no массе)
0 10 20 JO 40 SO 60 7O 80 9O WO
tsoo
W2f'
fOOO
863'
SOO
1
/*,
(a
1
< Nd)
i
У
1
1
/
1
• ним
(ОС t
\
\
\
1
r
Yd, Z,
I
«;
i
j
(Lu)
/
1790*
1663°
^7 /0 20 SO 40 50 60 70 80 90 WO
Nd Lu,'/> (am) l-u
Рис. 128. Lu-Nd
258
1м—Nd, Lu—Ni
Вследствие близости строения при высоких температурах растворы
на основе ocNd и Lu образуют непрерывные ряды твердых растворов,
которые распадаются при температурах ниже -700 °С на две фазы,
имеющих ДГПУ и ГПУ структуры.
С этим связано появление на диаграмме состояния области несме-
несмешиваемости (рис. 128), экспериментально установленной методами
микроструктурного и рентгеновского анализов [1]. В приближении
идеальных растворов между Nd и Lu, так же как в системе Nd—Ег
[1], должно наблюдаться перитектическое равновесие при температу-
температуре -1380 °С и концентрации -56 % (ат.) Lu [2]. Вследствие откло-
отклонения от идеальных растворов, соответствующего различию атомных
радиусов компонентов, равному 5 %, между линиями ликвидуса и
солидуса, а также солвуса образуются достаточно широкие двухфаз-
двухфазные области. Сплавы на основе Lu претерпевают полиморфное пре-
превращение в жидком состоянии Жгпу * Жоцк.
Литература
1 Gschneidner, Jr., K.A., Calderwood F.W. // Handbook of the Physics and Chemis-
Chemistry of Rare Earths Amsterdam, New York, Oxford, Tokyo: North-Holland Physics Publis-
Publishing Co V. 8. Chap. 54. P. 1-161.
2. Григорович В.К., Григорович К.В. // Строение и свойства металлических
расплавов' Тезисы докладов на VII Всесоюзной конференции ЧПИ, 1990. Т.2. № 2.
С 250-252.
В. К Григорович
Lu-Ni. ЛЮТЕЦИЙ—НИКЕЛЬ
Диаграмма состояния системы Lu—Ni не построена. Методом
рентгеноструктурного анализа установлены кристаллографические
характеристики четырех соединений: LuNi, LuNi2, LuNi5, Lu2Ni17
(табл. 115) [V-C].
Таблица 115. Кристаллическая структура соединений системы Lu—Ni
Соединение
LuNi
LuNi2
LuNi5
Lu2Ni17
Прототип
CrB
FeB
MgCu2
СаСи5
Th2Ni,7
Символ
Пирсона, пр.гр.
oC8, С тст
oPS, Pnma
cF24, Fdlm
hP6, Pblmmm
hP3&, Р6г/ттс
Параметры решетки
a
0,3668
0,6910
0,7083
0,4834
0,821
Ъ
0,9995
0,4068
с
0,4174
0,5362
0,3969
0,7995
Е.И. Гладышевскип, О.И. Бодак, В К Печорский
Lu-O, Lu-Os, Lu-P 259
Lu-O. ЛЮТЕЦИЙ—КИСЛОРОД
Диаграмма состояния Lu—О не построена. Установлено существо-
существование соединения Lu2O3, которое претерпевает полиморфное превра-
превращение [Ш]. Соединение Lu2O3 плавится при температуре =2410 "С.
Температура полиморфного превращения не установлена. Одна
модификация (С) имеет структуру типа Мп2О3 (символ Пирсона
с/80, пр.гр. 1аЪ) с параметром решетки а = 1,03907 нм [Э] или а =
= 1,0390 нм [Ш]. Вторая модификация (В) имеет структуру типа
Sm2O3 (символ Пирсона тСЗО, пр.гр. С2/т) и параметры решетки
а = 1,370 нм, * - 0,3410 нм, с = 0,8425 нм, р = 100,22° [1]. Моно-
Моноклинная В-модификация фиксируется при закалке от температуры
1005 °С при давлении 4 ГПа [Ш].
Литература
1. Hoekstra H.R. // Inorg Chem. 1966. V. 5. P. 754-755.
Ю.Б. Кузьма
Lu-Os. ЛЮТЕЦИЙ-ОСМИЙ
Диаграмма состояния Lu—Os не построена. Методом рентгено-
структурного анализа установлены структуры соединений LuOs2 и
Lu3Os.
Соединение LuOs2 (фаза Лавеса) имеет структуру типа MgZn2
(символ Пирсона hP\2, пр.гр. Pb^lmmc) с параметрами решетки а =
= 0,2629 нм, с = 0,86663 нм. Структура соединения Lu3Os изотипна
со структурой Fe3C (символ Пирсона оР16, пр.гр. Рпта, имеет пара-
параметры решетки а = 0,3310 нм, Ъ = 0,7989 нм, с = 937 нм [V-C].
Е.И. Гладышевски, О.И. Бодак, В.К. Печорский
Lu-P. ЛЮТЕЦИЙ-ФОСФОР
Диаграмма состояния Lu—P не построена. В системе образуется
соединение LuP, которое имеет гранецентрированную кубическую
структуру типа NaCl (символ Пирсона cFb, пр.гр. Fmbm) с парамет-
параметром решетки а = 0,5533 нм [III, 1}.
Литература
1. Iandelli A. // Atti Accad Naz. Line. Rend. C Sci. Fis Mat. Nat. 1964. V. 37.
P 160-164
Л.Л. Рохлин
260
Lu-Pb
Lu—Pb. ЛЮТЕЦИЙ-СВИНЕЦ
Диаграмма состояния Lu—Pb приведена на рис. 129 по данным
работы [1].
В системе образуются четыре соединения, одно из которых,
^и5РЬ3, илавятся конгруэнтно при температуре 1695 °С, три других
образуются по перитектическим реакциям:
Lu5Pb4 « Ж + Lu5Pb3 при 1550 °С;
Lu6Pb5 * Ж + Lu5Pb4 при 1170 "С;
LuPb2 * Ж + Lu6Pb5 при 570 *С.
Соединение Lu5Pb^ претерпевает полиморфное превращение при
температуре 1475 °С. В системе Lu—Pb имеют место два эвтектичес-
эвтектических равновесия:
Ж * LuPb2 + (Pb) при 324 "С и 99 % (ат.) Pb,
Ж - Lu5Pb3 + (Lu) при 1285 °С и 17,5 % (ат.) Pb.
Lu растворяет не более 1 % (ат.) Pb. Растворимость Pb в (Lu)
практически отсутствует.
¦i.'C
1600
MOO
1200
1000
800
SO О
Ш
200
20
РЬ, '/• (по массе)
W 60 80
100
1663"
\
\~1.0
i
\
/
1285'
17.5
)
-с?
51
¦«а
95°
Гч
1550*
~2
X)
«о
•ч
1
\j475
S
1170°
—La,
-о
\
Pbs
5
•ч
70'
324'
Ж
\
(
\
\
V
327,501°
О 10 20 30 40 SO 60 70 80 90 100
Lu РЬ,"/о (am) Pb
Рис. 129. Lu-Pb
Lu-Pb, Lu-Pd
261
Кристаллическая структура соединений приведена в табл. 116 по
данным справочника [V-C].
Кристаллографические данные об otLu5Pb4 отсутствуют.
Таблица 116 Кристаллическая структура соединений системы Lu—Pb [V-C]
Соединение
Lu5Pb3
pLu5Pb4'
Lu6Pb5*
LuPb2
Прототип
MnjSij
MoSi2
Ромбическая сингония
Символ Пирсо-
Пирсона, пр.гр.
hPl6, Р6г/тст
tl6, H/mmm
Параметры решетки, нм
а
0,8764
1,6550
2,000
0,37061
b
0,650
0,917
с
0,6419
1,954
0,642
1,3120
Литература
1 McMasters O.D., Gschneidner, Jr., K.A. // J. Less-Common Met. 1969. V. 19.
P 337-344
E И Гладышевский, О. И Бодак, В.К. Печарский
Lu-Pd. ЛЮТЕЦИЙ-ПАЛЛАДИЙ
Диаграмма состояния Lu—Pd не построена. Установлено существо-
существование четырех соединений, сведения о кристаллической структуре
которых по данным справочника [V-C] приведены в табл. 117.
Таблица 117. Кристаллическая структура соединений системы Lu—Pd
Соединение
LuPdj
Lu3Pd4
LuPd
Lu5Pd2
Прототип
AuCu3
Pu3Pd4
CsCl
Dy5Pd2
Символ
Пирсона, пр.гр.
сРЛ, РтЪт
ЛЯ14, ЯЪ
сРП, РтЗт
cF144, Fdbm
Параметры решетки, нм
а
0,40356
1,2870
0,3417
1,3241
с
0,5642
ЕЙ Гладышевский, О.И. Бодак, В.К Печарский
262
Lur-Pm
Lu—Pm. ЛЮТЕЦИЙ-41Р0МЕТИЙ
Фазовая диаграмма Lu—Pm экспериментально не построена [1,
M]. Однако Pm и Lu в металлическом состоянии изоэлектронны,
имеют три коллективизированных валентных 5dl6s2 электрона.
Плотные гексагональные структуры осРт (ДГПУ) и Lu (ГПУ) сходны
друг с другом и имеют близкие параметры решеток и атомные радиу-
радиусы, отличающиеся на 4,4 %. Сведения о кристаллической структуре
элементов системы Lu—Pm приведены в табл. 118.
Таблица 118 Кристаллическая структура и полиморфные превращения
элементов системы Lu—Pm
Атом-
иый
номер,
элемент
61, Pm
71, Lu
Моди-
фи-
фикация
aPm
pPm
—
Прототип,
структура
aLa, ДГПУ
W, ОЦК
Mg, ГПУ
Параметры ре-
решетки, нм
а
0,365
-0,410
0,35052
с
1,165
-
0,55494
Темпе-
Температура
превра-
превращений,
°С
890
1042
1663
1790
Реакция
aPm - PPm
Ж - PPm
Ж -Lu
Жту - Жоцк
Источ-
Источник
[1]
Ш
[1]
[2]
Благодаря близости электронно-кристаллического строения и
атомных радиусов Pm и Lu при высоких температурах должны обра-
образовывать непрерывный ряд ДГПУ — ГПУ растворов, переходящих
друг в друга по механизму дефектов упаковки.
Система Lu—Pm вследствие большой разницы температур плавле-
плавления должна быть перитектической, так же как система Ег—Nd. В
приближении идеальных растворов линии, соединяющие температуры
плавления A042—1663 °С) и превращения (890—1790 °С), пересека-
пересекаются в перитектической точке, отвечающей температуре -1370 "С и
-53 % (ат.) Lu (рис. 130). В расплавах, богатых Lu, происходит
изменение ближнего порядка ЖГПУ •* ЖОцк. Вероятно, как и в
системе Lu—Nd, при температурах ниже температуры -700 °С возни-
возникает двухфазная область в виде купола, разделяющего ДГПУ и ГПУ
твердые растворы.
Литература
1 Gschneidner, Jr., K.A., Calderwood F.W. // Handbook on the Physics and Chemis-
Chemistry of Rare Earths Amsterdam New York, Oxford, Tokyo North-Holland Physics Publising
Co, 1986 V 8 Chap 54 P 1-161
Lu—Pm
263
l-V, "A (no rtacce)
0 10 20 30 W SO SO 70 80 90 100
i,°Ci n П IT-1 П Г"I Г 1 r~T П Г-Л 1790°
ТШ°
1500
1042е
SSO'
SOD
1
1
(a. Pit
r)
1
y'
1
1
\
1
У
У
1
Ж
А
~7l
1 '
5J
У
tPm,L
0°
\
i
-Ут37
и)
\
\
\
\
1
У.
У
0°
Ш
1
0 10 20 30 40 50 ВО 10 80 SO 1O0
Pm Lu,%(am.) Lu
Рис. 130. Lu-Pm
264
Lu—Pm, Lu—Po, Lu—Pr
2. Григорович В.К., Григорович К.В. // Строение и свойства металлических и
шлаковых расплавов Тезисы докл на VII Всесоюзной конференции. Челябинск: ЧГЩ,
1990. Т 2 № 2. С. 250-252.
В. К. Григорович
Lu-Po. ЛЮТЕЦИЙ-41ОЛОНИЙ
Диаграмма состояния Lu—Ро не построена. В системе образуется
соединение LuPo. Соединение LuPo плавится инконгруэнтно при
температуре 1898 °С и имеет структуру типа NaCl (символ Пирсона
cF%, пр.гр. Fm3m), a = 0,6159 нм [1].
Литература
1. Kershner C.J., DeShando R.J., Heidelberg R.F., Steinmeyer R.H. // J. Inorg.
Nuclear Chem. 1966. V. 28. N 8. P. 1581-1588.
Л.Л. Рохлин
Lu-^r. ЛЮТЕЦИЙ-ПРАЗЕОДИМ
Фазовая диаграмма Lu—Рг экспериментально не построена [1, М].
Однако Рг и Lu в металлическом состоянии изоэлектронны, посколь-
поскольку имеют три коллективизированных валентных 5d 6s2 электрона.
Плотные гексагональные структуры осРг (ДГПУ) и Lu (ГПУ) имеют
близкие параметры решеток и атомные радиусы, отличающиеся на
2,36 %. В табл. 119 приведены сведения о кристаллической струк-
структуре элементов системы Lu—Pr.
Т а б л и ц а 119. Кристаллическая структура и полиморфное превращение
элементов системы Lu—Pr
Атом-
Атомный
номер,
элемент
59, Рг
71, Lu
Моди-
фи-
фикация
аРг
PPr
—
Прототип,
структура
aLa, ДГПУ
W, ОЦК
Mg, ГПУ
Параметры ре-
решетки, нм
а
0,36721
0,413
0,35052
с
1,18326
-
0,55494
Темпе-
Температура
превра-
превращений,
"С
795
931
1663
1790
Реакция
aPr « PPr
Ж - pPr
Ж »Lu
Жту - ЖОЦ1С
Источ-
Источник
[1]
[1]
[1]
[2]
Благодаря сходству электронно-кристаллического строения и
близости атомных радиусов аРг и Lu при высоких температурах
образуют непрерывные твердые растворы, переходящие друг в друга
по механизму дефектов укладки. Система Lu—Pr вследствие большой
Lu.~Pr
265
о га га
ТОО О
931°
795°
(аРг
г
У
/
*
)
Jff *0
I
/
I
I
I
I
i
\
1
у'
/
/
/
/
Lu, %
SO
г
/Г
У
(по массе)
БО 7О ВО 9О 100
Т"
/
XPr,L
~7О0°
—.
1
\
\
\
1
1
1
i
|
0
/
*
1790°
16SJ°
о io го jo
Pr
Рис. 131. Lu-Pr
50 60 70 80 30 100
Lu
266
1м-Рг, Lu—Pt
разницы температур плавления компонентов должна быть похожа на
перитектическую систему Er—Nd. В приближении идеальных раство-
растворов линии, соединяющие температуры плавления (931—1663 °С) в
превращения G95—1790 °С), пересекаются в перитектической точке»
отвечающей температуре -1300 "С и концентрации -50 % (ат.) Lu
(рис. 131). Расплавы, богатые Lu, испытывают изменение ближнего
порядка Жрпу •* ЖОцК. При температурах -700 "С непрерывные
ряды плотных гексагональных растворов должны распадаться на
ДГПУ и ГПУ растворы, как в системах La—Lu и Lu—Nd.
Литература
1. Gschneidner, Jr., K.A., Calderwood F.W. // Handbook on the Physics and Chemis-
Chemistry of Rare Earths. Amsterdam. New York, Oxford, Tokyo: North-Holland Physics Publising
Co., 1986. V 8. Chap. 54 P. 1-161.
2. Григорович В.К., Григорович К.В. // Строение и свойства металлических и
шлаковых расплавов. Тезисы докл. на VII Всесоюзной конференции. Челябинск. ЧПИ,
1990. Т.2. № 2. С 250-252.
В. К Григорович
. ЛЮТЕЦИЙ-ПЛАТИНА
Диаграмма состояния Lu—Pt не построена. В табл. 120 приведены
сведения о составах и структуре известных соединений в сплавах Lu
с Pt по данным справочников [Ш, V-C].
Таблица 120. Кристаллическая структура соединений системы Lu—Pt
Соединение
LujPt
Lu2Pt
Lu5Pt3
Lu5Pt4
LuPt
Lu3Pt4
LuPtj
Прототип
Fe,C
Co2Si
Mn5Si3
Sm5Ge4
FeB
Pu3Pd4
AuCu3
Символ
Пирсона,
пр.гр.
оР16, Рпта
оР16, Pnma
hP\d, РЬг1тст
оРЪЬ, Рпта
oPS, Pnma
HRU, R3
сРЛ, РтЗт
Параметры решетки, нм
а
0,6926
0,6978
0,8183
0,7323
0,6810
1,2842
0,4030
Ь
0,9225
0,4630
-
1,4261
0,4417
-
-
с
0,6293
0,8584
0,6155
0,7388
0,5479
0,5622
0,5622
Ё И Гладышевский, О. И Бодак, В К. Печарский
Lu—Pu, Lu~Re, Lu—Rh, Lu—Ru
267
Lu—Pu. ЛЮТЕЦИЙ-ПЛУТОНИЙ
Диаграмма состояния Lu—Pu не построена. Некоторые сведения о
системе Lu—Pu приведены в справочниках [Э, Ш]. Сообщается, что
легирование Pu ~5 % (ат.) Lu понижает температуру плавления Pu
от 640 до 634 °С. Максимальная растворимость Pu в (Lu) составляет
-20 % (ат.) Предельная растворимость Lu в (Pu) равна -2—3 %
(ат.). Добавка к Pu ~4 % (ат.) Lu стабилизирует при закалке (бРи).
Предполагается, что (еРи) образуется по перитектической реакции
(Lu) +Ж •» (sPu).
Е.И. Гладышевский, О.И. Бодак, В.К. Печорский
Lu-Re. ЛЮТЕЦИЙ-4>ЕНИЙ
Диаграмма состояния Lu—Re не построена. В системе образуется
соединение LuRe2 с гексагональной структурой типа MgZn2 (символ
Пирсона API2, пр.гр. РЬ3/ттс) и параметрами решетки а =
= 0,5317 нм, с = 0,8723 нм [1]; а = 0,5335 нм, с = 0,8717 нм [Э].
Литература
1 Гладышевский Е.И., Бодак О.И. Кристаллохимия интерметаллических соедине-
соединений редкоземельных металлов. Львов. Вища школа, 1982 255 с.
М.А. Тылкина
Lu-Rh. ЛЮТЕЦИЙ-РОДИЙ
Диаграмма состояния Lu—Rh не построена. Сообщается о сущес-
существовании двух соединений LuRh и LuRh2 (фаза Лавеса). В табл. 121
приведены сведения об их кристаллической структуре по данным
справочника [V-C].
Таблица 121 Кристаллическая структура соединений системы Lu—Rh
Соединение
LuRh
LuRh2
Прототип
CsCl
MgCu2
Символ
Пирсона, пр.гр.
сР2, Pmbm
cF2A, Fdlm
Параметры решетки, нм
а
0,3332
0,7416
с
—
ЕЙ Гладышевский, О И. Бодак, В.К. Печарский
Lu-Ru. ЛЮТЕЦИЙ-РУТЕНИЙ
Диаграмма состояния Lu-Ru не построена. Установлено существо-
существование ряда соединений, состав и кристаллическая структура которых,
по данным работы [1], приведены в табл. 122.
268
Lu—Ru, Lu—S, Lu—Sb
Таблица 122. Кристаллическая структура соединений системы Lu—Ru
Соединение
LuRu2
LuRu
Lu^*
Lu3Ru
*P - 97,3-
Прототип
MgCu2
MgZn2
CsCl
Mn5C2
Fe3C
Символ
Пирсона,
пр.гр.
cK24,
Fdlm
hP\1,
Р6г/ттс
cP2,
РтЪт
mC28,
C2/c
oPlb,
Pnma
Параметры решетки, нм
a
0,7412
0,5312
0,3329
1,5252
0,7247
b
—
—
0,6109
0,8915
с
—
0,8732
—
0,7223
0,6131
Литература
1. Гладышевский ЕЙ., Бодак О.И. Кристаллохимия интерметаллических соедине-
соединений редкоземельных металлов. Львов: Вища школа, 1982. 225 с.
Е.И. Гладышевский, О.И. Бодак, В К. Печарский
Lu-S. ЛЮТЕЦИЙ-СЕРА
Диаграмма состояния Lu—S не построена. В системе Lu—S образу-
образуются соединения LuS и Lu2S3. Соединение LuS имеет структуру типа
NaCl (символ Пирсона cFb, пр.гр. Fmbm) с параметром решетки а =
= 0,5323 нм [1]. Соединение Lu2S3 имеет ромбоэдрическую решетку
типа аА12О3 (символ Пирсона АЛЮ, пр.гр. Rbc) с параметрами
эквивалентной гексагональной решетки: а = 0,6730 нм, с = 1,821 нм
[2].
Литература
1. Iandelli A. // Atti Accad. Naz. Unc. Rend. С. Sci. Fie. Mat. Nat. 1964. V. 37.
P. 160-164.
2. Flahaut J., Domange JL, Guittard M. et al. // Compt. Rend. Acad. Sci. Paris. 1%3.
V. 257. N 8. P 1530-1533.
Л.Л. Рохлин
Lu-Sb. ЛЮТЕЦИЙ-СУРЬМА
На рис. 132 приведена диаграмма состояния, построенная в работе
[1] на основании данных дифференциального термического, рентге-
рентгеновского, микроструктурного анализов и измерения микротвердости.
Lu-Sb
269
2200
2000
1800
1663°
7S00
1400
1200
1000
800
600
400
200
70
Sb,% (no пассе)
20 JO 40 SO SO 70 60 90 Ю0
[4.
C5
\12OO
1" " "
|
J
1
o\ /
f-ttv)
|
1
72
' 1 гж°
s
/1B
1570
0
1
i
1
1
1
\
_ 930
1
\
о
625°
1
N
Д
(Sb) -*-
630,735°
20 JO
SO 60
Sb,%(am.)
70 BO
90 700
Sb
О Ю
Рис. 132. Lu-Sb
В системе образуются соединения Lu3Sb, Ьи^Ьз, LuSb, LuSb2. Соеди-
Соединение LuSb плавится конгруэнтно при температуре 2180 °С и претер-
претерпевает полиморфное превращение ocLuSb » pLuSb при температуре
1870 °С. Соединения Lu3Sb, LujSb3 и LuSb2 плавятся инконгруэнтно
при температурах 1290, 1570, 930 °С соответственно.
Растворимость Sb в (Lu) незначительная, растворимость Lu в (Sb)
практически отсутствует.
Сведения о кристаллической структуре соединений aLuSb, LuSb2
и Lu5Sb3 приведены в табл. 123. Кристаллическая структура соедине-
соединений PLuSb и Lu3Sb не определена.
Таблица 123 Кристаллическая структура соединений системы Lu—Sb
Соединение
Lu5Sb3
aLuSb
LuSb2
Прототип
MnjSij
NaCl
Символ
Пирсона,
пргр
hPlb,
РЬъ1тст
сРЪ,
Fm3m
оС6,
С222
Параметры решетки, нм
а
0,89
0,605
0,60555
0,6058
0,33211
0,3244
Ь
0,57251
0,5935
с
0,633
0,7782
0,7885
Источник
[1]
[1]
[2]
[3]
[4]
[5]
270
Lu—Sb, Lu—Sc
Литература
1. Abdusalyamova M.N., Faslyeva N.D., Eliseeo A.A. et al. // J. Less-Common Met.
1990. V. 166. N. 2. P. 229-232.
2. Przybylska M, Reddoch A.H., Bitter GJ. // J. Amer. Chem. Soc. 1963. V. 85. N 4.
p. 407—411.
3. Iandelli A. // Atti Accad. Naz. Line. Rend. С Sci. Fiz. Mat. Nat. 1964. V. 37.
P. 160-164.
4. Johnson Q. // Inorg. Chem. 1971. V. 10. N 9. P. 2089-2090.
5. Okamoto H. // J. Phase Equilibria. 1991. V. 12. N 3. P. 393-394.
T.B. Добаткина
Lu-Sc. ЛЮТЕЦИЙ-СКАНДИЙ
Фазовая диаграмма Lu—Sc экспериментально не построена. Однако
Sc и Lu в металлическом состоянии почти изоэлектронны и имеют по
три валентных коллективизированных электрона 3d14s2 и 5dl6s2
соответственно. Кроме того, ocSc и Lu имеют одинаковую ГПУ струк-
структуру с близкими параметрами а и с. Их атомные радиусы разли-
различаются на 5,75 %. В табл. 124 приведены сведения о кристалличес-
кристаллической структуре элементов системы Lu—Sc.
Таблица 124. Кристаллическая структура и полиморфные
превращения элементов системы Lu—Sc
Атом-
Атомный
номер,
элемент
71, Lu
21, Sc
Моди-
фи-
фикация
—
aSc
PSc
Прототип,
структура
Mg, ГПУ
Mg, ГПУ
W, ОЦК
Параметры ре-
решетки, нм
а
0,35052
0,33088
0,373
с
0,17349
0,16406
—
Темпе-
Температура
превра-
превращений,
"С
1663
1790
1337
1541
Реакция
Ж -Lu
Жту - ЖОцК
aSc - PSc
Ж - PSc
Источ-
Источник
[1]
[1]
[1]
[2]
Вследствие близкого электронного и кристаллического строения Lu
и Sc должны, так же как Sc и Но, Sc и Ег, образовывать непрерыв-
непрерывные фазы ГПУ растворов. Вследствие большого различия температур
плавления Lu и Sc в системе Lu—Sc, вероятнее всего, существует
перитектическое равновесие, как в системах Tb—Er, Dy—Ег. Значи-
Значительная разница атомных радиусов обусловливает отклонение раство-
растворов от идеальных и провисание кривых ликвидуса и солидуса. В
приближении идеальных растворов перитектическая точка отвечает
температуре -1600 "С и концентрации -40 % (ат.) Sc (рис. 133) [2].
Lu—Sc, Lu—Se
271
I
1663°
/500
7
1790°
Sc,"/°(no массе)
/О 20 30 40 SO 60 708090100
f
°'4
(ceS
0
r, Lu)
«^
i i
Ж
(J3Sc)
1
1 I
7*
О tO
Lu
Рис. 133. Lu-Sc
Литература
го
JO
ьо
Sc
so
. "'о
60
(am.)
70
SO
90
100
SC
1. Gschneidner, Jr., K.A., Calderwood RW. // Handbook of the Physics and Chemis-
Chemistry of Rare Earths. Amsterdam, New York, Oxford, Tokyo: North-Holland Physics Publis-
Publishing Co. V. 8. Chap. 54. P.—161.
2. Григорович В.К., Григорович К.В. // Строение и свойства металлических
расплавов: Тезисы докладов на VII Всесоюзной конференции. Челябинск: ЧПИ, 1990.
Т.2. № 2. С. 250-252.
В.К. Григорович
Lu-Se. ЛЮТЕЦИЙ-СЕЛЕН
Диаграмма состояния Lu—Se не построена. Установлено образова-
образование соединений LuSe, Lu2Se3 [Ш, 1—3], LuSej ,4 [4]. Согласно
данным работы [4] соединение LuSej 34 является более термически
устойчивым, чем Lu2Se3. При высоких давлениях и температуре
синтезированы соединение LuSe2 и новая модификация соединения
Lu2Se3. Сведения о кристаллической структуре указанных соедине-
соединений приведены в табл. 125.
272
Lu—Se, Lu—Si
Таблица
Соединение
LuSe
Lu2Se3
LuSe*
Lu2Se3
LuSe2
125. Кристаллическая
Прототип
NaCl
Sc2S3
—
Th3P4
Cu2Sb
Символ
Пирсона,
np.rp.
cF&,
Fm3m
0F8O,
Fddd
— •
c/28,
/43d
tP6,
P4/nmm
'Ромбическая сингония.
структура соединений
системы Lu—Se
Параметры решетки, нм
а
0,5576
1,124
1,1229B)
1,127
0,8570
0,3936
Ь
—
0,795
0,7986A)
0,795
—
с
—
2,384
0,3865C)
2,379
—
0,8147
Источник
[1]
[Ш]
[3]
[4]
[5]
[6]
Литература
1. Iandelli A. // Atti Accad. Naz. One. Rend. C. Sci. Fis. Mat. Nat. 1964. V. 37.
P. 160-164.
2. Flahaut J., Damange L., Guittard M. et al. // Сотр. Rend. Acad. Sci. Paris. 1963.
V. 257. N 8. P. 1530-1533.
3. Range K.-J., Eglmeier Ch. // J. Less-Common Met. 1991. V. 171. N 1.
P. L27-L30.
4. Словинских В.К., Кузнецов Н.Т., Грачева Н.В. // Журнал неорганической
химии. Т.27. № 5. С. 1323—1324.
5. Eatough N.L., Hall H.T. // Inorg. Chem. 1970. V. 9. N 2. P. 417—418.
6. Webb A.W., Hall H.T. // Inorg. Chem. 1970. V. 9. N 4. P. 843-847.
Л.Л. Рохлин
Lu-Si. ЛЮТЕЦИЙ-КРЕМНИЙ
Диаграмма состояния Lu—Si не построена. Сообщается о существо-
существовании со стороны Si эвтектики при температуре 1170 "Си содержа-
содержании 77 % (ат.) Si [1]. В работе [1] оценена также растворимость Si
в расплаве Lu и построена линия ликвидуса в области концентраций
100-77 % (ат.) Si.
Сведения о кристаллической структуре соединений, образующихся
в системе Lu—Si, по данным справочника [2], приведены в табл. 126.
Lu—Si, Lu—Sm
273
Таблица
Соединение
Lu5Si3
Lu5Si4"
LuSi
Lu2Si3
126. Кристаллическая структура соединений системы Lu—Si
Прототип
MtijSij
—
СгВ
А1В2
'Моноклинная сингония
Символ
пр.гр.
hPlb,
Р63/тст
Pl'ja
оСВ,
Стст
hP3,
РЫттт
, y = 92,Г.
Параметры решетки, нм
а
0,824
0,720
0,415
0,3745
Ь
1,411
1,024
с
0,613
0,746
0,375
0,4050
Литература
1. Лозовский В.Н., Колесниченко А.И. // Изв. АН СССР. Неорганические
материалы. 1981. Т. 17. № 3. С. 554-555.
2. Гладышевский ЕЙ., Водах О.И. Кристаллохимия интерметаллических соедине-
соединений редкоземельных металлов. Львов: Вища школа, 1982. 255 с.
Е.И. Гладышевский, О.И. Бодак, В.К. Печорский
Lu-Sm. ЛЮТЕЦИЙ-САМАРИЙ
Диаграмма состояния Lu—Sm экспериментально не построена.
Однако Sm и Lu имеют в металлическом состоянии идентичное
электронное строение с тремя коллективизированными вален-
валентными электронами 5dl6s2, одинаковую плотную гексагональную
структуру типа Mg с близкими параметрами решетки и атомные
радиусы, отличающиеся на 4,0 % [1]. В табл. 127 приведена крис-
кристаллическая структура элементов' системы Lu—Sm.
Т а б л и
ц а 127.
элементов системь
Атом-
Атомный
элемент
62, Sm
71, Lu
Моди-
фи-
aSm*
PSm
ySm
—
Кристаллическая структура
Lu-Sm
Прото-
Прототип,
ра
—
Mg, ГПУ
W, ОЦК
Mg, ГПУ
Параметры ре-
решетки, нм
а
0,36290
0,36630
0,410
0,35778
с
2,6207
0,58448
-
0,56178
Ромбоэдрическая сингония.
и полиморфное превращение
Темпе-
Температура
щения,
'С
734
1074
922
1663
1790
Реакция
aSm - pSm
Ж - YSm
PSm « YSm
Ж -Lu
жгпу-жоцк
Источ-
Источник
[1]
[1]
[1]
[1]
[2]
274
Lu—Sm
10
Sm, °/. (no массе)
20 30 40 SO 6O 70 80 SO 100
1663
ISOO
WOO
SO О
107b"
922°
О W 2O 30 40 50 6O 70 80 SO 100
Lu Sm, %> (am.) Sm
Рис. 134. Lu-Sm
Lu—Sm, Lu—Sn
275
Lu,% (no nacce)
20 40
На этом основании можно предполагать, что Sm и Lu образуют
друг с другом непрерывные ряды твердых растворов с ГПУ структу-
структурой типа Mg. В приближении идеальных растворов линии ликвиду-
ликвидуса—солидуса аппроксимируются прямой, соединяющей температуры
плавления компонентов. Lu в отличие от Sm и большинства редкозе-
редкоземельных металлов не имеют высо-
высокотемпературной ОЦК модифика-
модификации вблизи температуры плавле- f «/•
ния, однако в области жидкого '
состояния при температуре 1790 "С
испытывает соответствующее изме-
изменение ближнего порядка Жгпу •*
Жоцк [2]. Это позволяет провести
другую линию, соединяющую тем-
температуры превращения Sm и Lu, и
построить диаграмму состояния
Lu—Sm (рис. 134) перитектическо-
го типа с перитектической точкой
при температуре 1400 "С и содер-
содержании 45 % (ат.) Sm. Вследствие
различия атомных радиусов Lu и
Sm на 4 % их твердые растворы
немного отклоняются от идеаль-
идеальных, поэтому кривые ликвидуса —
солидуса и солвуса несколько рас-
расходятся, что отражено на диаграм-
диаграмме состояния. Область гомогеннос-
гомогенности растворов на основе aSm дости-
достигает 32—38 % (ат.) Lu вследствие
близости отношения с : а (соответ-
(соответственно 1,6048 и 1,583).
Литература
1 Gschneidner, Jr., K.A., Calderwood
F.W. // Handbook on the Physics and Che-
Chemistry of Rare Earths. Amsterdam. New York.
Oxford. Tokyo: North-Holland Physics Publis-
hing Co., 1986. V. 8. Chap. 54. P. 1-161. 200
2. Григорович В.К., Григорович К.В.
// Строение и свойства металлических и
шлаковых расплавов: Тезисы докл. на VII
Всесоюзной конференции. Челябинск:
ЧПИ, 1990. Т.2. № 2. С.250-252.
В.К. Григорович
Lu-Sn. ЛЮТЕЦИЙ-ОЛОВО
На рис. 135 приведена диаграм-
диаграмма состояния Lu—Sn, которая в
1000
доо
600
too
ж
1
I
/
5A00°)
s
1
s\
1
:>
'¦>
1
i
\
7°
\
-Л
Л
/
1
0
Sn
Рис.
135.
10 20
Lu,%(am.
Lu-Sn
JO
)
to
Lu
276
Lu—Sn, Lu—Ta
области, богатой Sn, построена в работе [1] по данным дифференци-
дифференциального термического и микроструктурного анализов. Обнаруженное
в изученной области концентраций соединение LuSn3 образуется из
расплава при температуре 1017 °С. Соединение LuSn3 участвует в
эвтектическом равновесии Ж •» LuSn3 + ? (фаза не известна) при
температуре ниже 1000 °С и при содержании 70 % (ат.) Sn, а также
входит, по-видимому, в состав вырожденной эвтектики (Sn) + LuSn3.
Растворимость Lu в (Sn) практически отсутствует. Структура соеди-
соединения LuSn3 не определена. Данные о структуре двух других соеди-
соединений Lu5Sn3 и LuSn2, образующихся в этой системе, приведены в
табл. 128 согласно справочнику [V-C].
Таблица 128. Кристаллическая структура соединений системы Lu—Sn
Соединение
LiijSrij
LuSn2
Прототип
Mn5Si3
ZrSi2
Символ
Пирсона,
пр.гр.
API 6, P63/mcm
оС12, Cmcm
Параметры решетки, нм
а
0,8679
0,4434
b
1,5997
с
0,6349
0,4273
Литература
1 Кулагина Н.Г., Баянов А.П., Кулагин Н.М. // Изв. АН СССР. Металлы. 1985.
№ 3 С. 211-216
Е.И. Гладышгвскип, О.И. Бодак, В.К Печарскш
Lu—Ta. ЛЮТЕЦИЙ—ТАНТАЛ
На рис. 136 приведена диаграмма состояния Lu—Ta, которая в
области, богатой Lu, построена в работе [1]. Сплавы изготовляли в
индукционной печи в вакууме путем нагрева Lu в толстостенных
тиглях из тантала с последующим сбрасыванием в водоохлаждаемый
медный приемник. В качестве исходных компонентов использовали
Lu чистотой 99,93 % (по массе) и Та чистотой 99,9 % (по массе).
В сплавах, богатых Lu, кристаллизуется эвтектика (Lu) + (Та)
при температурах 1660 °С и содержании 1,4 % (ат.) Та. Границу
между фазовыми областями Ж и Ж + (Та)'можно описать уравнени-
уравнением lgx = —5,336хЮ~3/Г + 0,8935, где х — атомная доля Та в жид-
жидкости; Т — температура, К.
Lu—Ta, Lu—Tb
277
t'C
2100
2000
tsoo
WOO
1700
1300
9
~ 1663° -
¦«—(La)
1
Та, a/a (no nacce)
2 J
ж
1,1±0,1
^-
-**
166O±7S°
*
0 0,5
Lu
Рис. 136. Lu-Ta
1,5 2 2,5
Та,'Л (am.)
3,5
Литература
1. Dennison D.H., Tschetter M.J., Gschneidner Jr., K.A. // J. Less-Common Met.
1965 V 10. № 2. P. 108-115
E И. Гладышевский, О И. Бодак, В.К. Печарский
Lu—Tb. ЛЮТЕЦИЙ—ТЕРБИЙ
Диаграмма состояния Lu—Tb экспериментально не построена.
Однако Lu и ТЬ достаточно близко расположены в периодической
системе, имеют в металлическом состоянии идентичное электронное
строение с тремя коллективизированными электронами 5d 6s ,
одинаковую плотную гексагональную структуру типа Mg с близкими
параметрами решетки и атомные радиусы, отличающиеся на 2,8 %.
В табл. 129 приведена кристаллическая структура ТЬ и Lu.
Таблица 129. Кристаллическая структура и полиморфное превращение
элементов системы Lu—Tb
Атомный
номер,
элемент
65, ТЬ
71, Lu
Моди-
фи-
фикация
«ТЬ
рть
Прото-
Прототип,
структу-
структура
Mg, ГПУ
W, ОЦК
Mg, ГПУ
Параметры ре-
решетки, нм
а
0,36055
0,402
0,35052
с
0,56966
-
0,55494
Темпера-
Температура
превра-
превращения,
•с
1289
1356
1663
1790
Реакция
«ТЬ « РТЬ
ж « рть
Ж-Lu
жгпу •* жоцк
Источ-
Источник
[2]
[2]
[2]
[3]
278
Lu—Tb
ть, '/о (по массе)
О 10 20 30 40 SO 60 70 80 90 100
1663 '
1500
1000
О 10
La
Рис. 137. Lu-Tb
го зо
4-0 SO 60
ТЬ, V. (am.)
70
90 WO
ТЬ
Авторы работы [1] нашли методом рентгеноструктурного анализа
и резистометрии, что в системе Lu—Tb существует полная взаимная
растворимость компонентов. Изменение параметра а в этой системе
указывает на положительное отклонение от правила Вегарда, пара-
параметр с изменяется почти линейно [1, 2]. В отличие от большинства
редкоземельных металлов Lu вблизи температуры плавления не
имеет высокотемпературной ОЦК модификации, но в жидком состоя-
состоянии при температуре 1790 "С испытывает изменение ближнего
порядка Жгпу » Жоцк [3]. В приближении идеальных растворов
линии ликвидуса — солидуса и ликвидуса — солвуса сливаются в две
пересекающиеся прямые, позволяющие определить точку их пересе-
пересечения при температуре 1475 °С и содержании 63 % (ат.) ТЬ. Такую
диаграмму можно представить как перитектическую (рис. 137).
Вследствие небольшой разницы атомных радиусов растворы немного
отклоняются от идеальных и линии ликвидуса — солидуса и солвуса
немного разделяются.
Lu-Tb, Lu-Tc, Lu~Te, Lu-Th 279
Литература
1. Smidt F.A., Daane A.H. // J. J. Phys. Chem. Solids. 1963. V. 24 P. 361.
2. Gschneidner, Jr., K.A., Calderwood F.W. // Handbook on the Physics and Chemis-
Chemistry of Rare Earths. Amsterdam. New York. Oxford. Tokyo: North-Hoiland Physics Publis-
Publishing Co., 1986. V. 8 Chap. 54. P. 1-161.
3. Григорович В.К., Григорович К.В. // Строение и свойства металлических и
шлаковых расплавов: Тезисы докл. на VII Всесоюзной конференции. Челябинск: ЧПИ,
1990. Т.2. № 2. С.250-252.
В.К. Григорович
Lu—Тс. ЛЮТЕЦИЙ—ТЕХНЕЦИЙ
Диаграмма состояния Lu—Тс не построена. В системе Lu—Тс
образуется соединение LuTc2 с гексагональной структурой типа
MgZn2 (символ Пирсона hPYl, пр.гр. Р63/ттс). Параметры решетки:
а = 0,5309, с = 0,8739 им [Ш, 1].
Литература
1. Darby J.B., Norton L.J., Downey J.M. // J. Less-Common Met. 1964. V. 6.
P. 165-167.
Л.Л. Рохлин
Lu—Те. ЛЮТЕЦИЙ—ТЕЛЛУР
Диаграмма состояния Lu—Те не построена. В системе образуется
ряд соединений. Соединение LuTe имеет структуру типа NaCl (сим-
(символ Пирсона C.F8, пр.гр. Fm3m) с параметром решетки а - 0,5961 нм
[1]. При высоких давлении и температуре были синтезированы
соединения LuTe^^ и LuTe3 [2]. Для соединения LuTe^^ определе-
определена тетрагональная структура с параметрами решетки а = 0,4222 нм,
с = 0,8807 нм. Соединение LuTe3 имеет орторомбическую структуру
с параметрами решетки а = 0,4277 нм, Ь - 2,5137 нм, с - 0,4278 нм
[2].
Литература
1. Iandelli A. // Atti Accad. Naz. Lins. Rend. С. Sci. Fiz. Mat. Nat. 1964. V. 37.
P. 160-164.
2. Cannon J.F., Hall H.T. // Ihorg. Chem. 1970. V. 9. № 7. P. 1639-1643.
Н.И. Никитина
Lu—Th. ЛЮТЕЦИЙ—ТОРИЙ
Диаграмма состояния Lu—Th построена в работе [1]. Авторами
этой работы было предположено наличие полиморфного превращения
aLu » pLu и в связи с этим установлено существование непрерывных
рядов твердых растворов между высокотемпературными модификаци-
280
Lu-Th
(па массе)
0
t г С
№00
1360'
ьоо
200
w
1
"i:>(flTh)
~ 155OI_
/У
(*
Th)
20
i
30
r
-^_
uo
1
(a 7
SO
I
Ж
f*8
60
0°
ч)
70
I
"\
>,\
78
80
1
—г
90 70
f
89
(Lu)
1663°
ьо
Lu,
SO
"Л
во
(am.)
70
ВО
90
100
Lu
О 10 20 30
Th
Рис. 138. Lu-Th
ями фТЬ) и (aLu), а также перитектоидного равновесия фТЬ, Lu) +
+ (aTh) •* (aLu) при температуре 1480 "С. Однако в дальнейшем не
было подтверждено, что Lu имеет полиморфное превращение [2],
поэтому приведенная в работе [1] диаграмма состояния Lu—Th может
быть интерпретирована, как показано на рис. 138. При температуре,
близкой к 1663 °С, предполагается существование перитектической
реакции Ж + фТЬ) » (Lu), а при температуре 1480 °С происходит
эвтектоидный распад (pTh) » (aTh) + (Lu). Граница фазового пре-
превращения pTh « aTh имеет максимум при температуре -1550 °С [1].
Растворимость Lu в (Th) при комнатной температуре достигает
40 % (ат.), а Th в (Lu) - 10 % (ат.) [3].
Литература
1. Бадаева Т.А., Кузнецова Р.И. // Изв. АН СССР. Металлы. 1969. №5.
С. 156-163.
2. Gschneidner, Jr., K.A., Calderwood F.W. // Handbook on the Physics and Chemis-
Chemistry of Rare Earths. Amsterdam. New York. Oxford. Tokyo: North-Holland Physics Publis-
Publishing Co., 1986. V. 8. Chap. 54. P. 1-161.
3. Бадаева Т.А., Кузнецова Р.И. // Физико-химия сплавов и тугоплавких соеди-
соединений с торием и ураном: Сб. статей. М.: Наука, 1968. С. 11—15.
Т. В. Добаткина
Lu-Tl, Lu-Tm
281
Lu—TI. ЛЮТЕЦИЙ—ТАЛЛИЙ
Диаграмма состояния Lu—T1 не построена. В системе образуются
соединения Lu5Tl3 и LuTl3, сведения о кристаллической структуре
которых приведены в табл. 130 по данным справочника [V-C].
Таблица 130. Кристаллическая структура соединений системы Lu—T1
Соединение
Lu5Tl3
LuTl3
Прототип
Mn5Si3
AuCuj
Символ
Пирсона, пр.гр.
hPlb, РЬъ1тст
сРА, РтЪт
Параметры решетки, нм
а
0,8726
0,4653
Ь
0,6446
Е.М. Гладышевский, О.И. Бодак, В.К. Лечарский
Lu—Tm. ЛЮТЕЦИЙ-ТУЛИЙ
Диаграмма состояния Lu—Tm экспериментально не построена. Tm
и Lu расположены рядом в периодической системе, имеют идентичное
электронное строение с тремя валентными электронами 5dl6s2,
одинаковую кристаллическую ГПУ структуру типа Mg с очень близ-
близкими постоянными решетки [1] и атомными радиусами, отличающи-
отличающимися на 0,65 %. В табл. 131 приведена кристаллическая структура
Lu и Тт.
Таблица 131. Кристаллическая структура и полиморфные превращения
элементов системы Lu—Tm
Атомный
номер,
элемент
69, Tm
71, Lu
Моди-
фи-
фикация
-
—
Прото-
Прототип,
структу-
структура
Mg, ГПУ
Mg, ГПУ
Параметры ре-
решетки, нм
а
0,35375
0,35052
с
0,55040
0,55494
Темпера-
Температура
превра-
превращения,
¦с
1545
1655
1663
1790
Реакция
Ж «Tm
Жрпу •• Жоцк
Ж - Lu
ЖГПу « ЖОцк
Источ-
Источник
[1]
[1]
[I]
[4]
Tm и Lu образуют между собой непрерывные ряды идеальных
твердых растворов с ГПУ структурой типа Mg. Линии ликвидуса и
солидуса на диаграмме состояния Lu—Tm (рис. 139) вследствие
идеальности растворов должны, так же как на экспериментально
построенной диаграмме Но—Ег [2], сливаться в одну прямую. Tm и
Lu не испытывают полиморфного превращения в твердом состоянии
282
Lu-Tm, Lu—U
Lu, % (no массе)
.„.0 10 20 30 40 SO 60 TO 80 90 Г00
1500
1000
1Б55'
1S4S'
- —
—
Ж
-
—
Ж on
Жг/
— —
(Tm
IK
ч
Lu)
- —
——
——
7790*
1Б6?
О
Tm
W
20 30
40 SO БО
Lu, % (am.)
70
80 30
100
Lu
Рис. 139. Lu-Tm
вблизи температуры плавления [1, 3], но имеют соответствующее
изменение ближнего порядка Ж^пу * Жоцк в жидком состоянии при
температурах 1655 и 1790 °С соответственно [4]. Поскольку жидкие
растворы Tm с Lu также идеальны, на диаграмме проведена прямая
линия ликвидуса, разделяющая области Жгау и Жоцк.
Литература
1. Gschneidner, Jr., K.A., Calderwood F.W. // Handbook on the Physics and Chemis-
Chemistry of Rare Earths. Amsterdam. New York. Oxford. Tokyo: North-Holland Physics Publis-
Publishing Co., 1986. V. 8. Chap. 54. P. 1-161.
2. Spedding F.H., Sanden В., Beadry B.J. // J. Less-Common Met. 1973. V. 31. N 1.
P. 1-13.
3. Gschneidner, Jr., K.A., Daane A.H. // Handbook on the Physics and Chemistry of
Rare Earths. Amsderdam: Elsevier Science Publ., 1988. V. 11. P. 409—484.
4. Григорович В.К., Григорович К.В. // Строение и свойства металлических и
шлаковых расплавов. Тезисы докл. на VII Всесоюзной конференции. Челябинск: ЧГШ,
1990. Т.2. № 2. С. 250-252.
В .К. Григорович
Lu-U. ЛЮТЕЦИЙ-УРАН
Диаграмма состояния Lu—U не построена. Растворимость Lu в
жидком U при температуре 1200 "С составляет 0,54 % (ат.) [1], а
при температуре 1150 °С — 0,27 % (ат.) [Э].
Lu-U, Lu-V, Lu-W, Lu-Y 283
Литература
1. Haefling J.F., Daane A.H. // Trans. AIME. 1959. V. 215. P. 336-338.
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
Lu-V. ЛЮТЕЦИЙ-ВАНАДИЙ
Диаграмма состояния Lu—V не построена. В работе [1] с помощью
металлографического анализа установлено, что Lu и V не смешива-
смешиваются в жидком состоянии.
Литература
1. Спеддинг Ф.Х., Даане А.Х. Редкоземельные металлы. М.: Металлургия, 1965.
610 с.
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
Lu-W. ЛЮТЕЦИЙ—ВОЛЬФРАМ
Диаграмма состояния не построена. Растворимость W в жидком
Lu, рассчитанная по уравнению lnx = —1 ,(№()*\<Т~ЪТ~Х + 1,790 (где
х — атомная доля W, Т — температура, К), составляет 0,461 % (ат.)
при температуре 1663 °С [1]. Растворимость W в (Lu) по данным
работы [1] приведена ниже:
Температура, °С 1668 1895 1996 2098
Растворимость W, % (ат.К . . .' 0,4445 1,465 1,859 2,242
Литература
1. Dennison D.H., Tschetter M.J., Gschneidner, Jr., K.A. // J. Less-Common Met.
1966. V. 11. N6. P. 423-435.
КБ. IJoeapoea
Lu—Y. ЛЮТЕЦИЙ—ИТТРИЙ
Диаграмма состояния Lu—Y экспериментально не построена.
Однако Y и Lu в металлическом состоянии имеют идентичное элек-
электронное строение с тремя коллективизированными валентными dls2
электронами, одинаковую плотную гексагональную структуру типа
Mg с близкими постоянными решетки и атомными радиусами, отли-
отличающимися на 3,8 %. Сведения о кристаллической структуре Lu и
Y приведены в табл. 132.
284
Lu-Y
Таблица 132. Кристаллическая структура и полиморфное превращение
элементов системы Lu—Y
Атомный
номер,
элемент
39, Y
71, Lu
Моди-
фи-
фикация
«Y
PY
—
Прото-
Прототип,
структу-
структура
Mg, ГПУ
W, ОЦК
Mg, ГПУ
Параметры ре-
решетки, нм
а
0,36482
0,411
0,35052
с
0,57318
-
0,55494
Темпера-
Температура
превра-
превращения,
°С
1522
1478
1663
1790
Реакция
Ж- PY
aY - pY
Ж -Lu
Жту ¦ Жоцк
Источ-
Источник
[1]
[1]
U]
[2]
Можно предположить, что Lu с Y образуют непрерывные ряды
твердых ГПУ растворов, близких к идеальным. Lu в отличие от
большинства редкоземельных металлов вблизи температуры плавле-
плавления не имеют высокотемпературной модификации ОЦК [1]. Однако
в жидком состоянии при температуре 1790 °С он испытывает соответ-
соответствующее изменение ближнего порядка [2]. В приближении идеаль-
идеальных растворов линии ликвидуса — солидуса и ликвидуса— солвуса
сливаются в две пересекающиеся прямые, позволяющие определить
точку их пересечения при температуре 1-570 °С и содержащие 73 %
t,°c
1663
rsoo
Yf V. (по массе)
20 30 4-0 SO SO 70 80 90 WO
WOO
О 1
О
(lu.aY)
(Л У)
JSZZ°
/4 78'
го JO
Lu
Рис. 140. Lu-Y
40 SO SO 70 SO 90 ГОО
Y. <V. (am.) Y
Lu-Y, Lu-Yb
285
(ат.) Y. Такую диаграмму можно представить как перитектическую
(рис. 140). Твердые растворы на основе ОЦК структуры pY содержат
до 27 % (ат.) Lu. Вследствие существенного различия атомных
радиусов и небольшого отклонения растворов от идеальных, линии
ликвидуса — солидуса и ликвидуса—солвуса разделяются.
Литература
1. Gschneidner, Jr., K.A., Calderwood F.W. // Handbook on the Physics and Chemis-
Chemistry of Rare Earths Amsterdam. New York. Oxford. Tokyo: North-Holland Physics Publis-
Publishing Co., 1986. V. 8. Chap. 54. P. 1-161.
3. Григорович В.К., Григорович К.В. // Строение и свойства металлических и
шлаковых расплавов: Тезисы докл. на VII Всесоюзной конкуренции. Челябинск: ЧПИ,
1990. Т.2. № 2. С.250-252.
В.К. Григорович
Lu—Yb. ЛЮТЕЦИЙ—ИТТЕРБИЙ
Диаграмма состояния Lu—Yb приведена на рис. 141 по данным
работы [1]. Температуры плавления и полиморфных превращений
чистых компонентов приняты согласно существующим стандартам.
Yb,
20
(по массе)
60
t,°c
1700
1600
15OO
tuoo
гзоа
1ZOO
1100
1000
900
800
750°
500
80
100
1663°
(Lu)
ж
(Lu) + Ж I
"ч
Iff
Г
1
I
/
\б.5
Л?
—,
/
/
п
(СиЛ
Uu) +
/
1
Ж1 + Жz
I
1530°
Ж
/1
/ 8Z0°
1
\
\
\
\
\
\
\
(ЯГЬ)
1 Ч
ч—^^
(aYbJ —-
819°
О
La
10
ZO SO
SO 60
Yb, °/o (am)
70
80
90
WO
Yb
Phc. HI. Lu-Yb
286
Lu-Yb, Lu-Zn
В соответствии с этим были скорректированы температуры нонвари-
антных превращений. Сплавы получены в танталовых тиглях с
заваренной крышкой. Тигель нагревали в индукционной печи при
температуре 1500 °С на протяжении 1 ч и охлаждали. Отжиг выпо-
выполняли в эвакуированных кварцевых ампулах при температуре 850 °С
на протяжении 24 ч с последующей закалкой.
В качестве исходных компонентов использовали Lu и Yb, содержа-
содержащие не более 0,008 % (по массе) неметаллических примесей.
Исследование выполняли методами дифференциального термичес-
термического, микроскопического, рентгеноструктурного и химического
анализов.
Двойные соединения в исследованной системе отсутствуют. При
температуре выше 1530 °С наблюдается довольно обширная область
несмешиваемости компонентов в жидком состоянии. В системе пред-
предположительно протекают перитектическое Ж + (Lu) ** (pYb) и пери-
тектоидное ((JYb) + (Lu) * (aYb) превращения. Растворимость Yb в
(Lu) при температуре 1530 °С составляет -15 % (ат.). Lu практичес-
практически нерастворим в (Yb).
Литература
1. Beaudry B.J., Spedding F.H. // Met. Trans. 1974. V. 5. № 7. P. 1631-1636.
Е.И. Гладышевский, О.И. Бодак, В.К. Печорский
Lu—Zn. ЛЮТЕЦИЙ-ЦИНК
Диаграмма состояния Lu—Zn не построена. В системе образуется
ряд соединений, сведения о кристаллической структуре которых
приведены в табл. 133 по данным справочника [V-C].
Таблица 133. Кристаллическая структура соединений системы Lu—Zn
Соединение
LuZn
LuZn2
Прототип
CsCl
CeCu2
Символ
Пирсона,
пр.гр.
сР2,
РтЪт
оЛ2,
Imma
Параметры решетки, нм
а
0,3491
0,4416
Ь
0,6866
с
0,7600
Lu—Zn, Lu—Zr, Mg—Mn
287
Соединение
LuZn3
Lu6Zn23
Lu,3Zn58
LuZn5
Lu2Zn,7
Lu2Zn,7
LuZn,2
Прототип
YZn3
Th6Mn23
Gd,3ZnJ8
ErZn5
Th2Zn17
Th2Ni,7
ThMnt2
Символ
Пирсона,
пр.гр.
оЯ16,
Рпта
сЛ 16,
Fmbm
ЛЯ142,
Р63тс
ЛЯ36,
Р63/ттс
Ш9,
R3m
' ЛР38,
Р63/ттс
г/26,
IAlmmm
Параметры решетки, нм
а
0,6650
1,263
1,409
0,8811
0,8920
0,8925
0,8831
Ь
0,4300
—
-
-
—
-
—
с
0,9974
—
1,389
0,9139
1,3096
0,8738
0,5179
ЕМ. Гладышевский, О.И. Бодак, В.К. Печарскип
Lu-Zr. ЛЮТЕЦИЙ-ЦИРКОНИЙ
Диаграмма состояния Lu—Zr не построена. На основании данных
металлографического анализа установлено, что Lu повышает темпе-
температуру aZr « pZr превращения от 863 до 932 °С (температура пери-
тектоидной реакции) [Э]. Максимальная растворимость Lu в aZr и
PZr равна соответственно 4,9 и 2,1 % (ат.) [Э].
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
Mg-Mn. МАГНИЙ-МАРГАНЕЦ
Диаграмма состояния Mg—Mn исследована в области концентра-
концентраций, примыкающей к Mg [X, 1—8]. Сплавы с высоким содержанием
Мп -3,5 % (ат.) получить путем сплавления компонентов не уда-
удалось. На рис. 142 диаграмма состояния Mg—Mn приведена по данным
работы [1], авторы которой обобщили данные работ [2—8]. Со сторо-
стороны Mg в системе имеет место нонвариантное превращение, темпера-
температура которого близка к температуре плавления Mg, так что тип прев-
288
Mg-Mn
L
t,"C
800
700
65$
600
500
400
1 1
1
(мд)
1
Мп, % (no
г з
/к
0,9/
/
1
/
/
653
f.03
(мд)*
массе)
t
т'
5
1
¦(рМл)
> Х+ (а Мп)
"а Мп)
О 0,5
мд
Рис. 142. Mg-Mn
' 1,5
Мп,'/. (am.)
Z.5
ращения определялся как эвтектический или перитектический в
зависимости от того, ниже или выше температуры плавления Mg
оказывалась температура нонвариантного превращения [X, 1]. Согласно
последним согласующимся между собой данным работ [2-4] нонвариан-
тное превращение является перитектическим и протекает при температу-
температуре 653 °С (на 3° выше температуры плавления Mg). Это же значение
температуры перитектического превращения принято в работе [1].
В равновесии с твердым раствором на основе Mg находится
практически чистый Мп [1, 8]. Учитывая полиморфное превращение
рМп -* аМп, на диаграмме проведена линия нонвариантного превраще-
превращения при температуре 727 °С.
Значение растворимости Мп в жидком Mg при температуре
перитектического превращения по данным различных работ [1, 2, 5, 6]
хорошо согласуется между собой и составляет 0,9 % (ат.) или 2 % (по
массе). Значения растворимости Мп в жидком Mg при более высоких
температурах расходятся между собой до-0,5 % (ат.) при 750-850 °С.
Кривая растворимости Мп в жидком Mg показана на рис. 142 по данным
работы [2], результаты которой являются предпочтительными и
согласуются с данными ряда других работ.
Mg-Mn. Mg-Mo 289
Растворимость Mn в (Mg) приведена по данным работы [3], значения
которой хорошо согласуются с данными работы [2]. При отдельных
температурах растворимость Мп в (Mg) приведена ниже:
Температура, °С. 653 630 600 570 530 500 400 300
Растворимость Мп.
%(ат) 1,03 0,85 0,71 0,58 0,39 0,30 0,11 0,053
%(по массе) 2,3 1,9 1,6 1,3 0,88 0,68 0,25 0,12
Согласно более ранней работе [7], максимальная растворимость Мп
в (Mg) (при 645 °С), определенная рентгеновским методом составляет
1,5 % (ат.) или 3,4 % (по массе). Однако данные работы [7] менее
предпочтительны, так как рентгеновский метод, использованный в этой
работе, при малой растворимости менее точен, чем метод электросопро-
электросопротивления, использованный в работе [3].
Литература
1 Nayeb-Hashemi A.A., Clark J.B. // Bull. Alloy Phase Diagrams. 1985. V. 6. N 2.
P 160-164
2 Петров Д.А., Миргаловская M.C., Стрельникова И.А., Комова Э.М. // Труды
Института металлургии им. А.А. Байкова АН СССР. М.: Изд-во АН СССР. 1957.
Вып. 1. С. 142-143
3 Дрии М.Б., Свидерская З.А., Рохлин ЛЛ. // Исследования металлов в жидком и
твердом состояниях Сб. статей. М.: Наука. 1964. С. 272—278.
4 Schneider A., Stobbe-Scholder Н. // Metall. 1950. Bd. 4. N 9/10. S. 178-183.
5 Grogan J.D., Haughton J.L. // J lnst. Metals. 1943. V. 69. P. 241-248.
6 TinerN.//Trans. AIME. 1945 V. 161. P. 351-359.
7 Schtnid E., Siebel G. // Metallwirtschaft. 1931. Bd. 10. N 49. S. 923-925.
8 Дрии М.Е., Свидерская З.А., Рохлни Л Л. // Металловедение и термическая обработка
металлов 1959 N 10 С 33-37.
Л.Л Рохлин
Mg-Mo. МАГНИЙ-МОЛИБДЕН
Диаграмма состояния Mg-Mo не построена. Мо не сплавляется с Mg.
При температурах до 1000 °С какого-либо растворения Мо в Mg не
обнаружено. Имеются указания о получении сплава Мо с 0,009 % (по
массе) Mg, но они вызывают сомнения. Mg в качестве раскислителя Мо
не эффективен [X, Ш].
Л.Л. Рохлин
290
Mg-N, Mg-Na
Mg-N. МАГНИЙ-АЗОТ
Диаграмма состояния Mg-N не построена. Согласно сведениям,
приведенным в работах [X, Э], в системе Mg-N образуется соединение
Mg3N2, существующее в трех модификациях, обозначаемых а, Р, у с
превращениями при температурах 550 и 788 °С. При температуре около
1520 °С Mg3N2 диссоциирует. Одна из модификаций Mg3N2 имеет
кристаллическую структуру типа Мп2О3 (символ Пирсона с180, пр. гр.
/аЗ) с параметром решетки а - 0,9964 нм [V-C]. Предполагается, что эта
модификация является низкотемпературной.
Л.Л. Рохлин
Mg-Na. МАГНИЙ-НАТРИЙ
Представленная на рис. 143 диаграмма состояния Mg-Na построена
в работе [1] по обобщенным данным работ [X, 2]. Диаграмма состояния
Mg-Na характеризуется значительной областью несмешиваемости в
жидком состоянии и отсутствием промежуточных фаз. В системе имеют
место два нонвариантных превращения. Одно из них, монотектическое,
t,'C
800
100.
650
600
500
400
300
ZOO
100
Ма,%(по массе)
О 10 Z0 30 *0 50 60 10 ВО 90 tOO
"Г
J
¦Z 1-
*-(M9)
Ж,
97,7
I
*ж;
637'
m
1
S2.7\
>9
\
\
\
1
%95,
(Ma)-*
91,8'
0 10 ZO 30 40 50 60 10 80 90 100
мд /fa, Vo (am.) Na
Рис. 143. Mg-Na
Mg-Na. Mg-Nb, Mg-Nd 291
проходит при температуре 637 °C [1,2], по данным работы [X] при 638 "С.
Монотектическая горизонталь простирается от 2,1 до 92,7 % (ат.) Na или
от 2,0 до 92,3 % (мае). В более раннем исследовании [X] для монотекти-
ческой точки определена концентрация Na, равная 98,6 % (ат.) [98,5 %
(по массе)].
Эвтектическое превращение проходит при температуре 97,7 °С,
практически совпадающей с температурой плавления Na. Эвтектическая
точка находится при содержании Na более 99,95 % (ат.) [1]. Теоретические
расчеты дают растворимость Na в (Mg) при температуре 637 "С около
0,5 % (ат.) или 0,47 % (по массе) [1).
Литература
1. Pelton A.D. // Bull. Alloy Phase Diagrams. 1984. V. 5. N 5. P. 454-456, 533-534.
2 Klemm W., KunzeD.//Proc Intern. Symp. on Alkali Metals. London Chem. 1967. Soc.
Special Publ., No. 22. P. 3-22.
Л.Л. Рохлин
Mg-Nb. МАГНИЙ-НИОБИЙ
В работе [1] установлено, что Mg и Nb практически не сплавляются.
Mg понижает температуру плавления Nb до 2380 "С. Согласно работе
[1] наблюдается некоторая растворимость MgB (Nb), которая составляет
0,20 % (ат.) или 0,05 % (по массе) при температуре 2380 "С и 0,16 % (ат.)
или 0,04 % (по массе) при 20 °С. Nb практически не растворим в (Mg) [1].
Литература
1. Савицкий Е.М., Барон В.В., Ефимов Ю.В., Бычкова 1У1.И. // Тр. Ин-та металлургии
им. А.А. Байкова АН СССР М.: Изд-во АН СССР, 1963. Вып. 14. С. 139-146.
Л.Л. Рохлин
Mg-Nd. МАГНИЙ-ЙЕОДИМ
Диаграмма состояния Mg-Nd, представленная на рис. 144, построена
по данным работ [1, 2] до концентрации Nd, соответствующей соедине-
соединению MgjNd, и по данным работы [3] в остальной концентрационной
области диаграммы.
Диаграмма состояния Mg-Nd характеризуется образованием
нескольких соединений: Mg12Nd, Mg4jNd5, Mg3Nd, Mg2Nd и MgNd
[1-12]. Формулы всех соединений приняты согласно рентгенографичес-
292
Mg-Nd
ОТО W50 60 70
Nd,'/o(no массе)
80 90
100
ZOO
о to
Mg
Рис. 144. Mg-Nd
го
30
«0 50 60
Nd,V.(am.)
70
80
90
100
Nd
ким исследованиям. Ранее для ближайшего к Mg соединения принималась
формула Mg9Nd P, 1]. Состав, соответствующий этой формуле, был
близок к составу наблюдаемой на шлифах фазы в богатых Mg сплавах
[1]. Однако в более поздних работах от формулы Mg9Nd отказались, как
не соответствующей рентгенографическим исследованиям.
Со стороны Mg в системе имеет место эвтектическое превращение
Ж •* (Mg) + Mg12Nd, которое согласно работам [1, 2], протекает при
температуре 552 "С. В более ранних работах для эвтектического
превращения со стороны Mg указывали температуры 548 и 546 °С [Э].
Концентрация Nd в эвтектике со стороны Mg согласно работе [1]
составила 7,6 % (ат.) [33 % (по массе)] Nd. В более ранних работах для
эвтектической точки приводятся значения концентраций 5,3-6,2 % (ат.)
[25-28 % (по массе)] Nd [4]; 1,7 % (ат.) [9,2 % (по массе)] Nd |Э]. Последнее
значение явно ошибочно. Строение диаграммы состояния между
эвтектической точкой со стороны Mg и -10,1 % (ат.) [40 % (по массе)] Nd
показано без масштаба на вставке в левом углу. Оно основывается
главным образом на наблюдениях микроструктуры [2]. Согласно этим
данным соединение Mg12Nd плавится конгруэнтно и распадается по
звтектоидной реакции на (Mg) и Mg41Nd5. К соединению Mg^Nd
примыкают два эвтектических превращения. Различия в температурах
обоих превращений и температуре кристаллизации соединения Mgl2Nd
Mg-Nd 293
установить не удалось. Они все оказались близкими к 552 "С. Температу-
Температура эвтектоидного распада соединения Mgj 2Nd составляет значение выше
530 °С. Концентрация эвтектической точки между Mgi2Nd и Mg4iNd5
- 9,2 % (ат.) [37,5 % (по массе)] Nd [2].
В работе [3] указано, что соединение Mg,2Nd образуется только в
образцах, закаленных из жидкого состояния.
Соединение Mg41Nd5 образуется по перитектической реакции из
жидкой фазы и Mg3Nd при температуре 560 "С.
Соединение Mg3Nd плавится конгруэнтно при температуре 744 °С
[1, 2]. Согласно данным работы [3] температура плавления Mg3Nd
составляет 780 °С, эта температура и принята на диаграмме (рис. 144).
Характер микроструктуры сплавов с некоторым избытком Mg по
сравнению со стехиометрическим составом указывает на наличие
растворимости Mg в соединении Mg3Nd, уменьшающейся с понижением
температуры [1, 2].
Соединение MgjNd образуется по перитектической реакции из жидкой
фазы и Mg3Nd при температуре, несколько превышающей 750 °С, и
эвтектоидно распадается на Mg3Nd и MgNd при температуре 660 °С.
Соединение MgNd плавится конгруэнтно при температуре 800 °С и
участвует в двух эвтектических превращениях. Одно из них Ж •* Mg^Nd +
+ MgNd проходит при температуре 750 °С и концентрации Nd в
эвтектической точке - 35,5 % (ат.), другое превращение Ж ** MgNd +
+ (pNd) - при 775 "С и 57,5 % (ат.) Nd.
Установлено, что со стороны Nd в системе имеет место эвтектоидное
превращение, связанное с полиморфизмом Nd. Это превращение
протекает при температуре 551 °С по данным работы [10] либо при
545 °С и концентрации 83 % (ат.) Nd [3].
Растворимость Nd в (Mg) наиболее подробно была изучена в работах
[1,13], в которых был применен наиболее подходящий для этой системы
метод электросопротивления. Значение растворимости Nd в (Mg)
приведено ниже по данным работ [1, 13]:
Температура, °С 552 540 500 400 300 200
Растворимость Nd:
%(ат.) 0,63 0,55 0,38 0,12 0,027 0,013
% (по массе) 3,6 3,2 2,2 0,70 0,16 0,08
В работе [4] получено меньшее, но близкое значение для максимальной
растворимости Nd в (Mg) - 0,31-0,34 % (ат.) [1,8-2 % (по массе)].
Растворимость Mg в (aNd) составляет 8,2 % (ат.) [1,5 %{по массе)] при
температуре эвтектоидного превращения 551 "Си снижается до -1,9 %
(ат.) [0,33 % (по массе)] при 200 °С [10].
294
Mg-Nd
Сведения о кристаллической структуре соединений приведены в
табл. 134.
Таблица 134. Кристаллическая структура соединений системы Mg-Nd
Соедине-
Соединение
Mg|2Nd
Mg4|Nd5
Mg3Nd
Mg'2Nd
MgNd
Прототип
Mgl2Th
Mg4lCe5
BiF3
¦ MgCu,
CsC!
Символ
Пирсона,
пр. гр.
Г/26,
/4 / ттт
t/92,
/4/m
cFlb,
Fmim
cFIA,
Fdlm
cP2,
РтЪт
Параметры решетки, нм
а
1,031
1,4741
0,737
0,741
0,7397
0,8662
0,3867
0,3881
с
0,593
1,0396
-
—
-
Источник
[3, 6, 8]
[2, 3, V-C]
[3, 7, V-C]
И
[12]
[3, 9, V-C]
[3, 5, V-C]
[И]
Литература
1. Дриц М.Е., Свидерская З.А., Рохлин ЛЛ. // Металлургия, металловедение, физико-
химические методы исследования: Сб. статей. М.: Изд-во АН СССР, 1962. N 2.
С. 126-130.
2. Рохлин ЛЛ. Магниевые сплавы, содержащие редкоземельные металлы. М.: Наука,
1980. 192 с.
3. Delfino S., Saccone A., Ferro R. // Metall Trans A. 1990. V. 21. P. 2109-2114.
4. Савицкий Е.М., Терехова В.Ф., Новикова И.А. // Журнал неорганической химии.
1958. Т. 3N 9 С 2138-2142.
5. landelli A. // The Physical Chemistry of Metallic Solutions and Intermetallic Compounds:
Proceedings of Symposium 4-6 June. 1958. London. National Physical Laboratory. 1958.
V. 1.N3F. P. 1-11.
6. Евдокимеико В.И., КрипикевичП.И. // Кристаллография. 1963. Т. 8. N 2. С. 186-193.
7. Крипякенич П.И., Евдокимеико В.И. // Вопросы теории и применения редкоземель-
редкоземельных металлов: Сб. статей. М.: Наука, 1964. С. 146-148.
8. Лашко Н.Ф., Морозова Г.И. // Заводская лаборатория. 1964. N 10. С. 1187-1189.
9. Евдокименко В.И., Крипякевич П.И.// Кристаллография. 1964. Т. 9. N4. С. 554-556.
10. Joseph R.R., Gschneidner Jr., K.A. // Trans. Metallurg. Soc. AIME. 1965. V. 233 N 12.
P. 2063-2069.
11. landelli A., Palenzona A. // J. Less-Common Met. 1965. V. 9. N I. P 1-6.
12 Buschow K.H.J. // J. Less-Common Met. 1976. V. 44. N 1. P. 301-306.
13 Рохлин Л.Л. // Нзв АН СССР. Металлургия и топливо. 1962. N 2. С. 126-130.
Л.Л. Рохлин
Mg-Ni
295
Mg-Ni. МАГНИЙ-НИКЕЛЬ
Впервые диаграмма состояния Mg-Ni была построена в работе [1] на
основании данных термического анализа. Определено существование
двух соединений Mg2Ni и MgNi2 и сделано предположение, что в области
сплавов, содержащих от 55,4 до 70,1 % (ат.) Ni имеется расслоение и
соединение MgNi2 образуется в результате взаимодействия двух
жидкостей. Для соединения Mg2Ni установлен инконгруэнтный характер
плавления при температуре 768 °С. В системе протекают два нонвариан-
тных превращения эвтектического типа при температурах 512 и 1082 °С
и нонвариантное превращение перитектического типа при 768 "С.
Данные этого исследования были подтверждены в работах [2-4] за
исключением существования области несмешиваемости. В работах [3, 4]
определено, что соединение MgNi2 плавится конгруэнтно.
На рис. 145 приведена обобщенная в работе [5] диаграмма состояния
Mg-Ni. При этом область концентраций от 0 до 34 % (ат.) построена по
данным работы [2], область концентрации от 80 до 100 % (ат.) Ni - по
данным работы [1]. Линии ликвидуса для соединения MgNi2 построены
по данным термодинамического расчета, основанного на результатах
Ni,%Cno массе)
0 10 20 30 4-0 50 60 70 80 90
100
14-00
1200
/000
800
600
400
700
i i
650'
N
1
/
tu
1 I
506'
*
Ж
/
0
t
1
. 7f!0'
*
6
MffA
i
• mr
-те
i
\\67J 80,3
1
(Ni)-
1*55'
О 10 20 30 W 50 60 10 B0 90 /00
Mg Ni,'/o(am.) Ni
Рис. 145. Mg-Ni
296
Mg-Ni
исследований [1,2,4]. Авторы работы [5] отмечают, что при изображении
диаграммы Mg-Ni ими не учитывались данные наиболее поздней работы
[6], так как диаграмма состояния, приведенная в этой работе, находится
в противоречии с правилом фаз. Как следует из диаграммы состояния
(рис. 145), соединение Mg2Ni образуется по перитектической реакции при
температуре 760 °С согласно работам [2, 4, 5], а соединение Mg№2
плавится конгруэнтно при 1147 "С и имеет узкую область гомогенности
при содержании Ni от 66,2 до 67,3 % (ат.) [4, 5]. Проходящие в системе
нонвариантные превращения указаны в табл. 135.
Таблица 135. Нонварнантные реакции в системе Mg-Ni |5)
Реакция
Ж - (Mg) + Mg2Ni
Ж - MgNi2 + (Ni)
Ж + MgNi2- Mg2Ni
Содержание Ni в фазах, %
(ат.)
11,3; 0; 33,3
80,3; 67,3; -100
29,0; 66,2; 33,3
Температура, °С
506
1097
760
Растворимость Ni в (Mg) очень мала и составляет при 500 °С менее
0,04 % (ат.) [2]. Растворимость Mg в (Ni) также незначительна и
составляет при 1100 "С менее 0,24 % (ат.) [X].
Кристаллическая структура соединений приведена в табл. 136.
Таблица 136. Кристаллический структура соединений системы Mg-Ni
Соединение
Mg2Ni*
MgNi2
Прототип
_
Mg№2
Символ Пир-
Пирсона, пр. fp.
hP\b,
Р6222
hPU,
Р631 ттс
Параметры решетки, им
а
0,519
0,5212
0,4814
0,4824
0,4833
0,4814
0,4812
0,4834
0,4825 A)
Структура Mg2Ni родственна структуре А12Си.
с
1,321 F)
1,3247
1,5798
1,5826
1,5855
1,580
1,585
1,5798
1,5827E)
Источник
[5, 7, V-C]
И
[5, 7, V-C]
[4]
И
[9]
[Ю1
[П]
[12]
Mg-Ni, Mg-O
297
Литература
1. VossG.//Z. Anorg. Chem. 1908. Bd. 57. N l.S. 34-71.
2. Haughton J. L., Payne R.J. // J. Inst. Met. 1934. V. 54. N I. P. 275-283.
3. Lieser K.H., Witte H. // Z. Metallkunde. 1952. Bd. 43. N 10. S. 396-401.
4. Bagnond P., Feschotte P. IIZ. Metallkunde. 1978. Bd. 69. N 2. S. 114-120.
5 Nayeb-Hashemi A.A., Clark J.B. // Bull. Alloy Phase Diagrams. 1985. V. 6. N 3.
P. 238-244.
6. Melo Tadeu A.A., Mnller A. // Metallurgia ABM. 1980. V. 36. N 269. P. 253-259.
7 Schubert K., Anderko K.//Z. Metallkunde. 1951. Bd. 42. S. 321-325.
8 Bnschow K.H.J. //Solid State Commun. 1975. V 17. N 7. P. 891-893.
9. Laves F., Witte H. // Metallwirtschaft. 1935. Bd. 14. N 33. S. 645-649.
10. Bachmetev E.F. // Metallwirtschaft. 1935. Bd. 14. N 49. S. 1001-1002.
11. Komura Y., Mitarai M., Nakaue A., Tsnjimoto S. // Acta Crystallogr. 1972. V. B28. N 3.
P. 976-978.
12. OhbaT.//J. Sci. Hiroshima Univ. 1984. V. 48. N 1. P. 1-22.
Т.В.Добаткина
Mg-O. МАГНИЙ-КИСЛОРОД
Диаграмма состояния системы Mg-O в области концентраций 0-50 %
(ат.) О представлена на рис. 146 согласно работе [1]. На диаграмме
схематично нанесены две ветви ликвидуса вблизи Mg и MgO. В работе
[1] высказывается предположение, что в указанной области составов
О, % (по массе)
t,L
2500
2000
1500
1000
чпп
1
|
•650'
—(Mff)
10
1
го
i
~650'
JO
Ж
2827tJD
MgO-~
0
Mg
Рис. 146. Mg-O
10
20
0,°'
JO
'o (am.)
50
298
Mg-O
протекает монотектическая реакция при температурах выше температуры
кипения Mg (при давлении 0,1 МПа).
В системе установлено существование следующих окислов магния:
MgO, MgO2, MgO4 и Mg2O (на рис. 146 указана только окись MgO). MgO
имеет узкую область гомогенности, причем отклонение от стехиометрии
влияет на цвет MgO [2]. Результаты определения температуры плавления
MgO противоречивы: приводятся значения от 2805 [3] до 2857 °С [4].
Наиболее современные данные находятся в хорошем соответствии друг
с другом: 2832130° [5], 2826130° [6], в работе [1] принято значение
2827130 °С.
Протяженность области гомогенности двуокиси магния MgO2
неизвестна. Из данных работы [7] следует, что в решетке двуокиси магния
от 2 до 5 % (по массе) ионов MgO2 замещено ионами MgO4.
Окисел MgO4 был впервые получен в чистом виде в работе [8], он
неустойчив при температуре выше 30 °С (при атмосферном давлении)
[9].
О существовании окисла Mg2O сообщалось в работе [10]. Mg2O был
обнаружен в виде черного слоя на границе между Mg и наружным слоем
MgO при окислении Mg с ограниченным доступом О2 E80 °С), а также
в результате нагрева Mg с MgO в запаянной ампуле при 1500 °С.
Кристаллическая структура соединений приведена в табл. 137.
Таблица 137. Кристаллическая структура соединений системы Mg-O
Соединение
MgO
MgO2
MgO4*
Mg2O**
Прототип
NaCl
FeS2
(пирнт)
-
-
Символ Пир-
Пирсона, пр. гр.
сП,
Fmim
с? 12,
Pal
-
-
Параметры решетки, нм
а
0,42117B)
0,4839 G)
1,144
-
с
-
-
1,26
-
Источник
[1,11,12]
[1, 13]
[1, U]
[1, Ю]
'Гексагональная сингония или ромбоэдрическая сингония со = 0,788 и « = 93° при
температуре- 196 °С.
Возможно кубическая сиигоиия.
Mg-Mn, Mg-Os, М-Р 299
Литература
1. Wriedt H.A. // Bull. Alloy Phase Diagr. 1987. V. 8. N 3. P. 227-233.
2 Weber H. IIZ. Phys. 1951. V. 130. P. 392-402.
3. Schneider S.J. // Natl. Bur. Stand. (U. S.) Monograph 68. 1963. P. 18-19.
4 Riley B. // Rev. Int. Hautes. Temp. Refract. 1966. V. 3. P. 327-336.
5 Chase Jr., M.W., Curnutt J.L., Me Donald R.A., Syverud A.N. // J. Phys. Chem. Ref.
Data. 1978. V. 7. N 3. P. 793-940.
6 Hlavac J. // Pure Appl. Chem. 1982. V. 54. N 3. P. 628-688.
7. Vannerberg N.-G. // Progr. Inorg. Chem 1962. V. 4. P. 125-197.
8 Вольнов И.И., Токарева С.А., Латышева Е.И., Климанов В.И. // Изв. АН СССР.
Серия химическая. 1967. N 10. С. 2365.
9. Вольнов И.И., Токарева С.А., Белевский В.Н., Латышева Е.И. // Изв. АН СССР.
Серия химическая. 1970. N 3. С. 513-516.
10 Petra F., Brozek V., Hajek В.//Collect. Czech. Chem. Commun 1966. V. 31. P. 921-927.
11 Skinner B.J. // Am Mineral. 1957. V. 42. P. 39-55.
12. Budworth D.W. II). Br. Ceram. Soc. 1967. V. 4. N 4. P 481-483.
13 Vannerberg N.-G. //Arkiv. Kemi 1959. V. 14. N 10. P. 99-105.
14 Бакулина В.М., Токарева С.А., Латышева Б.И., Вольиов И.И. // Журнал
структурной химии. Т 11 N 1. С. 158-159.
В.П. Полякова
Mg-Os. МАГНИЙ-ОСМИЙ
Указывается, что Os легко сплавляется с Mg, эвтектика наблюдается
вблизи чистого Mg [1].
Литература
1. Sauerwald F. // Z. Anorg Chem. 1949. V. 258. P. 269-300.
В.П. Полякова
Mg-P. МАГНИЙ-ФОСФОР
Диаграмма состояния Mg-P не построена. В сплавах системы Mg-P
образуются соединения Mg3P2 [1-3] и MgP4 [4-6]. Соединение MgP4
получали при взаимодействии газообразного Р с Mg3P2 при температуре
600 °С в герметичной кварцевой трубке [4] или путем нагрева магниевой
проволоки с красным Р в присутствии следов серы или йода в качестве
катализатора [5]. Взаимная растворимость элементов отсутствует.
Кристаллическая структура соединений указана в табл. 138.
300
Mg-P, Mg-Pb
Таблица 138 Кристаллическая структура соединений системы Mg-P
Соеди-
Соединение
Mg3P2
MgP4
Про-
Прототип
Мп2О3
CdP4
Символ
Пир-
Пирсона,
пр гр
с/80,
1а Ъ
тРЮ,
Р2х1с
Параметры решетки, им
а
1,203
1,201
0,515-0,5131
0,5144
Ь
0,510-0,5090
0,5085
с
0,750-0,7476
0,7526
Примечание
[1]
[2]
Р=81,17°[4]
Р=98,66° [5]
Литература
1 StackelbergM.V., PaulusR.//Z Phys Chem 1933 Bd B22 S 305-322
2 Zintl E., Husemann E IIZ Phys Chem 1933 Bd B21 S 138-155
3 Nayeb-HashemiA.A., Clark J.B //Bull Alloy Phase Diagrams 1985 V 6 N 3 P 244-245
4 Maslout A., Zame M., Jeannot F., Gleitzer С // J Solid State Chem 1975 V 14 N 1
P 85-90
5 Schnering H.G., MengeG HZ Anorg Chem 1976 Bd 422 N 3 S 219-225
6 Gerardin R., Aubry J //Acta Crystallogr В 1977 V 33 P 2091-2094
ТВ Добаткина
Mg-Pb. МАГНИЙ-СВИНЕЦ
На рис. 147 приведена диаграмма состояния Mg-Pb, построенная
авторами работы [1] на основании данных работ [X, 2,3, 5-7].
Исследования были проведены методами дифференциального
термического, рентгеновского, металлографического анализов,
измерения электросопротивления и твердости Диаграмма состояния
Mg-Pb характеризуется наличием одного соединения Mg2Pb, которое
плавится конгруэнтно при 549,5±1 "С.
В литературе имеются противоречивые данные относительно
существования в системе Mg-Pb еще одного соединения, так называемая
фаза Р' при содержании 35 % (ат.) РЬ [4] Согласно работе [4] Mg2Pb
образуется по перитектической реакции при температуре 538,2 "С, а фаза
Р' плавится конгруэнтно при 549 "С и при температуре 291 °С распадает-
распадается на Mg2Pb и расплав, обогащенный РЬ.
Авторы работы [5], анализируя свои экспериментальные данные по
определению теплоты образования соединения Mg2Pb, также допускают
возможность существования еще одной фазы в системе Mg-Pb, помимо
Mg2Pb Однако, на основе обзора литературных данных, проведенного
Mg-Pb
301
Pb, % (по массе)
02М05060 70 80 90 100
Щ
600\
OU0
*00
300
200
100
\
\
с
А
Нр.7 19,1
/
i
ft
\
9.5
tf"
i
Ж
ч
ч
'2*8,7"
ч
X
J27,5
93 ~3*у
(nf\
W
0
My
Рис. 147.
10 20
Mg-Pb
JO 4
0 50
Pb, %
60
(am)
70
80
90
100
Pb
в работе [1], сделан вывод о существовании только одного соединения
в системе Mg-Pb, а именно, Mg2Pb Условия проведения эксперимента
в работе [4] позволяют авторам работы [1] предполагать, что фаза Р'
является либо оксидом, либо метастабильной фазой, которая не может
быть нанесена на равновесную диаграмму состояния системы Mg-Pb.
Соединение Mg2Pb участвует в двух эвтектических равновесиях Ж -
- (Mg) + Mg2Pb при температуре 466,2 "С и содержании Pb в эвтектичес-
эвтектической точке 19,1 % (ат) и Ж « Mg2Pb + (Pb) при 248,7 "С и 83 % (ат ) Pb.
Кривая растворимости Pb в (Mg) на рис. 147 приведена согласно
данным работы [7], которым авторы работы (X, 1] отдают предпочтение
Растворимость Pb в (Mg) при эвтектической температуре составляет 7,7 %
(ат ) [41,7 % (по массе)], а при 200 "С - 0,5 % (ат.) [4 % (по массе)]
Растворимость Mg в (Pb) приведена ниже, при этом данные работы
[6] получены на основании термического анализа, а данные работы [8]
по измерению твердости
Температура "С
Растворимость Mg
% (ат)
% (по массе)
Источник
248+1
6
0,7
[6]
248,5
4-8
0,5-1,0
[2]
245
5,6
0,69
И
220
4,1
0,5
[8]
150
2,2
0,26
[8]
302 Mg-Pb, Mg-Pd
Соединение Mg2Pb относится к типу CaF2 (символ Пирсона cF\ 2, пр.
гр Fm3m), параметры решетки а = 0,6798-0,6860 нм [X, 9, 10]
В работе [4] полагают, что фаза р' имеет ромбическую решетку с
параметрами а - 0,445, Ь = 0,750, с = 0,882 нм, хотя рентгенограмму фазы
Р' не удалось однозначно индицировать. Параметры решетки твердого
раствора на основе Mg изменяются от я = 0,32094 нм, с = 0,52106 нм для
чистого Mg до значений а = 0,32138 нм, с = 0,52420 нм для сплава с
содержанием 6,2 % (ат.) РЬ [11]
В работе [5] измерена теплота образования соединения Mg2Pb и
рассчитаны некоторые его термодинамические свойства при 298 К.
Литература
1 Nayeb-Hashemi A.A., Clark J.B. // Bull Alloy Phase Diagrams 1985 V 6 N 1 P 56-66
2 Horsley G.W., Maskrey J.T. //J Inst Metals 1957-1958 V 86 N 10 P 446-448
3 Dobovisek В., Paulin A.//Rud-Metal Zb 1965 N3-4 P 373-387
4 EldridgeJ.M., Miller E., Komarek K.L.// Trans A1ME 1965 V 233 N 7 P 1303-1308
5 Beardmore P.. Howlett B.W., Lichter B.D., Bever M.B.//Trans AIME 1966 V 236 N 1
P 102-108
6 Graham CD. Jr., BurgoJ.A., Cooper J.M.etal //Metall Trans 1971 V 2 P 2964-2965
7 RaynorG.V.//J Inst Metals 1940 V 66 P 403-406
8 Курнаков Н.С., Погодин С.А., Вндусова Т.А. // Изв сектора физико-химического
анализа 1947 Т 15 С 74-79
9 EldridgeJ.M., Miller E., Komarek K.L.// Trans AIME 1967 V 239 P 775-781
10 RaynorG.V. //Science 1975 V 9 N9 P 430-431
11 Foote F., Jette E.R.// Trans AIME 1941 V 143 P 124-131
ТВ Добаткина
Mg-Pd. МАГНИЙ-ПАЛЛАДИЙ
Диаграмма состояния Mg-Pd построена авторами работы [1] во всей
области концентраций по результатам термического, металлографичес-
металлографического, рентгеновского анализов, а также измерения твердости и
плотности При исследовании использовали дистиллированный Mg и
Pd чистотой 99,9 % (по массе) Сплавы плавили в высокочастотной
индукционной печи в атмосфере гелия Согласно данным этих исследова-
исследований система характеризуется наличием пяти химических соединений
Mg6Pd, Mg4Pd, Mg3Pd, MgPd и Mg2Pd3 Четыре из указанных соединений
определены были и в других исследованиях Mg6Pd [2-6], Mg4Pd [2],
Mg3Pd [2, 4] и MgPd [2, 3, 7, 8] А существование соединения Mg2Pd3 при
содержании 60 % (ат) Pd не было подтверждено С другой стороны, в
приведенной в работе [1] диаграмме отсутствует соединение Mg5Pd2
(Mg2 7Pd) Оно установлено в работах [2, 3], причем, авторами работы
Mg-Pd
303
t:c
Pd, % (по массе)
01020 30 W 50 60 70 80 90
то
1200
woo
800
600
400
200
Ж
17Ш
W
V№IO°-
SUL
480'^-
\
<L
{pdj
kA
650°
~w\ i Г
J_
700tW
4
m:
—i
t
"(Mg)
—ti
BSJIjU
¦ ¦ lit»
ill
*
0
Mg
Рнс. 148.
10 20
Mg-Pd
JO
4-0
Pd,
50 60
7. (am)
70
во
90
WO
Pd
[3] проведен рентгеновский анализ образцов, которые были отожжены
при температуре 400 °С в течение трех недель и закалены в воде Также
авторы работы [1] не учитывают существование еще одного соединения
при содержании -50 % (ат) Pd, впервые установленного в работе [2] В
работе [7] этому соединению приписана формула Mg09Pd, j при
содержании 55 % (ат) Pd
В результате критического рассмотрения экспериментальных данных
авторы работы [9], используя результаты термического [1] и рентгенов-
рентгеновского [2, 7] анализов, приводят свой вариант диаграммы состояния
Mg-Pd (рис 148)
Из шести соединений, приведенных на диаграмме (рис 148), лишь
соединение Mg0 9Pd, | плавится конгруэнтно при температуре 1350 "С
[1, 9] Соединения MggPd, Mg4Pd и Mg3Pd образуются по перитектичес-
ким, а соединения Mg5Pd2 и MgPd по перитектоидным реакциям
Соединение Mg6Pd имеет область гомогенности при содержании Pd
от ~ 12,7 до -15 % (ат) [9]. В работе [2] сообщается, что соединение Mg4Pd
имеет узкую область гомогенности Соединение Mg3Pd имеет область
гомогенности при содержании Pd от -23,6 до -25 % (ат) [9] Область
гомогенности соединения Mg5Pd2 простирается от -25,5 до -28,6 % (ат)
Pd по данным работы [9], от 26,3 до 28 % (ат) Pd по данным работы [2]
304
Mg-Pd
или от 25 до 28,5 % (ат.) Pd по данным работы [3]. Соединение MgPd
имеет заметную область гомогенности от -46,85 до -53,5 % (ат.) Pd по
данным работ [7,9].
Нонвариантные реакции, проходящие в системе, указаны в табл. 139.
Таблица 13 9. Нонвариантные реакции в системе Mg-Pd
ж +
ж +
Ж+ V
Mg3Pd
MgjPd н
Ж-
Ж»
Реакция
Mg4Pd - Mg6Pd
Mg3Pd - Mg4Pd
lgo9Pdu - Mg3Pd
+ MgPd - Mg5Pd2
у Mg09Pd, , - MgPd
¦ (Mg) + Mg6Pd
Mg^Pd,, + (Pd)
Содержание Pd
в фазах % (ат.)
20;
-; -23; 6;
55;
25; -46,85;
25; 55;
-7,8; >0,23;
-63,7; 55;
11,3
20
25
-28,6
50
-12,7
-78,16
Температура,
°C
700
790
1130+10
-
700+10
540
1280
Источник
[2,9]
12,91
[2,9]
[9]
[2,9]
[2,9]
[91
Растворимость Pd в (Mg) очень мала [10]. По данным работы [I]
растворимость Pd в (Mg) при эвтектической температуре составляет
менее 0,23% (ат.) и при комнатной температуре не превышает 0,12% (ат.)
Pd. Растворимость Mg в (Pd) по данным работы [1] равна -21,84 % (ат.)
при эвтектической температуре и 18,73 % (ат.) при комнатной температу-
температуре.
Кристаллическая структура соединений указана в табл. 140.
Таблица 14 0. Кристаллическая структура соединений системы Mg-Pd.
Соединение
Mg6Pd*
Прототип
Символ
Пирсона,
пр. гр.
C-KJ96,
Fm Ът
Параметры решетки,
нм
а
2,0182
2,0108B)
с
-
Примечание
При содержании
12,87 %(aT.)Pd
П,9]
При содержании
14,14%(aT.)Pd[4]
Mg-Pd
305
Соединение
Mg4Pd"
Mg3Pd
Mg5Pd2
MgPd
MS0,9PdI.l
MgPd"'
Прототип
-
AsNa
C02AI5
CsCl
AuCu
Си
Символ
Пирсона,
пр. гр.
-
ИРЪ,
Рбу/ттс
й/>28,
Рб-j/mmc
сР1,
РтЪт
tP2,
Р4/ттт
cF4
Fmlm
Параметры решетки,
нм
а
-
0,4613
0,4609
0,8644-
-0,8663
0,8646-
-0,8660
0,317A)
0,3175
0,312
0,303A)
0,3920
с
-
0,8410
0,8420
0,8160-
-0,8170
0,8169-
-0,8175
—
0,342A)
—
Примечание
[9]
[2]
[3]
[2]
[3]
[7]
[3]
[8]
[7]
[2]
'^Структура подобна Na6Tl [4] и Mg^Th-; [9].
* Структура не известна [9].
*" Согласно работе [2] соединение MgPd3 образуется при распаде в сплавах,
содержащих более 75 % (ат.) Pd, однако, подтверждения его существования в других
работах не имеется.
Литература
1. Савицкий Е.М., Терехова В.Ф., Бирун Н.А. // Журнал неорганической химии. 1962.
Т. 7. N 10. С. 2367-2373.
2. FerroR.//J. Less-Common Met. 1959. V. 1. N 6. P. 424-438.
3. Westio L. // Acta Chem. Scand. 1968. V. 22. N 8. P. 2574-2580.
4. Samson S. // Acta Crystallogr. 1972. V. B28. N 3. P. 936-945.
5. AnderssonS.//Acta Crystallogr. 1978. V. A34. N 6. P. 833-835.
6. Hellner E., Koch E. // Acta Crystallogr. 1981. V. A37. N 1. P. 1-6.
7. Крплякевнч П.И., Гладытевский Е.И. // Кристаллография. 1960. Т. 5. N 4. С. 577-579.
8. Stadelmaier H.H., Hardy W.K. IIZ. Metallkunde. 1961. Bd. 52. N 6. S. 391-396.
9. Nayeb-Hashetni A.A., Clark J.B. // Bull. Alloy Phase Diagrams. 1985. V. 6. N 2. P. 164-167.
10. Busk R.S.//Trans. A1ME. 1950. V. 188. P. 1460-1464.
T.B. Добаткина
306 Mg-Pm, Mg-Po, Mg-Pr
Mg-Pm. МАГНИЙ-ПРОМЕТИЙ
Об исследовании диаграммы состояния сплавов Mg-Pm сведения
отсутствуют. Ориентируясь на закономерности в строении сплавов Mg
с различными редкоземельными металлами [1], можно предполагать, что
со стороны Mg диаграмма состояния Mg-Pm относится к эвтектическому
типу с температурой эвтектики, концентрацией эвтектической точки и
растворимостью в (Mg) промежуточными между соответствующими
характеристиками в системах Mg-Nd и Mg-Sm, т.е. температура
эвтектики равна -545 °С, концентрация Рт в эвтектической точке
-8,28 % (ат.) [35 % (по массе)], растворимость Рт в (Mg) при эвтектичес-
эвтектической температуре -0,78 % (ат.) [4,5 % (по массе)].
Следует ожидать, что в системе образуются такие же соединения, как
и в системах Mg-Nd и Mg-Sm, а именно, MgPm с решеткой типа CsCl
(символ Пирсона сР2, пр. гр. РтЪт), Mg2Pm с решеткой типа MgCu2
(символ Пирсона cF24, пр. гр. Fdlm), Mg3Pm с решеткой типа Fe3Al и
Mg4IPm5 с тетрагональной решеткой.
Литература
1 Рохлин ЛЛ.//Магниевые сплавы, содержащие редкоземельные металлы М Наука
1980 192 с
Л Л Рохлин
Mg-Po. МАГНИЙ-ПОЛОНИЙ
При взаимодействии Mg и Ро в запаяных капиллярах установлено
образование соединения MgPo. Рентгенографический анализ показал,
что MgPo имеет решетку типа NiAs (символ Пирсона hP4, пр. гр.
Р6ъ1пгтс) с параметрами а - 0,4345 нм, с = 0,7077 нм [1].
Литература
1 WiUeman W.G., Giorgi A.L., VierD.T.//J Phys Chem 1960 V 64 N 4 P 434-440
Л Л Рохлин
Mg-Pr. МАГНИЙ-ПРАЗЕОДИМ
В системе Mg-Pr образуется пять соединений' MgI2Pr, Mg4|Pr5, Mg3Pr,
Mg2Pr и MgPr согласно работам [X, 1-6]. Формулы соединений
соответствуют результатам рентгенографических исследований их
Mg-Pr
307
t,c
woo
900
800
700.
650
600
500
400
300
700
Jti
1
W5?
A*
0,3-
W
50 60
У'
fter
70
7.
\
18'
—
Pr, %
80
k
1
1
r
t
f/w массе)
90
1
,
—7^
\/
V
—92,8
10
93Г
/
/
\
\
\
0 W W JO 40 50 60 70 80 90 100
Mg Pr,%(am.) Pr
Рис. 149. Mg-Pr
кристаллических решеток. Существование предполагавшихся первона-
первоначально соединений MgPr4 и MggPr [2, 7, 8] в последующих работах не
подтвердилось. При построении диаграммы состояния Mg-Pr авторы
работ [X, 6] предположили, что она имеет такой же вид, что и диаграммы
состояния Mg-La и Mg-Ce На рис. 149 представлена диаграмма
состояния согласно работе [6].
Из пяти имеющихся на диаграмме соединений Mg3Pr плавится
конгруэнтно при температуре 798 °С [6], либо 790 ° [9] и имеет область
гомогенности при повышенных температурах. Остальные соединения
образуются по перитектическим реакциям:
Ж + Mg41Pr5 - Mg,2Pr при 585 "С [6], либо 580 °С [9];
Ж + Mg3Pr - Mg41Pr5 при -600 °С [6], либо 610 "С [9];
Ж + Mg3Pr - Mg2Pr;
Ж + Mg2Pr - MgPr.
Температуры двух последних реакций не установлены.
Со стороны Mg в системе имеет место эвтектическое превращение
Ж = (Mg) + Mg,2Pr при 575 °С и 4,4 % (ат.) Рг [6,10]. По данным других
работ концентрация Рг в эвтектике составляет 2,58 % (ат.) при температу-
температуре 573 °С [8] и 5,03 % (ат.) при 593 °С [7]. Данные работ [7, 8], однако, не
очень надежны, так как ряд их результатов не подтвердился в последую-
последующих исследованиях. Авторы работы [9] указывают для этого
эвтектического превращения температуру 510 "С и концентрацию Рг,
равную 6 % (ат.).
308 Mg-Pr
Co стороны Рг в системе протекают эвтектическое превращение Ж -
** MgPr + (pPr) при температуре 752 "С и эвтектоидное превращение
(pPr) - MgPr + (aPr) при 528 °С [11].
Растворимость Рг в (Mg), определенная в работах [6,10,12], приведена
ниже:
Температура, °С 575 540 500 400 300 200
Растворимость Рг:
%(ат.) 0,31 0,19 0,104 0,034 0,09 -0,002
% (по массе) 1,7 1,09 0,8 0,2 0,05 -0,01
Другие значения растворимости Рг в (Mg) составляют 0,087 % (ат.)
[0,5 % (по массе)] при температуре 573 °С и менее 0,035 % (ат.) [0,2 % (по
массе)] при 510 °С [8] и 0,069-0,087 % (ат.) [0,4-0,5 % (по массе)] [13] при
565 'С.
Растворимость Mg в (аРг) равна 9,2 % (ат.) [1,7 % (по массе)] при тем-
температуре 528 °С и снижается до -2,7 % (ат.) [0,48 % (по массе)] при 200 °С
[11].
Кристаллическая структура соединений указана в табл. 141.
Таблица 141. Кристаллическая структура соединений системы Mg-Pr
Соединение
Mg12Pr
Mg3Pr
Mg2Pr
MgPr
Прототип
Mn,2Th
BiF3
Cu2Mg
CsCI
Символ
Пирсона,
пр. гр.
г/26,
/4/mniffl
сЛ6,
Fmim
cFU,
Fdlm
cP2,
РтЪт
Параметры решетки, нм
а
1,034
0,7373
0,7415
0,7430
0,8689
0,3885
0,3898
0,3877
с
0,598
Источник
[5]
[1]
[4]
[3]
[3]
[3]
[14]
[V-C]
Предполагается, что соединение Mg4iPr5 должно как и соединение
Mg4iCe5 иметь тетрагональную объемно центрированную решетку.
Mg-Pr, Mg-Pl 309
Литература
1. Rossi A., landelli A. // Atti Reale Accademia Nazionale dei Lined. 1934. V. 19. N 6.
P. 415-420.
2. Vogel R., Heumann Th. // Z. Metallkunde. 1943. Bd. 35. N 2. S. 29-42.
3. landelli A. // Physical Chemistry of Metallic Solutions and lntermetatlic Compounds.
Proceedings of Symposium held at National Physical Laboratory on 4th. 5th and 6th June 1958.
London, 1959. V. I. P. 3F.
4. Buschow K.H.J. // J. Less-Common Met. (976. V. 44. N 1. P. 301-306.
5. Евдокименко В.И., Крилякевич П.И. // Кристаллография. 1964. Т. 9. N 4. С. 554—556.
6. Рохлин Л Л. // Магниевые сплавы, содержащие редкоземельные металлы. М.: Наука,
1980. 192 с.
7. Canneri G. // Metallurgia Ital. 1933. Т. 25. P. 250-252.
8. Park J.J., Wyman L.L. // Nat. Bur. Stand. Rep. WADC-TR-57-504. 1957. P. 33.
9. Chai Liang. Lin Hai-chun, Yeh Yu-pu. // Proc. 5th Nat. Symp. Phase Diagr., Wuhan., Nov.
18-21. 1988. Wuhan, 1988. P. 16.
10. Рохлин Л.Л., Бочвар Н. Р. //Металловедение цветных металлов и сплавов. М.: Наука.
1972. С. 58-61.
11. Joseph R.R., Gschneidner, Jr., K.A. //Trans Metallurgical Society of AIME. 1965. V. 233.
N 12. P. 2063-2069.
12. Бочвар H.P. // Структура и свойства легких сплавов. М.: Наука, 1971. С. 21—23.
13 Тихова Н.М., Афанасьева Л.А.// Металловедение и обработка металлов 1958. N 3.
С. 38-41.
14. landelli A., Palenzona A.// J. Less-Common Met. 1965. V. 9. N IP. 1-6.
Л.Л. Рохлин
Mg-Pt. МАГНИЙ-ПЛАТИНА
Диаграмма состояния Mg-Pt не построена. В работе [1] были
исследованы магниевые сплавы, содержащие до 30 % (ат.) Pt, методами
рентгеновского, металлографического, термического анализов. Сплавы
готовили путем нагрева Mg и Pt в герметичных железных тиглях. В
изученных сплавах авторами работы [1] по аналогии с системой Mg-Au
было определено существование эвтектики, которая кристаллизуется при
температуре 575 °С и содержании Pt 17,6 % (ат.). В работе [1] также
сообщается о существовании в системе, по крайней мере, двух соедине-
соединений: MgjPt и твердого раствора на основе соединения Mg6Pt.
В сплавах системы Mg-Pt, кроме вышеперечисленных соединений,
образуются также соединения MgPt [2], MgPt3, MgPt7 [3], сведения о
которых обобщены в работе [4]. В работе [4] высказывается предположе-
предположение, что упорядоченная фаза MgPt3 [3] и упорядоченная фаза, находящая-
находящаяся в равновесии с Pt, обнаруженная авторами работы [2] при концентра-
концентрации Pt -75 % (ат.), является одной и той же фазой.
310
Mg-Pt
Соединение, отвечающее составу Mg2Pt, найденное авторами работы
[5], в более поздних работах [1-3] обнаружено не было.
Соединение MgPt3 образуется при температуре 1100 °С и существует
в интервале концентраций 71,6-75,5 % (ат.) Pt.
Соединение MgPt7 образуется при восстановлении MgO при
температурах 1200-1400 °С в присутствии Pt и содержит 85,5-89,7 % (ат.)
Pt [3].
Растворимость Pt в (Mg) очень незначительна [6]. Растворимость Mg
в (Pt) не исследована.
Кристаллическая структура соединений указана в табл. 142
Таблица 142 Кристаллическая структура соединений системы Mg-Pt
Соединение
Mg6Pt
Mg3Pt
MgPt
MgPt3
MgPt,'
Прототип
Mg6Pd
Na3As
FeSi
AuCu3
-
Символ
Пирсона
пр гр
F43m
АЯ8,
РЬъ1ттс
сЯ8,
/>2,3
с РА,
РтЪт
-
Кубическая сингония при содержании
Параметры решетки, нм
а
2,011
0,4577
0,4863
0,3906
0,7824
с
-
0,8322
-
-
-
14%(ат)Мк
Источник
[1]
[1]
И
[3]
[3]
В работе [7] сообщается о соединении Mg7Pt, которое имеет структуру
типаGa7Ge (символ Пирсона cFb2, пр. гр. Fmbrri), однако, источник этих
данных не выяснен.
Литература
1 FerroR., RambaldiG.//J Less-Common Met 1960 V 2 N5 P 383-391
2 Stadelmaier H.H., Hardy W.K.//Z Metallkunde 1961 Bd 52 N 6 S 391-396
3 Bronger W., Klemm W. // Z Anorg All Chem 1962 Bd 319 N 1-2 S 58-81
4 Nayeb-Hashemi A.A., Clark J.B.//Bull Alloy Phase Diagrams 1985 V 6 N6 P 533-534
5 Hodgkinson W.R., Waring R., Desborough A.P.//Chem News 1899 V 80 P 185
6 BuskR.S. //Tians AIME 1950 V 188 P 1460-1464
7 Pearson W.B. // The crystal Chemistry and Physics of metals and alloys N Y Wiley-
lnterscience 1972 806 p
T В Добаткина
Mg-Pu
311
Mg-Pu. Магний-плутоний
Исследованию диаграммы состояния Mg-Pu посвящено небольшое
число работ. В работе [1] представлен общий вид диаграммы состояния,
но значительная часть ее показана штриховыми линиями, указывающими
на отсутствие достаточно полных экспериментальных данных. Эта
диаграмма воспроизведена в справочнике [Э].
На рис. 150 приведена диаграмма состояния Mg-Pu, построенная по
данным работы [1], с учетом полиморфных превращений еРи *» б'Ри и
б' »* бРи при температурах 483 и 463 °С соответственно, а также значений
растворимости Ри в (Mg), полученным по данным работы [Ш].
Установлено, что в системе имеется область несмешиваемости в
жидком состоянии, образуются два соединения с формулами: PuMg2 и
PuvMg су : х - 2. Со стороны Mg в системе имеет место эвтектическое
превращение с концентрацией эвтектической точки -15% (ат.) [64 % (по
массе)] Ри [1]. Точные значения температур нонвариантных превращений
в работе [1] не обозначены. В справочнике [Ш] приводятся результаты
определения растворимости Ри в (Mg) при отдельных температурах:
0 JO 60 70 80
Ри, % (пв массе)
90 95
100
t;c
700
650'
600
500
kOO
300
200
too
1
ж
/
1
1 1
1
1
1
\J
1
1
1
ж,+ж,
L1^
\
\
\
\
22Г
t
Ж
<%sTJZ
—7>
_. "i
¦ (?\
~1
puA
(ГРиД
(APUh*
(aPuy—
°
1Z5'
0 10
Мд
Рис. 150. Mg-Pu
20 30 ЬО SO ВО 70 80 90 100
Ри, % (am.) Ри
312
Mg-Pu, Mg-Rb
Температура, °С 534 475 420 365
Растворимость Pu:
% (ат.) 3,24 2,3 2,56 1,46
% (по массе) 25,2 19,1 20,9 13,0
Кристаллическая структура соединений представлена в табл. 143.
Таблица 143. Кристаллическая структура соединений системы Mg—Pu |1]
Соединение
PuMg2
Прототип
CaF2
'Гексагональная сингония.
Символ Пирсо-
Пирсона, пр. гр.
cF\l,
Fmim
Параметры решетки, нм
а
1,38
0,734
с
0,97
Ранее в работе [2] сообщалось об образовании двух фаз в системе
Mg-Pu с такими же кристаллическими решетками, но им приписывались
другие формулы: фазе с кубической решеткой - Pu2Mg, а фазе с
гексагональной решеткой - PuMg2.
Литература
I. Schonfeld F.W., Cramer E.M., Miner W.N. et al. // Progress in Nuclear Energy: London:
Pergamon Press, 1959. Ser.5. V. 2. P. 579-599.
2 Coffinberry A.S., Waldron M.B. // Progress in Nuclear Energy: London: Pergamon Press,
1956. Ser.5. V. I. P. 354-410.
Л.Л. Рохлин
Mg-Rb. МАГНИЙ-РУБИДИЙ
На рис. 151 представлена обобщенная диаграмма состояния Mg-Rb
согласно работе [1], авторы которой, в основном, использовали данные
работы [2].
В системе Mg-Rb существует обширная область расслаивания в
жидком состоянии. Температуры монотектической и эвтектической
реакции на диаграмме приведены по данным работы [2]. Они были
определены с помощью термического анализа и практически не
Mg-Rb
313
Mg, % (по массе)
,f
t,\
700
600
500
300\
200
/00
39fif\
1
~/,4
/
05(8
ft)
38mei
тике
20
i
Ж,
)
30 W 50
'"9)
i
650"
60 71
i i
18090)
i i
W)—
о ю го
Рис. 151. Mg-Rb
JO 40 JO 60 70
Mg, % (am.)
80
SO WO
Mg
отличались от температур плавления чистых Rb и Mg. Согласно
термодинамическому расчету работы [1] эвтектическая точка отвечает
концентрации 0,04 % (ат.) Mg, а температура плавления эвтектики на
0,15 "С ниже температуры плавления Rb. Промежуточные фазы в системе
Mg-Rb не были обнаружены при ее рентгенографическом исследовании
в работе [2].
Растворимость Rb в жидком Mg незначительна, а растворимость Mg
в жидком Rb составляет по данным работы [2] ~ 1,4 % (ат.) при температу-
температуре монотектической реакции (рис. 151). Авторы работы [1] предполагают,
что растворимость Mg в жидком Rb, определенная в работе [2], завышена
вследствие загрязнения материалов примесями, например кислородом.
Проведенный ими термодинамический расчет показал, что раствори-
растворимость Mg в жидком Rb при температуре монотектической реакции
оценивается в -0,2 % (ат.). Взаимная растворимость компонентов в
твердом состоянии очень мала (< 0,05 % Mg в (Rb) при температуре
39,5 -С) [2].
Литература
I Pelton A.D. // Bull. Alloy Phase Diagrams. 1985. V. 6. N I. P. 41-42.
2. Klemm W., Kunze D. // Systems of Alkali and Alkaline Earth Metals. Proc Int. Symp.
on Alkali Metals. London: Chem. Soc. 1967. Special. Publ. N 22. P. 3-22.
Л.Е. Шетшова
314
Mg-Rh
Mg-Rh. МАГНИЙ-РОДИЙ
Диаграмма состояния Mg-Rh не построена. В сплавах системы
образуется три соединения MgRh [I], Mg5Rh2.x [2] и Mg~6Rh, которое
более вероятно отвечает стехиометрическому составу (Mg44Rh7) [3, 4].
Сведения об этих соединениях обобщены в обзорной работе [5].
Соединение Mg5Rh2.v имеет область гомогенности при концентрации
Rh от 25,3 до 28,57 % (ат.). Согласно рентгеновским данным Rh имеет
незначительную растворимость в (Mg) [6].
Сведения о кристаллической структуре соединений приведены в
табл. 144.
Таблица 144. Кристаллическая структура соединений системы Mg-Rh
Соединение
MgRh
M*Rh2_.
Mg~6Rh
(Mg44Rh7)
Прототип
CsCl
Al5Co2
Mg^Rh7
или
Na6Ta
Символ
Пирсона, пр.
гр.
РтЪт
hPlb,
cF408,
F43m
Параметры
a
0,3099B)
0,8554-
-0,8515
2,0148A)
>ешетки, нм
с
-
0,8082-
-0,8016
—
Источник
[1,5]
[2,5]
[3, 4.5]
[7]
Характеристика структурного типа Mg44Rh7 дается в работах [8, 9].
Литература
1. Compton V.B. // Acta Crystallogr. 1958. V. 11. N 6. P. 446.
2. Ferro R.// Atti Accad. Naz. Line. Rend. Sci. Fiz. Mat. Nat. 1960. V. 29. N 1-2. P. 70-73.
3 WestinL., Edshammar L.E.//Acta Chem. Scand. 1971. V. 25. N 4. P. I48O-I48I.
4. WestinL. //Chem. Scr. I97I.V. 1.N3. P. 127-135.
5. Nayeb-Hashemi A.A., Clark J.B.// Bull. Alloy Phase Diagrams. 1987. V. 8. N 2. P 117.
6. Busk R.S.//Trans. A1ME. 1950. V. 188. P. 1460-1464.
7. Samson S. // Acta Crystallogr. B. 1972. V. 28. N 3. P. 936-942.
8. Andersson S. // Acta Crystallogr. A. 1978. V. 34. N 6. P. 833-835.
9. Chabot В., Cenzual K., Parthe E. // Acta Crystallogr, B. 1980. V. 36 N 10. P. 2202-2205.
ТВ. Добаткина
Mg-Ru, Mg-S, Mg-Sb 315
Mg-Ru. МАГНИЙ-РУТЕНИЙ
Согласно приведенным в работе [Ш] сведениям, в жидком Mg
растворяется при температуре 800 "С более 5,7 % (ат.) [20 % (по массе)]
Ru.
Л.Л. Рохлин
Mg-S. МАГНИЙ-СЕРА
В системе Mg-S образуется сульфид MgS со структурой типа NaCl
(символ Пирсона cFS, пр. гр. Fmim) [X, Э, Ш). Значения параметра а
кристаллической решетки MgS, полученные различными авторами,
находятся в пределах 0,509...0,52034 нм [X, Э, Ш]. В работе \П] приводятся
значения а = 0,51913 нм. При исследовании слоев MgS, осажденных из
газовой фазы, наряду с фазой, имеющей структуру типа NaCl, наблюдали
фазу с гексагональной структурой с параметрами а = 0,395 нм, с =
= 0,641 нм [Ш].
Л.Л. Рохлин
Mg-Sb. МАГНИЙ-СУРЬМА
Впервые диаграмма состояния Mg-Sb была построена в работе [1].
Исследование проводили методом термического анализа. Было
установлено существование соединения Mg3Sb2, которое с Mg и Sb
образовывало две эвтектики. В работе [2] были уточнены данные
термического анализа сплавов, обнаружено полиморфное превращение
у фазы Mg3Sb2 при 930 °С и определена температура плавления
высокотемпературной модификации pMg3Sb2, равная 1228 °С. На
основании данных, в основном работы [2], а также с учетом результатов
других исследований, в частности [3], в обзорной работе [X] приведена
диаграмма состояния Mg-Sb, которая характеризуется наличием одного
соединения Mg3Sb2, претерпевающего аллотропическое превращение.
Высокотемпературная модификация плавится конгруэнтно и участвует
в перитектическом и кататектическом превращениях с образованием
низкотемпературной модификации ocMg3Sb2 (рис. 152 вставка).
Низкотемпературная модификация образует две эвтектики при
температурах 629 и 579 °С.
На рис. 152 приведена диаграмма состояния Mg-Sb из обзорной
работы [4]. При построении диаграммы Mg-Sb авторы работ [4], кроме
316
Mg-Sb
Sb, % (по массе)
0 20 40 50 BO 70 80 90
39,0 33,5 НО «Л5
Sb,V.(am.)
500
0 10 20 JO <Ю 50 60 70 80 90 100
Мд Sb, % (am.) Sb
Рис. 152. Mg-Sb
данных работ [2, 3], использовали экспериментальные данные более
поздних работ в которых была уточнена температура плавления
соединения Mg3Sb? - 1245±5 °С [5] и определены его термодинамические
свойства [6].
Нонвариантные реакции, проходящие в системе, указаны в табл. 145.
Таблица 145. Нонвариантные реакции в системе Mg-Sb |4]
Реакция
Ж - (Mg) + aMg3Sb2
PMg3Sb2- aMg3Sb2+ Ж
Ж + PMg3Sb2 - aMg3Sb2
Ж - aMg3Sb2 + (Sb)
Содержание Sb
фазах
11,5;
-39,2;
-45,6;
86,0.
-0,0;
-39,7;
40,
40,
% (ат.) в
-38,5
33,5
-40,07
100
Температура, °С
629
894
930±2
579
Mg-Sb, Mg-Sc
317
Растворимость Sb в (Mg) очень незначительная и составляет по
данным микроскопического анализа менее 0,04 % (ат.) при температуре
550 °С и менее 0,02 % (ат.) при температуре вплоть до 500 °С [3].
Растворимость Mg в (Sb) не исследована.
Кристаллическая структура соединений представлена в табл. 146.
Таблица 146. Кристаллическая структура соединений системы Mg-Sb
Соедине-
Соединение
PMgjSb,
(xMg3Sb2
Прототип
рМп2О3
La2O3
Символ
Пирсона,
пр. гр.
с/80,
1аЪ
hPS,
РЪт]
Параметры решетки, нм
а
0,4582
0,4568
с
0,7244
0,7229
Источник
[Х,4]
[7]
[4,8]
Литература
1 Grube G. // Z. anorg. Chem. 1906. Bd. 49. N 1 S. 72-92.
2 Grube G., Bornhak R. //Z. Electrochem. 1934. Bd. 40. N 3. S. 140-142.
3. Jones W.R.D., Powell L. //J. Inst. Metal. 1941. V 67. N 6. P. 177-187
4. Nayeb-Hashemi A.A., Clark J.B. // Bull Alloy Phase Diagrams. 1984. V. 5 N 6.
P 579-584.
5 Большаков К.А., Бульонков Н.А., Цирлин М.С. // Журнал неорганической химии.
1962 Т 7. N 9. С 2271-2272
6 Rao Y.K., Patil B.V. // Metall. Trans. 1971. V 2 N 7. P 1829-1835.
7 Zintl E., Husemann E.//Z Physik Chem. В 1933. Bd. 21 S 138-155.
8 Martinez-Ripoll M., Hasse A., Brauer G. // Acta Crystallogr. B. 1974. V. 30. N 8.
P. 2006-2009.
T.B. Добаткина
Mg-Sc. МАГНИЙ-СКАНДИЙ
Диаграмма состояния Mg-Sc (рис. 153) построена по результатам
работ [1-4]. Она характеризуется со стороны Mg перитектическим
превращением Ж + @Sc) ** (Mg), температура которого 706 "С принята
согласно работе [1]. В другой работе [2] для температуры перитектическо-
го превращения получено близкое значение 71015 "С. Концентрация Sc
в жидкой фазе A2,3±0,5) % (ат.) также приводится по данным работы [1].
Растворимость Sc в (Mg), равная 15,9 % (ат.), указана на рис. 153 по
данным работы [3], в которой она специально подробно исследовалась.
Концентрация Sc в (PSc) - -18,57 % (ат.) принята по данным работы [2].
318
t, С
1500
то
то
то
то
woo
900
800
700.
650
600
500
wo
300
zoo
Mg-Sc
Sc, "/«(no массе)
) 10 20 30 40 50 60 70 80 90 WO
03 Щ
1 '
5/706,
(Мд)
Us,
ztz
1
i
у
48,5
\
у
У
у
/
Г"
I
Ж
^У
у
1
у
\ 1
MgSc \|
1
1
у'
Г.) ,
У
у
1
у
(aSc
1
\
1
\
1
h
1
\
\
\
1541"
1337°
О 10 Z0 30 40 50 60 70 ВО 90 100
Мд Sc, % (am.) Sc
Рис. 153. Mg-Sc
В остальном диаграмма состояния Mg-Sc при концентрации до 60 % (ат.)
Sc построена согласно работе [2]. При температурах ниже температур
солидуса в системе имеют место два нонвариантных превращения
перитектоидного и эвтектоидного типов, связанные с образованием фазы
MgSc: (PSc) + (aSc) <¦* MgSc и (PSc) •*¦ (Mg) + MgSc. Соответствующие этим
превращениям линии, согласно работе [2], проведены штриховыми, так
как имелась некоторая неопределенность в оценке термических эффектов,
отвечающих этим превращениям. Границы области MgSc, хотя и
проведены в работе [2] сплошными линиями, но, по-видимому, являются
приближенными, так как приведено слишком мало экспериментальных
точек, по которым они построены.
Диаграмма состояния Mg-Sc, экспериментально построенная в
интервале концентраций 0...60 % (ат.) Sc авторами работы [2], хорошо
экстраполируется до 100 % (ат.) Sc. Такого рода экстраполяция была
Mg-Sb, Mg-Se 319
проведена в работе [5] и показана на диаграмме штриховыми линиями.
При этом учитывались имеющиеся сведения, что растворимость Mg в
(aSc) более, чем 7 % (ат.) [6]. Растворимость Sc в (Mg) при отдельных
температурах согласно данным работы [3] указана ниже:
Температура, °С 706 600 500 400 300
Растворимость Sc:
%(ат.) 15,9 13,2 11,1 9,1 7,4
% (по массе) 25,9 22,0 18,8 15,7 12,8
В работах [1,2] также была установлена значительная растворимость
Sc в (Mg) до -18 % (ат.), но полученные ими результаты были приближен-
приближенными.
Фаза MgSc имеет структуру типа CsCl (символ Пирсона сР2, пр. гр.
РтЗт) с параметрами решетки а = 0,3594 нм [2] и а = 0,3597 нм [4].
Литература
1. Комиссарова Л.Н., Покровский Б.И. // Журнал неорганической химии. 1964. Т. 9.
N 10. С. 2277-2278.
2. Beaudry B.J., Daane A.H. // J. Less-Common Met. 1969. V. 18. N 3. P. 305-308.
3. Сввдерская З.А., Никитина Н.И. // Металловедение цветных металлов и сплавов:
Сб. Статей. М.: Наука, 1972. С. 61-65.
4. Schob О., Parthe Е. // Acta Crystallogr. 1965. V. 19. N 2. P. 214-224.
5. Nayeb-Hashemi A.A., Clark J.B. // Bull. Alloy Phase Diagrams. 1986. V. 7. N 6.
' P. 574-578, 599, 600.
6. Tsang T.W.E., Gschneidner, Jr., K.A., Schmidt F.A. // Phys. Reviews. 1980. V. B21. N 8.
P. 3100-3109.
Л.Л. Рохлин
Mg-Se. МАГНИЙ-СЕЛЕН
В сплавах системы Mg-Se образуется соединение MgSe, которое имеет
кубическую структуру ranaNaCl (символ Пирсона cF8, пр. гр. Fm3m)
с параметром решетки а = 0,5463B) нм [1].
Литература
1. Broch Е. // Z Phys. Chem. 1927. Bd. 127 No.5/6. P. 446-454.
Т. В. Добаткина
320
Mg-Si
Mg-Si. МАГНИЙ-КРЕМНИЙ
Впервые диаграмма состояния Mg-Si была построена авторами
работы [1] по результатам микроструктурного и термического анализов
во всей области концентраций. В системе обнаружено одно промежуточ-
промежуточное соединение Mg2Si, которое плавится конгруэнтно при температуре
1090-1102 "С. Оно участвует в двух нонвариантных эвтектических
равновесиях: Ж »¦* (Mg) + Mg2Si при температуре 645 °С и Ж •* (Si) +
Mg2Si при 950 °С. Дальнейшие исследования подтвердили указанный
характер физико-химического взаимодействия в сплавах этой системы.
По данным работы [2], соединение Mg2Si плавится при температуре
1070 "С, а эвтектика (Si) + Mg?Si кристаллизуется при температуре
920 "С. Согласно данным работы [3] эвтектика (Mg) + Mg2Si кристалли-
кристаллизуется при температуре 637,6 "С. На основании критического обзора
экспериментальных данных в справочнике [X] приведена диаграмма
состояния, построенная в основном по данным работ [L, 3]. Более поздние
исследования по уточнению положения линий ликвидуса и солидуса как
экспериментальными методами [4,5], так и расчетными методами [6, 7],
не внесли принципиальных изменений в предложенный ранее вид
диаграммы состояния.
На рис. 154 приведена диаграмма состояния Mg-Si, построенная
авторами обзорной работы [6] на основании данных работ [3-5].
Si,'А (по массе)
. .J 10 20 30 4-0 50 60 70 ВО 90 100
t, t>
то
1300
1200
1100
1000
900
800
700
650°
600
т
/
/
ll.W
1
/
I
С.
i
ЮР*'
637,5° \
1
1
1
ж
/
s/
аз
1
/
/
/
9Ь5,б°
(Si)-
Рис.
0
Мд
154.
10
Mg-Si
70
30
4-0
50
Si, %
SO
(am)
70
80
90
100
Si
Mg-Si 32?
Соединение Mg2Si плавится конгруэнтно при температуре 1085 "С, а
эвтектические реакции с его участием протекают при температурах 637,6
и 945,6 "С. Концентрация Si, соответствующая эвтектическим точкам,
составляет 1,16% (ат.) [3, 6] и 53 % (ат.) [6] соответственно.
Растворимость Si в (Mg) очень мала и составляет по данным
рентгенографического и микроскопического анализов менее 0,1 % (ат.)
[8]. По данным измерения параметров решетки растворимость Si в Mg
при температуре 600 "С составляет -0,003 (ат.) [3]. Растворимость Mg в
(Si) также практически отсутствует.
В работах [2,4] сообщается о возможном существовании соединения
MgSi, которое предположительно образуется при термической диссоциа-
диссоциации Mg2Si [2] и разлагается при температуре -805 °С [4]. Отмечается
также существование метастабильной системы, включающей фазу Mg4Si,
которая образует с (Mg) эвтектику при температуре 575 °С и содержании
2,34%(aT.)Si[6].
Соединение Mg2Si имеет кубическую структуру типа CaF2 (символ
Пирсона cF\ 2, пр. гр. Fmlm) с параметром решетки а = 0,6351 нм [8], а =
= 0,6347 нм [9], а = 0,6351 нм [10]. При давлении -2,5 ГПа и температуре
выше 900 °С кубическая структура переходит в гексагональную
структуру с параметрами решетки а = 0,720 нм, с = 0,812 нм [11].
Метастабильная гексагональная модификация может существовать при
нормальном давлении и температуре.
В работе [12] методами дифференциального термического анализа и
измерения давления пара построены Р-Ти Р ~Х проекции Р - Т- X
диаграммы состояния системы Mg-Si при содержании Si до 60 % (ат.).
Литература
I Vogel R.//Z Anorg. All Chem. 1909. Bd.6l S. 46-53.
2. Wohler L., Schliephake O.//Z. Anorg. All. Chem. 1926. Bd.151. S. 11-20.
3. RaynorG.V.//J Inst. Metal. 1940 V. 66. P. 403-426
4. Schurmann E., Fischer A. // Giessereiforschung. 1977 Bd.29. S. 111-113.
5. Gefficen R., Miller E. // Trans. AIME. 1968. V. 242. P 2323-2328.
6. Nayeb-Hashemi A.A., Clark J.B. // Bull. Alloy Phase Diagrams. 1984. V. 5. N 6.
P. 584-592
7. DornerP., KriegH., LukasHX. etal.//Calphad. I98l. V.5.N I.P. 41-55.
8. Klemm W., Westlinniiig H. // Z. Anorg. All. Chem. 1941. Bd.245. N 4. S. 365-380.
9. Большаков К.А., Бульоиков Н.А., Расторгуев Л.Н., Цирлнн М.С. // Журнал
неорганической химии. 1963. Т. 8. N 12. С. 2703-2705.
10. RaynorG.V.//Science 1975 V 9. N 9. P. 430-431
11. Cannon P., Conlin E.T. // Science 1964. V. 145. N 3631. P. 487-489.
12. Глазов В.М., Павлова Л.М., Поярков К.Б. // Изв АН СССР. Неорганические
материалы 1983 Т. 19 N 9. С. 1465-1469.
Т. В. Добаткина
322
Mg-Sm
Mg-Sm. МАГНИЙ-САМАРИЙ
В системе Mg-Sm обнаружены соединения Mg41Sm5, Mg5Sm, Mg3Sm,
Mg2Sm и MgSm [1-6]. Ранее в работе [7], где было проведено микроскопи-
микроскопическое исследование сплавов, наиболее богатая Mg фаза была идентифи-
идентифицирована как Mg6 2Sm [13,9% (ат.) Sm]. Рентгенографические исследова-
исследования авторов работы [5] показали, что соединение с формулой Mg6 2Sm
имеет кристаллическую решетку, соответствующую формуле Mg41Sm5.
Поэтому приведенная на рис. 155 фаза, обозначенная как Mg41Sm5,
расположена при содержании 13,9 % (ат.) Sm.
Соединения Mg2Sm и MgSm плавятся конгруэнтно при температурах
750 и 800 °С соответственно. Соединение Mg4jSm5 образуется по
перитектической реакции при температуре несколько превышающей
температуру эвтектического превращения со стороны Mg. Соединения
Mg3Sm и Mg2Sm также образуются по перитектическим реакциям при
температурах 565 и 700 °С соответственно. Все соединения имеют очень
fm,% (по массе)
0 2040 60 70 вО 85 90 95
100
200
0 t0 20 J0 40 50 60 70 ВО 90 WO
Мд Sm, % (am.) Sm
Рис. 155. Mg-Sm
Mg-Sm
323
узкие ряды гомогенности [6]. В работах [Ш, 4, 7] положение линий
нонвариантных и моновариантных превращений в системе определено
только со стороны Mg до -12 % (ат.) Sm и со стороны Sm до соединения
MgSm. Авторами работы [6] диаграмма была изучена полностью.
Приведенная на рис. 155 диаграмма состояния Mg-Sm построена по
данным работ [4,7,8] со стороны Mg и по данным работы [6] в остальной
области концентраций.
Со стороны Mg имеет место эвтектическое превращение Ж •* (Mg) +
+ Mg4|Sm5 при температуре 532 °С согласно работе [8] и концентрации
9,4 % (ат.) Sm согласно работам [4, 7]. По другим данным температура
кристаллизации эвтектики составила 530 °С [6] или 542 °С [4, 7], а
концентрация Sm - 8 % (ат.) [6]. Эвтектическая реакция со стороны Sm
Ж <¦* (ySm) + MgSm согласно работе [6] протекает при температуре
785 "С, концентрации 55 % (ат.) Sm. Твердый раствор на основе ySm при
температуре 580 °С и концентрации 80 %(ат.) Sm эвтектоидно распадает-
распадается на соединение MgSm и aSm [6]. Ранее, согласно данным справочника
[Ш], температура эвтектоидной реакции была определена равной 612 "С
и со стороны Sm было обнаружено перитектическое превращение при
температуре 780 °С и концентрации твердого раствора на основе Sm,
участвующего в этом превращении, 67,6 % (ат.) Sm. Однако более
тщательные исследования работы [6] предпочтительнее.
Растворимость Sm в (Mg) по данным работ [4, 8] при некоторых
температурах указана ниже:
Температура, "С 532 500 400 300 200
Растворимость Sm:
% (ат.) : 0,84 0,72 0,30 0,13 0,063
% (по массе) 5,0 4,3 1,8 0,8 0,4
Кристаллическая структура соединений показана в табл. 147.
Таблица 147. Кристаллическая структура соединений системы Mg-Sm
Соедине-
Соединение
Mg4|Sm5
Mg5Sm
Прототип
Mg4lCe5
Mg5Gd
Символ
Пирсона,
пр. гр.
«/92,
/4/т
cF440,
Параметры решетки, НМ
а
1,477
1,480
2,246
с
1,032
1,036
Источник
[5]
[6]
[6]
324
Mg—Sm, Mg-Sn
Соедине-
Соединение
Mg3Sm
MgjSm
MgSm
Прототип
BiF3
MgCu2
CsCl
Символ
Пирсона,
пр. гр.
сЛ6,
Fmim
cF24,
Fdim
cPl,
Pmim
Параметры решетки, НМ
a
0,7327
0,736
0,7371
0,8622
0,8639
0,3810
0,3845
0,3848
с
III II III
Источник
[1]
[2,9]
[6]
[1]
[6]
[1]
[3]
[6]
Литература
1. Jandelli A. / The Pgysical Chemistry of Metallic Solutions and Intermetallic Compounds.
Proceedings of a Symposium held at National Physical Laboratory on 4th, 5th and 6th
June 1958. London. 1959. V. 1. Paper 3F. 11 p.
2. Buschow K.H.J. //J. Less-Common Met. 1976 V 44. N 1. P. 301-306.
3 Iandelli A., Palenzona A. // J. Less-Common Met. 1965. V. 9. N 1. P. 1-6.
4. Рохлим Л Л. II Магниевые сплавы, содержащие редкоземельные металлы. М.: Наука,
1980. 192 с.
5. КинжибалоВ.В.,РохлииЛЛ., Абрукина И.П.//Изв. АН СССР. Металлы. 1985. N I.
С. 204-205.
6. Saccone A., Delfino S., Borzone С, Ferro R. // J. Less-Common Met. 1989. V. 154. N 1.
P. 47-60.
7. Рохлин ЛЛ.// Изв. АН СССР. Металлы 1979. N 4. С. 185-187.
8. Дриц М.Е., Рохлин ЛЛ., Сирченко Н.П. // Изв. ВУЗов. Цветная металлургия. 1983.
N 6. С. 78-82.
9. Крипякевич П. I., Евдокименко В. I. // Bjchhk Л ьв1вського Университету iM. 1в.Фран-
1в.Франка. Сер. XiMi4Ha. 1969. N 11. С. 3-7
Л.Л- Рохлин
Mg-Sn. МАГНИЙ-ОЛОВО
Диаграмма состояния Mg-Sn, приведенная в справочнике [X],
характеризуется наличием конгруэнтно плавящегося при температуре
778 "С соединения Mg2Sn, которое участвует в двух эвтектических
нонвариантных равновесиях с (Mg) и (Sn) при температурах 561 и 200 "С
соответственно. На рис. 156 приведена диаграмма состояния Mg-Sn,
построенная в работе [1], авторы которой, кроме данных работ,
приведенных в справочнике [X], использовали также результаты более
поздних исследований [2-5]. Согласно уточненным данным [2],
ь
700\
600\
500
МО
300
200
100
' 20 4050
р35
Ж
if)
Mg-Sn
325
Sn, % (no массе)
60 70 80 85 SO 95 WO
ПОХ
>
->
l
\
I
Ч
4
203,
ч
\
5±0,3
i
ч
\
в
7°
/0 f0 J0 40 50 60 70 80 30 WO
Mff Sn,'/-(am) Sn
Рис. 156. Mg-Sn
соединение Mg2Sn плавится при температуре 770,5 °C и участвует в двух
эвтектических превращениях Ж •* (Mg) + Mg2Sn иЖ- Mg2Sn + (Sn) при
температурах 561,2 и 203,5 °С соответственно. Чистота исходных
материалов, используемых в работе [2], составляла 99,99 % (по массе) Mg
и 99,999 % (по массе) Sn.
Растворимость Sn и Mg определена в целом ряде работ. В справочнике
[X] при построении диаграммы состояния использовали данные работы
[6], полученные методом измерения электросопротивления. Авторы
обзорной работы [1] отдают предпочтение данным микроструктурного
анализа, полученным в работе [7], которые хорошо согласуются с
данными работы [6]. Согласно данным работы [7], максимальная
растворимость Sn в (Mg) при эвтектической температуре составляет
3,35 % (ат.). С понижением температуры растворимость Sn уменьшается
и при температуре 300 °С составляет 0,374 % (ат.) [7]. Растворимость Mg
в (Sn) точно не определена и по данным изучения рекристаллизации и
твердости составляет 0,1-0,2 % (ат.) при температуре 200 "С и около 0,1 %
(ат.) при температуре 160 °С [X].
Соединение Mg2Sn имеет структуру типа CaF2 (символ Пирсона cF\ 2,
пр. гр. Fmbm) с параметром решетки а = 0,677-0,676 нм [X], а =
= 0,67625 нм [8], а - 0,67638 нм [9]. При увеличении температуры от 600
326 Mg-Sn, Mg-Sr
до 1200 "С и давления от 2,5 до 5,5 ГПа, кубическая структура фазы
Mg2Sn переходит в гексагональную [10]. В работе [11] подтверждается,
что в области температур 25-1000 "С и давлении до 10 ГПа происходит
переход кубической структуры фазы Mg2Sn в гексагональную. В
быстроохлажденных сплавах системы Mg-Sn образуются метастабиль-
ные фазы, сведения о которых обобщены в работе [1].
Литература
1. Nayeb-Hashemi A.A., Clark J.B. // Bull. Alloy Phase Diagrams. 1984. V. 5. N 5.
P. 486-489.
2. Steiner A., Miller E., Komarek K.L. //Trans. AIME. 1964. V. 230. P. 1361-1367.
3 Nayak A.K., Oelsen W. //Trans. Indian. Inst. Met. 1968. P. 15-20.
4. Nayak A.K., Oelsen W. // Trans. Indian. Inst. Met. 1969. P. 53-58.
5. Ellmer J., Hall K.E., Kamphefner R.W. et al. // Met. Trans. 1973. V. 4. N 3. P. 889-891.
6. Vosskuhler H. // Metallwirtschaft. 1941. Bd.20. S. 805-808.
7. Raynor G.V. // J. Inst. Metals. 1940. V. 66. P. 403-426.
8. EldridgeJ.M., Miller E., Komarek K.L. //Trans. AIME. 1966. V. 236. P. 114-121.
9. Skeleton E.F., Lin S.T., Rothber CM. // Acta Crystallogr. A. 1974. V. 30. P. 39-43.
10. Cannon P., Conlin E.T. // Science. 1964. V. 145. P. 487-489.
11. ДюжеваТ.И.,КабалкниаC.C.,ВерещагинЛ.Ф.//Кристаллография. 1972.Т. 17.N4.
С. 804-811.
Т. В. Добаткина
Mg-Sr. МАГНИЙ-СТРОНЦИЙ
Диаграмма состояния, построенная в справочнике [X], в дальнейшем
была уточнена в работах [1-6].
На рис. 157 приведена диаграмма состояния Mg-Sr, построенная
авторами обзорной работы [7] в результате критического рассмотрения
имеющегося экспериментального материала. Линия ликвидуса проведена
согласно данным справочника [X], температуры и характер нонвариан-
тных равновесий в работе [7] указаны на основании данных дифференци-
дифференциального термического анализа. Составы образующихся соединений
указаны на рис. 157 в соответствии с результатами более поздних, чем
в работе [X], исследований, которые позволили уточнить стехиометричес-
кие составы фаз Mg17Sr [1, 4] и Mg3gSr9 [9], ранее обозначаемые как
Mg9Sr и Mg4Sr соответственно. Существование соединения Mg3Sr [X]
подтверждено не было.
В сплавах системы Mg-Sr образуются соединения Mg17Sr2, Mg38Sr9,
Mg23Sr6, Mg2Sr. Соединения Mg17Sr2 и Mg2Sr плавятся конгруэнтно при
температурах 606 и 680 "С, соединения Mg23Sr6 и Mg38Sr9 образуются
по перитектической и перитектоидной реакциям.
327
Sr, % (по массе)
0101030 W 50 60 70 80
JOB
0
Mg
Рис. 157.
10
Mg-Sr
20
JO
40
50
Sr, %
60
(am.)
70
80
SO
WO
Sr
Характер образования соединений Mg23Sr6 и Mg38Sr9 требует по
мнению авторов работы [7] окончательного установления.
Нонвариантные равновесия, проходящие в системе, указаны в
табл. 148.
Т а б л и и а 148. Нонвариантные реакции в системе Mg-Sr |7J
Реакция
Ж + Mg2Sr - Mg23Sr6
Mgl7Sr2+ MgjjSr,,- Mg38Sr9
Ж - (Mg) + Mgl7Sr2
Ж - Mg,7Sr2 + Mg23Sr6
Ж - Mg2Sr + (aSr)
Содержание Sr, % (ат.), в
фазах
19,36; 33,33; 20,69
1O',53; 20,6, 19,15
5,9; 0,03; 10,53
15,1; 10,53; 20,69
70; 33,33; 93,7
Температура,
'С
603
592
585
599
426
328
Mg-Sr
Согласно данным термического и микроструктурного анализов
растворимость Sr в (Mg) очень незначительна и равна -0,03 % (ат.) по
данным работы [X] либо 0,1% (ат.) согласно работе [7] при эвтектической
температуре. Максимальная растворимость Mg в (Sr) составляет около
14,5 % (ат.) [X] или около 6,3 % (ат.) [7]. По мнению авторов работы [7],
эти значения являются слишком высокими, так как растворимость Mg
в Са и Ва незначительна. На представленной диаграмме показана
растворимость Mg в (Sr), равная 6,3 % (ат.), но как предположительная.
Кристаллическая структура фаз указана в табл. 149.
Таблица 149 Кристаллическая структура фаз системы Mg-Sr
Соедине-
Соединение
Mg|7Sr2
Mg38Sr9
Mg23Sr6
Mg2Sr
Прототип
N.l7Th2
Mg38Sr9
Mn23Th6
MgZn2
Символ
Пирсона,
пр гр
Л.Р38,
РЬ-Jmmc
Л«4,
Р6ъ1ттс
сЛ16,
Fmim
hPll,
Pb^lmmt
Параметры решетки, нм
а
1,0533G)
1,0535E)
1,0530
1,0511
1,0500
1,491
1,4914A5)
1,5000
0,6475
с
1,0341G)
1,0356E)
1,0408
2,8362
2,8251
1,043
Источник
ш
|4]
15]
|3]
|6]
[2]
[3]
[5]
[5]
В работе [8] получено соединение Mg5 2Sr, имеющее согласно данным
рентгеновского анализа кристаллическую структуру типа Mg5 2Eu (пр.
гр. Pd^lmmc) с параметрами решетки а = 1,0463 нм, с = 1,0834 нм.
Литература
1 Гладышевский Е.И., Крипякевич П.И., Теслюк М.Ю. и др // Кристаллография
1961 Т 6 N 2 С 267-268
2 Гладышевский Е.И., Крипякевич П.И., Кузьма Ю.Б., Теслюк М.Ю. // Кристалло-
Кристаллография 1961 Т 6 N 5 С 769-770
3 Wang F.E., Kanda F.A., Miskell C.F., King A.J. // Acta Crystallogr 1965 V 18 N1
P 24-31
4 Kanda F.A., Carter W.S.//J Less-Common Met 1973 V 32 N 1 P 97-102
5 Махмудов М.М., Бодак О.И., Вахобов А.В., Джураев Т.Д. // Изв АН СССР
Металлы 1981 N6 С 216-220
6 Merlo F., Fornasini M.L. // Acta Crystallogr В 1982 V 38 N 6 P 1797-1798
Mg-Sr, Mg-ТЬ
329
7 Nayeb-Hashemi A.A., Clark J.B. // Bull Alloy Phase Diagrams 1986 V 7 N 2
P 149-156
8 Erassme J., Brauers Т., Lueken H. // J Less-Common Met 1988 V 137 N 1/2
P 155-161
ТВ Добаткина
Mg-Tb. МАГНИЙ-ТЕРБИЙ
В системе Mg-Tb рентгенографическим методом установлено четыре
соединения: Mg24Tb5, Mg3Tb, Mg2Tb, MgTb [1-6]. Фазовые превращения
в системе изучались при этом лишь со стороны ТЬ, приблизительно до
его ближайшего соединения.
Диаграмма состояния (рис. 158) построена со стороны Mg по данным
работ [7, 8] и со стороны ТЬ по данным авторов работы [1]. Со стороны
Mg в системе имеет место эвтектическое превращение Ж •* (Mg) +
+ Mg24Tb5 при температуре 559 °С и содержании ТЬ 9,6 % (ат.) [41 % (по
массе)] [7, 8] При построении диаграммы состояния со стороны ТЬ
t;c
1300
1200
HDD
WOO
900
800
WO
650
600
500
WO
300
200
ть, % (no массе)
О 10 W50 60 70 80 85 90
95
toe
11! 1
Ж
1
'— к
1
А
е
1
1
ft:
Т
т
--<
t
1
а
1
к
4
/
/
/
695"
1
/
AfiTb) J
7
/
'A
/i
' I
i
i
i
\
\
(aTb)-^
\
\
\
1289'
Рис.
0 10
Mg
158. Mg-Tb
20
SO
Tb,
50 60
'/.(am.)
10
80
SO
100
Tb
330
Mg-Tb
принималось, что соединение MgTb образуется по перитектической
реакции из жидкой фазы и твердого раствора на основе высокотемпера-
высокотемпературной модификации ТЬ (рТЬ) [1]. Температура перитектического
превращения согласно работе [1] равна 857 "С. Твердый раствор (рТЬ)
эвтектоидно распадается на твердый раствор (аТЬ) и MgTb при
температуре 695 °С [1].
Растворимость ТЬ в (Mg) при отдельных температурах, исследованная
авторами работы [7], приведена ниже:
Температура, °С 559
Растворимость ТЬ:
%(ат.) 4,61
% (по массе) 24
540 500 400 300
4,31
22,8
3,91
21
2,98
16,7
2,08
12,2
200
1,49
9,0
Кристаллическая структура фаз приведена в табл. 150.
Таблица 150. Кристаллическая структура фаз системы Mg-Tb
Соедине-
Соединение
Mg24Tb5
MgjTb
Mg2Tb
MgTb
Прототип
Ti5Re24
BiF3
MgZn2
CsCl
Символ
Пирсона,
пр. rp.
с/...,
/43m
cF16,
Fniim
hPll,
РЬт/штс
cP2,
РтЪт
Параметры решетки, нм
а
1,1283
0,732
0,7296
0,609
0,3796
0,3784
с
-
-
-
0,981
-
-
Источник
[6]
[2]
[2,3]
[1,51
[6]
Литература
1. Miller A.E., DaaneA.H.// Trans. A1ME. 1964. V. 230 N 4. P. 568-572.
2. Крнпякевнч П.И., Евдокимеико В.И. // Вопросы теории и применения редкоземель-
редкоземельных металлов. М.: Наука, 1964. С. 146-148.
3. Крнпякевнч П.И., Евдокимеико В.И., Залуцкий И.И. // Доповш АН УРСР. 1964.
N 5. С. 766-767.
4 Крипякевнч П.И., Ёвдокнменко В.И., Гладышевскнй Е.И. // Кристаллография. 1964.
Т. 9. N 3. С. 410-411.
5 Iandelli A., Palenzona А. // J. Less-Common Met. 1965. V. 9. N 1. P. 1-6.
6. Krypiakewylsch P.I., Evdokimenko V.I. // Z. Anorg. All. Chem. 1967. B.355. N 1/2.
S. 104-112.
7 Дриц М.Е., Рохлин ЛЛ., Падежнова Е.М., Гузей Л.С. // Металловедение и
термическая обработка металлов. 1978. N 9. С. 70-73
8. Рохлни ЛЛ.//Магниевые сплавы, содержащиередкоземельныеметаллы. М.: Наука,
1980. 192 с.
9 Buschow K.H.J. // J. Less-Common Met. 1976. V 44 N 1. Р 301-306.
Л.Л. Рохлин
Mg-Te, Mg-Th
331
Mg-Te. МАГНИЙ-ТЕЛЛУР
Диаграмма состояния Mg-Te не построена. В работе [1] обобщены
литературные данные по системе Mg—Те. В системе Mg—Те обнаружено
существование двух соединений MgTe [2-4] и MgTe2 [4, 5]. Оба соедине-
соединения имеют узкие области гомогенности [4]. По данным авторов работы
[6] равновесие в области, богатой Mg, по-видимому, имеет эвтектический
характер. Растворимость Те в (Mg) [6] и Mg в (Те) [4] согласно рентгенов-
рентгеновским данным очень мала.
Кристаллическая структура соединений приведена в табл. 151.
Таблица 151. Кристаллическая структура соединений системы Mg-Te
Соедине-
Соединение
MgTe
MgTe2
Прототип
ZnS
(вюриит)
FeS2
(пирит)
Символ
Пирсона,
пр. гр.
А/Ч
РЬътс
сР 12,
Pal
Параметры решетки, нм
а
0,452B)
0,453A)
0,7025B)
с
0,733D)
0,738B)
Источник
[2]
[3]
[5]
Литература
1. Nayeb-Hashemi A.A., Clark J.B. // Bull. Alloy Phase Diagrams. 1986. V. 7. N 3.
P. 244-245.
2. Zachariasen W. // Z. Phys. Chem. 1927. Bd. 128. N 6. S. 417-420.
3. Klemm W., Wahl K. IIZ. Anorg. All. Chem. 1951. Bd. 266. N 6. S. 289-292.
4. Yanagisawa S., Tashiro M., Anzai S. // Trans. Jpn. Inst. Metals. 1968. V. 9. N 2.
P. 144-145.
5. YanagisawaS., Tashiro M., AnzaiS. // J. Inorg. Nucl. Chem. 1969. V. 31. N 4. P. 943-946.
6. Busk R.S. //Trans. AIME. 1950. V. 188. P. 1460-1464.
T.B. Добаткшш
Mg-Th. МАГНИЙ-ТОРИЙ
Опубликованные данные по исследованию сплавов системы Mg-Th
противоречивы в отношении количества и составов интерметаллических
фаз. В справочнике [X] имеются указания о наличии интерметаллидов
Mg2Th и Mg3Th. Однако в работе [1], проведенной с использованием
термического и рентгенографического анализов было подтверждено
существование только одного соединения Mg2Th, имеющего к тому же
по данным этой работы между температурами 700 и 800 °С полиморфное
332
Mg-Th
t,c
800
850°
КПП
йЛП
700
\ 10 3040
11 II
ж
Г^ '
5Ь
1
Ш9 7,05
0
Mg
Рнс. 159. Mg-Th
Th,
60
(- .
-J—77Z
40,6
$$7'
%(по массе)
70 80
-812'
10 20 JO
Th, % (am.)
превращение. В работе [2] также было найдено только одно соединение,
но другого состава, Mg5Th, которое образуется по перитектической
реакции при температуре 772 °С. В работе [3] рентгеновским исследова-
исследованием была установлена формула ближайшего к Mg соединения -
М||2зТпб- В работах [2,4] указано также на существование эвтектической
реакции со стороны Mg при температуре 582 °С [2], либо 580 "С [4] и
концентрации 7,05 % (ат.) Th [2], либо 6,5 % (ат.) Th [4].
В соответствии с критической оценкой всех ранее полученных
результатов в работе [5] построена диаграмма состояния Mg-Th, при
этом предположительно указано ее строение при концентрациях Th более
высоких, чем те, которые исследовались экспериментально, а именно,
от соединения Mg2Th до Th. Строение этой части диаграммы вызывает
сомнение, так как в работе [5] предполагается, что в этой области
концентраций никаких соединений не образуется. Однако образование
соединений нельзя исключать, так как для систем Mg с редкоземельными
металлами, с которыми у Th имеются общие черты, характерно
образование большого числа соединений.
Представленная на рис. 159 диаграмма состояния построена с учетом
вышеперечисленных работ до концентрации -34 % (ат.) Th. При
Mg-Th
333
концентрациях 0-20 % (ат.) Th диаграмма построена по данным работ
[2], результаты которой хорошо согласуются с результатами работы [4],
но первая работа выполнена в большем объеме. Формула ближайшего
к Mg соединения Mg23Th6 получена по результатам рентгенографическо-
рентгенографического исследования [3]. При концентрациях-20-34 % (ат.) Th диаграмма
построена по данным работы [5]. Согласно представленной диаграмме
соединение Mg2Th образуется по перитектической реакции при
температуре -812 °С. При температуре -750 "С имеет место полиморфное
превращение соединения Mg2Th.
Соединение Mg23Th6 образуется также по перитектической реакции
Ж + Mg2Th «* Mg23Th6 при температуре 772 "С и концентрации Th в
жидкой фазе -10,6 % (ат.).
Установлена ограниченная растворимость Th в (Mg), уменьшающаяся
с понижением температуры. Максимальная растворимость Th в (Mg) при
эвтектической температуре составила 0,49 % (ат.) [4,5 % (по массе)] [2] и
0,55 % (ат.) [5 % (по массе)] [4]. При температуре 300 "С она составляет
0,07 % (ат.) [0,7 % (по массе)] [2].
Кристаллическая структура соединений указана в табл. 152.
Таблица 152 Кристаллическая структура соедниеиий системы Mg-Th
Соединение
Mg23Th6
Mg2Th(BT)
Mg2Th(HT)
Прототип
Mg23Th6
MgCu2
MgNi,
Символ
Пирсона,
пр гр.
сЛ16,
Fmim
lFU,
Fdlm
hPU,
РЬ-jmmc
Параметры решетки,
нм
а
1,427
0,8570
0,6086
с
-
-
1,964
Источник
[2,3]
[1]
[1]
Литература
1 Peterson D.T., Diliak P.F., Void C.L. // ActaCrystallogr. 1956. V. 9. N 12. P. 1036-1037.
2 Yamamoto A.S., Rostoker W. // Trans. ASM. 1958 V. 50 P. 1090.
3 Гладышевскнй Е.И., Крнпякевнч tl.H., Кузьма Ю.Б., Теслюк М.Ю. // Кристалло-
Кристаллография 1961. V 6. N 5. Р. 769-770.
4 Дрнц М.Е., Мальцев М.В., Падежиова Е.М., Свидерская З.А. // Изв. АН СССР
Отделение технических наук 1958. №8 С. 93-96.
5 Nayeb-Hashemi A.A., Clark З.Ъ.П Bull. Alloy Phase Diagrams 1984 V 5.N 1 P. 43-48
Г И. Терехов, Л.Л. Рохлин
334
Mg-Ti
Mg-Ti. МАГНИЙ-ТИТАН
Сплавы системы Mg-Ti исследованы в работах [1-5], в которых в
основном изучалась растворимость Ti в жидком и твердом Mg.
Существования соединений в изученной системе не обнаружено. На
основании результатов исследования растворимости Ti в жидком Mg
авторы работы [5] сообщают о существовании перитектического
превращения при температуре 650 °С, атакже предполагают существова-
существование нонвариантного превращения при температуре 865 °С, связанного
с переходом pTi в aTi. Исследование сплавов системы Mg-Ti в работе
[5] проводили методами химического, термического и рентгеновского
анализов с использованием Mg чистотой 99,99 % (по массе) и Ti - 99,92 %
(по массе). Ранее о существовании перитектического превращения при
температуре 890 °С Ж + (pTi)" (aTi) с концентрацией Mg в жидкой фазе
- 99,7 % (ат.), в (PTi) - 0,3 % (ат.) и в (aTi) - 0,36 % (ат.) сообщалось в
работе [4]. Данные, полученные в работе [3], фактически характеризуют
фазовые взаимодействия в системе Mg-Ti-O, происходящие вследствие
присутствия в исследованных сплавах кислорода.
На рис. 160 приведена диаграмма состояния системы Mg-Ti согласно
работе [6], в которой эта диаграмма была рассчитана по эксперименталь-
экспериментальным данным, полученным в работах [1, 3, 5]. В сплавах системы
предполагается существование двух нонвариантных превращений:
перитектического типа Ж + (aTi) ^ (Mg) при температуре 651 °С и
кататектического типа (pTi) ^ (aTi) + Ж при температуре 865 °С с
концентрацией Mg в жидкой фазе - 99,986 % (ат.), в (pTi) - -2,4 % (ат.),
T6
Мд, % (по массе)
10 20 30 40 50 60 70 80 SO 100
88t
800
В00
I 1
T
¦Mix?
l-d
1
V
1
' 1 '
-865'
-6.
Ц'
\
i
1 i
0
f
Ж'"
Чду*
650°
О 10 20 30 40 50 60 70 80 90 100
Ti Мд,'/о(ат.) Мд
Рис. 160. Mg-Ti
Mg-Ti, Mg-Tl 335
0,433
0,85
[4]
0,152
0,30
0,086
0,17
[4]
0,009
0,018
[5]
0,006
0,012
[5]
Растворимость Ti в жидком Mg указана ниже:
Температура, 'С 1500 1200 900 700 650
Растворимость Ti:
% (ат.) 0,528
% (по массе) 1,035
Источник [5]
РаствориMOCTbTi в (Mg) изменяется от 0,096 % (ат.) [0,19 % (по массе)]
при температуре 650 °С до 0,041 % (ат.) [0,08 % (по массе)] при температу-
температуре 350 °С [4].
Растворимость Mg в (Ti) согласно работе [4] приведена ниже:
Температура, °С 1100 900 700
Растворимость Mg:
%(ат.) 1,331 0,590 0,138
% (по массе) 0,68 0,3 0,07
Литература
1. Aust K.T., Pidgeon L.M. // Trans. AIM E. 1949. V. 185. P. 585-587.
2. Eisenreich H. // Metall. 1953. V. 7. N 23/24. P. 1003-1006.
3. FredricksonJ.W.//J. Metals. 1955. V. 7. N 2. P. 368.
4. Obinata I., Takenchi Y., Kawanishi R. // Metall. 1959. V. 13. N 5. P. 392-397.
5. Fincher L.C., Desy D.H. // Trans. AIME. 1968. V. 242. N 10. P. 2069-2073.
6. Murray J.L. // Bull. Alloy Phase Diagrams. 1986. V. 7. N 3. P. 245-247.
Т. В. Добаткина
Mg-Tl. МАГНИЙ-ТАЛЛИЙ
Достаточно полный обзор исследований диаграммы состояния Mg-Tl
приведен в справочнике [X]. Диаграмма состояния (рис. 161) характеризу-
характеризуется значительной по протяженности областью (Mg) и образованием трех
промежуточных фаз: Mg5Tl2, Mg2Tl и MgTl. Фазы Mg5Tl2 и MgTl
плавятся конгруэнтно соответственно при температурах 413 и 358 °С.
Фаза Mg2Tl образуется по перитектической реакции при температуре
392 "С. От ранее принимавшихся для соединений формул MggTI3
(ближайшего к Mg) и Mg3Tl2 по мнению авторов справочника [X] следует
отказаться.
Приведенная в справочнике [М], обобщенная согласно данным
авторов работы [X] диаграмма состояния находится в хорошем
соответствии с диаграммой, показанной на рис. 161.
Нонвариантные реакции, имеющие место в системе, указаны в
табл. 153.
336
Mg-Tl
0
t:c
600
500
400
300
200
WO
40 60
\
\
1
\
\40.
7
/
\
1
Ti, % (no массе)
80 90 95 WO
К
~W-
*
1
кяд.
353*
1
П,5
1
i
?»
58°
s
\
W3°
160°
\
Ж
/>
H
у
304°
230°
0 W W 30 40 50 60 70 80 SO WO
Mg Tl,%(am.) Tl
Phc. 161. Mg-Tl
Таблица 153. Нонвариантные реакции в системе Mg-Tl
Реакция
5K + Mg5Tl2-Mg2Tl
Ж - (Mg) + Mg5Tl2
Ж - Mg2Tl + MgTl
Ж - MgTl + (PT1)
(PTl)-MgTl + (aTl)
Содержание Mg, % (ат.),
в фазах
34,26;
25,9;
25;
42,5;
-80;
80;
-95;
28,57;
28,57;
15,4;
15,4;
33,3;
50;
50;
50;
33,3 .
33,3
28,57
28,57
50
-95
-95,17
-97
Температура,
-с
392
405
353
203
160
Источник
[X]
IM]
[X]
[Ml
[Х,М]
[X]
[М]
[Х.М1
Mg-Tl, Mg-Tm
337
Растворимость Т1 в (Mg) при отдельных температурах согласно работе
[X] показана ниже:
Температура, °С 405 300 200
Растворимость Т1:
%(ат) 15,4 10,9 7,3
% (по массе) 60,5 50,7 39,8
Кристаллическая структура фаз приведена в табл. 154.
Таблица 154. Кристаллическая структура фаз системы Mg-Tl
Соедине-
Соединение
Mg5Tl2
Mg2Tl
MgTl
Прототип
Mg5Ga2
Fe2P
CsCl
Символ
Пирсона,
пр. гр.
о/28,
Ibem
ИР9,
Р62т
cPl,
Pmlm
Параметры решетки, нм
и
-
0,8121
0,3635
с
-
0,7352
-
Источник
[X]
[Х,М]
[X]
Л.Л. Рохлин
Mg-Tm. МАГНИЙ-ТУЛИЙ
Диаграмма состояния Mg-Tm приведена на рис. 162 в основном по
данным работ [1-5].
В системе Mg-Tm образуются три соединения: Mg24Tm5, Mg2Tm и
MgTm [1-3]. Формулы соединений установлены в этих работах на
основании рентгенографических исследований. Со стороны Mg в системе
протекает эвтектическое превращение Ж ^ (Mg) + Mg24Tm5 при
температуре 592 °С и концентрации 10,9 % (ат.) [46 % (по массе)] Тт [4,
5]. Наличие термических эффектов и характер микроструктуры сплавов
указывали также на наличие эвтектоидного превращения в этой части
системы при температуре 571 °С [4, 5].
Со стороны Тт в системе установлено перитектическое превращение
при температуре 761 "Си эвтектоидное превращение при температуре
671 °С [3]. При перитектическом превращении образуется соединение
MgTm. Эвтектоидное превращение авторы работы [3] связывают с
338
Mg-Tm
1500
то
1300
1200
1100
1000
900
800
я
О 30 50 60 70
Тт, % (по массе)
80 SO S5
1
ж
1 ¦
1
Mgzjms
J
7
i
1
1
Mg2Tm MgTm
1
~1
i
L
/
/
1—7B\
/
/
•
671°
1
/
i
л
t
/ 1
ft
\l
M
1 1
1
1
r-/
¦ 1
/
1
rTm)-
\
\
\
\
\
\
100
1545"
600
500
WO
300
200
0 10 20 30 W 50 60 70 80 90 100
Mg Tm, % (am.) Tm
Рис. 162. Mg-Tm
наличием полиморфизма у Тт. Согласно данным работы [6], полимор-
полиморфное превращение в Тт не существует. Поэтому строение в части
диаграммы, примыкающей к Тт, будет другим. Возможный вариант этой
части диаграммы Mg-Tm показан на рис. 162.
Растворимость Тт в (Mg) при различных температурах, полученная
в работах [4, 5], указана ниже:
Температура, °С 571 540 500 400 300
Растворимость Тт:
% (ат.) ' 6,26 5,74 5,19 3,85 2,98
%(по массе) 31,8 29,8 27,5 27,1 17,6
Кристаллическая структура соединений приведена в табл. 155.
Mg-Tm, Mg-U
339
Таблица 155. Кристаллическая структура соединений системы Mg-Tm
Соедине-
Соединение
Mg24Tm5
Mg2Tm
MgTm
Прототип
Ti5Re24
MgZn2
CsCl
Символ
Пирсона,
пр.гр.
-,
/43m
Л/>12,
РЬъ!ттс
cPl,
РтЪт
Параметры решетки, нм
а
1,1208
0,597
0,3707
0,3744
0,3749
с
-
0,974
-
Источник
[1]
[2]
[1]
[7]
[3]
Литература
1. Крипякевич П.И., Евдокименко В.И., Гладышевскнй Е.И. // Кристаллография. 1964.
Т. 9. N 3. С. 410-411.
2. Krypiaketvytsch P.I., Evdokimenko V.I. // Z. Anorg. All. Chera. 1967. B.355 N 1/2.
S. 104-112.
3. Miller A.E., Daane A.H. // Trans. AIME. 1964. V. 230. N 4. P. 568-572.
4. Рохлин Л.Л. // Изв. АН СССР. Металлы. 1977. N 1. С. 181-183.
5. Рохлии Л.Л. // Магниевые сплавы, содержащие редкоземельные металлы. М.:
Наука, 1980. С. 192.
6. Gschneidner, Jr., K.A., Calderwood F.W. // Handbook on the Physics and Chemistry of
Rare Earths. Amsterdam, New York, Oxford, Tokyo: North-Holland Physics Publishing
Co., 1986. V. 8. Chap.54. P. 1-161.
7. Iandelli A., Palenzona A. // J. Less-Common Met. 1965. V. 9. N 1. P. 1-6.
Л.Л. Рохлин
Mg-U. МАГНИЙ-УРАН.
Представленная на рис. 163 диаграмма состояния Mg-U была
построена в работе [1] для давления 0,3 МПа по результатам химическо-
химического, термического, микроскопического и рентгеновского анализов. В связи
с высокой упругостью паров Mg и высокой реакционной способностью
Mg и U нагрев металлов с целью изучения их взаимодействия проводился
в атмосфере Аг при давлении 0,3-0,4 МПа.
В системе соединения между компонентами не образуются, установле-
установлена очень ограниченная растворимость компонентов друг в друге как в
твердом, так и жидком состоянии. Температура монотектического
превращения Ж2 •* Ж, + (yU) составляет 1135 °С и практически совпадает
с температурой плавления U. При температуре 653 °С протекает
перитектическое превращение Ж + (aU) «* (Mg). При температуре,
340
Mg-U Mg-V
±л
1000
800
6ЬО
600
zoo
U,'/.
1 506070 80
1 '
_я
*(A
i i
1
X+(j5b
\+ (aU)
w
Ж
(no
SO
i
¦fir<
массе)
95
1)
Mf+Mt
(r"
{fiUt
'аи)
fffl
—»-
1135'
776°
668
О 10 Z0 JO 4-0 50 SO 70 80 90 100
мд U,%fam) U
Рис 163 Mg-U
несколько превышающей температуру монотектического превращения,
растворимость U в жидком Mg составляет 0,014 % (ат) [0,14 % (по массе)],
а растворимость Mg в жидком U - 0,04 % (ат) [0,004 % (по массе)]
Растворимость U в Mg согласно работе [1] уменьшается с 0,005 % (ат)
[0,05 % (по массе)] при температуре 675 "С до 0,00005 % (ат) [0,0005 %
(по массе)] при 650 °С Согласно сведениям, приводимым в справочнике
[Э], растворимость U в Mg составляет 0,017 % (ат) [0,17 % (по массе)] при
температуре 1132 °С и 0,0002 % (ат ) [0,002 % (по массе)] при 650 °С
Литература
1 ChioMiP,TracyGA,WilheimHA Hi Metals A1ME 1956 V 8 N 5 Sec 2 P 562-567
Л Л Рохлин
Mg-V. МАГНИЙ-ВАНАДИЙ
Авторами работы [1] установлено, что Mg и V практически не
сплавляются, и в системе наблюдается несмешиваемость в жидком и
твердом состоянии Температура плавления V, согласно работе [1], равна
Mg-V Mg-W
341
3000
2500
WOO
1500m
wso'
WOO
650"
500
V, %(/io массе)
0 10 20 30 40 SO 60 70 SO
90
WO
1 II 1
Газ
+(мд)
i
— -
i 11
Газ*Ж
Газ-*
Ж*
——|
(V)
— —
Г" -
(vh-
JW
mo"
20 JO 40 50 60 70 80 90
100
V
0 fO
Mff
Рис 164. Mg-V
1885 "С, а температура монотектического равновесия - 1860 °C В
справочнике [М] приведена обобщенная на основании данных работы
[1] диаграмма состояния Mg-V при давлении 0,1 МПа и с принятой по
стандартным данным температурой плавления V, равной 1910 °С, и
с корректированной температурой монотектического равновесия
(рис 164)
В жидком Mg растворимость V при температуре 950 °С равна 0,14 %
(ат) [0,3 % (по массе)] и понижается до 0,03 % (ат) [0,06 % (по массе)] при
температуре 650 °С [1] Растворимость Mg в (V) при температуре 1860 °С
определена равной 0,06-0,08 % (ат) [0,03-0,04 % (по массе)], а при 20 "С
она составляет 0,02 % (ат) [0,01 % (по массе)] [1]
Литература
1 Савицкий Е.М., Барои В.В., Ефимов Ю.В., Бычкова М.И. // Металлургия
металловедение физико-химические методы исследования Сб статей М Изд-во АН
СССР 1963 Вып 14 С 139-146
Л Л Рохлин
Mg-W. МАГНИЙ-ВОЛЬФРАМ
Диаграмма состояния системы не построена Mg практически не
взаимодействует с W, по крайней мере, при температурах до 1000 °С
[1-3] На основании незначительного изменения параметров
решетки а - 0,320880 нм, с = 0,520992 нм для Mg до а = 0,320971 нм,
342
Mg-W, Mg-Y
с - 0,520970 нм для Mg, в который вводился W, делается вывод о
чрезвычайно малой растворимости W в Mg [4].
Литература
1. Kremer D. //Abh. Inst. Metallhiittenwes. Elektrometall. Tech. Hochsch. Aachen. 1916
Bd. 1. S 8-9.
2. Sauerwald F. // Z. Anorg. All. Chem. 1949. Bd. 258. H. 3-5. S. 296-300.
3. Raub E., Plate W. // Z. Metallkunde. 1951. Bd. 42. N 3. S. 76-82.
4. Busk R.S. III. Metals. AIME. 1950. V. 2. N 12. P. 1460-1464.
КБ. Поварова
Mg-Y. МАГНИЙ-ИТТРИЙ
Диаграмма состояния Mg-Y (рис. 165) исследована в работах [1-8].
Для системы характерно образование нескольких соединений. Первона-
Первоначально приписываемые формулы соединениям Mg,7Y3, Mg5Y2, Mg3Y
t'c
1500
1400
1300
/ZOO
1100
1000
900
800
700
600
500
400
300
200
Y, % (по массе)
О го 40 50 60 70 80
too
1
650'-
$565
I
I 1
\
Ж
/.
*\
||
(
620'
I
i
7Л0*
1
J
1
1
1
1
|
1
1
*
/
W
773
/
X
/
i
f
68,9
/
n
1
I
i
i
1
1
(aY)
\
I
1
\
1
1
1
1522
Рис.
0 10
Mg
165. Mg-Y
20
30
40
Y,
%
50
(am)
SO
70
80
90
too
Y
Mg-Y 343
[1,2] при последующих исследованиях не подтвердились. В соответствии
с более поздними рентгенографическими исследованиями в работах [4-7]
соединениям, образующимся в сплавах, были приписаны формулы: е -
Mg24Y5, б- Mg2Y, y - MgY. Эти соединения образуются по перитектичес-
ким реакциям Ж + Mg2Y - Mg24Y5, Ж + MgY ^ Mg2Y и Ж + QJY) ^ MgY
при температурах 620 °С [8], 780 и 935 "С [1] соответственно.
Для фаз ей у, отожженных при температурах несколько ниже
температур соответствующих эвтектического или перитектического
превращений, в работе [7] были определены области гомогенности: они
расположены для фазы e(Mg24Y5) при концентрациях Y от 13 до 16 %
(ат.) [35,3-41,0 % (по массе)], для фазы v(MgY) от 48 до 50 % (ат.)
[77,3-78,5 % (по массе)]. Области гомогенности г и у фаз несколько
смещены от стехиометрического состава соединений Mg24Y5 и MgY в
сторону Mg. Протяженность области гомогенности фазы б не установле-
установлена в работе [7]. Изменение границ областей гомогенности фаз гиус
температурой не определено. Поэтому они на диаграмме обозначены
штриховыми линиями.
В построенной диаграмме состояния (рис. 165) со стороны Mg
использованы результаты работы [8].
Со стороны Mg диаграмма состояния относится к эвтектическому
типу. Эвтектическое равновесие Ж •* (Mg) + Mg24Y5 имеет место при
температуре 565 °С и концентрации 9 % (ат.) Y [8]. В области концентра-
концентраций от 20 до 100 % (ат.) Y диаграмма состояния построена по данным
работы [1], но с изменениями состава и формул образующихся соедине-
соединений, приведенных по результатам работ [4-7].
Со стороны Y имеет место эвтектоидное равновесие (pY) ** MgY +
+ (aY) при температуре 775 "С и концентрации 68,9 % (ат.) Y [1].
Растворимость Y в (Mg) при отдельных температурах, определенная в
работе [8] методом электросопротивления, составляет:
Температура, "С 565 550 500 400 300 200
Растворимость Y:
%(ат.) 3,61 3,44 2,95 1,87 1,19 0,62
% (по массе) 12,0 11,5 10,0 6,5 4,2 2,2
Кристаллическая структура соединений приведена в табл. 156.
344
Mg-Y, Mg-Yb
Таблица 156. Кристаллическая структура соединений системы Mg-Y
Соединение
e(Mg24Y5)
6(Mg2Y)
Y(MgY)
Прототип
аМп
MgZn2
CsCl
Согласно работе [5],
структура аМп).
Символ
Пирсона,
пр.гр.
с/58,
/43 т
hP\2,
Pb-jmmc
сР2,
РтЪт
Параметры решетки, нм
а
1,1257
1,125-1,128
0,602
0,376
0,378-0,381
с
-
-
0,974
-
-
Источник
[5]
[7J
[4,6]
[4,6]
[7]
прототипом соединения Mg24Y5 является Re24Ti5 (сверх-
Литература
1. Gibson E.D., Carlson O.N.// Trans. ASM. 1960. V. 52. P. 1084-1096.
2. ТереховаВ.Ф., Маркова И.А., Савицкий Е.М. //Журнал неорганической химии. 1960.
Т. 5. N 1.С. 235-236.
3. Mizer D., Clark J.B.// Trans. AIME. 1961. V. 221. N 2. P. 207-208.
4. Гладышевский Е.И., Крипякевич П.И., Черкашин E.E. и др. // Редкоземельные
элементы: Сб. статей. М.: Наука, 1963. С. 67-70.
5. Крипякевич П.И., Евдокимеико В.И., Гладышевский Е.И. // Кристаллография. 1964.
Т. 9. N3. С. 410-411.
6. Крипякевич П.И., Евдокимеико В.И. // Вопросы теории и применения редкоземельных
металлов: Сб. статей. М.: Наука, 1964. С. 146-148.
7. Smith J.F., Bailey D.M., Nowotny D.B. et al. // Acta Metallurgica. 1965. V. 13. N 8.
P. 889-895.
8. Свидерская З.А., Падежиова Е.М. // Изв. АН СССР. Металлы. 1968. N 6. С. 183-190.
Л.Л. Рохлин
Mg-Yb. МАГНИЙ-ИТТЕРБИЙ
Диаграмма состояния Mg-Yb (рис. 166) исследована во всем
диапазоне концентраций в работе [1] и со стороны Mg в работе [2]. Для
системы характерно образование одного конгруэнтно плавящегося
соединения при температуре 718 °С, что подтверждено рентгенографичес-
рентгенографически также в работах [3, 4]. Формула соединения, относящегося к фазам
Лавеса, Mg2Yb. Для соединения характерна существенная область
Mg-Yb
345
Y, % (по массе)
О JO 5060 70 SO SO 95
[aYb)
О Ш ZO JO
Mg
Рис. 166. Mg-Yb
50 60 70 80 90 100
Yb,a/.(am) Yb
гомогенности, простирающаяся от 29,3 до 36,2 % (ат.) Yb, либо от 75 до
80 % (по массе) Yb.
В системе имеют место два эвтектических превращения: Ж -* (Mg) +
+ Mg2Yb при температуре 500 °С и концентрации 10,7 % (ат.) Yb [2] и
Ж ** Mg2Yb + (PYb) при температуре 496 "С и концентрации - 68,5 % (ат.)
Yb [1]. При температуре 447 °С со стороны Yb протекает эвтектоидное
превращение (pYb) -* Mg2Yb + (aYb) при концентрации 92 % (ат.) Yb [1].
Растворимость Yb в (Mg), согласно работе [1], следующая:
Температура, °С . . .
Растворимость Yb:
% (ат.)
%(по массе) ...
500
1,2
7,95
400
0,7
4,8
200
0,35
2,4
Согласно исследованиям авторов работ [2,5] растворимость Yb в (Mg)
составляет:
Температура, °С 500 450 400 300 200
Растворимость Yb:
% (ат.) 0,48 0,31 0,21 0,071 0,049
% (по массе) 3,3 2,1 1,5 0,5 0,35
Последним данным следует отдать предпочтение, так как они
получены методом электросопротивления, который при малой
Mg-Yb. Mg-Zn
растворимости Yb в Mg более точный, чем рентгеновский метод,
использованный в работе [1].
Максимальная растворимость Mg в (Yb) при температуре эвтектоид-
ного превращения 447 °С определена равной 3,9 % (ат.) и около 0,7 %
'ят.) при температуре 200 "С [1].
Соединение Mg2Yb имеет прототип MgZn2 (символ Пирсона hPM,
.гр. Р6г1ттс) и параметры решетки: а - 0,62182...0,62362 нм, с =
1.0043. 1 П1П98 uu П1 п - П Ь">А uw ^ = 1 ППЯ uw П Л1
(ат.) при температуре 200 "С [1]
Соединение Mg2Yb имеет пр
пр.гр. Р6г1ттс) и параметры решетки: а - 0,62182...(i
= 1,0043... 1,01028 нм [1],а = 0,624 нм, с = 1,008 нм [3, 4].
Литература
1. McMasters O.D., Gschneidner, Jr., K.A. // J. Less-Common Met. 1965. V. 8. N 5.
P. 289-298.
2. Дриц М.Е., Рохлин Л.Л. II Изв. вузов. Цветная металлургия. 1977. NIC. 169-171.
3. Крипякевич П.И., Евдокименко В.И. // Вопросы теории и применения редкоземельных
металлов: Сб. статей. М.: Наука, 1964. С. 146-148.
4. Крипякевич П.И., Евдокименко В.И., Залуцкий И.И. // Доповпп АН УРСР. 1964. N 4.
С. 766-767.
5. Рохлин Л Л. К Магниевые сплавы, содержащие редкоземельные металлы. М.: Наука,
1980. 192 с.
Jl.ll. Рохлин
Mg-Zn. МАГНИЙ-ЦИНК
Представленная в справочнике [X] диаграмма состояния Mg-Zn с
учетом данных большого числа работ в дальнейшем была в основном
подтверждена результатами работ, приведенными в справочнике [Э].
Различие между диаграммами, данными в справочниках [X] и {Э] главным
образом состоит в температурах нонвариантных превращений и
уточнении границ областей гомогенности фаз. Представленная на
рис. 167 диаграмма состояния Mg-Zn воспроизводится согласно более
позднему обзору [Э]. При этом формула ближайшего к Mg соединения
приводится согласно работе [1] как Mg5|Zn20, обозначаемого ранее как
Mg7Zn3.
Диаграмма состояния системы Mg-Zn характеризуется наличием
соединений: Mg5|Zn20, MgZn, Mg2Zn3, MgZn2и Mg2Znn,которые имеют
незначительные области гомогенности. Область гомогенности соедине-
соединения MgZn2 простирается от 66 % (ат.) Zn при температуре 416±2 °С до
67,1 % (ат.) Zn при температуре 381 "С. Соединение MgZn2 плавится
конгруэнтно при температуре 588 °С. Остальные соединения образуются
по перитектическим реакциям:
Mg-Zn
347
Ж + MgZn - Mg5,Zn20 при --,<.... ^,
Ж + Mg2Zn3 ~ MgZn при 347± 1 °C;
Ж + MgZn2 - Mg2Zn3 при 416±2 °C;
Ж + MgZn2- Mg2Znlt при 381 °С.
В системе имеют место также два эвтектических равновесия: Ж -
•* (Mg) + Mg5 iZn20 при температуре 340± 1 "С и концентрации 28,1 % (ат.)
Zn и Ж ** Mg2Zn,, + (Zn) при температуре 364 "С и концентрации 92,2 %
(ат.) Zn, а также одно эвтектоидное равновесие Mg51Zn20 -* (Mg) + MgZn
при температуре 312±2 °С и концентрации 30 % (ат.) Zn.
Растворимость Zn в (Mg), приведенная в справочнике [X], согласно
результатам измерения параметров решетки, представлена ниже:
Zn,"/o(no массе)
0WZ030W 50 60 70 80 SO
/00
Ш.58"
@0
О Ю 20 30 ЬО 50 60 70 80 90 /00
Мд Zn, % (am.) Zn
Рис. 167. Mg-Zn
348
Mg-Zn
Температура, "С
Растворимость Zn, % (ат.) .
340
3,3
300
2,3
250
1,25
200
0,75
150
0,65
Эти данные хорошо согласуются с результатами определения
растворимости Zn в (Mg) в более поздней работе [2]. Согласно данным,
приведенным в справочнике \Э], растворимость Zn в (Mg) несколько
меньше и, при отдельных температурах, составляет:
Температура, °С 600
Растворимость Zn, % (ат.) 1,0
Температура, °С 400
Растворимость Zn, % (ат.) 2,25
Температура, °С 250
Растворимость Zn, % (ат.) 1,25
Растворимость Mg в (Zn) при эвтектической температуре равна около
0,3 % (ат.), а при температуре 200 °С около 0,18 % (ат.) [X].
Кристаллическая структура соединений представлена в табл. 157.
Таблица 157. Кристаллическая структура соединений системы Mg-Zn
567
1,28
380
2,4
200
1,0
550
1,3
339
2,4
150
0,8
500
1,7
325
2,2
100
0,7
450
1,95
300
1,75
Соедине-
Соединение
Mg5lZn20
MgZn*
Mg.Zn,"
MgZn,
MgjZn,,
Прототип
-
-
Mg4Zn7
MgZn2
Mg2Znn
Символ
Пирсона,
пр.гр.
о/142,
linmm
-
mCUO,
BVm
АЛ 2,
Pbjlmmc
с?39,
РтЗ
Параметры решетки, нм
а
1,4083
1,404
0,400
2,596
0,518
0,855
'Ромбическая сингония.
Моноклинная сингония, у = 102,5 °С.
Ь
1,4486
1,404
0,533
1,428
-
—
с
1,4025
1,445
1,76
0,524
0,852
—
Источник
[1]
[3]
[4]
[6,М]
[П]
[5, X, V-C]
В работе [6] соединение Mg2Zn3 рассматривается как Mg4Zn7, для
которого установлена решетка, указанная в табл. 157. Такой же тип
решетки для Mg2Zn3 принят в [М].
Mg-Zn, Mg-Zr 349
Литература
l.HigashiJ.,ShiotaniN.,UdaM.etal. III. Solid State Chem. 1981. V. 36. N 2. P. 225-233.
2. Дриц М.Е., Падежиова Е.М., Миклппа Н.В. // Изв. АН СССР. Металлы. 1974. N 3.
С. 225-229. .
3. Мельник Э.В., Костина М.Ф., Ярмолюк Я.П., Змий О.Ф. // Магниевые сплавы: Сб.
статей. М.: Наука, 1978. С. 95-99
4. Рейнор Г.В. // Металловедение магния и его сплавов: Пер. с англ. М.: Металлургия,
1964.488 с.
5. SamsoH S. // Acta Chem. Scand. 1949. V. 3. P. 835-843.
6. Ярмолюк Я.П., Крипякевич П.И., Мельник Э.В. // Кристаллография. 1975. Т. 20. N 3.
С. 538-542.
Т. В. Добаткино
Mg-Zr. МАГНИЙ-ЦИРКОНИЙ
Исследованию диаграммы состояния Mg-Zr со стороны Mg
посвящено большое число работ, обзор которых достаточно полно
представлен в справочниках [X, Ш] и в работе [1].
На рис. 168 представлена часть диаграммы состояния Mg-Zr в
области концентраций 0-1,5 % (ат.) Zr, построенная авторами работы
[2] с использованием данных работы [3] по растворимости Zr в (Mg).
Данные работы [2] являются наиболее убедительными и использованы
в справочнике [Ш] и в работе [1]. Диаграмма состояния исследована в
работе [2] методами микроскопического, дифференциального термичес-
термического, рентгеновского, микрорентгеноспектрального анализов и
измерения микротвердости. Никаких соединений между Mg и Zr в
системе не образуется. Возможность образования соединения Mg2Zr [4]
и фазы, содержащей около 3 % (ат.) Zr, со структурой, изотипной
cTpyKTypeZn22Zr [5], не подтверждаетсяэкспериментальными результата-
результатами работы [2]. В системе имеются равновесия между твердым и жидким
Mg и обоими модификациями Zr. Согласно температуре полиморфного
превращения Zr равновесие между (Mg) и жидким Mg и (aZr) происходит
предположительно при температуре ниже 863 °С, а между жидким Mg
и (pZr) - при температуре выше 863 "С.
В системе со стороны Mg имеет место нонвариантное равновесие
перитектического типа при температуре 654 °С, которая только на 4 "С
превышает температуру плавления Mg. Данные разных исследований
по температурам и составу фаз, участвующих в реакции Ж + (aZr) •*
- (Mg), представлены ниже:
350
Mg-Zr
Содержание Zr, % (ат.) в фазах:
Ж • 0,161 -0,161 0,134 0,112 0,155
(Mg) 0,985 1,24 - 0,35-1,042
Температура, °С 653,6 653-655 650,5 654 654
Источник [2] [6] [7] [4] [8]
Температура перитектического равновесия 657 °С, полученная в
работе [10] методом термоэлектродвижущих сил, по-видимому, слишком
высока.
Как видно, большая часть исследователей указывает на раствори-
растворимость Zr в жидком Mg при перитектической температуре в пределах
0,155-1,161 % (ат.). Наиболее низкое значение 0,112 % (ат.) [4], по-
видимому, связано с наличием примесей, которые оказывают сильное
влияние на растворимость Zr в расплаве Mg. Данные по растворимости
Zr в (Mg) при различных температурах, определенные методом измерения
электросопротивления [3] и методом электронных проб [2], представлены
ниже:
Zr, % (по массе)
800
700
650'
600
500
4-00
300
•X
\р.16
/
/
S
^—"
Ж+(с
(М0*(а
zr)
Zr)
i
S5V
0,985
0
Мд
Рис. 168.
0,2 L
Mg-Zr
',«- 0,6
Zr,'/.
0,8
(am.)
1.0
1.1
Mg-Zr, Mn-Mo 351
Температура, °С 654 500 450 400 350 300
Растворимость Zr, % (ат.) 0,985 0,172 0,148 0,114 0,092 0,080
Источник [2] [3] [3] [3] [3] [2]
Наиболее высокие значения растворимости Zr в (Mg) получены в
работах [6,10] и составляют 1,24 и 1,042 % (ат.) соответственно. Как уже
указывалось, на рис. 168 приведены данные по растворимости Zr в (Mg),
взятые из работ [2, 3], которые находятся в хорошем соответствии с
результатами работы [11], полученными методом изучения микрострукту-
микроструктуры.
Литература
1. Nayeb-Hashemi A.A., Clark J.B.//Bull. Alloy Phase Diagrams. 1985. V. 6. N 3. P. 246-250.
2. Vesey I.M., Bray H.J. // J. Inst. Met. 1964. V. 92. N 11. P. 383-384.
3. Crosby R.L., Fowler K.A. // U.S. Bur. Mines, Rep. Invest. 1962. N 6078.
4. Carson O.A., Austin D.T. // Can. Min. J. 1952. V. 73. P. 70-75.
5. PooleD.M., Martin P.M., Hodkin E.N./У J. Inst. Met 1965. V. 93. P. 168.
6. Sauerwald F. // Z. Anorg. All. Chem. 1947. V. 255. P. 212-220.
7. MellorQ.A. III. Inst. Met. 1950. V. 77. P. 163-174.
8. Schaum J.H., Burnett H.C. // J. Res. Natl. Bur. Stand. 1952. V. 49. P. 155-162.
9. Асанович В.Я., Брусов В.И., Срывалии И.Т. //Труды Краснодарского политехническо-
политехнического института: Краснодар, 1973. Т. 49. С. 149-152.
10. Emley E.F., Duncumb P.//J. Inst. Met. 1962. V. 90. P. 360-361.
11. Дриц М.Е., Добаткииа Т.В., Муратова Е.В. // Металловедение и обработка цветных
сплавов: Сб. статей. М.: Наука, 1992. С. 32-37.
Л.Л. Рохлин, Т.В.Добаткина
Miv-Mo. МАРГАНЕЦ-МОЛИБДЕН
Данные о взаимодействии в системе Mn-Мо приведены в справочни-
справочниках [X, Э]. Исследования сплавов, содержащих до 7,8 % (ат.) Мо [X] и
-2,5 % (ат.) Mo P], проводили методами термического, рентгеновского
и микроструктурного анализов.
Наиболее надежно в системе установлена фаза о (Мо36Мп64), которая
существует в температурном интервале 1090-1400 °С [X]. Авторами
работы [X] высказано предположение о существовании при температуре
1000 °С другого соединения между 80 и 88 % (ат.) Мп, которое в работах
[1, 2] интерпретировано как продолжение области (аМп). В работе [1]
предполагается также существование соединения между 50 и 60 % (ат.)
Мп, это соединение подтверждено авторами работы [2] (фаза ц). В работе
[2] построена обобщенная диаграмма состояния (рис. 169) с учетом
экспериментальных результатов прежних работ и термодинамических
данных компонентов.
352
Мп-Мо
to
го
Мп, % (по массе)
30 40 50 ВО ТО 80 90 100
Z0OO
1500
WOO
500
О 10 20 30
Мо
Рис. 169. Мп-Мо
50 SO 70 SO SO tOO
Мп, % (am.) Мп
Имеющиеся в системе соединения о и ц образуются по перитектичес-
ким реакциям Ж + ц "¦ о при температуре 1400+100 °С и концентрации
64±1 % (ат.) Мп и Ж + (Мо) - ц при температуре 1500±100 °С и
концентрации 55±5 % (ат.) Мп. Обе фазы имеют незначительные области
гомогенности. Реакции, проходящие со стороны Мп, связаны с участием
полиморфных модификаций Мп:
Ж () при 1325±100°С;
FMn) ~ (vMn) + о при 1110±10 °С;
(YMn) + o-(PMn) npHlll0±10°C-1090±15°C;
(PMn) + ц -* (аМп) при 1090± 15 °С.
Растворимость Мп в (Мо):
Температура. °С
Мп,%(ат.)
Источник
[800
30
[X]
15001200
-36
[2]
1000
>15
[X]
800
16
[1]
Согласно работе [2], растворимость Мо в (аМп) составляет 17±3 %
(ат.) при температуре 1100±50 "С.
Mn-Mo, Mn-N
353
Растворимость Mo в (рМп) при температуре 800 "С равна 2 % (ат.)
[1], а при температуре 1110±10 "С - до 2,6 % (ат.) [2].
Растворимость Мо в (уМп) составляет не более 0,6 % (ат.) при
температуре 1110± 10 °С Р, 2], растворимость Мо в FМп) - до - 20 % (ат.)
при1325±100°С[1].
Кристаллическая структура соединений приведена в табл. 158.
Таблица 158. Кристаллическая структура соединений системы Мп-Мо
Соединение
о(Мо36Мп64)
u.(Mo4Mn5)
Прототип
oFeCr
Mo6Fe7
Символ
Пирсона,
пр.гр.
tPiO,
Р4^ттт
Параметры решет-
решетки, им
а
0,910
с
0,474
Примечание
При 63,7 % (ат.) Мп [X,
Э]
[2]
Литература
1. Телегус B.C., Кузьма Ю.Б., Марко М.А. // Порошковая металлургия. 1971. № 10.
С. 898-903.
2. Brewer L., Lamoreaux R.H. // Atomic Energy Rewiew. Special Issue N 7 Molibdenum:
Physico-Chemical Properties of its Compounds and Alloys. Vienna: International Atomic Energy
Agency, 1980. P. 195-356.
К.Б. Поварова
Mn-N. МАРГАНЕЦ-АЗОТ
Диаграмма состояния Mn-N рассмотрена в работах [X, Э, Ш, 1-3].
На рис. 170 представлена ориентировочная диаграмма состояния,
построенная по данным работы [1] в интервале концентраций 0-50 % (ат.)
N. В системе имеются фазы: е, С, т) и 6. Фаза e(Mn4N) устойчива при
температуре до 1000 °С и при этой температуре диссоциирует на (уМп)
и N2- При температуре 478 "С фаза е претерпевает магнитное превраще-
превращение. Область гомогенности фазы е, находящаяся при температуре 400 °С
при концентрации 19-20,7 % (ат.) N, расширяется с повышением
температуры, смещаясь в сторону Мп при температуре -900 °С до 17,3 %
(ат.) N [1]. Фаза f(Mn2N) диссоциирует при температуре 900 °С на фазу
?HN2[1].
В работах [2, 3] сделана попытка уточнить диаграмму состояния
системы Mn-N в области концентраций 5-25 % (ат.) N и в интервале
354
Mn-N
N, У. (по массе)
О 12 3 4-5678 10 12
16 20
W
0
Мп
Рис. 170. Mn-N
10
20
30
'о (am )
50
температур 600-1000 "С. Согласно данным работы [2], фаза С распадается
по эвтектоидной реакции на фазы у и е при температуре 800 °С и
концентрации 13 % (ат.) N, а по данным работы [3] эвтектоидный распад
претерпевает фаза С при -800 °С и 12,9 % (ат) N. По данным недавней
работы [41, где Приведена обобщенная диаграмма состояния Mn-N, фаза
С устойчива при температуре до 1270 "С Эти данные не приведены на
рис. 170.
Фаза Ti(Mn3N2), существующая в области концентраций N 38,2-41 %
(ат.) при температуре 400 "С, диссоциирует при -700 °С на фазу С и N2
Фаза 6(Mn6Nj) существует в интервале концентраций 45,7-47,9 % (ат)
N при 400 °С, при повышении температуры она несколько сдвигается
в сторону меньших содержаний N при одновременном сужении области
существования. Температура диссоциации фазы 6 на фазу г| и N2
находится в пределах температур 580-600 "С
Кристаллическая структура соединений представлена в табл 159
Mn-N, Mn-Na
355
Таблица 159 Кристаллическая структура соединений системы Mn-N D|
Соединение
e(Mn4N)
«Mn2N)
n(Mn3N2)
в(Мп6М5)*
Прототип
Fe4N
Fe2N
-
Тетрагональная сингония
Символ Пирсона,
пргр
сР5,
Fmlm
hPi,
P63lmmc
Г/б,
\Mmmm
-
Параметры а
0,3825-0,3868
-
-
Литература
1 Мампории Г.Ш.// Доклады АН Груз ССР 1967 Т 45 N 3 С 663-667
2 KudielkaH.,GrabkeH.J.//Z Metallkunde 1975 Bd 66 N 8 S 469-471
3 PompeR.//Scand J Met 1979 V 8 N2 P 51-54
4 Goken N.A. // Bull Alloy Phase Diagrams 1990 V 11 N 1 P 33-42
А Л Татаркина
Mn-Na. МАРГАНЕЦ-НАТРИЙ
Диаграмма состояния Mn-Na в литературе отсутствует В работе [1]
имеются сведения об ограниченной растворимости Мп в Na с низким
содержанием О в жидком состоянии, а в работе [2] о положении линии
ликвидуса, рассчитанной с использованием модели субрегулярных
растворов Растворимость Мп определяли методом атомно-абсорбцион-
ного спектрофотометрического анализа Растворимость Мп увеличивает-
увеличивается от 0,7-10'4 % (по массе) при температуре 276 °С до 3,5-10~*% (по массе)
при температуре 538 °С Значения растворимости Мп в Na можно
описать уравнением IgS[l(T4%(no массе)] = 3,6406-2601,73/Т, где Т-
температура, К
Литература
1 PeriaswaniG.,GanesanV.,RajanBabuS., MathewsCK.// Mater Behav and Phys Chem
Liguid Metal Syst Pioc Conf Karlsruhe March 24-26 I98l New York London 1982
S 411-420
2 Кузин А.Н., Люблинский И.Е., Бескоровайиый Н.М. // Расчеты и экспериментальные
методы построения диаграмм состояния Сб статей М Наука, 1985 С 113-118
А Л Татаркина, Г К Алексеенко
356
Mn-Nb
Mn-Nb. МАРГАНЕЦ-НИОБИЙ
Диаграмма состояния Mn-Nb (рис. 171) построена на основе
обобщения данных работы [1] в интервале концентраций 0-20 % (ат.) Nb
и данных работы [3] в интервале концентраций 20-50 % (ат.) Nb.
Поскольку узкие двухфазные области со стороны Мп экспериментально
не были исследованы, на вставке (см. рис. 171) они показаны схематичес-
схематически. Диаграмма Mn-Nb была исследована методами микроструктурного,
рентгеноструктурного и термического анализов, сплавы выплавляли в
атмосфере Аг в тиглях из ThO2 [I], BeO [2] или дуговой выплавкой на
0C 5 10 E
Nb, % (no массе)
30
О 5
Мп
Рис. Г71.Мп-1ЧЬ
10 10 J0
N6,'/.farn.)
50
Mn-Nb, Mn-Nd 357
медном водоохлаждаемом поду с нерасходуемым вольфрамовым
электродом [3].
В системе конгруэнтно при температуре 1500 °С образуется
соединение Mn2Nb (фаза Лавеса), которое имеет область гомогенности
при 30-38 % (ат.) Nb. В системе протекают эвтектическая, перитектоид-
ная и эвтектоидная реакции соответственно:
Ж - FМп) + Mn2Nb при температуре 1224 "С и концентрации Nb в
жидкой фазе 3,6 % (ат.) [I];
FМп) + Mn2Nb - (PMn) при температуре 1145 "С и концентрации Nb
в(рМп)фазе~2%(ат.)[1];
FМп) - (PMn) + (-уМп) при температуре -1120 °С и концентрации Nb
в эвтектоидной точке 0,4 % (ат.) [1].
Согласно данным работы [2], Nb повышает температуру а ** р
превращения Мп с температуры 727 до 800 °С. Максимальная раствори-
растворимость Nb в (бМп) составляет 2,4 % (ат.).
Соединение Mn,Nb относится к типу MgZn2 (символ Пирсона hP\2,
пр.гр. Р63/ттс). Параметры решетки соединения Mn2Nb приведены
ниже:
Параметры решетки, нм:
а 0,490 0,4896-0,4865 0,4891
с 0,804 0,8015-0,7976 0,7969
Источник- [Ш] [3] [2]
Литература
1. Hellawell A. 111. Less-Common Met. 1959. V. 1. N 5. P. 343-347.
2. Савицкий Е.М., Конецкий Ч.В. //Журнал неорганической химии. 1960. Т. 5. Вып. 3.
С. 755-757.
3. Свечников В.Н., Петьков В.В. // Металлофизика. 1976. Вып. 64. С. 24-28.
Е.Н Шефтель
Mn-Nd. МАРГАНЕЦ-НЕОДИМ
Диаграмма состояния Mn-Nd построена в полном интервале
концентраций в работе [1 ] (рис. 172). Сплавы синтезировали в высокочас-
высокочастотной печи в тиглях из А12О3. В качестве исходных материалов
использовали электролитический Мп чистотой 99,9 % (по массе) и
дистиллированный Nd чистотой 99,9 % (по массе). Исследование
проводили методами термического, металлографического и рентгено-
структурного анализов.
358
Mn-Nd
t;c
Nu, % (no массе)
О40 20 JO ЬО 50 60 70 80 30
1200
1138°
two'
WOO
WO
I1
4
i
4J"Mn) ~/W0
{aHn,
S? '
Is
к,
—37.
4-
t
320°
T~
1
1
1
1
1
1
1
1
1
1
1
1
ч
Ж
\
W0°
\
\
i
/
73
/
/
(a/
/021°
fcf)—
863"
800
600
ш
0 tO 20 JO ЬО 50 60 70 80 90 WO
Mn Nd, % (am) Nit
Рис. 172. Mn-Nd
Соединения Mn2Nd, Mn23Nd6и Mri|2Nd образуются по перитектичес-
ким реакциям:
Ж + Mn23Nd6 - Mn2Nd при 920 °С;
Ж + Mn12Nd ^ Mn23Nd6 при 975 °С;
Ж + GМп)^Мп12Шпри~1100°С.
В системе также наблюдается эвтектическое равновесие: Ж - Mn2Nd +
+ (aNd) при температуре 700 "С и концентрации 73 % (ат.) Nd.
Взаимная растворимость компонентов в твердом состоянии
практически отсутствует.
Кристаллографические характеристики соединений приведены в
табл. 160 по данным работы [2].
Mn-Nd. Mn-Ni
359
Таблица 160. Кристаллическая структура соединений системы Mn-Nd
Соединение
Mn2Nd
Mn23Nd6
Mnl2Nd
Прототип
Zn2Mg
Mn23Th6
Mnl2Th
Символ Пирсо-
Пирсона, пр.гр.
hP\2,
Pb^lmmc
TJt
(/26,
/4/mmm
Параметры решетки, нм
a
0,5545
1,2657
0,8660
с
0,9037
-
0,4810
Литература
l.KirchmayrH.R., Lugscheider W.//Z. Metallkund. 1970. Bd, 61 N IS. 22-23.
2 Гладышевский Е.И., Бодак О.И. // Кристаллохимия интерметаллических соединений
редкоземельных металлов Львов: Вища школа, 1982. 255 с.
Е.И Гладышевский, О.И. Бодак. В.К. Печарский
Mn-Ni. МАРГАНЕЦ-НИКЕЛЬ
Диаграмма состояния Mn-Ni рассмотрена в работах [X, Э, Ш]. На
рис. 173 представлена диаграмма состояния по данным работы [I],
построенная по результатам микроструктурного, рентгеновского,
термического, магнитного и электронно-микроскопического анализов.
Сплавы выплавляли в высокочастотной печи в вакууме из Мп высокой
чистоты и электролитического №. В работе [2] уточнили ход линий
ликвидуса и солидуса в области, богатой NL Между уМп и Ni существует
непрерывный ряд твердых растворов (yMn, Ni). Соединения Mn2Ni,
MnNi(BT) и MnNi2(BT) образуются в твердом состоянии из (yMn, Ni)
при температурах 725,910 и 710 °С соответственно. Низкотемпературные
модификации соединений MnNi(HT) и Мп№2(НТ) образуются по
перитектоидным реакциям при температурах 480 и 440 °С. По перитекто-
идным реакциям образуются также соединения Mn3Ni при 430 °С и
MnNi3 при 520 °С. При температуре 775 °С по перитектоидной реакции
между высокотемпературной модификацией MnNi и (yMn, Ni) твердым
раствором образуется среднетемпературная модификация фазы
MnNi(CT). В работе [3] диаграмму состояния Mn-Ni построили
расчетным методом на основании термодинамических данных. В работе
[4] приведена обобщенная диаграмма состояния, которая имеет лишь
незначительные расхождения с диаграммой, построенной в работе [1].
360 Mn-Ni
Ni,'A (по моссе)
0 W 20 30 40 50 60 70 80 90 WO
П00
300
0
Mn
Рис. 173.
10
Mn-Ni
20
30
40
Ni,
50 60
% (от.)
70
80
90
WO
Ni
Кристаллическая структура фаз приведена в табл. 161.
Таблица 161 Кристаллическая структура соединений в системе Mn-Ni |41
Соединение
MnNi(BT)
MnNi(CT)
MnNi3(HT)
Прототип
CsCl
AuCu
AuCu-j
Сфукгура соединения
Символ
Пирсона,
пргр
сП,
Рт Зл!
/?4,
PAImmm
сГ4,
РтЪт
Параметры решет-
решетки, нм
о
0,3749
0,2977
0,3734
0,3729
0 3589
Mn-,Ni неизвестна
с
-
0,3645
0,3625
-
Примечание
При 47,7%(aT)Nin9-
35 °С
При 50 % (ат) Ni и
750 "С
При 46 % (ат ) Ni
При 52%(aT)Ni
При 75 % (ат ) N.
Mn-Ni, Mn-0
361
Литература
I.TsiuplakisK.E., Kneller E.//Z. Metallkunde. 1969. Bd. 60. N 5. S. 433-438
2 SchurmannE., PrinzB.//Z Metallkunde 1974 Bd. 65. N 8 S. 535-539.
3 Kaufman L.//Calphad. 1978. V 2. N 2 P. 117-146.
4 GoksenN^.//J. Phase Equilibria. 1991. V. 12.N 3. P. 313-321.
А.Л Татаркина, ЕМ. Соколовская
Mn-O. МАРГАНЕЦ-КИСЛОРОД
Сведения о взаимодействии Мп с О обобщены в обзорах р, Ш]. В
основном изучали оксиды: МпО, Мп3О4, Мп2О3, МпО2 и Мп2О7.
Методом оптической пирометрии определена температура плавления
МпО, равная 1842±10 °С, область гомогенности МпО находится в
интервале 47,4-52,4 % (ат.) О ЩЦ. Температура плавления Мп3О4 равна
156714 °С и область гомогенности находится в интервале 57-58,4 % (ат.)
О [Э]. Соединение Мп3О4 существует в двух модификациях: рМп3О4 и
<хМп3О4. Соединение Мп2О3 существует при температуре не выше 900 "С,
в интервале температур 600-940 °С Мп3О4 в присутствии О2 взаимо-
О, % (по массе)
W
20
30
1800
1600
{ВМп)
СвМл)
JKf + Жf
IS
Мл
гь 32
О, % (an.)
48 56
Рис. 174. Мп-О
362
Mn-0
действует с МпО2 с образованием Мп2О3, при температуре выше 940 "С
Мп2О3 распадается на Мп3О4 и О2 \Э].
В работе [1] диаграмма состояния системы Mn-О построена в области
составов MnO-MrijO4 в интервале температур 1000-1900 °С при
различном парциальном давлении О: 510, 310~5, 10~3 и 0,021 МПа по
результатам рентгеновского анализа, проведенного в высокотемператур-
высокотемпературной камере с контролем газовой атмосферы, с использованием Не
чистотой 99,995 % (по массе) и N2.
На рис. 174 приведена диаграмма состояния Mn-О при давлении
0,021 МПа в основном по данным работы [1]. Соединение МпО плавится
конгруэнтно, а соединение рМп3О4 - инконгруэнтно при температуре
1567±4 "С. Соединение аМп3О4 образуется по перитектоидной реакции
при температуре -1190 °С. При температуре 1160±5 °С рМп3О4распада-
рМп3О4распадается по эвтектоидной реакции.
Кристаллическая структура соединений системы Mn-О приведена в
табл. 162.
Таблица 162 Кристаллическая структура соединений системы Mn-О |Э]
Соединение
МпО
лМп,Од
умпго;а
<xMnO2
рмпо;4
elMno;4
Прототип
NaCl
-
-
-
ТЮ2
(рутил)
-
Тетрагональная сингония
*2Прототип ОЦК сингонии
Тетрагональная сингония
4Ромбическая сингония
Символ
Пирсона,
пр.гр-
cF8,
Fnilm
-
-
-
IP6,
PA-Jmnm
-
Параметры решетки, нм
а
0,4444
0,8140
0,9408
0,81
0,4397
0,4534
0,763
Ь
-
-
-
-
0,9303
0,779
с
-
0,943
-
0,94
0,2873
0,2859
0,932
Мп-О, Мп-Р 363
По данным обзора Р] Мп2О3 имеет еще одну модификацию с ОЦ
тетрагональной сингонией и параметрами а = 0,887 и с - 0,997 нм. В
обзоре [Ш] сообщается, что МпО2 имеет, по крайней мере, пять
модификаций, однако этот вопрос обсуждается.
Литература
1 TromelG., Fix W., Koch К., Schaberg F.//Erzmetall. 1976 Bd 29. N 5 S 234-237
Г К Ллексеенко
Mn-P. МАРГАНЕЦ-ФОСФОР
Диаграмма состояния Мп-Р рассмотрена в обзорах [X, Э, Ш]. На
рис. 175 представлена диаграмма состояния по данным обзора [X].
Диаграммапостроена по результатам термического, микроскопического
и рентгеновского анализов. В системе имеются четыре соединения: Мп3Р,
Мп2Р, Мп3Р2 и МпР. Наличие в системе фосфида Мп3Р2 не подтверждено
в работах [1, Э], авторами работы [1] сделано предположение о наличии
широкой области гомогенности Мп2Р в пределах концентраций 33-40 %
(ат.) Р Соединения Мп2Р и МпР плавятся конгруэнтно при температурах
1327 °С и -1147 °С соответственно. Соединения Мп3Р и Мп3Р2
образуются по перитектическим реакциям:
Ж + Мп2Р - Мп3Р при 1105 °С;
Ж + Мп2Р ^ Мп3Р2 при 1090 °С.
Соединение Мп3Р2 при температуре 1002 °С эвтектоидно распадается
на Мп2Р и МпР.
В системе имеют место два эвтектических равновесия:
Ж * (рМп) + Мп3Р при 960 °С и 13,1 % (ат.) Р;
Ж <* Мп3Р2 + МпР при 1085 °С и 42,6 % (ат.) Р.
Кристаллическая структура соединений представлена в табл. 163.
364
Мп-Р
Р, °/о (по массе)
1
t,L
/4-00
1300
1200
1138°
1100/
1100*
1000
900
800
727'
700
600
> 5
1
/гье*
fV
•(J3Mn)
Ч«м
10
1
ж
Мп)
ГМп)
1/
го
1
/
Sins*
\/960'
Щ1
710'
")
Г
\
13
А
30
1
с
гт\ с
\ 1 ?
М-0
1
1091
1002"
1о85*
О 10 Z0 30 40 50 60
Мп P,%fam.)
Рис. 175. Мп-Р
Таблица 163 Кристаллическая структура соединений системы Мп-Р
Соединение
Мп3Р
Прототип
Ni3P
Символ
Пирсона,
пргр
Г/32,
/4
Параметры решетки, им
а
0,918
Ь
-
с
0,4568
Источник
[М,Э]
Mn-P, Mn-Pb
365
Соединение
Мл2Р
МпР
Прототип
Fe2P
МпР
Символ
Пирсона,
пргр
АР9,
Р62т
оР%,
Рпта
Параметры решетки, нм
а
0,6081
0,5917
Ь
-
0,5260
с
0,3460
0,3173
Источник
Р]
[X]
Литература
1 Rundqvist S. // Acta Chem Scand 1962 V 16 P 992-998
Г К Алексеенко
Mn-Pb. МАРГАНЕЦ-СВИНЕЦ
Диаграмма состояния Mn-Pb схематически представленав обзоре [X]
(рис 176) во всей области концентраций. В области сплавов, богатых РЬ,
эта диаграмма была исследована также в работе [1 ] при концентрации
t;c
РЬ,"/о(по массе)
ого ьо во ю во so too
f 1
1
ж
1198'
)
*-(ГМп)
*-(aMi
0
1
1*
i
жг
noo'
327"
I 1
\
\
\
\
I
Ж
—Ti
1
J27,i
Pb)~*
1100
пзв*
то
400
зоо
200
0 20 4-0 60 80 Ю0
Mn Pb,"/c(am.) Pb
Рис. 176. Mn-Pb
366 Mn-Pb, Mn-Pd
до 35 % (ат.) Mn и в обзоре \Э\ при концентрации до 20 % (ат.) Мп.
Диаграмма состояния характеризуется наличием монотектического и
эвтектического равновесий. Температура монотектического равновесия
1198 "С [X, Э], содержание РЬ в монотектике 3 % (ат.) [10 % (по массе)]
РЬ [X]. При эвтектической температуре 327 "С [X, Э], либо 300 °С [1],
растворимость Мп в (РЬ) составляет менее 0,04 % (ат.) [Э], либо - 3,67 %
(ат.) [1]. Содержание марганца в эвтектике согласно работе [1] равно
10,45%(ат.).
В обзоре Р] приведена кривая растворимости Мп в жидком РЬ.
Растворимость Мп в РЬ при температуре монотектики 1198 °С составляет
26,4 % (ат.), при 20 °С - - 0,02 % (ат.) [Э].
Литература
1 Али-Заде З.И., Мехрабов А.О. // Журнал физической химии 1966 Т 40 N 12
С 3097-3099
СП Алисова
Mn-Pd. МАРГАНЕЦ-ПАЛЛАДИЙ
Результаты исследования диаграммы состояния Mn-Pd методами
термического, микроструктурного, низко- и высокотемпературного
рентгеноструктурного анализов приведены в обзорах [X, Э, Ш] и в
работах [1-3]. На рис. 177 построена диаграмма состояния согласно
работе [1].
Диаграмма состояния Mn-Pd представляет собой диаграмму
эвтектического типа с ограниченными твердыми растворами на основе
исходных компонентов и одним интерметаллическим соединением.
Фаза р плавится конгруэнтно при температуре 1500 "С и имеет
широкую область гомогенности 34-62 % (ат.) Мп. При понижении
температуры происходит конгруэнтное превращение р ** Р] и Р] •* р2-
Авторы работы [2] исследовали превращения в сплавах, лежащих в
области фазы р. Методами высокотемпературного рентгенографического
и дилатометрического анализов сплавов Pd, содержащих 40,45 и 50 %
(ат.) Мп они установили существование в эквиатомной области
концентраций структурного превращения CsCl - CuAu (сверхструктура),
а также фазового перехода, связанного с образованием сверхструктуры
неизвестного типа.
Максимальная растворимость Мп в (Pd) 30 % (ат.) Pd малорастворим
в а и р модификациях Мп, в (уМп) растворяется до 20 % (ат.) Pd [X, 1].
При температуре 1211 °С образуется у модификация Мп по перитектичес-
кой реакции: EМп) + Ж - (уМп) Р].
Mn-Pb
367
Мп,% (по массе)
О 10 20 30 W 50 60 70 ПО 90100
Г246'
Ш8'
IWO*
7ZT
BOO
Ш
0 10 20 30 W SO 60 70 BO SO 100
Pd Mn,7,(am.) Mn
Рис. 177. Mn-Pd
Кристаллическая структура соединений представлена в табл. 164.
Таблица 164 Кристаллическая структура соединений системы Mn-Pd |X]
Соединение
Р
рГ
Прототип
CsCl
Символ
Пирсона,
пр П>
сР2,
РтЪт
Параметр,
решетки
а, нм
0,3150
0,2992
0,2890
0,3817
Примечание
При 51 % (ат) Мп и 662 "С
При 51 %(ат)Мпи597 °С
Прч 20 "С
При 33,7 % (ат) Мп
'Тетрагональная искаженная решетка типа CsCl
**Гранецентрированная тетрагональная решетка со сложной сверхструктурой
368
Mn-Pb, Mn-Pm
В области твердого раствора на основе Pd при содержании 8-25 %
(ат.) Мп возникает упорядоченная структура Pd3Mn типа AuCu3. По
другим данным, в области 23-27 % (ат.) Мп происходит процесс
упорядочения при температуре 400-700 °С. Сплав с содержанием 23 %
(ат.) Мп неупорядочен и обладает ГЦК решеткой с параметром а =
= 0,3893 нм. Сплав с 27 % (ат.) Мп имеет тетрагональную сверхструктуру
типа CuAu (символ Пирсона tP4, пр. гр. Р4 I ттт) с параметрами
решетки а = 0,3913 нм, с = 0,3874 нм [3].
Литература
1. Савицкий Е.М.,ПоликоваВ.П.,ТылкииаМ.А.//Сплавы палладия. М.: Наука, 1967.
104 с.
2. Равдель МП., Евдокимова О.И. // Изв. АН СССР. Металлы. 1972. N 3. С. 166-168.
3. IwasakiH.,OkamuraK.,OgawaS.//J. Phys. Soc. Japan. 1971. V. 31. N 2. P. 497-505.
М.Б. Раевская, Е.М. Соколовская
Mn-Pm. МАРГАНЕЦ-ПРОМЕТИЙ
В работе [1] приведена обобщенная диаграмма состояния Mn-Pm
согласно данным работы [2] (рис. 178). Подобно системе Mn-Nd авторы
работы [2] предположили образование в системе Mn-Pm соединений
№6
1200
1138
1100
1000
800
600
Ш
гоо -,
О 10 20 30 ЬО 50
Рт, % (по массе)
60 70 80 90
100
1
*
\
777'
1 '
?Мп)
1
¦ь ffli
965*
(ДМп)
(аМп)
1
t
\
1
*
870'
*
к.
71
п*
Ж
^_
I
/
ffiPir
(«'
»/77)-»
Рис.
0 /0
Mn
178. Mn-Pm
20
30
Pm
50
,%
SO
(am.)
70
80
90
WO
Pm
Mn-Pb. Mn-Pr
369
Mni2Pm, Мп2зРт6 и Мп2Рт. Авторы работы [2] определили кристалли-
кристаллическую структуру и параметры соединений (табл. 165). .
Таблица 165. Кристаллическая структура соединений системы Mn-Pm |2|
Соединение
МпJРп1
МпвРт6
Мп2Рт
Прототип
Mn12Th
МпцТ116
MgZn2
Символ Пирсона,
пр. гр.
1126,
Hlnanm
сЛ16,
14/ттт
АЛ 2,
Я63 / ттс
Параметры решетки, нм
а
0,866
1,260
0,550
с
0,480
-
0,896
Литература
1. OkamotoH.//J. Phase Equilibria. 1991. V. 12. N 3. P. 395.
2. Saccone A., Delfino S., Ferro R. // Calphad. 1990 V. 14. N 2. P. 161.
E.B. Лысова
Mn-Pr. МАРГАНЕЦ-ПРАЗЕОДИМ
Диаграмма состояния Mn-Pr построена в полном интервале
концентраций в работе [1] и приведена на рис. 179.
Сплавы синтезировали в высокочастотной печи в тиглях из Та или
Мо. В качестве исходных материалов использовали Мп электролитичес-
электролитический чистотой 99,9 % (по массе) и Рг дистилированный чистотой 99,9 %
(по массе). Исследование проводили методами рентгеноспектрального,
термического, металлографического и рентгеноструктурного анализов.
В системе существует соединение Мп23Рг6, которое образуется по
перитектической реакции: Ж + (PMn) ** Мп23Рг6 при температуре 790 "С.
Соединение Мп23Рг6 существует в интервале концентраций 20,3-22,0 %
(ат.) Рг и в диапазоне температур 790-650 °С. При температуре 650 °С
оно распадается на (аМп) и (аРг). В системе наблюдается эвтектическое
равновесие Ж ** Мп23Рг6 + (сиРг) при температуре 660 °С и концентрации
75 % (ат.) Рг, а также кататектическое равновесие (РРг) **¦ Ж + (аРг) при
температуре 665 °С. При температуре 665 °С в (РРг) растворяется до 6 %
(ат.) Мп; в (аРг) растворяется при этой же температуре только 1 -2 % (ат.)
Мп. Растворимость Рг в (Мп) практически отсутствует. Соединение
370
Mn-Pr
О 20 ЬО
Pr, '/ofпа массе)
60 80
100
1200
1138°
1100 f1®-
1000
900
800
727°
700
600
1246'
\
X
1100'
'{№
*-fa
i
\
n,
мп)
\
79
t
\
ж
\
\
660° j
650°
\
V
i
665°_
VI
(aPr}\
I
О 10 20 JO W 50 60 TO 80 90 100
Mn Pr,Vo(am) Pr
Рис. 179. Mn-Pr
Mn23Pr6 имеет прототип Mn2jTh6(символ ПирсонаcF\ 16, пр. rp. Fmbm)
с параметром решетки а = 1,275 нм [2]. В работе [2] сообщается о
метастабильном соединении Мп2Рг, которое относится к типу MgZn2
(символ Пирсона hP\ 2, пр. гр. Р63 / ттс,а- 0,561 нм не- 0,916 нм).
Литература
1 Saccone A., Dclfino S., Ferro R. // J Less-Common Met 1985 V 108 N 1 P 89-105
2 Гладышевский Е.И., Болак О.И. // Кристаллохимия интерметаллических
соединений редкоземельных металлов Львов Вища школа 1982 255 с
Е И Гладышевский, О И Бодак, В К Печарский
Mn-Pl
371
Mn-Pt. МАРГАНЕЦ-ПЛАТИНА
Диаграмма состояния Mn-Pt исследована методами термического,
микроструктурного и рентгеновского анализов и имеет сложный
характер (рис. 180). Критический обзор результатов исследований дан
в работах [X, Ш, 1]. При температуре ниже 1000 "С в области твердого
раствора на основе Pt установлено образование упорядоченной
структуры типа Cu3Au вблизи состава MnPt3. Фаза р на основе
эквиатомного соединения MnPt имеет широкую область гомогенности
от 32,5 до 59 % (ат.) Pt и существует в двух модификациях: высокотемпе-
высокотемпературной р и низкотемпературной р] [X]. В более поздних работах
существование высокотемпературной модификации фазы р было
подвергнуто сомнению [Ш]. При температуре - 1050 "С в сплавах,
содержащих - 25 % (ат.) Pt, происходит упорядочение (уМп) ** у'Мп по
типу Cu3Au. Возможно также существование соединения Мп с 62 % (ат.)
Pt (структура его не расшифрована).
Растворимость Pt в (аМп) и (РМп) - 2,9 % (ат.), в (уМп) растворяется
30,5 % (ат.) Pt. Максимальная растворимость Мп в (Pt) - 38 % (ат.).
Pt, % (по массе)
оюгоэоы so 60 w во
90
ш[
0 10 W 30 40 50 60 70 80 SO 100
Мп Pt, % (am ) Pt
Рис. 180. Mn-Pt
372
Mn-Pt, Mn-Pu
Кристаллическая структура соединений приведена в табл. 166.
Таблица 166 Кристаллическая структура соединений системы Mn-Pt
Соединение
MnPt3
Р
Р.
у Мп
Прототип
CujAu
CsCl
AuCu
Cu3Au
Символ
Пирсона,
пр. гр
сР4,
РтЪт
сР2,
РтЪт
tP4,
P4l mmm
сР4,
РтЪт
Параметры решетки, нм
а
0,384>
-
0,2827
-
с
-
-
0,3669
-
Примечание
[Ш]
[X]
При 50 % (ат)
Pt[X]
[X]
Литература
1 Савицкий Е.М., Полякова В.П., Горииа Н.Б. и др // Металловедение платиновых
металлов М Металлургия, 1975 424 с
А Л. Татаркина
Mn-Pu. МАРГАНЕЦ-ПЛУТОНИЙ
Сплавы системы исследовали методами микроструктурного,
рентгеновского, термического и дилатометрического анализов [X, Э].
На рис. 181 приведен обобщенный вариант диаграммы состояния Mn-Pu
[М]. В системе образуется конгруэнтно плавящееся соединение PuMn2
при температуре 1050 °С и протекают две эвтектические реакции:
Ж ^ (pMn) + PuMn2 при 1000 °С
Ж ^ PuMn2 + (ePu) при 520 °С.
Mn-Pu. Mn-Re
О 20
flu, % (по массе)
ВО ВО 90
95
100
та
поо
IfOO*
moo
800
т'
600
ш
200
1 1 Т
пи'
1 1
(SMn)
-f~
1
1
Mn)
1000°
1
€50д
т-
1
1
^"
ьго
1
ч
1
^^
(ifРа)—*¦
(три) »¦
f^ra/—»¦
fofPtf^
6kO°
зго°
215'
125'
О 10 20 30 ЬО 50 60 70 ВО 90 100
Мп Ри,% (am) Pu
Рис. 181. Mn-Pu
В твердом состоянии в системе проходят реакции, связанные с
полиморфными превращениями Мп и Ри.
Соединение PuMn2 имеет решетку типа MgCu2 (символ Пирсона cF14,
пр. гр. Fdlm) с параметрами а = 0,7292A) нм или а = 0,7290E) нм.
А Л Ташаркина
Mn-Re. МАРГАНЕЦ-РЕНИЙ
Диаграмма состояния Mn-Re в интервале концентраций 0-80 % Re
приведена на рис. 182 [1]. При содержании до 30 % (ат.) Re диаграмма
состояния построена по результатам экспериментальных исследований,
богатая Re часть диаграммы была построена ориентировочно.
Исследование сплавов проводили методами микроструктурного,
рентгеноструктурного и термического анализов и измерением микро-
микротвердости фаз. Сплавы с содержанием до 30 % (ат.) получали плавкой
в индукционной печи в атмосфере Аг и отжигали в эвакуированных
374
Mn-Re
Re,% (по
0 Ш 20 JO4hO 50 60 5
t,°C
2600
2400
2200
2000
1800
1600
two
1Zb6
1200o
1138
1100
1000
800B
72T
600
i i
/
\ 1
У
t
wo"
xL(smh)
\fe(rMn)
JfCMn)
f
5,5
-(
vcMn)
i
Ж
/
/
1315'
1210°
925'
У
массе)
W 80 SO
у
1
1
1
1
1
1
1
|l
¦ 1
|
1
/
¦
*б
0 Iff 20 JO ЬО 50 60 70 80
Mn Re, % fo/n.)
Рис. 182. Mn-Re
кварцевых ампулах при 950 "С в течение 100 ч. Чистота исходных
металлов: Мп - 99,83 % (по массе), Re- 99,81 % (по массе). Диаграмма
состояния Mn—Re относится к системам перитектического типа. В системе
образуется фаза о по перитектической реакции Ж + (Re) •» о; температура
образования фазы о предполагается выше 1700 °С. Область,ее гомоген-
гомогенности не установлена. В фазе о содержится 52,24 % Re (ат.) [2].
Установлено, что твердый раствор на основе (бМп) образуется по
перитектической реакции Ж + о - (бМп) при температуре 1410 °С.
Перитектоидные превращения в системе: (бМп) + о<4(уМп), (уМп) + а**
¦— (РМп) и (рМп) + о — (аМп) проходят соответственно при температурах
1315, 1210 и 925 "С. В (аМп) растворяется до 5,5 % (ат.) Re. Параметры
тетрагональной решетки фазы о при концентрации 52,24 % (ат.) Re
следующие: а =0,914 нм, г = 0,475 нм Р, 2].
Mn-Re, Mn-Rh
375
В сплавах с 22,9 % (ат.) Re на рентгенограммах обнаружена фаза о с
параметрами решетки: а - 0,913 нм, с = 0,493 нм [2]. Сравнение
параметров решеток обеих фаз с 52,24 и 22,9 % (ат.) Re позволяет
предположить существование растворимости Мп в фазе о [Э].
Литература
1. Савицкий Е.М., Тылкииа М.А., Копецкий Ч.В. и др. // Журнал неорганической химии.
1961. Т. 6. Вып. 6. С. 1474-1476.
2 Копецкий Ч.В., Шехтман В.Ш., Агеев Н.В. и др. //Доклады АН СССР. 1959. Т. 125. N 1.
С. 87-88
М.А. Тылкина
Mn-Rh. МАРГАНЕЦ-РОДИЙ
Ориентировочная диаграмма состояния Mn-Rh, построенная по
результатам рентгеновского и микроскопического анализов, приведена
в обзоре [X]. Результаты исследования части системы, богатой Мп, даны
в обзорах [Э,Ш]. Обобщенный вариант диаграммы [X, Ш, Э] приведен
на рис. 183. В интервале концентраций 35-55 % (ат.) Rh в системе
/tfi, % (no массе)
50 60 70
400
Т
80
90
W0
В (8ТА
\
(Rh)
О 10 20 JO 40 SO 60
Мп ЯЬ, % (am.)
Рис. 183. Mn-Rh
70 80 90 100
376
Mn-Rh
существует промежуточная фаза р, которая при понижении температуры
претерпевает полиморфное превращение мартенситного типа. Высоко-
Высокотемпературная фаза р(ВТ) с решеткой типа CsCI переходит в низкотемпе-
низкотемпературную фазу Р(НТ) с решеткой типа CuAu. (уМп) кристаллизуется по
перитектической реакции Ж + (бМп) **(уМп) при температуре - 1234 °С
и образует обширную область твердых растворов [Ш]. При температуре
ниже 900 °С, вблизи соединения Mn3Rh, структура (уМп) становится
упорядоченной [X, Э, Ш, 1, 2].
Растворимость Мп в (Rh) составляет 33,0; 18,0 и 14,0 % (ат.) при
температурах 1300,1000 и 800 °С соответственно. Предельная раствори-
растворимость Rh в (уМп) равна - 4 % (ат.) [Х,Э].
Кристаллическая структура соединений системы приведена в
табл. 167.
Таблица 167 Кристаллическая структура соединений системы Mn-Rh
Соединение
Р(ВТ)
Р(НТ)
Y'(Mn3Rh)
Прототип
CsCI
CuAu
AuCu3
Символ
Пирсона,
пр гр
сР2,
РтЪт
iPA,
Р41 ттт
сР4,
РтЪт
Параметры решетки, нм
а
0,3051
0,278
—
с
'
0,356
—
Примечание
В области высо-
высоких температур
при 50 % (ат) Rh
[X]
В интервале тем-
температур
- 193-47 "С при
48,8 % (ат) Rh
[Ш]
При температуре
ниже900°С[1,2]
Литература
1 Савицкий Е.М., Полякова В.П., Горина Н.Б., Рошан Н.Р. // Металловедение платиновых
металлов М Металлургия 1975 С 215-216
2 Благородные металлы Справочник / Под ред ЕМ Савицкого М Металлургия 1984
592 с
Т П Лобода, А Л Татаркина
Mn-Ru, Mn-S
377
Mn-Ru. МАРГАНЕЦ-РУТЕНИЙ
Диаграмма состояния Mn-Ru при температурах ниже солидуса
рассмотрена в обзоре [X] и построена по результатам рентгеновского и
микроскопического исследований. Часть диаграммы состояния в системе
Mn-Ru в области, богатой Мп, при концентрации Re до 10 % (ат)
±'с
1300
W 10
Пи,%fno массе)
30 4-0 SO
60
70
1100
soo
700
500
300
I
ж
I |
(aCMn)
in) \
-—.
\
1
\
\
1
\
36
1
1
1
1
1
1
1
1
1
(Яа)
V9
1
1
1
1
О
Мп
Рис. 184. Mn-Ru
10
20 30
Ни ,•/» (am
50
SO
построена в обзоре [Э]. Обобщенный вариант диаграммы приведен на
рис. 184 Промежуточных фаз в системе не наблюдали. Фаза (бМп)
образуется по перитектической реакции Ж + (уМп) ** (бМп) при
температуре 1268 °С Предельная растворимость Ru в (бМп) составляет
8 % (ат.).
М В Раевская
Mn-S. МАРГАНЕЦ-СЕРА
Диаграмма состояния Mn-S исследована в работах [X, Э, Ш, 1]
Диаграмма состояния системы в области, богатой Мп, исследовали
методом дифференциального термического анал1па и расчетным путем
[1] Для приготовления сплавов использовали электролитический Мп
378
Mn-S
¦t'c
1600
mo
1246'
noo
me'
1000
BOO
SOD
10
S,°/o (по массе)
20 30
1
1
0,5
I
f580°
1230'
(fMn)
•*-(J3Mn
727'
¦*-(aMn)
1
1100"
t
1 i
\ 16
Ъ»-*1
4
1
ж'
WHO"
0
Mn
JO
20 30
S,'/o Гат)
SO
SO
Рис. 185. Mn-S
чистотой 99,99 % (по массе) и промышленный H2S. Нарис. 185 приведена
часть диаграммы состояния системы Mn-S по данным обзора [X]. В
системе имеется область несмешиваемости в жидком состоянии.
Химический анализ [X] показал, что область несмешиваемости
простирается от 0,5 до - 46 % (ат.) S. Температура монотектического
превращения согласно обзору [X] составляет - 1580 °С, согласно работе
[1] - 1570 "С. При температуре 1230 °С [X] либо 1242 °С [1] в системе
имеет место эвтектическое превращение Ж»* (бМп) + MnS, концентрация
S в эвтектике менее 0,24 % (ат.).
В системе существует соединение MnS, которое плавится конгруэнтно
при температуре 1610 °С. Оно имеет две метастабильные модификации:
PMnS и yMnS. В системе образуется еще одно соединение MnS2, которое
на рис. 185 не приведено. Растворимость S в Мп при температуре
монотектики равна - 0,5 % (ат.) [0,3 % (по массе)] [X] либо, 0,798 % (ат.)
[0,467% (по массе)] [1].
Кристаллическая структура соединений представлена в табл.168.
Mn-S. Mn-Sb
379
Таблица 168. Кристаллическая структура соединений системы Mn-S
Соединение
MnS
PMnS*
yMnS*
MnS2
Прототип
NaCl
ZnS
(сфалерит)
ZnS
(вюрцит)
FeS2
(пирит)
*Метастабильные фазы
Символ
Пирсона,
пр. гр.
cFi,
Fm 3 т
cFZ,
F43m
hP4,
Р63ГПС
сР12,
РаЪ
Параметры решетки, нм
а
0,522
0,561
0,398
0,6104
0,6108
с
-
-
0,644
-
Источник
[2]
[2]
[2]
*[Х]
Соединение MnS2 при высоких давлениях порядка 14 ГПа претерпева-
претерпевает структурное превращение от структуры типа FeS2 (пирита) к структуре
типа Fe2S (марказита) (символ Пирсона оРв, пр. гр. Рппгп) [4].
Литература
! Staffansson L.I. // Metall Trans В. 1976. V. 7. N I. P. 131-134.
2. Самсонов Г.В., Дроздова СВ. // Сульфиды. М.: Металлургия, 1979. 304 с
3 Brostigen С, Kjekshus A. // Acta Chem. Scand. 1970. V. 24. P. 2993-3012.
4. Cha«opadhyayT.,VonSchneringH.G.//J. Phys Chem Solids. 1985. V. 46. N 1 P. 113-116.
H И. Никитина
Mn-Sb. МАРГАНЕЦ-СУРЬМА
Диаграмма состояния Mn-Sb (рис. 186) построена по данным обзора
[X] и работы [1]. В работе [1] она уточнена в области концентрации
34-51 % (ат.) Sb. Для синтеза образцов использовали Мп электролитичес-
электролитический чистотой 99,97 % (по массе), выплавленный в атмосфере Н2, и Sb
чистотой 99,9999 % (по массе).
Сплавы получали в вакуумированных и графитизированных
кварцевых ампулах. Синтез Mn2Sb и MnSb вели при температуре 1000 °С
с последующим охлаждением в режиме выключенной печи, затем образцы
тщательно перетирали и отжигали при температуре 780 °С в течение
200 ч, при температурах 550 "С -720 ч и 400 "С -720 ч. Систему
380
Mn-Sb
Sb, % (по массе)
0 W 20 30 4-0 50 SO 10 80
Магнитное
превращение
h Магнитное
превращение
О 10 20 30 40 50 60 70 80 SO ГОО
Мп Sb, % (am.) Sb
Рис. 186. Mn-Sb
исследовали методами дифференциального термического и рентгенофазо-
вого анализов.
В системе имеется соединение Mn2Sb, которое плавится конгруэнтно
при температуре 948 °С. По данным рентгенофазового анализа
соединение Mn2Sb имеет узкую область гомогенности [2], причем при
температуре выше 700 "С его состав соответствует формуле - Mn2Sb, a
при температуре ниже 0 °С - Mn2 ,Sb. Соединение MnSb образуется по
перитектической реакции Ж + Mn2Sb •* MnSb при температуре 840 "С
[1] либо 872° [X] и имеет область гомогенности, границы которой точно
не установлены.
В системе протекают эвтектические реакции:
Ж - (yMn) + Mn2Sb при 922 "С и - 27 % (ат.) Sb;
Ж - MnSb + (Sb) при 570 °С и - 81 % (ат.) Sb.
Кристаллографические характеристики соединений приведены в
табл. 169 [V-C]
Mn-Sb, Mn-Sc
381
Таблица 169 Кристаллическая структура соединений системы Mn-Sb
Соединение
Mn2Sb
MnSb
Прототип
Cu2Sb
Ni2ln
Символ
Пирсона,
пр гр
IP6,
Р41 птт
hPb,
/>63 / ттс
Параметры решетки, нм
а
0,4078
0,4170
с
0,6557
0,5755
Литература
1 Ваяярхо В.Г., Мощалкова Н.А., Гуичеико В.М., Фадеева Н.В. // Изв. АН СССР.
Неорганические материалы 1988. Т 24. N 6. С. 900-903.
2 Askheim N.E., GronvaldF. //J Chem. Thermodyn. 1969 V 1 N 2. P. 153.
E If Гладышевский, О. И. Бодак, В К. Печарский
Mn-Sc. МАРГАНЕЦ-СКАНДИЙ
Диаграмма состояния Mn-Sc построена в узком интервале концентра-
концентраций 0-1,5 % (ат.) Sc в работе [1] и приведена на рис. 187. Методы синтеза
сплавов и чистота исходных компонентов не указаны. Для исследования
sc,V,(na массе)
0 1 ¦
1100
/150
1138"
1100
1050
-1
К'.
I/M'\
IIOO ~\
(J}Mn)j
1
\
\
\
11*0'
ж
4
~\
\
0
Mn
Sc, % (am.)
Рис. 187. Mn-Sc
382
MnSc, MnSe
использовались методы термического, металлографического и рен-
тгеноструктурного анализов.
Растворимость Sc в (бМп) и (PMn) близка к 1 % (ат.), (уМп) растворяет
не более 0,4 % (ат.) Sc. Эвтектоидный распад (бМп) •* (yMn) + (PMn)
происходит при температуре 1125 °С.
По данным работы [2] в системе существует одно двойное соединение
Mn2Sc, которое кристаллизуется в структурном типе MgZn2 (символ
Пирсона hP\2, пр. гр. />63/ ттс), параметры решетки а - 0,5545 нм, с =
= 0,9037 нм.
Литература
1 Hellaweli A. // J. Less-Common Met. 1962. V. 4. N 1. P. 101-103.
2 Гладышевский Е.И., Бодак О.И. // Кристаллохимия интерметаллических
соединений редкоземельных металлов. Львов: В ища школа. 1982. 255 с.
Е.И Гладышевский, О. И. Бодак, В. К. Печарскип
Mn-Se. МАРГАНЕЦ-СЕЛЕН
Диаграмма состояния Mn-Se не построена. Феноменологический
подход позволил предположить, что растворимость Se в уМп > 5 % (ат.)
и ничтожна в а- и бМп [Ш].
В системе образуются два соединения: MnSe и MnSe2. Соединение
MnSe имеет три модификации: одну стабильную aMnSe и две нестабиль-
нестабильные - pMnSe и yMnSe, переходящие в aMnSe [1-3]. Кристаллическая
структура соединений системы Mn-Se приведена в табл. 170.
Таблица 170 Кристаллическая структура соединений системы Mn-Se
Соединение
aMnSe
(JMnSe
yMnSe
MnSe2
Прототип
NaCI
ZnS
(сфалерит)
ZnS
(вюрцит)
FeS2
(пирит)
Символ
Пирсона,
пр гр
сП,
Fmim
сП,
F43m
hP4,
РЬ^тс
с? 12,
РаЪ
Параметры решетки, нм
а
0,5456
0,583
0,413
0,643
с
—
-
0,673
-
Источник
[1,4]
[1]
[1]
[5]
Mn-Se. MnSi
383
Литература
1. Baroni A. // Z. Krist. 1938. Bd. 99. N 4. S. 336-339.
2. Taylor A. // Appl. Spectrosc. I960. V. 14. N 5. P. 116-118. •
3 Маковецкий Г.И., Сирота Н.Н. // Докл. АН БССР. 1963. Т. 7. N 11. С. 740-742.
4. Маковецкий Г.И., Сирота Н.Н.//Докл АН БССР. 1964. Т. 8. N 5. С 289-291.
5 Elliott N. // J. Amer. Chem. Soc. 1937. V 59 P. 1958-1962.
Н.И Никитина
Mn-Si. МАРГАНЕЦ-КРЕМНИЙ
Исследованию диаграммы состояния Mn-Si посвящено большое число
работ. Наиболее полные данные по системе Mn-Si приведены в работах
[1-3]. На рис. 188 представлена уточненная диаграмма состояния Mn-Si
[2]. Для построения диаграммы состояния использованы результаты
термического, микроскопического и рентгеновского анализов, а также
расчетные данные. Сплавы выплавляли в индукционной печи из
Мп чистотой 99,95 % (по массе) и Si чистотой 98,90 % (по массе).
Si, % (по массе)
20 30 4*7 SO SO 70 80 90 WO
t,°C
200
Рис.
0
Мп
188.
10
Mn-Si
20
JO
ч4)
Si,
50 60
% (am)
70
80 SO
too
Si
384
MnSi
В системе существуют семь интерметаллических фаз: из них Mn5Si3
и MnSi плавятся конгруэнтно при 1238,2 и 1269,6 °С соответственно,
v(Mn9Si7), Mn3Si, Mn, ,Si19 образуются по перитектическим реакциям,
R(Mn6Si) и Mn5Si - по перитектоидным. Кроме того, Mn3Si претерпевает
полиморфное превращение при температуре 677 "С. Нонвариантные
реакции в системе Mn-Si представлены в табл. 171.
Таблица 171 Нонвариаитные реакции в системе Mn-Si
Реакция
Ж + FМп) - (уМп)*
Ж + (уМп) - (РМп)*
(РМп) - (аМп) + R
(PMn) + v- R
Ж + (РМп) - v
Ж-v + pMn3Si
Ж + Mn5Si3 - pMn3Si
ccMn3Si - pMn3Si
PMn3Si + Mn5Sij- Mn5Si2
Ж - Mn5Si3 + MnSi
Ж+ MnSi- MnMSi,9
Ж- MnnSi,, + (Si)
Предполагаемые реакции.
Содержание Si в фазах, % (ат.)
-3,75;
-9;
-8;
14,7;
18,2;
20,2;
-24;
-25,6;
43,8;
65,69;
66,4,
-0,3,
-2,8;
6;
16;
16,7;
18;
37,5;
25-25,6
37,5;
37,5;
50;
63,3;
-2
-5
12;
15,3
17,3
24
25,4
28,6
50
63,3
-100
Температура,
"С
1205
1155
-635
880
1060
1040
1075,3
677
850
1236,8
1150,2
1149
Источник
[1]
[1]
[4]
14]
[4]
[2]
[2]
[5]
[61
[2]
[2]
[3]
Растворимость Si в (РМп) составляет при 1060 °С 16,7 % (ат.), в (аМп)
при -635 °С - 6 % (ат.), при повышении температуры растворимость
уменьшается. Мп практически не растворяется в (Si).
Кристаллическая структура интерметаллических соединений,
образующихся в системе Mn-Si, представлена в табл. 172.
Mn-Si
385
Таблица 172. Кристаллическая структура соединений системы Mn-Si
Соединение
R или Mn6Si
v или Mn9Si2
PMn3Si
aMn3Si
Mn5Si2
M1I5S13
MnSi
Mn,,Si,9 или
MnSi,75.4
*a= 74,70°.
Прототип
-
-
BiF3
-
-
Mn5Si3
FeSi
-
Символ
Пирсона,
пр. гр.
АЛ 53,
ЛЗ
о/186,
Immm
сЛ_6,
FmSm
-
tP56,
hPlb,
Я63 / mem
cPS,
IP120,
P4n2
Параметры решетки, им
a
0,8959*
1,6992
0,5722
-
0,89097
0,6912
0,4548 '
0,5518
b
-
2,8634
-
-
-
-
с
-
0,4656
-
-
0,87153
0,4815
-
7,8136
Источник
[7]
[8,9]
НО]
[10]
[6]
[И]
[12]
[13]
Литература
I Gokhale A.B., Abbaschian R. // Bull. Alloy Phase Diagrams. 1990. V. 11. N 5. P. 468-480.
2. Okamoto H. // J. Phase Equilibria. 1991. V. 12. N 4. P. 505-507.
3. Зайцев А.Н., Земченко М.А., Могутиов В.М. // Изв АН СССР. Металлы. 1990. Т. 1.
С. 207-212.
4 Wieser P.F., Forgeng W.D. // Trans. A1ME. 1964. V. 230. N 7. P. 1675-1681.
5. Летун СМ., Гсльд П.В., Серебрянников Н.Н. // Изв. АН СССР. Металлы. 1965 Т 5.
С 97-103
6 Senateur J.P., Fruchart R.//Compt. Rend. Acad. Sci. Paris. 1964. V. 258. P. 1524-1525.
7 Shemaker СВ., Shdmaker D.P. // Acta Crystallogr. В 1978. V. 34. P. 701-705.
8 Sh6maker СВ., Shdmaker D.P. // Acta Crystallogr. B. 1971. V. 27. P. 227-235.
386
MnSi, Mn-Sm
9. Гладышевский Е.И., Крипякевич П.И., Ярмолюк Я.П. // Изв АН СССР.
Неорганические материалы. 1965. Т. 1. N 7. С. 1086-1089.
10. Бабанова Е.М., Верещагин Ю.А. // Тр. Уральского Политехнического института.
1974. Т. 231. С. 15-16.
11. Lander G.H., Brown P.J. // Philos. Mag. 1967. V. 16. P. 521-542.
12 Boren B. //Arkiv Kemi, Mineral. Geol 1933. B. 11A N 10. S. 1-28.
13. Ridder R.D., Amelinck X.//Mater. Res Bull 1971 V. 6. P 1223-1234.
А. С Адамова
Mn-Sm. МАРГАНЕЦ-САМАРИЙ
Диаграмма состояния Mn-Sm построена в работе [1] и приведена на
рис. 189.
Сплавы выплавляли в высокочастотной печи в корундизовых тиглях.
При исследовании использовали Мп электролитический чистотой 99,9 %
(по массе) и дистиллированный Sm чистотой 99, 9 % (по массе).
Для исследования использовали методы термического, металлогра-
металлографического и рентгеноструктурного анализов.
с
t,'?
1200
1138°
1000
800
600
] 20
!
4-0
r(rMn)mo'
-Ом
—В
-На/
1п)
7°
Г
I
Чп)
Sm,
SO
\
I
I
1025'
I
% (по массе)
80
930'^
791
-
*
\
6S
/
}
10
у
(ос
Sm)*
0 10
Мп
Рис. 189. Mn-Sm
20 JO 4-0 SO SO 70 80 90 100
Sm,°/o(am.) 5m
Mn—Sm, Mn—Sn
387
В системе образуются два интерметаллических соединения Mn23Sm6
и Mn2Sm в результате перитектических реакций:
Ж + Mn23Sm6 - Mn2Sm при 930 "С,
Ж + (PMn) ~ Mn23Sm6 при 1025 "С.
При температуре 795 °С и концентрации 69 % (ат.) Sm в системе
наблюдается эвтектическое равновесие:
Ж ^ Mn2Sm + (aSm).
Взаимная растворимость компонентов в твердом состоянии
практически отсутствует.
Кристаллическая структура соединений системы Mn-Sm приведена
в табл. 173 [2].
Таблица 173 Кристаллическая структура соединений системы Mn-Sm
Соединение
Mn2Sm
Mn2Sm
Mn23Sm6*
Температура
Прототип
Zn2Mg
Cu2Mg
Mn23Th6
Символ
Пирсона,
пр гр
hP\l,
Рб-^1 тст
сПЛ,
Fdlm
cFU6,
Fmim
Кюри 170±5°С
Параметры решетки, нм
а
0,5511
0,779
1,2572
с
0,8976
-
-
Примечание
[Ш]
[Ш]
[2]
Литература
1 Kirchmayr H.R., Lugscheider W.//Z. Metallkunde. 1970. Bd. 61. N 1. S. 22-23.
2 Е.И. Гладышевский, О.И. Бодак. Кристаллохимия интерметаллических соединений
редкоземельных металлов Львов: В ища школа. 1982.255 с.
А С Адамова, Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
Mn-Sn. МАРГАНЕЦ-ОЛОВО
Диаграмма состояния Mn-Sn рассмотрена в работах [X, Э]. На
рис. 190 представлена ориентировочная диаграмма, построенная по
результатам термического анализа [X] и уточненная позднее в области,
388
Mn—Sn
t
0 10 20 JO
Sn, % (no массе)
50 60 70 75 80 85 SO 95 100
Магнитное
превращение
178 Магнитное\
YVipeBpamtfue
231,9681'
О 10 20 JO 40 50 60 70 80 90 100
Мп Sn, % (am.) Sn
Рис. 190. Mn-Sn
богатой Mn [1]. Исследование выполнено методами микроструктурного
и рентгеновского анализов, с использованием Мп чистотой 99,9 % (по
массе) и Sn чистотой 99,99 % (по массе).
В системе образуются три соединения Mn3Sn, Mn2Sn, MnSn2 в
результате перитектических реакций при температурах 989,897 и 548 °С
соответственно. По данным работы [1] соединение Mn3Sn гомогенно в
области концентраций 23-28 % (ат.) Sn, соединение Mn2Sn в области
концентраций 37-40 % (ат.) Sn. Растворимость Sn в (рМп) немного
меньше 10 % (ат.), в (аМп) - не превышает 0,7 % (ат.). Влияние Sn на
температуры превращения Мп неизвестно. Растворимость Мп в (Sn)
исчезающе мала [X].
Кристаллическая структура соединений системы Mn-Sn приведена
в табл. 174.
Mn-Sn. Mn-Sr
389
Таблица 174 Кристаллическая структура соединений системы Mn-Sn
Соединение
Mn3Sn
Mn-,Sn
MnSn-,
Прототип
Ni3Sn
Ni2ln
CuAI2
Символ
Пирсона,
пр гр
лга,
Я63 / ттс
Л?6,
Я63 / ттс
an.
/4 / тст
Параметры
а
0,567
0,4385
0,4351
0,6659
решетки, нм
с
0,453
0,5504
0,5497
0,5436
Примечание
[I]
При максимальном со-
содержании Мп и тем-
температуре 475 "С [X]
При максимальном со-
содержании Sn и тем-
температуре 450 °С [X]
[I]
Литература
I Singh U.P., Pal А.К., Chandrasekaran L., Gupta K.P.// Trans AIME 1968 V 242 N 8
P 1661-1663
Г К Алексеенко
Mn-Sr. МАРГАНЕЦ-СТРОНЦИЙ
Предположительная диаграмма состояния Mn-Sr (рис.191)
построена в работе [1].
Сплавы Мп и Sr получали дуговой плавкой на медном водоохлаждае-
мом поду в атмосфере Аг, используя Мп и Sr чистотой 99,9 % (по массе).
Исследование проводили методами термического и металлографического
анализов.
Мп и Sr в жидком состоянии не смешиваются между собой в широком
диапазоне концентраций @,74-96,5 % (ат) Sr) при температуре 1240 °С.
390
Mn-Sr,
t, с
№00
1246°
1200
1138°
two'
1000
800
727'
600
400
Sr, % (по массе)
11 д 5 „97 98 99 100
Ж \
i
1
i
*-(Л
Мп)
—(аМп)
о 1 ;
Mn
Рис. 191. Mn-Sr
I j
I
г 4
i
i
\
\
\
\
К
\
~$
(j
с
_—¦ —
9,1
769°
547°
у " 95 96 97 98 93 100
Sr,°/.(am) Sr
Взаимная растворимость этих металлов при различных температурах
приведена ниже.
Температура, °С
Растворимость Sr в Мп,
% (ат)
П00
0,36
Растворимость Мп в жидком Sr,
% (ат) 2,73
1000
0,41
2,12
900
800
0,33 0,16
1,76 1,16
Влияние Sr на температуры аллотропических превращений Мп не
определялось \Щ].
Литература
1 Obinata I., Takeuchi Y., Kurihara К., Watanabe M. // Metall 1965 Bd 19 N 1 S 21-35
Л Л Зусман
Мп-Та
391
Мп-Та. МАРГАНЕЦ-ТАНТАЛ
Первые сведения о взаимодействии Мп с Та относились к образова-
образованию фазы Мп2Та и ее кристаллической структуре [X]. На рис 192
представлена часть диаграммы состояния системы Мп-Та в области,
богатой Мп (до 40 % (ат.) Та), построенная по результатам микроскопи-
микроскопического, термического и рентгеноструктурного анализов в работе [1].
Сплавы получали из Мп чистотой 99,83 % (по массе) и Та жести 99,9 %
(по массе) расплавлением в вакуумной высокочастотной печи в
атмосфере Не в двойных тиглях из окиси Be. Границы растворимости
Та в различных модификациях Мп даны предположительно. Температура
плавления фазы Мп2Та > 1670 "С.
Соединение Мп2Та является фазой Лавеса типа MgZn2, символ
Пирсона Ш2, пр. гр. />63 / mmc, параметры решетки а = 0,4852 нм, с -
= 0,7911 нм
, -Л
t, 6
К00
1300
№6
1200
tfff
поо/
поо"
WOO
900
OUUl
7271
70 0\
6oo\
.100]
n
' 10 10
\ l
Ж
JiMn)/
)y /
ryu:
I
1
1
h
1 i
', % (no массе)
30 ЬО SO
I i
у
1"" 1070 '
750'
)
у1*
1
60
s
1
О Ю 20
Мп Га, % (am.)
Рис. 192. Мп-Та
JO
392
Мп-Та. Мп-ТЬ
Литература
1 Савицкий Е.М., Копецкий Ч.В. // Журнал неорганической химии 1960 Т 5 N 11
С 2638-2640
Г К Алексеенко
Мп-ТЬ. МАРГАНЕЦ-ТЕРБИЙ
Диаграмма состояния Мп-ТЬ построена в работе [1] и приведена на
рис. 193
Сплавы выплавляли в высокочастотной печи в корундизовых тиглях
с использованием электролитического Мп чистотой 99,9 % (по массе) и
дистиллированного Tb чистотой 99,9 % (по массе).
ТЬГ % (по массе)
. о го to so во too
1289"
I, С
nt6e
1ZOO
1138°
ttOO"
rooo
800
oOO
ZOO
1
1
1
V-
/
1
to
i
\
1 v,
да
/к
1
\
768'
\
68
/
1
f
/
/
(ЛП
3f6"
)-*
о io го зо to so so ?o во за wo
МП Tb, %(am) Tb
Рис. 193. Mn-Tb
Мп-ТЬ
393
Для исследования применяли методы термического, металлографичес-
металлографического и рентгеноструктурного анализов.
В системе образуются три двойных соединения Mn,2Tb, Мп23ТЬ6 и
Мп2ТЬ в результате перитектических реакций. Достоверно установлен-
установленные нонвариантные реакции в системе Мп-ТЬ представлены в табл 175.
Таблица 175 Нонвариантные реакции в системе Мп-ТЬ
Реакция
FМп) + Ж- Мп12ТЬ
Мп12ТЬ + Ж- Мп23ТЬ6
Мп23ТЬ6 + Ж - Мп2ТЬ
Ж - Мп2ТЬ + (аТЬ)
Содержание ТЬ в фазах,
% (ат)
-0, 16, 8
8, 32, 21
21, 52, 33,3
68, 33,3, -100
Температура, °С
1140
1048
912
768
Взаимная растворимость компонентов в твердом состоянии
практически отсутствует. Кристаллическая структура соединений
системы Мп-ТЬ приведена в табл 176 по данным работы [2]
Таблица 176 Кристаллическая структура соединений системы Мп-ТЬ
Соединение
Мп2ТЬ
Мп23ТЬ6
Мп12ТЬ
Прототип
Cu2Mg
Mn23Th6
Mn,2Th
Символ
Пирсона,
пр гр
cF24,
Fdlm
сЯ16,
Fmim
1/26,
/4 / mmm
Параметры решетки, нм
а
0,7635
1,2447
0,8573
с
0,4760
394 Mn-Tb, Mn-Tc. Mn-Te
Литература
1. Kirchmayr H.R., Lugscheider W. IIZ. Metallkunde. 1970 Bd. 51 N1 S. 22-23.
2. Е.И. Гладышевский, О.И. Бодак. Кристаллохимия интерметаплических соединений
редкоземельных металлов. Львов: Вища школа. 1982. 255 с.
Е.И. Гладышевский. О.И. Бодак, В.К. Печорский
Мп-Тс. МАРГАНЕЦ-ТЕХНЕЦИЙ
Диаграмма состояния Мп-Тс не построена. Имеются данные о том,
что литой сплав с 40 % (ат.) Мп имеет тетрагональную структуру фазы о,
параметры решетки а - 0,915 A) нм,с = 0,480A) нм [Ш].
А.Л. Ташаркина
Mn-Те. МАРГАНЕЦ-ТЕЛЛУР
Сплавы системы Mn-Те исследовали методами дифференциального
термического, металлографического и рентгеноструктурного анализов
[1]. Для приготовления сплавов использовали электролитический Мп
чистотой 99,9 % (по массе) и Те чистотой 99,95 % (по массе) с незначи-
незначительным содержанием примесей (%, по массе): 0,037 Se; 0,005 Pb; 0,0003
Си; 0,002 Al; 0,001 Mg.
Диаграмма состояния Mn-Te, построенная авторами работы [1] на
основании собственных данных и данных предыдущих работ [Э, 2],
приведена на рис. 194. В богатых Мп сплавах обнаружена область
несмешиваемости в жидком состоянии. Температура монотектической
реакции равна 1230 "С. В системе присутствуют два соединения: МпТе
и МпТе2, образующиеся по перитектическим реакциям соответственно
при температурах 1151 и 741 "С. При исследовании [2], выполненном
методами бесконтактной термографии, рентгенографического и
дифференциального термического анализов с использованием электроли-
электролитического Мп и Те, очищенного вакуумной возгонкой, установлена
следующая схема фазовых превращений соединения МпТе:
950 °С 1020 "С 1055 °С
аМпТе > рМпТе уМпТе бМпТе.
Кристаллическая структура соединений системы Mn-Te приведена
в табл. 177.
Мп-Те
395
t,°C
Те, % /по массе)
О юго 30 40 50 60 70 80 90 fff0
Г300
1246
FМп)-*
/
1
1
i
1
/гзое
<
| us
тз^
%Мп)
727*
*-(<*¦
МП)
&
1
\J9,Z
ч
Ч
\
я
it
f
\
\
\
}
\
\
\
V
\
f/00
900
700
5О0
зоо
О 10 20 30 <Ю SO ВО 7О 80 90 fOO
Мп Те, % /ат.) Те
Рис. 194. Мп-Те
В работе [7] определены области гомогенности соединений МпТе и
МпТе2. Для соединения МпТе при температуре 1050 °С область
гомогенности составляет 48-50 % (ат.) Те, для соединения МпТе2 при
400 °С - 64,5-66,5 % (ат.) Те.
Таблица 177. Кристаллическая структура соединений системы Мп-Те
Соединение
аМпТе
Прототип
NiAs
Символ
Пирсона,
пр. гр.
й/Ч
РЬЪ1 mmc
Параметры решетки, нм
а
0,4155
0,4148
0,4143
с
0,6711
0,671
0,6711
Источник
[2]
[3]
W
396
Mn-Te, Mn-Th
Соединение
pMnTe
уМпТе
бМпТе
МпТе2
Прототип
ZnS
(вюрцит)
ZnS
(сфалерит)
NaCI
FeS2
(пирит)
Символ
Пирсона,
пр. гр.
hP4,
Р63 / ттс
сП,
с«.
с? 12,
РаЪ
Параметры решетки, им
а
-
-
0,6026
0,6957
0,6951
с
-
-
-
-
Источник
[2]
[2]
[3]
[5]
[6]
Литература
1. Mann G.S., Van Vlack L.H.// Metall. Trans. B. 1977. V. 8. N 1. P. 53-57.
2. Ванярко В.Г., Зломанов В.П., Новоселова А.В. // Изв. АН СССР. Неорганические
материалы. 1970. Т. 6. N 7. С. 1257-1262.
3. Johnston W.D., Sestrich D.E. // J. lnorg. Nucl. Chem. 1961. V. 19. P. 229-236.
4. Маковецкяй Г.И., Сирота Н.Н. // Докл. АН Белорусской ССР. 1964. Т. 8. N 5.
С. 289-291.
5. Elliott N.E. // J. Amer. Chem. Soc. 1937. V. 59. P. 1958-1962
6. Furberg S. // Acta Chem. Scand 1953. V. 7. P. 693-694.
7. Абрикосов Н.Х., Дюльдииа К.А., Жданова В.В. // Журнал неорганической химии.
Т. 4. N 11. С. 1878-1881.
Н.И. Никишина
Mn-Th. МАРГАНЕЦ-ТОРИЙ
Диаграмма состояния Mn-Th построена по данным работы [1] в
интервале концентраций 72 % (ат.) Мп. Исходными материалами при
синтезе сплавов служили Th компактный чистотой 99,6 % (по массе) и
Мп электролитический чистотой 99,98 % (по массе). Сплавы выплавляли
в атмосфере Аг, затем гомогенизировали при 800 °С в течение 150 ч.
Отжигали сплавы при 880 "С в течение 100 ч и при 600 °С в течение 125 ч
с последующей закалкой в воде. Сплавы исследовали методами
микроструктурного, рентгеновского и термического анализов, а также
измерением твердости и микротвердости.
На рис. 195 приведена часть диаграммы состояния системы Mn-Th
при концентрации от 0 до 80 % (ат.) Мп. Показано образование двух
Mn-Th
397
Mn, °/в /по массе)
5 ГО 20 SO 4050
к
1
1
\
\
9avv
Uh)
\
\
\
Ж
/
r
1
20°
1755'
1600
поо
1360°
1200
WOO
ffOO
600
400
0 10 20 JO 40 50 60 70 00
Th Mn/Vofam.)
Рис. 195. Mn-Th
соединений ThMn2 и Th6Mn23. В работе [Х] сообщается о существовании
еще одного соединения ThMn12, богатого Мп.
Соединение ThMn2 образуется при 1120 °С по перитектической
реакции Ж + ThgMn23 **¦ ThMn2. При температуре 950 ° С и концентрации
39 % (ат.) Мп кристаллизуется эвтектика (aTh) + ThMn2. Растворимость
Мп в (aTh) при 880 °С составляет -1 % (ат.). Данные о кристаллической
структуре соединений приведены в табл. 178.
Таблица 178. Кристаллическаа структура соединений системы Mn-Th
Соедине-
Соединение
ThMn2
Прототип
MgZn2
Символ
Пирсона,
пр.гр.
ИР12,
Pbjlmmc
Параметры решетки, им
а
0,5476
с
0,8931
Источник
т
398
Mn-Th, Mn-Tx
Соедине-
Соединение
Th6Mn23
ThMn|2
Прототип
Th6MnB
ThMn|2
Символ
Пирсона,
пргр
сЛ 16,
Fnxlm
1126,
Hlmmm
Параметры решетки, нм
а
1,2523
0,874
с
0,495
Источник
[X]
[X]
Литература
I. Бадаева Т.А., Александрова Л.Н. // Строение и свойства сплавов для атом энерг Сб.
статей М : Наука, 1973 С 26-30
П. Б Будберг
Mn-Ti. МАРГАНЕЦ-ТИТАН
Исследованию отдельных участков диаграммы состояния Ti-Mn,
выполненных различными методами физико-химического анализа, а
также с использованием методов расчета по термодинамическим данным,
Мп, % (по массе)
,о а го зо *о 50 60 70 so 90 too
- -(flMn)
/f0° о ю го зо
TL
Рис. 196. Mn-Ti
so so то so so too
Mn,e/o(am.) Mn
Mn~Ti 399
посвящено значительное число работ [1-9]. Исследования [1-3]
посвящены установлению фазовых равновесий главным образом в
сплавах на основе Ti. Диаграмма состояния представлена на рис. 196.
В системе Ti-Mn существуют четыре интерметаллических
соединения: TiMn, TiMn2, TiMn3 и TiMn4, соединение TiMn существует
в двух полиморфных модификациях аир, смещенных относительно друг
друга примерно на 1,5 % (ат.) по содержанию Мп. Соединения pTiMn,
TiMn3 и TiMn4 образуются по перитектическим реакциям при -1200,1250
и 1230 °С соответственно, «TiMn образуется по перитектоидной реакции
при -950 "С. TiMn2 плавится конгруэнтно при 1325 °С и имеет широкую
область гомогенности. Соединение TiMn4 устойчиво при температурах
до -930 "С. Растворяясь в pTi, Mn довольно резко снижает температуру
его кристаллизации. При температуре 1180 "С протекает эвтектическая
реакция Ж «¦* (pTi) + pTiMn. Максимальная растворимость Мп в (pTi)
достигает 30 % (ат.) при эвтектической температуре. При 550 °С
наблюдается эвтектоидный распад (PTi) на (ctTi) + otTiMn. Максимальная
растворимость Мп в (aTi) достигает 0,4 % (ат.) при эвтектоидной
температуре. Особенности фазового строения сплавов системы Ti-Mn
в интервале концентраций 40—80 % (ат.) Мп исследовали в работах [4-6],
в сплавах, богатых Мп, в работе [7].
Структурные типы фаз TiMn3, aTiMn и pTiMn не установлены. Фаза
TiMn2 относится к фазам Лавеса типа MgZn2, гомогенна в интервале
концентраций 60-70 % (ат.) Мп, в котором параметры решетки а и с
изменяются в пределах 0,4857-0,4818 нм и 0,8017-0,7879 нм соответствен-
соответственно, символ Пирсона hP\2, пр.гр. Рб^/ттс. Соединение TiMn4 изострук-
турно фазе 6 в системе Mo-Ni, имеет ромбоэдрическую кристаллическую
решетку с 53 атомами в элементарной ячейке, пр.гр. R Ът.
Литература
1 McQuillan A.D. // J. Inst Met 1951-1952. V. 80. P. 363-368.
2 Dimes P. // Trans ASM. 1953. V 45. P. 934-940.
3 Maukuth D.J., Ogden H.R., Jaffee R.I. //Trans. AIME. 1953. V. 197. P 225-231
4 Murakami Y., Enjyo T.// J.Japan Inst. Metals. 1958. V. 22. P. 261-265.
5. Свечников В.Н., Петьков В.В. // Металлофизика. 1976 Вып. 64. С. 24-28.
6 Waterstat R.M. // Trans. AIME 1961 V. 226. P. 687-690.
7 HellawellA.,Hume-RotheryW.//Phil Trans. Roy. Soc. (London). 1957 V 249 P 417-454.
8 Kaufman L. // Calphad 1978 V 2. N 2 P 117-146
9 Dew-Hughes David//Calphad 1979 V 3. N 3. P. 175-200
С П Алисова
400
Mn-Tl, Mn-Tm
Mn-TI. МАРГАНЕЦ-ТАЛЛИЙ
Диаграмма состояния Mn-Tl, представленная на рис. 197, построена
по данным только одной работы [X] на основании термического анализа
пяти сплавов. Для приготовления сплавов использовали Мп чистотой
Tt, "/о/по массе)
О 20 «О 60 70 во 90
/246"
ггоо
нзв°
нов"
WO
300
200
too
4
— 1
Мл)
*- (ft/in)
ж
i
,+»
1
Г»
~ff92°
ЗО2
гзо1
9
1
1
/
\
\
7
Т
)-*
-*
230 е
О 10 20 30 ЧО 50 60 70 80 90 ГОО
Мп Tl,°/afam) Tl
Рис. 197. Mn-Tl
99,8 % (по массе) с температурой плавления 1209 °С. Схематически
показана область несмешиваемости (Ж, + Ж^. По-видимому, имеются
две эвтектические реакции как со стороны Мп, так и Т1. Диаграмма
состояния Мп-Т1 требует дальнейшего уточнения.
Г К Алексеенко
Мп-Тш. МАРГАНЕЦ-ТУЛИЙ
Диаграмма состояния Mn-Tm не построена. Имеются сведения только
о соединениях Mn2Tm P] и Мп23Тт6 [Ш], кристаллическая структура
которых приведена в табл. 179 по данным авторов [1].
Mn-Tm, Mn-U
401
Таблица 179 Кристаллическая структура соединений системы Mn-Tm
Соединение
Mn2Tm
Mn23Tm6
МП|2Тт
Прототип
2n2Mg
Мп2зТЬ6
Mnl2Th
Символ Пир-
Пирсона, пр гр
АЛ 2,
Pbjlmmc
с Л 16,
Fmim
1/26,
/4/mmm
Параметры решетки, нм
а
0,528
1,2226
0,854
с
0,863
-
0,473
Литература
1 Гладышевский Е.И., Бодак О.И. Кристаллохимия интерметаллических соединений
редкоземельных металлов Львов Вища школа 1982 255 с
Е И Гладышевский, О И Бодак, В К Печарский
Mn-U. МАРГАНЕЦ-УРАН
Диаграмма состояния Mn-U (рис. 198) построена по данным
термического, микроструктурного и рентгенографического анализов [1].
Мп, "А (по массе)
о ю го w бо 80/00
t,'C
1100
$00
776°
500
7
716'
то"
I
(дМп) yi
(fMnltZ.
44-
138°
1100°
727"
О Ю 20 30 tO SO 60 70 60 90 tOO
U Mn,"/ofam.) Mn
Рис. I98. Mn-U
402
Mn-U, Mn-V
В системе установлено образование двух соединений MnU6 и Mn2U
Соединение MnU6 образуется инконгруэнтно, по перитектической
реакции при 726 "С. Mn2U плавится с открытым максимумом при
-1120 °С При 716 °С наблюдается эвтектическая реакция Ж -* MnU6 +
+ Mn2U, а при 1035 "С предполагается наличие тоже эвтектического
равновесия Ж •» Mn2U + (рМп) (РЦ) эвтектоидно распадается на (ocU) +
+ MnU6 при 626 °С
Максимальная растворимость Мп в (yU) составляет около 4,2 % (ат),
в (PU)-около 1,1 %(ат)при626°С Растворимость U во всех модифика-
модификациях Мп практически отсутствует
Кристаллическая структура соединений системы Mn-U приведена в
табл 180
Таблица 180 Кристаллическая структура соединений Mn-U
Соедине-
Соединение
MnU6
Mn,U
Прототип
MnU6
Cu2Mg
Символ
Пирсона,
пргр
//28,
14/тст
сП4,
Fdlm
Параметры решетки, нм
а
1,029
0,7147
с
0,524
Источник
[2]
[2,3]
Литература
1 Wilhelm H.A., Carlson O.N. // Trans ASM 1950 V 42 P 1311-1325
2 Baezinger N.C., Rundle R.E., Snow A.I., Wilson A.S. // Acta Crystallogr 1950 V 3
P 34-40
3 PetzowG., SteebS.,KiesslerG.//Z Metallkunde 1963 Bd 54 S 473-477
Г К Алексеенко
Mn-V. МАРГАНЕЦ-ВАНАДИЙ
Информация о взаимодействии Мп с V приведена в работах [X, Э, Ш]
На рис 199 представлена ориентировочная диаграмма состояния Mn-V,
построенная в работе [Ш] по данным работы [1]. Сплавы выплавляли в
дуговой печи в атмосфере Аг из Мп чистотой 99,9 % (по массе) и V
чистотой 99,7 % (по массе) Диаграмма построена по результатам
рентгеновского и металлографического анализов Твердый раствор
между V и (бМп) имеет ОЦК решетку, а при концентрации около
50 % (ат) V и при температуре между 1150 и 725 °С становится
t.'C
fpnn
Jct/if
1Г38'
tfoe*
//7/7/7
7(/{Д/
800
727°
КПП
ОС/С/
I
Mn-V, Mn-W
403
V, % {no массе)
7 ГО 20 30 40 5О 60 70 в0 W tOO
ТТ "
(dMnl
(ХМп)
t 7,S;tO2O'
r'"t '
h
1 /
'(an
\\
"\
I
1
1
1
1
t 1
\ 1
1
1 1
$
\
1
I
1
1'
1
1
™\
1
1
<v
)-*
7 Ю 10 30 40 SO 60 70 80 90 TOO
МП
V "A
Рис. 199. Mn-V
упорядоченным с решеткой типа CsCl, символ Пирсона сР2, пр.гр РтЗт
с а = 0,2904A) нм При температуре ниже 1050 °С и концентрации около
25 % (ат) V образуется фаза о [1]
Литература
1 Waterstrat R.M. // Trans AIME 1962 V 224 Р 240-243
Mn-W. МАРГАНЕЦ-ВОЛЬФРАМ
Г К Алексеенко
Данные о взаимодействии Мп с W ограничены [X], диаграмма
состояния не построена. W не растворяется в расплавленном Мп [1];
сплавы W с Мп не удалось получить путем совместного восстановления
С их оксидов Обзор литературных данных по этой системе приведен в
работе [2]
Литература
1 ZwickerU.//Z Metallkunde 1951 Bd 42 S 246-252
2 Nagender Naidi S.V., Rama Rao P. // J Alloy Phase Diagrams 1986 V 2 N 1 P 38-40
КБ Поварова
404
Mn-Y
Mn-Y. МАРГАНЕЦ-ИТТРИЙ
Диаграмма состояния Mn-Y построена во всем интервале концентра-
концентраций. Наиболее полно данные по работам, посвященным исследованию
системы Mn-Y, представлены в обзорной работе [1]. Диаграмма
состояния Mn-Y, приведенная на рис. 200, основана на данных работ
[2, 3].
Сплавы готовили в дуговой печи в атмосфере Аг из Мп электролити-
электролитического чистотой 99,9 % (по массе) и Y чистотой 99,65 % (по массе). Для
с
1
1W
Г200
ftOO'
/000
воо
727'
600
Wff
200
i
1096°
my
W4
—
20
V
W
t
1
1
Чп)
1— H
k-
/
Г0ТР
fiat
npedp.
1125
','/'
Г
О
1/07°
?6fi
2№
nr
5'
ттное
щение
i
(no массе)
60
1
Ж
\
do
i
/
/
/
в?
/
/
'в'
(CLY
10
1522*
H76°
I—*
(НУ)
о /а го зо ьо so so 70 во so wo
Mn Y,%(am.) Y
Рис. 200. Mn-Y
Mn-Y
405
исследования использовали методы термического, металлографического
и рентгеноструктурного анализов, измерения плотности.
Таблица 181. Нонвариантные реакции в системе Mn-Y
Реакция
FМп) - (уМп) + Ж
(уМп) + Ж~Мп,2У
(yMn)- (PMn)+ Mn,2Y
Ж- Mn,2Y + Mn23Y6
Ж, + Ж2- MnjjYj,
Ж - Mn23Y6 + Mn2Y
Ж - Mn2Y + (aY)
CY) - Ж + (aY)
Содержание в фазах
0,5;
-0,2;
-0,1;
П,9;
17;
28,4;
64,7;
-99,5;
-0,2;
10,5;
-0,05;
7,7;
23;
20,7;
33,3;
93,5;
% (ат.)
9
7,7
7,7
20,7
20,7
33,3
-100
-100
Температура, °С
1136
1096
1085
1075
1125
1100
878
1476
Таблица 182. Кристаллическая структура соединений системы Mn-Y
Соедине-
Соединение
Mn,2Y
Mn23Y6
Mn2Y
Mn2Y
Mn2Y*
Прото-
Прототип
Mnl2Th
Mn23Th6
Cu2Mg
Zn2Mg
-
Символ
Пирсона,
пр.гр.
/726,
74/mmm
сЛ1б,
Fm3m
cF24,
Fdlm
hP\2,
Pb-jmcm
-
Параметры решетки,
нм
a
0,8541
0,8574
0,8595
1,2447
1,2438
1,2457
1,24939
1,23975
0,762
0,7680
0,7678
0,76925
0,7692
0,7677
0,5404
0,773
с
0,4785
0,4773
0,4773
-
-
-
-
-
-
-
—
-
-
-
0,8848
0,770
Тетрагонально искаженная структура Cu2Mg.
Примечание
[2]
И]
[5]
[6]
[7]
[5]
При температуре
327 °С [8]
При температуре
-193 °С [8]
[9]
[Ю]
[11]
[4]
[5]
[8]
При температуре
1300 °С и давлении
4000 М Па [12]
При температуре
ниже-173 "С [13]
406 Mn-Y. Mn-Yb
В системе образуются три соединения: Mn23Y6 по синтектической
реакции при 1125 °С, MnJ2Y по перитектической реакции при 1096 °С
и Mn2Y при 1107 °С (плавится конгруэнтно). Взаимная растворимость
(аМп) и (cxY) практически отсутствует. В (бМп) растворяется при 1136 °С
0,5 % (ат.) Y, в (уМп) при 1096-1085 "С - 0,2-0,1 % (ат.) Y, в (PMn) при
1085 °С - -0,1 % (ат.) Y, в (PY) при 1476 °С - -0,5 % (ат.) Мп.
Нонвариантные реакции в системе Mn-Y даны в табл. 181 поданным
работы [1].
Кристаллическая структура соединений системы Mn-Y представлена
в табл. 182.
Литература
l.PalenzonaA., Cirafici S.//J. Phase Equilibria. 1991. V. 12. N 4. P. 474-478.
2. Muklebust R.L., Daane A.H. //Trans. A1ME. 1962. V. 224. P. 354-357.
3. Hellawell A. // J. Less-Common Met. 1959. V. I. P. 343-347.
4 Lihl F.//U.S. Govt. Res. Develop. Rep. 1965. V. 40. N 11. P. 88-89.
5. Kirchmayr H.R., Mach D. // Z. Krist. 1967. Bd. 124. S. 152-160.
6. Крипякевич П.И., Фраицевич Д.П. // Кристаллография. 1965. Т. 10 № 4. С. 560-565.
7. WangF.F., Holden J.R.//Trans. AIME. 1965. V. 233. P. 731-736.
8. James W.J., Van Schalkwyk T.G.D., Crowder C.E. // J. Less-Common Met. 1983. V. 94
P. 221-225.
9. Nassau K., Cherry L.V., Wallace W.E. // J Phys. Chem. Solids. I960. V. 16. P. 123-136
10. Beaudry B.J., Haefing J.F., Daane A.H. // Acta Crystallogr. 1960. V. 13. P. 743-744.
11. Dwight A.E. // Trans. ASM. 1961. V. 53. P. 479-500.
12. EatoughN., Hall H.T.//Inorg. Chem. 1972. V. IIP. 2608.
13. Gaidukova I.Yu., Kolarev V.V., Markosyan A.S., Menshikov A.Z., Pirogov A.N. // J
Magnetism Magn. Mater. 1988. V. 72. P. 357-359.
AC. Адамова, Е.И. Гладышевскип.
О. И. Бодак, В. К. Печорский
Mn-Yb. МАРГАНЕЦ-ИТТЕРБИЙ
Схематически диаграмма состояния Mn-Yb построена как диаграмма
монотектического типа [М] (рис. 201).
Система Mn-Yb характеризуется обширной областью расслоения в
жидком состоянии с весьма малой взаимной растворимостью компонен-
компонентов. Монотектическая температура лежит вблизи 1200 "С. Однако в
работе [V-C] имеются сведения о составах и структуре четырех двойных
соединений Мп с Yb (Mn3Yb4, Mn2Yb, Mn23Yb6, Мщ-jYb^).
Кристаллическая структура известных двойных фаз приведена в
табл. 183 по данным работы [V-C].
Mn-Yb
407
t,°C
гвоо
fWO
о го ft/
Yt, %fno массе)
60 8O
«ГО
1
j
1
m\
1
1
I
^J6Mn)
5 j_
t^.—•——
X-ttMn)
^-(/3Mn)
1 727"
МЛ)
1
~шо>
1
\
\
\
\
\
\
\
- \
1
(цгь)
fcLYt
//38°
two0
WOO
600
гоо
о /о го зо w 50 60 7о 80 90 то
Мп Yb,°/ofam.j Y6
Рис.201.Мп-?Ь
Таблица 183. Кристаллическая структура соединений системы Mn-Yb
819°
760°
Соединение
Mn3Yb4
Mn2Yb
Mn23Yb6
Mn17Yb2
Прототип
Co3Ho4
Zn2Mg
Mn23Th6
Ni17Th2
Символ Пир-
Пирсона, пр.гр.
hP22,
РЬъ1т
hP\2,
P6$lmmc
сЛ16,
Fmim
hPlZ,
РЬт/ттс
Параметры решетки, нм
а
1,1336
0,5233
1,2189
0,849
с
0,4029
0,8561
0,788
Е И Глабышевский, О. И. Бодак, В. К Печарский
408
Mn-Zn
Mn-Zn. МАРГАНЕЦ-ЦИНК
Наиболее полные данные по системе Mn-Zn приведены в обзорной
работе [1]. На рис 202 представлена диаграмма состояния системы
Mn—Zn, основанная на данных трех работ: [2] - при концентрациях
0-60 % (ат.) Zn, [3] - при концентрациях 30-100 % (ат.) Zn, [4] - при
концентрации 30-70 % (ат.) Zn для температур ниже 400 °С.
%-с
Z/т, % fm> массе)
о w zv зо W so so 70 во до гоо
-200
о го го зо
M/r
Рис. 202. Mn-Zn
о so so 70 во so юо
Zn, "/t/am j Zn
Для построения диаграммы состояния использовали результаты
микроструктурного, рентгеновского, дифференциального термического
и термомагнитного анализов. Сшивы выплавляли из Мп чистотой 99,9 %
(по массе) и Zn чистотой 99,99 % (по массе) в специальной печи в
атмосфере инертного газа при давлении 1 МПа для предотвращения
испарения Zn.
Для системы Mn-Zn характерно образование большого числа
промежуточных фаз с широкими областями гомогенности Нонвариан-
тные реакции, протекающие в системе Mn-Zn, представлены в табл 184
Mn-Zn
409
Таблица 184 Нонвариантные реакции в системе Mn-Zn
Реакция
(Шп) - р
Ж + р-Е
Р - (YMn) + е
(уМп) - (рМп) + е
е - (РМп) + а
(РМп) + ее - р.
а — а.
Ж + Е-Е,
Е| <" е + а
Ж + Е, - Е2
Е2-Е, + Y
e2-y
Y- Y|
Е| + y •* а
Ж + е2-6
6- Е2+ 6,
е2- Y+ 5|
Ж + 6-С
6+С-6,
Ж - С + (Zn)
Содержание Zn в
(ат)
-
-65,
-38,
-31,
62,
47,
-75
-76,5,
-67,
-83,
-76,
72,
96,3,
-86,5,
-85,
98,1,
90,6,
98,61,
-
-50,
-34,
-25,
48,
70,
-60,
-63,
-71,
-72,
80,8
-
77,
88,6,
-85,5,
-84,
96,6,
92,6,
92,9,
фазах, %
-
-53
-42
-46
69
50
-63
-70
-75
-77
74
90
-88
-88
92,7
90,8
99,4
Температура,
°С
900>t>800
815
620
530
220
180
-143
-740
-270
-640
-400
420
-
-325
462
380
350
428
-424
417,25
Источник
[3]
[3]
[3]
[3]
[4]
[4]
[5]
И
[2]
[2]
[2]
[2]
[6]
[6]
[6]
[2]
[2]
[6]
[6]
[7]
Кристаллическая структура соединений и упорядоченных фаз
приведена втабл 185
410
Mn-Zn
Таблица 185. Кристаллическая структура соединений системы Mn-Zn
Соедине-
Соединение
Р
Pi
е
е1
е2
ос'
*|
Y
y;
б"
C(MnZnl3)
Прото-
Прототип
CsCl
CsCl
Mg
Ni3Sn
-
AuCu3
AuCu
Cu5Zn8
-
-
-
CoZn!3
Символ
Пирсона,
пр.гр.
cP2,
Prnlm
cP2,
Pmim
hP2,
Рбу/ттс
hP&,
Pb-Jmmc
hP
cP4,
РтЪт
tPl,
P4/mmm
c/52,
/43 m
c/550,
-
hP,
/nC28,
P9/m
Параметры решетки, нм
U
0,3060
0,3065
0,3071
0,2731
0,27462
0,27514
0,2746
0,27548
0,27584
0,27593
0,27660
0,386
0,3857
0,390
0,9160
-
-
1,283
1.368
1,3483
Структура Y| похожа на структуру у
"Структура 6 фазы неизвестна.
Ь
-
—
—
-
-
-
-
-
-
0,763
0,76626
с
-
-
0,4455
0,44527
0,44507
0,4457
0,44475
0,44456
0,44446
0,44452
_
0,371
-
-
-
5,77
0,507
0,5134
фазы.
Примечание
При 39,8 % (ат.) Zn [6]
При 43,5 %(aT.)Zn
При 50 % (ат.) Zn [8]
При 45,7 % (ат.) Zn [9]
При55%(ат.)гп[10]
При60%(ат.)гп[10]
При65%(ат.)гп[11]
При65%(ат.)гп[10]
При70%(ат.)гп[10]
При75%(ат.)гп[10]
При85,5%(ат.)гп[10]
При73%(ат.)гп[12]
При 73,8 % (ат.) Zn [6]
При 73 % (ат.) Zn и
-170°С[11]
При 74 % (ат.) Zn и
-188-(-141)°С[5]
[6]
[6]
[6]
При 90 % (ат.) Zn [6]
При 92,9 % (ат.) Zn,
Р= 128,7°, [6]
Р= 127,8° [13]
Mn-Zn, Mn-Zr 411
Растворимость Zn в FМп) составляет 50 % (ат.) при температуре
815 °С, в (уМп) - -34 % (ат.) при 620 °С, в (рМп) - 25 % (ат.) при 530 °С
и 48 % (ат.) при 220 °С, в (сеМп) - до 2 % (ат.). Растворимость Мп в (Zn)
при температуре 417,25 "С составляет 0,6 % (ат.).
Литература
1. Okamoto H., Tanner L.E. // Bull. Alloy Phase Diagrams. 1990. V. 11. N 4. P. 377-384.
2. Wachtel E., Tsiuplakis K. // Z. Metallkunde. 1967. Bd. 58. N 1. S. 41-45.
3. Romer O., Wachtel E.//Z. Metallkunde. 1971. Bd. 62. N 11. S. 820-825.
4. Nakagawa Y., Hori T. //Trans. Japan. Inst. Met. 1972. V. 13. N 7. P. 167-170.
5. Uchishiba H., Hori Т., Nakagawa Y. // J. Phys. Soc. Japan. 1969. V. 27. N 3. P. 600-604.
6. SchrammJ.//Z. Metallkunde. 1940. Bd. 32. N 12. S. 399-407.
7. Weisse E., Blumenthal A., Henemann H. IIZ. Metallkunde. 1942. Bd. 34. N 9. S. 221.
8. Hori Т., Nakagawa Y., Sakurai J. //J. Phys. Soc. Japan. 1968. V. 24. N 5. P. 971-976.
9. Potter E.V., Huber R.W.// Trans. ASM. 1949. V. 41. P. 1001-1022.
10. Farrar R.A., King H.W. // Metallography. 1970. Bd. 3. N 1. S. 61-70.
11. Nakagawa Y.,SakaiS., Hori T.//J. Phys. Soc. Japan. 1962. V. 17. Suppl. B-l P. 168-171.
12. Nakagawa Y., Hori T. // J. Phys. Soc. Japan. 1964. V. 19. P. 2082-2087.
13. Brown P.J.//Acta Crystallogr. 1962. V. 15. N 6. P. 608-612.
А.С. Адамова
Mn-Zr. МАРГАНЕЦ-ЦИРКОНИЙ
Диаграмма состояния Mn-Zr (рис. 203) в богатой Zr области
исследована в работе [1], в богатой Мп части - в работах [2,3], результа-
результаты обобщены в работах [X, Э]. Сплавы выплавляли в дуговой печи,
исследовали методами термического, микроскопического, рентгеновско-
рентгеновского анализов.
В системе Mn-Zr образуется фаза Лавеса на основе конгруэнтно
плавящегося интерметаллического соединения ZrMn2 (А,). Температура
плавления ZrMn2 согласно работе [1] составляет 1340 °С, однако в более
поздних работах приводятся более высокие температуры плавления -
1400 "С [4], 1450 "С [5]. Последним работам следует отдать предпочтение,
так как для приготовления сплавов авторы работ [5, 6] использовали
иодидный Zr, а авторы работы [1] - магниетермический Zr. В отличие
отданных работ [1-3] исследования последних лет [5-8] свидетельствуют
о существовании широкой области гомогенности фазы Aj на основе
ZrMn2: 28-40 % (ат.) Zr [5], 22,7-35,7 % (ат.) Zr [6], 20,8-35,7 % (ат.) Zr [7].
Фаза А, образует эвтектику с твердым раствором на основе pZr при
температуре 1135± 10 "С и концентрации 67,5 % (ат.) Zr [1]. Эвтектика
с твердым раствором на основе Мп плавится при -1155 °С и содержит
-5 % (ат.) Zr [2, 3]. Существуют разноречивые версии по данным работ
412
Mn-Zr
t.°C
Zr, % (по массе)
10 20 30 40 50 60 70 80 90 Iffff
WOO -
/600 -
коо
(ЗМп)
по о"
600
I I
w
х-
*1 1125°
I
О S W
Zr,%(am.) fif$0
О 5 tO
\
\
Ж
Г6551
/
/ i
i
4j 1135±10c
67,5 89,8\
(pzr)
795±10°
95,1
fazr)-<
6SJ"
о to го jo w so 60 70 во до too
Mn Zr,%/am.) Zr
Рис. 203. Mn-Zr
[2, 3] относительно характера фазовых превращений при высоких
температурах твердых растворов на основе модификаций Мп. Оба
варианта показаны на вставках (см. рис. 203).
В (pZr) растворяется до 10,2 % (ат.) Мп. При температуре 795± 10 °С
происходит эвтектоидный распад (PZr) *¦ (aZr) + A); эвтектоидная точка
расположена при 4,9 % (ат.) Мп [1]. Растворимость Мп в (aZr) невелика.
При быстрой закалке из жидкого состояния образуется пересыщенный
твердый раствор на основе pZr с содержанием Мп в нем 20 % (ат.) [9].
Фаза Л, является фазой Лавеса и имеет структуру типа MgZn2 (символ
Пирсона Л/Ч 2, пр.гр. Р63/ттс). Параметры решетки приведены ниже:
Mn-Zr. Mo-N 413
Параметры решетки, нм
а 0,4985-0,5052 0,5026 0,5004 0,4957 0,5012
с 0,8190-0,8315 0,8258 0,8208 0,8088 0,8206
Концентрация Zr, % (ат.) 28-40 33,3 26,3 20,8 21,0
Источник [5] [7] [7] [7] [8]
ZrMn2 не претерпевает превращений в интервале температур
-268,8-20 "С, параметры решетки составляют а = 0,50307, с = 0,82679 нм
при 20 °С и а - 0,50191, с = 0,82566 нм при -268,8 °С [10].
Литература
1. Roberson A.H., Hayes EX, Donaldson V.V. // Zirconium and Zirconium Alloys. Cleveland:
ASM. 1953. P. 283-291.
2. Hellawell A.//J. Less-Common Met. 1959. V. 1. P. 343-347.
3. Савицкий К.М., Копецкий Ч.В. // Журнал неорганической химии. 1960. Т. 5. N 11.
С. 2422-2434.
4. Прима СБ., ТретьячеикоЛ.А.,ПетьковВ.В.//Мегаллофизика. 1974. Вып. 52. С. 75-80.
5. Свечников В.Н., Петьков В.В. // Металлофизика. 1976. Вып. 64. С. 24-28.
6. Van Essen R.M., Buschow K.H.J.// Mater. Res. Bull. 1980. V. 15. N8. P. 1149-1155.
7. Pourarian F., Fujii H., Wallace et al. II). Phys. Chem. 1981. V. 85. N 21. P. 3105-3111.
8. Nishimiya N. // Mater. Res. Bull. 1986. V. 21. N 9. P. 1025-1037.
9. Ковиеристый Ю.К., Вавилова В.В., Руда Г.И. и др. // Изв. АН СССР. Неорганические
материалы. 1986. Т 22. N 2. С. 335-337.
10. Didisheim JJ., Fisher P. //J. Less-Common Met. 1984. V. 103. N 2. P. 267-275.
Л.А. Третьяченко
Mo-N. МОЛИБДЕН-АЗОТ
Данные о взаимодействии Мо с N освещены в справочниках [X, Э,
Ш, М]. Наиболее детальное исследование сплавов системы Mo-N
методами микроструктурного, рентгеновского и термического анализов
проведено авторами работ [1-4]. Сплавы получали при низких давлениях
азота в высоковакуумном аппарате и при высоких (до 50 МПа) давлениях
в автоклаве.
На рис. 204 приведена часть диаграммы состояния Mo-N при
давлении - 85 МПа согласно наиболее полному обзору, данному в работе
[М]. Она была получена термодинамическим моделированием, с
использованием в основном результатов работы [1].
В системе существуют несколько нитридов молибдена. Высокотемпе-
Высокотемпературный нитрид yMo2N образуется по перитектической реакции при
температуре -2000 °С [1-4] или 1959150 °С [5], область гомогенности
27—35 % (ат.) N. Между (Мо) и yMoN2 образуется эвтектика при
-1800 °С и 19 % (ат.) N [1-4] или 1894125 °С и 20±1 % (ат.) N [5].
414
Mo-N
t.'C
2600
2200\
teoo
ftOO
woo
Рис. 204. Mo-N
N, %/по нассе)
г # б в to гг
Низкотемпературный нитрид pMoN2 образуется по перитектической
реакции из (Мо) и yMoN2 при 850 °С [4,5], имеет область гомогенности
-28-35 % (ат.) N. С повышением содержания N в промежуточной фазе
температура перехода yMo2N в pMo2N снижается и достигает -400 °С
при концентрации -34,5 % (ат.) N. При высоких содержаниях N эти фазы
неразличимы. Нитрид 6MoN образуется при -50 % (ат.) N и нестабилен
при высоких температурах [8]. Нитриды pMoN и 6MoN не нанесены на
рис. 204.
Растворимость N в Мо может быть выражена уравнениями:
lgx = 1/2 lgp - 0,523 - 4940/Г, A)
lgx = 3,72 - 7940/Г; B)
lgx= 1/2 lgp-1,46; C)
lgx=l/21gp-l,5, D)
где х - концентрация N, % (ат.),/? - давление, МПа, Т- температура, К.
По уравнениям A) и B) определяется растворимость N в твердом
(Мо): в интервале температур 1600-2400 °С по уравнению A) [2] и в
интервале 900-1800 °С по уравнению B) [4]. По уравнениям C) и D)
определяется растворимость N в жидком Мо: при температуре 2700 °С
Mo-N
415
и давлении < 0,046 МПа по уравнению C) [6] и при температуре 2650 °С
и давлении < 0,066 МПа по уравнению D) [7].
Кристаллическая структура соединений Мо с N приведена в табл. 186.
Таблица 186. Кристаллическая структура соединений системы Mo-N
Соединение
-mo,6n;
**
-Mo3N2
6M0N
6'MoN
6"MoN
Mo082N
Символ
Пирсона,
пргр
/4 ~lamd
—
РтЪт
АЛ6,
РЬ^ттс
РЪпп
РЪт\
АЛ6,
РЬ^ттс
Параметры
а
0,4200
0,4136
0,4157
0,4165
0,5725
0,572
0,5665
0,286
зешетки, нм
с
0,8010
-
-
0,5608
0,560
0,552
1,120
Примечание
При27,5%(ат.)К[8, 9]
При 38 % (ат.) N, закалка
от 400 °С [8]
При 43 % (ат.) N, закалка
от 700 °С [8]
И
[9]
[10]
[10]
[10]
Низкотемпературная упорядоченная модификация yMo2N.
Кубическая сингония.
Литература
1 Ettmayer P.//Monatsh. Chem. 1970 Bd 101. S. 127-140.
2. Fromm E., JehnH.//Z. Metallkunde. 1971. Bd. 62. S. 372-377.
3. Jehn H., Ettmayer P. // J. Less-Common Met. 1978. P. 85-98.
4 Фромм Е., Гебхардт Е. Газы и углерод в металлах. М: Металлургия, 1980 516 с.
5. Brewer L., Lamoreaux R.H. // Atomic Energy Review, Special Issue N 7. Molybdenum.
Physico-chemical properties of its compounds and alloys. Vienna- International Atomic Energy
Agency 1980 P 195-356.
6 Козина Л.Н., Ревякин А.В., Самарин A.M. //Доклады АН СССР. 1969. Т. 184. N 2.
С 397-399
7 Dohmke H., Frohberg M.G. // Z Metallkunde 1974 Bd. 65 S. 615-617
416 Mo-N. Ma-Na. Mo-Nb
8. Evans D.A., Jack K.H. // Acta Crystallogr. 1957. V. 10. P. 833-834.
9. Schonberg N. // Acta Chem. Scand. 1954. V. 8. N 12. P. 204-207.
10. Троицкая Н.В., Пиискер З.Г. // Кристаллография. 1963. N 8. С. 548-555.
К.Б. Поварова
Mo-Na. МОЛИБДЕН-НАТРИЙ
Диаграмма состояния не построена. В работе П] указывается, что
растворимость Мо в жидком Na меньше, чем 6-10 % (ат.) в интервале
температур 700-1000 "С.
Литература
1. Brewer L., Lamoreaux R.H. // Atomic Energy Review Special Issue. N 7. Molibdenum.
Physico-chemical properties of its compounds and alloys. Vienna: International Atomic Energy
Agency, 1980. P. 195-356.
К.Б. Поварова
Mo-Nb. МОЛИБДЕН-НИОБИЙ
Диаграмма состояния Mo-Nb исследована многими авторами [X, Э,
Ш] на сплавах, выплавленных из Мо и Nb высокой чистоты. В системе
существует неограниченная растворимость компонентов друг в друге в
жидком и твердом состоянии. По данным работы [1] на кривых
солидус-ликвидус имеется минимум, который соответствует тем-
температуре 2345-2350 °С и концентрации 19,5-29,3 % (ат.) Мо. По данным
работы [2] минимум наблюдается при температуре - 2350 °С и концентра-
концентрации -30 % (ат.) Мо, по данным работы [3] - при -2290 "С и -34,3 % (ат.)
Мо. Однако согласно результатам работы [4], полученным при
тщательно проведенном дифференциальном термическом анализе на
установке с оптическими датчиками температуры, температура
плавления плавно понижается от Мо к Nb. Диаграмма состояния,
согласно работе [4], приведена на рис. 205. В обзоре [5] этот вариант
рассматривается как наиболее достоверный и подтвержденный
термодинамическими расчетами. В обзорной работе [6] отмечено хорошее
соответствие рассчитанной и экспериментально полученной кривых
ликвидуса. Непрерывный ряд твердых растворов, образованный Мо и
Nb, характеризуется ОЦК кристаллической структурой.
Mo-Nb. Mo-Nd
417
i'C
2600
2500
Nb, °/o (по массе)
20 40 60 60
WO
2400
1
262
3°
i—,
**>
1
10, Nt
¦—,
1
2t69°
о to го jo #o so 60 70 во яо too
Mo Nb, Vofam.) Nb
Рис. 205. Mo-Nb
Параметры кристаллической решетки ОЦК твердого раствора
имеют незначительное отрицательное отклонение от аддитивности [7].
Литература
1 Корнилов И.И., ПоляковаР.С.//Тр. Ин-та металлургии им. А.А. Байкова АН СССР.
1957 Вып. 2. С. 149-153.
2 Кример Б.И. / Изв. высших учебных заведений. Черная металлургия. 1968. № 5.
С 143-145.
3. Барон В.В., Иванова К.Н., Савицкий Е.М. // Изв. АН СССР. Металлургия и топливо.
1960. №4. С. 143-149.
4. Кочержииский Ю.А., Василенко В.И. // Изв. АН СССР. Металлы. 1985. № 2.
С 188-189.
5 Brewer L., Lamoreaux R.H. // Atomic Energy Review. Special Issue N 7. Molybdenum:
Physico-chemical properties of its compounds and alloys. Vienna: International Atomic Energy
Agency. 1980. P. 195-356.
6. OkamotoH.//J. Phase Equilibria. 1991. N5. P 616-617. v
7 Goldschmidt H.J., Brand J.A. // J. Less-Common Met. 1961. V. 3. N 1. P. 44-61.
К.Б. Поварова
Mo-Nd. МОЛИБДЕН-НЕОДИМ
Диаграмма состояния не построена. По данным работы [1] раствори-
растворимость Nd в Мо более 0,046 % (ат.) и менее 0,067 % (ат.). Термодинамичес-
Термодинамический расчет показал [2], что в системе возможно существование монотек-
тического превращения Ж|»Ж2+(Мо) при температуре 2547±10 °С.
Содержание Nd в фазах Ж,, Ж2 и (Мо) равно 4±1 % (ат.), 0,3 % (ат.) и
418
Mo-Nd, Mo-Ni
75±8 % (ат.) соответственно. Расчетным путем показано, что возможно
образование вырожденной эвтектики при температуре 1012 °С и
концентрации 0,24±0,2 % (ат.) Мо.
Литература
1. Савицкий Е.М., Барои В.В., Тао Цзуцуи // Изв. АН СССР. ОТН Металлургия и
топливо. 1962. №1 С. 156-159.
2. Brewer L., Lamoreaux R.H.//Atomic Energy Review. Special issue N 7. Molybdenum:
Physico-chemical properties of its compounds and alloys. Vienna: International Atomic Energy
Agency. 1980. P. 195-356.
КБ. Поварова
Mo-Ni. МОЛИБДЕН-НИКЕЛЬ
Диаграмма состояния Mo-Ni исследовалась неоднократно [X, Э, Ш,
1-3]. Исследования проводили методами дифференциального термичес-
термического, микроструктурного и рентгеновского анализов. Варианты
,0
NC, % (по массе)
2О 30 W fO 60 7О 80 90 ЮО
2WO
2000
1600
1ZOO
воо
О W 2O 30 *fO 50 ffP 70 30 9О tOO
Mo Ni.,0/o fam.) Ni
Рис. 206. Mo-Ni
Mo-Ni
419
диаграмм состояния, предлагаемые различными авторами, хорошо
согласуются между собой. Диаграмма состояния (рис. 206) приведена по
данным наиболее достоверного исследования [1], результаты которого
были подтверждены другими экспериментальными работами [2-5] и
термодинамическими расчетами [8].
В системе образуются три стабильные промежуточные фазы MoNiF),
Мо№3(у), MoNi4(p) и твердые растворы на основе Мо и Ni.
MoNiF) образуется по перитектической реакции при температуре
1362±4 °С [1] или 1363±4 °С [6]; интервал гомогенности 47,5-52,3 % (ат.)
Ni [1,3,6]. MoNi3(v) образуется по перитектоидной реакции при 910±5 "С
из б и (Ni), интервал гомогенности 75-76 % (ат.) Ni [1, 3, 6]. MoNi4(p)
образуется по перитектоидной реакции при 875 °С [1] или 870±5 °С [6]
из у и (Ni), интервал гомогенности 80,0-81,1 % (ат.) Ni. Между б и (Ni)
образуется эвтектика при температуре 1318±4 °С и концентрации
65±0,5%(ат.)№[1,6].
Максимальная растворимость Мо в (Ni) равна 28,4 % (ат.) при
температуре эвтектики [1, 7]. В работе [6] приведены уравнения, по
которым можно рассчитать растворимость Мо в Ni при различных
температурах:
х = 0,220- 10~5Г(Т'- 1100) + 2,5-10 (Т- 1100J ± 0,006 в интервале
температур 910-1318 °С);
х - 0,303- 4,2-10 {Г- 1100) + 3,9-10~5 (Г- 1100J ± 0,007 в интервале
температур 870-910 °С;
In х = -19,70 + 8080/7" + 9,58-10~3Г + З-Ю1^ ± 0,04 в интервале
температур 527-870 "С,
где х - атомная доля Мо, Т- температура, К.
Кристаллическая структура соединений системы Mo-Ni описана в
табл. 187.
Таблица 18 7. Кристаллическая структура соединений системы Mo-Ni
Соединение
MoNiF)
MoNi3(y)
MoNi4(P)
Прототип
MoNi
pCu3Ti
MoNi4
Символ
Пирсона,
пр.гр.
ОР56,
'2,2,2,
оР%,
Pmmn
г/io,
/4/m
Параметры решетки, нм
а
0,9108
0,5064
0,5727
b
0,9108
0,4224
-
с
0,8852
0,4448
0,3566
Примечание
При 50,8 %
(ат.) Ni [7]
При 74-75 %
(ат.)№[1,8]
При 80 %
(ат.)№[1,2]
420 Mo-Ni. Mo-Np, Mo-0
В работе [6] отмечается, что в результате достаточно сложных реакций
упорядочения при охлаждении твердых растворов на основе Ni
образуются метастабильные фазы MoNi2 (символ Пирсона о/6), MoNi3
(символ Пирсона г/8) и Mo5NiI7.
Литература
1. Casselton R.E., Hume-Rothery W. // J. Less-Common Met. 1964. V. 7. P. 212-221
2. Guthrie R.V., Stansbury E.E. // U.S. At. Energy Comm. ORNL-3078. 1961. 57 p
3. Heijwegen СР., Rieck G.D. // Z. Metallkunde. 1973. Bd. 64. N. 6. S. 450-453.
4. Rudel E.//Mater. Res. Bull. 1975. V. 10. P. 267-272.
5. Van Tendeloo G. // Mater. Sci. Eng. 1976. V. 26. P. 209-220.
6. Brewer L., Lamoreaux R.H. // Atomic Energy Review, Special Issue N 7. Molybdenum:
Physico-chemical properties of its compounds and alloys. Vienna: International Atomic Energy.
1980. P. 195-356.
7. Shomakfr СВ., Shomaker D.P. // Ada Crystallogr. 1963. V. 16. N 10. P. 997-1009.
8. SaitoS., Beck P.A.//Trans. АШЕ. 1959. V. 215. N6. P. 938-941.
9. Koster W., Schmidt W. // Arch. Eisenhuttenwes. 1934/35. Bd. 8. S. 23-27.
К.Б. Поварова
M»-Np. МОЛИБДЕН-НЕПТУНИЙ
Диаграмма состояния Mo—Np не построена. Термодинамические
расчеты показали [1], что диаграмма состояния системы должна иметь
эвтектический вид. Эвтектика образуется при температуре 497±80 °С и
концентрации 9±2 % (ат.) Мо. Возможно снижение температур
полиморфных превращений Np при легировании Мо. Растворимость Np
в Мо не должна превышать -10 % (ат.) при 507 "С. Растворимость Мо
в Np контролируется примесями. Возможно образование фазы MoNp2
при температурах ниже 223 °С.
Литература
1. Brewer L., Lamoreaux R.H. // Atomic Energy Review, Special Issue N 7, Molybdenum:
Physico-chemical properties of its compounds and alloys. Vienna: International Atomic Energy
Agency.
К Б. Поварова
M»-O. МОЛИБДЕН-КИСЛОРОД
Взаимодействие Мо с О исследовалось многими авторами [Э, 1-9].
Обобщенная диаграмма состояния (рис. 207) построена в работе [2] на
основании экспериментальных данных [1, 2] и термодинамических
Мо-О
421
О,"/, (по массе)
ю го зо WS0 60 воюй
2000
1500
/000
500
ж
2150*100*
800
75П
И
818t7'
\\
1
ж* газ
782tl'
-77515'
*-MoOj
—MoB0te
70
•*-(М0)
75
О, V. (am.)
ВО
sietrl
Mo 02-*
О Ю 20 JO 40 SO 60 70 80 SO 100
Mo O,'/m(am) 0
Рис. 207. Mo-0
расчетов, проведенных в работе [4]. На вставке (рис. 207) показаны
превращения в области концентраций 72-75 % (ат.) О.
Стабильны два оксида: МоО3, который плавится при 782±7 °С, или
800±5 °С [2,3], МоО2, который плавится при 2227± 100 °С [2,5]. Интервал
гомогенности соединения МоО2 составляет 66,6-67,0 % (ат.) О [6]. При
концентрациях 63,7-65,8 % (ат.) О обнаружена серия соединений,
имеющих узкие интервалы гомогенности, составы которых могут быть
описаны формулой Мо„Оз_т, где и = 4,5 и 8-14 для т- 1 и л = 18-22 для
т = 2 [4]. Соединения различных серий иногда имеют одинаковые
значения отношения О/Мо и являются полиморфными модификациями.
Большинство фаз не стабильны в отдельности, но стабильны в
равновесии с МоО2 и МоО3 и могут рассматриваться как метастабильные
фазы; они также могут быть стабилизированы присадками оксидов
других переходных металлов. Даже более стабильные из них превраща-
превращаются в МоО2 и расплав Мо4О {{ при температуре 818±7 "С, а Мо9О26 при
780±5 °С [1]. Фаза Мо4Оц имеет полиморфное превращение при
602±50 °С. Фаза Мо8О23 обнаружена авторами работ [6, 7] при
температурах ниже 775-780 °С. По данным работы [7] Мо8О23 превраща-
превращается в Mo4O]j и МоО3 при температуре 780 °С. Предполагается, что
422
Мо-О
MOgO23 стабилен по отношению к Мо4О[, и расплаву при температуре
только несколько выше температуры превращения Мо9О26. В работе [1]
сообщается наличие фаз Мо9О26 и Мо18О52 при температуре 765. °С.
Однако в работе [9] приводятся другие сведения, указывающие на
образование Мо9О26 при температуре 750 °С и даже ниже 700 °С.
Соединение Mo)gO52 переходит в Мо9О26 при температуре 780 °С после
выдержки в течение 2 ч, но обратного превращения не происходит даже
после выдержки в течение трех дней при 700 °С или недели при 648 "С.
Это подтверждает, что Мо18О52 является метастабильной фазой, не
принадлежащей равновесной фазовой диаграмме. Другие фазы были
получены при низких температурах, при которых трудно достигается
равновесное состояние, в связи с чем такие фазы, как Мо3О, приготовлен-
приготовленная восстановлением МоО3 в водороде, и Мо2О5, приготовленная
дегидрированием МоО(ОНK [7], не включены в равновесную диаграмму
состояния.
Между МоО3 и Мо9О26 существует эвтектика при температуре
775±5 °С и концентрации 74,6±0,1 % (ат.) О [1]. По данным работы [8]
предполагается существование эвтектики между (Мо) и МоО2 при
2150± 100 °С, а в работе [1] сообщается о несмешиваемости их в жидком
состоянии.
Растворимость О в твердом (Мо) при температурах 1200-1400 "С
описывается уравнением:
In х = 1,67 - 4870/Г,
где х - концентрация 0, % (ат.), Т- температура, К [3].
Кристаллическая структура соединений указана в табл. 188.
Таблица 18 8. Кристаллическаи структура соединений системы Мо-0
Соединение
МоО2
Мо4Ои
Прототип
-
тю2
Символ
Пирсона,
пр.гр.
/я/>12,
1РЬ,
Ptymnm
mPbO,
Plxla
Параметры решетки, нм
а
0,5610
0,5584
0,487
2,454
Ь
0,4843
0,4842
—
0,5439
с
0,5526
0,5608
0,279
0,6701
Примечание
Р=119,62°
[Э]
Р=120,94°
[П]
[П]
При температу-
температуре ниже 615 °С,
Р = 94,28° [Э]
Мо-О
423
Соединение
Мо4Оц
Мо,7О47
(метаста-
бильное)
мо5о,;
(метаста-
бильное)
Мо8О23
Мо,О26*
Мо,8О52
(метаста-
бильное)
МоО3
Прототип
-
-
-
Символ
Пирсона,
пр.гр.
оРбО,
Рпта
оРП%,
Pbal
Р4/птп
/яР60,
Р21а
тПО,
Р21а
аРЫО,
Р\
oPld,
РЬпт
* Тетрагональная сингония.
Параметры решетки, нм
а
2,449
2,161
4,599
1,688
1,675
0,8145
0,39628
Ь
0,5457
1,963
0,4052
0,403
1,189
1,3855
с
0,6752'
0,3951
0,3937
1,339
1,445
2,123
0,36964
Примечание
При температу-
температуре
615— 800 °С
[Э]
[Э]
[5]
Р=106,19°
[П]
Р=96°[П]
а=102,67°;
Р=67,82°;
Y=109,97°
[П]
[1,5,9]
Литература
1. Perry Т., Spacil H.S., Wulff J. // Welding J. 1954. V. 33. P. 442-445.
2. Phillips В., Chang L.L.Y. // Trans. АШЕ. 1965. V. 233. N 7. P. 1433-1436.
3. Фромм Е., Гебхардт Е. Газы и углерод в металлах: Пер. с нем. / Под ред. Б.В. Линчев-
ского. М.: Металлургия, 1980. 712 с.
4. Bousqeut J., Guillon A. // Bull. Soc. Chim. France. 1966. P. 2250-2253.
5. Zador S., Alcock C.B. // J. Chem Thermodyn. 1970. V. 2. P. 9-16.
6. Srivastava S.C., Seigle L.L. // Metall. Trans. 1974. V. 5. N 1. P. 49-52.
7. Ekstrom Т., Tilley R.J.D. // J. Solid State Chem. 1976. V. 19. P. 125-133.
8. Халдояшши К.А., Граикина З.А, // Изв. Сибирск. отд. АН СССР. Серия химических
наук. 1976. № 1. С. 47-50.
9. Brewer L., Lamoreaux R.H. // Atomic Energy Review. Special Issue N 7. Molybdenum:
Physico-chemical properties of its compounds and alloys. Vienna: International Atomic Energy
Agency. 1980. P. 195-356.
К.Б. Поварена
424
Mo-Os
Mo-Os. МОЛИБДЕН-ОСМИЙ
Представленная на рис. 208 диаграмма состояния Mo-Os построена
в работе [1] по данным микроструктурного и рентгеновского анализа,
измерения температур плавления сплавов, выплавленных в дуговой печи
из Мо и Os чистотой 99,96 % (по массе) и 99,99 % (по массе) соответствен-
соответственно. Положения фазовых границ подтверждены в работе [2].
В системе образуются две промежуточные фазы: а, которой может
быть приписана формула Mo2Os, и Mo3Os(p), а также твердые растворы
на основе Мо и Os. Между (Мо) с 19,5 % (ат.) Os и а с 29,6 % (ат.) Os
образуется эвтектика при температуре 2380± 10 "С и концентрации 20,5 %
(ат.) Os. Mo2Os(a) образуется по перитектической реакции из расплава
с -22 % (ат.) Os и Os с 48 % (ат.) Мо при 2430110 °С и 37 % (ат.) Os.
Интервал гомогенности фазы a 29,6-39±1 % (ат.) Os при 1200 "С.
Mo3Os(P) образуется по перитектоидной реакции из (Мо) и а при
температуре 2210110 "С, интервал гомогенности 24-25 % (ат.) Os.
Растворимость Os в (Мо) в интервале температур 1027-2210 °С [4]
может быть описана уравнением:
Os, % /по массе)
О W 2030 40 SO 60 70 60 ЭО
3033'
О /О ZO 30 40 SO 60 70 во ЭО /GO
Мо OS,°/ofam.) Os
Рис. 208. Mo-Os
Ma-Os, Mo-P
425
lnx = -2,33 + 0,16In T - 2030/Г,
где x - атомная доля Os, T- температура, К.
Растворимость Мо в (Os) в интервале температур 727-2430 °С [3]
описывается уравнением:
lnx = -2,17 + 0,2In T - 300/Г,
где х - атомная доля Мо.
Кристаллическая структура соединений системы Mo-Os приведена
в табл. 189.
Таблица 189 Кристаллическая структура соединений системы Мо—Os
Соединение
. Mo3Os(P)
: Mo2Os(o)
Прототип
W3O
oCrFe
Символ
Пирсона,
пр.гр.
сРЬ,
РтЪп
г/>30,
Р42/птт
Параметры решет-
решетки
а
0,49712
0,4963
0,9632
0,9624
0,9615
0,9613
, нм
с
-
0,4950
0,4944
0,4941
0,4935
Примечание
При 24,5 %(aT.)Os.
Отжиг при 1400 °C[1J
[3]
npn30%(aT.)Os[I]
npH33,3%(aT.)Os[4]
При 35,0 % (ат.) Os [5]
При 37,5 %(aT.)Os[IJ
Литература
1. Raub E. // Z Metallkunde. 1954. Bd. 45. S. 23-30.
2. Knapton A.G. // J. Inst. Met. 1958-1959. V. 87. N I. P. 28-32.
3 Taylor A., Doyle N.. Kagle B.J. // J. Less-Common Met. 1962. V. 4. N 5. P. 436-450.
4. Spooner F.J., Wilson C.G. // Acta Crystallogr. 1964. V. 17. P. 1533-1538.
5. Erley W., Wagner H. // Phys. Status Solidi A. 1973. V. 19. N I. P. K23-K26.
6. Brewer L., Lamoreaux R.H. // Atomic Energy Review, Special Issue N 7. Molybdenum:
Physico-chemical properties of its compounds and alloys. Vienna. International Atomic Energy
Agency. 1980. P 195-356.
К.Б. Петрова
Mo-P. МОЛИБДЕН-ФОСФОР
Данные о взаимодействии Мо с Р приведены в справочниках {X, Э,
Ш].
Установлено образование пяти фосфидов: Мо3Р, Мо8Р5, Мо4Р3,
МоР,МоР2. На основании экспериментальных данных о давлении
426
Мо-Р
гооо
fSOO
tooo
5OO
9
\
\
(Mot
\
\
\
\ \_
lid'
I
1
to
!>
4 ^
\
~(f\
1
P, */a /no пассе)
го jo so
'A
t
tfffO 3AS
±i
71
(
7O±f6
p
r
7>
43
w
1750*6°
17OO
M
I
0P+
t
I
газ
*±tO"
7O а
I
о ю го зо to so 60 70 во so too
Mo P, °/фт./ Р
Рис. 209. Мо-Р
диссоциации МоР2 [I] рассчитано, что МоР2 должен диссоциировать на
МоР и пары фосфора Р2 при температуре 989±Ю °С. Об образовании
эвтектики между (Мо) и МоР при температуре 1650 °С и концентрации
29,7 % (ат.) Р сообщается в работе [2]; температура плавления МоР в^ше
1700 °С [2]. Экстраполяция данных о давлении диссоциации [3] указывает,
что МоР разлагается на Мо4Р3 и газообразный фосфор Р2 при давлении
0,1 МПа и температуре 1750 °С; предсказывается также, что Мо4Р3
разлагается перитектически на расплав и МоР при температуре 170Q °С
и расчетном давлении 0,05 МПа. В работе [4] сообщается, что соединение
MogP5 стабильно в интервале температур 1580^-1680 "С. Совместно с
g5
соединением Мо3Р существует гексагональная фаза Moj 7P при
температурах выше 1720 °С. В интервале температур 1670-1720 °С вместе
с Мо3Р существует другая фаза неизвестного состава. Эти данные, а
также данные работы [5] показывают, что Мо3Р может быть приготовлен
из расплава, и таким образом эвтектика между (Мо) » МоР [2] является
в действительности эвтектикой между Мо3Р и MogP5 или, возможно,
МО[ 7Р или другой близко расположенной фазой. Согласно работе [3]
соединение Мо4Р3 превращается в Мо3Р и МоР при температурах ниже
700 "С. При температурах 700-1300 *С Мо4Р3 яйляется единственной
стабильной фазой, расположенной между соединениями Мо3Р и МоР.
Мо-Р
427
В работе [6] на основании известных экспериментальных данных
предложен вариант диаграммы состояния Мо-Р, показанный на рис. 209
при давлении 0,1 МПа с рассчитанными границами фазовых областей.
На диаграмме состояния показано, что фаза MogPj, формирующаяся при
температуре 1680 °С [4], находится в равновесии с фазами Мо4Р3, Мо3Р.
При этом давление паров Р2 составляет 4-10 МПа (рассчитано
экстраполяцией давления диссоциации Мо4Р3 [3]). Согласно приведенной
диаграмме состояния эвтектика образуется между Мо3Р и Мо8Р5 (при
расчетном давлении паров Р2 ~10~3 МПа). Указано, что имеются
сомнения в точности формулы Мо8Р5 для соединения расположенного
между Мо3Р и Мо4Р3.
Согласно работе [7] растворимость Р в (Мо) достигает 14-16 % (ат.),
а между (Мо) и МоР существует эвтектика при температуре 1063 °С и
концентрации 29,7 % (ат.) Р. МоР плавится конгруэнтно при температуре
1550 "С. Эти данные противоречат вышеприведенным данным других
исследователей. Растворимость Р в (Мо), по-видимому, должна быть
существенно ниже из-за большой разницы атомных радиусов и
электроотрицательностей компонентов.
Структура фосфидов Мо приведена в табл. 190.
Таблица 190 Кристаллическая структура соединений системы Мо-Р
Соединение
Мо3Р
мо,р;
Мо4Р3
МоР
МоР2
*Р= 109, i
Прототип
aV3C
-
Rh4P3
we
ZrSi2
9°
Символ
Пирсона,
пргр
/42m
тРП,
Рт
оР56,
Рпта
ИР2,
Рбпп
оСП,
Стс2,
Параметры решетки, нм
а
0,9794
0,9399
1,2428
0,3223
0,3145
Ь
-
0,3209
0,3158
-
1,1184
с
0,4827
0,6537
2,0440
0,3191
0,4984
Источник
[5,8]
[4]
[8]
[8,9]
[8]
428
Mo-P. Mo-Pa
Литература
1. Faller F.E., Biltz W., Meisel K., Zumbusch M. // Z. Anorg. All. Chem. 1941. Bd. 248.
S. 214-228.
2. Vogel R., Horstmann D. // Arch. Eisenhiittenwes. 1953. Bd. 24. N 7/8. S. 369-374.
3. Gingerich K.A. /IS. Phys. Chem. 1964. V. 68. N 9. P. 2514-2522.
4. JohnssonT. //Acta Chem. Scand. 1972. V. 26. P. 365-382.
5. Sellberg В., Rundquist S. // Acta Chem. Scand. 1965. V. 19. P. 393-400; P. 700-762.
6. Brewer L., Lamoreaux R.H. // Atomic Energy Review, Special Issue N 7. Molybdenum:
Physico-chemical properties of its compounds and alloys. Vienna: International Atomic Energy
Agency, 1980. P. 195-356.
7. Самсонов Г.В., Верейкии Л Л. Фосфиды. Киев: Изд-во АН УССР, 1961, 126 с.
8. Rundquist S., Lundstrom Т. // Acta Chem. Scand. 1963. V. 17. P. 37-46.
9. Schonberg N. // Acta Chem. Scand. 1954. V. 8. P. 226-239.
К.Б. Поварова
Mo-Pa. МОЛИБДЕН-ПРОТАКТИНИЙ
Диаграмма состояния экспериментально не построена. В работе [1]
расчетным путем на основании данных о термодинамических свойствах
компонентов построена диаграмма состояния Mo-Ра эвтектического
типа (риС. 210). Эвтектика кристаллизуется при температуре 1467±50 "С
и концентрации 78±2 % (ат.) Ра. Возможно образование метастабильной
Ра, "/а (по массе)
О ГО гО JO 40 SO 60 70 SO SO
too
- ff70"
900
soo
о to го зо w so 60 70 во so roo
Mo Pa,eA>fam.) Pa
Рис.210. Mo-Pa
Mo-Pa, Мо-РЬ, Mo-Pd 429
фазы МоРа2 при температуре ниже 377 "С. Растворимость Ра в (Мо)
менее 10~2% (ат.) при температуре 467±50 "С.
Литература
!. Brewer L., Lamoreaux R.H. // Atomic Energy Review, Special Issue N 7. Molybdenum:
Physico-chemical properties of its compounds and alloys. Vienna: International Atomic Energy
Agency. 1980. P. 195-356.
К.Б. Поварова
Mo-Pb. МОЛИБДЕН-СВИНЕЦ
Диаграмма состояния не построена. Растворимость Мо в жидком РЬ
при температуре 1206 °С не превышает 0,011 % (ат.) [1]. Максимальная
растворимость Мо в РЬ при 1010 °С составляет 10 % (ат.) Мо [Ш].
Расчетным путем показано, что при температуре кипения РЬ, равной
1750 °С, растворимость Мо в расплаве -10~2 % (ат.); растворимость в
твердом состоянии столь мала, что не зависит от термодинамических
параметров системы и определяется концентрацией закаленных де-
дефектов [2].
Литература
1 Alden Т., Stevenson D.A., WulffJ.// Trans. AIME. 1958. V. 212. P. 15-17.
2 Brewer L., Lamoreaux R.H. // Atomic Energy Review, Special Issue N 7. Molybdenum:
Physico-chemical properties of its compounds and alloys. Vienna: International Atomic Energy
Agency. 1980. P. 195-356.
К.Б. Поварова
Mo-Pd. МОЛИБДЕН-ПАЛЛАДИЙ
Диаграмма состояния Mo-Pd построена в работах [1-8] по данным
микроструктурного, рентгеновского и других методов анализа.
Существуют некоторые разногласия относительно строения этой
диаграммы состояния.
В системе существуют два соединения (фаза е) -MoPd и MoPd2, a
также ограниченные твердые растворы на основе Мо и Pd. В наиболее
ранних работах [4, 5] промежуточных фаз в системе не было найдено.
Промежуточная фаза е стабильна только при высоких температурах.
430
Mo-Pd
Pd,
иа„0 tO 20 3O W
h L
3OO0
2623°
2OOO
WOO
i
1
1
~Г7;
1
S't
>
1370*J0°
10OO±WO"
Mo
Рис. 211. Mo-Pd
0 3
в/а/по массе)
SO 60 70 вй
'I '
t
1
•*s&№30?f760±
> 9O fOO
""i
47'-
1—
~~S2\\~fOOO±f0Oa
I
Ifal
1555
0 SO 60 7O 80 90 WO
Pd,"/o(am.) Pd
Фаза е имеет узкий интервал гомогенности вблизи 53,5 % (ат.) Pd [1] или
52 % (ат.) Pd [2]. Она образуется по перитектической реакции Ж+(Мо)»е
при температуре 1700 "С [1] или 1755110 "С [2], распадается по
эвтектоидной реакции при 1425±25 °С [1] или 1370±30 "С [2] на (Мо) и
(Pd).
В работе [4] по результатам измерения параметров решетки установле-
установлена небольшая растворимость Pd в (Мо) и значительная растворимость
Мо в (Pd), которая составляет при 1200 °С 47,5 % (ат.). Согласно работе
[51 имеется значительная растворимость Pd в (Мо), составляющая -25 %
(ат.). Растворимость Pd в (Мо) составляет 16 % (ат.) при температуре
1700 °С и 11 % (ат.) при 1400 °С [1]. По данным работы [2] растворимость
Pd в (Мо) более низкая: при перитектической температуре в (Мо)
растворяется 6,5 % (ат.) Pd. На основании термодинамических расчетов
в работе [6] предложены уравнения, описывающие растворимость Pd в
(Мо):
х = 0,037 - 6,7 10(Г- 1600) + 3,3-10~7(Г- 1600J в интервале
температур 1370±30- 1755±10 °С;
х = 0,030 - 810(Г- 1200) в интервале температур 1000±100 -
1370130 °С,
где х - атомная доля Pd, T- температура, К.
По данным работы [1], твердый раствор на основе Pd образуется по
перитектической реакции из расплава и фазы е при температуре
1700110 "С. Растворимость Мо в (Pd) при 1700 "С составляет -32 % (ат.)
[1] или 39 % (ат.) [2]. Согласно работе [2] между фазой е и (Pd) образуется
эвтектика при температуре, близкой к температуре перитектики
Mo-Pd
431
A755 °C), линии ликвидуса и солидуса для (Pd) имеют максимум при
температуре, несколько выше температуры перитектики.
По данным работы [3], в сплаве при 33 % (ат.) Мо образуется
сверхструктура. Температура упорядочения в ГЦК решетке на базе (Pd)
составляет -10001100 "С. В более поздней работе [7] сделан вывод, что
растворимость Мо в (Pd) достигает 46 % (ат.) при 1600 "С.
В работе [6] диаграмма состояния Mo-Pd построена с учетом
результатов предыдущих работ. Представленная на рис. 211 диаграмма
состояния приведена по данным работы [6] с учетом линий ликвидуса
и солидуса со стороны Pd по данным работы [2]. Согласно представлен-
представленной диаграмме, максимальная растворимость Pd в (Мо) составляет 7±2 %
(ат.), что согласуется с данными работы [2, 8]. Эвтектика между е с
содержанием 52±2 % (ат.) Pd и (Pd) с 43±2 % (ат.) Мо плавится при
температуре 1700±30 "Си концентрации 54±2 % (ат.) Pd. Максимальную
температуру плавления 1760±10 "С имеет сплав с 39 % (ат.) Мо.
Кристаллическая структура соединений системы Mo-Pd представле-
представлена в табл. 191.
Таблица 191. Кристаллическая структура соединений системы Mo-Pd
Соединение
MoPd(e)
MoPd2
Прототип
Mg
MoPt2
Символ
Пирсона
пргр.
АР2,
Рб^/ттс
о/б,
Immm
Параметры решетки, нм
а
0,2767-
0,2777
0,275
Ь
-
0,825
с
0,4485-
0,4490
0,389
Источник
[1,2]
[3]
Литература
1 Савицкий Е.М., Тылкииа М.А., Хамидов О.Х. // Журнал неорганической химии. 1964
Т 9 № 12 С 2738-2742
2. Anderson Е. // J Less-Common Met 1964. V. 6. N I. P. 81-84.
3. Maldouado A., Schubert К.//Z. Metallkunde. 1964. Bd. 55. N 10. S 619-626
4 RaubE.//Z. Metallkunde. 1954. Bd. 45 S. 23-30.
5 Greenfield P., Beck P.A. //Trans. AIME. 1956. V. 206. P. 265-276.
6. Brewer L., Lamoreaux R.H. // Atomic Energy Review, Special Issue N 7. Molybdenum:
Physico-chemical properties of its compounds and alloys. Vienna: International Atomic Energy
Agency 1980 P 195-356
7 Zaiss W., Steeb S., Krabichler T. // Z. Metallkunde. 1972. Bd. 63. N 4. S 180-184.
8 Haworth C.W., Hume-Rothery W. // J Inst Met. 1959 V. 87. N 8. P 265-269
К Б. Поварова
432 Мо-Рт, Мо-Ро. Ми-Рг
Мо-Рт. МОЛИБДЕН-ПРОМЕТИЙ
Согласно работе [М], рассчитанная схематически диаграмма сос-
состояния системы Мо-Рт характеризуется несмешиваемостью в жидком
состоянии.
Л Л Рохлин
Мо-Ро. МОЛИБДЕН-ПОЛОНИЙ
Мо не взаимодействует с парами Ро при температурах до 700 °С
Р,1].
Литература
I Wi«emanW.,GiorgiA.L.,WiekD.T.//J Phys Chem I960 V 64 N 4 Р 434-440
КБ Поварова
Мо-Рг. МОЛИБДЕН-ПРАЗЕОДИМ
В работах [1, Ш] сообщается, что растворимость Рг в Мо больше
0,02 % (ат.) и меньше 0,047 % (ат.) (температура не сообщается). Расчет
диаграммы состояния на основе термодинамических свойств исходных
компонентов [2] позволяет предположить, что в системе будет образовы-
образовываться монотектика при 2547110 "С; состав фаз, находящихся в
равновесии: (Мо) с 0,3 % (ат.) Рг и расплавы с 5±1 и 72±8 % (ат.) Рг.
Возможно образование эвтектики при температуре 931 "Си концентра-
концентрации 0,1 ±0,01 %(ат.)Мо.
Литература
1 Савицкий Е.М., Барон В.В., Тао Цзуцуи // Изв АН СССР Отделение технических
наук Металлургия и топливо 1962 № I. С 156-159
2 Brewer L., Lamoreaux R.H. // Atomic Energy Review, Special Issue N 7 Molybdenum
Physico-chemical properties of its compounds and alloys Vienna International Atomic Energy
Agency 1980 P 195-356
КБ Поварова
Mo-Pt
433
Mo-Pt. МОЛИБДЕН-ПЛАТИНА
Диаграмма состояния Mo-Pt неоднократно исследовалась [X, Э, Ш,
1-3]. Проводился микроструктурный, рентгеновский, дифференциальный
термический анализ, измерение температуры плавления сплавов.
В системе существуют пять промежуточных фаз: P(Mo6Pt), e(Mo3Pt),
e'(Mo3Pt), 5(MoPt), ^(MoPtj), а также ограниченные твердые растворы
на основе Мо и Pt.
Представленная на рис. 212 диаграмма состояния Mo-Pt построена
в работе [3] по данным работ [1,2] и других, а также термодинамических
расчетов.
Фаза р образуется по перитектоидной реакции при 1780120 °С и
18,5±0,5 % (ат) Pt из (Мо) с 12±1 % (ат.) Pt и фазы е' с 31 % (ат.) Pt,
распадается по эвтектоидной реакции при 1280±10 °С на (Мо) с ~4 % (ат.)
Pt и е' с 37 % (ат.) Pt.
Pt, % (по массе)
SO SO 7O 80 90 WO
/769'
t6OO
12OO
8OO
О 10 2O SO
Mo
SO SO 7O 80 SO fOO
Pt^/a/am) Pi
Рис. 212. Mo-Pt
434
Mo-Pl
Фаза ? плавится когруэнтно при 2175±20 °С и 4712 % (ат.) Pt [2],
распадается по эвтектоидной реакции при 1475120 °С на фазы е' и т),
интервал гомогенности 31 ± 1 * 54±2 % (ат.) Pt [1,2]. Между (Мо) и фазой
е образуется эвтектика при температуре 2080120 °С и концентрации
26-28 %(aT.)Pt [1,2].
Фаза е' образуется по перитектоидной реакции при 1880+30 "С из
(Мо) и фазы е, интервал гомогенности 3111 - 4512 % (ат.) Pt. Области фаз
е и е' смещены относительно стехиометрического состава соединения
Mo3Pt, которое приписывается этим фазам.
Фазаб образуется по перитектоидной реакции е'+т)»б при 1300120 "С
и имеет область гомогенности при концентрациях 4312-5312% (ат.)
Pt.
Фаза г| имеет интервал гомогенности 5812- 72+2 % (ат.) Pt, температу-
температура разупорядочения 1800120 °С при 65 % (ат.) Pt [2].
Значения растворимости Pt в (Мо) при различных температурах
приведены ниже:
Температура, °С 2080 2000 1780 1000
Растворимость Pt, % (ат.) 15±1 12 12 2
Источник [1] [2] [1] [2]
Согласно работе [3] граница (Мо) может быть описана уравнениями для
разных температурных интервалов:
In х = -0,430-3400/Т!0,07 в интервале температур 1780-2080 °С;
In х = 1,57-7600/П0,2 в интервале температур 1280-1780 °С,
где х - атомная доля Pt, T- температура, К. Максимальная раствори-
растворимость Мо в (Pt) составляет 56+2 % (ат.) при температуре 1600 "С. При
более низких температурах растворимость не превышает 20 % (ат.) Мо.
Кристаллическая структура соединений системы Mo-Pt приведена
в табл. 192.
Таблица 19 2. Кристаллическая структура соединений системы Mo-Pt
Соедине-
Соединение
P(Mo6Pt)
e(Mo3Pt)
Прото-
Прототип
W3O
Mg
Символ
Пирсона
пр.гр.
сР8,
РтЪп
hP2,
Pk^ltnmc
Параметры решетки, нм
а
0,4988
0,2820
0,2786
ь ¦
-
с
0,4526
0,4480
Примечание
[4,7]
При 33 % (ат.) Pt
При 60 % (ат.) Pt
[5-7]
Mo-Pt, Mo-Pu
435
Соедине-
Соединение
E'(MOjPt)
6(MoPt)
МоР12(я)
Прото-
Прототип
NijSn
MgjCd
p'AuCd
MoPt2
Символ
Пирсона
пр.гр.
hPZ,
РЬт/ттс
hPi,
Р&т/ттс
oPA,
Pmma
0I6,
Immm
Параметры решетки, нм
a
0,5640
0,559
0,5572
0,5615
0,447
0,4462
0,5484
0,248
0,2758
b
0,274
0,2725
0,4903
0,8238
0,827
с
0,4562
0,451
0,4480
0,4489
0,489
0,4951
0,4480
0,3915
0,394
Примечание
При 33 % (ат.) Pt
При 40 % (ат.) Pt [5-7]
При 45 % (ат.) Pt [5-7]
[1]
При 46 % (ат.) Pt [5; 7]
При 50 % (ат.) Pt [5; 7]
[1]
[5,7]
[1]
Литература
l.OckenH., Van Vucht J.H.N.//J. Less-Common Met. 1968. V. 15.N2.P. 193-199.
2. Flukiger R., Yvon K., Susz Ch. et al. // J. Less-Common Met. 1973. V. 32. N 2. P. 207-225.
3. Brewer L., Lamoreaux R.H. // Atomic Energy Review, Special Issue N 7. Molybdenum:
Physico-chemical properties of its compounds and alloys. Vienna: International Atomic Energy
Agency, 1980. p. 195-356.
4. Raub E., Roschel E.//Naturwissenschaften. 1966. B. 53. S. 17.
5. Maldonado A., Schubert K. // Z. Metallkunde. 1964. Bd. 55. S. 619-626.
6. Nishimura H. // J. Japan. Inst. Metals. 1958. V. 22. P. 425-428.
7. Rooksby H.P., Lewis B. // J. Less-Common Met. 1964. V. 6. P. 451-460.
8. Dwight A.E., Conner R.A., Downey J.W. // Acta Crystallogr. 1965. V. 18. P. 835.
9. Kimura H. // Trans. Nat. Research. Inst. Metals. (Jap.) I960. V. 2. P. 30.
К.Б. Поварова
Mo-Pu. МОЛИБДЕН-ПДУТОНИЙ
Результаты исследований системы Mo-Pu, опубликованные в работах
[Э, 1-4], а также термодинамические данные о компонентах системы
использованы в работе [5] при построении диаграммы состояния.
Показано, что это - диаграмма простого эвтектического типа, без
промежуточных фаз. Температура эвтектики 613 ° С, что ниже температу-
температуры плавления Ри F40 °С), но выше значения 590 "С, приводимого в
работе [4]. Ранее высказывалось предположение, что такое значение
температуры эвтектики связано с влиянием примесей. Содержание Мо
436
Мо-Ри
Ри, % (по массе)
,0102030 10 50 60 7О вО 9О
100
S
i i
i
i
ж
1
1
\
\
2500
2100
17ffO
13OO
9ОО
500
О Ю 20 30 Iff 50 60 70 вО SO 100
Ma Ри,'/в(а/п.) Ри
Рис. 213. Мо-Ри
в эвтектике -1,1 % (ат.); растворимость Мо в (Ри) при эвтектической
температуре 613 "С -0,2 % (ат.) Мо [5]. Максимальная растворимость Ри
в (Мо) при температуре 2100 °С -2 % (ат.). Температурная зависимость
растворимости Ри в (Мо) в интервале температур 613-2617 "С может
быть выражена уравнением:
lnx = -7600/Г + In B890 - Т) - 7,90 - 4,35- 1<Г4 Т +
+ 5,55-10-7Г2 - 8.17-1011 Г3,
где х - атомная доля Pt, T- температура, К [5].
Представленная на рис. 213 диаграмма состояния Мо-Pu построена
в работе [5].
Литература
1. Бочвар А.А., Коиобеевский СТ., Кутамцев В.И. и др. // Мирное использование
атомной энергии. Тр. 2-й Международной конференции. Женева. 1959. С. 376-395.
2. Bowersox D.F., Leary J.A. // J. Nucl. Mater. 1968. V. 27. N 2. P. 181-186.
3. Bowersox D.F., Leary J.A.//J. Nucl. Mater. 1969. V. 33. N 3. P. 311-317.
4. Ellinger F.H., Miner W.N., O'Boyle D.R., Schonfeld F.W. // Los Alamos Scientific
Laboratory. Rep. 3870 1968. P. 63-64.
5. Brewer L., Lamoreaux R.H. // Atomic Energy Review, Special Issue N 7. Molybdenum:
Physico-chemical properties of its compounds and alloys. Vienna: International Atomic Energy
Agency. 1980. P 195-356.
КБ. Поварова
Mo-Rb. Mo-Re
437
Mo-Rb. МОЛИБДЕН-РУБИДИЙ
Диаграмма состояния Mo-Rb экспериментально не построена. В
работе [1] приводится схема диаграммы состояния Mo-Rb, полученная
путем расчета.
Литература
1. Brewer L., Lamoreaux R.H. // Atomic Energy Review, Special Issue N 7. Molybdenum:
Physico-chemical properties of its compounds and alloys. Vienna: International Atomic Energy
Agency 1980 P. 195-356
Л.Л Рохлин
Mo-Re. МОЛИБДЕН-РЕНИЙ
Диаграмма состояния Mo-Re, представленная на рис. 214, построена
по совокупности данных работ [1-4] с учетом обзора [5].
t."C
/fer %{m> массе)
О Ю 20JO «О 5О 60 70 80 85 30 95 /00
"У "
3000
25OO
2ООО
/500
1ООО
I
1
J623'
гг
/
1
Mo)
1
1
1
ж
-—1
23
[
I/I
/
i
/
1 1
V
I
'26
•**
_\
/
1
-1/
л*б0
\
j
2O00±30\
\
\
\
i
О 10 2О JO 40 50 60 70 80 9О ЮО
Mo /?e, '/a /am.) Re
Рис. 214. Mo-Re
438 Mo-Re
В системе образуются две промежуточные фазы: o(Mo2Re3) и
X(MoRe3), а также твердые растворы на основе Мо и Re. Фаза о
образуется по перитектической реакции при температуре 2570±70 "С и
концентрации -62 % (ат.) Re [1] или 2520 °С и 72 % (ат.) Re [2], или
2645 °С и -68 % (ат.) Re [3]. Интервал гомогенности фазы о составляет
52,5-67,5 % (ат.) Re [1] или 52-72 % (ат.) Re [2], или 52-70±2 % (ат.) Re
[3]. В работе [2] указывается на возможность эвтектоидного распада фазы
а на (Мо) и фазу х при температурах между 1100 и 1150 °С. Однако при
отжиге образцов при 1100 °С в течение 28 дней распад фазы о не
наблюдался [2]. Такие же результаты получены в работах [1,3]. Поэтому
на диаграмме распад обозначен штриховыми линиями как предполагае-
предполагаемый, а область фазы о при температурах ниже 1125 °С показана так, как
это было установлено в работе [1].
Эвтектика между (Мо) и фазой а образуется при температуре 2440 °С
и концентрации 50 % (ат.) Re [2] или при -2500 °С и -49,3 % (ат.) Re [3].
По данным работы [1], на кривых ликвидуса и солидуса имеется минимум
при 2450±30 °С и 28-33 % (ат.) Re, а перитектическое превращение
Ж+о»(Мо) происходит при 2500125 °С и 42 % (ат.) Re.
Растворимость Re в (Мо) при различных температурах приведена
ниже:
Температура, °С 2500125
Растворимость Re, % (ат.). . . 42
Источник [1]
Растворимость Мо в (Re) при различных температурах приведена
ниже:
Температура, "С 2645 2570 2570 2520 2100 1500 1100 1100
Растворимость Мо, % (ат.) -20,9 -17,7 12 15 8 4 3,8-5,7 2
Источник [3] [1] [4] [2] [4] [4] [1] [4]
На основании анализа литературных данных и термодинамических
свойств сплавов системы в работе [6] для расчета растворимости Re в
(Мо) предлагаются уравнения:
In х = -2,180 + 0,2ln T - 733/Г ± 0,04 в интервале температур
1125-2505 °С;
In х - -0,61 - 865/Г± 0,1 в интервале температур 827-1125 "С,
где х- атомная доля Re, T- температура, К. Граница растворимости Мо
в (Re) может быть рассчитана по уравнениям:
2645
43
[3]
2440
43
[2]
1200
-29
[2]
1100
30,5
[1]
1100
-29
[3]
Mo-Re
439
In x = -0,22 - 5000/Г± 0,2 в интервале температур 2000130 - 264515 °C
и In x = -2,0 - 1000/Г1 0,3 в интервале температуры 927-2000 "С,
где х - атомная доля Мо.
Кристаллическая структура фаз приведена в табл. 193.
Таблица 193 Кристаллическая структура соединений системы Mo-Re {2]
Соединение
Mo,Re3(o)
MoRe3(x)
Прото-
Прототип
oFeCr
aMn
Символ
Пирсона
пр.гр.
г/>30,
/>42/mnm
с/58,
/43т
Параметры решетки,
нм
а
0,9607
0,9603
0,9581
0,9570
0,9593
0,9591
0,9586
с
0,4990
0,4990
0,4983
0,4980
_
-
Примечание
При 33 % (ат.) Re
Отжиг при 1200 " С
При 55 % (ат) Re
При 65 % (ат) Re
При 70 % (ат.) Re
Отжиг при 1200 °С
При 75 % (ат.) Re
При 77 % (ат.) Re
При 79 % (ат.) Re
Метастаблильная фаза со структурой типа А15 (W3O) (символ
Пирсона сР8, пр.гр. РтЪп, а - 0,498010,0001 нм) обнаружена в
полученных напылением тонких пленках состава Мо0 7Re0 3 наряду с
фазой, имеющей ОЦК решетку (Мо) с параметром а = 0|3130i0,0005 нм
[10].
Литература
1. Савицкий Е.М.,ТылкийаМ.А.,Поварова К.Б.//Журнал неорганич. химии 1959. Т. 4.
Вып. 2. С 424-434
2. Knapton A.G. // J. Inst. Met. 1958-59 V. it P. 62-64.
3 Dickinson J.M., Richardson L.S. // Trans ASM. 1959. V. 5,1. P. 1055-1066; discussion,
P. 1067-1071
4 Савицкий Е.М., ТылкрмаМ.А.,ХамидовО.Х.//Изв АН СССР. Металлы 1969. N4.
С. 200-208
5. Brewer L., Lamoreau* R.H. // Atomic Energy Review, Special Jssue N 7 Molybdenum-
Physico-chemical properties of its cpmpounds arid alloys Vienna Interfiational Atomic Energy
Agency 1980 P. 195-356.
6 Агеев Н.В.,ШсхтмаиB.C.//Изв„АН СССР."Серия физич 1959 Т 23 N 5 С 650-651
К Б Поварова
440
Mo-Rh
Mo-Rh. МОЛИБДЕН-РОДИЙ
Диаграмма состояния Mo-Rh исследована методами микроструктур-
микроструктурного, термического, рентгеновского анализов. Представленная на
рис. 215 диаграмма состояния построена по совокупности данных работ
11-3].
В системе образуются три промежуточные фазы: MoRh(e'), MoRh2(e)
и MoRh3, а также ограниченные твердые растворы на основе Мо и Rh.
Фаза е плавится конгруэнтно при 2075±10 °С и -67 % (ат.) Rh,
интервал гомогенности около 43-82 % (ат.) Rh [1]. Эвтектика между (Мо)
с 20±1 % (ат.) Rh и е с -43 % (ат.) Rh образуется при температуре
1940± 15 °С и концентрации 40± 1 % (ат.) Rh. Температура плавления (Rh)
возрастает при легировании Мо до перитектической температуры
2000110 °С при содержании Мо в расплаве 8 % (ат.). Фаза е распадается
по эвтектоидной реакции при 1100±100 °С на (Rh) и упорядоченную фазу
MoRhj, которая имеет узкий интервал гомогенности (-1 % (ат.)) при 75 %
(ат.) Rh [3]. MoRh образуется по перитектоидной реакции при
-1050±75 "С из (Мо) и фазы е с -50 % (ат.) Rh. Переход от неупорядочен-
неупорядоченной фазы е к упорядоченной MoRhj имеет место при 1200±200 °С [3].
Растворимость Rh в (Мо) не превышает 20 % (ат.) Rh при эвтектичес-
эвтектической температуре. Для интервала температур 1050-1940 "С растворимость
Rh в (Мо) описывается уравнением [4]:
/fhf °/a/no массе}
О /о го зо to so 60 7О во до гоо
25OO
2ЮО
1~гтчИ
1963'
17OO
tsoo
О tff
МО
го jo to so во 7о
/гь, °л/ат.)
гоо
Рис. 215. Mo-Rh
Mo-Rh, Mo-Ru
441
In x = -3,64 + 1,64-1 (Г3- Т- 2600/Г,
где x - атомная доля Rh, T- температура, К. Растворимость Мо в (Rh)
не превышает 15 % (ат.) Мо при температуре перитектики [1, 2].
Кристаллическая структура соединений представлена в табл. 194.
Таблица 194. Кристаллическая структура соединений системы Mo-Rh
Соедине-
Соединение
MoRh3
MoRh(e')
Прото-
Прототип
Mg
P'AuCd
Символ
Пирсона
пр.гр.
hP2,
P63lmmc
оР4,
Pmcm
Параметры решетки, нм
а
0,27673
0,27597
0,27333
0,27199
0,2745
b
-
—
—
0,4785
с
0,44589
0,43447
0,43637
0,43502
0,4413
Примечание
При 38,3 %(aT.)Rh
отжиг при 1500 °С
[1,2]
При 45,2 %(aT.)Rh
отжиг при 1700 °С
[1,2]
При 69,2 % (ат.) Rh
отжиг при 1700 °С
[1,2]
При 85,1 %(ат.) Rh
отжиг при 1500 °С
[1,2]
[3]
Литература
1. Anderson E., Hume-Rothery W.//J. Less-Common Met. 1960. V. 2. N I. P. 19-28.
2. Haworth C.W., Hume-Rothery W. // J. Inst Met. 1959. V. 87. N 8. P. 265-269.
3. Giessen B.C., Jahnigen U., Grant N.J. // J. Less-Common Met. 1966. V. 10. P. 147-150.
4 Brewer L., Lamoreaux R.H. // Atomic Energy Review, Special Issue N 7. Molybdenum:
Physico-chemical properties of its compounds and alloys. Vienna: International Atomic Energy
Agency. 1980. P 195-356.
К.Б. Поварова
Mo-Ru. МОЛИБДЕН-РУТЕНИЙ
Диаграмма состояния Mo-Ru, представленная на рис. 216, построена
в работе [1] по результатам микроструктурного, рентгеновского
анализов, определения температуры плавления порошковых сплавов,
приготовленных из Мо и Ru чистотой -99,9 % (по массе).
442
Mo-Ru
Ifu, %/понассе)
о to го jo to so 60 70 во so too
2600
гэоо
гэоо
2200
ггоо
¦гооо
fffOO
teoo
170O
Г6ОО
tJOO
two
262J" '
V
-Д
\
\
(Mo) ~
/
/
1
i
Л
\
зор.
f
i
¦
i
c/r/
_JL
ii
1
ж
sun
\
\
\
1
//
1
(/fu)
1
23J*'
0 tO го JO W SO вО 70 во 9О tOO
Mo /fu, VofamJ /fu
Рис. 216. Mo-Ru
В системе существует одна промежуточная фаза а, которой приписы-
приписывается формула Mo5Rii3 и ограниченные твердые растворы на основе Мо
и Ru. Эвтектика (Mo)+(Ru) образуется при температуре 1945 "С и
концентрации 41,6 % (ат.) Мо. Растворимость Ru в (Мо) снижается от
30,5 % (ат.) при эвтектической температуре до -13 % (ат.) при 1500 "С.
Растворимость Мо в (Ru) уменьшается от 51 % (ат.) при эвтектической
температуре до -45 % (ат.) при 1500 °С. Mo5Ru3(o) образуется по
перитектоидной реакции при температуре 1920 °С и концентрации
37,0±l%(aT.)Ru.
Mo5Ru3(o) имеет структуру типа oCrFe (символ Пирсона fP30, пр.гр.
Р421тпт), параметры решетки а = 0,99570 нм, с - 0,49323 нм при.34 %
(ат.) Ru; а = 0,954 нм, с = 0,495 нм при 37,5 % (ат.) Ru [3]; а = 0,95575 нм,
с = 0,49345 нм при 37,5 % (ат.) Ru [1]. Параметр ОЦК решетки (Мо) при
легировании Ru уменьшается от 0,31467 нм, для 100 %Мо до 0,31357 и
0,31251 нм при 9,5 и 18,7 % (ат.) Ru соответственно [1]. Параметры ГПУ
решетки (Ru) при легировании Мо увеличиваются для образцов,
отожженных при 1700-1800 °С ота = 0,27057 нм, с = 0,42811 нм при 0 %
Mo-Ru, Mo-S 443
(ат.) Mo до а - 0,27478 нм, с = 0,44103 нм при 41,5 % (ат.) Мо и
а = 0,27561 нм, с - 0,44408 нм при 55 % (ат.) Мо (двухфазный сплав)
[1,4].
Литература
1. Anderson E., Hume-Rothery W. // J. Less-Common Met. I960. V. 2. P. 443-450.
2 Bloom D.S.//J. Metals AIME. 1955. V. 7. N 2. Sec. 1. P. 420.
3. Greenfield P., Beck P.A. // J. Metals AIME. 1956. V. 8. N 2. Sec. 2. P. 265-276.
4. Moss M., Smith D.L., Lcfever R.A. // Appl. Phys. Lett. 1964. V. 5. P. 120-121.
К.Б. Поварова
Mo-S. МОЛИБДЕН-СЕРА
Взаимодействие Мо с S изучалось неоднократно [X, Э, Ш]. В системе
образуются два стабильных сульфида молибдена Mo2S3 и MoS2. При
содержании S более чем 72,1 % (ат.) были получены аморфные фазы,
которые являются метастабильными, так как даже высокое давление
паров S не может предотвратить их разложение [1]. По данным работы
[2] в фазе MoS2 может растворяться до 69 % (ат.) S при 1000 "С. Давление
р паров S в равновесии с MoS2+x при 1100 °С может быть рассчитано по
уравнению
\пр = -7,83 + 28,26-х,
где 0,02 < х < 0,23.
Фаза Mo3S4, полученная путем кислотной экстракции тройных
сульфидов MvMo3S4 [3], разлагается при нагреве и не рассматривается
как стабильная фаза в двойной системе [4, 5].
Фаза Mo2S3 не стабильна при температурах ниже 610 °С [5,6]. Следует
отметить, что скорость установления равновесия и образования Mo2S3
при температурах выше 610 "С низка, и требуется неделя при температуре
900 °С, чтобы достичь равновесия. Температура превращения Mo2S3 в
(Мо) и MoS2 была определена равной 664±50 "С [7] или 627±40 °С [8].
По данным работы [9] температура плавления MoS2 выше 1800 "С.
Термодинамические расчеты [8] показали, что необходимо давление
паров S2, равное 0,4 МПа, чтобы предотвратить разложение MoS2 при
температуре 1900 "С на жидкость, более бедную S. При 0,1 МПа S2
сульфид, согласно расчету, разлагается при 1750150 °С на жидкость с
65 % (ат.) S. По данным работы [4] Mo2S3 плавится конгруэнтно при
444
Mo-S
t,'C
2500
2000
/500
/Ooo
500
3, % (no массе)
0 5 10 20 30 W 50 6O7O8OS0WO
N
i
\
\
\
1550±f00°
664
l
s\
Ж
\
Ж+Га
/
— 50~
1
>
i i
I i
| /750±50°
4
1
-
Мо5г+Гаа
—
\мозг+ж
1 115.2'
—
0 10 20 30 40 50 60 70 80 90 /00
Mo Sf%/a/77.) S
Рис. 217. Mo-S
-1800 °C. В работе [5] указывается, что Mo2S3 образуется по перитекти-
ческой реакции при 1740110 °С. По данным работы [4] Mo2S3 образует
эвтектики с (Мо) при температуре 1550± 100 "С и концентрации 50 % (ат.)
S и с MoS2 при 1630±50 °С и концентрации около 63 % (ат.) S. Температу-
Температуры и составы эвтектик определены в работе [8] на основании термодина-
термодинамических расчетов. Согласно диаграмме состояния, построенной в работе
[5] по обобщенным литературным данным, эвтектика между Mo2S3 и
(Мо) образуется при температуре 1607± 12 °С и концентрации - 37 % (ат.)
S, что отличается от значений, рассчитанных в работе [8]. Растворимость
S в (Мо) достигает 1,5 % (ат.) при 1100 °С [2].
Диаграмма состояния (рис. 217) построена по данным работы [8], в
которой учтены наиболее достоверные экспериментальные результаты,
на основании термодинамических расчетов предложены уравнения,
описывающие границы фазовых равновесий, а также собраны данные
по термодинамическим свойствам и кристаллической структуре.
Кристаллическая структура сульфидов Мо представлена в табл. 195.
Mo-S
445
Таблица 195. Кристаллическая структура соединений системы Mo-S
Соединение
MoS2
MoS,
MoS205
MoS239
MoS2
Mo2,06S3
(Mo2S3)
wiou S >
Прототип
MoS2
MoS2
MoS2
MoS2
-
-
-
* Триклинная сингония,
** Метастабильная фаза.
Символ
Пирсона
пр.гр.
hP6,
Рб^/ттс
hP6,
/>63/mmc
hP6,
Рб^/ттс
hP6,
Pbjmmc
A/?3,
Ют
Pl[lm
-
hR 14,
ЯЗ
при -150 °.
Параметры решетки, нм
a
0,31604
0,316
0,315F)
0,315F)
0,315F)
0,3166E)
0,3163
0,8633
0,606
0,6432
b
-
-
-
-
-
0,3208
20,319
с
1,2295
1,243
1,226
1,234
1,243
1,841B)
1,8371
0,6092
0,860
Примечание
[10]
[И]
[1]
[1]
[1]
[10]
[И]
p= 102,43°
[10]
a=89,6°;
p= 102,6°;
[10]
a=30,31°
[3]
Литература
1. Anderson E.//J. Less-Common Met. 1964. V. 6. P. 81-84.
2. Stafer S.C., Larson A.H., Schlechten A.W. // Trans. AIME. 1964. V. 230. P. 594-595.
3. Chevrel R., Sergent M., Prigent J. // Mater. Res. Bull. 1974. V. 9. P 1487-1489.
4. Flukiger R., Devantay H., Jorda J.L., Muller J. // IEEE. Trans. Magn 1977. V. 13. P. 818.
5 Johnson W.B., Hong W.S., Readey D.W. // Scr. Metall. 1983. V. 17. N 7. P. 919-922.
6 Morimoro N., Kullerud G. // In: Carnegie Institution of Washington, Year Book. 1962. V. 61.
P. 143-144.
7. Poulard G., Perrot P. II Compt. Rend. Acad. Sci. Paris, Ser. С 1975 V. 281. P. 143-146.
446
Mo-S, Mo-Sb
8. Brewer L., Lamoreaux R.H. // Atomic Energy Review, Special Issue N 7. Molybdenum:
Physico-chemical properties of its compounds and alloys. Vienna: International Atomic Energy
Agency. 1980. P. 195-356.
9. Cannon P.//Nature (London). 1959. V. 183. P. 1612-1613.
10. De Jonge R., Popma T.J.A., Wiegers G.A., Jellinek F. // J. Solid State Chem. 1970. V. 2.
P. 188.
11. Wildervanck J.C., Jellinek F. IIZ. Anorg. All. Chem. 1964. Bd. 328. N 5/6. S. 309-318.
КБ. Поварова
Mo-Sb. МОЛИБДЕН-СУРЬМА
В работе [1] сообщается о получении твердого раствора Sb в Мо
электролизом расплава солей. По данным работ [2, 3] единственное
соединение в системе Mo3Sb7 стабильно в равновесии с твердым (Мо)
и расплавом Sb при температуре 650±20 °С, но становится нестабильным
при 800 "С. На основании термодинамических расчетов температура
образования Mo3Sb7 по перитектической реакции (Мо) + Ж ** Mo3Sb7
определена равной 780±20 °С (рис. 218); соединение образует эвтектику
с (Sb) при температуре - 630±1 °С и концентрации 10~4 % (ат.) MoJ4].
Mo3Sb7 имеет структуру типа Ir3Ge7, символ Пирсона с/40, пр. гр. 1т Ът,
а - 0,95688 нм [3, 5].
Sb, °/о /по магссе)
10 20 30 W 50 60 7О 80 90 ГОО
Г6ОО
ffOO
Г200
tOOO
800
6ОО
ЧОО
гоо
1
1МО)+ГЪЭ
(Moj.
-f*
i
f59O±1OO°
W-
780±i
>ffo
1
1
1
(Sb)
-•
63O, 7SS°
О /О го 30 ЧО SO ВО 7О вО 9О ГОО
Мо Sb^/ofam.) Sb
Рис. 218. Mo-Sb
Mo-Sb. Mo-Sc
447
Литература
1. Mansone M.G., Briggs J.Z. // Less-Common Alloys of Molybdenum. Climax Molybdenum
Company. New York, 1962. P. 17.
2. Boiler H., Nowotny H. // Monatsh. Chem. 1964. Bd. 95. S. 1272.
3. Jensen P., Kjekshus A., Skansen T. // Acta Chem. Scand. 1966. V. 20. P. 403-416.
4. Brewer L., Lamoreaux R.H. // Atomic Energy Review, Special Issue N 7. Molybdenum:
Physico-chemical properties of its compounds and alloys. Vienna: International Atomic Energy
Agency. 1980. P. 195-356.
5. Brown A. // Nature. 1965. V. 206. P. 502.
К.Б. Поварова
Mo-Sc. МОЛИБДЕН-СКАНДИЙ
Согласно работе [Ш] растворимость Sc в Mo при 1625 °С, определен-
определенная спектральным анализом Мо, выдержанного в расплаве Sc в течение
одной недели, ниже 2- 1(Г4 % (ат.) (разрешающая способность метода).
Промежуточных фаз в системе не обнаружено.
На основании термодинамических данных расчетным методом по-
построена диаграмма состояния Mo-Sc (рис. 219). Образование эвтектики
между (Мо) и (Sc) возможно при температуре 1370±50 "С и концентрации
10±3 % (ат.) Мо. Можно ожидать, что максимальная растворимость Sc
в (Мо) достигает 0,007 % (ат.) при 2127 °С и падает до 0,002 % (ат.) при
1372 "С [2].
с
гш
ггоо
гооо
tsoo
/600
/ш
/гоо
1
to
егз* '
Ч
i
Sc,
20
1
V
% (no массе/
30 W SO 60
T
/37O±SO"
/33S±3'
о to го io 4
МО
Рис.219. Mo-Sc
1
1
Ж
i
\
7080 90 tOO
т л
1 .
•/337"
-fctSc)
•0 SO 60 70 ВО 9О /ОО
SCf c/o ftZ/77. J Sc
448
Mo-Sc, Mo-Se
Литература
1. Brewer L., Lamoreaux R.H. // Atomic Energy Review, Special Issue N 7. Molybdenum-
Physico-chemical properties of its compounds and alloys. Vienna: International Atomic Energy
Agency. 1980. P 195-356.
К.Б. Поварова
Mo-Se. МОЛИБДЕН-СЕЛЕН
Равновесная диаграмма состояния Mo-Se не построена Р, Ш]. Обзор
работ по фазовому строению участка системы MoSe2.x - Mo3Se4±x
приведен в работе [1]. Рентгеновским методом установлено образование
в системе двух промежуточных фаз Mo3Se4 и MoSe2 [2, 3]. По данным
работы [3] соединение MoSe2, полученное при 1500 °С и давлении 4 ГПа,
изоструктурно MoS2. В работе [4] изучено давление диссоциации MoSe2
в интервале температур 960-1080 °С. На основании этой информации
и термодинамических данных расчетным путем построена [5] диаграмма
состояния Mo-Se (рис. 220), согласно которой имеются узкие области
гомогенности обоих соединений; Mo3Se4 образуется при взаимодействии
твердого Мо и Se2 (газ) при давлении 0,1 МПа и температуре при
14001100 °С; MoSe2 образуется при взаимодействии Mo3Se4 (тв.) и Se2
(газ) при давлении 0,1 МПа при 1150±50 "С. Предполагается [5], что при
температурах ниже 527 °С растворимость Se в (Мо) контролируется
дефектами решетки.
t,°c
/Sffff
woo
5О0
ГО 20
Se, % (по массе!
JO ?0 SO 6O 7O 60 90 WO
1
1
(МО
^— (Мо)
+Га.
j!
MOjSe«
i
1
V
1
|
1
1
9
i
H5O+S0*
MoSez+r<L3
*\ f
(se)-
685°
221°
О 1O 2O 3O W SO 6O 7O ВО 9О fOO
Mo se, %{am.) se
Рис.220. Mo-Se
Mo-Se, Mo-Si
449
Кристаллическая структура селенидов Мо представлена в табл. 196.
Таблица 196. Кристаллическая структура соединений системы Mo-Se
Соединение
MoSe2
MoSe2*
Mo3Se4
Mo3Se4"
Символ
Пирсона,
пр. гр.
/*6з / ттс
ЛЗ или
-
Параметры решетю
а
0,3288
0,3292
0,956
0,4632
Ь
-
-
0,4762
Гексагональная (ромбоэдрическая) сингония.
Моноклинная сингония.
1, ИМ
с
1,2900
1,9392
1,107
0,6649
Источник
[1.6,7]
[8]
[1.2]
Р = 92,56° [9]
Литература
l.SpiesserM., RouxeJ., Kerriou 1Y1., Goureaux M.G.// Bull. Soc. Chim. France. 1969. N 5.
P.1427-1431
2. Bales O., Guillevie J., Grandjean D. // J. Solid State Chem. 1973. V. 6 P. 48-57.
3 TowieL.C.,OberbeckV.,BrovmB.E.,StajdoharR.E.//Science. 1966. V. 154. P. 895-896
4. Глазунов М.П., Михайлов E.C., Пискарев Н.В., Чупахии М.С. // Порошковая
металлургия. 1976. N 11. С. 59-61.
5. Brewer L., Lamoreaux R.H. // Atomic Energy Review, Special Issue N 7. Molybdenum:
Physico-chemical properties of its compounds and alloys. Vienna: International Atomic Energy
Agency. 1980. P. 195-356.
6. Brixner L.H. // J Inorg. Nuclear Chem. 1962. V. 24. P. 257.
7. Опаловский А.А., Федоров В.Е. //Доклады АН СССР. 1965. Т. 163. С. 1163.
8. AI-Hilli A.A., Evans B.L. // J. Cryst. Growth. 1972. V. 15. P. 93.
9. De Jonge R., Popma T.J.A., Wiegers G.A., Jellinek F. // J. Solid State Chem. 1970. V. 2
P. 188.
К.Б. Поварова
Mo^Si. МОЛИБДЕН-КРЕМНИЙ
Строение диаграммы состояния Mo-Si изучали многие авторы (X, Э,
Ш, 1]. Первое определение фазовых равновесий в системе Mo-Si было
проведено на сплавах, приготовленных горячим прессованием в
450
Mo-Si
Si, % fno массе)
to го зо w so 60 во too
t600
12OO
О tO ZO ЗО <Ю SO 6О 7О вО 90 tOO
Mo si, °/o(am.) Si
Рис. 221. Mo-Si
атмосфере Ar из порошков Mo и Si чистотой 99,9 и 99 % (по массе)
соответственно [2]. После отжигов в интервале температур 1050-1800 °С
сплавы исследовали методами рентгеноструктурного, металлографичес-
металлографического анализов, а также определяли температуры плавления. В результате
исследования установлено образование интерметаллических фаз Mo3Si,
Mo3Si2 и MoSi2, построена диаграмма состояния.
Последующими исследованиями [3] на сплавах, приготовленных
плавлением Мо чистотой 99,9 % (по массе) и монокристаллического Si,
с использованием методов рентгеноструктурного, металлографического
и высокотемпературного дифференциального термического анализов
было уточнено строение диаграммы состояния системы Mo-Si. Авторы
работы [3] установили существование фазы с формулой Mo5Si3 вместо
Mo3Si2, а также наличие полиморфного превращения при 1900 "С у
интерметаллида MoSi2.
Авторы работы [1] на основании работ [2, 3, 4] дали обобщенную
диаграмму состояния Mo-Si, показанную на рис. 221. В системе
образуются трн соединения: Mo3Si (по перитектической реакции при
2025 °С); Mo5Si3 (плавится с открытым максимумом при 2180 °С) и MoSi2
(плавится с открытым максимумом при 2020 °С).
Нонвариантные реакции представлены в табл. 197 [1].
Mo-Si
451
Таблица 197. Ноивариантиые реакции в системе Mo-Si |1]
Реакция
(Мо) + Ж - Mo3Si
Ж - Mo3Si + Mo5Si3
Ж - Mo5Si3 + pMoSi2
PMoSi2- ocMoSi2
Ж - aMoSi2 + (Si)
Содержание Si в фазах, % (ат.)
4; 25,72; 25
26,4; 25; 37
54; 40; 66,7
66,7
98,3 66,7 -100
Температура, °С
2025
2020
1900
1900
1400
Кристаллическая структура силицидов Мо дана в табл. 198.
Таблица 198. Кристаллическая структура соединений системы Mo-Si
Соединение
Mo3Si
Mo5Si3
aMoSi2
CMoSi2
Прототип
Cr3Si
W5S.3
MoSi2
Символ
Пирсона,
пр. гр.
cPS,
РтЪп
//38,
/4/mcm
r/6,
/4/mmm
C622
Параметры решетки, нм
а
0,4890
0,9648
0,3202
0,4642
с
0,4310
0,7843
Источник
[5]
[3]
13]
[3]
Авторы работы [4] на основании измерения параметров решетки
твердого раствора определили растворимость Si в (Мо) при различных
температурах:
Температура, °С
Растворимость, % (ат.)
1316
0,727
1371
1,09
1427
2,52
Авторы работы [3] установили растворимость Si в (Мо) при
температуре 1820 "С менее 3,35 % (ат.) и путем экстраполяции получили
ее значение при 2025 °С порядка 9 % (ат.), авторы работы [2] определили
максимальную растворимость Si в (Мо) 3,52 % (ат.) при 2053 "С. По-
видимому, на основании всех данных следует считать растворимость Si
в (Мо) при перитектической температуре порядка 4 % (ат.).
452 Mo-Si. Mo-Sn
Нет никаких количественных данных по растворимости Мо в твердом
(Si), вероятно, она исчезающе мала.
Литература
1. Gokhale A.B., Abbaschian G.J. // 3. Phase Equilibria. 1991. V. 12. N 4. P. 493-498.
2. Kiefler R., Cerwenka E. HZ. Metallkunde. 1952. Bd. 43. S. 101-105.
3. Свечников В.Н., Кочержииский Ю.А., Юпко Л.М. // Диаграммы состояния
металлических систем: Сб. статей. М.: Наука, 1971. С. 116-119.
4. Ham iX.II Trans. A1ME. 1951. V. 73. Р. 723-731.
5. Tempieton D.H., Danben C.H. // Acta Crystallogr. 1950. V. 3. P. 261-262.
А С Адамова
Mo-Sn. МОЛИБДЕН-ОЛОВО
Взаимодействие Мо с Sn исследовалось рядом авторов [X, Ш]. При
исследовании сплавов, полученных нагревом до 600-900 °С при
встряхивании в течение 24 ч смеси порошка Мо с 75 % (ат.) Sn в
эвакуированных ампулах, установлено образование кристаллов MoSn2
(при 600 °С)[1]. При температуре 900 °С на рентгенограммах появлялись
дополнительно линии другой фазы с тетрагональной решеткой, состав
которой не был установлен (между Mo2Sn3 и MOjSn^, а также линии
новой фазы, которая не была идентифицирована. В работе [2] сообщается
о появлении фазы Mo3Sn, полученной порошковым методом при
температурах выше 1000 °С и давлении <, 3,4 ГПа. При более низких
давлениях и температуре > 1000 °С обнаружена только одна фаза с ОЦК
структурой. При давлении 0,1 МПа и температуре выше 300 °С фаза
Mo3Sn неустойчива.
В жидком Sn при 1450 °С растворяется до 5-Ю % Мо.
В работе [3] на основании известных экспериментальных данных и
термодинамических расчетов построена диаграмма состояния системы
Mo-Sn (рис. 222).
Растворимость Sn в (Мо) в интервале температур A527-2606 °С)
оценена зависимостью:
1пх = - 17000/Г,
где х - атомная доля Sn; T- температура, К.
Кристаллическая структура соединений Mo-Sn приведена в табл. 199.
Mo-Sn
453
5/7, %//го массг)
. orO /О гО 30 4О SO 6O 7О вО 9ОГОО
гвоо
26OO
г*и>о
то
wo
aoo
soo
wo
200
т
i t
1
j
—1
¦
г
1
2623'
2606»
(Мо)Ш
i
Г2йО*/ОО°
п
А
ft
и
i
г
1
1
1
воо±гооа
1
ч
(Sn)
ч
О fO 2O JO 4>O SO 60 7O во 9О ГОО
Mo Sn^ofam.) Sn
Рис. 222. Mo-Sn
T а б л и и а 199. Кристаллическая структура соединений системы Mo-Sn
Соединение
Mo3Sn
ММ^п7
MoSn2
Прототип
PW(W3O)
U3Si2
—
Символ
Пирсона,
пр гр.
сРЪ,
РпгЪп
P4lmbm
hP6,
Р6222 или
/>6422
Параметры решетки, нм
а
0,5094
-
0,5491
с
-
-
1,4171
Источник
[2]
П,м,
[1]
Литература
1. Brown A. // Nature. 1965. V. 206. Р. 502-503.
2. Killpatrick D.H. // J. Phys. Chem. Solids. 1964. V. 25. P. 1499-1500.
3. Brewer L., Lamoreaux R.H. // Atomic Energy Review, Special Issue N 7. Molybdenum:
Physico-chemical properties of its compounds and alloys. Vienna: International Atomic Energy
Agency. 1980 P 195-356.
К.Б Петрова
454
Мо-Та, Мо-Тс
Мо-Та. МОЛИБДЕН-ТАНТАЛ
Мо и Та неограниченно растворимы в жидком и твердом состоянии
(X, Э]. Температура плавления сплавов плавно повышается с увеличением
содержания Та [1]. Термодинамические расчеты [2] показывают, что
ширина области кристаллизации должна быть существенно уже, чем
определено в работе [1].
i'C
зооо
2900
гвоо
27OO
26OO
Та, % {по массе)
О /0 ZO 30 40 5О 60 70 в О 90 ТОО
1
i i
i
1
i
i
/
У
/,
(Mi
i
/
V
7,та)
зого
/
Рис.
223.
Мо-Та
0
Мо
to
20
30
40 $0 6О 70
Та,°/о(а/77.}
80
90
№0
Та
На рис. 223 диаграмма Мо-Та приведена согласно работе [М].
Литература
1. Geach G.A., Summers-Smith D. // J. Inst. Met. 1951-52. V 80. P. 143-146.
2. Brewer L., Lamoreaux R.H. // Atomic Energy Review, Special Issue N 7. Molybdenum:
Physico-chemical properties of its compounds and alloys. Vienna: International Atomic Energy
Agency. 1980, P. 195-356.
К.Б. Поварова
Мо-Тс. МОЛИБДЕН-ТЕХНЕЦИЙ
Взаимодействие Мо с Тс исследовалось рядом авторов [Э, Ш].
Положение фазовых областей в твердом состоянии определено
рентгеновским методом на литых и порошковых сплавах [1, 2],
приготовленных с использованием Тс чистотой 97,65 % (по массе).
Мо-Тс
455-
Экспериментального исследования диаграммы состояния в области
ликвидус-солидус не проводилось.
В системе образуются две промежуточные фазы: фаза р при 54 [1] или
55 % (ат.) Тс [2] и фаза о, имеющая 'интервал гомогенности 65-74 % (ат.)
Тс при 1200 °С и 68-72 % (ат.) Тс при 1800 °С [2]. Указывается также [1],
что литые сплавы с содержанием до 56 % (ат.) Тс имеют однофазную
структуру твердого раствора на основе Мо; по данным работы [3]
растворимость Тс в (Мо) достигает 55 % (по массе) Тс при 1000 °С, что
выше, чем по данным работ [1, 2]. По данным работы [1] граница
растворимости Мо в (Тс) находится между 23 % (ат.) Мо и 14,3 % (ат.)
Мо; по данным работы [3] растворимость Мо в (Тс) достигает 30 % (по
массе) Мо при 1000 "С.
На основании указанных экспериментальных данных и термодина-
термодинамических расчетов в работе [4] построена диаграмма состояния системы
Мо-Тс (рис. 224), согласно которой фаза р, по-видимому, должна
образовываться по перитектоидной реакции при 1700±100 °С из Мо и
фазы а; фаза а образуется по перитектической реакции при 2077± 100 °С.
Между Мо и фазой а можно ожидать образования эвтектики при
температуре 20271100 °С и концентрации 56±5 % (ат.) Тс. Интервал
гомогенности фазы а при 1000 °С составляет 70-73 % (ат.) Тс.
Растворимость Тс в (Мо) в интервале температур 927-1700 °С
подчиняется уравнению:
Тс, "/о {по массе)
,0 ГО 20 JO W 50 60 70 30 S0 T00
2600
2200
/800
tooo
?szJ°
\
(Mo)
/
—
7
Mo
/У
r
^3^-
l2O27±ZOdi
\f700±ffl04
TC(I
f
2O?
л
it
(
'7±U
fo°
4
4-J
\
\
^ 2204°
О
МО
W 2О ЗО
W 50 6О 70
Тс, "/о {am.)
80 90
*О0
7с
Pnc. 224. Mo-Tc
456
Мо-Тс, Мо-Те
\пх = 970/7-3,4 + 2,15-10 (Г-1000), [4]
где х - атомная доля Тс, Т— температура, К Для расчета растворимости
Мо в (Тс) в интервале температур (927-2077 °С) предложено уравнение
lnjc= - 3,2+ 1,8810(Г-1000)-1800/Г±0,5,
где х - атомная доля Mo, T- температура, К.
Кристаллическая структура соединений системы Мо-Тс представ-
представлена в табл 200.
Таблица 200 Кристаллическая стуктура соединений системы Мо-Тс
Соединение
МоТс ф)
Мо2Тс3_х(о)
Прототип
W3O
oCrFe
Символ
Пирсона,
пр гр
с/>8,
РтЪп
IP30,
Ptymnm
Параметры решетки, нм
а
0,49408
0,4942
0,95091
0,9530
0,9490
с
0,49448
0,4960
0 4940
Примечание
[1]
[2]
При 70 % (ат ) Тс
При 58 % (ат )Тс за-
закалка от 1200 °С{Ш]
При 78 % (ат ) Тс за-
закалка от 1200 °С[Ш]
Литература
1 Darby J.B., Zegler S.T. // J Phys Chem Solids 1962 V 23 P 1825-1827
2 NiemiecJ.//Bull Acad Polon Sci, Tech 1963 V 11 P 306-309
3 Алексеевский Н.Е., Балаковский О.А., Кириллов И.В. // Физика металлов и
металловедение 1975 Т 40 С 50-54
4 Brewer L., Lamoreaux R.H. // Atomic Energy Review, Special Issue N 7 Molybdenum
Physico-chemical properties of its compounds and alloys Vienna International Atomic Energ)
Agency 1980 P 195-356
КБ Повароаа
Мо-Те. МОЛИБДЕН-ТЕЛЛУР
Взаимодействие Мо с Те изучалось рядом авторов [X, Э, Ш]; обзор
ранних работ по этой системе приведен в работе [1] В системе существу-
существуют два соединения МоТе2 и Мо3Те4 [2-4] Соединение МоТе2 было
синтезировано при 1100 °С из Мо и Те чистотой 99,999 % (по массе) [3]
В работе [4] определен узкий интервал гомогенности МоТе, 90_j 99 при
750-950 °С, в работе [6] измерено давление диссоциации МоТе2 х при
Мо-Те
457
Рис. 225. Мо-Те
t»C
/500
WOO
500
Те, °/aftro массе)
О fO W 30 40 50 6О 70 60 90 WO
Л
15_
\ I
(Мо+Гал
*-(Мо)
i i
/
f3OO±7O°
ft*
*\
!
6$snoe±w
w
fiMoTettr<a звв1
pMTett>K
1 I
M
—
449,57°
О fO 20 JO 40 50 60 70 80 90 WO
Ма Те, "/ofа/л) Те
909-981 °C, эти результаты экстраполированы до 1180±40°СдляМо3Те4
иМоТе, 9 в равновесии с парами Те2 при давлении 0,1 МПа. Потери веса
сплавов системы Мо-Те при нагреве исследованы в работе [7].
В работе [8] на основании анализа экспериментальных данных и
термодинамических расчетов построена диаграмма состояния Мо-Те
(рис. 225). Граница области гомогенности соединения Мо3Те4 со стороны
Мо простирается от состава МоТе, 3 пРи низких температурах до
МоТе, tj при 1300±70 "С. При 1300 °С соединение находится в
равновесии с парами Те2 при давлении 0,1 МПа и твердым раствором
на основе Мо, содержащим 1,5±1 % (ат.) Те. Со стороны Те граница
области гомогенности проходит от МоТе, 35 ПРИ низких температурах
до МоТе, 4 при 1180±40 °С При температуре 1180 °С в равновесии с
Мо3Те4 находится (ЗМоТе2, содержащее 65,5 % (ат.) Те, и пары Те2 при
давлении 0,1 МПа При температуре 988 °С соединение (ЗМоТе2,
содержащее 66,6 % (ат) Те, находится в равновесии с твердым раствором
на основе Те и парами Те2 при давлении 0,1 МПа. При температуре
820 °С соединение рМоТе2, содержащее 66,6 % (ат.) Те, находится в
равновесии с (Те) и соединением аМоТе2, содержащим 66,7 % (ат.) Те.
Содержание Мо в парах, расплаве и (Те) предельно мало.
Растворимость Те в (Мо) может быть рассчитана для интервала
температур 427-1300 "С по уравнению.
In х = - 6600/Г,
где л - атомная доля Те, Т— температура, К [8]
458
Mo-Te. MO-Th
На основании анализа систем Мо с S и Se в работе [8] высказано
предположение, что при повышении давления Те2 в системе соединения
Мо3Те4 и МоТе2 плавятся конгруэнтно при 1500-1600 °С, и возможно
образование эвтектик между Мо и Мо3Те4 и Мо3 Те4 и МоТе2.
Кристаллическая структура теллуридов Мо представлена в табл. 201.
Таблица 201. Кристаллическаи структура соединений системы Мо-Те
Соединение
Мо3Те4*
МозТе4
аМоТе2
рМоТе2
Символ
Пирсона,
пр. гр.
ЯЗ
-
А/>6,
Pb-Jmmc
mP6,
/>2,/т
Параметры решетки, нм
а
1,013
0,4875
0,35182
0,633
Гексагональная сингония
"Моноклинная сингония.
Ь
-
0,5092
0,3469
с
1,170
0,7051
1,39736
1,386
Примечание
[И
Р = 93, 75° [5]
[1,2,4,6,7]
р = 93, 55° [1, 4, 9]
Литература
1. Spiesser M., Rouxe J., Kerriou M., Goureaux M.G. // Bull. Soc. Chim., France. 1969. N 5.
P. 1427-1431.
2. Knop O., MacDonaJd R.D. // Canad. J. Chem. 1961. V. 39. P. 897-904.
3. Puotmen D-, Newnham R.E.//Aeta Crystallogr. 1961. V. 14. P. 691-692.
4. Brixner L.J. // J. Inorg Nuclear Chem. 1962. V. 24. P. 257-263.
5. Vellinga M.B., De Jonge R., Haas C.U. // J. Solid State Chem. 1970. V. 2. N 20. P. 299-302.
6. Опаловский А.А., Федоров В.Е., Лобков Е.У., Тжикаиовский Б.И. // Журнал
физической химии. 1971. Т. 45. С. 1864.
7. Яиаки А.А., Оболоичик В.А. // Журнал прикладной химии. 1974. Т. 47. С. 1454-1458.
8. Brewer L., Lamoreaux R.H. // Atomic Energy Review, Special Issue N 7. Molybdenum:
Physico-chemical properties of its compounds and alloys. Vienna: International Atomic Energy
Agency. 1980. P. 195-356.
9 Revolinsly E., Beerntsen D. J. // J. Phys. Chem. Solids. 1966. V. 27. P. 523.
К.Б. Поварова
Mo-Th. МОЛИБДЕН-ТОРИЙ
Взаимодействие Мо с Th изучалось рядом авторов [X, Э, Ш].
Диаграмма состояния системы (рис. 226) была построена по результатам
микроструктурного, рентгеновского анализов и методом определения
температур плавления сплавов, полученных дуговой плавкой в вакууме
Mo-Th
459
t,"C
гбоо
гмо
ггоо
2000
teoo
ГбОО
то
ггоо
30
Th, °/в /по массе)
S0 70 60 90
ТОО
гбгэ°
*Ч
?
1
р.
to)
1
1380*10*
/Згв±5л
¦¦¦
I
N
ашт
1
Ж
\
тот
1
\
6t,t
Ж
А
' i
Н
(ЛГИ)
/0 20 30 W 50 60 70 вО 90 '00
Мо Щ °/о /am.) Ttr
Рис. 226. Mo-Th
из Мо чистотой 99,983 % (по массе) и Th чистотой 99,95 % (по массе), а
также по данным гравиметрического метода и метода определения
температуры плавления сплавов, полученных расплавлением Th с
< 0,01 % О в тиглях из монокристаллического Мо [2]. Полученные
результаты в основном хорошо согласуются между собой, основное
различие состоит в определении положения ликвидуса со стороны Мо.
В системе образуются ограниченные твердые растворы на основе Мо и
Th. Эвтектика между (Мо) и (Th) образуется при температуре 1380110 °С
и концентрации 15,4±1 % (ат.) Мо [Ш] или 1382 °С и 14,0 % (ат.) Мо [2].
Растворимость Мо в (aTh) составляет 0,12 % (ат.) при 1335 "С [Ш].
Расчетным путем установлено, что растворимость Мо в высокотемпера-
высокотемпературной модификации Th составляет - 0,8 % (ат.), в низкотемпературной
модификации растворимость Мо в Th может быть описана уравнением:
In (jcIO4) = - 6,34 + 5,510 Г,
где х- атомная доля Мо, Т- температура, К. При 877 °С растворимость
Мо в Th падает до Ю'2 % (ат.) [3].
Литература
1. McMastersO.D., Palmer P.E., Larsen W.L.//J.Nucl. Mater. 1962. V. 7. N 2. P. 151-156.
2 Garg S.P., Ackerraann R.J. // J. Nucl. Mater. 1977. V. 64. N 3. P. 265-274.
3 Brewer L., Lamoreaux R.H. // Atomic Energy Review, Special Issue N 7. Molybdenum:
Physico-chemical properties of its compounds and alloys. Vienna: International Atomic Energy
Agency. 1980. P 195-356.
К.Б. Поварова
460
Mo-Ti
Mo-Ti. МОЛИБДЕН-ТИТАН
Обзор и анализ экспериментальных и теоретических данных о
фазовых равновесиях и метастабильных фазах, образующихся в системе
Mo-Ti. Сделан в работах [X, Э, 1, 2]. Диаграмма состояния построена
методами микроструктурного, рентгеновского анализов, измерения
твердости, удельного электросопротивления и температур плавления
сплавов, выплавленных из Мо и иодидного Ti, а также методом
исследования диффузионных пар и термодинамического расчета границ
фазовых областей (рис. 227) [3, 5].
В системе образуется непрерывный ряд твердых растворов между Мо
и pTi, температура плавления монотонно возрастает от 1670 °С для Ti
до 2623 "С для Мо. Введение Мо в Ti понижает температуру полимор-
полиморфного а ** р превращения Ti от 882 до - 650 "С при -14 % (ат) Ti [X, 3]
По данным работы [4] существует область распада твердого раствора
(PTi, Мо) на твердые растворы Р, и р2 при температуре - 795 °С (850 °С)
и концентрации 20 % C0 %) (ат.) Мо [2,4], температура монотектоидного
превращения 695 °С. Область расслоения асимметрична и сильно
смещена в сторону Ti. В работе [1] на основании термодинамических
расчетов установлено монотектоидное превращение с симметричной
областью расслоения и более низкой F75 °С) по сравнению с указанной
в работе [4] критической температурой. Растворимость Мо в (aTi) не
превышает 0,4 % (ат.) при температуре монотектоидного превращения
[XI
t,°c
геоо
2300
2Ш
/700
моо
TWO
О 20
°/<> fro массе}
60 00
90
Г00
воо
500
то
68?
>
ал 1?~*
I
I
Ж
795°
-" ' ~—«.
69S{°
i
***
1 2623°
О 10 20 30 W SO 60 70 60 90 МО
Ti Mo,%fam.j МО
Рис 227. Mo-Ti
Mo-Ti
461
В богатых Ti сплавах, представляющих собой после закалки
пересыщенный Мо твердый раствор на основе (PTi) образуются
метастабильные фазы: а' (мартенсит) в интервале концентраций 0-2 %
(ат.) Мо и а" с орторомбическими искажениями в более богатых Мо (от
2-4,7 до 4-6,9 % (ат.)) сплавах [1] Фаза со образуется в сплавах,
содержащих от 4-6,4 до 6-15 % (ат.) Мо, как промежуточная фаза при
распаде метастабильной фазы р [1,2,5,7]. Концентрационные интервалы
существования указанных фаз в значительной мере зависят от содержа-
содержания в сплавах О [7]. Значения температуры Ms мартенситного превраще-
превращения приведены ниже.
Мо % (ат )
780
1,0
700
2,0
610
3,1
515
4,2
При содержании Мо более 5-6 % (ат.) Ms ниже комнатной температуры
и при закалке сохраняются фазы р или р + со [X, 8]. Обзор исследований
структурных изменений при термической обработке сплавов Ti с Мо
приведен в работе [2]
Параметр решетки а твердого раствора PTi в зависимости от
содержания Мо [1,3] указан ниже.
а, нм
Мо, % (ат)
0,33065 0,3256 0,3238 0,3196 0,3163 0,3149 0,3147
0 10 20 40 60 80 100
Кристаллическая структура метастабильных фаз системы Mo-Ti
приведена в табл. 202 по данным работы [1].
Таблица 202 Кристаллическая структура метастабильиых фаз системы Mo-Ti
Фаза
а
¦
а'
¦*
ш
Прототип
Mg
-
-
Символ
Пирсона,
пр гр
hPl,
РЬъ1ттс
Стоп
РЫпхтт
Параметры решетки, нм
а
0,2943
0,2945
0,2965
0,2994
0,4612
*Орторомбическая сингония
"Гексагональная сингония
Ь
-
0,2913
0,2881
-
с
0,4681
0,4676
0,4662
0,4644
0,2821
Примечание
При 1 % (ат) Мо [6]
При2%(ат)Мо[6]
ПриЗ,1%(ат)Мо[5, 6]
При4,2%(ат)Мо[5,6]
При 3 % (ат) Мо [7]
462
Mo-Ti. Mo-U
Литература
1. Brewer L., Lamoreaux R.H. // Atomic Energy Review, Special Issue N 7 Molybdenum:
Physico-chemical properties of its compounds and alloys. Vienna: International Atomic Energy
Agency. 1980. P. 195-356.
2. Murrey J.L.// Bull. Alloy Phase Diagrams. 1981. V. 2. N 2. P. 185-192.
3. Ронами Г.Н., Кузнецова СМ., Федоров С.Г., Константинов К.М. // Кристаллография
и техника. 1972. N 7. С. 615.
4. Terauchi S., Matsumoto H., Sugimoto Т., Kamei К. // J. Japan Inst. Met. 1977. V. 6. N 41.
P. 632.
5. Агеев Н.В., Гусева Л.Н., Долииская Л.К. // Изв. АН СССР. Металлы. 1975. № 4. С. 151.
6. Davis R., Flower H.M., West D.R.F. // J. Mater. Sci. 1979. V. 14. N3. P. 712.
7. Leibovitch Ch., Gartstein E., Rabinkin A. // Z Metallkunde. 1980. Bd. 7t. S. 438.
8. Huang Y.C., Kaneko H., Sato Т., Suzuki S. // Sci. Technol. Appl. Titanium Proc. Int. Conf.,
R.I. Jaffee, Ed. 1970 P. 691-695.
КБ. Поварова
Mo-U. МОЛИБДЕН-УРАН
Взаимодействие Mo с U исследовалось рядом авторов (X, Э, Ш].
Диаграмма состояния системы построена в работах [1-8] и представлена
на рис. 228.
В системе образуется одно соединение MoU2 и твердые растворы на
основе Мо и трех модификаций U (а, р, у). Соединение MoU2 образуется
t,->c
2500
2000
1500
1000
U, % fno массе)
оюгозом so 60 7о во
Г00
500
I
(
1
1
N
t28#tl*
5<
1
\
ж
\
\
1
fx
( 0
T9F
u)
Ш~
776'
fdl/J-*
1135'
л 668°
О ГО гО JO W 50 60 70 SO 9О 100
Mo U,%(am.) U
Рис. 228. Mo-U
Mo-U
463
при конгруэнтном превращении в твердом состоянии из (yU) при
температуре 595-615 °С и концентрации 32,4-33,3 % (ат.) Мо [1,3,7, 10],
интервал гомогенности 29,5-35 % (ат.) Мо [2]. Нонвариантные реакции
в системе Mo-U по данным разных авторов приведены в табл. 203.
Таблица 203. Нонвариантные реакции в системе Mo-U
Реакция
Ж + (Мо) - (yU)*
(YU) - (aU) + MoU2
(YU) - (Mo) + MoU2
(PU) - (aU) + (YU)
Содержание U в
Температура, °С
1284+2
565
572
560
570
580
600
605
580±7
639±5
648
635
645±2
Содержание U в фа-
фазах, % (ат.)
70,0; -3; 60
77,4; -; -66,7
78,5;
78,0;
79,0;
65,8;
65,2;
63,0;
64,0;
98,8;
98,7-98,6 -
97,0;
98,5;
-66,7
-66,7
-66,7
-66,7
-66,7
-66,7
-66,7
_
-
-
Источник
[61
[1]
[5]
О]
[Ш]
[1]
[2]
[3]
[5]
[1]
[2]
[3]
[8]
расплаве составляет 70,0±0,5 и 42,4% (ат.) при температурах 1284
и 2006 °C соответственно [6].
Содержание Мо в (aU) при 648 °С составляет < 0,1 % (ат.), в (yU) -
8 % (ат.) [2]. Растворимость Мо в (aU) при эвтектоидной температуре
- 570 °С составляет - 0,2 % (ат.) [2], 0,2 % (ат.) [6] или 0,7 % (ат.) [4].
Растворимость U в (Мо) достигает ~2 % (ат.) при - 600 °С [2].
Кристаллическая структура стабильных и метастабильных фаз
системы Mo-U приведена в табл. 204.
464
Mo-V
Таблица 204. Кристаллическая структура стабильных и метастабпльиых фаэ системы
Mo-U
Соединение
MoU2
(Yf)
yv (мартенсит)
у0 (мартен-
(мартенсит, частично
упорядочен-
упорядоченный)
а" (мартен-
(мартенсит)
а' (метаста-
бильная)
Прототип
MoSi2
W
кубичес-
кубическая
сверхстру-
сверхструктура W
Cu3Ti
ocU
Символ
Пирсона,
пр. гр.
;/6,
/4/mmm
с/2,
1тЪт
f/>4,
РУттт
<»С4,
Стст
'Моноклинная сингония.
Параметры решетки, им
а
0,3427
0,33693
0,34409
0,688
0,49091
0,49017
0,2866
0,2858
0,2861
0,2687
0,28479
ft
-
-
0,5742
0,5778
0,5794
0,5800
0,58580
с
0,9854
-
0,34062
0,33866
0,4946
0,4957
0,4957
0,4956
0,49455
Примечание
При 67,9 % (ат.) U,
отжиг при -540 °С
1]
При 64,5 % (ат.) U
При 87,3%(ат.)и,
закалка из облас-
области (TU)tl]
При 86 % (ат.) U
При -88%(ат.) U
При86,6%(ат.)и
При 90,4 % (ат.) U,
Р = 92,6°
При 92,8 % (ат.) U,
Р = 91,03°
При94,2%(ат.)и,
закалка от 950 °С
Р = 90,7°[9, 10]
При 94 % (ат )U
При 100%(ат)и
[10]
Литература
l.Dwight A.E. //J,Nucl. Mater. 1960. V. 2. P. 81-87
2. Иванов О.С., Багров Г.Н., Семеичеиков А.Т. // Строение и свойства сплавов урана,
тория и циркония Сборник статей. М.: Госатомиздат, 1963. С. 77-86.
3 Конобеевский СТ. и др // Тр. 2-й Международной конференции по мирному
использованию атомной энергии. 1958. Т. 3. Ядерное горючее и реакторные материалы
Атомнздат. 1959 С 396-413.
Mo-V. Mo-V
465
4. Bellot J. // Mem. Sci. Rev. Met. 1959. V. 56. P. 301-306.
5. Streets F.G., Stobo J.J. // J. Inst. Metals. 1963-64. V. 92. P. 172-174.
6. Garg S.P., Ackermann R.J. // J. Nucl Mater. 1977. V. 64. N 3. P. 265-274.
7. Hawkins T.D., Hultgren R. // Constitution of Binary Alloys, Metals Handbook, 8th ed.,
ASM Metal Park: Ohio, 1973. V. 8. P. 251-376.
8. Brewer L., Lamoreaux R.H. // Atomic Energy Review, Special Issue N 7. Molybdenum:
Physico-chemical properties of its compounds and alloys. Vienna: International Atomic Energy
Agency. 1980. P. 195-356
9. Lehmann J.//J. Nucl. Mater. 1964. V. 4. P. 218.
10 Tangri K., Williams G.I. // J. Nucl. Mater. 1961. V. 4. P. 226; Mem. Sci. Rev. Met. 1961.
V 58. P. 469.
К.Б. Поворота
Mo - V. МОЛИБДЕН - ВАНАДИЙ
Взаимодействие Mo с V исследовалось рядом авторов [X, Ш, Э].
Микроструктурное и рентгеновское исследование и определение
температур плавления сплавов, выплавленных из Мо чистотой 99, 99 %
(по массе) и V чистотой 99,4 % (по массе) [1] или Мо чистотой 99, 95 %
(по массе) и V чистотой 99,5 % (по массе) [2], показало, что Мо образует
с V непрерывный ряд твердых растворов [1, 2]. Диаграмма плавкости
(рис. 229), полученная расчетом' [3] в приближении идеальных и
У, "Л (по массе)
гвоо
ггоо
гооо
гя/гл
9 5
ГО
И |
2623'
Vs
\
S
70
s.
30
Ч
\
(МО vl
to
"ч
Ч,
50
I
Ж
60 ,
1
Ч,
'оаь
\
1
\
-л
19У0'
О ГО ZO ЗО ЬО 50 60 7О вО 9О tOO
Мо V, °/о (am.) V
Рис. 229. Mo-V
466
Mo-V. Mo-W
регулярных растворов, а также с использованием квазихимической
модели, хорошо согласуется с экспериментальными данными.
Параметр ОЦК кристаллической решетки твердого раствора в
зависимости от содержания V изменяется следующим образом [X, 4]:
V, %(ат.). .. О 30 33 45 60 66 90 100
а, нм 0,3147 0,3112 0,3100 0,3090 0,3078 0,3065 0,3050 0,3040
Литература
1. Барон В.В., Савицкий Е.М., Ефимов Ю.В. // Изв. АН СССР. Отделение технических
наук. Металлургия и топливо. I960. N 4. С. 143—149.
2. Кочержинский Ю.А., Василенко В.И. // Изв. АН СССР Металлы. 1985. N 2.
С 188-189.
3 Balakrishna S.S., Mallik А.К. // U.S. Dep. Commer Nat. Bur. Stand. Spec. Publ., 1978.
N496/2. P. I200-I2I9.
4. Rudy E., Benesovsky F. // Planseeber. Pulvermetall 1962. Bd. 10. S. 42.
К,Б. Поварова
Mo - W. МОЛИБДЕН - ВОЛЬФРАМ
Взаимодействие Mo с W исследовалось рядом авторов [X, Ш, Э].
Данные различных авторов хорошо согласуются между собой.
Микроструктурное, рентгеновское исследование и измерение нескольки-
несколькими % (/to массе}
.„,,010 2ОЗО «О 50 SO 70 60 90 /00
3400
3200
ЭООО
2800
2623°
геоо
2400
I I
У.
I
I
I
г
(Ml
3
?
О W гО 30 40 50 60 70 00 90 /ОО
Mo W, % (am.) W
Рис.ДЗО. Mo-W
Mo-W, Mo-Y 467
ми способами температур плавления сплавов, выплавленных из Мо и W
чистотой 99,99 % (по массе), показали, что в системе образуется
непрерывный ряд твердых растворов [X, 1].
Границы диаграммы плавкости системы Mo-W (рис. 230), полученные
расчетом [2], хорошо согласуются с экспериментальными данными.
Параметр ОЦК кристаллической решетки твердого раствора
практически аддитивно увеличивается от 0,31474 нм для 100 % Мо до
0,31650 нм для 100 % W [3,4]. Обзоры и анализ литературных данных о
строении и термодинамических свойствах сплавов системы Mo-W
приведены в работах [1, 5].
Литература
I. Brewer L., Lamoreaux R.H. // Atomic Energy Review, Special Issue N 7. Molybdenum'
Physico-chemical properties of its compounds and alloys. Vienna: International Atomic Energy
Agency, 1980. P. 195-356
2 Gustafson P.//Z. Metallkunde. 1988 Bd. 79. N 6. S 388-396
3 Rudy E. // Air Force Materials Laboratory, Wright-Patterson AFB, Ohio, Rept. N
AFML-TR-65-2, Part V.June 1969 P 154-156.
4. Taylor A., Doyle N.J. // J. Less-Common Met. 1965. V 9 P. 190-205
5 NagenderS.V., Schriramamurty A.M., Rama Rao P. // Bull. Alloy Phase Diagrams. 1984.
V. 5. N2. P 177-179.
К.Б. Поварова
Mo - Y. МОЛИБДЕН - ИТТРИЙ
Диаграмма состояния Mo-Y построена по результатам металлографи-
металлографического анализа и определения температур плавления сплавов,
приготовленных с использованием Y чистотой 99,6 % (по массе) [Э, 1].
Промежуточных фаз в системе не образуется. Между твердыми
растворами на основе Мо и Y образуется эвтектика при температуре
1498 °С и концентрации 90 % (ат.) Y [Э]. Растворимость Мо в (J3Y)
составляет при температуре 1498 °С -0,02 % (ат.) Р]; растворимость Y
в (Мо) при температуре 1585 °С - ~ 10~4 % (ат.) р], 0,03-0,065 % (ат.) Мо
при температуре 1450 °С [1]. Предполагается также, что существует
область расслоения в жидком состоянии, включающая состав сплава с
11 % (ат.) Y [2].
Указанные экспериментальные данные и термодинамические рас-
расчеты были положены в основу варианта диаграммы состояния Mo-Y
(рис. 231) [3]. Максимальная растворимость Y в твердом (Мо) рассчитана
468
Mo-Y. Mo-Yb
Y, % frro массе)
О 10 20 30 40 SO SO 7O вО 9О Г0О
24OO
2OOO
Г60О
/2ffO
2621
Ч
Г"
*—(Мо)
1
1
i
ч.ь
W0±50°
1
1
Ж
S.
ч
1
N
1
\
1
№70°
О 1O 20 30 *O SO 60 7O вО SO ГОО
Mo Y, "/<,'(am.) Y
Рис. 231. Mo-Y
равной 0,2 % (ат.) при 2127 "С и уменьшается до 0,04 % (ат.) при 1427 "С.
Растворимость Мо в (aY) рассчитана равной 0,1 % (ат.) Мо при 1477 °С.
Литература
1. Барои В.В., Савицкий Е.М., Тао Т.Т. // Изв. АН СССР. Отделение технических наук.
Металлургия и топливо 1962. N I.C. 15I-I59.
2. Савицкий Е.М., Терехова В.Ф. // Цветные металлы. 1959. N 1. С. 48-53.
3. Brewer L., Lamoreaux R.H. // Atomic Energy Review, Special issue N 7, Molybdenum:
Physico-chemical properties of its compounds and alloys. Vienna: International Atomic Energy
Agency, 1980. P. 195-356.
КБ. Поварова
Mo-Yb. МОЛИБДЕН - ИТТЕРБИЙ
Экспериментальных данных по взаимодействию Мо с Yb в литературе
нет, диаграмма состояния не построена. В работах [1, 2] приведены
данные прогноза химических соединений с помощью ЭВМ, указывающие
на возможность образования в системе соединений Yb2Mo, YbMo2 и
YbMo5 со структурой типа фаз Лавеса, а также соединений Yb3Mo,
YbMo и YbMo3. В работе [3] на основании оценки термодинамических
свойств компонентов высказано предположение, что в системе не должны
Mo-Yb. Mo-Zn
469
образовываться промежуточные фазы, а твердый Мо находится в
равновесии с твердым раствором на основе Yb, расплавом и парами Yb
в соответствующих температурных интервалах. Взаимная раствори-
растворимость элементов практически отсутствует (контролируется дефектами),
температура эвтектики (Mo) + (Yb) на 0,01 "С ниже температуры
плавления Yb, равной 824 °С при (l,4±l,QI0~3 % (ат.) Мо.
Литература
1. Савицкий Е.М., Девипгталъ Ю.В., Грибуля В.Б. // Доклады АН СССР. 1968. Т. 183.
С 1110; 1969 Т. 185. С. 561
2. Савиикий Е.М., Грибуля В.Б.// Доклады АН СССР. 1970. Т. 190. С. 1147; 1972. Т 206
С 848.
3. Brewer L., Lamoreaux R.H. // Atomic Energy Review, Special Issue N 7. Molybdenum:
Physico-chemical properties of its compounds and alloys. Vienna: International Atomic Energy
Agency, 1980 P. 195-356.
К.Б. Поварова
Mo - Zn. МОЛИБДЕН - ЦИНК
Данные о взаимодействии Мо с Zn разноречивы [X, Э]. Термическим
и металлографическим анализом установлено, что растворимость Мо
в расплаве Zn составляет 0,0025 % (ат.) при температуре плавления Zn
и 0,015 % (ат.) при 550-750 °С [Э].
В работе [1] дан обзор всех предшествовавших данных и приведена
диаграмма состояния системы Mo-Zn (рис. 232), характеризующаяся
t,°C
/гоо
воо
4ОО
tff
Zn, % fro массе)
2O 30 40 5О 60 7О 00 30 fOO
—(
г
1
I
(Мо)+Газ
9О7°
(мф-ж
(
мо)
МоI
I
I
I
575±2°
1
111"
93,
1
о w го so to so во 70 во 9о too
А/0 Z/r, % /а/Г/.) 2/т
Гис. 232. Mo-Zn
470
Mo-Zn, Mo-Zr
наличием двух соединений MoZn7 и MoZn2->. Соединения образуются
по перитектическим реакциям при 573±2 и 463±2 °С соответственно-
предполагается, что при этих температурах расплав содержит 1,46-10
и 5,2-10~3 % (ат.) Мо соответственно. Перитектика Ж + MoZn22-* (Zn)
образуется при -419 "С; в расплаве содержится 1,6-1 (Г3 % (ат) Мо.
Взаимная растворимость элементов практически отсутствует (контроли-
(контролируется дефектами) [2].
Кристаллическая структура соединений системы Mo-Zn приведена
в табл. 205.
Таблица 205 Кристаллическая структура соединений системы Мо—Zn
Соединение
MoZn7
MoZn22
Символ
Пирсона,
пр гр
cFll
Fmim
cF440,
Рссп
или
Peel
Параметры решетки, нм
а
0,772-0,773
1,841
0,6510
Ь
-
1,0633
с
-
-
0,9205
Источник
[Э, 1,3]
[3]
[4]
Литература
1 Neumann Т., Schleichcr H., Venker Н. // Z Metallkunde 1969 Bd 60 S 438-441
2 Brewer L., Lamoreaux R.H. // Atomic Energy Review, Special Issue N 7 Molybdenum
Physico-chemical properties of its compounds and alloys Vienna International Atomic Energy
Agency, 1980 P 195-356
3 Toussaint C.J., Venker H.//Acta Crystallogr Sec В 1968 V 24 P 743
4 Samson S.//Acta Crystallogr Sec В 1968 V 24 P 1567
К Б Поварова
Mo - Zr. МОЛИБДЕН - ЦИРКОНИЙ
Взаимодействие Мо с Zr исследовалось рядом авторов [X, Ш, Э].
Диаграмма состояния построена по данным микроструктурного,
рентгеновского, термического анализа сплавов, приготовленных из Мо
чистотой 99,9 % (по массе) и иодидного Zr [1]. В системе (рис 233)
образуется одно соединение Mo2Zr и твердые растворы Zr в Мо и Мо
в низко- и высокотемпературной модификациях Zr [1-3, X, Ш] Обзоры
Mo-Zr
471
Zr, e/a/fro массе)
, о to го зо w 50 во 70 во so too
c i—i i m ii—n n i i i
12OO
800
О to 20 30 40 50 60 7O 8O SO Ю0
MO Zr,%/a/T7.) Zr
Рис. 233. Mo-Zr
литературных данных по диаграмме состояния приведены в работах [4,
5]. Отмечено, что основные различия касаются установления границ
растворимости элементов друг в друге и характера взаимодействия
Mo2Zr с (pZr).
Mo2Zr образуется по перитектической реакции из (Мо) и расплава
c42±2%(aT.)Zr[2,4]npn 1900-1910 °С [1] или 1950±40 "С [2, 3], имеет
узкий интервал гомогенности вблизи 33,3 % (ат.) Zr [2], хотя в ряде работ
указывалось, что интервал гомогенности простирается от 33,3 до -40 %
, (ат.) Zr [Ш], -36 % (ат.) Zr [3], -30-35 % (ат.) Zr [1]. Растворимость Zr в
(Мо) при температуре перитектики достигает 10 % (ат.) при 1900 °С [1],
или 18±1 %(ат.) при 1950 °С [2]. Последнее значение превышает значения,
сообщаемые другими авторами [X, 4]. Поданным работы [X] при 600 "С
в (Мо) растворяется 7 % (ат.) Zr; однако термодинамическая оценка этой
величины, проведенная в работе [5], показала, что она сильно завышена,
так как предполагает нереально большое значение отрицательной
энтальпии. В работе [X] сообщается, что в (Мо) при 1100 °С растворяется
4± 1 % (ат) Zr. Это значение более удовлетворяет уравнению, предложен-
предложенному в работе [5] для описания границы растворимости Zr в (Мо)
lnx = -3370/Г+ 0,142 - 8,2-10 Т+ З.
где л - атомная доля Zr, T- температура, К.
± 0,04,
472 Mo-Zr
По данным работ [2, 3, X] между Mo2Zr и (pZr) образуется эвтектика
при температуре 1500 °С и концентрации 37 % Мо [1]. Однако в более
поздних и детальных исследованиях [2, 3] было установлено, что при
температуре 1573130 °С протекает перитектическая реакция Mo-,Zr +
+ Ж** (PZr) На кривых солидус-ликвидус (pZr) имеется минимум при
концентрации 28± 1 % (ат) Мо при температуре на 20 СС ниже температу-
температуры перитектики Растворимость Мо при температуре перитектики
составляет в расплаве 32±1 % (ат.), в (pZr) - 34,5±1,0 % (ат.) Мо [2]. В
работе [6] получено более высокое значение растворимости D1 % (ат.)
Мо) Растворимость Мо в (pZr) может быть описана уравнением"
Ых = -3370/Г + 1,643-10'2 - 4,239-10 Т - 1,19-10"8 Тг,
где х - атомная доля Мо; Г- температура, К
Введение Мо снижает температуру полиморфного превращения Zr
до -630 °С [1] или 738±15 "С [2, 7]. Состав эвтектоидной точки соотве-
соответствует -8 % (ат.) Мо [1], или 7,5± 1 % (ат) Мо [2] Предел растворимости
Мо в (aZr) может быть рассчитан по уравнению
х = -3,8-1(Г3 + 5,7-1(Г67\
где л - атомная доля Мо, Г- температура, К.
При температурах ниже 400 °С растворимость Мо в (aZr) падает ниже
10-2%(ат)
Значения параметра ОЦК решетки (Мо) в зависимости от содержания
Zr приведены ниже
а, нм 0,3141 0 315 0 3157 0,3165
Zr,%(aT) 0 3 5,5 11
Сплав с 11 % (ат ) Zr после отжига при 650 °С был двухфазным.
Mo2Zr имеет структуру типа MgCu2 (символ Пирсона cFIA, пр. гр
Fd3m), а = 0,7587 нм для сплава с 33,48 % (ат.) Zr, отожженного при
1800 °С; а = 0,7587 нм для сплава с 33,52 % (ат.) Zr, отожженного при
1700 °С, а - 0,75888 нм для сплава с 33,8 % (ат) Zr, отожженного при
1750 °С [X, 4-6] Сплав Zr с 0,4 % (ат.) Мо (aZr) имеет ГПУ решетку с
а = 0,3173 нм, с = 0,5141 нм по сравнению са = 0,3174 нм, с = 0,5161 нм,
для нелегированного Zr [7]. Установлено, что при закалке сплавов с 3-8 %
Мо образуется метастабильная фаза ы, которая имеет тетрагональную
решетку [X]
Лтература
1 Свечников В.Н , Спекгор А.Ц. Фазовые превращения Киев Наукова Думка, 1967
С 123-128
Mo-Zr, N-Na, N-Nb 473
2 Rudy E. Compendium of Phase Diagram Data //Air Force Materials Laboratory, Wright-
Patterson AFB, Ohio, Rept N AFML-TR-65-2, Part V June 1969 P 154-156
3 Garg S.P., Ackermann R.J.//Metall Trans 1977 V 8A P 239
4 Kubashewski-von Coldbeck O. // Atomic Energy Review, Special Issue N 6 Zirconium
Physiko-chemical properties of its compounds and alloys Vienna International Atomic Energy
Agency, 1976 P 67-140
5 Brewer L., Lamoreaux R.H. // Atomic Energy Review, Special issue N 7 Molybdenum
Physico chemical properties of its compounds and alloys Vienna International Atomic Energy
Agency, 1980 P 195-356
6 RappO.//J Less-Common Met 1971 V 21 P 27
7 Самсонов Г.В., Браун СМ., Рогозинская А.А. // Известия высших учебных заведений
Цветная металлургия 1972 № 6 С 118-122
КБ Поварова
N - Na. АЗОТ - НАТРИЙ
8 системе установлены два нитрида Na (Na3N, NaNj) и азид №(N3J
Нитрид Na3N распадается при 300 °С Нитрид NaN3 плавится без
разложения, имеет ромбоэдрическую решетку (символ Пирсона hR4, пр
гр R3m) с параметрами а = 0,544 нм, а = 38,7° [Ш] или а = 0,5481 нм, а =
= 38,7° Р]. При температуре 19±1 °С NaN3 испытывает превращение в
ромбическую модификацию [Э, Ш]
Л Л Рохлин
N - Nb. АЗОТ - НИОБИЙ
Результаты исследования фазовых равновесий в системе Nb-N
обобщены в работах [Э, 1,2] Вместе с тем полный вариант диаграммы
состояния этой системы получить не удается, поскольку равновесное
состояние в системе очень чувствительно к примесям и давлению N
На рис 234 приведена диаграмма состояния N-Nb [Э]. Диаграмма
построена по данным металлографического, рентгеноструктурного и
химического анализов сплавов, полученных дуговой плавкой или
диффузионным насыщением N порошков или полос Nb./7-Гдиаграммы
системы Nb-N, ее изобарные и изотермические сечения приведены в
работах [1, 2]
В системе N-Nb помимо а твердого раствора N в Nb установлено
существование соединений Nb2N(C), Nb4N3(y), NbN трех модификаций
б, б', е [Э. 1,3,4] Фаза Nb4N3 лежит внутри области гомогенности NbN,
а фаза б' нестабильна, поэтому указанные фазы не нанесены на рис 234
В работах [5, 6] обнаружено существование еще трех соединений
Nb4Nv Nb<;N6 и Nb32Nv которые также не представлены на рис 234
474
N-Nb
.о г
цо/о /по массе)
б в то ts
о то го so <ю so бо 70 во до too
N6 N, °/о/am.) n
Рис. 234. N-Nb
Растворимость N в твердом Nb описывается уравнениями [2]:
\%х ~ 0,5 \%р - 3,1 + 9300/Гв интервале температур 1500-2200 °С;
igx = 0,06 - 875/Тв интервале температур 450-800 "С,
где х - концентрация N, % (ат.),р - давление, МПа, Т- температура, К.
Растворимость N в жидком Nb описывается уравнениями [2]:
Igx = 0,5р + 0,28 при концентрации N < 15 % (ат.) и температуре
2350°С;
lgjc = 3,17 - 4920/Гв интервале температур 1500-2200 °С.
Твердый раствор на основе Nb имеет ОЦК структуру, параметр
решетки которого при комнатной температуре описывается выражением
а - 0,3299±0,006 % (ат.) N (в интервале концентрации 0 - 0,67 % (ат.) N)
[9]. В работе [7] приводится значение а = 0,3041 нм при концентрации 1 %
(ат.) N, а в работе [8] указывается, что параметр решетки зависит от
температуры и давления N.
Нитрид Nb2N(C) имеет область гомогенности в пределах концентра-
концентраций 28,6-34,4 % (ат.) N [Э], 28-31 % (ат.) N [2]. Давление диссоциации
Nb2N в интервале температур 1500-2200 °С описывается уравнением
Igp = 12,6 - 28400/Г[2].
N-Nb
475
Область гомогенности нитрида Nb4N3(v) находится в интервале
концентраций 43,9-44,5 % (ат.) N [Э, 2]. Фаза у стабильна во всем
интервале температур от комнатной до 1500 "С.
Состав фазы б изменяется в интервале концентраций 46,9-47,7 % (ат.)
N [1, Ш]. При высоких температурах фазы у и б могут превращаться одна
в другую. При температурах от 1250 до ~ 1500 "С существует двухфазная
область, при более высоких температурах образуется непрерывный
твердый раствор (у, 5) [1]. Зависимость состава твердых растворов (у, 5)
от температуры и давления N приведена в работе [6].
Фаза (б) стабильна при температурах выше 1250 "С, при более низких
температурах она переходит в фазу б', содержащую 48,8-49,0 % (ат.) N
Р]. Фаза б' нестабильна, чувствительна к давлению N и легко может
превращаться при низких давлениях N в фазу у, а при давлениях N выше
0,1 МПа-вфазуер].
Фаза в имеет область гомогенности в интервале концентраций
48-50,6 % (ат.) N, стабильна при температурах ниже 1350-1370 "С, при
более высоких температурах обедняется N и превращается в фазу б [1].
При азотировании тонких слоев Nb в NH3 были обнаружены
соединения Nb4N5 и Nb5N6. Отмечается, что при нагреве происходит
превращение Nb5N6 в б', б, у, р и е фазы [4].
При электронно-микроскопическом исследовании монокристалли-
монокристаллических образцов Nb, отожженных при 280-380 "С, в разреженной
атмосфере N F,65-10~8 МПа) обнаружен еще один нитрид Nb32N3 [6].
Элементарная ячейка характеризуется незначительной тетрагональнос-
тью.
Кристаллическая структура нитридов Nb представлена в табл. 206.
Таблица 206 Кристаллическая структура соединений системы N—Nb
Соединение
Nb2N(p)*
Nb4N3(Y)
NbNF)
NbNF)
Прототип
-
-
NaCl
Анги-
NiAs
Символ
Пирсона,
пргр
-
Г/16,
Wmmm
сП,
Fmim
hP4,
РЬ^/ттс
Параметры
а
0,3057-
-0,3050
0,4385
-0,4386
0,4373-
-0,4393
0,2968
0,2967
решетки, нм
с
0,4957-
0,5005
0,4311-
-0,4335
-
0,5549
0,5538
Источник
[3]
[Ш]
[1,2, Ш]
[Э]
[4]
476
N-Nb, N-Nd
Соединение
NbN(e)
Nb4N5
Nb5N/
Прототип
MoC
Ta4N5
—
Символ
Пирсона,
пр.гр.
Ш2,
Рб^/ттс
141т
—
Гексагональная сингония.
Параметры решетки, им
а
0,29591
0,6873
0,5193
с
1,12714
0,4298
1,038
Источник
[Э]
[4]
М
Литература
1. ЛевинскиП Ю.В. Диаграммы состояния металлов с газами М.: Металлургия, 1975.
295 с.
2 Фромм Е., Гебхард Е. Газы и углерод в металлах: Пер. с иемецк. / Под ред.
Б В Линчевского М.: Металлургия, 1980 712 с
3. Самсонов Г.В. Нитриды. Киев: Наукова думка, 1969. 380 с.
4 TeraoN.//J Less-Common Met. 1971. V 23 P. 159-169
5 Otrii G., Steeb S. // Z. Metallkunde. 1975 Bd. 66. N 8. S. 460-462
6. Шурик А.Г., Томилин И.А.// Журнал физической химии. 1971 Т. 41. N8.
С. 2049-2052.
7 GebhardtE., DiirrschnabelW., HorzG.//J. Nucl. Mater. 1966. V. 18 P 119-133.
8 Taylor A., Doyle N.J.//J. Less-Common Met 1967 V. 13. P. 399-412.
9. Волков А.К., Кнзии И.Н., Рожнов а Т.М., Штремель М.А. // Физика металлов и
металловедение. 1971. Т. 31. Вып. 2 С. 330-334.
Е.Н. Шефтель
N - Nd. АЗОТ - НЕОДИМ
Диаграмма состояния системы N-Nd не построена. Соединение NdN,
содержащее 8,85 % (по массе) N, имеет структуру типа NaCl (символ
Пирсона сРЪ, пр. rp. Fmbm, а - 0,525 нм [X, Э] или а = 0, 5128 нм) [Ш].
NdN находится в равновесии с твердым раствором на основе Nd и
диссоциирует при температуре -1600 °С [Ш].
С П. Алисова
N-Ni
477
N - Ni. АЗОТ - НИКЕЛЬ
Диаграмма состояния N-Ni не построена. Имеются данные о
существовании нитридов Ni3N, Ni4N, Ni3N2 и азида Ni(N3J [X, Э, 1].
Установлено, что Ni3N разлагается при нагреве в вакууме при 480 °С,
превращается непосредственно в Ni [4]. Согласно работе [5] Ni4N
образуется при температуре 230-240 °С.
Растворимость N в твердом и жидком Ni незначительна [X, Э, 1].
Химическим анализом нитрированной пленки Ni получено значение
растворимости менее 0,0018 % (ат.) N в твердом состоянии [Э]. В жидком
состоянии растворимость N в Ni при 1600 °С определена равной
0,001-0,0025 % (по массе) по данным различных авторов [Э]. При этом
первое значение определено с ошибкой 0,001 % (по массе) [2].
Кристаллическая структура нитридов Ni представлена в табл. 207.
Таблица 207 Кристаллическая структура соединений системы N-Ni
Соединение
Ni3N*
Ni4N**
Параметры решетки, нм
а
0,2670
0,2668
0,26677
0,266
0,372
Гексагональная сингония.
'Тетрагональная сингония
с
0,4307
0,4294
0,43122
0,434
0,728
Источник
[X]
И
[3]
М
[5]
Литература
I. Вол А.Е. Строение и свойства двойных металлических систем. М.: Физматгиз, 1959.
Т I 756 с.
2 Humbert J.C., Elliott J.F.// Trans. A1ME. 1960. V. 218 N 6. P. 1076-1088.
3 Jack K.H. // Acta Crystallogr. 1950. V. 3. P. 393-395.
4. Bush Т., Dodd R.A. // Trans A1ME. 1960. V. 218. P. 488-490.
5 Terao N. // J. Phys. Soc Japan. 1960. V. 15. N 2 P. 227-230
Л Л Рохлин
478 N-Np, N~Os, N-Pa
N-Np. АЗОТ-НЕПТУНИЙ
Диаграмма состояния N-Np не построена.
Известно, что существует соединение NpN, которое при давлении
азота 0,1 МПа разлагается при температуре 2675±20 "С, а при давлении
азота примерно 1 МПа конгруэнтно плавится при 2830±30 "С [1].
NpN обладает структурой типа NaCl (символ Пирсона cF0>, пр. гр.
Fmlm), а = 0,4987 нм [X].
Литература
1. Olson W.M. // U.S. At. Energy Comm ANL-6856. 1964. P. 10-11.
В.Н Кузнецов
N-Os. АЗОТ-ОСМИЙ
Диаграмма состояния N-Os не построена. Имеется сообщение о
получении нитрида Os с ОЦК решеткой, а = 0,345 нм [1]. Возможно,
соединение Os2N метастабильно.
Литература
1. Киперман С.Л., Грановская В.Ш. // Журнал физической химии. 1951. Т. 25. N 5
С.557-564
В.Н. Кузнецов
N-Pa. АЗОТ-ПРОТАКТИНИЙ
Диаграмма состояния N-Pa не построена. Получены сведения о
существовании двух соединений: нитрида PaN2, аналогичного UN2 [1]
и PaN, имеющего структуру типа NaCl (символ Пирсона cF&, пр. гр.
Fmlm) [Ш].
PaN стабилен при температуре до -1727 "С (давление пара <10~2 Па)
и разлагается при 2227 °С (давление пара >1 Па).
Так как PaN2 получен при взаимодействии РаС14(РаС15) и NH3, то
неясно, существует ли этот нитрид при давлении азота примерно
0,01 МПа в равновесных условиях [1].
Литература
1. Вол А.Е. Строение и свойства двойных металлических систем. М.: Физматгиз, 1959
Т 1 756 с
В.Н Кузнецов
N-Pb, N-Pd
479
N-Pb. АЗОТ-СВИНЕЦ
Диаграмма состояния N-Pb не построена. Характер взаимодействия
РЬ и N требует систематического изучения. Получены данные о
существовании нитрида Pb3N4 и азидов Pb(N3J, Pb(N3L [Э] и PbN3 [1].
Сообщается о существовании PbN6 в двух модификациях (Э].
Кристаллическая структура соединений РЬ с N представлена в табл.
208.
Таблица 208. Кристаллическая структура соединений системы N-Pb
Соедине-
Соединение
aPbN/
pPbN,"
Прото-
Прототип
aPbN6
Символ
Пирсона,
пр.гр.
oPU,
Рпта
* Ромбическая сиигония.
** Моноклинная сингоиия.
Параметры решетки, нм
а
0,663
0,6628
0,5090
1,849
Ь
1,625
1,1312
0,8844
0,884
с
1,131
1,6246
1,7508
0,512
Примечание
[2]
[Э]
Р = 90,17°[Э]
Р= 107,58°[Э]
Литература
1 Иванов Ф.И., Зуев Л.Б., Лукии М.А. и др.//Кристаллография 1983 Т 28. Вып. 1.
С 194-195.
2 Choi C.S., Prince Е., Garrett W.L.//Acta Crystallogr. В. 1977 V. 33. N 12. P. 3536-3537.
3 AzaroffV.//Z Knst. 1956. Bd 107 S. 362-369.
N-Pd. АЗОТ-ПАЛЛАДИЙ
В П. Полякова
Взаимодействие N с Pd практически не изучалось. Pd при температу-
температурах вплоть до 1400 "С не растворяет N [X, 1]. Однако дегазированный
в высоком вакууме Pd поглощает значительное количество N B80
объемов N на 1 объем Pd). Отмечено, что небольшое количество нитрида
Pd образуется в атмосфере N между электродами из Pd.
Литература
1 Савицкий Е.М., Полякова В.П., Горниа Н.Б., Рошан Н.Р. Металловедение плати-
платиновых металлов М Металлургия, 1975, 424 с
В П Полякова
480
N-Pr, N-Pu
N-Pr. АЗОТ-ПРАЗЕОДИМ
Диаграмма состояния N-Pr не известна. Установлено, что в системе
существует нитрид PrN [X, Э, Ш]. Кристаллическая структура PrN типа
NaCl (символ Пирсона cF&, пр. гр. Fmlm) а = 0,5165 нм [Э] или а =
= 0,5147F) нм [1]. В работе [2] изучено влияние температуры на изменения
параметра а решетки PrN в интервале температур 100-700 °С.
Литература
1. Dancy E.A., Everett L.H., McCabe C.L.//Trans. AIME. 1962. V. 224. N 6. P. 1095-1104.
2. EssenVonU., KlemmW.//Z. Anorg. All. Chem. 1962. Bd. 317. N 1. S. 25-34.
В.П. Полякова
N-Pu. АЗОТ-ПЛУТОНИЙ
Ориентировочная диаграмма состояния системы N-Pu (рис. 235) в
интервале концентраций 0-55 % (ат.) N при давлении 0,1 МПа, построена
на основании анализа опубликованных экспериментальных данных [1].
Предполагается, что соединение PuN плавится конгруэнтно при 2830 °С
[1] или >2770 °С [Ш]. PuN при давлении N2, равном 0,1 МПа, диссоцииру-
диссоциирует при температуре 2584±30 "С [2], 2556±15 °С или 2627 "С при
"атмосферном давлении" [Ш].
N, % /помассе)
, _ о t г з « 5
2500
гооо
i500
woo
ftt'PuJ
/
{
•— (?Pul
a— UJPUI
Щ— 'КЗС'
2— \/a%!j i
1
J LI
i
1
1
1
1
¦0°
"-?83"
^зго^чез"
\
1
1
влг°
О 5
PU
Рис. 235. N-Pu
fO fS 20 25 SO Jff 40 «5 SO S5
ty'/efem.)
N-Pu. N-Ra. N-Rb 481
Соединение PuN имеет кристаллическую структуру типа NaCl (символ
Пирсона cF8, пр. гр. Fmlma- 0,4905 нм Щ, 0,49055 нм [2], 0,49049 нм
[3, 4]).
Характер полиморфных превращений со стороны Ри и область
гомогенности соединения PuN требуют более детального эксперимен-
экспериментального изучения.
В работе [5] построена/>-Т-х диаграмма системы Pu-N при давлениях
1-1000 Па и в интервале температур 1127-3127 "С.
Литература
1. Wriedt H.A.//Bull. Alloy Phase Diagrams. 1989. V. 10. N 5. P. 593-602.
2. Olson W.M., Mulgord R.N.R7/J. Phys. Chem. 1964. V. 68. N 5. P. 1048-1051.
3. Anselin F./;Compt. Rend. 1963. V. 256. N 12. P. 2616-2619.
4. Tadasumi M.//J. Nucl. Sci. and Technol. 1982. V. 19. N 10. P. 852-854.
5. Alexander C.A., Clarck R.B., Kruger O.L. et al.//Plutonium 1975 and other Actinides. Proc.
5th Int. Conf., Baden-Baden, 1975. Amsterdam, 1976. P. 277-286.
В.П. Полякова
N-Ra. АЗОТ-РАДИЙ
Взаимодействие Ra с N практически не изучено. Химическим путем
получено соединение с формулой Ra3N2 или Ra^^, которое распадает-
распадается на N и Ra при нагреве в вакууме при 180-250 "С [Э].
В.П. Полякова
N-Rb. АЗОТ-РУБИДИЙ
Диаграмма состояния N-Rb не изучена. Предполагается, что
растворимость N в жидком Rb незначительна [1].
Установлено существование RbN3 с 32,96 % (по массе) N и Rb3N с
5,18% (по массе) N[2,3].'
RbN3 получен прямым синтезом рубидия с азотом [Э].
Установлено, что RbN3 имеет тетрагональную решетку, а = 0,637 нм,
с = 0,742 нм [3] или а - 0,4497 нм, с = 0,3707 нм [Э]. Следует отметить, что
приведенные элементарные ячейки отличаются только центрированным
базисом и удвоенным значением параметра с (Э].
Литература
1. Barker M.G.//Handbook of Thermodynamic and Transport Properties of Alkali Metals.
Oxford: Blackwell Scientific Publications, 1985. P. 897-899.
482 N-Rb. N-Re, N-Sb
2. Вол А.Е. Строение и свойства двойных металлических систем. М.: Физматгиз, 1959.
Т. 1.756 с.
3. Pauling L.//Z. Physic. Chem. В. 1930. Bd. 8. S. 326-328.
Л.Л. Зусман
N-Re. АЗОТ-РЕНИЙ
Растворимость N в Re определяли насыщением N проволоки из Re
диаметром 0,3-1 мм в течение 10 мин в интервале температур
1600-3000 "С и при давлении 20-80 МПа. Растворимость N в Re весьма
мала и составляет 0,6-10~3 - 1,5-10~3 % (ат.) при давлении 0,1 МПа.
Кривая растворимости в интервале температур 2000-2750 °С описывается
уравнением:
jcIO = v/0,52p ехр(-1600/Д7Х A)
где х - концентрация N, % (по массе), Т- температура, К.
N не взаимодействует с Re при нагреве до 900 "С в течение 4 ч [2, 3].
Методом нагрева перрената аммония в NH3 при 300-350 °С получен
нитрид ReN0 43 с ГЦК решеткой (а - 0,392 нм). Указывается также на
образование нестабильных нитридов ReN2 и Re3N, диссоциирующих при
температуре 280 °С в вакууме и, по-видимому, обладающих широкими
областями гомогенности [2, 3].
Литература
1. Jehn H., Hohloch K.D., Fromm E.//J. Less-Common Met. 1972. V. 27. N Г. Р. 98-100.
2. Hahn H., Konrad A.Z.//Z. Anorg. All. Chemie. 1951. Bd. 264. N. 2-4. S. 174.
3. Самсонов Г.В., Верхоглядова Г.С .//Украинский химический журнал. 1964. Т. 30.
Вып. 2. С. 143-146.
М.А. Тыпкина
N-Sb. АЗОТ-СУРЬМА
Данные по диаграмме состояния N-Sb отсутствуют. Нитрид,
которому приписана формула SbN, получен при дуговом разряде между
Sb-электродами в азотсодержащей атмосфере \Э].
Ю.Б. Кузьма
N-Sc, N-Se. N-Si 483
. АЗОТ-СКАНДИЙ
Взаимодействие N с Sc не изучено. Нитрид ScN имеет температуру
плавления 2650 °С [Э]. Кристаллическая структура ScN типа NaCl
(символ Пирсона cF8, пр. гр. Frnbmа = 0,445 нм JX], а = 0,4499 нм [1],
а = 0,449 нм [2]).
Литература
1. Лютая М.Д., Бухаиевич В.Ф.//Журнал неорганической химии. 1962. Т. 7. N II.
С. 2487-2994.
2. Nowotny H., Auer-Welsbach H.//Monatsh. Chem. 1961. Bd. 92. S. 789-793.
Л.Л. Рохлин
N^Se. АЗОТ-СЕЛЕН
Диаграмма состояния N-Se не построена. В системе идентифицирова-
идентифицировано одно соединение Se4N4. Структура Se4N4 принадлежит к типу AsS
(символ Пирсона тРЪ1, пр. гр. Р2х1с), а - 0,965, Ъ - 0,973, с = 0,647 нм,
Р = 104,9° [1]. В элементарной ячейке четыре молекулы Se4N4.
Литература
l.BarnighausenH.,VolkmannT.,JanderJ7/ActaCrystallogr. 1966. V. 21. N 3. Р. 571-577.
Ю.Б. Кузьма
NSi. АЗОТ-КРЕМНИЙ
Распределение N в твердом и жидком Si вблизи температуры
плавления Si с помощью методов активационного анализа или
инфракрасной спектроскопии и электросопротивления было измерено
в работах [1, 2]. На основе этих результатов в обзоре [3] построена
частичная диаграмма состояния системы Si-N для исчезающе малых
концентраций N (рис. 236).
Растворимость N в жидком Si при эвтектической температуре
(-1414 °С) составляет 0,012 % (ат.), в твердом Si - 910~6 % (ат.) [1], по
данным работы [2] при этой же температуре растворимость N в жидком
Si равна 0,02 % (ат.), в твердом Si - 2-10~^% (ат.).
Достоверно установлено существование соединения Si3N4, которое
разлагается при нагреве до 1800 °С, и находится в равновесии с жидким
Si в интервале температур 1800-1414 "С. Si3N4 существует в двух
484
N-Si
* °c l
Г414"
тз,9в
,90
1413,94
Г413,9г
7
Л
0
Рис. 236. N-Si
2 4 6
1
т
IBS
\
(Si)
/
1
4 8 12
У ч
xt0~6
М,°/о(по
(S
цат
»
U+SjMi
0,006
массе)
0,005 0,006 0,007
t
m+i
~f41?l
0,0f Ц012 O,t
°/<>(am.)
71*
0,008
*
I
0,016
модификациях, температура превращения составляет 1300-1450 "С \Э].
Кроме того, сообщается о соединениях SiN, Si2N3 и Si3N [Ш], SifN^ \Э]
Кристаллическая структура нитридов Si приведена в табл 209.
Т а б л и ц а 209 Кристаллическая структура соединений системы N-Si
Соединение
SiN
«Si3N4*
pS.3N4
Прототип
ZnS
«Si3N4
PS.3N4
Символ
Пирсона,
пргр
hP4,
Р6ъ1тс
hPZS,
Р3\с
Р6Ъ
* Метастабильная фаза
Параметры
а
0,317
0,7818
0,7595
зешетки, нм
с
0 505
0,5591
0,29025
Источник
[4]
[5]
И
Литература
1 Yatsurugi Y., Akiyama N., Endo Y. // J Electrochem Soc 1973 V 120 P 975-979
2 Kaiser W., Thurmond CD.//J Appl Physics 1959 V 30 P 427-431
3 Carlson O.N.//Bull Alloy Phase Diagrams 1990 V 11 N6 P 569-573
4 ArroHsmith J.M //J Iron Steel lust 1963 V 201 P 699-701
N-Si, N-Sm, NSn. NSr 485
5 Kato K., Ihoul Z., Kijima K., Kasada I., Tanaka H. // J Amer Ceram So с 197S V 58
P 90-91
6 Grim R. // Acta Crystallogr В 1979 V 35 N 4 P 800-804
А С Адамова
N-Sm. АЗОТ-САМАРИЙ
Диаграмма состояния системы не установлена. Единственный нитрид
SmN обладает структурой типа NaCl (символ Пирсона cF%, пр. гр РтЪт,
а = 0,50481 нм)[Э]
Ю Б Кузьма
N-Sn. АЗОТ-ОЛОВО
Взаимодействие N с Sn специально не изучалось. В системе N-Sn
образуется нитрид Sn3N4, который разлагается при 360 "С [X, Э]
Л Л Рохлин
N-Sr. АЗОТ-СТРОНЦИЙ
Диаграмма состояния N-Sr не изучена. В системе N-Sr установлено
образование шести соединений' Sr2N \Э], SrgN5 [I], Sr3N2 [Э], SrN [2],
Sr3N4P],Sr(N3JP].
Соединение Sr3N2 получено нагревом Sr в атмосфере N2 или NH3 и
разложением азида Sr(N3J в высоком вакууме, плавится при 1030 °С [Э].
Реакция взаимодействия Sr с N2 начинается при температуре 380 °С.
Пернитрид Sr3N4 был получен нагревом амида Sr в вакууме, его
температура плавления определена равной 1027 °С [4]. Азид Sr(N-5J6bm
получен препаративным способом, взрывается при нагреве до 169 °С \Э],
я. субнитрид Sr2N был получен разложением Sr3N2 в вакууме при
Давлении 0,13 Па и температуре 450-500 °С [3].
Кристаллическая структура соединений системы Sr-N приведена в
табл 210
486
N-Sr, N-Ta
Таблииа2!0. Кристаллическая структура соединений системы Sr-N
Соедине-
Соединение
Sr8N/
SrN
Sr(N3)"
Sr3N2"*
Прото-
Прототип
-
NaCl
-
Ba3N2
Символ
Пирсона,
пр.гр.
-
сП,
Fmim
-
-
Параметры решетки, нм
а
0,719
0,5495
1,182
-
Ь
0,385
_
1,147
-
с
0,665
_
0,608
-
Источник
[1]
[2]
[Э]
[Э]
* Моноклинная сингония, р = 108°. Область гомогенности 35,4-38,6 % (ат.) N.
Ромбическая сингония.
Псевдогексагональная сингония.
Литература
l.GaudeJ., Lang 3.11 Rev. Chim. Minerale. 1970. N 7 P. 1059-1067
2 Garvie R.C. // High Temperature Oxides Part II. New York: Academic Press, 1970.
P. 117-166.
3. Ария СМ., Прокофьева Е.А., Матвеева И.И. // Журнал органической химии. 1955.
Т 25 N 4. С. 634-638.
4. Ehrlich P., Hein H.J. // Z. Electrochem. 1953. Bd 57 N 5. S. 710-714.
Л.Л. Зусман
N-Ta. АЗОТ-ТАНТАЛ
Систему N-Ta исследовали методом рентгеновского и микроструктур-
микроструктурного анализов. На рис. 237 представлена диаграмма состояния N-Ta, на
которой указаны границы твердого раствора N в Та и области
гомогенности соединения Ta2N [Э]. Однако данная диаграмма не является
абсолютно достоверной, так как кроме соединения Ta2N с 29,1-33,3 %
(ат.) N в системе обнаружены соединения б или TaN_0 g0_0 90 с 44,5-47,5 %
(ат.) N, TaN с 50 % (ат.) N [1-3], р или TaN0 05 с - 5 % (ат.) N[1,2,4], Ta27N
с 0,1-4,0 % (ат.) N [Ш], Ta9N2 с -7 % (aT.)'N [4], Ta3N с 25 % (ат.) N [2].
В работах [X, Э] сообщается также о соединениях Ta3N5 и TaN2,
однако в работах [1, 3] они не были обнаружены.
В работе [2] исследовано различное соотношение появляющихся
промежуточных фаз, зависящее от температуры азотирования. Так, при
N-Ta
487
N,%/по массе)
f 2 3
гооо
то
гооо
soo
о
Та
Рис. 237. N-Ta
(Га) /
/
/
I
/
f
i
i i
\
ЬагМ
\
\
/О
го.
N,Vo(am.)
30
температуре ниже 1000 "С основным продуктом реакции является Ta2N.
При повышении температуры увеличивается доля TaN0 8-0 9 и TaN, а еще
при более высоких температурах наблюдается появление в п-
ов'ерхностном слое TaN0 65 и Ta3N. В работе [4] установлено образование
нитрида Ta2N при температурах выше 790 "С, а также указано, что
нитриды, содержащие -5 и -7 % (ат.) N устойчивы при температурах
600-750 °С и 450-500 °С соответственно.
Растворимость N в (Та) по данным различных исследований в
зависимости от температуры приведена ниже:
Температура,
°С
Растворимость
N, % (ат.) . . .
Источник
350
0,45
[5]
500
1,0
[5]
600
-0,3
[Ш]
1000
4,0
[3]
Кристаллическая структура нитридов Та представлена в табл. 211.
488
N-Ta
Таблииа211. Кристаллическая структура соединений системы N-Ta
Соединение
TaN0;0S
Ta27N*
Ta2N,-
Ta2N"
TaN**
Прототип
-
TaN005
-
-
—
Символ
Пирсона,
пр.гр.
-
-
-
НР6,
/•62т
—
Кубическая сингония.
Гексагональная сингония
Параметры решет-
решетки, нм
а
0,0 !0
0,010
0,3361
0,305
0,3041-
0,3048
0,3048
0,2925-
0,2933
0,5185
с
-
-
-
0,493
0,4907-
0,4918
0,4919
0,2876-
0,2883
0,2908
Примечание
[1]
Атомы N располагают-
располагаются в тетраэдрических
порах [Ш]
[4]
При 28,6-31,0 %(aT.)N
[X]
[И
При 33,3 %(aT.)N
[3]
[И
Три формульные еди-
единицы на элементарную
ячейку [!, 3]
Литература
1. Sh6nberg N. // Acta Chem. Scand. 1954. V. 8. P. 199-203.
2. Osthagen K., Kofsttd P. // J. Less-Common Met. 1963. V 5. N 1. P. 7-25.
3. BrauerK., ZappK.H.//Z. Anorg. All. Chem. 1954. Bd 277. S. 129-139.
4 Geils R.H., Potter D.J.//Met. Trans. 1973 V 4. N 6. P 1469-1474
5 Bunn P., Wert С // Trans AIME. 1964. V. 230. P 936-937.
E В Лысова
N-Tb, N-Tc. N-Te, N-Th 489
N-Tb. АЗОТ-ТЕРБИЙ
Диаграмма состояния N-Tb не построена. В системе установлено
образование нитрида TbN. TbN имеет кристаллическую структуру типа
NaCl (символ Пирсона cFi, пр.гр. Fmlm) с параметром а = 0,493 нм [1],
а = 0,4936 нм [2], а = 0,4933 нм [3].
Литература
I. Child H.R., Wilkison M.K., Cable J.M. et al. // Phys. Rev. 1963. V. 131. N 3. P. 922-931.
2 Busch G., Junod P., Vogt O., Hulliger F. // Phys. Letters. 1963. V. 6. P. 79-80.
3 Klemm W., Winkelmann G. // Z. Anorg. All. Chem. 1956. Bd. 288. N 1/2, S. 87-90.
Л.Л Рохлин
N-Tc. АЗОТ-ТЕХНЕЦИЙ
Диаграмма состояния N-Tc не построена.
При температурах 900-1100 °С Тс образует с азотом нитрид,
имеющий ГЦК структуру типа NaCl (символ Пирсона cF%, пр.гр. Fmlm)
с параметром решетки а = 0,3980-0,3985 нм в зависимости от содержания
азота. Максимальное содержание N в нитриде TcN соответствует 41,8 %
(ат.) [Ш].
Л.Л. Рохлин
N-Te. АЗОТ-ТЕЛЛУР
Диаграмма состояния N-Te не построена.
В работе [Э] сообщается о существовании нитрида Te3N4.
Л Л. Рохлин
N-Th. АЗОТ-ТОРИЙ
Диаграмма состояния N-Th (рис. 238) построена в интервале
концентраций 0-60 % (ат.) N в работе [1 ] на основе данных рентгенофазо-
вого, химического, микроструктурного и термического анализов при
давлении 0,3 МПа. Сплавы получены из Th чистотой 99,8 % (по массе).
Диаграмма состояния относится к перитектическому типу [1]. Реакция
Ж + ThN - (PTh) протекает при 1800±25 "С. Перитектоидная реакция
(pTh) + ThN - (aTh) наблюдается при 1605±20 °С. В системе образуются
490
N-Th
N, % fno массе)
Z500
2000
tmh
1500
/360'
(dTh) —
1000
9
ж
I/
1755°/e.Z
¦
I
«^
reoot?5<>
1605±2O°
i
^-—
'ft
7
\
WHO'
\
/v
/ \
I
3O W
f/,°/ofam.)
50
60
Рис. 238. N-Th
два соединения: ThN и Th3N4. ThN плавится конгруэнтно. Максимум
на кривой ликвидуса соответствует температуре 2820± 30 "Си концентра-
концентрации 49,75±0,5 % (ат.) N. По данным работы [2] ThN плавится при
2790±30 °С, что хорошо согласуется с данными работы [1].
ThN имеет область гомогенности от -46,5 до -52 % (ат.) N при
температуре 2000 "С [1]. ThN кристаллизуется в структуру типа NaCl
(символ Пирсона cF$, пр.гр. Fmbm, а = 0,521A) нм (X] или а =
= 0,5157A) нм[1]).
Соединение Th3N4 имеет узкую область гомогенности при температу-
температурах ниже -1800 °С. При 1960 °С граница области гомогенности со
стороны Th отвечает составу с 56,14 % (ат.) N. Th3N4 имеет ромбоэдри-
ромбоэдрическую решетку типа А14С3 (символ Пирсона hRl, пр.гр. R Ът, параметры
а - 0,3869B), с = 2,740B) нм).
Об образовании Th2N3 сообщалось в работе [X], однако по данным
работы [3] эта фаза идентична фазе Th2N2O, которая образуется при
окислении нитридов Th.
Литература
! BenzR., Hoffman C.G., Rupert G.N.//J Am Chem Soc 1967 V 89 N 2 P. 191-197
2 Olson W.M., MulfordR.N.R.//J Phys Chem 1965. V. 69 N4 P 1223-1226
3 BenzR.//J Am. Chem Soc 1967 V 89 N 2 P. 197-199
Л E UlemiMoea
N-Ti
49!
N-Ti. АЗОТ-ТИТАН
Диаграмму состояния N-Ti исследовали в ряде работ [1-5], многие
из которых посвящены уточнению отдельных элементов диаграммы
(рис. 239). Азот относится к группе элементов, значительно растворяю-
растворяющихся в (ccTi) и резко повышающих температуру а *•* р полиморфного
превращения Ti [1]. Азот, растворяясь в Ti, не только повышает
температуру его полиморфного превращения, но и температуру
плавления сплавов, которая при содержании -50 % (ат.) N достигает
3290 °С. При этой температуре плавится кубический нитрид TiNx (фаза
б). Этот нитрид имеет широкую область гомогенности, которая при
температуре 2350 ° простирается от 28 до 50 % (ат.) N.
Перитектическая реакция Ж + (ccTi)-» ([3Ti) протекает при 2020±25 °С,
а перитектическая горизонталь простирается от 4 до 12,5 % (ат.) N. При
температуре 2350±25 "С протекает перитектическая реакция Ж + б •*
(ccTi). Перитектическая горизонталь простирается от 15 до 28 % (ат.) N.
При температуре 2350 "С в (PTi) растворяется 20,5 % (ат.) N, а при
1050 "С- 23 % (ат.) N. При содержании -33 % (ат.) N при температуре
-1050-1100 °С образуется нитрид Ti2N (фаза е). В работах [6, 7]
полагают, что фаза е образуется по перитектической реакции при
1065±10°С.
В работе [2] сообщается, что при 800 °С по перитектоидной реакции
образуется еще один нитрид, о котором более подробно ничего не
сообщается.
/по массе)
Ю
о 5 га is го 25 зо ss to ts so
Рис. 239. N-Ti
492 N~Ti. N-Tl
Авторами работы [4] с использованием современных методов физико-
химического анализа предпринято повторное исследование диаграммы
состояния системы Ti-N. При 1495 °С зафиксирована область гомоген-
гомогенности фазы е в интервале составов с 26-34 % (ат.) N. Последнее
обстоятельство указывает, по мнению авторов работы [4], что нитрид
Ti2N образуется при гораздо более высоких температурах, чем считали
ранее [1].
Авторами работ [5] по результатам, полученным методом диффузион-
диффузионного насыщения азотом трубчатых образцов из Ti при температурах
1000-2165 °С с последующим отжигом при 1300 °С в течение 408-510 ч,
установлено, что растворимость N в (aTi) несколько выше значения,
указанного в работах [1-3]. Согласно работе [8] граница области
твердого раствора N в (aTi) изменяется от 23,1 % (ат.) N при 1150 °С до
14,5 %(aT.)N при 400 "С.
Кристаллическая структура фазы б относится к типу NaCl (символ
Пирсона cF%, пр.гр. Fm 3m), а = 0,428 нм [3]. Согласно работе [6] параметр
решетки фазы б зависит от степени отклонения от стехиометрии и
изменяется от 0,42073 нм для TiN0 4 до 0,42398 нм для TiN. Фаза s имеет
тетрагональную решетку типа анти-ТЮ2 с параметрами а - 0,494448 нм,
с = 0,30355 нм.
В работе [7] сообщается о существовании в системе Ti-N еще двух
промежуточных фаз: TlTi3N2_x и ijT^N^.
Литература
1 Palty A.E., Margolin H., Nielsen J.F. // Trans ASM, 1954 V 46. P. 312-328
2 Арбузов М.П., Голуб С.Я., Хаенко В.Ф. // Изв. АН СССР Неорганические материалы,
1977 Т. 13. N 10. С. 1779-1789.
3 Erelich P. // Z. Anorg. Allg. Chem , 1949 В. 259 N I. S. 1-9
4. Wood F.W., Romans P.A., McCune R.A., Paasche O. // Rep. Invest Bur Mines, U S Dep
Inter., 1974 N 7943. 40 p.
5 Etchessahar E., Bars J.P., Debuigne J. et al. //Titanium Science and Technology Proc
5Int.Conf, Munich, Sept. 10-14, 1984, Oberursel, 1985 V 3. P 1423-1430
6 Etchessahar E., Bars J.P., Debuigne J. // J. Less-Common Met 1987. V. 134 N 1
P. 123-139
7 Lengauer W., EMmayer P. // Mater Sci and Eng. A, 1988 V. 105. N 1-2. P 257-263.
8 Эм В.Т., Латергаус И.С., Лорян В.Э. // Изв. АН СССР. Неорганические материалы
1991 Т 27 N3 С 517-520.
Я Б. Будберг
N-T1. АЗОТ-ТАЛЛИЙ
Диаграмма состояния 1Ч-Т1 не построена.
Исследование, выполненное при 600 "С, показало, что N практически
нерастворим в Т1 [X].
N-Tl. N-Tm, N-U
493
Сообщается об образовании соединений TIN и T1N3. СоединениеT1N3
очень нестабильно и плавится предположительно при 334 °С [Э].
Л.Л. Рохлин
N-Tm. АЗОТ-ТУЛИЙ
Диаграмма состояния N-Tm не построена.
В системе установлено образование нитрида TmN, имеющего ГЦК
решетку типа NaCl (символ Пирсона cF%, пр.гр. Fm3m,a = 0,481 нм) [Э,
Ш].
Л.Л. Рохлин
N-U. АЗОТ-УРАН
Диаграмма состояния N-U (рис. 240) построена при давлении 0,1 МПа
по данным работы [Ш] с дополнениями из работы [М]. Азотированием
порошка U при давлении N, равном 0,1 МПа, в течение 4 ч при
температуре 850 °С получали соединение UN, 6±005. Это соединение
подвергали спеканию под давлением азота 29,4 Kffla по двум режимам:
И, % /по массе)
г «
J0
М, "A {am.)
6О
Рис. 240. N-U
494
N-V. N-V
при 1100 °C для получения кубической а фазы U2N3, при 1200 °С для
получения гексагональной Р фазы U2N3.
При охлаждении сплавов из области фазы р наблюдается эвтектоид-
ный распад PU2N3 •* UN + <xU2N3 при 1100 °С При 1132 °С и давлении
0,1 МПа в сплавах системы протекает перитектоидная реакция
PU2N3 + Газ •* aU2N3. При температуре выше 2805 °С существует смесь
Ж + Газ.
UN имеет кубическую структуру типа NaCl (символ Пирсона cF&,
пр.гр. Fm Ът, а = 0,48899 нм) \Э). Параметр а кубической решетки aU2N3
уменьшается от 1,0688 нм для UNj 5 ДО 1,0636 нм для UNj 15 [Ш]. PU2N3
имеет структуру типа La2O3 (символ Пирсона hP5, пр.гр. РЪт\,
параметры а - 0,3700, с = 0,5826 нм для UN, 5) [Ш]
П Б Будберг
N-V. АЗОТ-ВАНАДИЙ
Обобщенная в работе [1] диаграмма состояния системы N-V
представлена на рис. 241. В литературе существует много противоречий
относительно числа и стабильности фаз системы N-V. Установлено
существование двух промежуточных фаз: PV2N, и 6VNt_v [1-3, X, Ш].
PV2N | имеет область гомогенности от 29 до 31 % (ат.) N по данным
N, % /no массе)
5 tO /S
гооо
го за
Ы, "/о(ат.)
Рис.241 N-V
N-V
495
работы [1] или от 28,6 до 33 % (ат.) N по данным работы [X]. Согласно
работе [3] граница области гомогенности со стороны N, отвечает составу
с 33,77 % (ат.) N и практически не зависит от температуры.
Граница области гомогенности 6VN(_X со стороны N слабо зависит
от температуры и расположена близко к 50 % (ат.) N. Граница области
гомогенности со стороны V сильно зависит от температуры и соотве-
соответствует при 1700 °С - 37,5 % (ат.) N; при 1400 °С - 39,4 % (ат.) N и при
700 °С - 44,0 % (ат.) N [2, 3].
При температуре ниже 520 ° существует упорядоченная низкотемпера-
низкотемпературная фаза 6'VN(_X (стехиометрический состав V32N26) [4].
По данным работы [X] растворимость N в (V) составляет 3,5 % (ат)
при высоких температурах и менее 3,5 % (ат.) при 900 "С. Согласно
работе [Ш] растворимость N в (V) не превышает 1,8 % (ат) N. По данным
работы [4] предельная растворимость N в (V) возрастает от 2,6 % (ат )
при 500 °С до 10,7 % (ат.) при 1500 "С. Данные работы [6], где указывает-
указывается, что с повышением температуры от 500 до 1200 °С растворимость N
в (V) увеличивается от 2 до 8 % (ат.), близки к данным работы [5].
Кристаллографические данные для промежуточных фаз системы N-V
приведены в табл. 212.
Таблица 212 Кристаллическая структура соединений системы N-V
Соединение
PVNO43.037
6VN1(WO5
6-vn;I2 .„
Прототип
-
NaCl
-
Символ
Пирсона,
пргр
сП,
Fmim
-
'Кубическая сверхструктура
Параметры
а
0,4920-
0,4913
0,41398-
0,40738
0,4130-
0,4073
зешетки, нм
с
0,4550-
0,4542
-
-
Источник
[X]
[1,7]
[4]
Литература
1 Carlson O.N., Smith J.F., Nafziger R.H.// Met Trans A 1986 V 17 N 10 P 1647-1656
2 Арбузов М.П., Хаенко Б.В., Френкель О.А. // Изв АН СССР Неорганические
материалы 1975 T II N2 С 236-241
3 Kieda N, Vlizutani N, Kato M., J. Less-Common Met 1988 V 144 N 2 P 293-299
4 OnozukaT. Hi Appl Cryst , 1978 V II N I P 132
496
N-V, N-W
5. Нога G. // J. Less-Common Met., 1974. V. 35. N 2. P. 207-225.
6. Nouet G., Vicens J., Oelavignette P. // Phys. Status Solidi. 1980. V. A62. N 2. P. 449-457.
7. Brauer G., Schnell W.D. // J. Less-Common Met. 1964. V. 6. N 5. P. 326-332.
E В. Лысова
N-W. АЗОТ-ВОЛЬФРАМ
Диаграмма состояния N-W не построена. В системе образуются три
стабильных нитрида (WN067_, o)P, (WN,_XN и (WN2N«, [X, Э, Ш, 1-4].
Имеются также сведения о существовании целого ряда метастабильных
промежуточных фаз с гексагональной и ромбоэдрической структурой
[1,Э,Ш].
Кристаллическая структура равновесных и метастабильных фаз
системы N-W представлена в табл. 213.
Таблица 213. Кристаллическая структура соединений системы N-W |1J
Соединение
Р
б
в; (WNj)
»i! (WN05)
в;, (wn0 74.0,87)
•? (WN0,74)
Прототип
Символ
Пирсона,
пр.гр.
Параметры решетки,
нм
а
с
Равновесные фазы
NaCl
we
-
сП,
Fmlrn
hP2,
Р6т2
АЛ9
Л 3m
0,412-
0,414
0,2893
0,289
-
0,2826
1,640
Метастабильиые фазы
Л11
*
-
hP9,
Pi
hP-9
Рбт/ттс
-
0,289
0,2885
0,2885
2,285
1,546-
1,530
3,092
Примечание
(концентрация
N, % (ат.))
33-50?
-50
-67
-33
-43-47
-43
N-W
497
Соединение
С (WN085)
»н (WN09l)
Y**(WN,0)
(W2N3)
C(WN,,56)
C(WN,,67)
Прототип
-
-
-
-
"Г
Символ
Пирсона,
пр.гр.
АЛ-13,
ЛЗт
РЪ\с
-
сР1 или
сП,
-
АР6.5
Рбт/ттс
АР6.5
Гексагональная сверхструктура.
Тетрагональная сингоння.
Параметры решетки,
нм
а
0,289
0,289
0,5786
0,4130
-
0,287
0,289
с
2,335
1,08
0,6048
-
-
1,100
1,08
Примечание
(концентрация
Ы,%(ат))
-46
-48
-50
-57
-60
-61
-62,5
Растворимость N в W мала [0,001-0,01 % (ат.)] и в интервале
температур 2400-3050 "С может быть описана уравнением:
lgx = 0,5 lgp-0,036-10200/Г,
где х - концентрация, % (ат.);р - давление азота, МПа; Т- температура,
Литература
1. Wriedt Н.А. // Bull. Alloy Phase Diagrams. 1989. V 10. N 4. P. 358-367.
2. Fromm E., Jchn H. // High Temp. - High Pressure. 1971. V. 3 P. 553-564
3. Fromm E., Jehn H. HZ. Metallkunde. 1971. Bd. 62. S. 378-381
4. Fromm E., Jehn H. // J. Less-Common Met. V. 17. N 1. P 124-126.
К Б Поварова
498
N-Y
N-Y. АЗОТ-ИТТРИЙ
В работах [1, Э, Ш] установлено, что в равновесии с Y находится
нитрид YN. YN кристаллизуется в кубической гранецентрированной
структуре с параметром а = 0,4878 нм \Э], а = 0,48718 нм [2], а -
= 0,48675-0,48699 нм [Ш]. Температура плавления YN при давлении N2,
равном 0,1 МПа, свыше 2670 °С |Э]. При температуре -1600 °С YN
диссоциирует.
И. "С
f6OO
N,%//io массе)
О,2 0,$ O,S 0,8 t,0
Г,г
two
rooo
воо
600
1
ж
?=*
(ctr)
r
1
1 1
Mt-YN
~7
/
i
l
t540'
г * б
N,Vo(am.)
Рис. 242. N-Y
Авторы работы [1] по результатам дифференциального термического
анализа и исследования микроструктуры сплавов после закалки с
различных температур построили часть диаграммы состояния Y-N,
которая приведена на рис. 242. Максимальная растворимость N в
твердом Y, указанная на диаграмме, согласуется с приводимой в работе
[Э] и составляет 3,7 % (ат.).
Литература
1 Carlson O.N., Lichtenberg R.R., Warner J.C. // J Less-Common Met 1974 V 35 N 2
P 275-284
2 Kempter Ch.P., Krikorian N.H., McGuire J.C. // i Phys Chem 1957 V 61 N 9
P 1237-1238
Л Л Рок пин
N-Yb, N-Zn, N-Zr 499
N-Yb. АЗОТ-ИТТЕРБИЙ
Диаграмма N-Yb не построена.
В системе установлено образование нитрида YbN, имеющего ГЦК
решетку типа NaCl (символ Пирсона cF8, np.rp. Fm3m, а = 0,47852 нм).
Нитрид YbN получали взаимодействием Yb с NH3 или азотом \Э].
Л Л Рохлин
N-Zn. АЗОТ-ЦИНК
Диаграмма состояния N-Zn не построена.
В ряде работ не удалось установить взаимодействие N с Zn и
растворимость N в Zn [X]. По данным работы р] растворимость N в
жидком Zn составляет 0,006-0,012 % (ат.) при 448 "С.
В системе образуется нитрид Zn3N2, имеющий ОЦК решетку типа
Мп2О3 (симв°л Пирсона с/80, пр.гр. 1аЗ,а = 0,9743 нм). Zn3N2 разлагает-
разлагается в вакууме при температуре 350 °С или в случае атмосферного давления
при 800 "С на составные элементы \Э].
Азид Zn(N3J взрывается при нагреве [Э].
Л Л Рахтн
N-Zr. АЗОТ-ЦИРКОНИЙ
Диаграмма состояния N-Zr (рис. 243) в интервале концентраций
0-50 % (ат.) N построена по результатам микроскопическбго и
рентгеновского анализов и определения температур солидуса [1].
Азот повышает температуру плавления Zr и температуру его
Полиморфного р«- а превращения. Перитектические реакции Ж + (aZr)^
ч* (PZr) и Ж + ZrN •* (aZr) происходят при температурах -1880 "С и
-1985 °С соответственно. В (PZr) растворяется до 5 % (ат.) N, в (aZr) -
до 25 % (ат.) N ZrN плавится конгруэнтно при 2980±50 °С. Его область
гомогенности лежит в пределах 40-50 % (ат.) N [2].
ZrN имеет кубическую структуру типа NaCl (символ Пирсона cF%,
пр.гр. Fmbm, а = 0,4575 нм для эквиатомного состава [X], а =
* 0,4564-0,4572 нм для состава с 40-50 % (ат.) N) [2J.
В результате дегидрирования гидронитрида Zr - ZrN035H035
получена метастабильная фаза с ромбической структурой <xZr2N с
500
N-Zr, Na-Nb
N, % (no массе)
2 3 tS678ffll0/2
70O
Рис. 243. N-Zr
го 30
N,c/o(am.)
упорядоченным расположением атомов [3]. Параметры решетки этой
фазы: а = 0,5634, Ь = 0,5253, с = 0,3253 нм (пр.гр. Рпта, структурный тип
анти-СаС12).
Литература
1 DomagalaR.F., McPhcnsonDJ., HansenM.// Trans AIME. 1956. V 206 N I P 98-105
2 Самсонов Г.В., Верхоглядова T.C.//Доповшд! АН УPCP. 1962 N 1 С 48-50
3 Хидиров И., Эм В.Т., Каримов И., Лорян В.Э. // Физика металлов и металловедение
1987 Т 64 N6 С 1218-1221
Л А Третьячепко
Na-Nb. НАТРИЙ-НИОБИЙ
Металлографическое исследование Nb после выдержки в жидком Na
при 870 °С в течение 50 ч указывает на отсутствие взаимной раствори-
растворимости этих компонентов в жидком и твердом состоянии [1].
Согласно работе [2] вплоть до температуры 150 "С жидкий Na не
смачивает Nb В интервале температур 800-1400 °С растворимость Nb
Na-Nb, Na-Ni 501
в жидком Na составляет соответственно 3-10—9-10 % (по массе) после
выдержки в течение 50 ч и содержании кислорода в Na 4-10 % (по массе)
[3] С увеличением содержания кислорода в расплавленном Na раствори-
растворимость Nb возрастает.
В работе [4] растворимость Nb в жидком Na рассчитывали с
использованием модели субрегулярных растворов. По результатам
расчетов в интервале температур 630-820 °С растворимость Nb в Na
возрастает от 10" до 10~8 % (по массе) соответственно.
В работе [5] диаграмму состояния системы Na-Nb рассчитывали с
использованием модели регулярных растворов для жидкой фазы и
идеальных растворов для газообразной фазы при давлении 0,1 МПа, а
также при давлении, обеспечивающем существование только конденсиро-
конденсированных фаз В последнем случае по данным расчета в системе существует
практически полная несмешиваемость в жидком состоянии. Критическая
точка на бинодальной кривой согласно расчету должна соответствовать
концентрации 50 % (ат.) Nb и температуре выше 9730 °С.
Литература
1 Stoop J., Strauss S.W., Brown B.F.//AIME Metallurgical Society Conference V 10 New
York Interscience Publishers, 1961 P 405-406
2 Barker M.G. // Rev Int Haut Temp Refract 1979 V 16 N 3 P 237-243
3 Claar T.D.//Reactor Technol Spring 1970 V 3 N2 P 124-146
4 Кузин А.Н., Люблинский И.Е., Бескоровайный Н.М. // Расчеты и экспериментальные
методы построения диаграмм состояния Сб статей М Наука, 1985 С 113-118
5 Smith J.F., Lee K.J.// Bull Alloy Phase Diagrams 1988 V 9 N4 P 479-483
Л Л Зусман
Na-Ni. НАТРИЙ-НИКЕЛЬ
Ni незначительно растворим в жидком Na. По данным работы [1]
вплоть до температуры 195 "С жидкий Na не смачивает Ni. В интервале
температур 200-600 °С растворимость изотопа Ni63 в жидком Na
возрастает от 4-10 7 до 2-10 % (по массе), при этом загрязнение Na
кислородом приводит к заметному увеличению растворимости [2].
В интервале температур 450-1300 °С растворимость Ni в жидком Na
составляет соответственно 0,3 10-4,0-10 % (по массе) [3].
Согласно расчетам с использованием модели субрегулярных
растворов в интервале температур 350-820 °С растворимость Ni в
жидком Na изменяется от 10~6 до 10"' % (по массе) соответственно [4]
502
Na~Ni, Na-O
Литература
1. Barker M.G./7 Rev Int Haut Temp. Refract. 1979 V. 16 N 3 P. 237-243.
2 Kovacina T.A., Miller R.R.//Nucl. Sci. Eng. 1961 V 10 N 1. P. 163-166.
3 Claar T.D.//Reactor Technol Spring. 1970 V 3. N2 P 124-146
4. Кузни А.Н., Люблинский И.Е., Бескоровайный Н.М. // Расчеты и экспериментальные
методы построения диаграмм состояния: Сб. статей М Наука, 1985. С 113-118
Л Л Зусмап
Na-O. НАТРИЙ-КИСЛОРОД
Диаграмма состояния Na-O, исследованная методами термического
и рентгеновского анализов, представлена на рис. 244 [1].
Для исследования взаимодействия Na с кислородом применяли тигли
из коррозионно-стойкой стали \Э], использовали спектрально-чистый
О и Na, содержащий примеси порядка 1(Г3 % (по массе) [2].
Характер взаимодействия Na с кислородом окончательно не
установлен.
Растворимость О в расплавленном Na в интервале температур
100-900 "С может быть рассчитана по уравнению:
10
О, % (по массе)
10 30 ЬО 50
60 70
т
/
1
1
1
i
i
1
97.8'
-изо
Г Mate
~ SB"
•*—(JJNa)
T\
i '
i
i
i
\
\
\ 6
i
ж
5'
1" г—rf-\
IT
_lL
l| /YffUffj
\
T
OzW
1
~S5H iv
1
11
fl
юоо
800
600
гоо
0 10 20 30 40 50 SO 70 80
Na 0, % (am )
Рис. 244. Na-O
Na-O
503
lgjt-lO~* = 6,1579-2384/T,
где х - концентрация О, % (по массе), Т- температура, К [3].
Температура монотектики составляет -1130 "С, а область расслаива-
расслаивания в жидком состоянии находится в пределах от -4,7 до 33,3 % (ат.) О.
В системе образуются четыре соединения: Na2O,Na2O2, NaO2 и NaO3,
из которых три первые плавятся конгруэнтно при 1134, 675 и 552 °С
соответственно. Температура плавления NaO3 не известна.
Na2O - соединение с узкой областью гомогенности, кристаллизующее-
кристаллизующееся в структуре типа CaF2 [Э]. Na2O2 при давлении 0,1 МПа существует
в двух модификациях: Na2O2(I) и Na2O2(II) [4, 5]. Низкотемпературная
модификация Na2O2(I) имеет гексагональную структуру типа Fe2P [4],
а структура высокотем пературной модификации Na2O2(II) не установле-
установлена. Превращение Na2O2(I) •* Na2O2(II) происходит при -512 °С.
Существует еще метастабильная фаза Na2O2(Q), полученная резкой
закалкой жидкого Na2O, [1 ]. Соединение Na2O2 может существовать при
значительном дефиците О до концентрации 49,4 % (ат.) О, а возможно
и до 45,5 % (ат.) О [1].
NaO2 имеет заметную область гомогенности, концентрация 64,3 %
(ат.) О соответствует границе области гомогенности со стороны Na при
275±25 °С. Известны три полиморфные модификации NaO2 при давлении
0,1 МПа [1], две из которых существуют при минусовых температурах.
При температуре -230 "С NaO-, претерпевает магнитное превращение
в фазуКаО2A\0 без изменения кристаллической структуры [6].
Данные по кристаллической структуре оксидов Na представлены в
табл. 214.
Таблица 214 Кристаллическая структура соединений системы Na-O
Соединение
NaO
Na2O2(l)
Na2O2(ll)
NaO,(l)
Прототип
CaF,
Fe2P
-
NaCI
Символ
Пирсона,
пр.гр
cFl2,
Fmbrn
hP9,
P62m
-
cFS,
Fm 3 m
Параметры решетки, нм
a
0,556
0,6208
-
0,5490
0,5512
b
-
-
-
-
-
с
-
0,4469
-
-
-
Примечание
При 25 "С [Э]
При 25 °С [41
[5]
При 25 "С [Э]
При 25 °С [7]
504
Na-O, Na-РЬ
Соединение
NaO2(II)
NdO2(lII)
NaO2(IV)
NaO3
Прототип
FeS2
(пирит)
FeS2
(марказит)
FeS2
(марказит)
-
Символ
Пирсона,
пргр
сР\2,
Pub
оР6,
Рппт
оР6,
Рппт
Шттт
Параметры решетки, нм
а
0,546
0,426
0,4335
1,165
Ь
-
0,554
0,5537
-
с
-
0,344
0,3353
0,766
Примечание
При-70 °С [8]
При 100 "С [8]
При-269° С [6,
7]
При-196°С[Ш]
Литература
1 Wriedt H.A. // Bull Alloy Phase Diagrams 1987 V 8 N3 P 234-246
2 Smith D.L.//Met Trans 1971 V 2 N 2 P 579-583
3 NodenJ.D.//J Brit Nuci Energy Soc 1959 V 63 N 1 P 68-74
4 FopplH. IIZ Anorg Allg Chem 1957 Bd 291 N 1 S 12-50
5 Tallman R.L., Margrave J.L. // J Inorg Nuci Chem 1961 V 21 N 1 P 40-44
6 ZumstegA., ZiegerM., RanzigW., Bosch M.//Phys Condens Matter 1974 V 17 N4
P 267-291
7 Ziegler M., Rosenfeld M., Kanzig W., Fisher P. // Helv Phys Acta 1976 V 49 N 1
P 57-90
8 Carter G.F., Templeton D.H.// Chem Rev 1953 V 52 N 1 P 1-75
Л Л Зусман, Л Е Шетшова
Na-Pb. НАТРИЙ-СВИНЕЦ
Диаграмма состояния системы Na-Pb, изученная методами термичес-
термического, микроструктурного и рентгеновского анализов, а также измерением
твердости, плотности и электросопротивления, приведена на рис 245 [X,
М]
Сплавы Na с РЬ получали в вакуумированных стеклянных ампулах,
либо в среде инертного газа в Fe-тиглях из компонентов
Согласно работе [М] в системе Na-Pb образуются пять промежуточ-
промежуточных фаз, из которых РЬ4№M, Pb4Na^, PbNa и фаза р плавятся конгруэн-
конгруэнтно при 386, 403, 372 и 320 °С соответственно, a Pb2Na5 плавится
инконгруэнтно при 391 °С
В литературе имеются противоречивые данные относительно числа
и состава фаз, образующихся в интервале концентраций 78-83 % (ат)
Na, в котором согласно ранним исследованиям отмечалось существова-
Na-Pb
505
Л/а, % (no массе)
5 10 ZO SO 40 50 10 100
S7.8'
О Ю 20 JO 40 50 60 70 80 90 100
РЬ Na, '/. (am ) Na
Рис. 245. Na-Pb
ние соединения PbNa4 [X] В работе f 1] получены результаты, отличающи-
отличающиеся от данных, обобщенных в работе [X] указано на существование двух
соединений - PbNa4 и PbNa5, причем первое соединение не является
стабильным и реагирует с жидким Na с образованием PbNa5 PbNa4
имеет кубическую решетку с а - 1,302 нм PbNa5 плавится при 390 °С и
имеет гексагональную решетку с параметрами а - 1,06; с - 1,15 нм Из
приведенных данных следует, что диаграмма состояния Na-Pb в
интервале концентраций 78-83 % (ат) Na нуждается в дополнительном
исследовании
PbNa имеет тетрагональную решетку с параметрами а - 1,0580 нм,
с = 1,7746 нм, число атомов в элементарной ячейке равно 64
Наиболее богатая РЬ фаза ф) имеет упорядоченную кубическую
структуру типа Cu3Au (символ Пирсона с.Р4, пр гр. РтЪт) Параметр
решетки а возрастает с увеличением содержания Na и находится в
пределах 0,4882-0,4893 нм. Область гомогенности фазы (Р) не включает
стехиометрический состав Pb3Na и простирается от 27 до 32,5 % (ат) Na
Растворимость РЬ в твердом Na в интервале температур 17-91 °С
возрастает от 2,5 10 4 до 2,7-10 3 % (ат) [2] В интервале температур
100-260 "С растворимость РЬ в жидком Na определяется по уравнению
506 Na-Pb, Na-Pd, Na-Po, Na-Pt
\gx = 3,515- 2,639' 103/Г,
где x - атомная доля Pb, T- температура, К [1].
Растворимость Na в твердом РЬ возрастает от 1,2 % (ат.) при 0 °С до
12,7 % (ат.) при эвтектической температуре.
Литература
1 LamprechtGJ., Dicks L., Crowther P.//J Phys Chem 1968 V 72 N 5 P 1439-1441
2 Александров Б.Н., Далакова H.B.//Изв АН СССР Металлы 1982 N1 С 133-140
ЛЕ Шелимоиа, Л Л Зусман
Na-Pd. НАТРИЙ-ПАЛЛАДИЙ
Систематическое исследование системы Na-Pd не проводилось.
Максимальное понижение температуры плавления Na составляет 0,4 °С
при добавлении 2,8 % (по массе) @,62 % (ат.) Pd) [X].
Л Л Зусман
Na-Po. НАТРИЙ-ПОЛОНИЙ
Диаграмма состояния Na-Po не построена. В работе [Ш] сообщается
о существовании соединения Na2Po, которое имеет структуру типа CaF2
(символ Пирсона cF\ 2, пр.гр. Fm 3m, a = 0,7473 нм.).
Л Л Зусман
Na-Pt. НАТРИЙ-ПЛАТИНА
Диаграмма состояния Na-Pt не построена. Добавление до -1,5 % (по
массе) @,18 % (ат.) Pt) почти не влияет на температуру плавления Na [X].
Расплавленный Na заметно воздействует на Pt только при температурах
выше 450 "С [X]. Синтезом из компонентов получено химическое
соединение NaPt2 с ГЦК кристаллической решеткой типа MgCu2, a -
= 0,748 нм \Э].
Л Л Зусман
Na-Pu, Na-Rb
507
Na-Pu. НАТРИЙ-ПЛУТОНИЙ
В работе Р] сообщается, что Na с Pu не смешиваются ни в твердом,
ни в жидком состояниях.
Л Л Зусмап
Na-Rb. НАТРИЙ-РУБИДИЙ
Диаграмма состояния Na-Rb (рис. 246) построена в работе [1] по
данным термического анализа. Сплавы Na с Rb получены в вакуумиро-
ванных стеклянных ампулах из Na чистотой 99,99 % (по массе) и Rb
чистотой 99,98 % (по массе).
Rb,% (по массе)
010 iO 3010 50 SO 70 ВО SO
100
1 1
О7Я*
\
\
*/#
1 1
t 1
•
-4,5*
1
—¦^
Ж
^ч
\
1
ч.
\
¦ f
/
80
SO
4/7
20
О
-20
-10
О 10 20 30 ЬО 50 SO 70 80 SO ЮО
NO Rb,'/>(am) Rb
Рис. 246. Na-Rb
Диаграмма состояния Na-Rb относится к простому эвтектическому
Типу. Эвтектическое превращение происходит при температуре -4,5 °С
И концентрации Rb, равной 82,1 % (ат.). Растворимость Rb в (Na) при
эвтектической температуре составляет 0,5 % (ат.), a Na в (Rb) - 1,1 % (ат.).
Литература
1 Goatcs J.R., OttJ., Hsu C.C.// Trans Faraday Soc 1970 V 66 N 1 P 75-83
// Л Зуснаи
508 Na-S, Na-Sb
Na-S. НАТРИЙ-СЕРА
Диаграмма состояния Na-S не построена. Установлено существование
ряда сульфидов.
Na2S3 плавится при температуре 230 °С и распадается до Na2Sj 9 при
нагреве выше 550 °С [1]. Температура плавления Na2S, 9 -460 °С'. При
температурах выше 1260 °С Na2S| 9 диссоциирует с образованием
Na2S| 37- Na2S, 37 кристаллизуется в интервале температур 650-830 °С
Р]. '
Na2S имеет кубическую структуру с параметром решетки а = 0,652 нм
[2]. Полисульфид Na2S2 обладает гексагональной структурой с
параметрами решетки а = 0,44869 нм, с - 1,02210 нм [3].
Na,S, существует в двух полиморфных модификациях [Ш]. <xNa2S2
имеет гексагональную структуру типа Fe2P (символ Пирсона hP9, пр.гр.
Р62т, а = 0,7629 нм, с = 0,5394 нм), pNa2S, - гексагональную структуру
типа Li2O2 (пр.гр. Рб^/ттс) с параметрами решетки а = 0,4494 нм, с =
= 1,0228 нм. Na7S4 обладает тетрагональной структурой собственного
типа (символ Пирсона г/48, пр.гр. /42flf, а = 0,95965 нм, с = 1,17885 нм)
[3, 4]. Na7S5 имеет орторомбическую структуру с параметрами решетки
а = 0,76505 нм, Ь - 1,45036 нм, с = 0,58430 нм [3].
Литература
l.KohlmeyerE.J., Brinkmann Н.//Z. Anorg. All. Chem. 1959. Bd. 299. S. 182-187
2. Klemm W., Sodomann H., Langmesser P. // Z. Anorg. All. Chem. 1939. Bd. 241. N 2-3.
S. 281-304.
3 Rosen E., Tegman R. // Acta Chem. Scand. 1971 V. 25. N 9 P. 3329-3336.
4. TegmanR. //Acta Crystallogr. B. 1973 V. 29. N 7. P. 1463-1469.
J1.J1. Зусмаи
Na-Sb. НАТРИЙ-СУРЬМА
На рис. 247 приведена диаграмма состояния Na-Sb [X], построенная
по данным термического и рентгеновского анализов работ [1, 2].
В системе Na-Sb образуются два соединения Na3Sb и NaSb, которые
плавятся конгруэнтно при температурах соответственно 856 и 465 "С.
Установлены три эвтектических реакции: Ж ° (Na) + Na3Sb при
температуре 97 °С и концентрации -100 % (ат.) Na; Ж - Na3Sb + NaSb
при температуре 435 "С и концентрации 44,5 % (ат.) Sb; Ж - NaSb + (Sb)
при температуре 400 °С и концентрации 60,6 % (ат.) Sb.
Na3Sb имеет гексагональную структуру TnnaNa3As (символ Пирсона
5, пр.гр. Рву/ттс) с параметрами решетки а = 0,5366 нм, с = 0,9515 нм
Na-Sb, Na-Se
509
Sb, % (по моссе)
010 JO 50 60 W 80 90
'JO,755'
О 10 10 JO ЬО SO 60 70 80 90 100
Na Sb, % (am) Sb
Рис. 247. Na-Sb
[X]. Соединение NaSb имеет моноклинную структуру типа LiAs (символ
Пирсона тР\6, пр.гр. P2ilc, а = 0,680 нм, Ъ = 0,634 нм, с = 1,248 нм, р =
= 117,6 "ИЗ].
Литература
1. Mathewson С.Н. // Z Anorg All Chem. 1906. Bd. 50. S. 192-195.
2. Zintl E., Dullenkopf W.//Z. Physic Chem. 1932. Bd. 16. S 183-194.
3 Comer D.T.//Acta Crystallogr.' 1959. V. 12. P. 41-45.
Na-Se. НАТРИЙ-СЕЛЕН
Л Л. Зусман
На рис. 248 приведена диаграмма состояния Na-Se [X], построенная
по результатам термического анализа [1].
В системе Na-Se существует единственное конгруэнтно плавящееся
соединение Na2Se, температуру плавления которого не удалось
определить из-за несовершенства методики синтеза сплавов в работе [1].
Остальные соединения Na2Se7, Na2Se3, Na2Se4 и Na2Se6 образуются по
510
Na-Sb, Na-St
Se, ?• (no массе)
О 2030*050 SO 10 80 SO
100
1 1
1
i \
t
1
1
I
f
,97"
97,8'
1 >'
875.
\
\
IS'
\
\
1
Ж
\
T
•
|
>
N
3
i
JSS
0
1
t'C
800
700
600
500
400
300
ZOO
100
^ 10 tO 30 *ff Л? 60 70 80 SO WO
Na Se, Tt (am.) Se
Рис. 248. Na-Se
перитектическим реакциям при температурах соответственно: 495, 313,
290 и 258 "С.
Структура соединения Na2Se кубическая типа CaF, (символ Пирсона
cF\2, пр.гр. Fm3m) с параметром решетки а = 0,6823 нм [2]; оно не
растворяет в твердом состоянии избыток Se [3]. Na2Se2 имеет гексагональ-
гексагональную структуру (на элементарную ячейку приходится две формульных
единицы) с параметрами решетки а - 0,4685 нм, с = 1,0530 нм [4].
Структура других соединений неизвестна.
Литература
1 Mathewson С.Н. // J Amer Chem Soc 1932 V 11 N2 Р 141-147
2 Zintl E., Harder A., Dauth В. // Z Elektrochem 1934 Bd 40 S 588-59*3
3 KlemmW.,SodomannH.,LangmesserP.//Z Anorg All Chem 1939 Bd 241 S 281-304
4 FopplH., BusmannE.,FrorathF.K.//Z Anorg All Chem 1962 Bd 314 N 1-2 S 12-20
Л Л Зусман
Na-Si. НАТРИЙ-КРЕМНИЙ
Диаграмма состояния Na-Si не построена.
В системе образуется ряд соединений Соединение NaSi имеет
моноклинную структуру (символ Пирсона шС32, пр гр С2к,а- 1,219 нм,
NaSi. NaSn
511
* = 0,655 нм, с = 1,118 нм, p = 119°) [1]. В работе [2] сообщается о
существовании соединения NaSi2, которое, по-видимому, имеет
тетрагональную структуру с параметрами решетки а - 0,496 нм, с =
= 1,667 нм, содержащую 12 атомов в элементарной ячейке.
Авторы работы [3] сообщают о двух соединениях Na8Si46 и NaxSi,36
(х < 11) с кубической структурой. NagSi^ (пр.гр, РтЪп) имеет параметр
решетки а = 1,019 нм, NaxSi136 (пр.гр. Fd3m) - параметр решетки а =
- 1,462 нм. При давлении 10 ГПа и температуре 25 "С это соединение
претерпевает фазовое превращение [4].
Растворимость Na в (Si) при температуре 650 °С составляет 2,4-10~3 %
(ат.) [Ш].
Литература
1 Witte J., Schnering H.G. // Z Anorg All Chem 1964 Bd 327 N 3-4 S 260-273
2 Nowotny H., Scheil E. // Z Metallkunde 1947 Bd 38 S 76-80
3 Kasper J.S., Hagenmuller P., Pouchard M., Cros C. // Science 1965 V 150 N3703
P 1713-1714
4 BundyF.P., Kasper J.S.// High Temper -High Pressures. 1970 V 2 N2 P 429-436
Na-Sn. НАТРИЙ-ОЛОВО
Л Л Зуслит
Диаграмма состояния Na-Sn приведена на рис. 249. При построении
диаграммы состояния были использованы преимущественно данные
термического и металлографического анализов [1], а также результаты
Sn, % (no массе)
О I0J0W SO SO 10 ВО 90 95 100
V
0
Na
не. 249
10 20
. Na-Sn
JO
40
Sn,
so
У.
so
(am)
70
SO
90
WO
Sn
512
Na-Sn
рентгеновского анализа [2] В системе образуются девять интерметалли-
интерметаллических соединений ~Na|5Sn4 или Na4Sn [X], Na3Sn, Na9Sn4HflH Na2Sn [X],
Na4Sn3, NaSn, имеющее полиморфное превращение при температуре
483 "С, NaSn2, NaSn3, NaSn4 и NaSn6. Два из них, Na,Sn4 (Na2Sn) и NaSn,
плавятся конгруэнтно при температурах 478 и 578 °С соответственно.
Соединения Na15Sn4 (Na4Sn), Na4Sn3 (существующее выше температуры
357 °С), NaSn2, NaSn3, NaSn4 и NaSn6 образуются по перитектическим
реакциям при температурах 408,479, 307, 289,229 и 226 °С соответствен-
соответственно. Na3Sn образуется при температуре 377 °С по перитектоидной
реакции В системе существуют три эвтектических превращения при
температуре 441 °С и концентрации 38,0 % (ат) Sn, при 220 °С и 96,0 %
(ат) Sn, при 97 °С и концентрации в эвтектике почти чистого Na
Растворимость Sn в (Na) при температуре 86 °С составляет 14-10~5 %
(ат) [3], растворимость Na в (Sn) также очень мала [1].
Кристаллическая структура соединений -Na [ 5Sn4, Na9Sn4 и NaSn(HT)
приведена в табл. 215. Структуры других соединений не установлены
Таблица 215 Кристаллическим структура соединений системы Na-Sn
Соединение
-NalsSn;
Na9Sn4
NaSn(HT)
Прототип
CU|5Si4
Na9Sn4
NaPb
Символ
Пирсона,
пргр
с/76,
/43 d
оС52,
Стст
Г/64,
/4,/W
Параметры решетки, нм
а
1,314
0,542
1,046
Ь
-
0,939
-
с
-
2,962
1,739
Источник
[2]
[2]
[4]
'Согласно справочнику [X] для соединения Naj5Sn4 была определена ромбическая
структура (символ Пирсона оР40, пр гр Рпта) с параметрами решетки а = 0,981 нм,
Л= 2.283 им. с = 0,537 нм
Электрические и термодинамические свойства сплавов Na-Sn изучены
в работах [5, 6]
Литература
1 Hume-Rothery W.//J Chem Soc 1928 V 131 Р 947-963
2 MullerW., VolkK.//Z Naturforschung В 1978 Bd 33 N 3 S 275-278
3 Александров Б.Н., Далакова H.B.//Изв АН СССР Металлы 1982 N 1 С 133-140
Na-Sn, Na-?r
513
4 Muller W., Volk К.//Z Naturlorschung В 1997 Bd 32 N 6 S 709-710
5 Van der Marel C, van Oosten A.B., Geertsma W., van der Lngt W.//J Phys F Met Phys
1982 V 12 N 10 P 2349-2361
6 Rivier M., Pelton A.D.//J Electrochem Soc 1978 V 125 N 9 P 1377-1382
Л Л Зусмап
Na-Sr. НАТРИЙ-СТРОНЦИЙ
На рис. 250 приведена диаграмма состояния Na-Sr, построенная в
работе [1] по данным работ [2, 3], в которых были использованы методы
термического и рентгеновского анализов.
Sr, 7o(no массе)
01010301050 ВО 70 80 SO
100
t;c
700
600
500
U0O
JOO
zoo
wo,
31.B
0 10 ZO 30 «0 50 60 70
Ma Sr,"/. (am.)
Рис. 250. Na-Sr
1 t
J
f
1
0,65
I
f
I
,
I
-—-
Ж
1
1 / /
j
h-JV/
769'
CffSr)
so too
Sr
Установлено, что Na и Sr полностью смешиваются друг с другом в
жидком состоянии и не образуют соединений. Со стороны Na при
температуре 94,8 "С кристаллизуется эвтектика, содержащая 0,65 % (ат)
Sr. Растворимость Sr в (Na) незначительна; растворимость Na в (Sr) при
эвтектической температуре достигает 12,4 % (ат.).
Литература
1 Pclton A.D.//Bull Alloy Phase Diagrams 1985 V 6 N I P 43-45
2 RobertsW.O //US At EnergyComm 1964 TID-20639 99p
3 Busscv P.R., Hubberstey P., Pulham R.J. // J Chem Soc Dalton Trans 1976 V 22
P 2327-2329
Л Л Зусмап
514
Na-Ta
Na-Ta. НАТРИЙ-ТАНТАЛ
Сведения о сплавах системы Na-Ta очень ограничены. В работе [1]
определена растворимость Та в жидком Na при температурах 325, 425
и 525 "С, которая составляет 2,Ф1(Г6% (ат.), 3,7-10~5 % (ат.) и 2,9- КГ4 %
(ат.) Та соответственно. Согласно расчету, проведенному в работе [2],
растворимость Та в жидком Na в интервале температур 700-850 °С
возрастает от 10"|0 до 10~9 % (по массе) Та. По данным работы [3]
растворимость Та в жидком Na в интервале температур 350-900 °С
возрастает от 0,07-10 % (по массе) до 0,1-Ю % (по массе) Na
Расхождение в полученных значениях растворимости Та связано с
чистотой используемого Na. В работе [4] установлено, что загрязнение
жидкого Na кислородом до 0,5 % увеличивает растворимость Та
примерно в 11 раз по сравнению с химически чистым Na. Учитывая это,
на рис. 251 приведена предполагаемая диаграмма состояния Na-Ta [5],
согласно которой Na и Та не смешиваются ни в твердом, ни в жидком
состояниях.
Ala, % (по массе)
го 40 60 юо
500
0
(
'a)
Га)
+ ra
ТВ)
3 8B3-
+ Ж
97,
8"
1
(.
T
3°
0 tO 20 30 40 SO 60 70 80 SO 100
га A/a,"/-fa/n) Na
Рис. 251. Na-Ta
Na-Ta. Na-Te
515
Литература
1 Grand J.A.//J Phys Chem 1959 V 63 N 8 P 1192-1194
2 Кузин А.Н., Люблинский И.Е., Бескоровайиый Н.М. // Сб статей Расчеты и
экспериментальные методы построения диаграмм состояния М Наука, 1985 С 113-118
3 ClaarT.D.//ReactorTechnol 1970 V 3 N2 Р 124-146
4 Barker M.G.//Rev Int Haul Temp Refract 1979 V 16 N 3 P 237-243
5 GargS.P., VenkatramanM., KrishnamurthyN./n Alloy Phase Diagrams 1990 V 6 N 1
P 10-11
Л Л Зусман
Na-Te. НАТРИЙ-ТЕЛЛУР
На рис 252 приведена диаграмма состояния Na-Te, построенная в
работе [1], по результатам исследований [2-4]. Установлено, что в системе
существуют три соединения. Na2Te и NaTe3 плавятся конгруэнтно при
температурах соответственно 953 и 436 °С, а соединение NaTe образуется
по перитектической реакции при температуре 349±6 °С. У соединений
отсутствуют области гомогенности.
Сведения о кристаллической структуре соединений системы Na-Te
приведены в табл. 216 В работе [8] формула соединения, богатого Те,
указана как Na2Te9; структура соединения не установлена.
гс,%(ло массе)
ого 405060 70 80 90
100
О 10 гО 30 40 50 60 70 80 90 tOO
на те, %»(am.) те
Рис. 252. Na-Te
S16
Na-Te, Na-Th
Таблица 216 Кристаллическая структура соединений системы Na-Te
Соединение
Na2Te
NaTe*
Прототип
CaF2
Символ
Пирсона,
пргр
с Л 2,
/тяЗш
РЬсп
Параметры решетки, нм
а
0,7329
0,7294
1,5892
Ь
0,9947
с
0,9179
Ромбическая сингония с 12 формульными единицами в элементарно!
Источник
15]
[6]
[8]
[ ячейке
Литература
1 Pelton A.D., Petric A. // Bull Alloy Phase Diagrams 1990 V 11 N5 P 447-451
2 PelliniG.,QuercighE.//AttiReal Accad Lincei 1910 V 19 N 5 P 19-22
3 KravsCA., Glass S.W.//J Phys Chem 1929 V 33 P 995-999
4 Petric A., Pelton A.D.//Ber Bunseges Phys Chem 1989 V 93 P 18-24
5 Zintl E., Harder A., Dauth B.//Z Elektrochem 1934 Bd 40 S 588-593
6 Фнпогенова В.К., Поповкин Б.А., Новоселова А.В. //Журнал неорганической химии
1970 Т 15 N6 С 749-751
7 KlemmW.,SodomannH.,LangmesSerP.//Z Anorg All Chem 1939 Bd 241 S 281-304
8 Bottcher P., Keller R. // J Less-Common Met 1985 V 109 N 2 P 311-321
Л Л Зусман
Na-Th. НАТРИЙ-ТОРИЙ
Диаграмма состояния Na-Th (рис. 253) построена по данным работы
[1], полученным методом термического анализа. Для соединения,
образующегося при температуре 121 °С, установлена формула Na4Th.
Th,%(no массе)
ОW 30 40 50 ВО 70 80
150
WO
1 1 1
97.8'/
i i
/^
)
i
121'
¦МГ-
i
Ыа
Рис. 253. Na-Th
w is го
Th, % (am.)
25 SO
Na-Th. Na-Ti
517
Этот вариант не окончательный, так как имеются данные об отсутствии
взаимодействия Th и Na вплоть до температур 650-800 °С [X].
Литература
1 Grube G., Botzenhardt L. // Z Elektrochem 1942 Bd 48 S 418-425
Л Л Зусман
Na-Ti. НАТРИЙ-ТИТАН
В работе [1] установлено, что вплоть до температуры 200 °С Ti не
смачивается жидким Na. Экспериментальные данные о взаимодействии
Ti с жидким Na при более высокой температуре отсутствуют. Согласно
расчетам, проведенным в работе [2], с использованием субрегулярной
модели растворов, в интервале температур 400-800 "С растворимость
Ti в жидком Na увеличивается от 10 ' до 10~4 % (по массе).
t°c
1800
Ti, % (по массе)
о ю го зо ьо 50 во го so
90
too
1
1
S7t86'
I
t
raj*
n
I
Ж
3+0
ж+k
Na)+
1
1
~I67O~
m)
~88Z~
<П)
-98-
(*W
WOO
600
200
-200
О Ю 10 30 ЬО 50 60 70 80 30 WO
Na Tit•/. (am) Ti
Phc. 254. Na-Ti
На рис 254 приведена диаграмма состояния Na-Ti, которая построена
в работе [3], с учетом того, что Na и Ti полностью не смешиваются ни
в жидком, ни в твердом состояниях.
518
Na-Ti, Na-TI
Литература
1. Barker M.G. // Rev. Int. Haut. Temp. Refrac. 1979. V. 16. N 3. P. 237-243.
2. Кузин А.Н., Люблинский И.Е., Бескоровайиый Н.М. // Сб.статей: Расчеты и
экспериментальные методы построения диаграмм состояния. М.: Наука, 1985 С. 113-118.
3. Bale C.W. // Bull. Alloy Phase Diagrams. 1989. V. 10. N 2. P. 138-139
Л.Л. Зусман
Na-TI. НАТРИЙ-ТАЛЛИЙ
На рис. 255 представлена диаграмма состояния Na-TI, построенная
в справочнике [X]. В системе образуются несколько соединений". Na6TI,
Na2TI, NaTl и NaTl2. Соединение NaTl плавится конгруэнтно при
температуре 305 "С и имеет значительную по протяженности область
гомогенности. Соединения Na6Tl,Na2Tl образуются по перитектическим
реакциям при температурах 77,4, 154 °С соответственно. Соединение
NaTl2 образуется по перитектоидной реакции при 154 "С.
В справочнике [X] растворимость Т1 в (Na) при эвтектической
температуре указана равной -1,1 % (ат.). Согласно более позднему
тщательно проведенному исследованию [1], она значительно меньше и
при температурах 17-21 "С составляет 0,3 % (ат.) Т1 и при 62 °С -0,06 %
(ат.) Т1, т.е. уменьшается с повышением температуры.
Сведения о кристаллической структуре соединений системы Na-TI
приведены в табл. 217.
TL, % (по массе)
020Ш060 70 80 SO 92 S4 96
98
WO
О 10 20 JO ЬО 50 60 70 80 90 WO
Na TL, % (am.) TL
Рис. 255. Na-TI
Na-TI, Na-U, Na-V
519
Таблица 217. Кристаллическая структура соединений системы Na-TI
Соедине-
Соединение
Na6Tl
Na2Tl
NaTl
NaTi;
Прото-
Прототип
-
Na2Tl
NaTl
-
Символ
Пирсона,
пр.гр.
-"¦
«С48,
С222,
cF16,
Fdlm
-
Параметры решетки, нм
а
2,4154
1,39350
0,7469
0,7488
Ь
-
0,88797
_
-
с
-
1,16927
_
-
'Кубическая сингония, вероятно типа NaCl
Источник
[2]
[3]
[4]
[4]
Литература
1 Александров Б.Н., Далакова Н.В. // Изв. АН СССР. Металлы. 1982. N 1. С 133-140
2. Samson S., Hansen D.A. // Acta Crystallogr. В. 1970. V. 28. N 3. P. 930-935.
Ъ. Hansen D.A., Smith J.F. // Acta Crystallogr. 1967. V. 22. N 6. P. 836-845.
4. Bennett L.H. // Acta Metall. 1966. V. 14. N 8. P. 997-999.
Л.Л. Рохлин
Na-U. НАТРИЙ-УРАН
Диаграмма состояния Na-U не построена. Na и U имеют незначитель-
незначительную взаимную растворимость [X, Э, Ш]. Согласно наиболее поздней
работе растворимость U в Na при температуре 97,8 "С составляет
0,0007 % (ат.) \Ц1].
Л.Л. Рохлин
Na-V. НАТРИЙ-ВАНАДИЙ
Диаграмма состояния Na-V не построена. Проведен теоретический
расчет растворимости V в жидком Na на основе модели субрегулярных
растворов [1]. Рассчитанное значение растворимости V в жидком Na
составило -1,6100 % (ат.), -10"8 % (ат.), 2-10~7 % (ат.), 4-10 % (ат.) при
,температурах 500, 600, 700, 800 °С соответственно.
520 Na-V Na-W Na-Xe. Na-Zn
Литература
I Кузин А.Н., Люблинский И.Е., Бескоровайный Н.М. // Сб статей Расчеты и
экспериментальные методы построения диаграмм состояния М Наука, 1985 С 113-118
Л Л Рохлин
Na-W. НАТРИЙ-ВОЛЬФРАМ
Диаграмма состояния Na-W не построена Растворимость W в
жидком Na, рассчитанная в работе [1] на основе модели субрегулярных
растворов, составила 4 10"|0 % (по массе) [5 10"" % (ат )] Растворимость
Na в (W) очень мала [2]
Литератора
1 Кузин А.Н., Люблинский И.Е., Бескоровайный Н.М. // Сб статей Расчеты и
экспериментальные методы построения диаграмм состояния М Наука 1985 С 113-118
2 Sangster J., Pelton A.D. // J Phase Equilibria 1991 V 12 N2 P 204
Л Л Рохлин
Na-Xe. НАТРИЙ-КСЕНОН
Диаграмма состояния Na—Xe не построена Методом меченых атомов
определена растворимость Хе в Na при давлении -0,1 МПа и получена
зависимость lg [ат доля Хе] = -3,248 - 522/Г(К) [Э]
В работе [1] приводится уравнение для расчета отношения абсорбиро-
абсорбированного объема Хе к объему жидкого Na в интервале температур
352-602 °С
Литература
1 Veleckis E., Dhar S.K., Cafasso F.A., Feder H M. // J Phys Chem 1971 V 75 N 12
P 2832-2839
Л Л Рохлин
Na-Zn. НАТРИЙ-ЦИНК
Диаграмма состояния Na-Zn, приведенная в справочнике [X], была
уточнена в работе [1] В качестве исходных материалов были использова-
использованы Zn чистотой 99,9 % (по массе) и Na чистотой 99,95 % (по массе)
Сплавы выплавляли в атмосфере аргона в запаянных контейнерах,
изготовленных из сплава Мо с 30 % (по массе) W, которые нагревали до
температуры 900 °С
Na-Zn
521
Zn, У. (по массе)
01020 JO40 50 60 70 80
90
100
t.'c
800
600
Ь00\4 W,58'
zoo
S7,i
0 10 ZO 30 40 50 60 70 80 SO tOO
A/a zn, % (am.) Zn
Phc 256. Na-Zn
1 1
/
1 1
/
1
ж
—^=
* ж г
548i?
97*0,5
>—*
{Zn
Построенная по результатам термического анализа диаграмма
состояния Na-Zn приведена на рис 256 Диаграмма характеризуется
наличием области несмешиваемости, протяженность которой составляет
11-92 % (ат) Zn [1] Критическая температура купола расслаивания
составляет 820 "С В системе установлено соединение NaZn^ [X, 1],
которое образуется по синтектической реакции Ж! + Ж2 я NaZn]3 при
температуре 548+2 °С Эвтектическая реакция Ж - (Na) + NaZn13
протекает при температуре 97±0,5 °С при концентрации Na почти 100 %
(ат) Характер реакции между (Zn),NaZn13 и жидкостью при температу-
температуре, близкой к температуре плавления Zn, точно не установлен (эвтекти-
(эвтектическая или перитектическая реакция) [1]
Используя модель регулярных растворов, авторы работы [1] также
рассчитали протяженность области расслаивания при температуре
548 "С, которая хорошо согласуется с полученной экспериментально В
работе [2] была предложена формула для расчета растворимости Zn в
Na в интервале температур 190-550 °С lgx = 0,998 - 2,562-103/Г, где х -
молярная доля Zn, T- температура, К Однако значение растворимости
Zn в Na, полученное по этой формуле при температуре 548 °С, составляет
0,8 % (ат), что намного меньше значения, полученного экспериментально
в работе [1] (см рис 256) Поэтому данные работы [2] маловероятны
В работах [3, 4] исследованы термодинамические свойства жидких
tonaBOB системы Na-Zn Было установлено, что при температурах
575-640 °С система характеризуется значительными отклонениями от
522
Na-Zn, Na-Zr
закона Рауля и ее свойства не подчиняются закономерностям регулярных
растворов во всей области составов.
Соединение NaZn^ имеет структуру собственного типа (символ
Пирсона cF\ 12, пр.гр. Fm Ъс), параметр решетки а = 1,22836 нм [5].
Литература
1 CetinH., RossR.G.//J Phase Equilibria 1991 V 12 N 1 P 6-9
2 Lamprecht G.J., Growther P. // Trans AIME 1968 V 242 N 10 P 2169-2171
3 Лантратов М.Ф., Морачевскнн А.Г., Антонова М.И. // Журнал прикладной химии
1963 Т 36 N6 С 1278-1283
4 МорачевскнйА.Г., Майорова Е.А., Воробьева О.И.//Электрохимия 1982 Т 18 N 1
С 148-150
5 Schomaker D.P., Marsh R.E., Ewing F.J. et al //Acta Crystallogr 1952 V 5 P 637-644
Л Л Зусман, Н Р Бочвар
Na-Zr. НАТРИЙ-ЦИРКОНИЙ
Диаграмма состояния Na-Zr представлена на рис. 257 схематически
согласно работе [1] в предположении, что она имеет сходство с
диаграммой состояния Li-Ti Zr не образует с Na каких-либо соединений
и не обнаруживает взаимной растворимости [2]. В работе [3] выполнен
расчет линии ликвидуса со стороны Na с использованием модели
Zr,'/' (по массе)
О ТО 1*0 50 60 70 80 90
t,c
1500
woo
883
500
S7.i
I I
1
(Л
1
Га:
Va)i
Газ+Ж
zr)
ж
т. + (aZf
^ faZr)
i
)
Zf)
wo
1855'
8S3°
О 10 20 30 +0 50 60 10 80 SO 100
Na Zr, "/• (am) Zr
Рис. 257. Na-Zr
Na-Zr, Na-Nd, Na-Ni 523
субрегулярных растворов. Получено уравнение линии ликвидуса:
true = 6,05 - 24,94-10 IT, где х - мольная доля Zr, T- температура, К.
Согласно данным, приведенным в работе [4], растворимость Zr в
жидком Na может быть выражена уравнением
lgx = -3464/T+ 0,831,
где х - концентрация Zr, % (ат.)
Литература
1 MoffattW.G.// Handbook of Binary Phase Diagrams New York Business Growth Services
General Electric Co Schenectady, 1978 V 4 278 p
2 Weeks J.R.//Trans ASM 1965 V 58 P 302-322
3 Кузни А.Н., Люблинский И.Е., Бескоровайный Н.М. // Расчеты и экспериментальные
методы построения диаграмм состояния Сб статей М Наука, 1985 С 113-118
4 Kubaschewski von Goldbeck О. // Atomic Energy Review Spesial Issue N 6 Zirconium
Phisico-chemical properties of its compounds and alloys Vienna international Atomic Energy
Agency 1976 P 67-140
Л А Третьяченко
Nb-Nd. НИОБИЙ-НЕОДИМ
Диаграмма состояния Nb-Nd не построена. В работе [1] сообщается,
что Nb в Nd при температуре плавления последнего практически не
растворяется
Литература
1 Гшнейднер К.А. Сплавы редкоземельных металлов Пер с англ / Под ред
ЕМ Савицкого М Мир, 1965 427с
Е И Гладышевскип, О И Бодак, В К Печорский
Nb-Ni. НИОБИЙ-НИКЕЛЬ
В работе [1] проанализированы данные опубликованных работ по
системе Nb-Ni и построена обобщенная диаграмма состояния,
приведенная на рис. 258. Диаграмма в основном совпадает с диаграммой,
построенной в работе [2], которая признана наиболее достоверной и
подтверждается другими исследованиями Линии ликвидуса и солидуса
твердого раствора (Nb) построены по данным работы [3].
524
Nb-Ni
no, -/а [по массе/
L
t, i
2400
2200
2000
WO
1600
mo
1100
woo
BOO
600
400
)
10
1
(Mi).
f\
A
20 JO
i
. ¦>
I
S^
fl26li
II
1
40 SO 60
Г" I
4400'
"*?
ж
45
70
%
У
80
1
/
/
SD
i
у
/
0
12S0
(Nb)
10
246
/
-I
\
1
0 fO 20 JO 40 50 60 70 80 SO WO
Ni Nb, % (am.) Nb
Рис. 258. Nb-Ni
В работе [2] применялись методы микроструктурного, рентгеновского
и термического анализов. Исходными материалами служили Ni чистотой
99,98 % (по массе) и Nb чистотой 99,91 % (по массе).
Система характеризуется наличием трех соединений Ni8Nb, Ni5Nb
и Ni6Nb7. Соединение Ni3Nb плавится конгруэнтно при температуре
-1400 "С. Соединение Ni6Nb7 образуется по перитектической реакции
Ж + (Nb) - Ni6Nb7 при температуре 1290 "С. Соединения Ni3Nb и Ni6Nb7
имеют широкие области гомогенности. Область гомогенности Ni3Nb при
температуре 1000 °С расположена в интервале 23,5-26,5 % (ат.) Nb,
область гомогенности Ni6Nb7 при температуре 1100 °С - в интервале
50-54 % (ат.) Nb.
Соединение Ni8Nb согласно данным работы [4] существует при
температурах ниже 535 "С. Предположительно оно образуется по
перитектоидной реакции при 535 "С. Область гомогенности этого
соединения не установлена.
В системе кристаллизуются две эвтектики по реакциям:
Ж> (Ni) + Ni3Nb при 1282 °С и -16 % (aT.)Nb,
Ж - Ni3Nb + Ni6Nb7 при 1175 "С и 40,5 % (ат.) Nb.
Nb-Ni, Nb-O 525
Растворимость Ni в Nb составляет 4,5 % (ат.) при температуре 1400 °С
[3]. Построенная в работе [5] линия солидуса (Nb) дает значение 8 % (ат.)
Ni при температуре 1570 "С, однако эти данные не согласуются с
результатами работ [2, 3].
Линия сольвуса (Ni) построена по данным работ [2,6,7]. В некоторых
работах, в частности в работе [8], делается вывод о более плавном
падении растворимости Nb в (Ni), так что она оказывается значительной
даже при 800 °С. Однако наличие при низких температурах соединения
Ni8Nb должно приводить к снижению растворимости, поэтому
предпочтение следует отдать данным работы [2].
Соединение Ni6Nb7 (во многих работах обозначается KaKNiNb) имеет
кристаллическую структуру типа W6Fe7 (символ Пирсона hR 13, пр.гр.
R3m, параметры решетки а = 0,4893, с = 2,664 нм).
Соединение Ni3Nb имеет структуру типа pCu3Ti (символ Пирсона оР8,
пр.гр. Рттп, параметры решетки а = 0,5116, Ъ - 0,4565, с = 0,4258 нм).
Соединение Ni8Nb обладает тетрагональной структурой, параметры
решетки а= 1,08, с = 0,36 нм [4, 9].
Литература
1. Nash P., Nash А. II Bull. Alloy Phase Diagrams. 1986. V. 7. N 2. P. 124-130.
2 Duerden I.J., Hume-Rothery W. // J. Less-Common Met. 1966. V. 11. N 6. P. 381-387.
3 Wicker A., Allibert C, Oriole J., Bonier E. // C.R. Hebd. Seances Acad. Sci.. Ser. С 1970.
V. 271. N4 P 273-275.
4. Van der Wekken C.J., Taggart R., Polonis D.H. // Met Sci. Journ. 1971. V. 5. P. 219-223.
5. Корнилов И.И., Пылаева Е.Н. // Изв. АН СССР. Металлы. 1966. N 5.С. 132-136.
6. GrubeС, Kubaschewski О.,Zwianer К. HZ. Elektrochem. 1939. Bd. 45. N 12. S. 881-884.
7. Arajs S., Chessin H., Colvin R.V. // Phys. State Solidi. 1963. V 3. P. 2337-2346.
8. Duvall D.S., Donachie M.J. Hi. Ins. Met. 1970. V. 98 N 7. P. 182-187.
9. Guist W.E., Van der Wekken C.J., Taggart R., Polonis D.H. // Trans. AIME. 1969. V. 245.
N 2. P 345-349.
Е.Н. Шефтепъ
Nb-O. НИОБИЙ-КИСЛОРОД
Диаграмма состояния Nb-O приведена на рис. 259 по справочнику
|Э], линия сольвуса твердого раствора (Nb) - согласно справочнику [Ш].
В системе установлены оксиды NbO, NbO2 и Nb2O5. Оксиды NbO и NbO2
плавятся конгруэнтно при температурах 1945 и 1915 °С соответственно.
Оксид Nb2O5 предположительно образуется по перитектической реакции
при температуре 1510 "С.
526
Nb-O
2400
ггоо
woo
1800
1600
1200
woo
BOO
600
1*00
гьб.
t v4<
\
¦ i
1
I
1
1
i°
9
0
s
1
% (no массе)
10 IS 20 25 30
f
Ж
К
I1 '
с
Г
Щ5
*•%
ш
t
в
0,1
I5W*
~l
Ǥ
\
13'
\
\
1
ft
1
|
1
1
i
1
|
о to го зо w so 60 70 во
Nb 0, Г. (am.)
Рис. 259. Nb-O
В работе, [1] была обнаружена еще одна равновесная фаза, состав
которой отвечает формуле Nb4O5. Эта фаза была обнаружена в катодных
осадках при электролизе расплавов, содержащих в определенных
соотношениях оксифторидные комплексные ионы Nb(V) и фторидные
комплексные ионы Nb(IV). Оксид Nb4O5 также был получен путем
химического взаимодействия пентаксида Nb с расплавом, содержащим
фторидные комплексные ионы Nb(IV). Характер образования указанного
оксида не установлен.
В системе имеют место две эвтектические реакции:
Ж - (Nb) + NbO при 1915 °С и 40,5 % (ат.) О,
Ж - NbO + NbO2 при 1810 °С и 60,7 % (ат.) О.
Растворимость О в (Nb) составляет -1,5 % (ат.) при температуре
850 °Си -3,5 %(ат.) при температуре 1200 °С [2]; в интервале температур
800-1500 °С она описывается уравнением [3]:
lg х = - 0,33 - 1680/Г,
где х - концентрация О, % (ат.), Т— температура, К.
N6-0. Nb-Os 527
По данным рентгеноструктурных исследований монокристаллов и
порошков оксид NbO имеет ГЦК структуру с параметром решетки а -
- 0,42102 нм [4]. Оксид NbO2 имеет упорядоченную тетрагональную
структуру, параметры решетки а - 1,368 нм, с = 0,597 нм [5]. Оксид Nb2O5
имеет несколько полиморфных модификаций, однако не все из них
стабильные: <xNb2O5 образуется при окислении при температурах ниже
800 "С; YNb2O5 может образоваться при температурах выше 1285 "С;
стабильной модификацией является оксид pNb2O5, который принадлежит
моноклинной сингонии, параметры решетки а - 1,963 нм, Ь - 0,3835 нм,
с = 0,2093 нм, Р= 120 °С или а = 0,2039 нм, Ь = 0,382 нм, с - 0,1947 нм,
Р= 115,55° Р].
Оксид Nb4O5 принадлежит новому структурному типу оксидов Nb,
имеет тетрагональную структуру (пр.гр. P42/nmc), параметры решетки
а = 0,6651, с = 0,4814 нм) [1].
Литература
1. Грнневич В.В., Модель М.С., Аракчеева А.А. и др. //Доклады АН СССР. 1991 Т. 319
№ 2. С. 380-394
2 Altstetter C.J. // Bull Alloy Phase Diagrams. 1984. V. 5. N 6. P. 543-553.
3 Фромм Е., Гебхардг Е. Газы и углерод в металлах: Пер. с нем. /Под ред Б.В. Линчевс-
кого. М Металлургия, 1980 712 с.
4. Brauer С, Morawiets Н. // Z. Anorg All. Chem. 1962. V. 37. P. 13-20.
5. Terao N. //Jpn. J. Appl. Phys 1963 V. 2. P. 565-573.
E.H. Шефтель
Nb-Os. НИОБИЙ-ОСМИЙ
Диаграмма состояния Nb-Os исследована методами микроскопичес-
микроскопического, рентгеновского и микрорентгеноспектрального анализов [1]. В
качестве исходных материалов были использованы порошок Nb
чистотой 99,8 % (по массе) и порошок Os чистотой 99,9 % (по массе). В
системе (рис. 260) присутствуют три промежуточные фазы х, о, р. Фаза
X образуется по перитектической реакции при температуре -2270 °С; фаза
о плавится конгруэнтно при температуре -2200 "С; фаза р образуется по
Перитектоидной реакции при температуре -1975 "С. Все три фазы %, о
h p имеют широкие области гомогенности, которые находятся в пределах
35-51, 54-73 и 71-75 % (ат.) Nb соответственно.
В системе протекают две эвтектические реакции:
Ж « х + ° ПРИ температуре - 2120 °С и концентрации 53 % (ат.) Nb,
528
Nb-Oi
Nb, % (no моссе)
IZ030 40 SO 60 70 80 30
100
I
I 1
3033"
@
4
4
\
\
s)
1
ч
/
1
1
\
1
S3
X
1
ж
170
\
¦ 2200°
1
QtfZST
\m
6 /1
(Nb)
3000
2600
zzoo
1800
rtao
1000
о w го зо 40 so so 70 во зо wo
05 ЫЬ,т/'(От.) Nb
Рис. 260. Nb-Os
Ж « о + (Nb) при температуре -2175 "С и концентрации -74 % (ат )
Nb.
Кристаллическая структура фаз системы Nb-Os приведена в табл. 218
Таблица 218 Кристаллическая структура фаз системы Nb-Os [1]
Фаза
X
0
Прототип
кМп
pu
Символ
Пирсона,
пргр
с/58,
/43 т
г?30,
Pb-Jmnm
Параметры решетки, нм
а
0,9661-
0,9776
0,9820
0,9897
с
0,5050
0,5083
Примечание
При 1600 °С
Со стороны Os
Со стороны Nb
Nb-Oi. Nb-P. Nb-Pb
529
Фаза
P
(Nb)
(Os)
Прототип
Cr3Si
W
Mg
Символ
Пирсона,
пргр
cP&,
РтЪп
с/2,
Imim
hPl,
Pd-Jnvne
Параметры решетки, нм
а
0,5118-
0,5135
0,3233-
0,3263
0,2752-
0,2762
с
-
-
0,4368-
0,4415
Примечание
-
При 83-90 % (ат) Nb
При 10-20 %(aT)Nb
Литература
1 Watcrstrat R.M., Manuszewski R.C. // J Less-Common Met 1977 V 51 N 1 P 55-67
E H Шефтель
Nb-P. НИОБИЙ-ФОСФОР
Сведения о системе Nb-P приведены в справочнике (III]. Исследование
системы было проведено методами рентгеновского, магнитного,
термического и микроскопического анализов. Установлено образование
двух соединений NbP и NbP2. Соединение NbP плавится конгруэнтно,
температура образования его не установлена. Соединение NbP2
распадается при нагреве (-1730 °С) с образованием жидкости и паров
фосфора. При концентрации 16 % (ат.) Р протекает эвтектическая
реакция Ж « Nb + NbP (температура реакции не установлена).
CoeflHHeHHeNbP2 имеет моноклинную структуру, параметры решетки
а = 0,8878(9), Ь - 0,3266B), с = 0,7529(9) нм, р = 119,8°. Соединение NbP
обладает тетрагональной структурой (пр гр. \A^md, параметры решетки
а = 0,333D), с = 1,14@) нм при 44,7 % (ат.) Р и а = 0,333D),с = 1,137(8) нм
при 50 % (ат) Р).
Е Н Шефтель
Nb-Pb. НИОБИЙ-СВИНЕЦ
Сведения о сплавах системы Nb-Pb приведены в справочнике [Ш].
По данным металлографического анализа при нагреве до температуры
850 °С соединения в системе не обнаружены. В сплавах, полученных
смешиванием порошка Nb с РЬ (проволока) при давлении 20 МПа и
температуре 1500 °С с последующим спеканием в графитовых контейне-
530
Nb-Pb Nb-Pd
pax при температуре 1100 °C, было обнаружено соединение Nb3Pb с
кубической структурой типа W (символ Пирсона с/2, пр гр Imbm,
параметр решетки а = 0,5270 нм)
Е Н Щефтепь
Nb-Pd. НИОБИЙ-ПАЛЛАДИЙ
Диаграмма состояния Nb-Pd приведена в справочниках [X, Э] В
справочнике [Ш] на основании обзора экспериментальных данных по
рентгеновским исследованиям указано на более сложный характер
строения диаграммы. В работе [1] построена диаграмма состояния
(рис 261) по результатам микроструктурного и рентгеновского анализов
В качестве исходных материалов использовали порошки Nb чистотой
99,8 % (по массе) и Pd чистотой 99,95 % (по массе) Авторы работы [1]
не обнаружили фазу б, о которой сообщалось в справочниках [X, Э, Ш],
и предположили, что фаза Nb3Pd2 со структурой типа NbRu [Ш] является
метастабильной
В системе Nb-Pd установлено существование трех соединений [1]
Соединения NbPd2 и aNbPd образуются по перитектическим реакциям
го
Pd, % (по массе)
SO ЬО SO 60 70
ВО SO WO
1555
700
Рис
261
0 10
Nb
Nb-Pd
10
30
ЬО 50
Pd,'/'
60 70
(am )
80
SO
100
Pd
Nh-Pd
531
Ж + (Pd) * NbPd, при -1610 °C и -67 % (ат.) Pd,
Ж + NbPd2 - aNbPd при - 1565 °C и -60 % (ат ) Pd
Соединение NbPd3 образуется конгруэнтно в твердом состоянии при
температуре -1610 °С и имеет две модификации Все три соединения
имеют области гомогенности.
В системе протекает одна эвтектическая реакция
Ж - (Nb) + aNbPd при 1520+10 "С и -47 % (ат) Pd
и две эвтектоидные реакции
aNbPd * (Nb) + NbPd2 при 1255+5 °С и -50 % (ат) Pd,
(Pd) - NbPd2 + NbPd3 при - 1560 °C и -71 % (ат) Pd
В твердом растворе (Nb) растворяется до 35 % (ат) Pd при 1255 °С
и -20 % (ат ) Pd при 800 "С В твердом растворе (Pd) растворяется до
-31 % (ат) Nb при 1610 °С и -18 % (ат) Nb при температурах < 1500 "С
Кристаллическая структура соединений приведена в табл 219.
Таблица 219 Кристаллическая структура соединений системы Nb-Pd
Соедине-
Соединение
aNbPd
NbPd2
aNbPdj
PNbPd,
Прото-
Прототип
Си
MoPt2
TiAI3
NbPd3
Символ
Пирсона,
пргр
РтЗт
<>16,
Immrn
г/8,
Шгптт
Рттт
Параметры решетки, нм
а
0,4020*'
0,4012*2
0 4004*3
0 2839
0.3895*4
0,5486
Ь
-
0,8376
-
0,4845
с
:
0 3886
0J913*4
1,3602
*'При концентрации 50 % (ат) Pd
*2При концентрации 52 % (ат) Pd
*3Г1ри концентрации 55 % (ат ) Pd
При температуре 850 °С
*' Данные получены на быстрозакаленных образцах
Источник
[1]
m
[и
[2]
[3]
[4]
532 Nb-Pd, Nh-Pr, Nb-Pt
Литература
1. Giessen B.C., Grant N.J., Parker D.P. et al. // Metall. Trans. A. 1980. V. 11. N 5.
P 709-715.
2. Giessen B.C., Grant N.J. // J. Less-Common Met. 1965. V. 8. P. 114-119.
3. Dwight A.E. // Columbium Metallurgy. AIME Met. Soc. Conf. New York: Interseience
РцЫ., 1961. V. 10. P. 383-406.
4. Giessen B.C., Grant N.J.//Acta Cristallogr. 1964. V. 17. P. 615-616.
A.JI. Татаркина, Е.М. Соколовская
Nb-Pr. НИОБИЙ-ПРАЗЕОДИМ
Диаграмма состояния Nb-Pr не построена. По данным работы [1] Nb
и Pf не смешиваются в жидком состоянии. Система, по-видимому,
принадлежит к монотектическому типу. Двойные соединения отсутству-
отсутствуют.
Литература
1. Савицкий Е.М., Барон В.В., Ефимов Ю.В. // Редкоземельные металлы и сплавы: Сб.
статей. М.-. Наука, 1971. С. 81.
Е.И. Гладышевскип, О. И. Бодак, В. К. Печарский
Nb-Pt. НИОБИЙ-ПЛАТИНА
Диаграмма состояния Nb-Pt, приведенная на рис. 262, построена в
работе [1] по результатам микроскопического, рентгеновского,
микрорентгеноспектрального и термического анализов. В качестве
исходных компонентов использовали Nb чистотой 99,6 % (мае.) и Pt
чистотой 99,9 % (мае). Сплавы выплавляли в дуговой печи, термическая
обработка сплавов включала длительные отжиги при различных
температурах: от 3 ч при температуре 1900 "С до 1 мес. при 1000 °С.
В системе Nb-Pt установлено существование шести соединений, из
которых одно NbPt3 образуется конгруэнтно при температуре 2040 "С,
остальные Nb3Pt, Nb2Pt(o), Nb|_x, Pt|+X, a'Pt, NbPt2 образуются по
перитектическим реакциям. Соединение a'Pt существует в узком
температурном интервале 1780-1670 °С. Соединение Nb3Pt имеет
значительную область гомогенности, протяженностью 19-28 % (ат.) Pt
при температуре 1800 °С. Соединение Nb2Pt также имеет область
гомогенности, которая при температуре 1700 °С расположена в
интервале 31-38 % (ат.) Pt. Области гомогенности других соединений
Nb-Pi
533
0 10 20 JO
t;c
2300
2100
WOO
1700
1500
1300
1100
SOD
0 10 20 30
Nb
Рис. 262. Nb-Pt
Pt,°/.(no массе)
50 60 70 80
90
100
\
У/
/
1
\
\
к
4
\
k-
Is
ж
H
к
у
1990
''\
Ymo°
itrfa'Pt
16
1
rO°
•si
1!
- опьп
г
Z^2OO0
%
и
(P
1769'
W 50 60 70 80 SO 100
Pt, % (От.) Pt
составляют 1-2 % (ат.). Соединение NbPt3 существует в двух модифика-
модификациях, но температура перехода не установлена.
Нонвариантные реакции приведены в табл. 220.
Таблица 220. Нонвариантные реакции в системе Nb-Pt [1]
Ж +
Ж +
ж =
Ж +
Ж +
a'Pt
Ж +
Ж +
Реакция
(Nb) =• Nb3Pt
NbjPt - Nb2Pt
Nb2Pt + Nb,_vPtl+x
a'Pt=.Nb,_vPtl+A
NbPt2»a'Pt
- Nb,_4Pt1+A + NbPt2
NbPt3=-NbPt2
NbPt3 » (Pt)
-26,
36,
-43,
-,
-,
-,
-,
-,
Содержание Pt
в фазах, % (ат.)
-12,
-28,
-38,
-57,
-67,
-54,
-75,
-76,
-19
-31
-51
-51
-57
-67
-67
-80
Температура, °С
2040т10
1800т 10
1700т10
1750
1780+10
1670
1990
2000
534
Nb-Pl
В системе отмечается значительная растворимость компонентов друг
в друге. Растворимость Pt в (Nb) составляет -12 % (ат.) при температуре
2040 "С и -5 % (ат.) при 1150 "С. Растворимость Nb в (Pt) составляет
-20 % (ат.) при температуре 2000 "С и при понижении температуры
снижается незначительно.
Кристаллическая структура соединений системы Nb-Pt приведена в
табл.221.
Таблица 221. Кристаллическая структура фаз системы Nb-Pf
Фаза
Nb3Pt
Nb2Pt(o)
Nb,_APt,+A
NbPt2
etNbPt3
pNbPt;
(Nb)
(Pt)
Прото-
Прототип
Cr3Si
CrFe
AuCd
MoPt2
PCu3Ti
NbPt3
W
Cu
Символ
Пирсона,
пр.гр.
cPi.
РтЪп
IPSO,
PA^mnm
»i>4,
Pmma
0/6,
Immm
oPb,
Pmmn
mPA8,
Plxlm
ell,
1тЪт
cF4,
Fmim
Параметры решетки, нм
a
0,5181-
0,5138
0,9940-
0,9902
0.2780
0,2801
0,5534
0,5537
0,3277
0,3260
0,3940
0,3935
0,3927
0,3924
*a = 90,63°.
Структура соединения a'Pt неизвестна.
Ь
-
-
0,4983
0,8459
0,4873
0,4870
-
_
с
-
0,5145-
0,5132
0,4611
0,3951
0,4564
2,233
-
Примечание
При концентрации
Pt, % (ат.):
20-28 [1]
32-38 [1]
50 [1,2]
67 [1,2]
75 [1,2]
75 [1,2]
5[1]
10[1]
82 [1]
85[1]
90 [1]
95 [1]
Nb-Pl, Nh-Pu. Nb-Rh
535
Литература
1 Watersfraf R.M., Giessen B.C. // Metal. Trans. A. 1985. V. 16. P. 1943-1949.
2 Giessen B.C., Gram N.J.//Acta Crystallogr. 1964. V. 17. P. 615-616.
А Л. Татаркшш, E. М. Соколовская
Nb-Pu. НИОБИЙ-ПЛУТОНИЙ
Диаграмма состояния Nb-Pu не построена. Промежуточных фаз в
системе не обнаружено [Э]. Растворимость Ри в (Nb) согласно данным
металлографического анализа, приведенным в справочнике [Ш],
составляет менее 1 % (по массе).
Е Н Шефтепь
Nb-Rb. НИОБИЙ-РУБИДИЙ
Обобщенная диаграмма при давлении 0,1 МПа (рис. 263) приведена
в справочнике [М]. Она построена по данным работ [1, 2], полученным
путем расчета.
Nb, % (по массе)
О 10 ZO 30 ?3 50 60 70 ВО 90 100
wo
7000
WOO
[
{
688*
39At.
1
Газ
•
i
—--
1
1——
(Nb)
t
p-
Газ
i
Газ-i
t /л/ж.]
1
—1 ¦
-Ж
Kb)
1
1
2469"
О 10 20 JO <tO 50 60 ТО 80 SO 100
Kb Nb, У. (am.) Nb
Рис. 263. Nb-Rb
536
Nb-Rb. Nb-Re
Литература
1 Chase M.YV. // Bull Alloy Phase Diagrams 1983 V 4 N 2 P 124
2 Niessen A.K., de Boer F.R., Boom R. et al //Calphad 1983 V 7 P 51-70
H P Бочвар
Nb-Re. НИОБИЙ-РЕНИЙ
Диаграмма состояния Nb-Re исследована многократно, построена
в работах [1-4] и уточнена в работе [5]. Все построенные диаграммы в
основном подобны, характеризуются наличием двух промежуточных фаз
(х и о) и широкой областью твердого раствора (Nb). Основное различие
заключается в определении характера образования фазы х и температур-
температурного интервала существования фазы о.
На рис. 264 диаграмма Nb-Re приведена по данным работы [5].
Согласно работе [5] фаза % образуется по перитектической реакции, тогда
как в работах [2, 4] говорится о конгруэнтном плавлении этой фазы при
температуре 2800 °С и концентрации 80 % (ат.) Re [2] или при -2750 °С
ГТе, % (по массе)
О10 20 J0 40 50 60 W 80 90 100
\jtB6'
Яе)
1000
500
О 10 ТО JO
*ff SO ВО 70
fie, % (am.)
90
too
ffe
Рис. 264. Nb-Re
Nb-Re
537
и 85 % (ат.) Re [4]. Фаза х имеет широкую область гомогенности, которая
при температуре 2200 °С расположена в интервале 62-87 % (ат.) Re [2],
69,5-86,5 % (ат.) Re [1, 5], 61,5-87 % (ат.) Re [4]. Фаза о по данным всех
исследователей образуется по перитектической реакции и существует в
узком температурном интервале, распадаясь по эвтектоидной реакции
на (Nb) и фазу х
В системе образуется эвтектика между (Nb) и фазой о [1-5]. По данным
работ [2-4] существует еще одна эвтектика между фазой х и (Re) при
температуре 2715? 15 °С и концентрации 87*0,5 % (ат.) Re [4] или при
2730 °С и 90 % (ат.) Re [2].
Нонвариантные реакции приведены в табл. 222.
Таблица 222 Нонвариантные реакции в системе Nb-Re
Реакция
Ж - (Nb) + о
Ж- + Х-О
o-(Nb) + x
Ж + (Re) - х
Содержание Re
в фазах, % (ат )
51,
48,
52,
-56,
-53,
-57,
57,
54,
57,
-66,
46,5,
44,5,
46,
-57,
-53,
-57,
46,
45,5
96,
55
54
69,5
61,5
62
69,5
61,5
62
-75
Температура,
°С
2350
2435
2400
2400
2565
2450
2200
2162
>2300
2520
Источник
[5>
[4]
[2]
[5]
[4]
[2]
[5]
[4]
[2]
[5]
Данные по растворимости Re в (Nb), определенные различными
исследователями, хорошо согласуются между собой. При эвтектической
температуре растворимость Re в (Nb) составляет 46 % (ат.) [2]; 45,5 % (ат.)
{4]; 46,5 % (ат.) [5], а при температуре 1000 °С соответственно 43; 45,5;
38,5 % (ат.). Максимальная растворимость Nb в (Re) равна 4+0,5 % (ат.)
{4], при температуре 1500 "С растворимость снижается до 0,4 % (ат.) [5].
Фаза х имеет структуру типа аМп (символ Пирсона с/58, пр.гр. 143т),
параметр решетки уменьшается от а = 0,967 нм для сплава с 83,4 % (ат.)
Re до а = 0,961 нм для сплава с 90,9 % (ат.) Re [2, 5].
Фаза о имеет структуру типа ри (символ Пирсона гРЗО, пр.гр.
РА^тпт, параметры решетки а = 0,875 нм, с = 0,406 нм [2] или а =
= 0,978 нм, с = 0,511 нм[4]
538
Nb-Re. Nb-Rh
Литература
1 Савицкий Е.М., Тылкииа М.А., Поварова К.Б. // Атомная энергия 1959. Т. 7. Вып. 5.
С 470-472
2. Knapton A.G. // J. Less-Common Met 1959. V. 1 N 6. P. 480-483.
3. Giesscn B.C., Nordhcim R., Grant N.J.// Trans. AIME. 1961. V 221. P. 1009-1013
4. Grant N.J., Giessen B.C. // J. Metals. 1961. V. 13. P 87-90
5 Савицкий Е.М., Тылкина М.А., Левин A.M. Сплавы рення в электронике. М : Энергия,
1980 216 с.
М А Тылкииа
Nb-Rh. НИОБИЙ-РОДИЙ
Диаграмма состояния Nb-Rh была построена в работе [1] во всем
интервале концентраций по результатам рентгеновского, металлографи-
10 20 JO
Rh,°/*(no массе)
40 SO BO 70
SO 90 100
Nb-Rh
539
ческого и термического анализов. В системе обнаружено образование
девяти промежуточных фаз, из которых одно NbRh3 плавится конгруэн-
конгруэнтно при температуре 1950 °С и концентрации 72 % (ат.) Rh. Остальные
промежуточные фазы образуются по перитектическим или перитектоид-
ным реакциям, которые приведены в табл. 223. В табл. 223 также
Приведены имеющие место в системе две эвтектические и две эвтектоид-
ные реакции.
Таблица 223 Нонвариантные реакции в системе Nb-Rh |1]
Реакция
Ж + NbRh3 ° Л
ж + л-с
Ж + С = е
Ж + е-Р
Ж + (Nb) - о
§ + Е - 6
P + 5-y
(Nb) + о - Nb3Rh
Ж = о + р
Ж- NbRh3 + (Rh)
Е- 6+С
P-o + y
-67,
-55,
-54,
-53,
33,
-,
-,
14,
45,
-83,
57,5,
49,5,
Содержание Rh
в фазах, % (ат )
71,
66,
-63,
-60,
20,5,
54,5,
-52,
28,5
39,
79,
-,
39,5,
-69
63,5
62
57,5
30
-
-
-25
46,5
83,5
-
51,5
Температура, °С
-1900
-1625
1600
1580
1660
-1420
-1350
1220
1550
-1900
1335
1335
Кристаллическая структура соединений приведена в табл. 224.
540
Nb-Rh, Nb-Ru
Таблица 224 Кристаллическая структура соединений Nb-^Rh |1|
Соедине-
Соединение
NbRh3
Л
С*
е
5"
Y
о
Nb3Rh
Прото-
Прототип
AuCu3
VCo3
-
AuCd
-
AuCu
CrFe
Cr3Si
Символ
Пирсона,
пргр
сР4,
РтЗт
й/>24,
/>6ш2
-
с>Р4,
Ртта
Ртст
г/>4,
Р41ттт
Г/>30,
сП,
РтЪп
Моноклинная сингония
Ромбическая сингония
Параметры решетки, нм
а
0,3857
0,3844
0,5483
0,2806
0,2813
0,2827
0,4019
0,9869
0,9810
0,5120
Ь
-
-
0,4772
0,4808
0,4770
-
-
-
с
-
1,3405
2,025
0,4510
1,3587
0,3809
0,5106
0,5068
-
Примечание
При Rh, % (ат)
74,5
77,2
69,2
62,3
58,8
55,9
51,3
29,7
37,8
24,8
Литература
1 RitterD.L., Giessen B.C., Grant N.J.// Trans AIME 1964 V 230 P 1250-1267
А Л Татаркина, Е М Соколовская
Nb-Ru. НИОБИЙ-РУТЕНИЙ
Диаграмма состояния Nb-Ru, построенная в работе [1], приведена
на рис. 266 Кривые ликвидуса и солидуса построены пирометрическим
методом. Система характеризуется широкими областями твердых
растворов (Ru) и (Nb). Кривые ликвидуса и солидуса в области (Nb)
имеют минимум при температуре 1870 °С и концентрации 39 % (ат) Ru
Nb-Ru
541
Ru,"/»(no массе)
0 tO 20 30 40 SO SO 70 80 SO 100
tic
2*00
2200
2000
1800
1600
1*00
1200
WOO
II я 1
4
(Nb
1
)
i
187C
>*«
39
1
Ж
- 1QL.
\
it
p
-If
I
7v
1
233th'
0 10 20 30 40 SO SO 70 80 90 100
Nb Ru,V»(am.) Пи
Рис. 266. Nb-Ru
И максимум при температуре 1942 "С и концентрации 50 % (ат.) Ru.
Эвтектика (Nb) + (Ru) кристаллизуется при температуре 1774 "С и
концентрации 65 % (ат.) Ru. В системе по перитектоидной реакции при
температуре 1540 °С образуется соединение NbRu3.
Согласно данным работы [1] твердый раствор (Nb) имеет ОЦК
структуру, которая стабильна при концентрации до 58 % (ат.) Ru.
Обнаруженная авторами работ [2-4] при концентрациях -37-60 % (ат.)
Ru структура с тетрагональной ОЦ решеткой появляется в сплавах в
результате мартенситного превращения.
Соединение NbRu3 имеет структуру типа AuCu3 (символ Пирсона сРА,
пр.гр. РтЪт, параметры решетки а = 0,2750 нм, с - 0,4418 нм) [1].
Параметры решетки (Nb) уменьшаются с увеличением содержания Ru.
В работе [2] сообщается, что вблизи эквиатомного состава при охлажде-
охлаждении сплавов происходит переход тетрагональной ОЦ структуры
(Параметры решетки а = 0,3194 нм, с = 0,3311 нм при 45 % (ат.) Ru) в
ромбическую ГЦ структуру (параметры решетки а = 0,4285 нм, Ь =
= 0,4197 нм, с = 0,4326 нм при 55 % (ат.) Ru).
Литература
1 Hurley G.F., Broph> J.H. Hi Less-Common Met 1964 V 7 P 267-277
2 Raub E., Frit/.she W.//Z Metallkunde 1963 Bd 54 S 317-319
542 Nb-Ru. Nb-S
3. Greenfield P., Beek P.A. // J. Metals. 1956. V. 8. P. 265
4. Das B.K., Schtnerling M.A., Lieberman D.S. // Mater. Sci. Eng. 1970. V. 6. P 248.
А Л. Татаркина, Е.М Соколовская
Nb-S. НИОБИЙ-СЕРА
Диаграмма состояния Nb-S не построена. Данные, приведенные в
справочнике [X], были пересмотрены в более поздних работах, с учетом
новых исследований [Ш]. Установлены и изучены следующие соединения.
Соединение NbS3 имеет моноклинную структуру, параметры решетки
а = 0,494 нм, Ъ = 0,674 нм, с = 1,81 нм, р = 97,5° [1-3]. Соединение NbS2
существует в двух модификациях. При температурах ниже 800 °С
стабильна модификация с ромбоэдрической структурой, возможно типа
MoS2 (символ Пирсона hR3, пр.гр. КЪт), параметры эквивалентной
гексагональной решетки а = 0,333 нм, с = 1,189 нм. В интервале
температур 850-1050 "С стабильна модификация с гексагональной
структурой типа MoS2 (символ Пирсона hP6, пр.гр. Р6ъ1ттс, параметры
решетки о = 0,331 нм, с = 1,189 нм).
Соединение Nb1+xS2 при температуре 1100 °С и х = 0,12-0,25 и при
температуре 800 "С и х - 0,12-0,5 имеет ромбоэдрическую структуру
(пр.гр. R3m, параметры эквивалентной гексагональной решетки а -
- 0,333 нм, с - 1,780-1,785 нм). При более высоких содержаниях Nb при
х = 0,30-0,43 и температурах выше 1000 "С стабильно соединение
Nb1+vS2 с гексагональной структурой (пр.гр. Р6ъ1ттс, параметры
решетки а- 0,331 нм, с - 1,253-1,265 нм).
Соединение Nb2_vS2 при х = 0,0-0,3 стабильно при температурах
ниже 850 °С и имеет гексагональную структуру, параметры решетки
а = 0,332 нм, с = 1,292 нм [1, 3]. Структура соединения NbS,_x, находяще-
находящегося в равновесии с Nb, гексагональная типа NiAs (символ Пирсона hPA,
пр.гр. Р631ттс, параметры решетки а = 0,333, с = 0,639 нм). При
температурах выше 850 °С появляется одна или несколько фаз при
концентрациях около 50 % (ат.) S.
Литература
1 Jcllinek F., Braner G., Muller H. // Nature I960. Bd. 185. S. 376-377
2. Григорян Л.А., Новоселова А.В. //Доклады АН СССР. 1962. Т. 144. С. 795-797
3. Jcllinek F.//Arkiv Kemi. 1963 Bd. 20. S. 447-480.
E.H Шефтель
Nb-Sb
543
Nb-Sb. НИОБИЙ-СУРЬМА
Диаграмма состояния Nb—Sb построена в работе [1] по результатам
металлографического, термического, рентгеновского анализов и
измерения микротвердости (рис. 267). В качестве исходных материалов
t°c
Sb, % (no массе)
0 W 20 JO *0 SO BO 70 80 go WO
2200
woo
ffOO
1000
BOO
200
ztis
\
\
(Nb.
J
1
:
V,
1—
T
I
i
-
r~
...
-i—
Si
i—
0*20
n—
ж
:^
~T~"
1020 ±1
\
ГЗ"
«•. i
—r~
0"
—г
JSOtW*
\
SlOt 10" '
(Si)—
S30.753'
о to го зо ьо so so то во до too
нь sb.'/г (am-) sb
Рис. 267. Nb-Sb
использовали Nb чистотой 99,8 % (по массе) и Sb чистотой 99,9 % (по
массе). Сплавы с содержанием Nb до 60 % (ат.) выплавляли в индукцион-
индукционной печи, остальные сплавы - дуговой плавкой в атмосфере очищенного
Не. Затем образцы отжигали при температурах 800 и 600 °С в течение
150 ч.
Согласно данным работы [1] в системе существуют четыре соединения
NbjSb, Nb3Sb2, NbSb, Nb4Sb5. Все эти соединения образуются по
перитектическим реакциям при температурах 1750, 1140, 1020 и 760 °С
соответственно. Авторами работы [2] обнаружено еще одно соединение
NbSb2, однако характер образования его не сообщается. При температу-
температуре, близкой к температуре плавления Sb, в системе кристаллизуется
эвтектика. Растворимость Sb в (Nb) при температуре 800 °С составляет
-4 % (ат.) и увеличивается при повышении температуры. Nb практически
не растворяется в (Sb).
Кристаллическая структура соединений приведена в табл. 225.
544
Nb-Sb. Nb-Sc
T а б л и и а 225 Кристаллическая структура соединений системы Nb-Sb
Соедине-
Соединение
NbjSb
NbSb
Nb4SB5
NbSb2*
Прото-
Прототип
Cr3Si
NiAs
Te4T>5
-
Символ
Пирсона,
пргр
c/>8,
РтЪп
hP4,
Ptylmmc
//18,
/4m
-
'Моноклинная сингония, (J = 12C
Параметры решетки, нм
а
0,52643
0,4270
1,0314
1,031
1,0239
Ь
-
-
0,36319
с
0,5447
0,35566
0,357
0,8333
Источник
[2]
[1]
[2]
[3]
[2]
,07°, возможная пр гр С2, Cm или С2/т
Структура соединения Nb3Sb2 не установлена.
Литература
1 Мызенкова Л.Ф., Барои В.В., Савицкий Е.М.//Изв АН СССР Металлы 1966. N 2
С 163-I6S
2 FurusethS., Kjekshus A.//Acta Chem Scand 1964 V 8 P 1180-1195
3 Boiler H., Nowothy H.//Monatsh Chem 1964 Bd 95 S 1272-1282
E H Шефтель
Nb-Sc. НИОБИЙ-СКАНДИЙ
Диаграмма состояния Nb-Sc (рис. 268) построена в работе [1]
Диаграмма состояния представляет собой систему эвтектического типа
с ограниченной растворимостью компонентов в твердом состоянии.
Эвтектика кристаллизуется при температуре 1500 "С и концентрации
97 % (ат.) Sc. Растворимость Sc в (Nb) не превышает 0,1 % (ат), а
растворимость Nb в (Sc) не превышает 0,4 % (ат.)
Nb-Sc. Nb-?e
545
Sc, '/. (по массе)
ZO 4ff SO 80 WO
2700
1800
won
гш
О
b)
1
150
I
Ж
N
0'
4^
(JiSc)—
Sc)-*
1337'
0 10 ZO JO 40 50 SO 70 80 SO 100
Nb Sc, % (am.) Sc
Рис. 268. Nb-Sc
Литература
I Наумкин О.П., Терехова В.Ф., Савицкий Е.М. // Редкоземельные металлы и сплавы
Сб статей М Наука 1971 С 28-34
Е И. Гладышевскип, О И Бодак. В К Печорский
Nb-Se. НИОБИЙ-СЕЛЕН
На протяжении последних 30 лет проводились интенсивные
исследования соединений, образующихся в этой системе, однако
диаграмма состояния не построена. Отчасти это связано с эксперимен-
экспериментальными трудностями, и как результат этого с противоречивостью
Данных различных исследователей. Следует отметить, что в системе
могут образовываться различные политипные структуры. Такие
йрлитипы имеют сходное кристаллическое строение и близкие энергии
Образования [1, 2].
Частично диаграмма состояния Nb-Se была построена в работе [1].
Однако авторы отмечают, что трудно достигнуть равновесия в системе
И воспроизводимость результатов неудовлетворительная. Часть
диаграммы состояния в области NbSe2 - Se исследована в работе [3].
546
Nb-Se
Se, % (no массе)
70 80 SO
WO
800
600
400
ZOO
-ih
780'
690°
2ZI°
0
Рис. 269. Nb-Se
10
80
se, %
so
(am)
TOO
Se
Смеси порошков Nb и Se высокой чистоты нагревали в вакуумированных
кварцевых ампулах, и полученные сплавы исследовали методами
дифференциального термического, химического и рентгеновского
анализов Построенная диаграмма Nb-Se приведена на рис 269. В
исследованной части системы установлено образование следующих
соединений: NbSe2,NbSe3,Nb2Se9. Два последних соединения образуются
по перитектическим реакциям при температурах 780 и 690 °С соотве-
соответственно Характер образования соединения NbSe2 не определен. При
температуре 220 °С кристаллизуется эвтектика Nb2Se9 + (Se)
В работе [2] говорится о существовании нескольких соединений
NbSe
0 8
, NbSet 33
2#'З
в области концентраций 50-80 % (ат)
8 j t 3 ^
Se, трех политипов 2#,'ЗЛ, 4# в области концентраций 60-66,7 % (ат)
Se, трех модификаций а, р, у вблизи концентрации 80 % (ат) Se. В работе
[4] сообщается о фазе NbSe15, в работе [5] - о пяти фазах, полученных
в области концентраций 59,7-66,7 % (ат) Se в зависимости от температу-
температуры и парциального давления Se: NbSe15 (моноклинная сингония),
политипы 2Н(а) (гексагональная сингония), 3R (ромбоэдрическая
сингония) с широкой областью гомогенности, 4Н (гексагональная
сингония), 2Н(Р) (структура не выяснена) с узкой областью гомогенности
вблизи концентрации 66,7 % (ат) Se. По данным работы [6] одно из
соединений должно описываться формулой Nb2Se9 (NbSe4 5) В работе
[7] было получено соединение NbSe0 5
Кристаллическая структура соединений приведена в табл 226
NbSe
547
Таблица 226 Кристаллическая структура соединений системы Nb-Se
Соедине-
Соединение
NbSe,
NbSe,"'
Nb2Se,'2
Nb5Se4
Nb3Se4
NbSe,'53
NbSeo'54
Прото-
Прототип
Cdl2
MoS2
-
-
Т,5Те4
MoNiP2
-
-
Символ
Пирсо-
Пирсона,
пргр
Л/>3,
РЪт\
ИР6
Pb-jlmmc
m/>24,
-
г/18,
/4/ш
hPi,
РЬъ1ттс
РТ/т
CVm
*'Моноклинная сингония, р =
*2Триклинная сингония а -
a = 120,893D)°, p = 124,017G)°, у
*3Моноклинная сингония, р =
^Моноклинная сингония, р =
Параметры решетки, нм
а
0,3447D)
-
1,0009G)
1,0006
0,8187G)
0,81829F)
-
1,0012
0,6503
1,3992
= 124,017G)°
20,87B)°, р
= 92,274(8)°
= 103,39°
= 91,76°
b
—
-
0,3477C)
0,3478
0,8321(9)
0,83230F)
-
-
0,3434
0,3422
с
1,2561F)
-
1,5632(8)
1,5626
1,3074(8)
1,3084A)
-
0,34707
0,9215
0,9283
Примечание
[3]
При температуре
>-233 °С [М]
При температуре
-980 'С [М]
[3]
[8]
[3]
[6]
[М]
[2]
[4]
[7]
[3], р = 109,3° [8]
= 123,98A)°, у = 92,37C)° [3],
[6]
Литература
1 Revolinskiy E., Brown B.E., Becrntsen DJ., Armitagc С.Н.//J Less-Common Met 1965
V 8 N 1 P 63-72
2 SelteK., Bjerkelund E., Kjekshus A. Hi Less-Common Met 1966 V 11 N 1 P 14-30
3 Федоров В.Е., Мищенко А.В., Устименко Ю.Б. // Изв АН СССР Неорганические
материалы 1984 Т 20 N 7 С 1085-1089
4 Kadijk F., Huisman R., Jellinek F. // Acta Crystallogr В 1968 V 24 N 8 P 1102-1106
5 Igaki K., Nishine S.//Trans Japan Inst Met 1979 V 20 N 5 P 219-226
6 Meerschaut A., Guemas L., Bergcr R., Rouxel J.//Acta Crysrtallogr В 1979 V 35 N 9
P 1747-1750
7 Conard B.R., Norrby L.J., Franzen H.F. // Acta Crystallogr В 1969 V 25 N 9
P 1729-1735
8 Meerschaut A., Rouxcl J //J Less-Common Met 1975 V 39 N 2 P 197-204
E H Шефтель
548
Nb-Si
Nb-Si. НИОБИЙ-КРЕМНИЙ
Диаграмма состояния Nb-Si (рис. 270) исследована во всем интервале
концентраций и построена в работе [1]. Сплавы для исследования
получали методом дуговой плавки в атмосфере Аг. В качестве исходных
материалов использовали Nb чистотой 99,8 % (по массе) и монокристал-
монокристаллический Si. Исследование проводили методами металлографического,
рентгеновского и термического анализов.
В системе образуются три соединения Nb5Si3, Nb3Si и NbSi2.
Соединения Nb5Si3 и NbSi2 плавятся конгруэнтно при температурах
2520т25 "С и J 940+20 °С. СоединениеNb5Si3 имеет область гомогенности
и претерпевает полиморфное превращение в интервале температур
1940т20 - 1650т 15 °С в зависимости от состава. Область гомогенности
высокотемпературной модификации pNb5Si3 составляет около 3 % (ат.)
Л", % (по массе)
10 20 W 60 80 100
Z400
гооо
1600
1100
О 10 10 30 40 SO 60 70 80 90 100
fib Si, V. (am) Si
Рис. 270. Nb-Si
NbSi
549
при температуре 1900 °С. Область гомогенности низкотемпературной
модификации ocNb5Si3 составляет менее 1 % (ат.). Соединение Nb3Si
образуется по перитектической реакции и существует в узкой температур-
температурной области A980-1770 °С). В системе образуются три эвтектики и два
эвтектоида
Нонвариантные реакции приведены в табл. 227.
Таблица 227 Нонвариантные реакции в системе Nb-Si
Реакция
5K+pNb5Si3-Nb3Si
5K=(Nb)+Nb3Si
5K«pNb5Si3+NbSi2
)K»NbSi2+(Si)
Nb3Si-(Nb)+aNb5Si3
PNb5Si3-aNb5Si3+NbSi2
-18
20,
17,5
18,
57,
98,
25,
39,5
Содержание Si
в фазах, % (ат)
37,5,
37,5,
1,2,
-4,
40,5,
66,7,
0,5,
-38,5,
25
25
25
25
66,7
-100
37,5
66,7
Температура,
°С
1980т20
1920т 10
1920т20
1880т 10
1900т20
1400тЮ
1770т15
1650т 15
Источник
["]
[2]
tu
[2]
ш
[1]
И]
ш
Растворимость Si в (Nb) составляет 0,5 %(ат.) при 1770 "Си 1,2%(ат.)
при 1920 °С; Nb практически не растворяется в (Si).
Кристаллическая структура соединений приведена в табл. 228.
Таблица 228 Кристаллическая структура соединений системы Nb-Si
Соединение
Nb3Si
PNb5Si3
Прототип
TijP
W5S,3
Символ
Пирсона,
пргр
г/>32,
РЦп
г/32,
14/тст
Параметры решетки,
нм
а
1,023
1,0040
1,0018
с
0,518
0,5081
0,5072
Источник
[1,21
[1]
[3]
550
Nb-Si Nb-Sm
Соединение
<xNb5Si3
NbSi2
(Nb)
Прототип
Cr5B3
CrSi2
w
Символ
Пирсона,
пр.гр.
r/32,
IAImcm
ИР9,
P6222
ell,
1тЪ т
Параметры решет-
решетки, нм
a
0,6571
0,656
0,4791
0,3299-
0,3308
с
1,1889
1,186
0,6588
—
Источник
[1]
[3]
[1]
[4]
В работе [5] построена р—Т диаграмма для соединения Nb3Si при
температурах 1000-2000 °С и давлениях 2-7 ГПа. При температурах
выше 2000 °С силицид ниобия имеет гексагональную структуру с
параметрами решетки а = 0,7536, с = 0,5257 нм. При температурах ниже
2000 "С и давлениях 2-3 ГПа имеет место смесь двух структур: гексаго-
гексагональной (ГПУ) с параметрами а = 0,6593 нм, с = 1,2652 нм и кубической
(ОЦК) с параметром а = 0,3377 нм. При температурах ниже 2000 "С и
давлениях выше 3 ГПа Nb3Si имеет тетрагональную структуру.
В работе [6] диаграмма состояния Nb-Si построена расчетным путем
с использованием данных по параметрам стабильности кристаллических
структур компонентов. Расчетная диаграмма соответствует эксперимен-
экспериментально построенной.
Литература
1. Кочержниский Ю.А., Юпко Л.М., Шишкин Е.А. // Изв. АН СССР. Металлы. 1980
N 1.С. 206-211
2. ПаиВ.М.,Петьков В.В.,КуликО.Г.//Металловедение, физико-химия и металлофизи-
металлофизика сверхпроводников: Сб статей. М.: Наука, 1967. С 161-165.
3. Wang Wew-Kni, Xu Xiao-Ping, Chew Hong, Zhao Yon-Xiang//Wuli. Physics 1980 V 9
N 4. P. 309-311
4. KnaptonA.G.//Nature. 1955. Bd. 175. S. 730.
5 Hall H.T., Leger J.-M. // J. Less-Common Met. 1973. V. 32. N 2. P. 181-187.
6. Kaufman K. // Calphad. 1979. V. 3 N 3. P. 45-76.
E.H. Шефтель
Nb-Sm. НИОБИЙ-САМАРИЙ
Диаграмма состояния Nb-Sm (рис. 271) приведена в работе [М].
Максимальная растворимость Sm в (Nb) составляет менее 0,05 % (ат.),
Nb-Sm, Nb-Sn
551
t;c
2500
Sm, % (no массе)
0 10 ZO JO 4ff SO SO 70 BO SO
гооо
1500
woo
500
ioo
f
<-o.os
—№)
L0.05
1
(Nb)
газ '
Zb6L
у Газ
-US
+ ж
Ifhi
1
zl_
its'
-927+5'—
f
\
Газ
\
\
-л
\
1
u (fSm) С
tJiSm)—i
¦>Я9.яЛ
(asm)—
1870°
1074'
ЯТ2'
7J4*
о to го jo to so so 70 do so too
Nb Sm, % (am.) Sm
Рис. 271. Nb-Sm
a Nb в (Sm) - менее 0,1 % (ат.).
Е.И. Гладышевский, О.И. Бодак, В. К. Печарский
Nb-Sn. НИОБИЙ-ОЛОВО
Диаграмма состояния Nb-Sn изучалась неоднократно и в обобщенном
виде приведена в справочнике [Ш]. Установлено, что в системе
образуются три соединения. Разногласия в основном касаются состава
-соединений и температурного интервала их существования. В работах,
появившихся позднее [1-4], было уточнено строение системы в области
существования двойных соединений. На рис. 272 приведена диаграмма
состояния Nb-Sn по результатам дифференциального термического [2,
3], рентгеноструктурного [1-4], металлографического [2, 3] и микрорен-
тгеноспектрального [1, 4] анализов. Во всех исследованиях в качестве
исходных материалов были использованы Nb чистотой 99,9 % (по массе)
[\], 99,6 % (по массе) [3, 4] и Sn чистотой 99,8 % (по массе) [1], 99,999 %
(по массе) [3, 4]. Сплавы выплавляли в дуговых печах в атмосфере
очищенного аргона или гелия.
Соединения Nb3Sn, Nb6Sn5 и NbSn2 образуются по перитектическим
реакциям. Соединение Nb3Sn имеет широкую область гомогенности. В
ряде работ [Ш] указывалось, что это соединение стабильно при
552
Nb-Sn
Sn, % (no массе)
О 10 10 30 14 SO ВО 70 80 90 WO
2000
№00
1200
800
2*ks
1
1
—¦
1
<
к
no
*- -
1-
I*
930'-
\
\
\
!
——-.
1
Ж
8W
-231
(Sn
\
)—*¦
231.9SB'
0 10 20 30 ЬО 50 SO 70 BO 90 100
Nb Sn.'/ofam) Sn
Рис. 272. Nb-Sn
температурах выше -750 °C Однако результаты исследований сплавов
после длительных отжигов (до 2000 ч при 550-1500 °С) и термического
анализа позволили установить, что Nb>3Sn является стабильным при
температурах ниже 750 °С вплоть до комнатной [1-4] Данные о
протяженности области гомогенности приведены ниже
Температура, °С 500-1500 700 1000 1400 1500 1800
Растворимость Sn, % (ат) 17-27 13-27,2 14,2-3115,1-30 23 1-26 02 16 0-26,3
Источник [1] [4] [4] [4] [2] [4]
Соединение Nb6Sn5 (в ряде работ, таких как [2, 5], приводится
формула Nb3Sri2) имеет небольшой температурный интервал стабильнос-
стабильности от -820 до -930 "С [III, 2,3] В то же время в работе [2] отмечается, что
структура литых сплавов, отожженных при температурах ниже 820 "С,
не позволяет сделать однозначного вывода о стабильности или
нестабильности этого соединения при комнатной температуре В работах
[1,5] указывается на существование соединения Nb6Sn5 при температурах
вплоть до комнатной
Нонвариантные реакции приведены в табл 229
Nb-Sn
Таблица 229 Ноивариантные реакции в системе Nb-Sn
553
Реакция
>K+(Nb)=Nb3Sn
X+Nb3Sn=>Nb6Sn5
Ж+МЬ68п5»МЬ5п2
Ж»МЬ5п2+Eп)
Nb6Sn5=Nb3Sn+NbSn2
Содержание Sn в
(ат)
-21
99,74,
-,
-,
-,
-,
99,85,
-
-
-
-,
99,96,
40,
45,5,
-и,
25,1,
26,
25,
31,
-,
45,5,
45,5,
45,5,
45,5,
-,
66,7,
25,
30,
фазах, %
17
45,5
40
45,5
45,5
-
66,7
66,7
66,7
66,7
-
-100
66,7
66,7
Температура
°С
2130т15
920т 10
910
930? 8
920
905*10
835т20
845*7
840
860
860т 10
-219
820
815
Источник
[Ш, 1]
[Ш]
[2]
[1]
[3]
[6]
[Ш]
[1]
[2]
[3]
[6]
[Ш]
И
[3]
В работах [3, 7] указывается на существование монотектического
равновесия Монотектическая точка по данным работы [3] находится при
концентрации 97 % (ат) Sn и температуре 960 "С, купол расслоения
жидкости очень мал и сильно смещен в сторону Sn Вероятно, в этой
части система Nb-Sn является метастабильной, так же как диаграмма,
приведенная в работе [7]
Растворимость Sn в (Nb) составляет 9 и 1 % (ат ) при температурах
2130 и 1495 °С соответственно [1] При температуре 1800 "С в (Nb)
растворяется 3 % (ат) Sn [2], при 1000 ° С - - 2,4 % (ат ) Sn [5], при 500 ° С -
1,97 % (ат) Sn [5] Растворим ость Nb в жидком Sn мала и составляет 0,198
и 0,027 % (мае) при температурах 1000 и 580 °С соответственно [1]
Кристаллическая структура соединений приведена в табл 230
554
Nb-Sn
Таблица 230 Кристаллическая структура соединений системы Nb-Sn |8]
Соединение
NbjSn
Nb6Sn5
NbSn2
Прототип
W
Ti6Sn5
CuMg2
Символ
Пирсона,
пргр
с/2,
1тЪт
«/44,
Immm
<>F48,
Fddd
Параметры решетки, мм
а
0,52902-
0,52816
1,6814A)
0,9852A)
Ь
-
0,92057D)
0,5645A)
с
-
0,5649E)
1,9126C)
В работе [9] построенар-Г диаграмма соединения Nb3Sn в интервале
температур 800-2200 °С и давлений 2 ..7 ГПа. Установлено, что при
температурах 1400-2200 °С и давлении более 6,4 ГПа существует
модификация со структурой ГЦК и параметром а - 0,4412C) нм; в
интервале температур 1500-1800 "С стабильна модификация со
структурой типа Cr3Si (символ Пирсона сР8, пр гр РтЪп) с параметром
решетки а = 0,5300D) нм, при температурах ниже 1200 °С существует
модификация с тетрагональной структурой и параметрами решетки а =
= 0,5619E) нм, с = 1,0539(9) нм.
Литература
1 CharlesworthJ.P.,MacPhailJ.,MadsenP.E.//J Mater Sci 1970 V 5 N 7 Р 580-603
2 Кузнецова В.Г., Ковалева В.А., Безиосикова А.В. // Металловедение, физико-химия
и металлофизика сверхпроводников Сб статей М Наука, 1967 С 146-152
3 Свечников В.Н., Пан В.М., Белецкий Ю.И. // Металловедение, физико-химия и
металлофизика сверхпроводников Сб статей М Наука, 1967 С 152-157
4 Свечников'В.Н., Пан В.М., Белецкий Ю.И. // Металловедение, физико-химия и
металлофизика сверхпроводников Сб статей М Наука, 1967 С 100-108
5 Ellis T.G., WilheImH.A.//J Less-Common Met 1964 V 7 P 67-83
6 Мацакова А.А., Лазарев Б.Г. // Физика металлов и металловедение 1973 Т 35 N 1
С 148-156
7 Агафонов М.И., Барон В.В., Савицкий Е.М.//Изв АН СССР Отделение технических
наук Металлургия и топливо 1959 N5 С 138-141
8 Van Vucht J.H.N., van Ooijen D.J., BrunmgH.A.// Philips Res Repts 1965 V 20 N 2
P 13-61
9 LegerJ-M., Hall H.T. Hi Less-Common Met 1974 V 34 N 1 P 17-24
E H Шефтелъ Н Р Бочвар
Nb-Ta Nb-Tb
555
Nb-Ta. НИОБИЙ-ТАНТАЛ
Диаграмма состояния Nb-Ta построена в работе [1] и приведена на
рис 273 Сплавы получали дуговой плавкой в атмосфере очищенного
Не и исследовали методами термического, рентгеновского и металлогра-
металлографического анализов Nb и Та неограниченно взаимно растворяются в
жидком и твердом состояниях Кривые ликвидуса и солидуса плавно
возрастают от Nb к Та Разница между температурами ликвидуса и
солидуса составляет менее 10 "С. Параметр решетки твердых растворов
изменяется по закону Вегарда и почти не меняется при переходе от Nb
к Та.
t.'C
Та, % (по массе)
О 10 ZO 30 ЬО 50 60 70 80
90
100
3000
2900
Z800
2700
2600
2500
2W0
1
2Ш
i i
#
I
,<*
Ж
1
1
(Nb
i
та)
i
зо го'
О 10 U 30 ЬО 50 ВО 70 80 SO tOO
Nb Ta'/'(am) Та
Рис. 273. Nb-Ta
Литература
1 Williams D.E., Pechin W.H.//Trans ASM 1958 V 50 P 1081-1089
Nb-Tb. НИОБИЙ-ТЕРБИЙ
EH Шефтель
Диаграмма состояния Nb-Tb не построена В работе [1] указывается,
что Nb и ТЪ в жидком состоянии не смешиваются Система, по-видимому,
принадлежит к монотектическому типу Двойные соединения отсут-
отсутствуют
556 Nb-Tb, Nb-Tc, Nb-Te
Литература
1 Савицкий Е.М., Барон В.В., Ефимов Ю.В. // Редкоземельные металлы и сплавы Сб
статей М Наука, 1971 С 81
Е И Гладышевский, О И БоОак, В К Печорский
Nb-Tc. НИОБИЙ-ТЕХНЕЦИЙ
Диаграмма состояния Nb-Tc не построена. В работе [1] рентгеновским
анализом сплавов, полученных дуговой плавкой в атмосфере Не,
обнаружена фаза NbTc3. Эта фаза имеет структуру типа аМп (символ
Пирсона с/58, пр гр. 143т, параметр решетки а = 0,9547.. 0,9625 нм).
Предполагается, что фаза NbTc3 существует в широком интервале
концентраций
Литература
1 Darby J.B., Lam, Jr., D.J., Downey J.W. // J Less-Common Met 1962 V 4 N 6
P 558-563
E H Шефтепъ
Nb-Te. НИОБИЙ-ТЕЛЛУР
Данные по сплавам системы Nb-Te суммированы в справочниках [Э,
Ш] В системе найден ряд соединений, таких как Nb5Te4, NbTe, Nb3Te4,
pNbTe2, yNbTe3, NbTe4 [Э, Ш, 1]. Обсуждая все опубликованные данные
(до 1966 г) по системе Nb-Te, авторы работы [2] заключили, что из
вышеупомянутых только четыре соединения могут существовать в
системе за исключением NbTe и NbTe3. Авторами работы [3] были
исследованы сплавы в интервале концентрации 70-80 % (ат) Те Сплавы
синтезировали из Nb чистотой 99,999 % (по массе) и Те чистотой 99,92 %
(по массе) в кварцевых ампулах при температуре 1000 °С в течение трех
недель На основании измерения равновесной упругости пара Те в
интервале температур 362-700 °С была построена часть диаграммы
состояния Nb-Te, приведенная на рис 274
В системе были найдены шесть фаз Три и? них, а, р, у, образованные
при концентрациях 70,7; 73,79 % (ат) Те соответственно, имеют широкие
области гомогенности. Составы других трех фаз соответствуют
Nb-Te
557
формулам Nb3Te7, Nb3Teg и
NbTe3 (на рис 274 не указаны). #
Согласно данным работы [3] все '
сплавы в области от Nb3Te7 до цоо
Те имеют тетрагональную струк-
структуру с очень близкими парамет- S00
рами решетки (табл. 231), что
затрудняет обнаружение новых **"
фаз зоо
Кристаллическая структура 70
соединений приведена в
табл 231.
Те, % (по массе)
80 85
it' I
я/
L
0J
/X
/°!
*
75 80
Те,'/* (am.)
Рис. 274. Nb-Te
Таблица 231 Кристаллическая структура соединений системы Nb-Te
Соедине-
Соединение
NbTeo'^j
Nb5Te4
NbTe*2
NbTe*3
nW
PNbTe,"
NbTe;3
Nbje,
Nb3Te,'5
NbTe,'5
Прото-
Прототип
-
T,5Te4
-
-
-
-
-
-
-
-
Символ
Пирсона,
пргр
-
//18,
/4/m
-
Rim
?63/m
-
R 3m
-
-
-
Параметры решетки, нм
a
0,8419A)
1,0231
0,516A)
1,0904E)
1,0671
1,939
1,0904E)
0,6489
0,6466
0 6504
b
-
-
-
-
-
0,364
-
-
-
-
с
-
0,31794
0,762E)
2,0119E)
0,3646
0,936
1,9888E)
0,6820
0,6820
0,6868
Источник
P]
[Ш]
PI
[Ш]
[Ш]
[11
ПИ]
[3]
[3]
[3]
558
Nb-Te, Nb~Th
Соедине-
Соединение
а'5
NbTe;5
Прото-
Прототип
-
-
-
Символ
Пирсона,
пр.гр.
-
-
Р4/ттс
Параметры решетки, нм
а
0.6498*6
0,6475*7
0,651
0,6499
• Ь
-
-
-
с
0,6845*6
0.6826*7
0,685
0,6837
Источник
[3]
[3]
[И
[Ш] .
*' Кубическая сингония.
*2 Гексагональная сингония.
*3 Ромбоэдрическая сингония.
*4 Моноклинная сингония, р = 134,25°.
*5 Тетрагональная сингония.
*6 При низкой концентрации Те.
*7 При высокой концентрации Те.
Литература
1. Revolinsky E., Brown B.E., Bernstein D.I., Armitage C.H. // J. Less-Common Met. 1965.
V. &. N 1. P. 63-72.
2. Selte K., Kjekshus A. // J. Less-Common Mel 1966. V. 11. N I. P. 11.
3 Smith D.I., Mochel A.R., Banewicz J.J., Maguire J.A. // J. Less-Common Met. 1972. V. 26.
N I. P. 139-144.
EH. Шефтелъ
Nb-Th. НИОБИЙ-ТОРИЙ
Диаграмма состояния Nb-Th (рис. 275) построена в работе [1]. Сплавы
выплавляли дуговой плавкой в атмосфере инертного газа из Nb чистотой
>99 % (по массе) и Th чистотой >99,86 % (по массе). Сплавы исследовали
методами металлографического, рентгеноструктурного и термического
анализов. Диаграмма состояния Nb-Th - простого эвтектического типа;
эвтектика кристаллизуется при температуре 1435 °С и концентрации
17,8 % (ат.) Nb. Растворимость Nb в (aTh) составляет менее 0,25 % (ат.);
растворимость Nb в (pTh) составляет менее 2 % (ат.); растворимость Th
в (Nb) практически отсутствует.
Nb-Th. Nb-Ti
559
10
Nb, % (no массе)
20 JO W 50 60 70 80SO 100
G55'
i
4
1
Ж
У
у
У
—-
1
0
"
2Ш
2Z00
2000
1800
1600
1*00
1200
О Ю 20 JO 40 50 60 70 80 90 100
Th Nb, % (am.) Nb
Рис. 275. Nb-Th
Литература
1. Dickinson J.M. // J. Sci. 1955. V. 29. N 3. P. 402-403.
Е.Н. Шефтель
Nb-Ti. НИОБИЙ-ТИТАН
Диаграмма состояния Nb-Ti, во всем интервале концентраций была
впервые построена в работе [1], в которой исследовались фазовые
равновесия в системе при температурах выше 600 °С. Анализ и
обобщение имеющихся данных по системе Nb-Ti проведены в работах
B-5]. Диаграмма состояния Nb-Ti (рис. 276) построена согласно работе
[4]. Установлена полная взаимная растворимость Nb и pTi в жидком
состоянии.
Фазовая граница между (pTi) и [(pTi) + (ocTi)] построена на рис. 276
по данным работ [7, 8]. Ее положение сильно зависит от чистоты
исходного Ti [4, 6].
560
Nb-Ti
О 10 20 JO
Aft, % (па массе)
50 60 10 80 SO
0 10 20 SO 4-0 SO 60 70 SO SO WO
Ti Nb, % (am) Nb
Рис. 276. Nb-Ti
Растворимость Nb в (aTi) была измерена в работах [1, 9, 10]. С
понижением температуры растворимость увеличивается, достигая
максимального значения при концентрации -2,5 % (ат) Nb при
температуре 600 "С и затем уменьшаясь.
Вследствие малой скорости протекания процессов диффузии
определение растворимости при температуре ниже 600 °С было
затруднительно. Термодинамический расчет, проведенный в работах [6,
9, 11] на основе модели регулярных растворов, показал, что раствори-
растворимость Nb в (aTi) при температурах 400, 200 и 20 °С составляет 1,0,25 и
<0,01 % (ат.) соответственно
Твердый раствор фТ), Nb) при комнатной температуре может быть
получен после закалки сплавов с содержанием Nb выше 18-30 % (ат) в
зависимости от содержания примесей [1,8,12]. В сплавах с более низким
содержанием Nb после закалки из области (pTi, Nb) образуются
метастабильные фазы а', а" и ы [5] Кристаллографические характеристи-
характеристики метастабильных фаз приведены в работе [13]
Nb-Ti, Nb-Tl
561
Литература
1 Hansen M., Kamen EX., Kessler H.D., McPherson DJ. // J Metal 1951 V 3 N 10
P 881-888
2 Иванов О.С., Раевский И.И., Степанов Н.В. Сверхпроводящие сплавы системы
ннобий-титан-цнрконнй-гафннй М Наука, 1971 166 с
3 Корнилов И.И. Титан М Наука, 1975 308 с
4 Murray J.L.// Bull Alloy Phase Diagrams 1981 V 2 N 1 P 55-61
5 Еременко В.Н., Третьяченко Л.А. Тронные системы титана с переходными металлами
IV-VI групп Киев Наукова Думка, 1987 229 с
6 Молоканов В.В., Будберг П.Б., Чернов Д.Б. // Фазовые равновесия в металлических
сплавах Сб статей М Наука, 1981 С 135-138
7 Brown A.R.G., Clark P., Eastabrook J., Jepson J.S. //Nature 1964 Bd 201 S 914-915
8 Гусева Л.Н., Долинская Л.К.//Докл АН СССР 1982 Т 266 N 3 С 634-637
9 KoulM.K., BreedisJ.F.//ActaMetall 1970 V 18 N6 Р 579
10 RomaniG.N. //Knst Techn 1972 Bd 7 N 6 S 615-638
11 Чернов Д.Б., Шиняев А.Я. // Изв АН СССР Металлы 1975 N5 С 212-219
12 Петрова Л.А.//Титановые сплавы для новой техники Сб статей М Наука, 1968
С 119-131
13 Rogl P. //Atomic Energy Review Special Issue N 9 Titanium Phisiko-Chemical Properties
ot its Compounds and Alloys Vienna International Atomic Energy Agency, 1983 P 201-369
? Я Шефтель
Nb-Tl. НИОБИЙ-ТАЛЛИЙ
Nb, % (no массе)
О ю го зо 40 so во ю во 90 wo
t;c
Z600
1200
800
400
*{т
I)
1
Ж,
Ж*
1
t-Ж?
(Nb4
1
1
2
(N
1
Ч-69 |
1
Pile
0
TL
111
to го
Nb-Tl
JO
40 SO
Nb,"/.
BO 70
(от)
80
SO
WO
Nb
562 Nb-TI, Nb-Tm, Nb-V
Диаграмма состояния Nb-TI построена в работе [1] (рис. 277). Смеси
порошков Nb чистотой 99,85 % (по массе) и Т1 чистотой 99,9 % (по массе)
подвергали изостатическому прессованию под давлением 0,8 ГПа, а затем
отжигали в эвакуированных кварцевых ампулах (остаточное давление
1,3 Па) при температуре 700 °С в течение трех месяцев. Исследование
проводили методами дифференциального термического, рентгеновско-
рентгеновского, металлографического и микрорентгеноспектрального анализов.
Nb и Т1 не растворимы друг в друге ни в жидком, ни в твердом
состояниях.
Литература
I VillarsP., GirgisK.//Z Metallkunde 1982 Bd 73 N 3 S 169-171
EH Шефтель
Nb-Tm. НИОБИЙ-ТУЛИЙ
По данным работы [1] в системе Nb-Tm компоненты не смешиваются
в жидком состоянии. Система, вероятно, относится к монотектическому
типу. Двойные соединения отсутствуют.
Литература
1 Савицкий Е.М., Барон В.В., Ефимов Ю.В. // Редкоземельные металлы и сплавы М
Наука, 1971 С 81
ЕН Шефтель
Nb-U. НИОБИЙ-УРАН
Данные по системе Nb-U обобщены в справочниках [Э, Ш] и
дополнены данными работ [1-4]. На рис. 278 приведена диаграмма
состояния Nb-U, построенная в основном по результатам работы [5]
Ликвидус и солидус сплавов в области концентраций 0-40 % (ат.) Nb
построены по данным работы [2]. В качестве исходных материалов были
использованы Nb и U чистотой не менее 99,9 % (по массе), исследование
проведено методами металлографического, рентгеноструктурного и
дилатометрического анализов, атакже методом измерения электросопро-
электросопротивления. Для определения температур ликвидуса и солидуса был
использован термический анализ, при этом исходными материалами
были U чистотой 99,79 % (по массе) и Nb чистотой 99,9 % (по массе)
Nb-U
563
U, % (по пассе)
„ 010 2030 40 50 60 70 80 90 100
2400
2200
2000
1800
1600
1400
1200
1000
900
800
700
600
500
i i i
N
\
\
1
\
ч
/
1
S,
\
I
Ч
"^
(Nb,TU)
в
1 1
ж
( {Hb)+{jTU\\
6,9
0 10 20 30 4
Nb
Рис. 278. Nb-U
\
14
i i
1135"
р
/jLW)
98.T3S
i
0 50 60 70 80 90 100
U, % (am.) U
Nb и yU образуют непрерывный ряд твердых растворов, интервал
кристаллизации которых в интервале концентраций 60—90 % (ат.) U
составляет 68-80 °С [1]. Для остальных составов установлены только
температуры солидуса [Э, Ш, 6]. При понижении температуры область
твердых растворов (Nb, yU) расслаивается на два твердых раствора (Nb)
н (yU). Критическая точка расслаивания находится при температуре
975 °С и концентрации 47,7 % (ат.) U [5] или 990 °С и -50 % (ат.) U [7].
В системе протекают две эвтектоидные реакции:
(PU)-(oU)+(Nb, yU) при 663 "С и -98,73 % (ат.) U [5];
(Nb, YU)»(Nb)+(aU) при 647 °С и 85,5 % (ат.) U [5],
634°Си-81,6%(ат.)ир],
650 "С и ~86,7%(ат.)ир]
564 Nb-U
В отличие от приведенной диаграммы состояния в работах [7, 8]
указывается на протекание других эвтектоидных реакций:
(pU)»(aU)+(Nb) при 640 °С и 98,7 % (ат.) U;
(Nb, yU)-(Nb)+(pU) при 650 °С и 82,5 % (ат.) U,
однако приведенные данные недостаточно убедительны вследствие
ненадежной трактовки результатов термического анализа.
Сведения о перитектоидном характере нонвариантного превращения
(aU) из (pU) [M] не подтверждаются большинством авторов.
Растворимость Nb в (aU) в зависимости от температуры приведена
ниже:
Температура, °С 550 600 630 640 659 660 665
Растворимость Nb, % (ат.) 0,08 0,16 0,24 -0,5 >0,64 0,34 -1,9
Источник [1] [1] [1] [8] [5] [1] [9]
Растворимость Nb в (pU) приведена ниже:
Температура, °С 650 663 667 720
Растворимость Nb, % (ат.) 3,8 >1,27 -0,6 1,9
Источник [8] [5] [9] [9]
Литература
1. Гомозов Л.И., Лютииа Э.М., Иванов О.С. // Изв. АН СССР. Металлы. 1970. N 2.
С. 210-215
2. Бадаева Т.Д., Кузнецова Р.И. // Изв. АН СССР. Металлы. 1971. N 2. С. 188-190.
3. Иванов О.С, Удовский АЛ. // Физико-химический анализ сплавов урана, тория и
циркония: Сб. статей. М.: Наука, 1974. С. 91-103.
4. Williams R.O.//J. Nucl. Mater. 1979. V. 82. N 1. P. 184-192.
5. Rogers B.A., Atkins D.F., Manthos E.J., Kirkpatrick M.E. // Advanc. Nucl. Engng. 1957.
V. 2. P. 244-253.
6 Кутайцев В.И. Сплавы тория, урана и плутония. М.: Госатомиздат, 1962. 99 с.
7. Иванов О.С, Терехов Г.И. // Строение сплавов некоторых систем с ураном и торием:
Сб. статей. М.: Госатомиздат, 1961. С. 20-34.
8 Терехов Г.И. // Изв. АН СССР. Металлы. 1982. N 4. С. 188-189.
9. PfeilP.CL., Browne J.D., Williamson G.K.//J. Inst. Met. 1958-1959. V. 87. P. 204-208.
EH. Шефтель
Nb-V
565
Nb-V. НИОБИЙ-ВАНАДИЙ
Диаграмма состояния Nb-V (рис. 279) характеризуется наличием
непрерывной взаимной растворимости компонентов в жидком и твердом
состояниях [1]. Линии ликвидуса и солидуса имеют минимум, который
по данным различных исследователей находится при следующих
температурах и концентрациях: 1810 °С и 23 % (ат.) Nb [X], 1720 "С и
26,8 % (ат.) Nb [Ш], 1812 °С и 25,5 % (ат.) Nb [2], 1860т 10 °С и 22 % (ат.)
Nb [1]. Различие данных обусловлено разной чистотой использовавшихся
исходных материалов и точностью методов определения температур
плавления сплавов. Результаты исследования диаграммы обобщены в
работе [1].
f/6,% (no массе)
о ю го зо ьо so go ю во
90
WO
t,"c
Z4OO
2300
Z200
г too
гооо
1900
1900
Рнс. 279. Nb-V
то'
1 i
1
ж
| lesotn
1
/
i
4
у
1
/
/
1
4
/
/
/
/
/
/
1Mb.
/
У)
2*69'
О fO 20 30 ЬО 50 60 70 80 90 100
V Nb, •/• (am) Nb
Согласно расчету диаграммы Nb-V, проведенному авторами работы
[3] в приближении модели регулярных растворов, минимум на линии
ликвидус-солидус лежит при температуре 1817 "С и концентрации 22 %
(ат.) Nb. Расчет предполагает расслоение твердых растворов (Nb, V) на
две изоморфные фазы при температуре ниже 380 °С.
Параметр решетки я, нм, ОЦК твердых растворов (Nb, V) при
температуре 20 °С описывается уравнением:
а = 0,30322 + 0,0361 Зх - 0,00914х2,
где \ - атомная доля Nb [4].
566
Nb-V Nb-W
Литература
1 Smith J.F., Carloson O.N.//Bull Alloy Phase Diagrams 1983 V 4 N1 P 46-49
2 Кочер*ннский Ю.А., Василенко В.И. // Изв АН СССР Металлы 1985 N 2
С 188-189
3 Молоканов В.В., Чернов Д.Б., Будберг П.Б.// Журнал физической химии 1977 Т 51
Вып 8 С 2022-2025
4 Geiss R.C , Hartley C.S., Steedly J.E. // J Less-Common Met 1965 V 9 N5 P 309-320
E H Шефтель
Nb-W. НИОБИЙ-ВОЛЬФРАМ
Обзор работ по системе Nb-W проведен в работе [1] Nb образует с
W непрерывные ряды растворов как в жидком, так и в твердом
состояниях (рис 280) Приведенная диаграмма построена по суммарным
данным работ [2-5] Сплавы имеют ОЦК структуру, параметр решетки
которой изменяется от 0,33007 нм для Nb до 0,31651 нм для W Все
исследователи отмечают значительное отрицательное отклонение от
закона Вегарда в интервале концентраций 3-80 % (ат) W и небольшое
положительное отклонение от закона Вегарда при -93-97 % (ат) W [2,
t;c
70
W.'/.fno массе)
60 80
100
2Ш'
1
Ж
гад
Y
г
лоо
3000
Z8O0
Z600
2Ш
О 10 20 JO 40 SO 60 70 80 SO 100
Nb W.V'fam) W
Рис 280 Nb-W
Nb-W Nb-Y
567
Литерат) рл
1 Nagendcr Naidu S V , Sriramamarthy A M., Rama Rao P. // Bull Alloy Phase Diagrams
1988 V 4 N 3 P 184-190
2 Кример В.И.//Журнал неорганической химии 1958 Т 3 N 4 С 895
3 Мнхеев В С , Певцов В.М // Журнал неорганической химии 1958 Т 3 N 4
С 861-866
4 Барон В.В , Савицкнн Е М., Иванова К.Н // Изв АН СССР Отделение технических
K Металлургия и топливо 1962 N2 С 119-125
5 RudyE //Compendium of Phase Diagram Dala Air Force Materials Lab Wright Patterson
Air Force Base Ohio Rep No AFML TR-65 2 Part Y 1969 P 134-136
6 Scmchyshen M , Barr R Q. // Development of Tungsten Base Alloys Climax Molybdenum
Co Michigan Detroit Final Rept 1961 P 32-49
К Б Поварова
Nb-Y. НИОБИЙ-ИТТРИЙ
Диаграмма состояния Nb-Y (рис 281) построена в работе [1] на
основании данных работ [2-4] Система характеризуется наличием
области несмешиваемости в жидком состоянии при концентрациях
0,5—53,9 % (ат) Y, монотектическая реакция протекает при температуре
2600
2469
2200
1800
1400
20
Y, % (по массе)
40 60 80 100
1
1
0.5
IT
ж,+жг
Ib)
\
?*rUU
\
1
1470"
Ж
•
\
\
\
4
\
(a
yj*
О 10 20 30 40 50 60 70 80 SO 100
А/6 Y,Vo(a/rr) Y
Рис 281 Nb-Y
568 Nb-Y, Nb-Yb, Nb-Zn
-2400 °C [4]. В работе [4] в качестве исходных материалов использовали
Y чистотой 99,1 % (по массе) и Nb чистотой 99,8 % (по массе), сплавы
выплавляли дуговой плавкой в атмосфере Аг. Исследование проводили
методом металлографического и термического анализов. Информация
о критической температуре купола расслаивания отсутствует. Эвтектика
имеет температуру кристаллизации 1470 °С и содержит 94,2 % (ат.) Y [4].
Реакцию, связанную с полиморфным превращением Y, авторы работы
[4] оценивают как кататектическую. Растворимость Nb в (<xY) при
эвтектической температуре менее 0,1 % (ат.).
Литература
1 Palenzona A., Cirafici S. // J Phase Equilibria 1991 V 12 N 2 Р 204-207
2 Carlson O.N., Marcotte V.C., Williams D.E.//ISC-1050 USAES Rep 1959 С 53-54
3 Carlson O.N., Larsen W.L., Marcotte V.C., Williams D.E. // USAEC Rep JS-17 1959
С 76-77
4 LundinCE., KlodtD.T.//J Inst Met 1960 V 90 P 341-347
E И Гпадышевский, О И Бодак, В К Печорский
Nb-Yb. НИОБИЙ-ИТТЕРБИЙ
Диаграмма состояния Nb-Yb не построена. Система характеризуется
отсутствием промежуточных фаз, очень малой растворимостью
компонентов в твердом состоянии и несмешиваемостью в жидком [Ш].
М И Бычкова
Nb-Zn. НИОБИЙ-ЦИНК
Методами металлографического, рентгеновского и электрон ографи-
ческого анализов в работе [1] исследованы сплавы системы Nb-Zn,
приготовленные из Nb чистотой 99,93 % (по массе) и Zn чистотой
99,999 % (по массе) методом диффузионного насыщения Nb в вакууме
{р - 1 Па) в интервале температур 500-870 °С.
В системе (рис. 282) установлено образование шести соединений
NbZn, Nb2Zn3, NbZn2, NbZn3, NbZn7, NbZn,5. Все соединения образуют-
образуются по перитектическим реакциям при температурах 1120,1114,1054,1034,
478, 429 °С соответственно. В работе [Э] сообщается, что соединение
NbZn3 упорядочивается в интервале температур 475-470 °С. Кристалли-
Кристаллическая структура соединений приведена в табл. 232
Nb-Zn
Zn, % (no массе)
О Ю 20 JO 40 50 60 70 80 90 100
569
t;c
two
woo
soo
800
700
SOO
500
WO
300
ttzo±z
-(Nb)
1
1
1 t
1
1
1
.
кптг Ю5
i
r
\i
i
r|
Г
j_j
SI
t
\
\
\
\
\
\
\
W
Щ58"
0 10 20 3D 40 50 60 70 80 SO WO
Nb Zn, % (am.) Zn
Рис. 282. Nb-Zn
Таблица 232 Кристаллическая структура соединений системы Nb-Zn |Ш)
Соединение
NbjZn,"
NbZn2
NbZn3
Прототип
-
MgNi2
AuCu3
Символ
Пирсона,
пргр
-
hP24,
РЬ-jmmc
сР4,
РтЪт
Параметры решетки, нм
а
0,5063
0,505
0,3934
с
2,643
1,632
-
Литература
I Meussner R.A., Goode R.J. // Trans AIME 1965 V 233 N 4 P 661-671
EH Шефтепъ
570
Nb-Zr
Nb-Zr. НИОБИЙ-ЦИРКОНИЙ
Диаграмма состояния Nb-Zr (рис. 283) проанализирована и обобщена
в работах [1-3]. В работе [4] диаграмма Nb-Zr была рассчитана на основе
использования модели растворов замещения и экспериментальных
данных по фазовым равновесиям и термодинамическим свойствам
компонентов.
Система характеризуется наличием при высоких температурах
непрерывной взаимной растворимости Nb и Zr в жидком и твердом
состояниях. Ликвидус имеет точку минимума при температуре 1740 °С
и концентрации 21,7 % (ат.) Nb [5, 6], согласно расчету - при 1743 °С и
21,68 % (ат.) [4]. При понижении температуры в интервале концентраций
-19-91 % (ат.) Nb происходит расслоение твердого раствора (pZr, Nb)
на две изоморфные фазы (pZr) и (Nb). Критическая точка кривой
расслаивания соответствует температуре 988 °С и концентрации -60 %
(ат.) Nb [3, 7], согласно расчету [4] - 977 °С и 58,85 % (ат.) Nb.
Монотектоидная реакция (PZr, Nb)°(aZr)+(Nb) протекает при
температуре 610 °С и концентрации 17,5 % (ат.) Nb [5], 620т 10 "С и 18,5 %
(ат.) Nb [3, 7], 620 °С и 18,7 % (ат.) Nb [4]. Некоторое расхождение
приведенных данных обусловлено присутствием в сплавах примесей
элементов внедрения, особенно О и N. От чистоты сплавов сильно
зависит растворимость Nb в
Nb, % (по массе)
О 20 40 60 60 ЮО
t,°C
IBS
1
В63*
П^\\
[,6 Д
1/
<j*(aZ,
l<*0
7.7
У
h
')
т ^
Ж
(fiZr, Nb)
***
.л
'60,6"
его"
у'
гчб9°4
у
ч
ТУ
ч
\
\
2200
1800
KOO
WOO
600
200
0 10 20 30 W 50 60 70 80 90 100
Zr Nb,%(em.) #b
Рис. 283. Nb-Zr
(aZr), положение фазовых гра-
границ области несмешиваемости и
протяженность области под
монотектическим куполом [3,
7-9].
Растворимость Nb в (aZr)
составляет 6,5 % (ат.) при 610 °С
[7]; 1,1 % (ат.) при 600 °С [8];
0,68 % (ат.) при 620 °С [4]; 0,8 %
(ат.) в интервале температур
560-690 °С [10]; 0,6 % (ат.) при
620 °С [3]. Растворимость Zr в
(Nb) при температуре монотек-
тоидного превращения равна
91 % (ат.) [3, 11]; 92,06 % (ат.) [4].
Фаза (PZr) имеет ОЦК струк-
структуру, параметр решетки которой
уменьшается с повышением со-
содержания Nb в соответствии с
правилом Вегарда [3, 5, 7, 12].
Nb-Zn 57^
Фазы (pZr) и (Nb) имеют также ОЦК структуру, параметры решетки
которой зависят от температуры при определенном давлении остаточных
газов, что иллюстрируется ниже для давления 5-10~7 Па [9]:
Температура, °С 650 800 930
Параметр решетки а, нм:
(pZr) 0,3512 0,3485 0,3402
(Nb) 0,3342 0,3346 0,3402
При увеличении содержания О, например, до 1,1 (Г4 Па, система
становится трехкомпонентной [9].
При больших скоростях охлаждения фаза (PZr, Nb) может быть
частично или полностью сохранена при температурах до 20 °С, при этом
образуются различные метастабильные фазы [1, 3, 12, 13].
Литература
1. Иванов О.С., Адамова А.С., Тарараева Е.М., Трегубое И.А. Структура сплавов
циркония. М. Наука, 1973 198 с.
2. Kubaschewski-von Goldbeck О. // Atomic Energy Review. Special Issue N 6. Zirconium:
Physico-Chemical Properties of its Compounds and Alloys. Vienna. International Atomic Energy
Agency. 1976. P. 67-140.
3. Abriata J.P., Bolchich J.C. // Bull. Alloy Phase Diagrams. 1982. V 3. N 1. P. 34.
4. Cuillermet A.F. // Z. Metallkunde. 1991. Bd. 82. N 6. S. 478-487.
5. Rogers B.A., Afkins D.F. // J. Metalals, AIME. 1955, V. 7. N 912. P. 1034-1041.
6. Бадаева Т.А., Кузнецова Р.И. // Изв. АН СССР. Металлы. 1971. N 2. С. 188-190.
7. Flewitt P.E.J.//J. Appl. Cristallogr. 1972. V. 5. N 6. P. 423-425.
8. Bethumel.T., Williams CD.//J. Nucl. Mater. 1969. V. 29. N 1. P. 129-132.
9. NakaiK., Kinoshita C, KitajimaS.//J. Nucl. Mater. 1981. V 98. N 1-2. P. 131-143.
10. Зуев М.Т., Бычков Ю.Ф., Евстюхнн И.А. и др. // Цирконий и его сплавы; Сб. статей.
М.: Энергоиздат, 1982. С. 22-32.
11. Milne J., Finlayson T.R. // Phil. Mag. 1974. V. 29. N 5. P. 965-981.
12. Иванов O.C., Раевский И.И., Степанов Н.В. // Диаграммы состояния металлических
систем. Сб. статей. М.: Наука, 1968. С. 52-57.
13 Алексеенко Г.К., Жнрнова В.В., Иванов О.С. // Структурный механизм фазовых
превращений металлов и сплавов: Сб. статей. М.: Наука, 1976. С. 65-68.
Е.Н. Шефтель
Nd-Ni. НЕОДИМ-НИКЕЛЬ
Диаграмма состояния Nd-Ni (рис. 284) построена в работе [1] по
данным дифференциального термического и рентгеноструктурного
анализов. В качестве исходных компонентов были использованы Nd
чистотой 99,9 % (по массе) и Ni чистотой 99,99 % (по массе).
572
t;c
Nd-Ni
Ni, 'А (по массе)
20 40 SO SO /00
о /о го so щ so so ю во so too
Nd №,'/.( am) Ni
Рис. 284. Nd-Ni
В системе образуется восемь соединений, четыре из которых Nd3Ni,
Nd7Ni3, NdNi и NdNi5 плавятся конгруэнтно при температурах 590,616,
780 и 1420 °С соответственно. Реакции и температуры образования
остальных соединений приведены в табл. 233. В системе кристаллизуются
три эвтектики.
Таблица 233 Нонвариаитиые реакции в системе Nd-Ni
Реакция
)K+NdNi3»NdNi2
HC+Nd2Ni7-NdNi,
Содержание Ni
в фазах, % (ат.)
63, 75, 66,67
64, 77,78, 75
Температура, °С
940
1030
Nd-Ni
573
Реакция
3K+NdNi5-Nd2Ni7
3K+NdNi5-Nd2Ni17
3K-(aNd)+Nd3Ni
Ж-NdзNl+Nd7Niз
Ж-Nd7Nlз+NdNi
Ж-NdNl+NdNi2
Ж=М2№17+(№)
Nd2Ni17-NdNi5+(Ni)
66;
-91;
-19;
-27;
-35;
56;
91;
89,47;
Содержание Ni
в фазах, % (ат)
83,33,
-83,33;
0;
25;
30;
50;
89,47;
-83,33
77,78
89,47
25
30
50
66,67
100
100
Температура, °С
1134
1300
570
565
540
720
1290
1250
Взаимная растворимость компонентов в твердом состоянии
практически отсутствует. Кристаллическая структура соединений
приведена в табл. 234.
Таблица 23 4. Кристаллическая структура соединений системы Nd-Ni |2]
Соединение
Nd3Ni
Nd7Ni3
NdNi
NdNi2
NdNi3
Nd2Ni7
NdNi5
Nd2Ni17
Прототип
Fe3C
Th,Fe3
BCr
MgCu2
PuNi3
Ce2Ni7
CaCu5
Th2Ni17
Символ
Пирсона,
пр.гр.
o?16,
Pnma
hP20,
0C8,
Cmcm
cF24,
Fdim
Rbm
A?36,
Pd^lmmc
hP6,
РЫттт
Л?38,
РЬ-jmmc
Параметры решетки, им
а
0,704
0,9879
0,3803
0,7270
0,5015
0,4981
0,4926
0,8402
Ь
0,986
-
1,0461
-
-
-
-
-
с
0,643
0,6290
0,4339
—
2,467
2,438
0,3957
0,8048
574
Nd-Ni, Nd-O
Для соединения Nd2Ni 17 известны еще две гексагональные структуры,
которые являются, вероятно, метастабильными. Для одной из них
параметры решетки а = 0,4986, с - 7,263 нм, для другой а - 0,4981, с =
= 9,627 нм [2]. Метастабильной является также структура типа Ег2Со7
(соединение Nd2Ni7), символ Пирсона hR 18, пр.гр. RSma = 0,5000, с =
= 3,631 нм [2].
Литература
1 Pan Y.Y., Cheng J.X. // Acta Phys. Sin (Chin. J. Phys) 1985. V. 34. N 3. P. 384-389.
2 Гладышевский Е.И., Бодак О.И. Кристаллохимия интерметаллических соединений
редкоземельных металлов. Львов: В ища школа, 1982. 255 с.
Е.И Гладышевский, О.И. Бодак, В К. Печарский
Nd-O. НЕОДИМ-КИСЛОРОД
В справочнике [Э] предложен вариант диаграммы состояния Nd-O,
приведенный на рис. 285. В системе установлено образование двух
оксидов NdO и Nd2O3, причем температура и реакция образования
оксида NdO не определена. Оксид Nd2O3 плавится конгруэнтно при
t;c
ZOOD
I5OO
WOO
О, У« (по массе)
5 Ю 15 20
500
*-твт
В6Э'
-r{aNd)
ж
1
\
И
с
rtdto3(h
О 10 20 30 40 50 60 70
Nd О, % (am.)
Рис. 285. Nd-O
Nd-O
575
температуре 2272т 20 °С. Оксид Nd?O3 существует в двух модификациях
Nd2O3(BT) и Nd2O3(HT). Температура превращения по данным
различных авторов составляет 600, 650 или 775-850 °С \Э].
Сообщается также о третьей модификации Nd2O3(CT) [1], однако в
экспериментах, в которых можно было ожидать ее образование, она не
наблюдалась [2]. В работе [2] указывается, что модификация Nd2O3(HT)
является нестабильной: при нагреве в интервале температур 800-1000 °С
она переходит в модификацию Nd?O3(BT), но при последующем
медленном охлаждении обратного превращения не происходит.
В работе [3] на основании электронографического исследования
подвергнутых окислению пленок Nd делается вывод о возможности
увеличения содержания кислорода в модификации Nd2O3(HT) до Nd6Oj [.
Окисление паров Nd при распылении их при температурах 1800-1900 °С
приводит к образованию оксида NdO9. Однако образование оксидов
более богатых кислородом, чем Nd2O3 не подтвердилось в работе [2].
Кристаллическая структура соединений приведена в табл. 235.
Таблица 235 Кристаллическая структура соединений Nd-О )Э]
Соединение
NdO
Nd2O3(BT)
Nd2O3(HT)
Прототип
NaCl
u2o3
Mn,O3
Символ
Пирсона,
nprp
cFb,
Fmlm
hP5,
P3ml
c/80,
Параметры решетки, нм
а
0,5068B)
0,384
0,3831
0,382
0,384
1,1078
1,1072
1,1048
1,1050
с
-
0,6002
0,5999
0,598
0,601
I I I i
Соединение Nd,O3(CT) имеет моноклинную структуру с параметрами
решетки а - 1,435> = 0,3666, с = 0,899 нм, р = 100,34° [1], однако эти
данные требуют проверки
Литература
1 ShaferM.W., Roy R.J.//J Amer Cerara Soc 1949 V 42 P 563-570
2 ГлушковаВ.Б., Соколов Ю.Г., КелсрЭ.К.// Журнал физической химии 1962 Т 38
N 5 С 1126-1134
3 Белецкий М.С., Иерусалимский М.И. //Доклады АН СССР 1960 Т ПЗ N 2
С 355-358
А I Рохлин
576
Nd-Os. Nd-P. Nd-Pb
Nd-Os. НЕОДИМ-ОСМИЙ
Диаграмма состояния Nd-Os не построена. Известны два соединения
Nd с Os, сведения о которых приведены в табл. 236.
Таблица 236 Кристаллическая структура соединений Nd-Os
Соедине-
Соединение
NdOs2
Nd3Os
Прото-
Прототип
MgZn2
Fe3C
Символ
Пирсона,
пргр
Л/Ч2,
Pd^lmmc
оР\Ь,
Рппш
Параметры решетки, нм
а
0,5368B)
0,7406
Ь
0,9573
с
0,8926B)
0,6430
Источник
[Э]
[V-C]
? И Гладышевскип, О. И Бодак, В К Печарский
Nd-P. НЕОДИМ-ФОСФОР
Диаграмма состояния Nd-P не построена. Имеются сведения о
соединении NdP, температура плавления которого выше 2500 °С [Э, Ш].
Соединение имеет структуру типа NaCl (символ Пирсона cF&, пр.гр.
Fm3m, параметр решетки а = 0,5838 нм) (Э].
Л Л Рохлин
Nd-Pb. НЕОДИМ-СВИНЕЦ
Диаграмма состояния Nd-Pb не построена. О незначительной
растворимости Nd в твердом (РЬ) сообщается в справочнике [Ш]. В
табл. 237 приведены данные о кристаллической структуре известных
соединений в этой системе. Кроме указанных в табл. 237, вероятно, в
системе существуют еще два соединения Nd2Pb и NdPb, структура
которых неизвестна.
Nd-Pb, Nd-Pd
577
Таблица 237 Кристаллическая структура соединений Nd-Pb |1]
Соединение
Nd5Pb3
Nd5Pb4
NdPb3
Прототип
Mn5Si3
Sm5Ge4
AuCu3
Символ
Пирсона,
пр.гр.
hP\6,
Рб-jmcm
0РЗ6,
Рпта
с?4,
РтЪт
Параметры решетки, нм
а
0,9264
0,8331
0,4852
Ь
1,594
с
0,6770
0,8467
Литература
1 Гладышевскнй Е.И., Бодак О.И. Кристаллохимия интерметаллических соединений
редкоземельных металлов. Львов В ища школа 1982. 255 с
Е.И. Гладышевсюш, О.И Бодак, В. К. Печарскип
Nd-Pd. НЕОДИМ-ПАЛЛАДИЙ
Диаграмма состояния Nd-Pd исследована в работах [1-3] методами
дифференциального термического, рентгеновского и металлографическо-
металлографического анализов. Сплавы готовили из Nd чистотой 99,88 % (по массе) и Pd
чистотой 99,95 % (по массе) дуговой плавкой и отжигали при температу-
температурах 650-950 °С в зависимости от состава [1]. В работах [2-3] использовали
Nd чистотой 99,9 % (по массе) и Pd чистотой 99,99 % (по массе). Сплавы
готовили плавкой в индукционной печи в тиглях из нитрида бора в
атмосфере Аг и отжигали при температуре 800 "С в течение 200 ч. На
рис. 286 диаграмма состояния построена по данным работ [2-3] в области
составов 0-50 % (ат.) Nd и [1] в области составов 50-100 % (ат.) Nd.
В системе установлено шесть соединений, три их которых NdPd3,
Nd4Pd5 и NdPd плавятся конгруэнтно при температурах 1217*4 °С [2,
3] A450 оСт4 [1]), 970*4 °С [2,3], 953 °С [2,3] A040*4 °С [1]) соответствен-
соответственно. Соединение NdPd3 имеет область гомогенности, границы которой
при температурах 900-700 °С проходят при концентрациях 23,5 и 25,2 %
(ат) Nd Остальные соединения образуются по перитектическим
реакциям, приведенным ниже:
578
Nd-Pd
Nd, % (по массе)
60
BO
mo
400
200
0
Pd
Рис. 286.
to
Nd-Pd
20
JO
40
Nd,
SO 60,
% (am.)
70
80
SO
too
Nd
}K+NdPd3-NdPd5 при 1127*4 "С [2, 3] или 1145 °C [1],
}K+NdPd3-NdPd2 при 1101*4 °C [2,3],
5K+Nd4Pd5-Nd2Pd3 при 936*4 °C [2,3],
)K+NdPd»Nd3Pd при 690 °C [1].
В системе протекают четыре эвтектические реакции:
>K»(Pd)+NdPd5 при 1067*4 °С и 7,3 % (ат.) Nd {2, 3]
или при 1080 "С и 5 % (ат.) Nd [1],
)K>NdPd2+Nd2Pd3 при 896*4 "С и 38 % (ат.) Nd [2, 3],
>K»Nd4Pd5+NdPd при 860+4 °С и 47 % (ат.) Nd [2, 3],
при620оСи85%(ат.)Ш[1].
Растворимость Nd в (Pd) составляет -2,5 % (ат.) при 1080 "С [1], 2,5 %
(ат.) при 900 °С [2] и 2,1 % (ат.) при 700 °С [2].
Кристаллическая структура соединений приведена в табл. 238.
Nd-Pd, Nd-Pm
579
Таблица 238 Кристаллическая структура соединений системы Nd-Pd
Соедине-
Соединение
NdPd5
NdPd3
NdPd
Прото-
Прототип
SmPt5
АиСиз
CrB
Символ
Пирсона,
пр.гр.
-
с/>4,
РтЪт
оС8,
Стст
Параметры решетки, нм
а
0,5265
0,4137
0,41181
0,3827
0,3832
b
0,9219
-
-
1,079
1,0776
с
2,570
-
-
0,4547
0,4609
Источник
[3]
[3]
[4]
[3]
[4]
Литература
1. Parnell K.A., Brett N.H., Haines H.R., Potter P.E. // J. Less-Common Met. 1986. V. 115.
N 1 P 167-176.
2 Chen L., Zhang K. // Proc. 6th Nat. Symp. Phase Diagr. Shenyang. Nov. 20-24. 1990.
Shenyang, 1990. P. 113-115
3. Chen L., Zhang K.//Acta Met Sin. 1991. V. 27. N I. P. 1317-1320.
4. Гладышевский Е.И., Бодак О.И. // Кристаллохимия интерметаллических соединений
редкоземельных металлов. Львов: Вища школа, 1982. 255 с.
Е.И. Гладышевский, О. И. Бодак. В. К. Печарский, Н.Р. Бочвар
Nd-Pm. НЕОДИМ-ПРОМЕТИЙ
Диаграмма состояния Nd-Pm экспериментально не построена. Однако
можно предположить, что Nd и Ptn образуют непрерывные ряды твердых
растворов между аир модификациями. Это предположение исходит из
того, что Nd и Рт являются ближайшими соседями в Периодической
системе, в металлическом состоянии имеют идентичное электронное
строение с тремя валентными коллективизированными электронами
5d 6s2, обладают одинаковыми кристаллическими структурами типа aLa
для модификаций ccNd и аРт и типа W для модификаций pNd и рРт с
очень близкими параметрами решеток; атомные радиусы Nd и Ptn
отличаются всего на 0,6 % [1].
Вследствие исключительной близости строения Nd и Рт можно
считать, что твердые растворы, образующиеся между ними, являются
идеальными, поэтому линии ликвидуса-солидуса и две линии сольвуса
практически сливаются в прямые с очень узкими двухфазными областями
между ними. Диаграмма состояния, построенная на основе этих
представлений, показана на рис. 287.
580
Nd-Pm, Nd-Po
Pm,'h(no массе)
О 10 20 J0 40 50 60 70 80 90 100
woo
50A
1
ton
863
1
•
•
t
(¦
i
BNd
(a)
1
,IiPt
/if, с
1
Ж
m)
Pm
i
i
1
/
0 tO го JO 40 SO 60 70 80 SO 100
Nd Pm, % (am.) Pm
Рис. 287. Nd-Pm
Литература
1. Gschneidner, Jr, K.A., Calderwood F.W. // Handbook on the Physics and Chemistry of Rare
Earths. Amsterdam, New York. Oxford, Tokyo: North-Holland Physics Publishing Co , 1986
V. 8. Chap. 54. P. 1-161.
B.K. Григорович
Nd-Po. НЕОДИМ-ПОЛОНИЙ
Диаграмма состояния Nd-Po не построена. Имеются сведения, что
при взаимодействии паров Ро с Nd образуется сплав с атомным
отнршением компонентов равным 2:2. Температура плавления его
составляет 1460+50 °С [Ш].
Л.Л Рохлин
Nd-Pr
581
Nd-Pr. НЕОДИМ-ПРАЗЕОДИМ
Диаграмма состояния Nd-Pr, построенная по данным работ [1-2],
приведена на рис. 288. Сплавы выплавляли в дуговой печи в атмосфере
Аг из Nd чистотой 99,88 % (по массе) и Рг чистотой 99,89 % (по массе).
Исследование выполняли методами микроструктурного, термического
и рентгеновского анализов, а также измерением твердости и плотности
сплавов.
Диаграмма характеризуется полной растворимостью компонентов
в жидком состоянии и образованием непрерывных рядов твердых
растворов между высокотемпературными и низкотемпературными
модификациями Nd и Рг. При образовании твердого раствора (ccNd, aPr)
наблюдается линейное изменение параметров решетки от а - 0,36715G),
с = 1,184C) нм для Рг до а = 0,36567E), с = 1,17984B) нм для Nd; для
состава 50 % (ат.) Nd - 50 % (ат.) Рг параметры решетки имеют
следующие значения: а = 0,3664, с = 1,1819 нм [V-C].
Pr, % (по массе)
с
t.L
WOO
950
900
ЙЧП
800
750
1
1021'
№'
20
^¦^
t-0
1
I
Ж
(RNd,BPr)
—.
Ш,аРг)
'—
1
^*,
tot
755'
0 10 20 30 $0 50 ВО 70 80 SO 100
Nd Pr, % (am) Pr
Рис. 288. Nd-Pr
582
Nd-Pr, Nd-Pt
Литература
1 LundinC.E., NachmanJ.F., YamamotoA.S.// Rare Earth Res New York London Gordon
and Breach Sci Publishers, 1964 V 2 P 315-318
2 Маркова И.А., Терехова В.Ф., Савицкий Е.М. // Журнал неорганической химии 1963
Т 8 №8 С 1998-2000
Е И Гладышевский, О И Бодак, В К Печарскип
Nd-Pt. НЕОДИМ-ПЛАТИНА
Диаграмма состояния Nd-Pt по данным работы [1] приведена на
рис. 289. Сплавы выплавляли в дуговой печи в атмосфере Аг и отжигали
при температурах 1200 и 700 "С в течение 200 ч. В качестве исходных
компонентов были использованы Nd чистотой 99,7 % (по массе) и Pt
Pt, % (по массе)
О 20 40 60 80 100
t,c
гооо
1600
1200
1000
800
1021
3?
I
i
BNd
750" ^
%
Ж
А
1
юг
А
1
а.
А
ио'
д'
§
JS'
Т ч
i
i
i
/
i
i
f
1
к
г
то'
\
и
(t
1769'
1
80'
Рис.
289. Nd-Pt
0
Nd
W
20
30
h-0
Pt,
SO
,%
60
(am)
70
80
SO
106
Pt
Nd-Pi
583
чистотой 99,91 % (по массе) Исследование выполняли методами
дифференциального термического, рентгеновского и микроскопическо-
микроскопического анализов.
В системе образуются пять соединений, два из которых NdPt и NdPt2
плавятся конгруэнтно при температурах 1535 и 2020 °С соответственно.
Три других образуются по перитектическим реакциям:
)K+NdPt2»NdPt5 при 1730 °С;
)K+NdPt»Nd3Pt4 при 1420 "С;
)K+NdPt»Nd5Pt2 при 1030 "С.
Соединение NdPt2 имеет широкую область гомогенности, протяжен-
протяженность которой при температурах ниже 1730 °С составляет -11 % (ат.).
В системе существуют три эвтектических равновесия:
Д/IU 1\V lVUV'l HUM 1 Ч-IYl IIVMU 1 J ?/1Л.Л 1IJ1/1W » / »/V *^s V
системе существуют три эвтектических равнов
)K>((xNd)+Nd5Pt2 при 750 °С и 15 % (ат.) Pt;
}K»NdPt2+Nd3Pt4 при 1400 °С и 60 % (ат.) Pt;
)K>NdPt5+(Pt) при 1580 °С и 91 % (ат.) Pt.
Растворимость элементов друг в друге незначительна. При температу-
температуре 1000 °С растворимость Nd в (Pt) составляет -0,75 % (ат.), а раствори-
растворимость Pt в (Nd) - 0,97 % (ат.).
Кристаллическая структура соединений приведена в табл. 239.
Таблица 239 Кристаллическая структура соединений системы Nd-Pt
Соедине-
Соединение
NdPt5
NdPt2
Nd3Pt4
NdPt
* При
Прототип
CaCu5
MgCu2
Pu3Pd4
FeB
Символ
Пирсона,
nprp
hP6,
P6lmmm
cFU,
Fdlm
АЙ14,
Pnma
Параметры решетки, нм
a
0,5345
0,7694A)
0,7688-
0,7508
1,3530
0,7256
b
-
-
-
0,4551
с
0,4391
—
0,5476
0,5675
концентрациях 66,7-71,4 % (ат) Pt
Источник
[Э]
[Э]
[2]
[2]
[Ш]
584 Nd-Pi. Nd-Pu
Структура соединения Nd5Pt2 не установлена. В работе [V-C]
сообщается также об еще одной модификации соединения NdPt, имеющей
структуру типа СгВ (символ Пирсона оС8, пр.гр. Стст) с параметрами
решетки я = 0,3848, Ь = 1,0769, с - 0,4542 нм), приводятся данные о
соединениях NdPt3 со структурой типа AuCu3 (символ Пирсона сРА,
пр.гр. РтЪт с параметром решетки а = 0,40590 нм) и Nd3Pt2 со
структурой Er3Ni2 (символ Пирсона hR\S, пр.гр. RI с параметрами
решетки а - 0,8893, с = 1,6871 нм).
Литература
1 Колесниченко В.Е., Терехова В.Ф., Савицкий Е.М. // Диаграммы состояния
металлических систем: Сб. статей. М.: Наука, 1971. С. 174-176.
2. Гладышевский Е.И., Бодак О.И. Кристаллохимия интерметаллических соединений
редкоземельных металлов. Львов: Вища школа, 1982. 255 с.
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
Nd-Pu. НЕОДИМ-ПЛУТОНИЙ
Диаграмма состояния Nd-Pu (рис. 290) исследована частично в работе
[1] и полностью построена в работе [2]. Сплавы приготовляли в дуговой
печи в инертной атмосфере из металлов высокой чистоты, содержащих
не менее 99,99 % (по массе) основного компонента. Исследование
выполнено методами дифференциального термического, микрострук-
микроструктурного и рентгеновского анализов.
Диаграмма характеризуется полной смешиваемостью компонентов
в жидком состоянии. Двойные соединения не образуются. При температу-
температуре 820 °С протекает метатектическая реакция (PNd) » (aNd) + Ж. При
температуре 628 °С и концентрации 97-98 % (ат.) Ри кристаллизуется
эвтектика (aNd) + (ePu). Все остальные превращения в твердом состоянии
связаны с полиморфизмом Ри.
Растворимость Ри в (pNd) равна 33 % (ат.), а в (aNd) - 27-29 % (ат.).
Растворимость Nd в (бРи) и (ePu) составляет -2 % (ат.), а в остальных
модификациях Pu (a, р, у, 5') она незначительна.
Nd-Pu, Nd-Re
585
Pu, % (по массе)
20 40 60 80 100
t;c
1000
800
600
<юо
200
1
(aNd)
t
|
/i
I
-»-
V
-x«
33-
1
ж
x-«.
6
г
Г
re*
'Г
I
——.
(
em
J
\
Л
{ffiiFT
(tPu)-^
(fPu)—*-
(
\flPu
r—
aPu
h—
1
«¦0*
0 10 ZO 30 «0 50 SO 70 80 SO /00
Nd Pu. V. (am) Pu
Рис. 290. Nd-Pu
Литература
I Кугайцев В.И., Чеботарев Н.Т., Андрианов М.А. и др. // Атомная энергия. 1967. Т. 23.
N6 С. 511-519.
2. Ellinger F.H., Land С.С., Johnson K.A. //J Nucl. Mater. 1969. V. 29. N 2. P. 178-183.
Е.И. Гладышевский, О. И. Бодак, В. К. Печорский
Nd-Re. НЕОДИМ-РЕНИЙ
Диаграмма состояния Nd-Re не построена. В работе [1] сообщается
о получении соединения NdRe2 со структурой типа MgZn2 (символ
Пирсона hP\2, пр.гр. Рб^ттс), параметры решетки а - 0,5364, с -
- 0,877 нм. В работе [2] рентгеновским анализом литых и отожженных
сплавов было подтверждено образование соединения NdRe2, параметры
решетки которого были определены равными а - 0,55, с = 0,895 нм. В
исследованных сплавах в равновесии находились чистые компоненты
и соединение NdRe2, что указывает на отсутствие других промежуточных
586 Nd-Re. Nd-Rh
фаз в системе. Растворимость Nd в Re очень мала. Предполагается, что
система подобна системе Y-Re [2].
Литература
1 Elliott R.P. // Pare Earth Research III New York Gordon and Breach Sci Publishers
Inc, 1965 P 215-245
2 Хамидов О.Х., Савицкий Е.М. //Диаграммы состояния металлических систем Сб
статей М Наука, 1968 С 178-185
М А Тылктш
Nd-Rh. НЕОДИМ-РОДИЙ
Гипотетическая диаграмма состояния Nd-Rh построена по данным
работы [1] и приведена на рис. 291. Методы приготовления и исследова-
исследования сплавов, а также чистота исходных материалов не описаны.
Установлено, что пять соединений Nd4Rh, Nd3Rh, Nd4Rh3, NdRh2,
NdRh3 кристаллизуются из расплава при температурах -790, -920, -1420,
-1410, -1600 "С соответственно. Соединение NdRh2 имеет область
гомогенности, которая находится при концентрациях 66-68,5 % (ат.) Rh
Два соединения образуются по перитектическим реакциям:
Ж + Nd4Rh3 - Nd5Rh3 приП40°С,
Ж + Nd4Rh3 - NdRh при 1270 °С.
В системе кристаллизуется шесть эвтектик по реакциям:
Ж - (aNd) + Nd4Rh при 720 °С и 13 % (ат.) Rh,
Ж - Nd4Rh + Nd3Rh при 730 °С и 22 % (ат.) Rh,
Ж » Nd3Rh + Nd5Rh3 при 890 °С и 27 % (ат.) Rh,
Ж - NdRh + NdRh2 при 1250 °С и 63 % (ат.) Rh,
Ж - NdRh2 + NdRh3 при 1380 °С и 69 % (ат.) Rh,
Ж»(Rh) + NdRh3 при 1410 °С и 84% (ат.) Rh.
Кристаллическая структура соединений приведена в табл 240 [V-C],
структура соединений Nd5Rh3 и Nd4Rh3 неизвестна.
Nd-Rh
587
й
t,'c
1800
WOO
1Ш
1200
WOO
863
дОО
600
да//'
721ГУ
20
1
Kh,'/'(no массе)
40 SO
"i
-
•91
,1
L
f
.7.
/
f
W'
w'
ill
ж
mo'
n
N
-/*«
1
W- ¦
4600
I
1
-
-
N
13
80
i
i
V
80-
(Л
10
4
I
WO'
I9S3'
о w го зо ьо so so ю so so too
Nd Я/г.'/. (am.) Kh
Рис.291. Nd-Rh
Таблица 240 Кристаллическая структура соединений системы Nd-Rh
Соединение
Nd4Rh*
Nd3Rh
NdRh
NdRh2
NdRh3
* Ромбическа
Прототип
-
Fe3C
CrB
MgCu2
CeNi3
IСИНГОНИЯ
Символ
Пирсона,
пргр
-
оР16,
Pnma
oC%,
Cmcm
cF24,
Fdim
A/>24,
РЬт/ттс
Параметры решетки, нм
а
1,4666
0,7258
0,3890
0,7564
0,5282
Ь
1,038
0,9840
1,0839
-
с
1,313
0,6431
0,4247
-
1,752
588
Nd-Rh, Nd-Ru
Литература
1 Sing P.P., Raman A.//Trans AIME 1969 V 245 N 7 P 1561-1568
E И ГлаОышевский, О И Бодак В К Печарскии
Nd-Ru. НЕОДИМ-РУТЕНИЙ
Диаграмма состояния Nd-Ru (рис. 292) построена в работе [1] на
основании анализа данных работ [2-3]. В работе [2] сообщается об
интерметаллических соединениях и указывается на подобие системы
1
t,\
2000
1600
1200
890'
800
400
Г
-7»°
—(at/
10
t
Ж
13
70
i
Ra,
30
i
11
яяп'М
ggfy-
—
&?/
855'
%(по
40
t
9
пассе)
Я
i
у
20'
1
S1
70
1
<-
>т
80
i
0'
{
30 100
^**^ 233
Ru) —^
10
20 30
Nd
Рис. 292. Nd-Ru
4 SO 60
Ru, % (am )
70 80
SO WO
Ru
Nd-Ru системам Gd-Ru и Dy-Ru. В работе [З] методом дифференциаль-
дифференциального термического анализа исследованы сплавы в интервале концентра-
концентраций 0-66,7 % (ат.) Ru и установлены температуры ликвидуса и нонвари-
антных превращений В системе образуются пять соединений, одно из
которых Nd5Ru2 плавится конгруэнтно при температуре 915 "С
Остальные образуются по перитектическим реакциям В системе
кристаллизуются две эвтектики Нонвариантные реакции приведены в
табл 241 по данным работы [1].
Nd-Ru
589
Таблица 241 Нонвариаитные реакции в системе Nd—Ru
Реакция
)K+Nd5Ru2-Nd3Ru
Ж+Nd5Ru2=Nd7Ruз
Ж+NdRu2»NdRuv
Ж+(Ru)-NdRu2
Ж-(aNd)+NdзRu
Ж»Nd7RUз+NdRuv
24,
31,
36,
9
13,
34,
Содержание Ru
в фазах, % (ат )
28,5,
28,5,
66,7,
100,
0,
30,
25
30
37
66,7
25
37
Температура, °С
880
890
920
>1600
725
855
Следует отметить, что соединение NdRux, описанное в работе [2] как
"Nd5Ru3", по мнению авторов работы [4], подобно соединению Y^Ri^-
Кристаллическая структура соединений приведена в табл. 242.
Таблица 242 Кристаллическая структура соединений Nd-Ru
Соедине-
Соединение
Nd3Ru
NdsRu2"
Nd7Ru3
NdRu*;
NdRu2
Прото-
Прототип
Fe3C
—
-
-
Cu2Mg
Символ
Пирсо-
Пирсона,
пргр
о/Ч 6,
Рпта
тС28,
С2/с
о/Ч0,
Рпта
-
cF24,
Fdlm
Параметры решетки,
а
0,7355
0,7359
0,7353
1,6295
1,6289
1,6290
0,7303
18,630
0,7637
0,7608
*J3 = 96 67° [4] P = 96,66° [2], p = 96,63° [3]
Ромбическая сингония
Ъ
0,9675
0,9650
0,9649
0,6509
0,6505
0,6503
2,2830
1,560
им
с
0,6406
0,6448
0,6406
0,7342
0,7339
0,7330
0,6532
1,560
-
Источник
[4]
[2]
[3]
[4]
[2]
[3]
[3]
[3]
[2]
[3]
590 Nd-Ru, Nd-S
Литература
1 OkamotoH.//J Phase Equilibria 1991 V 12 N 2 P 250-252
2 Sharifrazi P., Mohanty R.C., Raman A.//Z Metallkunde 1984 Bd 75 N Ю S 801-805
3 Palenzona А., Сапера F. // J Less-Common Met 1990 V 157 P 307-313
4 Palenzona A. Hi Less-Common Met 1979 V 66 P P27-P33
H P Бочвар
Nd-S. НЕОДИМ-СЕРА
Диаграмма состояния Nd-S не построена В системе образуется ряд
соединений, сведения о которых обобщены в справочнике Р]
Сульфид NdS плавится при температуре 2200т60 °С, имеет структуру
типа NaCl (символ Пирсона cF8, np rp. Fm3m). Параметр решетки по
данным различных авторов а = 0,5691 нм \Э], а = 0,564 нм [1],
а = 0,5715нм[2]
Сульфид Nd3S4 плавится при температуре 2040 °С, имеет структуру
типаТЬ3Р4 (символ Пирсона с/28, пр гр. I4id) с параметром решетки
а = 0,8524 нм р]
Сульфид Nd2S3 имеет три модификации. От комнатной температуры
до температуры 1050+50 °С существует модификация ocNd2S3 В
интервале температур 1050*50 "С- 1300+200 ° С существует модификация
pNd2S3, которая при более высоких температурах переходитв модифика-
модификацию yNt^j Последняя плавится при температуре -2200 °С с одновре-
одновременной диссоциацией до NdS. Структура модификаций аир неизвестна
Модификация YNd2S3, как и сульфид Nd3S4, имеет структуру типа Th3P4,
но с вакансиями металлических ионов, параметр решетки а - 0,8527 нм
Между сульфидами yNd2S3 и Nd3S4 образуется непрерывный ряд твердых
растворов [Э]
Сульфид NdS2 плавится при температуре 1760 "С, имеет структуру
типа LaS2 с восемью формульными единицами в элементарной ячейке
(пр гр Рпта) [3]
Литература
1 Жузе В.П., Голубков А.В., Гончарова Е.В., Сергеева В.М. // Физика твердого тела
1964 Т 6 N 1 С 257-267
2 Журавлев Н.Н., Степанов А.А., Щебашинов М.П. // Кристаллография 1964 Т 6 N I
С 116—117
3 Picon M., Patrie М.//Cornpt Rend 1956 V 243 N 22 Р 1769-1772
Л Л Рохлин
Nd-Sb
591
Nd-Sb. НЕОДИМ-СУРЬМА
Диаграмма состояния Nd-Sb приведена на рис. 293 по данным работы
[1]. Исследование проводили методами микроструктурного, рентгенов-
рентгеновского, термического, химического анализов и измерения микротвердости
В качестве исходных материалов использовали Nd чистотой 99,34 % (по
массе) и Sb чистотой 99,999 % (по массе)
Система характеризуется наличием четырех соединений, одно из
которых NdSb плавится конгруэнтно при температуре 2075 "С, а другие
образуются по перитектическим реакциям.
Ж + Nd4Sb3 -Nd5Sb3 при 1690 °С,
Ж + NdSb - Nd4Sb3 при 1800 'С,
Ж + NdSb - NdSb2 при 1650°.
В системе протекает два эвтектических превращения:
Ж - (pNd) + Nd5Sb3 при 955 °С и ~5 % (ат.) Sb,
Ж - NdSb2 + (Sb) при 600 °С и -97 % (ат.) Sb.
Эвтектоидное превращение при температуре 840 °С связано с
Полиморфизмом Nd (PNd) - (aNd) + Nd5Sb3.
о
t,'c
2000
I80O
1600
1400
IZOO
IOOo
8OO
BOO
чоа\
гоо
10
Si,'A (no массе)
70 30 40 SO 60 70 60 90 IOO
i
ж
/
г
-SSi
1
НИ) 940"
\-(aNit)
1
А
~Т69 »
¦«? '
¦*«
ЦП'
Г*
К
1650'
1
\
10'
1
\
\
\-
630,795'
Рис.
293.
О
Nd
Nd-Sb
10
TO
30
Sb, %
50
(am)
60
70
60
SO
IOO
Si
592
Nd-Sb, Nd-Sc
Структура соединения Nd5Sb3 типа Mn5Si3 (символ Пирсона ИР16,
пр. гр. Рб^/тст), структура соединения Nd4Sb3 типа Th3P4 (символ
Пирсона с/28, пр. гр. I43d); соединение NdSb2 имеет структуру типа
SmSb2 (символ Пирсона оС24, пр. гр. Стса) [М], соединение NdSb -
структуру типа NaCl (символ Пирсона C.F8, пр. гр. Fm Ът) с параметром
решетки а = 0,6322 нм \Э].
Литература
1 Кобзеико Г.Ф., Черногореико В.Б., Мартыичук Э.П. идр //Изв АН СССР Металлы
1972 N 3 С 224-227
Е В Лысова
Nd-Sc. НЕОДИМ-СКАНДИЙ
Диаграмма состояния Nd-Sc приведена на рис. 294 [1]. Сплавы
изготовляли дуговой плавкой из Nd чистотой 99,91 % (по массе) и Sc
чистотой 99,84 (по массе) и отжигали в танталовых капсулах при
Sc, % (по массе)
20 40 SO SO 100
1400
аоо
1000
о ю го зо tto so so n so so too
Hi Sc.'U(am) Sc
Рис 294. Nd-Sc
Nd-Se, Nd-Se 593
температурах 450 °C в течение 260 ч и 1060 °С в течение 16 ч. Исследова-
Исследование проведено методами рентгеновского, дифференциального термичес-
термического и металлографического анализов.
Диаграмма характеризуется полной взаимной растворимостью
высокотемпературных и низкотемпературных модификаций Nd и Sc.
Линии сольвуса имеют минимум при температуре 800 °С и концентрации
22 % (ат) Sc При температурах ниже 700 °С наблюдается расслоение
твердого раствора (ocNd, aSc) на два твердых раствора (aNd) и (aSc).
Критическая точка кривой расслаивания расположена при 62 % (ат.) Sc.
Литература
1 Gschneidner, Jr., K.A., Calderwood F.W. // Bull Alloy Phase Diagrams 1982 V 3 N3
P 356-357
E И Гладышевский, О И Бодак, В К Печорский
Nd-Se. НЕОДИМ-СЕЛЕН
Диаграмма состояния Nd-Se не построена. В системе образуется ряд
соединений р, Ш, 1]
Селенид NdSe имеет структуру типа NaCl (символ Пирсона cF%, пр
гр FmZrri), параметр решетки по данным различных исследователей а -
= 0,5909 нм, а = 0,5891 нм,а = 0,591 нм р, 1].
Селенид Nd3Se4 имеет структуру типа Th3P4 (символ Пирсона с/28,
пр гр I43d) с параметром решетки а - 0,8859 нм р].
Селенид Nd2Se3 обладает кристаллической структурой того же типа,
что и Nd3Se4. Между обоими селенидами Nd2Se3 и Nd3Se4 образуется
непрерывный ряд твердых растворов с переменным количеством
вакантных позиций Nd. Параметр решетки а соединения Nd2Se3 равен
0,885 нм р, Ш] В работе [Ш] сообщается также о получении Nd2Se3 с
ромбической структурой,которуюможнорассматриватькак высокотем-
высокотемпературную модификацию.
Селенид Nd2Se4 имеет тетрагональную структуру с параметрами
решетки а = 0,835, с = 0,843 нм Это соединение имеет область гомоген-
гомогенности, которая ограничивается составом, соответствующим формуле
Nd2Se36 Для указанного состава параметры решетки а = 0,828, с =
= 0,841'нм[Э].
Литература
1 Жузе В.П., Голубков А.В., Гончарова Е.В., Сергеева В.М. // Физика твердого тела
1964 Т 6 N 1 С 257-267
Л Л Рохлин
594
Nd-Si
Nd-Si. НЕОДИМ-КРЕМНИЙ
Диаграмма состояния Nd-Si, построенная в работе [1] по данным
дифференциального термического, рентгеновского и металлографическо-
металлографического анализов, приведена на рис. 295. Сплавы готовили в дуговой печи из
Nd чистотой 99,44 % (по массе) и Si чистотой 99,9 % (по массе) и
отжигали в вакуумной печи при разных температурах.
В системе образуется шесть соединений, два из которых NdSi и NdSi[ g
плавятся конгруэнтно при температурах 1680 и 1760 °С соответственно.
Два соединения
реакциям:
р
Nd5Si3 и Nd5Si4 образуются по перитектическим
Ж + Nd5Si4 - Nd5Si3 при 1445 °С,
Ж + NdSi » Nd5Si4 при 1565 "С.
Два других соединения Nd3Si4 и NdSij 5 образуются по перитектоид-
ным реакциям:
Si, % (по массе)
20
40 SO 80100
2000
№00
1200
800
Ж
-(aNd)
/mr
735'
то
то'
изо'
/¦/*'
¦S30'
ISO'
N
{Si)—
too'
О 10
Nil
JO 40 SO SO 70 Й0 30 WO
Si,'/, (am) Si
Рис. 295. Nd-Si
Nd-Si
NdSi + NdSi, 5 - Nd3Si4 при 1390 °C,
NdSi + pNdSi'u»pNdSi15 при 1510 °C.
595
Соединения NdSi[ 5 и NdSilg существуют в двух модификациях.
Температура перехода для соединения NdSi j 5 составляет 530 "С. Для
соединения NdSit g она находится в интервале 150-100 "С, что свиде-
свидетельствует о наличии узкой области гомогенности этого силицида.
В системе кристаллизуются три эвтектики по реакциям:
Ж - (aNd) + Nd5Si3 при 795 °С и 12,5 % (ат.) Si,
Ж « NdSi + pNdSij 8 при 1570 °С и 56 % (ат.) Si,
Ж » pNdSi, g + (Si)' при 1205 °С и 83 % (ат.) Si.
Взаимная растворимость компонентов в твердом состоянии
составляет менее 1 % (ат.).
Кристаллическая структура соединений приведена в табл. 243 [2].
Таблица 243 Кристаллическая структура соединений системы Nd—Si
Соединение
Nd5Si3
Nd5Si4
NdSi
NdSi, 5
aNdSi, g
PNdS,18
Прототип
Cr5B3
Zr5Si4
FeB
AIB2
aGdSi2
aThSi2
Символ
Пирсона,
пргр
1/32,
/4/mcm
(«6,
/•4,2,2
oPi,
Pnma
АЛ,
РЫттт
ol 12,
Imrna
thl,
14,/amd
Параметры решетки, нм
a
0,7768
0,7868
0,8158
0,3940
0,413
0,4111
b
-
-
0,3918
-
0,410
-
с
1,369
1,478
0,5887
0,4258
1,375
1,3556
Литература
1 Еременко В.Н., МслешевичК.А., Буянов Ю.И., Обушенко И.М. // Докл АН УССР
1984 Сер А N 11 С 80-85
2 Гладышевский Е.И., Бодак О.И. Кристаллохимия интерметаллических соединений
редкоземельных металлов Львов Вища школа 1982 255 с
ЕЙ Гладышевский. О И Бодак. В К Печарскип
596
Nd-Sm
Nd-Sm. НЕОДИМ-САМАРИЙ
Диаграмма состояния Nd-Sm, приведенная на рис. 296, базируется
на данных работ [1, 2]. Исследование [1] было проведено методами
дифференциального термического, рентгеновского и микроструктурно-
микроструктурного анализов. Сплавы выплавляли в дуговой печи в атмосфере Аг из Nd
чистотой >99,64 % (по массе) и Sm чистотой >99,80 % (по массе).
Sm, % (по массе)
20 40 60
ВО
то
юоо
600
—•
1
1 ¦
Ж
¦•—¦
fflNd,rSm)
(aM.flSm)
¦¦^
1
1
1
1074'
??
г?
f
Рис.
296.
Nd-Sm
/5
Я»
Sm,
SO 60
70
80
90
too
Sm
Согласно результатам работы [1] в системе существуют непрерывные
ряды твердых растворов, причем двухфазные области между линиями
ликвидуса и солидуса и двумя линиями сольвуса очень узкие. Поскольку
Nd и Sm близко расположены в Периодической системе, в металлическом
состоянии оба являются трехвалентными, высокотемпературные
модификации pNd и ySm, как и aNd и pSm имеют одинаковые кристалли-
кристаллические структуры, твердые растворы между ними являются практически
идеальными и могут быть представлены прямыми линиями. В работе [1]
не отражено существование третьей модификации Sm, поэтому линии,
соединяющие температуры превращений aNd и PSm и фазовые границы
в богатой Sm области проведены штриховой линией [2]
NdSm. Nd-Sn
597
Литература
1 КобзеикоГ.Ф.,МартиичукЕЛ.//Доповщ1АНУРСР 1975 Сер А N3 С 263-266
2 Gschneidner, Jr., K.A., Calderwood F.W. //Bull Alloy Phase Diagrams 1982 V 3 N2
P 201-202
E И Гладышевский, О И Бодак, В К Печорский
Nd-Sn. НЕОДИМ-ОЛОВО
Диаграмма состояния Nd-Sn построена в работе [1] с учетом данных
работ [2-3] (рис. 297). Сплавы получали дуговой плавкой из Nd чистотой
99,85 % (по массе) и Sn чистотой 99,9995 % (по массе) и отжигали в
танталовых контейнерах в вакууме при температурах 900-300 °С в
течение от 1 до 260 ч. Исследование проводили методами микроструктур-
jHoro, рентгеновского и химического анализов.
В сплавах системы образуется шесть соединений, два из которых
Nd5Sn3 и NdSn3 плавятся конгруэнтно при температурах 1660 и 1170 °С
ю
20
Sn, % (no массе)
30 АО SO ВО 70
SO SO
Nd
Рис: 297. Nd-Sn
40 SB ВО
Sn, % (am)
598
Nd-Sn
соответственно. Три соединения образуются по перитектическим
реакциям:
Ж + Nd5Sn3 - Nd5Sn4 при 1558* 11 °С;
Ж + Nd5Sn4 » Nd||Sn10 при 1396*15 °С;
Ж + Nd,,Sn10 - NdSn при 1257*4 "С.
Соединение Nd3Sn5 образуется по перитектоидной реакции:
NdSn + NdSn3 " Nd3Sn5 при 1130*2 "С.
В сплавах системы кристаллизуются три эвтектики по реакциям:
Ж " (PNd) + Nd5Sn3 при 870 ° и 12 % (ат.) Sn,
Ж - NdSn + NdSn3 при 1159*4 °С и -65 % (ат.) Sn,
Ж - NdSn3 + (Sn) при -231 "С и -100 % (ат.) Sn.
При температуре 820 "С происходит эвтектоидный распад (PNd) на
(ocNd) и Nd5Sn3. Максимальная растворимость Sn в (ocNd) составляет
около 3 % (ат.). Растворимость Nd в (Sn) практически отсутствует.
Кристаллическая структура соединений приведена в табл. 244.
Таблица 24 4. Кристаллическая структура соединений системы Nd-Sn |V-C|
Соединение
Nd5Sn3
Nd5Sn4
Nd,,Sn10
NdSn3
Прототип
Mn5Si3
Sm5Ge4
HonGe10
AuCu3
Символ
Пирсона,
пр.гр.
АЛ6,
Pb^lmcm
оРЪб,
Pnma
Г/84,
/4/mmm
cP4,
РтЪт
Параметры решетки, нм
а
0,9208
0,8282
1,187
0,4705
Ь
1,584
с
0,6717
0,8376
1,759
Литература
1. Еременко В.Н., Супанова М.В., Марцеиюк П.С., Листовиичий В.Е. // Украинский
химический журнал. 1988. Т. 54. N 12. С. 1240-1244.
2. Еременко В.Н., Харькова A.M., Обушенко И.М. //Докл. АН УССР. Сер А. N 12
С 1133-1137.
3. Кулагина Н.Г., Баянов А.П., Кулагин Н.М. // Изв АН СССР. Металлы. 1985. N 3
С. 211-216
Е.И Гладышевскип, О И Бодак, В.К Печарский
Nd-Sr
599
Nd-Sr. НЕОДИМ-СТРОНЦИЙ
Диаграмма состояния Nd-Sr приведена на рис. 298 по данным работ
[1,2]. Сплавы выплавляли из Nd чистотой 99,6 % (по массе) и Sr чистотой
99,7 % (по массе) в печи в инертной атмосфере. Термическую обработку
сплавов проводили в вакуумированных кварцевых ампулах при
температурах 400 и 600 "С в течение 170 ч. Исследование было выполнено
методами дифференциального термического, микроструктурного,
рентгеновского анализов и измерения микротвердости.
t.l
woo
800
7В$Г
600
400
*/
1
0.8
20
1
-(Mr)
541"
lr)
40
Nd,'
/etna
BO
940'
8B5°
740°
массе)
80
жг
(J3h
\
\
1021'
f
raNd)+z?
\
\
\
\
\
О 10 20 30 40 SO 60 70 80 90 100
Sr Nd, % (am.) Nd
Рис. 298. Nd-Sr
Система характеризуется наличием области несмешиваемости в
жидком состоянии, протяженность которой при температуре монотекти-
ческого равновесия 940 °С составляет 0,8-87 % (ат.) Nd. Кроме
монотектического равновесия в системе имеет место эвтектическое
равновесие при температуре 740 °С-Ж» (pSr) + (ocNd) и перитектическое
равновесие при температуре 865 °С - Ж + (pNd) - (ocNd).
Растворимость Sr в (ocNd) при эвтектической температуре 740 "С
составляет 5,8 % (ат.), а при 400 °С - 4,5 (ат.). Растворимость Nd в (pSr)
не превышает 0,33 % (ат.) при 740 "С.
600
Nd-Sr, Nd-Ta. Nd-Tb
Литература
1. Эшоиов К.К., Вахобов А.В., Джураев ТД. и др. // Изв. АН СССР. Металлы. 1977. N 6
С. 196-199.
2. Эшоиов К.К., Зухуритдииов М.А., Вахобов А.В., Джураев Т.Д. // Изв. АН СССР.
Металлы. 1978. N 1. С. 191-192.
Е.И. Гладышевский, О. И. Бодак, В. К. Печарский
Nd-Ta. НЕОДИМ-ТАНТАЛ
Диаграмма состояния Nd-Ta (рис. 299) построена в области очень
малых концентраций Та [М]. Растворимость Та в жидком Nd незначи-
незначительна, а в твердом состоянии практически отсутствует Р].
Та,'/, (по массе)
0,08 0.12 0,16 0.20
1800
1100
1011*
WOO
О 0,04 0,08 О.П 0,15 0,20
Nd Ta,V. (am.)
Рис. 299. Nd-Ta
Е.И. Гладышевский, О И Бодак, В К. Печарский
Nd-Tb. НЕОДИМ-ТЕРБИЙ
Диаграмма состояния Nd-Tb экспериментально не построена. Оба
элемента Nd и ТЬ близки по электронному и кристаллическому строению,
что дает основание предполагать образование между ними при высоких
Nd-ТЬ
601
t;c
1300
ПВО
IIOO
WOO
300
800
TOO
soo
500
'tOO
Tb, % (по массе)
о ю го jo w so so 70 во so wo
1
1021
I
И
i
v
(а Ни)
1
/ИГ
I
-7Л
Л
1
1
i
%
\
\\
\\
1
1
(«П)
G /0
«^7 ^ W 7^7 SO SO 100
Г6,'/.(am) П
Рис. 300. Nd-Tb
температурах непрерывного ряда твердых растворов с кубической
структурой (PNd, РТЬ), а при более низких температурах непрерывного
ряда твердых растворов с плотной гексагональной структурой (aNd,
аТЪ). При температурах ниже 750 "С твердый раствор (aNd, aTb)
упорядочивается с образованием фазы б со структурой типа (aSm) и
разделяется на два твердых раствора Nd в (aTb) и ТЬ в (aNd). Благодаря
близкому строению Nd и Tb и малой разницы их атомных радиусов
(отличаются на 2,1 %) линии ликвидуса-солидуса и две линии сольвуса
почти сливаются в прямые, соединяющие температуры плавления и
превращения. На предлагаемой диаграмме Nd-Tb (рис. 300) они
разделены очень узкими двухфазными областями. Область гомогенности
фазы б изображена штриховой линией и нанесена на диаграмму по
аналогии с известными диаграммами Nd-Gd и Nd-Dy [1].
Литература
1. Gschneidner, Jr., K.A., Calderwood F.W. // Handbook on the Physics and Chemistry of
Rare Earths. Amsterdam New York Oxford. Tokyo' North-Holland Physics Publishing Co 1986
V. 8 Chap 54 P. 1-161
В К Григорович
602
Nd-Te
Nd-Te. НЕОДИМ-ТЕЛЛУР
Диаграмма состояния Nd-Te, приведенная в справочнике [Ш], была
уточнена в работах [1, 2]. На рис. 301 показана диаграмма, построенная
в работе [1] методами рентгеновского, дифференциального термического
и микроструктурного анализов. Сплавы были синтезированы в
вакуумированных кварцевых ампулах.
t;c
1700
1300
1021°
900
863'
500
го
Те, % (по массе)
40 60 во
100
(ДМ
J
/
Nd)
i
Ж
/
/
/
/
1 70
IBID'
it
4
w
N
Vi
Г
1
j
i
11
\i 1 \
Г Уо°
II ill
II 1
1
U Hi.
\
850*
(T
\
\
\
1445; 5'
100
0 W 20 JO 4-0 50 60 10 80 90 WO
Nd Те, % (am) Те
Рис. 301. Nd-Te
В системе образуется семь соединений, одно из них NdTe кристаллизу-
кристаллизуется из расплава при температуре 2025 °С (по данным работы [2] при
1755 °С), шесть других образуются по перитектическим реакциям
Ж + NdTe - Nd3Te4 при 1660 °С [1] или 1465 "С [2],
Ж + Nd3Te4 » Nd2Te3 при 1610 "С [1] или 1315 "С [2],
Ж + Nd2Te3 = Nd4Te7 при 1290 °С [1] или 1255 °С [2],
Ж + Nd4Te7 - NdTe, при 1250 °С [1] или 1120 °С [2],
Nd-Te
603
Ж + NdTe2 » Nd2Te5 при910°С[1] или 925 °C [2],
Ж + Nd2Te5 » NdTe3 при850°С[1] или 855 "С [2].
Соединения Nd3Te4, Nd4Te7, NdTe2, Nd2Te5 и NdTe3 имеют области
гомогенности, протяженностью 2,8; 2,2; 3; 1 и 3,6 % (ат.) соответственно
[1]. Соединение Nd2Te3 претерпевает полиморфное превращение при
температуре -1000 "С.
В системе кристаллизуются две эвтектики' (pNd) + NdTe и (Те) +
+ NdTe3 при температурах 948 и -449 "С соответственно. Взаимная
растворимость компонентов в твердом состоянии практически
отсутствует.
Кристаллическая структура соединений приведена в табл. 245.
Таблица 245 Кристаллическая структура соединений системы Nd-Te
Соединение
NdTe
Nd3Te4
Nd2Te3(HT)
Nd2Te3(BT)
Ndje;
NdTe2
Nd2Te;
NdTe3"
Прототип
NaCl
Th3P4
Th3P4
Sb2S3
-
Cu2Sb
-
-
Символ
Пирсона,
пргр
cFZ,
Fmlm
cm.
ihd
cm,
oPW,
Pnma
-
IP6,
P4lnmm
-
-
Тетрагональная сингония
Ромбическая сингония
Параметры решетки, нм
a
0,6262
0,943
0,9456
0,9427
1,216
0,8799
0,4405
0,442
0,4347
0,435
Ь
—
-
-
1,193
-
-
-
0,435
с
_
-
-
0,437
0,9001
0,9008
0,902
2,5794
2,580
Источник
[1]
[Ш]
[3]
[1]
[1]
[Ш]
[1]
[1]
604
Nd-Te, Nd-Th
Литература
1. Зинченко К.А., Лужная Н.П., Ярембаш Е.И. и др. // Изв. АН СССР. Неорганические
материалы. 1966. Т. 2. N 10. С. 1747-1756.
2. Абрикосов Н.Х., Загарян В.Ш. // Изв. АН СССР. Неорганические материалы. 1965
Т. 1.N9. С. 1462-1467.
3. Flahaut J. // Compt Rend. Acad. Sci. Paris. 1963 V. 257. P. 1530-1533.
Н.И. Никитина
Nd-Th. НЕОДИМ-ТОРИЙ
Диаграмма состояния Nd-Th исследовалась многократно [Э, ITT];
наиболее полно она изучена в работах [1,2]. Сплавы получали сплавлени-
сплавлением компонентов в дуговой печи из Nd чистотой 99,893 % (по массе) [1]
или 99,9 % (по массе) [2] и Th чистотой 99,5 % (по массе) [1], отжигали
Nd,%(no массе)
20 40 60
80 100
поо
1000
800
600
/330
\
(a Th)
ж
О 10 Z0 30 40 50 60 70 80 90 100
Th Nil,V.I am.) Nd
Рис. 302. Nd-Th
Nd-Th, Nd-Ti 605
перед закалкой в ледяной воде при 750 °С в течение 336 ч [1] или при
950 "С. 170 ч [2]. Исследования проводили методами микроструктурно-
микроструктурного, рентгеновского, дифференциального термического анализов и
измерения твердости и микротвердости.
Диаграмма состояния Nd-Th (рис. 302) представлена из работы [2].
Добавки 5 ат. % Nd увеличивают температуру превращения (ocTh)»(pTh)
с 1380 до 1405 °С, являющейся температурой перитектического
образования (ocTh) с областью гомогенности, простирающейся от 0 до
=80 ат. % Nd. Th увеличивает температуру полиморфного превращения
Nd от 863 до 930 "С - температуры перитектоидного образования (ocNd),
что согласуется с данными работы [1]. Еще одно нонвариантное
равновесие имеет место при 1140 "С и соответствует перитектическому
образованию (PNd).
В работе [2] приведен параметр решетки сплава Nd0 16Т\\0 24 (а =
= 0,5131 нм).
Литература
1. Бадаева ТА., Кузнецова Р.И.// Изв. АН СССР. Металлы. 1967. N 1. С. 175-181.
2. Trzebiatowski W., Niemiec J. // Rocz. Chem., 1968. Т. 42. N 3. С. 413-419.
EM. Гладышевский, О. И. Бодак, В К. Печарский
Nd-Ti. НЕОДИМ-ТИТАН
Данные о системе Nd-Ti приведены в работах \Э, Ш]; диаграмма
состояния этой системы при содержании 0-4 % (ат.) Nd дана в работе
f3]. Диаграмма состояния приведена по работе [М] (рис. 303). Монотекто-
идная точка реакции Ж, - (pTi) + Ж2 лежит при концентрации 13 % (ат.)
Nd; перитектоидная точка реакции (PTi) + (PNd) » (ocTi) лежит при 0,4 %
(ат.) Nd. Эвтектическое равновесие Ж » (PTi) + (PNd) существует при
температуре 960 "С [III] и концентрации 95 % (ат.) Nd.
606
Nd-Ti, Nd-Tl
0
t°c
1800
1600
1200
WOO
881
800
го чо
1670°
~(*
i
I
1
1
1
N
Ti)
/
NdtV.(no массе)
60 80 WO
i
4
4550'
9B0°
900°
•835°
i
N
\
V
\
\
\
ж
\
\
\to
-1
'/•
8B3°
Jcr/Vd)
о
П
ю го зо
ьо 50 so w
Nd,°/'(am)
во
90 100
Nd
Рис. 303. Nd-Ti
При температуре -835 °С [М] (800 °С [Ш]) и концентрации 99 % (ат.) Nd
(PNd) распадается эвтектоидно на (ocNd) и (ocTi). Растворимость Nd в (Ti)
составляет 0,6 % (ат.) при 600 "С.
С П Алисова
Nd-Tl. НЕОДИМ-ТАЛЛИЙ
Диаграмма состояния Nd-Tl (рис. 304) построена в работе [1]. Сплавы
готовили в индукционной печи в небольших заваренных таллиевых
контейнерах из Nd чистотой 99,99 % (по массе) и Т1 чистотой 99,99 % (по
массе). Исследования проводили методами дифференциального
термического, микроструктурного, рентгеновского и химического
анализов.
Nd-Tt
607
t,'C
1400
1200
/027'
wo
BSJ"
800
600
20
40
no массе)
60
80
WO
200
I
i
Ж
v
С
т?-
\
1045
/
/
795
/ 785°
Ь(р Nd)
4. 685
1 (a/fd)
1
О
-1
К!?
1!
¦А
= —
1
А
1
1
1
1
1
1
1
1
1
1
1
1
1
1
ПВО'
\ ч
\
\
1
—г
й
1045°
95
\
\
\
\
I
J00°
iw»
)-*
-30V
О 10 20 30 40 50 60 70 80 90 100
Nd П,%(ат.) П
Рис. 304. Nd-TI
В системе обнаружено шесть соединений, из которых NdTl3 и NdTl
плавятся конгруэнтно соответственно при 1065 и 1280 "С; остальные
образуются по перитектическим реакциям:
Ж + Nd2Tl «* Nd3Tl при 795 °С;
Ж + Nd5Ti3 = Nd2Tl при 1045 "С;
Ж + NdTl » Nd5Tlj при 1095 "С,
Ж + NdTi - Nd3Tl5 при 1100 ° С
608
Nd-Tl
В системе протекают три эвтектические реакции:
Ж - (PNd) + Nd3Tl при 785 "С и 17,5 % (ат.) Т1;
Ж - Nd3Tl5 + NdTI3 при 1045 °С и 69,5 % (ат.) Т1;
Ж - (TI) + NdTl3 при 300 °С и >99 % (ат.) Т1.
(PNd) при температуре 685 °С и концентрации 10 % (ат.) Т1 подверга-
подвергается эвтектоидному распаду согласно реакции (PNd) « («Nd) + Nd3TI.
Максимальная растворимость Т1 в (pNd) составляет 12 % (ат.) при
785 °С; а в (aNd) при эвтектоидной температуре F85 °С) уменьшается
до 2-3 % (ат.).
Кристаллическая структура образующихся в системе Nd-Tl
соединений приведена в табл. 246 согласно работам [ 1, 2].
Таблица 246 Кристаллическая структура соединений системы Nd-Tl
Соединение
Nd3Tl
Nd2Tl
Nd5Tl3
NdTl
Nd3TI5
NdTl3
Прототип
AuCu3
Ni2ln
W5S.3
CsCl
Pu3Pd5
AuCu3
Символ
Пирсона,
пргр
с /,
РтЪт
hPd,
Pdjlmmt.
(/32,
/4/тст
сР2, ,
РтЪт
осъг,
Стст
сРА,
РтЗт
Параметры решетки, нм
а
0,4922
0,5520
1,246
0,3844
1,021
0,4737
b
_
-
-
-
0,823
-
с
_
0,6818
-
-
1,044
-
Литература
1 Delfino S., Saccone A., Borzone G., Ferro R. // J Less-Common Met 1978 V 59 N 1
P 69-78
2 Гчлдышевским Е.И., Бодак О.И. // Кристаллохимия интерметаллических соединений
редкоземельных металлов Львов Вища школа 1982 255 с
€ И Гладышевский, О И БоОак В К
Nd-Tm
609
Nd-Tm. НЕОДИМ-ТУЛИЙ
Диаграмма состояния Nd-Tm экспериментально не построена [М, 1].
В работе [2] методом рентгеновского анализа исследован сплав Nd с 37 %
(ат.) Тт, приготовленный из исходных компонентов чистотой 99,9 % (по
массе). В его структуре присутствует фаза с гексагональной решеткой
(а = 0,3763 нм, с = 1,232 нм) и фаза со структурой типа aSm. По данным
работы [3] сплав номинального состава Nd0 5Tm0 5 первоначально имел
однофазную структуру типа aSm (появление однофазной структуры типа
oSm обусловлено, по-видимому, значительной потерей Тт в виде пара
при приготовлении сплава). После термической обработки в течение 5 ч
при 450 "Си давлении 4 ГПа структура типа aSm превратилась в
плотноупакованную гексагональную структуру (а = 0,360 нм, с =
1= 1,150 нм). Фаза б имеет структуру типа aSm (символ Пирсона ЛЯЗ, пр.
гр. R Ът), параметры решетки а = 0,350, с = 2,600 нм [3], а = 0,3656, с =
- 2,636 нм [2]. Основываясь на этих фактах и принимая во внимание
Тт,'Л(/го массе)
о ю го зо 40 so so ю to so too
1500
tozr
woo
500
T
ж
1
i
i
13
у
Is
у
-
ж
Й
40
w X
/It 1
M
1
1 1
1
*
I
1
I
1
|
|
I
F
f
У
к
у
(Tm)
0 10 TO JO 40 SO SO 1O 80 90 100
Nil Tm,'/.(am) Tm
Рис.305. Nd-Tm
610 Nd-Tm. Nd-U
идентичность электронных структур компонентов в твердом состоянии
(три валентных коллективизированных электрона, 5dx6s2), близость
параметров решеток плотных гексагональных структур ocNd и Тт (пр.
гр. Рб^/ттс) и атомных радиусов, различающихся всего на 4,3 %, можно
построить предположительную диаграмму состояния системы Nd-Tm
(рис. 305). Диаграмма состояния характеризуется полной растворимос-
растворимостью ocNd и Тт в жидком и твердом состояниях при высоких температу-
температурах. Ввиду большого различия в температурах плавления компонентов
A021 °С для Nd и 1545 °С для Тт) и отсутствия превращения ГПУ »
ОЦК в Тт следует предположить большую схожесть диаграмм состояния
исследуемой системы и системы Nd-Er [1]. Это означает, что диаграмма
состояния Nd-Tm также является диаграммой перитектического типа.
Положение перитектической точки оценили исходя из модели идеальных
растворов для жидкого состояния. Такое приближение предсказывает
переход ГПУ - ОЦК для жидкого Тт при 1655 °С [4]. Координаты
перитектической точки (-1310 °С и 56 % (ат.) Тт) соответствуют
пересечению линий, соединяющих точки плавления и точки полиморфно-
полиморфного перехода (ГПУ » ОЦК) компонентов. Температура образования фазы
5 составляет -735 °С.
Литература
1. Gschneidner, Jr., K.A., Caldenrood F. W. // Handbook on the Physics and Chemistry of Rare
Earths Amsterdam, New York, Oxford, Tokyo. North-Holland Physics Publishing Co., 1986.
Vol. 8. Chap. 54 P. 1-161
2. Spedding F.H., Valletta R.M., Daane A.H.// Trans, ASM 1962 V. 55 P 483-491
3 Jayaraman A., Sherwood R.C., Williams H.J., Corenzwit E. // Phys. Rev 1966 V 148.
P. 502
4. Григорович В.К., Григорович К.В. // Строение и свойства металлических и шлаковых
расплавов Челябинск, октябрь 1990. Т. 2, ч. 2, с. 250-252.
В. К Григорович
Nd-U. НЕОДИМ-УРАН
Диаграмма состояния Nd-U исследовалась неоднократно (Э, 1Щ;
предположительная диаграмма состояния этой системы, представленная
на рис. 306, предложена в работе [1] на основе обобщения литературных
данных. Систему характеризует несмешиваемость в жидком состоянии.
Вырожденная эвтектика Ж » (pNd) + (yU) кристаллизуется при
концентрации -99 % (ат.) Nd и температуре -970 °С. Монотектическая
реакция Ж2 « (yU) + Ж, имеет место при температуре 1100 °С и
концентрации более 99 ат. % U. В системе существуют три эвтектоидных
превращения: (pNd) - (aNd) + (yU), (yU) - (pU) + (aNd) и (pU) - (aU) +
+ (aNd).
Nd-U, Nd-V
611
t,'C
1200
ton*
1000
863
800
U, % (по массе)
0 12 3 4- 38 99 100
600
Ж
J-
/
1
I
rM/fd
t-(CtAHt)
\
?
)
1
1
+жг
\
\
(га
JZZI
V
1135Г
TT6'
668*
0 I I 3 Ц- 31 98 99 WO
Nd !/•/»( am.) U
Рис. 306. Nd-U
Согласно работе |Э], растворимость U в жидком Nd составляет 0,8 %
(ат.) при 1050 °С и 1,08 % (ат.) при 1250 °С; растворимость Nd в жидком
U составляет 0,23 % (ат.) при 1150 °С и 0,31 % (ат.) при 1250 "С.
Литература
1 Parnell D.G., Brett N.H., Haines H.R., Potter P.E. IIJ. Less-Common Met. 1986. V. 118
N 1 P 141-152
Е.И. Гладышевский, О. И. Бодак, B.fC Печарский
Nd-V. НЕОДИМ-ВАНАДИЙ
Растворимость V в жидком Nd составляет около 14 % (ат.) при
температуре -2200 °С. Взаимное влияние V и Nd на их температуры
плавления незначительно. Растворимость Nd в твердом V очень
маленькая [Э]. На рис. 307 представлена рассчитанная в приближении
регулярных и субрегулярных растворов [1] диаграмма состояния системы
Nd-V; монотектоидная реакция имеет место при 1900 °С; при температу-
температурах выше 1900 °С существует широкая область несмешиваемости.
612
Nd-V, Nd-W
¦6,"С
2000
t500
1021'
fOOO
363
V, % (no массе)
tO 20 30 4050 70 tOO
500
J
/
/
[
у
\
1
- (fiHUl
-1
d)
1
19
'Oft
1
00*
I
?(ft
1
Щ
1 11 »4
\\
tfftoA
О tO 20 30 W 50 60 70 80 90 WO
Atd V,c/ofam.) V
Рис. 307. Nd-V
Эвтектическое равновесие Ж « (PNd) + (V) предположительно существует
при 1018 °С, а эвтектоидное равновесие (PNd) «* (aNd) + (V) - при 863 °С
Литература
1 Smith J.F., Lee K.J., Martin D.M. // Calphad, 1988 V 12 N 1 P 89-96
С П Алисова
Nd-W. НЕОДИМ-ВОЛЬФРАМ
Диаграмма состояния Nd-W не построена Растворимость W чистотой
99,9 % (по массе) в жидком Nd приведена ниже [1].
Температура, °С
Растворимость W%(aT)
1670 1826 1888 2027 2142
0,048 0 064 0,118 0,118 0,254
Растворимость W в жидком Nd описывается уравнением
Nd-W, Nd-Y
613
lgxw = - 6,750-10-3/Г+ 0,10,
где xw - атомная доля W в Nd, T- температура, К. При температуре
плавления Nd, равной 1016 "С, она составляет 5,9-10~4 % (ат).
Литература
1 DennisonD.H.,TscheHerM.J.,Gschneidner,Jr.,K.A.//J Less-Common Met 1966 V 11
N6 Р 423-435
КБ Поварова
Nd-Y. НЕОДИМ-ИТТРИЙ
CncTeMaNd-Y изучалась неоднократно \Э, Ш] Обобщенный вариант
диаграммы состояния Nd-Y представлен на рис. 308 согласно [М] и
основан на данных работы [1] Сплавы плавили в дуговой печи из
высокочистых металлов, исследовали методами дифференциального,
термического, металлографического и рентгеновского анализов и
определения точек плавления Высокотемпературные модификации Nd
t.'C
ttoo
1О0О
600
zoo
У, % (no массе)
го fo 60 во too
1021"
863'
(a
Nd)
/
/
f
1
|
630»
T\y
1 \
1 \
a\
01
1
1
ж
?"*-
\
\
\
1
1
1
1
%
fa
1
~Y)
tSZ2"
/478°
О tO ZO 30
SO 60 70 80 90 WO
Y,%fam) Y
Рис. 308. Nd-Y
614 Nd-Y, Nd-Yb
и Y образуют непрерывный ряд твердых растворов (pNd, pY) Низкотем-
Низкотемпературные модификации Nd и Y также образуют непрерывный ряд
твердых растворов (ocNd, ocY), но не во всем температурном интервале.
При температуре 630 °С конгруэнтно образуется фаза б, имеющая
область гомогенности при концентрациях 31-39 % (ат) Y. Максимальная
растворимость Y в (Nd) при 20 °С составляет 27 % (ат.); a Nd в (Y) - 56 %
(ат.) [Ш].
Фаза б имеет ромбоэдрическую структуру типа ccSm, символ Пирсона
hR3, пр. rp. R Ът, параметры решетки а = 0,3657 нм, с - 2,6377 нм для
33 % (ат.) Y; а = 0,3658 нм, с = 2,6376 нм для 42,3 % (ат.) Y [Ш].
Литература
I Beaudry B.J., Michel V., Daane A.H., Spedding F.H. // Rare Earth Research III 1964 New
York Gordon and Breach So Publ, Inc , P 247-260
E И Гладышевский, О И Бодак, В К Печарский
Nd-Yb. НЕОДИМ-ИТТЕРБИЙ
На рис. 309 представлена диаграмма состояния Nd-Yb [I, M]. Сплавы
выплавляли из компактных Yb и Nd в дуговой печи в среде очищенного
Аг, исследовали методами дифференциального термического, микрос-
микроструктурного и рентгеновского анализов. Диаграмма состояния системы
Yb-Nd представляет собой диаграмму монотектического типа, которая
не является характерной для взаимодействия редкоземельных металлов;
взаимная растворимость Nd и Yb достаточно низкая как в твердом, так
и в жидком состояниях.
Установлено четыре инвариантных превращения [1]:
,р) Ж2 при 985 °С A005 °
(PNd) - (aNd) + Ж2 при 840 °С (855 °С [М]);
Ж2 - (aNd) + (pYb) при 810 °С (810 °С [М]);
(PYb) * (aNd) + (aYb) при 665 °С G80 °С [М])
Различия температур инвариантных превращений обусловлены, по-
видимому , различием температур плавления и температур полиморфных
Nd-Yb. Nd-Zn
615
Yb, % (no массе)
tOO
WOO
П00
1Z00
fOZf
WOO
863'
800
600
t,'C
1021'
-1000
-900
86Г
-am
mj
J . I
840"
s to ts
Yb, %lamj
(a.Nd)
t,'C
810
800-
760
I
8W°\
810'
(АГ6)-
78O'
(d-Yb)
i i
С
I
—1
8Я'
79S°
8$ 30 95 /00
Yb,%(am.) \
985°
840°
780C
f/3Yb)
(cLYb)
819°
79f°
о w го зо 40 so во 70 so so too
Nd Yb, % (am.) Y6
Рис. 309. Nd-Yb
превращений Yb, Nd, принятых в этих двух работах: 680,820 °С для Yb,
850, 1000°СдляШ[1]и795, 819°СдляУЬ, 863, 1021 °СдляШ[М].
Литература
1 Свечников В.Н., Кобзенко Г.Ф., Мартынчук Э.Л. // Металлофизика 1975 Вып 59
С 71-76
Е И ГлаОышевский, О И Бодак, В К Печарский
Nd-Zn. НЕОДИМ-ЦИНК
Структура и состав соединений системы Nd-Zn исследовались
многократно [Э, Ш] Диаграмма состояния (рис. 310) представлена
согласно работе [М]
616
Nd-Zn
> (no массе)
40 60
80 tOO
0 10 10 30 40 SO 60 70 80 90 100
NU Zn,V.(am.) Zn
Рис. 310. Nd-Zn
В системе обнаружено восемь соединений. NdZn, NdZn2 и Nd2ZnJ7
плавятся конгруэнтно соответственно при 923, 926 и 981 °С. Четыре
соединения образуются перитектически:
Ж + Nd,3Zn58 - Nd3Zn,, при 870 "С;
Ж + Nd3Zn22 - Nd13Zn58 при 902 "С;
Ж + Ш2гп17»Шзгп22 при 950 °С;
Ж + Nd2Zn17»NdZn11 при 780 "С.
Одно соединение образуется перитектоидно:
NdZn2 + Nd3Zn,, « NdZn3 при 849 "С.
Nd-Zn
6I7
in претерпевает полиморфное превращение при температурах о^
700 до =615 °С в зависимости от состава.
Обнаружены четыре эвтектические реакции:
Ж « (pNd) + NdZn при 630 °С и 23,1 % (ат.) Zn;
Ж « NdZn + NdZn2 при 868 °С и 57,5 % (ат.) Zn;
Ж « NdZn, + Nd3Zn,, при 854 °С и 73,7 % (ат.) Zn
и вырожденная на стороне Zn при 99,9 % (ат.) Zn.
(PNd) эвтектоидно распадается при 622 °С и 10 % (ат.) Zn на (ocNd)
и NdZn.
Максимальная растворимость Zn в (PNd) составляет 11 % (ат.) прц
630 °С; а в (ocNd) -2 % (ат.) при эвтектоидной температуре F22 °С).
Кристаллическая структура Nd-Zn соединений представлена ^
табл. 247 [1.V-C].
Таблица 247. Кристаллическая структура соединений системы Nd-Zn
Соединение
NdZn
NdZn2
NdZn3
NdjZn,,
Nd,3Zn58
Nd3Zn,7
Nd2Znl7
NdZn,,
Прототип
CsCI
KHg2
YZn3
La3Aln
Gd,3Zn58
Ce3Zn22
Th2Zn17
или
Th2Ni17
BaCd,,
Символ
Пирсона,
пр.гр.
cP2,
Pmim
-
Imma
oPib,
Pnma
o/28,
Immm
API 42,
РЬътс
ttlamd
hR\9,
Rim
AP38,
РЬъ1ттс
/4,W
Параметры решетки, нм
a
0,3667
0,4597
0,6717
0,4485
1,453
0,8886
0,9052
0,9024-
0,9038
1,0635
b
0,7408
0,4544
1,3318
_
-
-
_
—
с
0,7555
1,0284
0,8855
1,409
2,1251
1,3236
0,8861-
0,8842
0,6839
618 Nd-Zn. Nd-Zr, Ni -О
Литература
1 Гладышевский Е.И., Бодак О.И. // Кристаллохимия интерметаллических соединений
редкоземельных металлов Львов- Виша школа 1982 255 с
Е И Глабьшевский, О И Бодак, В К Печарский
Nd-Zr. НЕОДИМ-ЦИРКОНИЙ
Диаграмма состояния Nd-Zr не построена. Согласно работе [1]
добавки Nd незначительно повышают температуру а»р превращения
Zr: до 865 °С при растворении 0,5 % (ат.) Nd в (ocZr). Эти данные
получены методами измерения термического расширения и электросоп-
электросопротивления сплавов, приготовленных плавлением в дуговой печи. Исходя
из пределов растворимости Nd в (pZr) и (ocZr) при температуре нонвари-
антного превращения (растворимость Nd в (pZr) составляет -0,89 % (ат.),
а в (otZr) —0,57 % (ат.), приведенных в работе Р]), можно сделать
заключение скорее об эвтектоидном, чем о перитектоидном характере
превращения в богатых Zr сплавах. Данные рентгеновского анализа
показывают, что отношение параметров с/а гексагональной решетки
(ocZr) увеличивается при растворении Nd; растворимость Nd в (aZr) при
800 "С составляет более 0,33 % (ат.) [Ш].
Литература
1 Laniello L., Burr A. // J Appl Phys 1962 V 33, N 9 Р 2689-2690
Л А Третъяченко
Ni-O. НИКЕЛЬ-КИСЛОРОД
Диаграмма состояния Ni-О в интервале концентраций 0-60 % (ат.)
О (рис 311) построена в работе [1] на основании экспериментальных
данных работы [X] и термодинамических расчетов. Состав эвтектической
точки определен путем экстраполяции кривой растворимости кислорода
в жидком Ni и равен =0,9 % (ат.) О при 1440 °С @,87 % (ат.) О при 1438 "С
[X]). Не подтверждено сообщение о разрыве растворимости в жидком
состоянии, так что линия ликвидуса должна плавно продолжаться до
точки плавления NiO B9,42 % (по массе) О) при =2000 °С A957 °С [1] или
1984 °С [X]) В работе [Э] сообщено, что область гомогенности NiO
простирается от NiOj 002 до NiO| 32 Две изобары, изображенные на
Ni-O
619
i,'C
1900
/500
11ПЛ
7
|1
5
Ж
tff_p(Jk>
P@2h-
ff, % (no массе)
tO IS 20
i
ж+р
1W0"
fNil-f-1
3
1
я
-
25
1
57'
NiO
ю
го
зо «о
0, % (am. I
so
Рис. 311. Ni-O
рис. 169, означают, что при низком давлении и повышенных температу-
температурах происходит диссоциация NiO.
Растворимость О в жидком Ni, определенная химическим анализом,
составляет в % (ат.): 5,8 при 1652 "С, 5,4 при 1613 "С; 3,68 при 1590 °С;
2,49 при 1553 °С; 1,51 при 1504 °С; 1,65 при 1494 °С и 1,35 при 1465 °С
[Ш]. Эти данные более предпочтительны, чем данные, приведенные в
работе [X]. Растворимость О в твердом Ni увеличивается с понижением
температуры и равна 0,044 % (ат.) при 1200 °С; 0,051 % (ат.) при 1000 °С;
0,070 % (ат.) при 800 °С и 0,073 % (ат.) при 600 °С [X].
NiO при температурах выше 200 "С имеет кубическую решетку типа
NaCl (символ Пирсона cF8, пр rp. Fm3m),a = 0,4172 нм, а при 18 °С-
ромбоэдрическую, а - 0,29518 нм, а = 60,7° \Э]. Соединения Ni2O3 и Ni2O
имеют кубическую решетку с параметрами а = 0,4186 нм и а = 0,4620 нм
соответственно [Э] В работе Р] сообщено о шпинеле с избытком металла
состава Ni2g032.
Литература
1 Neumann J.P., Zhog Т., Chang Y.A. // Bull Alloy Phase Diagrams 1984 V 5 N 2
P 141-144
В Н Кузнецов
620
Ni-Os. Ni-P
Ni-Os. НИКЕЛЬ-ОСМИЙ
Взаимную растворимость Ni и Os в отожженных при 1200 °С сплавах
и охлажденных с печью изучали методами микроструктурного,
рентгеновского анализов, магнитных исследований и измерения
твердости. Растворимость Os в (Ni) составляет -5 % (ат.), Ni в (Os) -
-38 % (ат.). Параметр решетки (Ni) при растворении Os до 3,47 % (ат.)
возрастает \Ш\; параметр решетки твердого раствора на основе Os при
растворении Ni не меняется [X].
СП. Алисова
Ni-P. НИКЕЛЬ-ФОСФОР
Диаграмма состояния Ni-P, приведенная в работе [X], в области
концентраций 0-36 % (ат.) Р построена по данным термического и
микроскопического анализов. В этой части системы обнаружено три
соединения: Ni3P, Ni5P2, претерпевающее полиморфное превращение,
и Ni2P. Предполагается, что высокотемпературная модификация Ni5P2
(ВТ) имеет некоторую область гомогенности, распространяющуюся в
сторону Р. В других исследованиях, сведения о которых также приведены
в работе [X], сообщается о наличии соединений Ni6P5, NiP, NiP2, NiP3,
t«c
woo
/300
/200
two
/000
goo
800
700
10
P, a/o (no массе)
го зо
SO 60
\
\
\
\
\ w
Л
/9
-1/
&
A
4
-
1
75'
h
1110'
j\
i\
Г
i
1
с
""У )
!
Г""
1
1
7ZZ.
i
f
1
1
О
Mi
10
20
30 10 50
P,"U(am.)
60
70 80
Рис. 312. Ni-P
Ni-P
621
Ni4P, Ni3P2> Ni2P3, NiP4 и предположено с большой степенью вероятнос-
вероятности, что фаза Ni5P2 в действительности имеет формулу Ni7P3. Возможно,
что Ni5P2 и Ni7P3 - это граничные составы области гомогенности одной
фазы, так как рентгенограммы, снятые с порошков этих соединений,
близки. Высказано сомнение относительно полиморфизмаNi5P2. В более
поздних работах [Э, Ш] приведены соединения Nil2P5 и NiP_08. Фаза
NiP_0 g согласно работе [Ш] эквивалентна Ni6P5. Обобщенная диаграмма
состояния NiP представлена в справочнике [М] и приведена на рис. 312.
Согласно этой диаграмме соединение Ni JР5 образуется по перитектичес-
кой реакции
Ж + №5Р2(ВТ)-№12Р5 при -1150 -С.
Способ образования соединений NiP, NiP2, NiP3, существующих в
системе согласно работе [X], не установлен. Соединение Ni5P4 (или -Ni6P5
[К], вероятно, образуется по перитектической реакции Ж + NiP « Ni5P4
при -850 °С. На диаграмму нанесено соединениеNi_, 22 P, образующееся
перитектоидно при температуре 825 °С и распадающееся эвтектоидно
при -770 "С. Предложено существование эвтектики Ж « Ni2P + Ni5P4 при
-830 "С. Кристаллическая структура соединений приведена в табл. 248
[Х,Э,Ш].
Таблица 248 Кристаллическая структура соединений системы Ni-P
Соединение
NijP
Ni2P
N>12P5
N.5P2
NiP
NiP2'
NiP3"
Прототип
Ni3P
Fe2P
Ni,2P5
Ni5As2
NiP
PdP2
-
*J3= 126,22"
Кубическая сингония.
Символ
Пирсона,
пр.гр
1/32,
/4
hP9,
P62m
(/34,
Mm
Л?42,
Р6гст
оР16,
Pbca
тСП,
CVc
Параметры решетки, им
а
0,8934
0,8954
0,5862
0,5859
0,8646
1,3220
0,605
0,63659
0,7819
6
-
-
-
-
0,488
0,56152
-
с
0,4398
0,4386
0,3372
0,3382
0,5070
2,4632
0,689
0,60715
-
Источник
IX]
[Ш]
[X]
[Э]
Р]
[Ш]
[Ш]
[Э]
[Э]
622
Nt-P, Ni-Pb
В работе [Э] отмечается, что соединение Ni2P имеет значительную
область гомогенности и его элементарная ячейка сжимается с увеличени-
увеличением содержания Р. Различный тип решетки для соединений Nii2P5 и Ni5P2
свидетельствует о том, что предположение о их принадлежности к одной
фазе с областью гомогенности, включающей оба состава, несостоятельно.
Имеется, однако, предположение, что Ni12P5 и Ni7P3 относятся к одной
фазе.
Л.Л. Рохлин
Ni-Pb. НИКЕЛЬ-СВИНЕЦ
Диаграмма состояния Ni-Pb характеризуется отсутствием промежу-
промежуточных фаз и наличием области несмешиваемости в жидком состоянии
РЬ, % (по массе)
О 20 W5D ВО 70 10
то t превращение ,
361 t——i г 1
zoo
О 10 10 30 40 SO SO ?0 tO SO 100
Ni Pb,Vo(am) Pb
Рис. 313. Ni-Pb
Ni-Pb, Ni-Pd 623
1340
50
1250
30
1200
25
1000
13
800
8,2
600
2,1
400
0,7
324
0,46
[X, Э, 1, 2]. Диаграмма состояния представлена на рис. 313 согласно [2].
Авторы работы [2] провели тщательное исследование границ области
несмешиваемости и растворимости Ni в РЬ при 450 "Си более высоких
температурах. Полученные данные находятся в хорошем соответствии
с данными работы [3]. При монотектической температуре A340 "С [X,
Э]) область несмешиваемости распространяется от 13,8 % (ат.) РЬ [2]
(-12,7 % (ат.) [X] или 11,5 % (ат.) [3]) до 50 % (ат.) РЬ [2] E0,3 % (ат.) |Э],
79 % (ат.) [X] или 57 % (ат.) [3]). Критическая точка имеет координаты:
1415 °С [2] (или -1550 "С [Э]) и -25 % (ат.) РЬ [Э, 1]. Растворимость РЬ
в твердом Ni при температуре 1340 °С составляет -1,2 % (ат.) по данным
работ [X, Э]. Растворимость Ni в жидком РЬ по данным работы [2]
приведена ниже:
Температура, "С
Растворимость Ni, % (ат.)
Данные о растворимости Ni в жидком РЬ по данным работ [X]
приведены ниже:
Температура, °С . ... 727 635 540 500 450 370
Растворимость Ni, % (ат.) . 4,85 2,94 1,62 1,35 0,92 0,53
Температура инвариантного превращения на стороне РЬ, равная
324 °С [2, Э], указывает на то, что оно эвтектическое. Содержание Ni в
эвтектике согласно [X] равно 0,38 % (ат.) или 0,46 % (ат.) [Э]. Однако в
некоторых ранних работах температура этого превращения указана
более высокой C29 °С), чем температура плавления РЬ C27 °С), что дает
основание считать это превращение перитектическим [X]. Растворимость
Ni в твердом РЬ определена равной 0,68 % (ат.) при 327 °С и 0,08 % (ат.)
при комнатной температуре (X]. Зависимость растворимости Ni в
твердом РЬ от температуры показана на вставке (см. рис. 313).
Литература
1 Miller K.O., Elliott J.F. // Trans AIME. 1960 V. 218 N5 900-910.
2 Рыбалкин Е.М., Бурылев Б.П. // Термодинамические свойства расплавов
Новокузнецк 1969 С 225-232
3 Nash P.//Bull Alloy Phase Diagrams 1987 V 8. N 3 P. 264-266, 301-302
Л.Л Рохлин
Ni-Pd. НИКЕЛЬ-ПАЛЛАДИЙ
Диаграмма состояния Ni-Pd рассмотрена в справочниках [X, Э, Ш].
На рис. 314 представлена диаграмма состояния по данным работы [1],
624
Ni-Pd, Ni-Po
Pd, o/o(no массе)
anO Ю 2030 W SO SO 70 60 SO WO
i.'C
two
1200
woo
200
-200
1
I
о
1
1
In
ж
'237
i,Pd
tee
i
)
¦——_
1
^-
,
———
It
rsssc
О ТО 20 JO *0 50 60 70 80 90 WO
Ni Pd,e/o(am.) Pel
Рис. 314. Ni-Pd
построенная на основе обобщения литературных данных по фазовым
равновесиям в системе. Ni и Pd образуют непрерывный ряд твердых
растворов. Координаты точки минимума по данным работ [X] и [1]
хорошо согласуются: 45 % (ат.) Pd, 1237 "С Щ, 45,4 % (ат.) Pd, 1237 °С
Литература
1 Nash A., Nash P.//Bull Alloy Phase Diagrams. 1984 V. 5 N 5 P 446-450
Г К Алексеенко
Ni-Po. НИКЕЛЬ-ПОЛОНИЙ
В системы Ni-Po установлено образование твердых растворов между
соединениями NiPo и NiPo2 с постепенным переходом гексагональной
кристаллической решетки от типа NiAs до типа Cd(OHJ- Параметры
кристаллической решетки при этом изменяются от а - 0,395 нм, с =
= 0,568 нм до а = 0,398 нм, с = 0,571 нм [Э].
Л Л Рохлин
Ni-Pr
625
Ni-Pr. НИКЕЛЬ-ПРАЗЕОДИМ
Диаграмма состояния Ni-Pr (рис. 315) построена в работе [1] по
результатам термического и рентгеноструктурного анализов. Авторы
использовали Рг чистотой 98-99 % (по массе). В системе обнаружено
шесть соединений, три из которых - Ni5Pr, NiPr и NiPr3, плавятся
конгруэнтно соответственно при 1365, 730 и 530 "С Остальные
образуются в результате перитектических реакций:
Ж + Ni5Pr и. Ni7Pr2 при 1100 °С;
" №3Ргпри970°С;
"U Ni2Pr при 880 "С.
Ж + Ni7Pr2
ж + :
В системе существует четыре эвтектических равновесия:
Ж -н. (NO
Ж NiP
- (Ni) + Ni5Pr при 1270 °С и 10 % (ат.) Рг;
Ж ~ Ni2Pr + NiPr при 705 "С и 47 % (ат.) Рг;
Рг, % (по массе)
О 10 *О 60 80
400
о to to зо ьо so ее 70 во so too
Ni Pr,V.(am) Pr
Рис. 315. Ni-Pr
626
Ni-Pr
Ж * NiPr + NiPrj при 500 °C и 70 % (ат.) Рг;
Ж - (aPr) + NiPr3 при 480 °C и 85 % (ат.) Рг.
Взаимная растворимость компонентов в твердом состоянии практически
отсутствует.
Кристаллохимические характеристики соединений системы Ni-Pr
собраны в табл. 249 по данным работ [2, V-C]. В таблицу включено также
соединение Ni3Pr7, не обнаруженное при исследовании диаграммы
состояния. Соединение Ni7Pr2 возможно имеет полиморфное превраще-
превращение.
Таблица 249 Кристаллическая структура соединений системы Ni-Pr
Соединение
NiPr3
N.3Pr7
NiPr
Ni2Pr
N!3Pr
N,7P.2
Ni5Pr
Прототип
CFe3
Fe3Th7
CrB
Cu2Mg
Ni3Pu
N<7Ce2
Co7Er2
Cu5Cd
Символ
Пирсона,
пргр
oP\6,
Pnma
hP20,
РЬътс
oCS,
Cmcm
c/=24,
Fdlm
R3m
hP36,
Pbylmmc
ЛЯ18,
Rim
hP6,
Pdlmmm
Параметры решетки (им)
a
0,707
0,9904
0,3816
0,7285
0,503
0,5015
0,5015
0,4964
Ь
0,996
1,0503
-
-
-
-
-
с
0,649
0,6322
0,4354
-
2,501
2,444
3,664
0,3975
Литература
1 Гшиейднер К.А. // Сплавы редкоземельных металлов Пер с англ / Под ред
ЕМ Савицкого М Мир, 1965 427с
2 Гладышевский Е.И., Бодак О.И. // Кристаллохимия иитерметаллических соединений
редкоземельных металлов Львов Виша школа, 1982 255 с
k И ГчаОышексши, О И Бодак, В К Печарсмш
Nt-Pi, N\-Pu
627
Ni-Pt. НИКЕЛЬ-ПЛАТИНА
Диаграмма состояния Ni-Pt, представленная на рис. 316, построена
по данным термического, микроструктурного и рентгеновского
анализов [X]. При высоких температурах Ni и Pt образуют непрерывный
cr
16OO
two
ггоо
воо
soo
wo
zoo
9 го
i
> 46
i
^6f
Mae»
пребр
7
ащень
i
1
60 '
1
ж
о
i
li
% (no массе/
во
г.
1
i
\'
1
1
\
90
i
\
\
/!
О 10 ZO 3O 10 SO 60 70 SO SO ГОО
Ш Pt,°/o(am) Pt
Рис. 316. Ni-Pt
ряд твердых растворов. Установлено наличие двух соединений Ni3Pt и
NiPt, образующихся конгруэнтно из твердого раствора (Ni, Pt) при -580
и -645 "С соответственно.
Фаза Ni3Pt имеет структуру типа Си3А1, фаза NiPt - решетку
тетрагональной сингонии типа CuAu (символ Пирсона tPA, пр.гр. -
Р41ттт) с параметрами а = 3823 нм, с = 0,3589 нм, с/а = 0,939 для сплава
стехиометрического состава
Г К Алексеенко
Ni-Pu. НИКЕЛЬ-ПЛУТОНИЙ
Диаграмма состояния Ni-Pu приведена в справочниках [X, Э]. В
работе [1] проведен расчет кривых солидуса и ликвидуса для (еРи)
.Диаграмма состояния Ni-Pu, показанная на рис 317, построена в работе
628
Ni-Pu
t,"C
1*00
1200
1000
600
Hi, % (no массе)
10 20 30 tO 50 60 TO B090100
¦ptt)
A
U-QPu)
F*-(PPu)
\*~(aPu)
1
ж
465"
i ms°
110°
m°
1ZS'
<
/
»5
i
i
75
IP
I
Z60
a
{
i
:
•я
92 A
ss,z\
200
0 10 20 30 40 50 60 10 80 90 Ю0
Pu Ni,%(am.) Ni
Рис. 317. Ni-Pu
[2] на основании обобщения литературных данных по фазовым
равновесиям системы. В системе обнаружено шесть соединений, пять из
которых (PuNi, PuNi2, PuNi3, PuNi4, Pu2Ni17) образуются по перигекти-
ческим реакциям при температурах 800, 1210, 1230, 1260 и 1235 °С
соответственно, соединение PuNi5 плавится конгруэнтно при 1300 "С.
Максимальная растворимость Ри в (Ni) составляет 1,8 % (ат.) при
температуре 1210 "С; максимальная растворимость Ni в (еРи) при 465 °С
равна 4,3 % (ат.). Сведения о кристаллической структуре соединений
приведены в табл. 250 [2].
Таблица 250 Кристаллическая структура соединений системы Ni-Pu
Соединение
PuNi
Прототип
СгВ
Символ
Пирсона,
пр.гр.
оС8,
Стст
Параметры решетки, нм
и
0,363
ъ
1,024
с
0,420
Nt-Pu. Ni-Re
629
Соединение
PuNi2
PuNi/
PuNi4"
PuNi5
Pu2Ni17
Прототип
MgCu2
NbBe3
Ni4Pu4
CaCu5
Th2Ni17
Символ
Пирсона,
пр.гр
cF24,
Fdlm
hR\2,
«3m
жСЗО,
CVm
hPb,
РЫттт
hPlZ,
РЬъ1ттс
*a= 33,73°.
"p= 100°
** Для сплавов, богатых Pu.
****Для сплавов, богатых Ni.
Параметры решетки
a
0,7141
0,8615
0,487
0,4872"*
0,486""
0,829
Ь
-
-
0,846
-
-
, нм
с
-
-
0,1027
0,398"*
0,3982""
0,801
Литература
1. Womiakova В., Kuchar L. // Sb Ved. Pr Vys Sc. Ban Ost. / Rada Hutn. 1978. V. 24. N 2.
P. 67-80.
2. Peterson D.E. // Bull. Alloy Phase Diagrams 1988. V. 9. N 4. P. 483-486, 537-538.
Г К. Алексеенко
Ni-Re. НИКЕЛЬ-РЕНИЙ
Диаграмма состояния Ni-Re построена в работе [1] и представлена
на рис. 318. Сплавы системы выплавляли в дуговой вакуумной печи с
многократным переплавом. Для сплавов с содержанием Re < 70 % (по
массе) использовали Ni и лигатуру с 50 % (по массе) Re. Сплавы, богатые
Re, перед плавкой брикетировали из порошков и спекали при 1400 "С.
Чистота исходных металлов 99,98 % (по массе). Исследование выполнено
[1] методами определения температуры плавления, микроструктурного
и рентгеновского анализа, измерением твердости, микротвердости и
некоторых свойств сплавов литых и отожженных при 1200,1000 и 800 °С
с выдержкой 100, 500 и 750 ч соответственно. Перед отжигами сплавы
деформировали методом ковки без предварительного нагрева.
630
Ni-Re
Re.7. (am.)
26 W SO 80100
trc
3000
2600
zzoo
1800
1*00
1000
600
I
Рис. 318. Ni-Re
>
(M)
4
/
/
и
/
MO.
*
П5
1
•
7 10 10 30 4-0 50 SO 10 90 3
Hi /te,% (no массе)
1
f
'Re)
Диаграмма состояния Ni-Re относится к перитектическому типу.
Соединений не обнаружено. Перитектическая реакция протекает при
температуре 1620 °С (см. рис. 318).
Область твердых растворов Re в Ni простирается до 17,4 % (ат.) Re
(или 40 % (по массе) Re) при температуре, близкой к перитектической
реакции, и сужается с понижением температуры до 12,2 % (ат.) при
800 "С. Параметр решетки (Ni) увеличивается от а = 0,3524 нм для Ni до
а = 0,3576 нм для сплава с 14,12 % (ат.) Re. Максимальная растворимость
Ni в (Re) составляет -14,3 % (ат.) и почти не меняется с температурой.
Параметры решетки (PRe) изменяются ота = 0,2761 нм,с = 0,4456 нм для
Re до а - 0,2758 нм, с - 0,4451 нм для сплава с 90,47 % (ат.) Re. Двухфаз-
Двухфазная область представляет собой смесь двух твердых растворов (aNi) +
+
Диаграмма состояния, приведенная в работе [2], полностью соотве-
соответствует построенной [1, 3, 4].
Литература
1. Савицкий Е.М., Тылкмиа М.А., АрскаяЕ.П.//Изв Вузов. Цветная металлургия. 1970
N 4. С. 113-116.
2. Nash A., Nash P.//Bull Alloy Phase Diagrams. 1985. V 6 N 4. P. 348-350.
3. Савицкий Е.М., Тылкина М.А., Арская Е.П. // Сплавы цветных металлов: Сб статей
М : Наука 1972. С. 220-229
Ni-Re, Ni-Rh
631
4. Савицкий Е.М., Тылкииа M.A., Левин A.M. Сплавы рения в электронике. М.: Энергия,
1980.216 с.
М А. Тылкина
Ni-Rh. НИКЕЛЬ-РОДИЙ
Взаимодействие Ni с Rh характеризуется образованием непрерыв-
непрерывного ряда твердых растворов [Ш]. В работе [1] исследовали диаграмму
плавкости, а в работе [2] рассчитали кривую начала расслоения
непрерывного ряда твердых растворов. На рис. 319 представлена
t°c
WOO
ff'OO
rooo
600
zoo
-200
tO ZO 30
/fh, % (no массе)
SO 60 70 80
SO /OO
1
№5
1 i
о
fc=
.--
1
=
I
I
m
Ш,
1
Rh)
i
- —
r—'
.
О tO ZO 30 <Ю 50 60 70 во 90 fOD
Ni Rh,"/<,(a/Tr.) Rh
Рис. 319. Ni-Rh
диаграмма состояния системы Ni-Rh по данным работы [3], построенная
на основе обобщения литературных данных по фазовым равновесиям
в системе. Положение бинодальной кривой расслоения твердого раствора
точно не установлено.
Литература
1. Корнилов И.И.,МясниковаК.П. //Изв. АН СССР. Металлы 1965. N 2 С 175-179.
2 Pratt J.N. // Proj Meet. Calphad VII. Stuttgart. 1978. Altendorf. P. 88-95.
3 Nash A., Nash P. // Bull Alloy Phase Diagrams. 1984. V. 5. N 4. P. 403-405
Г К Алексеенко
632
Ni-Ru
Ni-Ru. НИКЕЛЬ-РУТЕНИЙ
Диаграмма состояния Ni-Ru принадлежит к перитектическому типу
со значительной взаимной растворимостью компонентов и представ-
представлена на рис. 320 по данным работы [1], в которой обобщены немногочис-
немногочисленные, но достаточные для установления почти всех особенностей
строения, литературные данные [2, 3].
Промежуточных фаз в системе не образуется. Перитектическая
реакция Ж + (Ru) *» (Ni) протекает при температуре 1550 "С; составы фаз
- 27 % (ат.) Ru (Ж), 50 % (ат.) Ru (твердый раствор на основе (Ru)) и
34,5 % (ат.) Ru (твердый раствор на основе (Ni)) получены в работе [1]
экстраполяцией фазовых границ и несколько отличаются от составов,
приведенных в работах [2, 3]. По данным работы [2] солидус (Ru) имеет
ретроградный характер (максимум растворимости, равный 53 % (ат.) Ru,
соответствует температуре около 1600 °С), в работе [3] эти данные не
подтверждены. Значения растворимости при температурах ниже солидуса
хорошо согласуются между собой.
Ки,'А(по массе)
О 1020304090 tO 70 80 90 100
гооо
$00
a w го зо ?>50 во п во so то
Ni /fa, % (am) К и
Рнс. 320. Ni-Ru
Ni-Ru, NiS 633
Параметры решеток твердых растворов практически линейно
зависят от состава: для (Ni) а = 0,3624 при 30 % (ат.) Ru [1], для (Ru) a =
- 0,2660 нм, с = 0,4241 нм при 76 % (ат.) Ru [3]. В работе [4] показано, что
при сверхбыстрой закалке со скоростью -10 К/с расплава, содержащего
30-40 % (ат.) Ru, образуется метастабильная фаза с тетрагональной
решеткой (а = 0,45106 нм, с = 0,36202 нм). Состав и структура фазы
неизвестны.
Литература
1 Nash P.//Bull Alloy Phase Diagrams. 1986 V 7 N2 P 130-133
2 RaubE., MenzelD.//Z Metallkunde 1961 В 52 N 12 S 831-833
3 Корнилов И.И., Мясннкова К.П. // Изв АН СССР Металлургия и горное дело 1964
N4 С 159-165
4 Варич Н.К., Петруиииа А.Н.//Изв АН СССР Металлы 1979 N2 С 112-114
В Н Кузнецов
Ni-S. НИКЕЛЬ-СЕРА
Диаграмма состояния Ni-S приведена на рис. 321 по данным работ
РС,Э,Ш, 1-3].
В системе существует пять сульфидов: Ni3S2, Ni7S6, NiS, Ni3S4 и NiS2,
из которых три - Ni3S2, Ni7S6 и NiS имеют полиморфные превращения.
Высокотемпературная модификация pNi3S2 образуется по перитекти-
ческой реакции: Ж + (pNiS) -* (pNi3S2) при 805 °С и переходит в
низкотемпературную (aNi3S2) при 550 °С.
Высокотемпературная модификация (pNiySg) образуется по перитекто-
идной реакции: (pNi3S2) + (PNiS) -* (pNi7S6) при 573 °С, превращаясь в
низкотемпературную (aNi7S6) при 399 °С.
Сульфид NiS обладает областью гомогенности -4 % (ат.). Его
Высокотемпературная модификация (PNiS) плавится конгруэнтно при
992 °С и претерпевает полиморфное превращение в интервале температур
379-280 °С в зависимости от состава, в частности, эвтектоидный распад
с образованием низкотемпературной модификации (aNiS) и соединения
Ni3S4 зафиксирован при 280 °С.
Соединение NiS2 плавится конгруэнтно при 1010 °С и образует с
соединением (PNiS) эвтектику при 982 "С и 54,8 % (ат.) S.
Соединение Ni3S4 кристаллизуется по перитектоидной реакции
(PNiS) + NiS2<- Ni3S4 при 303 °С.
При температурах выше монотектики (998 °С) в сплавах, богатых S,
сосуществуют две жидкости. Эвтектическое превращение Ж ~ (Ni) +
+ (PNi3S2) протекает при 637 "С и 33,4 % (ат) S.
634
Nt-S
t,"C
fitOO
noo
woo
goo
600
«oo
200
10
S, % I no массе)
20 30 ^0 50 SO 70 80 90 100
\
s.
1
\
Г7'
no'
i)
i
\
V
\
S2S'
Л9*
$
в
i
Л
S9i
/
i
¦I
1 &Ы
^"
VJ
1
JOi
г»
i
ЯР
i
Г* 1
is)-*
Mi
US'
20 30 W SO 60 TO BO SO /00
S,'/o(am) S
Рис. 321. Ni-S
Кристаллическая структура соединений представлена в табл. 251.
Таблица 251 Кристаллическая структура соединений системы Ni-S
Соедине-
Соединение
PNi3S2'2>
Прототип
_
Символ
Пирсона,
пр.гр.
—
Параметры решетки, нм
а
0,5746
с
0,7134
Источник
[Ш]
[Ш]
Ni-S, Ni-Sb
635
Соедине-
Соединение
ttNi7S6-!>
PNiTS,'«
ttNiS*'>
PNiS
N,3S4
NiS2
Прототип
-
-
-
NiAs
Co,S8
FeS2
Символ
Пирсона,
пр.гр.
-
-
-
hP4,
Pb^lmmc
fF68,
Fmim
сРП,
РЛ
Параметры решетки, нм
а
-
-
0,9616
0,3439-0,3424
0,34392
0,3438-0,3426
0,948
0,5676-0,5678
0,56893-0,56890
с
-
-
0,3152
0,5347-0,5326
0,53484
0,5348-0,5316
-
-
Источник
[Ш]
[Ш]
[Ш]
[X]
Р]
[Ш]
[Ш]
[X]
[Э]
''Ромбоэдрическая сингония, указаны параметры решетки гексагональной
ячейки.
'^Тетрагональная сингония
*3'Ромбическая сингония.
* 4'Моноклинная или триклинная сингония.
Литература
1 Соколова М.А. // Журнал неорганической химии 1956. Т. 1. N 6 С. 1440-1454.
2 Соколова М.А. //Доклады АН СССР. 1956. Т. 107. С. 286-289.
3 Kullerud С, Yund R.A. // J Petrology. 1962. V. 3 Р 126-175.
Н.И. Никитина
Ni-Sb. НИКЕЛЬ-СУРЬМА
Диаграмма состояния Ni-Sb (рис. 322) построена на основании
Проведенного обобщения данных, опубликованных в справочнике [X],
И результатов экспериментальных исследований последних лет [1-3].
Диаграмма состояния Ni-Sb представляет собой систему со сложными
фазовыми равновесиями в твердом состоянии. В системе Ni-Sb
обнаружено шесть промежуточных фаз, из которых pNijSb и NiSb
Плавятся конгруэнтно при температурах 1162 и 1153 "С соответственно.
Соединение pNi3Sb существует в ограниченном температурном
Интервале и при температуре - 530 "С эвтектоидно распадается на aNi3Sb
636
Ni-Sb
St, У. fire пассе)
Of I0I510Z630J3 MM
0*5/2 16 ZO
Ml St. % (am )
too
200
0 /0 20 JO 4-0 SO SO JO 80 SO 100
Mi Sb, */• (am) St
Рис. 322. Ni-Sb
и Ni5Sb2 При температуре 900 °C область гомогенности соединения
pNijSb максимальна и простирается от 26 до 29 % (ат.) Sb. Соединение
NiSb обладает широкой областью гомогенности, простирающейся от 47,2
flo54,l%(aT.)Sb.
Фаза типа марказита NiSb2 + x или Ni( _ vSb2 образуется непосре-
непосредственно из расплава по перитектической реакции Ж + NiSb ** NiSb, + Л
при 625 °С.
Соединения ocNi3Sb, Ni5Sb2 образуются в твердом состоянии по
перитектоидным реакциям при температурах 685 и -570 °С соответствен-
соответственно Сверхструктурная <J)a3aNi15Sb образуется в результате упорядочения
Nt-Sb, Ni-Sc
637
твердого раствора на основе Ni при температуре -460 "С. Кристалличес-
Кристаллическая структура промежуточных фаз в системе Ni-Sb приведена в табл. 252.
Таблица 252 Кристаллическая структура соединений системы Ni-Sb
Соедине-
Соединение
Ni^Sb*)
ccNijSb
№sSb2">
NiSb
NiSb2+4
Прото-
Прототип
-
CujTi
-
NiAs
FeS2
Символ
Пирсона,
пргр
-
<>Р%,
Рттп
-
Л/Ч,
РЬ/ттс
оРЬ,
Рппт
Параметры решетки, нм
а
0,7076-0,7135
0,5317
1,14566
0,39325
0,5180
''Кубическая сингония
* 'Моноклинная сингония, р = 90,486°
Ъ
-
0,4227
0,5432
-
0,6314
с
-
0,4519
0,6134
0,51351
0,3838
Источник
[X]
[3]
[1]
[2]
[X]
В системе Ni-Sb наблюдаются три эвтектических равновесия-
Ж •* (Ni) + pNi3Sb при 1100 "С и 21,5 % (ат.) Sb,
Ж - pNi3Sb + NiSb при 1070 °С и 37 % (ат.) Sb,
Ж и. NiSb2 + х + (Sb) при 616 °С и 97 % (ат.) Sb.
Растворимость Sb в (Ni) при эвтектической температуре составляет
8,4 % (ат) и практически не изменяется с понижением температуры.
Литература
1 HeinrichS., Rexet H.U., Schubert К.// J Less-Common Met 1978 V 60 N 1 P 65-74
2 Chen Tu., Miklcelsen J.C., Charlan G.B. // J Cryst Growth 1978 V 43 N 1 P 5-12
3 Bakkouri M., Dirand M. // J Less-Common Met 1986 V 124 N 1 P 1-10
НИ Никитина
Ni-Sc. НИКЕЛЬ-СКАНДИЙ
Обобщенная диаграмма состояния Ni-Sc представлена на рис 323 по
данным работ [1, 2] Исследование проводилось методами дифференци-
638
Ni-Sc
Sc, % (па массе)
О 10 20 30 М SO 60 70 00 90 /00
— 1337°
t,°c
1400
1200
1000
600
600
400
200
О ГО 20 30 40 SO 60 70 60 90 100
Ni Sc,%{a/n.) Sc
Рис. 323. Ni-Sc
\
riiW
<il
К
Nj
' 1
290' 1310
^?
j
i
' >,
39,8
7
270°
>
1
/Я
1
f
, 1OO0"
63 -
г*
/
I—
f
•
ального термического, рентгеновского, микроструктурного, иикрорен-
тгеноспектрального анализов и измерения твердости.
В системе установлено образование пяти промежуточных фаз, из
которых Ni7Sc2, Ni2Sc, NiSc и NiSc2 плавятся конгруэнтно при 1290,1310,
1270 и 1000 °С соответственно. Соединение Ni5Sc образуется по
перитектической реакции при температуре 1180 °С [1] A170 °С [2])
Область гомогенности соединения Ni2Sc простирается от 31 до 35 % (ат)
Sc при 800 "С. Соединение NiSc не имеет области гомогенности и его
ордината расположена при 53 % (ат.) Sc, т е сдвинута от стехиометричес-
кого соотношения 1:1 в сторону Sc. Соединение NiSc2 зафиксировано при
70,5 % (ат) Sc [2]. В системе наблюдаются пять эвтектических взаимодей-
взаимодействий (табл. 253).
Растворимость Ni в твердом Sc практически отсутствует [2]
Растворимость Sc в (Ni) составляет -0,7 % (ат.) при 1130 °С, 0,4 % (ат)
при 1000 "С, < 0,1 % (ат.) при 800 "С [1].
Кристаллические структуры соединений приведены в табл. 254
Ni-Sc
639
Таблица 253 Эвтектические реакции в системе Ni—Sc
Реакция
Ж~(М1) + М155с
Ж-М175с2 + >1125с
Ж-К123с + К15с
Ж-М.Бс + М^
Ж - NiSc2 + (aSc)
Содержание Sc в жидкой
фазе, % (ат)
13,0
12,5
25
25
39,8
-63
-78
Температура,
-с
1140
ИЗО
1270
1260
1110
1120
860
-870
Источник
[2]
[1]
[1]
[2]
[2]
[1]
[2]
[2]
Таблица 254 Кристаллическая структура соединений системы Ni-Sc
Соединение
Ni5Sc
Ni7Sc2
Ni2Sc
NiSc
NiSc2
Прототип
CaCu5
Ce2Ni7
Ti2Ni
CsCl
MgCu2
Символ
Пирсона,
пргр
hP6,
P&lmmm
ИР36,
Pb^lmmc
cF96,
Fdlm
cPl,
РтЪт
cF24,
Fdlm
Параметры решетки, нм
a
4,74
4,690 C)
4,74
4,761 C)
0,6926
0,6866-0,6938
0,6870-0,6920
0,315
0,3171
1,229
1,2120A)
с
3,76
3,887 E)
22,56
22,395E)
—
-
-
Источник
[3]
[4]
[3]
[4]
Р]
[2]
[1]
[Ш]
[Ш]
[Ш]
[Ш]
Литература
1 Масленков СБ., Браславская Г.С.//Изв АН СССР Металлы 1984 N1 С 203-206
2 Маркнв В.Я., Гавриленко И.С., Петьков В.В., Белявина Н.Н. // Металлофизика 1978
№7 С 39-45
3 GocbelJ.A., Rosen S.//J Less-Common Met 1982 V 85 N 2 P 285-306
4 Браслааская Г.С, Масленков СБ. // Изв АН СССР Металлы 1987 N 1 С 112-118
В П Полякова
640
Ni-Se
Ni-Se. НИКЕЛЬ-СЕЛЕН
Диаграмма состояния Ni-Se представлена на рис. 324 по данным
работы [1]. Сплавы синтезировали в вакуумированных эвакуированных
кварцевых ампулах и исследовали методами термического и рентгенов-
рентгеновского анализов. Для приготовления сплавов использовали электролити-
электролитический Ni с содержанием примесей < 0,3 % (по массе) и карбонильный
Se высокой чистоты с содержанием примесей < 0,01 % (по массе).
Со стороны Ni образуется эвтектика при 750 °С и 34 % (ат.) Se.
В системе обнаружено пять соединений: Ni3Se2, Ni6Se5, Ni2iSe2o5 NiSe
и NiSe2.
Соединение Ni3Se2 образуется по перитектической реакции при
800 "С, Ni6Se5 и Ni2|Se20 образуются по перитектоидным реакциям
соответственно при температурах 670 и 375 °С, Ni6Se5 существует в
интервале температур 400-670 "С.
Соединения Ni3Se2 и NiSe образуются в нескольких модификациях.
Область гомогенности соединения NiSe, плавящегося конгруэнтно при
980 °С, составляет 50,5-56,5 % (ат.) Se (Э].
Кристаллические структуры соединений системы Ni-Se приведены
в табл. 255.
Se, °/o (no массе)
0 10 20 30 40 SO 60 70 80 90
too
tzoo
800
too
0 10
Ni
Рис. 324. Ni-Se
1Ч5&
чч
1
\
>
f
\
i
к /
\s
6Z0°iii15et(eTf
i
'вое'
670"
\
VS"^
1
980'
^^
•v|
^1
Л
1
1
t *
I
est
1°
(Sej
6SS"
JOT.
—*
20 30 W SO 60 70 вО SO WO
$e,'/o(am.) Se
Nt-Se, Ni-Si
641
Таблица 255 Кристаллическая структура соединений системы Ni-Se |Э|
Соединение
Ni3Se,
(НТ)
Ni.Se,™
Ni21Se20
NiSe ф)
NiSe (P')**
NiSe2
Прото-
Прототип
-
-
NiS
NiAs
-
FeS2
Символ
Пирсона,
пргр
Л32
-
ЛД6,
ЛЗт
hP4,
Pb-jmmc
-
сР\2,
Pal
'Ромбоэдрическая сингония
Моноклинная сингония
Гексагональная сингония
Параметры решетки, нм
а
0,603
0,424
0,378A)
0,58834
0,36613
0,6196
0,59626
0,59604
Ь
-
-
-
0,3633
-
с
0,726
1,589A)
-
0,33562
1,0464
-
Примечание
а = 90,64°
-
а= 116,52°
-
При 56,5 %(aT)Se,
р = 90,78°
При 66,39 %(aT)Se
При 66,67 % (ат) Se
Литература
1 Кузнецов Г.В., Алексеев А.А., Шпак З.С. и др // Вопросы металлургии и физики
полупроводников Тр 4-го совещания М Из-во АН СССР 1961 С 159—173
НИ Никитина
Ni-Si. НИКЕЛЬ-КРЕМНИЙ
Сведения о диаграмме состояния Ni-Si до середины 60-х годов можно
найти в справочниках \Х, Э, 1Щ, Результаты более поздних исследований
по этой системе [1-7] были обобщены в обзорной работе [8]. Диаграмма
состояния Ni-Si приведена на рис. 325 по данным работы [8].
В системе определены следующие фазы: Р], Р3, Y> &, 9. ?'» NiSi и NiSi2,
из них три фазы у, в и NiSi плавятся конгруэнтно при 1242,1306 и 992 °С
соответственно. Фазы рз, б и pNiSi2 образуются по перитектическим
реакциям при 1170, 1255 и 993 °С соответственно. В твердом состоянии
по перитектоидным реакциям образуются фазы Р| A035 °С) и е' (845 °С)
Три фазы имеют высоко- и низкотемпературные модификации' р3 »¦* Р2
642
Nt-Si
го
/. (no массе)
зо wi so во 7o во so too
О Ю to 30 «О 50 60 70 80 SO WO
f/t Si,*/e(am.) Si
Рис. 325. Ni-Si
(-1115 °C), e' - e (-830 °C) и pNiSi2 ~ aNiSi2 (-981 °C). Максимальная
растворимость Si в (Ni) достигает 15,8 % (ат.) при 1143 °С (эвтектическая
температура). Кристаллическая структура соединений приведена в
табл. 256 [8, Э].
Таблица 256 Кристаллическая структура соединений системы Ni—Si (8, Э]
Соединение
P,(~N.3S.)
Р/'
р;2
rt-Ni,,*,,)-»
Прототип
AuCuj
(GePtj-0
(GePtj')
-
Символ
Пирсона,
пргр
сР4,
РтЪт
тС\Ь
тС16
-
Параметры решетки, им
а
0,350
0,697 B)
0,704 G)
0,667 A)
*
-
0,625 D)
0,626 D)
-
с
-
0,507 (8)
0,508 A)
1,228(8)
Ni-Si, Ni-Sm
643
Соединение
6( Ni,Si)
B*3
e(-Ni3Sl2)'4
N1S1
aNiSi2
Прототип
Co2Si
-
-
MnP
CaF2
*'p = 48 74°
*2P = 48 84°
*3Гексагональная сингония
*4Ромбическая сингония
Символ
Пирсона,
пргр
оРП,
Рппга
-
Олс2,
оР&,
Рпта
сЛ2,
Fmim
Параметры решетки, нм
а
0,706
0,3805
1,2229
0,562
0,5406
Ь
0,499
-
1,0805
0,518
-
с
0,372
0,489
0,6924
0,334
-
Литература
1 Бадтиев Э.Б., Петрушкова О.С., Пантелеймонов Л.А. // Вестник Моек ун-та Химия
1974 Т 15 N 3 С 367-368
2 Gray I., Miller СР.//i Inst Met 1965 V 93 N 9 P 315-316
3 EllnerM., HeinrichS., Bhargava M.K., Schubert K.// J Less-Common Met 1979 V 66
N 2 P 163-173
4 LebailiS., Hamar-Thibaul S.//Z Metallkunde 1984 Bd 75 N 10 S 764-770
5 Kaufman L.//Calphad 1979 V 3 N 1 P 45-76
6 Jansson В., Agren J. // Mater Sci Eng 1984 V 63 N 1 P 51-60
7 MeyS.//Z Metailkunde 1986 Bd 77 N 12 S 805-810
8 Nash P., Nash A.//Bull Alloy Phase Diagrams 1987 V 8 N 1 P 6-14
Г К Алексеенко
Ni-Sm. НИКЕЛЬ-САМАРИЙ
Диаграмма состояния системы Ni-Sm представлена на рис 326 и
построена в работе [1]. Исследование проводили методами дифференци-
дифференциального термического, рентгеновского и микроструктурного анализов.
В качестве исходных компонентов использовали Ni чистотой 99,99 % (по
массе) и Sm чистотой 99,9 % (по массе).
В системе установлено образование восьми промежуточных фаз, из
которых NiSm и Ni5Sm кристаллизуются конгруэнтно при температурах
1079 и 1430 "С соответственно Соединения Ni|7Sm2, Ni4Sm, Ni7Sm2,
644
Ni-Sm
010 2030
Sm, °/of/?o массе)
50 60 70 80
90
WO
О 10 20 30 40 50 60 70 80 90 WO
N1 Sm,%(am.} Sm
Рис. 326. Ni-Sm
Ni3Sm, NijSm и NiSm3 образуются по перитектическим реакциям при
1288,1282,1220,1135,1034 и 664 °С соответственно. Области гомогеннос-
гомогенности промежуточных фаз не обнаружены
В системе имеют место три эвтектических равновесия'
Ж ^ (Ni) + Ni17Sm2 при 1280 °С и 6 % (ат) Sm,
Ж ** Ni2Sm + NiSm при 809 °С и 46,5 % (ат) Sm;
Ж ~ NiSm3 + NiSm при 570 °С и -68 % (ат) Sm.
Растворимость Sm в (Ni) исследовалась в рабрте [4] методом
рентгеноспектрального анализа Диффузионные пары, составленные из
Ni и Sm, отжигали в интервале температур 1100-860 °С в течение
30-550 ч и закаливали в воде. Показано, что растворимость Sm в (Ni)
при 1050 и 980 °С равна 0,479 и 0,483 % (ат.) соответственно
Кристаллическая структура соединений системы Ni-Sm приведена
в табл 257
Nt-Sm, NiSn
645
Таблица 257 Кристаллическая структура соединений системы l\i-Sm
Соедине-
Соединение
Ni|7Sm7
Ni5Sm
N13S1T1
Ni2Sm
NiSm
NiSm3
Прото-
Прототип
Ni17Th2
CaCu5
Ni3Pu
Cu2Mg
CrB
AI3N1
Символ
Пирсона,
nprp
ЛЯ38,
hP6,
РЫттт
-
cF24,
Fdim
0C8,
Cmcm
0/Ч6,
Pnma
Параметры решетки, нм
о
0,847
0,4924 E)
0,5003
0,7218
0,718E)
0,7226 E)
0,337
0,3776
0,3772A)
0,699
b
-
-
-
-
1,034
1,0358
1,0341 C)
0,972
с
0,806
0,3974 E)
2,459
0,427
0,4291
0,4270 B)
0,637
Источник
[2]
[2]
[2]
[2]
[Ш]
[Э]
И
[Ш]
[Ш]
И
Литература
1 Pan Y., Zheng J.X.//Acta Phys Sin 1983 V 32 N 1 P 92-95
2 Савицкий Е.М., Терехова В.Ф. // Металловедение редкоземельных металлов М
Наука 1975 С 192-193
3 Parte Е., Moreau J.-M. // J Less-Common Met 1974 V 53 N 1 Р 1-24
4 Si Xingkang, Wong Lhigum, Li Guoguan, Lhang Weijung, PanShuning//Proc 6th Nat
Simp Phase Diagr Shenyang Nov 20-24 1990 Shenyang (990 P 125-126
В П Полякова
Ni-Sn. НИКЕЛЬ-ОЛОВО
Обширные сведения по диаграмме состояния системы Ni-Sn до
середины 60-х годов приведена в работах \Х, Э, Ш]. На рис. 327
представлена диаграмма состояния по данным работы [1], построенная
путем обобщения имеющихся литературных данных.
В системе существует три соединения, из которых Ni3Sn и Ni3Sn2
плавятся конгруэнтно при 1174 и 1264 "С соответственно, из них
соединение Ni3Sn имеет две модификации' высоко- и низкотемператур-
низкотемпературную (температура перехода 977 °С), а соединение Ni3Sn4 образуется по
перитектической реакции Ж + Ni3Sn2**Ni3Sn4 при 794,5 "С Наибольшая
растворимость Sn в (Ni) составляет 10,6 % (ат) при 1130 "С. В сплавах
646
Ni-Sn. Ni-Sr
Sn, % (no моссе)
0 20 40 60 вО
100
1200
100
600
300
(Hi)
Изо*
920.5'
126b'
/160^
977'
H—
850*
79b,5' N
231,15"
231,Э'
0 10 20 SO 40 SO 60 70 BO 90 100
Hi Sn,%(am.) Sn
Рис. 327. Ni-Sn
системы кристаллизуется две эвтектики: (Ni) + p№3Sn при ИЗО °С и
вырожденная эвтектика со стороны Sn при 231,15 °С.
Высоко- и низкотемпературные модификации Ni3Sn имеют гексаго-
гексагональную структуру с параметрами а = 0,263 нм и с = 0,423 нм, а =
= 0,5295 нм и с - 0,4254 нм соответственно. Кристаллическая структура
фазы Ni3Sn2THna NiAs (символ Пирсона ЛР4, пр.гр. РЬг1ттс, параметры
решетки а = 0,405 нм, с = 0,512 нм). Фаза Ni3Sn4 имеет моноклинную
структуру {а = 1,217 нм, Ъ = 0,406 нм, с = 0,516 нм, р = 104,3°) [Ш].
Литература
1 Nash P., Nash A.//Bull Alloy Phase Diagrams 1985 V. 6. N 4 P. 350-359.
Г К Алексеепко
Ni-Sr. НИКЕЛЬ-СТРОНЦИЙ
Диаграмма состояния Ni-Sr, построенная методами микроструктурно-
микроструктурного, рентгеновского и термического анализов, приведена на рис. 328. Для
получения сплавов использовали Ni чистотой 99,9 % (по массе) и Sr
чистотой 99 % (по массе).
В сплавах системы образуется одно соединение по перитектической
реакции Ж + (Ni) -* NiSr при 860 "С. При этой температуре в (Ni)
содержится 0,34 % (по массе) Sr. При 660 ° С наблюдается кристаллизация
Ni-Sr, Ni-Ta
647
Sr,% (am)
20 40 60 80 tOO
•{USD
500
0 W 20 SOW 50 SO TO 80 90 100
Hi Sr,%(no массе) sr
Рис. 328. Ni-Sr
эвтектики (NiSr + (PSr)), эвтектическая точка соответствует 92 % (по
массе) Sr. Соединение NiSr обладает гексагональной кристаллической
структурой с параметрами решетки а = 0,3332 нм, с = 0,7009 нм, da -
= 2,112.
Литература
l.TakeutiJ.,MotidzukiK.,VatanabeM.,ObinataI.//J.JapanInst Metals. 1965 V 29. N 8.
P. 801-806
Л.Л. Зусман
Ni-Ta. НИКЕЛЬ-ТАНТАЛ
Система Ni-Ta исследовалась многократно [X, Э, Ш]. На рис. 329
представлена диаграмма состояния Ni-Ta согласно работе [1], в которой
обобщены результаты работ [X, Э, Ш, 2, 3].
648
Ni-Ta
t-c
1800
1600
О
1*00
1100
1000
800
Рис. 329. Ni-Ta
7 20
1
<ю
1
й ?
1*55"
ml
1
1
1
!
1 \
155
пг/
Та,'/<> (по массе)
60 во 90
1
S
II
9*
ж/
1
Г7«в° J
/I
J13S0'
Г
-
(V
во
100
1
' (та)
s
о to го зо to so во 70 so 90 roo
Ni Ta,'A(am.) та
В системе образуется пять соединений. Существование в системе фаз
Ni3Ta, Ni2Ta, NiTa и NiTa2 установлено многими исследованиями
Наличие в системе фазы №8Табыло установлено в работе [2], а в работе
[3] было определено, что соединение Ni8Ta образуется по перитектоидной
реакции при 1330 °С.
Фаза NijTa конгруэнтно плавится при 1550 °С.
Фазы Ni2Ta, NiTa и NiTa2 образуются по перитектическим реакциям
при 1405, 1570 и 1788 °С соответственно. Наибольшая растворимость
Ni в (Та) равна 20 % (ат.) при 1788 "С, а Та в (Ni) - 14 % (ат) при 1360 °С
В системе существуют два эвтектических равновесия.
Кристаллическая структура соединений приведена в табл. 258 [1]
Таблица 258 Кристаллическая структура соединений системы Ni-Ta |1|
Соединение
Ni3Ta
Прототип
TiAl3
Символ
Пирсона,
пргр
Г/8,
Шттт
Параметры решетки, нм
а
0 3627
с
0,7455
Ni-Ta, Ni-Tb
649
Соединение
Ni2Ta
NiTa
NiTa2
Прототип
MoSi2
W6Fe7
CuAl2
Символ
Пирсона,
пргр.
f/6,
IAImmm
АЛ 13,
R3m
tin,
J4/mcm
Параметры решетки, нм
a
0,3154
0,4951
0,6216
с
0,7905
2,690
0,4872
Литература
1 Nash A., Nash P. // Bui) Alloy Phase Diagrams 1984 V 5 N3 P 259-271
2 ПимеиовВ.Н.,УгастеЮ.Э.,АккушкароваК.А.//Изв АН СССР Металлы 1977 N 1
С 184-189
3 Nash P., West D.R.F.//Met Sci 1983 V 17 N 2 P 99-100
Г К Алексеепко
Ni-Tb. НИКЕЛЬ-ТЕРБИЙ
Диаграмма состояния Ni-Tb не исследована. Кристаллические
структуры известных фаз приведены в табл. 259 по данным работ [Ш,
V-C].
Таблица 259 Кристаллическая структура соединений системы Ni-Tb |Ш, V-C|
Соединение
NiTb3(BT)
Ni2Tb3(HT)*
NiTb
NiTb"
Ni2Tb
Ni3Tb
Прототип
CFe3
N.2Dy3
NiTb
NiTb
Cu2Mg
Be3Nb
Символ
Пирсона,
пргр
of 16,
Pnma
mC20,
CVm
oP24,
Pnma
mP24,
Plxlm
cF24,
Fcfim
hR\l,
Rim
Параметры решетки, нм
a
0,688
1,338
0,688
2,126
0,7278
0,4975
b
0,961
0,371
0,961
0,421
-
—
с
0,629
0,964
0,629
0,545
-
2,442
650
Ni-ТЬ, Ni-Tc
Соединение
№7ТЬ2
№7Tb2
Ni5Tb
№17Tb2
*B= 106,0°.
* 0=97,4°
Прототип
Ni7Ce2
Co7Er2
CusCa
№l7Th2
Символ
Пирсона,
пр.гр.
hP36,
РЬ-jmmc
ЛЛ18,
Rim
hP6,
Pftlmmm
hPX,
Pbjmmc
Параметры решетки, нм
a
0,4948
0,4948
0,4894
0,831
b
-
-
с
2,412
3,623
0,3966
0,804
Е.И. Гладышевский, О. И. Бодак, В. К. Печарскип
Ni-Tc. НИКЕЛЬ-ТЕХНЕЦИЙ
Сплавы системы Ni-Tc, отожженные при 1050 "С, исследовали
рентгенографическим методом [1]. Промежуточных фаз между (Ni) и (Тс)
Тс,%(ла массе)
о О 10 20 30 +0 50 60 70 80 90 100
t, С
2200
ПОО
1600
1500
1455"
ПОО
1300
100
1
№)
i
1
(
1
1
Ж
/
/
У
1
/
/
i
\
\
/
/
1
(Тс)
\
1
1204'
Рнс.
330.
Ni-Tc
0
Ni
10
го
30
40 50 60
Tc,°/o(am.)
70
во
90
100
Тс
Ni-Tb, Ni-Te 651
це образуется. В (Тс) растворяется значительное количество Ni: при
1050 °С растворяется свыше 50 % (ат.) Ni, но не более 66,6 % (ат.) Ni.
Растворимость Тс в (Ni) не превышает 25 % (ат.) [1]. На рис. 330
представлена диаграмма состояния Ni-Tc [2], исследованная методами
цикроструктурного, рентгеновского и диффренциального термического
анализов. Синтез сплавов осуществляли в дуговой печи из Ni частотой
99,99 % (по массе) и Тс чистотой 99,92 % (по массе). При температуре
-1495 "С протекает перитектическая реакция Ж + (Те) » (Ni). Раствори-
Растворимость Тс в (Ni) равна 29,4 % (ат.) при 1495 °С.
Литература
1 Darby J.B., Norton L J., Downey J.W. // Less-Common Met. 1963. V. 5. N 5. P. 397-402.
2. Спнцын В.И., Гришина СП., Балаховский О.А., Красовский А.И. // Изв. АН СССР.
Металлы. 1975. N 6. С 196-198.
Л.Л Рохлин
Ni-Te. НИКЕЛЬ-ТЕЛЛУР
Многочисленные сведения о характере взаимодействия Ni и Те
приведены в работах [X, Э, Ш]. Часть диаграммы состояния в интервале
концентраций -40-70 % (ат.) Те представлена на рис. 331 по данным
работы [1]. В этой области концентраций она получена при изучении
термодинамических свойств сплавов. В качестве исходных компонентов
использовали Ni и Те чистотой 99,9 % (по массе). Установлено существо-
существование трех фаз: р, у и б.
Фаза б обладает широкой областью гомогенности 53-66 % (ат.) Те.
По данным работы [Э] б образует эвтектику с Те при температуре
448,4 °С (на 1 "С ниже температуры плавления Те) и концентрации 99,7 %
(ат.) Те.
Область гомогенности фазы р находится в интервале концентраций
40-40,9 % (ат.) Те [2], а фазы у - в пределах NiTe0 77-NiTe0 775.
Кристаллическая структура соединений приведена в табл. 260.
652
Ni-Te
Таблица 260 Кристаллическая структура соединений системы Ni-Te
Соединение
P(-N>3Te2)*1-*3
Y(-N>4Te3)*4
NiTe
NiTe2
6*5
Прототип
—
-
NiAs
Cdl2
-
Символ
Пирсона,
пр гр
—
-
А/Ч,
Р63/ттс
нп.
-
Параметры решетки, им
а
0,7557
0,7591
0,3771
0,3912
0,398
0,3869
0,3968-
0,3854
Ь
0,38
0,3795
0,6872
-
-
-
с
0,61
0,605
0,6077
1,2375
0,538
0,5308
0,5362-
0,5261
Источник
[2]
[1]
[1]
[1]
[X]
[X]
[1]
*' Моноклинная сиигоиия р = 91,22°( при 40 % (ат) Те)
*2 Ромбическая сиигония (при 40,9 % (ат) Те)
*3 Тетрагональная сиигоиия (при 40,9 % (ат) Те, медленное охлаждение)
*4 Ромбическая сингония (при 43,5 % (ат) Те)
*5ГПУ
1000
350
900
850
800
750
700
650
600
550
500
450 h.
35
60
Te,'/m (no массе)
70 80
\
л
-
-
i
\\
\\
/
п
1
i
L
m
1
s
1
\
50
Те, '/
60
70
Рис. 331. Ni-Te
Ni-Te, Ni-Th
653
Литература
1 Ettenberg M., Komorek K.L., Miller E.J.//J Solid State Chem 1970 V 1 P 583-592
2 Barstad J., Gronvold F., Kost E., Vestersgo E.//Acta Chem Scand 1966 V 20 N 10
P 2865-2879
НИ Никитина
Ni-Th. НИКЕЛЬ-ТОРИЙ
Один из первых вариантов диаграммы состояния Ni-Th рассмотрен
в справочнике [X]. Основываясь на исследовании [1] с учетом данных
работы [X] авторами работы [2] был предложен обобщенный вариант
диаграммы состояния этой системы. Надо отметить, что даже после
сделанного обобщения не удалось уточнить ряд вопросов, связанных с
Nl,a/»(no массе)
10 20 30 40 5060 70 100
600
О Ю 20 30 W SO SO 70 80 SO 100
Th Ni,*/<,(am) Ni
Рис. 332 Ni-Th
654
Ni-Th
образованием некоторых соединений и их стехиометрии. Эта задача была
наиболее успешно выполнена в исследовании [3], которое практически
решает все спорные вопросы взаимодействия в системе Ni-Th.
Диаграмма состояния Ni-Th, представленная на рис. 332 по данным
работы [3], исследована методами микроструктурного, рентгеновского,
электронно-микроскопического и дифференциального термического
анализов.
В системе образуются семь соединений: Th7Ni3, ThNi, Th4Ni7, ThNi2,
Th2Ni7,ThNi5,Th2Ni19.
Четыре соединения плавятся конгруэнтно: Th7Ni3 при 1040 °С; ThNi
при 1190 °С; Th4Ni7 при 1075 °С и ThNi5 при 1510 °С.
Остальные три соединения: ThNi,, Th2Ni7 и Th,Ni|9, образуются по
перитектическим реакциям.
Соединение Th2Ni7 имеет а » р полиморфное превращение при
1195°С.
В системе кристаллизуются пять эвтектик. Все нонвариантные
равновесия, имеющие место в системе, указаны в табл. 261. Кристалличес-
Кристаллическая структура соединений приведена в табл. 262.
Таблица 261. Ноивариаитиые реакции в системе Ni-Th
Реакция
Ж - (Th) + Th7Ni3
Ж - Th7Ni3 + ThNi
Ж » ThNi + Th4Ni7
Ж - ThNi2 + «Th2Ni7
Ж-ТЬ2№,9 + (№)
Ж + Th4Ni7 - ThNi2
Ж + ThNi5 - pTh2Ni7
Ж + ТЬМ15 = ТЬ2^19
Содержание Ni
в жидкой фазе, % (ат)
20;
-34
-53
70
-94
-
-
-
Температура, °С
1000
1010
1025
1020
1305
1050
1245
1310
Ni-Th. Ni-Ti
655
Таблица 262 Кристаллическая структура соединений системы Ni-Th |3]
Соединение
Th7Ni3
ThNi
Th4Ni,-
ThNi2
aTh2Ni7
PTh2Ni7
ThNi5
Th2Ni19
*P= 111,71°
Прототип
Th7Fe3
SrAg
Th4Ni7
AIB2
Ce2Ni7
Er2Co7
CaCu5
Th2Ni,9
Символ
Пирсона,
пр.гр.
hP2Q,
oP\f>,
Pnma
mCll,
C2/c
AW,
РЫттт
Рбу/ттс
АЛ 18,
Л 3m
А/>6,
РЫттт
hPiO,
Рб^/ттс
Параметры решетки, нм
а
0,9887
1,4174
0,5509
0,3967
0,4945
0,4945
0,4926
0,837
Ъ
-
0,430
0,551
-
-
-
-
с
0,6231
0,5695
0,7445
0,3845
2,580
3,870
0,3985
0,816
Литература
1. Thompson J.R..//J. Less-Common Met. 1972. V. 29. N 2. Р, 183-188.
2. Santandrea C.J., Peterson D.E. // Bull. Alloy Phase Diagrams. 1988. V. 9. N 4. P. 487-490,
539-540
3 Palenzona A., Cirafici S. // i Less-Common Met. 1988. V. 142. P. 311-317.
Я Б. Будберг
Ni-Ti. НИКЕЛЬ-ТИТАН
Результаты исследований сплавов системы Ni-Ti приведены в работах
[X, Э, III, M]. Обобщенная диаграмма состояния Ni-Ti представлена на
рис. 333 [М].
656
Ni-Ti
Л/с, '/ofno масее!
0 fO 20 30 4O 50 60 70 вО 90
О fO 20 30 W SO SO 70 вО SO tOO
П Ni, <Уо(ат.) NC
Рис. 333. Ni-Ti
В системе образуются три соединения: Ti,Ni, TiNi и TiNi3.
Соединение Ti2Ni образуется по перитектической реакции и имеет
область гомогенности. При температуре 700 °С область гомогенности
составляет ~2 % (ат.) и несколько сужается с понижением температуры.
Соединение TiNi кристаллизуется из расплава при 1310 °С. С
понижением температуры растворяет в себе некоторое количество Ni в
Ti, что приводит к образованию области его гомогенности. Максималь-
Максимальная область гомогенности TiNi при 1118 "С простирается от 49,5 до 57 %
(ат.) Ni. Предполагается, что при температуре ниже 630 °С TiNi
эвтектоидно распадается на смесь двух фаз Ti2Ni + TiNi3 [X, М].
Соединение TiNi3 плавится конгруэнтно при 1380 °С.
В системе Ni-Ti имеют место три эвтектических, одно перитектическое
и одно эвтектоидное превращение (другое при 630 "С точно не
установлено). Нонвариантные реакции в этой системе приведены в
табл. 263.
Таблица 263 Нонвариантные реакции в системе Ni-Ti
Реакция
Ж - (pTi) + Ti2Ni
Содержание Ni
в фазах, %(ат)
24, 10, 33,3
Температура, °С
942
Ni-Ti
657
Реакция
Ж - TiNi + T1N13
Ж - TiNij + (N1)
((JTi) - (aTi) + Ti2Ni
Ж + TiNi - Ti2Ni
61,
83,5,
4,5,
32,
Содержание Ni
в фазах, % (ат)
57,
75,
0,2,
49,5,
75
86,1
33,3
33,3
Температура, "С
1118
1304
765
984
Максимальная растворимость Ni в (aTi) равна 0,2 % (ат.), в (pTi) -8 %
(ат.).
Максимальная растворимость Ti в (Ni) достигает 13,9 % (ат.) при
1304 °С и снижается при уменьшении температуры. В работе [1]
приведено модельное описание фазовых равновесий в системе Ti-Ni.
По разработанной модели реальных кристаллов оптимизированы
термодинамические параметры фазовых составляющих системы. Набор
констант стабильности элементов, соединений позволил дать адекватное
описание фазовых равновесий в системе в субсолидусной области.
Кристаллическая структура соединений приведена в табл. 264 [1].
Таблица 264 Кристаллическая структура соединений системы Ni—Ti (I)
Соединение
Ti2Ni
TiNi
T1N13
Прототип
Ti2Ni
CsCl
T1N13
Символ
Пирсона,
пргр
cF96,
Fdim
cPl,
Pmim
АЛ6,
РЬт/ттс
Параметры решетки, нм
а
1,131
0,302
0,5093
Ь
-
-
-
с
-
-
0,8276
Литература
1 ДанилеикоВ.М.,ЛукашенкоГ.М.,Прима СБ.//Порошковая металлургия 1991 N5
С 73-75
С П Алисова
658
Ni-Tl, Ni-Tm
Ni-Tl. НИКЕЛЬ-ТАЛЛИЙ
Ориентировочная диаграмма состояния Ni-Tl, построенная по
данным термического и микроструктурного анализов, представлена на
рис. 334 согласно работе [X]. Отмечено существование твердого раствора
га, % (по массе)
40 60 80 SO 100
300
200
230'
13ВТ-
Магнитное
превращение
soy'.
о w го зо ьо so 60 ю во so too
Ni П,Уш (am.) Tl
Рис. 334. Ni-Tl
на основе Ni, на что указывает понижение температуры магнитного
превращения Ni до 300 °С при добавлении Т1. Монотектическая
горизонталь простирается при температуре 1387 °С от 0,9 % (ат.) Т1 до
практически 100 % (ат.) Т1.
Г К Алексеенко
Ni-Tm. НИКЕЛЬ-ТУЛИЙ
Диаграмма состояния Ni-Tm не построена
Кристаллическая структура известных двойных соединений приведена
в табл 265 по данным работ [V-C].
Ni-Tm, Ni-U
659
Таблица 265 Кристаллическая структура соединений системы Ni-Tm |V-C)
Соединение
NiTi3
NiTm
Ni2Tm
Ni3Tm
Ni5Tm
Nii7Tm2
Прототип
CFe3
BCr
MgCu2
Be3Nb
Cu5Ca
N,17Th2
Символ
Пирсона,
пргр
о/Мб,
Pnma
0C8,
Cmcm
cF24,
Fcttm
АЯ12,
Rim
AP8,
РЫттт
A/»38,
Pb-jmmc
Параметры решетки, нм
a
0,677
0,3675
0,7105
0,4937
0,4834
0,825
Ь
0,940
1,0040
-
-
-
-
с
0,6119
0,4159
-
2,4213
0,3970
0,8008
Е И Гладышевский, О И Бодак, В К Печарский
Ni-U. НИКЕЛЬ-УРАН
Система Ni-U исследована многократно. Результаты исследований,
проведенных до 60-х гг., отражены в справочниках [X, Ш]. Обобщенная
диаграмма состояния приведена на рис. 335 по данным работы [1], в
которой использованы результаты как ранних исследований [X, Ш], так
и работ [2-4].
В системе установлено существование семи соединений: U6Ni A4,3 %
<ат.) Ni); U7Ni9 E6,2 % (ат.) Ni); U5Ni7 E8,3-59,5 % (ат.) Ni); UNi2
F6,7-66 % (ат.) Ni); б G7,0 % (ат.) Ni); e G8,0 % (ат.) Ni); UNi5
(82,5-83,3 % (ат.) Ni).
Только одно соединение UNi5 плавится конгруэнтно, остальные
образуются по перитектическим реакциям.
Отмечено, что в области фаз б и е диаграмма недостаточно надежно
лзучена. В ранних работах было высказано предположение о существова-
существовании соединения г\ с содержанием -82 % (ат) Ni В дальнейших работах
•это предположение не нашло подтверждения и фаза г\ на диаграмме
состояния не нанесена.
660
Ni-U
two
1ZO0
woo
ГО
(no массе)
20 30 W 50 60 80 WO
BOO
776'
668'
6OO
400
200
I
12 790*
sse°
¦!?
4
760°
I
Ж
-7Я1
JJ
1
i
iko^
/
/ №°\
820
?<
1 ¦
\
/30f'
\
i
1 1 1
W5°
l\
fmir.
0 10 20 30 to 50 60 70 80 90 100
U f/i,"/o (am.) Ni
Рис. 335. Ni-U
В системе установлены две эвтектические реакции и одна эвтектоидная
в области, богатой U. Нонвариантные реакции, протекающие в системе,
приведены в табл. 266
Таблица 266 Ноявариантиые реакции в системе Ni-U |1)
(YU)
(уи)
ж»
ж +
ж +
ж +
ж +
Реакция
- (PU) + U6Ni
+ Ж- U6Ni
U6Ni + U7Ni9
U5Ni7 - U7Ni9
UNi2 - U5Ni7
6-UNi2
e = 6
1,25,
2,
33,
42,
48,
62,5,
74
Содержание Ni
в фазах, % (ат)
1,
27,5,
14,3,
58,2,
66 7,
77,
78,
14,3
14,3
56,2
56,2
59,5
66,7
77
Температура, °С
760
790
740
785
820
985
1260
Ni-U
661
ж +
ж»
ж»
UNi5
UNi5
UN15
Реакция
» с
+ (Ni)
77,5,
-,
91,
Содержание Ni
в фазах, % (ат)
83,3,
83,3,
83,3,
78
-
90
Температура, °С
1290
1305
1110
Максимальная растворимость Ni в (yU) при температуре 790 °С
составляет -2 % (ат) Ni и снижается до 1,25 % (ат) Ni при эвтектоидной
температуре 760 °С. Растворимость Ni в (PU) составляет -1 % (ат) при
температуре 760 °С и снижается до 0,1 % (ат.) при 700 "С. Растворимость
Ni в (aU) весьма мала при всех температурах. Растворимость U в (Ni)
также весьма мала и составляет по разным данным [X, Ш, Э] примерно
0,18-0,3%(ат)при 1000-1075 °С
Кристаллическая структура соединений приведена в табл. 267
Таблица 267 Кристаллическая структура соединений системы Ni-U |11
Соединение
U6N,
UNi2
UNi5
Прототип
MnU6
MgZn2
AuBe5
Символ
Пирсона,
пргр
г/28,
lAlmcm
АЛ2,
Ptymmc
(F24,
F43m
Параметры решетки, нм
а
1,0390
0,4966
0,6783
с
0,5156
0,8252
Литература
1 Peterson D.E. // Bull Alloy Phase Diagrams 1988 V 9 N4 P 490-493
2 Лебедев В.А.,ПятковВ.И., АбдрахмановP.P. идр //Журнал физической химии 1974
Т 48 Вып 10 С 2521-2524
3 Zanghi J.-P., Craeynest A., Calais D.//J Nud Mater 1971 V 39 P 133-144
4 EngelhardtJJ.//J Phys Chem Solids 1975 V 36 N 3 P 123-126
3 M Алексеева
662
Ni-V
Ni-V. НИКЕЛЬ-ВАНАДИЙ
Система Ni-V исследовалась в ряде работ с использованием методов
дифференциального термического, металлографического и рентгеновско-
рентгеновского анализов [X, Э, Ш, 1-4]. На рис. 336 представлена обобщенная
диаграмма состояния по данным работы [3]. В системе установлено
существование пяти соединений и наличие широких областей твердых
растворов на основе компонентов.
Три соединения NigV, Ni3V и Ni2V образуются в области твердого
раствора V в Ni при температурах 405, 1045 и 922 "С соответственно.
Соединение NiV3 образуется по перитектоидной реакции (V) + о(ВТ) -
» NiV3 при температуре 900 °С и концентрации 77,8 % (ат.) V.
Фаза о кристаллизуется по перитектической реакции Ж + (V) - о при
температуре 1280 °С и концентрации 67 % (ат.) V и имеет широкую
область гомогенности, простирающуюся от 55 до 75 % (ат.) V. Фаза о
претерпевает полиморфное превращение, температура которого в
зависимости от состава фазы о изменяется от -790 до 650 "С.
Эвтектическое равновесие Ж »(Ni) + o(BT) имеет место при температу-
температуре 1202 °С и концентрации 51 % (ат.) V.
Ю 20
V,% (по массе)
30 40 SO 60 70 60 90 100
о \/0 го зо
Nt Магнитное
превращение
tO SO 60
v,'Man)
70
вО 90 ЮО
V
Рис. 336. Ni-V
Nt-V
663
Максимальная растворимость V в (Ni) при эвтектической температуре
A202°) достигает 43 % (ат) V. Растворимость Ni в (V) при перитектичес-
кой температуре 1280 °С равна 24 % (ат.) V и снижается до 10,5 % (ат )
V при 900 °С.
Кристаллическая структура соединений приведена в табл. 268.
Таблица 268 Кристаллическая структура соединений системы Ni-V'
Соединение
N.8V
Ni3V
Ni2V
Ni,V
о(НТ)
NiV3
Прототип
NbNi8?
AI3T1
MoPt2?
-
-
Cr3Si
Символ
Пирсона,
пргр
-
1/8,
Wmmm
-,
-
-
сЯ8,
РтЪп
Параметры решетки, нм
а
0,749
0,3542
0,255
0,2577
0,8954-
0,8996
0,4712
Ь
0,749
-
0,771
0,2620
-
-
с
0,353
0,7213
0,354
0,3545
0,4635-
0,453
-
Источник
[5]
[V-C]
И
[3]
[3]
[2]
Литература
1 Daire M., Gerspacker М.//J Less-Common Met 1969 V 17 N 3 Р 334-335
2 Stevens E.R., Carlson O.N.//Metall Trans 1970 V 1 N5 P 1267-1271
3 Smith J.F., Carlson O.N., Nash P.G. // Bull Alloy Phase Diagrams 1982 V 3 N 3
P 342-348
4 Maldonado A., Schubert K. // Z Metallkunde 1964 Bd 55 N 10 S 619-626
5 Moreen H.A., Taggart R., Polonis D.H. // J Mater Sci 1971 V 6 P 1425-1432
6 Schubert K., Frank K., Gohle R. et al // Naturwissenschaften 1963 Bd 50 S 41-43
M А Тылкипа
664
Ni-W
Ni-W. НИКЕЛЬ-ВОЛЬФРАМ
Взаимодействие Ni с W исследовалось многократно в работах [X, Э,
Ш, В, 1-8]. В обзорной работе [5] приведена обобщенная диаграмма
состояния (рис. 337) по данным работ [1-4].
В системе существуют три промежуточные фазы: Ni4W (P), NiW (б)
и NiW2 (у), а также твердые растворы на основе Ni (Ni) и W (W).
Между (Ni) и (W) образуется эвтектика при 1500110 "С и 20,7 %
(ат.) W.
Кривые ликвидус и солидус (Ni) имеют пологий максимум при
-1510 °С и 14,7 % (ат.) W, температурный интервал кристаллизации (Ni)
очень узок.
Растворимость W в (Ni) составляет 17,5 % (ат.) при эвтектической
температуре, 16,3 % (ат.) при перитектоидной температуре 970 "Си далее
снижается до 13,1; 12,0 и 11,8 % (ат.) при 800,600 и 500 "С соответственно
[2]. Эти оценки сделаны на основе более длительных термических
обработок и являются предпочтительнее данных других работ, где
приводятся более низкие или более высокие значения растворимости.
W, % (по массе)
О 20JO 40 50 60
О 10 20 SO 40 50 60 70 80 90 100
Ni w, •/. (am) w
Рис. 337. Ni-W
Ni-W
665
Растворимость Ni в (W) оценивалась диффузионным методом с
использованием микроанализатора [6, 7]; получены близкие значения-
0,6 % (ат.) при 1927 °С [7], 0,46 % (ат.) Ni при 1640 °С [6], 0,3 % (ат.) Ni
при 1500оС[5]или0,2и0,05%(ат)№при 1527 и 1187 °С соответственно
[П
Ni4W (фаза р) образуется по перитектоидной реакции из (Ni) с 16,4 %
(ат ) W и фазы б с -49,4 % (ат.) W при 970 °С [2], имеет узкий интервал
гомогенности, не превышающий 3 % (ат) [8]. Ранее было высказано
мнение, что фаза р образуется при взаимодействии (Ni) и (W) [2].
NiW (фаза б), обнаруженная в структуре сплавов, приготовленных
методом диффузионных пар [3], образуется по перитектоидной реакции
между (Ni) и (W) при 1060 "С, имеет узкий интервал гомогенности вблизи
концентрации 49,6 % (ат.) W. Существование этой фазы подтверждено
в работах [4, 5].
NiW2 (фаза у) обнаружена при исследовании упорядоченного
вольфрамовыми волокнами композиционного материала с никелевой
матрицей [4] Она образуется по перитектоидной реакции между фазой
б и (W) при температуре ~ 1025 °С, стабильна в исследованном темпера-
температурном интервале 800-1040 "С, имеет узкую область гомогенности
вблизи 66 % (ат.) W
Кристаллическая структура соединений приведена в табл. 269.
Таблица 269 Кристаллическая структура соединений системы Ni-W
Соединение
N.4W(P)
NiWF)*
NiW2(y)
Прототип
MoNi4
MoNi
-
В работе [5] высказано
уточнении
Символ
Пирсона,
пргр
г/10,
/4/ш
- оР5в,
'2,2,2,
-
мнение, что
Параметры решетки, нм
а
0,5730
0,776
1,040
Ь
-
1,248
-
с
0,3553
0,710
1 090
Источник
[5]
14
[4,5]
кристаллическая структура NiW нуждается в
Литература
1 VogclR.//Z Anoig All С hem 1921 Bd 116 S 231-242
2 HlmgerF.H., Sjkcs \V V //Trans ASM !c>40 V 28 P 619-643
666
Ni-W. Ni-Y
3. Walsh J.M., Donachie M.J. // Metall. Trans. 1973. V. 4. P. 2854-2855.
4. Poulsen K.E., Rubaek S., Langer E.M. II Scr. Metall. 1974. V. 8. P. 1297-1300.
5. Nagender Naidu S.V., Sriramamurthy A.M., Rama Rao P. // J. Alloy Phase Diagrams. 1986.
V. 2. N 1. P. 1-11.
6. Muster W.J., Yoon D.N., Hoppmann WJ. // J. Less-Common Met. 1979. V. 65. P. 211-216.
7. Kozma L., Labar J. // High Temper. High Pressures 1981. V. 13. P. 251-254.
8. Raynor G.V., Rivlin V.G.// Int. Met. Rev. 1981. V. 26. N 4. P. 213-249.
К.Б. Поварова
Ni-Y. НИКЕЛЬ-ИТТРИЙ
Обобщенная диаграмма состояния (Ni-Y) (рис. 338) построена в
работе (Э], используя данные работ [1-3].
В системе установлено образование десяти соединений, из которых
Ni5Y и NiY кристаллизуются конгруэнтно при температурах 1490 и
1065 °С соответственно. Фазы: Ni17Y2, Ni4Y, Ni7Y2, Ni3Y, Ni2Y, Ni2Y3,
NiY3 образуются перитектически при температурах 1360,1375,1337,1237,
1115, 835 и 896 "С соответственно. Предполагается образование
небольших областей гомогенности у соединений Ni5Y и Ni2Y (-0,7 %
(ат.)). Кристаллическая структура соединений приведена в табл. 270.
Y,°/o(no массе)
,0 W 20 30 W SO 60 70 80
90 ЮО
JffO
о to го зо ьо so so 70 go 90 too
Nl Y,°/o(am.) Y
Рис. 338. Ni-Y
Ni-Y
667
Таблица 270 Кристаллическая структура соединений системы Ni-Y
Соединение
Ni,7Y2
Ni5Y
Ni7Y2
Ni3Y*
Ni,Y
NiY**
Ni2Y3
NiY3
Прототип
Th2Ni17
CaCu5
Er2Co7
PuNi3
MgCu,
-
Ni2Y3
Al3Ni
Символ
Пирсона,
пр.гр.
A/>38,
P63/mmc
hPb,
РЫттт
ЛЛ18,
R 3m
Rim
tF24,
Fdim
-
tPSO,
<)P\6,
Pnma
\. = 33,08° [Э].
** Моноклинная сингония, E = 90+0
Параметры решетки, нм
a
0,830
0,834B)
0,4883
0,4891
0,494
0,49756C)
0,4973
0,860B)
0,7184B)
0,712
0,715
0.714A)
0,7104
0,692
b
-
-
-
-
0,4114D)
-
0,949
,5° [Ш].
с
0,804
0,808B)
0,3967
0,3961
3,612
2,4449C)
2,437
_
0,6501(8)
3,6547
0,636
Источник
[4]
[Э]
[Э]
[Э]
[4]
[Ш]
14]
[Э]
[Э]
[Э]
[Ш]
[Ш]
[5]
[4]
Взаимная растворимость компонентов в твердом состоянии не
превышает 0,1-0,2 % (ат.)
В системе образуются эвтектики:
(Ni) + Ni17Y2 при 1280 °С и -7 % (ат.) Y;
Ni2Y + NiY при 950 °С и 42,5 % (ат.) Y;
NijY3 + NiYj при 802 "С и 66,5 % (ат.) Y.
Литература
1 Beaudry B.J., Daanc А.Н.// Trans. A1ME 1960 V 218. Р 854-860
2 Domagota R.F., Rausch J.J., Levinson D.W.//Trans ASM 1961 V. 53 P 137-155
668
Ni-Y, Ni-Yb
3 Гшнейдиер К.А. Сплавы редкоземельных металлов Пер с англ / Под ред
ЕМ Савицкого М Мир, 1965 427с
4 СавицкийЕ.М.,ТереховаВ.Ф. Металловедение редкоземельных металлов М Наука,
1975 271 с
5 ParteE., Moreau J.M.//J Less-Common Met 1974 V 53 N 1 P 1-24
В П Полякова
Ni-Yb. НИКЕЛЬ-ИТТЕРБИЙ
Диаграмма состояния Ni-Yb (рис. 339) построена в работе [1] по
данным исследований, проведенных методами дифференциального
термического, металлографического и рентгеноструктурного анализов
В качестве исходных материалов использованы Yb чистотой 99,9 % (по
массе) и Ni чистотой 99,999 % (по массе). В системе установлено
образование пяти соединений
Два соединения Ni3Yb и NiYb кристаллизуются непосредственно из
расплава при температурах 1310 и 1035 °С соответственно. Соединения
Ni|7Yb2, Ni5Yb и Ni2Yb образуются по перитектическим реакциям при
температурах 1245, 1295 и 1255 °С соответственно Кристаллическая
структура соединений приведена в табл. 271.
Yb, % Irw массе)
Л 20 W 50 60 70 80
90
/00
6O0 -
400
О ГО 20 ЭО W 50 60 7O 80 90 WO
Hi. Y6f % (am) Yb
Рис. 339. Ni-Yb
Ni-Yb. Ni-Zn
669
Таблица 271 Кристаллическая структура соединений системы Ni-Vb
Соедине-
Соединение
N.17Yb2
Ni5Yb
NijYb
Ni2Yb
aNiYb
Прототип
Th,Nil7
CaCu,
PuNi,
MgCu2
FeB
Символ
Пирсона,
пргр
AP38,
РЬ-jlmmt
hPb,
РЫттт
_
Rim
f71
oPB,
Pnma
Параметры решетки нм
a
0,8272
0 8280
0,4828
0,4828
0,4919
0,4920
0,7104
0,6934
0,6938
b
_
-
-
_
-
-
0,4078
0,4083
с
0,8029
0,8024
0,3999
0,3962
2,414
2,419
-
0,5387
0,5389
Источник
[1]
[2]
[1]
[2]
[1]
[2]
[I]
[1]
[2]
В системе Ni-Yb имеет место расслоение двух жидких фаз в интервале
концентраций -54-92 % (ат) Yb. Температура монотектической реакции
1025 "С
Две эвтектики образуются в системе
aNiYb + Ni2Yb при 990 °С и 45 % (ат ) Yb,
NiOYb, + (Ni) при 1230 °С и 7,5 % (ат.) Yb
Ni и Yb в твердом состоянии практически нерастворимы друг в друге.
Приведенная в обзорной работе [3] диаграмма состояния Ni-Yb
соответствует диаграмме, построенной в работе [I].
Литера! ура
1 Palemona A., Cirafici S.//J Less-Common Met 1973 V 33 N 3 Р 361-367
2 Busch(mK.H.J.//J Less-Common Met 1972 V 26 N 3 P 329-334
3 NashP.//Bu!l Alloy Phase Diagrams 1989 V 10 N 2 P 129-132
В П Полякова
Ni-Zn. НИКЕЛЬ-ЦИНК
Диаграмма состояния Ni-Zn приведена на рис 340 в соответствии с
обзором [1] Система характеризуется сложным характером взаимо-
взаимодействия компонентов, типичным для систем Zn с переходными
металлами
670
Hi-Zn
zn,V»(nt мессе)
О 10 20 JO *в SO tO 10 10 10
too
О 10 tO JO *O SO SO TO вО tO ГОО
Mi Zn,V.(am) Zn
Рис. 340. Ni-Zn
В системе отмечается существование широкой области твердых
растворов на основе Ni и четырех промежуточных фаз Р, Р(, у и б.
Ближайшие к Ni фазы Р и Р] включают в область гомогенности
эквиатомный состав.
Высокотемпературная фазаР образуется по перитектическойреакции
Ж + (Ni) = р при 1040 °С и затем при температуре 675 °С эвтектоидно
распадается на фазы р( и у. Область гомогенности фазы р простирается
от 47,5 до 58,3 % (ат.) Zn. Фаза р плохо фиксируется закалкой.
Низкотемпературная фаза р, образуется по перитектоидной реакции
(Ni) + р = Pj при температуре 810 "С. Область гомогенности фазы Р(
составляет 45,3-51,8 % (ат.) Zn.
Фаза у кристаллизуется непосредственно из расплава при температуре
881 "С. Область гомогенности фазы y 74-85 % (ат.) Zn. Этой фазе
приписывались также формулы NiZn3, Ni3Znj0, Ni5Zn2J, Ni4Zn22- В
работе [2] указано, что фаза у имеет полиморфное превращение в
интервале температур 500-600 °С (см. вставку на рис. 340).
Ni-Zn
671
Наиболее богатая Zn фаза б образуется по перитектической реакции
Ж + у * 5 при температуре 490 °С и концентрации -8,89 % (ат.) Zn.
Между б и (Zn) протекает эвтектическая реакция при температуре
418,5 "С и концентрации 0,2 % (ат.) Ni. Рассчитанное количество Ni в (Zn)
при эвтектической температуре составляет 0,23 %(ат) [1] и соответствует
экспериментальным данным.
Кристаллическая структура соединений приведена в табл. 272.
Таблица 272 Кристаллическая структура соединений системы Ni-Zn
Соеди-
Соединение
Р
Р.
у(ВТ)
Y(HT)*
6
Прото-
Прототип
CsCl
AuCu
Cu5Zn8
-
CoZriu
* Ромбическая
Символ
Пирсона,
пргр
сР2
РтЪт
1Р4,
PAImmm
с/52,
/43 m
-
шС28,
Cllm
сингония
Параметры решетки, нм
и
0,2914
0,27468
0,27321
0,27413
0,27504
0,8844
0,867
0,89069
0,89186
3,33268
-
h
-
I I II
II II
0,8869A)
-
с
-
0,31901
0,31739
0,31768
0,32006
II II
1,2499D)
-
Примечание
[X]
При50%(ат)гп[Х]
При 37,44%(aT)Zn
[X]
При 46,49 % (ат) Zn
[X]
При 5l,5%(aT)Zn[l]
При72%(ат)гп[1]
При 77,26 %(aT)Zn
[1]
При 80,2 %(aT)Zn[l]
При 85,0 %(aT)Zn[l]
[2]
[1]
Литература
1 Nash P., Pan Y.Y.// Bull Alloy Phase Diagrams 1987 V 8 N5 P 422-430
2 NoverG., Schubert K.//J Less-Common Met 1980 V 75 N 1 P 51-63
В П Полякова
672
Ni-Zr
Ni-Zr. НИКЕЛЬ-ЦИРКОНИЙ
Система Ni-Zr исследована многократно [X, Э, Ш, 1-18]. Обобщенная
диаграмма состояния (рис. 341) построена по данным исследований [1,
2] с учетом обзора этой системы в работе, [3]. В работе [3] учтены
результаты исследований по строению диаграмм состояния и кристалли-
кристаллической структуре фаз этой системы, выполненные до 1983 г.
В работах [1, 2] сплавы системы были исследованы методами
микроструктурного, рентгеноструктурного анализов, определением
температур плавления и измерением электросопротивления. Исходными
материалами служили спектрально чистый Ni и иодидный Zr.
В системе установлено существование восьми соединений: ZrNi5,
Zr2Ni7, ZrNi3, Zr8Ni?I, Zr7Ni10, Zr?Ni,,, ZrNi, Zr2Ni.
Соединения Zr2Ni7, ZrNi и Zr2Ni плавятся конгруэнтно при 1440,1260
и 1120 °С соответственно [1].
t;c
1800
Zr, */• (по массе)
О 10 20 SO ЬО 50 60 70 ВО
90
ГОО
1000
800
О 10 ZO 30 40 SO 60 70 80 90 100
NL Zr,m/.(am.) Zr
Рнс. 341. Ni-Zr
Ni-Zr
673
Богатая Ni фаза ZrNi5 образуется по перитектической реакции Ж +
+ Zr,Ni7 - ZrNi5 при температуре 1300 "С. Эвтектика (Ni) + ZrNi5
кристаллизуется при температуре 1170 °С и концентрации 8,8 % (ат.) Zr.
Соединение ZrNi5 имеет область гомогенности, которая при 1000 °С
простирается от 15 до 18 % (ат.) Zr.
Фаза ZigNi2| образуется по перитектической реакции Ж + Zr2Ni7 -
- Zr8Ni,| при 1180 °С. ФазаZrNi3-по перитектоиднойреакцииZr2Ni7 +
+ Zr8Nf21 •> ZrNi3 при 930 °С [2] (940 °С по работе [4]) и имеет область
гомогенности 24,5-26 % (ат.) Zr [4].
Фаза Zr9Ni|| образуется по перитектической реакции Ж + ZrNi =
» Zr9Ni| | при 1170 °С и распадается по эвтектоидной реакции Zr9Ni( ( »
- ZrNi + Zr7Ni10 при 975 °С [1].
Образование фазы Zr7Ni@ происходит по перитектической реакции
Ж +Zr9Ni|| = Zr7Ni|0 при 1160 °С, она имеет область гомогенности
41,1-43,5 % (ат.) Zr [1]. Эвтектика Zr7Ni,0 + Zr8Ni2, кристаллизуется при
1075±10 °С и концентрации 36 %(aT.)Zr [2]. Эвтектические реакции Ж -
- ZrNi + Zr2Ni кЖ» Zr2Ni + (pZr) протекают при температурах 1010 и
960 °С и концентрациях 63,5 и 76 % (ат.) Zr соответственно [1].
Максимальная растворимость Ni в (PZr) составляет 2,3 % (ат.) [1]. Ni
понижает температуру полиморфного превращения Zr и при температуре
845 °С происходит звтектоидный распад по реакции (PZr) - (aZr) + Zr2Ni,
эвтектоидная точка находится при концентрации 2,0 % (ат.) Ni. В (aZr)
растворимость Ni менее 0,2 (ат.).
Максимальная растворимость Zr в (Ni) < 1,3 % (ат.) [1]. Параметры
решетки Ni увеличиваются при растворении Zr. Для сплава Ni с 1 % (по
массе) Zr, закаленном при 800 °С, а = 0,35296 нм (для чистого Ni при
, 25 °С,а = 0,35166 нм) [5].
Ni уменьшает параметры решетки (aZr): при 0,1 % (ат.) Ni a = 0,3171,
с = 0,5143нм[6].
Кристаллическая структура соединений приведена в табл. 273.
Таблица 273 Кристаллическая структура соединений системы Ni-Zr
Соедине-
Соединение
ZrNi5
Zr.Ni,"
Прототип
AuBe5
Z,2N,7
Символ
Пирсона,
пргр
cF24,
F41m
шСЗб,
Cllm
Параметры решетки, нм
а
0,67064F)
0,4698(9)
0,4691A)
Ь
0,8235A3)
0,8225B)
с
1,2193A6)
1,2192C)
Источник
[1]
[7]
18]
674
Ni-Zr
Соедине-
Соединение
ZrNi3
ад?
Zr9Ni,,
ZrNi
Zr2Ni
Прототип
Ni3Sn
Hf8Ni2l
Zr7Nil0
Zr9Pt,,
CrB
CuAI2
Символ
Пирсона,
пр.гр.
AP8,
aP29,
0C68,
Aba2
Pb?*
//40,
/4/m
oC8,
Cmcm
tin,
Mtncm
Параметры решетки, им
a
0,53090
0,64721A3)
1,2386
1,2497
0,990B)
0,988A)
1,02996
0,3268
0,6477
0,6462
6
-
0,80645A5)
0,9156
0,9210
_
0,9937
-
*' Моноклиииая сингония, р = 95,83A3)° [7], p = 95,594° [8
*2 a. - 75,19°, P = 68,04°, у = 75,26° [2].
*3 Ромбическая сингония.
*4 При максимальном содержании Zr.
с
0,43034
0,85878A4)
0,9211
0,9325
0,662D)
0,661A)
0,69359
0,4101
0,5241
0,5266
]•
Источник
[4]
[2]
[1,2]
[12]
[1]
[9]
[13]
[13]
[1,13]
[II]
Термодинамические свойства жидких сплавов Ni-Zr определены в
работах [15, 16]. Аналитическое описание диаграммы состояния Ni-Zr
с использованием данных о термодинамических свойствах выполнено
в работах [17,18]. В работе [14] определена температурная зависимость
параметров решетки ZrNi3 в интервале температур 25-760 °С а =
= 0,51597 + 1,6285кг4 Т- I^S-KT^hm, с = 0,41881 +0,2134-1(Г4 Т-
- 0,8936-10~87^hm.
Литература
1 Kirkpatrick M.E., Larsen MX. //Trans. ASM. 1961. V. 54. P. 580-590.
2. BsenkoL.// У Less-Common Met. 1979. V. 63. N 2. P. 171-179.
3. Nash P., Yavanth C.S. // Bull. Alloy Phase Diagrams. 1984. V. 5. N 2. P. 144-148
4 Becle C, Bourniguel В., Develey G., Saillard M. // J. Less-Common Met. 1979. V 66
P. 59-66.
5 Huffstutler M.C., Petersen O.G. // J. lnst. Met 1967 V. 95. N I. P. 23-24.
Ni-Zr, Np-Pd
675
6. Самсонов Г.В., БрауиС.М., Рогозииская А.А.// Изв. вузов. Цветная металлургия. 1972.
N6 С 118-122.
7 Eshelman F.R., Smith J.F. // Acta Crystallogr. В. 1972. V 28. N 5. P. 1594-1600.
8 Dattagupta J.K., Schubert K. IIZ. Metallkunde. 1973. Bd. 64. N II S 789-792.
9 GlimoisG.L.,BecleC.,DeveleyG., Moreau J.M.//J. Less-Comraon Met 1979. V 64. N I
T. 87-90.
10 Van Swijgenhoven H., Stals L.M., Buschow K.H.J. // Phys. Status Solidi (a). 1982. V. 72.
^ IP 153-160.
11 Gachon J.C., Dirand M., Hertz J.//J. Less-Comraon Met. 1983. V. 92. N 2. P. 307-315.
12 Kirkpalrick M.E., Smith J.F., Larsen W.L. // Acta Crystallogr. 1962. V. 15. N 9.
P. 894-903.
13. Kirkpatrick M.E., Bailey D.M., Smith J.F. // Acta Crystallogr. 1962 V. 15. N 3.
ft. 252-255.
14. Shadangi S.K., Panda S.C., Brian S. // J. Appl. Crystallogr. 1983. V. 16. N 6. P. 645-646.
15 СидоровО.Ю., Есии Ю.О., Гельд П.В. // Расплавы. 1988. Т. 2. N 3. С. 9-11.
16 Luck Arpshofen R., Predel В., Smith J.F. // J. Phase Equilibria. 1991. V. 12. N 2.
p. 141-147.
17 Gachon J.C., Cherles J., Hertz J. // Calphad. 1985. V.9.NI.P. 35-42.
18. Saunders N. // Calphad 1985. V. 9. N 4. P. 297-309.
Л.А. Третьяченко
Mp-Pd. НЕПТУНИЙ-ПАЛЛАДИЙ
Диаграмма состояния Np-Pd не построена. В работах [V-C] приведены
данные по кристаллической структуре соединения NpPd3. Можно
предполагать, что это соединение существует в двух модификациях. В
табл. 274 приведены кристаллические характеристики соединения NpPd3
Системы Np-Pd.
Таблица 27 4. Кристаллическая структура соединений системы Np-Pd |V-C]
Соединение
NpP<f3(l)
NpPd3(ll)
Прототип
NijTi
AuCu3
Символ
Пирсона,
пр.гр.
Л/Ч 6,
РЬт/ттс
еР4,
Ртгт
Параметры решетки, нм
а
0,5767
0,4069
с
0,9544
ЕМ. Гладышевский, О.И. Бодак, В.К. Печарский
676
Np-Pu
Np-Pu. НЕПТУНИЙ-ПЛУТОНИЙ
Диаграмма состояния Np-Pu исследована методами термического,
дилатометрического и рентгеновского анализов и измерением элек-
электросопротивления сплавов [1]. При исследовании использовали Np с
содержанием 0,34 % (по массе) Са и 0,22 % (по массе) U; Pu с содержанием
<0,01 % (по массе) всех примесей. Расчетным путем с использованием
метода Л. Кауфмана диаграмма состояния этой системы построена в
работе [2].
На рис. 342 приведена обобщенная диаграмма состояния Np-Pu
согласно обзору [3]. При ее построении авторы работы [3] использовали
данные работы [1], а также более поздние литературные данные по
характеру взаимодействия Np и Pu и кристаллическим структурам
образующихся фаз.
Минимум линий солидуса и ликвидуса соответствует 558 °С и 46 %
(ат.) Pu.
В системе между (yNp) и (еРи) образуется непрерывный ряд твердых
растворов (yNp, ePu). Ограниченные твердые растворы образуют
остальные модификации Np и Pu:
Pu, '/а (по массе)
.0 to 10 30 #0 SO 60 П
so too
600
(SPul
ЧХРи)
то
о to го зо (to so 60 то во so too
Up Pu,'/<,(am) Pu
Рис. 342. Np-Pu
Np-Pu
677
Фаза
Концентрация,
Pu % (ат)
(PNp) (aNp) E'Pu) FPu) (yPu) (PPu) (aPu)
0-10 0-19 97,6-100 98,3-100 98,3-100 15-100 4-100
В интервале концентраций 51-97 % (ат.) Pu существует фаза ц,
образующаяся по перитектоидной реакции и распадающаяся по
эвтектоидной реакции Кроме того, в системе протекают еще три
перитектоидные и три эвтектоидные реакции. Нонвариантные реакции,
протекающие в системе, указаны в табл. 275.
Данные по кристаллической структуре фаз, имеющихся в системе,
приведена в табл. 276.
Таблица 275 Нонварнантные реакции в системе Np-Pu PJ
Реакция
(yNp, ePu) + (PNp) = (pPu)
(yNp, ePu) + (pPu) - t|
(yNp, ePu)» t|+ F'Pu)
FPu) = r| + FPu)
11 + FPu) - (yPu)
(PNp) + (PPu) - (aPu)
11 - (PPu) + (YPu)
(PNp) » (aNp) + (aPu)
22,
66,
95,5,
97,6,
97,1,
5,0,
96,5,
1,6,
Содержание Pu
в фазах, % (ат.)
Ю,
47,
94,5,
95,
99,4,
38,5,
95,5,
1,0,
15
51
97,8
98,3
99,0
25
98,3
4,0
Температура, °С
540
508
440
428
325
300
288
275
Таблица 276 Кристаллическая структура соединений системы Np-Pu |3|
Соеди-
Соединение
(YNp)
(PNp)
Прото-
Прототип
W
pNp
Символ
Пирсона,
пргр
/mini
tP4,
/J42,2
Параметры решетки, нм
а
0,352
0,4897
Ь
-
-
с
-
0,3388
Примечание
При 600 °Си0%(ат) Pu
При 313 °С и 0%(ат) Pu
678
Np-Pu, Np-S
Соеди-
Соединение
(«Np)
4
I
(ePu)
F'Pu)
FPu)
(YPu)
(PPu)"
(ocPu)*"
Прото-
Прототип
aNp
-
W
In
Cu
yPu
PPu
aPu
Символ
Пирсона,
пр.гр.
oPS,
Pnma
-
Iniim
til,
lAlmmm
cF4,
Fm 3 m
oFb,
Fddd
m/34,
121m
тР16,
P2{/m
Орторомбическая.
"p = 92,13°.
*"p= 101,79°.
Параметры решетки, нм
a
0,6663
1,086
0,3638
0,3339
0,46370
0,31587
0,9284
0,6183
b
0,4723
1,067
-
-
-
0,57682
1,0463
0,4822
с
0,4887
1,043
-
0,4446
-
1,0162
0,7859
1,0963
Примечание
При20°Си0%(ат.) Pu
При 375 "Си 81 %(ат.)Ри
При 500 'С и 100%(ат.)
Ри
При 477 "С и 100%(ат.)
Ри
При 320 °С и 100%(ат.)
Ри
При 235 'Си 100%(ат.)
Ри
При 190 °С и 100%(ат.)
Ри
При 21 "Си 100%(ат.)Ри
Литература
1. MardonP.G.,Pearce J.H., MarpksJ.A.C.//J. Less-Common Met. 1961. V. 3. P. 281-292.
2. ChaHK.S., Lu J.K., AronssoHH.//J Nucl. Mater. 1980. V. 92. N 2-3. P. 237-242.
3. Sheldon R.J., Peterson D.E. // Bull. Alloy Phase Diagrams. 1985. V. 6. N 3. P. 215-217
Е.И. ГлаОышевский. ОМ. Бодак. В.К. Печарскип, М.А. Тылкшш
Np-S. НЕПТУНИЙ-СЕРА
В работе [1] сообщается о пяти сульфидах, имеющих место в системе
Np-S: NpS3, Np2S5, Np3S5, Np2S3 и NpS.
Соединение Np2S3 существует в трех модификациях: а, р и у, которые
переходят друг в друга соответственно при температурах 1200 °С (а °
Np-S. Np-Se
679
» P) и 1500 °C (P - у)- Модификации aNp2S3, PNp2S3, yNp2S3 изоморфны
модификациям aU2S3, PU2S3 и yU2S3. В работе [2] указывается о
существовании в системе соединения Np3S4-
Кристаллическая структура соединений приведена в табл. 277.
Таблица 277. Кристаллическая структура соединений системы Np—S
Соедине-
Соединение
Nps;1
Np,S5
NpjSJ
NpS
NP3S4
*' Р = 99
Прототип
US3
Th2S5
U3S5
NaCe
-
5°
Символ
Пирсона,
пр.гр.
-
iPU,
РЦп
оРП,
Рппш
cFb,
Fm 3 m
-
Параметры решетки, им
а
0,536
0,740
0,742
0,5532
0,844
b
0,387
-
0,807
-
-
с
1,810
0,984
1,171
-
-
Источник
[1]
[1]
[1]
[1]
[2]
Литература
1. Marcon J.P.//Compt. Rend. Acad. Sci. Paris. Ser. С 1967. V. 256. N 4. P. 235-237.
2 Самсонов Г.В., Дроздова СВ. // Сульфиды. М.: Металлургия, 1972. 304 с.
Np-Se. НЕПТУНИЙ-СЕЛЕН
Н.И. Никитина
В работе [1] сообщается о попытке приготовления сплава Np с Se. Оба
компонента помещали в кварцевую ампулу, которую вакуумировали и
нагревали при 750 °С в течение 16 ч. Соединения Np с Se этим методом
получить не удалось.
Литература
I Shcft I., Fried S. // J Amer. Chem. Soc. 1953. V. 75. N 5. P. 1236-1237
H И. Никитина
680 Np-Si, Np-Te. Np-U
Np-Si. НЕПТУНИЙ-КРЕМНИЙ
Диаграмма состояния Np-Si не построена. Установлено существова-
существование соединения NpSi2 с тетрагональной структурой типа ThSi2 (Символ
Пирсона г/12, np.rp. Hxlamd), параметры решетки: а - 0,397 нм, с =
= 1,37 нм [1,2].
Литература
1 Zachariasen W.H. //Acta Crystallogr. 1949. V. 2. P. 94-99.
2 Sheft I., Fried S.//J Amer. Chem Soc 1953. V. 75. N5 P 1236-1237
Н.И Никитина
Np-Te. НЕПТУНИЙ-ТЕЛЛУР
Для приготовления сплава Np и Те помещали в кварцевую ампулу,
которую вакуумировали, запаивали и нагревали до 750 °С в течение 16 ч.
Соединения Np с Те получить этим методом не удалось [1].
Литература
l.Shertl., Fried S.//J. Amer Chem. Soc. 1953 V. 75 N 5 P 1236-1237.
Н.И. Никитина
Np-U. НЕПТУНИЙ-УРАН
Диаграмма состояния Np-U (рис. 343) построена по данным работ
[1, Э]. Исследование проводилось методами термического, дилатометри-
дилатометрического, металлографического и рентгеновского анализов. Сплавы
готовили растворением U в расплавленном Np. Для приготовления
сплавов использовали Np чистотой 99,44 % (по массе) и U чистотой более
99,9 % (по массе). Высокотемпературные модификации (yNp) и (yU)
образуют непрерывный ряд твердых растворов. Модификации р и a Np
и U образуют ограниченные твердые растворы. Твердые растворы (PNp)
и (PU) распадаются по эвтектоидным реакциям с образованием (aNp)
и (aU) соответственно при температурах 185 и 645 °С.
Максимальная растворимость U в (PNp) и Np в (PU) около 26 % (ат.).
Растворимость U в (aNp) при температуре 185 "С составляет около 20 %
(ат.), а Np в (aU) - 43 % (ат.) при -100 °С. При температуре 668 °С в
системе Np-U по перитектоидной реакции образуется промежуточная
Np-U, O-Os
681
t,'C
го
U, '/а (по массе)
40 60
80
900
TOO
639'
576
500
300
гво°
ТОО
— и»
(рн
/
Р) 1
1
1
у
Ж
612°
7ге/
1
185
¦
в
О
(хл
_—¦
у^
^--
/
/ /
К
I
л
i
*/
(ЛО
^—
/
100
1135е
776'
ббв"
О 10 20 30 40 50 60 70 80 90 100
Up If, "/•> (am.) V
Рис. 343. Np-U
фаза б. Фаза б имеет широкую область гомогенности. Структура фазы
кубическая, а = 1,055 нм при 25 % (ат.) U и а = 1,063 нм при 50 % (ат.) U.
Эта фаза изоструктурна с фазой С системы Pu—U. Указывается, что при
температуре 500 °С кубическая решетка претерпевает тетрагональное
искажение [Э].
Литература
1 Mardon P.G., Pierce J.H. // J Less-Common Met 1959. V 1. P. 467-475
H И Никитина
O-Os. КИСЛОРОД-ОСМИЙ
По данным работ [Ш, 1] в системе существуют оксиды OsO2 и OsO4.
Точка плавления OsO4 составляет 40,1 °С [Ш] и 40,6 "С [1], температура
кипения 131 "С [1]. Температура разложения OsO2 -650 °С [1].
682 O-Os, O-Pa
OsO2 обладает тетрагональной структурой типа рутила (символ
Пирсона tP6, пр.гр. Р42/тпт), параметры решетки: а - 0,452±0,002 нм,
с = 0,32010,002 нм.
OsO4 имеет моноклинную структуру, параметры решетки: а -
= 0,866 нм, b = 0,452 нм, с = 0,475 нм, р = 117,9° [III].
Литература
I. Благородные металлы: Справочник/Под ред. Е.М.Савиикого. М.: Металлургия, 1984
592 с.
В П Полякова
О-Ра. КИСЛОРОД-ПРОТАКТИНИЙ
В системе О-Ра установлено существование нескольких оксидов Ра
[Э,Ш, 1-3].
РаО имеет структуру типа NaCl (символ Пирсона сР2, пр.гр. Рт Ът)
с параметром решетки а = 0,4961C) нм [Э, 1].
РаО2 обладает структурой флюоритного типа (символ Пирсона cF\ 2,
пр.гр. Fm3m) с параметром решетки а - 0,5505A) нм Р, 2], получен
восстановлением Ра2О5 в Н2 при температуре 550 "С [2].
Ра,О5 в зависимости от способов получения обладает различной
структурой. Ра2О5, полученный нагревом гидроокиси Ра до 500 °С на
воздухе, имеет структуру флюоритного типа с параметром решетки а -
= 0,5455G) нм. При воздействии B2F5 на окись Ра при 500 °С получен
оксид Ра2О5 с ромбической структурой, изоморфной U2O5 с параметрами
решетки а - 0,692B) нм, 6 = 0,402A) нм, с = 0,418B) нм [Э, 2]. После
нагрева в вакууме до 1000-1500 "С структура Ра2О5 изменяется на
тетрагональную с параметрами решетки а - 0,3835A) нм, с = 5573A) нм,
а после нагрева до 1800 °С Ра2О5 имеет опять кубическую структуру с
параметром решетки а - 0,5476A) нм [2]. Для тетрагональной структуры
этого оксида, обедненного кислородом (Ра2О5_х), в работе [Ш]
приводятся следующие значения параметров решетки: а - 1,0891A) нм,
с= 1,3225A0).
Идентифицирован также оксид с гексагональной структурой,
которому приписывается формула Ра4О9. Параметры решетки этого
оксида: а = 0,3820A) нм, с = 1,3225A0) нм [Ш].
Указывается также на возможность образования еще четырех оксидов
междуРаО2и Ра2О5 в процессе абсорбции кислорода при 200-300 °С.
O-Pa, O-Pb
683
Один из полученных оксидов, по-видимому, будет обладать кубической
структурой, а три оксида - тетрагональной структурой [Ш, 3].
Литература
1. Zachariasen W.H. // Acta Crystallogr. 1952. V. 5. P. 19-20.
2. Sellers P.A. // J. Amer. Chem. Soc. 1954. V. 76. P. 5935-5938.
3 Фромм Е., Гебхардт Е. Газы и углерод в металлах: Пер. с нем. / Под ред. Б.В. Лин-
чевского. М.: Металлургия, 1980. 712 с.
Л. Л. Рохлин
О-Pb. КИСЛОРОД-СВИНЕЦ
Анализ исследования кристаллической структуры фаз, образующихся
в системе О-Pb, их термодинамических свойств и фазовых равновесий
приведен в работе [1]. Обобщенная диаграмма состояния этой системы
(рис. 344) со стороны РЬ [1] дополнена данными справочника [Ш] по
стабильности оксидов РЬ в зависимости от давления кислорода.
Установлен способ образования лишь одного оксида РЬО. Он
плавится конгруэнтно при 887 "С. Остальные оксиды при повышении
температуры разлагаются: температуры разложения зависят от давления
О в пределах 0,1-1000 МПа. Изобары О показаны на рис. 344 штриховы-
штриховыми линиями.
о.'/а 1по массе)
0
t,°c
SOO
чао
327,502'
200
1
OfiS
0,013
-«////
1
2 3
\ i
~872°
-5fO'
~327"
5 6
4S.S
1
1
6 10 12
1 I
двг, ,
ffS
-2-1
кг \L".
t
\fftg0\\
L
д
ч
О 10
РЬ
Рис. 344. О-РЬ
20 30 W
О'/с (am.)
SO
60 70
684
О-РЬ
В системе обнаружено существование следующих нонвариантных
равновесий: вероятно, Ж - (РЬ) + РЬО(НТ) при температуре -327 °С,
практически не отличающейся от температуры плавления РЬ, и
концентрации О =10 % (ат.); Ж2 - Ж, + РЬО(ВТ) при -872 "С с
монотектической точкой при 49,9 % (ат.) О.
Данные растворимости О в жидком РЬ приведены ниже [Ш]:
Температура, °С
Растворимость О, %
400 500 510 595 600 700 800 900
0,01 0,03 0,01 0,03 0,06 0,12 0,23 0,50
По данным, приведенным в работе [1], растворимость О при 540 °С
составляет 0,013 % (ат.), а при 872 °С - 0,85 % (ат.).
При атмосферном давлении стабильны пять оксидов: РЬО, РЬ3О4,
РЬ12О17,РЬ12О19,РЬО2[1].
Фаза РЬО существует в двух модификациях и стабильна при
температуре ниже 540±50 °С. Большая неопределенность в температуре
полиморфного перехода обусловлена чрезвычайной замедленностью
этого перехода.
Фаза РЬ3О4 также обнаружена в двух модификациях, температура
перехода составляет - 103 "С.
Указанная в справочнике [Ш] фаза РЬ2О3 согласно обзору [1]
существует лишь при давлении более 0,2 МПа.
Кроме того, в системе имеется еще несколько метастабильных оксидов
фаз, в некоторых случаях стабилизированных примесью водорода при
их электрохимическом получении.
Кристаллическая структура соединений приведена в табл. 278.
Таблица 278 Кристаллическая структура соединений системы РЬ-О [1]
Соединение
РЬО(ВТ)
РЬО(НТ)
РЬ3О4(ВТ)
РЬ3О4(НТ)*
Прототип
РЬО
РЬО
РЬ3О4
РЬ3О4
Символ
Пирсона,
пргр
JP4,
РШтт
о/"8,
РЬта
tPlb,
РЛ-Jmbc
о/>28,
РЬат
Параметры решетки, нм
а
0,39759
0,5489
0,8815
0,9124
Ь
-
0,4755
0,8467
с
0,5023
0,5891
0,6565
0,6567
O-Pb. O-Pd
685
Соединение
Pbl20l7
рь,2о,у
PbO,
Pb2o;"
Прототип
-
-
ТЮ2
-
Символ
Пирсона,
пргр
oPSZ,
Pmc2tC>)
тРЫ,
lP6,
PA-Jmnm
thP20,
Plja
*При-268°С
"f = 91,08°
РЬ2ОЧ существует при давлении более 0,2
Параметры решетки, им
а
0,778
1,1500
0,49556
0,7814
b
1,098
1,0843
-
0,5625
с
1,148
0,7730
0,33867
0,8466
МПа, р= 124,8°
Литература
1 Wriedt Н.Р.//Bull Alloy Phase Diagrams 1988 V 9 N2 P 106-127
Л С Гузей
O-Pd. КИСЛОРОД-ПАЛЛАДИЙ
В системе O-Pd образуется оксид PdO, который находится в
равновесии с (Pd) при температуре 750 "С [Ш, 1].
PdO обладает тетрагональной решеткой (пр.гр. PAjImmc) с двумя
атомами на элементарную ячейку и параметрами а = 0,303510,0005 нм,
с - 0,532510,0005 нм (Э]. Растворимость О в (Pd) при 1200 °С составляет
- 0,63 % (ат.) [Ш] и 0,5 % (ат.) [2].
Растворимость О в Pd в твердом состоянии в интервале температур
900-1300 ° исследована методом насыщения в атмосфере кислорода
(давлении 6,65-10 МПа) и на воздухе [3].
Изобарическая растворимость О в Pd уменьшается при повышении
температуры и подчиняется закону Сивертса.
' Изобарическая растворимость О в Pd описывается уравнением.
LgCo = 0,5, LgPo - 3,5 + 920/Г,
686
O-Pd. O-Pm
где Со - растворимость О, % (ат.); Ро - парциальное давление О, Т -
температура, К.
Литература
1 Благородные металлы Справочник/Под ред. Е М. Савицкого. М.: Металлургия, 1984.
592 с
2 Fromm E., Gebhardt Е. // Gase und Kohlenstoff in Metallen. New York: Springer Verlag
Berlin Heidellerg, 1976.710 р.
3. Jehn H., Grallath E. // Precious Metals: Mining. Extr. and Process. Proc Int. Sympo AYME
Annu. Meet. Loss Angeles. Calif. Febr. 27-29. 1984. Warrendale. Pd. 1984. P. 595-602.
В П. Полякова
O-Pm. КИСЛОРОД-ПРОМЕТИЙ
В работах [1-4] указывается о существовании в системе O-Pm
соединения Рт2О3.
Рт2О3 имеет три полиморфные модификации со структурами:
кубической (А-форма), моноклинной (В-форма), гексагональной
(С-форма). Переход из моноклинной в гексагональную имеет место при
1600 °С [1]. Температура плавления Рт2О3 равна 2320 "С [2]. Кристалли-
Кристаллическая структура трех модификаций Рт2О3 приведена в табл. 279.
Таблица 279. Кристаллическая структура соединений системы O-Pm
Соедине-
Соединение
Ргл,О3
(С-форма)
рш2о;
(В-форма)
Рт2О3
(А-форма)
*р= юо
Прото-
Прототип
Мп,О3
SrrijOj
Lap,
,5°
Символ
Пирсона,
пр.гр.
с№,
1а 3
тСЗО.
С21т
hPS,
Plm\
Параметры решетки, нм
а
1,096
1,099
1,425
0,3802
Ь
_
0,366
_
с
_
0,893
0,5954
Источник
[Ш]
[31
[1]
[1]
О-Рт, О-Ро, О-Рг 687
Литература
1. Weigel F., Scerer U. // Radiochim. Acta. 1965. V. 4. N 2. P. 197-201.
2. Chikalla T.D., McNeily C.E., Bates J.L., et. al. // Collogue Intern. CNRS N 205. Paris:
Edition CNRS. 1972. P. 351-360.
3. FoexM., Traverse J.P., CouturesJ.P.//Compt. Rend. Acad Sci Paris. Ser. С 1965. V. 260.
N 13. P. 3670-3672.
4. Фромм Е., Гебхард Т.Е. // Газы и углерод в металлах. Пер. с нем / Под ред.
Б.В. Линчевского. М.: Металлургия, 1980. 712 с.
Ю.Б. Кузьма
О-Ро. КИСЛОРОД-ПОЛОНИЙ
В работах [1, 2, Э] установлено образование оксида РоО2.
РоО2 существует в двух модификациях, одна из которых имеет
структуру типа CaF2 (символ Пирсона cF\ 2 пр.гр. Fm Ът) с параметром
решетки а = 0,599 нм [1] или а = 0,5637 нм [2], а другая - тетрагональную
структуру с параметром решетки а = 0,545 нм, с = 0,836 нм [Э, 2]. РОО2
сублимирует при 885 °С в кислороде при давлении 0,1 МПа и разлагается
на элементы при 500 °С в вакууме [Ш]. Имеются указания об образова-
образовании оксидов РоО и РоО3. Оксид РоО, однако, склонен к быстрому
окислению на воздухе до РоО2, а относительно существования окисла
РоО3 высказывается сомнение [Ш].
Литература
1. Martin A.W.//J. Phys. Chem. 1954 V. 58. P. 911-913.
2. Bagnall K.W., D'Eye R.W.M. // J. Chem. Soc. 1954. V. 4. P. 4295-4299.
JJ.JJ. Рохлин
O-Pr. КИСЛОРОД-ПРАЗЕОДИМ
Данные о характере взаимодействия О и Р сообщаются в работах Р,
Ш, 1-6].
Диаграмма состояния части системы Рг-0 в интервале концентраций
62-67 % (ат.) О приведена на рис. 345 по данным работы [1]. В этой части
системы установлены семь соединений. При концентрациях О < 62 % (ат.)
вид диаграммы не известен. Однако установлены два соединения РЮ и
Рг2О3
Соединение РЮ получено при давлении 1,5 ГПа и температурах
600-800 °С [V-C].
Температура плавления Рг2О3 по данным разных исследователей
колеблется от 2127 до 2296 °С [3, 4]. Соединение Рг2О3 существует в
нескольких полиморфных модификациях: низкотемпературных -
688
O-Pr
/6
О, "/о/по массе)
t7 Гв
1000
800
6OO
UO0
ZOO
62
65 66
O, Vofdm.)
67
Рис. 345. O-Pr
гексагональной (А-форма), моноклинной (В-форма), кубической
(С-форма) и высокотемпературных - гексагональной (Н-форма),
кубической (Х-форма). Полиморфные превращения Рг2О3 протекают при
температурах 650 "С (ОА), 810 °С (В^А), 1950 °С (А^Н), 2150 °С (Н-Х)
И-
Кристаллическая структура соединений приведена в табл. 280.
Таблица 280. Кристаллическая структура соединений системы О-Рг
Соединение
о
Р. О*1
Рг2О,(С)
Прототип
Мп2О3
-
Мп2О3
Символ
Пирсона,
пргр
с/80,
la i
-
с /80,
1а %
Параметры решетки, нм
а
1,1070
0,5031
1,1115
b
-
-
-
с
-
-
-
Источник
[Ш]
[V-C]
[3]
O-Pr
689
Соединение
Pr2O,(B)
Рг,О,(А)
Р2О3(Н)*2
Р2ОЯ(Х)*'
рго,;;5
рг7о,;5
рг,о,Г
рг5о;5
¦ ргно;«
(Рг|2022)(Р)
РгО2(а)
Прототип
SmO3
La,O3
-
-
-
Pr7O12
-
Рг5О9
-
-
CaF2
Символ
Пирсона,
пргр
СУт
ИР5,
/>3ml
-
-
-
АЯ19,
ЯЗ
-
тР\\2,
-
Рп
сЛ2,
Fmlm
''Кубическая сингония
*2Гексагоиальная сингония
а = 99,91°
4Триклинная сингония а = 97,3°, р =
*5Р= 125,46°
*6Монокли»ная сичгония, р= 125,2°
Моноклинная сингония, р = 125,28
Параметры решетки, нм
а
1,445
0,385
0,3975
0,441
1,1070
0,67431
0,65
0,6728
0,67
0,5462
0,6687
0,53938
b
0,3720
-
-
-
-
-
0,84
1,9319
4,25
1,1602
99,6°, у = 75,0°
с
0,9090
0,600
0,631
-
-
-
0,65
1,5480
1,55
1,5470
Источник
[4]
[3]
[3]
[2]
[Ш]
[5]
[2]
[1]
[1]
р]
[6]
[Э]
Литсра1\ра
I luring L. // Handbook on the Physice and Chemistry oi" Rare Earths Amsterdam ea.
NoiHi -Holland Publ Co 1979 V 3 337 p
690
O-Pr, O-Pt
2. Арсеиьев П.А., Ковба Л.М., Багдасаров Х.С. // Соединения редкоземельных элементов.
I-II1 групп. М.: Металлургия, 1988. 280 с.
3. Портной К.И., Тимофеева Н.И.// Кислородные соединения редкоземельных элемен-
элементов. М.: Металлургия, 1986. 480 с.
4. Daire M., Wilier В. // С. R. Acad. Sci. 1968. V. С266. N 8. P. 548-550.
5. Dreele von R.B., Eyring L., Bowman A.L., Yarnell J.L. // Acta CrystaHogr. B. 1975. V. 31.
N4. P. 971-974.
6. Sawier J.O., Hyde B.C., Eyring L. // Bull. Soc. Chim. France. 1965. N 4. P. 1190-1199.
Ю.Б. Кузьма
O-Pt. КИСЛОРОД-ПЛАТИНА
Диаграмма состояния O-Pt не построена. Кристаллическая структура
оксидов Pt-PtO, Pt3O4 и PtO2 приведена в табл. 281. Данные по
кристаллической структуре и параметрам решетки довольно противоре-
противоречивы, что связано с различием в составе и различием условий приготов-
приготовления образцов. Существование оксида PtO, о котором сообщалось в
работе [Э], в работе [1] подвергается сомнению. Предполагается, что
образцы PtO не были однофазными и содержали смесь РЮ2, ^ЦО^ и Pt.
Pt3O4 является неустойчивым оксидом и разлагается при нагреве на Pt
иО2р].
В работе [1] построена р-Т диаграмма на основе результатов
исследования системы O-Pt при высоких давлениях О (до 350 МПа) в
области температур 400-900 "С. Фаза РЮ2, описанная в работе [Э],
образуется при температурах ниже 580 °С и давлениях кислорода
порядка 100-200 МПа. При температурах выше 580 °С и высоких
давлениях кислорода образуется новая фаза с ромбической решеткой
(pPtO2), существование которой подтверждено также в работе [2].
Таблица 281. Кристаллическая структура соединений системы O-Pt
Соединение
PtO?
Р4О4
aPtO2
Прототип
PtS
Cdl2
Символ
Пирсона,
пр.гр
1Р4,
PVmmc
IP28,
или
c?14,
Pniin
A/>3,
/>3ml
Параметры решетки, им
a
0,305
0,798
0,5585
0,310
Ь
-
-
-
с
0,535
0,544
-0,48
Источник
Р]
[Э]
[I]
[Э]
O-Pt, O-Pu
691
Соединение
aPtOj"
ppto2
Прототип
СаС12
Символ
Пирсона,
пргр.
оР6,
Рппт
Гексагональная сингония.
Параметры решетки, нм
а
0,310
0,4486
0,4488
Л
0,4537
0,4533
с
0,429-0,441
0,3138
0,3135
Источник
[1]
[1]
[2]
Литература
1 lYIuller О., Roy R. //J Less-Common Met. 1968. V. 16. N 2. P. 129-146
2. SicglS., HockstraH.R.,TaniB.S.//J. Inorg. Nucl Chem. 1969. V 31. N 12. P. 3803-3807.
Л.Е Шелимова
O-Pu. КИСЛОРОД-ПЛУТОНИЙ
Диаграмма состояния O-Pu, представленная на рис. 346, построена
в работе [1] на основе обобщения литературных данных. Согласно работе
О, '/• (по массе)
О Ю 20
Ра
Рис. 346. O-Pu
40 SO
О, '/. (am.)
692
О-Ри
[1] в системе протекает монотектическая реакция при 1825 "С. Область
расслаивания в жидком состоянии простирается от ~8 до -50 % (ат.) О.
В ранних работах ее существование не было отмечено.
В системе образуются четыре промежуточные фазы. Соединение Ри2О3
плавится конгруэнтно при 2080 °С и имеет область гомогенности в
пределах -59,3-60,5 % (ат.) О. Фаза РиО, 52 (-60,3 % (ат.) О) образуется
по перитектической реакции при 450 °С. Фаза РиО( б1 с областью
гомогенности, лежащей в пределах -61,7-63,0 % (ат.) О, превращается
конгруэнтно в РиО2 при 1180 °С и распадается эвтектоидно на РиО[ 52
и РиО2 при 335 "С. Соединение РиО2 плавится конгруэнтно при 2425 iC
и имеет область гомогенности в пределах -61,3-63,0 % (ат.) О. При 630 "С
протекает монотектоидная реакция РиО2B) - РиО, б1 + РиО2A).
Максимальная температура расслаивания составляет 670 "С.
Нонвариантные реакции в системе О-Ри даны в табл. 282.
Т а б л и и а 282. Нонвариантные реакции в системе О-Ри |1|
Реакция
Ж - (ePu) + Ри2О3
(еРи) - F'Ри) + Ри2О3
ИЛИ
(еРи) + Ри2О3 - FРи)
FРи) - FРи) + Ри2О3
FРи) = (уРи) + Ри2О3
(уРи) - фРи) + Ри2О3
(PPu) - (аРи) + Ри2О3
Ж2-Ж, + Ри2Оз
Ри2О3 + РиО, 6| - РиО, 52
РиО2-Ри2Оз + РиО|6|
РиО|6| » РиО, 52+ РиО2
РиО2B) » РиО, 6, + РиО2A)
Ж2 = Ри2О3 + РиО2
~0;
-0;
~0;
~0;
-0;
-0;
-0;
-50;
-60;
-61,6;
-62,0;
-62,9;
-60,5;
Содержание О
в фазах, % (ат.)
-0;
-0;
.-60;
-0;
-0;
-0;
-0;
-8;
-61,9;
-60,5;
-60,3;
-62,8;
-60,0;
-60
-60
-0
-60
-60
-60
-60
-60
-60,3
-62
-66,0
-66,5
-61,3
Температура, °С
-640
-483
-483
-463
-320
-215
-125
-1825
-450
-1080
-335
-630
-2000
O-Pu. O-Rb
693
Данные по кристаллической структуре промежуточных фаз в системе
O-Pu представлены в табл. 283.
Т а б л и и а 283. Кристаллическая структура соединений системы O-Pu
Соединение
Ри2О3
PuO, 52
PuO|,6l
PuO2
Прототип
La2O3
Mn2O3
Mn2O3
CaF2
Символ
Пирсона,
пр.гр.
hP5,
Р3т\
с/80,
Iai
с/80,
1а 3
cF\2,
Fmlm
Параметры решетки, нм
а
0,38388
1,1045
1,0991
0,53952
0,53960
с
0,59594
-
-
-
Источник
И
13]
[1]
[1]
[Э]
Литература
l.WricdtH.A.//Bull. Alloy Phase Diagrams. 1990. V. 11.N2.P. 184-202.
2. Gardner E.R., Markin T.L., Street R.S. // J. Inorg. Nucl. Chem. 1965. V. 27. N 3.
P 541-551.
3. Boivineau J.-C.//J. Nucl. Mater. 1976. V. 60. N 1. P. 31-38.
Л. Е. Шелимова
t.'c
O-Rb. КИСЛОРОД-РУБИДИЙ
По результатам исследования
системы O-Rb методом термического
анализа схематично построена часть
диаграммы состояния Rb-О в интер-
интервале концентраций 0-25 % (ат.) О
(рис. 347) [1].
Взаимодействие Rb с О изучали в
ампулах из пирексовогб стекла в
атмосфере спектрально-чистого Аг,
используя Rb и О чистотой 99,99 %
(по массе) [1].
В системе обнаружена эвтектика
при температуре-14 °С и концентра-
концентрации 10 % (ат.) О и две, возможно, рис. 347. O-Rb
О, % (по массе)
I Z 3 4
-50
Ж
«Я
¦
к
-/¦• \
1
1-
_|_
1
' *. '.
f
h»--i—
—i
i
i
о
10 15 20
0,% (am )
25
694
O-Rb, O-Re
перитектические горизонтали притемпературах-11 и 20 ° С, соответству-
соответствующие температурам инконгруэнтного плавления соединений Rb7O и
Rb4O. Предполагается, что диаграмма состояния Rb-О аналогична по
своему строению диаграмме состояния Cs-0 [1].
Растворимость кислорода в жидком Rb согласно работе [2] выражает-
выражается уравнением:
igx= 1,5753- 93,15/Г,
где х - концентрация Rb, % (ат.), Т- температура, К.
В системе установлено существование соединений: Rb2O, Rb2O2, RbO2
и, возможно, "Rb2O5" Р, Ш]. Соединения Rb2O2 и RbO2 плавятся
примерно при 570 и 412 °С соответственно [Ш].
Данные по кристаллической структуре соединений системы Rb-0
представлены в табл. 284.
Таблица 284. Кристаллическая структура соединений системы O-Rb
Соединение
Rb2O
Rb2O2
"Rb2Os"
RbO2
Прототип
AHTH-CaF2
-
-
CaC2
Символ
Пирсона,
пр.гр.
сЛ2,
Fmim
Immm
г/16,
/4/mmm
Параметры решетки, нм
a
0,6742
0,4201
0,930
0,425
b
-
0,7075
-
-
с
-
0,5983
-
0,704
Источник
[Э]
[Ш]
[Э]
[Ш]
Литература
1. Suzuki Т., MasudaS.,TanazavaY.//J. Nucl. Mater. 1985. V. 127. N 1. P. 113-115.
2. Borgstedt H.U. // Handbook ofThermodynamic and Transport Properties of Alkali Metals.
Oxford: Blackwell Scientific Publications, 1985. P. 901.
Л.Л. Зусмап
O-Re. КИСЛОРОД-РЕНИЙ
Диаграмма состояния O-Re не построена. Известно существование
следующих оксидов Re: ReO4, Re2O7, ReO3, Re2O5, ReO2, Re2O3, ReO и
Re2O, характеризующихся разной устойчивостью [1-3].
O-Re, O-Rh 695
Высший и наиболее устойчивый оксид Re2O7 получают при обработке
металлического Re в кислороде при температуре выше 150 "С. Re2O7
также образуется при окислении на воздухе при температуре выше
600 "С. Температура плавления Re2O7 равна 297 "С. Re2O7 кипит при
360 °С [Э], имеет ромбическую решетку (символ Пирсона оР72, пр.гр.
Рттс) с параметрами а = 1,525; Ъ - 0,548 и с = 1,25 нм [Э].
ReO3 получают восстановлением Re2O7 или химическим способом.
ReO3 быстро разлагается при температуре выше 300 °С на Re2O7 и ReO2.
ReO3 имеет кубическую решетку с параметром а - 0,37510 нм р].
ReO, может быть получен восстановлением высших оксидов
водородом или другими химическими методами, имеет две модификации:
низкотемпературную (г < 300 °С) с моноклинной решеткой с параметра-
параметрами а = 0,5562; Ь - 0,4838; с = 0,5561 нм, р = 120,87 "С и высокотемператур-
высокотемпературную (I = 300-1050 °С) с ромбической решеткой с а = 0,48094, Ъ - 0,56433;
с - 0,46007 нм Р].
Растворимость кислорода в Re незначительна и составляет менее
1,510'2% (по массе) [1,2].
Литература
1. Sims СТ. // Rhenium: Amsterdam, New York: Elsevier, 1962. P 24-35.
2 Фромм Е., Гебхардт Е. Газы и углерод в металлах: Пер. с нем. / Под ред. Б.В. Линчев-
ского. М: Металлургия, 1980. 712 с.
3 Борисова Л.В., Ермаков А.Н. Аналитическая химия рения. М.: Наука, 1974. 316 с.
М.А. Тыпкипа
O-Rh. КИСЛОРОД-РОДИЙ
Диаграмма состояния O-Rh не построена. Rh растворяет значитель-
значительное количество кислорода при высоких температурах Р, Ш]. Элементы
при взаимодействии образуют соединение Rh2O3, которое распадается
при -1100 °С при давлении 0,1 МПа [Ш]. Оксид существует в двух
модификациях. Низкотемпературная модификация имеет структуру
типааА12О3(символПирсонаhR 10, пр.гр. В.Ъс)са = 0,546 нм, а = 55,72°
[Р]. При температуре выше 750 °С эта модификация переходит в
высокотемпературную ГЦК структуру, производную от перовскита [Ш].
В работе [Э] сообщается о существовании летучего оксида RhxO2.
Т.П.Лобода
696 O-Ru. O-Sb
O-Ru. КИСЛОРОД-РУТЕНИЙ
Диаграмма состояния O-Ru не построена. В системе образуется
соединение RuO9, которое имеет тетрагональную решетку типа рутила
(TiO^ (символ Пирсона iP6, пр.гр. P4Jmnm) с параметрами: а = 0,452B),
с = 0,312B) нм по данным [Р], или а = 0,4490E), с = 0,3110E) нм по
данным [Ш].
Соединение RuO2 вступает в реакцию с кислородом при температуре
выше 800 °С, образуя газообразный RuO3 или RuO4 в зависимости от
температуры и давления \Э].
Содержание кислорода в Ru, полученном в результате разложения
RuO при парциальном давлении кислорода -0,034 МПа и 1450 °С
составляет менее 0,4 % (ат.) [Ш].
М В Раевская
O-Sb. КИСЛОРОД-СУРЬМА
Диаграмма состояния O-Sb не построена. Изопиестическим методом
определена растворимость кислорода в жидкой Sb чистотой 99,999 % (по
массе) в интервале температур 722-902 °С [1], которая описывается
уравнением:
lgx = -5500/T+3,754A0,04),
где х - концентрация О, % (ат.), Г- температура, К.
В работах р, Ш] даны составы, температуры плавления, кипения и
разложения оксидов Sb, а также их кристаллическая структура.
Установлено существование соединений: Sb2O3, Sb2O4 (SbOj), Sb2O5 и,
возможно, фазы Sb6O13. Соединение Sb2O3 плавится при 665 "С,
разлагается при - 1380 "С, имеет две модификации. При температуре
выше 570 °С устойчива ромбическая решетка (пр.гр. Рссп) с параметрами
а = 0,493; Ъ - 1,248; с = 0,534 нм, а ниже 570 °С - ГЦК решетка (пр.гр.
Fd3m)ca= 1,115нмР].
Соединение Sb2O4 должно по результатам экстраполяции плавиться
при 1820110 °С и давлении 5,9 МПа. При давлении 0,1 МПа и температу-
температуре 1230 °С этот оксид полностью разлагается на Sb2O3 и кислород. Sb2O4
также имеет две модификации: ромбическую, изоморфную SbTaO4, с а -
= 0,4814; Ъ - 0,5435; с = 1,178 нм Р] и моноклинную, получающую при
нагреве ромбической в токе кислорода при 1130 "С, с а = 1,2060C); Ъ -
- 0,4834B); с = 0,5383B) нм, р = 104,58C)° [Ш]. Оксид Sb2O5 при 525 °С
распадается Ha.Sb,O4 и кислород.
O-Sb, O-Sc
697
Эвтектика из Sb2O3 и Sb2O4 образуется при температуре 650 °С и
концентрации 60,08 % (ат.) О. При температуре 1250 °С и давлении
0,1 МПа О, в жидком Sb2O3 растворяется около 18 % (мол.) Sb,O4
F1,35%(атГ)О)[1Щ
Литература
1 Jacob K.T., MathewP. IIZ Metallkunde 1979 Bd 70 N 6 S 366-371.
В П Полякова
O-Sc. КИСЛОРОД-СКАНДИЙ
На рис. 348 приведен экспериментально исследованный участоь.
диаграммы O-Sc по данным работы [1]. Образцы выплавляли в дуговой
печи в атмосфере Не из окиси Sc с содержанием примесей % (по массе):
< 0,05 Fe, s 0,05 Са, < 0,05 Si, < 0,05 Y, < 0,05 Yb, < 0,1 Th, < 0,05 Ti,
< 0,01 A], 0,01 Mg и Sc с содержанием примесей, % (no массе): < 0,001 Si,
< 0,01 Ti, < 0,01 Al, 0,01 Ca, 0,06 Fe, 0,15 Cu, 0,03 N, 0,1 О и 0,0079 С.
Сплавы, закаленные от 1200, 1000 °С (после выдержки 100 ч), 900 и
700 °С (после выдержки 200 ч), исследовали методами металлографичес-
t.'c
2000
t6O0
О, %fno массе)
fO ff ZO 25 JO
1337-
12О0
800
(fiSc
(dSch
1
1
1
1
1
1
i
. !
\
Ж
(cLSc
1
у
3335
1 *ЗсгО3
1130е
156O" _
$
roo°
о
sc
to
го
зо
<ю
50
6O
Рис. 348. O-Sc
698 O-Sc, OSe, O-Si
кого, рентгенофазового и термического анализов, а также измерения
твердости, микротвердости и термоэлектродвижущей силы.
Кислород повышает температуру плавления Sc от 1541 до > 1600 °С
(при 10 % (ат.) О). По данным работы [1] в системе существует эвтектика
между Sc и Sc2O3 при температуре 1560 °С и концентрации 35 % (ат.) О.
При температуре 1130 ° С обнаружен эвтектоидный распад: (pSc) » (aSc) +
+ Sc2O3. Sc2O3 по данным работы [1] плавится при 2300 °С. По данным
работ Р, Ш] Sc2O3 плавится при 2470150 "С. Оксид имеет ОЦК решетку
типа Мп2О3 (символ Пирсона с/80, пр.гр. la 3) с а = 0,9845B) нм.
Литература
1. КупрашвилиИ.С.,НаумкииО.П.,Савицкий Е.М. // Известия АН СССР. Неорганичес-
Неорганические материалы. 1969. Т.5. N 12. С. 2123-2127.
В. П. Полякова
O-Se. КИСЛОРОД-СЕЛЕН
Диаграмма состояния O-Se не построена. Установлено существование
трех оксидов: SeO2, Se2O5 и SeO3 с температурами плавления: 315-317 °С,
224 и 118 °С соответственно [Ш].
SeO2 имеет тетрагональную решетку (символ Пирсона tP24, пр.гр.
РЫтЬс) с параметрами: а = 0,8353E),с = 0,5051 A0) нм. SeO3кристаллизу-
SeO3кристаллизуется в тетрагональной решетке (пр.гр. Р42, с) с параметрами: а -
- 0,9636E), с = 0,528B) нм [Ш].
Тройная точка SeO3 соответствует 121 °С и 715 Па \Щ\. При нагреве
до 175 °С жидкий SeO3 разлагается с образованием Se2O5, при температу-
температуре выше 175 °С получается SeO2.
Л. С. Гузей
O-SL КИСЛОРОД-КРЕМНИЙ
Диаграмма состояния O-Si (рис. 349) построена в интервале
концентраций 0-66,7 % (ат.) О в работе [1] на основе обобщения
литературных данных. Представленная диаграмма согласуется с ранее
построенной в работе [2]. В работе [2] система была изучена методами
микроструктурного и рентгенофазового анализов сплавов, закаленных
с различных температур в области 1375-1710 °С.
В системе существует обширная область расслаивания в жидком
состоянии. Температура монотектической реакции отвечает 1703 °С по
O-Si
699
0
1600
1Ш
1200
torn
too
400
0.Z
0.04
V.ijOJ
-№>
-b'tO'5
•z*to3-
0, % (no массе)
10 ZO JO «G 50
~I7O3'
-1470'
-070'
o
1
i
<SS,7
(крисяговаяит
SiOt
'mpuduf
с
A
mm)
sio\
SiOt
0 10 ZO JO 40 50 SO
Si 0, V. (am.)
Рис. 349. O-Si
sh
SSI
SS
SB
J
7
70
данным работы [1] и 1700 °C по данным работы [2]. При 1417 "С [1}
A405 °С [2]) происходит кристаллизация эвтектики Si + SiO2 (тридимит).
Никаких других промежуточных фаз, кроме SiO2, в системе не было
обнаружено [1, 2]. Имеются сведения о существовании целого ряда
метастабильных фаз в системе O-Si, данные о которых обобщены в
работе [1].
Растворимость кислорода в твердом Si была определена с помощью
метода ИК-спектроскопии [Э] и представлена ниже:
Температура, °С
Растворимость О, % (ат.)
1412
3,4 10 3
1250
п-3
1100
1,8-10"-* 810"
1000
4-Ю
Данные о некоторых полиморфных модификациях SiO2 представлены
в табл. 285. Четыре из них (pSiO2, aSiO2, тридимит и кристобалит)
устойчивы при нормальном давлении. Превращение aSiO2 » SiO2 (коэзит)
происходит при давлении 1,8-2,0 ГПа и температуре 500 °С [Ш].
Стишовит образуется при давлении 16-18 ГПа и температурах
1200-1400 "С Р].
700
O-Si, O-Sm
Таблица 285. Кристаллическая структура соединений системы O-Si
Соедине-
Соединение
pSiO2
aSiO2
SiO2
(триди-
мит)
SiO2
(кристоба-
лит)
SiO2
(коэзит)
SiO2
(стишо-
вит)
Прото-
Прототип
psio2
aSiO2
SiO2
SiO2
SiO2
TiO2
Символ
Пирсона,
пр.гр.
hP9,
«,21
или
/>3221
hP9,
P6266
или
/>6422
hP\2,
Pb-Jmmc
cf24,
Fdlm
mC48,
Cllc
tP6,
Pijfmnm
Параметры решетки, нм
a
0,49132
0,491265G)
0,4998
0,5046
0,71315
0,7137
0,4176
b
~
—
1,2370
с
0,54049
0,540441E)
0,5461
0,8236
—
0,7174
0,2666
Примечание
< 574 °C
[1]
[4]*
574-870 • С
[1]
870-1470"С
[1]
1470-1726 °С
[1]
При давлении
2ГПа,
Р= 120,33° [1]
При давлении
18ГПа[3]
Значения параметров решетки для эталонного особо чистого природного кварца
получены при 18±2 °С [4]
Литература
1. Wriedt H.A. // Bull. Alloy Phase Diagrams. 1990. V. 11. N 1. P 43-61.
2. Johnson R.E., Muan A.//J. Amer. Ceram. Soc. 1968. V. 51. N 8. P. 430-433.
3 Стишов СМ., Белов Н.В. // Доклады АН СССР. Т. 143. N 4. С. 951-954.
4. Франк-Камеиецкий В.А. // Кристаллография. 1960. Т. 5. N 4. С. 650-654.
Л.Е. Шишлова
O-Sm. КИСЛОРОД-САМАРИЙ
Диаграмма состояния O-Sm изучена в ограниченной области составов
[Э]. В интервале концентраций 0-22,5 % (ат.) О кривые ликвидуса и
O-Sm
701
солидуса очень близки к горизонтали при 1070-1080 "С. Соединение SmO
образуется при 625 °С по перитектоидной реакции [Э]. Температура
плавления Sm2O3 составляет 2350±50 °С [Ш]. Оксид Sm2O3 существует
в пяти полиморфных формах (А, В, С, Н, X). Переход С » В происходит
при 875 "С, В - А при 1830 °С или 1920 "С, А » Н при 2100 °С или
2130 °С и Н - X при 2280 °С [1].
В работе [Э] сообщается о существовании промежуточной фазы
SmO0,4-0,6-
Температура полиморфного превращения Sm повышается от 930 до
1000 °С при увеличении содержания кислорода [Э].
Данные по кристаллической структуре соединений системы O-Sm
представлены в табл. 286.
Таблица 286. Кристаллическая структура соединений системы O-Sm
Соедине-
Соединение
SmO04_06
SmO
Sm2O3(C)
Sm2O3(B)
Sm2O3(A)
Sm2O3(H)*
Sm2O3(X)
Прототип
ZnS
NaCl
Mn2O3
Sm2O3(C)
Sm2O3(B)
La2O3
-
-
Символ
Пирсона,
пргр.
cF8,
/•3/w
cFS,
Fmim
c/80,
/2,3
-,
hP5,
/>3ml
-
Iniim
'Гексагональная сингония
Параметры решетки, нм
a
0,53698-
0,53790
0,49883
1,0934-
1 0928
1,093
1,4177
1,411
0,3778
0,3905
0,434
b
-
-
-
-
0,3633
0,362
-
-
-
с
-
-
-
-
0,8847
0,8-25
0,5940
0,6215
—
Примечание
PI
P]
PI
[2]
P = 99,96°
PI
P = 98,93°
ra
[4]
[31
[1]
702
O-Sm, OSn
Литература
1. Арсеньев П.А., Ковба Л.М., Багдасаров Х.С. и др. Соединение редкоземельных
элементов. Системы с оксидами элементов I—III групп. М.: Наука, 1983. 280 с.
2. Завьялова А.А., Имамов P.M., Рагимли Н.А., Семилетов С.А. // Кристаллография
1976. Т. 21. N4. С. 727-729.
3. Портной К.И., Тимофеева Н.И. Кислородные соединения редкоземельных элементов.
М.: Металлургия, 1986. 480 с.
4. Gouteron J., Michel D., Lejus A.M., Zarembowitch J. // J. Solid State Chem. 1981. V. 38.
N 3. P. 288-296.
Ю.Б, Кузьма
O-Sn. КИСЛОРОД-ОЛОВО
Диаграмма состояния O-Sn в интервале концентраций от Sn до SnO2
была впервые построена в работе [1], где сообщалось о существовании
оксидов: SnO (устойчивом в интервале температур 1040-1800 °С), Sn3O4
и SnO, (с температурами плавления и кипения 2000 и 2500 °С соотве-
О, % /м> массе) »
,0 0,5 Г Z в ГО Т2 П t6 t820
5О 60
Рис. 350. O-Sn
O-Sn, O-Sr 703
тственно). В других работах существование Sn3O4 не подтвердилось [X].
В работе [2] показано, что SnO превращается в Sn и SnO2 после нагрева
175 °С. На основе закалочных экспериментов сделан вывод о существова-
существовании молекул SnO в расплаве при температурах выше 1080 "С. В
противоречии с остальными работами в работе [3] для плавления SnO2
указана температура 1630±5 "С.
На рис. 350 приведена диаграмма состояния O-Sn в интервале
концентраций от Sn до SnO2, построенная по данным термического,
химического и рентгеновского анализов и на основании критического
анализа литературных данных [4]. Для получения сплавов, которые
готовили в атмосфере Аг в тиглях из А12О3, использовали Sn чистотой
99,96 % (по массе), SnO и SnO2 высокой частоты. Отжиг проводили при
температурах 380-1030 °С в течение 72-120 ч с последующей закалкой
в воде. Погрешность определения температур критических точек
составила ±B-4) "С.
По данным работы [Э] SnO красного цвета имеет ромбическую
решетку (символ Пирсона оР16) с параметрами а = 0,500A), b - 0,572A),
с = 1,112B) нм[Х]. Соединение SnO2 имеет тетрагональную решетку типа
рутила (символ Пирсона 1Р6, пр.гр. РЩтпт) са = 0,4738, с - 0,3188 нм
И-
Литература
1. Spandau U., Kohlmeyer E.J. IIZ. Anorg. All. Chem. 1977. Bd. 254. N 1-2. S. 65-82.
2. БерезкииаЛ.Г., Ермакова Н.И., Чижиков Д.М.//Журнал неорганической химии. 1964.
Т. 9. N7. С. 1760-1762.
3. Barczak V.J., Insley R.H. // J. Amer. Ceram. Soc. 1962. V. 45. N 3. P. 144.
4. Kuxmann U., Dobner R. // Metall. 1980. Bd. 34. N 9. S. 821-827.
В.П. Полякова
O-Sr. КИСЛОРОД-СТРОНЦИЙ
Диаграмма состояния O-Sr не построена. В системе установлено
существование соединений: SrO и SrO2, которые были получены
химическим способом [Э].
SrO имеет температуру плавления 2420 "С [Ш], кристаллизуется в
решетке THnaNaCl с а - 0,51602 нм. Соединение SrO2 имеет решетку типа
СаС2(символ Пирсона tl\6, пр.гр. IMmmm) ca- 0,50445, с = 0,66161 нм
[Э].
77 77. Зусман
704
О~Та
О-Та. КИСЛОРОД-ТАНТАЛ
Данные по взаимодействию Та с О рассмотрены в обзорах [X, Э, Ш].
Установлено, что кислород ограниченно растворим в твердом Та и
величина растворимости довольно велика. Предполагалось, что Та с О
образует ряд оксидов различного состава: Та4О, Та2О, ТаО, ТаО2 и
Та2О5 [X, Э]. Однако более поздние работы показывают, что в равнове-
равновесии с твердым Та находится только один оксид с формулой Та,О5 [Ш,
1,2].
На рис. 351 представлена диаграмма состояния Та-0 в области
концентраций от Та до Та2О5 G1,4 % (ат.) О). Она построена по данным
работы [2], в которой определены характер и температуры нонвариан-
тных превращений, а также растворимость О в твердом Та в интервале
температур 1100-2500 °С. Для более низких температур G50-1100 °С)
указанная диаграмма состояния [2] была дополнена значениями
растворимости О в Та, полученными в работе [3]. Результаты других
t,'C
3000
2600
2200
1800
то
woo
О, % (по массе)
* 6 8 Ю 12PH6t8
600
3020'
I
(Tah-
I
1
\
1880-
155O±
I
t30° >
30"
(Та
1 i
1
1
1
1
43—
)+Tut0-
1 1 1 1
\
\
1
71
0 10 20 30 40 50 60 70
Та О, % (am.)
Рис. 351.О-Та
О-Та, O-Tb
705
1880
5,7
1550
5,1
1100
3,2
1000
2,8
900
2,4
800
2,1
750
1,8
работ [X, Э, 4, 5] по растворимости О в твердом Та достаточно хорошо
согласуются с данными, представленными на диаграмме.
Растворимость О в (Та) по данным работ [2, 3] представлена ниже:
Температура, °С
Растворимость, О, % (ат.) ....
Та2О5 существует по крайней мере в двух модификациях [X, Э, Ш, 1],
однако условия образования модификаций и температурные интервалы
их существования установлены недостаточно надежно и требуют
уточнения. Данные по Кристаллической структуре Та2О5 представлены
в табл. 287.
Таблица 287. Кристаллическая структура соединений системы О-Та |Р|
Соединение
рТа2О5
аТа2О5
Символ
Пирсона,
пр.гр.
оП4,
/•2,2,2
//42,
/4,/amrf
Параметры решетки, им
а
0,619
0,380
6
4,40
с
0,389
3,56
Литература
I. Дубровская Л.Б., Швейкин Г.П., Гельд П.В. // Журнал неорганической химии. 1964.
Т. 9. N5 С 1182-1186
2 Jehn Y., OIzi E. // J Less-Common Met. 1972. V. 27. N 3. Р 297-309
3. Fromm E., Kirchheim R. IIZ. Metallkunde. 1975. Bd. 66. N 3. S. 144-150.
4. Jehn H., Obi E. // Metal. Ital. 1970. V. 62. N 10. P. 381-384.
5. Stecura S. // Metal. Trans 1974. V. 5. N 6. P. 1337-1340
Л.Л Рохлин
O-Tb. КИСЛОРОД-ТЕРБИЙ
Диаграмма состояния O-Tb представлена на рис. 352 в интервале
концентраций 60-66 % (ат.) О по данным работ [ 1, 2]. В этом интервале
концентраций образуется целый ряд промежуточных фаз, кристаллогра-
кристаллографические данные которых указаны в табл. 288.
Температура плавления ТЬ2О3 точно не установлена. В работе [3]
приведены два значения: 2303 и 2370 °С. ТЬ2О3 существует в нескольких
полиморфных формах (А, В, С, Н, X). Полиморфные превращения
происходят при следующих температурах: С = В при 1850 °С, В » А при
706
O-Tb
t,°c
1600
1200
600
WO
О, % /по массе)
О 14 /5 16
I
/
?
•
Л'
fi
469°
60 6Z 64 66
Tb 0. °/ofam.)
Рис. 352. O-Tb
2175 "С, В - H при 2160 °C, A - H при 2175 "С и Н - X при 2340 "С [4].
Совпадение температур В » А и А » Н превращений связано с тем, что
на термограммах наблюдалось наложение эффектов нескольких
полиморфных превращений.
Таблица 288. Кристаллическая структура соединений системы О-ТЬ
Соединение
ТЬ2О3(С)
ТЬ,О3(В)
ТЬ2О3(Н)*'
ТЬ2О3(Х)*2
Прототип
Мп2О3
Sm2O3
-
-
Символ
Пирсона,
пр.гр.
с/80,
laZ
тСЗО,
СИт
-
-
Параметры решетки, им
а
1,07281
1,0730
1,0752
1,404
1.394
0,384
0.427
6
-
0,3541
0,3536
-
-
с
-
0,8725
0,8646
0,613
-
Примечание
[Э]
[5]
[4]
Р = 100,06° [6]
При 1960 °С,
Р= 100,2° [1]
При 2200 °С
[4]
При 2370 °С
[4]
о-ть
707
Соединение
ТЬ7О|2A)
ТЬ31О56F')*3
ть5о;3
ТЬ„О20(о)
тьо,;;и
ТЬ6Оп(р)*5
(ТЬ12О22)
ТЬ6О„(а)*3
(ТЬ12О22)
тьо2
Прототип
ть„о20
-
-
ть6о„
CaF2
Символ
Пирсона,
пр.гр.
яз
Р~\
-
Рп
сЛ2,
Fm3m
Гексагональная сингония.
Кубическая сингония.
*3Триклиниая сингония.
'^Тригональная сингония.
*5Моноклинная сингония.
Параметры решетки, нм
а
0,6509
0,5319
1,38
0,5286
0,65
0,5283
0,67
0,64
0,5220
6
-
1,62
0,5286
0,99
-
2,32
1,224
—
с
-
1,21
0,5286
0,65
-
1,55
1,224
Примечание
При 813 °С,
а = 99,35° [Э]
При 25 °С,
а= 89,71° [1]
а= 107,4°;
Р= 100,1°,
у = 92,2°[7]
а =89,4°;
Р = 89,4°;
Y=90,0°[8]
а =90°;
Р = 99,6°;
Y = 90,3°[8]
При 332 °С,
а = 89,68° [8]
р= 125,2° [7]
0 = 79,52°;
Р= 100,03°;
Y = 69,63° [8]
При 200 °С [1]
Согласно работе [8] ТЬ6ОП имеет две полиморфные модификации:
моноклинную и триклинную.
Литература
1 Burnham D.A., Eyring L.R., Kordies J. // J. Phys. Chem. 1968. V 72 N 13. P. 4424-4431
2 Eyring L. // Handbook on Physics and Chemistry of Rare Earths1 Amsterdam North-
Holland Publ Co., 1979. V. 3 P 337
3 Арсспьсв П.А., Ковба Л.М., Багдасаров Х.С. и др. Соединения редкоземельных
элементов Системы с оксидами элементов I-HI групп / М.1. Наука, 1983 280 с.
708 О-ТЬ, О-Тс, О-Те
4. Портной К.Н., Тимофеева Н.И. Кислородные соединения редкоземельных элементов.
М.: Металлургия, 1986. 480 с.
5. McCarthy G.J. //J. Appl. Crystallogr. 1971. V. 4. N 5. P. 399-400.
6. Hoekstra H.R. // Inorg. Chem. 1966. V. 5. N 5. P. 754-755.
7. KunzmanP., Eyring L. // J. Solid State Chem. 1975. V. 14. N 2. P. 229-2J7.
8. Tuenge R.T., Eyring L. // J. Solid State Chem. 1982. V. 41. N I. P. 75-89.
Ю.Б. Кузьма, Л.Е. Шелимова
O-Tc. КИСЛОРОД-ТЕХНЕЦИЙ
В работе (Э] сообщается об образовании соединения ТсО2 с моноклин-
моноклинной решеткой типа МоО2 (символ Пирсона mPll, пр.гр. Р2,/с с
параметрамия - 0,553, b - 0,479, с- 0,553 нм,Р - 120°. Имеются сведения
о наличии соединения Тс2О7 с температурой плавления 119,5 °С [Ш].
Возможно существование одной или двух промежуточных фаз в
интервале концентраций от Тс до ТсО2 и наличие некоторой раствори-
растворимости О в (Тс) [Ш].
Л.Л. Рохлин
О-Те. КИСЛОРОД-ТЕЛЛУР
По данным работы [1] в системе О-Те по данным термического и
рентгеновского анализов существует полная несмешиваемость Те и ТеО2
как в жидком, так и в твердом состоянии. Согласно работе [Ш] ТеО2
плавится при 733±1 "С. ТеО2, осажденный из водных растворов или
плавленный, имеет тетрагональную решетку с параметрами: а - 0,4796,
с = 0,7588 нм (Э] или а = 0,4796, с = 0,7626 нм [Ш] (пр.гр. Р4,2,2 или
Р432|2). Однако минерал теллурит имеет ромбическую решетку с а -
= 0,550, Ь = 1,175, с = 0,559 нм [Э].
Литература
1. Букетов Е.А., Меклер Л.И., Надиров Е.Г. и др. // Журнал неорганической химии. 1964
Т. 9. N 1.С. 224-225
В.П Полякова
O-Th
709
O-Th. КИСЛОРОД-ТОРИЙ
Диаграмма состояния O-Th представлена на рис. 353 в области
концентраций 0-66,7 % (ат.) О по данным работы [1]. В системе
существует область несмешиваемости в жидком состоянии в интервале
концентраций 28,5-60 % (ат.) О, температура монотектической реакции
2740±100 "С. Соединение ThO2 плавится при 3390 °С поданным работы
[1] и при 3250±50 °С по данным работы [Ш]. Соединение ThO2 имеет
кубическую решетку типа CaF2 (символ Пирсона cF\2, пр.гр. Fm3m) с
параметром а - 0,55961 нм \Э].
t,°c
О, °/о/по массе)
5 10
ЗООО
2ООО
t36O°
tooo
1.6
т
28,5
TfiOz
II
Ч370±30°
i
66,5
3390°
65,2
О tO 20 30 W 50 60 70
Th O,"/afa/T7.)
Рис. 353. O-Th
Максимальная растворимость О в (Th) составляет при 1415 °С 0,4 %
(ат.) [Э].
Литература
1 Benz R. // J Nucl. Mater. 1969. V. 29. N 1. Р 43-49.
Г. И. Терехов
710
O-Ti
O-Ti. КИСЛОРОД-ТИТАН
Диаграмма состояния O-Ti в интервале концентраций 0-50 % (ат.)
О была впервые построена в работе [1]. На рис. 354 приведен современ-
современный вариант диаграммы состояния O-Ti, построенный в работе [2] на
основе обобщения экспериментальных данных.
Кислород обладает значительной растворимостью в aTi, резко
повышая при этом температуру полиморфного превращения Ti. При
1720 °С протекает перитектическая реакция Ж + (aTi) « (pTi). Макси-
Максимальная растворимость О в (pTi) составляет 8 % (ат.) при 1720±25 °С.
Температура плавления (aTi) достигает максимума, равного 1885±25 °С,
при содержании -24 % (ат.) О. При дальнейшем увеличении содержания
О температура плавления сплавов несколько снижается, эта область
составов характеризуется образованием оксидов разного стехиометричес-
кого состава. При температурах ниже 600 "С существуют два оксида Ti3O
и Ti2O с гексагональной кристаллической решеткой. При этих температу-
температурах в сплавах с более высоким содержанием Ti возможно образование
субоксида Ti6O [3].
t;c
2000
1800
1600
1400
1200
1000
BOO
600
400
О
П
Рис. 354. O-Ti
О, % (по массе)
W 20
J0
40
itiff]
I J
1/
ж
——5"
1
(an)
i
1 И
i
sac
¦— —
\ rn\
~IT5o' \ 1
1—Д I—
V
7!
«4
cs
mo
L_
г
1
Огпч
N
I
1
Г
г
10
20
JO 40
О'/, (am.)
50
60
70
O-Ti
711
При температуре 1770 °С по перитектической реакции Ж + (aTi) »
« уТЮ образуется монооксид Ti, существующий в трех модификациях
а, р, у. При 940 °С по перитектоидной реакции (aTi) + pTiO » aTiO
образуется aTiO, который, взаимодействуя с aTi, при 920 °С образует
Ti3O2, претерпевающий полиморфное превращение в процессе охлажде-
охлаждения.
Оксид Ti2O3 существует в интервале концентраций 59,8-60,2 % (ат.)
О, плавится конгруэнтно при 1842 "С и имеет решетку типа аА12О3. При
1870 °С конгруэнтно плавится еще одно соединение - TiO2, которое
имеет пять полиморфных модификаций. При низких температурах и
низких давлениях известны модификации: рутил, анатаз и броокит. По
данным работы [4] превращения анатаз - рутил и броокит - рутил
необратимы.
Между соединениями Ti2O3-TiO2 существует гомологический ряд
оксидов Ti/1O2n_i при 4 <. п <. 10. В него входят оксиды типов Ti4O7, Ti5O9,
Ti7O13, TigO15, Ti9O|7> получившие название фаз Магнели [5, 6]. Все эти
оксиды расположены в очень узком интервале концентраций и их
положение на диаграмме состояния нанесено схематически.
Данные по кристаллической структуре промежуточных фаз системы
O-Ti представлены в табл. 289.
Таблица 289 Кристаллическая структура соединений системы O-Ti
Соедине-
Соединение
Ti3O
Ti2O
T.3O2
yTiO
«TiO
aTi2O3
Прото-
Прототип
-
-
-
NaCI
-
aAI2O3
Символ
Пирсона,
пргр
A/>64,
hP9,
/>3ml
РЫттт
cF%,
Fmim
Cllm
АЛ10,
ЯЗс
Параметры решетки, нм
а
0,51411
0,29593
0,49915
0,4180
0,5855
0,542
0,5454
Ь
-
-
-
-
0,9340
-
с
0,95334
0,48454
0,28794
-
0,4142
-
Примечание
[Ш]
[Ш]
[2]
[Р]
Р= 107,53° [21
а= 56,9° [Э]
а=59,Г[Р]
712
O-Ti. 0-77
Соедине-
Соединение
aTi3O5
р-п3о;
TiO2
Прото-
Прототип
-
TiO2
(рутил)
TiO2
(анатаз)
TiO2
(броо-
кит)
Символ
Пирсона,
пр.гр.
_
Cllm
-
tP6,
РЩтпт
Г Л 2,
F4\/adm
оРТАу
РЬса
Моноклинная сингония.
Параметры решетки, нм
а
0,97524
0,982
0,45929
0,3785
0,9166
6
0,38020
0,378
_
-
0,5436
с
0,94419
0,997
0,29591
0,9514
0,5135
Примечание
Р = 91,547" [Э]
Р = 91,0°[Э]
[Р]
[Р]
[Р]
Кристаллографические данные для фаз Магнели приведены в работе
[2].
Литература
1. Bumps E.,KesslerH.,HansenM.// Trans. ASM. 1953. V. 45. P. 1008-1021.
2. Murray J.L., Wriedt H.A. // Bull. Alloy Phase Diagrams. 1987. V. 8. N 2. P. 148-165.
3. Корнилов И.И., Глазова В.В. // Металловедение титана: Сб. статей. М.: Наука, 1964.
С. 15-25.
4. VahldickF.W.//J. Less-Common Met. 1966. V. II. P. 99-110.
5. Magneli A. // Transition Metal Compounds - Transport and Magnetic Properties: New
York: Gordon and Breach, Science Publishers. Inc., 1964. N 4. P. 109-122.
6. Bursill L.A., Hude B.G. //Acta Crestallogr. 1971. V. 27. P. 210-215.
П.Б. Будберг
O-Tl. КИСЛОРОД-ТАЛЛИЙ
В работе \Э) сообщается о существовании двух оксидов Т1: Т12О и
Т12О3. Оксид Т12О3 плавится при 717±5 °С или 716±2 "С по данным
различных исследователей и кипит при 1169 °С (Э]. Т12О3 имеет решетку
типа Мп?03 (символ Пирсона с/80, пр.гр. 1аЪ) с параметром а - 1,057 нм
или а = 1,0534 нм (Э]. Возможно растворение в Т12О3 кислорода.
Предполагается также существование оксида более богатого
кислородом, чем Т12О3[Э].
77.77. Рохлин
0-Tm, O-U 713
O-Tm. КИСЛОРОД-ТУЛИЙ
Согласно данным работы [1] соединение Тт2О3 плавится при 2380 °С
и претерпевает полиморфное превращение при 2350 "С. Низкотемпера-
Низкотемпературная модификация Тт2О3 имеет кристаллическую структуру типа
Мп2О3 (символ Пирсона с/80, пр.гр. 1аЪ) с параметром а = 1,04866 нм.
По данным работы [2] высокотемпературная модификация Тт2О3 имеет
структуру типа Sm2O3 (пр.гр. С21т) с параметрами а = 1,381, Ъ = 0,3447,
с = 0,8505 нм,Р= 1*00,20°.
Закалкой от 1005 °С при давлении 4,0 ГПа зафиксирована моноклин-
моноклинная модификация Tm?03 \Э, Ш].
Литература
1. Лопато Л.М., Шевченко А.В., Кущевский А.Е., Тресвятский С.Г. // Известия АН СССР.
Неорганические материалы. 1974. Т. 10. N8. С. 1481-1487.
2. Hoekstra H.R. // Inorg Chera. 1966. V. 5. N 5. P. 754-755.
Ю.Б. Кузьма
O-U. КИСЛОРОД-УРАН
Об особенностях взаимодействия О с U сообщается в работах [1-3,
Э, Ш]. В этих работах основное внимание уделялось исследованию
интервала концентраций от U до UO2. В системе при температуре
2500±30 °С в интервале составов 2-65 % (ат.) О существует область
несмешиваемости в жидком состоянии. По данным работы [3] температу-
температура плавления UO2 равна 2810±30 °С.
На рис. 355 представлена низкотемпературная часть диаграммы
состояния O-U по данным работы [М]. В системе образуются следующие
соединения: UO2, U3Og, UO3 и U2O7, характер плавления которых
неизвестен. Соединение U4O9 образуется по перитектоидной реакции:
UO2 + U3Og - U4O9.
Данные по кристаллической структуре соединений системы O-U
представлены в табл. 290. В табл. 290 приведены температурные области
существования трех полиморфных модификаций U3O8.
714
O-U
t,'C
гооо
760О
7200 -
воо
О, °/о{ло массе!
5
to
20
-Ж
*"'а
*~(Ai/t
и)
- 776°
-
1
1
1
1
Р
—1
1
\
\
1 1
i
11
i
f
/о го jo «<? so во 70 во
О, %t fCi777.1
Рис. 355. O-U
Таблица 290 Кристаллическая структура соединений системы O-U
Соедине-
Соединение
ио.
U4O9
YU3O8
pu3o;
aU3O,"
aUO3
puo,"
Прото-
Прототип
CaF,
-
-
-
-
_
Гекслгоналыыя
Символ
Пирсона,
пргр
с Л 2,
ЛлЗ/и
-,
/43 d
-
-
_
С222
-,
сингония
Ромбическая сингония
Параметры решетки, нм
а
0,5469B)
2,177
-
0,6814
0,671
0,3971
1,301
0 970
b
-
-
-
-
1,1901
-
1,072
0,980
с
-
-
-
0.4136
0,828
0.4168
0,751
1,992
Примечание
[Э]
[Э]
>940 °С[Э]
940-770 °С [Э]
770-350 "С [Э]
[Р]
[Р]
[Э]
o-u, o-v
715
Литература
1 Martin A.T., Edwards R.K.//J. Phys. Chem. 1965 V. 69 N 5. P 1788-1792.
2. Bannister M.J. //J. Nud Mater. 1967. V. 24. N 3. P. 340-342
3 Benz R., Balog G., Baca B.H. // High Temp Sci. 1970. V. 2 N 3. P. 221-251.
П.Б. Будберг
O-V. КИСЛОРОД-ВАНАДИЙ
Результаты многочисленных исследований системы O-V обобщены
в работах [X, Э, Ш]. Приведенная на рис. 356 диаграмма состояния
построена при давлении 0,1 МПа в работе [1] на основе обобщения
данных работ [2] в интервале концентраций 0-55 % (ат.) О и работ [3,
4] в интервале концентраций 67-100 % (ат.) О.
0°/о (по массе)
20ОО
1600
1200
воо
ш
60
70
О, °/о (ат.)
Рис. 356. O-V
716 O-V
В области концентраций 0-50 % (ат.) О образуются четыре промежу-
промежуточные фазы с широкими областями гомогенности: а', р, у и б. Фаза р
образуется по перитектической реакции: Ж + (V)» р при 1665 °С и имеет
область гомогенности, лежащую в пределах: 13,2-22,0; 10,6-23,0 и
11,4-26,0 % (ат.) О при 25, 800 и 1000 °С соответственно. Превращение
Р » а' происходит при 519 °С и связано с упорядочением. При 508 °С
протекаетэвтектоидная реакция: р «(V) + а'. Согласно работе [2] область
гомогенности фазы а' лежит в пределах 9-11,8 % (ат.) О при 25 °С.
Превращение р « р' происходит при -400 °С за счет упорядочения.
Между фазами р и б образуется эвтектика при температуре 1640±5 °С
и концентрации 29 % (ат.) О. Фаза у образуется по перитектоидной
реакции р + б « у при 1185±10 "С и имеет область гомогенности от 31
до 35,5 % (ат.) О при 900 °С. Фаза б плавится конгруэнтно при 1790 °С
по данным работы [2] или при 1760 °С по данным работы [5]. Область
гомогенности фазы б имеет протяженность 43-57 % (ат.) О при -1600 °С.
Согласно работе [2] растворимость О в (V) составляет 3,2; 8-9 и 17 %
(ат.) при 25; 800 и 1665 "С соответственно.
В области концентраций от 50 до -72 % (ат.) О существуют следующие
соединения: V2O3, V3O5, гомологический ряд оксидов УПО2„_1 D < п <;
< 8) (фазы Магнели) [6, Э], VO2, V6O13, V3O7 и V2O5. Соединение V2O3
плавится конгруэнтно при 1957 °С и имеет область гомогенности от 59
до 62,3 % (ат.) О [Э]. Оно существует в двух модификациях yV2O3 и
aV2O3, температура перехода составляет -112 °С [1]. При 810 °С
происходит перитектоидная реакция: б + pV2O3 « б'.
Соединение V3O5 имеет две модификации, температура перехода
PV3O5 - aV3O5 составляет 155 °С [1].
Соединение VO2 плавится конгруэнтно при 1542 °С, имеет область
гомогенности в пределах VOt 995—VO2 000 и две полиморфные модифика-
модификации, температура перехода pVO2 ¦=> aVO2 составляет 68 °С. Соединения
V6Ol3 и V3O7 образуются по перитектоидным реакциям при 700 и
-665 °С соответственно. V2O5 плавится при 678 "С [1]. Соединение V6O[3
имеет две полиморфные модификации, температура перехода PV6O3 »
«• aV6O13 составляет-124 "С [1].
В системе существует целый ряд неравновесных фаз, обзор которых
приведен в работе [1].
Данные по кристаллической структуре соединений системы O-V
представлены в табл. 291.
o-v
717
Таблииа 29 I Кристаллическая структура соединений системы O-V
Соедине-
Соединение
а'
Р
Р'
Y
б
б'
aV2O3
pv2o3
«V,Oj
PV3OS
V4O7
V5O9
v6o,,
Прото-
Прототип
-
-
v16o3
v14o6
NaCI
v52o64
-
aAI2O3
V3O5
-
V,O7
V5O9
6 11
Символ
Пирсона,
пр.гр.
r/216,
r/2,5,
lAlmmm
(/76,
lMmrnrn
mC20,
Cllm
Fmim
Г/116,
m/20,
12a
АЛ10,
Ric
тРП,
Pile
121c
P~\
aP2S,
P\
a/>34,
P~\
• Параметры решетки, нм
a
1,2436
0,2970
1,196
0,9507
0,4093
1,172
0,7255
0,49515
0,9859
0,9846
0,5504
0,5470
0,5448
6
-
-
0,2935
-
-
0,5002
-
0,50416
0,50268
0,7007
0,7005
0,6998
с
1,7940
0,340
0,6604
0,7695
-
0,8245
0,5548
1,4003
0,6991
0,7009
1,9243
2,4669
3,0063
Примечани
е
[1]
[2]
При < 400 °С [7]
Р = 90,84° [1]
[1]
Р = 96,75° [8]
[1]
Р= 104,48° [1]
Р= 109,54° [1]
а = 41,3°
Р = 72,5°
Y= 109,4°
а = 41,4°
Р = 72,5°
Y= 109,0°
п = 41,0°
Р=72,5°
Y = 108,9°
И
[И
718
o-v, o-w
Соедине-
Соединение
V7O,3
VgO,s
aVO,
pvo2
«v6ol3
PV6OI3
v3o7
V2O5
Прото-
Прототип
V7<>I3
vo2
TiO2
(рутил)
-
v6oI3
V3O7
v2o5
Символ
Пирсона,
пр.гр.
aP40,
f'l
а/>46,
P~\
mP\2,
f/>6,
P42lnmm
ш/>38,
mC38, ¦
CVm
шС120,
^ Cllc
oP\H,
Pmnm
Параметры решетки, нм
a
0,5439
0,5432
0,575173
0,455358
1,196
1,1922
2,1921
1,1510
b
0,7005
0,6989
0,452596
-
0,3713
0,3680
0,3679
0,4369
с
3,5516
3,7078
0,538326
0,284982
1,007
1,0138
1,8341 '
0,3563
Примечание
a = 40,9°;
P = 72,6°;
Y= 109,0° [1]
a= 98,76°;
P= 128.39°;
Y= 108,93° [1]
P= 122,615° [1]
[1]
P= 100,9° [1]
p= 100,87° [1]
P = 95,61° [1]
[1]
Литература
1. Wriedt H.A. // Bull. Alloy Phase Diagrams. 1989. V. 10. N 3. P. 271-276.
2. Alexander D.G., Carlson O.N. // Met. Trans. 1971. V. 2. N 10. P. 2805-2811.
3. Toda Т., KosugeK., Kachi S. // Nippon Kagaku Zasshi. 1966. V. 87. P. 1311-1314.
4. Васильева И.А., Сухушииа И.С. // Журнал физической химии. 1980. Т. 54. N 9.
С.2251-2254.
5. Stringer J.//J. Less-Common Met. 1965. V.-8. N 1. P. 1-14. ,
6. Anderson J.S., Khan A.S. // J. Less-Common Met. 1970. V. 22. N 2. P. 209-218.
7 Hiraga K., Hirabayashi M. // J. Phys. Soc. Japan. 1973. V 34 N 4. P. 965-972.
8 McWhan D.B., Rcmeika J.P. // Phys. Rev. B. 1970. V. 2. N 9. P. 3734-375,0.
Л.Е. Шалимова
O-W. КИСЛОРОД-ВОЛЬФРАМ
Обзоры данных по взаимодействию О с W приведены в работах [X,
Э, Ш, 1, 2]. На рис. 357 представлена обобщенная диаграмма состояния
О—W в интервале концентраций 0—80 % (ат.) О, предложенная в работе
[1] на основе критической оценки экспериментальных данных.
o-w
719
О, % fno массе)
to tf го
F00
гоо
Рис. 357. O-W
SO 70
О, % /am.)
В системе обнаружены следующие стабильные промежуточные фазы:
WO2, WlgO49, W24O68, гомологический ряд оксидов WnO3n_2 (фазы
Магнели), гомологический ряд оксидов WnO3n_[ и WO3 [X, Э, Ш, 1, 2].
Соединение WO2 образуется по перитектоидной реакции: (W) + W(gO49 «
•* WO2 при 1530 "С. Оксид WlgO49, характер плавления которого
неизвестен, распадается по эвтектоидной реакции: W)gO49 * WO2 +
+ W^O3n_2 ПРИ 5%5 "С. Фазы Магнели устойчивы от температур
образования до -484 °С, при более низких температурах они распадаются
по эвтектоидной реакции: WnO3/I_2 •» WO2 + WO3 [I].
Соединение WO3 плавится конгруэнтно при 1474 "С и имеет
одиннадцать модификаций. Согласно классификации, предложенной в
работе [1], эти модификации обозначаются в алфавитном порядке WO3
(А, В ... К, М), при этом WO3 (А) находится в равновесии с жидкой фазой,
a WO3 (В, С ... К, М) образуются по мере понижения температуры.
Структура четырех низкотемпературных (/ < -143 °С) модификаций не
исследована, а структура остальных модификаций, существующих в
интервале температур от-143 °С до 1474 "С, представлена в табл. 292
720
o-w
наряду с данными по кристаллической структуре других промежуточ-
промежуточных фаз.
Согласно данным работ [X, 1] растворимость кислорода в (W)
ничтожно мала.
Таблица 29 2. Кристаллическая структура соединений системы O-W
Соедине-
Соединение
WO2"
W18O49
wMo-
wX-
wso;
wX
WO3(A)
WO3(B)
WO3(C)
WO3(D)
WO3(E)
WO,(F)
Темпера-
Температурная об-
область, °C
<1530
-1600-550
-
-
-
-
-
1474-1230
1230-900
900-740
740-330
330-17
17-(-40)
Символ
Пирсона,
пр.гр.
mP\l,
тР61,
PVm
-
тРП,
PVm
^94
m/>98,
PVc
mP99,
PVm
r/>8?
/¦4/nmm?
(PS,
PAInmm
(PS,
PAInmm
оРЪ1
Pmnb
тРЪ1,
P2tln
аргг,
p~\
Параметры решетки, нм
а
0,55560
1,8324
1,931
1,205
1,207
1,193
-1,190
0,5257
0,5272
0,5250
0,7341
0,7306
0,7309
Ь
0,48931
0,3784
0,3781
0,3767
0,378
0,382
-0,3826
-
-
-
0,7570
0,7540
0,7522
с
0,56577
1,4035
1,707
2,359
2,89
5,972
-2,982
0,3912
0,3920
0,3915
0,7754
0,7692
0,7678
Примечание
Р= 120,422° [1]
Р= 115,20° [3]
Р= 104,4° [3]
Р= 85,47° [4]
Р = 98,6° [5]
Р = 98,3°[6]
Р - 98,4° [1]
При 1260 °С[1]
При950°С[1]
При 770 °С [1]
При 480 °С [7]
Р = 90,881° [1]
а =88,81°;
Р = 90,92°;
у = 90,93° [1]
0-W. O-Y
721
Соедине-
Соединение
WO3(G)
Темпера-
Температурная об-
область, °С
-40-4-143)
Символ
Пирсона,
пр.гр.
тР\6,
Рс
Параметры решетки, нм
а
0,5275
Ь
0,5155
с
0,7672
'* Прототип VO2.
• 2* Моноклинная сингония.
3* Соединения гомологического ряда WnO3n_2-
4* Соединения гомологического ряда WnO3w_|.
Примечание
При -70 °С;
Р = 91,7°Ш
Литература
1. Wriedt Н.А. // Bull. Alloy Phase Diagrams 1989. V. 10. N 4. P. 368-384.
2. Altstetter C.J. // Bull. Alloy Phase Diagrams. 1984. V. 5. N 6. P. 543-553.
3 Booth J., Ekstrdm Т., Iguchi E., Tilley R.J.D. // J. Solid State Chem 1982 V. 41. N 3.
P. 293-307.
4. Magneli A. II Acta Crystallogr. 1953. V. 6. P. 495-500.
5. Sundberg M. // J. Solid State Chem. 1980. V. 35. P. 120-127.
6. Sundberg M. II Acta Crystallogr. B. 1976. V. 32. N 7 P. 2144-2149.
7 Salye E. // Acta Crystallogr. 1977. V В 33. N 2. P. 574-577.
К.Б. Поварова. Л.Е Шелимова
O-Y. КИСЛОРОД-ИТТРИЙ
Диаграмма состояния O-Y в интервале концентраций 0-60 % (ат.) О
представлена на рис. 358 [Ш]. Соединение Y2O3 плавится конгруэнтно
при 2458 °С. Максимальная растворимость кислорода в (pY) составляет
30,4 % (ат.), в aY - 15,9 % (ат.). Кислород, входя в решетку твердого
раствора, снижает температуру полиморфного превращения pY » aY.
Соединение Y2O3 образует с твердым раствором (pY) эвтектику при
температуре 1560 °С и концентрации 37,4 % (ат.) О [1].
Y2O3 имеет несколько полиморфных превращений в узком интервале
. температур вблизи 2350 °С [2]. Высокотемпературная модификация Y2O3
(С-форма) имеет структуру типа Мп2О3 (символ Пирсона с/80, пр.гр. /йЗ)
с а - 1,0605 нм р]. Моноклинная модификация Y2O3 (В-форма) обладает
структурой типа Sm2O3 (символ Пирсона/иСЗО, пр.гр. СИт) са= 1,391,
Ъ = 0,3483, с = 0,8593 нм, р = 100,17° [3]. Гексагональная модификация
722
0-Y
0, % fro массе/
з s 7 а го
2WO
WOO
1600
1200 -
800
wo
I
1S2Z
frlYI
/
1
0&
i
1 1
Ж
1670°
Ьу}/з
r
i
*» /
/
/
JiP
/1
'i
j
1
j
1
1
|
j
to го jo w so so 7o
o, %/atrr.i
Рис. 358.0-Y
(Н-форма) имеет структуру типа La2O3 (символ Пирсона hP5, пр гр
Р3т\) с а = 0,3805, с = 0,6085 нм при 2330 "С [V-C].
В работе [V-C] сообщается о соединении YO с кубической структурой
сй = 0,549 нм
Литература
1 Carlson O.N., Lichtenberg R.R., Werner J.C. // J Less-Common Met 1974 V 35 N 2
P 275-284
2 Лопато Л.М., Шевчеико А.В., Кущевский А.Е., Тресвятский С.Г. // Изв АН СССР
Неорганические материалы 1974 Т 10 N 8 С 1481-1487
3 Hoekstra H.R. // Inorg Chem 1966 V 5 N5 Р 754-755
Ю Б Кузьма
O-Yb O-Zn 723
O-Yb. КИСЛОРОД-ИТТЕРБИЙ
Диаграмма состояния O-Yb не построена
Температур^ плавления Yb,O3 равна 2440 °С по данным работы [1]
или 2400 °С по данным работы [2] Для Yb2O3 характерен полиморфизм,
температура полиморфного превращения составляет 2380 °С [2]
Высокотемпературная модификация Yb2O3 (С-форма) имеет структуру
типа Мп,О3 (символ Пирсона с/80, пр гр /вЗ) с а = 1,04334 нм [Э]
Моноклинная модификация Yb2O3 (В-форма) обладает структурой типа
Sm2O3 (символ Пирсона «гСЗО, пр rp Cllm) с параметрами п - 1,373, Ъ =
= 03425, с - 0,8452 нм, р = 100,17° [3]
Низший оксид YbO имеет структуру типа NaCl (символ Пирсона cF%,
пр rp Fm Ът) с а- 0,486 нм \Э]
Соединение Yb3O4 образуется при давлении 4-5 ГПа и температуре
1100-1300 °С [4] Yb3O4 имеет структуру типа CeFe2O4 (пр гр Рпат) с
параметрами а - 0,9758, Ъ - 0,3333, с - 1,1620 нм [4]
Литература
1 Арсеиьев П А., Ковба Л М., Багдасаров Х.С. и др. Соединения редкоземельных
эчементов Системы с оксидами элементов 1-Ш групп М Наука 1983 280 с
2 Лопато Л.М., Шевченко А.В., Кушевский А.Е., Тресвятский С.Г. // Изв АН СССР
Неорганические материалы 1974 Т 10 N 8 С 1481-1487
3 HoekstraH.R //Inorg Chem 1966 V 5 N5 Р 754-755
4 Lcgcr J.M , Maugnon J., Albert L etal.//Compt Rend Acad Sci Ser С 1978 V 286
N 6 P 201-203
Ю Б Кузьма
O-Zn. КИСЛОРОД-ЦИНК
Диаграмма состояния O-Zn не построена В системе существует
соединение ZnO с температурой плавления 1972±25 °С [1] Соединение
ZnO обладает структурой типа ZnS (вюртцита) (символ Пирсона hP4,
пр гр РЬ3тс) са = 0,324961, с - 0,520653 нм по данным работы Р] или
а = 0,3249856, с = 0,5206619 нм [2]
Соединение ZnO имеет узкую область гомогенности При изменении
степени отклонения от стехиометрии ZnO меняет цвет от тёмнокрасного
при избытке Zn до светложелтого при избытке О [3] Положение границы
области гомогенности со стороны Zn определено в работе [4] в интервале
724
O-Zn. O-Zr
температур 700-1100 "С. Величина б в формуле Zn,+6O составляет
5,9-10" и 1.510 при 700 "С и 1100 "С соответственно.
Соединение ZnO2 имеет структуру типа FeS2 (пирита) (символ
Пирсона сРП, пр.гр. РаЪ) с а = 0,4871 нм [Э].
При давлении выше 9,1 ГПа получена кубическая модификация ZnO
(структурный тип NaCl) с а - 0,4280 нм [1].
Литература
1. Wriedt Н.А. // Bull. Alloy Phase Diagrams 1987. V. 8. N 2. P. 166-176.
2. Abrahams S.C., Bernstein J.L.//Acta Crystallogr. 1969. V. В 25. N 5. P. 1233-1236.
3 Teske К., Оррегамп H., Stdver G.//Z. Anorg. Chem. 1984. Bd. 511 Nl.S. 72-76.
4. Hagemark K.I., Toren P.E. // J. Electrochem. Soc. 1975. V. 122. N 7. P. 992-994.
Ю.Б. Кузьма
O-Zr. КИСЛОРОД-ЦИРКОНИЙ
Диаграмма состояния O-Zr (рис. 359) приведена по данным работы
[1], в которой проанализированы и обобщены результаты исследования
системы за период 1954-1984 гг.
О, % (по массе)
.0123*5 К> 20 30
t,-C
ж
2600
ггоо
/800
two
O-Zr
725
Кислород повышает температуру р - а превращения Zr вплоть до
температуры плавления. При содержании 25 % (ат.) О твердый раствор
(aZr) плавится конгруэнтно при 2130 °С. Максимальная растворимость
О в (aZr) составляет 35±1 % (ат.) при 2065 "С. Максимальная раствори-
растворимость О в (pZr) - 10,5 %(ат.) при 1970±10 "С, температуре перитектичес-
кой реакции: Ж + (aZr) » (pZr).
Ликвидус и солидус системы O-Zr показаны в основном в соотве-
соответствии с данными работы [2], где использовали более чистый Zr, чем в
предыдущих исследованиях [X, Э]. Граница растворимости О в Zr
показана по данным работ [2, Э].
При температурах -970 °С происходит образование частично
упорядоченных фаз (a'Zr) или ZrO или полностью упорядоченных фаз
(a'Zr) или ZrOv ZrOz и др. на основе (aZr) [3-7]. Явление упорядочения
изучено недостаточно, равновесия в этой части диаграммы состояния
показаны ориентировочно в соответствии с данными работ [3, 4].
Область гомогенности соединения ZrO2 простирается в сторону
уменьшения кислорода - ZrO2_x (x s 0,44). При атмосферном давлении
существуют три модификации ZrO2_x: Y> P и a PL Высокотемпературная
модификация yZrO2_x плавится конгруэнтно при 2710 °С при стехиомет-
рическом составе. Границы области гомогенности yZtO2_^ определяли
в работах Р, 2, 8, 9]. Солидус yZrO2_x носит ретроградный характер.
Область гомогенности имеет наибольшую протяженность при -2300 °С
F1-66,7 % (ат.) О). При -2377 °С и стехиометрическом составе
происходит превращение yZrO2 - pZrO2, температура которого
понижается при отклонении от стехиометрии, и при -1525 "С происходит
эвтектоидный распад: yZrO2 - (aZr) + pZrO2. Эвтектоидная точка
расположена при 63,6±0,4 % (ат.) О. При -1205 °С происходит превраще-
превращение pZrO2 - aZrO2, состав фаз аир близок к стехиометрическому
составу. Превращение имеет мартенситный характер [10]. Полиморфные
превращения в ZrO2_x рассмотрены в работе [11].
Кристаллическая структура различных модификаций
представлена в табл. 293.
Таблица 293 Кристаллическая структура соединений системы O-Zr
Соедине-
Соединение
7Zr02
Прото-
Прототип
CaF2
Символ
Пирсона,
пргр
с Л 2,
ЛяЗт
Параметры решетки, нм
а
0,509
0,527B)
b
-
с
-
Примечание
[12]
При 2400 °С [Ш]
726
O-Zr, Ол-Р
Соедине-
Соединение
PZrO,
aZrO,
6Zto;
Прото-
Прототип
Hgl2
-
-
Символ
Пирсона,
пр.гр.
tJ>6,
РЩптс
тР\2,
РЬст
Параметры решетки, нм
а
0,364
0,51505
0,5007
Ромбическая фаза высокого давления
b
-
0,52116
0,5227
с
0,527
0,53173
0,5058
Примечание
При 1250 °С[Ш]
Р = 99,230° [13]
При 600 "С и 6 ГПа[14]
Кристаллическую структуру низкотемпературных упорядоченных фаз
а' и а" изучали методами рентгеновского и нейтронографического
анализов [3-6,15]. Результаты этих исследований обобщены в работе [1].
\
Литература
1. Abriata J.P., Garces J., Versaci R. // Bull. Alloy Phase Diagrams. 1986. V. 7. N 2
P 116-124.
2. AckermanR.J.,GargS.P.,RauchE.G.//J Am Ceram.Soc. 1977. V. 60. N 7-8. P. 341-345
3. AraiT., HirabayashiM.//J. Less-Common Met. 1976. V. 44. N 1. P. 291-300.
4. Hirabayashi M., Yamaguchi S., Arai T. et. al. // Phys. Status Solidi(A). 1974. V 23. N 1
P. 331-339.
5. Dubertret A. // Metaux-Corros. Ind 1971. N 345 P. 124.
6 Dubertret A. //Metaux-Corros. Ind. 1971. N 546 P. 69-83.
7. Claisse F., Giam T.M. // J Less-Common Met. 1973. V. 30. N 3 P. 377-385.
8. AckermanRJ.,GargS.P.,RauhE.G.//J. Am. Ceram. Soc. 1978. V. 61. N 5-6. P 275-276
9 Rauh E.G., Garg S.P. // J. Am Ceram. Soc. 1980 V. 63 N 3-4. P. 239-240.
10. Subbarao E.C., Maiti H.S., Srivastava K.K. // Phys. Status Solidi (A). 1974. V. 21. N 1
P 9-40.
1 1. ChenS.-K.// Physica. 1988. V. ВС 150. N 1-2 P. 212-222.
12. KatzG.//J. Am. Ceram. Soc. 1971. V. 54. N 10. P. 531.
13. Howard O.J., Hill R.J., Reichert B.E.//Acta Crystallogr. B. 1988. V. 44. N 2 P 116-120
14. Suyama R., Horiuchi H., Kume S. // ). Ceram. Soc. Japan. 1987. V. 95. N 6. P. 567-568
15. Hashimoto S.,lwasakiH.,OgawaS.et.al.//J. Appl. Crystallogr. 1974. V. 7. N 1. P. 67-73
Л.А. Третьячепко
Os-P. ОСМИЙ-ФОСФОР
Диаграмма состояния Os-P не построена.
Сплавы Os-P сложны в изготовлении. Попытка получить богатые
Os сплавы дуговой плавкой под Аг оказалась безуспешной [Э].
Os-P. Os-Pd
727
Соединение OsP2 было получено синтезом в запаянных кварцевых
ампулах из порошков металлического Os и красного Р при нагреве в
интервале температур 500-1000 °С. OsP2 имеет ромбическую структуру
типа марказита FeS2(символ ПирсонаоР6, пр.гр. Рппт) са = 0,5098, Ъ -
= 0,5898, с = 0,2918 нм [Э].
В. П. Полякова
Os-Pd. ОСМИЙ-ПАЛЛАДИЙ
Диаграмма состояния Os-Pd, представленная на рис 360, построена
вработах [1,2] порезультатам микроструктурного, рентген оструктурно-
го анализов и измерения микротвердости, твердости, термоэлектродви-
термоэлектродвижущей силы, удельного электросопротивления и прочности.
Сплавы готовили в дуговой печи в атмосфере гелия, отжигали в
вакууме при 1500, 1300 и 1200 °С в течение 1-6 ч.
Диаграмма состояния Os-Pd - перитектического типа с двумя
ограниченными твердыми растворами на основе Os и Pd. Перитектичес-
кая реакция Ж + (Os) - (Pd) протекает при 1640±25 °С. Протяженность
Pd, % (по массе)
3000
2600
ггоо
1800
1000
i
\
\
\
t
1
to
1
ГЗ*
4
r
f
(OS
20
К*
)
(Os
JOW
1
4
)
i
ч
IS tOt 15
л
4
*
ьо
1
X
4
0
Kb
10
\
1555*
0 10 20 30 *0 50 BO 70 SO 90 100
0$ Pd, % (am.) Pd
Рис. 360. Os-Pd
728
Os-Pd, Os-Pr
области твердого раствора (Pd) невелика - до 1,1 % (ат.) Os. Раствори-
Растворимость Pd в (Os) составляет 5,2 % (ат.).
Свойства сплавов приведены в работах [1-3].
Литература
1 Тылкина М.А., Полякова В.П., Хамидов О.Х. // Журнал неорганической химии 1963
Т 8 N 3 С 776-779
2 Благородные металлы Справочник/Под ред ЕМ Савицкого М Металлургия, 1984
592 с
3 Савицкий Е.М., Полякова В.П., Горина Н.Б., Рошан Н.Р. Металловедение платино-
платиновых металлов М Металлургия, 1975 424 с
М А Тылкина
Os-Pr. ОСМИЙ-ПРАЗЕОДИМ
Диаграмма состояния Os-Pr изучена в интервале концентраций
0-14 % (ат.) Os и приведена на рис. 361 по данным работы [М].
В системе протекает эвтектическая реакция Ж « (aPr) + Os2Pr при
температуре 670 °С и концентрации 13,8 % (ат.) Os. Обнаружена
незначительная растворимость Os в (рРг). При 790 °С твердый раствор
(РРг) распадается по метагектической реакции: (РРг) - (аРг) + Ж.
Данные по кристаллической структуре фаз, образующихся в системе
Os-Pr, представлены в табл. 294 [V-C].
900
ffOO
795°
700
600
500
931°
ОГ)
0 1
Pr
Рис.361. Os-Pr
0s,°
790°*
/о /ПО
1С
\
—. ^4»%
r—
массе}
1 id
*\
tn/y
fcLPr^OS2Pr
' 6
8
Os,",
i
Ж
к
13,8
10 12 A
'o(am.J
'/ 16
Os
Os-Pr, Os-Pl
729
Таблица 294 Кристаллическая структура соединений системы Os-Pr |V-C]
Соединение
Os2Pr
Os2Pr
OsPr3
Прототип
Zn2Mg
Cu2Mg
Fe3C
Символ
Пирсона,
пр.гр.
hPM,
Pd-Jmmc
с ПА,
Fdlm
о/Ч 6,
Pnnia
Параметры решетки, им
a
0,5359
0,7660
0,7423
b
0,9650
с
0,8938
0,6449
ЕЙ Гладышевский, О И Бодак, В.К. Печарский
Os-Pt. ОСМИЙ-ПЛАТИНА
Диаграмма состояния Os-Pt, представленная на рис. 362, построена
в работе [1] по результатам термического, микроструктурного и
рентгеноструктурного анализов, а также измерения микротвердости,
твердости и удельного электросопротивления сплавов.
Os, % fno массе)
2500
2oqo
1789°
1500
9
/
/
/
tPt)
V
ж
jf'
/'
A2-
/
t
to
/
SO
?55t/5°
/
80
/
i
/
1
frrt)
\
\
1
1
1
1
О ID 20 30 W 50 SO 70 80 90 TOO
Pi Os^/ofam.) OS
Рис. 362. Os-Pt
730
Os-Pt, Os-Pu
Сплавы выплавляли в дуговой печи из порошковых металлов
чистотой 99,9 % (по массе).
Диаграмма состояния Os-Pt - перитектического типа, без образова-
образования промежуточных фаз. Максимальная растворимость Os в (Pt)
составляет 25 % (ат.), растворимость Pt в (Os) не превышает 9,3 % (ат.).
Os уменьшает параметр решетки Pt от 0,3923 нм для Pt до 0,3916 нм
при содержании 25 % (по массе) Os.
Литература
1. Воронова Л.И., Полякова В.П., Савицкий Е.М. // Изв. АН СССР. Металлы. 1984. N 5.
С. 191-193.
В.П Полякова
Os-Pu. ОСМИЙ-ПЛУ^ОНИЙ
Диаграмма состояния Os-Pu (рис. 363) построена на основе данных
термического, микроструктурного, рентгеновского и дилатометрического
анализов образцов массой несколько сот миллиграммов [X]. В системе
to
fWO
two
1OOO
800
(t'Pu)-
(вРи! ¦
(ГРи1-
lpPu)+
(cLpul-
Рис. 363. Os-Pu
Os, % fnanacce)
20 30 40 SO
SO 70
F
¦«¦
ЫОи
/
/
{
Ш
*11
бгв*_
°u,to
/
*
i
1
ЮГО'
>tsi
9*
[
4
го зо w so
0з,% (a/nl
SO
Os-Pu, Os-Re
731
обнаружено существование четырех промежуточных фаз: т\, Pu3Os,
Pu5Os3 и PuOs,, из которых только PuOs2 плавится конгруэнтно при
температуре выше 1500 °С.
Соединение Ри3О5 имеет две модификации: рРи3О5 и аРи3О5, причем
переход из одной модификации в другую происходит в интервале
температур 625-620 °С. Соединения Pu5Os3 и pPu3Os образуются по
перитектическим реакциям при температурах 1010и680 ° С соответствен-
соответственно. Фаза т\ образуется по перитектоидной реакции при температуре
425 °С: (sPu) + aPu3Os5 - ц.
Максимальная растворимость Os в (sPu) составляет 6,8 % (ат.) при
495 °С; в (aPu), (pPu) и (YPu) - менее 0,3 % (ат.); в (бРи) - 0,4 % (ат.) при
температуреэвтектоидной реакции 418 "С. Узкая область существования
(б'Ри) на диаграмме состояния не показана. Эвтектоидной точке при
418 "С соответствует 2,45 % (ат.) Os.
Соединение PuOs2 имеет гексагональную решетку типа MgZn2 (символ
Пирсона ЛР12, пр.гр. P63lmmc) с параметрами а = 0,5337, с = 0,8682 нм
[X].
В.П Полякова
Os-Re. ОСМИЙ-РЕНИЙ
Диаграмма состояния Os-Re (рис. 364) во всем интервале концентра-
концентраций построена в работах [1,2] на основании данных микроструктурного,
рентгеноструктурного анализов и измерения температуры плавления и
твердости.
Сплавы выплавляли в дуговой печи в атмосфере гелия. Исходные
металлы были чистотой 99,8 % (по массе). Фазовый анализ проводили
Не, °/о I'по массе)
о го w во во too
t,'C
3160
31ZO
3080
3040
ЗОЗЗ°
3000
***
(Os,Re)
•
О Ю 2D 30 W 50 60 70 SO 90 ТОО
Os Re,%(am.) /fe
Рис. 364. Os-Re
732
Os-Re, Os-Rh
на литых и отожженных в вакууме при 2000 и 1000 °С с выдержкой 1 и
500 ч соответственно сплавах
В системе существует непрерывный ряд твердых растворов между
компонентами. Параметры ГПУ решетки твердого раствора увеличива-
увеличиваются по мере роста содержания Re от а - 0,27298, с = 0,43104 нм для Os
до а - 0,27538, с = 0,43890 нм для сплава с содержанием 60 % (ат.) Re и
до а - 0,2755, с - 0,4493 нм для Re.
Литература
1 Тылкина М.А., Полякова В.П., Савицкий Е.М. // Журнал неорганической химии 1962
Т 7 N6 С 1469-1470
2 Благородные металлы Справочник / Под ред Е М Савицкого М Металлургия,
1984 592 с \
М А Тылкшш
Os-Rh. ОСМИЙ-РОДИЙ
Диаграмма состояния Os-Rh, представленная на рис. 365, построена
в работе [1] по результатам микроструктурного и рентгеноструктурного
Os,'/' (по массе)
. с
t, с
JOOO
2500
2000
1963'
1500
1 10
20 Л
i i
1 40
Ж
А
ьа
1
ЧЯЛ
60
I
У
10
но
"ж*
'OS).
2600ti5'/,_
'~55
С/гл;
*@S
\
1
S0
1
/
(Os)
too
J03
г
О Ю 20 30 40 50 60 70 80 90 100
Rh Os'/.farn) Os
Рис. 365. Os-Rh
Os-Rh, Os-Ru
733
анализов, измерения температуры солидуса, микротвердости, твердости
и удельного электросопротивления.
В качестве исходных материалов использовали порошковые Os и Rh
чистотой 99,95 % (по массе). Сплавы готовили в дуговой вакуумной печи
в атмосфере очищенного гелия. Исследование проводили на литых и
отожженных при 1500 и 1000 "С сплавах.
Диаграмма состояния Os-Rh - перитектического типа, без образова-
образования промежуточных фаз. Температура перитектической реакции
составляет 2600125 "С. Растворимость Os в (Rh) при температуре
перитектической реакции равна -55 % (ат.), а при 1500 °С - >50 % (ат.).
Растворимость Rh в (Os) составляет 30 % (ат.) при температуре
перитектики и 20 % (ат.) при 1500 "С.
Литература
1 Кореновский Н Л., Полякова В.П., Савицкий Е.М. // Стабильные и метастабильные
фазовые равновесия в металлических системах М Наука, 1985 С 142-145
В П Полякова
Os-Ru. ОСМИЙ-РУТЕНИЙ
Диаграмма состояния Os-Ru (рис. 366) построена в работах [1, 2] на
основании данных микроструктурного и рентгеноструктурного анализов,
измерения температуры плавления и твердости.
/fa, % fno массе)
,„„О ТО 20 30 W 50 60 7060X100
ЗООО
2900
2600
2700
2600
2500
2W
2300
2200
3033'l
•*¦¦»
ч
1
\
(Os,Ru)
ч
1
1
т
>
1 1
л
< 233*°
О ГО 20 30 40 50 60 70 SO 30 /00
Os /fи, "/ofam) Ди
Рис. 366. Os-Ru
734 O.\-Ru, Oi-S, Ox-Sb
Сплавы выплавляли в дуговой печи в атмосфере гелия из брикетов
предварительно спрессованных порошков металлов в требуемых
соотношениях и спеченых при 1200 "С. Чистота исходных металлов
составляла 99,8 % (по массе). Фазовый анализ проводили на литых и
отожженных в вакууме при 2000 °С и 1000 "С в течение 1 и 500 ч
соответственно сплавах.
В системе существует непрерывный ряд твердых растворов. Парамет-
Параметры решетки твердого раствора с ГПУ решеткой аддитивно уменьшаются
от Os к Ru: от а = 0,27298, с = 0,43104 нм для Os до а = 0,2716, с =
= 0,4297 нм для сплава с 55,62 % (ат.) Ru и до а = 0,27003, с = 0,42730 нм
для Ru.
Литература
1. Тылкииа М.А., Полякова В.П., Савицкий Е.М. //Журнал неорганической химии. 1962.
Т. 7. N6. С. 1467-1468.
2. Благородные металлы: Справочник/Под ред. Е.М. Савицкого. М.. Металлургия, 1984.
592 с.
М.А. Тылкииа
Os-S. ОСМИЙ-СЕРА
По данным тензиметрического и рентгеновского анализов в системе
Os-S существует только сульфид OsS2 [X, I]. Соединение OsS2 имеет
структуру типа FeS, (пирит) (символ Пирсона с/Ч 2, пр.гр. РаЪ) с а -
= 0,5619 нм [X] или а = 0,56075 [Р].
Литература
1. Благородные металлы Справочник/Под ред. Е М.Савицкого. М.: Металлургия, 1984
592 с.
В. П. Полякова
Os-Sb. ОСМИЙ-СУРЬМА
В системе Os-Sb существует соединение OsSb2 с ромбической
решеткой типа лоллингита с а - 0,6684, Ь - 0,5937, с = 0,3210 нм или
марказита (символ Пирсона оР6, пр. гр. Pimm) ca- 0,5924, Ь = 0,6666,
с = 0,3202 нм [Э].
В П Полякова
О.ч-Sc, Os-Se, OsSi
735
Os-Sc. ОСМИЙ-СКАНДИЙ
Согласно данным работ [Э, V-C] в системе Os-Sc существуют
соединения: Os7Sc, Os4Sctl и Os7Sc44> данные по кристаллической
структуре которых представлены в таблице 295.
Таблица 295 Кристаллическая структура соединений системы Os-Sc
Соединение
Os2Sc
Os4Scn
Прототип
MgZrb
Ir4Sc,,
Rh7Mg44
Символ
Пирсона,
пр.гр
й/42,
Рвъ1ттс
сЯ20,
Fm3m
C-F408,
F43m
Параметры решетки, нм
а
0,5188
0,5179
1,3344
2,0771
с
0,8505
0,8484
Источник
[V-C]
Р]
[V-C]
[V-C]
Е.И. Гладышевский. О. И. Бодак, В. К. Печорский
Os-Se. ОСМИЙ-СЕЛЕН
В системе установлено существование селенида OsSe2, изоструктур-
ного пириту FeS2 (символ Пирсона сР\2, пр. гр. РаЪ) с а- 0,5945 нм [X]
или а - 0,5933 нм [Р].
В.П. Полякова
ОСМИЙ-КРЕМНИЙ
Диаграмма состояния Os-Si (рис. 367) построена в работе [1] по
результатам термического, рентгеновского и микрорентгеноспектрально-
го анализов, а также измерения электросопротивления сплавов.
Сплавы готовили дуговой плавкой с использованием Os и Si чистотой
59,9 и 99,9999 % (по массе).
В системе найдены три полупроводниковых соединения: OsSi, Os2Si3
и OsSi7. Соединение Os2Si3 плавится конгруэнтно при 1840120 °С, a OsSi
и OsSi~2 плавятся инконгруэнтно при 1730110 "С и 1640120 °С соотве-
соответственно. В системе существуют две эвтектики: (Os) + OsSi и (Si) + OsSi2
с температурами плавления 1720 и 1360 °С соответственно.
736
Os-Si
Si, % //га массе!
t,°C
/soo
rsoo
/7OO
16O0
t50O
f<fOO
fSOO
Г200
30
60 100
*-(.
f72O±fO°
7S)
V Os
\J
tst,
7\
'r
i .
1
OsScg
[Ml
-V
/73a
-юн
ж
tro°
1±20
*2
V
\8
i м
136O*W°
О ГО 20 30 10 SO 60 70 80 SO 100
Os Sl,% fofn.) Si
Рис. 367. Os-Si
Область гомогенности OsSi лежит в пределах от 49,8 до 5i,5 % (ат.)
Si при 1460 °С и с увеличением температуры сдвигается в сторону
избытка Si. Области гомогенности Os2Si3 и OsSi2 имеют незначительную
протяженность.
Данные по кристаллической структуре соединений OsSi, Os2Si3, OsSi2,
а также метастабильной фазы OsSi2(m), полученной закалкой из расплава
[I], представлены в табл. 296.
В работе [i] предполагается, что загрязнение образцов AI при плавке
в тиглях из А12О3 стабилизирует описанную в работе [2] для OsSi
структуру типа CsCl, а также метастабильную фазу OsSi2{ffi).
Таблица 296. Кристаллическая структура соединений системы Os-Si Щ
Соедине-
Соединение
OsSi
Os2Si3
OsSi 2
OsSi2(m)
Прото-
Прототип
FeSi
Ru2Ge3
PFeSi2
OsOe2
Символ
Пирсона,
пр.гр.
cP$,
P2,i
Pb'cn
oC48,
Cmca
mC\2,
Cllm
Параметры решетки, нм
a
0,4722A)
0,4735A)
1,1157
1,0144
0,8661
b
-
0,8964
0,8108
0,2984
с
-
0,5580
0,8218
0,7472
Примечание
С избытком Os
С избытком Si
—
—
р= 119,01°
Os-Si. Os-Sm. Os-Sn
737
Литература
1 Schelleuberg L., Вгаии H.F., Mullet J. // J. Less-Common Met 1988 V 144. N 2.
P 341-350.
2 Finnie J.N. 111. Less-Common Met. 1962. V. 4. N I. P. 24-34.
Л E. Шелимова
Os-Sm. ОСМИЙ-САМАРИЙ
Диаграмма состояния Os-Sm не построена.
В работах Р, V-C] сообщается о существовании двух соединений:
Os,Sm и OsSm3, кристаллическая структура которых представлена в
табл. 297.
Таблица 297. Кристаллическая структура соединений Os-Sm
Соедине-
Соединение
Os2Sm
OsSm3
Прото-
Прототип
MgZn,
Fe3C
Символ
Пирсона,
пргр
hP\l,
Pb-Jinmi
oPid,
Рпта
Параметры решетки, им
а
0,5336B)
0,7419
b
0,9367
с
0,8879B)
0,6364
Источник
Р]
[V-C]
Е И ГлаОышевский, О. И. Бодак, В. К Печарский
Os-Sn. ОСМИЙ-ОЛОВО
Диаграмма состояния системы Os-Sn не построена. По данным ряда
работ [X, 1] предполагается, что Os и Sn при атмосферном давлении не
растворяются друг в друге и не образуют промежуточных фаз.
В работе [2] проведены рентгеновские исследования полученных под
давлением сплавов Os-Sn в интервале концентраций 25-75 % (ат.) Sn.
Сплавы изготовляли в танталовых контейнерах или алундовых ампулах
из порошков Os чистотой 99,993 % (по массе) и Sn чистотой 99,99 % (по
массе).
Установлено, что при давлении 7,7 ГПа в интервале температур
627-1327 °С в системе кристаллизуется единственная промежуточная
фаза Os3Sn7 структурного типа Ru3Sn7: а = 0,9385±0,0006 нм при 67 %
(ат.) Sn. В чистом виде фаза не была получена, во всех образцах
наблюдалась примесь Sn и Os.
738
Os-Sn, Os-Ta
Литература
1 Благородные металлы Справочник / Под ред Е М Савицкого М Металлургия,
1984 235 с
2 Каляева Н.В., Попова СВ. //Известия АН СССР Неорганические материалы 1983
Т 19 N 7 С 1106-1109
В П Полякова
Os-Ta. ОСМИЙ-ТАНТАЛ
Диаграмма состояния Os-Ta приведена на рис. 368 по данным работы
[Э]. Система исследована методами микроструктурного, рентген острук-
турного, микрорентгеноспектрального и термического анализов. В
качестве исходных материалов были использованы металлы чистотой
99,9 % (по массе).
Диаграмма состояния системы Os—Та характеризуется образованием
широких областей твердых растворов на основе исходных металлов и
двух промежуточных фаз, у и о. ,
Растворимость Та в (Os) составляет -19 % (ат.) при перитектической
температуре -2420 °С; растворимость Os в (Та) - -22 % (ат.) при -2500 °С
и -14 % (ат.) при 2200 °С. Обе промежуточные фазы у и о образуются по
перитектическим реакциям, при температурах 2420,2500 "С и концентра-
Ta,°/offro массе)
.0 TO 20 30 *0 50 60 70 80 30 ТОО
3000
2800
2600
2W0
2200
2000
fffOO
ГбОО
\
\
>
(OS)
го
|
\
\\
1
¦^
/
ж
ни
X
ч
1
у'
i
н
S6
б
"V
(та)
J020'
О W 20 ЗО tO 50 60 70 вО 90 1ОО
Os Ta,%{am.) Та
Рис. 368. Os-Ta
O.s-Ta, Os-ТЬ
739
циях 43 и 73 % (ат.) Та соответственно. Они обладают широкими
областями гомогенности: 37-52 % (ат.) Та фаза у и 56-78 % (ат.) Та
фаза о.
Между фазами у и о образуется эвтектика при температуре <2400 °С
и концентрации -53 % (ат.) Та.
Кристаллическая структура промежуточных фаз приведена в
табл. 298.
Таблиц а 298 Кристаллическая структура соединений системы Os-Ta |Э)
Соединение
т
о
Прототип
аМп
ри
Символ
Пирсона,
пргр
с/58,
/43 m
(/•30,
Ptymnm
Параметры решет-
решетки, нм
а
0,9689
0,9569
0,992
с
0,510
Примечание
При 25 % (ат ) Та
При 34 % (ат ) Та
При 50 % (ат ) Та
В П Полякова
Os-Tb. ОСМИЙ-ТЕРБИЙ
Диаграмма состояния системы Os-Tb не построена. Имеются сведения
о составах и структуре двух известных соединений, приведенных в
табл. 299 [V-C]
Таблица 299 Кристаллическая структура соединений системы Os-Tb
Соединение
Os,Tb
OsTb,
Прототип
MgZn2
Fe3C
Символ
Пирсона,
пргр
АЛ 2,
Pb-jtnmt
t>P\6,
Pnma
Параметры решетки, нм
а
0,5314
0,7368
Ь
0,9123
с
0,8802
0,'6286
Е И Гладышевский, О И Бодак, В К Печорский
740 Os-Tc, Os-Te. Os-Th
Os-Tc. ОСМИЙ-ТЕХНЕЦИЙ
Диаграмма состояния Os-Tc не построена. В работе [1] на основании
изменения параметров решетки закаленных с 700 "С сплавов, полученных
методом дуговой плавки, сделан вывод о существовании в системе
непрерывных рядов твердых растворов. Параметры решетки в зависимос-
зависимости от состава изменяются: а - с небольшим положительным, с - с
заметным отрицательным отклонением от правила Вегарда.
Литература
1 Darby J.B., Lam D.J., Norton L J., Dowvoy J.W. // J Less-Common Met 1962 V 4 N 6
P 558-563
В П Полякова
. ОСМИЙ-ТЕЛЛУР
Диаграмма состояния системы Os-Te не построена. По данным работ
[X, Э, Ш] в системе существует теллурид OsTe2 с 57,30 % (по массе) Те со
структурой пирита FeS2 (символ Пирсона сР2, пр. гр. РаУ) с параметрами
а = 0,6398A) нм |Э], а = 0,6382 нм [X], а = 0,63974 нм [Ш].
В П Полякова
Os-Th. ОСМИЙ-ТОРИЙ
Диаграмма состояния Os-Th построена экспериментально при
температурах ниже 1500 "С на основании данных металлографического
и рентгеновского анализов (рис. 369) [1]. В системе установлено
существование трех промежуточных фаз, причем предполагается, что
Th7Os3 и ThOs2 образуются конгруэнтно, a ThOsx (-40 % (ат) Os) -по
перитектической реакции. Температуры образования соединений не
установлены, но они выше 1500 "С.
Нонвариантные реакции, обнаруженные в системе Os-Th, представле-
представлены в табл.300
Os-Th
741
t,'C
/воо
fSoo
Os, % (no массе)
0 tO 20 30 W SO 60 70 80 SO /00
noo
Г0ОО
T7S5°
\
JX
\
*-@7l
Ш0"
1
\
л/
/3
*-@LTh)
1
>*
J
i
wo°
\
'07'
i
36
4
1
1
ж
~50a
i
>/,%
H
i
0°
'3W
1
/
/IS
If
I
(OS) —
О Ю 20 JO 40 50 SO 70 SO 90 /00
Th as,%fa/T7.) OS
Рис. 369. Os-Th
Таблица 300 Нонвариаитиые реакции в системе Os—Th
Ж
ж
ж
ж
Реакция
» aTh + Th7Os3
- Th7Os3 + ThOsx
+ ThOs2 - ThOsx
- ThOs2 + (Os)
13,
36,
-38,5,
85,
Содержание Os
в фазах, % (ат)
-о,
30,
66,6
66,6,
30
40
40
-100
Температура, °С
1287
1482
>1500
>1500
Кристаллическая структура соединений Th7Os3 и ThOs2 дана в
табл 301 Структура соединения ThOsx не определена.
742
Os-Th. O\~Ti
T а б л и u a 301 Кристаллическая структура соединений системы Os-Th
Соединение
Th7Os3
ThOs,
Прототип
Th7Fe3
MgCu2
Символ
Пирсона,
пргр
hP20,
Р63тс
cF24,
Fdlm
Параметры решетки, нм
а
1,0031C)
1,002
0,77151B)
0,77050A5)
с
0,6296B)
0,6285
Источник
[1]
[Э]
[1]
Р]
Литература
I Thomson J.R.//J Less-Common Met 1964 V 6 N1 P 3-10
В П Полякова
Os-Ti. ОСМИЙ-ТИТАН
Диаграмма состояния Os-Ti построена по данным работ [1-3] и
приведена на рис. 370 Os, растворяясь в Ti, стабилизирует фазу (pTi)
Максимальная растворимость Os в (Ti) достигает 23 % (ат ) при 1710 "С,
Os, °/o(no массе)
j ^0 г0 UO 50 60 7О 80 30 /00
3000
2600
ггоо
/воо
/ооо
боо
1
то*
/е
•
12'
1
7
(рп) 1
Г"
i
ж
2)
Г
\
11
w
"—~
1
/
«-7S
4
\
\
\
\
\
</
(OS)
о to го зо to so so 70 во so то
Ti Os,e/t(am) os
Рис. 370. Os-li
О\-П Os-lm
743
при этой температуре протекает перитектическая реакция Ж + 6 - (PTi)
С понижением температуры растворимость Os в фазе фТл) снижается и
в интервале температур 1500-1000 °С практически остается постоянной
на уровне -20 % (ат) Соединение TiOs (фаза 6) плавится конгруэнтно
при 2160 "С, оно растворяет в себе как Ti, так и Os Область гомогеннос-
гомогенности фазы 6 при 1710 °С находится в интервале концентраций 38-51 % (ат.)
Os При температуре 2100 °С и концентрации 65 % (ат) Os кристаллизу-
кристаллизуется эвтектика б + (Os) Растворимость Ti в (Os) составляет -21 % (ат)
при 2100 °С и снижается до 13 % (ат) при 1000 °С Растворимость Os в
(ccTi) при 600 "С равна -1 % (ат) Соединение TiOs имеет кубическую
решетку типа CsCl (символ Пирсона сР2, пр. гр. РтЪт) с параметром
а = 0,308 нм
Литература
1 Еременко В.Н., Штепа Т.Д., Семенова Е.А.//Изв АН СССР Металлы 1971 N4
С 210-213
2 Jeremenko W.N., Stepa T.D. // Collog mt CNRS 1972 N205 P 403-413
3 Штепа Т.Д. //Физическая химия конденсированных фаз, сверхтвердых материалов
и их границ раздели Сб статей Киев Наукова думка 1975 С 175-191
С П Алисова
Os-Tm. ОСМИЙ-ТУЛИЙ
Диаграмма состояния Os-Tm не построена Имеются сведения о
составах и структуре двух известных соединений, приведенных в табл
302 [V-C]
Таблица 302 Кристаллическая структура соединений системы Os-Tm
Соединение
Os2Tm
Osirn,
Прототип
MgZn2
Fe3C
Символ
Пирсона,
пргр
Л? 12,
Ptymmc
оР 16,
Рпта
Параметры решетки, им
а
0,5424
0,7339
Ь
0,8873
с
0,8808
0,6136
ЕЙ Гладышевский О И Бодак В К Печорский
744
Os-U
Os-U. ОСМИЙ-УРАН
Диаграмма состояния Os-U построена на основании данных
металлографического, рентгеновского анализов и измерения точек
плавления (рис. 371) [1] Система характеризуется образованием четырех
промежуточных фаз, из которых Os2U и OsU3 образуются конгруэнтно
при температурах -2280 °С и 1030 °С соответственно, Os4U5 образуется
по перитектической реакции при 1280 °С Образование соединения OsU2
по перитектической реакции установлено не окончательно Предполага-
Предполагается узкая область гомогенности соединений
Нонвариантные реакции в системе Os-U представлены в табл 303
U, а/о (по массе)
, О ГО 20 30 W 50 60 70 30 90 ГОО
о to го зо
Os
50 бо 7о во до то
U,"/о (am) U
Рис. 371 Os-U
O\-U Оч-V
Т а б л н и а 303 Нопвариантиые реакции в системе Os—U
745
Реакция
Ж = (Os) + Os,l)
Ж + Os2U - Os4U,
Ж = Os4U5 + OsU2
Ж + OsUj - OsU2'
Ж - OsU3 + (yU)
(yU) - OsU3 + (fJU)
(PU) => OsU3 + (aU)
28,
58
60,
61
78,
92,
97,
Содержание Os
в фазах, % (ат)
<1,
-зз,
55,5
75,
75,
75,
75,
-33
55,5
66,6
66,6
82
96
>99,5
Температура, "С
2170
1280
900
920'
970
685
620
Максимальная растворимость U в (Os) <1 % (ат), растворимость Os
в (yU) 18 % (ат) при 970 °С, в фЦ) - 4 % (ат) при 685 "С, в (aU) <0,5 %
(ат) при 620°С
Соединение Os2U имеет кристаллическую структуру типа MgCu2
символ Пирсона cFlA, np rp Fd3m, a = 0,75125E) нм Сведений о
кристаллической структуре соединений Os4U5, OsU2 и OsU3 не имеется
Литература
I KnaptonA.G.//J Nucl Mat 1963 V 9 Р 309-319
В П Полякова, А С Адамова
Os-V. ОСМИЙ-ВАНАДИЙ
Диаграмма состояния Os-V построена по данным работы [1] и
приведена на рис 372 Сплавы выплавляли в дуговой печи из Os и V
высокой чистоты Исследованиевыполнено методами микроструктурно-
микроструктурного, рентгеновского и термического анализов
Система характеризуется наличием двух соединений Os2V3 и OsV
Os,V3 плавится конгруэнтно при 2140 °С, соединение OsV образуется по
перитектоидной реакции при 640 "С. При 2010 "С в системе протекает
перитектическая реакция Ж + Os2V3 •* (V). Растворимость Os в (V) при
2010 °С равна 31 % (ат) При 1910 °С кристаллизуется эвтектика
Os,V3 + (Os) Максимальная растворимость V в (Os) при 1910 °С равна
46%(ат)
746
Os-V, Os-W
Os,4»(no массе)
020*0 BO SO 90
100
гьоа
2000
rsoo
0 tO 20 30 tO SO SO 70 BO 90 100
V OS, •/• (am.) os
Рис. 372. Os-V
Соединение Os2V3 имеет кубическую решетку с параметром а =
= 0,3005 нм. Соединение OsV обладает решеткой типа pW (символ
Пирсона с/2, пр.гр. 1тЪт) с а = 0,7845 нм [1].
Литература
I. Raub E., Roschel Е. // Z. MetalIkunde. 1966. Bd. 57. N 6. S. 470-472.
Г.К. Алексеенко
Os-W. ОСМИЙ-ВОЛЬФРАМ
Взаимодействие Os с W изучалось рядом авторов [X, Э]. Диаграмма
состояния системы Os-W (рис. 373) построена по данным работы [1]. В
системе образуется одна промежуточная фаза OsW3 (о) и твердые
растворы (Os) и (W). OsW3 образуется при 78 % (ат.) W и 2945 °С по
перитектической реакции из расплава с 66,5 % (ат.) W. Между OsW3 и
(Os) образуется эвтектика при температуре 2725 °С и концентрации 58 %
(ат.) W.
Значения растворимости W в (Os) и Os в (W) при различных
температурах приведены ниже:
Os-W
747
I, °C 2725 1400 1200
W, %(ат) 54 -34 -32
t,'C 2945 2200 1200
Os, %(ат.) 18,5 10 6
Значения параметров решетки (а, с) твердого раствора (Os) (символ
Пирсона/г/^, пр.гр. Рбу/ттс) в зависимости отконцентрации Wуказаны
ниже:
W, %(ат.) 0 0 10 20 40
а,им 0,27348 0,27341 0,27437 0,27533 0,27655
с,нм 0,43913 0,43199 0,43418 0,43707 0,44498
Источник [2] [1] [1] [I] [1]
Значения параметра решетки (а) твердого раствора (W) (символ
Пирсона с/2, пр.гр. 1тЪт) в зависимости от концентрации Os приведены
ниже:
Os, %(ат.) 0
я, нм 0,31651
Источник [2]
0
0,31650
[1]
2,5
0,31623
[И
5,0
0,31603
[1]
10
0,31572
И]
W, °/о/по массе}
ГО 20 30 «О SO SO 70 ВО 90 Ж
гооо
О ГО го 30 ЧО SO 60 70 вО SO ГОО
OS w,°/ofam.) w
Рис. 373. Os-W
748
Os-W. Os-Y
Значения параметров решетки (а, с) соединения OsWj (тип pU, символ
Пирсона /.РЗО, пр.гр. Р421тпт) в зависимости от концентрации W
приведены ниже:
W, % (ат.).
а, нм
с, нм
Источник .
66,7
0,96714
0,50158
[1.3]
50
0,9656
0,5003
[4]
65-67
0,9686
0,5012
[5]
Обзор исследований системы Os-W приведен в работе [5].
Литература
1. Taylor A., Kagle B.J., Doyle N.J. // J. Less-Common Met. 1961. V. 3. N 4. P. 333-347.
2. King H.W. // Bull. Alloy Phase Diagrams. 1981. V. 2. N 3. P. 401-402.
3. Spooner F.J., Wilson C.G.//Acta Crystallogr. 1964. V.I 7. P. 1533-1538.
4. Knapton A.G.// J. Inst. Metals. 1958. V. 87. N 1. P. 28-32.
5. Nagender Naidu S. V., Rama Rao P. // J. Alloy Phase Diagrams. 1986. V. 2. N 2. P. 93-96.
КБ. Поварова
Os-Y. ОСМИЙ-ИТТРИЙ
Диаграмма состояния Os-Y изучена и приведена на рис. 374 по
данным [М].
Y,V.(no массе)
О 10 «О ВО 80 100
3000
2500
2000
1500
1000
son
\/0Г1
\
\
\
1
\
u
-S.
r
¦~@i)
1
1
2501
IIOO'
i
Ж
/г»
\
\
>•
1
1
\
V
\
-А
.
S8
(о
Г)*
1521'
Рис.
374.
Os-Y
0
OS
го
20
JO
*0 50 SO
К,'/, firm.)
70
80
so
too
Y
Os-Y. Os-Yb, Os-Zn
749
Методы синтеза и исследования, а также степень чистоты исходных
компонентов не описаны.
В системе Os-Y обнаружено существование двух соединений. Одно
из них - Os2Y - образуется с открытым максимумом при -2500 °С, а
другое - OsY3 - в результате перитектической реакции:
OsY3-)K + Os2YA290oC).
Существуют эвтектические равновесия:
(Os) + Os2Y - Ж при 2100 "С и 6 % (ат.) Y
Ж - (oY) + OsY3 при 1150 °С и 88 % (ат.) Y.
Взаимная растворимость компонентов не обнаружена.
Сведения о составах и структуре двойных фаз приведены в табл. 304
[V-C].
Таблица 304. Кристаллическая структура соединений системы Os-Y
Соединение
Os2Y
OsY3
Прототип
MgZn2
Fe3C
Символ
Пирсона,
пр.гр.
АЛ 2,
Pfymmc
()Р\6,
Рпта
Параметры решетки, нм
а
0,5307
0,7425
b
0,9132
с
0,8786
0,6337
ЕМ. Гладышевский, О.И. Бодак, В. К. Печарский
Os-Yb. ОСМИЙ-ИТТЕРБИЙ
Диаграмма состояния Os-Yb не изучена.
Единственное известное соединениеОв2У принадлежит к типу MgZnj,
символ Пирсона kP 12, пр.гр. Р6^/ттс,а = 0,5314, с = 0,8802 нм [1].
Литература
l.IandelliA., Palenzona A.// Rev. Chim. Mineral. 1976. V. 13.N I. P. 55-61.
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
Os-Zn. ОСМИЙ-ЦИНК
Диаграмма состояния Os-Zn не построена.
Предполагается, что Zn и Os не образуют соединений. При растворе-
растворении богатых Zn сплавов в разбавленной HCI в осадке наблюдается
чистый Os [X].
В. П. Полякова
750
Os-Zr
Os-Zr. ОСМИЙ-ЦИРКОНИЙ
Информация о взаимодействии Os с Zr приведена в работах [1-4].
Диаграмма состояния Os-Zr (рис. 375) была построена по результатам
дифференциального термического, микроскопического, рентгеновского
анализов при использовании также метода Альтерума-Пирани [1-7].
Сплавы для исследования готовили методом дуговой плавки в среде Аг
из иодидного Zr и порошка Os, отожженного в вакууме и переплавленно-
переплавленного в дуговой печи. Сплавы исследовали в отожженном B500-500 "С,
0,5-480 ч) и закаленном (богатые Zr сплавы) от 1000, 800 и 700 "С
состоянии.
Подтверждено существование ранее найденных соединений ZrOs2,
ZrOs [X] и Zr, |Os4 [5, 6]. Установлено, что ZrOs2 (Aj) плавится конгруэн-
конгруэнтно при температуре 2660 °С и концентрации 35 % (ат.) Zr, при 2300 °С
протяженность области гомогенности около 4 % (ат.), при температурах
ниже 1700 °С область гомогенности отсутствует. Соединение ZrOs
образуется по перитектической реакции ZrOs2 + Ж <¦* ZrOs при 2040 "С,
Zr, '/о {по массе)
W 20 30 W 50 60 70 90 ЮО
300О
26OO
вв 92 96 Zr
ZrOs Zr,%/am.)
О Ю 20 30 <iO 50 60 70 80 90 fOO
Os Zr, "/ofamj Zr
Рис. 375. Os-Zr
Ол-Zr
751
а соединение Zr||Os4 при 1350±10 °С по перитектической реакции
ZrOs + Ж" Zr, ,Os4. В системе протекают эвтектические реакции:
Ж - (Os) + Я, при 2440120 °С и 19 % (ат.) Zr;
Ж и. Zr, ,Os4 + (pZr) при 1270± 10 °С и 80 % (ат.) Zr.
Растворимость Zr в (Os) при эвтектической температуре составляет
~8%(ат.), при 1100 °С-4%(ат.). В (pZr) при эвтектической температуре
растворяется около 14 % (ат.) Os, с понижением температуры раствори-
растворимость изменяется мало. Os понижает температуру р <¦* а превращения Zr.
В (aZr) растворяется < 1 % (ат.) Os.
При закалке богатых Zr сплавов из области фазы р образуются
метастабильные фазы [7]. Аморфные сплавы были получены резкой
закалкой лент при содержании 70—80 % (ат.) Zr [8].
Кристаллическая структура соединений представлена в табл. 305.
Т а б л и и а 305 Кристаллическая структура соединений системы Os-Zr
Соединение
ZrOs2
ZrOs
Zr,,Os4
Прототип
MgZn2
CsCl
Sc,,Ir4
Символ
Пирсона,
пргр.
ЛЛ2,
РЬфтпс
cPl,
РтЪт
Finim
Параметры решетки, нм
а
0,520
0,326
1,3428
1,3414
1,343
с
0,853
-
-
Источник
[1]
[1,2]
[5]
[б]
[2]
Литература
1 Еременко В.Н., Штепа Т.Д., Семенова Е.А. //Доповщ1 АН УССР. Сер. Б. 1972. N 1.
С 50-52.
2 Еременко В.Н., Семенова Е.А., Штепа Т.Д. // Доклады АН УССР. Сер. А. 1976. N 7.
С. 663-666.
3 Еременко В.Н., Семенова Е.А., Штепа ТД. // Известия АН СССР. Металлы. 1978. N 2.
С. 200-202.
4. Еременко В.Н., Семенова Е.А., Хоружая В.Г., Штепа Т.Д. // Физическая химия
неорганических материалов: Сб. статей. Киев: Наукова думка, 1988. Т. 1. С. 256-323.
5 McCarthy S.L., Schmidt J. //J. Less-Common Met 1971. V. 23. N 2. P. 241-242.
6 Chabot В., Cenzual K., Parthe E. // Acta Crystallogr. B. 1980. V. 36. N 1. P. 7-11.
7. Коломнеи Л Л., Скороход В.В., Солонии Ю.М. // Стабильные и метастабильные фазы
в материалах- Сб. статей. Киев: Наукова думка, 1987. С. 132-137.
8. Inoue A., Matsuzaki К., Masutnoto Т., Chen H.S. // J. Mater. Sci. 1986. V 21. N 4
P 1258-1268.
Л А. Третъяченко
752
Р-РЬ. P-Pd
Р-Pb. ФОСФОР-СВИНЕЦ
Диаграмма состояния Р-Pb не построена.
В работе [X] указывается на то, что путем реакции в водном растворе
удалось получить соединение РЬ3Р2 Высказывается предположение, что
это соединение, содержащее 9,06 % (по массе) Р, может образовываться
в богатых РЬ сплавах Однако попытка приготовить какое-либо
соединение РЬ с Р прямым синтезом или хлоридным способом оказалось
безуспешной [X]
Л Л Рохлин
P-Pd. ФОСФОР-ПАЛЛАДИЙ
Информация о взаимодействии Р с Pd сообщается в работах [X, Э, Ш]
Диаграмма состояния Pd-P (рис. 376) построена по данным термическо-
термического, тензиметрического, микроскопического,рентгеновского и химическо-
химического анализов при концентрациях Р 0-70 % (ат.) [X, 1]
Система характеризуется образованием семи соединений Pd8P и Pd6P
образуются по перитектическим реакциям при 799 и 792 °С, имеют
незначительные области гомогенности и стабильны до температуры
t°C
1200
woo
воо
600
wo
гао
5 Ю
Р, °А> (по массе)
20 30
10О
799"
\
к}
I
i
i
3
I
ж
к (
- 778°
I
-'%rf1SPt
i
Г, С
700
500
300
г.
i
eh
n
*2$>
796'
К
1 I.I
T 30 35
",% (no мессе)
О
Pd
Рис. 376. P-Pd
1О
го зо
40 5Р SO
Р, % Cam )
7О
во
90
too
Р
P-Pd
753
20 ° С Фаза Pd4 8P плавится конгруэнтно при 780 "Си входит в состав
двух эвтектик при 771 °С с Pd6P и Pd3P. В интервале 660-700 °С фаза
Pd4 8P распадается по эвтектоидной реакции на Pd6P и Pd3P. Фаза Pd3P
образуется конгруэнтно, имеет широкую область гомогенности в
пределах концентраций 20-25 % (ат.) Р. Соединения Pd5P2 и Pd7P3
образуются по перитектическим реакциям при 852 и 814 °С соответствен-
соответственно При 778 "С протекает эвтектическая реакция между Pd7P3 и PdP2. В
работе [2] уточнены температуры и области гомогенности соединений
Pd5P7 и Pd7P3 (см. вставку на рис. 376).
РастворимостьР в (Pd) мала. Легирование Pd фосфором сопровожда-
сопровождается резким снижением температуры плавления Pd.
При нагреве порошка Pd и красного Р в интервале температур
500-1100 °С бьшо получено новое соединение PdP3 \Э]. Нарис. 376 это
соединение не показано.
Кристаллическая структура соединений приведена в табл 306.
Таблица 306 Кристаллическая структура соединений системы P-Pd
Соеди-
Соединение
Р<ЧвР*
Pd3P
Pd7P3
PdP2
PdP3
Про-
Прототип
-
Fe3C
-
NiP2
NiP3
или
1гР3
Символ
Пирсона,
пргр
-
оР16,
Рпта
ЙЯ20,
R3
тС\2,
ciic
с/32,
/тЗ
'Моноклинная сингонш
Параметры решетм
а
0,50059
0,5080-0,5645
0,5978
0,518
1,1976
1.Г94
0,6777
0,6207
0,7705
Ь
0,7608
0,7440-0,7558
6,7442
0,600
-
0,5856
0,5857
л, нм
с
0,84199
0,5164-0,5071
0,5165
0,746
0,70552
0,704
0,6206
0,5874
Примеча-
Примечание
р = 95,64°
[1]
Р]
При 25 %
(ат)Р[П
[Ш]
[2]
[Ш]
Р= 126,43°
Р1
Р= 111,8°
[Ш]
[Э]
754
P-Pd, P-Pr
Литература
1. GullmanL.-O. /П. Less-Common Met. 1966. V. 11. N 3. P. 157-167.
2 Matkovic Т., Schubert K. // i. Less-Common Met 1977. V 55. N 2 P. 177-184.
В.П. Полякова
P-Pr. ФОСФОР-ПРАЗЕОДИМ
Взаимодействие Р с Pr описано в работах [X, Э, Ш]. Диаграмма
состояния системы Pd-P (рис. 377) представлена из работы [1]. Исследова-
Исследование проведено методом дифференциального термического анализа.
В системе образуется устойчивое соединение РгР с температурой
плавления 3120 °С [1]. Имеются сведения, что оно обладает небольшой
областью гомогенности: РгР0 8^_, 0 или РгР0 ?_, 0 [Ш]. Кристаллическая
решетка РгР-ГЦК са = 0,588 нм [Х],а = 0,5870..!0,5912 нм [Ш]. В системе
установлено еще три соединения РгР2, РгР5 и РгР7, которые образуются
по перитектическим реакциям при 1097, -697 и -497 °С [1].
t;c
2500
2000
1500
1000
331\
195'
500
О
Р, % (по массе)
5 10 20 10*050 80/00
1
/
h
l\
/
/
97
781
1
/
It'
r
In
и
a.
101
i
\
\
\
\
?7
d
*
\
[
\
1
\
\
S9fi
>
T ™ T
\
0 10 20 JO *0 50 60 70 80 90 100
Pr P,'/.(am.) P
Рис. 377. Р-Рг
P-Pr. P-Pt
755
Литера i ура
1 Миронов К.Е. II Ил» АН СССР Неорганические материалы 1981 Т 17. N 2
С 197-200.
Л Л Рохлин
P-Pt. ФОСФОР-ПЛАТИНА
Обзор работ по строению системы P-Pt приведен в работе [1].
Диаграмма состояния системы P-Pt (рис. 378) построена на основании
результатов термического, микроструктурного и рентгеновского
анализов в работе [2].
Установлено существование двух промежуточных фаз: Pt5P? с 25,9 %
(ат.) Р и PtP2c 66,6 % (ат.) Р. Соединение Pt5P2 образуется по перитекти-
ческой реакции Ж + PtP, -* Pt5?2 при 590 °С и образует эвтектику с (Pt)
при температуре 588 °С и концентрации 20 % (ат.) Р. Соединение PtP2
плавится конгруэнтно при температуре > 1500 "С. В системе отмечается
значительная область несмешиваемости в жидком состоянии в интервале
концентраций 26-52 % (ат.) Р при температуре выше 683 °С. Кристалли-
Кристаллическая структура соединений приведена в табл. 307.
/600
ffOO
fZOO
/000
дОО
600
Р, °/о /ло массе I
ю го
30
too
\
\
\
\
*
1
1
see'
-(pt)
A
гоч?
1
6
f
\
\
/f(f''Art9
без"
590"
I
1
t
1
\ 1
v
!
5Z
Pi
* p +/pl
о
Pt
/о
JO $O JO SO 70
P, '/ofam.\
80
Рис. 378.1'-Р(
756
P-Pt. P-Pu, P~Re
Таблица 307. Кристаллическая структура соединений системы P-Pt
Соедине-
Соединение
PtP2
Pt5P2
Прото-
Прототип
FeS2
(пирит)
Символ
Пирсона,
пр.гр.
сРП,
РаЪ
тС 12,
CVc
Параметры решетки, нм
а
0,5694
0,56956
0,56955
1,07642
Ь
0,58854
с
0,74378
Примечание
[3]
[4,5]
[б]
р = 99,17°[7]
Растворимость Р в Pt в твердом состоянии не превышает 0,03 % (ат.)
[X].
Литература
1. Okamoto Н. // Bull Alloy Phase Diagrams. 1990. V. UN 5. P. 511-513.
2. BHtt W., Weibke F., May E., Meisel K. // Z. Anorg. All. Chem. 1935. Bd. 223. S. 129-143.
3. Rimdqvist S. // Nature. I960. V. 185. P. 31-32.
4. FurusethS., SelteK., Kjekshus A. //ActaChem. Scand. 1965. V. 19. N 3. P. 735-741.
5. Dahl E. // Acta Chem. Scand. 1969. V. 23. N 8. P. 2677-2684.
6. Baghdad! A., Finley A., Russo P. et al.//J. Less-Common Met. 1974. V. 34. N I. P. 31-38.
7. Dahl E.//Acta Chem. Scand. 1967. V. 21. N5. P. 1131-1137.
AC. Адамова. В. П. Полякова
P-Pu. ФОСФОР-ПЛУТОНИЙ
Путем индукционного нагрева Ри и Р под вакуумом или в атмосфере
Не под давлением, несколько меньшим чем атмосферное, получено
соединение PuP с кристаллической структурой типа NaCl (символ
Пирсона cF8, пр.гр. Fmlm) с а = 0,5644 нм [1]. Согласно работе [1]
соединение Претерпевает скорее распад, чем плавится, при температуре,
близкой к 2000 °С.
Литература
I. Gorum А.Е. // Acta Crystallogr. 1957. V. 10. N 2. P. 144.
P-Re. ФОСФОР-РЕНИЙ
Л.Л. Рохлин
Диаграмма состояния P-Re не построена. Имеются сведения, что Re
взаимодействует с Р при температурах выше 800 "С с образованием
четырех фосфидов: ReP3, ReP7, ReP, Re2P с содержанием Р 33,28; 24,95,
P-Re, P-Rh
757
14,26 и 7,68 % (по массе) соответственно [1, 2]. Re2P имеет решетку типа
Co2Si (символ Пирсона о/Ч 2, пр.гр. Рпта) с параметрами а = 0,5540,
Ъ = 0,2939, с = 1,004 нм [Э]. Рентгеновским методом исследовали
взаимодействие Re с Р [3]. Порошки из исходных компонентов прессова-
прессовали и спекали при 1070 °С с выдержкой 100 ч. В системе Re-P указывается
на наличие фосфидов ReP4, Re12P26, ^з^ и ^е2^ Р1-
Литература
1. Horaldsen Н.//Z. Anorg. All. Chemie. 1935. Bd. 221. S. 397-417.
2. Борисова Л.В., Ермаков А.Н. Аналитическая химия рения. М.: Наука, 1974. 318 с.
3. Оришин СВ., Кузьма Ю.Б., Герлецкин P.M., Данкевич Я.Г. // Исследование и
применение сплавов тугоплавких металлов: Сб. статей. М: Наука, 1983. С. 11-15.
М.А. Тылкина
P-Rh. ФОСФОР-РОДИЙ
В обзорной работе [1] приведена ориентировочная диаграмма
состояния системы P-Rh (рис. 379), построенная в основном по данным
термического анализа.
В системе установлено существование пяти соединений: P3Rh, P2Rh,
P3Rh4, P2Rh3 и PRh2, из них только P3Rh имеет интервал гомогенности
с измеримой протяженностью [2]. PRh2 образует эвтектику с (Rh) при
-77 % (ат.) Rh и 1255 °С. Температура плавления или возгонки
P3Rh > 1000 "С, поскольку давление Р над P3Rh при 1000 "С только
t'C
Г600
woo
Rh, e/e (no массе)
О го W50 60 70 80 90 tOO
SOP
\ 1
1 1
1
.1
с
с
г
l
1
4: »
>a
a.
Ж
'00°
\
/
i
f,
tzt
(Rt
/
V—
tS63"
О W 20 30 VO 5O SO 7O 80 SO fOO
P Rh, %(am.) Rh
Phc. 379. P-Rh
758
P-Rh, P-Ru
10,7 кПа [2] и P3Rh образуется при реакции элементов в кварцевой трубке
при 1000 ° С [3].
Кристаллическая структура фосфидов Rh дана в табл. 308.
Таблица 308 Кристаллическая структура соединений системы Р—Rh
Соедине-
Соединение
P3Rh
P2Rh
P3RI14
P2Rh3
PRh2
Прото-
Прототип
CoAs-,
-
-
-
CaF2
Символ
Пирсона,
пргр.
с/32,
1ml
тСП,
C2tk
оР1%,
Рпта
1Р5,
Р4т2
с/12,
/•шЗш
Параметры решетки, нм
а
0,7996
0,79951
0,57429
0,57417
1,1662
0,3327
0,5516
0,5498
h
-
0,57942
0,57951
0,3317
-
-
с
-
0,58370
0,58389
0,9994
0,6151
-
Примечание
[4]
[3]
р= 112,92° [5]
Р= 112,91° [6]
[7]
Монокристалл
[8]
[9]
[4]
Литература
I. OkamotoH.// Bull. Alloy Phase Diagrams. 1990. V. 11. N 4. P. 415-417.
2 Faller F.E., Strotzer E.F., BiltzW.//Z. Anorg. All. Chem. 1940. Bd. 244. S. 313-328.
3. Rundqvist S., Ersson N.O. // Ark. Kemi. 1969. V. 30. N 10 P. 103-114.
4. Rundqvist S.//Nature. 1960 V. 185. P. 31-32.
5 Rundqvist S.//Acta Chem. Scand. 1961. V. 15. N 2 P. 451-453.
6 Kjekshus A.//Acta Chem. Scand. 1971. V. 25. N 2. P. 411-422.
7 Rundqvist S., Hede A. // Acta Chem. Scand. 1960. V. 14 P. 893-902
8 El Ghadraoui E.H., Guerin R., Sergent M.//Acta Crystallogr. С 1983. V. 39 P. 1493-1494
9 Zumbusch M. IIZ Anorg All. Chem. 1940. Bd. 243. S. 322-329.
А С Адамова
P-Ru. ФОСФОР-РУТЕНИЙ
Диаграмма состояния Р—Ru (рис. 380) построена в работе [1] на
основании данных микроструктурного, рентгеновского, термического
анализов, измерения микротвердости. В качестве шихтовых материалов
использовали Ru чистотой 99,98 % (по массе) и красный Р.
В системе P-Ru установлено образование трех промежуточных фаз:
Ru2P A3,22% (по массе) Р), RuP B3,35 % (по массе) Р), RuP2 C7,85 %
P-Ru
759
2100
/700
1300
900
500
P, °/o//7o массе/
TO 20 30 fO 50
Z33f°
\
\
iw
*-(/f.
\
\1SOO°
30
X.
i
1
К
t555e
95
I
0°
1
Газ
О ГО 20 30 40 50 60 70 80
Ru P, °/o /am.)
Рис. 380. P-Ru
(по массе) Р). Соединения Ru7P и RuP плавятся конгруэнтно при
температурах 1500 и 1555 "С соответственно. Соединение RuP2 при
температуре 950 "С разлагается на RuP и газообразный Р.
В системе установлены эвтектические равновесия при температурах
1480 °С [1] A425 "С (X]) и 1400 °С при содержании Р -30 и 41 % (ат.) со-
соответственно.
В табл. 309 приведены данные о кристаллической структуре
соединений системы P-Ru.
Таблица 309 Кристаллическая структура соединений системы P-Ru [Э|
Соединение
Ru2P
RuP
RuP2
Прототип
PbCI,
(Со2Р)
МпР
FeS2
Символ
Пирсона,
пргр.
оРЬ,
Ртпа
оРЪ,
Рппт
Параметры решетки, нм
а
0,5902
0,5520
0,5115
b
0,3859
0,3168
0,5888
с
0.6896
0,6120
0,2870
760
P-Ru, PS
Литература
1 Черногоренко В.Б., Иванченко В.Г., Кулик Л.Я. // Изв АН СССР Металлы 1976
N4 С 176-177
В П Полякова
P-S. ФОСФОР-СЕРА
Диаграмма состояния P-S приведена на рис. 381 по данным работ
[1, 2]. В системе обнаружено шесть соединений: P4S2 C4 % (по массе) S),
P4S3 D4,7 % (по массе) S), P4S5 E6 % (по массе) S), P4S6 F0 % (по массе)
S), P4S7 F4,4 % (по массе) S), P4S,0 G2,1 % (по массе) S).
Соединения P4S7) P4S3, P4S7 и P4Sl0 плавятся конгруэнтно при
температурах 47, 172" 305-310, 280-285 °С соответственно. Соединения
P4S5 и P4S6 образуются по перитектическим реакциям при температурах
162 и 232 "С.
О 10 20 SO <>О SO 60 70 SO 90
О ГО ZO 30 W 50 6О 70 80 90 WO
p S, °a> fro массе) S
Рнс. 381.P-S
PS P-Sh
761
При температурах -65, -20, 106, 250 и 112 °С кристаллизуются
эвтектики (Р) + P4S2, P4S2 + P4S3, P4S3 + P4S5, P4S7 + P4S10 и P4S10 + (S)
соответственно
Соединение P4S3 согласно работе [3] имеет орторомбическую
структуру с параметрами решетки а = 0,996 нм, b = 1,0597 нм, с =
= 1,3671 нм. По данным работы [4] кристаллическая структура соедине-
соединения P4S7 моноклинная с параметрами решетки а = 0,887 нм, b = 1,745 нм,
с - 0,683 нм, р = 92,7°. кристаллическая структура соединения P4S10
относится к триклинной сингонии, параметры решетки а = 0,907 нм,
Ь = 0,918нм,г = 0,919 нм, а = 92,4°, р= 101,5°, у = 110,5°.
Jlnreparjpa
1 lorthmann R., Schneider A. // Z Phys Chem 1966 Bd 49 S 22-37
2 Forthmann R., Schneider A. // Naturwissenshaften 1965 Bd 52 S 390-391
3 Loijng Y.C., Waser I., Houten S. et al //Acta Crystallogr 1957 V 10 P 574-575
4 Vos A., Wiebenga H.//Acta Crystallogr 1955 V 8 P 214-223
H И Никитина
P-Sb. ФОСФОР-СУРЬМА
Часть диаграммы состояния P-Sb со стороны Sb до 5 % (ат) Р
построена в работе [1] на основании результатов микроструктурного,
термического и химического анализов. На рис 382 приведен участок
Si, a/o (no массе)
99,0 99,2 99,* 99,6 99,8 WO
Г2О0
WOO
see
600
wo
zoo
1 i
i
Газ+ж
612" _,
96,7
Газ+(&5
1
у
ь)
m-htct sb j
Газ/
/
т
(dLSb)X
630JSS°
95 96 97 98 99 fOff
S6, %(am.) Sb
Pnc. 382. P-Sb
762
P-Sb, P-Sc. P-Se
диаграммы состояния P-Sb по данным работы [2], основанной на
результатах исследования [1].
Согласно [М2] температуры плавления и кипения аР составляют 44,14
и 277 °С соответственно; температуры кипения и плавления Sb равны
1587 и 630,755 °С соответственно. При охлаждении ниже температуры
612 °С насыщенный расплав распадается на твердую и газовую фазы.
Соединений Sb с Р не обнаружено.
Литература
1 Vogel R., Horstmann D. //Arch. Eisenhuttenwes. 1952. Bd. 23 S 127-128.
2 OkamotoH. //J Phase Equilibria. 1991. V. 12. N2 P. 2|4
Н.И. Никитина
P-Sc. ФОСФОР-СКАНДИЙ
В системе P-Sc установлено образование соединения ScP при нагреве
опилок Sc с Р при температуре 1000 "С [Ш, 1]. Соединение ScP имеет
структуру типаИаС! (символ ПирсонаcF8, пр.гр. Fm3m),a = 0,5312 нм.
Литература
I Parthe Е. //Acta Crystallogr. 1963. V. 16 N I. P. 71
Л Л. Рохлин
P-Se. ФОСФОР-СЕЛЕН
Диаграмма состояния P-Se приведена на рис. 383 по данным работы
[М]. В системе P-Se образуются инконгруэнтно два соединения P4Se3 и
5е, '/• (по пассе)
too
500
WO
300
200
100
О 10 20 JO 4-0 SO 60 70
во
SO
100
1 1
г
(/тур
i i
опив
/печка)
rs
t "v
34-0'
здо'
1
i
,+ж
1
\
V
\
—
1
ж
V"
я,
О 10 20 30
Р
50 60 70 10 90 ЮО
, % (am.) Se
Рис. 383. P-Se
P-Se. P-Si
763
P2Se3 при температурах 300 и 270 °C соответственно. Монотектическое
превращение осуществляется при температуре 340 "С. В сплавах, богатых
Se, при температуре 150 "С и содержании -75 % (ат.) Р происходит
эвтектическое превращение.
Соединение P4Se3 имеет ромбическую кристаллическую решетку с
параметрами а = 0,9739 нм, Ь - 1,1797 нм, с - 2,6270 нм [Э].
Н.И. Никитина
Р - Si. ФОСФОР - КРЕМНИЙ
Диаграмма состояния Р - Si приведена на рис. 384 по обобщенным
данным работы [1] с учетом данных работы [2]. В системе Si - Р
инконгруэнтно образуется соединение SiP из жидкой и газовой фазы. При
температуре 1131 "С и содержании 32,8 % (ат.) Р осуществляется
эвтектическое превращение Ж •* (Si) + SiP.
Растворимость Р в Si при эвтектической температуре составляет
0,5%(ат.).
Р, % (по массе)
О 0,510 Z0 30 W 50 ВО 70
t;c
то ** t
поо
1000
600
0.5 10 JO 50
Si P, к (am)
Рис. 384. P-Si
764
P-Si. P-Sm
Растворимость Р в Si была определена методом измерения микротвер-
микротвердости [3], а также методом локального анализа состава фаз, образующих-
образующихся в диффузионных парах \Э]. В табл. 310 указаны значения растворимос-
растворимости Р в (Si) согласно этим двум работам.
Таблица 310 Растворимость Р в Si
Температура, °С
1300
1200
1100
1000
900
800
700
Растворимость Р в Si
% (ат )
0,61
0,47
0,77
0,72
0,55
0,50
0,50
0,33
0,35
0,15
% (мае )
0,55
0,43
0,70
0,65
0,50
0,45
0,45
0,30
0,32
0,14
Источник
[Э]
[3]
[Э]
[Э]
[3]
[Э]
[3]
[Э]
[3]
[3]
Соединение SiP имеет ромбическую решетку с параметрами а =
= 0,690 нм, Ь = 0,940 нм, с = 0,768 нм [III].
Литература
1 Olesinski R.W., Kanani N., Abbaschian G.J. // Bull Alloy Phase Diagrams 1985 V 6 №2
P 130-133 203-204
2 Giessen В., Vogel R.//Z Metallkunde 1959 Bd 50 № 5 S. 274-277
3 Абрикосов Н.Х., Глазов В.М., Лю Чжзнь-Юань. // Журнал неорганической химии
1962 Т 7 №4 С 831-835
Л Л Рохлин
Р - Sm. ФОСФОР - САМАРИЙ
Диаграмма состояния Р - Sm не построена В работе [1] методами
масс-спектрального и рентгеновского анализов установлено существова-
существование моносульфида SmP при температурах 1315-2020 °С и определена
P-Sm. P-Sn
765
область гомогенности этого соединения, описываемая формулой
SmP, ooo-o,982- ^ работе [2] указано на соединение SmP5, которое
разлагается при температуре выше 700 "С.
Соединение SmP имеет кристаллическую структуру THnaNaCl (символ
Пирсона, rF8, пр. гр. Fmbm,а = 0,5760 Р].
Соединение SmP5 согласно работе [3] имеет моноклинную структуру
(пр. гр. Р2хт или Р2Х) с параметрами решетки а = 0,4936 нм, b -
- 0,9508 нм, с = 0,5411 нм, р = 102,9° [3].
Литература
1 Гольник В.Ф., Гордиеико СП., Миронов К.Е. Получение, свойства и применение
фосфидов Киев Наукова Думка, 1977 107 с.
2 Ono S., Nomura К., Hayakawa Н.//J Less-Common Met 1974 V 38 N I P 119-130
3 Wichelhaus W., Schnering H.G.//Z Anorg All Chem 1976. Bd. 419 N 1 § 77-86.
Ю Б Кузьма
P - Sn. ФОСФОР - ОЛОВО
Диаграмма состояния Р - Sn приведена на рис. 385 по данным работы
PC]. В системе установлено образование трех соединений: соединение
Sn3P4 плавится конгруэнтно при температуре 560 °С, соединения Sn4P3
800
700
600
500
WO
300
200
100
Р,%(/70 пассе)
0135 ю го зо w so бо во wo
\ -
/
г
^,231
—г
Г
,9681
*r(PSn)
1
а
i
\\~
~5В0
. .43,7/W
s*o°\
1
|
||
1
т—
¦ ч
\\
">>s'53a
63,6
—\—
Жг+)
Гво*
о ю го зо чо so so io so so 100
Sn P,o/a(am.) P
Рис. 385. P-Sn
766 P-Sn P-Sr
и SnP3 образуются по синтектическим реакциям при температурах 550
и 580 °С В работе [1] сообщается об образовании соединения Sn7P|0 и
не исключено, что составы фаз Sn3P4 E7, 14 % (ат) Р) и Sn7P]0 E8, 82 %
(ат) Р) представляют одно и то же соединение тем более, что на
диаграмме состояния область гомогенности соединения Sn3P4 точно не
установлена
При давлении 1,5-6,5 ГПа и температурах 500-1300 "С получено
соединение SnP, имеющее две модификации [2].
Соединение Sn3P4 имеет структуру типа Bi3Se4 (символ Пирсона hR7,
пр rp R Ът) с параметрами а = 0,3968 нм, с = 3,534 нм согласно работам
[1,3] В работе [1] структура соединения Sn7P|0 полностью не расшифро-
расшифрована, кристаллическая решетка соединения Sn7P|0 относится к гексаго-
гексагональной сингонии и имеет параметры а = 0,4433 нм, с - 2,8394 нм Также
в работе [1] указано на образование соединения SnP3 со структурой
собственного типа (символ Пирсона Л/?8, пр rp R Ът) и параметрами
а = 0,72642 нм, с = 1,0528 нм (или а = 0,73785 нм, с = 1,05125 нм [4]) В
работе [2] установлено, что фосфид SnP, полученный при высоком
давлении, имеет структуру типа NaCl (символ Пирсона cF8,np rp FmZm
с параметром решетки а = 0,55359 нм (высокотемпературная модифика-
модификация) и структуру типа AsGe (пр. гр 14тт) с параметрами решетки а =
= 0,3831 нм, с - 0,5963 нм (низкотемпературная модификация)
Литература
1 Olofsson О. // Acta Chem Scand 1970 V 24 N4 Р 1153-1162
2 Donohue P.C.//Inorg Chem 1970 V 9 N2 P 335-337
3 EcherlinP., KishioW.//Z Anorg All Chem 1968 Bd 363 N 1-2 S 1-9
4 GullmanJ., Olofsson O.//J Solid State Chem 1972 V 5 N3 P 441-445
Ю Б Кузьма
P - Sr. ФОСФОР - СТРОНЦИЙ
Диаграмма состояния Р— Sr не построена В работе |Э] указано, что
синтезом компонентов при нагреве в стеклянной ампуле в вакууме
получен фосфид Sr с формулой P2Sr3
В работе [1] установлена кристаллическая структура этого соединения,
изоморфная Ва3Р2 (пр. гр /43 d) с параметром решетки а — 0,0775 нм
Литература
1 MaasshE. //Z Anoig All Chem 1970 Bd 374 S 19-25
Л Л Зусчан
P-Ta P-Tb P-Te 767
Р - Та. ФОСФОР - ТАНТАЛ
Диаграмма состояния Р- Та не построена В системе образуются два
соединения ТаР и ТаР, [X, Э, Ш] Температура разложения соединения
ТаР по наблюдению за горением оценена в 1660 °С; по результатам
исследования давления паров и масс-спектроскопии температура
разложения ТаР в вакууме составляет менее 1728 °С
Предполагается, что соединение ТаР существует в двух модификациях
[X] аТаР имеет частично упорядоченную тетрагональную структуру с
четырьмя атомами на элементарную ячейку, параметры решетки а =
= 0,3322 нм, с = 0,5690 нм, рТаР имеет упорядоченную тетрагональную
структуру с восемью атомами на элементарную ячейку, параметры
решетки а - 0,3330 нм, с = 1,139 нм [X] (а - 0,3334 нм, с = 1,134 нм [Э])
Однако в работе [Ш] йысказано сомнение относительно существования
аТаР и рТаР как равновесных фаз
Соединение ТаР2 по данным работы [Ш] имеет моноклинную
кристаллическую структуру типа NbAs2 (символ Пирсона тР\ 2, пр гр
Р2,/с) с параметрами а = 0,8870 нм, b = 0,3267 нм, с = 0,7497 нм, р =
= П9°24'
Л Л Рохлин
Р - ТЬ. ФОСФОР - ТЕРБИЙ
Диаграмма состояния Р - ТЬ не построена В работе \Э] указано на
существование соединения ТЬР, в работе [1] сообщается об образовании
соединения ТЬР5 Соединение ТЬР имеет структуру типа NaCl (символ
Пирсона cF8,mp rp Fm 3m) с параметром а - 0,5688 нм Нейтронографи-
ческими исследованиями [Ш] подтверждены эти результаты, параметр
решетки а соединения ТЬР составил 0,569 нм
Литера! ура
1 SchneringH.G., Wichelhaus W., Wittman M. //Reps 5-th Intern Conf Solid Compounds
ot Transition Elements Uppsala 1976 Rep 11 P 68
Ю Б Kysbua
P - Те. ФОСФОР - ТЕЛЛУР
Диаграмма состояния Р- Те не построена
В системе установлено образование соединения Р,Те3 (86,07 % (мае )
Те), стабильного в сухом воздухе [X]
Н II Никитича
768
P-Th, P-Ti
P - Th. ФОСФОР - ТОРИЙ
Диаграмма состояния P-Th приведена на рис. 386 по данным работы
[1], в которой подтверждено образование соединений ThP и ThaP4>
установленных в работе [X]. Соединение ThP плавится конгруэнтно при
t,'C
2<№
№00
BOO
1
i
1755'
«-(/it*)
1360"
¦(оСГЛ)
2
Ж
Чо
', % (то массе)
5 7
1
a"
10
2
990° rf-
S
0 10 20 50 МО
Th p, % (am.)
SO
60
Рис. 386. P-Th
температуре 2990 "С. Температура кристаллизации соединения Th3P4 не
установлена. При температуре 1608 "С и содержании 9,9 % (ат.) Р
осуществляется эвтектическая кристаллизация. Растворимость Р в (aTh)
и (pTh) практически отсутствует.
Литература
I Yavorsky C.A., BenzR//J Nucl Mater 1967 V 23. №2 P 192-198.
Г.И Терехов
Р - Ti. ФОСФОР - ТИТАН
Взаимодействие Р с Ti изучено в работах [X, Э, Ш]. Диаграмма
состояния Ti - Р приведена на рис. 387 по данным работы [1]. В системе
установлено образование пяти соединений: Ti3P, Ti2P, Ti3P2, Ti4P3, TiP
P-Ti
769
t,'c
1000
1800
1600
№00
P,V.(no массе)
5 W
П00
woo
800
О Ю 20 30
П P, V. (am.)
№70'
4
4
-(fir
*(aTi
ж
/
t
')
832m
)
1 1 гяё-
Vn
A'
П6
r
¦«
4
tosot
||
1
!
SO
Рис. 387. P-Ti
Сплавы изготовлены с использованием лигатуры Ti - 45 % (ат.) Р.
Лигатура получена прямым взаимодействием Ti и Р в герметическом
водоохлаждаемом реакторе в атмосфере Аг. Сплавы из иодидного Ti и
лигатуры изготовлены в дуговой печи в атмосфере Аг. Исследование
выполнено методами термического и рентгеновского анализов.
Соединение Ti3P2 плавится конгруэнтно при температуре 2100 °С,
соединения Ti3P, Ti3P2, Ti4P3 и TiP образуются по перитектическим
реакциям при температурах 1760, 1920, 2060, 1990 °С соответственно.
Растворимость Р в (pTi) при 1495 "С не превышает 0,2 % (ат.), снижаясь
до 0,08 % (ат.) при температуре 1300 °С.
При температуре 1495 °С и содержании 9,5 % (ат.) Р кристаллизуется
эвтектика. При температуре 882 °С осуществляется эвтектоидное
превращение (pTi) « (aTi) + Ti3P.
Соединение Ti3P имеет тетрагональную решетку с параметрами а =
= 0,928 нм, с = 0,499 нм. Соединение Ti2P обладает гексагональной
структурой с параметрами а - 0,6715 нм, с = 0,3462 нм. Соединение Ti3P2
обладает тетрагональной структурой с параметрами решетки а -
= 0,7483 нм, с = 1,0495 нм. Соединение Ti4P3 имеет кубическую решетку
с параметром а = 0,7428 нм.
770
P-Ti, P-Tl
Литература
1 Еременко В.Н., Листовиичий В.Е. // Новые исследования титановых сплавов
Сб статей М Наука, 1965, 1965 С 20-24
Л С Гумй
Р - Т1. ФОСФОР - ТАЛЛИЙ
Диаграмма состояния Т1 - Р приведена на рис. 388 по данным работы
[X]. При исследовании использованы Т1 чистотой 99,5 % (по массе) и
красный Р чистотой 99,91 % (по массе). Исследование проведено методом
термического анализа в предварительно вакуумированных стеклянных
ампулах.
t;c
600
500
400
300
200Ш.
р, •/• (по массе)
5 Ю 20 J0
50 вО 100
Ж
&0*
1
\
1
|/«,
1
S
ж,
i
гзо'
\
л
1
—з
1
ж
I
. _L_
1
/г
t
(Г
i
о w го so *o so во io во so wo
Tl P, % (am.) P
Рис. 388. P-TI
В системе протекает монотектическая реакция при температуре 418 °С
в интервале концентраций 14,5-71 % (ат.) Р. При температуре 302 "С
осуществляется эвтектическая реакция.
Сведения о существовании соединений TI с Р противоречивы; в работе
[X] сообщается о получении фосфида Т13Р с содержанием 4,81 % (по
массе) Р, полученного сплавлением TI с белым Р в запаянной ампуле при
температуре 400 °С.
С Я Алисова
P-Tm. P-U. P-V 771
P - Tm. ФОСФОР - ТУЛИЙ
Диаграмма состояния Р - Tm не построена. В работе Р] сообщено
о соединении ТтР, в работе [1] об образовании фосфида ТтР5.
Соединение ТтР по данным работы [Э] имеет кристаллическую
структуру типа NaCl (символ Пирсона cF8, пр. гр. Fm Ът) с параметром
решетки а - 0,5573 нм.
Литература
1 Schnering H.G., Wichelhaus W., Wittmann M. H Reps 5-th Intern Conf Solid Compounds
of Transition Elements. Uppsala 1976 Rep II P 68
Ю Б Кузьма
P-U. ФОСФОР-УРАН
Диаграмма состояния Р - U не построена. В работах [X, Э, Ш]
сообщается о существовании фосфидов UP, U3P4 и UP2. Фосфид UP
имеет кубическую структуру типа NaCl (символ Пирсона cF%, пр. гр.
Fm Ът) с параметром решетки а = 0,5589 нм [Ш] или а - 0,5600 нм [X].
Фосфид U3P4 обладает структурой типа Th3P4 (символ Пирсона с/28, пр.
гр I43d) с параметром а = 0,8207 нм или а = 0,8220 нм по данным работы
[Ш] или а = 0,8230 по данным работы \Э]. Фосфид UP2 имеет тетраго-
тетрагональную структуру типа Cu2Sb (символ Пирсона tP6, пр. гр. РЫптт) с
параметрами а - 0,3810 нм, с - 0,7764 нм или а - 0,3808 нм, с = 0,7780 нм
по данным работы [Ш] или а - 0,3800 нм, с = 0,7762 нм по данным
работы [X].
Г К Аяексеепко
Р - V. ФОСФОР - ВАНАДИЙ
Диаграмма состояния Р - V не построена. В системе образуются семь
соединений в интервале концентраций 20-75 % (ат.) Р. В работе [1]
проведено обобщение данных по кристаллической структуре соединений
(табл.311).
772
P-V, P-W
Таблица 31 1 Кристаллическая структура соединений системы Р - V
Соедине-
Соединение
P4V*
P2V**
Р V"
PV
P3V4
P7V,2
PV2
PV3
Прототип
-
OsGe2
-
NiAs
AS3ND4
Th,SJ
Co2P
PT!3
Символ
Пирсона,
пр.гр.
mC20, CUc
mC 12, C2/m
tP25, Plml
hP4, РЬъ1ттс
oC56, Cmcm
hP\9, РЬъ1т
oP\2, Pnma
tP32, P42/n
Параметры решетки, нм
a
0,5259
0,8464
0,6323
0,3180
0,3261
0,9299
0,6204
0,9387
* p= 110,87°
** p= 119,26°.
*** Соединение получено при давлении 3,5—5,5
Ь
1,0997
0,3105
-
-
1,323
-
0,3307
-
с
0,5879
0,7169
0,7267
0,6224
1,73
0,3279
0,7536
0,5756
ГПа.
Источник
[2]
[Ш, 3, 4]
[5]
[X, 7, 6]
[8]
[9]
[3, Ю]
[X, И]
Литература
1. Smith F.J.//J Phase Equilibria. 1991. V. 12. №4. P. 431-434.
2. JeitschkoW., Fliorke U., ScholzU.D.//J. Solid State Chem. 1984. V. 52. P. 320-326.
3 Hulliger F. //Nature. 1964. V. 204. N 4960. P. 775.
4. Golin M., Carlsson В., Rundqust S. // Acta Chem. Scand A. 1975. V. 29. P. 706-708.
5 Jeitschko W., Donohue P.C., Johnson V. // Acta Crystallogr. B. 1976. V. 32 P. 1499-1505
6. Ripley R.L. //J Less-Common Met. 1962. V. 4.N6.P 496-503.
7. Selte K., Kjekshus A., Andresen A.F. // Acta Chem. Scand. 1972. V. 26. P. 4057-4062
8. Boiler H.//Monatsh. Chem. 1973. V. 104. P. 48-56.
9. Olofsson O., Ganglberger E. //Acta Chem Scand. 1970. V. 24. P 2389-2396
10. BergerR.//Acta Chem. Scand A. 1975. V 29. P. 641-646.
11. Jawad H., Lurdstrom Т., Rundquist S. // Phys Scri. 1971. V. 3. P. 43-44
СП. Алисова
P-W. ФОСФОР - ВОЛЬФРАМ
Сведения о взаимодействии W с Р приведены в работах [X, Э, Ш]
Диаграмма состояния Р - W не построена. В работах [1-3] установлено
существование двух соединений WP A4,4 % (по массе) Р) и WP2 B5,20 %
P-W, P-Y, P-Yb 773
(по массе) Р). Соединение WP получено синтезом из элементов при
температурах 700-970 "С при длительной выдержке или при нагреве WP2
в вакууме при температуре 900-1100 "С. При нагреве в вакууме до
температуры 1050 °С WP разлагается с образованием металлического
W. Соединение WP-, также получено из чистых элементов при 700-900 °С.
При нагреве в вакууме оно разлагается при температуре 600 °С и при
температуре 900-1100 °С переходит в WP [2, 3].
Соединение WP имеет ромбическую структуру типа МпР (символ
Пирсона оР%, пр. гр. Рпта) с параметрами решетки а = 0,5734 нм, Ь =
= 0,3249 нм, с = 0,6223 нм [4].
Соединение WP2 существует в двух модификациях. Согласно работе
[Ш] aWP2 имеет моноклинную решетку типа NbAs2 (символ Пирсона
тР\2, пр.гр. Р2|/с) с параметрами а = 0,8501 нм, b - 0,3167 нм, с -
- 0,7471 нм, Р = 119°20'. Высокотемпературная модификация pWP2 по
тем же данным имеет ромбическую структуру типа МоР2, близкую к типу
ZrSi2 (символ Пирсона оС\ 2, пр. гр. Стст) с параметрами решетки а =
= 0,3166 нм, Ь= 1,1161 нм, с = 0,4973 нм.
Литература
1 Schneider R., Vogel R. // Arch. Eisenhuttenwes. 1955. Bd. 26. S. 483
2 Falter F.E., Biltz W. // Z Anorg. All. Chem. 1941. Bd. 248. N 3. S. 209-228.
3 Schonberg N. // Acta Chem. Scand. 1954. V. 8. N 2. P. 226-239.
4. Rundquist S.// Acta Chem Scand. 1962. V. 16. P. 287-292.
КБ. Поварови
P-Y. ФОСФОР - ИТТРИЙ
Диаграмма состояния Р - Y не построена. В работах |Э, Ш] сообщается
о существовании монофосфида YP со структурой типа NaCI (символ
Пирсона cF8, пр. гр. Fm 3m) с параметром решетки а = 0,5662 нм.
Ю.Б Кузьма
Р - Yb. ФОСФОР - ИТТЕРБИЙ
Диаграмма состояния Р - Yb не построена. По данным работы [Э] в
системе P-Yb существует монофосфид YbP. В работе [I] установлено
образование соединения YbP5, обладающего полиморфизмом. В работе
[2] из раствора аммиака получен фосфид Yb3P2.
774
P-Yb. -Zn
Фосфид YbP обладает кристаллической структурой типа NaCl (символ
Пирсона cFS, пр. гр. Fm Ът) с параметром решетки а = 0,5554 нм согласно
работе \Э] или а = 0,5555 нм [Ш].
Литература
I Sdmering H.C., Wichelhaus W., Wittmann М.// Reps. 5-th Intern Conf. Solid Compounds
of Transition Elements, Uppsala. 1976. Rep. П. Р.68.
2. Pytlewski L.L., Howell J.K. // Chem. Communi 1967. N 24. P. 1280-1282.
Ю Б. Кузьма
P - Zn. ФОСФОР - ЦИНК
Диаграмма состояния Р - Zn (рис. 389) построена в работе [1] по
данным в основном работ [2, 3]; исследования проведены методами
микроструктурного, рентгеновского и термического анализов.
В системе установлено образование двух соединений Zn3P2 и ZnP2. Оба
соединения образуются конгруэнтно при температурах 1173 и 1040 "С
соответственно. При температурах 850 и 990 "С соединения Zn3P2H ZnP,
претерпевают полиморфные а = р превращения. При температуре 980 °С
и содержании 55 % (ат.) Р протекает эвтектическая реакция с образовани-
образованием смеси высокотемпературных модификаций соединений pZn3P2 +
+ pZnP7. Эвтектика при температуре 416 "С и содержании 0,66 % (ат.)
Р практически вырождена.
р, •/• (по массе)
О tO 20 SO 40 SO
3001
/
f
1
I
(Ш
\
Ж
^
850'
4f6'
1
ff
,. '—
1
TJ*
980°-
1
¦#-
i
и**
«s
N
Q
r
10
20
Zn
30 40
/»'% (am)
50
SO
Рис. 389.1'-Zn
P-Zn
775
Кристаллическая структура соединений Zn3P2 и ZnP2 приведена в
табл. 312.
Таблица 312 Кристаллическая структура соединений Zn3P2 и ZnP2
Соедине-
Соединение
pZn3P2
aZn^P2
pznp;
aZnP2
Yznp2"
Прототип
CaF2
Zn3P2
As2Zn
ZnP2
Символ
Пирсона,
np.rp.
cFl2,Fm3m
IP40, Ptynmc
mP24, Plxlc
tP24, />4, 2, 2
Параметры решетки, им
a
0,582
0,80889
0,885
0,508
0,5322
b
0,729
с
1,1486
0,756
1,859
Источник
[2,4]
[4,5]
[61
[7]
¦ pi 102,3°.
*¦ Соединение получено при давлении 0,2 ГПа и температуре выше 150 °С.
В работе [1] по данным работы [4] приведена р - Т диаграмма для
соединения Zn3P2. Установлены координаты тройной точки при 890 °С
и 0,1 ГПа для модификаций ocZn3P2, pZn5P2 и Zn3P2(III). Форма Zn3P2(IH)
получена при температуре 1000 "С и давлении 0,4 ГПа.
Литература
I.DutkiewiczJ.//J. Phase Equilibria, 1991. V. 12. N4. P. 435.
2. Berak J., Pruchnik Z. // Rocz. Chem. 1969. V. 43. N 43. P. 1141—1146.
3. Schneider M., Krumnacker M. // Neue Hatte. 1973. V. 18. P. 715-718.
4. Pistorius C.W.F.T., Ctarc J.B., Coetzer J., et aL // High Temp. - High Pressure. 1977. V. 9.
P. 471-482.
5 Stackelberg M.V., Paulus R. // Z. Phys. Chem. 1985. Bd. 28. P. 427-460.
6. Hegyi J., Loelmer E.E., Poor E.W., White J.G. // J. Phys. Chem. Solids. 1963. V. 24.
P. 333-337.
7 Tanaca Y. // Rev. Phys. Chem.Japan. 1969. V. 38. P. 151-169.
СП. Алисова
776
P-Zr
p - Zr. фосфор - Цирконий
Диаграм ма состояния Р - Zr не построена. В системе Р - Zr установле-
установлено образование шести фосфидов циркония, полученных прямым синтезом
из Zr и красного Р (иногда с переплавкой в дуговой печи с добавлением
Zr) [X]. В табл. 313 приведены данные по кристаллической структуре
соединений системы Р - Zr.
Таблица 313 Кристаллическая структура соединений системы P-Zr
Соеди-
Соединение
ZrP2
(JZrP
aZrP
Zr3P
zrp;
(Zr14P9)
Zr7P4
zr4p;-
Прото-
Прототип
PbCl2
TiP
NaCl
Ti3P
-
Nb2P4
-
Символ
Пирсона,
пргр.
<>Р\2,
Рпта
Рб^/ттс
cF8,
Fmim
1РП, Р42п
-
mC44,
cllm
-
*Ромбическая сингония.
¦'Гексагональная сингония
' Параметры решетм
а
0,6494
' 0,3677
0,368
0.5261-
0,5278
0,5242
1,10799
1,6715
1,58111
0,3706
Ь
0,8744
-
-
-
-
-
2,7572
0,36049
-
1, ИМ
с
0,3513
1,252
1,2554
-
-
0,5354
0,3674
1,47357
0,9111
Примечание
[Х,Ш]
Ш
При 49,7 % (ат ) Р [2]
При 47,3 %(aT.)P[t]
При 48,2 % (ат.) Р [2]
[3,4]
[3,5]
Р= 104,831° [7,6]
i
¦ [7]
Согласно работе [2] переход aZrP » pZrP является концентрационным
и зависит не только от температуры, но и от давления. При нагреве в
вакууме pZrP при температуре 1525 "С теряет часть Р и превращается
в aZrP, обратное превращение возможно лишь при более низких
температурах и избыточном давлении Р. В работе [3] установлено
существование области гомогенности pZrP по изменению параметров
решетки соединения в зависимости от состава.
P-Zr. Pb-Pd 111
В работе [З] также была обнаружена фаза ZrPx, которая сосуществует
с aZrP или другой фазой, более богатой Р, чем соединение Zr3P. Состав
и кристаллическая структура этой фазы уточнены в работе [5]; ей
приписана формула Zr|4P9.
Два новых фосфида Zn7P4 и ZrPx @,4 < х < 0,5) получены синтезом
Zr и красного Р в эвакуированных кварцевых ампулах при температуре
900 °С в течение трех суток с последующей переплавкой в среде Аг [6].
Фосфид Zn|7P]4 получен спеканием предварительно спрессованных
компонентов в эвакуированных кварцевых ампулах при температуре
- 800 °С в течение 800 ч [7]. Структура этого соединения не установлена.
Литература
I.SnellP.-O.//ActaChem Scand. 1968. V. 22. N 6. P. 1942-1952.
2. Irani K.S.,GingerichK.A.//J. Phys. Chen». Solids. 1963. V. 24. N 10 P. ¦ 153—1158.
3. Lundstrom T. // Acta Chem. Scand. 1966. V. 20 N 6. P. 1712-1714.
4. Nawapong P.C. // Acta Chem Scand. 1966. V. 20. N 10. P. 2737-2741.
5 Tergenius L.-E., Noland B.I., Lundstr6m T. // Acta Chem. Scand. A. 1981. V. 35 N 9.
P.693-699
6 Willerstrom J.-O.// Acta Chem. Scand. A. 1984 V 38. N I. P. 91-93.
7 Ломшщкая Я.Ф., Кузьма Ю.Б. // Им. АН СССР. Неорганические материалы. 1982.
Т. 18 N8 С. 1385-1386.
Л А. Третьяченко
Pb - Pd. СВИНЕЦ - ПАЛЛАДИЙ
Диаграмма состояния Pd - Pb представлена на рис. 390 по данным
работ [1-4] (в основном по данным работы [1], в которой приведена
средняя часть диаграммы при концентрациях от 25 до 75 % (ат.) Pb). В
системе существуют пять соединений: Pd3Pb, Pd5Pb3, Pd|3Pb9, PdPb и
PdPb2. Соединения Pd3Pb и PdPb2 образуются конгруэнтно при
температурах 1220 и 454 °С; Pd5Pb3, Pd|3Pb9 и PdPb кристаллизуются по
перитектическим реакциям при температурах 835, 611 и 501 "С
соответственно. При температурах 1197, 447 и 260 °С и содержании 21,
60,7 и 90,7 % (ат.) Pb соответственно осуществляется эвтектическая
кристаллизация. В сплавах на основе Pd существует широкая область
твердых растворов, растворимость Pb в (Pd) при температуре эвтектики
1197 "С составляет - 14 % (ат.) [X]. Растворимость Pd в (Pb) практически
отсутствует (X, 1].
Соединение Pd3Pb имеет область гомогенности - 3 % (ат.). Кристалли-
Кристаллическая структура соединения Pd3Pb относится к типу Cu3Au (символ
ПирсонасРА, пр. гр. РтЪт,а = 0,492нм [X]).
778
Pb-Pd
О № 20 30
Pb, % (no массе)
50 SO 70 80
90
100
Рис 390. Pb-Pd
Соединение Pd5Pb3 обладает полиморфизмом высокотемпературная
модификация имеет широкую область гомогенности и кристаллизуется
в структуре типа NiAs (символ Пирсона 1гР4, пр гр Рб^/ттт, а =
= 0,446 нм, с = 0,572 нм [2]), средняя модификация соединения Pd5Pb3,
существующая в интервале температур - 518-423 °С, является вариацией
структуры типа NiAs [)], низкотемпературная модификация PcLPb,,
образующаяся по перитектоидной реакции при температуре 430 "С,
обладает структурой типа Ni5Ge3 (символ Пирсона тСЫ, пр гр С2),
а = 1,333 нм, b - 0,766 нм, с = 0,725 нм, р = 52,22° [2].
Соединение Pd13Pb9 имеет квазиорторомбическую структуру,
являющуюся сверхструктурой к типу NiAs [3]
Исследование монокристалла соединения PdPb показали, что
структура этого соединения относится к моноклинной трансляционной
группе, параметры решетки а = 0,709 нм, b = 0,884 нм, с - 0,557 нм, р =
= 71°[Х]
В работе [4] структура соединения PdPb отнесена к ромбоэдрическому
типу с последовательно чередующимися слоями, в которых параметры
решетки соответственно а, = 0,17153 нм, а, = 90,06°,а, = 0,8519 нм,а2 =
= 90,42°, о3 = 4,238 нм, а3 = 89,80"
Кристаллическая структура соединения PdPb2 принадлежит к типу
CuAl-, (символ Пирсона г/12, пр гр IAImcm, о = 0,684 нм, с = 0,583 нм)
[X]
Pb-Pd РЬ-Рт. РЬ-Ро, Pb-Pr 779
Литература
1 Marcotte V.C. // Metall Trans 1977 V 8 N I P 185-188
2 Ellner ML, Godecke Т., Schubert K. // Z Metallkunde 1973 V 64 N8 P 566-568
3 Mayer HW, Ellner M., Schubert K.//J Less-Common Met 1980 V 71 N 2 P 29-38
4 Mayer H.W., Schubert K.//J Less-Common Met 1980 V 72 N I P 1-10
В П Полякова
Pb - Pm. СВИНЕЦ - ПРОМЕТИЙ
Диаграмма состояния Pb - Pm не построена. В работе [Ш] на
основании исследования диффузии методом радиоактивных изотопов
сделан вывод о ничтожно малой растворимости Pm в Pb в твердом
состоянии
Л Л Рохлин
РЬ - Ро. СВИНЕЦ - ПОЛОНИЙ
Диаграмма состояния РЬ - Ро не построена Согласно работам [X, Э,
Ш] в системе РЬ - Ро существует соединение РЬРо, которое при
температуре - 600 °С разлагается Соединение имеет кристаллическую
структуру типа NaCl (символ Пирсона cFS, пр rp Fm Ът, а - 0,659 нм
[V-C])
Е И ГлаОышевский, О И Бодак, В К Печарский
РЬ - Рг. СВИНЕЦ - ПРАЗЕОДИМ
Диаграмма состояния системы РЬ - Рг приведена на рис 391 по
данным работы [1] Для приготовления сплавов использовали Рг
чистотой 99,95 % (по массе) и РЬ чистотой 99,99 % (по массе) Исследова-
Исследование выполняли методами термического, микроструктурного и рентгенов-
рентгеновского анализов В системе существуют семь соединений: Рг5РЬ3, Р^РЦ
и РгРЬ3 образуются конгруэнтно из расплава при температурах 1495,1180
и 1120 "С соответственно, соединения Рг3РЬ, Рг5РЬ4, Рг,,РЬ10 и РгРЬ2
кристаллизуются по перитектическим реакциям при температурах 860,
1455, 1365 и 1090 °С соответственно При температурах 824, 1145, 1085
и 325 °С осуществляются эвтектические превращения, при температуре
325 °С эвтектика вырождена При температуре 778 "С происходит
780
Pb-Pr
Pb, % (m массе)
О ТО ttO 60 SO 90 100
trc
1500
1300
two
300
О to TO JO ¦<? SO gO 70 80 90 100
Pr Pb,%(am) Pb
Рис. 391. Pb-Pr
эвтектоидная реакция, связанная с полиморфным превращением Рг
Растворимость Pb в (аРг) составляет 4 % (ат.).
Сведения о кристаллической структуре соединений в системе Pb - Рг
приведены в табл. 314 по данным работы [2, V-C]
Таблица 3 14 Кристаллическая структура соединений системы РЬ - Рг
Соединение
Рг3РЬ
Рг5РЬ3
Прототип
AuCu3
Mn5Si3
Символ Пир-
Пирсона, пр гр
сР4, РтЗт
Л/Ч6, РЬт/тст
Параметры решетки, нм
а
0,4949
0 9337
Ь
-
-
с
-
0,6814
Pb-Pr Pb-Pl
781
Соединение
Pr,Pb4
P.nPb|0
PrPb2
PiPb3
Прототип
Sm5Ge4
HonGel0
HfGa2
AuCu3
Символ Пир-
Пирсона, пр гр
»Р36, Рпта
г/84, Шттт
г/24, /4,/оик/
с/>4, РтЪт
Параметры решетки, нм
и
0,8377
1,187
0,466
0,4867
Ъ
1,604
с
0,8532
1,730
3,20
Кристаллическая структура соединения Рг3РЬ4 не расшифрована
Литература
1 McMastcr O.D., Gschncidncr, Jr., K.A. // J Less-Common Met 1976 V 45 N 2
P 275-281
2 Гладышсвский Е.И., Бодак О.И. Кристаллохимия интерметаллических соединений
редкоземельных металлов Львов Вища школа, 1982 255 с
Е И Гтйышевский, О И Бодак В К Печарский
РЬ - Pt. СВИНЕЦ - ПЛАТИНА
Диаграмма состояния РЬ - Рг приведена на рис 392 согласно работе
[X] В системе существуют три соединения Pt3Pb, PtPb и PtPb4, образую-
t.'c
1600
two
/zoo
woo
too
воо
200
to
рь,'/.(по массе)
10 30 <tO SO SO 70 tO SO 100
nss.o-—'¦
—ii.
—С
\
)
I
4
.*»
i
\
7S9
1
i
4
Г
ж
i
1
Щ
(>
л
Я7.1
О 10 20 SO
Pt
40 50 60 70 вО SO 100
РЬ, V. (am) Pt
Рис. 392. Pb-Pt
782
Pb-Pt, Pb-Pu
щиеся по перитектическим реакциям при температурах 915,795 и 360 °С
соответственно. При температуре 290 °С осуществляется эвтектическая
кристаллизация. Кристаллическая структура соединений системы РЬ -
Pt указана в табл. 315.
Таблица 315 Кристаллическая структура соединений системы Pb - Pt
Соединение
РцРЬ
PtPb
PtPb4
Прототип
Cu3Au
NiAs
CuAI,
Символ Пирсо-
Пирсона, пр гр
с Р4, Рт Ът
hP4, Рб^/ттс
tl\2, Wmcm
Параметры решетки, нм
а
0,4053
0,4258
0,666
с
0,5467
0,5978
В П Полякова
Pb-Pu. СВИНЕЦ-ПЛУТОНИЙ
Диаграмма состояния Pb-Pu исследована в работах [1-3]. На рис. 393
приведена диаграмма состояния по данным работы [3]. Сплавы
изготовляли в печах сопротивления в атмосфере Аг в тиглях из Та.
РЬ, % (па моссе)
О
J20' —
200
125'
О 10 20 30
Pu
W 50 60 70 80 90 WO
Pb,°/,(om) Pb
Рис. 393. Pb-Pu
РЬ-Ри
783
Исходными материалами служили Pu чистотой 99,9 % (по массе) и РЬ
чистотой 99,999 % (по массе). Исследование сплавов проводили методом
микроструктурного, рентгеновского, термического и микрорентгеноспек-
трального анализов.
В системе существует шесть соединений: Pu5Pb4 и PuPb3 плавятся с
открытым максимумом при температурах 1385 и 1138 °С соответственно;
соединения Pu3Pb, Pu5Pb3, Pu4Pb5 и PuPb, кристаллизуются по
перитектическим реакциям при температурах 896, 1300, 1185, 1129 °С
соответственно. Соединение PuPb, при температуре 1106 °С претерпевает
полиморфное превращение. При температуре 1124 °С и содержании
68,8 % (ат.) РЬ осуществляется эвтектическая кристаллизация. При
температуре 328 "С происходит перитектическая реакция Ж + PuPb3 °
= (РЬ) Кристаллическая структура соединений системы Pb-Pu приведена
в табл. 316 согласно работе [2].
Таблица 3 16 Кристаллическая структура соединений системы Pb-Pu
Соединение
РияРЬ
Ри,РЬл
Pu5Pb4
aPuPb,
PuPb-,
Прототип
Cu3Au
W5S.3
Ti5Ga4
HfGa2
Cu3Au
Символ
Пирсона,
nprp
с PA,
Pm 3m
1/32,
Штст
hP\8,
Pb^lmcm
1124,
cP4,
РтЗт
Параметры решетки, нм
а
0,4737
1.231
0,9523
0,4621
0,4807
с
0,6084
0,6482
0,129
Кристаллическая структура соединения Pu4Pb5 относится к гексаго-
гексагональной сингонии. Структура высокотемпературной модификации
соединения PuPb2 не определена [2]
Литература
1 Nickerson R.F. /П Nucl Mater 1969 В32 Р 208-217
2 Wood O.H., Cramer E.M., Wallace R.Z., Ramsey W.J. // J Nucl Mater 1969 B32
P 193-207
3 FortjnE.M., Peterson D.E.// Bull Alloy Phase Diagrams 1988 V 9 N3 P 269-271,
109-310
Я Б Будберг
784
Pb-Rb
Pb-Rb. СВИНЕЦ-РУБИДИЙ
Диаграмма состояния Pb-Rb приведена на рис. 394 по данным работ
[1-3]. Сплавы изготовляли в герметичных тиглях из Nb или Та в инертной
среде. В качестве исходных материалов использовали РЬ чистотой
99,999 % (по массе) и Rb 99,9 % (по массе).
10
Kb, '/. (по массе)
Z0 30 40 SO 60108030100
600
500
400
300
200
100
"-^/^01
It
*-(p
7
Ь)
1
ж
/
У
1
«¦«1
.«
/
Г9(Г
ы
Z
:
Ш
1
9
О
в
1
N
465"
Ч*"
75
Л"
1
Г/
Т ~\^
95\
Щ 1
\39№'
О 10
РЬ
Л7 J<7 «О J» ^Р 70 80 90 100
/T*,V. (am.) Rb
Рис. 394. РЬ-Rb
В системе существуют пять соединений. Соединение RbPb плавится
конгруэнтно при температуре 610 °С; соединения RbPb3, RbPb2, Rb2Pb3
и Rb4Pb5 кристаллизуются по перитекти^еским реакциям при температу-
температурах 390, 490, 510 и 553 °С соответственно. При температуре 39 °С и
содержании 10 % (ат.) Rb осуществляется эвтектическая кристаллизация.
При температуре 465 °С и концентрации 75 % (ат.) Rb наблюдается
монотектическая реакция: Ж, ¦* Ж2 + RbPb, монотектическая горизон-
горизонталь лежит в пределах 50-95 % (ат.) Rb.
Согласно работе [4] соединение RbPb имеет структуру типа NaPb
(символ Пирсона 7/64, пр.гр. IAxlacd) с параметрами а = 0,1184 нм, с -
- 0,1942 нм. Структура остальных соединений не расшифрована.
Лшсратура
1 Кузнецов Л.Н., Чунтонов К.А., Яцеико СП.//Изв АН СССР Металлы 1977 N5
С 223-225
Pb-Rb, Pb-Rh
785
2 Кузнецов А.Н. Физико-химическое исследование взаимодействия рубидия с
некоторыми ^-элементами в бинарных системах. Свердловск- Институт химии АН СССР,
1978 115 с.
3 Колнвердов В.Ф., Григорьев Б.А., Голубев Н.А. // Журнал физической химии. 1977
Т 51 N 7 С 1776-1782.
Л.Л. Зусман
Pb-Rh. СВИНЕЦ-РОДИЙ
Часть диаграммы состояния Pb-Rh со стороны РЬ A00-20 % (ат.) РЬ)
приведена на рис. 395 по данным работы [1]. Исследование проведено
на литых сплавах, изготовленных из компонентов чистотой не менее
99,5 % (по массе), методами микроструктурного, рентгеновского и
термического анализов. В изученной области в системе существуют шесть
соединений: Rh3Pb, Rh3Pb2, RhPb, Rh5Pb7, RhPb2, образующихся по
перитектическим реакциям при температурах 1230,980,870,720, 640 °С
соответственно, и RhPb4, образующегося по перитектоидной реакции
при температуре 300 "С. При температуре 320 °С осуществляется
эвтектическая реакция. В табл. 317 приведены данные о кристаллической
структуре соединений системы Pb-Rh.
рь, '/о (по массе)
о ю га зо *ff so so ю ев до too
IZOO
BOO
too
1
1
/
гзр'_т
98Om
В
\
ol
1
«4
II-
N^
7Z0'
Si
r\
\
зго'
a io го зо ьо so во w во so wo
Kh Pb'/e (am.) РЬ
Рис. 395. Pb-Rh
786
Pb-Rh. Pb-Ru, Pb-S
Таблица 317 Кристаллическая структура соединений системы Pb-Rh
Соединение
Rh3Pb
Rh3Pb2
RhPb
Rh5Pb7
RhPb2
Прототип
Cu3Au
NiAs
CoSn
Rh5Pb7
CuAl2
Символ
Пирсона,
пргр
cP4,
РтЗт
hP4,
РЬт/ттс
hP6,
РЫттт
-
tin,
Штст
Параметры решетки, нм
а
0,402
0,433
0,5678
0,9824
0,674
Ь
-
-
-
0,5712
-
с
—
0,564
0,4428
2,6538
0,5831
Литература
1 El-Boragy ML, Jam K.Ch., Mayer H.W., Schubert K.// Z Metallkunde 1972 Bd 63 N 11
S 751-753
В П Полякова
Pb-Ru. СВИНЕЦ-РУТЕНИЙ
Диаграмма состояния Pb-Ru не построена. В работе [X] указано, что
при обработке сплавов, богатых свинцом, разбавленной HNO3 получен
осадок, состоящий из чистого Ru. В работе [\] изучены электрохимичес-
электрохимические свойства сплавов Ru с РЬ, содержащих 0,1; 0,5,1,0; 2,5,5,0 % (ат) Ru
Литература
1 Брыицева В.И., Дунаев Ю Д. //Тр института катализа и электрохимии АН Каз ССР
1975 Т 2 С 53-62
М В Раевская
Pb-S. СВИНЕЦ-СЕРА
Диаграмма состояния Pb-S приведена на рис 396 по данным работы
[1], в которой использованы результаты работы [X] по построению
участка диаграммы от 0 до 50 % (аг) S Установлено образование одного
PbS
787
woo
800
600
400
too
0
s, •/• (no массе)
5 10 20 10 60 tOWO
/
Ж
3Z7.50Z'
'РЬ)
1
згт
i
Ц1В
1
\
7
/
Г
0.1
1
} 1 1
Ч**г II
/W7ff* II
-US'
'tS
i usf
0 10 tO 30 40 50 60 70 80 90 100
Pb S,"/. (am) S
:^;
Рис. 396. Pb-S
соединения PbS, плавящегося конгруэнтно при 1118 °C При температуре
800 °С в интервале концентраций 70,7-98,9 % (ат.) S осуществляется
монотектическое превращение, однако металлографически расслоение
не наблюдается из-за возможного "отжига" структуры с участием столь
легкоплавкого компонента как РЬ
Данные о растворимости S в жидком РЬ [Э] приведены ниже.
Температура, °С
Растворимость, S, % (ат )
925 900 850 750 700 650 600 550 500 450
7,6 6,25 4,25 1,85 1,10 0,59 0,33 0,16 0,08 0,03
Растворимость S в (РЬ) при температуре 300 "С не превышает 6-10 %
(ат)
Эвтектическая точка при температуре реакции 327 °С содержит
0,0017 %(aT)S.
Структура соединения PbS относится к типу NaCl (символ Пирсона
cF8, пр гр Fmbrn), а = 0,5931 нм.
Из газовой фазы конденсируется аморфный субстрат, кристаллизую-
кристаллизующийся при температуре 135 °С в ту же решетку с параметром а = 0,597 нм.
При давлении 2,4 ГПа идентифицирована ромбоэдрическая
модификация соединения PbS со структурой типа SnS
В работе [2] было построено сечение р-Т-х диаграммы Pb-S при
давлении насыщенных паров PbS до -200 ГПа и температуре -1500 °С
788
Pb-S, Pb-Sb
Литература
1. Lin J.-C, Sharma R.C., Chang Y.A. // Bull. Alloy Phase Diagrams. 1986. V. 7. N 4.
P. 374-381.
2. Рнкель М.О., Алексеева З.М. // Изв. АН СССР. Неорганические материалы. 1981
Т. 17. N II. С. 2089-2094.
Л С. Гузей
Pb-Sb. СВИНЕЦ-СУРЬМА
Диаграмма состояния Pb-Sb (рис. 397) построена в работе [X] на
основе обобщения большого числа экспериментальных данных. Строение
системы подтверждено в работе [1], в которой исследование было
выполнено методами термического, рентгеновского анализов, измерени-
измерением электродвижущей силы, а также был использован термодинамический
расчет. В качестве шихтовых материалов использовали РЬ и Sb чистотой
99,99% (по массе).
Максимальная растворимость РЬ в (Sb) при эвтектической температу-
температуре 252 "С составляет -2,0 % (ат.); растворимость Sb в (РЬ) - 5,8 % (ат.).
В работе [2] изучено влияние давления на положение фазовых границ
в системе Pb-Sb. Температура эвтектики при давлении 2,39 ГПа
достигает 323 °С; зависимость температуры эвтектической кристаллиза-
кристаллизации от давления в системе может быть представлена зависимостью t -
- 251 + 4,04/? - 0,0433/г, где t - температура, °С,р- давление, ГПа. При
повышении давления на 0,1 ГПа увеличивается содержание Sb в
t'C
600
500
МО
300
200
100
Sb,% (no массе)
0246810 15 20 30 *О 50 60 70 8030Ю0
1 I
11
{327,502°
\ тч-
i
WS.8 Т7.5
Г
1
1
ж
1
1
^»
1Z/L
1
1
[
i
630,755°
Рнс.
397.
О
РЬ
Pb-Sb
10
20
30
40 50 60
Sb,%(am.)
70
80
90
100
Sb
Pb-Sh, Pb-Sc. Pb-Se 789
эвтектической точке на -0,4 % (ат.). В работе [3] построены изобаричес-
изобарические разрезы х-р-Т диаграммы Pb-Sb в интервале давлений 0,1-2 ГПа.
При давлении 5 ГПа в структуре сплавов появляются две фазы t и р. Фаза
е устойчива в интервале концентраций 14-23 % (ат.) Sb и является
твердым раствором со структурой Mg (символ Пирсона hPl пр.гр.
Рв^/ттс), параметры решетки а = 0,3464 нм, с = 0,5914 нм [4]. Фаза р
C1-47 % (ат.) Sb) образуется при давлении выше 2,36 ГПа. Структура
фазы р имеет решетку типа W (символ Пирсона с/2, пр.гр. 1т Ът), а -
- 0,3894 нм. После закалки из области фазы е структура сплавов отвечает
пересыщенному твердому раствору на основе РЬ, при медленном
охлаждении до комнатной температуры выделяется избыточная фаза
(Sb).
Литература
1. Mozcr Z., Komarek K.L., Mikula A. // Z. Metallkunde. 1976. Bd. 67. N 5. S. 303-306.
2. Clark J.B., Pistorius C.W.F.T. // J. Less-Common Met. 1975. V 42 N I P. 59-67.
3. Ивахненко С.А., Поиятовский Е.Г. // Физика металлов и металловедение. 1979. Т. 47.
N4. С. 809-814.
4. Понятовский Е.Г., Дегтярева В.Ф. // Физика и техника высоких давлений. (Киев). 1981.
N 6. С. 3-24.
Л. С. Гузеп
Pb-Sc. СВИНЕЦ-СКАНДИЙ
Диаграмма состояния Pb-Sc не построена. В работе [1] сообщено о
существовании соединения Pb-jSc5 со структурой типа Si3Mn5 (символ
Пирсона НР\6, пр.гр. Рв^/тст,а- 0,8467 нм,с = 0,6158 нм). Исследование
выполнено методом рентгеновского анализа.
Литература
I. JeitschkoW., Parthe Е. //Acta Crystallogr. 1965. V. 19. N 2. P. 275-277
Е.И. Гладышевский, О.И. Бодак, В. К. Печарскип
Pb-Se. СВИНЕЦ-СЕЛЕН
Диаграмма состояния Pb-Se представлена на рис. 398 по обобщенным
данным работ [X, Э, Ш, 1,2]. В работе [2] использовали РЬ и Se чистотой
99,999 % (по массе). Исследование проводили методами микроструктур-
микроструктурного, термического и химического анализов.
790
Pb-Se
1000
soo
too
700
600
SOO
400
300
W
Se, % (no массе)
TO JO *O SO 60 70 8090 WO
too
у
/
1
'317,
Ж
/
901'
•~-(Pt)
1
1
/п. г'
/
¦V
к
\
618,3'
г
V
\/
76
V
1
/
-л
г \
V
\
(г} j
О 10 ZO 30 40 SO 60 70 ВО SO 100
РЬ Se,•/. (am) Se
Рис. 398. Pb-Se
Растворимость Se в жидком РЬ в интервале температур 826-1006 °С
приведена ниже:
l °С
Se, % (ат.)
I "С
Se, % (ат.)
1006
40
710
2,31
980
35
650
1,59
970
36
610
0,55
952
25
560
0,323
926
20,5
500
0,16
825,9
10
465
0,084
390
0,026
Эвтектика при 327,2 "С вырождена, сплав эвтектического состава
содержит 0,013 % (ат.) Se.
В системе существует одно соединение PbSe, практически не имеющее
области гомогенности. Структура соединений PbSe относится к типу
NaCl (символ Пирсона cF8, пр.гр. FmZm, a = 0,6118 нм). При высоких
давлениях PbSe приобретает ромбическую структуру типа SnS. В работе
[3] построена Т-р диаграмма соединения PbSe в интервале температур
20-127 °С и давлений 4-4,4 ГПа.
Литература
1. SiedmanD.N. //Trans. AlME. 1966. V. 236. N 9. P. 1361-1362.
2. Глазов В.М., Павлова Л.М., Гаев Д.С. // Изв АН СССР. Неорганические материалы
1984 Т. 20. N 9. С 1470-1482
Pb-Se. PbSi
791
3. Боримский Л.Н., Нагорный П.Л., Маламян Т.А., Моисеева Н.А. Сверхтвердые
материалы. Производство и применение. Киев: Наукова Думка, 1990. 285 с.
В. П. Полякова
Pb-Si. СВИНЕЦ-КРЕМНИЙ
В работах [1, 2] с учетом экспериментальных данных работ [X, Э]
проведен теоретический расчет диаграммы состояний Pb-Si, при условии
псевдорегулярности жидкой фазы и отсутствия растворимости в твердом
состоянии. Нарис. 399 приведена диаграмма состояния Si—Pb по данным
работы [1]. При температуре 1402 °С и концентрации 2,5 % (ат.) РЬ
осуществляется монотектическая реакция Ж1 - Жг + (Si). Критическая
точка области несмешиваемости расположена при 2470 °С и концентра-
концентрации 50 % (ат.) РЬ. По данным работы [3] растворимость Si в жидком РЬ
при температуре 1420 "С составляет 3,2 % (ат.), а растворимость РЬ в
жидком Si - 2,1 % (ат.). Растворимость Si в жидком РЬ по данным работ
PC, Э] в интервале температур 1550-1050 °С приведена ниже:
РЬ,*/.(по пассе)
OZOW S0 10 80 SO 95
ЮО
1600
то
800
400
Ж
?
2,5
SiJ
Ж,+Жг
fhOZ'
ЗП5'~
321501"
О Ю 10 30 40 SO 60 10 80 90 100
Si РЬ,Уш(ат.) РЬ
Рис. 399. Pb-Si
792
Температура, "С
Растворимость
Si, % (ат)
Источник
1550
5,5
[X]
1450
1 53
[X]
Pb-Si, Pb-Sm
1400
1,1
[XI
1330
0 51
[X]
1250
0 15
[XI
1250
1 17
PI
1201
0 76
Р]
1150
PI
1100
0 75
PI
1076
0 75
PI
1050
0,22
PI
Литература
1 OlesinskiR.W.,AbbaschianG.J.//Bu11 Alloy Phase Diagrams 1984 V 5 N3 P 271-273
2 Olesinski R.W., Abbaschian G.J.//Metal Progress 1985 V 128 N 2 P 55-57
3 Kirkwood D.H., СЫртан J.//J Phys Chem 1961 V 65 N 6 P 1082-1084
Л Л Рохлин
Pb-Sm. СВИНЕЦ-САМАРИЙ
Диаграмма состояния Pb-Sm приведена на рис. 400 по данным работы
[М]. В системе установлено шесть соединений. Соединения РЬзЗт, Pb2Sm
и Pb3Sm5 плавятся с открытым максимумом при температурах-1040,
PbI0Smn
и Pb4Sm5
-715 и -1580 °С соответственно; соединения
кристаллизуются по перитектическим реакциям при температурах -865
и -980 "С соответственно, соединение PbSm3 образуется, видимо, по
перитектоидной реакции При температурах -280, -580, -690 и -1030 °С
осуществляется эвтектическая кристаллизация.
В работе [1] приведено уравнение для определения растворимости Sm
в жидком РЬ в интервале температур 400-800 "С:
IgA: = 5;0] -4656/7,
где х - концентрация Sm, % (по массе), Т- температура, К.
В табл 318 приведены сведения о кристаллической структуре
соединений в системе Pb-Sm по данным работы [V-C].
Таблица 318 Кристаллическая структура соединений системы Pb-Sm
Соединение
Pb,Sm
Pb4Sm5
Прототип
CuaAu
Ge4Sra5
Символ
Пирсона,
пргр
сР4,
РтЗт
оргь,
Рпта
Параметры решетки, им
а
0,4835
0,8244
ft
1,578
с
0,8363
Pb-Sm
793
Соединение
PbjSra5
Прототип
SbjMn5
Символ
Пирсона,
пргр
hPN,
РЬ^тст
Параметры решетки, нм
а
0,9163
Ь
-
с
0,6687
5т,'/*(по пассе)
0
*,"с
1200
1000
880
чао
zoo
/
ZO
1
/;
1 \
Ik
1
1
i
-28
f-in)
с
' i
Г
1
i
40
f
f
.•W
1
\~8SS*
ij J
* «¦ «•
S8V
f
9
«0
""
с
»» —
4
\
1
|!
1
1
90
I
\
\
N
10
\
\
*
107*'
О Ю ZO SO W 50 SO 70 BO SO 100
Pb $m,V»(am) Sm
Рис. 400. Pb-Sm
Кристаллическая структура соединений Pb2Sm, Pb^Sni), и PbSmj не
определена.
Литература
1 Smith V. i.lll Less-Common Met 1973 V 32 N2 P 297-300
E И Гладышевский, О И Бодак, В К Печарский
794
Pb-Sn
Pb-Sn. СВИНЕЦ-ОЛОВО
Диаграмма состояния Pb-Sn (рис. 401) приведена по данным работ
[X, 1, 2]. В работе [3] по результатам измерения электросопротивления
при различных температурах определена растворимость Sn в (РЬ),
которая приведена ниже:
Температура, °С
Растворимость Sn, % (ат.)
173
26,4
145,5
17,7
124
12,8
97,5
8,4
70-80
5,1
РЬ, % (по массе)
о to го зо 4п so во ю so so то
231.919"
71
W.S0Z'
м
О Ю 20 30 40 SO 60 70 80 ВО 100
Sn РЬ, % Гвт) РЬ
Рис.401. РЬ-Sn
Экстраполяцией этих значений до температуры эвтектической
кристаллизации получено значение максимальной растворимости Sn в
(РЬ), равное 29,0 % (ат.) Sn, что согласуется с данными работы [X]. При
температурах ниже 70—80 "С на основании результатов измерений
скрытой теплоты превращений определена растворимость Sn в твердом
РЬ, приведенная ниже:
Температура, °С
Растворимость Sn, % (ат.).
75
7,7
50
3,3
25
2,2
0
1,4
Растворимость РЬ в (Sn) при эвтектической температуре составляет
1,45 %(ат.).
Данные термодинамического расчета в работе [4] хорошо согласуются
с представленными на рисунке фазовыми равновесиями в системе Pb-Sn.
Ph-Sn, PbSr
795
В работе [5] изучена зависимость температуры плавления эвтектики
от давления в интервале 0,5-2,5 ГПа.
Литература
1. Dobovisck В., Smajic N. // Rudarsko-Met. Zbornic. 1962. N. 4. P. 353-360.
2 Ефимов В.И., Горский Ф.К. // Науч. тр. Белорус, ин-та механизации сельского
хочяйства. 1970. N 14. С 10-13.
3. Cahn J.W., Trcaftis H.N. //Trans AIME 1960 V. 218. N 2. P. 376-377.
4. Karakaya I., Thompson W.T. // Bull. Alloy Phase Diagrams 1988. V. 9 N 2. P. 144-152,
201-202
5. Zhou W., Shcn Z., Vin X., Zhang Y., Zhao M. // J. Less-Common Met. 1988. V. 143.
P 59-69.
Pb-Sr. СВИНЕЦ-СТРОНЦИЙ
Л Л Рохлин
Диаграмма состояния Pb-Sr приведена на рис. 402 по данным работы
[1]. Исследование проводили методами термического, микроструктурного
ю
Sr, У» (по массе)
го за 4о so во7вввяоюо
1100
1OOQ
600
400
317,50
zoo
О 10 20 30 40 SO SO 70 ВО 90 100
РЬ Sr, % (am.) sr
Рис. -@2. Pb-Sr
796
Pb-Sr
и рентгеновского анализов Сплавы получали в заваренных железных
тиглях в атмосфере Аг В качестве исходных компонентов использовали
РЬ чистотой 99,999 % (по массе) и Sr чистотой 99,8 % (по массе)
В системе существует семь соединений: SrPb3 и Sr2Pb плавятся
конгруэнтно при температурах 677 и 1156 °С соответственно, осталь-
остальные- Sr3Pb5, Sr2Pb3, SrPb, Sr5Pb4 и Sr5Pb3 кристаллизуются по перитекти-
ческим реакциям при температурах 645, 717, 795, 943 и 1054 "С
соответственно.
При температурах 324,5, 627 и 725 °С осуществляется эвтектическая
кристаллизация; эвтектика при 324,5 "С практически вырождена,
растворимость Sr в (РЬ) при этой температуре составляет -0,33 % (ат.)
согласно работе [2], а в сплаве эвтектического состава содержится I %
(ат.) Sr.
Кристаллическая структура соединений в системе Pb-Sr приведена
втабл 319 [I]
Таблица 319 Кристаллическая структура соединений системы Pb-Sr
Соединение
Sr2Pb
Sr5Pb3
Sr5Pb4
SrPb
Sr2Pb,'
Sr,Pb;
SrPb3
Прототип
Анти-РЬС12
Cr5B3
Pu5Rh4
CrB
-
-
TiCuj
Тетрагональная сингония
Символ
Пирсона,
пргр
о Л 2,
Рпта
аъг,
ШгЛст
-
оС8,
Стст
-
-
1РА,
P4Jmmm
Параметры решетки, нм
а
0,8445
0,867
0,846
0,5018
0,838
1,618
0,4965
Ь
0,5391
-
1,727
1,223
-
-
—
с
1,0139
1,594
0,901
0,4648
0,490
0,490
0,5035
Pb-Sr Pb-Tb, Pb-Te
797
Литература
1 Bruzzone G., Franceschi E., Merio F. // J Less-Common Met 1981 V 81 N I P 155-160
2 Marshall D., Chang Y.A.//Met Trans A 1984 V 15 N 1-6 P 43-54
Л Л Зусман
Pb-Tb. СВИНЕЦ-ТЕРБИЙ
Диаграмма состояния Pb-Tb не построена В работе [Ш] сообщается,
что соединение ТЬРЬ3 находится в равновесии с РЬ Кристаллическая
структура соединений, установленных в системе Pb-Tb, приведена в
табл 320 по данным работы [1]
Таблица 320 Кристаллическая структура соединений системы Pb-Tb
Соединение
РЬ3ТЬ5
РЬ4ТЬ5
РЬ3ТЬ
Прототип
S^Mnj
Ge4Sm5
CU3A11
Символ
Пирсона,
пргр
АР16,
Pb^lmcm
0PI6,
Рпта
сР4,
РтЗт
Параметры решетки, нм
а
0,9019
0,8169
0,4810
Ь
1,555
с
0,6596
0,8218
Литература
1 Гладышевский Е.И., Бодак О.И. Кристаллохимия интерметаллических соединений
редкоземельных металлов Львов Вища школа, 1982 255 с
Е И Гладышевский, О И Бодак, В К Печорский
Pb-Те. СВИНЕЦ-ТЕЛЛУР
Диаграмма состояния Pb-Те приведена на рис. 403 по данным работы
[1] с учетом экспериментальных результатов работы [2] и данных
термодинамического расчета, проведенного вработах [3,4] Установлено
образование соединения РЬТе с узкой областью гомогенности в
798
РЬ-Те
Те, "/о (по массе)
10 го J0 40 SO 60 70 ЙО 90 100
900
800
700
600
500
/
/
1
1
**^
26,8'
9ZV
5
\
1
L
\
411
1 '
Ж
\
\
.9'
1
\
1
89,1
(Те
57°
О 10 20 J0 40 SO 60 70 80 90 100
РЬ Те, У. (ат) те
Рис. 403. РЬ-Те
интервале концентраций 50-50,014 % (ат.) Те. Соединение РЬТе
образуется конгруэнтно при температуре 924 °С и участвует в эвтектичес-
эвтектической кристаллизации при температурах 326,8 и 410,9 °С при содержании
0,04 и 89,1 % (ат.) РЬ соответственно.
Растворимость Те в (РЬ) незначительна и составляет 0,0065 %(ат.) при
температуре 300 "С. Растворимость РЬ в (Те) при комнатной температуре
равна 0,85 % (ат.) [5].
Структура соединения РЬТе относится к типу NaCl (символ Пирсона
cF8, пр.гр Fm3m, а - 0,6460 нм). Согласно работе [1] при комнатной
температуре и давлении 4,1 ГПа кристаллическая структура соединения
РЬТе типа NaCl переходит в орторомбическую структуру типа GeS
(символ Пирсона оРЪ, пр.гр. Pnma). При давлении от 5,0 до 8,0 ГПа
наблюдается совместное существование этих двух структур. Соединение
РЬТе имеет орторомбическую структуру с параметрами а - 1,191 нм,6 =
= 0,42 нм, с = 0,451 нм при давлении 75 ГПа.
Литература
1 Lin,I.-C.,HsiehK.-C.,SharmaR.C, Chang Y.A.//Bull Alloy Phase Diagrams 1989 V 10
N4 P 340-347
2 iMoniri N., Petot С // J Calonm Anal Thermodyn 1978 V 9B B24 195-201
Ph-Te. Ph-Ti
799
3 Хариф Я.Л., Кофтуненко П.В., Манер А.А., Аветнсов И.Х. // Журнал физической
химии 1982 Т 56 N 9 С 2180-2185
4 Ngai T.L., Marshall D., Sharma R.C., Chang Y.A. // Monatch Chem 1987 V 118
P 277-300
Л С Гузей
Pb-Ti. СВИНЕЦ-ТИТАН
Диаграмма состояния Pb-Ti в пределах концентраций 0-40 % (ат.)
РЬ приведена на рис. 404 по данным работы [1]. Установлено образование
соединения Ti4Pb, которое кристаллизуется по перитектической реакции
при температуре 1305 °С. При температуре 725 °С и концентрации 7,5 %
(ат) РЬ происходит эвтектоидный распад (pTi) на смесь (ccTi) + Ti4Pb.
Максимальная растворимость РЬ в (PTi) при температуре перитектики
составляет -16% (ат.), в (<xTi) при температуре эвтектоидного превраще-
превращения - 4,2 % (ат). При содержании -33,3 % (ат.) РЬ предполагается
образование соединения Ti2Pb, а при -28 % (ат.) РЬ предполагается
эвтектическая реакция между соединениями Ti4Pb и Ti2Pb.
0
l;l
1700
1600
1500
two
1300
1200
1100
woo
900
800
700
600
to го jo
1
stfjo'
882
1
ч:
(ЛП)
\/
y^Z Z5 -
40
1
/
/
f
РЬ, %
so
1
ЪзоР
(по массе)
60
1
ж
70
—г-
T
1
Г
L
el
kl
1
1
1
о
п
Рис. 404. РЬ - Л i
10
15
20
SO
J5
> fa/r?)
800
РЬ-Ti. Pb-TI
Литература
I Murray J.L.//Bull Alloy Phase Diagrams 1984 V 5 N6 P 613-615
Pb-TI. СВИНЕЦ-ТАЛЛИЙ
С Я Алисова
Диаграмма состояния РЬ-Т1 приведена на рис. 405 по данным работы
[1] с учетом проведенных ранее исследований [Э, Ш]. Данные работы [1]
не подтвердили возможность образования соединений Т13РЬ, Т17РЬ и
Т12РЬ, которые обсуждались в работе [X], однако термодинамический
расчет показал тенденцию к упорядочению состава Т13РЬ. Максимум на
кривых ликвидуса и солидуса при температуре 380 "С расположен при
37,5 % (ат.) РЬ. Температура перитектического образования (РТ1)
определена равной 312 °С C10 °С [X]), температура эвтектоидного
распада @Ti) на (aTi) + (Pb) равна 183 °С A40 °С [X]).
Растворимость РЬ в (РТ1) при температуре перитектики составляет
6,2 % (ат.) РЬ; растворимость Т1 в (РЬ) при температуре перитектики
равна 13,8%(ат.).
Pb, % (no массе)
О 10 20 30 4Q 50 ВО 70
ВО 90 100
О 10 20 30 40 50 ВО 70 80 90 100
П РЬ,%(ат) РЬ
Рнс. 405. РЬ - TI
Pb-Tl, Pb-Tm, Pb-U
801
Литература
I Predel В., Schwermann W. // Mat Sci Eng 1970 V 6 N5 P 303-312
Л Л Рохлин
Pb-Tm. СВИНЕЦ-ТУЛИЙ
Диаграмма состояния Pb-Tm не построена. В работе [1] сообщено об
образовании трех соединений: Pb3Tm5, РЬ4Тт5 и РЬзТт, кристалличес-
кристаллическая структура которых приведена в табл. 321. Исследование проведено
методом рентгеновского анализа.
Таблица 321 Кристаллическан структура соединений системы Pb-Tm
Соединение
Pb3Tm5
Pb4Tm5
Pb3Tm
Прототип
Si3Mn5
Ge4Sm5
Cu3Au
Символ
Пирсона,
пргр
АЛ6,
Рб^тст
о/>36,
Рпта
с/>4,
Prrilm
Параметры решетки, нм
а
0,8832
0,8049
0,4794
Ь
1,526
с
0,6487
0,8090
Литература
1 Гладышевский Е.И., Бодак О.И. Кристаллохимия интерметаллических соединений
редкоземельных металлов Львов Вища школа, 1982 255 с
Е И Гладышевский, О И Бодак, В К Печарский
Pb-U. СВИНЕЦ-УРАН
Диаграмма состояния Pb-U приведена на рис. 406 по данным работы
[1] с учетом результатов проведенных ранее исследований, представлен-
представленных в работах [X, Ш] Сплавы системы Pb-U изучены методами
микроструктурного и рентгеновского анализов. Установлено образова-
образование двух соединений: Pb3U и PbU, первое из которых плавится
конгруэнтно при 1220 °С, второе кристаллизуется по перитектической
реакции при 1280 °С В интервале концентраций от 37 до 98,5 % (ат) РЬ
802
0 10 20 JO
t,°C
mo
1200
1000
800
600
400
200
1
/
Л7.5
i
OZ'
/ Mb'
0,1
b)
ж
mo
5s
Pb-U
U, % (по массе)
40 SO 60 70 80
/
ttiO*
1 1
it * ж
*^fZ
1280'
1125'
90 100
T
(i
1
(J3
\
\
\
\
39,5
1135'
776'
668°
О 10 20 JO 4-0 50 60 70 80 90 100
Pb U, % (am) U
Рнс. 406. Pb-U
образуется область несмешиваемости, существование которой дискутиро-
дискутировалось в работах [X, Ш].
При температурах 325,1210 и 1125 °С осуществляются эвтектические
превращения. Эвтектика со стороны Pb практически вырождена,
растворимость U в (Pb) составляет не более 0,1% (ат.). Сплав эвтектичес-
эвтектического состава при температуре превращения 1125 °С содержит 0,5 % (ат.)
Pb.
Растворимость Pb во всех модификациях U предельно мала. Тип
реакций (pU) и (aU) с соединением PbU не установлен.
Соединение Pb3U имеет объемно-центрированную тетрагональную
решетку с параметрами а = 1,104нм,с= 1,060 нм. Соединение PbU имеет
простую кубическую решетку с параметром а = 0,4971 нм.
Литература
I Sheldon R.L., Foltyn E.M., Peterson D.E. // Bull Alloy Phase Diagrams 1987. V 8 N 6
P 536-541
Г И Терехов
Pb-W, Pb-Y
803
Pb-W. СВИНЕЦ-ВОЛЬФРАМ
Диаграмма состояния Pb-W не построена. В работе [Ш] сообщается,
что в интервале температур 650-1740 "С при совместном нагреве РЬ с
пористыми спеченными брикетами W никаких превращений не
установлено, что указывает на отсутствие взаимодействия в системе.
Согласно результатам работ Р, X] растворимость W в РЬ при температу-
температуре 1200 °С не превышает 0,0056 % (ат.).
К. Б. Поварова
Pb-Y. СВИНЕЦ-ИТТРИЙ
Диаграмма состояния Pb-Y приведена на рис. 407 по данным работы
[1]. Сплавы изготовляли в дуговой печи с использованием Y чистотой
99,9 % (по массе) и РЬ чистотой 99,99 % (по массе). Исследование про-
проводили методами микроструктурного, рентгеновского и термического
анализов. Установлено образование четырех соединений, из которых
Y5Pb3 плавится конгруэнтно при температуре 1760 "С, остальные Y5Pb4,
YPb2 и YPb3 кристаллизуются по перитектическим реакциям при
температурах 1650,945 и 740 "С соответственно. При температурах 1240
и 325 °С осуществляются эвтектические превращения. Реакция при
температуре 1440 °С является кататектической (pY) « (aY) + Ж.
Эвтектика при температуре 1240 °С содержит 14 % (ат.) РЬ.
Соединение Y5Pb3 имеет узкую область гомогенности в пределах 1 %
(ат.) в интервале концентраций от 37 до 38 % (ат.) РЬ.
Данные о кристаллической структуре соединений системы Pb-Y
приведены согласно работам [1, 2] в табл. 322.
Таблица 322
Соединение
YjPb3
Y3Pb4
YPb2
YPb3
Кристаллическая структура соединений системы Pb-Y
Прототип
Si3Mn5
Ge4Sm5
Si2Zr
Cu3Au
Символ
Пирсона,
пргр
АЛ6,
Pd-Jmcm
0РЗ6,
Рпта
оСЧ,
Стст
с РА,
РтЪт
Параметры решетки, нм
а
0,8971
0,7991
0,4540
0,4814
b
1,510
1,646
-
с
0,6614
0,8241
0,4450
-
804
Pb-Y
t
t;c
mo
1600
1478'\
140^
1200
1000
600
600
400
). 20
1
n
1
•
OY).
V
л У)
Pb, % (по массе)
40 60 80 100
/
J
1240
176
0"
N
6S0'
\
\
ж
\
\
945" |
S
4.
740' \
1
(Pb) !
325
• \
327,502'
О 10 20 JO 40 50 60 70 80 30 WO
Y Pb,'/,(am.) Pb
Рис. 407. Pb-Y
Литература
1 Carlson O.N., Schmidt F.A., Diesburg D.E.//"Trans ASM 1967 V 60 P 119-124
2 Jeitschko W., Parlhe E. // Acta Crystallog 1965 V 19 N 2 P 275-277
ЕЙ Гладышевкий. О И Бодак. В К Печарский
Pb-Yb
805
Pb-Yb. СВИНЕЦ-ИТТЕРБИЙ
Диаграмма состояния Pb-Yb (рис. 408) построена по данным работы
[1] с учетом результатов работы [2]. Сплавы синтезировали в запаянных
танталовых тиглях, гомогенизировали в жидком состоянии в течение 1 ч,
охлаждали, а затем еще раз расплавляли. В качестве шихтовых
материалов использовали Yb чистотой 99,91 % (по массе) и РЬ чистотой
99,99 % (по массе). Исследование выполняли методами микроструктурно-
микроструктурного, рентгеновского и термического анализов.
В системе существуют четыре соединения. Соединения Pb3Yb, PbYb
и PbYb2 плавятся конгруэнтно при температурах 742, 1116 и 1246 "С,
соединение Pb3Yb5 образуется по перитектической реакции при
температуре 1150 "С. При температурах 717,1086 и 769 °С осуществляет-
осуществляется эвтектическая кристаллизация. При температуре 329 °С происходит
перитектическая реакция, растворимость Yb в (РЬ) при температуре
перитектики составляет 0,15 % (ат.). При температуре 787 °С существует
кататектическая реакция распада (PYb) - Ж + (aYb).
В табл. 323 приведены данные о кристаллической структуре
соединений системы Pb-Yb по данным работ [1-3].
to
1200
1000
800
600
чао
7,S0i
200
о го
РЬ
Рис. 408. Pb-Yb
Yb, % (по массе)
20 JO +0 50 60 70 80 SO 100
/
1
У
*-(Pb)
1
1
ж
7W
2
1
/
1
/f)
/\
507°
2
g>
ts
i i i
1150' 1
Г066*.
if
24
\
$
71
ы
к
l
4
4
¦9'-
(«>
1
ten)
(¦*">>. 819'
* S%795'
20 30 40 50 ВО 70 ВО 90 100
Yb,%(am.) Yb
806
Pb-Yb, Pb-Zn
Таблица 32 3. Кристаллическая структура соединений системы Pb-Yb
Соединение
РЬ3УЬ
aPbYb
Pb3Yb5
PbYb2
Прототип
AuCu3
AuCu(I)
Co2Si
Символ
Пирсона,
пр.гр.
с/>4,
РтЪт
tn,
PAImmm
API6,
P63/mcm
о/>12,
Рпта
Параметры решетки, нм
а
0,4867
0,5085
0,9325
0,7478
Ь
0,5225
с
0,4443
0,6920
0,9549
Литература
l.Palenzona A., CiraficiS.//J. Phase Equilibria 1991 V. I2.N4.P 479-481.
2. McMastm O.D., Gschneidner, Jr., K.A.//Trans. AIME. [967. V. 239. N 6 P 781-785
3. Bnizzone G., Merlo F. // J. Less-Common Met. 1976 V. 48. N I. P. 103-109.
E И. Гладышевский, О. И. Бодак, К В Печорский
Pb-Zn. СВИНЕЦ-ЦИНК
РЬ,% (по массе)
х „„О Ю20 30 tO 50 60 ТО 80
90
то
too
200
о ю
Zn
Рис. 409. Pb-Zn
327,502"
30 tO 50 60 ТО 80 90 100
РЬ,%(ат.) РЬ
Pb-Zn. Pb-Zr
807
Диаграмма состояния Pb-Zn приведена на рис. 409 по данным работы
[X]. Система Pb-Zn характеризуется образованием широкой области
несмешиваемости и отсутствием соединений, что подтверждено в более
поздних исследованиях [1-3]. В работе [1] определены координаты
критической точки кривой расслоения: 798 °С и 28 % (ат.) РЬ. Температу-
Температура монотектической реакции составляет -417,8 "С по данным работы
[X, Э, 3]. Сплав в монотектической точке содержит от 0,27 до 0,41 % (ат.)
РЬ [X, Э, 3]. При температуре 318,2 °С осуществляется эвтектическая
кристаллизация, эвтектическая точка расположена при 97,80-98,4 % (ат.)
РЬ по данным работ \Х, Э, Ш]. Растворимость РЬ в (Zn) незначительна
и примерно равна 0,32-Ю~5 % (ат.); растворимость Zn в (РЬ) составляет
от 0,16 до 0,36 % (ат.) при эвтектической температуре 318,2 °С.
Литература
1 Cafasso F.A., Feder H.M., Johnson I. // J. Phys. Chem. 1964. V. 68. N 7. P. 1944-1948.
2. Gaye H., Lupis C.H.P. // Metal. Trans 1975. V. 6. N 5. P. 1049-1056.
3 Esdaile J.D.,Sweet F.// Metal Trans. A 1983 V. 14. N II P. 2211-2218.
Л.Л. Рохлин
Pb-Zr. СВИНЕЦ-ЦИРКОНИЙ
Диаграмма состояния Pb-Zr со
стороны Zr приведена на рис. 410 по
данным работ [I, Ш, Э]. Установлено,
что РЬ повышает температуру а » р
перехода Zr; при температуре -900 °С
происходит перитектоидная реакция
образования (aZr). В системе существу-
существует одно соединение Zr5Pb3, которое при
температуре 1400 °С и содержании
77 % (ат.) Zr образует эвтектику с (PZr).
В работе [2] указано, что соединение
Zr5Pb3 может быть получено различ-
различными методами; наиболее оптималь-
оптимальным является изостатическое прессо-
прессование смеси порошков компонентов
при температуре 870 °С и давлении
150 МПа с последующим отжигом при
этой температуре.
Растворимость РЬ в (PZr) составляет
7,5 % (ат.) при 1100 "С и 3,8 % (ат.) при
температуре перитектоидной реакции
1г,%(по массе)
JO W 60 80 100
SO 60 70 ВО 90 ЮО
Zr'/.(am.) Zr
Рис. 410. Pb-Zr
808
Pb-Zr, Pd-Pr
-900 °C. Максимальная растворимость Pb в (ccZr) равна 5 % (ат.) при
температуре перитектоидной реакции -900 "Си уменьшается до 3,8 %
(ат.) при 600 °С.
В работе [3] указано, что кристаллическая структура соединения
Zr5Pb3 относится к типу Mn5Si3 (символ Пирсона А/Ч 6, пр.гр. РЬг1тст,
а = 0,853 нм, с = 0,586 нм).
Литература
I. Бадаева Т.Д., Рыбакова Л.И. // Строение и свойства сплавов урана, тория и циркония
Сб. статей. М.: Госатомиздат, 1963. 379 с
2 DalleD.M.,DomerS.,LuptonD.F.//J.Nucl. Mater., 1988. P. I4I-I43. Part A. P. 369-372
3. Nowotny H., Schachner H. // Monatsh. Chem. 1953. V. 84. N I. P. 169-180.
Л А. Третъяченко
Pd-Pr. ПАЛЛАДИЙ-ПРАЗЕОДИМ
Диаграмма состояния Pd-Pr не построена. В работах [V-C, 1]
сообщается о пяти соединениях (табл. 324) в системе Pd-Pr: Pd3Pr7, PdPr,
Pd4Pr3, Pd3Pr и Pd5Pr. Исследование проведено методом рентгеновского
анализа.
Таблица 324 Кристаллическая структура соединений системы Pd-Pr
Соединение
Pd3Pr7
PdPr
Pd4Pr3
PdjPr
Прототип
Fe3Th7
CrB
Pd4Pu3
Cu3Au
Символ
Пирсона,
пр.гр.
hPZO,
Рбупс
оС8,
Cmcm
Ш4,
ЛЗ
сРА,
РтЪт
Параметры решетки, нм
а
1,0176
0,3850
1,3595
0,4135
Ь
1,0826
с
0,6415
0,4614
0,5804
Кристаллическая структура соединения Pd5Pr не определена.
Литература
Гладышевский Е.И., Бодак О.И. Кристаллография интерметаллических соединений
редкоземельных металлов. Львов: Вища школа, 1982, 255 с
Е.И. Гладышевский, О.И. Бодак. В.К. Печорский
Pd-Pt
809
Pd-Pt. ПАЛЛАДИЙ-ПЛАТИНА
Диаграмма состояния Pd-Pt (рис. 411) построена в работе [1] методом
"пятна" с помощью ячейки Кнудсена и оптического пирометра с
исчезающей нитью накаливания. В качестве исходных материалов
использованы Pd и Pt чистотой 99,95 % (по массе). Образцы синтезирова-
синтезировали в тиглях из А12О3 в вакууме в индукционной печи и отжигали при
температуре 1300 °С в течение семи суток.
Установлено, что Pd и Pt образуют непрерывный ряд твердых
растворов. Кривые ликвидуса и солидуса расположены ниже рас-
рассчитанной кривой солидуса согласно работе [2] и выше кривых ликвидуса
и солидуса, рассчитанных с использованием модели регулярных
растворов в работе [3].
Литература
1 Bharadwaj S.R., Kerkar A.S., Tripathi S.N., Dharwadkar S.P. // J. Less-Common Met. 1991.
V 169. N I. P 167-172
Pt, •/• (no массе)
0 10 20 SO 40 50 6078 88 90fOO
t;c
1750
1700
1650
tunn
1550
1
/
/1
ttsss"
1
и
1
ж
г
-
¦7.
1
f
1
г
1
(Pd,Pt)
\ 1
г
1
'69
О fO 20 30 40 50 60 78 80 90 100
Pi Pt, •/• lam.) Pt
Рис. 411. Pd-Pt
810
Pd-Pt, Pd-Pu
2 Кузнецов Г.М., Рытвин Е.Н., Ннконова И.В. и др. // Изв АН СССР Металлы 1985
N 4 С 194-197
3 Bharadwaj S.R., TripathiS.N.//J Alloy Phase Diagrams 1990 V 6 P 118-122
С П Алисова
Pd-Pu. ПАЛЛАДИЙ-ПЛУТОНИЙ
Диаграм ма состояния Pd-Pu приведена на рис. 412 по данным работы
[1 ] В системе существуют четыре соединения. Соеди нения Pu3Pd4 и PuPd3
образуются конгруэнтно при температурах 1190 и 1500 °С соответствен-
соответственно; соединения Pu5Pd4 и PuPd кристаллизуются по перитектическим
реакциям при температурах 970 и 1150 °С соответственно; соединение
PuPd при температуре 950 °С распадается по эвтектоидной реакции на
смесь Pu5Pd4 + Pu3Pd4. При температурах 630,1060 и 1240 °С осуществля-
осуществляются эвтектические превращения.
Растворимость Pd в (еРи) и (бРи) не превышает 1 % (ат.), раствори-
растворимость Ри в (Pd) при комнатной температуре составляет 13,6 % (ат.) и
возрастает до 14,3 % (ат.) При температуре 1000 °С [III].
Pd,v»(no массе)
10 20 JO 40 50 6070 809010Q
1555'
two
1200
WOO
800
640е
600
400
200
Ж
/
r
30'
t—(Cruf
' [6'Pu)
~(SPu)
1
-11,
fOli
fO
/
W'
ЗЮ'
»(fPu) zfgm
•(jbpu)—
*-(aPu)
fif
I
¦«e
.1
я
It
if
w
\
4
i
\s<H
J
1
fit'
•¦—
л у
г
WO
fd)
0 tO 20 JO *0 50 60 70 80 90 100
Pu Pit, % (am.) Pd
Рис.412. Pd-Pu
Pd-Pu. Pd-Rc
811
Соединение PuPd3 имеет кристаллическую структуру типа AuCu3
(символ Пирсона сР4, пр.гр. Рт Ът) с параметром а = 0,4077-0,4119 нм
в пределах области гомогенности соединения, равной 5 % (ат.).
Согласно работе [2] соединение Pu3Pd4 имеет ромбоэдрическую
структуру с параметром а = 0,7916 нм, а = 114,2°, что в гексагональной
симметрии соответствует параметрам решетки а - 1,3304 нм, с =
= 0,5783 нм (а = 1,3344 нм, с = 0,5744 нм [1]). В работе [2] указано, что
кристаллическая решетка соединения Pu5Pd4 относится к новому
структурному типу, пр гр. R 3.
Литература
1 Кутайцев В.И., Чеботарев Н.Т., Аядрианов МЛ. в др. // Атомная энергия 1967 Т 23
№6 С 511-519
2 CromerD.T., Larson A..C, Roof R.B.//Acta Crystallogr В 1973 V 29 N 3 P 564-567
M В Раевская, Е М Соколовская
Pd-Re. ПАЛЛАДИЙ-РЕНИЙ
Диаграмма состояния Pd-Re приведена на рис. 413 по данным работ
[1, 2]. Система Pd-Re характеризуется образованием ограниченных
твердых растворов на основе
ве,"А>(по массе)
О 20 4-0 60 80 90 100
компонентов и осуществлением
перитектического превращения
при 1650+25 °С. Растворимость
Re в (Pd) при температурах
1000-1500 "С составляет -11 %
(ат.). Установлено, что добавка
Re к Pd увеличивает твер-
твердость и удельное электросоп-
электросопротивление сплавов, что сопро-
сопровождается уменьшением пара-
параметра решетки а твердого рас-
раствора на основе Pd с гранецен-
трированной кубической
структурой от 0,3882 нм для Pd
до 0,3650 нм (для сплава с со-
содержанием 11 % (ат.) Re).
0
4
/
1)
Ж
/
У
У
1650*25'
1
J
У
(Re)-
Вб\
\Л
\
1
\
1
1
/
1
V
\
\
3000
2600
2200
>воо
1555'
то
WOO
О 10 20 30 40 50 60 70 80 30 ЮО
Pd ке,"/о(ат.) Re
Рис. 413. Pd-Re
812
Pd-Re. Pd-Rh
Литература
I ТылкииаМ.А., Цыганова И.А., Савицкий Е.М.//Журнал неорганической химии. 1962
Т. 7. Вып. 8. С. 1917-1927.
2. Благородные металлы: Справочник /Под ред. Савицкого Е.М. М.: Металлургия. 1984.
592 с.
М.А. Тылкина
Pd-Rh. ПАЛЛАДИЙ-РОДИЙ
Диаграмма состояния Pd-Rh приведена на рис. 414 по данным работы
[1]. Исследование проведено рентгеновским анализом. Установлено
образование непрерывного ряда твердых растворов с гранецентрирован-
ной кубической структурой; предполагаемое в работе [2] полиморфное
превращение Rh и связанное с ним превращение в твердом состоянии в
работе [1] не подтверждено. При температурах ниже 1000 °С существует
широкая область расслаивания твердых растворов с критической
температурой 845 "С.
ftfi,'/» (па массе)
О 20 W 60 80 100
'сI Ml Ml Ml I ¦ I 1/1196Г
1500
1000
500
(Pd,Rh\
I
0 10 20 SO 4050 SO 10 80 90100
Pd Rh'/, (am.)
Рис. 414. Pd-Rh
Литература
I. Raub E., Beeskow H., Menzel D. // Z. Metallkunde. 1959. Bd. 50. N 7. S. 428-431.
2 Рудницкий А.А., Полякова Р.С., Тюрии И.И. // Известия сектора платины и других
благородных металлов. М.: Ин-т общей и неорганической химии АН СССР, 1955. Вып. 29
С.190-196
М.В. Раевская, Е.М. Соколовская
Pd-Ru
813
Pd-Ru. ПАЛЛАДИЙ-РУТЕНИЙ
Диаграмма состояния Pd-Ru (рис. 415) построена по расчетным
данным работы [1], которые хорошо согласуются с экспериментальными
результатами, полученными микроструктурным, рентгеновским и
термическим анализами в работах [X, Э, Ш]. При температуре 1583 "С
и содержании 17,2 % (ат.) Ru осуществляется перитектическое равновесие.
Растворимость Pd в (Ru) при перитектической температуре составляет
17 % (ат.). Растворимость Ru в (Pd) уменьшается с понижением
температуры:
Температура, °С
Растворимость Ru, % (ат.).
600
3,3
1000
5,5
1100
7,0
1300
10,7
1400
13,5
Согласно работе [2] параметр решетки а твердого раствора на основе
Pd с гранецентрированной структурой уменьшается с увеличением в
сплавах Ru от 0,3879 нм при 8,57 % (ат.) Ru до 0,3875 нм при 15,07 % (ат.)
Ru.
Ru, '/о (по массе)
О 10 20 30 ЬО 50 60 70 80 30 100
гззь'
ZOO0
1555°
1500
1000
на
1
(
1\
ж
~—
i
***
№
I
-«<
93*
\
i
/
J(ftu)
\
\
\\
О 10 20 30 40 50 60 70 ВО SO 100
Pd Ru, % (am.) Ru
Рис. 415. Pd-Ru
Литература
1 Rand M.N., Potter P.E.//Physica. 1981. Bd. 103. N I.S 21-30.
2 Koster W., Hadmann D., Lueck R. //Ann. Phys. 1963 Bd 11. N 6. S. 307-310.
M В Раевская, Е М Соколовская
814
Pd-S
PdS. ПАЛЛАДИЙ-СЕРА
Диаграмма состояния Pd-S в интервале концентраций 0-40 % (ат.)
S приведена на рис. 416 по данным работы (X]. Установлено образование
четырех соединений: Pd4S, Pd3S, PdS и PdS2. Условия образования
соединений PdS и PdS2 не определены и они не показаны на рис. 416.
Соединение Pd4S образуется по перитектической реакции при температу-
температуре 761 "С. Соединение Pd3S кристаллизуется также инконгруэнтно при
температуре 635 °С и распадается по эвтектоидной реакции при 555 °С.
При температуре 623 °С осуществляется монотектическая реакция.
В работе [2] приведен участок диаграммы состояния Pd-S в интервале
концентраций от 23 до 32 % (ат.) S (рис. 416, вставка); указано на
образование по перитектоидной реакции соединения Pd16S7, имеющего
область гомогенности. Температурный интервал существования
соединения Pd3S подтверждают данные, приведенные в работе [X].
Кристаллическая структура соединений системы Pd-S дана
в табл. 325.
t.'C
1500
1ЧОО
1300
поо
1100
IOOO
900
BOO
700
BOO
soo
S, % (по массе)
о г ь б в ю го jo
400
M5
\
\
\ %
i i
» 4.
\??
~\
|
761'
~-(Pd)
4
i 11
t |
- ffw
500
1
JL
•
t
i
ZJZ5 21 29 31 33
S,У. (am)
1
t
I
1
623?
—-J-
555;
О W ZO JO 40 50 60 70
Pd-S, Pd-Sb
815
Таблица 325 Кристаллическая структура соединений системы Pd-S
Соедине-
Соединение
Pd4S
Pd3S
Pd16S7
PdS
PdS2
Прототип
Pd4Se
Pd3S
Pd,6S7
PdS
PdSe2
Символ
Пирсона,
nprp
tPlQ,
/>42,c
0CI6,
Amal
с/46,
/43 m
IP\6,
P42lm
oP\Z,
Pbca
Параметры решетки, нм
a
0,51147
0,6088
0,89300
0,8954
0,643
0,6429
0,5460
h
-
0,5374
-
0,5541
с
0,55903
0,7453
-
0,F3
0,6611
0,753!
Источник
[Э]
[2]
[Э]
[1]
[X]
[3]
[X]
Литература
1 Matkovic P., El-Boragy M., Schubert К.//J Less-Common Met 1976 V 50 N1-2
Р 165-176
2 Rost E., Vestersio E. // Acta Chem Scand 1968 V. 22 N 3 P 819-826
3 BreseN.,SquaHitoP.J., Ibers J.A.//Acta Crystallogr С 1985 V 41 N 12 P 1829-1830
Ю Б Кузьма
Pd-Sb. ПАЛЛАДИЙ-СУРЬМА
Диаграмма состояния Pd-Sb приведена на рис. 417 по данным работы
[X] В системе существуют четыре соединения. Соединения Pd3Sb (P) и
PdSb плавятся конгруэнтно при температурах 1220 и 805 °С соответствен-
соответственно, соединения Pd5Sb3(y) и PdSb2 кристаллизуются по перитектическим
реакциям при 845 и 678 "С. При температурах 1070, 731 и 590 °С и
концентрациях -21, -42,3 и -89 % (ат.) Sb осуществляются эвтектические
реакции. При температуре 550 °С соединение Pd5Sb3 распадается по
эвтектоидной реакции. Предполагают, что соединение Pd3Sb обладает
полиморфизмом, температура полиморфного перехода Р e P', видимо,
зависит от состава, как следует из рисунка.
В работе [1] система Pd-Sb исследована в интервале концентрации
от 23 до 30 % (ат) Sb Сплавы синтезировали в эвакуированных
816
Pd-Sb
t.'C
14-00
1200
го
S6,"/» (no массе)
ЬО 60 80
wo
WOO
630,755"
0 10 ZO JO #0 50 60 70 80 SO 100
Pd 5b,'/. (am.) Sb
Рис. 417. Pd-Sb
кварцевых ампулах при температуре на 100 °С выше температуры
плавления и охлаждали на воздухе. Затем образцы гомогенизировали
при температуре 480 °С в течение 12 ч и закаливали в воде. Исследование
проводили методом рентгеновского анализа. Установлено образование
четырех соединений, отличных от приведенных в работе [X]: Pd5Sb2,
Pd2Sb, PdgSb3 и Pd5+Sb2_, определены их области гомогенности.
Соединение PdsSb2 получено напылением тонких пленок согласно
работам [2, 3], таким же методом получено соединение Pd5Sb3 в работах
[3, 4]. Структуры этих соединений исследованы электронографически.
В работе [б] определена структура соединения Pd20Sb7. В табл. 326
приведены данные о кристаллической структуре соединений системы
Pd-Sb согласно работе [V-C].
Pd-Sb, Pd-Sc
817
Таблица 326 Кристаллическая структура соединений системы Pd-Sb
Соединение
PdjSb
Pd2OSb7
Pd5Sb3
Pd5Sb2
Pb5Sb2
Pd2Sb
PdSb
PdSb2
Прототип
NaTl
Pd20Sb7
Pd5Sb3
Ni5As2
Pb5Sb2
Pd2As
NiAs
FeS2
Символ
Пирсона,
пр.гр.
cF16,
Fdlm
hR27,
Rl
Rlc
hP42,
/>63cm
hPM,
РЬъ1ттс
<>C24,
Cmc2,
hPA,
P63/mmc
cPll,
Pal
Параметры решетки, нм
a
0,63905
1,1734
0,76152
0,7606
0,7598
0,3354
0,4076
0,64524
b
-
-
-
-
1,7444
с
-
1,1021
4,3032
1,3863
2,8112
0,6909
0,559
Литература
1. El-Boragy M., Schubert К. // Z. Metallkunde. 1971. Bd. 62. N 4. S. 314-323.
2 El-Boragy H., Bhan S., Schubert K. // J Less-Common Met. 1970. V. 22. P. 445
3 Wopersnow W., Schubert K. //J Less-Common Met. 1976. V. 48. P. 79-87.
4. Май Л.И., Исиамов P.M. // Кристаллография. 1977. Т. 24. Вып. 3 С. 632-635.
5 Wopersnow W., Schubert К. // J Less-Common Met. 1977. V. 51 P. 35-44.
E.H Гладышевский, О. И Бодак, В К. Печорский
Pd-Sc. ПАЛЛАДИЙ-СКАНДИЙ
Диаграмм а состояния Pd-Sc приведена на рис. 418 по данным работы
[1]. Исследование выполнено методами термического, микроструктурно-
микроструктурного и рентгеновского анализов. В системе существуют пять соединений:
соединение PdSc плавится конгруэнтно при температуре 1600 "С,
818
Pd^Sc
tfC
о to
Sc, °/o (no массе)
20 40 60 80 100
15*5
(Pd)
9
\f*5
1b)
\
\
Id
Ж
- 4
k
г
\
M5
V
oo°
\
\
not
1
ч
t
i
\
104
I
г
\
0° \
^
j
s
1
1
(J3SC)-r-
tobtr
(«.
1
1
1
1
1
1
J
92
ну»
1600
1*00
1200
WOO
800
о to го jo ьо so 60 70 во so too
Pd sc,% (am.) Sc
Рис. 418. Pd-Sc
соединения Pd3Sc, Pd2Sc, PdSc7 и PdSc4 кристаллизуются по перитектичес-
ким реакциям при температурах 1450,1430, 1200,1040 °С соответственно.
При температурах 1415 и 1000 °С и концентрации 40 и 92 % (ат.) Sc
соответственно осуществляется эвтектическая кристаллизация.
Растворимость Sc в (Pd) при температуре перитектики 1450 °С
составляет 15%(ат.), растворимость Pd в (Sc) практически от-
отсутствует.
Сведения о кристаллической структуре соединений системы Pd-Sc
приведены в табл. 327 по данным работ [2, V-C].
Pd-Sc, Pd-Se
819
Таблица 327. Кристаллическая структура соединений системы Pd-Sc
Соединение
PdSc2
PdSc
Pd2Sc
PdjSc
Прототип
NiTi2
CsCI
Cu2Mg
Cu3Au
Символ Пирсона, пр.гр.
cFN,
Fdim
cP2,
Pmim
cF24,
Fdlm
cPA,
РтЪт
Параметр решетки а, нм
1,2427
0,3283
0,3963
0,3969
Литература
1. Савицкий Е.М., Полякова В.П., Кривдии Б.П. и др. // Диаграммы состояния
металлических систем: Сб статей. М.: Наука, 1971. С 200-203.
2. Гладышевский Е.И., Бодак О.И. Кристаллохимия интерметаллических соединений
редкоземельных металлов. Львов: Вища школа, 1982. 255 с.
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
Pd-Se. ПАЛЛАДИЙ-СЕЛЕН
Диаграмма состояния Pd-Se приведена на рис. 419 по данным работы
[1]. Исследование проведено методами микроструктурного, рентгеновско-
рентгеновского и термического анализов, а также определением энтальпии образцов,
полученных взаимодействием Pd чистотой 99,99 % (по массе) и Se
чистотой 99,998 % (по массе). Установлено образование восьми
соединений. Соединения Pd4 5Se, Pd4Se, Pd7Se, Pd3Se, Pd7Se4 и Pd]7Sel5
кристаллизуются по перитектическим реакциям при температурах 635,
544, 538, 430,415 и 680 °С соответственно; соединение PdSe2 образуется
по синтектической реакции при температуре 760 °С. Соединение PdSe
образуется по перитектоидной реакции при температуре 620 °С. При
температуре 385 °С осуществляется эвтектическое превращение.
CoeflHHeHHePd4 5Se при температуре 390 °С распадается по эвтектоидной
реакции с образованием смеси твердого раствора на основе Pd и
соединения Pd4Se.
В работе [2] высказано предположение об образовании соединения
Pd9Se в интервале температур 385-625 °С со структурой, имеющей
тригональную симметрию (тип не установлен).
820
Pd-Se
КС
two
900
inn
500
300
t
Рис. 419. Pd-Se
Se
1 fO 20 30
ЙЙ
635°
i
39
27'
!
7'
-r(fd)
7
Pd
л т
1
№.
$
ж
ft*
?±538
"л
TVY
3S5'
20
, % (по массе)
40 SO SO 70 80
i
1
s
f
1
у
1
ж,
.680°
вго'
60
•/. (am)
i
i
760°
~Oft
80
90 tOO
1
1
1
4
\
221'
too
Se
Соединение Pd4Se претерпевает полиморфное превращение при
527 °С.
Максимальная растворимость Pd в (Se) составляет 5 % (ат.) при
температуре 760 °С согласно работе [1]. Растворимость Se в (Pd) не
превышает 1,5 % (ат.) при температуре 590 "С согласно данным работы
[2]. В табл. 328 приведена кристаллическая структура соединений системы
Pd-Se.
Таблица 32 8. Кристаллическая структура соединений системы Pd-Se
Соединение
Pd4Se
Pd,Se2"
Pd3Se*2
Прототип
Pd4Se
-
-
Символ
Пирсона,
пр'.гр.
-
-
Параметры решетки, нм
а
0,52324
0,9462
2.1414
Ъ
-
0,5354
0,5504
с
0,56470
0,5501
1,2030
Источник
[Э]
[1]
[3,1]
Pd-Se. Pd^Si
821
Соединение
Pd7Se4°
Pd,Se,;4
PdSe
PdSe2
Прототип
-
-
PdS
FeS2
Символ
Пирсона,
пр.гр.
«|2,2,
РтЪт
tP\6,
о/>6,
Рппт
*' Моноклинная сингония, р = 86,5
*2 Моноклинная сингония, р = 99,9'
*3 Орторомбическая сингония.
4 Кубическая сингония.
Параметры решетки, нм
а
1,0162
1,0172
1,0606
0,673
0,5741
1°.
Ь
0,6863
0,6873
-
-
0,5866
с
0,5375
0,5381
-
0,691
0,7691
Источник
[3]
[1]
[Ш]
[X]
[X]
Литература
1 Olsen Т., Rost E., Gronvold P. // Acta Chem. Scand. A. 1979. V. 33. N 2. P. 251-256.
2. Takabatake Т., Ishikava M., Jorda J.L. // J. Less-Common Met. 1987. V. 134. P. 79-89.
3. Matkovic Т., Schnbert K. // J. Less-Common Met. 1978. V. 59. N 1. P. 57-63.
E.M. Соколовская, М.В. Раевская
PdSi. ПАЛЛАДИЙ-КРЕМНИЙ
Система сплавов Pd-Si исследовалась неоднократно [X, Э, Ш, 1-6]
методами дифференциального термического, термомагнитного, микро-
и рентгеноструктурного анализов, измерения плотности сплавов. На
рис. 420 приведена диаграмма состояния Pd-Si по данным работ [1, 2].
В качестве исходных компонентов использовали Pd и Si чистотой
99,999 % (по массе). Сплавы готовили в дуговой печи в атмосфере аргона.
В системе Pd-Si по данным работ [1, 2] при кристаллизации из
расплава образуется пять промежуточных фаз, из которых Pd5Si, Pd3Si,
Pd2Si плавятся конгруэнтно при температурах 818, 1070, 1394 °С
соответственно. Соединения Pd4Si и PdSi образуются по перитектическим
реакциям при температурах 830 и 901 °С. В работе [1] предполагается,
822
Pd-Si
t,°c
1555°
1500
П00
1300
1200
1100
WOO
900
600
700
600
10
Si,°/o (по массе)
20 JO fO 50 60 TO 80 100
\
— •*
«
1
i
•> ¦ /
II 1 (
321"
727°
~(Pd)
/|
/
W
7/
да
t
•
с
1
с
\
7J
/
П2
о
g
1\
ч
1
\
WWT»\
п
! л
ГУ
у
52
1
/
/
8,
i i
/
1 1
/
892°
i 1
ад-
0 70 20 30
Pd
40 SO 60 70
$i,°/e(am.)
60 90 100
Si
Рис. 420. Pd-Si
что фаза Pd2Si претерпевает упорядочение при температуре 1097 °С;фаза
Pd4Si имеет полимерное превращение при температуре 772 °С. В системе
протекают четыре эвтектические реакции:
Ж - (Pd) + Pd5Si при 821 "С и 15,5 % (ат.) Si;
Ж - Pd5Si + Pd4Su при 816 °С и при -17 % (ат.) Si;
Ж - Pd3Si + Pd2Si при 1050 °С и -28 % (ат.) Si;
Ж - PdSi + (Si)" при 892 °С и 52 % (ат.) Si
Pd-Si
823
Кроме того, в системе установлено два нонвариантных эвтектоидных
равновесия:
Pd5Si - (Pd) + Pd4 Si при 727 °C;
PdSi " Pd2Si + (Si) при 824 °C [1-2].
По данным работы [3] соединения Pd5Si, Pd4Si (Pd9Si2) и Pd3Si
образуются по перитектическим реакциям при температурах -810, 823
и 1045 "С соответственно. Авторы обзора [4] считают, что соединение
PdSi образуется конгруэнтно при температуре 972 "С. Кристаллическая
структура промежуточных фаз приведена в табл. 329.
В работе [5] диаграмма состояния Pd—Si построена по расчетным
данным. По результатам расчета ближайшая к Pd эвтектика содержит
16%(aT.)Si.
В литературе [2, 6] указывается на образование метастабильных
соединений в системе Pd-Si при высоких скоростях охлаждения из
расплава. При кристаллизации из расплава со скоростью охлаждения
102-104 °С/с в интервале концентрации от 0 до 30 % (ат.) Si кроме
стабильных фаз Pd5Si и Pd4Si образуются две метастабильные фазы
Pd5 25Si и Pd4 5Si, а при скорости охлаждения <102 °С/с образуется фаза
Pd525Si[2]. '
Таблица 329 Кристаллическая структура соединений системы Pd-Si |4|
Соединение
Pd5Si*
Pd9Si2
Pd3Si
Pd2Si
Pd2sr
PdSi
Прототип
Pd5P
-
Fe3C
Fe2P
-
MnP
*JJ = 100,7°
Гексагональная сингония
Символ
Пирсона,
пр.гр.
m/>24,
«I
oP44,
Pnma
oP\6,
Pnma
hP9,
P62m
-
oPH,
Pnma
Параметры решетки, нм
a
0,8465
0,9414
0,5735
0,6496
1,3055
0,5599
b
0,7485
0,74188
0,7555
—
-
0,3381
с
0,5555
0,90548
0,5260
0,3433
2,7490
0,6133.
824
PdSl, Pd-Sm
Литература
l.LangerH., Wachtel E.//Z. Metallkunde. 1981. Bd. 72. N U.S. 769—775.
2. Lang» H., Wachtel E. // Z. Metallkunde. 1983. Bd. 74. N 8. S. 535-544.
3. Wysocki J., Duwez P.E. // Metal. Trans. A 1981. V. 12. N 8. P. 1455-1460.
4. Roschel E., Raub ChJ. // Z. Metallkunde. 1971. Bd. 62. N 11. S. 840-842.
5. Baxi H.C., Massalski T.B. // J. Phase Equilibria. 1991. V. 3. N 3. P. 349-356.
6. Saunders N. // Calphad. 1985. V. 9. N 4. P. 297-309.
В.П. Полякова
Pd-Sm. ПАЛЛАДИЙ-САМАРИЙ
Диаграмма состояния Pd-Sm (рис. 421) построена по данным
дифференциального термического, металлографического и рентгеновско-
рентгеновского анализов [1] и имеет сложный характер. В системе установлено
существование семи промежуточных фаз, из которых SmPd3, Sm4Pd5 и
SmPd плавятся конгруэнтно при температурах -1620, 1260 и 1270 "С
соответственно. Соединения SmPd5, SmPd2, Sm3Pd2 и Sm5Pd2 образуются
по перитектическим реакциям:
t'C
Pd,e/e(no rtacce)
30 W 50 60 10 80 90 100
600
Q Ю
Sm
Рис. 421. Pd-Sm
Z0 JO W 50 60 70 80 90 100
Pd,%(am) Pd
Pd-Sm
825
и
Жн
Жн
Жн
у SmPd3 •
у SmPd3 *
у SmPd -
н Sm3Pd2
¦ SmPd5
¦ SmPd,
Sm3Pd2
- Sm5Pd2
при
при
при
при
1120
1160
795°
730°
°с
° с
С;
С.
Область гомогенности соединения SmPd3 достигает - 4 % (ат.) при
1120 °С и несколько снижается с уменьшением температуры; область
гомогенности фазы SmPd составляет 1-1,5 % (ат.). При понижении
температуры до 982-960 ° С соединение SmPd претерпевает полиморфное
превращение. По данным работ [2-3] соединение Sm5Pd2 более
достоверно соответствует формуле Sm7Pd3. Кристаллическая структура
промежуточных фаз приведена в табл. 330.
В работе [1] показано, что в системе Pd-Sm существуют четыре
эвтектических равновесия:
Ж - (Pd) + SmPd5 при 1078 °t и -86,5 % (ат.) Pd;
Ж - SmPd2 + Sm4Pd5 при 1080 "С и 62 % (ат.) Pd;
Ж - Sm4Pd5 + SmPd при 1225 °С и -53,3 % (ат.) Pd;
Ж SPd (S) 692 °
(т)
- SmPd2 + Sm4Pd5 при 1080 "С и 62 % (ат.) Pd;
- Sm4Pd5 + SmPd при 1225 °С и -53,3 % (ат.) Pd;
« Sm5Pd2 + (aSm) при 692 °С и -20 % (ат.) Pd.
бо [12] бола ратооь Sm
В работах [1-2] отмечается большая растворимость Sm в (Pd): область
твердого раствора на основе (Pd) при температуре эвтектики 1078 °С
достигает 10,3 [1] или 11,3 % (ат.) Sm [2].
Растворимость Pd в (aSm) и (PSm) >1 % (ат.). При добавлении Sm к
Pd повышается температура полиморфного превращения aSm в pSm. Это
превращение протекает по перитектической реакции при -955 °С [1].
В работах [4,9] изучены магнитная восприимчивость и намагничен-
намагниченность соединений Sm3Pd4, Sm3Pd2, Sm5Pd2.
Таблица 330. Кристаллическая структура соединений системы Pd-Sm
Соединение
SmPd5
SmPd3
SmPd2'
(Sm,0Pd2l)
Прототип
SmPt5
A11C113
Символ
Пирсона,
пр.гр.
сР4,
Pnilm
mC 124,
С2/с
Параметры решетки, нм
а
0,5253
0,4110
0,410
2,4853
Ь
0,9015
0,5765
с
0,2568
1,6508
Источник
[6]
[1]
[7]
[81
826
Pd-Sm, Pd-Sn
Соединение
Sm4Pd5
(Sm3Pd4)
SmPd(HT)
Sm3Pd2
Sm7Pd3
* P = 90,88
Прототип
Pu3Pd4
CrB
U3Si2
Th7Fe3
Символ
Пирсона,
пр.гр.
АЛИ,
R3
оС8,
Стст
1Р\0,
PAImbm
hP20,
Р6ътс
Параметры решетки, нм
а
1,340
0,377
_
1,0014
Ь
_
1,065
_
_
с
0,574
0,456
_
0,6301
Источник
[9]
[1]
[1]
[4]
Литература
1 Loebich О., Raub Е. III. Less-Common Met. 1973. V. 30. N 1. P. 47-62
2. Савицкий Е.М., Полякова В.П., Рошан Н.Р. // Редкоземельные металлы, сплавы и
соединения: Сб. статей. М.: Наука. 1973 С. 71-81.
3. OlceseG.L.,//J. Less-Common Met. 1973. V. 33. N 1 P. 71-81.
4. Morcau J.-M., PartheE.//J. Less-Common Met. 1973. V. 32. N 1. P. 91-96.
5 Parthe E., Moreau J.-M.//J Less-Common Met. 1977. V. 53. N IP. 1-24.
6 Zhang K., Chen L. // Acta Met. Sinica. 1968. V. 24 NIP. B65-B67.
7. SteebS., Gebhardt E., Reule H.//Monatsh. Chem 1972. Bd. 103. N 3. S. 716-735.
8. Fornasini M.L., Mugnoli A., Palenzona A. // Acta Crystallogr. B. 1979. V. 35. N 9
P 1950-1953.
9 Palenzona A., landelli A. Hi. Less-Common Met. 1974. V. 34. N 1. P. 121-125.
10 Yakinthos J.K., Gamari-seale H., La Forest J. // Physica Status Solidi(a). 1977. V. 40. N 2.
P. K105-K108.
В.П. Полякова
Pd-Sn. ПАЛЛАДИЙ-ОЛОВО
Диаграмма состояния Pd-Sn (рис. 422) приведена по данным
аналитического обзора [Э]. Она построена на основании результатов
термического, микроструктурного и рентгеноструктурного анализов.
В системе установлено образование восьми промежуточных фаз, из
которых соединения Pd3Sn и pPd3Sn2 образуются из расплава конгруэн-
конгруэнтно при температурах 1326 и 1287 "С соответственно. Соединения
aPdjSn,, PdSn, PdSn2, PdSn3, PdSn4 образуются по перитектическим
реакциям:
Pd-Sn
827
Snr°/o (помассв)
О 10 W 30 W SO 60 70 BO
90 WO
\0fV3Srii+M(
/
MS'
600*^
Чш
К tf lilt
8lOa
—
36 3d 40 «2
Sn,%(am.)
231,9661"
О № 20 JO 40 SO 60
Pd SnfMam.)
Ряс. 422. Pd-Sn
70 вО 90 tOO
Sn
Ж 32
Ж + aPd3Sn2
aPd3Sn
3
Ж + PdSn
Ж + PdSn2
Ж + PdSn,
3
2 PdSn
PdSn2
PdSn3
PdSn.
3Sn2
при 900 °C;
при 810 °C;
при 600 °C;
при 345 °C;
при 295 °C.
Фаза Pd2Sn образуется в твердом состоянии по перитектоидной
реакции Pd3Sn + pPd3Sn2» Pd2Sn при температуре 820 °С. Кристалличес-
Кристаллическая структура промежуточных фаз приведена в табл. 331.
В системе наблюдаются три эвтектических равновесия:
Ж « (Pd) + Pd3Sn при 1280 "С и 21,1 % (ат.) Sn;
Ж * Pd3Sn + pPd3Sn2 при 1215 °С и 30,2 % (ат.) Sn;
Ж - PdSn4 + (Sn) при 230 °С и 0,22 % (ат.) Pd.
Максимальная растворимость Sn в (Pd) составляет -17 % (ат.) или
19 % (по массе) при температуре эвтектики 1280 "С J3].
828
Pd-Sn
В работе [1] методами дифференциального термического, микрострук-
микроструктурного (с применением поляризованного света) и рентгеновского
анализов уточнена часть диаграммы состояния Pd-Sn в интервале
концентраций 36-43 % (ат.) Sn, т.е. в области предполагаемого
соединения Pd2oSn]3 (вставка на рис. 280). В качестве исходных
компонентов были использованы Pd и Sn чистотой 99,9 % (по массе).
Установлен более сложный характер фазовых равновесий в этой части
системы. Соединение Pd2oSnj3 упорядочивается при температуре
600±50 °С и концентрации 39,8 % (ат.) Sn.
Таблица 33 1. Кристаллическая структура соединений системы Pd-Sn
Соединение
PdjSn
Pd2Sn
Pd20Snl3
PdSn
PdSnj"
PdSn2
PdSn2'"
PdSn4
Прототип
Си
Ni2Si
(Co2Si)
Ni|2Ga3Ge6
MnP
PdSn2
CuAl2
PdSn4
Символ
Пирсона,
пр.гр.
cF4,
Fmim
oP\l,
Pnma
hP66,
oPb,
Pnma
<,C24,
Aba!
tin,
Hlmcm
«C20,
Aba!
Параметры решетки, нм
a
0,397
0,812
0,87985
0,647
0,387
0,393
0,6491
0,6546
0,6490
0,640
Сверхструктура pPd3Sn2.
Моноклинно искаженная структура типа МпР,
состояния.
После медленного охлаждения.
Ь
0,565
0,650
0,613
0,618
0,6491
0,643
с
0,431
1,69837
1,720
0,632
0,638
1,2179
2,457
2,4378
1,144
Источник
[Э]
Р,Х]
[Э]
[1]
Р]
[X]
[Х,Э]
[X]
[X]
Р]
[X]
J = 88,5° после закалки из жидкого
Pd-iSn, PdSr, Pd-Ta
829
Литература
1. Saran N., Alasafi K., Schubert K. IIZ. Metallkunde. 1981. Bd. 72. N 7. S. 517-520.
В.П. Полякова
Pd-Sr. ПАЛЛАДИЙ-СТРОНЦИЙ
Диаграмма состояния Pd-Sr не построена. Рентгеновские и металлог-
металлографические исследования, проведенные в работах [1-3], позволили
установить существование в системе трех соединений SrPd5, SrPd2 и SrPd,
из которых SrPd5, вероятно, плавится конгруэнтно. Предполагается, что
между (Pd) и SrPd5, так же как между SrPd5 и SrPd2, образуются
эвтектики [1]. Кристаллическая структура промежуточных фаз в системе
Pd-Sr приведена в табл. 332.
Таблица 33 2. Кристаллическая структура соединений системы Pd-Sr
Соединение
SrPd5
SrPd2
SrPd
Прототип
CaCu5
MgCu2
CrB
Символ
Пирсона,
np.rp.
hP6,
РЫттт
cF24,
Fdlm
ось,
Cmcm
Параметры решетки, нм
а
0,5411
0,7800
0,7826
-
с
0,4416
-
-
Источник
[1]
[U
т
[3]
Литература
1 Heumann Т., Kniepmeyr М. IIZ. Anorg. All. Chem. 1957. Bd. 290. S. 191-204.
2. Wood E.A., Compton V.B. // Acta Crystallogr. 1958. V. IIP. 429-433.
3. Bruzzone G., Merlo F. // 3. Less-Common Met. 1982. V. 85. N 2. P. 285-306.
В.П. Полякова
Pd-Ta. ПАЛЛАДИЙ-ТАНТАЛ
Диаграмма состояния Pd-Ta требует детального дополнительного
исследования. Существует два варианта диаграммы состояния Pd-Ta
(рис. 423, а [1], 6 [3]), построенных на основании данных термического
анализа (измерения температуры солидуса с помощью оптического
830
Pd-Ta
Та, "Л (по массе)
О 10 20 30 10 50 60 70 80 90 100
2800
2400
2000
1600
1555'
1200
800
I.
$
'*~'^L
-mot is'
4--к /
I
-1670'
1670" I V'
—| \.*JL
302v
(та)
О 10 20 J0 40 50 60 70 80 90 100
Pd Га, % (am) Та
а)
Га,°/о (по массе)
О 10 20 J0 10 50 60 70 80 90 100
1200
800
О 10 20 JO "Ю SO 60 70 80 90 100
Рй Та, Vofam.) Та
Рис. 423. Pd-Ta
Pd-Ta !Ш
пирометра), микро- и рентгеноструктурного анализов, измерения свойств
сплавов. Они отличаются друг от друга характером образования
промежуточных фаз.
В системе установлено существование широких областей твердых
растворов на основе (Pd) и (Та) и четырех промежуточных фаз: Pd3Ta,
Pd2Ta, PdTa и фаза о [1-3].
Максимальная растворимость (Pd) в (Та) при температуре перитекти-
перитектики составляет -20 % (ат.) [3] и 24,6 % (ат.) [1]. В обеих работах отмечается
температурная зависимость растворимости Pd в (Та); при 1000 °С она
составляет -8-10 % (ат.).
Твердый раствор на основе Pd образуется по перитектической реакции
(Pd) = Ж + Pd3Ta при температуре 1860 °С [1] или 1730 °С [3]. Мак-
Максимальная растворимость Та в Pd при температуре перитектики
составляет 22 [3] или 18 % (ат.) [1].
По данным обеих работ [1, 3] фаза о образуется по перитектической
реакции Ж + (Та) - а при температуре 2350 °С [1] или 2550 "С [3]. По
данным работы [1] фаза о существует в ограниченном интервале
температур и при 1575 °С распадается по эвтектоидной реакции о »
= (Та) + PdTa. По данным работы [3] фаза о существует во всем интервале
температур от температуры плавления до 1000 "С и имеет заметную
область гомогенности.
Большие противоречия имеют место при определении характера
образования и областей существования трех других промежуточных фаз.
По данным работы [1] соединение PdTa плавится конгруэнтно при
-2000 °С, соединение Pd3Ta образуется по перитектической реакции при
1920 "С, а соединение Pd2Ta - по перитектоидной реакции при
температуре >1670 °С. Согласно данным работы [3] соединение PdTa
образуется по перитектической реакции при 1720 °С, а два других Pd3Ta
и Pd2Ta плавятся конгруэнтно при температуре 1770 и 1800 °С соотве-
соответственно.
В работе [3] предположили, что соединение PdTa существует в двух
модификациях. Высокотемпературная модификация pPdTa при
температуре 1550 °С эвтектоидно распадается на о + Pd2Ta, низкотемпе-
низкотемпературная модификация aPdTa образуется в твердом состоянии по
перитектоидной реакции при температуре 1410 °С. Кристаллическая
структура промежуточных фаз в системе Pd-Ta приведена в табл. 333.
Между фазой а и соединением PdTa наблюдается эвтектическая
реакция Ж » о + PdTa при температуре 1720 °С и концентрации -56,6 %
(ат.) Та [1] или при 1700 °С и 52 % (ат.) Та [3].
В работах [4,7] показано, что при исследовании диффузионных слоев
методом микрорентгеноспектрального анализа в системе Pd-Ta в
интервале температур 700-1030 "С кроме известных ранее фаз обнаруже-
обнаружены соединения PdiSTa4, Pd6Ta, Pd12Ta, Pd17Ta, что, вероятно, связано
832
Pd-Ta
с неравновесным состоянием системы. Физико-механические свойства
сплавов приведены в работах [2, 3].
Таблица 33 3. Кристаллическая структура соединения системы Pd-Ta
Соединение
Pd3Ta
Pd2Ta
Pd,Ta
aPdTa
pPdTa*
0
(PdTa3)
Прототип
TiAl3
MoPt2
NbPt2
yTiCu
—
pu
Символ
Пирсона,
пр.гр.
//8,
lAlmmm
«Л 6,
Immm
*
о
f/>4,
PMnmm
Fmlni
lP30,
Pb-jnnm
Получено после быстрой закалки,
Параметры решетки, нм
a
0,3880
0,388
0,290
0,2896
0,3279
0,4006
0,966
0,9978
Ь
-
0,844
0,8397
-
—
-
кубическая сингония.
с
0,7978
0,796
0,377
0,3790
0,6036
-
0,503
0.5208
Источник
[2]
[1]
[5]
[6]
[2]
[1]
[2]
Литература
!. Савицкий Е.М., Полякова В.П., Тылкина М.А.//Журнал неорганической химии
1964. Т. 9. N7. С. 1645-1649.
2. Darby J.B., Downey I.W., Norton L.J. //Trans. AIME. 1963. V. 227. P. 1028-1029
3. Waterstrat R.M., Gissen R.C., Kosh R., Manuzewski R.C. Metal. Trans A. 1978. V. 9 N 5
P. 343-348.
4. Савицкий Е.М., Полякова В.П., Тылкина М.А. Сплавы палладия. М.. Наука. 1967
214с.
5. Maldonado A., Schubert К. //Z. Metallkunde. 1964. В. 55. N 10. S. 619-626.
6. Gissen R.C, Grant N.J.//Acta Crystallogr. 1964. V. 17. P. 615-616.
7. Brunsch A., Steeb S. // Z. Naturforsh. 1971. N 2 S. 274-279
В.П. Полякова
Pd-Tb. ПАЛЛАДИЙ-ТЕРБИЙ
Диаграмма состояния Pd-Tb приведена на рис. 424 по данным
аналитического обзора [1], в котором были использованы результаты
работ [2, 3]. В работах [4-9] приведены данные по исследованию
структуры и термодинамических параметров отдельных соединений в
системе Pd-Tb.
Диаграмма состояния Pd-Tb характеризуется широкой областью
твердых растворов на основе Pd и образованием семи промежуточных
Pd-Tb
833
Pd, °/o (no массе)
10 ZO 30 40 SO 60 70 ВО 90100
то
1356°
too
О 10 20 30 fO 50 60 70 ВО 90 100
Tb Pd°/o(am.) Pd
Рис. 424. Pd-Tb
фаз, Соединения Tb5Pd2,TbPd,Tb3Pd4,TbPd3 образуются непосредствен-
непосредственно из расплава конгруэнтно при температурах 860, 1420, 1370, 1670 °С
соответственно. Фазы Tb3Pd7, Tb7Pd3,Tb10Pd7| образуются из расплава
по перитектическим реакциям при температурах 915, 1200, 1280 °С
соответственно. В твердом состоянии по перитектоидной реакции
образуется, вероятно, соединение TbPd7, аналогичное соединениям этой
стехиометрии в системах Pd с другими РЗМ. Соединения TbPd и Tb7Pd3
существуют в двух модификациях. Полиморфный переходе соединении
TbPd протекает в интервале температур 880-850 "С. Температура
полиморфного перехода соединения Tb2Pd3 равна 1120 °С, область
гомогенности этого соединения требует уточнения.
В системе Pd-Tb наблюдаются пять эвтектических взаимодействий:
Ж - (оТЪ) + Tb5Pd2 при 820 "С и 24 % (ат.) Pd;
Ж » Tb5Pd2 + Tb3Pd2 при 850 °С и 31 % (ат.) Pd;
* BTbPd"+ Tb,Pd. при -1350 "С и 55 % (ат.) F
1 ЮГ ОГ1 ._ /Г Л П/ / \ Т\ ¦
ж
Ж
% (ат.) Pd;
pTbPd+ Tb3Pd4 при -1350 °С и 55 % (ат.) Pd;
Tb2Pd3 + Tb10Pd21 при 1185 °С и 64 % (ат.) Pd;
Ж » TbPd3 + (Pd) при 1170 °С и 85,5 % (ат.) Pd.
834
Pd-Tb
Кристаллическая структура промежуточных фаз системы Tb-Pd
приведена в табл. 334.
Таблица 334. Кристаллическая структура соединений системы Pd-Tb
Соединение
Tb5Pd2
Tb5Pd2
pTbPd
aTbPd
Tb3Pd4
TbPd3
Прототип
Ho5Pd2
Dy5Pd2
FeB
CrB
Pu3Pd4
AuCu3
Символ
Пирсона,
пр.гр.
с Л 44,
Fdim
//49,
/4,/а
oPZ,
Рпта.
oCS,
Стоп
ЛЯ 14,
ЛЗ
сЯ4,
РтЗт
Параметры решетки, нм
а
1,3607
0,960
0,7192
0,3722
1,3178
0,4074
0,4069
0,407
Ь
-
-
0,4344
1,0523
-
-
с
-
1,358
0,5599
0,4554
0,5708
-
Источник
[5]
[6, V-C]
Ц\
[V-C]
[8]
[7]
[8]
№
Литература
1. Okamoto H.111. Phase Equilibria. 1991. V. 12. N 2. P. 252-253.
2. BorzoneG., Cacciamani G.//Calphad. 1990. V. 14. N 2. P. 139-149.
3. Loebich O., Ranb E. // J. Less-Common Met. 1973. V. 30. N 1. P. 47-62.
4. Зайцев А.И., Пронин А.В., Призельков Ю.А., Несмеянов А.Н. // Теплофизика высоких
температур. 1986. V. 24. N 2. С. 271-275.
5. Fornasini M.L., Palenzona A. // J Less-Common Met. 1974. V 38 N1 P. 77-82.
6. Steeb S., Gebhardt E., Reule H. // Monatsh. Chem 1972 Bd 103. N 3. S. 716-735
7. Гладышевский Е.И., Бодак О.И. Кристаллохимия интерметаллических соединений
редкоземельных металлов. Львов: Вища школа. 1982. 255 с.
8. Благородные металлы: Справочник/ Подред. Савицкого Е.М. М.: Металлургия, 1984.
592 с
9 Harris J.R., Raynor G.V.// J. Less-Common Metals. 1965. V. 9. P. 263-265.
В.П Полякова
Pd-Tc, Pd-Te 835
Pd-Tc. ПАЛЛАДИЙ-ТЕХНЕЦИЙ
Диаграмма состояния Pd-Tc не построена. По данным справочника
[Ш] сплавы данной системы в интервале концентраций 25-86 % (ат.) Тс
изучены методом рентгенофазового анализа. Установлено, что в системе
существуют только ограниченные твердые растворы на основе исходных
компонентов, взаимная растворимость которых приведена ниже [Ш]:
Температура, °С 1500 1050
Растворимость, % (ат.):
PdB(Tc) -28 >25
TcB(Pd) -50 47
М. В. Раевская
Pd-Te. ПАЛЛАДИЙ-ТЕЛЛУР
Диаграмма состояния Pd-Te (рис. 425) построена на основании
результатов дифференциального термического, микрорентгеноспектраль-
ного и рентгеноструктурного анализов, а также оптической пирометрии
[1,2].
Диаграмма Pd-Te характеризуется сложным строением. В системе
установлено образование девяти промежуточных фаз и широкой области
твердых растворов на основе Pd. Наблюдается ретроградный солидус
у твердых растворов (Pd): максимальная растворимость Те в (Pd)
обнаружена при температуре -1050 "С и составляет 12,5 % (ат.). В
интервале температур 459-780 °С растворимость Те в (Pd) не превышает
11 % (ат.) [1]. Те увеличивает параметры решетки Pd с 0,38903 до 0,396 нм
при содержании в сплаве 12 % (ат.) Те [1].
Промежуточные фазы б" B5,8-29,4 % (ат.) Те), PdTe E0-56 % (ат.) Те),
PdTe2 F5-66,5 % (ат.) Те) образуются из расплава конгруэнтно при
температурах 905±5, 746 и 752 "С соответственно [1-2].
Соединения у' B4,2 % (ат.) Те), Pd,,Te4 (б') B9,5-31 % (ат.) Те), Pd3Te2
(е) 40 % (ат.) Те) образуются по перитектическим реакциям:
Ж + б" « у' при 785 "С;
Ж + б" - Pd9Te4 (б') при 610 "С;
Ж + PdTe - Pd3Te2 (е) при 507 "С.
Фазы Pd4Te (P) A8,2 % (ат.) Те), Pd20Te7 (у) B5,2-26,5 % (ат.) Те),
Pd25Te (б) B7,5-30,0 % (ат.) Те) образуются по перитектоидным
реакциям:
836
Pd-Te
поо
1300
поо
то
то
900
воо
700
600
500
400
о to
\
\\
\
20
1
\\
-
(Pd)
J
0
/
1
Те,'/а (по массе)
W 50 60
1_
[' 1 «1. !
lxbflrJ
Г
г
IE
7Т
1
1
(Иг1
щ
mV
i
»
s
I
7*6°
п
1
/К
/1/ Гтм"
507* 1 /
III
1
j
7Я
80
т
i
\
100
\
\
(Те)—*¦
0 10 10 30 fO 50 60 10 80 90 Ю0
Pd Te,y»(am.) Те
Рис. 425. Pd-Te
(Pd) + Y' - Pd4Te (p) при 770 °C;
Y' + 6" - Pd20Te7 (Y) при 754 °C;
Pd20Te7 (Y) + Pd9Te4 (p) = Pd2 5Te (б) при 500 "С [1].
Кристаллическая структура промежуточных фаз приведена в
табл 335.
Pd-Te
837
Таблица 335 Кристаллическая структура соединений системы Pd-Te
Соедине-
Соединение
Pd4Te
Pd3Te2
PdTe
PdTe2
Прототип
-
-
PdMSb7
Rh3Te2
NiAs
Cdl2
Символ
Пирсона,
пргр
cF.
Fm3m
mP,
P2,/c
АЛ27,
КЗ
Amam
hP4,
РЬъ1ттс
hP3
/>3ml
*J} = 91,97°.
Ромбоэдрическая сингония
Параметры решетки, нм
a
1,269
1,2674
0,7458
1,1797
0,7900
0,905
0,4135
0,41521
0,4036
0,40365
Ь
-
1,3938
-
1,2687
1,354
-
-
с
-
0,8839
1,1172
0,3858
0,755
0,5674
0,56719
0,5128
0,51262
Источник
[31
PI
HI
[5]
[61
[31
[X]
[Э]
[X]
[Э]
В системе Pd-Te установлены четыре эвтектических и три эвтектоид-
ных реакции [1-2]:
Ж - Pd9Te4 + Pd3Te2 (e)
d PdT
Ж - (Pd) + у'
Pd9Te4 +
Ж - PdTe + PdTe^
б" - Pd20Te7 (у) + Pd9Te4 (б')
Pd9Te4V) - Pd2 5Те (б) +
при 780 ° С и 22,5 % (ат.) Те;
при 503 °С и 37 % (ат.) Те;
при 730 "С и 59,5 % (ат.) Те;
при 446 "С,
при 563 "С;
при 727 "С;
(е) при 474 °С.
Литература
1 Chattopadhyay G., Bhatt Y.J., Khera S.K. // J Less-Common Met V 123 Complete
P 251-266
2 IpscrH., Schuster W.//J Less-Common Met 1986 V 125 Complete P 183-185
3 Харькин B.C., Имамов P.M., Семилетов С.А. // Изв АН СССР Неорганические
материалы 1968 T IV N 10 С 1801-1802
838
Pd-Te, Pd-Th
4. MatkoviC P., Schubert K. Hi. Less-Common Met. 1978. V. 58. N 2. P39-P46.
5. Wopersuow W., Schubert K. // J. Less-Common Met. 1977. V. 51. N I. P. 35-44.
6. Matkovic P., Schubert K. // J. Less-Common Met. 1977. V. 52. N 2. P. 217-220.
В.П. Полякова
Pd-Th. ПАЛЛАДИЙ-ТОРИЙ
Диаграмма состояния Pd-Th (рис. 426) построена на основании
данных дифференциального термического, микроструктурного и
рентгеновского анализов, измерения свойств по совокупности работ
[1-4]. В качестве исходных материалов использованы электролитический
го 40
тн,У.(по массе)
60 вО 90
too
Рис.
426.
Pd-Th
О
to
20
30
ЬО
Th,
SO
V,
SO 70
(am.)
во
SO
WO
Th
Pd-Th
839
Th и Pd чистотой 99,96 % (по массе) [1], Pd чистотой 99,8 % (по массе),
и Th чистотой 99,6 % (по массе) [2-4].
Диаграмма состояния Pd-Th имеет сложный характер. В системе
установлено семь промежуточных фаз, из которых ThPd3, ThPd, Th2Pd
образуются непосредственно из расплава конгруэнтно при температурах
>1500, 1412 и 1162±12 °С соответственно [1]. Соединения Th3Pd13 F),
ThPd4 (s) [3], Th3Pd5 и Th3Pd4 [1] образуются по перитектическим
реакциям при температурах 1215, 1340,1387 и 1325±12 °С соответствен-
соответственно. Область гомогенности фазы б 17,9-18,7 % (ат.) Th, ThPd4 -22,5-25 %
(ат.) [4]. Кристаллическая структура промежуточных фаз приведена в
табл. 336.
Таблица 336 Кристаллическая структура соединений системы Pd-Th
Соедине-
Соединение
Th3Pdl3F)*
ThPd4(e)
ThPd3
Th3Pd5
Th3Pd4
ThPd
Th2Pd
Прототип
-
AuCu3
TiNi3
-
Pu3Pd4
FeB
Al2Cu
Символ
Пирсона,
пр.гр.
-
Pmlm
ИР\6,
hP&,
Pb^mmc
-
oPS,
Pnma
tl\2,
Wmcm
* Тетрагональная сннгония.
Параметры решетки, им
a
0,4094-
-0,4130
0,4102-
-0,4113
0,5858-
0,7149
-
0,7249
0,733
0,7308
b
-
-
-
-
-
0,4571
-
с
0,4031-
-0,4034
-
0,9814-
0,3899
-
0,5856
0,593
0,5960
Источник
[3-4]
[3-4]
[I]
[I]
[M]
[5]
И
[1]
В системе наблюдаются три эвтектические реакции [1]:
Ж - Th3Pd5 + Th3Pd4 при 1212 °С и 38 % (ат.) Th;
Ж - ThPd + Th2Pd при 1137± 12 °С и -64 % (ат.) Th;
Ж - Th,Pd + (Th) при 1112± 12 °С и -77 % (ат.) Th.
840 Pd-Th, Pd-Ti
Твердый раствор на основе Pd образуется непосредственно из
расплава и по перитектической реакции при температуре 1145 °С.
Перитектическая точка твердого раствора, полученная экстраполяцией,
соответствует 15,3 % (ат.) Th. Кривая плавкости твердого раствора на
основе Pd проходит через минимум при температуре 1125± 12 °С и -12 %
(ат.) Th [3]. Растворимость Th в (Pd) при температуре 950 °С составляет
-14,5 %, при 650 "С -14,2 % (ат.) [3].
Растворимость Pd в (Th) менее 1 % (ат.) [1].
Литература
1. Thomson J.R., // J. Less-Common Met. 1964. V. 6. N 1. P. 94-99.
2. Терехов Г.И., Тагирова Р.Х., Иванов О.С. // Сплавы для атомной энергетики: Сб.
статей. М.: Наука, 1979. С. 109-129.
3. Терехов Г.И., Александрова Л.Н., Тагирова Р.Х. // Изв. АН СССР. Металлы. 1984.
N6. С. 189-193.
4. Терехов Г.И., Александрова Л .Н. // Стабильные н метастабнлъные фазовые равновесия
в металлических системах: Сб. статей. М.. Наука, 1985. С. 146-150.
5 Thomson J.R. // Acta Crystallogr. 1964. V. 17 N 1 P. 64-65.
В.П. Полякова, Г. И. Терехов
Pd-Ti. ПАЛЛАДИЙ-ТИТАН
Диаграмма состояния Pd-Ti (рис. 427) построена на основании
результатов дифференциального термического анализа, измерения
температуры солидуса сплавов с помощью оптического пирометра по
методу Пирани-Альтертурна, металлографического и рентгеновского
анализов [1-3]. В качестве исходных материалов для изготовления
сплавов использовали иодидный Ti и Pd чистотой 99,9 % (по массе) [1-2].
По данным исследований [1, 2] в системе Pd-Ti существует шесть
промежуточных фаз: TiPd3, TiPd2, Ti2Pd3, TiPd, Ti2Pd и Ti4Pd. Анализ
литературных данных по исследованию системы Pd-Ti, проведенный в
работе [3], указывает на возможное существование в данной системе еще
двух соединений: Ti3Pd5 [62,5 % (ат.) Pd] и у [75-84 % (ат.) Pd]. Соединения
TiPd3 и TiPd образуются из расплава конгруэнтно при температурах 1530
и 1400 соответственно. Фазы Ti2Pd3 и TiPd2 кристаллизуются по
перитектическим реакциям при температурах 1330 и 1400 "С. Соединение
Ti2Pd образуется в твердом состоянии конгруэнтно при температуре
960 °С, а соединение Ti4Pd по перитектоидной реакции (ocTi) + Ti2Pd =
= Ti4Pd при -585 °С. Характер и температуры образования, область
Pd-Ti
841
Рй, *Л (по массе)
о ю го so *o so бо 70 во
90
too
Ш
О 10 20 30 ЬО 50 60 ТО 80 SO ЮО
Ti Pd, % (am.) Pd
Рис. 427. Pd-Ti
существования соединений у и Ti3Pd5 требуют уточнения. Фаза TiPd
существует в двух модификациях, полиморфный переход в этом
соединении протекает по мартенситному типу. В работе [3] предполагает-
предполагается существование двух модификаций соединения TiPd2.
В системе наблюдаются эвтектическое и два эвтектоидных равновесия:
В системе наблюдаются эвтектическое и два
Ж - pTiPd + Ti2Pd3 при -1280 "С [1, 2];
(PTi) - (aTi) + Ti2Pd при 600 °С [2] или 595 °С
(pTi) - Ti2Pd + pTiPd при 820 "С [1, 2].
К стор а с
[3];
Кривые плавкости твердых растворов на основе Pd и Ti проходят
через минимум. Отмечается образование широкой области твердых
растворов на основе pTi (до 45 % (ат.); растворимость Pd в (aTi) менее
1 % (ат.). Растворимость Ti в (Pd) достигает 22 % (ат.).
Кристаллическая структура промежуточных фаз системы Pd-Ti
приведена в табл. 337.
842
Pd-Ti. Pd-Tl
Таблица 337. Кристаллическая структура соединений системы Pd-Ti
Соедине-
Соединение
Y
TiPd3
TiPd2
TiPd2'
Ti3Pd5
pTiPd
aTiPd
Ti2Pd
Ti2Pd
Ti4Pd
Прото-
Прототип
AuCuj
TiNi3
MoSi2
-
Ti3Pd5
-Au2V
AuCd
MoSi2
Zr2Cu
Cr3Si
Символ
Пирсона,
пргр.
cP4,
Prnlm
ИР16,
Pb^lmmc
116,
I4/mmm
-
IPS,
PAImmm
oC12,
Cmcm
oP4,
Pmma
lib,
14/mmm
-
cPS,
РтЪп
Параметры решетки, нм
а
0,3985
0,3885
0,5489
0,54895
0,324
0,341
0,3263
0,461
0,456
0,3090
0,3095
3,095
0,5005
b
-
_
-
0,307
-
1,433
0,28!
-
-
-
с
—
0,8964
0,89739
0,848
0,856
1,143.6
0,464
0,489
1,0054
1,005
1,005
-
* Ромбическая структура, искаженная MoSi2
Источник
[3]
[3]
[3]
[3]
[3, V-C]
[3]
М
13]
12]
[3]
Литература
1. Еременко В.Н., Штепа Т.Д. // Порошковая металлургия. 1972. N 3. С. 75-81.
2 Штепа Т.Д. // Физика и химия конденсированных фаз, сверхпроводниковых
материалов и их границ раздела- Сб. статей. Киев: Наукова Думка, 1975. С. 175-191.
3. Murray J.L. // Bull. Alloy Phase Diagrams 1982. V. 3. N 3. P. 321-329.
В.П. Полякова
Pd-Tl. ПАЛЛАДИЙ-ТАЛЛИЙ
Диаграмма состояния Pd-Tl (рис. 428) построена на основании
данных дифференциального термического, микро- и рентгенострук-
турного анализов [1]. В системе установлено образование четырех
промежуточных фаз, образующихся по перитектическим реакциям:
Pd-Tl
843
Tl, % (no массе)
О 10 20 JO 40 SO 60 70 80 SO
100
1600
1200
800
400
I
J55t
Ь-1
1
H—
N
1077
1
и
к
f
1
Л7ва
И
1
4
Г1
г;
—
tTL(
\$0
С
J
j'
S35'
301?
О 10 20 JO *0 50 60 70 80 90 100
Pd Т1,а/.(ат.) п
Рис. 428. Pd-Tl
Ж + (Pd)-PdзTl при 1198 "С;
Ж + PdjTl « Pd2Tl при 1079 °С;
Ж + Pd2Tl - Pd13Tl9 при -900 "С;
"" "' ~ при 538 *С.
Соединения Pd3Tl и Pd2Tl существуют в двух модификациях.
Температура полиморфного перехода в соединении Pd3Tl составляет
1022 "С. Полиморфный переход в соединении Pd2Tl происходит в
интервале температур 630-610 °С по мере увеличения содержания Т1 в
сплаве.
Растворимость компонентов друг в друге не определена. Эвтектичес-
Эвтектическая реакция Ж - (РТ1) + PdTl2 протекает при 293, °С; эвтектическая точка
сдвинута в сторону Т1.
Кристаллическая структура промежуточных фаз системы Pd-TI
приведена в табл. 338 по данным работы [1].
844
Pd-Tl. Pd-Tm
Таблица 338. Кристаллическая структура соединений системы Pd-Tl 11]
Соединение
Pd3Tl(BT)
Pd3Tl(HT)
Pd2Tl(BT)
Pd2Tl(HT)
Pdl3Tl9
PdTl2
Прототип
TiAl3
ZrAl3
Ni2ln
Ni2Si
Pdl3Tl9
CuAl2
Символ
Пирсона,
пр.гр.
(/8,
/4/fflmn
(/16,
lAlmmm
hP6,
Pdjmmc
hP6,
РЬ3/т
ИР22,
Piml
till.
I4/mcm
Параметры решетки, нм
a
0,4146
0,4117
0,453
-
0,895
0,6707
с
0,7497
1,5274
0,566
-
0,562
0,5743
Литература
l.BhanS.,GodeckeТ., Panday P.K.,Schubert K. Hi. Less-Common Met. 1968. V. 16. N 4.
P. 415-425.
В.П. Полякови
Pd-Tm. ПАЛЛАДИЙ-ТУЛИЙ
Диаграмма состояния Pd-Tm не построена. Сообщается об образова-
образовании в системе Pd-Tm нескольких соединений, кристаллическая структура
которых приведена в табл. 339.
Таблица 339. Кристаллическая структура соединений системы Pd-Tm
Соединение
Pd2Tm5
PdTm(B)
Pd4Tm3
PdjTm
Прототип
Ho5Pd2
или
Dy5Pd2
CsCl
Pd4Pu3
Cu3Au
Символ
Пирсона,
пр.гр.
сЛ44,
Fdlm
cPl,
Pnilm
АЛ 14,
яг
cP4,
Pnilm
Параметры решетки, нм
а
1,3368
1,3297
0,3440
1,2946
0,4044
с
0,5657
Источник
[1]
[2]
[3]
[4]
[2]
Pd-Tm, Pd-U
845
Литература
1. Fornasini M.L., Palenzona A. Ill Less-Common Met. 1974. V 38. N 1. P. 77-82.
2. Гладышевский Е.И., Бодак О.И. Кристаллохимия интерметаллических соединений
редкоземельных металлов. Львов: Вища школа. 1982. 255 с.
3 PartheE., Moreau M.-J.//J. Less-Common Met. 1977. V. 53. N 1. P. 1-24.
4 Paienzona A., Iandeiii A. II J. Less-Common Met. 1974. V. 34. N 1. P. 121-124.
EM. Гладышевский, О.И. Бодак, В.К Печарскип
Pd-U. ПАЛЛАДИЙ-УРАН
Диаграмма состояния Pd-U (рис. 429) построена в работе [1] на
основании обобщения литературных данных [2-4]. Системахарактеризу-
ется образованием семи промежуточных фаз: UPd, U5Pd6, UPd3, UPd4,
UPd5, U2Pd,,, U2Pd17. Соединения UPd, U5Pd6, UPd4, UPd5 образуются
из расплава по перитектическим реакциям при температурах 1047+7,
1110+10, 1525, 1440+10 °С соответственно, и имеют узкие области
Pd, % (по массе)
20 30 40 50 60 ТО 00 90 100
800
600
о w го jo
и
Рис. 429. Pd-U
О 50 60 70 80 90 100
Pd, % (am.) Pd
846
Pd-U
гомогенности. Фаза UPd3 кристаллизуется конгруэнтно при температуре
1640 °С.
При понижении температуры из твердого раствора на основе Pd в
твердом состоянии конгруэнтно образуются соединения U2Pd| | и U2Pd17
при температурах 1015*5 и 800т 5 °С.
В системе наблюдаются два эвтектических равновесия: Ж « (Pd) +
+ UPd5 при 1300^5 °С и 83,4 % (ат.) Pd; Ж - (yU) + UPd при 988*3 °С и
37,4 % (ат.) Pd [ 1], одно эвтектоидное равновесие (Pd) « U2Pd17 + U2Pd,,
при 694 т 2 "С и 86,5 % (ат.) Pd [1].
Растворимость Pd в (yU) равна 5 % (ат.) при температуре 998 °С и
1,1 % (ат.) при 760 "С. В (ocU) и (PU) растворимость Pd не превышает
0,3 % (ат.). Максимальная растворимость U в (Pd) -16 % (ат.) [1]. По
данным работы [2] при температуре 1500 °С в (Pd) растворяется 21,8 %
(ат.) U; при температуре 1385 °С - 18,3 % (ат.) U.
По данным работы [2] соединению U2Pdl7 приписывается формула
UPd8; кристаллическая структура - тетрагонально-искаженная ГЦК с
параметрами решетки а - 0,3882, с = 0,4083 нм [2]. Кристаллическая
структура идентифицированных промежуточных фаз приведена в
табл. 340.
Таблица 340. Кристаллическая структура соединений системы Pd-U ]1]
Соединение
UPd4
UPd3
Прототип
AuCu3
TiNi3
Символ
Пирсона,
пр.гр.
с/>4,
РтЪт
Л/Ч6,
РЬъ1ттс
Параметры решетки, нм
а
0,4068-
-0,4061
0,5769
с
0,9640
Литература
!. Pamell D.G., Brett N.H., Haines H.R., Potter P.E. // J. Less-Common Met. 1986. V. 118.
N 1. P. 141-152.
2. Терехов Г.И., Сииякова СИ., Ведерияков М.В., Иванов О.С. //Физико-химня сплавов
и тугоплавких соединений с торием и ураном. Сб. статей. М.: Наука, 1968. С. 103—104.
3. Catterall J.A., Grogan J.D., Pleasance R.J. // J. Inst. Met. 1956. V. 85. P. 63-67.
4. PellsG.P.//J. Inst. Met. 1963-1964. V. 92. P. 416-418.
В.П. Полякова, Г.И Терехов
Pd-V. ПАЛЛАДИЙ-ВАНАДИЙ
Диаграмма состояния Pd-V (рис. 430) построена на основании данных
термического, микроскопического, рентгеноструктурного и дилатометри-
дилатометрического анализов [1]. Система Pd-V представляет собой систему
эвтектического типа; эвтектика кристаллизуется при температуре
-1340 °С и концентрации 60 % (ат.) V.
Pd-V
847
v, % (по массе)
20 JO 40 SO ВО 70 BO SO /00
400
0 10 20 30 40 SO 60 70 во 90 100
pd v, V. (a/nj v
Рис. 430. Pd-V
Максимальная растворимость Pd в (V) при температуре эвтектики
составляет 37,5 % (ат.), при 500 "С - 15 % (ат.). Растворимость V в
твердом Pd при температуре 1340 °С равна 58 % (ат.), при 500 °С - 50 %
(ат.) [1]. По данным работы [2] при температуре 700 °С в (Pd) растворяет-
растворяется 49,1т 1,3 % (ат.) V. При понижении температуры в твердом состоянии
происходит несколько превращений, в результате которых образуются
промежуточные фазы Pd3V, Pd2V, PdV3. Соединения Pd3V и Pd2V
образуются в результате упорядочения твердого раствора на основе Pd
конгруэнтно при температурах 815 и 905 °С соответственно; при
температуре 720 °С и 28 % (ат.) V между соединениями наблюдается
эвтектоидная реакция [1]. Фаза PdV3 образуется в результате перитекто-
идной реакции (Pd) + (V) » PdV3 при температуре 840 °С [1]. Область
гомогенности при температурах <800 °С простирается от 23,8*0,8 до
29,0*0,3 %(aT.)Pd [2].
В работе [3] на основе рентгеноструктурных исследований показано
существование двух модификаций соединения Pd2V и нового соединения
PdV. Эти данные на рис. 430 не приведены. Кристаллическая структура
промежуточных фаз системы Pd-V приведена в табл. 341.
848
Pd-V. Pd-W
Таблица 341 Кристаллическая структура соединений системы Pd-V
Соедине-
Соединение
Pd3V
Pd2V*
Pd2V(HT)
PdV"
PdV3
Прото-
Прототип
TiAl3
-
MoPt2
PdV
Cr3Si
Символ
Пирсона,
пр.гр.
г/8,
lAlmmm
-
old,
lmmm
-
сР4,
Pmln
Тетрагональная сингония
* Кубическая сингония
Параметры решетки, нм
а
0,3847
0,3847
0,3889
0,274
0,383
0,4815
Ь
_
-
0,823
-
-
с
0,7749
0,7753
0,3736
0,373
- ,
-
Источник
Ш
[3]
[1]
[4]
[4]
[1]
Литература
1. KOster W., Haehl W.D. IIZ. Metallkunde. 1958. Bd. 49. N 12. S. 647-649.
2. WaterstratR.M.// J Less-Common Met. 1981. V. 80. N 1. P. 31-36.
3. Dwight A.E., Downey I.W., Conner R.A. // Acta Crystallogr. 1961. V. 14. N 1. P. 75-76.
4. Maldonado A., Schubert K. // Z. Metallkunde. 1964. Bd. 55. N 10. S. 619-626.
В.П. Полякова
Pd-W. ПАЛЛАДИЙ-ВОЛЬФРАМ
По данным большинства исследователей [X, Э, Ш, 1-4] диаграмма
состояния Pd-W относится к перитектическому типу без промежуточных
фаз (рис. 431). Температура перитектического превращения 1815т 15 °С
[2] или 1850т 25 °С [4]. Растворимость W в (Pd) при температуре
перитектики равна 22 % (ат.) [2] или -20 % (ат.) [3], при 1100°С - 21,5 [2]
или 16 % (ат.) [3]. Растворимость Pd в (W) при 1815 °С не превышает 5
[2] или 3,6 % (ат.) [3], при 1500 °С -2,7 % (ат.) [3]. В работе [5] после отжига
при температуре 700 °С в течение 1000 ч показано, что растворимость
W в (Pd) больше 15, но меньше 20% (ат.). В сплавах, содержащих 20-
70 % (ат.) W, кроме смеси твердых растворов (Pd) и (W) обнаружена
Pd-W, Pd-Y
849
с
t,L
гооо
/800
1600
1200
woo
1 10
i
ж
'isjp
С
га jo 40
j
*sL
f
d)
i
гг
X ~
1
w
1
50
i
% (no массе)
60 ,70 80
T
1815
1
'ft'
90
10
1
\
4
\
fwt—
98,5
о to
Pd
Рис. 431. Pd-W
20 JO 40 50 60 70 80 90 WO
W, V. (am.) W
неидентифицированная фаза. По аналогии со сплавами Pt-Mo и Pd—Мо
сделано предположение, что эта низкотемпературная фаза имеет
гексагональную или ромбическую структуру [5].
Литература
1. Raub E., Waller P. // J. Inst. Metals. Metal Abstr. 1952. V. 19. N 5. P. 368.
2. Goetz W.K., Brophy J.H. // J. Less-Common Met. 1964. V. 6. N 5. P. 345-353.
3. ТылкинаМ.А., ПоляковаВ.П., СавицкийЕ.М. //Журнал неорганической химии. 1961.
Т. 6. N6. С. 1471-1474.
4. Савицкий Е.М., Полякова В.П., Горииа Н.Б., Рошаи Н.Р. Металловедение платино-
платиновых металлов. М. Металлургия. 1975. 424 с.
5 Khan H., Raub Ch.J. //J. Less-Common Met. 1971. V 25. N 4. P. 441-442
КБ. Поварова, В.П. Полякова
Pd-Y. ПАЛЛАДИЙ-ИТТРИЙ
Диаграмма состояния Pd-Y (рис. 432) построена на основании данных
дифференциального термического, микро- и рентгеноструктурного
анализов [1]. В качестве исходных материалов использован Pd чистотой
99,9 % (по массе) и Y, содержащий 0,1 % (по массе) других РЗМ в сумме,
850
Pd-Y
Pel, "/• (ло массе)
10 20 JO *O SO SO 70 вО SO 100
7555*
600
О to TO 30 40 SO SO 70 80 90 100
у Pit, % (am.) Pd
Рис. 432. Pd-Y
Ж + YPd,
Ж + Y4Pd
Ж + YPd
до 1 % (по массе) Та, -0,02 % (по массе) других металлов. Система Pd-Y
характеризуется сложным строением с большим числом промежуточных
фаз.
В системе образуется семь соединений, из которых YPd3, Y4Pd5, YPd,
Y,Pd2 кристаллизуются из расплава конгруэнтно при температурах
-1700, -1410, 1450 и 915 °С соответственно. По перитектическим
реакциям образуются три фазы:
YPd, при 1305 °С;
5-Y2Pd3 при 1274 "С;
- Y3Pd2 при 960 °С [I].
Соединения Y2Pd3 и YPd существуют в двух модификациях.
Температура фазового перехода aY2Pd3 - pY2Pd3 равна 1045 °С; фазовый
переход в соединении YPd протекает в интервале температур 870-900 "С.
Большинство соединений в системе имеют узкие области гомогенности.
Область гомогенности фазы YPd3 расположена в интервале 75-79,5 %
(ат.) Pd.
В системе Pd-Y наблюдается пять эвтектических реакций:
Ж « (Pd) + YPd^ при 1205 °С и 15 % (ат.) Y;
при 1245 °С и 37 % (ат.) Y;
при 1385°Си47%(ат.)У;
при 903 °С и 70 % (ат.) Y;
при 907 "С и 75 % (ат.) Y [1].
(Pd)
Ж - YPd
Ж
Ж
Y4Pd
YPd
ж
32
Y5Pd2
pY?3Pd3
f pYPd
* («V) 2
Pd-Y. Pd-Yb
851
Максимальная растворимость Y в (Pd) при температуре эвтектики
1205 °С составляет -13 % (ат.); Pd практически нерастворим в (Y).
Авторы работы [2] методами рентгеновской металлографии, атомной
абсорбционной спектроскопии, измерения магнитных свойств и
теплоемкости в интервале температур —253—(—271,6) "С исследовали
электронные свойства и стабильность упорядоченных сплавов:
YPd3, YPd2, Y2Pd3, Y3Pd4, YPd, Y3Pd2, Y5Pd2, Y3Pd.
Кристаллическая структура промежуточных фаз в системе Pd-Y по
данным различных исследований [1-4] приведена в табл. 342.
Таблица 342. Кристаллическая структура соединений системы Pd-Y
Соединение
YPd3
Y3Pd4
Y3Pd2
Y5Pd2
Y3Pd
Прототип
AuCu3
Pu3Pd4
Er3Ni2
Dy5Pd2
Fe3C
Символ
Пирсона,
пр.гр.
cP4,
РтЪт
hR\4,
Rl
hRl5,
Rl
cF\44,
Fdlm
oP\b,
Pnma
Параметры решетки, нм
a
0,404-
-0,4068
1,3147
0,87502
1,3625
0,7664
b
-
-
-
-
0,9678
с
-
0,5697
1,64685
-
0,6500
Литература
1 Loebich О., Raub E. // J. Less-Common Met. 1973. V. 30. N 1. P. 47-62.
2. Le Roy J., Moreau J.-M., Paccard D., Parthe E. // Acta. Crystallogr. B. 1977. V. 33. N 8.
P. 2414-2417.
3. Palenzona A., Iandelli A. II). Less-Common Met. 1974. V. 34. N I. P. 121-125.
4. Благородные металлы: Справочник /Под ред. Е.М. Савицкого. М.-. Металлургия, 1984.
592 с.
5 Kuentzier R., Loebich О. II). Less-Common Met. 1985. V. 106. N 2. P. 335-348.
В. П. Полякова
Pd-Yb. ПАЛЛАДИЙ-ИТТЕРБИЙ
Диаграмма состояния Pd-Yb (рис. 433) построена в работе [1] на
основании данных дифференциального термического, микро- и
рентгеноструктурного анализов, измерения магнитных свойств
промежуточных фаз [1]. В системе наблюдается образование восьми
852
Pd-Yb
Yt, % (no массе)
0 Ю 20 JO «0 SO 60 70
80
SO
Рис.
0
Pd
433.
ю
Pd-Yb
20
30
40
Yb
SO 60
>,"/. (am.)
10
BO
90
too
Yb
промежуточных фаз, из которых pPdYb, Pd4Yb3, pPdj 63Yb и Pd3Yb
кристаллизуются конгруэнтно непосредственно из расплава при
температурах 1460,1415,1360 и 1700 °С соответственно, a PdYb3, Pd2Yb5
и Pd2Yb образуются по перитектическим реакциям:
PdYb3 - Ж + <xPd2Yb5 при 670 °С;
pPd2Yb5 - Ж + aPdYb при 695 °С;
Pd2Yb - Ж + Pd3Yb при 1380 "С.
Фаза Pd2Yb существует в узком интервале температур и при
температуре 1145 "С эвтектоидно распадается. Соединение Pd213Yb
образуется в твердом состоянии по перитектоидной реакции Pd2 |3Yb =
«¦ Pd3Yb + Pd2Yb при температуре 1195 °С. Предполагается, что
соединения Pd3Yb и Pdj 6з^Ь имеют заметные области гомогенности.
Соединения PdYb, Pdt 63Vb и Pd2Yb5 существуют в двух модификациях.
Температура полиморфного превращения соединения Pd2Yb требует
уточнения.
Pd-Yb, Pd-Zn
853
Часть диаграммы состояния со стороны Pd требует дополнительного
изучения. Области существования соединения Pd3Yb и твердого раствора
Pd нанесены на диаграмме ориентировочно [1].
Pd практически нерастворим в (Yb) [1]. Растворимость Yb в (Pd)
составляет - 16,5 % (ат.) [5].
Кристаллическая структура промежуточных фаз системы Pd—Yb
приведена в табл. 343 по данным авторов [1-5].
Таблица 343. Кристаллическая структура соединений системы Pd-Yb |l-5]
Соединение
PdYb3
Pd2Yb5"
PdYb
Pd4Yb3
Pd3Yb
*P=97,5°.
Прототип
Fe3C
Mn5C2
CsCl
Pu3Pd4
AuCu3
Символ
Пирсона,
пр.гр.
<>P16,
Pnma
mC28,
Cllc
cPl,
РтЪт
АЛ 14,
Ri ¦
c/»4,
Pm Ът
Параметры решетки, нм
а
0,7664
1,632!
0,3447
0,3417
1,2900
0,4054
b
0,9678
0,6550
-
—
—
с
0,6500
0,7680
—
0,5654
—
Литература
1. landelli A., Palenzona A. // Rev Chim. Miner. 1973. V. 10. N 1-2. P. 3083-3087.
2 McMasters O.D., Gschneidner, Jr., K.A. // J. Nuclear. Metallurg. Series. 1964. V. 10.
P. 93-158.
3. Parthe E., Moreau J.-M. // J Less-Common Met. 1977. V. 53. N 1. P. 1-24.
4 landelli A., Palenzona A. // J. Less-Common Metals. 1974. V. 38. N 1. P. 1-7
5 Благородные металлы: Справочник/Под ред. Е.М. Савиикого. М.: Металлургия, 1984.
592 с.
В.П Полякова
Pd-Zn. ПАЛЛАДИЙ-ЦИНК
Ориентировочная диаграмма состояния Pd-Zn представлена на
рис. 434 на основании данных термического, микроструктурного и
рентгеноструктурного анализов [X, 1]. Система отличается сложным
строением и требует дальнейших систематических исследований в
854
Pd-Zn
Zn, % (no массе)
30 +0 50 SO 70 10 90 100
JOO
0 10 20 JO ЬО SO BO 70
Fd Zn,V.(am.)
Рис. 434. Pd-Zn
80 90 100
In
области существования фаз р. Следует отметить, что кроме нанесенных
на диаграмме фаз предполагается существование еще двух промежуточ-
промежуточных фаз, образующихся по перитектоидным реакциям при температурах
-590 и 430 "С, содержании Zn -60 и 92,5 % (ат.) соответственно [X].
В интервале концентраций 57-82 % (ат.) Zn на монокристаллических
и поликристаллических образцах установлено образование низкотемпе-
низкотемпературной фазы PdZn2 с орторомбической структурой и нескольких
метастабильных фаз [1].
Растворимость Zn в (Pd) при температуре 780 °С составляет 18 % (ат.),
при 530 °С -9 % (ат). Растворимость Pd в (Zn) не превышает 2 % (ат.)
[X].
Кристаллическая структура промежуточных фаз системы Pd-Zn
приведена в табл. 344.
Pd-Zn. Pd-Zr
855
Таблица 344. Кристаллическая структура соединений системы Pd-Zn
Соедине-
Соединение
Р"
Р'
Pi
Y
pdzn;
Прото-
Прототип
CsCl
CsCl
CuAu
Cu5Zng
-
Символ
Пирсона,
пргр.
сР2,
Рт 1т
сР2,
РтЪт
(Р2,
Р41ттт
с/52,
/43 т
-
¦ Ромбическая сингония
Параметры решетки, нм
а
0,3055
0,304
0,413
0,4101
0,902-
0,911
0,75252
0,535
Ь
-
-
-
—
0,73631
0,765
с
-
-
0,335
0,3338
-
1,23072
0,414
Источник
[X]
[X]
[X]
[2]
[X]
[I]
Р]
Литература
1. AlasafiK.M., Chattopadhyay Т., Schubert К. IIJ. Less-Common Met. 1978. V. 59. N 1.
Р 41-50.
2. Jawasaki H. // Acta Crystallogr. A. 1980. V. 36. N 2. P. 299-303.
В.П. Полякова
Pd-Zr. ПАЛЛАДИЙ-ЦИРКОНИЙ
Диаграмма состояния Pd-Zr (рис. 435) построена по результатам
работ [1] (в интервале концентраций 0-50 % (ат.) Zr) и [2] (в интервале
концентраций 50—100 % (ат.) Zr) на основании данных ДТА, измерения
температуры солидуса с помощью оптического пирометра, микро- и
рентгеноструктурного анализов. В системе надежно установлено
образование четырех промежуточных фаз, из которых Pd3Zr, PdZr и
PdZr2 плавятся конгруэнтно при температурах 1780, 1600 и 1085 °С
соответственно. Соединение Pd2Zr образуется по перитектической
реакции при температуре 1600 °С [1, 2]. Предполагается, что соединение
PdZr при температуре 550 °С претерпевает полиморфное превращение,
протекающее по мартенситному типу [3].
Pd понижает температуру плавления Zr, и при температуре 1030 °С
происходит эвтектическая реакция Ж = (pZr) + PdZr2. Температура а/р-
превращения Zr снижается добавками Pd до температуры эвтектоидного
856
Pd-Zr
о to
1800
1600
1*00
IZOO
1000
800
600
о to
Pd
Рис. 435. Pd-Zr
го
Zr, •/. (no массе)
SO 40 SO 60 70 80 30 100
IS.
fSS5'
1
)
%
•
1
pr
N
i
±25'
-1
/'
)±Z5*
i.
i
too'
\
\
Г08С
I
? -
i
ж
5' /
¦75.5
I
i
T
/
/
130'7
i
I
//
/
/
/
/
f
S3 99Л
(cflr)-^
Ш*
ZO 30 ЬО SO 60 70 80 SO 100
Zr. % (am) zr
превращения (pZr) ¦» (ocZr) + PdZr2; концентрация Pd в эвтектоидной
точке 7 % (ат.)- Растворимость Pd в (PZr) при эвтектической температуре
составляет 11,5 % (ат.); в (aZr) при температуре 700 °С <0,1 % (ат.) [2],
при температуре 800 °С <0,2 % (ат.) [Ш].
Zr повышает температуру плавления Pd, и при 1590 "С в системе
протекает перитектическая реакция Ж + Pd3Zr - (Pd). Растворимость Zr
в (Pd) при перитектической температуре составляет 14 % (ат.) и при
температуре 700 °С -12 % (ат.) [1]. По данным других авторов раствори-
растворимость Zr в (Pd) несколько выше: при 1000 "С 20 % (ат.) [Э], при 900 "С
15,7 % (ат.) [5], при 700 °С 20 % (ат.) [4].
В системе Pd-Zr наблюдается еще два эвтектических равновесия:
ж
ж
Pd2Zr
PdZr н
+ PdZr при 1400°Си43%(ат.)гг[1];
PdZr2 при 1080 "С и -66 % (ат.) Zr [2].
Помимо перечисленных фаз авторы работы [4] обнаружили новую
фазу при содержании 43 % (ат.) Zr. По данным работы [5] в системе
существует соединение Pd4Zr со структурой ГЦК и соединение с
тетрагональной структурой между (Pd) и соединением Pd2Zr. Кристалли-
Кристаллическая структура промежуточных фаз системы Pd-Zr приведена в
Pd-Zr
857
табл. 345 Сведения о термодинамических свойствах сплавов Pd-Zr
представлены в работах [6-8]. В работах [6-7] отмечается высокая
термодинамическая стабильность соединения Pd3Zr. По данным работы
[8] энтальпия образования соединения PdZr определена равной
122,6т7,0кДж/моль.
При высоких скоростях закалки из жидкого состояния в сплавах
системы при содержании 25-35 % (ат.) Pd образуются аморфные сплавы
[9]. Аморфный сплав при содержании 33,3 % (ат.) Pd при нагреве
претерпевает двухстадийную кристаллизацию с образованием сначала
неупорядоченной фазы ОЦК, а затем тетрагональной фазы со структурой
типа MoSi2 [10-11].
Таблица 345 Кристаллическая структура соединений системы Pd-Zr
Соединение
Pd4Zr*
Pd3Zr
Pd2Zr
PdZr(BT)
PdZi2
Прототип
-
TiNi3
MoSi2
CsCIO
MoSi2
Символ
Пирсона,
пргр
-
АР16,
Рбу/ттс
ЧЬ,
14/ттт
сР2.
Рт Ът
Г/16,
14/ттт
Параметры
а
0,3962
0,3969
0,5612
0,340
-
0,33086
* Кубическая или тетрагональная сингония
решетки, нм
с
0,3913
0,9231
0,859
-
1,08915
Источник
[5]
[5]
[5]
[1]
[3]
[1,2]
Литература
1 Савицкий Е.М., Полякова В.П., Кривдии Б.П. и др. // Диаграммы состояния
металлических систем Сб статей М Наука 1971 С 200-203
2 AnderkoK.//Z Metallkunde 1959 Bd 50 N 12 S 681-687
3 WangF.E.//J Appl Phys 1967 V 38 N 2 P 822-824
4 StoizE., Schubert K.//Z Metallkunde 1962 Bd 53 N 7 S 433-444
5 Norman ML, Harris I.R. // J Less-Common Met 1969 V 18 N 4 P 333-345
6 Brewer L., Wengert P.R.// Met Trans 1984 V 4 N 1 P 83-104
7 Gibson J.K., Brewer L., Gingerich K.A. // Met Trans 1984 V 15 N11 P 2075-2085
858 Pd-Zr
8. Topor L., Kleppa O.J.//Met. Trans. 1987. V. 18. N II. P. 1889-1994.
9. Inoue A., Matsuzaki K., Masumoto Т., Chen H.S. // J. Mater. Sci. 1986. V. 21. N 4.
P. 1258-1268.
10. Cantrell J.S., Wagner J.E., Bowman R.C. //J. Appl. Phys. 1985. V. 57. N 2. P. 545-553.
11. Wagner J.E., Bowman R.C, Cantrell J.S. // J. Appl. Phys. 1985. V. 58. N 12. P. 4573-4581.
12. Maeland A.J., Lucacevic E., Rush J.J. // J. Less-Common Met. 1987. V. 129. N 1-2.
P. 77-91.
Л.А. Третъяченко, В. П. Полякова
ОГЛАВЛЕНИЕ
Предисловие 5
In—lr. Индий-иридий g
ln-K. Индий-калий 8
ln-Kr. Индий-криптон 10
ln-La. Индий-лантан 10
In—Li. Индий-литий 13
ln-Lu. Индий-лютеций 15
ln-Mg. Индий-магний 17
ln-Mn. Индий-марганец 19
ln-Mo. Индий-молибден 20
ln-N. Индий-азот 21
ln-Na. Индий-натрий 21
ln-Nb. Индий-ниобий 22
In-Nd. Индий- неодим 24
In—Ni. Индий-никель 26
ln-O. Индий-кислород ¦ 28
ln-Os. Индий-осмий 29
In—P. Индий-фосфор 29
ln-Pb. Индий-свинец 31
ln-Pd. Индий-палладий 31
ln-Ртй. Индий-прометий 34
ln-Pr. Индий-празеодим 35
ln-Pt. Индий-платина 37
ln-Pu. Индий-плутоний 39
ln-Rb. Индий-рубидий 41
In-Rh. Индий-родий 43
In-Ru. Индий-рутений 44
ln-S. Индий—сера 44
ln-Sb. Индий-сурьма 46
ln-Sc. Индий-скандий 48
ln-Se. Индий- селен 51
In—Si. Индий—кремний 53
ln-Sm. Индий-самарий 54
In-Sn. Индий-олово 57
In—Sr. Индий-стронций 59
In-Ta. Индий-тантал 60
ln-Tb. Индий-тербий 61
In—Те. Индий—теллур 64
In—Th. Индий—торий 67
In—Ti. Индий-титан 69
ln-TI. Индий-таллий 70
ln-Tm. Индий-тулий 72
In—V. Индий-ванадий 74
ln-Y Индий-иттрий 75
ln-Yb. Индий-иттербий 78
ln-Zn. Индий-цинк 80
In-Zr. Индий-цирконий 82
lr-K. Иридий-калий 84
lr-La. Иридий-лантан 84
Ir—Li. Иридий-литий 86
lr-Lu. Иридий-лютеций 86
lr-Mg. Иридий-магний 87
860 Оглавление
Ir-Mn. Иридий-марганеи 88
lr—Mo. Иридий—молибден 89
Ir-N. Иридий-азот 92
Ir-Na. Иридий-натрий 92
Ir-Nb. Иридий-ниобий 92
Ir-Nd. Иридий-неодим 94
lr-Ni. Иридий-никель 95
Ir-O. Иридий-кислород 97
Ir-Os. Иридий-осмий 97
lr-P. Иридий-фосфор . 99
Ir-Pa. Иридий-протактиний 100
lr-Pb. Иридий-свиней 100
Ir-Pd. Иридий-палладий 101
Ir-Pm. Иридий-прометий 102
lr—Pr. Иридий—празеодим 103
lr—Pt. Иридий—платина 104
Ir-Pu. Иридий-плутоний 105
Ir-Ra. Иридий-радий 106
Ir-Rb. Иридий-рубидий 106
Ir-Re. Иридий-рений 106
Ir-Rh. Иридий-родий 107
Ir-Ru. Иридий-рутений 108
Ir-S. Иридий-сера 110
Ir-Sb. Иридий-сурьма 110
lr—Sc. Иридий—скандий 112
Ir-Se. Иридий-селен 112
Ir-Si. Иридий-кремний 113
Ir-Sm. Иридий-самарий 115
lr— Sn. Иридий—олово 115
Ir-Sr. Иридий-строниий 116
Ir-Ta. Иридий-тантал 117
Ir-Tb. Иридий-тербий 118
lr—Тс. Иридий-технеций 119
Ir-Te. Иридий-теллур 119
lr—Th. Иридий-торий 120
lr—Ti. Иридий-титан 123
lr—Tl. Иридий-таллий 124
Ir-Tm. Иридий-тулий 125
Ir-U. Иридий-уран 125
Ir-V. Иридий-ванадий 127
Ir-W. Иридий-вольфрам 129
Ir-Y. Иридий-иттрий 131
lr—Yb. Иридий—иттербий 131
lr—Zn. Иридий—цинк 132
Ir-Zr. Иридий-цирконий 132
K-La. Калий-лантан 135
К—Li. Калий—литий ¦ 135
K-Lu. Калий-лютеций 136
K-Mg. Калий-магний 137
К—Мп. Калий-марганец 138
K-Mo. Калий-молибден 138
K-N. Калий-азот 138
Оглавление 861
K-Na. Калий-натрий 139
K-Nb. Калий-ниобий 140
К—Nd. Калий—неодим 141
К—Ni. Калий—никель 141
K-Np. Калий-нептуний 142
К-О. Калий-кислород 142
K-Os. Калий-осмий 143
К-Р. Калий-фосфор 143
К-Ра. Калий-протактиний 144
К-Pb. Калий-свиней 144
K-Pd. Калий-палладий 146
К-Ро. Калий-полоний 146
К-Рг. Калий-празеодим 146
K-Pt. Калий-платина 147
К-Pu. Калий-плутоний 147
K-Ra. Калий-радий 147
K-Rb. Калий-рубидий 147
K-Re. Калий-рений 148
K-Rh. Калий-родий 149
K-Ru. Калий-рутений 149
K-S. Калий-сера 149
K-Sb. Калий-сурьма 151
K-Sc. Калий-скандий 152
K-Se. Калий-селен 152
К—Si. Калий-кремний 154
K-Sm. Калий-самарий 154
K-Sn. Калий-олово 155
K-Sr. Калий-стронций 156
К—Та. Калий—тантал 156
К-ТЬ. Калий-тербий 157
К-Те. Калий-теллур 158
K-Th. Калий-торий ' 159
K-Ti. Калий-титан 160
К-Т1. Калий-таллий 160
K-U. Калий-уран 161
K-V. Калий-ванадий 162
K-Yb. Калий-иттербий 163
K-Zn. Калий-иинк 163
K-Zr. Калий-цирконий 164
La-Lu. Лантан-лютеций 165
La-Mg. Лантан-магний 167
La-Mn. Лантан-марганец 170
La-Mo. Лантан-молибден 171
La-N. Лантан-азот 172
La—Na. Лантан—натрий 172
La-Nb. Лантан-ниобий 172
La-Nd. Лантан-неодим 174
La-Ni. Лантан-никель 175
La-O. Лантан-кислород 177
La-Os. Лантан—осмий 177"
La-P. Лантан-фосфор 178
La-Pb. Лантан-свинец 178
862 Оглавление
La-Pd. Лантан-палладий 180
La-Pm. Лантан-прометий 180
La-Po. Лантан-полоний 182
La-Pr. Лантан-празеодим 182
La-Pt. Лантан-платина 184
La-Pu. Лантан-плутоний 186
La-Re. Лантан-рений 187
La-Rh. Лантан-родий 188
La-Ru. Лантан-рутений 190
La-S. Лантан-сера 192
La-Sb. Лантан-сурьма 194
La-Sc. Лантан-скандий 196
La-Se. Лантан-селен 197
La-Si. Лантан-кремний 198
La-Sm. Лантан-самарий 199
La—Sn. Лантан—олово 201
La-Sr. Лантан-строниий 203
La-Ta. Лантан-тантал 203
La-Tb. Лантан-тербий 204
La-Te. Лантан-теллур 206
La-Th. Лантан-торий 208
La—Ti. Лантан—титан 209
La-TI. Лантан-таллий 210
La-Tm. Лантан-тулий • 212
La-U. Лантан-уран 214
La-V. Лантан-ванадий 214
La—W. Лантан—вольфрам 215
La-Y. Лантан-иттрий 216
La-Yb. Лантан-иттербий 217
La-Zn. Лантан-иинк 217
La-Zr. Лантан-цирконий 219
Li-Lu. Литий-лютеций 220
Li-Mg. Литий-магний 220
Li-Mn. Литий-марганец 222
Li-Mo. Литий-молибден 223
Li-N. Литий-азот 224
Li-Na. Литий-натрий 225
Li-Nb. Литий-ниобий 226
Li-Nd. Литий-неодим 228
Li-Ni. Литий-никель 228
Li-O. Литий-кислород 229
Li-P. Литий-фосфор '. . . 229
Li-Pb. Литий-свинец 229
Li-Pd. Литий-палладий 231
Li-Pr. Литий-празеодим 234
Li-Pt. Литий-платина 234
Li-Pu. Литий-плутоний 236
Li-Rb. Литий-рубидий 236
Li-Re. Литий-рений 237
Li-Rh. Литий-родий 237
Li-Ru. Литий-рутений 239
Li-S. Литий-сера 239
Оглавление 863
Li—Sb. Литий—сурьма 239
Li-Se. Литий-селен 239
Li-Si. Литий-кремний 240
Li—Sn. Литий—олово 242
Li—Sr. Литий—стронций 243
Li-Ta. Литий-тантал 245
Li-Te. Литий-теллур 246
Li—Ti. Литий-титан 246
Li-Tl. Литий-таллий 247
Li-U. Литий-уран 248
Li-V. Литий-ванадий 248
Li-W. Литий-вольфрам 249
Li-Zn. Литий-цинк 250
Li-Zr. Литий-цирконий 252
Lr-Mo. Лоуренсий-молибден 253
Lu-Mg. Лютеций-магний 254
Lu-Mn. Лютеций-марганец 255
Lu-Mo. Лютеций-молибден 256
Lu-N. Лютеций-азот ¦ 256.
Lu-Nd. Лютеций-неодим 256
Lu-Ni. Лютеиий-иикель 258
Lu-O. Лютеций-кислород 259
Lu—Os. Лютеций—осмий 259
Lu-P. Лютеций-фосфор 259
Lu-Pb. Лютеций-свинец 260
Lu-Pd. Лютеций-палладий 261
Lu-Pm. Лютеций-Прометий 262
Lu-Po. Лютеций-полоний 264
Lu-Pr. Лютеций-празеодим 264
Lu-Pt, Лютеций-платина 266
Lu-Pu. Лютеций-плутоний 267
Lu-Re. Лютеций-рений 267
Lu-Rh. Лютеций-родий 267
Lu-Ru. Лютеций-рутений 267
Lu-S. Лютеций-сера 268
Lu-Sb. Лютеций-сурьма 268
Lu-Sc. Лютеций-скандий 270
Lu-Se. Лютеиий-селен 271
Lu-Si, Лютеций-кремний 272
Lu-Sra. Лютеций-самарий 273
Lu—Sn. Лютеций—олово 275
Lu-rTa. Лютеций-тантал 276
Lu-Tb. Лютеций-тербий 277
Lu-Tc. Лютеций-технеций 279
Lu-Te. Лютеиий-теллур 279
Lu-Th. Лютеций-торий 279
Lu-Tl. Лютеций-таллий 281
Lu-Tm. Лютеций-тулий 281
Lu-U. Лютеций-уран 282
Lu-V. Лютеций-ванадий 283
Lu-W. Лютеций-вольфрам 283
Lu-Y, Лютеций-иттрий 283
864 Оглавление
Lu-Yb Лютеций-иттербий 285
Lu-Zn Лютеций-цинк 286
Lu-Zr Лютеций-цирконий 287
Mg-Mn Магний-марганец 287
Mg-Mo Магний-молибден 289
Mg-N Магний-азот 290
Mg-Na Магний-натрий 290
Mg-Nb Магний-ниобий 291
Mg-Nd Магний-неодим 291
Mg-Ni Магний-никель 295
Mg-0 Магний-кислород 297
Mg-Os Магний-осмий 299
Mg-P Магний-фосфор 299
Mg-Pb Магний-свинец 300
Mg-Pd Магний-палладий 302
Mg-Pra Магний-прометий 306
Mg-Po Магний-полоний 306
Mg-Pr Магний-празеодим 306
Mg-Pt Магний-платина 309
Mg-Pu Магний-плутоний 311
Mg-Rb Магний-рубидий 312
Mg-Rh Магний-родий 314
Mg-Ru Магний-рутений 315
Mg-S Магний-сера 315
Mg—Sb Магний—сурьма 315
Mg-Sc Магний-скандий 317
Mg-Se Магний-селен 319
Mg-Si Магний-кремний 320
Mg-Sm Магний-самарий 322
Mg-Sn Магний-олово 324
Mg-Sr Магний-стронций 326
Mg-Tb Магний-тербий 329
Mg-Te Магний-теллур 331
Mg-Th Магний-торий 331
Mg-Ti Магний-титан 334
Mg-TI Магний-таллий 335
Mg—Tm Магний—тулий 337
Mg-U Магний-уран 339
Mg-V Магний-ванадий 340
Mg-W Магний-вольфрам 341
Mg-Y Магний-иттрий 342
Mg-Yb Магний-иттербий 344
Mg-Zn Магний-цинк 346
Mg-Zr Магний-цирконий 349
Mn—Mo Марганец—молибден 351
Mn—N Марганец—азот 353
Mn-Na Марганец-натрий 355
Mn—Nb Марганец—ниобий 356
Mn-Nd Марганец-неодим 357
Mn-Ni Марганец-никель 359
Mn-О Марганец-кислород 361
Mn—P Марганец—фосфор 363
Оглавление 865
Mn-Pb Марганец-свинец 365
Mn-Pd Марганец-палладий 366
Mn-Pm Марганец-прометий 368
Mn—Pr Марганец—празеодим 369
Mn-Pt Марганец-платина 371
Mn-Pu Марганец-плутоний 372
Mn-Re Марганец-рений 373
Mn-Rh Марганец-родий 375
Mn-Ru Марганец-рутений 377
Mn-S Марганец-сера 377
Mn-Sb Марганец-сурьма 379
Mn-Sc Марганец-скандий 38!
Mn-Se Марганец-селен 382
Mn-Si Марганец-кремний 383
Mn-Sm Марганец-самарнй 386
Mn—Sn Марганец—олово 387
Mn-Sr Марганец-стронций 389
Mn-Та Марганец-тантал 39!
Mn-Tb Марганец-тербий 392
Mn—Тс Марганец—технеций 394
Mn-Те Марганец-теллур 394
Mn-Th Марганец-торий 396
Mn—Ti Марганец—титан 398
Мп-Т1 Марганец-таллий 400
Mn-Tm Марганец-тулий 400
Mn-U Марганец-уран 401
Mn-V Марганец-ванадий 402
Mn-W Марганец-вольфрам 403
Mn-Y Марганец-иттрий 404
Mn-Yb Марганец-иттербий 406
Mn—Zn Маргаиец—цинк 408
Mn—Zr Марганец—цирконий 411
Mo-N Молибден-азот 413
Mo-Na Молибден-натрий 416
Mo-Nb Молибден-ниобий 416
Mo-Nd Молибден-неодим 417
Mo—Ni Молибден—никель 418
Mo—Np Молибден—нептуний 420
Мо-О Молибден-кислород 420
Mo—Os Молибден—осмий 424
Мо-Р Молибден-фосфор 425
Mo-Ра Молибден-протактиний 428
Мо-Pb Молибден-свинец 429
Mo-Pd Молибден-палладий 429
Мо-Рт Молибден-прометий 432
Мо-Ро Молибден-полоний 432
Мо-Pr Молибден-празеодим 432
Mo-Pt Молибден-платина 433
Мо-Pu Молибден-плутоний 435
Mo-Rb Молибден-рубидий 437
Mo—Re Молибден—рений 437
Mo-Rh Молибден-родий 440
866 Оглавление
Mo-Ru Молибден-рутений 441
Mo-S Молибден-сера 443
Mo-Sb Молибден-сурьма 446
Mo-Sc Молибден-скандий 447
Mo-Se Молибден-селен 448
Mo-Si Молибден-кремний 449
Mo-Sn Молибден-олово 452
Мо-Та Молибден-тантал 454
Мо-Тс Молибден-техиеций 454
Мо-Те Молибден-теллур 4^6
Mo-Th Молибден-торий 458
Mo-Ti Молибден-титаи 460
Мб-U Молибден-уран 462
Mo-V Молибден-ванадий 465
Mo-W Молибден-вольфрам 466
Mo-Y Молибден-иттрий 467
Mo-Yb Молибден-иттербий 468
Mo-Zn Молибден—цинк 469
Mo-Zr Молибден-циркоиий 470
N-Na Азот-натрий 473
N-Nb Азот-ниобий 473
N-Nd Азот—неодим 476
N-Ni Азот-никель 477
N-Np Азот-нептуний 478
N-Os Азот-осмий 478
N-Pa Азот-протактиний 478
N-Pb Азот-свинец 479
N-Pd Азот-палладий 479
N-Pr Азот-празеодим 480
N-Pu Азот-плутоний 480
N-Ra Азот-радий 481
N-Rb Азот-рубидий 481
N-Re Азот-рений 482
N-Sb Азот-сурьма 482
N-Sc Азот-скандий 483
N-Se Азот-селен 483
N-Si Азот-кремний 483
N—Sm Азот—самарий 485
N-Sn Азот-олово 485
N-Sr Азот-строиций 485
N-Ta Азот—тантал 486
N-Tb Азот-тербий 489
N-Tc Азот-техиеций 489
N-Te Азот-теллур 489
N-Th Азот-торий 489
N-Ti Азот-титаи 491
"N-T! Азот-таллий 492
N-Tm Азот-тулий 493
N-U Азот-ураи 493
N-V Азот-ванадий 494
N-W Азот-вольфрам 496
N-Y Азот-иприй 498
Оглавление 867
N-Yb Азот-иттербий 499
N-Zn Азот-цинк 499
N-Zr Азот-цирконий 499
Nd-Nb Штрий-ниобий 500
Na-Ni Натрий-никель 501
Na-O Натрий—кислород 502
Nd-Pb Натрий-свинец 504
Na-Pd Натрий-палладий 506
Na-Po Натрий-полоний 506
Na-Pt Натрий-платина 506
Na-Pu Натрий-плутоний 507
Na-Rb Hdтpий-pyбидий 507
Na-S Натрий-сера 508
Nd-Sb Натрий-сурьма 508
Nd-Se Натрий-селен 509
Na-Si Натрий-кремний 510
Na-Sn Натрий-олово 511
Na-Sr Натрий-стронций 513
Na-Ta Натрий-тантал 514
Na-Te Натрий-теллур 515
Na-Th Натрий-торий 516
Na-Ti Натрий-титан 517
Na-Tl Натрий-таллий 518
Nd-U Натрий-уран 519
Na-V Натрий-ванадий 519
Na-W Натрий-вольфрам 520
Na-Xe Штрий-ксенои 520
Na-Zn Натрий-цинк 520
Na-Zr Натрий-цирконий 522
Nb-Nd Ниобий-неодим 523
Nb-Ni Ниобий-никель 523
Nb-0 Ниобий-кислород 525
Nb-Os Ниобий-осмий 527
Nb-P Ниобий-фосфор 529
Nb-Pb Ниобий-свинец 529
Nb-Pd Ниобий-палладий 530
Nb-Pr Ниобий-празеодим 532
Nb-Pt Ниобий-платииа 532
Nb-Pu Ниобий-плутоний 535
Nb-Rb Ниобий-рубидий 535
Nb-Re Ниобий-рений 536
Nb-Rh Ниобий-роднй 538
Nb-Ru Ниобий-рутений 540
Nb-S Ниобий-cepd 542
Nb-Sb Ниобий-сурьма 543
Nb-Sc Ниобий-скандий 544
Nb-Se Ниобий-селен 545
Nb-Si Ниобий-кремиий 548
Nb-Sm Ниобий-самарий 550
Nb-Sn Ниобий-олово 551
Nb-Ta Ниобий-тантал 555
Nb-Tb Ниобий-тербий 555
868 Оглавление
Nb-Tc Ниобий-технеций 556
Nb-Te Ниобий-теллур 556
Nb-Th Ниобий-торий 558
Nb-Ti Ниобий-титан 559
Nb-TI Ниобий-таллий 561
Nb-Tm Ниобий-тулий 562
Nb-U Ниобий-уран 562
Nb-V Ниобий-ванадий 565
Nb-W Ниобий-вольфрам 566
Nb-Y Ниобий-иттрий 567
Nb-Yb Ниобий-иттербий 568
Nb-Zn Ниобий-цинк 568
Nb-Zr Ниобий-цирконий 570
Nd-Ni Неодим-никель 571
Nd-O Неодим-кислород 574
Nd-Os Неодим-осмий 576
Nd-P Неодим-фосфор 576
Nd-Pb Неодим-свинец 576
Nd-Pd Неодим-палладий 577
Nd-Pm Неодим-прометий 579
Nd-Po Неодим-полоний 580
Nd-Pr Неодим-празеодим 581
Nd-Pt Неодим-платина 582
Nd-Pu Неодим-плутоний 584
Nd-Re Неодим-рений 585
Nd-Rh Неодим-родий 586
Nd-Ru Неодим-рутений 588
Nd-S Неодим-сера 590
Nd—Sb Неодим—сурьма 591
Nd-Sc Неодим-скандий 592
Nd-Se Неодим-селен 593
Nd-Si Неодим-кремний 594
Nd-Sm Неодим-самарий 596
Nd—Sn Неодим—олово 597
Nd—Sr Неодим—стронций 599
Nd-Ta Неодим-тантал 600
Nd-Tb Неодим-тербий 600
Nd-Te Неодим-теллур 602
Nd-Th Неодим-торий 604
Nd-Ti Неодим-титан 605
Nd-TI Неодим-таллий 606
Nd—Tm Неодим—тулий 609
Nd—U Неодим—уран 610
Nd-V Неодим-ванадий 611
Nd-W Неодим-вольфрам 612
Nd-Y Неодим-иттрий 613
Nd—Yb Неодим—иттербий 614
Nd-Zn Неодим-цинк 615
Nd-Zr Неоднм-цирконий 618
Ni-O Никель-кислород 618
Ni—Os Никель—осмий 620
Ni-P Никель-фосфор 620
Оглавление 869
Ni-Pb Никель-свинец 622
Ni-Pd Никель-палладий 623
Ni-Po Никель-полоний 624
Ni-Pr Никель-празеодим 625
Ni-Pt Никель-платииа 627
Ni-Pu Никель-плутоний 627
Ni-Re Никель-рений 629
Ni-Rh Никель-родий 63!
Ni-Ru Никель-рутений 632
Ni-S Никель-сера 633
Ni-Sb Никель-сурьма 635
Ni-Sc Никель-скандий 637
Ni-Se Никель-селен 640
Ni-Si Никель-кремний 641
Ni-Sm Никель-самарий 643
Ni-Sn Никель-олово 645
Ni-Sr Никель-стронций 646
Ni-Ta Никель-тантал 647
Ni-Tb Никель-тербий 649
Ni-Tc Никель-технеций 650
Ni-Te Никель-теллур 651
Ni-Th Никель-торий 653
Ni-Ti Никель-титан 655
Ni-TI Никель-таллий 658
Ni-Tm Никель-тулий 658
Ni-U Никель-уран 659
Ni-V Никель-ванадий 662
Ni-W Никель-вольфрам 664
Ni-Y Никель-иттрий 666
Ni-Yb Никель-иттербий 668
Ni-Zn Никель-цинк 669
Ni-Zr Никель-цирконий 672
Np-Pd Нептуиий-папладий 675
Np-Pu Нептуний-плутоний 676
Np-S Нептуний-сера 678
Np-Se Нептуний-селен 679
Np-Si Нептуний-кремний 680
Np-Te Нептуний-теллур 680
Np-U Нептуний-уран 680
O-Os Кислород-осмий 681
О-Ра Кислород-протактиний 682
О-Pb Кислород-свинец 683
O-Pd Кислород-палладий 685
О-Рт Кислород-прометий 686
О-Ро Кислород-полоний 687
О-Pr Кислород-празеодим 687
O-Pt Кислород-платина 690
О-Ри Кислород-плутоний 69!
O-Rb Кислород-рубидий 693
O-Re Кислород-рений 694
O-Rh Кислород-родий 695
O-Ru Кислород-рутений 696
870 Оглавление
O-Sb. Кислород-сурьма 696
O-Sc. Кислород-скаидий 697
Q-Se. Кислород-селен 698
O-Si. Кислород-кремиий 698
O-Sm. Кислород-самарий 700
O-Sn. Кислород-олово 702
O-Sr. Кислород-стронций 703
О—Та. Кислород—тантал 704
О-ТЬ. Кислород-тербий 705
О-Тс. Кислород-технеций 708
О-Те. Кислород-теллур 708
O-Th. Кислород-торий 709
O-Ti. Кислород-титан 710
O-TI. Кислород-таллий 712
О-Тш. Кислород-тулий 7В
O-U. Кислород-ураи 713
O-V. Кислород-ваиадий 715
O-W. Кислород-вольфрам 718
O-Y. Кислород-иттрий 721
O-Yb. Кислород-иттербий 723
O-Zn. Кислород-циик 723
O-Zr. Кислород-циркоиий 724
Os-P. Осмий-фосфор 726
Os-Pd. Осмий-палладий , 727
Os-Pr. Осмий-празеодим 728
Os-Pt. Осмий-платина 729
Os-Pu. Осмий-плутоний 730
Os-Re. Осмий-реиий 731
Os-Rh. Осмий-родий 732
Os-Ru. Осмий-рутений 733
Os-S. Осмий-сера 734
Os-Sb. Осмий-сурьма 734
Os-Sc. Осмий-скандий 735
Os-Se. Осмий-селен 735
Os-Si. Осмий-кремиий 735
Os-Sm. Осмий-самарий 737
Os-Sn. Осмий-олово 737
Os-Ta. Осмий-таитал '. 738
Os-Tb. Осмий-тербий 739
Os-Tc. Осмий-технеций 740
Os-Te. Осмий-теллур 740
Os-Th. Осмий-торий 740
Os-Ti. Осмий-титан 742
Os-Tm. Осмий-тулий 743
Os-U. Осмий-уран 744
Os-V. Осмий ванадий 745
Os-W. Осмий-вольфрам 746
Os-Y. Осмий-иттрий 748
Os-Yb. Осмий-иттербий 749
Os-Zn. Осмий-цинк 749
Os-Zr. Осмий-цирконий 750
Р-Pb. Фосфор-свинец 752
Оглавление 871
P-Pd. Фосфор-палладий 752
Р-Рг. Фосфор-празеодим 754
P-Pt. Фосфор-платина 755
P-Pu. Фосфор-плутоний 756
P-Re. Фосфор-рений 756
P-Rh. Фосфор-родий 757
P-Ru. Фосфор-рутений 758
P-S. Фосфор-сера 760
P-Sb. Фосфор-сурьма 76!
P-Sc. Фосфор-скандий 762
P-Se. Фосфор-селен 762
Р—Si. Фосфор-кремиий 763
P-Sm. Фосфор-самарий 764
P-Sn. Фосфор-олово 765
P-Sr. Фосфор-стронций 766
Р-Та. Фосфор-тантал 767
Р-ТЬ. Фосфор-тербий 767
Р-Те. Фосфор-теллур 767
P-Th. Фосфор-торий 768
P-Ti. Фосфор-титан 768
P-TI. Фосфор-таллий 770
Р-Тт. Фосфор-тулий 771
P-U. Фосфор-уран 77!
P-V. Фосфор-ванадий 771
P-W. Фосфор-вольфрам 772
P-Y. Фосфор-иттрий 773
P-Yb. Фосфор-иттербий 773
P-Zn. Фосфор-цинк 774
P-Zr. Фосфор-цирконий 776
Pb-Pd. Свинец-палладий 777
Pb-Pm. Свинец-прометий 779
Pb-Ро. Свинец-полоиий 779
Pb-Pr. Свииец-празеодим 779
Pb-Pt. Свинец-платина 781
Pb-Pu. Свииец-плутоиий 782
Pb-Rb. Свииец-рубидий 784
Pb-Rh. С»инец-родий 785
Pb-Ru. Свинец-рутений 786
Pb-S. Свииец-сера 786
Pb-Sb. Свинец-сурьма 788
Pb-Sc. Свинец-скандий 789
Pb-Se. Свинец-селен 789
Pb—Si. Свинец-кремний 79!
Pb-Sm. Свинец-самарий 792
Pb-Sn. Свинец-олово 794
Pb-Sr. Свинец-строиций 795
Pb-Tb. Свииец-тербий 797
Pb-Те. Свинец-теллур 797
Pb-Ti. Свинец-титан 799
РЬ-TI. Свииец-таллий 800
Pb-Tm. Свинец-тулий 801
Pb-U. Свинец-уран 801
872 Оглавление
Pb-W Свинец-вольфрам 803
Pb-Y Свинец-иттрий 803
Pb-Yb Свинец-иттербий 805
Pb-Zn Свинец-цинк 806
Pb-Zr Свииец-цирконий 807
Pd-Pr Палладий-празеодим 808
Pd-Pt Палладий-платина 809
Pd-Pu Палладий-плутоний 810
Pd-Re Палладий-рений 811
Pd-Rh Палладий-родий 812
Pd-Ru Палладий-рутений 813
Pd-S Палладий-сера 814
Pd-Sb Палладий-сурьма 815
Pd-Sc Палладий-скандий 817
Pd-Se Палладий-селен 819
Pd-Si Палладий-кремний 821
Pd-Sm Палладий-самарий 824
Pd-Sn Палладий-олово 826
Pd-Sr Палладий-стронций 829
Pd-Ta Палладий-тантал 829
Pd-Tb Палладий-тербий 832
Pd-Tc Палладий-технеций 835
Pd-Te Палладий-теллур 835
Pd-Th Палладий-торий 838
Pd-Ti Палладий-титан 840
Pd-Tl Палладий-таллий 842
Pd-Tm Палладий-тулий 844
Pd-U Палладий-уран 845
Pd-V Палладий-ванадий 846
Pd-W Палладий-вольфрам 848
Pd-Y Палладий-иттрий 849
Pd-Yb Палладий-иттербнй 851
Pd-Zn Палладий-циик 853
Pd-Zr Палладий-цирконий 855
СПРАВОЧНОЕ ИЗДАНИЕ
ДИАГРАММЫ СОСТОЯНИЯ ДВОЙНЫХ МЕТАЛЛИЧЕСКИХ СИСТЕМ
ТомЗ Книга I
Редактор Н Г Сальникова
Оформление художника В К Погорелова
Художественный редактор ТН Погорелова
Технический редактор ТИ Андреева, С А Жиркина
Корректоры Л Е Сонюшкина, Л И Сажина
Лицензия ЛР N9080003 от 12 09 96
Сдано в набор 26 10 98 Подписано в печать 03 01 01 Формат 60x881/16
Бумага офсетная Гарнитура Тайме Печать офсетная
Уел печ л 53 41 Уел кр отт S3 41 Уч изд л 54 9
Доп тираж 620 экз Заказ 13 I
Ордена Трудового Красного Знамени издательство "Машиностроение'
107076 Мосхва Стромынский пер , 4
Отпечатано в типографии НИИ'Геодезия г Красиоармейсх Московской обл