Автор: Лякишев Н.П.
Теги: металлургия металловедение физика инженерия инженерное дело издательство машиностроение диаграммы
ISBN: 5-217-02932-3
Год: 1996
Текст
ДИАГРАММЫ
СОСТОЯНИЯ
двойных
металлических
систем у
справочник
диаграммы
состояния
двойных
металлических
систем
Справочник в трех томах
Редакционный совет:
акад. РАН Н.П. Лякишев
(главный редактор издания),
акад. РАН О.А. Банных
(зам. гл. ред.),
д-р техн, наук Л.Л. Рохлин
(зам. гл. ред.),
канд. техн, наук С.П. Алисова,
канд. техн, наук Н.Р. Бочвар,
канд. техн, наук П.Б. Будберг,
канд. техн, наук Т.В. Добаткина,
канд. техн, наук Е.В. Лысова,
д-р техн, наук В.П. Полякова,
д-р техн, наук К.Б. Поварова,
д-р техн, наук М.А. Тылкина,
д-р хим. наук Л.Е. Шелимова,
д-р техн, наук Е.Н. Шефтель
МОСКВА
МАШИНОСТРОЕНИЕ
2000
ИНСТИТУТ МЕТАЛЛУРГИИ И МАТЕРИАЛОВЕДЕНИЯ им. А.А. БАЙКОВА
РОССИЙСКОЙ АКАДЕМИИ НАУК
ДИАГРАММЫ
СОСТОЯНИЯ
двойных
металлических
систем
том 3 КНИГА 2_____________________
Под общей редакцией
академика РАН Н.П. Лякишева
МОСКВА
МАШИНОСТРОЕНИЕ
2000
УДК 669.017.11
ББК 34.2
Д44
»»
У
Издание осуществлено при поддержке
Российского фонда фундаментальных
исследований по проекту 96-03-46024
Диаграммы состояния двойных металлических систем:
Д44 Справочник: В 3 т.: Т. 3. Кн. 2 / Под общ. ред. Н.П. Лякишева. -
М.: Машиностроение, 2000. - 448 с.: ил.
ISBN 5-217-02932-3
Приведены критически рассмотренные и обобщенные сведения о диаграммах
состояния двойных металлических систем, знание которых необходимо для
выбора и разработки промышленных металлических материалов, технологии их
производства и практического использования. Содержатся сведения об
образующихся в системах соединениях и их кристаллических структурах,
типах и температурах фазовых превращений, взаимных растворимостях
компонентов друг в друге и изменении их с температурой.
Для инженерно-технических работников научно-исследовательских инсти-
тутов и промышленных предприятий металлургии, машиностроения и других
отраслей промышленности, а также для профессорско-преподавательского сос-
тава и студентов высших учебных заведений.
ISBN 5-217-02932-3(Т. 3, кн. 2) ББК 34.2
ISBN 5-217-02687-1
© Н.П. Лякишев, О.А. Банных,
Л.Л. Рохлин и др., 2000
© Издательство "Машиностроение", 2000
Pm-Pr
5
Pm-Pr. ПРОМЕТИЙ-ПРАЗЕОДИМ
Диаграмма состояния Pm-Pr экспериментально не построена. Од-
нако Pm и Рг в Периодической системе элементов расположены рядом.
В металлическом состоянии металлы имеют идентичное электронное
строение с тремя внешними коллективизированными электронами
5tr 6s1, одинаковые кристаллические структуры с близкими постоянными
решетки, атомные радиусы, отличающиеся всего лишь на 0,9 %.
Рг Рт, °/° (ат) Рт
Рис. 436. Рт - Рг
На этом основании следует считать, что Рт и Рг образуют непрерыв-
ные ряды твердых растворов. Вследствие близости электронного
строения растворы являются идеальными, и поэтому линии ликвидуса-
солидуса и две линии сольвуса сливаются в прямые с очень узкими
двухфазными областями между ними. Построенная на этой основе
диаграмма состояния Pm-Pr приведена на рис. 436.
В. К. ГГригорович
6
Pm-Sc
Pm-Sc. ПРОМЕТИЙ-СКАНДИЙ
Диаграмма состояния Pm-Sc не построена. Известно, что Pm и Sc
имеют при высоких температурах изоструктурные модификации, а
низкотемпературные модификации обладают близкими гексагональными
структурами: ДГПУ для аРт и ГПУ для aSc; их атомные радиусы
различаются на 10,4 %. Исходя из изложенного выше, вследствие
близости электронного строения Pm и Sc должны образовывать
непрерывные ряды твердых растворов при высоких температурах
(рис. 437). При температурах ниже -700 °C твердый раствор на основе
гексагональных модификаций (aPm, aSm) будет распадаться на (aPm)
и (aSc), так же как в системе Nd-Sc [1], где значительное различие
Рис. 437. Pm - Sc
Pm-Sc, Pm-Sm
7
атомных радиусов приводит к отклонению растворов от идеальных и
провисанию линий ликвидуса-солидуса и сольвуса, а также возникнове-
нию купола несмешиваемости при температурах ниже -700 °C.
Литература
1. Gschneidner, Jr., К.А., Calderwood F.W. // Handbook on the Physics and Chemistry of Rare
Earths. Amsterdam, New York, Oxford, Tokyo: North-Holland. Physics Publishing Co., 1986.
V. 8. Chap. 54. P. 1-161.
B.K. Григорович
Pm-Sm. ПРОМЕТИЙ-САМАРИЙ
Диаграмма состояния Pm-Sm экспериментально не построена. Так
как Pm и Sm являются ближайшими соседями в Периодической системе
элементов, имеют в металлическом состоянии идентичную электронную
Pm Sm,*/»(am.) Sm
Рис. 438. Pm - Sm
8
Pm-Sm, Pm-Tb
структуру с тремя коллективизированными электронами 5dl6s2,
одинаковое кристаллическое строение высокотемпературных моди-
фикаций с очень близкими параметрами решеток, разницу атомных
радиусов лишь 0,4 %, следует ожидать, что металлы образуют идеальные
твердые растворы при высоких температурах. Идеальность растворов
приводит к слиянию линий ликвидуса и солидуса, а также линий сольвуса
в прямые линии. На предполагаемой диаграмме состояния Pm-Sm (рис.
438) показана также область твердого раствора на основе aSm(5), в
которой вероятно, растворяется 30-40 % (ат.) Pm.
В. К. Григорович
Pm-Tb. ПРОМЕТИЙ-ТЕРБИЙ
Диаграмма состояния Pm-Tb экспериментально не построена. Близко
расположенные в ряду лантонидов Pm и Tb в металлическом состоянии
имеют идентичное электронное строение с тремя коллективизированны-
ТЬ, 7о (по массе)
Pm Tb, % (am.) Tb
Рис. 439. Pm - Tb
ми валентными электронами
5d[6s2, изоструктурные высоко-
температурные модификации с
близкими параметрами реше-
ток, структурно близкими низко-
температурными модификация-
ми. Их атомные радиусы отлича-
ются всего на 1,5 %. На этом
основании можно предполагать,
что Pm и ТЬ будут образовывать
между собой непрерывные ряды
почти идеальных твердых рас-
творов высоко- и низкотемпера-
турных модификаций (рис. 439).
При температурах ниже -750 °C
в системе предполагается воз-
никновение промежуточной
упорядоченной фазы б со струк-
турой типа aSm аналогично
фазам, наблюдаемым в систе-
мах между легкими и тяже-
лыми лантонидами (Nd-Gd,
Nd-Dy) [1].
Pm-Tb, Pm-Tm
9
Литература
1. Gshneidner, Jr., K.A., Calderwood F.W. // Handbook on the Physics and Chemistry of Rare
Earths. Amsterdam, New York, Oxford, Tokyo: North-Holland. Physics Publishing Co. 1986.
V. 8. Chap. 54. P. 1-161.
B.K. Григорович
Pm-Tm. ПРОМЕТИЙ-ТУЛИЙ
Фазовая диаграмма Pm-Tm экспериментально не построена. Pm и
Tm в металлическом состоянии изоэлектронны, имеют три коллективизи-
рованных валентных б^б^2 электрона. Плотные гексагональные
структуры аРт и Тт сходны между собой и имеют близкие параметры.
Атомные радиусы отличаются на 3,7 %. Вследствие близости электронно-
го, % (по массе)
Рис. 440. Pm - Tm
10
Pm-Tm, Pm-Y
кристаллического строения и атомных радиусов Рт и Тт при высоких
температурах должны образовывать непрерывный ряд ДГПУ-ГПУ
растворов, переходящих друг в друга по механизму дефектов упаковки.
В то же время система Pm-Tm из-за большой разницы температур
плавления, подобно системе Nd-Er, должна относиться к перитектическо-
му типу (рис. 440). В приближении идеальных растворов перитектическая
точка, определяемая пересечением прямых, соединяющих температуры
плавлений (1042-1545 °C) Рт и Тт, соответствует 1350 °C и 60 % (ат.)
Тт. Следует отметить, что превращение Тт имеет место в жидком
состоянии [1], когда расплав с ГПУ структурой переходит в расплав со
структурой ОЦК. При температуре 735 °C возникает фаза б типа aSm,
которая разделяет непрерывный ряд твердых растворов с ГПУ
структурой на растворы на основе aPm и Тт.
Литература
1. Григорович В.К., Григорович К.В. // Строение и свойства металлических и шлаковых
расплавов: Тезисы докладов на VII Всесоюзной конференции. Челябинск: ЧПИ, 1990. Т. 2.
Ч. 2. С. 250-252.
В. К. Григорович
Pm-Y. ПРОМЕТИЙ-ИТТРИЙ
Фазовая диаграмма Pm-Y экспериментально не построена. Рт и Y
имеют близкое электронное строение с тремя коллективизированными
валентными электронами Sd^s2 и 4dl5s2 в металлическом состоянии. Они
имеют изоморфные структуры высокотемпературных 0 модификаций,
аналогичные ДГПУ и ГПУ структуры а модификаций с близкими
параметрами решетки; атомные радиусы различаются всего лишь на
0,5 %.
Близость электронного и кристаллического строения Рт и Y должны
приводить к образованию непрерывных рядов твердых растворов со
структурой ОЦК между высокотемпературными модификациями и со
структурой ГПУ между низкотемпературными модификациями.
Вследствие малого различия параметров решеток и атомных размеров
растворы близки к идеальным, и линии ликвидуса-солидуса и сольвуса
мало отклоняются от прямых, соединяющих температуры плавлений и
превращений Рт и Y. На предлагаемой фазовой диаграмме (рис. 441)
эти линии разделены узкими двухфазными областями. При температурах
ниже 750 °C появляется промежуточная фаза (б) типа aSm по аналогии
с известными системами Nd-Tb, Nd-Y.
Pm-Y, Po-Pt
11
Рис. 441. Pm - Y
Литература
I. Gschneidner, Jr., K.A., Calderwood F.W. // Handbook on the Physics and Chemistry of Rare
Earths. Amsterdam, New York, Oxford, Tokyo: North-Holland Physics Publishing Co 1986
V. 8. Chap. 54. P. 1-161. ”
В. К. Григорович
Po-Pt. ПОЛОНИЙ-ПЛАТИНА
Диаграмма состояния Po-Pt неизвестна. Существует соединение PtPo2
^гексагональной структурой и параметрами решетки а - 0,4104, с -
- 0,5606 нм [Ш]. Это соединение разлагается при 600 °C.
В. П. Полякова
12
Po-Sb, Po-Sc, Ро-Sm, Po-Sn
Po-Sb. ПОЛОНИЙ-СУРЬМА
Диаграмма состояния Po-Sb не построена.
В работе [X] приводятся данные по растворимости Ро в Sb при
температурах несколько выше температуры плавления Sb, полученные
методом активационного анализа. Величина растворимости оценена в
~ КГ11 % (по массе).
Е.И. Гладышевский, О. И. Бодак, В. К. Печорский
Po-Sc. ПОЛОНИЙ-СКАНДИЙ
Диаграмма состояния Po-Sc не построена. При взаимодействии паров
Ро с массивным образцом Sc получен продукт с атомным отношением
Po:Sc = 0,07:2, плавящийся при температуре больше 1840+50 °C [1].
Однако эти результаты вызывают сомнение в отношении получения
действительно двойного соединения [Ш].
Литература
1. Kershner C.J., Steinmeyer R.H. // U.S. At. Energy Comm. MLM-1163. 1963. P. F1--F6.
Л.Л. Рохлин
Ро-Sm. ПОЛОНИЙ-САМАРИЙ
Диаграмма состояния Ро-Sm не построена. При взаимодействии
паров Ро с массивным образцом Sm получен продукт с атомным
отношением Po:Sm = 1,6:2, который плавится при температурах более
1495т50 °C [1]. Эти результаты, однако, вызывают сомнение в отношении
получения действительно двойного соединения [Ш].
Литература
1. Kershner C.J., Steinmeyer R.H.//U.S. At. Energy Comm. MLM-1 163. 1963. P. F1-F6.
Л.Л. Рохлин
Po-Sn. ПОЛОНИЙ-ОЛОВО
Диаграмма состояния Po-Sn не построена. В справочнике [X]
приводятся данные по растворимости Ро в Sn, которые получены
методом активационного анализа. Растворимость Ро в Sn составляет
10 11 % (по массе).
Е.И. Гладышевский, О.И. Бодак, В.К. Печорский
Po-Sr, Ро-Ta, Ро-Tb, Po-Te
13
Po-Sr. ПОЛОНИЙ-СТРОНЦИЙ
Диаграмма Po-Sr не построена. В системе существует соединение SrPo
[1], которое было получено сублимацией при температуре более 600 °C.
Кристаллическая структура соединений SrPo относится к типу NaCl
(символ Пирсона cFS, пр.гр. Fm 3m) са = 0,6796 нм.
Литература
1. Witteman W.G., Giorgi A.L., Vier D.T. H J. Phys. Chem. 1960. V. 64. N 4. P. 434-440.
Л.Л. Рохлин
Ро-Ta. ПОЛОНИЙ-ТАНТАЛ
Диаграмма состояния Ро-Ta не изучена. В работе [1] установлено, что
при воздействии паров Ро на Та не происходит взаимодействия Ро и Та
вплоть до температуры 700 °C.
Литература
1. Witteman W.G., Giorgi A.L., Vier D.T. // J. Phys. Chem. 1960. V. 64. N 4. P. 434-440.
Po-Tb. ПОЛОНИЙ-ТЕРБИЙ
Диаграмма состояния Po-Tb не построена. В работе [1] указывается,
что при взаимодействии паров Ро с массивным образцом ТЬ получен
продукт с атомным отношением Ро:ТЬ = 1,2:2, который плавится при
температурах более 1370т50 °C. Однако имеются сомнения в отношении
получения действительно двойного соединения [Ш].
Литература
1. Kershner C.J., Steinmeyer R.H. // U.S. At. Energy Comm. MLM-1 163. 1963. P. F1-F6.
Л.Л. Рохлин
Po-Te. ПОЛОНИЙ-ТЕЛЛУР
Диаграмма состояния Po-Te не исследована. Изучена только
растворимость Ро в Те при температурах несколько выше температуры
плавления Те [X]. Величина растворимости оценена в ~ 10“10 % (по массе).
Е. И. Гпадышевский, О. И. Бодак, В. К. Печорский
14
Po-Tm, Po-W, Po-Y
Po-Tm. ПОЛОНИЙ-ТУЛИЙ
Диаграмма состояния Po-Tm не изучена. При взаимодействии паров
Ро с массивным образцом Tm был получен продукт с атомным
отношением Ро:Тт = 0,6:2 [1]. Эти результаты, однако, вызывают
сомнение в отношении получения действительно двойного соединения
[Ш].
Литература
1. Kershner C.J., Steinmeyer R.H. // U.S. At. Energy Comm. MLM-1 163. 1963. P. F1-F6.
Л.Л. Рохлин
Po-W. ПОЛОНИЙ-ВОЛЬФРАМ
Диаграмма состояния Po-W не изучена. W не взаимодействует с Ро
при температурах вплоть до 700 °C [1]. По аналогии с диаграммами
Po-U, Ро-Ри, Ро образует с W вырожденную эвтектику при температуре,
практически совпадающей с температурой плавления Ро, а взаимная
растворимость элементов друг в друге находится на уровне примесной
растворимости.
Литература
1. Witteman W.G., Giorgi A.L., Vier D.T. // J. Phys. Chem. 1960. V. 64. N 4. P. 434-440.
К.Б. Поварова
Po-Y. ПОЛОНИЙ-ИТТРИЙ
Диаграмма состояния Po-Y не изучена. В работе [1] сообщается, что
при взаимодействии паров Ро с массивным образцом Y был получен
продукт с атомным отношением Po:Y = 2,1:2, который плавится при
температуре более 1700т50 °C. Однако эти результаты вызывают
сомнения в отношении получения действительно двойного соединения
[Ш].
Литература
1. Kershner С.J., Steinmeyer R.H. И U.S. At. Energy Comm. MLM-1163. 1963. P. F1-F6.
Л.Л. Рохлин
Po-Yb, Po—Zn, Pr—Pt
15
Po-Yb. ПОЛОНИЙ-ИТТЕРБИЙ
Диаграмма состояния Po-Yb не построена. В работе [1] указано, что
пары Ро реагируют с массивным образцом Yb и образуют продукт,
который плавится при температурах более 2400 °C. Состав этого
продукта не определен. Как указано в справочнике [Ш], вероятно, это
двойное нестабильное соединение.
Литература
1. Kershner C.J., Steinmeyer R.H. // U.S. Energy Comm. MLM-1 163. 1963. P. F1-F6.
Po-Zn. ПОЛОНИЙ-ЦИНК
Диаграмма состояния Po-Zn не построена. В работе [1] указано на
образование соединения PoZn, которое сублимируется при температуре
500 или 400 °C. Соединение PoZn имеет структуру типа ZnS (символ
Пирсона <?Е8, пр.гр. F43m), а = 0,6308 нм.
Литература
1. Witteman W.G., Giorgi A.L., Vier D.T. // J. Phys. Chem. 1960. V. 64. N 4. P. 434-440.
Pr-Pt. ПРАЗЕОДИМ-ПЛАТИНА
Диаграмма состояния Pr-Pt (рис. 442) построена только со стороны
Рг [1]. Она корректирована согласно данным работы [М]. При температу-
ре 718 °C и содержании 13,4 % (ат.) Pt в системе кристаллизуется
Рис. 442. Рг - Pt
16
Pr-Pt, Pr-Pu
эвтектика (aPr) + PrPt. При температуре 789 °C имеет место кататекти-
ческая реакция: (0Pr) (aPr) + Ж.
Растворимость Рг в (Pt) не исследовалась. Растворимость Pt в (aPr)
составляет менее 0,12 % (ат.), а в (РРг) - 0,45 % (ат.).
В системе установлено образование нескольких соединений,
кристаллическая структура которых приведена в табл. 346 [2].
Таблица 346. Кристаллическая структура соединений системы Pt-Pr
Соединение Прототип Символ Пирсона, пр.гр. Параметры решетки, нм
а b с
PrPt5 CaCu5 ЛР6, РЫттт 0,5348 - 0,4385
PrPt3 AuCu3 сР4, РтЗт 0,40650
PrPt2 MgCu2 cF24, Fd3m 0,76470
PrPt FeB оРЪ, Рпта 0,7294 0,4560 0,5698
Литература
1. Griffin R.B., Gschneidner, Jr., К.А. // Metal. Trans. 1971. V. 2. N 9. P. 2517-2524.
2. Благородные металлы: Справочник / Под ред. Е.М. Савицкого. М.: Металлургия,
1984. 592 с.
Pr-Pu. ПРАЗЕОДИМ-ПЛУТОНИЙ
Исследованию диаграммы состояния Pr-Pu посвящены работы [1,2].
Исследование выполнено методами дифференциального термического,
микроскопического и рентгеновского анализов, в качестве шихтовых
материалов были использованы металлы чистотой не менее 99,9 % (по
массе). Диаграмма состояния Pr-Pu (рис. 443) характеризуется полной
смешиваемостью компонентов в жидком состоянии, двойные соединения
не образуются. Твердый раствор, обозначенный (ос'Рг) с простой
гексагональной плотноупакованной структурой сосуществует с твердым
раствором (аРг) с двойной гексагональной структурой. Границы области
(а'Рг) на рис. 443 приведены штриховой линией. Однако существование
(а'Рг) как самостоятельной фазы вызывает сомнение. Эта фаза может
Pr-Pu
17
Рг, % (по массе)
Рис. 443. Рг - Ри
быть стабилизирована примесями, присутствующими в исследованных
сплавах, или образовываться вследствие распада (РРг) при понижении
температуры.
В системе протекает эвтектическая реакция Ж « (сРи) + (осРг) при
625 °C и -2,5 % (ат.) Рг и кататектическая реакция (рРг) « Ж + (аРг) при
794 °C и 70 % (ат.) Рг. Остальные реакции протекают в твердом
состоянии и связаны с полиморфизмом Ри.
Двухфазная область (аРг) + (рРг) очень узкая и имеет максимум при
801 °C и ~90%(ат.)Рг.
Максимальная растворимость Ри в (РРг) при температуре 794 °C
равна 30 % (ат.), а в (аРг) - 29 % (ат.). Растворимость Рг в (еРи) и (бРи)
составляет около 2 % (ат.), а в остальных модификациях Ри она
незначительна.
Литература
1. Кутайцев В.И., Чеботарев Н.Т., Андрианов М.А. и др. //Атомная энергия. 1967. Т. 23.
№6. С. 511-519.
2. Ellinger F.H., Land С.С., Johnson К.А. // J. Nucl. Mater. 1969. V. 29. N 2. P. 178-183.
*
Е.И. Гпадышевский, О.И. Бодак, В. К. Печарский
18
Pr-Re
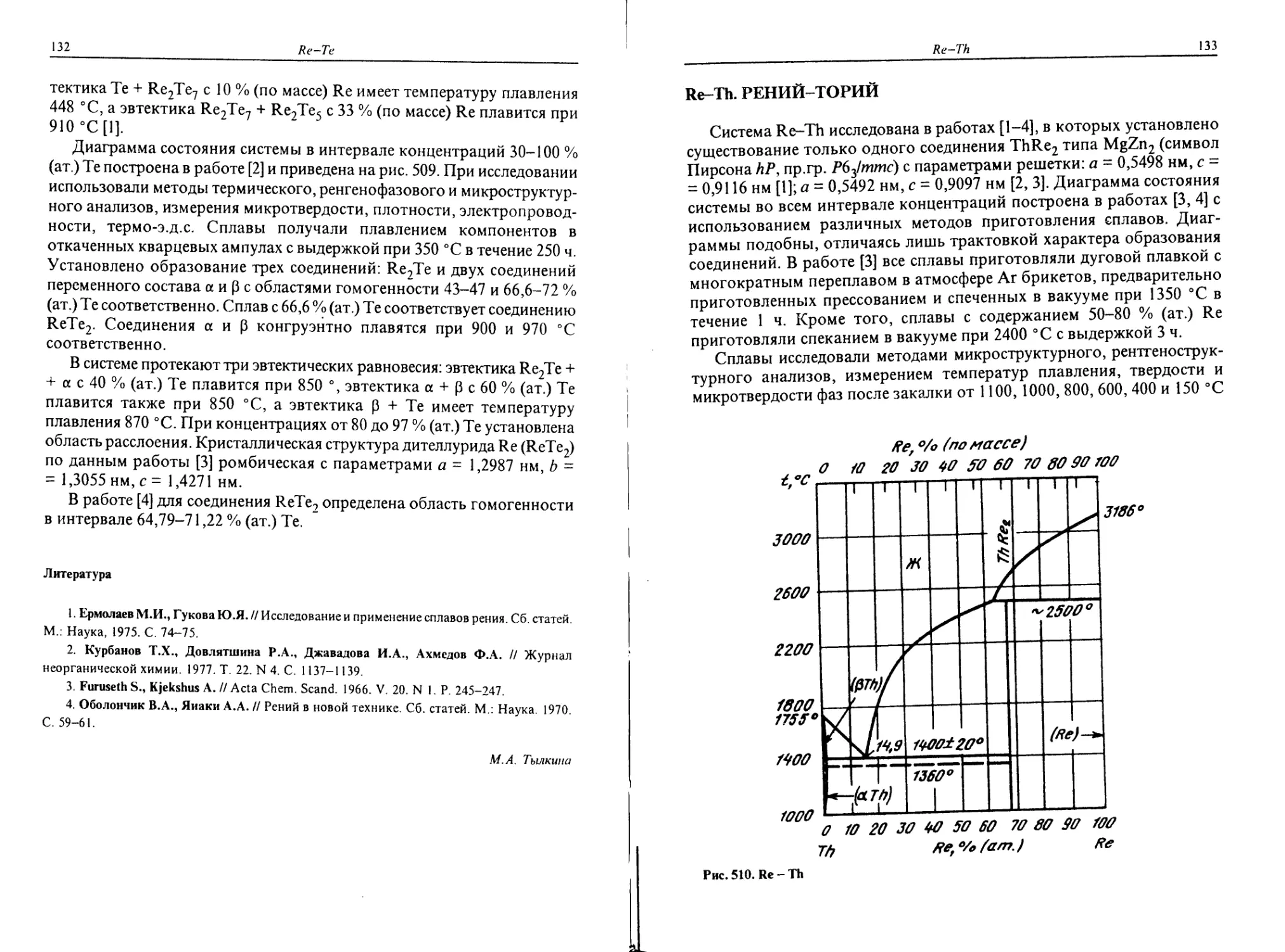
Pr-Re. ПРАЗЕОДИМ-РЕНИЙ
Диаграмма состояния Pr-Re полностью не исследована. Средняя часть
системы изучена в работе [1]. Исследование проведено методами
микроструктурного и рентгеновского анализа, а также измерением мик-
ротвердости фаз. Сплавы готовили из материалов чистотой, % (по массе):
99,98 Re и 99,0 Рг. Было установлено образование соединения PrRe2,
имеющего две модификации. Высокотемпературная модификация
кристаллизуется в кубической решетке фазы Лавеса типа Cu2Mg (символ
Пирсона с/24, пр.гр. Fd3m), параметр решетки а = 0,7572 нм.
Низкотемпературная модификация кристаллизуется в гексагональ-
ной решетке фазы Лавеса типа MgZn2 (символ Пирсона hP12, пр.гр.
Р63/ттс), параметры решетки а = 0,5336, с = 0,8805 нм. Температура
полиморфного превращения не установлена. Соединение PrRe2
стабильно и не имеет широкой области гомогенности. О наличии двух
Рг Ref’/O(am)
Рис. 444. Рг - Re
модификаций соединения PrRe2
сообщается также в работе [3].
Часть диаграммы состояния,
богатая Рг, изучена в работе [2]
(рис. 444). Сплавы готовили в
танталовых тиглях в атмосфере Не
и выдерживали в течение 1 ч при
температурах, превышающих
температуру плавления на
200-250 °C. Чистота исходных
материалов составляла 99,49 % (по
массе.) Рг и 99,99 % (по массе) Re.
Исследование проводили метода-
ми рентгеноструктурного, микрос-
труктурного и термического ана-
лизов. Было установлено, что Re
снижает температуру плавления Рг
примерно на 5 °C, так что при
температуре 926 °C кристаллизу-
ется эвтектика. Содержание Re в эвтектике составляет 0,24 % (ат.). С
повышением содержания Re наблюдается непрерывное повышение
температуры начала плавления сплавов.
Растворимость Re в жидкости при различных температурах приведена
ниже:
Температура расплава, °C................
Растворимость Re, % (ат.)...............
1140 1362 1480 1765
0,63 2,38 2,57 4,50
Pr-Re, Pr-Rh, Pr-Ru
19
Литература
1. Савицкий E.M., Хамидов O.X. // Изв. АН СССР. Неорганические материалы. 1965.
Т. I. №9. С. 1621-1622.
2. Griffin R.B., Gschneidner, Jr.,K.A. И Metal. Trans. 1971. V. 2. N 9. P. 2517-2524.
3. Гладышевский Е.И., Бодак О.И. Кристаллохимия интерметаллических соединений
редкоземельных металлов. Львов: Вища школа, 1982. 255 с.
М.А. Тылкина
Pr-Rh. ПРАЗЕОДИМ-РОДИЙ
Диаграмма состояния Pr-Rh не построена. Тем не менее имеются
сведения о существовании нескольких соединений в этой системе. В
табл. 347 собраны сведения о составах и структуре всех известных
двойных фаз системы Pr-Rh [V-С].
Таблица 347. Кристаллическая структура соединений системы Pr-Rh |V-C]
Соединение Прототип Символ Пирсона, пр.гр. Параметры решетки, нм
a Ь с
Pr7Rh3 Th7Fe3 ЛР20, PG^/mc 1,0012 - 0,6846
Pr3Rh2 Ег3М12 hR, КЗ 0,8784 - 1,668
Pr5Rh4 Sm5Ge4 oP, Pnma 0,7465 1,483 0,7707
PrRh CrB oCZ, Cmcm 0,3905 1,0910 0,4210
PrRh2 MgCu2 cF24, Fd^m 0,7575 - -
Е.И. Гладышевский, О.И. Бодак, В.К. Печорский
Pr-Ru. ПРАЗЕОДИМ-РУТЕНИЙ
Диаграмма состояния Pr-Ru не построена. По данным работ [1, Э,
Ш, V-С] в системе существует не менее трех промежуточных фаз.
Соединение PrRu2 образуется инконгруэнтно при температуре
1681 ± 15 °C [Ш]. Кристаллическая структура промежуточных фаз
приведена в табл. 348.
20
Pr-Ru, Pr-S
T а б л и ц a 348. Кристаллическая структура соединений системы Pr-Ru |V-C]
Соединение Прототип Символ Пирсона, пр.гр. Параметры решетки, нм
а b с
PrRu2 MgCu2 сПА, Fd3m 0,76223 - -
Pr3Ru Fe3C oP\f>, Pnma 0,7379 0,9768 0,6435
Pr5Ru2* Mn5C2 /пС28, Cllc 1,6424 0,6545 0,7341
*Р = 96,26°.
Литература
1. Гладышевский Е.И., Бодак О.И. Кристаллохимия интерметаллических соединений
редкоземельных металлов. Львов: Вища школа, 1982. 255 с.
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
Pr-S. ПРАЗЕОДИМ-СЕРА
Диаграмма состояния Pr-S не построена. В работах [1-5] имеются
данные о существовании в системе нескольких промежуточных фаз,
структура которых приведена в табл. 349.
Моносульфид PrS плавится при 2230 °C [Э]; его область гомогенности
описывается формулой PrS0 75_| или PrS0 84-1 [1]. Фаза Pr3S4 плавится при
2100 °C [Э]. Соединение Pr2S3 существует в трех модификациях. При
температуре 1795 °C кристаллизуется высокотемпературная модифика-
ция yPr2S3, существующая до температуры 1300 °C. Соединение yPr2S3
образует непрерывный ряд твердых растворов с фазой Pr3S4, его состав
соответствует формуле PrSj 33_j 50 [1]. В интервале температур
1300-925 °C стабильна фаза pPr2S3 [Э]. При температурах ниже 925 °C
существует модификация aPr2S3 [Э]. По данным работы [2] соединение
pPr2S3 не существует. Вместо этого соединения авторы работы [3]
обнаружили при температуре 1100 °C соединение Pr48_5S7.
Pr-S, Pr-Sb
21
Таблица 349. Кристаллическая структура соединений системы Pr-S
Соединение Прототип Символ Пирсона, пр.гр. Параметры решетки, нм Источник
а b с
PrS \ NaCl / cF8, Fm Зт 0,5727 - - О]
Pr5S^ - 14^/acd 1,510 - 2,005 [4]
aPr2S3 оР20, Рпта 0,749 0,7472 1,569 1,5604 0,410 0,4058 [5] [2]
pPr2S3 pNd2S3 cF_, Fd3m 1,995 - - [6]
YPr2S3 Th3P4 с12Ъ, 143 d 0,8589 - - [6]
Pr3S4 - l_I, 742 d 0,8539 - 0,8539 [7]
PrS2 LaS2 - 0,808 - - [Э]
PrS2 (Pr4S7) La4Te7 ZP44, P462 0,798 - 0,807 [1,8]
Литература
1. Ярембаш Е.И., Елисеев А.А. Халькогениды редкоземельных элементов. М.: Наука,
1975. 258 с.
2. Sleight A.W., Prewitt С.Т. И Inorgan. Chem. 1968. V. 7. N 11. Р. 2232-2237.
3. Besancon Р. // Comp. Rend. Acad. Sci. C. 1968. V. 67. N 7. P. 1130-1132.
4. Besancon P., Adolphe C., Fiahaut J. et. al. // Mat. Res. Bull. 1969. V. 4. N 2. P. 227-231.
5. Besancon P., Adolphe C., Fiahaut J. // Comp. Rend. Acad. Sci. С. V. 266. N 1. P. 111-113.
6. Picon M., Domanbge L., Fiahaut J.//Bull. Soc. Chim. France. 1960. V. 26. N 2. P. 221-228.
7. Dernier P.-D., Bucher E., Longinotti L.D. // J. Solid State Chem. 1975. V. 15. N 2.
P. 203-207.
8. Елисеев A.A., Толстова B.A., Кузьмичева Г.М. // Журнал неорганической химии. 1978.
Т. 23. № 12. С. 3171-3180.
Pr-Sb. ПРАЗЕОДИМ-СУРЬМА
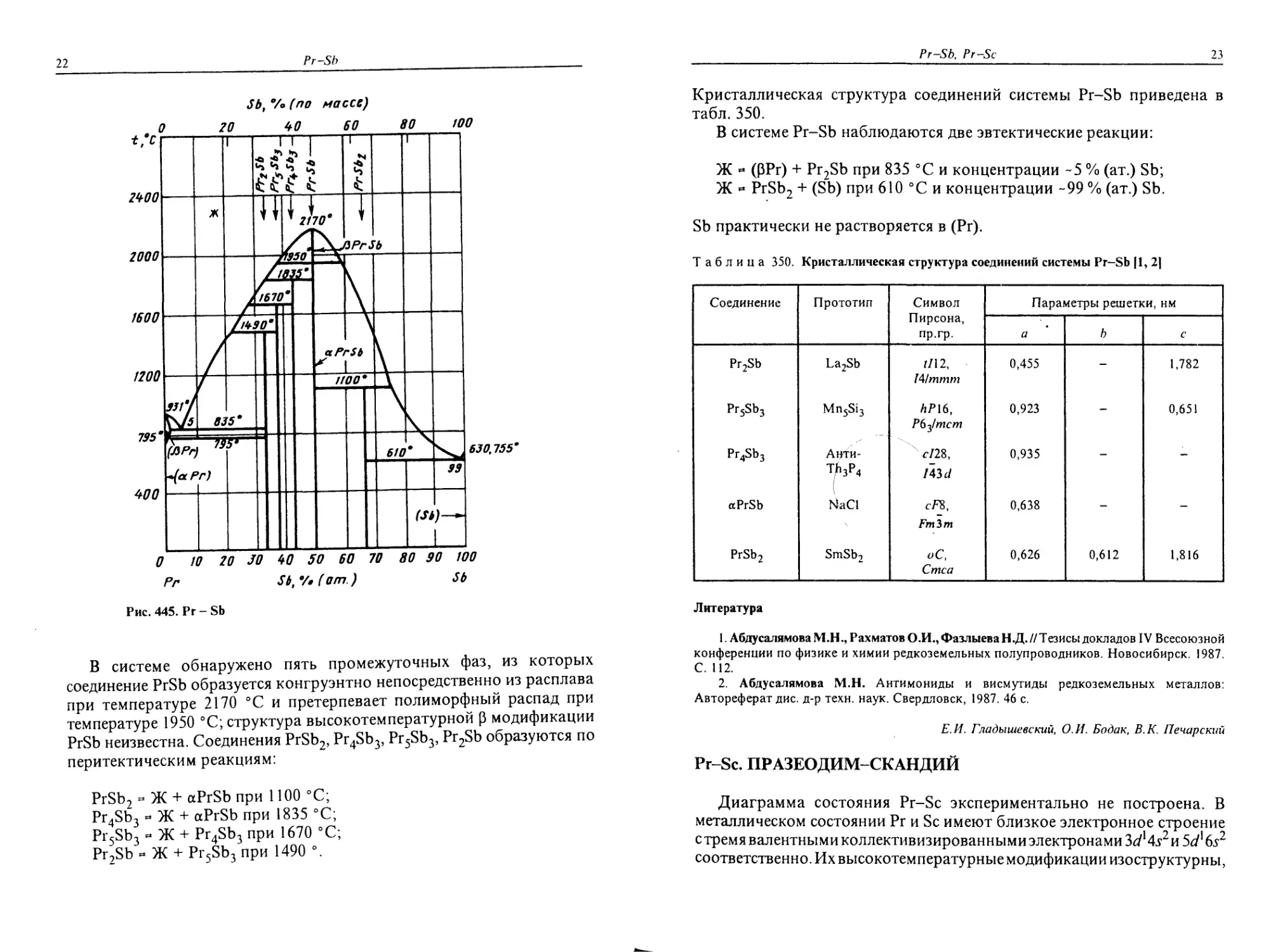
Диаграмма состояния Pr-Sb (рис. 445) построена по результатам
Дифференциального термического, рентгенофазового и микроструктур-
ного анализов [1-2].
22
Pr-Sb
Pr Sb, 7» (am.) Sb
Рис. 445. Pr - Sb
В системе обнаружено пять промежуточных фаз, из которых
соединение PrSb образуется конгруэнтно непосредственно из расплава
при температуре 2170 °C и претерпевает полиморфный распад при
температуре 1950 °C; структура высокотемпературной р модификации
PrSb неизвестна. Соединения PrSb2, Pr4Sb3, Pr5Sb3, Pr2Sb образуются по
перитектическим реакциям:
PrSb2 - Ж + aPrSb при 1100 °C;
Pr4Sb3 ~ Ж + aPrSb при 1835 °C;
Pr5Sb3 » Ж + Pr4Sb3 при 1670 °C;
Pr2Sb « Ж + Pr5Sb3 при 1490 °.
Pr-Sb, Pr-Sc
23
Кристаллическая структура соединений системы Pr-Sb приведена в
табл. 350.
В системе Pr-Sb наблюдаются две эвтектические реакции:
Ж « (РРг) + Pr2Sb при 835 °C и концентрации -5 % (ат.) Sb;
Ж « PrSb2 + (Sb) при 610 °C и концентрации -99 % (ат.) Sb.
Sb практически не растворяется в (Рг).
Т а б л и ц а 350. Кристаллическая структура соединений системы Pr-Sb [1, 2]
Соединение Прототип Символ Пирсона, пр.гр. Параметры решетки, нм
a b c
Pr2Sb La2Sb Z/12, Mlmmm 0,455 - 1,782
Pr5Sb3 Mn5Si3 hP\6, Pbyhncm 0,923 - 0,651
Pr4Sb3 Анти- TbP4 \c/28, /43 d 0,935 - -
aPrSb NaCl cF8, Fmlm 0,638 - -
PrSb2 SmSb2 oC, Cmca 0,626 0,612 1,816
Литература
1. Абдусалямова М.Н., Рахматов О.И., Фазлыева Н.Д. И Т езисы докладов IV Всесоюзной
конференции по физике и химии редкоземельных полупроводников. Новосибирск. 1987.
С. 112.
2. Абдусалямова М.Н. Антимониды и висмутиды редкоземельных металлов:
Автореферат дис. д-р техн. наук. Свердловск, 1987. 46 с.
Е.И. Гладышевский, О. И. Бодак, В. К. Печарский
Pr-Sc. ПРАЗЕОДИМ-СКАНДИЙ
Диаграмма состояния Pr-Sc экспериментально не построена. В
металлическом состоянии Рг и Sc имеют близкое электронное строение
стремя валентными коллективизированными электронами 3d1 А^иб^'б.?2
соответственно. Их высокотемпературные модификации изоструктурны,
24
Pr-Sc
низкотемпературные гексагональные модификации ДГПУ аРг и ГПУ
aSc имеют сходное строение, но существенно отличаются по параметрам
а и с. Разница атомных радиусов составляет 11,5 %. Исходя из этого
следует ожидать, что в системе Pr-Sc изоморфные высокотемпературные
модификации при кристаллизации будут образовывать непрерывные
ряды твердых растворов. При понижении температуры до -700 °C
растворы (РРг, pSc) распадаются по эвтектической реакции на твердые
растворы (аРг) с решеткой ДГПУ и (aSc) с решеткой ГПУ (рис. 446).
Растворимость Sc в (аРг) и Рг в (aSc) будет выше, чем в системах La-Sc
и Ce-Sc вследствие меньшей разницы атомных радиусов.
В. К. Григорович
Pr-Se
25
Pr-Se. ПРАЗЕОДИМ-СЕЛЕН
Диаграмма состояния Pr-Se (рис. 447) построена в работе [1]. В
системе достоверно установлено существование пяти промежуточных
фаз, из которых PrSe плавится конгруэнтно, а соединения Pr3_xSe4,
Pr4Se7±x, PrSe2_x, Pr3Se7±x образуются по перитектическим реакциям. В
интервале концентраций между PrSe и Pr3_xSe4 предполагается
образование по перитектической реакции еще одного соединения.
Соединение Pr3_xSe4 гомогенно в пределах концентраций 57,14-59,97 %
(ат.) Se (при х - 0-0,33), соединение Pr4Se7±x гомогенно в пределах
концентраций 62,96-64,28 % (ат.) Se (при 0 < х < 0,2). Область гомоген-
ности фазы PrSe2 простирается от 64,3 до 65,5 % (ат.) Se [2]. Кристалли-
ческая структура промежуточных фаз в системе Pr-Se приведена в
табл. 351. При температурах ниже -233 °C кубическая структура Pr3Se4
деформируется в тетрагональную [3].
Рг Se, % (ат.) Se
Рис. 447. Рг - Se
26
Pr-Se
В области высокого содержания Se при температуре 1090 °C в системе
Pr-Se имеет место монотектическая реакция [1]. Температуры нонвариан-
тных превращений со стороны Рг и Se практически совпадают с
температурами плавления компонентов. Температура нонвариантного
превращения 780 °C заметно ниже температуры связанного с ним
полиморфного превращения Рг (795 °C). Это указывает на эвтектоидный
характер превращения со стороны Рг.
Таблица 351. Кристаллическая структура соединений системы Pr-Se
Соединение Прототип Символ Пирсона, пр.гр. Параметры решетки, нм Источник
a b c
PrSe NaCl cF8, Fmlm 0,5947 0,5952 - - [Э] [Э]
Pr3-xSe4 Th3p4 cI2%, 743 d или 0,8881- -0,8895 0,89038 - - [2] [3]
- tl, 142 d 0,8844 - 0,8890 [3]
Pr4Se7ii - tP, P'Mmbm или 0,844 — 0,849 [2]
La4Se7 mP, P2x!a 0,844 0,832 0,844 0,832 0,849 0,843 [4]* [5]
prSe2_v *0 = 90,0° SbCu2 [4, 5]. tP6, P4/nmm 0,4170 - 0,8400 [2]
Литература
1. Калитин В.И., Ярембаш Е.И., Лужная Н.П. И Известия АН СССР. Неорганические
материалы. 1966. Т. 2. N 11. С. 1930-1938.
2. Ярембаш Е.И., Елисеев А.А., Калитин В.И., Антонова Л.И. И Известия АН СССР.
Неорганические материалы. 1966. Т. 2. N 6. С. 984-990.
3. Dernier P.D., Ducher Е., Longinotti L.D. И J. Solid State Chem. 1975. V. 15. N 2.
P. 203-207.
4. Елисеев A.A., Ярембаш Е.И. И Известия АН СССР. Неорганические материалы. 1967.
Т. 3. N 9. С. 1467-1471.
5. Елисеев А.А., Кузнецов В.Г., Новицкая Г.Н. // Химическая связь в кристаллах. Минск.
Наука и техника, 1969. С. 372-376.
Ю.Б. Кузьма
Pr-Si
27
Рг-Si. ПРАЗЕОДИМ-КРЕМНИЙ
Диаграмма состояния Pr-Si (рис. 448) исследована методами
дифференциального термического, микро- и рентгеноструктурного
анализов [1]. Для исследования использовали Рг чистотой 99,75 % (по
массе) Si и чистотой 99,99 % (по массе).
В системе Pr-Si установлено пять соединений, из которых PrSi и PrSi, 8
образуются конгруэнтно при температурах 1657 и 1712 °C соответствен-
но. Соединение PrSi, 8 претерпевает полиморфное превращение,
температура которого требует уточнения. Соединения Pr5Si4 и Pr5Si3
образуются по перитектическим реакциям:
Ж + PrSi « Pr5Si4 при 1532 °C;
Ж + Pr5Si4 * Pr5Si3 при 1417 °C.
Соединение Pr3Si4 образуется в твердом состоянии по перитектоидной
Рис. 448. Рг - Si
28
Pr—Si
реакции при температуре 1352 °C. Существование ранее известного
соединения Pr3Si2 [2] не было подтверждено в работе [1].
В системе существуют три эвтектических равновесия:
Ж - (Si) + PrSij 8 при 1212 °C и 83 % (ат.) Si;
Ж - PrSi j 8 + PrSi при 1542 °C и 58 % (ат.) Si;
Ж - Pr5Sig + (Рг) при 732 °C и 11 % (ат.) Si.
Взаимная растворимость компонентов друг в друге практически
отсутствует [1].
Кристаллическая структура промежуточных фаз системы Pr—Si
приведена в табл. 352.
Таблица 352. Кристаллическая структура соединений системы Pr-Si [2|
Соединение Прототип Символ Пирсона, пр.гр. Параметры решетки, нм
a b c
Pr5Si3 Сг5В5 Z/32, 14lmcm 0,793 - 1,397
Pr5Si4 Zr5Si4 tP36, P4]2]2 0,790 - 1,491
PrSi FeB oP8, Pnma 0,829 0,394 0,594
PPrSi । 8 aThSi2 an, 14\lamd 0,429 - 1,376
aPrSi| 8 aGdSi2 ol\2, Imma 0,417 0,411 1,385
Литература
1. Еременко В.Н., Мелешевич К.А., Буянов Ю.И. И Изв. Вузов. Цветная металлургия.
1986. N 3. С. 82-87.
2. Гладышевский Е.И., Бодак О.И. Кристаллохимия интерметаллических соединений
редкоземельных металлов. Львов: Вища школа. 255 с.
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
Pr-Sm
29
Pr-Sm. ПРАЗЕОДИМ-САМАРИЙ
Диаграмма состояния Pr-Sm экспериментально не построена. Рг и Sm
близко расположены в Периодической системе, имеют в металлическом
состоянии идентичное электронное строение с тремя коллективизиро-
ванными5<7!6.г электронам и, изоморфные структуры высокотемператур-
ных модификаций и почти одинаковые гексагональные структуры ДГПУ
аРг и ГПУ pSm с близкими параметрами решеток. Их атомные радиусы
f>r Sm, % (am.) Sm
Рис. 449. Pr - Sm
отличаются всего на 1,3 %. На этом основании следует предположить,
что Рг и Sm должны образовывать друг с другом непрерывные ряды
идеальных растворов.
Вследствие идеальности растворов линии солидуса и ликвидуса и две
линии сольвуса представлены на диаграмме (рис. 449) слившимися
практически в прямые линии с предполагаемой узкой двухфазной
областью между ними.
На основе aSm образуется область растворов, содержащих до 15-25 %
(ат.) Рг. Над нею происходит переход от ДГПУ к ГПУ растворам по
механизму образования дефектов упаковки.
В. К. Григорович
30
Pr—Sn
Pr-Sn. ПРАЗЕОДИМ-ОЛОВО
Диаграмма состояния Рг-Sn (рис. 450) построена в работе [1] на
основании собственных экспериментальных и литературных данных.
Диаграмма Pr-Sn характеризуется образованием шести соединений:
Pr3Sn, Pr5Sn3, Pr5Sn4, PrSn, Pr3Sn5, PrSn3. Фазы Pr5Sn3 и PrSn3 существуют
в двух модификациях. Кристаллическая структура промежуточных фаз
системы Pr-Sn представлена в табл. 353.
Рис. 450. Рг - Sn
Моновариантные и нонвариантные превращения, наблюдаемые в
системе Pr-Sn, представлены в табл. 354. Эвтектические точки в реакциях
Ж « (РРг) + + Pr3Sn и Ж PrSn + PrSn3 находятся при 10 и -67 % (ат.)
Sn соответственно.
Pr-Sn
31
Таблица 353. Кристаллическая структура соединений системы Pr-Sn
Соедине- ние Прото- тип Символ Пирсона, пр.гр. Параметры решетки, нм Источник
a b c
aPr5Sn3 W5Si3 r/32, I4lmcm 1,2512 - 0,6146 [V-C]
pPr5Sn3 Mn5Si3 hP\b, P^j/mcm 0,9275 0,9287 - 0,6752 0,6577 [V-C] [1]
Pr5Sn4 Sm5Ge4 oP36, Pnma 0,8270 1,594 0,8429 [V-C]
PrSn3 AuCu3 cP4, Pm 3m 0,4713 0,4716 - - [V-C] [1]
aPr3Sn5 Pii3Pd5 oC32, Cmcm 1,018 0,821 1,054 [1]
Таблица 354. Моно- и нонвариантные превращения в системе Pr-Sn
Превращение Температура, °C Характер превращения
Ж » (РРг) + Pr3Sn 794±8 Эвтектическое
Ж + pPr5Sn3 ° Pr3Sn 942± 16 Перитектическое
Ж - 0Pr5Sn3 1610 Плавление
Ж + pPr5Sn3 ° Pr5Sn4 1440±8 Перитектическое
Ж + Pr5Sn4 » PrSn 1253±7 11
Ж - PrSn + PrSn3 1169±8 Эвтектическое
Ж » PrSn3 1180 Плавление
Ж + PrSn3 = (Sn) 235±5 Перитектическое
PrSn + PrSn3 = pPr3Sn5 1152+2 Перитектоидное
PPr3Sn5 я aPr3Sn5 1129±6 Полиморфное
PPr5Sn3 ° aPr5Sn3 352+7
(PPr) » (aPr) + Pr3Sn 754±8 Эвтектоидное
32
Pr-Sn, Pr-Ta
Литература
1. Еременко В.Н., Бурлакова М.В., Листовичий В.Е., Петюх В.М. И Украинский
химический журнал. Т. 54. N 8. С. 787-795.
Рг-Ta. ПР АЗЕО ДИМ-ТАНТАЛ
Л.Л. Рохлин
Диаграмма состояния Рг-Ta (рис. 451) построена в области богатой
Рг [М]. По данным работы [1] в системе Рг-Ta существует широкая
область расслоения в жидком состоянии. Промежуточные фазы не
Та, */» (по массе)
Рг Та, 7. (ат.)
Рис. 451. Рг - Та
обнаружены. Растворимость Та в жидком Рг растет в интервале
температур 1200-2000 °C от 0,0397 до 0,1746 % (ат.). Растворимость Та
в жидком Рг при температуре плавления 931 °C составляет 0,0055 % (ат.)
[1].
Литература
1. Dennison D.H., Tschetter M.J., Gschncidner, Jr., K.A. // J. Less-Common Met. 1966. V. 11.
N 6. P. 423-435.
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
Pr-Tb, Pr-Tc, Pr-Te
33
Pr-Tb. ПРАЗЕОДИМ-ТЕРБИЙ
Диаграмма состояния Pr-Tb не построена. В работе [1] сообщается
о некоторых результатах определения взаимной растворимости
компонентов в системе методом рентгеноструктурного анализа. На
основе Рг и ТЬ существуют ограниченные твердые растворы. (аРг)
растворяет до 28,4 % (ат.) ТЬ; (аТЬ) растворяет до 20 % (ат.) Рг.
Обнаружена одна промежуточная фаза со структурой типа aSm, символ
Пирсона hR3, пр.гр. R Зт, а = 0,3626 нм, с = 2,617 нм. Ей приписана
формула РГ|_гТЪг, где* = 0,501 ...0,665 [V-C].
Литература
1. Speight J.D.,Harris L.R., Raynor G.V. // J. Less-Common Met. V. 15. N 3. P. 317-330.
Е.И. Гладышевский, О.И. Бодак, В.К. Печорский
Рг-Тс. ПРАЗЕОДИМ-ТЕХНЕЦИЙ
Диаграмма состояния Рг-Тс не построена. При рентгеновском
исследовании сплава Рг, содержащего 66,7 % (ат.) Тс и отожженного при
900 °C, не выявлено ни одной из фаз Лавеса (типа MgZn2, MgCu2 или
MgNi2) [1,Ш].
Литература
1. Darby J.B., Norton L.J., Downey J.W. // J. Less-Common Met. 1964. V. 6. P. 165-167.
Е.И. Гладышевский, О.И. Бодак. В.К. Печорский
Рг-Те. ПРАЗЕОДИМ-ТЕЛЛУР
Диаграмма состояния Рг-Те (рис. 452) построена по результатам
дифференциального термического, микроструктурного и рентгеновско-
го анализов [1]. Для приготовления сплавов использован Рг с содержани-
ем примесей 0,5-0,6 % (по массе) и Те с содержанием примесей 0,01 % (по
массе).
В системе обнаружено девять промежуточных фаз, из которых РгТе
и Рг3Те4 образуются конгруэнтно при температурах 1950±50 и
1650±50 °C соответственно. Соединения Рг2Те3, Рг4Те7, РгТе| 9, Рг3Те7,
Рг2Те5, Рг4Тен, РгТе3 образуются по перитектическим реакциям при
температурах 1500±50, 1280±20, 1210±20, 1140±20, 880, 830 и 455 °C
соответственно. Концентрационные пределы областей гомогенности
соединений приведены ниже:
34
Pr-Те
Те, */• (по массе)
Рис. 452. Рг - Те
Соединение ............
Концентрация Те, % (ат.) .
Рг3Те4 Рг4Те7 РгТе, 9 Рг3Те7 Рг2Те5 РгТе3
57,2-60 62,7-64 64,3-65,5 69,5-70,5 71,8-72 74-74,5
Кристаллическая структура промежуточных фаз приведена в
табл. 355. В работе [1] предполагается, что структура соединений Рг3Те7
и Рг4Теи относится к тетрагональной сингонии.
В системе наблюдаются три эвтектических реакции:
Ж - (РРг) + РгТе при 905 °C и -5-7 % (ат.) Те;
Ж •» РгТе + Рг3Те4 при 1560 °C и 56 % (ат.) Те;
Ж - РгТе3 + (Те) при 445 °C.
Pr-Те, Pr-Th
35
Таблица 355. Кристаллическая структура соединений системы Рг-Те
Соединение Прототип Символ Пирсона, пр.гр. Параметры решетки, нм Источник
a с
РгТе NaCl cF8, 0,6307 — [1]
Fm3m 0,6322 — [2]
Рг3Те4 Th3P4 с/28, 0,9481 — [И
/43 d 0,9487 — [4]
Рг2Те3 Th3P4 cI2&, 0,9482 — [1]
143 d 0,9481 — [1]
Рг4Те7 - tP, P4/mbm 0,8853 0,9064 [1]
РгТе19 Анти- tP6, 0,4459 0,9072 [1]
Cu2Sb P4lnmm 0,446-0,444 0,905-0,906 [5]
Рг2Те; - - 0,436 ? [1]
РгТе/ - 0,4374 2,557 [1]
Тетрагональная сингония.
Литература
1. Ярембаш Е.И., Вагилева Е.П. И Изв. АН СССР. Неорганические материалы. 1970.
Т. 6. N 9. С. 1572-1578.
2. landelli А. // Atti Accad. Nazi. Linsei Rend. Classe Sci Fis. Mat. 1960. V. 29. P. 62-69.
3. Жузе В.П., Голубков А.В., Гончарова E.B. и др. И Физика твердого тела. 1964. Т. 6.
С. 257-267.
4. Prado М.Р., Flahaut J., Domange L. // Compt. Rend. 1963. V. 256. P. 1793-1796.
5. Prado M.P., Flahaut J., Domange I. H Compt. Rend. 1963. V. 256. P. 953-955.
Н.И. Никитина
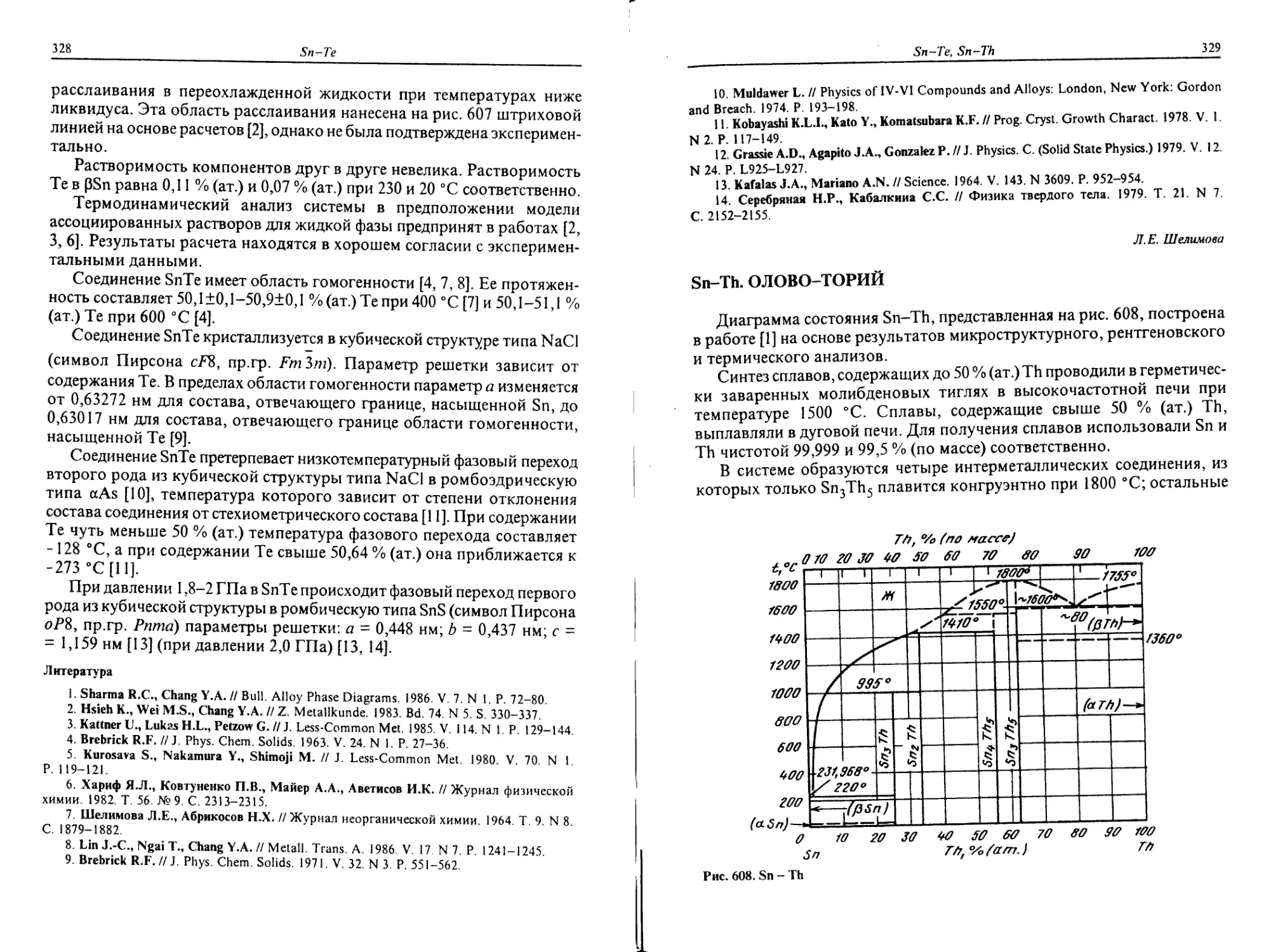
Pr-Th. ПРАЗЕОДИМ-ТОРИЙ
Диаграмма состояния Pr-Th (рис. 453) исследована методами
дифференциального термического, микро- и рентгеноструктурного
Диализов и измерения твердости сплавов [1]. Система Pr-Th характеризу-
ется образованием непрерывного ряда твердых растворов с ОЦК
36
Pr-Th
Th РГ'°/о (am.) Pr
Рис. 453. Pr - Th
решеткой между высокотемпературными модификациями Th и Pr.
Твердый раствор на основе aTh простирается до 80 % (ат.) Рг. Твердый
раствор на основе аРг имеет небольшую протяженность. Растворимость
Th в (аРг) резко снижается с понижением температуры и при 650 °C
приближается к 0. Перитектоидное превращение (0Th, 0Рг) + (aTh) « (aPr)
протекает при -940 °C; концентрация Рг, % (ат.), в участвующих в
превращении фазах составляет 85 для (0Th, 0Рг), 80 для (aTh), 82 для
(аРг). Предложенный в работе [1] вариант диаграммы состояния Pr-Th
является предпочтительнее, чем вариант диаграммы, опубликованный
в работе [2].
Литература
1. Бадаева Т.А., Кузнецова Р.И.// Известия АН СССР. Металлы. 1967.№ 1. С. 175-181.
2. Niemiec J. И Roczn. Chem. 1968. V. 42. N 13. Р. 413-419.
Л.Л. Рохлин
Pr-Ti. Pr-Tl
37
Pr-Ti. ПРАЗЕОДИМ-ТИТАН
По данным справочника [Ш] диаграмма состояния Pr-Ti описывается
как монотектическая с широкой областью несмешиваемости компонен-
тов в жидком состоянии и почти полной нерастворимостью в твердом.
Е.И. Гладышевский, О.И. Бодак, В.К. Печорский
Pr-Tl. ПРАЗЕОДИМ-ТАЛЛИЙ
Диаграмма состояния Рг-Т1 (рис. 454) исследована методами
дифференциального термического, микро- и рентгеноструктурного
анализов [1]. Для изготовления сплавов использовали Рг чистотой 99,9 %
и Т1 чистотой 99,99 % (по массе).
Рг П,а/а (ат.) TL
Рис. 454. Рг - Т1
38
Pr-Tl
В системе Pr-Tl установлено образование шести промежуточных фаз,
из которых РгТ1, Рг3Т15, РгТ13 образуются конгруэнтно из расплава при
температурах 1260, 1120, 1065 °C соответственно. По перитектическим
реакциям образуются три других соединения:
Рг3Т1 « Ж + Рг2Т1 при 800 °C;
Рг2Т1 - Ж + Рг5Т13 при 940 °C;
Рг5Т13 - Ж + РгТ1 при 1020 °C.
Кристаллическая структура промежуточных фаз системы Рг-Т1 приведена
в табл. 356.
В системе наблюдаются четыре эвтектических равновесия:
Ж - (РРг) + Рг3Т1 при 767 °C и 13,9 % (ат.) Т1;
Ж « РгТ1 + Рг3Т15 при 1090 °C и 58 % (ат.) Т1;
Ж - Рг3Т15 + РгТ13 при 1035 °C и 69 % (ат.) Т1;
Ж « РгТ13 + (РТ1) - вырожденная эвтектика при 304 °C и менее 0,5 %
(ат.) Т1.
Растворимость Рг в (Т1) практически отсутствует [1]. В (0Рг)
растворяется ~9 % (ат.) Т1 при температуре эвтектики; в (аРг) ~2,5 % (ат.)
Т1 при температуре эвтектоидного распада 687 °C [2].
Та б л и и а 356. Кристаллическая структура соединений системы Pr-Tl |3, V-C]
Соединение Прототип Символ Пирсона, пр.гр. Параметры решетки, нм
а b с
Рг3Т1 AuCu3 сР4, РтЗт 0,4926 - -
Рг2Т1 Ni2ln hPb, Рб^/ттс 0,5522 - 0,6869
Рг5Т13 W5Si3 И32, IMmcm 1,2553 - 0,6172
PrTI CsCl сР2, Рт Зт 0,3895 - -
Рг3Т15 Pu3Pd5 оС32, Стет 0,828 0,3867 1,026
РгТ13 AuCu3 сР4, РтЗт 0,4752 - -
1
Pr-Tl, Pr-Tm
39
Литература
1. Delfino S., Saccone A., Ferro R. // J. Less-Common Met. 1981. V. 79. N 1. P. 47-55.
2. Griffin R.B., Gschneidner, Jr., K.A., // Metal. Trans. 1971. V. 2. N 9. P. 2517-2524.
3. Гладышевский Е.И., Бодак О.И. Кристаллохимия интерметаллических соединений
редкоземельных металлов. Львов: Вища школа. 1982. 255 с.
Е.И. Гладышевский, О.И. Бодак, В.К. Печорский
Pr-Tm. ПРАЗЕОДИМ-ТУЛИЙ
Диаграмма состояния Pr-Tm экспериментально не построена. Рг и
Tm в металлическом состоянии изоэлектронны, имеют три коллективизи-
рованных валентных электрона 5£/|б52. Плотные гексагональные
структуры ДГПУ аРг и ГПУ Tm имеют близкие параметры решеток.
Атомные радиусы отличаются на 4,7 %.
Вследствие близости электронно-кристаллического строения и малой
разницы атомных радиусов Рг и Tm при высоких температурах должны
40
Pr-Тт, Pr-U
образовывать непрерывный ряд твердых растворов ДГПУ-ГПУ,
переходящих друг в друга по механизму дефектов упаковки. Система
Рг-Тт, аналогично системе Nd-Er, относится к перитектическому типу.
В приближении идеальных растворов перитектическая точка, отвечаю-
щая пересечению прямых плавления и превращения [1], соответствует
температуре 1270 °C и 55 % (ат.) Тт (рис. 455). Над ликвидусом богатых
Тт сплавов указана линия превращения ближнего порядка расплавов
Жту-Жопк’ отвечающая температуре полиморфного превращения в
Тт при 1655 °C [1]. При температуре ниже -735 °C в системе образуется
фаза б со структурой aSm.
Литература
1. Григорович В.К., Григорович К.В. // Строение и свойства металлических и шлаковых
расплавов: Тезисы докладов на VII Всесоюзной конференции. Челябинск: ЧПИ, 1990. Т. 2.
Ч. 2. С. 250-252.
В. К. Григорович
Pr-U. ПРАЗЕОДИМ-УРАН
Диаграмма состояния Pr-U (рис. 456) построена теоретически по
аналогии с системой Nd-U [1] с учетом результатов работы [2]. Система
характеризуется обширной областью несмешиваемости компонентов в
жидком состоянии. Отмечается заметная растворимость Рг в (yU).
Значения растворимости компонентов друг в друге в жидком состоянии
приведены в табл. 357.
Таблица 357. Взаимная растворимость Рг и U в жидком состоянии [2, Э|
Температура, °C Растворимость Рг в Тт Растворимость Тт в U
% (ат.) % (по массе) % (ат.) % (по массе)
1250 0,66 0,39 1,22 2,028
1200 0,51 0,30 1,18 1,987
1150 0,38 0,22 0,92 1,555
1100 - - 0,71 1,189
1000 - - 0,63 1,062
Pr-U. Pr-U
41
U, °/<> (no массе)
_ 0 10 20 99,0 99,5
1 / М / / Ж, *Ж, \ \ \ 1135*
1000 931*
/ (7^*Ж (ГО)
795* (ДРг)НГ и) (огре) ЧГО)
И/ Ь— 776*
~-(аРг) (аРП\(fiU) (fiU)
500 (aPr)f(aU) 11 1 • (ао)
7 Рг 1,0 U, */. (ат) 99,0 и
Рис. 456. Pr-U
Литература
1. Peatfield M., Brett N.H., Potter P.E. // J. Nucl. Mater. 1980. V. 89. N 1. P. 27-34.
2. Haefling J.F., Daane A.H. // Trans. A1ME. 1950. V. 215. P. 336-338.
Е.И. Гладышевский, О.И. Бодак, В.К. Печорский
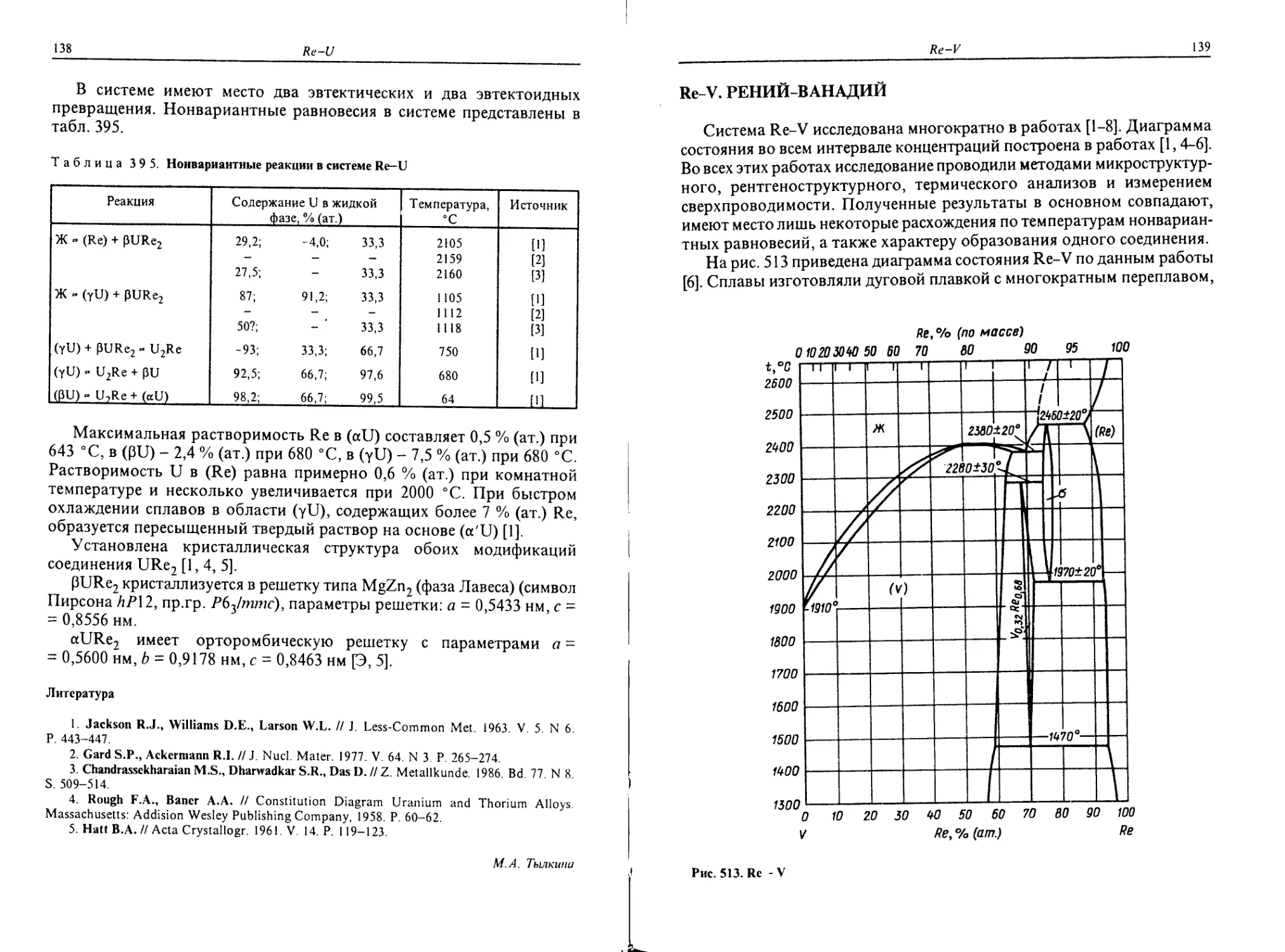
Pr-V. ПРАЗЕОДИМ-ВАНАДИЙ
Диаграмма состояния Pr-V (рис. 457) характеризуется широкой
областью несмешиваемости в жидком состоянии. Монотектическое
Рис. 457. Pr-V
превращение протекает при температуре 1890 °C. Промежуточные фазы
не обнаружены [М].
Л.Л. Рохлин
42
Pr-W. Pr-Y
Pr-W. ПРАЗЕОДИМ-ВОЛЬФРАМ
Диаграмма состояния Pr-W не построена. По данным работы [1]
растворимость W в Рг приведена ниже:
Температура, °C 1473 1668 1803 1922 2037 2134
Растворимость W:
% (ат.) 0,005 0,039 0,104 0,062 0,091 0,074
% (по массе) 0,007 0,051 0,135 0,081 0,110 0,965
Растворимость W в жидком Рг может быть описана уравнением:
Igx = -7,246-10-3 7^1 + 0,125,
где х - атомная доля W, Т- температура, К.
Растворимость W в жидком Рг при температуре его плавления 931 °C,
рассчитанная по этому уравнению, составляет 1,3-10 4 % (ат.).
Литература
1. Dennison D.H., Tschetter M.J., Gschneidner, Jr., К.A., // J. Less-Common Met. 1966. V. 11.
N 5. P. 423-435.
КБ. Поварова
Рг-Y. ПРАЗЕОДИМ-ИТТРИЙ
Диаграмма состояния Pr-Y экспериментально не построена.
Авторами работ [1] методом рентгеноструктурного анализа обнаружена
одна промежуточная фаза 6(Pr3Y2) со структурой типа aSm, символ
Пирсона hR3, пр.гр. R 3m, а = 0,3666, с = 2,6417 нм [V-C].
Металлографические и рентгеноструктурные исследования [1, 2]
показали, что при низких температурах сплавы на основе Рг, содержащие
до 30 % (ат.) Y, имеют ДГПУ структуру. Сплавы, содержащие 50-100 %
(ат.) Y, обнаруживают ГПУ структуру. Область существования фазы б
находится в интервале концентраций 33-46 % (ат.) Y.
Так как Рг и Y в металлическом состоянии имеют близкое электронное
строение с тремя коллективизированными валентными электронами
4<715.г2 и 5rf*6jr соответственно, одинаковые высокотемпературные ОЦК
модификации вблизи температур плавления и плотные гексагональные
модификации ДГПУ аРг и ГПУ aY с близкими параметрами решеток,
а их атомные радиусы отличаются всего на 1,5 %, то следует ожидать,
что Рг и Y должны образовывать непрерывные ряды почти идеальных
Pr-Y. Pr-Zn
43
Pr Y,7»(am.) У
Рис. 458. Pr-Y
твердых растворов между 0 и а модификациями, и кривые ликвидуса -
солидуса и сольвуса лишь немного отклоняются от прямых, соединяющих
температуры плавления и превращения компонентов, образуя узкие
двухфазные области (рис. 458). Фаза б образуется при температуре ниже
-750 °C.
Литература
1. Harris I.R., Koch С.С., Raynor G.V. И J. Less-Common Met. 1966. V. 11. P. 439.
2. Tayaraman A., Sherwood R.C., Williams H.J. // Phys. Rev. 1966. V. 148. P. 502.
B.K. Григорович
Pr-Zn. ПРАЗЕОДИМ-ЦИНК
Диаграмма состояния Pr-Zn (рис. 459) исследована методами
дифференциального термического, рентгеновского и микроструктурно-
го анализов [1].
44
Pr—Zn
Zn, % (no массе)
Рис. 459. Рг - Zn
В системе Рг-Zn установлено восемь промежуточных фаз, из которых
PrZn, PrZn2 и Pr2Zn17 кристаллизуются из расплава конгруэнтно при
температурах 882, 898 и 978 °C соответственно. В результате перитекти-
ческих реакций образуются соединения:
PrZn3 Ж + Pr3Zn,, при 833 °C;
Pr3Zn| ] Ж + Pr13Zn58 при 855 °C;
Pr13Zn58 Ж + Pr3Zn22 при 891 °C;
Pr3Zn22 - Ж + Pr2Zn17 при 956 °C;
PrZn| ] -Ж + Pr2Zn17 при 743 °C.
Все соединения в системе Рг-Zn имеют узкие области гомогенности. Фазы
Pr-Zn
45
Pr2Zn ,7 и PrZn2 претерпевают полиморфное превращение при температу-
рах 775 и 550 °C соответственно. Фаза состава ~PrZn5 25 при системати-
ческом изучении и построении диаграммы состояния в работе [1]
обнаружена не была. Кристаллическая структура промежуточных фаз
системы Pr-Zn приведена в табл. 358.
В системе протекают четыре эвтектических реакции: \
Ж (РРг) + PrZn при 576 °C и 22,5 % (ат.) Zn; j
Ж PrZn + PrZn2 при 833 °C и 58 % (ат.) Zn; ч /
Ж PrZn2 + PrZn3 при 830 °C и 74 % (ат.) Zn; v 7
Ж PrZn,, + (Zn) при 419 °C и 99,9 % (ат.) Zn.
Растворимость Рг в твердом Zn практически отсутствует. (0Рг)
растворяет до 11 % (ат.) Zn при температуре эвтектики 576 °C. (рРг)
эвтектоидно распадается при температуре 558 °C на (аРг) + PrZn. (аРг)
содержит до 1 % (ат.) Zn.
Таблица 358. Кристаллическая структура соединений системы Pr-Zn fV-C, 2|
Соединение Прототип Символ Пирсона, пр.гр. Параметры решетки, нм
a b c
PrZn CsCl cP2, Pm 3 m 0,3684 - -
PrZn2 KHg2 ol, Imma 0,4621 0,7459 0,7516
PrZn3 YZn3 oP\6, Pnma 0,6555 0,4575 1,0383
Рг3гпц La3Al 11 oI28, Immm 0,4502 1,3384 0,8756
Pr13Zn58 Gd13Zn58 hP\42, Pfi^mc 1,4560 - 1,4109
-PrZn5 25 CaCu5 hPf>, РЫттт 0,5414 - 0,4211
Pr3Zn22 Ce3Zn22 tl, I^lamd 0,8708 - 1,2303
Pr2Zn)7 Th2Zn,7 hRV), R3m 0,9067 - 1,3253
46
Pr-Zn. Pt-Pu
Соединение Прототип Символ Пирсона, пр.гр. Параметры решетки, нм
а b С
Pr2Th|7 Th2N i । у ЛР, Ptymmc 0,9063 - 0,8847
PrZn 11 BaCd| । /748, M\!amd 1,0646 - 0,6850
Литература
1. Mason J.T., Chiotti P. // Metal. Trans. 1970. V. I. N 8. P. 2119—2123.
2. Гладышевский Е.И., Бодак О.И. Кристаллохимия интерметаллических соединений
редкоземельных металлов. Львов: Вища школа. 1982. 255 с.
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
Pt-Pu. ПЛАТИНА-ПЛУТОНИЙ
Диаграмма состояния Pt-Pu (рис. 460) исследована методами
дифференциального термического, металлографического, рентгенос-
Рис. 460. Pt - Ри
Pt-Pu, Pt-Re
47
труктурного и дилатометрического анализов [1]. В системе Pt-Pu
установлено образование пяти промежуточных фаз, из которых'РиРЦ
и PuPt5 плавятся конгруэнтно при температурах -1800 и -1700 °C
соответственно. Соединения Pu5Pt3, PuPt, PuPt2 образуются по
перитектическим реакциям при температурах ИЗО, 1250, 1475 °C
соответственно. Фаза PuPt2 имеет область гомогенности -1,5 % (ат.).
Кристаллическая структура расшифрованных промежуточных фаз
системы Pt-Pu приведена в табл. 359.
При -10 % (ат.) Ри в системе наблюдается эвтектическое равновесие
Ж (Pt) + PuPt5, температура которого требует уточнения. Раствори-
мость Ри в (Pt) незначительна. Растворимость Pt в (cPu) -1 % (ат.), в (бРи)
менее 1 %.
Таблица 359. Кристаллическая структура соединений системы Pt-Pu |1]
Соединение Прототип Символ Пирсона, пр.гр. Параметры решетки, нм
а b с
PuPt ТаВ (СгВ) оС8, Стет 0,3816 1,0694 0,4428
PuPt2 MgCu2 cF24, Fd3m 0,7631 - -
PuPt3 AuCu3 сР4, РтЗт 0,4107 - -
Литература
1. Кутайцев В.И., Чеботарев Н.Т., Андрианов М.А. и др. // Атомная энергия. 1967. Т. 23.
N 6. С. 511-519.
Г. П. Жмурко
Pt-Re. ПЛАТИНА-РЕНИЙ
Диаграмма состояния Pt-Re (рис. 461) исследована методами
измерения температур плавления, рентгеноструктурного и микрострук-
турного анализов, измерения твердости [1].
Система Pt-Re перитектического типа без промежуточных фаз.
Температура перитектической реакции 2450 °C. Растворимость Re в (Pt)
и Pt в (Re) примерно одинакова и составляет -40 % и почти не изменяется
с понижением температуры.
48
Pl-Re, Pl-Rh
Pt Re, 7, (am.) Re
Рис. 461. Pt - Re
В работе [2] была измерена твердость и электросопротивление сплавов
в области (Pt). На основании аномального хода кривых твердости и
электросопротивления высказано предположение об образовании в
твердом состоянии при температурах ниже 1600 °C и концентрациях
23-25 % (ат.) Re соединения Курнакова.
Литература
1. ТжебяговскийВ.,БеракИ.//Известия Польской Академии Наук. 1954. Т. 2. N 1. С. 37.
2. Воронова Л.И., Полякова В.П., Савицкий Е.М.// Изв. АН СССР. Металлы. 1984. N 1.
С. 185-187.
М.А. Тылкина
Pt-Rh. ПЛАТИНА-РОДИЙ
Диаграмма плавкости Pt-Rh (рис. 462) построена на основании
измерения температуры солидуса сплавов по методу Пирани с точностью
± 25 °C [1]. Полученные результаты использовали для расчета линии
ликвидуса на диаграмме состояния. По данным работ [Ш, Э, X, 1]
взаимодействие Pt с Rh приводит к образованию непрерывного ряда
Pt-Rh. Pt-Ru
49
Рис. 462. Pt - Rh
твердых растворов. По аналогии с другими системами платиноидов
предполагался распад твердых растворов при температурах ниже 780 °C.
Результаты измерения термоэлектродвижущей силы и магнитных свойств
в сплавах системы Pt-Rh свидетельствовали об этом предположении.
Однако зафиксировать двухфазную область не удалось даже после
отжига в течение четырех лет [Ш].
Литература
1. Кузнецов Г.М., Рытвин Е.И., Никонова И.В. и др. // Изв. АН СССР. Металлы. 1985.
N 4. С. 194-197.
Г. П. Жмурко
Pt-Ru. ПЛАТИНА-РУТЕНИЙ
Диаграмма состояния Pt-Ru (рис. 463) построена по совокупности
данных работ [1, 2]. Диаграмма состояния Pt-Ru представляет собой
диаграмму перитектического типа без промежуточных фаз, что
полностью подтверждает ранее проведенные исследования [X, Ш].
Температура перитектической реакции Ж + (Ru) (Pt) составляет
2100 °C [1] или 2000°С [2]. Растворимость Ru в (Pt) при 1000 °C равна
62 %, при 1900 °C - 70 % (ат.) [1] или 67 % (ат.) при температуре
перитектической реакции 2000 °C [2]. Растворимость Pt в (Ru) практичес-
ки не меняется при температурах от 1000 °C до температуры перитекти-
ческой реакции и составляет 20 % [1] или -13 % (ат.) [2].
50
Pl-Ru, Pt-S
Рис. 463. Pt - Ru
Литература
1. Hitchinson J.H. // Platinum Metals Rev. 1972. V. 16. N 3. P. 88-90.
2. Савицкий E.M., Полякова В.П., Рошан H.P. // Общие закономерности в строении
диаграмм состояния металлических систем: Сб. статей. М.: Наука. 1973. С. 47-49.
Г. П. Жмурко
Pt-S. ПЛАТИНА-СЕРА
Диаграмма состояния Pt-S не построена. По данным обзора [X] в
системе существуют только два сульфида PtS (14,11% (по массе) S) и PtS2
(24,73 % (по массе) S). Оба соединения имеют узкую область гомогеннос-
ти. Кристаллическая структура соединений приведена в табл. 360. В
твердом состоянии в (Pt) растворяется до 1,4 % (ат.) или 0,23 % (по мас-
се) S [X].
Таблица 360. Кристаллическая структура соединений системы Pt-S
Соединение Прототип Символ Пирсона, пр.гр. Параметры решетки, нм Источник
а с
PtS PtS /Р4, P42/mmc 0,493 0,34700 1,044 0,613 0,61096 0,612 [X] [Э] [Ш]
PtS2 Cdl2 ЙРЗ, РЗ ml 0,3544 0,35432 0,5029 0,50388 [X] [Э]
В.П. Полякова
Pt-Sb
51
Pt-Sb. ПЛАТИНА-СУРЬМА
Диаграмма состояния Pt-Sb (рис. 464) построена в работе [X] по
совокупности данных исследований, проведенных методами дифференци-
ального термического и металлографического анализов. В системе Pt-Sb
5Ь,°/о(по массе)
Рис. 464. Pt - Sb
установлено существование четырех соединений Pt4Sb, Pt5Sb2, PtSb,
PtSb2, из которых PtSb2 кристаллизуется из расплава конгруэнтно при
температуре 1226 °C; PtSb, Pt5Sb2, Pt4Sb образуются по перитектическим
реакциям при температурах 1045, 671 и 758 °C соответственно.
Кристаллическая структура промежуточных фаз системы Pt-Sb
приведена в табл. 361 [1].
52
Pt-Sb, Pt-Sc
Таблица 361. Кристаллическая структура соединений системы Pt-Sb [ 1 ]
Соединение Прототип Символ Пирсона, пр.гр. Параметры решетки, нм
а с
PtSb2 FeS2 сР12, РаЪ 0,64400 -
PtSb NiAs hP4, Р63Уттс 0,413 0,5488
Литература
1. Савицкий Е.М., Полякова В.П., Горина Н.Б., Рошан Н.Р. Металловедение
платиновых металлов. М.: Металлургия. 1975. 424 с.
Г.П. Жмурко
Pt-Sc. ПЛАТИНА-СКАНДИЙ
Диаграмма состояния Pt-Sc (рис. 465) исследована в интервале
концентраций 0-50 % Sc методами термического, микроструктурного
и рентгеноструктурного анализов [1]. В исследованном интервале
концентраций в системе подтверждено существование двух соединений
PtSc и Pt3Sc. Соединение PtSc, вероятно, кристаллизуется конгруэнтно
при температуре <2000 °C. Фаза Pt3Sc образуется при температуре
1850±25 °C по перитектической реакции Pt3Sc PtSc + Ж [1]. В
Sc, °/<> (по массе)
Рис. 465. Pt - Sc
Pt-Sc, Pt-Se
53
справочнике [V-C] приведена структура соединения PtSc2. Кристалличес-
кая структура промежуточных фаз системы Pt-Sc приведена в табл. 362.
Максимальная растворимость Sc в Pt при температуре перитектики
составляет -8,14 % (ат.) [1].
Таблица 362. Кристаллическая структура соединений системы Pt-Sc
Соедине- ние Прото- тип Символ Пирсона, пр.гр. Параметры решетки, нм Источник
а b с
PtjSc AuCu5 сР4, РтЗт 0,3956 0,3958 - - [21 [3]
PtSc CsCl сР2, РтЗт 0,3270 - - [4]
PtSc2 Co2Si оР\2, Рпта 0,6592 0,4991 0,8206 [V-C]
Литература
1. Савицкий Е.М., Полякова В.П., Горина Н.Б., Рошан Н.Р. Металловедение
платиновых металлов. М.: Металлургия. 1975. 424 с.
2. Bronger W., Klemm W. // Z. Anorg. All. Chem. 1962. V. 319. N 1. P. 58-81.
3. Dwidht A.E., Downey J.M., Conner R.A. // Acta Cristallogr. 1961. V. 14. N 1. P. 75-76.
4. Aldred A.J. // Trans. AIME. 1962. V. 224. N 5. P. 1082-1083.
В. П. Полякова
Pt-Se. ПЛАТИНА-СЕЛЕН
Диаграмма состояния Pt-Se не построена. В системе имеются два
селенида [Э]. Моноселенид PtS (28,8 % (по массе) Se) плавится при
температуре 1055± 15 °C и имеет моноклинную решетку с параметрами
а = 0,65806 нм; b = 0,46248 нм; с = 1,1145 нм; 0 = 78,40°. Область
гомогенности этой фазы находится в интервале концентраций
Р^е0,70-Р^е0,85-
Диселенид PtSe2 (44,72 % (по массе) Se) обладает структурой типа
СсП2, символ Пирсона hP3, пр.гр. Р3т\, а = 0,37278 нм; с ~ 0,50813 нм
и не имеет области гомогенности. Se практически не растворяется в Pt
|Э].
В. П. Полякова
54
Pt-Si
Pt-Si. ПЛАТИНА-КРЕМНИЙ
Диаграмма состояния Pt-Si (рис. 466) построена по совокупности
данных работ [X, Э, Ш]. Исследования проведены методами дифференци-
ального термического, микроструктурного и рентгеноструктурного
анализов.
В системе установлено существование пяти промежуточных фаз: Pt3Si,
Pt7Si3 (Pt12Si5), Pt2Si, Pt6Si5, PtSi и предполагается соединение Pt4Si.
Соединения Pt2Si и PtSi плавятся конгруэнтно при температурах 1100 и
1229 °C соответственно. Силициды Pt3Si и Pt7Si3 образуются по
перитектическим реакциям при температурах -870 и 986 °C соответствен-
но; силицид Pt6Si5 образуется в твердом состоянии по перитектоидной
Рис. 466. Pt - Si
Pt-Si
55
реакции при температуре 975 °C. Силицид Pt3Si существует в трех
модификациях; температуры перехода и для Pt3Si составляют
360±20 и -775 °C соответственно [Ш, 1]. Фазы Pt7Si3 (Pt|2Si5) и Pt2Si
существуют в двух модификациях, температуры полиморфного
превращения 280 °C и 695±5 °C [1, Ш].
В системе Pt-Si существуют три эвтектических равновесия:
Ж * (Pt) + yPt3Si при 830 °C и 23 % (ат.) Si;
Ж pPt2Si + PtSi при 983±5 °C и 39 % (ат.) Si;
Ж PtSi + (Si) при 979±4 °C и 67,5 % (ат.) Si.
Pt практически не растворяется в (Si). Растворимость Si в (Pt) при
температуре эвтектики 830 °C составляет 1,4 % (ат.) [X].
Авторы работы [2] исследовали энтальпию смешения жидких сплавов
Pt с Si при 1400 °C и рассчитали стандартные энтальпии образования,
энтальпии и энтропии плавления фаз Pt2Si и PtSi.
Кристаллическая структура промежуточных фаз системы приведена
в табл. 363.
Таблица 363. Кристаллическая структура соединений системы Pt-Si
Соедине- ние Прототип Символ Пирсона, пр.гр. Параметры решетки, нм Источник
а b с
aPt3Si* Pt3Ge тС, с2/т 0,7702 0,7765 0,7765 [3]
pPt3Si Fe3C? hP\6, Рб/ттт - - - [М]
YPt3Si U3Si //16, 14Ьпст 0,546 - 0,786 [3]
pPt7Sij” - - 1,3395 - 0,554 [3]
aPt7Si3 №12С5 //, IMm 1,3404 - 0,5451 [1]
pPt2Si Fe2P hP9, 0,6440 - 0,3573 [3]
P62m
aPt2Si ZrH2 (искаженная структура) //, 0,3933 - 0,5910 [3]
56
Pt-Si. Pt-Sm
Соедине- ние Прототип Символ Пирсона, пр.гр. Параметры решетки, нм Источник
а b с
PtxSi( _ х CaF2 cF\2, 0,563 — - [3]
Fni3m
PtSi МпР оР8, Рпта 0,5932 0,5595 0,3608 [4]
*£ = 80,18°. Тетрагональная сингония.
Литература
1. Gold W., Schubert К. IIZ. Kryst. 1969. Bd. 128. N 3-6. S. 406-413.
2. Topor L., Klehha O.J. //Z. Metallkunde. 1986. Bd. 77. N 2. S. 65-71.
3. Gohlt R., Schubert K. //Z. Metallkunde. 1964. Bd. 55. N 9. S. 503-511.
4. Pfistere H., Schubert K.//Z. Metallkunde. 1950. Bd. 41. S. 358-367.
Г.П. Жмурко
Pt-Sm. ПЛАТИНА-САМАРИЙ
Диаграмма состояния Pt-Sm не построена. Имеются данные [1-4] о
существовании в системе соединений SmPt5, SmPt3, SmPt2, SmPt,
кристаллическая структура которых приведена в табл. 364.
Таблица 364. Кристаллическая структура соединений системы Pt-Sm
Соедине- ние Прото- тип Символ Пирсона, пр.гр. Параметры решетки, нм Примечание
а b с
SmPt5 SmPt5 - 0,530 0,911 2,642 [1]
SmPt3 AuCu3 сР4, Рт 3m 0,406 - - [2]
SmPt2 MgCu2 cF24, Fdlm 0,766 — - [3]
SmPt FeB ор8, Рпта 0,715 0,453 0,563 [3,4]
Pi-Sm, Pt-Sn
57
Литература
1. Bronger W.//J. Less-Common Met. 1967. V. 12. N 1. P. 63-68.
2. Moriarty J.L., Humphreys J.E., Gordon R.O., Baenziger N.C. // Acta Crystallogr. 1966.
V. 21. N 5. P. 840-841.
3. Steeb S., Gebhardt E., Reule H. // Monatsh. Chem. V. 103. N 3. P. 716-735.
4. Baenziger N.C., Moriarty J.L. // Acta Crystallogr. 1961. V. 14. N 9. P. 946-950.
В. П. Полякова
Pt-Sn. ПЛАТИНА-ОЛОВО
Диаграмма состояния Pt-Sn (рис. 467) представлена в справочнике
[X] по совокупности ряда работ. В системе установлено существование
пяти промежуточных фаз, из которых Pt3Sn и PtSn плавятся конгруэнтно
при температурах 1406 и 1305 °C. Соединения Pt2Sn3, PtSn2 и PtSn4
образуются по перитектическим реакциям при температурах 840, 745 и
522 °C соответственно. Кристаллическая структура промежуточных фаз
системы Pt-Sn приведена в табл. 365.
В системе Pt-Sn существуют три эвтектических равновесия: Ж ** (Pt) +
+ Pt3Sn при температуре 1365 °C, состав эвтектической точки не
определен; Ж Pt3Sn + PtSn при 1070 °C и 40 % (ат.) Sn; Ж PtSn4 +
+ (Sn) при -228 °C и -99,5 % (ат.) Sn. Растворимость Sn в (Pt) требует
уточнения, предполагается ~8 % (ат.) при температуре 750-800 °C.
Растворимость Pt в (Sn) менее 0,1 % (ат.).
Рис. 467. Pt - Sn
58
Pt-Sn, Pt-Sr
Таблица 365. Кристаллическая структура соединений системы Pt-Sn |Х|
Соединение Прототип Символ Пирсона, пр.гр. Параметры решетки, нм
a b c
Pt3Sn AuCu3 сР4, Рт Зт 0,401 - -
PtSn NiAs hP4, P6j/mmc 0,4103-0,4115 — 0,5437-0,5441
Pt2Sn3 Pt2Sn3 hPIO, Рб^/ттс 0,4334 - 1,2960
PtSn2 CaF2 cF\2, Fm3m 0,6425 — —
PtSn4 PdSn4 oCIQ, Abai 0,6388 0,6419 1,1357
ГП. Жмурко
Pt-Sr. ПЛАТИНА-СТРОНЦИЙ
Диаграмма состояния Pt-Sr (рис. 468) исследована методами
дифференциального термического, рентгеновского и микроструктурно-
Pt, % (по массе)
Рис. 468. Pt - Sr
Pt-Sr. Pt-Та
59
го анализов в интервале концентраций 0-50 % (ат.) Pt [1]. Для приготов-
ления сплавов использовали: Pt чистотой 99,999 % и Sr чистотой 99,5 %
(по массе) [1]. В системе Pt-Sr обнаружено семь химических соединений:
~Sr9Pt, Sr7Pt3, Sr3Pt2, Sr5Pt4, SrPt2, SrPt3 и SrPt5. Соединения, наиболее
богатые Sr, такие как Sr9Pt, Sr7Pt3, Sr3Pt2, Sr5Pt4 образуются no
перитектическим реакциям при температурах соответственно 720, 715,
930,970 °C. Характер и температуры образования остальных соединений
требуют детального исследования. Кристаллическая структура
промежуточных фаз системы Pt-Sr приведена в табл. 366. Эвтектическое
равновесие Ж Sr9Pt + Sr7Pt3 протекает при температуре 670 °C и
концентрации 23 % (ат.) Pt.
Таблица 366. Кристаллическая структура соединений системы Pt-Sr
Соедине- ние Прототип Символ Пирсона, пр.гр. Параметры решетки, нм Источник
а b с
Sr9Pt - - 0,6091 - - [1]
Sr7Pt3 - оР, Рпта 0,7937 2,4333 0,71019 [1]
Sr3Pt2 Er3Ni2 ЛЯ15, 0,9337 - 1,7762 Ш
R3
Sr5pt4 Pu5Rh4 оР, Рпта 0,7879 1,5606 0,8147 [1]
SrPt2 MgCu2 cF24, 0,7742 — — [2]
Fd3m 0,7777 — — [3]
SrPt5 CaCu5 hPb, Р6/ттт 0,5397 - 0,4364 [3]
Литература
1. Palenzona A.// J. Less-Common Met. 1981. V. 78. N 2. Р. 49-53.
2. Wood Е.А., Compton V.B. // Acta Crystallogr. 1958. V. 11. P. 420-433.
3. Heumann T., Kniepmeyr M. // Z. Anorg. All. Chem. 1957. V. 290. N 3-4. S. 191-204.
Л. JI. 3усман
Pt-Та. ПЛАТИНА-ТАНТАЛ
Диаграмма состояния Pt-Та (рис. 469) построена по совокупности
исследований [1, 2], проведенных методами измерения температуры
плавления, микроструктурного, рентгеноструктурного и микрорентгенос-
пектрального анализов, измерения некоторых свойств.
60
Pt-Та
Pt Та, У. (ат.) та
Рис. 469. Pt - Та
В системе Pt-Ta наиболее достоверно установлено существование пяти
промежуточных фаз, из которых Pt3Ta и Pt2Ta образуются конгруэнтно
из расплава при температурах 2065 и 2245 °C соответственно. В работах
[3, X, Э, Ш] указывается, что оба соединения существуют в двух
модификациях.
Соединение PtTa образуется по перитектической реакции Pt2Ta +
+ Ж PtTa при температуре 1795 °C, существует в узком интервале
концентраций и температур и при температуре 1635 °C эвтектоидно
распадается на Pt2Ta и фазу о (PtTa2).
Соединение PtTa2 (фаза о) также образуется по перитектической
реакции (Та) + Ж PtTa2 при температуре 2470 °C. PtTa2 содержит
15±0,3 % (ат.) Pt при температуре 2300 °C и 16,5±0,3 % (ат.) Pt при
температуре 2000 °C.
Фаза PtTa3 образуется в твердом состоянии по перитектоидной
реакции при температуре -1725 °C. Кроме приведенных на диаграмме
соединений в справочниках [3, Ш] указано на существование соединения
Pt4Ta. Кристаллическая структура промежуточных фаз приведена в
табл. 367.
В системе наблюдаются два эвтектических взаимодействия:
Ж Pt3Ta + Pt2Ta при температуре 2050 °C и Ж ₽» PtTa + о при
температуре 1760 °C.
Pt-Та. Pt-Tb
61
Таблица 367. Кристаллическая структура соединений системы Pt-Ta |1-3|
Соединение Прототип Символ Пирсона, пр.гр. Параметры решетки, нм
a b c
Pt4Ta - - 0,858 - 1,060
TiAl3 //8, 14/mmm 0,391 - 0,794
aPt3Ta* TiCu3 oP8, Pmnrn 0,5538 0,4874 0,4560
Pt2Ta** VAu3 - 0,8403 0,837 0,4785 0,478 0,4744 0,473
PtTa 2 pu tP30, Ptymnm 0,995 - 0,516
PtTa3 Cr3Si cP8, - - -
Pm3n
*{J = 90,5°. Ромбическая сингония.
Литература
1. Giessen В.С., Kane R.H., Grant NJ. //Trans. Met. 1965. V. 233. N 5. P. 855-864.
2. Waterstrat R.M. //J. Less-Common Met. 1981. V. 80. P. 31-36.
3. Благородные металлы. Справочник. / Под ред. Е.М. Савицкого. М.: Металлургия.
1984. 592 с.
В.П. Полякова
Pt-Tb. ПЛАТИНА-ТЕРБИЙ
Диаграмма состояния Pt-Tb не построена. По данным различных
авторов в системе существует девять соединений, кристаллическая
структура которых приведена в табл. 368.
Литература
1. Bronger W. //J. Less-Common Met. 1967. V. 12. N 1. Р. 63-68.
2. Steeb S., Gefhardt E., Reule H. // Monatsh. Chem. 1972. Bd. 103. N 3. S. 716-735.
3. Palenzpna A. //J. Less-Comm. Met. 1977. V. 53. N 1. P. 133-136.
4. Le Roy F., Moreau F.M., Paccard D., Parthe E. // Acta Crystallogr. 1978. V. B34. N 1.
62
Pt-Tb. Pt-Tc
5. Le Roy F., Moreau F.M., Paccard D., Parthe E.// Acta Crystallogr. 1978. V. B34. Nil.
P. 3315-3318.
6. Le Roy F., Moreau F.M., Paccard D., Parthe E.// Acta Crystallogr. 1979. V. B35. N 6.
P. 1437-1439.
Таблица 368. Кристаллическая структура соединений системы Pt-Tb
Соедине- ние Прототип Символ Пирсона, пр.гр. Параметры решетки, нм Источник
а b с
Pt5Tb Pt5Sm - 0,5278 0,9092 2,644 [1]
Pt3Tb AuCu3 сР4, РтЗт 0,40823 - - [2]
Pt2Tb Cu2Mg cF24, Fd3m 0,760 — - [2]
Pt4Tb3 Pd4Pu3 hR\4, R3 1,3163 - 0,5689 [3]
PtTb FeB oPS, Рпта 0,7021 0,4491 0,5558 [2]
Pt4Tb5 Ge4Sm5 оРЗб, Рпта 0,7495 1,4602 0,7565 [4]
Pt3Tb5 Mn5Si3 hP\f>, Р6^1ттс 0,8415 - 0,6230 [5]
PtTb2 Co2Si оР\2, Рпта 0,7147 0,4772 0,8763 [4]
PtTb3 Fe3C оР\6, Рпта 0,7077 0,9541 0,6444 [6]
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
Pt-Tc. ПЛАТИНА-ТЕХНЕЦИЙ
Диаграмма состояния Pt-Tc не построена. В работах [1, 2, Ш]
установлено, что в системе нет промежуточных фаз и наблюдается
образование широких областей твердых растворов на основе исходных
компонентов. Растворимость Тс в (Pt) составляет -40 % (ат.) при
температуре 1500 °C [1] и 25-33 % (ат.) при 1050 °C [2]. Растворимость
Pt-Tc, Pt-Те
63
Pt в (Тс) равна -30 % (ат.) при температуре 1500 °C [1] и 14-33 % (ат.) при
1050 °C [2].
Литература
I. Niemiec J. И Bull. Acad. Polon. Sci. Ser. Sci. Chim. 1963. V. 11. P. 665-669.
2. Darby J.B., Norton L.J., Downey J.W.//J. Less-Common Met. 1963. V. 5. N 5. P. 397-402.
Г. П. Жмурко
Pt-Те. ПЛАТИНА-ТЕЛЛУР
Диаграмма состояния Pt-Те (рис. 470) построена на основании
результатов дифференциального термического, микро- и рентгенострук-
турного анализов высокочистых сплавов [Ш]. В системе установлено
существование двух промежуточных фаз PtTe и PtTe2.
Соединение PtTe образуется по перитектической реакции Ж +
+ PtTe2 PtTe при температуре 920 °C. Между Pt и соединением PtTe
наблюдается эвтектическое равновесие при температуре 860 °C и
концентрации 32,2 % (ат.) или 23,7 % (по массе) Те.
При избыточном давлении паров Те фаза PtTe2 плавится при
температуре 1125 °C. При атмосферном давлении соединение PtTe2 при
температуре 1020 °C разлагается и происходит сублимация Те.
Рис. 470. Pt - Те
64
Pt-Те. Pt-Th
Кристаллическая структура соединений приведена в табл. 369.
В работе [Ш] указывается нулевая растворимость компонентов друг
в друге в твердом состоянии.
Таблица 369. Кристаллическая структура соединений системы Pt-Te |Э, Ш|
Соединение Прототип Символ Пирсона, пр.гр. Параметры решетки, нм
а b С
PtTe* — — 0,66144 0,56360 1,1862
или
NiAs ЛР4, Phyhnmc 0,4111 - 0,5446
PtTe2 Cdl2 hP3, 0,40259 - 0,52209
P3ml
Ромбическая сингония.
В.П. Полякова
Pt-Th. ПЛАТИНА-ТОРИЙ
Диаграмма состояния Pt-Th (рис. 471) построена по результатам
дифференциального термического, микро- и рентгеноструктурного
анализов в интервале температур 1000-1500 °C [1]. В системе обнаружено
восемь промежуточных фаз.
По мнению автора работы [1] соединения ThPt, Th3Pt5, ThPt3,
вероятно, образуются конгруэнтно непосредственно из расплава при
температурах выше 1500 °C. По перитектическим реакциям при
температурах выше 1500 °C образуются соединения Th3Pt4, ThPt2, ThPt4.
ThPt5. Соединение Th7Pt3 также образуется по перитектической реакции
Ж + ThPt « Th7Pt3 при температуре 1362± 12 °C.
Взаимная растворимость компонентов друг в друге менее 1 % (ат.)
В системе Pt-Th установлены четыре эвтектических взаимодействия
Ж « (Pt) + ThPt5 при 1337±12°Си 10 % (ат.) Th;
Ж » ThPt3 + ThPt2 при t > 1500 °C и 31 % (ат.) Th;
Ж « Th3Pt4 + ThPt при t> 1500 °C и 47 % (ат.) Th;
Ж « Th7Pt3 + (Th) при 1237± 12 °C и 83 % (ат.) Th.
Кристаллическая структура большинства промежуточных фаз нс
Pt-Th
65
Рис. 471. Pt - Th
индифицирована. Кристаллическая структура индифицированных фаз
приведена в табл. 370.
Таблица 370. Кристаллическая структура соединений системы Pt-Th
Соединение Прототип Символ Пирсона, пр.гр. Параметры решетки, нм
а Ь с
Th3Pl5 Th3Pd5 hPZ, 0,7162 — 0,3908
Р62т
ThPt CrB oCi, Стет 0,3900 1,109 0,4454
Th7Pt; Th70s3 (Th7Ir3) - 1,0126 - 0,6346 ч
Гексагональная сингония.
Литература
1. Thomson J.R.//J. Less-Common Met. 1964. V. 6. N 1. P. 3-10.
В.П. Полякова
66
Pt-Ti
Pt-Ti. ПЛАТИНА-ТИТАН
Диаграмма состояния Pt-Ti (рис. 472) приведена на основании
анализа литературных данных в работе [1]. В системе Pt-Ti отмечается
образование большого числа промежуточных фаз, из которых наиболее
достоверны TiPt8 (89-98 % (ат.) Pt), фаза у (75-81 % (ат.) Pt), TiPt3 (<75 %
(ат.) Pt), Ti3Pt5 (62,5 % (ат.) Pt), TiPt (46-54 % (ат.) Pt), Ti3Pt (22-29 % (ат.)
Pt). В справочнике [X] указывается на существование соединения TiPt2
со структурой типа Ti2Ni, однако автор работы [1] предполагает, что
данная структура относится к тройному соединению системы Ti-Pt-O.
По данным работы [1] соединения фаза у, Ti3Pt5, TiPt и Ti3Pt
кристаллизуются из расплава конгруэнтно при температурах -1950,
-1900, 1830 и 1370 °C соответственно; соединение TiPt3 образуется по
перитектической реакции, температура протекания которой требует
уточнения. Соединение TiPtg образуется в твердом состоянии по
перитектоидной реакции при температуре 1080 °C. Эквиатомное
соединение TiPt существует в двух модификациях, при этом фазовый
Рис. 472. Pt - Ti
Pt-Ti
67
переход протекает по мартенситному типу в интервале температур и
концентраций [2]:
^перехода’
Pt, % . . . .
1030 1052 1055 998
45 47,5 50 52,5
В работе [1] предполагается, что соединение Ti3Pt5 существует в
ограниченном интервале температур и при температуре -1000 °C
эвтектоидно распадается. Кристаллическая структура промежуточных
фаз системы Pt-Ti приведена в табл. 371.
Максимальная растворимость Ti в (Pt) составляет 10-11 % (ат.) [1],
Pt в (0Ti) - 10 % (ат.), Pt в (aTi) - 0,5 % (ат.) [Э].
Pt снижает температуру а « 0 перехода Ti: эвтектоидная реакция
протекает при температуре 840 °C и концентрации 3,2 % (ат.) Pt [1].
По данным работы [1] в системе Pt-Ti установлены два эвтектических
равновесия Ж « (0Ti) + Ti3Pt при температуре 1310 °C и концентрации
15,6 % (ат.) Pt и Ж « Ti3Pt + pTiPt при температуре 1320 °C и концентра-
ции 34,3 % (ат.) Pt; предполагаются также эвтектические реакции Ж »
₽ PTiPt + Ti3Pt5 и Ж « Ti3Pt5 + TiPt3 [1].
В работе [3] сообщается о существовании двух новых длиннопериод-
ных структур с антифазными границами на основе исходной решетки
твердого раствора Pt, установленными методами высокоразрешающей
электронной микроскопии.
Таблица 371. Кристаллическая структура соединений системы Pt-Ti 11]
Соединение Прототип Символ Пирсона, пр.гр. Параметры решетки, нм
а b с
TiPt8 MoNi4 /ПО, lAlmmm 0,8312 - 0,3897
Y AuCu3 сР4, РтЗт 0,3898-0,3916 - -
TiPt3 Ni3Ti hP\6, Рбт/ттс 0,552 - 0,9029
Ti3Pt5 Au5GaZn2 ol, Ibam 0,8312 - 0,3897
aTiPt CsCl сР2, Рт Зт 0,3172 - -
pTiPt AuCd о/>4, Ртта 0,4592-0,455 0,2761-0,273 0,4838-0,479
Ti3Pt Cr3Si сР8, РтЗп 0,5024 - -
68
Pt-Ti, Pt-Tl
Литература
1. Murray J.L. // Bull. Alloy Phase Diagrams. 1982. V. 3. N 3. P. 329-335.
2. Donkirsloot H.C., Vucht J.H.N. //J. Less-Common Met. 1970. V. 20. N 1. P. 83-91.
3. Schryvers D, van Landuyt J., van Tendeloo G., Amelinckx S. // Phys. Status. A. 1983. V. 76.
N 2. P. 575-593.
В.П. Полякова
Pt-Tl. ПЛАТИНА-ТАЛЛИЙ
Диаграмма состояния Pt-Tl (рис. 473) построена на основании данных
термического и рентгеноструктурного анализов [1]. Для изготовления
сплавов использовали Pt чистотой 99,9 % (по массе) и Т1 чистотой 99 %
(по массе).
В системе Pt-Tl существуют три интерметаллические фазы: Pt3Tl2,
PtTl, PtTl2, которые образуются по перитектическим реакциям при
температурах 900, 750 и 480 °C соответственно. Кристаллическая
структура промежуточных фаз приведена в табл. 372.
Эвтектическая реакция Ж « (Tl) + PtTl2 протекает при температуре
291 °C и концентрации 98,3 % (ат.) Т1 [1].
Таблица 372. Кристаллическая структура соединений системы Pt-Tl [1]
Соединение Прототип Символ Пирсона, пр.гр. Параметры решетки, нм
а с
Pt3Tl2 Pt3Tl2 - 0,5645 1,3851
PtTl CoSn ЛР6, РЫттт 0,5605 0,4639
PtTl2 A12Cu 1112, 14/тст 0,682 0,5563
Pt-Tl, Pt-Тт
69
Pt Tl,°/ofam.) Tt
Рис. 473. Pt - T1
Литература
1. Bhan S., Godeske T., Pfaday R.K., Schubert K. // J. Less-Common Met. 1968. V. 16 N 4
P. 415-425.
Т.П. Жмурко
Pt-Tm. ПЛАТИНА-ТУЛИЙ
Диаграмма состояния Pt-Tm не построена. По данным ряда авторов
в системе существует девять промежуточных фаз, состав и кристалличес-
кая структура которых приведены в табл. 373.
70
Pt-Тт
Таблица 373. Кристаллическая структура соединений системы Pt—Тт
Соединение Прототип Символ Пирсона, пр.гр. Параметры решетки, нм Источник
a b c
Pt5Tm Pt5Sm - 0,5213 0,9071 2,649 [1]
Pt3Tm Cu3Au cP4, РтЗт 0,4044 - - [2]
Pt2Tm MgCu2 cFTA, Fd3m 0,7556 - - [2]
Pt4Tm3 Pd4Pu3 hR\4, R3 1,2933 - 0,5635 [3]
PtTm FeB oP8, Pnma 0,6855 0,4446 0,5496 [4]
Pt4Tm5 Ge4Sm5 oP36, Pnma 0,7385 1,4378 0,7460 [5]
Pt3Tm5 Mn5Si3 hP\6, Pbylmcm 0,8252 - 0,6128 [6]
PtTm 2 Co2Si oP 12, Pnma 0,7008 0,4688 0,8619 [6]
PtTm3 Fe3C Opl6, Pnma 0,6981 0,9314 0,6349 [7]
Литература
I. Bronger W. //J. Less-Common Met. 1967. V. 12. N IP. 63-68.
2. Moriarty J.L., Humphreys J.E., Gordon R.O., Baenziger N.C. И Acta Crystallogr. 1966.
V. 21. N 5. P. 840-841.
3. Palenzona A. // J. Less-Common Met. 1977. V. 53. N 1. P. 133-136.
4. Dwight A.E., Conner R.A., Downey J. W.//Acta Crystallogr. 1965. V. 18. N 5. P. 835-839.
5. Le Roy J., Moreau J.M., Paccard D., Parthe E. H Acta Crystallogr. В. 1978. V. 34. N 11.
P.3315-3318.
6. Le Roy J., Moreau J.M., Paccard D., Parthe E. // Acta Crystallogr. B. 1978. V. 34. N 1.
P. 9-13.
7. Le Roy J., Moreau J.M., Paccard D., Parthe E. // Acta Crystallogr. B. 1979. V. 35. N 6.
P. 1437-1439.
E. И. Гпадышевский, О. И. Бодак, В. К. Печарский
Pt-и
71
Pt-U. ПЛАТИНА-УРАН
Диаграмма состояния Pt-U (рис. 474) построена на основании данных
дифференциального термического, микро- и рентгеноструктурного
анализов, измерения твердости [1]. В системе Pt-U установлены четыре
промежуточные фазы: PtU, Pt2U, Pt3U и Pt5U.
Соединение Pt3U кристаллизуется из расплава конгруэнтно при
температуре 1700 °C; фазы Pt2U и Pt5U образуются по перитектическим
реакциям при температурах 1370 °C [1] или 1220 °C [Э] и 1460 °C [1]
соответственно; соединение PtU образуется в твердом состоянии в
результате перитектоидной реакции при температуре 961 °C [1].
Кристаллическая структура промежуточных фаз системы Pt-U приведена
в табл. 374.
В системе наблюдаются две эвтектические реакции:
Ж * (Pt) + Pt5U при 1345 °C и 12,5 % (ат.) U;
Ж * Pt2U + (yU) при 1005 °C и 88 % (ат.) U.
Рис. 474. Pt - и
72
Pl-U, Pi-V
Максимальная растворимость U в (Pt) при эвтектической температуре
1345 °C составляет 4,5 % (ат.), при комнатной температуре - 4 % (ат.).
В твердых растворах на основе U установлены эвтектоидные
превращения: (yU) « (0U) + PtU при температуре 705 °C и концентрации
96,5 % (ат.) U; (0U) « (aU) + PtU при температуре 589 °C и концентрации
98,5 % (ат.) U. Максимальная растворимость Pt в (yU) составляет - 5 %
(ат.); в (0U) -2,35 %; в (aU) -0,9 % (ат.).
Таблица 374. Кристаллическая структура соединений системы Pr-S [V-C]
Соединение Прототип Символ Пирсона, пр.гр. Параметры решетки, нм Источник
а b С
Pt2U* - Ата2 0,560 0,968 0,412 [Э]
Pt3U - hP, РЫттс 0,5764 0,5763 - 0,4899 0,4898 [X] [2]
Pt5U -АиВе5 сПА, F43m 0,7417 - - [2]
Ромбическая сингония.
Литература
1. Park J.J., Fickle D.P. И J. Res. Nat. Bur. Standards. 1960. V. A64. N I. P. 107-117.
2. Erdmann B., Keller C. // Inorg. Nucl. Chem. Letters. 1971. V. 7. N 7. P. 675-683.
Г.К. Алексеенко
Pt-V. ПЛАТИНА-ВАНАДИЙ
Диаграмма состояния Pt-V (рис. 475) построена в работе [1] на
основании данных дифференциального термического, микро- и
рентгеноструктурного анализов, полученных в работах [2, 3]. Система
характеризуется образованием четырех промежуточных фаз и широких
областей ограниченных твердых растворов на основе исходных
компонентов. При понижении температуры в твердом состоянии
конгруэнтно образуются соединения Pt3V, Pt9V и PtV при температурах
-1015, 1100 и 1500 °C, между соединениями наблюдаются эвтектоидные
равновесия: (Pt) « Pt3V + Pt2V при температуре -970 °C; (Pt) * Pt2V + PtV
при -980 °C и 39 % (ат.) V; (Pt) - PtV + PtV3 при -1410 °C и 55 % (ат.) V.
Pt-V
73
Рис. 475. Pt-V
Соединение PtV3 кристаллизуется из расплава по перитектической
реакции Ж + (V) » PtV3 при температуре -1800 °C и концентрации 82 %
(ат.) V. Область гомогенности PtV3 располагается при концентрации
-66—82 % (ат.) V при температуре 1720 °C и -67-82% (ат.) V при 1410 °C
[1-3]. Кроме того, в литературе имеются данные [4-6] об образовании
в системе Pt-V метастабильных фаз, которые, возможно, стабилизируют-
ся примесями внедрения [1]. Кристаллическая структура промежуточных
фаз приведена в табл. 375.
Между соединением Pt3V и [Pt] наблюдается эвтектическое равновесие
при температуре -1720 °C и концентрации 63 % (ат.) V. Максимальная
растворимость V в Pt при температуре эвтектики составляет -57 % (ат.)
[1]. Температуры плавления твердых растворов на основе [Pt] проходят
через максимум при температуре - 1805 °C и концентрации -27 % (ат.)
V[l],
74
Pt-V Pt-IV
Таблица 375. Кристаллическая структура соединений системы Pt-V
Соедине- ние Прототип Символ Пирсона, пр.гр. Параметры решетки, нм Источник
a b c
Pt3V Al3Ti t/8, Шттт 0,3860- 0,3847 - 0,7819- 0,7796 [2]
Pt2V MoPt2 oI6, Immm 0,2724 0,8302 0,3786 [2]
PtV AuCd oP4, Рпта 0,4413 0,2693 0,4767 [2]
PtV3 Cr3Si cP8, РтЗп 0,4831- 0,4813 - - [2]
Pt3V AuCu3 cP4, РтЗт 0,387 - - [5]
PtV AuCu tP2, P4lmmm 0,381 - 0,388 [5]
PtV3 AuCu3 cP4, Pm 3 m 0,3918 - - [6]
Литература
1. Smith J.F. И J. Alloy Phase Diagrams. 1988. V. 4. N l.P. 5-13.
2. Waterstrat R.M. // Met. Trans. 1973. V. 4. N 1. P. 455-466.
3. Статнова E.A., Куприна В.В. И Вестник Московского университета. Сер. 2. Химия.
1974. Т. 15. №2. С. 243-245.
4. Schryvers D., Amelinckx S. // Acta Metalurg. 1986. V. 34. N 1. P. 43-54.
5. Maldonado A., Schubert K. // Z. Metallkunde. 1964. Bd. 55. N 7. S. 619-626.
6. Philipsborn H., Laves F. Acta Crystallogr. 1964. V. 17. P. 213-214.
Г.П. Жмурко
Pt-W. ПЛАТИНА-ВОЛЬФРАМ
Диаграмма состояния Pt-W приведена на рис. 476 на основании
обобщения результатов ранее опубликованных работ и проведенного
специально рентгеноструктурного и микрорентгеноспектрального
исследования сплавов платины при температуре 1400 ° С [1].
Подтверждено, что система Pt-W перитектического типа, в перитекти-
ческом равновесии при 2460 °C участвуют только два граничных твердых
Pt-W
75
Рис. 476. Pt-W
раствора (Pt) и (W). При этом отмечается, что растворимость W в (Pt)
составляет ~60 % (ат.), Pt в (W) - не более 3,5-5 % (ат.).
При низких температурах -1400 °C в твердом состоянии обнаружены
две фазы, границы существования которых требуют уточнения. Фаза у
по химическому составу и кристаллической структуре аналогична фазе
p(Pt3Mo) в системе Pt-Mo, имеет тетрагональную решетку с параметрами
а = 0,3895; с = 0,3943 нм (в спеченном сплаве) и а = 0,3896; с = 0,3933 нм
(в сплаве дуговой плавки) при 35 % (ат.) W. Фаза 8 аналогична фазе
6(Pt3Mo2) и имеет гексагональную решетку типа Mg (символ Пирсона
hP2, пр.гр Рбт/ттс) с параметрами а - 0,2796; с - 0,4493 нм в спеченном
сплаве при 50 % (ат.) W и а ~ 0,279; с - 0,450 нм в сплаве дуговой плавки
при 70 % (ат.) W [1].
Литература
1. Knapton A.G.// Platinum Metals Rev. 1980. V. 24. N 2. P. 64-69.
К.Б. Поварова, В.П. Полякова
76
Pt-Y
Pt-Y. ПЛАТИНА-ИТТРИЙ
Часть диаграммы состояния в интервале концентраций 0-16 % (ат.)
Y исследована методами дифференциального термического, микрострук-
турного и рентгеновского анализов. Для исследования использовали Pt,
чистотой 99,99 % (по массе) и Y чистотой 99,6 % (по массе) [1]. В
исследованном интервале температур и концентраций подтверждено
существование соединения Pt5Y, образующееся, вероятно, конгруэнтно
непосредственно из расплава при температуре -1800 °C [1]; установлено
эвтектическое равновесие Ж •* (Pt) + Pt5Y при температуре 1615 °C и
концентрации -7 % (ат.) Y [1]. В работе [2] указывается температура
1495 °C. Растворимость Y в твердой Pt по данным работы [2] приведена
ниже:
Температура, °C.....................
Растворимость Y, % (по массе).......
1500 1400 1300 1200 1000
0,34 0,26 0,14 0,105 0,032
Кроме того, известно о существовании в системе помимо соединения
Pt5Y девяти промежуточных фаз, состав и кристаллическая структура
которых приведены в табл. 376.
Рис. 477. Pt-Y
Pt-Y
77
Таблица 376. Кристаллическая структура соединений системы Pt-Y
Соединение Прототип Символ Пирсона, пр.гр. Параметры решетки, нм Источник
а b с
Pt5Y* Pt5Sm - 0,5240 0,0123 2,653 [3]
Pt3Y AuCu3 сР4, Рт Зт 0,40751 - - [4]
Pt2Y MgCu2 cF24, Fd3m 0,7590 - - [5]
PtY FeB аР8, Рпта 0,7010 0,4471 0,5552 [6]
Pt4Y3 Pd4Pu3 hR42, R3 1,312 - 0,578 [Ю]
Pt4Y5 Ge4Sm5 оРЗб, Рпта 0,7458 1,4546 0,7519 [7]
Pt3Y5 Mn5Si3 hP\6, Рб^/ттс 0,8370 - 0,6276 [8]
PtY2 Co2Si оР\2, Рпта 0,7141 0,4764 0,8753 [8]
PtY3 Fe3C оР\6, Рпта 0,7101 0,9584 0,6454 [9]
Pt3Y7 Ромбич Fe3Th7 еская сингон hP2Q, Рбупс ИЯ. 0,9864 0,6299 [8]
В работе [10] обобщены все результаты, полученные по диаграмме
Pt-Y и вычерчена предполагаемая диаграмма, приведенная на рис. 477.
Литература
1. Воронова Л.И., Полякова В.П., Савицкий Е.М.// Изв. АН СССР. Металлы. 1983. N 4.
С. 176-179.
2. Yifen X., Loebich О. // J. Less-Common Met. 1988. V. 144. N 2. P. 301-309.
3. Bronger W.II J. Less-Common Met. 1967. V 12. N 1. P. 63-68.
4. Steeb S., Gebhardt E., Reuie H. // Monatsh. Chem. 1972. Bd. 103. N 3. S. 716-735.
78
Pt-Y, Pi-Yb
5. Compton V., Matthias B.T. // Acta Crystallogr. 1959. V. 12. P. 651-654.
6. Dwight A.E., Conner R.A., Downey T.W.// Acta Crystallogr. 1965. V. 18. N 5. P. 835-839.
7. Le Roy J., Moreau J.M., Paccard D., Parthe E. // Acta Crystallogr. B. 1978 V. 34. N 11.
P. 3315-3318.
8. Le Roy J., Moreau J.M., Paccard D., Parthe E. // Acta Crystallogr. B. 1978 V. 34 N 1.
P. 9-13.
9. Le Roy J., Moreau J.M., Paccard D., Parthe E. // Acta Crystallogr. B. 1979. V. 34. N 6.
P. 1437-1439.
10. Palenzona A., Cirafici S. И Bull. Alloy Phase Diagram. 1990. V. 11. N 5. P. 493-497.
Е.И. Гладышевский, О.И. Бодак, В.К. Печорский
Pt-Yb. ПЛАТИНА-ИТТЕРБИЙ
Диаграмма состояния Pt-Yb в интервале концентраций 0-50 % (ат.)
Y (рис. 478) построена на основании данных дифференциального
термического, металлографического и рентгеноструктурного анализов
Рис. 478. Pt - Yb
Pi-Yb
79
[1]. Для исследования использованы Pt чистотой 99,99 % (по массе) и Yb
чистотой 99,91 % (по массе).
В исследованном интервале концентраций в системе Pt-Yb подтвер-
ждено существование пяти промежуточных фаз, из которых соединение
PtYb кристаллизуется, вероятно, конгруэнтно непосредственно из
расплава при температуре -1600 °C. Соединения Pt2Yb5, PtYb2, Pt3Yb5
и Pt4Yb3 образуются по перитектическим реакциям при температурах
745, 965, 1245 и 1400 °C соответственно. Для соединения Pt3Yb5
обнаружено полиморфное превращение при температуре 1200 °C.
В работе [1] также указано на существование еще нескольких
соединений, более богатых Pt. Кристаллическая структура промежуточ-
ных фаз системы Pt-Yb приведена в табл. 377.
В сплавах системы Pt-Yb существует эвтектическое равновесие:
Ж » (pYb) + Pt9Yb5 при температуре 635 °C и концентрации 12,5 % (ат.)
Pt.
Таблица 377. Кристаллическая структура соединений системы Pt-Yb [11
Соединение Прототип Символ Пирсона, пр.гр. Параметры решетки, нм
а Ь С
Pt3Yb AuCu3 сР4, РтЗт 0,4040— 0,4047 - -
Pt2Yb MgCu2 cF2A, Fd3m 0,7546 - -
Pt4Yb3 Pd4Pu3 hR\4, 1,2888 - 0,5629
R3
PtYb FeB оРЪ, Рпта 0,6814 0,4429 0,5480
Pt4Yb5 Ge4Sm5 орЗв, Рпта 0,7390 1,4319 0,7506
Pt3Yb5 Mn5Si3 hP\6, P6ylmcm 0,8337 - 0,6251
PtYb2 Co2Si оР 12, Рпта 0,7614 0,4400 0,8957
pt2Yb; Mn5C2 /яС28, СИс 1,5896 0,6476 0,7576
__ *P = 97,6“.
Литература
1. landelli A., Palenzona А. И J. Less-Common Met. 1975. V. 43. Р. 205-209.
Е. И. Гпадышевский. О. И. Бодак, В. К. Пекарский
80
Pt-Zn
Pt-Zn. ПЛАТИНА-ЦИНК
Фазовая диаграмма системы Pt-Zn (рис. 479) [1] построена на основе
анализа результатов микроструктурного и рентгеноструктурного
исследований в интервале температур 400-750 °C. Для сплавов,
содержащих 87,4-96,5 % (ат.) Zn, были сняты термические кривые.
В исследованном интервале температур фазовые равновесия сложны
и их особенности еще требуют дополнительных исследований, а состав,
характер образования, области существования и кристаллическая
структура промежуточных фаз системы Pt-Zn требуют уточнения.
По данным работы [X] при температуре 800 °C образуется упорядо-
ченная фаза Pt3Zn или Pt5Zn2 [Э]. Соединение Pt3Zn обладает кристалли-
ческой структурой типа AuCu3, символ Пирсона сР4, пр.гр. РтЗт,
параметр решетки а = 0,3893 нм [2].
Фаза и (PtZn) имеет область гомогенности, расположенную от 30 до
50 % (ат.) Zn, и обладает кристаллической структурой типа AuCu,
символ Пирсона tP2, пр.гр. РМттт, параметры решетки « = 0,4307;
с = 0,3473 нм; da ~ 0,860 при содержании в сплаве 47,2 % (ат.) Zn.
Отношение da уменьшается от 0,954 до 0,860 по мере увеличения в сплаве
содержания Zn [2].
Рис. 479. Pt - Zn
Pt-Zn, Pt-Zr
81
Предполагается, что фаза е (PtZn2_| 7) имеет гексагональную решетку
и относится к структурному типу А1В2 (символ Пирсона hP3, пр.гр.
РЫттт, параметры решетки а = 0,4111; с = 0,2744 нм при содержании
64,7 % (ат.) Zn) [2]. По кристаллической структуре фаза Ej подобна фазе
е, но имеет более низкую симметрию [2]. По данным работы [3]
кристаллическая структура соединения E|(Pt7Zn12) ромбическая (пр.гр.
РЬат), параметры решетки а = 2,879; b = 0,694; с - 0,276 нм по концентра-
ции 38 % (ат.) Pt после отжига при температуре 700 °C.
Фазы у, у, относятся к структурному типу у латуни, структура фазы
Y| (Pt5Zn21) несколько сложнее, а - 1,8116 нм. Соединение PtZn8 (88,89 %
(ат.) Zn) имеет структуру низкой симметрии [X].
В системе Pt-Zn отмечается значительная (< 20 % (ат.)) растворимость
Zn в (Pt) [4]; Pt практически нерастворима в (Zn) [X].
Литература
1. Moser Z.//J. Phase Equilibria. 1991. V. 12. N 4. Р. 439-443.
2. Nowotny H., Bauer E., Stempfl A., Bittner H. // Monatsh. Chem. 1952. Bd. 83. S. 221-236.
3. Carl W., Schubert K. // J. Less-Common Met. 1969. V. 19. N 3. P. 279-283.
4. Harris I.R., Normann M., Bryant A.W. // J. Less-Common Met. 1968. V. 16. N 4.
P. 427-440.
В. П. Полякова
Pt-Zr. ПЛАТИНА-ЦИРКОНИЙ
Исследование диаграммы состояния Pt-Zr (рис. 480) выполнено
методами микроскопического и рентгеновского анализов, а также
определения температуры солидуса (начинающееся плавление) [1] и
дифференциального термического анализа измерения твердости и
микротвердости [2], рентгеновского анализа [3-6]. Работа [1] посвящена
более подробному исследованию диаграммы со стороны Zr, а работа [2]
изучению диаграммы состояния со стороны Pt. В системе найдены
соединения ZrPt3, ZrPt, Zr5Pt3, Zr9PtH, Zr7Pt10. В работе [3] было
установлено, что в действительности фаза, которой был приписан состав
Zr2Pt [1], отвечает стехиометрии Zr5Pt3. В этой же работе [3] обнаружена
также фаза типа Ti2Ni, возникновение которой связано с присутствием
кислорода в сплавах, и фаза ZrPt1+x, стабильная только при высоких
температурах. Эти фазы на диаграмме (рис. 480) не указаны. В работе
[4] установлено существование соединений Zr9Ptj । (соответствует Zr4Pt5,
найденному в работах [3], [6]) и Zr7Pt10 (вероятно, то же, что Zr2Pt3 [3]).
Существование соединения Zr9PtH при 1000 °C подтверждено в работе
82
Pl-Zr
Рис. 480. Pt - Zr
Соединения ZrPt3 и ZrPt плавятся конгруэнтно: ZrPt3 при >2120 °C
[1] или 2000 °C [2] и ZrPt - при 2100 °C [1, 2]; эвтектика между этими
соединениями плавится при 2000 °C [1] или 1855 °C [2]. Соединение Zr5Pt3
(Zr2Pt) образуется по перитектической реакции при 1725 °C [1]. Способ
образования соединений Zr9Pt j j (Zr4Pt5) и Zr7Pt10 (Zr2Pt3) не установлен.
Платина понижает температуру превращения (pZr) ** (aZr). При
1185 °C происходит эвтектическая реакция Ж ° (PZr) + Zr5Pt3, при 826 °C
- эвтектоидный распад (PZr) « (aZr) + Zr5Pt3. Растворимость Pt в (PZr)
около 7 % (ат.) при температуре эвтектической реакции, уменьшается до
-4 % (ат.) при температуре эвтектоидной реакции. В (aZr) растворяется
0,5 % (ат.) Pt [1].
Температура плавления Pt повышается при растворении Zr и при
1780 °C происходит перитектическая реакция Ж + ZrPt3 « (Pt). Раствори-
мость Zr при перитектической температуре составляет 11 % (ат.) и
уменьшается до 10 % (ат.) при 1500 °C [2]. Следует отметить, что в
справочнике [М] указана температура перитектической реакции 1963 °C
Pl-/г
83
и растворимость Zr в (Pt), равная 22 % (ат.), однако, источник этих
сведений не известен. Параметры решетки твердых растворов на основе
палладия определяли в работе [7].
Сведения о кристаллической структуре соединений даны в табл. 378.
Таблица 378. Кристаллическая структура соединений системы Pt-Zr
Соединение Прототип Символ Пирсона, пр.гр. Параметры решетки, нм Источник
a h c
ZrPt3 Ni3Ti ЛР16, Pfiylmmc 0,5644- 0,5624 - 0,9225 0,9213 [X] [3]
Zr9Pt|| - if, IMm 1,0296 - 0,6888 [4]
ZrPt1+x CsCI cP2, Pm3m 0,333 — — [3]
ZrPt CrB oCK, Cntcm 0,3409 1,031 0,4277 [3]
Zr5Pt3 Mn5Si3 hP\f>, Pbj/mcm 0,8201 - 0,5405 [8]
Кристаллографические данные о соединении Zr7Pt10 отсутствуют.
В работе [3] Zr5Pt3 относят к типу Zr5Ir3, полагая последнее соедине-
ние первым представителем нового структурного типа (см. также [9]).
Литература
I. Kendall E.G., Hays С., Swift R.E. И Trans. AIM ME. 1961. V. 221. N 3. P. 445-452.
2. Савицкий E.M., Полякова В.П., Воронова Л.М. И Структура фаз, фазовые
превращения и диаграммы состояния металлических систем. М.: Наука, 1974. С. 164-166.
3. Raman A., Schubert К. И Z. Metallkunde. 1964. В. 55. N II. S. 704-710.
4. Panda S.C., Bhan S. И J. Less-Common Met. 1974. V. 34. N 2. P. 344-347.
5. Соколовская E.M., Соколова И.Г. // Вестник Моск, ун-та. Химия. 1987. Т. 28. N 6
С. 566-568.
6. Konobas Y.J., Raevskaya M.V., Sokolova LG. H J. Less-Common Met. 1985. V. 115 N 2
P.L5-L6.
7. Schaller H.-J.//Z. Metallkunde. 1979. Bd. 70. N 5. S. 318-321.
8. Biswas T.K., Schubert K. // Z. Metallkunde. 1967. Bd. 58. N 8. S. 558-559.
9. Cenzual K., Parthe E. // Acta Crystallogr. 1986. V. 42. N 9. P. 1101-1105.
Л.А. Третьяченко
84
Pt-Re, Ри-Rh
Pu-Re. ПЛУТОНИЙ-РЕНИЙ
В системе обнаружено соединение PuRe2, образующее эвтектику с Ри
|Э]. В работе [Ш] указывается, что в области с содержанием более 80 %
(ат.) Ри промежуточные фазы не обнаружены. Соединение PuRe2
относится к фазам Лавеса, имеет структуру типа MgZn2 (символ Пирсона
API 2, пр.гр. Р651ттс), параметры решетки а - 0,5396 нм, с - 0,8729 нм
[Э].
М.А. Тылкина
Pu-Rh. ПЛУТОНИЙ РОДИЙ
Диаграмма состояния Pu-Rh приведена на рис. 481 по данным работы
[М]. Она в основном соответствует диаграмме, построенной в работе [1]
на основании термического анализа, микроскопического, рентгеновского
и других методов. В системе обнаружено восемь промежуточных фаз, из
(по массе)
Ри Ph, •/. (am.) Ph
Рис. 481. Pu - Rh
Pu-Rh, Pu-Ru
85
которых PuRh и PuRh3 образуются непосредственно из расплава при
температурах -1300 и 1495 °C. Показано, что PuRh3 имеет область
гомогенности -3 % (ат.). Соединения Pu2Rh, Pu5Rh3, Pu3|Rh20, Pu5Rh4,
Pu3Rh4, PuRh2 кристаллизуются из расплава по перитектическим
реакциям при температурах 940, 980, 1020 (?), 1180, 1310, 1340 °C
соответственно и практически не имеют областей гомогенности.
Взаимная растворимость Ри в (Rh) и Rh во всех модификациях (Ри) мала,
за исключением (еРи), где растворимость Rh составляет -2 % (ат.). В
системе установлены три эвтектических равновесия: (ePu) + Pu2Rh при
590 °C, PuRh + Pu3Rh4 при 1260 °C, PuRh3 + (Rh) при 1400 °C.
Кристаллическая структура индицирована только для богатых Rh
фаз PuRh2 и PuRh3 (табл. 379).
Таблица 379. Кристаллическая структура соединений системы Pu-Rh |1|
Соединение Прототип Символ Пирсона, пр.гр. Параметр решетки а, нм
PuRh3 AuCu3 сР4, РтЗт 0,4009-0,4040
PuRh2 MgCu2 cF24, Fd3m 0,7488
Литература
1. Кутайцев В.И., Чеботарев Н.Т., Андрианов М.А. и др. // Атомная энергия. 1967. Т. 23
N6. С. 511-519.
Полякова
Pu-Ru. ПЛУТОНИЙ-РУТЕНИЙ
Диаграмма состояния Pu-Ru представлена на рис. 482 по данным
работы [1]. Растворимость Ru в (ePu) составляет -3 % (ат.). Соединение
PuRu2 образуется непосредственно из расплава при температуре выше
1600 °C и относится к фазам Лавеса с решеткой типа MgCu2.
Соединения PuRu, Pu5Ru3, Pu3Ru образуются по перитектическим
реакциям при 1250, 1025, 600 °C соответственно.
Соединение Pu)9Ru (фаза Q образуется по перитектоидной реакции
при 325 °C и имеет область гомогенности -3-7 % (ат.) Ru. В системе
кристаллизуются две эвтектики: (ePu) + Pu3Ru и PuRu2 + (Ru) при 575
и -1500 °C соответственно [1].
86
Pu~Ru
Ри Ни, °/о (am.) Ru
Рис. 482. Pu - Ru
Кристаллическая структура фаз указана в табл. 380.
Таблица 380. Кристаллическая структура соединений системы Pu-Ru
Соединение Прототип Символ Пирсона, пр.гр. Параметры решетки, н.м Источник
а b с
PuRu2 MgCu2 с/?24, Fd3m 0,7472- 0,7476 - - [1]
PuRu CsCl cPZ, РтЗт 0,33635 - - [В
Pu5Ru3 - tP, РМттт 0,8092 - 1,0023 [Ш, 2]
Pu3Ru - оР, Рттт 0,6216 0,6924 0,8093 [Ш.2]
Структура Pu19Ru не установлена.
Ри-Ru, Pu-S, Pu-Sc
87
Литература
1. Кутайцев В.И., Чеботарев H.T., Андрианов М.А. и др. /I Атомная энергия. 1967. Т. 23.
N 6. С. 511-519.
2. Berndt А.Е.//Adva. X-Ray Anal. 1980. V. 91. N 2-3. P. 306-310.
MB. Раевская
Pu-S. ПЛУТОНИЙ-СЕРА
Диаграмма состояния Pu-S не построена. Известно о существовании
двух сульфидов: PuS и Pu2S3, кристаллографические характеристики
которых указаны в табл. 381 [Э, 1].
Таблица 381. Кристаллическая структура соедииений системы Pu-S
Соединение Прототип Символ Пирсона, пр.гр. Параметр решетки а, нм
PuS NaCl cF8, Fm3m 0,5536
Pu2S3 Th3P4 cI2S, 743 d 0,8454
Сульфид Pu2S3 плавится конгруэнтно при 1725±10 °C (давление
1,3 Па) и не разлагается при температурах <2300 ° в Аг [Ш].
Литература
1. Кутайцев В.И. Сплавы тория, урана и плутония. М.: Госатомиздат, 1962. 224 с.
Л.Л. Рохлин
Pu-Sc. ПЛУТОНИЙ-СКАНДИЙ
Диаграмма состояния Pu-Sc представлена на рис. 483 согласно
данным работы [1] с некоторыми исправлениями, обусловленными
наличием у Sc только двух модификаций: высокотемпературной р с ОЦК
решеткой и низкотемпературной а с гексагональной плотноупакованной
решеткой.
Диаграмма состояния характеризуется полной смешиваемостью
компонентов в жидком состоянии и непрерывным рядом твердых
растворов между высокотемпературными модификациями компонентов
е?и и pSc с ОЦК решеткой. При содержании ~40 % (ат.) Sc образуется
88
Ри-Sc
Рис. 483. Pu - Sc
фаза С В работе [1] предполагалось, что между температурами 1090 и
-1340 °C существует третья модификация Sc с ГЦК решеткой. Твердый
раствор на основе этой модификации предположительно распадается
эвтектоидно при 850 °C на (ePu, pSc) и (aSc). Поскольку указанная
модификация Sc с ГЦК решеткой не существует, следует отказаться оз
наличия на диаграмме областей твердого раствора на ее основе. С учетом
этого, предположительно внесено изменение в диаграмму, которое
показано штриховой линией, разграничивающей области (aSc) и
(aSc) + (ePu, PSc). Термический анализ четко фиксировал нонвариантные
превращения при 850 и 760 °C. В связи с этим можно предположить, что
фаза С образуется не при 760 °C, как указано в работе [1], а при 850 °C
Реакция образования фазы (, согласно представленной диаграмме.
Pu~Sc, Pu-Se
89
перитектоидная: (aSc) + (ePu, 0Sc) « £ при 850 °C. При температуре 760 °C
возможно полиморфное превращение этой фазы.
Максимальная растворимость Ри в (aSc) определена равной 40 % (ат.)
при температуре 850 °C. Растворимость Sc в (бРи) составляет -25 % (ат.),
а в остальных полиморфных модификациях (а, 0 и у) - не превышает 10 %
(ат.).
Состав фазы С соответствует формуле Sc2_f 2^*из—2 7- Приблизительно
можно принять для нее формулу Sc2Pu3. Фаза <(Sc2Pii3) имеет структуру
типа (aLa), символ Пирсона ЛР4, пр.гр. Рб^ттс, параметры решетки:
а = 0,3310...0,3307 нм, с = 1,0715...1,0718 нм.
Литература
I. Кутайцев В.И., Чеботарев Н.Т., Андрианов М.А. и др. // Атомная энергия. 1967. Т. 23.
№6. С. 511-519.
Л.Л. Рохлин
Pu-Se. ПЛУТОНИЙ-СЕЛЕН
Диаграмма состояния не построена, но установлено существование
нескольких соединений: PuSe, pPu2Se3 (НТ), yPu2Se3(BT), PuSe2 и PuSe?_v.
Соединение PuSe плавится при 2075 °C [1]. При нагреве до 1400 °C
Таблица 382. Кристаллическая структура соединений системы Pu-Se
Соединение Прототип Символ Пирсона, пр.гр. Параметры решетки, нм Источник
a b c
PuSe NaCl cF8, Fm 3 m 0,57934 - - [1]
T)Pu2Se3(HT) Sb2S3 (>P20, Pnma 1,110 0,410 1,132 [4]
yPu2Se3(BT) Th3P4 cI2Z, /43 d 0,87868 - - [4]
PuSe2 Cu2Sb lP(>, PMnmm 0,833 - 0,841 [41
PuSe2_K Cu?Sb lP6, PMnmm 0,8198 - 0,8364 [4]
90
Ри-Se, Ри-Si
r)Pu2Se3 переходит в другую полиморфную модификацию yPu2Se3 [2].
Обзор данных о системе Pu-Se проведен в работе [3].
Кристаллическая структура соединений приведена в табл. 382.
Соединение PuSe2 нестабильно и разлагается, переходя в соединение
PuSe2„v
Литература
1. Kruger O.L., Moser J.B.//J. Phys. Chem. Solids. 1967. V. 28. N 11. P. 2321-2325.
2. Marcon J.P., Pascard R. //J. Inorg. Nuclear. Chem. 1966. V. 28. N 12. P. 2551-2560.
3. Оболончик B.A. // Селениды. M.: Металлургия, 1972. 296 c.
4. Marcon J.P., Pascard R., Rerrin F. И Compt. Rend. Acad. Sci. Paris. Ser. C. 1966. V. 262.
N 24. P. 1679-1681.
Ю.Б. Кузьма
Pu-Si. ПЛУТОНИЙ-КРЕМНИЙ
Представленная на рис. 484 диаграмма состояния Pu-Si построена по
данным работы [1]. Исследование выполнено методами микроструктур-
ного, рентгеновского, термического и дилатометрического анализов
О Ю 20 SO 40 ОО ОО 70 ОО 90 100
Ри sl,°/ofafn.) Sc
Рис. 484. Pu - Si
Pu-Si
91
и путем определения температур начала плавления сплавов. Исходными
материалами служили Ри чистотой 99,96 % (по массе) (примеси, % (по
массе): 0,0215 С, 0,006 Fe, 0,0045 Ni, 0,005 О и Si полупроводниковый).
В сплавах существуют пять соединений: Pu5Si3, Pu3Si2, PuSi, Pu3Si5,
PuSi2- Соединение Pu5Si3 содержит -38 % (ат.) Si и образуется по
перитектической реакции при 1377 °C: Ж + Pu3Si2 * Pu5Si3. Соединение
Pu3Si2 с 40 % (ат.) Si образуется при 1441 °C по реакции Ж + PuSi «
° Pu3Si2. Соединение PuSi (50 % (ат.) Si) плавится конгруэнтно при
1576 °C. Соединение Pu3Si5 (63,5 % (ат.) Si) плавится при 1646 °C, a PuSi2
(64,5 % (ат.) Si) - при 1638 °C.
В сплавах системы кристаллизуются три эвтектики:
Ж « (ePu) + Pu5Si3 при 590±2 °C и 3,6±0,3 % (ат.) Si;
Ж « PuSi + Pu3Si5 при 1521 ±10 °C и 54,5±0,05 % (ат.) Si;
Ж - PuSi2 + (Si) при 1232±5 °C и 83,6±0,2 % (ат.) Si.
Фаза (б'Ри) образуется по перитектоидной реакции: (ePu) + Pu5Si3 «
« (б'Ри) при 497±3 °C. При температуре 312±2 °C (бРи) распадается по
реакции (6Pu) « (уРи) + Pu5Si3. Растворимость Si в (еРи) и (б'Ри) при
497 °C составляет 0,5 и 1 % (ат.) соответственно.
Кристаллическая структура соединений приведена в табл. 383.
Таблица 383. Кристаллическая структура соединений системы Pu-Si
Соединение Прототип Символ Пирсона, пр.гр. Параметры решетки, нм Источник
а b с
Pu5Si3 W5Si3 г/32, I'Xlmcm 1,1407 - 0,5444 [Ш, 1]
Pu3Si2 U3Si2 lP\Q, Р^/тот 0,7483 - 0,4048 [Ш, 1]
PuSi TiSi оРЪ, Рпти 0,5727 0,7933 0,3847 [1]
Pu3Si5 А1В2 ЬРЗ, РЫттт 3,875 - 4,102 [X, Ш, 1]
PuSi 2* - ol, 3,988 3,957 1,354 [Ш, 1]
Указаны значения параметров решетки, полученные для сплава PuSi2 с 64,5 % (ат.) Si.
92
Pu~Si, Pu-Sm
Литература
1. Land C.C., Jonson K.A., Ellinger F.N.//J. Nucl. Mater., 1965 V. 15. N IP. 23-32.
Pu-Sm. ПЛУТОНИЙ-САМАРИЙ
П.Б. Будберг
Результаты исследования диаграммы состояния Pu-Sm приведены
в работе [1]. Уточненная диаграмма состояния (рис. 485) построена в
основном по данным работы [1] с учетом данных о полиморфизме Sm.
Исследование [1] выполнено с помощью микроструктурного, рентгенов-
ского и термического анализов.
При температуре 637 °C и содержании 2-3 % (ат.) Sm кристаллизуется
эвтектика (ePu) + (0Sm), а при температуре 491 °C протекает перитекто-
идная реакция (ePu) + (0Sm) « (б'Ри). Максимальная растворимость Ри
в (pSm) составляет 29 % (ат.). Эта точка соответствует кататектической
Рис. 485. Pu - Sm
Pu-Sm, Ри-Sn
93
реакции распада (ySm) на (pSm) и жидкость, обогащенную Ри. Раствори-
мость Sm в (бРи) и (ePu) составляет ~2 % (ат.).
В области твердого раствора (aSm) с ромбоэдрической структурой
в интервале концентраций 7-17 % (ат.) Ри обнаружено существование
ГП-структуры с удвоенной ячейкой.
Литература
1. Ellinger F.H., Land С.С., Jonson К.А. // J. Nucl. Mater. 1969. V. 29. N 2. P. 178-183.
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
Pu-Sn. ПЛУТОНИЙ-ОЛОВО
Исследованию физико-химического взаимодействия Pu-Sn посвящены
работы [1-3 и др.]. Было установлено образование нескольких соедине-
ний в системе: Pu3Sn, Pu5Sn3, Pu5Sn4, PugSn7, Pu7Sng, PuSn2, PuSn3.
Согласно работе [1] в системе имеет место эвтектическое превращение
Ж « (ePu) + + Pu3Sn при содержании в жидкости 13 % (ат.) Sn. Соедине-
ние PuSn3 плавится при 1198±5 °C [2]. В работе [2] определена также
растворимость Ри в жидком Sn, которая с повышением температуры
возрастает от 0,0032 % (ат.) при 400 °C до 8,21 % (ат.) при 1102 °C.
Результаты исследований взаимодействия Pu с Sn обобщены в работе
[4], в которой построена диаграмма состояния Pu-Sn, показанная на
рис. 486.
Значительная часть диаграммы является предположительной
(штриховые линии). При построении диаграммы предполагалась ее
аналогия с диаграммой состояния Pu-Pb.
Кристаллическая структура фаз указана в табл. 384. Она установлена
только для ряда соединений.
Таблица 384. Кристаллическая структура соединений системы Pu-Sn [4]
Соединение Прототип Символ Пирсона, пр.гр. Параметры решетки, нм Источник
а с
Pu3Sn AuCu3 <Р4, РтЪт 0,4680 - [4]
PuSn2 Ga2Hf tI24, I4]/amd 0,443 0,310 [4]
PuSn3 AuCu3 сР4, Рт 3 т 0,463 - 14]
94
Ри-Sn, Pu-Sr
Рис. 486. Pu - Sn
Сведения о кристаллической структуре соединений Pu5Sn3, Pu5Sn4,
Pu8Sn7, Pu7Sn8 отсутствуют.
Литература
1. Schonfield F.W., Cramer E.M., Miner W.H., Ellinger F.H., Coffinberry A.S. // Metallurgy
and Fuels 2.1 H.M. Finniston and J.P. Howe. Eds., Progress in Nuclear Energy. Ser. V. Pergamon
Press. 1959. P. 578.
2. Ward J.W., Mulford R.N.R.//J Nucl. Mater. 1964. V. 12. P. 335-336.
3. Wallace P.L., Harvey M.R.// J. Nucl. Mater. 1974. V. 54. N 2. P. 171-174.
4. Foltyn E.M., Peterson D.E. // Bull. Alloy Phase Diagrams. 1988. V. 9. N 2. P. 152-155, 203.
204.
Pu-Sr. ПЛУТОНИЙ-СТРОНЦИЙ
Г.И. Терехов
Изучение малых количеств сплавов Pu-Sr указывает, что в системе
существует неограниченная растворимость в твердом и жидком
состояниях [1]. Эти данные можно, однако, рассматривать лишь как
ориентировочные ввиду наличия нескольких различных модификаций
у Pu и Sr.
Pu-Sr, Ри-Ta, Ри-Tb
95
Литература
I. Кутайцев В.И. Сплавы тория, урана и плутония. М.: Госатомиздат, 1962. 224 с.
Л.Л. Рохлин
Pu-Та. ПЛУТОНИЙ-ТАНТАЛ
Диаграмма состояния Pu-Та по данным работы [М] приведена на
рис. 487. В сплавах системы не образуются интерметаллические
Рис. 487. Pu - Та
соединения, а в сплавах богатых Pu при 640 °C кристаллизуется
вырожденная эвтектика (ePu) + (Та). Взаимной растворимости ком-
понентов друг в друге не установлено.
П.Б. Будберг
Pu-Tb. ПЛУТОНИЙ-ТЕРБИЙ
Предварительное исследование выплавленных в дуговой печи сплавов
свидетельствует об отсутствии промежуточных фаз в системе. Рентгенов-
ские данные показывают, что максимальная растворимость в твердом
состоянии ТЬ в (Pu) (по-видимому, e-модификация) составляет 2-3 %
(ат.), a Pu в (ТЬ) -20 % (ат.) [Ш].
Е.И Гладышевский, О.И. Бодак, В.К. Печарский
96
Ри-Te, Ри-Th
Pu-Te. ПЛУТОНИЙ-ТЕЛЛУР
Путем нагрева в вакууме или в гелии под давлением, несколько
меньшим атмосферного, получено соединение РиТе, которое имеет
структуру типа NaCl (символ Пирсона сЕ8, пр.гр. Fm3m), параметр
решетки а - 0,6183 нм [1].
Согласно работе [1] соединение достаточно стабильно и при нагреве
скорее разлагается, чем плавится при температурах вблизи 2000 °C.
Литература
1. Gorum А.Е.//Acta Crystallogr. 1957. V. 10. N 2. Р. 144.
Pu-Th. ПЛУТОНИЙ-ТОРИЙ
Л.Л. Рохлин
Результаты исследования диаграммы состояния Pu-Th приведены в
работах [1-3 и др.]. В работе [4] представлен расчетный вариант
диаграммы, базирующийся на экспериментальных данных. Окончатель-
Ри Th, Th
Рис. 488. Pu - Th
Pu-Th, Pu-Ti
97
ный вариант диаграммы состояния Pu-Th (рис. 488) приведен в обзоре
[5].
Единственное соединение Pu7Th3 (фаза 0, относительно кристалличес-
кой структуры и состава которого есть разногласия [6], образуется по
перитектической реакции Ж + (0Th) « С при 615 °C. При температуре
несколько ниже 605 °C протекает эвтектическая реакция Ж » (ePu) + С
при концентрации 7 % (ат.) Ри. Максимальная растворимость Th в (ePu)
-5,6 % (ат.). При температуре 500 °C имеет место перитектоидная реакция
(ePu) + С « (бРи) с перитектоидной точкой, соответствующей максималь-
ному значению растворимости Th в (бРи) около 2,6 % (ат.). Предполага-
ется, что перитектоидная реакция (ePu) + (бРи) « (б'Ри) протекает при
490 °C и концентрации -1,4 % (ат.) Th. Превращения, связанные с (б'Ри),
схематически показаны в увеличенном масштабе на диаграмме состояния
в виде вставки. Растворимость Th в (уРи) и (рРи) незначительна.
Температуры эвтектоидных реакций (бРи) « (уРи) + С (315 °C) и
(уРи) « (рРи) + С (215 °C) близки к температурам соответствующих
полиморфных превращений Ри. Характер взаимодействия фаз (аРи),
(рРи) и С на стороне Ри не установлен. Температура 125 °C этого
превращения соответствует а « p-превращению чистого плутония.
На стороне Th диаграммы установлено эвтектоидное превращение
(PTh) « С + (“Th) при 582 °C. Максимальная растворимость Ри в (aTh)
составляет около 48 % (ат.), а эвтектоидная точка существует при 51 %
(ат.) Th. Границы фазовых областей (PTh) и (PTh) + (aTh) намечены
предположительно, поскольку экспериментальныеточки, определяющие
положения этих областей, недостаточно согласуются между собой.
Кристаллическая структура соединения Pu7Th3 (фаза С) принимается
орторомбической с параметрами а = 0,622 нм, b = 1,162 нм, с - 0,709 нм
[5].
Литература
1. Poole D.M., Williamson G.K., Marples J.A. H J. Inst. Met. 1957. V. 86. N 4. P. 172-176.
2. Portnoff A.Y., Calais D.//J. Less. Common Met. 1965. V. 9. N l.P. 74-76.
3. Portnoff A.Y., Calais D.//J. Nucl. Mater. 1967. V. 24. N 2. P. 158-163.
4. Chan K.S., Lee J.K., Aaronson H.I. // J. Nucl. Mater. 1980. V. 92. N 2/3. P. 237-242.
5. Peterson D.E. // Bull. Alloy Phase Diagrams. 1985. V. 6. N 4. P. 342-345, 397, 398.
6. Кутайцев В.И. Сплавы тория, урана и плутония. М.: Госатомиздат, 1962. 224 с.
Г И. Терехов
Pu-Ti. ПЛУТОНИЙ-ТИТАН
Исследованию диаграммы состояния Pu-Ti посвящен ряд работ [1-4].
Общепризнанным является вариант диаграммы состояния (рис. 489),
установленный в работе [1]. Сплавы исследованы методами микрострук-
98
Ри-Ti
Рис. 489. Pu - Ti
турного, рентгеновского, термического анализов, а также методами
определения электропроводности и магнитных свойств.
Максимальная растворимость Ti в (ePu) достигает 14 % (ат.) при
730 °C, снижаясь до -6 % (ат.) при 450 °C. Растворимость Ti в (бРи)
находится в пределах 4-2,5 % (ат.). Максимальная растворимость Ti в
(РРи) достигает 2 % (ат.), а в (аРи) и (уРи) составляет ~0,5 % (ат.).
Растворимость Pu в (pTi) достигает 12 % (ат.) при 730 °C, снижаясь до
6 % (ат.) при 580 °C, при этой температуре протекает эвтектоидный
распад (pTi).
По данным работы [2] максимальная растворимость Pu в (pTi)
достигает 22 % (ат.) при 765 °C; эвтектоидная точка расположена при
-15 % (ат.) Pu и 527 °C. Pu расширяет область устойчивости (pTi) и
Ри-Ti, Pu-Tl. Pu-Tm
99
является так называемым [3-стабилизатором. Авторы работы [3]
исследовали влияние высокого давления до 5,0 ГПа на устойчивость
полиморфных модификаций в сплавах Pu с 1,3 и 6 % (ат.) Ti. В работе
[4] сделана попытка рассчитать на основе термодинамических приближе-
ний кривые ликвидуса и солидуса в сплавах системы Pu-Ti, при
содержании Ti до 10 % (ат.).
Литература
1. Кутайцев В.И., Чеботарев Н.Т., Андрианов М.А. и др. //Атомная энергия. 1967. Т. 23.
№6. С. 511-519.
2. Zanguille А. И Met. Sci. Rev. 1971. V. 68. N 6. P. 435-441.
3. Ziptai R.G., Friddle R.G.//J. Nucl. Mater. 1967. V. 21. N 1. P. 114-116.
4. Woznikova B., KucharZ.//Sb. Ved. Pr. Vys. Sk. Ban. Ost. I Rada hutn. 1978, V. 24. N 2.
P. 67-80.
П.Б. Будберг
Pu-Tl. ПЛУТОНИЙ-ТАЛЛИЙ
Диаграмма состояния Pu-Tl не построена. В работе [Ш] сообщается
об исследовании кристаллических структур соединений системы Pu-Tl,
характеристики которых указаны в табл. 385.
Таблица 385. Кристаллическая структура соединений системы Pu-Tl |Ш)
Соединение Прототип Символ Пирсона, пр.гр. Параметры решетки, нм
а Ь с
PujTl AuCu3 сР4, 0,4723 - -
РтЗт
PuTl3 Mg hP2, Рбу/ттс 0,3458 - 0,5519
Е.И. Гладышевский, О.И. Бодак. В.К. Печарский
Pu-Tm. ПЛУТОНИЙ-ТУЛИЙ
Согласно работе [Ш] в системе Pu-Tm промежуточные фазы не
образуются. Максимальная растворимость в твердом состоянии Тт в
(ePu) составляет 2-3 % (ат.), а Ри в (Тт) -20 % (ат.).
Е.И. Гладышевский, О.И. Бодак. В.К. Печарский
100
Pu-U
Pu-U. ПЛУТОНИЙ-УРАН
Диаграмма состояния Pu-U исследована экспериментально [1].
Исследование сплавов проводили методами микроструктурного,
термического, рентгеновского и дилатометрического анализов, а также
измерением плотности.
Диаграмма состояния Pu-U приведена на рис. 490 [М], в которой она
построена, в основном, по данным работы [1]. На вставке показана часть
диаграммы Pu-U со стороны Ри в увеличенном масштабе согласно
работе [1]. В сплавах системы при высоких температурах наблюдается
образование непрерывных рядов твердых растворов между (сРи) и (уЦ).
Температурный интервал существования непрерывной растворимости
Рис. 490. Pu-U
Pu-U, Pu-U
101
является наименьшим в сплавах с 30-40 % (ат.) U. На кривых ликвидуса
и солидуса имеется минимум с общей точкой касания при температуре
610 °C и концентрации 12 % (ат.) U.
U незначительно растворяется в полиморфных модификациях Ри: в
а <0,2 % (ат.), в 0 - 2 % (ат.), в у - 0,7 % (ат.), в б - 0,3 % (ат.), в 5' -1,5 %
(ат.). Ри снижает температуры полиморфных превращений U. В сплавах
системы в широких интервалах температур и составов существуют две
промежуточные фазы д и <, первая из них устойчива только при высоких
температурах, а вторая - до комнатной температуры. Фаза т] образуется
по перитектоидной реакции (ePu, yU) + (0U) * д при температуре 705 °C.
Интервал гомогенности фазы т| простирается от -68 % (ат.) при
перитектоидной реакции до 2 % (ат.) U при 320 °C. Фаза т) устойчива при
понижении температуры до 278 °C, затем она распадается эвтектоидно
т] * (0Ри) + С при концентрации -3 % (ат.) U. Фаза С также образуется по
перитектоидной реакции: д + (0U) С при температуре 590 °C и
концентрации 72 % (ат.). Максимальное содержание Ри в С достигает
75 % (ат.) при 278 °C, снижаясь до -69 % (ат.) Ри при комнатной
температуре. При 560 °C в (aU) растворяется -15 % (ат.) Ри, при 250 °C
-11 % (ат.) Ри. Максимальная растворимость Ри в (0U) -20 % (ат.) при
705 °C и понижается до - 18 % (ат.) при 560 °C [1].
Фаза т) имеет сложную решетку на основе тетрагональной решетки
с параметрами а = 1,057 нм, с = 1,076 нм. Фаза < обладает кубической
решеткой с параметрами а - 1,0692 нм при 35 % (ат.) U и а = 1,0651 нм
при 70 % (ат.) U [1].
В работах [2, 3] с использованием различных термодинамических
приближений приведен расчет линий ликвидуса и солидуса системы
Pu-U. Подтверждены в основном данные работы [1].
Литература
1. Ellinger F.H., Elliot R.O., Cramer Е.М. //J. Nucl. Mater. 1959. V.1.N3.P. 233-243.
2. Иванов O.C., Удовский АЛ., Гайдуков А.М. И Диаграммы состояния металлических
систем. Термодинамические расчеты и экспериментальные методы. Сб. статей: М.: Наука,
1981. С. 60-64.
3. Chan K.S., Lee J.K., Aaronson H.I. H J. Nucl. Mater. 1980. V. 92. N 2/3. P. 237-242.
П.Б. Будберг
Pu-V. ПЛУТОНИЙ-ВАНАДИЙ
На рис. 491 дана диаграмма состояния Pu-V, построенная в работе
[М] по данным работы [1]. Сплавы исследовали методами микроструктур-
ного, рентгеновского и термического анализов. При температуре 625 °C
кристаллизуется эвтектика (ePu) + (V), эвтектическая точка расположена
102
Pu-V. Pu-W
Vt°/o(am.)
V
Pu
Рис. 491. Pu - V
при <2,3 % (ат.) V. Остальные температуры на рис. 491 соответствуют
температурам полиморфных превращений в чистом Pu.
Литература
1. Конобеевский С.Т. // Тр. сессии АН СССР по мирному использованию атомной
энергии. М.: Изд-во АН СССР, 1955. С. 352-376.
П.Б. Будберг
Pu-W. ПЛУТОНИЙ-ВОЛЬФРАМ
Результаты исследования взаимодействия Pu с W [Э, Ш, 1-2]
обобщены в работе [3] (рис. 492).
Pu и W практически не растворяются друг в друге в твердом
состоянии и не образуют промежуточных фаз [1, Э], что подтверждено
термодинамическими расчетами [2]. Растворимость W в жидком Pu
составляет 0,0038; 0,0072; 0,0105; 0,0159; 0,0255 и 0,0379 % (ат.) при 700,
750,800,850,900 и 950 °C соответственно [3]. По аналогии с диаграммой
состояния Pu-Мо предполагается, что в системе Pu-W образуется
эвтектика, близкорасположенная к Pu [Э]. Нонвариантные превращения
Pu-W
103
Рис. 492. Pu-W
в твердом состоянии происходят при температурах, практически
совпадающих с температурами соответствующих полиморфных
превращений Pu.
Литература
1. Ellinger F.H., Miner W.N., O'Boyle D.R., Schonfeld F.W. // Constitution of Plutonium
Alloys. New Mexico: Los Alamos Scientific Laboratory. University of California, 1968. P. 63-64,
125-126.
2. Miedema A.R. // Philips Technical Review. 1976. V. 36. N 8. P. 217-231.
3. Pandian S., Nagender Naidu S.V., Rama Rao P. // J. Alloy Phase Diagrams. 1988. V. 4 N 3.
P. 154-159.
К.Б. Поварова
104
Pu-Y
Pu-Y. ПЛУТОНИЙ-ИТТРИЙ
Диаграмма состояния Pu-Y (рис. 493) исследована с помощью
методов дифференциального термического, микроскопического,
рентгеноструктурного и других анализов [1].
Диаграмма состояния характеризуется полной смешиваемостью
компонентов в жидком состоянии. Двойные соединения не образуются.
Максимальная растворимость Ри в (aY) равна -15 % (ат.) при -820 °C.
Растворимость во всех полиморфных модификациях Ри - незначительна.
В системе наблюдалось семь нонвариантных превращений, связанных
с кристаллизацией и полиморфными превращениями Ри. Это вырожден-
ное эвтектическое превращение Ж « (ePu) + (aY) при 640 °C, эвтектоид-
ные превращения: (ePu) (б'Ри) + (aY) при 475 °C, (бРи) « (уРи) + (aY)
при 318 °C, (уРи) « (PPu) + (aY) при 208 °C и (PPu) * (aPu) + (aY) при
122 °C. Нонвариантного превращения, связанного с б' « б превращением
О го 20 30 40 90 60 70 60 90 700
Ри Y,9/o fam.) Y
Рис. 493. Pu-Y
Pu-Y. Pu-Yb, Pu-Zn
105
при 318 °C, (yPu) « (PPu) + (aY) при 208 °C и (0Pu) и (aPu) + (aY) при
122 °C. Нонвариантного превращения, связанного с б'« б превращением
Ри при термическом анализе не обнаружено. Можно предполагать, что
оно очень близко к превращению при 475 °C и поэтому не выявляется.
Это превращение, показанное штриховой линией, происходит при
температуре -475 °C более высокой, чем температура б' « б превращения
Ри (463 °C) и поэтому должно быть перитектоидным: (б'Ри) + (aY) =*
« (бРи). При - 820 °C происходит кататектическое превращение: (PY) «
« Ж + (aY).
Литература
1. Кутайцев В.И., Чеботарев Н.Т., Андрианов М.А. и др. // Атомная энергия. 1967. Т. 23.
№6. С. 511-519.
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
Pu-Yb. ПЛУТОНИЙ-ИТТЕРБИЙ
Диаграмма состояния Pu-Yb не построена. По данным работы [Ш]
система характеризуется несмешиваемостью в жидком состоянии.
Промежуточные фазы не образуются.
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
Pu-Zn. ПЛУТОНИЙ-ЦИНК
Представленная на рис. 494 диаграмма состояния Pu-Zn приведена
согласно работе [М]. В значительной степени она основывается на
данных работ [1, 2]. Для системы характерно образование нескольких
соединений: PuZn2, Pu13Zn58, Pu3Zn22, Pu2Zn17, К и А. Соединению
Pu)3Zn58 в работах [1,2] приписывалась формула Pu2Zn9. В работе [2],
в которой подробно исследовалась часть диаграммы со стороны Zn -
до 25 % (ат.) Ри, соединениям К и А также приписывалась формула
Pu2Zn17, но принималось, что они имеют другие кристаллические
решетки. Соединения PuZn2 и Pu2Zn)7 плавятся конгруэнтно соотве-
тственно при 935 и 928 °C. Остальные соединения по перитектическим
реакциям; Pu13Zn58 - 879 °C, Pu3Zn22 - 890 °C, фаза К - 812 °C, фаза А
- 700 °C. Фаза К претерпевает полиморфное превращение при 770 °C.
Эвтектика PuZn2 + Pu13Zn58 кристаллизуется при температуре 829 °C
(при 827 °C [2], 830 °C [1]). Со стороны Zn протекает нонвариантное
превращение при температуре, практически совпадающей с температурой
плавления Zn. Со стороны Ри имеет место перитектическое превращение:
106
Ри-Zn
Рис. 494. Pu - Zn
Ж + PuZn2 11 (ePu) при 695 °C и ряд нонвариантных превращений в
твердом состоянии, связанных с полиморфизмом Ри:
(ePu) + PuZn2 - (б'Ри) при 490 °C;
PuZn2 + (б'Ри) * (бРи) при <490 °C;
(бРи) « (уРи) + PuZn2 при 240 °C.
Имеющиеся экспериментальные данные не позволяют выявить
различие в температурах реакций образования (б) и (б') фаз. Нонвариан-
тные превращения, связанные су « 0 и р « а превращениями Ри, проходят
практически при этих же температурах, что и в чистом Ри.
Кристаллическая структура промежуточных фаз приведена в
табл. 386.
Ри-Zn, Pu~Zr
107
Таблица 386. Кристаллическая структура соединений системы Pu-Zn
Соединение Прототип Символ Пирсона, пр.гр. Параметры решетки, нм Источник
a С
PuZn2 MgCu2 cF24, 0,7760 -0,7747 [1]
Fd3m
PU|3Zn58 Gd)3Zn58 hP\42, Рбупс 1,443 1,414 [3]
Pu3Zn22 Pu3Zn22 tflOO, 14^/amd 0,885 2,118 ‘[4]
Pu2Zn । -j Th2Zn17 hR\9, 0,895 1,31 [2]
R3m
К (ВТ) - hP*, PUmmm 0,89 1,77 [2]
К (НТ) Th2Ni,7 hP3%, Pbjlmmc 0,898 0,885 [2]
X - hP*, P6322 0,898 0,885 [2]
Гексагональная сингония.
Литература
1. Ellinger F.H., Cramer Е.М., Land С.С. // Extractive and Physical Metallurgy of Plutonium
and Its Alloys. New York: Interscience Publishers. Inc., 1960. P. 169-180.
2. Cramer E.M., Wood D.H.//J. Less-Common Met. 1967. V. 13. N 1. P. 112-121.
3. Larson A.C., Cromer D.T. // Acta Crystallogr. 1967. V. 23. N I. P. 70-77.
4. Johnson Q., Wood D.H., Smith G.S. // Acta Crystallogr. 1968. V. B24. N 4. P. 480-484.
Л.Л. Рохлин
Pu-Zr. ПЛУТОНИЙ-ЦИРКОНИЙ
Диаграмма состояния Pu-Zr (рис. 495) построена с использованием
данных [1-3,6,9]. Изоструктурные высокотемпературные модификации
(sPu) и (PZr) образуют непрерывный ряд твердых растворов, температура
плавления которых непрерывно повышается с увеличением содержания
Zr [1,2]. На основе бРи имеется значительный по протяженности твердый
раствор: до 74 % (ат.) Zr [1] или до -70 % (ат.) Zr [2]. Максимальная
108
Pu—Zr
Pu Zr, Vo fam.) Zr
Рис. 495. Pu - Zr
растворимость Pu в (aZr) составляет -13 % (ат.). Твердые растворы на
основе б'Ри, PPu, yPu и aPu имеют незначительную протяженность.
При температуре -618 °C происходит перитектоидная реакция
образования фазы (6Pu): (ePu, 0Zr) + (aZr) •* (бРи) [3]. В работе [1]
температура этой реакции соответствует 630 °C, а в работе [2] указывает-
ся на эвтектоидный распад (ePu, 0Zr) при 618 °C.
В твердом состоянии обнаружено три фазы: С [4—6], 0 и К [2]. Фаза
С образуется по перитектоидной реакции (yPu) + (бРи) « £ при 275 °C и
устойчива при охлаждении до комнатной температуры. Она имеет
область гомогенности в интервале концентраций 2,5-2,9 % (ат.) Zr [6].
В работе [5] указывается, что фаза С стабильна лишь при температурах
220-300 °C, а при более низкой температуре может существовать в
метастабильном состоянии. Фаза 0 образуется при 345 °C и имеет
широкую область гомогенности от 10 до 30 % (ат.) Zr [2]. Фаза К (PuZr3)
образуется по перитектоидной реакции: (бРи) + (aZr) « К при 380± 10 °C
Pu-Zr
109
[2] . В работе [1] вместо фаз 0 и К указываются фазы Pu6Zr и PuZr2. При
температурах 270 и 267 °C происходят две эвтектоидные реакции:
(бРи) Ч + 9 и (бРи) « 0 + К.
Подтверждена незначительная растворимость Zr во всех модифи-
кациях Pu (<1 % (ат.)).
Кристаллическая структура фаз указана в табл. 387.
Таблица 387. Кристаллическая структура соединений системы Pu-Zr
Соедине- ние Прото- тип Символ Пирсона, пр.гр. Параметры решетки, нм Источник
а b С
; - Z4, Z4t/a 1,81899(2) - 0,78576(2) [7]
0 (Pu6Zr) - o*56 1,039 1,044 1,118 [1]
К aib2 ЛРЗ, Pfilmmm 0,5060 0,5055 - 0,3119 0,3123 [1] [2]
Структура фазы С имеет некоторые общие черты со структурой рРи.
Прямые доказательства упорядоченного расположения атомов Zr в
решетке фазы С не получены.
Параметры решетки твердых растворов (ePu, pZr) (0-20 % (ат.) Zr)
и (бРи) (0-60 % (ат.) Zr) при высоких температурах указаны в работе [8].
Найдено положительное отклонение от правила Вегарда.
В работе [9] были рассчитаны ликвидус и солидус Pu-Zr в предположе-
нии идеального поведения жидких растворов и регулярного поведения
твердых растворов. Рассчитанные данные диаграммы плавкости более
близки к данным работы [2], чем к данным работы [1].
Литература
1. Бочвар А.А., Конобеевский С.Т., Кутайцев В.И. и др. И Тр. Второй Международной
конференции по мирному использованию атомной энергии. Доклады советских ученых.
Т. 3. Ядерное горючее и реакторные металлы. М.: Атомиздат, 1959. С. 376-395.
2. Marples J.A.C.Z/J, Less-Common Met. 1960. V. 2. N 5. P. 331-351.
3. Lautier J.C., Housseau N., van Craeynest A., Calais D. // J. Nucl. Mater. 1967. V. 23. N 3.
P. 313-319.
4. Дуглас Д. // Металловедение циркония / Пер. с англ.; Под ред. А.С. Займовского. М.:
Атомиздат. 1975. 360 с.
5. Кутайцев В.И., Чеботарев Н.Т., Андрианов М.А. и др. // Атомная энергия. 1967. Т. 23.
N 6. С. 511-519.
6. Taylor J.M. // J. Nucl. Mater. 1969. V. 30. В 3. Р. 346-350.
7. Cromer D.T.//Acta Crystallogr. В. 1979. V. 35. N 1. P. 14-19.
110
Pu-Zr, Rb-S, Rb-Sb
8. Marples J.A.C. // J. Phys. Chem. Solids. 1964. V. 25. N 6. P. 521-534.
9. Leibowitz L., Veleckis E., Blomquist R.A., Pelton A.D. //J. Nucl. Mater. 1988 V. 154. N 1.
P. 145-153.
Rb-S. РУБИДИЙ-СЕРА
Л.А. Третъяченко
Известно существование сульфида Rb2S, который имеет кристалличес-
кую структуру типа CaF2, символ Пирсона cF12, пр.гр. Fm3 т, а -
= 0,7665 нм [И]. В работе [1] при взаимодействии Rb с жидким аммиаком
получены сульфиды с формулами Rb2S2, Rb2S3, Rb2S5. О характеристи-
ках кристаллической структуры этих сульфидов в работе [1] не
сообщается.
Литература
1. Feher F., Naused K.//Z. Anorg. All. Chem. 1956. Bd. 283. N 1/6. S. 79-87.
Rb-Sb. РУБИДИЙ-СУРЬМА
JI.JI. Рохлин
Диаграмма состояния Rb-Sb (рис. 496) построена по результатам
термического и рентгеновского анализов [1].
Sb, % (по массе)
Рис. 496. Rb - Sb
Pb-Sb, Rb-Se
111
В системе Rb-Sb установлено существование шести химических
соединений. Rb3Sb и RbSb плавятся конгруэнтно при температурах
соответственно 733 и 610 °C. Rb5Sb4, RbSb2 и Rb3Sb7 образуются по
перитектическим реакциям при температурах 515, 418 и 456 °C
соответственно. Соединения RbSb2 и Rb3Sb7 могут содержать на 1,5 %
(ат.) Sb меньше, чем это следует из формул соединений. Еще одно
соединение имеет предположительно формулу Rb5Sb2. Оно образуется
по перитектической реакции при 466 °C и при 239 °C претерпевает
превращение.
Кристаллическая структура соединений, для которых она известна,
приведена в табл. 388.
Таблица 388. Кристаллическая структура соединений системы Rb-Sb
Соединение Прототип Символ Пирсона, пр.гр. Параметры решетки, нм Источник
а b С
Rb3Sb Na3As hP8, РЬт/ттс 0,6283 - 1,118 [2]
RbSb NaP оР\Ь, PWx 0,7315 0,7197 1,2815 [3]
Известна также метастабильная фаза с кубической решеткой состава
Rb3Sb с параметрами а = 0,884 нм [4].
Литература
1. Dorn F.W., Klemm W. И Z. Anorg. All. Chem. 1961. Bd. 309. N 3/4. S. 189-203.
2. Gnutzmann C., Dorn F.W., Klemm W. И Z. Anorg. All. Chem. 1961. Bd. 309. N 3/4.
S. 210-225.
3. Schvering H.G., Hoole W., Krogull G. // Z. Naturforsch. B. 1979. Bd. 34B. N 12.
S. 1678-1682.
4. Chikawa J., Imamura S., Tanaka K., Shiojiri M. //J. Phys. Soc. Japan. 1961. V. 16. N 8.
P. 1175-1180.
Л.Л. Зусмап
Rb-Se. РУБИДИЙ-СЕЛЕН
Диаграмма состояния Rb-Se исследована методами дифференциально-
го термического, рентгеновского анализов и путем измерения плотности
[1]. Диаграмма состояния представлена на рис. 497. Она характеризуется
образованием нескольких соединений: Rb2Se, Rb1(Se8, RbSe, Rb2Se3,
RbSe2, RbSe3. Два соединения: Rb2Se и Rb2Se3 плавятся конгруэнтно при
112
Rb-Se, Rb-Si
0 10 20 30 40 50 60 70 00 90 100
Se Rb,°/o(a/n.) Rb
Рис. 497. Rb - Se
730 и 385 °C, остальные плавятся инконгруэнтно. Авторы работы [I]
отмечают, что точный состав соединений, плавящихся инконгруэнтно,
установить не представляется возможным, но соединения с формулами
RbSe и RbSe2 имели аналоги в других системах S и Se со щелочными
металлами, так что эти формулы можно принять с достаточной
определенностью. Формулы же Rb, ISe8 и RbSe3, с точки зрения авторов
работы [I], менее надежны. В системе кристаллизуются три эвтектики при
39, 355 и 165 °C. Со стороны Se в системе имеет место расслаивание в
жидком состоянии с температурой монотектики при 217 °C.
Литература
I. Яценко С.П., Кузнецов А.Н., Чунтонов К.А. И Изв. АН СССР. Неорганические
материалы. 1977. Т. 13. N 4. С. 738-739.
Л.Л. Рохлин
Rb-Si. РУБИДИЙ-КРЕМНИЙ
Диаграмма состояния сплавов Rb с Si не построена.
Синтезировано эквиатомное химическое соединение RbSi, крис-
таллическая решетка которого указана в табл. 389. Соединение RbSi6
Rb-Si, Rb—Sn
113
образуется при разложении RbSi в вакууме приблизительно при 525 °C.
Рентгенограмма, снятая с порошка этого соединения, имеет очень
сложный вид и близка к рентгенограммам KSi6, KGe4 и RbGe4.
Характеристики кристаллической решетки соединения RbSi6 указаны
в табл. 389 как предположительные [Э].
Таблица 389. Кристаллическая структура соединений в системе Rb-Si [Э]
Соединение Прототип Символ Пирсона, пр.гр. Параметр решет- ки а, нм
RbSi KGe сР64, Р43л 1,304
RbSi; - - 1,34
Кубическая сингония.
Л.Л. Зусман
Rb-Sn. РУБИДИЙ-ОЛОВО
Диаграмма состояния Rb-Sn, изученная методами термического и
нейтронографического анализов [1], приведена на рис. 498. При
Рис. 498. Rb - Sn
114
Rb-Sn, Rb-Sr
содержании в сплавах приблизительно от 10 до 40 % (ат.) Sn, вероятно,
имеет место расслаивание в жидком состоянии; температура монотектики
составляет 610 °C.
В системе Rb-Sn имеется лишь одно конгруэнтно плавящееся
соединение Rb2Sn3 при температуре 890 °C. Остальные три соединения
RbSn, RbSn2 и RbSn4 образуются по нонвариантным перитектическим
реакциям при температурах соответственно 570, 830 и 507 °C.
По результатам нейтронографического анализа установлено, что
соединение Rb2Sn3 кристаллизуется в одну из двух пространственных
групп: Р41тс или Р4сс, параметры кристаллической решетки указаны в
табл. 390.
Таблица 390. Кристаллическая структура-соединений системы Rb-Sn
Соединение Прототип Символ Пирсона, пр.гр. Параметры решетки, нм Источник
а b с
Rb2Sn3 - /Р, PM тсс или P4cc 0,738 - 1,280 [2]
RbSn NaPb //64, MJacd 1,171 - 1,909 [Ш, 3]
Литература
1. Дриц М.Е., Фридман А.С., Зусман Л.Л., Кусиков В.А. // Фазовые равновесия в
металлических сплавах. Сб. статей. М.: Наука. 1981. С. 176-178.
2. Дриц М.Е., Фридман А.С., Зусман Л.Л., Сизов Р.А. // Тезисы докладов на VIII
Всесоюзной конференции по химии редких щелочных металлов. Апатиты. 1988. С. 21.
3. Hawaidy I.F., Busmann Е., Klemm W. ИZ. Anorg. All. Chem. 1964. Bd. 328. S. 283-293.
Л.Л. Зусман
Rb-Sr. РУБИДИЙ-СТРОНЦИЙ
Система Rb-Sr характеризуется фактически полной несмешиваемос-
тью в жидком и твердом состоянии. При рентгеновских исследованиях
никаких соединений в системе обнаружено не было [1].
Литература
1. Pelton A.D. // Bull. Alloy Phase Diagrams. 1985. V. 6. N l .p. 46.
Л.Л. Рохлин
Rb~Te, Rb-Ti
115
Rb-Te. РУБИДИЙ-ТЕЛЛУР
Соединение Rb2Te3 удалось синтезировать из чистых компонентов
в жидком аммиаке при 227 °C и давлении 100 МПа [1]. Соединение
Rb2Te5 синтезировали из чистых компонентов также в среде аммиака при
температуре 200 °C и давлении 200 МПа [2]. Кристаллическая структура
соединений указана в табл. 391.
Таблица 391. Кристаллическая структура соединений системы Rb-Te
Соединение Прототип Символ Пирсона, пр.гр. Параметры решетки, нм \ Источник
a b c
Rb2Te3 K2Te3 oP20, Pnma 1,6109 1,0591 0,4786 [И
Rb2Te5' Rb2Te5 niC14, C2hn 1,2144 0,9124 0,5750 [2]
*P = 121,13°.
Литература
1. Bottcher Р. И J/ Less-Common Met. 1980. V. 70. N 2. S. 263-271.
2. Bottcher P., Kretschmann U.//J. Less-Common Met. 1983. V. 95. N 1. S. 81-91.
Л.Л. Рохлин
Rb-Ti. РУБИДИЙ-ТИТАН
В работе [1] по аналогии с другими системами (щелочной ме-
талл-металл IV А группы) делается предположение, что система Rb-Ti
имеет почти полную несмешиваемость компонентов в жидком и твердом
состояниях. Путем расчета делается предположение, что в газовой фазе
на основе Rb при давлении 0,1 МПа и температуре 2000 °C может
содержаться в равновесных условиях над жидким Ti приблизительно
0,04 % (ат.) Ti. Значение растворимости Ti в жидком Rb при температурах
760-1093 °C, равное 0,0002—0,0007 % (ат.), приводимое в работе [1],
является весьма ненадежным, так как устанавливалось при изучении
взаимодействия жидкого Rb со сплавом Мо - 0,5 Ti.
Литература
1. Bale C.W. // Bull. Alloy Phase Diagrams. 1989. V. 10. N 2. P. 140-141.
Л. Л. Рохлин
116
Rb-Tl
Rb-Tl. РУБИДИЙ-ТАЛЛИЙ
Диаграмма состояния Rb-Tl (рис. 499) построена на основании
данных термического анализа, измерения плотности и рентгеновским
методом [1]. Она характеризуется наличием одного конгруэнтно
плавящегося соединения Rb4Tl5 и двух инкоконгруэнтно плавящихся
соединений: RbTI2 и RbTl3. Со стороны Т1 в системе имеет место
Рис. 499. Rb - Т1
эвтектическое превращение при температуре 190 °C и концентрации 13
(ат.) Rb. Соединения RbTl2 и RbTl3 образуются по перитектическим
реакциям, протекающим при 335 и 260 °C. В соответствии с приведенной
диаграммой температура плавления Rb4Tl5, по данным работы [1],
составляет около 375 °C, а температура эвтектики со стороны Rb - на
несколько градусов ниже температуры плавления Rb и равна приблизи-
тельно 33 °C. Кристаллическая структура промежуточных фаз в работе
[1] установлена не была.
Литература
1 Thiimmel R., Klemm W.//Z. Anorg. All. Chem. 1970. Bd. 376. N 1. S. 44-63.
Л.Л. Рохлин
Rb-Zn, Rb-Zr
117
Rb-Zn. РУБИДИЙ-ЦИНК
В работе [1] путем совместного нагрева до 400 °CRb чистотой 99,98%
(по массе) и Zn чистотой 99,999 % (по массе) под низким давлением
чистого Аг было получено соединение с формулой Rb-Zn 13. В работе [2]
по аналогии с диаграммами состояния Na-Zn и K-Zn построена
диаграмма состояния Rb-Zn (рис. 500). Диаграмма характеризуется
Рис. 500. Rb - Zn
значительной несмешиваемостью в жидком состоянии. С учетом того,
что область несмешиваемости в системе K-Zn больше, чем в Na-Zn,
оценена область несмешиваемости в Rb-Zn в соответствии с увеличением
величины атомного радиуса щелочного металла. По этой оценке при
температуре 500 °C растворимость Zn в Rb < 0,1 % (ат.), a Rb в Zn < 0,5 %
(ат.).
Соединение RbZn13 имеет структуру типа NaZn)3 (символ Пирсона
cF\ 12, пр.гр. Fm3c), параметр решетки а = 1,2420 нм [1].
Литература
1. Bruzzone G. // Acta Crystallogr. В. 1971. V. 27. N 4. Р. 762-763.
2. Pelton A.D. И Bull. Alloy Phase Diagrams. 1987. V. 8. N 5. P. 485-486, 505, 506.
Л.Л. Рохлин
Rb-Zr. РУБИДИЙ-ЦИРКОНИЙ
Сообщается, что при температуре 929-1093 °C растворимость Zr в
жидком Rb составляет порядка 0,01 % (ат.) при содержании кислорода
118
Rb-Zr, Re-Rh
в Rb 55-10 4 % (ат.) [1]. Зависимость растворимости Zr в жидком Rb от
температуры может быть рассчитана по уравнению
Igx = 1,238 - 4566/Т,
где х - концентрация Zr, % (ат.), Т- температура, К.
Литература
1. Bale C.W. // Bull. Alloy Phase Diagrams. 1987. V. 8. N 1. P. 51-52.
Л.Л. Зусман
Re-Rh. РЕНИЙ-РОДИЙ
Систему Re-Rh исследовали методами микроструктурного и
рентгеновского анализов, измерением температуры плавления и
твердости [1]. Сплавы получали вакуумным плавлением из металлов
чистотой 99,8 % (по массе) с последующими отжигами при 800 и 1000 °C.
Диаграмма состояния системы представляет собой диаграмму перитекти-
ческого типа (рис. 501 [1]).
Перитектическая реакция имеет место при 2620±25 °C: Ж + (Re) »
« (Rh). Растворимость Re в (Rh) при температуре 1000 °C составляет 19 %
О ГО 20 JO 40 JO 60 70 &O 90 ГОО
Rh Re, °/o fam.) Re
Рис. 501. Re - Rh
Re-Rh, Re-Ru
119
(по массе) или 12 % (ат.), a Rh в (Re) - 15 % (по массе) или 24 % (ат.).
Сплавы в области (Rh) имеют ГЦК решетку с параметрами, плавно
уменьшающимися от 0,380 до 0,364 нм по мере увеличения содержания
Re до 12 % (ат.). Промежуточных соединений в системе не обнаружено
[1,2].
Литература
1. Тылкина М.А., Цыганова И.А., Савицкий Е.М. //Журнал неорганической химии. 1962.
Т. 7. Вып. 8. С. 1917-1927.
2. Благородные металлы: Справочник / Под ред. Е.М. Савицкого. М.: Металлургия,
1984.592 с.
М.А. Тылкина
Re-Ru. РЕНИЙ-РУТЕНИЙ
Диаграмма состояния Re-Ru построена в работе [1] и представлена
на рис. 502. Сплавы выплавляли в дуговой печи в атмосфере гелия из
брикетов, предварительно спрессованных в требуемых соотношениях
порошков исходных металлов и спеченных при 1200 °C. Чистота
исходных металлов 99,8 % (по массе). Сплавы исследовали методами
микроструктурного и рентгеноструктурного анализов, измерением
температуры плавления и твердости. Были изучены литые и деформиро-
ванные сплавы после ряда отжигов и закалки при 2000, 1500 и 1000 °C
с выдержкой 1,2 и 30 ч соответственно [1].
Рис. 502. Re - Ru
120
Re—Ru, Re—S, Re-Sc
Re и Ru образуют непрерывный ряд твердых растворов во всем
интервале концентраций (рис. 502). Параметры твердого раствора с ГПУ
решеткой плавно возрастают по мере увеличения содержания Re с а ~
- 0,27003 нм, с - 0,4273 нм для 0 % (ат.) Re до а = 0,27277 нм, с =
= 0,43204 нм для 64,0 % (ат.) Re и до а = 0,2755 нм, с = 0,4493 нм для
100 % (ат.) Re. Температура плавления сплавов плавно повышается от
2234 °C для Ru до 3186 °C для Re [1, 2].
Литература
1. Савицкий Е.М., Тыл кина М.А., Полякова В.П. И Журнал неорганической химии. 1962.
Т. 7. Вып. 2. С. 439-441.
2. Благородные металлы: Справочник/Под ред. Е.М. Савицкого. М.: Металлургия, 1984.
592 с.
М.А. Тылкина
Re-S. РЕНИЙ-СЕРА
Диаграмма состояния Re-S не построена. В системе образуются три
сульфида Re2S7, ReS2 и ReS3 [1].
Re2S7 получен при взаимодействии сероводорода и перрената, имеет
тетрагональную решетку (а = 0,137 нм, с = 0,1024 нм), почти нерастворим
в воде и соляной кислоте и растворим в азотной кислоте.
Дисульфид ReS2 получен при взаимодействии Re с S при -700-800 °C
или термическим разложением Re2S7 в вакууме. ReS2 растворяется в
азотной кислоте. Обладает гексагональной структурой с параметрами
а = 0,3166 нм, с = 1,2192 нм [Ш].
ReS3 при температуре 800 °C разлагается на S и ReS2. Низшие
сульфиды Re2S3 и ReS аморфны.
Литература
1. Борисова Л.В., Ермаков А.Н. Аналитическая химия рения. М.: Наука, 1974. 318 с.
М.А. Тылкина
Re-Sc. РЕНИЙ-СКАНДИЙ
Диаграмма состояния Re-Sc представлена на рис. 503 по данным
работы [1] и является диаграммой перитект ического типа, характеризую-
щейся наличием двух соединений ScRe2 и Sc5Re24.
Re-Sc
121
Sc Re, 0/olam./ Re
Рис. 503. Re - Sc
Система исследована во всем интервале концентраций. Сплавы
изготовляли в дуговой печи с применением заранее приготовленной
лигатуры с 24,32 % (ат.) Sc в атмосфере очищенного гелия с многократ-
ным переплавом. В качестве исходных компонентов использовали Re
чистотой 99,98 % (по массе) и дистиллированный Sc чистотой 99,5 % (по
массе). Сплавы исследовали методами рентгеноструктурного, микрос-
труктурного, дифференциального термического анализов, определением
температуры плавления, твердости сплавов, микротвердости структур-
ных составляющих и термо-э.д.с. Фазовый анализ проводили на литых
и отожженных в вакууме сплавах при 1600 и 1100 °C с выдержкой 3 и
150 ч соответственно.
Соединение Sc5Re24 образуется по перитектической реакции Ж +
+ (Re) « Sc5Re24 при 2570 °C.
Соединение ScRe2 также образуется по перитектической реакции Ж +
+ Sc5Re24 « ScRe2 при 2030 °C. Оба соединения стабильны и обладают
узкой областью гомогенности.
122
Re-Sc, Re-Se
Между твердым раствором на основе Sc и ScRe2 образуется эвтектика
при температуре 1360 °C и содержании -1 % (ат.) Re. Растворимость Re
в (Sc) весьма мала и составляет <1 % (ат.) при 1360 °C, растворимость
Sc в (Re) установлена ориентировочно и равна - 5 % (ат.) при 2570 °C [1].
Кристаллическая структура соединений приведена в табл. 392. Данные
по параметрам решеток обоих соединений согласуются с данными
работы [3].
Таблица 39 2. Кристаллическая структура соединений системы Re-Sc
Соединение Прототип Символ Пирсона, пр.гр. Параметры решетки, нм Источник
'а с
ScRe2 MgZn2 АР12, Р 6-Jmm с 0,5270 0,5271 0,8590 0,8592 [1] [2]
Sc5Re24 Re24Ti5 143 m 0,9645 0,965 - [1] [2]
Литература
1. Савицкий Е.М., Тылкина М.А., Хамидов О.Х. // Изв. АН СССР. Металлы. 1966. N 4.
С. 116-121.
2. Крипякевич П.И., Кузьма Ю.Б., Протасов В.С. // Доклады АН УССР. 1963. N 4.
С.492-495.
3. Гладышевский Е.И., Бодак О.И. Кристаллохимия интерметаллических соединений
редкоземельных металлов. Львов: Вища школа. 1982. 255 с.
М.А. Тылкина
Re-Se. РЕНИЙ-СЕЛЕН
Диаграмма состояния Re-Se не построена. В системе имеются два
соединения: Re2Se7 и ReSe2, получаемые при химических реакциях.
Re2Se7 разлагается при нагреве до 330 °C в вакууме с образованием
ReSe2 и свободного селена [1].
ReSe9 синтезирован также из Re и Se чистотой 99 и 99,9 % (по массе)
соответственно при 700 °C в вакууме [2]. Предполагается, что его
кристаллическая структура имеет более низкую симметрию, чем
гексагональная [2, 3].
Литература
1. Briscoe H.V.A., Robinson P.L., Stoddart Е.М. // J. Chem. Soc. 1931. V. 134. P. 1439-1443.
Re-Se, Re-Si
123
2. Украинский Ю.М., Новоселова А.В. И Доклады АН СССР. 1961. Т. 139. N 5.
С. 1136-1137.
3. Борисова Л.В., Ермаков А.Н. Аналитическая химия рения. М.: Наука. 1974. 318 с.
М.А. Тылкина
Re-Si. РЕНИЙ-КРЕМНИЙ
Система Re-Si изучена в ряде работ [X, Э, 1-4]. Диаграмма состояния
этой системы построена лишь в одной работе [1]. Литые, выплавленные
в дуговой печи, и спеченные сплавы исследовали методами рентгенос-
труктурного, микроструктурного и термического анализов. На рис. 504
представлена диаграмма состояния, построенная по данным работы [1]
и скорректированная по результатам более поздней работы [2] в части,
касающейся идентификации одного из соединений.
В системе имеет место существование трех силицидов: ReSi2, ReSi и
Re2Si.
Re SLt°/o(arn.) Si
Рис. 504. Re - Si
124
Re-Si, Re.-Sin
ReSi2 образуется конгруэнтно при - 1980 °C. Между ReSi2 и Si
установлено наличие эвтектики при температуре ~ 1125 °C и концентра-
ции -90 % (ат.) Si.
ReSi образуется по перитектической реакции Ж + ReSi2 «* ReSi при
температуре 1880 °C.
Re2Si образуется конгруэнтно при - I960 °C. Следует отметить, что
в работах [Э, 1] этому соединению приписывалась формула Re5Si3,
которая была уточнена при детальном исследовании [2]. Силицид Re2Si
образует две эвтектики: при ~ 1820 °C и 47 % (ат.) Si с ReSi, а при
- 1900 °C и 33 % (ат.) Si с Re. Растворимость Si в (Re) весьма мала. В
работе [2] уточнена структура силицида Re2Si и установлена температура
его перехода в сверхпроводящее состояние, равная 3,8 К. Кристалличес-
кая структура силицидов приведена в табл. 393.
Таблица 39 3. Кристаллическая структура соединений системы Re-Si
Соединение Прототип Символ Пирсона, пр.гр. Параметры решетки, нм Источник
а h с
ReSi 2 MoSi2 /76, Шютт 0,3131 - 0,7676 [3]
ReSi FeSi сРЪ, Р2|3 0,4775 - - [4]
Re2Si* Re2Si шР24, Р2\/Ь 0,6444 0,53898 0,96019 [2]
* Р = 94,215°.
Литература
1. Knapton A.G. И Plansee Proceedings. 1958. New York: Pergamon Press, 1959. P. 412—418.
2. Siegrist T., Greedan F.E., Garrett F.D. et. al. // J. Less-Common Met. 1991. V. 171. N 2
P. 171-177.
3. Siegrist T., Hulliger F., Travaglini G. // J. Less-Common Met. 1983. V. 92. P. 119—121.
4. SearsyA.W., McNees R.A. // J. Amer. Chem. Soc. 1955. V 77. P. 5290-5291.
M.A. Тылкипи
Re-Sm. РЕНИЙ-САМАРИЙ
Диаграмма состояния Re-Sm не построена. В системе Re-Sm было
получено соединение SmRe2 путем спекания металлов в эвакуированных
ампулах при наличии жидкой фазы [1, Ш].
Re—Sm, Re-Sn
125
SmRe2 обладает решеткой типа MgZn2 (символ Пирсона hP 12, пр.гр.
Ptymmc) са- 0,5303 нм, с = 0,8804 нм [1, Ш]. В работе [2] рентгенострук-
турным методом на литых и отожженных сплавах в богатой Re области
подтверждено существование SmRe2 со структурой MgZn2 с а =
= 0,5440 нм, с = 0,8870 нм [2]. В исследованных сплавах в равновесии
находились чистые компоненты и соединение SmRe2, что указывает на
отсутствие других промежуточных фаз в системе. Растворимость Sm в
Re очень мала. Предполагается, что диаграмма состояния этой системы
подобна системе Re-Y [2]. Тип решетки и параметры SmRe2, указанные
в работе [3], согласуются с данными работ [1,2]. -
Литература
1. Elliott R.P. // Rare Earth Research HI. New York: Gordon and Breach. Science Publishers,
1965. P. 215-245.
2. Хамидов O.X., Савицкий E.M. // Диаграммы состояния металлических систем. Сб.
статей. М.: Наука, 1968. С. 178-185.
3. Гладышевский Е.И., Бодак О.И. Кристаллохимия интерметаллических соединений
редкоземельных металлов. Львов: Вища школа, 1982. 255 с.
М.А. Тылкина
Re-Sn. РЕНИЙ-ОЛОВО
Взаимодействие Re с Sn исследовано на сплавах, полученных
различными методами [1].
Сплавы приготовляли во всем интервале концентраций дуговой
плавкой в атмосфере очищенного гелия, при этом Sn нагревался почти
до температуры кипения. Продолжительность выдержки в жидком
состоянии - не более 2-5 мин.
При индукционной плавке шихтовые материалы выдерживали в
жидком состоянии 40 мин.
Кроме того, использовали метод длительной выдержки Re в
оловянной ванне в ампулах при 300, 350 и 1000 °C в течение 700, 200 и
50 ч соответственно. В качестве исходных металлов использовали Re
чистотой 99,8 % (по массе) и Sn чистотой 99,99 % (по массе). Исследова-
ние проводили методами микроструктурного и спектрального анализов,
измерением микротвердости фаз.
Диаграмма состояния Re-Sn приведена по данным работы [1] на
рис. 505. Re и Sn не взаимодействуют друг с другом во всем интервале
концентраций. Взаимная растворимость металлов в твердом состоянии
126
Re-Sn, Re-Ta
Рис. 505. Re - Sn
практически отсутствует. В работе [2, Ш] указывается на слабое
взаимодействие Re с жидким Sn при 330 °C.
Литература
1. Цыганова И.А., Тылкина М.А., Савицкий Е.М. // Рений в новой технике. Сб. статей.
М.: Наука. 1970. С. 39-41.
2. Sims С.Т., Jaffee R.I.// Trans. AIME. 1956. V. 206. P. 613-916.
M.A. Тылкина
Re-Ta. РЕНИЙ-ТАНТАЛ
Диаграмма состояния Re-Ta построена в работах [1-4] и уточнена
в работах [5,6]. Авторы этих работ использовали методы микроструктур-
ного, рентгеноструктурного анализов, определения температуры
плавления, измерения твердости и микротвердости фаз. Сравнивая
построенные диаграммы, можно было видеть, что в основном они были
подобны и отличались лишь характером образования одного соединения.
Представленная на рис. 506 диаграмма состояния Re-Ta построена
по данным работ [2, 6].
Re-Ta
127
Рис. 506. Re - Та
В системе установлено наличие широкой области твердого раствора
на основе Та, небольшой по протяженности области твердого раствора
на основе Re и двух соединений: % и о.
Растворимость Re в (Та) достигает 48 % (ат.) и практически не
меняется с температурой [1, 5, 6]. В работе [2] максимальная раствори-
мость 47,3 % (ат.) Re установлена при температуре 2460 °C и снижается
до 44 % (ат.) Re при 2000 °C. Максимальная растворимость Та в (Re)
составляет 3 % (ат.) и снижается до -0,25 % (ат.) при 1100 °C [1,3]. По
результатам работы [2] максимальная растворимость Та в (Re) равна
5,1 % (ат.) при 2755 °C и 3 % (ат.) при 2000 °C (см. рис. 506).
По данным работы [2] фаза / плавится конгруэнтно при 2790 °C и
78,5 % (ат.) Re и образует эвтектику % + (Re) при температуре 2755 °C
и концентрации 83,6 % (ат.) Re. Область гомогенности фазы % расположе-
на в интервале 60,3-80 % (ат.) Re (см. рис. 506).
128
Re-Ta
Наряду с такой трактовкой образования фазы х имеется другая (см.
вставку на рис. 506). По данным работ [1, 5, 6] фаза х образуется по
перитектической реакции Ж + (Re) •* х ПРИ 2830 °C. Область ее
гомогенности 63,5-84,5 % (ат.) Re (64-84,8 % (по массе)). Перитектичес-
кий характер образования фазы х установлен также в работе [3].
Фаза о (Ta2Re3) (см. вставку на рис. 506) образуется по перитектичес-
кой реакции Ж + х •* о при 2680 °C. Область ее гомогенности 34-60 %
(ат.) Re. Между фазой о и (Та) образуется эвтектика при температуре
2400 °C и концентрации 50 % (ат.) Re. Фаза о нестабильна и распадается
при -2200 °C по эвтектоидной реакции на (Та) и фазу х П, 5, 6].
Перитектический характер образования фазы о и наличие эвтектики
установлены также в работах [2-4]. Согласно работе [2], как показано
на рис. 506, фаза о образуется при температуре 2740 °C и концентрации
58,5 % (ат.) Re, эвтектика - при 2690 °C и 50,3 % (ат.) Re. Фаза о
распадается при 2460 °C.
Кристаллическая структура фаз приведена в табл. 394.
Таблица 39 4. Кристаллическая структура соединений системы Re-Ta |2j
Соеди- нение Прото- тип Символ Пирсона, пр.гр. Параметры ре- шетки, нм Примечание
а с
Z аМп с-758, 0,9650 — При концентрации 63,9 % (ат.)
— Re
143т 0,9621 - При концентрации 84,1 % (ат.) Re
о ри ZP30, PA-Jmnm 0,9630 0,4928 -
Литература
1. Тылкина М.А., Цыганова И.А., Савицкий Е.М. //Журнал неорганической химии. 1960.
Т. 5. Вып. 8. С. 1905-1907.
2. Brophy J.H., Scwartzkopf Р., Wullf J. //Trans. Al ME. 1960. V. 218. N 5. P. 910—914.
3. Knapton A.G.//J. Inst. Met. 1958. V. 87. N 1. P. 28-32.
4. Knapton A.G.//J. Less-Common Met. 1960. V. 2. P. 113—124.
5. Тылкина M.A., Савицкий E.M., Алюшин B.E. // Изв. АН СССР. Металлы. 1973. N 4
С. 225-227.
6. Савицкий Е.М., Тылкина М.А., Левин А.М. Сплавы рения в электронике. М.. Энергия,
1980. 215 с.
М.А. Тылкина
Re-Tb
129
Re-Tb. РЕНИЙ-ТЕРБИЙ
Диаграмма состояния Re-Tb представлена на рис. 507 по данным
работы [1]. Система исследована во всем интервале концентраций
методами микроструктурного, рентгеноструктурного, дифференциально-
го термического анализов, измерением температуры плавления,
твердости, микротвердости, удельного электросопротивления, термо-
э.д.с. [I]. Чистота исходных металлов: Re - 99,98 % и Tb - 99,6 % (по
массе).
Построенная диаграмма состояния характеризуется полной
взаимной растворимостью компонентов в жидком состоянии и
ограниченной - в твердом. В системе при температуре 2450±50 °C по
перитектической реакции образуется соединение TbRe2.
Отмечается некоторое понижение температур плавления ТЬ и его
полиморфного превращения при введении Re. В системе образуется
эвтектика, близкая по составу к чистому ТЬ при температуре 1305 °C,
и имеет место эвтектоидная реакция при 1285 °C. (Температуры этих
Re, °/о fro массе)
О ГО 20 30 ОО 50 50 70 ОО 00 700
76 Re, °/ofam.) Re
Рис. 507. Re - ТЬ
130
Re-Tb, Re-Tc
превращений скорректированы в соответствии с принятой температурой
плавления ТЬ - 1356 °C). Составы эвтектического и эвтектоидного
сплавов нанесены на диаграмме ориентировочно. Растворимость ТЬ в
(Re) незначительна: -0,2 % (ат.) [1].
Кристаллическая структура TbRe2 гексагональная, типа MgZn2,
(символ Пирсона API 2, пр.гр. Рб^/ттс) с параметрами решетки а =
= 0,5272 нм, с = 0,8448 нм [2].
Литература
1. Савицкий Е.М., Хамидов О.Х. // Изв. АН СССР. Металлы. 1968. N 6. С. 158-162.
2. Гладышевский Е.И., Бодак О.И. Кристаллохимия интерметаллических соединений
редкоземельных металлов. Львов: Вища школа, 1982. 255 с.
М.А. Тылкина
Re-Tc. РЕНИЙ-ТЕХНЕЦИЙ
Диаграмма состояния Re-Tc представлена на рис. 508 по данным
работы [1].
Сплавы для исследования системы приготовляли спеканием при
1800 °C в течение 24 ч с последующим отжигом при 1500 и 1200 °C в
течение 240 ч в атмосфере азота [1], а также выплавляли в дуговой печи
и отжигали при 700 °C [Ш].
Рентгеноструктурным методом установлена неограниченная
растворимость Re и Тс друг в друге в жидком и твердом состояниях.
Рис. 508. Re - Тс
Re-Tc, Re-Te
131
Твердый раствор имеет ГПУ решетку с параметрами, значения которых
плавно уменьшаются с увеличением содержания Тс:
Содержание Тс, % (ат.)........... О
Параметры решетки, нм:
а............................. 0,2761
с.......................... 0,4458
10 25 50 75 100
0,2759 0,2756 0,2750 0,2746 0,2741
0,4455 0,4449 0,4432 0,4415 0,4400
Промежуточных фаз в системе не обнаружено. Данные по характеру
взаимодействия Тс с Re и другими элементами периодической системы
и свойствам сплавов обобщены в работах [2, 3].
Литература
1. Niemies J. И Bull. Acad. Polon. Sci., Tech. 1963. V. 11. N 6. P. 311-316.
2. Котегов K.B., Павлов O.H., Шведов В.П. Технеций. М.: Атомиздат, 1965. 119 с.
3. Савицкий Е.М., Тылкина М.А., Грибуля В.Б., Казанская Н.К. // Редкие металлы в
цветных сплавах. Сб. статей. М.: Наука, 1975. С. 31-43.
М.А. Тылкина
Re-Te. РЕНИЙ-ТЕЛЛУР
Сведения о системе разноречивы [1-4]. Диаграмма состояния при
Те,°/>(по массе)
Рис. 509. Th - Те
концентрации до 50 % (по массе)
Re построена в работе [ 1 ]. Иссле-
дование проводилось методами
термического и микроструктур-
ного анализов. Сплавы плавили
в двойных кварцевых ампулах,
выдерживали после расплавле-
ния Те 3 ч, затем отжигали при
800 °C в течение 150 ч с последу-
ющим быстрым охлаждением.
В системе образуются три
соединения: Re2Te7, конгруэнтно
плавящееся при 1000 °C, Re2Te5,
образующееся по перитектичес-
кой реакции при 968 °C, и
ReTe2, плавящееся конгруэнтно
при температуре 1200 °C.
В системе имеют место два
эвтектических равновесия. Эв-
132
Re-Te
тектика Те + Re2Te7 с 10 % (по массе) Re имеет температуру плавления
448 °C, а эвтектика Re2Te7 + Re2Te5 с 33 % (по массе) Re плавится при
910 °С[1].
Диаграмма состояния системы в интервале концентраций 30-100 %
(ат.) Те построена в работе [2] и приведена на рис. 509. При исследовании
использовали методы термического, ренгенофазового и микроструктур-
ного анализов, измерения микротвердости, плотности, электропровод-
ности, термо-э.д.с. Сплавы получали плавлением компонентов в
откаченных кварцевых ампулах с выдержкой при 350 °C в течение 250 ч.
Установлено образование трех соединений: Re2Te и двух соединений
переменного состава аире областями гомогенности 43-47 и 66,6-72 %
(ат.) Те соответственно. Сплав с 66,6 % (ат.) Те соответствует соединению
ReTe2. Соединения аир конгруэнтно плавятся при 900 и 970 °C
соответственно.
В системе протекают три эвтектических равновесия: эвтектика Re2Te +
+ а с 40 % (ат.) Те плавится при 850 °, эвтектика а + р с 60 % (ат.) Те
плавится также при 850 °C, а эвтектика р + Те имеет температуру
плавления 870 °C. При концентрациях от 80 до 97 % (ат.) Те установлена
область расслоения. Кристаллическая структура дителлурида Re (ReTe2)
по данным работы [3] ромбическая с параметрами а = 1,2987 нм, b =
= 1,3055 нм, с = 1,4271 нм.
В работе [4] для соединения ReTe? определена область гомогенности
в интервале 64,79-71,22 % (ат.) Те.
Литература
1. Ермолаев М.И., Гукова Ю.Я.//Исследование и применение сплавов рения. Сб. статей.
М.: Наука, 1975. С. 74-75.
2. Курбанов Т.Х., Довлятшина Р.А., Джавадова И.А., Ахмедов Ф.А. И Журнал
неорганической химии. 1977. Т. 22. N 4. С. 1137-1139.
3. FurusethS., Kjekshus А.//Acta Chem. Scand. 1966. V. 20. N 1. P. 245-247.
4. Оболончик B.A., Яиаки A.A. // Рений в новой технике. Сб. статей. М.: Наука. 1970.
С. 59-61.
М.А. Тылкина
Re-Th
133
Re-Th. РЕНИЙ-ТОРИЙ
Система Re-Th исследована в работах [1-4], в которых установлено
существование только одного соединения ThRe2 типа MgZn2 (символ
Пирсона hP, пр.гр. с параметрами решетки: а = 0,5498 нм, с =
= 0,9116 нм [1]; а - 0,5492 нм, с - 0,9097 нм [2, 3]. Диаграмма состояния
системы во всем интервале концентраций построена в работах [3, 4] с
использованием различных методов приготовления сплавов. Диаг-
раммы подобны, отличаясь лишь трактовкой характера образования
соединений. В работе [3] все сплавы приготовляли дуговой плавкой с
многократным переплавом в атмосфере Аг брикетов, предварительно
приготовленных прессованием и спеченных в вакууме при 1350 °C в
течение 1 ч. Кроме того, сплавы с содержанием 50-80 % (ат.) Re
приготовляли спеканием в вакууме при 2400 °C с выдержкой 3 ч.
Сплавы исследовали методами микроструктурного, ренттенострук-
турного анализов, измерением температур плавления, твердости и
микротвердости фаз после закалки от 1100, 1000, 800, 600, 400 и 150 °C
Th Ref°/ofam.) Re
Рис.510. Re-Th
134
Re-Th, Re-Ti
и выдержки 72, 120, 240, 368, 720 и 1056 ч соответственно. Чистота
исходных металлов: Re - 99,8 % (по массе), Th - 99,5 % (по массе).
В работе [4] сплавы приготовляли расплавлением Th в тигле из
монокристаллического Re в вакууме, Th нагревали до заданной
температуры, пока жидкий Th не становился пересыщенным Re. После
охлаждения закристаллизовавшийся Th извлекали из тигля путем
растворения его в НС1 (Re не растворяется в НС1). Растворимость Re в
Th при температуре ликвидуса определяли гравиметрическим методом.
Диаграмма состояния Re-Th представлена на рис. 510 по данным работы
[3]. В системе установлено образование соединения ThRe2 по перитекти-
ческой реакции Ж + (Re) •* ThRe2 при температуре -2500 °C [3].
Авторы работы [4] предполагают, что ThRe2 плавится конгруэнтно
и образует эвтектику с Re при 231-6 °C. Согласно работе [3] ThRe2
образует с (pTh) эвтектику при температуре 1400 °C и концентрации
14,9 % (ат.) Re. По данным работы [4] эвтектика образуется при 1389 °C
и 15,5 % (ат.) Re. Взаимная растворимость компонентов практически
отсутствует.
Литература
1. Niemiec J. // Bull. Acad. Polon. Sci., Tech. 1961. V. 9. P. 501-506.
2. Dwight A.E. H Trans. ASM. 1961. V. 53. P. 479-500.
3. Бадаева T.A., Дашевская Л.И. // Диаграммы состояния металлических систем. Сб.
статей. М.: Наука, 1968. С. 212-218.
4. Garg S.P., Ackermann R.J. // J. Nucl. Mater. 1977. V. 64. N 3. P. 265-274.
M.A. Тылкина
Re-Ti. РЕНИЙ -ТИТАН
Диаграмма состояния Re-Ti представлена на рис. 511 по данным
работы [1].
Сплавы приготовляли в дуговой печи в атмосфере Аг и исследовали
методами металлографического и рентгеноструктурного анализов,
измерением температур плавления, электросопротивления, твердости и
микротвердости фаз. Полиморфные превращения в части, богатой Ti,
исследовали с помощью емкостного дилатометра и фазовым анализом
сплавов, закаленных в интервале температур 650-950 °C. Исходные
металлы: иодидный Ti и Re чистотой 99,9 % (по массе).В системе Re-Ti
образуется одно соединение Ti5Re24 (фаза %) по перитектической реакции
Ж + (Re) •» Ti5Re24 при температуре 2750 °C и концентрации 82 % (ат.)
Re. Соединение имеет ОЦК решетку типа аМп (символ Пирсона с/58,
Re-Ti
135
Рис. 511. Re - Ti
пр.гр. /43m) с параметром a = 0,959 нм, микротвердостью Ti5Re24, равной
20000 МПа и электронной концентрацией 6,48 эл/атом.
Область твердых растворов Re в (pTi) простирается до 50 % (ат.) Re.
Растворимость Re в (aTi) мала —0,1 % (по массе) при 750 °C и
несколько возрастает с понижением температуры. С повышением
содержания Re температура полиморфного превращения Ti снижается
с 882 °C для Ti до 650 °C для сплава с 20 % (по массе) Re, а интервал
существования двухфазной области a + р расширяется. Стабилизация
фазы р имеет место при содержании Re более 20 % (по массе). При
меньшем содержании Re сплавы после закалки из р области претерпева-
ют мартенситное превращение. При содержании 10-15 % Re в закаленных
из р области сплавов наряду со стабилизированной фазой р наблюдается
метастабильная фаза со.
В работе [2] уточнена растворимость Ti в Re. Растворимость при
температуре 2750 °C составляет 2,3 % (ат.) и снижается до 0,8 % (ат.) при
2100° и до 0,4 % (ат.) при 1500 °C.
136
Re-Ti, Re-Тт, Re-U
В обзорной работе [3] подтверждается диаграмма состояния системы
Ti-Re, построенная в работе [1] и приводятся данные о метастабильных
превращениях, протекающих в двухфазной (а + р) области.
Механические, электрические, термодинамические и другие свойства
сплавов твердых растворов Ti с содержанием Re до -40 % (по массе)
приведены в работах [1,3, 4].
Литература
1. Савицкий Е.М., Тыл кина М.А., Зотьев Ю.А. // Журнал неорганической химии. 1959.
Т. 4. Вып. 3. С. 702-704.
2. Савицкий Е.М., Тылкииа М.А., Хамидов О.Х. II Изв. АН СССР. Металлы. 1969. N 4.
С. 200-208.
3. Murray J.L. // Bull. Alloy Phase Diagrams. 1982. V. 2. N 4. P. 462-465.
4. Савицкий E.M., Тылкииа M.A., Левин A.M. // Сплавы рения в электронике. М.:
Энергия, 1980. 215 с.
М.А. Тылкииа
Re-Tm. РЕНИЙ-ТУЛИЙ
В литературе нет сведений о диаграмме состояния Re-Tm. В работе
[Ш] приведены данные о существовании соединения TmRe2 со структурой
типа MgZn2 (символ Пирсона hP\2, пр.гр. Ptymmc), а - 0,5359 нм, с -
= 0,8761 нм.
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
Re-U. РЕНИЙ-УРАН
Система Re-U исследована в работах [Э, 1-5]. Диаграмма состояния
системы построена в работе [1] во всем интервале концентраций на литых
сплавах методами микроструктурного,рентгеноструктурного, термичес-
кого анализов и измерением температур плавления.
Высокотемпературная часть диаграммы системы исследована в
работах [2,3]. В работе [2] сплавы приготовляли по следующей методике.
В тигель из монокристаллического Re помещали U, нагревали до
заданной температуры в вакууме, пока жидкий растворитель (U) не
становился пересыщенным Re, после охлаждения закристаллизовавшийся
растворитель извлекали из тигля путем растворения его в соляной
кислоте (Re не растворяется в НС1). Температура плавления сплавов
определялась оптическим пирометром. В работе [3] определяли
Re-U
137
/7 Ю 20 30 4/7 50 60 70 80 90 700
Re U,°/o(a/n.) U
Рис. 512. Re-U
температуры солидуса и ликвидуса у сплавов в интервале концентраций
33,31 —83,7 % (ат.) Re. Диаграмма состояния системы Re-U представлена
на рис. 512 по данным работ [Э, 1 ]. Линия ликвидуса нанесена по данным
работ [3, 4].
В системе образуются два соединения: URe2 и U2Re.
Соединение URe2 плавится конгруэнтно при 2200 °C и имеет две
полиморфные модификации aURe2 « pURe2 с температурой превращения
180±3 °C. В работе [3] предполагается существование области гомоген-
ности у соединения URe2 (66,7 % (ат.) Re), сдвинутой в сторону Re до
71 % (ат.) Re.
Соединение U2Re, обнаруженное ранее в работе [4], образуется по
перитектоидной реакции.
138
Re-U
В системе имеют место два эвтектических и два эвтектоидных
превращения. Нонвариантные равновесия в системе представлены в
табл. 395.
Таблица 39 5. Нонвариантные реакции в системе Re-U
Реакция Содержание U в жидкой фазе, % (ат.) Температура, °C Источник
Ж = (Re) + pURe2 29,2; -4,0; 33,3 2105 [1]
— — — 2159 [2]
27,5; - 33,3 2160 [3]
Ж = (yU) + pURe2 87; 91,2; 33,3 1105 [1]
— — — 1112 [2]
50?; — 33,3 1118 [3]
(yU) + pURe2 - U2Re -93; 33,3; 66,7 750 [1]
(yU) - U2Re + pU 92,5; 66,7; 97,6 680 [1]
(PU) » U?Re + (aU) 98,2; 66,7; 99,5 64 ш
Максимальная растворимость Re в (aU) составляет 0,5 % (ат.) при
643 °C, в (PU) - 2,4 % (ат.) при 680 °C, в (yU) - 7,5 % (ат.) при 680 °C.
Растворимость U в (Re) равна примерно 0,6 % (ат.) при комнатной
температуре и несколько увеличивается при 2000 °C. При быстром
охлаждении сплавов в области (yU), содержащих более 7 % (ат.) Re,
образуется пересыщенный твердый раствор на основе (a'U) [1].
Установлена кристаллическая структура обоих модификаций
соединения URe2 [1,4, 5].
pURe2 кристаллизуется в решетку типа MgZn2 (фаза Лавеса) (символ
Пирсона hP\2, пр.гр. Ptymmc), параметры решетки: а = 0,5433 нм, с -
= 0,8556 нм.
aURe2 имеет орторомбическую решетку с параметрами а =
= 0,5600 нм, b = 0,9178 нм, с = 0,8463 нм [Э, 5].
Литература
1. Jackson R.J., Williams D.E., Larson W.L. // J. Less-Common Met. 1963. V. 5. N 6.
P. 443-447.
2. Gard S.P., Ackermann R.I. // J. Nucl. Mater. 1977. V. 64. N 3. P. 265-274.
3. Chandrassekharaian M.S., Dharwadkar S.R., Das D. // Z. Metallkunde. 1986. Bd. 77. N 8.
S. 509-514.
4. Rough F.A., Baner А.А. I/ Constitution Diagram Uranium and Thorium Alloys.
Massachusetts: Addision Wesley Publishing Company, 1958. P. 60-62.
5. Hatt B.A. // Acta Crystallogr. 1961. V. 14. P. 119-123.
M.A. Тылкина
Re-V
139
Re-V. РЕНИЙ-ВАНАДИЙ
Система Re-V исследована многократно в работах [1-8]. Диаграмма
состояния во всем интервале концентраций построена в работах [1,4-6].
Во всех этих работах исследование проводили методами микроструктур-
ного, рентгеноструктурного, термического анализов и измерением
сверхпроводимости. Полученные результаты в основном совпадают,
имеют место лишь некоторые расхождения по температурам нонвариан-
тных равновесий, а также характеру образования одного соединения.
На рис. 513 приведена диаграмма состояния Re-V по данным работы
[6]. Сплавы изготовляли дуговой плавкой с многократным переплавом,
Re, °/о (по массе)
Рис. 513. Re - V
140
Re-V
гомогенизировали при 2000 °C в течение 10 ч в атмосфере Аг и
закаливали от температур: >1500 °C после выдержки в течение 6 ч,
1000 °C - 90 ч. В качестве исходных компонентов использовали V -
чистотой 99,9 % (по массе), Re - чистотой 99,98 % (по массе).
В системе установлено существование двух соединений: Vo 32Re0 68
и VRe3 (фаза о).
Соединение Vo 32Re0 68 образуется по перитектоидной реакции и
претерпевает эвтектоидный распад на два твердых раствора (V) и (Re).
Vo 32Re0 68 обладает небольшой областью гомогенности, простираю-
щейся от 68 до 72 % (ат.) Re при 1970 °C. Фаза V0 32Re0 68 имеет
максимальную температуру Тк перехода в сверхпроводящее состояние.
В области концентрации 69,3-73 % (ат.) Re температура Тк составляет
8,8-8,6 К [4] и 9 К [6].
VRe3 (фаза о) образуется по перитектической реакции [1,5, 6], она
имеет незначительную область гомогенности и распадается по эвтектоид-
ной реакции. В работе [4] показано, что фаза о плавится конгруэнтно при
2630 °C.
Нонвариантные равновесия, протекающие в системе V-Re при
образовании и распаде соединений, а также при эвтектической
кристаллизации, представлены в табл. 396.
Таблица 396. Нонвариантные реакции в системе Re-V
Реакция Содержание Re в жидкой фазе, % (ат.) Температура, °C Источник
(V) + о » Vo 32Re0 68 -63; ~75; 68 2280+30 [6]
— — — 1950-2100 [4]
— — — 2290 [5]
^0,32^е0,68 “ (V) + (Re) 75; 59; -95 1470 [6]
Ж + (Re) » о -72; 87,5; 75 2460+20 [6]
— — — 1450-1500 [4]
— — - 2490 [1. 2, 7]
о ~ Vo 32Re0 68 + (Re) 75; 72; 94 1970+20 [6]
— — — 1450-1500 [4,8]
— — — 1500 [1,7]
Ж - (V) + о 70; 66; -75 2380±20 [6]
Растворимость Re в (V) весьма значительна и при 1400 °C равна 58 %
(ат.) Re. С увеличением температуры растворимость Re в V увеличивает-
ся, достигая 66 % (ат.) Re при температуре эвтектики 2380 °C [6].
Re-V, Re-W
141
Цифровые значения растворимости по данным работы [4] совпадают с
результатами работы [6].
Растворимость V в Re при 2460,1800 и 1400 °C соответственно равна
12±2, 5,5 и 5 % (ат.) [6], что также примерно совпадает с результатами
работ [1,4, 5].
Данные по кристаллической структуре соединений приведены в
табл. 397.
Таблица 39 7. Кристаллическая структура соединений системы V-Re
Соединение Прототип Символ Пирсона, пр.гр. Параметры решет- ки, нм Примечание
а b
^0,32^е0,68 Cr3Si сР8, 0,48768 — 69,3 % (ат.) Re
РтЗп 0,48783 — 71,4 % (ат.) Re
0,48792 — 72,3 % (ат.) Re
0,48792 — 73,0 % (ат.) Re
0,48792 - 74 % (ат.) Re
О ри tP3Q, 0,936 0,486 [7]
РЩтпт 0,9444— 0,9475 0,490 [6]
Литература
1. ТылкинаМ.А., Поварова К.Б., Савицкий Е.М.//Журнал неорганической химии. 1960.
Т. 5. Вып. 8. С. 1907-1910.
2. Кузьма Ю.Б., Ковалик Д.А. // Изв. АН СССР. Неорганические материалы. 1969. Т. 5.
N 10. С. 1687-1690.
3. Giorgi A.L., Matthias В.Т., Stewart G.R. // Solid State Commun. 1978. V. 27. P. 291—294.
4. Еременко B.H., Харькова A.M., Великанова Т.Я. //Доклады АН УССР. Серия физико-
математическая. 1983. N 1. С. 77—80.
5. Смолянинова Э.А., Стрибук Е.К. //Доклады АН БССР. 1985. Т. 29. N 7. С. 601—603.
6. Jord a J.L., Muller J. // J. Less-Common Met. 1986. V. 119. N 2. P. 337-345.
7. Тылкина M.A., Поварова К.Б., Савицкий Е.М. //Доклады АН СССР. 1960. Т. 131.
N 2. С. 332-334.
8. ЕременкоВ.Н., Харькова А.М., ВеликановаТ.Я.//Доклады АН УССР. Серия физико-
математическая. 1983. N 2. С. 75—79.
М.А. Тылкина
Re-W. РЕНИЙ-ВОЛЬФРАМ
Сведения о взаимодействии Re с W приведены в ряде работ [X, Э, Ш,
В, М, 1-9]. Диаграмма состояния W-Re во всем интервале концентраций
построена в работах [1,2]. По характеру взаимодействия компонентов
они хорошо согласуются между собой, незначительно отличаясь по
142
Re-W
W fie, % (am.) fie
Рис. 514. Re - W
значениям растворимости R: в (V/). Часть системы со стороны Re с
содержанием до 15 % (ат.) W исследована в работе [3].
На рис. 514 представлена обобщенная диаграмма состояния W- Re,
в основу которой положены результаты работ [1,3, 9] с корректировкой
по данным работы [2].
Сплавы приготовляли дуговой плавкой в атмосфере Аг из 1федвари-
тельно спеченных брикетов. Спекание смешанных порошков Re и W
проводилось в вакууме при 1600-1800 °C в течение 30 мин. Чистота
исходных W и Re равна 99,99 и 99,8 % (по массе) соответственно. Сплавы
подвергали ступенчатой термической обработке: отжигу при 2000 °C 2 ч,
1700 °C 3 ч, 1500 °C 1 ч, 1100 °C 100 ч с последующей закалкой.
Исследование проводили методами микроструктурного, рентгенос-
труктурного анализов, определения температур плавления, твердости
и микротвердости фаз.
Re-W
143
В системе образуются два соединения.
W2Re3 (фаза о) образуется по перитектической реакции и имеет
широкий интервал гомогенности от 40 до 66 % (ат.) Re при 1100 °C и от
45 до 66 % (ат.) Re при 2000 °C [1]. По данным работы [2] интервал
гомогенности фазы о при 2000 °C - 43,5-71 % (ат.) Re, согласно работе
[5] 55-65 % (ат.) Re.
WRe3 (фаза и) образуется по перитектоидной реакции. Интервал
гомогенности этой фазы составляет -72-75 % (ат.) Re при 1100 °C [1],
73-75 % (ат.) Re при 1500 °C [2].
В работе [7] указывается, что в сплавах с содержанием >8 % (ат.) Re,
полученных газофазным осаждением при 500-700 °C, наблюдается
метастабильная фаза А15 (типа Cr3Si), разлагающаяся при нагреве до
2000 °C. В системе имеет место одна эвтектическая реакция. Нонвариан-
тные реакции, протекающие в системе, приведены в табл 398. Кристалли-
ческая структура соединений указана в табл. 399.
Таблица 398. Нонвариантные реакции в системе W-Re
Реакция Содержание Re в фазах, % (ат.) Температура, °C Источник
Ж + (W) - W2Re3(o) WRe3(x) - W2Re3(o) + (Re) Ж - W2Re7(o) + (Re) -65; 45; 55 55; 37; 43,5 -50; 37; 43,7 75; 68; 85 73: 66; 91 71; 70; 85 75; 66; 85 74; 71; 80 74; 70,3; 79,8 2890 3000 3006 1050 2125 2129 2815 2825 2830 [1] [2] [М] [1] [2] [М] [1] [2] [MJ
Таблица 399. Кристаллическая структура соединений системы W-Re
Соединение Прототип Символ Пирсона, пр.гр. Параметры решетки, нм Источник
а с
W2Re3(o) ри tP30, 0,953 0,495* [1]
WRe3(x) аМп Ptymnm с 158, 0,9645 0,955 0,957 0,5038 * 0,496 [6] [5] [1]
При ког При ко центрации 5 нцентрации 143т 0 % (ат.) Re. 59,5 % (ат.) R 0,9588 е. [5]
144
Ae--B< Re-Y
В системе установлена большая область твердых растворов Re в (W),
простирающаяся до 45 % (ат.) Re при -2800 °C и сужающаяся до 32 %
(ат.) Re при 1100 °C [1]. По данным работы [2] растворимость Re в (W)
равна 37 % (ат.) при 3000 °C и 28 % (ат.) при 1600 °C.
Растворимость W в (Re) равна 15,9,7 и 4,5 % (ат.) W при 2815, 2100,
1500 и 1100 °C соответственно [3]. По данным работы [2] растворимость
W равна 20,0 и 11 % (ат.) при 2800 и 1600 °C соответствененно.
Литература
1. СавицкийЕ.М., Тылкина М.А., Шишкина Л Л.//Изв. АН СССР. Металлы. 1959 N 3.
С. 99-107.
2. Dickinson J.M., Richardson L.S. И Trans. ASM. 1959. V. 51. Р. 758-771.
3. Савицкий Е.М., Тылкина М.А., Хамидов О.Х. И Изв. АН СССР. Металлы. 1969. N 4.
С. 200-208.
4. Greenfield Р., Beck Р.А. //Trans. Am. Inst. Min. Metall. Pet. Eng. 1956. V. 206. P. 265.
5. Wilson C.G.//Acta Crystallogr. 1963. V. 16. P. 724-730.
6. Knapton A.G.//J. Inst. Met. 1955/56. V. 84. N 2. P. 21-22.
7. Хусаинов M.A., Лахоткин Ю.В., Умидов Д.М., Красовский А.И. И Изв. АН СССР.
Металлы. 1981. №4 С. 191-196.
8. СавицкийЕ.М., Поварова К.Б., Макаров П.В. Металловедение вольфрама. М.: Наука,
1978. 223 с.
9. Савицкий Е.М., Тылкина М.А., Левин А.М. Сплавы рения в электронике. М.: Энергия,
1980. 215 с.
КБ. Поварова, М.А. Тылкина
Re-Y. РЕНИЙ-ИТТРИЙ
Диаграмма состояния Re-Y построена в работе [1] методами
микроструктурного и рентгеноструктурного анализов и определения
температур плавления и представлена на рис. 515.
В системе образуется соединение YRe2 (фаза Лавеса) со структурой
типа MgZn2 (символ Пирсона API 2, пр.гр. Р6ъ1ттс) и параметрами а -
= 0,5397 нм, с = 0,8828 нм. Соединение образуется по перитектической
реакции Ж + (Re) « YRe2 при 2520 °C. Растворимость Y в (Re) не
превышает 1 % (ат.). Растворимость Re в (PY) - менее 1 % (ат.). Со
стороны Y при температуре 1450 °C образуется эвтектика (aY) + YRe2
с содержанием Re -5 % (ат.). Существование соединения YRe?, тип
решетки и ее параметры подтверждаются в работах [2-4].
Литература
1. Лундин К.Е. Редкоземельные металлы / Пер. с англ. Под ред. Ф. Спеллинга. М.:
Металлургия, 1965. С. 293-294.
Re-Y, Re-Yb
145
2. Хамидов O.X., Савицкий E.M. //Диаграммы состояния металлических систем. Сб.
статей. М.: Наука, 1968. С. 178-185.
3. Compton V.B., Mattias В.Т. И Acta Crystallogr. 1959. V. 12. Р. 651-654.
4. Гладышевский Е.И., Бодак О.И. Кристаллохимия интерметаллических соединений
редкоземельных металлов. Львов: Вища школа, 1982. 255 с.
М.А. Тылкина
Re-Yb. РЕНИЙ-ИТТЕРБИЙ
Сведения о системе Re-Yb противоречивы. В работе [Ш] указывается,
что спеканием в эвакуированной ампуле при наличии жидкой фазы
получено соединение YbRe2 с гексагональной решеткой типа MgZn2 и
параметрами а - 0,5340 нм, с - 0,8685 нм. В работе [1] рентгеноструктур-
ным методом на литых и отожженных при 1200 °C сплавах, расположен-
ных в области предполагаемого соединения, образование соединения не
наблюдалось.
1
146
Re-Yb, Re-Zn, Re-Zr
Литература
I. Хамидов O.X., Савицкий E.M. //Диаграммы состояния металлических систем. Сб.
статей. М.: Наука, 1968. С. 178-185.
М.А. Тылкииа
Re-Zn. РЕНИЙ-ЦИНК
Диаграмма состояния Re-Zn не построена. В работе [1] сообщается,
что при 520 °C твердый Re лишь слабо реагирует с расплавленным Zn,
что свидетельствует о весьма малой растворимости Re в Zn.
Литература
1. Sims С.Т., Jaffee R.I.// Trans. AIME. 1956. V. 206. P. 913-916.
М.А. Тылкииа
Re-Zr. РЕНИЙ-ЦИРКОНИЙ
Диаграмма состояния Re-Zr во всем интервале концентраций
построена в работе [1].
Сплавы приготовляли многократной дуговой плавкой в атмосфере
Не из иодидного Zr и Re чистотой 99,8 % (по массе). Богатая Zr часть
системы исследована на сплавах предварительно деформированных
(методом горячей ковки при 800-1000 °C). Изотермические отжиги с
последующей закалкой проводились при 1050 и 950 °C в течение 30 мин,
при 850, 800, 700 °C - 60 мин и при 400 °C - 2 месяца. Исследование
участка диаграммы от 45 до 100 % Re (по массе) проводили на литых
сплавах после отжига при 1000 °C в течение 560 ч.
При исследовании использовали методы микроскопического,
рентгеновского анализов, измерения температур плавления, твердости
сплавов и микротвердости фаз. В работах [2, 3] проведен детальный
рентгеноструктурный анализ образующихся в системе соединений. На
рис. 516 представлена диаграмма состояния системы Re-Zr по данным
работ [1-3].
В системе установлено существование трех соединений, образующихся
по перитектическим реакциям [1-3]:
Zr2Re (фаза о) с ~50 % (по массе) Re;
ZrRe2 (фаза А), с ~80 % (по массе) Re и областью гомогенности от ~80
до 82 % (по массе) Re (по данным работы [4] это соединение плавится
конгруэнтно при 2750 °C);
Re-Zr
147
Re,°/o (am.)
Рис. 516. Re - Zr
Zr5Re24 (фаза к), область гомогенности -90-92 % (по массе) Re [1-3].
В работе [5] проведено рентгеноструктурное исследование сплавов
в области существования Zr2Re. Авторы работы [5] считают, что в этой
области существует соединение Zr?1Re25.
Со стороны Zr в системе образуются твердые растворы (aZr) и (0Zr).
Между (pZr) и Zr2Re кристаллизуется эвтектика. (pZr) эвтектоидно
распадается с образованием aZr и Zr2Re. В работе [6] проведено
исследование в высокотемпературной области (в интервале температур
1593-1640 °C) части системы Re-Zr, богатой Zr. Определяли температуры
кристаллизации эвтектики и перитектической реакции, а также
растворимость Re в Zr при этих температурах.
148
Re-Zr
Нонвариантные реакции, протекающие в системе, приведены в
табл. 400.
Таблица 400. Нонвариантные реакции в системе Zr-Re
Реакция Температура, °C Источник
Ж + ZrRe2 e Zr2Re(o) 1900 [1]
1640 [7]
Ж + Zr5Re24 » ZrRe2(A.) 2450 [I]
Ж + (Re) » Zr5Re24 2500 [1]
Ж « (PZr) + Zr2Re 1600 [1]
1593 [7]
pZr « (aZr) + Zr2Re 550 [1]
Растворимость Re в (0Zr) при 1600 °C достигает 15 % (по массе) (8 %
(ат.)) и снижается до 8 % (по массе) Re при 550 °C, при содержании >4 %
(по массе) Re (0Zr) стабилизируется.
Температура полиморфного превращения (aZr) » (pZr) снижается с
863 до 550 °C с увеличением содержания Re [1,3]. По данным работы [6]
растворимость Re в (PZr) при температурах 1603, 1617 и 1635 °C равна
23,83; 24,55 и 29,78 % (ат.) Re, что значительно превышает значения
растворимости, полученные в работе [1].
Растворимость Re в (aZr) составляет -0,5 % (по массе) при 700-800 °C
и увеличивается с понижением температуры до 3 % (по массе) при 400 °C)
[1-3].
В богатых Zr сплавах с содержанием 5-6 % (ат.) Zr, закаленных от
1000 °C, обнаружена метастабильная фаза со [1].
Растворимость Zr в (Re) уточнена в работе [7]: при 2500 °C она
составляет 0,2 % (ат.) и снижается до 0,1 % (ат.) при 2100 и 1500 °C.
Кристаллическая структура соединений в этой системе приведена в
табл. 401.
Re-Zr
149
Таблица 401, Кристаллическая структура соединений системы Re-Zr
Соединение Прототип Символ Пирсона, пр.гр. Параметры решетки, нм Источник
а с
Zr2Re(o) ри ZP30, Р42/тит 1,012 0,542 [1,2]
ZrRe2(X) MgZn2 hP\2, Ptymmc 0,521-0,525 0,527 0,85-0,856 0,8635 [1,2] (4]
Zr21Re25(X) - R3c 0,25847 0,8771 [5]
Zr5Re24(K) аМп с/58, /43т 0,9693* 0,9626** - [3]
+<Для сплава с 80,6 % (ат.) Re. Для сплава с 82,0 % (ат.) Re.
В работе [3] отмечается интересная кристаллографическая особенность
системы Re-Zr. Она является единственной двойной системой, в которой
существуют одновременно соединения типа MgZn2 (фаза Л) и фаза к.
Обычно они исключают друг друга. Существование фазы Л в системе
Re-Zr связано с тем, что отношение атомных радиусов (rZr/rRe - 1,17)
выше, чем в системах Re с Nb, Та, Мо и W и находится в интервале
(1,10-1,50), что свойственно этим фазам.
Литература
1. Савицкий Е.М., Тылкина М.А., Цыганова И.А. // Атомная энергия. 1959. Т. 7. Вып. 3.
С. 231-235.
2. Крипякевич П.И., Тылкина М. А.,СавицкийЕ.М.//Научныедоклады высшей школы
М.: Металлургия, 1959. N 3. С. 171-173.
3. Крипякевич П.И., Тылкина М.А., Савицкий Е.М. И Изв. вузов. Черная металлургия.
1960. N 1.С. 12-15.
4. Krikorian N.H.//J. Phys. Chem. 1960. V. 64. Р. 1517-1519.
5. Cenzual К., Parthe Е., Waterstrat R.M. П Acta Crystallogr. C. 1986. V. 42. P. 261-266.
6. Gard S.P., Ackerman R.I.//Scr. Metall. 1979. V. 13. N 7. P. 611-613.
7. Савицкий E.M., Тылкина M.A., Хамидов O.X. // Изв. АН СССР. Металлы. 1969. N 4.
С. 200-208.
М.А. Тылкина
150
Rh-Ru, Rh-S
Rh-Ru. РОДИЙ-РУТЕНИЙ
На рис. 517 приведена диаграмма
Рис. 517. Rh-Ru
состояния Rh-Ru, которая
построена в работе [1] по
результатам дифференци-
ального, микроструктурно-
го, рентгенофазового ана-
лизов, измерения твердости
и микротвердости. Диаг-
рамма состояния Rh-Ru
представляет собой диаг-
рамму простого перитекти-
ческого типа с широкой
областью твердых раство-
ров без промежуточных
фаз. Температура перитек-
тической реакции равна
2100 °C.
Растворимость Ru в (Rh) составляет 50 % (ат.), область твердого
раствора на основе (Ru) распространяется до 45 % (ат.) Rh [X, Ш].
Литература
1. Савицкий Е.М., Полякова В.П., Рошан Н.Р. И Общие закономерности в строении
диаграмм состояния металлических систем. Сб. статей. М.: Наука, 1973. С. 47—49.
Г.П. Жмурки
Rh-S. РОДИЙ-СЕРА
Диаграмма состояния Rh-S не построена. По данным работ [X, Ш,
Э, 1,2] Rh и S образуют сульфиды следующих составов: Rh17S15, Rh3S4,
Rh2S3,RhS2,Rh2S5,RhS_3.
Кристаллическая структура соединений приведена в табл. 402.
Структура соединений Rh3S4 и Rh2S5 не установлена.
Rh-S. Rh-Sb
151
Таблица 402 Кристаллическая структура соединений системы Rh-S
Соедине- ние Прототип Символ Пирсона, пр.гр._ Параметры решетки, нм Источник
а b с
Rh17S15 Pd17S15 сР64, РтЗт 0,99103(23) - - [Ш]
Rh2s; - оР20, РЬсп 0,8462 0,5985 0,6138 [V-C]
RhS2 FeS2 сР\2, РаЗ 0,5585 - - [V-C]
RhS.3 * РомбИ1 Деформи- рованный FeS2 1еская сингс сР\2, РаЗ НИЯ. 0,558 [V-C]
Литература
1. Благородные металлы. / Под ред. Е.М. Савицкого. М.: Металлургия, 1984. 592 с.
2. Савицкий Е.М., Полякова В.П., Горина Н.Б., Рошан Н.Р. Металловедение пла-
тиновых металлов. М.: Металлургия, 1975. 424 с.
7". 77. Лобода
Rh-Sb. РОДИЙ-СУРЬМА
Результаты исследований различных авторов, изучавших систему
Rh-Sb, суммированы в справочниках [X, Э Ш] и работах [1, 2].
Обобщенная диаграмма состояния Rh-Sb, построенная по результа-
там термического, металлографического и рентгеновского анализов,
представлена на рис. 518 согласно справочнику [Ш].
В системе существует пять соединений, из которых Rh2Sb и RhSb
плавятся конгруэнтно при температурах > 1400 и 1310 °C соответственно,
a RhSb2 и RhSb3 образуются по перитектическим реакциям при
температурах 1100 и 900 °C соответственно. Соединение Rh2Sb имеет
область гомогенности от 33,2 до 35,1 % (ат.) Sb. Соединение Rh3Sb7
существует при высоких температурах и вероятно распадается по
эвтектоидной реакции при охлаждении до температуры 1000 °C [Ш,
1,2].
152
Rh-Sb
Рис. 518. Rh - Sb
Растворимость Sb в (Rh) при температуре 1150 °C составляет 8 % (ат.).
Растворимость Rh в (Sb) незначительна.
Сведения о кристаллической структуре соединений системы Rh-Sb
приведены в табл. 403. Структуры соединений Rh2Sb и Rh3Sb2 не
установлены.
Rh-Sb. Rh-Sc
153
Таблица 403. Кристаллическая структура соединений системы Rh-Sb
Соединение Прототип Символ Пирсона, пр.гр. Параметры решетки, нм Источник
а b с
RhSb MnP оР8, Рпта 0,6333 0,5952 0,3876 12]
RhSb/ CoSb2 тР\2, Р2{!с 0,657(2) 0,6604 0,652(2) 0,6557 0,660(2) 0,6668 [Э] [Ш]
RhSb3 CoAs3 с/32, 1т 3 0,9229 — — О, 2]
*0 = 116,9 о
Литература
1. Благородные металлы. / Под ред. Е.М. Савицкого. М.: Металлургия, 1984. 592 с.
2. Савицкий Е.М., Полякова В.П., Горина Н.Б., Рошан Н.Р. Металловедение платиновых
металлов. М.: Металлургия, 1975. 424 с.
Т.П. Лобода, Е.М. Соколовская
Rh-Sc. РОДИЙ-СКАНДИЙ
Диаграмма состояния Rh-Sc не построена. В системе образуются
соединения Rh3Sc и RhSc, сведения о кристаллической структуре которых
приведены в табл. 404.
Таблица 404. Кристаллическая структура соединений системы Rh-Sc [11
Соединение Прототип Символ Пирсона, пр.гр. Параметр решетки а, нм
Rh3Sc AuCu3 сР4, Рт Зт 0,3909
RhSc CsCl сР2, РтЗт 0,3204
154
Rh~Sc, Rh~Se
Литература
1. Гладышевский Е.И., Бодак О.И. Кристаллохимия интерметаллических соединений
редкоземельных металлов. Львов: Вища школа, 1982. 253 с.
Е.И. Гладышевский, О.И. Бодак, В.К. Печорский
Rh-Se. РОДИЙ-СЕЛЕН
На рис. 519 приведена диаграмма состояния Rh-Se, построенная в
работе [1] в области концентраций 40-80 % (ат.) Se. Сплавы готовили в
кварцевых ампулах с использованием Rh чистотой 99,84 и 99,98 % (по
массе), отжигали при температурах 450-500 и 700-1000 °C, закаливали
в воде и исследовали методами термического и рентгеновского анализов.
В системе образуется одиннадцать соединений: RhSe0 9_j 1? RhSej 29,
RhSe, 32, RhSe, 34 (претерпевает полиморфное превращение при
температуре 633’ °C), RhSej 5_х, RhSej 5 (претерпевает полиморфное
превращение при 727 °C), RhSe1>9, RhSej 95, RhSe2, RhSe2+v RhSe267
Рис. 519. Rh - Se
Rh-Se
155
(Rh3Se8). Соединение RhSej 29 плавится конгруэнтно при температуре
1240 °C и при 674 °C распадается по эвтектоидной реакции. Соединения
RhSe2 67, RhSej 95, RhSej 34 и RhSej 32 образуются по перитектическим
реакциям при температурах -825, Й43, -1200 °C и несколько меньшей
700 °C соответственно. Температура перитектической реакции,
протекающей с образованием фазы RhSe09_j р не установлена. Не
определен характер и температуры образования остальных соединений.
Авторы работы [1] предполагают, что при температуре 1235 °C имеет
место монотектическая реакция, а при температуре, близкой к температу-
ре плавления Se - эвтектическая реакция.
Растворимость Se в (Rh) вплоть до температуры 975 °C и Rh в (Se)
отсутствует [X, Ш, Э].
Кристаллическая структура соединений приведена в табл. 405.
Таблица 405. Кристаллическая структура соединений системы Rh-Se
Соедине- ние Прототип Символ Пирсона, пр.гр. Параметры решетки, нм Примечание
a h c
RhSej 29 NiAs hP4, Р63/ттс 0,3650 - 0,5530 [2]
RhSe, 32 NiAs hP4, Рбт/ттс 0,3664 - 0,5504 [2]
aRhSej 34 NiAs hP4, Ptymmc 0,3648 - 0,5493 [2]
RhSej 5 (Rl^Sej) Rh2S3 oP2Q, Pbcn 0,8888 0,6294 0,6423 [V-C]
RhSe2 FeS2 cP 12, РаЗ 0,6012- -0,5957 — - [2]
RhSej 95 IrSe2 oP24, Pnma 2,0925 0,5950 0,3707 [2]
RhSe,',. Rh3Se8 hRW, R3 0,5964 0,59632 — — [2] [V-C]
* a = 90,41° [2], a = 90,77° [V-C].
156
Rh—Se, Rh-Si
Литература
I. Rummary T.E., HeidingR.D. // Canad. J. Chem. 1967. V. 45. N 2. P. 131—137.
2. Савицкий E.M., Полякова В.П., Горина Н.Б., Рошан Н.Р. Металловедение плати-
новых металлов. М.: Металлургия, 1975. 424 с.
Т. П. Лобода
Rh-Si. РОДИЙ-КРЕМНИЙ
На рис. 520 приведена диаграмма состояния Rh-Si, построенная в
работе [1]. Сплавы плавили методом дуговой плавки в атмосфере Аг из
порошкового Rh [99 % (по массе) Rh].H Si [99,9995 и 99,9999 % (по массе)
Рис. 520. Rh - Si
Rh-Si
157
Таблица 406. Кристаллическая структура соединений системы Rh-Si
Соедине- ние Прототип Символ Пирсона, пр.гр. Параметры решетки, нм Источник
a h c
RhjSi Co2Si oPl 2, Pnma 0,540(8) 0,5404 0,393(0) 0,393 0,738(3) 0,739 [Э] [1]
Rh5Si3 Rh5Ge3 oP\(>, Pham 0,5322 1,0126 0,3897 [1]
Rh3Si2‘ - P3m\ 0,3965 - 0,5051 [1]
RhSi(HT) MnP ()PS, Pnma 0,5545 0,3067 0,6376 [1]
RhSi(BT) FeSi cP8, P2{3 0,4685 - - [1]
RhSifx)** - Pl\lc 0,4588 0,4568 0,5535 [1]
Rh20Si13 13 hP34, P63lm 1,186 — 0,362 [1]
Rh.SL” 4 j Rh4Si5 mP\%, P2y!m 1,234 0,3512 0,5929 [1]
Rh3Si4 Rh3Si4 OP28, Pnma 1,880 0,3613 0,5808 [1]
Тригональная сингония (?). Моноклинная сингония, 0 = 1 15,923°(для RhSi(.x)), 0 = 100,18° (для Rh4Si5).
Si] и отжигали в вакууме при разных температурах. Исследование
проводили методами дифференциального термического, рентгеновско-
го, микроскопического анализов, а также измерения твердости и
магнитной восприимчивости. В системе установлено образование семи
соединений: Rh2Si, Rh5Si3, Rh20Si13, Rh3Si2, RhSi, Rh4Si5 и Rh3Si4.
Причем данные по структуре двух соединений Rh3Si2 и RhSi находятся
в противоречии с данными, приведенными в справочнике [Э].
Соединения Rh2Si и RhSi образуются из расплава при температурах
1650± 10 °C и 1450± 10 °C соответственно. Соединение RhSi существует
158
Rh-Si, Rh-Sm
в виде трех различных модификаций: высокотемпературной RhSi(BT)
с кубической структурой, низкотемпературной RhSi(HT) с орторомбичес-
кой структурой и в виде фазы с моноклинной структурой RhSi(x),
образующейся в результате мартенситного превращения. Температура
полиморфного превращения RhSi зависит от состава (см. вставку на
рис. 520). Переход RhSi(BT) RhSi(HT) происходит при температуре
1080 °C (со стороны Rh) и около 1030 °C (со стороны Si). Низкотемпера-
турная модификация - RhSi (НТ) имеет область гомогенности от 49,8
до 50,7±0,2 % (ат.) Si. Соединение Rh5Si3 образуется по перитектической
реакции Rh2Si + Ж « Rh5Si3 при температуре 1470± 10 °C и содержании
37,5±0,3 % (ат.) Si. Соединения Rh20Si13, Rh3Si2, Rh4Si5 и Rh3Si4
образуются по перитектоидным реакциям при температурах 1225± 10 °C,
820± 10 °C, 1030± 10 °C и 1040± 10 °C соответственно и при содержаниях
Si 40,0±0,6; 40,0± 1,5; 55,5±0,2; 57,1 ±0,2 % (ат.) соответственно. Соедине-
ние Rh20Si13 распадается эвтектоидно по реакции: Rh20Si13 Rh5Si3 +
+ RhSi при температуре 1050±20 °C.
В системе кристаллизуются три эвтектики: (Rh) + Rh2Si при
температуре 1430± 10 °C и содержании 21,5 % (ат.) Si; Rh5Si3 + RhSi(BT)
при температуре 1250±10 °C и содержании 40,8±0,5 % (ат.) Si и
RhSi(BT) + (Si) при температуре 1060± 10 °C и содержании 68,5± 10 % (ат.)
Si.
Растворимость Si в (Rh) при температуре 1430± 10 °C равна 2,3±0,2 %
(ат.).
Сведения о кристаллической структуре соединений системы Rh—Si
приведены в табл. 406. Фаза Rh4Si5 обладает свойством сверхпроводи-
мости [1].
Литература
1. Schellenberg L., Jorda J.L., Muller J. П J. Less-Common Met. 1985. V. 109. N 2.
P. 261-274.
T. П. Лобода, E. M. Соколовская
Rh-Sm. РОДИЙ-САМАРИЙ
Диаграмма состояния Rh-Sm не построена. В системе образуется ряд
соединений, которые исследованы методом рентгеноструктурного
анализа. Сведения о кристаллической структуре соединений приведены
в табл. 407 по данным справочника [V-C].
Rh-Sm, Rh-Sn
159
Таблица 407. Кристаллическая структура соединений системы Rh-Sm
Соединение Прототип Символ Пирсона, пр.гр. Параметры решетки, нм
а Ь С
Rh3Sm Ni3Ce ЛР24, Рбт/ттс 0,5255 - 1,746
RhjSm Cu2Mg cF24, Fd3m 0,7540 - -
RhSm CsCl c Pl, РтЗт 0,3466 - -
Rh4Sm5 Ge4Sm5 аРЗб, Рпта 0,7335 1,467 0,7557
RhjSmj Ni2Er3 hR\5, R3 0,8701 - 1,6526
RhSm3 CFe3 oP\6, Рпта 0,7245 0,9675 0,6368
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
Rh-Sn. РОДИЙ-ОЛОВО
Диаграмма состояния Rh-Sn точно не установлена. На рис. 521
приведена схематическая диаграмма состояния системы Rh-Sn,
построенная в справочнике [X].
Sn, % fnn массе)
Рис.521. Rh-Sn
*
160
Rh-Sn, Rh-Sг
Установлено образование пяти соединений: Rh2Sn, "Rh3Sn2", RhSn,
RhSn2, RhSn4. Соединения Rh2Sn и RhSn2 плавятся, по-видимому,
конгруэнтно, соединения RhSn и RhSn4 образуются по перитектическим
реакциям; возможно, это относится и к соединению "Rh3Sn2". Соединение
RhSn2 имеет две модификации с температурой перехода RhSn2 (ВТ) -
- RhSn2 (НТ) при 500 °C. В системе кристаллизуются три эвтектики:
(Rh) + Rh2Sn; RhSn + RhSn2 при содержании 62,7 % (ат.) Sn; RhSn4? +
+ (Sn). Предполагается заметная область твердых растворов на основе
Rh.
Сведения о кристаллической структуре соединений системы Rh-Sn
приведены в табл. 408 по данным справочников [X, Э].
Таблица 408. Кристаллическая структура соединений системы Rh-Sn
Соединение Прототип Символ Пирсона, пр.гр. Параметры решетки, нм
а Ь С
Rh2Sn Co2Si оР12, Рпта 0,820 0,552 0,442
"Rh3Sn2" (37,5-40,5 % (ат.) NiAs hP4, Рбу/ттс 0,4338- -0,4340 - 0,5544— -0,5553
RhSn2(BT) CuA12 tin, 14!тст 0,6412 - 0,5655
RhSn2(HT) CoGe2 оС24, Aba2 0,6332 0,6332 1,119
Структура соединения RhSn4 не установлена.
Т. П. Лобода, Е. М. Соколовская
Rh-Sr. РОДИЙ-СТРОНЦИЙ
Диаграмма состояния Rh-Sr не построена. Известно лишь о
существовании соединения Rh2Sr, имеющего структуру типа MgCu2
(символ Пирсона cF24, пр.гр. Fd3m) [1].
Литература
1. Bruzzone G., Merlo F. // J. Less-Common Met. 1982. V. 85. N 2. P. 295-306.
Л.Л. Зусман
Rh-Та
161
Rh-Ta. РОДИЙ-ТАНТАЛ
Диаграмма состояния Rh-Ta построена в работе [1] по результатам
металлографического и рентгеновского анализов (рис. 522). Сплавы для
исследования получены из компонентов чистотой -99,8 % (по массе). В
системе образуются пять фаз: o(Ta2Rh), а3, а,, a(TaRh2), TaRh3. TaRh3
плавится конгруэнтно при температуре -2125 °C, имеет широкую
область гомогенности (от 22 % (ат.) Та при температуре 2015 °C до 31 %
(ат.) Та при 1890 °C). Фазы TaRh?, а,, а3, Ta2Rh(o) образуются по
перитектическим реакциям при температурах 1890, 1860, 1840 и
2110±30 °C соответственно [1] и имеют значительные области гомоген-
ности.
Эвтектоидный распад а3 « ОС] + о происходит при температуре
1375±20 °C и содержании 48 % (ат.) Та.
Кристаллическая структура фаз системы Rh-Ta по данным работы
[1] приведена в табл. 409.
Rh Га, */• (ат.) га
Рис. 522. Rh - Та
162
Rh-Та, Rh-Tb
Таблица 409. Кристаллическая структура соединений системы Rh-Ta
Соедине- ние Прото- тип Символ Пирсона, пр.гр. Параметры решетки, нм Примечание
а h с
TaRh3 AuCu3 сР4, РтЗт 0,3860 - - При 25 % (ат.) Та
0,3884 ~~ - При 30 % (ат.) Та
TaRh, J. Co2Si оР\2, Рпта 0,8179 0,5443 0,4027 При 33,5 % (ат.) Та
“1 - Ртст 0,2822 0,4742 1,3551 При 39,5 % (ат.) Та
о pu » Ptymnm 0,9822 - 0,5102 При 65 % (ат.) Та
0,9904 - 0,5160 При 75 % (ат.) Та
Литература
I. GiessenВ.С., Ibach Н., Grant N.J.//Trans. A1ME. 1964. V. 230. N IP. 113-122.
В.П. Полякова
Rh-Tb. РОДИЙ-ТЕРБИЙ
Диаграмма состояния Rh-Tb не построена. Установлено существова-
ние ряда интерметаллических соединений [1-6], состав и структура
которых приведены в табл. 410.
Rh-Tb. Rh-Tc
163
Таблица 410. Кристаллическая структура соединений системы Rh-Tb
Соединение Прото- тип Символ Пирсона, пр.гр. Параметры решетки, нм Примечание
a b c
RhTb3 Fe3C oP\6, Pnma 0,7156 0,9505 0,6308 [1.6]
Rh3Tb7 Th7Fe3 ЛР20, Pf^mc 0,9789 - 0,6158 [2]
Rh3Tb5(BT) Mn5Si3 hP\6. Pbylmcm 0,8176 - 0,6385 [3.6]
Rh2Tb3 Y3Rh2 UM, Mlmcm 1,125 - 2,520 [4]
RhTb CsCl cP2, Pm 3 m 0,3417 - - [5]
Rh2Tb MgCu2 cF2A, Fd3m 0,7492 - - В области, богатой Tb[l]
0,7452 - - В области, богатой Rh]l]
Rh5Tb(BT) CaCu5 hP6, Pbtmmm 0,5134 - 0,4290 [1.6]
Литература
1. Ghassen Н., Raman A.//Z. Metallkunde. 1973. Bd. 64. N 3. S. 197—199.
2. OkeseG.L.//J. Less-Common Met. 1973. V. 33. N l.P. 71-81.
3. Raman A., Ghassen H. // J. Less-Common Met. 1973. V. 30. N 1. P. 185—197.
4. Moreau J.M., Paccard D., Parthe E. //Acta Crystallogr. B. 1976. V. 32. N 7. P. 1767—1771.
5. Dwight A.E., Conner R.A., Downey J.W. // Acta Crystallogr. 1967. V. 18. N 5. P. 837—839.
6. Благородные металлы: Справочник/Под ред. Е.М. Савицкого. М.: Металлургия, 1984.
592 с.
Т. П. Лобода, Е. М. Соколовская
Rh-Tc. РОДИЙ-ТЕХНЕЦИЙ
Предполагается, что Rh-Tc представляет собой простую диаграмму
перитектического типа без промежуточных фаз [Ш]. В работе [1] в
результате расчета с использованием модели регулярных растворов
построена диаграмма состояния Rh-Tc, которая приведена на рис. 523.
164
Rh-Тс, Rh-Те
Рис. 523. Rh - Тс
Растворимость Rh в (Тс) составляет -70 % (ат.) при температуре
1500 °C или 65-75 % (ат.) при температуре 1050 °C. Растворимость Тс
в (Rh) при температуре 1500 °C равна -4,5 % (ат.) [Ш].
Литература
1. Haines H.R., Potter Р.Е., Rand М.Н. // Proc. 1 Int. Symp. Thermodyn. Nucl. Mater. Vienna.
1980. V. 1. P. 471-501.
B.I1. Полякова
Rh-Те. РОДИЙ-ТЕЛЛУР
Диаграмма состояния Rh-Те (рис. 524) построена в работе [1] по
данным рентгеновского и дифференциального термического анализов
[2] (в области температур 500 -1250 °C при концентрации Те от 0 до 64 %
(ат.)) и результатам рентгеновского, дифференциального термического
и микроструктурного анализов [3] (в области температур 400-1100 °C
при концентрации Те от 63 до 74 % (ат.)).
Установлено существование семи соединений. Соединение RhTe2_Y
плавится конгруэнтно при температуре 1228 °C. Соединения RhTe2+y и
Rh3Te8 плавятся инконгруэнтно при температурах 1075 и 627 °C
соответственно. Соединения Rh3Te2, Rh3Te4, R.hTe0 9, RhTe образуются
по перитектоидным реакциям при температурах $86, 983, 829, 657 °C
Rh-Те
165
Рис. 524. Rh - Те
Таблица 411. Нонвариантные реакции в системе Rh-Te
Реакция Содержание Те в фазах, % (ат.) Температура, °C
Ж - (Rh) + pRhTe2_v 49; 1; 62 993
(Rh) + pRhTe2_x - Rh3Te2 1; 62; 41 986
Rh3Te2 - (Rh) + RhTeo;, 41; -0; 46 >450
Rh3Te2 + pRhTe2_v - Rh3Te4 41; 62; 54 983
Rh3Te2 + Rh3Te4 - RhTe0 9 41,5; 53,5; 46,5 829
RhTe0 9 + Rh3Te4 « RhTe 47; 54; 50 657
Ж + pRhTe2_x - RhTe2+y -84; 65,4; 67,5 1075
Ж + RhTe2+>, « Rh3Te8 -99; 71,4; 72,7 627
Ж - Rh3Te8 + (Те) -100; 72,7; 100 449
* В работе [4] указывается реакция Rh3Te2 -• (Rh) + RhTe] г
166
Rh-Те
соответственно. Соединение RhTe2_v претерпевает полиморфное
превращение при температуре 702 °C. Сведения о нонвариантных
превращениях, в которых принимают участие указанные выше
соединения, приведены в табл. 411.
Сведения о кристаллической структуре соединений приведены в
табл. 412.
Таблица 412. Кристаллическая структура соединений системы Rh-Te
Соедине- ние Прото- тип Символ Пирсона, пр.гр. Параметры решетки, нм Примечание
а Ь С
Rh3Te2 - «С20, Стет 0,7694 .1,2446 0,3697 При 40 % (ат.) Те [4]
0,7712 1,246 0,3702 При 40,5 % (ат.) Те [2]
0,7731 1,248 0,3702 При 41,5 % (ат.) Те [2]
RhTe NiAs hP4, Pbjlmmc 0,3987 - 0,5661 [5]
Rh3Te4 - тС 14, СИт 0,6812 0,3954 1,123 При 57,1 % (ат.) Те, р = 92,55° [6]
0,679 0,393 1,119 При 52,5 % (ат.) Те, р = 92,3° [2]
PRhTe2_x Cdl2 hP3, P3ml 0,392 - 0,541 Для RhTe2 [5]
RhTe2+>, FeS2 cP 12, РаЗ 0,6428 0,64481 - - [1] [3]
Rh3Te8 - hRll, R3 0,64255 - - а = 90,724° [3]
Литература
1. Okamoto Н. // J. Phase Equilibria. 1991. V. 12. N 1. Р. 121-122.
2. Ding Z., Kleykamp Н., Thummler F.//J. Nucl. Mater. 1990. V. 171. P. 134-138.
3. Kjekshus A., RakkeR., Andersen A.F.,//Acta Chem. Scand. A. 1978. V. 32. N 3. P. 209-217.
4. Zachariasen W.H. //Acta Crystallogr. 1966. V. 20. N 3. P. 334-336.
5. Geller S. // J. Amer. Chem. Soc. 1955. V. 77. P. 2641-2644.
6. Plovnick R.H. // Inorg. Chem. 1968. V. 7. N 12. P. 2596-2598.
T. В. Добаткина, В.П. Полякова
Rh-Th
167
Rh-Th. РОДИЙ-ТОРИЙ
На рис. 525 приведена диаграмма состояния Rh-Th, которая была
построена в работе [1] по данным термического, рентгеновского и
микроструктурного анализов в интервале температур от 1000 °C до
1500 °C. В системе образуются семь соединений. ThRh3,ThRh и Th7Rh3
плавятся конгруэнтно при температурах > 1500 °C, > 1500 °C, 1362± 12 °C
соответственно. Остальные соединения ThRh5, ThRh2, Th3Rh5, Th3Rh4
образуются по перитектическим реакциям при температурах >1500,
>1500, 1450±12, 1487±12 °C соответственно. Соединение ThRh2
существует в двух модификациях: высокотемпературной ThRh2(BT) и
низкотемпературной ThRh2(HT). Температура полиморфного прев-
ращения составляет ~ 1250 °C. Вышеперечисленные соединения участвуют
в четырех эвтектических равновесиях:
Ж « (Rh) + ThRh5 при 1450± 12 °C и 13 % (ат.) Th;
Ж ~ ThRh2 + Th3Rh5 при 1425± 12 °C и 36 % (ат.) Th;
Ж « ThRh + Th7Rh3 при 1312± 12 °C и 64 % (ат.) Th;
Ж * Th7Rh3 + (aTh) при 1237± 12 °C и 80 % (ат.) Th.
ЯЛ Th,°/a(am) Th
Рис. 525. Rh - Th
168
Rh-Те
Взаимная растворимость Rh в (Th) и Th в (Rh) не превышает ~ 1 %
(ат.).
Сведения о кристаллической структуре соединений системы Rh-Th
приведены в табл. 413.
Таблица 413. Кристаллическая структура соединений системы Rh-Th
Соедине- ние Прототип Символ Пирсона, пр.гр. Параметры решетки, нм Источник
а b с
ThRh3 AuCu3 сР4, РтЗт 0,4148 - - [2]
ThRh, (ВТ) Niln2 hP6, Рб^/ттс 0,4629 - 0,5849 [И
Th3Rh4” - - 0,5085 — - [1]
ThRh CrB о С8, Стет 0,3866 1,124 0,4220 [1,3]
Th7Rh3 При ко Вероя- Fe3Th7 нцентрации гно кубичес АР20, Рбупс 35 % (ат.) Th кая сингония 1,0031 1,0028 0,6287 0,6293 [1] [4]
Литература
1. Thomson J.R. // J. Less-Common Met. 1963. V. 5. N 6. P. 437-442.
2. Dwight A.E., Downey J.W., Conner R.A. // Acta Crystallogr. 1961. V. 4. N 1. P. 75-76.
3. Thomson J.R.//Acta Crystallogr. 1962. V. 15. P. 1308-1309.
4. Ferro R., Rambaldi G.//Acta Crystallogr. 1961. V. 14. N 10. P. 1094.
В.П. Полякова
Rh-Ti
169
Rh-Ti. РОДИЙ-ТИТАН
Диаграмма состояния Rh-Ti (рис. 526) построена в работе [1] по
данным дифференциального термического анализа, измерения тем-
ператур солидуса с помощью оптического пирометра, микроструктурно-
го и рентгеновского анализов. При исследовании использовали Rh и Ti
чистотой 99,9 % (по массе). Установлено существование соединений:
Ti2Rh, TiRh, TiRh3 и, вероятно, Ti3Rh5. Авторы работы [1] считают, что
соединения TiRh5, обнаруженного ранее в работе [2], в системе Rh-Ti не
существует, а наличие ряда соединений в области состава TiRh, о
которых также сообщается в работе [2], связано с полиморфизмом
соединения TiRh. Соединение TiRh3 образуется по перитектической
реакции при температуре 1750 °C, имеет область гомогенности от 72 до
79 % (ат.) Rh при температуре 1500 °C. Соединение TiRh образуется
конгруэнтно из расплава при температуре 1940 °C, при понижении
температуры претерпевает превращение мартенситного типа, темпера-
турная и концентрационная граница которого требует уточнения.
Область гомогенности TiRh составляет от 42,5 до 55 % (ат.) Rh [3] или
от 40 до 63 % (ат.) Rh [1] при температуре 1500 °C. Соединение Ti2Rh
Рис. 526. Rh - Ti
170
Rh-Ti
образуется конгруэнтно из твердого раствора (0Ti) при температуре
790 °C и эвтектоидно распадается с образованием TiRh.
Эвтектическое взаимодействие Ж « TiRh + TiRh3 протекает при
температуре 1650 °C.
Сведения о кристаллической структуре соединений системы Rh-Ti
приведены в табл. 414 по данным работы [4]. Следует отметить, что для
соединения aTiRh указаны все структуры, обнаруженные в области
эквиатомного состава.
Таблица414. Кристаллическая структура соединений системы Rh-Ti [4|
Соедине- ние Прото- тип Символ Пирсона, пр.гр. Параметры решетки, нм Примечание
a b c
Ti2Rh MoSi2 r/6, НЬптт. 0,306 - 0,981 -
pTiRh CsCl cP2, РтЗт 0,3114 - - -
aTiRh AuCu tP4, 0,417 — 0,3354 При 50 % (ат.) Rh
P4/mmm 0,411 — 0,336 При 57 % (ат. ) Rh
TiRh NbRu — 0,415 0,411 0,340 —
TiRh* — — 0,296 0,286 0,341 —
TiRh** - - 0,2735 - 0,3679 -
Ti3Rh5 Ge3Rh5 oP16, Pbam 0,536 1,042 0,408 -
TiRh3 AuCu3 cP4, Pm 3m 0,3822 - - -
* Моноклинная сингония (В = 90,61°).
** Тетрагональная искаженная типа CsCl сингония.
Диаграмма состояния Rh-Ti, полученная путем расчета в работе [5],
хорошо согласуется с экспериментальными данными. Обзор литератур-
ных данных по системе Rh-Ti приведен в работе [6].
Литература
1. Rauh Е., Rbschel Е.//Z. Metallkunde. 1966. Bd. 57. N 7. S. 546-551.
2. Raman A., Schubert К.//Z. Metallkunde. 1964. Bd. 55. N 11. S. 704-707.
Rh-Ti. Rh-Тт, Rh-U
171
3. Штепа Т.Д. И Физическая химия конденсированных фаз сверхтвердых материалов
и их границ раздела, Сб, статей. Киев: Наукова думка. 1975. С. 175-191.
4. Благородные металлы: Справочник/Под ред. Е М. Савицкого. М.: Металлургия, 1984.
592 с.
5. Sluiter М., Turchi Р., Lezhong F. et al. // Phys. Rev. Letters. 1988. V. 60. N 8 P. 716-719.
6. Murray J.L. // Bull. Alloy Phase Diagrams. 1982. V. 3. N 3. P. 335-342.
В.П. Полякова
Rh-Tm. РОДИЙ-ТУЛИЙ
Диаграмма состояния Rh-Tm не построена. Известно о существова-
нии соединений Rh2Tm, RhTm, Rh3Tm5, кристаллическая структура
которых приведена в табл. 415.
Таблица 415. Кристаллическая структура соединений системы Rh-Tm
Соедине- ние Прото- тип Символ Пирсона, пр.гр. Параметры решетки, нм Источник
a h c
TmRh2 Cu2Mg cF24, Fd3m 0,7416 - - [1]
TmRh CsCl cP2, Pm 3 m 0,3358 - - [2]
Tm5Rh3 Si3Mn5 hP\6, P6y/mcm 0,8058 - 0,6252 [3]
Литература
1. Moriarty J.L., Humphreys J.E., Gordon R.O., Baenziger N.C. // Acta Crystallogr. 1966.
V. 21.N 5. P. 840-841.
2. Dwight A.E., Conner R.A., Downey J.W. // Acta Crystallogr. 1965. V. 18. N 5. P. 837-839.
3. Le Roy J., Moreau J.M., Paccard D., Parthe E. // Acta Crystallogr. В. 1977. V. 33. N 8.
P. 2414—2417.
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
Rh-U. РОДИЙ-УРАН
Диаграмма состояния Rh-U (рис. 527) построена по результатам
дифференциального термического, микроструктурного и рентгеновско-
го анализов в работе [1]. В системе установлено существование четырех
соединений. Соединение URh3 плавится конгруэнтно при температуре
172
Rh-U
U Rh, Vo fam.) Rh
Рис. 527. Rh - U
1700 °C. U4Rh3, U3Rh4 и U3Rh5 образуются по перитектическим
реакциям при температурах 1155, 1450 и 1550 °C соответственно. U4Rh3
существует в двух модификациях; температура изоморфного перехода
720 °C [1,2].
В системе Rh-U наблюдаются два эвтектических равновесия:
Ж « (yU) + U4Rh3 при 865 °C и 24,5 % (ат.) Rh [1]
(885 или 867 °C при 22, 5 или
18,7 % (ат.) Rh [2];
Ж « (Rh) + URh3 при 1393 °C и 87 % (ат.) Rh [1].
Установлен эвтектоидный характер полиморфных превращений в
сплавах на основе U.
Максимальная растворимость Rh в (yU) составляет ~8 % (ат.), в (0U) -
~2 % (ат.). Растворимость U в (Rh) при температуре 1393 °C определена
равной ~3 % (ат.) [1].
Структура большинства соединений не установлена. Соединение
URh3 имеет структуру типа AuCu3 (символ Пирсона сР4, пр. гр. РтЗт,
а = 0,3992 нм [1]).
Rh-U, Rh-V
173
Литература
1. Park J J.//J. Res. Natl. Bur. Standards. A. 1968. V. 72. N 1. P. 11-14.
2. Диаграммы состояния и фазовые превращения сплавов урана / Под ред. О.С. Иванова.
М.: Наука, 1972. 254 с.
Г.П. Жмурко
Rh-V. РОДИЙ-ВАНАДИЙ
Наиболее предпочтительной является диаграмма состояния Rh-V
(рис. 528), которая построена в работе [1] по результатам термического,
микроструктурного, рентгеновского и микрорентгеноспектрального
анализов.
В системе установлено образование шести соединений, которые имеют
области гомогенности.
Фаза .... Y е а2 а3 а1 Р
Содержание V, % (ат.).... 22-35 37,5-40 40-48 49-52 50-55 61-75
Фазы у, е, а2, а] и 0 образуются по перитектическим реакциям при
температурах 1740, 1615, 1560, 1535 и 1730 °C соответственно. Фаза а3
Рис. 528. Rh-V
174
Rh-V. Rh-W
образуется по перитектоидной реакции при температуре 1406 °C. Фаза
«1 существует в узком интервале температур и эвтектоидно распадается
при температуре 1320 °C.
Растворимость V в (Rh) достигает 19,5 % (ат.) при температуре
1740 °C и мало зависит от температуры. Растворимость Rh в (V)
составляет 18 % (ат.) при температуре 1730 °C и 14 % (ат.) при 900 °C [1].
Кристаллическая структура соединений и область их существования
приведены в табл. 416.
Т аблица416. Кристаллическая структура соединений системы Rh-V
Соедине- ние Прото- тип Символ Пирсона, пр.гр. Параметры решетки, нм Примечание
а h с
Y AuCu3 <7>4, РтЗт 0,3787- -0,3789 - - При 22 % (ат.) V [1]
е - Стет 0,5420 0,9276 0,4320 При 37,5 % (ат.) V [21
а2 AuCu tP4, РМттт 0,3895 0,3855 - 0,3599 0,3599 При 47 % (ат.) V [1] При 40 % (ат.) V [1]
а3 IrV оСЪ, Сттт 0,578 0,665 0,278 При 50 % (ат.) V [1]
Р Cr3Si сРЪ, РтЗп 0,4788 - - При 75 % (ат.) V [1]
Литература
1. Waterstrat R.M., Manuszewski R.C. //J. Less-Common Met. 1977. V. 52. N 2. P. 293-305.
2. Waterstrat R.M., Dickens B.//J. Less-Common Met. 1973. V. 31. N 1. P. 61-67.
Г. П. Жмурки
Rh-W. РОДИЙ-ВОЛЬФРАМ
На рис. 529 приведена диаграмма состояния Rh-W, которая построена
наосновании данных микроскопического, пирометрического,рентгенос-
пектрального и рентгеновского анализов [Ш]. В системе образуется
только одна промежуточная фаза переменного состава - е. Фаза е
кристаллизуется конгруэнтно из расплава при температуре -2250 °C и
содержании -52 % (ат.) W; область ее гомогенности составляет -19 - 53 %
(ат.) W при температуре 2000 °C и сужается с понижением температуры.
Фаза с участвует в двух нонвариантных равновесиях. Эвтектическое
Rh-W
175
Рис. 529. Rh-W
равновесие Ж « e + (W) протекает при температуре 2240±25 °C и
содержании 67 % (ат.) W. Перитектическая реакция Ж + е « (Rh) имеет
место при температуре 2100±25 °C.
Максимальная растворимость W в (Rh) составляет ~ 19 % (ат.), a Rh
в (W) -6 % (ат.)
Фаза с обладает структурой типа Mg (символ Пирсона hPl, пр. гр.
Pbjltnmc), параметры решетки а - 0,2708 нм, с - 0,4328 нм при 19,2 % (ат.)
W[l],
В интервале гомогенности фазы е при температурах >1200 °C была
установлена упорядоченная фаза WRh3 с решеткой типа Mg3Cd (символ
Пирсона ЛР8, пр. гр. Ptymmc) с восемью атомами в элементарной ячейке
[2, 3].
Литература
1. Greenfield Р., Beck Р.А. // Trans. AIME. 1956. V. 206. Р. 265-276.
2. Giessen В.С. И J. Less-Common Met. 1966. V. 10. N 2. Р. 147-150.
3. Waterstrat R., Manuszewski R. //J. Less-Common Mel. 1973. V. 32. N 1. P. 79-89.
К.Б. Поварова, В.П. Полякова
176
ЛА-Г
Rh-Y. РОДИЙ-ИТТРИЙ
Диаграмма состояния Rh-Y не построена. Сведения о кристалличес-
кой структуре соединений, образующихся в системе Rh-Y, приведены
в табл. 417.
Т аблица417. Кристаллическая структура соединений системы Rh-Y
Соедине- ние Прото- тип Символ Пирсона, пр.гр. Параметры решетки, нм Источник
a . b c
Rh5Y CaCus hP6, 0,5141 — 0,4294 [1,2]
(CaZn5) РЫттт
Rh3Y CeNi3 hP2^ 0,5230 — 1,738 [1,2]
Рб^/ттс
Rh2Y MgCu2 cF24, 0,7459 — — [3]
Fd3m 0,7488 — — [4]
0,7498* — — [1]
0,7465** — — [1]
RhY CsCl cP2, 0,3410 — — [5]
Pm 3m 0,3407 - — [6]
0,3409 — — [1]
Rh2Y3 Rh2Y3 /7140, 1,1232 — 2,516 [7]
l^lmcm
Rh3Y5 Er5Rh3 - - - - [1]
Rh3Y7 Fe3Th7 hP20, 0,9793 — 0,6196 [8]
Pbync 0,9775 — 0,6190 [1,9]
RhY3 Fe3C oP\6, 0,7138 0,9438 0,6319 [8]
Pnma
* При концентрации 66 % (ат.) Rh.
** При концентрации 70 % (ат.) Rh.
Литература
1. Ghassem Н., Raman А. // Z. Metallkunde. 1973. Bd. 63. N 3. S. 197-199.
2. Raman A., Ghassem H. // J. Less-Common Met. 1973. V. 30. N 2. P. 185-197.
3. Compton V.B., Matthias B.T. // Acta Crystallogr. 1959. V. 12. P. 651-654.
4. Dwight A.E.//Trans. ASM. 1961. V. 53. P. 479.
5. Loebich O., Raub E. // J. Less-Common Met. 1976. V. 46. N 1. P. 1-6.
Rh-Y. Rh-Yb
177
6. Dwight A.E., Comer R.A., Downey J.W. // Acta Crystallogr. 1965. V. 18. N 5. P. 835-839.
7. Moreau J.M., Paccard D., Parthe E. // Acta Crystallogr. B. 1976. V. 32. P. 1767-1771.
8. Raman A.//J. Less-Common Met. 1972. V. 26. P. 199-206.
9. Parthe E., Moreau J.M.//J. Less-Common Met. 1977. V. 53. N 1. P. 1-24.
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
Rh-Yb. РОДИЙ-ИТТЕРБИЙ
На рис. 530 приведена диаграмма состояния Rh-Yb, которая
построена в справочнике [М]. В системе Rh-Yb предполагается
образование трех соединений Rh5Yb, Rh2Yb и RhYb, состав, область
существования и характер образования которых требуют уточнения.
Указывается, что Rh5Yb существует при температурах выше 1450 °C. Rh
незначительно снижает температуру плавления Yb [1]. В области
концентраций 55-96 % (ат.) Yb наблюдается область несмешиваемости.
Температура монотектической реакции составляет 1320 °C. Протяжен-
ность монотектической горизонтали требуют уточнения. Во всех
соединениях Yb находится в трехвалентном состоянии.
Кристаллическая структура соединений RhYb и Rh2Yb приведена в
табл. 418. Структура соединения Rh5Yb неизвестна.
Rh Yb, % (am.) Yb
Рис. 530. Rh - Yb
178
Rh-Yb, Rh-Zn
T аблица418. Кристаллическая структура соединений системы Rh-Yb
Соедине- ние Прототип Символ Пирсона, пр.гр. Параметры решетки а, нм Источник
RhYb CsCl сР2, РтЗт 0,3347- -0,3328 [1]
Rh2Yb MgCu2 cF24, Fd3m 0,7432 0,7432- -0,7379 [2] [1]
Литература
1. landelli A., Palenzona А. // Rev. Chimie. Mineraic. 1976. V. 13. N 1. P. 55-61.
2. Moriarty J.L., Humphreys J.E., Gordon R.O. et al. // Acta Crystallogr. 1966. V. 21. N 5.
P. 840-841.
E И. Гладышевский, О.И. Бодак, В.К. Печарский
Rh-Zn. РОДИЙ-ЦИНК
Диаграмма состояния Rh-Zn не построена. Имеются данные об
образовании фазы с кристаллической структурой типа у-латуни. Эта
фаза, весьма вероятно, имеет состав, отвечающий формуле Rh5Zn2| [X].
Растворимость Rh в жидком Zn приведена ниже [Ш]:
Температура, °C .... 700 650 600 550
Содержание Rh:
% (ат.) 1,71 0,81 0,315 0,154
% (по массе) 2,66 1,27 0,495 0,241
Исследовано влияние высокого давления (10—27)* I О2 МПа на скорость
роста фазы со структурой у-латуни в двойной системе Rh-Zn в
результате отжига при температуре 400-450 °C [1]. Сделан вывод, что
в области фазы у (Rh5Zn21), имеющей дефектную решетку, процесс
диффузии осуществляется по структурным вакансиям, концентрация
которых значительно выше равновесной.
Rh-Zn, Rh-Zr
179
Литература
1. Шиняев А.Я., Пивкина О.Г. И Диффузионные процессы в металлах. 1977. N 4.
С. 90-97.
В.П. Полякова
Rh-Zr. РОДИЙ-ЦИРКОНИЙ
Диаграмма состояния Rh-Zr (рис. 531) построена по данным
дифференциального термического, термического анализа во взвешен-
ном состоянии, микроскопического, рентгеновского анализов, измерения
Rh, % (по массе)
0 10 20 30 90 50 60 70 80 90 100
0 10 20 30 90 50 60 70 80 90 100
Zr Rh, % (am.) Rh
Рис. 531. Rh-Zr
180
Rh-Zr
температур перехода в сверхпроводящее состояние и калориметрического
определения теплот образования фаз [1,2]. В отличие от ранее опублико-
ванного варианта диаграммы состояния Rh-Zr [3-8], настоящая
диаграмма характеризуется более сложным строением средней части. В
системе подтверждено существование пяти промежуточных фаз.
Соединения ZrRh и ZrRh3 плавятся конгруэнтно при температурах 1935
и 1920 °C соответственно (по данным работы [7] эти температуры - 1890
и 1880 °C). Соединения Zr3Rh5 и Zr2Rh образуются по перитектическим
реакциям при температурах 1790 и 1175 °C (1150 °C [8] соответственно.
Соединение Zr3Rh4 (Zr42Rh58 [8]) образуется конгруэнтно в твердом
состоянии при температуре 1660 °C. Область гомогенности Zr2Rh
составляет - 1 % (ат.), что полностью согласуется с данными работ [3-8].
Область гомогенности ZrRh простирается от 50 до 61 % (ат.) Rh при
температуре 1790 °C. Соединение ZrRh стехиометрического состава
претерпевает полиморфное превращение при температуре 670 °C;
увеличение содержания Rh в сплаве снижает температуру полиморфного
перехода, которая составляет 430 °C при 51,5 % (ат.) Rh [1]. Область
гомогенности соединения Zr3Rh4 составляет ~2 % (ат.), область
гомогенности соединения Zr3Rh5 составляет -1 % (ат.) при температуре
1000 °C; максимальная область гомогенности соединения ZrRh3
составляет 12 % (ат.) при температурах 1725-1740 °C [1].
В системе установлено три эвтектических равновесия:
Ж - (pZr) + Zr2Rh при 1080 °C и 24 ± 0,5 % (ат.) (1065 °C и
22 % (ат.) Rh [8]);
Ж - Zr3Rh5 + ZrRh3 при 1725 °C и 69 ± 1 % (ат.) Rh (1720 °C [8]);
Ж - ZrRh3 + (Rh) при 1740 °C и 83 ± 1 % (ат.) Rh (1715 °C [8]);
и два эвтектоидных равновесия:
(pZr) - (aZr) + Zr2Rh при 740 °C и 5 ± 0,5 % (ат.) Rh (725 °C и
6 % (ат.) Rh)[8];
ZrRh » Zr3Rh4 + Zr3Rh5 при 1550 °C и 58 % (ат.) Rh (1560 °C [8]).
Кривая солидус (PZr) носит ретроградный характер. Максимальная
растворимость Rh в (PZr) наблюдается при температурах 1200-1400 °C.
При температуре эвтектики растворимость Rh в (PZr) составляет -10%
(ат.). Растворимость Rh в (aZr) равна -1 % (ат.). Растворимость Zr в (Rh)
при температуре эвтектики 1740 °C достигает 12 % (ат.) [1].
Кристаллическая структура соединений приведена в табл. 419.
Rh-Zr
181
Таблица419. Кристаллическая структура соединений системы Rh-Zr
Соедине- ние Прото- тип Символ Пирсона, пр.гр. Параметры решетки, нм Источник
а h с
Zr2Rh А1?Си 1112, 0,64937(5) — 0,56058(6) [9]
14/тст 0,6496(3) — 0,5605(3) [Ю]
0,6493(2) — 0,5604(3) [1]
ZrRh(BT) CsCl сР2, 0,325 — — [Н]
Рт Зт 0,3295* 0,3255(3) — — [6] [2]
ZrRh(HT) FeB ()Р8, Рпта 0,663 0,441 0,538 [2]
Z^FAjg - - 0,316 - 0,328 [7]
Zr3Rh5 Pu3Pd5 оС32, 0,85634(9) 0,69860 0,86218 [12]
Стет 0,8663 0,6986 0,8622 [1]
ZrRh3 AuCu3 сР4, 0,3927 — — [13]
РтЗт 0,3926 0,3922- — — [14] [1]
0,3891***
* При 670 °C.
** Тетрагональная сингония *** При концентрации -72- 77 % (ат.) Rh.
При быстрой закалке из жидкого состояния образуются аморфные
сплавы Rh-Zr в интервале концентраций 20-35 % (ат.) Rh [15]. При
кристаллизации аморфных сплавов состава Zr3Rh могут образовываться
метастабильные фазы с тетрагональной структурой типа Ni3P (символ
Пирсона Z/32, пр. гр. /4) или гранецентрированной кубической типа
Fe3W3C (символ Пирсона cFl 12, пр. гр. Fd3m}, которые при дальнейшем
нагреве превращаются в стабильные фазы (aZr), Zr2Rh [16, 17].
В работе [2] дано термодинамическое описание системы Rh-Zr. В
работе [18] определена стандартная энтальпия образования ZrRh.
Литература
1. Jorda J.L., Graf Т., Schellenberg L. et al. // J. Less-Common Met. 1988 V. 136. N 2.
P. 313-328.
2. Jorda J.L.,GachonJ.G., Charles J., Hertz J. //J. Therm. Anal. 1988. V. 34. N 2. P. 551-557.
182
Rh-Zr, Ru-S
3. Еременко B.H., Семенова Е.Л., Штепа Т.Д. И Металлофизика. 1974. N 52. С. 112-116.
4. Еременко В.Н., Семенова Е.Л., Штепа Т.Д. // Сплавы благородных металлов. Сб.
статей. М.: Наука, 1977. С. 109-111.
5. Еременко В.Н., Семенова Е.Л., Штепа Т.Д. // Изв. АН СССР. Металлы. 1978. N 2. С.
200-202.
6. Еременко В.Н., Семенова Е.Л., Штепа Т.Д., Кудрявцев Ю.В. // Доклады АН УССР.
А. 1978. N 10. С. 945-947.
7. Еременко В.Н., Семенова Е.Л., Штепа Т.Д. И Диаграммы состояния тугоплавких
систем. Сб. статей. Киев: ИПМ АН УССР, 1980. С. 119-132.
8. Еременко В.Н., Семенова Е.Л., Штепа Т.Д. // Термический анализ и фазовые
равновесия. Сб. статей. Пермь: Перм. ун-т, 1983. С. 109-113.
9. ZeglerS.T.// J. Phys. Chem. Solids. 1965. V. 26. N 8. P. 1347-1349.
10. Havinga E.E., Damsma H., Hokkeling P. // J. Less-Common Met. 1972. V. 27. N 2.
P. 169-186.
11. Dwight A.E., Beck P.A. //Trans. AIME. 1969. V. 245. N 2. P. 389-390.
12. Cenzual K., Jorda J.L., Parthe E.//Acta Crystallogr. C. 1938. V. 44. N 1. P. 14-18.
13. Dwight A.E., Beck P.A. // Trans. AIME. 1959. V. 215. N 12. P. 976-979.
14. Raman A., Schubert K. // Z. Metallkunde. 1964. Bd. 55. N 11. S. 704-710.
15. Inoue A., Matsuzaki K., Masumoto T., Chen H.S. // J. Mater. Sci. 1956. V. 21. N 6.
P. 1258-1268.
16. Cantrell J.S., Wagner J.E., Bowman R.C. // J. Appl. Phys. 1985. V. 57. N 2. P. 545-553.
17. Drehman A.J., Johnson W.L. // Phys. Status Solidi (a). 1979. V. 52. N 2. P. 498-507.
18. Topor L., Kleppa O.J.//J. Less-Common Met. 1987. V. 135. N l.P. 67-75.
Л.А. Третьяченко
Ru-S. РУТЕНИЙ-СЕРА
Систематического исследования системы Ru-S не проведено.
Рентгенографическим методом и методом определения упругости паров
обнаружено существование одного стабильного сульфида RuS2 [38,68 %
(по массе)8]. Соединение RuS2 имеет кристаллическую структуру типа
пирита FeS2 (символ Пирсона <?Р12, пр. гр. Р1) с параметром решетки
а - 0,558 нм - 0,5610 нм [X].
При нагреве смеси Ru и RuS2 с S при температуре 950 °C получают
сульфид Ru9S8 [1]. Сульфид трехвалентного Ru неизвестен. Тем не менее,
удалось выделить Ru2S3-2H2O [2], который не переходит в безводное
состояние.
Литература
1. Reid K.I., Sutarno V., Knop О. // Can. J. Chem. 1967. V. 45. P. 1391.
2. Rundgwist S. // Acta Chem. Scand. 1962. V. 16. P. 287.
M.B. Раевская
Ru~Sb, Ru-Sc
183
Ru-Sb. РУТЕНИЙ-СУРЬМА
Диаграмма состояния Ru-Sb не построена. В системе Ru-Sb найдено
два соединения RuSb и RuSb2 [1,2].
Соединение RuSb2 имеет структуру типа марказита (символ Пирсона
оР6, пр. гр. Рппт) с параметрами решетки а - 0,5930 нм, b = 0,6637 нм,
с - 0,3168 нм [1]; а - 0,5942 нм, b = 0,6650 нм, с = 0,3174 нм [2]; а =
= 0,59524 нм, b = 0,667 нм, с ~ 0,31803 нм [3]. Авторы работы [1]
предполагают, что соединение RuSb имеет структуру типа МпР (символ
Пирсона оР8, пр. гр. Рпта). Микротвердость соединения RuSb2 равна
4200 МПа [1].
Литература
1. Кузьмин Р.Н., Журавлев Н.Н., Лосиевская С.А. // Кристаллография. 1960. Т. 5.
С. 218-223.
2. Журавлев Н.Н., Жданов Г.С., Кузьмин Р.Н.//Кристаллография. 1960. Т. 5. С. 553-562.
3. Rundgwist S. // Nature. 1960. V. 185. Р. 31.
М.В. Раевская
Ru-Sc. РУТЕНИЙ-СКАНДИЙ
Диаграмма состояния Ru-Sc (рис. 532) построена в работе [1] по
данным дифференциального термического, микроструктурного и
Рис. 532. Ru-Sc
184
Ru-Sc
рентгеноструктурного анализов, измерения температур солидуса,
измерения микротвердости фаз, твердости и удельного электросопротив-
ления сплавов в зависимости от состава. В качестве исходных компонен-
тов использованы Ru чистотой 99,96 % (по массе) и дистиллированный
Sc чистотой 99,8 % (по массе). Сплавы были приготовлены в дуговой
печи.
В системе установлено существование трех соединений. Соединение
RuSc плавится конгруэнтно непосредственно из расплава при температу-
ре -2200 °C. Соединения Ru9Sc и Ru4Scjj (RuSc3) образуются по
перитектическим реакциям при температурах 1840 и 1510±25 °C
соответственно.
В системе наблюдаются два эвтектических равновесия:
Ж « (Ru) + Ru2Sc при температуре 1790 °C
и содержании 16 % (ат.) Sc;
Ж » Ru4Scm + (aSc) при температуре 1100 °C
и - 88 % (ат.) Sc.
Растворимость Sc в (Ru) не превышает 1,5 % (ат.). Растворимость Ru
в (aSc) составляет менее 1 % (ат.).
Кристаллическая структура соединений системы Ru-Sc по данным
работы [2] приведена в табл. 420.
Т а б л и н а 420. Кристаллическая структура соединений системы Ru-Sc
Соединение Прототип Символ Пирсона, пр.гр. Параметры решетки, нм
a с
Ru2Sc MgZn2 hPW, Ptymmc 0,5119 0,8542
RuSc CsCl cP2, Pm 3 m 0,3203 -
Ru4SC]] Ir4ScH cF120, Fm 3 m - -
Литература
1. Савицкий Е.М., Полякова В.П., Горина Н.Б. И Изв. АН СССР. Металлы. 1970. N 6.
С. 161-163.
2. Chabot В., Ceuzual К., Parthe Е. И Acta Crystallogr. В. 1980. V. 36. N 1. Р. 7-11.
В. П. Полякова
Ru-Se, Ru-Si
185
Ru-Se. РУТЕНИЙ-СЕЛЕН
Диаграмма состояния Ru-Se не построена.
В работе [1] при нагреве соответствующих количеств элементов в
вакууме при температуре 1200 °C в течение четырех дней получен
диселенид RuSe2 и определена его кристаллическая структура. Соедине-
ние RuSe2 имеет кубическую структуру типа пирита (символ Пирсона
сР12, пр. гр. Р1) с параметром решетки а - 0,5935 нм [1].
Литература
1. Raub Ch., Compton V.B., Jebelle T.U. И J. Phys. Chem. Soc. 1965. V. 26. P. 2051.
M.B. Раевская
Ru-Si. РУТЕНИЙ-КРЕМНИЙ
Диаграмма состояния Ru-Si (рис. 533) построена на основании
результатов определения температур плавления оптическим методом и
данных рентгеновского анализа, полученных в работе [1]. При исследова-
нии использовали Ru и Si в виде порошка чистотой 99,9 % (по массе).
В отличие от диаграммы состояния, предложенной авторами работы
[2], в данной работе в системе Ru-Si установлено пять соединений.
Рис. 533. Ru - Si
186
Ru-Si
Соединения Ru2Si3 и RuSi плавятся конгруэнтно при температурах -1710
и -1800 °C соответственно. Соединения Ru4Si3, Ru5Si3 и Ru2Si плавятся
инконгруэнтно при температурах 1695, 1550 и 1545 °C соответственно.
Ru5Si3 существует при температурах от -1550 °C до -1330 °C и
эвтектоидно распадается при -1330 °C. Соединение Ru2Si также
эвтектоидно распадается при температуре -1225 °C. Температурный
интервал его существования составляет 1545-1225 °C. Соединения RuSi
и Ru2Si3 имеют две модификации. Температуры перехода одной
модификации в другую у этих соединений не установлены.
В системе наблюдаются три эвтектических равновесия:
Ж - (Si) + Ru2Si3 при 1370 °C и 17 % (ат.) Ru;
Ж - Ru2Si3 + RuSi при -1690 °C и 44 % (ат.) Ru;
Ж - (Ru) + Ru2Si при 1505 °C и 70 % (ат.) Ru (1490 °C
и 70 % (ат.) Ru [2]).
Растворимость Si в (Ru) составляет -2 % (ат.), a Ru в (Si) - -3 % (ат.)
[2].
Кристаллическая структура соединений системы Ru-Si приведена в
табл. 421 поданным работы [1].
Таблица 421. Кристаллическая структура соединений системы Ru-Si
Соединение Прототип Символ Пирсона, пр.гр. Параметры решетки, нм
а b с
Ru2Si Co2Si оР12, Рпта 0,52835 0,40044 0,74186
Ru5Si3 Rh5Ge3 оР16, Pham 0,52457 0,98190 0,40236
Ru4Si3 Ru4Si3 оР2Ъ, Рпта 0,51872 0,40239 1,71584
RuSi CsCI сР2, 0,29073 - -
Рт Ът
FeSi сР8, Р213 0,47075 - -
Ru2Si3(HT) Ru2Ge3 Phen 1,10678 0,89512 0,55339
Ru2Si3(BT)* Ru?Sn3 tP20, Р4с2 1,1075 — 0,8954
* По данным работы [3].
Rh-Si. Ru-Sm
187
Литература
1. Weitzer F., Rogl P., Schuster J.C. // Z. Metallkunde. 1988. Bd. 79. N 3. S. 154-156.
2. Obrowski W. // Metall. 1965. V. 19. N 7. P. 741-742.
3. Schwomma O., Nowotny H., Wittmann A. // Monatsh. Chem. 1963. V. 94. P. 681-682.
В.П. Полякова
Ru-Sm. РУТЕНИЙ-САМАРИЙ
Диаграмма состояния Ru-Sm не построена. Имеются данные о
существовании в системе следующих соединений: SmRu2, SmRu, Sm3Ru
[1], Sm5Ru2 [1, 2], Sm5Ru3 [3]. Установлено, что соединение Sm3Ru
образуется по перитектической реакции. Характер образования других
фаз не определен. Сведения о кристаллической структуре соединений
системы Ru-Sm приведены в табл. 422. Имеются данные, что Лавес-фаза
SmRu2 с кубической структурой типа MgCu2 претерпевает при
температуре 1230 °C и давлении (65-88)'1О8 Па полиморфное превраще-
ние и переходит в гексагональную структуру типа MgZn2 [2].
Таблица 422. Кристаллическая структура соединений системы Ru-Sm
Соедине- ние Прото- тип Символ Пирсона, пр.гр. Параметры решетки, нм Источник
а b с
Sm3Ru FeC3 оР16, Рпта 0,7330 0,9461 0,6334 [1]
Sm5Ru2' Mn5C2 тС28, С2/с 1,6083 0,6438 0,7314 [1]
SmRu CsCl сР2, Рт Зт - - - [3]
Sm5Ru3 Er5Ru3 - - - - [3]
SmRu2 MgCu2 cF24, Fd3m 0,7580 - - [5]
* 0 = 9( MgZn2 3,89°. hP\2, PG^/mmc 0,5298 — 0,8939 [4]
188
Ru—Sm, Ru-Sn, Ru-Ta
Литература
1. Palenzona A.//J. Less-Common Met. 1979. V. 66. N I. P. 27-33.
2. Wood A., Compton N.//Acta Crystallogr. 1959. V. 12. P. 651-662.
3. Sharifrazi P., Mohanty R.C., Raman A. //Z. Metallkunde. 1984. Bd. 75. N 10. S. 801-805.
4. landelli A., Ferro R. // J. Less-Common Met. 1972. V. 29. N 1. P. 141-146.
5. Dwight A.E.//Trans. AIME. 1959. V. 215. N 2. P. 283-286.
MB Раевская
Ru-Sn. РУТЕНИЙ-ОЛОВО
Диаграмма состояния Ru-Sn не построена. В системе образуются три
соединения, отвечающих составам: Ru2Sn3, RuSn2, Ru3Sn7 [X, Ш, 1].
Предполагается, что соединение RuSn2 образуется по перитектической
реакции; ниже 700 °C оно претерпевает распад с образованием Ru2Sn3
и Ru3Sn7. Соединение Ru2Sn3 образуется по перитектоидной реакции
(Ru) + RuSn2 ** Ru2Sn3 при температуре -1000-1200 °C. Фаза Ru3Sn7
образуется конгруэнтно из расплава, имеет значительную область
гомогенности и находится в равновесии с Sn. В системе следует ожидать
наличия эвтектического равновесия со стороны Ru [Ш]. Ru практически
не растворяется в Sn [X].
Кристаллические структуры фаз в сплавах системы Ru-Sn анализиро-
вали на основе двойной корреляционной модели. Фазы Ru2Sn3, RuSn2,
Ru3Sn7 имеют связи типа In [1]. Структура соединения RuSn2- объемно
центрированная тетрагональная типа СиА12 (символ Пирсона til 2, пр. гр.
IMmcm) с параметрами решетки а - 0,6389 нм, с - 0,5693 нм [Ш].
Соединение Ru2Sn3 имеет тетрагональную структуру собственного типа
(символ Пирсона /Р20, пр. гр. Р4г2) с параметрами решетки а -
- 0,6172 нм, с = 0,9915 нм [Ш]. Соединение Ru3Sn7 обладает кубической
структурой с 40 атомами на элементарную ячейку; параметр решетки:
а = 0,935...0,9364 нм [Ш].
Литература
1. Heinrich S., Schubert К. // J. Less-Common Met. 1977. V. 52. N 1. P. 87-91.
M. В. Раевская
Ru-Ta. РУТЕНИЙ-ТАНТАЛ
Ориентировочная диаграмма состояния Ru-Ta построена по
результатам термического, рентгеновского, микроструктурного и
микрорентгеноспектрального анализов в справочнике [Э]. Предпола-
Ru-Ta
189
Рис. 534. Ru-Ta
гается существование в системе двух промежуточных фаз у и ц. Фаза ц
образуется по перитектической реакции при температуре -2080 °C и
содержании 45 % (ат.) Та. Фаза у образуется по перитектоидной реакции
при температуре 1667 °C и содержании 38 % (ат.) Та. Однако, данные
поздних работ [1 ~4] позволяют сделать вывод о более сложном характере
диаграммы состояния при температурах ниже солидуса. На рис. 534
приведена обобщенная диаграмма состояния Ru-Ta, построенная в
работе [5], с учетом имеющихся экспериментальных данных, и предпола-
гая, что изученные в работе [3] фазы RuTa и RuTa' находятся в
равновесии с фазой у. Фаза у имеет область гомогенности в пределах 3
% (ат.) Ru. RuTa имеет широкую область гомогенности (от 38 % (ат.) Та
до ?). RuTa претерпевает два превращения в твердом состоянии, которые
можно отнести к мартенситному типу. Максимальная растворимость Та
в (Ru) составляет -24 % (ат.) [Ш].
Сведения о кристаллической структуре соединений системы Ru-Ta
приведены в табл. 423.
190
Ru-Та
Таблица 423. Кристаллическая структура соединений системы Ru-Ta
Соедине- ние Прото- тип Символ Пирсона, пр.гр. Параметры решетки, нм Примечание
a b c
RuTa CsCl cP2, Pm 3 m 0,3201 - - При 70 % (ат.)Та [1]
0,3187 - - При 50 % (ат.) Та, t = 1160 °C [4]
RuTa' AuCu rP2, Pihnmm 0,3020 - 0,3395 При 50 % (ат.) Та [1]
0,3100 - 0,3340 При 50 % (ат.) Та, { = 900 °C [4]
0,3032 - 0,3385 При 45 % (ат.) Та [2]
RuTa" - oC4t Cntmm 0,4351 0,4199 0,3388 При 50 % (ат.) Та [1]
0,4368 0,4241 0,3387 (21
0,4371 0,4247 0,3391 [4]
По предварительным данным работы [1] структура фазы у гранецен-
трированная тетрагональная (пр. гр. P^hnmni) с параметрами решетки
а = 0,4271 нм, с - 0,3395 нм. Эти данные получены при исследовании
двухфазного сплава Ru - 45 % Та. Однако в соответствии с данными
работы [3], авторы которой установили, что фазы RuTa и RuTa' должны
находиться в равновесии с гексагональной фазой и согласно принятой
версии диаграммы состояния (см. рис. 534) структура фазы у - возможно
гексагональная.
Литература
1. Raub Е., Beeskow Н., Fritzsche VV.Z. // Z. Metallkunde. 1963. Bd. 54. N 8. S. 451-454.
2. SchmerlingM.A., Das B.K., Lieberman D.S.//Metall. Trans. 1970. V. l.N 12. P. 3273-3278.
3. Chen B.H., Franzen H.F. // J. Less-Common Met. 1990. V. 157. P. 37-45.
4. Rietveld H.M.//J. Appl. Crystallogr 1969. V. 2. P. 65-71.
5. Okamoto H. //J. Phase Equilibria. 1991. V. 12. N 3. P. 395-397.
В. П. Полякова
Ru-Tb, Ru-Тс
191
Ru-Tb. РУТЕНИЙ-ТЕРБИЙ
Диаграмма состояния Ru-Tb не построена. В системе установлено
существование трех соединений Tb3Ru, Tb5Ru2, TbRu2, кристаллическая
структура которых приведена в табл. 424.
Таблица 424. Кристаллическая структура соединений системы Ru-Tb
Соедине- ние Прото- тип Символ Пирсона, пр.гр. Параметры решетки, нм Источник
a b c
Tb3Ru Fe3C г?П6, Pnma 0,7294 0,9248 0,6280 [И
Tb5Ru2’ Mn5C2 mC28, C2/c 1,5745 0,6318 0,7279 [1]
TbRu2 MgZn2 hP\2, PGylmmc 0,5265 - 0,8853 [2]
* P = 97,21“
Литература
1. Palenzona А. И J. Less-Common Met. 1979. V. 66. N 2. Р. 27-33.
2 Dwight А.Е., Downey J.W., Conner R.A.//Trans. AIME. 1966. V. 236. N 10. P. 1509-1510.
M.B. Раевская
Ru-Тс. РУТЕНИЙ-ТЕХНЕЦИЙ
Система Ru-Тс характеризуется образованием непрерывного ряда
твердых растворов с гексагональной плотно упакованной структурой
[1]. Рентгеновский анализ четырех сплавов, закаленных от температуры
700 °C, показал полную взаимную растворимость компонентов в твердом
состоянии.
Литература
1. Darby J.B. // J. Less-Common Met. 1962. V. 4. N 6. P. 558-563.
M B Раевская
192
Ru-Те, Ru—Th
Ru-Те. РУТЕНИЙ-ТЕЛЛУР
Диаграмма состояния Ru-Te не построена. При спекании элементов
в соответствующей пропорции [71,51% (по массе) Те и 28,5 % (по массе)
Ru] в вакууме при температуре 850 °C получено соединение RuTe2 [Э].
По данным работы [1] температура плавления соединения RuTe2 выше
600 °C. Соединение имеет кубическую структуру пирита (FeS2) (символ
Пирсона сР\2, пр. гр. Р1) с параметром решетки а - 0,6377 нм [X].
Литература
1. Raub Ch.G., Compton V.B., Jebelle T.U. И J. Phys. Chem. Solids. 1965. V. 26. P. 2051.
M.B. Раевская
Ru-Th. РУТЕНИЙ-ТОРИЙ
Диаграмма состояния Ru-Th построена в работе [1] во всем интервале
концентраций при температурах 1000-1500 °C по данным дифференци-
ального термического, металлографического, рентгенофазового анализов
Ей Те, fam) Th
Рис. 535. Ru - Th
Ru-Th
193
сплавов, полученных из высокочистых металлов дуговой плавкой
(рис. 535).
В системе установлены четыре соединения: Ru3Th7, Ru2Th3, RuTh и
Ru2Th, которые плавятся конгруэнтно при температурах 1412± 12 °C,
1425±12 °C, 1462±12 °C, выше 1500 °C, соответственно. В системе
протекают пять нонвариантных эвтектических реакций, сведения о
которых приведены в табл. 425.
Таблица 425. Нонвариантные реакции в системе Ru-Th |lj
Реакция Содержание Th в жидкой фазе, % (ат.) Температура, °C
Ж « (Ru) + Ru2Th -27 - 1550± 12
Ж - Ru2Th + RuTh 43 1438± 12
Ж - RuTh + Ru2Th3 59 1388± 12
Ж - Ru2Th3 + Ru3Th7 63 1388+12
Ж ° Ru3Th7 + (aTh) 84 1262+12
Растворимость Ru в (Th) незначительная и составляет менее 1 % (ат.).
Сведения о кристаллической структуре соединений приведены в
табл. 426.
Таблица 426. Кристаллическая структура соединений системы Ru-Th
Соедине- ние Прото- тип Символ Пирсона, пр.гр. Параметры решетки, нм Источник
а b с
Ru2Th Cu2Mg cF24, 0,7657 — — [1]
Fdim 0,7654(4) — — [2]
RuTh СгВ оСЪ, 0,3878(2) 1,129(1) 0,4071(2) [1]
Стет 0,3903 1,127 0,4046 [2]
0,3879 1,126 0,4069 [2]
Ru3Th7 Th7Fe3 hP20, 0,9969(3) — 0,6302(2) [1]
Рбупс 0,9971 — 0,6288 [2]
194
Ru-Th, Ru-Ti
В работе [3] исследовано удельное сопротивление Ru2Th в интервале
температур от-268,8 до 3 °C. Показано, что величина сопротивления
р, линейно зависит от температуры.
Литература
1. Thomson J.B. //J. Less-Common Met. J 963. V. 5. N 6. P. 434-442.
2. Kleykamp H., Murabayashi M. П J. Less-Common Met. 1974. V. 35. N 2. P. 227-233.
3. Lawson A.C. H Physics Letters. A. 1985. V. 107. N 1. P. 45-47.
M.B. Раевская, В. П. Полякова
Ru-Ti. РУТЕНИЙ-ТИТАН
Диаграмма состояния Ru-Ti исследована методами дифференциально-
го термического, микроструктурного и рентгеновского анализов,
измерения температур солидуса с помощью оптической пирометрии [X,
Э, III, 1-4]. Диаграмма состояния Ru-Ti (рис. 536) построена на
основании анализа ранее проведенных экспериментальных работ [1-3]
Ti Ru,”/<>(по массе) Ru
Рис. 536. Ru - Ti
Ru-Ti, Ru-Tm
195
и результатов микроструктурного и рентгеноструктурного анализов,
полученных в работе [4]. Система Ru-Ti характеризуется образованием
широких областей твердых растворов на основе £Ti и Ru. Установлено
образование соединения TiRu, которое плавится конгруэнтно при
температуре 2150 °C [1] (2125 °C [2]), имеет область гомогенности -5 %
(ат.).
Твердый раствор на основе pTi образуется по перитектической
реакции при температуре 1570 °C [4] (1575 °C [2]). Перитектическая
горизонталь имеет протяженность от 20 до 65 % (по массе) Ru [4]. Кривые
ликвидус и солидус (pTi) проходят через минимум при температуре
1510 °C и содержании 15 % (по массе) Ru [4].
Эвтектическое взаимодействие Ж « (Ru) + TiRu протекает при
температуре 1860 °C и содержании 75 % (ат.) Ru [2] (1825 °C и -73 % (ат.)
Ru [1]. Ru понижает температуру а « 0 перехода в Ti. Максимальная
растворимость Ru в (0Ti) составляет -35 % (по массе) [4] (24 % (ат.) Ru
[ID-
Соединение TiRu имеет структуру типа CsCl (символ Пирсона сР2,
пр. гр. РтЗт, а = 0,3076 нм при содержании 45 % (ат.) Ru или а =
= 0,3067 нм при 50 % (ат.) Ru [2].
В работе [3] установлены условия образования метастабильных фаз
а', а", со, характерных для сплавов на основеTi. Показано, что критичес-
кий состав при образовании фазы о находится в пределах 3,8-8 % (ат.)
Ru. Определены параметры решетки фазы со: а = 0,4599 нм; с = 0,2898 нм.
Литература
1. Raub Е., Roschel Е. // Z. Metallkunde. 1963. Bd. 54. N 8. S. 455-459.
2. Штепа Т.Д. // Физическая химия конденсированных фаз, сверхтвердых материалов
и их границ раздела. Сб. статей. Киев: Наукова думка, 1975. С. 175-191.
3. Гусева Л.Н., Борискина Н.Г., Долинская Л.К.//Изв. АН СССР. Металлы. 1973. N 3.
С.215-217.
4. Борискина Н.Г., Корнилов И.И. // Изв. АН СССР. Металлы. 1976. N 2. С. 214-217.
В. П. Полякова
Ru-Tm. РУТЕНИЙ-ТУЛИЙ
Диаграмма состояния Ru-Tm не построена. Имеются данные о
существовании в системе соединений RuTm3, Ru2Tm5, RuTm, Ru2Tm,
кристаллическая структура которых приведена в табл. 427.
196
Ru-Тт, Ru-U
Таблица 427. Кристаллическая структура соединений системы Ru-Tm
Соедине- ние Прото- тип Символ Пирсона, пр.гр. Параметры решетки, нм Источник
а b с
RuTm3 Fe3C oPI6, Рпта 0,7260 0,8986 0,6173 [1]
Ru2Tm5 Mn5C2 тС28, С2/с 1,5362 0,6152 0,7223 [1]
RuTm CsCl сР2, Рт Зт 0,3373 - - [Ш]
Ru2Tm MgZn2 Рбу/ттс 0,5320 - 0,8790 [2]
Литература
1. Palenzona А. // J. Less-Common Met. 1979. V. 66. N 2. Р. 27-33.
2. Dwight А.Е., Downey J.W., Conner R.A. //Trans. AIME. 1966. V. 236. N 10. P. 1509-1510.
M. В. Раевская
Ru-U. РУТЕНИЙ-УРАН
На рис. 537 приведена диаграмма состояния Ru-U, построенная
авторами работы [1] по данным дифференциального термического,
микроструктурного и рентгеновского анализов, полученным в работе
[2].
В системе Ru-U установлено образование пяти соединений: U9Ru,
URu, U3Ru4, U3Ru5, URu3. Существование соединения U2Ru3 [3]
подтверждено не было. Соединения U?Ru, U3Ru4, U3Ru5 и URu3
образуются по перитектическим реакциям при температурах 937 (897 [4]),
1163, 1182 и 1850 °C соответственно. Соединение URu плавится
конгруэнтно при температуре 1158 °C и существует в двух модификациях:
aURu и pURu. Температура полиморфного превращения составляет
795 °C.
В системе существуют два эвтектических равновесия: Ж « (yU) + U2Ru
при температуре 886 °C и содержании 18,5 % (ат.) U и Ж » URu + U3Ru4
Ru-U
197
I/ Ruf°/ofarn.) Ru
Рис. 537. Ru-U
при температуре 1148 °C, а также два эвтектоидных равновесия,
связанные с полиморфизмом U: (yU) « (PU) + U2Ru при температуре
681 °C и (pU) « (aU) + U2Ru при температуре 625 °C. Температура
эвтектоидной реакции (PU) ° (aU) + U2Ru по данным работы [5]
составляет 633 °C.
Максимальная растворимость Ru в (yU) составляет -4,5 % (ат.), в
(PU) - -2,0 % (ат.), в (aU) - 1,1 % (ат.). В работе [5] растворимость Ru в
(aU) определена равной -0,4 % (ат.), в (PU) -2 % (ат.). Растворимость U
в (Ru) составляет -1,3 % (ат.).
Кристаллическая структура aURu, pURu, U3Ru4, U3Ru5 не определе-
на. Кристаллические структуры остальных соединений приведены в
табл. 428 по данным работы [1].
198
Ru-U. Ru-V
Таблица 428. Кристаллическая структура соединений системы Ru-U
Соединение Прототип Символ Пирсона, пр.гр. Параметры решетки, нм
а Ь с
URu3 U2Ru* *0 = 96,16°. AuCu3 U2Ru <?Р4, Рт Зт РИт или Р2х!т 0,3988 1,31106 0,3343 0,5252
Литература
1. Chiotti Р., Akhachinskii V.V., Ansara I., Kand M.H. П Bull. Alloy Phase Diagrams. 1982.
V. 2.N4. P. 490-491.
2. Park J.J. // J. Res. Natl. Bur. Standards. A. 1968. V. 72. N l.P. 1-10.
3. Berndt A.F., Dwight A.E. //Trans. AIME. 1968. V. 242. P. 340-341.
4. Berndt A.F., Dwight A.E. П Trans. AIME. 1965. V. 233. P. 2078-2079.
5. Abou-Lahra A.A., Hammad F.H.//J. Less-Common Met. 1976. V. 48. N l.P. 177-181.
M.B. Раевская, Е.М. Соколовская
Ru-V. РУТЕНИЙ-ВАНАДИЙ
Система Ru-V исследована методами термического, микроструктур-
ного, рентгеноструктурного и микрорентгеноспектрального анализов
[1-3]. На рис. 538 приведена диаграмма состояния Ru-V по данным
работы [1]. В системе существует одно соединение RuV, которое
образуется непосредственно из расплава при температуре 1950±25 °C.
Соединение RuV участвует в двух эвтектических равновесиях: Ж «(Ru) +
+ RuV при температуре 1710 °C и содержании -41 % (ат.) V; Ж « RuV +
+ (V) при температуре 1850 °C и содержании 62,5 % (ат.) V в жидкой фазе.
Максимальная растворимость V в (Ru) составляет -33 % (ат.); при
температуре 1000 °C она составляет 13 % (ат.) V. Растворимость Ru в (V)
равна -28 % (ат.) и мало зависит от температуры.
Соединение RuV имеет тетрагонально искаженную структуру типа
CsCl с параметрами решетки а = 0,296 нм, с - 0,306 нм [1]. Область
гомогенности RuV находится в пределах 48-60 % (ат.) V.
Имеется другой вариант диаграммы состояния Ru-V. По данным
работы [2] диаграмма состояния Ru-V представляет собой систему
Ru-V
199
Рис. 538. Ru-V
эвтектического типа без образования промежуточных фаз. Эвтектика
Ж •* (Ru) + (V) кристаллизуется при температуре 1790 °C и содержании
-40 % (ат.) V. Максимальная растворимость V в (Ru) составляет 31 % (ат.)
и с понижением температуры снижается до <20 % (ат.) V. Максимальная
растворимость Ru в (V) равна -45 % (ат.). При низких температурах
рентгеноструктурным анализом в работе [2] установлено существование
фаз со структурами типа CsCl и тетрагонально искаженной CsCl. Эти
фазы обнаружены также в работах [3-5].
Поданным работы [3] в интервале температур 1600-1200 °C в системе
существуют две промежуточные фазы: со структурой типа CsCl (символ
Пирсона сР2, пр. гр. Pin Зт, а = 0,3000-0,2998 нм) в области концентра-
ций 54-75 % (ат.) V и со структурой тетрагонально искаженной CsCl (пр.
гр. РЫттпт, а - 0,2945 нм, с - 0,3219 нм) в области концентраций
33,3-50 % (ат.) V.
Физические свойства сплавов системы Ru-V (температура перехода
в сверхпроводящее состояние, магнитная восприимчивость), полученные
в работах [4, 6, 7], резко изменяются вблизи эквиатомного состава.
Аномальный ход кривых зависимости физических свойств от состава
обусловлен превращением кубической структуры в тетрагональную. Так,
температура перехода в сверхпроводящее состояние составля-
ет -271,27 °C (при 50 % (ат.) V) и -269 °C (при 55 % (ат.) V) [6].
200
Ru-У, Ru-W
Возможно, в системе Ru-V протекает мартенситное превращение,
аналогичное превращению, известному в системе Ru-Ta [8].
Литература
1. Рошан Н.Р., Полякова В.П., Савицкий Е.М. //Диаграммы состояния металлических
систем. Сб. статей. М.: Наука, 1971. С. 190-195.
2. WaterstratR.M., Manuszewsky R.C.//J. Less-Common Met. 1976. V. 48. N 1. P. 151-158.
3. Raub E., Fritzsche W.//Z. Metallkunde. 1963. Bd. 54, N 1. S. 21-23.
4. Chu C.W., Bucher E., Cooper A.S. et. al. // Phys. Rev. B. 1971. V. 4. N 1. P. 320-326.
5. Marezio M., Dernier P.D., Chu C.W. // Phys. Rev. B. 1971. V. 4. N 8. P. 2825-2826.
6. Oota A., Tsuchiya M., Noguchi S. // J. Phys. F, Met. Phys. 1984. V. 14. P. 899-904.
7. Bernasson M., Descouts P., Donze P. // J. Phys. Chem. Solids. 1969. V. 30. P. 2453-2457.
8. SchmerlingM.A.,DasB.K., LiebermanD.S.//Metall. Trans. 1970. V. l.N 12. P. 3273-3278.
MB. Раевская, Е.М. Соколовская
Ru-W. РУТЕНИЙ-ВОЛЬФРАМ
Данные по взаимодействию Ru с W приведены в работах [X, Э, Ш].
На рис. 539 показана диаграмма состояния Ru-W, построенная по
данным работы [Э]. В системе существует одна промежуточная фаза
Ru2W3 (о фаза). Фаза о образуется по перитектической реакции при
температуре 2300 °C и содержании 60 % (ат.) W, а при температуре
1667 °C распадается по эвтектоидной реакции на (Ru) и (W). Между
Ru н,%/ат.) w
Рис. 539. Ru-W
Ru-W, Ru-Y
201
фазой о и (Ru) образуется эвтектика при температуре 2205 °C и
содержании -55 % (ат.) W.
Растворимость W в (Ru) составляет -48 % (ат.) при температуре
2205 °C и снижается до -42 % (ат.) при температуре 1667 °C. Раствори-
мость Ru в (W) равна -23 % (ат.) при температуре 2300 °C и -13 % (ат.)
Ru при температуре 1667 °C.
Ru2W3 (фаза о) имеет тетрагональную структуру с параметрами
решетки а - 0,9349-0,955 нм, с = 0,4855-0,496 нм [1]. Область гомогеннос-
ти фазы о при температуре 1700 °C составляет -59-63 % (ат.) W, а при
2117 °C--59-67 % (ат.) W.
Литература
1. Obrowski W. //Naturwissenschaften. 1957. Bd. 44. N 22. S. 581.
К.Б. Поварова
Ru-Y. РУТЕНИЙ-ИТТРИЙ
На рис. 540 приведена предполагаемая диаграмма состояния Ru-Y,
построенная по имеющимся
взаимодействий Rue други-
ми РЗМ.
В системе Ru-Y установ-
лено существование соеди-
нений: YRu2, Y3Ru2, Y 5Ru3,
Y5Ru2 (Y73Ru27), Y3Ru
[1-4]. По данным работы [1]
соединение YRu2 образует-
ся непосредственно из рас-
плава при температуре
1910 °C, а соединение Y3Ru
- по перитектической
реакции при температуре
1200 °C. Эвтектические рав-
новесия Ж « (Ru) + YRu2 и
Ж * (aY) + Y3Ru протекают
при температурах 1840 и
1080 °C соответственно.
Температуры и характер
образования других соеди-
нений не определены.
Сведения о кристалли-
ческой структуре соедине-
ний приведены в табл. 429.
экспериментальным данным с учетом
Яи Y, °/о (am.) Y
Рис. 540. Ru-Y
202
Ru-Y, Ru-Yb
Таблица 429. Кристаллическая структура соединений системы Ru-Y
Соедине- ние Прото- тип Символ Пирсона, пр.гр. Параметры решетки, нм Источник
a b c
YRu2 MgZn2 API 2, Pfhjmmc 0,5256 - 0,8792 [1]
Y3Ru2 Er3Ru2 - 0,9854 - - [4]
Y5Ru3 ErsRu4 — — — —
или [4]
Er5Rh3 — — — —
Y5Ruj (Y73Ru22) Mn5C2 mC28, Cllc 1,5769 0,6341 0,7320 [5]
Y3Ru Fe3C oP\f>, 0,7313 0,9192 0,6323 [6]
Pnma 0,7342 0,9214 0,6333 [4]
* P = 97 ,20°.
Литература
1. Савицкий Е.М., Полякова В.П., Рошан Н.Р. И Изв. АН СССР. Металлы. 1972. N 5.
С. 129-132.
2. Palenzona А. // J. Less-Common Met. 1979. V. 66. N 1. Р. 27-33.
3. Loebich О., Raub Е.//J. Less-Common Met. 1976. V. 46. N 1. P. 7-15.
4. Sharifrazi P., Mohanty R.C., Raman A. // Z. Metallkunde. 1984. Bd. 75. N 10. S. 801-805.
5. Cenzual K., Palenzona A., Parthe E. //Acta Crystallogr. 1980. V. 36. N 7. P. 1631-1634.
6. Zeballos R.S., Chabot B., Parthe E.//J. Less-Common Met. 1980. V. 72. N 1. P. 17-20.
В.П. Полякова
Ru-Yb. РУТЕНИЙ-ИТТЕРБИЙ
Диаграмма состояния Ru-Yb не построена. Сообщается об образова-
нии соединений Ru2Yb и RuYb, кристаллическая структура которых
приведена в табл. 430 по данным работы [1].
Ru-Yb, Ru-Zn, Ru-Zr
203
Таблица 430. Кристаллическая структура соединений системы Ru-Yb
Соединение Прототип Символ Пирсона, пр.гр. Параметры решетки, нм
а с
Ru2Yb MgZn2 ЛР12, Рб^/ттс 0,5220 0,5223 0,8750 0,8737
RuYb CsCl сР2, Рт Зт 0,3360 -
Литература
1. Гладышевский Е.И., Бодак О.И. И Кристаллохимия интерметаллических соединений
редкоземельных металлов. Львов: Вища школа, 1982. 255 с.
Л.Л. Рохлин
Ru-Zn. РУТЕНИЙ-ЦИНК
Система Ru-Zn практически не изучена. Методом химического
анализа расплавов после приведения системы в равновесие и фильтрации
определена растворимость Ru в жидком Zn в интервале температур
450-725 °C. Растворимость изменяется от 0,937 % (ат.) Ru при температу-
ре 725 °C до 0,04 % (ат.) Ru при температуре 450 °C [Ш].
М.В. Раевская
Ru-Zr. РУТЕНИЙ-ЦИРКОНИЙ
Диаграмма состояния Ru-Zr (рис. 541) построена в работе [1] по
данным микроскопического, рентгеновского, термического, локального
рентгеноспектрального анализов с определением температур начала
плавления по методу Пирани-Альтерума.
В системе установлено образование двух соединений: ZrRu (б) и ZrRu2
(Zj). Области гомогенности ZrRu и ZrRu2 не превышают 3-4 % (ат.) [1].
ZrRu образуется непосредственно из расплава при температуре 2130 °C,
ZrRu2- по перитектической реакции при температуре 1825 °C (1910 °C
[2]) и эвтектоидно распадается при температуре 1285 °C (1300±20 °C [2]).
В системе наблюдаются две эвтектические реакции:
Ж - (Ru) + ZrRu2 при 1715 °C и 22 % (ат.) Zr;
204
Ru-Zr
Рис. 541. Ru - Zr
Ж « (PZr) + ZrRu при 1240 °C и 79 % (ат.) Zr.
Растворимость Ru в (pZr) при эвтектической температуре составляет
11 % (ат.) [1], растворимость Zr в (Ru) - 1,9 % (ат.) при температуре
1715 °C [1] (2,15 % (ат.) при -1520 °C [3]). Ru понижает температуру р-а
перехода в сплавах на основе Zr [1, 2] (см. вставку на рис. 541). При
закалке сплавов от 1000 и 800 °C фаза pZr полностью сохраняется при
содержании Ru 6 % (ат.) и более. При меньшем содержании Ru
образуются также метастабильные фазы а' и со. Наибольшее количество
фазы w образуется в сплаве с 2 % (ат.) Ru [4].
Кристаллическая структура ZrRu - кубическая, типа CsCl (символ
Пирсона сР2, пр. гр. Рт Зт), с параметром решетки а - 0,3253 нм [5, 6].
ZrRu2 относится к фазам Лавеса с гексагональной структурой типа
MgZn2 (символ Пирсона API 2, пр. гр. Рб^/ттс), параметры решетки
определены в пределах а = 0,5141-0,5146 нм, с = 0,8504-0,8511 нм [7].
Ru-Zr, S-Sb
205
Метастабильная фаза w в сплаве с 2 % (ат.) Ru имеет гексагональную
структуру, параметры решетки а - 0,4986 нм, с = 0,3133 нм [4].
Литература
1. Еременко В.Н., Хоружая В.Г., Штепа Т.Д. // Изв. АН СССР. Металлы. 1988. N 1.
С. 197-202.
2. Raub Е., Roschel Е. // Z. Metallkunde. 1963. Bd. 54. N 8. S. 455-462.
3. Brewer L., Wengert P. H Meta!!. Trans. 1973. V. 4. N l.P. 83-104.
4. Еременко B.H., Семенова ЕЛ., Штепа Т.Д. // Изв. АН СССР. Металлы. 1980. N 1. С.
212-214.
5. Dwight А.Е.//Trans. AIME. 1959. V. 215. Р. 283-286.
6. WangF.E.//J. Appl. Phys. 1967. V. 38. N 2. P. 822-824.
7. Matthias B.T., Compton V.B., Corenzwit E. // J. Phys. Chem. Solids. 1961. V. 19. N 1/2.
P. 130-133.
Л.А. Третъяченко
S-Sb. СЕРА-СУРЬМА
Диаграмма состояния S-Sb характеризуется образованием одного
соединения Sb2S3 и двух областей несмешиваемости в жидком состоянии.
Представленная на рис. 542 диаграмма состояния построена согласно
Рис. 542. S-Sb
206
S-Sb. S-Sc
справочнику [X] с внесением некоторых дополнений и уточнений в
соответствии с более поздними работами [Ш, 1-3].
Температура монотектического превращения со стороны Sb
составляет 600 °C. Область расслоения при монотектической температуре
находится в пределах 5,5-53,8 % (ат.) S [Ш, 2,3]. Температура монотекти-
ческого превращения со стороны S составляет -530 °C [X].
Соединение Sb2S3 образуется конгруэнтно при температуре 550 °C
[1]. В работах [X] и [III] она определена равной 546 и 559 °C соответствен-
но. Температура эвтектического превращения со стороны Sb составляет
500 °C [1,2]. Содержание S в эвтектике определено равным 54,7 % (ат.)
[Ш, 2, 3]. По данным [X] и [Ш] температура эвтектики составляет 520 и
524 °C соответственно, а содержание S —57 % (ат.) и 45,1 % (ат.)
соответственно.
Кристаллическая структура Sb2S3 - ромбическая (пр. гр. Рпта) с
параметрами решетки а = 1,122 нм, b - 1,130 нм, с - 0,384 нм [X].
Литература
I. Ивлиева В.И., Абрикосов Н.Х.// Доклады АН СССР. 1964. Т. 159. N 6. С. 1326-1329.
2. Уразов Г.Г., Большаков К.А., Федоров П.Р., Василевская И.И. И Журнал
неорганической химии. 1960. Т. 5. N 2. С. 449-455.
3. Yanase Т., Derge G. И J. Electrochem. Soc. 1956. V. 103. N 5. Р. 303-306.
Л.Л. Рохлин
S-Sc. СЕРА-СКАНДИЙ
Диаграмма состояния S-Sc не построена.
В системе S-Sc образуются соединения Sc2S3, ScS Р, Ш, 1,2]. Имеются
предварительные данные о существовании соединения с ромбоэдричес-
кой структурой, имеющего состав между ScS и Sc2S3. Кристаллическая
структура соединений приведена в табл. 431.
Т а б л и и а 431. Кристаллическая структура соединений системы S-Sc
Соедине- ние Прото- тип Символ Пирсона, пр.гр. Параметры решетки, нм Источник
а b с
Sc2S3 - - 1,041 0,739 2,205 [1]
ScS NaCl cF8, Fm Ъпг 0,519 - - [Ш]
* Ромбическая сингония; структура упорядочена, субъячейка типа NaCl (а = 0,521 нм)
[1J-
S-Sc, S-Se
207
Литература
1. White J.G., Dismukes J.//Acta Crystallogr. 1963. V. 16. N 13. Supplement, P. A24.
2. Меньков A.A., Комиссарова Л.Н., Симанов Ю.П., Спицын В.И.//Доклады АН СССР.
1961. Т. 141. N 2. С. 364-367.
Л.Л. Рохлин
S-Se. СЕРА-СЕЛЕН
На рис. 543 приведена ориентировочная диаграмма состояния S-Se,
построенная в работе [X] по результатам термического и дилатометричес-
кого анализов. В системе образуется фаза у в результате перитектической
реакции при температуре 160 °C и содержании S, равном 17 % (ат.).
Рис. 543. S -Se
В работах [1, 2] было изучено равновесие жидкость - газ для малых
и больших давлений в интервале концентраций 0,32-89 % (ат.) Se.
Результаты этих исследований подтверждают образование промежуточ-
ной фазы в системе S-Se.
Литература
I. Девятых Г.Г., Односевцев А.И., Умилин В.А. И Журнал неорганической химии. 1962.
Т. 7. N 8. С. 1928-1932.
2. Девятых Г.Г., Умилин В.А., Руновская И.В. // Журнал неорганической химии. 1963.
Т. 8. N 1. С. 149-154.
В.П. Полякова
208
S-Si, S-Sm
S-Si. СЕРА-КРЕМНИЙ
Диаграмма состояния S-Si не построена. В системе образуется
сульфид SiS2, который имеет температуру плавления -1090 °C. Имеются
также сведения об образовании сульфида SiS, однако относительно его
существования высказывается сомнение [X].
Растворимость S в (Si) имеет ретроградный характер и составляет по
данным справочника [Э]:
Температура, °C..........1400 1300 1200 1100
Растворимость S, % (ат.).4х10~5 6x10“5 ЗхЮ-5 6х10“5
Кристаллическая структура 5152ромбическая с параметрами решетки
а = 0,957 нм, b - 0,561 нм, с = 0,554 нм [X].
Л.Л. Рохлин
S-Sm. СЕРА-САМАРИЙ
Обзор исследований по сульфидам Sm дан в справочнике [Э]. SmS
плавится при 1500 или 1940 °C,Sm3S4-npH 1800 °C,Sm2S3-npn 1780
или 1900 °C; это соединение существует в двух модификациях: aSm2S3
и ySm2S3. SmS2 имеет область гомогенности, простирающуюся до состава
SmS] 94. Температура плавления SmS2 равна 1730 °C.
Сведения о кристаллической структуре соединений приведены в табл.
432 по данным справочника [Э].
Структура соединения aSm2S3 не установлена.
Таблица 432. Кристаллическая структура соединений системы S-Sm
Соединение Прототип Символ Пирсона, пр.гр. Параметр решетки а, нм
SmS NaCl cF8, Fm 3 m 0,5970- 0,5863
Sm3S4 P4Th3 cI28, 143d 0,8556
ySm2S3 P4Th3 cI2S, 143d 0,8448
SmS2 LaS2 oP24, Pnma 0,796- 0,787
S-Sm, S-Sn
209
При растворении Sm в SmS2 происходит тетрагональное искажение
кристаллической решетки до а = 0,788 нм, с - 0,797 нм [Э].
Л.Л. Рохлин
S-Sn. СЕРА-ОЛОВО
Представленная на рис. 544 диаграмма состояния S-Sn приведена по
данным работы [1], в которой обобщены результаты предыдущих
исследований и использованы собственные экспериментальные данные.
Система характеризуется наличием четырех соединений: SnS, Sn3S4,
Sn2S3 и SnS2 и двух областей несмешиваемости в жидком состоянии.
Соединения SnS и SnS2 плавятся конгруэнтно при температурах 875 и
-865 °C соответственно. Соединения Sn3S4 и SnS2 образуются по
перитектическим реакциям при температурах 710 и 745 °C соответствен-
но. Температуры плавления соединений SnS (881 °C [X], 880 °C [Э],
881,5 °C [2]) и SnS2(~860 °C [Ш], -870 °C [2]), полученные в этих работах,
близки к указанным на рис. 404. Соединение SnS претерпевает полимор-
фное превращение при температуре 600 °C. Указанные на диаграмме
температуры нонвариантных превращений, кроме превращения со
стороны S, были определены авторами [1]. Температура нонвариантного
S, % (по массе)
Рис. 544. S-Sn
210
S~Sn
превращения co стороны S, равная 119 °C, была определена в работе [2].
Положение линий на диаграмме между Sn и SnS в общем совпадает с
принятым в работе [X], а между SnS2 и S - с принятым в работах [2, 3].
Для температуры монотектического превращения со стороны Sn указаны
также значения 858 °C [X], 860 °C [Э, 2]. Для температуры эвтектики
между SnS и Sn3S4 в работах [Ш, 2] принято значение 740 °C.
Сведения о кристаллической структуре соединений приведены в
табл. 433.
Таблица 433. Кристаллическая структура соединений системы S-Sn
Соедине- ние Прото- тип Символ Пирсона, пр.гр. Параметры решетки, нм Источник
а b с
SnS* —~ — 0,4349 0,3988 1,1203 [1]
0,399 0,434 1,120 [X]
0,399 0,433 1,120 [Ш]
0,3978 0,4328 1,190 [Ш]
SnS2 CdJ2' ЙРЗ, 0,366 — 0,599 [1]
Р 3ml 0,364(6) - 0,588(0) [X]
Sn7S,” — 0,8881 0,3761 4,214 [1]
Рстп
— 0,879 1,402 0,374 [Ш]
Рпта 0,8864 1,4020 0,3747 [Ш]
Sn-iS.” — — 0,7488 — 3,3130 [1]
3 4 0,7553 —• 0,8383 [Э]
* Ромбическая сингония.
* * Тетрагональная сингония.
Литература
1. Караханова М.И., Пашинкин А.С., Новоселова А.В.И Изв. АН СССР. Неорганические
материалы. 1966. Т. 2. N 6. С. 991-996.
2. Albers W., Schol К. // Phillips Res. Rep. I Phillips J. Res. 1961. V. 16. N 4. P. 329-342.
3. Albers W., Haas C., Vink H.J., Wasscher J.D. // J. AppL Phys. 1961. V. 32. N 10.
P. 2220-2225.
Л.Л. Рохлин
S-Sr. СЕРА-СТРОНЦИЙ
Диаграмма состояния S-Sr не построена. Установлено существование
двух сульфидов Sr. Методом прямого синтеза из компонентов при
нагреве получен сульфид SrS, который имеет структуру типа NaCl
(символ Пирсона cF8, пр. гр. Fm3m) с параметром решетки а =
= 0,60199 нм при температуре 20 °C [1].
5-Sr, S-Ta
211
Получен сульфид SrS2, который имеет разную структуру в зависимос-
ти от давления. Соединение SrS2 при нормальном давлении имеет
тетрагональную структуру (пр. гр. IMmcrri) [2, 3) с параметрами решетки
а - 0,6905 нм, с = 0,7616 нм.
Литература
1. Guntert O.J., Faessler A.Z.//Z. Krist. 1956. Bd. 107. S. 357-361.
2. Schnering H.G., Goh Ngou-Khang // Naturwissenschaften. 1974. Bd. 61. S. 272-278.
3. Kawada I., Kato K., Yamaoka S. // Acta Crystallogr. B. 1976. V. 32. N 10. P. 3110-3112.
Л.Л. Зусман
S-Ta. СЕРА-ТАНТАЛ
Диаграмма состояния S-Та не построена. Согласно данным наиболее
поздних работ, рассмотренных в справочнике [Ш], в системе S-Ta
образуется девять сульфидов Та, сведения об их кристаллической
структуре приведены в табл. 434.
Т а б л и ц а 434. Кристаллическая структура соединений системы S-Ta
Соединение Прото- тип Символ Пирсона, пр.гр. Параметры решетки, нм Примечание
а b с
Та1+л.52(т- -1,22-1, 35) Nbi+AS2 ЛР6, P63/mmc 0,3295 0,329 — 1,245 1,265 богатое S [ill] богатое Та [Ш]
Ta.i 2S2 Nb1+A.S2 ЛЯ4, АЗл; 0,3315 - 3,62 [Ш]
Ta-i,)5S2 Nb1+AS2 ЙЯ4, А3л1 0,331 - 1,82 [Ш]
aTaS2’ Cd(OH)2 - 0,336 - 0,590 [Ш]
PTaS” NbS2 ЙР6, Ptymmc 0,3315 - 1,210 [П1]
yTaS2’ NbS2 ЛЯ4, Rim 0,332 - 1,79 [III]
6TaS2' - Rim 0,3335 - 3,585 [III]
eTaS2" - - 0,192 - 0,599 [HI]
TaS/” - - 3,6804 1,5173 0,3340 [1,2]
Ромбоэдрическая сингония.
*** Гексагональная сингония.
Ромбическая сингония.
212
S-Та, S-Tb, S-Tc, S-Te
Литература
1. Bjerkeiund T., Kjekshus A. И Z. Anorg/ All. Chem. 1964. Bd. 328. N 5/6. S. 235 - 242.
2. Асланов Л.А., Симанов Ю.П., Новоселова A.Br., Украинский Ю.М. // Журнал
неорганической химии. 1964. Т. 8 N 12. С. 2635 - 2637.
Л.Л. Рохлин
S-Tb. СЕРА-ТЕРБИЙ
Диаграмма состояния S-Tb не построена. В системе образуются
соединение TbS Р] и соединение, близкое по составу к дисульфиду
TbS, 74_| 80 [Ш]. Кристаллическая структура соединений указана в
табл.’ 435.
Таблица 435. Кристаллическая структура соединений системы S-Tb
Соединение Прототип Символ Пирсона, пр.гр. Параметры решетки, нм Источник
а с
TbS NaCl cF8, 0,5516 — [Э]
РтЗт 0,5517 — [Э]
TbS 1,74-1,80 - 1**, 0,776 0,791 [Ш]
Л.Л. Рохлин
S-Tc. СЕРА-ТЕХНЕЦИЙ
Диаграмма состояния системы S-Tc не построена. В работе [X]
сообщается об образовании в системе сульфида Tc2S7.
S-Te. СЕРА-ТЕЛЛУР
На рис. 545 представлена диаграмма состояния S-Te, построенная
авторами работы [1] по результатам исследований, приведенных в обзоре
[X]. Она представляет собой диаграмму эвтектического типа с образова-
нием ограниченных твердых растворов. Температура эвтектики 109 °C
и содержание в ней S, равное 98,6 % (ат.), указаны как средние значения
экспериментальных данных, приведенных в обзоре [X].
Для растворимости S в твердом Те при эвтектической температуре
получены значения, значительно различающиеся между собой: 26; 7,5 и
14,5 % (ат.). На диаграмме нанесено последнее значение.
Растворимость Те в (pS), стабильной при температуре выше 95 °C,
составляет около 0,5 % (ат.).
Температура аллотропического превращения aS - PS, равная 95 °C,
снижается до 90 °C при добавке 0,3 % (ат.) Те.
S-Те, S-Th
213
Литература
1. Shanna R.C., Chang Y.A. // Bull. Alloy Phase Diagrams. 1989. V. 10. N 4. P. 348-350.
Л.Л. Рохлин
S-Th. СЕРА-ТОРИЙ
Диаграмма состояния S-Th не построена. Имеются сведения о
температурах плавления и кристаллической структуре фаз, образующихся
в системе [X, Э, Ш]. Фаза ThS плавится при температуре >2200 °C [X],
2400-2450 °C [Э] и 2335 °C в среде Н2 [Ш]; фаза ThS2 имеет температуру
плавления 1905 °C PC]; фаза Th7SI2 (в работе [Ш] это фаза ThS, 7)
плавится при 1770 °C [X]. Для образования сульфидов Th2S3 [X] и Th2S5
[Э] необходимо небольшое количество О. Для выяснения фазовых
равновесий в системе S-Th требуются дальнейшие эксперименты.
Кристаллическая структура соединений указана в табл. 436.
214
S-Th, S-Ti
Таблица 436. Кристаллическая структура соединений в системе S-Th
Соедине- ние Прото- тип Символ Пирсо- на, пр.гр. Параметры решетки, нм Источник
а Ь с
ThS NaCl cF8, РтЗт 0,5683 0,56809 0,5685 - - [X] [Ш] [Ш]
ThS2 PbCl2 оРП, Рпта 0,4267 0,4283 0,4276 0,7264 0,7275 0,7276 0,8617 0,8617 0,8634 [X] [Э] [Ш]
Th7S|2 — hP\9, 1,1063 — 0,3991 [X]
(ThS17) Рб-^/т 1,1067 — 0,3992 [Ш]
Th2S3(?) Sb2S3 оР20, Рпта 1,099 1,085 0,396 [X]
Th2S5(?) — tP2i, Р42/п или ZP28, Ptynma 0,543 — 1,015 [Э]
Г. К. Алексеенко
S-Ti. СЕРА -ТИТАН
Информация о взаимодействии S с Ti приведена в работах [X, Э, Ш].
Диаграмма состояния системы S-Ti в обобщенном варианте приведена
на рис. 546 [1]. При ее построении в работе [1] были, в основном,
использованы данные, полученные авторами.
Растворимость S в (aTi) при комнатной температуре составляет
0,009 % (по массе), а при 850 °C - 0,017 % (по массе) [2]. Растворимость
S в (PTi) меньше, чем в (aTi).
При температуре 1212 °C и содержании 14 % (ат.) S кристаллизуется
эвтектика (PTi) + Ti3S. Соединение Ti3S не обладает заметной областью
гомогенности, плавится при 1305 °C, распадаясь на жидкость и фазуТ^В.
Последняя имеет довольно широкую (до 4 % (ат.)) область гомогенности,
которая несколько сужается при понижении температуры. Сульфид Ti2S
плавится при 1410 °C и распадается на жидкость и фазу 6'(Ti) + YS).
которая при температуре 935 °C претерпевает полиморфное превраще-
S-Ti
215
S, % (ло массе)
ние. ФазаТ1]+х8 гомогенна при 1410 °C в интервале составов 46-49,7 %
(ат.) S. При низких температурах эта фаза не имеет области гомогеннос-
ти, содержит 49,7 % (ат.) S и, по существу, является сульфидом TiS. Фаза
Ti1+vS образуется по перитектической реакции при -1780 °C. Соединение
Ti8S9 плавится конгруэнтно при температуре -1950 °C.
В сплавах системы Ti—S обнаружены еще сульфиды типов Ti8S]0,
Ti16S2], TiS2 и TiS3. Последний из них образуется по перитектической
реакции при 632 °C. При длительном отжиге сплавов, богатых Ti,
обнаружено существование соединения Ti6S - субсульфида Ti [4].
Наиболее вероятным считается перитектоидный характер его образова-
ния при температуре -925 °C.
Кристаллическая структура соединений указана в табл. 437.
Таблица 437. Кристаллическая структура соединений системы S-Ti [1J
Соединение Прототип Символ Пирсона, пр.гр. Параметры решетки, нм
а b С
Ti6S* - - 0,2967 - 1,450
Ti3S - /*24, 0,9978 - 0,490
216
S-Ti, S-Tl
Соединение Прототип Символ Пирсона, пр.гр. Параметры решетки, нм
а b с
Т' 1+a-S - ЙР2, Р6т2 0,3282- 0,330 - 0,6380- 0,644
TiS NiAs ЙР4, РЬу/ттс - - -
Ti8S9 - ЛЛ18, R3m 0,3147- 0,3425 - 2,645- 2,6493
Tigsio - ЙР18, Рб^/ттс ' 0,3429- 0,3439 - 0,2893
T*16s21 - ЙЯ37,1, R Зт 0,3441 - 6,048
TiS2 Cdl2 hP3, РЗт 0,339- 0,34073 - 0,56912- 0,570
TiS,” — тР^ 0,4973- 0,338 0,8714-
* Гексагонал ** P = 97,17^ ьная сингония. 97,74°. Р2}/т 0,501 0,3433 0,888
Соединение Ti2S имеет низкую симметрию [Ц.
Литература
I. Murray J.L.//Bull. Alloy Phase Diagrams. 1986. V. 7. N 2. P. 156-163.
2. Berger L., Williams D., Yaffe R. // Trans ASM. 1957. V. 49. P. 300-304.
3. Еременко B.H., Листовничий B.E. // Халькогениды. Сб. статей. Киев: Наукова Думка.
1967. С. 67-78.
4. Bartran S.P. // Diss. Abstr. 1958. V. 19. Р. 1216.
П.Б. Будберг
S-T1. СЕРА-ТАЛЛИЙ
Диаграмма состояния S-T1, построенная по результатам нескольких
ранних исследований, была представлена в работе [X]. Однако некоторые
элементы этой диаграммы вызывают сомнение.
S-TI
217
Рис. 547. S-Tl
Диаграмма состояния S-T1 (рис. 547) дана по работе [1], в которой
она представлена в таком же виде, как и в работе [X], но с некоторыми
корректировками, сделанными на основании более поздних исследова-
ний.
Система характеризуется наличием двух областей несмешиваемости
жидкостей и образованием нескольких соединений, состав которых,
согласно работе [1], отвечает формулам: T12S5, T18S17, TIS, T14S3, T12S. В
области концентраций, близкой к T1S, предполагалось также соединение
с формулой T18S7, однако рентгеновские исследования и химический
анализ соединения, полученного непосредственно химической реакцией,
подтверждали формулу T1S [X].
В отличие от обзора [X] в работе [1] установлено образование двух
соединений: T18S17 и T12S5 в области, где согласно работе [X] предполага-
лось соединение T1S2- Указана также температура нонвариантного
превращения -145 °C в области концентраций -50-70 % (ат.) S, для
соединения T14S3 показана область гомогенности. Согласно работе [X]
температура монотектического превращения со стороны Т1 равна
450 °C, а температура нонвариантного превращения, связанная с
полиморфизмом Т1 - 232 °C.
Кристаллическая структура соединений представлена в табл. 438. Для
соединения T12S5 известны две модификации: красная и черная.
218
S-Tl, S-Tm
Таблица 438. Кристаллическая структура соединений системы S-T1
Соедине- ние Прото- тип Символ Пирсо- на, пр.гр. Параметры решетки, нм Источник
а b с
T12S - Иска- женная Cdl2 й/?27, ЯЗ 1,222 - 1,821 [X, Р]
T1S TISe Н16, 141тст 0,779 0,77869 - 0,680 0,68071 [X] [Э]
T12S5 (красная) - оР28, Р2,2,2, 0,666 0,652 1,675 [Э, 2]
T12S5 (черная) - оР84, РЬсп 2,345 0,8877 1,057 [Э, 2]
Литература
1. Васильев В.П., Никольская А.В., Герасимов Я.И. И Термодинамические свойства
металлических сплавов. Сб. статей. Баку: Элм. 1975. С. 40-46.
2. Frasson Е., Scatturin V. // Chemical abstracts. 1958. V. 52. N 12. P. 9705-9706.
Л.Л. Рохлин
S-Tm. СЕРА-ТУЛИЙ
Диаграмма состояния S-Tm не построена. В работе сообщается [Э],
что в системе образуется сульфид TmS. Кроме того, идентифицирован
сульфид Tm5S7 с базоцентрированной моноклинной решеткой [III, 1]. В
других работах получено соединение ТmS j 47 и указано на существование
соединения с моноклинной решеткой, состав которого предположительно
TmSx, где 1,33 < х < 1,5 [Ш]. Последние два соединения близки по составу
Tm5S7 и, по-видимому, совпадают с ним.
Кристаллическая структура соединений указана в табл. 439.
S-Tm. S-U
219
Таблица 439. Кристаллическая структура соединений системы S-Tm
Соедине- ние Прото- тип Символ Пирсо- на, пр.гр. Параметры решетки, нм Источник
а b С
TmS Tm5s; Р= 104 NaCl Y5S7 ,82°. cfB, Fm3 т mC24, С2!т 0,5412 1,2628 0,3761 1,1462 PJ [Ш, П, 1]
Литература
1. Adolphe G., Guittard М., Laruelle Р. // Compt. Rend. Acad. Sci. Paris. 1964. V. 258. N 19.
P.4773-4775.
Л.Л. Рохлин
S-U. СЕРА-УРАН
Информация о взаимодействии S c U приведена в работах [X, Э, Ш,
1,2]. Диаграмма состояния S-U (рис. 548) построена по данным работы
[2]. Сплавы синтезировали из порошковых материалов вакуумно-
термическим методом при температуре 800-900 °C в течение 50-80 ч.
S,%(am.)
и
Рис. 548. S-U
220
S-U, S-U
В системе образуется пять соединений, из которых US плавится с
открытым максимумом при 2462 °C. Соединение US3 кристаллизуется
по перитектической реакции при 905 °C. Соединение US2 имеет две
полиморфные модификации. Температура полиморфного превращения
не установлена.
Кристаллическая структура соединений представлена в табл. 440.
Таблица 440. Кристаллическая структура соединений системы S-U
Соедине- ние Прото- тип Символ Пирсо- на, пр.гр. Параметры решетки, нм Источник
а ь с
US NaCl cFb, Fm Зт 0,5484 - - [И]
u2s3 Sb2S3 оР20, Рпта 1,065 1,036 0,389 1,06 1,041 0,386 [П] [2]
u3s; - - 0,741 0,733 0,806 0,804 1,170 1,164 [П] [2]
aUS2 aUS2 г/30, IMmcm 1,028 1,067 — 0,627 0,630 [И] [1]
0US2 PbCl2 оР12, Рпта 0,708 0,413 0,422 0,711 0,845 0,844 1П] [2]
us;* * Ромб ** Мон ическая си оклинная нгония. сингония, | 0,540 3 = ? 0,391 1,829 [2]
Литература
1. Эллерт Г.В., Словинских В.К., Севастьянов В.Г. // Журнал неорганической химии.
1971. Т. 16. N 6. С. 1721-1724.
2. Эллерт Г.В., Севастьянов В.Г., Словинских В.К. // Журнал неорганической химии.
1974.Т 19.N 11.С. 3107-3111.
П. Б. Будберг
S-V. СЕРА-ВАНАДИЙ
В системе образуется ряд сульфидов, относительно которых имеются
не всегда согласующиеся данные [X, Э, Ш].
Согласно работе [1] существует сульфид V3S. Он был получен путем
сплавления компонентов при 1400 °C. V3S имеет две модификации:
s-v
221
высокотемпературную а и низкотемпературную р с температурой
перехода, находящейся между 825 и 950 °C.
V5S4 имеет объемно центрированную тетрагональную решетку по
предварительным данным типа Ti5Te4 [Ш]. В области концентраций
45,9-60,8 % (ат.) S образуется две фазы. Более богатая V фаза, соотве-
тствующая VS0 98_| 125, имеет ромбическую решетку с различными
кратными параметрами элементарной ячейки. В другой работе для этой
фазы указывается область гомогенности, соответствующая формуле
VS0 85_] os, и другие параметры ромбической решетки. Более богатая S
фаза имеет состав, соответствующий формуле VSj ]25_] 55, и моноклин-
ную кристаллическую решетку [Ш]. Ранее для этого состава указывалась
формула VS и гексагональная решетка типа NiAs (символ Пирсона ЛР4,
пр. гр. Р63/ттс) [X, Э] и V2S3 [Э, 2].
В работе [X] приведена часть диаграммы состояния S-V, в которой
имеет место эвтектическое превращение при 1312 °C между V и VS. Эту
часть диаграммы состояния нельзя считать правильной, так как она не
учитывает образование более богатых ванадием соединений V5S4 и V3S.
В системе образуется также сульфид V5S8 [Ш]. Имеются сведения
Р, Ш] об образовании сульфида VS4 с моноклинной кристаллической
решеткой, для которой в двух источниках указываются различающиеся
между собой параметры.
Характеристики кристаллических решеток сульфидов представлены
в табл. 441.
Таблица 441. Кристаллическая структура соединений системы S-V
Соединение Прото- тип Символ Пирсона, пр.гр. Параметры решетки, нм Примечание
a b c
aV3S — Г/32, 0,9470 — 0,4589 [П, 1]
/42>п
pv3s - tP-32, Ptynbc 0,9381 - 0,4663 [П, 1]
V5S4 Ti5Te4 tl\K, 141m 0,8988 - 0,3224 [Ш]
VS * * ^0,98-1,125 - - 2x0,5825 2x0,3310 0,5854 Для состава vs1>0 [Ш]
VS ‘ * ^0,85-1,05 - - 0,5860 0,3304 0,5826 [Ш]
222
S-K S-W
Соединение Прото- тип Символ Пирсона, пр.гр. Параметры решетки, нм Примечание
а b с
VSI,125-I,55 - т/*, 121т 0,5870 0,3284 2x0,5689 р = 92,03° [Ш]
v5se - mF52, F2Jm 1,137 0,665 1,129 р = 91,52° [Ш,П]
vs4 - тС40, Се 1,267 1,041 1,211 р= 148,37° [Ш,П]
* Ромбич еская син т/40, 121с гония. 0,678 1,042 1,211 р= 100,8° [Ш,П]
Литература
1. Pedersen В., Gronvold F. //Acta Crystallogr. 1959. V. 12. N 12. P. 1022-1027.
2. Логинов Г.М. //Журнал неорганической химии. 1961. Т. 6. N 2. С. 261-264.
Л.Л. Рохлин
S-W. СЕРА-ВОЛЬФРАМ
Взаимодействие W с S изучалось рядом авторов [X, Э, Ш]. Схемати-
ческая диаграмма состояния (рис. 549) приводится в работе [1] по данным
работы [2], которые в общих чертах согласуются с результатами работ
[3-5]. В системе образуются две промежуточные фазы WS2 и WS3. WS2,
плавящаяся конгруэнтно при низком давлении паров серы при -1800 °C
[2, 5] или при высоком равновесном давлении паров серы при -2400 °C
[2], имеет узкий интервал гомогенности 66,1-66,7 % (ат.) S [6]. Предпола-
гается наличие несмешиваемости в жидком состоянии в области при
температуре выше 2000 °C и образование эвтектики (W) + WS2 при
2000 °C [2] или при температуре ниже 1800 °C [5]. Предполагается
наличие другой области несмешиваемости в жидком состоянии в сплавах
с содержанием S >80 % (ат.) с температурой монотектики -1150 °C. WS3
диссоциирует на WS2 и PS при температурах выше 375 °C [2] или
300-400 °C [5], или 270-500 °C при атмосферном давлении [Ш] и при
температуре выше 170 °C в вакууме [3]. Взаимная растворимость W и S
практически отсутствует. WS2 имеет гексагональную структуру типа
S-W
223
Рис. 549. S-W
0MoS2, но в определенных условиях возможно получение и WS2 с
ромбоэдрической структурой.
В табл. 442 приведены характеристики кристаллической решетки WS2.
Таблица 442. Кристаллическая структура соединений системы S-W
Соедине- ние Прото- тип Символ Пирсо- на, пр.гр. Параметры решетки, нм Источник
а b с
WS2 pMoS2 ЛД6, Pftylmmc 0,3155 0,3151* 0,3146** - 1,235 1,229 1,234 [Ш] [4] [4]
WS2 aMoS2 hR3, R3m 0,3162 - 1,850 [Ш]
* При концентрации 66,1 % (ат.) S.
* * При концентрации 66,6 % (ат.) S.
Литература
1. Raghavan V. ИJ Alloy Phase Diagrams. 1988. V. 4. N 3. P. 175-183.
2. Moh G.H.//Fortschritte Mineral. 1972. Bd. 50. N l.S. 65-67.
3. Glemser O., Sauer H., Konig P. // Z. Anorg. All. Chem. 1948. Bd. 257. S. 241-246.
4. Ehrlich P. // Z. Anorg. All. Chem. 1948. Bd. 257. S. 247-253.
5. Vogel R., Weizenkorn H.-H. //Arch. Eisenhuettenwes. 1961. Bd. 32. S. 413-420.
224
S~W. S-Y
6. Stemprok M. // Mineral Deposita. 1971. V. 6. P 302-312.
КБ. Поварова
S-Y. СЕРА-ИТТРИЙ
Диаграмма состояния S-Y не построена. Имеются сведения, что в
системе S-Y образуются следующие соединения: YS, Y5S7, Y2S3, YS2. YS
имеет температуру плавления 2060 °C, усредненную по результатам
отдельных работ. Параметр кубической кристаллической решетки а
изменяется в пределах 0,5466-0,5495 нм, что указывает на определенную
область гомогенности [1].
Соединение Y5S7 плавится при температуре 1630 °C [4].
Соединение Y2S3 стабильно при температуре от 850 °C до
температуры плавления, находящейся в пределах 1900-1950 °C или
равной 1600 °C по данным различных исследований [Э].
YS2 имеет температуру плавления 1660 °С[Э] и определенную область
гомогенности, так что сплавы, содержащие 63,1-64 % (ат.) S (YSj 72_] 78)
являются однофазными [Ш].
Характеристики кристаллических решеток соединений указаны в
табл. 443.
Таблица 443. Кристаллическая структура соединений системы S-Y
Соедине- ние Прото- тип Символ Пирсо- на, пр.гр. Параметры решетки, нм Примечание
а b с
YS NaCl cFZ, Fm Зт 0,5466- 0,5495 — — [1]
0,5493 [2]
Y5S7 y5s7 Н1С24, СИт 1,2768 0,3803 1,1545 Р= 104,82", [3]
y2s; - - 1,747 0,402 1,017 Р = 81,17°, [Э]
ys2" — — 0,771 0,773 — 0,789 0,790 [Э] Для YS1>72_|i78 [Ш]
* Моноклинная сингония.
** Тетрагональная сингония.
5-Y. S-Yb
225
Литература
1. Flahaut J., Guittard M. // Compt. Rend. Acad. Sci. Paris. 1956. V. 242. N 10. P. 1318-1321.
2, landelli A. // Rare Earth Research. New York: The Macmillan Co. 1961. P. 135-141.
3. Adolphe C., Guittard M., Laruelle P. // Compt. Rend. Acad. Sci. Paris. 1964. V. 258. N 19.
P. 4773-4775.
4. Flahaut J., Guittard M.//Comt. Rend. Acad. Sci. Paris. 1956. V. 243. N 17. P. 1210-1212.
Л.Л. Рохлин
S-Yb. СЕРА-ИТТЕРБИЙ
В системе образуются следующие соединения [Э, Ш]: YbS, Yb2S3,
Yb3S4. Соединение YbS обладает кубической решеткой с параметром
а, находящимся, по данным различных исследователей, в пределах
0,5658-0,5694 нм. Это соединение имеет область гомогенности,
соответствующую формуле YbS! )5.
Соединение Yb3S4 имеет область гомогенности, соответствующую
формуле YbS] 33_] В некоторых работах этому соединению приписыва-
ется также формула Yb5S7 |Э].
Для соединения Yb2S3 указывается несколько типов кристаллической
решетки: ромбическая, гексагональная [Э], ромбоэдрическая [Ш] с
эквивалентными гексагональными параметрами, близкими к приведен-
ным для гексагональной решетки в работе [Э].
В табл. 444 приведена кристаллическая структура соединений.
Таблица 444. Кристаллическая структура соединений системы S-Yb
Соедине- ние Прото- тип Символ Пирсо- на, пр.гр. Параметры решетки, нм Источник
а b с
YbS NaCI сЛВ, Fm3m 0,5658- 0,5694 - - [Э, Ш]
Yb3s; - - 1,281 1,297 0,384 [Э]
Yb2S3 * Ромб аА12О3 ическая си л/по, R3c нгония. 0,6772 — 1,828 [Ш,П]
Л.Л. Рохлин
226
S-Zn
S-Zn. СЕРА-ЦИНК
В системе образуется сульфид ZnS, который известен в двух
модификациях: цинковая обманка (сфалерит) (0ZnS) с кубической
кристаллической решеткой и вюрцит (aZnS) с гексагональной кристалли-
ческой решеткой [X, Э, Ш]. Имеются также сведения об образовании
третьей модификации ZnS с ромбоэдрической решеткой: yZnS [Э], но они,
по-видимому, требуют проверки.
Кубическая модификация является низкотемпературной и при нагреве
переходит в гексагональную модификацию. Наиболее надежным
значением температуры перехода от кубической модификации к
гексагональной следует считать 1025-°C, приведенное в работе [Ш]. ZnS
склонен к сублимации, так что температура плавления его могла быть
определена лишь при давлении, больше атмосферного. Согласно [Э],
температура плавления ZnS в аргоне при давлении 1 МПа равна
1830±20 °C.
Сведения о кристаллической структуре ZnS приведены в табл. 445.
Таблица 445. Кристаллическая структура соединений системы S-Zn
Соедине- ние Прото- тип Символ Пирсо- на, пр.гр. Параметры решетки, нм Примечание
а h с
aZnS aZnS ЛР4, 0,3823 — 0,6261 [Ш]
pZnS PZnS Pf^lmc cFi, 0,54109 — — [Ш]
yZnS* F43m 0,3830 0,9477 При температуре
* Ромб< ээдрическг 1Я СИНГОНИ! 0,3811 г - 0,9348 отжига 1000 °C [Э] При температуре отжига 850 °C [Э]
Л Л. Рохлин
S-Zr
227
S-Zr. СЕРА-ЦИРКОНИЙ
Диаграмма состояния S-Zr фактически не построена. Найден ряд
сульфидов, относительно числа и состава которых существуют
разногласия [X, Э, Ш, 1-5]. Схематично диаграмма состояния показана
на рис. 550 по [3].
Установлено существование богатых S соединений ZrS3 и ZrS2.
Соединение ZrS3 не имеет области гомогенности, выше 700 °C распадает-
ся с образованием сульфидов с меньшим содержанием S, кристаллическая
решетка моноклинная. Для ZrS2 найдена область гомогенности
65,6-66,6 % (ат.) S при 500-600 °C. Температура плавления ZrS2 равна
-1550 °C PQ, -1450 °C [3].
Относительно богатых Zr соединений имеются разногласия. В работе
[1] сообщается о существовании соединений: Zr9S2 и Zr2S. Авторы работы
[3] эти соединения не обнаружили в образцах, закаленных от 1450 °C. В
этом исследовании установлена наиболее богатая Zr фаза Zr3S2. Этот
сульфид при 1450 °C находился в равновесии с (aZr), содержавшим
0,16 мол. долей S. Растворимость S в (PZr) не определяли. В области
концентраций 40-60 % (ат.) S образуются фазы на основе моносульфидов
Zr-низшего, Zr)+vS, со структурой типа WC, который можно идентифи-
цировать с Zr3S2 [3], и высшего, Zr^S, обладающего дефектной
структурой на основе решетки типа NaCl с упорядоченными вакансиями
[Х,Э, 3-5].
В работе [5] исследовали сплавы с отношением S/Zr = 0,5... 1,5 методом
высокотемпературного рентгеновского анализа. В образцах с отношени-
S, 7» (по массе)
Zr S, 7» (am) S
Рис. 550. S-Zr
228
S-Zr
ем S/Zr = 0,90... 1,0 обнаружена структура типа WC, при отношении S/Zr =
= 1,32 - сверхструктура на основе решетки типа NaCl. Такая же
сверхструктура обнаружена при исследовании сульфида с S/Zr = 1,34 при
температуре ниже 1250±20 °C. При более высокой температуре
(>1250 °C) сульфид имеет структуру типа NaCl. При самой высокой
температуре появляется структура типа WC. В общем результаты [5]
согласуются с [3].
Сведения о кристаллической структуре соединений представлены в
табл. 446.
Таблица 446. Кристаллическая структура соединений системы S-Zr
Соедине- ние Прото- тип Символ Пирсо- на, пр.гр. Параметры решетки, нм Источник
a b c
zrs; ZrSe3 mP8, P2|/m 0,51243 0,36244 0,8980 [6]
ZrS2 Cdl2 ЛРЗ, P 3m 1 0,3662 - 0,5813 [3, П]
Zr9S2 - f/88, lAylamd 0,9752 - 1,9216 P]
Zr2S Ti2S oP36, Pnnm 1,53328 1,2340 0,3520 [8]
Zr3S2 (Zr1+A.S) WC hP2, P6m2 0,3436 - 0,3435 [Э, П]
ZrS (Zr,_A.S) * P = 97 NaCl ,28°. cF8, Fm3m 0,5250 — — [П]
Литература
1. Conard B.R., Franzen H.F. И High Temp. Sci. 1971. V. 3. P. 49.
2. Kubaschewski-von Goldbeck O. // Atomic Energy Review. Special Issue. N 6. Zirconium:
Physico-Chemical Properties of its Compounds and Alloys. Vienna: International Atomic Energy.
1976. P. 67-139.
3. Benz R.//Arch. Eisenhuttenwes. 1978. V. 49. N 2. S. 59-62.
4. Franzen H.F., Folmer J.C.W. // J. Solid State Chem. 1984. V. 51. N 3. P. 396-402.
5. Kim S.J., Nguyen Т.Н., Franzen H.F. // J. Solid State Chem. 1987. V. 70. N I. P. 88-92.
6. Brattas L., Kjekshus A. // Acta Chem. Scand. 1972. V. 26. N 9. P. 3441-3449.
7. Cheng H.Y., Franzen H.F. // Acta Crystallogr. B. 1972. V. 28. N 5. P. 1399-1404.
8. Yao X., Franzen H.F.//J. Less-Common Met. 1988. V. 142. P. 127-129.
Л.А. Третьяченко
Sb-Sc. Sb-Se
229
Sb-Sc. СУРЬМА-СКАНДИЙ
Диаграмма состояния системы не построена. Имеются сведения [1,
2], что в системе Sb-Sc образуется соединение SbSc, типа NaCl (символ
Пирсона cF8, пр. гр. Fm Зт), параметр решетки а = 0,5838 нм [1] или а =
= 0,5859 нм [2]
Литература
(.Журавлев Н.Н., Смирнова Е.М.//Кристаллография. 1962. Т. 7. N 2. С. 312-313.
2. Brixner L.H.//J. Inorg. Nuclear Chem. 1960. V. 15. P. 199-201.
Н.И. Никитина
Sb-Se. СУРЬМА-СЕЛЕН
Диаграмма состояния Sb-Se (рис. 551) приведена из работы [X], где
она построена по результатам нескольких исследований. В системе
наблюдается область несмешиваемости в жидком состоянии. Вид
диаграммы состояния данной системы зависит от скорости охлаждения,
так как расслоение может происходить лишь при медленном охлаждении,
поскольку разница в плотности обеих жидкостей мала. В системе
установлено существование соединения Sb2Se3, температура плавления
которого по данным различных работ равна 617,605, 575 [X], 600 °C [1].
Соединение Sb2Se3 имеет структуру собственного типа (символ Пирсона
Рис. 551. Sb-Se
230
Sb-Se, Sb-Si
II II
oP20, пр.гр. Рпта), параметры решетки: а = 1,15 нм, b = 1,16 нм, с
= 0,39 нм [2]; а = 1,162 нм, Ь= 1,177 нм, с = 0,3962 нм [3]; а = 1,15 нм, b
- 1,16 нм, с - 0,398 нм [4].
Литература
1. Кузнецов В.Г., Палкина К.К. // Журнал неорганической химии. 1963. Т. 8. N 5.
С. 1204-1218.
2. Ddnges Е.//Z. Anorg. All. Chem. 1950. Bd. 263. S. 289-291.
3. Tideswell N.W., Kruse F.H., McCullough J.D. // Acta Crystallogr. 1957. V. 10. N 7.
P. 99-102.
4. Коломиец Б.Т., Горюнова H.A. И Журнал технической физики. 1955. Т. 25. Вып. 6.
С. 984-994.
Н.П. Никитина
Sb-Si. СУРЬМА-КРЕМНИЙ
Рис. 552. Sb-Si
Sb-Si. Sb-Sm
231
Информация о взаимодействии Sb с Si приведена в работах [X, Э].
Диаграмма состояния системы характеризуется отсутствием
соединений и наличием эвтектического превращения. На рис. 552
представлена диаграмма состояния этой системы согласно работе [X] с
дополнениями и исправлениями, полученными в более поздних
исследованиях, рассмотренных в работе [Э]. Часть линии ликвидус со
стороны Sb от 0 до 15 % (ат.) Si, построенная в работе [Э], хорошо
согласуется с остальной частью линии ликвидус, приведенной в работе
[X]. Внесено уточнение в температуру эвтектического превращения -
629,4 °C [Э] вместо 630 °C по [X]. Концентрация Si в эвтектике - 0,3 %
(ат.) [Э].
В системе имеется небольшая растворимость Sb в (Si) твердом
состоянии. Солидус имеет ретроградный характер [Э, 1,2] и показан на
вставке диаграммы состояния согласно работе [1], в которой использо-
вался метод микротвердости. Максимальная растворимость Sb в твердом
Si имеет место при 850 °C и составляет 0,22 % (ат.) [^.Теоретические
расчеты, выполненные в работе [2], дали максимальную растворимость
Sb в твердом Si -0,4 % (ат.) при температуре -1325 °C. Согласно другим
экспериментальным работам, максимальная растворимость Sb в твердом
Si составляет -0,14 % (ат.) при температуре -1325 °C [Э]. В работе [3] в
приближении теории регулярных растворов рассчитаны ликвидус
системы Sb-Si и растворимость Sb в Si. Получено хорошее совпадение
расчетных данных с экспериментальными результатами.
Литература
1. Глазов В.М., Лю Чжэнь-юань // Изв. АН СССР. ОТН. Металлургия и топливо. 1960.
N 4. С. 150-155.
2. Козловская В.М., Рубенштейн Р.Н. // Физика твердого тела. 1961. Т. 3. N 11.
С. 3354-3362.
3. Никитина Г.В., Романенко В.Н., Ишутинова П.Н. И Изв. Ан СССР. Неорганические
материалы. 1971. Т. 7. N 1. С. 45-49.
Л.Л. Рохлин
Sb-Sm. СУРЬМА-САМАРИЙ
Диаграмма состояния Sb-Sm исследовалась в работе [1] методами
дифференциального термического, микроструктурного и рентгеновско-
го анализов. Сплавы готовили нагревом смесей компонентов в
танталовых тиглях, заваренных электрической дугой в атмосфере аргона.
Для приготовления сплавов использовали Sb чистотой 99,99 % (по массе)
и Sm чистотой 99,9 % (по массе).
232
Sb-Sm
Sb, % (no массе)
Рис. 553. Sb-Sm
На рис. 553 представлена диаграмма состояния системы по данным
работы [1]. Вблизи точки плавления Sb обнаружена эвтектика при
температуре 610 °C. В сплавах системы найдено пять соединений: Sm2Sb,
Sm5Sb3, Sm4Sb3, SmSb и SmSb2. Соединения Sm2Sb, Sm5Sb3, Sm4Sb3 и
SmSb2 образуются по перитектическим реакциям. Температура
перитектического превращения с образованием соединения SmSb2
составляет -1300 °C. Соединение SmSb плавится конгруэнтно при
температуре -2000 °C.
Кристаллическая структура соединений представлена в табл. 447.
Sb-Sm, Sb-Sn
233
Таблица 447. Кристаллическая структура соединений системы Sb-Sm
Соедине- ние Прото- тип Символ Пирсона, пр.гр. Параметры решетки, нм Источник
a b c
Sm2Sb La2Sb z/12, I4lmmm 0,4468-0,4478 - 1,746-1,745 [1]
Sm5Sb3 Mn5Si3 hP\6, P6y/mcm 0,9100-0,9115 - 0,640-0,6389 [1]
Sm4Sb3 Th3P4 cI2S, 14 3d 0,9308-0,9316 0,930 — - [1] [2]
SmSb NaCl cFi, Fm 3 m 0,6268-0,6272 0,6271 - - [1] [3]
SmSb2 LaSb2 aC24, 0,617-0,620 0,605 1,791-1,793 [1]
Литература
1. BorzoneG., Borsese A., DelfmoS., Ferro R.//Z. Metallkunde. 1985. Bd. 76. N 3. S. 208-213.
2. Gambino R.J.//J. Less-Common Met. 1967. V. 12. N 4. P. 344-352.
3. Brixner L.H.//J. Inorg. Nuclear. Chem. 1960. V. 15. P. 199-201.
4. landelli A. // Atti Accad. Naz. Line., Rend., C. Sci. Fiz. Mat. Nat. 1964. V. 37. P. 160-164.
НИ. Никитина
Sb-Sn. СУРЬМА-ОЛОВО
Диаграмма состояния Sb-Sn подробно исследована методами
термического и микроструктурного анализов и приведена в работе [1].
При этом уточнена диаграмма, построенная в работе [X] по данным,
полученным в более ранних исследованиях. Диаграмма состояния
системы по данным работы [1] приведена на рис. 554. В системе при
температуре 425 °C и содержании 65,2 % (ат.) Sb по перитектической
реакции образуется фаза 0 (SbSn). Фаза 0 имеет широкую область
гомогенности: 43,0-60,5 % (ат.) Sb при 250 °C. При температуре 324 °C
по перитектической реакции кристаллизуется соединение Sb2Sn3,
которое при температуре 242 °C распадается с образованием фазы 0,
содержащей 43 % (aT.)Sb, и твердого раствора Sb в Sn, содержащего 9,4
% (ат.) Sb. Перитектическая реакция Ж + Sb2Sn3 « (0Sn) имеет место при
температуре 250 °C. Растворимость Sb в (Sn) по данным работы [Э]
приведена ниже:
Температура, °C ........ 223 200 150 100 50
Растворимость Sb, % (ат.) ... 6,4 4 2,2 1,3 0,7
234
Sb-Sn
Sb,% (по массе)
В работе [2] в основном подтверждена диаграмма состояния Sb-Sn,
построенная в [1].
В отношении кристаллической структуры соединений имеются
противоречия. Так, соединение SbSn согласно работе [3]лмеет кубичес-
кую структуру типа NaCl, а согласно работе [4] - ромбоэдрическую
структуру. По данным работы [2] кубической кристаллической
структурой типа NaCl обладает соединение Sb2Sn3, а ромбоэдрической
- SbSn, во всяком случае при температурах, близких к комнатной.
Характеристики кристаллических решеток соединений указаны в
табл. 448.
Таблица 448. Кристаллическая структура соединений системы Sb-Sn
Соединение Прототип Символ Пирсона, пр.гр. Параметр решетки, нм Примечание
а
SbSn NaCl cFK, Fm Зт 0,6136 0,6127 При 45 % (ат.) Sb [3] При 52 % (ат.) Sb
SbSn* - - 0,6129 0,6150 При 45 % (ат.) Sb, а - 89,7° [4] При 55 % (ат.) Sb, а = 89,18°
Ромбоэдрическая сингония.
Sb-Sn, Sb-Sr
235
Литература
1. Predel B., Schwermann W. // J. Inst. Met. 1971. V. 99. P. 169-173.
2. Allen W.P., Perepezko J.H. // Scr. Metall. 1990. V. 24. N 11. P. 2215-2220.
3. Bowen E.G., Jones W.M.//Philos. Mag. 1931. V. 12. S. 441-462.
4. Hagg G., Hybinetti A.G. // Philos. Mag. 1935. V. 20. P. 913-929.
Н И. Никитина
Sb-Sr. СУРЬМА-СТРОНЦИЙ
На основании исследований металлографическим методом путем
построения кривых зависимости плотности от состава и методом
термического анализа в работе [1] установлено образование четырех
соединений: SrSb3, SrSb, Sr3Sb2 и Sr2Sb. Образование соединения Sr2Sb
было подтверждено в работе [2]. В работе [3], используя
дифференциально-термический и микроскопический анализы, была
построена диаграмма состояния Sb-Sr, которая показана на рис. 555.
Соединение SrSb плавится конгруэнтно, остальные соединения - по
перитектическим реакциям. Со стороны Sb в системе протекает
эвтектическое превращение при температуре 600 °C и концентрации
5 % (ат.) Sr, что согласуется с данными работы [1]. Со стороны Sr также
Sr Sb, 7° (am.) Sb
Рис. 555. Sb-Sr
236
Sb-Sr, Sb-Та
имеет место эвтектическое превращение. Оно протекает при 710 °C.
Эвтектическая точка, согласно представленной диаграмме, находится
около 10 % (ат.) Sb, однако в работе [3] указана концентрация Sb в
эвтектике 5 % (ат.).
Предельная растворимость Sr в (Sb) и Sb в (pSr) при температурах
нонвариантных превращений составляет -2 % (ат.) (1,4 % (по массе)) и
3,7 % (ат.) (5,1 % (по массе)) соответственно [3].
Кристаллическая структура известна только для одного из соединений
- Sr2Sb (символ Пирсона //12, пр.гр. Шттт), параметры решетки а -
= 0,500 нм, с = 1,741 нм [2].
Литература
1. Шукарев С.А., Морозова М.П., Кан Хо-Мн // Журнал общей химии. 1957. Т. 27. N 7.
С. 1737-1743.
2. Brauer G., Muller О.//Angew. Chem. 1961. Bd. 73. N 5. S. 169.
3. Вахобов A.B., Ниязова З.У., Полев Б.Н.//Изв. АН СССР. Неорганические материалы.
1975. Т. 11.N 2. С. 363-364.
Л.Л. Рохлин
Sb-Ta. СУРЬМА-ТАНТАЛ
Диаграмма состояния Sb-Ta не построена. Имеются сведения только
о кристаллической структуре промежуточных фаз, которые представлены
в табл. 449.
Таблица 449. Кристаллическая структура соединений системы Sb-Ta
Соедине- ние Прототип Символ Пирсона, пр.гр. Параметры решетки, нм Источник
а b с
Ta3Sb Cr3Si СР8, РтЪп 0,52595 - - [1]
Т a5Sb4 Ti5Te4 1/18, /4/т 1,023 - 3,54 [2]
TaSb2' NbAs2 тС12, С2 1,02218 3,6447 8,2915 [П]
*0 = 120,39°.
Sb-Ta, Sb-Tb
237
Литература
1. Nevitt M.V.//Trans. AIME. 1958. V. 212. P. 350-355.
2. Boiler H., Nowotny H. // Monatsh. Chem. 1964. Bd. 95. S. 1272-1282.
Г.К. Алексеенко
Sb-Tb. СУРБМА-ТЕРБИЙ
На рис. 556 представлена диаграмма состояния Sb-Tb по данным
работы [1], в которой проводили исследования методами дифференциаль-
ного термического, микроскопического и рентгеновского анализов.
Сплавы получали путем нагрева в печи сопротивления порошков
компонентов, помещенных в молибденовый тигель. Для приготовления
сплавов использовали дистиллированный ТЬ чистотой более 99,9 % (по
массе) и Sb полупроводниковой чистоты. •
В системе имеют место две эвтектики: при температуре 1130 °C и
содержании 14 % (ат.) Sb и температуре 623 °C и содержании более 99 %
(ат.) Sb. В системе обнаружено четыре соединения: Tb5Sb3 (37,5 % (ат.)
Sb), Tb4Sb3 (42,86 % (ат.) Sb), TbSb (50 % (ат.) Sb) и TbSb2 (66,67 % (ат.)
Sb). Соединения Tb5Sb3,Tb4Sb3 и TbSb2 образуются по перитектическим
Tb Sb, '/• (am) Sb
Рис. 556. Sb-Tb
238
Sb-Tb, Sb-Те
реакциям при температурах 1650, 1770 и 740 °C соответственно.
Соединение TbSb плавится конгруэнтно при температуре 2160 °C.
Соединения Tb4Sb3 и TbSb существуют в двух модификациях. Температу-
ры полиморфных превращений соответственно равны 1600 и 1860 °C.
Кристаллическая структура соединений представлена в табл. 450.
Таблица 450. Кристаллическая структура соединений системы Sb-Tb
Соедине- ние Прототип Символ Пирсона, пр.гр. Параметры решетки, нм Источник
а b С
Tb5Sb3 МП<;8Ц ЛР16, 0,8919 — 0,6302 [1]
РЬу/тст 0,892 - 0,6304 [2]
Tb4Sb3 Th3P4 <?/28, 0,717 - - [И
74 3J
TbSb NaCl cF8, 0,6178 — — [1]
Fm'Sm 0,616 - - [3]
0,617 — — [4]
0,6181 — — [5. 3J
IbSb/ - - 0,6123 0,6969 1,772 [6]
Ромбическая сингония.
Литература
1. Abdusalymova M.N., Bvrnashev О.’Т Mironov К.Е. И J. Less-Common Met. 1981. V. 77
n ’. р. si <
2. Rieger W., Parte E. '< Acta Cry^aik F 1968. V. 24. P. 456-458.
3. Кузьмин P.H., Никитина C.B. /,' Kp..rталлография. 1963. Г. 8. С. 453-454.
4. Child H R., Wilkinson М,К., Cable JAV. // °hys. Rev. 1963. V. 131. P. 922-931.
5. Landelii A.//Att* Accad. Naz. Line. Rend. C. Sci. Fiz. Mat. Nat. 1964. V. 37 P. 160-164.
6. Eatough N.L., Hall K.T // Inorg. Chem. 1969. V. 8. N 7. P. 1439-1445.
Н.И. i
Sb-Те. СУРЬМ А-ТЕЛ Л УР
На рис. 557 приведена диаграмма состояния Sb-Te по данным работы
[1]. Сплавы готовили в кварцевых ампулах с использованием Sb и Те
чистотой 99,999 % (по массе). Исследование проводили методами
термического и микроструктурного анализов.
Sb-Те
239
$b Те, % fam.) Те
Рис. 557. Sb-Те
Согласно работе [1] эвтектическая точка, обнаруженная ранее при
29 % (ат.) Те [X], является точкой минимума на кривых ликвидуса и
солидуса. Она находится при температуре 540 °C. В сплавах системы
имеет место перитектическое превращение при температуре 548 °C и
эвтектическое при температуре 424 °C и концентрации -89 % (ат.) Те.
Соединение Sb2Te3, обнаруженное в данной системе, плавится конгруэн-
тно при 618 °C. По данным других работ температура его плавления
составляет 616 °C [2], 621 °C [3], 630 °C [4]. Результаты работы [1]
согласуются с данными работы [3], в которой в области концентрации
11-60 % (ат.) Те также установлено наличие только одной промежуточ-
ной фазы б в отличие от работы [2], где в данной области концентраций
обнаружены две промежуточные фазы. Растворимость в твердом
состоянии Те в Sb в работе [Ш] установлена равной 0,005 % (ат.), а по
данным работы [2] она составляет 1 % (ат.) Те при температуре 500 °C.
Соединение Sb2Te3 имеет кристаллическую структуру типа Bi2Te3
(символ Пирсона hR5, пр.гр. R3т), параметры решетки: а = 0,4264 нм,
с = 3,042 нм [4]; а = 0,4273 нм, с = 2,9445 нм при концентрации 33,3 % (ат.)
Те и а = 0,4264 нм, с = 3,0428 нм при концентрации 60,0 % (ат.) Те [5].
Литература
1. Matsumura Akira, Hayashi Akio // Sumitomo Electrical. Technical. Review. 1968. Nil.
P. 103-111.
2. Абрикосов H.X., Порецкая Л.В., Иванов И.П. //Журнал неорганической химии. 1959.
Т. 4. С. 2525-2550.
3. Порецкая Л.В., Абрикосов Н.Х., Глазов В.М. И Журнал неорганической химии. 1963.
Т. 8. N 5. С. 1196-1198.
4. Кузнецов В.Г., Палкина К.К. И Журнал неорганической химии. 1963. Т. 8. N 5.
С. 1204-1218.
5. Brown A., Lewis В. И J. Phys. Chem. Solids. 1962. V. 23. Р. 1597-1604.
Н И. Никитина
240
Sb-Th, Sb-Ti
Sb-Th. СУРЬМА-ТОРИЙ
Диаграмма состояния Sb-Th не построена. В системе Sb-Th найдено
три соединения: ThSb2, Th3Sb4 и ThSb. Сплавы готовили прямым
синтезом из элементов при температуре около 1000 °C. Для приготовле-
ния сплавов использовали Sb чистотой не менее 99,9 % (по массе) и Th
чистотой -99,7 % (по массе). В работе использовали метод рентгеновско-
го анализа [1]. Характеристики кристаллических решеток соединений
приведены в табл. 451.
Таблица 451. Кристаллическая структура соединений системы Sb-Th fl, Щ
Соединение Прототип Символ Пирсона, пр.гр. Параметры решетки, нм
a с
ThSb2 CujSb tP6, P4lnmm 0,4353 0,9176
Th3Sb4 Th.P4 c/28, /4 3d 0,9372 —
ThSb NaCl cF8, Fm3m 0,6318 -
Растворимость Th в жидкой Sb по данным работы [Э] приводится
ниже:
Температура. °C ............ 900 850
Растворимость Th:
% (ио массе) ............. 1,6
% (ат.) .................. 9,53
800 750 700 550
- 0,1 <0,05 <0,05
0,16 0,05 <0,02 <0,02
Литература
J. Ferro R. /7 А» Спи ik-gr. 1956 V. 9. N 10. Р. 817-818.
Н.И Никитина
Sb-Ti. СУРЬМА-ТИТАН
Диаграмма состояния Sb-Ti практически не исследована, определены
только стехиометрия и структура интерметаллических соединений,
образующихся в этой системе [1, 2]. Обобщение имеющихся данных
позволило в работе [М] предположить вариант диаграммы состояния,
Sb-Ti
241
Ti Sb, °/* (am ) Sb
Рис. 558. Sb-Ti
представленный на рис. 558. В сплавах системы образуется семь
интерметаллических соединений, из которых наиболее устойчивы Ti3Sb,
TiSb и TiSb2. Кроме того, в сплавах системы образуются еще следующие
соединения: Ti4Sb, Ti? 5Sb, Ti5Sb3, Ti6Sb5.
Кристаллическая структура соединений представлена в табл. 452.
Т а б л и и а 45?. Кристаллическая структура соединений системы Sb-Ti
Се едине- ние Г——' Прото- тип Символ Пирсона, пр.гр. Параметры решетки, нм Источник
а Ь с
Ti4Sb Ni3Sn ;> ?я ТЬт/ттс 0,5964 0,4798 ПЛ]
Ti3Sb Cr3Si сРЗ, РтЗп 0,5217 - - [3]
Ti25Sb Cu2Sb tPb, Р4/птт 0,401 - 1,45 [Э]
242
Sb-Ti, Sb-Tl
Соедине- ние Прото- тип Символ Пирсона, пр.гр. Параметры решетки, нм Источник
а b с
Ti5Sb3 - оР*, Ртта, Ртс2\ или Рта2 1,0172 0,8346 0,7135 [Ш,П]
Ti6Sb5 - оР*, РЬат или РЬа2 1,455 1,634 0,531 [Ш,П]
TiSb AsNi hP4, РЩттс 0,4115 0,398 - 0,6264 0,617 [Ш,П] [Э]
TiSb2 Al?Cu //12, 14!тст 0,666 - 0,581 [П]
Соединение TiSb, по данным работы [2] гомогенно в интервале
составов 66,2-67,1 % (ат.) Sb.
Литература
1. Nowotny Н., I’esl J. // Monatsh. Chem. 1951. Bd. 82. S. 336-343.
2. Donaldson J.D., Kjekshus A., Nicholson D.S., Rakke F. // J. Less-Common Met. 1975. V. 41.
P. 225-263.
П.Б. Будберг
Sb-Tl. СУРЬМА-ТАЛЛИЙ
Диаграмма состояния Sb-Tl исследована в работе [Г] методами
дифференциального термического, микроструктурного и рентгеновско-
го анализов. Сплавы синтезировали в эвакуированных кварцевых
ампулах, используя Sb чистотой 99,9995 % (по массе) и Т1 чистотой
99,9998 % (по массе).
Диаграмма состояния сплавов системы по данным работы [1]
приведена на рис. 559. Диаграмма относится к эвтектическому типу.
Эвтектика фТ1) + TiSb кристаллизуется при температуре 193 °C.
Содержание Sb в эвтектике составляет 29,2 % (ат.). Максимальная
растворимость Sb в (РТ1) при температуре эвтектики составляет 23,8 %
(ат.). В системе обнаружено два соединения: Tl3Sb и TiSb. Соединение
TISb образуется по перитектической реакции при температуре 195 °C.
При температуре 191 °C оно распадается на смесь (pTi) + (Sb). Из этой
смеси при температуре 187 °C образуется соединение TI3Sb.
Sb-Tl
243
TI Sb, °/o fa07J Sb
Рис. 559. Sb-Tl
(PTI) претерпевает эвтектоидный распад при температуре 125 °C на
фазу у и соединение TkSb. Эвтектоидная точка расположена при
содержании 16,5 % (ат.) Sb. Фаза у образуется по перитектоидной
реакции при температуре 152 °C и содержании 8 % (ат.) Sb. Раствори-
мость Sb в (аТ1) при 20 °C составляет 1,6 % (ат.). В более ранних работах
[2,3] с использованием метода рентгеновского анализа было установлено
существование при комнатной температуре следующих фаз: (аТ1) с
содержанием до I % (ат.) Sb, фазы с ГЦК решеткой, стабильной при
содержании Sb около 10 % (ат.) и соединения Tl7Sb2 при 22 % (ат.) Sb.
Результаты исследований [2, 3] в общем согласуются с более поздним
исследованием (1], при этом фаза с ГЦК решеткой и Tl7Sb2 по данным
работы (2, 3| соответствуют фазе у и Tl3Sb по данным работы [1].
Соединение TI3Sb имеет структуру типа 1 l7Sb2 (символ Пирсона cl 54,
пр.гр. 1тЗт), параметр решетки а - 1,161 нм [1] или а = 1,159 нм [3].
Литература
I. Predel В., Schwermann W. /7 Z. Naturforsch. А. 1970. Bd. 25. N 6. S. 877-886.
2. Suganuma RJ. I/ J. Phys. Soc. Japan. 1960. V. 15. P. 1395-1409.
3. Persson E., Westgren A. // Z. Phys. Chem. 1928. Bd. 136. S. 208-214.
Н.И. Никитина
244
Sb-Тт
Sb - Tm. СУРЬМА - ТУЛИЙ
Диаграмма состояния Sb - Tm исследована в работе [1] методами
дифференциального термического, микроскопического и рентгеновско-
го анализов. Построенная диаграмма представлена на рис. 560. Она
характеризуется образованием трех соединений: Tm5Sb3, TmSb и TmSb2.
Одно из этих соединений TmSb плавится конгруэнтно при 2020 °C, а два
других образуются по перитектическим реакциям (1640 и 640 °C).
СоединениеТтБЬперетерпеваетполиморфное превращение при 1780 °С5
а соединение Tm5Sb3 - при 1620 °C. В системе имеют место два
эвтектических превращения - при температуре 1180 °C и концентрации
15 % (ат.) Sb и при температуре 620 °C и концентрации более 99 % (ат.)
Sb. Растворимость Sb в твердом Тпггне превышает согласно работе [1]
1,5 % (ат.). Ранее в системе было установлено только образование
Sb,*/*(по массе)
Гт St, (am) Sb
Рис. 560. Sb-Tm
Sb-Тт, Sb-U
245
соединения TmSb [Э]. Кристаллическая структура установлена только
для соединений Tm5Sb3 и TmSb (табл. 453).
Таблица 45 3. Кристаллическая структура соединений системы Tm - Sb
Соединение Прототип Символ Пирсона, пр.гр. Параметры решетки, нм Источник
а с
Tm5Sb3 Mn5Si3 ЛР16, РЬ^тст 1,010 0,4173 [1]
TmSb NaCl cF8, 0,619 — [1]
Fm Зт 0,6083 — [Э]
0,6091 — [Э]
Литература
1. Абдусалимова М.Н., Рахматов О.П., Фазлыева Н.Д., Чуйко А.Г. И Изв. АН СССР.
Неорганические материалы. 1991. Т. 27.N 8. С. 1650-1652.
Л.Л. Рохлин, Н.И. Никитина
Sb - и. СУРЬМА - УРАН
Информация о взаимодействии Sb с U приведена в работах [X, Э, Ш].
Диаграмма состояния Sb - U по данным работы [1] приведена на рис. 561.
Сплавы готовили индукционной и дуговой плавкой. Для приготовления
сплавов использовали высокочистый реакторный U с содержанием
примесей: 0,04 % (по массе) С и 0,02 % (по массе) Fe и высокочистую Sb
(99,99 % (по массе)). Исследование проводили методами металлографи-
ческого, термического и рентгеновского анализов.
В системе обнаружено четыре соединения: U4Sb3 (фаза б), USb, U3Sb4
и USb2. Соединения U4Sb3 и USb плавятся конгруэнтно при 1800 и
1850 °C соответственно. Соединения U3Sb4 и USb2 образуются по
перитектическим реакциям при температурах 1695 и 1355 °C. Между
соединениями U4Sb3 и USb образуется эвтектика при температуре
1770 °C и концентрации 47 % (ат.) Sb. Соединение U4Sb3 имеет область
гомогенности приблизительно 1,5 % (ат.) при температуре 1770 °C.
Характер реакций между U, соединением U4Sb3 и жидкостью, а также
между Sb, соединением USb2 и жидкостью не определен. Температуры
реакций идентичны температурам плавления U и Sb. Растворимость Sb
в (aU), (PU) и (yU) составляет 0,02 % (ат.), 0,1 % (ат.) и 0,05 % (ат.)
246
Sb-U
U Sb,7o(am) Sb
Рис. 561. Sb-U
соответственно при температурах 620, 720 и 825 °C. Растворимость U
в жидкой Sb изменяется от 0,1 % (ат.) при 650 °C до 1,5 % (ат.) при 900 °C
и 31,2 % (ат.) при температуре 1355 °C. В работе [Э] даны следующие
значения растворимости U в жидкой Sb:
Температура, °C......................
Растворимость, U % (ат.).............
900 850 800 750 700 650
1,5 0,9 0,4 0,26 0,15 0,05
В работе [4] для соединения U3Sb4 приведен диапазон значений
параметра решетки, что указывает на наличие у него определенной
области гомогенности.
Кристаллическая структура соединений приведена в табл. 454.
Sb-U, Sb-V
247
Таблица 45 4. Кристаллическая структура соединений системы Sb-U
Соедине- ние Прототип Символ Пирсона, пр.гр. Параметры решетки, нм Источник
a с
U4Sb3 - hP*, Ptymcm или Р6с2 0,9268 0,6201 [1]
USb NaCl cFfi, Fm3m 0,6191 0,618 - [2] [3]
U3Sb4 Th3P4 с128, I43d 0,9095 0,9120- 0,9109 — [2] [4]
USb2 Cu2Sb tP6, РЫптт 0,4272 0,8471 [5]
Литература
1. Beaudry B.J., Daane А.Н. //Trans. AIME. 1959. V. 215. Р. 199-203.
2. Ferro R. П Atti Accad. Naz. Line. Rend. C. Sci. Fiz. Mat. Nat. 1952. V. 13. P. 53-61.
3. Warren J.H., Price E.E. // Canad. Metall. Quart. 1964. V. 3. P. 183-196.
4. Warren J.H., Price E.E. // Canad. Metall. Quart. 1964. V. 3. P. 245-256.
5. Ferro R.//Atti Accad. Naz. Line. Rend., C. Sci. Fiz. Mat. Nat. 1952. V. 13. P. 151-157.
Н.И. Никитина
Sb - V. СУРЬМА - ВАНАДИЙ
Диаграмма состояния Sb - V не построена. Имеются сообщения лишь
об образовании соединений [X, Э, Ш], кристаллическая структура
которых указана в табл. 455.
Таблица 45 5. Кристаллическая структура соединений системы Sb-V
Соединение Прототип Символ Пирсона, пр.гр. Параметры решетки, нм Источник
а с
VSb2 A12Cu t/12,14/mcm 0,656 0,564 [X]
VSb NiAs hP4, Рб^/ттс 0,4270 0,5447 [2]
V3Sb Cr3Si cP8, Pm3n 0,4932 0,49335 — [Э] [Э]
248
Sb-V, Sb-W, Sb-Y
Согласно работе [1] Sb2V образуется по перитектической реакции при
900 °C, имеется вероятность полиморфного превращения в Sb2V при
870 °C. Согласно работе [Ш] SbV имеет значительную область гомоген-
ности.
Литература
1. Дудкин Л.Д., Вайданич В.И. // Физика твердого тела. 1960. Т. 2. С. 404-405.
2. Grison В., Beck Р.А. И Acta Crystallogr. 1962. V. 15. Р. 807-808.
Г. К. Алексеенко
Sb - W. СУРЬМА - ВОЛЬФРАМ
Диаграмма состояния Sb - W не построена. Данные различных
исследователей противоречат друг другу. Согласно работе [1] в системе
может быть синтезировано соединение WSb (60,17 % (по массе) W) путем
электролиза окиси Sb и вольфрамового ангидрида в ванне расплавленной
буры и фтористого натрия. В более поздней работе [2] при изучении
системы в интервале концентраций 50-100 % (ат.) W установлено, что
компоненты слабо взаимодействуют друг с другом, и эквиатомного
соединения (типа NiAs) в системе не образуется, что, по-видимому,
больше соответствует действительности.
Литература
1. Weiss G.//Ann. Chim. 1946. V. 1. N 4. Р. 446.
2. Boiler H., Nowotny H. И Monatsh. Chem. 1964. Bd. 95. S. 1272-1282.
К.Б. Поварова
Sb - У. СУРЬМА - ИТТРИЙ
В работах [Ш, Э] сообщалось лишь о существовании соединения YSb.
В работе [1] построена диаграмма состояния Sb-Y (рис. 562) во всем
интервале концентраций.
Исследование проведено с использованием термического, рентгенов-
ского и микроструктурного методов анализа.
Температура полиморфного превращения а « 0 чистого Y при
добавлении Sb снижается на 16 °C. Sb растворяется в Y незначительно.
Эвтектика существует при концентрации 14,5 % (ат.) Sb и температуре
1220 °C. Добавление Y понижает температуру плавления Sb. При
температуре 629 °C имеет место эвтектическая реакция.
Sb-Y
249
Y Si, */• (am.) Sb
Рис. 562. Sb-Y
В системе обнаружено четыре соединения. Фаза YSb плавится
конгруэнтно при 2310 °C, остальные образуются по перитектическим
реакциям соответственно при 1240 °C (Y3Sb), 1690 °C (Y5Sb3) и 2120 °C
(Y4Sb3). Фаза Y4Sb3 эвтектоидно распадается при 1660 °C.
Кристаллографические характеристики соединений приведены в
табл. 456. В работе [V-C] сообщается также о соединении Sb2Y, которое
не подтверждено данными работы [1].
Таблица 45 6. Кристаллическая структура соединений системы Sb-Y (1, V-C]
Соединение Прототип Символ Пирсо- на, пр. гр. Параметры решетки, нм
а с
YSb NaCl cF8, Fm Зт 0,61645 -
Y4Sb3 Анти - Th3P4 с/28, /43d 0,91390 -
Y5Sb3 Mn5Si3 hP\6, Рб^/тст 0,89114 0,62960
Y3Sb Ti3P lP32, Р4^п 1,2361 0,6180
250
Sb-Y, Sb-Yb
Литература
1. Schmidt F.A., McMasters О.D.// J. Less-Common Met. 1970. V. 21. P. 415-425.
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
Sb - Yb. СУРЬМА - ИТТЕРБИЙ
Система Sb - Yb исследовалась неоднократно [Э, Ш], в работе [1]
приведена полная диаграмма состояния Sb - Yb (рис. 563). Сплавы в
основном получали сплавлением компонентов с последующим гомогени-
зирующим отжигом.
В системе существует шесть соединений. Интерметаллиды Yb4Sb3 и
YbSb2 плавятся конгруэнтно при температурах 1540 и 845 °C соотве-
Рис. 563. Sb-Yb
Sb-Yb
251
тственно. Другие соединения образуются по перитектическим реакциям:
Yb5Sb2 при - 1430 °C, Yb5Sb3 при ~ 1520 °C, Yb5Sb4 при - 1400 °C и
YbSb при - 800 °C.
Температуры реакций найдены путем изучения фазового состава
образцов с различным содержанием компонентов, закаленных от разных
температур. Соединение Yb5Sb4 существует в двух модификациях: при
1030 °C ромбическая структура переходит в тетрагональную. Согласно
работе [2], Yb5Sb2 не существует, а является низкотемпературной
модификацией Y5Sb3. Высокотемпературная модификация существует
в интервале температур от 1350 до 1520 °C. На образцах, закаленных
выше 1350 °C, установлено, что Yb5Sb3 имеет гексагональную структуру
типа Mn5Si3. Низкотемпературная фаза Yb5Sb3 кристаллизуется в
ромбической структуре типа анти - U3S5 [2].
В приведенной системе Sb - Yb состав и температура эвтектик точно
не определялись. Наличие областей существования твердых растворов
не рассматривалось. Линия ликвидуса построена схематично на
основании изучения закаленных образцов. В работе [3] состав фазы
Vb5Sb4 указан как Yb; |Sb10.
Кристаллографические характеристики соединений приведены в
табл. 457.
Таблица 457. Кристаллическая структура соединений системы Sb - Yb
Соедине- ние Прототип Символ Пирсона, пр.гр. Параметры решетки, нм Источник
a b c
Yb5Sb2 Yb5Sb2 oP , Pnma 1,232 0,960 0,832 [1]
Yb5Sb3 Mn5Si3 hP\f>, Рбу/тст 0,8995 - 0,6870 ll]
Yb4Sb3 Th3P4 c/28,143d 0,9320 - - m
aYb5Sb4 - ll , I4lmmm 1,190 - 1,706 in
pYb5Sb4 - oP*, Pnma или Pnl^a 0,813 1,597 2,439 [и
YbSb NaCl cF8, Fm 3m 0,60785 — — [i]
0,5922 — — [Э]
0,6079 — — [Э]
YbSb2 ZrSi2 oC\2, Cmcm 0,4536 1,663 0,4271 [1]
YbjjSbjQ Ho„Ge10 tl?>4, IMmmm 1,186 - 1,710 13]
252
Sb~Yb, Sb-Zn
Литература
1. Bodnar R., Steinfink H. // Inorg. Chem. 1967. V. 6. N 2. P. 327-330.
2. Hulliger F. // Handbook on the Physics and Chemistry of Rare Earth. Amsterdam: North-
Holland Publ. Co., 1979. P. 153-237.
3. Clark H.L., Simpson H.D., Steinfink H. // Inorg. Chem. 1970. V. 9. N 8. P. 1962-1964.
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
Sb-Zn. СУРЬМА-ЦИНК
Обзор ранних исследований диаграммы состояния Sb-Zn дан в работе
[X]. В дальнейшем были проведены дополнительные исследования этой
системы |Э, Ш, 1-8]. Система характеризуется наличием эвтектических
превращений со стороны Sb и Zn и образованием соединений в довольно
узкой области концентраций: от 50 до 60 % (ат.) Zn. Соединения имеют
формулы ZnSb, Zn4Sb3 и Zn3Sb2 и претерпевают полиморфные
Рис. 564. Sb-Zn
Sb-Zn
253
превращения. Наиболее существенные расхождения между результатами
работ различных исследований имеют место в области концентраций,
в которой образуются эти соединения. Они касаются температур и
реакций, по которым они образуются (по перитектическим или
непосредственно из расплава), а также реакций в этой части системы в
твердом состоянии и диапазонов температур устойчивости фаз.
Указанные расхождения в результатах исследований возможно обу-
словлены склонностью сплавов системы к протеканию метастабильных
реакций.
Представленная на рис. 564 диаграмма состояния Sb-Zn построена
в основном согласно последним, тщательно выполненным исследованиям
[6,7]. Эти исследования касались части диаграммы в области концентра-
ций, соответствующей образованию соединений в системе (50-65 % (ат.)
Zn) (см. вставку на рис. 564). Вне этой области концентраций данные
работ [6, 7] при построении диаграммы были дополнены данными
работы [X], в которой приведенные основные сведения в областях со
стороны Sb и Zn можно было считать достаточно надежными. Для
построенной диаграммы состояния характерно образование ZnSb (фаза
Р) по перитектической реакции при 545 °C, в то время как по данным
работы [1] она образовывалась непосредственно из расплава. Два других
соединения: Zn4Sb3 (фаза б) и Zn3Sb2 (фаза 0 образуются непосредствен-
но из расплава, в то время как по данным работы [X] Zn4Sb3 образуется
по перитектической реакции. Соединение ZnSb не претерпевает
полиморфного превращения. Соединение Zn4Sb3 образует две модифика-
ции: б и с, а соединение Zn3Sb2 - также две модификации: £ и ц, в то время
как в работе [X] указывается на наличие трех модификаций у соединения
Zn3Sb2. Соединение Zn3Sb2 неустойчиво при комнатной температуре и
эвтектоидно распадается при 409 °C. Эвтектическое превращение со
стороны Zn имеет место при температуре 411 °C и концентрации 98,6 %
(ат.) Zn (со стороны Sb - при 505 °C и 32 % (ат.) Zn). Согласно работам
[6, 7] в системе образуется еще одна промежуточная фаза у, которую
нельзя отнести ни к одному из трех вышеупомянутых соединений. Она
образуется перитектоидно при 527 °C и распадается эвтектоидно при
500 °C. Температура полиморфного превращения Zn4Sb3 (б * е)
составляет 493 °C со стороны ZnSb и практически совпадает с температу-
рой этого превращения со стороны Zn3Sb2. Температура полиморфного
превращения Zn3Sb2 равна 440 °C со стороны Zn4Sb3 и 455 °C со стороны
Zn. Характеристики кристаллической структуры промежуточных фаз
указаны в табл. 458.
По кристаллическим структурам Zn4Sb3 и Zn3Sb2 имеются существен-
ные разногласия между результатами отдельных работ. Кроме того, в
ряде случаев имеются сомнения, что они относятся к низкотемператур-
ным модификациям.
254
Sb-Zn, Sb-Zr
Таблица 458. Кристаллическая структура соединений системы Sb-Zn
Соедине- ние Прототип Символ Пирсона, пр.гр. Параметры решетки, нм Источник
а b с
ZnSb CdSb оР16, 0,6202 0,7742 0,810 [2]
(Р) РЬса 0,6218 0,62016 0,7741 0,77416 0,8115 0,80995 [1] [Ш]
Zn4Sbj - тС', 0,825 0,123 1,0897 [Э]
(е) гексагон. 1,072 — 0,354 [9]
Zn4Sb3 (с) Zn4Sb3 hR22, R3c 1,2233 - 1,2428 [8]
- оР2Ъ, Рппт 0,7981 0,7495 1,072 [1]
Zn3Sb2 (п) - оГ, 2,50 1,46 0,76 [81
Zn3Sb2 (л) Монок линная синп оРЗЪ, Рппт >ния, Р = 99 0,8032 5°. 0,7322 1,134 [1]
Литература
I. Добрыдень К.А. И Изв. АН СССР. Неорганические материалы. 1983. Т. 19. N 4.
С. 549-557.
2. Carter F.L., Mazelsky R. //J. Phys. Chem. Solids. 1964. V. 25. P. 571-581.
3. Бокий Г.Б., Клевцова Р.Ф. И Журнал структурной химии. 1965. Т. 6. С. 866-871.
4. Tydlitat V. И Czechoslov. J. Phys. 1959. V. 9. N 5. Р. 638-640.
5. Алейникова К.Б., Игнатьев Н.А., У гай Я.А. и др. // Полупроводниковые материалы
и их применение: Сб. статей. Воронеж: Изд-во Воронежского ун-та, 1971. С. 21-25.
6. Koneska S., Mavrodiev G. И Fizica. 1980. V. 12. N 1. P. 137-142.
7. Koneska S.//Fizica. 1980. V. 12. N 1. P. 143-147.
8. Mayer H.W., Mikhail I., Schubert K.//J. Less-Common Met. 1978. V. 59 . N 1. P. 43-52.
9. Келоглу Ю.П., Федорко A.C. // Журнал физической химии. 1962. Т. 36. N 11.
С. 2544-2547.
Л.Л. Рохлин
Sb-Zr. СУРЬМА-ЦИРКОНИЙ
Диаграмма состояния Sb-Zr в полном объеме концентраций не
построена. Предполагаемая диаграмма состояния Sb-Zr в интервале
концентрации 0-40 % (ат.) Sb приведена в обзоре [X]. Участок от 0 до
Sb-Zr
255
20 % (ат.) Sb уточнен в работе [1] и показан на
рис. 565. Sb повышает температуру 0 - а-
превращения Zr на -10 °C, что приводит к
протеканию перитектоидной реакции при
-873 °C. Растворимость Sb в aZr 0,6 % (ат.)
[!]•
В сплавах Sb-Zr различными исследовате-
лями идентифицированы интерметаллиды
ZrSb2 [2,3]; Zr5Sb3 [4,5]; Zr2Sb, существующий
в двух модификациях [4]; Zr3Sb [4]. Авторы
работ [7, 11], используя различные методы
получения сплавов Sb-Zr (дуговая плавка и
отжиг сплавов, спекание прессовок из порош-
ков компонентов, транспортные реакции в
газовой фазе) и рентгеновский анализ, под-
твердили существование и структуру ранее
найденных промежуточных фаз, перечислен-
ных выше, и нашли новые фазы: ZrSbj^,
Zr2Sb3, ZrSb, ZrSb| 96.
Zr2Sb имеет очень малую область гомоген-
ности и существует в двух модификациях.
Низкотемпературная модификация Zr2Sb
получена при отжиге сплавов при 950 °C [7]
или 1000 °C [4]. Высокотемпературная моди-
фикация Zr2Sb получена в сплаве после
отжига при 1150 °C [4] или при 1200 °C [7].
Она является субстехиометрической фазой
Zr зь,*7» (ат.}
Рис. 565. Sb-Zr
состава Zq 94Sb, ее кристаллическая структура ромбическая, структур-
ный тип ее не установлен.
Обнаружены две модификации фазы Zr5Sb3.
Низкотемпературная модификация Zr5Sb3 согласно работам [7, 8]
имеет состав Zr5Sb3+v (0 < х < 0,4). Это бинарная фаза системы Sb-Zr,
а не стабилизированная кислородом, как предполагали в работе [4], хотя
решетка ее пригодна для внедрения атомов других элементов [9]. В
присутствии кислорода (сплавы, полученные спеканием порошков в
тиглях из ZrO2) параметры решетки значительно меньше (а = 0,83146,
с = 0,56954 нм [7]). Высокотемпературная модификация Zr5Sb3 образуется
инконгруэнтно при плавлении сплавов Zr5Sb3+Y при 0 < х < 0,2. Она
практически не обладает областью гомогенности.
Новая промежуточная фаза ZrSb, найденная авторами работ [7, 10],
также имеет две модификации. С богатой Zr стороны она описывается
как ZrSbj_Y, обладает примитивной кубической решеткой типа FeSi. С
256
Sb-Zr
богатой Sb стороны стехиометрическая фаза ZrSb имеет ромбическую
решетку нового структурного типа ZrSb.
В равновесии с ZrSb находится фаза Zr2Sb3, впервые обнаруженная
в работе [7].
Фаза ZrSb] 96 является модификацией фазы ZrSb2 и была получена
при взаимодействии порошков компонентов при 700-800 °C в запаянном
кварцевом контейнере с Cdl2 в качестве транспортного вещества [11].
Кристаллическая структура соединений приведена в табл. 459.
Таблица 459. Кристаллическая структура соединений системы Sb-Zr
Соедине- ние Прототип Символ Пирсона, пр.гр. Параметры решетки, нм Источник
a b c
Zr3Sb Ni3P Г/32, /4 1,135 1,1351- 1,13386 - 0,567 0,5671- 0,5669 [4, 6] [7]
Zr2Sb(HT) La2Sb 1П2, I4lmmm 0,41154 - 1,57786 [7]
Zr2Sb(BT)* - - 1,4652 0,9058 0,7756 [7]
Zr5Sb3(HT) Mn5Si3 ЛР16, Pb-Jmcm 0,846 0,84267 - 0,580 0,57856 [5] [8]
Zr5Sb3(BT) Y5Bi3 оРЪ2, , Pnma 0,7465 0,8801 1,0865 [7, 8]
ZrSb,_x FeSi cPS, P2(3 0,56358 - - [7]
ZrSb ZrSb oC24, Cmcm 0,3827 1,4020 1,0426 1,0406 1,4007 0,38394 [H] [10]
Zr2Sb3 - tP*, 0,9651 - 0,5288 [7]
ZrSb] PbCl2 oP\2, Pnma 0,7393 0,39780 0,9581 [H]
ZrSb2 TiAs2 oP24, Pnnm 1,498 1,3203 1,4963 0,994 0,89147 0,9963 0,386 0,34793 0,38779 [2] [3] [7]
Ромбическая сингония.
Sb-Zr. Sc-Se, Sc-Si
257
Литература
1. Betterton J.O., Spicer W.M. // Trans AIME. 1958. V. 212. N 4. P. 456-457.
2. Eberle D., Schubert K. // Z. Metallkunde. 1968. Bd. 59. N 4. S. 306-308.
3. Kjekshus A. // Acta Chem. Scand. 1972. V. 26. N 4. P. 1633-1639.
4. Rossteutscher W., Schubert К. И Z. Metallkunde. 1965. Bd. 56. N 11. S. 813—822.
5. Boiler H„ Parthd E. // Monatsh. Chem. 1963. Bd. 94. N 1. S. 225-226.
6. Schubert K., Raman A., Rossteutscher W. // Naturwissenschaften. 1964. Bd. 51. N 21.
S. 506-507.
7. Garcia E., Corbett J.D. //J. Solid State Chem. 1988. V. 73. N 2. P. 440-451.
8. Garcia E., Corbett J.D.// Inorg. Chem. 1988. V. 27. N 13. P. 2353-2359.
9. Garcia E., Corbett J.D. // Inorg. Chem. 1988. V. 27. N 17. P. 2907-2908.
10. Block H., Jeitschko W. //Z. Krist. 1988. Bd. 182. N 1-4. S. 27-28.
11. Garcia E., Corbett J.D.//J. Solid State Chem. 1988. V. 73. N 2. P. 452-467.
Л.А. Третьяченко
Sc-Se. СКАНДИЙ-СЕЛЕН
Диаграмма состояния Sc-Se не построена. Установлено существование
соединения Sc2Se3, которое, согласно ранним работам, имеет гранецен-
трированную кубическую решетку типа у1 А12О3 с параметром 0,5416 нм,
производную от цинковой обманки ZnS с недостатком Sc [Э]. Позднее
было показано, что соединение Sc2Se3 имеет структуру собственного типа
(символ Пирсона tzF80, пр.гр. Fddd) и следующие параметры решетки:
а = 1,0832 нм, b - 0,7658 нм, с - 2,2974 нм [Ш]. В работе [1] указывается,
что соединения ScSe не существует.
Литература
1. Меньков А.А., Комиссарова Л.Н., Симаков Ю.П. и др. И Доклады АН СССР. 1961.
Т. 141. N 2. С. 364-367.
Л. С. Гузей
Sc-Si. СКАНДИЙ-КРЕМНИЙ
Диаграмма состояния Sc-Si построена в работе [1]. Сплавы получали
плавлением шихты в дуговой печи на медном водоохлаждаемом поду с
нерасходуемым вольфрамовым электродом в среде геттерированного
аргона. В качестве исходных компонентов применяли Sc чистотой
99,85 % (по массе) Sc и Si - не менее 99,9 % (по массе) Si. Исследова-
258
Sc-Si
Sr Si, °/o (ал?.) Si
Рис. 566. Sc-Si
ние проводили методами рентгеновского, дифференциального
термического и микроструктурного анализов.
Диаграмма состояния системы Sc-Si показана на рис. 566. Силицид
Sc5Si3 плавится конгруэнтно при -2060 °C, остальные соединения
образуются по перитектическим реакциям: ScSi при температуре 1786 °C,
a ScSi 15 - при 1260 °C.
Соединение ScSi । 5 претерпевает полиморфное превращение при
температуре 1070 °C и эвтектоидно распадается при 925 °C на ScSi и (Si).
Совместная эвтектическая кристаллизация силицида ScSi j 5 и твердого
раствора на основе Si осуществляется при 1155 °C. В эвтектике
содержится 77 % (ат.) Si. Установлено, что высокотемпературная
модификация ScSi 15 (0) не сохраняется в литых сплавах при охлаждении
расплава на медном водоохлаждаемом поду. Силицид Sc5Si3 и твердый
раствор на основе (aSc) совместно кристаллизуются при 1270 °C. В
эвтектике содержится 12 % (ат.) Si. Взаимная растворимость компонентов
составляет менее 1 % (ат.). Фазы на основе силицидов Sc5Si3, ScSi и ScSi 15
заметной области гомогенности не имеют.
Кристалллографические характеристики соединений приведены в
табл. 460.
Sc-Si, Sc-Sm
259
Таблица 460. Кристаллическая структура соединении системы Sc-Si (2J
Соединение Прототип Символ Пирсона, пр.гр. Параметры решетки, нм
а b с
Sc5Si3 MnsSi3 АР16, Рб-Jmcm 0,7861 - 0,5812
ScSi CrB оСЪ, Стет 0,3958 0,9882 0,3659
ScSi ] 5 aib2 hP3, РЫттт 0,366 - 0,387
Литература
1. Малешевич К.А. И Автореф. дис... канд. техн. наук. Киев, 1989.
2. Гладышевский Е.И., Бодак О.И. // Кристаллохимия интерметаллических соединений
редкоземельных металлов. Львов: Вища школа, 1982. 255 с.
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
Sc-Sm. СКАНДИЙ-САМАРИЙ
Фазовая диаграмма состояния Sc-Sm отсутствует. Однако Sc и Sm
имеют близкое электронное строение с тремя коллективизированными
З^/14s-2 и 5</б52 электронами соответственно, а также изоструктурные
низкотемпературные (ГПУ) и высокотемпературные (ОЦК) модификации
с достаточно близкими параметрами решеток. Их атомные радиусы
различаются приблизительно на 10 %.
Вледствие близости электронного кристаллического строения и
атомных радиусов можно предположить, что Sm и Sc должны образовы-
вать непрерывные ряды низкотемпературных гексагональных плотноупа-
кованных и высокотемпературных объемно центрированных кубических
твердых растворов. Тем не менее имеющееся различие в атомных
радиусах обоих металлов приводит к возникновению минимума на линии
сольвуса, как и в системах Nd-Sc и Gd-Sc [1, М] (рис. 567). При
температуре ниже 734 °C можно предполагать образование области
ограниченных твердых растворов на основе aSm.
260
Sc-Sm, Sc-Sn
Рис. 567. Sc-Sm
Литература
1. Gschneidner, Jr., K.A., Calderwood F. W. // Handbook on the Physics and Chemistry of Rare
Earths. Amsterdam, New York, Oxford, Tokyo: North-Holland Physics Publishing Co., 1986.
V. 8. Chap. 54. P. 1-161.
B.K. Григорович
Sc-Sn. СКАНДИЙ-ОЛОВО
Диаграмма состояния Sc-Sn не построена. В работе [1] сообщено о
существовании соединения Sc5Sn3 со структурой типа Mn5Si3 (символ
Пирсона hPl6, пр.гр. Ptymcm), параметры решетки а - 0,8408 нм, с -
= 0,6081 нм.
Литература
1. Гладышевский Е.И., Бодак О.И. И Кристаллохимия интерметаллических соединений
редкоземельных металлов. Львов: Вища школа. 1982. 255 с.
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
Sc-Та, Sc-Та
261
Sc-Ta. СКАНДИЙ-ТАНТАЛ
Диаграмма состояния Sc-Ta исследована частично в интервале
концентраций от 0 до ~5 % (ат.) Та (рис. 568) в работе [1].
Рис. 568. Sc-Ta
Сплавы изготовляли в индукционной печи в вакууме путем нагрева
Sc в толстостенных танталовых тиглях с последующим сбрасыванием
в водоохлаждаемый медный приемник. Температуру плавления сплавов
измеряли капельным методом. Часть диаграммы состояния системы
показывает наличие в системе эвтектического равновесия: Ж « (pSc) +
+ (Та) при 1519 °C с эвтектической точкой при 3,2 % (ат.) Та. Раствори-
мость Та в жидком Sc можно описать уравнением: lg(N) = А/Т + В, где
N- атомная доля Та в жидком Sc; Т~ температура (К); А = -2,317, В =
= -0,2079 (константы).
Литература
1. Dennison D.H.,Tschetter MJ., Gschneidner K.A.//J. Less-Common Met. 1966. V. 10. N 2.
P. 108-115.
Е.И. Гладышевский, О.И. Бодак, B.K. Печарский
Sc-Tb. СКАНДИЙ-ТЕРБИЙ
Диаграмма состояния Sc-Tb экспериментально не построена. Однако
Sc (3p6-3dl 45’2) и Tb (5p6~5dl6s2) имеют близкое электронное строение
атомов, изоструктурны в низкотемпературных ГПУ и высокотемператур-
262
Sc-Tb, Sc-Tc
ных ОЦК модификациях, их
атомные радиусы отличают-
ся всего на 8,7 %. Вследствие
близости электронного и
кристаллического строения
и сравнительно небольшого
различия атомных радиусов
можно предполагать, что Sc
и ТЬ образуют непрерывные
твердые растворы для обоих
видов модификаций. Дей-
ствительно, рентгенострук-
турные исследования спла-
вов ТЬ с И; 17,5; 30,5; 50;
Sc,%,(na массе)
Tb sc,7o(am.) Sc
Рис. 569. Sc-Tb
75 % (ат.) Sc [1] показало, что они имеют гексагональную плотноупако-
ванную структуру, параметры решетки которой линейно уменьшаются
от ТЬ к Sc в соответствии с правилом Вегарда [2]. Схематически
предполагаемый вид диаграммы состояния Sc-Tb показан на рис. 569.
Хотя различие в атомных радиусах Sc и ТЬ невелико, но оно достаточно
существенно, чтобы считать, что растворы отклоняются от идеальных,
и по аналогии с системой Y-Sc (разница в атомных радиусах 9,8 %)
можно предположить, что кривые ликвидуса-солидуса и сольвуса
имеют минимумы.
Литература
1. Chatterjee D., Corner W.D. И J. Phys. (Paris) Suppl. 1971. V. 32. P. 1-243.
2. Gschneidner, Jr., K.A., Calderwood F.W. // Handbook on the Physics and Chemistry of Rare
Earths. Amsterdam, New York, Oxford, Tokyo: North-Holland Physics Publishing Co., 1986.
V. 8. Chap. 54. P. 1-161.
B.K. Григорович
Sc-Tc. СКАНДИЙ-ТЕХНЕЦИЙ
Диаграмма состояния Sc-Tc не построена. Имеются сведения, что
рентгеноструктурное исследование сплавов Тс, насыщенных Sc, показало,
что у сплава с 12,5 % (ат.) Sc ОЦК решетка типа аМп с а = 0,9509 нм. При
концентрации 33,3 % (ат.) Sc наблюдается фаза ScTc2 с кристаллической
структурой типа MgZn2 (символ Пирсона ЛР12, пр.гр. Рв^ттс),
параметры решетки а = 0,5223 нм, с = 0,8571 нм [Э].
Л.Л. Рохлин
Sc-Te, Sc-Th
263
Sc-Те. СКАНДИЙ- ТЕЛЛУР
Диаграмма состояния Sc-Te не построена. Имеются сведения лишь
о кристаллической структуре соединений Sc2Te3 и ScTe [Э, Ш, 1-3],
которые приведены в табл. 461.
Сведения о кристаллических решетках соединений Sc2Te3 и ScTe
различных исследователей существенно отличаются между собой. В
работе [Ш] высказано предположение о существовании промежуточной
фазы в области концентраций от ScTe до Sc2Te3.
Таблица 461. Кристаллическая структура соединений системы Sc-Te
Соединение Прототип Символ Пирсона, пр.гр. Параметры решетки, нм Источник
а b с
Sc2Te3 у'А12О3 с/, 0,5817 - - [1]
- R Зап 0,4109 - 4,059 [2]
ScTe NiAs ЛР4, Рбу/ттс 0,4120 0,672 — 0,6749 0,8360 [З.Э] [Э]
Литература
1. Меньков А.А., Комиссарова Л.Н., Симанов Ю.П. и др. Доклады АН СССР. 1961.
Т. 141. N 2. С. 364-367.
2. White J.G., Dismukes J.P.//Inorg. Chem. 1965. V. 4. N 12. P. 1760—1763.
3. Меньков А.А., Комиссарова Л.Н., Симанов Ю.П. и др. Доклады АН СССР. 1959.
Т. 128. N 1. С. 92-94.
Г. К. Алексеенко
Sc-Th. СКАНДИЙ-ТОРИЙ
Диаграмма состояния Sc-Th построена в работе [1]. В системе
обнаружена непрерывная взаимная растворимость высокотемпературных
модификаций компонентов с ОЦК решеткой. При температуре 900 °C
и концентрации приблизительно 80 % (ат.) Sc существует эвтектоидное
превращение с распадом высокотемпературного твердого раствора на
твердые растворы: (aTh) и (aSc). Кривая солидус при температуре
-1415 °C и концентрации-60 % (ат.) Sc имеет минимум. Растворимость
264
Sc-Th
<гс, % (no массе)
Th Sc,’/«(am.) sc
Рис. 570. Sc-Th
Th в Sc при 600 °C составляет 55 % (ат.). Результаты работы [1] были в
общем подтверждены в работе [2]. Представленная нарис. 570 диаграмма
состояния Sc-Th приведена по данным более поздней и более полно
выполненной работы [2]. Согласно работе [2] минимум на кривых
ликвидус-солидус имеет место при температуре 1405 °C и концентрации
76 % (ат.) Sc. Эвтектоидное превращение по данным работы [2] имеет
место при -1150 °C, а растворимость Sc в (aTh) и Th в (aSc) при этой
температуре соответственно равны 66 % (ат.) и 20 % (ат.).
Литература
1. Бадаева Т.А., Кузнецова Р.И.//Изв. АН СССР. Металлы. 1969. N 5. С. 156-163.
2. Терехов Г.И., Синякова С.И. И Изв. АН СССР. Металлы. 1990. N 3. С. 215-218.
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
Sc-Ti
265
Sc-Ti. СКАНДИЙ-ТИТАН
Диаграмма состояния Sc-Ti приведена на рис. 571 по данным работы
[1]. Сплавы изготовлены из иодидного Ti и дистиллированного Sc
плавкой в дуговой печи в инертной среде. Исследование выполнено
методами микроструктурного, рентгеновского и термического анализов.
Диаграмма состояния Sc-Ti характеризуется образованием непрерыв-
ного ряда растворов на основе высокотемпературных 0 модификаций
Sc и Ti. При температуре 1050 °C происходит монотектоидное превраще-
Рис. 571. Sc-Ti
ние. Максимальная растворимость Ti в aSc составляет 13,5 % (ат.),
растворимость Sc в aTi при температуре эвтектической кристаллизации
875 °C равна 6,5 % (ат.).
Литература
1. Beaudry B.J., Daane А.Н. И Trans. AIME. 1962. V. 224. N 4. Р. 770-775.
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
266
Sc-Тт
Sc-Tm. СКАНДИЙ-ТУЛИЙ
Диаграмма состояния Sc-Tm экспериментально не построена. Sc и
Тт в металлическом состоянии почти изоэлектронны, имеют три
валентных З^Ч.?2 и З^’бл2 коллективизированных электрона соотве-
тственно; также изоструктурны высокотемпературная модификация pSc
и Тт, структура которых имеет близкие параметры решеток.
Атомные радиусы компонентов отличаются на 6,5 %.
Кристаллическая структура и полиморфные превращения элементов
приведены в табл. 462.
Таблица 462. Кристаллическая структура и полиморфные превращения элементов
системы Sc-Tm fl]
Атомный номер, эле- мент Модифика- ция Прототип, структура Параметры решетки, нм Темпера- тура пре- враще- ния, °C Реакция
а с
69, Тт - Mg, ГПУ 0,35375 0,55540 1545 Ж ° Тт
21, Sc Sc(a) Mg, ГПУ 0,33088 0,52680 1312 aSc « PSc
Sc(P) W, оцк 0,373 - 1541 Ж » PSc
На рис. 572 приведена гипотетическая диаграмма системы Sc-Tm [1],
подобная диаграммам состояния Er-Sc и Er-Y. При температуре
-1500 °C и содержании 45 % (ат.) Sc возможно образование эвтектики.
Гт Sc, °/° (am) Sc
Рис. 572. Sc - Tm
Sc-Tm, Sc-U, Sc-V
267
Литература
1. Григорович B.K., Григорович K.B. И Строение и свойства металлических и шлаковых
расплавов: Тезисы докладов на VII Всесоюзной конференции. Челябинск: ЧПИ, 1990. Т. 2.
Ч. 2. С. 250-252.
В. К. Григорович
Sc-U. СКАНДИЙ-УРАН
Диаграмма состояния Sc-U не построена.
По данным работы [I] в системе Sc-U наблюдается широкая область
несмешиваемости.
Литература
1. Гшнейднер К.А. Сплавы редкоземельных металлов: / Пер. с англ.; Под ред.
Е.М. Савицкого М.: Мир, 1965. 427 с.
С.П. Алисова
Sc-V. СКАНДИЙ-ВАНАДИЙ
Диаграмма состояния Sc-V приведена на рис. 573 по данным работы
[1]. Сплавы синтезировали в дуговой печи в атмосфере Не; затем образцы,
завернутые в танталовую фольгу, отжигали в эвакуированных кварцевых
Рис. 573. Sc-V
268
Sc-V, Sc-W
ампулах. В качестве шихтовых материалов использовали Sc чистотой
99,7 % (по массе) и V чистотой 99,9 % (по массе). Исследование
выполнено методами микроструктурного, рентгеновского и микрорентге-
носпектрального анализов, а также измерением твердости.
В системе Sc-V при температуре 1410 °C и содержании 86 % (ат.) Sc
осуществляется эвтектическое превращение. Растворимость Sc в (V) при
температуре эвтектики составляет ~2 % (ат.), растворимость V в (PSc) в
этих условиях равна 2 % (ат.).
При температуре 1300 °C происходит эвтектоидная реакция распада
(|3Sc) на (aSc) и твердый раствор Sc в V; растворимость Sc в (V) и V в (aSc)
при температуре эвтектоидного превращения составляет 0,3 % (ат.) и
0,5 % (ат.) соответственно.
Литература
1. Савицкий Е.М., Наумкин О.П., Ефимов Ю.В. И Изв. АН СССР. Металлы. 1971. N 2.
С. 178-179.
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
Sc-W. СКАНДИЙ-ВОЛЬФРАМ
Диаграмма состояния Sc-W приведена на рис. 574 по данным работы
[1]. В системе Sc-W кристаллизуется эвтектика при температуре 1510 °C
и концентрации W в эвтектике 2,0 % (ат.) [1] (1,33 % (ат.) [2], 2,7 % (ат.)
[3]). В работах [2, 3] интерметаллических соединений в системе Sc-W так
же, как и в работе [1], не обнаружено.
В работе [2] изучали растворимость W в Sc в жидком и твердом
состоянии. В качестве исходных компонентов использовали W чистотой
99,9 % (по массе) и Sc, содержащий следующие примеси, % (по массе):
0,0045 Mg, <0,015 Al, 0,002 Si, <0,035 Са, 0,025 Ti, 0,002 Cr, 0,0175 Fe,
0,0005 Ni, 0,0007 Си. Растворимость W в (Sc) приведена ниже:
Температура, °C................. 1539 1647 1695 1856 1981 2045
Растворимость W, % (по массе). . 5,05 9,21 8,20 10,04 17,40 25,90
Для жидкого состояния растворимость W в Sc согласно работе [2] может
быть представлена зависимостью: Inx = -5405/Т + 1,108 (х - концентра-
ция, % (ат.), Т-температура, К).
Согласно работам [4, Ш] растворимость Sc в W при температуре
1625 °C не превышает 0,004 % (по массе).
Sc-lV, Sc-Y
269
Рис. 574. Sc-W
В работе [5] проведен термодинамический расчет диаграммы
состояния Sc-W и указано на существование соединений ScW5, ScW2,
ScW, Sc2W и Sc5W.
Литература
1. Pandian S., Nagender S.V., Rama Rao P. // J. Alloy Phase Diagrams. 1988. V. 4. N 2.
P. 73-116.
2. Dennison D.H., Tshetter M.J., Cschneidner, Jr., K.A. //J. Less-Common Met. 1966. V. 11.
N 6. P. 423-435.
3. Ackermann R.J., Rauh E.G. // High Temp. Sci. 1972. V. 4. P. 272-282.
4. Taylor A., Hickmann W.M., Doyle N.J. //J. Less-Common Met. 1965. V. 9. P. 214-232’.
5. De Boer F.R., Room R., Miedema A.R. // Physica. B. 1976. V. 101. P. 294-319.
К.Б. Поварова
Sc-Y. СКАНДИЙ-ИТТРИЙ
Диаграмма состояния Sc-Y приведена на рис. 575 по данным работы
[1]. Сплавы синтезировали в дуговой печи в атмосфере Не или Аг,
заворачивали в танталовую фольгу и гомогенизировали в эвакуирован-
ных кварцевых ампулах при температуре 1100 °C в течение 15 ч. В
качестве шихтовых материалов использован Y чистотой 99,88 % (по
270
Sc-Y, Sc-Zn
Sc Y, °/o(am.) Y
Рис. 575. Sc-Y
массе) и Sc чистотой 99,72 % (по массе). Исследование проведено
методами термического и рентгеновского анализов.
Диаграмма состояния Sc-Y характеризуется полной взаимной
растворимостью компонентов в жидком и твердом состояниях и
образованием твердых растворов на основе высокотемпературных 0
модификаций со структурой объемно центрированного куба и низкотем-
пературных а модификаций с гексагональной структурой.
Литература
1. Beaudry B.J., Daane А.Н. //Trans. AIME. 1963. V. 227. N 4. P. 865-868.
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
Sc-Zn. СКАНДИЙ-ЦИНК
Диаграмма состояния Sc-Zn не построена.
В работе [1] сообщено о существовании соединений ScZn, ScZn2 и
ScZn|2, в работе [2] приведены данные о кристаллической структуре
соединения Sc3Znj7.
В табл. 463 даны сведения о кристаллической структуре соединений
системы Sc-Zn.
Sc-Zn, Sc-Zr
271
Таблица 463. Кристаллическая структура соединений системы Sc-Zn
Соединение Прототип Символ Пирсона, пр.гр. Параметры решетки, нм Источник
a с
ScZn CsCl cP2, Pm 3 m 0,334 - [1]
ScZn2 A1B2 hP3, Pftlmmm 0,4363 0,3196 [1]
Sc3Zn)7 Ru3Be)7 сП 60, Im 3 1,3852 - [2]
ScZn 12 ThMn)2 z/26, IMmmm 0,8814 0,5140 [1]
Литература
1. Гладышевский Е.И., Бодак О.И. Кристаллохимия интерметаллических соединений
редкоземельных металлов. Львов: Вища школа, 1982. 255 с.
2. Андрусяк Р.И. Взаимодействие скандия с переходными металлами IV периода и
германием (диаграммы фазовых равновесий, кристаллические структуры и физические
свойства соединений). Автореф. дис... канд. техн. наук. Львов, 1988.
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
Sc-Zr. СКАНДИЙ-ЦИРКОНИЙ
Диаграмма состояния Sc-Zr (рис. 576) построена в работе [1] с
использованием экспериментальных результатов работы [2].
Исследование системы проводили методами термического и
рентгеновского анализов, температуру плавления сплавов измеряли
оптическим пирометром. В качестве исходных материалов использовали
Sc с содержанием, % (по массе): 0,04 Fe, 0,029 С, 0,01 А1, 0,002 Ti, 0,01 N,
0,0025 Mg, 0,005 Si, 0,01 Си, 0,0075 Ni, 0,005 Са, 0,0075 Cr, 0,110,0,025 Та,
0,475 F; Zr, содержащий (% по массе) 0,0027 Fe, 0,0033 С, 0,0025 Al,
0,0008 Ti, 0,0010 N, 0,0025 Mg. Сплавы получали в дуговой печи в среде
Аг или Не.
Установлено образование непрерывных рядов твердых растворов на
основе низко- и высокотемпературной модификаций компонентов.
Согласно [2] максимум на кривой а « 0 превращения наблюдается при
температуре 1415 °C и содержании 30 % (ат.) Zr.
272
Sc-Zr, SeSi, Se-Sm
Zr, °/o [по массе)
Sc Zr, °/o (am.) Zr
Рис. 576. Sc - Zr
Литература
1. Palenzona A., Cirafici S. // J. Phase Equilibria. 1991. V. 12. N 1. P. 53-56.
2. Beaudry B.J., Daane A.H. // Trans. AIME. 1963. V. 227. N 4. P. 865-868.
Л.А. Третьяченко
Se-Si. СЕЛЕН-КРЕМНИЙ
Диаграмма состояния Se-Si не построена. В работе [X] указано на
образование соединения SiSe2 со структурой типа SiS2 (символ Пирсона
о1\ 2, пр.гр. Ibam, а = 0,976 нм, b = 0,603 нм, с - 0,576 нм). Там же
высказано предположение о существовании соединения SiSe по аналогии
с соединением SiS в системе Si-S.
Ю.Б. Кузьма
Se-nSm. СЕЛЕН-САМАРИЙ
Диаграмма состояния Se-Sm не построена. Обзор работ, в которых
исследованы соединения в системе, дан в работах [Э, Ш]. Установлено
образование трех соединений: SmSe, Sm3Se4 и Sm2Se4. Соединение SmSe
Se—Sm, Se-Sn
273
плавится при температуре -2100 °C. Соединение Sm3Se4 имеет область
гомогенности в пределах - 55-60 % (ат.) Se. Температура плавления
Sm3Se4 составляет от 1900 до 2000 °C.
Соединение Sm2Se3 6 соответствует предельной растворимости Sm в
Sm2Se4 и находится в равновесии с Sm2Se3.
Кристаллическая структура соединений системы Se-Sm приведена в
табл. 464.
Таблица 464. Кристаллическая структура соединения системы Se-Sm
Соединение Прототип Символ Пирсона, пр.гр. Параметры решетки, нм Источник
а с
SmSe NaCl cFS, Fm Зт 0,6200 0,6171 - [1] [Ш]
Sm3Se4 Th3P4 с 128, 143d 0,8894 0,8785 - [Ш] Р1
Sm2Se3;6 - — 0,818 0,838 Р]
Тетрагональная структура.
Литература
1. landelli A. Rare Earth Research. New York: Macmillan Co., 1961. P. 135-141.
Л.Л. Рохлин
Se-nSn. СЕЛЕН-ОЛОВО
Диаграмма состояния Se-Sn, приведенная на рис. 577, построена в
работе [1] с учетом данных обзора [X]. Диаграмма состояния Se-Sn
изучена в работе [1] в интервале концентраций 40-100 % (ат.) Se.
Исследование проводили методами рентгеновского и термического
анализов. Строение диаграммы Se-Sn, полученное в работе [1],
подтверждено в работах [2, 3].
В системе Se-Sn существуют два соединения: SnSe и SnSe2, плавящиеся
конгруэнтно при температурах 880 и 675 °C соответственно. При
температуре 625 °C и содержании 61 % (ат.) Se кристаллизуется эвтектика
SnSe + SnSe2. При температуре, близкой к температуре плавления Sn,
274
Se-Sn
Sn Se, °/o (am.) Se
Рис. 577. Se - Sn
протекает эвтектическая реакция Ж = (Sn) + SnSe. Содержание Sn в
жидкости соответствует практически 100 % (ат.). Вырожденная эвтектика
наблюдается и при температуре, близкой к температуре плавления Se.
Растворимость Se в жидком Sn по данным работы [X] приведена ниже:
Температура, °C.......................
550 500 450 350 300
Растворимость Se, % (ат.).............. 1,30 0,70 0,510 0,057 0,018
Согласно работе [1] при температуре 540 °C соединение SnSe
претерпевает, видимо, полиморфное превращение.
Соединение SnSe имеет ромбическую структуру (пр.гр. Рстп) с
параметрами решетки а - 0,447 нм, b = 0,419 нм, с - 1,148 нм [Э]. Также
согласно работе [Э] соединение обладает кристаллической структурой
типа Cdl2 (символ Пирсона hP3, пр.гр. Рзт\) с параметрами решетки
а = 0,3811 нм, с = 0,6137 нм (а = 0,3795 нм, с = 0,6132 нм [1]).
Литература
1. Караханова М.И., Пашинкин А.С., Новоселова А.В.// Изв. АН СССР. Неорганические
материалы. 1966. Т. 2. N 7. С. 1186-1189.
Se-Sn, Se-Sr
275
2. Гаськов A.M. и др. И Вестник Моск. гос. ун-та. Сер. Химия. 1968. N 3. С. 48-51.
3. Глазов В.М., Павлова Л.М., Гаев Д.С. И Изв. АН СССР. Неорганические материалы.
1984. Т. 20. N 9. С. 1476-1482.
Ю.Б. Кузьма
Se-Sr. СЕЛЕН-СТРОНЦИЙ
Диаграмма состояния Se-Sr приведена на рис. 578 по данным работы
[1]. Сплавы изготовляли из Se чистотой 99,8 % (по массе) и Sr чистотой
99,0 % (по массе) в герметичных стальных гильзах в атмосфере Аг.
Исследование проводили методами рентгеновского и термического
анализов. Установлено образование четырех соединений: SrSe, Sr2Se3,
SrSe2 и SrSe3.
Соединение SrSe плавится конгруэнтно при 1600 °C; Sr2Se3, SrSe2 и
SrSe3 кристаллизуются по перитектическим реакциям при температурах
910, 820 и 730 °C соответственно. При температурах 760 и 221 °C
осуществляются эвтектические превращения, эвтектики вырождены.
Sr Se,°/ofam.) Se
Рис. 578. Se - Sr
276
Se-Sr, Se-Ta
Соединение SrSe согласно работе [2] имеет структуру типа NaCl
(символ Пирсона cF$, пр.гр. Fm3m, а - 0,6243 нм).
Литература
1. Лыскова Ю.Б., Вахобов А.В.// Изв. АН СССР. Неорганические материалы. 1975. Т. 11.
N 2. С. 361-362.
2. KohleJ., Petrel T.//Z. Anorg. АП. Chem. 1977. Bd. 437. N 1. S. 193-196.
Л.Л. Зусман
Se-Ta. СЕЛЕН-ТАНТАЛ
Диаграмма состояния Se-Ta не построена. В системе рентгеновским
анализом установлено существование сем и соединений в концентрацион-
ном интервале 50-75 % (ат.) Se [I] (рис. 579). Согласно работе [1]
стехиометрическому составу TaSe2 соответствуют две фазы е и С e(TaSe2)
существует в двух модификациях: двухслойная структура типа NbSe2
(символ Пирсона hPl^, пр.гр. P63/mmc, а = 0,343 нм, с = 1,271 нм) и
четырехслойная структура нового типа (пр.гр. Ptymmc, а = 0,346 нм, с -
= 2,518 нм). Фаза (ДТаБеД имеет структуру типа МЬ8е2(символ Пирсона
hP\l, пр.гр. Рб/и2).
Согласно работе [Ш] соединение TaSe2 имеет четыре модификации:
а, р, у, б, кристаллические решетки которых отличаются периодичностью
вдоль гексагональной оси с. Так, а имеет гексагональную структуру,
параметры решетки а - 0,3429 нм, с = 1,273 нм при концентрации 66,44 %
Se-Ta, Se-Tb, Se-Te
277
(ат.) Se или a = 0,3437 нм, c = 1,291 нм при содержании 62,55 % (ат.) Se
[21-
Структура соединения р ромбоэдрическая с параметрами а =
= 0,3429 нм, с = 1,911 нм при концентрации 66,41 % (ат.) Se и а =
- 0,3437 нм, с = 0,1882 нм при концентрации 62,55 % (ат.) Se [2]. Фаза у
обладает гексагональной структурой (пр.гр. Р6т2), а = 0,343 нм, с =
= 2,44 нм. Фаза б имеет ромбоэдрическую структуру с параметрами
решетки а = 0,346 нм, с = 3,79 нм [2].
Согласно работе [2] субструктура TaSe2 имеет интервал области
гомогенности 60-66,44 % (ат.) Se.
В работе [Ш] указано, что соединение TaSe имеет гексагональную
структуру (пр.гр. РЬу/ттс) с параметрами решетки а = 0,3425 нм, с =
= 1,2746 нм.
Согласно работе [Ш] соединение p(TaSe3) имеет моноклинную
структуру (пр.гр. Р2,) с параметрами а = 1,00 нм, b = 0,350 нм, с =
=0,948 нм, 0=91,6°. Кристаллическая структура соединений
a(TaSe| q_| |8), p(TaSe| 0-1 04), y(TaSej 7), 6(Taj 23_| ^8Se2) (рис. 579) не
установлена.
Литература
1. Revolinsky Е., Brown В.Е., Beerntsen D.J., Armitage С.Н. И J. Less-Common Met. 1965.
V. 8. N 1. Р. 63-72.
2. Асланов Л.А., Симанов Ю.П., Новоселова А.В., Украинский Ю.М. // Журнал
неорганической химии. 1964. Т. 9. N 9. С. 2264-2265.
Ю.Б. Кузьма
Se-Tb. СЕЛЕН-ТЕРБИЙ
Диаграмма состояния Se-Tb не построена. В работе [Э] указано на
образование соединения TbSe со структурой типа NaCl (символ Пирсона
cF8, пр.гр. Fm3m, а = 9,574 нм). В работе [Ш] установлено образование
соединения Tb2Se3 с ромбической структурой.
Л.Л. Рохлин
Se-Te. СЕЛЕН-ТЕЛЛУР
Диаграмма состояния Se-Te приведена на рис. 580 по данным работы
[1]. Установлено образование непрерывного ряда твердых растворов во
всем интервале концентраций. Построенная диаграмма плавкости
278
Se-Te, Se-Th
Se Гс,7о(ат) Те
Рис. 580. Se - Те
подтверждает проведенные ранее исследования в работах [X, Э].
Результаты расчета диаграммы Se-Te на основе полученных авторами
работы [2] экспериментальных данных по термодинамическим свойствам
сплавов также указывают на неограниченную растворимость компонен-
тов друг в друге.
Литература
I. Lanyon H.P.D., Hockings E.F/// Phys. Status Solidi (a). 1966. V. 17. N 2. P. 185-186
2. Rao S.V., MisraS. //Trans. Indian Inst. Met. 1974. V. 27. N 5. P. 311-316.
Ю.Б. Кузьма
Se-Th. СЕЛЕН-ТОРИЙ
Диаграмма состояния Se-Th приведена на рис. 581 по данным работы
[X]. Исследование проведено измерением температур плавления сплавов
и упругости паров также микроструктурным и рентгеновским методами
анализа. Установлено существование пяти соединений: ThSe, Th2Se3,
Th7Se12, ThSe2 и Th4Se10, из которых ThSe, Th2Se3 и Th7Se12 указаны на
диаграмме состояния. Соединения ThSe и Th7Sei2 плавятся с открытым
максимумом при температурах 1880 и -1470 °C (1460 - 1490 °C)
соответственно. Соединение Th2Se3 кристаллизуется по перитектической
реакции при температуре 1490 °C. При температурах -1600 и 1460 °C
осуществляется эвтектическая кристаллизация. Эвтектика, кристаллизую-
Se-Th
279
F'
щаяся при -1600 °C, содержит Se в пределах 9-16,7 % (ат.). Соединение
ThSe имеет область гомогенности в интервале концентраций 48,7-52,4 %
(ат.) Se. Область гомогенности соединения Th2Se3 расположена от -58,3
до 60 % (ат.) Se. Однако в работе [1] предполагается, что соединения ThSe,
Th2Se3 и Th4Se10 не являются двойными, так как содержат небольшое
количество кислорода.
Сведения о кристаллической структуре соединений системы Se-Th
даны в табл. 465.
Таблица 465. Кристаллическая структура соединений системы Se-Th
Соедине- ние Прототип Символ Пирсона, пр.гр. Параметры решетки, нм Источник
а b с
ThSe NaCl cF8, Fm3m 0,5872 — - [X]
Th2Se3 Sb2$3 оР20, Рпта 1,1354 1,1575 0,427 [X]
Th7SC|’2 - Р б^п 1,1569 - 0,423 [X]
ThSe2 РЬС12 оР12, Рпта 0,4420 0,7610 0,9064 [X]
Th^Se" (Th3Se7 [X]) - - 0,5629 - 1,0764 [Э]
^Гексагональная структура. Тетрагональная структура.
280
Se-Tb, Se-Ti
Рис. 581. Se - Th
Se, % (по массе)
Литература
1. Graham J., McTaggart F.K. // Australian J. Chem. 1960. V. 13. N 1. P. 67-73.
Ю.Б. Кузьма
Se-Ti. СЕЛЕН-ТИТАН
Диаграмма состояния Se-Ti не построена. В работах [X, Э, Ш]
приведены данные исследований сплавов системы Se-Ti методом
рентгеновского анализа в интервале концентраций 50-67 % (ат.) Se.
Установлено существование соединений: TiSe, TiSe2, Ti3Se4. В работе [X]
указано на непрерывный переход от гексагональной структуры типа
NiAs (символ Пирсона ЛР4, пр.гр. Р63/ттс) с параметрами а = 0,3566 нм,
с = 0,6232 нм для состава TiSe к гексагональной структуре типа Cdl2
(символ Пирсона hP3, пр.гр. Рзш!) с параметрами а = 0,3548 нм, с =
= 0,5998 нм (или а = 0,3535 нм, с - Q,6004 нм Р]) для состава TiSe2.
В работе [Э] уточняется, что соединение TiSe при концентрации 48,7 %
(ат.) Se имеет ромбически искаженную решетку типа NiAs с параметрами
а = 0,3494 нм, b - 0,6222 нм, с = 0,6462 нм, а при 51,2 % (ат.) Se -
гексагональную типа NiAs с параметрами а - 0,3571 нм, с = 0,6297 нм
(или гексагональную структуру того же типа с удвоенными параметрами
а = 0,7135 нм, с = 1,1976 нм).
Se-Ti, Se-Tl
281
В работе [Ш] указано, что в интервале концентраций 61,24-61,98 %
(ат.) Se сплавы, отожженные при температурах 800-900 °C, имеют
моноклинную решетку (искаженную типа CdJ2) с параметрами а =
= 0,3608 нм, b = 0,619 нм, с = 2x0,597 нм, 0 = 90,36°; сплавы, отожженные
при температурах менее 500-600 °C или превышающих 1000 °C, имеют
гексагональную структуру типа Cdl2 с параметрами а - 0,3593 нм, с =
= 0,5982 нм.
Соединение Ti3Se4, полученное при температуре 1000 °C и содержании
Se в сплавах от 54,95 до 57,63 % (ат.), имеет структуру, изоморфную
Cr3Se4 с параметрами а - 0,635 нм, b - 0,357 нм, с = 1,201 нм, 0 = 90,5°
[Ш].
Ю.Б. Кузьма
Se-TI. СЕЛЕН-ТАЛЛИЙ
Диаграмма состояния Se-Tl приведена на рис. 582 по данным работы
[X]. Установлено образование трех соединений Tl2Se, TiSe, Tl2Se3.
Соединения Tl2Se и TiSe плавятся с открытым максимумом при
температурах 390 и 330 °C соответственно; соединение Tl2Se3 кристалли-
зуется по перитектической реакции при 274 °C и при температуре 192 °C
претерпевает полиморфное превращение.
При температурах 354 и 202 °C осуществляются монотектические
превращения. При температурах 284 и 172 °C образуются эвтектики
Se,°/o (по массе)
Рис. 582. Se-Tl
282
Se-Tl, Se-Тт, Se-U
TI2Se + TISe и Tl2Se3 + (Se). В работе [1] изучены границы областей
расслаивания в жидкой фазе; растворимость Se в Т1 при температуре
354 °C, как и Т1 в Se при температуре 202 °C, составляет не более 0,1 %
(ат.).
Соединение TISe имеет тетрагональную структуру собственного типа
(символ Пирсона 7/16, пр.гр. 1<Ытст,а = 0,8036 нм, с = 0,7014 нм [X]). По
данным работы [2] соединение Tl2Se имеет также тетрагональную
структуру собственного типа (символ Пирсоеа ?/*32,пр.гр. Р41псс, а -
= 0,854 нм, с = 0,271 нм).
Литература
1. Kanda F.A., Faxon R., Keller D.V. // Phys. Chem. Liquids. 1968. V. 1. N 1. P. 61—65.
2. Стасова M.M., Вайишейн Б.К. // Кристаллография. 1958. Т. 3. N 2. С. 141-147.
Ю.Б. Кузьма
Se-Tm. СЕЛЕН-ТУЛИЙ
Диаграмма состояния Se-Tm не построена. В работе [Э] сообщено об
образовании соединения TmSe со структурой типа NaCl (символ Пирсона
cF8, пр.гр. Fm3m, а = 0,5640 нм). В работе [1] установлено существование
соединения Tm2Se3. Исследование сплавов проведено рентгеновским
методом после отжига образцов при 800 °C 120 ч и 600 °C 24 ч.
Соединение Tm2Se3 имеет орторомбическую структуру (пр.гр. Fddd) с
параметрами решетки а = 1,130 нм, b = 0,8044 нм, с - 2,404 нм.
Литература
1. Range K.-J., Eqlmeier Ch. // J. Less-Common Met. 1991. V. 171. N l.P. L27.
Л.Л. Рохлин
S^U. СЕЛЕН-УРАН
Диаграмма состояния U-Se приведена на рис. 583 по данным работы
[М]. Установлено образование семи соединений: USe, U2Se3, USe! 88,
U3Se4, U3Se5, USe2 и USe3. USe, U2Se3 и USe] 88 плавятся конгруэнтно
при температурах 1990,1610 и 1460 °C соответственно; соединения U3Se4,
U3Se5, USe2 и USe3 образуются по перитектическим реакциям при
температурах 1680, 1560, £1400, 1160 °C соответственно. Соединение
U3Se4 существует в двух модификациях, температура полиморфного а *
« Р перехода составляет 1600 °C.
Se-U, Se-V
283
Рис. 583. Se-U
При температурах -1100 и-221 °C кристаллизуются эвтектики (yU) +
+ USe и USe3 + (Se) соответственно.
В работе [1] при взаимодействии измельченных монокристаллов U3Se5
с Se при температуре 500-520 °C в течение 50 ч была получена метаста-
бильная фаза USe2. Метастабильная фаза USe2 имеет гексагональную
структуру с параметрами решетки а = 0,764 нм, с = 0,424 нм и при нагреве
выше 760 °C превращается в стабильную фазу USe2. В работе [1]
отмечается также, что метастабильная фаза USe2 при синтезе из
элементов не образуется.
Литература
1. Эллерт Г.В., Словянских В.К., Севастьянов В.Г. И Журнал неорганической
химии. 1971, Т. 16. Вып. 6. С. 1721-1724.
Ю.Б. Кузьма
Se-V. СЕЛЕН-ВАНАДИЙ
Диаграмма состояния Se-V приведена на рис. 584 по данным работы
[1]. Образцы изготовляли прямым синтезом компонентов из V чистотой
284
Se-V
99,83 % (по массе) и Se чистотой 99,99 % (по массе) в тиглях из А12О3.
Сплавы закаливали в воде после отжига при температурах 1000 и 750 °C.
Образцы, содержащие более 50 % (ат.) Se, были кратковременно нагреты
до 1550 °C перед закалкой. Исследование выполнено методами
микроструктурного, рентгеновского анализов, измерением магнитной
восприимчивости и плотности.
Таблица 466. Кристаллическая структура соединений системы Se-V
Соединение Прототип Символ Пирсона, пр.гр. Параметры решетки, нм Источник
а b с
V5Se4 Ti5Se4 - 0,9294 - 0,3417 [1]
VSe NiAs AF4, 0,3587 — 0,598 [X]
РЬу/ттс 0,366 — 0,599 [Э]
VSe0 9 - - 0,3721 - 0,5992 [1]
VSe( >0 - - 0,3689 - 0,5986 [1]
VSeu - - 0,3624 - 0,6002 [1]
VSe,t,5* - - 0,6248 0,3566 2x0,5994 [1]
VSe,/* - - 0,6163 0,3440 2x0,5926 [1]
VSe, >6~* - - 0,5984 0,3440 2x0,5941 [11
V3Se4 NiAs hP4, Рбу/ттс - - [1]
VSe2 Cd J 2 hP3, 0,341 — 0,598 [X]
(61,8 % (ат.) Se) (63,3 % (ат.) Se) Р3т\ 0,335 - 0,623 [X]
VSe1>7 - - 0,3433 - 0,5971 [1]
VSe18 - - 0,3406 - 0,6028 [1]
VSe, g9 - - 0,3374 * - 0,6070 [1]
VSe, 96 - - 0,3353 - 0,6101 [1]
VSe205 - - 0,3356 - 0,6104 [1]
Моноклинная сингония, Р= 90,69°
Моноклинная сингония ,Р = 91,59°
Моноклинная сингония, р = 90,34°
Se-V. Se-W
285
Рис. 584.Se-V
В системе существуют четыре соединения: V5Se4, VSe, V3Se4, VSe2.
Соединение VSe плавится конгруэнтно, условия образования соединений
V3Se4 и VSe2 не установлены. Соединение V5Se4 образуется по перитекти-
ческой реакции при -1000 °C. В широкой области концентраций при 750
и 1000 °C образуется фаза, имеющая значительную область гомогеннос-
ти, в пределах которой структура меняется от гексагональной (VSe0 9-
-VSej t) через моноклинную (VSej 2 - VScj 65) в гексагональную (VSe, '7 -
-VSe2 05). При температурах < 1506 и -221 °C осуществляется эвтектичес-
кая кристаллизация. В табл. 466 дана кристаллическая структура
соединений системы Se-V.
Литература
1. Rost Е., Giertsen L. И Z. Anorg. All. Chem. 1964. Bd. 328. N 5-6. S. 299—308.
Л.Л. Рохлин
Sc-W. СЕЛЕН-ВОЛЬФРАМ
Диаграмма состояния Se-W не построена. В работе [X] сообщается
об образовании соединения WSe2 с областью гомогенности в пределах
концентраций 66,1-66,6 % (ат.) Se и соединения WSe3. Соединение WSe2
имеет структуру типа MoS2 (символ Пирсона hP6, пр.гр. РЬ^ттс, а =
286
Se-W, Se-Y, Se-Yb
= 0,329 нм, c = 1,297 нм). Согласно работе [Ш] параметры решетки
соединения WSe2, полученного в виде монокристаллов осаждением из
газовой фазы, составляют а - 0,328 нм, с = 1,295 нм, а для соединения,
полученного порошковым методом, а = 0,3286 нм, с = 1,29*76 нм.
К. Б. Поварова
Se-Y. СЕЛЕН-ИТТРИЙ
Диаграмма состояния Se-Y не построена. В работах [Э, Ш, 1]
установлено образование соединения YSe со структурой типа NaCl
(символ Пирсона cF8, пр.гр. РтЪт а - 0,5703 нм). Согласно работам Р,
Ш] в системе Se-Y существует соединение Y2Se3 с температурой
плавления более 1800 °C. Кристаллическая структура соединения Y2Se3
ромбическая гранецентрированная с параметрами решетки а = 1,15 нм,
b = 0,813 нм, с - 2,43 нм. В тех же работах указано на существование
подячейки с гранецентрированной структурой у соединения Y2Se3 с
параметром а = 0,575 нм.
Литература
1. landelli А. // Rare Earth Research. New York: Macmillin Co., 1961. P. 135—141.
Л.Л. Рохлин
Se-Yb. СЕЛЕН-ИТТЕРБИЙ
Диаграмма состояния Se-Yb не построена. В работах [Э, 1-4]
установлено образование четырех соединений: YbSe, Yb3Se4, Yb2Se3 и
YbSe2. Согласно работе [Э] соединение YbSe плавится при температуре
1940-1950 °C, соединение Yb2Se3 - при температуре выше 1665 °C.
Соединение Yb3Se4 в температурном интервале 1200-1250 °C претерпева-
ет полиморфное превращение, соединения Yb2Se3, YbSe также существу-
ют в двух модификациях. Кристаллическая структура соединений в
системе Se-Yb приведена в табл. 467.
Se-Yb, Se-Zn
287
Таблица 467. Кристаллическая структура соединений системы Yb-Se
Соединение Прототип Символ Пирсона, пр.гр. Параметры решетки, нм Источник
а b с
pYbSe NaCl cF8, РтЗт 0,5933- 0,5882 - [1]
aYbSe ZnS (вюрцит) hP4, Рву! тс 0,414 - 0,726 [V-C]
pYb3Se4 CaHo2Se4 R3m 0,404 - 2,042 [2, 3]
aYb3Se4 - Рпат 1,328 1,355 0,399 [2, 3]
Yb2Se3 J Fddd 1,1274 0,8021 2,398 [1]
Yb2Sej’ Th3P4 с/28, /43d 0,8615 - [4]
YbSef SbCu2 /Р6, Р4/птт 0,3970 - 0,8151 [V-C]
При давлении 8,0 ГПа. При давлении 1,4-7,0 ГПа и температуре 400-2000 °C.
Литература
1. Вол А.Е., Каган И.К. Строение и свойства двойных металлических систем. М.: Наука,
1976. Т. 3. 815 с.
2. Guittard N., Flahaut J., DomangeL. П Comp. Rend. Acad. Sci. Paris. Ser. C. 1996. V. 266.
N 6. P. 1002-1005.
3. Souleau C., Guittard M., Laruelle P. // Bull. Soc. Chim. France. 1969. N 1. P. 9—14.
4. Eatough N.L., Hall H.T. // Inorg. Chem. 1970. V. 9. N 3. P. 417-421.
Ю.Б. Кузьма
Se-Zn. СЕЛЕН-ЦИНК
Диаграмма состояния Se-Zn не построена. В работах [X, Э, Ш]
установлено образование соединения ZnSe, температура плавления
которого в замкнутом объеме составляет 1515т 20 °C [Э] (значительно
288
Se-Zn, Se-Zr
выше 1100 °C [X]). Соединение ZnSe имеет кристаллическую решетку
типа ZnS (сфалерит), символ Пирсона cF8, пр.гр. F43w, а = 0,5672 нм или
а = 5667 нм PQ (а = 0,56687 нм [Ш], а = 0,5656 нм [1]). В работе [Ш]
указано, что монокристаллы соединения ZnSe, выращенные в кварцевой
трубе нагревом порошковой смеси в среде Аг при 1000 °C, имеют
гексагональную структуру типа ZnS (вюрцит) символ Пирсона ЛР4,
пр.гр. Рб^тс, а ~ 0,398 нм, с = 0,655 нм [Э], (а = 0,401 нм, с = 0,654 нм [Э],
а = 0,4003 нм, с = 0,6540 [Ш]). В работе [Э] высказано предположение,
что соединение ZnSe с гексагональной структурой является метастабиль-
ным.
Литература
1. Жердев Ю.В., Ормонт Б.Ф. И Журнал неорганической химии. 1960. Т. 5. N 8.
С. 1796-1799.
Л.Л. Рохлин
Se-Zr. СЕЛЕН-ЦИРКОНИЙ
Диаграмма состояния Se-Zr не построена. В работах [X, Э, Ш]
установлено образование пяти соединений в системе Se-Zr: ZrSe3, ZrSe2,
Zr3Se4, Zr4Se3 и Zr3Se2, кристаллическая структура которых приведена
в табл. 468.
Таблица 468. Кристаллическая структура соединений системы Se-Zr
Соединение Прототип Символ Пирсона, пр.гр. Параметры решетки, нм
а b С
ZrSe3‘ - - 0,542 0,375 1,95
ZrSe2 Cdl2 hP3, F3ml 0,380 0,619
Zr3Se4" NaCl cFS, Fm Зт 0,5337 - -
Zr3Se2 WC hPl, P6m2 0,3546 — 0,3614
Моноклинная структура, р = 97,6°. Ромбоэдрически искаженная структура типа NaCl (а = гексагональными параметрами а = 0,7509 нм, с = 0,9338 нм. 89,39°) с эквивалентными
Se-Zr, Si-Sm
289
Соединение Zr4Se3 образуется при сублимации и по существу
представляет собой тройное соединение ZrSiSe с тетрагональной
структурой типа Zr4S3, а = 0,3634 нм, с = 0,8361 нм.
Растворимость Se в Zr составляет 23 % (ат.), при этом параметр
решетки твердого раствора на основе Zr возрастает.
Ю.Б. Кузьма
Si-Sm. КРЕМНИЙ-САМАРИЙ
Диаграмма состояния Si-Sm не построена. В работах [1,2] рентгенов-
ским методом исследованы сплавы системы Si-Sm, изготовленные из Sm
чистотой 99,9 % (по массе) и Si чистотой 99,6 % (по массе) в тиглях из Та.
Установлено образование четырех соединений: Si3Sm5, Si4Sm5, SiSm и
Si2Sm, кристаллическая структура которых приведена в табл. 469 по
данным работы [3].
Таблица 469. Кристаллическая структура соединений системы Si-Sm
Соединение Прототип Символ Пирсона, пр.гр. Параметры решетки, нм
а b с
Si3Sm5 Mn5Si3 ЛР16, Рб^/ттс 0,856 - 0,6453
Si4Sm5 Sm5Ge4 оРЗб, Рпта 0,757 1,488 0,778
SiSm FeB оР$, Рпта 0,813 0,390 0,778
Si3Srri5 A1B2 hP3, РЫттт 0,3903 - 0,42407
aSi2Sm aGdSi2 о/12, Imma 0,4105 0,4035 1,346
pSi2Sm aThSi2 til 2, I4\!amd 0,4041 - 1,333
В системе Si-Sm со стороны Sm обнаружена эвтектическая кристалли-
зация, сплав в эвтектической точке содержит 96,5 % (ат.) Sm. Раствори-
мость Si в Sm не превышает 1,1 % (ат.).
290
Si-Sm, Si-Sn
Литература
I. Copeland M., Kato H. // Physics and Material Problems of Reactor Control Rods. Vienna:
Int. At. En. Agency, 1964. P. 295-317.
2. Гладышевский Е.И., Крипякевич П.И. IIЖурнал структурной химии. 1964. Т. 5. С. 853.
3. Гладышевский Е.И., Бодак О.И. Кристаллохимия интерметаллических соединений
редкоземельных металлов. Львов: Вища школа. 1982. 255 с.
Е.И. Гладышевский, О.И. Бодак, В.К. Печорский
Si-Sn. КРЕМНИЙ-ОЛОВО
Диаграмма состояния Si-Sn приведена на рис. 585 по данным работы
[1], которые подтверждены в работе [2]. Диаграмма Si-Sn построена на
основании обобщенных данных о фазовых равновесиях в системе Si-Sn
с использованием сведений о термодинамических свойствах компонентов.
Отмечено отсутствие взаимной растворимости компонентов и осуще-
О 10 20 30 40 30 60 70 80 90 700
Si Sn, °/ofctm.) Sn
Рис. 585. Si - Sn
ствление эвтектической кристаллизации при температуре, близкой к
температуре плавления Sn, эвтектика вырождена.
Si-Sn, Si-Sr
291
Литература
1. Olesinski R.W., Abbashian GJ. // Bull. Alloy Phase Diagrams. 1984. V. 5. N 3. P. 273-276.
2. Кожитов Л.В., Николаев А.Г., Кузнецов Г.М. и др. // Журнал неорганической химии.
1986. Т. 31.N 2.С. 444-447.
Е.И. Гладышевский, О.И. Бодак, В.К. Печорский
Si-Sr. КРЕМНИЙ-СТРОНЦИЙ
Диаграмма состояния Si-Sr приведена на рис. 586 по данным работ
ЦП, М]. Сплавы изготовляли в дуговой печи в атмосфере Аг с использова-
нием Sr чистотой 99,9 % (по массе) и Si чистотой 99,4 % (по массе).
Исследование проведено методами микроструктурного, рентгеновского
и термического анализов.
В системе существуют два соединения SrSi и SrSi2, которые образуются
с открытым максимумом непосредственно из расплава при температурах
1140 и 1150 °C соответственно. При температурах 700,1044 и 1000 °C и
содержании -12, -57 и -76 % (ат.) Si кристаллизуются эвтектики: (pSr) +
+ SrSi, SrSi + SrSi2 и SrSi2 + (Si).
Растворимость Sr в Si при эвтектической температуре 1000 °C
составляет 0,62 % (ат.) согласно работе [Ш] (0,2 % (ат.) [М]).
Рис. 586. Si - Sr
292
Si-Sr, Si-Та
В табл. 470 по данным работы [V-С] приведена кристаллическая
структура соединений системы Si-Sr, в том числе не обозначенных на
диаграмме авторами работ [Ш, М].
Таблица 470. Кристаллическая структура соединений системы Si-Sr
Соединение Прототип Символ Пирсона, пр.гр. Параметры решетки, нм
a b c
SrjSi SiCo2 оРП, Pnma 0,811 0,515 0,954
Sr5Si3 Si3Sr5 tI32, I4cm 0,8055 - 1,5688
SrSi CrB oC%, Cmcm 0,4826 1,1287 0,4042
SrSi Ge2Sr3 Immm 1,298 0,489 1,803
SrSi2 aSi2Th tl\2, M\lamd 0,4438 - 1,3831
SrSi 2 - F4332 0,654 - -
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
Si-Ta. КРЕМНИЙ-ТАНТАЛ
Диаграмма состояния Si-Ta приведена на рис. 587 по данным работ
[X, М]. Сплавы изготовляли методом порршковой металлургии и
исследовали методами микроструктурного, рентгеновского и термическо-
го анализов.
В системе Si-Ta установлено образование четырех соединений. Та4 5Si,
Ta5Si3 и TaSi2 плавятся с открытым максимумом при температурах
2510т 10, 2500т 10 и 2200т 100 °C соответственно: соединение Ta2Si
кристаллизуется по перитектической реакции при температуре -2460 °C
[X]. В системе Si-Ta осуществляются четыре эвтектических превращения
при температурах -2300 °C [X], -2400 °C И, -2100 °C [X], 1385 °C [М].
Соединение Ta5Si3 при температуре -1700 °C претерпевает полиморфное
превращение.
Si-Ta
293
Si, % (no массе)
Рис. 587. Si-Ta
Растворимость Та в Si при эвтектической температуре -2300 °C
составляет 0,2 % (ат.) [X].
Таблица 471. Кристаллическая структура соединений системы Si-Ta
Соединение Прототип Символ Пирсона, пр.гр. Параметры решетки, нм
a с
Ta3Si (Ta4 5Si) SnNi3 или ЛР8, Pbylmmc 0,6105 0,4919
PTi3 tP32, P42/n 1,0193 0,5175
Ta2Si CuA12 tl\l, 14/mcm 0,6160 0,5056
aTa5Si3 Mn5Si3 hP\6, Pftylmcm 0,7474 0,5226
PTa5Si3 Cr5B3 till, 14/mcm 0,6516 1,1873
T a5Si j W5Si3 till, 14/mcm 0,988 0,506
TaSi2 CrSi2 hP9, P62ll 0,47821 0,65695
294
Si-Та, Si-Tb
В табл. 471 приведены данные о кристаллической структуре
соединений системы Si-Ta [V-С]. ФазаТа4 5Si согласно этой работе имеет
формулу Ta3Si.
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
Si-Tb. КРЕМНИЙ-ТЕРБИЙ
Диаграмма состояния Si-Tb не построена. В работе [1] приведен
участок линии ликвидуса со стороны Si при концентрации от 0 до 40 %
(ат.) ТЬ (рис. 588). Синтез сплавов осуществляли в вакууме методом
диффузионных пар из Si в виде монокристаллов и фольги ТЬ чистотой
99,911 % (по массе). Образцы выдерживали 30 мин при температуре
контактного плавления. Толщину слоя Si, растворенного в ТЬ, определя-
ли при помощи компаратора ИВА-2.
При температуре 1170 °C и концентрации 25 % (ат.) ТЬ осуществляется
эвтектическая кристаллизация.
В сплавах системы Si-Tb установлено образование пяти соединений:
Si3Tb5, Si4Tb5, SiTb, Si2_vTb и aSi2Tb, кристаллическая структура
которых приведена в табл. 472 по данным работы [2].
Рис. 588. Si - Tb
Si-Tb, Si-Тс
295
Таблица 472. Кристаллическая структура соединений системы Si-Tb
Соединение Прототип Символ Пирсона, пр.гр. Параметры решетки, нм
a b c
Si3Tb5 Mn5Si3 hP16, P6j[mcm 0,842 - 0,629
Si4Tb5 Sm5Ge4 oP36, Pntna 0,741 1,458 0,769
SiTb FeB oP8, Pnma 0,797 0,382 0,569
Si2_A.Tb A1B2 hP3, P6lmmm 0,3847 - 0,4146
aSi2Tb aGdSi2 o/12, Imma 0,4075 0,398 1,337
Литература
1. Лозовский В.Н., Колесниченко А.И. // Изв. АН СССР. Неорганические материалы,
1981. Т. 17. N 3. С. 554-555.
2. Гладышевский Е.И., Бодак О.И. Кристаллохимия интерметаллических соединений
редкоземельных металлов. Львов: Вища школа, 1982. 255 с.
Е.И. Гладышевский, О.И. Бодак, В.К. Печорский
Si-Tc. КРЕМНИЙ-ТЕХНЕЦИЙ
Диаграмма состояния системы Si-Tc не построена. В работе [Ш]
сообщено о существовании пяти соединений в системе Si-Tc, кристалли-
ческая структура которых приведена в табл. 473.
Таблица 473. Кристаллическая структура соединений системы Tc-Si
Соединение Прототип Символ Пирсона, пр.гр. Параметры решетки, нм
a С
Tc4Si W c/2, Im 3 m 0,3009 -
TcjSi Cu5Zn8 cISl, /4 3m 0,9014 -
Tc5Si3 W5Si3 tI32, IMmcm 0,9403 0,4849
TcSi FeSi cP8, P2i3 0,4755 -
TcSi2 MnSi7 - - -
Л.Л. Рохлин
296
Si-Те, Si-Th
Si-Те. КРЕМНИЙ-ТЕЛЛУР
Диаграмма состояния Si-Te приведена на рис. 589 по данным работы
[М]. Соединение Si2Te3 образуется по перитектической реакции при
температуре 885 °C. При температуре 407 °C и содержании ~4 % (ат.) Si
кристаллизуется эвтектика из (Те) и соединения Si2Te3 (символ Пирсона
ЛР40, пр. гр. Рз1с.).
Рис. 589. Si-Te
Ранее в работах [X, Э] было указано на существование соединений
SiTe и SiTe2; соединение SiTe плавится при температуре 898 °C и имеет
сложную кубическую решетку. Предполагают, что соединение SiTe2
имеет две модификации с гексагональной структурой типа Cdl2 (символ
Пирсона hP3, пр.гр. Рът\, а = 0,0428*0,001 нм, с = 0,671*0,001 нм) и
ромбической структурой типа SiSe2 [X, Э].
Ю.Б. Кузьма
Si-Th. КРЕМНИЙ-ТОРИЙ
Диаграмма состояния Si-Th построена в работах [1, М]. На рис. 590
приведена диаграмма состояния согласно работе [М], построенная с
учетом экспериментальных данных работы [1]. Синтез образцов
осуществляли из компонентов горячим прессованием порошков в
Si-Th
297
Si, a/o (по массе)
Рис. 590. Si - Th
графитовых пресс-формах. В качестве шихтовых материалов использова-
ли Th чистотой 99,55 % (по массе) и Si чистотой 99,7 % (по массе).
Исследование проводили методами рентгеновского и термического
анализов.
В системе Si-Th существуют четыре соединения: Th3Si2, ThSi, Th3Si5
и ThSi2- Соединения Th3Si2 и ThSi2 плавятся конгруэнтно при температу-
Таблица 474. Кристаллическая структура соединений системы Th-Si
Соединение Прототип Символ Пирсона, пр.гр. Параметры решетки, нм Источник
a b c
ThSi FeB oP8, Рпта 0,788 0,4148 0,5896 [1,M, V-C]
Th3Si2 Si2U3 tP\O, РЫтЬт 0,7835 - 0,4154 [1, M, V-C]
Th3Si5 aib2 hP3, РЫттт 0,3987 - 0,4204 [1, M, V-C]
aThSi2 aThSi2 tin, MJatnd 0,4105 0,4035 1,346 [1, M, V-C]
0ThSi2 A1B2 hP3, Pft/mmm 0,4136 - 0,4126 [l.V-C]
298
Si-Th, Si-Ti
pax - 1900 °C. Соединения ThSi и Th3Si5 кристаллизуются по перитекти-
ческим реакциям при 1780 °C (-1800 °C [1]) и -1750 °C. При температурах
1438т 12 и -1360 °C осуществляются эвтектические превращения. В
табл. 474 приведены данные о кристаллической структуре соединений
по данным работ [1, М, V-С].
Литература
1. Stecher Р., Benesovsky F., Nowotny Н. И Monatsh. Chem., 1963. Bd. 94. N 3. S. 549—564.
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
Si-Ti. КРЕМНИЙ-ТИТАН
Диаграмма состояния Si-Ti приведена на рис. 591 по данным работы
[М], основывающейся в основном на экспериментальных результатах
работы [1].
Сплавы изготовляли плавкой в дуговой печи в инертной среде с
использованием в качестве шихтовых материалов монокристаллов Si и
иодидного Ti. Слитки после многоступенчатого отжига в кварцевых
Рис. 591. Si-Ti
Si-Ti
299
ампулах закаливали в воде и исследовали микроструктурным и
рентгеновским анализами.
В системе Si-Ti существуют пять соединений: Ti3Si, Ti5Si3, Ti3Si4, TiSi
и TiSi2. Соединение Ti3Si образуется по перитектоидной реакции при
температуре 1170 °C, соединения Ti5Si3 и TiSi2 плавятся с открытым
максимумом при температурах 2130 и 1500 °C соответственно. Соедине-
ния Ti3Si4 и TiSi кристаллизуются по перитектическим реакциям при
температурах 1920 и 1570 °C соответственно. Соединение Ti5Si3 имеет
заметную область гомогенности, составляющую при температуре
-1300 °C 4 % (ат.) в концентрационном интервале от 35,5 до 39,5 % (ат.)
Si. При температуре 1330 °C в сплавах, богатых Ti и Si, осуществляется
эвтектическая кристаллизация при содержании 13,7 и 86 % (ат.) Si
соответственно.
Растворимость Si в Ti составляет менее 0,7 % (ат.) при температуре
800 °C, -3,35 % (ат.) при температуре 1000 °C и -5 % (ат.) при температу-
ре 1200 °C.
Кристаллическая структура соединений системы Si-Ti приведена в
табл. 475.
Таблица 475. Кристаллическая структура соединений системы Si-Ti
Соединение Прототип Символ Пирсона, пр.гр. Параметры решетки, нм
a с
Ti3Si Ti3P ?Р32, P42/n 0,7133 1,297
Ti5Si3 Mn5Si3 АР16, Pbytmcm 0,7429 0,5139
TicSin Zr5Si4 1Р36, P4'2\2 0,7133 1,2977
TiSi TiSi или <>P8, Pmm2 — —
FeB (oPt, Pnma) — —
TiSi2 TiSi2 oF24, Fddd - -
Литература
1. Свечников В.Н., Кочержинский Ю.А., Юпко Л.М. и др. И Доклады АН СССР. 1970.
Т. 193. N 2. С. 393-396.
С. П. Алисова
300
Si-Tl
Si-Tl. КРЕМНИЙ-ТАЛЛИЙ
Диаграмма состояния Si—Т1, приведенная на рис. 592 согласно работе
[М], построена в основном по данным работ [1,2].
В системе Si-Tl осуществляется монотектическое превращение при
температуре 1414 °C, близкой к температуре плавления Si. Раствори-
мость компонентов друг в друге незначительна.
Рис. 592. Si-Tl
Литература
1. Olesinski R.W., Abbaschian G.J. // Bull. Alloy Phase Diagrams. 1985. V. 6. N 6. P. 543-544.
2. Савицкий E.M., Барон B.B., Тылкина M.A. И Журнал неорганической химии 1958
N 3. С. 310-327.
Е.И. Гладышевский, О.И. Бодак, В.К. Печорский
Si-Tm. Si-W
301
Si-Tm. КРЕМНИЙ-ТУЛЛИЙ
Диаграмма состояния Si-Tm не построена. Кристаллическая
структура трех соединений, установленных в системе Si-Tm, приведена
в табл. 476 по данным работы [1].
Таблица 476. Кристаллическая структура соединений системы Si-Tm
Соединение Прототип Символ Пирсона, пр.гр. Параметры решетки, нм
а b с
Tm5Si3 Mn5Si3 ЙЛ16, Pbj/mcm 0,825 - 0,618
TmSi CrB оРЪ, Стет 0,418 1,035 0,375
TmSi2.v А1В2 hP3, РЫттт 0,3773 - 0,4070
Литература
1. Гладышевский Е.И., Бодак О.И. Кристаллохимия интерметаллических соединений
редкоземельных металлов. Львов: Вища школа, 1982. 255 с.
Е.И. Гладышевский, О.И. Бодак, В.К. Печорский
Si-W. КРЕМНИЙ-ВОЛЬФРАМ
Диаграмма состояния Si-W приведена на рис. 593 по данным работы
[1]. В системе установлено образование двух соединений: W5Si3 и WSi2.
Соединение W5Si3 плавится конгруэнтно при 2095 °C [1] или 2324 °C [М]
(или по перитектической реакции при 2370 °C [X]). Соединение WSi2
также образуется конгруэнтно при температуре 2020 °C [1] (2165 °C [X,
М], 2160 [Е], 2150 и 2182 °C [Ш]).
При температуре 2085±20 °C и концентрации 68 % (ат.) W [1] (2210 °C
и -79 % (ат.) W [X], или 2183 °C и -69 % (ат.) W [М]) кристаллизуется
эвтектика W5Si3 + (W).
Эвтектика (Si) + WSi2 образуется при температуре 1400±10 °C и
концентрации -1,0 % (ат.) W [1] (при 1390 °C и -1,0 % (ат.) W [X] или
1392 °C и 0,8 % (ат.) [М]).
Растворимость Si в W составляет 2,35 % (ат.) при температуре 2000 °C
и 0,97 % (ат.) при 1750 °C [1] (5,5 % (ат.) Si при 1800 °C [X]).
302
Si-И/, Si-Y
W SL,°/°fam.) Si
Рис. 593. Si - W
Соединение W5Si3 имеет тетрагональную структуру с 16 атомами на
элементарную ячейку [X] (символ Пирсона /732, пр.гр. М/тст, а =
- 0,956—0,9645 нм, с = 0,4940—0,4969 нм. Соединение WSi2 обладает
тетрагональной структурой типа MoSi2 (символ Пирсона tI6 , пр.гр.
]А1ттт, а = 0,3212-0,3210 нм, с = 0,7829-0,7855 нм [X, Ш]).
Литература
ч
1. Кочержинский Ю.А., Кулик О.Г., Шишкин Е.А., Юпко Л.М. И Доклады АН СССР.
1973. Т. 218. N 3. С. 642-643.
К. Б. Поварова
Si-Y. КРЕМНИЙ-ИТТРИЙ
Диаграмма состояния Si-Y, представленная на рис. 594, построена
в работе [1] на основе анализа литературных данных, в основном, работы
[2] и результатов ранее проведенного обобщения, сделанного в работе
[3].
Исследование системы в работе [2] проводили методами термического,
микроструктурного, рентгенофазового анализов и измерения твердости.
Si-Y
303
si, % (по массе)
Рис. 594. Si-Y
Для получения сплавов использовали Y и Si чистотой 99,9 и 99,999 % (по
массе). Сплавы синтезировали методом дуговой плавки в атмосфере
аргона.
В системе существуют четыре соединения: Y5Si3, Y5Si4, YSi и Y3Si5,
из которых только Y5Si3 плавится конгруэнтно при 1875 °C. Согласно
работе [2], соединение YSi2, которое описывалось в более ранних
работах, обобщенных в обзоре [3], не образуется в системе Si-Y в
качестве равновесной фазы. Наиболее богатой Si фазой является Y3Si5,
которая имеет дефектную решетку с вакансиями в подрешетке Si.
Нонвариантные реакции, протекающие в системе Si-Y, представлены
в табл. 477.
Таблица 477. Нонвариантные реакции в системе Si-Y по данным работы [1]
Реакция Содержание в фазах Si, % (ат.) Температура, °C
Ж » (aY) + V5Si3 13; 0; 37,5 1260
Ж + Y5Si3 ° Y5Si4 51.3; -40; 44,5 1836
Ж + Y5Si4 » YSi -53; 44,5; 50 ?
Ж + YSi » Y3Si5 65; 50; 62,5 1635
Ж » Y3Si5 + (Si) 82; 62,5; -100 1230
304
Si-Y
Согласно данным работы [Э], соединение Y3Si5 имеет полиморфное
превращение при 450 °C. Низкотемпературная модификация описана
как ромбическая фаза, а высокотемпературная модификация как
тетрагональная или гексагональная в зависимости от содержания Si. По
данным работы [2], ромбическая фаза Y3Si5 образуется при закалке
сплавов и обогащена Si относительно состава Y3Si5. Отжиг при 900 °C
приводит к исчезновению ромбической фазы и к образованию гексаго-
нальной фазы. Из приведенных данных следует, что вопрос о полимор-
физме Y3Si5 нуждается в уточнении.
Данные по кристаллической структуре соединений системы Si-Y
представлены в табл. 478.
Таблица 478. Кристаллическая структура соединений системы Si-Y
Соединение Прототип Символ Пирсона, пр.гр. Параметры решетки, нм Источник
а b с
Y5Si3 Mn$Si3 ЛР16, 0,8429 — 0,6352 [2]
РЬт/ттс 0,8418 — 0,6337 [Э]
Y5Si4 Y5Si4 оРЗб, Рпта 0,7311 1,4157 0,7627 [2]
YSi CrB оС8, 0,4269 1,0555 0,3837 [2]
Спгст 0,4257 1,0527 0,3839 [Э]
Y3Si5 A1B2 hP3, 0,3849 — 0,4147 [2]
РЫттт 0,3842 — 0,4140 [Ш]
Y,Si," — — 0,4060 0,3967 1,339 [2]
з s 0,4052 0,3954 1,3360 О]
’Ромбическая сингония.
Литература
1. Okamoto Н. // J. Phase Equilibria. 1991. V. 12. N 3. Р. 397-399.
2. Button T.W., McColm L.J., Ward J.M. // J. Less-Common Met. 1990. V. 159. N 1-2.
P. 205-222.
3. Gokhale A.B., Abbaschian G.J. // Bull. Alloy Phase Diagrams. 1986, V. 7. N 5. P. 485-489.
Л.Л. Рохлин, Л.Е. Шелимова
Si-Yb, Si-Zn
305
Si-Yb. КРЕМНИЙ-ИТТЕРБИЙ
Диаграмма состояния Si-Yb не построена. В работе [1] сообщается
о существовании в системе трех соединений: Yb5Si3, YbSi и YbSi2_ х,
данные по кристаллической структуре которых представлены в табл. 479.
Таблица 479. Кристаллическая структура соединений системы Si-Yb |1]
Соединение Прототип Символ Пирсона, пр.гр. Параметры решетки, нм
а b с
Yb5Si3 Mn5Si3 ЙР16, Pbylmcm 0,823 - 0,619
YbSi CrB оСЪ, Стет 0,419 1,035 0,377
YbSi2_x. A1B2 hP3, РЫттт 0,3771 - 0,4098
Литература
1. Гладышевский Е.И., Бодак О.И. Кристаллохимия интерметаллических соединений
редкоземельных металлов. Львов: Вища школа, 1982. 255 с.
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
Si-Zn. КРЕМНИЙ-ЦИНК
Диаграмма состояния Si-Zn характеризуется отсутствием промежу-
точных фаз [X, Э]. Диаграмма относится к эвтектическому типу.
Температура эвтектической реакции всего лишь на 0,58 °C ниже
температуры плавления Zn, а концентрация Si в эвтектике очень мала
и составляет 0,04 % (ат.) [Э].
Наиболее достоверные результаты по растворимости Si в жидком Zn
получены в работе [1]. Они представлены на диаграмме состояния,
приведенной на рис. 595. В работе [1] положение линии ликвидуса
определялось с помощью дифференциального термического анализа
сплавов, помещенных в запаянные кварцевые ампулы, предварительно
откачанные до вакуума (р = 0,13 Па). Это исключало окисление и
испарение компонентов сплавов. Для сравнения на диаграмме представ-
лены результаты исследований растворимости Si в жидком Zn,
приводимые в работах [X] и [Э]. Как можно видеть, положение линий
306
Si-Zn, Si-Zr
Рис. 595. Si - Zn
ликвидуса, представленных в работах [X, Э], заметно выше и определено
для интервала концентраций с содержанием Si не более, чем 5 % (ат.).
Растворимость Zn в твердом Si, рассчитанная с использованием
коэффициентов распределения, составила по данным работы (Э]:
Температура, °C .. ;............ 1400 1350 1300 1200 1100 1000
Растворимость Zn, % (ат.)-10'5 . 18 84 12 6 2 0,6
В работе [2] проведен термодинамический расчет системы Si-Zn.
Литература
I. Schneider М., Krumnacker М. // Neue Huette. 1972. Bd. 17. N 9. S. 519-521.
2. Mey S., Hack K. HZ. Metallkunde. 1986. Bd. 77. N 7. S. 454-459.
Л.Л. Рохлин
Si-Zr. КРЕМНИЙ-ЦИРКОНИЙ
Данные многочисленных исследований системы Si-Zr обобщены в
работах [X, Э, Ш, 1,2]. На рис. 596 представлена обобщенная диаграмма
состояния Si-Zr, предложенная в работе [1] и основанная, главным
образом, на экспериментальных данных работы [3].
Si-Zr
307
Рис. 596. Si - Zr
В системе образуются следующие равновесные промежуточные фазы:
Si2Zr, р и aSiZr, 0 и aSi4Zr5, Si2Zr3, Si3Zr5, SiZr2 и SiZr3, из которых только
Si4Zr5 плавится конгруэнтно при 2250 °C. Соединения Si2Zr, SiZr, Si2Zr3,
Si3Zr5, SiZr2 и SiZr3 образуются по перитектическим реакциям при 1620,
2210, 2215, 2180, 1925 и 1650 °C соответственно. Соединение Si3Zr5
существует в узком интервале температур и распадается при 1745 °C по
эвтектоидной реакции: Si3Zr5 « Si2Zr3 + SiZr2. В работе [1] подчеркивает-
ся, что использование загрязненного Zr, а также присутствие таких
примесей, как О, С, N приводит к стабилизации соединения Si3Zr5 и
делает другие промежуточные фазы относительно неустойчивыми. Это
явилось одной из причин расхождения литературных данных по числу
и стехиометрии соединений в системе Si-Zr.
Растворимость Si в Zr незначительна: < 0,6 % (ат.) в PZr и < 0,3 % (ат.)
в aZr [X]. Si практически не влияет на температуру 0 « а превращения в
Zr.
Данные по кристаллической структуре соединений системы Si-Zr
представлены в табл. 480. Температуры полиморфных превращений в
SiZr и Si4Zr5 соответствуют температурам 1460 и 1860 °C соответственно.
Кристаллическая структура 0Si4Zr5 не изучена, а aSi4Zr5 имеет тетраго-
нальную решетку собственного структурного типа.
308
Si-Zr
Таблица 480. Кристаллическая структура соединений системы Si-Zr
Соединение Прототип Символ Пирсона, пр.гр. Параметры решетки, нм Источник
а b с
Si2Zr Si2Zr oC\2, Стет 0,372 0,3724 1,461 1,407 0,368 0,3672 [4] [5]
pSiZr CrB оСЪ, Стет 0,3764 0,9917 0,3748 [6]
aSiZr FeB оР8, Рпта 0,6982 0,6995 0,6987 0,4786 0,3786 0,3783 0,5302 0,5296 0,5302 [4] [7] [5]
aSi4Zr5 aSi4Zr5 1Р36, Р4,2,2 0,7122 0,7123 - 1,3000 1,3002 [8] [9]
Si2Zr3 U3Si2 /РЮ, P^lmbtn 0,7082 0,7072 - 0,3715 0,3693 [Э, 5] [3]
Si3Zr5 Mn5Si3 hP\6, Рбу/тст 0,7886 0,7945 - 0,5558 0,5559 [X] [Ш]
SiZr2 CuAl2 tl\2, lAlmcm 0,6609 0,6609 - 0,5298 0,5303 [4] [5]
SiZr3 Ti3P lP32, P42/n 1,101 1,1011 - 0,545 0,5453 [Ш] [3]
Литература
1. Okamoto Н. И Bull. Alloy Phase Diagrams. 1990. V. 11. N 5. P. 513-519.
2. Kubaschewski-von Goldbeck O. // Atomic Energy Review Special. Issue N 6. Zirconium:
Physico-chemical Properties of its Compounds and Alloys. Vienna: International Atomic Energy
Agency, 1976. P. 67-140.
3. Кочержинский Ю.А., Кулик О.Г., Шишкин E.A. И Металлофизика. АН УССР. 1976
Т. 64. N 1. С. 48-52.
4. Kubaschewski-von Goldbeck О. // Atomic Energy Review. Special. Issue N 6. Zirconium:
Physico-chemical Properties of its Compounds and Alloys. Vienna: International Atomic Energy
Agency, 1976. P. 67-140.
5. Серопегин Ю.Д., Пантелеймонов Л.А., Гусева И.А., Осипова Л.В. Исследование
сплавов системы Zr—Si / Моск. гос. ун-т. М., 1979. 7 с. Деп. в ВИНИТИ 21.05.79, № 2322.
6. Карпинский О.Г., Шамрай В.Ф. // Изв. АН СССР. Металлы. 1969. N 4. С. 209-210.
7. Карпинский О.Г., Евсеев Б.А. И Изв. АН СССР. Неорганические материалы. 1965.
Т. I. N 3. С. 337-339.
8. Pfeifer H.-С., Schubert К. И Z. Metallkunde. 1966. Bd. 57. N 12. S. 884-888.
9. Karpinskii O.G., Evseev B.A. // Acta Crystallogr. 1966. V. 21. Suppl. 7. P. A82-A83.
Л.А. Третьячепко, Л.Е. Шелимова
Sm-Sn
309
Sm-Sn. САМАРИЙ-ОЛОВО
Диаграмма состояния Sm-Sn, представленная на рис. 597, построена
в работе [1]. Для получения сплавов использовали Sm и Sn чистотой 99,88
и 99,99 % (по массе) соответственно.
В системе образуются шесть соединений: Sm5Sn3, Sm4Sn3, Sm5Sn4,
Smj|Sn|0, Sm2Sn3 и SmSn3, из которых соединения Sm5Sn3 и SmSn3
плавятся конгруэнтно при 1505 и 1090 °C соответственно. Соединения
Sm4Sn3, Sm5Sn4, SmHSnI0 и Sm2Sn3 образуются по перитектическим
реакциям при 1440, 1420, 1240 и 1105 °C соответственно.
В системе существуют три эвтектических равновесия:
Рис. 597. Sm - Sn
310
Sm-Sn, Sm-Та
Ж » Sm5Sn3 + (psm) (906 °C, 8 % (ат.) Sn),
Ж « Sm2Sn3 + SmSn3 (1080 °C, 65 % (ат.) Sn),
Ж « SmSn3 + (pSn) (229 °C, > 99 % (ат.) Sn).
Растворимость Sn заметна только для высокотемпературной
модификации Sm. Самарий незначительно [менее 1 % (ат.)] растворим
в Sn.
Данные по кристаллической структуре соединений системы Sm-Sn
представлены в табл. 481.
Таблица 481. Кристаллическая структура соединений системы Sm-Sn [ V-C|
Соединение Прототип Символ Пирсона, пр.гр. Параметры решетки, нм
а b с
Sm5Sn3 Mn5Si3 АР16, Рб^/ттс 0,9089 - 0,6610
Sm4Sn3 Th3P4 сПЯ, 143 d 0,915 - -
Sm5Sn4 Sm5Ge4 оРЗб, Рпта 0,8126 1,567 0,8290
Sm,|Sn10 H°| |Geio НМ, 14/ттт 1,176 - 1,732
Sfn2Sn3* - - 0,91 - , 1,54
SmSn3 Тетрагонал AuCu3 эная сингония. сР4, РтЗт 0,4687 — —
Литература
1. СавицкийЕ.М., Терехова В.Ф. Металловедение редкоземельных металлов. М.: Наука,
1975. 271 с.
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
Sm-Ta. САМАРИЙ-ТАНТАЛ
Диаграмма состояния Sm-Ta изучена лишь частично в области очень
низких концентраций Та (рис. 598) [1].
Sm-Ta
311
Рис. 598. Sm - Та
Сплавы готовили в индукционной печи в вакууме в толстостенных
танталовых тиглях путем нагрева Sm и Sn при 1677-2078 °C с последую-
щей закалкой. Для получения сплавов использовали Sm и Та чистотой
99,98 и 99,99 % (по массе) соответственно. Исследование проводили
методами дифференциального термического и химического анализов.
В системе при температуре 1000 °C и концентрации 0,013 % (ат.) Та
существует эвтектическое равновесие:
Ж » (ySm) + (Та).
Промежуточные фазы в системе Sm-Ta не обнаружены.
Литература
1. Dennison D.H., Tschetter M.J., Gschneidner, Jr., К.А. П J. Less-Common Met. 1966. V. 11.
N 6. P. 423-435.
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
312
Sm-Th
Sm-Tb. САМАРИЙ-ТЕРБИЙ
Диаграмма состояния Sm-Tb экспериментально не построена [1, М].
Однако Sm и ТЬ близко расположены в периодической системе
элементов, имеют идентичное электронное строение в металлическом
Рис. 599. Sm - Tb
состоянии с тремя валентными электронами 5г/16s2, одинаковое
кристаллическое строение ГПУ и ОЦК фаз с близкими параметрами
решеток и близкие значения атомных радиусов, отличающихся всего на
1,2 %. Характеристики элементов системы Sm-Tb представлены в
табл. 482.
Sm-Tb, Sm-Те
313
T а б л и ц а 482. Кристаллическая структура и полиморфные превращения элементов
системы Sm-Tb |1|
Атомный номер, элемент Модифи- кация Прототип, структура Параметры решетки, нм Темпера- тура, ° С Реакция
а с
62Sm aSm aSm 0,36290 2,6207 1074 Ж » ySm
pSm Mg, ГПУ 0,36630 0,58448 922 ySm « pSm
ySm W, ОЦК 0,410 - 734 PSm “ aSm
65Tb aTb Mg, ГПУ 0,36055 0,56966 1356 ж - рть
рть W, ОЦК 0,402 1289 pTb » aTb
*Ромбоэдрическая решетка.
На этом основании можно предположить, что Sm и ТЬ образуют
непрерывные ряды идеальных твердых растворов на базе своих ГПУ и
ОЦК модификаций (рис. 599). Вследствие идеальности растворов линии
ликвидус-солидус практически сливаются в общую прямую с очень узкой
двухфазной областью между ними. На основе aSm при температуре ниже
734 °C образуется твердый раствор, содержащий до 23 % (ат.) ТЬ при
комнатной температуре.
Литература
1. Gschneidner, Jr., К.А., Calderwood F.W. И Handbook on the Physics and Chemistry of Rare
Earths. Amsterdam, New York, Oxford, Tokyo: North-Holland Physics Publishing Co., 1986.
V. 8. Chap. 54. P. 1-161.
B.K. Григорович
Sm-Те. САМАРИЙ-ТЕЛЛУР
Диаграмма состояния Sm-Те (рис. 600), построенная в работе [1],
исследована методами термического, рентгеновского, химического и
микроструктурного анализов.
Образцы получали методом прямого синтеза в запаянных вакууми-
рованных кварцевых ампулах.
В системе обнаружено восемь соединений, из которых только SmTe
плавится конгруэнтно при 1850 °C. Соединения Sm3Te4, Sm2Te3, Sm3Te7,
314
Sm—Te
Те,°/о [по массе)
Рис. 600. Sm - Те
Sm2Te5 и SmTe3 образуются по перитектическим реакциям при 1690,1500,
890,830 и 465 °C соответственно. Способ и температура кристаллизации
соединений Sm4Te7 и SmTe| 85 не описаны.
SmTe имеет область гомогенности притяженностью 46-50 % (ат.) Те.
Соединение Sm2Te3 претерпевает полиморфное превращение при 640 °C.
В системе обнаружены два эвтектических равновесия:
Ж « Sm + SmTe (980 °C),
Ж « Те + SmTe3 (445 °C).
Данные по кристаллической структуре соединений системы Sm-Te
представлены в табл. 483.
Sm-Те, Sm-Th
315
Таблица 483. Кристаллическая структура соединений системы Srn-Te
Соединение Прототип Символ Пирсона, пр.гр. Параметры решетки, нм Источник
a b c
SmTe NaCl cFS, Fm 3 m 0,6593 - - [1]
Sm3Te4 Th3P4 c/28, /43 d 0,9511 - - [И
pSm2Te3 Th3P4 cM, 143 d 0,9480 - - [И
aSm2Te3 Sb2S3 oP20, Pnma 1,206 1,186 0,434 [1]
Sm4Te7 La4Te7 tP44, P4b2 0,9030 - 0,9195 [П
SmTe, 85 Fe2As P4!nmm 0,4337 - 0,8994 [1]
Sm2Te5 Nd2Te5 oC2K, Cmcm 0,4362 4,362 0,4362 [V-C]
SmTe3 NdTe3 oC16, Cmcm 0,4339 ,2,588 0,4339 [V-C]
Литература
1. Ярембаш Е.И., Елисеев А.А. Халькогениды редкоземельных элементов. М.: Наука,
1975. 258 с.
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
Sm-Th. САМАРИЙ-ТОРИЙ
Диаграмма состояния Sm-Th не построена. В работе [1] на основе
изучения изменения параметров решетки установлено, что растворимость
Sm в Th при 900 °C составляет 50 % (ат.).
Литература
1. Norman М., Harris I.R., Raynor G.V. И J. Less-Common Met. 1966. V. 11. N 6. P. 395-402.
Е.И. Гладышевский, О.И. Бодак, В. К. Печарский
316
Sm-Ti, Sm-Tl
Sm-Ti. САМАРИЙ-ТИТАН
Единственное упоминание в работе [1] о системе Sm-Ti касается
констатации факта трудности изготовления сплавов системы из-за
высокого давления паров Sm.
Литература
1. Гшнейднер К.А. Сплавы редкоземельных металлов. / Пер. с англ.; Под ред.
Е.М. Савицкого. М.: Мир, 1965. 427 с.
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
Sm-Tl. САМАРИЙ-ТАЛЛИЙ
Диаграмма состояния Sm-Tl не построена. В работах [Э, Ш]
сообщается о существовании двух интерметаллических соединений, а в
работах [1-3] - еще трех. Сведения о кристаллической структуре этих
соединений представлены в табл. 484.
Таблица 484. Кристаллическая структура соединений системы Sm-Tl
Соединение Прототип Символ Пирсона, пр.гр. Параметры решетки, нм Источник
a b c
Sm2Tl Ni2In hP6, Pbylmmc 0,5445 - 0,6778 [1]
Sm5Tl3 W5Si3 Z/32, Wmcm. 1,2346 - 0,6140 [2]
SmTl CsCl cP2, Pm 3m 0,3813 - - [Э]
Sm3Tl5 Pu3Pd5 oC32, Cmcm 1,011 0,8155 1,044 [3]
SmTI3 AuCu3 cP4, Pm 3 m 0,48075 - - [Э]
Литература
1. Palenzona A., Franceschi Е. II Colloq. Inst. CNRS. 1970. N 180/1. P. 135-141.
2. Franceschi E., Palenzona A. //J. Less-Common Met. 1969. V. 18. N 2. P. 93-98.
3. Delfino S., Saccone A., Mazzone D., Ferro R. //J. Less-Common Met. 1981. V. 81. N 1
P. 45-53.
Е.И. Гладышевский, О.И. Бодак, B.K. Печарский
Sm-Tm
317
Sm-Tm. САМАРИЙ-ТУЛИЙ
Диаграмма состояния Sm-Tm экспериментально не построена [1, М].
Однако Sm и Tm имеют идентичное электронное строение с тремя
валентными коллективизированными электронами 5^*б52, одинаковую
структуру типа Mg с близкими параметрами решетки [1] и атомными
радиусами, отличающимися всего на 3,3 %. Характеристики элементов
системы Sm-Tm представлены в табл. 485.
Таблица 485. Кристаллическая структура и полиморфные превращения элементов
системы Sm-Tm
Атомный номер, элемент Моди- фикация Прото- тип, струк- тура Параметры решет- ки, нм Темпе- ратура, °C Реакция Источ- ник
а с
62, Sm aSm aSm 0,36290 2,6207 1074 Ж - ySm [1]
PSm Mg, ГПУ 0,36630 0,58448 922 ySm “ PSm [1]
ySm W, ОЦК 0,410 - 734 PSm “ aSm [1]
69, Tm Mg, ГПУ 0,35375 0,55040 1545 Ж - Tm [1]
1655 Жгпу “ ЖОЦК [2]
На основе этих данных можно предположить, что Sm и Tm образуют
друг с другом непрерывные ряды твердых растворов с ГПУ решеткой.
Близость растворов к идеальным позволяет аппроксимировать линии
ликвидуса-солидуса общей прямой, соединяющей температуры
плавления компонентов. Tm в отличие от Sm и большинства РЗМ не
имеет высокотемпературной ОЦК модификации вблизи температуры
плавления [1], но в жидком состоянии при 1655 °C испытывает превраще-
ние ближнего порядка Жгпу « ЖОцК [2]. Это позволяет провести еще
одну прямую, соединяющую температуры превращения Sm и Tm, и
построить диаграмму состояния Sm-Tm (рис. 601) перитектического типа
с перитектической точкой при температуре 1350 °C и концентрации 58 %
(ат.) Tm. При различии атомных радиусов более чем на 3 %, растворы
отклоняются от идеальных, и кривые ликвидуса, солидуса и сольвуса
немного расходятся, что отражено на диаграмме Sm-Tm. Предельная
растворимость Tm в ОЦК фазе достигает ~58 % (ат.). Сплавы с более
высоким содержанием Tm плавятся, сохраняя ГПУ ближний порядок,
318
Sm-Tm, Sm-U
но по достижении температуры, отвечающей штриховой линии,
испытывают превращение ближнего порядка Жгт, « ЖПП1г В aSm
растворяется до 20 % (ат.) Tm. цк
Литература
I. Gschneidner Jr., К.А., Calderwood F.W. // Handbook on the Physics and Chemistry of Rare
V8 Cha™5Tpa7-16|W Y°rk’ °Xf°rd’ Tokyo: North-Holland Physics Publishing Co., 1986.
2. Григорович B.K., Григорович K.B. И Строение и свойства металлических и шлаковых
расплавов. Тезисы докладов на VII Всесоюзной конференции. Челябинск: ЧПИ, 1990. Т 2
В. К. Григорович
Sm-U. САМАРИЙ-УРАН
Диаграмма состояния Sm-U не построена. В работе [Э] собраны
сведения об исследовании взаимной растворимости компонентов в
Sm-U, Sm-V
319
жидком состоянии. Растворимость Sm в U приведена ниже:
Температура, °C......................... 1250 1225 1200 1175 1150
Растворимость Sm, % (ат.)............... 0,33 0,40 0,40 0,33 0,32
Растворимость U в Sm имеет следующие значения:
Температура, °C.............. 1250 1225 1200 1175 1150 1100 1050
Растворимость U, % (ат.)..... 0,70 0,86 0,86 0,63 0,48 0,48 0,48
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
Sm-V. САМАРИЙ-ВАНАДИЙ
Диаграмма состояния Sm-V, представленная на рис. 602, построена
в работе [1].
Двойные соединения в системе не образуются. В жидком состоянии
практически во всем интервале концентраций компоненты не смешива-
ются. Взаимная растворимость компонентов незначительна. При
температурах 1075 и 945 °C протекают следующие реакции:
Ж + (V) « (ySm),
(ySm) + (V) - (pSm).
Характер реакции, связанной с фазовым переходом pSm « aSm, не
изучен.
Рис. 602. Sm-V
320
Sm-Г Sm-W, Sm-Y
Литература
1. Copeland M., Kato H. // Physics and Material Problems of Reactor Control Rods. Vienna:
International Atomic Energy Agency, 1964. P. 295-317.
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
Sm-W. САМАРИЙ-ВОЛЬФРАМ
В работе [1] определена растворимость W в Sm. При исследовании
использовали W чистотой 99,9 % (по массе) и Sm с содержанием
примесей, % (по массе): 0,0065 N; 0,0005 О; < 0,002 Mg; 0,001 Al; < 0,002
Si; < 0,01 Са; < 0,001 Cr; < 0,002 Fe; < 0,005 Ni; 0,005 Си; < 0,005 Y; < 0,01
Nd; < 0,008 Eu; < 0,01 Gd, 0,04 Та и < 0,02 W.
Растворимость W в Sm имеет следующие значения:
Температура, °C...................... 1418 1590 1603 1718 1765
Содержание W, % (ат.)................ 0,0067 0,0116 0,0139 0,0182 0,0149
Растворимость W в жидком Sm описывается уравнением:
1пх =-3,949-10'3 Т-1 - 1,811,
где х - атомная доля W, Т - температура, К. Рассчитанная по этому
уравнению растворимость W в жидком Sm при температуре его
плавления (1074 °C) составляет 0,0018 % (ат.).
I v
Литература
1. Dennison D.H., Tschetter M.J., Gschneidner, Jr., К.A. H J. Less-Common Met. 1966. V. 11
N 6. P. 423-435.
КБ. Поварова
Sm-Y. САМАРИЙ-ИТТРИЙ
Диаграмма состояния Sm-Y, представленная на рис. 603, построена
в работе [1] на основе обобщения литературных данных.
Высокотемпературные модификации компонентов (ySm и 0Y)
образуют между собой непрерывный ряд твердых растворов. Непрерыв-
ный ряд твердых растворов наблюдается также и между 0Sm и aY при
температурах выше 734 °C. Ниже этой температуры в системе существуют
два твердых раствора на основе aSm и aY и двухфазная область между
Sm-Y, Sm-Zn
321
Рис. 603. Sm-Y
ними, которая нанесена условно по аналогии с другими системами между
РЗМ.
Литература
1. Gschneidner, Jr., К.A., Calderwood F.W. // Bull. Alloy Phase Diagrams. 1983. V. 4. N 2.
P. 129-131.
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
Sm-Zn. САМАРИЙ-ЦИНК
Диаграмма состояния Sm-Zn представлена на рис. 604 по данным
работы [1].
Сплавы синтезировали в танталовых тиглях из Zn чистотой 99,99 %
(по массе) и Sm с содержанием примесей, % (по массе): > 0,02 Nd; > 0,01
Ей; > 0,01 Ge; 0,0225 Са; 0,04 Та и 0,0175 О. Исследование проводили
методами микроструктурного, рентгеновского и термического анализов.
В системе существует восемь соединений, из которых SmZn, SmZn2,
Sm13Zn58 и Sm2Zn17 плавятся конгруэнтно при 960, 942, 908 и 940 °C
соответственно. Остальные соединения образуются по перитектическим
реакциям.
Нонвариантные реакции, протекающие в системе Sm-Zn, представ-
лены в табл. 486.
322
Sm-Zn
Рис. 604. Sm - Zn
Таблица 486. Нонвариантные реакции в системе Sm~Zn |1]
Реакция Содержание Zn в фазах, % (ат.) Температура, “С
(ySm) «• (pSm) + SmZn -8; -2; 50 670
Ж » (ySm) + SmZn 23,9 -12; 50 680
Ж = SmZn + aSmZn2 56,4; 50; -64 890
Ж + aSmZn2 3 SmZn3 -74; -67; 75 855
Ж ° SmZn3 + Sm3Zn(1 76; 75; 78,5 850
Ж + Sm)3Zn58 » Sm3Znn -77; 81,7; 78,5 870
Ж » Sm)3Zn58 + Sm2Zn|7 85,5; 81,7; 89,5 900
Sm13Zn58 + Sm2Zn17 « » Sm3Zn22 81,7; 89,5; 88,0 890
Ж + Sm2Zn17 = SmZn(1_12 -97; 89,5; -92 760
Ж » SmZn| (_|7 + (Zn) -100; -92; -100 -419
Sm—7.n
323
Соединение SmZn2 претерпевает полиморфное превращение в
интервале температур 905-865 °C. В литературе сообщается также о
существовании соединения SmZn5, которое не отображено на диаграмме
состояния.
Данные по кристаллической структуре соединений представлены в
табл. 487.
Таблица 487. Кристаллическая структура соединений системы Sm-Zn (V-C)
Соединение Прототип Символ Пирсона, пр.гр. Параметры решетки, нм
a b c
SmZn CsCl cP2, РтЗт 0,3627 - -
SmZn2 KHg2 Imma 0,4552 0,7299 0,7590
SmZn3 YZn3 оР\Ь, Pnma 0,6725 0,4489 1,0199
SnisZn,, La3Al| । оПИ, Immm 0,4452 1,3199 0,8838
Sm)3Zn58 Gd13Zn58 ИР142, P63mc 1,440 - 1,407
SmZn5 CaCu5 hPf>, Pblmmm 0,5357 - 0,4268
Sm3Zn22 Pu^Zn-^ tnoo, I4\lamd 0,8856 - 2,1175
Sm2Zn)7 Th2Ni)7 ЛР38, P63/mmc 0,8979 - 0,8876
Th2Zn17 hR\9, R3m 0,9017 - 1,3211
SmZn|)_)2 SmZn и hP42, P6/mmm 0,8974 - 0,8918
SmZn)2 ThMn)2 П26, I4fmmm 0,8930 - 0,5214
Литература
1. Chiotti Р., Mason V.T. //Trans. AIME. 1967. V. 239. N 4. P. 547-552.
Е.И. Гладышевский. О.И. Бодак, В.К. Печарский
324
Sm-Zr
Sm-Zr. САМАРИЙ-ЦИРКОНИЙ
Методами термического, рентгеновского и микроструктурного
анализов в работе [I] исследовали фазовые равновесия в богатой Sm
части диаграммы состояния системы Sm-Zr. Сплавы готовили плавлени-
ем в индукционной печи в танталовых тиглях в среде гелия.
Zr повышает температуру плавления Sm от 1074 °C до температуры
перитектической реакции Ж + (PZr) « (ySm) при 1090 °C, а температуру
превращения Sm в высокотемпературную модификацию ySm от 922 °C
до температуры перитектоидной реакции (ySm) + (pZr) =* (pSm) при
945 °C. Растворимость Zr в Sm при 1040 °C составляет менее 0,33 % (ат.).
Интерметаллические соединения в системе не образуются.
На рис. 605 приведена компилятивная схематическая диаграмма
состояния Sm-Zr, построенная в работе [2] на основе ограниченных
экспериментальных данных о взаимодействии компонентов и данных
Рис. 605. Sm - Zr
Sm-Zr, Sn—Sr
325
о температурах плавления и превращения Sm и Zr [3-5]. Данных о
влиянии Sm на температуру превращения Zr нет, перитектоидная реакция
(PZr) + (PSm)«(aZr) показана условно. Предполагается, что при высоких
температурах в равновесии с (PZr) и расплавом на основе Zr сосуществует
расплав на основе Sm или газообразный Sm, поскольку температура
кипения Sm (1791 °C) ниже температуры плавления Zr.
Горизонталь при 734 °C соответствует реакции, связанной с
превращением aSm а 0Sm [5], характер которой не определен.
Литература
1. Copeland М., Cato Н. И Physics and Material Problems of Reactor Control Rods. Vienna:
International Atomic Energy Agency, 1964. P. 295-317.
2. Chase M.W.//Bull. Alloy Phase Diagrams. 1983. V. 4. N 1. P. 124-125.
3. Савицкий E.M., Терехова В.Ф. Металловедение редкоземельных металлов. М.: Наука,
1975. 259 с.
4. Спасская А.А., Шишков В.В.//Изв. АН СССР. Металлы. 1982. N 1. С. 150-152.
5. Бурков А.Т., Ведерников М.В., Никифорова Т.В., Рытус Н.Н. // Физика твердого тела.
1983. Т. 25. N 2. С. 570-572.
Л.А. Третъяченко
Sn-Sr. ОЛОВО-СТРОНЦИЙ
Диаграмма состояния Sn-Sr, построенная по результатам термическо-
го, рентгеноструктурного, микроструктурного, микрорентгеноспектраль-
ного анализов и измерением плотности сплавов, представлена на рис. 606
по данным работ [1,2].
5л, °/о(по массе)
Рис. 606. Sn - Zr
326
Sn-Sr
Сплавы получали в среде Аг в тиглях из инконеля, используя Sn и Sr
чистотой 99,999 % (по массе) и более 99 % (по массе) соответственно [1].
В системе существуют пять соединений, из которых Sr2Sn, Sr5Sn3 и
SrSn плавятся конгруэнтно при 1255, 1205 и 1140 °C соответственно.
Соединения SrSn3 и SrSn5 образуются по перитектическим реакциям при
температурах 598 и 334 °C соответственно.
В системе протекают четыре эвтектических реакции:
Ж 11 (PSn) + SrSn5 при 230 °C и 99 % (ат.) Sn;
Ж Sr5Sn3 + SrSn при 1080 °C и 47 % (ат.) Sn;
Ж « Sr2Sn + Sr5Sn3 при 1170 °C и 35 % (ат.) Sn;
Ж « (Sr) + Sr2Sn при 745 °C и 4 % (ат.) Sn.
Кристаллическая структура соединений дана в табл. 488.
Таблица 488. Кристаллическая структура соединений системы Sn-Sr
Соединение Прототип Символ Пирсона, пр.гр. Параметры решетки, нм Источник
а b с
Sr2Sn РЬС12 оРП, Рпта 0,8401 0,5378 1,0078 [2]
Sr5Sn3 Сг5В3 U32, IMmcm 0,8565 - 1,6261 [2]
SrSn* СгВ оСЪ, Стет 0,504 1,204 0,449 [2]
SrSn " - - 1,200 - 3,294 [1]
SrSn$“” - - 1,217 0,406 0,516 [Ш]
Низкотемпературная модификация. Тригональная сингония. Моноклинная сингония, 0 = 104,3°.
Литература
1. Marshall D., Chang Y.А. II J. Less-Common Met. 1981. V. 78. N 1. P. 139-145.
2. Widera A., Schafer H.//J. Less-Common Met. 1981. V. 77. N 1. P. 29-36.
Л.Л. Зусмап
Sn-Та, Sn-Те
327
Sn-Ta. ОЛОВО-ТАНТАЛ
В системе существует соединение Ta3Sn [X, Э]. Оно имеет кубическую
кристаллическую решетку типа W с параметром а - 0,5276 нм [X], а -
- 0,5278 нм [Э]. Предполагается, что Ta3Sn образуется по перитектичес-
кой реакции при температуре между 1200 и 1550 °C [X].
Л.Л. Рохлин
Sn-Te. ОЛОВО-ТЕЛЛУР
Диаграмма состояния Sn-Te, построенная в работе [1] на основе
обобщения данных работ [X, Э, Ш, 2, 3], представлена на рис. 607.
В системе существует одно соединение SnTe, плавящееся конгруэнтно
при 806±0,3 °C [4], причем положение максимума на кривой ликвидуса
отвечает составу 50,4 % (ат.) Те. В системе протекают две эвтектические
реакции:
Ж « SnTe + (Те) при 401 °C и 85 % (ат.) Те [5];
Ж « (pSn) + SnTe при 231,5 °C и 0,01 % (ат.) Те [2].
Кривая ликвидуса в области концентраций между Sn и SnTe имеет
точку перегиба, что указывает на возможность метастабильной области
Sn Те. % (ат.) Те
Рис. 607. Sn - Те
328
Sn-Те
расслаивания в переохлажденной жидкости при температурах ниже
ликвидуса. Эта область расслаивания нанесена на рис. 607 штриховой
линией на основе расчетов [2], однако не была подтверждена эксперимен-
тально.
Растворимость компонентов друг в друге невелика. Растворимость
Те в pSn равна 0,11 % (ат.) и 0,07 % (ат.) при 230 и 20 °C соответственно.
Термодинамический анализ системы в предположении модели
ассоциированных растворов для жидкой фазы предпринят в работах [2,
3, 6]. Результаты расчета находятся в хорошем согласии с эксперимен-
тальными данными.
Соединение SnTe имеет область гомогенности [4, 7, 8]. Ее протяжен-
ность составляет 50,1±0,1-50,9±0,1 % (ат.) Те при 400 °C [7] и 50,1-51,1 %
(ат.) Те при 600 °C [4].
Соединение SnTe кристаллизуется в кубической структуре типа NaCl
(символ Пирсона cF%, пр.гр. Fm3m). Параметр решетки зависит от
содержания Те. В пределах области гомогенности параметр а изменяется
от 0,63272 нм для состава, отвечающего границе, насыщенной Sn, до
0,63017 нм для состава, отвечающего границе области гомогенности,
насыщенной Те [9].
Соединение SnTe претерпевает низкотемпературный фазовый переход
второго рода из кубической структуры типа NaCl в ромбоэдрическую
типа aAs [10], температура которого зависит от степени отклонения
состава соединения от стехиометрического состава [11]. При содержании
Те чуть меньше 50 % (ат.) температура фазового перехода составляет
- 128 °C, а при содержании Те свыше 50,64 % (ат.) она приближается к
-273 °C [11].
При давлении 1,8-2 ГПа в SnTe происходит фазовый переход первого
рода из кубической структуры в ромбическую типа SnS (символ Пирсона
оР8, пр.гр. Рпта) параметры решетки: а - 0,448 нм; b = 0,437 нм; с =
= 1,159 нм [13] (при давлении 2,0 ГПа) [13, 14].
Литература
1. Sharma R.C., Chang Y.A. И Bull. Alloy Phase Diagrams. 1986. V. 7. N 1. P. 72-80.
2. Hsieh K., Wei M.S., Chang Y.A. // Z. Metallkunde. 1983. Bd. 74. N 5. S. 330-337.
3. Kattner U., Lukas H.L., Petzow G.//J. Less-Common Met. 1985. V. 114. N 1. P. 129-144.
4. Brebrick R.F. // J. Phys. Chem. Solids. 1963. V. 24. N 1. P. 27-36.
5. Kurosava S., Nakamura Y., Shimoji M. // J. Less-Common Met. 1980. V. 70. N 1.
P. 119-121.
6. Хариф Я.Л., Ковтуненко П.В., Майер A.A., Аветисов И.К. // Журнал физической
химии. 1982. Т. 56. № 9. С. 2313-2315.
7. Шелимова Л.Е., Абрикосов Н.Х. // Журнал неорганической химии. 1964. Т. 9. N 8.
С. 1879-1882.
8. LinJ.-C., NgaiT., Chang Y.A.//Metall. Trans. A. 1986. V. 17. N 7. P. 1241-1245.
9. Brebrick R.F.//J. Phys. Chem. Solids. 1971. V. 32. N 3. P. 551-562.
Sn-Те, Sn~Th
329
10. Muldawer L. // Physics of IV-VI Compounds and Alloys: London, New York: Gordon
and Breach. 1974. P. 193-198.
11. Kobayashi K.L.I., Kato ¥., Komatsubara K.F. // Prog. Cryst. Growth Charact. 1978. V. 1.
N2. P. 117-149.
12. Grassie A.D., Agapito J.A., Gonzalez P. //J. Physics. C. (Solid State Physics.) 1979. V. 12.
N 24. P. L925-L927.
13. Kafalas J.A., Mariano A.N. // Science. 1964. V. 143. N 3609. P. 952-954.
14. Серебряная H.P., Кабалкииа C.C. // Физика твердого тела. 1979. Т. 21. N 7.
С. 2152-2155.
Л.Е. Шелимова
Sn-Th. ОЛОВО-ТОРИЙ
Диаграмма состояния Sn-Th, представленная на рис. 608, построена
в работе [1] на основе результатов микроструктурного, рентгеновского
и термического анализов.
Синтез сплавов, содержащих до 50 % (ат.) Th проводили в герметичес-
ки заваренных молибденовых тиглях в высокочастотной печи при
температуре 1500 °C. Сплавы, содержащие свыше 50 % (ат.) Th,
выплавляли в дуговой печи. Для получения сплавов использовали Sn и
Th чистотой 99,999 и 99,5 % (по массе) соответственно.
В системе образуются четыре интерметаллических соединения, из
которых только Sn3Th5 плавится конгруэнтно при 1800 °C; остальные
Рис. 608. Sn - Th
330
Sn-Th, Sn-Ti
соединения: Sn4Th5, Sn2Th и Sn3Th образуются по перитектическим
реакциям при 1550, 1410 и 995 °C соответственно. Со стороны Sn при
температуре 220 °C кристаллизуется эвтектика Sn3Th + (0Sn). Другая
эвтектическая реакция: Ж « (0Th) + Sn3Th5 протекает, вероятно, при
1600 °C и -80% (ат.) Th.
Соединение Sn3Th имеет кристаллическую структуру типа AuCu3
(символ ПирсонасР4, пр.гр. РтЗт) са- 0,4719 нм. Соединение Sn2Th
обладает ромбической структурой типа ZrSi2 (символ Пирсона оС12,
пр.гр. Cmcni) с параметрами а = 0,4463 нм; b - 1,7008 нм; с = 0,4379 нм.
Соединение Sn4Th5 имеет гексагональную решетку типа Ca4Ti5 с а =
= 0,9643 нм; с - 0,6445 нм. Соединение Sn3Th5 кристаллизуется в
структуре типа Mn5Si3 (символ Пирсона API 6, пр.гр. Ptymcm) с
параметрами а = 0,9332 нм; с = 0,6477 нм.
Литература
1. CiraficiS., Palenzona A., ManfrinettiP.//J. Less-Common Met. 1983. V. 90. N 1. P. 49-56.
П.Б. Будберг
Sn-Ti. ОЛОВО-ТИТАН
На основании анализа данных экспериментальных работ, проведен-
ных методами дифференциального термического, микроструктурного
Sn, % (по массе)
Рис. 609. Sn-Ti
Sn-Ti
331
и рентгеноструктурного анализов, построена диаграмма состояния
системы Sn-Ti (рис. 609) [М]. В системе установлено существование
четырех промежуточных фаз: Ti3Sn (23-25 % (ат.) Sn), Ti2Sn3 (32,7-35,9 %
(ат.), Ti5Sn3 (37,5 % (ат.) Sn) и Ti6Sn5 (45,5 % (ат.) Sn). Отмечается, что
соединение Ti6Sn5 существует в двух модификациях с температурой
фазового перехода -790 °C.
Соединения Ti3Sn и Ti6Sn5 плавятся конгруэнтно при температурах
1670 °C (1663 °C [X]) и 1490 °C (1494 °C [X]) соответственно. Фазы Ti2Sn
и Ti5Sn3 образуются по перитектическим реакциям при температурах
1550 (1552 °C [X]) и 1505 °C соответственно.
Олово понижает температуру плавления титана. Координаты
эвтектической точки (pTi) + Ti3Sn соответствуют: 17 ат. % Sn и 1620 °C
[М]; 18 ат. % Sn и 1605 °C [X]. Результаты экспериментальных работ по
влиянию Sn на переход (aTi) « (pTi) неоднозначны. Однако минимум в
области (а + р) подтверждается данными, полученными разными
методами [X, Э, Ш].
Таблица 489. Кристаллическая структура соединений системы Sn-Ti
Соединение Прототип Символ Пирсона, пр.гр. Параметры решетки, нм Источник
a b c
Ti3Sn Ni3Sn ЛР8, Ptymmc 0,5916 - 0,4764 [X]
Ti2Sn NiAs hP4, Pbylmmc 0,4653 - 0,5700 [X]
Ti5Sn3 Mn5Si3 hP16, P63/mcm 0,8049 - 0,4454 [X]
aTi6Sn5 Sn5Th6 hP22, P6jlmmc 0,922 - 0,569 [Ш]
pTi6Sn5 Sn5Th6 olM. Immm 1,6930 0,9144 0,5735 [Ш]
Максимальная растворимость Sn в (pTi) составляет -16 % (ат.) при
эвтектической температуре, а в (aTi) - ~9 % (ат.) при температуре
перитектоидной реакции (PTi) + Ti3Sn « (aTi).
Влияние Ti на точку кристаллизации Sn точно не установлено.
Предполагается, что Ti снижает температуру плавления Sn на 1-2°.
Температура ликвидуса в зависимости от содержания Ti по данным
работы [III] приведена ниже:
332
Sn-Ti, Sn-Tl
Температура, °C................................
Содержание Ti, % (ат.).........................
880 810 515 320
21,6 18,4 6,1 3,6
Растворимость Ti в твердом Sn составляет -0,015-0,020 % (ат.).
Данные по кристаллической структуре станнидов Ti приведены в
табл. 489.
В.П. Полякова
Sn-Tl. ОЛОВО-ТАЛЛИЙ
Представленная в работе [X] диаграмма состояния Sn-Tl, базирующа-
яся на результатах ранних работ, была дополнительно исследована и
уточнена в средней части и со стороны Т1 [Э, Ш, 1-6]. Было установлено,
что в системе образуется промежуточная фаза у с ГЦК решеткой и
соединение, содержащее несколько более 60 % (ат.) Sn. Приведенная на
рис. 610 диаграмма состояния Sn-Tl была построена в работе [6] с учетом
последних исследований, в том числе и собственных результатов.
Для диаграммы состояния характерно наличие со стороны Т1
перитектического превращения Ж + фТ1) - у при температуре 275 °C и
эвтектоидного превращения (рТ1) « (аТ1) + у при 140 °C. Для температу-
рю. 610. Sn - TI
Sn-Tl, Sn-U
333
ры перитектического превращения получены также значения: -265 °C
[4], а для эвтектоидного - 84 °C [4] и 125 °C [5]. Для эвтектоидной точки
в работе [4] указана концентрация -4,5 % (ат.) Sn, а в работе [5] - 5-8 %
(ат.) Sn. Содержание Sn в образующемся в системе соединении принято
равным 63 % (ат.) Sn. Это значение близко к тому, которое указывается
в работе [3] - около 62 % (ат.) Sn и к составу - 66,7 % (ат.) Sn (отвечает
формуле Sn2Tl). Для температур образования по перитектической
реакции и эвтектоидного распада этого соединения в работе [3]
приведены значения 178 и 153 °C соответственно. Для максимальной
растворимости Sn в фазе у дается значение 48 % (ат.) Sn [Э, 1].
Температура эвтектического превращения со стороны Sn по данным
работы [6] равна 172 °C, по данным других источников: 170 °C [X],
170,6 °C [Э, 1], 165 °C [2], а концентрация Sn в эвтектике-69,1 % (ат.) [X,
Э, 1], т.е. хорошо согласуются с указанной на диаграмме (69 % (ат.) Sn).
Растворимость Т1 в твердом Sn при эвтектической температуре 172 °C
составляет 1,6 % (ат.) [6], при эвтектоидной температуре 170,6 °C - 0,5 %
(ат.) [Э, 1], при 165 °C - 0,99 % (ат.), при 156 °C - 0,3 % (ат.) [2].
В работе [X] для растворимости Т1 в твердом Sn даются следующие
значения:
Температура, °C................................. 140 120 100 60
Растворимость TI, % (ат.) ..................... 0,35 0,275 0,175 0,125
Литература
1. Blade J.C., Elwood E.C.//J. Inst. Met. 1959-1960. V. 88. N 4. P. 186-189.
2. Rayson H.W., Goulding C.W., Raynor G.V. // Metallurgia. 1959. V. 59. N 352. P. 57-62.
3. Schumann E., Oberle В. H Arch. Eisenhiittenwes. 1961. Bd. 32. N U.S. 791-797.
4. Захаров А.И., Понятовский Е.Г. // Журнал неорганической химии. 1962. Т. 7. № 10.
С. 2374-2377.
5. Takezawa Т., Shimakura К., Hishujama Y. И J. Inst. Met. 1968. V. 96. N 3. Р. 94-95.
6. Predel В., Schwermann W. H Acta Metall. 1971. V. 19. N 2. P. 85-92.
Л.Л. Рохлин
Sn-U. ОЛОВО-УРАН
Диаграмма состояния Sn-U приведена на рис. 611 по данным работы
[1]. В системе образуются соединения Sn3U, Sn5U3, Sn2U3. Обзор более
ранних результатов дан в работах [X, Ш] на основе исследования
сплавов, приготовленных из Sn и U чистотой более 99,9 % (по массе),
методами металлографического, рентгенографического и термического
анализов.
334
Sn-U
Рис. 611. Sn-U
В работах [X, Ш] сообщается о существовании соединения Sn4U5, а
в работе [2] были найдены соединения SnU, Sn2U, Sn7U3, составы
которых определены приблизительно. На обобщенной диаграмме
состояния, построенной с учетом расчетных данных [1], эти результаты
не нашли отражения.
Соединение Sn3U образуется по перитектической реакции Ж +
+ Sn5U3 « Sn3U при температуре 1350 °C. По данным работы [1] Sn3U
имеет структуру типа AuCu3 (символ Пирсона сР4, пр.гр. РтЗт) с
параметром решетки а - 0,46089 нм.
Соединение Sn5U3 образуется по перитектической реакции Ж +
+ Sn2U3 « Sn5U3 при температуре 1380 °C. Соединение Sn2U3 предполо-
жительно плавится конгруэнтно при 1500 °C. Надежность представлен-
ных схем образования соединений Sn2U3 и Sn5U3 остается под сомнением
из-за трудностей постановки прямого эксперимента по причине
пирофорности этих соединений, высокой их испаряемости и приблизи-
тельности составов.
Взаимная растворимость U и Sn крайне незначительна во всех
модификациях. Характер фазовых превращений при легировании U
оловом ввиду почти полного отсутствия растворимости остается
неустановленным с точки зрения изменения температур а - 0 и 0 * у
полиморфных превращений.
Sn-U, Sn-U
335
Литература
I. Sheldon R.I., Foltyn E.M., Peterson D.E. // Bull. Alloy Phase Diagrams. 1987. V. 8. N 4.
P. 347-352.
2. Sari C., Vernazza F., Muller W. // J. Less-Common Met. 1983. V. 92. N 2. P. 301-306.
Г.И. Терехов
Sn-V. ОЛОВО-ВАНАДИЙ
Представленная на рис. 612 диаграмма состояния Sn-V приведена в
работе [1], в которой она была изучена наиболее полно и подробно.
Полученные в работе [1] результаты в основном подтверждают
предыдущие исследования [X, Э, Ш, 2, 3].
Для системы характерно образование по перитектической реакции
соединения V3Sn. Это соединение имеет узкую область гомогенности
[< 1 % (ат.)], которая находится в интервале 20-21 % (ат.) Sn и, таким
образом, смещена относительно стехиометрического состава в сторону
избытка V. В работах [X, 2] температура перитектического превращения,
при котором образуется V3Sn, оценивалась в -1300 °C, но это значение
менее надежно, чем приведенное на диаграмме - 1600 °. Авторами
работы [2] установлено, что в сплавах, содержащих до 21,2 % (ат.) Sn, в
равновесии с (V) находится V3Sn, а при более высоких содержаниях Sn
наблюдается V3Sn совместно с Sn. Это указывает, как и в работе [1], на
то, что V3Sn образуется с отклонением от стехиометрии в сторону
избытка V.
В системе имеется область несмешиваемости в жидком состоянии и
предполагается образование еще одного соединения V2Sn3. На образова-
ние этого соединения указывали результаты термического анализа и
рентгеновского исследования [1].
Растворимость Sn в твердом (V) составляет при 1500 °C около 14 %
(ат.) [1]. Согласно работе [2], растворимость Sn в твердом (V) при всех
температурах оценивается в 20 % (ат.). Согласно работе [3], раствори-
мость Sn в твердом (V) находится между 9,1 и 9,7 % (ат.). Результаты
работы [1] предпочтительнее, так как они получены при большом числе
экспериментов.
336
Sn—К
У Sn, % (am.) Sn
Рис. 612. Sn-V
Ванадий практически не изменяет параметров кристаллической
решетки Sn, что дает основание предполагать отсутствие существенной
растворимости V в твердом (Sn) [2].
Соединение V3Sn имеет структуру типа 0W (символ Пирсона с112,
пр.гр. 1тЗт) са- 0,494 нм [X],а - 0,496 нм (Э],а - 0,4953...0,4980 нм [1].
Соединение V2Sn3 имеет ромбическую решетку с параметрами: а -
= 0,9498 нм, b = 0,5485 нм, с = 1,867 нм [1].
Литература
1. Марчукова Л.В., Матвеева Н.М., Корнилов И.И. И Изв. АН СССР. Металлы. 1973.
№2. С. 207-211.
2. Koster W., Haug К. И Z. Metallkunde. 1957. Bd. 48. N 6. S. 327-330.
3. Komjathy S.//J. Less-Common Met. 1961. V. 3. N 6. P. 468-488.
Л.Л. Рохлин
SnSn -Y
337
Sn-W. ОЛОВО-ВОЛЬФРАМ
Олово не взаимодействует с вольфрамом при нагреве, по крайней
мере, до 1680 °C [X, 1].
Литература
1. Raub Е., Plate W.//Z. Metallkunde. 1951. Bd. 42. N 3. S. 76.
КБ. Поварова
Sn-Y. ОЛОВО-ИТТРИЙ
Диаграмма состояния Sn-Y представлена на рис. 613 по данным
работы [1]. Предварительный вариант диаграммы приведен в работе [Э].
В работе [1] для синтеза сплавов применяли Y с примесями: 0,02 Fe;
0,009 Си; 0,004 Si; 0,038 О % (по массе) и спектрально чистое олово.
Исследование выполняли методами микроструктурного, рентгенов-
ского и термического анализов.
Рис. 613. Sn-Y
338
Sn-Y
Согласно работе [1], в системе существуют пять интерметаллических
соединений, из которых только одно - Y5Sn3 плавится с открытым
максимумом при 1940 °C, а остальные образуются по перитектическим
реакциям:
Ж + Y5Sn3 - Y5Sn4 при 1790 °C,
Ж + Y5Sn4 » YuSn1() при 1600 °C,
Ж + YuSn10 « YSn2 при 1140 °C,
Ж +YSn2-YSn3 при 515 °C.
В системе существуют две эвтектики: (aY) + Y5Sn3 и (pSn) + YSn3 при
1260 и 229 °C соответственно. Эвтектические точки расположены при
11 и 98,5 % (ат.) Sn соответственно. Растворимость Sn в (aY) составляет
1,5 и 1,0 % (ат.) при 1260 и 1150 °C соответственно. Растворимость Y в
(Sn) меньше 0,5 % (ат.).
Добавка 4 % (ат.) Sn снижает температуру полиморфного превраще-
ния Y примерно на 100 °C. При 1360 °C протекает метатектическая
реакция: (PY) « (aY) + Ж.
Кристаллическая структура соединений в системе Sn-Y приведена в
табл. 490 по данным работы [V-С].
Таблица 490. Кристаллическая структура соединений системы Sn-Y |V-C|
Соединение Прототип Символ Пирсона, пр.гр. Параметры решетки, нм
а Ь с
Y5Sn3 Mn5Si3 hP\6, Рб^/тст 0,8902 - 0,6536
Y5Sn4 Sm5Ge4 оРЗб, Рпта 0,805 1,525 0,805
YjjSnjo HoiiGejo ИМ, 141ттт 1,153 - 1,691
YSn2 ZrSi2 оС12, Стет 0,4394 1,6340 0,4305
YSn3 AuCu3 сР4, РтЗт 0,4666 — -
Литература
1. Schmidt F.A., McMasters O.D.//J. Less-Common Met. 1968. V. 15. N 1. P. 1-11.
Е.И. Гладышевский, О.И.Бодак, В.К. Печарский
Sn-Yb
339
Sn-Yb. ОЛОВО-ИТТЕРБИЙ
Диаграмма состояния Sn-Yb (рис. 614) была построена в работе [1]
по данным дифференциального термического, рентгеновского и
микроструктурного анализов. Обобщение результатов исследований
системы Sn-Yb проведено в работе [2].
В системе образуются пять соединений: Yb2Sn, Yb5Sn3, Yb5Sn4, YbSn
и YbSn3. Соединение Yb5Sn3 претерпевает полиморфное превращение
при 1090 °C. Два соединения Yb2Sn и YbSn3 плавятся конгруэнтно при
1385 и 805 °C соответственно. Соединения Yb5Sn3, Yb5Sn4 и YbSn
образуются по перитектическим реакциям при 1235, 1160 и 1035 °C
соответственно. В системе протекают три эвтектических реакции при 800,
750 и 230 °C. Концентрация Sn в эвтектических точках составляет 2,0,
64,5 и около 99,5 % (ат.) Sn соответственно.
Кристаллическая структура промежуточных фаз дана в табл. 491.
Sn, °/о (по массе)
Рис. 614. Sn-Yb
340
Sn-Yb, Sn-Zn
Таблица 491. Кристаллическая структура соединений системы Yb-Sn (1 j
Соединение Прототип Символ Пирсона, пр.гр. Параметры решетки, нм
а b с
Yb2Sn Ni2In hP6, P6ylmmc 0,5371 - 0,7063
pYb5Sn3 Cr5B3 /732, I4!mcm 0,7939 - 1,4686
aYb5Sn3 Mn5Si3 hP\6, Pty me m 0,947 - 0,690
Yb5Sn4 Sm5Ge4 oP36, Pnma 0,7822 1,5813 0,8280
YbSn AuCu tP4, P4/mmm 0,4960 - 0,4400
YbSn3 AuCu3 cP4, РтЗт 0,4683 - -
В работе [1] выражаются некоторые сомнения в отношении кристалли-
ческой структуры низкотемпературной модификации Yb5Sn3 из-за
возможности окисления сплавов.
Литература
1. Palenzona A., Cirafici S. //J. Less-Common Met. 1976. V. 46. N 2. P. 321-326.
2. Palenzona A., Cirafici S. // J. Phase Equilibria. 1991. V. 12. N 4. P. 482-485.
Л.Л. Рохлин
Sn-Zn. ОЛОВО-ЦИНК
Диаграмма состояния Sn-Zn приведена на рис. 615 по данным работы
[1]. Система эвтектического типа без образования промежуточных фаз.
Эвтектика образуется при температуре 198,5 °C и концентрации 85,1 %
(ат.) Sn.
Растворимость Sn в (Zn) при 400 °C немного превышает 0,06 % (ат.);
при эвтектической температуре в (Zn) растворяется -0,06-0,1 % (ат.) Sn
[X]. По данным работы [Э] растворимость Sn в (Zn) составляет -0,14 %
(ат.).
При эвтектической температуре растворимость Zn в (Sn) оценивается
в 0,7 % (ат.) [X]; по результатам металлографического и резистометричес-
кого анализов [Э] растворимость Zn в (Sn) составляет:
Sn-Zn, Sn-Zr
341
дал
Рис. 615. Sn - Zn
Температура, °C................................. 25
Растворимость Zn, % (ат.)....................... 0,36
156 199
>1,1 0,582
В работах [1, 2] проведен термодинамический расчет диаграммы
состояния системы Sn-Zn. Результаты расчета хорошо согласуются с
экспериментом.
Литература
1. Moser Z., Dutkiewicz J., Gasior W., Salawa J. // Bull. Alloy Phase Diagrams. 1985. V. 6.
N 4. P. 330-334.
2. Pelton A.D., Bale C'h.W., Rigand M. // Z. Metallkunde. 1977. Bd. 68. N 2. S. 135-140.
В. П. Полякова
Sn-Zr. ОЛОВО-ЦИРКОНИЙ
Анализ экспериментальных данных о фазовых равновесиях в системе
Sn-Zr дан в работе [1]. Предложенная в работе [1] диаграмма состояния
(рис. 616) основывается, главным образом, на результатах работы [2],
выполненной методами микроструктурного и рентгеновского, дифферен-
циального термического (до -1650 °C) анализов и определения
температуры солидуса оптическим пирометром.
342
Sn~Zr
Рис. 616. Sn - Zr
Олово понижает температуру плавления и повышает температуру р «
» а превращения Zr. Максимальная растворимость Sn в (pZr) достигает
17 % (ат.), в (aZr) - 7,3 % (ат.). С понижением температуры растворимость
Sn уменьшается как в (PZr), так и в (aZr) [2].
В системе Sn-Zr установлено существование соединений: ZrSn2 [2, 3],
Zr5Sn3 [2, 4, X], Zr4Sn [2, 5, 6]. Соединение Zr5Sn3 плавится конгруэнтно
при 1988 °C [1], состав этого соединения (60 % (ат.) Zr) несколько
отличается от стехиометрического [2]. В ряде работ приводится
различный состав фазы в интервале концентраций 60-67 % (ат.) Zr:
ZrSn0 55±005 [3], Zr5Sn4 [7], Zr2Sn [4]. По-видимому, все эти данные
относятся’ к Zr5Sn3, а разногласия возникают вследствие неточности
определения состава сплавов и присутствия примесей в сплавах [1,8].
Соединение Zr5Sn3, вероятно, не имеет области гомогенности, участвует
в эвтектической реакции Ж » (pZr) + ZrsSn3 при температуре 1592 °C и
концентрации 80,9 % (ат.) Zr [2].
Соединение Zr4Sn образуется по перитектоидной реакции (pZr) +
+ Zr5Sn3« Zr4Sn при 1327 °C, участвует в перитектодной реакции (0Zr) +
+ Zr4Sn « (aZr).
Sn-Z, Sr-Те
343
Соединение ZrSn2 образуется по перитектической реакции Ж +
+ Zr5Sn3 ZrSn2 при 1142 °C [2] (в работе [2] состав этого соединения
установлен недостаточно точно, предположительно ему приписан сос-
тав, близкий к составу ZrSn).
В олове Zr растворяется очень мало, богатые оловом сплавы плавятся
при 231 ±1 °C, т.е. в пределах ошибки эксперимента при той же
температуре, что и чистое олово pSn [2].
Кристаллическая структура промежуточных фаз представлена в
табл. 492.
Таблица 492. Кристаллическая структура соединений системы Zr-Sn
Соединение Прототип Символ Пирсона, пр.гр. Параметры решетки, нм Источник
а b с
ZrSn2 TiSi2 oF24, Fddd 0,9573 0,5644 0,9927 [3]
Zr5Sn3 Mn5Sij hPl6, РЬт/тст 0,8461 - 0,5795 [X]
Zr4Sn - сРЪ, РтЗт 0,565 - - [5]
Литература
1. Abriata J.P., Bolcich J.C. И Bull. Alloy Phase Diagrams. 1983. V. 4. N 2. P. 147-154.
2. McPherson D.J., Hansen M. //Trans. ASM. 1953. V. 45. P. 915-931.
3. Nowotny H., Schachner H. // Momatsh. Chem. 1953. Bd. 84. N I. S. 169-180.
4. Gran G., Anderson S. // Acta Chem. Scand. 1960. V. 14. N 4. P. 956-957.
5. Schubert K., Anantharaman T.R., Ata H.O.K. et al. // Naturwissenschaften. 1960. Bd. 47.
N 22. S. 512.
5. Rossteutscher W., Schubert K. //Z. Metallkunde. 1965. Bd. 56. N 11. S. 813.
7. Schubert K., Meissner H.G., Raman A., Rossteutscher W. // Naturwissenschaften. 1964.
Bd. 51. N 12. S. 287.
8. Carlson O.N., Smith J.F. // Bull. Alloy Phase Diagrams. 1987. V. 8. N 3. P. 208-213.
Л.А. Третьячепко
SrTe. СТРОНЦИЙ-ТЕЛЛУР
Диаграмма состояния Sr-Те (рис. 617) построена по результатам
термического, рентгеновского и микроструктурного анализов в работе
[1]. Сплавы получали в стальных тиглях в атмосфере аргона.
Установлено существование в системе трех соединений: SrTe, Sr2Te3
и SrTe2. Соединение SrTe плавится конгруэнтно при 1490 °C, a Sr2Te3 и
4.
344
Sr-Те. Sr-Ti
Sr Ter°/ofam.) Те
Рис. 617. Sr - Те
SrTe2 образуются по перитектическим реакциям при 920 и 850 °C
соответственно.
Соединение SrTe имеет структуру типа NaCl (символ Пирсона cF8,
пр.гр. Fm Зт) с а = 0,663 нм.
Литература
1. Лыскова Ю.Б., Вахобов А.В.// Изв. АН СССР. Неорганические материалы. 1975. Т. 11.
№ 12. С. 361-362.
Л.Л. Зусман
Sr-Ti. СТРОНЦИЙ-ТИТАН
Стронций практически не взаимодействует с титаном ни в жидком,
ни в твердом состояниях [1]. При температуре -769 °C кристаллизуется
вырожденная эвтектика: (aTi) + (PSr), эвтектическая точка расположена
при 99,983 % (ат.) Sr. Растворимость Ti в (PSr) при эвтектической
температуре составляет -0,017 % (ат.). При 882 °C протекает перитекти-
ческая реакция Ж + (PTi) » (aTi).
Sr-Ti. Sr-Tl
345
Sr, °/o (no массе)
Рис. 618. Sr - TI
Растворимость Sr в (aTi) и (0Ti) при 882 °C, согласно работе [1],
составляет 0,019 и 0,0059 % (ат.) соответственно, однако трудно оценить
надежность этих данных, так как метод анализа, с помощью которого
получены эти результаты, в работе не описан.
Вариант диаграммы состояния, приведенный в работе [М] на основе
данных работы [1], представлен на рис. 618.
Литература
I. Алиджанов Ф.Н., Вахобов А.В., Джураев Т.Д. // Изв. АН СССР. Металлы. 1978. № 2.
С.223-224.
П.Б. Будберг
Sr-Tl. СТРОНЦИЙ-ТАЛЛИЙ
На рис. 619 представлена диаграмма состояния Sr-Tl по данным
работы [М]. В системе образуются шесть соединений, три из которых:
Sr2Tl, SrTl и SrTl3 плавятся конгруэнтно при 650, 906 и 536 °C соотве-
тственно. Соединения Sr3Tl, Sr2Tl3 и SrTl2 образуются по перитектичес-
ким реакциям при 465, 658 и 538 °C соответственно.
В системе протекают четыре реакции эвтектического типа:
Ж * (aSr) + Sr3Tl при 450 °C и - 19 % (ат.) Т1,
Ж * Sr2Tl + SrTl при 640 °C и 34,6 % (ат.) Т1,
4
Sr-Tl, Sr-U, Sr-V, Sr-Y
347
346
Sr-Tl
Рис. 619. Sr - TI
Ж « SrTl2 + SrTl3 при 525 °C и 69,3 % (ат.) TI,
Ж « (PTI) + SrTl3 при 304 °C и -95 % (ат.) Т1.
По данным работы [ 1 ] возможно также существование соединения Sr5Tl3.
образующегося по перитектической реакции: Ж + SrTI « Sr5Tl3, однако
это соединение на диаграмме состояния [М] отсутствует.
Данные по кристаллической структуре соединений системы Sr-Tl
представлены в табл. 493.
Таблица 493. Кристаллическая структура соединений системы Sr -TI
Соединение Прототип Символ Пирсона, пр.гр. Параметры решетки, нм Источник
а с
SrTI CsCl с/>2. РтЗт 0,4032 - [X]
SrTl2 Caln2 hP6, Рб^ттс 0,5074 0,8217 [Ш]
SrTl3 CuTi3 tP4, Р4/ттт - - [1]
Литература
1. Bruzzone G., Merlo F.//J. Less-Common Met. 1982. V. 85. N 2. P. 285-306.
Л.Л Зусман
Sr-U. СТРОНЦИЙ-УРАН
Диаграмма состояния Sr-U не построена. В работе [1] указывается,
что растворимость Sr в U очень мала.
Литература
1. Adda Y., Levy V., Hadari Z., Tournier J. // Compt. Rend. Acad. Sci. Paris. 1960. V. 250.
N 3. P. 536-538.
Л.Л. Зусман
Sr - V. СТРОНЦИЙ - ВАНАДИЙ
Экспериментальные данные о характере взаимодействия стронция
с ванадием в литературе отсутствуют. На основе оценки взаимодействия
ванадия с другими щелочноземельными элементами, а также на основе
термодинамического моделирования в работах [1,2] рассчитаны фазовые
равновесия в системе Sr - V. Согласно расчету в системе существует
практически полная несмешиваемость в жидком и твердом состояниях.
Литература
1. Deboer F.R., Boom R., Miedema A.R.//Physica В. 1980. V. 101. P. 294-319.
2. Niessen A.K., Deboer F.R., Boom R. et al. // Calphad. 1983. V. 7. P. 51-70.
Л.Л. Зусман
Sr - Y. СТРОНЦИЙ - ИТТРИЙ
На рис. 620 представлена диаграмма состояния Sr - Y, построенная
по результатам термического, рентгеновского и микроструктурного
анализов; сплавы готовили в корундизовых тиглях в атмосфере Не [1].
При температуре 1085 °C в системе обнаружена монотектическая
реакция, с монотектической горизонталью от 11,5 до 93,6 % (ат.) Y и
монотектической точкой при 81,3 % (ат.) Y. Максимальная раствори-
мость Sr в (aY) составляет 6,4 % (ат.) при 1085 °C; максимальная
348
Sr-Y. Sr-Yb
Рис. 620. Sr-Y
растворимость Y в (0Sr) равна 0,22 % (ат.) при температуре 740 °C.
которая является температурой эвтектической реакции Ж - (pSr) + (aY)
[2].
Литература
1. Нагибина Л.Е., Выхобов А.В., Джураев Т.Д. И Изв. АН СССР. Металлы. 1977. № 2
С. 200-201.
2. Бескаравайный А.К. / Определение границ растворимости в сплавах: Сб. статей.
Ростов: Изд-во Ростовского университета. 1964. С. 19.
Л.Л. Зус.хшн
Sr - Yb. СТРОНЦИЙ - ИТТЕРБИЙ
Диаграмма состояния Sr - Yb не изучена. Согласно работе [1] эти
металлы при сплавлении образуют твердые растворы при любом
соотношении компонентов.
Литература
1. Bruzzone G., Merlo F. И J. Less-Common Met. 1982. V. 85. N 2. P. 295-306.
Л.Л. Зусман
Sr-Zn 349
Sr - Zn. СТРОНЦИЙ - ЦИНК
На рис. 621 представлена диаграмма состояния системы Sr - Zn,
построенная по результатам рентгеновского, микроструктурного и
термического анализов в работе [1].
Сплавы в интервале концентраций 0-75 % (ат.) Zn готовили в тиглях
из Fe; а сплавы с содержанием более 75 % (ат.) Zn - в контейнерах из Мо,
заваренных в атмосфере Аг. В качестве исходных материалов использова-
ли Sr чистотой 99 % (по массе) и Zn чистотой 99,999 % (по массе).
Установлено существование четырех соединений. Соединение SrZn5
имеет две модификации. Модификация pSrZn5 стабильна при температу-
рах между 620 и 650 °C, aSrZn5 - при температурах ниже 620 °C.
Соединения SrZn2 и SrZn[3 плавятся конгруэнтно соответственно при
575 и 830 °C. Соединения SrZn и SrZn5 образуются перитектически при
434 и 650 °C.
В системе имеется три эвтектических равновесия: при температуре
369 °C и концентрации 32,5 % (ат.) Zn, при 554 °C и 72,5 % (ат.) Zn и
вырожденное на стороне Zn при -420 °C.
Данные о кристаллической структуре двойных соединений системы
Sr - Zn приведены в табл. 494.
Рис. 621. Sr-Zn
350
Sr-Zn. T-Ta
Таблица 494. Кристаллическая структура соединений системы Sr - Zn
Соединение Прототип Символ Пирсона, пр. гр- Параметры решетки, нм
a b c
SrZn FeB оР8, Pnma 0,8724 0,4607 0,6417
SrZn2 CeCu2 oil 12, Imma 0,4777 0,7790 0,7865
pSrZn5 hP6, P6/mmm 0,5549 - 0,4283
aSrZn5 SrZn5 oP24, Pnma 1,3147 0,5312 0,6707
SrZn13 NaZn13 cFl 12, Fm3c 1,2242 - -
Литература
I. Bruzzone G., Merlo F. //J. Less-Common Met, 1983. V. 92. N 1. P. 75-79.
Л.Л. Зусман
T - Та. ТРИТИЙ - ТАНТАЛ
На рис. 622 приведен вариант диаграммы состояния Та - Т при
температурах ниже 100 °C. Авторы работы [1] считают, что системы
Та - Т, Та - D и Та - Н имеют аналогичное строение. При температурах
Рис. 622. Т - Та
T-Ta, Ta-Tb
351
выше О °C во всех системах существуют фазы а(а'), 0 и е. Фаза е
образуется конгруэнтно при ~ 65 °C и распадается по перитектоидной
реакции при 15 °C с образованием широкой области а + 0. При ~ 60 °C
по перитектоидной реакции образуется фаза 0. При -70 и -65 °C
конгруэнтно образуются фазы £ и у, на рисунке они не указаны.
Литература
1. Condo J.B., Schober R., Lasser R.//J Nucl. Mater. 1990. 170. P. 24-30.
С.П. Алисова
Ta - Tb. ТАНТАЛ - ТЕРБИЙ
Диаграмма состояния Та - ТЬ (рис. 623) построена лишь в области
очень низких концентраций Та [М]. Сплавы готовили в индукционной
печи в вакууме. В толстостенные тигли из Та помещали ТЬ и нагревали
при 1677-2078 °C, затем тигли закаливали в воде. В качестве исходных
материалов использовали ТЬ чистотой 99,56 % и Та чистотой 99,9 %.
Исследования проводили методами дифференциального термического
и химического анализа.
В системе не обнаружено двойных соединений. Существует эвтектичес-
кое равновесие Ж (0ТЬ) + (Та) при 1354 °C и 0,15 % (ат.) Та.
Растворимость Та в жидком ТЬ согласно работе [1] увеличивается от
- 0,1 до - 0,6 % (ат.) при повышении температуры от 1430 до 1746 °C.
Рис. 623. Та - ТЬ
4
352
Ta-Th. Ta-Tc, Ta-Te
Литература
1. Dennison D.H., Tschetter M.J., Gschneidner К.А. П J. Less-Common Met. 1966. V. 10. N 2.
P. 108-115.
Е.И. Гладышевский, О.И. Бодак, B.K. Печарский
Та - Тс. ТАНТАЛ - ТЕХНЕЦИЙ
С помощью рентгеноструктурного анализа установлено, что в сплаве
с 16,6 % (ат.) Та наблюдается фаза с ОЦК решеткой типа аМп (символ
Пирсона с/58, пр. гр. /43тн), а = 0,9565 нм. У сплава эквиатомного
состава обнаружена кристаллическая решетка типа - CsCl (символ
Пирсона сР2, пр. гр. РтЗт) с параметром а = 0,3172 нм.
Литература
1. Darby J.B., Lam D.J., Norton L.J., Downey J.W. //J. Less-Common Met. 1962. V 4. N 6.
P. 558-563.
Л.Л. Рохлин
Ta - Те. ТАНТАЛ - ТЕЛЛУР
В работе [1], проводившейся с использованием рентгенофазового
анализа и измерения электрических свойств, установлено образование
в системе трех промежуточных фаз: ТаТе3, фазы 0 переменного состава
в пределах концентраций, отвечающих формулам ТаТе2-ТаТе( 5, и фазы
а переменного состава в пределах концентраций, отвечающих формулам
ТаТе, 2~ТаТе0 85. Кроме того, на основе анализа рентгенограмм было
выдвинуто предположение об образовании еще одного соединения с
меньшим, чем у фазы а содержанием Те. Для фазы а установлено
полиморфное превращение при 840 °C.
В работе [2] на основании рентгеновских исследований и измерения
электросопротивления и электродвижущей силы был подтвержден
интервал концентрационной однородности фазы 0: TaTej 5_2 0.
В работе [3] проведен рентгеноструктурный анализ фаз, образующихся
в системе Та - Те, и сделан вывод, что при температурах ниже 800 °C в
области концентрации от ТаТе2 до ТаТе0 85 существует лишь одна фаза
а, а не две фазы: а и 0, как это было установлено в работе [1]. При
температурах выше 800 °C фаза а имеет более узкий интервал гомоген-
Ta-Te, Ta-Th
353
ности: от Taj 16Te2 до ТаТе2. Фаза, обозначенная в работе [3] как 0,
образуется при температуре выше 800 °C в интервале концентраций от
ТаТе до - ТаТе1 5. В работе [3] принимается, что наиболее богатое
теллуром соединение имеет формулу ТаТе3.
В работе [4] на основании результатов рентгеноструктурного анализа
и сопоставления их с измерениями плотности делается вывод, что
соединению ТаТе3, установленному в работе [1], более правильно
приписать формулу ТаТе4.
Кристаллическая решетка ТаТе4 (ТаТе3) имеет тетрагональную
структуру с параметрами элементарной ячейки а - 0,653 нм, с - 0,682 нм
[3], или а = 0,65 нм, с = 1,18 нм [1], иЛи а = 2 х 0,6514 нм, с - 3 х 0,66809 нм
[4, 5]. Согласно работе [5] решетка ТаТе4 должна рассматриваться как
изотипная NbTe4. Для фазы 0, установленной в работах [1,2] с интерва-
лом гомогенности 60-66,7 % (ат.) Те, указывается ромбическая решетка
с параметрами а - 0,642(8) нм, Ъ - 1,09(2) нм, с - 0,669 нм. Находящаяся
в этом же диапазоне концентраций фаза а, установленная в работе [3] и
рассматриваемая как ТаТе2, имеет моноклинную решетку, близкую к
гексагональной решетке типа Cdl2, с параметрами а= 1,931 нм, b =
= 0,365 нм, с = 0,937 нм, 0 = 134,75°.
Литература
1. Украинский Ю.М., Новоселова А.В., Симанов Ю.П.//Журнал неорганической химии.
1959. Т.4. № 1. С. 148-152.
2. Украинский Ю.М., Ковба Л.ML, Симанов Ю.П., Новоселова А.В. // Журнал
неорганической химии. 1959. Т. 4. № 12. С. 2820-2823.
3. Revolinsky Е., Brown В.Е., Beerntse D.J., Armitage С.Н. И J. Less-Common Met. 1965.
V. 8. N 1. Р. 63-75.
4. Bjerkelund E., Kjekshus A. //Z. Ann. All. Chemie. 1964. Bd. 328. N 5/6. S. 235-242.
5. Bjerkelund E., Kjekshus A. //J. Less-Common Met. 1964. V. 7. N 3. P. 231-234.
Л.Л. Рохлин
Ta - Th. ТАНТАЛ - ТОРИЙ
Диаграмма состояния Та - Th (рис. 624) является диаграммой
простого эвтектического типа [1].
Сплавы готовили в дуговой печи, используя высокочистый листовой
Та и иодидный Th. Исследования проводили методами термического и
рентгеновского анализов. Эвтектическая реакция
Ж *> (0Th) + (Та)
354
Ta-Th. Ta-Ti
Рис. 624. Ta-Th
протекает при 1565 °C (1680 °C [2]) и 5,1 % (ат.) Та (- 2 % (ат.) Та [2]).
Растворимость Та в (0Th) максимальна при эвтектической температуре
и не превышает 0,52 % (ат.); максимальная растворимость Th в (Та) при
той же температуре менее 0,25 % (ат.).
Нонвариантное равновесие при 1338 °C соответствует эвтектоидному
распаду (0Th) « (aTh) + (Та). В работе [2] сделано предположение о
существовании соединения ThTa2 со структурой Лавес-фазы, инконгруэн-
тно плавящегося при - 1892 °C.
Литература
1. McMasters O.D., Larsen W.L. И J. Less-Common Met. 1961. V. 3. P. 312-320.
2. Ackermann R.J., Rauh E.G. // High Temp. Sci. 1972. V. 4. N 4. P. 272-282.
Г.И. Терехов
Ta - Ti. ТАНТАЛ - ТИТАН
Исследованию диаграммы состояния Ta-Ti посвящены работы [1-5].
В отличие от остальных работ в работе [1] максимальная растворимость
Та в (aTi) при 600 °C определена равной 2 % (по массе), в то время как
большинство исследователей дают значения от 10 до 11 % (по массе).
Оптимальная версия диаграммы состояния системы с ретроградной
растворимостью Та в (aTi) представлена на рис. 625 [5]. С увеличением
Ta-Ti, Ta-Tl
355
содержания Та в Ti температура ликвидуса растет непрерывно, в то время
как температура а « 0 полиморфного превращения, наоборот, понижает-
ся. Та стабилизирует (0Ti), увеличивая устойчивость этой фазы. Все
остальные особенности диаграммы состояния Та - Ti хорошо видны на
рисунке и специального пояснения не требуют.
Литература
1. Sammere-Smith D.J.//J. Inst. Met. 1952. V. 81. Р. 73-75.
2. Duwe Z.P. П Trans. ASM. 1952. V. 45. P. 934-940.
3. Maykath D.J., Ogden H.R., Jaffee R.I. // Trans. AIME. 1953. V. 197. P. 231-237.
4. БудбергП.Б., Шахова К.И. // Изв. АН СССР. Неорганические материалы. 1967. Т. 3.
№ 4. С. 656-660.
5. Никитин П.Н., Михеев В.С. И Физика металлов и металловедение. 1969. Т. 28. № 6.
С. 1127-1129.
С. П. Алисова
Та - Т1. ТАНТАЛ - ТАЛЛИЙ
Проведенное в работе [1] исследование показало отсутствие
взаимодействия между танталом и таллием. Смеси их порошков
подвергали изостатическому прессованию, а затем диффузионному
отжигу при 700 °C в течение 3 мес. в вакууме. Даже отжиг смеси
порошков при 500 °C в течение 2 мес. под давлением 700 МПа не привел
к образованию каких-либо соединений между танталом и таллием.
356
Ta-Tl, Ta-Tm
Литература
1 Villars Р., GirgisK.//Z. Metallkunde. 1982. Bd. 73. N 3. S. 169-171.
Ta - Tm. ТАНТАЛ - ТУЛИЙ
Диаграмма состояния Та - Tm (рис. 626) построена лишь в области
очень низких концентраций Та [М]. Сплавы готовили в индукционной
Та,% (ат.)
Рис. 626. Та - Тт
печи в вакууме. В толстостенных тиглях из Та помещали Тт и нагревали
при 1677-2078 °C. Затем тигли закаливали в воде. В качестве исходных
компонентов использовали Тт чистотой 99,91 % (по массе) и Та чистотой
99,9 % (по массе). Исследования проводили методами дифференциально-
го термического и химического анализа.
В системе не обнаружено двойных соединений. Существует эвтектичес-
кое равновесие при 1545 °C и 0,55 % (ат.) Та [1] или 1548 ± 15°С и 0,63 ±
± 0,07 % (ат.) Та [М]; не исключено перитектическое равновесие [1].
Растворимость Та в жидком Тт согласно работам [1,2] увеличивается
от - 0,41 до - 1,6 % (ат.) при повышении температуры от 1500 до 1800 °C.
Растворимость Та в жидком Тт в интервале температур 1576-1781 °C
согласно работе [1] подчиняется зависимости lg N = -5,990 • 103/Т +
+ 1,1007, что в численном выражении составляет 0,8 и 1,6 % (ат.) Та (здесь
N- атомная доля Та, температура Твыражена в К).
Ta-Tm, Ta-U
357
Литература
I. Dennison D.H., Tschetter M.J., Gschneidner, Jr., K.A. //J. Less-Common Met. 1966. V. 10.
N 2. P. 108-115.
2. Dennison D.H., Tschetter M.J., Gschneidner, Jr, K.A. // J. Less-Common Met. 1966. V. 11.
N 6. P. 423-435.
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
Та - U. ТАНТАЛ - УРАН
Вариант диаграммы состояния системы Ta-U (рис. 627) приведен
в работе [1] с использованием данных работ [X, 2]. Перитектическая
реакция Ж + (Та) - (yU) осуществляется при температуре 1160 °C.
Нонвариантные реакции при 776 и 669 °C являются перитектоидными:
(Та) + (yU) - (PU) и (Та) + (PU) » (aU).
Рис. 627. Та - и
Литература
1. Krishnan R., Gard S.P., Krishnammurthy // J. Alloy Phase Diagrams. 1988. V. 4. N 3.
P. 204-208.
2. Chandrasekhariah M.S., Dharwadkar S.R., Das D. // Z. Metallkunde. 1986. Bd. 77. N 8.
S. 509-514.
Г.И. Терехов
358
Ta-V,
Та - V. ТАНТАЛ - ВАНАДИЙ
Диаграмма состояния Та - U была построена в работах [1-5]. На
рис. 628 она приведена по данным работ [5]. Установлено образование
непрерывного ряда твердых растворов между Та и V при высоких
температурах. На диаграмме плавкости имеется минимум при температу*
ре 1825 °C и концентрации 15 % (ат.) Та.
В работах [2,3] минимум на кривых ликвидуса и солидуса не отмечен.
Однако в этих работах температура плавления ванадия была определена
равной 1800 °C, а не 1885 °C или близкой к этому значению [1,4, 5]. При
температуре ~ 1310 °C (1320 °C [1], 1420 °C [3]) из твердого раствора
образуется соединение V2Ta (Р), область гомогенности которого при
900 °C находится в интервале концентраций 32-39 % (ат.) Та [5] (30-43 %
(ат.) Та [3]). Двухфазная область (V,Ta) + р простирается от 9 до 52 % (ат.)
Та при 900 °C [5] (5-65 % (ат.) Та [3]).
Рис. 628. Ta-V
Ta-V, Ta-W
359
Литература
1. Carlson O.N., Eash D.T., Eustice A.L. // Peactive Metals. New York, London: Interscince,
1959. P. 277-293.
2. Еременко ВЛ., Третьяченко Л.А., Яхимович Р.И. И Журнал неорганической химии.
1960. Т. 5. № 10. С. 2290-2293.
3. Еременко В.Н., Третьяченко Л.А., Голубенко З.П. И Допов1д1 АН УРСР. 1962. № 2.
С.192-195.
4. Нефедов А.П., Соколовская Е.М., Григорьев А.Т., Чечерников В.И. и др. // Вестник
Моск, ун-та. Химия. 1965. № 5. С. 42-47.
5. Нефедов А.П., Соколовская Е.М., Григорьев А.Т., Соколова И.Г., Недумов Н.А. И
Журнал неорганической химии. 1964. Т. 9. № 4. С. 883-889.
Л.Л. Рохлин
Та - W. ТАНТАЛ - ВОЛЬФРАМ
На рис. 629 представлена диаграмма состояния Та - W, демонстриру-
ющая полную растворимость между компонентами как в жидком, так
и в твердом состояниях [1]. Параметр решетки ОЦК твердого раствора
изменяется от а = 0,33031 нм для чистого Та доп = 0,31651 нм для чистого
W с небольшим отрицательным отклонением от закона Вегарда,
достигающим максимума около 10 % (ат.) Та [X, 1, 2]. В работе [3]
определены термодинамические свойства сплавов при 1200 К.
Рис. 629. Ta-W
360
Th-Щ Ta-Y
Литература
1. Krishnan R., Garg A.P., Krishnamurthy N. //J. Alloy Phase Diagrams. 1987. V. 3. N 1
P. 1-3.
2. Myers R.H. II Metallurgia. 1950. V. 42. P. 3-8.
3. Singhall S.C., Worrell W.L. И Met. Trans. 1973. V. 4. P. 895-898.
К.Б. Поварова
Ta - Y. ТАНТАЛ - ИТТРИЙ
На рис. 630 представлена диаграмма состояния Ta-Y [1], дополнен-
ная данными из работы [2], в которой исследовали растворимость Та в
жидком Y.
Сплавы готовили в индукционной печи в вакууме. В толстостенные
тигли из Та помещали Y и нагревали при 1636-2083 °C. Затем тигли
закаливали в воде, в качестве исходных компонентов использовали Y
чистотой 99,61 % (по массе) и Та чистотой 99,91 % (по массе). Исследова-
ние проводили методами дифференциального термического и химическо-
го анализа.
Рис. 630. Ta-Y
Та-Y, Ta-Yb Та-Zn
361
Двойные соединения в системе отсутствуют. Практически во всем
интервале концентраций жидкие Та и Y не смешиваются. Взаимная
растворимость компонентов в твердом состоянии также отсутствует.
Согласно работе [2], растворимость Та в жидком Y составляет 0,523,0,961
и 1,345 % (ат.) при 1636,1907 и 2083 °C соответственно. Растворимость
Y в (Та) при 1585 °C не превышает 2 • 10~4 % (ат.) [Ш]. Теплота
растворения Та в жидком Y составляет 78,83 кДж/мол.
Литература
1. Гшнейднер К.А. И Сплавы редкоземельных металлов: Пер. с англ. / Под ред.
Е.М. Савицкого. М.: Мир, 1965. 427 с.
2. Dennison D.H., Tschetter M.J., Gschneidner, Jr., K.A. H J. Less-Common Met. 1966. V. 11.
N 6. P. 423-435.
Е.И. Гладышевский, О.И. Бодак. B.K. Печарский
Та - Yb. ТАНТАЛ - ИТТЕРБИЙ
Диаграмма состояния Ta-Yb не построена. В работе [1] исследовали
растворимость Та в жидком Yb, используя дифференциальный
термический и химический анализ. Сплавы готовили в индукционной
печи в вакууме. В толстостенные тигли из Та помещали Yb и отжигали
при 1594-1752 °C, затем тигли закаливали в воде. В качестве исходных
компонентов использовали Yb чистотой 99,82 % (по массе) и Та чистотой
99,9 % (по массе). В системе отсутствуют двойные соединения. Взаимная
растворимость в твердом состоянии также отсутствует. Растворимость
Та в жидком Yb составляет 0,0166,0,0101,0,0150 и 0,0280 % (ат.) при 1594,
1638, 1709 и 1752 °C соответственно. Теплота растворения Та в жидком
Yb равна 112,27 кДж/мол.
Литература
1. Dennison D.H., Tschetter M.J., Gschneidner, Jr., К.А. // J. Less-Common Met. 1966. V. 11.
N 6. P. 423-435.
Е.И. Гладышевский. О.И. Бодак. B.K. Печарский
Та - Zn. ТАНТАЛ - ЦИНК
В работе [Ш] приведены некоторые сведения по результатам
исследования системы Та - Zn, которые рассматриваются как предвари-
тельные. Предполагается образование по крайней мере пяти соединений,
362
Та-Zn, Та-Zr
одно из которых является фазой Лавеса. Согласно результатам
дифференциального термического анализа большинство из этих
соединений распадаются по перитектическим реакциям.
Л.Л. Рохлин
Та - Zr. ТАНТАЛ - ЦИРКОНИЙ
Диаграмма состояния Та - Zr, приведенная в работе [Э], построена
в работе [1]; позднее авторами работы [2] проведено повторное
исследование системы с использованием более чистых материалов
(рис. 631). Между Та и 0Zr существует непрерывный ряд твердых
растворов с ОЦК структурой, которые плавятся с пологим минимумом
при 1875 °C и ~ 85 % (ат.) Та (1820 °C [1]). При более низкой температуре
происходит распад ОЦК твердых растворов на две изоструктурные фазы;
критическая точка бинодальной кривой расположена при 1775 °C и 33 %
Рис. 631. Та-Zr
Та-Zr, Tb-Tc. Tb-Te
363
(ат.) Zr [2] (1780 °C [1]). Добавки Та снижают температуру 0 - а
превращения Zr; монотектоидная реакция (0Zr) >* (aZr) + (Та) протекает
при 785 °C и 95,5 % (ат.) Zr [2] (800 °C [1]). При монотектоидной
температуре максимальная растворимость Zr в (Та) составляет 6,5 % (ат.)
И (9,5 % (ат.) {!]); максимальная растворимость Та в (aZr) около 2,5 %
(ат.) [2] (~ 1 % (ат.) [1]). С понижением температуры взаимная раствори-
мость Zr и Та уменьшается.
Фаза на основе (0Zr) при охлаждении претерпевает мартенситное
превращение. При закалке из области (0Zr) удается сохранить фазу 0 при
содержании Та не менее 17,8 % (мае.) [1].
Литература
1. Williams D.E., Jackson R.J., Larsen W.L. // Trans. AIME. 1962. V. 224. N 4. P. 751-756.
2. Pease L.F., Brophy J.H. //Trans. AIME. 1963. V. 227. N 5. P. 1245-1249.
Л. А. Третъяченко
Tb - Тс. ТЕРБИЙ - ТЕХНЕЦИЙ
Диаграмма состояния Tb - Тс не построена. Согласно работе [Ш]
единственное известное соединение имеет состав ТЬТс2 и структуру типа
MgZn2 (Символ Пирсона Ph\2, пр.гр. РЩттс, а - 0,5373 нм, с ~
= 0,8843 нм).
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
ТЬ - Те. ТЕРБИЙ - ТЕЛЛУР
Диаграмма состояния ТЬ - Те не построена. Двойные соединения
TbTe, Tb2Te3, TbTej 5, ТЬ2Те5 и ТЬТе3 получены при непосредственном
взаимодействии компонентов в запаяных кварцевых ампулах. ФазаТЬТе
плавится конгруэнтно при температуре выше 1300 °C; температуры
перитектического разложения соединений ТЬ2Те5 и ТЪТе3 одинаковы и
равны 870 °C. Эти данные заимствованы из работы [1]. Кристаллографи-
ческие характеристики двойных соединений системы ТЬ - Те собраны
в табл. 495.
364
Tb-Te, Tb-Th
Таблица 495. Кристаллическая структура соединений системы ТЬ - Те |1, V-Cj
Соединение Прототип Символ Пирсона, пр.гр. Параметры решетки, нм
a b c
ТЬТе NaCl cF%, Fm3m 0,6102 - -
ТЬ2Те3 Sc2S3 oF80, Fddd 1,2276 0,8679 2,6037
ТЬТе, 8 Cu2Sb tP6, P4lnmm 0,431 - 0,795
ТЬ2Те5 Nd2Te5 oC28, Cmcm - - -
ТЬТе3 NdTe3 oC16, Cmcm 0,4310 2,552 0,4310
Литература
1. Ярембаш Е.И., Елисеев А.А. //Халькогениды редкоземельных элементов. М.: Наука.
1975. 258 с.
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
Tb-Th. ТЕРБИЙ-ТОРИЙ
На рис. 632 представлена диаграмма состояния Tb-Th, взятая из
работы [1]. Сплавы готовили плавлением компонентов в дуговой печи
в атмосфере аргона; полученные образцы отжигали при 900 °C 24 ч и при
Рис. 632. ТЬ - Th
Tb-Th, Tb-Tl
365
600 °C 168 ч, затем охлаждали с печкой до комнатной температуры.
Кроме того, некоторые образцы выдерживали в течение 2,5 ч при 1100 °C
и закаливали в 10 %-ном водном растворе NaCl с разбиванием кварцевых
ампул. Исследования проводили методами рентгеновского, микрострук-
турного и термического анализов и измерения твердости. В системе
обнаружен непрерывный ряд твердых ОЦК растворов между высокотем-
пературными модификациями Th и ТЬ. Перитектоидная реакция (PTh,
pTb) + (aTh) (aTb) протекает при 1320 °C и 80 % (ат.) ТЬ. Область
твердого раствора на основе (aTh) достигает 57 (ат.) ТЬ при 1100 °C. При
этой же температуре растворимость Th в (aTb) составляет менее 1 % (ат.)
и остается практически неизменной до температуры 20 °C. Растворимость
ТЬ в (aTh) при 20 °C равна 50 % (ат.).
Литература
1. Бадаева Т.А., Кузнецова Р.И.//Изв. АН СССР. Металлы. 1967. №6. С. 186-192.
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
ТЬ-Т1. ТЕРБИЙ-ТАЛЛИЙ
Диаграмма состояния ТЬ-Т1, приведенная на рис. 633, построена в
работе [1]. В качестве исходных компонентов использовали ТЬ чистотой
99,9 % (по массе) и Т1 чистотой 99,99 % (по массе). Сплавы готовили
путем нагрева исходных компонентов в тиглях из Та, заваренных дугой
в атмосфере Аг. Исследование проводили методами дифференциального
термического, металлографического, микрорентгеноспектрального,
рентгеноструктурного анализов и электронной микроскопии. В системе
обнаружено пять соединений, три из которых - ТЬ5Т13, ТЬТ1 и ТЬТ13,
плавятся конгруэнтно соответственно при 1290,1300 и 940 °C. Остальные
образуются в результате перитектических реакций:
Ж + ТЬ5Т13 ТЬ2Т1;
Ж + ТЬТ1 ТЬ3Т15
соответственно при 1040 и 1006 °C.
В системе существуют четыре эвтектических равновесия:
Ж фТЬ) + ТЬ2Т1 при 990 °C и 21,5 % (ат.) Т1,
Ж ТЬ5Т13 4- ТЬТ1 при 1210 °C и 43,5 % (ат.) Т1,
Ж ТЬ3Т15 4- ТЬТ13 при 930 °C и 73 % (ат.) Т1,
Ж (РТ1) 4- ТЬТ13 при -304 °C и 99 % (ат.) Т1.
Максимальная растворимость Т1 в (РТЬ) в твердом состоянии
составляет -5 %.
Кристаллохимические характеристики двойных соединений системы
ТЬ-Т1 приведены в табл. 496 по данным работы [V-C].
366
Tb-Tl
Рис. 633. Tb-Tl
Таблица 496. Кристаллическая структура соединений системы ТЬ-Т1
Соединение Прототип Символ Пирсона, пр.гр. Параметры решетки, нм
а b с
Tb2Tl Ni2In hP6, Pb-Jmmc 0,5365 - 0,6694
Tb5Tl3 Mn5Si3 hPl6, Pbylmcm 0,8978 - 0,6596
TbTl CsCI cP2, РтЗт 0,3760 - -
Tb3Tl5 Pu3Pd5 oC32, Стет 0,999 0,806 1,035
TbTl3 AuCu3 сРЬ, Рт Зт 0,4680 - -
Литература
ISacconeA., DelfinoS., Cacciamani В., Ferro R.//J. Less-Common Met. 1988 V 136 N 2
P. 249-259.
Е.И. Гладышевский, О.И. Бодак. B.K. Печарский
Tb-Tm
367
ТЬ-Тш. ТЕРБИЙ-ТУЛИЙ
Экспериментальные данные о диаграмме состояния Tb-Tm отсут-
ствуют. Тербий и тулий, близко расположенные в периодической системе,
имеют идентичное электронное строение с тремя валентными электрона-
ми 5 dl 6 s2 и одинаковую плотную гексагональную структуру типа Mg
с близкими постоянными решетки и атомными радиусами, отличающи-
мися всего на 2,1 %. Можно полагать, что эти элементы образуют между
собой непрерывные ряды твердых растворов с ГПУ структурой (рис. 634).
Вследствие близости строения растворы должны быть близки к
идеальным. Поэтому линии ликвидуса и солидуса практически сливаются
в одну общую прямую с очень узкой двухфазной областью между ними.
Диаграмма состояния Tb-Tm относится к перитектическому типу. Тулий
в отличие от большинства лантанидов не имеет полиморфного
превращения при высоких температурах вблизи температуры плавления
[1, М], но испытывает аналогичное изменение ближнего порядка в
жидком состоянии при 1655 °C [2]. Вследствие идеальности растворов
линии ликвидуса и сольвуса также сливаются в одну общую прямую.
Перитектическая точка отвечает 1430 °C и 37 % (ат.) Tm. Сплавы,
содержащие более 37 % (ат.) Tm плавятся, сохраняя ближний порядок,
соответствующий их структуре перед плавлением. При нагреве до
температур, отмеченных штриховой линией на рис. 496, расплавы
испытывают превращение ближнего порядка ЖОцК Жгпу.
О 10 20 JO 40 SO 60 70 ОО 90 ГОО
Tb Tm, °/о fam.) Тт
Рис. 634. ТЬ - Tm
368
Tb-Tm, Tb-U, Tb-W, Tb-Y
Литература
1. Gschneidner, Jr., K.A, Calderwood F.W.Z/Handbook on the Physics and Chemistry of Rare
Earths. Amsterdam, New York, Oxford, Tokyo: North-Holland. Physics Publishing Co., 1986.
V. 8. Chap. 54. P. 1-161.
2. Григорович B.K., Григорович К.В.//Строение и свойства металлических и шлаковых
расплавов: Тезисы докладов на VII Всесоюзной конференции. Челябинск: ЧПИ. 1990.
Т. 2, Ч. 2. С. 250-252.
В. К. Григорович
Tb-U. ТЕРБИЙ-УРАН
Диаграмма состояния Tb-U не построена. Согласно работе [Э] ТЬ и
U в жидком состоянии взаимно не растворяются. Растворимость ТЬ в
жидком U увеличивается с 0,3 % (ат.) при 1150 °C до 0,6 % (ат.) при
1250 °C.
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
Tb-W. ТЕРБИЙ-ВОЛЬФРАМ
Диаграмма состояния Tb-W не построена. Растворимость W чистотой
99,9 % (по массе) в ТЬ, содержащем, % (по массе): 0,0003 Si, 0,0012 Са,
0,006 Fe, <0,05 Y, <0,05 Sm, 0,05 Eu, <0,05 Gd, <0,225 Та, приведена ниже
Температура, °C............ 1630 1768 1862 1968 2020
Растворимость, % (ат.)..... 0,127 0,209 0,311 0,430 0,470
Растворимость W в жидком ТЬ может быть описана уравнением 1g х =
= -5,485-10'3/Т + 0,525, где х - атомная доля W, Т- температура, К.
Растворимость W в жидком ТЬ при его температуре плавления (1375 °C),
рассчитанная по этому уравнению, составляет 0,322 % (ат.) [1].
Литература
1. Dennison D.H., Tschetter M.J., Gschneidner, Jr., K.A.//J. Less-Common Met. 1966. V. 11.
N 6. P. 423-435.
К.Б. Поварова
Tb-Y. ТЕРБИЙ-ИТТРИЙ
Диаграмма состояния Tb-Y приведена на рис. 635 согласно работе
[1] и характеризуется полной взаимной растворимостью изоморфных
модификаций металлов друг в друге. Для приготовления сплавов
Tb-Y. Tb-Zn
369
Г Tb, •/. (am.) Tb
Рис. 635. Tb-Y
использовали дистиллированный Y чистотой 99,6-99,7 % (по массе) и
металлический ТЬ чистотой 98,5-99 % (по массе). Сплавы выплавляли
в дуговой печи в атмосфере очищенного Не, отжигали в печи ТВВ-4 при
850 °C в течение 70 ч. Исследование проводили микроструктурным
анализом и определением температуры солидуса капельным методом в
вакууме.
Литература
1. Маркова И.А., Терехова В.Ф., Савицкий Е.М.//Изв. АН СССР. Неорганические
материалы. 1967. Т. 3. № 2. С. 392-394.
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
Tb-Zn. ТЕРБИЙ-ЦИНК
Диаграмма состояния Tb-Zn не построена. В системе обнаружены
соединения, кристаллографические характеристики которых приведены
в табл. 497 по данным работ [1, V-С].
370
Tb-Zn, Tb-Zr
Таблица 497. Кристаллическая структура соединений системы Tb-Zn
Соединение Прототип Символ Пирсона, пр.гр. Параметры решетки, нм
a b c
TbZn CsCl cP2. 0,3576 - -
РтЗт
TbZn2 CeCu2 ol\2, Imma 0,4492 0,7142 0,7595
TbZn3 YZn3 oP\f>, Pnma 0,6690 0,4411 1,0104
TbjZn 11 La jAl 11 o/28, Immm 0,4408 1,2989 0,8825
TbgZn^ TheMny cF\ 16, 1,269 - -
Fm3m
Tb13Zn58 Gd13Zn58 hP\42, P63mc 1,431 - 1,407
Tb2Zn|7 Th2Ni17 hP3S, Pby/mmc 0,8984 - 0,8770
Tb2Zn J? Th2Zn17 hR\9, 0,8977 - 1,3161
R3m
TbZri|2 ThMn12 tI26, IMmmm 0,8884 - 0,5200
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
Tb-Zr. ТЕРБИЙ-ЦИРКОНИЙ
Добавление ТЬ приводит к повышению температуры а 0 превраще-
ния Zr примерно на 50 °C. При перитектоидной температуре в (0Zr)
растворяется около 3,5 % (ат.), а в (aZr) - около 4,1 % (ат.) ТЬ [Э].
Диаграмма состояния Tb-Zr, приведенная на рис. 636, сконструирована
[1], исходя из аналигии в строении диаграммы состояния данной системы
и других систем РЗМ-Zr. Температуры плавления и a 0 превращения
ТЬ указаны из работы [2].
Tb-Zr, Tc-Ti
371
Рис. 636. Tb - Zr
При закалке сплавов из жидкого состояния (скорость охлаждения
107 ° С/с) образуются метастабильные твердые растворы а' с ГПУ
кристаллической структурой, содержание до 36 % (ат.) Zr и до 21 % (ат.)
ТЬ. Параметры решетки богатой ТЬ фазы подчиняются правилу Вегарда,
отрицательное отклонение от правила Вегарда наблюдается в твердом
растворе на основе Zr [3, 4].
Литература
1. Moffatt W.G. Handbook of Binary Phase Diagrams. New York: Business Growth Services.
General Electric Co. Schenectady, 1976. 1977. V. 1,2, 658 p.
2. Spedding F.H., Sanden B., Beadry B.J.//J. Less-Common Met. 1973. V. 31. N 1. P. 1-13.
3. Wang R.//Met. Trans. 1972. V. 3. N 5. P. 1213-1221.
4. WangR., Kim I.B.//Met. Trans. 1974. V. 5. N 3. P. 1973-1977.
Л.А. Третьяченко
Tc-Ti. ТЕХНЕЦИЙ-ТИТАН
Диаграмма состояния Tc-Ti практически не исследована, хотя
имеются публикации [1,2], посвященные исследованию кристаллической
структуры фаз, образующихся в сплавах системы и их возможному
372
Tc-Ti, Tc-Tm
Рис. 637. Тс - Ti
распределению. Гипотетическая диаграмма состояния системы Tc-Ti,
представленная на рис. 637, построена по экспериментальным данным
[1,2]. В системе обнаружено два соединения: TiTc и фаза %. Соединение
TiTc кристаллизуется при -50 % (ат.) Тс в результате упорядочения
твердого раствора 0, простирающегося практически до ~70 % (ат.)Тс,
имеет кубическую структуру типа CsCl. Фаза % образуется по перитекти-
ческой реакции при ~85 % (ат.) Тс, имеет кубическую структуру типа аМп
с 58 атомами в элементарной ячейке. В сплавах обнаружены также
эвтектика (0Ti) + % и эвтектоид TiTc + %.
Литература
1. Darby J.B., Lam D.J., Norton L.J., Downey J.M.//J. Less-Common Met. 1962. V. 4.
P. 558-565.
2. KochC.C.//J, Less-Common Met. 1976. V. 44. P. 177-181.
С.П. Алисова
Tc-Tm. ТЕХНЕЦИЙ-ТУЛИЙ
Диаграмма состояния Tc-Tm не построена. Согласно работе [Ш]
единственное известное соединение имеет состав Тс2Тт и структуру типа
Zn2Mg (символ Пирсона hP\2 пр.гр. Рб^/ттс) а = 0,5334 нм, с =
= 0,8775 нм.
Е.И. Гладышевский. О.И. Бодак, В.К. Печарский
Tc-W. Tc-Y, Tc-Zn
373
Tc-W. ТЕХНЕЦИЙ-ВОЛЬФРАМ
Диаграмма состояния Tc-W не построена [Э, Ш]. Согласно работе
[1] в системе образуются одна промежуточная фаза о, интервал
гомогенности которой при 1800 °C составляет 72-77 % (ат.) W, при
1200 °C - 67-77 % (ат.) W, и твердые растворы на основе W и Тс.
Растворимость W в (Тс) равна -12% (ат.) при 1800 °C и -7 % (ат.) при
1200 °C; растворимость Тс в (W) составляет -55 % (ат.) при 1800 °C и
-17 % (ат.) при 1200 °C.
Фаза о имеет тетрагональную структуру типа pU с параметрами
решетки а = 0,9479 нм, с = 0,4952 нм [1] или а - 0,9480 нм, с = 0,5166 нм
[2] для сплава с 25 % (ат.) W.
Литература
1. Niemiec F.//Bull. Acad. Polon Sci., Ser. Sci. Chim. 1963. V. 11. N 6. P. 311-316.
2. Darby J.B. (Jr), Norton L.I., Downey S.WJIJ. Less-Common Met. 1964. V. 6. P. 165-167.
КБ. Поварова
Tc-Y. ТЕХНЕЦИЙ-ИТТРИЙ
Диаграмма состояния Tc-Y не построена. Согласно работе [Ш]
единственное известное соединение имеет состав Tc2Y и структуру типа
Zn2Mg (символ Пирсона hP\2 пр.гр. Ptymmc, а - 0,5373 нм, с -
= 0,8847 нм).
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
Tc-Zn. ТЕХНЕЦИЙ-ЦИНК
Фрагмент диаграммы состояния Tc-Zn (рис. 638), приведенный в
справочниках р, Ш], построен согласно работе [1]. В системе образуются
по перитектическим реакциям при 544 и 950 °C два соединения: TcZn13_18
и TcZn6.
Растворимость Тс в жидком Zn в интервале температур 470-544 °C
может быть описана уравнением 1g х = 6,431—7159/7", а в интервале
температур 544-758 °C - уравнением 1g х = 9,413-15690/7 + 4,979-106/Т2,
где х - % (ат.) Тс, Т - температура, К. Согласно этим уравнениям
растворимость Тс в Zn составляет 0,0004 % (ат.) при 428,4 °C и 0,079 %
(ат.) при 757,5 °C. Растворимость Тс в твердом Zn не обнаружена.
374
Тс-Zn, Тс-Zr
Рис. 638. Tc-Zn
Соединение TcZn6 имеет кубическую структуру типа AuCu3 с
параметром решетки а = 0,7588 нм.
Литература
1. Chasanov M.G., Johnson I., Schablaske R.V.//J. Less-Common Met. 1964. V. 7. N 2.
P.165-167.
Л.Л. Рохлин
Тс-Zr. ТЕХНЕЦИЙ-ЦИРКОНИЙ
Диаграмма состояния Тс-Zr не построена. Согласно работе [Ш] в
системе Tc-Zr возможно образование по крайней мере пяти соединений
и существование эвтектической кристаллизации. Установлено соединение
с кубической структурой типа аМп (параметр решетки а = 0,9637 нм) при
содержании 14,3 % (ат.) Zr, которое соответствует формуле ZrTc6, и
соединение - фаза Лавеса ZrTc2 с гексагональной структурой типа MgZn2
и параметрами решетки а - 0,5219 нм, с = 0,8655 нм Р, Ш].
Л.А. Третьяченко
Te-Th
375
Te-Th. ТЕЛЛУР-ТОРИЙ
Данные об изучении сплавов системы Te-Th приведены в справочни-
ках [X, Э]. Система изучена с использованием Th и Те высокой чистоты.
Для приведения сплавов в равновесие использовали выдержки продолжи-
тельностью от двух до трех недель.
В системе обнаружено четыре соединения: Te3Th, Te2Th, Te3Th2 и
TeTh, кристаллографические характеристики которых приведены в
табл. 498 [V-CJ. После выдержки в течение нескольких часов при 900 °C
Te3Th превращается в Te2Th. После нагрева Te2Th в течение нескольких
недель при 800 °C в вакууме образуется новая фаза, состав которой
можно представить формулой Te12Th7.
Кристаллическая структура Te12Th7 близка к структуре Te3Th2. В
работе [Э] предполагается, что эти соединения лежат в области
гомогенности одной фазы, причем Te3Th2 имеет дефектную по катионам
решетку.
Таблица 498. Кристаллическая структура соединений системы Te-Th
Соединение Прототип Символ Пирсона, пр.гр. Параметры решетки, нм
а b с
Te3Th* - - 0,6614 0,431 1,044
Te2Th** - - 0,849 - 0,901
Te3Th2" - Ptym 1,249 - 0,4354
TeTh CsCl сР2, РтЗт 0,3827 - -
Моноклинная сингония, 0 Гексагональная сингония. = 98,4°.
Е. И. Гпадышевский, О. И. Бодак, В. К. Печарский
376
Te-Ti
Te-Ti. ТЕЛЛУР-ТИТАН
Информация о взаимодействии Те с Ti представлена в работах [X, Э,
Ш]. Диаграмма состояния Te-Ti не построена. Авторы работы [1]
методом рентгеновской диффракции исследовали сплавы в области
составов от 20 до 68 % (ат.) Те. Сплавы плавили в тиглях из А12О3,
помещенных в эвакуированные и запаянные кварцевые ампулы. В
качестве исходных материалов использовали Ti чистотой 99,99 % (по
массе) с примесями в % (по массе): -0,003 % Fe, 0,003 % Мп, <0,01 % Fe
и Те, дистиллированного в вакууме и содержащего <0,01% (по массе) Fe
и следы Al, Mg и РЬ.
В исследованной области составов обнаружено два соединения: Ti3Te4
и Ti2_vTe2 (дефицитная по Ti фаза). Область гомогенности Ti2_x.Te2
простирается от 55,4 до 66,67 % (ат.) Те; от 60 до 59,2 % (ат.) Те
соединение имеет моноклинную решетку; от 60,0 до 66,67 % (ат.) Те -
гексагональную.
Информация о кристаллической структуре двойных соединений
системы Te-Ti приведена в табл. 499.
Таблица 499. Кристаллическая структура соединений системы Te-Ti
Соединение Прототип Символ Пирсона, пр.гр. Параметры решетки, нм
а Ь с
Ti5Te4 Ti5Te4 (П18, !4/т 1,0164 - 0,37720
- - 0,6954-0,6840 0,3836-0,3850 1,2716-1,2658
- - 0,3884-0,3766 - 0,6348-0,6491
Моноклинная сингония, p = 90,63... Гексагональная сингония, при л = 90,42°, при х = 1,8<-2. 1,6...1,8.
Литература
1. Raaum F., Grdnvold F., Kjeksnus A., Haraldsen H. // Z. Anorg. All. Chem. 1962. Bd. 37,
N 1-2. S. 91-104.
Г.К. Алексеенко
Te-Tl
ЪП
Te-Tl. ТЕЛЛУР-ТАЛЛИЙ
Диаграмма состояния Те-Т1, приведенная в работе [7], (рис. 639)
построена в основном по данным работы [8,9] и только область
несмешиваемости в жидком состоянии представлена из работы [10]. В
работе [3] перепроверены температуры плавления соединений Те3Т12,
ТеТ1, Те3Т15, и так как их значения мало отличаются от данных,
приведенных в работе [8], и точность измерения температуры неизвестна,
то на рис. 639 приведены значения [8].
Рис. 639. Те-Т1
Сведения о кристаллической структуре соединений приведены в табл.
500. Кристаллическая структура соединения ТеТ12 неизвестна, хотя его
существование подтверждено методами термического, рентгеновского
анализов и измерения микротвердости [8].
378
Te-Tl, Te-Tm
Таблица 500. Кристаллическая структура соединений системы Те~Т1
Соединение Символ Пирсона, пр.гр. Параметры решетки, им Источник
а b с
Те3Т12 тС20, 1,35 0,65 0,79 вС
Сс 1,7413 0,6552 0,7910 га...
1,331 0,655 0,791 [3]
ТеТ1 //32, 1,2950 — 0,6175 m
14!тст 1,2954 — 0,6178 [4]
1,295 — 0,618 [5]
1,2961 — 0,618 [3]
Те3Т15 1132, 0,892 — 1,263 [И
141т 0,8929 — 1,2620 [4]
0,892 — 1,263 [6]
0,8917 — 1,2613 [3]
*В = 73°.
В= 133,16°.
“ 0 = 107,42°.
Литература
1. Rabenau A., Stegherr A., Eckerlin Р. // Z. Metallkunde. 1960. V. 51. N. 5. Р. 295-299.
2. Bhan S., Schubert К. // J. Less-Common Met. 1970. V. 20. N. 3. P. 229-235.
3. Toure A.A., Kra G., Ecolie R. et al. //J. Solid State Chem. 1990. V. 87. P. 1137-1140.
4. Burkhardt K., Schubert K. // J. Less-Common Met. 1969. V. 18. N. 4. P. 426-429.
5. Weis J., Schafer H., Eisenmaim B., Schon G. II Z. Naturforschung. B. 1974. V. 29. N. 5.
P. 585-589.
6. Ман Л.И., Имамов P.M., Пинскер З.Г. И Кристаллография. 1971. Т. 16. № 1.
С. 122-126.
7. Okamoto H.//J. Phase Equilibria. 1991. V. 12. N. 4. P. 507-508.
8. Асадов M.M., Бабанлы М.Б., Кулиев Ф.Ф. // Изв. АН СССР. Неорганические
материалы. 1977. Т. 13. № 8. С. 1407-1410.
9. Васильев В.П., Никольская А.В., Герасимов Я.И. // Термодинамические свойства
металлических сплавов: Сб. статей. Баку: Элм, 1975. С. 40-46.
10. Wobst М. //Scr. Metall. 1971. V. 5. N. 7. Р. 583-585.
Л.Л. Рохлин
Te-Tm. ТЕЛЛУР-ТУЛИЙ
Диаграмма состояния Te-Tm не построена. В справочнике [Э]
указывается на существование соединения ТеТт. В работе [1] сообщено
о соединении Те3Тт2, имеющего область гомогенности, и о соединении
Te-Tm, Te-U
379
Te5Tm2. В работе [2] указано на существование соединения Те3Тт.
Дителлурид тулия Те2Тт получен лишь в условиях высоких давлений
и температур [3]. Все теллуриды получены в запаянных кварцевых
ампулах в температурном интервале 500-650 °C. Образцы гомогенизиро-
вали при температуре 600-650 °C в течение 120 ч. Исследование
проводили методом рентгеноструктурного анализа.
Кристаллическая структура двойных соединений системы Te-Tm
приведена в табл. 501 [V-С].
Таблица 501. Кристаллическая структура соединений системы Te-Tm
Соединение Прототип Символ Пирсона, пр.гр. Параметры решетки, нм
а b с
Те3Тт Te3Nd оС16, Стет 0,4274 2,534 0,4274
Те5Тт2 Te5Nd2 оС28, Стет 0,444 4,497 0,444
Те2Тт Cu2Sb 1Р6, Р4/птт 0,4240 - 0,8831
Те3Тт2 S3Sc2 oF8Q, Fddd 1,2084 0,8543 2,563
ТеТт NaCl cF8, Fm3m 0,6337 - -
Литература
1. Елисеев А.А., Зинченко К.А., Землянухина В.М. // Журнал неорганической химии.
1976. Т. 21. № 10. С. 2603-2605.
2. Pardo М.-P., Flahaut J. // Bull. Soc. Chim. France. 1967. N. 10. P. 3658.
3. Cannon J.F., Hall H.T. // Inorg. Chem. 1970. V. 9. P. 1639.
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
Te-U. ТЕЛЛУР-УРАН
Результаты исследований теллуридов урана приведены в справочни-
ках [X, Э, Ш]. Графический вариант диаграммы состояния (рис. 640)
впервые предложен в справочнике [М]. В сплавах системы существует
восемь соединений, из которых только TeU плавится конгруэнтно при
380
Te-U
Рис. 640. Te-U
1740 °C, остальные образуются по перитектическим реакциям:
Ж + TeU Те4 3U2 3 при 1540-1500 °C,
Ж + Те4 3U2 3 Te5U3 при 1300-1260 °C,
Ж + Те5й3 Te2U при 1180 °C,
Ж + Te2U Te7U3 при 950 °C,
Ж + Te7U3 Te3U при 935 °C,
Ж + Te3U Te5U при 490 °C.
Соединение Te2U претерпевает полиморфное превращение при
1125 °C. В сплавах системы кристаллизуются две вырожденных
эвтектики, одна со стороны U, другая со стороны Те. Кристаллографи-
ческие характеристики соединений системы Te-U приведены в табл. 502.
Te-U, Te-W
381
Таблица 502. Кристаллическая структура соединений системы Te-U |V-C|
Соединение Прототип Символ Пирсона, пр.гр. Параметры решетки, нм
a b c
Te3U* - - 0,8703 - 1,3086
Te3U** S3Ti лгР8, P2\lm 0,6090 0,4226 1,0302
Te2U Te2U о 112, hnmm 0,41617 0,61276 1,39656
Te2U Cu2Sb IP6, P4/nmm 0,4243 - 0,8946
Te12U7'" S12Th7 hP20, Pb-Jm 1,2304 - 0,4242
Te5U3 s5u3 oP32, Pnma 0,797 0,872 1,302
Te4U3 P4Th3 c/28, 143d 0,9397 - -
Te3U2 S3Sb2 oP20, Pnma 1,222 1,171 0,436
TeU NaCl cF8, Fm3m 0,6162 - -
Тетрагональная сингония. **£} = 98,0°. На диаграмме этому соединению приписана формула Te7U3.
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
Te-W. ТЕЛЛУР-ВОЛЬФРАМ
В системе образуется одна промежуточная фаза Te2W по перитекти-
ческой реакции при 1020± 15 °C из расплава и твердого раствора на
основе W (рис. 641 )[М]. Взаимная растворимость Те и W находится на
примесном уровне. Перитектическая реакция Ж + Te2W (Те) протекает
при 451 ±2 °C [М]. Соединение Te2W имеет орторомбическую структуру
(символ Пирсона 2, пр.гр. Рттп, параметры решетки а = 1,4028 нм,
382
Te-W, Te-Y
Те Wt°/o(am.) w
Рис. 641. Te-W
b - 0,3495 нм, c - 0,627 нм, на одну элементарную ячейку приходится
четыре формульные единицы [Ш].
К. Б. Поварова
Те-Y. ТЕЛЛУР-ИТТРИЙ
Диаграмма состояния Te-Y не исследовалась. Двойные соединения
TeY, Te3Y2, Te5Y2 и Te3Y получены при непосредственном синтезе из
компонентов, фазаТе2У образуется под давлением 6,9 ГПа. Соединение
Te3Y2 плавится конгруэнтно при 1525 °C [Э]; соединения Те5У2иТе3У
образуются инконгруэнтно соответственно при 788 и 762 °C (составы
реакционных смесей не приведены). Эти данные заимствованы из работы
[ 1 ]. Кристаллографические характеристики двойных соединений системы
Te-Y собраны в таблицу 503.
Te-Y. Те-Yb
383
Таблица 503. Кристаллическая структура соединений системы Te-Y |1, V-C|
Соединение Прототип Символ Пирсона, пр.гр. Параметры решетки, нм
a b c
Te3Y Te3Nd oC16, Cmcm 0,4303 2,549 0,4303
Te5Y2 Te5Nd2 оСТЬ, Cmcm - - -
Te2_xY Cu2Sb tP6, P4/nmm 0,4291 - 0,891112
Te3Y2 S3Sc2 oF8Q, Fddd 1,2228 0,8645 2,5935
TeY NaCl cF8, Fm3m 0,6093 - -
Литература
1. Ярембаш Е.И., Елисеев А.А. И Халькогениды редкоземельных элементов. М.: Наука,
1975. 258 с.
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
Te-Yb. ТЕЛЛУР-ИТТЕРБИЙ
В работе [1] приведены результаты исследования диаграммы
состояния системы Te-Yb во всей области концентраций, а также
изучены некоторые физические свойства монотеллурида иттербия.
Синтез сплавов проводили в двухсекционных кварцевых ампулах. После
откачки ампулу запаивали и помещали в горизонтально расположенную
трубчатую печь, имеющую две зоны нагрева. При помощи специального
приспособления ампула в печи вращалась со скоростью 25-30 об/мин.
В зависимости от выбранного состава температуру печи медленно
повышали до 700-950 °C. Скорость нагрева составляла 200 °С/мин. Зона
печи, в которой помещалась часть ампулы, содержащая Yb, имела
температуру на 100-120 °C ниже, чем зона, в которой находился Те.
Ампулу выдерживали в заданном режиме в течение 4-5 ч до полной
возгонки Те, после чего печь выключали. Описанный метод позволяет
синтезировать сплавы, содержащие до 75 % (ат.) Те.
384
Те-Yb
гь Те, “/• lam.) Те
Рис. 642. Те - Yb
Сплавы в области между Yb и TeYb отжигали в течение 200 ч при
800 °C, сплавы, лежащие между TeYb и Те - с той же продолжительнос-
тью при 425 °C, т.е. при температуре на 20-30 °C ниже температуры
плавления эвтектик TeYb + (Yb) и TeYb + (Те). Монотеллурид иттербия
отжигали при 1700 °C в течение 10 ч.
Полученные образцы исследовали методами термического, микрос-
труктурного и рентгеновского анализов, по результатам которых
построили диаграмму состояния Te-Yb (рис. 642).
TeYb плавится с открытым максимумом при 1730 °C, с Yb образует
вырожденную эвтектику при 820 °C, а с Те - вырожденную перитектику
при 455 °C. В интервале концентраций от 100 до 50 % (ат.) Yb наблюда-
лись термические эффекты, отвечающие полиморфному превращению
Yb.
TeYb кристаллизуется в кубическую структуру типа NaCl с парамет-
ром решетки а - 0,6366 нм (символ Пирсона cF3, пр.гр. Fm3m).
Литература
I. Абрикосов Н.Х., Зинченко К.А., Елисеев А.А. И Изв. АН СССР. Неорганические
материалы. 1970. Т. 6. № 6. С. 1172.
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
Те-Zn
385
Те-Zn. ТЕЛЛУР-ЦИНК
Экспериментальные версии диаграммы состояния Te-Zn, приведенные
в справочниках [X, Ш], характеризуются образованием одного
интерметаллического соединения, ZnTe, плавящегося конгруэнтно при
1239±2 °C. Термодинамические расчеты, проведенные в работе [1],
показали, что взаимодействие между Те и Zn (рис. 643) более сложное,
чем сообщалось ранее; на стороне Zn протекает монотектическая реакция
при температуре 1215 °C и концентрации 34,6 % (ат.) Те, координаты
критической точки на бинодальной кривой - 17,8 % (ат.) Те и 1340 °C.
Соединение ZnTe конгруэнтно плавится при 1300 °C. ZnTe эвтектически
взаимодействует как с Те, так и с Zn; обе эвтектики вырожденные.
Те, % (по массе)
Zn Те, % (ат.) Те
Рис. 643. Те - Zn
Было высказано предположение (Э], что ZnTe имеет две модификации:
гексагональную структуру (а = 0,4310 нм, с = 0,7090 нм), характерную
для метастабильного состояния, и стабильную кубическую со структурой
цинковой обманки (пр.гр. F4 3m, а - 0,61037 или 0,6105 нм) [Ш].
Измерения электросопротивления показали существование особой
модификации ZnTe в условиях высокого давления; при комнатной
температуре полиморфное превращение происходит под давлением
14-14,5 ГПа.
Литература
I. Sharma R.C., Chang Y.А.//Bull. Alloy Phase Diagrams. 1987. V. 8, N l.P. 14-19.
П.Б. Будберг
386
Te-Zr
Te-Zr. ТЕЛЛУР-ЦИРКОНИЙ
Низкотемпературная часть диаграммы состояния системы Te-Zr в
интервале концентраций 50-100 % (ат.) Zr по данным [1] представлена
на рис. 644. Исследование выполнено методами микроструктурного и
рентгеновского анализов. Установлено существование следующих фаз:
TeZr; Te4Zr5, TeZr3. Соединение TeZr3 находится в равновесии с твердым
раствором на основе a-Zr. Согласно работе [Э] в области, богатой Те,
существует соединение Te3Zr. Кристаллографические характеристики
соединений системы Te-Zr собраны в табл. 504.
Таблица 504. Кристаллическая структура соединений системы Te-Zr |1, Э]
Соединение Прототип Символ Пирсона, пр.гр. Параметры решетки, нм
а b с
Te3Zr* ZrSe3 - 0,595 0,392 2,08
TeZr3" Be3Nb ЛА 12, R3m 0,8374 - -
TeZr/" - - 0,5354 - 2,3346
TeZr NiAs ЛА4, Ptymmc 0,3953 - 0,6647
Te-Zr, Th-Ti, Th-Tl
387
Литература
1. Matkovic T., Kesic-Racan M., Matkovic P. // J. Less-Com. Met. 1988. 138. N 1. P. Ll—L4.
П.Б. Будберг
Th-Ti. ТОРИЙ-ТИТАН
Диаграмма состояния Th-Ti (рис. 645) заимствована из справочника
[X]. Образцы сплавов готовили из ториевой губки высокой чистоты и
магниетермического титана. По результатам термического, микрострук-
турного и рентгеновского анализов в системе не обнаружено соединений,
Ti, % (по массе)
Рис. 645. Th - Ti
а взаимная растворимость Th и Ti в твердом состоянии практически
отсутствует, составляя менее 0,1 %. Диаграмма состояния характеризует-
ся эвтектической реакцией при температуре 1190 °C и концентрации
39,8 % (ат.) Ti. Другая нонвариантная реакция, связанная с р^а
полиморфным превращением Ti, протекает при 882 °C.
Г. И. Терехов
Th-Tl. ТОРИЙ-ТАЛЛИЙ
На рис. 646 представлена диаграмма состояния Th-Tl, исследованная
методами дифференциального термического и рентгеновского анализов
[1]. В системе обнаружено пять соединений Th2Tl, Th5Tl3, ThTI, Th3Tl5
388
Th-Tl
и ThTl3. Два из них, Th5TI3 и ThTl3, плавятся конгруэнтно при соотве-
тственно 1350 и 1225 °C; остальные, Th2Tl, ThTI и Th3TI5, образуются
перитектически соответственно при 1120, 1305 и 1195 °C. В системе
имеются три эвтектических равновесия и одно эвтектоидное равнове-
сие :
Ж (PTi) + Th2Tl, при 1080 °C;
Ж ThTI + Th3Tl5 при 1180 °C;
Ж^ТЬТ13 + (Т1) при 295 °C.
(PTh) - (aTh) + Th2Tl.
Растворимость Th в (Т1) менее 1,0 % (ат.) при эвтектической
температуре 295 °C.
Кристаллографические характеристики соединений собраны в
табл. 505.
Th Т1
Рис. 646. Th - Т1
Th-Tl, Th-U
389
Таблица 505. Кристаллическая структура соединений системы Th-Tl
Соединение Прототип Символ Пирсона, пр.гр. Параметры решетки, нм Источник
а b с
Th2Tl CuA12 z/12, 14/mcm 0,7708 - 0,6212 [1]
Th5Tl3 Mn5Si3 hP16, Рв^/тст 0,9388 - 0,6420 [1]
ThTI Thin - 1,0770 0,9932 0,6554 [1]
Th3Tl5 Pu3Pd5 oC32, Cmcm 1,0249 0,8260 1,0419 [1]
ThTl3 AuCu3 cP4, 0,4751 — — [1]
Pm3m 0,4748 — — (Э]
Литература
1. Palenzona A., Cirafici S., Сапера F. // J. Less-Common Met. 1985. V. 114, N 2. Р. 311-316.
Л.Л. Рохлин
Th-U. ТОРИЙ-УРАН
Диаграмма состояния Th-U (рис. 647), построенная по данным
работы [1], обобщает результаты нескольких исследований, некоторые
и,9/» (помассе)
Рис. 647. Th-U
390
Th-U, Th-V
из которых приведены в работе [X]. В части богатой Th привлечены
результаты исследований Ветла [Э]. Диаграмма представляет собой
монотектику, граница области расслоения жидких растворов варьируется
различными исследователями в широких пределах, от 8,0-72 % (ат.) Th
Идо 6-49 % (ат.) Th [Э]. Из анализа работ следует, что высокотемпера-
турная область на стороне Th осталась недостаточно исследованной, в
связи с чем положение монотектической горизонтали при 1375 °C и ее
границы в пределах ~ 12,2 и 94,0 % (ат.) U с указанием монотектической
точки при 51 % (ат.) U следует принимать с известной долей осторожнос-
ти. Нонвариантная кататектическая реакция (PTh) *•> (aTh) + Ж протекает
при температуре 1270 °C и концентрации 10,5 % (ат.) U. Жидкая фаза
содержит 95 % (ат.) U, a (aTh) - 6,8 % (ат.) U. Эвтектическая реакция
Ж (aTh) + (yU) протекает при температуре 1100 °C и концентрации
96 % (ат.) U. Растворимость Th в (yU) при этой температуре составляет
менее 1 % (ат.), а растворимость U в (aTh) - около 2,5 % (ат.). Характер
нонвариантных превращений при 775 и 668 °C, связанных с существова-
нием аир модификаций U, остается пока невыясненным.
Литература
1. Peterson D.E. И Bull. Alloy Phase Diagrams. 1985. V. 6. N 5. P. 443-445.
Г.И. Терехов
Th-V. ТОРИЙ-ВАНАДИЙ
Диаграмма состояния Th-V впервые исследована Левингстоном и
Роджером [X] различными методами физико-химического анализа.
Повторное исследование сплавов системы на более чистых материалах
методами микроструктурного, рентгеновского, термического и
резистометрического анализов, предпринятое в работе [1], подтвердило
результаты предыдущих исследователей. Диаграмма состояния системы
является диаграммой эвтектического типа Ж ** (0Th) + (V) с температу-
рой плавления эвтектики 1435 °C и эвтектической точкой при 19 % (ат.)
Th, эвтектоидное превращение (0Th) (aTh) + (V) имеет место при
температуре 1345 °C и концентрации 0,15 % (ат.) Th. Максимальная
растворимость V в (0Th) составляет 0,16 % (ат.), а в (aTh) - 0,06 % (ат.).
Растворимость Th в (V) около 0,1 % (ат.) обнаружена при температуре
1390 °C.
Обобщенная диаграмма состояния системы, представленная на
рис. 648 [2], включает кроме экспериментальных результатов результаты
термодинамических расчетов, что повлекло за собой повышение
Th-V, Th-lV
391
Рис. 648. Th - V
эвтектической температуры до 1441 °C и снижение эвтектоидной
температуры до 1337 °C. Несколько изменились также координаты
эвтектической (20,3 % (ат.) Th) и эвтектоидной (0,62 % (ат.) Th) точек.
Остальные детали диаграммы состояния соответствуют данным работы
[1].
Литература
1. Palmer Р.Е., McMasters O.D., Larsen W.L. П Trans ASM. 1962. V. 55. P. 301-306.
2. Smith I.F., Lee K.I., Peterson D.E. // Bull. Alloy Phase Diagrams. 1985. V. 6. N 4.
P. 369-371, 401.
Г.И. Терехов
Th-W. ТОРИЙ-ВОЛЬФРАМ
Взаимодействию Th c W посвящен ряд работ [X]. Диаграмма
состояния системы, вероятно, простого эвтектического типа без
промежуточных соединений. Данные различных исследователей о
положении эвтектической точки сильно различаются: от ~ 1380-1475 °C
и -8 % (ат.) W [X, Э] до 1695 °C и 1,2 % (ат.) W [1]. Растворимость Th в
W приведена ниже:
392
Th-W, Th-Y
Температура, °C........... 2000 1800 1250
Растворимость Th, % (ат.) 0,24 0,18 0,09
Литература
1. Ackermann R.J., Rauh E.G. // High Temp. Sci. 1972. V. 4. N 4. P. 272-282.
К.Б. Поварова
Th-Y. ТОРИЙ-ИТТРИЙ
Система Th-Y изучена в работах [1,2]. Сплавы готовили из исходных
компонентов высокой чистоты в дуговой печи и исследовали методами
рентгеновского,микроструктурного,термическогоирезистометрическо-
го анализов.
Диаграмма состояния Th-Y (рис. 649) представлена из работы [1]. Она
характеризуется полной растворимостью компонентов как в жидком,
так и в твердом состояниях (при высоких температурах); непрерывный
ряд твердых растворов эвтектоидно распадается при температуре 1375 °C
по реакции (pTh, (SY) ** (aTh) + (aY) на смесь двух низкотемпературных
га ч,°/о(ат') у
Рис. 649. Th-Y
Th-Y, Th-Yh, Th-Zn
393
модификаций компонентов; концентрация Y в эвтектоидной точке
составляет 46,5 % (ат.).
Литература
1. Eash D.T., Carlson O.N. //Trans. ASM. 1959. V. 52. P. 1097-1113.
2. Evans D.S., Raynor G.V. //J. Nucl. Mater. 1960. V. 2. N 3. P. 209-215.
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
Th-Yb. ТОРИЙ-ИТТЕРБИЙ
Th и Yb полностью нерастворимы в жидком состоянии. Измерения
параметров решетки показали небольшую взаимную растворимость в
твердом состоянии. Параметр ГЦК решетки увеличивается с 0,5085 нм
у чистого тория до 0,5086 нм у (aTh) и уменьшается от 0,5486 нм у
чистого иттербия до 0,5485 нм у твердого раствора Th в Yb. Если
допустить линейное изменение параметров решетки, то эти данные
свидетельствуют о растворимости в Th 0,4 % (ат.) Yb и в Yb 0,25 % (ат.)
Th (Э].
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
Th-Zn. ТОРИЙ-ЦИНК
Диаграмма состояния Th-Zn (рис. 650) опубликована Джилом и
Чиотти [Э]. Исследование проводили методом термического анализа на
образцах, помещенных в контейнеры из Та. Для приготовления сплавов
использовали Zn чистотой 99,9 % (по массе) и Th чистотой 99,95 % (по
массе). Установлено существование четырех соединений: Th2Zn, ThZn2,
ThZn4 и Th2Zn17 конгруэнтно плавящиеся соответственно при 1055,1105,
1095 и 1015 °C. Все перечисленные соединения, а также исходные
компоненты участвуют в эвтектических реакциях:
Ж (aTh) + Th2Zn при 1040°С и 30,5 % (ат.) Zn,
Ж - Th2Zn + ThZn2 при 945 °C и 48,6 % (ат.) Zn,
Ж ThZn2 + ThZn4 при 1045 °C и 74,4 % (ат.) Zn,
Ж ThZn4 + Th2Zn17 при 995 °C и 86,8 % (ат.) Zn,
Ж-ТЬ2гп17 + Zn при 419 °C и -100 % (ат.) Zn.
Взаимная растворимость между Th и Zn практически отсутствует.
Кристаллографические характеристики двойных соединений
приведены в табл. 506.
394
Th-Zn
Рис. 650. Th - Zn
Таблица 506. Кристаллическая структура соединений системы Th-Zn
Соединение Прототип Символ Пирсона, пр.гр. Параметры решетки, нм Источник
a с
Th2Zn CuA12 z/12, IMmcm 0,760 0,564 [Х,Э]
ThZn2 aib2 hPlb, Рб^/тст 0,4497(2) 0,3718(2) [Э]
ThZn4 BaAl4 //10, Hlmmm 0,4273 1,0359 [Э]
Th2Zri|7 hRl9, R3m 0,903 1,320 [1]
Литература
1. Макаров Е.С., Виноградов С.И. // Кристаллография. 1956. Т. 1. № 6. С. 634.
Г. И. Терехов
Th-Zr
395
Th-Zr. ТОРИЙ-ЦИРКОНИЙ
Диаграмма состояния системы, представленная на рис. 651, взята из
работ [1,2]. Сплавы исследовали методами металлографии, рентгеновско-
го и термического анализов. Кривые ликвидуса и солидуса имеют
минимум при температуре 1350 °C и концентрации ~50 % (ат.) Zr [2] (54 %
(ат.) Zr [Э]). Между высокотемпературными модификациями 0Th и 0Zr
образуется непрерывный ряд твердых растворов. Согласно данным
высокотемпературного рентгеновского анализа параметр решетки а
этого раствора линейно изменяется с концентрацией [Э].
Добавки Zr снижают температуру 0 а превращения Th; монотекто-
идная реакция (0Th, 0Zr)1 ** (aTh) + (0Th, 0Zr)2 имеет место при 920 °C
и 40 % (ат.) Zr. Область несмешиваемости при этой температуре
простирается от 40 до 69,5 % (ат.) Zr, критическая точка расслаивания
расположена при 945 °C и -54 % (ат.) Zr. Максимальная растворимость
Zr в (aTh) соответствует монотектоидной температуре и составляет 14 %
(ат.), снижаясь до ~5 % (ат.) при 400 °C [2]. Более низкие значения (9,9 %
(ат.) при 920 °C) приведены в работе |Э]. Согласно работе [3], различная
растворимость, установленная разными исследователями, может быть
объяснена влиянием примесей внедрения. Легирование Th понижает
температуру 0 - а превращения Zr; эвтектоидная реакция (0Th, 0Zr)
- (aTh) + (aZr), происходит при 650 °C; растворимость Th в (aZr) при
этой температуре менее 2,2 % (ат.) [Э].
Рис. 651. Th-Zr
396
ГА-Zr, Ti-U
Ряд работ [4, 5] посвящен исследованию метастабильных фаз,
образующихся при закалке сплавов, богатых Zr (66—100 % (ат.) Zr).
Согласно рентгеновским исследованиям [4], закалка в воде от 905 и
955 °C ведет к образованию:
а) гексагональной плотноупакованной (ГПУ) структуры в сплавах
с 90-100 % (ат.) Zr;
б) орторомбической структуры, которую можно рассматривать как
искаженную ГПУ структуру с параметрами решетки а = 0,3385 нм, b =
= 0,5558 нм, с = 0,5323 нм при 80 % (ат.) Zr и а = 0,3315 нм, b = 0,5629 нм,
с - 0,5263 нм при 85 % (ат.) Zr;
в) кубической структуры в сплаве с 75 % (ат.) Zr;
г) ГЦК структуры для сплавов с 66-70 % (ат.) Zr.
Образование фазы о не зафиксировано.
Авторы работы [5] исследовали сплавы, выплавленные в дуговой печи
в атмосфере Не и закристаллизованные с высокой скоростью охлажде-
ния. В сплавах с 0-15 % (ат.) Zr и 90-100 % (ат.) Zr была зафиксирована
ГЦК структура; в сплавах с 40-80 % (ат.) Zr - ОЦК структура.
В работе [6] был проведен термодинамический расчет кривых солидуса
и ликвидуса с использованием модели регулярных растворов и было
показано, что минимум на этих кривых расположен при температуре
1345 °C и концентрации 54 % (ат.) Th.
Литература
1. Бадаева Т.А., Алексеенко Г.К. И Журнал неорганической химии. 1959. Т. 4. № 8.
С.1873-1880.
2. Бадаева Т.А., Кузнецова Р.И.//Изв. АН СССР. Металлы. 1972. № 1.С. 196-200.
3. Carlson O.N., Smith J.F. И Bull. Alloy Phase Diagrams. 1987. V. 8. N 3. P. 208-213.
4. Peterson D.T., Ostenson J.E.//J. Less-Common Met. 1978. V. 60. N l.P. 115-121.
5. Luo H.L. // J. Less-Common Met. 1979. V. 65. N 1. P. 13-17.
6. Brostow W., Macip M.A. // Alloy Phase Diagrams Symp. Boston. Mass. Nov. 1982. New
York. 1983. P. 217-222.
Л.А. Третьяченко
Ti-U. ТИТАН-УРАН
Диаграмма состояния системы Ti-U взята из справочников [X, Э]
(рис. 652). Из диаграммы следует, что между полиморфными модифика-
циями pTi и yU, имеющими одинаковую кристаллическую решетку, при
высоких температурах существует непрерывный ряд твердых растворов.
Это объясняется незначительным различием (4,1 %) атомных диаметров
Ti и U. Уран снижает температуру полиморфного превращения Ti с 882
Ti-U. Ti-V
397
Ti U^/ofam.) I/
Рис. 652. Ti-U
до 655 °C, при которой происходит эвтектоидное превращение (£Ti,
yU) ’*> (aTi) + TiU2, эвтектоидная точка отвечает 15 % (ат.) U.
Соединение TiU2 образуется в твердом состоянии при охлаждении
сплавов из области твердых растворов при 898 °C. Это соединение не
растворяет в себе компонентов системы, существует при практически
постоянном составе 66,7 % (ат.) U, обладает гексагональной структурой
типа А1В2 (символ Пирсона ЛРЗ, пр.гр. Рб/mmm) параметры решетки а
- 0,481 нм, с = = 0,2844 нм, с/а = 0,588.
Растворимость U в (aTi) при эвтектоидной температуре составляет
~2 % (ат.). В сплавах, богатых ураном, при 720 °C и 93 % (ат.) U
протекает эвтектоидное превращение (£Ti, yU) (0U) + TiU2.
При 668 °C протекает, вероятно, вырожденное перитектоидное
превращение (0U) + TiU2^ (aU). При этой температуре в (all) растворя-
ется до 4 % (ат.) Ti.
П. Б. Будберг
Ti-V. ТИТАН-ВАНАДИЙ
Первые исследования по диаграмме состояния Ti-V показали, что V
является весьма активным 0-стабилизатором, снижающим температуру
а ** 0 превращения Ti, а также несколько повышающим температуру
начала плавления сплавов. Положение границы областей (aTi) + (0Ti,V)
/ (0Ti,V) при температуре 600 °C согласно работам [X, Э] отвечает
398
Ti-V
Рис. 653. Ti-V
~20 % (ат.) V. Однако дальнейшие исследования показали, что твердый
раствор (0Ti, V) при содержании 30-50 % (ат.) V не является стабильным
и при длительных выдержках (300 ч) при 500 °C распадается на два
изоморфных раствора на основе (0Ti) и (V) [1-3]. В работе [2] провели
термодинамический расчет диаграммы состояния системы Ti-V,
подтвердивший данные работы [1] о расслоении твердого раствора (0Ti,
V), при температуре -680 °C протекает монотектоидная реакция. В
работе [3] экспериментально показано, что растворимость V в (aTi) носит
ретроградный характер, достигая при 500-600 °C значений 3,7-3,8 % (ат.)
V и снижаясь до 2,5 % (ат.) V при 400 °C. Эти результаты нашли
подтверждение в работе [4], в которой экспериментально установлено
существование в сплавах системы Ti-V монотектоидного превращения
(рис. 653) при 675 °C, температура критической точки кривой расслоения
соответствует 850 °C, монотектоидная точка расположена при 18 % (ат.)
V, максимальная растворимость V в (aTi) составляет 2,7 % (ат.),
монотектоидная горизонталь простирается до 80 % (ат.). На кривой
плавкости примерно при 34% (ат.) V наблюдается минимум при 1605 °C.
Литература
I. Молоканов В.В., Будберг П.Б. //Доклады АН СССР. 1974. Т. 215. № 5. С. 1125-1127.
2. Чернов Д.Б., Шиняев А.Я. // Изв. АН СССР. Металлы. 1975. № 5. С. 212-219.
3. Молоканов В.В., Чернов Д.Б., Будберг П.Б. И Металловедение и термическая
обработка металлов. 1977. № 8. С. 60-61.
Ti-V. Ti-W
399
4. Nakano O., Sasano H., Suzuki T., Kimura H. // J. Jap. Inst. Metals. 1981. V. 45. N 7.
P. 653-660.
П.Б. Будберг
Ti-W. ТИТАН-ВОЛЬФРАМ
Взаимодействие между Ti и W исследовали в ряде работ [X]. В работе
[1] сделан обзор экспериментальных данных о фазовых равновесиях в
системе, метастабильных фазах и термодинамических свойствах сплавов
системы (рис. 654).
В системе образуется непрерывный ряд твердых растворов между £Ti
и W. Температура плавления Ti возрастает от 1670 до 1800-1900 °C для
сплавов с 10-50 % (ат.) W. Введение W в Ti понижает температуру его
полиморфного превращения а ~ £ с 882 °C для Ti до температуры 740 °C,
при которой протекает монотектоидное превращение, сопровождающее-
ся расслоением твердого раствора (PTi, W) на твердые растворы р] и £2.
Критической точке бинодальной кривой соответствуют температура
1230 °C и содержание 33 % (ат.) W. Концентрация монотектоидной точки
соответствует 9 % (ат.) W.
Растворимость W в (aTi) не превышает 0,2 % (ат.) при температуре
монотектоидного превращения. В богатых Ti сплавах, представляющих
собой после закалки пересыщенный вольфрамом твердый раствор на
основе (PTi), образуются метастабильные фазы: а' (мартенсит) в
интервале концентраций 0-2 % (ат.) W и а" с орторомбическими
Рис. 654. Ti-W
400
Ti-W, Ti-Y
искажениями в более богатых W (от >2 до 5,5 % (ат.) W) сплавах.
Температура начала мартенситного превращения снижается с 600 °C при
4 % (ат.) W до 400 °C при 6,2 % (ат.) W. Фаза о) образуется в сплавах с
6-10 % W как переходная структура между высокотемпературной (0Ti)
и низкотемпературной (aTi) фазами. Параметр решетки ОЦК твердого
раствора (0Ti, W) меняется с повышением содержания W:
Содержание W, % (ат.) . 0 15 25 40 50 65 70 80 100
Параметра, нм...... 0,33065 0,324 0,3222 0,3200 0,3184 0,3170 0,3167 0,3164 0,3164
Метастабильная фаза а' имеет ГПУ структуру типа Mg (символ
Пирсона API 2, пр.гр. РС^ттс). Метастабильная фаза а" имеет
орторомбическую структуру (пр.гр. Стет), параметры решетки а -
= 0,3000 нм, b = 0,4995 нм, с = 4655 нм для сплава с 4 % (ат.) W.
Термодинамическим расчетом [2] подтверждена достоверность варианта
диаграммы состояния, приведенного на рис. 654.
Литература
1. Murray J.L.//Bull. Alloy Phase Diagrams. 1981. V.2. N 2. P. 192-196.
2. ZeeS.K., Zee D.N.//Calphad. 1986. V. 10. N l.P. 61-78.
К.Б. Поварова
Ti-Y. ТИТАН-ИТТРИЙ
На рис. 655 представлен скорректированный вариант диаграммы
состояния Ti-Y, учитывающий данные, приведенные в работах р, Ш,
1]. Титан понижает температуры плавления и полиморфного превраще-
ния иттрия. При температуре 1440 °C и содержании 2,2 % (ат.) Ti
протекает кататектическая реакция (0Y) (aY) + Ж. При 1355 °C
кристаллизуется эвтектика (aY) + (pTi), эвтектическая точка расположена
при 18,7 % (ат.) Ti. Максимальная предельная растворимость Ti в (aY),
которая имеет место при эвтектической температуре, составляет -1,8 %
(ат.). Нонвариантная реакция при 880 °C связана с полиморфизмом Ti.
Вероятно, это реакция эвтектического типа.
Ti-Y, Ti-Zn
401
Рис. 655. Ti-Y
Литература
I. Beaudry B.J.//J. Less-Common Met. 1968. V. 14. N 3. P. 370-372.
Е.И. Гладышевский, О.И. Бодак, B.K. Печарский
Ti-Zn. ТИТАН-ЦИНК
Диаграмма состояния Ti-Zn исследована в основном со стороны Zn
[1]. Установлено, что при температуре 418,6 °C кристаллизуется
эвтектика Zn + TiZnI5, эвтектическая точка расположена при 0,21 % (ат.)
Ti, максимальная растворимость Ti в (Zn) -0,0006 % (ат.). Соединение
TiZn15 образуется по перитектической реакции при 445 °C. Кроме того,
в сплавах обнаружено еще два перитектических превращения при 468 и
486 °C. Этот вариант диаграммы получил подтверждение в работе [2].
В работе [3] провели критический анализ данных ранее опубликован-
ных работ по системе Ti-Zn и построили диаграмму состояния,
приведенную на рис. 656. Соединения TiZnI5, TiZn10 и TiZn5 образуются
по перитектическим реакциям при температурах 445, 468 и 486 °C.
Соединение TiZn3 также образуется по перитектической реакции при
-650 °C. Условия образования остальных соединений TiZn2, TiZn, Ti2Zn
не установлены, так же как и кристаллическая структура соединений
TiZn15, TiZnI0, TiZn5. Соединение TiZn3 имеет упорядоченную кубичес-
кую решетку AuCu3 (символ Пирсона сР4, пр.гр. РтЗт) с параметром
402
Ti-Zn, Ti-Zr
Рис. 656. Ti - Zn
a = 0,3022 нм [Ш]. Примитивную кубическую решетку типа CsCl (символ
Пирсона сР2, пр.гр. РтЗт) имеет соединение TiZn. Тетрагональной
структурой типа MoSi2 (символ Пирсона /76, пр.гр. IMmmm) обладает
соединение Ti2Zn Щ1].
С. П. Алисова
Литература
1. Renhack Е.Н.// Trans. AIME. 1966. V. 236. N 6. Р. 941-942.
2. Добрев Р., Димова В., Георгиев И.//Металловедение и технология. 1977. Т. 5. С. 40-43.
3. Murray J.L. И Bull. Alloy Phase Diagrams. 1984. V. 5. N 1. P. 52-56
Ti-Zr. ТИТАН-ЦИРКОНИЙ
Как между 0, так и между a-модификациями Ti и Zr образуются
непрерывные ряды твердых растворов [X]. Кривые ликвидуса и солидуса
имеют минимум при температуре 1535± 10 °C и содержании ~35 % (ат.)
Zr [10] (рис. 657).
Легирование Ti цирконием и Zr титаном понижает температуру
превращения 0 ** а, которая согласно работам [1,2] достигает минимума
при 535 °C и 50 % (ат.) Zr. Определение положения минимума было
повторено недавно дилатометрическим [3] и микрокалориметрическим
[4] методами с использованием высокочистых материалов и обеспечением
условий, предотвращающих загрязнение сплавов в процессе длительных
экспериментов. Было показано, что превращение а 0 в сплаве
эквиатомного состава имеет место при более высокой температуре (621 ±2
°C [3] или 616 °C [4] при нагреве и при 586±20 °C [3] или 600 °C [4] при
Ti-Zr
403
Рис. 657. Ti - Zr
охлаждении). Позднее эти результаты подтверждены методом адиабати-
ческой калориметрии [5].
' х Расчеты, проведенные с использованием модели регулярных
> растворов в работе [6], показали, что положение минимума при
превращении р а соответствует 610 °C.
В работах [7, 8] исследовали Ti-Zr сплавы после закалки и отпуска
’ методами рентгеновской диффракции, металлографии, электронной
микроскопии и измерения твердости. Метастабильных фаз р и со
; обнаружено не было. Предыдущие данные об образовании этих фаз, по-
, видимому, следует объяснить присутствием примесей внедрения.
* В работе [9] фазу со в сплавах Ti-Zr наблюдали при содержании <40
( и >95 % (ат.) Ti под давлением 8 ГПа.
J Литература
11. Farrar Р.А., Adler S. // Trans. AIME. 1966. V. 236. N 7. C. 1061-1064.
2. Chatterji D., Hepworth M.T., Hruska S.J. И Met. Trans. 1971. V. 2. N 4. C. 1271-1272.
3. Etchessahar E. Debuigne J. // Mem. Sci. Rev. Met. 1977. V. 74. N 3. C. 195-205.
4. Auffredic J.-P., Etchessahar E., Debuigne .J. // J. Less-Common Met. 1982. V. 84. N 1.
C. 49-64.
5. Blacktop J., Crangle J., Argent B.B. //J. Less-Common Met. 1985. V. 109. N 2. C. 375-380.
6. Saunders N., Argent B.B. // J. Less-Common Met. 1986. V. 125. N I. C. L11-L13.
7. Banerjee S., Krishnan R. // Met. Trans. 1973. V. 4. N 8. C. 1811-1819.
8. Добромыслов A.B., Талуц Н.И. И Физика металлов и металловедение. 1987. Т. 63. № 1
С. 127-132.
9. Добромыслов А.В., Талуц Н.И., Демчук К.М., Мартемьянов А.В. И Физика металлов
и металловедение. 1988. Т. 65. № 3. С. 588-593.
10. Moffatt W.G. Handbook of Binary Phase Diagrams. New York: Business Grow th
Services. General Electric Co. Schenectady, 1976. 1977. V. 1,2. 658 p.
Л.А. Третьяченко
404
Tl-Tm. Tl-U
Tl-Tm. ТАЛЛИЙ-ТУЛИЙ
Диаграмма состояния Tl-Tm не исследована, имеются только данные
о существовании отдельных соединений, кристаллические характеристи-
ки приведены в табл. 507 по данным работ [1, V-С].
Таблица 507. Кристаллическая структура соединений системы Tl-Tm
Соединение Структурный тип Символ Пирсона, пр.гр. Параметры решетки, нм
а с
Т13Тш Cu3Au сР4, 0,4655 -
РтЗт
Т1Тт CsCl сР2, 0,3670 -
РтЗт
Т13Тт5 Si3Mn5 hP\f>, Рбу/тст 0,8798 0,6495
Литература
1. Гладышевский Е.И., Бодак О.И. // Кристаллохимия интерметаллических соединений
редкоземельных металлов. Львов: Вища школа. 1982. 255 с.
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
TI-U. ТАЛЛИЙ-УРАН
Диаграмма состояния T1-U не построена. В работе [X] сообщено о
существовании наиболее богатого Т1 соединения UT13, предположитель-
но имеющего упорядоченную кубическую структуру типа Cu3Au с
параметром решетки а = 0,4675 нм. Растворимость U в жидком Т1 при
отдельных температурах приведена ниже [III]:
Растворимость
U, %(ат.).......... 0,133 2,7-Ю'2 6,7-10'3 2,7-10’3 8,4-Ю’4 2,110*4 4,610’5
Температура, °C ... . 854 722 630 574 509 453 400
Указанные значения согласуются с ранее приведенными в работе [Э]
(800 °C - -0,10 % (ат.), 900 °C-0,145 % (ат.)).
Л.Л. Рохлин
Tl-Y
405
Tl-Y. ТАЛЛИЙ-ИТТРИЙ
Диаграмма состояния Tl-Y обобщена в работе [1] и приведена на
рис. 658 согласно данным работы [2]. Система исследовалась методами
дифференциального термического, металлографического, рентгенов-
ского и микрорентгеноспектрального анализов [2]. В системе установле-
П Yt°/o(am.) Y
Рис. 658. TI - Y
но пять соединений, два из которых T1Y и Tl3+xY5 имеют, вероятно,
области гомогенности, которые не определялись экспериментально. В
работе [2] указывается, что соединение Tl3+xY5 образуется по перитекти-
ческой реакции, но температура ее не определена. По перитектическим
реакциям образуются соединения T1Y, T15Y3 и T13Y, а соединение T13Y5
плавится конгруэнтно при 1470 °C. Соединение T1Y претерпевает
полиморфное превращение при 1180 °C. Нонвариантные реакции
приведены в табл. 508, а в табл. 509 даны кристаллическая структура и
параметры решеток соединений системы T1-Y. Кристаллическая
структура соединения Tl3+xY5 не определена.
406
TI-Y
Таблица 508. Нонвариантные реакции в системе TI-Y
Реакции Содержание Y, % (ат.), в фазах Температура, °C
Ж - (0Т1) + T13Y 0 0 25 302
Ж + T15Y3 - T13Y 20 37 25 880
Ж + T1Y - T15Y3 35 45 37,5 980
Ж + T13+xY5 ** T1Y 47 58 50 1220
Ж + T13Y5 •* Tl3+xY5 ? 62,5 61 ?
Ж T13Y5 + (aY) 80 63 98 1085
фУ)-Ж + (аУ) ? ? ? ?
Таблица 509. Кристаллическая структура соединений системы T1-Y
Соедине- ние Прото- тип Символ Пирсона, пр.гр. Параметры решетки, нм Источник
а b С
T13Y Cu3Au cP4, РтЗт 0,4685-0,4686 - - [2]
ti5y3 Pd5Pu3 oC32, Стет 0,9965 0,808 1,037 [3]
0T1Y CsCl cP2, РтЗт 0,3751 - - [3]
ti3y5 Si3Mn5 hP\6, Рбу/тст 0,8935-0,8942 - 0,6594-0,6615 [2]
aTlY AuCu tP2, PMmmm - - - [2]
Литература
1.Okamoto Н.//J. Phase Equilibria. 1991. V. 12. N 2. Р. 255-256.
2. Saccone A., Delfino S., Cacciamani G., Ferro R. // J. Less-Common Met. 1989. V. 154
P. 99-107.
3. Гладышевский Е.И., Бодак О.И. //Кристаллохимия интерметаллических соедине-
ний редкоземельных металлов. Львов: Вища школа. 1982. 255 с.
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
Tl-Yb
407
Tl-Yb. ТАЛЛИЙ-ИТТЕРБИЙ
Диаграмма состояния Tl-Yb (рис. 659) построена авторами работы
[1]. Сплавы для исследования синтезировали из Т1 высокой чистоты
(99,9993 % (по массе)) и Yb чистотой 99,92 % (по массе) в танталовых
тиглях, которые герметизировали лазерной сваркой в вакууме. Образцы
получали двух- или трехкратным переплавом шихты с последующим
гомогенизирующим отжигом в течение 250-300 ч. Диаграмму состояния
системы исследовали методами микроструктурного, рентгеновского и
дифференциального термического анализов.
В системе обнаружили четыре соединения. Наибольшей термической
стабильностью обладает конгруэнтно плавящееся при 1127 °C соединение
TlYb, остальные соединения образуются по перитектическим реакциям:
Ж + Т1УЬ2 Т12УЬ5 при 812 °C,
Ж + TlYb Т1УЬ2 при 827 °C,
Ж + TlYb Tl3Yb при 577 °C.
Рис. 659. Г1 - Yb
408
Tl-Yb, Tl-Zn
Максимальная растворимость TI в (aYb) составляет 6 % (ат.) при
607 °C, а в (pYb) - 14 % (ат.) при 647 °C. При 607 °C и 10 % (ат.) Т1 в
системе протекает эвтектоидная реакция распада (PYb). В системе
кристаллизуются две эвтектики:
Ж * (pYb) + Tl2Yb5 при 647 °C и 16 % (ат.) Т1;
Ж и. (pTi) + Tl3Yb при 287 °C и >98 % (ат.) Т1.
Кристаллическая структура соединений приведена в табл. 510.
Структура соединения Tl2Yb5 не определена.
Таблица 510. Кристаллическая структура соединений системы Tl-Yb
Соединение Структурный тип Символ Пирсона, пр.гр. Параметры решетки, нм
а b с
T13Y Cu3Au сР4. Pin 3 т 0,4766 - 1
TlYb CsCl сР2, Pin 3 т 0,3821 - -
TlYb2 РЬС12 J Рпта 0,7170 0,5248 0,9802
Литература
I. Sabirzyanov N.A., Yatseiiko S.P., Melekhov L.Z. //J. Less-Common Met. 1987. V. 135.
N 1. P. 87-93.
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
Tl-Zn. ТАЛЛИЙ-ЦИНК
Диаграмма состояния Tl-Zn (рис. 660) характеризуется широкой
областью несмешиваемости в жидком состоянии и отсутствием
соединений. Обзор ранних исследований диаграммы состояния этой
системы дан в работе [X]. В последующих исследованиях [Э, 1, 2]
диаграмма состояния, приведенная в работе [X], в общем подтверждена,
но сделаны некоторые уточнения в положении критических точек. Так
авторами работы [1] прецезионным термическим анализом при
использовании очень чистых материалов изучена часть диаграммы с
небольшим содержанием Т1. Установлено, что концентрация Т1 в
монотектике равна 0,42 % (ат.), что отличается от значения 0,88 % (ат.),
Tl-Zn, Tl-Zr
409
Zn TL,°/o(a.m.) TL
Рис. 660. TI - Zn
указанного в работе [X]. В работе [2] уточнено положение линии,
ограничивающей область несмешиваемости в жидком состоянии при
температуре ниже 600 °C, которое в работе [X] указано как ориентиро-
вочное.
Литература
1. McLaren Е.П., Weinberg F. И Canad. Journ. Phys. 1961. V. 39. N 4. P. 588-595.
2. PredelB./ZZ. Metallkunde. 1965. Bd. 56. N11. S. 791-798.
Л.Л. Рохлин
Tl-Zr. ТАЛЛИЙ-ЦИРКОНИЙ
Диаграмма состояния Tl-Zr не исследована. В работе [1] получено
соединение Zr4Tl с кубической структурой типа А15, которое не является
сверхпроводником при температуре до 0,35 К.
Литература
1. Vielhaber Е., Luo H.L. И Solid State Commun. 1967. V. 5. N 4. P. 221-223.
Л.А. Третьяченко
410
Tm-U, Tm-V, Tm-W
Tm-U. ТУЛИЙ-УРАН
Диаграмма состояния Tm-U не построена. Согласно работе р] Тт
и U в жидком состоянии практически взаимно не растворяются.
Растворимость Тт в жидком U увеличивается с 0,035 % (ат.) при 1150 °C
до 0,098 % (ат.) при 1250 °C. При 1225 °C в U растворяется 0,056 % (ат.)
Тт.
Е.И. Гладышевский, О.И. Бодак, В. К. Печарский
Тт-V. ТУЛИЙ-ВАНАДИЙ
На рис. 661 представлена рассчитанная диаграмма состояния системы
Тт И
Рис.661.Tin- v
Tm-V при атмосферном давлении [1].
Литература
1. Smith Y.F., Lee K.J., Martin D.M.//Calphad. 1988. V. 12. N l.P. 89-96.
П.Б. Буддерг
Tm-W. ТУЛИЙ-ВОЛЬФРАМ
Диаграмма состояния Tm-W не построена. Растворимость W
чистотой 99,9 % (но массе) в Тт, чистотой 99,8 % (по массе), при
различных температурах приведена ниже:
Tm-W, Tm-Y
411
Растворимость W, % (ат.) ............... 0,50 0,077 1,78
Температура, °C......................... 1645 1865 2097
Растворимость W в жидком Тт в интервале температур 1645-2097 °C
может быть описана уравнением 1пх = - 5,485-Ю'^/Т + 0,525, где х -
атомная доля W, Т- температура, К. Растворимость W в жидком Тт при
его температуре плавления (1545 °) составляет 0,322 % (ат.) [1].
Литература
1. Dennison D.H., Tschetter M.J., Gschneidner, Jr., K.A. // J. Less-Common Met. 1966. V. 11.
N 6. P. 423-435.
КБ. Поварова
Tm-Y. ТУЛИЙ-ИТТРИЙ
Диаграмма состояния Tm-Y экспериментально не построена. Однако
Тт и Y имеют идентичное электронное строение с тремя валентными
электронами d]s2, одинаковые плотноупакованные гексагональные
структуры с близкими параметрами решетки и атомные радиусы,
отличающиеся на 3,1 %. На этом основании можно предположить, что
Тт и Y образуют между собой непрерывные ряды твердых растворов
с ГПУ структурой. Вследствие близости атомного строения исходных
элементов растворы почти идеальны, поэтому ликвидус и солидус
практически сливаются в общую прямую с узкой двухфазной областью
Рис. 662. Tm-Y
412
Tm-Y, Tm-Zn
между ними. По той же причине в общую прямую практически сливаются
обе линии сольвуса. Тулий в твердом состоянии не испытывает
превращений. Перитектическая точка отвечает 1530 °C и 70 % (ат.) Y.
Ее положение определяется изменением ближнего порядка Жгпу * ЖОцК
в жидком состоянии при температуре 1655 °C [1]. В связи с этим сплавы,
содержащие до 70 % (ат.) Y, плавятся, сохраняя ближний порядок,
соответствующий их ГПУ кристаллической структуре. Однако при
дальнейшем нагреве ближний порядок расплавов становится ОЦК
(рис. 662).
Литература
1. Григорович В.К., Григорович К.В. И Строение и свойства металлических и шлаковых
расплавов. Тезисы докладов на VII Всесоюзной конференции. Челябинск: ЧПИ, 1990. Т. 2.
Ч. 2. С. 250-252.
В. К. Григорович
Tm-Zn. ТУЛИЙ-ЦИНК
Диаграмма состояния системы Tm-Zn не исследована. Однако
известно существование ряда соединений этой системы, кристаллические
характеристики которых приведены в табл. 511 по данным работы [V-C].
Таблица 511. Кристаллическая структура соединений системы Tm-Zn
Соединение Прототип Символ Пирсона, пр.гр. Параметры решетки, нм
a b c
TmZn CsCl cP2, РтЗт 0,3515 - -
TmZn2 CeCu2 oZI2, Imma 0,4433 0,6944 0,7604
TmZn3 YZn3 оР16, Pnma 0,6661 0,4330 0,9997
Tm6Zn23 Th6Mn23 cF\ 16, Fm 3 m 1,256 - —
Tml3Zn55 Tm13Zn55 Рбупс 1,414 - -
TmZn5 ErZn5 hP36, Pbylmmc 0,8833 - 0,9147
Tm-Zn. Tm-Zr, U-V
413
Соединение Прототип Символ Пирсона, Пр.гр. Параметры решетки, нм
a b c
Tm2Zn17 Th2Ni(7 ЬРЗК, Pbyhnmc 0,8939 - 0,8736
Tm2Znl7 Th2ZnI7 R3m 0,8937 - 1,3110
TmZn]2 ТЬМп|2 t!26, I4lmmm 0,8852 - 0,5190
Е.И. Гладышевский, О.И. Бодак, B.K. Печарский
Tm-Zr. ТУЛИЙ-ЦИРКОНИЙ
Диаграмма состояния Tm-Zr не построена. Согласно работе [1]
сплавы Tm-Zr не удалось получить дуговой плавкой вследствие высокой
летучести Tm.
Литература
1. Wang R.//Met. Trans. 1972. V. 3. N 5. P. 1213-1221.
Л.А. Третьяченко
U-V. УРАН-ВАНАДИЙ
Первая диаграмма состояния U-V приведена в справочнике [X].
Установлено наличие трех нонвариантных равновесий: эвтектического
Ж * (V) + (yU) при 1040±5 °C
и двух эвтектоидных
(yU) - (V) + (ри) при 727+5 °C;
(PU) ~ (aU) + (V) при 652±5 °C.
Растворимость V в (aU) при эвтектической температуре составляет 12 %
(ат.). Промежуточных соединений не обнаружено.
Последующими исследованиями [1] системы методами дифференци-
ального термического, микроструктурного и рентгеновского анализов
414
U'-K U-W
U v,°/o(am.) к
Рис. 663. и - V
i
и измерения твердости на сплавах U чистотой 99,8 % (по массе) и
электролитического V уточнены данные о взаимной растворимости
компонентов, температуры нонвариантных превращений и дополнитель-
но изучены кристаллические структуры составляющих фаз. На рис. 663
указаны уточненные температуры нонвариантных превращений,
соответственно равные 1048, 733 и 647 °C, которые оказались близкими
к ранее опубликованным. Подтверждено значение растворимости V в
(уЦ), равное 12 % (ат.), растворимость V в (PU) составляет 2,5 % (ат.),
в(аЦ)-~1 % (ат.). Растворимость U в (V) при температуре 850 °C равна
3,2 % (ат.). Во время закалки сплавов из области (yU) при содержании
V > 6 % (ат.) установлено образование новой метастабильной фазы у".
Литература
1. Терехов Г.Н., Александрова Л.Н. И Изв. АН СССР. Металлы. 1988. № 5. С. 197-200.
Г. И. Терехов
U-W. УРАН-ВОЛЬФРАМ
Данные различных исследователей о характере взаимодействия
металлов хорошо совпадают между собой [X, Э]. Диаграмма состояния
U-W (рис. 664) эвтектического типа, в которой отсутствуют промежуточ-
ные фазы, а эвтектическая реакция вырождена [1,2]. Растворимость W
в (yU) при 1 000 °C составляет0,4-0,9 % (ат.) [X]. Растворимость W в (pU)
и (aU) настолько мала, что не влияет на температуры полиморфных
превращений U. На основании термодинамических данных расчетным
U-W
415
W Ut°/ofan7.) U
Рис. 664. U-W
путем установлено, что при температуре 1000 °C растворимость W в (yU)
составляет -0,222 % (ат.), U в (W)- -0,121 % (ат.).
Растворимость W в жидком U, определенная по потере массы
вольфрамового тигля при различных температурах, приведена ниже [2]:
Температура, °C.......................
Растворимость W, % (ат.) .............
2211 2315 2410 2497 2660
11,9 16,6 22,2 23,5 33,2
Данные о взаимодействии U с W обобщены в работе [4].
Литература
1. Ackermann R.J., Rauch Е.С. И High Temp. Science. 1972. V. 4. Р. 496-505.
2. Mallarsctty S., Chandra Sekharaiah, Sanjiv R. et al. // Z. Metallkunde. 1986. Bd. 77. N 8.
S. 509-514.
3. Udowski A.L., Ivanov O.S. //Thermodyn. Nucl. Mater. Proc. Symp. Vienna. 1974. Vienna.
1975. V. 2. P. 285-302.
4. Pandian S., Nagender Naidu S.V., Rama Rao P. // J. Alloy Phase Diagrams. 1988. V. 4. N 3.
P. 148-153.
К.Б. Поварова
416
U-Y, U-Yb
U-Y. УРАН-ИТТРИЙ
Диаграмма состояния U-Y не построена, хотя имеется работа [1], в
которой определяли растворимость Y в U. Сплавы выплавляли в тигле
из Y в высокотемпературной печи. Урановый стержень длиной 1,9 см и
диаметром 1,27 см помещали в тигель высотой 2,5 см, диаметром 2,5 см
с толщиной стенок 0,31 см и выдерживали в тигле при 1430 °C 70 мин в
вакууме. Растворимость определяли в центральной части слитка, где
сегрегация минимальна. При исследовании использовалиU, содержащий
0,06 % (по массе) примесей, после плавки общее количество примесей
уменьшалось до 0,102 % (по массе). Исследование приводили методами
микроструктурного и химического ана^зов. Определено, что в U
растворяется 0,48 % (ат.) Y. По данным работы [Э] растворимость Y в
U при различных температурах приведена ниже:
Растворимость Y, % (ат.).....................
Температура, °C..............................
0,29 0,37 0,32 0,23
1250 1225 1200 1175
Система U-Y характеризуется неполной смешиваемостью компонентов
в жидком состоянии. В твердом состоянии они не образуют соединений
и практически нерастворимы друг в друге.
Литература
1. Condon J.B., Holcombe С.Е. И J. Less-Common Met. 1977. V. 55. N 2. Р. 297-298.
Е.И. Гладышевский, О.И. Бодак, В,К. Печарский
U-Yb. УРАН-ИТТЕРБИЙ
Диаграмма состояния U-Yb не построена. Согласно работе [1 j Yb и
U в жидком состоянии практически взаимно не растворяются. Раствори-
мость Yb в жидком U составляет 0,30 % (ат.) при 1150 °C - 1250 °C.
Растворимость U в жидком Yb при температуре 1050 °C не превышает
0,13 % (ат.) и 0,23 % (ат.) при 1250 С°.
Литература
1. Спеллинг Ф., Дааи А. // Редкоземельные металлы. М.: Металлургия. 1965. 610 с.
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
U-Zn
417
U-Zn. УРАН-ЦИНК
Данные о взаимодействии U и Zn приведены в справочнике [X], где
описано соединение UZn9. Полностью система исследована в работе [1].
Сплавы готовили нагревом компонентов в танталовых контейнерах,
заваренных дугой в атмосфере Аг. Для приведения в равновесное
состояние сплавы отжигали при 1100 °C с последующей закалкой.
Давление паров Zn при этой температуре составляло 0,2 МПа. Затем
сплавы отжигали при различных температурах (при 850 и 930 °C 2 ч, при
675 °C 312 ч, при 450 °C 96 ч) и охлаждали вместе с печью до комнатной
температуры. При исследовании применяли U с общим содержанием
примесей < 0,05 % (по массе), Zn чистотой 99,99 % (по массе). Исследова-
ние проводили методами дифференциального термического анализа,
измерения давления паров Zn (сплавы в интервале концентраций
100-10 % (ат.) U) и измерением электродвижущей силы (сплавы, богатые
Zn).
Диаграмма состояния U-Zn (рис. 665) построена при избыточном
давлении паров Zn. Горизонтали при 824 и 724 °C соответствуют
температурам полиморфного превращения aU2Zn17 » pU2ZnI7.
Растворимость Zn в U в твердом состоянии незначительна или
Рис. 665. U-Zn
418
U-Zn, U-Zr
практически отсутствует. Эвтектическая точка на горизонтали при 942 °C
отвечает 83,7 % (ат.) Zn. Область гомогенности соединения UZn17
простирается от 90,4 до 92 % (ат.) Zn. Кристаллическая структура
известных соединений приведена в табл. 512 по данным работы [У-С].
Таблица 512. Кристаллическая структура соединений системы U-Zn
Соединение Структурный тип Символ \ Пирсона, \ пр.гр. j Параметры решетки, нм
а с
U2Z11 р Th2Ni,7 AP38, Pbj/mmc 0,8974 0,8804
U2^H|7 Th2Zn17 hR\<), R 3m 0,8983 1,3160
UZn|2 UZn|0 0,8950 0,8902
Необходимо отметить, что соединение UZn,2 имеет дефектную
кристаллическую структуру, поэтому оно должно быть записано как
UZn124_n.
Литература
1. Chiotti Р., Mason J.T. // J. Less-Common Met. 1975. V. 40. N 1. P. 39-55.
Е.И. Гладышевский, О.И. Бодак, B.K. Печарский
U-Zr. УРАН-ЦИРКОНИЙ
Диаграмма состояния U-Zr является предметом многочисленных
исследований. Исследования, проведенные ранее, обобщены в справочни-
ках [X, Э, Ш]. Диаграмма состояния (рис. 666) основана на результатах
работы [1], в которой исследование проводили методами металлографии,
рентгеновского анализа, измерения твердости, плотности и электросоп-
ротивления.
Между высокотемпературными ОЦК модификациями (yU) и (PZr)
обнаружен непрерывный ряд твердых растворов, параметр решетки (а)
которого линейно увеличивается с увеличением концентрации Zr [X].
В сплавах, богатых U (-14 —50 % (ат.) Zr), выявлена область
несмешиваемости. Твердый раствор (yU, pZr) распадается на два твердых
раствора, обогащенных U и Zr, при температурах ниже 735 °C.
Критическая точка области несмешиваемости соответствует 35 % (ат.)
U-Zr
419
Рис. 666. U-Zr
Zr [1]. Приводятся и другие координаты критической точки: 740 °C,
-44 % (ат.) Zr [Э], 722 °C, 30 % (ат.) Zr [М].
Легирование Zr понижает температуру у * 0 и р « а превращений U.
Монотектоидная реакция
(YU, PZr), « (yU, 0Zr)2 + (pU)
имеет место при 695 °C и 14 % (ат.) Zr; растворимость Zr в (PU) при этой
температуре составляет около 2,5 % (ат.) [I]. Монотектоидная горизон-
таль простирается до - 57 % (ат) Zr [X], 51 % (ат.) Zr [1], 42,4 % (ат.) Zr [Ш].
Эвтектоидная реакция
(PU) « (aU) + (PZr)
имеет место при 662 °C и 1,5 % (ат.) Zr Р] (0,68 % (ат.) Zr [Ш]). Раствори-
мость Zr в (aU) при этой температуре равна -0,5 % (ат.) и уменьшается
до 0,17 % (ат.) при 560 °C [Ш, 2].
420
U-Zr
При температуре 617 °C происходит реакция перитектоидного
образования из (aU) и (yU, 0Zr) фазы б, которая является единственным
соединением в этой системе. Температура перитектоидной реакции
варьируется по данным различных исследователей от 607 до 620 °C [1,
Э]; значение 617 °C, обозначенное на рисунке, является средним из
имеющихся значений [Э]. Область гомогенности фазы б простирается от
65 до 78 % (ат.) Zr [1]. Согласно работе [Э], состав фазы б при перитекто-
идной температуре по данным различнее исследований колеблется от
-60 до 68 % (ат.) Zr; предельнее содержание Zr в фазе б достигает -79 %
(ат.). Ширина области гомогенности фазф б сильно зависит от прису-
тствия в сплавах кислорода и азота, сужаясь с увеличением концентраций
примесей. При достаточно высокой концентрации примесей фаза б
исчезает, в результате чего можно наблюдать равновесие между (aU) и
(aZr) [3]. Это объясняет результаты некоторых ранних исследований, в
которых это равновесие было обнаружено (см. [X]).
Эвтектоидная реакция (yU, PZr) * (aZr) + б протекает при температуре
607 °C и содержит -82 % (ат.) Zr [1, Э]. Растворимость U в (aZr) при
эвтектоидной температуре менее 0,3 % (ат.) [Ш].
Кристаллическая структура соединения б относится к типу А1В2
(символ Пирсона hP3, пр.гр. Рб/ттт), параметры решетки а = 0,503 нм
и с = 0,308 нм [4].
В работах [1,4] отмечена схожесть структур фазы б и метастабильной
фазы со, которая образуется в сплавах Zr при закалке из области ОЦК
твердых растворов. Проведены термодинамические расчеты системы
U-Zr. Кривые ликвидуса и солидуса рассчитаны в работах [5-7]. В работе
[5] использовали модель регулярных растворов; расчеты в работе [6]
основаны на данных о давлении пара Zr и U; в работе [7] сделано
предположение о субрегулярном поведении расплава. В работах [8-10]
проведен расчет кривой области несмешиваемости (yU, 0Zr).
Данные о метастабильных фазах, образующихся при закалке и
последующем отжиге, можно найти в работах [4,11,12]. Согласно работе
[11], закалка сплавов, богатых U, из области (yU, 0Zr) в жидкий азот или
воду ведет к образованию а' мартенситной (пересыщенный твердый
раствор на основе aU) или метастабильной фазы со. В сплавах с 45-70 %
(ат.) Zr фаза (yU, 0Zr) может быть получена при комнатной температуре
в результате быстрой закалки из расплава [12]. В сплавах, богатых Zr,
а' мартенсит образуется при концентрациях до -9 % (ат.) U, фаза w
наблюдается после закалки сплавов, содержащих от 5 до 22 % (ат.) U,
фаза (yU,(5Zr) найдена в сплавах, содержащих от 11 до 45 % (ат.) U [4].
U-Zr, V-W
421
Литература
1. Иванов O.C., Багров Г.Н. И Строение сплавов некоторых систем с ураном и торием.
Сб. статей. М.: Госатомиздат, 1961. С. 5-19.
2. Гомозов Л.И., Лютина Э.М., Иванов О.С. // Изв. АН СССР. Металлы. 1970. № 2.
С. 210-215.
3. Бадаева Т.А., Кузнецова Р.И.// Изв. АН СССР. Металлы. 1971. № 2. С. 188-190.
4. Иванов О.С., Адамова А.С., Тарараева Е.М., Трегубов И.А. Структура сплавов
циркония. М.: Наука, 1973. 200 с.
5. Chatterji D.//Met. Trans. 1971. V. 2. N 10. P. 2939-2942.
6. К anno M., Yamawaki M., Koyama T., Morioka N. Hi. Nucl. Mater. 1988. V. 154. N 1.
P. 154-160.
7. Leibowitz L., Veleckis E., Blomquist R.A., Pelton A.D. // J. Nucl. Mater. 1988. V. 154. N 1.
P. 145-153.
8. Иванов O.C., Удовский А.Л. И Физико-химический анализ сплавов урана, тория и
циркония. Сб. Статей. М.: Наука, 1974. С. 91-103.
9. Удовский А.Л., Исаичев М.Н., Шелест А.Б., Иванов О.С. И Физико-химические
исследования в металлургии и металловедении с применением ЭВМ. Сб. статей. М.: Наука,
1974. С. 76-92.
10. Williams R.O.//J. Nucl. Mater. 1979. V. 82. N 1. P. 184-192.
11. Терехов Г.И., Тагирова P.X., Иванов О.С. II Физико-химия сплавов и тугоплавких
соединений с торием и ураном.,Сб. статей. М.: Наука, 1968. С. 37-41.
12. Huber J.G., Ansari Р.Н. И Physica. 1985. V. 135. N 1-3. Р. 441-444.
Л.А. Третъяченко
V-W. ВАНАДИЙ-ВОЛЬФРАМ
Диаграмма состояния V-W приведена на рис. 667 [1]. V образует с W
непрерывный ряд твердых растворов в жидком и твердом состояниях.
По данным работы [Л] температура плавления сплавов возрастает от
температуры плавления V до температуры плавления W. По данным
работ [Ш, 2] температура плавления сплавов проходит через минимум
при 1635 °C и 4,5 % (ат.) W [Ш] или 1630 °C и 6,5 % (ат.) W [2].
Рис. 667. V - W
422
V-W, V-Y
Параметр кристаллической решетки твердых растворов (V, W)
изменяется аддитивно с небольшим положительным отклонением от
закона Вегарда в интервале концентраций -2-12 % (ат.) W [1,3].
Литература
1. Nagender N.S.V., Sriramamurthy Д.М., Vijayakwnar М., Rama R.P. // J. Alloy Phase
Diagrams. 1988. V. 4. N 3. P. 191-198.'
2. Барон B.B., Ефимов Ю.В., Савицкий Е.М. // Изв. АН СССР. Отделение технических
наук. Металлургия и топливо. 1960. № 1. С. 70—74.
3. Kieffer R.//J. Less-Common Met. 1959. V.’l.N l.P 19-33.
КБ. Поварова
V-Y. ВАНАДИЙ-ИТТРИЙ
Диаграмма состояния V-Y (рис. 668) построена на основании
металлографических исследований и измерения температур плавления
[1]. Система характеризуется образованием широкой области несмешива-
емости в жидком состоянии, промежуточные фазы не обнаружены [Э].
Растворимость V в (Y) составляет < 0,1 % (ат.) при 1400 °C и
увеличивается до 0,3 % (ат.) при эвтектической температуре 1455 °C.
Область несмешиваемости в жидком состоянии существует от 15 до
> 99,9 % (ат.) V. Монотектическая реакция происходит при 1900 °C [1].
Рис. 668. V - Y
r-K V-Yb
423
Литература
1. Lundin C.E., Klodt P.T. // J. Inst. Met. 1961. V. 90. P. 341-347.
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
V-Yb. ВАНАДИЙ-ИТТЕРБИЙ
Диаграмма состояния V-Yb при давлении, достаточном для
поддержания всех фаз в конденсированном состоянии (рис. 669),
Рис. 669. V-Yb
рассчитана с использованием модели субрегулярных растворов для
жидкой фазы с ОЦК и ГЦК решетками, при условии, что газовая фаза
ведет себя идеально [1].
Расчитанная диаграмма состояния V-Yb монотектического типа;
температура монотектической реакции 1908 °C, содержание V в
монотектической точке составляет 0,3% (ат.). По расчету растворимость
Yb в (V) составляет 0;2 % (ат.) при температуре монотектической реакции
ПК
Литература
1. Smith J.F., Lee K.J. // Bull. Alloy Phase Diagrams. 1987. V. 8. N 3. P. 221-224.
М.И. Бычкова
424
V-Zn
V-Zn. ВАНАДИЙ-ЦИНК
Диаграмма состояния V-Zn, представленная на рис. 670, была
построена в работе [1]. Она характеризуется образованием двух
соединений VZn3 и V4Zn5, образующихся по перитектическим реакциям
соответственно при 629 и 670 °C. Со стороны Zn в системе имеет место
эвтектическое превращение при -417 °C с эвтектической точкой при
0,17 % (ат.) V.
Растворимость V в жидком Zn при отдельных температурах
составляет:
Температура, °C.......................
Растворимость V:
% (ат.)..........................
% (мае.)..........................
750,5 699,5 670 623 550,4 449,5
0,820 0,889 0,962 0,856 0,438 0,208
0,640 0,702 0,751 0,668 0,342 0,162
Соединение VZn3 имеет структуру типа AuCu3 (символ Пирсона сР4,
пр.гр. Рт Зт), параметр решетки а = 0,3848 нм [1] или а = 0,3849 нм [Ш].
Соединение V4Zn5 имеет структуру типа Te4Ti5 (символ Пирсона tl\ 8,
пр.гр. 1Мт), параметры решетки а = 1,0164 нм, с= 0,37720 нм [1]. В работе
[2] для монокристалла сплава с 50 % (ат.) Zn приводятся следующие
значения параметров решетки а = 0,891 нм, с = 0,322 для пр.гр. IMmmm.
Рис. 670. V-Zn
V-Zn, V-Zr
425
Литература
1. Chasanov M.G., Schablaske R., Hunt P.D. et al. Trans. AIME. 1963. V. 227. N 2.
P. 485-488.
2. Rosteutscher W., Schubert K. // Z. Metallkunde. 1964. Bd. 55. N 10. S. 617-618.
Л.Л. Рохлин
V-Zr. ВАНАДИЙ-ЦИРКОНИЙ
Диаграмма состояния V-Zr, приведенная на рис. 671, построена по
данным работ [1-4]. В системе обнаружено одно соединение ZrV2,
образующееся по перитектической реакции Ж + (V) «* ZrV2 при
температуре 1290± 10 °C [2]. Эвтектическая реакция Ж « ZrV2 + (0Zr)
протекает при температуре 1230 °C и концентрации 56,5 % (ат.) Zr [1].
Согласно данным работы [5], полученным при изучении направленно
кристаллизованных заэвтектических сплавов, концентрация Zr в
эвтектике составляет 59,8±0,4 % (ат.).
Растворимость V в (0Zr) при эвтектической температуре равна 16,5 %
(ат.) [1], а растворимость Zr в (V) при перитектической температуре -
5,2 % (ат.) [6].
Добавки V снижают температуру превращения (0Zr) « (aZr) до 777 °C,
при которой имеет место эвтектоидный распад (0Zr) * (aZr) + ZrV2.
Состав эвтектоида 8,6 % (ат.) V [1 ], или 5,2-6,9 % (ат.) V [Э], или 6,9-7,2 %
(ат.)У[7].
V 1г°/о(ат.) 1г
Рис. 671. V-Zr
426
V—Zr
Соединение ZrV2 имеет область гомогенности, протяженностью
1,5-2 % (ат.) [3] или 2-3 % (ат.) [8]. При высоких температурах не
обнаружен полиморфизм соединения ZrV2 [9], однако при температурах
- 173-(- 143) °C наблюдается ряд аномалий физических свойств [9, 10].
Нейтронографические исследования в работе [10] показали, что при
- 156,3 °C имеет место мартенситное превращение высокотемпературной
кубической фазы в низкотемпературную ромбоэдрическую фазу с
параметрами решетки а = 0,5300 нм, с - 1,2498 нм [11].
Соединение ZrV2 имеет Структуру типа MgCu2 (символ Пирсона сПА,
пр.гр. Fdlm), параметр решетки а = 0,744 нм [12] или а = 0,7392 нм [11].
Закалка сплавов из области (PZr) может привести либо к полному
превращению (pZr) в (aZr) для сплавов, содержащих до 12 % (ат.) V при
температуре закалки 800 °C, либо к образованию метастабильной фазы
ы для сплавов с 15,1-16,6 % (ат.) V [13]. При температуре закалки
900-1000 °C наблюдалось существование трех фаз р, со и ZrV2. Метаста-
бильную фазу со наблюдали также в работе [14] при 13 % (ат.) V и в работе
[15] при 7 % (ат.) V. Гексагональная фаза со имеет параметры решетки а =
= 0,502 нм, с = 0,300 нм [15].
Литература
1. Williams J.T.//J. Metals. 1955. V. 8. N 2/2. Р. 345-350.
2. Барон В.В., Ефимов Ю.Е., Савицкий Е.М. // Труды Ин-та металлургии АН СССР.
1961. Вып. 8. С. 278-285.
3. Раевская М.В., Соколовская Е.М., Соколова И.Г. и др. И Вестник Моск. Ун-та Сер.
Химия. 1967. № 2. С. 58-64.
4. Матвеева Н.М., Малахова Т.О. И Физико-химия, металловедение и металлофизика
сверхпроводников. Сб. статей. М.: Наука, 1969. С. 28-36
5. Свердлов В.Я., Сомов А.И., Тихоновский М.А. И Физика металлов и металловедение.
1980. Т. 50. №6. С. 1161-1167.
6. Третьяченко Л.А., Гусаренко Л.А., Еременко В.Н. // Металлофизика. 1973. Вып. 47.
С. 108-112.
7. Сирота Н.Н., Малишевский В.Ф. И Изв. АН БССР. Сер. физико-техническая. 1977.
№ I. С. 35-36.
8. Алексеевский Н.Е., Гусева Л.Н., Матвеева Н.М. // Доклады АН СССР. 1968. Т. 178.
№ 5. С. 1047-1050.
9. Пан В.М., Булах И.Е., Шевченко А.Д., Латышева В.И. И Физика металлов и
металловедение. 1978. Т. 46. № 4. С. 745-841.
10. Moncton D.E.// Solid State Commun. 1973. V. 13. N 11. P. 1779-1782.
11. Кожанов B.H., Романов Е.П., Верховский C.B., Степанов А.П. И Физика металлов
и металловедение. 1979. Т. 48. №6. С. 1249-1255.
12. Джиеибекова А.А., Сакавов И.Е., Асанов У.А., Будберг П.Б. И Физические свойства
диэлектрических полупроводниковых кристаллов. Сб. статей. Фрунзе: ИЛИМ, 1967.
С. 36-42.
13. Петрова Л. П. // Изв. АН СССР. Отделение технических наук. Металлургия и топливо.
1962. №6. С. 159-161.
14. Hatt В.A., Roberts J.A., Williams G.J. И Nature. 1967. Bd. 180. S. 1406.
15. Hatt B.A., Roberts J. A. //Acta Metal. 1960. V. 8. N 8. P. 575-584.
Л.А. Третьяченко
W-Y
427
W-Y. ВОЛЬФРАМ-ИТТРИЙ
Диаграмма состояния W-Y изучена в интервале концентрации 0-1 %
(ат.) W [Э, Ш]. W и Y образуют эвтектику, сильно сдвинутую к Y,
температура плавления которой практически совпадает с температурой
плавления Y. Эвтектическая точка отвечает 0,5 % (ат.) W [Э] или 0,1 %
Рис. 672. W - ¥
(ат.) W [1]. Растворимость W в жидком расплаве по данным работы [2]
приведена ниже:
Температура, °C.....................................
Растворимость W:
% (ат.).........................................
% (мае.)........................................
1848 1967 2054 2100
0,218 0,381 0,448 0,517
0,449 0,785 0,926 1,062
Максимальная растворимость Y в W составляет менее 1 % (ат.) [Э].
На основании термодинамических расчетов предполагается
возможность образования соединений Y3W, YW и YW3 [3]. В обзорной
работе [4] приводится обобщенный вариант диаграммы состояния с
эвтектической точкой при температуре -1522 °C и концентрации 0,0725 %
(ат.) W (рис. 672).
Литература
1. Гшиейднер К.А. Сплавы редкоземельных металлов / Пер. с англ.; Под ред.
Е.М. Савицкого. М.: Мир, 1965. 427 с.
2. Dennison D.H., Tschetter M.J., Gschneidner, Jr., К.А. // J. Less-Common Met, 1966. V. 11.
N 6. P. 423-435.
3. Miedema A.R. // J. Less-Common Met. 1976. V. 46. N l.P. 67-83.
4. Pandian S., Nagender N.S.V., Rama R.P. // J. Alloy Phase Diagrams. 1988. V. 4. N 2.
P. 73-116.
К.Б. Поварова
428
IV-Yb, IV-Zn, IV-Zr
W-Yb. ВОЛЬФРАМ-ИТТЕРБИЙ
Диаграмма состояния W-Yb не построена. Растворимость W чистотой
99,9 % (по массе) в (Yb) чистотой 99,86 % (по массе) в интервале
температур 816-1685 °C составляет < 0,00019 % (ат.) W; при температуре
1708 °C -0,0007 % (ат.) W [1].
Литература
1. Dennison D.H., Tschetter M.J., Gschneidner, Jr., K.A. // J. Less-Common Met. 1966. V. 11.
N 6. P. 423-435.
К.Б. Поварова
W-Zn, ВОЛЬФРАМ-ЦИНК
Взаимодействие W c Zn исследовалось рядом авторов, результаты
которых обобщены в работе [1]. W не растворяется в расплавленном Zn,
не смачивается им. Обнаруженная в работе [2] богатая Zn промежуточная
фаза, по-видимому, является соединением Zn с какой-либо примесью,
наиболее вероятно Fe [1].
Литература
l.Nagender N.S.V., Rama R.P. // J. Alloy Phase Diagrams. 1986. V. 2. N 1. P. 66-67.
2. Heumann T. // Z. Metallkunde. 1948. Bd. 39. S. 51-52.
КБ. Поварова
W-Zr. ВОЛЬФРАМ-ЦИРКОНИЙ
Результаты взаимодействия W с Zr обобщены в работе [1].
Диаграмма состояния W-Zr (рис. 673) построена авторами аналити-
ческого обзора [1]. В системе образуется одна промежуточная фаза W2Zr
и твердые растворы на основе W и Zr. W2Zr образуется по перитектичес-
кой реакции из расплава при 2160 °C [1], 2260 °C [3]. Эвтектическое
равновесие со стороны Zr наблюдается при 10 % (ат.) W и температуре
1739 °C [1] (1660 °C [3]), 1735-1739 °C [4], 1795 °C [2].
Растворимость Zr в (W) при эвтектической температуре составляет
около 3,5 % (ат.) [2] и снижается с понижением температуры до 1,4 и 0,9 %
(ат.) при 2000 и 1500 °C [5]. Растворимость W в (PZr) составляет около
4 % (ат.) при эвтектической температуре и -0,25 % (ат.) при эвтектоидной
температуре [2]. Растворимость W в (aZr) ничтожно мала.
W-Zr. Y-Zn
429
Рис. 673. W-Zr
Соединение W2Zr имеет структуру типа MgCu2 (символ Пирсона с7<24,
пр.гр. Fd3m), параметр решетки а = 0,7612 нм для двухфазного сплава,
богатого W, и а - 0,7616 нм для двухфазного сплава, богатого Zr [2].
Литература
1. Nagender N.S.V., Rama R.P.//J. Alloy Phase Diagrams. 1987. V. 3. N 1. P. 47-56.
2. Chang Y.A.//J. Less-Common Met. 1969. V. 17. P. 325-328.
3. Савицкий E.M., Захаров A.M. // Журнал неорганической химии. (962. Т. 7.
С. 2575-2580.
4. Ackermann R.J., Rauh E.G. И High Temp. Sci. 1972. V. 4. N 4. P. 272-282.
5. Савицкий E.M., Поварова К.Б., Макаров П.В. Металловедение вольфрама. М.:
Металлургия, 1978. 223 с.
К.Б. Поварова
Y-Zn. ИТТРИЙ-ЦИНК
Диаграмма состояния Y-Zn (рис. 674) построена методами дифферен-
циального термического, микроскопического и рентгеновского анализов
[1]. В качестве исходных компонентов использованы Zn чистотой 99,99 %
(по массе) и Y чистотой 99,6 % (по массе). Система Y-Zn характеризуется
образованием восьми промежуточных фаз, из которых соединения YZn,
YZn2 и YZn 17 (или YZn8 5) плавятся конгруэнтно при температурах 1105,
430
Y-Zn
Y Znf0/ofam.) Zn
Рис. 674. Y - Zn
1080 и 890 °C соответственно. Соединения YZn3, Y6Zn23 (или YZn3 67),
Y13Zn58 (или YZn4 46), YZn6, YZn12 образуются по перитектическим
реакциям:
Ж + pYZn2 YZn3 при 905 °C;
Ж + YZn3 « Y6Zn23 при 895 °C;
Ж + Y6Zn23 « Y13Zn58 при 880 °C;
Ж + Yi3Zn58 « YZn6 при 870 °C;
Ж + YZn17 « YZn12 при 685 °C.
Соединение YZn2 претерпевает полиморфное превращение при
температуре 750 °C, а соединение YZn3 при~630 °C [1]. В системе
протекают эвтектические равновесия:
Ж » (aY) + YZn при 875 °C и 30 % (ат.) Zn;
Ж « YZn + pYZn2 при 1015 °C и 58 % (ат.) Zn;
Ж « YZn6 + YZn8 5 при 860 °C и 86 % (ат.) Zn;
Ж « YZn12 + (Zn) ’при -419 “С и -100 % (ат.) Zn.
Кристаллографические характеристики всех известных соединений
системы Y-Zn приведены в табл. 513.
Y-Zn, Y-Zr
431
Таблица 513. Кристаллическая структура соединений системы Y-Zn
Соединение Прототип Символ Пирсона, пр.гр. Параметры решетки, нм Источник
a b c
YZn CsCl cP2, РтЗт 0,3578 - - [2]
YZn2 KHg2 Imma 0,4504 0,7143 0,7664 [V-C]
YZn3 YZn3 oP16, Рпта 0,6690 0,4405 1,0111 [2]
Y3Znn La3AI]| о/28, Immm 0,4388 0,8871 1,2929 [V-C]
Y6Zn23 Th6Mna <?F1J6, Fm3ni 1,269 - - [2]
^1з2п58 Gd|3Zn58 API 42, P63m<? 1,4283 - 1,4080 [2]
YZn5 CaCu5 AP6, Pblmnun 0,5183 - 0,4382 [V-C]
YZn6-YZn5 EuMg5 J Pbylmmc 0,8885 - 0,9207 [2]
Y2Zn17 Th2Ni)7 hP3i, P6j/mmc 0,8991 - 0,8764 [V-C]
YZn12 ThMn12 Z/26, 14/mmm 0,8879 - 0,5201 [2]
Литература
1. Mason J.T., Chiotti Р., Gill K.J. // Met. Trans. A. 1976. V. 7. N 2. P. 287-291.
2. Гладышевский Е.И., Бодак О.И. И Кристаллохимия интерметаллических соединений
редкоземельных металлов. Львов: Вища школа. 1982. 255 с.
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
Y-Zr. ИТТРИЙ-ЦИРКОНИЙ
Согласно данным, обобщенным в работе [1], в системе Y-Zr
соединения не образуются, диаграмма состояния является системой
эвтектического типа (рис. 675). Zr понижает температуру а « 0-пре-
432
Y-Zr
Рис. 675. Y - Zr
вращения Y до температуры 1063 ° С эвтектоидной реакции (0Y) » (aY)
+ (0Zr). Иттрий повышает температуру а ₽ ^-превращения Zr до
температуры перитектоидной реакции 886 °C ((3Zr) + (aY) * (aZr) [2].
Растворимость Y в (Zr) составляет -0,5 % (ат.) [2].
При закалке из жидкого состояния (скорость охлаждения около
10' ° С/с) в системе Y-Zr образуются метастабильные твердые растворы
(а') с ГПУ кристаллической структурой [3, 4]. В области концентраций
40—70 % (ат.) Zr фаза а' сосуществует с метастабильной ОЦК фазой 0.
При меньших скоростях охлаждения на основе обоих компонентов
образуются два типа твердых растворов с ГПУ структурой - а' и а с
меньшей концентрацией легирующего элемента. Со стороны Y фаза a
ограничивается 10 % (ат.) Zr, фаза а' простирается почти до 50 % (ат.)
Zr [3, 4].
Литература
1. Palenzona A., Cirafici S. //J. Phase Equilibria. 1991. V. 12. N 4. Р. 485-489.
2. laniello L., Burr A. // J. Appl. Phys. 1962. V. 33. N 9. P. 2689-2690.
3. Wang R.//Met. Trans. 1972. V. 3. N 5. P. 1213-1221.
4. Wang R., Kim I.B. // Met. Trans. 1974. V. 5. N 9. P. 1973-1977.
Л.А. Третьяченко
Yb—Zn
433
Yb-Zn. ИТТЕРБИЙ-ЦИНК
Диаграмма состояния Yb-Zn (рис. 676) построена на основании
дифференциального термического, микро- и рентгеноструктурного
анализов [1]. В качестве исходных материалов применяли Yb чистотой
99,94 % (по массе), Zn чистотой 99,99 % (по массе).
В сплавах системы образуется шесть соединений, из которых пять:
YbZn, YbZn2, Yb13Zn58, Yb2Zn12, YbZn,, плавятся с открытым
максимумом при температурах 650,751,752,754,755 °C соответственно.
Соединение Yb3Zn,| образуется по перитектической реакции Ж +
+ Yb13Zn58 - Yb32nH при температуре 695 °C. Соединение YbZn2
претерпевает полиморфное превращение в интервале температур
400-630 °C в зависимости от состава. В сплавах системы кристаллизуют-
ся эвтектики:
(aYb) + YbZn при 491 °C и 26,5 % (ат.) Zn;
YbZn + YbZn, при 645 °C и 55,5 % (ат.) Zn;
YbZn2 + Yb3Znj । при 687 °C и 75,6 % (ат.) Zn;
Zn, "/о (по массе)
Рис. 676. Yb - Zn
434
Yb-Zn
УЬ|т7п58 + YbjZnp при 742 °C и 87,3 % (ат.) Zn;
Yb7Zn17 + YbZn[. при 750 °C и 89,9 % (ат.) Zn;
YbZn,, + (Zn) при -491 °C и - 100 % (ат.) Zn.
В работе [2] приведены структурные характеристики соединения
YbZn13, которое не отображено на диаграмме. Данные структурных
исследований указывают также на полиморфизм соединения Yb2Zn17 [2].
Кристаллографические характеристики всех известных соединений
системы Yb-Zn приведены в табл. 514.
Таблица 514. Кристаллическая структура соединений системы Yb-Zn
Соединение Прототип Символ Пирсона, пр.гр. Параметры решетки, нм Источник
i a b c
YbZn CsCl cP2, Pm 3 m 0,3629 - - [1]
YbZn2 KHg2 Imma 0,4570 0,4573 0,7290 0,7325 0,7562 0,7569 [1] [2]
Yb3Znn La jA 111 o/28, Immm 0,4421 0,8891 1,3127 [1]
Yb13Zn58 (Yb2Zn7) Gd|3Zn58 hP\42, Pbyhnc 1,432 - 1,415 [V-C]
Yb3Zn17 Ru3Be17 Im3 1,4291 - - [2]
Yb2Zn । Th2Ni)7 hP38, Рб^/ттс 0,9022 - 0,8798 [V-C]
Yb2Zn17 Th2Zn!7 hRV), R3m 0,9040 - 1,3216 [1]
YbZn u BaCd| । /748, I4\lamd 1,0637 - 0,6822 [1]
YbZn13 NaZn!3 cF\ 1_2, Fm 3 c 1,2172 - - [2]
Литература
1. Mason J.T., Chiotti Р.//Trans. AIME. 1968. V. 242. N 6. P. 1167-1171.
2. Гладышевский Е.И., Бодак О.И. И Кристаллохимия интерметаллических соединений
редкоземельных металлов. Львов: Вища школа, 1982. 255 с.
Е.И. Гладышевский О.И. Бодак. В.К. Печарский
Yb-Zr, Zn-Zr
435
Yb-Zr. ИТТЕРБИЙ-ЦИРКОНИЙ
Диаграмма состояния (рис. 677) схематически приведена в справочни
ке [1]. Результаты расчета термодинамических данных для системы Yb-Zr
указывают на отсутствие интерметаллических соединений и существова-
ние. 677. Vb - Zr
ние обширной области несмешиваемости в жидком состоянии [2].
Литература
1. Moffatt W.G. Handbook of Binary Phase Diagrams. New York: Business Growth Services.
Generul Electric Co. Schenectady, 1978. V. 4. 278 p.
2. De Boer F.R., Dijkman W.H., Matteus W.C.M., Miedema A.R. // J. Less-Common Met.
1979. V. 64. N 2. P. 241-253.
Л.А. Третьяченко
Zn-Zr. ЦИНК-ЦИРКОНИЙ
Диаграмма состояния Zn-Zr, представленная на рис. 678, построена
на данных, сообщенных в справочнике [Э]. Она показывает фазовые
равновесия в системе при давлении 0,1 МПа (рис. 678, а) и при более
высоком давлении, но не превышающем 1 МПа (рис. 678, б).
436
Zn-Zr
Zr, 7> (no массе}
„ 010 20 JO 90 50 60 70 60 90 100
t,c
1900
1200
1000
BOO
600
917 tf
900
ZOO
S)
a)
Рис. 678. Zn - Zr
В системе образуются следующие соединения: ZrZn22, ZrZn14, ZrZn6,
ZrZn3, ZrZn5, ZrZn2, ZrZn, Zi\Zn2 и Zr^Zn.
Первые два соединения ZrZn22 и ZrZn14 имеют идентичную кристал-
лическую структуру [Э] (табл. 515). Возможно, что одно из этих
соединений метастабильно, или оба лежат в области гомогенности одной
фазы, или стехиометрия ZrZn^ установлена недостаточно корректно.
Соединение Zr3Zn2 сначала было получено из магниевого флюса [1],
а затем его существование было подтверждено в работе [2] в процессе
изучения синтезированных сплавов Zn-Zr методом рентгеновского
анализа. Существование соединений ZrZn5 и Zr2Zn было установлено
в работе [2]. Соединение ZrZn5 может быть стабилизировано примесями.
Соединение Zr2Zn было получено в сплаве с 67 % (ат.) Zr и 33 % (ат.) Zn
после отжига при 600 °C в течение 20 ч. Это соединение существовало
в равновесии с ZrZn и (aZr). При температуре выше 800 °C соединение
Zr2Zn существовало в равновесии с (PZr) и ZrZn. Поэтому перитектоид-
7.П-7.Г
437
Таблица 515. Кристаллическая структура соединений системы Zr-Zn
t Соединение Прототип Символ Пирсона, пр.гр. Параметры решетки, нм Источник
а b с
1 ZrZn2'2 - Fd3m 1,4101(1) - - [4]
ZrZrC - Fd3m 1,411 1,4103(1) - - [Э] [4]
1 ZrZn6” ZrZn3(HT)*** - 1,28 0,816 1,25 0,868 1,623 [Э] [Э]
1 ZrZn2 MgCu2 cF2A, Fd3m 0,7394 - - [5]
ZrZn CsCl cP2, РтЗт 0,3336 - - [Э]
4 Zr3Zn2’” P^2nm или />4и2 или РЦтпт 0,7633 0,6965 [1]
4 Zr2Zn*** Кубическая Ромбическ Тетрагон^ сингония. ая сингония шьная сингс )НИЯ. 0,330 0,3303 - 1,126 1,126 [2] [Ш]
ное образование Zr2Zn при температуре ниже 750 °C на рис. 678а,б
показано штриховой линией. Плавление соединений, содержащих более
50 % (ат.) Zn можно было наблюдать только при давлениях более 0,1
МПа. Соединение ZrZn2 плавится конгруэнтно при температуре 1180 °C.
Соединение ZrZn3 образуется ио перитектической реакции и претерпева-
ет полиморфное превращение при температуре 910 °C. В системе
кристаллизуются две эвтектики:
(Zn) + ZrZn22(ZrZn14) при 417± 1 °C и 0,2±0,04 % (ат.) Zr;
(PZr) + ZrZn при 1015 ° С и 61,5 % (ат.) Zr.
Растворимость Zn в (pZr) при 1015 °C составляет 27,1 % (ат.).
438
Zn-Zr
Добавки Zn понижают температуру превращения (PZr) « (aZr) до
750 °C, при которой происходит эвтектоидное превращение (PZr) при
концентрации 80,2 % (ат.) Zr. Растворимость Zn в (aZr) незначительна
[Э].
В работе [3] были исследованы сплавы Zn-Zr, полученные закалкой
из газовой фазы. В области 20-70 % (ат.) Zr были получены аморфные
сплавы. В области < 20 и > 75 % (ат.) Zr, закаленные сплавы имели ГПУ
структуру с параметрами решетки, увеличивающимися с возрастанием
концентрации Zr (параметр с изменяется линейно, параметр а не
подчиняется закону Вегарда). Температура кристаллизации аморфных
сплавов увеличивается от 247 до 557 °C с возрастанием концентрации
Zr.
Кристаллическая структура соединений приведена в табл. 515.
Литература
1. Petersen D.R., Rinn H.W. // Acta Crystallogr. 19б!1. V. 14. N 3. P. 328-329.
2. Rossteutscher W., Schubert K. // Z. Metallkunde. 1^65. Bd. 56. N 10. S. 730-734.
3. Yasuda H., Sumiyama K., Nakamura Y. // Trans?Jap. Inst. Met. 1987. V. 28. N 9.
P. 692-698.
4. Samson S.//Acta Crystallogr. 1961. V. 14. N 12. P. 1229-1236.
Л.А. Третьяченко
ОГЛАВЛЕНИЕ
Pm-Pr. Прометий-празеодим ............................. 5
Pm-Sc. Прометий-скандий ................................6
Pm-Sm. Прометий-самарий ................................7
Pm-Tb. Прометий-тербий..................................8
Pm-Tm. Прометий-тулий ..................................9
Pm-Y. Прометий-иттрий................................. 10
Po-Pt. Полоний-платина.................................. 11
Po-Sb. Полоний-сурьма .............................. 12
Po-Sc. Полоний-скандий................................ 12
Po-Sm. Полоний-самарий................................ 12
Po-Sn. Полоний-олово ................................. 12
Po-Sr. Полоний-стронций............................. 13
Ро-Ta. Полоний-тантал ................................ 13
Po-Tb. Полоний-тербий .............................. 13
Ро~Те. Полоний-теллур................................. 13
Ро-Tm. Полоний-тулий.................................. 14
Po-W. Полоний-вольфрам ............................... 14
Ро-Y. Полоний-иттрий................................. 14
Po-Yb. Полоний-иттербий .............................. 15
Po-Zn. Полоний-цинк .................................. 15
Pr-Pt. Празеодим-платина ........................... 15
Pr-Pu. Празеодим-плутоний............................. 16
Pr-Re. Празеодим-рений................................ 18
Pr-Rh. Празеодим-родий ............................... 19
Pr-Ru. Празеодим-рутений.............................. 19
Pr-S. Празеодим-сера ................................. 20
Pr-Sb. Празеодим-сурьма............................... 21
Pr-Sc. Празеодим-скандий ............................. 23
Pr-Se. Празеодим-селен................................ 25
Pr—Si. Празеодим-кремний ............................ 27
Pr-Sm. Празеодим-самарий ............................ 29
Pr-Sn. Празеодим-олово................................ 30
Pr-Та. Празеодим-тантал ............................. 32
Рг-Tb. Празеодим-тербий.............................. 33
Pr-Тс. Празеодим-технеций ............................ 33
Pr-Те. Празеодим-теллур ............................. 33
Pr-Th. Празеодим-торий . ?.......................... 35
Pr-Ti. Празеодим-титан .............................. 37
440
Оглавление
Pr-Tl. Празеодим-таллий ............................. 37
Pr-Tm. Празеодим-тулий .............................. 39
Pr-U. Празеодим-уран..................................40
Pr-V. Празеодим-ванадий...............................41
Pr-W. Празеодим-вольфрам..............................42
Pr-Y. Празеодим-иттрий............................. 42
Pr-Zn. Празеодим-цинк.................................43
Pt-Pu. Платина-плутоний.............................. 46
Pt-Re. Платина-рений..................................47
Pt-Rh. Платина-родий..................................48
Pt-Ru. Платина-рутений................................49
Pt-S. Платина-сера.................../............... 50
Pt-Sb. Платина-сурьма .............................. 51
Pt-Sc. Платина-скандий ............................. 52
Pt-Se. Платина-селен................................ 53
Pt-Si. Платина-кремний ............................ 54
Pt-Sm. Платина-самарий .............................. 56
Pt-Sn. Платина-олово ............................... 57
Pt-Sr. Платина-стронций ............................. 58
Pt-Та. Платина-тантал ............................... 59
Pt-Tb. Платина-тербий ................................61
Pt-Tc. Платина-технеций ..............................62
Pt-Te. Платина-теллур ................................63
Pt-Th. Платина-торий..................................64
Pt-Ti. Платина-титан..................................66
Pt-Т1. Платина-таллий ............................... 68
Pt-Tm. Платина-тулий .................................69
Pt-U. Платина-уран....................................71
Pt-V. Платина-ванадий................................ 72
Pt-W. Платина-вольфрам................................74
Pt-Y. Платина-иттрий................................. 76
Pt-Yb. Платина-иттербий.............................. 78
Pt-Zn. Платина-цинк.................................. 80
Pt-Zr. Платина-цирконий.............................. 81
Pu-Re. Плутоний-рений ............................... 84
Pu-Rh. Плутоний-родий................................ 84
Pu-Ru. Плутоний-рутений ............................. 85
Pu-S. Плутоний-сера ................................. 87
Pu-Sc. Плутоний-скандий.............................. 87
Pu-Se. Плутоний-селен ............................... 89
Pu-Si. Плутоний-кремний.............................. 90
Pu-Sm. Плутоний-самарий.............................. 92
441
Оглавление
Pu-Sn. Плутоний-олово 93
Pu-Sr. Плутоний-стронц^............................. 94
Pu-Ta. Плутоний-тантал 11.......................... 95
Pu-Tb. Плутоний-тербий ............................. 95
Pu-Te. Плутоний-теллур .............................. 96
Pu-Th. Плутоний-торий ................................ 96
Pu-Ti. Плутоний-титан . ............................ 97
Pu-Tl. Плутоний-таллий .............................. 99
Pu-Tm. Плутоний-тулий ............................... 99
Pu-U. Плутоний-уран ............................... 100
Pu-V. Плутоний-ванадий............................. 101
Pu-W. Плутоний-вольфрам............................ 102
Pu-Y, Плутоний-иттрий ............................. 104
Pu-Yb. Плутоний-иттер§Ий............................. 105
Pu-Zn. Плутоний-цинк . 105
Pu-Zr. Плутоний-циркон .............................. 107
Rb-S. Рубидий-сера ................................... 110
Rb-Sb. Рубидий-сурьма .............................. 110
Rb-Se. Рубидий-селен ................................ Ill
Rb-Si. Рубидий-кремний............................... 112
Rb-Sn. Рубидий-олово................................. 113
Rb-Sr. Рубидий-стронций.............................. 114
Rb-Te. Рубидий-теллур................................ 115
Rb-Ti. Рубидий-титан................................. 115
Rb-Tl. Рубидйй^таллий................................ 116
Rb-Zn. Рубидий-цинк ................................ 117
Rb-Zr. Рубидий-цирконий .............................. in
Re-Rh. Рений-родий . ................................. 118
Re-Ru. Рений-рутений .........•....................... 119
Re-S. Рений-сера..............•...................... 120
Re-Sc. Рений-скандий .........•...................... 120
Re-Se. Рений-селен ... .......•...................... 122
Re-Si. Рений-кремний •...................... 123
Re-Sm. Рений-самарий .........••..................... 124
Re-Sn. Рений-олово . . ............................. 125
Re-Ta. Рений-тантал . ........••..................... 126
Re-Tb. Рений-тербий . .............................. 129
Re-Tc. Рений-технеций.............................. 130
Re-Te. Рений-теллур . 131
Re-Th. Рений-торий . . 133
Re-Ti. Рений-титан . . ....... ....................... 134
Re-Tm. Рений-тулий . .................. 136
442
Оглавление
Re-U. Рений-уран.......................................
Re-V. Рений-ванадий....................................
Re-W. Рений-вольфрам...................................
Re-Y. Рений-иттрий.....................................
Re-Yb. Рений-иттербий..................................
Re-Zn. Рений-цинк......................................
Re-Zr. Рений-цирконий . . .............................
Rh-Ru. Родий-рутений ..................................
Rh-S. Родий-сера ......................................
Rh-Sb. Родий-сурьма....................................
Rh-Sc. Родий-скандий...................................
Rh-Se. Родий-селен ....................................
Rh-Si. Родий-кремний................... ...............
Rh-Sm. Родий-самарий...................................
Rh-Sn. Родий-олово.....................................
Rh-Sr. Родий-стронций..................................
Rh-Ta. Родий-тантал....................................
Rh-Tb. Родий-тербий ...................................
Rh-Tc. Родий-технеций..................................
Rh-Te. Родий-теллур....................................
Rh-Th. Родий-торий ....................................
Rh-Ti. Родий-титан ....................................
Rh-Tm. Родий-тулий.....................................
Rh-U. Родий-уран ......................................
Rh-V. Родий-ванадий ...................................
Rh-W. Родий-вольфрам ..................................
Rh-Y. Родий-иттрий ....................................
Rh-Yb. Родий-иттербий .................................
Rh-Zn.Родий-цинк ......................................
Rh-Zr. Родий-цирконий .................................
Ru-S. Рутений-сера ....................................
Ru-Sb. Рутений-сурьма..................................
Ru-Sc. Рутений-скандий ................................
Ru-Se. Рутений-селен...................................
Ru-Si. Рутений-кремний ................................
Ru-Sm. Рутений-самарий ................................
Ru-Sn. Рутений-олово...................................
Ru-Ta. Рутений-тантал..................................
Ru-Tb. Рутений-тербий..................................
Ru-Tc. Рутений-технеций ...............................
Ru-Te. Рутений-теллур .................................
Ru~Th. Рутений-торий...................................
136
139
141
144
145
146
146
150
150
151
153
154
156
158
159
160
161
162
163
164
167
169
171
171
173
174
176
177
178
179
182
183
183
185
185
187
188
188
191
191
192
192
Оглавление
443
Ru-Ti. Рутений-титан ................................. 194
Ru-Tm. Рутений-тулий ................................. 195
Ru-U. Рутений-уран ................................... 196
Ru-V. Рутений-ванадий................................. 198
I Ru-W. Рутений-вольфрам................................. 200
I Ru-Y. Рутений-иттрий .................................. 201
Ru-Yb. Рутений-иттербий............................... 202
Ru-Zn. Рутений-цинк................................... 203
Ru-Zr. Рутений-цирконий............................... 203
S-Sb. Сера-сурьма .................................... 205
S-Sc. Сера-скандий.................................... 206
S-Se. Сера-селен ..................................... 207
S-Si. Сера-кремний ................................... 208
S-Sm. Сера-самарий.................................... 208
S-Sn. Сера-олово ..................................... 209
S-Sr. Сера-стронций .................................. 210
S-Та. Сера-тантал .................................... 211
S-Tb. Сера-тербий .................................... 212
S-Тс. Сера-технеций................................... 212
S-Те. Сера-теллур..................................... 212
S-Th. Сера-торий...................................... 213
S-Ti. Сера-титан...................................... 214
S-T1. Сера-таллий..................................... 216
I S-Tm. Сера-тулий....................................... 218
I S-U. Сера-уран......................................... 219
i S-V. Сера-ванадий...................................... 220
i’ S-W. Сера-вольфрам .................................... 222
S-Y. Сера-иттрий...................................... 224
S-Yb. Сера-иттербий................................... 225
S-Zn. Сера-цинк....................................... 226
S-Zr. Сера-цирконий................................... 227
Sb-Sc. Сурьма-скандий ................................ 229
Sb-Se. Сурьма-селен................................... 229
Sb—Si. Сурьма-кремний................................. 230
Sb-Sm. Сурьма-самарий ................................ 231
Sb-Sn. Сурьма-олово................................... 233
Sb-Sr. Сурьма-стронций ............................... 235
Sb-Та. Сурьма-тантал.................................. 236
I Sb-Tb. Сурьма-тербий................................... 237
Sb-Те. Сурьма-теллур ................................. 238
i Sb-Th. Сурьма-торий.................................... 240
Sb-Ti. Сурьма-титан .................................. 240
444
Оглавление
Sb-Tl. Сурьма-таллий .................................
Sb-Tm. Сурьма-тулий ..................................
Sb-U. Сурьма-уран ....................................
Sb-V. Сурьма-ванадий..................................
Sb-W. Сурьма-вольфрам.................................
Sb-Y. Сурьма-иттрий ..................................
Sb - Yb. Сурьма - иттербий............................
Sb - Zu. Сурьма - цинк................................
Sb - Zr. Сурьма - цирконий.............../............
Sc - Se. Скандий - селен..............................
Sc-Si. Скандий - кремний ..............(..............
Sc - Sm. Скандий - самарий ...........\...............
Sc - Sn. Скандий -олово................\ ............
Sc - Та. Скандий - тантал ............................
Sc - ТЬ. Скандий - тербий.............................
Sc - Тс. Скандий - технеций ..........................
Sc - Те. Скандий - теллур ............................
Sc-Th. Скандий - торий................................
Sc - Ti. Скандий - титан..............................
Sc-Тт. Скандий-тулий .................................
Sc - U. Скандий - уран................................
Sc - V. Скандий - ванадий.............................
Sc - W. Скандий - вольфрам............................
Sc - Y. Скандий - иттрий..............................
Sc - Zn. Скандий - цинк...............................
Sc - Zr. Скандий - цирконий...........................
Se - Si. Селен - кремний..............................
Se - Sm. Селен - самарий..............................
Se - Sn. Селен - олово................................
242
244
245
247
248
248
250
252
254
257
257
259
260
261
261
262
263
263
265
266
267
267
268
269
270
271
272
272
273
Se - Sr. Селен - стронций............................. 275
Se - Та. Селен - тантал............................... 276
Se-Tb. Селен-тербий .................................. 277
Se-Te. Селен-теллур................................... 277
Se - Th. Селен - торий ............................... 278
Se - Ti. Селен - титан................................ 280
Se - Т1. Селен - таллий............................... 281
Se-Tm. Селен - тулий.................................. 282
Se-U. Селен - уран ................................... 282
Se - V. Селен - ванадий .............................. 283
Se - W. Селен - вольфрам ............................. 285
Se - Y. Селен - иттрий ............................... 286
Se - Yb. Селен - иттербий ............................ 286
Оглавление
445
Se-Zn. Селен - цинк ................................. 287
Se - Zr. Селен - цирконий ........................... 288
Si - Sm. Кремний - самарий .......................... 289
Si - Sn. Кремний - олово ............................ 290
Si - Sr. Кремний - стронций ......................... 291
Si - Та. Кремний - тантал ........................... 292
Si - ТЬ. Кремний - тербий ........................... 294
Si - Тс. Кремний - технеций ......................... 295
Si - Те. Кремний - теллур ........................... 296
Si - Th. Кремний - торий............................. 296
Si - Ti. Кремний - титан............................. 298
Si - Т1. Кремний - таллий............................ 300
Si - Тт. Кремний - тулий ............................ 301
Si - W. Кремний - вольфрам........................... 301
Si - Y. Кремний - иттрий............................. 302
Si - Yb. Кремний - иттербий.......................... 305
Si - Zn. Кремний - цинк.............................. 305
Si - Zr. Кремний - цирконий.......................... 306
Sm - Sn. Самарий- олово............................. 309
Sm - Та. Самарий - тантал ........................... 310
Sm-ТЬ. Самарий - тербий.............................. 312
Sm - Те. Самарий - теллур ........................... 313
Sm-Th. Самарий-торий................................. 315
Sm - Ti. Самарий - титан............................. 316
Sm - Т1. Самарий - таллий ........................... 316
Sm - Тт. Самарий - тулий ............................ 317
Sm - U. Самарий - уран .............................. 318
Sm - V. Самарий - ванадий............................ 319
Sm - W. Самарий - вольфрам........................... 320
Sm - Y. Самарий - иттрий............................. 320
Sm - Zn. Самарий - цинк.............................. 321
Sm - Zr. Самарий - цирконий.......................... 324
Sn - Sr. Олово - стронций ........................... 325
Sn-Та. Олово-тантал.................................. 327
Sn - Те. Олово - теллур ............................. 327
Sn - Th. Олово - торий............................... 329
Sn - Ti. Олово - титан .............................. 330
Sn - TI. Олово - таллий ............................. 332
Sn - U. Олово - уран................................. 333
Sn - V. Олово - ванадий.............................. 335
Sn - W. Олово - вольфрам............................. 337
Sn - Y. Олово - иттрий............................. 337
446
Оглавление
Sn - Yb. Олово - иттербий............................ 339
Sn - Zn. Олово - цинк................................ 340
Sn - Zr. Олово - цирконий............................ 341
Sr - Те. Стронций - теллур .......................... 343
Sr - Ti. Стронций - титан ........................... 344
Sr-Т1. Стронций-таллий ............................ 345
Sr - U. Стронций - уран............................. 347
Sr - V. Стронций - ванадий.......................... 347
Sr - Y. Стронций - иттрий.......................... 347
Sr - Yb. Стронций - иттербий......................... 348
Sr - Zn. Стронций - цинк........................... 349
Та-Т. Тантал-тритий.................................. 350
Та-ТЬ. Тантал-тербий................................. 351
Та-Тс. Тантал-технеций .............................. 352
Та - Те. Тантал - теллур ............................ 352
Та-Th. Тантал - торий................................ 353
Та - Ti. Тантал - титан.............................. 354
Та - Т1. Тантал - таллий ............................ 355
Та - Tm. Тантал - тулий ............................. 356
Та - U. Тантал - уран................................ 357
Та - V. Тантал - ванадий............................. 358
Та - W. Тантал - вольфрам............................ 359
Та - Y. Тантал - иттрий.............................. 360
Та-Yb. Тантал-иттербий............................... 361
Та-Zn. Тантал - цинк............................... 361
Та-Zr. Тантал - цирконий............................. 362
ТЬ - Тс. Тербий - технеций .......................... 363
ТЬ - Те. Тербий - теллур ............................ 363
Tb - Th. Тербий - торий ............................. 364
Tb - Т1. Тербий - таллий ............................ 365
Tb - Tm. Тербий - тулий ............................. 367
Tb - U. Тербий - уран ............................... 368
Tb - W. Тербий - вольфрам............................ 368
Tb - Y. Тербий - иттрий ............................. 368
Tb - Zn. Тербий - цинк............................... 369
Tb - Zr. Тербий - цирконий........................... 370
Тс-Ti. Технеций - титан.............................. 371
Тс-Tm. Технеций - тулий.............................. 372
Тс - W. Технеций - вольфрам ......................... 373
Тс-Y. Технеций - иттрий.............................. 373
Тс - Zn. Технеций - цинк............................. 373
Тс - Zr. Технеций - цирконий......................... 374
Оглавление
447
Те - Th. Теллур - торий.............................. 375
Те-Ti. Теллур - титан................................ 376
Те-Т1. Теллур-таллий................................. 377
Те-Tm. Теллур-тулий.................................. 378
Те-U. Теллур - уран.................................. 379
Те-W. Теллур - вольфрам ............................. 381
Те-Y. Теллур - иттрий................................ 382
Те - Yb. Теллур - иттербий........................... 383
Те-Zn. Теллур-цинк................................... 385
Те - Zr. Теллур - цирконий........................... 386
Th - Ti. Торий - титан .............................. 387
Th-Т1. Торий - таллий ............................... 387
Th - U. Торий - уран ................................ 389
Th - V. Торий - ванадий ............................. 390
Th - W. Торий - вольфрам ............................ 391
Th - Y. Торий - иттрий .............................. 392
Th - Yb. Торий - иттербий ........................... 393
Th-Zn. Торий - цинк ................................. 393
Th - Zr. Торий - цирконий ........................... 395
Ti - U. Титан - уран ................................ 396
Ti - V. Титан - ванадий ............................. 397
Ti - W. Титан - вольфрам ............................ 399
Ti - Y. Титан - иттрий .............................. 400
Ti - Zn. Титан - цинк ............................... 401
Ti - Zr. Титан - цирконий ............................402
TI - Tm. Таллий - тулий...............................404
TI - U. Таллий - уран.................................404
TI - Y. Таллий - иттрий.............................. 405
TI - Yb. Таллий - иттербий...........................407
TI - Zn. Таллий - цинк.............................. 408
Т1 - Zr. Таллий - цирконий...........................409
Tm ~ U. Тулий - уран................................ 410
Tm - V. Тулий - ванадий ............................ 410
Tm - W. Тулий - вольфрам ......................... 410
Tm - Y. Тулий - иттрий.............................. 411
Tm-Zn. Тулий - цинк............................... 412
Tm -Zr. Тулий - цирконий............................ 413
U - V. Уран - ванадий ...............................413
U - W. Уран - вольфрам ............................. 414
U - Y. Уран - иттрий ................................416
U - Yb. Уран - иттербий ............................ 416
U - Zn. Уран - цинк ................................ 417
448
Оглавление
U - Zr. Уран - цирконий ............................ 418
V - W. Ванадий - вольфрам........................... 421
V - Y. Ванадий - иттрий ............................ 422
V - Yb. Ванадий - иттербий ........................ 423
V - Zn. Ванадий - цинк ............................. 424
V - Zr. Ванадий - цирконий ......................... 425
W - Y. Вольфрам - иттрий ........................... 427
W - Yb. Вольфрам - иттербий ........................ 428
W - Zn. Вольфрам - цинк ............................ 428
W - Zr. Вольфрам - цирконий ........................ 428
Y - Zn. Иттрий - цинк .............................. 429
Y - Zr. Иттрий - цирконий .......................... 431
Yb - Zn. Иттербий - цинк ........................... 433
Yb - Zr. Иттербий - цирконий ....................... 435
Zn - Zr. Цинк - цирконий ........................... 435
СП РА ВО ЧНОЕ ИЗД А НИЕ
ДИАГРАММЫ СОСТОЯНИЯ
ДВОЙНЫХ МЕТАЛЛИЧЕСКИХ СИСТЕМ
Том 3. Книга 2
Редактор Н.Г. Сальникова
Оформление художника В.К. Погорелова. Художественный редактор Т.Н. Погорелова
Технические редакторы Т.П. Андреева. С.А. Жиркина
Корректоры Л.Е. Сонюшкина. Л.И. Сажина
Лицензия ЛР .№080003 от 12.09.96
Сдано в набор 21.09.99. Подписано в печать 11.05.2000. Формат 60x881/16.
Бумага офсетная. Гарнитура Таймс. Печать офсетная.
Уел. печ. л. 27,44. Усл. кр.-отт. 27,44. Уч.-изд. л. 30,84.
Тираж 500 экз. Заказ 219т
Ордена Трудового Красного Знамени издательство "Машиностроение",
107076, Москва, Стромынский пер., 4
Отпечатано в типографии НИИ "Геодезия", г. Красноармейск Московской обл.