Текст
PDF processed with CutePDF evaluation edition www.CutePDF.com
АКАДЕМИЯ НАУК УКРАИНСКОЙ ССР
ВНУТРИМОЛЕКУЛЯРНОЕ ВЗАИМОДЕЙСТВИЕ НИТРИЛЬНОЙ
и СИ. ОН и S-Нтрупп
КИЕВ НАУКОВА ДУМКА 1985
УДК 547.239.2
Внутримолекулярное взаимодействие ширильной в С-Н-, О-Н- и S-H-rpynn / Бабичев Ф.С., Шаранин Ю.А., Литвинов В.П. и др.; Под общ. ред. Бабичева Ф.С. - Киев Наук, думка, 1985. - 200 с.
В монографии обобщены литературные данные по синтезу аминов карбо- и гетероциклического рядов циклизацией нитрилов. Полученные таким путем карбоциклические амины, ариламины, аминофураны, аминопираны, аминотиофены, а также аминогетероциклы с двумя и большим количеством гетероатомов применяются в качестве лекарственных препаратов, химических средств защиты растений, красителей, их полупродуктов и др.
Для исследователей в области химии ароматических и гетероциклических соединений, физиологически активных веществ, пестицидов, красителей, полимеров, а также для студентов, специализирующихся по химии ароматических и гетероциклических соединений.
Табл. 9. Библиогр.: 960 назв.
Авторы: Ф.С.Бабичев, Ю.А.Шаранин, В.П.Литвинов, В.К.Промоненков, Ю.М.Воловенко
Рецензенты Г.Е.Заиков, М.Ю.Корнилов
технологрне ‘к й ин-тут им. Д. И. М-дндолэева рнЬлИОТЕКЛ
Федор Семенович Бабичев, Юлий Алексеевич Шаранин,
Виктор Петрович Литвинов, Виктор Кириллович Промоненков,
Юлиан Михайлович Воловенко
Внутримолекулярное взаимодействие нитрильной
и С-Н-, О-Н- и S-Н-групп
Редакция химической литературы
Редактор Л.П.Кругляк. Оформление художника Л.В.Максимчук
Художественный редактор Л.А.Комяхова. Технический редактор Л.Н.Муравцсва Оператор Н.Г.Калинникова. Корректоры М.Т.Кравчук, Е.И.Мазничеико
ИБ № 6998
Подп. в печ. 19.04.85. БФ 01044. Формат 60x84/16. Бум. офс. № 1. Гари. Пресс Роман. Офс. печ. Усл. печ. л. 11,63. Уел. кр.-отт. 11,98. Уч.-изд. л. 15,22. Тираж 1125 экз. Заказ 5—345. Цена 2 р. 40 к.
Издательство "Наукова думка”. 252601 Клев 4, ул. Репина, 3.
Киевская книжная типография научной книги. 252004 Киев 4, ул. Репина, 4.
в 1803000000-312 203-85
М221(04)-85
©Издательство "Паукова думка”, 1985
ВВЕДЕНИЕ
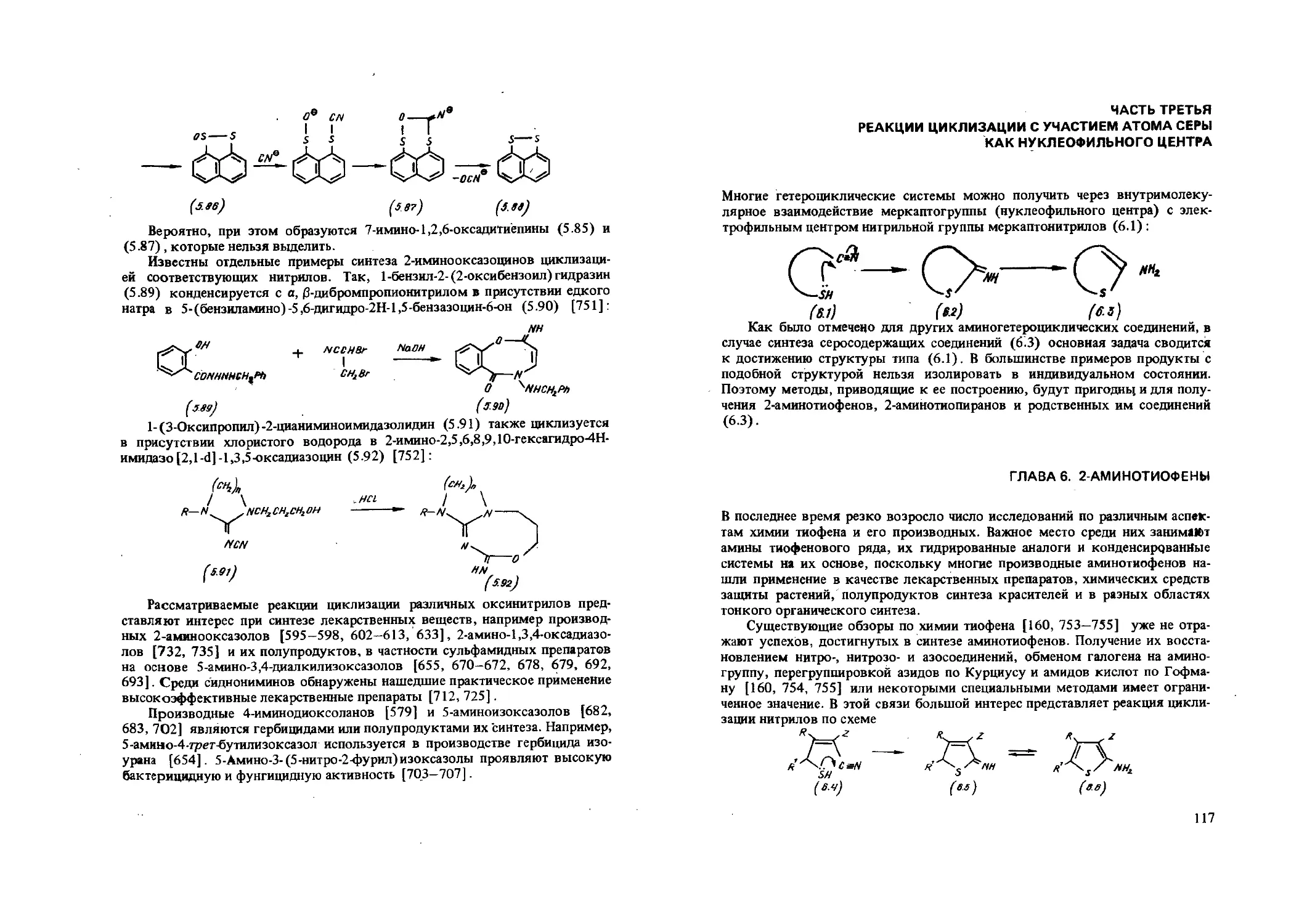
Перед советской химической наукой партией и правительством поставлены задачи, связанные с выполнением Продовольственной программы СССР, повышением выпуска продукции медицинской промышленности, созданием новых полимерных материалов. В связи с этим актуальным является обобщение известных сведений о химических реакциях и процессах, приводящих к полифункциональным соединениям, которые могут применяться в качестве синтонов тонкого органического синтеза, а также целевых продуктов химического производства. Один из важнейших синтетических методов основан на внутримолекулярном взаимодействии нитрильной группы с различными группировками, содержащими подвижный атом водорода.
Нитрилы как класс соединений и нитрильная группа как функциональная играют большую роль в органической химии. Трудно найти другую функциональную группу, которая столь легко вводилась бы в молекулу и обладала такой высокой активностью, обусловленной сочетанием поляризуемости и ненасыщенности.
Наиболее хорошо изучено внутримолекулярное присоединение активированной метиленовой группы к нитрильной, носящее название реакции Торпа. В имеющихся обзорах Циглера (1934 и 1955 гг.), монографиях Тейлора и Маккилопа (1970г.),Е.Н.Зильбермана (1972г.),Раппопорта (1970г.) часто рассматриваются лишь отдельные работы по этой тематике, к настоящему времени устаревшие. Мы попытались обобщить литературные данные, прежде всего результаты работ последних 10—15 лет.
В монографии освещены реакции циклизации с участием атома углерода как нуклеофильного центра, которые охватывают синтез карбоциклических (производных циклопентадиена, циклогексадиена, аренов) и гетероциклических аминов (производных фурана, тиофена, пиррола, пиридина и других гетероциклов, их гидрированных аналогов и конденсированных систем с их участием), атома кислорода как нуклеофильного центра, приводящие к 2-аминофуранам, 2-аминопиранам, 5-аминоизоксазолам, оксазолам, другим гетероциклам с двумя и большим числом гетероатомов в цикле (диоксоланам, тиоксоланам, оксадиазолам и пр.), атома серы как нуклеофильного центра с образованием 2-аминотиофенов, 2-амино-1 -тиахромонов, аминов пятичленных с двумя и большим числом гегероатомов в цикле и шестичленных ядер. Дается сравнительная характеристика различных способов синтеза аминов карбо- и гетероциклического рядов.
Каждый раздел содержит методики синтеза конкретных соединений, которые позволят избежать обращения к оригинальным, подчас труднодоступным источникам.
Данная монография будет полезна специалистам в области тонкого органического синтеза, химии ароматических и гетероциклических соединений, физиологически активных веществ, пестицидов, красителей и полимеров.
ЧАСТЬ ПЕРВАЯ РЕАКЦИИ ЦИКЛИЗАЦИИ С УЧАСТИЕМ АТОМА УГЛЕРОДА КАК НУКЛЕОФИЛЬНОГО ЦЕНТРА
В органической химии находят широкое применение реакции циклизации нитрилов, приводящие к гетероциклическим аминам. В общем виде их можно представить следующей схемой;
Г~СНг2 В Г—С HZ f—ZWZ 2—CHZ
я с3 Г* I е = я I И
'—CN -вп^ v—CsN v—C=N В К C=NH \^.С-ЮТг
{1.1) (1.2) (l3) (**) (»в)
Метиленовая и метиновая группы, как правило, должны быть активированы одной или двумя электроотрицательными группировками (Z). Если в качестве электроотрицательного заместителя выступает нитрильная группа (1.1, Z = CN), а в цепочке атомов между нитрильной и активирующей группировками отсутствуют гетероатомы, то имеет место реакция Торпа. Впервые такую реакцию описали Мур и Торп на примере катализируемого этилатом натрия превращения о-ди (цианометил) бензола в 2-амино-1-циано-индей-2, строение которого как непредельного аминонитрила было доказано позже [1, 2J.
Циглер распространил ее на получение больших циклов, применив технику ’’высокого разбавления” Руггли и использовав в качестве катализатора этилфениламид лития в диэтиловом эфире. В литературе эта реакция известна как реакция Торпа — Циглера [1—7].
Обзорные работы Циглера [3, 4] по циклизации нитрилов и синтезу макроциклических соединений к настоящему времени устарели. Наиболее полно химия енаминонитрилов освещается в работе Тейлора и Маккилло-па [1]. В той или иной мере реакции циклизации нитрилов затрагиваются в монографиях [6, 7], а также в обзорных работах [2—5, 8—13].
Как следует из приведенной схемы, циклизацией нитрилов (1.1) могут быть получены не только карбоциклические, но и гетероциклические амины, если в цепочке атомов А(1.1) — (1.5) находится один или несколько гетероатомов. Кроме того, представляет интерес циклизация нитрилов, приводящая к ароматическим аминам, когда нуклеофильным центром служит атом углерода двойной связи или ароматической системы. Все подобные превращения рассматриваются далее как реакции Торпа.
Реакция Торпа является частным случаем конденсации Дикмана [1, 2]. Основание (В) отрывает протон от активированной метиленовой или метиковой группы нитрила (1.1). Возникающий нуклеофильный центр атакует электрофильный атом углерода нитрильной группы с образованием цикла (1-3) — (1.4). Имин (1.4.), если возможно, обычно стабилизируется в форме амина (1.5).
4
Общие закономерности циклизации Торпа сводятся к следующим положениям. Амины малых циклов вследствие их классического байеровского напряжения не известны [1, 7]. Однако они могут получаться в качестве промежуточных соединений. Так, вероятно, образуются гипотетические яминотииран в синтезе дифенилацетонитрила из тиобензофенона и цианида калия [5] и замещенный иминоциклобутан при реакции четыреххлористого углерода с непредельным нитрилом [14]. Наиболее легко происходит циклизация нитрилов в пяти- и шестичленные циклы. Чаще всего выходы карбо-и гетероциклических аминов приближаются к количественным. Циклизация протекает настолько легко, что отдельные нитрилы (1.1) при их получении самопроизвольно или при слабом нагревании дают циклы. Например, при промышленном производстве адиподинитрила гидрированием акрилонитрила практически всегда получается побочный продукт (1-амино-2-циано-1-циклопентан) [15].
Ряд 3-аминотиофенов получен без указания на возможность выделения соединений типа (1.1), которые являются промежуточными продуктами [16]. Достаточно легко образуются аминопроизводные семичленных циклов [1,7].
Циклизацию динитрилов (1.1, Z = CN), содержащих в основной цепи (А) восемь и более атомов углерода, для предотвращения димеризации, рекомендуется проводить по методу ’’высокого разбавления” Руггли — Циглера [ 1, 4]. Практически это достигается медленным прибавлением реагента, чтобы его концентрация в реакционной среде оставалась в заданных пределах, благоприятных для циклизации. При переходе от динитрилов с девятью углеродными атомами к динитрилам с тринадцатью атомами углерода в цепи циклизация затрудняется, особенно у последних соединений, которые димеризуются, несмотря на разбавление, значительно легче, чем образуют циклы. Начиная от Cls и далее динитрилы с четным числом углеродных атомов в цепи циклизуются легче, чем с нечетным [1, 4, 7].
В качестве исходных реагентов в реакции Торпа широко применяются а, w-динитрилы или а-циано-со-7-замещенные соединения (Z — электроотрицательный заместитель). Удобную для внутримолекулярной циклизации структуру можно создать, исходя из различных нитрилов: малононитрила, циануксусного эфира, цианацетамида, нитрилов хлоруксусной и меркаптоуксус-ной кислот, алкилиден-, арилиденмалононитрилов и др. Как правило, такие динитрилы и их производные гладко циклизуются в присутствии различных добавок. Поэтому возможности рассматриваемой реакции будут определяться прежде всего доступностью исходных или промежуточных нитрилов, выделение которых не всегда целесообразно. Иногда их нельзя выделить в индивидуальном состоянии.
Во всех случаях электрофильным центром служит атом углерода нитрильной группы, а нуклеофильным — углерод активированной метиленовой (или метиновой) группы, поэтому легкость и направление циклизации будут определяться относительной электрофильностью первого и нуклеофиль-
5
костью второго. Увеличение нуклеофильности метильной (метиленовой) группы, определяемое применяемым основанием, должно способствовать стабилизации циклической структуры (1.5), т.е. сила основания, безусловно, влияет на легкость взаимодействия.
Для циклизации а,ы-динитрилов, димеризации илиденмалодонитрилов и подобных соединений используются катализаторы основной природы: щелочи, алкоголяты, карбонаты, амиды щелочных металлов, органические основания. Часто амиды натрия более предпочтительны, чем катализатор Циглера, но последний широко применяется и до настоящего времени. Для циклизации нитрилов с участием зр2 -гибридизованного атома углерода используются протонные (H2SO4, Н3РО4, НС1) и апротонные кислоты: А1С13, ZnCl2, MgC104. При этом следует считаться с возможностью гидролиза имина (1.4) или амина (1.5).
Циклизацию нитрилов иногда можно осуществлять при термическом воздействии [16], а также путем внутримолекулярного гомолитического присоединения по цианогруппе [17]. Однако в последнем случае образующиеся амины (1.6) вследствие гидролиза выделить не удалось:
/ С HR я
V--CN
t--CHR
I О =.
f--CHR
A I
<•-C=NH<
rCHR
A I
(is)
(А— цепь из 3—5 углеродистых атомов; R = Н, AIK).
При изучении свободнорадикального присоединения СС14 к нитрилу 2,2-дихлор-4-пентеновой кислоты было сделано предположение о том, что промежуточный радикал (1.9) образуется через радикал иминоциклобутана (1.8) [14]:
R1
. I
С^ССНг С-С - СС12 CN
R R1
й ен r'
Ла II.
—СС3ССНг-С -С-СС1г
R Я1
По-видимому, изомеризация в ряду стероид-20-циангидринов при обработке их йодом и тетраацетатом свинца или ацетатом серебра в циклогексане и последующем окислении оксидом хрома (III) происходит по радикальному механизму с участием нитрильной группы [4]. К этому типу превращения следует отнести фотохимическое [3 + 2] присоединение 2-метил-2-бутена к 6-циано-1,3-диметилурацилу и 2-цианхромону, приводящее к 2, 4, 7, 8, 8-пентаметил-9-имино-2,4-диазобицикло- [4,3,0]-1-нонен-1,3-диону (1.10) |18, 19] и 2-имино-3,3-диметилциклопентено [Ь] хромену (1.11) [19, 20]:
6
Имеющийся экспериментальный материал свидетельствует о том, что реакция Торпа, за некоторым исключением [21], протекает необратимо.
ГЛАВА 1. СИНТЕЗ КАРБОЦИКЛИЧЕСКИХ АМИНОВ
1.1. Циклизация а, ш-дииитрилов
Циклизация а,ы-динитрилов (1.12) изучена хорошо [1-7,10]. При проведении реакции в тетрагидрофуране н атмосфере инертного газа выходы 1-амино-2-цианоциклопентена и циклогексена достигают 63 и 67 % соответственно [22]:
п = t+s.
Динитрил (1.13) дает енаминонитрил (1.14) с выходом 90 % [23]:
( 7-W)
Пространственно затрудненные динитрилы циклизуются хуже, выходы их ниже [24].
При катодной [15, 25—27] и восстановительной димеризации [28] акрилонитрила и его замещенных гомологов образуются соответствующие 1-амино-2-цианоциклопентены. Изучена стереоселективная восстановительная димеризация производных 1-циано-3-(4-пиридил) акриловой кислоты при гидрировании их в спирте в присутствии палладия на угле. С помощью дейтероводорода показано, что восстановление протекает через стадию образе-
вания замещенного адиподинитрила [28]. Применение боргидрида натрия ведет к насыщению двойной связи акрилонитрила. При катодной димеризации замещенных акрилонитрилов Получена рацемическая смесь изомеров производных 1-амино-2-цианоциклопентена [9, 26].
Можно предположить, что циклизация 1,2-ди(2-циано-3-метоксифенил)-пропионитрила в присутствии диэтилкарбоната прот кает в первой стадии как реакция Торпа [29]
Замещенные 1,2-ди (цианометил) бензолы [30-32] и 3,4-ди (цианометил) тиофены [32, 33] при циклизации дают енаминонитрилы рядов индана и циклопента [с] тиофена. При синтезе таких динитрилов [34] наряду с другими процессами происходит циклизация Торпа. При метилировании йодистым метилом 2-амино-5,6-диметокси-З-цианоиндена в диметилсульфокси-де в присутствии гидрида натрия циклопентеновое кольце раскрывается с образованием 4,5 -диметокси-1,2-бис (диметилцианометил) бензола [30]. Аналогично с 31 %-ным выходом получен 4'-амино-3’-цианоадамантанспиро-3’-циклопентен [35]:
снгснгсн
СН,СГ4 г
Полицианопроизводные соединения (динатриевая соль 1,1,2,3,4,4-гекса-циано-2-бутена [36], аммонийная соль 1,1,2,4,5,5-гексациано-3-алкил-1,3-пен-тадиена [10, 37], тетрацианоэтилен [6, 37]) циклизуются в нейтральной среде или буферной смеси (в уксусной кислоте с ацетатом калия на ионообменной смоле) в 1-амино-2,3,4,5-тетрацианоанилины. Наиболее часто в этих реакциях используются тетрацианоэтилен и малононитрил [1, 5—10, 37]. Мало-. нонитрил вступает в многочисленные реакции полимеризации и конденсации. Недавно открыта новая реакция его тримеризации в присутствии три-алкилсилилперфторалкансульфонатов [38]:
HNSi(CHs)3
, I , М
ЗСНг(СП}г + frS/bOSlfcH,), ---------------- £ ]Г
(СН,\ CN '
8
При взаимодействии хиноксалиниевых солей и малононитрила образуются иминоциклопентахиноксалины [39]:
снг(сы)г
f CN
1.2. Циклизация с участием аллильного или способного к енолизации атома углерода
Циан- или дицианэтилирование ацетона [40, 41], метилэтилкетона [42], ме-тилизопропилкетона [43], 3-пентанона [44], 2-октанона [41] и 1,3-дикето-нов [45, 46] приводит к 1,5-кетонитрилам, которые под действием алкого-лятов, амидов и гидридов щелочных металлов циклизуютсд в соответствующие З-амино-2-циклогексеноны (1.16). Активность метильной группы, обусловленная присутствием карбонила, в кетонитрилах (1-15) оказывается достаточной для протекания циклизации:
М,СОСНКК’ ----------- CHjCOC CHjCHjCN
I
H„N
(1.15)
(1.1В)
В случае пространственно затрудненных кетонитрилов (1.15) выходы аминов понижаются. При цианэтилировании 2-октанона (трет-BuOH, N2, КОН, 55—60 °C) получается смесь 39 % исходного 2-октанона, 24 % 3-(2-циано-этил)-2-октанона и 13 % 1-амино-4-ацетил-4-пентил-2-циано-1-циклогексена [41]. Здесь циклизация протекает за счет метиленовой, а не метильной группы. Если строение продуктов циклизации установлено правильна, то не ясно, почему в гомологическом ряду изменяется реакционная способность продуктов цианэтилирования кетонов. В качестве полупродуктов для получения отвердителей эпоксидных смол предложены циклические амины (1.16).
1-Амиио-4-метил-4-СЗ-цианоэтил)-1-циклогексен-3-он [42]. 0,6 г натрия растворяют при двухчасовом нагреваний в 120 мл трег-бутилового спирта и к раствору добавляют 35,6 г динитрила 4-ацегил-4-метилпимелиновой кислоты. Смесь кипятят 1,5 ч. При охлаждении из прозрачного раствора выделяется осадок, который отфильтровывают, промывают изопропиловым спиртом и высушивают при 80 °C в вакууме. Выход продукта с т.пл. 154-156 °C составляет 19,1 г. Упариванием фильтрата и кристаллизацией остатка из 20 мл изопропилового спирта дополнительно получают 7,9 г продукта. Общий выход амина 76 %.
Кетимины (1.17), Хинтезируемые из алифатических кетонов и анилина, реагируют с акрилонитрилом в присутствии безводного хлорида алюминия с образованием иминонитрилов, которые далее превращаются в амины
(118) [47]-
2
снгя
Ph~N={ + RCH-CCN
СИгСН3 к
''chch(k')i:h(r,)cn сиз
1-Амнно-2,4-Диметил-3-феиил-иминоцнклогексен [471- 15,1 г (70 ммолей) нитрила 4-метил-5-фенилиминогептановой кислоты растворяют в 50 мл толуола и при охлаждении льдом прибавляют 7,4 г (70 ммолей) безводного хлорида алюминия. При температуре 20 °C получают прозрачный раствор, который через 10 мин медленно затвердевает. К реакционной массе приливают 150 мл 2 н. раствора КОН и экстрагируют продукт эфиром. Экстракт сушат Na;SO4, растворитель упаривают. Остаток перекристаллизовывают из смеси гексана с бензолом. Получают 12,2 г (80 %) продукта с т.пл. 122 °C.
Илиденмалононитрилы, производные окиси мезитила и пулегона (1.19), циклизуются в концентрированной серной кислоте соответственно в 3,5-ди-метил-2-цианоанилин и 2-амино-4,6-диметил-1-циано-5,6,7,8-тетрагидронафта-лин (1-20). В обоих случаях циклизация осуществляется по метильной группе [48]:
Нитрил 4,6-диметилантраниловой кислоты [48]. К 20 мл концентрированной серной кислоты, охлажденной до 5 °C, медленно, при перемешивании прибавляют 4 г нитрила 3,5-диметил-2-циаио-2,4-гексадиеиовой кислоты. Раствор оставляют при комнатной температуре иа 4 ч, после чего выливают на лед. Кислый раствор нейтрализуют раствором щелочи. Образовавшийся осадок отфильтровывают, промывают водой н сушат на воздухе. После сублимирования в вакууме и перекристаллизации из петролейного эфира получают 3,2 г (80 %) бесцветных кристаллов с т.пл. 6-2-63 °C.
1,3,4-Триметил-2-аминокарбазол образуется из 2-этил-3-(1-метил-2-циа-новинил) пиридина в дифениловом эфире под действием гидрида натрия [49]. 1,1 -Дициано-4-метилтио-1,4-пентадиены (1.25), (1.26), получаемые на основе дитиоацеталей (1.22), (1.23) и илиденмалононитрилов (1-21) или 1,1-дициа-но-4,4-димегилтио-1,3-бугадиенов (1.24) и метиленоактивных нитрилов, представляют интерес при синтезе 2,6-дизамещенных анилинов (1.27), (1.28) [50-52]:
10
нс'^сн.
(1.21)
CHjS Z _______ НСZ
CHJs'*'z’ NV''CH3^'z'~*
(1.22) z~CN,Носова (i.25)z-cn,z'~h
(1.23) г=НВг,2'~н [t26) Z‘HO2,i-H
' fr.27) Z -CH
(l2g) Z = NO,
НС. , К
5C»3 + zcn2z' ----------
H SCti3 H" SCH3
5-Метилтио-6нитро-3-феиил-2-цианоаннлин (52]. Смесь 0,01 моля нитрила 3-метил-2-цианокоричной кислоты, 1,65 г (0,01 моля) нитрокетен-5,5-диметилацеталя и 2 г сухого карбоната калия в 10 мл ДМФА при перемешивании кипятят 2 мин. После охлаждения до 20 °C реакционную массу разбавляют при перемешивании 50 мл воды и 2,5 мл концентрированной соляной кислоты. Осадок Отфильтровывают, многократно промывают водой и перекристаллизовывают из уксусной кислоты. Получают 80 % продукта с т.пл. 209- 211 °C.
5-Мегнлт1Ю-3-фенцл-2,6-дицианоаннлин [50]. 0,01 моля этилового эфира 3-метил-тио-5-фенил-2,6-трициано-2,5-гексадиеновой кислоты в 20 мл концентрированного водного раствора аммиака (d ~ 0,9) нагревают с обратным холодильником в течение 10 мин. После охлаждения осадок отфильтровывают, промывают водой и перекристаллизовывают из уксусной кислоты. Получают 83 % продукта с т.пл. 242-244 °C.
1.3. Димеризация и содимеризация непредельных нитрилов
Значительное место в реакции Торпа принадлежит димеризации непредельных нитрилов. Так, продуктами димеризации нитрилов 3-метилкротоновой [53, 54] и З-метил-З-бутеновой кислот [55] в теграгидрофуране под действием диэтил- или диизопропиламидов лития при -78 °C являются 3-амино-1,5,5-триметил-4-циано- и 1-амино-3,5,5-триметил-4-циано-1,3-циклогексадие-ны. Вероятно, первоначально протекает депротонирование непредельного нитрила (1.29) в соответствующий аллильный анион, который реагирует по реакции Михаэля и дает анион (1.31), циклизующийся по реакции Торпа в аминоциклогексадиен (1.32) [55]:
2
3-Амнио-1,5^-гриметил4-циаио-1,3-циклогексадиен (1.32) [55]. К перемешиваемому раствору 1,8 г (14 ммолей) нафталина в 20 мл тетрагидрофурана прибавляют при комнатной температуре небольшими кусочками 0,1 г лития. После 1 ч перемешивания раствор охлаждают до 0 °C и прикапывают 1,0 г (14 ммолей) диэтиламииа. Смесь перемащивают 30 мин, затем приливают раствор 1,0 г (12 ммолей) нитрила 3-метил-3-бутеновой кислоты в 8 мл тетрагидрофурша. Через 30 мин перемешивания добавляют по каплям 1,0 г (12 ммолей) нитрила 3-метилкротоновой кислоты в 8 мл тетрагидрофурана и смесь перемешивают 1 ч. Затем реакционную массу перемешивают еще 3 ч при комнатной температуре, снова охлаждают до 0 6С и при охлаждении прибавляют 2 мл этилового спирта. После упаривания растворителя к остатку приливают 50 мл эфира, промывают водой, в которой растворена соль, сушат над MgSO4. После испарения эфира сырой продукт хроматографируют иа оксиде алюминия (элюент гексан-эфир). Получают 1,69 г (85 %) продукта с т.пл. 97-98 °C.
0-Метиленглутаронитрил или ^-метилглутакононитрил при димеризации под действием оснований или в результате термического воздействия дает 3,5-диметил-2,4-дицианоанилин [56]:
смгсл/ ---------------
лч ................и,
Значительной реакционной способностью в реакциях димеризации обладают алкилидеималононитрилы — продукты кневенагелевского взаимодействия алифатических или жирноароматических кетонов, в том числе циклического ряда, с малононитрилом. Среди продуктов взаимодействия формальдегида и малононитрила обнаружен 2-амино-1,3,3,5,5-пентациано-1-циклогексен [8]. Неоднозначно ведет себя в этой реакции и ацетальдегид, причем выделить соответствующие мономерные продукты конденсации не
удается.
Илиденпроизводные малононитрила, циануксусного эфира и других нитрилов, содержащих активную-метиленовую группу, могут быть выделены и охарактеризованы. Однако, как правило, при наличии рядом л двойной связью метиленовой группы они легко димеризуются при хранении или в условиях проведения конденсации по Кневенагелю [ 1, 5, 8, 57—64]. При этом следует иметь в виду, что при образовании циклических аминов с алкильным заместителем в положении 3, т.е. при использовании алифатических кетонов, необходимо считаться с возможностью изомеризации аминоциклогексадиенов в 3-илиденпроизводные аминоциклогексанов. В общем случае такие илиденпроизводные более стабильны. Например, димер нитрила 3-метил-2-циано-2-пентеновой кислоты имеет строение 2-амино-6-метил-1,1,3-трициано-6-этил-4-этилиден-2-циклогексена [57-60].
Изучена [60] димеризация алкилиденмалононитрнлов (1.33, а—ж), приводящая к смеси циклических изомеров (1.34) — (1.36, а—ж):
12
It ОНа ила оилеридин к’щы
NH ЛГ U С» + RTH/V''SK'CN,* ЛСН, w’
№f.
1 <
лд^'7 T VZ^x> HCHt
(1.36,6-м)
(133,а-м)
(г.з^а-м)
(1.33,a,6,д~»)
В зависимости от строения соединений (1.34) — (1-36) наблюдается преимущественное образование одного из изомеров (табл. 1.1).
' Таблица 1.1. Данные о соотношении продуктов димеризации алкилиденмалоионитрилов, % [60]
Соединение (133) -(1.36) R R1 Соотношение изомеров, %
(1.34) (1.35) (1.36)
а Н в 40 60
б (СНа), 90 10 10
в (СН,)а 30 70
г СИ, н 20 —- 80
д сн, сн3 10 10 80
е СЩСН, н 10 80 10
ж СН(СН,)2 н 10 90 10
Установлено [65], что димеризация илиденпроизводных циануксусного эфира происходит при их взаимодействии с реактивами Гриньяра [65]. В реакцию могут быть введены илиденпроизводные различного строения [1, 5, 66-68]. Так, в результате присоединения циклогексилиденмалононит-рила (1.37) к арилиденмалононитрилам (1.39) или арилиденциануксусным эфирам (1.40) получены [67] 3-амино-6-арил-2,4-дициано-4,7-бицикло [4,4,0]-2,10-декадиены [41, 42], имеющие гетероаннулярное строение„что соответствует данным [68,69]:
(1.39)Z~CN
f 13в) X = UCHf (1.W) Z-COO£t
(l.vr)
(tv) к* сн,,?* cooct
(1.43) х-л/а^,2-сн
(t<w) X-CHt (ins) X*NCH,
~ Реакции димеризации или кроссдимеризации легко осуществляются под действием органических оснований в спиртовой среде:
13
Основание (В) переводит алкилиденпроизводные нитрилов (1-46) в анион (1.47), который присоединяется по Михаэлю к арилиденпроизводному
Таблица 1.2. Выход (%) 2,4,4-тр||Циаио-3-амино-5-арил- (1.41), (1.42) и 8-метил-8-азобицикло (4,4,0) -2,10-декадиенов (1.43)
Номер соединения Аг Из илидеи-производ-ных (1.37) и (1.39) Трехкомпонентной конденсацией из альдегидов, кетонов и малононитрила Литература
1.41, а с.н/ 94 70 (66)
1.41,6 4-(СН3) 3СНС6Н4 87 60 [67]
1.41, в 4-CHjOCjH, 87 90 [67]
1.41, г 4-FC.H, 96 88 [67]
1.41, д 4-ВгС6Н4 96 95 [67]
1.41, е 4-O,NC4H4 64 — [67]
1.42, а c4hs 75 — [66]
1.42,6 4-(СН3) 3СНСФН4 56 — [67]
1.42, в 4-СН3СбН4 70 — [67]
1.42, г 4-FC.H. 81 — [67]
1.42, д 4-ВгС.Н, 87 — [67]
142, е 4-O,NC.H4 96 — [67]
1.43, а с.н, — 95 [68]
1.43,6 4-СН3С.Н4 — 83 [68]
1.43,8 4-СН3ОС.Н4 — 93 [68]
1.43, г з-сн3ос4н„ — 47 [68]
1.43, д 4-С1С,Н4 — 94 [68]
1.43, е 2-СН3ОС4Н4 — 44 [68]
14 3, ж 2-С)С, Н4 — 78 [68]
1.43,3 4-(СН3) а NC. Н„ — 59 [68]
1.43, и 2-OjNC.H4 — 72 [68]
1 Продукт получен, кроме того, из 1 -(1 -циклогексенил) морфолина и бен-зилиденмалоионитрила (69), а также из 2-бензоилциклогексанона и мало-нонитрила (70] .
14
(1.39) с образованием аниона (1.48). В результате внутримолекулярного взаимодействия нуклеофильного и электрофильного центров (1.48) возникает анион циклического имина (1.49). Последний отрывает протон от BIT или протонизируется растворителем. Имин (1.50) в результате 1,5-миграции Н-атома изомеризуется в соответствии с рассмотренными закономерностями в амин (1-51) или получается смесь изомеров (1.34) —(1.36).
Гладко и с большими выходами протекает циклизация при ароматизации, осуществляемой путем отщепления молекулы простых веществ, например ацетонитрила [56], диметиламина [5]. Ароматизация циклогексадиенов (1.43)—(1-45), (1.53) сопровождается отщеплением цианистого водорода (Z = CN) в присутствии едкого кали [66—68] или декарбэтоксилированием (Z = COOC2H5).
К данной группе реакций относится одновременное действие малононитрила на смесь кетона (лучше циклического) и ароматического альдегида [5, 66—68]. В случае 1-метил-4-пиперидона спонтанно образуются продукты (1.43) [68], вероятно, за счет автокатализа.
6-Амино-2-мет11Л-8-феиил-5,7,7-трициано-1,2,3,7,8,8а-гексагидроизохинолин [68]. 6,7 г (0,1 моля) малононитрила, 5,3 г (0,05 моля) бензальдегида растворяют в 50 мл метилового спирта и при перемешивании прибавляют 5,7 г (0,05 моля) М-метил-4-пи-перидона. Из охлажденной реакционной смеси выпадает мелкокристаллический осадок, который отфильтровывают, промывают метиловым спиртом и сушат. После перекристаллизации из бутилового спирта получают 95 % продукта ст.пл. 197—198 °C (табл. 1.2).
1.4. Синтезы на основе кетонов и енаминов
2,3-Бензотропон в уксусном ангидриде дает наряду с нормальным продуктом кневенагелевского взаимодействия (31 %) 7-амино-6-циано-3,4-бензо [3, 2,2]-3,6,8-нонатриен-2-он (1.53) с выходом 9 % [71]:
снг (cn),
Гомологи 2,3-бензотропона, содержащие метильные группы в бензольном и циклогептатриеновом циклах, в этих условиях образуют значительно меньшие количества аналогов бензобициклононатриена (1.53).
2-Инданон реагирует с малононитрилом до5-амино-б-циаиоиндено[2,1-а]-флуорена [72] в отличие от 1-ацетил-3-оксо-2,3-дигидроиндола, который конденсируется с малононитрилом с последующей димеризацией, не сопровождающейся замыканием цикла [73]. Енамины, производные кетонов, взаимодействуют с непредельными нитрилами и цианоциклопропанами [74]. Так, N-морфолино-!-циклогексен (1.54) в эфирном растворе с бензи-лиденмалононитрилом (1.39) дает декалин (1.56). Последний под действием
15
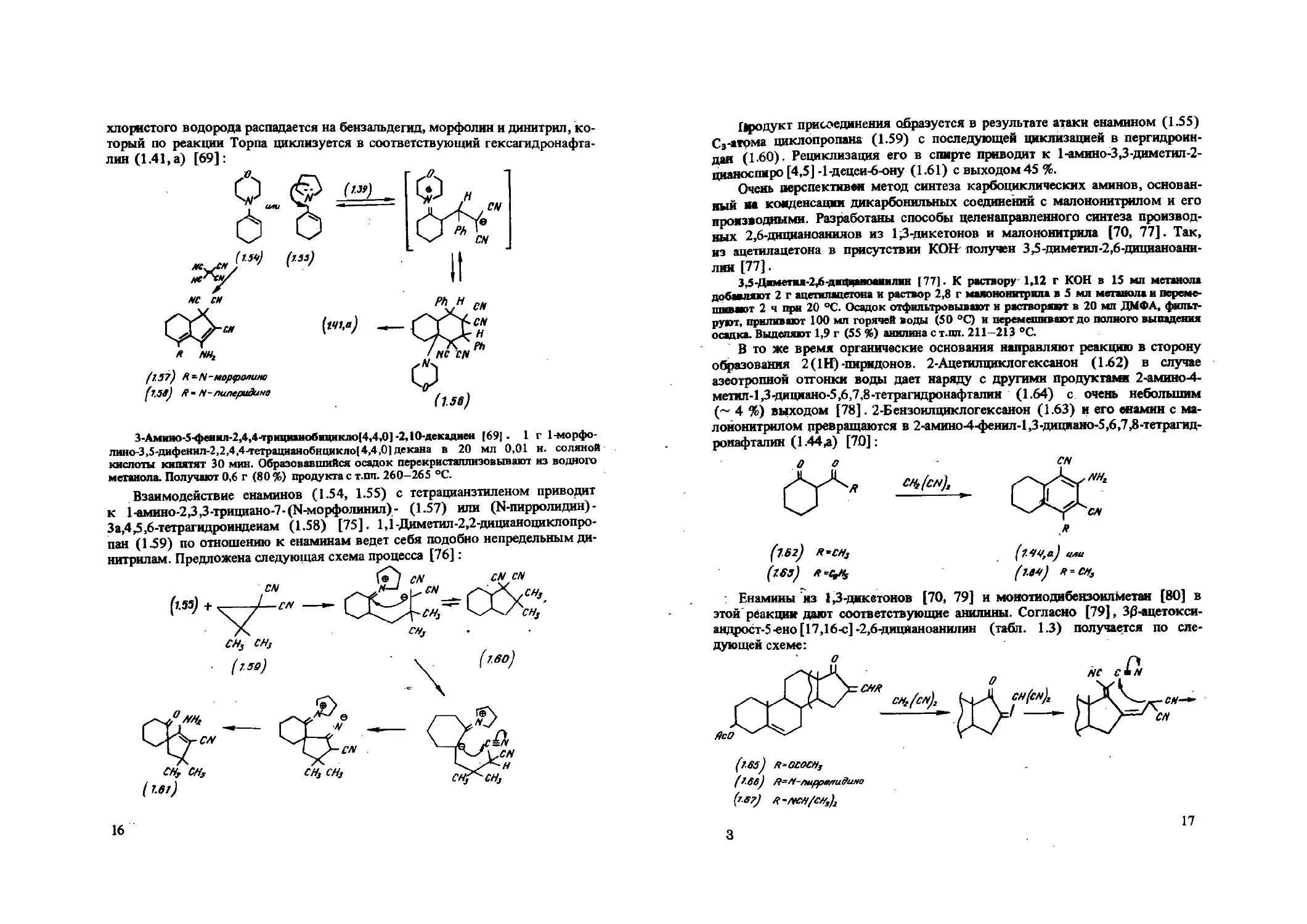
хлористого водорода распадается на бензальдегид, морфолин и динитрил, который по реакции Торпа циклизуется в соответствующий гексагидронафталин (1.41, а) [69]:
(IS?) R-N-Moptpoaune (13в) Я - N-пиперидина
3-Амино-5-фенил-2,4,4-трициаиобнцикло(4,4,0] -2,10-декадиен (69} - 1 г 1-морфолино-3,5-Дифенил-2,2,4,4л,етрацианобнцикло( 4,4,0) декана в 20 мл 0,01 н. соляной кислоты кипятят 30 мин. Образовавшийся осадок перекристаллизовывают из водного метанола. Получают 0,6 г (80 %) продукта с т.пл. 260-265 °C.
Взаимодействие енаминов (1.54, 1.55) с тетрацианзтиленом приводит к 1-амино-2,3,3-трициано-7-(1Ч-морфолинил)- (1.57) или (N-пирролидин)-За,4,5,6-тетрагидроиндеиам (1.58) [75]. 1,1-Диметил-2,2-дицианоциклопропан (1.59) по отношению к енаминам ведет себя подобно непредельным динитрилам. Предложена следующая схема процесса [76]:
16
11родукт присоединения образуется в результате атаки енамином (1.55) С3-1тома циклопропана (1.59) с последующей циклизацией в пергидроин-даи (1.60). Рециклизация его в спирте приводит к 1-амино-3,3-диметил-2-цианоспиро [4,5] -1-децеи-6-ону (1.61) с выходом 45 %.
Очень перспективен метод синтеза карбоциклических аминов, основанный на конденсации дикарбонильных соединений с малоконитрилом и его производными. Разработаны способы целенаправленного синтеза производных 2,6-дицианоанилов из 1,3-дикетонов и малононитрила [70, 77]. Так, из ацетилацетона в присутствии КОН- получен 3,5 -диметил-2,6-дицианоани-лия [77].
3,5-Дмметил-2^-двциаловиилин [77]. К раствору 1,12 г КОН в 15 мл метанола добавляют 2 г ацетилщетона и раствор 2,8 г малононитрила в 5 мл метанола и перемешивают 2 ч при 20 °C. Осадок отфильтровывают и растворяют в 20 мл ДМФА, фильтруют, приливают 100 мл горячей воды (50 °C) и перемешивают до полного выпадения осадка. Выделяют 1,9 г (55 %) анилина с т.пл. 211-213 °C
В то же время органические основания направляют реакцию в сторону образования 2(1Н)-пиридонов. 2-Ацетилциклогексанон (1.62) в случае азеотропной отгонки воды дает наряду с другими продуктаья 2-амино-4-метил-1,3-дициано-5,6,7,8-тетрагидронафталин (1.64) с очень небольшим (~ 4 %) выходом [78]. 2-Бензоилциклогексанон (1.63) и его енамин с ма-лоионитрилом превращаются в 2 -амино-4-фенил-1,3 -дициано-5,6,7 ,8 -тетрагидронафталин (1.44 д) [70]:
0 0 CN
СНг(сн),
ся я
(1.62) Я*СН3 С
или
(гвз) яч^ (}.вя) я = съ
Енамины из 1,3-дикетонов [70, 79] и монотиодибензоилметан [80] в этой реакции дают соответствующие анилины. Согласно [79], 30-ацетокси-андрост-5-ено[17,16-с]-2,6-цицианоанилин (табл. 1.3) получается по следующей схеме:
(гез) я-ососн, (f-ве) ff=ff-nuff№/ruffuHO
(’О?) Я -НСН/СН})г
17
(?.в8)
Таблица 1.3. Условия проведения синтеза 30-ацетоксиандрост-5-ено[17,16-с]-2,6-дици-аноанилина (1.68)
Соотношение стероид - ма-лононитрид Растворитель, катализатор, обработка Время, ч Выход (1.68),%
(1.65) - МН, 1,0 :6,5 Бензол, АсОН, NH4 ОАс, нагревание с насадкой Дина - Старка 48 10
(1.66) - МН, 1,0 :6,0 То же 48 42
(1.66) - МН, 1,0 : 1,4 Бензол, АсОН, пирролидин, нагревание в аппарате Сокслета с молекулярным ситом ЗА 48 13
(1.66) -МН, 1,0 : 1,2 Бензол, диизопропиламин, АсОН, нагревание в аппарате Сокслета с молекулярным ситом ЗА 37 28
(1.67) - МН, 1,0 : 2,0 Бензол, диизопропиламин, АсОН, нагревание с насадкой Дина — Старка 40 19
Приведенная схема, по-видимому, имеет общие стадии с процессом превращения монотиодибензоилметана (1.69) и малононитрила в анилин (1.70), осуществляемом в присутствии КОН. Считается, что взаимодействие начинается с атаки анионом малононитрила тиокарбонильной группы [5, 80]:
ncch^ch
18
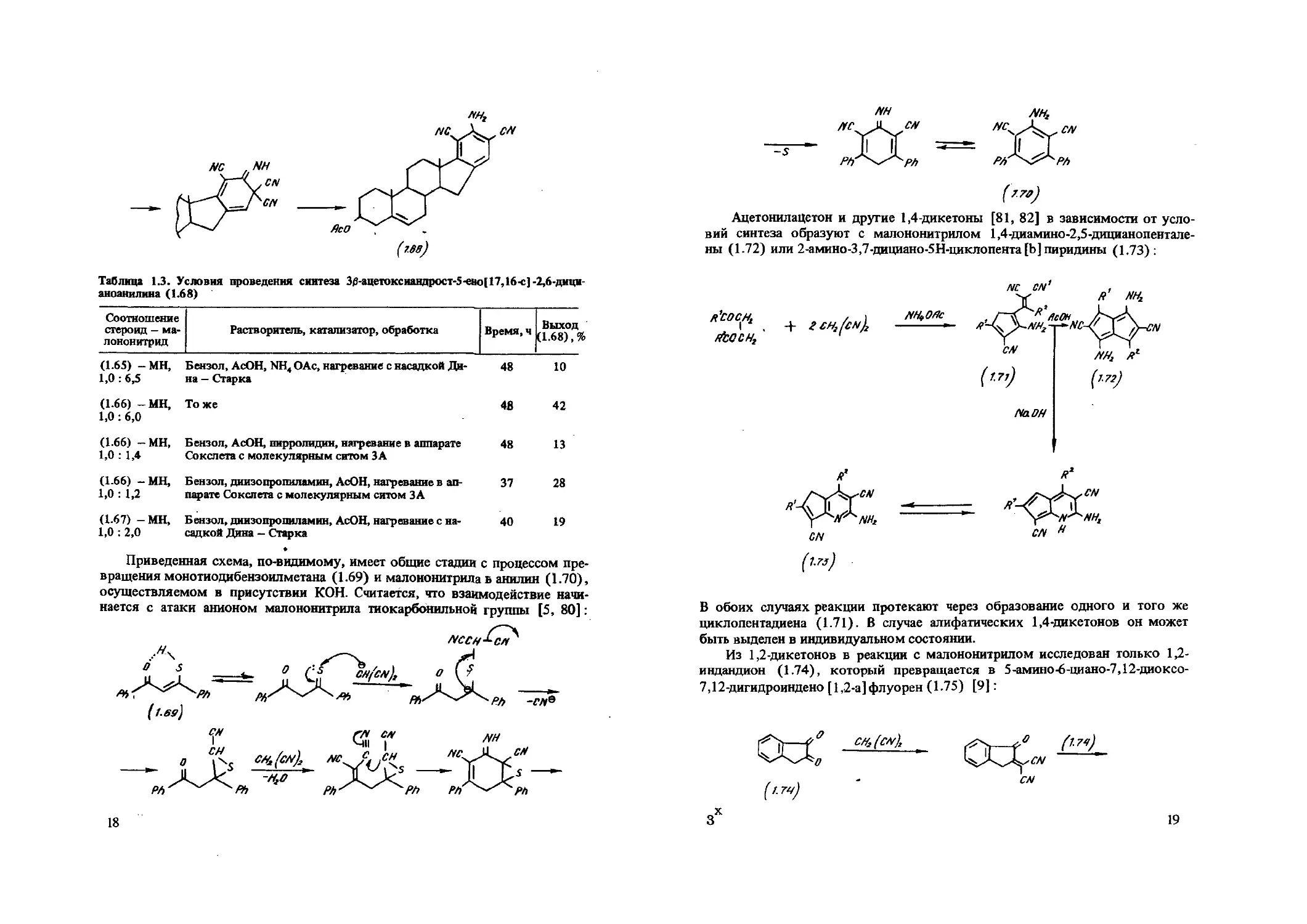
АцетонилаЦетон и другие 1,4-дикетоны [81, 82] в зависимости от условий синтеза образуют с малононитрилом 1,4-диамино-2,5-дицианопентале-ны (1-72) или 2-амино-3,7-дициано-5Н-циклопента[Ь] пиридины (1.73) :
CN
ННг
В обоих случаях реакции протекают через образование одного и того же циклопентадиена (1.71). В случае алифатических 1,4-дикетонов он может быть выделен в индивидуальном состоянии.
Из 1,2-дикетонов в реакции с малононитрилом исследован только 1,2-индандион (1.74), который превращается в 5-амино-6-циано-7,12-диоксо-7,12-дигидроиндено [1,2-а]флуорен (1-75) [9]:
зх
СНг(м)г
19
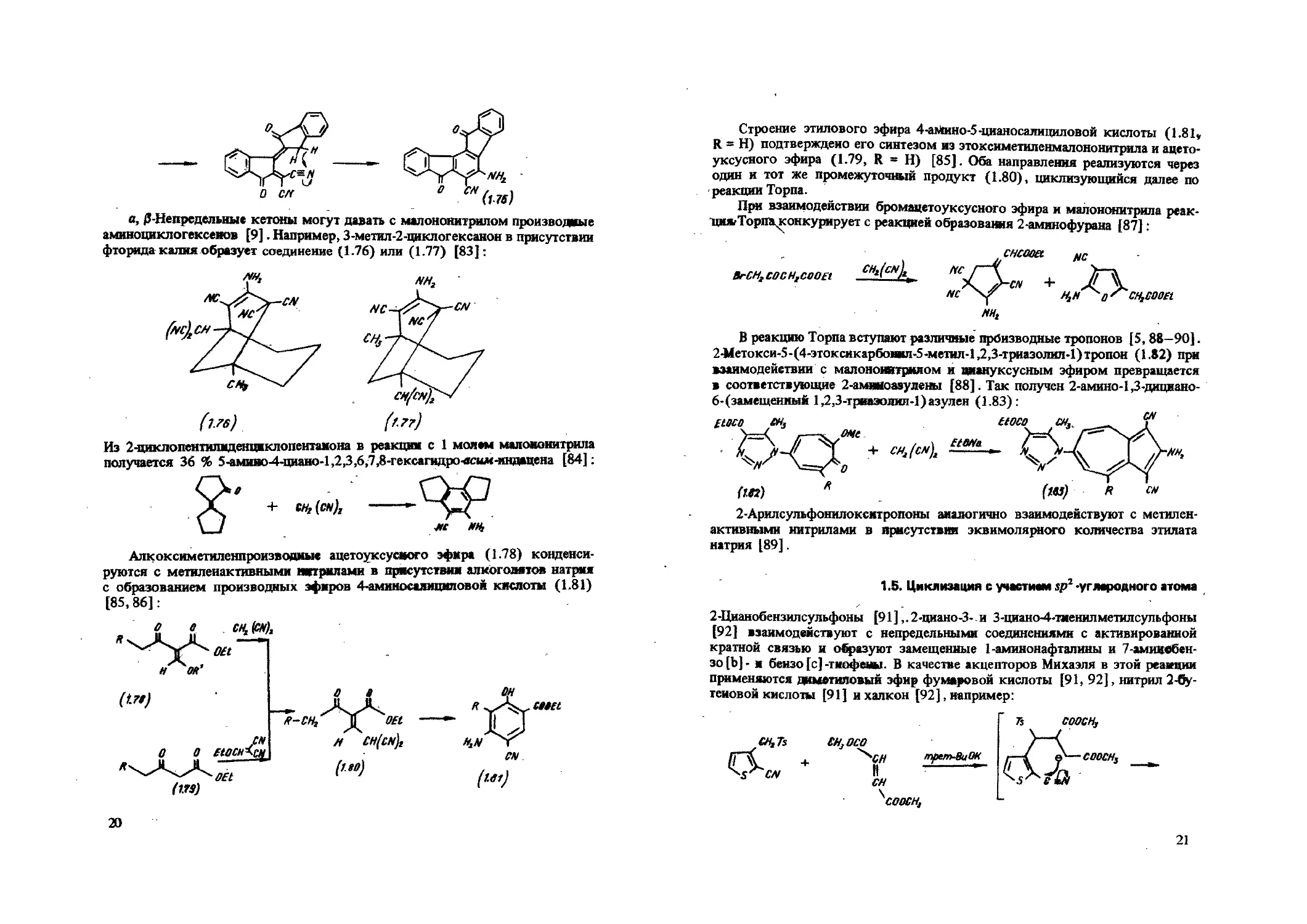
a, p-Непределыам кетоны могут давать с малононитрилом производные аминоциклогексенов [9]. Например, З-метил-2-циклогексанон в присутствии фторида калия образует соединение (1.76) или (1.77) [83]:
Из 2-щтклопентилвденциклопентамона в реакции с 1 молем малононитрила получается 36 % 5^мияо4-циано-1,2,3,6,7,8-гексагндро-ясил<-мндацена [84]:
Алкоксиметиленпроизводиые ацетоуксусного эфира (1.78) конденсируются с метиленактивными нитрилами в присутствии алкогодятов натрия с образованием производных эфиров 4-аминосалициловой кислоты (1.81) [85,86] :
20
Строение этилового эфира 4-амино-5 -цианосалициловой кислоты (1.81, R = Н) подтверждено его синтезом из этоксиметиленмалононитрила и ацетоуксусного эфира (1.79, R = Н) [85]. Оба направления реализуются через один и тот же промежуточный продукт (1.80), циклизующийся далее по реакции Торпа.
При взаимодействии бромацетоуксусного эфира и малононитрила реак-цилТорпа^конкурирует с реакцией образования 2-аминофурана [87]:
BrCHfCOCHgCOOEt
В реакцию Торпа вступают различные производные тропонов [5,88-90]. 2-Метокси-5-(4-этоксикарбоиил-5-метил-1,2,3-триазолил-1)тропон (1.82) при взаимодействии с малононитрилом и аяануксусным эфиром превращается в соответствующие 2-аминоазулены [88]. Так получен 2-амино-1,3-дициано-6-(замещенный 1,2,3-гриаэолил-1) азулен (1.83):
2-Арилсульфонилокситропоны аналогично взаимодействуют с метилен-активными нитрилами в присутствии эквимолярного количества этилата натрия [89].
1.5. Циклизация с участиям sp1 -углеродного атома
2-Цианобензилсульфоны [91],. 2-циано-З-. и З-циано-4-тменилметилсульфоны [92] взаимодействуют с непредельными соединениями с активированной кратной связью и образуют замещенные 1-аминонафталины и 7-аминебен-зо [Ь]- и бензо [с]-тиофены. В качестве акцепторов Михаэля в этой реакции применяются димотиловый эфир фумаровой кислоты [91, 92], нитрил 2-бу-теиовой кислоты [91] ихалкон [92], например:
CH,Ts
ГСП
ен3осо
'"'•'•CH mptm-BuQK
II --------------
сн \оосн,
21
вн
-в, - TsH
В качестве нуклеофильного центра может выступать атом углерода кратной связи. В известной мере такие процессы напоминают реакцию Риттера [93]. Их можно разделить на две группы: циклизация непредельных нитрилов [7] и циклизация ароматических соединений [7,13].
Непредельные нитрилы,, производные циклических углеводородов, содержащих фрагмент 1,1-дициано-1,4-пентадиена (1.84), циклизуются в присутствии серной кислоты при комнатной температуре в соответствующие 1,2-дицианоанилины (1.85) [94]:
3,3-Дициано-2-пропенилпроизводные ароматических углеводородов (1.86) в серной кислоте на холоду циклизуются в 1-аминонафталии (1.89) (табл. 1.4) [95]. В случае соединений (1.87) с алкильными* заместителями в положении 3 ароматического ядра получены смеси 1-аминонафталинов (1.89) — (1.91) [96]. Симметрично замещенные нитрилы (1.88), например нитрил 3-метил-4-(4-толил)-2-циано-2-бутеновой кислоты (1.88, R = СН3), при циклизации не образуют изомеров [97] :
(}.Вб) в’^в’^н (1.87) R'=CH3,R**H
(г.вй) В’—Н, В1 - СН3
(1.89) R’=B‘^H
(l.9O) R,=H,R,=CH3
(1.91,aj В’-Н, R’=CH} (191,5) B'=CH3,R^H
22
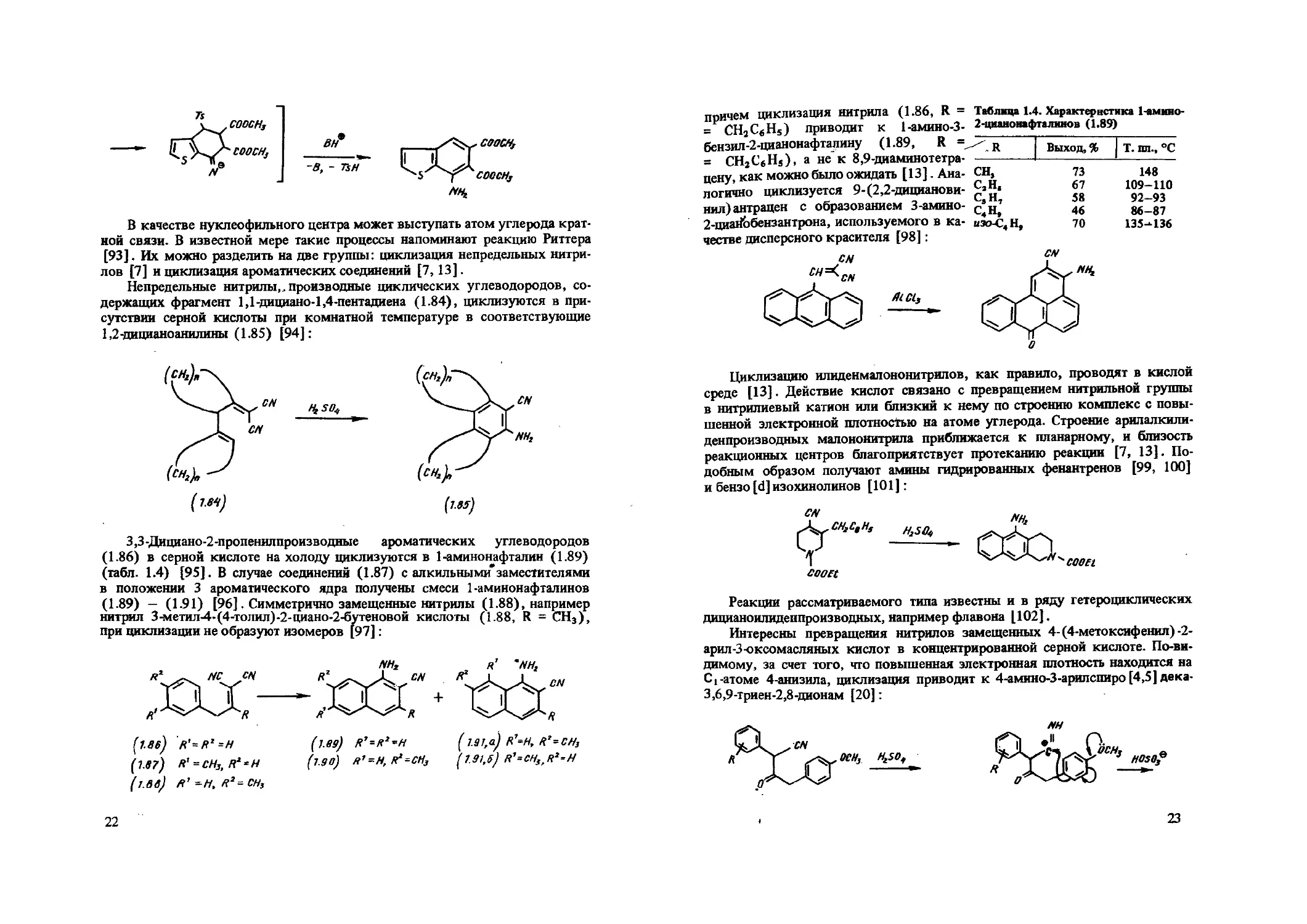
причем циклизация нитрила (1.86, R = Таблица 1.4. Характеристика 1-амнно-= СН3С«Н5) приводит к 1-амино-3- 2-цнанонафталинов (1.89) бензил-2-цианонафтапину (1.89, R = = CH2CeHs), а не к 8,9-диаминотетрацену, как можно было ожидать [13]. Аналогично циклизуется 9-(2,2-дициановинил) антрацен с образованием 3-амино-З-циайЬбензантрона, используемого в качестве дисперсного красителя [98]:
CN СП AlCls
R | Выход, %
T. пп., °C
148 109-110 92—93 86-87 135-136
Циклизацию илиденмалононитрилов, как правило, проводят в кислой среде [13]. Действие кислот связано с превращением нитрильной группы в нитрилиевый катион или близкий к нему по строению комплекс с повышенной электронной плотностью на атоме углерода. Строение арилалкили-денпроизводных малононитрила приближается к планарному, и близость реакционных центров благоприятствует протеканию реакции [7, 13]. Подобным образом получают амины гидрированных фенантренов [99, 100] и бензо [d] изохинолинов [101]:
H2S0f,
cooet
Реакции рассматриваемого типа известны и в ряду гетероциклических дицианоилиденпроизводных, например флавона [102].
Интересны превращения нитрилов замещенных 4-(4-метоксифенил)-2-арил-3-оксомасляных кислот в концентрированной серной кислоте. По-видимому, за счет того, что повышенная электронная плотность находится на С1-атоме 4-анизила, циклизация приводит к 4-амино-З-арилспиро [4,5] дека-3,6,9-триен-2,8-дионам [20]:
МН
23
1.6. Реакции рециклизации
Циклизация Торпа может сопутствовать рециклизации различных соединений. Так, производные циклопропана [5,6] и циклопропена [ЮЗ] рециклизуют-ся под действием анионов метилеиактивных нитрилов в замещенные аминоциклопентены [5,6] и аминоциклопентадиены, например [103]:
2Н-Циклогепта [Ь] фураноны (1.92) [104, 105] и 2-ацетилимино-2Н-цик-логепта[Ь] фураны (1.93) [106] при взаимодействии с мершенактивными соединениями превращаются в аминоазулены (1.94):
(Ю,
г =c/f, сомиг, cooet; рьео, eooet, соосн?.
Однако применение цивкуксусиого эфира ведет к соответствующему 2-окси-азулену, а выходы аминоазуленов (1.94) значительно снижаются.
5-Ацетил-4-метил- или 5-ацетил-2,4-диметилоксазоп в мягких условиях рециклизуется в присутствии малононитрила в 5-амино-2-ацетил-1,1,4-три-циано-3-метилциклапентадиен [107]:
24
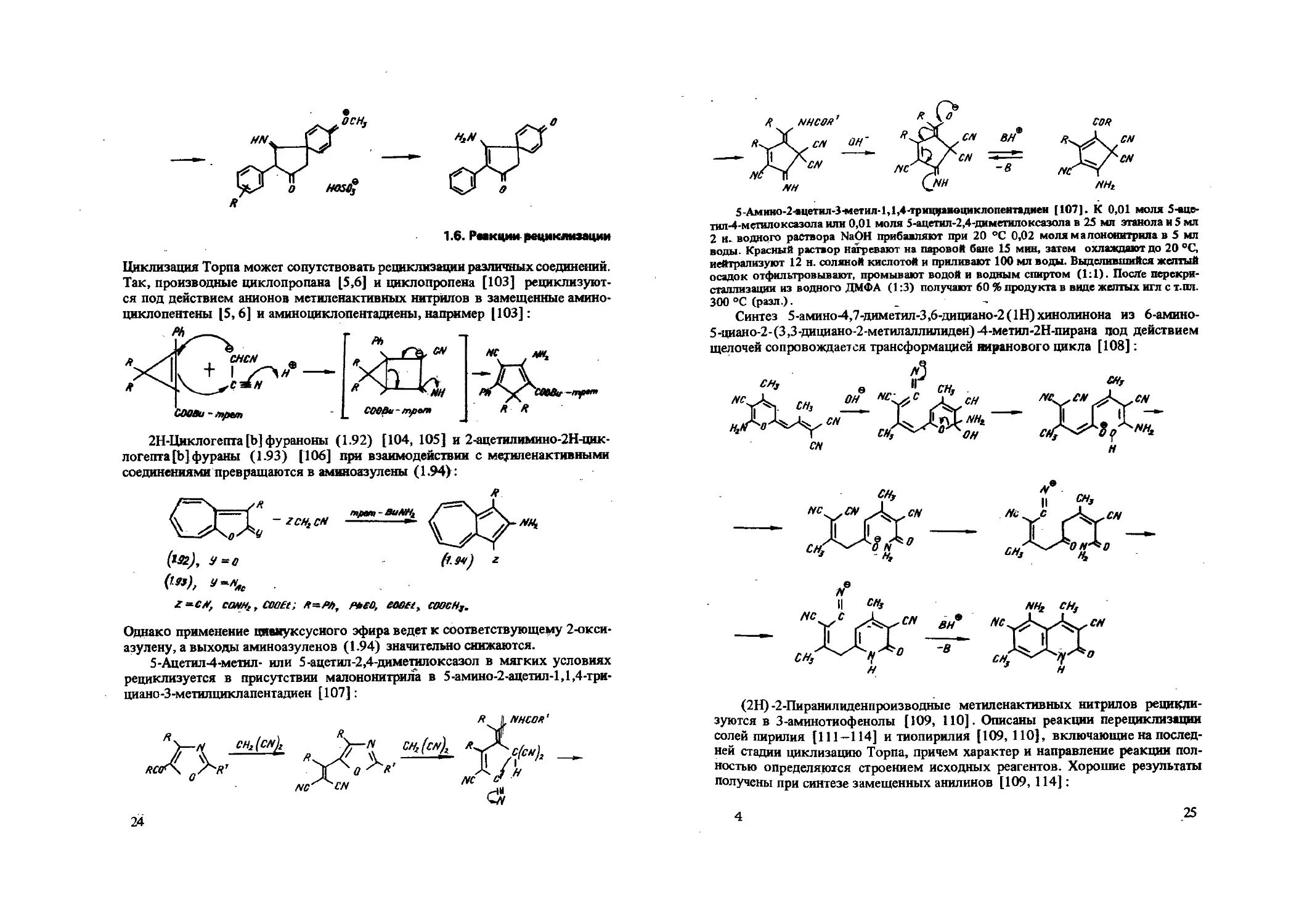
nhcs/i’
5-Дмино-2-яцетил-3-метил-1,1,4-триц1рш<»циклопентадиен [107]. К 0,01 моля 5-вце-тил-4-метилоксазола или 0,01 моля 5-ацетал-2,4-диметилоксазола в 25 мл этанола и 5 мл 2 н. водного раствора NaOH прибавляют при 20 °C 0,02 моля малононитрила в 5 мл воды. Красный раствор нагревают на паровой бане 15 мин, затем охлаждают до 20 °C, нейтрализуют 12 н. соляной кислотой и приливают 100 мл воды. Выделившийся желтый осадок отфильтровывают, промывают водой и водным спиртом (1:1). После перекристаллизации из водного ДМФА (1:3) получают 60 % продукта в виде желтых игл с т.пл. 300 °C (разл.). _ • ,
Синтез 5-амино-4,7-диметил-3,6-дициано-2(1Н)хинолинона из 6-амино-5-циано-2-(3,3-дициано-2-метилаллилиден)-4-метил-2Н-пирана под действием щелочей сопровождается трансформацией пиранового цикла [108]:
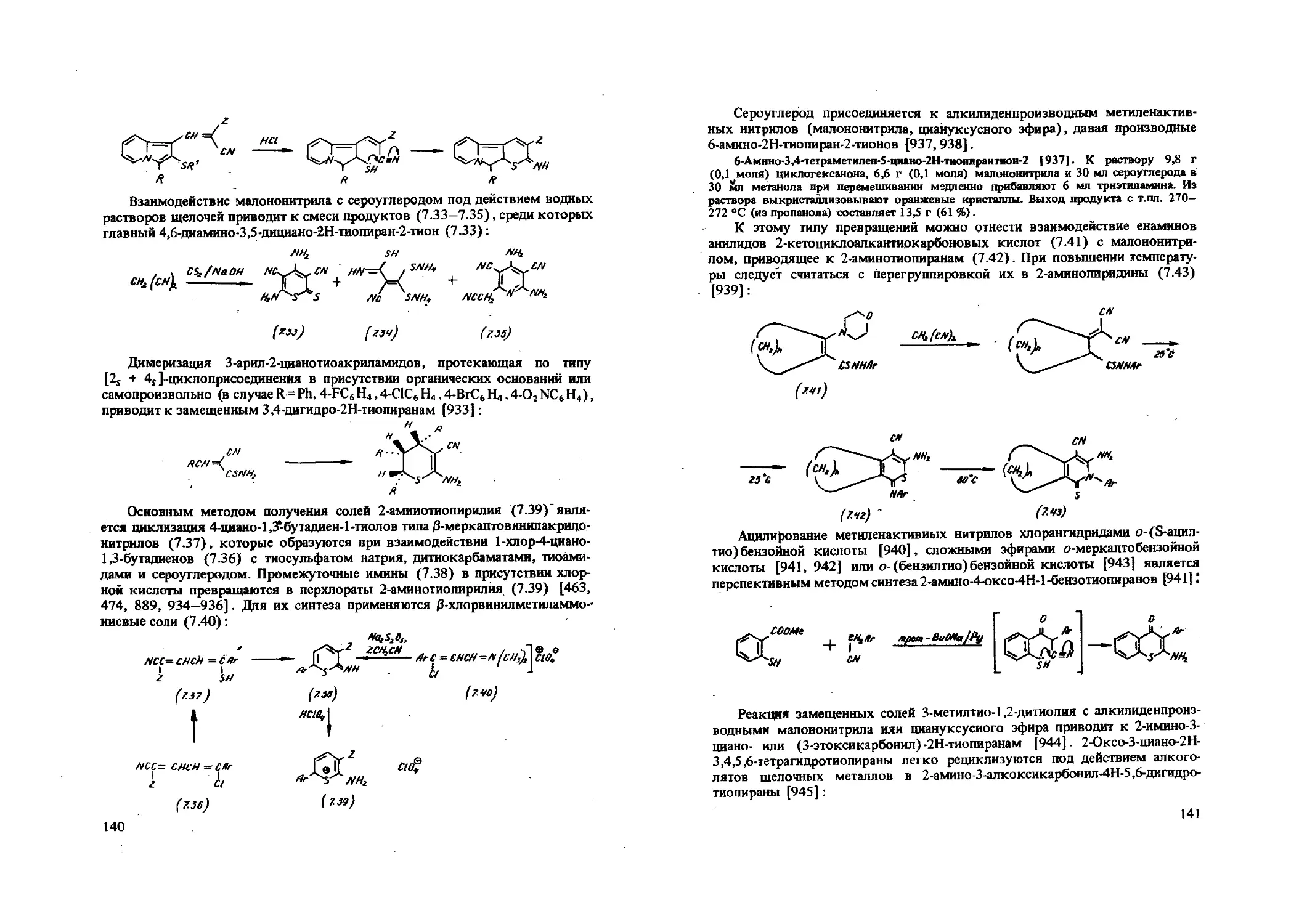
(2Н)-2-Пиранилиденпроизводные метилеиактивных нитрилов рецикди-зуются в 3-аминотиофенолы [109, ПО]. Описаны реакции перециклизации солей пирилия [111—114] и тиопирилия [109,110], включающие на последней стадии циклизацию Торпа, причем характер и направление реакции полностью определяются строением исходных реагентов. Хорошие результаты получены при синтезе замещенных анилинов [109, 114]:
4
25
X
X
З-Амшю-бмегяш-гЛ-ДяцмшсН-этшпяофеяол [110]. В нагретый до 35-40 °C раствор из 0,5 г натрия или 0,3 г КОН и 30 мл метанола добавляют при перемешивании 10 ммолей 2-амино-3-циано-6-тиопиранилиденциануксусного эфира (или 10 ммолей г-вмино-З-циано-б-тиопиранилиденцианацетамнда). Реакционную массу перемешивают до полного растворения компонентов, через 12 ч разбавляют 30 мл воды и подкисляют концентрированной соляной кислотой. Осадок отфильтровывают, промывают водой. Получают 92 % продукта с т.пл. 210-213 °C (из уксусной кислоты).
Если в обложении 4 пирилиевой соли содержится метоксильная группа, то она может замещаться различными нуклеофильными остатками. В частности, так можно получить замещенные м-фенилендиамины [113]. Иначе взаимодействуют соли пирилия с циануксусным эфиром. Следует отметить, что [Ь] -конденсированные сопи пирилия также вступают в эту реакцию. Например, перхлорат 5Н-ивдено [2,1-Ь] пирилия образует 3-амино-2-бензоил-1-фенил-4-цианофлуорен [115]:
Известны реакции трансформации циклопропанов в 1-амино-2-циано-циклопеитены, протекающие под действием нуклеофилов [6,72].
3-Амнно-2-бензоил1-фенил-4-цианофлуорен [115]. Смесь 2,1 г (0,005 моля) перхлората 2,4-дифеиил-5Н-индено-[ 2,1-Ъ] пирилия, 1,0 г (0,015 моля) малононитрила и 2 мл пиперидина в 10 мл ацетонитрила нагревают с обратным холодильником 2 ч. После охлаждения осадок отфильтровывают, перекристаллизовывают из смет пиридина с метиловым спиртом. Получают 89 % продукта с т.пл. 229-230 °C.
Амины карбоциклического ряда, получаемые циклизацией нитрилов, применяются в различных областях тонкого органического синтеза. Так, ароматические амины предложены в качестве полупродуктов азокрасителей [56, 77] и красителей для полиэфирных волокон [98]. 1 -Амино-1 -циклогек-сен-3-он, выделяемый при циклизации нитрила 5-оксогексановой кислоты, служит исходным продуктом в синтезе м-аминофенола и 1,3-циклогексан-диона [40]. Соединения этого ряда являются эффективными отвердителями эпоксидных смол [45,46]
ГЛАВА 2. СИНТЕЗ ГЕТЕРОЦИКЛИЧЕСКИХ АМИНОВ
При циклизации нитрилов, содержащих в цепочке атомов между реакщюн-ными центрами один или несколько гетероатомов, получаются амины гетероциклического ряда. Реакцию могут ограничивать устойчивость элементоорганических нитрилов и способность их вступать в различные превращения в условиях циклизации Торпа, определяемые прежде всего наличием гетероатома. Общие закономерности реакции Торпа будут справедливы и при синтезе аминогетероциклических соединений. Однако характер такого взаимодействия определяется препаративными возможностями получения исходных нитрилов. Часто такие возможности в случае гетероциклических аминов значительно тире, чем в собственно реакции Торпа. Циклизацией нитрилов синтезированы всевозможные пяти-, шести- и семичленные гетероциклические амины с одним, двумя и большим числом гетероатомов в цикле, а также многие конденсированные амины. При этом сохраняются общие закономерности циклизации нитрилов, рассмотренные в первой главе. Все реакции классифицированы по характеру образования цикла.
* 2.1.3-Аминофураны
C-Нуклеозиды фуранового ряда можно получить конденсацией а-бром-0-гли-козилакрилонитрила с производными гликолевой кислоты [116]:
где R - 1,2-О-иэопропилиден-3-О-метил-а-1>ксилофуранозил-4. Реакция ацетонциангидрина с трлис4,4-диметокси-2-бутеналем в присутствии триэтила-мина ведет к 3-имино-2,2-дИметил-4-(2,2-диметоксиэтил)тетрагидрофурано-ну-5 [117].
Однако более детально синтез 3-аминофуранов разработан применительно к конденсированным системам и основан на О-алкилировании галогенал-килами (2.4) некоторых 1,2-оксинитрилов (2.1-2.3)
-нх
(2.S.2.S)
ХСНг1. li-ч)
(zs) (г.ге- г.гг)
4х
(2.1, 2.5, 2.9, 2.10) A = -CH-CHCH-CH- (C4H4) или RC4H3: (2.2, 2.11) A = -SCH-CH-;
(2.3,2.6,2.12) A = —N—CHCH—CH— (C3H3N) или RC3H2N; .
(2.4—2.6, 2.10-2.12) Z = COCH3 (a) ; COOR (6),CONH2 (b),CN (rj NO, (д).
Метод дает хорошие результаты при использовании алкилирующих агентов, содержащих достаточно сильный электроотрицательный заместитель Z (2.4, а—д). Большинство промежуточных соединений (2.5), (2.6) выделены. В Присутствии оснований (алкоголятов щелочных металлов, поташа, триэтиламина) они образуют анион (2.7), циклизация которого протекает путем внутримолекулярного взаимодействия реакционных центров. Анион (2-8) переходит в имин (2.9) и при наличии подвижного атома водорода в положении 2 стабилизируется в виде аминов (2.10)-(2.12). Этим методом получены 3-аминобензо [Ь] фураны (2.10) [118—128], тиено[3,2-Ь]фураны (2.11) [129, 130] и 3-аминофуро [2,3-Ь] пиридины (2.12) [131, 132].
3-Амино-2-згоксикарбоиилбеизо[Ь) фуран [ 123 J. К раствору этилата натрия, полученному из 0,05 г натрия и 10 мл абсолютного спирта, прибавляют 1 г этилового эфира 2-цианофенилоксиуксусной кислоты. Смесь нагревают 2 ч при 50 °C, затем разбавляют 50 мл воды со льдом. Выделившийся осадок отфильтровывают и перекристаллизовывают йз лигроина. Получают 0,72 г (72 %) продукта с т.пл. 77-78 °C.
Интересно, что 2-хлор-6-нитробензонитрил реагирует с оксиацетонитрилом в присутствии гидроксида или гидрида лития [128] и обменивает не галоген, а нитрогруппу на цианометоксйльную с образованием простого эфира (2.5,a, R = 6-CI), который под действием поташа циклизуется по Торпу в 2-циано-4-хлорбензо [Ь] фуран. Использование в качестве катализаторов едкого натра или кали не дает желаемых результатов вследствие побочных реакций нитрильной группы. При алкилировании замещенных 3-циано-2(1Н)-пиридонов а-галогенкетонами следует считаться с конкурирующей реакцией образования N-алкилпроизводныхШиридона [132].
2.2. З-Амииопирролы
Если в цепи а-динитрила содержится атом азота, то при циклизации Торпа может образоваться 3-аминопиррол или его гидрированный аналог. Этот тип реакций иллюстрируется циклизацией нитрила №(2-цианоэтил)аминоуксус-иой кислоты в 3-амино-4-циано-2,5-дигидропиррол [133]. (N-Цианометил)-ациламиды (2.13), получаемые из цианометиламинов и дикетена, циклизуются под действием триэтиламина или метилата натрия в 3-аминопирроли-доны (2.14) [134]:
RCoch2 ы
(2.и)
28
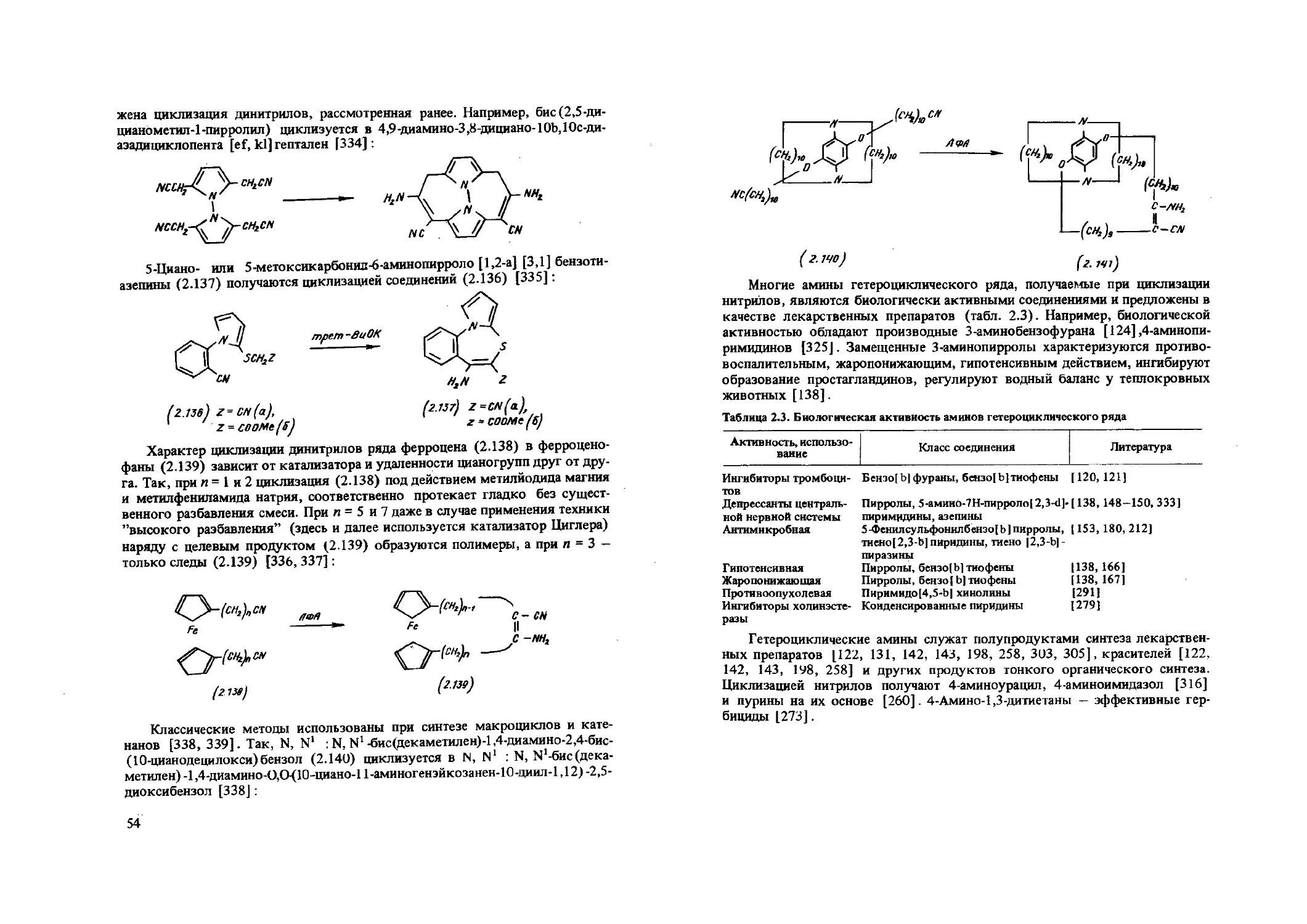
Метод представляет определенный интерес, так как исходные продукты можно синтезировать простым алкилированием хлорацетонитрилом и акрилонитрилом амидов карбоновых кислот или ацилированием аминоацето* нитрилов.
Взаимодействие геминальных аминонитрилов (2.15) с 1,3-дикарбониль-ными соединениями 1135—141] или ацетиленами [135, 136] является препаративным методом получения 3-аминопирролов (2.19), причем промежуточные аминонитрилы типа (2.16), находящиеся в равновесии с таутомерными формами (2.17) и (2.18), выделены и внутримолекулярным превращением циклизованы в пирролы (2.19) :
HCHCN I
НН,
(Сг. is)
Я COCH, ,1 ясо
ТзОИ
NHC-CHCOK
I, К
" — Я CHEN
N= С СН, СОЯ* 1 I, я
(2.1?)
' - ЯССЫ II НСНСН,СОЯ‘
I, Я
(2.T9)
Следует отметить, что при получении 3-аминопирролов из енаминов, синтезированных на основе ацетоуксусного эфира [140], 1,3-циклогексан-диена [139, 141], амида [140] и трет-бутилового эфира аминоциануксусной кислоты [139, 141], необходимо использовать алкилирование промежуточных енаминов бромуксусным эфиром, метилвинилкетоном или замещенными акриловой кислоты. Например, енамин (2.20) дает имин (2.21), превращающийся при обработке соляной кислотой в 3-аминотетрагидроиндол (2.22) [139]:
о
Вт с н, сооп, ЯОЛ/а
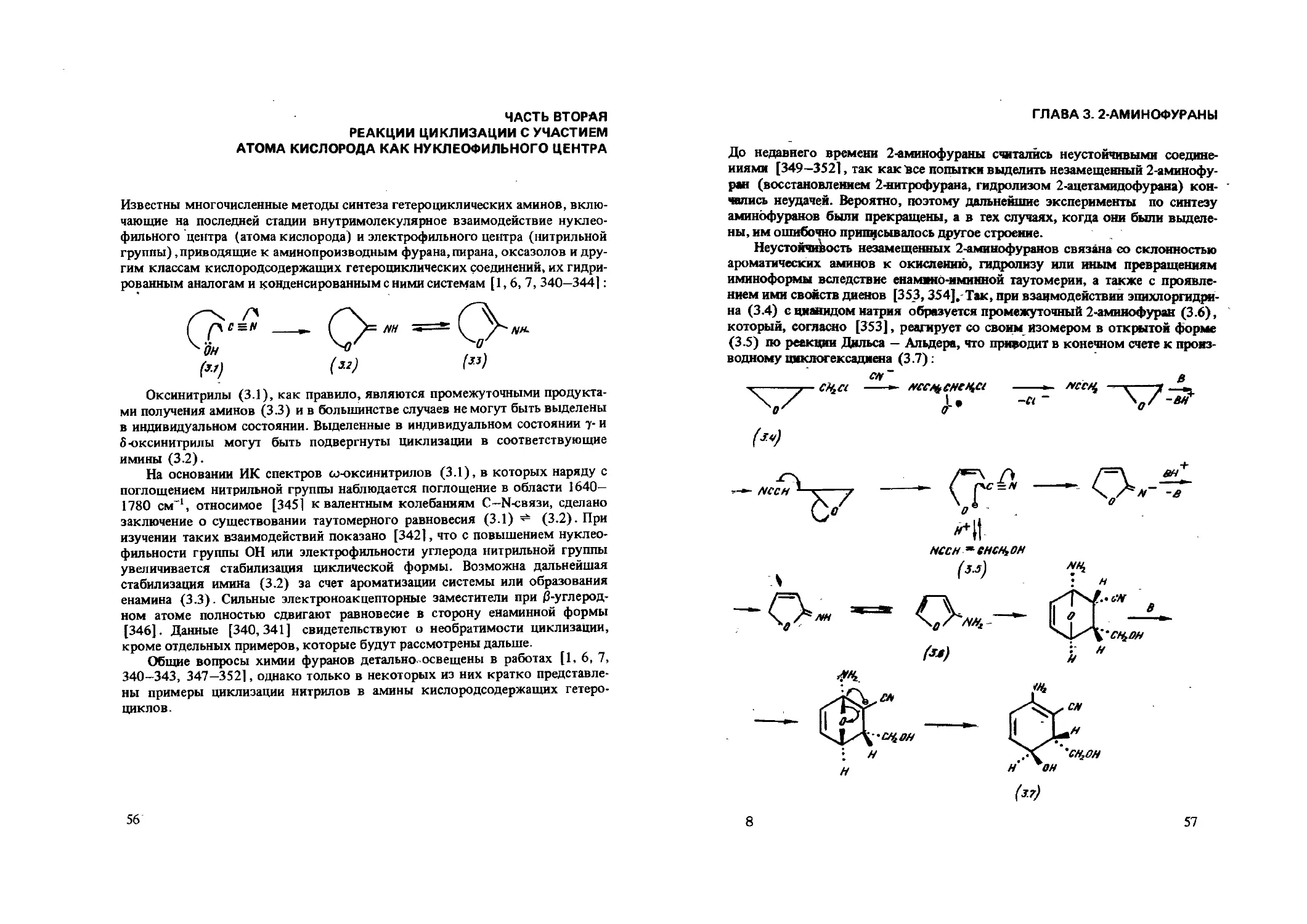
NHCHCOOBu-mpetn
CN
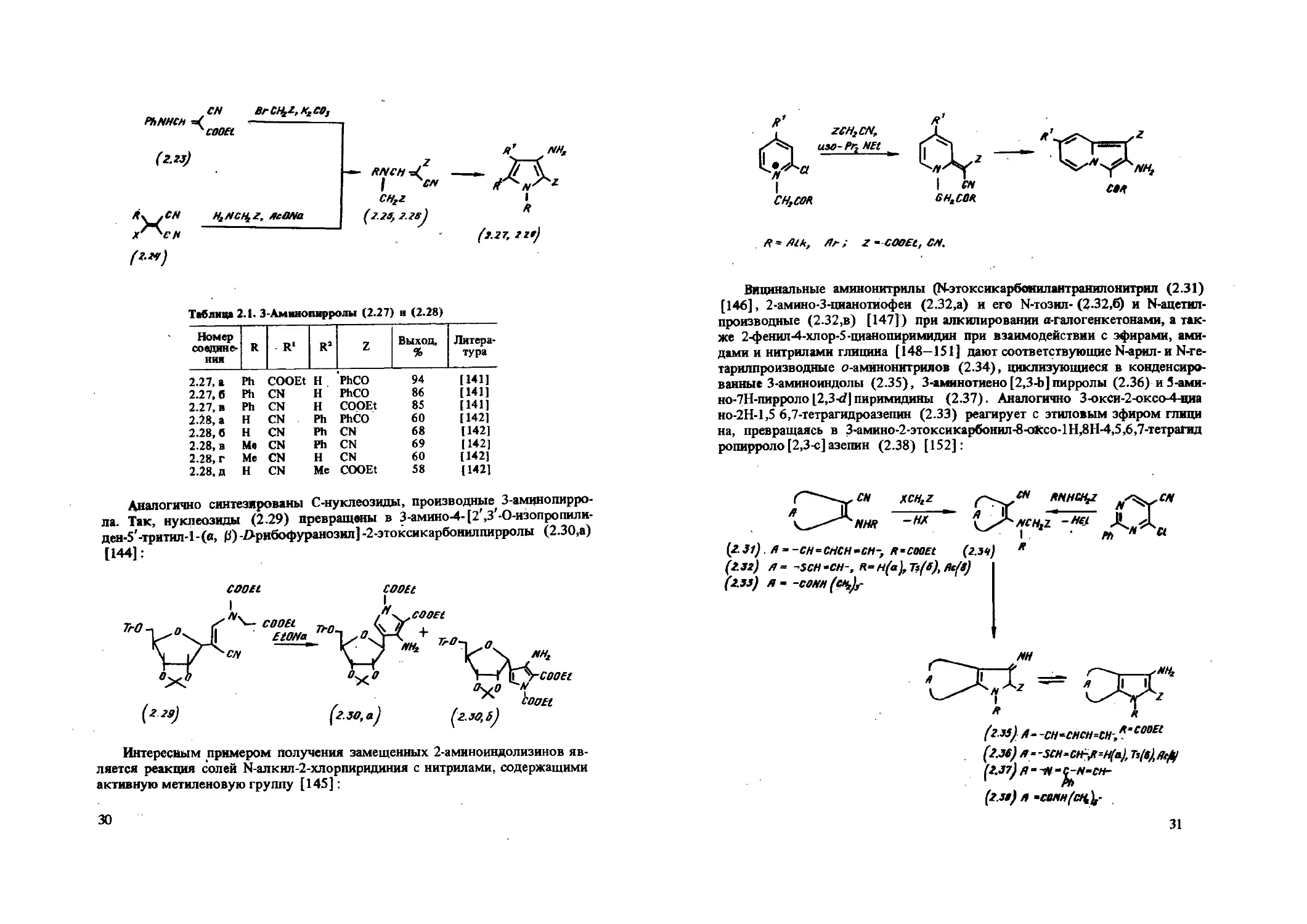
N-Замещенные аминонитрилы (2.26), легко циклизующиеся в присутствии этилата натрия или триэтиламина в 3-аминопирролы (табл. 2.1), получают бромированием эфиров а-циано-0-аминоакриловой кислоты (2.23) [142] или конденсацией акрилонитрилов (2.24), содержащих в /3-положе-нии нуклеофильную группу, с эфирами глицина (2.25) [149]:
29
CN PhNHCH =< ^cooet
BrCt^,XtCOj
Г™)
Таблица 2.1. З-Амииопирролы (2.27) н (2.28)
Номер соединения R R‘ R1 Z Выход, % Литература
2.27, а Ph COOEt H PhCO 94 [Ml]
2.27, б Ph CN H PhCO 86 [141]
2.27, в Ph CN H COOEt 85 [141]
2.28, а Н CN Ph PhCO 60 [142]
2.28, б Н CN Ph CN 68 [142]
2.28, в Me CN Ph CN 69 [142]
2.28, г Me CN H CN 60 [142]
2.28, д Н CN Me COOEt 58 [142]
Аналогично синтезированы С-нуклеозиды, производные 3-аминопирро-ла. Так, нуклеозиды (2.29) превращены в 3-амино-4-[2',3'-О-изопропили-ден-5'-тритил-1-(в, 0) -D-рибофуранозил]-2-этоксикарбонилпирролы (2.30,а) [144]:
COO£t
COOtt
Интересным примером получения замещенных 2-аминоиндолизинов является реакция солей М-алкил-2-хлорпиридиния с нитрилами, содержащими активную метиленовую группу [145]:
30
я1
I СНгСОН
гСНгСМ, uso-Ptj N£t
£33
K=Atk, flr; Z - COOEt, СЯ.
Вицинальные аминонитрилы (N-этоксикарбонилантранилонитрил (2.31) [146], 2-амино-З-цианотиофеи (2.32,а) и ere N-тозил- (2.32,6) и N-ацетил-производные (2.32,в) [147]) при алкилировании а-галогенкетонами, а также 2-фенил-4-хлор-5-цианопиримидин при взаимодействии с эфирами, амидами и нитрилами глицина [148—151] дают соответствующие N-арил- и N-re-тарилпроизводные о-аминонитрилов (2.34), циклизующиеся в конденсированные З-аминоиндолы (2.35), 3-аьщнотиено [2,3-Ь] пирролы (2.36) и 5-амино-711-пирроло [2,3-rf] пиримидины (2.37). Аналогично 3-окси-2-оксо-4-циа но-2Н-1,5 6,7-тетрагидроазепин (2.33) реагирует с этиловым эфиром глици на, превращаясь в 3-амино-2-этоксикарбонил-8чйссо-1Н,8Н-4,5,6,7-тетраГид ропирроло [2,3-с] азепин (2.38) [152]:
MUCH?
{£31) я =--сн’=снсн~сн-г я*сооа (г.зч) к
(2.32) -SCH-CH-, К=Н(а),Тз(в),/к(3)
(2.33) Я - -CONHfa),-
(2.35) a. -cH‘CHcn=cH-/'eooEt
(2М)я-5СН~аь^Н(о.),Ъ(в)я^
(2.37)
(2.33) Я •сояи(сц)г
31
3-Амино-2-бензоил-1-этоксикарбоннлиидол [146]. К охлажденному перемешива-мому раствору 38 г (0,2 моля) N-этоксикарбонилантранилоиитрила в 400 мл диме-тилформамида прибавляют по частям 8,4 г (0,2 моля) 57 %-ного гидрида натрия в масле, а через 15 мин -40 г (0,2 моля) фенацилбромида и оставляют при перемешивании и комнатной температуре иа ночь. Затем смесь выливают в воду со льдом и экстрагируют этилацетатом. Экстракт промывают водой, концентрируют досуха и приливают 1800 мл эфира. Раствор упаривают до 1 л, фильтруют горячим и снова упаривают до 600 мл. После охлаждения выделившиеся желтые кристаллы отфильтровывают и получают 27,2 г (44 %) продукта с т.пл. 131-133 °C (из ацетонитрила).
4,5-Диамино-7-метил-2-метилтио-6-циаио-7Н-лирроло[2,3-d]пиримидин [ 149].Крас-твору 0,2 г натрия в 30 мл абсолютного этанола прибавляют 2,3 г 6-амино-2-метилтио-5-циано-4-( (цианометил) метиламино] пиримидина. Смесь кипятят 1,2 ч. После охлаждения осадок отфильтровывают и получают 1,8 г (79 %) продукта с т.разл. 238-240 °C. После перекристаллизации из абсолютного этанола т.пл. 240-242 °C (разл.).
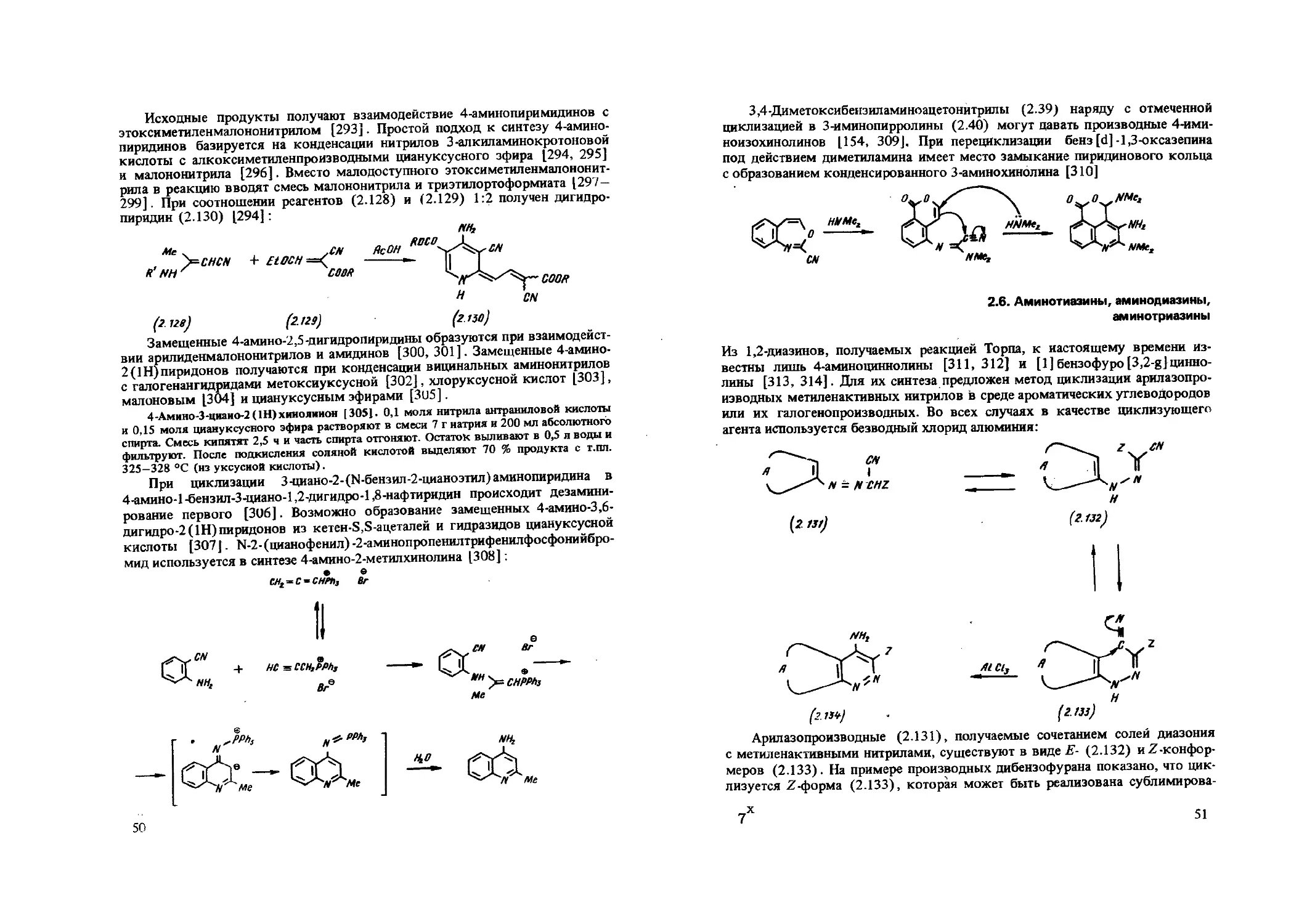
Описана циклизация нитрилов с участием sp2 -углеродного атома. Если в цепи атомов между реакционными центрами содержится атом азота, то получаются 3-аминопирролы и их гидрированные аналоги [153—156]. Так, 3-амино-2-арил-5-фенилсульфонилиндолы синтезированы циклизацией N-ци-анометил-4-арилсульфониланилинов в концентрированной серной кислоте [153]. Интересно, что в таких же условиях бензиламиноацетонитрилы (239) дают спиросоединения (2.40) [154]:
I
NC- с -Л-Ы2 А- ОМе
R* Я* оме
(239)
fitSOb
Циклизация протекает тем легче, чем больше нуклеофильность sp1 -углеродного атома, например в случае соединения (2.39) и 1 - (2-циановинил) пирролов [155]
2-Метилтио-З-этоксикарбонилтиазоло [2,3-а] изохинолин (2.41) рецикли-зуется с циануксусным эфиром или малононцтрилом в присутствии поташа или гидроксида калия в соответствующие 2-амино-З-этоксикарбонилпиррв-ло [2,1 -а]изохинолины (2.42) [157]:
+ ZCH2CN
г = COOEt, CN.
32
Изучены реакции циклизации нитрилов в производные 3-аминопирро-лов [135 151, 156, 158].
2.3. 3-Аминотиофены
Синтез замешенных 3-аминотиофенов и конденсированных с ним систем по реакции Торпа исследован лучше, чем фуранов и пирролов, что связано с большей доступностью исходных реагентов [5, 159-161]. Известно много методов получения 3-имино- (2.45) или 3-аминотиофенов (2.46), конечной стадией которых является внутримолекулярное взаимодействие метиленовой или метиновой группы (2.43—2.44) с нитрильной:
В большинстве случаев выделить соединения со структурой Z-метилтио-нитрила (2.43) нельзя из-за их легкой циклизации в условиях реакции. Мы рассмотрим методы, которые могут привести к соединениям со структурой (2 43). При этом следует учитывать то обстоятельство, что речь идет об активированной метиленовой или метиновой группе, связанной с сильным электроноакцепторным заместителем Z, так как в противном случае циклизация подобных соединений затруднена или вообще невозможна.
2.3.1. Конденсация вицинальных галогенонитрилов с меркаптанами
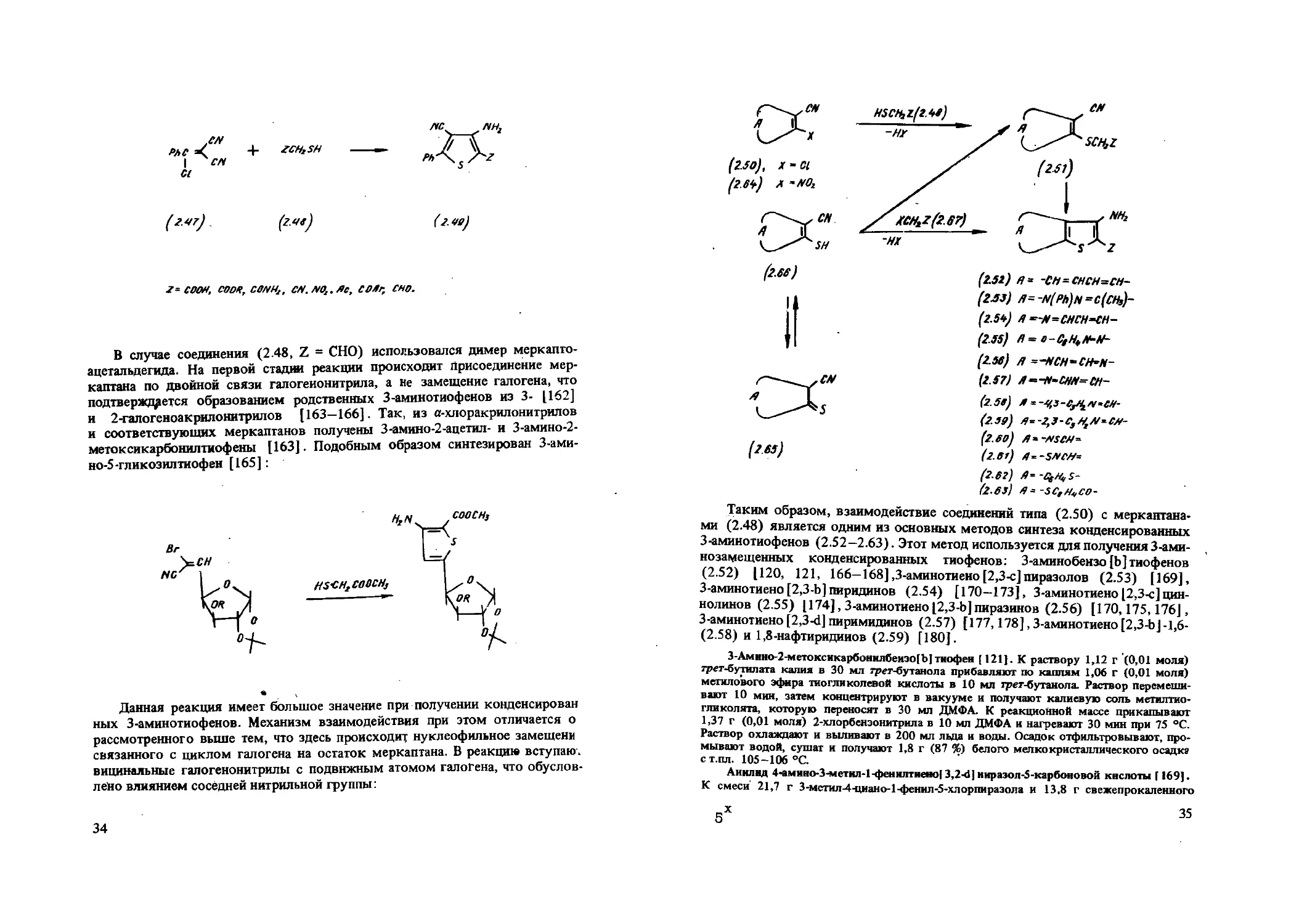
Один из основных методов получения 3-аминотиофенов основан на взаимодействии вицинальных галогенонитрилов с меркаптанами, содержащими метиленовую группу, активированную электроотрицательным заместителем Z. Например, в результате реакции а-хлорбензилиденмалононигрила (2.47) с меркаптанами (2.48) синтезированы замещенные З-амино-5-фенил-4-цианотиофены (2.49) [162]:
5
33
,cn
РЛС < + zch,sh
| CN
С1
(ж)
(2.00)
(2.УС)
2= COM, COOP, CONHt, М.МЦ.Лс, СОЛг, СНО.
В случае соединения (2.48, Z = СНО) использовался димер меркаптоацетальдегида. На первой стадии реакции происходит присоединение меркаптана по двойной связи галогеионитрила, а не замещение галогена, что подтверждается образованием родственных 3-аминотиофенов из 3- [162] и 2-галогеноакрилонитрилов [163—166]. Так, из а-хлоракрилонитрилов и соответствующих меркаптанов получены 3-амино-2-ацетил- и З-амино-2-метоксикарбонилтиофены [163]. Подобным образом синтезирован 3-ами-но-5-гликозилтиофен [165]:
Данная реакция имеет большое значение при получении конденсирован ных 3-аминотиофенов. Механизм взаимодействия при этом отличается о рассмотренного выше тем, что здесь происходит нуклеофильное замещени связанного с циклом галогена на остаток меркаптана. В реакцию вступаю, вицинальные галогенонитрилы с подвижным атомом галогена, что обусловлено влиянием соседней нитрильной группы:
34
(2.50), X-Cl
(2.6+) А ~ЯОг
(2.52) H* -CH = CHCH=CH-
(2.53) fl=-N(Ph)N=c(CH^~
(2.5+) Я ~-H=CHCH-CH-
(2.55) Я = o-CtH^U-
(2.56) Я =-NCH-CH-H~
(2.57) Я^-Н-СНН^СН-
(2.5f) Я ^-ЦЗ-Bjf^fi^CH-
(2.39) Я=-2,3-В,Н,Н*Ы-
(2.60) fl'-HSCH*
(z.Sf) Я--5ЛСН=
(2.6г) я=
(г.бз) я - -sc,hvco-
№)
Таким образом, взаимодействие соединений типа (2.SO) с меркаптанами (2.48) является одним из основных методов синтеза конденсированных 3-аминотиофенов (2.52-2.63). Этот метод используется для получения 3-ами-нозамещенных конденсированных тиофенов: 3-аминобензо [Ь] тиофенов (2.52) [120, 121, 166—168],3-аминотиено [2,3-с]пиразолов (2.53) [169], 3-аминотиено [2,3-Ь] пиридинов (2.54) [170—173], 3-аминотиено [2,3-с] цин-нолинов (2.55) [174], 3-аминотиено [2,3-Ь] пиразинов (2.56) [170,175,176], 3-аминотиено[2,3-d]пиримидинов (2.57) [177,178], 3-аминотиено [2,3-Ь]-1,6-(2.58) и 1,8-нафтиридииов (2.59) [180].
3-Амино-2-метоксикарбонилбеизо[Ъ] тиофен [121]. К раствору 1,12 г (0,01 моля) трет-бутилата калия в 30 мл трет-бутанола прибавляют по каплям 1,06 г (0,01 моля) метилового эфира тиогли колевой кислоты в 10 мл трет-бутанола. Раствор перемешивают 10 мин, затем концентрируют в вакууме и получают калиевую соль метилтио-гликолята, которую переносят в 30 мл ДМФА. К реакционной массе прикапывают 1,37 г (0,01 моля) 2-хлорбензонитрила в 10 мл ДМФА и нагревают 30 мин при 75 °C. Раствор охлаждают и выливают в 200 мл льда и воды. Осадок отфильтровывают, промывают водой, сушат и получают 1,8 г (87 %) белого мелкокристаллического осадка с т.пл. 105-106 °C.
Анилид 4-амино-3-метил-1-фенилтиено[ 3,2-d] нираэол-5-карбоновой кислоты [169]. К смеси 21,7 г 3-метил-4-циано-1-фенил-5-хлорпиразола и 13,8 г свежепрокаленного
_х 35
о
поташа в 100 мл этанола прибавляют 16,3 г анилида тиогликолевой кислоты. Смесь кипятят при перемешивании 4 ч. Растворитель отгоняют в вакууме, к остатку добавляют 100 мл воды и выделившийся осадок отфильтровывают, промывают водой, спиртом, эфиром й сушат. Получают 26 г (75 %) продукта с т.пл. 223-224 °C (из водного этанола).
С целью увеличения подвижности галогена и облегчения реакции в молекулу исходного галогенонитрйла (2.5.0) вводят дополнительные заместители [166, 167]. Для проведения процесса (2.50) -+ (2.52-2.59) применяют различные катализаторы: алкоголяты и гидроксиды щелочных металлов, поташ, соду, триэтиламин, карбонаты щелочных металлов [169, 171, 174, 175, 177—180]. В то же время существуют ограничения при выборе катализаторов. Так, иногда не удается провести циклизацию в присутствии триэтил-амина и карбоната натрия [172], а применение этилата натрия при синтезе 3-аминотиено [2,3-Ь] пиридинов приводит к образованию побочных продуктов [172].
В: указанных условиях реагируют и о-нитробензонитрилы (2.64), обменивая вначале нитрогруппу на остаток тиогликолевого эфира [181—183], амида [170] или бензилмеркаптана [167], а затем циклизуясь в 3-аминобен-зо [Ь] тиофены. В о-нитробензонитрилах, в том числе с атомом хлора в положении 6 [170, 181—184], нитрогруппа обладает определенной подвижностью и может быть замещена на тиольный или алкилтиоостатки. Следовательно, в о-нитробензонитрилах подвижность нитрогруппы большая по сравнению с подвижностью галогена в о-хлорбензонитрилах. 2-Бензилмеркаптобензо-нитрил может быть окислен до соответствующего диоксида, который в присутствии* метилата натрия превращается в З-амино-2-фенилбензо [Ь]тиофен-1,1-диоксид [184].
3-Амино-2-метоксикарбоиилбеизо[Ь] тиофеи [ 181]. К охлажденному на ледяной бане раствору, содержащему 3b ммолей о-нитробензонитрила и 30 ммолей метилового эфира тиогликолевой кислоты в 60 мл ДМФА, прибавляют по каплям раствор 3 г КОН в 15 мл воды. Смесь перемешивают при охлаждении 30 мин и выливают в ледяную воду. Сырой продукт собирают и перекристаллизовывают из водного спирта. Выход продукта с т.пл. 110-111 °C составляет 72 %. Аналогично получены замещенные 3-амино-2-метоксикарбоиилбензо[Ь] тиофены (табл. 2.2).
Таблица 2.2. 3-Амино-2-метоксикарбонилбеизо[Ь] тио-
фены (2.52, Z =СООСН3)
Заместитель Время пе* ремешива-ния смеси, мин Выход, % Т.пл., °C
4-С1 60 84 111-112
6-С1 60 72 151-152
4-NO2 30 67 132-138
6-NO, 30 47 229-232
4-NOj, 6-CF, 5 80 189-191
Удобную для циклизации структуру можно создать путем замены аминогруппы в (о-аминофенил) тиогликолевой кислоте на цианогруппу по реакции Зандмейера. Однако единственным продуктом реакции оказалась 3-амино-
36
тионафтен-2-карбоновая кислота [185], полученная обработкой основаниями (о-цианофенил) тиогликолевой кислоты [159, 161]. При нагревании З-аминотионафтен-2-карбоновая кислота легко декарбоксилируется в 3-ами-нобензо [Ь] тиофен, охарактеризованный в виде N-ацилпроизводиого [161].
2.3.2. Конденсация 2-меркапто-или 2-тиоксонитрилов с галогенопроизводными метиленактивных нитрилов
3-Аминотиофены образуются при взаимодействии вицинальных меркапто-(2.66) и тирксонитрилов (2.65), способных к таутомерному превращению в тиолы (2.66), с а-галогенопроизводными карбонильных соединений, нитрилов, нитросоединений и других веществ с активной метиленовой группой (2.67). Так, из нитрила /3-меркаптопропионовой кислоты и а-хлоркарбониль-ных соединений получен ряд замещенных 3-аминотиофенов, предложенных в качестве депрессантов центральной нервной системы [186]. Метод представляет препаративный интерес вследствие большей доступности вицинальных меркапто- (2.66) или тиоксонитрилов (2.65) по сравнению с галоген- (2.50) или нитронитрилами (2.64). 3-Амииобензо[Ь] тиофены были получены на основе о-цианотиофенолов [ПО, 187].
Этиловый эфир 3,4-диамино-7-метил-5-циано-6-этилбензо[Ь]тиофен-2-карбоновой кислоты [110]. В растворе этилата натрия, полученном из 0,6 г натрия и 40 мл абсолютного спирта, растворяют 10 ммолей 3-амино-6-мегил-2,4-дициано-5-этилтиофенола и прибавляют 10 ммолей бромуксусного эфира в 30 мл абсолютного этанола. Смесь перемешивают 2 ч при 20-25 °C и разбавляют 100 мл воды. Выделившийся осадок отфильтровывают и перекристаллизовывают из ацетонитрила. Получают 67 % продукта с т.пл. 214-218 °C.
Алкилирование о-цианотиофенола бромацетоуксусным эфиром в присутствии NaOH ведет к 3-аминобензо [Ь] теноил-2-уксусному эфиру, который затем подвергается циклизации в 4ч>кси-1,2-дигидро[1]бензотиено[3, 2-Ь] пиридин-2-он [188].
В синтезе конденсированных 3-аминотиофенов чаще всего используют 3-цианазол- или азин-2-тионы (2.65), алкилированием которых получают 2,3-, 3,4- или 4,5-алкилтионитрилы (2.51). Последние при обработке спиртовым или диметилформамидным раствором щелочи либо алкоголятов щелочных металлов с высоким выходом дают 3-аминотиофены, конденсированные с пиразолом, изотиазолом, пиридином, пиримидином и другими гетероциклами. Легкость циклизации нитрилов (2.51) зависит от природы заместителя Z и изменяется в следующем ряду: COAr > CN > COOR > CONH2 > > СООН > Аг. Нитрилы (2.51) можно циклизовать, не выделяя из реакционной среды.
Алкилирование 2-тионов (2.65) галогенидами (2.67) применяется при синтезе 4-аминотиено [3,24] пиразолов (2.53) [189], 4-аминотиено [2,3-с] -(2.60) [190—193],4-аминотиено[3,2ч/]-(2.60) [192—195] и4-аминотиено[3, 2-с]изотиазолов (2.61) [195], 3-аминотиено[2,3-Ь]пиридинов (2.54) [196— 208], 5-аминотиено [2,3-d] пиримидинов (2.57) [209—211],3-аминотиено [2,
37
З-b] пиразинов (2.56) [212], 3-аминотиено [2,3-Ь]бензотиофенов (2.52) [213], 3-амино-4^-дигидротиено [2,3-Ь] хинолинонов4 (2.62) [214], 3-ами-нотиено [2,3-Ь] тиохромонов4 (2.63) [214,215].
Изучено [207, 208] взаимодействие некоторых замещенных кетогалогенкарбоновых кислот с циантиоацетамидом и показано, что реакция тиоамида (2.69) с ацетилхлорпировиноградным эфиром (2.68), протекающая через стадии образования пиридинтиона (2.70) и его S-алкилированного производного (2.71), с хорошим выходом приводит к 3-амино-2-ацетил-6-метил-5-хлор4-этоксикарбонилтиено [2,3-Ь] пиридину (2.72) :
coott
СО I 4-
СНС1 '
I соме
(г.о^ (2.70) (2-71) (г-72)
Выделенные в индивидуальном состоянии алкилтиопроизводные (2.51) [168, 176, 184, 190-195, 198, 200, 201, 205, 209', 210, 216] под действием оснований или при термической обработке [200, 213-215] могут быть переведены в конденсированные 3-аминотиофены.
4-Дмиио-3-метилтио-5-ци»нотиено[3,2-<1] изотиазол [192]. Горячий прозрачный раствор 10 ммолей З-мегилтио-4-циаиометилтиоизотиазола в 20-30 мл абсолютного этанола добавляют при перемешивании к теплому раствору этилата натрия, полученному из 0,2-0,3 г натрия и 8 мл абсолютного спирта. Через 1 ч смесь разбавляют водой, осадок отфильтровывают и перекристаллизовывают из пропанола. Получают 85 % продукта с т.пл. 192- 195 °C.
3-Амино-2-(4-бромбензоил)тнено[2,3-Ь]бензотиофен [213]. 3,9 г (0,01 моля) 3-циано-2-(4-бромфенацилтио)бензо[Ь] тиофена кипятят в 30 мл ДМФА 3 ч. После охлаждения раствор выливают в 200 мл ледяной, воды. Остаток отфильтровывают и перекристаллизовывают из ацетона. Получают 45 % продукта с т.пл. 270-271 °C.
2.3.3. Синтезы на основе алкилтио-и алкилоксиилиденпроизводных нитрилов
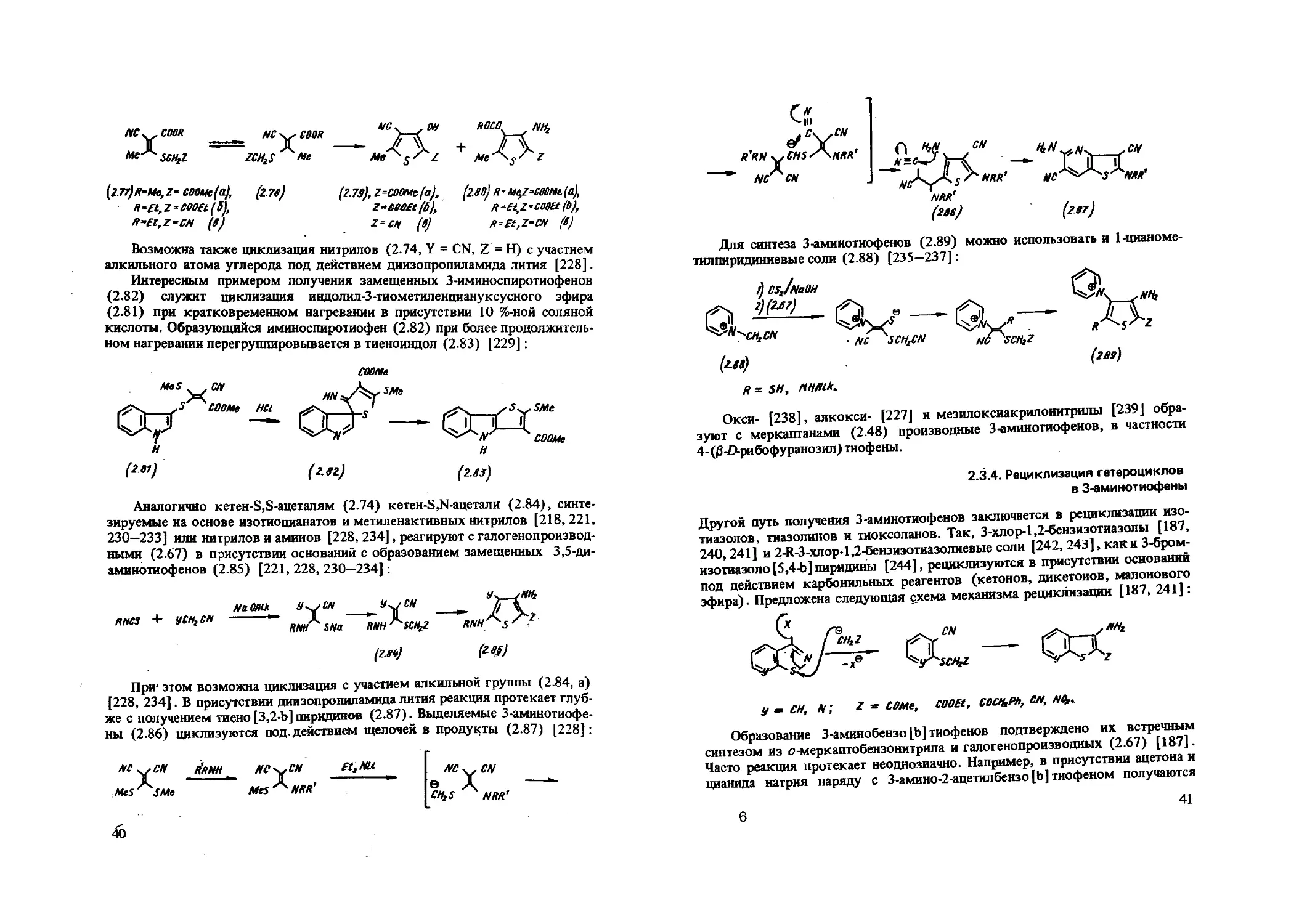
3-Аминотиофены можно синтезировать на основе нитрилов, содержащих активную метиленовую группу [214—216]. Взаимодействие их с сероуглеродом в присутствии щелочей приводит к 1-цианоэтилен-2,2-дитиолатам натрия или калия (2.73). Последние гладко алкилируются а-галогенкарбо-нильными соединениями и галогенидами (2.67) с образованием 1-циано-2,2-ди (Z-метилтио) этиленов (2.74), которые под действием алкоголятов натрия или органических оснований циклизуются в 3-аминотиофены (2.75) [217—220]. Если в полученном 3-аминотиофене (2.75) содержится достаточно активная метиленовая группа, связанная со вторым заместителем Z, то в случае Y = CN возможна циклизация Торпа, приводящая к 3,4-диами-нотиено [2,3-Ь] тиофенам (2.76) [218—220]:
38
NaOff У\ .SHa (2.B7)
ЯС 'зснгг
( 2”)
(2.?^)
[2.7S)
(2.7В)
В то же время продукты моноалкилирования (2.73), по данным [219], соответствующих тиофенов не дают. Отмечено также, чТо 2-(4-бромбензоил)-3-амино-4-циано-5-(4-бромфенацилтио)тиофен (2.75, Y = CN, Z = 4-ВгС6Н5СО), синтезированный по приведенной схеме, не вступает в реакцию Торпа [220]. 4-Фенилтиазолил-2-ацетонитрил в аналогичных условиях реагирует с сероуглеродом и галогенидами (2.67) с образованием производных З-амино-4-(2-тиазолил) тиофенов [221]. Таким способом получены различные замещенные 3-аминотиофены [222—225].
3-Амино4-карбамоил-5-метилтио-2-метоксикарбоиилтиофеи [219]. К раствору метилата натрия, полученному из 0,9 г (0,04 моля) натрия и 25 мл Метанола, прибавляют 3,5 г (0,02 моля) амида 2-меркапто-2-металмеркапто-1-цианакриловой кислоты и смесь перемешивают до растворения. Затем приливают 4,4 мл (0,04 моля) метилового эфира бромуксусной кислоты. Начинается экзотермическая реакция и вскоре выделяется осадок, который перекристаллизовывают из водного диоксана. Выход продукта в виде желтых кристаллов с т.пл. 225-227 °C составляет 2,9 г (59 %).
2-(3-Амино-2-бензоил-5-феиацилтио-4-тиенил) -фенилтиаэел [221]. В 30 мл абсолютного этанола растворяют 4 г (0,02 моля) 4-фенил-2-цианометилтиазола, добавляют 2 г сероуглерода и при перемешивании прикапывают раствор этилата калия, приготовленного из 1,7 г калия и 30 мл абсолютного этанола. Смесь выдерживают 30 мин, доливают 250 мл эфира и выделившийся осадок ди калиевой соли отфильтровывают. 1,75 г (0,01 моля) полученной дикалиевой соли растворяют в 100 мл метанола, прибавляют 2 г фенацилбромида в 25 мл метанола и нагревают 40 мин до кипения. Из кипящего раствора выделяется осадок, который отфильтровывают, промывают водой и перекристаллизовывают из ацетонитрила. Выход продукта с т.пл. 183-184 °C 48 %.
Если в исходных нитрилах (2.77) в гем -положении содержится сложно-эфирная группировка, то возможны две конкурирующие реакции с одновременным участием обеих групп [226, 227], приводящие независимо от геометрической конфигурации исходного нитрила (2.77) £ (2.78) [226] к смеси 3-окситиофенов (2.79) и 3-аминотиофенов (2.80). Иногда преобладают 3-окситиофены (2.80). Так, в присутствии поташа нагревание в метаноле нитрила (2.77, а) ведет к смеси тиофенов (2.79, а) и (2.80, а) с выходами 43 и 31 % [227]:
39
AtC у, COOR
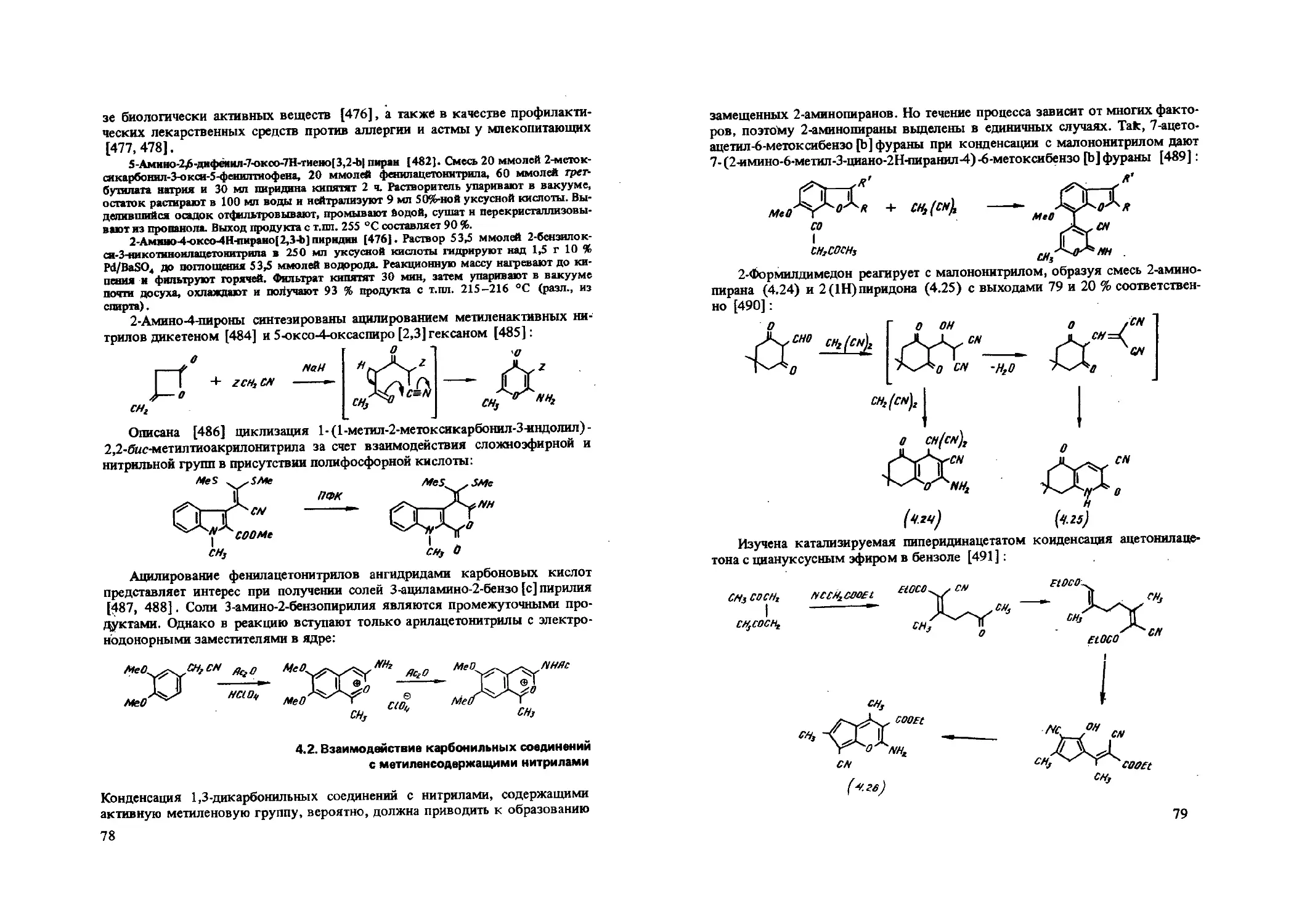
IT
(2.00( O’ Mtp'COONH (a),
R~£$Z-aM£t(6), As£t,Z“CV (/)
NC^COOR ZCHtS ^Me
(2.7г)й*Ме,г- COOMe(a), (270) (2.79),2=С00ме(а),
R'£t,2*C00£t(6), Z-M0£tf6),
7t’£t,Z-CN (0) Z= СП (в)
Возможна также циклизация нитрилов (2.74, Y = CN, Z = H) с участием алкильного атома углерода под действием диизопропиламида лития [228].
Интересным примером получения замещенных 3-иминоспиротиофенов (2.82) служит циклизация ицдолил-3-тиометиленциануксусного эфира (2.81) при кратковременном нагревании в присутствии 10 %-ной соляной кислоты. Образующийся иминоспиротиофен (2.82) при более продолжительном нагревании перегруппировывается в тиеноиндол (2.83) [229]:
сооме
(*'*)
Аналогично кетен-S,S-ацеталям (2.74) кетен-S .N-ацетали (2.84), синтезируемые на основе изотиоцианатов и метиленактивных нитрилов [218, 221, 230—233] или нитрилов и аминов [228,234], реагируют с галогенопроизводными (2.67) в присутствии оснований с образованием замещенных 3,5-ди-аминотиофенов (2.85) [221,228,230—234]:
Уу_jWi
ылояи ____4'VC* ____
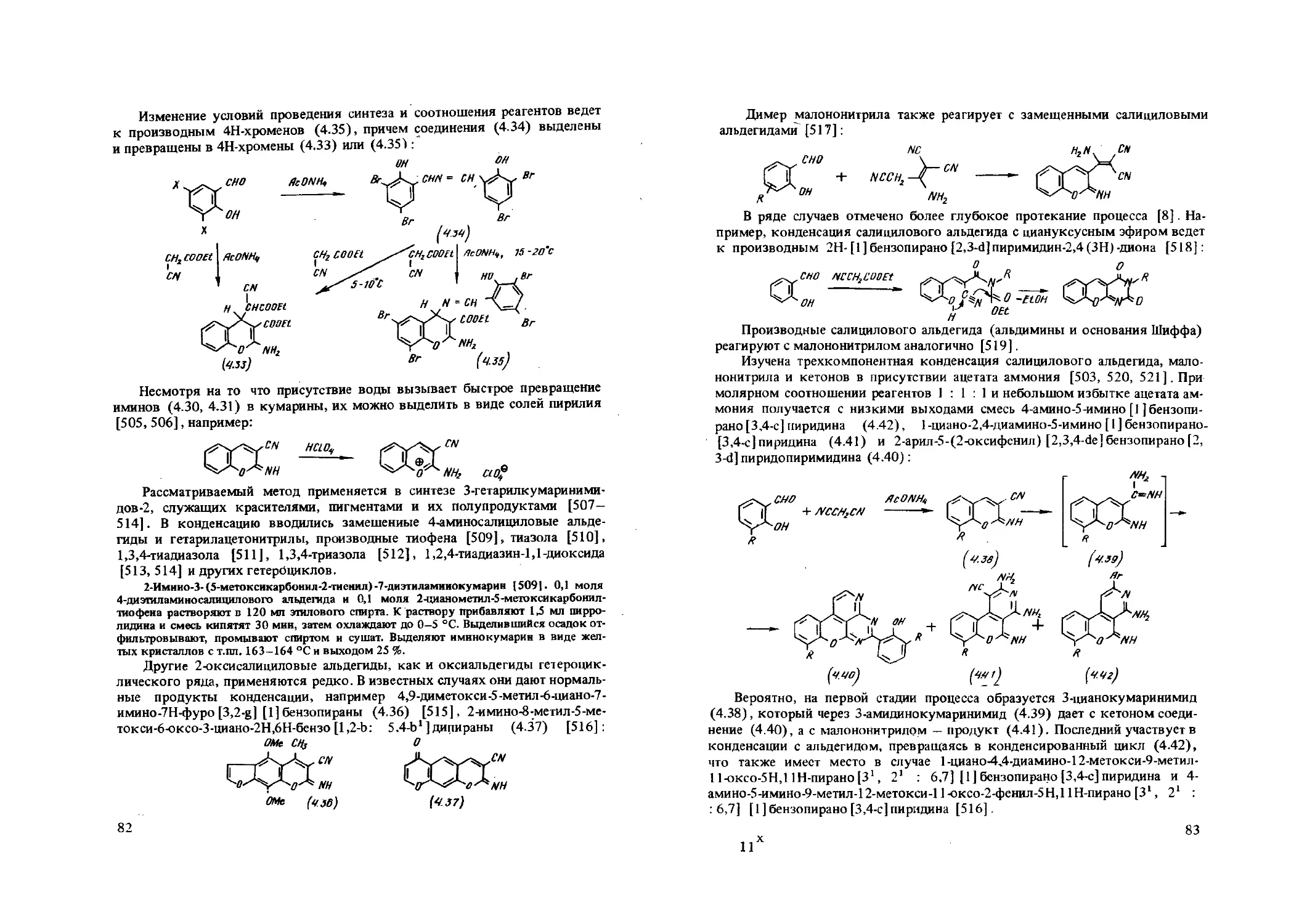
RNC3 + rnh<5>2
/204) (г#$)
При1 этом возможна циклизация с участием алкильной группы (2.84, а) [228, 234]. В присутствии диизопропиламида лития реакция протекает глубже с получением тиено [3,2-Ъ] пиридинов (2.87). Выделяемые 3-аминотиофены (2.86) циклизуются под. действием щелочей в продукты (2.87) [228]:
r'rnh не у сн fttNU
MeS^SMe
AfCy^CA!
NRK
4o
Для синтеза 3-аминотиофенов (2.89) можно использовать и 1-цианометилпиридиниевые соли (2.88) [235-237]:
f) С$г/наОИ
(ш)
Я = SH, fiHfilh.
Окси- [238], алкокси- [227] и мезилоксиакрилонитрилы [239] образуют с меркаптанами (2.48) производные 3-аминотиофенов, в частности 4-(0-£>-рибофуранозил) тиофены.
2.3.4. Рециклизация гетероциклов в 3-аминотиофены
Другой путь получения 3-аминотиофенов заключается в рециклизации изотиазолов, тиазолинов и тиоксоланов. Так, 3-хлор-1,2-бензизотиазолы [187, 240,241] и 2-И-3-хлор-1,2-бензизотиазолиевые соли [242, 243], каки 3-бром-изогиазоло [5,4-Ь] пиридины [244], рециклизуются в присутствии оснований под действием карбонильных реагентов (кетонов, дикетоиов, малонового эфира). Предложена следующая схема механизма рециклизации [187, 241]:
у - СИ, н ; Z ~ СОМе, COO£t, СОСНгРО, см,
Образование 3-аминобензо [b] тиофенов подтверждено их встречным синтезом из о-меркаптобензонитрила и галогенопроизводных (2.67) [187]. Часто реакция протекает неоднозначно. Например, в присутствии ацетона и цианида натрия наряду с З-амино-2-ацетил бензо [Ь] тиофеном получаются
2-роданобензонитрил и 2,2-дицианодифенилдисульфид [240]. Эти превращения кратко рассмотрены в обзоре [241 ].
3-Амиио-4,6-диметнл-2-этоксикарбонилтиено( 2,3-Ь] пиридин ] 244]. К раствору этилата натрия, приготовленному из 0,46 г натрия и 5 мл абсолютного этанола, при 25 °C и переманивании прибавляют 1,6 г (0,01 моля) малонового эфира, затем 2,4 г (0,01 моля) З-бром-4,6-диметализотиазоло(5,4-Ь] пиридина. Смесь оставляют на ночь и выливают в 100 мл воды. Получают 1,5 г (60 %) продукта с т.пл. 156-158 °C (из бензола).
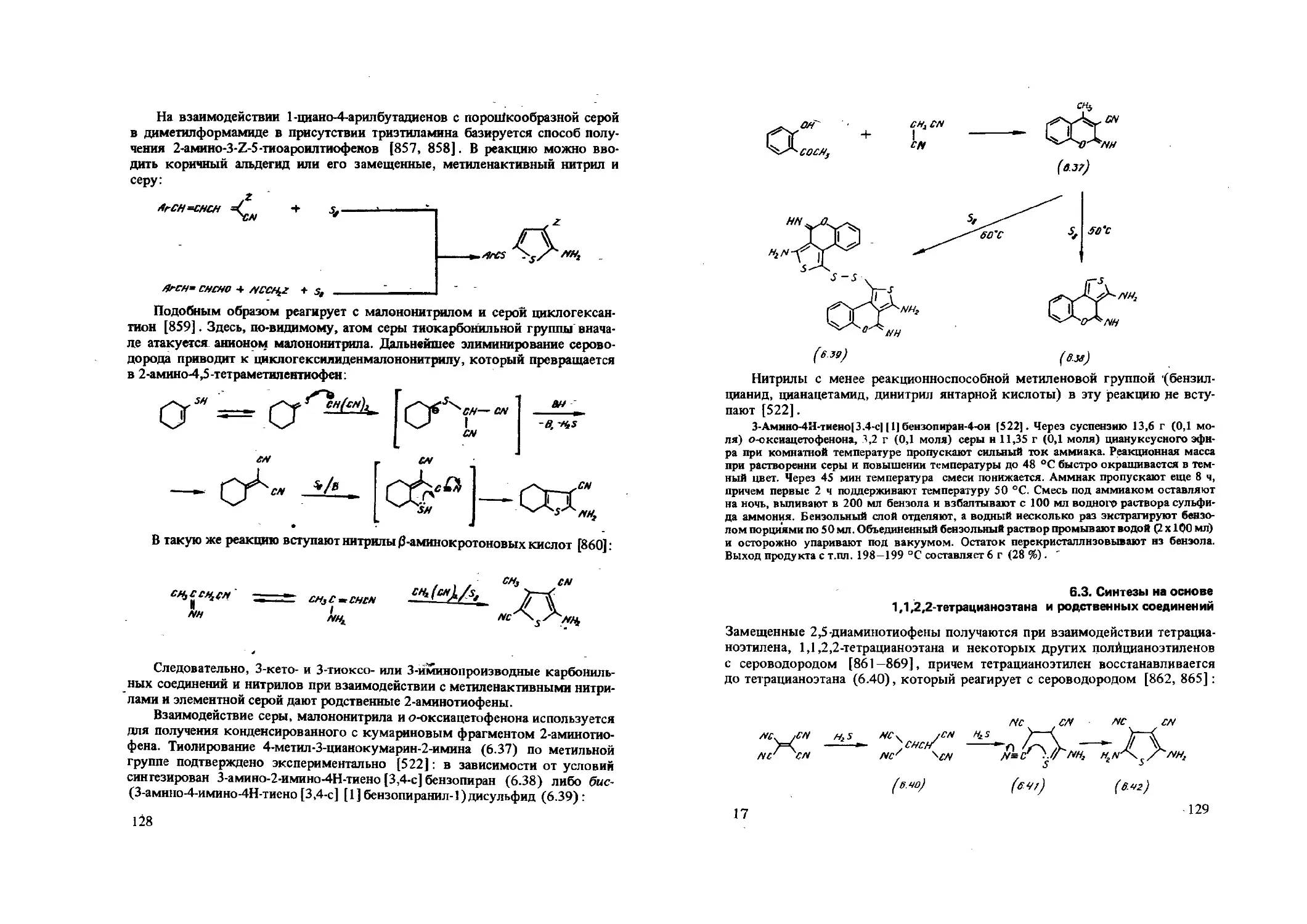
Производные 3-аминотиофенов образуются и при рециклизации 1,3-ок-сатиолиевых солей с малононитрилом, осуществляемой под действием оснований [245—249]. В условиях реакции вслед за первоначальной атакой нуклеофилом (анионом малононитрила) положения 2 оксатиолиевой соли происходит раскрытие цикла с последующим внутримолекулярным взаимодействием метиленовой и нитрильной групп:
В реакции 1,3-оксатиазолиевых солей с циануксусным эфиром на последней стадии происходит атака карбонильного углерода сложноэфирной группы нуклеофилом, приводящая в конечном счете к 3-окситиофенам. Однако здесь не исключается образование 3-аминотиофенов [246, 248]. Аналогично протекает рециклизация 2-[(циано)этоксикарбонилметилен]-4-оксо-13-дитиола [220], 2-дицианометилентиазолинов и тиазолинонов [232, 250, 251]. При реакции малононитрила с фенилизотиоцианатом в присутствии этилата натрия и последующей обработке реакционной смеси бромацетоуксусным эфиром получается смесь тиазолина (2.90) и 3-аминотиофена (2.91), причем действие на тиазолин (2.90) этилата натрия приводит к его превращению в тиофен (2.91) [232]:
ЕШСОСНг
NaOEt
(г.ев) М t
4-Амиио-2-метиламино-3,5-дициаиотиофеи [ 2511. К раствору этилата натрия (0,8 г натрия и 25 мл этанола) прибавляют 10 ммолей 4-амино-3-мегил-5-карбамоил-4-тиазо-линилиденмалононитрила или 2-.фцианометилен-4-тиазолина и кипятят 1 ч. После охлаждения смесь при перемешивании разбавляют соляной кислотой. Осадок отфильт
42
ровывают, перекристаллизовывают из пропанола. Выход продукта с т.пл. 214-216 °C равен 1,5 г (83 %).
4-Амино-2-аиилиио-5-циаиотиазол синтезируют аналогично из 4-амино-5-карбамоил-3-феиил-2-циаиимино-Д''-тиазолидана. Выход 55 %, т.пл.158-160 °C.
2.4. Аминоазолы
Реакцией циклизации нитрилов можно получить различные аминопроизводные азолов. В литературе имеется единственное сообщение [252] о синтезе 4-аминоизоксазолов (2.97) из солей изонитрозопроизводных метиленактив-ных нитрилов (2.92) с а-галогенкетонами (2.67). Выделенные о-фенацил-изонитрозосоединения (2.95) циклизуются в присутствии гидроксида лития с 40—60 %-ным выходом конечных продуктов (2.97):
/=NONa НС
(2.9г)
Я, «
* У=-^чсн,г -----------«►
NC
(295) 9=0,г = СОЙг
(2.96) 9=8
Л У Ш>Т$ NC
(29?) У*0 (2-98) 9*6 (2.99) У-**
(2.93) -
4-Амиио-5-бензоилизоксазол-3-карбоновая кислота [252]. 1,3 г (5 ммолей) циано-(фенацилоксимино) уксусного эфира суспендируют в 40 мл воды. При перемешивании медленно прибавляют 0,6 г тонкоизмепьченного 1ЛОН • 2Н, О. Пбсле 16-часовой выдержки при комнатной температуре осадок отфильтровывают и размешивают с концентрированной соляной кислотой до кислой реакции, после чего снова отфильтровывают, сушат и перекристаллизовывают из спирта. Получают 0,63 г (48 %) продукта с т.пл. 192-194 °C.
При действии меркаптанов (2.48) на тозилаты изонитрозопроизводных метиленактивных нитрилов (2.98) в присутствии пиридина выделены нитрилы (2.96), которые циклизуются по реакции Торпа в абсолютном спирте под действием морфолина или триэтиламина в соответствующие 4-аминоизоти-азолы (2.98) [253,254].
4-Амиио-3-карбамоил-5-этоксикарбонилизотиазол [254]. К смеси 10 ммолей о-тозилоксиминоцианацегамида, 10-15 ммолей меркаптоуксусного эфира и 8 мп абсолютного этилового спирта прикапывают при перемешивании 15 ммолей морфолина (или триэтиламина) в 1—2 мл абсолютного спирта так, чтобы температура не поднималась выше 40 °C. Через 20 мин добавляют при перемешивании трехкратный объем воды с небольшим количеством уксусной кислоты. Выделившийся осадок отфильтровывают и перекристаллизовывают из спирта. Получают 60 % продукта с т.пл. 203-204 °C.
43
6
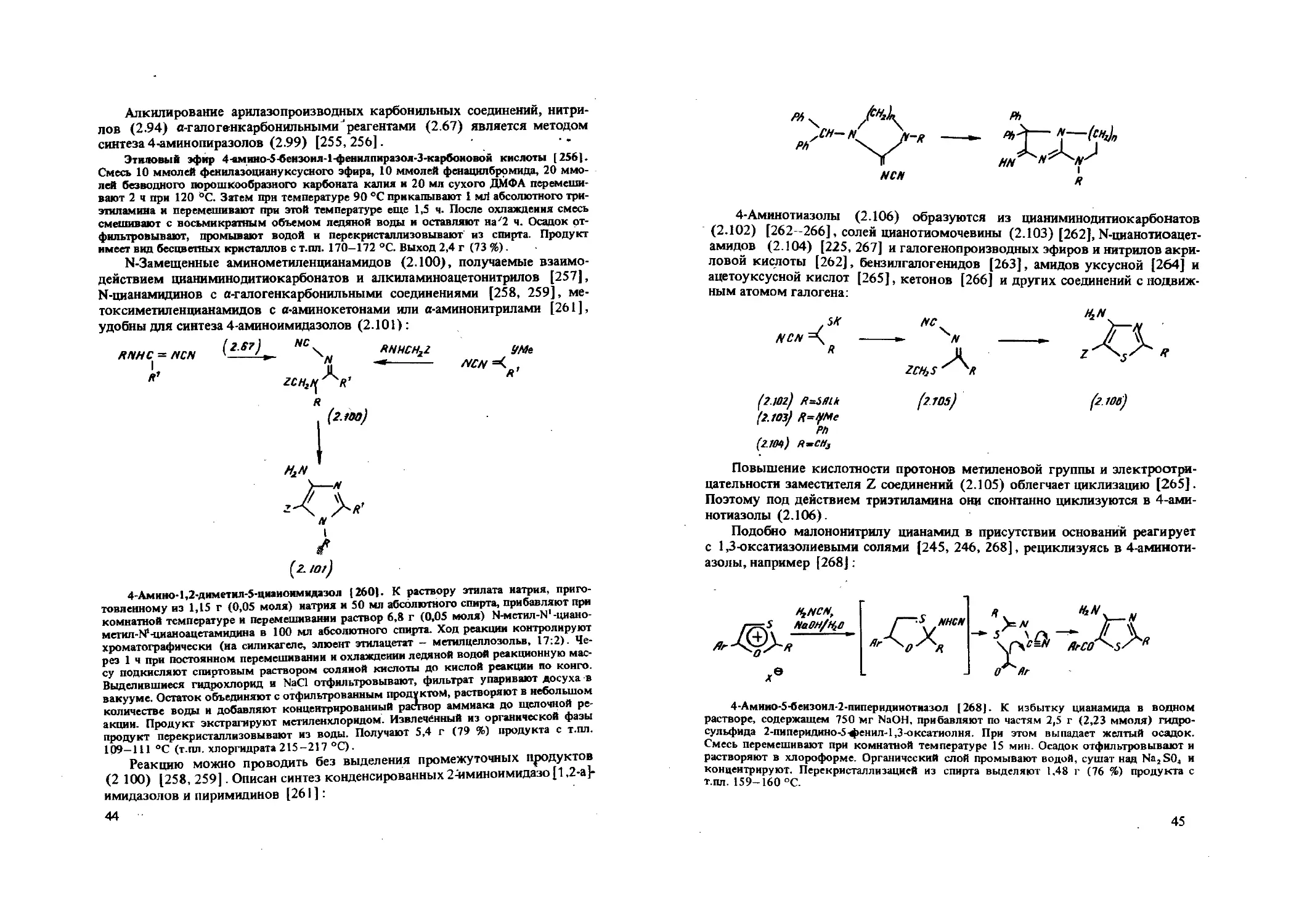
Алкилирование арилазопроизводных карбонильных соединений, нитрилов (2.94) а-галогенкарбонильными 'реагентами (2.67) является методом синтеза 4-аминопиразолов (2.99) [255,256].
Этиловый эфир 4-амино-5-беизоил-1-фенилпиразол-3-карбоиовой кислоты [256]. Смесь 10 ммолей фенилазоциануксусного эфира, 10 ммолей фенацилбромида, 20 ммолей безводного порошкообразного карбоната калия и 20 мл сухого ДМФА перемешивают 2 ч при 120 °C. Затем прн температуре 90 °C прикапывают 1 мЛ абсолютного три-этипамина и перемешивают при этой температуре еще 1,5 ч. После охлаждения смесь смешивают с восьмикратным объемом ледяной воды и оставляют на'2 ч. Осадок отфильтровывают, промывают водой и перекристаллизовывают из спирта. Продукт имеет вид бесцветных кристаллов с т.пл. 170-172 °C. Выход 2,4 г (73 %).
N-Замещенные аминометиленцианамидов (2.100), получаемые взаимодействием цианиминодитиокарбонатов и алкиламиноацетонитрилов [257], N-цианамидинов с а-галогенкарбонильными соединениями [258, 259], ме-токсиметиленцианамидов с а-аминокетонами или а-аминонитрилами [261], удобны для синтеза 4-аминоимидазолов (2.101):
RNHC=NCN I я'
(2S7) С\ ЯННСН22 UMe
% ------ ЖЧ ,
гснг^я’ я
Я
(г.гоо)
4-Амнно-1,2-диметил-5-циаиоимидазол (260). К раствору этилата натрия, приготовленному из 1,15 г (0,05 моля) натрия и 50 мл абсолютного спирта, прибавляют при комнатной температуре н перемешивании раствор 6,8 г (0,05 моля) Ы-метил-К'-циано-мстип-Ь^-цианпацетамидина в 100 мл абсолютного спирта. Ход реакции контролируют хроматографически (на силикагеле, элюент этилацетат - метилцеллозольв, 17:2). Через 1 ч при постоянном перемешивании н охлаждении ледяной водой реакционную массу подкисляют спиртовым раствором соляной кислоты до кислой реакции по конго. Выделившиеся гидрохлорид и NaCl отфильтровывают, фильтрат упаривают досуха в вакууме. Остаток объединяют с отфильтрованным продуктом, растворяют в небольшом количестве воды и добавляют концентрированный раствор аммиака до щелочной реакции. Продукт экстрагируют мстиленхлоридом. Извлечённый нз органической фазы продукт перекристаллизовывают нз воды. Получают 5,4 г (79 %) продукта с т.пл. 109-111 °C (т.пл. хлоргидрата 215-217 °C).
Реакцию можно проводить без выделения промежуточных продуктов (2 100) (258, 259]. Описан синтез конденсированных 2-иминоимидазо]1,2-а]-имидазолов и пиримидинов [261 ]:
44
NON
Ph
R
4-Аминотиазолы (2.106) образуются из цианиминодитиокарбонатов (2.102) [262-266], солей цианотиомочевины (2.103) [262], N-цианотиоацет-амидов (2.104) [225, 267] и галогенопроизводных эфиров и нитрилов акриловой кислоты [262], бензилгалогенидов [263], амидов уксусной [264] и ацетоуксусной кислот [265], кетонов [266] и других соединений с подвижным атомом галогена:
(2.101) RsSOlk (z.TDS) (l.lOB)
(2.103) R=!fMe
Ph
(2.IO4) R~CH3
Повышение кислотности протонов метиленовой группы и электроотрицательности заместителя Z соединений (2.105) облегчает циклизацию [265]. Поэтому под действием триэтиламина они спонтанно циклизуются в 4-ами-нотиазолы (2.106).
Подобно малононитрилу цианамид в присутствии оснований реагирует с 1,3-оксатиазолиевыми солями [245, 246, 268], рециклизуясь в 4-аминотиазолы, например [268]:
Яг
NaOH/HjO
Я
HtNCN,
4-Амиио-5-бензоил-2-пиперидииотназол [268). К избытку цианамида в водном растворе, содержащем 750 мг NaOH, прибавляют по частям 2,5 г (2,23 ммоля) гидросульфида 2-пиперидино-5фенил-1,3-оксатиолня. При этом выпадает желтый осадок. Смесь перемешивают при комнатной температуре 15 мин. Осадок отфильтровывают и растворяют в хлороформе. Органический слой промывают водой, сушат над Na, SO, и концентрируют. Перекристаллизацией из спирта выделяют 1,48 г (76 %) продукта с т.пл. 159-160 °C.
45
2.5. Шестичленные гетероциклические амины с одним гетероатамом в цикле
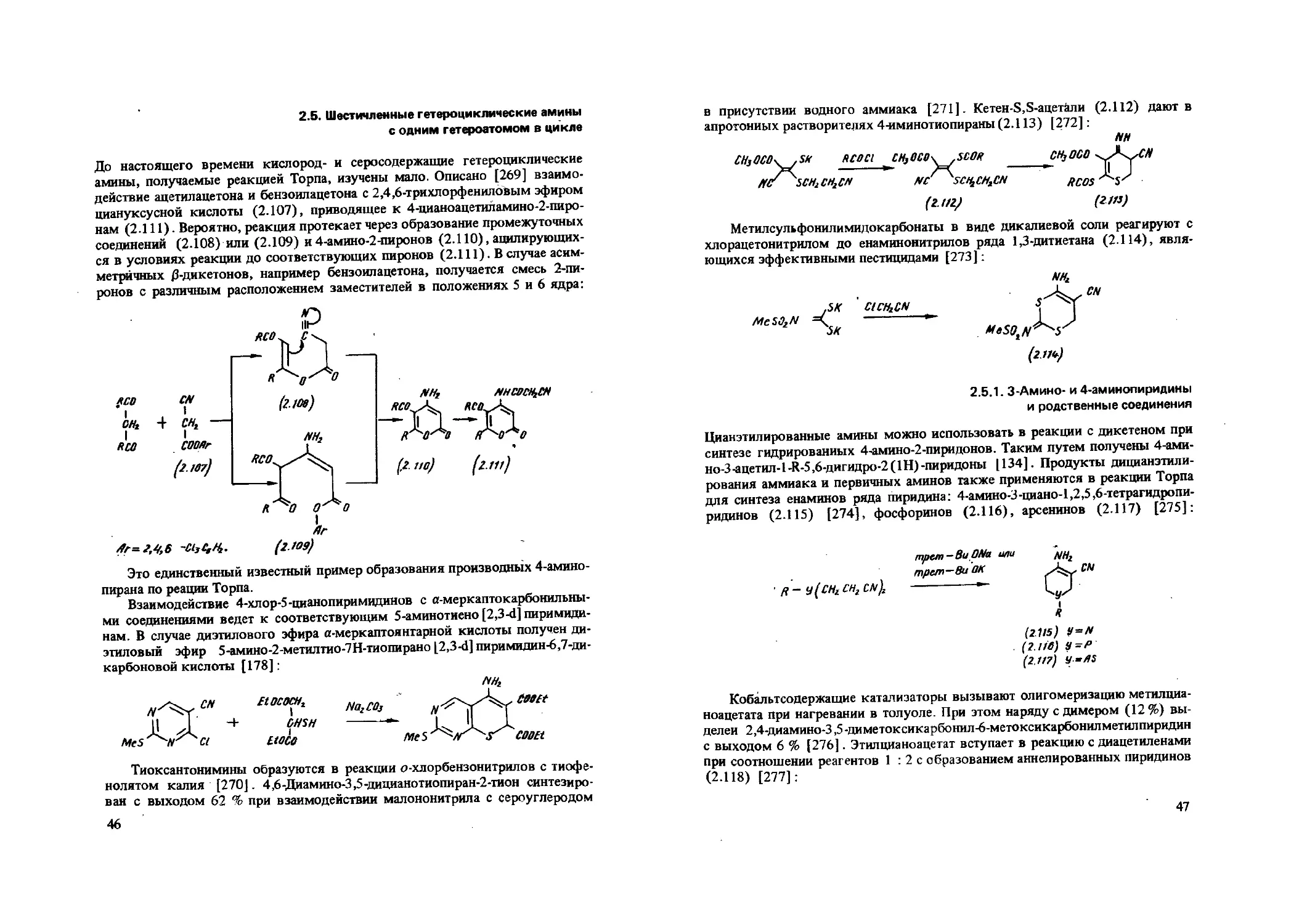
До настоящего времени кислород- и серосодержащие гетероциклические амины, получаемые реакцией Торпа, изучены мало. Описано [269] взаимодействие ацетилацетона и бензоилацетона с 2,4,6-трихлорфенилоВым эфиром циануксусной кислоты (2.107), приводящее к 4-цианоацетиламино-2-пиронам (2.111). Вероятно, реакция протекает через образование промежуточных соединений (2.108) или (2.109) и4-амино-2-пиронов (2.110), ацилирующихся в условиях реакции до соответствующих пиронов (2.111). В случае асимметричных 0-дикетонов, например бензоилацетона, получается смесь 2-пи-ронов с различным расположением заместителей в положениях 5 и 6 ядра:
Л-= 2,4,6 (г.Ю9)
Это единственный известный пример образования производных 4-амино-пирана по реации Торпа.
Взаимодействие 4-хлор-5-цианопиримидинов с а-меркаптокарбонильны-ми соединениями ведет к соответствующим 5-аминотиено [2,3-d] пиримидинам. В случае диэтилового эфира а-меркаптоянгарной кислоты получен диэтиловый эфир 5-амино-2-метилтио-7Н-тиопирано [2,3-d] пиримидин-6,7-дикарбоновой кислоты [178]:
£toeоснг
0HSH LtOCO
Тиоксантонимины образуются в реакции о-хлорбензонитрилов с тиофенолятом калия [270]. 4,6-Диамино-3,5-дицианотиопиран-2-тион синтезирован с выходом 62 % при взаимодействии малононитрила с сероуглеродом 46
в присутствии водного аммиака [271]. Кетен-S,S-ацетали (2.112) дают в апротонных растворителях 4-иминотиопираны (2.113) [272] :
NH
СН30С0\,$К ЯС0С1
SCHtCHtCN
СН}ОСО\,ЗСОН
Nc \cfbCHtCN
(газ)
Метилсульфонилимидокарбонаты в виде дикалиевой соли реагируют с хлорацетонитрилом до енаминонитрилов ряда 1,3-дитиетана (2.114), являющихся эффективными пестицидами [273]:
,SK CICHiCN
MeS^N =< --------*-
SK
NHt
CN
2.5.1. 3-Амино- и 4-аминопиридины и родственные соединения
Цианэтилированные амины можно использовать в реакции с дикетеном при синтезе гидрированных 4-амино-2-пиридонов. Таким путем получены 4-ами-но-3-ацетил-1-К-5,6-дигидро-2(1Н)-пиридоны [134]. Продукты дицианэтилирования аммиака и первичных аминов также применяются в реакции Торпа для синтеза енаминов ряда пиридина: 4-амино-3-циано-1,2,5,6-тетрагидропи-ридинов (2.115) [274], фосфоринов (2.116), арсенинов (2.117) [275]:
tnpem—BuONa или трет—8и ОК
’ /? - 9 (СН, СНг CN); -------—
(2.115) 0=N
(2.110)
(2.11?) y uPS
Кобальтсодержащие катализаторы вызывают олигомеризацию метилцианоацетата при нагревании в толуоле. При этом наряду с димером (12%) выделен 2,4-диамино-3,5 -диметоксикарбонил-6-метоксикарбонилметилпиридин с выходом 6 % [276]. Этилцианоацетат вступает в реакцию с диацетиленами при соотношении реагентов 1:2с образованием аннелированных пиридинов (2.118) [277]:
47
COOEt
HC*C(CHjnC?iCH +NCCH,C00tt c’H'c°(coh о
(2.1t!)
N-Замещенные цианацетамиды димеризуются под действием алкоголя-тов металлов в 4,6-диамино-1-К-5-К-карбамоил-2(1Н)пиридоны [278]. Непредельные енаминонитрилы (2.119) реагируют с карбонильными соединениями в присутствии фосфорной кислоты [279] или безводного хлористого цинка, давая 4-аминопиридины (2.122) [280]. Описана циклизация циан-этилированных енаминов [278]. Вероятно, енаминонитрилы (2.119) образуют с циклическими кетонами илиденаминонигрилы (2.120) (2.121), ко-
торые циклизуются в 4-аминопиридины (2.122) :
9-Амино-2,3.5,6,7,8-гексагидро-1Н-циклопента[ Ыхинолии [279].Смесь 4 г (0,037 моля) 1-амино-2-цианоциклопентена, 3,8 г (0,039 моля) циклогексанона, 40 г полифос-форной кислоты н 40 мл сухого бензола перемешивают 3 ч при температуре кипения бензола. После охлаждения реакционную массу разбавляют 50 мл воды и экстрагируют эфиром. Водный слой нейтрализуют раствором аммиака до pH 7,0 и фильтруют. Фильтрат экстрагируют хлороформом. Водный слой доводят концентрированным водным аммиаком до pH 10,0. Выделившийся осадок отфильтровывают, промывают водой. Выход продукта с т.пл. 202—203 °C (из смеси метанола с водой) 4,5 г (85 %).
4-Амиио-2,3-триметилен-6,7-дигидро-5Н-1-пиридьн [279]. Смесь 2 г (0,0185 моля) 1-амино-2-цианоциклопентена, 2,5 г (0,03 моля) циклопентанона, 1,5 г безводного хлорида цинка и 25 мл сухого ксилола нагревают при перемешивании и температуре 130— 140 °C в течение 3 ч. Ксилольный слой отбрасывают, остаток растворяют в возможно меньшем количестве метанола и доводят водным раствором аммиака до pH 10,0. Выделившийся осадок отфильтровывают, промывают водой. Выход продукта с т.пл. 198-200 °C (из смеси метанола с водой) 1г (31 %).
В общем случае илиденпроизводные (2.120) таутомерны енаминам (2.121) . Для их циклизации предложено применять перхлорат магния [281]. Нельзя исключить альтернативный путь превращения, предполагающий на первой стадии присоединение по нитрильной группе. Родственные енам'-
48
нитрилы, получаемые на основе енаминов (2.119) и 1,3-дикарбонильных [282, 283] и 0-енаминокарбонильных соединений [284, 285], также вступают в реакцию циклизации. Наличие второго электроноакцепторного заместителя облегчает процесс. В качестве катализатора можно применять алкого-ляты щелочных металлов [282—285]. Превращения изучены в рядах енами-нонитрилов ароматических углеводородов [282], пирролов [283] и тиофенов [284, 285].
4-Амиио-3-ацетил-2-метилхинолин |282J. Вначале синтезируем 2-(2-цианофенил-амино)пентен-4-он. 23,6 г (0,2 моля) нитрила антраниловой кислоты, 30 г (0,3 моля) ацетилацетона н 100 мг n-толуолсульфокислоты в 50 мл толуола нагревают 1,5 ч при кипении. Из реакционной смеси отгоняют 30 мл толуола. После охлаждения осадок отфильтровывают и перекристаллизовывают из бензола. Выход продукта с т.пл. 115— 117 °C составляет 30 г (75 %). 6 г (0,03 моля) 2-(2-цианофениламино)-2-пентен-4-ена прибавляют к раствору 0,75 г натрия в 30 мл метанола и смесь кипятят 15 мин. После охлаждения реакционную массу фильтруют. К фильтрату добавляют 300 мл воды. После потирания и длительного стояния выделившийся продукт отфильтровывают и промывают водой. Перекристаллизацией из бензола выделяют 4,5 г (75 %) продукта с т.пл. 151-153 °C.
Общим методом синтеза 4-аминопиридинов, конденсированных с другими ядрами (2.124—2.127), является циклизация замещенных 3-ариламино-акрилонитрилов (2.123) в присутствии кислот Льюиса [286, 287], фосфорной [288], серной [289] или при термическом воздействии [290]:
(2Г23)
юг
(2124) ц=-сн=снсн=сн-я=ъсн=ен-
(212б) fi=-N=CHCH‘CH-
(2127) - ен-
4-Амиио-2-метилхинолин [282}. Смесь 6 г (0,03 моля) 2-(2-цианофениламнно) -2-пентен-4-она и 25 мл хлорбензола с добавкой 8 г порошкообразного хлорида алюминия кипятят 30 мин. После охлаждения массу разбавляют 200 мл 5%-ной соляной кислоты. Хлорбензол отделяют и водную фазу подщелачивают 4 н. раствором КОН. Через 12 ч выделившийся осадок отфильтровывают и промывают водой. Получают 3,0 г продукта ст.пл. 168-169 °C (из этилацетата).
Метод синтеза обладающих противоопухолевой активностью 2,4-дизаме-щенных 5-аминопиримидо [4,5-Ь] хинолинов основан на циклизации 2,6-ди-замещенных 4-анилино-5-цианопиримидинов в полифосфорной кислоте [291,292]:
Х70Иг/ 1во ~200‘С
7
49
Исходные продукты получают взаимодействие 4-аминопиримидинов с этоксиметиленмалононитрилом [293]. Простой подход к синтезу 4-амино-пиридинов базируется на конденсации нитрилов 3-алкиламинокротоновой кислоты с алкоксиметиленпроизводными циануксусного эфира [294, 295] и малононитрила [296]. Вместо малодоступного этоксиметиленмалононит-рила в реакцию вводят смесь малононитрила и триэтилортоформиата [297— 299]. При соотношении реагентов (2.128) и (2.129) 1:2 получен дигидропиридин (2.130) [294]:
Me
Я' NH
нн2
.CM
coo#
COOft
(212g) (2.129) (г.но)
Замещенные 4-амино-2,5 -дигидропиридины образуются при взаимодействии арилиденмалононитрилов и амидинов [300, 301 ]. Замещенные 4-амино-2(1Н)пиридинов получаются при конденсации вицинальных аминонитрилов с галогенангидридами метоксиуксусной [302], хлоруксусной кислот [303], малоновым [304] и циануксусным эфирами [Зи5].
4-Амино-3-циаио-2(1Н)хииолиион f 3051. 0,1 моля нитрила антраниловой кислоты и 0,15 моля циануксусного эфира растворяют в смеси 7 г натрия и 200 мл абсолютного спирта. Смесь кипятят 2,5 ч и часть спирта отгоняют. Остаток выливают в 0,5 л воды и фильтруют. После подкисления соляной кислотой выделяют 70 % продукта с т.пл. 325-328 °C (из уксусной кислоты).
При циклизации 3-циано-2-(М-бензил-2-цианоэтил) аминопиридина в 4-амино-1-бензил-3-циано-1,2-дигидро-1,8-нафтиридин происходит дезаминирование первого [306]. Возможно образование замещенных 4-амино-3,6-дигидро-2(1Н)пиридонов из кетен-S,S-ацеталей и гидразидов циануксусной кислоты [307]. N-2-(цианофенил)-2-аминопропенилтрифенилфосфонийбро-мид используется в синтезе 4-амино-2-метилхинолина [308]:
• е вл
НС sCCH,l>Ph, Вгв
см
е Вт
""^cmppoj Me
ЦО
50
3,4-Диметоксибензиламиноацетонитрилы (2.39) наряду с отмеченной циклизацией в 3-иминопирролины (2.40) могут давать производные 4-ими-ноизохинолинов (154, 309]. При перециклизации бенз [d]-1,3-оксазепина под действием диметиламина имеет место замыкание пиридинового кольца с образованием конденсированного 3-аминохинолина [310]
нме,
2.6. Аминотиазмны, аминодиазины, аминотриазины
Из 1,2-диазинов, получаемых реакцией Торпа, к настоящему времени известны лишь 4-аминоциннолины [311, 312] и [1] бензофуро [3,2-g] цинно-лины [313, 314]. Для их синтеза предложен метод циклизации арилазопро-иэводных метиленактивных нитрилов в среде ароматических углеводородов или их галогенопроизводных. Во всех случаях в качестве циклизующего агента используется безводный хлорид алюминия:
(2 t3f)
н
Z ZN
Арилазопроизводные (2.131), получаемые сочетанием солей диазония с метиленактивными нитрилами, существуют в виде!?- (2.132) иZ-конформеров (2.133). На примере производных дибензофурана показано, что циклизуется Z-форма (2.133), которая может быть реализована сублимирова
нием 2Г-формы [314]. При этом выходы 4-амино-З-фенилциинолинов превышают 80 %, а иногда приближаются к количественным [311]. Хлоргидрат 5-амино-1-цианометил-8а,8Ь-диаза-асши-индацена образуется при . циклизации 2,5-дицианометил-1,1-дипирролпила в эфире под действием хлористого водорода [315].
4-Амиио[1]бензофуро[2,3-$)цнниолин [313]. К суспензии 2,35 г (0,01 моля) Е- (2-дибензофурилгидразоно) ацетонитрила в 200 мл толуола прибавляют 0,04 моля безводного хлорида алюминия. Смесь кипятят при перемешивании 3 ч и после охлаждения выливают в 300 г льда. Осадок отфильтровывают и промывают водой, затем пет-ролейным эфиром. Продукт энергично перемешивают со 100 мл горячего водного раствора щелочи и смесь охлаждают. Осадок отфильтровывают, промывают водой, сушат. После сублимации в вакууме получают 0,94 г (40 %) желтых кристаллов с т.пл. 320 °C.
2.6.1.4-Аминопиримцдины
Циклизация М-ацетил-ЬР-цианомочевины в присутствии гидроксида натрия является промышленным способом получения 6-аминоурацила. Для сокращения времени протекания процесса и повышения выхода предложено осаждение 6-аминоурацила кислотой [316].
Обработка М‘-(0-цианоэтил) ацетамидина цианамидом в присутствии изопропилата натрия дает 4-амино-2-метил-5-цианопиримидин [317]. При циклизации соединений, содержащих фрагменты N-циано-М‘-арилмочевины (синтезируемых на основе арилизоцианатов и цианамидов) [318], N-циано-N1-гетарилизомочевины (из гетероциклических аминов и диметилцианоди-тиокарбона) [319], Ы-циано-ЬР-арилгуанидина [320], получены 4-амино-[318] и 2,4-диаминохиназолины [320] и 5-амино-1,3-диметнл-7-метилтио-пиримидо [4,5-d]пиримидин-2,4(1Н,ЗН)дион (2.135) [319], например:
MeS
Afes
У=-АГСМ
(2.135)
Конденсированные 4-аминопиримидины образуются при конденсации циклических кетонов [321—324] с дициандиамидом, а также хлоргидратов ароматических аминов с дициандиамидом натрия [325-328]. В большинстве случаев реакция протекает в отсутствие растворителя [156, 329]. Промежуточными продуктами, по-видимому, являются М-циано-N‘-замещенные гуанидины:
НИ,
52
2,4-Диамино-5,6,7,8-тетрагкдрохитзолкн {321 ]. Смесь 42 г дициандиамида, 8 мп триэтиламина и 150 мл циклогексанона нагревают с азеотропной отгонкой воды, на что требуется 5 ч, затем охлаждают, оставляют на ночь и разбавляют 150 мл холодного 2-пропанола. Осадок отфильтровывают, промывают 2-пропанояом, горячей водой й сушат. Выход продукта с т.пл. 240 °C (из водного 2-пропанола, 1:1) составляет 55,3 г (67%).
Из других гетероциклических систем следует отметить 1,4-диазины и 1,2-тиазины. Вероятно, рециклизация 8-азидо-1,3,7-трйметилпурин-2,4-диона в 7-амино-1,3-диметилптеридин-2,4-дион основывается на реакции Торпа [330]:
А/е Не
Активность метильной группы в 2-(М-метил-Ы-метилсульфонил)амино-8-цианопиридине оказывается достаточной для его циклизации?* в 4:амиио-1-метилпиридо,[2,3-с]-1,2-тиазин-2,2-диоксид. Исходный замещенный пиридин образуется при взаимодействии 2-хлор-З-цианопиридина с метнламидом метилсерной кислоты [331]:
нн
Me
2.7. Аминоазепины и амины больших циклов
1,8-Динитрилы, содержащие в цепи атом азота, циклизуются под действием катализатора Торпа в соответствующие енаминонитрилы ряда азепина [332]. Возможна также циклизация с участием ар2-углеродного атома ароматического кольца. Так, 2-цианометил(ГЧ-метил-1Й-фенил)анилин циклизуется в присутствии хлористого водорода в 10-амино-5-метил-10,11-дигидродибенз-[b,f] азепин [333].
Для синтеза производных аминодиаэепинов и аминотиазепинов предло
53
жена циклизация динитрилов, рассмотренная ранее. Например, бис(2,5-ди-цианометил-1-пирролил) циклизуется в 4,9-диамино-3,8-дициано-10Ь,10с-ди-аэадициклопента [ef, kl] гептален 1334]:
5-Циано- или 5-метоксикарбониц-6-аминопирроло [1,2-а] [3,1] бензоти-азепины (2.137) получаются циклизацией соединений (2.136) [335]:
/W г-см (а), (глзт) г=ач(л),
z- cooMe(ti) z = cooMt fs'j
Характер циклизации динитрилов ряда ферроцена (2.138) в ферроцено-фаны (2.139) зависит от катализатора и удаленности цианогрупп друг от друга. Так, при п = 1 и 2 циклизация (2.138) под действием метилйодида магния и метилфениламида натрия, соответственно протекает гладко без существенного разбавления смеси. При п = 5 и 7 даже в случае применения техники ’’высокого разбавления” (здесь и далее используется катализатор Циглера) наряду с целевым продуктом (2.139) образуются полимеры, а при и = 3 — только следы (2.139) [336, 337]:
^у-lcn^
CN
(2 13в)
Классические методы использованы при синтезе макроциклов и катенанов [338, 339]. Так, N, N1 :М^1-бис(декаметилен)-1,4-диамино-2,4-бис-(10-цианодецилокси)бензол (2.140) циклизуется в N, № : N, №-бис(декаметилен) -1,4-диамино-О,О(10-Циано-11-аминогенэйкозанен-10-диил-1,12) -2,5-диоксибензол [338]:
54
(г™) few)
Многие амины гетероциклического ряда, получаемые при циклизации нитрилов, являются биологически активными соединениями и предложены в качестве лекарственных препаратов (табл. 2.3). Например, биологической активностью обладают производные 3-аминобензофурана [ 124] ,4-аминопи-римидинов [325J. Замещенные 3-аминопирролы характеризуются противовоспалительным, жаропонижающим, гипотенсивным действием, ингибируют образование простагландинов, регулируют водный баланс у теплокровных животных [138].
Таблица 2.3. Биологическая активность аминов гетероциклического ряда
Активность, использование
Класс соединения
Литература
Ингибиторы тромбоцитов
Депрессанты центральной нервной системы Антимикробная
Бензо[Ь]фураны, бензо]Ь]тиофены [ 120,121]
Гипотенсивная Жаропонижающая Противоопухолевая Ингибиторы холинэстеразы
Пирролы, 5-аминО-7Н-пирроло[ 2,3-d]-[138, 148-150, 333] пиримидины, азепины 5-Фенилсульфонилбензо[Ь]пирролы, [153, 180,212] тиено[2,3-Ь] пиридины, тиено [2,3-Ь] -пиразины
Пирролы, бензо[Ь]тиофены [138,166]
Пирролы, бензо [Ь] тиофены [138, 167]
Пирнмидо[4,5-Ь] хинолины [291]
Конденсированные пиридины [279]
Гетероциклические амины служат полупродуктами синтеза лекарственных препаратов [122, 131, 142, 143, 198, 258, 303, 305], красителей [122, 142, 143, 198, 258] и других продуктов тонкого органического синтеза. Циклизацией нитрилов получают 4-аминоурацил, 4-аминоимидазол [316] и пурины на их основе [260]. 4-Амино-1,3-дитиетаны — эффективные гербициды [273].
ЧАСТЬ ВТОРАЯ РЕАКЦИИ ЦИКЛИЗАЦИИ С УЧАСТИЕМ АТОМА КИСЛОРОДА КАК НУКЛЕОФИЛЬНОГО ЦЕНТРА
Известны многочисленные методы синтеза гетероциклических аминов, включающие на последней стадии внутримолекулярное взаимодействие нуклеофильного центра (атома кислорода) и электрофильного центра (нитрильной группы), приводящие к аминопроизводным фурана, пирана, оксазолов и другим классам кислородсодержащих гетероциклических соединений, их гидрированным аналогам и конденсированным с ними системам [1,6, 7, 340—344]:
6”?
(”)
Оксинитрилы (3.1), как правило, являются промежуточными продуктами получения аминов (3.3) и в большинстве случаев не могут быть выделены в индивидуальном состоянии. Выделенные в индивидуальном состоянии 7- и 8 -оксинитрилы могут быть подвергнуты циклизации в соответствующие имины (3.2).
На основании ИК спектров со-оксинитрилов (3.1), в которых наряду с поглощением нитрильной группы наблюдается поглощение в области 1640— 1780 см"1, относимое [345] к валентным колебаниям С—N-связи, сделано заключение о существовании таутомерного равновесия (3.1) (3.2). При
изучении таких взаимодействий показано [342], что с повышением нуклеофильности группы ОН или электрофильности углерода нитрильной группы увеличивается стабилизация циклической формы. Возможна дальнейшая стабилизация имина (3.2) за счет ароматизации системы или образования енамина (3.3). Сильные электроноакцепторные заместители при /3-углерод-ном атоме полностью сдвигают равновесие в сторону енаминной формы [346]. Данные [340,341] свидетельствуют о необратимости циклизации, кроме отдельных примеров, которые будут рассмотрены дальше.
Общие вопросы химии фуранов детально..освещены в работах [1, 6, 7, 340—343, 347—352], однако только в некоторых из них кратко представлены примеры циклизации нитрилов в амины кислородсодержащих гетероциклов.
56
ГЛАВА 3. 2-АМИНОФУР АН Ы
До недавнего времени 2-аминофураны считались неустойчивыми соединениями [349—3521, так как Все попытки выделить незамещенный 2-аминофуран (восстановившем 2-нитрофурана, гидролизом 2-ацетамидофурана) кончались неудачей. Вероятно, поэтому дальнейшие эксперименты по синтезу аминофуранов были прекращены, а в тех случаях, когда они были выделены, им ошибочно приписывалось другое строение.
Неустойчивость незамещенных 2-аминофуранов связана со склонностью ароматических аминов к окислению, гидролизу или иным превращениям иминоформы вследствие енамшо-имишой таутомерии, а также с проявлением ими свойств диенов [353,354]. Так, при взаимодействии эпихлоргидрина (3.4) с цианидом натрия образуется промежуточный 2-аминофуран (3.6), который, согласно [353], реагирует со своим изомером в открытой форме (3.5) по реакции Дильса — Альдера, что приводит в конечном счете к производному циклогексадиена (3.7):
---•- мсс^сне^а Г*
---—
-л “
8
57
Доказано [354], что 2-амино-3-циано-4-метилфуран (3.8), который должен получиться в результате взаимодействия оксиацетона с малононитрилом, существует в виде димера 2,4-диамино-3,5-дициано-За,6-диметил-За,4,7,7а-тет-рагидро-эндо-4,7-эпоксибензофурана (3.9):
CHjCOCfizOH +
(л/)
Интересно, что взаимодействие-его с малеиновым ангидридом приводит к 3-амино-4-циано-5-метилфталевому ангидриду вследствие равновесия (3.8) (3.9) в условиях реакции [354].
Замещенные по аминогруппе 2-аминофураны, такие, как ацетамидо- или 2-(N, N-диалкиламино)фураны, устойчивы. Наличие в молекуле 2-аминофу-ранов электроноакцепторных заместителей в значительной степени их стабилизирует. Чем больше в фурановом ядре таких заместителей и выше их электроноакцепторные свойства, тем устойчивее фураны. Известно, что концентрированная серная кислота вызывает быстрое осмоление фурана. Однако 2-амино-З-циано-4,5-диарил фу раны растворяются в ней и выделяются вновь при разбавлении раствора водой [344]. Повышение устойчивости фуранов этого ряда объясняется сопряжением свободной электронной пары атома азота аминогруппы с нитрильной группой [355].
З-Аминофураны в оТличие от их 2-изомеров — более устойчивые соединения. Так, З-а'мино-2-метилфуран в реакциях ацилирования, диазотирования и других ведет себя подобно ароматическим аминам.
Впервые 2-аминофуран выделил Бахер [356], изучивший взаимодействие хлористого дезила с натрийциануксусным эфиром. Выделенный им дезил-циануксусный эфир при перекристаллизации из пиридина переходит в продукт с температурой плавления 151 “С, который далее не был исследован. Позже было установлено (357, 358], что он представляет собой 2-амино-З-этоксикарбонил4,5-дифенилфуран. В дальнейшем при описании строения у-оксинитрилов возможности их циклизации не рассматривались, так как гипотетические 2-аминофураны считались неустойчивыми соединениями. '« только в 1959 г. взаимодействием хлорацетилацетона с малононитрилом оЫл получен 2-амино-3-циано-4-ацетил-5-метилфуран — первый представитель 2-аминофуранов с четко установленным строением [355]. В настоящее время замещенные 2-аминофураны стали легкодоступными веществами.
Основными методами получения замещенных 2-аминофуранов являются циклизация у-оксинитрилов, конденсация «-галоген- и а-оксикетонов, оксиранов с соединениями, содержащими активную метиленовую группу, присоединение цианидов к №, 0-непредельным кетонам.
58
3.1. Циклизация 1,4-оксинитрилов
3-(а-Циано-а-этоксикарбонилметил)-2ч>ксо-1,2-дигидрохинолин (3.10), со-'' держащий фрагмент у-кетонитрила, существует в растворе диметилсульфоксида в виде равновесной смеси с 2-амино-3-этоксикарбонилфуро[2,3-Ь]-хинолином (3.11) 1359]:
В других случаях 1,4-оксинитрилы необратимо циклизуются под действием веществ основной или кислой природы в имины тетрагидрофуранового ряда [7, 340—344, 360—363]. Для предотвращения гидролиза образующихся иминов реакцию целесообразно проводить в безводной среде. Таким путем синтезированы иминотетрагидрофураны и пираны [360]:
- HCl .
где п = 1; 2. 18-Циано-5а-прегнандиол-3|3, 20 (3 под действием концентрированной соляной кислоты [362] гладко циклизуется с выходом 89 % в соответствующий иминолактон. По-видимому, к этому типу превращений можно отнести циклизацию нитрилов у, б-непредельных кислот [364].
Третичные цианацетиленовые (3.12) или этиленовые спирты циклизуются при взаимодействии с бромистым водородом [365], аммиаком [366— 368] и щелочами [369] в 4-бром-, 4-амино- (3.15) и 4-(1-имидазолил)-2-имино-5,5 -диалкил-2,5 -дигидрофураны:
/ГОН
(3.1Ч) (dis)
Аминоимины (3.15) легко образуются в безводном жидком [366—368] или 25%-ном водном аммидке [368]. В первом случае |3-аминоакрилонитри-лы (3.13, 3.14) выделены с выходами 91—97 %. Циклизация их может проис
59
8
ходить спонтанно при хранении [367, 368J или под действием каталитических количеств воды [368]. По-видимому, не следует исключать автокатализ циклизации.
3-Амиио-5-имино-2,2-диметял-2,5-дигидрофуран [362]. Смесь 0,54 г нитрила 4-ме-тил-4юкси-2-пентиновой кислоты и 10, мл 25%-ного водного раствора аммиака переме-шжают 30 мин. Раствор упаривают под вакуумом и остаток перекристаллизовывают из эфира. Получают 0,59 г. (95 %) продукта с т.пл. 136-138 °C (разл.).
В циклизацию вступают также оксинитрилы (3.1) с защищенной гидроксильной функцией. Простые эфиры [370] (2-цианобензиловый [371],2-ди-аиометил-3-пиридиловый [372, 373], 4-циано-5-пиримидинметиловый эфиры карбоновых кислот [374]) циклизуются по типу внутримолекулярного взаимодействия 1,4-оксинитрипов в кислой [370—373] или щелочной среде [374J. Так были синтезированы 2-аминофуро [3,2-Ь] пиридины (3.17) из N-оксида 3-оксипиридина (3.16) и метилеиактивимх нитрилов [372]:
4- гсНгЫ
Z =COOC2HS (a), 4-O2NC6H4COO(6), CN(b), Ас(г).
Однако образующиеся имины легко гидролизуются в соответствующие лактоны [370, 311, 374].
4-Нитроф«тиювый эфир 2-аминофуро] 3,2-Ь] пиридня-3-карбоновой кислоты (3.17, <9 [373) • К 3 мн концентрированной серной кислоты прибавляют по частям 500 мг 4-нит-рофения-0- (З-ацетокси-2-пиридил) цианоацетата. После 30 мин перемешивания раствор выливают на лед и нейтрализуют концентрированным, а затем 2%-тадм раствором аммиака. Светло-желтый осадок отфильтровывают, промывают водой и перекристаллизо-- вывают из этилацетата. Выход продукта с т.пл. 204—205 °C составляет 62 % (при плавлении переходит в 2-оксо-3-циаНо-2,3-дигидрофуро [3,2-Ь] пиридин).
Дибромметил-3 -цианопиридин действием нитрата серебра в метаноле превращается в 3-циано-1-метокси-13-Дигидрофуро[3,4-с] пиридин [375]. Оригинальный способ получения 1 -имино-1,3-дигидробензо [с] фуранов, заключающийся в нитровании некоторых и-ксилонитрилов, предложен в работе [376]: .
60
3.2. Синтезы на основе я-галогенкарбонильных соединений
Перспективным методом синтеза замещенных 2-аминофуранов (3.31—3.35) является циклизация у-кетонитрилов в (3.25—3.28) или изомерные им непредельные у-оксинитрилы (3.29):
(it/) Я=СОСИ,, л’^СЯз, х~С</а) (зге) я=соснз. я'= сн,, л=Яг/в) (зля) я= я’ = cooei, х=ш/а) (ЗГЗ) R-COO£tt Я^СОСНз, X=Cl(i)
(Згз) г=с—ы (з.м) я=н, яЬяг, г.=сеоес (зге) я~н, я-л-, z-ся (127) я^я’=Яг, z=sooet (3-2я) Я=я’=Яг, Z-CN
(но) К-ЦЯ'-Яг, Х-Вг (3.21) я=я’ = яг, я-а я^я'-яг, *=&
(лз>) я~евхяз, Z~M (3.31) я-Я,Я^Яй, z^coott
(З.3з) Я-Н, й'-Лг, Z-CH (ззя) Я^Я'=Лг,г=С00£2 (135) Я~Я’=Лг, 2= с»
Вероятно, большую роль при этом играет возможность енолизации (3.25— 3.29) [377]. Однако в препаративных целях далеко не всегда можно использовать готовые у-кетонитрилы -(3.25—3.28) и тем более непредельные у-окси-нитрилы (3.29). Более доступны исходные а-окси- и а-галогенкетоны (3.18— 3.22), способные при конденсации с метиленактивными соединениями давать нитрилы (3.25—3.29), которые в условиях реакции часто циклизуются в 2-аминофураны (3.31—3.35). Хорошо исследовано взаимодействие а-гало-генкетонов с натриевыми производными метиленактивных нитрилов (3.23, 3.24). Первоначально было изучено поведение а-галоген-0-дикетонов и кетоэфиров [344, 355, 377]. Характер конечных продуктов определяется строением исходных реагентов и условиями проведения синтеза. Так, в-хлор-я-ацетилацетон (3.18,а) образует с натрийциануксусным эфиром 2-амино-4-ацетил-3-этоксикарбонил-5-метилфуран (3.31), тогда как я-бромдикетон
61
(3.18,6) в этой реакции дает 2-амино-4,4,5-триацетил-6-метил-3-этоксикарбо-,нил-4Н-пиран [355].
Реакция протекает через образование промежуточных 7-кетонитрилов (3.25—3.28); некоторые из них выделены [358,371—380] и циклизованы в 2-аминофураны (3.32—3.35). Возможность получения рассматриваемых кетонитрилов определяется их строением, способом выделения, условиями проведения синтеза и соотношением исходных реагентов. По-видимому, в циклизации участвует енол (3.29).
Изучена кинетика циклизации дезилциануксусных эфиров [379]. Установлены закономерности взаимодействия замещенных фенацилбромидов (3.20) с натриймалононитрилом. Показано, что электроно донорные заместители в положении 4 ядра увеличивают скорость диалкилирования метиленовой компоненты по сравнению со скоростью циклизации.'Например, в случае 4-этилфенацилбромида в качестве основного продукта выделен дицианоди(4-этилфенацил) метан [358]. Фенацилбромид и некоторые его производные (3.20) образуют фенацилмалононитрилы (3.26) [358, 371, 378], причем ре-акция лучше протекает при избытке соответствующего бромида [377]. Выделенные фенацилмалононитрилы (3.26) легко циклизуются при нагревании в спиртовой среде в присутствии органических аминов до 2-амино-З-циано-5-арилфуранов (3.33). Электроноакцепторные заместители увеличивают ско
рость-циклизации, что затрудняет выделение промежуточных кетонитрилов [358]. Так, образование 4-цианофенацилмалононитрила обнаружено только хроматографически.
По-разному ведут себя в условиях реакции дезилмалононитрилы (3.28) и дезилциануксусные эфиры (3.27) [358, 379]. Первые, как правило, выделить нельзя, а вторые охарактеризованы и циклизованы в 2-аминофураны, что свидетельствует о значительных различиях их реакционной способности. Из соединений этого класса к настоящему времени выделен лишь дезилма-лононитрил [380].
Методом ЯМР спектроскопии изучен механизм взаимодействия бромистого дезила с малононитрилом натрия [380]. Установлено, что скорость реакции, идущей через стадию образования оксирана (3.36, путь Л), в’ мета-
ноле на порядок выше скорости циклизации, протекающей через дезилма-лононитрил (путь Б):
СН,Ма пути
PhCOCHPh 1 Вг
( j.jc)
осн, PhCH-C- ph он сн(сн)г
PhCOCHPh путь б |
сн(м)г
(3.33}
62
Направление А подтверждено экспериментально реакцией оксирана (3.36) с малононитрилом натрия. При проведении реакции в диметилформа-миде удалось выделить дезилмалононитрил.
Этим методом получены замещенные 2-аминофураны [381—384]. Синтез 2-амино-3-циано-4,5-дифенилфурана (3.35,а) из хлористого дезила и малононитрила в присутствии диэтиламина [385] не обладает никакими преимуществами по сравнению с указанным методом, тем более что выход целевого продукта составляет всего 14 %.
2-Амино-4-этоксикарбоиил-5-метнл-3-циаиофуран [384]. К раствору этилата натрия, полученному из 1,15 г (0,5 моля) натрия и 75 мл спирта, при 30-40 °C прибавляют 3,3 г (0,5 моля) малононитрила. После растворения малононитрила смесь охлаждают до 5-10 °C и приливают в течение 10 мин 8,2 г (0,5 моля) а-хлорацетоуксусного эфира так, чтобы температура не поднималась выше 15—20 °C. Смесь перемешивают при этой температуре еще 30 мин и фуран высаживают водой. Осадок отфильтровывают, промывают водным спиртом и перекристаллизовывают из спирта. Выход продукта с т.пл. 208 °C составляет 80 %.
Из этилового эфира 4-бром-Зоксобутановой кислоты и малононитрила наряду с 2-амино-3-циано-5 -этоксикарбонилметилфураном образуется 1 -амино-2, 5-дициано-З-этоксикарбонилметилен-1 -циклопентен, а из циануксусного эфира (3.23) — диэтиловый эфир 4-оксо-2-цианоадипиновой кислоты [87]:
(3.29) (лго) .cwooet
NtCHCODEt -»-----BrCH^DCH^OOEt -!-----+ MC\I\
СН^ОСЦСООЯ. EtDCOCHt ГНН,
Mil
Фенацилциануксусные эфиры (3.25) легко бромируются в соответствующие бромпроизводные, которые в присутствии трйметилфосфита превращаются в 5-арил-3-этоксикарбонил-2-фосфориламинофураны [386]:
Вт
, . -в'г I Р/0Ме). ^COOEt
[Л25) -----— A-C0CHt С СИ —--------И—
COOEt
О
К рассматриваемому типу превращений следует отнести взаимодействие 1,4-диокси-2,3-дихлорантрахинона с малононитрилом или циануксусным эфиром, приводящее к 2-амино-5-ок|си-4-хлор-3-2-антра[1,2-Ь] фуран-6,11-дионам [387]:
NH,
2-Хлортропон (3.37) аналогично 2-арилсульфонилтропонам (3.38) реагирует с метиленактивными нитрилами (3.23, 3.24) с образованием различных продуктов в зависимости от соотношение исходных реагентов и катали-
63
затора. Так, 2-хлортропон с малононитрилом в присутствии зрет-бутиламина дает 1-окса-2 (1Н)азуленонимин (3.39) [388]:
При соотношении арилоксисульфонилтропон* (3.38), нитрилов (3.23, 3.24) и этилата натрия 1:2:2 в абсолютном спирте получается смесь фуранов (3.40,3.41) и азуленов (3.42,3.43) с выходами 55 и 25 % соответственно [54].
341иано-2,5-гександион (3.45), который является продуктом взаимодействия хлорацетона (3.44) с цианидом калия, циклизуется под действием избытка цианида в 5-амино-4-ацетил.2-метил-2-циано-23-Дигидрофуран (3.46), а не в 2,5-диметил-5-окси-2,4-диоданотетрагидрофураи, как считалось раньше [389]:
сцсосца
fS нем
сн^осмсн^аси, см (лчо)
[ СИ, сосны ]
кем На^СОз
сн,с=енсн
o'
а
CH3CQCHZ
I (З.М7)
(з ул) З'СМ, СООС1
Вероятно, промежуточным продуктом здесь выступает цианацетон, а не 2-цианоэпоксипропан. В то же время с галогенидами (3.47) получены 2-аминофураны (3.48) [390].
64
3.3. Синтезы на основе а-окоикарбонимьных соединений
Изучено взаимодействие а-оксикетонов (ацилоинов, бензоинов) с метилен-активными нитрилами [382, 383, 385, 391—396]. Эти рвакдаи аналогичны рассмотренным выше и протекают с образованием промежуточного нитрила (3.51), изомерного (3.29):
(3.53)
(3.54) ***’-&.
или (з,5г) цшгякикилиден
(ЗЯ>) fi ^Л'/>г
Продукту реакции бензоина (3.50, R = R1 = Ph) и малононитрила первоначально было приписано строение (3.51, R = R1 =Ph) [396]. Однако соединения типа (3.51) до настоящего времени не известны, так как они циклизуются в 2-амииофураиы (3.52—3.54). Позже продукт был описан как имин (3.30) [397] хотя раньше было доказано, что в действительное™ он представляет собой 2-амиио-Зщиано-4,5-дифенилфуран (3.35,а) [382—384, 392]. С приведенными результатами согласуются данные работ [385, 393].
2-Амиво-4,5-дя (2-фурнл) -3-щшюфуран (382]. 0,05 моля фуроияа и 0,055 моля малононктрпа растворяют в 25 мп диметилформамида ц добавляют 3 мл пиперидина. После прекращения экзотермической реакции смесь перемешивают еще 30 мин при 45 -50 °C. Реакционную массу разбавляют водным спиртом (2,5 : 1,0). Выделившийся осадок отфильтровывают, промывают водным спиртом и перекристаллизовывают из спирта. Выход продукта с т.пл. 184—185 °C составляет 77 %.
~ По-видимому, нельзя полностью исключать в качестве первой стадии взаимодействие гидроксильной и нитрильной групп, но специальные эксперименты, подтверждающие такое предположение, не проводилась. Тем не менее приведенная схема более предпочтительна, так как описано получение 2-аминофуранов из бензоинов и малононитрила в условиях реакции Кневенагеля [393], хотя и с меньшим выходом, чем в случае проведения реакции в спиртовой среде или Диметилформамиде в присутствии органических оснований. Кроме того, сильные электронодонорные заместители (диметиламиногруппа и др.), находящиеся в положении 4 бензоина, препятствуют протеканию реакции [343].
Одни и те же 2-амино-З-цианофураны (3.35, 3.54), изомерные по строению (различное положение заместителей в положениях 4 и 5 ядра), можно получить, исходя из а-галогеидезоксибензоинов .(3.21, 3.22) или бензоинов (3.50) и метиленактивных нитрилов. Это обусловлено тем, что в указанных бифункциональных субстратах первоначальной атаке нуклеофила подвергаются а-углеродный атом галогендезоксибензоина в первом случае и углеродный атом карбонильной группы — во втором [383]. Реакция имеет и другие
65
9
ограничения. Так, взаимодействие а-оксикетонов с циануксусным эфиром дает не соответствующие аминофураиы, а цианолактоны [344,398].
Взаимодействие бис-силоксиалкенов с малононитрилом также приводит к фуранам (3.53) [399,400]:
os/Mt} (лги)/Et, w .сн
I -----------------* ]l fl
I*™) n-2+3 (3.53)
При конденсации тетраокси-1,4-бензохинона с малононитрилом получается 2,6-диамино-3,7-дицианобензо [1,24): 4,5-Ь1 [днфуран [401]:
3.4. Синтезы на основе оксиранов
Близко к рассмотренным реакциям стоит взаимодействие оксиранов [363, 402-410] и эпигалогенгидринов [411, 412] с нитрилами, содержащими активную метиленовую или метановую группу. Так, оксираны (3.57, 3.58) реагируют с диарил- (3.56) [7, 363, 402], диалкилацетонитрилами (3.55) 1403] и малононитрилом [404, 405] с образованием производных 2-имиио-етрагидрофуранов (3.60) [363, 402, 403] или 2-амино-4Д-дигидрофуренов 3.61, 3.62) [404, 405]. На первой стадии процесса под действием аниояа итрила раскрывается окисный цикл с получениемпромежуточного у-окси-оприла (3.59), который далее циклизуется в соответствии с установлпоты-
т закономерностями:
. - я1 .^снаг + я—________________________
* X /*
о
(з.ы) А-н, • (J.S7) л* к>, я'- н,Ме.л-
(Из) (35в) &*К*-Н,Ме
(3.33) А
(ззд) н,ме
^СН^СНСНг!Юг он
(з.6о) /зв/) Я,= СЛ,я,= САгА0г,я!я,ч^М1 (з.ез) Я^Н.Ме
(ззг)
66
Направление раскрытия окисного цикла в основном определяется стериче-скими факторами [7, 404]. Образование оксинитрилов (3.59) доказывает^ ся их выделением [406]. В качестве катализаторов применяются гидрид и амиднатрия, диметипамид лития.
Аналогичные закономерности наблюдаются -при действии малононитрила на соединение (3.58) [407—409]. Подтверждением схемы процесса служит присоединение малононитрила к нитроалкенолам (3.63), приводящее к идентичным 2-амино-3-циано-4-нитрометил-4,5-дагидрофуранам (3.61) [407,409].
2-Амиио-3-цнаио-4-нитрометил4,5-дигидрофуран [408]. К смеси 0,5 г 1-нитро-2,3-эпоксэшропана и 0,33 г малононитрила в 3 мл безводного метанола прибавляют 2 мл метанола, содержащего 0,6 10~* моля триэтиламина, н оставляют на двое суток при 18-20 °C. После удаления метанола получают 0,51 г (60 %) продукта с т.пл. 127-128 °C (из хлороформа).
Из 2-метокси-2,3-дифенилоксирана и малононитрила получен 2-амино-З-циано-4,5-дифенил фу ран (3.55,а) [380]. Применение циануксусного эфира приводит к образованию 3-цианобутиролактонов [413].
В случае а-галогенокисей олефинов как исходных реагентов оказалось, что на первой стадии их взаимодействия с малононитрилом [411 ] или цианидом натрия [353] также происходит раскрытие окисного кольца, а не алкилирование. Так, реакция 1-бром-3-метил-2,3-эпоксибутана с малононитрилом калия неожиданно приводит к иминолактону 2-а-оксиизопропил-1-цианоцнк-лопропанкарбоновой-1 кислоты, по-видимому, через интермедиаты (1х-бром-метил-2*-оксиизобутил)малононитрйл и 1,1 -дициано-2- (I1-оксиизопропил) -циклопропан [411]:
ВгСН.
NC сн — сн — ссн3
М СНгВг CHj
В то же время имеются указания на возможность первоначального алкилирования метилеиактивных нитрилов с последующей их циклизацией в иминолактоны [7, 412]. Часто имииолактоны являются промежуточным! продуктами: они могут гидролизоваться или претерпевать другие превращения. Однако такие реакции здесь не рассматриваются. С димером малононитрила реакция протекает глубже за счет циклизации промежуточных 2-ами-нодигидрофуранов в 4,6-диамино-5-циано-2,3-дигидрофуро [2,3-Ь] пиридины
[410].
3.5. Синтезы на основе карбонильных соединений
В качестве исходшх соединений, взаимодействие которых с цианидами, малоионитрилом, тетрацианэтиленом и тетравданэтаном приводит к получению 2-аминофуранов, можно использовать кетоны различного строения. Цианид калия в реакциях присоединения к а, 0-непредельным кетонам аналогично циамхалжонам [414] и 3-нитробензилидеиацетилацетону [415] образует замещенные 2-аминофураны:
2-Амино-4-«1зетил-5-метил-3-(4-нитрофенил)фуран [415]. К распору 3-(4-нитро-бензилидси)-2,4-иентандиона в 15 мл этилового спирта прибавляют распор 3,5 г мини-да калия в 7,5 мл воды. После завершения экзотермической реакции смесь разбавляют водой и взбалтывав» с эфиром. Водный слой подкисляют разбавленной соляной кислотой и экстрагируют эфиром. Экстракт промывают водой и сушит над безводным сульфатом магния. Выпариванием эфирного распора и кристаллизацией из сиирта получают 3,0 г продукта в виде красных нгя с т.пл. 140 °C (разл.).
Интересные данные получены при изучении реакции нуклеофильного присоединения 2-нафтола к 0-циановинилкетонам. Так, на основе /3-бензоил-акрилонитрила получен 2-аьиионафто[2,1-Ь]фураи. Выделяемый аддукт (3.64) циклизуется в тот же нафтофураи [416]:
Циангидрин салицилового альдегида в кислой среде дает крайне неустойчивый 2-аьжно-3-оксо-2,3-дигидробензо [Ь] фураж [417]:
Аналоги имиюаскорбиновой кислоты получаиы при взаимодействии аромаяпескмх или гетероциклических альдегидов с бисульфитным производным глиоксаля и цианида калия [418—420]:
ЛСй*» + + кСМ
сно
Интересно, что бромциан присоединяется к 2-оксикетимашам [421]
68
и альдаминам [422] с образованием производных 2-ммино-2,3-дагидробен-зо [Ь] фурана:
Монокарбонилыше соединения с малоионитрилом превращаются в соответствующие илиденпроиэводные, но во мюгих случаях реакция может протекать"глубже. Тропой и 2-феиилтропон реагируют с малоионитрилом до 2-амино-3-циано-4Н-ш1клогента [Ь] фуранов [423,424].
а-Дикарбонилыше соедшшия (3.65—3.67) по отношению к малононнт-рилу ведут себя по-разному. В первой стадии такого взаимодействия получаются обычные продукты кневенагелевскон конденсации по одной из карбонильных групп. В случае бензила эти продукты (3.70) выделены и охарактеризованы [385, 397]. Алифатические и жирноароматическме а-дике-тоны при действии пиперидана вступают в дальнейшие превращения. Иии-денпроизводше (3.68—3.70) с малоионитрилом дают пирролиномы (3.71— 3.73) [385, 397, 425]. Последние, за исключением соединения (3.73), вступают в реакцию с а-дикетонами, приводящую к 2,10-даокса-6-азатетрацик-та[6,3,0,04'”,05'9]ундеканам (3.74-3.77) [425]:
(зЛз) R~R*-RUt (з./з) R~Alk,R'*f>h [звТ) R'R’-Hi №
(™)
(itt) R-RU.R'-Ph
(3.71) R-R'-Rlk (372) R’RUt, R'^n (З.73) R-R’-Ph
HU
(3.7H) (3.73)
r^r’=R*-R3-RIR
R*Rh, R’-R^’R’-CHj
(37t) R’R^^-CH,,R,-7>h (37?) R^/e^-CH^R^Ph
(ift) ячг-ш
№)
№ r
69
л . ^.'^*^^1^’^’1^’,в*₽^е*га"7«к«М,8-двди1ио-2,10-да<>кса-6-азатетраиюсж>(6,3, 0,0 •“, 0 *]увдек*н (3.74) [425]. Суспендируют 2,0 г 4-циаио-2,3-диметал-5-оксо-З-пирролинил-2-малоноиитрила (3.71,а) в 50 мл дахлорметаиа, содержащего 0,86 г даацетнл*. К смеси прибавляют две капли пиперидина я кипятят 30 мин. Выделившийся осадок после охлаждения отфильтровывают, промывают водой, дихлорметаном и небольшим количеством охлажденного спирта. Выход продукта с т.пл. 220 °C (разл.) составляет 90 %,
1-Бензоил-1-фенил-2,2-дицианоэтилен (3.70) циклизуется в спирте под действием триэтиламина (но не диметиланилина) в 2-имино-4,5-дифенил-3-циано-5-этокси-2,5-дигидрофуран (3.78) [385]. Описано взаимодействие арилацетонитрилов с диэтилоксалатом, приводящее к вульпиновым кислотам — 2-имино-3-арип-5-арилцианометилен-4-окси-2,5-дигидрофуранам [426]:
йг
Я-СНгСН + COOEt -----------
оооа йг о' нн
2-Иммио-4-окси-3-(3-хлорфсннл)-5-(3-хлорфемилцианомегилен)-2^-дигидрофурая [426]. К охлажденному раствору этилата натрия, полученному из 0,32 молей натрия и 100 мл абсолютного спирта, прибавляют 0,158 молей диэтилоксалата и 0,32 моля 3-хлор-фенилацетонитрипа. Смесь перемешивают 1 ч при 60-70 °C, затем разбавляют 30 мл воды. Получают 34 % продукта с т.пл. 284—285 °C (из смеси ДМФА - вода).
3.6. Синтеаы на основе тетрацианоэтана и тетрацианоэтилена
Структуры тина 1,3-кето- и 1,4-оксинитрилов можно получить исходя из карбонильных соединений и тетрацианоэтилена или 1,1,2,2-тетрацианоэтана [427-434]. Изучены [427-432] реакции тетрацианоэтана (3.79) с алифати-скими, ароматическими и гетероциклическими альдегидами и кетонами 3.80). Они протекают по типу альдольного присоединения с последующей клизацией аддуктов (3.81, 3.82) в соответствующие 2-амино-4,5-дигидро-зураны (3.84) через имины (3.83), выделить которые не удается:
(nc), снсн(м), + г?мо
(3.73) (ЗМ)
cn сн
, 1 I
—— ЛМ — c-i — скя' lilt ви Ctf сн он
(з.вз)
70
Реакция ацетальдегида и хлоральгидрата в присутствии воды имеет экзотермический характер [427—429]. Алифатические кетоны, ароматические и гетероциклические альдегиды вводят в реакцию в виде бисульфнтных производных или в условиях основного катализа [431, 432]. Тетрациано-1,4-гликоли (3.82) выделены из абсолютного спирта при соотношении реагентов 1 : 2. Присутствие небольшого количества воды вызывает циклизацию 3,3,4,4-тетрациано-2,5-гександиола [427,428].
5-Амино-2-трихлорметил-3,4,4-трицияно-2,3-дигвдрофур*н (428]. Смесь 6Л г тег-рацианоэтана, 25 г хлоральгидрата и 10. мл воды кипятят 10 мин, затем разбавляют 100 мл воды и охлаждают до 10 °C. Выделившийся осадок отфильтровывают, промывают водой, сушат и переосаждают из этилацетата гептаном. Получают 9 г (65 %) продукта с тдш. 181 °C (разл.).
0-Дикетоны присоединяются к тетрацианоэтилену в присутствии оснований с образованием лабильных 2-имино-3-циано-3-дицианометил-2,3-ди-гидрофуранов [433].
4-Ацетил-2-имино-5-метнл-3-ш1зно-3-диц11аиометял-2,3-дагидрофураи [433]. К раствору 1,28 г тетрацианоэтилена и 1,0 г ацетилацетона в 25 мл бензола прибавляют при перемешивании одну каплю пиридина. При этом сразу выделяется белый осадок, который отфильтровывают, осторожно промывают бензолом и перекристаллизовывают из охлажденной смеси ацетона и легкого петролейного эфира. Выход продукта с т.пл. 122 °C (разл.) составляет 2,2 г (96 %).
При фотохимической реакции хромона (3.85) и тетрацианоэтилена получается смесь продуктов (3.86) и (3.87) [434]:
3.7. Синтезы на основе хинонов
Образование окрашенных соединений при взаимодействии хинонов с нитрилами, содержащими активную метиленовую группу, известно как реакция Крейвена [435—438]. В частности, она предложена для определения 1,4-наф-тохинона во фталевом ангидриде с помощью малононитрила [439]. Изучено взаимодействие л-бензохинона [440] и его замещенных [438,441] с циануксусным эфиром, цианацетамидом и малононитрилом. Выделенные продукты охарактеризованы в качестве обычных аддуктов присоединения по Михаэлю. Например, продукт реакдам ^бензохинона и циануксусного эфира описан как 2,5-ди(этоксикарбошлцианометил)-1,4-диоксибензол (3.88) [440]:
(лев) (зм)
71
Несколько позже было доказано, что они имеют строение 2-аминобензо-[Ъ] фуранов [442, 443]. Продукт (3.88) оказался 2,6-диамино-3,7-диэтокси-карбонилбенэо [1,2-Ь:4,5-Ь1 ] дифураном (3.89) [444, 445]. 2,6-Диамино-3,7-дицианобензо (1,2-Ь:4,5-Ь1]дифуран, полученный этим методом [442], идентичен продукту, синтезированному из тетраокси-1,4-бензохинона и малононитрила [401].
2-Амяно-4,6,7-тряметил-5-окса-3-шы1к>бенэо[в] фуран [442]. Смесь 10 г тримгшп-; 1,4-бенэоплюна, 9 г маловежитрняа и 150 мп водного раствора аммиака (</ = 0,9) кипятят 10 мни. Выделившийся осадок отфильтровывают и после высушивания перекристаллизовывают из ннтробеивола. Вьпсод продукта с т.пл. 258 °C поставляет 4,5 г.
Замещенные хиноны (2-моно-, 2,3-ди-, 2,3,5-тризамещенные 1,4-нафтохи-ноны [446]) образуют смалононитрилом [442],циаиуксуснымэфиром [443, 446], цианацетамидом [442] и 2-бензимидазолилацетонитрилом [447] нормальные конденсированные 2-аминонафто [ 1,2-Ь] фураны в отличие от 2,6-дизамещенных п-бензохинонов, которые в таких условиях не циклизуются [9, 448]. Кроме того, триметил-1,4-бензохинон с «мнацетамидом дает 3-циано-4,6,7-триметил-5-оксииндол, а не ожидаемый 2-аминобенэофуран [449]. Выделенный Юнеком с сотрудниками [442] 2-амшо-З -циано-5,6, 11-триоксиантра[1,2-Ь]фураи(3.93), как было показано [448], является продуктом его окисления 2-амино-3-циано-5-оксиаитра[1,2-Ь] фуран-6,11-дионом (3.94). Следовательно, хинизарин (3.90) реагирует, по-видимому, в таутомерной форме (3.92) :
(з90) R-H (з.Ог) (з.93)'я-Ц2-СН (з.9я) fcH,Z=CN
(ш) я=а (3*^
' (3.96) t~H,Z‘COOEl
(33?) R-Cl,Z*CN
Если реакцию проводить в диметилсульфоксиде при комнатной температуре, то достигаются высокие выходы соединений (3.94—3.97) [450].
3.8. Реакции рециклизации
а-Цианлактоны можно использовать при синтезе эфиров 2-амино-4,5-дигид-рофуран-3-карбоновой кислоты [451, 452]. Рециклизация легко протекает под действием алкоголятов щелочных металлов [451]:
С^О^О
CN EtC
НГ
0
COOEt
COOEt ff
COOEt
COOEt
R^Jk
R'jrWH Гц
72
Непредельные цианлактоны в аналогичных условиях не изменяются [392]. Следует учитывать преимущественное образование ненасыщенных цианлактонов при конденсации «-гапогенкетонов и циануксусиой кислоты или ее эфиров [398]. Известны примеры рециклизации 2-аминофуранов в цианлактоны. Например, этиловый эфир 2-аминофуро[3,2-Ь]пиридин-3-карбоновой кислоты (3.17,а) под действием этилата натрия превращается в 2-оксо-3-циано-2,3-дигидрофуро[3,2-Ь] пиридин (3.101) [373]:
(зав), R*£i(a}t
Использование эквимолярного количества этилата натрия при комнатной температуре позволяет выделить 2-окси-2-этокеи-3-циано-4Н-фуро [3,2-Ь]пиридин (3.100), который под действием этилата натрия переходит в лактон (3.101), а в кислой среде вновь рециклизуется в исходный фуран: (3.99,а) (3.17,а). 4-Нитрофенил-р-(3-ацетокси-2-пиридил)цианоацетат
(3.98,6) в присутствии концентрированной серной кислоты дает 2-аминофу-ро[3,2-Ь] пиридин (3.99,в) (3.17,в) [372, 373]. Действие щелочей изме-
няет направление реакции в сторону образования лактона (3.101) [373]. Аминофуран (3.17,6) также рециклизуется в лактон (3.101) в присутствии этилата натрия в спирте или при термическом воздействии.
2-Аминофураны применяются в качестве полупродуктов в различных областях тонкого органического синтеза.
ГЛАВА 4. 2-АМИНОПИРАНЫ
2-Аминопираны приобретают большое значение в органической химии, поскольку представляют интерес для получения лекарственных препаратов, пестицидов, аналогов природных продуктов, красителей. Их легко модифицировать в органические соединения различных классов (ароматические
10
73
углеводороды, азины), которые трудно синтезировать другими методами. Общие вопросы превращений пиранов и солей пирилия широко освещены в обзорах [453-458], но данные по 2-аминопиранам представлены единичными примерами.
Главные методы получения 2-амииопиранов основываются на внутримолекулярной циклизации б-окси- или 5-оксонитрилов типа
ГУ
и
(«г)
Мы рассмотрим только реакции соединений (4.Г), приводящие к иминам (4.2) в результате взаимодействия нуклеофильного центра (атома кислорода) с электрофильным центром нитрильной группы. При благоприятных возможностях имин (4.2) стабилизируется в форме амина (4.3). Этот тип превращений кратко описан в работах по химии нитрилов [6, 7, 459], кольчато-цепной изомерии [340, 341], химии малононитрила [8—10, 460], илиденмалононитрилов [11], 3,4-конденсированных кумаронов [461], каротиноидов и витамина А [462], активированных винилгалогенидов [463]. В настоящей главе приведены данные по циклизации нитрилов в 2-аминопираны, их гидрированные и конденсированные с ними системы, соли 2-амино-пирилия. Указанные методы базируются на циклизации насыщенных или ненасыщенных 1,5-оксинитрилов, конденсации дикарбонильных соединений и таутомерных им оксиальдегидов или кетонов с нитрилами, содержащими активную метиленовую группу, присоединении нитрилов к а, 0-непредель-ным кетонам или карбонильных соединений с активной метиленовой группой к а, /3-непредельным нитрилам, рециклизации. В результате образуются структуры типа (4.1), которые в большинстве случаев нельзя изолировать вследствие их самопроизвольной циклизации в пираны (4.2,4.3).
4.1. Циклизация 6-окси- и §-оксонитрилов
5-Оксинитрилы легко и необратимо изомеризуются в присутствии кислот и оснований или при термическом воздействии [340, 346]. При этом наблюдаются закономерности, отмеченные при образовании фуранов: действие кислот связано с увеличением электрофильного характера углерода нитрильной группы за счет протонизации [6, 7], а действие оснований обусловлено повышением нуклеофильности атома кислорода гидроксильной группы за счет ее поляризации, причем для 5-оксонитрилов действие сильных минеральных кислот рассматривается как частный случай реакции Риттера [7 ]. Здесь1 первоначально протонируется карбонильная группа и в конечном счете образуются 2(1Н)пиридоны. Поэтому в синтезе 2-аминопиранов чаще всего используется катализ основаниями [6, 7,459].
Как отмечалось, данные ИК спектров показывают, что соединения (4.1),
74
например 5-цианопентанол и его производные, существуют в виде циклических иминов [6, 7, 340, 341, 345,459, 464, 465]. Безусловно, внутримолекулярное взаимодействие по типу (4.1) -+ (4.2) в молекулах 3-оксинитри-лов осуществляется, однако для препаративных целей необходим катализ кислотами или основаниями. Так, катализ основаниями применяется в ряду 18-цианкортикостероидов [466]:
4-Оксикумарин (4.4) и 4-оксикарбостирил (4.5) реагируют с тетраци-анэтиленом (4.6) с образованием аддуктов (4.7) и (4.8), которые в зависимости от условий могут существовать в виде 2-амино-4Н-пирано [3,2-с] кума-
рина (4.9) и хинолина (4.10)
(«6)
О
(ч.ч) У=О \ч.5) У-NH
Интересно, что в отличие от аналогичных реакций 1,3-индандиона и нингидрина хинизатингидрат (4.11) дает идентичные продукты (4.8) ч* (4.10) [467, 468]. В то же время кетонитрилы, получаемые тетрацианэтилированием ацетилацетона [433], цианэтилированием енаминов [11,469] и присоединением кетонов к фурфурилиден- и пиперонилиденмаЛононитрилам [470], существуют в нециклической форме. Однако продукты тетрацианэтилирования очень легко претерпевают различные превращения (в фураны, пирролы) , а 2-амино-3,4,4-трициано-4Н-пиран, вероятно, является промежуточным, очень устойчивым соединением [433]. Применение менее электронодефи-
юх
75
цитных этиленов приводит кч2-аминопиранам. Так, 2-(2,2-дицианоэтил)-1-тетралон гладко циклизуется в 2;амино-3-циано-5,6-дигидро-4Н-нафто[1, 2-Ь] ниран [471]:
а- (2-Цианофенил) кетоны циклизуются под действием кислот в 1-аминобензо [с] пирилиевые соли (472]:
НВг
NH,
Предполагается [415], что 1-окси-2-фенацил-З-цианоиндол (4.12) с течением времени в спиртовой среде дает аминопиран (4.13), у которого при обработке щелочью неожиданно раскрывается пирановый цикл:
6-Аммио-4-метил-5-циано-2-(2-метил-3,3-дицианоаллилнден)-2Н-пиран (108|.Раствор 0,1 моля 2,6-дабутиламино-2,5-гептадисн-4-оиа в 80 мл этилового старта прибавляют к раствору 0,2 моля малононитрила в 80 мл спирта. Выделившийся осадок отфильтровывают и перекристаллизовывают из пиридина. Выход пирана с т.пл. 252-253 °C составляет 64 %.
Циклизация (3-оксивинил- (4.14) или /3-аминовинилакрилонитрилов (4.15) в присутствии кислот служит удобным методом синтеза 2-аминопи-рилиевых солей (4.16) [463,473,474]:
У М
(«/*) у=он
(Ч15) У
на.о„
Перхлорат 2-амино-6-фенил-3-этокснкарбоиилпирилия (463]. 10 ммолей, этилового . эфира 3-(2-анилиновинил) -2-цианоакриловой кислоты растворяют в 15 мл уксусной кислоты и смешивают с 0,5 мл воды и 3 мл 70%-ной хлорной кислоты. Суаесь кипятят 5 мин. После охлаждения к реакционной массе добавляют эфир, выделившийся осадок отфильтровывают и перекристаллизовывают из смеси нитрометана и уксусной кислоты. Выход перхлората с т.пл. 237-241 °C равен 58 %.
В реакцию можно вводить оксинитрилы с защищенной гидроксильной 76
группой [475—478]. В частности, предложен способ получения конденсированных 2-аминопиранов каталитическим гидрогенолизом бензилоксинико-тиноилацетонитрилов (4.17, 4.18). Реакция протекает через соответствующие оксиникотиноилацетонитрилы. Так, удалось выделить промежуточный 2-оксиникотиноилацетоиитрил (4.19) [475];
СОСНИН
f X
(ч.п) Х=сн, У-N
(Ч.!в) Х = Н, У-CM
Иг /pd/ва 50ц СОС^М
(«») Л=£М, У-У
О
ННг (у 20) Х-СН, У-М (Ун) X=N, У-СМ
Следует отметить, что первоначально 2-аминопираны были получены в виде солей с сильными минеральными кислотами, а затем стабилизированы введением сильного электроотрицательного заместителя в положение 3 пиранового ядра. Метод [475, 476] пригоден для синтеза 2-амино-4-оксо-4Н-пи-рано [2,3-Ь]- (4.20) и 2-амино-4-оксо-4Н-пирано[3,2-с]пиридинов (4.21), незамещенных в положении 3.
Ацетильная защитная группа применена в синтезе 2-аминохромонов [477, 478]. Предложенный способ ацилирования малононитрила хлорангид-ридом 2-окси-5-хлорбензойной кислоты (4.22) включает защиту гидроксильной функции. В присутствии щелочей малононитрил ацилируется хлорангид-ридом (4.22). Затем в условиях реакции следуют снятие ацильной защитной группы и циклизация интермедиата в 2-амино-6-хлор-3-циано-4Н-хромон-4 (4:23);
(чгг) (у.гз)
Однако более перспективен разработанный Ф.С.Бабичевым с сотрудниками метод ацилирования нитрилов с активной метиленовой группой эфирами 2-оксибеизойных кислот [479 —483]. При этом отпадает надобиость во введении О-защитной группы. Кроме того, сложные эфиры 2-оксибензойных кислот более доступны, чем соответствующие галогенангидриды, и работать с ними намного удобнее. В качестве катализатора здесь применяется трет-бутилат натрия:
'-3-арил- и 3-гетарил-4Н-хромоны, 2-ами-тны предложено использовать в синте-
ZCH2CN
Таким путем получены 2-<. ноарено[Ь]циран-4-оиы. 2-Амино.
77
зе биологически активных веществ [476], а также в качестве профилактических лекарственных средств против аллергии и астмы у млекопитающих [477, 478].
5-Амино-2/>-дифёиил-7-оксо-7Н-тиено[ 3,2-Ь) пиран [482]. Смесь 20 ммолей 2-меток-сикарбонил-З-окси-5-фенилтиофена, 20 ммолей фенилацетонитрила, 60 ммолей трет-бутилата натрия и 30 мл пиридина кипятят 2 ч. Растворитель упаривают в вакууме, остаток растирают в 100 мл воды и нейтрализуют 9 мл 50%-ной уксусной кислоты. Выделившийся осадок отфильтровывают, промывают Водой, сушат и перекристаллизовывают из пропанола. Выход продукта с т.пл. 255 °C составляет 90 %.
2-Амшю-4ч>ксо-4Н-пирано[2,3-Ь]пнрнднн [476]. Раствор 53,5 ммолей 2-бензилок-ся-3-никотиноилацетонитрила в 250 мл уксусной кислоты гидрируют над 1,5 г 10 % Pd/BaSO4 до поглощения 53,5 ммолей водорода. Реакционную массу нагревают до кипения и фильтруют горячей. Фильтрат кипятят 30 мин, затем упаривают в вакууме почти досуха, охлаждают и поручают 93 % продукта с т.пл. 215-216 °C (разл., из спирта).
2-Амино-4-пироны синтезированы ацилированием метиленактивных нитрилов дикетеном [484] и 5-оксо-4-оксаспиро [2,3] гексаном [485]:
4- гснг СИ
Na И
Описана [486] циклизация 1-(1-метил-2-метоксикарбонил-3-индолил)-2,2-бмс-метилтиоакрилонитрила за счет взаимодействия сложноэфирной и нитрильной групп в присутствии полифосфорной кислоты:
Ацилирование фенилацетонитрилов ангидридами карбоновых кислот представляет интерес при получении солей З-ациламино-2-бензо [с] пирилия [487, 488]. Соли З-амино-2-бензопирилия являются промежуточными продуктами. Однако в реакцию вступают только арилацетонитрилы с электронодонорными заместителями в ядре:
4.2. Взаимодействие карбонильных соединений с метиленсодержащими нитрилами
Конденсация 1,3-дикарбонильных соединений с нитрилами, содержащими активную метиленовую группу, вероятно, должна приводить к образованию 78
замещенных 2-аминопиранов. Но течение процесса зависит от многих факторов, поэтому 2-аминопираны выделены в единичных случаях. Так, 7-ацето-ацетил-6-метоксибензо [Ь] фураны при конденсации с малоионитрилом дают 7- (2-имино-6-метил-3-циано-2Н-пиранил-4) -6-метоксибензо [Ь] фураны [489]:
2-Формилдимедон реагирует с малононитрилом, образуя смесь 2-амино-пирана (4.24) и 2(1Н)пиридоиа (4.25) с выходами 79 и 20 % соответственно [490]:
Изучена катализируемая пиперидинацетатом тона с циануксусным эфиром в бензоле [491 ]:
конденсация ацетонилаце-
79
Из смеси 2,4-диметил-4-(этоксикарбонилцианометил)-З-этоксикарбонил-4-циано-1-циклопентена, 1,6диэтоксикарбонил-2,5-диметил-1,6-дициано-1,5-гек-садиена, 1-метил-3 (этоксикарбонилцианометилен)-1-циклопентана, 7-этоксикарбонил-4,6-диметил-3-циано-5Н-циклопентено[Ь] пиридона-2 (1Н), 4,6-ди-метил-3-циано-5Н-циклопента [Ь] пиридона-2 (1Н), 4,6-диметил-3-циано-5 Н-циклопента [Ь] пиридона-2 (1Н) удалось выделить с выходом 16 % 2-амино-4,6-диметил-3-этоксикарбонил-7-цианоциклопента [Ь] пиран (4.26). Эти результаты согласуются с данными исследования реакции /3-кетоэфиров и /3-ке-тоамидов с малононитрилом [492], которая протекает с образованием продуктов кневенагелевского взаимодействия и производных иминопиранов, рециклизуюшихся в соответствующие пиридоны. Последующая рециклизация 2-аминопирана, гидролиз и декарбоксилирование приводят к 5Н-цикло-пента [Ь] пиридинам-2 (1Н) [491]. Кроме того, выделен продукт конденсации по Кневенагелю ацетилацетона с 2 молями циануксусного эфира. Таким образом, ход процесса представляется вполне закономерным.
Реакции протекают в различиях направлениях и при взаимодействии 3-хлор- и 3-бром-2,4-пентандионов в щелочной среде с малононитрилом и циануксусным эфиром [355]. Малононитрил дает с обоими реагентами 2-ами-но-4-ацетил-5-метил-3-цианофуран, в то время как с циануксусным эфиром хлорпентандион образует соответствующий 2-аминофуран (4.27), а 3-бром-2,4-пеитандион — 2-амино-4,4,5-триацетил-3-этоксикарбони5Г-6-метил-4Н-пи-ран (4.28):
COOEt о
NCCHrCODEt
CH,
Л=С1
сн,соснсосн}
НССНгС00Е1 CH, CD COCH,
Л = вг CH,co
COCH,
CH,CO COOEt
СН,"()'ННг
CH,CO COCH, CH, CO COOEt
CH, CO CH.CO^y
CH,
COCH, <- COOEt
о
(Hit)
Наблюдаемые отличия объясняются тем, что скорость образования промежуточного тетраацетилэтилена в присутствии щелочей выше скорости алкилирования циануксусного эфира.
Более избирательно с метиленактивными нитрилами реагируют ароматические 2-оксикарбонильные соединения, формально таутомерные 1,3-дикар-бонильным производным. Подробно изучены реакции салицилового альдегида и его замещенных [493—502]. Первоначально данные были противоречивы [493—496]. Так, указывалось на возможность выделения хлорГидрата
80
2-иминокумарина циклизацией 0-(2-оксифенил) акрилонитрила и свободного кумаринимина [454, 493]. Описанный 2-оксибензилиденмалононитрил (4.29) [494] в действительности является З-циано-2-иминокумарином (4.30), а продукт (4.29) выступает как интермедиат, который не может быть изолирован:
снг (см)}
(ч.29)
З-Цианокумарииимид [5031. К раствору 0,05 моля малононитрила и 0,05 моля салицилового альдегида в 30 мл этилового спирта прибавляют 0,03 моля ацетата аммония и смесь перемешивают в течение нескольких минут. Выделившийся осадок отфильтровывают. Выход продукта с т.пл. 162—164 °C составляет 65 % (его используют по возможности быстро без предварительной кристаллизации).
Во всех случаях необходимо считаться с возможностью гидролиза иминов (4.30) до соответствующих кумаринов [504]. Присутствие' в реакционной массе воды благоприятствует гидролизу, поэтому необходимо быстро изолировать целевой продукт.
Изучено взаимодействие салицилового альдегида с циануксусным эфиром [500]. Показано, что при эквимолярном соотношении реагентов выход имина (4.31) достигает 35 и 32 %, если в качестве катализаторов использовать этилат натрия и карбонат калия соответственно. Кумарин (4.32) выделен с выходами 5 и 4 %. С увеличением концентрации циануксусного эфира выход имина возрастает:
-f- NCCH2COOEt
В присутствии органических оснований направление реакции изменяется. При двукратном избытке выход кумаринимина (4.31) приближается к количественному. По данным [496], салициловый альдегид при наличии пиперидина реагирует с 2 молями циануксусного эфира с образованием 1-ами-но-1 - (3-кумаринил) -2-этоксикарбонил-2-цианоэтилена и 2-амино-З-этокси-карбонил-2-(зтоксикарбонилцианометил)-2Н[1] бензопирана. Однако, согласно [501, 502].. последний имеет строение этилового эфира а-циано-в-(2-амино-3-этоксикарбонил-4Н [1] бензопиранил-4) уксусной кислоты (4.33).
- 2-Амино-3-этоксикарбоинл-4-(этоксикарбонилцианометил) -4Н-хромен [501]. К раствору 10 ммолей салицилового альдегида и 20 ммолей' циануксусного эфира в 30 мл спирта, охлажденному до 5—10 °C, прибавляют при энергичном перемешивании 10—20 ммолей ацетата аммония. Смесь перемешивают 2 ч, поддерживая указанную температуру. Выделившийся осадок отфильтровывают, промывают холодным спиртом н перекристаллизовывают из дихлорметана. Выход кристаллического продукта с т.пл. 142 — 143 °C составляет 70 %.
81
11
Изменение условий проведения синтеза и соотношения реагентов ведет к производным 4Н-хроменов (4.35), причем соединения (4.34) выделены и превращены в 4Н-хромены (4.33) или (4.35) :
он он
Несмотря на то что присутствие воды вызывает быстрое превращение иминов (4.30, 4.31) в кумарины, их можно выделить в виде солей пирилия [505, 506], например:
Рассматриваемый метод применяется в синтезе 3-гетарилкумариними-дов-2, служащих красителями, пигментами и их полупродуктами [507— 514]. В конденсацию вводились замешенные 4-аминосалициловые альдегиды и гетарилацетонитрилы, производные тиофена [509], тиазола [510], 1,3,4-тиадиазола [511], 1,3,4-триазола [512], 1,2,4-тиадиазин-1,1 -диоксида [513,514] и других гетероциклов.
2-Имиио-3-(5-метоксикарбонил-2-тиенил)-7-диэтиламииокумарин [509]. 0,1 моля 4-диэтиламиносалицилового альдегида и 0,1 моля 2-цианометил-5-метоксикарбонил-тиофена растворяют в 120 мл этилового спирта. К раствору прибавляют 1,5 мл пирролидина и смесь кипятят 30 мин, затем охлаждают до 0-5 °C. Выделившийся осадок отфильтровывают, промывают спиртом и сушат. Выделяют имннокумарин в виде желтых кристаллов с т.пл. 163-164 °C и выходом 25 %.
Другие 2-оксисалициловые альдегиды, как и оксиальдегиды гетероциклического ряда, применяются редко. В известных случаях они дают нормальные продукты конденсации, например 4,9-диметокси-5-метил-6-циано-7-имино-7Н-фуро [3,2-g] [1] бензопираны (4.36) [515], 2-имино-8-метил-5-ме-токси-6-оксо-3-циано-2Н,6Н-бензо [1,2-Ь: 5.4-Ь1] дипираны (4.37) [516]:
(озб) {^37)
82
Димер малононитрила также реагирует с замещенными салициловыми альдегидами [517]:
CN
NH2
В ряде случаев отмечено более глубокое протекание процесса [8]. Например, конденсация салицилового альдегида с циануксусным эфиром ведет к производным 2Н-[1] бензопирано [2,3-d] пиримидин-2,4 (ЗН)-диона [518]:
Производные салицилового альдегида (альдимины и основания Шиффа) реагируют с малононитрилом аналогично [519].
Изучена трехкомпонентная конденсация салицилового альдегида, малононитрила и кетонов в присутствии ацетата аммония [503, 520, 521]. При молярном соотношении реагентов 1 : 1 : 1 и небольшом избытке ацетата аммония получается с низкими выходами смесь 4-амино-5-имино [1 ]бензопи-рано [3,4-с] пиридина (4.42), 1 -циано-2,4-диамино-5-имино [ 1 ] бензопирано-[3,4-с] пиридина (4.41) и 2-арил-5-(2-оксифенил) [2,3,4-de] бензопирано [2,
З-d] пиридопиримидина (4.40):
Вероятно, на первой стадии процесса образуется 3-цианокумаринимид (4.38), который через 3-амидинокумаринимид (4.39) дает с кетоном соединение (4.40), а с малононитрилом — продукт (4.41). Последний участвует в конденсации с альдегидом, превращаясь в конденсированный цикл (4.42), что также имеет место в случае 1-циано-4,4-диамино-12-меток си-9-метил-11-оксо-5Н,11Н-пирано [З1, 21 : 6,7] [1]бензопирано [3,4-с] пиридина и 4-амино-5-имино-9-метил-12-метокси-11-оксо-2-фенил-5Н,11Н-пирано [З1, 21 : : 6,7] [1 ] бензопирано [3,4-с]пиридина [516].
83
И
2-Оксиацетофеноны подобным образом реагируют с метиленактивными нитрилами [8, 459]. В мягких условиях удалосв выделить З-циано-2-имино-4-метил [1] бензопиран и ввести его в реакцию с элементной серой [522].
4.3. Синтезы, основанные на реакции Михаэля
Синтезы 2-аминопиранов, основанные на реакции Михаэля, можно разделить на две большие группы: циклоприсоединение метилеиактивных карбонилсо-держащих соединений к непредельным нитрилам и циклоприсоединение ме-
гиленактивных нитрилов к непредельным кетонам;
1,3-Дикарбонильные соединения легко присоединяются к электрбноде-фицитным этиленам, прежде всего тетрацианоэтилену [433, 523, 524] и 1,2-диэтоксикарбонил-1,2-дицианоэтилену [84]. Имеются указания [433, 523J на возможность образования соединений, не содержащих пиранового кольца (4.43). При проведении реакции в спиртовой среде образуется смесь продуктов (4.43) и (4.44):
(y.VJ? (wj
2-Аминопиран (4.44) можно получить при длительном выдерживании компонентов в ацетонитриле при комнатной температуре [523]. Интересно, что 2-аминопиран (4.47), синтезируемый нз димедона и непредельного нитрила (4.45), при кипячении в спирте в течение 8 ч или при комнатной температуре в течение суток раскрывает пирановое кольцо с образованием нециклического продукта (4.46):
NC-C-с-CN I । ctoco cooet
о nс cooet
В эту реак-цию* вступают другие электронодефицитные этилены: арили-денпроизводные малононитрила, циануксусного эфира [525, 526] и нитроацетонитрила [527, 528]. Из 1,3-дикарбонильных соединений изучены ацетоуксусный [525] и щавелевоуксусный эфиры [526], димедон [526-528] и др.
2-Амнно-5-этоксикарбонил-6-метил-4-{2-фурил]-3-циаио-4Н-пнран [529]. Смесь 10 ммолей фурфурилнденмалононитрила и 10 ммолей ацетоуксусного эфира растворяют при слабом нагревании в 25 мл этилового спирта, прибавляют одну каплю морфолина и оставляют кристаллизоваться. Выделившийся осадок отфильтровывают, промывают небольшим количеством спирта и перекристаллизовывают из диоксана. Выход продукта с т.пл. 205 -206 °C составляет 73 %.
З-Метил-5-пиразолоны гладко реагируют с арилиденмалононитрилами • [529—535]. При реакции пиразолонов (4.48, 4.49) с арилиденмалононитри-
84
лами (4.50-4.52) с высокими выходами выделены дицианоэвдлпиразоло-ны (4.56—4.59), которые гладко зациклизованы при термическом воздействии или в присутствии Оснований в пиразолопираны (4.61—4.64) [529— 532, 534] .Арилиден- (4.53, 4.55) и алкилиденпиразолоны (4.54) с малоно-
нитрилом в присутствии органических оснований превращаются в те же пи-
разолопираны (4.61, 4.62, 4.65) [530-533]. Это свидетельствует о том, что
в качестве промежуточных продуктов выступают одни и те же аддукты Ми-
хаэля (4.56—4.59):
(ч.чв) R—H (ч.5>) R'=2-f>ypun,K^ (ч.Зв) Р=Я>,К=Яг, /? =Н (ш)
(Ч.ЧЗ) Р-РЬ (452^ = R‘ (ЧП'/) К = ^=Н,н’=Яг (ч.5ч) R=Phf «=!?=СН3
(ЧЗв) Я-2фурЩ № (ч») Я=^»,Я^Р/>
(Ч59) Я = Яг=Н,я'^2-ipypun
(Ч.вв)
я’=Н, tf—Arfs)
(Ч.В2) Я=Я = Ph,R=H
R =Pfi, й’-З-фдрШ!,
(Ч еч) Р=Я= 2-tpypu/l (чм) r*h, р= си.
В работе [534] отвергается возможность их выделения, что можно объяснить применением катализаторов основной природы. Имеются данные [533] о выделении пиразолопиранов (4.66,а,б),которые нуждаются в уточнении. »
Синтез пиразолопиранов (4.61—4.64) можно упростить, если использовать трехкомпонентную конденсацию альдегидов, пиразолонов и малоно-
85
нитрила [529—532]. Среди пиразолопиранов (4.61—4.62) найдены пестициды, обладающие умеренной активностью [534].
6-Амиио-3-метил-1,4-дифеиил-5-циано-1Н,4Н-пиразоло( 3,4-Ь] пиран [531]. К суспензии 0,01 моля 3-метил-1-фенил-5'Пиразолона, 0,01 моля арилиденмалононитрила и 50 мл этилового спирта прибавляют 0,2 мл морфолина. Смесь нагревают до растворения исходных реагентов и оставляют кристаллизоваться. Выделившийся осадок отфильтровывают н перекристаллизовывают из нитрометана. Выход продукта с т.пл. 167-168 °C составляет 93 %.
Тетрацианоэтилен аналогично реагирует с 5-пиразолонами, давая соответствующие 2-амино-1 Н,4Н-пиразоло [3,4-Ь]пираны [535]. Необходимо отметить, что в случае З-амино-5-пиразолона и бензилиденмалононитрила получен 3,6-диамино-4-фенил-5-цианопиразоло [3,4-Ь] пиран [536]. Следовательно, промежуточный аддукт Михаэля циклизуется за счет атома кислорода, а не азота аминогруппы. В указанную реакцию вступают и другие гетероциклы, содержащие по соседству с карбонилом активную метиленовую группу, например производные пирана [535], пиримидиндиона [535,537].
2-Амино-7-метил-5-оксо-3,4,4дрициано-4Н,5Н-пирано(4,3-Ь| пиран [535]. К 14 ммолям тетрацианоэтилена и 50 мл этилового спирта прибавляют при перемешивании 10 ммолей лактона триадетовой кислоты при комнатной температуре. Через 2 ч осадок отфильтровывают и перекристаллизовывают из водного диметилформамида. Выход продукта с т.пл. 220 °C (разл.) 47 %.
Барбитуровая кислота даже в отсутствие оснований присоединяется к тетрацианоэтилену [535], арилиденпронзводным малононитрила и циануксусного эфира [537] при кратковременном нагревании в тетрагидрофуране или диоксане с образованием соответствующих 2-амино-4Н-пирано [2,3-d] пи-римидиндионов (4.67-4.69):
(ч.вв) д' =н,к‘=Яг,1^сп
(ч,69) й'*и, дг=йг, z = соон
Проведение реакции в спиртовой среде изменяет ее направление [535].
Присоединение по Михаэлю карбонильных соединений к 2-оксогетари-лиденмалононитрилам, производных различных гетероциклов, расширяет границы применимости реакции к синтезу спчросоединений пиранового ряда [538—540], например спиро [оксиндол-3,41-(21-амино-3|-циано-51, 6*. 7‘, в^тетрагидроЛ’ Н-пирано [2,3-d] пиримидин-51,7 ‘-диона) ]:
86
В качестве оксосоединений использовались З-метил-1 -фенил-5 -пиразо-лон [538], 2-метилгомофталимид [540] и 1,3-циклогександион [538]. Специфически реагирует этоксиметиленмалононитрил [460].
Реакции присоединения нитрилов с активной метиленовой группой к а, р-непредельным карбонильным соединениям изучены достаточно хорошо на примере тетраацетилэтилена, арилидензамещенных ацетоуксусного эфира [525, 541], непредельных кетонов [9, 542] и халконов [543]. Этот тип превращений также можно классифицировать как реакцию Михаэля. Обычно в ней используют катализ основаниями. Интересно, что в случае пулегона (4.70) катализатором служит фторид калия [542]:
{Ч-70)
а-Цианхалконы (4.71) [544- 541] или а-этоксикарбонилхалконы (4.72) [111] при взаимодействии с циануксусным эфиром [544—547] или малононитрилом [545—550] дают с высокими выходами замещенные 2-амино-4Н-пираны (4.74—4.76). Как правило, реакцию проводят, нагревая компоненты в спиртовой среде в присутствии органических оснований. Процесс протекает через образование промежуточного аддукта Михаэля (4.73). Все стадии обратимы, о чем свидетельствует тот факт, что 2-амино-З-этоксикарбонил-4Н-пиран (4.75) при нагревании с малононитрилом в идентичных условиях рециклизуется в 2-амино-3,5-дициано-4Н-пиран (4.74) [544]:
flrCOC\= СНЯг' -f- ^с/!гСЯ R
(^71) R-CH
(4.7г) R^cooet
Яг Яг'
(Ч-7Ч) R-Z^CN
(47з) R = CH, Z = COOPt (47S) R= COOCt, Z=CN
2-Амиио-4,6-дифенил-5-циаио-3-этоксикарбоиил-4Н-пиран [544]. К раствору 0,1 моля бензилиденцианоацетофенона в 100 мл абсолютного спирта прибавляют 0,1 моля циануксуеного эфира и 1 мл пиперидина. Реакционную массу кипятят 7 ч, затем наполовину упаривают и оставляют при комнатной температуре. Выделившийся осадок отфильтровывают и перекристаллизовывают из спирта. Выход продукта в виде бесцветных кристаллов с т.пл. 135 °C составляет 65 %.
Однако реакция имеет ограничения. Так, при взаимодействии цианхал-кона (4.71, Аг = Ph, Аг1= 2,4-(СН3)2С6Н3) с малононитрилом получен соответствующий пиран с выходом лишь 19 %. Применение циануксусного эфира ведет с выходом 56 % к 2,4-диметоксибензилиденциануксусному эфиру [547], т.е. имеет место конкурирующая реакция обмена метиленовыми компонентами. На это указывается и в работе [549]. Оказалось, что а-этоксикарбонилхалкон (4.72) с циануксусным эфиром не реагирует [550]. Следует отметить, что на реакцию влияют стерические воздействия и присоединение малононитрила к непредельным кетонам может протекать по 1,4- или 1,2-положениям [542], причем только в последнем‘случае следует ожидать образования 2-аминопиранов.
Конденсированные 2-амино/1Н-пираны получают из 2,6-диарилиденцик-логексанона и его замещенных [9, 551, 552], 2-арилиден-1-тетралона [553], 4-арилиден-5-изоксазолонов [544], 5-пиразолонов [532], 1,3-дифенил-2-тиогидантоина [555] и метиленактивных нитрилов. На возможность циклизации аддуктов Михаэля в конденсированные пираны указывалось в работе [471]. На основании экспериментальных данных можно предположить, что 2-арилиденоксопроизводные пятичленных гетероциклов труднее превращаются в конденсированные 2-аминопираны, чем соответствующие шестичленные гетероциклические производные. Например, 4-бензилиден-З-метил-5-изоксазолон присоединяет малононитрил, но указаний о циклизации полученного аддукта Михаэля в пиран нет [556]. Тиогидантоин (4.77) с малононитрилом дает 6-амино-5-циано-1,3-дифенил-2-тиоксо-1,2,3,4-тетрагидропи-рано[3,2-<1] имидазол (4.79), а тиогидантоин (4.78) — 1-оксо-3-тиоксо-2,3, 7,7а-тетрагидро-1Н-пирроло [1,2-с]имидазол (4.80) [555]:
{^73) (^-7?)
(4.7в)
6-Амино-3-метил-1,4-дифеиил-5-циано-1Н,4Н-пираэоло[3,4-Ъ] пиран [534J. К перемешиваемой смеси 10 ммолей 4-бензилиден-3-метил-1-фенил-5-пиразолона и 15 мл бензола прибавляют 15 ммолей малононитрила в 20 мл бензола и 0,5 мл триэтиламина. Реакционную массу перемешивают 4,5 ч, выделившийся осадок отфильтровывают и перекристаллизовывают из спирта. Выход продукта с т.пл. 175-177 °C составляет 93 %.
6-Амнно-1,3,4-'трифеиил-5-циано-2-тиоксо-1,2,3,4-тетрагидропирано[2.3ч1] имидазол [555]. К перемешиваемой смеси 10 ммолей бензилиденмалононитрила, 10 ммолей 1,3-дифснил-2-тиогидантоина и 50 мл этилового спирта прибавляют 1 мл пиперидина. Реакционную массу кипятят 5 ч, затем охлаждают. Выделившийся осадок отфильтровывают и перекристаллизовывают из спирта. Выход продукта с т.пл. 150 °C равен 60 %.
Гетероциклическая система 7,8-дигидро-6Н,1 ЗН- [Цбензопирано [4, 3-сЦипдено [1,2-Ь] пиридина (4.81) получена присоединением циануксусного эфира к 2-(21-оксибензилиден)-1-инданону [557]:
88
он
+ нсснгсооа
(net)
Часто при синтезе 2-амино-4Н-пиранов хорошие результаты достигаются в случае трехкомпонентной конденсации альдегидов, карбонилсодержащих соединений и метиленактивных нитрилов [525, 530—532]. Вероятно, здесь первоначально происходит конденсация Кневенагеля ароматического альдегида с метиленактивным нитрилом с последующей реакцией карбонильного соединения с аддуктом Михаэля. Дальнейшая циклизация дает 2-амино-пиран.
Возможен и другой путь, по которому на первой стадии происходят взаимодействие альдегида с карбонильным реагентом, присоединение к продукту реакции метиленактивного нитрила и циклизация. Конечными продуктами являются идентичные 2-аминопираны. По-видимому, реакция протекает по обоим направлениям одновременно с удельным вкладом каждого пропорционально скорости взаимодействия.
Учитывая обратимость реакции Михаэля, в трехкомпонентной конденсации для получения 2-амино-3-циано-4Н-пиранов л место альдегида можно использовать арилиденциануксусный эфир [525], что возможно только при обмене метиленовыми компонентами. Именно этим объясняется возможность рециклизации пирана (4.65) в пиран (4.74) [544]. Продукты присоединения по Михаэлю малонового эфира к арилиденацетоуксусному эфиру при реакции с малононитрилом дают 2-амино-5-этоксикарбонил-6-метил-4-арил-3-циано-4Н-пиран [10, 558], что также подтверждает* обмен метиленовыми компонентами.
К рассматриваемому типу превращений следует отнести взаимодействие активных фенолов, 2-нафтола с илиденпроизводными малононитрила и циануксусного эфира. Фенолы можно рассматривать как таутомерную форму циклических кетонов. Вероятно, поэтому 4-оксикарбостирил и его производные легко вступают в реакцию присоединения к тетрацианоэтилену [647, 648]. 4-Оксикумарин также присоединяется к бензилиденмалононитрилу с образованием 2-амино-5-оксо-4-фенил-3-цианопирано [3,2-с] [ 1 ] бензопирана [559, 560]. Кроме того, в данной реакции можно применять активные фенолы (резорцин [561], 3-аминофенолы [562, 563], 2-нафтол [564]). З-Ди-эгиламинофенол и 1,1-дициано-2-хлор-2-перфторалкилэтилены превращаются в 2-амино-4-перфторалкил-3-циано-7-диэтиламинокумарин [562]. Предложен простой подход к синтезу 7-диалкиламино-3-циано-2-М-(2,2-дициановинил) иминокумаринов из 1,3-аминофенолов, малононитрила и триэтилортоформиата [563]. По-видимому, в реакцию вступает первоначально образующийся этоксиметиленмалононитрил. 2-Оксинафтол в реакции нуклео
12
89
фильного присоединения дает 2-амино-4-арил-3-замещенные-4Н-нафто [2, 1-Ь] пираны [564]:
,CN Дг-сн =< и. г
он
4.4. Рециклизация гетероциклических соединений
Как было показано, 2,4-диилиден-1,3-дитиетаны (4.82) взаимодействуют с бензоилацетонитрилом с образованием 2-амино-4Н-пирантионов-4 (4.83) [565]: NC S СОЯ
вгл^ Ж + PhCOCH CN—~ КС0 s CN
( Ц.82)
r = ocHJt octnStnHt ' (^оз)
5-Метилизоксазол рециклизуется в присутствии салицилового альдегида в 3-ацетилкумарин через соответствующий кумаринимид [566]. Вероятно, салициловый альдегид реагирует с цианацетоном, образующимся из 5-метил-изоксазола. 2-Имино-4-оксикумарины получены рециклизацией при нагревании 5-(2-оксифенил)изоксазолов [567. 568]:
В зависимости от строения и условий превращения изоксазолы можно рассматривать как латентную форму цианкетонов, иминокетонов и некоторых других соединений [569].
Известны реакции рециклизации соединений, содержащих пирановый цикл, например изомеризация цианлактонов под действием алкоголятов щелочных металлов, приводящая к 2-аминопиранам [451]:
00Na
Кумарин в реакции с малононитрилом превращается в амид 2-амино-З-циано-4Н [1]бензопиранил-4-уксусной кислоты [570]. Известна также рецик-лкзация 2-аминопиранов. Так, 2-амино-4,6-дифенил-5-циано-3-этоксикарбо-нил-4Н-пиран (4.75) при нагревании в течение 10 ч с малононитрилом в спирте переходит в 2-амино-4,6-дифенил-3,5-дициано-4Н-пиран (4.74) [544]. 90
2-Амино-4,6-дифеиил-3,5-дициаио-4Н-пираи [544]. К раствору 0,1 моля 2-амино-4,6-дифенил-5-циано-3-этоксикарбонил-4Н-пирана в 100 мл этилового спирта прибавляют 0,1 моля малононитрила. Реакционную массу кипятят 10 ч, затем упаривают в вакууме. Остаток растирают со спиртом, твердый продукт отфильтровывают и перекристаллизовывают из спирта. Выход продукта в виде бесцветных кристаллов с т.пл. 167 °C составляет 60 %.
4-Дицианометилен-2-фенил-4Н-[1]бензопиран (4.84) при нагревании в пиридине в присутствии водного аммиака трансформируется в 4-амино-5-имино-2-фенил-4Н-[1]бензопирано[3,4-с] пиридин (4.86) [571]:
(w) я = Ph
[1.85) /? - J- хаяогшнш!
(1вб) Я- Ph
(дв?) Я'3- чшнояшщп
Аналогично под действием водного аммиака 4-дицианометилен-2-(2-хи-нолинил)-4Н-[1] бензопиран (4.85) превращается в продукт (4.87), являющийся ключевым продуктом в синтезе стрептонигрина [572]. 2,6-Диметил-4-пиранон раскрывает пирановое кольцо под действием бутиламина с образованием 2,6-дибутиламино-2,5-гептадиен-4-она, который с малононитрилом дает 2-амино-6-(2-метил-3,3-дицианоаллилиден)-4-метил-3-цианопиран, легко переходящий в соответствующую соль пирилия [570].
Дикетен применяется в синтезе 2-амино-З-этоксикарбонил- и 2-амино-3-циано-6-метил-4-пиронов [484]. 5-Оксо-4-оксаспиро [2,3] гексаны (4.88,
4,89) рециклизуются с циануксусным эфиром или малононитрилом под действием гидрида натрия в 2-аминопироны (4.90—4.93). В случае исходного
продукта (4.88) получены смеси 4-пиронов (4.90, 4.91) с циклопентенона-
ш (4.94, 4.95) в соотношении (4.90, 4,94) 3,7 : 1 и (4.91,4.95) 2 : 1 [485]:
о + гснгсн
cooet
я=сн3г яо(омё)г
(1вд)
О Н. 1 ОН
j А/ ч- н.:гу
(190) ff = H,p'=Z = COOEt °
(991) COOEt, Z=CH flоо) z^cteet
(9.92) К=СЦ^/С=РО(ОМе)гг1~ COOEt №95) Z~CN (093) я=сн3г я’=Р0 (OMe)2^CH
91
12X
Отдельные вопросы рециклизации гетероциклических соединений в 2-аминопираны обсуждаются в работах [8—10,459, 573].
Рассматриваемые реакции могут представлять интерес при синтезе биологически активных веществ и аналогов природных продуктов [462, 466, 476, 559, 560], пестицидов [534], лекарственных препаратов [477, 478, 541 ]. В качестве красителей и пигментов большое значение имеют замещенные 2-иминобензопираны [507—509, 5.11, 511]. Так, они предложены как труднорастворимые в воде красители [498, 514],флюоресцентные дисперсные красители [510, 514], красители для полимерных материалов в массе [512] и гидрофобных волокон [514], катионные красители [574].
ГЛАВА 5. АМИНОГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ С ДВУМЯ И БОЛЬШИМ ЧИСЛОМ ГЕТЕРОАТОМОВ В ЦИКЛЕ
Трех- и четырехчленные гетероциклические амины или имины с двумя или тремя гетероатомами в цикле неизвестны. В отдельных случаях предполагается их образование как промежуточных продуктов реакций. Например, при окислении нитрилов с цианогруппой у вторичного атома углерода в присутствии оснований получающиеся гипотетические иминодиоксетаны неустойчивы и распадаются на кетоны и цианаты [575]:
к’
0г А—О
b'xchcn ----к'ксоо9 —— " I —- h’kco + ncq9
-н* I о
cff W
Не известны и другие синтезируемые циклизацией нитрилов амииогете-роциклы, содержащие в 1,2-положениях гетероатомы кислорода, серы, селена или их комбинации, кроме 1,2-дитиоланов- Напротив, азотсодержащие аминогетероциклы с двумя и большим числом гетероатомов в цикле устойчивы и описаны многочисленные методы их получения из соответствующих нитрилов.
, 5.1. 1,3-Диоксоланы
2-Иминодиоксоланы, или 1,2-иминокарбонаты, образуются при взаимодействии замещенных пирокатехинов с бромцианом. Так, получены 3,4,5,6-тет-рагалогенфенилен-1,2-иминокарбонаты [576]:
л вгсн х о JLI ------------------------ LT
х'^он j/V4*
' х
х • а, вг
92
Образование иминокарбонатов доказано при исследовании механизма взаимодействия целлюлозы с бромцианом после ее мерсеризации [577].
Обладающие гербицидной активностью 2-трихлорметил-4-имино-1,3-ди-о ксолан и его алкилзамещенные по положению 5 синтезированы из циангидринов и хлораля в присутствии кислот или оснований [578, 579]. Предложена следующая схема процесса, катализируемого пиридином [578]:
cijCCHo + о-с(сн^гсы --------------а3сснос{сн3)г —
Н---ЫСН
4-Имино-2-трихлорметил-1,3-диоксолаи [578, 579]. К смеси 0,05 моля хлораля, 0,05 моля циангидрина формальдегида и 25 мл сухого петролейного эфира при охлаждении до -10 °C и перемешивании прибавляют 0,05 г пиридина. Реакционную массу оставляют на 12 ч в холодильнике. Выделившийся осадок отфильтровывают, промывают петролейным эфиром н сушат на воздухе. Выход продукта с т.пл. 95-96 °C составляет 4,73 г (95 %).
4-Иминодиоксоланы легко рециклизуются в соответствующие 4-окса-золиноны [1].
5.2.1,3-Тиа-и 1,3-свтноксоланы
Оксираны, или эпоксиды, с роданидом калия дают 2-иминотиоксоланы [580—583], селеноксоланы [580]. Окисное кольцо раскрывается под действием роданистого водорода. В присутствии ацилирующих агентов выделены 2-ацилиминопроизводные соответствующих оксоланов [580, 581]. Образующиеся 0-роданоспирты в кислой среде, циклизуются до 2-имино-тиоксоланов [582]:
hscn/hi
Реакция бензоилоксиранов (5.1) с роданистым водородом протекает через промежуточный 1-бензрил-2-родано-1-этанол (5.2), циклизующийся в 2-имино-13-тиоксолан (5.3). Его образование подтверждено встречным синтезом из 1-бензоил-2-тозилокси-1-этанола (5.4) и роданида калия [583]: О
PhCO . . л ---------PhCOCH CHSCN —•- / \ -в PhCOCH-CWTs
он*
(S-V (S.3) (5.4)
93
Обмен кислорода в оксиранах на серу при реакции их с тиоцианатами может протекать через соответствующие 2-иминотиоксоланы. Подробно реакции оксиранов с родановодородом обсуждаются в монографии [584]. По-виднмому, 1,3-диоксолан-2-оны с тиоцианатами металлов стереоспецифично превращаются в тиираны. О двойном вальденовском обращении свидетельствует тот факт, что .мезо-4,5-диметил-1,3-диоксолан-2-он с тиоцианатом калия дает цис-2,3-бутилсульфид [584]:
К рассматриваемому типу можно отнести реакции (3-галогенспиртов с тиоцианатами щелочных металлов. При действии тиоцианата калия на транс-2-бром-1 -циклогексанол образуется смесь 7-тиабициикло [4,1,0] гептана, транс-и цыс-2-имино-4,5-тетраметилен-1,3-тиоксоланов [585]. 2-(N-карбамоил)-!, 3-тиоксоланы.получаются из роданоуксусного эфира и альдегидов в присутствии фторида или карбоната калия [586, 587]. В случае гидрида натрия образуется смесь 2-имино-1,3-тиоксолана и соответствующего а-карбамоил-тиоуксусного эфира [587]. Реакции циклизации с участием роданогруппы описаны в работе [588].
5.3. 2-Амино- и 5-аминооксазолы
К реакциям циклизации соединений (5.5) и (5.7) в результате взаимодействия атомов кислорода (нуклеофильный центр) и углерода нитрильной группы (электрофильный центр) можно отнести взаимодействие 2- (5.6) и 5-ами-нооксазолов (5.8):
($.7) (s.a)
94
Структуры типа (5.5) и (5.7), их гидрированные и конденсированные аналоги при синтезе аминооксазолов являются чаще всего промежуточными. В отличие от а-цианаминокетонов (5.5), которые за редким исключением не могут быть выделены в условиях реакции, ациламиноацетонитрилы (5.7) вполне устойчивы. Они образуются при взаимодействии 1,2-оксикетонов, 1,2-галогенкетонов, спиртов, а также эпоксидов с цианамидом и 1,2-аминоспиртов или фенолов с галогенцианидами. Несмотря на то что многие аминооксазолы обладают высокой биологической активностью, синтез их циклизацией нитрилов изучен недостаточно [589—592].
5.3.1. 2-Аминооксазолы
1,2-Оксицианамиды, в тех случаях, когда их можно выделить, циклизуются в 2-аминооксазолы. Так, 2-цианаминотропон, получаемый из 2-метокситро-пона и цианамида, циклизуется в 2-имино-2Н-циклогептаоксазол [593]:
N-Цианоэфедрин в кислой среде дает 2-имино-3,4-диметил-5-фенилокса-золидин [594]:
Ph CH-CH-NCN || । • ОН CHj CHj
на
Взаимодействие а-оксикетонов с цианамидом приводит к 2-аминоокса-золам. Изучены ацилоины простого строения [595—599]. Хотя механизм реакции не исследовался, принято считать, что с цианамидом реагируют лишь активные оксикетоны [590, 600]. Вероятно, первоначально гидроксильная группа ацилоина (ацетоина) присоединяется к нитрильной группе цианамида (путь А), а далее следует замыкание в оксазол [590,592]:
н
НО
2-Амиио-4-метилоксазол [595 -597]. Смесь 0,5 моля цианамида, 0,5 моля окси-ацетона и 80 мл воды осторожно нагревают до 40 °C до начала реакции и выдерживают при 40-50 °C. Через 3 мин раствор охлаждают до 20 °C и добавляют щелочь до pH 10. Смесь экстрагируют эфиром пять раз порциями по 80 мл. Объединенный экстракт упаривают в вакууме. Остаток перегоняют под уменьшенным давлением и получают 31,9 г (65 %) бесцветного масла с т.кип. 79-81 °C (266,6 Па).
Реакция может протекать по пути Б с первоначальным взаимодействием по карбонильной группе [601 ]. Предложенные схемы, по-видимому, справедливы для замещенных цианамида. Однако не следует исключать первоначального взаимодействия цианамида с карбонильной группой оксикетона (путь В), так как известно, что кетоны реагируют с цианамидом с образованием не только алкилиденцианамидов, но и продуктов их дальнейшего превращения. Последующая циклизация приводит к соответствующему окса-золину и его таутомеру — 2-аминооксазолу, если с ядром связан хотя бы один способный к таутомерному превращению атом водорода, поскольку ароматическая система более стабильна:
В зависимости от строения исходных реагентов и условий реакция может протекать по одному из направлений. Хорошие результаты дает проведение реакции в водной среде при комнатной температуре, например синтез 170-(2-аминооксазолил-4)стероидов (5.9) [602], 2-амино-а-О-рибофурано [I1, 21: 4,5]-2-оксазолинов (5.10) [603—606]:
17(3-(2-Амиио-4-оксазолил)-4-андростеи-3-он(5.9, R = R* = R1 = Н) [602]. 2 г кор-тексона растворяют в 100 мл 3,2%-ного метанольного раствора аммиака (из 31%-ного водного раствора) и добавляют 0,25 г цианамида, стабилизированного 2 % борной кислоты. Смесь оставляют на ночь в холодильнике при 5 °C, затем упаривают в вакууме. Остаток перекристаллизовывают из водного этанола. Выход продукта с т.пл. 259-261 °C (разл.) составляет 1,1 г (51 %).
2-Амино-а-Р-рибофурано[ I1, 2* : 4,5]-2-оксазолни (5.10) [605]. Смесь 0,3 моля О-рибозы, 0,6 моля цианамида и 50 мл 1 н. водного раствора аммиака перемешивают при 30 °C. Через 30 мин при комнатной температуре начинается экзотермическая кристаллизация, которая продолжается несколько минут. Смесь нагревают 30 мин при 60 °C, после чего прибавляют 100 мл метанола и оставляют на ночь в холодильнике. Осадок отфильтровывают, промывают метанолом, эфиром и сушат в вакууме. B^txon продукта с т.пл. 197 °C (разл.) равен 42,2 г (66 %).
Аналогично глицидил-4-ацетамидофениловые эфиры с иатрийцианами-
96
дом дают 2-амино-2-оксазолины, обладающие антигипертенсивной активностью [607].
Совместная конденсатдая нитрила миндальной кислоты, цианамида и бензальдегида является удобным методом получения 2-амино-4,5-дифенилоксазола. Гевальд и сотрудники [600] считают, что анион нитрила миндальной кислоты присоединяется к промежуточному бензальцианамиду и последующая циклизация продукта приводит к 2-амино-4,5-дифенил-5-циано-2-оксазолину. Последний под действием едкого кали отщепляет цианистый водород и переходит в 2-амино-4,5-дифенилоксазол. В данном случае также нет оснований исключать образование производного бензоина по приведенной схеме, тем более что цианистый водород может присоеданяться к 2-ами-ио-4,5-дафеиилоксазолу. Кроме того, оказалось, что бензоин гладко реагирует с цианамидом [608]. Метод представляет препаративный интерес.
2-Амияа-4И>-дифеншюксазол [606]. Смесь 0,02 моля бензоине, 0,03 моля цианамида, стабилизированного 2 % борной кислоты, 0,01 моля гидроксида калия или натрия и 15 ми этанола кипятят 30 мин и оставляют кристаллизоваться. Выделившийся осадок отфильтровывают, промывают спиртом и перекристаллизовывают из смеси бензола и спирта. Выход продукта с т.пл. 161 162 °C 95 %.
При получении 2-аминоок'сазолов использованы цианамид и «-галогенкарбонильные соединения [589, 592, 608].
Другой подход к синтезу 2-амимо-2-оксазолинов заключается в применении в качестве исходных веществ /3-этаноламинов [609—614]. Взаимодействие их с галогешщанвми дает 2-аминооксазолины, представляющие интерес как стимуляторы центральной нервной системы [609—614];
2-Амино-5-феиилтиометил-2-оксазолим [610]. К 20 мл метанола, содержащего 0,00546 моля 2-окси-З-фенилтиопропиламина, 0,0122 моля безводного ацетата натрия, прибавляют по каплям 0,0057 моля бромпиана, растворенного в 80 мп метанола, и перемешивают 20 я. Растворитель удаляют в вакууме. Остаток обрабатывают раствором щелочи до щелочной реакции и экстрагируют хлороформом. Экстракт сушат безводным сульфатом магний и концентрируют в вакууме. После перекристаллизации из смеси хлороформа с гексаном выделяют 88 % продукта с т.пл, 111 -112 °C.
Изучение стереоспецифического аспекта циклоконденсации а, а>-дизаме-щенных этаноламинов, в том числе эфедринов, под действием XCN показало, что реакция протекает с сохранением конфигурации и приводит к соответствующим 2-имимооксазолидинам [615, 616]. В реакции можно использовать эпоксиды (5.11), при взаимодействии которых с цианамидом (в присутствии оснований) или цианамидом натрия происходит раскрытие окисиоГо кольца. Образующийся замещенный N-циано-^-этаноламин (5.12) за счет внутримолекулярного присоединения оксигруппы к нитрипьиой циклизуется в 2-аминооксазолин (5.13). Подтверждением такого хода реакции служит
97
13
получение из 0-этаноламина (5.14) и бромцнаиа идентичных 2-аминооксазо-линов (5.13) (592]:
л v Л* + ННгСН Х О
iS.1l)
HOCHCHNH, + ВгСН
*' *'(5.Н)
Эпихлоргидрин реагирует с цианамидами. Из фенил- и бутилцианамидов образуется смесь 3-К-2-имино-5-хлорметилоксазолидина н 2-Я-амино-5-хлор-метилоксазолина [617]. Если в'реакцию вместо аминоспиртов вводить а-ами-нокетоны, то получаются 2-аминооксазолы [618-620]. В случае N-замещен-ных а-аминокетонов (5.15) выделены 2-имино-4-оксазолины (5.17) [621-625]:
- (bis) (З.гв) (5.17)
Вероятно, реакция протекает через енольную форму (5.16) [621]. Экспериментально показано, что применение хлорциана по сравнению с бромцианом снижает выходы конечных 2-имино-4-оксазолинов (5.17) примерно на 10 % [624].
Взаимодействие о-аминофенолов [591, 592, 625—628], 2-амино-З-окси-пиридина [629] или N-замещенных о-амииофенолов [630-632] с бромцианом [625, 627, 629—632] или циановыми эфирами [628] является удобным способом получения 4,5-конденсированных 2-амино- и 2-нминопроизводных оксазолов:
аянв
он
А-Н
о-Ацетиламино- или о-формиламинофснолы в реакцию с бромцианом не вступают [631]. Интересно, что о-диметиламинофенол дает при этом 2-ими-но-3-метилбензоокеазолии [632]:
BrCN
СМ
98
По данным [633], электрохимическое восстановление ацетона и цианамида в присутствии 20%-ной серной кислоты (5 °C, 1,3 В, 2,72 А/дм) приводит к 2-амино-4,4,5,5-тетрамегил-2-оксазолинону, который охарактеризован в виде пикрата. 5-(2-Бромэтил)-2-иминоксазолидины (5,19) получены по реакции Брауна расщеплением N-замещенных пирролидинов (5.18) бромцианом, сопровождающимся циклизацией [634]:
(Art) (5.19)
Химическим превращениям 2-аминооксазолов посвящена работа [63S],
5.3.2. 5-Аминоокеаядлы
Основным методом синтеза 5-аминооксазолов (5.21) является щпипшима замещенных а-ацил-или а-ароиламиноацетонитрмлов (5.20) [590,636-638]:
В виду того что атом кислорода ациламиноацетонитрилов (5.20) обладает слабой нуклеофильностью, циклизацию их чаще всего осуществляют под действием сильных кислот (НС1, НСЮ4, HBF4 и др.). В случае замещенных N-ациламиноацетонитрилов получают соли 2-амююоксазолия [592, 639, 640], которые служат аналогами соединений Ренсерта с открытой цепью, например [529]:
рлсонснсн I I ft rr>
л*.
ж *
нвъ/лон
Аминомалононитрил оказался удобным полупродуктом синтеза 2-R-4-циано-5-аминооксазолов [641, 642]. Он конденсируется с ангидридами карбоновых кислот с образованием промежуточных N-ациламиномалононитри-лов, спонтанно циклизующихся в оксазолы:
NCCHCH
(ясо)го
I
99
5-Ами1Ю-4-ц1Ииооксазол [641]. К 0,08 молям тозипата аминомалоионитрила в 400 мл муравьиной кислоты при 5-10 °C небольшими порциями за 2,5 ч прибавляют 10 мл уксусного ангидрида, поддерживая указанную температуру. Смеси дают нагреться До комнатной температуры в течение 2 ч, после чего добавляют лед и концентрируют ее почти досуха. Перекристаллизацией остатка из воды выделяют 4,9 г (43 %) продукта с т.пл. 185—186 °C.
Обычно вместо нестабильного аминомалоионитрила применяют его то-зкпат. К недостатку метода следует отнести то, что тозилат или другие соли аминомалоионитрила труднодоступны. Во избежание этого в работе [643] использован интересный нрием. Феиилазомалононитрил восстанавливался цинком в 99%-ной муравьиной кислоте, а образующийся амино мал оионитрил ацилировался и в условиях реакции циклизовался в 4-циано-5-аминооксазол. Производные аминомалоионитрила дают вицинальные аминоннтрилы ряда оксазола, представляющие интерес для тонкого органического синтеза.
Взаимодействие N-бензилиденамииопиридиниевых солей с цианидом калия приводит к замещенным 5-аминооксазолам [644]:
Иминоинтрилы (5.22) выделены с хорошими выходами. Однако в случае производных алифатических альдегидов (R = Aik) получают 2,4-диалкил-оксазолоиы-5. При ацилировании 1(1-цианоалкил)-2-оксимочев»1 образуется смесь веществ, среди которых обнаружен 5-иминооксазолидин [645]. 5-Имнид-4-оксазолндинтионы (5.24) легко получаются из даанотноедрбо-ииламидов (5.23) и карбонильных соединений [646]:
Гидролиз соединен»» Рейсерта, используемый как мазед получения ароматических альдегидов, протекам ио схеме, включающей образование оксазольного ядра [647—651]. Соли, налримар 2-бензомя-1,2-диИ1Дроизохиналь-доиитрила, имеют строение амииооксазоло [4,3-d] изохинолниия (5.25) . Аналогичное строение у фторбората 1-амииооксазоло [4,3-а] фталазивжя (5.26) [647, 648]:
(526)
100
•торборат 1-амм1о-3-фекилоксааоло[4,3-а] фталазиния (5.26) [648]. Сммь
0,019 моля 1-Циано-2-бензоил-1,2-дигид₽офталазина и 21 мл ледяной уксуеной киелош нагревают до полноге растворшия. Раствор охлаждают до начала кристаллизации и при бавляют при перемешивании 20 мл 50%-ной борфториетоводородной кислоты, в результате чего он становится оранжево-красным. Перемешивание продолжают 30 Мии и смесь охлаждают ледяной водой. Выделившиеся кристаллы отфильтровывают, промывают несколько раз эфиром, сушат. Выход соям с т.пл. 125—227 °C сосмвляиг 6,25 г (93,5 %).
Соединения Рейсерта более подробно здесь не рассматриваются.
5.4. б-Аминоиаекамоды
Реакции циклизации нитрилов в 5-аминоизоксаэолы протекают ио аидую-щей схеме:
(3-27) (5.2в) (з.29)
Предложено несколько способов построения структуры (5.27), иаири-иер под действием реагентов, в том числе содержащих нитрильвую группу (метиленактивного нитрила, цианида и т.д.), на субстраты, представляющие ербой бифункциональные соединения с двумя реакционными центрами (непредельные нитрилы с галогеном, алкоксигрупиой в /З-лоложеиш, амщаио-кетоны, производные гидроксамовых кислот, о-галогснкетоксимы и пр.), рециклизацией и некоторыми другими приемами. Так как рассматриваемые субстраты являются бифункциональными соединениями, возможны различные пути их превращения. Поэтому для осуществления направленного синтеза необходимы специальные методы (защита функциональных групп, строгое соблюдение условий проведения синтеза и т.д.). В большинстве случаев выделить соединения тина (5.27) нельзя вследствие дальнейшей циклизации их в имины (5.28), которые при благоприятных условиях стабилизируются в 5-аминоизоксазолы (5.29). Этими методами получают также гидрированные аналоги изоксазолов и кондвисм реванше системы [1, 651—653].
Большую группу реакщш, приводящих к 5-аминоизоксазолам (5.29), составляют методы, основанные на взаимодействии 1,2-цианокарбоиильнык соединений и нитрилов (замещенных циануксусного эфира [592], ^-кето-нитрилов [592, 654—656], а-замещенных |3-кетонитрилов [657—659], в том числе гетероциклического ряда [660] и ряда стероидов [661, 662], а-арм-азо-0-кетонитрилов [663]) с гидроксиламином, используемым обычно в виде хлоргидрата. /З-Кетоиитрилы содержат два электрофильных реакционных центра: углеродные атомы карбонильной и нитрильной групп. Гидроксиламин также имеет два реакционных центра: на атомах азота и кислорода. Из четырех возможных направления реакции целесообразно остановиться на
101
двух. Одно из них (путь А) включает первоначальную атаку электрофильного атома углерода карбонильной группы нуклеофильным центром атома азота гидрокеиламина и последующую циклизацию путем взаимодействия нуклеофильного атома кислорода с электрофильным центром нитрильной группы. Другое направление (путь Б) Заключается в присоединении гидроксиламина к нитрильной группе за счет атаки нуклеофильным атомом кислорода электрофильного центра штрильной группы и циклизации через внутримолекулярное присоединение по карбонилу с отщеплением воды:
Несмотря на отсутствие четких доказательств механизма реакции путь А, по-видимому, более предпочтителен [592]. Из экспериментальных данных можно заключить, что карбонильная группа более реакционноспособна по отношению к гидроксиламину. Кроме того, азот гидроксиламина обладает большей нуклеофильностью, чем кислород, в противном случае следовало бы ожидать образования 3-аминоизоксазолов либо смеси 3-и 5-аминоизомеров. При планировании синтеза, безусловно, необходимо учитывать роль среды. Выделить промежуточные а-цианокетоксимы при этом нельзя, так как внутримолекулярная циклизация, по-видимому, протекает быстрее первой стадии процесса. Поэтому вместо окиси 0-цианопировиноградной кислоты получен изомерный ему 5-амино-4-этокснкарбонилизоксазол [664].
Сложно протекает взаимодействие замещенных эфиров циануксусной кислоты с гидроксиламином. В качестве типичного примера рассмотрим реакцию этилового эфира а-циано-|3-фенилпропноновой кислоты (5.30) [665]. Взаимодействие его с 1 молем гидроксиламина и 1 молем этилата натрия в этаноле при 25 °C приводит к единственному продукту — 5-амино-4-бензил-изоксазолону-3 (5.33) — с выходом 68 %. . Для подтверждения данного на
102
правления реакции синтезирована О-бензил-а-циано-0-фенилпропангидрокса-мовая кислота (5.31), так как промежуточный продукт с открытой структурой типа (5.32) выделить не удалось. Восстановление кислоты (5.31) над палладием на угле ведет к снятию защитной О-бензильной группы и образованию гидроксамовой кислоты (5.32), циклизующейся в 5-аминоизоксазо-лон (5.33):
Следовательно, первоначально нуклеофилом атакуется карбонильный атом сложноэфирной группы. В реакции того же бензилциануксусного эфира (5.30) с гидроксиламином в горячем этаноле и в отсутствие этилата натрия нуклеофилом атакуется углерод нитрильной группы с образованием амидок-сима эфира (5.34), который циклизуется в 3-амино-4-бензилизоксазолон-5 (5.35). Аналогично 5-амино-З-изоксазолоны получаются при циклизации цианацетогидроксамата калия под действием метилата натрия [666]. При использовании вместо циануксусного эфира малононитрила получаются 3,5-диаминоизоксазолы [667].
N-Оксиды нитрилов с метиленактивными нитрилами дают 5-аминоизокса-золы. Реакция катализируется основаниями и по характеру напоминает рассмотренные процессы. Однако, по данным [668], конечными продуктами здесь являются изомерные аминоизоксазолам пиразолоны, что объясняется аминоизоксазолииразолоновой и ретроаминоизоксазолоновой перегруппи
ровками.
Олефшы можно применять в двухступенчатом синтезе 5-аминоизокса-золов [592, 669—672]. Хлористый нитрозил легко присоединяется по С=С-свя-зн с образованием вицинальных хлорнитрозосоединений, существующих в виде а-хлороксимов. При обработке их цианидом калия в спирте или диметилсульфоксиде галоген замещается на цианогруппу, давая цианокетоны, которые гладко циклизуются в 5-аминоизоксазолы:
103
неа сна ------*- ясна
n J
СНА' Я CHNO
KCH
он
ясна
,1
а с = нон
A
5-Амиио-3,4-диметилнзоксаэол {670]. В раствор 0,2 моля троис-2-бутена в 20 мл хлористого метилена в течение 10 мин при 5-15 ®С пропускают хлористый водород, затем в течение 1 ч вводят 0,2 моля хлористого нитроэила одновременно с небольшим током хлористого водорода, поддерживая указанную температуру. Реакционную маесу охлаждают н выдерживают 2 ч при 2-5 °C. Растворитель упаривают в вакууме при 30-40 °C. Получают 22 г оксима З-хлор-2-бутаноиа в виде масла, которое растворяют в 200 мл метанола. К раствору прибавляют 0,362 моля цианида натрия. Смесь кииятят 15-20 вам при pH 9-10 и фильтруют. Фильтрат упаривают, остаток обрабатывают водой. Выход продукта с т.пл. 122-123 °C (из метанола) составляет 67 %.
5-Аминоизоксазолы с алкильными заместителями предложены для получения сульфамидных препаратов [655, 671] и пестицидов [654]. В синтезе 5-аминоизоксазолов можно также использовать этиленовые [673] н ацетиленовые нитрилы [673—677]. Присоединение .гидроксиламина к 0-заме-щенным акрилонитрилам идет преимущественно по С=С-связи с образованием аддуктов (5.36):
R-H - снснгсн (5.3в)
он я
В случае гидроксиламина (R ~ Н) выделены 5-амино-З-метилизоксазол [673] и продукты присоединения гидроксиламина по нитрильной группе, например аьяадоксим коричной кислоты [675]...Аналогичные закономерности наблюдаются для нитрила фенилпропиоловой кислоты. При этом наряду с 5-амино-З-фенилизокеазолом получен фенилпропиоламидоксим. При возгонке он превращается в изомерный З-амино-5-фенилизоксазол [675]. Вероятно, для сопряженных непредельных нитрилов характерно присоединение гидроксиламина по кратной углерод-углеродиой связи в; нейтральной среде, что приводит к 5-аминоизоксаэолам. В щелочной среде более реакционноспособной по отношению к гидроксиламину будет нитриль-ная группа, что вызывает образование изомерных 3-аминоизоксазолои. Ция несопряженмых нитрилов в большей степени на направление реакции шияет их строение. Так, взаимодействие нитрила 3-бутиновой кислоты с* идроксиламином приводит к 5-амино-З-метилизоксазолу, а нитрила 3-пен-иновой кислоты — к З-амино-5-этилизоксазолу [676].
Большую роль в синтезе 5-аминоизоксазолов играют замещенные акрилонитрилы, содержащие в 3-положении нуклеофильную группу, способную замещаться в реакциях присоединения — отщепления на остаток гидроксил-
104
амина. Например, оксиметиленмалононитрилы предложены для получения 5-аминоизоксазолов, используемых в синтезе бактерицидов [678, 679], причем незамещенный 5-аминоизоксазол получен с выходом 98 %:
+ нгион
К = Н, Яг- ; к'-н, Me, Et , z- н, Своя', CN, At-SOf,
Более доступны метокси- [680,681] и этоксиметиленпроизводные [682— 684] циануксусного эфира [680, 681], малононитрила [680—683], арисуль-фонилацетонитрила [684], димедона [685]. В свою очередь, этоксиметилён-малононитрилы можно синтезировать из 3-алкилизоксазолов [682, 683]. Легко получаемые таким путем 5-амино-4-карбамоил(или 4-циано)изокса-золы представляют определенный интерес при синтезе гербицидов. В случае 3, /3-диалкоксиакрилонитрила и гидроксиламина образуется смесь 5-амино-3-алкокси-, 3-амино-5,5-диалкоксиизоксазолов и 3-амино-5,5-диалкокси-2-изоксазолина [686].
5-Амиио-4-фенилсульфоиилнзоксазол [684]. К взвеси 1 ммоля 2-фенилсульфонил-2-диановинилэтилового эфира в 10 мл воды добавляют 1 ммоль хлоргидрата гидроксиламина и доводят pH реакционной среды до 8 добавлением 1%-ного раствора едкого натра. Смесь перемешивают 5 ч при комнатной температуре. Осадок отфильтровывают, промывают водой н сушат. После перекристаллизации из 40%-иого водного спирта выделено 0,14 г (63 %) продукта с т.пл. 128 °C.
Аналогично /3-алкоксиакрилонитрилам в реакцию с гидроксиламином вступают замещенные 0-амино- [673, 687] и /3-диметиламиноакрилонитрилы [688—690]. Акрилонитрилы (5.37), (5.38) могут взаимодействовать по Михаэлю с соединениями с подвижными• атомами водорода. Присоединение гидроксиламина идет исключительно за счет аминогруппы с образованием аддуктов (5.39). Отщепление молекулы спирта или амина приводит к интермедиату (5.40), циклизующемуся в изоксазолы (5.41), (5.42) :
,CN ЪНОН I \=/
Меде =< -----— МеУ-C-CHZ ------------— '\„2Х -------—
I Z II =
p НОНН CN ОН
у*0 (5.39) (s^°)
(s.Ofj У=НМс2
Cs.y/) Z =Н
(i.Hz) Z •= г’13,-0-и.зопропипиден~
5*-0- тритил-О -рибозил
14
105
Такое направление реакции доказано выделением этилового эфира а-циано-0-метоксиаминокротоновой кислоты — продукта взаимодействия ме_-токсиметиленциануксусного эфира с О-мегилгидроксиламином [680]. При. наличии в /3-положении объемных заместителей, например трет-бутильной группы, наряду с основным продуктом образуется 3-трет-бутил-4-циано-5-, изоксазолон [680].
5-Аминоизоксазол [688, 6891 • К раствору 40 мл (37,6 г) 3-диметиламияоакрило-нитрила в 200 мл диметилформамида при перемешивании и комнатной температуре прибавляют 30 г хлоргидрата гидроксиламина в 200 мл диметилформамида. Реакционную массу нагревают 3,5 ч при 65—70 °C и упаривают в высоком вакууме. Остаток растворяют в 500 мл насыщенного водного раствора бикарбоната натрия и продукт экстрагируют шесть раз диэтиловым эфиром (500 мл). Объединенный экстракт сушат безводным сульфатом магния, обрабатывают активированным углем и фильтруют. Растворитель упаривают в вакууме и остаток перекристаллизовывают из смеси диэтилового и петролейиого эфиров. 5-Аминоизоксазол (19,5 г) имеет вид бесцветных игл с т.пл. 77-78,5 °C. Дополнительно концентрированием маточного раствора выделено 5,1 г продукта с т.пл. 75-78 °C. Общий выход составляет 74 %.
/З-Бром- [674, 691], (З-хлор- [692,693] и а-бромакрилонитрилы [694, 695] также являются удобными реагентами в синтезе 5-аминоизоксазолов. Взаимодействие замещенных /3-бромакрилонитрилов с хлоргидратом гидроксиламина в присутствии эквивалентного количества едкого натра приводит к образованию с высокими выходами (86—94 %) 5-амино-3-В-изоксазолов (R = СН3, Ph). В то же время применение метилата натрия в метаноле не дает удовлетворительных результатов и соответствующий 5-амино-З-метилизокса-зол получается с выходом 14 % наряду с небольшим количеством (5 %) 3-аминоизомера [674]. Идентичные 5-аминоизоксазолы синтезируют из 1-га-логеналкилальдоксимов и цианацетамидов [682].
5-Амино-4-карбамоил-3-этилизоксазол [682]. Суспензию 72 г гидрида натрия и 1200 мл диметилформамида охлаждают до -20 °C и медленно при перемешивании прибавляют 252,3 г цианацетамида с такой скоростью, чтобы предотвратить сильное вспенивание. Смесь охлаждают до -40 °C н медленно приливают охлажденный до -20 °C раствор свежеприготовленного 1-хлоризобутиральдоксима в 90 мл хлористого метилена. Смесь перемешивают 18 ч при температуре от 40 до 70 °C, затем медленно, в течение 24 ч нагревают до комнатной температуры. Растворитель упаривают под вакуумом до 1/3 объема и выливают на лед. Осадок отфильтровывают и сушат. Выход продукта с т.пл. 179-182 °C составляет 255 г (55 %).
Интересные закономерности установлены при изучении реакции а-бром-/3-гликозилакрилонитрила (5.43) с гидроксиламином и некоторыми его производными [694,695]. Фактором, определяющим направление превращения, является защита N-функции гидроксиламина. Со свободным основанием образуются производные 5-аминоизоксазолов:
106
К рассматриваемому типу относится взаимодействие 1-(4-метиламино-фенил)-1,2,2-трицианоэтилена с гидроксиламином в присутствии гидроксида калия [696]:
НС. ,CN
+ н^он ~~
Яг.__ CN
По данным [697], 5-аминоизоксазол можно получить окислением нитрила /3-аминопропионовой кислоты 30%-ным пероксидом водорода при нагревании в метаноле. Хотя выход 5-аминоизоксазола составляет 17 %, метод
представляет интерес вследствие доступности исходного сырья. Применение вольфрамата натрия повышает выходы 5-амино-4-метил- и 5-амино-З-метил-изоксазолов до 40—50 % [686].
Изучены электрохимическое восстановление замещенных (3-нитроакри-лонитрилов [658, 698, 699], а также восстановление их меркаптанами в присутствии щелочей [700] до соответствующих 5-аминоизоксазолов:
ф
+ 4ё, +4Н
-НО
Хлорангидриды гидроксамовых кислот (5.44) содержат подвижный атом галогена, который легко обменивается на остаток метиленактивного Нитрила [701—707] с образованием промежуточных а-цианокетоксимов (5.45), имеющих, как лравило, в п-положении второй сильный электроотрицательный заместитель Z. Такое взаимодействие с последующей циклизацией ведет к замещенным 5-аминоизоксазолам (5.46). Метод перспективен при получении 5-аминоизоксазолов -с различными электроотрицательными заместителями в положении 4. В случае трет-бутилового эфира циануксусной кислоты в качестве конденсирующего агента используется гидрид натрия [705]:
я-с-с< гснгсн -V— II ---------------" \ л
си {5.Н6)
Z - С//, СОНЯ*, CODEt, ;
Я - Я1КТ Zfr, -5-Нцтро~2-1рурил,
(S.HB)
14Х
107
5-Амино-З- (5-нитро-2-фурил) -4-циаиоизоксазол [703.. К раствору метилата натрия, приготовленному из 1,15 г натрия и 20 мл безводного метанола, медленно прибавляют раствор 9,5 г 5-нитро-2-фурогидроксамоилхлорида н 3,3 г малононитрила в 80 мл безводного метанола, поддерживая комнатную температуру. Выделившийся осадок отфильтровывают, промывают водой и перекристаллизовывают из смесн диметилформ-амида с водой. Продукт имеет т.пл. 263 °C.
По-видимому, наличие в положении 3 изоксазольного ядра 5-нитрофу-рильного заместителя обусловливает бактериостатическую активность [703-706], Гидроксамовые кислоты (5.47) обычным образом реагируют с димером малононитрила в присутствии метилата натрия, в то время как едкий натр вызывает образование изоксазоло [5,4-Ь] пиридина (5.49), который также получен из изоксазола (5.48) [7081:
(зч?) (з«в) (зчд)
Изоксазолы (5.50) со свободным положением 3 раскрывают кольцо под действием оснований. Возникающие при этом д-цианокетоны с различными реагентами дают новые гетероциклические системы. В частности, взаимодействие их с гидроксиламином приводит к 5-аминоизоксазолам (5.51) [682,683]:
( S-SO ) (5.S/)
5-Амино-3-метил-4-метоксиизоксазол [692, 693]. К раствору 4,6 г метилата натрия в 50 мл метанола прибавляют 4,81 г 5-метил-4-метоксиизоксазола и смесь быстро охлаждают до температуры ниже 40 °C. При этой температуре натриевая соль кетонитрила частично выкристаллизовывается. Через 1 ч метанол упаривают в вакууме. К остатку добавляют 10 мл воды и 2,98 г хлоргидрата гидроксиламина и смесь нагревают при 60 ®С в течение 30 мин. После 16 ч выдержки при комнатной температуре продукт пять раз экстрагируют эфиром порциями по 10 мл. Объединенный экстракт сушат безводным сульфатом натрия и упаривают в вакууме. Получают 4,90 г продукта, который перекристаллизовывают из смеси диэтилового и Петролейного эфиров (5:1) при охлаждении льдом с солыо. Выход продукта с т.пл. 48-49 °C составляет 3,3 г. Концентрированием фильтрата дополнительно выделяют 0,95 г продукта с т.пл. 48—49 °C. Общий выход 89 %.
Реакция динитрила 2,3-дифениляцтарной кислоты (5.52) с нитрозобензолом в присутствии метилата натрия и метанола дает с высоким выходом 2,3,4-трифенил-5-имино-3-изоксазолин. Здесь в гетероциклическом ядре отсутствует атом водорода, способный к таутомерному превращению, и продукт выделен в иминоформе (5.53). Иминоизоксазолин (5.53) получен также из фенилацетонитрила и N-оксида N-(а-цианобензилиден)анилина (5.54) [709]. Вероятно, реакция начинается с присоединения динитрила (5.52) 108
или фенилацетонитрила к активным двойным связям N - О в первом и С - N -> О — во втором случае:
PfyCHCN
I
much
PhHO
PflCHgCN Ph .---------\^N-Ph
NC | О
(SS2) (SSJ)
Интересно, что З-нитрохинолин-Ы-оксид (5.55) при нагревании в метаноле с 2 молями цианида калия дает смесь продуктов З-метокси-4-цианохи-нолин-М-оксида (5.59) и пиразолохинолина (5.58). Последний образуется в результате рециклизации соответствующего аминоизоксазолохинолина (5.57):
Все стадии процесса доказаны выделением аминоизоксазолохинолинов (5.56), (5.57) [710]. Такое взаимодействие можно рассматривать как составную часть реакции Рихтера.
5.5. 1,2,3-Оксадиазолы (5-сиднонимины)
Единственным известным классом амино-1,2,3-оксадиазолов, получаемых циклизацией нитрилов, являются 5-сиднонимины, принадлежащие к мезо-ионным гетероциклам [711]. Недавно опубликован первый обзор по методам получения, строению, свойствам, реакционной способности и биологической активности сиднониминов, в котором обобщены данные по 1978 г. включительно [712]. Поэтому мы рассмотрим только основные результаты циклизации нитрилов в сиднонимины.
До настоящего времени 5-имино-1,2,3-оксадиазолы получают только протоциклизацией N-нитрозаминоацетонитрилов [711, 712]. Наиболее часто применяется циклизация под действием хлористого водорода в раз-
109
личных растворителях при 0—5 °C, в том числе в водном растворе. Основная задача сводится к синтезу N-нитрозаминоацетонитрилов, получаемых нитрозированием аминонитрилов, а последние — цианметилированием первичных аминов. Следует иметь в виду, что синтез сиднониминов можно проводить без выделения промежуточных продуктов, что и используется чаще всего. Однако требования к чистоте исходных реагентов при этом возрастают [712]:
r’cho/hcn
ЯгННг -----------
RNHCHCN
ММ1,/НС(
I Я’
Н —СНЯ -/ \ /V*. с*н о
на
Имеются и другие ограничения реакции: характер заместителя R, де-нитрозирование, применение в некоторых случаях избытка соляной кислоты, повышение температуры реакционной смеси.
При исследовании кинетики кислотной циклизации N-нитрозаминов (5.60) спектрофотометрическим методом установлено, что она является реакцией первого порядка по нитрозонитрилу и второго — по протонам [713]. С помощью корреляционного анализа оценен количественный вклад электронного и стерического факторов. Скорость процесса возрастает с увеличением индукционного эффекта заместителя у атома азота и объема заместителей R и R1. Так, скорость циклизации N-нитрозоадамантилацето-нитрила на три порядка выше, чем его метильного аналога. Приведенные данные согласуются с тем, что на первой стадии происходит протонирование нитрильной группы (5.61). Далее следует циклизация в иминоэфирдиазотат (5.62), который образует катион сиднонимина (5.65) через основание последнего (5.63) либо его дикатион (5.64) [711, 712]:
(5.64}
Таким путем получено большое число сиднониминов [711, 712, 714— 718], причем сиднонлмины со свободным положением 3 не известны [712]. Реакция является обратимой, а существование сиднонимина в виде основа
110
ния (5.63) вполне реально. Спектрофотометрически установлено, что при действии на хлоргидрат 3-циклогексилсиднонимина (5.66) эквивалентного количества КОН в растворе абсолютных спиртов, а также, при сольволизе fS-триметилсилил-3-циклогексилсиднонимина (5.67) образуется основание 3-циклогексилсиднонимина:
Доказано, что 3-циклогексилсиднонимин (5.63) в растворах находится в равновесии с цепным изомером (5.60). Доля циклического изомера (5.63) увеличивается с повышением электронодонорных свойств заместителя R [719]. Кроме того, необычно легкий щелочной гидролиз М-нитрозо-2-(ме-тиламино)ацетонитрила (5.60, R = СН3, R1 = Н) свидетельствует о том, что нитрозогруппа активирует нитрильиую. Это служит подтверждением внутримолекулярного катализа с образованием реакционноспособных циклических промежуточных продуктов, а именно сиднонимина, на первой стадии процесса [720].
Однако выделить свободное основание из щелочной среды вследствие высокой лабильности не удалось. Добавление ацилирующих агентов в присутствии триэтиламина позволяет получать 1Ч£-фенилкарбамоильные производные сиднониминов [721-724]. На основании кинетического изучения реакции установлено, что скорость ее зависит от температуры, характера заместителей, природы растворителя, концентрации, основности применяемого третичного амина, а не от концентрации арилизоцианата и его реакционной способности. В отличие от циклизации N-нитрозаминоацетонитрилов в кислой среде скорость их циклизации в присутствии оснований возрастает с увеличением объема заместителя R, но понижается с повышением его электронодонорных свойств. На основании приведенных данных предложена следующая схема процесса [722]:
. г 'И ft К
£t}N + N СНг быстро Н— С —и медленно быстро \у—\
*** CsN
Д,/У*
Хлоргидрат З-фенилизопропилсиднон-5-имина (сиднофена) (725]. К 425 г ацетонциангидрина при температуре не выше 18 °C приливают 450 мл 37%-ного формалина и раствор 5 г карбоната калия в 25 мл воды. Смесь перемешивают 4 ч при 10-15 °C, охлаждают до 0-5 °C, добавляют 675 г фенилизопропиламина и после перемешивания в течение 2 ч при той же температуре оставляют на ночь. Затем при охлаждении прибавляют раствор 465 мл концентрированной соляной кислоты в 2 л воды и образующуюся густую массу Обрабатывают при 0 °C раствором 35 0 г нитрита натрия в 1 л воды. Через 3 ч приливают 800 мл эфира, органический слой отделяют и дважды экстрагируют эфиром. Объединенный экстракт сушат безводным сульфатом магния и обрабатывают
111
2,5 л 3 н. раствора хлористого водорода в эфире. Выделившийся осадок перекристаллизовывают из смеси изопропана с ацетоном (4:1). Выход продукта с т.пл. 153 154 °C равен 620 г (51,5 %).
Хлоргидрат З-диметиламиносидион-5-имииа [726]. К раствору 1,1-диметилгидра-зина в 120 мл воды или водного этанола прибавляют при перемешивании при 5 “Св течение 10 мин раствор 0,5 моля цианида калия в 70 мл воды, в течение 1 ч - 0,5 моля формальдегида (в виде формалина). Смесь перемешивают 1 ч при комнатной температуре, охлаждают до 5 °C и прикапывают 50 мл концентрированной соляной кислоты и 0,5 моля нитрита натрия в 75 мл воды так, чтобы pH раствора оставалось кислым. Нитрозогидразин экстрагируют хлороформом. Экстракт сушат безводным сульфатом магния и упаривают досуха под вакуумом. Остаток Перемешивают с 10-кратным по массе количеством метанола и насыщают хлористым водородом. Растворитель удаляют в вакууме при комнатной температуре. Остаток перекристаллизовывают из смеси метанола с эфиром. Выход продукта с т.пл. 178 °C составляет 79 %.
5.6. 1,2,4-Оксадиазолы
Циклизацией нитрилов можно получить только 5-амино-1,2,4-оксадиазолы. Так, оксадиазолы (5.69) синтезируют из цианимидодитиокарбонатов (5.68) [727, 728]:
,54/е HNM’ ,SMe H,N0H
- Nc-H —5______
5/We ?//?/?'
p.W)
, (s.6g)
R - h, A =aia, CHCooEt.
Aik
Аналогично гидроксиламин вступает в реакцию с цианамидинами [729], давая наряду с 5-амино-З-К-1,2,4-оксадиазолами З-амино-5-R-l,2,4-оксадиазолы [728, 729], причем выходы последних могут преобладать [729]. Соотно-шение их зависит от концентрации исходных реагентов и природы заместите-ля R . Выходы 5-амино-1,2,4-оксадиазолов достигают 60-65 % при взаимодействии амидоксимов с бромцианом в присутствии бикарбоната калия [730].
А —U + BrCN — NH2
112
5.7. 1,3,4-Оксадиазолы
Основным методом синтеза 2-амино-1,3,4-окс4диазолов (5.71) является взаимодействие гидразидов карбоновых кислот (5.70) с бромцианом [731 — 739]:
XCONHNHC=NH
оя’
'Реакцию можно проводить непосредственно в водной среде в присутствии веществ, связывающих кислоту, например бикарбоната калия. В случае эфиров циановой кислоты [739, 740] реакция протекает через амидоэфиры (5.72), которые, как правило, могут быть выделены и при нагревании циклизованы в оксадиазолы (5.71) [740]. При синтезе аминооксадиазолов этого класса можно использовать цианат калия [736].
5.8. 1,2,3-Оксатриазолы
Подобно получению сиднонимииов М-нигрозо-М-фенилгидразинонитрил циклизуется в метаноле под действием хлористого водорода с высоким выходом в хлоргидрат 5-имино-1,2,3,4-оксатриазола [741]:
—nh НС1 —м
^0 *А4Л-®
Хлоргидрат 3-фенил-5-имиио-3,5-дигидро-1,2,3,4-оксатриаэола [741J. К раствору 0,1 моля фенилгидразина в 50 мл эфира или тетрагидрофурана при температуре от 5 до 0 °C приливают раствор 5,3 г бромциана в 30 мл эфира. Через 1 ч реакционную массу фильтруют охлажденной. Фильтрат при температуре от 20 до 40 °C насыщают оксидами азота и прибавляют к нему метанольный раствор хлористого водорода. Смесь выдерживают 4 ч при температуре не выше 5 °C и выделяют хлоргидрат (60,5 %) с т.лл. 191— 192 °C.
5.9. Амины шести-, семи- и восьмичленных кислородсодержащих гетероциклов
Известны реакции циклизации нитрилов, приводящие к амино- или имино-1, 3-, 1,4-оксазинам. 7-Имино-1,2,3-триазоло [4,5-й]-1,3-оксазин (5.73) как побочный продукт в синтезе 1-метил-4-(диметиламино) метиленамино-5-циано-имидазола существует в двух таутомерных формах (5.73) и (5.74) [742]:
15
113
5-Аминоимид' г4,5-б]-1,3-оксазин - нуклеозидный антибиотик - при действии щепоче. крывает оксазиновый цикл (5.75). Реакция обратима и ее направление зависит от pH среды [743]:
е О
(S.VS)
1,3-Аминоспирты при действии бромциана превращаются в 2-амино-1, 3-оксазины [612, 615]. Например, 2-(в-аминобензил)-1-инданол (5.76) циклизуется в 2-амино-2,4а,5,9Ь-тетрагидро-4-Я-фенилиндено [2,1 -е] -1,3-оксазин (5.77) [612]. Реакция носит стереоспецифический характер [615]:
Тиоамид (5.78) алкилируется бромуксусным эфиром по атому серы и в результате двойной циклизации переходит в 4-имино-4Н-тиено [2,3-d]-1,3-ок-сазин (5.79) [744]:
HCCHCOH I BrC/^COOCl
ArNHCO C = S ----------*
п НС COR
п Y
Ai-c~nhcsch2 coon
NH
(5-7t)
(579)
Хорошо изучены превращения 1,3-оксазинов [745]. Циангидрины используются в синтезе имино-1,4-оксазинов. В этом отношении характерна реакция нитрила миндальной кислоты с метиламином, в которой в качестве основного продукта выделен 2,5-диимино-3,6-дифенил-4-метилморфолин (5.81) [746]. Побочным продуктом является метиламинофенилацетонит-
114
рил (5.82). По-видимому, образование замещенного морфолина (5.81) включает взаимодействие нитрилов (5.80) и (5.82):
PhCHCN
MeNH,
Ph
ОН
PhCHCN
I
NHCff,
(мг)
Примером получения 1,3,5-оксадиазинового цикла может служить реакция дициандиамида с хлоральгидратом [747]:
HjN- С =NCN
МНг
-I- сессна
При взаимодействии тиодиацетонитрила с 1,2-дикарбонильными соединениями как промежуточный продукт получается 2-имино-1,4-оксатиан [748]. Однако образование 1 -имино-1,4-тиоксанов при циклизации нитрилов не известно.
Гладко и с высокими выходами получены 7-амино-6-этоксикарбонил-1,4-оксазепин-4(5Н)тионы из о-аминофенолов и 2,4-диилиден-1,3-дитиета-нов (5.83) [749]:
2-Амиио-3-этоксикарбонил-1,4-бензоксазепии-4 (5Н) тиои (749). К раствору 5 ммолей 2,4-ди[ (циано) этоксикарбонил] метилен-1,3-дитиетана в 10 мл хлороформа прибавляют 0,01 моля о-аминофенола и 10 мл спирта. Смесь кипятят 30 мин и охлаждают до комнатной теь&ературы. Выделившийся осадок отфильтровывают. Маточный раствор упаривают под вакуумом. Оба осадка объединяют и перекристаллизовывают из спирта. Выход продукта с т.пл. 147-150 °C 92 %.
Интересно протекает дезоксигенирование тиолсульфинатов (5.86) и тиолсульфонатов (5.84) до дисульфида (5.88) при действии на них цианидов металлов [750]:
Ог5—о
сне
О9 CN I I 0 = 5 3
-0CN
15Х
(™>) (5.8?) (5.88)
Вероятно, при этом образуются 7-имино-1,2,6-оксадитиёпины (5.85) и (5.87) , которые нельзя выделить.
Известны отдельные примеры синтеза 2-иминооксазоцинов циклизацией соответствующих нитрилов. Так, 1-бензил-2- (2-оксибензоил) гидразин (5.89) конденсируется с а, 0-дибромпропионитрилом в присутствии едкого натра в 5-(бензиламино)-5,6-дигидро-2Н-1,5-бензазоцин-6-он (5.90) [751]:
Ж
1-(3-Оксипропил)-2-цианиминоимидазолидин (5.91) также циклизуется в присутствии хлористого водорода в 2-имино-2,5,6,8,9,10-гексагидро-4Н-имидазо[2,1-<1]-1,3,5-оксадиазоцин (5.92) [752]:
f"i), / \ ft— ^НгСНгСНгОН
NCN
(5.9J)
Рассматриваемые реакции циклизации различных оксинитрилов представляют интерес при синтезе лекарственных веществ, например производных 2-аминооксазолов [595—598, 602—613, 633], 2-амино-1,3,4-оксадиазо-лов [732, 735] и их полупродуктов, в частности сульфамидных препаратов на основе 5-амино-3,4-диалкилизоксазолов [655, 670—672, 678, 679, 692, 693]. Среди сиднониминов обнаружены нашедшие практическое применение высокоэффективные лекарственные препараты [712, 725].
Производные 4-иминодиоксоланов [579] и 5-аминоизоксазолов [682, 683, 702] являются гербицидами или полупродуктами их синтеза. Например, 5-амино-4-трет-бутилизоксазол используется в производстве гербицида изоурана [654]. 5-Амино-3-(5-нитро-2-фурил)изоксазолы проявляют высокую бактерицидную и фунгицидную активность [703—707].
ЧАСТЬ ТРЕТЬЯ
РЕАКЦИИ ЦИКЛИЗАЦИИ С УЧАСТИЕМ АТОМА СЕРЫ КАК НУКЛЕОФИЛЬНОГО ЦЕНТРА
Многие гетероциклические системы можно получить через внутримолекулярное взаимодействие меркаптогруппы (нуклеофильного центра) с электрофильным центром нитрильной группы меркаптонитрилов (6.1) :
(s.i) (и) (e.s)
Как было отмечено для других аминогетероциклических соединений, в случае синтеза серосодержащих соединений (6.3) основная задача сводится к достижению структуры типа (6.1). В большинстве примеров продукты с подобной структурой нельзя изолировать в индивидуальном состоянии. Поэтому методы, приводящие к ее построению, будут пригодны, и для получения 2-аминотиофенов, 2-аминотиопиранов и родственных им соединений (6.3).
ГЛАВА 6. 2-АМИНОТИОФЕНЫ
В последнее время резко возросло число исследований по различным аспектам химии тиофена и его производных. Важное место среди них занимают амины тиофенового ряда, их гидрированные аналоги и конденсированные системы на их основе, поскольку многие производные аминотиофенов нашли применение в качестве лекарственных препаратов, химических средств защиты растений, полупродуктов синтеза красителей и в разных областях тонкого органического синтеза.
Существующие обзоры по химии тиофена [160, 753—755] уже не отражают успехов, достигнутых в синтезе аминотиофенов. Получение их восстановлением нитро-, нитрозо- и азосоединений, обменом галогена на аминогруппу, перегруппировкой азидов по Курциусу и амидов кислот по Гофману [160, 754, 755] или некоторыми специальными методами имеет ограниченное значение. В этой связи большой интерес представляет реакция циклизации нитрилов по схеме
117
Следует иметь в виду, что соединения (6.4) благодаря наличию в их молекуле двух реакционноспособных центров (нуклеофильного на атоме серы и электрофильного на атоме углерода нитрильной группы) могут циклизоваться в имины (6.5). Последние, как правило, стабилизируются в виде аминов (6.6). В монографии Тейлора и Маккиллопа [1] рассмотрены данные по енаминонитрилам тиофенового ряда. Другие обзоры [16, 156, 756—760] рассматривают отдельные, порой незначительные стороны данной проблемы.
6.1. Циклизация у-меркаптонитрилов
Незамещенные аминотиофены — довольно лабильные соединения, причем считалось, что 2-аминотиофен менее устойчив, чем 3-аминотиофен. Однако Стаси и Эку [761, 762] удалось выделить 2-аминотиофен (т.пл. 12—13 °C) при обработке его хлоргидрата (полученного циклизацией нитрила цис-бен-зилтиокротоновой кислоты) безводным аммиаком в среде хлористого метилена и очистить перекристаллизацией из смеси гексана и хлористого метилена при пониженной температуре в атмосфере азота. Однако из щелочного раствора экстракцией бензолом получен с выходом 25 % 2,5-бис (цианометил)-1,4-дитиан, что объясняется образованием промежуточного нитрила 7-меркаптобутеновой кислоты в результате раскрытия кольца 2-аминотио-фена [763].
2-Аминотиофен [762]. Раствор 11,45 г (0,043 моля) нитрила цис-4-(дифеиилме-тилтио) кротоновой кислоты в 100 мл сухого эфира, охлаждаемый льдом, насыщают безводным хлористым водородом. Смесь перемешивают 5 ч при 20—25 °C. Избыток НС1 удаляют под уменьшенным давлением. Осадок отфильтровывают и выделяют 4,9 г (82 %) бесцветных пластинок хлоргидрата 2-аминотнофена (при использовании нитрила цис-4-бензилтиокротоиовой кислоты выход и качество хлоргидрата 2-аминотиофена значительно хуже).
Охлаждаемую суспензию 5,0 г (0,037 моля) хлоргидрата 2-аминотиофена и 25 мл хлористого метилена насыщают 20'мин газообразным аммиаком. Осадок солей отфильтровывают в токе азота и растворитель удаляют в вакууме. Перегонкой получают 1,05 г (29 %) 2-аминотиофена. Однако если остаток экстрагировать (5 х 15 мл) смесью хлористого метилена с гексаном (9 : 1) и объединенный экстракт охладить сухим льдом в ацетоне, то выделяются кристаллы 2-аминотиофена. Фильтрованием на воронке, охлаждаемой ацетоном с сухой углекислотой в токе азота, отделяют продукт с т.пл. 11— 13 °C (51 %) в виде желтых пластинок. Аналитический образец получен сублимацией выделенного продукта, т.пл. 12-13 °C.
Первоначально было показано, что 2-цианобензилмеркаптан, синтезируемый из о-цианбензилхлорида, существует в форме циклического ими-
на [764]:
ннг
CH2SH
Кольчато-цепную таутомерию конденсированных иминотиолактонов изучил Стаси с сотрудниками [761, 765—767]. Указанные реакции основаны на получении 1,4-меркаптонитрилов из соответствующих галогенидов. Пред-118
ставляется перспективным синтез тиурониевых солей, которые циклизуются в [с] -аннелированные системы [766]:
Предложен [761, 768] метод получения [Ь]'-аннелированных 2-амино-тиофенов, заключающийся в циклизации бензиловых тиоэфиров (6.7, 6.8) в 2-аминобензо [Ь] тиофен (6.10) или 2-иминобензо [Ь] тиофен (6.9,а) под действием безводного А1Вг3 или А1С13 :
К *
3CH2Ph
ЦН2
(В?) W-H (s.a)
(В.9) (б10)
К ^н’^н(б)
2-АминобеЯзо[Ь] тиофеи (6.10). К охлажденному раствору 8,0 г (0,03 моля) безводного бромида алюминия в 30 мл бензола при перемешивании прикапывают раствор 5,0 г (0,02 моля) 2-(бензилтио) бензилцианида в 10 мл бензола. Смесь перемешивают в токе азота при комнатной температуре 48 ч н прибавляют к ней при охлаждении 75 мл воды. Продукт экстрагируют эфиром (3 х 40 мл). Объединенный экстракт промывают насыщенным раствором хлорида натрия (2 х 30 мл) и сушат безводным сульфатом магния. Эфир удаляют, остаток перекристаллизовывают из 25 мл четыреххлористого углерода. Выход продукта с т.пл. 115-117 °C в виде длинных бесцветных игл равен 2,5 г (80 %).
Аналогичный подход использован при получении 2-аминотиофена [761, 762] из нитрила чис-бензилтиокротоновой кислоты, а нитрил трвмс-бензил-тиокротоновой кислоты в таких же условиях превращается с выходом 60 % в 4-бензилтио-З-хлорбутиронитрил. Применение хлористого водорода как катализатора дает лучшие результаты по сравнению с А1Вг3. Данные по синтезу [Ь] - и [с] -аннелированных 2-аминотиофенов кратко рассмотрены в работах [1,7, 16,769,770].
1,4- Меркаптонитрилы образуются не только из соответствующих галогенидов, но и при насыщении растворов у-кетонитрилов в метаноле сероводородом и хлористым водородом. Действие последнего, как и других кислотных агентов, увеличивает электрофильность углерода нитрильной группы, что приводит к повышению скорости циклизации, конечными продуктами которой являются 2-аминотиофены [771, 772]. Этот путь использован для получения 2-амино-5-фенилтиофена и 2-амино-4,5,6,7-тетрагидробензо [Ь] -тиофена:
119
При попытке синтеза Тиолактона из этилового эфира 2-циан-4-меркап-томасляной кислоты, полученного из 1-бром-2-ацетилтиоэтана (6.11) и на-трийциануксусного эфира, выделен этиловый эфир 2-амино-4,5-дигидротио-фен-3-карбоновой кислоты (6.14) [773]. Следует отметить, что циантиолактоны (6.15) под действием этилата натрия легко рециклизуются в амино-произвоДные дегидротиофена [774].
2-Имино-З-метнл-З-этокснкарбонилтетрагидротиофен (6.13,а) [773]. 7,1 г (50 ммолей) З-метил-2-оксо-З-цианотетрагидротиофена вносят в раствор этилата натрия, состоящий из 5 ммолей натрия и 40 мл абсолютного спирта. Смесь кипятят 19 ч, после чего нейтрализуют 0,3 г уксусной кислоты. Спирт удаляют в вакууме, остаток растворяют в хлороформе и взбалтывают с водой. Растворитель удаляют перегонкой под вакуумом. Выход продукта в виде бесцветного масла с т.кип. 59 °C (1,33 Па) составляет 5,2 г (56 %).
Этиловый эфир 2-метил-2-циан-4-ацетилмеркаптомасляной кислоты (6.12,а) также циклизуется в имин (6.13,а) [773] :
NaC(ft)W cooet *
АсЗСНгСНгВг -------- Дс5СНгСН2С ОН
cooet
(в.н) (б.к) а=.СН3(а1
н = и (е)
ХлорацетилЦиануксусный эфир (6.1
(su) H=CHs(a) (б.н) '
: H=n(s)
при нагревании в водной среде с
гидросульфидом калия наряду с сульфидом (6.17) даете выходом 46 %-этиловый эфир 2-амино-4-окситиофен-3-карбоновой кислоты (6.18) [775, 776].
Данные ПМР-спектроскопии свидетельствуют о присутствии в растворе трех изомерных форм — (6.18) — (6.20), из которых наиболее устойчива аминоформа (6.19) [776]:
Сульфид (6.17) в присутствии концентрированной серной кислоты циклизуется в аминотиофен (6.18) [776].
2-Амино-4-окси-3-этоксикарбоиилтиофен (6.18) [776]. 0,048 моля этилового эфира хлорацетилциануксусной кислоты растворяют в 90 мл 15%-ного водного гидросульфида калия. Смесь нагревают на паровой бане. Через 15 мин выделившийся осадок отфильтровывают, промывают водой н перекристаллизовывают из спирта. Выход продукта с т.пл. 219-220 °C составляет 4,2 г (45 %).
Этот подход распространен и на производные гетероциклических кетонов [777]. Ацетилированием гетарилацетрнитрилов меркаптоуксусным эфи: ром в присутствии трет-бутилата натрия можно получить 2-амино-З-гетарил-4-(5Н) оксотиофены [778], используемые в синтезе физиологически актив-ныхвеществ.
6.2. Синтезы на основе карбонильных соединений
Взаимодействие а-меркаптокарбонильных соединений с нитрилами, содержащими активную метиленовую группу, в присутствии оснований приводит с хорошими выходами к 2-аминотиофенам (реакция Гевальда) [760, 779]. На первой стадии, по-видимому, происходит конденсаты нитрила по карбонильной группе а-меркаптокетона (по типу Кневенагеля) с образованием удобной для циклизации структуры 1,4-меркаптонитрила (путь Л). Предполагается также, что первой стадией процесса может быть присоединение а-меркаптокарбонильного производного к нитрильной группе (путь Б} [760], легко протекающее при комнатной температуре. Не следует, вероятно, исключать и электроциклический механизм реакции (путь В):
(А2г)
2-Амино-3-цнано-4,5-тетраметилентнофен [779]. 0,1 моля малононитрила н 0,1 моля 2-меркаптоциклогексанона растворяют в 30 мл этилового спирта и прибавляют по каплям при перемешивании 0,5-2,0 мл пиперидина или 2-5 мл триэтиламина с такой скоростью, чтобы температура смеси не поднималась выше 50 °C (для цианацетамида,
16
121
w-цианацетофена реакционную массу нагревают 03 ч при 50 °C). Через 0,5-2 ч реакция заканчивается и начинает выделяться тиофен. После выдерживания смеси в холодильнике, выкристаллизовавшийся осадок отфильтровывают (при разбавлении фильтрата водой в случае растворимых конечных продуктов дополнительно получают некоторое количество продукта) и перекристаллизовывают из спирта. Выход продукта с т.пл. 147-148 °C 70 %.
Для подтверждения строения 2-аминотиофенов (6.21) применяют реакции я-галогенилиденпроизводных (6.24) и (6.25) с гидросульфидом натрия. Соединения (6.24) и (6.25) получаются при взаимодействии 2-хлорцикло-гексанона (6.22) с метиленактивными нитрилами в присутствии (3-аланина (другие я-галогенкетоны в реакцию Кневенагеля не вступают) либо прямым бромированиемилиденлроизводныхметиленактивныхнитрилов (6.23) [779]:
Z
„ + Л;
Me
(егз)
2-Амиио-3-циано-43-тетраметилент1Юфеи [779]. 0,05 моля 2-хлорциклогексилиден-малононитрила растворяют в небольшом количестве диоксана и прикапывают при перемешивании и температуре 0 °C к 50 мл этилового спирта, содержащего раствор 10 ммолей гидросульфида натрия. Через 10 мин смесь выливают в воду н выделившийся осадок отфильтровывают. Выход продукта с т.пл. 146 °C 95 %.
Однако в препаративном отношении последний метод уступает реакции Гевальда вследствие малой доступности исходных соединений (6.24, 6.25). Впоследствии реакция была распространена на различные я-меркаптокарбо-нипьные соединения [780—785]. Конденсацию, как правило, осуществляют в среде полярного растворителя (спирта, ДМФА) и в присутствии органического основания (диэтиламина, триэтиламина, морфолина, пиперидина и др.). С увеличением электроноакцепторных свойств заместителя Z, связанного с метиленовой группой, реакция идет быстрее. Так, меркаптокетоны с малононитрилом взаимодействуют настолько легко, что реакцию можно проводить в водной среде и использовать для определения лабильного меркаптоацетона [786]. Циануксусная кислота и бензилцианид не реагируют с я-меркаптокарбонильными соединениями, в то время как 2-меркаптоциклогексанон в этих условиях присоединяется к нитрильной группе динитрила янтарной кислоты, давая в качестве конечного продукта соответствующий тиазол [779].
122
Реакция имеет ограничения, связанные с малой доступностью и неустойчивостью исходных а-меркаптокарбонильных соединений. Например, димеркаптоацетон с малононитрилом под действием кислорода воздуха образует бис- (2-амино-3-циано-4-тиенилметил) дисульфид [779], который, не выделяя, можно превращать в другие соединения [787].
С целью упрощения синтеза замещенных 2-аминотиофенов предложено применять 2,5-диокси-1,4-дитианы — димеры а-меркаптокарбонильных соединений. Выходы тиофенов достигают 75-90 % [788-795]. Таким образом получен 2-амино-З-карбамоилтиофен, служащий диазосоставляющей в синтезе дисперсных красителей [792]:
+ мссигг.
Z^cOOH, СОМ, СОМНг, CONHMfM, СМНг, ООЯк
Этим методом синтезирован ряд 2-аминотиофенов со свободными 4- и 5-положениями тиофенового кольца на основе амидов [789—792] и тиоамидов циануксусной кислоты [788], фенацилцианидов [791, 794, 795], циануксусной кислоты [789, 790]. Сложные эфиры меркаптоуксусной кислоты реагируют с метиленактивными нитрилами в спирте под действием диэтиламина с образованием соответствующих 2-2-метилентиазюлидиоиов-4, а не изомерных им 2-амино-3-2-4-ок'ситиофенов [767].
Еще более эффективным усовершенствованием реакщш Гевальда опасалось использование вместо а-меркаптокетонов смеси карбонильного соединения (альдегидов [796—803], кетонов [221, 780—782, 796,804—824], 0-ди-карбонильных соединений [825, 826]) и порошкообразной серы [796, 797]. При этом выходы 2-аминотиофенов часто повышаются. Реакцию желательно проводить в спирте и ДМФА. Из альдегидов получены 2-аминотмофеиы со свободным положением 4 гетероцикла [797—803]:
а
/К, о
М.2 + 5,
СМ
Сложнее протекает взаимодействие с простейшими карбонильными соединениями. Так, ацетальдегид подвергается альдольной конденсации, поэтому 2-аминотиофеи не образуется. Однако в случае ацетона реакция протекает глубже: основным продуктом трехкомпонентной конденсации ацетона, цтн-уксусного эфира, и серы в спиртовой среде в присутствии ди- или триэтещ-аминов является бис-(2-амино-4-метил-3-этоксикарбо|шлтненил-5)дисуль-фид, получающийся в результате окисления промежуточного 2-амино-4-ме-тил-5-меркапто-З-этоксикарбонилтиофена кислородом воздуха или серой [804].
В аналогичных условиях ацетилацетон реагирует с циануксусным эфиром и серой, превращаясь в 2-амино-5-ацетил-4-метил-3-метоксикарбонил-
123
тиофен и нитрил 0-(2-амино-4-метил-З-метоксикарбонил тиенил-5)кротоновой кислоты [797]. В данную реакцию вводились малононигрил [796, 797, 804, 806—811, 821—826], циануксусный эфир [797—799, 802-804, 806, 807, 812—814, 818—821f, цианацетамид и его N-замещенные [797, 801,803, 815— 817], а-цианкетоны [800, 805] и гетарилацетонитрилы [221 ]. Вероятно, вначале карбонильное соединение (6.26) реагирует с метиленактивным нитрилом в условиях реакции Кневендгеля с образованием алкилиденпроизвод-ных метиленактивных нитрилов (6.27), которые при взаимодействии с серой дают 2-аминотиофены (6221):
(s.je) (в.з?) (бг»)
в
----—— (в.?/)
* _ w (i ?s)
Подтверждением данного направления реакции может служить тот факт, что выделенные в индивидуальном состоянии алкилиденпроизводные метиленактивных нитрилов (6.27) реагируют с серой, также образуя 2-аминотиофены (621) [797, 803, 804, 808, 809, 827—835], причем с несколько большими выходами. Характер взаимодействия определяется активностью метиленовой компоненты, строением исходного альдегида или кетона, характером катализатора и природой растворителя. На основании имеющихся данных (количественно реакция не изучалась) отдать предпочтение этому методу или тому, в котором первоначально происходило тиолирование карбонильного соединения, не представляется возможным.
Некоторые вопросы взаимодействия СН»кислотных соединений с серой рассмотрены в работе [757]. Следует отметить, что сначала может образоваться енамин (6.28), поскольку в большинстве известных примеров катализаторами служат органические основания. Кроме того, енамины (6.28), реагируя с метиленактивными нитрилами и серой, дают 2-аминотиофены (6.21) [797, 807]. При этом, а также в случае карбонильных соединений (6.26) и енаминов (6.28) промежуточными продуктами реакции являются 1,4-меркаптонитрилы (6.29). На возможность их образования нз а-меркапто-карбонильных соединений указывалось раньше.
2-Аминотиофены из карбонильных соединений, метиленактивных нитрилов и се» ры [797]. К смеси 0,1 моля кетона, 0,1 моля нитрила, 0,1-0,11 моля порошкообразной 124
серы и 20-30 мл этилового спирта при перемешивании прибавляют 10 мл диэтиламина или морфолина. При нагревании, но не выше 60 °C, сера почти полностью растворяется. Смесь нагревают на водяной бане при 30-40 °C в течение 1-3 ч. При охлаждении начинается кристаллизация. Смесь разбавляют в два-три раза водой. Выделнвишйся осадок отфильтровывают и перекристаллизовывают из этанола.
2-Аминотиофены из алкилидеипроизводиых метиленактивных нитрилов и серы [797]. Смесь 0,1 моля алкилиденпроизводного нитрила, 0,1 моля порошкообразной серы и 20-40 мл этилового спирта обрабатывают по приведенной методике. Выходы ие-- которых 2-аминотиофенов приведены в табл. 6.1.
Таблица 6.1. Константы 2-аминотиофенов (6.21)
R R1 Z Т.Ш1., °C Выход, %, по методам
a 6 В Г
СНЭ СНЭ CN 141-142 70J779] 42(797] 41(797]
сн3 сн3 COOEt 91-92 — 39(797] 40(797], 55(829] —
н С2Н, COOEt 73 — 60(798], 75(797] — 46(807]
н COOEt COOEt 107-108 — 32(797] — 34(807]
(СН2). — CN 147-148 701779] 86(797], 61(808] 90(797] 85(807]
(СН2), — COOEt 115 80(779] 82( 797] 91(797]
Обозначения: а - конденсация меркапто карбонильных соединенийс метинеиактивными нитрилами; б - трехкомпонентная конденсация карбонильных соединений, метиленактивных нитрилов и серы; в - взаимодействие илиденпроиэводных нитрилов с серой; г - конденсация енаминов, метиленактивных нитрилов и серы.
Высокие выходы замещенных 2-аминотиофенов свидетельствуют о том, что стереохимия алкилидеипроизводиых метиленактивных нитрилов (6.27) ие влияет на ход реакции, так как в присутствии оснований они легко изомеризуются [760,804, 832].
Необходимое условие протекания реакции — наличие электроноакцепторных заместителей в молекуле промежуточного метиленактивяого соединения [760], например нитрилов, которые содержат заместитель Z, связанный с метиленовой группойи облегчающий взаимодействие по Кнёвенагелю. Наиболее реакционноспособным из метиленактивных нитрилов является малоно-нитрил, в меньшей степени — циануксусный эфир, в еще меньшей - цианацетамид. Тиолированию подвергается преимущественно метиленовая, а не метильная группа [757, 760], что иллюстрируется получением 2-амино-3-2-4,5-диметилгиофенов из метилэтилкетона [797]. Введение электронодонорного заместителя не только способствует протеканию процесса, но и стабилизирует образующиеся 2-аминотиофены.
Реакцию Гевальда ограничивает димеризация алкилиденпроизводных метиленактивных нитрилов [16, 760], конкурирующая с тиолированием, что особенно важно в случае малоактивных арилкетонов, по-видимому, не дающих по этой причине соответствующих 2-аминотиофенов. Однако арил-этилкетоны взаимодействуют с малононитрилом и серой в присутствии мор-
125
фолина с образованием 2-амино-З-цианотиофенов [809]. Более гладко реакция протекает с циклическими кетонами: циклогексаноном [781, 782, 796, 797, 807, 810—816], его замещенными [781, 808, 817—822] и конденсированными системами [808, 822,823], циклоалкилиденпроизводными ме-тиленактивных нитрилов [797, 808,830,831,833].
В случае гидразида циануксусной кислоты, циклогексанона и серы получен 3-циклогексилиденамино-2,2-пентаметилен-5,6-тетраметилен-1,2-дигидро-тиено [2,3-d] пиримидон-4, вероятно, вследствие дальнейших превращений гидразида 2-аминотиофен-З-карбоновой кислоты, который можно выделить кислотным гидролизом продуктов реакции [816].
2-Амино-5,5-диметил-4,5-дигидро-7Н-пирано- и тиопирано[3,4-Ь]тиофены [842,843]. Смесь 0,1 моля 2,2-диметил-4-тетрагидропиранилиден-нли 0,1 моля 2,2-диметил-4-тет-рагидротиопираиилидеипроизводных'малононитрила либо циануксусного эфира, 0,1 моля порошкообразной серы и 80—100 мл 96%-ного этанола нагревают при перемешивании до 50 °C и прибавляют 10 мл дизтиламина в течение 30 мин. Затем температуру повышают до 60 °C и смесь перемешивают до полного растворения серы. После охлаждения смесь выливают в 200 мл охлажденной воды н подкисляют 18%-ной соляной
кислотой (по конго). Осадок отделяют, промывают водой и гептаном. При этом продукт полностью закристаллизовывается. Кристаллы отфильтровывают, промывают гептаном и сушат в вакуум-эксикаторе. Константы синтезированных веществ приведены в табл. 6.2.
Таблица 6.2. Константы 2-амино-5,5-диметил-4,5-дигидро-7Н-пирано- н тиопирано[3,4-Ь]тио-
фенов
Y Z 1 Выход, % I Т. пл., I °C Литература ‘
о CN 83 109-111 [842]
о COOEt 77 54-55 [843]
S CN 92 40* 97-98 [842]
S COOOEt 98 46* 59-60 [843]
1 Соединения получены трехкомпонеятной кои-
Аналогично с образованием конденсированных 2-аминотиофенов реагируют кетоны более сложных циклических систем (бицикло [2,2,1] гептаноя-2 [836], стероиды [824, 837, 838] и 1, 3, За,4,9,9а-гексагидро-2-метил-4,5-этано-2Н-бенз [f] изоиндолон-10 [823]). Так, холестанон-3 (6 30) дает 21 -амино-31 -циаиохолест-
2-ено [2,3-Ь] тиофен (6.33) [837]:
(б.зо) (ви)
Промежуточным соединением, по-видимому, является продукт тиолиро-вания (6.31), который затем циклизуемся в имин (6.32), изомеризующийся в более устойчивый амин (6.33). В работе [824] конечному продукту реакции ошибочно приписана структура амина (6.34). Строение холестенотиофе-на (6.33) подтверждено его синтезом из 2-этилксантана 3-холестанона [837]. Вмёсто этилксантана в реакции можно использовать З-холестанон-2-тиол и малононитрил.
2-Амнно-31-цианохолест-2-ено[2,3-Ь] тиофен (6.33) [837]. Смесь 3,86 г 3-холестанона, 0,66 г малононитрила, 0,32 г серы н 2 мл морфолина в сухом этаноле перемешивают при 48 °C в течение 5 ч. Смесь охлаждают, выделившийся осадок отфильтровывают и промывают спиртом. Продукт имеет т.пл. 270-278 °C (разл.). После перекристаллизации из смеси тетрагидрофурана с метанолом выделяют 2,5 г (54 %) соединения в виде бесцветных игл с т.пл. 279-281 °C (разл.).
С малононитрилом или циануксусным эфиром и серой в присутствии морфолина аналогично взаимодействует андростан-3,17-дион (6.35), причем реагирует только 3-кетогруппа стероида. Образующиеся продукты (6.37) идентичны соединениям, полученным из 3-илиденпроизводных (6.36) [838]:
щен
С целью синтеза физиологически активных соединений и расширения границ применимости реакция Гевальда изучена в ряду гетероциклических кетонов [818,839—855] и их илиденпроизводных [842—844, 847, 855], на основе которых получены 2-амино-3-2-6,7-дигидро-4Н-1,4-дитиепино[6,5-Ь]-тиофен [855], 5,5-диметил-4,5-дигидро-7Н-пирано [3,4-Ь] тиофен [840—844], тиопирано [3,4-Ь] тиофены [841—846], 4,5-дигидротиено [2,3-Ь] тиофен [839], 2-амино-6-К-3-2-4,5,6,7-тетрагидротиено [2,3-с] пиридины [846—854] (в том числе из хинуклидона-3) [853, 854], 2-амино-9-аза-3-цианометилтиено [2, 3-Ь] бицикло [3,2,1] октан [825]. Исходные гетероциклоалканоны-4 легко получаются циклоприсоединением сероводорода, аммиака и аминов к хал-конам. Учитывая это, а также, что циклические кетоны, как правило, дают конденсированные 2-аминотиофены с хорошими выходами, видим, что метод достаточно перспективен.
В качестве катализаторов наиболее распространены диэтиламин, три-этиламин, морфолин, пиперидин и другие, причем природа основания имеет большое значение, так как его действие связано с повышением нуклеофильности тиольной группы. Так, алкоголяты щелочных металлов могут вызывать рециклнзацию 2-амино-З-алкоксикарбонилтиофенов в 3-цнанотиолак-тоны [856], при этом исключается возможность образования илиденовых. производных типа 1,4-меркаптонитрилов.
127
На взаимодействии 1-циано-4-а рил бутадиенов с порошкообразной серой в диметилформамиде в присутствии триэтиламина базируется способ получения 2-амино-3-Z-S-тиоароил тиофенов [857, 858]. В реакцию можно вводить коричный альдегид или его замещенные, метиленактивный нитрил и серу:
АгСН=СНСН
/)гсн~ снсно + нссцг + s.
Подобным образом реагирует с малононитрилом и серой циклогексан-тион [859]. Здесь, по-видимому, атом серы тиокарбонильной группы вначале атакуется анионом малононитрила. Дальнейшее элиминирование сероводорода приводит к циклогексилиденмалононитрипу, который превращается в 2-амино-4,5-тетраметилентиофен:
В такую же реакцию вступают нитрилы 0-аминокротоновых кислот [860]:
__ * CH3C^CHCN
И /
"Н
Следовательно, 3-кето- и 3-тиоксо- или 3-йминопроизводные карбонильных соединений и нитрилов при взаимодействии с метиленактивными нитрилами и элементной серой дают родственные 2-аминотиофены.
Взаимодействие серы, малононитрила и о-оксиацетофенона используется для получения конденсированного с кумариновым фрагментом 2-аминотиофена. Тиолирование 4-метил-3-цианокумарин-2-имина (6.37) по метильной группе подтверждено экспериментально [522]: в зависимости от условий синтезирован 3-амино-2-имино-4Н-тиено [3,4-с] бензопиран (6.38) либо бис-(3-амнно-4-имино-4Н-тиено [3,4-с] [1] бензопиранил-1)дисульфид (6.39):
128
Нитрилы с менее реакционноспособной метиленовой группой -(бензил-цианид, цианацетамид, динитрил янтарной кислоты) в эту реакцию де вступают [522].
3-Амино-4Н-тнено[3.4-с] [1] бензопнран-4-ои [522]. Через суспензию 13,6 г (0,1 моля) о-оксиацетофенона, 3,2 г (0,1 моля) серы н 11,35 г (0,1 моля) циануксусного эфира при комнатной температуре пропускают сильный ток аммиака. Реакционная масса при растворении серы и повышении температуры до 48 °C быстро окрашивается в темный цвет. Через 45 мин температура смеси понижается. Аммиак пропускают еще 8 ч, причем первые 2 ч поддерживают температуру 50 °C. Смесь под аммиаком оставляют на ночь, выливают в 200 мл бензола и взбалтывают с 100 мл водного раствора сульфида аммония. Бензольный спой отделяют, а водный несколько раз экстрагируют бензолом порциями по 50 мл. Объединенный бензольный раствор промывают водой (2 х 100 мл) и осторожно упаривают под вакуумом. Остаток перекристаллизовывают нз бензола. Выход продукта с т.пл. 198-199 °C составляет 6 г (28 %) . '
6.3. Синтезы на основе 1,1,2,2-тетрацианоэтана и родственных соединений
Замещенные 2,5-диаминотиофены получаются при взаимодействии тетрацианоэтилена, 1,1,2,2-тетрацианоэтана и некоторых других полйцианоэтиленов с сероводородом [861—869], причем тетрацианоэтилен восстанавливается до тетрацианоэтана (6.40), который реагирует с сероводородом [862, 865]:
17
/СИ nc/'cn
NCx. /си 'сне/-/
NC' fsw)
NC CN NC CN
129
Реакция пригодна для препаративных целей (868]. В ней можно использовать замешенные 1,1,2-трицианоэтаны [869].
2,5-Диамино-3,4-дицианотиофен (862]. Раствор 12,8 г (0,1 моля) тетрацианоэтилена в 150 мл ацетона и 150 мл четыреххлористого углерода насыщают сероводородом. Помутневший раствор охлаждают на ледяной бане и медленно прибавляют 50 мл пиридина. Прозрачный раствор снова насыщают сероводородом. Осадок отфильтровывают, промывают ацетоном н сушат. Выход сырого продукта в виде желтого кристаллического порошка составляет 15,1 г (92 %). После перекристаллизации из водного диме-тилформаммда (1 : 3) выделяют 9,0 г почти бесцветных игл', сублимирующихся при 240-244 °C (разл.).
К рассматриваемому типу реакций можно отнести взаимодействие метиленактивных нитрилов или их димеров с элементной серой. Так, малононит-рилы легко реагируют с серой в диметилформамиде в присутствии триэтиламина при комнатной температуре [870]:
___.CN
сн,(м)г + ~t,N’гас.—_
(ыг)
Основные продукты реакции (2,5-диамино-3,4-дицианотиофен (6.42) с выходом 30 % и 2,4-диамино-3,5-дицианотиофен (6.43) с выходом 20 %) образуются через промежуточный тетрацианоэтан (6.40) и димер малононитрила соответственно, что подтверждается синтезом 2,4-диамино-3,5-дицианотиофена из димера малононитрила с выходом 85 % [870, 871]. Сложнее протекает взаимодействие циануксусного эфира [870, 872] и цианацетамида [870] с серой.
2,4-Диамино-З^-дицианотиофен [870]. К раствору 13,2 г (0,1 моля) 2-амино-1, 1,3-трицианопропена (димера малононитрила) в 30 мл диметилформамида при перемешивании прибавляют 3,2 г (0,1 моля) тонкоизмсльченной серы и прикапывают 20 мл диэтиламина так, чтобы температура смеси не поднималась-выше 40 °C. Перемешивание продолжают 3 ч прн комнатной температуре, после чего реакционную массу выливают в 300 мл воды. Выделившийся осадок отфильтровывают и перекристаллизовывают из смеси воды с этанолом (4:1). Выход продукта с т.пл. 252-254 °C 14 г (85 %).
6.4. Взаимодействие тииранов и тииренов с метиленактивными нитрилами и некоторые другие реакции рециклизации
Для синтеза 2-аминотиофенов можно также использовать реакцию рециклизации некоторых гетероциклических систем под действием метиленактивных нитрилов. Так, тиираны реагируют с метиленактивными нитрилами с образованием продуктов типа меркаптоэтилциануксусного эфира, которые без выделения могут циклизоваться в 2-аминодигидротиофены [573, 584, 873— 876]. При проведении реакции с циануксусным эфиром в среде метилового спирта происходит переэтерификация [873]. По-видимому, рсциклизация тииранов, как и оксиранов, азиридинов с метиленактивными нитрилами в 130
производные гидрированных 2-аминотиофенов, фуранов, пирролов имеет общий характер [573].
Взаимодействие 1,2-диметилтиирен-1,1-диоксида (6.44) как амбидентного электрофила с а-металлированными нитрилами (6.45, 6.46) может привести к 2-имино-2,3-диметил-2-сульфоленам (6.47,6.48) [877,878]. Реакция в значительной степени зависит от нуклеофильности аниона. В случае (6.46) в качестве электрофильного центра выступают винильные атомы углерода, а при действии (6.45) на диоксид (6.44) первоначальной атаке подвергается атом серы:
СН,
CHj
\е
Vav
Я'
л сн,
С 6.4S) R-Me (б.Чв)
При рециклизации замещенных 5-алкилиденроданинов в щелочной среде образуются 2-аминотиафен-5-карбоновые кислоты с выходом 90 % [879]:
о
—ян
Наон
соя
NCCHCH
HaC0''S''HHl
соя
Некоторые вопросы внутримолекулярного взаимодействия 1,4-окси-, 1,4-амино- и 1,4-меркаптонитрилов рассматриваются в работах [340, 341].
Замещенные 2-аминотиофенов, получаемые циклизацией у-меркапто-нитрилов, и их производные имеют наибольшее значений в синтезе физиологически активных веществ [778, 780, 794, 800, 801, 805, 808,812,818—823, 827, 830, 836, 841—854], гербицидов [16, 809, 810, 812, 813, 834], красителей [771, 783, 792, 814, 860] и в других областях органического синтеза. Имеются обзоры [880, 881] по использованию производных тиофена в качестве пестицидов, ветеринарных препаратов и красителей.-Тиноридин (2-амино-6-беизил-3-этоксикарбонил-4,5,6,7-тетрагидротиено [2,3-с] пиридин) применяется в фармакологии [882]. 4
6.5. Реакции циклизации с участием атома селена как нуклеофильного центра
Известно мало примеров циклизации нитрилов в 2-аминопроизводные селенсодержащих гетероциклов. Вероятно, реакцию Гевальда можно применить к синтезу замещенных 2-аминоселенофенов. В литературе описан единственный представитель 2-аминоселенофенов, а именно 2-амино-4,5-тетраметилен-3-этоксикарбонилселенофен, получаемый этим способом [759, 883-885] :
131
ChtCOOEt
CN
Аналогично 2,5-диамино-3,4-дицианотиофенам 2,5-диамино-3,4-дицианоселенофен можно синтезировать из тетрацианоэтилена [867] и 1,1,2,2-тетрацианоэтана [866]. При этом тетрацианоэтилен, по-видимому, также первоначально восстанавливается до тетрацианоэтана (6.40)
Изучено [866] взаимодействие тетрацианоэтана (6.40) с гидридами элементов подгруппы VIA и показано влияние на ход реакции кислотности Н2Э(Э = О, S, Se, Те) , которая должна быть не выше кислотности исходного соединения (6.40) и в то же время, достаточной для образования промежуточного соединения (6.49) и его циклизации в гетероциклы (6.42), (6.50). Поэтому вода не реагирует с нитрилом (6.40) (Ка ~ • Ю-16);Н2Те, кислотность которого (Ка = 2 • 10-3) ниже кислотности исходного соединения (6.40), тоже не вступает в реакцию, a H2S(/Te =9,1 • 10-7) и H2Se(6"e = = 1 • 10~4) легко реагируют с тетрацианоэтаном. В результате выделены 2,5-диамино-3,4-дицианотиофен (6.42) и соответствующий селенофен (6.50):
NC' . CN ~ Л (&«i) 3=3 (6.50) 3*3e
При взаимодействии замещенных 0-(0-хлорвинил)акрилонитрилов (6.51) с гидроселенидом'натрия и 0-аминовинилселенонов (6.52) с метиленактивными нитрилами [886—889] можно получить различные перхлораты 2-ами-носеленопирилия (6.53):
NrCCN-CNN*'*2 II Зе (*”)
ЯгС —CHCN—C—Z
(s.st)
СНг2. CN
NoNSf
-HNHR*
-Na Cl
Ncta,
132
ГЛАВА 7. АМИНЫ ПЯТИЧЛЕННЫХ С ДВУМЯ И БОЛЬШИМ ЧИСЛОМ ГЕТЕРОАТОМОВ В ЦИКЛЕ И ШЕСТИЧЛЕННЫХ ГЕТЕРОЦИКЛИЧЕСКИХ СОЕДИНЕНИЙ
Циклизацией нитрилов можно получить разнообразные амины серосодержащих гетероциклических аминов. Если в цепи атомов между реакционными центрами содержится один или несколько гетероатомов, то образуются гетероциклические амины с двумя и большим числом гетероатомов в цикле. Таким путем синтезированы 1,2-дитиолы, 1,3-дитиоланы, тиазолы, тиазины и некоторые другие классы соединений [1,67, 890],
7.1. 1,2-Дитиолы и родственные им соединения
Основной метод получения производных 3-амино-1,2-дитиолов заключается во взаимодействии метиленактивных нитрилов, сероуглерода и элементной серы в полярных растворителях в присутствии оснований (аммиака или аминов) [8, 891—894]. Наиболее вероятен следующий путь. Метиленактивный нитрил (7.1) и сероуглерод при действии оснований образуют соль (на схеме приведена аммоншшая соль) (7.2), которая реагирует с серой:
5-Амнно-4-циано-1Д-дитиол-3-тиои [893]. К смеси 3,3 г (0,05 моля) малононитрн-ла, 5 мл сероуглерода, 1,6 г серы и 20 мл диметилформамида при энергичном перемешивании добавляют 0,5 мл диэтиламина н 1 мл триэтиламина. При повышении температуры в пределах 40—50 °C сера быстро растворяется. После 2 ч перемешивания смесь выливают в 4—5-кратный объем воды. Выделившийся желтый осадок отфильтровывают, промывают спиртом и сушат; для удаления серы его перемешивают с сероуглеродом и отфильтровывают. Выход продукта с т. рази. 230 °C составляет 7,5 г (86 %).
Если в реакцию вводить соли типа (7.2) с серой, то можно выделить 3-амино-4-7-1,2-дитиол-3-тионы (7.3) (893—896]. Вероятно, соли (7.2) взаимодействуют с сероводородом. При этом выходы 3-амино-1,2-дитиолов (7.3) приближаются к количественным. Предполагается, что сероводород присоединяется к нитрильной группе (7.2) и продукт (7.4) в результате-де-гидрирования переходит в дитиол (7.3) [896].
133
5-Амиио-4-карбамонл-1,2-дитиол-3-тион [896]. Через смесь 8 г (0,04 моля) аммонийной соли 1-циано-1-карбамоил-2,2-димеркаптоэтилена и 50 мл воды в течение 30 мин при комнатной температуре пропускают сероводород. Смесь перемешивают 3 ч, при уменьшенном давлении н температуре 30-40 °C удаляют избыток сероводорода. Остаток разбавляют 50 мл воды, насыщенной бромом, и оставляют на несколько часов. Осадок отфильтровывают, промывают водой, эфиром и перекристаллизовывают из смеси пиридина и воды. Выход продукта в виде призм с т.пл. 247-248 °C составляет 9,0 г (94 %).
Аналогично при нагревании в метаноле смеси замещенных нитрилов 4-нитрометил-3-метилтио-2-2-кротоновой кислоты, порошкообразной серы и вторичного амина получаются 3-амино-5-нитрометилен-4,1,2-дитиолы [897].
Интересно, что оксиметиленбензилцианид реагирует с пентасульфидом фосфора с образованием солей 3-амнно 1,2-дитиолия [898]:
5-Арил-3-дицианометилен-1,2-дитиолы (7.5) при обработке сероводородом в пиридине и триэтиламине [899] или 5-фенил-1,2-дитиол-3-илиденциан-оцетамид (7.6) с пентасульфидом фосфора [900] превращаются в 2-амино-3-циано-1,6,6а,81У-тритиапенталены (7.7):
(7.S) Z - соннг
Таким путем синтезированы различные замещенные 1,2-дитиолов [8, 901].
При ацилировании цианодитибкарбоксилата натрия (7.8), получаемого из цианида натрия и сероуглерода, в зависимости от условий. образуются 3-ацилимино-4-алкилтиоксикарбонил-5-циано-1,2-дитиолы (7.9) [902, 903] или 3,6-бис (ациламино)-ЗН, бН-дитиоло [4,3-с] [1,2] дитиолы (7.10) [903 905]:
ЯСОС1
MaSCCN я.ДМ<М --------------
II * S
-----— ясозс = СЗСОР I I см см
ясо-s -с- см
Scoo
(7.9)
134
3,6-Бис (ацетилнмино)-ЗН, 6Н-днтноло[4,3-с] [1,2] дитиол [903]. 0,1 моля цианди-тноформната растворяют в смеси 50 мл бензола и 50 мл пиридина и при комнатной температуре в течение 30 мин при перемешивании медленно по каплям прибавляют 0,1 моля хлористого ацетила, растворенного в 25 мл бензола. Реакционную массу кипятят при перемешивании 1 ч, охлаждают, выделившийся осадок смеси продукта и солей отфильтровывают, промывают метанолом, водой и снова многократно метанолом. Выход продукта с т.пл. 253-255 °C (разл.) 70%.
Ди (2-цианоэтил)фосфин (7.10) также реагирует с серой. Вероятно, при этом образуется 3-имино-1,2-тиофосфолановое кольцо [906]. Свободная кислота (7.13) (7.14) не выделена, но пиридиновая соль (7.11) (7.12)
получена с выходом 95 %:
(nCCHjCH,
s . 11
7.2. 1,3-Тиоксолаиы и 1,3-дитиоланы
Ц здитиокарбоксилат натрия (7.8) при взаимодействии с циклическими кетонами дает натриевые соли — 4-имино-5-тиоксо-1,3-тиоксолан-2-спиро-циклоалканы [207]:
Вицинальные дитиоцианаты, образующиеся в случае присоединения диродана к олефинам, циклизуются под действием кислот в соли 2-нмино-1,3-дитиолана [908—910]:
к
ксн-сик’ ~ MesoZ
5-Иминоциклогексанспиро-2'1 ‘.З'-дитиолан-Д1 -спироциклогексан (7.15) и соответствующий ему 5-тион (7.16) получены из 1,1-циклогександитиола и цианида калия, по-видимому, по следующей схеме [911]:
135
2-Иминоциклогексанспиро-21-I1,3‘-дитиолан-4’-спироциклогексан (7.15) нцикло-гексаислиро-21-1',3*-дитиолаи-41-спироциклогексан-5-тиои (7.16) [911]. Раствор 2,6 г цианида калия в 20 мл воды и 10 мл диоксана медленно, в течение 20 мин прибавляют при перемешивании к раствору 5,92 г циклогексан-1,1-дитиола в 5 мл диоксана при 23 °C. Через 6 ч прибавляют воду и органический продукт экстрагируют хлороформом. Объединенные вытяжки промывают водой и сушат. При испарении растворителя остается 5,32 г масла. Хроматографическая очистка дает 45 % 1,3-дитиолан-5-тиона (7.16), который перекристаллизовывают нз легкого петролейного эфира в виде оранжевых пластинок с т.пл. 53,5-54 °C. Более полярный 1,3-дитиол-5-имин (7.15) выделен в виде твердого продукта (52 %), который после перекристаллизации нз петролейного эфира имеет вид игл с т.пл. 85-85,5 °C.
7.3. 2-Амино- и 5-аминотиазолы и родственные системы
По реакции Гевальда аналогично 2-аминотиофенам синтезированы 2-аминотиазолы. Так взаимодействуют п-меркаптокарбонильные соединения с цианамидом и серой [912, 913]. Реакция может протекать с промежуточным образованием алкилиденцианамидов (7.21). Действительно, алкилиденциан-амиды (7.18) дают с серой те же 2-аминотиазолы (7.19) [912]. 2-Аминотиа-золы (7.19) получены также при взаимодействии карбонильных соединений (7.17), цианамида и серы в присутствии вторичных аминов [912]. Вместо карбонильных соединений в трехкомпонентную конденсацию можно вводить соответствующие им енамины (7.20) [914], подвергающиеся тиолиро-ванию, которые при реакции с цианамидом приводят к 2-аминотиазолам [913]. Но не следует исключать первоначальное образование илиденциана-мидов (7.18) или а-меркаптоалкилиденцианамидов (7.21). В трехкомпонентной конденсации на первой стадии могут получиться енамины (7.20). По-видимому, реакция протекает одновременно по всем направлениям:
136
Предложено выделять целевые продукты (7.19) в виде солей, например хлоргидратов [912].
2-Амино-4,5-тетраметилентиазол [912]. К перемешиваемой смеси 0,1 моля циклогексанона, 0,1 моля цианамида, 3,2 г порошкообразной серы и 10 мл спирта прибавляют 10 мл диэтипамина. Начинается экзотермическая реакция, и сера растворяется. Смесь перемешивают при нагревании на водяной бане 0,5-1 ч, выливают в 100 мл воды, подкисляют и отфильтровывают. (Непрореагировавший кетон можно экстрагировать эфиром) . Раствор подщелачивают и продукт экстрагируют эфиром. После удаления эфира остаток нри стоянии медленно кристаллизуется. После перекристаллизации из спирта выделяют 85 % продукта с т.пл. 89,5-90,5 °C. Из эфирного экстракта продукт при пропускании хлористого водорода можно осадить в виде хлоргидрата с т.пл. 248-250 °C.
Аминоацетонитрил и соединения, содержащие его фрагмент, используются в синтезе 5-аминотиазолов. Так, замещенные N-тиобензоиламиноацето-нитрила при циклизации под действием кислот дают мезоиоимые производные 5-иминоти&зола [915]:
Я
Ж J
S СН3
Хлорид 5-амино-3-метил-2,4-дифенилтиазолня [915] - Раствор 1 г N-тиобензоил-а-фенилметиламиноацетонитрила в 40 мл безводного эфира насыщают хлористым водородом. Выпавший осадок отфильтровывают и перекристаллизовывают из смеси этанола с ацетоном (2:5). Выход продукта с т.пл. 206-207 °C в виде бесцветных призм составляет 1 г (90 %).
Простой метод получения замещенных 5-аминотиазолов заключается во взаимодействии изотиоцианатов с аминоацетонитрилом и его производными [916-919]. Образующиеся N1-замещенные N-цианометилтиомочевины гладко циклизуются в 5-аминотиазолы:
137
1R
Я - HCS + яснея i
NHt
ЯННСЯИСНЯ'
S CH
5-Амино-2-метиламино-4-этоксикарбони11гиазол [916]. Смешивают растворы мстил-изоцианата в 15 мл эфира и 26 г аминоцианацетата в 100 мл эфира и оставляют на ночь. Выделившийся осадок отфильтровывают,промывают эфиром и получают 30,5 г продукта. Из фильтра можно дополнительно выделить после длительного стояния 5 г продукта. Общий выход продукта с т.пл. 162 °C составляет 84 %.
С аминоацетонитрилами аналогично реагируют производные хлортио-угольного эфира [920] и сероуглерод [921-923]. Проведение этих реакций в присутствии альдегидов приводит к азометинам или основаниям Шиффа, которые обладают бактерицидным и гербицидным действием [922—924]:
,— N
Одновременное действие ароматических альдегидов (7.22) и серы можно использовать для получения оснований Шиффа и производных 5-амино-4-фенилтиазолов (7.25). Ход процесса объясняется появлением на первой стадии азометинов (7.24), которые при действии серы в присутствии оснований дают 2-аминотиазолы (7.25), реагирующие с альдегидам, находящимся в реакционной среде [925]:
/»
В. ie
ЯСНО + H,NCHPh -------— ЯСНъНСН/Ъ — - ИСН-Н-С
I I ВН9 1
СН М СИ
(сгг) . (ггз) (гги)
л»
НС
5-Аминотиазолы (7.28) удобно получать из сероводорода и зтоксимети-ленаминопроизводных метиленактивных нитрилов [926, 927]. Метод представляет интерес и в том отношении, что образующиеся 5-амино-4-карбамо-илтиазолы, 5-меркаптоимидазолы (7.29), а также некоторые другие производные можно использовать в различных областях тонкого органического синтеза. Причем рециклизация 5-аминотиазолов (7.28) в имидазолы (7.29) часто происходит уже при их получении [927]:
138
•zcH-N=c(R)oet-----LX
CH
(7.29)
При пропускании сероводорода через раствор алкилмалононитрилов в хлористом метилене в присутствии триэтиламина образуются 4-алкил-5-аминотиазолы [928]. 6-Амино-З-гетарил-сим-триазоло [3,4-Ь]-1,3,4-тиадиазолы (7.30) получаются при действии бромциана на 1-амино2-меркапто-2-5-(2-,3-или 4-пиридил) -сим-триазолы [929]:
*—# вгсн
I NHt
(*30)
6-Амино-3-(2-пиридил)-сим-триаэоло[3,4-Ь[-1,3,4-тиадиазол [929]. Раствор 0,06 молей бромциана и 0,05 молей 3- (2-пиридил) -5-триазол-5-тиона в 75%-ном водном спирте кипятят 2-3 ч. Растворитель упаривают до 1/4 исходного объема и разбавляют насыщенным раствором ацетата натрия в воде. Осадок отфильтровывают и перекристаллизовывают из спирта. Выход продукта с т.пл. 283 °C 92 %.
7.4. 2-Аминотиопираны
В общем случае б-меркаптонитрилы при циклизации дают 2-аминотиопираны [459, 930—932]. Например, 3- (2-циановинил) -2 (1Н)пиридинтионы циклизуются в сухом диоксане в хлоргидраты 2-имино-2Н-тиопирано [2,3-Ь] пиридина (7.31) [930], которые, вероятно, представляют собой соли 2-аминотио-пирилия (7.32), легко гидролизующегося до 2Н-тиопирано [2,3-Ь] пиридин-2-онов:
НС1
(7.32)
2
О
Соединения с защищенной меркаптогруппой, как, например, 2-алкил-тио-3-(2-циановинил) индолизины, циклизуются в 2-иминотиопирано[3,2-а]-иидолизины [931]:
18Х
139
на
Взаимодействие малононитрила с сероуглеродом под действием водных растворов щелочей приводит к смеси продуктов (7.33—7.35), среди которых главный 4,6-диамино-3,5-дициано-2Н-тиопиран-2-тион (7.33):
сУп"“. НС SHH,
(гзч)
НН,
сн
ннг
(7.3S)
Димеризация З-арил-2-цнанотиоакриламидов, протекающая по типу [2S + 4; ]-циклоприсоединения в присутствии органических оснований или самопроизвольно (в случае R = Ph, 4-FC6Н4,4-С1С6Н4,4-BrC6 Н4,4-О2 NC6 Н4), приводит к замещенным 3,4-дигидро-2Н-тиопиранам [933]:
сн
С5ННг
Основным методом получения солей 2-амииотиопирилия (7.39)' является циклизация 4-циано-1,?-бутадиен-1 -тиолов типа /3-меркаптовинилакридо-нитрилов (7.37), которые образуются при взаимодействии 1-хлор-4-циано-1,3-бутадиенов (7.36) с тиосульфатом натрия, дитиокарбаматами, гиоами-дами и сероуглеродом. Промежуточные имины (7.38) в присутствии хлорной кислоты превращаются в перхлораты 2-аминотиопирилия (7.39) [463, 474, 889, 934—936]. Для их синтеза применяются 0-хлорвинилметиламмо-ииевыесоли (7.40):
НСС~ СНСН=£Яг -----— ]М ягс = снсн=н{сн,№о*
; яг^ян . ъ 1
(7.37) (73в) (7.ЯО)
а
НСС= СМИ = СЯг lol Cl^
Z а 'Ь^'-'З'ННг
(7.36) (739)
140
Сероуглерод присоединяется к алкилиденпроизводным метиленактив-ных нитрилов (малононитрила, циануксусного эфира), давая производные 6-амино-2Н-тиопиран-2-тионов {937,938].
6-Амнно-3,4-тетраметилен-5-циано-2Н-тиопирантион-2 [937]. К раствору 9,8 г (0,1 моля) циклогексанона, 6,6 г (0,1 моля) малононитрила и 30 мл сероуглерода в 30 йл метанола при перемешивании медленно прибавляют 6 мл трнэтиламина. Из раствора выкристаллизовывают оранжевые кристаллы. Выход продукта с т.пл. 270-272 °C (из пропанола) составляет 13,5 г (61 %).
К этому типу превращений можно отнести взаимодействие енаминов анилидов 2-кетоциклоалкантиркарбоновых кислот (7.41) с малононитрилом, приводящее к 2-аминотиопиранам (7.42). При повышении температуры следует считаться с перегруппировкой их в 2-аминопиридины (7.43) [939]:
Ацилирование метилеиактивных нитрилов хлорангидридами о-(8-ацил-тио) бензойной кислоты [940], сложными эфирами о-меркаптобензойной кислоты [941, 942] или о-(бензилтио) бензойной кислоты [943] является перспективным методом синтеза 2-амино-4-оксо-4Н-1-бензотиопиранов [941] .*
Реакция замещенных солей 3-метилтио-1,2-дитиолия с алкилиденпроиэ-водными малононитрила или циануксусиого эфира приводит к 2-имино-З-циано- или (3-этоксикарбонил) -2Н-тиопиранам [944]. 2-Оксо-3-циано-2Н-3,4,5,6-тетрагидротиопираны легко рециклизуются под действием алкого-лятов щелочных металлов в 2-амино-3-алкоксикарбонил-4Н-5,6-дигидротиопираны [945]:
141
ЫаОя/яОН
7.5. 2-Аминотиазины
При взаимодействии вицинальных енаминонитрилов с сероуглеродом в пиридине образуются имино-1,3-тиазины, рециклизующиеся в соответствующие пиримидинтионы. Например, в случае 2-амино-З-цианопиразола реакция протекает следующим образом [946]:
сн
н
Аналогично взаимодействуют вицинальные алкоксиметиленаминонитрилы с сероводородом [947].
Нагревание З-меркапто-2-нафтойной кислоты (7.44) с цианамидом в ди-метилформамиде приводит к 2-имино-4-оксонафто-[2,3-е]-1,3-тиазину (7.45) с выходом 72 % [948]. Кроме того, 2-имино-2,3-дигидро-4Н-1,3-бензотиа-зин-4-он (7.46) раскрывает тиазиновое кольцо при алкилировании в присутствии оснований, давая о-алкилмеркаптобензоилцианамиды (7.47) [949]:
о
(г*у) (7^s) К-х’-~сн=снсн=сн-
я-я’^н
Na ОН
Такие реакции осуществлены в ряду конденсированных
1,3-тиазинов
[950].
2-(2-Меркаптофенил) -4,5 -дигидроимидазол реагирует с бромцианом по схеме [951];
BrCN.
142
Изучено [952] взаимодействие 2-хлорникотинонитрила с замещенными тио мочевинами. В случае циклических мочевин — 2-меркапто-1,4,5,6-тетра-гидропиримидина — получен 5-имино-9,10-дигидро:5Н,8Н-пиридо [2,3-d] пи-римидо [2,1-Ь] [1,3] тиазин (7.48): сн
NH '
(™>)
2-Имино-9,10-дигидро-5Н,8Н-пнридо[2,3-<1]пиримидо[2,1-Ь][1,3]тиазнн [952]. К раствору 3,4 г 3,4,5,6-тстрагидро-2-пиримидинтиола в 50 мл диметилацетамида прибавляют порциями 1,4 г гидрида натрия. Смесь перемешивают при комнатной температуре 15 мин, затем прибавляют по частям 4 г 2-хлор-З-цианопиридина. Перемешивание продолжают 1 ч при комнатной температуре н 1 ч при 100 °C. Растворитель удаляют под уменьшенным давлением, остаток разбавляют водой. Осадок отфильтровывают, промывают последовательно водой, спиртом и хлористым метиленом. Получают 2,6 г (41 %) продукта. После перекристаллизации из метанола его т.пл. 196-199 °C.
Реакция дицианамида натрия с N, N*-замещенными тиомочевинами в присутствии хлористого водорода приводит к хлоргидратам 5-R1 -6- (N-R-ими-но)-2-амино-4-имино-5,6-дигидро-4Н-1,3,5-тиадиазинов [953]:
, на
+ NaN(CH)3 -----------RNHC-S-CHHCN-----------»-
ЯМНСПНК>
N/f HR
Взаимодействие изотиазолиевых солей с цианидом калия протекает с расширением изотиазолиевого ядра [955] и может быть использовано для получения 2-иминотиазинов (7.49):
мен
{7.49)
Однако соединения (7.49) устойчивы лишь на холоду.
• 7.6. Амииодитианы
2-Имино-5-диметиламино-1,3-дитиан (7.50), предложенный в качестве инсектицида, получен при взаимодействии 2-диметиламино-1,3-диацилтиопро-пана с хлорцианом [956]:
143
fcSCHtCHtVhSJC р(сн£
CICN
(г so)
Реакция еем-дитиолов с малононитрилом применяется в синтезе замещенных 4-амино-5-циано-1,3-ДИТиа-4-цнклогексенов [957—959]. гем-Дитио-лы аналогично взаимодействуют с арилиденмалононитрилами:
/М Аг ОН =/ +
\n
4-Амиио-2,2/>,6-тетраметил-5-циано-|,3-дитиа^1-циклогексен |957|. 3,3 г (0,05 моля) малононитрила и 10,8 г (0,1 моля) пропан-2,2-дитиола растворяют в 50 мл метанола и медленно прибавляют несколько капель 5%-ного метанольного раствора КОН. После выдержки в течение 5 ч при 20 °C первоначально светло-красный, затем желтый раствор растирают до затвердения с водой. Осадок перекристаллизовывают из водного метанола. Выделяют 7,0 г (66 %) продукта с т.пл. 89-90 °C.
1,1-Дицианозтилен-2,2-дитиолаты димеризуются с образованием производных 2-амино-1,3-дитиа-4-циклогексенов [894]. Димеризация 1,2-дициано-этилен-1,2-дитиолатов, приводящая к изотиазоло [2,3-с]-1,4-дитианам [960], протекает, по-видимому, через промежуточный 2-имино-1,4-дитиол:
Амины серосодержащих гетероциклических соединений можно использовать в различных областях тонкого органического синтеза.
СПИСОК ЛИТЕРАТУРЫ
1. Taylor Е.С., McKillop A. The chemistry of cyclic enaminonitriles and o-aminonitri-les. - New York etc. : Intersci. publ., 1970. - 415 p.
2. Schaefer J.P., Bloomfield J.J. Dieckmann condensation. - Org. react., 1967, 15, p. 28—30.
3. Ziegler K. Uber Ringschlu^-Reaktion. - Berichte, 1934, 67, T. A, S. 139-149.
4. Ziegler K. Methoden zur Herstellung und Umwandlung gro^en Ringsysteme. — In: Methoden der Organischen Chemie. Houben-Weyl. Stuttgart: Thieme, 1955, Bd 4, T. 2, S. 729-822.
5. Синтез амино (гетеро) циклических соединений по реакции Торпа / Ю.А.Шаранин, В.К.Промоненков, Л.Г.Шаранина, К.С.Вайнерт. - М., 1976. - 27 с. - (Обзор, информ. / НИИТЭХИМ. Сер. Хим. средства защиты растений).
6. The chemistry of the cyano group / Ed. Z.Rappoport. - New York etc. : Intersci. publ., 1970. - 1044 p.
7. Зильберман Я.Я.Реакции нитрилов. - M. : Химия, 1972. - 448 с.
8. Freeman F. The chemistry of malononitrile. - Chem. Revs, 1969,69,N5,p.591-624.
9. Fatiadi A.J. New applications of malononitrile in organic chemistry. Pt 1. — Synthesis, 1978, N 3, p. 165-204.
10. Fatiadi A.J. New applications of malononitrile in organic chemistry. Pt 2. - Ibid., N 4, p. 241-282.
11. Freeman F. Properties and reactions of ylidenmalononitriles. - Chem. Revs, 1980, 80, N4, p. 329-350.
12. Jones G. The Knoevenagcl condensation. - Org. React., 1967, 15, p. 204-604.
13. Campaigne E„ Schneller S.W. Cyclization of ylidenmalononitriles. — Synthesis, 1976, N 11, p. 705-716.
14. 1,3-Migration of a cyano-group in substituted 3-cyanopropyl radicals / A.Bury, P.Bo-ugeard, S.I.Corker et al. - J. Chem. Soc. Perkin Trans. Pt II, 1982, N 11, p. 1367-1372.
15. Томилов А.П., Смирнов С.К.Адиподинитрил и гемсаметилендиамин. - М. : Химия, 1974. - 280 с.
16 Шаранин Ю.А., Промоненков В.К. Синтез аминотиофенов. - М., 1981. - 24 с. -(Обзор информ. / НИИТЭХИМ. Сер. Хим. средства защиты растений) .
17. ' Огибин Ю.Н., Троянский Э.И, Никитин Г.И. Циклизация цианалкильных радикалов. - Изв. АН СССР. Сер. хим., 1977,№ 4, с. 843-846.
18. Saito /., Shimozono К., Matsuura Т. Photoinduced reactions. 115. A novel photoaddition of 6-cyanogracils to alkenes and alkynes involving migration of a cyano group. - J. Amer. Chem. Soc., 1980, 102, N 11, p. 3948-3950.
19. Saito I., Shimozono K„ Matsuura T. Trapping of intermediates with molecular oxygen in cyanoenone-olefin photocycloaddition. — Tetrahedron Lett., 1983, 24, N 21, p. 2195—2198.
20. Saito I., Shimozono K.. Matsuura T. Photochemical p+2] cycloaddition of p-eyanoe-nones to alkenes. — Heterocycles, 1983,.20, N 1, p. 172.
21. Gajewski R.P. Substituted spiro[4,5]deca-3,6,9-triene-2,8-diones from electrophilic reactions of nitrilium ions. - Tetrahedron Lett., 1976, N 46, p. 4125-4128.
22. Brown Ch.A. Rapid, high yield condensations of esters and nitriles via kaliation. -Synthesis, 1975, N 5, p. 326-327.
23. Synthesis of the stemodane carbon skeleton: nonstereoselectivc photoaddition of allene to a cyclopentone and a novel rearrangement reaction / E.Piers, B.F.Abeysekcra, D.J.Herbert, I.D.Suckling. - J. Chem. Soc. Chem. Communs, 1982, N 7, p. 404-406.
24. Klages С.-P., Voss J. a,a,a',a' -Tetramethylcyeloalkanimincs and -cycloalkanethi-ones by cyclization. — J. Chem. Res. Synop., 1977, N 6, p. 146.
25. Beck F. Kathodische Dimerisierung. - Angew. Chem. Inter. Ed., 1972, 11, N 9, S. 760-781.
19
145
26. Avaca L.A., Uteley J.H.P. Electro-organic reactions. Pt 4. Preparative aspects of the cathodic hydrogenation of activated carbon-carbon double bonds. - J. Chcm. Soc. Perkin Trans. Pt I, 1975, N 10, p. 971-974.
27. Lerflaten O., Parker V.D. Mechanisms of the electrohydrodimerization of activated olefins. 6. Cyclohydrodimerization of p-methylbenzylidene'malononitrile anion radical. - Acta chem. scand., 1982, 36, N 4, p. 225-234.
28. Kompis I., Schonholzer P. Stcreoselektive reduktive Dimerisierung von a-Cyan-0-(4-pyridyl)acryls'aurederivatcn. - Helv. chim. acta, 1977, 60, N 2, S. 618-628.
29. Ando К. Tokoroyama T„ Kubota T. Cyclization reactions of i,2-bis(2-cyanophenyl)-propionitriles. 1. Structure of the ’’red pigment” formed by the Basecatalyzed cyclization of l,2-bis(2-cyano-3-methoxyphenyl)propionitrile in the presence of diethyl carbonate. - Bull. Chem. Soc. Jap., 1974, 47, N 4 p. 1008-1013.
30 Helmers R., Kaiser W. Uber eine Alkylierende Retro-Thorpe-Reaction. - Tetrahedron Lett., 1971,N42,S. 3853-3855.
31. Slates H.L., Zelawski Z.S., Wendler N.L. A stereoselective total synthesis of nat(-)-prostaglandin E, and its optical antipode. - Tetrahedron, 1974, 30, N 7, p. 819-830.
32. Helmers R. 2-Amino-indene und deren Heterologe. 5. Thorpc-Cyclisierungen von o-Arylen-diacetonitrilen. - J. Lied. Ann. Chem., 1973, N 2, S. 181-189.
33. Stitz G„ Monnighoff H. Thorpe-Ziegler-Cydisierung zur Synthese von substituierten Cyclopetita(c)thiophene. - Tetrahedron Lett., 1971, N 51, S. 4889-4890.
34. Helmers R. 2-Aminoindene und deren Heterologe. 2. Sterische Hinderung der Enol-form bei heterologen Alkoxycarbonylindanon-2) derivaten. - J. prakt. Chem., 1972, 314, N2,S. 334-352.
35. Synthesis and antiviral activities of adamantane spiro compounds. 2 / R. Van Hes, A.Smit, T.Kralt, A.Peters. - J. Med. Chem., 1972, 15, N 2, p. 132-136.
36. Пат. 3853943 (США). Cyclopentadienes in which at least four of the ring carbons carry cyano substituents and methods for their preparation / O.W.Webster. - Опубл. 10.12.74.
37. Gardner H.C., Kochi J.K. Alkylation of tctracyanoethylene. Reaction with Grignard reagents. - J. Amer. Chem. Soc.,J976, 98, N 2, p. 558-566.
38. Trialkylsilyl perfluoroalkanesulfonates. Highly reactive silylating agents and lewis acids in organic synthesis / H.Emde, D.Domsch, H. Feger et al. — Synthesis, 1982, N 1, p. 1-26.
39. Реакции N-алкилазнниевых катионов. 2. Взаимодействие хиноксалиниевых солей с малоиодинитрилом и циануксусным эфиром / В.Н.Чарушин, О.Н.Чупахнн.Г.М.Пет-рова и др. - Химия гетероцикл, соединений, 1981, № 2, с. 255-260.
40. Пат. 54-92942 (Япония). Получение З-амнноциклогексил-2-она / Й.Кисо, К.Са-эки. - Опубл. 07.11.79. - РЖ Химия, 1980, 9Н120П.
41. Products from cyanoethylation of 2-octanone / LCason, C.W.Koch, R.P.Fisher et al. - J. Org. Chem., 1972,37, N 16, p. 2573-2579.
42. Пат. 566315 (р!вейцария). Verfahrcn zur Herstellung von 7-Aminodccahydrochi-nolinen und ihre anwendung / W.Pfleiderer, H.Zondler. — Опубл. 15.09.75.
43. Фаворская T.A., Барон Н.Ю., Якимович С.И. Поведение 6-кетонитрилов в условиях основного катализа. - Журн. орган, химии, 1969,5,№7,с. 1187-1190.
44. Пат. 2010124 (ФРГ). Vcrfahren zur Herstellung von 2,6-Dimethyl-3-amino-6-</3-cyanoathyl)cyclohexen-(2>on / M.Cherubim, D.Abo. - Опубл. 15.02.73.
45. Пат. 565143 (Швейцария) Verfahrcn zur Herstellung von 5-amino-2-(/3-cyanoathyl)-5-cyclohcxcn-l-on / H.Zondler. - Опубл. 15-08.75.
46. Пат. 3905940 (США). Process for the manufacture of5-amino-2-(/3-cyanocthyl> cyclohcxcn-5-one-l / H.Zondler. - Опубл. 16.09.75.
47. Hoberg H., Kieffer R. Durch Aluminiumchlorid Katalysierte Cyclisierung. - J. Lieb. Ann. Chem., 760, N 1, S. 151-156.
48. Sepiol J., Mirek J., Soulen R.L. Cyclization of ylidencmalonadinitrilcs and ylidenccy-anoacetatcs obtained from mesityl oxide and pulegone. — Pol. J. Chem., 1978, 52, N 7/8, p. 1389-1394.
49. Bergman J., Carlsson R. A novel synthesis of 2-amino- and 2-hydroxycarbazoles. -Tetrahedron Lett , 1978, N 42, p. 4051-4054.
146
50. Peseke К. Reaktionen von 2-Aryl-4,4-bis(methylthio)buta-l,3-dien-l,l-dicarbonitri-len mit Malononitrile und Cyanessigsaureethylester. - J. prakt. Chem., 1981, 323, N 3, S. 499-505.
51. Пат. 142541 (ГДР). Verfahrcn zur Herstellung von Benzcn-l,3-dicarbonitrilen / K.Peseke, I.Bohn. - Опубл. 02.07.80. - РЖ Химия, 1981, 10Н141П.
52. Peseke К., Suarez J.Q. Push-pull Butadiene, Darstellung von substituierten. Nitrobenzo- und toluonitrilen. Z. Chem., 1981, N 11, S. 405 -406.
53. Tucker 11., Golding G„ Purvis S.R. The cyclodimerisation of 3-methyl-2-butenenit-rile. - Tetrahedron Lett., 1981, 22, N 14, p. 1373-1376.
54. A novel cyclodimerization of 3-methyl-3-butenenitrile. An efficient synthesis of 4-cyanoisophorone / K.Takabe, S.Ohkawa, T.Sato et al. - Ibid., 1980, 21, N 40, p. 3883—3884.
55. Takabe K., Ohkawa S., Katagiri T. A convenient synthesis of 3-amino-4-cyano-l,5-trimethylcyclohexa-l,3-diene and its derivatives. - Synthesis, 1981, N 5, p. 358—359.
56. Angew.. Chem. Inter. Ed., 1974, 13, N 4, p. 287.
57. Nanjo K„ Suzuki K„ Sekiya M. Formic acid reduction. 26. a, ft- Reduction of conjugated nitriles with formic acid. - Chem. Pharm. Bull., 1977, 25, N 9, p. 2396—2400.
58. Baldwin J.J., Raab A.W., Ponticello G.S. Utilization of a, /З-unsaturated aldehyde equivalents in the synthesis of substituted 2-halonicotinic acid derivatives. - J. Org. Chem., 1978, 43, N 12, p. 2529-2535.
59. Mirek J., Adamczyk M., Mokrosz M. Synthesis with unsaturated nitriles. 1. Selective hydrolysis of l-amino-2,6,6-tricyano-l,3-cyclohexadienes to 2,6,6-tricyano-2-cyclohexeno-nes. - Synthesis, 1980, N 4, p. 296-299.
60. Adamczyk M., Mokrosz M. Synthesis with unsaturated nitriles. Pt 3. Exo/endo ami-ne-dicnc(iminc-cnc tautomeric structures of some ylidencmalononitrile dimers. - Chem. scr., 1981, 18, N 5, p. 237-239.
61. Quincoses I., Peseke K. Sintesis de dcrivados furanicos con propiedades CH-cidas comportamiento de derivados del l-[Furilo(2)|alquilidcno del acido malonico en presencia de bases. - Centro. Rev. cient. Univ. cent. Las. Villas., 1978, 6, 1/2, p. 95-102. - РЖ Химия, 1982,13Ж167.
62. Nitrile ~ ketenimine tautomerism in substituted alkylidene malononitrilcs and alkylidene cyanoacetates / T.R.Kasturi, V.K.Sharma, A.Srinivasan, G.Subrahmanyam. - Tetrahedron, 1973, 29, N 24, p. 4103-4109.
63. Ригерте Б.А., Гудриниеце Э.Ю. Конденсация дикарбонильных соединений с малононитрилом. 9. Взаимодействие ацетоуксусного эфира с малононитрилом. — Изв. АН ЛатвССР. Сер. хим., 1977, № 5, с. 601-603.
64. Cornells A., Ration A., Laszlo Р. Base-catalyzed dimerisation of ethyl-2-(dicyanomethy-lenejpropanoate. - Bull. Soc. chirn. belg., 1976, 85, N 3, p. 141-145.
65. Hayashi Sh„ Anii T, Tamano T. Cyclic dimerisation of ethyl 1-arylethylidcnecyanoace fates with Grignard reagents. - Bull. Chem. Soc. Jap., 1975, 48, N 11, p. 3317-3318.
66. Gewald K., Schill W. Zur Addition von Alkylidenmalonitrilen an aktivierte C-C-Dop-pelbindungen. - J. prakt. Chem., 1971, 313, N 4, S. 678-685.
67. Реакции циклизации нитрилов. 3. Синтез о-цианоанилинов по реакции Торпа / 0.А.Шаранин, Ю.АЖаскаков, Ю.Т.Абраменко и др. - Журн. орган, химии, 1980, 16, Р 10, с. 2192 -2204.
68. Andersen O.R., Pedersen ЕВ. A spontaneous ring closure reaction as a new route о isoquinoline derivatives. - Heterocycles, 1982, 19, N 8, p. 1467-1471.
69. Addition von Enaminen an elektrisch neutrale organische Lewissaurc / S.Penades. l.Kiseh, K.Tortschanoff et al. - Monatsh. Chem., 1973, 104, N 2, S. 447-456.
70. Взаимодействие 2-бензоилциклогексанона и соответствующего ему енамина с малононитрилом / Ю.А.Шаранин, П.А.Родиновская, В.К.Промоненков, А.М.Шестопа-лов. - Журн. орган, химии, 1983, 19, № 8, с. 1781-1782.
71. Studies on seven-membered ring compounds. 37. The reaction of benzotropones with malononitrile / Y.Sugimura, K.llno, H.Kuwano et al. - Chem. Pharm. Bull.. 1972, 20, N'12,p. 2515-2521.
72. Wolfbeis О.-S., Zacharias G„ June к H. Synthesen mit Nitrilen. Mitt. 40. Reaktionen von 2-Indanon mit Malodinitril bzw. Cyanessigester und TetracyanSthylen. - Monatsh. Chem., 1975, 106, N 5, S. 1207-1212.
73. Производные индола. 61. Введение 3-нндолильиого радикала в СН-кислоты / В.С.Вележева, В.П.Сееодин, Ю.В.Ерофеев и др. - Химия гетероцикл, соединений, 1977, № 3, с. 360-368.
74. Hickmott P.W. Enamines: Recent advances in synthetic, spectroscopic, mechanistic and stereochemical aspects. 2. -Tetrahedron, 1982, 38, N 23, p. 3363-3446.
75. Hubtchwerien G, Fleury J.-P., Fritz H. Reaction d’enamines derivces de la cyclohexanone avec le tetracyanoethylene. - Helv. chim. acta, 1977, 60, N 8, p. 2576-2583.
76. Berkowitz W.F., Grenetz S.C. Cycloaddition of an enamine to an activated cyclopropane. - J. Org. Chem., 1976,41, N 1, p. 10-13.
77. A.c. 521260 (СССР). Способ получения 2,6-дициано-ЗД-диметиланилина / Э.Ю.Гудриниеце, Б.А.Ригорте. - Опубл, в Б.И., 1976, № 26.
78. Ducker J.W., Gunter M.J. The reaction of malononitrile with some 0-dicarbonyl compounds. - Austral. J. Chem., 1975, 28. N 3, p. 581-590.
79. Unusual К л oe venagel condensations of 16a-substituted-16-methylcne-17-ketostero-ids / B.Green, I.S.Khaidem, R.I.Crane.S.S.Newaz. - Tetrahedron, 1976,32, N 24, p. 2997-3001
80. Шаранин Ю.А., Лопатинская Х.Я. Новый простой метод получения замещенных циаиинилинов. - Жури, орган, химии, 1976, 12, № 3, с. 691.
81. Hartke К., Matusch R. Aminopcntalencarbonitrile, eine Gruppe stabilen Pentalenc. -Angew. Chem., 1972, 84, N 2, S. 61—62.
82. Hartke K„ Matus ch R. Aminopentalcncarbonitrile und Aminopyrtdincarbonitrilc..-Chem. Ber., 1972, 105, N 8, S. 2584-2593.
83. Peters J.A. Synthesis of bicyclo[3,3,ljnonanes. - Synthesis, 1979, N 5, p. 321-336.
84. Le Guillanton G. Utilisation de la cyclopentylidene-2-cyclopentanone a la preparation de derives decahydro-as-indacenigues et hexahydro-as-indacenigues. 6. Condansatiqn de la cyclopentylidene-2 cyclopentanone avec le malononitrile et la cyanacetatc d’ethyle. -C.r. Acad. sci. C, 1972,274, N 9. p. 895 - 897.
85. Schmidt H.-W,, Junek H. Neu* einfachc Syhthese von 4-Aminosalicyls’aurc- und Isophthafallurederivaten. - J. Lieb. Ann. Chem., 1979, N 12, S. 2005-2010.
86. Polyketo-enoles and chelates. Synthesis of 2-pyrones, 2-pyridones, 2-methoxypyri-dines and m-hydroxyanilines by control of the cyclisation of nitril-substituted glutaconic types / S R.Beker, L.Crombie, R.V.Dove, D.A.Slack. — J. Chem. Soc. Perkin Trans. Pt 1, 1979, N 3, p. 677—685.
87. Rato T., Kimura H„ Tanji K. Reaction of ethyl 4-halo-3-oxobutanoate with diethyl malonate, methyl cyanoacetate and malononitrile. - Chem. Pharm. Bull., 1978, 26, N 12, p. 3880-3883.
88. Horino H., Toda T. Reactions of 5N-(l,2,3-triazol-l-yl)tropolones. - Bull. Chem. Soc. Jap., 1972, 45, N 2, p. 584-587.
89. The Reaction of 2-arylsulfonyloxutropones and active methylene compounds. The formation of 8-hydroxy-2H-cyclohcpta|bJfuran-2-one and 2-amino-8H-cyclohepta[b]furan-8-one derivatives / T.Nozoe. K.Takase, M.Kato, T.Nogi. - Tetrahedron, 1971, 27, N 24, p. 6023-6035.
90. Мочалин В.Б., Поршнев Ю.Н. Успехи химии азулена. - Успехи химии, 1977, 46, №6, с. 1002-1040.
91. Synthesis of naphthalenes from ortho-substituted benzyl sulfones and Michael acceptors / J.Wildenman, P.C.Borgen, H.Pluim et al. - Tetrahedron Lett., 1978, N 25, p. 2213-2216.
92. Terpstra J.W. Annulation reactions of heteroaromatic compounds. A new synthetic route to benzofbjthiophene, bcnzo[c]thiophcne and quinoline derivatives. - Bariet : Ruincn, 1982,- 125 p.
93. Krimen L.J., Cota D.J. The Ritter reaction. - Org. React.. 1969. 17, p. 213-325.
148
94. Sepiol J., Kawalek B., Mirek J. A new synthesis of benzo-and naphto-fused cycloal-koncs. - Synthesis, 1977, N 10, p. 701-704.
95. Sepiol J. Elimination of the nitrile groups from o-aminonitriles. Pt 2. Synthesis of 3-alkyl-l-naphthylamines from alkyl benzyl ketones. - Pol. J. Chem., 1979, 53, N 3, p. 695-700.
96. Sepiol J. New route to dimethylnaphtalenes involving cyclization of ylidenemalono-dinitriles and ethyl ylidenecyanoacetates, Pt 1. Synthesis of 1,2-1,6- and 2,7-Dimethylnaphta-lenes. - Synthesis, 1983, N 6,p. 504-507.
97. Sepiol J. New route to dimethylnaphtalenes involving cyclization of ylidenemalonodi-nitriles and ethyl ylidenecyanoacetates. Pt 2. Synthesis of 1,7- 2,6- and 2,7-Dimethylnaphta-ienes. - Ibid.,.N 7, p. 559-563.
98. Пат. 4067889 (США). Disperse dyestuffs / S.Dengler, P.Loew, C.Zickendraht, H.Schwander. - Опубл. 10.01.78.
99. Пат. 104286 (ГДР). Vcrfahren zur Synthese von trans-l,2,3,4,4a,9a-hexahydro-6-methoxy-9a-methylfluoren-9-on und von trans-l,2,3,4,4a,9,10,10a-octahydro-6-methoxy-9-oxo-lO0-methyl-lOa,lOaa-cpoxyphenantren / P.Palitzsch. - Опубл. 05.03.74.
100. Floyd A.J., Dyke S.F., Ward S.E. The synthesis of phenanthrenes. - Chem. Revs, 1976,76,N5.p.509-562.
101. Пат. 605783 (Швейцария). Verfahren zur Herstellung neuer Tetrahydrobenz[g] isochinoline / J.-M.Bastian. - Опубл. 13.10.78.
102. Van Allan J.A., Reynolds G.A. Preparation of pyrylium salts from 2-phenyl-5H-phenaleno[l,9-bc]pyran-5-one. - J. Heterocycl. Chem., 1972, 9, N 3. p. 669-673.
103. Norden W„ Sander V., Weyerstahl P. Synthese und Additionsreaktionen von 2- . Phcnyl-l-cyclopropen-l-carbonsaureestern. - Chem. Ber., 1983, 116, N 9, S. 3097—3111.
104. Nozoe T., Takase K„ Fukuda S. The synthesis of 1-phenylazulene and 2-phenyla-zulene from the troponoid compound. - Bull. Chem. Soc. Jap., 1971,44, N 8, p. 2210-2214.
105. The formation of azulene derivatives from 2H-cyclohepta[b]furan-2-one derivatives I T.Nozoe, K.Takase, T.Nakazawa, S.Fukuda. - Tetrahedron, 1971, 27, N 15, p. 3357-3368.
106. Takase K., Nakazawa T, Nozoe T. The formation of azuleno(2,l-d}pyrimidine derivatives by the reaction of 2-acethylimino-2H-cycloheptalb)furan derivatives with active methylene compounds. - Heterocycles, 1981, 15, N 2, spec, issue, p. 839-842. - РЖ Химия, 1982, 2Ж246.
107. Ghosh P.B., Ternal B. The reaction of 4- and 5-acetyloxazoles with malononitri-1c. - J. Org. Chem., 1972, 37, N 7, p. 1047-1049.
108. Van Allan J.A., Reynolds G.A. Reaction of 2,6-dibutylaminohepta-2,5-dicn-4-onc with malononitrile. - J.Hcterocycl. Chem.. 1971,8, N 5, p. 923-929.
109. Пат. 158396 (ГДР). Verfahren zur Herstellung von Substituierten 3-aminr thiophe-nolcn / K.Gewald, H.Schafer. - Опубл. 12.01.83.
110. Gewald K., Schafer H. 3-Amino-2,4-dicyan-thiophenole aus 2-Amino-3-cyanthiopy-ran-6-yliden-cyanessigsaurcdcrivatcn. - Z. Chem., 1981, 21, N 5, S. 183-184.
111. Dimroth K. Ncucrc Mcthodcn der praparativen organischen Chemie. 3. Aroma-tische Vcrbindungen aus Pyryliumsalz.cn. - Angew. Chem., 1960, 72, N 10, S. 331-342.
112. Dimroth K„ Wolf K.H. - In: Newer Methods of Preparative Organic Chemistry. New York : Acad, press. 1964, vol. 3, p. 357.
113. Van Allan J.A., Reynolds G.A., Petropoulos C.C Reactions of 4-mcthoxypyrylium salts with secondary amines. - J. Heterocycl. Chem., 1972, 9, N 4, p. 783—787.
114. Van Allan J.A., Reynolds G.A. The preparation and some reactions of a 2,1-bcnz-isoxazol-3-ylpyrylium salt. - Ibid., 1974, 11, N 3, p. 395—396.
115. Van Allan J.A., Reynolds G.A. Some reactions of 5H-indeno[2,l-b]pyrylium, thio-pyrylium and pyridinium derivatives. - Ibid.. 1977, 14, N 1, p. 119-122.
116. Troncher J.M.J., Martin O.R. Derives C-glycosyliques. 30. Utilisation cn chimie des sucres du synthon bromo-2-cyano-2-cthcnylc. — Helv chim. acta, 1976. 59, N 3, p. 945 — 948.
149
117. Яновская Л.А., Степанова Р.Н., Кучеров В.Ф. Реакция ацетонциангидрина с гряис-4,4-диметоксибутен-2-алем. - Изв. АН СССР. Отд-нне хим. наук, 1965, № 8,с. 1509.
118. Vaidya V.P., Mahajan S.B., Agasimundin Y.S. Synthetic studies in benzofurans. Pt 11. Synthesis of some benzofurop,2-b]pyridine derivatives. - Indian J. Chem. B, 1981, 20, N5,p. 391-393.
119. Sangapure S.S., Agasimundin Y.S. Synthetic studies in benzofurans. Pt 1. Synthesis of some benzofuro[3,2-d]pyrimidine derivatives. Ibid., 1976, 14, N 9, p. 688-691.
120. Пат. 3706747 (США). Benzothieno[3,2-d]- and bcnzofuro[3,2-d]pyrimidines / G.G. de Angelis, H.-I.Hess. - Опубл. 19.12.72.
121. Пат. 3755583 (США). Benzothieno(3,2-d]- and benzofuro[3,2-d]pyrimidines inhibitors of platelet aggregation / G.G. de Angelis, H.-I.Hess. - Опубл. 28.08.73.
122. Пат. 99369 (ГДР). Verfahren zur Herstellung von 3-Aminobenzo(b]furanen / K.Gewald, H.-J.Jahsch. - Опубл. 5.08.73.
123. Gewald K., Jansch H.-J. 3-Amino-benzo[bJfurane. - J. prakt. Chem., 1973, 315, N 4, S. 779-785.
124. Recherches sur les derives nitres dinteret biologique. 17. Cas des amino-3-nitro-benzofurannes / L.Rene, S.Risse, P.Demerseman et al. — Eur. J. Med. Chem., 1979, 14, N 3, p. 281-282.
125. Конденсация нитрила салициловой кислоты с некоторыми а-галогенкарбониль-ными соединениями / Ф.А.Трофимов, Г.Ф.Леляк, Л.И.Шевченко, А.Н.Гринев. - Химия гетероцикл, соединений, 1974, №9, с. 1171-1173.
126. Исследование в области 2-ацил-З-амннобензофуранов. 2. Синтез гетероциклических систем на основе производных 2-ацил-З-аминобензофурана / Ф.А.Трофимов, Л.И.П1евченко, Г.Ф.Леляк, А.Н.Гринев. — Там же, 1975, № 10, с. 1319-1321.
127. Пат. 3927023 (США). Imidazobenzofuranes / R.E.Brown, I.Shavel. - Опубл. 16.12.75.
128. Beck J.R., Suhr R.G.' Synthesis of 3-aminobenzofuran dervatives involving nitro displacement. - J. Heterocycl. Chem., 1974,11, N 2, p. 227.
129. Pankiewicz J., Decroix B., Morel J. Proprietes de nitriles substitues ou non en ortho par un groupe hydroxyeen serie thiophenique et furannique. - C.r. Acad. sci. C, 1975, 281, Nl,p. 39-41.
130. Gewald K., Bellmann P. 3-Amino-thieno[2,3-b]furane und 3-Amino;thieno|3,2-bJ-furane. - J. prakt. Chem., 1983, 325, N 3, S. 457-462.
131. Пат. 107287 (ГДР). Verfahren zur Herstellung von substituierten 3-Amino-furo [2,3-b]pyridinen / K.Gewald, H.-J.JXnsch. - Опубл. 20.07.74.
132. Gewald K„ JSnsch H.-J. 3-Amino-furo[2,3-b]pyridine. - J. prakt. Chem., 1976, 318, N 2, S. 313-320.
133. 2,4-Diamino-6,7-dihydro-5H-pyrrolo[3,4-d]pyrimidines. Synthesis cyclic structures of pyrrolo(3,4-d]pyrimidines / P.L.Southwick, R.Madhav, V.Amarnath, T.Sheradsky. - Nucl. Acids Chem., 1978, N 1, p. 141-144.
134. Kato T., Sato M. Исследование кетона и его производных. 52. Реакция дикетена с а (Я-аминонитрилом. — J. Pharm. Soc Jap., 1972, 92, N 12, p. 1515-1520. - РЖ Химия, 1973, 17Ж226.
135. Tarzia G„ Panzone G.A. Synthesis of 0-amincpyrroles. - Ann. chim. (Ital.), 1974, 64, N 11/12, p. 807-824.
136. Пат. 1427942 (Великобритания). New aminopyrrole derivatives / G.Tarzia, G.Pan-zone. - Опубл. 10.03.76.
137. Пат. 1446153 (Великобритания). Pyrrolo[3,4-d]pyrimidines and methods for their preparation I G.Tarzia, G.Panzone. - Опубл. 18.08.76.
138. Пат. 1492663 (Великобритания). 4-Amino-3-pyrrole carboxamides / G.Tarzia, G.Panzone. - Опубл. 23.11.77.
139. Murata T„ Sugawara T„ Ukawa K. Intramolecular reactions of enaminonitriles. 1. A novel synthesis of new 0-aminopyrroles and related heterocycles. - Chem. Pharm. Bull., 1973, 21, N 11, p. 2571-2575.
150
140. Murata T„ Vkawa К. Intramolecular reactions of enaminonitriles. 2. Synthesis of new 3-aminopyrrole-2-carboxamides - a new route to pyrrolop,2-d)pyrimidines. - Ibid., 1994, 22, N 1, p. 240-241.
141. Murata T., Sugawara T., Ukawa K. Intramolecular reactions of enaminonitriles. A new synthesis of 0-aminopyrroles and related heterocycles. - Ibid., 1978, 26, N 10, p. 3080-3100.
142. Пат. 112756 (ГДР). Verfahren zur Herstellung von substituierten 3-Aminopyr-rolen / K.Gewald, U.Hain. - Опубл. 5.05.75.
143. Пат. 138976 (ГДР). Verfahren zur Herstellung von substituierten 3-Aminopyr-rolen / K.Gewald, H.Schafer. — Опубл. 05.12.79.
144. Synthesis of ”9-deazaguanosine” and other new pyrrolo[3,2-d]pyrimidine C-nucleo-sides / M.-I.Lim, W.-Y. Ren, B.A.Otter, R.S.Klein. - J. Org. Chem., 1983, 48, N 6, p. 780-788.
145. Pauls H., Krohnke F. Untersuchungen an 2-Chlorpyridinium - Salzen. 3. Umsetzun-gen mit CH-aciden Verbindungen und tibergang in Indolizinc. - Chem. Ber., 1977, 110, N 4, S. 1294-1303.
146. Garcia E.E., Benjamin L.E., Fryer R.I. Acyl indoles. 3. The synthesis of [l,4]diaze-pino(6,5-b]indoles. - J. Heterocycl. Chem. 1973, 10, N 1, p. 51-53.
147. Svnthesis of substituted thieno(2,3-b]pyrroles / R.A.Crochet, J.T.Boatright, C.D.Blanton et al. - Ibid., 1974, 11, N 2, p. 143-150.
148. Пат. 3867386 (CHIA). 5-Amino-2,6-substituted-7H-pyrrolo[2,3-d]pyrimidines and related compounds / D.H.Kim, A.A.Santilli. - Опубл. 18.02.75.
149. Пат. 3910913 (США). 4,5-Diamino-7H-pyrrolo[2,3-d]pyrimidine derivatives / D.H.Kim, A.A.Santilli. - Опубл. 07.10.75.
150. Kim D.H., Santilli A.A. 7-Deazapurines. II. Synthesis and reactions of 5-aminopyr-rolo[2,3-d]pyrimidine-6-carbonitrile and related compounds. - J. Heterocycl. Chem., 1971, 8, N 5, p. 715-719.
151. Wibberley D.G. Naphtiridines and polyazoheteroaromatic compounds. — In: Heterocyclic compounds / Ed. K.Schofield. Butterworths ; London : Univ. Parks press, 1973, vol. 4, p. 167-201.
152. Глушков Р.Г, Стежка T.B. Синтез н реакции производных пирроло] 2,3-е] азепина. - Химия гетероцикл, соединений, 1980, № 8, с. 1097-1100.
153. Goghari М.Н., Pakikh A.R. A new method for the synthesis of indoles: preparation and antimicrobial activity of 3-amino-2-apyl-5-phenylsulphonyl indoles. - J. Inst. Chem. 1979,51, N4,p. 143-145.
154. Harcourt D.N., Taylor N„ Waigh R.D. Cyclisation of benzylaminoacetonitriles. Pt 2. Evidence for two mechanisms of cyclisation. - J. Chem. Soc. Perkin Trans. Pt 1, 1978, N 7, p. 722-725.
155. Neidein R„ Jeromin G. Synthese neuer N-Vinylpyrrole. - Chem. Ber., 1982, 115, N 2, S. 714-721.
156. Meyers A.!., Sircar J.C. Additions to the cyano group to form heterocycles. - In: The chemistry of the cyano group / Ed. Z.Rappoport. London etc. : Intersci. publ., 1970, p 341-421.
157. Reaction of 3-ethoxycarbonyl-2-methylthiothiazolo(2,3-a]isoquinolinium sulfate with active methyl and methylene compounds / K.Mizuyama, Y.Matsuo, Y.Tominaga et al. -Chem. Pharm. Bull., 1976, 24, N6, p. 1299—1304.
158. Шаранин Ю.А., Промоненков B.K. Синтезы аминов ряда пиррола. - Черкассы, 1978. - 47 с. - Рукопись дел. в ОНИИТЭХИМ 24.10.73, № 2155/78Деп.
159. Гетероциклические соединения / Под ред. Р.Эльдерфильда. - М. : Изд-во иностр. лит., 1954. - Т. 2. 437 с.
160. Hartoung H.D. Thiophene and its derivatives. - New York :lntersci. publ., 1952. -533 p.
161. Hartough H.D., Meisel S.I.. Compounds with condensed thiophene rings. - New York. London : Intersci. publ.. 1954. - 515 p.
162. Пат. 146952 (ГДР). Verfahren zur Herstellungvon substituierten 3-Amino-4-cyan-
5-phenylthiophencn / K.Gewald. Y.Hain, E.Schindler. - Опубл. 11.03.81.
151
163. Huddleston P.R., Barker J.M. A convenient synthesis of 2-substituted 3-hydroxy-and 3-aminothiophenes from derivatives of 2-chloroacrylic acid. - Synth. Commun., 1979, 9, N 8, p. 731-734.
164. Schollberg K„ Schafer H., Gewald K. Vereinfachte Darstellung von a-Chlor- und 0-Chlor-a-cyanzimtsUurenitrilen. - J. prakt. Chem., 1983, 325, N 5, S. 876-879.
165. Deriwes C-glycosyliques. 26. Nouveiles voies d’acces a des C-nucleosides isoxazoli-ques et thiopheniques / J.M.J.Tronchet, O.Martin, J.-B.Zumwald et al. - Helv. chim. acta, 1975, 58, N 6, p. 1735-1738.
166. Пат. 3808335 (США). (2-Imidazolin-2-ylamino)substituted benzo(b)thiophenes for treating hypertension / H.-J.E.Hess, R.P.Nelson. - Опубл. 30.04.74.
167. Lombardino J.G., Wiseman E.H. Preparation and antiinflammatory activity of some 2-arylbenzo(b)thiophe-3(2H)-one 1,1-dioxide, - J. Med. Chem., 1970, 13, N 2, p. 206-210.
168. [I \BenZothienopyrimidines. 2. Study of the electrophilic substitutions of [IJBenzothi-eno[3,2-d]pyrimidine and[l]benzothieno[3,2-d]pyrimidin-4(3H)-one / H.El-Kashef, S.Raulf, M.C.de Sevricourt et al. - J. Heterocycl. Chem., 1980, 17, N 7, p. 1399-1404.
169. Захаров Л.Н., Квитко И.Я., Ельцов A.B. Гетероциклические аналоги 3-оксн-беизо[Ь] тиофена. Синтез, таутомерия и превращения 4-окси (амино) тиено[ 3,2-d) пиразолом- - Журн. орган, химии, 1973, 9, № 11, с. 2416-2421.
170. Schneller S.W., Clough F.W. Fused thieno(3,2-d]-v-triazine-4(3H>ones. - Heterocycles, 1975,3, N 2, p. 135-138.
171. Schneller S.W., Gough F.W. Synthesis of pyrido[3', 2’ :4,5]thieno[3,2-d]pyrimidine derivatives. - J. Heterocycl. Chem., 1974, 11, N 6, p. 975 -977.
112. Шведов В.И., Сычева Т.П., Сакович Т.В. Исследования в ряду тиенопиридинов и пиридотиенопиримидинов. 1. Синтез некоторых замещенных 3-аминотиено[ 2,3-Ь] пиридинов. - Химия гетероцикл, соединений, 1979, № 10, с. 1331-1335.
173. Synthese von N-Alkylpyridinium-salzen aus N-Alkylcyanacetamiden / A.L.Cossey, R.L.N.Harris, J.L.Huppafz, J.N.Phillips. - Angew. Chem., 1972, 84, N 24, S. 1184-1185.
174. Ames D.E., Byrne C.J.A. Cinnolines. Pt 17. Reactions of 4-chlorocinnoline-3-carbo-nitrile and preparation of 2,3-dihydro-3-imino-lH-pyrazolo[4,3-c]cinnolines. - J. Chem. Soc. Perkin Trans. Pt 1, 1976, N 6, p. 592-594.
175. Schneller S.W., Clough F.W. Studies of thieno[2,3-b]pirazines in preparation of py-razino[2’, 34,5]thieno(3,2-d]pyrimidines and related molecules. - J. Heterocycl. Chem., 1975, 12, N 3, p. 513-516.
176. Taylor E.C., Reiter I..A. Pteridines. 50. Unequivocal total synthesis of deoxyurot-hione. - J. Org. Chem., 1982, 47, N 3, p. 528-531.
177. Santilli A.A.. Kim D.H., Wanser 8. К Thicno(2,3-d]pyrimidines. 1. A new method for the preparation of esters and amides of thieno(2,3-d]pyrimidinc-6-carboxylic acids. - J. Heterocycl. Chem., 1971, 8, N 3, p. 445-453.
178. Santilli A.A., Scotese A.C. Synthesis of thiopyrano[2,3-d)pyrimidines and thieno [2,3-d]pyridincs. - Ibid., 1977, 14, N 3,p. 361-365.
179. Hawes E.M., Gorecki D.K.J. 1,6-Naphthyridines. 2. 2,3-Disubstituted derivatives and some new tricyclic ring systems. - Ibid., 1974, 11, N 3, p. 151-155.
180. Suzuki N. Synthesis of antimicrobial agents. 5. Synthesis and antimicrobial activities of some heterocyclic condenced 1.8-naphthyridine derivatives. - Chem. Pharm. Bull., 1980, 28, N3,p. 761-768.
181. Beck J.R. A direct synthesis of benzo[b]thiophene-2-carboxylate esters involving nitro displacement. - J. Org. Chem., 1972, 37, N 21, p. 3224-3226.
182. Beck J.R.. Yahner I.A. Synthesis of 2-cyano-, 2-acyl- and 2-carboxamido derivatives of 3-aminobenzo]b]thiophene involving nitro displacement. - Ibid., 1974, 39, N 23, p. 3440—3441.
183. Coppola G.M., Hardtmann G.E., Pfister O.R. Synthesis and reactions of 2H-ben?.o-|3,2-d][l.3|oxazinc-2,4(lH)-dione. - J. Heterocycl. Chem., 1982, 19, N4, p. 717-720.
184. Beck J.R. A Facile synthesis of 2-Phcnylbenzo|b|thiophcne-3-amine and the corresponding S-oxidcs. - Ibid., 1978, 15, N 3. p. 513-514.
152
185. А.с. 405896 {СССР). Способ получения натриевых солей замещенной 3-ами-нотиоиафтен-2-карбоновой кислоты / Н.Т.Гончаров, И.Н.Пономарев. — Опубл в Б.И., 1973, №45.
186. Пат. 1945964 (ФРГ). 2-Acyl-3-aminothiophenen / H.Kiehne. - Опубл. 25.03.71.
187. Carrington D.E.L., Clarke К., Scrowston R.M. 1,2-Benzoisothiazoles. Pt 2. Reactions of 3-chloro-l,2-benzisothiazole with carbanions. - J. Chem. Soc. C, 1971, N 23, p. 3903-3906.
188. Clarke K., Fox W.R., Scrowston R.M. Tricyclic systems obtained from some 3-ami-nobenzo[b]thiophen derivatives. - J. Chem. Res. Synop., 1980, N 2, p. 33. - РЖ Химия, 1980, 23Ж289.
189. Квитко И.Я., Соколова Н.Б. Синтез 1-фенил-3-мегил-4-амино-5-циантиено-[ 3,2-d] пиразола и его превращения. — В кн.: Вопросы химии и технологии органических красителей и промежуточных продуктов. Л. : Леиингр.технол. ин-т, 1978, с. 12—19. Рукопись дел. в ОНИИТЭХИМ 26.04.79, № 2663/79 Деп.
190. Clarke К., Fox W.R., Scrowston R.M. Condensed isothiazoles. Pt 5. Thienop,3-d] isothiazoles and thieno[3,2-d]isothiazoles. - J.Chem. Soc.Perkin Trans. Pt. 1, 1980, N 4, p. 1029-1037.
191. James F.C., Krebs H.D. Thienoisothiazoles. 1. The synthesis of thieno[2,3-c]isothi-azole and some of its derivatives. - Austral. J. Chem., 1982, 35, N 2, p. 385-391.
192. Gewald K., Radke IV., Hain IV. Substituierte 4-aminothienop ,3-c]isothiazole and 4-aminothieno|3,2-d]isothiazole. - J.prakt. Chem., 1980, 322, N 6, p. 1021-1031.
193. Synthesis of substituted thieno(2,3-c]- and [3,2-d]isothiazoles / B.Tornetta, G.Ron-sisvalle, E.Bousquet et al. — Gazz. chim. ital., 1980,110, N 4, p. 233—236,
194, James F.C., Krebs H.D. Thienoisothiazoles. 2. The synthesis of 5-alkylthioisothia-zoles and the preparation of thieno[3,2-d]isothiazole derivatives. - Austral. 1. Chem., 1982, 35,N2,p. 393-403.
195. Пат. 136968 (ГДР). Verfahren zur Herstellung von substituierten 4-Aminothieno p,3-cJisotHiazolen und 4-Aminothieno[3,2-d]isothiazolen / K.Gewald. - Опубл. 08.08.79.
196. Guerrera F„ Siracusa M.A., Tometta B. Sintesi di derivati della 3-aminotienop,3-b] piridina. Nota 2. — Farmaco. Ed. sci., 1916, 31, N 1, p. 21—30.
197. Пат. 105805 (ГДР). Verfahren zur Herstellung von 3-AminothienoP,3-b]pyri-dinen / K.Gewald, M.HentscheL - Опубл. 12.05.74.
198. Пат. 2502589 (ФРГ). Verfahren zur Herstellung von Bis-(triazinylamino)-stilben-verbindungen / H.Hagen, R.Hiess. - Опубл. 05.08.76.
199. Gewald K., Hentschel M., Klgen U. 3-Aminothienop,3-b]pyridine. - J. prakt. Chem. 1974, 316, N 6, S. 1030-1036.
200. Синтез и некоторые реакции З-цианопиридин-2-тионов / А.А.Краузе, З.А.Бо-мнка, А.М.Шестопалов и др. - Химия гетероцикл, соединений, 1981, № 3, с. 377-382.
201. Шаранин ЮЛ., Промоненков В.К, Шестопалов А.М. Реакции циклизации нитрилов. 5. 2-Арил-3(2-теноил)-1,1-дицианопропаны н производные пиридинов на их основе. - Журн. орган, химии, 1982,18, № 3, с. 630-640.
202. Шаранин ЮЛ., Промоненков В.К, Шестопалов А.М. Новый синтез замещенных пиридин-2 (1Н)-тионов и гетероциклических соединений на их основе. - Там же, № 9, с. 2003-2005.
203. Шаранин ЮЛ., Промоненков В.К., Шестопалов А.М. Рециклизация 4-амино-6-арил-5-циано-1,3-дитиа-4-циклогексин-2-спироциклоалканов в 4-арил-3-циано-5,6-по-лиметиленпиридин-2 (1Н)-тионы. - Там же, № 8, с 1782-1783.
204. Synthesis and spectral behaviour of pyridothienoisothiazole and pyridothienopyrimi-dine derivatives / B.Tornetta, M.A.Siracusa, G.Ronsisvalle, F.Guerrera. - Gazz. chin, ital., 1978,108, N 1/2, p. 57-62.
205. Пат. 2241717 (ФРГ). 3-Aminothieno[2,3-b]pyridine / R.Niess, H.Eilingsfeld. -Опубл. 14.03.74.
206. Пат. 4355164 (США). Pyridothienopyridazine antiallergy compounds / R.D.Yous-sefyeh. - Опубл. 19.10.82.
153
20
207. Tornetta B„ Guerrera E, Ronsisvalle G. Reazioni della cianotioacetammidc con bromo piruvato di etile e 0-cloroacetonossalato di etile. Nota 1. Una nuova sintcsi di derivati della tieno[2,3-b]piridina. - Ann. chim. (Ital.), 1974, 64, N 11/12, p. 833-842.
208. Tornetta B., Guerrera E, Ronsisvalle G. Reazioni della cianotioacetammidc con bromo piruvato di etile c |3-cloroacetonossalato di etile - Una nuova sintesi di derivati della tieno[2,3-b]pindina. — Chim. ind., 1975, 57, N 5, p. 367.
209. Rajappa S., Sreenivasan R. Synthesis of thiophenes. Pt 2.Two approaches to thi-eno[2,3-d]pyrimidines. - Indian J. Chem., 1971, 9, N 8, p. 761 762.
210. Пат. 136500 (ГДР). Verfahren zur Herstellung von 2,4-Diaryl-5-amino[2,3-d)thie-nopyrimidinen / J.Licbscher, H.Hartmann. - Опубл. 11.07.79.
211. Perez M.A., Soto I.L., Carrillo J.R. A simple, unambiguous synthesis of 2-amino-4-oxo-and 4-thioxo-3,4-dihydropyrimidine-5-carbonitriles. - Synthesis, 1983, N 5, p. 402-404.
212. Synteza i dzialanie tuberkulostatyczne niektorych pochodnych kwasu 3-alkilotio-i 3-fenylotiopirazyno-2-karboksylowego oraz ticno[2,3-b]pirazyny / D.Panccchowska-Ksepko, J. Sawlewicz, J.Samulska, M.Janowiec. — Acta pol. pharm., 1979, 36, N 3, s. 289—294.
213. Rudorf W.-D-, Schierhom A., Augustin M. Zur Reaction von o-Halogenbcnzoylcya-niden mit Schwefelkohlenstoff und Phenylisothiocyanat. - J. prakt. Chem., 1979, 321, N 6. S. 1021-1028.
214. Rudorf W.-D., Augustin M. Synthesis of heterocycles from o-chlorobenzoylaceto-nitrile. - Heterocycles, 1978, 9, N 10, p. 1488.
215. Rudorf W.-D. Heterocyclensynthesen mit o-Chlorbenzoyl acctonitril. - Tetrahedron, 1978, 34, N 6, p. 725-730.
216. Chiba T., Sato H., Kato T. Reaction of ethyl-4-bromoacetate with carbon disulfide and active methylene compounds. - Chem. Pharm. Bull., 1983, 31, N 7, p. 2480-2483.
217. Gompper R., Kutter E. Neue thiophene und thicno[2,3-b]thiophenc. - Angew. Chem., 1962, 74, N 7. S.251.
218. Gompper R., Kutter E„ TSrpfl W. Kctcnderivate. 4. Neue Thiophene und Thieno [2,3-b]thiophcnc. - J. Lieb. Ann. Chem., 1962, 659, N 1, S. 90-101.
219. Augustin M„ Rudorf W.-D., Schmidt U. Thiophene durch S-alkylierung. - Tetrahedron, 1976, 32, N 24, p. 3055-3061.
220. Jensen K.A., Henriksen I.. Studies of thioacids and their derivatives. 14. Reactions of carbon disulfide with active methylene compounds. - Acta chem. scand., 1968, 22, N 4, p. 1107-1128.
221. Schafer H., Gewald K. Zur Chemie der 4-Phenylthiazolyl-2-acetonitrils. — J. prakt. Chem., 1974, 316, N 4, S. 684-692.
222. Пат. 127512 (ГДР). Verfahren zur Herstellung von substituierten 4-Aminothiope-hen / G.Ohn, H.Brauniger, K.Pcsckc. - Опубл. 28.09.77.
223. Augustin M„ Schmidt U„ Rudorf W.-D. Synthese und Reaktivitat von Phenylsul-fonylcyanketen-5,5-acetalen. - Z. Chem., 1977, 17, N 8, S. 289-290.
224. Rudorf W.-D., Augustin M. Dithiocarboxylierung von Benzylidcnaminoacetonit-ril. - Ibid., 1982, 22, N 7, S. 255-256^
225. Hartke K., G8lz G. Thion- und Dithioestcr. 13. Schwefelheterocyclen durch Thio-acyiicrung. - J. Lieb. Ann. Chem., 1973, N 10, S. 1644-1651.
226. Hartke K„ Meissner F. Stereochemischc Aspektc dcr Thioacyl-Cyancssigester Thion-und Dithioester. - Tetrahedron, 1972, 28, N 3, S. 875—891.
227. Saito K., Kambe S., Sakurai A. A One-step synthesis of thiophene derivatives. -Synthesis, 1982, N 12, p. 1056-1059.
228. Synthesis of thieno[3,2-b]pyridines / M.Yokoyama, M.Tohnishi, A.Kurihara, T.Ima-moto. Chem. Lett., 1982, N 12, p. 1933-1936.
229. Studies on indole derivatives. 22. Synthesis and reactions of mcthyl-3-(2-substi-tuted-3-indolyl)thio-2-cyano-3-mcthylthioacrylates f G.Kobayashi, Y.Tominaga, S.Kisaki et al. - Chem. Pharm. Bull., 1973, 21, N 10, p. 2344-2345.
230. Laliberte R., Medawar G. 0-Ketoalkylthioacrylic acid derivatives as precursors of thiophenes, thiazolines and thienopyrimidines. - Can. J. Chem.. 1970,48. N17, p. 2709-2717.
154
231. Laliberte R„ Medawar G. Quelques imino-4-thiophenes particulierement stables. -Ibid., 1971.49, N 9, p. 1372-1376.
232. Chiba T, Sato H„ Kato T. Synthesis of ethyl-2-thioxo(and 2-methylene)thiazoline-4-acetates. - Chem. Pharm. Bull., 1982, 30, N 10, p. 3548-3554.
233. Augustin M„ Dolling W. Zur Reaktion von Phenylisothiocyanat mit a-Hetarylnitri-len und Ketonen. — J.prakt. Chem., 1982, 324, N 2, S. 322—328.
234. Yokoyama M., Kurauchi M., Imamoto T. Diaminothiazoles and diaminothiophe-ets. - Tetrahedron Lett., 1981, 22, N 24, p. 2285-2288.
235. A novel synthesis of 3,4-Diaminothiophcnes / Y. Tominaga, H.Fujito, Y.Matsuda, G.Kobayashi. - Heterocycles, 1977,6, N 11, p. 1871—1876.
236. Synthesis and reactions of 3,4-diaminothiophenes / Y.Tominaga, H. Fujito, H.No-risue et al. - J. Pharm. Soc. Jap., 1979, 99, N 11, p. 1081-1090. - РЖ Химия, 1980, 18Ж203.
237. Fischer E„ Rembarz G., Wollin K.-M. Cyclisierungsreaktionen von l-[2 Aminol-cyan-2-thio|cthylen-pyridiniumbetainen. - J.prakt. Chem., 1979, 321, N 3, S. 429—436.
238. Kirsch G., Cagniant M.D., Cagniant P. Synthese d’amino-3-thiophenes a partir d’aryl-ct d’hctarylacctonitrile. — J. Heterocycl. Chem., 1982, 19, N 2, p. 443—445.
239. Svnthetic studies of the thieno[3,2-djpyrimidine C-nucleoside isostere of inosine / W.-Y.Ren, M.-I.Lim. B.A.Otter, R.S.Klein. - J. Org. Chem., 1982, 47, N 24, p. 4633-4637.
240. Carrington D.E.L., Qarke K., Scrowston R.M. 1Л-Benzisothiazoles. Pt 1. Reaction of 3-chloro-1.2-benzisothiazoles with nuclophiles. — J.Chem. Soc. C, 1971, N 19, p. 3262-3265.
241. Heterocyclic compounds : MTP Intern. Rev. Sci.', Org., Chem. Ser. One, vol. 4. Cons. Ed. D.H.Hey, vol. Ed. K.Schofield. — Schofield, Butterworth : Univ. Park, press, 1973. — 350 p.
242. Boshagen H., Geiger W. Reaktionen mit 3-chloro-l,2-benzisothiazolium-chlorideh. Synthese von 2-substituierten 3-aminobenzo|b]thiophenen. - Synthesis, 1979, N6, S. 442-444.
243. Boshagen H„ Geiger W. Reactions with 3-chloro-1,2-benzisothiazolium-chlorides. A new synthesis of 3-aminobenzo[b]thiophenes. — Phosph, and Sulph., 1979, 6, N 1/2, p. 43.
244. Gewald K., Schafer H., Schlegel U. Synthese und Reaktionen von 3-bromisothi-azolo[5,4-blpyridinen. - J. prakt. Chem., 1976, 318, N 5, S. 779-784.
245. Hartmann H., Schafer H., Gewald K. Heterocyclische Farbstoffe und Vor stufen. 22. Synthese von Thiophen- und Thiazol-Derivaten durch Reaktion von 1,3-Oxathioliumsalzen mit Nucleophilen. - Ibid., 1973, 315, N 3, S. 497-504.
246. Hartmann H. Kationische Farbstoffe und Vorstufcn. Zur Umsetzung von 2-Aryl-1,3-oxathioliumsalzen mit nuclophilen Reaktionspartnern. - Z.Chem.,1971, 11, N 11, S. 421-422.
247. Czerney P, Hartmann H. 3-a-Brom-acetyl-cumarine als Synthesebausteine fur he-tcrocyclisch substituierte Cumarine. - J. prakt. Chem., 1983, 325, N 4, S. 551-560.
248. Hirai K., Ishiba T. Novel Synthesis of thiophene derivatives from 1,3-oxathiol-2-ylideneimmonium salt.-Chem. Pharm. Bull., 1971, 19, N 10, p. 2194-2197.
249. Hirai K., Ishiba T. New synthesis of thiophenes. Use of N-(l,3-oxathiol-2-ylidene) ternary iminium salts. - Ibid., 1972, 20, N 11, p. 2384-2393.
250. Gewald K., Hentschel M. 4-Amino-2-eyanomethylen-A*-thiazoline. - J.prakt. Chem.. 1976,318, N 2, S. 343-346.
251. Gewald K„ Hain V., Hartung P. Zur Chemie der 4-Aminothiazolin-2-thione. -Monatsh. Chem., 1981, 112, N 12, S. 1393-1404.
252. Gewald K„ Bellmann P., Jansch H.-J. 4-AminoisoxazoIe durch Thorpc-cyclisierung. -J. Lieb. Ann. Chem., 1980, N 10, S. 1623-1629.
253. Gewald K„ Bellmann P. Synthese und Reaktionen von 4-Aminoisothiazolcn. -Ibid., 1979. N 10. S. 1534-1546.
254. Gewald K., Bellmann P„ Jansch H.-J. Neue Synthese von 4-Aminoisothiazolen. -Z.Chcm., 1975, 15, N 1, S. 18 19.
255. Gewald K., Calderon O. 4-Amino-l-arylpyrazolc durch Thorpc-cyclisierung. -Monatsh. Chem.. 1977, 108, N 3, S. 611-616.
256. Пат. 113359 (ГДР). Verfahren zur Herstellung von substituirten 4-Aminopyra-zolen / K.Gewald, H.-J.JSnsch, O.Calderon. - Опубл. 05.06.74.
257. Gompper R„ GSng M., Saygin F. Synthesen mit N-cyaniminodithiokohlens3ure-ester: ein neuer weg zu imidazolen und Purinen, Thiazolen und Thiazolo[4,5-d]pyrimidinen. -Tetrahedron Lett., 1966, N 17, S. 1885-1889.
258. Пат. 118640 (ГДР). Verfahren zur Herstellung von neuer substituierten 4-Ami-noimidazolen / K.Gewald, G.Heinhold. - Опубл. 12.03.76.
259. Gewald K., Heinhold G. 4-Aminoimidazole dutch Thorpe-cyclisierung. - Mo-natsh. Chem., 1976,107, N 6, S. 1413-1421.
260. Edenhofer A. Ober einen neuen Zugang zu Imidazolen, siwie deren Verwendung zur Synthese von Purinen und 4,6-Dihydro-l,2-dimethyl-8-phenylimidazo[4,5-e]-l ,4-diaze-pin-5(lH>on. - Helv. chim. acta, 1975,58, N 7, S. 2192-2209.
261. Ishikawa F., Kosasayama A., Konuo T. Cyclic guanidines. 2. Synthesis of hypoglycemic acyl or alkyl derivatives of 1-substituted 2-imind-l,3-diazacycloalkane. — Chem. Pharm. Bull., 1978,66, N 12, p. 3666-3674.
262. Wobig D. Thiazolderivate. 4. Reaktionen von Cyanimidodithiocarbonaten und Cyanthiohamstoffsalzen mit 7-BromcrotonsSurederivaten. — J. Lieb. Ann. Chem., 1978, N7, S. 1118-1122.
263. Lipka P., Wobig D. Thiazolderivate. 5. Reaktion der S-Kaliumsalze von N-cyan-(dithiocarbonimidsaure)-S-estern mit substituierten benzylhalogeniden. - Ibid., 1979, N 6, S. 757-760.
264. Wobig D. Reaktionen von Cyanimidodithiocarbonaten mit a-Chloracetamiden. -Ibid., 1977, N 3, S. 400-406.
265. Walek W., Pallas M„ Augustin M. BeitrSge zum Reaktionsverhalten von Derivaten der Imidodithiokohlen&ure. 1. Cyclisierungsreaktionen mit Kalium-Alkyl-Cyanimidodithio-carbonaten. — Tetrahedron, 1976, 32, N 5, S. 623-627.
266. Wobig D. Notiz liber die Reaktion von (Kalium)(alkyl)cyanimidodithiocarbo-naten mit 1,3-Dichloraceton. - J. Lieb. Ann. Chem., 1976, N 6, S. 1166-1168.
267. Walek W., G'dtzschel K. 7-Hydroxythiazolo[4,5-b]pyridone. - J. prakt. Chem., 1979, 321, N 2, S. 260-266.
268. Hirai K., Sugimoto H., Ishiba T. Heterocyclic cation system. 14. Synthesis of thi-eno[3,2-e][l,4]diazepine, thiazolo[4,5-e][l,4]diazepine, and S-triazolo[3,4-c]thiazolo[4,5-e] diazepine derivatives. - J. Org. Chem., 1980,45, N 2, p. 253-260.
269. Zieger E., Raninger F„ MUller A.K. Synthesen von Heterocyclert. 183. Synthesen von Pyronen. 1. - J. Lieb. Ann. Chem., 1976, N 2, S. 250-256.
270. The Synthesis of hycanthone / G.M.Laidlaw, J.C.Callins, S.Arduv et al. - J. Org. Chem., 1973, 38, N 9, p. 1743-1746.
271. Reaction of malononitrile with carbon disulfide in an aqueous alkaline medium / T. Takeshima, M.Yokoyama, N.Fukada, M.Akano. - Ibid., 1970, 35, N 7, p. 2438-2440.
272. Пат. 127515 (ГДР). Verfahren zur Herstellung von Derivaten des Thiopyrans / G.Ohm, H.Braunigern, K.Peseke. - Опубл. 28.09.77.
273. Пат. 3846448 (США). 7,3-Dithietanes / S.Greenfield. - Опубл. 5.11.74.
274. Taub D„ Kuo C.H., Wendler N.L. Transformations in the 1,2,5,6-tetrahydropyridine series. - J.Org. Chem. C, 1967, N 16, p. 1558-1564.
275. Welcher R.P., Johnson G.A., Wystrach V.P. 4-Phosphorinanes. - J.Amer. Chem. Soc., 1960, 82, N 16, p. 4437-4438.
276. Yamamoo Y., Yamazaki H. The oligomerization and Co-oligomerization of active methylene compounds and isocyanides catalysed by octaisocyanidediocobalt. - Bull. Chem. Soc. Jap., 1981,54, N 3, p. 784-789.
277. Пат.4328343 (США). Cobali-catalyzed one-step synthesis of annulated pyridines / K.Vollhardt, C.Peter. - Опубл. 04.05.82.
278. Schmitz E„ Schramm S. Synthese von Heterocyclen dutch C-C-Knupfung Eine ne-ue Pyridonsynthese. - J. prakt. Chem., 1982, 324, N 1, S. 82-84.
279. Синтез и нейрофармакологическая активность 2,3-замещенных 4-амино-6,7-ди-
156.
гидро-5Н-1-пиридинов / А. В .У падышева, Н.Д.Григорева, А.П.Знаменс1Сая н др. — Хим-фарм. жури., 1977, № 2, с. 40—44.
280. Коншин М.Е. 2,3-Полиметиленхинолины и родственные им соединения. - Химия гетероцикл, соединений, 1975, № 3, с. 291-305.
281. Eisner U., Kutham J. The Chemistry of dihydropyridines. - Chem. Revs, 1972, 72, N 1, p. 1—42.
282. Schdfer H., Sattler K., Gewald K. Zur Synthese von 4-aminochinolinen und chinoli-nonen-(2) aus Anthranilsaurenitril. - J. prakt. Chem., 1979, 321, N 4, S. 695-698.
283. Zimmermann W., Eger K„ Roth HJ. Pyrrolo[2,3-b]pyridine. - Arch. Pharm., 1976, 309, N 7, S. 597-600.
284. ' Lalezari I., Sadeghi-Milani S. A convenient method for the preparation of thieno [2,3-b]pyridines. — Heterocycles, 1978, 9, N 10, p. 1493.
285. Lalezari I. Synthesis of 4-aminothienop,3-b]pyridine-5-carboxylic acids. — J. Heterocycl. Chem., 1979,16, N 3, p. 603-604.
286. Gewald K., Schafer H. Zur Synthese von 4-Aminochinolinen durch intramolekulare Friedel - Crafts-reaktion. - Monatsh. Chem., 1978, 109, N 3, S. 527-535.
287. Gewald K., Schafer H„ Sattler K. Synthesen von 4-Aminothienop,3-b]pyridinen. -Ibid., 1979, 110, N 5, S. 1189 1196.
288. Шрамм Н.И., Коншин М.Е. Реакции 6-метил- и 4,6-диметил-2-ариламиионико-тинонитрилов с кислотами. - Химия гетероцикл, соединений, 1982, № 5, с. 674-678.
289. Робев СК. Получение 1-арил-1-ариламино-2,2-дицианэтиленов из N-моноарил-замещенных амидинов и малононитрила. - Докл. Болт. Акад, наук, 1978, 31, № 7, с. 865-868.
290. Крохтяк В.И., Ильченко А.Я., Ягуполъский Л.М. Синтез и превращения 1-ци-ано-2-хлорэтиленов с перфторалкильными и трифторметилыюй группами. — Журн. орган, химии, 1981,17, № 2, с. 268-272.
291. А.с. 25879 (НРБ). 2,4-Дисубституирани-5-амииопиримидо[4,5-Ь]хинолини и метод за получаването им / С.К.Робев. - Опубл. 25:01.79.
292. Робев СК Синтез пиримидо( 4,5-Ь] хинолиновых производных. — Докл. Болт. Акад, наук, 1978, 31, №5, с. 551-554.
293. Пат. 56-125386 (Япония). Производные пиридо[2,3-4] пиримидина и способ их получения / С.Такэнака, Й.Накаяма, М.Тога. - Опубл. 01.10.81. - РЖ Химия, 1983, 70153П.
294. Functional derivatives of 2-propenylidene-l,2-dihydropyridine / J.Kuthan, D.Ilav-sky, J.Krechl, P.Trska. - Tetrahedron Lett., 1976, N 51, p. 4763-4764.
295. New cyclocondensation reaction of 3-alkylaminocrotononitriles / J. Kuthan, D.Ilav-sky, J.Krechl et al. - Collect. Czech. Chem. Communs, 1978, 48, N 8, s. 2024-2036.
296. Пат. 2073741 (Великобритания). 2-Amino-2,3-dicyano-6-methylpyridine/T.S.B.Sayer, R.Thompson. - Опубл. 21.10.81.
297. Пат. 2074565 (Великобритания). 3-Amino-6-methyl-7-cyanoisothiazolo(4,3-c]-pyridine/ T.S.B.Sayer, R.Thompson.-Опубл. 04.11.81.
298. Пат. 2073742 (Великобритания). 4-Amino-3,5-dicyanopyridine compounds / T.S.B.Sayer, R.Thompson. - Опубл. 09.03.81.
299. Пат. 36638 (Eur. Pat. Appl. EP). Herbicidal and plant growth regulant 2-sulfinyl and 2-sulfonyl pyridine N-oxides / W.W.Brand, J.M.Gullo. — Опубл. 30.09.81. — C.A., 1982, 96, 142709.
300. Robev S.K. Synthesis of polysubstituted cis- and tranc-2,5-dihydronicotinonitri-les. - Tetrahedron Lett., 1980, 21, N 21, p. 2097-2100.
301. A.c. 29776 (НРБ). 3-Циано-4-амнно-6-(М-алкил-Г4-ариламино-2,5-двузаместе-ни-2,5-дихидропиридини и метод за получаването им / С.К.Робев. - Опубл. 25.02.81.
302. Schmidtchen F.P., Rappoport Н. Polyprenylpyridinols. Synthesis of pievicidin analogues. -J. Amer. Chem. Soc., 1977, 99, N 21, p. 7014-7019. .
303. Пат. 142877 (ГДР). Verfahren zur Herstellung von 3-substituierten 4-Aminochi-nolonen-(2) / K.Gewald, H.Schafer, K. Sattler. - Опубл. 16.07.80.
304. Пат. 4245094 (США). 5-Amino-2,8-dialkyl-7,8-dihydro-7-oxopyrido[2,3-d]pyri-midine-6-carboxylic acid derivatives / A.Scotese, R.L.Morris, A.Santilli. — Опубл. 01.12.81.
157
305. Пат. 143426 (ГДР). Verfahren zur Herstellung von 5,6-Kondensiertcn 4-Amino-3-cyanpyridoncn-(2) / K.Gewald, H.Sch’dfer, K.Sattler. - Опубл. 20.08.80.
306. Artus J.J., Bonet J.-J., Palau M. Synthesis de 4-amino-l-bcncil-3-cyano-1.2-dihid-ro-1,8-naftiridina. - An quint. Real soc. esp. fis. у quint., 1974, 69, N 11, p. 1203-1204. -РЖ Химия, 1974,22Ж317.
307. Peseke. K„ Quincoces J. Synthese von substituicrten l-[l-(fur-2-yl)alkyh'denami-no]-l,2-dihydropyridin-3,5-dicarbonitrilen. - Pharmazie, 1981,36,-N 8, S. 534-535.
308. Schweizer E.E., De Voegoff S., Murray W.P. Reactions of phosphorus compounds. 37. Preparation of 0-iminopropyl- and p-aminopropenyltriphenylphbsphonium bromides and the use of the latter in heterocyclic synthesis. - J. Org. Chem., 1977, 42, N 2, p. 200-205.
309. Harcourt D.N., Waigh R.D. Synthesis of isoquinolincs from benzylaminoacetonitriles. Pt 1. Compounds prepared from veratrylaminc. — J. Chem. Soc. C, 1971, N 5, p. 967—970.
310. Kaneco C„ Yamamoto A., Hasiba M. Ring contraction reactions of methyl quinoline 1-oxide 5-carboxylates via the corresponding bcnz|d|-l ,3-oxazepines. A facile synthesis of methyl indole 4-carboxylate and its derivatives. - Chem. Pharm. Bull., 1979, 27, N 4, p. 946-952.
311. Lament M.M. Nouvelle synthese des phenyl-3-amino-4-cinnolines. - C.r. Acad. Sci. C, 1973,277, N 8, S. 319-322.
312. Пат. 123525 (ГДР). Verfahren zur Herstellung von substituicrten 4-Aminocinnoli-nen / K.Gewald, H.Schafer, O. Calderon. - Опубл. 05.01.77.
313. Laduree D„ Florentin D„ Robba M. Synthesis of 4-amino[l )benzofuro(3,2-g]cin-nolines. - J.Heterocycl. Chem., 1980, 17, N 9, p. 1189-1193.
314. Laduree D„ Robba M. Synthese d’Amino-4-[l]benzofuro[2,3-g]cinnolincs. - Chem. Pharm. Bull., 1982, 30, N 3, p. 789-795.
315. Flitsch W., Lemer H., Zimmermann H. Beitragc zur Chemie der 8b,8c-Diazapyracy-lene. - Chem. Ber.,.1977, 110, N 8, S. 2765-2773.
316. Усовершенствование синтеза 6-амнноурацила / B.M.Нестеров, Л.А.Кучеря, Л.А.Третьякова, Л.И.Маркитанова. - Хим.-фармац. журн., 1981, 15, № 8, с. 80-81.
317. Пат. 603575 (Швейцария). Verfahren zur Herstellung von Cyanverbindungcn / A.Edenhofer, H.Spiegclbcrg. - Опубл. 31.08.78.
318. Пат. 4098788 (США). Process for preparing guinazolines / R.R.Crenshaw, G.M.Par-tyka. - Опубл. 04.07.78.
319. Synthesis of pyrimido[4,5-d)pyrimidines / Y.Tominaga, H.Okuda, Y.Mitsutomi et al. - Heterocycles, 1979, 12, N 4, p. 503-504.
320. Пат. 1121817 (Канада). Cyanocarboxamides and quinazoline process / R.R.Crenshaw, G.M.Luke, R.A.Partyka. - Опубл. 13.04.82.
321. Водопьянов В.Г., Голов В.Г., Мушкин Ю.И. Каталитическая конденсация дициандиамида с циклогексаном. - Журн. орган, химии, 1972, 7, № 5, с. 1000—1003.
322. Rosowsky A., Huang R.C., Modest E.J. [l]Benzopyrano[3,4-d]pyrimidincs and (l]Benzothiopyrano(3,4-d]pyridines. Two new heterocyclic ring systems. - J. Heterocycl. Chem., 1970, 7, N 1, p. 197-200.
323. Synthesis of two new heterocyclic ring systems. Bcnz.o[3,4]cycTohcpta(l,2-d]pyri-midines and benzo(3,4]eyclohcpta[2,l-d]pyrimidines (1,2) / A.Rosowsky, K.K.N.Chen. M.Lin et al. - Ibid., 1971,8, N 4, p. 789-795.
324. 2,4-Diaminopyrimidines from dicyadiamide. 4. Condensation with bicyclic aromatic ketones / S.K.Sengupta, S.Chattcrjcc, H.K.Protopapa, E.J.Modest. — J. Org. Chem., 1972, 37, N9, p. 1312-1328.
325. Quinazolines. 12. 1,3-Diaminobcnzo[f]quinazolincs containing longchain alkylor chloro substituents on the central ring. Synthesis and biological evaluation as candidate antifolate and antimalarial agents / A.Rosowsky, P.C.Huang, N.Papathanasopoulos, E.J.Modest. — J. Med. Chem.. 1974, 17, N 11, p. 1217-1222.
326. Rosowsky A. Quinazolincs. 13. Synthesis of polycyclic 2,4-diaminopyrimidines from aromatic amine hydrochlorides and sodium dicyanamide. - J. Org. Chem., 1974, 39, N 22, p. 3293-3295.
158
327. Пат. 4118561 (США). 7-(Substitutcd)-7H-pyrrolo[3,2-f]qiiinazoline-l,3-diamines / K.W.Lcdig. - Опубл. 03.10.78.
328. Пат. 4208520 (США). 7-(Substituted)-7H-pyrrolo[3,2-f]quinazoline-l,3-diami-ncs / K.W.Lcdig. - Опубл. 17.06.80.
329. Sliwa W., Zamarlik H. Polyazaphcnantrencs. - Heterocycles, 1979, 12, N 4, p. 529-576.
330. Sutherland D.R., Pickard J. The photolysis and pyrolysis of 8-azidocaffeine. — J. Heterocycl. Chem., 1974, 11, N 3, p. 457-458.
331. Coppola G.M., Hardtmann G.E. Novel heterocycles. 4. Synthesis of the pyrrolo-12,3-c]-l,2-thiazine ring system. - Ibid., 1979, 16, N 7, p. 1361-1363.
332. The total synthesis of de-epiibogamine/Y.Ban, T.Wakamatsu,Y.Fujimoto,T.Oishi. -Tetrahedron Lett., 1968, N 30, p. 3383-3386.
333. Synthesis and pharmacological properties of 8-chloro-10-(2-dimethylaminoethoxy)-dibenzo[b, f]thiepin and related compounds. Neurotropic and psychotropic agents. 3 / I.Ueda, Y.Sato', S.Maeno, S.Umio. - Chem. Pharm. Bull., 1978,62, p. 3058-3070.
334. Flitsch W., Peeters H. Hydrazinuberbruckte[14]Annulene. Eine einfache Synthese des 4,9-Bis(diacetylamino)-3,8-dicyan-10b,10c-diazadieyclopenta[ef, kljheptalcns. - Chem. Ber., 1973. 106,N6, S. 1731-1735.
335. Cheeseman G.W.H., Hawi A.A. Synthesis of Some Pyrrolobenzothiazcpines via N-Aryl-2-thiocyanatopyrroles. - J. Heterocycl. Chem., 1983, 20, N 3, p. 585-590.
336. Synthesis of ferrocettophanes by cyclization of dinitriles / A.N.Nesmeyanov, M.U.Ry-binskaya, G.B.Schulpin, A.A.Pogrebnyak. - J.Organometal. Chem., 1975,92,N 3, n. 341 -367.
337. Синтез ферроценофенов циклизацией динитрилов / А.Н.Несмеянов, М.И.Рыбинская, Г.Б.Шульпин, А.А.Погребняк. - Докл. АН СССР, 1973, 212, № 1, с. 105-107.
338. Doornbos Т., Strafing J. Ring closure of N,N* : N,N'-bis (dccamethylenc)-l,4-dia-mino-2,5-bis-10(cyanodecy!oxy)benzene. - Synth. Commun., 1971, 1, N 3, p. 193-200.
339. Isele G.L., Vuano B.M. Untersuchungen uber die Bildungstendenz von Catenaver-bindungen. - J.Lieb. Ann. Chem., 1976, N 10, S. 1903-1913.
340. Волтер Р.Э. Кольчато-цепная изомерия в органической химии. — Рига : Зи-натне, 1978. - 238 с.
341. Валтер Р.Э. Кольчато-цепные изомерные превращения оксн-, амино- и меркаптопроизводных карбонильных соединений и их гетероаналогов. — Успехи химии, 1974, 43, №8, с. 1417-1442.
342. Джонс П.Р. Кольчато-цепиая таутомерия. - Там же, 1966, 35, № 9, с. 1589-1637.
343. Шаранин Ю.А., Семенова С.Н. Реакции циклизации с участием нитрилзной группы. - В кн.: Реакционная способность и механизмы реакций органических соединений. Л. : Изд-во Ленингр. ун-та, 1971, с. 115-126.
344. Шаранин Ю.А., Промоненков В.К. Синтез аминофуранов из нитрилов. — Черкассы, 1978. - 28 с. - Рукопись деп. в ОНИИТЭХИМ, № 1858-78 Деп.
345. Matsui Н., Ishimoto S. The structure of ur-cyanoalkanoles (infrared spectrometric studies. - Tetrahedron Lett., 1966, N 17, p. 1827-1830.
346. Ahlbrecht H.. Fischer S. Vinylamine. 5. Neue beispiele auf der Gebiet der imin-cnamin-tautomerie. - Tetrahedron, 1970, 26, N 11, S. 2837-2848.
347. Dean F. Recent advances in furan chemistry. - Adv. Heterocycl. Chem., 1982, 30, p. 167-238.
348. Успехи химии фурана / Я.Я.Блейделис, К.К.Вентер, Р.А.Гавар и др. - Рига : Зинатне, 1978. - 302 с.
349. Williams A. Furans. Synthesis and applications. - New York : Noyes Data Corp., 1973. - 303 p.
350. Bosshard P., Eugster C.H. Advances in furan chemistry. - Adv. Heterocycl. Chem., 1966,7, p. 377-488.
351. Dunlop A.P., Peters F.N. The Furans. — New York : Reinhold, 1953. — 867 p.
352. Элъдерфилъд P„ Додд T. фуран. - В кн: Гетероциклические соединения / Под ред. Р.Эльдерфильда. М. : Изд-во иностр, лит., 1953, т. 1, с. 95-164.
159
353. Johnson F., Heeschen J.P. An unusual reaction product from epichlorohydrin and sodium cyanide. — J. Org. Chem., 1964,29, N 11, p. 3252-3258.
354. Isidor J.L., Brookhart M.S., McKee R.L. A novel furan dimer. - Ibid., 1973, 38, N 3, p. 612-613.
355. Westdo G. Reactions of 3-Chloro- and 3-bromo-2,4-pentanedione with malonitrile and with ethyl cyanoacetate. - Acta chem. scand., 1959, 13, N 4, p. 692-694.
356. Bacher F. Studier zur Truxin- und Truxillsauresynthese. - J. prakt. Chem., 1929, 120, N 11/12, S. 301-338.
357. Темникова Т.И., Ковалевская P.H. О взаимодействии а-бромдезоксибензои-на с Na-циануксусным эфиром. - Журн. орган, химии, 1965, 1, № 3, с. 612.
358. Темникова Т.Н, Семенова С.Н., Бондарь Н.Ф. Химические превращения а-галогеикетонов. 26. Взаимодействие паразамещенных со-бромацетофенонов и а-бром-дезоксибензоинов с натрмалоноиитрилом и натрциануксусным эфиром. — Там же, 1973, 9, N 9, с. 1809-1814.
359. Bennett G.B., Mason R.B., Shapiro M.J. Reactivity of oxoindole-A3, a-acrylates toward diazoalkanes. An unusual ring expansion. — J. Org. Chem., 1978, 43, N 22, p. 4383-4385.
360. Davrinche C., Brion J.-D., Reynaund P. Sur la preparation et la reactivite de la tet-rahydrofurannethione-2 et la tetrahydropyrannethione-2. - C.r. Acad. sci. C, 1980, 290, N 4, p. 77-80.
361. Achini R., Oppolzer W. Synthesis of pyrrolidines by intramolecular carbanionic epoxide opening. — Tetrahedron Lett., 1975, N 6, p. 369-372.
362. A new photochemical reaction/D.H.R.Barton, J.M.'Beaton,L.E.Geller,M.M.Pcchet. -J. Amer. Chem. Soc., 1961, 83, N 19, p. 4076-4083.
363. Easton N.R., Gardner J.H., Stevens J.M. A new synthesis and confirmation of the Structure of amidone. — Ibid., 1947,69, N 12, p. 2941-2942.
364. Raffauf R.F. The cyclization of disubstituted pentenoic acid derivatives. - Ibid., 1952, 74, N 17, p. 4460-4661.
365. Ac. 925957 (СССР). Способ получения гидробромидов 2-имино-4-бром-5,5-диалкил-2,5-дигидрофуранов / Е.Б.Олейникова, Ю.М.Скворцов, Б.А.Трофимов и др. -Опубл, в Б.И., 1982, №17.
366. А.с. 794011 (СССР). Способ получения 2-имино-4-амино-55-диалкил-2,5-ди-гидрофуранов / Ю.М.Скворцов, А.Г.Малькина, Б.А.Трофимов, М.В.Сигалов. — Опубл, в Б.И., 1981, №1.
367. 2-Имино-4-амино-5,5-диалкил-2,5-дигидрофураны / Ю.М.Скворцов, А.Г.Мапь-кина, Б.А.Трофимов и др. - Журн. орган, химии, 1981,17, № 4, с. 884 -885.
368. Цианацетилен и его производные. 5. О взаимодействии третичных пианаце-тиленовых спиртов с аммиаком / Ю.М.Скворцов, А.Г.Малькина, Б.А.Трофимов и др. -Там же, 1982,18, № 1, с. 59-64.
369. Скворцов Ю.М., Мамкина А.Г., Трофимов Б.А. 1-(2-Имиио-5,5-ДИметил-2,5-дигидро-4-фурил) имидазол. - Там же, 1983, 19, № 6, с. 1351.
370. HUI R.K. Fragmentation of Д-keto ether oximes. — J.Org. Chem., 1962, 27, N 1, p. 29-35.
371. Grochowski E., Boleslawska T. Electrophilic reaction of the cyano group. 8. Intramolecular cyclisation of w-hydroxynitriles. - Bull. Acad. pol. sci. Ser. sci. chim., 1972, 20, N5, p. 411—415.
372. Stein M.L., Manna F., Lombardi C.C. The reaction of 3-hydroxypyridine N-oxide with active hydrogen compounds and the synthesis of 3-substituted 2-aminofuro[3,2-b]pyri-dines. — J. Heterocycl. Chem., 1979,15, N 8, p. 1411-1414.
373. Desideri N„ Manna F., Stein M.L. Rearrangement of 2-aminofuro[3,2-b]pyridine-3-carboxylic esters. - Ibid., 1981, 18, N 6, p. 1085- 1087.
374. Shadbolt R.S., Ulbricht T.L. Pyrimidines. Pt 4. The preparation of some analogues of vitamin Be. — J. Chem. Soc. C , 1968, N 10. p. 1203—1208.
160
375. Alam M„ Khan M.H. Preparation of some nicotinic acid derivatives. - Philipp. J. Sci., 1980,109,JU 1/2, p. 19-21.
376. Suzuki H., Koge M„ Hanafusa T. Iminophthalene (imino-1, 3-dihydroisobenzofu-rans) from’the nitration of some p-xylonitrile derivatives. - J. Chem. Soc. Chem. Communs, 1977, N 10, p. 341-342.
377. Темникова Т.И., Шаранин ЮЛ., Караван В.С. Перегруппировка фенацилма-лононитрила в 2-амино-3-циано-5-фенилфуран. - Журн. орган, химии, 1967,3, с. 596-597.
378. Караван В.С., Семенова С.Н., Шуринова А.К. Химические превращения а-гало-генкегонов. 20. Взаимодействие n-эамешенных бромацетофенонов с натриймалонони-трнлом. - Там же, 1969,5, № 12, с. 2161-2164.
379. Семенова С.И., Бондарь Н.Ф., Темникова Т.И. Кинетика циклизации 4-Х-де-зилциануксусных эфиров в 2-амино-3-карбэтокси-4-фенил-5-арилфураиы. - Там же, 1973, 9,1* 10, с. 2111-2114.
380. Изучение механизмов образования гетероциклов методом ЯМР спектроскопии в струе. 2-Амино-З-цианофураны / С.И.Селиванов, Ю.А.Шаранин, Р.А.Богаткнн, Б.А.Ершов. - Там же, 1981, 17, № 3, с. 666.
381. Korte Е, Trautner К. Pyrrol- und Pyrrolidincarbons3ure-(3>-3thylester durch ka-talyt. Hydrierung von a-Cyanketocarbonsaureathylestern. - Chem. Ber., 1962, 95, N 2, S. 307-318.
382. Шаранин Ю.А., Караван B.C.; Темникова Т.И. Взаимодействие металлических производных соединений, имеюпщх подвижный атом водорода с о-галогенкетонами. 4. Свойства 2-амино-З-цианфуранов. - Журн. орган, химии, 1967, 3, № 11, с. 1987-1996.
383. Темникова Т.И., Шаранин Ю.А., Караван В.С. Взаимодействие металлических производных соединений, имеющих подвижный атом водорода, с а-галогенкетонами. 2. Превращение замещенных а-галогендеэоксибенэоина в 2-амино-3-циан-4Д-дмарилфу-раны. - Там же, № 4, с. 681-684.
384. Темникова Т.И., Шаранин Ю.А. Взаимодействие металлических производных соединений, имеющих подвижный атом водорода, с а-галогенкетвнами. 1. Реакция а-галогенкетонов с Na-малононитрилом. - Там же, 1966, 2, № 11, с. 2018-2020.
385. Ducker J.W., Gunter M.J. The reactions of malononitrile with a-diketones and related studies. — Austral. J. Chem., 1974,27, N 10, p. 2229-2241.
386. Corre E., Foucaud A. A new method for the conversion of 3-aroyl-2-cyanoestcrs into phosphorylaminofuranes. Use of N-phosphorylketenimines. - J. Chem. Soc. C, 1971, Nl,p. 10.
387. Горелик M.B., Мишина E.B. Взаимодействие 2,3-дихлор- и 2-хлор-1,4-диокси-антрахинонов с карбанионами. - Журн. орган, химии, 1983, 19, № 10, с. 2185-2190.
388. Пат. 17834 (Япония). l-Oxa-2(lH)azulenonimine derivatives /Т.Nozoe. -Опубл. 25.08.62. - С.А., 1965,62,13127.
389. Action des cyanures alcalins sur la chloracetone: isolement d’une Aiaminocetone / H.Galons, C.Combet-Famoux, J.-F.Gigardeau, M.Miocque. — C.r. Acad. sci. C, 1978, 286, N 24, p. 663-666.
390. Mount J.F., Coffen D.L., Katonak D.A. Synthesis of some 2-aminofurans from cyanoacetone enolate and their rearrangement to 3-cyanopyrroles with ammonia. - J. Org. Chem., 1978,43, N 20, p. 3821-3824.
391. Gewald K. 2-Aminothiophcne aus a-Oxomercaptanen und methylenaktiven Nitri-len.-Chem. Ber., 1965,98, N 11, 3. 3571-3577.
392. Gewald K. Heterocyclen aus CH-aciden Nitrilen. 9. Uber de Reaktion von a-Hyd-roxyketonen mit Malodinitril. - Ibid., 1966, 99, N 3, S. 1002-1007.
393. Hayashi T, Kagawa M. Reactions of acetoin and benzoin with malononitrile. -Bull. Chem. Soc. Jap., 1970,43, N 10, p. 3290.
394. Пат. 2817449 (ФРГ). Mittel zur Regulierung des Pflanzenwachstums / K.Dickore, K.LSrssen. - Опубл. 31.10.79.
395. Frousek J., Jurdfek A., Koval! J. Reactions and spectral properties of 2-amino-3-cyano44-disubstituted furane derivatives. — Collect. Czech. Chem. Communs, 1980, 45, N5,p. 1581-1588.
161
21
396. Anderson D.M.W., Bell F., Duncan J.L. Some condensation products of malononitrile. - J. Chem. Soc., 1961, N 11, p. 4705-4711.
397. Junek H., Homischer B., Hambock H. Synthesen mit Nitrilen. Mitt. 23. Die anio-notrope 1,2-Arylverschiebung bei Benzil-Malonitril-Kondensationsprodukten. - Monatsh. Chem., 1969,100, N2, S. 503-509.
. 398. Rao Y.S. Recent advances in the chemistry of unsaturated lactones. -Chem.Revs, 1976, 76, N 5, p. 625-694.
399. Uber die tlmsetzung von Saurederivaten und Halogensilanen mit Alkalimetallen. 8. Synthese henerocyclischer systeme aus Bistrimethylsiloxyalkenen / K.RUhlmann, A.Kok-kali, H.Becker et al. - J. prakt. Chem., 1969, 311, N 5, S. 844-850.
400. Ruhlmann K. Die Umsetzung von Carbonsaureestern mit Natrium in Gegenwart von Trimethylchlorsilan. — Synthesis, 1971, N 5, S. 236-253.
401. Peltzmann R., Unterweger B, Junek H. Zur Bildung eines Benzodifurans aus Tet-rahydroxybenzochinon. Synthesen mit Nitrilen. 53.’Mitt. - Monatsh. Chem, 1979, 1J0, N3, S. 739-743.
402. Schultz E.M., Robb C.M., Sprague J.M. The reaction of l-Dimethylamino-2-chlo-ropronane with diphenylacetonitrile. The structure of amidone. - 1. Amer. Chem. Soc, 1947, 69, N 10, p. 2454-2459.
403. Hyperbacic media. 2. Metallation of hydrazones. Synthesis of substituted or functional nitriles. 2-iminotetrahydrofurans and y-butyrolactones / J.F.Le Borgne, T.Cuvigry, M.Larcheveque, H.Normant. - Synthesis, 1976, N 4, p. 238-240.
404. Campaigns E., Ellis R.L., Bradford M. Synthesis of substituted 2-amino-3-cyano-dihydrofurans from styrene oxides and malononitrile. - J. Heterocycl. Chem, 1969, 6, N 2, p. 159-162.
405. Пат. 5255 (Япония). Способ получения производных дигидрофурана / К.Ямад-заки, Т.Мацуда. - Опубл. 15.02.72. - РЖ Химия, 1973, 7Н37ОП.
406. Larcheveque М., DebalA. A convenient synthesis of 7-hydroxy and?-keto nitriles. -Synth. Commun, 1980, 10, N 1, p. 49-57.
407. Синтез и изомеризация нитро-а-окисей / И.Ф .Соковишина, В.В.Перекалин, О.МЛернер, Л.М.Аидреева. - Журн. орган, химии, 1965,1, № 3, с. 636—640.
408. Соковишина И.Ф., Перекалин В.В. Реакция динитрила малоновой кислоты с 0-нитро-с-окисями. - Там же, 1974,11, № 1, с. 52-54.
409. Соковишина И.Ф., Зорина Л.Н. Реакция динитрила малоновой кислоты с 0-иитро-а-окисями. - В кн.: XXVI Герцен, чтения. Химия. Науч. докл. Л, 1973, вып. 2, с. 105-107. - РЖ Химия, 1973,21Ж181.
410. Ducker J.W., Williams В.К. The synthesis and mass spectra of some dihydrofuro-(2,3-bJpyridines. - Austral. J. Chem, 1978, 31, N 10, p. 2321-2331.
411. Изомерные превращения а-окисей с подвижными атомами водорода в боковой углеродной цепи. 14. Строение продукта взаимодействия К-малононитрила с 1-бром-3-метил-2,3-эпоксибутаном / Б.А.Ершов, Л.А.Каунова, Ю.Д.Клейман, Г.В.Маркина. -Журн. орган, химии, 1968,4, № 10, с. 1764-1767.
412. Темникова Т.И., Ковалевская Р.Н. Взаимодействие а-бромокисей с металлическими производными соединений, имеющих подвижный атом водорода. - Жури. общ. химии, 1965 , 35, № 2, с. 246-248.
413. Hashem АЛ., Shaban М.Е. Reactions of styrene oxide with some active hydrogen compounds. - Indian J. Chem. B. 1981. 20, N 9, p. 807-808.
414. Aran V.J., Soto J.L. A simple preparation of 5-amino-3-cyano-2,4-diarylfurans and their use in the synthesis of 3-amino-5-cyanophthalic anhydrides. - Synthesis, 1982, N 6, p. 513-514.
415. Sword I. Reactions of some benzylidene compounds with potassium cyanide. -J. Chem. Soc. C, 1970, N 14/15, p. 1916-1922.
416. Несмеянов A.H. Присоединение нуклеофильных реагентов к Д-цианвинилкетонам. — В кн.: Исследования в области органической химии. М. : Наука, 1971, с. 209-217.
417. Howe R., Rao B.S., Heyneker Н. 2,3-Dihydro-2-hydroxybenzo[bJfuran-3-one, the cyclic hemiacetal of 2-hydroxyphenyl glyoxal. - J. Chem. Soc. С, 1967, N 23, p. 2510-2514.
162
418. Mokhtar H.M. Hydrazine and quinoxaline derivatives of aryl £-ascorbic acid analogs. - Pharmazie, 1978, 33, N 11, p; 709-711.
419. Mokhtar H., Soliman R. Pyrazolone and quinoxaline derivatives of triazolyl analogs of £-ascorbic acid. - Carbohyd. Res., 1981, 90, N 1, p. 144-148.
420. Mokhtar H„ Feid-Allah H. Synthesis and properties of aryliminoascorbic acid analogues. - Pharmazie, 181, 36, N 11, p. 751-753.
421. Manrao M.R., Kohli S. Synthesis of benzofurans from ketimines. — Indian J. Chem. B, 1982, 21, N 3, p. 252-253.
422. Reaction of cyanolen bromide with o-hydroxybenzalanilines, p-hydroxybenzalani-lines and vanilin schiff bases / S.Kumaz, M.Rai, K.Krishan, A.Singh. - Ibid., N 6, p. 578-579.
423. Nozoe T„ Mukai T., Suzuke T. Syhthesis of l-oxazulen-2-imine derivatives from tropone. - Bull. Chem. Soc. Jap., 1963, 36, N 1, p. 38-44.
424. Nozoe T Recent advances in the Chemistry of troponoids related compounds in Japan. - Pure and Appl. Chem., 1971, 28, N 2/3, p. 239-280.
425. Roeber H., Matasch R., Hartke K. Zur Reaktion von 1,2-Diketonen mit Malononitrile unter Piperidin-Katalyse. - Chem. Ber., 1975, 108, N 10, S, 3247-3255.
426. Foden F.R., McCormick J., O’Mant D.M. Vulpinic acids as potential antiinflammatory agents. 1. Vulpinic acids with substituents in the aromatic rings. - J. Med. Chem., 1975, 18, N 2, p. 199-203.
427. Циклизация 1,1,2,2-тетрацианэтана с алифатическими альдегидами / В.В.Алексеев, О.Е.Насакин, А.Х.Булай, С.Ю.Сильвестрова. - Химия гетероцикл, соединений, 1980, №8, с. 1137.
428. Химия симм-тетрацианэтана. 1. Конденсация симм-тетрацианэтана с альдегидами и кетонами / О.Е.Насакин, В.В.Алексеев, В.К.Промоненков и др. - Там же, 1981, №6,0.744-746.
429. А. с. 899557 (СССР). Способ получения 5-амино-3,3,4-трициано-2,3-дигидрофу-ранов / В.В.Алексеев, О.Е.Насакин, В.А.Кухтин и др. - Опубл, в Б.И., 1982; № 3.
430. Химия симм-тетрацианэтана. 2. Конденсация с карбонильными соединениями / О.Е.Насакин, В.В.Алексеев, П.Б.Терентьев и др. - Химия гетероцикл, соединений, 1982, №12, с. 1605-1610.
431. А. с. 910630 (СССР). Способ получения 5-амино-3,3,4-трициано-2,3-дигидро-фуранов / В.В.Алексеев, О.Е.Насакин, В.А.Кухтин и др. — Опубл, в Б.И., 1982, № 9.
432. Циклизация 1,1,2,2-тетрацианэтана с кетонами и ароматическими альдегидами / В.В.Алексеев, О.Е.Насакин, В.К.Промоненков и др. - Химия гетероцикл, соединений, 1980, № И, с. 1565-1566.
433. Ducker J. W„ Gunter M.J. The reaction of ethenetetracarbonitrile with acyclic (J-di-carbonic compounds and related studies. - Austral. J. Chem., 1973, 26, N 7, p. 1551-1569.
'434 . Reversible cyclohexadiene-hexatriene valence isomerizations. A new class of photochromic compounds / K.R.Huffman, M.Loy, W.A.Henderson, Jr., E.F.Ullman. - Tetrahedron Lett., 1967, N 10, p. 931-934.
435 Craven R. A sensitive colour reaction for certain quinones. - J. Chem. Soc., 1931, N 6, p. 1605-1606.
436. Акацука M. Изучение хинонов. 5. О реакции производных нафтохинона с соединениями, содержащими активную метиленовую группу, реакция Крейвена. — I.Pharm. Soc. Jap., 1970, 90, № 2, с. 160-168. - РЖ Химия, 1970, 20Ж277.
437. Kaliamayer H.J. Zur Kenntnis der Craven-Reaktion des 2-Methyl-l,4-naphtochi-ons. - Arch. Pharm.,,1973, 306, N 4, S.257-267.
438. Junek H. Uber die Reaktion von Cyanessigsaure mit Chinonen. - Monatsh. Chem., 1960, 91, N3,S. 479-483.
439. Confer C.E., Petty J.J. Spectrophotometric determination of 1,4-naphthoquinone in phthalic anhydrine. - Anal. Chem., 1963, 35, N 6, p. 663-665.
440. 2,5-Dihydroxy-p-benzenediacetic acid and related compounds form p-benzoquino-ne / J.H. Wood, C.S.Colburn, L.Cox, H.C.Gariand. - J. Amer. Chem. Soc., 1944, 66, N 9, p. 1540-1542.
163 21X
441. Jeffreys J.A.D. Michael additions to methoxy-p-benzoquinone. - J. Chem. Soc., 1959, N 6, p. 2153-2157.
442. Junek H., Sterk H., Homischer B. Syntheses mit Nitrilen. Mitt. 22. Cyclisierende additionsreactionen von malonitril an 1,4-chinone. - Monatsh. Chem., 1968, 99, N 6, S. 2359-2364.
443. King T.J., Newall C.E. The chemistry of colour reactions. The craven reaction. -J. Chem. Soc., 1965, N 2, p. 974-977.
444. berkoseh J., Specht J. Die Konstitution der Michael-1,3-Addukte von Cyanessig-s3ure2thyleater аи Konjugierte Systeme. — Monatsh. Chem., 1961, 92, N 3, S. 542-543.
445. Katritzky A.R., Derkosch J. Uber das NMR-Spektrum eines Benzofuranaminocar-bonsaureesters. _ ibid., 1962, 93, N 2, S. 541-543.
Производные 2-амино-3-карбэтокси-5-оксикумарона / В.П.Маковецкий, ИБ.Дзвинчук, в.В.Яремеико, А.А.Свищук. - Укр. хим. жури., 1979,45, № 7, с. 652-655.
447. 2-Амино-З-(бензимидазол-2-ил) бекэо[Ъ]фураны /В.П.Маковецкий, И.Б.Дзвин-’УК^ЮЛ^-Цоловенко, А.А.Свнщук. — Химия гетероцикл, соединений, 1980, № 2,
448. frjeker A. Notiz zur direkten Olefinierung von p-Chinonen mit Melodinitril. - Chem. Ber-L9o70’ 103, N 21 s- 656~658'
449. ^становление направления реакции триметилбензохинона-1,4 с цианацетами-Д*ми / Ь.(цлаковецкий, И.БДзвинчук, КХМ.Воловенко, А.А.Свищук. - Химия гете-
роцикл. соединений, 1979, N» 1, с. 129-130.
450. Рърелик М.В., Мишина Е.В. Взаимодействие 1,4-диоксиантрахинонов с анионами СН-кислот. - Журн. орган, химии, 1983, 19, № 3, с. 607-615.
451. Дгогге F„ Trantner К. Acylacton-Umlagerung. 18. Die Umlagerung von a-Cyanlacto-nen. - Chetn Ber., 1962,95, N 2, S. 281-294.
452. Synthesis of some ureidodihydrofurans and related pyrimidoncs as potential antima-larials / E.C2ampaigne, R.L.EIlis, M.Bradford, J.Ho. - J. Med. Chem., 1969,12, N2,p. 339-342.
453. грред Д. Пираны. - В кн.: Гетероциклические соединения / Под ред. Р.Эль-Дерфильда. м.: Изд-во иностр, лит., 1953, Т. 1, с.269-310.
454. Навзонек С. Кумарины. - В кн.: Гетероциклические соединения / Под ред. Р.Эльдерф^едедд од . Изд-во иностр, лит., 1954, т. 2, с. 153.
455. kilter A. Oxygen heterocyclic molecules. - Int. Rev. Sci. Org. Chem. Ser., 1973, 4, p. 203-^з7
456. Гетероциклы в органическом синтезе / И.Ф.Бельский, Г.Н.Дорофеенко, Н.С.Простдков и др. — Киев : Техшка, 1970. - 384 с.
457, Hferlini I.. Advances in the chemistry of chrom-3-enes. - Adv. Heterocycl. Chem., 1974. 18, p 159-198.
458. Taleban A.T., Schroth W., Fischer G. Pyrylium salts. - Ibid., 1969, 10, p. 241-326.
459. Чромоненков В.К., Шаранин Ю.А. Реакции циклизации нитрилов в аминопроиз-
водные тирана, тио (селено) пирана. - Черкассы, 1978. - 28 с. - Рукопись деп. в ОНИИТЭХим^ 1859-79 Деп.
460. Freeman F. Reactions of malononitrile derivatives. — Synthesis, 1981, N 12, p. 925- 9S4
46]. frbrbarwar M„ Sundaramurthy F. Syhthesis of coumarins with 3 : 4-fused ring systems and their physiological activity. - Ibid., 1982, N 5, p. 337-388.
462. h/слер О., Шудель П. Методы синтеза в области каротиноидов и витамина А. -В кн.: Усцехи органической химии / Под ред. ИЛ.Кнунянца. М. : Мнр, 1966, т. 4, с. 124—238.
463. Pjebscher J., Hartmann Н. Zur Chemie aktivierter Vinylhalogenidc. Synthese und ReaktionsvQfhjiiten von 3-0-Chlorvinyl) acrylnitrilcn. - J. prakt. Chem., 1976, 318, N 5,
464. a., Schleyer P. Nitriles and isonitriles as proton acceptors in hydrogen
bonding. Correlation of OH with acceptor structure. - J. Amer. Chem. Soc. 1963. 85, N 7, P.866-87C).
164
465. Intramolecular hydrogen bonds. 3. Cyanoalkanols / N.Mori, S.Omura, H_Yama-kawa, Y.Tsuzuki. - Bull. Chem. Soc. Jap., 1965, Зв, N 10, p. 1627-1630. *
, 466. Kalvoda J., Botta L. Eine neuartige radikalinduzierte intramolekulare Gruppenu-bertragung. Synthese von 18-Cyancorticosteroiden. - Helv. chim. acta, 1972 SS N 2 S. 356-366. ’ *
467. Junek H. Synthesen mit Nitrilen. Mitt. 10. Addition yon TetracyahSthylen an 4-Hydroxycumarine. - Monatsh. Chem., 1965, 96, N 5, S. 1421-1426.
468. Junek H„ Aigner H. Synthesen mit Nitrilen. Mitt. 30. Die direkte Tetracyanalkylierung von Chinisatin mit Malonsluredinitril. - Ibid., 1971, 102, N 2, S. 622—626.
469. Шмушкевич Дж. Енамины. ~ В кн.: Успехи органической химии / Под ред. ИЛ -Кнунянца. М.: Мир, 1966, т. 4; с. 5-123.
470. El-HashashM., Mohamed М.М. Some reactions with arylidene malononitrile, malonic add and malonic ester. - Pakistan J. Sc’i. and Ind. Res., 1977, 20, N 6, p. 325-329.
471. Otto H.-H., Sinus O. Heterocyclen durch Michael-Reaktionen. Mitt. 6. Synthese von benzo[h]chinolin-2-onen. - Arch. Pharm., 1979, 312, N 6, S. 548-550.
472. Bhadsher C.K., Willis T.G. a-Acyl-o-tolunitriles as intermediates in the preparation of 3-substituted isoquinolines and l-amino-2-benzopyrylium derivatives. - J. Org. Chem., 1978,43, N 20, p. 3817-3820.
473. Liebscher J., Hartmann H. Zur Bildung von 2-Aminopyryliumsalzen aus 0-Hydro-xyvinyl bzw. d-AminovinylacrylsSure-Derivaten. - Z. Chem., 1973, 13, N 4, S. 132-133.
474. Czemey P., Hartmann H. Heterocyclisch substituirte Cumarine aus 0-chloropropen iminiurtisalzen. - J. prakt. Chem., 1982,324, N 2, S. 255-266.
475. Жмуренко Л.А., Глозман O.M., Заеоревский B.A. Синтез азааналогов 2-ами-нохромона. - Химия гетероцикл, соединений, 1974, № 12, с. 1616-1619.
476. А- с. 403673 (СССР). Способ получения 2-амино-4Н-пирано( 2,3-Ь] пиридина ( В.А.Загоревский, О.М.Глозман, Л.А.Жмуренко. - Опубл, в Б.И., 1973, №43.
477. /Ьг 3932466 (США). Substituted 2-amino chromones and process for the preparation thereof / RE.Brown, D.M.Lustgarten. — Опубл. 13.01.76.
478. Пит. 4024160 (США). Substituted 2-amino chromones and process for the preparation thereof / R.E.Brown, D.M.Lustgarten. - Опубл. 17.05.77.
479. A. c. SS3040 (СССР). Способ получения 2-амино-3-(гет)арил-4Н-арено(Ь]-пиран-4-оиов / Ю.М.Волавенко, Ф.С.Бабичев, В.АЛитенко. - Опубл, в Б.И., 1981, №43.
480. Литенко В.А., Воловенко Ю.М., Бабичев Ф.С. Конденсированные 2-амино-З-(бензимидазол-2-ил)арено]Ь]пираны. - Укр хим. журн., 1983, 49, № 11, с. 1202—1204.
481. Аннелирование (4Н) -2-аминопиран-4-онового цикла к аренам / Ю.М.Волов емко, В.АЛитенко, А.Д.Капустян, Ф.С.Бабичев. - Докл. АН УССР. Сер. Б, 1981, № 7, с. 40-43.
482. Гетероциклические енамннокетоны в ряду (7Н) -тиено] 3,2-Ь] пиранонов / Ю.М.Воловшко, В.АЛитенко, Т.В.Шокол, Ф.С.Бабичев. - Там же, 1982, № 7, с. 42-43.
483. Аннелирование 2-аминопиран-4юнового цикла к конденсированным тиофенам / Ю.М.Воловенко, В.АЛитенко, Т.В.Храпак, Ф.С.Бабичев. - Химия гетероцикл, соединений, 1983, № 11, с. 1476—1478.
484. Studies on ketene and its derivatives. 40. Reaction of diketenc with ethyl cyanoacetate and malononitrile / T.Kato, Y.Kubota, M. Tanaka et al. - Heterocycles. 1978, 9, N 7, p. 841-844.
485. Kato T., Katagiri C.. Sato R. Ring transformation of 5-oxo4-oxaspiro|2,3]hexa-nes. - Chem. Pharnt. Bull.. 1981, 29, N 8, p. 2361-2366.
486. Исследование производных индола. 13. Реакция 1-(1-метил-2-мстоксикарбо-иилиндол-3-ил)-2Д-бис-метилтиоакрнлонитрила / G.Kobayashi, Y. Matsuda, R.Natsuki, Y.Tomiaga. — J. Pharm. Soc. Jap., 1972, 92, N 6, c. 713—718. — РЖ Химия, 1972, 24Ж336.
487. Синтез З-ациламииЬ-2-бензопирийиевых солей / Г.Н.Дорофеенко, С.В.Кривун, В.И.Дуленко, Е.И.Садекова. - Жури, орган, химии, 1970, 6, № 7, с. 1519-1520.
488. Дорофеенко Г.Н., Кривун С.В.. Садекова Е.И. Синтез 3-ациламиио- и 3-карб-этокси-2-бензопирнлиевых солей. — Химия гетероцикл, соединений, 1971,№6,с. 730-732.
165
489. Abdel-Rahman A.H., Kandeel E.M. , Reactions of some benzofuran derivatives with amides, nitriles and hydrazines. - J. Indian Chem. Soc. 1981, 58, N 4, p. 404-407.
490. Гудриниеце Э.Ю., Пахурова Т.Ф., Лиепиныи Э.Э. Конденсация днкарбоиильнык соединений с малононитрилом. 10. 2-Формилднмедон в реакции с малононитрилом. -Журн. орган, химии, 1982,18, № 11, с. 2361-2363.
491. Matusch R., Hartke К. Zur Kondensation von Acetonylaceton mit Cyanessigester. -Chem. Ber., 1972, 10S, N 8, S. 2594-2603.
492. Ducker J.W., Gunter MJ. The reaction of malononitrile with some Д-dicarbonyl compounds. - Austral. J. Chem., 1975,28, N 3, p. 581-590.
493. Hoyben J., Pfnakuch E. Uber Iminolactone und Salze ungcsattigter Nitrile. - Be-richte, 1926,59, T. 2, S. 1594-1605.
494. Baker W„ Howes C.S. Stereochemistry of arylidenecyanoacetic acids and aryli-deneacetonitriles. - J. Chem. Soc., 1953, N 1, p. 119-124.
495. Schiemenz G.P. Synthesen mit Cyanessigsaure. 3. Reaktion von 2-Hydroxyben-zaldehyd mit Cyanacetamid und Malodinitril. - Chem. Ber., 1962, 95, N 2, S. 483-486.
496. Yasuda H., Midorikawa H. The knoevenagel reaction between hydroxybenzalolehy-des and ethyl cyanoacetate. - Bull. Chem. Soc. Jap., 1966, 39, N 8, p. 1754-1759.
497. Czemey P., Hartmann H. Zur Darstellung von 3-Cyancumarinen. - J. prakt. Chem., 1981, 323, N 4, S. 691-693.
498. Пат. 564061 (Швейцария). Vurfahren zur Herstellung in Wasser schwer loslicher Cumarinimidverbindungcn / W.Koch. — Опубл. 15.07.75.
499. A convenient synthesis of cumarin-3-thiocarboxamides / J.S.A.Brunskill, A.De, Z.Elagbar et al. - Synth. Commun., 1978, 8, N 8, p. 533-539.
500. Аветисян А. А., Ванян Э.В., Данеян M.T. Синтез функционально замещенных кумаринов. - Химия гетероцикл, соединений, 1979, №9, с. 1181-1182.
501. Fujimoto A., Sakurai A. A new selective preparation of 4H-chromenes by reaction alkyl cyanoacetate with 3,5-dibromosalicylaldehyde in the presence of ammoniun acetate. — Synthesis, 1977, N 2, p. 871-872.
502. Renzi G., Mascagni P., Piumelli E.I. Reaction 2-hydroxybenzaldehyde and ethyl cyanoacetate: a re-examination. - Bull, chim., 1981, 120, N 9, p. 525-527. - РЖ Химия, 1982, 9Ж278.
503. Sakurai A., Motomura Y„ Midorikawa H. Substituted benzopyranopyridopyrimi-dine ring synthesis by the ternary condensation of malononitrile, salicyialdehyde, and aromatic ketones in the presence of ammonium acetate. - J. Org. Chem., 1972, 37, N 7, p. 1523-1526.
504. Руайе P. Синтез гетероциклов с помощью галогенводородных солей пиридина. - Химия гетероцикл, соединений, 1977, №5, с. 579-594.
505. Шаранина Л.Г., Баранов С.Н. Синтез бензопирилиевых солей с функциональными амино- и цианогруппами. - Там же, 1972, № 1, с. 132-133.
506. Czemey Р„ Hartmann Н. Synthese und Charakterisierung von 2-aminochromeny-lium-salzen. - Z. Chem., 1981,21, Nil, S. 408-409.
507. Пат. 616445 (Швейцария). Verfahren zur Herstellung von sulfonsauregruppen-freien besischen Farbstoffen / B.Gertisser, B.Henzi. - Опубл. 31.02.80.
508. Пат. 3044128 (ФРГ). Cumarine, Verfahren zu ihrer Herstellung ung ihre Verwen-dung/ H.Harnisch. - Опубл. 15.07.82.
509. Пат. 3801602 (США). 2-Imino-6-amino-substituted coumarins / H.Scheuermann, V.Radke. - Опубл. 02.04.74.
510. Пат. 2807761 (ФРГ). Cumarindcrivate / Ch. Vamvakaris. - Опубл. 30.08.79.
511. Пат. 2553294 (ФРГ). Farbstoffc der Cumarinreichc / M.Patsch., Ch. Vamvakaris. - Опубл. 16.06.77.
512. Пат. 2415661 (ФРГ). Hctcrocyclische farbstoffe / H.Scheuermann, W.Mach, D.Au-gart. - Опубл. 23.10.75.
513. Пат. 580610 (Швейцария). Verfahren zur Herstellung von Thiadiazin-1,1-dioxiden / W.Koch. - Опубл. 15.10.76.
166
514. Пат. 559764 (Швейцария). Verfahren zur Herstellung in Wasser schwer loslicher heterocyclischer Verbindungen / W.Koch. - Опубл. 14.03.75.
.515. Sintesi di derivati del 4,9-dimetossi-5-metil-7H-furo[3,2-g]-l-benzopirano-6-carbos-si-7 one / V.L.Pecori, G.Auzzi, P.Papini, F.Bruni. - Farmaco. Ed. sci., 1975,30,N9,p. 754-760.
516. Convenient synthesis of some substituted 5H, 11 H-pyrano(3', 2': 6,7][l]benzopyra-no[3,4-c|pyridines and 7,9-dioxa-3,4,6-triazabenzo(de]naphthacenes / O.-H.Hishmat, N.M.A.E1-Ebrashi, Sh.E.El-Naem et al. - Synthesis, 1982, N 12, p. 1075-1077.
517. Junek H. Synthesen mit Nitrilen. Mitt. 5. Kondensationen von o-Hydroxybenzal-dehyden mit dimerem Maionsauredinitrile. - Monatsh. Chem., 1963, 94, N 1, S. 192-196.
518. Simple synthetic route to ’’oxodeazaflavins” (2H-(l]benzopyrano(2,3-d]pyrimi-dine-2,4(3H)-diones / D.J.Blythin, M.S.Domalski, Y.C.Kim et al. - Heterocycles, 1981, 16, N 2, p. 203-207.
519. Новый синтез 2-аминобензопирилиевых солей / Ю.А.Шаранин, Х.Я.Лопатин-ская, Л.Г.Шаранина, С.Н.Баранов. - Химия гетероцикл, соединений, 1974, № 9, с. 1293.
520. Sakurai A., Midorikawa Н. The condensation of active methylene compounds with hydroxybenzaldehydes by ammonium acetate.- J. Org. Chem., 1969, 34, N 11, p. 3612-3615.
521. Sakurai A.. Motonura Y., Midorikawa H. The synthesis of heterocyclic compounds by the ternary condensation of malononitrile, salicylaldehyde, and aliphatic ketons in the presence of ammonium acetate. - Bull. Chgm. Soc. Jap., 1973, 46, N 3, p. 973-977.
522. Ried W., Nyiondi-Bonguen E. Uber die gemeinsame Einwirkung von Schwefel und methylenaktiven Nitrilen oder Ammoniate auf 2-Hydroxyacetophenon. — J. Lieb. Ann. Chem., 1973, Nl, S. 134-140.
523. Rappoport Z„ Ladkani D. Nucleophilic attacks on carbon-carbon double bonds. Pt 10. Reaction of active methylene compounds with electrophilic olefins. Formation of substituted 2-amino4-cyano-4H-pyrans. - J. Chem. Soc. Perkin Trans. Pt 1, 1974, N 22, p. 2595-2601.
524. Junek H., Aigner H. Synthesen mit Mitrilen. 31. Chromene und chinoline durch Tetracyanalkylierung von cyclischen 1,3-Diketonen. - Z. Naturforsch. B, 1970, 25, N 12, S. 1423-1426.
525. Простые методы получения производных 2-амиио-3-циан-4Н-пиранов / Ю.Т.Абраменко, Н.А.Борщев, Н.Б.Всеволожская и др. — В кн.: Новые химические средства защиты растений. М. : НИИТЭХИМ, 1979, с. 7-11.
526. Шаранин Ю.А. Реакции циклизации нитрилов. 2. Взаимодействие арилиденовых и фурфурилиденовых производных малононитрила с щавелевоуксусным эфиром. - Журн. орган, химии, 1980, 16, № 10, с. 2186-2192.
527. Соколова Л.Н., Полянская А.С., Абоскалова И.И. Химия нитроацетонитрила. -В кн.: XXYII Герценовскиечтения : Химия. Л., 1975, с. 25-27.
528. Химия цианнитроалкенов. 2. Синтез и строение гетерилцианнитроалкенов / Л.Н.Соколова, А.С.Полянская, Н.И.Абоскалова и др. - В кн.: XXX Герценовские чтения : Химия. Л., 1977, с. 59-63.
529. Реакции циклизации нитрилов. 6. Синтез 2-амино-4-(2-фурил)-4Н-пиранов / Ю.А.Шаранин, Л.Н.Щербииа, Л.Г.Шаранина, В.В.Пузанова. - Жури, орган, химии, 1983, 19, №1, с. 164-173.
530. Шаранина Л.Г., Марштупа В.П, Шаранин Ю.А. Синтез 6-амино-5-циано-1Н-4Н-пиразоло] 3,4-Ь| пиранов. - Химия гетероцикл, соединений, 1980, № 10, с. 1420.
531. 6-Амино-5-циано-1Н,4Н-пиразоло[ 3,4-Ь] пираны / Л.Г.Шаранина, В. К. Промоненков, В.П.Марштупа и др. - Там же, 1982, № 6, с. 801-806.
532. Шаранин Ю.А., Шаранина Л.Г., Пузанова В.В. Реакции циклизации нитрилов. 7. Синтез 6-амино4-арил-3-метил-5-циано-1Н,4Н-пиразоло[3,4-Ь] пиранов. - Журн. орган, химии, 1983, 19, № 12, с. 2609-2615.
533. Activated nitriles in heterocyclic synthesis. A novel synthesis of pyrano[2,3-c]py-razoles / S.Abdou, S.M.Fahmy, K.U.Sadek, M.H.Elnagdi. - Heterocycles, 1981, 16, N 12, p. 2177-2180.
534. A new route to 4H-pyrano[2,3-c]pyrazoles / G.Tacconi, G.Gatti, G.Desimoni, V.Mes-sori. - J. prakt. Chem., 1980, 322, N 5, p. 831-834.
167
535. Junek H., Aigner H. Reaktionen von TetracyanXthylen mit Heterocyclen. - Chem. Ber., 1973,106, N 3, S. 914-921.
536. Activated nitriles in heterocyclic synthesis. A novel synthesis of pyrazolo[l ,5-a] pyrimidines and pyrano(2,3-c]pyrazoles / H.A.Elfahham, F?M. Abdel-Galii, J.R.Ibraheim, M.H.Elriagdi. - J. Heterocycl. Chem., 1983,20, N 3, p. 667-670.
537. Шаранин Ю.А., Кяокол ГВ. Простой подход к производным 7-амино-5Н-пи-рано[ 2,3-d] пиримидин-2,4 (1Н, ЗН)-дионам. - Химия гетероцикл, соединений, 1983, 1*2,с.277.
538. Higashiyama К., Otomasu Н. Spiro heterocyclic compounds. 3. Synthesis of spi-ro(oxindole-3,4'-(4’H-pyran)]compounds. - Chem. Pharm. Bull., 1980, 28, N 2, p. 648-651.
539. Higashiyama K., Otomasu H. Spiro heterocyclic compounds. 4. Synthesis of spiro-(oxindole-3,4'-(2',3,-dihydro-4’H-pyran)]- and spirooxindole-3,4'-(r,4'-dihydropyridine) compounds. - Ibid., N 5, p. 1540-1545.
540. Fujimaki T„ Otomasu H. Spiro heterocyclic compounds. 5. Synthesis of spirofho-mophtalimide-4,4'-(4’H-pyran)] compounds.- Ibid., 1982, 30, N 4, p. 1215-1220.
541. Пат. 2235406 (ФРГ). 2-Amino4H-pyrane, Verfahren zu ihrer Herstellung sowie ihre Verwendung als arzneimittel / H.Meyer, F.Bossert, W. Vater, K.Stoepel. - Опубл. 07.02.74.
542. Apsimon J.W., Hooper J.W., Laishes B.A. Potassium fluoride catalyzed reactions between malononitrile and a, ^-unsaturated ketones. - Can. J. Chem., 1970, 48, N 19, p. 3064-3075.
543. Michael condensation of furochalkones with ethyl acetoacetate, ethyl cyanoacetate, acetylacetone, malonamide and N.N'-dibenzylmalonamide / G.Aziz, M.H.Nosseir, N.L.Doss, S.F.Selim. - Indian J. Chem. B, 1976,14, N 7, p. 499-503.
544. Reactions with heterocyclic 0-enamiboesters. A Novel synthesis of 2-amino-3-etho-xycarbonyl-(4H-pyrans / M.R.H.Elmoghayer, M.A.E.Khalifa, M.K.A.Ibraheim, M.H.Elnagdi. -Monatsh. Chem., 1982, 113, N 1, p. 53-57.
545. Khalifa M.A.E., Tammam G.H., Zayed E.M. The reactivity of a-cyanochalcones as michael acceptors. - Curr. Sci., 1981, SO, N 10, p. 441-442.
546. Khalifa M.A.E., Tammam G.H., Zayed E.M. The reactivity of a-cyanochalconesas michael acceptors. - Ibid., N 14, p. 615-617.
547. Quinteiro M„ Seoane C„ Soto J.L. Heterocycle synthesis. 11. 6-Amino-4-(ortho-aryl)-2-phenyl-4H-pyrans. - An. Quim., 1978, 74, N 4, p. 678-679.
548. Quinteiro M., Seoane C., Soto J.L. Synthesis of heterocyclic compounds. 7. 6-Ami-no-2,4-diaryl-3,5-dicyano-4H-pyrans. - Tetrahedron Lett., 1977, N 21, p. 1835-1836.
549. Quinteiro M„ Seoane C„ Soto J.L. Synthesis of heterocyclic compounds. 8. 4H-Py-rans from a-benzoylcinnamonitriles. - J. Heterocycl. Chem., 1978, 15, N 1, p. 57-61.
550. Quinteiro M., Seoane C.. Soto J.L. Sintesis de heterociclos. 9. 4H-Piranos a partir de a-b«nzoilcnamatos de etilo. - Rev. roum. chim., 1979, 24, N 6, p. 859-864.
551. Otto H.-H. Zur Reaktion von Diarylidencyclohexanonen mit Malondinitril. Reaktionen von l,4-Pentadien-3-onen. Mitt. 5. - Arch. Pharm., 1974, 307, N 5, S. 367—372.
552. Otto H.-H. Umsetzungen verschiedener Propenon-Systeme mit Cyanacetamid. Reaktionen von l,4-Pentadien-3-onen. Mitt. 16. - Monatsh. Chem., 1978, 109, N 3, S. 681-693.
553. Otto H.-H., Rinus O., Schmelz H. Zur Synthese von 4-Aryl-5,6-dihydrobenzo[h] chinolinen. Heterocyclen durch Michael-Rerrtionen. Mitt. 2. - Ibid., 1979,110, N1, S. 115-119.
554. Activated nitriles in heterocyclic synthesis. Novel synthesis of pyrazolo(5,6 : 3’4']py-rano[5,4-b|isoxazoles / S.I.Aziz, B.Y.Riad, H.A.Elfahham, M.H.Elnagdi. - Heterocycles, 1982, 19, N 12, p. 2251-2254.
555. Activated nitriles in heterocyclic synthesis. Novel synthesis of pyrrolo(l,2-c]imi-dazole and pyrano(2,3-d]imidazole derivatives / H.A.F.Daboun, S.E.Abdon, M.M.Hussein, M.H.Elnagdi. - Synthesis, 1982, N 6, p. 502-504.
556. Reactions with 4-substituted-2-isoxazolin-5-ones / A.H.Harhash, M.H.Elnagdi, N.A.L.Kassab, M.Abdalla. - J. Chem. Eng. Data, 1975,20, N 1. p. 120-122.
557. Synthesis of 5H-in<ieno(l,2-b]pyridine, 9H-indeno[2,l-c]pyridine, and 7,8-dihydro-6H13H-[l)benzopyrano(4,3-d]indeno-(l,2-b]pyridine derivatives / I.I.Abdel-Gawad. A.M.Kad-dah, AM.Khali et al. - Indian J. Chem. B, 1981, 20, N 1, p. 37-38.
168
558. Elkasaby M.A. Michael condensation of ethyl a-acetylcinnamates with diethyl ma-lonate, deoxybenzoin, ethyl phenylacetate, benzyl 'cyanide and malononitrile. - Ibid., 1976, 14, N 10, p. 739—741.
559. Пат. 12901 (Япония). Метод получения 0-К-0-(4-оксикумарил-3)пропионовой кислоты/М.Масубути. - Опубл. 23.06.63.
560. Пат. 3097213 (США). Warfarin intermediates/С. Wiener, C.H.Schroeder, K.P.Link. -Опубл. 09.07.63.
561. Шаранин Ю.А., Клокол ГВ. Синтез 2-амино-4Н-хроменов. - Журн. орган, химии, 1983, 19, №8, с. 1782-1784.
562. Синтез З-циано-4-перфторал кил-7-(диэтиламино) кумаринов / А.Я.Ильченко, Р.Е.Ковальчук, В.И.Крохтяк, Л.М.Ягупольский. - Там же, 1982, 18, № 12, с. 2630-2631.
563. Czerney Р., Hartmann И. Ein einfacher Zugang zu 7-N,N-DiaJkyiamjno-3-cyan-2-N (p, 0-dicyanvinyl)iminocumarinen. - Z. Chem., 1982, 22, N 11, S. 406-407.
564. Шаранин Ю.А., Клокол Г.В. Синтез 2-амино-4-арил-4Н-нафто{2,1-Ь] пиранов. -Журн. орган, химии, 1982, 18,№ 9, с. 2005 -2006.
565. Peseke К., Suarez I.Q. Synthesen mit 1.3-Dithietanen; Darstellung von 4H-Pyran-3-carbons5urederivatcn. - Z. Chem.-, 1981, 21, N 11, S. 406.
566. Eugster C.H, Leichner L., Jenny E. Kondensationsreaktionen mit Isoxazolen. Eine Erwciterung der Rittcr-Reaktion. - Helv. chim. acta, 1963,46, N 2, S. 543-571.
567. Szabtf И, Borda I., Theisz E. A Kromon reakcioja hidroxilaminnal. - Magy. kem. folyoirat, 1978, 84, N 3, p. 134-137.
568. Szabtf V., Borda I. Ringumwandlung von Chromon in 4-lJydroxycuniarine. - Acta chim. Acad. sci. hung., 1977, 95,№ 2/3, S. 333-334. - РЖ Химия, 1979, 6Ж202.
569. Ахрем А.А., Лахаич Ф.А., Хрипач В.А. Производные изоксазола в синтезе бифункциональных соединений путем расщепления гетероцикла. - Химия гетероцикл, соединений, 1981, № 9, с. 1155-1173.
570. Junek Н., Sterk Н. Zum Problem der Michael-Addition an Cumarin. - Monatsh. Chem., 1967.98, N 1, S. 144-150.
571. Reynolds G.A., Van Allan J.A., Petropoulos C.C. The reactions of 4-dicyanomcthy-lene-2-phenyl-4H-(lJbenzopyran and some benzologs with nucleophiles. - J. Heterocycl Chem., 1970, 7, N 5, p. 1061-1069.
572. Cushman M„ Mathew I. Novel synthesis of the tetracyclic ring system present in streptonigrin. - J. Org. Chem., 1981, 46, p. 4921-4923.
573. Van der Plus H.C. Ring transformations of heterocycles. - London : Now York : Acad, press, 1973. - Vol. 1.484 p.
574. Пат. 81582 (ПНР). Srodek barwiacy stanowiacy stezone kwasne rostwory soli kationowych barwnikow z szeregu 1,2-piranu. - Опубл. 30.04.76.
575. Aurich H.G. Zum Mechanismus der Autoxydation von Nitrilen in Gogenwart von Bason. - Tetrahedron Lett., 1964, N 12. S. 657-658.
576. Hedayatullah M„ Binick A., Denivelle I.. Action du bromure de cyanogene sur guel-gucs orthodiphenols. - C.r. Acad. sci. C, 1970, 271, N 25. p. 1599-1601.
577. A study of the mechanism of cyanogen bromide activation of cellulose / G.J.Bart-ling. H.D.Brown, L.J Forrester et al. - Biotechnol. and Bioeng., 1972. 14, N 6, p. 1039-1044.
578. Доелатян B.B., Констанян Д.А. Синтез производных 1,3-диоксолана. - Химия гетероцикл, соединений, 1974, № 2, с. 186-188.
579. А.с. 266776 (СССР). Способ получения 2-трихлорметил-4-имино-1,3-диоксо-лана или 2-трихлорметил-4-имиио-5-алкил (или 5,5-диалкил)-1,3-диоксолана / В.В.Дов-латян, Д.А.Констаняи. - Опубл, в Б. И., 1973, № 3.
580. Robert A.. I.c Marechai A. Preparation of derivatives of a new heterocyclic system. 2-N-Acylimino-1,3-o.xaselenolcs. - .1. Chem. Soc. Chem. Communs, 1978. N 10. p. 447-448.
581. Bandy M.. Robert A., Foucand A. Reaction of N-substitutcd thioamidcs with gem-dicvano epoxides. A new synthetic route to anhydro-4-hydroxvthiazolium hydroxides. — J. Org. Chem.. 1978, 43, N 19. p. 3732-3736.
582. Wagner-Jauregg T.. Jlarig M. fiber Derivatc und Analoge des 2-lmino-1.3-Oxathiacyc-lopentans (2-lmino-1.3-oxatiolans). — Helv. chim. acta. 1958, 41, N 2, S. 377—385.
169
22
583. Тищенко И.Г., Станишевский Л.С., Гузиков А.Я. Взаимодействие а, (3-эпок-сикетоиов с роданистоводородной кислотой. - Химия гетероцикл, соединений, 1971, №3, с. 90-91.
584. Фокин А.В., Коломиец А.Ф. Химия тииранов. -• М. : Наука, 1978. - 334 с.
585. Haufe G., Muhlstlldt М. UngewShnliche Reaktion von trans-2-bromcyclohexanol mit kaliumthiocyanat. - Tetrahedron Lett., 1978, N 4, S. 341-344.
586. Studies on geometrical isomerism by nuclear magnetic resonance. 5. Stereochemistry of 5-substituted 4-alkoxycarbonyl-2-carbamoylimino-l,3-oxathiolanes / T.Hayashi, M.Aka-no, T.Yokono et al. - Bull. Chem. Soc. Jap., 1972, 45, N 2, p. 578-584.
587. Hayashi T. Mercaptoacetate derivatives. 1. Reaction of thiocyanatoacetic esters with aldehydes. - Ibid., N 5, p. 1507—1515.
588. Schulze B., Muhlstlldt M. Die Thiocyanatgruppe als intramolekularer Ringschluppart-ner. - Z. Chem., 1979,19, N 2, S. 41-48.
589. Корнфорт Дж. Оксазол и его производные. - В кн.: Гетероциклические соединения / Под ред. Р.Эльдерфильда. М. : Изд-во иностр, лит., 1961, т. 5, с. 242-339.
590. Lakhan R., Temai В. Advances in oxasole chemistry. — Adv. Heterocycl. Chem., 1973,17, p. 100-213.
591. Turhci I., Dewar MJ.S. The chemistry of oxazoles. - Chem. Revs, 1975, 75, N 4, p. 389-437.
592. Шаранин Ю.А., Промоненков В.К. Синтез амииоокса(изокса)эолов. - М., 1978. - 30 с. - (Обзор, информ. / НИИТЭХИМ. Сер. Хим. средства защиты растений).
593. Пат. 7546 (Япония). Получение производных циклогепгапиррола / Г.Суна-гава, М.Ватая. - Опубл. 16.03.70. - РЖ Химия, 1971,6Н257П.
594. Malik A., Afza N., Siddiqui Si Some extensions of von braun (BrCN) reaction of organic bases. Pt 2. - Z. Naturforsch. B, 1982, 37, N 4, p. 512-518.
595. Crank G., Faults MJ. Derivatives of 2-aminooxazoles showing antiinflammatory activity. - J. Med. Chem., 1971,14, N 11, p. 1075-1077.
596. Пат. 1264258 (Великобритания). Antiinflammatory oxazole derivatives / G. Crank. — Опубл. 16.02.72.
597. Пат. 1328205 (Великобритания). Oxazolotriazines / G.Crank. - Опубл. 30.08.73.
598. Antianaphylactic agents. 1. 2-(Acylamino)oxazoles / W.J.Ross. R.G.Harrison, M.R.J.Jolley et al. - J. Med. Chem., 1979, 22, N 4, p. 412-417.
599. Пат. 1497537 (Великобритания). 2-Aminooxazole derivatives / M.C.Neville, J.P.Verge. - Опубл. 12.01.78.
600- Gewald K., Schafer H., Plumbohm B. Notiz zur Reaktion von Mandelsliurenitril mit Cyanamid. — J. prakt. Chem., 1973, 315, N 1, S. 44-46.
601. An improved synthesis of 2-amino-l ,3-oxazoles under basic catalysis / A.F.Cocke-rill, A.Deacon, R.G.Harrison et al. - Synthesis, 1976, N 9, p. 591-593.
602. Rapi G., Ginanneschi M., Chelli M. Synthesis of 17p-(2-aminooxazol-4-yl)steroids. J. Chem. Soc. Perkin Trans. Pt 1, 1975, N 19,p. 1999-2001.
603. Sanchez R.A., Orgel L.E. Studies in prebiotic synthesis. 5. Synthesis and photo-anomerization of pyrimidine nucleosides. - J. Mol. Biol., 1970, 47, N 3, p. 531-543.
604. Пат. 3658788 (США). Aminooxazolines and products thereof and processes for synthesizing same / L.Orgel. R.A.Sanchez. — Опубл. 25.04.72.
605. Shannahoff D.H., Sanchez R.A. 2,2'-Anhydropyrimidine nucleosides. Novel synthesis and reactions. - J. Org. Chem.. 1973, 38, N 3, p. 593-598.
606. Пат. 3920630 (США). 2,2'-Anhydroazacytidine compounds and process of preparation / W.J.Wecnter, D.T.Giah. - Опубл. 18.11.75.
607. Synthesis and structural study of 2-amino-2-oxazolines as antihypertensive agents / C.Jarri, R.Golse, G.Devaux et al. - Bull. Soc. pharm. Bordeaux, 1981, 120, N 3/4, p. 153-162.
608. Шаранин Ю.А. Реакции циклизации нитрилов. 1. Синтез 2-амино-4,5-диарил-н дигегерилоксазолов. - Журн. орган, химии, 1980,16,№ 10, с. 2185-2188.
609. Пат. 118241 (Дания). Fremgangsmade til fremstilling of 2-aminooxazoliner eller syreadditionssalte heraf / G.LPoos. - Опубл. 14.12.70.
170
610. Freiter E.R., Abdallah A.H., Strycker S.J. Some 2-amino-5-substituted oxazoliges and intermediates as potential anoreactants. - J. Med. Chem., 1973, 16, N 5, p. 510-512.
611. Hamden M.R., Rasmussen R.R. Synthesis of compounds with potential central nervous system Stimulant activity. 2. 5-Spirosubstituted 2-amino-2-oxazolines. - Ibid., 1970, 13, N 2, p. 305-308.
612. Trepanier D.L., Faith H.E., Eble NJV. Synthesis and scraning for antidepressant activity of some aminoindanooxazolines, aminoindanooxazines, and aminoacenaphtooxazo-lines. - Ibid., N 4, p. 729-733.
613. Пат. 3577428 (США}. 2-Amino-4-aryloxyalkyl-4-alkyl-2-oxazolines / J.Suh, J.A.Skorcz. - Опубл. 04.05.71.
614. Tanaka C, Ogata I., Nishida M. Синтез производных оксазолкарбоновых кислот. 13. Гидрогенолиз аминооксазолов. 6. Синтез и гидрогенолиз 2-амино-2-оксазоли-нов. - J. Pharm. Soc. Jap., 1977, 92,№ 2, с. 157-164. - РЖ Химия, 1978, 4Ж314.
615. Wollweber Н.. Hiltmdnn R. Stereospezifische Cyclisierungen a, co-disubstituierter Amino3thanole. Mitt. 1. l-Aryl-3-amino-3H-oxazolo[3,4-a]perhydropiridine шх! Verwandte -Arch. Pharm., 1973, 306, N 4, S. 284-299.
616. Wollweber H., Pohl H.U., Stoepel K. Stereochemische Untersuchungen uber Arznei-mittel. Mitt. 7. l-Phenyl-3-iminoperhydro-3H-thiazolo[3,4-a]pyridine. Stereochemie und blutdrucksteigernde Wirksamkeit. - Eur J. Med. Chem., 1978, 13, N 2, p. 141-148.
617. Матвеев И.С. Исследование реакций эпихлоргидрина с фенил- и бутилциана-мидами. - Изв. вузов. Химия и хим. технология, 1972, 15, N* 2, с. 231-233.
618. Synthesis of N-acetyl derivatives of 170-(2-aminooxazol-4-yl)steroids and revised structure of N-acetylated 4 or 4,5-disubstituted 2-aminooxazoles / G.Rapy, M.Ginaneschi, M.Chelli, A.Biocelli. - J. Chem. Soc. Perkin Trans. Pt 1, 1978, N 3, p. 249-252.
619. Schuart J., Wendt U., Muller H.K. 2-Aminooxazole und 2-Iminooxazoline. Mitt. 4. Untersuchungen der Acetylierungsprodukte. - Pharmazie, 1974, 29, N 12, S. 763—765.
620. Schuart J., MSller H.K., Wendt U. 2-Aminooxazole und 2-Iminooxazoline. Mitt. 2. Darstellung, Eigenschaften und spektroskopische Daten von 2-Imino-3-alkyl(aryl)-4,5-diphe-nyloxazolinen. - Ibid., N 2, S. 100-102.
621. Schuart J., Muller H.K. 2-Aminooxazole und 2-Iminooxazoline. Mitt. 1. Reaktion von rac-a-Methylaminopropiophenon mit Bromcyan. - Ibid., 1973, 28, N 7, S. 438-439.
622. Schuart J., MSller H.K. 2-Aminooxazole und 2-Iminooxazoline. Mitt. 3. Ausgewahlte Beispiele der homologen Reihe 3-substituierter 2-lmino-4-methyl-5-phenyloxazoline. — Ibid., 1974, 29, N 3, S. 170-172.
623. Schuart J., Muller H, 2-Aminooxazole und 2-Iminooxazoline. Mitt. 5. Versuche ziir aromatischen substitution des thiophenes in l-Imino-5-thien-(2)-yloxazolinen. - Ibid., 1975, 30, N 2, S. 80-81.
624. Schuart J., Muller H. 2-Aminooxazole und 2-Iminooxazoline. Mitt. 6. 2-Imino-oxazoline-Synthesen mit Chlorcyan. - Ibid., S. 82-83.
625. Пат. 99795 (ГДР). Verfahren zur Synthese vor 2-Iminooxazoline- und 2-Imino-benzoxazolin-Derivaten / H.MBller, J.Schuart. - Опубл. 20.08.73.
626. Kampe K.-D. Synthesen mit 2-Amino-2-oxazolinen. 1. Reaktionen von 2-Amino-2-oxazolinen mit a, 0-ungesattigen Estern. - J. Lieb. Ann. Chem., 1974, N 4, S. 593-607.
627. Schuart J., Muller H.K. 2-Aminooxazole und 2-Iminooxazoline. Mitt. 8. Reaktionen mit 2-Aminobenzoxazolen. - Pharmazie, 1975, 30, N 3, S. 155-157.
628. Grigat E. Neue Umsetzungen mit Cyansaureestern. - Angew. Chem., 1972, 84, N21, S. 1008-1021.
629. Нат. 2239311 (ФРГ). 2-Aminooxazolo[4,5-b]pyridine / J. Phillipe. - Опубл. 22.02.73.
630. Simov D.A., Kalcheva V.B., Peshakova L.S. Cyanethylation of 2-aminobenzoxa-zoles. - Докл. Болг. Акад, наук, 1979, 32,№ 10, с. 1365-1368.
631. Пешакова Л.С., Каляева В.Б., Симов ДА. Синтез и некоторые реакции 3-N-замещенных 2-иминобензоксазолинов. - Химия гетероцикл, соединений, 1981, № 10, с. 1420.
171
22Х
632. Schuart J., Muller H.K., HSussner W. 2-Aminooxazoie und 2-Iminooxazoline. Mitt 7. Synthese von 2-Iminobenzoxazolinen. - Pharmazie, 1975, 30, S. 152-1'55.
633. Пат. 48-15936 (Япония). Способ получения производных аминооксазолина , Ц.Нонака, К.Ото. - Опубл. 18.05.73. - РЖ Химия, 1974, 5Н290П.
634. Fielden М.1.. The preparation of 5-(2Bromoethyl)-2-iminooxazolidines via the von Braun cyanogen bromide reaction. - J. Heterecycl. Chem., 1973, 10, N 5, p. 813-814.
635. Пешакова Л.С., Каляева В.Б.. Симов Д.А. 2-Аминооксазолы и их производные. - Химия гетероцикл, соединений, 1981, № 8, с. 1011-1024. 1
636. Clerin D., Kille G., Fleury J.-P. Heteroryclisation des teacylaminoamides. 4. Me-canismes d’ouverture et de foimation du cycle amino-5-oxazole. - Tetrahedron. 1974. 30, N 3, p. 469-474.
637. Sekiya M., Suzuki J. Azoic series. 3. Reactions of 2-acylamine-2-cyanoacetamides leading to 5-aminooxazole-4-canboxamides and to oxazolo(5,4-d]pyrimidines. - Chem. Pharm. Bull., 1970, 18, N 11, p. 2242-2246.
638. Sekiya M., Suzuki J. Azole series. 2. Reactions of 2-acylamino-2-cyanoacetamides leading to 5-acylaminooxazole-4-carboxamides and to oxazolo(5,4-djpyrimidines. - Ibid., N 6, p. 1233-1238.
639. Synthetic uses of openchain analogues of reissert compounds / W.E.McEwen, A.V.Grossi, R.J.DcDonald, A.P.Stamcgna. - J. Org Chem., 1980, 45, N 8, p. 1301-1308.
640. Gotz M., Zeile K. Mesoionic 3-aniino-5-ininooxazoline derivatives. - Tetrahedron. 1970, 26, N 13,p.3185-3193.
641. Ferris J.P., Orgel I..E. Studies in prcbiotioc synthesis. 1. Aminomalononitrile and 4-amino-5-cyanoimidazole. - J.Amer. Chem. Soc., 1S66. 88, N 16, p. 3829-3831.
642. Пат. 3670007 (США). Aminomalonitrile and method of preparation thereof / J.P.Ferris. - Опубл. 13.06.72.
643. Ohtsuka Y. Study on oxazolopyrimidines. 1. Synthesis and spectroscopic properties of 7-aminooxazolo[5,4-d|pyrimidines. - Bull. Chem. Soc. Jap., 1970. 43, N l,p. 187-191.
644. Hirobe M., Sato M., Okamoto T. Реакции N-аминопиридиниевых солей. 11. Реакция N-бензилиденамннопиридиниевых солей с цианид-ионом. Новый синтез производных 5-аминооксазолов. - Fac. Pharm. Sci.. 1971. 91, № 8, с. 834-840. - РЖ Химия, 1972.6Ж476.
645. Kruger U„ Zinner G. o-Acylierung von • N-cyanoalkyl-N-hydroxyharnstoffen. -Arch. Pharm., 1978, 311, N 7, S. 579-585.
646. Ketcham R., Schaumann E., Niemer T. Heterocyclic ringelosure reactions. 7. A facile synthesis of 5-imino-4-oxazolidinethioncs and 4-lhioxo-5-oxazolidones. - Synthesis, 1980, N 11, p. 869-870.
647. Condensation of reissert hydrofluoroboiatc salts with alkenes and alkynes / W.E.McEwen, C.C.CabclIo, M.A.Calabro et al. - J. Org. Chem., 1979, 44, N l.p. 111-117.
648. Vhattacharjee D., Popp F.D. Reissert compound studies. 35. Acidcatalyzed condensations of the phthalazine. Reissert compound salt. - J. Heterocycl. Chem., 1980, 17, N5,p. 1035-1040.
649. Popp F.D. Reissert compounds. — Adv. Heterocycl. Chem., 1968, 9, p. 1 -25.
650. Popp F.D. Developments in the chemistry of reissert compounds (1968-1978). -Ibid., 1979, 24, p. 187-214.
651. Popp F.D. Reissert compounds derived from diazaaromatic systems. - Heterocycles, 1980, 14, N7,p. 1033-1043.
652. Барнес P. Изоксазолы. - В ки.: Гетероциклические соединения / Под ред. Р.Эльдерфильда. М. : Изд-во иностр, лит. 1961, т. 5, с. 368-394.
653. Wakefield B.J., Wright D.J. Isoxazol chemistry since 1963. - Adv. Heterocycl. Chem.. 1979,25, p. 147-204. •' »
654. Пат. 4256899 (США). Process for the production of 3-hmino-5-Tbutylisoxazo-le / Y.Makisumi. A.Murabayashi. A.Takase etal. - Опубл. 17.03.81.
655. Пат. 67700 (CPP). Procedeu pentu prtpararea 3,4-dimethyl-5-aminoisoxazolului C. [lie, G.Putina. S.I.Cilianu et al. - Опубл. 15.07.79,
172
656. Structure of pithecolobine. 3. The synthesis of the 1,5- and 1,3-desoxypithecolo-lines / K.Weisner, Z.Valenta, D.E.Orr et al. - Can. J. Chem., 1968, 46, N 23, p. 3617-3624.
657. Изучение реакций амииазолов с азотистой кислотой. 2. 5-Галоидизоксазолы / Н.Сайто, Т.Курихара, С.Ясуда, М.Акаги. - J. Pharm. Soc. Jap., 1970,90, N 1, с. 32-35. -РЖ Химия, 1970,17Ж452.
658. Preparation et reduction electrochimique d’a-cyano-0-nitrostyrenes / Ch. Bellec, R.Colau, S.Deswarte et al. - C.r. Acad, sci., 1975,281, N 11, p. 885-888.
659. Nishiwaki T., Saito T. Studies on heterocyclic chemistry. Pt 9. Reaction of 2-(car-bonyl)-2H-azipines with hydrazine. A novel and unequivocal synthesis of 1,2,4-triazin-6-ones. - J. Chem. Soc. C, 1970, N 15, p. 2648-2652.
660. ЛЬт. 464204 (Швейцария). Verfahren zur Herstellung neuer Isoxazole I P.Schmidt, K.Eichcnberger, M.Wilhelm. - Опубл. 13.12.68.
661. De Ruggieri P., Gandolfi C, Guzzi U. Deidrogenazione e bromurazione di 0-cheto-nitrili steroidali. Steroidi. Nota 22. (l)-2-Cianocolestan-3-one e suoi-A*"4-, A4-, As*-e’ A*»4’*-derivatiV). - Farmaco. Ed. sci., 1965, 20, N 5, p. 358-388.
662. De Ruggieri P„ Gandolfi C., Guzzi U. Deidrogenazione e bromurazione di (J-che-tonitrili steroidali. Steroidi. Nota 24. Eterociclici Sterdidali{3,2-cJ-5'-Aminoisocsazoli inter-medi nella sintesi di[3,2-d]-2’, б'-disostituite pirimidine. - Gazz. chim. ital., 1966, 96, N 1/2, p. 179-205.
663. Reaction of 2'-arylhydrazono-3-oxomtriles with hydroxylamine. Synthesis of 3-ami-no-4-arylazoisoxazoles / M.H.Elnagdi, M.Elmoghayar, H.Rifaat et al. - J. Org. Chem., 1975, 40, N 18, p. 2604-2607.
664. Harsanyi K., Heja G. Notiz uber die Ringstruktur von 0-CyanbrenztraubensSureeste-roximen. - Chem. Ber., 1974, 107, N 8, S. 2794-2795.
665. Bauer I... Nambury C.N.V. Synthesis of aminoisoxazolones from a-cyanoesters and hydroxylamine. - J. Org. Chem., 1961, 26, N 12, p. 4917-4922.
666. Khan M.A., Rafia F.K. Synthesis and reactions of potassium cyanoacetohydroxa-mate. - J. Chem. Soc. Perkin. Trans. Pt 1, 1974, N 2, p. 327-328.
667. Zvilichovsky G„ David M. Molecular rearrangements. Synthesis, stability and rearrangements of l-imino-2H-isoxazolo[2,3-a]pyrimidines and 2'-aminoisoxazolo|2,3-a]pyrimidi-nium salts. - J. Org. Chem., 1983, 48, N 4, p. 575-579.
668. Junek H. Die Aminoisbxazol-Pyrazolon- und Retro-Aminoisoxazol-Umlagerung. — Angew. Chem., 1971.83, N 22, S. 912.
669. Dines M., Scheinbaum M.L. A two-step synthesis of 5-aminoisoxazoIes from olefins. - Tetrahedron Lett., 1969, N 54, p. 4817-4819.
670. Пат. 47-50633 (Япония). Способ получения изоксазолов / М.Оно. - Опубл. 19.12.72. - РЖ Химия, 1974,14Н369П.
671. Пат. 49-5341 (Япония). Способ получения производных изоксазола / М.Оно, Н.Кавабэ, М.Катиока. - Опубл. 06.02.74. — РЖ Химия, 1974,19Н345П.
672- ЛЬт. 50-10861 (Япония). Получение 5-амино-3,4-диалкилизоксазола / Н.Кавабэ, Н.Нарусэ, М.Оно. - Опубл. 24.04.75. - РЖ Химия, 1976, 70102П.
673. Recherche dans la serie des azoles. Action des hydroxylamines sur les nitriles a-ethy-Ichiques (note de laboratoire) / R.Jacquer, J.-L. Olive, F.Petrus, J.Verducci. - Bull. Soc. chim. France, 1973, N 2, pt 2, p. 800-803.
674. Iwai I.. Nakamura N. Studies on acetylenic compounds. 44. Synthesis of 3-amino-isoxazoles and 3-hydroxyisoxazoles (3-isoxazolones). - Chem. Pharm. Bull., 1966, 14, N 11, p. 1277-1286.
675. Lopez L., Barrens J. Action de L’hydroxylamine sur le nitrile phenylpropiolique: Synthese de la phenylpropiolamidoxime et de l’amino-3 phenyl-2 isoxazole. — C.r. Acad, sci. C, 1966, 263, N 7, p. 557-559.
676. Haruki E., Hirai Y., Imoto E. Synthesis of some substituted heterocyclic compounds from propargvl cyanide and methylpropargyl cyanide. - Bull. Chem. Soc. Jap., 1968, 41, Nl,p. 267.
677. Винтерфельд E. Ионные реакции присоединения. - В кн.: Химия аиетцпеновых соединений / Под ред. Г.Г.Внйе. М.: Химия, 1973, с. 125-204.
173
678. Pat. 43024 (Eur. Pat. Appl.). 5-Aminoisoxazoles / H.Peeters, W.Vogt. - C.A., 1982, 96,181271.
679. Пат. 3024989 (ФРГ). Verfahren zur Herstellung von 5-aminoisoxazolen / H.Peeters, W.Vogt. - Опубл. 28.0182.
680. Reactions of a-cyano-0-methoxy-0-alkylaerylic esters with hydraziae and hydroxylamine / H.Baba, I.Hori, T.Hayashi, H.Midorikawa. - Bull. Chem. Soc. Jap., 1969, 42, N 6, p. 1653-1659.
681. Domow A., Teckenburg H. Synthesen stickstoffhaltiger Heterocyclen. 21. Uber die Darstellung und Umsetzung einiger Isoxazole. - Chem. Ber., 1960, 93, N 5, S. 1103-1105.
682. Пат. 3679682 (США). Certain 5H-isoxazolo[5,4-d]pyrimidin-4-ones/L.K.Gibbons. -Опубл. 25.07.72.
683. Пат. 3816090 (США). Isoxazolopyrimidine herbicides and method of controlling plant growth / L.K.Gibbons. - Опубл. 11.06Л4.
684. Неплюее B.M., Синенко T.A., Пелькис П.С. Синтез производных пиразола, изоксазола и пиримидина на основе 2-арилсульфоиил-2-цианвинилэтиловых эфиров. — Химия гетероцикл, соединений, 1978, № 7, с. 969-971.
685. Синтез некоторых гетероциклов иа основе 2-циано-3-этокси-5,5-диметил-циклогексеи-2-она-1 / А.Я.Старков, М.Б.Андабурская, А.М.Моисеенков, А.А.Ахрем. -Изв. АН ЛатвССР. Сер. хим., 1973, № 3, с. 330-332.
686. Синтез изоксазолов и пиразолов из нитрилов, содержащих три углеродных атома / K.Matsumura, T.Saraie, Y.Kawano et al. - J. Takeda Res. Lab., 1971, 30, N 3, c. 475-492. - РЖ Химия, 1972, 9Ж430.
687. Activated nitriles in heterocyclic synthesis. Novel synthesis of pyridazines, pyridines and isoxazoles / S.M.Fahmy, N.M.Abed, R.M.Mohareb, M.H.Elnagdi. - Synthesis, 1982. N 6, p. 490-493.
688. Пат. 3917632 (США). 5-Aminoisoxazole from 3-aminoacrilonitrile / W.Leimgru-ber, M.Weigele. - Опубл. 04.11.75.
689. Пат. 3709922 (США). o-Lower alkonoyl oxines of cyanoacetaldehyde / W.Leim-gruber, M.Weigele. - Опубл. 09.01.73.
690. De Bernardo S., Weigele M. Synthesis of oxazinomycin (minimycin). - J. Org. Chem., 1977, 42,Nl,p. 109-112.
691. Pochat F. Voie d’acces aux amino-5 isoxazolessubstitues en 4 par un groupement SR. - Tetrahedron. Lett., 1980, 21, N 39, p. 3755-3758.
692. Пат. 3755410 (США). Intermediates / H.A.Albrecht, J.T.Ptati. - Опубл. 28.08.73.
693. Пат. 3706761 (США). 5-Amino-4-methoxyisoxazoles and 3-amino-4-methoxyiso-xazoles / H.A.Albrecht, J.T.Plati. - Опубл. 19.12.72.
694. Derives C-glycosyliques. 25. Nouvelles voies d’acces a des C-nucleosides isoxazo-liques et thiophSniques / J.M.J.Tronchet, O.R.Martin, Y.-B.Zumwald et al. - Helv. chim. acta, 1975,58, N 6, p. 1735-1738.
695. С-Nucleosides aminoisoxazoliqucs ( J.M.J.Tronchet, O.R.Martin, A.Grouillcr, N.Sar-da. - Ibid., 1979, 62, N 3, p. 833-837.
696. Пат. 152786 (ГДР). Substituierten 5-amino-4-cvanoisoxazolen / H.Willitzer, M.To-new. - Опубл. 09.12.81.
697. Пат. 16139 (Япония). Способ получения 5-аминоизоксазола / К.Морита, Н.Хасимото. — Опубл. 08.07.68.
698. Preparation, configuration et reduction electrochimique d'a-cyano-0-nitrostyrenes. Synthese d’amino-5 isoxazoles / Ch. Bellec, D.Bertin, R.Colau et al. - J. Heterocycl. Chem., 1979, 16, N 8, p. 1611-1616.
699. Pulse radiolysis of the reduction of 1-phenyl-l-cyanonitroethylene. Cyclisation leading to 5-amino-4-phcnylisoxazole / S. Deswarte, Ch. Bellec. J.Pucheault et al. - Ibid., 1980,17, N 7, p. 891-896.
700. Colau R„ Viel C. Preparation de Д-alcoxy acrylonitriles et d’amino-5 isoxazoles a partir d’u-cyano Д-nitrostyrcnes etstilbenes. - Bull. Soc. chim. France, 1980, N 3/4, pt 2, p. 163-164.
174
701. Dal P.V., Pinzauti S., Lacrimini P. 4-Nitro-l ,2-oxazoles from hydroximic acid chlorides. - Synthesis, 1975, N 10, p. 664-665.
702. Пат. 3816421 (США). Dihydroisazolopyrimidineherbicides/ L.K.Gibbons, A.A.Ram-sey. - Опубл. 11.06.74.
703. Пат. 3686408 (США). Compositions with 5-nitro-2-furylisoxazoles and their use as antibacterial and.antifungal agents / G.A.Howarth, W.Hoyl. - Опубл. 22.08.72.
704. Пат, 24016 (Япония). Способ получения 4-замещенных-5-амино-3-(5-иитро-фурил-2)изоксазолов / С.Минами, Д.Мацумото. - Опубл. 09.07.71. - РЖ Химия, 1972, 7Н321П.
705. Micetich R.G., Raap R„ Chin CG. Studies in isoxazole chemistry. 5. N-A!kylation and N-acylation of 5-amino-3-(5-nitro-2-furyl)isoxazoles. - J. Med. Chem., 1971, 14, N 9, p. 856-860.
706. Пат. 361175 (Швеция). Satt att framst'dlla 3-(5'-nitrofur-2'-yl)isoxazolderivat / R.U.Lemieux, R.G.Micetich. - Опубл. 22.10.73.
707. Пат. 133450 (Норвегия). Analogifremgangsmate til fremstilling av terapentisk vivksomme 5-substituerte-amino-4-cyano-3-(5’-mitrofur-2'-yl)isoksazoler/ R.U.Lemieux, R.G.Micetich. - Опубл. 05.05.76.
708. Junek H„ Thierrichter B., Lukas G. Synthesen mit Nitrilen. 58. Ein neuer Weg zu Isoxazolo[5,4-bjpyridinen. - Chem. Der., 1980,113, N 3, S. 1195-1200.
709. Aurich H.G., Blinne G. Ringumwandlungsreaktionen von 5-Imino-3-isoxalinen. -Ibid., 1974,107, N l.S. 13-23.
710. Okamoto T„ Takahashi H. Reaction of ’ aromatic heterocyclic nitro compounds with potassium cyanide. 3. Some nitroquinoline-1-oxides. - Chem. Pharm. Bull., 1971, 19, N9,p. 1809-1814.
711. Яшунский В.Г., Огородникова В.В. Реакции образования мезоионных гетероциклов. - Химия гетероцикл, соединений, 1981, № 3, с. 291-303.
712. Яшунский В.Г., Холодов Л.Е. Химия сидноннминов. - Успехи химии, 1980, 49, № 1, с. 54-91.
713. Огородникова В.В., Холодов Л.Е., Яшунский В.Г. Кинетика и механизм кислотной циклизации N-замещенных N-нитрозо-а-аминоацетонитрилов в сиднонимины. -Химия гетероцикл, соединений, 1977, № 1, с. 39-46.
714. Синтез и колебательные спектры N-экзоарилкарбамоилсиднониминоз и их солей / З.В.Оловянишникова, Т.М.Иванова, В.Е.Свиридова, В.Г.Яшунский. - Там же, 1978, №2, с. 170-175.
715. Пат. 4277609 (США). Sydnone imines / R.P.Stein. - Опубл. 07.07.81.
716. Пат. 4324897 (США). Oxadiazolium salts / R.P.Stein. - Опубл. 13.04.82.
717. Сиднонимины на основе аналогов £-амино капроновой кислоты / И.С.Слюса ренко, В.В.Огородникова, В.И.Мамонов, В.Г.Яшунский. - Химия гетероцикл, соединений, 1973, № 11, с. 1469—1472.
718. Vohra S.K., Harrington G.W., Swern D. Revercible interconversion of N-nitroso (2-methylamino)acetonitrile and 3-methyl-5-amino-1.2,3-oxadiazolium chloride and related reactions. - J. Org. Chem., 1978, 43, N 9, p. 1671-1673.
719. Огородникова B.B., Холодов Л.Е., Яшунский В.Г. Основание сиднонимина. -Химия гетероцикл, соединений, 1983, № 6, с. 749-753.
720. The Unusually mild and facile basic hydrolysis of N-nitroso-2-(methylamind)aceto-nitrilc / S.K.Chang, G.W.Harrington. S.H.Vealc. D.Swern. - J. Org. Chem., 1976, 41, N 23, p. 3753-3755..
721. Новый способ образования производных сидноннминов / В.Г.Яшунский, З.А.ОловянишникойЬ, В.В.Огородникова, Л’.Е.Холодов. - Химия гетероцикл, соединений, 1980, № 1, с. 117.
722. Яшунский В.Г., Огородникова В.В., Холодов Л.Е. Сиднонимины - основной циклизацией N-нитрозоамииоацетонитрилов. - Там же, № 9, с. 1244-1247.
723. А. с. 690008 (СССР). Способ получения сидноннминов / Л.Е.Холодрв, В.В.Ого-родиикова, З.А.Оловянйшникова и др. - Опубл, в Б.И., 1979. № 37.
175
724. Hit. 4289885, (США). 3-[ 2-(Dimcthylamino)-2-phcnylethyl]-N-(phenylaminocar-bonyl)sydnone imine, a new central nervous system stimulant / R.P.Stein. - Опубл. 15.09.81.
725. A. c- 437762 (СССР) Сиднофен / P. А. Альтшулер, М.Д.Машковский, В.Г.Яшун-ский. - Опубл, в Б.И., 1974, № 28.
726. G8tz М„ Grozinger К. Synthesis of 3-aminosydnone imines. - J. Heterocycl. Chem., 1970, 7, N l,p. 123-129.
727. Gante J., Mohr G. Neue Aminosaure-Derivate. - Chem. Ber., 1975. 108, N 1, S. 174-180.
728. Tilley J.W., Ramu H. The synthesis of 3,5-diamino-l,2,4-oxadiazoles. - Helv. ehim. acta, 1980, 63, N 4, p. 832-840.
729. Eloy F., Deryckere A. Synthese d’amino-3-(oxadiazoles-l,2,4.— Bull. Soc. chim. belg., 1969, 78, N 1/2, p. 41-46.
730. Dost J.L.R. Darstellung von 3-substituierten 5-Amino-l ,2,4-oxadiazolen aus Ami-doximen mit Bromcyan. - Z. Chem., 1975, 15, N 2, S. 57.
731. Becker H.G.O., Gormav G., Timpe H.-J. Darstellung und Reaktionen von 4-Hyd-roxy-l,2,4-triazolen. - J. prakt. Chem., 1970, 312, N 4, S. 610-621.
732. Пат. 12158 (Япония). Противомикробные препараты / Р.Уэно. - Опубл. 02.05.70. - РЖ Химия, 1972,6Н327П.
733. Westphal G.f Pabe Н. Uber die darstellung von 2-aniino-5-(oxoalkyl)-l .3.4-oxadi-azolen. - Z. Chem., 1980, 20, N 4, S. 142-143.
734. Gehlen H., Demin P„ Uteg K.H. Darstellung und reaktionen.von in 5-stellung hete-rocyclisch substituierten 2-amino-l,3,4-ox diazolen. -. Arch. Pharm., 1970, 303, N 4, S. 310-317.
735. Пат. 67432 (ГДР). Verfahren zur Herstellung von Aryloxy(thio)alkylsubstituicr-ten 1,3,4-Oxdiazolen / K.-H.Uteg, H.Gehlen, R.Semerad. - Опубл. 20.06.69.
736. Gehlen H„ Zeiger G. fiber die Umsetzung von AldonsSurehydraziden mit Broni-cyan. - J. prakt. Chem., 1968, 37, N 5/6, S. 269-277.
737. Gehlen H„ Uteg К.-H., Vieweg J. Zur Kenntnis der 2-Amino-l,3,4-oxdiazole.'Mitt. 27. Hydroxyalkylsubstituicrte 2-Amino-l,3.4-Oxdiazole. -•Arch. Pharm.. 1969, 302, N 2, S. 105-112.
738. Gehlen H., Neumann R. Zur Kenntnis 2-Amino-l,3,4-oxdiazole. Mitt. 20. Uber die Bildung von in 5-Stellung hcterocyclisch substituierten 1-Acyldiaminoguanidincn. - J. prakt. Chem., 1968, 37, N 3/4, S. 182-191.
739. 2-Amino-l,3,4-oxdiazole I H.H.Glatt, R.Bacaloglu. C.Csunderlik et al. - Bull. sti. si tehn. Inst, politehn. Timisoara. Ser. chim., 1981, 26, N 2, S. 111-116.
740. Zinner G., Neitzel M„ Holdt I. Reaktion von Cyansaureestern mit Carbonsaurchyd-raziden. - Arch. Pharm.. 1978, 311,N 12, S. 1050-1055.
741. Masuda K.. Kamiya T, Kashiwa K. Studies on mesoionic compounds. 3. Synthesis of 3-aryb5-imino-3,5-dihydro-l-oxa-2,3.4-triaz.olc hydrochlorides and their derivatives. -Chem. Pharm. Bull., 1971, 19, N 3. p. 559-563.
742. Albert A. 1,2.3-Triazole analogues of 2-aminobenzylamine. - 1 Chem. Soc. Chem. Communs, 1970, N 14, p. 858.
743. A facile total synthesis of oxanosinc, a novel nucleoside antibiotic / N.Yagisawa, T.Takita, H.Umczawa et al. - Tetrahedron Lett.. 1983, 24, N 9, p. 931 -932.
744. Krey P„ Dehne H. Substituiertc 4H-Thieno[2.3-d][l,3]oxazine dureh doppclten Ringschlu-0. - Z. Chem., 1.981, 21, N 1. S. 31.
745. Kato T., Katagiri H„ Yamamoto Y. Последние достижения в химии 1,3-оксази-нов. - J. Jap. Orem.. 1980, spec. 124, с. 225-279. - РЖ Химия, 1980,16Ж339.
746. Pfoertner К.-H., Foricher J. Photoreaktionen des 3-Methyl-4-phenylsydnones. Helv. chim. acta, 1980, 63, N 3, S. 653-657.
747. Довлатян B.B., Папоян T.3., Тарханян Г.К. О конденсации дициандиамида хлоральгидратом. - Химия гетероцикл, соединений, 1975, № 4, с. 473-474.
748. Crombie D.A., Kiely J.R., Ryan C.J. Sulphur heterocycles from thiodiacetonitrilc and sulphonyldiacetonitrile. - 1. Heterocycl. Chem.. 1979. 16, N 2. p. 381-382.
176
749. Пат. 99796 (ГДР). Verfahren zur Herstellung von substituierten 1,4-Oxazepinen und 1,4-Diazepinen / K.Peseke. - Опубл. 20.08.73.
750. Tamagakis S., Hirota H., Oae Sh. Derivatives of cyclic disulfides. 3. A new method of deoxygenation of thiolsulfinates and thiosulfonates with inorganic cyanide. - Bull. Chem. Soc. Jap., 1974, 47, N 8, p. 2075-2076.
751. DallAsta I.., Pedrazzoli A., Perotti A. Nouveaux derives d’aralkylamino-2 dihydro-2,3(4H)-benzoxazepin-l,4-ones*5. - Bull. Soc. chim. France, 1968, N 1, p. 401-406.
752. Kosasayama A., Konno T, Higashi K. Cyclic guanidines. 4. Synthesis of hypoglycemic N-benzhydryl bicyclic guanidines. - Chem. Pharm. Bull., 1979, 27, N 4, p. 841-847.
753. Steinkopf If. Die Chemie des Thiophenes. - Dresden ; Leipzig : Steinkopf, 1941. -232 S.
754. Блике Ф. Химия тиофена. - В кн.: Гетероциклические соединения / Под ред. Р.Эльдсрфильда. М. : Изд-во иностр, лит., 1953, т. 1, с. 165-218.
755. Gronowitz S. Recent advances in the chemistry of thiophenes. - Adv. Heterocycl. Chem., 1963, l,p. 2-124.
756. Новые направления химии тиофена I Л.И.Белепький, Е.П.Захаров, М.А.Калик и др. — М. : Наука, 1976. - 424 с.
757. Реакции серы с органическими соединениями / М.Г.Воронков, Н.С.Вязанкин, Э.Н.Дерягииа и др. - Новосибирск : Наука, 1979. - 367 с.
758. Gronowitz S. Thiophenes and their selenium and tellurium analogues. - In: Organic compounds of Sulphur, Selenium and Tellurium / Ed. D.H.Reid. London : Chem. Soc., 1973, vol. 2, p. 352-496.
759. Gronowitz S. Thiophenes and their selenium and tellurium analogues. - Ibid., 1975, vol. 3, p. 400-493.
760. ГевалЬд К. Методы синтеза и реакции 2-аминотиофенов. - Химия гетероцикл, соединений, 1976, № 10, с. 1299-1315.
761. Stacy G.W., Eck D.L. 2-Aminothiophene. Heterocyclization of benzylthionitriles. - Tetrahedron Lett., 1967, N 51, p. 5201-5204.
762. Eck D.L., Stacy G. W. 2-Aminothiophene. HeterocycMzation of benzylthionitriles. -J. Heterocycl. Chem., 1969, 6, N 2, p. 147-151.
763. Blechert S., Gericke R., Winterfeld E. Polycyclische Thiophenderivate durch Hetero-Cope-Umlagerung. — Chem. Ber., 1973, 106, N 1, S. 368—373.
764. Day A.W., Gabriel S. Zur Kenntniss des o-Cyanbenzylchlorids. - Berichte, 1890, 23, T. 2, S. 2478-2489.
765. Stacy G.W., Papa A.J., Ray S.C A tautomeric nitrile-thiol-iminolactone system. -J. Org. Chem., 1961, 26, N 11, p. 4779.
766. A tautomeric nitrile - thiol - iminolactone system / G.W.Stacy, A.J.Papa, F.W.Vil-laescusa, S.C.Ray. - Ibid., 1964, 29, N 3, p. 607-612.
767. Stacy G.W., Villaescusa F.W., Wollner T.E. 2-Aminobenzo[b]thiophene. An aromatic ring tautomer. 5 Ibid., 1965, 30, N 12, p. 4074-4078.
768. Stacy G.W., Wollner T.E. Rautomerism of 2-substituted benzo[b]thiophenes. Ultraviolet spectral correlation of tautomer structure with aromaticity. - Ibid., 1967, 32, N 10, p. 3028-3032.
769. Iddon B., Scrowston R.M. Recent advances in the chemistry benzo[b]thiophenes. — Adv. Heterocycl. Chem., 1970, 11, p. 177-381.
770. Iddon B. Benzofcjthiophencs. - Ibid., 1972, 14, p. 331-381.
771. Пат. 1470542 (Великобритания). Process for manufacturing salts of 2-amino-thiophenes / D.B.Baird, I.K.Barben, B.R.Fishwick, J.M.Holland. - Опубл. 14.04.77.
772. Пат. 2526086 (ФРГ). 2-Aminothiophenesalzen / D.B.Baird, I.K.Barben, B.R.Fishwick, J.M.Holland. — Опубл. 08.01.76.
773. Korte F., Wamhoff H. Acyllacton-Umlagerung. 31. Synthesen von a-Cyanlactamen, a-Cyan-y und 6-thiollactonen und deren Verhalten unter den Bedingungen der Acyllacton-Umlugerung. - Chem. Ber., 1964, 97, N 7, S. 1970-1980.
774. Wamhoff H, Korte F. The synthesis of heterocyclic compounds starting from lactones, lactams and thiolactones. - Synthesis, 1972, N 4, p. 151-175.
177
23
775. Senary E. (Jber schwefelhaltige Derivate des chloroacetylcyaneessigesters. - Be-richte, 1910,43, N 2, S. 1943-1956.
776. Isidor J.L., McKee R.L. Synthesis of 2-methylene-4-thiazolidinones. - J. Org. Chem., 1973, 38, N 20, p. 3615-3617.
777. Воловенко Ю.М., Бабичев Ф.С Синтез 2-амино-4-(5Н)кетотиофенов. - Химия гетероцикл, соединений, 1977, № 10, с. 1425—1426.
778. Л. с. 767105 (СССР). Способ получения 2-амиио-4(5Н)-кетотиофенов ( Ю.М.Во-ловенко, Ф.С.Бабичев. - Опубл, в Б.И., 1980, № 36.
779. Gewald К. Heterocyclen aus CH-aciden Nitrilen. 7. 2-Aminothiophene aus a-Oxomer-captanen und methylenaktiven Nitrilen. - Chem. Ber., 1965, 98, N 11, S. 3571-3577.
780. Tinney F.J., Sanchez J.P., Nogas J.A. Synthesis and pharmacological evaluation of 2,3-dihydro-lH-thfeno[2,3-e](l,4]diazepincs. - J. Med. Chem., 1974, 17, N 6, p. 624-630,
781. Taylor E,C, Berger J.G. Heterocyclic synthesis from o-aminonitriles. 29. A new synthesis of 5-substituted pyrimidines. - J. Org. Chem., 1967, 32, N 8, p. 2376-2378.
782. Corral C, Madrenero R., Ulecia N. Reacciones de Bischler у de Friedlander con 2-amino-2-aroyltiofenos. - Afinidad, 1978, 35, N 354, p. 129-133.
783. Пат. 56-100780 (Япония). Способ получения производных тиофена / С.Та-да. — Опубл. 12.08.81.
784. Robba М., Lecomte J.M., de Sevricourt М.С. Thienopyrimidincs. 4. Synthese et etude de derives d’aminoacldes et d’aminoacetones thiopheniqucs. - Bull. Soc. chim. France, 1974, N 12, p. 2864-2870.
785. Ried W., Gieffe R. Reactionen mit Imidsaiireestern. 10. Neue 4-Hydroxythieno — [2,3-dJ- und -thieno[3,2-d]pyrimidine. - J. Lieb. Ann. Chem., 1968, 713, N 1, S. 143—148.
786. Funk K.F., Mayer R. Die Umsetzung von Thiacyclobutanon-(3( mit sek. Aminen, ein Beitrag zum Mechanismus der Willgerodt-Kindler-Reaktion. - J. prakt. Chem., 1963, 21,N4,S. 65-74.
787. Foye W.6>., Mickles J., Boyce G. Antiradiation compounds. 14. Ditiocarbamates of aminothipohenes. - J. Pharm. Sci., 1970, 59, N 9, p. 1348-1350.
788. Пат. 2042984 (ФРГ). 2-Amino-3-thiophenethiocarboxamide / H.Eilingsfeld, R.Niess. - Опубл. 02.03.72.
789. Пат. 1419075 (Великобритания). Process for manufacturing substituted thiopehene compounds / D.B.Baird, R.Baker, B.R.Fishwick, R.D.McClelland. - Опубл. 24.12.75.
790. Пат. 483530 (Австралия). Process for manufacturing of 2-acylaminothiophene-3-carboxylic acids / D.B.Baird, R.Baker, B.R.Fishwick, R.D.McQelland. - Опубл. 18.05.77.
791. Fortea J. Estudio sobre la formacionde 3-(2-acetamido)thienilfenilcetoximas. -Afinidad, 1974, 31, N 314,-p. 133-140.
792. Пат. 1546574 (Великобритания). Thiophene derivatives / R.D.McClelland, D.B.Baird, J.S.Campbell, B.R.Fishwick. - Опубл. 23.05.79.
793. Weber К.-H., Daniel H. Vhieno[3,2-f][l,2,4]triazolo[4,3-a][l,4]diazepin-6-on. -J. Lieb. Ann. Chem., 1979, N 3, S. 328-333.
794. Ihiophen als strukturelement physiologisch aktiver substanze. Mitt. 4. o-Substi-tuierte 5-Phenylthieno[2,3-e][l,4]diazepine / D.Binder, O.Hromatka, Ch.R.Noe et al. - Arch. Pharm., 1980, 313, N 7, S. 587-602.
795. Binder D., Stanetty P. Attempted synthesis of 5-(2,6-dichlorophenyl)-lH-thieno [2,3-e][l,4]diazepin-2 (3H)-onc. - J. Chem. Res. Synop., 1981, N 4, p. 102. - РЖ Химия, 1982,4Ж523.
796- Gewald K. Einfache Synthese von 2-Aminothiophenen. - Z. Chem., 1962, 2, N 10, S. 305-306.
797. Gewald K„ Schinke E., Bottcher H. 2-Aminothiophene aus methylenaktiven Nitrilen Carbonylverbindungen und Schwefel. - Chem. Ber., 1966, 99, N 1, S. 94-100.
798. Шведов В.И., Рыжкова B.K., Гринев A.H. Новый метод синтеза эфиров тиофен-/?-карбоиовых кислот. - Химия гетероцикл, соединений, 1967, № 6, с. 1010-1014.
799. Pedersen Е.В., Carlsen D. Phosphoramidcs. 5. Synthesis of 4,6-bis(dimethylamino)-thieno(2,3-blpyridines by an HMPT induced ring closure reaction. - Tetrahedron, 1977, 33; N 16, p. 2089-2092.
178
800. Пат. 3806512 (США). 2-Amino-3-pyridylcarbonylthiophene compounds / M.Na-kanishi, M.Shiroki, T.Tahara, K.Araki. — Опубл. 23.04.74.
* 801. Пат. 1468012 (Великобритания). 2-Amino-3-carboxythiophene derivatives / A.C.Goudie.- Опубл. 23.03.77.
802. Synthesis and antiallergy activity of 4-oxo-4H-pyridoIl,2-a]thieno[2,3-d]pyrimi-dines / F.J.Tinney, W.A.Cetenko, J.J.Kerbleflti, D.J.Herzig. - J. Med. Chem., 1981, 24, N 7, p. 878-882.
803. Arya V.P., Ghate S.P. Synthesis of new heterocycles. Pt 5. Synthesis of thieno[2,3-d] pyrimidines and certain related condensed thiophenes. - Indian J. Chem., 1971, 9, N 11, p. 1209-1212.
804. Gewald K., Schinke E. Heterocyclen aus CH-aciden Nitrilen. 10. Notiz zur Reak-tion von Aceton mit Cyanessigester und Schwefel. — Chem. Ber., 1966, 99, N 8, S. 2712—2715.
805. Stydies on psychotropic drugs. 18. Synthesis and structure - activity relationships 5-phenyl-l,3-dihydro-2Hthieno[2,3-e]diazepin-2-ones / M.Nakanishi, T.Tahara, K.Araki et al. - J. Med. Chem., 1973, 16, N 2, p. 214-219.
806. Wierzbicki M., Cagniant D., Cagniant P. Reactivite des amino-2-thiophenes Application a la synthese de quelques thieno[2,3-b]pyrroles. - Bull. Soc. chim. France, 1975, N 7/8, pt 2, p. 1786-1792.
807. Шведов В.И., Гринев А.Я. Исследования в области енаминов. 3. Замещенные аминотиофены. - Журн. орган, химии, 1965, 1, № 12, с. 2228—2231.
808. Elslager E.F., Jacob Р., Werbel L.M. Folate antagonists. 6. Synthesis and antimala-rial effects of fuced 2,4-diaminothieno[2,3-d]pyrimidines. - J. Heterocycl. Chem., 1972, 9, N4, p. 775 -782.
809. Пат. 2817449 (ФРГ). Mittel zur Regulierung des Pflanzenwachstums I K.Dickore, K.Lurssen. - Опубл. 31.10.79.
810. Пат. 4013681 (США). Derivatives of thiophene / I.V.Karabinos, L.G.Nickell. -Опубл. 22.03.77.
811. Manhas M.S., Rao V. V., Amin S.G. Heterocyclic compounds. 7. Synthesis of thia-diazasteroid analogs. - J. Heterocycl. Chem., 1976, 13, N 4, p. 821-824.
812. Ram V.J. Thieno[2,3-d]pyrimidines as Potential Chemotherapeutic Agents. - Arch. Pharm., 1979, 312, N 1, S. 19-25.
813. Пат. 3705910 (США). N-[2(4,5,6,7-Tetrahydrobenzothienyl)]propionamides / C.A.Dundberg, J.E.Engelhart. - Опубл. 12.12.72.
814. Пат. 1429484 (Великобритания). Azodyestuffs derived from carbocyclicfused 2-aminothiophene diazo components / D.B.Baird, D.Eckersley, B.R.Fishwick, R.D.McClel-land. - Опубл. 24.03.76.
815. Sauter F., Reich G., Stanetty P. Methaqualon-analoge Benzothienopyrimidine. -Arch. Pharm., 1976, 309, N 11, S. 908-913.
816. Gewald K., Hofmann I. Natiz zur Reaktion von Ketonen mit Cyanessigsiure-hyd-razid und Schwefel. - J. prakt. Chem., 1969, 311, N 3, S. 402-407.
817. Manhas M.S., Sugiura M., Chawla H.P.S. Heterocyclic compounds. 10. A new synthesis of thiadiazasteroids. - J. Heterocycl. Chem., 1978, 15, N 6, p. 949—953.
818. 2,4-Diaminothieno(2,3-d]pyrimidines as antifolates and antimalarials. 1. Synthesis of 2,4-diamino-5,6,7,8-tetrahydrothionaphtheno[2,3-d]pyrimidines and related compounds / A.Rosowsky, M.Chaykovsky, K.K.N.Chen et al. - J. Med. Chem., 1973, 16, N 3, p. 185-188.
819. Пат. 508649 (Швейцария). Verfahren zur Herstellung von 5,6,7,8-tetrahydro]!] benzothieno[2,3-d]pyrimidinen / E.Schweizer, P.Schmidt, K.Eichenberger. - Опубл. 30.07.71.
820. Пат. 507972 (Швейцария). Verfahren zur Herstellung von 5,6,7,8-Tetrahydro(l]-benzothieno|2,3-d]pyrimidinen / E.Schweizer, P.Schmidt, K.Eichenberger. — Опубл. 15.07.71.
821. Пат. 530412 (Швейцария). Verfahren zur Herstellung von(l]benzothieno[2,3-d]-pyrimidinen / E.Schweizer, P.Schmidt, K.Eichenberger. — Опубл. 29.12.72.
822. Rosowsky A., Chen K.K.N., Lin M. 2,4-Diaminothieno[2,3-d]pyrimidines as antifolates and antimalarials. 3. Synthesis of 5,6-disubstituted derivatives and related tetracyclic analogs. - J. Med. Chem., 1973,16, N 3, p. 191-194.
23х 179
823. Пат. 3763184 (США). Pharmacentically active pyrrolidinonaphthothiophenes / L.Wellings. - Опубл. 02.10.73.
824. Synthesis of thieno- and furopyrimidinethiones / M.S.Manhas. V.V.Rao, P.A.Seetha-raman et al. — J. Chem. Soc. C, 1969, N 14, p. 1937-1939. i
825. Пат. 2513331 (ФРГ). Varfahren zur Herstellung von Thiophenderivaten / J.Mar-tinek, G.Lamm. - Опубл. 07.10.76.
826. Шаранина Л.Г., Баранов C.H. Синтез цианаминотиофенов с активными функциональными группами. - Химия гетероцикл, соединений, 1974, № 2, с. 196—198.
827. Koebel R.F., Needham L.L., Blanton C-D.-W. Synthesis of thieno(2,3-b]azepin-4-ones as potential antineoplastic agents. - J.Med. Chem., 1975, 18, N 2, p. 192-194.
828. Шведов В.И., Гринев A.H. Синтез производных 2-аминотиофбна и тиеноокса-зина. — Химия гетероцикл, соединений, 1966, № 4, с. 515-518.
829. Шведов В.И., Рыжкова В.К., Гринев А.Н. Синтез производных 2-амино-З-карб-этокситиофена. - Там же, 1967, № 2, с. 239-242.
830. Biological activity of some 2-amino-4,5,6,7-tetrahydrobenzo(b]thiephenes and their derivatives / J.D.Ramanathan, D.G.Namboothiri, G.F.Shah et al. - J. Indian Chem. Soc., 1978,55, N 8, p.822-825.
831. McDowell D.W.H., Patrick T.B. The chemistry of indenothiophenes. 1. 8H-Indeno-[2,l-b]thiophene. - J. Org. Chem., 1967, 32, N 8, p. 2441-2445.
832. Gewald K.; Hentschel M, Hetkel R. 2-Aminothieno[2,3-d]thiazole und 3-Amino-thieno[2,3-c]isothiazole. - J. prakt. Chem., 1973, 315, N 3, S. 539-548.
833. Ary a V.P. Senthesis of new heterocycles. Pt. 6. Synthesis of certain novel condensed thiophenes. - Indian J. Chem., 1972, 10, N 12, p. 1141-1150.
834. Пат. 3956315 (США). Herbicidal N-(3-cyan-4-alkylthien-2-yl)ureas I J.W.Kobzi-na. - Опубл. 11.05.75.
835. Synthese et pharmacologie des derives de l’amino-2 Ethoxycarbonyl-3 phenyl-4 thiopehene / M.Perrissin, Due Cuong Lun, G.Narcisseg et al. - Eur. J. Med. Chem., 1980, 15, N 6, p. 563-565. - РЖ Химия, 1981,15Ж181.
836. Arya V.P. Synthesis and hypotensive activity of 2-amino-3-cyano-4,7-meth*no-4,5, 6,7-tetrahydrobenzo[b)thiophene. - Indian J. Pharm., 1976, 38, N 4, p. 107-108.
837. Roy S.K. Heterocyclic derivatives of cholestane. - J.Org. Chem., 1973, 38, N 24, p.4211-4213.
838. Шаранин Ю.А., ПроМоненков B.K. 2-Амииоаидрост-2-ено( 2,3-b] тиофены. -Химия гетероцикл, соединений, 1980, № 11, с. 1564-1565.
839. Gewtdd К., Schael J. Zur Reaktion von Thiacyclopentanon-(3)mit Cyanessigester und Schwefel. - J. prakt. Chem., 1973, 315, N 1, S. 39-43.
840. Пат. 54-151564 (Япония). Тетрациклические соединения / Ф.Исикава. -Опубл. 22.06.81.
841. Синтез и противосудорожная активность производных конденсированных систем 1,4-диазепина / А.С.Норавян, А.П.Мкртчян, И.А.Лжагацпанян, С.А.Вартаняи. -Хим.-фармац. жури., 1977, 11, № 10, с. 62-64.
842. Синтез и противосудорожная активность 4-алкил(арил)амиио-6,6-диметил-5,6-дигидро-8Н-пирано(тиопирано)[ 3,4-Ь) тиено[ 4,5-d] пиримидинов / А.СНоравян, А.П.Мкртчян, И.А.Лжагацпанян и др. - Там же, № 9, с. 38-42.
843. Синтез и противосудорожная активность 2,3-замещенных 5,5-диметилтетрагнд-ротиопирано- и 5,5-диметилтетрагидротиопирано[ 3,4-Ь] тиофенов / А.С.Норавян, А.П.Мкртчян, И.А.Лжагацпанян и др. - Там же, № 8, с. 20-24.
844. Конденсированные тиенопиримидины. 3. Синтез тиенопиримидиндиоиов, конденсированных с шестичлениыми гетероциклами, содержащими серу и кислород / А.С.Норавян, А.Ш.Оганисян, К.Е.Басснцян, С.А.Вартанян. - Арм. хим. жури., 1983, 36, №2, с. 108-115.
845. Пат. 1908497 (ФРГ). Pyrimidines / P.Schmidt, K.Eichenberger, E.Schweizer. -Опубл. 18.09.69.
846. 2r4-Diaminothieno[2,3-d)pyrimidines as antifolates *and antimalarials. 2. Synthesis 180
of 2,4-diaminopyrido[4',3’: 4^]thieno[2,3-d]pyrimidines and 2,4-diamino-8H-thiopyrano-]4',3 : 4,5]thieno[2,3-d] pyrimidines / M.Chaykovsky, M.Lin, A.Rosowsky, E.J.Modest. -J. Med. Chem., 1973, 16, N 3, p. 188-191.
847. Пат. 4072 (Япония). Способ получения тиенопиридинов / М.Наканиси, Т.Та-хара. - Опубл. 04.02.72. - РЖ Химия, 1973,6Н459П.
^48. Пат. 48-15957 (Япония). Способ получения аминоалкилтиенопиридинов / М.Наканиси, Т.Тахара. - Опубл. 18.05.73. - РЖ Химия, 1974, 5Н369П.
849. Пат. 21932 /Япония). Способ получения производных тиофена / М.Наканиси, Т.Тахара, Х.Имамура. - Опубл. 14.06.71. - РЖ Химия, 1972,4Н377П.
850. Пат. 511874 (Швейцария). Verfahren zur Herstellung von neuen 4,5,6,7-Tetra-hydrothieno]2,3-c]pyridinen / K.Eichenberger, P.Schmidt, E.Schweizer. - Опубл. 15.10.71.
851. Synthesis of 2-aminothiophenes and thieno[2,3-d]pyrimidines / M.B.Devani, C.J.Shi-stloo, U.S.Pathal et al. - Indian J. Chem. B, 1976,14, N 5, p. 357-360.
852. Синтез 5,6,7,8-тетрагидро-7-изопропилпиридо[4,3 : 4,5]тиено]2,3-dJпиримидинов / А.С.Норавян, А.П.Мкртчян, Р.А.Акопян, С.А.Вартаияи. — Хим.-фармац. журн., 1980, 14,№ 2, с. 37-40.
853. Пат. 7217797 (Япония). Производные хинуклидона / М.Накаииши, К.Ариму-ра. - Опубл. 09.09.72. - С.А., 1972, 77,152143.
854. Hit. 3644379 (США). 2-Amino-4,5,6,7-tetrahydro-4,7-ethanothieno[2,3-b]pyri-dines and pharmaceutically acceptable salts thereof / I.Wellings. - Опубл. 22.02.72.
855. Arya V.P., Ghate S.P. Synthesis of new heterocycles. Pt 1. Synthesis of 1,4-dithiepi-nes derived from 1,4-dithiacycloheptan4>-one. - Indian J. Chem., 1971, 9, N 9, p. 904-909.
856. Gewald K., Hentschel M„ JaHokoff H. Synthese und Reaktionen von 2-Hydroxy-3-cyanthiophenen. - J. prakt. Chem., 1975, 317, N 5, S. 861-866.
857. Nguyen Kim Sin, Pinel R., Melfier У. Composes sulfures heterocycligues. 49- Synthese et structure d’amino-2 thioaroyl-5 thiophenes diversonent substitues. - Bull. Sop. chim. France, 1973, N 3/4, pt 2, p. 471-474.
858. Nguen Kim Son, Mollier Y. Synthese et reactivite d’amino-2 thioaroyl-5 thiophenes deversement substitues. — C.r. Acad. sci. C, 1?71,273, N 3, p. 278-281.
859. Шаранин Ю.А., Шаранина Л. Г. Новы* синтез 2-амино-3-циан-4,5-т«траметилен-тиофена. - Химия гетероцикл, еоедгжеиий, 1974, № 10, с. 1432.
860. Пат. 599951 (Швейцария) : 2-Amino-5-cyanothiophenverbindungen / A.Jotterand. -. Опубл. 15.06.78.
861. ПаТ. 2891908 (США). Substituted 2,5-diamino-3-cyanothiophenes / W.J.Middle-ton. - Опубл. 06.08.57.
862. Middleton W.J., Engelhardt V.A., Fisher B.S. Cyanocarbon chemistry. 8. Heterocyclic compounds drem tetracyanoethylene. - J. Amer. Chem. Soc., 1958, 80, N 11, p. 2822-2829.
863. Cyanocarbon chemistry. 1. Preparation and reactions of tetracyanoethylene / T.L.Ca-ims, R.A.Carboni, D.D.Coffman et al. - Ibid., p. 2775-2778.
864. Taylor E.C., Hendess R.W. Synthesis of 4-amino-5-cyanopyrrolo[2,3-d]pyrimidine, the aglycone of toyocamycin. - Ibid., 1964, 86, N 5, p. 951-952.
865. A. c. 706414 (СССР). Способ получения 2,5-диамино-3,4-дицианотиофена / О.Е.Насакин, А.В.Казакова, В.А.Кухтин и др. - Опубл, в Б.И., 1979, N*48.
866. Взаимодействие симм-тетрацианоэтана с гидридами элементов подгрупп VI и VIIA / О.Е.Насакин, В.В.Алексеев, В.К.Промоненков и др. - Журн. орган, химии, 1981,17, №9, с. 1958-1961.
867. Wudl Е, Zellers Е.Т., Nalewajek В. Organic semiconductors baxed on diaminodi-cyanothiophene and diaminodicyanoselenophene. - J. Org. Chem., 1980, 45, N 16, p. 3211— 3215.
868. Миддлтон У.Дж. 2,5-Диамино-3,4-дицианотиофен. - В кн.: Синтезы органических препаратов / Под ред. Б.А.Казанского. М. : Изд-во иностр, лит., 1961,т. 11,с. 11-13.
869. Sausen G.N., Engelhardt V.A., Middleton W.J. Cyanocarbon chemistry. 7. Tricyanoethylenes. - J. Amer. Chem. Soc., 1958, 80, N 11, p. 2815-2822.
181
870. Zur basen Katalysieren Reaktion von methylenaktiven Nitrilen mit Schwefel / K.Gewald, M.Kleinert, B.Thiele, M.Hentschel. - J. prakt. Chem., 1972, 314, N 2, S. 303-314.
871. Carboni R.A., Coffman D.D., Howard E.G. Cyanocarbon chemistry. 11. Malononitrile dimer. - J. Amer. Chem. Soc., 1958, 80, N 11, p. 2838-2840.
872. Gewald K„ Martin A. Notiz zur Reaktion von Cyanessgester mit Schwefel. - J. ' prakt. Chem., 1981, 323, N 5, S. 843-846.
873. Snyder H.R., Alexander W. The synthesis of 2-aminothiophanes from ethyl cyanoacetate and alkene sulfides. — J. Amer. Chem. Soc., 1948, 70, N 1, p. 217-218.
874. Guss C.O., Chamberlain D.J. Styrene sulfide. - Ibid., 1952, 74, N 5, p. 1342-1343.
875. Studies on heterocyclic enaminonitriles. 2. Synthesis and aromatization of 2-ami-no-3-cyano-4,5-dihydrothiophenes / J.Yamagata, Y.Tomioka, M.Yamazaki et al. - Chem. Pharm. Bull., 1982, 30, N 12, p. 4396-4401.
876. Фокин A.B., Коломиец А.Ф. Реакционная способность эпитиосоединений. -Успехи химии, 1976,45,№ 1, с, 71-105.
877. Reactivity of 2,3-dimethylthiiren 1,1-dioxide as an ambident electrophilen reaction with a-metallated nitriles / T.Agawa, Y.Yoshida, M.Komatsu, Y.Ohshiro. - J. Chem. Soc. Chem. Communs, 1977, N 24, p. 931-932.
878. Reactions of thiirene 1,1-dioxides with a-metalated nitriles / Y.Yoshida, M.Komatsu, Y.Ohshiro, T.Agawa. - J. Org. Chem., 1979, 44, N 5, p. 830-834.
879. Behringer H„ Falkenberg K. Synthesen von substituierten Thiophen- und 5-Ami-nothiophencarbosauren-(2). - Chem. Ber., 1966,99, N 10, S. 3309-3315.
8^0. Fuller L.S., Pratt J.W., Yates F.S. Ja chime du thiophene. 1. Utilisations dans 1’industrie pharmaceutique. - Inform, chim., 1979, N 187, p. 147-151. - РЖ Химия, 1979,1406.
881. Fuller L.S., Pratt J.W., Yates F.S. La chimie du thiophene. 2. Utilisations non phar-maceutiques..— Ibid., N 194, p. 177-181. - РЖ Химия, 1980. 11Ж219.
882. Horig C., Koch H. Forschritte auf dem Gebiet der Arzneimittelen twicklung. — Pharmazie, 1973, 28, N 9, S. 553-574.
883. Хрипак C.M., Добош A.A., Смолянка И.В. Синтез 2-амино-3-карбэтокси-4,5, 6,7-тетрагидробензоселенофена и некоторые превращения на его основе. - Химия гетероцикл. соединений, 1973, № 3, с. 326-328.
884. А. с. 400591 (СССР). Способ получения 2-амиио-3-этилкарбокси-4,5,6,7-тет-рагидробеизо[Ь] селеиофена / А.А.Добош, С.М.Хрипак, И.В.Смоланка. - Опубл, в Б.И., 1973, №40.
885. Homfeldt А.-В. Selenophenes. - Adv. Heterocycl. Chem., 1982, 30, S. 127-166.
886. Liebscher J., Hartmann H. Ein einfacher Zugang zu neuartigen Selenopyran- bzw. Selenopyrylium-derivaten aus (3-Chlorpropenylidenimmoniumsalzen und Selennucleophilen. -Tetrahedron, 1977, 33, N 7, S. 731-734.
887. Пат. 191186 (ГДР). Verfahren zur Herstellung von 2-(N-Formamido)selenopy-ryliumsalzen / J.Liebscher, H.Hartmann. - Опубл. 05.01.77.
888. Пат. 192839 (ГДР). Verfahren zur Herstellung von n-Unsubstituierten 2-Ami-no-6-arylselenopyryliumsalzen / J.Liebscher, H.Hartmann. - Опубл. 06.07.77.
889. Liebscher J., Hartmann H. 3-Chloro-2-propeniminirnsalze (vinyloge Amidchloride) als vorteilhafte Syntheselausteine der organischen Chemie. - Synthesis, 1979, N 4, S. 241-264.
890. Thiazole and its derivatives / Ed. I.V.Metzger. - New York : London : Wiley, 1979. -Pt 2. 590 p.
891. Gewald K. Schwefel-Heterocyclen. 13. Reaktion von Malonitril mit Schwefel-Koh-lenstoff und Schwefel. — Z. Chem., 1963, 3, N 1, S. 26.
892. Gewald K. Reaktion von Schwefelkohlenstoff und Senfolen mit methylenaktiven Nitrilen und Schwefel. - Angew. Chem., 1965, 77, N 20, S. 916.
893. Gewald K. Gemeinsame Einwirkung von Schwefel und Schwefelkohlenstoff auf methylenaktive Nitrile. - J. prakt. Chem., 1966, 31, N 3/4, S. 214-220.
894. Gewald K. Heterocyclen aus CH-aciden Nitrilen. 13. Stabilisierungsreaktionen von a-Cyandithiosauren. — Chem. Ber., 1968, 101, N 2, S. 383—390.
182
895. Henriksen L., Baltzer B. Protonation and rearrangement of some 2-cyanoethylene-1,1-dithiolates. - Int. J. Sulfur Chem. A, 1972, 2, N 3, p. 220-221.
896. Yokoyama Y. 1,2-Dithiole-3-thione and 1,2-trithiole from a-cyanodithiocarboxyla-te. - Bull. Chem. Soc. Jap., 1970, 43, N 9, p. 2938-2941.
897. Gewald K., Schafer H. 3-Amino-5-nitromethylen-l,2-dithiol-4-carbon&ureester. -J. prakt. Chem., 1981, 323, N 1, S. 133-136.
898. FanghUel E. Synthese und Eigenschaften substituierter 1,4,2-Dithiazine. — Ibid., 1976,318, N1,S. 127-143.
899. Rouessac A. Composes organiques sulfures. 20. (Aryl-5-dithiole-l,2-ylidene-3) malononitriles. - Bull. Soc. chim. France, 1968, N 5, p. 2054-2056.
900. Klingsberg E. The 1,2-dithiolium cation. 6. New dithioles and no-bond resonance compounds. - J. Org. Chem., 1966, 31, N ll,p. 3489-3493.
901. Lozach N. l,6,6as*''-Trithiapentalenes and related structures. — Adv. Heterocycl. Chem., 1971, 13,p. 161-234.
902. Пат. 122248 (ГДР). Verfahren zur Herstellung von 3-Aroylimino-4-apoylmer-capto-5-cyano-3H-l,2-dithiolen / P.Hansen, H.U.Kibbel, A.Reiter. - Опубл. 20.09.76.
903. Reiter A., Hansen P., Kibbel H.U. 3,6-Bis-acylimino-3H,6H-dithiolo[4,3-c][l,2J-dithiole. - Z. Chem., 1977, 17, N 6, S. 221-222.
904. Пат. 122539 (ГДР). Verfahren zur Herstellung von 3,6-Bis-acylimino-3H,6H-dithiolo[4,3-c][l,2]dithiolen / P.Hansen. H.U.Kibbel, A.Reiter. — Опубл. 12.10.76.
905. Kibbel H.V., Hansen P. Synthesen mit cyanodithioformiaten. - Z. Chem., 1981, 21, N4, S. 121-127.
906. Anomalous reaction of bis-(2-cyanoethyl)phosphine with sulfur / M.M.Rauhut, H.A.Currier, G.A.Peters et al. - J. Org. Chem., 1961,26, N 12, p. 5135-5138.
907. Пат. 140884 (ГДР). Verfahren zur Herstellung von Natriumsalzen der 4-imino-5-thioxo-l,3-oxathiolane / H.U.Kibbel, J.Teller. - Опубл. 02.04.80.
908. Corey E.J., Carey F.A., Winter R.A.E. Stereospecific synthesis of olefins from 1,2-thionocarbanates and 1,2-trithiocarbonates. trans-Cycloheptene. - J. Amer. Chem. Soc., 1965, 87, N 4, p. 934-935.
909. Maxwell R.J., Silbert I..S. Thiocyanations. 3. Preparation of 2-imino-l ,3-dithiolane salts by cyclization of vic-dithiocyanates. - J. Org. Chem., 1977, 42, N 9, p. 1515-1517.
910. Maxwell R.J., Moore G.G., Silbert L.S. Thiocyanations. 4. Cyclization of 1-isot-hiocyanato-2-thiocyanates. A stereospecific route to the preparation of 4,5-thiazolidine-2-thiones. - Ibid., p. 1517-1520.
911. Barton D.H.R., Willis B.J. Olefin synthesis by two-fold extrusion processes. Pt 1. Preliminary experiments. - J. Chem. Soc., 1972, Pt 1, N 3, p. 305-310.
912. Gewald K., Bottcher H., Mayer R. Schwefel-Heterocyclen und Vorstufen. 30. Eifache Synthese von 2-Aminothiazolen. - J. prakt. Chem., 1964, 23, N 5/6, S. 298-300.
913. Пат. 4289524 (США). Herbicidal 3-(tetrahydrobenzothiazol-2-yl)tetrahydro 1,3, 5-oxadiazin-4-ones / B.A.Belkind. - Опубл.15.09.81.
914. Gewald K., Spies H., Mayer R. Zur Reaktion von(Enaminen mit Schwefel und Cyanamid. - J. prakt. Chem., 1970, 312, S. 776-779.
915. Shiba T.~Kato H. The preparation and properties of mesoionic 5-iminothiazole derivatives. — Bull. Chem. Soc. Jap., 1971, 44, N 7, p. 1864—1868.
916. Cook A.H., Downer J.D., Heilbron I. Studies in'the azole series. Pt 9. The interaction of a-aminonitriles and alkyl iso-thiocyanates. - J. Chem. Soc., 1948, В 12, p. 2028-2031.
917. Balquist J.M., Goetz F.J. A Re investigation of the reaction between isothiocynates and aminoacetonitrile. - J. Heterocycl. Chem., 1972, 9, N 4, p. 937-938.
918. Sen A.K., Ray S. Synthesis of compounds relater to 4(5)-an«noimidazole-5(4)-carboxamides. Pt 2. - Indian J. Chem. B, 1976, 14, N 5, p. 351-353.
919. Esmail R ., Kurzer F. The chemistry of ethoxycarbonyl isothiocyanate and related compounds. — Synthesis, 1975, N 5, p. 301-314.
920. Пат. 540279 (Швейцария). Herstellung neuer 5-Iminothiazohne / P.Brenneisen, A.G.Weiss, W.Schmidt. - Опубл. 28.09.73.
183
921. Chubb F.L., Edward J.T. The reaction between carbon disulfide and some a-met-hylaminonitriles. The supposed isomerism of 4,4-dialkyl-5-imino-3-m*thylthiazolidine-2-thiones. - Can. J. Chem., 1981, 59, N 18, p. 2724-2728.
922. Пат. 15934 (Япония). Способ получения производных тиазола /С.Хокудзё. -Опубл. 30.04.71. - РЖ Химия, 1972, 2Н344П.
923. Пат. 48—25496 (Япония). Производные тиазола в качеств* бактерицидов и фунгицидов / Й.Хасэгава, М.Дотани, С.Китадзё и др. - Опубл. 30.07.73. - РЖ Химия, 1974,12Н495П.
924. Промоненков В.К., Шаранин ЮЛ. Синтез аминотиазолов. — Черкассы, 1980. -27 с. - Рукопись деп. в ОНИИТЭХИМ, № 2742-79 Деп.
925. Gewald К., Schonfelder Н., Hain U. Uber die Reaktion von <-Aminobenzylcyanid mit Aldehyden und Schwefel. - J. prakt. Chem., 1974, 316, N 2, S. 299-303.
926. Sen A.K., Chattopadhyay G. Synthesis of compounds related to 4(5)-aminoimi-dazol-5(4)-carboxamides, Imidazoles. - Indian J. Chem. B, 1979,17, N 3, p. 222-225.
927. Sen A.K., Mukhopadhyay A.K.. Synthesis of compounds related to 4(5)-amino-imidazole-5(4)-carboxamides. Pt 4. Synthesis of 2-substituted 5-aminothiazoles and reaction of related thiazolium and imidozolium salts with bases. - Ibid., 1982, 20, N 4, p. 275-278.
928. Schollkopf U., Hartke K. Synthesen von 5-Alkoxy und 5-Alkylthio-4-alkyllmidazo-len sowie 4-Alkyl-5-ammothiazolen. - J. Lieb. Ann. Chem., 1979, N 10, S. 1602-1605.
929. Sasaki T., Ito E. s-Triazolo[4,3-b]-as-triazine, s-triazolofrM-dj-as-triazine and s-tri-azolo[3,4-b]-l,3,4-thiadiazole ring systems. - J. Heterocycl. Chem., 1981, 18, N 7, p. 1353-1356.
930. Christensen M.C., Becher J. Pyridinethiones. 6. The synthesis of 2H-thiopyrano-[2,3-b]pyridin-2-ones. - Ibid., p. 1357- 1363.
931. Synthesis using allylidenedihydropyridines. 9. First preparation of thiino[3,2-a] indolixine derivatives / A.Kakchi, S.Ito, T.Ohizumi, T.Maeda. - J. Org. Chem., 1982, 47, N 2, p. 369-371.
932. Schneller S.W. Thiochromanones and related compounds. — Adv. Heterocycl. Chem., 1974,18, p. 59-98.
933. BrunskiU J.S.A., De Asish, Ewing D.F. Dimerisation of 3-aryl-2-cyanethioacryla-mides. A [2S + 4s]cycloaddition to give substituted 3,4-dihydro-2H-thiopyrans. - J. Chem. Soc. Perkin Trans. Pt 2,1978, N 6, p. 629-633.
934. Пат. 106176 (ГДР). Verfahren zur Herstellung von N-unsubstituierten 2-Amino-thiapyryliumsalzen / J.Liebscher, H.Hartmann. - Опубл. 05.06.74.
935. Liebscher J., Hartmann H. Zur Umsetzung von Д-Chlorvinylmethinimmoniumsal-zen mit alkalirhodaniden bzw. Alkalithiosulfaten. - Z. Chem., 1974, 14, N 5, S. 189-190.
936. Пат. 149365 (ГДР). Verfahren zur Herstellung von 2-amino46-cumaryl-(3')-thio-pyryliumsalzen / P.Czemey, H.Hartmann, J.Liebscher. - Опубл. 08.07.81.
937. Gewald K. Addition von Schwefelkohlenstoff an Alkylidenmalononitrile und cya-nessigester. - J. prakt. Chem., 1976, 31, N 3/4, S. 205-213.
938. Пат. 154539 (ГДР). Verfahren zur Herstellung von thiindederivaten / K.Peseke, M.Aguila, I.Bohn. - Опубл. 31.03.82.
939. Bogdanowicz-Szwed K. The knoevenagel reaction of malononitrile with some cyclic 0-ketocarbothionic acid anilides. Synthesis of cycloalkenopyridines and cycloakenothiopy-rans. - Monatsh. Chem., 1982,113, N 5, p. 583-592.
940. Пат- 4013771 (США). Substituted 2'aminochromenes / R.E.Brown, D.M.Lustgarten. - Опубл. 22.03.77.
941. Новый синтез 2-амино-1-тиахромонов-4 / Ю.М.Воловенко, В.А.Литеико, Е.ВЩашковская, Ф.С.Бабичев. — Химия гетероцикл, соединений, 1982, № 8, с. 1047—1048.
942. Литенко В.А., Воловенко Ю.М., Бабичев Ф.С. Конденсированные 2-амино-З-(беизимидазол-2-ил) арено[ Ь] пираны. - Укр. хим. жури., 1983, 49, № 11, с. 1202-1204.
943. Жмуренко Л.А., Глозман О.М., Загоревский В.А. Синтез и свойства производных 2-амино-1-тиохромона-4. - Химия гетероцикл, соединений, 1978, № 2, с. 182-185.
944. Catel J.-M., Mollier Y. Composes sulfures heterocycliques. 47. Reactivite en milien
184
basique d’ions methylthio-3 dithiole-1,2 ylium vis-a-vis de derives depropenenitriles. - Bull. Soc. chim. France, 1982, pt 2, N 11/12, p. 342—351.
945. Wamhoff H., Korte F. Heterocyclen durch Abfaugreaktionen an geoffneten Acyl-lactonen. 1. 5-(2-Mercapto3thyl)- und 5-[3-MercaptopropylJ-5-hydroxypyrimidine und deren Ringschlup zu 5,6-Dihydrothiopheno- und 6,7-Dihydro-5H-thiopyranop,3-d]pyrimidinen. — Chem. Ber., 1966, 99, N 3, S. 872 -878.
946. Taylor E.C., Warrener R.N., McKillop A. Einstufige Synthese anellierter Pyrimi-dinthione. - Angew. Chem., 1966, 78, N 6, S. 333.
947. Steradsky T„ Southwick R.L. The Synthesis of 6,7-dihydro-5H-pyrrolo[3,4-d]py-rimidines. 2.4 Hydroxy-, 4-mercapto-, 2-amino-4-hydroxy and 2,4-ddiy dr oxy-derivatives. — J. Heterocycl. Chem., 1967, 4, N 1, p. 1-7.
- 948. Кретов A.E., Беспалый A.C. Нафтотиазииидинпроизводные. — Журн. общ. химии, 1964, 34, № 3, с. 999-1001.
949. Howard J.C. Ring cleavage of 2,3-dihydro-2-imino-4H-l,3-benzothiazin-4-one. — J. Org. Chem., 1964, 29, N 3, p. 761-762.
950. Сабо Я. 1,3-Беизотиазины. - Химия гетероцикл, соединений, 1979, № 3, с.291-308.
951. Пат. 2811131 (ФРГ). Iminobenzoxazin- und Iminobenzothiazin-Derivate sowie Verfahren zu deren Herstellung / P.Stoss, G.Satzinger. - Опубл. 20.09.79.
952. Coppola G.M., Shapiro MJ. Novel heterocycles. 7. Reaction of 2-chloronicotino-nitrile with thioureas. Synthesis of the pyrido[2,3-d]pyrimido[2,l-b]thiazine ring system. — J. Heterocycl. Chem., 1981, 18, N 5, p. 495-497.
953. Fischer E., Evers R., Gerhard R. Uber Reaktionen von Dicyanimid (DCJ) mit N, N'-disubstituierten Thioharnstoffen. — Chimia, 1974, 28, N 8, S. 388—389.
954. Fischer E„ Evers R., Gerhard R. Untersuchungen zum Reaktionverhalten von N, N-disubstituierten Thioharnstoffen gegenliber Dicyanimid (DCI). - Ibid., S. 390—391.
955. Ring expansion in the isothiazole and 1,2,5-thiadiazole ring systems. Preparation of novel heterocycles / J.Rokach, P.Hamel, Y.Girard, G.Reader. - Tetrahedron Lett., 1979, N 15, p. 1281-1284.
956. Пат. 550815 (Швейцария). Verfahren zur Herstellung von neuen 2-Imino-l,3-dithian-Verbindungen / R.Schneider. - Опубл. 28.06.74.
957. Mayer R., Jentzsch J. Schwefel-Heterocyclen. 9. Reaktionen geminaler Dithiole mit MalonsSuredinitril, Alkyliden- und ArylidenmalonsSuredinitrilen. — J. prakt. Chem., 1962,18, N 4, S. 211-214.
958. Mayer R., Jentzsch J. Schwefel-Heterocyclen. 10. Einfache Synthese monomerer Thioketone. - Angew. Chem., 1962,74, N 8, S. 292.
959. Mayer R., Morgenstern J., Fabian J. Aliphatische Thioketone. - Ibid., 1964, 76, N2,S. 157-196.
960. Thiacyanocarbont. 1. Tetracyano-l,4-ditiin, tetracyanotiophene and tricyano-1,4-dithiino(c)isothiazole / H.E.Simmons, R.D.Vest, D.C.Blomstrom et al. . — J. Amer. Chem. Soc., 1962,84, N 24, p. 4746-4756.
24
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
2-Амино-9-аза-3-цианометилтиено [2,3-Ь] бицикло [3,2,1 ] октан 127
2-Аминоазулены 24,64
2-Амино-3-алкоксикарбонил-4Н-5,6-дигидротиопираны 141
5-Амино-З-алкоксиизоксазолы 105
4-Амино-2-анилино-5-цианотиазол 43
2-Аминоарено [Ы пиран-4-оны 77
3-Амино-6-арил-2,4-дициано-4,7-бицикло[4,4,0]-2,10-декадиен 13,16
2-Амино-4-арил-4Н-нафто [2,1-Ы пираны 90
4-Амино-З-арилспиро-[4,5] дека-3,6-9-триен-2,8-дион 23
3-Амино-2-арил-5-фенилсульфонилиндолы 32
2-Амино-3-ар1й1-4Н-хромоны 77
З-Амино-2-ацетилбензо [Ь] тиофен 41
4-Амино-3-ацетил-5,6-дигидро-2 (1Н)пиридоны 47
2-Амино-5-ацетил-4-метил-3-метоксикарбднилтиофен 123
2 Амино-4-ацетил-5 -метил-3- (4-нитрофенил) фуран* 68
5-Амино-2-ацетил-3-метил-1,1,4-трицианоцикл опентадиен 25
4-Амино-3-ацетил-2-метилхинолин* 49
3-Амино-2-ацетил-6-метил-5-хлор-4-этоксикарбонилтиено [2,3-Ь] пиридин 38
5-Амино-4-ацетил-2-метил-2-циано-2,3-дигидрофуран 64
2-Амино-4-ацетил-5-метил-3-цианофуран 80
2 Амино-4-ацетил-3-этоксикарбонил-5-метилфуран 61
2-Амино-1,3,3,5,5-пентациано-1-циклогек сен 12
1-Амино-4-ацетил-4-пентил-2-циано-1-циклогексен 9
З-Амино-2-ацетилтиофен 34
3-Амино-4-бензилизоксазолон-5 1оЗ
5-Амино-4-бензилизоксазолон-3 102
4-Амино-1 -бензил-3-циано-1,2-дигидро-1,8-нафтиридин 50
1-Амино-2-бензил-2-цианонафталин 23
2Амино-6-бензил-3-этоксикарбонил-4,5,6,7-тетрагидротиено [2,3-с]пиридин 131
4-Амино-5-бензоилизоксазол-3-карбоновая кислота* 43
4-Амино-5-бензоил-2-пиперидинотиазол* 45
2-(3-Амино-2-бензоил-5-фейацилтио-4-тиенил)-4-феиилтиазол* 39
4-Амино-5-бензоил-1-фенилпиразол-3-карбоновой кислоты этиловый эфир*44
3-Амино-2-бензоил-1-фенил-4-цианофлуорен* 26
3-Амино-2-беизоил-1-этоксикарбонилиндол* 32
1 -Аминобензо [с] пирилия соли 76
3-Аминобензо [Ь] теноил-2-уксусный эфир 37
2-Аминобензо [Ь] тиофен 119
3-Аминобензо [Ь] тиофены 35,41,55
7-Аминобензо [Ь] тиофен 21,55
2-Аминобензо [Ь] фураны 72
4-Амино<{1] бензофуро [3,2^]циннолины 51, 52
186
3-Амино-2-(4-бромбензоил)тиено [2,3-b] бензотиофен* 38
З-Амино-2- (4-бромбензоил) -4-циано-5- (4-бромфенацилтио) тиофен 39
5-Амино-4-трет-бутилизоксазол 116
9-Амино-2,3>5,6,7,8-гексагидро- 1Н-циклопента [Ь] хинолин* 4g
2-Амино-3-гетарил-4(5Н) оксотиофены 121
2-Амино-3-гетарил-4Н-хромоны 77
З-Амино-5-гликозилтиофены 34
3-Амино-5,5-диалкоксн-2-изоксазолины 105
3-Амино-5,5-диалкоксиизоксазолы 105
3-Амино-4,9-дигидротиено [2,3-Ь]хинолиноны-4 38
z-Амино-4,5 -дигидротиено [2,3-Ь] тиофен 127
2-Амино-6,7-дигидро-4Н-1,4-дитиепино [6,5-Ь] тиофены 127
2-Амино-4,5-дигидротиофен-3-карбоновой кислоты этиловый эфир 120
2-Амино-4,5-дигидрофуран-3-карбоновой кислоты эфиры 72
2-Амино-4,5 -дигидрофураны 66,70
4-Амино-2,6-диимино-1,3,5-тиадиазины 143
2-Амино-5,6-диметокси-3-цианоннден 8
2-Амино-1,3-дитиа-4-циклогексены 144
4-Амино-1,3-дитиетаны 55
3-Амино-1,2-дитиолия соли 134
3- Амино- 1,2-дитиолы 133
2-Амино-4,6-дифенил-33-Дициано-4Н-пиран* 90,91
2-Амино-4,5-дифенилоксазол* 97
5-Амино-2,6-дифенил-7-оксо-7Н-тиено [3,2-Ь] пиран* 78
2-Амино-4,5-дифенил-5-циано-2-оксазолин 97
2 Амино-4,6-дифенил-5-диано-3-этоксикарбонил-4Н-пиран* 87,90
2-Амино-4,5-ди(2-фурил)-3-цианофуран* 65
2-Амино-3,5 -дициано-4Н-пираны 87
2 - Амино-1,3 -дициано-6- (1,2,3-триазолил-1) азулен 21
2-Амино-3,7-дициано-5Н-циклопента [Ь] пиридин 19
5 - Амино-4,7-диметил-3,6-дициано-2 (1Н)хинолиион 25
5-Амино-3,4-димётилизоксазол* 104
5-Амино-13-Димегил-7-метилтиопиримидо[4,5-с1]пиримидин-2,4^11^,ЗН)дион 52
7-Амино-1,3-диметилптеридин-2,4-дион 53
1-Амино-2,4-диметил-З-фенилиминоциклогек сен* 10
4-Амино-1,2-диметил-5-цианоимидазол* 44
1 -Амино-3,3-диметил-2-цианоспиро [4,5 ] -1 -децен-6-6н 17 2-Амино-4,7-диметил-1-циано-5,6,7,8-тетрагидронафталин 10
2-Амино-5,5-диметил-3-этоксикарбонил-45-дигидро-7Н-пирано [3,4-Ь] тиофен* 126
3-Амино-4,6-диметил-2-этоксикарбонилтиено [2,3-Ь] пиридин* 42
2-Амино-5,5-диметил-З- этоксикарбонил-4,5-дигидро-7Н-тиопирано [3,4-Ь] тиофен* 126
2-Амино-Ч,6-диметил-3-этоксикарбонил-7-цианоциклопента [Ь] пиран 80
5-Аминоизоксазол* 106
187 24Х
5-Аминоизоксазолон-З юз
З-Аминоизоксазолы Ю2,104
4-Аминоизоксазолы 43
5-Аминоизоксазолы 101
З-Амино-4- [2*,31-0]изопропилиден-5*-0-тритил-1-(а, 0-2>рибофуранозил]-
2-этоксикарбонилпирролы 30
4-Аминоизотиазолы 43
5-Аминоимидазо [4,5-d]-l,3-оксазин 114
4-Аминоимидазолы 44
4-Амино-5-имино [1 ] бензопирано [3,4-с| пиридин 83
4-Амино-2-имино-5,5-диалкил-2,5-дигидрофураны 59
3-Амино-5-имино-2,2-диметил-2,5-дигидрофуран* 60
4-Амино-9-имино-9-метил-12-метокси-11-оксо-2-фенил-5Н,1 lH-пирано [3* ,2*
6,7] [11 бензопирано [3,4-с]пиридин 83
3-Амино-2-имино-4Н-тиено [3,4-с] [1] бензопиран-4-он 128
4-Амино-5-имино-2-фенил-4Н- [ 1 ] бензопирано [3,4-с] пиридин 91
2-Аминоиндолизины зо
5 -Амино-4-карбомонл-1,2-дитиол-З-тион* 134
5-Амино-4-карбамоилизоксазол 105
3-Амино-4-карбамоил-5-метилтио-2-метоксикарбонилтиофен* 39
2-Амино- 3-карбамоилтиофен 123
5-Амино-4-карбамоил-3-этилизоксазол* 106
4-Амино-3-карбамоил-5-этоксикарбонилизотиазол* 43
1 - Амино-1 - (3-кумаринил) -2-этоксикарбонил-2-цианоэтилен 81
Аминомалононитрил 99,100
4-Амино-2-метиламино-3,5-дицианотиофен* 42
5-Амино-2-метиламино-4- этоксикарбонилтиазол* 138
10-Амино-5-метил-10,11-дигидродибенз [b,f] азепин 53
5-Амино-3-метил-2,4-дифенилтиазолилхлорид* 137
6-Амино-3-метил-1,4-дифенил-5-циано-1Н,4Н-пиразоло [3,4-Ь] пиран* 86,88
2-Амино-6-(2-метил-3,3-дицианоаллилиден)-4-метил-3-цианопиран 91
2-Амино-4-метил-1,3-дициано-5,6,7,8 -тетрагидронафталин 17
3-Амино-6-метил-2,4-дициано-5-этилтиофенол* 26
5 -Амино-З-метил-4-метоксиизоксазол* 108
/3-(2-Амино-4-метил-3-метоксикарбонилтиенил-5)кротоновой кислоты нитрил 123,124
2-Амино-4-метилоксазол* 96
5-Амино-З-метилизоксазол 104,107
5-Амино-4-метилизоксазол 107
2-Амино-7-метил-5-оксо-3,4,4-трициано-4Н,5Н-пирано [4,3-Ь] пиран* 86
4-Амино-1-метилпиридо [2,3-с] -1,2-тиазин-2,2-диоксид 53
5-Амино-2-метилтио-7Н-тиопирано [2,3-d] пиримидин-6,7-дикарбоновой кислоты диэтиловый эфир 46
4-Амино-3-метилтио-5-цианотиено [3,2-d] изотиазол* 38
6-Амино-2-метил-8-фенил-5,7,7-трициано-1,2,3,7,8,8а-гексагидроизохино-лин* 15
188
2-Амино-6-метил-1,1З-трициано-6-этил-4-этилиден-2-циклогексен 12 4-Амино-3-метил-1-фенилтиено [3,2-d] пиразол-5-карбоновой кислоты анилид* 35
З-Амино-2-метилфуран 58
4-Амино-2-метилхинолин* 49, 50
6-Амино-4-метил-5-циано-2- (2-метил-3,3-дицианоаллилиден)-2Н-пиран* 76
4-Амино-2-метил-5-цианопиримидин 52
1 -Амино-4-метил-4- (/3-цианоэтил) -1 -циклогексен-3-ои* 9
бис- (2-Амино-4-метил-3-этоксикарбонилтиенил-5) дисульфид 123
З-Амино-2-метоксикарбонилбензо [Ь]тиофены* 35,36
6-Амино-5-метоксикарбонилпирроло[1,2-а] [3,1]бензотиазепин 54
З-Амино-2-метоксикарбонилтиофен 34
1-Аминонафталины 22
2-Аминонафто [2,1-Ь] фураны 68,72
3-Амино-5-нитрометилен-4,1,2-дитиолы 134
5-Амино-3-(5-нитро-2-фурил)-4-цианоизоксазол* 108,116
2-Амино-4-перфторалкил-3-циано-7-диэтиламинокумарин 89
З-Амино-5-пиразолон 85
4-Аминопиразолы 43
2-Амино-4Н-пирано [3,2-с] кумарин 75
2-Амино-4Н-пирано [2,3-d] пиримидиндионы 86
2-Амино-4Н-пирано [3,2-с] хинолин 75
2-Амино-4Н-пирантионы-4 90
2-Аминопираны 76,77,84,87,90,92
6-Амино-З-(2-пиридил)-сим-триазоло [3,4-Ь]-1,3,4-тиадиазол* 139
4-Аминопиридины 48,49
4-Амино-2-пиридоны 47, 50
2-Аминопирилия соли 76
4-Аминопиримидины 52
5-Аминопиримидо [4,5-Ь] хинолины 49
2-Амино-4-пироны 78,91
4-Амино-2-пироны 46
З-Аминопирролидоны 28
5-Амино-7Н-пирроло [2,3-dl пиримидины 31
З-Аминопирролы 28-30,55
2-Амино-а-/> рибофурано [Г,2’: 4,5]-2-оксазолин* 96
2-Аминоселенопирилия перхлораты 132
2-Аминоселенофены 131
5-Амино-1,2,3-оксадиазолы 109
З-Амино-1,2,4-,оксадиазолы ] 12
5-Амино-1,2,4-оксадиазолы Ц2
2-Амино-1,3,4-оксадиазолы 113,116
17|3-(2-Амино-4-оксазолил)-4-андростен-3-он* 96
17/3- (2-Аминооксазолин-4) стероиды 96
2-Аминооксазолия соли 99
Аминооксазоло [4,3-d] изохинолиния соли 100
189
2 - Амино-13-оксазины 114
2-Амино-2-оксазолины 97
2-Аминооксазолы 94,97,98
5-Аминооксазолы 94,99,103
2-Амино-5-окси-4-хлорантра [1,2-Ь] фуран-6,11-дион 63
2 Амино-4-окси-З-этоксикарбонилгиофен* 120,121
2-Амино-4-оксо-4Н-1-бензотиопираны 141
2-Амино-3-оксо-2,3-дигидробензо [Ь] фуран 68
2-Амино-4-оксо-4Н-пирано[2,3-Ь] пиридин* 77,78
2-Амино-4-оксо-4Н-пирано [2,3-Ь] пиридины 77,78
2-Амино-4-оксо-4Н-пирано[3,2-с] пиридины 77
2-Амино-5-оксо-4-фенил-3-цианопирано [3,2-с] [ 1 ] бензопиран 89
3-Амино-4-(2-тиазолил) тиофен 39
2-Аминотиазолы 136,138
4-Аминотиазолы 45
5-Аминотиазолы 137,138
З-Аминотиено [2,3-Ь] бензотиофены 38
З-Аминотиено [2,3-с] изотиазолы 37
З-Аминотиено [3,2-с] изотиазолы 37
З-Аминотиено [3,2-d] изотиазолы 37
З-Аминотиено [2,3-Ь1-1,6-нафтиридины 35
З-Аминотиено [2,3-Ь]-1,8-нафтиридины 35
З-Аминотиено[2,3-Ь]пиразины: 35,38,55
З-Аминотиено [2,3-с] пиразолы 35
З-Аминотиено [2,3-Ь] пиридины 35,37, 55
З-Аминотиено [2,3-d] пиримидины 35,37
5-Аминотиено [2,3-d] пиримидины 37
З-Аминотиено [2,3-Ь] пирролы 31
З-Аминотиено [2,3-Ь] тиохромоны-4 38
З-Аминотиено [3,2-Ы фуран 27
З-Аминотиено [2,3-с] циннолины 35
2-Амино-5-тиоароилтиофены 128
З-Аминотионафтеи-2-карбоновая кислота 37
2-Аминотиопираны 139,141
2-Аминотиопирилия перхлораты 140
2-Аминотиопирилия соли 140
2-Аминотиофен* 118
2-Аминотиофен-5-карбоновая кислота 131
З-Аминотиофенолы 25
2-Аминотиофены* Ц7, Ц8,124,128, 130
3-Аминотиофены 33, 37
2-Амино-43,6,7-тетрагидробензо [Ы тиофен 119
З-Аминотетрагидроиндолы 29
2-Амиро-4,5,6,7-тетрагидротиено [2,3-с] пиридин 127
2-Амино-2,4а,5,9Ь-тетрагидр6-4-фенилиндено [2,1-е] -1,3-оксазин 114
2-Амино-4,5-тетраме1илентиазол' 137 190
2-Амино-4,5-тетраметил ентиофен 122,128
6-Амино-3,4-тетраметилен-5-циано-2Н-тиопирантион-2 * 141
2-Амино-4,5 -тетраметилен-3-этоксикарбонилселенофен 131
2-Амино-4,43 З-тетраметил-2-оксазолинон 99
4-Амино-2,2,6,6-тетраметил-5-циано-1,3-дитиа-4-циклогексен* 144
1-Амино-23,43-тетрацианоанилин 8
2-Амино-4,4Д-триацетил-6-метил-3-этоксикарбонил-4Н-пиран 62,80
4-Амино-2,3 -триметилен-6,7-дигидро-5 Н-1 -пиридин* 48
2-Амино-4,6,7-триметил-5-окси-3-цианобензо [Ь] фуран* 72
З-Амино-13 3-триметил-4-циано-1З-Диклогександиен* 12
6-Амино-13,4-трифенил-5 -циано-2-тиоксо-133,7-тетрагидропирано [2,3-d] -имидазол* 88
5 -Амино-2-трихлорметил-3,4,4-трициано-2,3-Дигидрофуран* 71
1 -Амино-23 З-трициано-7- (N-морфолинил) -За,43,6-тетрагидроинден 16
2-Амино-3,4,4-трициано-4Н-пиран 75
1 -Амино-23 З-трициано-7-(N-пирролидинил) -За,43,6-тетрагидроинден 16
1-Амино-23 З-триЦиано-З-этоксикарбонилметилен-1-циклопентен 20,63
6-Аминоурацил 52
З-Амино-2-фенилбензо [Ъ] тиофен-1,1-диоксид 36
2-Амино-4-фенил-13-Дициано-5,6,73-тетрагидронафталин 17
5-Амино-З-фенилизоксазол 104
1 -Амино-З-фенилоксазоло [43-а] фталазиния фторборат* 101
5-Амино-4-фенилсульфонилизоксазол* 105
2-Амино-5 -фенилтиометил-2 -оксазолин* 97
2-Амино-5-феНилтиофен 119
3-Амино-5-фенил-2,4,4-трицианобицикло [4,4,0] -2,10-декадиен* 16
3-Амино-5-фенил-4-цианотиофены 33
2-Амино-6-фснил-3-этоксикарбонилпирилия перхлорат* 76
2-Аминофураны 57,61,62,68
2-Аминофуро [33-Ь] пиридин 60,73
2-Аминофуро[33-Ь]пиридин-3-карбоновой кислоты этиловый эфир 73
2-Аминофуро[3,2-Ъ]пиридин-3-карбоновой кислоты 4-нитрофениловый эфир* 60
2-Аминофуро [3,2-Ь] пиридины 60
3-Амйнофуро[23-Ь]пиридины -28
4-Аминохиназолины 52
З-Аминохинолины 51
2-Амино-6-хлор-3-циано-4Н-хромон-4 77
2-Аминохромоны 77
4'-Амино-3'-цианоадамантанспиро-3'-циклопентен 8
2-Амино-3-циано-5-арилфураны 62
2-Амино-3-циано-4-ацетил-5-мегилфуран 58
З-Амино-2-цнанобензантрон 23
7-Амино-6-циано-3,4-бензо [3,2,2] -3,63-нонатриен-2-он* 15
2-Амино-3-циано-4Н- [11 бензопиранил-4-уксусной кислоты амид 90
5-Амино-4-циано-1,2,3,6,7,8-гексагидро-ассим-индацен 20
191
2-Амино-3-циано-5,6-дигидро-4Н-нафто [ 1,2-Ь] пиран 76
3-Амино-4-циано-23-дигидропиррол 28
транс-5-Амино-6-циано-7,12-диоксо-7,12-дигидроиндено [1,2-а] флуорен 19 4-Амино-5-циано-1Л-Дитиа-4-циклогексены 144 5-Амиио-4-циано-1,2-дитиол-3-тион* 133
6-Амино-5-циано-1,3-Дифенил-2-тиоксо-1,23,7-тетрагидропирано[3,2-(1]имид-азол 88
2-Амино-3-циано-4,5-дифенилфуран 58,63,65,67
6-Амино-5-циано-2- (3,3-дициано-2-метилаллилиден) -4-метил-2Н-пиран 25 5-Амино-4-цианоизоксазол 105
1 -Амино-4-цианоизоксазоло [3,4-с] хинолин 109
5-Амино-1 -цианометил-8а,8Ь-диаза-ассим-индацен 52
2-Амино-3-циано-6-метил-4-пирон 91
3-Амино-4-циано-5-метилфталевый ангидрид 58
2-Амино-3-циано-4-метилфуран 58
1-Амино-2-цианонафталины 22 2-Амино-3-циано-4-нитрометил-4Д-дигидрофуран* 67 5-Амино-4-цианооксазол* 100
2-Амино-3-циано-5-оксиантра [1,2-Ь] фуран-6,11-дион 72
2-Амино-З-цианопиразол 142
6-Амино-5-цианопирроло [ 1,2-а] [3,1 ] бензотиазепин 54
4-Амино-5-цианосалициловая кислота 21
быс-(2-Амино-3-циано-4-тиенил) дисульфид 123 4-Амино-3-циано-133,6-теграгидроарсенины 47
4-Амино-3-циано-1,2,5,6-теграгидропиридины 47
4-Амино-3-циано-133,6-тетрагидрофосфорины 47
2-Амино-З-циано-4,5-тетраметилентиофен* 121,122
2-Амино-3-циано-5,6,11 -триоксиантра [ 1,2-Ь] фуран 72
2-Амино-3-циано-1,6,6а,З'У-тритиапенталены 134
2-Амино-З-цианофураны 65
4-Амино-3-циано-2(1Н)хинолинон* 50
3-Амино-2-циано-4-хлорбензо[Ы фуран 28
2'-Амино-3'-цианохолест-2-ено [2,3-Ь] тиофен* 127 1-Амино-2-цианоциклогексен б
2-Амино-3-циано-5-этоксикарбонилметилфуран 63 1-Амино-1-циклогексен-3-он 26
З-Амино-2-циклогексеноны 9
1-Амино-2-цианоциклопентен 68
4-Аминоциннолины 51
З-Амиио-5-этилизоксазол 104
З-Амино-2-этоксикарбонилбензо [Ыфуран 28
2-Амино-3-этоксикарбонил-4,5-дифенилфуран 58 5-Амино-4-этоксикарбонилизоксазол 102 2-Амино-5-этоксикарбонил-6-метил-4-арил-3-циано-4Н-пиран 89 2-Амино-5-этоксикарбонил-6-метил-4-(2-фурил)-3-циано-4Н-пиран* 84 2-Амино-4-этоксикарбонил-5-метил-3-цианофуран* 63 192
2-Амино-3-этоксикарбонил-4Н-пираны 87
2-Амино-3-этоксикарбонил-6-метил-4-пирон 91
7-Амино-6-этоксикарбонил-1,4-бензоксазепин-4 (5Н) -тион* 115
3-Амино-2-этоксикарбонил-8-оксо-1 Н.8Н-43,6,7-тетрагидропирроло [2,3-с]-азепин 31
2-Амино-З-этоксикарбонилпирроло [2,1-а]изохинолины 32
2-Амино-З-зтоксикарбонил-2-(этоксикарбонилцианометил)-2Н [1 ] -бензопиран 81
2-Амино-З-этоксикарбонил-4- (этоксикарбонилцианометил) -4Н-хромен* 81
2-Амино-З-этоксикарбонилфуро [2,3-Ь] хинолин 59
Акрилонитрил 104, 105,132
4-Алкил-5-аминоимидазолы 139
З-Алкилизоксазолы 105
Андростан-3,17-дион 127
2-Арил-5- (2-оксифенил) [2,3,4-de] бензопирано [2,3-d] пиримидины 83
З-Арил-2-цианотиоакриламиды 140
5-Арил-3-этоксикарбонил-2-фосфориламинофураны 63
4-Ацетил-2-имино-5-метил-3-циано-3-дицианометил-2,3-дигидрофуран* 71
30-Ацетоксиандрост-5-ено [ 17,16-с ] -2,6-дицианоанилин 17,18
Ацетонциангидрин 27,111
3-Ацила1^ино-4-алкилтиоксикарбонил-5-циано-1,2-дитиолы 134
З-Ациламино-2-бензо [с] пирилия соли 78
3,6-бис-(Ациламино)-ЗН,6Н-дитИоло [4,3-с1 [1,2] дитиолы 134
3,6-бис-(Ацетилимино)-ЗН,6Н-дитиоло [4,3-с] [1,21 дитиол* 135
2-Ацетилимино-1 ^-оксоланы 93
Барбитуровая кислота 86
Бензилиденмалононитрил 86
4-Бензилиден-3-метил-5-изоксазолон 88
транс-Бензилтиокротоновой кислоты нитрил 119
дас-Бензилтиокротоновой кислоты нитрил 119
4-Бензилтио-З-хлорбутиронитрил 119
2-Бензимидазолилацетонитрил 72
О-Бензил-а-циано-0-Фенилпропангидроксамовая кислота 101
0-Бензоилакрилонитрил 68
2Н- [11 Бензопирано [2,3-d] пиримидин-2,4 (ЗН)дионы 83
Бицикло[2,2,1]гептанон-2 126
а-Бром-0-гликозилакрилонитрил 27
З-Бромизотиазоло [5,4-Ь] пиридины 41
4-Б ром-2 -имино-5,5 -диалкил-2,5-дигидрофураны 59
Бромциан 98,99,139,142
5-(2-Бромэтил)-2-иминооксазолидины 99
3-трет-Бутил-4-циано-5-изоксазолоч 106
13>За,4,9,9а-Г ексагидро-2-метил-4,5-этано-2Н-бенз [fl изоиндолон-10 126
1,1,2,4,5,5-Гексациано-3-алкил-1,3-пентадиены 8
1,1,2,3,4,4-Гексациано-2-бутен 8
193
25
З-Гетарилкумаринимиды-2 82
2,4-Диамино-3,5-диметоксикарбонил-6-метоксикарбонилметилпиридин 47
2,6-Диамино-3,7-дицианобензо [1,2-b:4,5-b] дифуран 66,72
4,9-Диамино-3,8 -дициано-1ОЬ ,1 Ос-диазадициклопен та [е f ,kb ] гептален 54
2,4-Диамино-ЗД-дициано-За,6-диметил-За,4,7,7а-тетрагидро-эндо4,7-эпок-сибензофуран 68
1,4-Диамино-2,5 -дицианопентален 19
2,5-Диамино-3,4-дицианоселенофен 132
4,6-Диамино-3 Д-дициано-2Н-тиопиран-2-тион 46,140
2,4- Ди амино-3,5 -дицианотиофен* 130
2,5- Диамино-3,4-дицианогиофен* 130,132
2,6- Диамино-3,7-диэтоксикарбонилбензо[1,2-Ь:4Д-Ь]дифуран 72 ЗД-Диаминоизоксазолы 103
4 Д-Диамино-7 -метил- 1-метилтио-6-циано-7Н-пирроло [2,3-d] пиримидин* 32
3,4-Диамино-7-метил-5-циано-6-этилбензо [b J тиофен-2-карбоновой кислоты этиловый эфир* 37
4,6-Диамино-2 (1Н) пиридоны 48
2,4-Диамино-5,6,7Д-тетрагидрохиназолин* 53
3,4-Диаминотиено [2,3-Ь] тиофены 38
3,5-Диаминотиофены 40
2,4-Диаминохиназолины 52
4,6-Диамино-5-циано-2,3-дигидрофуро [2,3-Ь] пиридин 67
Дезилмалононитрилы 62,63
Дезилциануксусные эфиры 63
N, N' : N, Ыг-бис(Декаметилен)-1,4-диамино-О,О'-(Ю-циано-11-аминогенэйко-зан-10-диил-1,12)-2,5-диоксибензол 54-
2,4-Диилиден-1,3-дитиетаны од
2 Д-Диимино-3,6-дифенил-4-метилморфолин 114
Дикетен 78
З-Диметиламиносиднон-5-имина хлоргидрат* 112
4,6-Диметилантраниловой кислоты нитрил* 10 л<езо-4Д-Диметил-13-диоксолан-2-он 94
3,5-Диметил-2,4-дицианоанилин 1
3,5-Диметил-2,6-дицианоанилин* 17
1,1-Диметил-2,2-дицианоциклопропан 16 ЗД-Диметил-2-цианоанилин 10
2,4-Диметоксибензилиденциануксусный эфир 88
4,9-Диметокси-5-метил-6-циано-7-имино-7Н-фуро [3,2-gl [11 бензопиран 82
3,4-Диметоксифенилацетонитрил 78
2,10-Диокса-6-азатетрацикло[63,0,0,4 п,05 9]ундекан 69,70
2,5-Диокси-1,4-дитианы 123
2,3-Дифенилянтарной кислоты динитрил 108
2,2-Дихлор-4-пентеновой кислоты нитрил 7
1,2-Дицианоанилины 22
Дициандиамид 52,115
194
Дициано ди (4-этпшфенацил) метан 62
1,2-Ди (цианометил) бензол 8
4-Дицианометилкн-2- (2-хинолинил) -4Н- [ 1 ] бензопиран 91
2-(2,2-Дицианоэтил)-1-тетралон 76
Ди (2-цианоэтил) фосфин 135
1,2-Диэтоксика;рбонил-1,2-дицианоэтилен 84
4- (1 -Имидазолил) -2-имино-5,5-диалкил-2,5-дигидрофураны 59
2-Имино-3-арил-5-арилцианометилен-4-окси-2 Д-дигидрофураны 70
2-Имино-5-(бензиламино)-5,6-дигидро-2Н-1,5-бензазоцин-6-он 116
2-Имино-2,5,6,8 ,9,10-гексагидро-4Н-имидазо [2,1-d]-1,3 Д-оксадиазоцин 116
2-Имино-23 дигидробензо[Ь] фураны 69
1 -Имино-1Д -дигидробензо [с ] фуран 60
2-Имино-2,3-дигидро-4Н-1 Д-бензотиазин-4-он 142
5-Имино-9,10-дмгидро-5Н,8Н-1шридо[2,3-<1]11иримидо[2,1-Ь] [1,3] тиазин* 143
2-Имино-5-диметиламино-1,3-дитиан 143
З-Имино-2,2-диметил-4-(2,2-диметоксиэтил)тетрагидрофуранон-5 27
2-Имино-23-димегил-2-сульфолены 131
2-Имино-3,4-димегил-5-фенилоксазолидин 95
2-Имино-3,3-димегилциклопентено [Ь] хромен 7
4-Иминодиоксоланы 92,116
2-Имино-13-дигиоланы 135
2-Имино-1,4-дигиолы 144
2-Имино-43 -дифенил-3 -циано-5 -этокси-2 3 -дигидрофур^г 70
4-Имииоизохинолины 51
2-Иминоимидазю [ 1,2-а] имидазолы 44
2-Имдноимидазю [1,2-а] пиримидины 44
2-Имино-4-метшпбензоксазолин 98
З-Имино-1-метокси-1 Д-дигидрофуро [3,4-с] пиридин 60
2-Имино-8-метил-5-метокси-6-оксо-3-циано-2Н,6Н-бензо [ 1,2-b -5,44b1] дипиран 82
7- (2-Имино-6-м«етил-3-циано-2Н-пиранил-4) -6-метоксибензо [Ь] фураны 79
2-Имино-З-метил-З-этоксикарбонилтетрагидротиофен* 120
2-Имино-З- (5-метокси-2-тиенил) -7-диэтиламинокумарин* 82
б-Имино-1,33-оксадиазины 115
7-Имино-1,2,6-оксадитиепины 116
5-Иминооксазолидин 100
5-Имино-4-оксазолидинтионы 100
2-Иминооксазолидины 97,98
1 -Имино-1,4-оксатиан 115
2-Имино-4-окси кумарины 90
2-Имино-4-окси:-3- (3-хлорфенил) -5- (3-хлорфенил) цианометилен-2,5-дигид-
рофуран* 70
2-Имино-4-окса1нафто [2,3-е1 -1,3-тиазин 142
2-Иминоселеноксоланы 93
З-Имино-13,9,11-тетраметил-7-оксо-4,8-дициано-2,10-диокса-6-азатетрацикло-
[6,3,0,04'1105-9 ]ундекан* 69
„ 195
Г»Е
тртЛс-2-Имино-4^-тетраметилен-13-тиоксоланы 94 час-2-Имино-4,5-тетраметилен-1,3-тиоксоланы 94 2-Имино-1,3-тиазины 142 4-Имино-4Н-тиено-[2,3-d]-1,3-оксазин 114
2-Имино-1,3-тиоксоланы 93
4-Имино-5-тиоксо-1,3-оксатиолан-2-спироциклоалканы 135
2-Иминотиопирано[3,2-а] индолизины 139
2-Имино-2Н-тиопирано [2,3-bJ пиридина хлоргидрат 139
4-Иминотиопираны 47
7-Имино-1,2,3-триазоло [4,5-d] -1,3-оксазин 113
4-Имино-2-трихлорметил-1,3-диоксолан* 93
5-Имино-З-фенил-З Д-дигидро-1,23,4-оксатриазола хлоргидрат* 113
2-Имино-3-циано-2Н-тиопираны 141
2-Иминоциклогексанспиро-2'-Г,3'-дитиолан-4'-спироциклогексан* 135,136 2-Имино-2Н-циклогептаоксазол 95 2-Имино-3-этоксикарбонил-2Н-тиопираны 141
Кетен-S,S-ацетали 40,47,50
0-Кетонитрилы 101
Кумаринимины 81,82,83
Малононитрил 17,26,42,46,58,62-67,69,71,72,77,79
Малононитрила димер 130
2-Меркаптоацетон 122
2- (2-Меркаптофенил) -4,5-дигидроимидазол 142
2-Меркаптоциклогексанон 121,122
1-(4-Метиламинофенил)-1,2,2-трицианоэтилен 107
2-Метил-2 -бутен 7
2-Метилентиаэолидиноны-4 123
5-Метилизоксазол 90
1- (1-Метил-2-метоксикарбонил-3-индолил) -1-циано-2,2-бкс-метилтиоакрило-нитрил 78
1-Метил-4-пиперидон 13
З-Метил-5-пиразолбны 84
5-Метилтио-б-нитро-3-фенил-2-цианоанилин* ] 1
5-Метилтио-3-фенил-2,6-дицианоанилин* 11
2-Метил-2-циано-4-ацети!лмеркаптомасляной кислоты этиловый эфир 120
4-Мегил-3-цианокумарин-2-имин 128
0-Нитроакрилонитрил 107
N-Нитрозоадамантилацетонитрил ЦО
N-Нитрозоаминоацетонитрилы 109
М-Нитрозо-2- (метиламино) ацетонитрил 110, 111
М-Нитрозо-М-фенилгидразинонитрил 113
4-Нитрофенил-0-(3-ацетокси-2-пиридил) цианоацегат 60,73
З-НитрохинолинЫ-оксид 109
1 -Окса-2 (1 Н)азуленонимин 64
13-Оксатиазолиевые соли 42
1,3-Оксатаолиевые соли 42
196
1-(2'-Оксибензилиден)-1-инданон 88
4-Окси-Х ,2-дигидро [ 1] бензотиено [3,2-Ъ] пирид-2-он 37
К-Оксид-N- (а-цианобензилиден) анилин 108 2-а-Оксиизопропил-1-цианоциклопропанкарбоновой кислоты иминолактон 67 2-Оксиникотиноилацетбнитрил 77 6-Оксинитрилы 74,75 5-Оксонитрилы 74 3-Окситиофены 39,42 1-Окси-2-фенацил-3-цианоиндол 76 5-(2-Оксифенил)изоксазолы 90 2-Окси-2-этокси-3-циано-4Н-фуро[3,2-Ъ] пиридин 73 5-Оксо-4-оксаспиро [2,3 J гексан 78, 91 1 -Оксо-3 -тиоксо-2 Л ,7,7а-тетрагидропиримидазол 88 2-Оксо-3-циано-2,3-дигидрофуро [3,2-Ы пиридин 60,73 2,4,7,8,8-Пентаметил-9-имино-2,4-диазобицикло[4,3,0]-1-нонен-1,3-дион 7 Пулегон 87
Реакции
Брауна 99
Гевальда 121,125, 131,136
Гофмана 117
Дильса — Альдера 57
Зандмейера 36
Кневенагеля 12,65,80,121
Крейвена 71
Курдиуса 117
Михаэля 21,85,86,105
Риттера 22
Рихтера 109
Торпа 4,8,9,11,39,46,47,53
Торпа-Циглера 4,54 цианэтилирования 9,47,104 5-Сиднонимины 109 .
Сиднофен* i 11
Спиро [оксиндол-3,4'- (2'-амино-3'-циано-5',б',7',8' -тетрагидро-4Н-пирано] -[2,3-d]-пиримидин-5',7'-дион 86 3,4,5,6-Тетрагалогенфенилен-1,2-иминокарбонаты 92 33,4,4-Тетрациано-2Л-гексавдиол 71 Тетрацианоэтан 68, 70, 129, 132 Тетрацианоэтилен.46,68, 70,89, 129, 132 Тиноридин 131 Тиоксантонимины 46 1,3,4-Триметил-2-аминокарбазол 10 N6 -Триметилсилил-З-циклогексилсиднонимин 111 23,4-Трифенил-5-имино-3-изоксазолин 108 Фенацилмалононитрилы 62
197
Фенилазомалононитрил 100
.м-Фенилендиамины 26
З-Фенилизопропилсиднон-5-имина хлоргидрат* 111
Ферроценофаны 54
Хинуклидон-3 127
3-Хлор-1,2-бензизотиазолы 41
2-Хлор-6-нитробензонитрил 28
З-Холестанон-2-тиол 127
Цианамид 45,95
Цианацетамид 48, 121, 129 ,
18-Цианкортикостероиды 75
а-Циано-а- (2-амино-3-этоксикарбонил-4Н- [ 1 ] бензопиранил-4) уксусная кислота 81
4-Цианоацетиламино-2-пироны 46
2 -Цианобензилмеркаптан 118
1-Циано-2,4-диамино-5-имино [11 бензопирано [3,4-с] пиридин 83
1-Циано-4,4-диамино-12-метокси-9-метил-11-оксо-5Н,11Н-пирано [З’,2':6,7]-
[11 бензопирано (3,4-с] пиридин 83
2,5-6ыс-(Цианометил)-1,4-дитиан 118
а-Циано-0-метоксиаминокротоновой кислоты этиловый эфир 106
З-Цианокумаринимин* 81
1 -Циано-3-(4-пиридил) акриловая кислота 6
18-Циано-5а-принандиол-3/3,20/3 59
3-Циано-4,6,7-триметил-5-оксииндол 72
в-Циано-0-фенилпропионовой кислоты этиловый эфир 102
1-Цианоэтилен-2,2-дитиолат натрия 38
3- (а-Циано-а-этоксикарбонилметил) -2-оксо-1,2-дигидрохинолин 59
N-Циано эфедрин 95
Циануксусный эфир 24,47, 63, 66,67,71—73,79,129
Циантиоацетамид 38,71,123
Циклогексанспиро-2-Г,3'-дитиолан-4'-спироциклогексан-5-тион* 135,136
З-Циклогексил иденамино-2,2 -пентаметилен-5,6-тетраметилен-1,2-дигидро-
тиено [2,3-d] пиримидон-4 126
З-Циклогексилсиднонимин 111
З-Циклогексилсиднонимина хлоргидрат 111
Этоксиметиленмалононитрил 50, 89
ОГЛАВЛЕНИЕ
Введение........................................................ 3
ЧАСТЬ ПЕРВАЯ. РЕАКЦИИ ЦИКЛИЗАЦИИ С УЧАСТИЕМ АТОМА УГЛЕРОДА КАК НУКЛЕОФИЛЬНОГО ЦЕНТРА................................... 4
ГЛАВА 1. СИНТЕЗ КАРБОЦИКЛИЧЕСКИХ АМИНОВ......................... 7
1.1. Циклизация а, ы -динитрилов.......................... 7
1.2. Циклизация с участием аллильного или способного к енолизации атома углерода................................,............. 9
1.3. Димеризация и содимеризация непредельных нитрилов.......И
1.4. Синтезы на основе кетонов и енаминов...................15
13. Циклизация с участием$р2-углеродиого атома.............21
1.6. Реакции рециклизации...................................24
ГЛАВА 2. СИНТЕЗ ГЕТЕРОЦИКЛИЧЕСКИХ АМИНОВ........................27
2.1. З-Амииофураиы..........................................27
2.2. 3-Аминопирролы...................................... 28
2.3. 3-Аминотиофены.........................................33
2.3.1. Конденсация вицинальных галогеннитрилов с меркаптанами 33
2,3.2. Конденсация 2-мёркапто- или 2-тиоксонитрилов с галогенопроизводными метиленактивных нитрилов...................37
2.3.3. Синтезы на основе алкилтио- и алкилоксиилиденпроизводных нитрилов . . . .........................................38
2.3.4. Рециклизация гетероциклов в 3-аминотиофены.......41
' 2.4. Аминоазолы.............................................43
23. Шестичленные гетероциклические амины с одним гетероатомом в цикле...................................................46
23.1. З-Амино-и 4-аминопиридины и родственные соединения . . . . 47
2.6. Аминотиаэины, аминодиазины, амияотриазины..............51
2.6.1. 4-Аминопиримидины ...............................52
2.7. Аминоазепины н амины больших циклов....................53
ЧАСТЬ ВТОРАЯ . РЕАКЦИИ ЦИКЛИЗАЦИИ С УЧАСТИЕМ АТОМА КИСЛОРОДА КАК НУКЛЕОФИЛЬНОГО ЦЕНТРА..................................56
ГЛАВА 3. 2-АМИЦОФУРАНЫ......................................... 57
3.1. Циклизация 1,4-оксннитрилов.......................... 59
3.2. Синтезы на основе а-галогенкарбоннльных соединений.....61
3.3. Синтезы наоснове а-оксикарбоиильных соединений . . .'..65
3.4. Синтезы на основе оксиранов.............................66
33. Синтезы иа основе карбонильных соединений............. 68
33. Синтезы иа основе тетрацианоэтана и тетрацианоэтилена..70
3.7. Синтезы иа основе хиноиов..............................71
33. Реакции рециклизацни....................................72
ГЛАВА 4. 2-АМИНОПИРАНЫ..........................................73
4.1. Циклизация 6-окси-и 6-оксоиитрилов.....................74
4.2. Взаимодействие карбонильных соединений с метиленсодержащими нитрилами.................................................. 78
4.3. Синтезы, основанные на реакции Михаэля ................84
4.4. Рециклизация гетероциклических соединений..............90
ГЛАВА 5. АМИНОГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ С ДВУМЯ И БОЛЬ-
ШИМ ЧИСЛОМ ГЕТЕРОАТОМОВ В ЦИКЛЕ.................................92
5.1. 1,3-Диоксолаиы.........................................92
5.2. 1 Д-Тиа- и 1,3-селеноксоланы...........................93
5.3. 2-Амино- и 5-аминооксазолы.............................94
199
5.3.1. 2-Аминооксазолы ................................... 95
5.3.2. 5-Аминооксазолы ................................... 99
5.4. 5-Аминоизоксазолы....................................... 101
5.5. 1,2,3-Оксадиаэолы (5-сиднонимины) .................... 109 ,
5.6. 1Д,4-Оксадиазолы........................................ 112
5.7. 1,3,4-Оксадиазолы....................................... ИЗ
5.8. 1,2,3,4-Оксатриазолы..................................... ИЗ
5.9. Амины шести-, семи- и восьмичленных кислородсодержащих гетероциклов ...................................................... ИЗ
ЧАСТЬ ТРЕТЬЯ. РЕАКЦИИ ЦИКЛИЗАЦИИ С УЧАСТИЕМ АТОМА СЕРЫ КАК
НУКЛЕ ОФИЛЬНОГО ЦЕНТРА ...................................... И7
ГЛАВА 6. 2-АМИНОТИОФЕНЫ.......................................... 117
6.1. Циклизация умеркаптонитрилов . . . ...................... И8
6.2. Синтезы на основе карбонильных соединений............... 121
6.3. Синтезы на основе 1,1,2,2-тетрацианоэтана и родственных соединений 129
6.4. Взаимодействие тииранов и тииренов с метиленактивными нитрилами и некоторые другие реакции рециклизацин.................. 130
6.5. Реакции циклизации с участием атома селена как нуклеофильного центра....................................................... 13'1
ГЛАВА 7. АМИНЫ ПЯТИЧЛЕННЫХ С ДВУМЯ И БОЛЬШИМ ЧИСЛОМ ГЕТЕРОАТОМОВ В ЦИКЛЕ И ШЕСГИЧЛЕННЫХ ГЕТЕРОЦИКЛИЧЕСКИХ СОЕДИНЕНИЙ ........................................................ 133
7.1. 1,2-Дитиолы и родственные им соединения................. 133
7.2. 1,3-Тиоксоланы и 1,3-дитиоланы.......................... 135
7.3. 2-Амино- и 5-аминотиазолы и родственные системы ........ 136
7.4. 2-Аминотиопираны........................................ 139
7.5. 2-Аминотиазины......Л................................... 1*2
7.6. Аминодитиаиы............................................ 143
Список литературы................................................ 145
Предметный указатель ............................................ 186