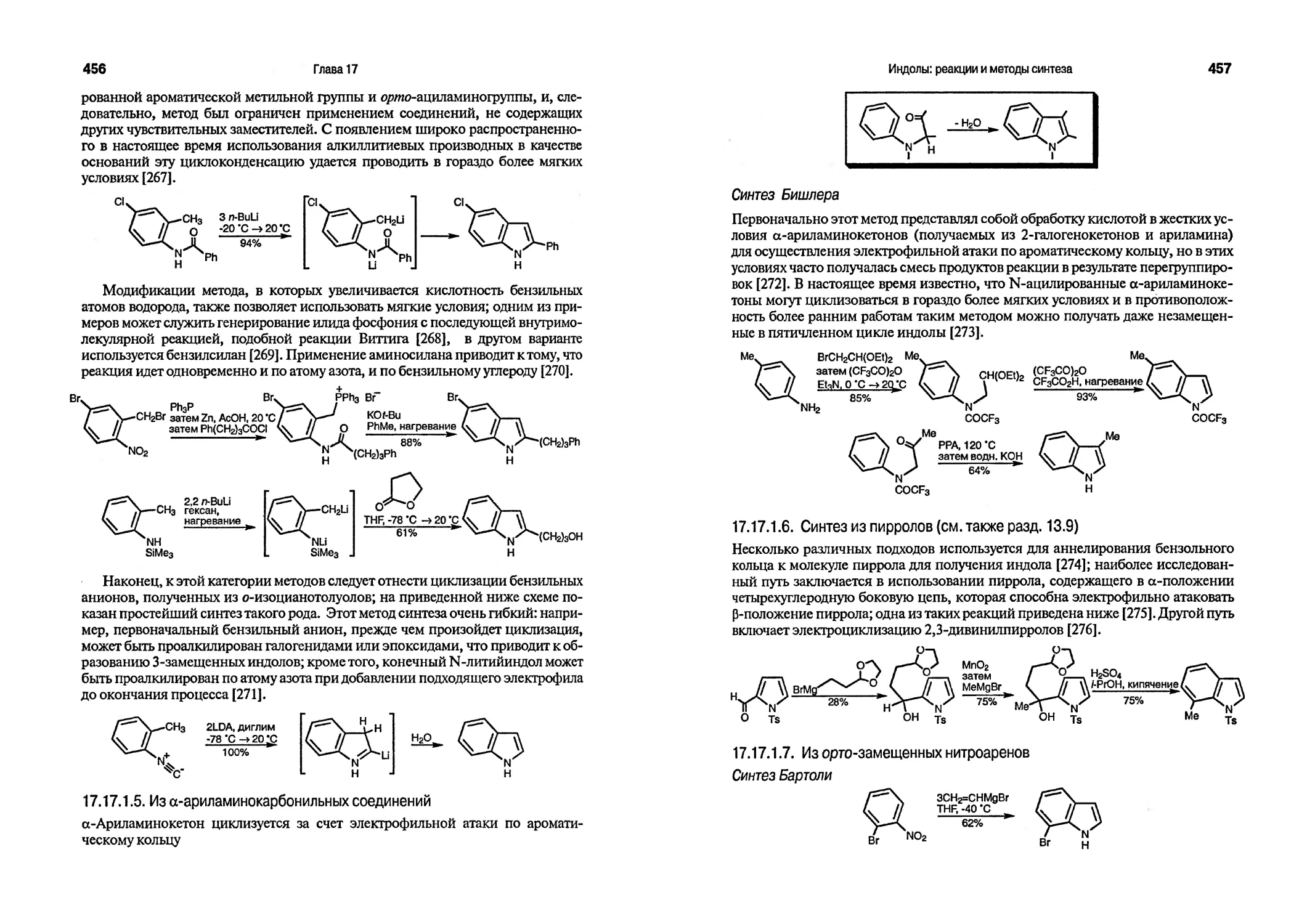
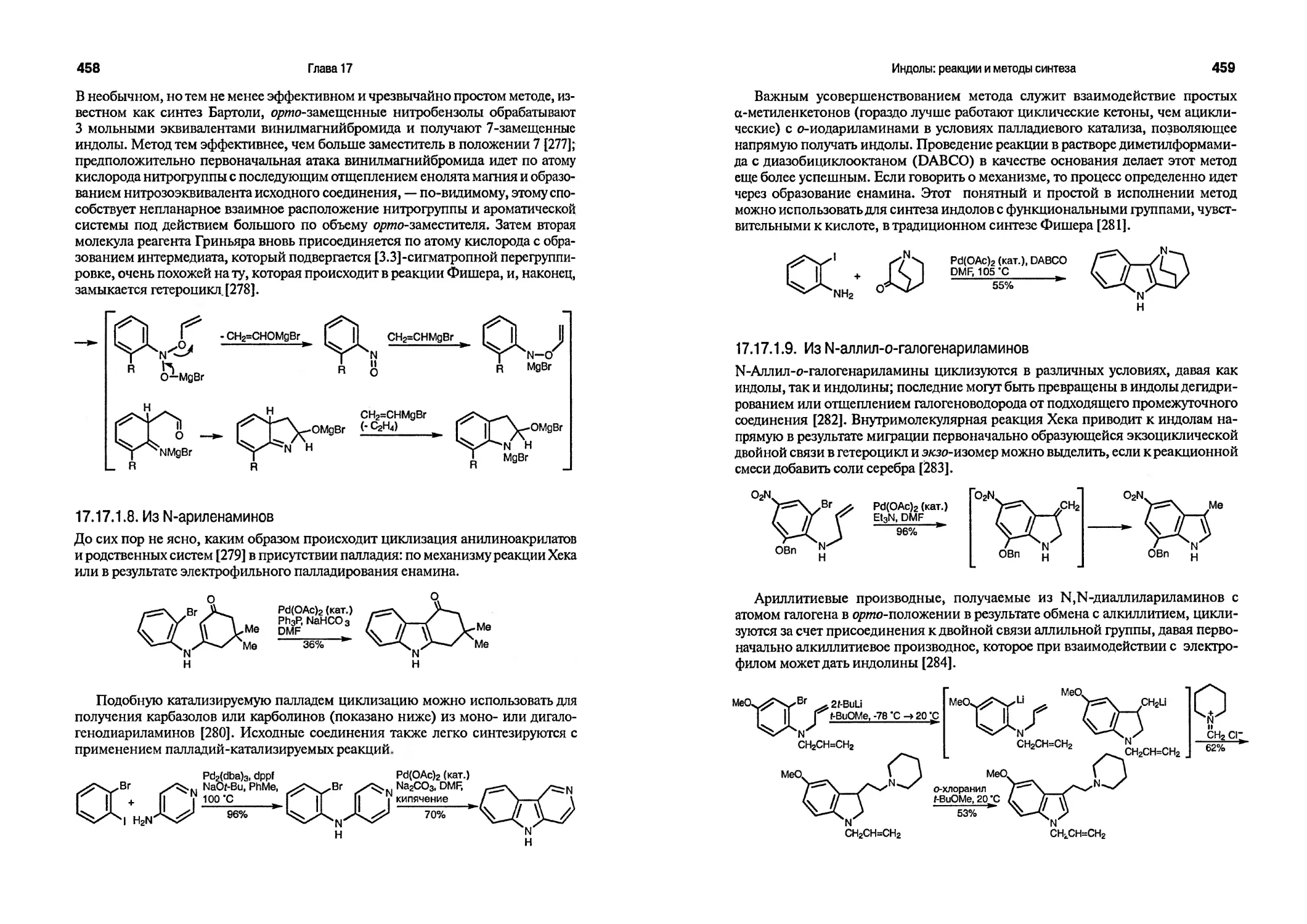
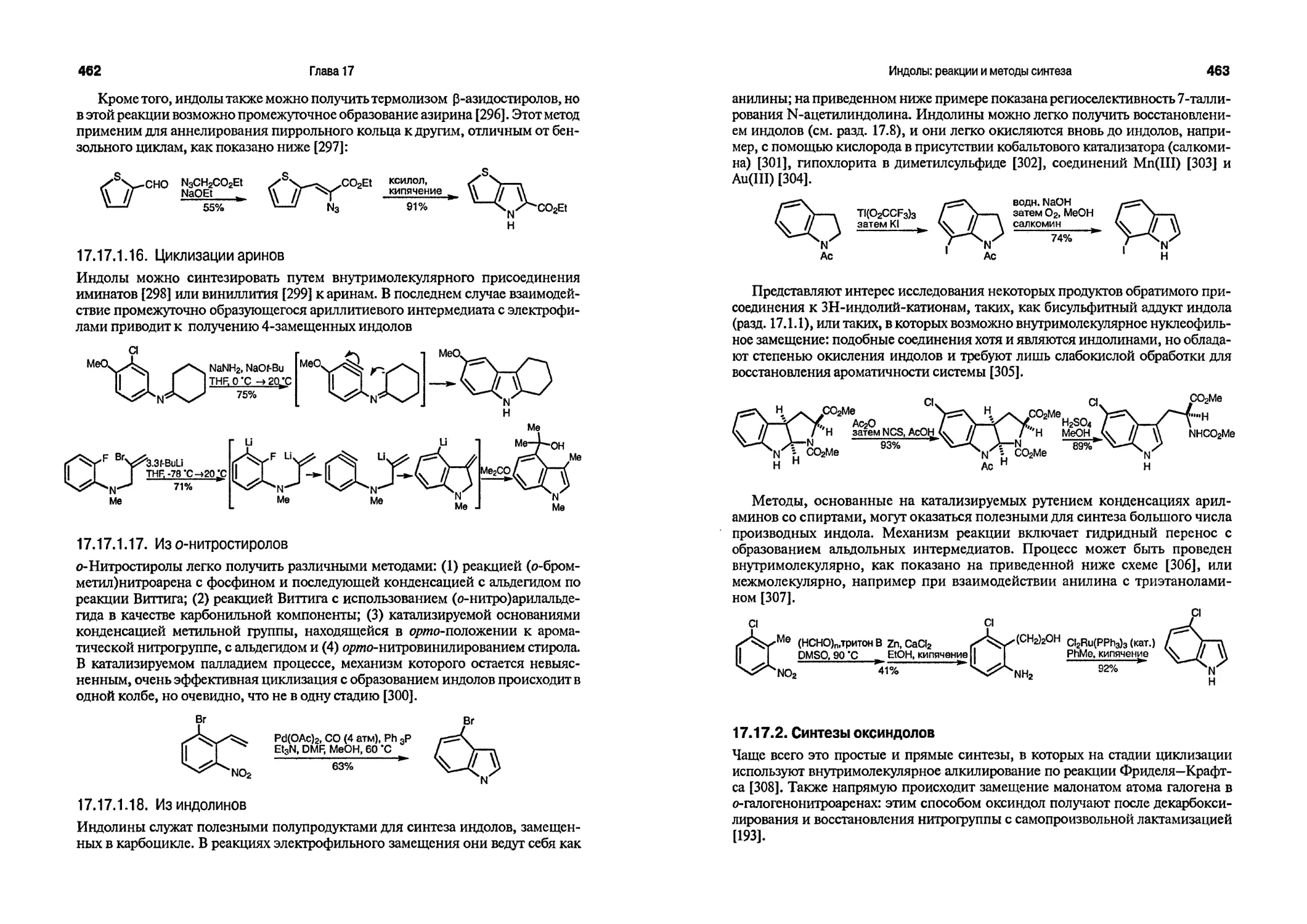
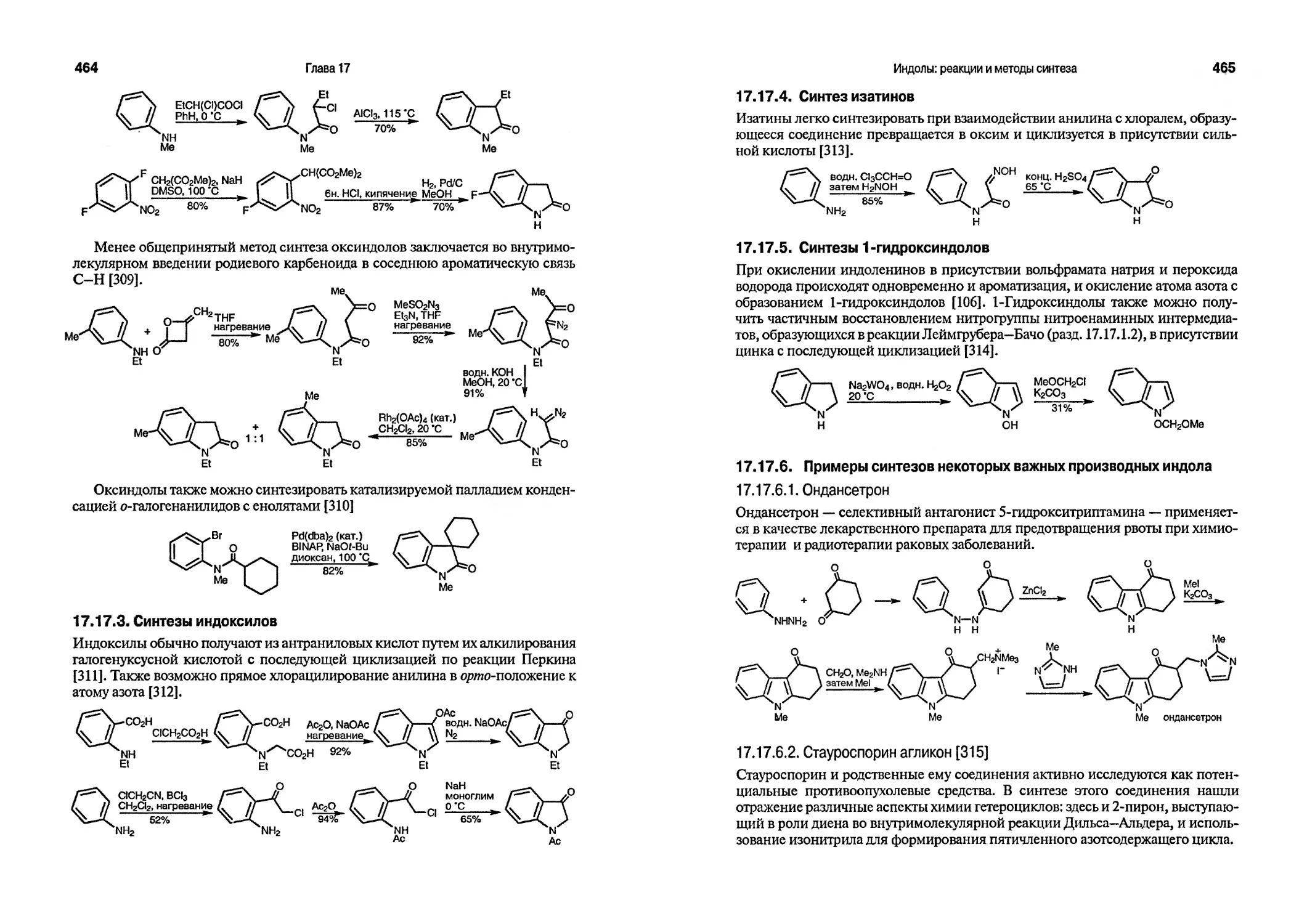
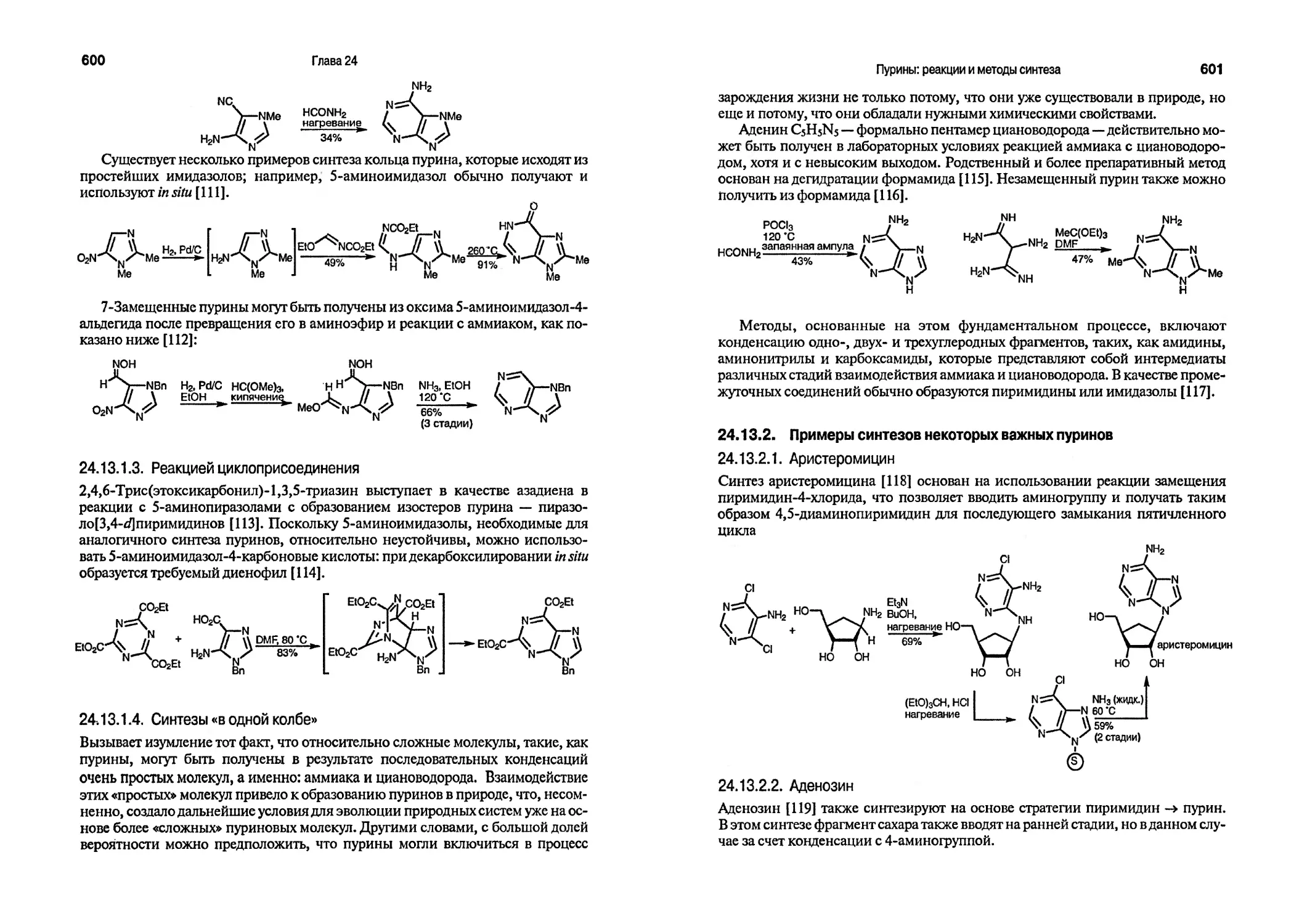
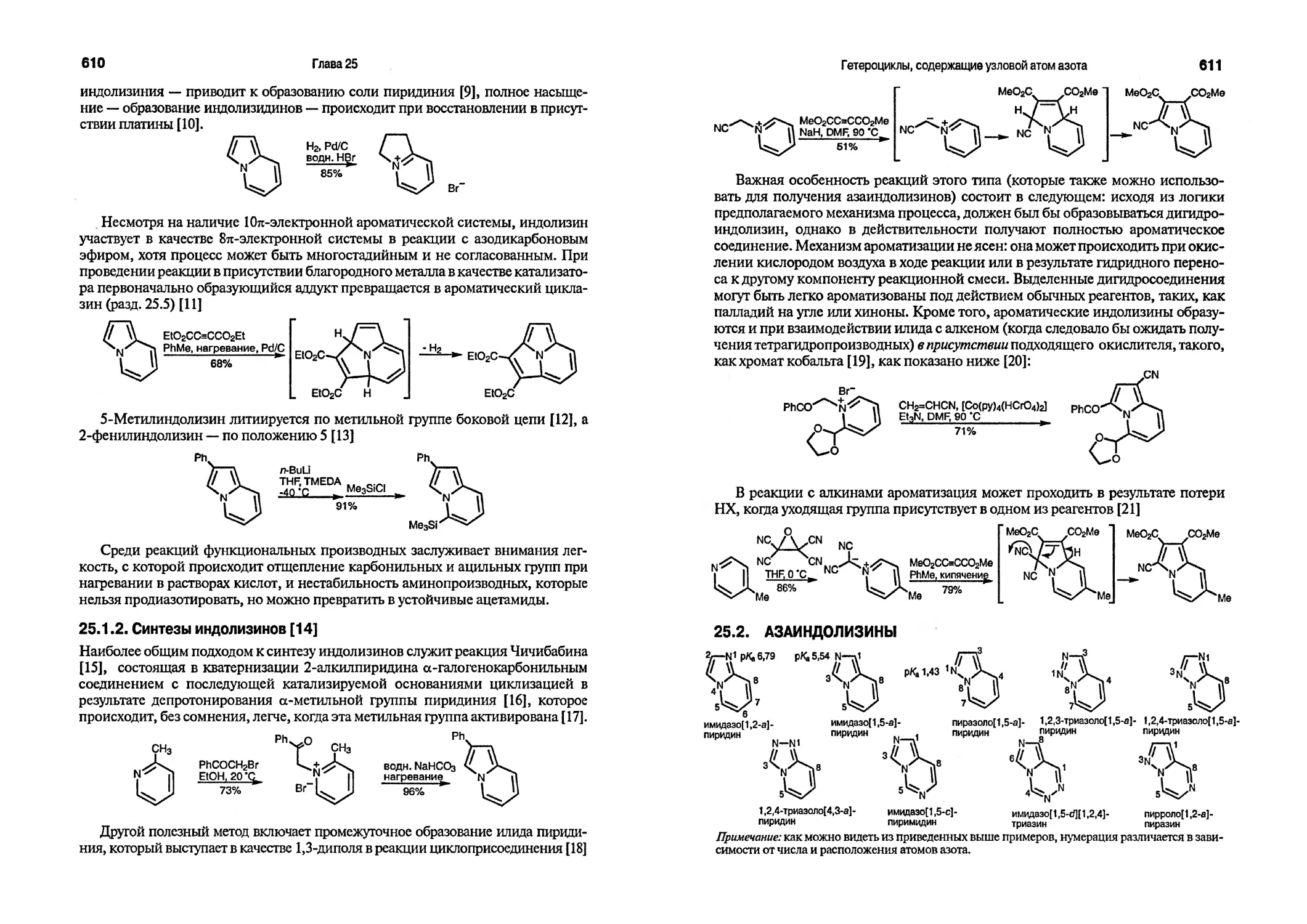
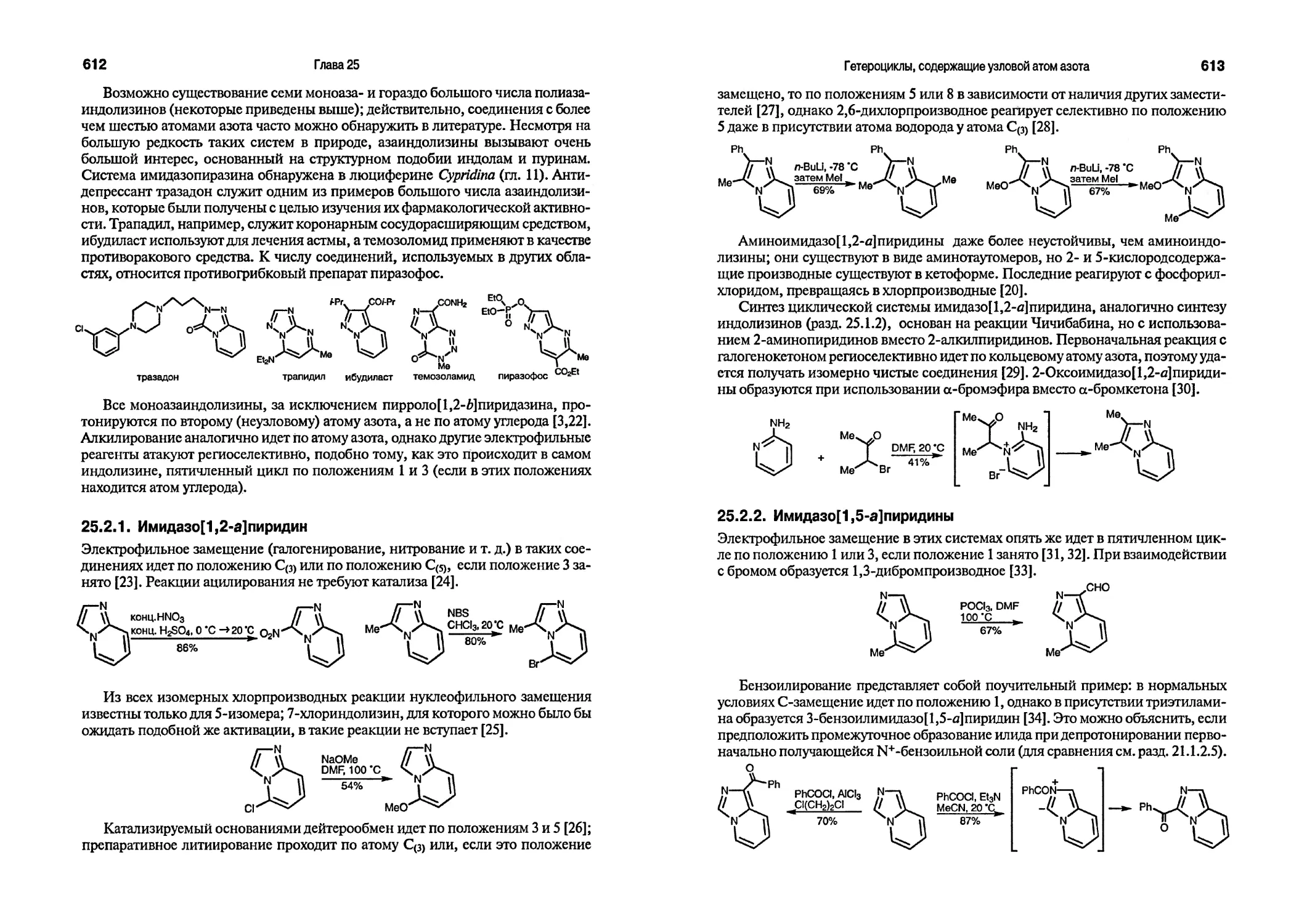
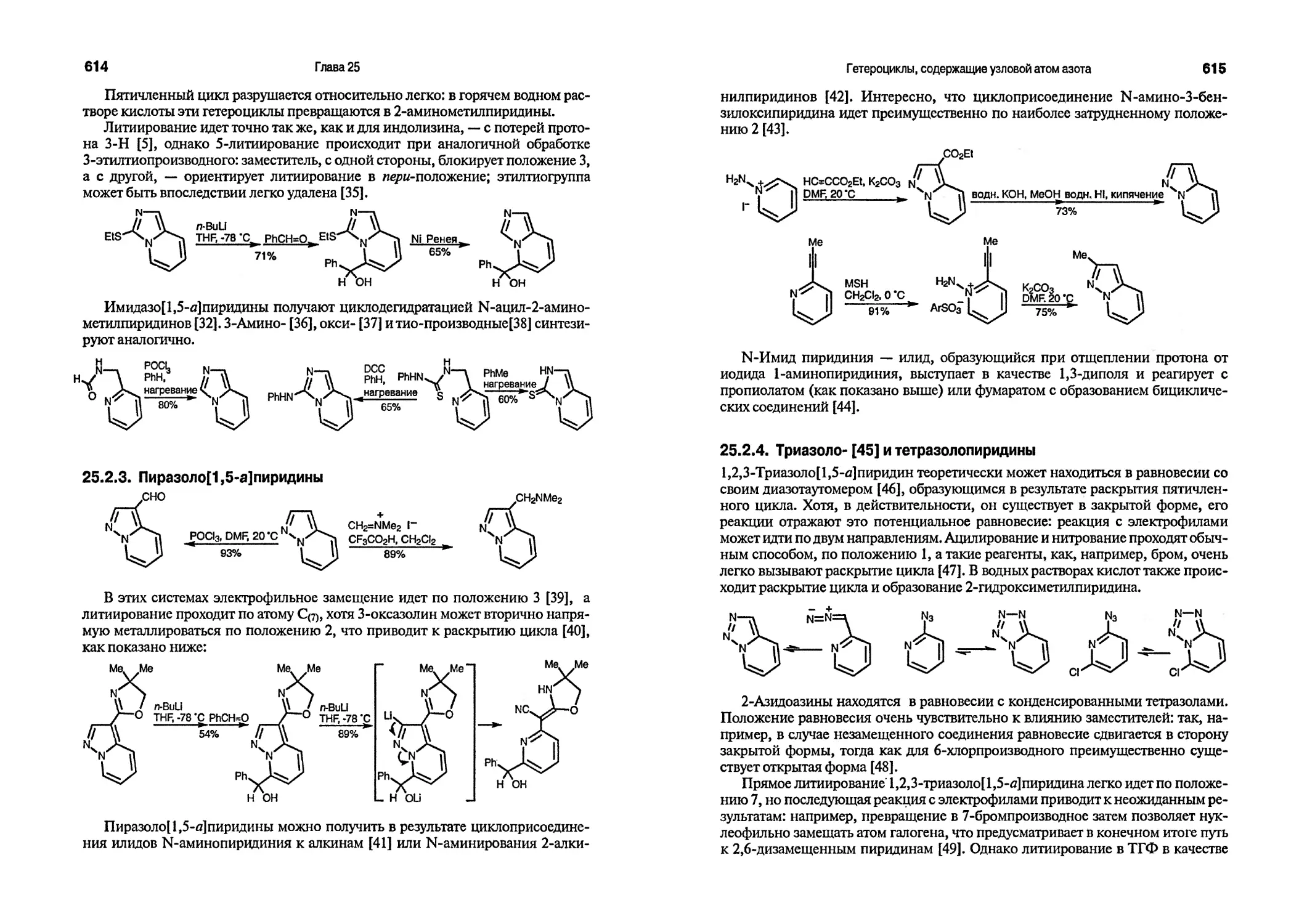
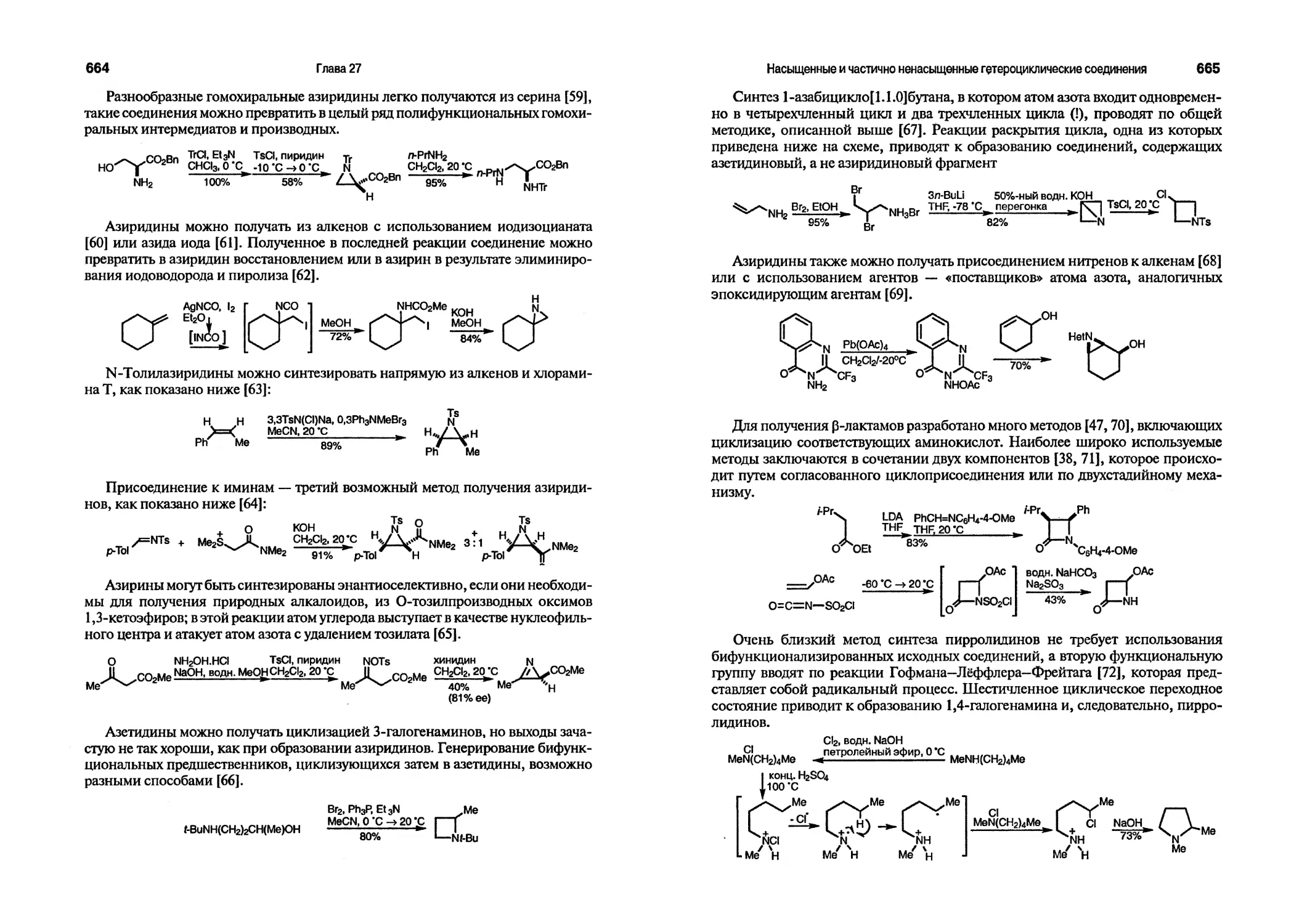
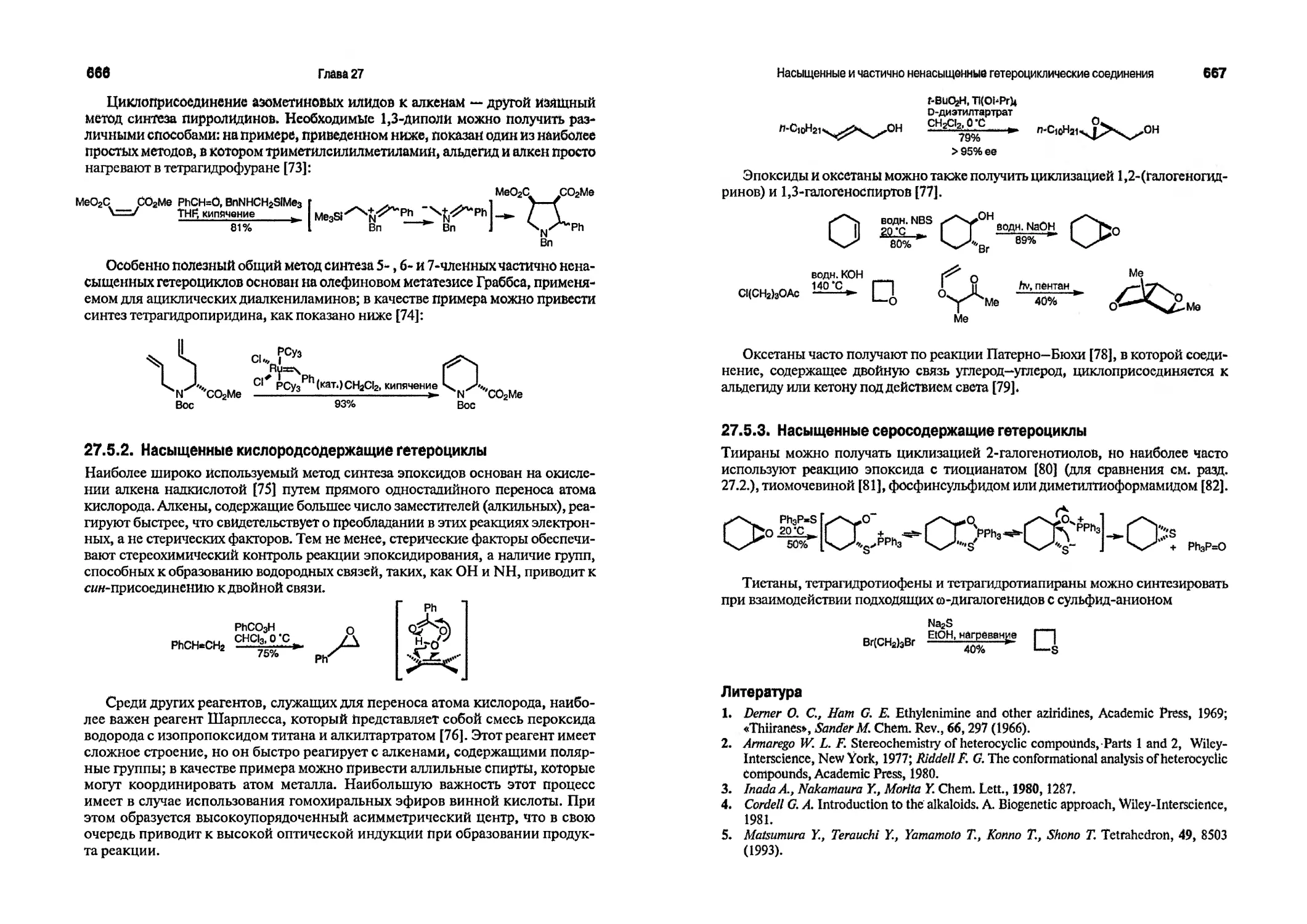
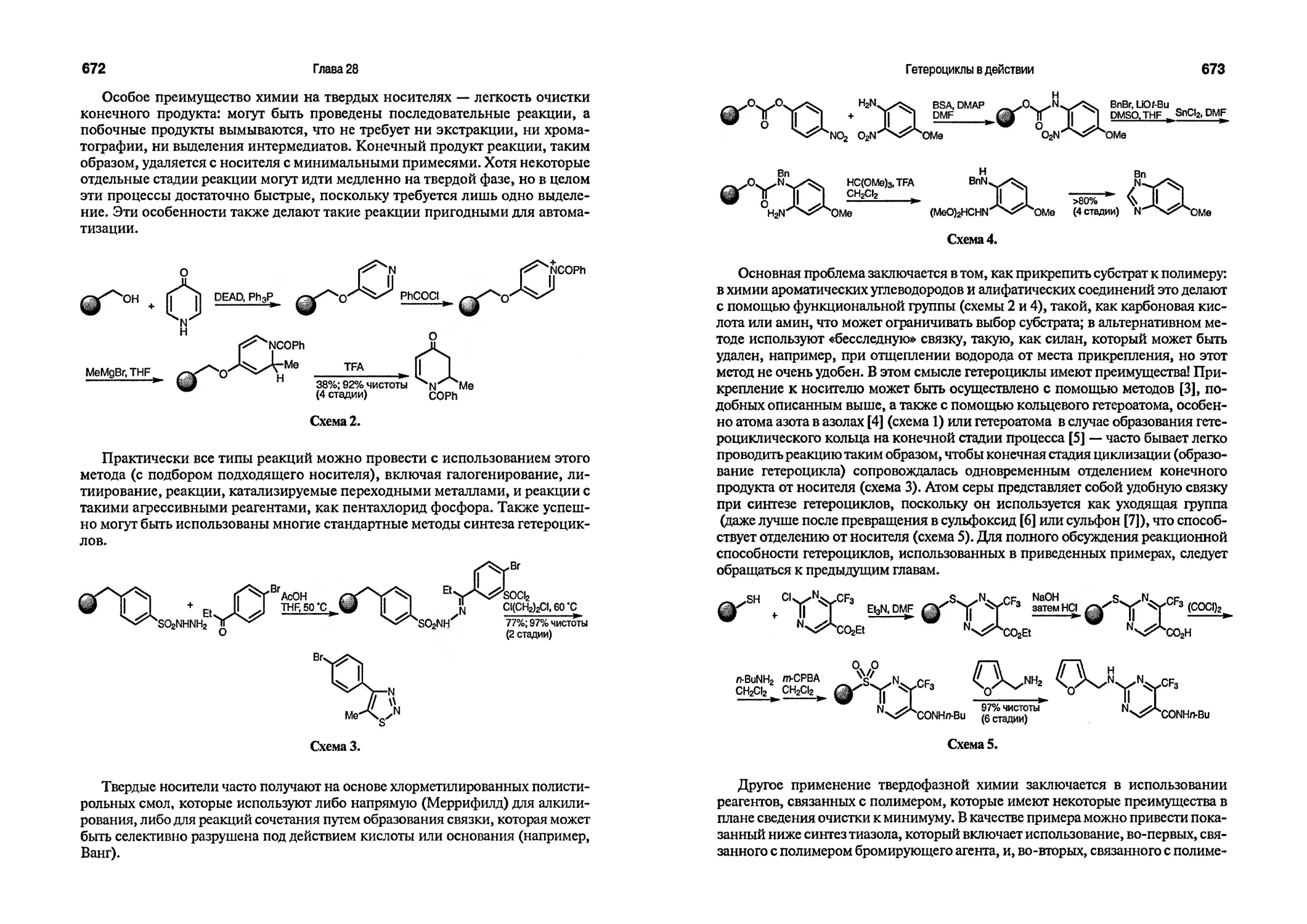
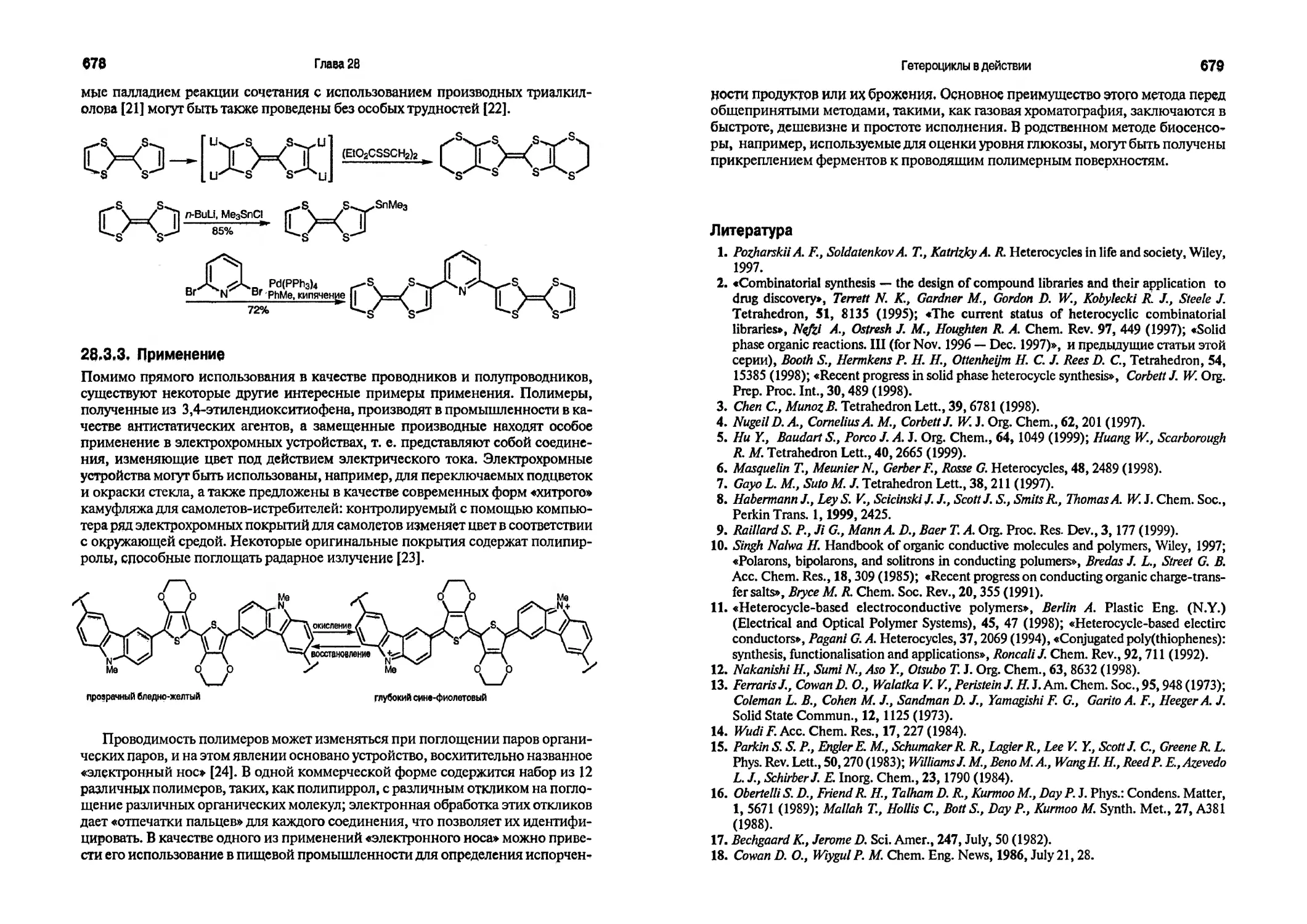
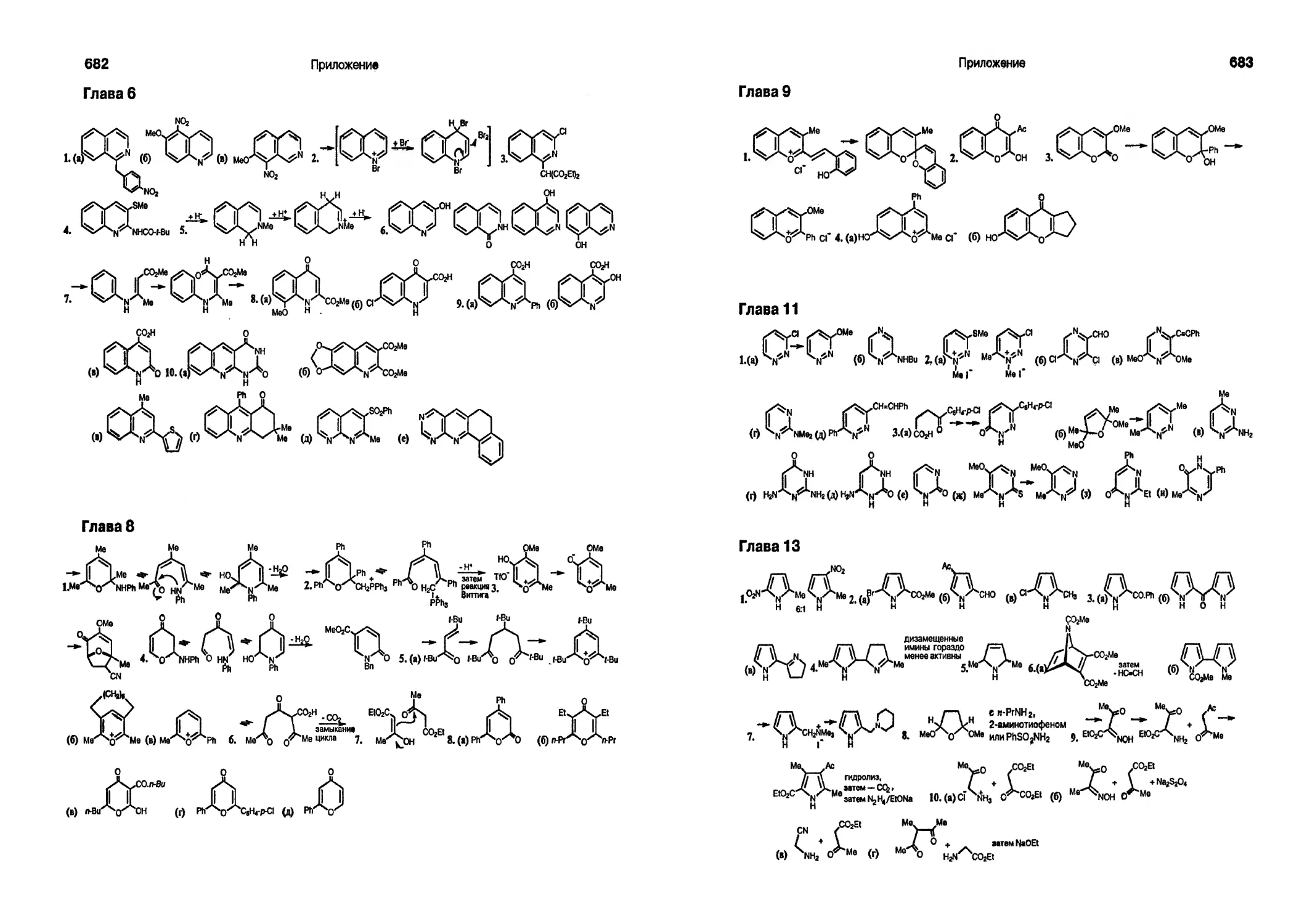
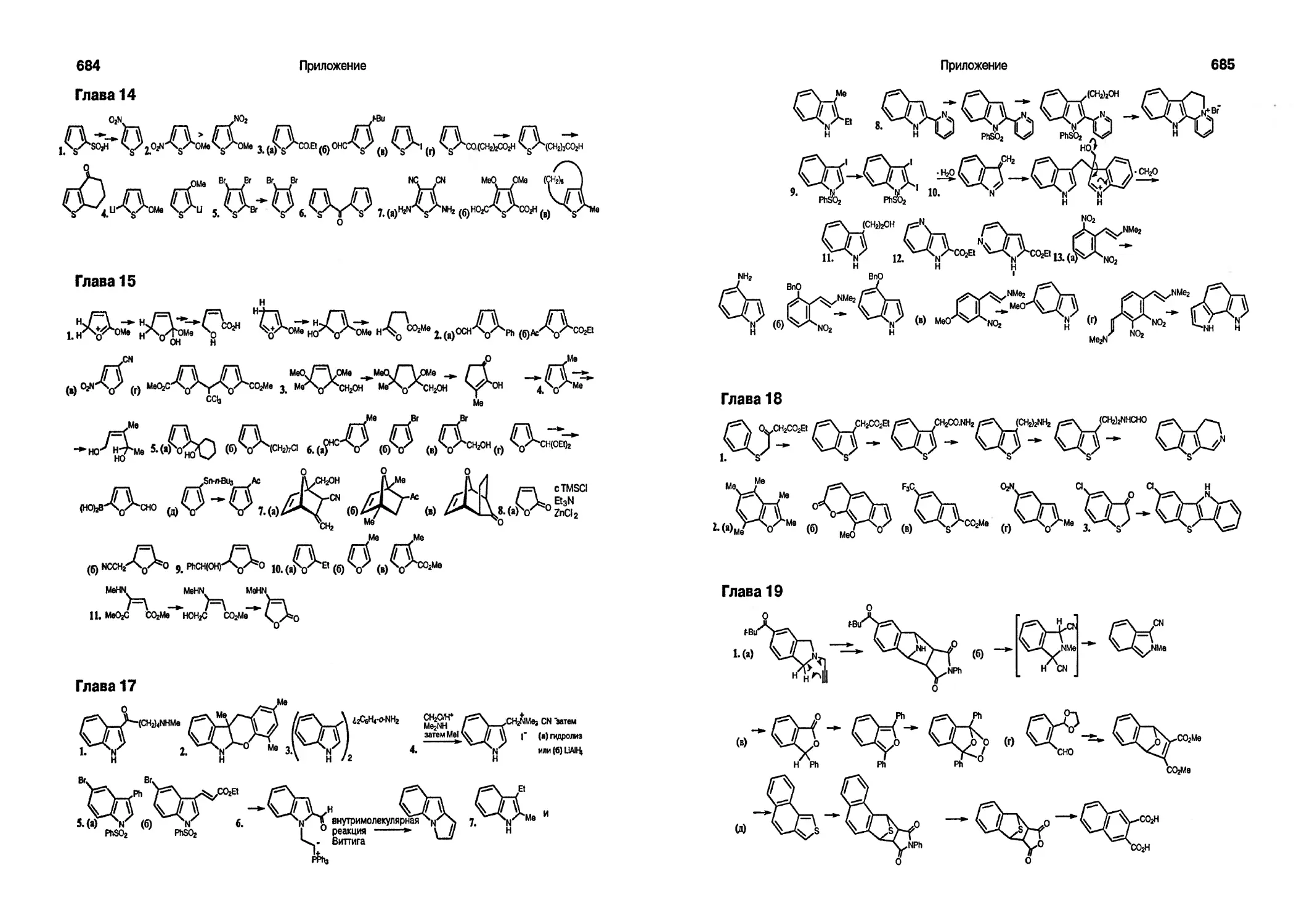
Текст
ЛУЧШИМ w ЗАРУБЕЖНЫЙ УЧЕБНИК
Дж. Джоуль, К. Миллс
ХИМИЯ ГЕТЕРОЦИКЛИЧЕСКИХ СОЕДИНЕНИЙ
Издательство «МИР»
ЛУЧШИЙ w зарубежный УЧЕБНИК
Для студента эта книга окажется прекрасным понятным учебником, для дипломника и аспиранта -настоящим «кладом» знаний, для научного сотрудника, работающего в смежных областях, - исчерпывающим справочником, для специалиста - генератором идей.
Heterocyclic Chemistry
Fourth edition
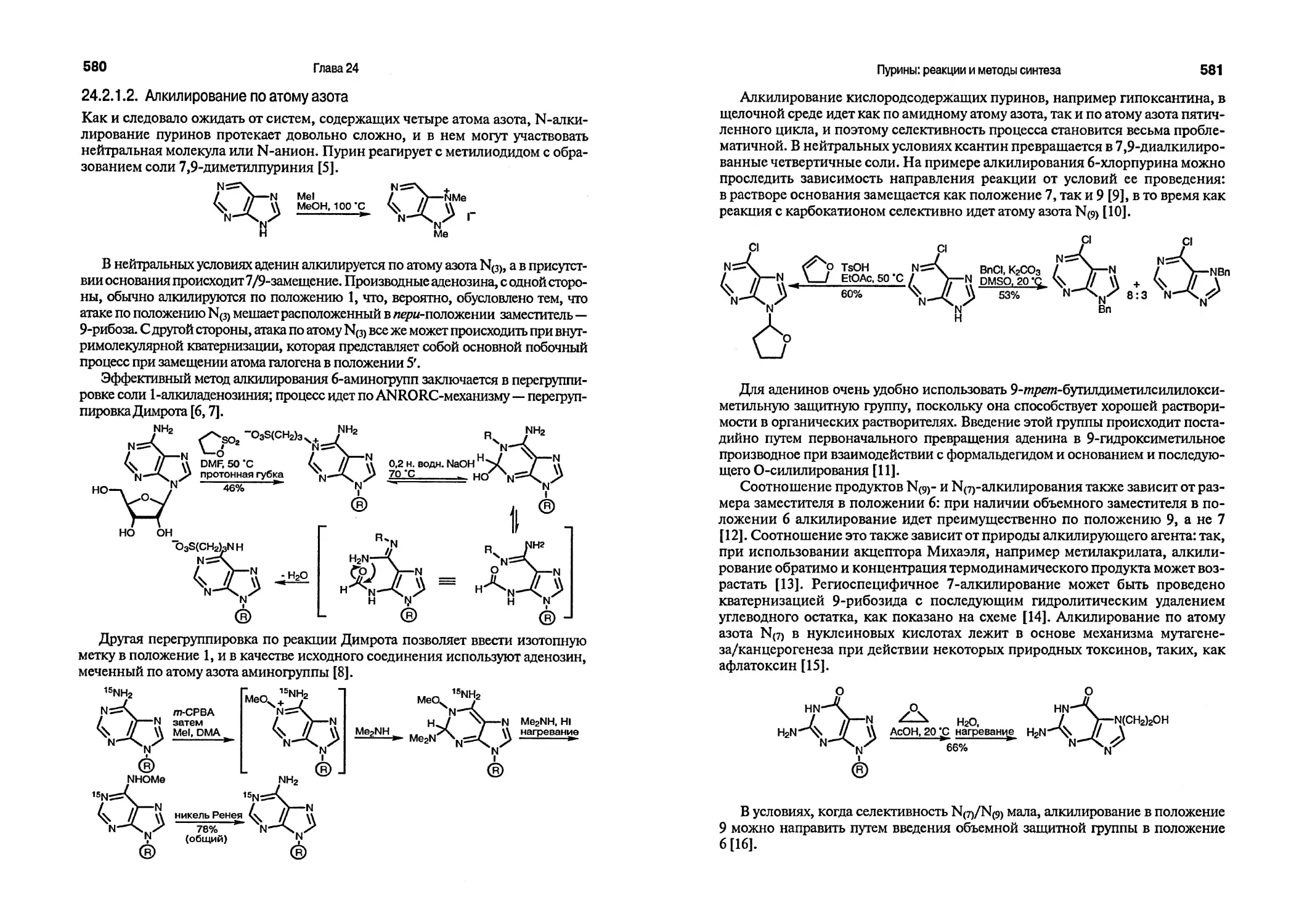
J. A. Joule & K. Mills
b
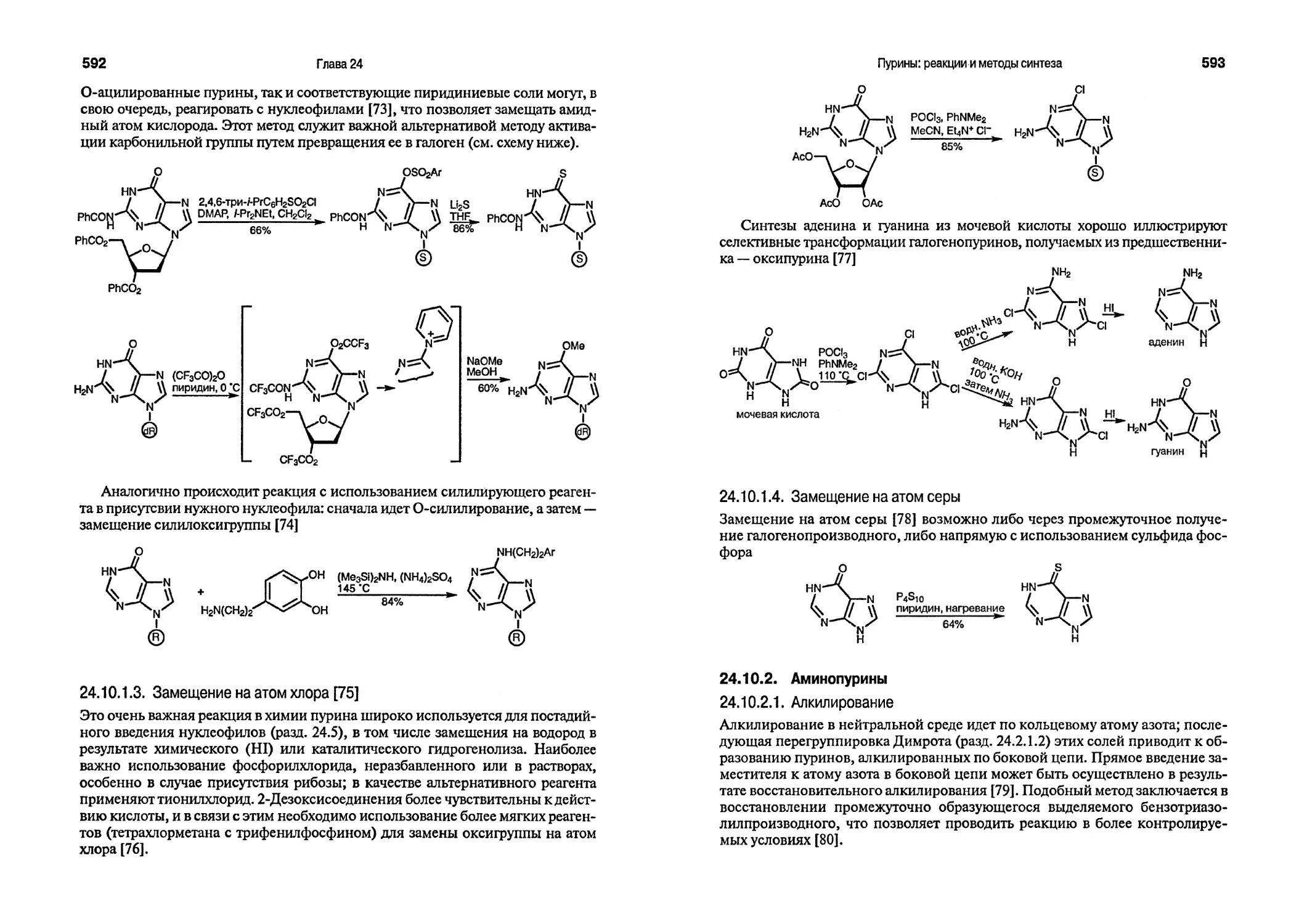
Blackwell Science
ЛУЧШИЙ
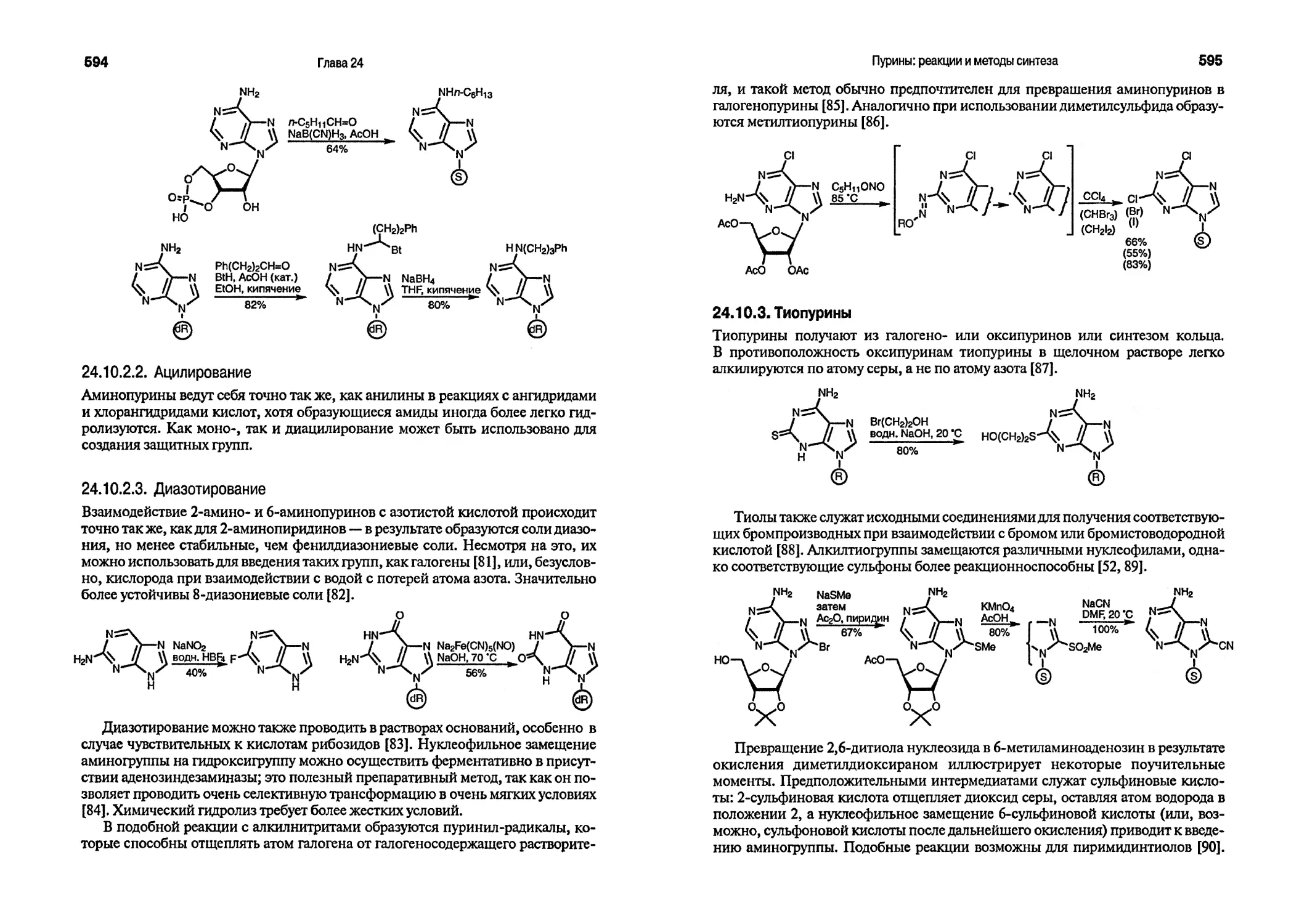
ЗАРУБЕЖНЫЙ
УЧЕБНИК
Дж. Джоуль, К. Миллс
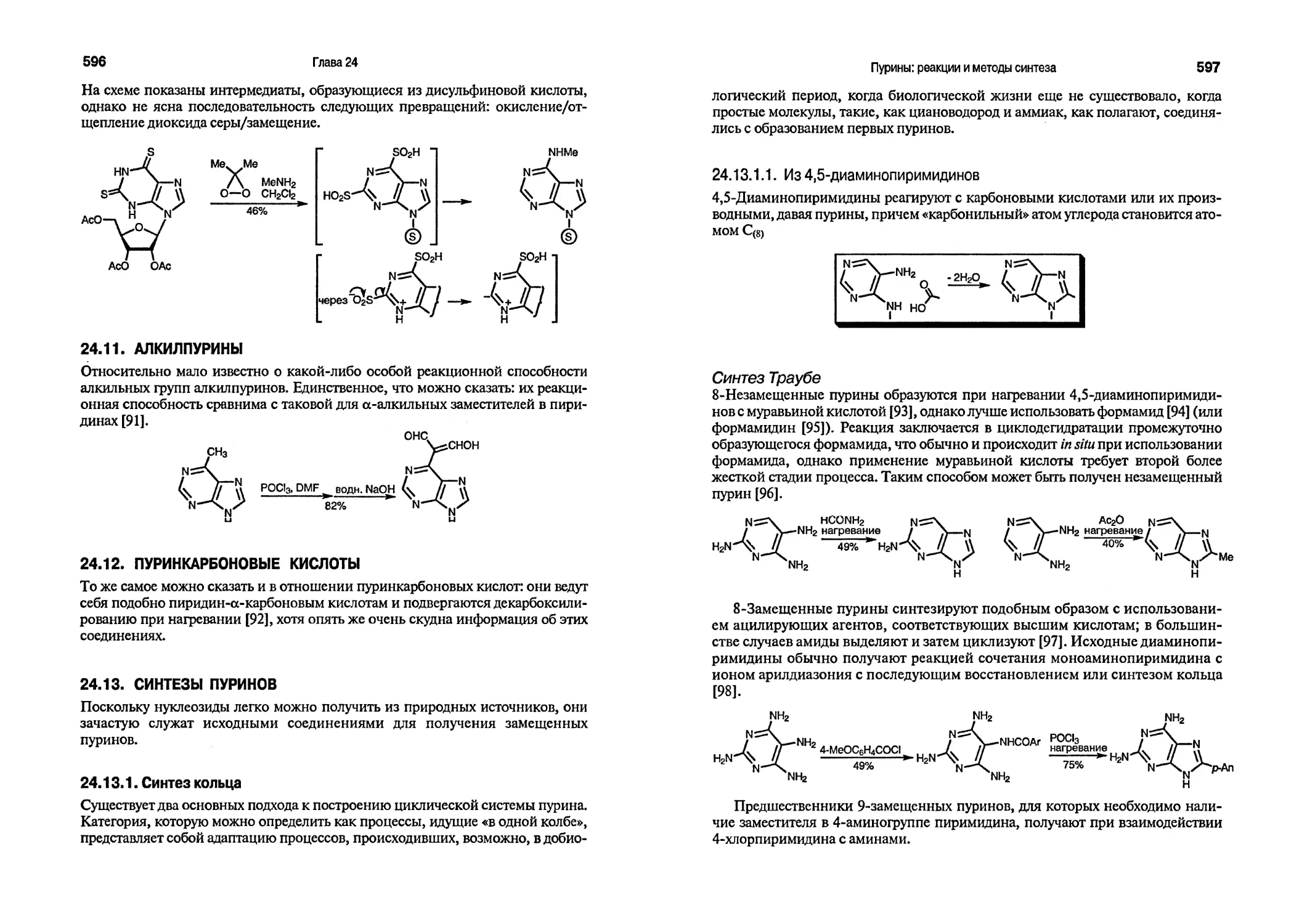
химия
ГЕТЕРОЦИКЛИЧЕСКИХ
СОЕДИНЕНИИ
2-е переработанное издание
Перевод с английского канд. хим. наук Ф. В. Зайцевой и канд. хим наук. А. В. Карчава
под редакцией профессора, д-ра хим. наук М. А. Юровской
Москва «Мир» 2004
УДК 547.7/8я73
ББК 24.236
Д42
Джоуль Дж., Миллс К.
Д42 Химия гетероциклических соединений. 2-е переработан. изд./ Пер. с англ. Ф. В. Зайцевой и А. В. Карчава. — М.: Мир, 2004. — 728 с., ил. — (Лучший зарубежный учебник).
ISBN 5-03-003461-7
В учебном издании, написанном известными английскими учеными, изложены основные теоретические представления о реакционной способности и методах синтеза различных классов гетероциклических соединений и отдельных их представителей; показана роль гетероциклических соединений в химии твердого тела, биологических процессах, химии полимеров-полупроводников. Особое внимание уделено освещению последних достижений в этой важной области органической химии, имеющей большое значение в медицинской химии, фармакологии и биохимии. По полноте и широте представленного материала может использоваться как справочно-энциклопедическое издание.
Для студентов, аспирантов и преподавателей химических, биологических и медицинских вузов, а также специалистов.
УДК 547.7/8я73
ББК 24.236
Редакция литературы по химии
Издание осуществлено при финансовой поддержке Российского фонда фундаментальных исследований по проекту
№ 01-03-46012
Издание выпущено в свет при участии химического факультета
Московского государственного университета им. М. В. Ломоносова
© 1972, 1978 J. A. Joule and G. F. Smith;
1995 J. A. Joule, K. Mills and G. F. Smith;
2000 J. A. Joule and K. Mills.
This edition is published by arrangement with
Blackwell Science Limited, Oxford.
ISBN 5-03-003461-7 (русск.)
ISBN 0-632-05453-0 (англ.)
© перевод на русский язык, оформление, издательство «Мир», 2004
ПРЕДИСЛОВИЕ РЕДАКТОРА ПЕРЕВОДА
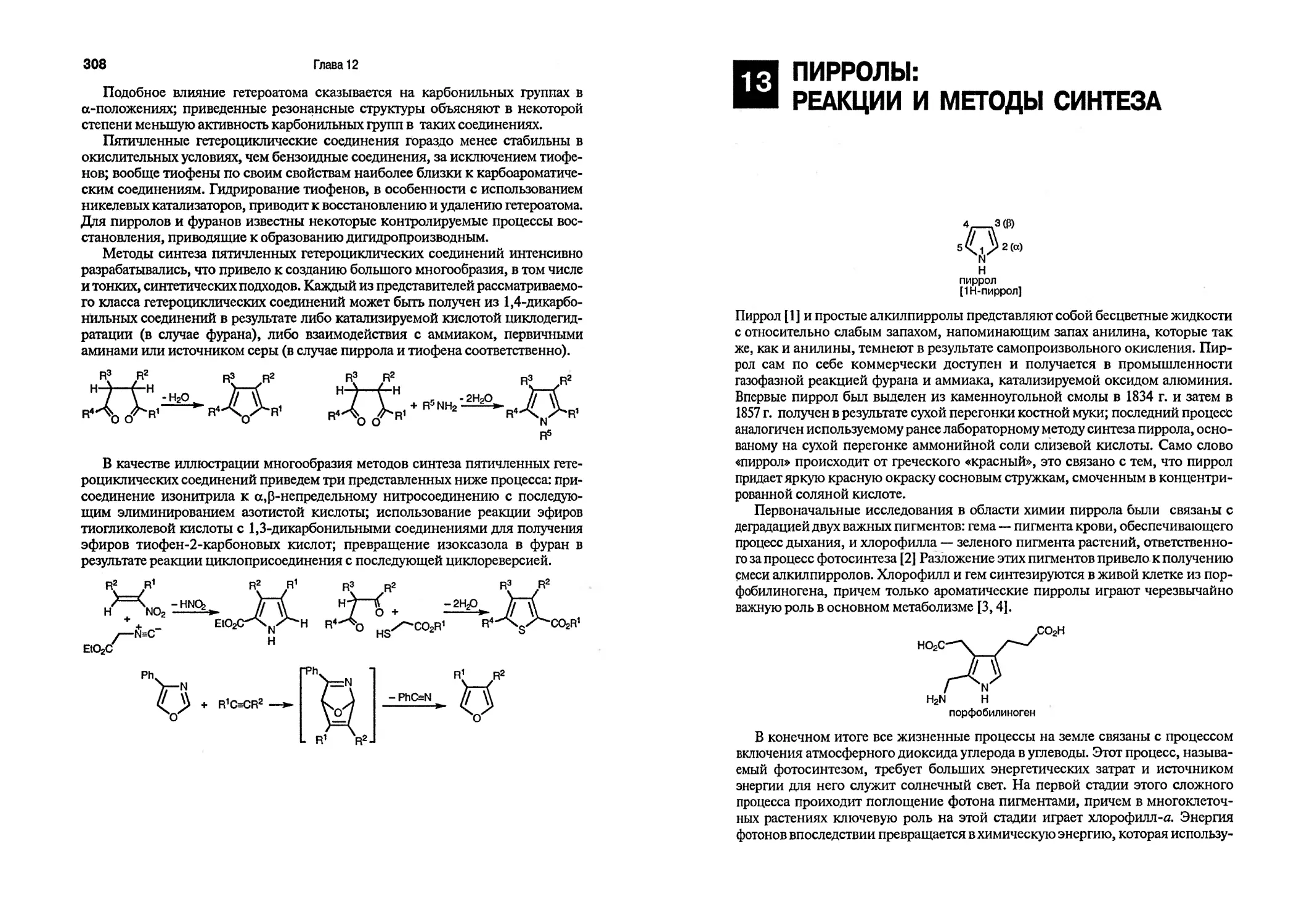
Химия гетероциклических соединений — одно из ведущих направлений органической химии. Гетероциклические соединения различной природы служат основой многих природных и синтетических биологически активных веществ, а также обладают целым рядом других полезных свойств; многие из них применяются, например, как органические полупроводники, фотоактив-ные материалы, антиоксиданты, присадки к топливам и маслам, материалы для активных сред жидкостных лазеров (на красителях), технические и пищевые красители, консерванты и т. д. Наряду с большой практической значимостью гетероциклические соединения представляют несомненный теоретический интерес как модели для изучения взаимосвязи химических свойств соединений с их строением, а также для разработки методов органического синтеза, что, конечно же, напрямую связано со строением соединения, причем важнейшее значение имеют размер цикла, степень насыщенности, природа и число гетероатомов.
Химия гетероциклических соединений чрезвычайно бурно развивается, активно аккумулируя успехи синтетической органической химии, а также методов физико-химических исследований. В этой связи очевидна насущная необходимость в своевременном обновлении учебников и учебных пособий в этой области знаний. Все эти факторы, по-видимому, и обусловили выделение Российским фондом фундаментальных исследований (РФФИ) гранта (за что авторы выражают признательность) на перевод и издание на русском языке современного учебника Дж. Джоуля и К Миллса «Химия гетероциклических соединений».
В нашей стране специалистам-органикам, особенно работающим в области химии гетероциклических соединений, хорошо известен один из авторов этого учебника д-р Джон Джоуль, поскольку книга Дж. Джоуля и Г. Смита «Химия гетероциклических соединений» (Пер. с англ. — М.: Мир, 1975) долгое время оставалась почти единственным фундаментальным учебным изданием по этому разделу органической химии, которым пользовалось не одно поколение химиков-органиков (перевод был осуществлен с 1-го английского издания, вышедшего в 1972 г.). Со времени публикации книги Джоуля и Смита органическая химия и химия гетероциклических соединений претерпела существенные изменения многих теоретических концепций, а также методов синтеза и методов исследования. Вышедшая, казалось бы, не столь давно очень полезная и компактная книга Т. Джилкриста «Химия гетероциклических соединений» (Пер. с англ. — М.: Мир, 1996) также востребована читателем, однако она все-таки ори-
оптирована главным образом на читателя, начинающего изучение химии гетероциклических соединений, и не может претендовать на полноту охвата и энциклопедичность. Учебник Дж. Джоуля и Г. Смита после дополнения и переработки выходил в свет за рубежом в виде 2- и 3-го изданий, которые, к сожалению, не были переведены на русский язык.
Итак, перед читателем перевод 4-го издания с измененным авторским коллективом, которому удалось блестяще продолжить и развить ранее начатое дело. В книге нашли отражение все достижения последних лет как в химии гетероциклических соединений, так и органической химии в целом. Особое внимание уделено новейшим методам органического синтеза и их применению для получения и модификации различных гетероциклических соединений; при этом подробно рассмотрены радикальные реакции, процессы, катализируемые палладием, синтезы с использованием металлоорганических соединений. Авторы цитируют огромное количество оригинальной литературы (включены публикации вплоть до 1999 г.); последнее обстоятельство повышает научный статус этого издания как «путеводителя» по современной химии гетероциклических соединений.
Особо хочется подчеркнуть, что, как и ранние издания, эта книга, прежде всего, прекрасный учебник, который может быть доступен для изучения и понимания даже тем студентам, которые только начинают изучение органической химии, а все перечисленные выше достоинства лишь усиливают его обучающие качества. Собранная авторами обширная информация окажет помощь и аспирантам, и научным работникам в научном поиске, будет способствовать повышению их теоретического и практического уровня (изложены не только общие и широко известные аспекты химии гетероциклических соединений, но также обобщены недавно опубликованные результаты).
Универсальность этого учебника, адресованного студентам и специалистам разного уровня подготовки, объясняется его правильной композицией. Рассмотрение общих вопросов строения, физико-химических свойств и реакционной способности ароматических гетероциклических соединений в целом (в сравнении с реакционной способностью карбоциклических ароматических систем), а также методов синтеза ароматических гетероциклических соединений предваряет (три первые главы) изложение химии гетероциклических соединений по классам. Далее каждому классу гетероциклов отведено по две главы: одна посвящена общей характеристике строения и реакционной способности данного класса соединений, в другой приведены примеры методов синтеза и характеристика конкретных представителей этого класса. Поэтому читатель может остановить свое внимание на том материале, который соответствует его интересам и уровню подготовки.
В конце глав, где описаны методы синтеза определенного класса гетероциклов, имеются упражнения, которые разделены по степени своей сложности: вначале приведены упражнения для самоконтроля, ориентированные на уже подготовленного благодаря предыдущему изложению читателя; далее — упражнения повышенной сложности, в основу которых положены примеры из оригинальной литературы (на эти задачи в конце книги есть ответы).
При подготовке перевода были использованы в основном сокращения и обозначения, принятые в англоязычной литературе. Это, по нашему мнению,
поможет читателю более свободно ориентироваться в оригинальной литературе, в большинстве англоязычной.
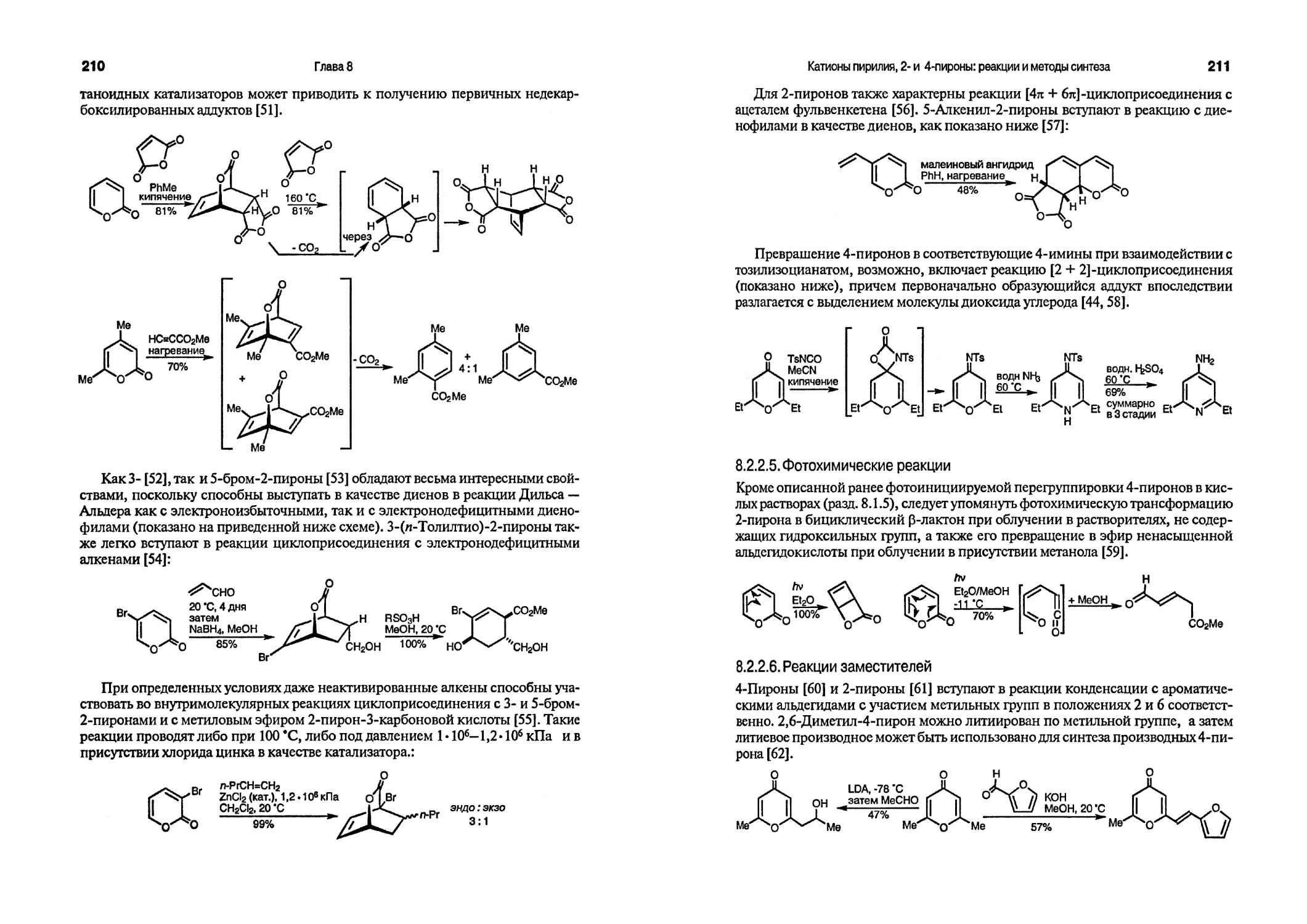
Таким образом, книга Джоуля и Миллса может быть рекомендована как фундаментальное учебное издание для студентов и аспирантов химических вузов, а также как справочное пособие для широкого круга химиков-органиков.
Мы надеемся, этот учебник будет способствовать развитию отечественной химии гетероциклических соединений.
М. А. Юровская
ПРЕДИСЛОВИЕ
К ЧЕТВЕРТОМУ ИЗДАНИЮ
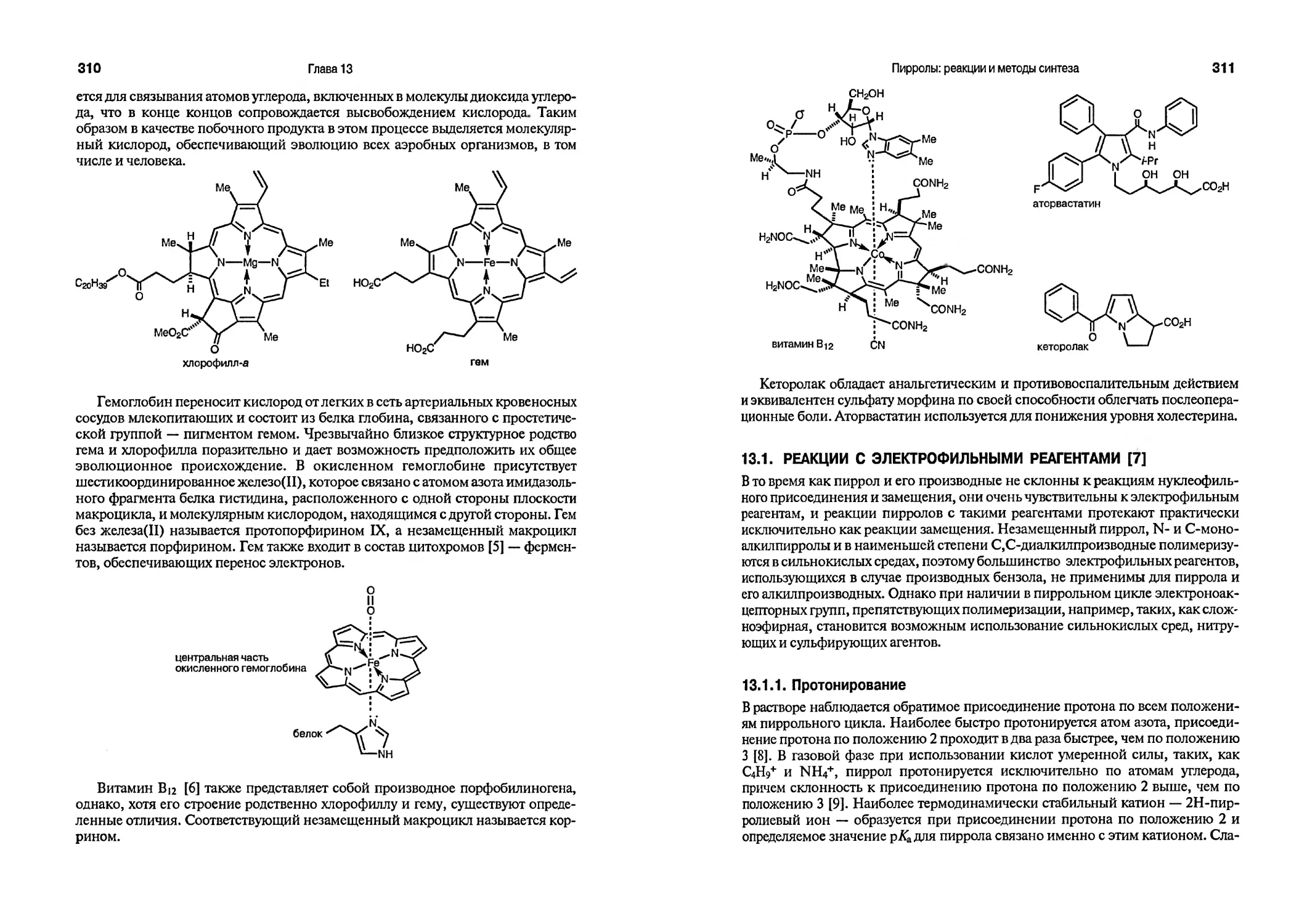
Со времени подготовки к печати третьего издания этой книги Георга Смита, соавтора первого и второго изданий, не стало. Многим поколениям студентов химического факультета Манчестерского университета посчастливилось присутствовать на его вдохновляющих лекциях и получить заряд его энтузиазма. В этом отношении не составляют исключения и авторы четвертого издания. Мы посвящаем, этот учебник по химии гетероциклических соединений памяти Георга Смита.
Гетероциклические соединения играют особую роль в медицинской химии, и именно это обстоятельство способствует открытию и развитию новых направлений и методов в химии гетероциклических соединений. При подготовке четвертого издания мы тщательно проанализировали материал, включенный в ранние издания, внесли некоторые исправления и дополнения в соответствии с самыми последними публикациями. Несмотря на то что наши возможности были ограничены объемом книги, мы полагаем, что нам удалось рассмотреть здесь все основные достижения в химии гетероциклических соединений двадцатого столетия.
ВВЕДЕНИЕ
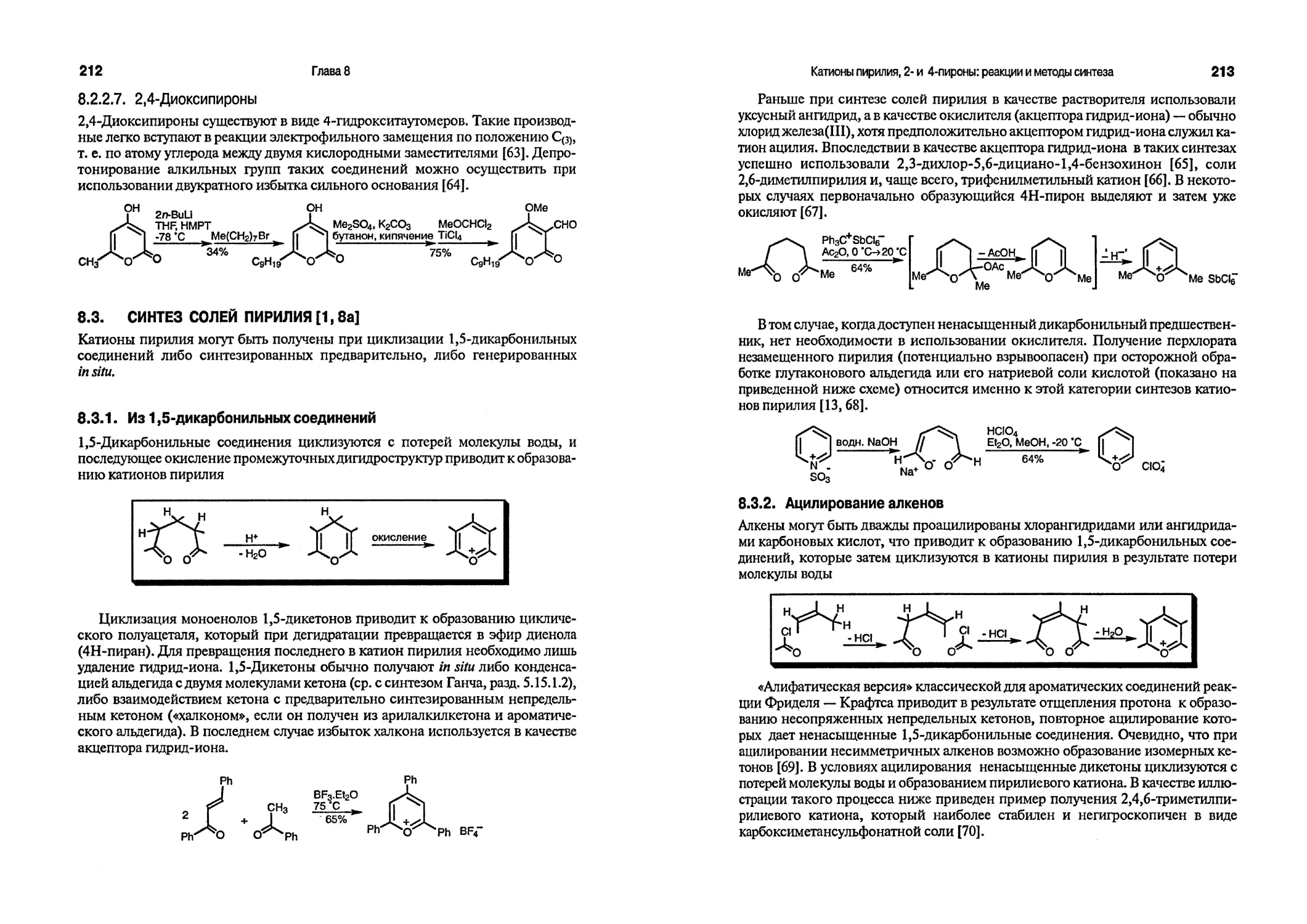
Настоящее четвертое издание, как и все более ранние издания, посвящено изложению фундаментальных аспектов химии гетероциклических соединений, их реакционной способности и методов синтеза; изложение построено так, чтобы быть доступным для студентов, приступающих к изучению гетероциклических соединений. В книгу также включен материал, отражающий современные достижения в области химии гетероциклических соединений, что позволяет ее рекомендовать и аспирантам. Кроме того, книга может служить в качестве справочного пособия.
1. Изложение основного фактического материала по каждому классу гетероциклических соединений приводится в главах типа «Реакции и методы синтеза...». Дидактически важный материал присутствует также в главе, посвященной общему обсуждению реакционной способности гетероциклических соединений (гл. 2), и в шести обобщающих главах (например, «Общая характеристика реакционной способности пиридинов, хинолинов и изохинолинов», гл. 4), в которых дана краткая характеристика реакционной способности конкретного класса гетероциклических соединений. Такие обобщающие главы служат вводными при рассмотрении свойств конкретного класса гетероциклических соединений и обязательно требуют последующего изучения глав «Реакции и методы синтеза...». Обобщающие главы весьма полезны для аспирантов для освежения в памяти основных свойств, присущих конкретному классу гетероциклических соединений.
2. Приведено более 3500 ссылок на литературу. При этом были выбраны наиболее представительные статьи, возможно, и не всегда связанные с самым первым упоминанием описываемого направления или метода. Некоторые из цитируемых статей могут быть названы «этапными», другие имеют исторический интерес. Подобная литература в учебниках обычно отсутствует, но для данной книги очень полезна, так как для специализирующихся в этой области цитируемая литература включает большое число обзорных работ, причем приводятся также названия статей.
3. В конце каждой главы, посвященной обсуждению свойств конкретного класса гетероциклических соединений, приводятся рекомендуемые для студентов упражнения, причем они разделены на простые упражнения, позволяющие проверить усвоения изложенного материала, и упражнения повышенной сложности, которые дают возможность применить полученные знания. Ответы на упражнения повышенной сложности приведены в конце книга. В качестве упражнений повышенной сложности взяты конкретные примеры из научной литературы, однако при этом нет ссылки на используемую работу.
4. В схемах реакций мы старались избегать общих обозначений типа R или Аг, а приводили конкретные примеры реакций. Мы полагаем, что это должно
облегчить восприятие, особенно для студентов. Кроме того, такой подход позволяет избежать неоправданных обобщений.
5. Структурные формулы и нумерация атомов в гетероциклических соединениях приведены в начале глав. Мы использовали общепринятые названия гетероциклических соединений, а не названия, принятые в реферативном журнале Chemical Abstracts. Названия, приведенные в скобках, соответствуют названиям, принятым в Chemical Abstracts, например индол [Ш-индол]. Мы полагаем, что систематические названия гетероциклических соединений безусловно важны, и не только для использования в компьютерных базах данных, однако эти названия мало пригодны при обучении и не способствуют пониманию материала, поэтому в книге мы не уделили большого внимания номенклатуре гетероциклических соединений. Читатель, в случае необходимости, может обратиться к соответстующим публикациям [1] или к разделам Chemical Abstracts (Ring Index и Chemical Substances Index), где приведены систематические названия и нумерация для всех известных гетероциклических соединений.
6. Некоторые общие обзорные работы, посвященные химии гетроциклических соединений, цитируются в конце данной главы. Для сокращения объема книги эти чрезвычайно важные источники не цитируются повторно в последующих главах, однако все разделы химии гетероциклических соединений, включенные в эту книгу, присутствуют и в этих источниках, и любой литературный поиск следует начинать с этих публикаций.
7. Литература по химии гетероциклических соединений чрезвычайно обширна и собрана в «The Literature of Heterocyclic Chemistry», Part I-V [2], которые предоставляют для желающих огромнейший объем для поиска. Все пять частей опубликованы в Advances in Heterocyclic Chemistry [3]; само по себе это издание представляет собой превосходный источник ключевых обзоров по химии гетероциклических соединений. Весьма полезные обзоры, относящиеся к гетероциклическим соединениям, можно найти в журнале Heterocycles. Журнал Progress in Heterocyclic Chemistry [4], издаваемый Международным обществом по химии гетероциклических соединений (International Society of Heterocyclic Chemistry) [5], также содержит тематические и ежегодные обзорные статьи. На начальном этапе литературного поиска весьма полезными могут быть обращения к соответствующим разделам «Comprehensive Heterocyclic Chemistry» как первого [ба], так и второго [6] изданий. Более общая информация может быть найдена в «справочнике» по химии гетероциклических соединений [7].
8. Взаимные превращения гетероциклических соединений, сопровождающиеся изменением гетероатома и/или размера цикла, обсуждаются в отдельном издании [8]. Три современных обзора по дегенеративной трансформации гетероциклических соединений включены в 74-й том Advances in Heterocyclic Chemistry [9]. Синтетическое использование гетероциклических соединений подробно описано в книге [10].
9. В ранее издававшейся серии [11] под редакцией Элдерфильда содержатся обсуждения пионерских работ по химии гетероциклических соединений. Серия монографий, связанных с химией гетероциклических соединений, первоначально
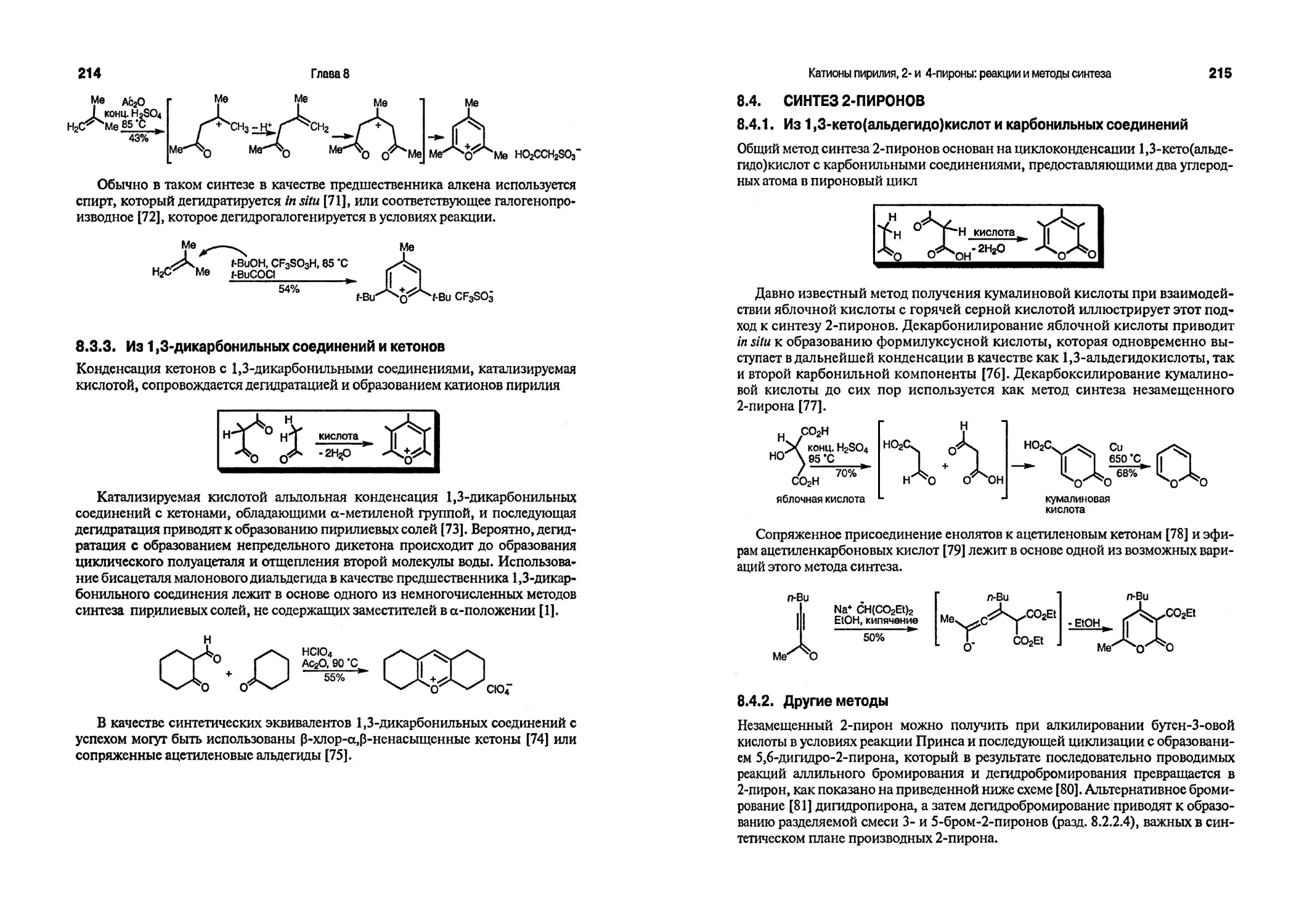
выходившая под редакцией Арнольда Вайсберга, а впоследствии под редакцией Эдварда С. Тэйлора, представляет собой незаменимый источник информации для работающих в области химии гетероциклических соединений. В заключение отметим многотомное издание «Rodd’s Chemistry of Carbon Compounds» [13], где содержится обширная и хорошо подобранная информация.
Как пользоваться учебником
Как было отмечено выше, настоящее четвертое издание книги «Химия гетероциклических соединений», в отличие от ранних изданий, содержит много дополнительного материала, который в большей степени подходит для изучения химии гетероциклических соединений на более позднем, чем на начальном этапе. Тем не менее, мы надеемся, что наша книга будет полезна также студентам, только приступающим к изучению химии гетероциклических соединений.
В начале курса можно рекомендовать гл. 1, которая дает общее представление о строении гетероциклических соединений. Мы полагаем, что материал, изложенный на начальном этапе, может быть пропущен с тем, чтобы вернуться к нему в дальнейшем. Мы советуем после гл. 1 изучить те главы (4,7,10,12,16 и 20), в которых в общих чертах описаны основание свойства гетероциклических соединений. Эти главы легко усваиваются студентами, имеющими общие представления о реакциях органических соединений, особенно ароматических соединений.
Затем следует перейти к более детальному изучению свойств и методов синтеза конкретных классов гетероциклических соединений (главы типа «Реакции и методы синтеза...»). Эти главы содержат повторное упоминание одних и техже фактов, но в разных контекстах, что способствует обобщению материала и выявлению аналогий.
В гл. 2 рассмотрена реакционная способность, в целом класса гетероциклических соединений. Разделы этой главы можно читать при изучении реакций электрофильного замещения, скажем, в тиофене; в то же время гл. 2 можно изучать всю сразу, не откладывая; там подробно обсуждаются радикальные реакции замещения, реакции металлирования и реакции, катализируемые палладием. Роль этих поцессов в химии гетероциклических соединений существенно возросла с момента опубликования третьего издания. Следует также отметить, что в учебниках по общей органической химии таким процесса уделено относительно мало внимания.
Литература
1. «The nomenclature of heterocycles», McNaught A. D. Adv. Heterocycl. Chem., 20, 175 (1976).
2. KatritzkyA. R., Weeds S. M.№. Heterocycl. Chem., 7,225 (1966); KatritzkyA. R., Jones P. M. ibid., 44, 269 (1988); Belen’kii L. L, Krachkovskaya N. D. ibid., 55, 31 (1992); 71, 291 (1998).
3. Adv. Heterocycl. Chem., 1-74,1963-1999.
4. Progr. Heterocycl. Chem., 1—11, 1989-1999.
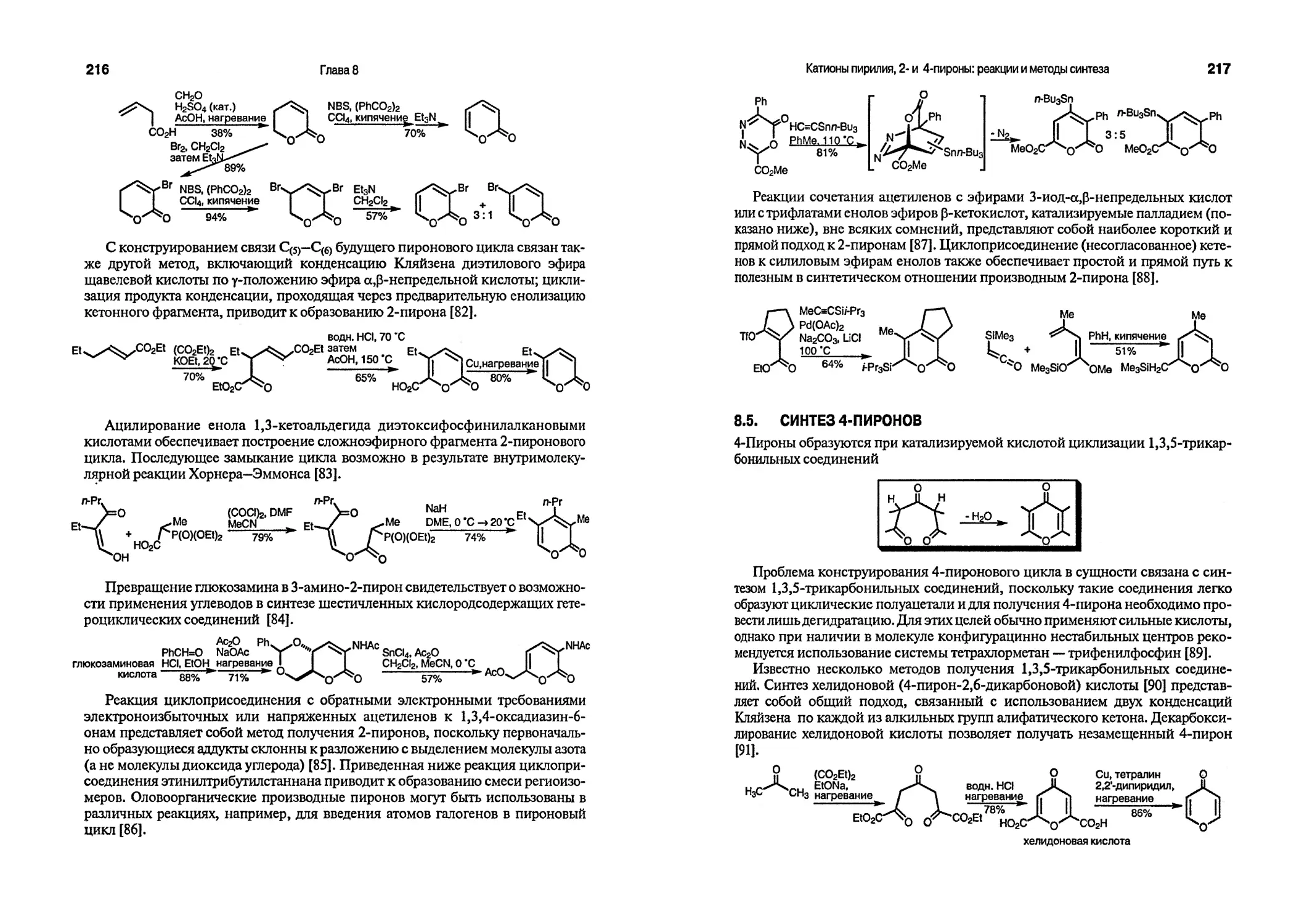
5. http://euch6f. chem. emory. edu/ishc. html and related the Royal Society of Chemistry site: http://www. rsc. org/lap/rsccom/dab/perk003. htm
6. a) Comprehensive heterocyclic chemistry. The structure, reaction, synthesis, and uses of heterocyclic compounds, KatritzkyA. R., Rees C. W. (eds.), Vols. 1—8, Pergamon Press,
Oxford, 1984; б) Comprehensive heterocyclic chemistry II. A review of the literature 1982-1995, Katritzky A. R., Rees C. W., Scriven E. F. V. (eds.), Vols. 1-11, Pergamon Press, 1996.
7. Katritzky A. R. Handbook of heterocycles chemistry, Pergamon Press, Oxford, 1985.
8. Van derPlas H. C. Ring transformations of heterocycles, Vols. 1 and 2, Academic Press, New York, 1973.
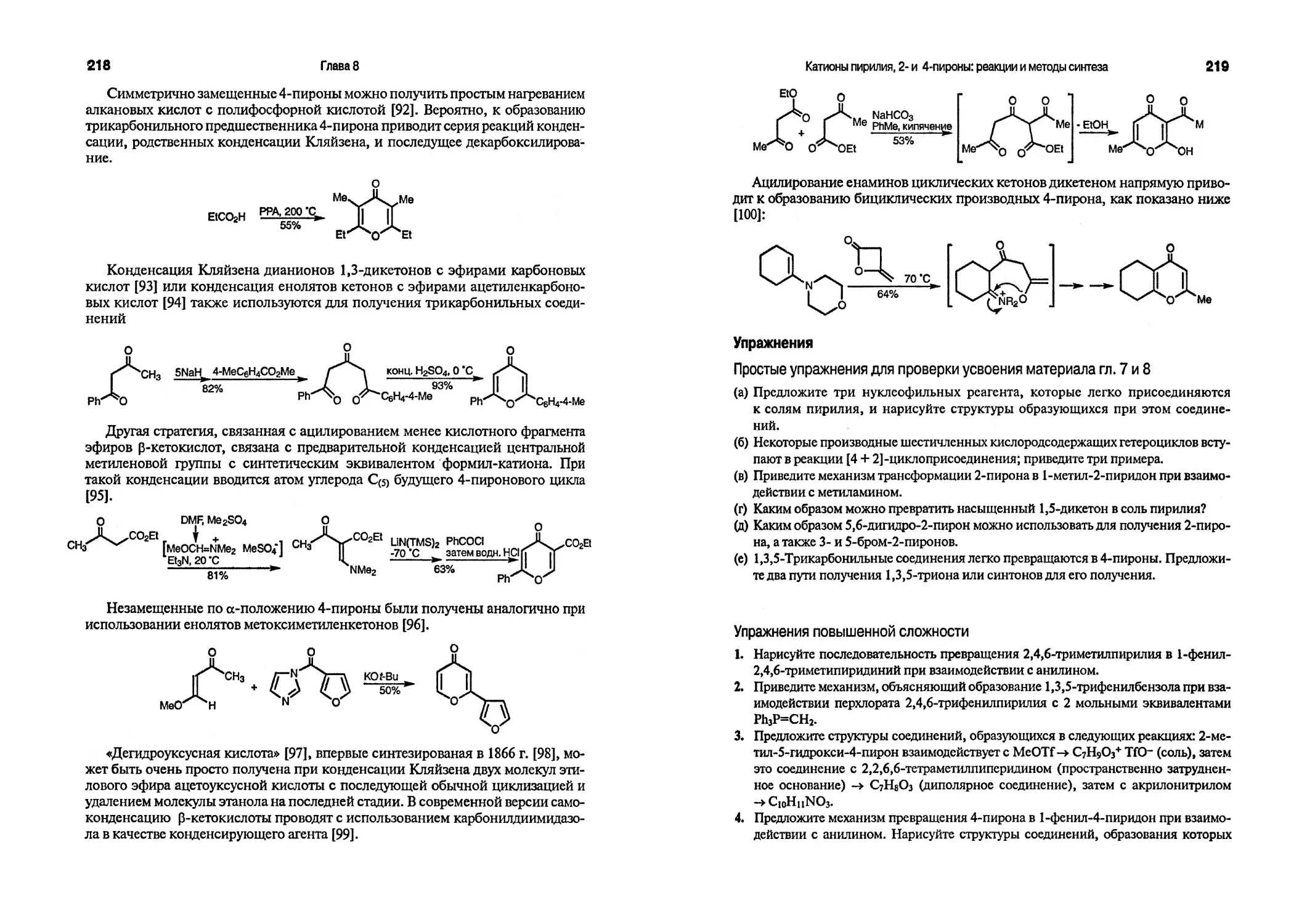
9. «Degenerate ring transformations of heterocyclic compounds», van der Plas A. C. Adv. Heterocycl. Chem., 74, 1999.
10. Meyers A. I. Heterocycles in organic synthesis, Wiley-Interscience, New York, 1974; более современная статья, посвященная этой же проблеме, см.: «Five-membered heteroaromatic rings as intermediates in organic synthesis», Lipshuhz В. H. Chem. Rev., 86, 795(1986).
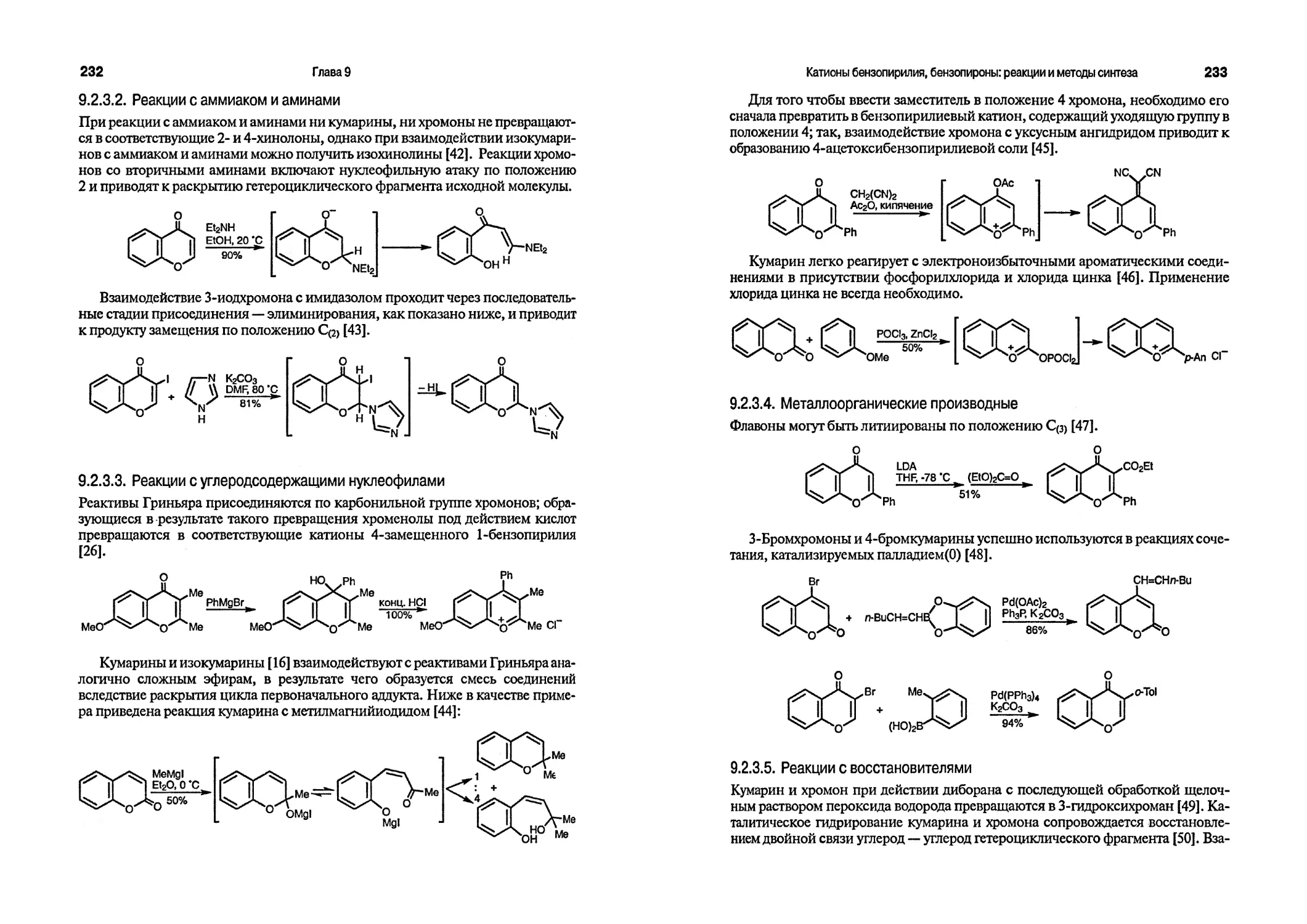
11. Heterocyclic compounds, Elderfield R. S. (ed.), Vols. 1-9, Wiley, 1950-1967.
12. The chemistry of heterocyclic compounds, Series Weissberger A., Taylor E. C. (eds.), Vols. 1-56, Wiley-Interscience, 1950-1999.
13. Rodd’s chemistry of carbon compounds, Coffey S. then Ansell M. F. (eds.), Vols. IVa-IVl and Supplements, Elsevier, Amsterdam, 1973-1994.
СОКРАЩЕНИЯ, ИСПОЛЬЗУЕМЫЕ В КНИГЕ
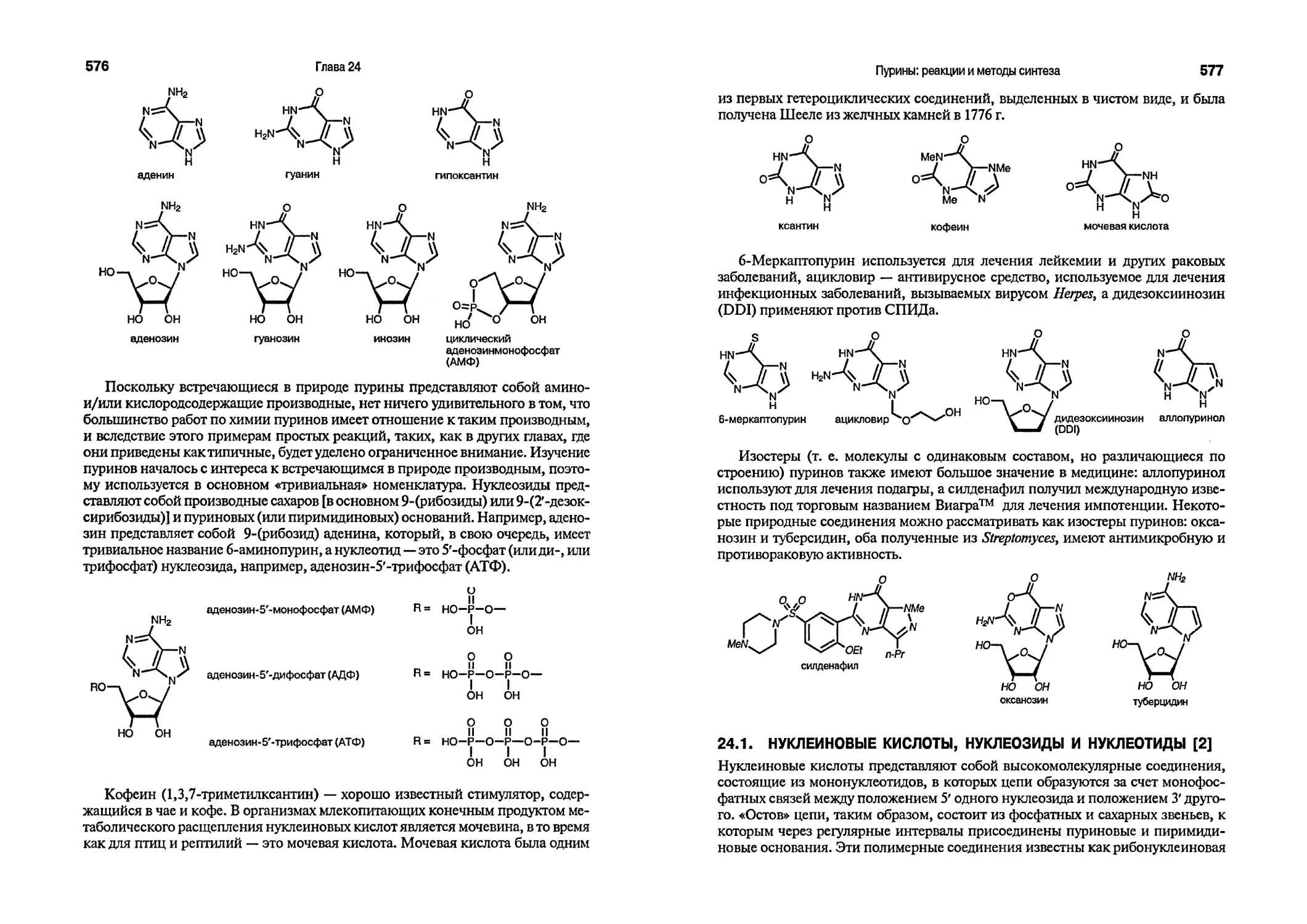
Adoc адамантилоксикарбонил (Ci0Hi5OC=O)
Aliquat® хлорид трикаприлметиламммония [MeNfCgHnhCl]
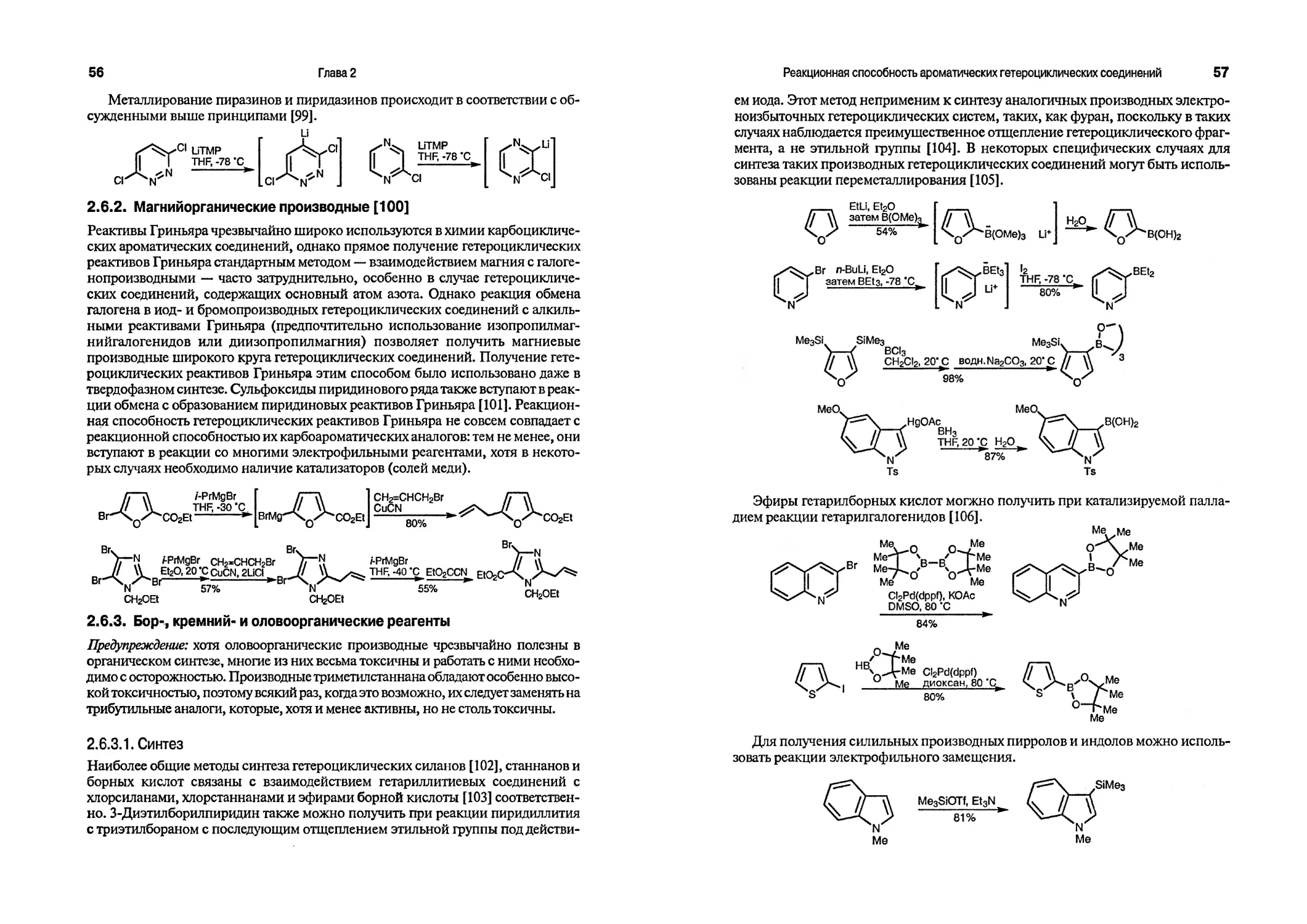
p-An лоро-анизил (4-МеОСбН4)
9-BBN 9-борабицикло[3.3.1]нонил
BINAP 2,2*-бис(дифенилфосфино)-1, Г-бинафтил
BINOL 1,Г-би(2-нафтол) (С20Н14О2)
Bn бензил (РЬСНг)
Boc mpem-бутилоксикарбонил (Ме3СОС=О)
Bt бензотриазол-1-ил (C6H4N3)
BSA НО-бис(триметилсилил)ацетамид
[MeC(OSiMe3)=NSiMe3 ]
f-Bu (шо-Ви) изобутил (Ме2СНСН2)
л-Ви (н-Ви) н-бутил [Ме(СН2)з]
f-Ви (шо-Ви) изобутил (Ме2СНСН2)
н-Ви (н-Ви) н-бутил[Ме(СН2)з]
5-Ви (втор-Ви) emop-бутил [МеСНгС(Ме)Н]
f-Ви (трет-Ви) mpem-бутил (Ме3С)
с цикло-, например с-С5Н9 — циклопентил
CAN церий(1У)-аммонийнитрат
CDI 1, Г-карбонилдиимидазол [(C3H3N2)2 С^О]
CIMgTMP (2.2,6,6-тетраметилпиперидино)магнийхлорид (ClMgN(CMe2(CH2)3CMe2)]
cod циклоокта-1,5-диен (CgHn)
Ср циклопентадиенил-анион (С-С5Н5)
m-CPBA .мвлш-хлорнадбензойная кислота (З-ООДЦСОзН)
СиТС медная(1) соль тиофен-2-илкарбоновой кислоты (C5H3CUO2S)
DABCO 1,4-диазобицикло[2.2.2]октан (С6Н 12N2>
dba дибензилцденацетон (PhCH=CHCOCH=CHPh)
DBU 1,8-диазобицикло[5.4.0]ундецен-7 (C9H]6N2)
DCCCUUK) ^№-дициклогексилкарбодимид
(c-C6Hi1N=C=NC6Hll-c)
DDQ 2,3-дихлор-5,6-дициано-1,4-бензохинон (С8С12^О2)
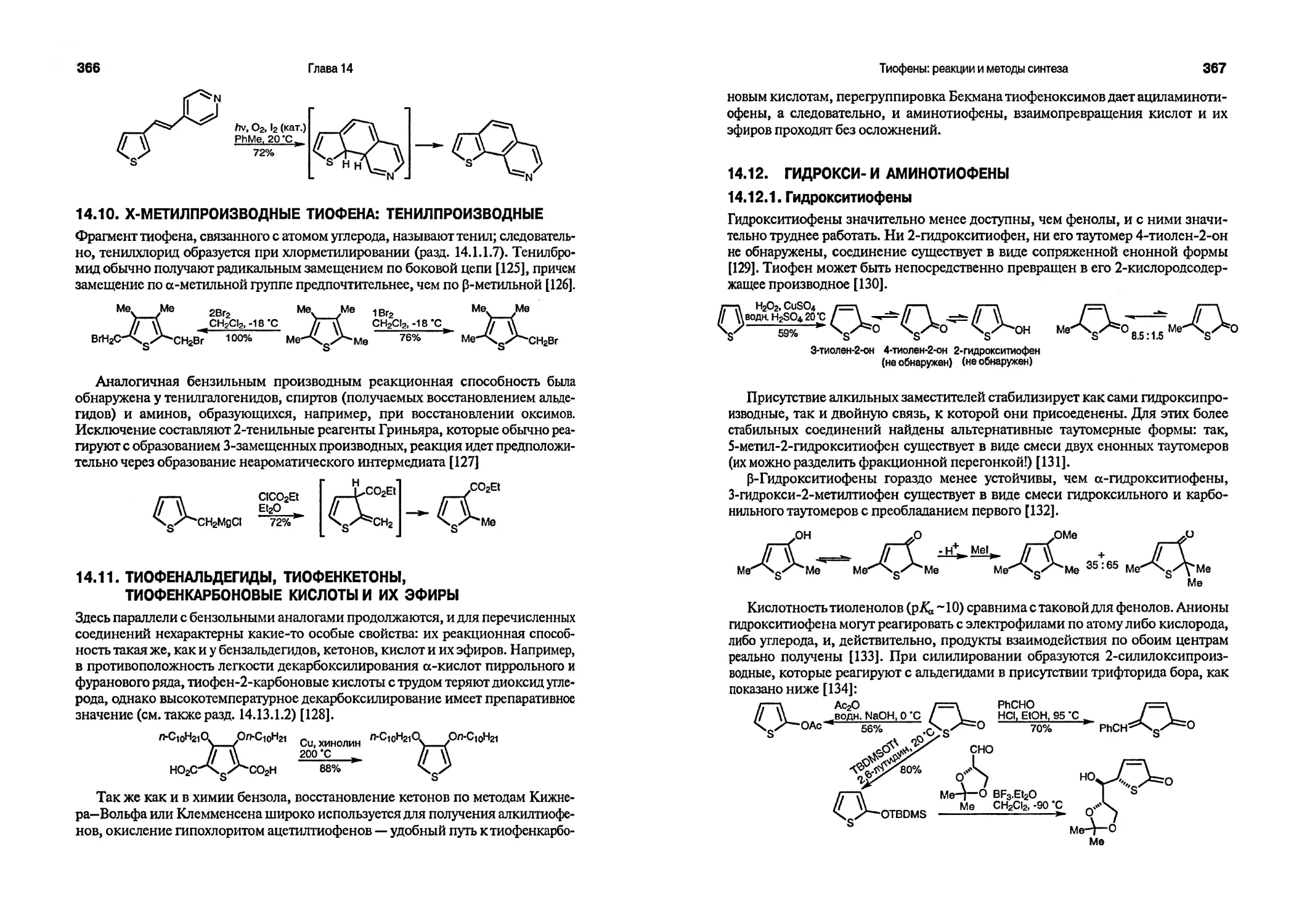
DEAD диэтиловый эфир азодикарбоновой кислоты
(EtO2CN=NCO2Et)
DIBALH диизобутилалюминийгидрид [(Ме2СНСН2)А1Н]
DMA NjN-диметилацетамид (MeCONMe2>
DMAP 4-диметиламинопиридин (C7H10N2)
ОМЕ(ДМЭ) 1,2-диметоксиэтан [МеО(СН2)2ОМе]
DMF (ДМФА) диметил формамид (Me2NCH=O)
DMFDMA диметилацеталь диметилформамида [Me2NCH(OMe)2]
DMSO (ДМСО) диметилсульфоксид (Me2S=O)
DPPA дифенилфосфорилазид [(PhO)2P(O)N3]
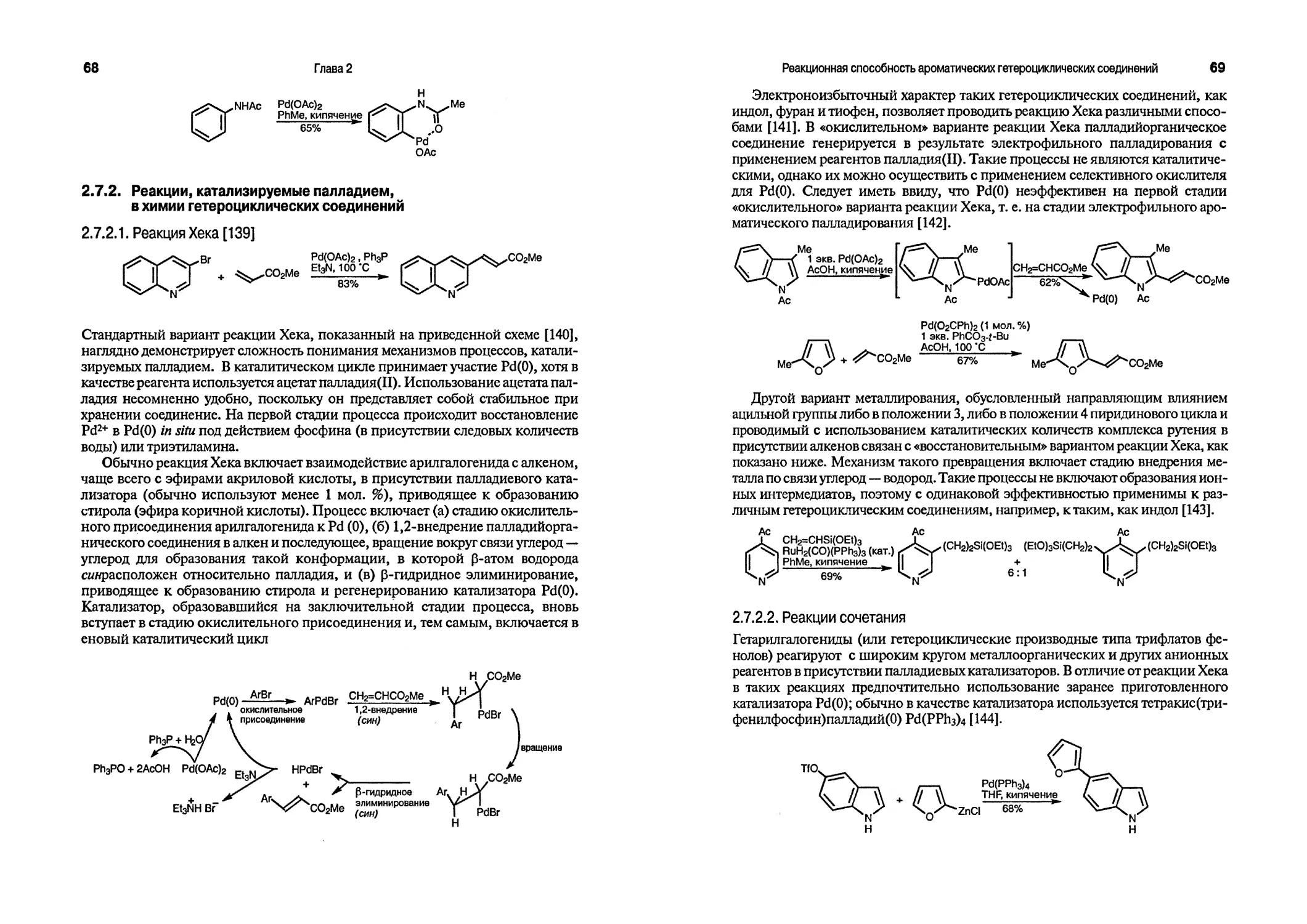
dppb 1,4-бис(цифенилфосфино)бутан [РНгРССНг^РРИг]
dppf 1, Г-бис(дифенилфосфино)ферроцен (C34H28FeP2)
dppp 1,3-бис(дифенилфосфино)пропан [РЬгССНгЪРРИг]
Et этил(СН3СН2)
Het общее обозначение гетероциклического фрагмента
HMDS 1,1,1,3,3,3-гексаметилдисилазан (Me3SiNHSiMe3)
14 Сокращения, используемые в книге
Av LDA LiTMP облучение ультрафиолетовым или видимым светом диизопропиламид лития [UN (изо-Рг)2] 2,2,6,6-тетраметилпиперидид лития [1Ж(СМе2(СН2)зСМе2)]
LR Me MOM MTBD реагент Лоуссона (Ci4Hi4O2P2S4) метил (СН3) метоксиметил (СН3ОСН2О) 1,3,4,6,7.8-гексагидро-1-метил-2Н-пиримидо[ 1,2-с-пиридин (C8H15N3)
MSH О-(мезитиленсульфонил)гвдроксиламин (H2NOSO2C6H2Me3-2,4,6)
NBS (NBC) NIS NMP OXONE® Ph PhH PhMe PMB PMP PP PPA Z-Pr (изо-Рг) л-Рг (w-Pr) РУ SDS SEM TASF N-бромсукцинимид (C4H4BrNO2) N-иодсукцинимид (C4H4INO2) N-метилпирролидон (C5H9NO) пероксимоносульфат калия (2KHSO5 -KHSO4 -K2SO4) фенил (C6H5) бензол толуол лдро-метоксибензил (4-МеОС6Н4СН2) 1,2,2,6,6-пентаметилпиперидин (Ci0H2iN) пирофосфат [ОР(=О)(ОН)ОР(=О)ОН] полифосфорная кислота изопропил (Ме2СН) я-пропил (СНзСН2СН2) пиридил (C5H4N) додецилсульфат натрия (Ci2H25SO3Na) триметилсилилэтоксиметил [Me3Si(CH2)2OCH2] трис(диметиламино)сера(триметилсилил)дифторид [(Me2N)3S(Me3SiF2)]
TBAF TBAS TBDMS TfO-tfp THF(TFO> ТНР(ТГП) TIPS TMEDA TMP TMS TMSOTf o-Tol p-Tol TolH TOSMIC Ts фторид тетрабутиламмония [«-BiuN+F"] гидросульфат тетрабутиламмония (h-Bu4N+HSO~) mpem-бутилдиметилсилил [Me3C(Me2)Si] трифлат (трифторметансульфонат) (CF3SO~) трифуран-2-илфосфин [Р(С4Н3О)з] тетрагидрофуран (2,3,4,5-тетрагидрофуран) тетрагидропиран-2-ил (С5Н9О) триизопропилсилил (Я30-РГз81) Й^^^-тетраметилэтилевдиамин [Me2N(CH2)2NMe2] 2,2,6,6-тетраметилпиперидин (C9H19N) триметилсилил (Me3Si) триметилсилилтрифлат (Мез$Юз8СР3) орто-толил (2-МеСбН4) лора-толил (4-МеСбН4) толуол тозилметилизоцианид (4-MeC6H4SO2CH2NC) тозил (4-MeCeH4SO2) p-d-2-дезоксирибофуранозил
p-d-рибофуранозил
© углеводный остаток, обычно фрагмент рибозы или дезоксирибозы, присоединенный к гетероциклическому атому азота и не изменяющийся в ходе реакции
))))) ультразвуковое облучение
1
СТРОЕНИЕ И СПЕКТРАЛЬНЫЕ ХАРАКТЕРИСТИКИ АРОМАТИЧЕСКИХ ГЕТЕРОЦИКЛИЧЕСКИХ СОЕДИНЕНИЙ
Эта глава посвящена строению ароматических гетероциклических соединений и кратким сведениям об их физических свойствах [1]. При описании строения ароматических гетероциклов нами был использован метод валентных связей. Применение этого метода, как мы полагаем, весьма эффективно при рассмотрении реакционной способности таких соединений; кроме того, этот метод наиболее подходит для общих учебников по химии гетероциклических соединений. Более фундаментальный подход к описанию строения гетероциклических ароматических соединений на основе метода молекулярных орбиталей до сих пор не нашел широкого применения при рассмотрении реакционной способности таких соединений. Применение в некоторых случаях метода граничных орбиталей [2], хотя и необходимо, однако рассмотрение таких ситуаций выходит за рамки этой книги.
1.1. КАРБОЦИКЛИЧЕСКИЕ АРОМАТИЧЕСКИЕ СИСТЕМЫ
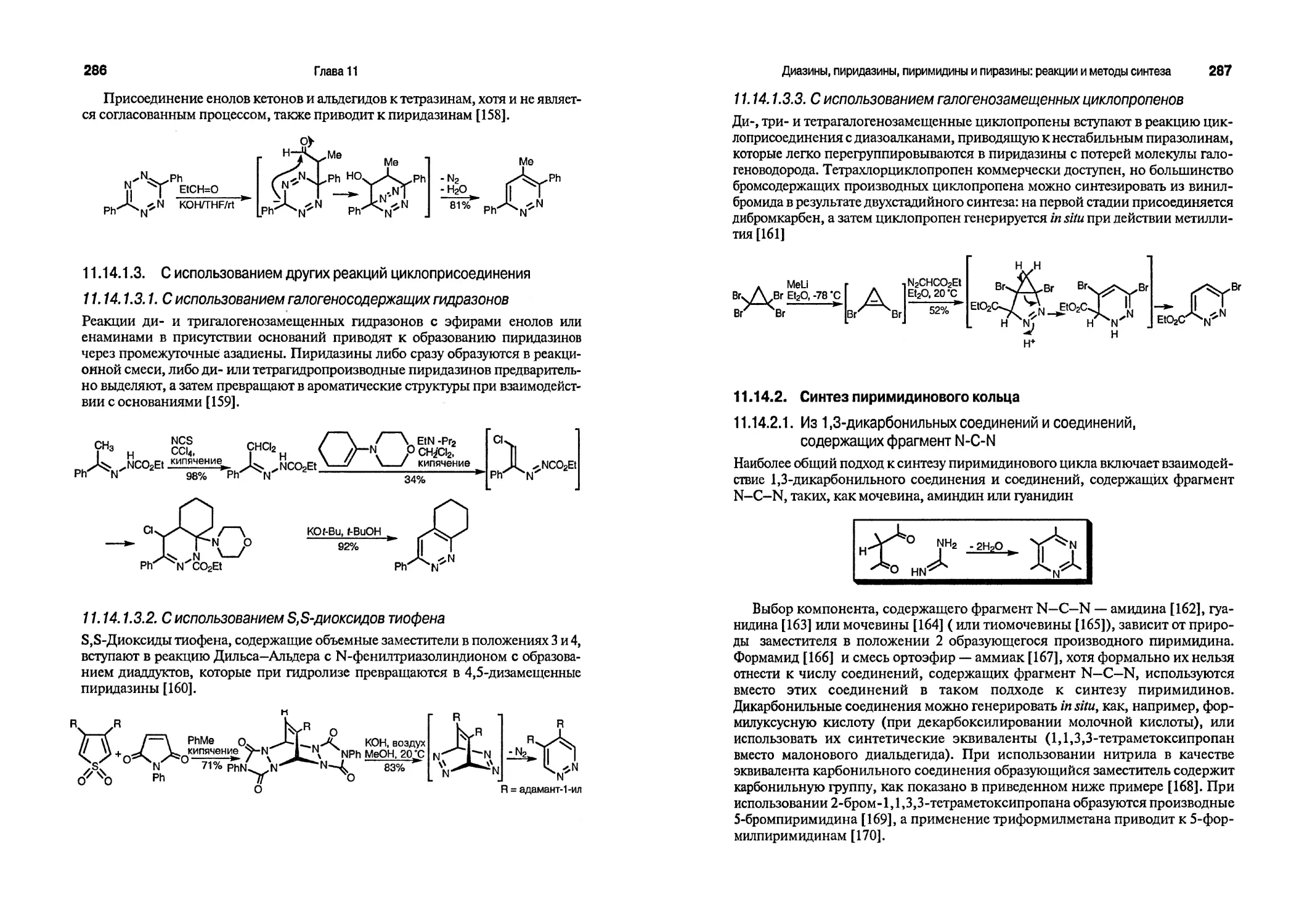
1.1.1. Строение бензола и нафталина
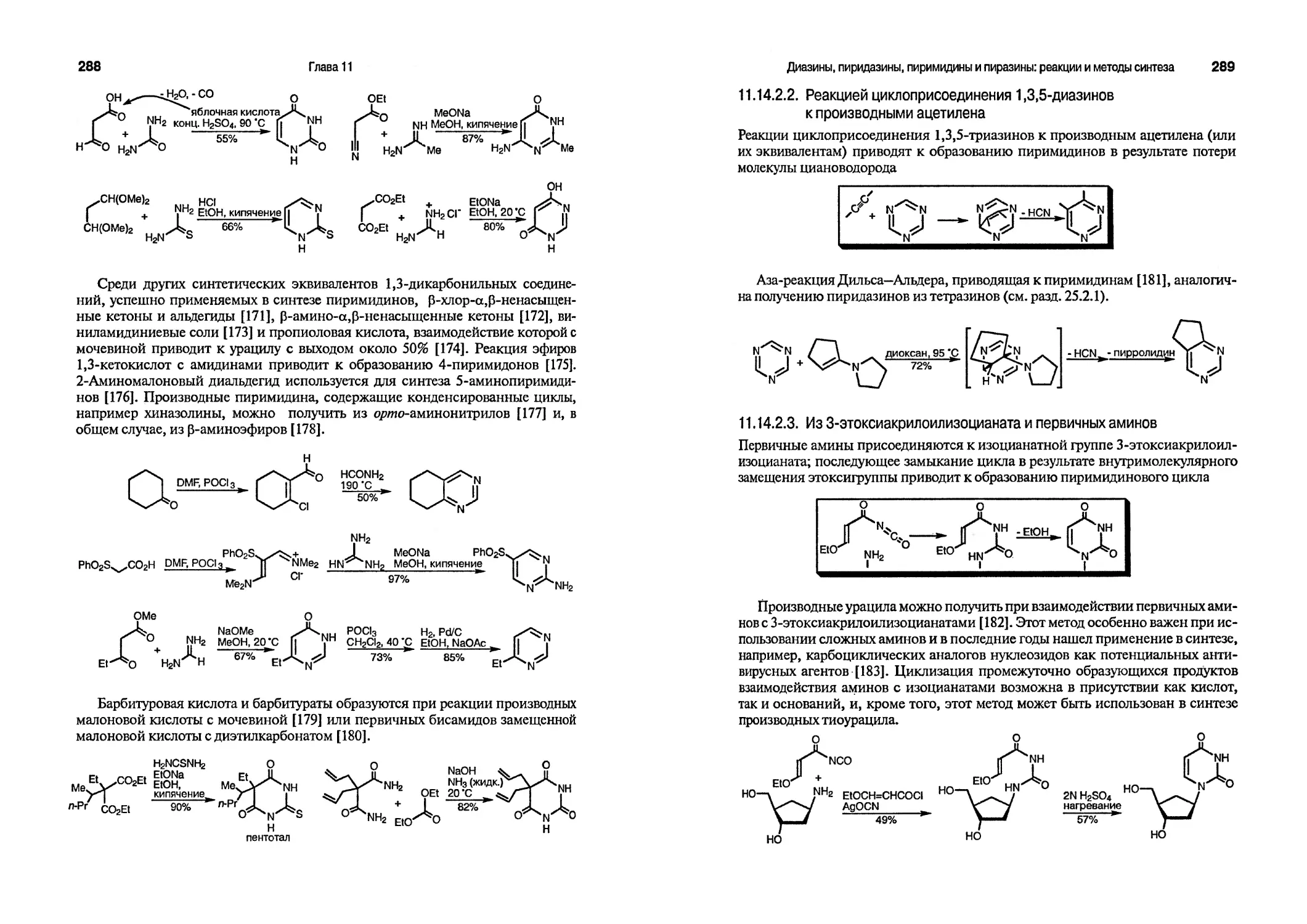
Концепция ароматичности бензола хорошо знакома и относительно проста. Различие между бензолом, с одной стороны, и алкенами, с другой, хорошо известно: алкены вступают в реакции присоединения электрофилов, таких, как бром, в то время как реакции бензола с такими реагентами требуют гораздо более жестких условий и практически всегда проходят как реакции замещения. Такое различие определяется циклической природой шести л-электронов в бензоле, которые образуют сопряженную молекулярную орбиталь, термодинамически гораздо более стабильную, чем соответствующая нециклическая сопряженная система. Дополнительная стабилизация приводит к уменьшению тенденции к реакциям присоединения и увеличению тенденции вступать в реакции замещения, поскольку в последнем случае происходит сохранение циклической сопряженной системы в продукте реакции. Общее правило, предложенное Хюккелем в 1931 г., заключается в том, что соединение ароматично, если в образовании его циклической сопряженной системы участвует 4и + 2 электронов, т. е. 2,6,10, 14 и т. д. л-электронов. Наиболее распространены мо-ноциклические ароматические и гетероароматические системы, содержащие шесть л-электронов.
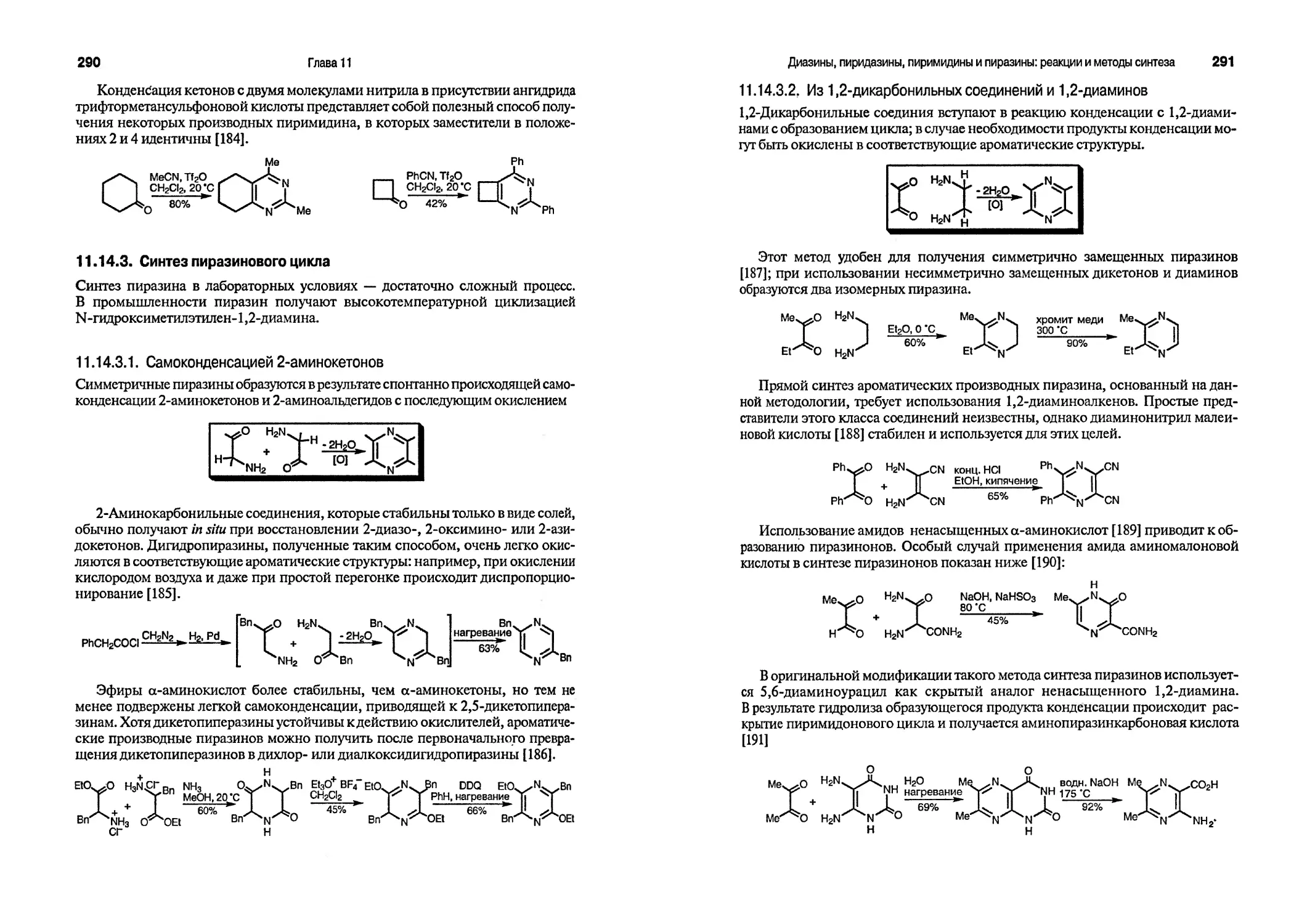
В этой книге мы используем метод резонанса для описания строения и реакционной способности гетероароматических соединений. Хотя этот метод и не
достаточно строгий, он широко используется при изучении органической химии, а на более высоком уровне Изучения может быть заменен более сложным математическим квантово-механическим подходом. Начнем с рассмотрения строения бензола с позиций метода валентных связей.
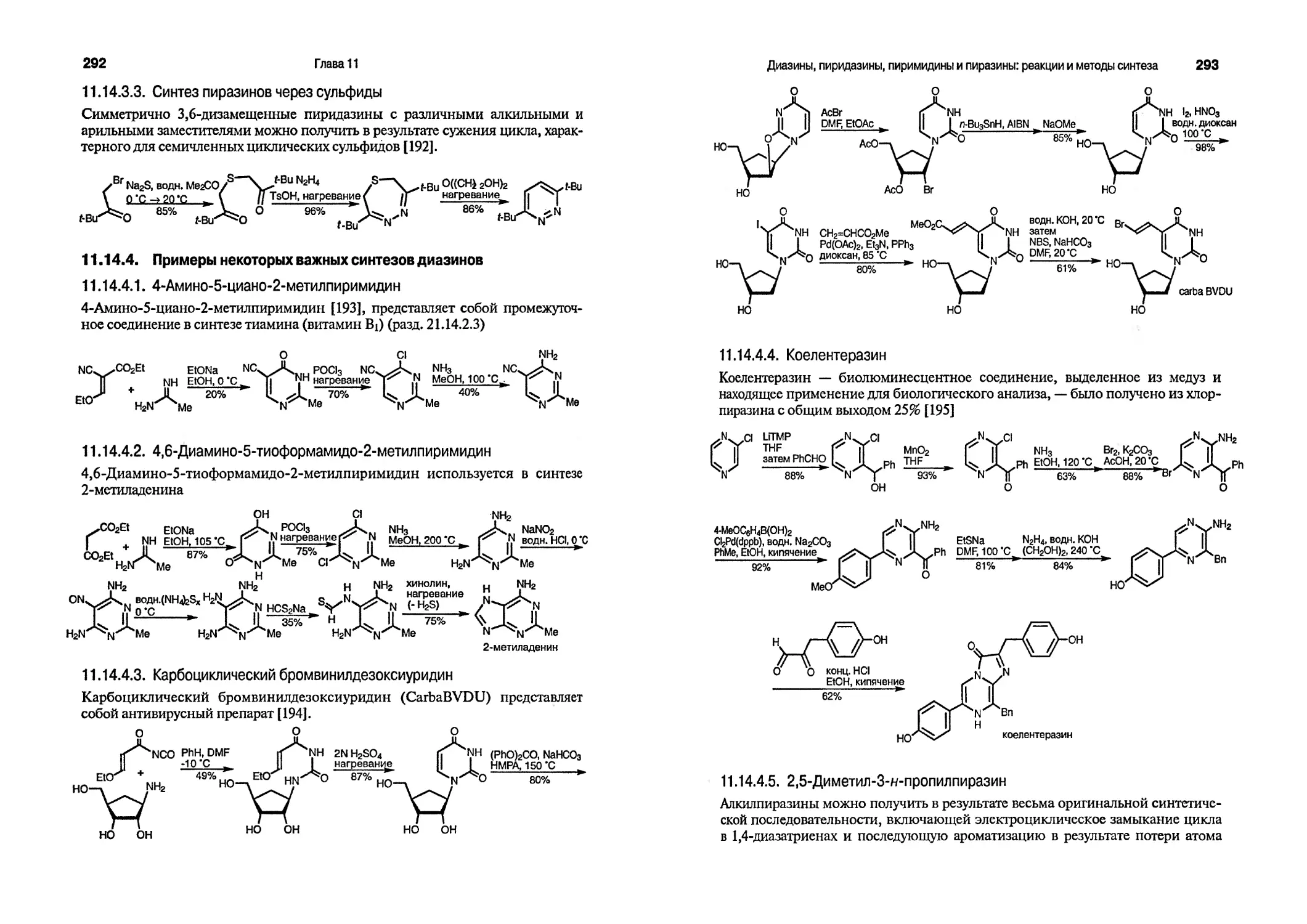
Геометрия молекулы бензола такова, что величины углов углеродного цикла Составляют 120е, что точно соответствует геометрии тригонально гибридизован-ного атома углерода. Это позволяет шести sp2- гибридизованным атомам углерода образовывать ненапряженное планарное кольцо — о-скелет. Каждый атом углерода обладает одним электроном, который занимает атомную р-орбиталь, ортогональную плоскости кольца. Взаимодействие р-орбиталей приводит к образованию 71-молскулярной орбитали, составляющей ароматическую систему.
Бензол можно описать как резонансный гибрид двух крайних форм, которые соответствуют, в терминах орбитального взаимодействия, двум возможным вариантам спаривания двух соседних р-электронов — структуры 1 и 2. Такие структуры называют каноническими, они не существуют сами по себе и представляют собой две крайние структуры, вносящие вклад в «реальную» структуру бензола.
Иногда бензоидные ароматические соединения представляют с использованием гексагона с включенной в него окружностью, тем самым подчеркивая делокализацию связей и близкое значение их длин (абсолютно одинаковые по длине связи присутствуют только в незамещенном бензоле). Однако такое представление ни в коей мере не помогает при описании реакций ароматических соединений и поэтому не используется в этой книге.
используется в этой книге для обозначения бензола
все связи С-С имеют одинаковую длину 1,39 А
не используется для обозначения бензола
Рассмотрение с аналогичных позиций молекулы нафталина позволяет выявить три канонические структуры: 3,4 и 5. Обратите внимание, что для обозначения взаимосвязи между каноническими формами используются обоюдонаправ-ленная стрелка, которую не следует путать с совокупностью двух противоположно направленных стрелок. Последние используются для обозначения взаимосвязи между двумя структурами, находящимися в равновесии, а резонансные формы не существуют по отдельности и не находятся в равновесии одна с другой.
Метод валентных связей предсказывает неэквивалентность длин связей в нафталине: в двух из трех возможных резонансных форм связь C(i)—С<2) — двойная и в одной — одинарная, в то время как связь С<2)—С(з) — двойная в двух резонансных формах и одинарная в одной. Статистически можно предположить, что первая связь представляет 0,67 долей от двойной связи, а вторая — 0,33 доли. Измеренные значения длин этих связей находятся в соответствии со статистическими предсказаниями.
1.1.2. Энергия ароматического резонанса [3]
Различие в энергиях основного состояния бензола и гипотетического неароматического циклогекса-1,3,5-триена соответствует степени стабилизации, определяемой специфицеским циклическим взаимодействием шести л-элек-тронов. Такое различие в энергии называется энергией ароматического резонанса. Очевидно, что количественное выражение энергии резонанса зависит от оценки энергии соответствующей «неароматической» структуры, поэтому (хотя и не только) различные значения энергии резонанса могут быть рассчитаны для различных гетероароматических систем. Однако следует заметить, что абсолютное значение энергии резонанса не такая уж важная характеристика, гораздо большее значение имеет ее относительное значение. С уверенностью можно утверждать, что резонансная энергия бициклических ароматических соединений, таких, как нафталин, значительно меньше, чем сумма энергий резонанса двух соответствующих моноциклических систем. Это означает, что в результате образования интермедиата (например, при реакции электрофильного замещения, разд. 2.2.2) потеря в энергии стабилизации меньше для бициклических систем, поскольку одно бензольное кольцо остается незатронутым в ходе реакции. Энергия резонанса пиридина того же порядка, что и энергия резонанса бензола, а энергия резонанса тиофена меньше по значению, чем энергия резонанса бензола. При переходе к пирролу и, наконец, к фурану наблюдается дополнительное уменьшение энергии стабилизации. Истинные значения энергии стабилизации для этих гетероциклических ароматических соединений варьируются в зависимости от сделанных предположений относительно энергии соответствующих им «неароматических» систем; относительные энергии резонанса для бензола, пиридина, тиофена, пиррола и фурана равны 150,117, 122, 90 и 68 кДж/моль соответственно.
1.2. СТРОЕНИЕ ШЕСТИЧЛЕННЫХ ГЕТЕРОАРОМАТИЧЕСКИХ СОЕДИНЕНИЙ
1.2.1. Строение пиридина
Строение пиридина полностью аналогично строению бензола, с той лишь разницей, что одна группа СН бензола заменена в пиридине на атом азота. Такая замена приводит к следующим существенным изменениям: (а) нарушается геометрия правильного гексагона, поскольку связь углерод — азот короче, чем
связь углерод — углерод; (б) в молекуле пиридина вместо одного атома водорода, расположеного в плоскости цикла, присутствует неподеленная пара электронов, также расположенная в плоскости цикла, занимающая s/Лгибридную орбиталь и не принимающая участия в образовании ароматического секстета электронов (именно эта неподеленная пара электронов обусловливает основные свойства пиридина); (в) молекула пиридина представляет собой постоянный диполь вследствие большей электроотрицательности атома азота по сравнению с атомом углерода.
Электроотрицательный атом азота способствует индуктивной поляризации молекулы пиридина в результате смещения электронной плотности преимущественно по о-связям. Кроме того, атом азота определяет стабильность поляризованных канонических структур, в которых он отрицательно заряжен — структуры 8, 9 и 10. Эти структуры вместе со структурами 6 и 7, которые полностью аналогичны формулам Кекуле бензола, вносят вклад в строение молекулы пиридина. Полязированные канонические структуры подразумевают также постоянно присутствующую в молекуле пиридина поляризацию системы л-электронов (при рассмотрении с позиций более строгого метода молекулярных орбиталей это связано с относительным различием в орбитальных коэффициентах ВЗМО иНСМО).
Поскольку индуктивный и мезомерный эффекты имеют одну и ту же направленность, молекула пиридина поляризована со смещением электронной плотности к атому азота. Это также означает, что на атомах углерода пиридинового цикла локализуется частичный положительный заряд, особенно на а- и у-атомах углерода. Поскольку на атомах углерода молекулы пиридина наблюдается некий дефицит электронов, пиридин и аналогичные гетероароматические соединения принято относить к электронодефицитным гетероциклическим соединениям или, как иногда говорят, л-дефицитным. Сравнение дипольного момента пиридина с дипольным моментом пиперидина, полярность которого связана исключительно с индуктивным эффектом, показывает, что пиридин дополнительно поляризован вследствие перераспределения электронной плотности в системе л-электронов.
2,2 0
пиридин
1,17 0
1.2.2. Строение диазинов
Строение диазинов (шестичленных гетероциклических соединений с двумя атомами азота в цикле) аналогично строению пиридина. Разница заключается лишь в том, что в молекулах диазинов присутствует два атома азота и, соответственно, две неподеленные пары электронов. Ниже приведены основные канонические формы (11—18), вносящие вклад в строение пиримидина:
пиримидин
1.2.3. Строение катиона пиридиния и родственных систем
Присоединение электрофилов к атому азота пиридина приводит к образованию пиридиниевого катиона. В простейшем случае при присоединении протона образуется 1Н-пиридиниевый катион, который полностью изоэлектронен бензолу, однако наличие положительного заряда на атоме азота делает всю систему в целом положительно заряженной. Катион пиридиния — система ароматическая, так как в ней присутствуют шесть р-орбиталей, необходимых для образования ароматической молекулярной орбитали. Следует, однако, отметить, что положительный заряд на атоме азота значительно искажает л-систему таким образом, что частичный положительный заряд на а- и р-атомах углерода становится гораздо больше, чем в самом пиридине, причем эти положения пиридиниевого катиона весьма активны в реакциях с нуклеофильными агентами. Электронная плотность на p-углеродном атоме также понижена по сравнению с самим пиридином.
катион 1Н-пиридиния
катион пирилия
В катионе пирилия положительно заряженный атом кислорода, так же как и атом азота в пиридине, обладает неподеленной парой электронов, локализованной на5р2-орбитали. Резонансные структуры 19—23 показывают, что положения 2,4 и 6 катиона пирилия в некоторой степени заряжены положительно. Однако, поскольку более электроотрицательный атом кислорода в меньшей степени
склонен быть положительно заряженным, катион пирилия менее стабилизированная система, чем пиридиниевый катион.
1.2.4. Строение пиридонов и пиронов
Производные пиридина, содержащие кислород в качестве заместителя в положении 2 или 4, существуют преимущественно в виде карбонильного таутомера и известны как пиридоны [4] (разд. 1.5). В случае аналогичных систем, содержащих атом кислорода в цикле, альтернативный таутомер не существует, и такие системы известны как пироны. Степень ароматичности подобных молекул долгое время была предметом обсуждений и экпериментов и широко варьировалась. Степень ароматичности связана с вкладом диполярных структур 25 и 27, содержащих «полный» ароматический цикл, в структуру пиридонов (пиронов). Пироны значительно менее ароматичны, чем пиридоны, что следует из их способности вступать в реакции присоединения (разд. 8.2.2.4). Такое же заключение можно сделать при рассмотрении структур 25 и 27, содержащих положительно заряженный гетероатом, с учетом того, что атом кислорода, будучи более электроотрицательным, чем атом азота, в меньшей степени склонен быть положительно заряженным.
4-пиридон [4(1Н)-пиридон]
4-гидроксипиридин [4-пиридинол]
2-пирон [2Н-пиран-2-он]
1.3. СТРОЕНИЕ ПЯТИЧЛЕННЫХ ГЕТЕРОАРОМАТИЧЕСКИХ СИСТЕМ [5]
1.3.1. Строение пиррола
Прежде, чем обсуждать строение пиррола, вспомним строение циклопента-диенил-аниона, который представляет собой бя-электронную ароматическую систему, образующуюся при депротонировании циклопентадиена. Эта система служит прекрасной иллюстрацией различия между ароматической стабилизацией и реакционной способностью. Циклопентадиенил-анион — очень реакционноспособный, полностью отрицательно заряженный и, тем не менее, «резонансно стабилизированный». Значение p/fa циклопентадиена равно -14, т. е. кислотность этого соединения значительно выше, чем кислотность простых диенов, что обусловлено исключительно тем, что образующийся анион резонансно стабилизирован. Пять одинаковых канонических структур 28—32 демонстрируют, что все атомы углерода эквивалентны и несут 1/5 отрицательного заряда
циклопентадиенил-анион
Пиррол изоэлектронен циклопентадиенил-аниону, но электрически нейтрален вследствие присутствия в нем атома трехвалентного азота. Другое следствие, связанное с присутствием атома азота в цикле, обусловлено отсутствием у пиррола радиальной симметрии: для пиррола не существует одинаковых канонических форм, для него могут быть написаны одна каноническая структура без разделения зарядов 33 и две пары эквивалентных структур с разделенными зарядами, которые демонстрируют смещение электронной плотности от атома азота. Вклад резонансных форм в истинное строение пиррола не одинаков и может быть представлен следующей последовательностью: 33 > 35, 37 > 34, 36.
Резонансное распределение электронной плотности в молекуле пиррола приводит к возникновению частичного отрицательного заряда на атомах углерода и частичного положительного заряда на атоме азота. Несомненно, что индуктивный эффект атома азота имеет обычную направленность, т. е. электронная плотность смещена от атомов углерода к атомам азота. Таким образом, распределение электронов в молекуле пиррола определяется балансом между двумя противоположно направленными эффектами, причем мезомерный эффект оказывает более сильное влияние. Длина связи С(з)—С(4) в пирроле гораздо больше, чем длины связей С^)—С(3) и С(4)-С(5), и заметно меньше, чем длина нормальной одинарной связи, что согласуется с вкладом канонических форм 34—37 в строение пиррола. Поскольку в пятичленных гетероциклических соединениях типа пиррола электронная плотность смещена от гетероатома к атомам углерода, такие гетероциклические соединения относят к «электроноизбыточным» или «л-избыточным» гетероциклам.
1,55
(2.15) D
(в зависимости от растворителя)
Важно отметить, что неподеленная пара электронов атома азота молекулы пиррола принимает участие в образовании ароматической шестиэлектронной системы.
1.3.2. Строение тиофена и фурана
тиофен
фуран
Строение тиофена и фурана аналогично детально обсужденному выше строению пиррола, с той лишь разницей, что в гетероцикл вместо группы NH включен атом серы или кислорода соответственно. Гетероатом предоставляет одну пару электронов для образования ароматической системы, так же как и в случае пиррола, а другая пара электронов, не включенная в ароматическую систему, занимает $р2-гибридную орбиталь, расположенную в плоскости цикла. Канонические формы тиофена и фурана полностью аналогичны каноническим структурам пиррола. Однако большая электроотрицательность атомов серы и кислорода по сравнению с атомом азота определяют меньший вклад поляризованных канонических структур с положительно заряженным гетероатомом в истинное строение гетероциклических молекул. Для тиофена и фурана мезо-мерное смещение электронной плотности от гетероатома к атомам углерода цикла не перекрывает индуктивную поляризацию молекул в результате смещения электронной плотности к гетероатому (определяемые индуктивной поляризацией дипольные моменты тетрагидротиофена и тетрагидрофурана, равные 1,87 и 1,68 D соответственно, все же больше, чем дипольные моменты соответствующих ароматических молекул). В целом, молекулы тиофена и фурана представляют собой диполи со смещением электронной плотности к гетероатому
0,52 D
1’44Ач>?Ч
1.35А
1,37А 0
фуран
0,71 D
Больший атомный радиус серы — один из факторов, обеспечивающих ббль-шую стабильность (ббльшую ароматичность) тиофена по сравнению с фураном и пирролом, поскольку углы связей в тиофене больше, и вследствие этого в некоторой степени снимается угловое напряжение. Кроме того, существенный дополнительный вклад в стабилизацию тиофена может вносить cf-орбиталь атома серы.
1.3.3. Строение азолов
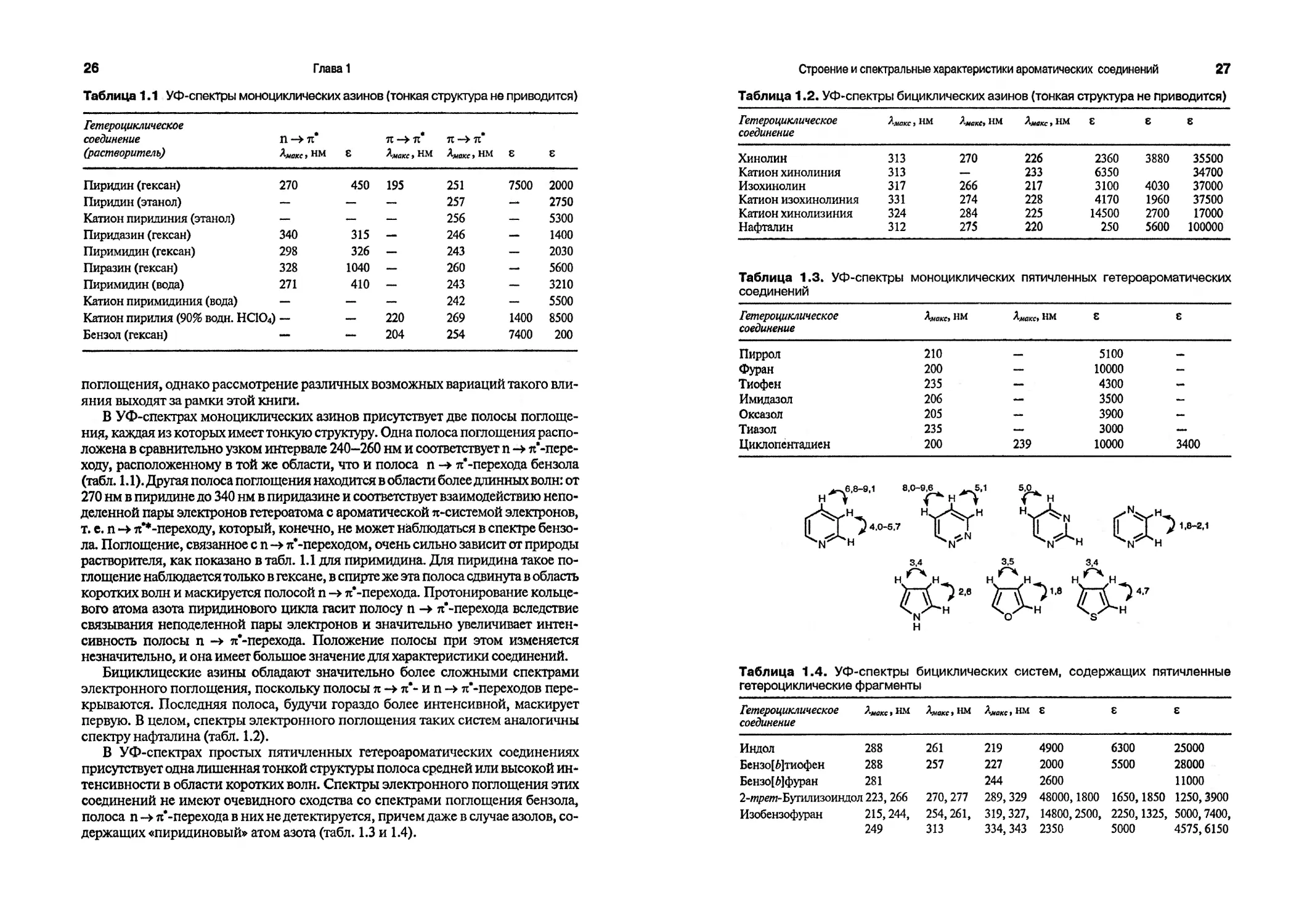
1,3- и 1,2-Азолы — пятичленные гетероциклические соединения с двумя гетероатомами — представляют собой сочетание гетероциклических соединений двух типов. В молекулах всех азолов присутствует один гетероатом, аналогичный гетероатому пятичленных гетероциклических соединений (пиррол, тиофен, фуран), и один гетероатом иминного типа, как в пиридине. Лучшей иллюстрацией такого сочетания служит имидазол, содержащий два атома азота
разных типов. Для имидазола наиболее предпочтитетальна каноническая структура 39.
1.4. СТРОЕНИЕ БИЦИКЛИЧЕСКИХ ГЕТЕРОАРОМАТИЧЕСКИХ СОЕДИНЕНИЙ
Молекулы бензола, нафталина, пиридина и пиррола могут быть приняты в качестве прототипов при рассмотрении более сложных систем, представляющих собой комбинацию двух (или более) гетероциклов. Так, хинолин аналогичен по своему строению нафталину, с той лишь разницей, что один из циклов — пиридиновый, а индол аналогичен пирролу с присоединенным к нему бензольным циклом
хинолин
индол
При резонансном представление таких систем следует принимать во внимание резонансные структуры, определяющие строение молекулы бензола и других прототипных систем. Резонансные структуры, в которых разрушены оба ароматических цикла, вносят незначительный вклад в истинное строение ароматических бициклических молекул.
1.5. ТАУТОМЕРИЯ ГЕТЕРОЦИКЛИЧЕСКИХ СИСТЕМ [6]
Проблема определения точной структуры гетероциклических молекул, склонных к таутомерным превращениям, таких, как пиридинол/пиридон (разд. 1.2.4), многие годы привлекала внимание большого числа исследователей. В том случае, когда кислородный заместитель расположен в а- или у-положениях относи-
тельно атома азота, возможно существование двух таутомерных форм; то же справедливо для аминогруппы
положение равновесия
? положение равновесия
Ранние попытки использования результатов химических реакций для определения положения таутомерного равновесия приводили к заблуждениям, поскольку минорный таутомер может быть более реакционноспособным и основной продукт реакции может возникать именно за счет минорного таутомера. Более точно определить положение равновесия можно при сравнении спектральных данных исследуемого соединения со спектральными данными модельных структур с однозначным строением: чаще всего в качестве модельных соединений используют N- и О-метилированные производные.
сравнение спектральных данных
исследуемых соединений и \ &
соединений с однозначным строением N
ОМе
и
Me
После определенных усилий, предпринятых в этой области, ситуация выглядит следующим образом: а- и у-оксигетероциклы существуют предпочтительно в карбонильной таутомерной форме, аминопроизводные гетероциклических соединений практически всегда существуют в виде аминных таутомерных форм. Серные аналоги — тионы и тиолы — в случае шестичленных гетероциклических соединений существуют в виде тионов, а в случае пятичленных гетероциклов — в виде тиолов.
Установление предпочтительной таутомерной формы имеет большое значение для пуриновых и пиримидиновых оснований, которые входят в состав ДНК и РНК, поскольку водородные связи с участием карбонильного атома кислорода обеспечивают возможность спаривания.
1.6. МЕЗОИОННЫЕ СОЕДИНЕНИЯ [7]
Существует значительный ряд гетероциклических соединений, для которых не могут быть написаны неполяризованные канонические формы; такие соединения называются «мезоионными». Несмотря на присутствие в молекулах мезо-ионных соединений положительного и отрицательного зарядов во всех возможных резонансных структурах, такие соединения не представляют собой солеобразные вещества. Мезоионные соединения в целом нейтральны и подобно обычным органическим веществам растворяются в обычных органических растворителях. Примеры мезоионных соединений будут встречаться далее в книге. Среди давно изученных мезоионных соединений можно назвать сццноны, резонансные структуры которых приведены на с. 25 вверху.
Мезоионные соединения встречаются также и среди шестичленных гетероциклических соединений. Два примера таких структур приведены ниже:
Единственное, что отличает мезоионные соединение от других, это ихдипо-лярное строение, позволяющее им вступать в реакции циклоприсоединения в качестве 1,3-диполей.
1.7. НЕКОТОРЫЕ СПЕКТРАЛЬНЫЕ СВОЙСТВА ГЕТЕРОАРОМАТИЧЕСКИХ СОЕДИНЕНИЙ
Спектральные методы занимают центральное место в химических исследованиях и анализе. Однако точное знание величины химического сдвига, например какого-нибудь протона пиридина, или точное знание максимума поглощения в УФ-спектре индола, ни в кой мере не способствует пониманию реакционной способности гетероароматических соединений, а лишь является результатом специально проведенного измерения. В этом разделе мы приведем лишь краткое обсуждение спектральных свойств гетероароматических соединений с привлечением небольшого количества спектральных данных. Более детальная информация может быть найдена в соответствующих обзорах [1] и оригинальных статьях.
Ароматический характер гетероциклических соединений проявляется в ультрафиолетовых и инфракрасных спектрах. Спектральные исследования, особенно в УФ и видимой области, а также спектроскопия ядерного магнитного резонанса имеют чрезвычайно важное значение для оценки степени ароматичности соединений, определения положения таутомерного равновесия и изучения невыделяемых интермедиатов различных превращений.
1.7.1. УФ-спектроскопия и спектроскопия видимой области (электронная спектроскопия)
Положения максимумов поглощения в УФ-спектрах простых незамещенных гетероциклических систем колеблются в широких пределах — от простой полосы фурана при 200 нм до, например, максимума поглощения пиридазина при 340 нм. Так же как и в случае производных бензола, присутствие заместителей, способных к сопряжению, приводит к глубокому изменению электронного
Таблица 1.1 УФ-спектры моноциклических азинов (тонкая структура не приводится)
Гетероциклическое соединение (растворитель) П->«‘ Лмоке j НМ 8 л-> л* л л‘ Лмокс > НМ 8 8
Пиридин (гексан) 270 450 195 251 7500 2000
Пиридин (этанол) — — 257 — 2750
Катион пиридиния (этанол) — — — 256 — 5300
Пиридазин (гексан) 340 315 — 246 — 1400
Пиримидин (гексан) 298 326 — 243 — 2030
Пиразин (гексан) 328 1040 — 260 — 5600
Пиримидин (вода) 271 410 — 243 — 3210
Катион пиримидиния (вода) — — — 242 — 5500
Катион пирилия (90% водн. НСЮ4) — — 220 269 1400 8500
Бензол (гексан) — — 204 254 7400 200
поглощения, однако рассмотрение различных возможных вариаций такого влияния выходят за рамки этой книги.
В УФ-спектрах моноциклических азинов присутствует две полосы поглощения, каждая из которых имеет тонкую структуру. Одна полоса поглощения расположена в сравнительно узком интервале 240-260 нм и соответствует п ->л‘-пере-ходу, расположенному в той же области, что и полоса п -> «‘-перехода бензола (табл. 1.1). Другая полоса поглощения находится в области более длинных волн: от 270 нм в пиридине до 340 нм в пиридазине и соответствует взаимодействию непо-деленной пары электронов гетероатома с ароматической л-системой электронов, т. е. п -> «**-переходу, который, конечно, не может наблюдаться в спектре бензола. Поглощение, связанное с п -> «‘-переходом, очень сильно зависит от природы растворителя, как показано в табл. 1.1 для пиримидина. Для пиридина такое поглощение наблюдается только в гексане, в спирте же эта полоса сдвинута в область коротких волн и маскируется полосой п -> «‘-перехода. Протонирование кольцевого атома азота пиридинового цикла гасит полосу п -> «‘-перехода вследствие связывания неподеленной пары электронов и значительно увеличивает интенсивность полосы п «‘-перехода. Положение полосы при этом изменяется незначительно, и она имеет большое значение для характеристики соединений.
Бициклицеские азины обладают значительно более сложными спектрами электронного поглощения, поскольку полосы л -> «‘- и п -> «‘-переходов перекрываются. Последняя полоса, будучи гораздо более интенсивной, маскирует первую. В целом, спектры электронного поглощения таких систем аналогичны спектру нафталина (табл. 1.2).
В УФ-спектрах простых пятичленных гетероароматических соединениях присутствует одна лишенная тонкой структуры полоса средней или высокой интенсивности в области коротких волн. Спектры электронного поглощения этих соединений не имеют очевидного сходства со спектрами поглощения бензола, полоса п -> «’-перехода в них не детектируется, причем даже в случае азолов, содержащих «пиридиновый» атом азота (табл. 1.3 и 1.4).
Таблица 1.2. УФ-спектры бициклических азинов (тонкая структура не приводится)
Гетероциклическое соединение Лмокс j НМ Лиоке» НМ Кмкс , нм 8 Б Б
Хинолин 313 270 226 2360 3880 35500
Катион хинолиния 313 — 233 6350 34700
Изохинолин 317 266 217 3100 4030 37000
Катион изохинолиния 331 274 228 4170 1960 37500
Катион хинолизиния 324 284 225 14500 2700 17000
Нафталин 312 275 220 250 5600 100000
Таблица 1.3. УФ-спектры моноциклических пятичленных гетероароматических соединений
Гетероциклическое соединение Лмокс, НМ НМ 8 €
Пиррол Фуран Тиофен Имидазол Оксазол Тиазол Циклопентадиен 210 - 5100 200 - 10000 235 - 4300 206 - 3500 205 - 3900 235 - 3000 - 200 239 10000 3400
Таблица 1.4. УФ-спектры бициклических систем, содержащих пятичленные гетероциклические фрагменты
Гетероциклическое соединение 2-макс > НМ Лмвкс» НМ Лиокс» НМ Б 8 8
Индол 288 261 219 4900 6300 25000
Бензо[6]тиофен 288 257 227 2000 5500 28000
Бензо[/>]фуран 281 244 2600 11000
2-лгре/и-Бутилизоиндол 223,266 270,277 289,329 48000,1800 1650, 1850 1250,3900
Изобензофуран 215,244, 254,261, 319,327, 14800,2500, 2250,1325, 5000,7400,
249 313 334,343 2350 5000 4575,6150
Таблица 1.4 (продолжение)
Гетероциклическое соединение Лмдкс s НМ Я-макс»НМ ^максг НМ е Е Е
Индолизин 347 295 238 1950 3600 32000
Бензимидазол 259 275 5620 5010
Бензотиазол 217,251 285 295 18620,5500 1700 1350
Бензоксазол 231,263 270 276 7940,2400 3390 3240
2-Метил-2Н-индазол 275 292 295 6310 6170 6030
2,1 -Бензизотиазол 203,221 263 288sh, 298 315sh 14450, 16220 7590,2880 3980
Пурин — — 7950 — —
1.7.2. Спектроскопия ядерного магнитного резонанса (ЯМР) [8]
Величины химических сдвигов [9] протонов, в особенности присоединенных к атомам углерода гетероциклических систем, могут служить мерой электронной плотности в данном конкретном положении: смещение сигналов в низкие поля соответствует меньшей электронной плотности на атоме углерода. Например, в спектре Н1 ЯМР пиридина в наиболее слабых полях расположен сигнал, соответствующий а-протону (табл. 1.5), в более сильных—сигнал, соответствующий у-протону и, наконец, в наиболее сильных — сигнал, соответствующий р-про-тону. Аналогичная картина наблюдается и в спектре 13С-ЯМР (табл. 1.6). Кроме того, имеет значение индуктивный эффект гетероатома: например, атом водорода, связанный с у-атомом углерода, резонирует в более слабых полях, чем атом водорода, связанный с у-атомом углерода; аналогично в случае фурана а-протон резонирует в более слабых полях, чем p-протон. Протон в а-положе-нии катиона пирилия резонирует в самых слабых полях. В случае электроноизбыточных систем ситуация совершенно противоположная: протоны таких гетероциклических систем, как, например, пиррол, резонируют в существенно более сильных полях.
Константы спин-спинового взаимодействия 1,2-связанных (ор/ло-распо-ложенных) протонов существенно варьируются в зависимости от типа гетероциклического соединения. Обычно в шестичленных гетероциклических системах константы уменьшаются по мере приближения к гетероатому. В пятичленных гетероциклических системах значения констант спин-спинового взаимодействия обычно невелики, однако и в этом случае сохраняется упомянутая выше тенденция. Исключение составляют тиофены, в которых проявляется влияние большого радиуса атома серы. Величина константы спин-спинового взаимодействия отражает степень двоесвязности (фиксации связи) связи С—С.
Использование спектроскопии 15Ы-ЯМР в некоторых случаях бывает чрезвычайно важным для исследования азотсодержащих гетероциклических систем; так, например, этот метод позволяет оценить гибридизацию атома азота [10].
Таблица 1.5. Химические сдвиги 1Н (м. д.) для гетероароматических соединений
Гетероциклическое <5/ $2 <5? 84 $5 дб <?7 8g Другие
соединение сдвиги
Пиридин — 8,5 7,1 7,5 — — — —
2-Пиридон — — 6,6 7,3 6,2 7,3 — — —
Хинолин — 8,8 7,3 8,0 7,7 7,4 7,6 8,1 —
N-Оксид хинолина — 8,6 7,3 7,7 — — — 8,8 —
Изохинолин 9,1 — 8,5 7,5 7,7 7,6 7,5 7,9 —
N-Оксид 8,8 — 8,1 — — — — —
изохинолина
Пиридазин — — 9,2 7,7 — — — — —
Пиримидин — 9,2 — 8,6 7,1 — — —
N-Оксид пиримидина — 9,0 — 8,2 7,3 8,4 — — —
Пиразин — 8,5 — — — — — — —
1,2,4-Триазин — — 9,6 — 8,5 9,2 — — —
1,3,5-Триазин 9,2 — — — — — — —
Циннолин — — 9,15 7,75 — — — — —
Хиназолин — 9,2 — 9,3 — — — — —
Хиноксалин — 9,7 — — — — — —
Фталазин 9,4
Катион пирилия — 9,6 8,5 9,3 — — — - вжидк. SO2
Пиррол 6,6 6,2 — — —- — — —
Тиофен — 7,2 7,1 — — — — — —
Фуран __ 7,4 6,3 — — — — — —
Индол — 6,5 6,3 7,5 7,0 7,1 7,4 — —
Бензо[6]фуран — 7,5 6,7 7,5 7,1 7,2 7,4 — —
Бензо[д]тиофен — 7,3 7,3 7,7 7,3 7,3 7,8 — —
Индолизин 6,3 6,6 7,1 — 7,8 6,3 6,5 7,2 —.
Имидазол — 7,9 — 7,25 — — — — —
1-Метил имидазол — 7,5 — 7,1 6,9 — — — —
Пиразол — — 7,6 6,3 — — — —
1-Метил пиразол — — 7,5 6,2 7,4 — — — 3,8(СНз)
Тиазол — 8,9 — 8,0 7,4 — — — —
Оксазол 7,95 — 7,1 7,7 — — — —
Бензимидазол — 7,4 — 7,0 6,9 — — — —
Бензоксазол — 7,5 — 7,7 7,8 7,8 7,7 — —
Пиразол — 7,6 7,3 — — — — —
Изотиазол — — 8,5 7,3 8,7 — — — —
Изоксазол — — 8,1 6,3 8,4 — — — —
Индазол — — 8,1 7,8 7,1 7,35 7,55
1,2,3-Триазол — — — 7,75 — — — — —
1,2,4-Триазол — — 7,9 — 8,85 — — — —
Тетразол — — — — 9,5 —* — —- —
Пурин — 9,0 — — — 9,2 — 8,6 —
Бензол 7,27
Анизол — 6,9 7,2 6,9 —- — — — —
Анилин — 6,5 7,0 6,6 — — — —
Нитробензол — 8,2 7,4 7,6 — — — — —
Нафталин 7,8 7,5 — — — — — —
Гетероцикличекое соединение $1 $2 8j 84 85 8б 87 8g 8узяового атома 8узповогоатйм> а Другие сдвиги
Пиридин — 150 124 136 — — — — — — —
Катион 1Н-пиридиния — 143 129 148 — — — — — — —
N-Оксид пиридина — 139 126 126 — — —
1-Метилпиридин — 146 129 146 — — 50(СН3)
2-Пиридон — 165 121 142 107 136 — — — — —-
4-Пиридон — 140 116 176 — — — — — — —
Хинолин — 151 122 136 1289 127 130 131 129(4а) 149(8а) —
Изохинолин 153 - 143 120 126 130 127 128 136(4а) 129(8а)
Пиридазин — - 153 128 — — — — — — —
Катион Ш-пиридазиния — - 152 138 — — — — — — —
Пиримидин — 158 — 156 121 — — — — — —
Катион 1Н-пиримидиния— 152 - 159 125 — — — — — —
Пиразин — 146 - — — — — — — — —
Катион 1-Н-пиразиния — 143 - —. — — — — — —
Циннолин — - 146 125 128 132 132 130 127(4а) 151(8а) —
Хиназолин — 161 - 156 127 128 134 129 135(4а) 150(8а)
Хиноксалин — 146 - — 130 130 — — 143(4а) — —
Фталазин 152 — — — 127 133 — — 126(4а) —
1,2,3-Трйазин — — — 150 118 — — — — — —
1,2,4-Триазин — - 158 — 150 151 — — — — —
1,3,5-Триазин — 166- — — — — — — — —
Катион пирилия (BF“) — 169 128 161 — — — — — — —
2-Пирон — 162 117 143 106 152 — — — — —
2,6-Диметил-4-пирон — 166 114 180 — — — — — 20(СН3)
Кумарин — 161 117 144 129 124 132 117 119(4f> 154(80 —
Хромон — 156 ИЗ 177 125 126 134 118 125(40 156(80
Пиррол — 117 108 — — — — — — — —
Тиофен 126 127 — — — — — — — —
Фуран — 144 110 —- — — — — — — —
Индол — 124 102 121 122 120 111 — 128(30 136(70 —
Оксиндол — 179 36 124 122 ПО — — 125(3а) 143(7а) —
Бензо[6]фуран — 145 107 122 123 125 112 — 128(3а) 155(7а)
Бензо[6]тиофен — 126 124 124 124 124 123 — 140(За) 140(7а) —
Индолизин 100 114 113 — 126 111 117 120 133(8а) — —
Имидазол — 135 - 122 — — — — — — —
1-Метилимидазол — 138- 130 120 — — — З(СНз)
Тиазол — 154 — 143 120 — — — — — —
Оксазол — 151 - 125 138 — — — — — —
Бензимидазол — 144 - 110 123 122 119 — — — —
Бензотиазол — 155 - 123 126 125 122 — 153(3а) 134(7а) —
Бензоксазол — 153 - 121 125 124111 — 140(За) 150(7а> —
Пиразол — - 135 106 135 — — — — — —
Изотиазол — - 157 123 148 — — — — — —
Изоксазол — - 150 105 159 — — — — — —
Таблица 1.6 (продолжение)
Гетероцикличекое 81 8л 8j 84 8$ 8б 87 8g Ьузмяио етама 8уммого атама Другие
соединение сдвиги
Индазол 133 120 120 126 110 - 123(3а) 140(7а)
З-Метил-1,2-бензизо- — 163 — —— — —- _ 152(7а) — —.
тиазол
Пурин — 152 - 155 131 146 - 146- — —
Урацил — 151 - 142 100 164 - — — —-
Бензол 129 — — — — — — —— —- — —
Анизол 160 114 130 121 — — — —Ч— •шшм. — —.
Анилин 149 114 129 116 — — — — — — —
Нитробензол 149 124 130 135 — — — — —— — —
Нафталин 128 126 — - 133(4а) — —
Литература
1. Physical methods in heterocyclic chemistry, Vols. 15, Katritzky A. R. (ed.), Academic Press, New York, 1960-1972. Comprehensive heterocyclic chemistry. The structure, reactions, synthesis and uses of heterocyclic compounds, Katritzky A. R., Rees C. W. (eds.), Vols. 1—8, Pergamon Press, Oxford, 1984; Comprehensive heterocyclic chemistiy II. A review of the literature 1982-1995, Katritzky A. R., Rees C. W., Scriven E. F. V. (eds.), Vols. 1—11, Pergamon Press, 1996.
2. Fleming I. Frontier orbitals and organic chemical reactions, Wiley-Interscince, 1976.
3. «Aromaticity of heterocycles», Cook M. J. Katritzky A, R., Linda P. Adv. Heterocycl. Chem., 17,257 (1974); «Aromaticity of heterocycles: experimental realisation of Dewar-Breslow definition of aromaticity», Hosmane R. A., Liebman J, F. Tetrahedron Lett., 32, 3949 (1991); «The relationship between bond type, bond order and bond lenghts. A re-evaluation of the aromaticity of some heterocyclic molecules», Box V. G. S. Heterocycles, 32, 2023 (1991); «Heterocyclic aromaticity», Katritzky A. R., Karelson M.t Malhotra N. Heterocycles, 32, 127 (1991); «Concept of aromaticity in reterocyclic chemistry», Simkin B. Ja., Minkin V. L, Glukhovtsev M. A. Adv. Heterocycl. Chem., 56,303 (1993).
4. В сильно разбавленных растворах и в газовой фазе концентрация гидрокситаутомера оксипиримидинов повышена или даже доминирует в таутомерной равновесной смеси: Beak Р., Covington J. В., Smith S. G.t White J. M.t Leigler J. M. J. Org. Chem., 45,1354(1980).
5. Fringuelli E, Marino G., TaticchiA., Grandolini G. J. Chem. Soc., Perkin Trans. 2,1974, 332.
6. «Tautomerism of heterocycles», Elguero J., Martin C. Katritzky A. R., Linda P. Adv. Heterocycl. Chem. Supplement 1, 1976; «Energies and alkylations of tautomeric heterocyclic compounds; old problems new answers», Beak P. Acc. Chem. Res., 10,186 (1977); «Prototropic tautomerism of heteroaromatic compounds», Katritzky A. R. Karelson M., Harris P. A. Heterocycles, 32,329 (1991).
7. «Mesoionic compounds», Ollis W. D.f Ramsden C. A. Adv. Heterocycl. Chem., 19, 1 (1976); «Heterocyclic betaine derivatives of alternant hydrocarbons», Ramsden C. A. ibid., 26,1 (1980); «Mesoionic heterocycles (1976-1980)», Newton C. G., Ramsden C. A. Tetrahedron, 38, 2965 (1982); «Six-membered mesoionic heterocycles of the /я-quino-
dimethane dianion type», Friedrichsen Ж. Карре T, BottcherA. Heterocycles, 19,1083 (1982).
8. Jackman L. M., Stemhell S. Applications of nuclear magnetic resonance spectroscopy in organic chemistry, Pergamon Press, 1969; Breitmaier E, Voelter W. Carbon-13 NMR spectroscopy, VCH, 1990.
9. Химические сдвиги как ’H, так и 13С зависят от природы растворителя; значения, приведенные в табл. 1.5 и 1.6, демонстрируют относительное положение сигналов протонов и атомов углерода в соотвествующих спектрах гетероциклических соединений.
10. Von Philipsbom Ж, Muller R. Angew. Chem., Int. Ed. Engl., 25,383 (1986).
2
РЕАКЦИОННАЯ СПОСОБНОСТЬ АРОМАТИЧЕСКИХ
ГЕТЕРОЦИКЛИЧЕСКИХ СОЕДИНЕНИЙ
В этой главе в общих чертах рассматривается реакционная способность ароматических гетероциклических соединений. Помимо классических реакций замещения, значительное внимание также уделено реакциям радикального замещения, металлирования и реакциям, катализируемым соединениями палладия, которые приобретают в последнее время все большее значение в химии гетероциклических соединений. Для того чтобы подчеркнуть важность этих методов именно для синтеза и превращений гетероциклических соединений, в данной главе им посвящены отдельные разделы, поскольку в учебниках по общей органической химии такие процессы обсуждаются крайне скудно. Более детальное обсуждение общей реакционной способности гетероциклических соединений каждого конкретного класса приводится в кратких обобщающих главах (гл. 4, 7, 10, 12, 16 и 20), а детальное рассмотрение реакционной способности с привлечением большего числа примеров конкретных реакций можно найти в главах типа гл. 5 «Пиридин: реакции и методы синтеза». Тем, кто уже продолжает изучение химии гетероциклических соединений, рекомендуется изучить эту главу до перехода к последующим главам, а краткие обобщающие главы, аналогичные гл. 4 «Общая характеристика реакционной способности пиридинов, хинолинов и изохинолинов», следует прочесть перед изучением более детального обсуждения свойств каждого из классов гетероциклических соединений.
2.1. РЕАКЦИИ ЭЛЕКТРОФИЛЬНОГО ПРИСОЕДИНЕНИЯ К АТОМУ АЗОТА
В гетероциклических соединениях, содержащих иминовый фрагмент (C=N) как составную часть структуры — пиридинах, хинолинах, изохинолинах, 1,2- и 1,3-азолах и других, неподеленная электронная пара атома азота не включена в ароматическую л-систему (разд. 1.2) и, следовательно, способна к взаимодействию с электрофильными реагентами аналогично простым аминам. Другими словами, такие гетероциклические соединения проявляют свойства оснований и способны присоединять протон и другие электрофилы по атому азота. Образующиеся при этом соли могут быть выделены.
Например, Х+ = HCI
Н СГ
Х+=Ме1
Me I'
В случае обратимых реакций присоединения, например, протонирования, положение равновесия определяется значением рЛа гетероциклического соединения [1] и зависит от заместителей, присутствующих в гетероцикле. Электронодонорные заместители увеличивают основность, а электроноакцепторные понижают силу основания. Значения pAfa простых производных пиридина близко к 5, основность 1,2- и 1,3-азолов зависит от характера второго гетероатома, а для пиразола и имидазола, содержащих два атома азота, значение рА^ равно соответственно 2,5 и 7,1.
Нуклеофильность атома азота иминного фрагмента коррелирует с основностью, хотя и не всегда. Заместители у атома углерода, соседнего с иминым атомом азота, могут оказывать существенное влияние на легкость протекания реакции с алкилгалогенидами, приводящей либо к образованию соответствующих М+-алкильных солей [2], либо Ы+Н-солей в результате 1,2-элиминирования молекулы галогеноводорода. Показано, что скорость реакции N-алкилирования уменьшается в 3 раза за счет стерического взаимодействия при введении одной метильной группы в сс-положение к атому азота пиридина, а введение двух метильных групп в положения 2 и 6 уменьшает скорость реакций алкилирования в 12-40 раз [3]. Экстремальный случай — 2,6-ди-шрет-бутилпиридин, который не алкилируется метилиодидом даже при повышенном давлении; метилирование такого производного пиридина может быть осуществлено при использовании чрезвычайно реакционноспособного метилового эфира фторсульфоновой кислоты при высоком давлении [4]. Количественная оценка реакционной способности атома азота определеяется как стерическими (особенно при наличии заместителя в а-положении), так и электронными эффектами: так, 3-метилпи-ридин реагирует быстрее (х1,6) незамещенного пиридина, а 3-хлорпиридин — медленнее (х0,14). Заместители в лерм-положении оказывают существенное влияние на скорость реакции с метилодидом: так, скорости реакции пиридина, изохинолина (отсутствует атом водорода в лерм-положении), хинолина и 8-метилхинолина равны соответственно 50,69,8 и 0,008.
На скорость образования четвертичных солей оказывают влияние также и другие факторы. Например, все диазины взаимодействуют с метилиодидом медленнее, чем пиридин. Пиридазин, хотя и представляет собой наиболее слабое среди диазинов основание по сравнению с пиридином (р/& 2,3), реагирует с метилиодидом быстрее, чем другие диазины. Связано это с проявлением «а-эф-фекта», т. е. увеличением нуклеофильности в результате взаимного отталкивания неподеленных пар электронов двух непосредственно связанных атомов азота [5]. Скорости реакций с метилиодидом пиридазина, пиримидина и пиразина относительно пиридина составляют 0,25,0,044 и 0,036 соответственно.
2.2. РЕАКЦИИ ЭЛЕКТРОФИЛЬНОГО ЗАМЕЩЕНИЯ ПРИ АТОМЕ УГЛЕРОДА [6]
Можно сказать, что изучение реакционной способности ароматических органических соединений было начато с изучения процессов электрофильного замещения, традиционно используемых для введения заместителей в гетероцикл. Значительное расширение этой методологиии связано с использованием гета-
Реакционная способность ароматических гетероциклических соединений 35 риллитиевых производных (разд. 2.6) и процессов, катализируемых палладием (разд. 2.7). Особенно важно применение этих методов для введения углеродных заместителей в гетероциклические соединения. Тем не менее, реакции электрофильного замещения с участием простых электрофильных реагентов все еще остаются чрезвычайно важными во многих случаях, особенно для введения заместителей в электроноизбыточные пятичленные гетероциклические соединения.
2.2.1. Механизм ароматического электрофильного замещения
Процесс электрофильного замещения в ароматических (и гетероароматических) молекулах реализуется в две стадии: первоначальное присоединение (Х+) приводит к образованию положительно заряженного интермедиата (а-комплекса, интермедиата Уэлацда), затем происходит элиминирование (обычно Н+). Первая стадия обычно протекает медленнее второй и определяет скорость всего процесса. В большинстве случаев такие реакции замещения необратимы и соотношение образующихся продуктов определяется кинетическим контролем.
Ароматическое электрофильное замещение
2.2.2. Шестичленные гетероциклические соединения
При рассмотрении реакций ароматического электрофильного замещения следует разделить гетероциклические соединения на две группы: к первой группе относятся те, которые проявляют свойства оснований, ко второй — те, которые не проявляют основных свойств. Для представителей первой группы характерно взаимодействие неподеленной пары электронов атома азота с электрофильными реагентами (разд. 2.1), присутствующими в реакционной смеси (протон в случае нитрующей смеси, хлорид алюминия в случае реакции Фриделя — Крафтса), которое проходит быстрее, чем какое-либо замещение при атоме углерода, И превращает субстрат в положительно заряженный катион, склонность которого к взаимодействию с электрофильной частицей Х+ существенно понижена. Стоит вспомнить понижение скорости реакции электрофильного замещения при переходе от незамещенного бензола к катиону Ы,Ь1,Ы-триметиланилиния (PhN+Me3) в 108 раз, хотя в этом случае фрагмент, несущий положительный заряд, лишь присоединен к ароматической системе, а не является ее частью. Таким образом, все гетероциклические соединения, содержащие атом азота пиридинового типа (т. е. фрагмент C=N), с трудом вступают в реакции электрофильного замещения, если (а) в молекуле отсутствуют заместители, активирующие кольцо к атаке электрофилами, (б) в молекуле нет конденсированного бензольного кольца, в котором могут проходить реакции электрофильного
замещения, или (в) молекула представляет собой пятичленный гетероцикл с двумя гетероатомами и второй гетероатом повышает электронную плотность в цикле. Например, простые производные пиридина не вступают в реакции электрофильного замещения, однако хинолины и изохинолины склонны к замещению в бензольном кольце. По оценочным данным, истинная реакционная способность пиридина в реакциях электрофильного замещения приблизительно в 107 раз меньше, чем реакционная способность бензола в подобные реакциях, т. е. такая же, как и у нитробензола.
При нитровании хинолина или изохинолина электрофильной атаке подвергается бензольное кольцо протонированного гетероцикла, и, хотя замещение проходит в бензольном кольце, такие процессы неизбежно протекают с участием дважды положительно заряженного интермедиата. Вследствие этого замещение реализуется в таких системах значительно труднее, чем в случае нафталина, положения 5 и 8 хинолиниевого катиона атакуются электрофильными частицами приблизительно в 1010 раз медленее, чем положение 1 нафталина, и по оценочным данным нитрование пиридиниевого катиона проходит еще медленее в 105 раз [7]. Изучение процесса бромирования метилпиридинов позволило оценить парциальный фактор скорости бромирования пиридиниевого катиона как 10~13 [8].
«Активирующие заместители» [9], т. е. 1руппы, увеличивающие электронную плотность в пиридиновом цикле в результате как индуктивного, так и ме-зомерного влияния, приводят к ускорению процессов электрофильного замещения: например, 4-пиридон нитруется в положение 3 с промежуточным образованием протонированной по атому кислорода соли [10]. Для того чтобы понять активирующее влияние заместителя в этом случае, полезно рассмотреть процесс как электрофильную атаку по протонированному субстрату, аналогичному фенолу. Электрофильная атака непротонированного пиридона лучшим образом иллюстрируется аналогичной реакцией по енамидному фрагменту. Диметоксипиридины также нитруются через предварительное образование катиона, однако так происходит не всегда: например, 2-аминопи-ридин бромируется по положению 5 в кислой среде без предварительного протонирования [11].
г+х* - и аналогично реакциям енамидов
В том случае, если активирующие заместители присутствуют в положении С(2) пиридина, атака электрофилами идет по положениям С(3) и С^, а если такие
группы расположены в положении С<з), электрофил атакует положение 2, но не положение 4, а если активирующий заместитель находится в положении С<4), то электрофильная атака направляется по положению 3.
Направления ||
электрофильной атаки U , в замещенных пиридинах
срто/пара-ориентант
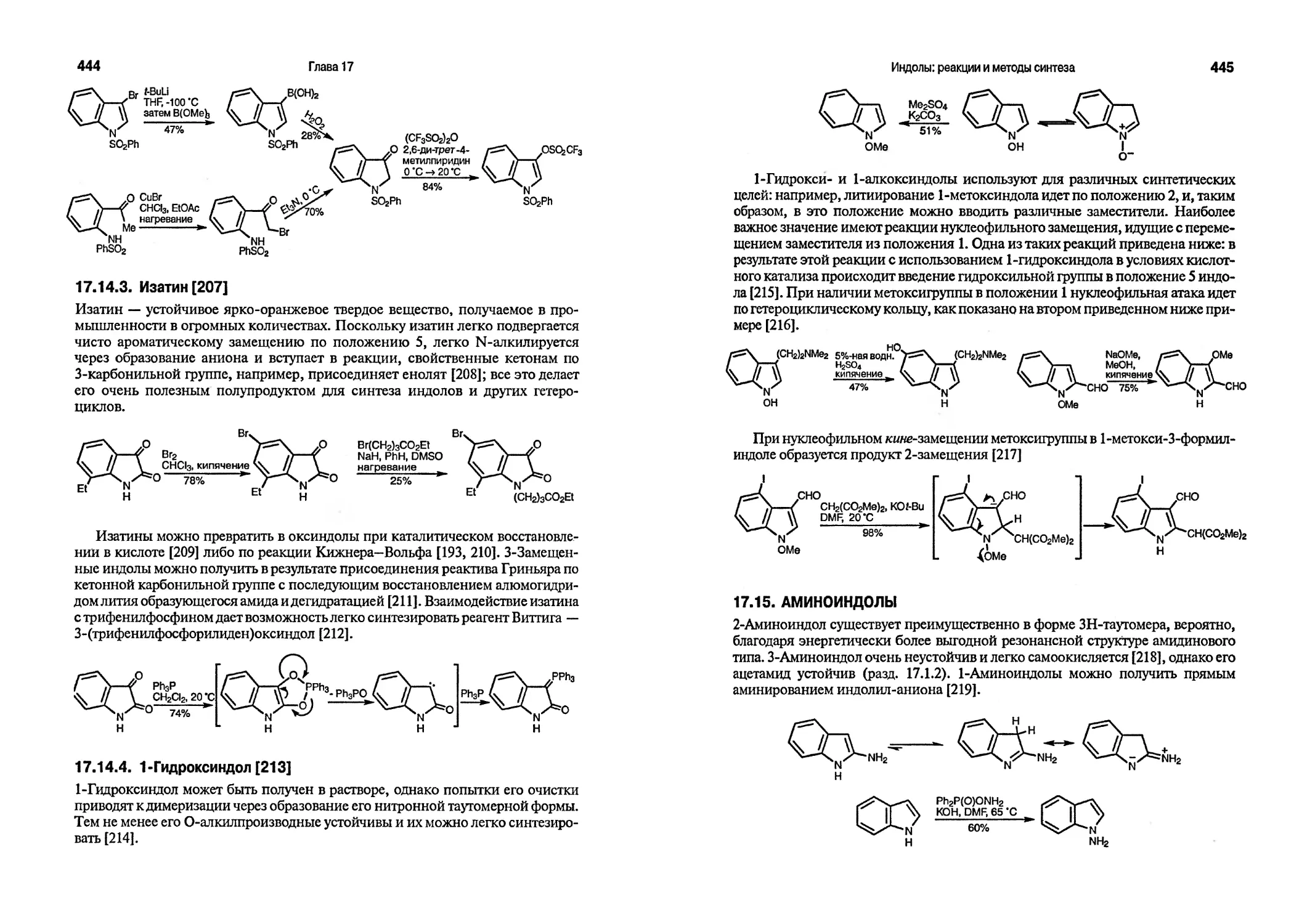
орто/пара-ориентант
Заместители, понижающие основность пиридинового атома азота, таюке оказывают влияние на склонность производных пиридина к реакциям электрофильного замещения, что связано в этом случае с увеличением концентрации нейтральных (более реакционноспособных) молекул в равновесной смеси. Так, 2,6-дихлорпиридин нитруется в положении 3 в виде свободного основания лишь в 103 раз медленнее, чем 1,3-дихлорбензол. Эмпирически установленное правило таково: (а) производные пиридина со значением рК >1 нитруются в виде соответствующих катионов, причем медленно, и если отсутствуют сильные активирующие группы, реакции проходят по а- или 0-положениям в зависимости от природы заместителя; (б) производные пиридина, проявляющие свойства слабых оснований (рД<2.5), нитруются в виде свободных оснований по а- или 0-положениям в зависимости от природы заместителя [11].
Производные пиридина, содержащие сильные электроноакцепторные группы, или гетероциклические соединения с дополнительным гетероатомом, например диазины, настолько дезактивированы, что вовсе не вступают в реакции электрофильного замещения.
2.2.3. Пятичленные гетероциклические соединения
Реакции электрофильного ароматического замещения гораздо чаще использую-ся в случае пятичленных электроноизбыточных ароматических соединений [ 12]. Такие соединения, как пиррол, тиофен и фуран, с чрезвычайной легкостью вступают в реакции электрофильного замещения, причем замещение проходит по любому положению цикла, однако предпочтительнее по положению, ближайшему к гетероатому, т. е. по a-положениям. Такие реакции облегчаются электронодонорными свойствами гетероатома, поэтому пиррол более реакционноспособен, чем фуран, который в свою очередь более реакционноспособен, чем тиофен. Количественное сравнение [13] реакционной способности этих гетероциклических соединений зависит от электрофильного реагента: например, соотношение скоростей трифторацетилирования пиррола, тиофена и фурана равно, 5* 107 :1,5* 102:1 [14], формилирование фурана проходит в 12 раз быстрее, чем тиофена [15], а ацилирование — в 9,3 раза [16]. Парциальные факторы скоростей протонного обмена по положениям а и 0 1-метилпиррола [17] равны соответственно 3,9* 1010 и 2,0 • 1010, в случае фурана — 1,6* 108 и 3,2* 104, в случае тиофена — 3,9-108 и 1,0*105 [18]. Соотношение скорости замещения по а- и 0-положениям тиофена существенно различаются (от 100:1 до 1000:1) в зависимости от электрофильного агента [19]. Относительная реакционная спо
собность пятичленных гетероциклических соединений изменяется параллельно региоселективности а : 0 замещения в следующем порядке: фуран > тиофен > пиррол [20]. Прекрасной иллюстрацией такого соотношения могут служить реакции ацилирования субстратов, содержащих два связанных гетероциклических фрагмента [21].
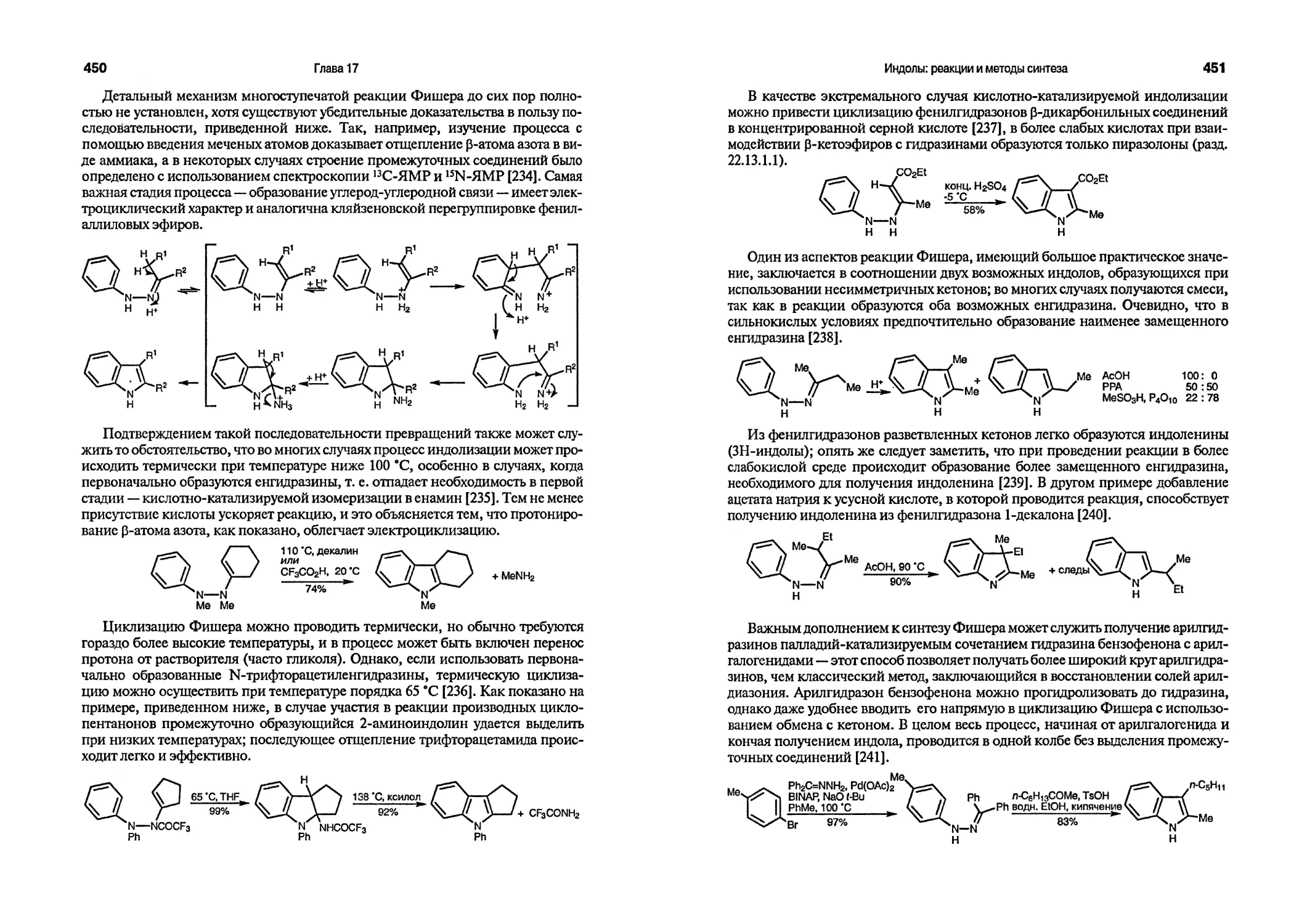
sO-O^sO-O
H H
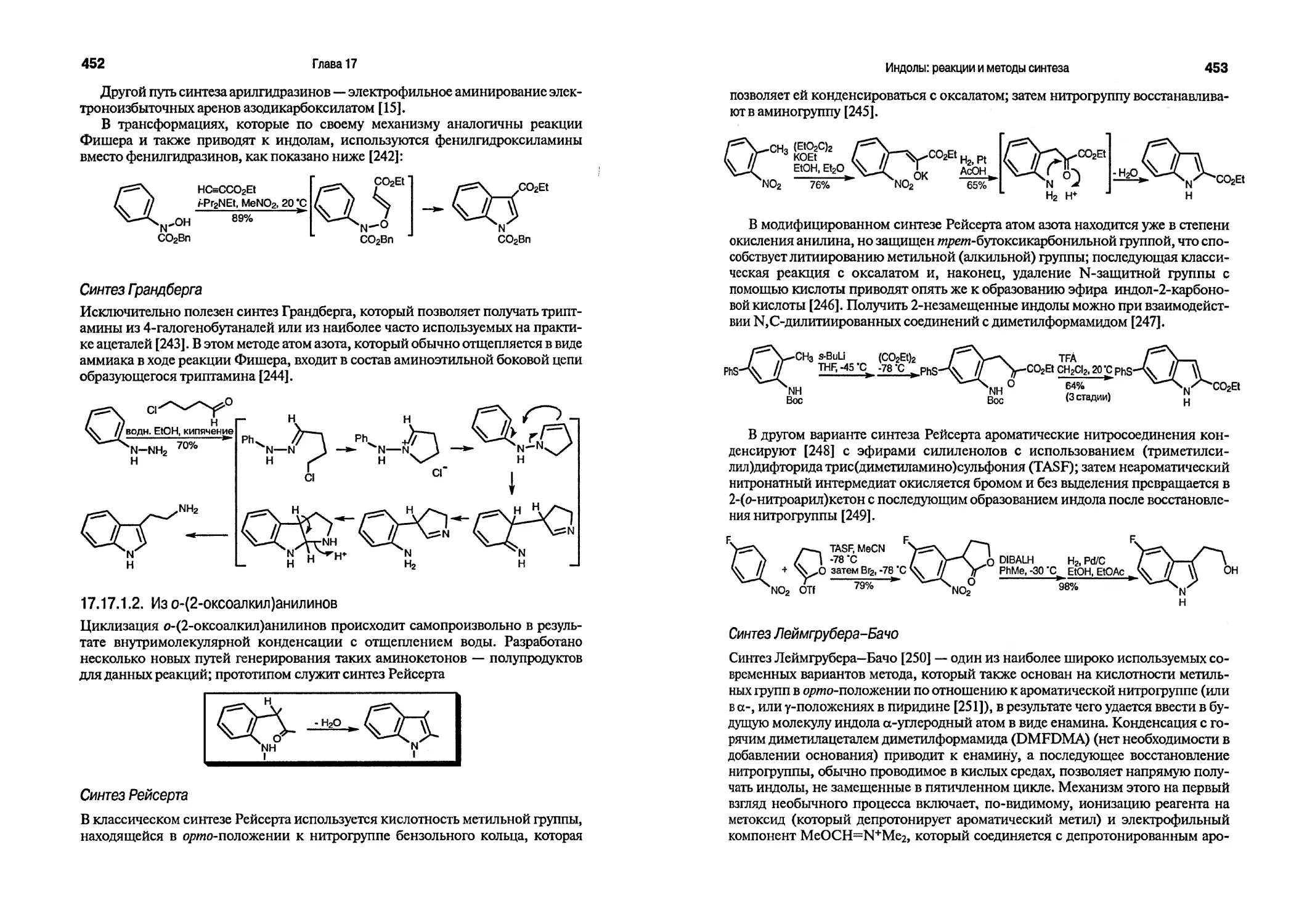
Региоселективность электрофильной атаки пиррольного цикла может быть изменена введением в положение 1 объемного заместителя, например 1-(трет-бутилдиметилилсилил)пиррол и 1-(три-«зо-пропилсилил)пиррол атакуются электрофильными реагентами исключительно по 0-положению [22]. Сильные электрофильные реагенты, такие, как триметилсилилтрифлат, также атакуют пиррол исключительно по 0-положению [23].
Индолы лишь немногим менее активны в реакциях электрофильного замещения по сравнению с пирролами, и такие реакции проходят по 0-положению гетероциклического фрагмента. Скорости ацетилирования в условиях реакции Вильсмейера (Р4,М-диметилацетамид — фосген) индола и пиррола соотносятся как 1:3 [24]. В противоположность пирролу, для индола наблюдается очень высокая региоселективность при реакциях электрофильного замещения; так, при ацетилировании в условиях реакции Вильсмейера соотношение скоростей атаки по 0- и a-положениям равно 2600:1. Индол вступает в реакции с электрофилами по 0-положению в 5*1013 раз быстрее, чем бензол [25]. Иллюстрацией различия в реакционной способности индола и фурана может служить приведенная ниже [26] реакция формилирования.
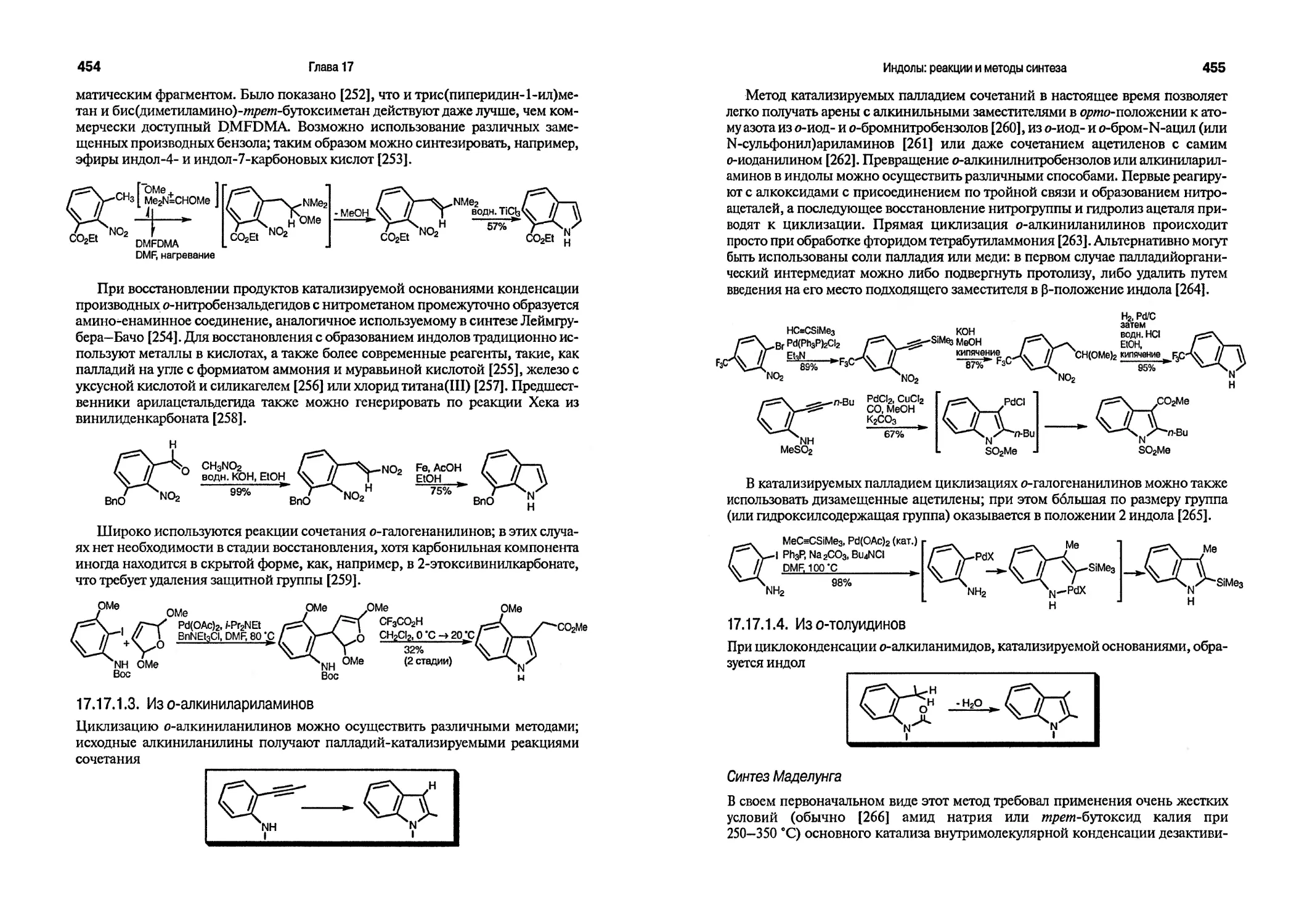
Реакционная способность индола аналогична реакционной способности фенола: как и фенол, индол (и пиррол) вступает в реакции со слабыми электрофилами типа катиона фенилдиазония. В зависимости от pH среды индол способен вступать в такие реакции в виде соответствующего аниона, образующегося в результате N-депротонирования (разд. 2.5) и присутствующего в небольшой равновесной концентрации. Очевидно, что реакция индолил-аниона с катионом фенилдиазония — еще более быстрый процесс, который проходит в 108 раз быстрее, чем с нейтральной молекулой [27]. Реакция Манниха (электрофил СН2=Ы+Мег) 5- и 6-гидроксииндолов идет по положению, соседнему с гидроксильной группой, а не по 0-положению индола [28]. Сравнение реакционной способности фурана и бензо[6]фурана, с одной стороны, и тиофена и бензо[6]тио-фена, с другой, в реакциях электрофильного замещения показывает, что бициклические системы менее активны в таких превращениях, чем моноциклические, хотя степень различия существенно зависит от природы электрофила [29].
Для 1,2- и 1,3-азолов характерны свойства как пятичленных электроноизбыточных гетероциклических соединений, так и гетероциклических соединений, содержащих иминный атом азота. Присутствие иминного фрагмента в азолах понижает их активность в реакциях электрофильного замещения по атому углерода как в результате индуктивного, так и мезомерного влияния. Кроме того, присутствие основного атома азота способствует образованию солей азолов в кислых средах. Например, в зависимости от кислотности среды нитрование пиразола может проходить либо через предварительное образование пиразолиевого катиона [30], либо с участием свободного основания [31]. Изучение протонного обмена, катализируемого кислотой, обнаружило следующий порядок реакционной способности: пиразол > изоксазол > изотиазол. Среди пятичленных гетероциклических соединений с одним гетероатомом порядок активности в реакциях протонного обмена следующий: пиррол > фуран > тиофен, причем каждое из этих соединений более активно в таких превращениях, чем гетероциклические соединения, содержащие иминный атом азота. При этом азолы более активны в реакциях протонного обмена, чем бензол, парциальные факторы скоростей для реакций по положению 4 пиразола, изоксазола и изотиазола равны 6,3 • 109, 2,0 • 104 и 4,0 • 103 соответственно. Нитрование тиофена проходит в 3 • 105 раз быстрее, чем нитрование 4-метилтиазола [32]. Относительная активность тиофенового и тиазольного циклов в реакциях нитрования иллюстрируется приведенной ниже реакцией [33]:
2.3. РЕАКЦИИ НУКЛЕОФИЛЬНОГО ЗАМЕЩЕНИЯ
ПРИ АТОМЕ УГЛЕРОДА [34]
2.3.1. Механизм реакции ароматического нуклеофильного замещения
Нуклеофильное замещение в ароматических соединениях проходит в два этапа, через присоединение нуклеофильной частицы (Y~) и элиминирование отрицательно заряженной частицы (чаще всего На1~), причем скорость всего процесса определяет первая стадия. В качестве интермедиата такого процесса выступают отрицательно заряженные аддукты (комплексы Мейзенгейме-ра), которые стабилизированы в результате делокализации отрицательного заряда. Например, при нуклеофильном замещении в орто- и ядрд-хлорнит-робензолах нитрогруппа участвует в делокализации отрицательно заряда в интермедиате.
комплекс \
Мейзенгеймера вр3-гибридный
2.3.2. Шестичленные гетероциклические соединения
Нуклеофильное замещение хорошо уходящей группы, обычно атома галогена, имеет очень важное значение в химии гетероциклических соединений, особенно для получения различных производных шестичленных электронодефицитных гетероциклических соединений. Для производных пятичленных гетероциклических соединений процессы нуклеофильного замещения возможны только в некоторых особых случаях, аналогичных тем, при которых такие реакции возможны для производных бензола, т. е. когда уходящая группа активирована нитрогруппой, расположенной в орто- и иара-положениях. Реакции нуклеофильного замещения возможны также в азолах в том случае, если уходящая группа присоединена к иминному фрагменту.
а- и р-Положения шестичленных гетероциклических соединений относительно иминного атома азота, содержащие уходящие группы, активированы к атаке нуклеофильными частицами вследствие двух причин: во-первых, атом азота оказывает индуктивное и мезомерное электроноакцепторное влияние на эти положения, и, во-вторых, атом галогена оказывает индуктивное электроноакцепторное влияние. а-Дпдукты, образующиеся в результате присоединения по а- и p-положениям относительно иминного атома азота, наиболее стабилизированы электроноакцепторным влиянием атома азота. Таким образом, уходящие группы, расположенные в а- и у-положениях, в большей степени подвержены нуклеофильному замещению, чем группы в p-положении. Количественное изучение скорости реакции нуклеофильного замещения атома хлора на метоксигруппу при реакции 2- и 4-хлорпиридинов с метилат-ионом в метаноле показало, что оба хлорпроизводных пиридина реагируют приблизительно с той же скоростью, что и 4-хлорнитробензол, хотя а-изомер в некоторой степени более активен, чем а-изомер [35]. Следует отметить, что даже 3-хлорпиридин, в котором атом хлора активирован лишь индуктивным влиянием атома азота, вступает в реакции нуклеофильного замещения и более активен, чем хлорбензол.
Скорости реакций нуклеофильного замещения атома хлора МеО-группой при 50 °C (относительно хлорбензола)
Присутствие формального положительного заряда на атоме азота, как в случае N-оксидов или четвертичных солей пиридина, в значительной степени увеличивает скорость нуклеофильного замещения. Введение N-оксидной группы в меньшей степени увеличивает скорость нуклеофильного замещения, чем превращение в четвертичные соли, поскольку в последнем случае в молекуле возникает полный формальный положительный заряд, а молекулы N-оксидов пиридина нейтральные. Нуклеофильное замещение атома хлора метилат-ионом в
N-оксидах 2-, 3- и 4-хлорпиридинов проходит соответственно в 1,9 *104, 1,1 • 105 и 1,1 • 103 раз быстрее, чем в соответствующих хлорпиридинах. При переходе к соответствующим 1-метилпиридиниевым солям скорости замещения увеличиваются в 4,6 • 1012, 2,9 • 108 и 5,7 • 109 раз соответственно. Другой важный вывод, который был сделан в результате количественного изучения скоростей реакций нуклеофильного замещения в различных производных пиридина, связан с влиянием положительного заряда на атоме азота на скорость замещения в различных положениях цикла. Так, порядок активности в реакциях нуклеофильного замещения в пиридиниевых солях (2>4>3)не совпадаете порядком активности нейтральных пиридинов (4 > 2 > 3). Для N-оксидов пиридина скорость замещения в a-положении приблизительно такая же, как и скорость замещения в у-положении [36]. Применение в качестве уходящей группы нитрит-аниона существенно облегчает процесс нуклеофильного замещения в гетероциклических соединениях: так, 4-нитропиридин в 1100 раз более активен в таких реакциях, чем 4-бромпиридин. Скорость нуклеофильного замещения в К-метил-4-метилсульфонилпиридине в 7 • 108 раз выше, чем в соответствующем нейтральном пиридине [37]. Хотя метокситруппа обычно не относится к легко уходящим группам, реакции нуклеофильного замещения метокситруппы в метоксипиридиниевых солях проходит лишь в 4 раза медленее, чем замещение атомов иода, брома или хлора в таких же ситуациях. Замещение атома фтора происходит в 250 раз быстрее, чем атомов других галогенов [38].
Изучение реакции нуклеофильного замещения этоксид-ионом показало некоторое увеличение скорости при переходе от хлорпиридинов к хлорхиноли-нам, содержащим атомы хлора в сравнимых положениях [39]. Нуклеофильное замещение в четвертичных солях бициклических систем, так же как и в случае пиридина, протекает быстро, причем эффект проявляется в большей степени в положении С(2) (~107), чем в положении С(4) (~105) [40].
Относительные скорости нуклеофильного замещения этоксид-ионом при 20 °C
Cl CI
1,7-10? 5,3-10* 7,3-10? 5,4-10* 5,8-10* 1 1,3-10?
Диазины, содержащие атомы галогена в а- и у-положениях относительно атома азота, гораздо более активны в реакциях нуклеофильного замещения, чем аналогичные пиридины: например, реакции 2-хлорпиримидина проходят в ~106 раз быстрее, чем реакции 2-хлорпиридина.
2.3.3. Викариозное нуклеофильное замещение [41]
Процессы, известные как реакции «викариозного нуклеофильного замещения» атома водорода (в англоязычной литературе принято обозначение VNS — Vicarious Nucleophilic Substitution), широко применимы как к карбоциклическим, так и гетероциклическим ароматическим соединениям. Обычно для реализации
такого нуклеофильного замещения необходимо присутствие нитрогруппы в молекуле субстрата, что обеспечивает возможность присоединения углеродного нуклеофила, образующегося из C(X)(Y)(R), где X — потенциально уходящая группа, a Y — группа, стабилизирующая анион. Присутствие электроноакцепторной группы Y позволяет также получить в результате депротонирования соответствующий анион на первой стадии процесса. Наиболее часто X представляет собой атом галогена, a Y— арилсульфонильную группу. Типичная последовательность превращений при викариозном нуклеофильном замещении приведена ниже. Первоначально происходит присоединение углеродного нуклеофила по орто- или шра-положению относительно нитрогруппы, затем элиминирование молекулы НХ из образующегося в результате присоединения сопряженного неароматического нитроната, а затем последующее протонирование приводит к образованию ароматической молекулы продукта замещения. Обычно в таких процессах используется избыток основания, который генерирует карбанион и направляет процесс дальше за счет отщепления и необратимого связывания молекулы НХ.
Примеры реакций викариозного нуклеофильного замещения даны в некоторых последующих главах книги. Ниже приведены три типичных примера таких превращений. Первый пример связан с реакцией викариозного нуклеофильного замещения в пятичленных гетероциклических соединениях [42]. Во втором примере стабилизирующая анион трифторметансульфонильная группа (Y) одновременно служит и уходящей группой (X) [43]. Третий пример в некоторой степени необычен, поскольку нуклеофил присоединяется не по орто- или пара-положению относительно нитрогруппы. Присоединение карбаниона проходит по положению С{2> 6-нитрохиноксалина; образующийся в результате такого присоединения анион стабилизирован делокализацией отрицательного заряда одновременно с участием атома азота Ng) и нитрогруппы [44].
CICH2SO2p-Tol, КОН, DMSO, rt 73% **
n-BuSO2CF3
NaH, DMF, 2(ГС || I
47% MeO'^N^vi-Bu
2.4. РЕАКЦИИ РАДИКАЛЬНОГО ЗАМЕЩЕНИЯ
ПРИ АТОМЕ УГЛЕРОДА [45]
Как для элекгроноизбыточных, так и для электронодефицитных гетероциклических соединений известны реакции замещения атома водорода свободными радикалами. Свободные радикалы, хотя и электрически нейтральны, могут про
являть в различной степени нуклеофильный и электрофильный характер, что существенно отражается на их реакционной способности по отношению к различным типам гетероциклических соединений. Электронные свойства радикалов проявляются во взаимодействии между молекулярной орбиталью радикала либо с ВЗМО, либо с НСМО субстрата в зависимости от их относительной энергии. Такие взаимодействия полезно сравнивать со взаимодействиями, связанными с переносом заряда.
Нуклеофильные радикалы содержат группу, стабилизирующую катион при углеродном радикальном центре, что способствует переносу электронной плотности от радикала к электронодефицитному гетероциклу. Такие радикалы взаимодействуют только с электронодефицитными гетероциклическими соединениями и не взаимодействуют с электроноизбыточными. К нуклеофильным радикалам относятся - СНгОН, алкил- и ацил-радикалы. Замещение с участием таких радикалов может быть представлено следующей схемой:
н-f-Het) + R' -<-> [н-f-Het) R+]—] •—^(Hetf-R электроно- нуклео-дефицитный фильный гетероцикл радикал
Электрофильные радикалы содержат группу, стабилизирующую анион при радикальном центре, и, следовательно, взаимодействуют с электроноизбыточными системами. К таким радикалам относятся *СР3 и ‘СЩССНЕОг. Замещение с участием таких радикалов представленно приведенной ниже схемой:
H-f-Het) + R* •*—► электроно- электро-избыточный фильный гетероцикл радикал
[ H-f- Het) R ]—[ н-f- Н<й-)-н] -j5f*(Het -)-R
Арильные радикалы способны проявлять свойства как электрофильных, так и нуклеофильных радикалов. Большое число работ (особенно ранних) связано с изучением реакций именно арил-радикалов. Такие радикалы способны реагировать и с электроноизбыточными и с электронодефицитными соединениями приблизительно с одинаковой скоростью, хотя процессы с участием арил-радикалов обычно характеризуются низкой региоселективностью [46].
2.4.1. Реакции гетероциклических соединений
с нуклеофильными радикалами. Реакция Минисци [47]
Реакции нуклеофильных радикалов с гетероциклическими соединениями, содержащими иминный фрагмент, в присутствии кислот представляют собой наиболее важные и синтетически полезные процессы с участием гетероциклических соединений. Пиридины, хинолины, диазины, имидазолы, бензотиазолы и пурины способны вступать в реакции со многими нуклеофильными радикалами с замещением атома водорода в а- и у-положениях относительно атома азота. Присутствие кислоты в таких реакциях весьма существенно, поскольку протонирование сильно увеличивает реакционную способность субстратов по отношению к нуклеофильным радикалам и региоселективность такого взаимо
действия. С нейтральными основаниями реакции идут очень трудно. Практическая значимость таких процессов связана с возможность прямого введения ацильных групп в гетероцикл, чем достигается эффект реакции Фриделя-Крафтса, обычно невозможной для таких субстратов (разд. 2.2.2). Третичные радикалы более стабильны и более нуклеофильны и, следовательно, более активны в реакции Минисци, чем метил-радикалы. Большинство примеров реакции Минисци было проведено в водных средах или, по крайней мере, в средах с высоким содержанием воды, что облегчает выделение органических продуктов реакции.
Для генерирования необходимых радикалов было применено несколько методов, многие из них связаны с первоначальным образованием гидрокси- или метил-радикалов, которые затем отщепляют атом водорода или иода от подходящих субстратов. Ниже приведены оба примера генерирования радикалов [48]. Ароматизация промежуточно образующихся радикал-катионов обычно происходит при их взаимодействии с избытком окислителя, используемого для генерирования изначального радикала.
HCONH2, водн, H2SO4, t-BuO2H, FeSO4, О ‘С 71%
[l-BuOOH (.Buo-------^>0 * Me- о=< ]
[ Mez NH2]
МеСН=О, водн. H2SO4, t-BuO2H, FeSO4,20 ’С 53%
MeCH=O -------► О=\ 1
Me
FPrl, DMSO, H2O2, 50 'С 88%
[Me2S=O t H2O2----- MeSO2H + Me
Кроме окислительных методов генерирования радикалов, приведенных выше, также возможно образование алкил-радикалов при восстановлении алкил-иодидов трис(триметилсилил)силаном в условиях, подходящих для проведения реакции Минисци [49]. Карбоновые кислоты (а-кетокислоты) могут служить источниками алкил-радикалов [50] (ацил-радикалов [51]) при их окислении пероксидами, катализируемом солями серебра. Радикалы могут быть также генерированы и в неводной среде из производных карбоновых кислот и 1-гид-роксипиридин-2-тиона (метод Бартона) [52].
RCO2HAgNO3(KaT-MN^S2°^[R-]+CO2 RCOCO2H (^)^)2S2O^[r6qj
/ 7rco2h
Ag+ + S2O82’ ---► Ag2+
CO2Me
ftv, камфорсульфоновая кислота CHgCia,
81%
CO2Me
1-Ad = 1-адамантил
NjN-Диалкилформамиды можно превратить либо в алкил-, либо в ацил-ра-дикалы в зависимости от условий [53]
Me Me Ме
Интересный и полезный в синтетическом плане процесс связан с первоначальным взаимодействием электрофильного радикала с алкеном: сам электрофильный радикал не взаимодействует с протонированным гетероциклическим соединением, однако после присоединения такого радикала к алкену образуется нуклеофильный радикал, который и присоединяеся к гетероциклу [54].
(электрофильный радикал) (нуклеофильный радикал)
В том случае, когда в субстрате имеется более чем одно положение, способное участвовать в реакции с радикалом, как, например, в случае пиридина, возникает проблема региоселективности замещения и возможности образования
продуктов полизамещения, поскольку соединение, образующееся в результате первой реакции замещения, обычно более активно в таких реакциях, чем исходное соединение. Региоселективность процесса радикального замещения в значительной степени зависит от характера радикала и от природы используемого для проведения реакции растворителя, однако иногда контроль региоселекгив-ности таких процессов трудно осуществить [55].
a Y a Y
23 77 [f-Bu*] (| [л-Bu*] ------► 56 44
71 29 -------74 26
н
Следует отметить, что радикальное замещение часто не сопровождается полной конверсией субстрата, но, поскольку продукт реакции замещения обычно легко отделить от исходного, сложностей с выделением целевого соединения обычно не возникает. Для того чтобы избежать вторичного замещения, обычно либо контролируют кислотность среды (в том случае, если продукт реакции — основание меньшей силы, чем исходное соединение), либо проводят реакцию в двухфазной системе, тогда более липофильный продукт реакции замещения переходит в органический слой и, тем самым, удается избежать повторного замещения.
Селективное монозамещение может быть осуществлено при использовании Ы+-метоксипроизводных гетероциклических соединений вместо проведения реакций в присутствии кислот. В этом случае ароматизация первоначально образующегося аддукта связана с потерей молекулы метанола, а образующийся при этом нейтральный пиридин гораздо менее склонен к радикальному замещению [56].
В некотрых случаях с нормальным процессом радикального замещения атома водорода может конкурировать млсо-замещение нитро-, сульфонильной и ацильной групп [57].
2.4.2. Реакции с электрофильными радикалами
Хотя реакции с участием электрофильных радикалов изучены гораздо в меньшей степени, чем реакция Минисци, в некоторых случаях такие процессы можно успешно использовать для селективных превращений электроноизбыточных гетероциклических соединений [58].
0CF3I, Zn, №2S2O5 л-л /7~7\ HC(CO2Et)3, Мп(ОАс)з /г-л
DMF, 2-пиколин^ И \\ П и АсОН, 65 'С______ // \\
N 62% й% * \/^С(СОгЕ0з
Me Me
2.5. ДЕПРОТОНИРОВАНИЕ АТОМА АЗОТА [59]
Пирролы, имидазолы, пиразолы и бензоконденсированные аналоги, обладающие NH-группой, способны депротонироваться (значение $Кй лежит в интервале 14—18). Следовательно, эти соединения могут быть полностью превращены в соответствующие анионы при действии сильных оснований, таких, как гидрид натрия или и-бутиллитий. Незамещенный пиррол (рА^ 17,5) проявляет кислотные свойства в гораздо большей степени, чем соответствующий насыщенный аналог пирролидин (рА^ ~ 44). Кислотность индола (рА^ 16,2) значительно выше, чем кислотность анилина (рА^ 30,7). Такое различие в кислотности можно объяснить возможностью делокализации отрицательного заряда в анионе ароматического гетероцикла. Введение электроноакцепторных заместителей или дополнительного гетероатома, особенно иминного атома азота, существенно повышает кислотные свойства гетероциклических соединений. Прекрасный иллюстрацией такого влияния может служить тетразол, рА^ которого (4,8) имеет тот же порядок, что и рКа карбоновых кислот
пиррил-анион 17,5
N—N N—N N—N
// \\ // \ / \
N. _ ** *" N /)ит.Д.
N N N
тетразолил-анион 4,8
2.6. МЕТАЛЛООРГАНИЧЕСКИЕ ПРОИЗВОДНЫЕ
Наиболее существенные достижения в химии гетероциклических соединений за последние приблизительно двадцать лет связаны с использованием металлоорганических производных и, особенно, с реакциями, катализируемыми переходными металлами и литийорганическими производными, что отражает достижения органической химии в целом в этих областях. Даже со времени выхода в свет третьего издания этой книги значительные успехи были достигнуты в получении бор-, магний- и цинкорганических произвольных гетероциклических соединений и были разработаны новые лиганды для палладиевых катализаторов, что позволило существенно расширить возможности реакций сочетания, катализируемых палладием.
2.6.1. Литийорганические производные [60]
Литийорганические производные гетероциклических соединений весьма полезны в синтетическом плане, поскольку вступают в реакции с широким кругом электрофильных реагентов, аналогично ариллитиевым соединениям. Литийорганические производные гетероциклических соединений могут быть получены как в результате прямого литиирования (депротонирования атома углерода), так и в результате реакции обмена между галогенопроизвсдными гетероциклических соединений и алкиллитиевыми соединениями. Литийорганические сое-
динения служат удобными предшественниками металлоорганических производных менее электроположительных металлов, таких, как цинк, бор, кремний и олово (разд. 2.6.2 и 2.6.3), которые используются в широко распространенных в настоящее время реакциях сочетания (разд. 2.7.2.2).
n-BuLi
Et2O, О ’С
Br n-BuLi Et2O, -78 *С
2.6.1.1. Прямое литиирование (депротонирование при атоме углерода)
Большинство гетероциклических соединений при взаимодействии с алкиллитиевыми соединениями или амидами лития превращается в результате отщепления протона в соответствующие литиевые производные. Хотя и «свободные» анионы никогда при этом не образуются, легкость литиирования связана с кислотностью атома водорода при атоме углерода и, соответственно, со стабильностью сопряженного основания (карбаниона) [61]. Прямое литиирование в результате депротонирования напрямую связано с катализируемым основанием протонным обменом [62] при использовании таких реагентов, как метилат натрия. Именно такие процессы, проводимые при температурах, значительно более высоких, чем требуется для прямого литиирования, впервые продемонстрировали возможность селективного проведения процессов депротонирования и их использования в синтетических целях. Следует помнить, что кинетические факторы и положение кислотного равновесия не всегда способствуют одному и тому же направлению процесса: термодинамически более стабильные продукты депротонирования обычно образуются при повышенной температуре и при проведении реакции в более полярных растворителях.
Детали механизма прямого металлирования все еще остается предметом дискуссий/возможно процесс включает четырехцентровое переходное состояние
Прямое
депротонирование
nr2
/|1
< + R2NH
Основной фактор, приводящий к увеличению кислотности атома водорода, связанного с атомом углерода гетероцикла — индуктивный эффект гетероатома или гетероатомов. Вследствие этого прямое литиирование проходит по а-поло-жению относительно гетероатома, поскольку в этом положении индуктивный эффект проявляется наиболее сильно. Однако такое направление процесса прямого литиирования может быть изменено под влиянием других факторов, которые обсуждаются ниже.
Мезомерия
«Анионная» орбиталь во всех случаях, за исключением тех, в которых анионный центр расположен в боковой цепи гетероциклического соединения, ортогональна л-системе и по этой причине не взаимодействует с ней мезомерно. Тем не ме
нее, на электронную плотность и, следовательно, на кислотность атомов водорода, связанных с атомами углерода гетероцикла, оказывает влияние резонансный эффект.
Координация металла с гетероатомом
Сильная координация между металлом основания и гетероатомом приводит к увеличению СН-кислотности вследствие индуктивного оттягивания электронной плотности, которое проявляется в большей степени в случае кислорода, чем в случае серы.
Взаимодествия неподеленной пары электронов
Взаимное отталкивание между «анионной» орбиталью и неподеленной парой электронов гетероатома оказывет дестабилизирующее влияние на анион. Этот эффект особенно проявляется в производных пиридина и диазинов [63].
Поляризуемость гетероатома
Гетероатомы, способные к поляризации, такие, как сера, способствуют эффективному «рассеиванию» отрицательного заряда.
Эффекты заместителя
Процессы направленного металлирования имеют очень важное значение в химии гетероциклических соединений. Металлирование в орюо-положение относительно ориентирующей группы может быть обусловлено либо индуктивным эффектом (такие группы, как Cl, F), либо эффектом хелатирования (СН2ОН -* CHiOLi), либо совокупностью обоих эффектов. Причем в некоторых случаях эффекты направляющих групп могут изменять «обычную» региоселективность при металлировании гетероциклических соединений. В том случае, когда проявление такого эффекта возможно, он оказывает наиболее сильное влияние на региоселективность процесса металлирования.
Литиирующие агенты
Обычно прямое литиировании проводят с использованием алкиллитиевых соединений или амидов лития. Наиболее широко используется и-бутиллитий, однако в том случае, когда необходимо использовать более эффективный лити-ирующий агент, применяют етиор-бутиллитий, а иногда и /лре/и-бутиллитий. Ранее широкое применение находил фениллитий; в последнее время этот реагент практически не используется, однако в тех случаях, когда необходим менее активный и более селективный литиирующий агент, фениллитий может оказаться весьма полезным [65]. Наиболее сильный металлирующий агент получают из смеси я-бутиллития и wpew-бутилата калия; при использовании этого металлирующего агента получаются калиевые производные гетероциклических соединений.
Среди амидов лития наиболее часто используемый литиирующий агент — диизопропиламид лития (LDA). 2,2,6,6-Тетраметилпиперидит лития (LiTMP) — более основный и менее нуклеофильный агент — нашел широкое применение при литиировании диазинов. Алкиллитиевые соединение — основания более сильные, чем амиды лития, хотя обычно литиирование с использованием алкил» литиевых реагентов проходит медленно. Металлирование амидами лития обратимо и, следовательно, эффективное превращение гетероциклических субстратов возможно в том случае, если их кислотность (рД >4) выше, чем кислотность соответствующих амидов
Растворители
Обычно для проведения таких реакций используют эфирные растворители — диэтиловый эфир и тетрагидрофуран. Более сильные координирующие свойства, присущие тетрагидрофурану, повышают активность литиирующих агентов, так как увеличивают степень их диссоциации. Смесь эфира, ТГФ и пентана используется для проведения реакций при очень низких температурах (—100 ’С, чистый ТГФ замерзает при этих температурах). Для увеличения активности литиирующих агентов в реакционную смесь в некоторых случаях добавляют лиганды, способные к сильной координации по катиону металла, такие, как КННК-тетраметилэтилендиамин (TMEDA) или гексаметилтриамид фосфорной кислоты (канцероген). Несмотря на то, что применение таких добавок в ряде случаев несомненно приводит к успешному металлированию, эффективность TMEDA служит предметом обсуждений [66].
2.6.1.2. Обмен атома галогена
Бром- и иодпроизводные гетероциклических соединений легко реагируют с алкиллитиевыми соединениями даже при температуре —100 °C с образованием соответствующих литиевых производных. В тех случаях, когда возможно протекание процесса в нескольких направлениях, реализуется тот, который приводит к образованию наиболее стабильного аниона, точно так же, как и в случае прямого металлирования. Обмен атома фтора неизвестен, а атом хлора способен участвовать в таких процессах, хотя вследствие его малой активности примеры таких превращений немногочисленны.
(Het-)—Вг + RU --------► (Het-)—-Li + RBr
Механизм процесса обмена может включать образование четырехчленного переходного состояния или стадию переноса электрона, однако и прямая нуклеофильная атака, по крайней мере, в случае иодидов, как было показано для иодбензола [67], не может быть исключена
четырехчленное переходное состояние
атака на атом галогена
+ RI
Реагенты, используемые для металлирования в результате обмена
Обычно используемый реагент — я-бутиллитий, образующийся в результате обмена и-бутилбромид, — не препятствует последующим превращениям. В тех случаях, когда присутствие алкилбромида нежелательно, используют двойной избыток /и^е/и-бутиллития; при этом первоначально образующийся mpem-бу-тилбромид при взаимодействии со вторым эквивалентом литийорганического соединения превращается в изобутилен.
(Het-)“Br+2r-BuLi—►(Hetи [+ f-BuBr f-BuH + Ме2С=СН2 + UBr]
Следует иметь в виду, что амиды лития способны выступать в роли оснований и применяются только для прямого литиирования, в то время как алкиллитиевые соединения могут быть использованы и как основания в процессах прямого литиирования, и как реагенты для литиирования в результате реакции обмена. При низких температурах алкиллитиевые реагенты предпочтительно вступают в реакции обмена, а не депротонирования. Ниже приведены примеры двух процессов с участием З-иод-1-фенил сульфонилиндола [68]:
2.6.1.3. Литиирование пятичленных гетероциклических соединений
а-атом водорода
П , более подвижен,
V)__чем р-атом
^^индуктивный эффект
X = NR,S или О
Индуктивное влияние гетероатома, оттягивающего электронную плотность, проявляется в большей степени в a-положении, что позволяет проводить прямое а-литиирование практически всех пятичленных гетероциклических соединений. Относительная кислотность а-Н-атомов некоторых различных гетероциклических соединений приведена ниже.
Равновесные значения рКа* для некотрых пятичленных гетероциклических соединений при депротонировании в ТГФ [69]
* Измеряемые значения рЛ, варьируются в зависимости от природы растворителя.
Несмотря на низкую электроотрицательность атома серы и соответсвенно более слабый индуктивный эффект, проявляемый этим гетероатомом, тиофены способны металлироватся с той же легкостью, что и фураны. Связано это с большей поляризуемостью атома серы, что способствует большему распределению отрицательного заряда в анионе [70], хотя участие d-орбитали в стабилизации анионного центра не очень существенно. Направление литиирования 2-(2-фу-рил)тиофена зависит от условий [71] проведения процесса: в неполярных растворителях литиирование преимущественно идет по фурановому циклу, поскольку литий сильно координирован по атому кислорода, что приводит к увеличению индуктивного эффекта этого гетероатома
Использование более сильного основания может приводить к образованию диметаллопроизводных [72]
n-BuLi, KO-f-Bu
Влияние направляющих групп может нарушать свойственную пятичленным гетероциклическим соединениям ос-сслекгивность литиирования, как это показано в приведенном ниже примере для тиофена, однако использование диизопропилами-да лития позволяет осуществить процесс литиирования «обычным» образом [73]
LDA
ТГФ, -78 *С
n-BuLi
ТГФ, -78 'С
Литиирование пиррола осложняется в присутствии более подвижного атома водорода, связанного с атомом азота; так, 1-метилпиррол литиируется по положению С(2), хотя и в более жестких условиях, чем фуран [74]. Введение удаляемой защитной группы в положение 1 пиррола позволяет получать а-литиевые производные. Для этих целей может быть использовано wpe/я-бутилоксикарбо-нильная группа, преимущество которой связано не только с легкой удаляемо-стью в результате гидролиза, но и с ее электроноакцепторными свойствами, повышающими кислотность а-Н-атома. Кроме того, mpew-бутилоксикарбо-нильная группа способствует литиированию за счет хелатирования [75].
СО2ЬВи
Литиирование бензо[ЭДтиофенов, бензо[6]фуранов и индолов, содержащих защитную группу в положении 1, идет по a-положению относительно гетероатома [76]. Литиирование в другие положения гетероциклической системы воз-
можно в результате реакций обмена, однако при повышенных температурах такие литиевые производные склонны изомеризоваться в 2-литийпроизводные [68].
Ph
Литиирование по бензольному кольцу может быть достигнуто при реакции обмена даже без предварительной защиты NH-группы в случае индола, т. е. с образованием Ы,С-дилитийпроизводных [77].
Литиирование 1,3-азолов осуществляется очень легко по положению С(2>. Легкость такого металлирования обусловлена одновременно двумя факторами, повышающими кислотность атома водорода в этом положении: индуктивным и мезомерным электроноакцепторным влиянием «пиридинового» атома азота (разд. 2.6.1.4) и индуктивным электроноакцепторным влиянием второго гетероатома, аналогичным тому, которое проявляется в тиофене, фуране и пирроле. При наличии заместителя в положении 2 литиирование 1,3-азолов обычно идет по положению 5 [78].
индуктивный наиболее подвижный
наиболее индуктивный подвижный
При литиировании имидазола первоначально необходимо введение защитной группы к атому азота N(i). В качестве защитной обычно используют группу, которая обеспечивает дополнительную стабилизацию образующегося аниона и увеличивает селективность а-литиирования вследствие координации иона лития; одна из таких групп — триметилсилилэтоксиметильная [МезБЦСВДгОСНг, SEM] [80].
€N n-BuLi Л THF, -78 *С
N
SEM
CH2NMe2
n-BuLi
Et2O, -70 *С
Существенно, что пиразол, содержащий защитную группу у атома N<i), лити-ируется по положению 5, т. е. по положению, соседнему с «пиррольным» атомом азота; такое же направление литиирования наблюдается при наличии в положении N(d группы, способной содействовать металлированию в результате хелатирования [81].
При литиировании пятичленных гетероциклических систем по 0-положе-нию [82] возможно раскрытие гетероцикла при повышении температуры, гетероатом в этом случае выступает в роли уходящей группы [83].
л-BuLt,
-70 ‘С -» 20 ;с
2.6.1.4. Литиирование шестичленных гетероциклических соединений
Получение литийорганических производных шестичленных гетероциклических соединений, таких, как пиридины, хинолины и диазины, осложняется тем, что они очень склонны к реакциям нуклеофильного присоединения или замещения (разд. 2.3.2) при взаимодействии с литийорганическими соединениями. В противоположность простому и селективному литиированию пятичленных гетероциклических соединений, лигирование пиридина — процесс сложный и неоднозначный. Однако эффективное металлирование пиридина можно осуществить при использовании металлирующей системы и-бутиллитий — wpew-бутилат калия. В относительно неполярных растворителях (эфир/гексан) реализуется кинетически предпочтительное металлирование по положению С<2), в полярных растворителях (ТГФ/ГМФТА/гексан) и в равновесных условиях преимущественно образуется 4-изомер, а- и у-Положения пиридина более электронодефицитны, чем у-по-ложение, и, следовательно, атомы водорода в первых двух случаях кинетически более подвижны и способны отщепляться при действии оснований с образованием соответствующих анионов. Депротонирование у-положения приводит к образованию более стабильного аниона; вероятно, это связано с отсутствием взаимного отталкивания между неподеленной парой электронов атома азота и копланар-ной ей «анионной» орбиталью, которое существует в а-анионе. В неполярных растворителях сильная координация катиона металла с неподеленной парой электронов атома азота способствует уменьшению такого нежелательного взаимодействия и, тем самым, увеличивает стабильность а-аниона [84]. Селективное литиирование пиридина по положению 2 возможно при предварительном связывании неподеленной пары электронов в результате комплексообразования с трифторидом бора [85]. Такие наблюдения согласуются с результатами более ранних исследований, обнаруживших большую скорость лигирования N-оксидов пиридина и их четвертичных солей по а-положениЮ в результате обмена [86].
мезомерный Н и- слабый д' индуктивный мезомерный
I и индуктивный
Me
6BF3 LiTMP
Et2O, (ГС* Et2O,-78 "C*
IN
Изомерно чистые литиевые производные пиридина можно получить в результате реакций обмена. Для успешного литиирования 3-бромпиридина необходимо проводить реакцию при низкой температуре, что позволяет предотвратить возможные процессы нуклеофильного присоединения. Бромпиколины также могут быть превращены в результате реакции обмена в соответствующие литиевые производные без депротонирования метильной группы (разд. 2.6.3.1).
Литиирование производных пиридина, содержащих ор/ло-напраЕляющие 1руппы, вследствие как индуктивного влияния, так и хелатирования не осложняется процессами нуклеофильного присоединения. В том случае, когда такие группы присутствуют в положении 2 [87] или 4 [88], образуются p-производные, а в том случае, если такая группа расположена в положении Ср), образуются у-литиевые производные. Такие закономерности справедливы для хлор- и фторпиридинов [89], 3-метоксиметокси- [90], 3-пивалоиламино- [91], 3-триме-тилсилилэтоксиметокси- [92] и З-ягре/и-бутиламиносульфонилпиридинов [93], а также для производных пиридина, содержащих 3-диэтиламинокарбонилокси-или 3-диэтиламинотиокарбонилоксигруппы [94], и аддуктов, образующихся из 3-формилпиридина и Me2N(CH2)NMeLi [95]. З-Этоксипиридин металлируется по положению С(2) [96].
Зп-BuLi
THF, Et2O,TMEDA
-Ю’С
Металлирование хинолинов идет аналогично металлированию пиридинов, однако в этом случае возникает вероятность нуклеофильного присоединения [97]. Проблема, связанная с нуклеофильным присоединением, становится весьма существенной в случае диазинов; тем не менее, литиевые производные пири-
мидина можно получить в результате как депротонирования, так и реакции обмена галогена при проведении реакции при низкой температуре (около
-100 °C). Присутствие заместителей в положении 2 и/или 4 в некоторой степени стабилизируют литиевые производные пиримидинов [98].
л-Вии Et2O, THF ,-100 *с
LDA
Et2O,-10*С
в присутствии электрофильного агента
LiTMP
THF, НМРА
-70 *С
LITMP
Et2O, THF
-100 ’С
Металлирование пиразинов и пиридазинов происходит в соответствии с обсужденными выше принципами [99].
2.6.2. Магнийорганические производные [100]
Реактивы Гриньяра чрезвычайно широко используются в химии карбоциклических ароматических соединений, однако прямое получение гетероциклических реактивов Гриньяра стандартным методом — взаимодействием магния с галогенопроизводными — часто затруднительно, особенно в случае гетероциклических соединений, содержащих основный атом азота. Однако реакция обмена галогена в иод- и бромопроизводных гетероциклических соединений с алкильными реактивами Гриньяра (предпочтительно использование изопропилмаг-нийгалогенидов или диизопропилмагния) позволяет получить магниевые производные широкого круга гетероциклических соединений. Получение гетероциклических реактивов Гриньяра этим способом было использовано даже в твердофазном синтезе. Сульфоксиды пиридинового ряда также вступают в реакции обмена с образованием пиридиновых реактивов Гриньяра [101]. Реакционная способность гетероциклических реактивов Гриньяра не совсем совпадает с реакционной способностью их карбоароматических аналогов: тем не менее, они вступают в реакции со многими электрофильными реагентами, хотя в некоторых случаях необходимо наличие катализаторов (солей меди).
/-PrMgBr
THF, -30 *С
CO2Et----------
СН2=СНСН2Вг
CuCN
80%
Вгч Вгч
)j-“N APrMgBr СН2-СНСН2Вг
и // \V Et2O,2Q-CcuCN, 2LiCI в J[ \Y
CH2OEt CH2OEt
/-PrMgBr
THF, -40 *C EtO2CCN e
55%
CH2OEt
2.6.3. Бор-, кремний- и оловоорганические реагенты
Предупреждение: хотя оловоорганические производные чрезвычайно полезны в органическом синтезе, многие из них весьма токсичны и работать с ними необходимо с осторожностью. Производные триметилстаннана обладают особенно высокой токсичностью, поэтому всякий раз, когда это возможно, их следует заменять на трибутильные аналоги, которые, хотя и менее активны, но не столь токсичны.
2.6.3.1. Синтез
Наиболее общие методы синтеза гетероциклических силанов [102], станнанов и борных кислот связаны с взаимодействием гетариллитиевых соединений с хлорсиланами, хлорстаннанами и эфирами борной кислоты [103] соответственно. З-Диэтилборилпиридин также можно получить при реакции пиридиллития с триэтилбораном с последующим отщеплением этильной группы под действи-
ем иода. Этот метод неприменим к синтезу аналогичных производных электроноизбыточных гетероциклических систем, таких, как фуран, поскольку в таких случаях наблюдается преимущественное отщепление гетероциклического фрагмента, а не этильной группы £104]. В некоторых специфических случаях для синтеза таких производных гетероциклических соединений могут быть использованы реакции переметаллирования [105].
Н2О
В(ОН)2
Br n-BuLi, Et2O затем BEt3, -78 *С
•г
THF, -78 ‘С
80%
Эфиры гетарилборных кислот могжно получить при катализируемой палла-
дием реакции гетарилгалогенидов [106].
CI2Pd(dppf), КОАс
DMSO, 80 ’С
84%
Me
СМе
t-Me CI2Pd(dppf)
Me диоксан, 80
80%
Для получения силильных производных пирролов и индолов можно использовать реакции электрофильного замещения.
Me
Me3SiOTf, Et3N —
Синтетически полезный альтернативный метод получения станнанов заключается в катализируемом палладием декарбоксилировании станниловых эфиров или сочетании гетарилгалогенидов с гексаалкиддистаннанами [108], последний метод требует проведения реакции в значительно более жестких условиях [109]. Триалкилстаннильные и триалкилсилильные анионы весьма реакционноспособны и замещают атом галогена без использования катализаторов [НО].
N SMe
xs*. n-Bu6Sn2, Рс!(ОАс)2(Р11зР)2 | TBAF.THF, 20’С
46% *”
N<^SMe
CO2Sn-n-Bu3
✓k , PdCI2(MeC.N)2 Cl
। PhOMe, кипячение
MegSiK (+ MeOSiMeg) | I 80%
44 N Br MegSiSiMea, KOMe
HMPA, 20 *C
SiMeg
Me3SnNa, -10 'C
I 81%
Me3SnCi + Na
Связи углерод — кремний, углерод — бор и углерод — олово настолько стабильны, что многие превращения удается осуществить, не затрагивая такие заместители. Ниже приведен ряд примеров подобных превращений [111]:
НОСН2С=ССН2ОН ^3SnCu.Me2S I пг, о и
62%
________^Sn-л-Виз носн2 сн2он
_ Sn-л-Виз
НСгО3С1, пиридин ----/
CH2CI2,0 'С //Л
81%
п-Виз8п
PhH, 20 *С 81% *
Ph Мез8к____SiMes
Me3SiC=CSIMe3 +
2.6.3.2. Реакции
Гетероароматические бор-, кремний и оловоорганические соединения проявляют реакционную способность, аналогичную реакционной способности родственных производных ароматических соединений, и нашли широкое применение в различных синтетических превращениях, связанных с гетероциклическими соединениями. В противоположность литиевым производным, такие элементоорганические гетероароматические соединения обычно достаточно устойчивы к действию воздуха и воды и вступают в широкий круг селективных реакций в относительно мягких условиях. Гетарилборные кислоты и станнаны нашли широкое применение в качестве металлоорганических компонентов в реакциях сочетания, катализируемых палладием (разд. 2.7.2.2); в таких превращениях используются и некоторые гетероароматические силаны, такие, как 2-(этилдифторсилил)тиофен [112], 2-(фтордиметил-
силил )тиофен [113], 2-триметилсилилтиазол и 1-метил-2-[триметил (меток-си)силил]пиррол [114].
Для всех обсуждаемых в этом разделе металлоорганических соединений характерны реакции электрофильного мясо-замещения. Такие процессы особенно интенсивно изучались на примере арилсиланов и арилстаннанов. млсо-Замещение проходит через стадии присоединения электрофила — элиминирования элементоорганического заместителя, совершенно аналогично простым реакциям электрофильного замещения. Существенное отличие состоит в том, что скорость таких процессов значительно выше, чем скорость электрофильного замещения водорода. Гетероциклические аналоги таких элементоорганических производных также вступают в реакции мясо-замещения, и в случае электроноизбыточных систем, вероятно, сохраняется тот же механизм.
PhCOCI PhH, 20 *С ’ 68%
СН2=ЙМе2 CI ‘ СН2С12, 20 ’С
66%
- Me3SnCt
Наиболее широкое применение нашли гетероциклические производные, содержащие иминный фрагмент и кремний(олово)органический заместитель, расположенный непосредственно у иминного атома углерода [116]. Такие соединения с трудом подвергаются электрофильной атаке (разд. 2.2.2), поэтому механизм взаимодействия с электрофильными реагентами может включать координацию реагента по атому азота [117]. Например, 2-триметилстаннилпири-дин легко взаимодействуете хлорангидридами кислот, однако соответствующий 3-изомер в аналогичных условиях инертен. 3- и 4-Триметилстаннилпиридины могут быть вовлечены в такое взаимодействие при использовании палладиевого катализатора, но в этих случаях реализуется иной механизм и необходимы совершенно иные условия для осуществления превращения [118]. На приведенном ниже примере превращения кремниевого производного оксазола показано первоначальное взаимодействие электрофильного реагента с атомом азота цикла
Me
APrCHsO, 70 'С затем водн. НС!
SiMe3 74%
Силаны также склонны к реакциям с электрофильными реагентами при катализе фторид- или метокси-ионами [119]. В этом случае промежуточно in situ образуется комплекс, который далее реагирует аналогично карбаниону, однако реакция в целом проходит в значительно более мягких условиях, чем превращение с участием литиевых производных. Такой процесс можно использовать даже
для генерирования эквивалента НегСНг-аниона пятичленных азотсодержащих гетероциклических соединений [120].
Ph2C=O, KOFBu THF, кипячени^ 40%
’SiMe3
Силильные группы можно также использовать в качестве защитных групп для подвижных атомов водорода, связанных с атомом углерода, впоследствии такие группы легко удаляются при действии фторид-иона или кислот [121]. Станнаны также можно применять для региоселективного получения гетарил-литиевых соединений в результате взаимодействия с алкиллитиевыми реагентами [111].
\—n n-BuLi л-BuLi Me3Sn— водн. HC|Me3Sn
// а затем Me3SiCI затем Me3SnCI // THF, 20 ’С у/ \\
<q/-SiMe3 "96%
____zSn'n‘Bu3 n-BuLi
THF> ~78 ‘cx
Хотя арилборные кислоты очень легко вступают в реакции млсо-замещения с такими электрофильными агентами, как ионы галогенония, такие процессы не нашли широкого синтетического использования. Связь углерод —- бор может быть расщеплена под действием как кислот, так и оснований, и легкость такого расщепления зависит от стабильности соответствующего аниона или от легкости протонирования цикла соответственно. В том случае, когда возможна стабилизация аниона, как, например, при расщеплении фурилборных кислот, содержащих электроноакцепторную группу, реакции деборирования, катализируемые основаниями, представляют собой нежелательные побочные процессы [122]. Имидазолил- и оксазолил-2-борные кислоты до сих пор не удалось выделить, вероятно, вследствие их способности к легкому деборированию.
2.6.4. Цинкорганические производные
Гетарилцинковые производные нашли широкое применение в катализируемых палладием реакциях сочетания, поскольку в случае использования таких металлоорганических соединений многие функциональные группы остаются незатронутыми. Цинкорганические соединения можно получить реакцией обмена между галогенидами цинка и гетариллитиевыми соединениями [123], однако такой метод получения органических соединений цинка значительно ограничивает возможность их использования. Другой эффективный подход к синтезу таких соединений связан со взаимодействием галогенопроизводных гетероциклических ароматических соединений либо с активированным цинком (цинк Рике* [124]) или коммерчески доступной цинковой пылью [125], причем этот подход применим как к электроноизбыточным, так и электронодефицитным гетероциклическим системам.
Zn пыль THF, 20 *0
91%
Прямое ор/но-металлирование может быть осуществлено при использовании тетраметилпиперидилцинкатов, для образующихся в результате прямого метал-
* Получение активированных металлов по методу Рике заключается в восстановлении галогенидов соответствующих металлов литием в присутствии каталитических количеств нафталина в качестве переносчика электронов. — Прим, перев.
лирования гетероарилцинкатов описаны лишь реакции с иодом и бензальдегидом [126].
Znf-Bu2+UTMP t
Li Zn(M3u)2TMP
THF, 20 *C
ZnFBu2 + LiTMP
2.6.5. Металлирование боковой цепи
шестичленных гетероциклических соединений («латеральное металлирование»)
Карбанионы, образующиеся при депротонировании алкильных групп, непосредственно связанных с гетероциклическим фрагментом, в различной степени стабилизированы в результате взаимодействия с ароматическим циклом. Наиболее стабильные анионы образуются при депротонировании алкильных групп, расположенных в а- и у-положениях относительно фрагмента C=N, например, в положениях 2, 4 и 6 пиридинового цикла. Стабилизация таких анионов осуществляется тем же самым путем, что и стабилизация енолят-ионов (сопряженных енолятов). Далее в книге будет использоваться термин «енаминатный ион» для обозначения таких азотсодержащих анионов, аналогичных енолят-анионам.
енаминат-ион
сн2
сравните: енолят-ион
сопряженный енаминат-ион
сравните:
Приведем количественные показатели способности к депротонированию некоторых метильных производных ароматических гетероциклических соединений: 2-метилпиридин (рЛ^ 34), 3-метилпиридин (рКа 37,7), 4-метилпиридин (рА^ 32,2), 4-метилхинолин (рД 27.5) [128]. Полезно сравнить эти значения с значениями рК кетонов (19—20 для а-депротонирования) и толуола (~ 40). Таким образом, для количественного превращения метилпиридинов в соответствующие анионы в результате латерального депротонирования необходимы сильные основания. Однако высокая стабилизация, возможная для таких анионов, позволяет применять слабые основания для генерирования этих анионов в небольшой равновесной концентрации и проводить реакции с их участием в таких условиях. Возможно, что депротонированию боковой цепи в этом случае
содействует координация по атому азота или образование водородных связей с участием пиридинового атома азота.
n-BuLi
анион образуется в
небольшой равновесной концентрации
THF, -70 ’С
затем APrCONMeg
85% **
СН3
полное превращение в анион
Альтернативный способ осуществления превращений по боковой цепи связан с предварительным электрофильным присоединением по атому азота, в результате чего кислотность протонов боковой цепи дополнительно повышается и депротонирование такого аддукта приводит либо к енаминам, либо к ена-мидам, проявляющим свойства нуклеофилов.
R = алкил:енамин R = ацил: енамид
Наиболее элегантный пример использования такого принципа связан с генерированием N-диалкилборильных производных пиридина [129].
Q9-BBN трифлат /-Pr2NEt, CH2CI2^ PhCH=Q*
IN СНз
2.6.6. Металлирование боковой цепи пятичленных гетероциклических соединений
Металлирование боковой цепи простых пятичленных гетероциклических соединений вызывает значительные затруднения по сравнению с металлированием боковой цепи шестичленных гетероциклов, поскольку в этом случае невозможна енаминатная стабилизация соответствующих анионов. Все же такое металлирование удается осуществить для алкильных групп, соседствующих с гетероатомом, поскольку его индуктивное влияние повышает кислотность атомов водорода алкильных групп. В том случае, если в молекуле присутствует NH-rpynna [130], необходимы относительно более жесткие условия для депротонирования боковой цепи. Элегантный метод, разработанный для индола, заключается в блокировании первоначально образующегося N-аниона в результате присоединения ди-окида углерода по атому азота. Литиевое производное, образующееся в результате такого присоединения, оказывает дополнительное содействие литиированию метильной группы в положении 2 индола вследствие внутримолекулярного хелатирования. Полученное таким образом дилитиевое соединение может быть использовано в реакциях с различными электрофильными реагентами, а защитная группа легко удаляется с атома азота при обработке водой [131].
Алкильный заместитель в положении 2 1,3-азолов активирован аналогично а-алкильному заместителю в пиридине и может быть металлирован. Однако следует соблюдать осторожность, чтобы избежать металлирования гетероцикла [132].
n-BuLi
Et2O, О 'С
4NZ^CH2Li Me
2.7. РЕАКЦИИ, КАТАЛИЗИРУЕМЫЕ ПАЛЛАДИЕМ [133]
Одна из наиболее быстро развивающихся в последние годы областей органической химии — реакции, катализируемые переходными металлами. Такие процессы широко применяются и для синтеза гетероциклических соединений, и для их функционализации. Использование процессов, катализируемых переходными металлами, способствовало развитию не только совершенно новых методов, но и позволило усовершенствовать давно известные, повысить селективность и простоту осуществления многих процессов. Палладий — один из наиболее важных и широко применяемых катализаторов, в реакциях различного типа. Никель также используется в качестве катализатора, однако круг реакций, катализируемых никелем, значительно уже.
В целом гетероциклические соединения вступают в реакции, катализируемые палладием, аналогично карбоциклическим. Атомы серы и азота, включенные в цикл, редко препятствуют осуществлению таких (гомогенных) процессов, катализируемых палладием, хотя хорошо известно, что сера- и азотсодержащие молекулы оказывают отравляющее действие на катализаторы гетерогенного гидрирования (металлический палладий на угле).
Процессы, катализируемые палладием, обычно проводят, используя 1—5 мол. % катализатора, и палладиевые активные интермедиаты образуются в низкой концентрации. Такие процессы представляют собой последовательность стадий, каждая из которых связана с участием палладийорганического соединения. Механизм процессов с участием палладийорганических интермедиатов скорее согласованный, чем ионный, и сравнивать такие реакции с близкими, на первый взгляд, процессами «классической» органической химии недопустимо. Для облегчения запоминания таких процессов можно использовать изогнутие стрелки, аналогично тому, как при рассмотрении реакций циклоприсоединения, и именно такое «объяснение» реакций, катализируемых палладием, будет использоваться при их дальнейшем обсуждении.
2.7.1. Основные процессы с участием палладийорганических соединений [134]
Примечание. Для простоты, в приведенных ниже схемах опущены лиганды, однако необходимо помнить, что палладийорганические соединения представляют собой четырехкоординационные плоско-квадратные комплексы:
Ph3P
R-Pd-Ph zPPha
PPhg будет представлен как RPdPh Pd(0) обычно Pd.
PPh3
Несмотря на кажующееся сходство между RPdX и RMgX, химические свойства этих соединений совершенно различны. Палладийорганические соединения обычно устойчивы к действию воздуха и воды и не реагируют с обычными электрофильными агентами типа карбонильных соединений, в то время как магнийорганические соединения весьма реакционноспособны по отношению к кислороду, воде и карбонильным соединениям.
2.7.1.1. Согласованные реакции
Окислительное присоединение
Арил- и винилгалогениды при реакции с Pd(0) образуют соответствующие палладийорганические соединения. Такие процессы формально аналогичны образованию реактивов Гриньяра из металлического магния Mg(0) и органического галогенида. Однако в случае образования палладийорганического соединения предполагают, что происходит согласованное прямое «внедрение» палладия по связи углерод — галоген. Порядок реакционной способности при образовании палладийорганических соединений I > Вг ~ OTf » Cl » F, показывает, что хлор- и фторпроизводные обычно инертны в таких процессах. Например, Pd(PPhs)3 реагирует с иодбензолом при комнатной температуре, а аналогичное внедрение палладия в бромбензол требует нагревания до 80 ’С. Хотя алкилгалогениды вступают в реакции окислительного присоединения Pd(0), образующиеся ал кил палладиевые соединения обычно отличаются малой стабильностью.
Палладий(О) проявляет в некоторой степени нуклеофильные свойства, поэтому электроноакцепторные заместители увеличивают активность арил-галогенидов в реакциях окислительного присоединения. Так, индуктивный эффект иминного фрагмента позволяет вступать в реакции окислительного присоединения Pd(0) 2-хлорпиримидину (лишь немногим менее активен, чем
бромбензол) и даже 3-хлорпиридину [135] (даже малое влияние существенно увеличивает скорость процесса по сравнению с хлорбензолом). Однако следует отметить, что в последнем случае необходимо использование более активного палладиевого катализатора (разд. 2.1.2.2). Паралель между активностью субстратов по отношению к атаке нуклеофилами и их способностью вступать в реакции окислительного присоединения Pd(0) не всегда удается обнаружить. Например, 4-хлорпиридин более склонен к реакциям с нуклеофильными реагентами, чем 2-хлорпиридин, и тем не менее именно 2-изомер проявляет большую активность в реакциях сочетания, катализируемых палладием^) [136].
Восстановительное элиминирование
Палладийорганические соединения, содержащие два органических фрагмента, связанных с металлом, RJPdR2, обычно неустойчивы, и для них характерно элиминирование металла в степени окисления 0, сопровождающееся одновременным связыванием двух органических фрагментов. Поскольку такой процесс реализуется по согласованному механизму, стереохимия органических фрагментов остается неизменной.
R1 Pd^K . ^R2
R11 R1
Pd' ; Pd(0) + I
''R2J R2
1,2-Внедрение
Арилпалладийгалогениды легко присоединяются к двойным и тройным связям по согласованному и, следовательно, сия-механизму, через предварительное образование л-комплекса (на схеме не показан)
(RO2C)
Такие процессы реализуются наилучшим образом с участием электронодефицитных алкенов, таких, как этиловый эфир акриловой кислоты, хотя возможны и для изолированных, и даже для электроноизбыточных алкенов. В случае реакции с акрилатом палладий присоединяется к атому углерода двойной связи, ближайшему к карбонильной группе, т. е. арильная группа присоединяется к Р-углеродному атому.
1,1-Внедрение
Монооксид углерода и изонитрилы способны внедряться по связи палладий — углерод
хч
Pd' I Аг
Р-Гидридное элиминирование
В том случае, когда в алкилпалладиевом соединении присутствует снн-р-водо-родный атом, возможно быстрое элимирование гидрида палладия, приводящее к образованию алкена. Такие реакции проходят значительно быстрее в соединениях типа RPdX, чем в соединениях типа R^Pd. Именно такие процессы ответственны за неудачу при проведении катализируемых палладием реакций сочетания с алкилгалогенидами.
Переметаллирование
Соединения палладия(П) (ArPdX и PdX2), реагируют с широким кругом металлоорганических соединений различной степени нуклеофильности, такими, как RjSn, RB(OH)2, RMgX и RZnX с переносом группы R к палладию и замещением X. Детали механизма такого взаимодействия не вполне понятны и зависят от используемого металла, однако лучшая интерпретация таких процессов возможна, если предположить их синхронный характер
PCL
2.7.1.2. Ионные реакции
Присоединение к я-комплексам палладий - алкен
Комплексы Pd2+ — алкен, аналогично таким же комплексам Hg2+ и Вг+, склонны присоединять нуклеофильные агенты. В противоположность процессам, описанным в разд. 2.7.1.1 (1,2-внедрение), такому присоединение нуклеофильных агентов свойственна ямин-стереоспецифичность.
•PdX
Ni
X
Прямое палладирование ароматических соединений
Соли палладия(П) способны металлировать ароматические соединения в результате электрофильного замещения; такие процессы аналогичны реакциям ароматического меркурирования. Электроноизбыточные ароматические системы наиболее активны в реакциях прямого палладирования [137]. Чаще всего используются процессы opwo-палладирования, протекающие при содействии электрононодонорной группы, способной к хелатированию [138].
NHAc
Pd(OAc)2
PhMe, кипячение
65%
2.7.2. Реакции, катализируемые палладием, в химии гетероциклических соединений
2.7.2.1. Реакция Хека [139]
•^^COgMe
Pd(OAc)2, Ph3P
Et3N, 100'С
83%
CO2Me
Стандартный вариант реакции Хека, показанный на приведенной схеме [140], наглядно демонстрирует сложность понимания механизмов процессов, катализируемых палладием. В каталитическом цикле принимает участие Pd(O), хотя в качестве реагента используется ацетат палладия(П). Использование ацетата палладия несомненно удобно, поскольку он представляет собой стабильное при хранении соединение. На первой стадии процесса происходит восстановление Pd2+ в Pd(O) in situ под действием фосфина (в присутствии следовых количеств воды) или триэтиламина.
Обычно реакция Хека включает взаимодействие арилгалогенида с алкеном, чаще всего с эфирами акриловой кислоты, в присутствии палладиевого катализатора (обычно используют менее 1 мол. %), приводящее к образованию стирола (эфира коричной кислоты). Процесс включает (а) стадию окислительного присоединения арилгалогенида к Pd (0), (б) 1,2-внедрение палладийорга-нического соединения в алкен и последующее, вращение вокруг связи углерод — углерод для образования такой конформации, в которой 0-атом водорода «/«расположен относительно палладия, и (в) р-гцдридное элиминирование, приводящее к образованию стирола и регенерированию катализатора Pd(0). Катализатор, образовавшийся на заключительной стадии процесса, вновь вступает в стадию окислительного присоединения и, тем самым, включается в еновый каталитический цикл
Pd(O) ArPdBr
окислительное присоединение
Et3NH Br“
. г ₽-гидридное
X^COgMe ^нирование
СН2=СНСО2Ме 1,2-внедрение (син)
Н
Ph3P + Нг<
Ph3PO + 2АсОН Pd(OAc)2
HPdBr
Электроноизбыточный характер таких гетероциклических соединений, как индол, фуран и тиофен, позволяет проводить реакцию Хека различными способами [141]. В «окислительном» варианте реакции Хека палладийорганическое соединение генерируется в результате электрофильного палладирования с применением реагентов палладия(П). Такие процессы не являются каталитическими, однако их можно осуществить с применением селективного окислителя для Pd(0). Следует иметь ввиду, что Pd(0) неэффективен на первой стадии «окислительного» варианта реакции Хека, т. е. на стадии электрофильного ароматического палладирования [142].
Другой вариант металлирования, обусловленный направляющим влиянием ацильной группы либо в положении 3, либо в положении 4 пиридинового цикла и проводимый с использованием каталитических количеств комплекса рутения в присутствии алкенов связан с «восстановительным» вариантом реакции Хека, как показано ниже. Механизм такого превращения включает стадию внедрения металла по связи углерод — водород. Такие процессы не включают образования ионных интермедиатов, поэтому с одинаковой эффективностью применимы к различным гетероциклическим соединениям, например, к таким, как индол [143].
CH2=CHSi(OEt)3 RuH2(CO)(PPh3)3 (кат.) PhMe, кипячение
69%
27.2.2. Реакции сочетания
Гетарилгалогениды (или гетероциклические производные типа трифлатов фенолов) реагируют с широким кругом металлоорганических и других анионных реагентов в присутствии палладиевых катализаторов. В отличие от реакции Хека в таких реакциях предпочтительно использование заранее приготовленного катализатора Pd(0); обычно в качестве катализатора используется тетракис(три-фенилфосфин)палладий(О) Pd(PPh3)4 [144].
Cl HCsCPh
Л. | PdCI2(PPh3)2
| Cul, Et3N, 60‘C v
Js 70%
N Me Me
CN
DME, кипячение
Br 85%
SO2Ph
Подобные превращения также включают каталитический цикл, а именно: (а) окислительное присоединение, (б) переметаллирование и (в) восстановительное элиминирование, приводящее к продукту реакции сочетания и регенерированию катализатора Pd(O).
Ar! + Pd (0)------------► ArPdl ВМ--------------М!
окислительное переметаллирование\
присоединение \
ArR
восстановительное элиминирование
ArPdR
RM=HetSnR3, HetB(OH)2, HetBEt2, HetMgX, HetZnX, HetTiXa, HetZrXb. M-s-Het
Электроноакцепторное влияние азинового цикла приводит к тому, что атомы хлора, присоединениные к гетероциклу, и даже атом хлора в р-положении пиридинового цикла становятся активными в реакциях сочетания, катализируемых палладием [145]. Активация в a-положении существенно выше, что позволяет провести процесс селективно именно по этому положению в присутствии атома галогена в p-положении (см. разд. 2.7.1.1, окислительное присоединение). Наблюдаемая в этом случае селективность противоположна селективности литиирования в результате реакции обмена.
(НО)2
Pd(PPh3)4, водн. К2 СО3, DME кипячение
СНгОН 53%
N'
72%
Cl PhB(OH)2, CI2Pd(dppb)
' PhMe, ЕЮН
водн. KgCOg, кипячение
1,1 PhB(OH)2 в Pd(PPh3)4, водн. Na2CO3 DME, кипячение
Br 88%
В том случае, когда для таких процессов сочетания необходимы гетероциклические металлоорганические соединения, с успехом можно использовать реактивы Гриньяра и цинкорганические реагенты; в некоторых случаях также можно применять литиевые производные гетероциклических соединений. В последнее время все более популярным становится использование в таких процессах гетарилборных кислот. Реакции с участием этих соединений проходят чисто,
сами борные кислоты обычно устойчивы к действию воздуха и воды; кроме того, могут быть получены борные кислоты, содержащие практически любые функциональные группы, например фурил-, тиенил-, индолил- и пиридилборные кислоты [146].
Некоторые гетарилборные кислоты нестабильны, особенно диазолилборные кислоты; в таких случаях можно использовать соответствующие оловоорганические соединения [147], хотя применение оловоорганических соединений осложняется их высокой токсичностью.
2.7.2.3. Реакции карбонилирования
Ацилпалладиевые соединения, образующиеся при внедрении монооксида углерода в обычные арилпалладийгалогенцды, легко взаимодействуют с нуклеофильными реагентами, такими, как амины и спирты, с образованием амвдов и эфиров соответственно. Аналогичные процессы с гидрид-ионом приводят к образованию альдегидов [148].
CI2Pd(PPh3)2
СО (7 атм.) Et3N, EtOH, 100 *С
95%
М(°) » — -О
окислительное ВгРа Х х<1-|_внедрение EtO2C
присоединение ° О / °
ЕГОН -
2.7.2.4. Синтез бензоконденсированных гетероциклических соединений
Нуклеофильныые циклизации комплексов алкенов с палладием были использованы для синтеза производных индола, бензофурана и других конденсированных систем. В некоторых случаях такие процессы могут быть осуществлены в присутствии каталитических количеств палладия с участием в качестве окислителя бензохинона или солей меди(П).
2.8. ОКИСЛЕНИЕ И ВОССТАНОВЛЕНИЕ [149] ГЕТЕРОЦИКЛИЧЕСКИХ СОЕДИНЕНИЙ
Электронодефицитные гетероциклические соединения более устойчивы к окислительному расщеплению цикла, чем электроноизбыточные системы. В случае электронодефицитных гетероциклов обычно удается окислить алкильные труппы, присоединенные к циклу, без окисления самого цикла. Осуществить такие превращения с пятичленными элекгроноизбыточными гетероциклическими соединениями обычно невозможно.
Превращение моноциклических гетероароматических соединений в полностью или частично восстановленные производные, возможно особенно при проведении реакций восстановления в присутствии кислоты, что способствует первоначальному протонированию; дальнейшему восстановлению подвергаются образующиеся при протонировании катионы.
Шестичленные ароматические гетероциклы, практически всегда содержащие основный атом азота, восстанавливаются значительно легче пятичленных гетероциклических систем. Четвертичные соли также подвергаются легкому восстановлению.
2.9. БИОЛОГИЧЕСКИЕ ПРОЦЕССЫ В ХИМИИ ГЕТЕРОЦИКЛИЧЕСКИХ СОЕДИНЕНИЙ [150]
Биологические методы редко применяются в химии гетероциклических соединений, хотя в некоторых случаях их значение достаточно велико. Такие методы с одинаковым успехом можно использовать как при лабораторных исследованиях, так и при производстве химических реактивов. Биологические процессы могут быть осуществлены как с применением предварительно выделенных ферментов, так и при использовании живых микроорганизмов. В основном биологическими методами проводят окисление самих гетероциклов или связанных с ними заместителей. Некоторые другие реакции, осуществляемые биологическими методами, например, катализируемый ферментами обмен оснований в нуклеозидах или дезаминирование аденозина, будут рассмотрены в других разделах книги.
и р- Putida
40%
н
со2н ч
о
‘s'
Основное преимущество биологических методов перед обычными химическими методами заключается в их высокой регио-, стерео- и энантиоселектив-ности. Применение находят также и неселективные реакции; например, при неселективном окислении природных соединений удается получить целую серию исходных веществ, которые в дальнейшем можно использовать для синтеза широкого круга других соединений.
Среди биологических процессов достаточно подробно изучены окисление пиридинов в пиридоны [151] и селективное окисление боковых цепей в алкил-пиридинах и других азинах [152].
Энантиоселективное цнс-дигидроксилирование [153] бензотиофенов и бензофуранов под действием Pseudomonas putida проходит так же, как и в случае простых бензольных соединений. Однако а -центр соответствующих гетероциклических производных, содержащий гидроксильную группу, склонен к легкой эпимеризации. Индол в таких условиях превращается в индоксил, вероятно, вследствие дегидратации первоначально образующегося 2,3-диола.
Катализируемое ферментами введение аминокислотных фрагментов в 4-, 5-, 6- и 7-азаиндолы при алкилировании серином наглядно демонстрирует поразительные возможности биологических методов [155].
со2н
НО \’Н триптофансинтетаза, ________NH2 р Н 8, пиридоксаль 88%
Литература
1. Сродство к протону в газовой фазе [ср. «The reactivityof heteroaromatic compounds in gas phase», Speranza M. Adv. Heterocycl. Chem., 40, 25 (1986)] приблизительно одинаково для всех оснований и, хотя такие измерения и представляют теоретический интерес, их привлечение при обсуждении процессов, происходящиъ в растворах, ограничено.
2. «The quatemisation of heterocyclic compounds», Duffin G. F. Adv. Heterocycl. Chem., 3,1 (1964); «Quatemisation of heteroaromatic compounds: quantitative aspects», Zolte-wiczJ. A., Deady L. W. Adv. Heterocycl. Chem., 22,71, (1978); «The quantitative analysis of steric effects in heteroaromatics», Gallo R., Roussel C., Berg. U. Adv. Heterocycl. Chem., 43,173 (1988).
3. Brown H. C. Deady L. W. Adv. Chem. Soc., 77,1715 (1955).
4. Okamoto Y. Lee К. I. J. Am Chem. Soc., 97,4015 (1975).
5. Zoltewicz J. A. Deady L. W. J. Am. Chem. Soc., 97,4015 (1975).
6. «Electrophilic substitution of heterocycles: quantitative aspects: Part I, Electrophilic substitution reactions; Part II, Five-membered heterocyclic rigns, Part III, Six-membered heterocyclic rings», KatrizJcy A. R., Taylor R. Adv. Heterocycl. Chem., 47, 1 (1990); «Halogenation of heterocyclic compounds» Eisch J. J. Adv. Heterocycl. Chem., 7, 1 (1966); «Halogenation of heterocycles: I. Five-membered rings», Grimmett M. R. ibid., 57,291 (1993); «II. Six- and seven-membered rings», ibid., 58, 271 (1994).
7. Austin M. W., RiddJ. H. J. Chem. Soc., 1963,4204.
8. Gilow H. V., RiddJ. H. J. Org. Chem., 39, 3481 (1974).
9. «Substitution in the pyridine series: effect of substituents», Abramovitch R. A., Saha J. G. Adv. Heterocycl. Chem., 6,229 (1966).
10. «Mechanisms and rates of the electrophilic substitution reactions of heterocycles» KatritzkyA. R., Fan fZ.-O. Heterocycles, 34,2179 (1992).
11. «Electrophilic substitution of heteroaromatic six-membered rigns», Katrizky A. R., Johnson C. D. Angew. Chem., Int. Ed. Engl., 6,608 (1967).
12. «Electrophilic subsititutions of five-membered rings», Marino G. Adv. Heterocycl. Chem., 13,235 (1971).
13. Marino G. Heterocycl. Chem., 9,817 (1972).
14. Clementi S., Marino G. Tetrahedron, 25,4599 (1969).
15. Clementi S., Fringuelli E, Linda P., Marino G., Savelli G., Taticchi A. J. Chem. Soc., Perkin Trans. 2,1973,2097.
16. Linda P., Marino S. Tetrahedron, 23,1739 (1967).
17. Количественная оценка не должна игнорировать активирующее влияние метильной группы на атом кольца в тех случаях, когда метильная группа присоединена либо к атому углерода, либо к атому азота.
18. Bean G. Р. J. Chem. Soc., Chem. Commun., 1971, 421; Clementi S., Forsythe P. P., Johnson C. D., Katritzky A. R. J. Chem. Soc., Perkin Trans. 2,1973, 1675; Clementi S., Forsythe P. R, Johnson C. D., Katritzky A. R., Terem B. ibid., 1974, 399.
19. Clementi S., Linda P., Marino G. J. Chem. Soc. (B), 1970,1153.
20. Ckementi S, Marino G. J. Chem. Soc., Perkin Trans. 2,1972, 71.
21. GoVdfarb Y. L., Danyushevskii Y. L. J. Gen. Chem. USSR (Engl. Transl.), 31, 3410 (1961); Boukou-Poba J.-P., Farnier M., Guilard R. Can. J. Chem., 59, 2962 (1981).
22. MuchowskiJ. M., MaefR. Helv. Chim. Acta, 67,1168 (1984); Simchen G., Majchrzak M. W. Tetrahedron, 26,5035 (1985).
23. Frick V., Simchen G. Synthesis, 1984, 929; Majchrzak M. IK, Simchen G. Tetrahedron, 42,1299 (1986).
24. Cipiciani A., ClementiS., Linda P., Marino G., Savelli G. J. Chem. Soc., Perkin Trans. 2, 1977, 1284.
25. Laws A. P., Taylor R. J. Chem. Soc., Perkin Trans. 2,1987, 591.
26. Holla B. S, AmbekcrS. Y. Indian J. Chem., Sect. В, 14B, 579 (1976).
27. Challis В. С. Rzepa Н. S. J. Chem. Soc., Perkin Trans. 2, 1975, 1209; Butler A. R,, Pogorzelec P., Shepherd P. R. idem., 1977,1452.
28. Monti S. A., Johnson W. O. Tetrahedron, 26, 3685 (1970).
29. Clementi S., Linda P., Marino G. J. Chem. Soc. (B), 1971,79.
30. Austin M. FK, Blackborrow J. R., Ridd J. H, Smith В. V. J. Chem. Soc., 1965,1051.
31. Austin M. Chem Ind., 1982,57.
32. Poite C, RoggeroJ., Dou H. J., M., Vemin G., Metzger J. Bull. Soc. Chim. Fr., 1972, 162.
33. Chauvin P., Morel J, Pastour P., Martinez J. Bull. Soc. Chim. Fr., 1974,2099.
34. «Nucleophilic heteroaromatic substitution», Illuminati G. Adv. Heterocycl. Chem., 3, 285 (1964);. «Reactivity of azine, benzoazine, and azinoazine derivatives with simple anionic o-adducts from heteroaromatic compounds: structures, rates ans equilibria», Illuminati G., StegelF. ibid., 34, 306 (1983).
35. Liveris M., Miller J. J. Chem. Soc., 1963,3486; Miller J., Kai-Yan W ibid., 3492.
36. Johnson R. M. J. Chem. Soc. (B), 1966,1058.
37. Barlin G. B., Benbow J. A. J. Chem. Soc., Perkin Trans. 2,1974,790.
38. O’Leary M. H.t Stach R. ИС J. Org. Chem., 37,1491 (1972).
39. Chapman N. B., Russell-Hill D. Q. J. Chem. Soc., 1956,1563.
40. Barlin G. B., Benbow J. A. J. Chem. Soc., Perkin Trans. 2,1975,298.
41. «Vacarious nucleophilic substitution of hydrogen», Makosza M., Winiarski J, Acc. Chem. Res., 20, 282 (1987); «Application of vicarions nucleophilic substitution in organic synthesis», Makosza M. Wojciechowski K. Liebigs Ann./Receuil, 1997, 1805.
42. Wojciechowski K. Synth. Commun., 27,135 (1997).
43. Wrobel Z., Makosza M. Oig. Prep. Proc. Int., 1990, 575.
44. Ostrowski S., Makosza M. Tetrahedron, 44, 1721 (1988).
45. Giese B. Radicals in oiganic synthesis: formation of carbon-carbon bonds, Norman R. О. C., Pergamon Press, 1986; Free radical substitution of heteroaromatic compounds, Norman R. О. C., Radda G. K. Adv. Heterocycl. Chem., 2, 131 (1963).
46. Klemm L. H, Dorsey J. J. Heterocycl. Chem., 28,1153 (1991).
47. Minisci E, Galli R.f Cecere M., Malatesta V.f Caronna T. Tetrahedron Lett., 1968,5609, «Substitutions by nucleophilic free radicals: a new general reaction of heteroaromatic bases», Ninisci E, Fontana E, Vismara E. J. Heterocycl. Chem., 27, 79 (1990), Minisci E, CitterioA., Vismara E., Giordano C. Tetrahedron, 41,4157 (1985); «Advances in the synthesis of substituted pyridazines via introduction of carbon functional groups into the parent heterocycle», Heinisch G. Heterocycles, 26,481 (1987); «Recent developments of free radical substitutions of heteroaromatic bases», Minisci E, Vismara E., Fonatana E Heterocycles, 28,489 (1989).
48. Buratti W., Gardini G. P., Minisci E, Bertini E, Galli R., Perchinunno M. Tetrahedron, 1971, 3655; Minisci E, Gardini G. P., Galli R., Bertini F. Tetrahedron Lett., 1970, 15; Sakamoto T., Sakasai T., Yamanaka H. Chem. Pharm. Bull., 28,571 (1980); Minisci E> Vismara E., Fontana E J. Org. Chem., 54,5224, (1989).
49. Togo H, Hayashi K., Yokoyama M. Chem. Lett., 1993,641.
50. Fontata E, Minisci E, Nogueira-Barbosa M. C, Vismara E. Tetrahedron, 46, 2525 (1990).
51. Fontana E, Minisci E, Nogueira-Barbosa M, C.t Vismara E. J. Org. Chem., 56, 2866 (1991).
52. Barton D. H. R., Garcia B., Togo H., Zard S. Z. Tetrahedron Lett., 27, 1327 (1986); Barton D.H.R., Chern С-Y., Jaszberenyi J, Cs. ibid., 33,5013 (1992).
53. Gardini G. P., Minisci E, Palla G., Arnone A., Galli R. Tetrahedron Lett., 1971, 59; Citterio A., Gentile A., Minisci F., Serravale M., Ventura S. J. Org. Chem., 49, 3364 (1984).
54. Citterio A., Gentile A., Minisci E Tetrahedron Lett., 23, 5587 (1982).
55. MinisciE, Vismara E., Fontana E, Morini G., Serravalle M., Giordano G. J. Org. Chem., 52,730 (1987).
56. Katz R. B., Mistry J. Mitchell M. B. Synth. Commun., 19, 317 (1989).
57. «Radical ipso attack and ipso substitution in aromatic compounds», Tiecco M. Acc. Chem. Res., 13, 51 (1980).
58. Tordeaux M., Langlois B., Wakselman C. J. Chem. Soc., Perkin Trans. 1, 1990, 2293; Cho I.-S., Muchowski J. M. Synthesis, 1991,567.
59. «Basicity and acidity of azoles», Catalan J., Abboud J. L. M., Elguero J. Adv. Heterocycl. Chem., 41,187(1987).
60. Blandsma L., Verkruijsse H. D. Preparative polar organometallic chemistry, Vol. 1, Springer-Verlag, 1987; The chemistry of organolithium compounds, Pergamon Press, 1974; «Generation and reactions of sp2-carbanionic centers in the vicinity of heterocyclic nitrogen atoms», Rewcastle C. W., KatrizkyA. R. Adv. Heterocycl. Chem., 56,155 (1993); Ring and lateral metalation of heteroaromatic substrates using strong base systems, FMC Lithium Link, Spring 1993, FMC Lithium Division, 449, North Cox Road, Gastonia, NC 28054, USA.
61. Von Rague, Schleyer P., Chandrasekhar J., Kos A. J., Clark T., Spitznagel G. W. J. Chem. Soc., Chem. Commun., 1981,882.
62. «Base catalysed hydrogen exchange», Elvidge J. A., Jones J. R., О 'Brien C., Evans E. A., Sheppard H. C. Adv. Heterocycl. Chem., 16, 1 (1974).
63. ZoltewiczJ. A., Grahe G., Smith C. L J. Am. Chem. Soc., 91, 5501 (1969); Meot-Ner (Mauther) M., Kafafi S. A. ibid., 110,6297 (1988).
64. «Heteroatom-facilitated lithiations», Gschwend H. W., Rodriguez H. R. Org. React. 26,1 (1979); «Directed metallation of те-deficient azaaromatics: strategies of functionalisation of pyridines, quinolines, and diazines», Queguiner G., Marsais E, Snieckus И, Epsztain J. Adv. Heterocycl. Chem., 52, 187 (1991); «Metallation and metal-assisted bond formation in те-electron deficient heterocycles», Undheim K, Benneche T. Heterocycles, 30, 1155 (1990); «Directed ortho metallation. Tertiary amide and O-car-bamate directors in synthetic stategies for polysubstituted aromatics», Sniekus V. Chem. Rev., 90,879 (1990).
65. Mallet M. J. Oiganomet. Chem., 406,49 (1991).
66. «Is N,N,N’,N’-tetramethylethylenediamine a good ligand for lithium?» Coolum D. B. Acc. Chem. Res., 25,448 (1992).
67. Reich H. J., Phillips N. H, Reich 1. L. J. Am. Chem. Soc., 107,4101 (1985).
68. Saulnier M. G., Gribble G. IV. J. Org. Chem., 47,757 (1982).
69. Fraser R. R., Mansour T. S., Savard S. Can. J. Chem., 63, 3505 (1985).
70. Von Rague SchleverP., Clark T., Kos A. J., Spitznagel G. W., Rohde C, Arad D., Houk К N., Rondan N. G. J. Am. Chem. Soc., 106,6467 (1984).
71. Carpita A., Rossi R., Veracini C. A. Tetrahedron, 41, 1919 (1985).
72. Feringa B. L., Hulst R., Rikers R., Brandsma L. Synthesis, 1988,316.
73. Carpenter A. J., Chadwick D. J. Tetrahedron Lett., 26,1777 (1985).
74. Gronowitz S., Kada R. J. Heterocycl. Chem., 21,1041 (1984).
75. Hasan L, Marinelli E. R., Lin L.-C., Fowler E IV., Levy A. B. J. Org. Chem., 46, 157 (1981).
76. Например, для бензо [^тиофена и бензо[6]фурана см.: Kerdesky F. A. J., Basha А. Tetrahedron Lett., 32,2003 (1991).
77. Moyer М. Р., Shiurba J. Е, Rapoport Н. J. Org. Chem., 51, 5106 (1986).
78. «Metallation and metal-halogen exchange reactions of imidazoles», Oddon B. Heterocycles, 23,41 (1985).
79. Однако см.: KatritzkyA. R., Slawinski J. J., Brunner F., Gorun S. J. Chem. Soc., Perkin Trans. 1,1989,1139.
80. LipshutzB. H., HuffB., Hagen W. Tetrahedron Lett., 29,3411 (1988).
81. KatritzkyA. R., Rewcastle G. W., Fan W.-Q. J. Org. Chem., 53,5685 (1988); Heinisch G.t Holzer W., Pock S. J. Chem. Soc., Perkin Trans. 1,1990,1829.
82. «Ring-opening of five-membered heteroaromatic anions», Gilchrist T. L. Adv. Heterocycl. Chem., 41,41 (1987).
83. Dickinson R. P., Iddon B. J. Chem. Soc. {C), 1971,3447.
84. Verbeek J., George A. V. E., De Jong R. L. P., Brandsma L. J. Chem. Soc., Chem. Commun., 1984, 257; Verbeek J., Brandsma L. J. Org. Chem. 49, 3857 (1984).
85. Kessar S. V, Singh P., Singh K. N., Dutt M. J. Chem. Soc., Chem. Commun., 1991, 570.
86. Zoltewicz J. A. Helmick L. S. J. Am. Chem. Soc., 92, 7547 (1970); Zoltewicz J. A., Cantwell V. W. J. Org. Chem., 38, 829 (1973); Zoltewicz J. A., Sale A. A. J. Am. Chem. Soc., 95,3928 (1973).
87. Mallet M. J. Organomet. Chem., 406,49 (1991).
88. Miah M. A. J., Snieckus V., J. Org. Tetrahedron Lett., 21,5436 (1985).
89. Gribble G. Saulnier M. G. Tetrahedron Lett., 21,4137 (1980).
90. Ronald R. C, Winkle M. R. Tetrahedron, 39, 2031 (1983).
91. Estel L., Linard E, Marsais E, Godard A., Queguiner G. J. Heterocycl. Chem. 26,105 (1989).
92. Sengupta S., Snieckus V. Tetrahedron Lett., 31,4267 (1990).
93. Alo В. I., Familoni О. B., Marsais E, Queguiner G. J. Heterocycl. Chem., 29, 61 (1992).
94. Beaulieu F., Snieckus V. Synthesis, 1992, 112; Tsukazjaki M., Snieckus V. Heterocycles, 33,533(1992).
95. Kelly T. R., Xu W., Sundaresan J. Tetrahedron Lett., 34,6173 (1993).
96. Marsais E, Le Nard G, Queguiner G. Synthesis, 1982, 235.
97. Godard A., JaquelinJ.-M., Queguiner G. J. Organomet. Chem., 354, 273 (1988).
98. Kress T. J. J. Org. Chem., 44, 2081 (1979); Frissen A. E., Marcelis A. T. M., Buur-man D. G, Pollmann C.A.M., van derPlas H. C. Tetrahedron, 45,5611 (1989); TurckA., Pie N., Majovic L., Queguiner G. J. Heterocycl. Chem., 27,1377 (1990).
99. Turk A., Mojovic L., Queguiner G. Synthesis, 1988, 881; Ward H. S., Merrit L. J. Heterocycl. Chem., 28,765 (1991).
100. Turner R. M., Ley S. V.f Lindell S. D. Synlett., 1993, 748; Boymond L., Rottlander M., Cahiez G., KnochelP. Angew. Chem., Int. Ed. Engl. 37, 1701 (1998); Berillon L., Lepet-re A., Turck A., Pie N., Queguiner G, Cahiez G, Knochel P. Synlett., 1998, 1359; TrecourtF., Breton G., Bonnet V., Mongin E, MarsaisE, Queguiner G. Tetrahedron Lett., 40,4339 (1999);Abarbi M., DehmelF., KnochelP. ibid., 7449.
101. Furukawa N., Shibutani N., Matsumura K, Fujihara H, Oae S. Tetrahedron Lett., 27, 3899(1986).
102. «Preparation of aryl- and heteroaryltrimethylsilanes», Habich D., Effenberger F. Synthesis, 1979,841.
103. Florentin D., Roques В. Р.г Fournie-Zalaski M. C, Bull. Soc. Chim. Fr., 1976,1999.
104. Terashima M., Kakimi H, Ishikura M., Kamata K. Chem. Pharm. Bull., 31, 4573 (1983).
105. SongZ. Z., Than Z, К, Mak T. C. W., WongH N. C. Angew. Chem., Int. Ed. Engl., 32, 432 (1993); Zheng O., Yang Y., Martin A. R. Tetrahedron Lett., 34,2235 (1993).
106. Ishiyama T., Murata M., Miyaura N. J. Org. Chem., 60, 7508 (1995); Murata M., Watanabe S., Masuda Y ibid., 62,6458 (1997).
107. Frick U., Simchen G. Synthesis, 1984,929.
108. MajeedA. J., Antonsen 0., Benneche T, Undheim K. Tetrahedron, 45,993 (1989).
109. Shippey M. A., Dervan P. B. J. Org. Chem., 42, 2654 (1977); Babin P., Bennetau B., TheurigM., DunoguesJ. J. Organometal. Chem., 446,135 (1993).
110. Yanonoto K, YanagiA. Chem. Pharm. Bull., 30, 1731 (1982).
111. Fleming L, Taddei M. Synthesis, 1985, 898; Kondo K, Uchiyama D., Sakamaoto T, Yamanaka H. Tetrahedron Lett., 30,4249 (1989).
112. Hatanaka Y., Fukushima S., Hiyama T. Heterocycles, 30, 303, (1990).
113. Kang S.-К., Yamaguchi T, Hong R.-K., Kim Т.-H., Pyun S.-J. Tetrahedron, 53, 3027 (1997).
114. Ito H., SensuiH.-о., Arimoto R,t Miura K, HosomiA. Chem Lett., 1997,639.
115. Colvin L. Silicon reagents in Organic synthesis, Academic Press, 1988; Pereyre M., Quintard J.-P., Rahm A. Tin in organic synthesis, Butterworths, 1987; «Nonconventional electrophilic aromatic substitutions and related reactions», Hartshorn S. R. Chem. Soc. Rev., 3,167 (1974);«Unusual electrophilic substitution in the aromatic series via organosilicon intermediates», Bennetau B., DunoguesJ. Synlett, 1993, 171; «Tin for organic synthesis. VI. The new role for organotin reagents in organic synthesis», Neumann W. P. J. Organometal. Chem., 437,23, (1992); Cooper M. S., Fairhurst R. A., Heaney H, Papageorgiou G., Wilkins R. F. Tetrahedron, 45, 1155 (1989).
116. Pinkerton F. H,Thames S. F. J. Heterocycl. Chem., 6,433 (1969); ibid., 8, 257 (1971); ibid., 9, 67 (1972); Dondonl A., Dall’Occo T, Galliani G., Mastellari A., Medici A. Tetrahedron Lett., 25,3637 (1974).
117. Jutzi P., Gilge U. J. Heterocycl. Chem., 20, 1011 (1983); Dondoni A., Fantin G, Fogognolo M., Medici A., PedriniP. J. Org. Chem., 52, 3413 (1987).
118. Yamamoto Y., Yanagi A. Chem. Pharm. Bull., 30,2003 (1982).
119. Effenberger F, Schollkopf R. Angew. Chem. Int. Ed. Engl., 20, 266 (1991); Ricci A., Fiorenza M., Grifagni M. A., Bartolini G. Tetrahedron Lett., 23,5079 (1982).
120. Shimizu S, Ogata M. J. Org. Chem., 51,3897 (1986).
121. Dondoni A., Mastellari A. R., Medici A., NegriniE., Pedrini P. Synthesis, 1986,757.
122. Florentin D., Foumie-Zaluski M. C., Callanquin M., Roques В. P. J. Heterocycl. Chem., 13, 1265 (1976); Brandao M. A., De Oliveira A. B., Snieckus V. Tetrahedron Lett., 34, 2437(1993).
123. Bell A. S., Roberts D. A., Ruddock K. S. Synthesis, 1987, 843; Sakamoto T, Kondo Y.f Takazawa N., Yamanaka H. Heterocycles, 36,941 (1993); Browder С. C., Mitchell M. O., Smith R. L., el-Sulayman G. Tetrahedron Lett., 34,6245 (1993).
124. Sakamoto T, Kondo Y., Takazawa N. Yamanaka H Tetrahedron Lett., 34, 5955 (1993); Sakamoto T, Kondo Y, Murata N., Yamanaka H Tetrahedron, 49, 9713 (1993).
125. Prasad A. S. B., Stevenson T. M. Citineni J. R., Nyzam V.f Knochel P. Tetrahedron, 53, 7237 (1997).
126. Kondo Y, Shilai M., Uchiyama N., Sakamoto T. J. Am. Chem. Soc., 121,3539 (1999).
127. «Lateral lithiation reactions promoted by heteroatomic substitutcnts», Clark R. D., JahingerA. Org. React., 47,1 (1995).
128. Fraser R, R., Mansour T. S, SavardS. J. Org. Chem., 50, 3232 (1985).
129. Hamana H, Sugasawa T. Chem. Lett., 1984,1591.
130. Naruse Y., Ito Y., InagakiS. J. Org. Chem., 56,2256 (1991).
131. Katritzky A. R., Akutagawa K. J. Am. Chem. Soc., 108,6808 (1986).
132. Noyce D. S., Stowe G, T., Wong W. J, Org. Chem., 39,2301 (1974).
133. «Carbon-carbon bond formation in heterocycles using Ni- and Pd-catalysed reactions», Kalinin V. N. Synthesis, 1992,413; «Transition metals in the synthesis and functionali-dation of indoles», Hegedus L. S. Angew. Chem., Int. Ed. Engl., 27 1113 (1988); «Synthesis of condensed heteroaromatic compounds using palladium-catalysed reactions», Sakamoto T, Kondo Y.t Yamanaka H, Heterocycles, 27, 2225 (1988); «Organometallics in coupling reactions in я-deficient azaheterocycles», Undheim K, Benneche T. Adv. Heterocycl. Chem. 62, 305 (1995); «Connection between metalation of azines and diazines and cross-coupling strategies for the synthesis of natural and biologically active molecules», Godard A., Marsais E, Pie N.t Trecourt E, Turck A., Queguiner G. Heterocycles, 40, 1055 (1995).
134. Heck R.F. Palladium reagents in organic synthesis, Academic Press, 1985; Collman J. P., Hegedus L. S., Norton J. R., Finke R. G. Principles and applications of organotransition metal chemistry, University Science Books, 1987.
135. Ali N. M., McKillop A., Mitchell M. B., Rebelo R. A., Wallbank P. J. Tetrahedron, 40, 8117(1992).
136. Lohse O., Thevenin P,, Waldovogel E. Synlett, 1999,45.
137. Stock L. M., Tse K, Vorvick L, J., Waistrum S. A. J. Org. Chem., 46,1757 (1981).
138. «Cyclopalladated complexes in organic synthesis», Ryabov A. D. Synthesis, 1985, 233; «Mechanisms of intramolecular activation of C-H bonds in transition metal complexes», Ryabov A. D. Chem. Rev., 90,403 (1990).
139. «Palladium catalysed vinylation of organic halides», Heck R. E Org. React., 27, 345 (1982).
140. Frank W. C., Kim Y C.t HeckR. E J. Org. Chem., 43, 2947 (1978).
141. Itahara T., Ikeda M., Sakakibara T., J. Chem. Soc., Perkin Trans. 1,1983,1361.
142. Tsuji J., Nagashima H. Tetrahedron, 46,2699 (1984).
143. Grigg R., Savic V. Tetrahedron Lett., 38,5737 (1997).
144. Arcadi A., Burini A., Cacchi S., Delmastro M., Marinelli E, Pietrani B. Synlett, 1990,47; Sakamoto T., Kondo Y., Watanabe R,, Yamanaka H. Chem. Pharm. Bull., 34, 2719 (1986); Sakamoto T., Katoh E., Kondo Y., Yamanaka H, Heterocycles, 27, 1353 (1988).
145. Ali N. M., McKillop A., Mitchell M. B., Rehelo R. A., Wallbank P. J. Tetrahedron, 37, 8117(1992).
146. Thompson W. J. Gaudino J. J. Org. Chem., 49, 5237 (1984); Yang K, Hornfeldt A.-B., Gronowitz S. J. Heterocycl. Chem., 26,865 (1989).
147. Dondoni A., Fantin G., Fogagnolo M., Medici A., Pedrini P. Synthesis, 1987, 693; Bailey T. R. Tetrahedron Lett., 27,4407 (1986).
148. HeadR. A., IbbotsonA. Tetrahedron Lett., 25,5939 (1984); Baillargean И P,, Stille J. К J. Am. Chem. Soc., 105,7175 (1985).
149. «The reduction of nitrogen heterocycles with complex metal hydrides», Lyle R. E, Anderson P. S. Adv. Heterocycl. Chem., 6, 46 (1966); «The reduction of nitrogen heterocycles with complex metal hydrides», Reay J. G. ibid., 39,1 (1986).
150. «Biocatalysis», Petersen M., KienerA. Green Chem., 1, 99 (1999); «Biotransformations
for fine chemical production», Meyer H. P. KienerA., Imwinkelried R., Shaw N. Chimia, 51,287 (1997); «Biotechnological processes in the fine chemicals industry», Birch О. M., Brass J. M., KienerA., Robins K, Schmidhalter D., Shaw N., Zimmermann T. Chim., Oggi, 13,9 (1995); «Biosynthesis of functionalised aromatic N-heterocycles», KienerA. Chemtech, 25, 31 (1995).
151. KienerA., GlockerR., Heinzmann K. J. Chem. Soc., Perkin Trans. 1,1993,1201.
152. Kiener A. Angew. Chem., Int. Ed. Engl., 31,774 (1992).
153. Boyd D. R., Sharma N. D., Boyle R., McMurray В. T., Evans T. A., Malone J. F., Dalton H., Chima J., Sheldrake G. N. J. Chem. Soc., Chem. Common., 1993, 49; BoydD. R., Sharma N. D., Brannigan I. N., Haughey S. A., Malone J. E, Clarke D. A., Dalton H. Chem. Commun., 1996, 2361.
154. «Enzymatic dihydroxylation of aromatics in enantioselective synthesis: expanding asymmetric methodology», Hudlicky T., Gonzalez D., Gibson D. T. Aldrichimica Acta, 32,35 (1999).
155. Sloan M. J., Phillips R. S. Bioorg. Med. Chem. Lett., 2,1053 (1992).
СИНТЕЗ АРОМАТИЧЕСКИХ
ГЕТЕРОЦИКЛИЧЕСКИХ СОЕДИНЕНИЙ
При получении бензоидных соединений практически всегда исходят из подходящим образом замещенного, легко доступного производного бензола. Лишь в крайне редких случаях возникает необходимость использовать в качестве исходного ациклическое соединение и конструировать бензольное кольцо в ходе синтеза. Синтез гетероароматических соединений представляет собой совершенно иную картину, поскольку они чаще всего включают построение гетероциклической системы [1]. Конечно, при выборе метода синтеза конкретной гетероциклической структуры следует прежде всего рассмотреть возможность использования коммерчески доступного соединения, уже содержащего желаемое гетероциклическое ядро, которое может быть подвегнуто различным модификациям, введению и/или удалению заместителей [2]. Например, при синтезе триптофана используют в качестве исходного соединения индол (разд. 17.12). В том же случае, когда очевидный путь синтеза желаемого гетероциклического соединения не найден, следует синтезировать такое соединение, содержащее тот же гетероциклический фрагмент и определенные заместители, дальнейшие превращения которого привели бы к целевой молекуле.
В данной главе приведены основные принципы, позволяющие уяснить методы, на первый взгляд различные, используемые для конструирования гетероциклических ароматических соединений из предшественников, не содержащих гетероциклического фрагмента. Кроме того, обсуждаются принципы построения гетероциклов, анализируются типы реакций и возможные комбинации реагентов, приводящих к их образованию.
3.1. ТИПЫ РЕАКЦИЙ, ОБЫЧНО ИСПОЛЬЗУЕМЫЕ
ДЛЯ СИНТЕЗА ГЕТЕРОЦИКЛИЧЕСКИХ СОЕДИНЕНИЙ
Наиболее часто используются процессы присоединения нуклеофилов к карбонильной группе (или более реакционноспособной протонированной по атому кислорода карбонильной группе). Когда в качестве нуклеофила выступает р-атом углерода енола, енолят-аниона или енамина, такие реакции (альдольного типа) приводят к образованию связи углерод — углерод:
В том же случае, когда нуклеофилом служит либо анионный (Х~), либо нейтральный (ХН) гетероатом, образуется связь углерод — гетероатом:
Во всех случаях происходит последующее отщепление молекулы воды, что приводит к образованию двойных связей углерод — углерод или углерод — гетероатом. Простые примеры таких процессов — образование продукта альдольной конденсации и образование имина или енамина соответственно.
Эти два процесса с небольшими вариациями лежат в основе классических синтезов гетероароматических соединений. В некоторых случаях используются также реакции нуклеофильного замещения атома галогена или другой уходящей группы при насыщенном атоме углерода. Другая категория синтезов основана на электроциклических процессах (см. разд. 3.4) и реакциях, катализируемых палладием(О), которые приводят к замыканию цикла (разд. 2.7.2.4).
3.2. ТИПИЧНЫЕ КОМБИНАЦИИ РЕАГЕНТОВ
Хотя существует множество примеров, определяемых ретросинтетическим анализом, близких комбинаций реагентов для построения пяти- и шестичленных гетероциклических соединений, все основные подходы к конструированию таких гетероциклов можно разделить на две группы. Первая группа связана с замыканием цикла в результате образования связи углерод — гетероатом,
т. е. скелет будущей молекулы уже присутствует в ациклическом предшественнике. Вторая группа связана с образованием при замыканнии цикла одной связи углерод — гетероатом и одной связи углерод — углерод. Подобные синтезы известны как для пяти-, так и для шестичленных гетероциклических соединений.
3.2.1.1.
Теперь мы можем привести конкретные примеры синтезов гетероароматических соединений и проследить, каким образом упомянутые выше принципы построения гетероциклических фрагментов приводят к образованию гетероароматических соединений. В синтезах первой группы для замыкания гетероцикла необходимо лишь образование связи углерод — гетероатом. При синтезе пятичленных гетероциклических соединений необходимо использовать дикарбо-нильное соединение, содержащее карбонильные группы в положениях 1 и 4. Например, 1,4-дикетоны при взаимодействии с аммиаком или первичными аминами образуют 2,5-дизамещенные пирролы:
3.2.1.2.
При синтезе шестичленных гетероциклических соединений 1,5-дикарбониль-ное соединение, содержащее двойную связь углерод — углерод, при взаимодействии с аммиаком образует ароматическую систему (в том случае, когда используется насыщенное 1,5-дикарбонильное соединение, образуется дигидропроизводное, которое легко окисляется в соответствующее ароматическое соединение):
3.2.2.
Вторая группа синтезов связана с образованием связей С—С и С-гетероатом. Один компонент должен содержать енольный, енолятный или енаминный фрагмент (или быть эквивалентом таких соединений), в то время как второй должен обладать соответствующими электрофильными центрами. Ниже приведены примеры таких комбинаций для синтеза пятичленных и шестичленных гетероциклических соединений:
Примечания
1. Заместитель R в двух последних реакциях, должен повышать кислотность соседних атомов водорода (R = кетонная, сложноэфирная, нитрильная и иногда нитротруппа).
2. Некоторые из компонентов, показанных на схеме, обладают двумя электрофильными центрами, другие одновременно содержат электрофильный и нуклеофильный центры. В целом, реагенты, которые содержат два реакционноспособных центра либо в 1,2-, либо в 1,3-положениях, широко применяются в синтезе гетероциклических соединений. Можно использовать также 1,4- (например, НХ—С—С—YH, где X, Y—гетероатомы) и 1,5-бифункцио-нальные соединения (например, О=С—(С)з—С=О). Кроме того, в синтезе гетероциклических соединений часто используются «одноуглеродные» реагенты (производные муравьиной и угольной кислот, например фосген и другие). Среди наиболее часто применяемых 1,2-бифункциональных соединений — 1,2-дикарбонильные соединения, енолы (которые первоначально вступают в реакции с участием нуклеофильного атома углерода, а затем с участием электрофильного карбонильного атома углерода), Hal—С—С=О и системы, содержащие фрагмент НХ—YH. Среди часто используемых 1,3-бифункцио-нальных соединений — диэлекгрофильные 1,3-дикарбонильные соединения, ос,р-непредельные карбонильные соединения (С=С—С=О), биснуклео-фильные реагенты общей формулы HX-C-YH (например, амидины и моче
вина). В качестве 1,3-бисфункциональных соединений также используются а-амино- и а-гидроксикарбонильные соединения (НХ—С—С=О), которые одновременно содержат электрофильный и нуклеофильный реакционные центры.
3. Точная последовательность стадий — нуклеофильное присоединение, депротонирование, протонирование и дегидратация, — приводящих к образованию гетероцикла, никогда не известна. Однако последовательность, приведенная на схеме, наиболее вероятна. В действительности порядок стадий может существенно варьироваться в зависимости от условий проведения процесса, в частности от pH среды [3].
4. В том случае, когда используются компоненты, аналогичные ос-галогено-карбонильным соединениям, и цикл замыкается в результате замещения атома галогена, процесс реализуется по экзо-тет-типу. Если же замыкание цикла происходит в результате атаки по атому углерода карбонильной или нитрильной групп, реализуются экзо-триг- и экзо-диг-процессы соответственно [4].
5. Если в качестве карбонильной компоненты используется производное карбоновой кислоты (как, например, амид во втором примере на приведенной выше схеме), в результате замыкания цикла образуется соединение, содержащее кислородный заместитель при атоме углерода (пиридон в упомянутом примере). При использовании нитрильной группы вместо карбонильной в качестве электрофильного центра в результате замыкания цикла образуются соединения, содержащие аминогруппу при атоме углерода:
Два нуклеофильных центра одновременно могут быть гетероатомными, как в случае синтеза пиримидинов и пиразолов:
В синтезе бензаннелированных гетероциклических систем фенолы можно использовать в качестве аналогов енолов, а анилины — в качестве аналогов енаминов [5].
3.3. ВЫВОДЫ
Химические процессы, приводящие к образованию гетероциклических систем, в большинстве своем простые и прямые, даже если при первом взгляде на формулы исходных соединений и продуктов их превращений сами превращения кажутся почти алхимическими. При написании последовательностей стадий, приводящих к образованию гетероциклических соединений, очень важно избежать явных ошибок, например, предполагая, что электрофильный реагент взаимодействует с электрофильным центром или нуклеофильный реагент — с центром с повышенной электронной плотностью. В целом, достаточно просто предложить правомерный механизм образования гетероциклических соединений.
н+
(-2Н2О)г
Ниже приведен подробнейший анализ реакции 1,3-дифенилпропан-1,3-диона с ацетофеноном. Такое взаимодействие включает большое число стадий, но каждая из них чрезвычайно проста, если ее рассматривать отдельно.
Приведенная выше последовательность включает на первом этапе нуклеофильную атаку енола ацетофенона по протонированному по атому кислорода карбонильной группы 1,3-дикетона. Вполне правдоподобен и приведенный ниже вариант первоначального взаимодействия — нуклеофильная атака енольной гидроксильной труппы 1,3-дикетона по протонированной карбонильной группе ацетофенона:
В заключение следует отметить, что большинство стадий в последовательностях, приводящих к образованию гетероциклических соединений, обратимы. В целом, такие последовательности все-таки приводят к образованию продуктов реакции в том случае, если последние представляют собой наиболее термодинамически стабильные молекулы, или вследствие того, что продукты реакции удаляются из равновесной системы дистилляцией или кристаллизацией. Прекрасная иллюстрация вышесказанного — взаимные превращения 1,4-дикетонов и фуранов. Фураны можно получить при нагревании 1,4-дикетонов в присутствии кислоты, причем образующиеся фураны удаляются из реакционной среды дистилляцией (разд. 15.13.1.1). В то же время 1,4-дикетоны можно получить при гидролизе фуранов в присутствии кислоты (разд. 15.1.1).
3.4. ЭЛЕКТРОЦИКЛИЧЕСКИЕ ПРОЦЕССЫ
В СИНТЕЗЕ ГЕТЕРОЦИКЛИЧЕСКИХ СОЕДИНЕНИЙ
При синтезе гетероциклических соединений используется два типа электроцик-лических процессов: реакции 1,3-диполярного циклоприсоединения и реакция Дильса — Альдера с участием азадиенов [6]. Последние обычно не. приводят к образованию ароматических гетероциклических соединений, и, хотя имеют существенное значение, в этом разделе не будут рассматриваться.
1,3-Диполи обязательно содержат либо зр-, либо зр? -гибридизованный центральный гетероатом. Среди прочих известны реакции циклоприсоединения азидов (N=N+—N~—R), нитрилоксидов (R-C=N+-O~) и нитрилилидов (R-C==N+-C“R2), в которых центральный атом — sp-гибридизованный атом азота, а также нитронов (R2C=N+(R)-O~), карбонилилидов (R2C=O+-C~—R2) и азометинилидов (R2C=N+(R)-C“—R2), содержащих sp2-гибридизованный центральный атом азота.
- +^R а—b ч ч
а—Ь=с а—b
ч —V
Очевидно, что 1,3-диполярное циклоприсоединение приводит к образованию пятичленных гетероциклических соединений [7], причем, как показано выше, возможно образование тетрагидро-, дигидрострукгур или ароматических молекул. 1,3-Диполярное циклоприсоединение алкенов с уходящими группами приводит к тому же результату, что и в случае алкинов.
r2n f
CH=CHPh
Асон, 20 *С (-C4H9N)r 46% **
Взаимодействие азидов в качестве 1,3-диполей с енаминами приводит к образованию 1,2,3-триазолов [8] в результате элиминирования из первоначально образующегося аддукта молекулы амина.
Большинство мезоионных соединений способно вступать в реакции 1,3-ди-полярного циклоприсоединения, причем последующее элиминирование малой молекулы, например, диоксида углерода, как в приведенном ниже примере, приводит к образованию ароматических гетероциклических соединений [9].
3.5. НИТРЕНЫ В СИНТЕЗЕ ГЕТЕРОЦИКЛИЧЕСКИХ СОЕДИНЕНИЙ [10]
Реакции внедрения по связи С—Н нитренов, — частиц с моновалентным, шестиэлектронным нейтральным атомом азота, обычно генерируемых при термолизе или фотолизе азидов (RN3 -> RN + N2) или при дезоксигенировании нитротруппы, — были использованы на ключевой стадии синтеза некоторых пятичленных и шестичленных ароматических соединений. В общем виде процесс может быть представлен следующим образом:
Возможности таких процессов можно проиллюстрировать на примере синтеза производных индола [11] [в частности кофермента метоксатина (см. также разд. 6.16.2.4)] и карбазола [12].
3.6. орто-ХИНОДИМЕТАНЫ В СИНТЕЗЕ ГЕТЕРОЦИКЛИЧЕСКИХ СОЕДИНЕНИЙ [13]
В последние годы существенное значение при синтезе полициклических соединений приобрели реакции, связанные с генерированием и дальнейшими превращениями орто-хинодиметанов. В этом разделе приведены наиболее важные методы генерования qpzwo-хинодиметанов и некоторые примеры их использования. Для построения циклов наибольшее значение имеют процессы, в которых o/wzo-хинодиметаны выступают в качестве диенов в реакциях Дильса-Альдера,
приводящих, как показано ниже, к образованию ароматических циклов [14]. Хотя спектральные и некоторые другие физические свойства ор/по-хинодимета-нов были изучены, эти соединения нестабильны, обладают высокой реакционной способностью и не могут быть выделены. Генерирование таких соединений обычно проводят в присутствии реагентов, способных взаимодействовать с ними. Аддукты ор/по-хинодиметанов с диоксидом серы используются для «хранения» таких соединений.
Легкость образования ортио-хинодиметанов связана со стабильностью ароматического соединения, из производного которого они образуются, и от степени двоесвязности двух соседних атомов углерода будущего хинодиметанового фрагмента. Первый аспект можно проиллюстрировать сравнением легкости образования тиофен-2,3-хинодиметана [15] и аналогичного производного фурана [16]. Фурановый орио-хинодиметан гораздо более стабилен, чем соответствующее производное тиофена. Образование такого производного тиофена из ароматического тиофена требует большей затраты энергии; кроме того, реакции тиофенового производного, вновь приводящие к образованию ароматической системы, проходят значительно легче, чем в случае фуранового ормо-хинодиметана.
Образование ор/ио-хинодиметанов происходит значительно легче, если степень двоесвязности ор/по-атомов углерода в предшественнике выше. Так, в случае пятичленных гетероароматических соединений легче образуются 2,3-хино-диметаны, а не их 3,4-аналоги. В действительности, для 3,4-хинодиметанов может быть написана резонансная структура, имеющая бирадикальный характер, и, следовательно, обладающая высокой энергией. В случае бициклических шестичленных ароматических соединений, например, хинолина [17], гораздо легче образуются 3,4-хинодиметаны, а не 2,3-аналоги. Это связано с тем, что при образовании 3,4-хинодиметанов не происходит потери в резонансной стабилизации второго цикла.
Основные стратегии, используемые для генерирования гетероциклических ор/ио-хинодиметанов, связаны с реакцией 1,4-элиминирования, хелетропным элиминированием диоксида серы из 2,5-дигидротиофен-8,S-диоксидов и элек-троциклическим раскрытием цикла в циклобутеновых производных гетероциклических соединений. Каждый из этих процессов, приводящих к образованию ор/ло-хинодиметанов, схематически приведен ниже: {х>Ш {хх-Чх] iMix
X
Возможность использования циклобутеновых производных гетероциклических соединений безусловно определяется возможностью синтеза таких соединений (см., например, разд. 11.14.2.3), однако в тех случаях, когда такие предшественники доступны, электроциклическое раскрытие циклобутенового цикла представляет собой наилучший способ генерирования o/wzo-хиноди-метанов. Раскрытие цикла происходит при простом нагревании циклобутеновых производных, как показано ниже. Первоначально образующийся аддукт Дильса—Альдера ароматизуется при взаимодействии с избытком хинона [18].
1,4-Элиминирование, приводящее к образованию о/иио-хинодиметана, может происходить при взаимодействии 1,2-бис(бромметил)производных гетероциклических соединений с иодидом натрия при нагревании [19], ор?ио-(три-метилсилилметил)гетаренметиламмониевых солей [20] и мезитилатов орто-(триметилсилилметил)гетаренкарбинолов [21] с фторид-ионом или при реакции ацетатов орио-(три-я-бутилстаннилметил)гетаренкарбинолов с кислотами Льюиса [21].
Метод, получивший в последние годы интенсивное развитие, — синтез индольных (и пиррольных [22]) орщо-хинодиметанов путем депротонирования N-ацилированных иминов индол-3-илкарбальдегида, — показан на приведенной ниже схеме [23]:
Наиболее общий метод генерирования ортяо-хинодиметанов, нашедший широкое применение, связан с экструзией молекулы диоксида серы из гетероциклических сульфонов. Сульфоны — предшественники ор/ио-хинодиметанов — обычно стабильные соединения, легко получаются различными способами. Кроме того, кислотность протонов, соседних с сульфоновой группой, позволяет вводить заместители в такие молекулы при использовании оснований перед стадиями термической экструзии молекулы диоксида серы и реакции Дильса-Альдера. Ниже приведено несколько примеров генерирования ор/ло-хинодиме-танов таким способом [24]:
Литература
1. «Synthesis of aromatic heterocycles,» Gilchrist T. L. J. Chem. Soc., Perkin Trans. 1,1999, 2849 и предыдущие обзоры этой серии.
2. «С-substitution of nitrogen heterocycles», Vorbriiggen H., Maas M. Heterocycles, 27, 2659 (1988) (обсуждаются реакции электрофильного и радикального замещения,
реакции литиирования и использование N-оксидов); «Regioselective substitution in aromatic six-membered nitrogen heterocycles», Commins D. L., O'Connor S. Adv. Heretocycl. Chem., 44,199 (1988) (обсуждаются реакции электрофильного, нуклеофильного, и радикального замещения, а также металлирования).
3. «The mechanism of heterocyclic ring closures», Katritzky A. R., Ostercamp D. L., YousafT. I. Tetrahedron, 43,5171 (1987).
4. Эти термины введены Болдуином для анализа возможности процессов циклизации с позиций стереоэлектронного рассмотрения и подробно описаны в книге: Deslonghamps Р. Stereoelectronic effects in organic chemistiy, Pergamon Press, 1983.
5. «Heteroannelations with о-aminoaldehydes», Caluwe P. Tetrahedron, 36, 2359 (1980).
6. Boger D. R., Weinreb S. M. Hetero Diels-Alder metodology in organic synthesis, Academic Press, 1987.
7. 1,3-Dipolar cycloaddition chemistry, Vols. 1 and 2, Padwa A. (ed.), Wiley-Interscience, 1984.
8. Nomura Y., Takeuchi Y, Tomoda S., ItoM. M. Bull. Chem. Soc. Jpn., 54,261 (1981).
9. Huisgen R., Gotthardt H, Bayer H. O., Schaefer E C. Chem. Ber., 103, 2611 (1970); Potts К. T., McKeough D. J. Am. Chem. Soc., 96,4268 (1974).
10. «Synthesis of heterocycles through nitrenes», Kametani T, Ebetino F. F., Jama-naka T., Nyu Y. Heterocycles, 2,209 (1974).
11. MacKenzie A. R., Moddy C. J., Rees C. W. J. Chem. Soc., Chem. Commun., 1983, 1372.
12. «Recent advances in the chemistry of carbazoles», Joule J. A. Adv. Heterocycl. Chem., 35, 84 (1984); «Phosphite-reduction of aromatic nitro-compounds as a route to heterocycles», Cadogan J. I. G. Synthesis, 1969,11.
13. «Heterocyclic ortho-quinodimethanes», Collier S. J., Storr R. C. Prog. Heterocycl. Chem., 10,25 (1998).
14. Carly P. R., Cappelle S. L., Compemolle E, Hoornaetr C. J. Tetrahedron, 52, 11889 (1996).
15. Munzel N, SchweigA. Chem. Ber., 121, 791 (1988).
16. Trahanovsky Ж S., Cassady T. J., Woods T. L. J. Am. Chem. Soc., 103, 6691 (1981).
17. White L. A., O'NeillP. M., ParkB. K, Storr R. C. Tetrahedron Lett., 37,5983 (1995).
18. Herrera A., Martinez R-, GonzdlezB., IllescasB., Matrin N, Seoane C. Tetrahedron Lett., 38,4873 (1997).
19. Metrzanos G. E., Stephanidou-Stephanatou J., Tsoleridis C. A., Alezandrow N. E. Tetrahedron Lett. 33, 4499 (1992); Alezandrou N. E., Mertzanos G. E. Stephanidou-Stephanatou J., Tsoleridis C. A. Zachariou P. ibid., 36, 6777 (1995); Metrzanos G. E., Pindur U., Gonzalez E, Mehrabani F. J. Chem. Soc., Perkin Trans. 1,1997, 1861.
20. Kinsman A. C., Snieckus V. Tetrahedron Lett., 40,2453 (1999).
21. Lin G.-B., Mori H., Katsumura S. Chem. Commum., 1996,2254.
22. Leusink E R., Ten Have R„ van derBergK. J., van Lewsen A. M. J. Chem. Soc., Chem. Commun., 1992,1401.
23. Magnus P., Gallagher T, Brown P., Pappalardo P. Acc. Chem. Res., 17, 25 (1984).
24. Ko C.-W., Chow T. Tetrahedron Lett., 38, 5315 (1997); Tome A. C., Cavaleiro J. A. S., Storr R. C. Tetrahedron, 52, 1723 (1996); Chen H.-С., Chou T. Tetrahedron, 54, 12609 (1998).
4
ОБЩАЯ ХАРАКТЕРИСТИКА РЕАКЦИОННОЙ СПОСОБНОСТИ ПИРИДИНОВ, ХИНОЛИНОВ И ИЗОХИНОЛИНОВ
пиридин
хинолин
Прежде чем начать детальное описание химии гетероциклических соединений, в промежутках между основными главами мы приводим сжатое и упрощенное описание типов реакций, простых реакции и их региохимических особенностей для групп родственных гетероциклических соединений. В данной главе рассматриваются пиридин как типичный представитель электронодефицитных шестичленных гетероциклических соединений и его бензоконденсированные аналоги — хинолин и изохинолин. Как и в других главах, посвященных рассмотрению общей характеристики реакционной способности гетероциклических соединений, в этой главе приводятся краткое описание реакций пиридина, простейшие примеры и общие рассуждения.
Типичные реакции пиридина
электрофильное присоединение нуклеофильное по атому азота с образованием
замещение по пирдиниевых солей
Формальное замещение группы СН в бензоле на атом азота приводит к весьма существенным изменениям реакционной способности: пиридин гораздо в меньшей степени склонен к реакциям электрофильного замещения, чем бензол, и в большей степени подвержен атаке нуклеофилами. В то же время пиридин вступает в реакции присоединения с рядом электрофильных агентов; в некоторых случаях такие реакции обратимы, а иногда приводят к образованию
выделяемых аддуктов. В результате такого присоединения происходит перенос неподеленной электронной пары атома азота к электрофилу и образуется «пиридиниевая» соль. Разумеется, что такое невозможно в случае бензола. Такой легкий перенос электронной плотности от атома азота пиридина к электрофильной частице возможен потому, что при этом не происходит разрушения ароматического секстета (ср. с пирролом, гл. 12). Пиридиниевые соли представляют собой ароматические соединения, хотя они и гораздо более поляризованы, чем нейтральные пиридины (см. разд. 1.2.3)
Электрофильное замещение в ароматических соединениях осуществляется как двухстадийный процесс: первоначально происходит присоединение электрофильной частицы (Х+), а затем элиминирование (Н+). Первая из этих стадий протекает медленнее и определяет скорость реакции. Качественные предсказания относительных скоростей замещения в различных положениях ароматического кольца можно сделать на основании рассмотрения структуры образующихся при присоединении электрофильных частиц ст-комплексов (интермедиатов Уэланда) с позиций оценки их относительной стабильности, которая отражает относительные энергии приводящих к ним переходных состояний.
Электрофильное замещение при атоме углерода, по крайней мере в случае простых производних пиридина, протекает очень сложно по сравнению с бензолом; так, например, реакция Фриделя—Крафтса вообще не характерна для пиридина. Такая низкая реакционная способность пиридина может быть связана с двумя факторами:
Очень низкая скорость
Н
2) низкой реакционной способности пиридина
реакции из-за
1) низкой концентрации
, нейтрального пиридина,
положительно заряженного интермедиата
Очень низкая скорость реакции из-за большой энергии d образования дважды
N'
X
1. В реакционной среде, содержащей электрофильные частицы, пиридин немедленно превращается в пиридиниевый катион в результате присоединения электрофила (протона или кислоты Льюиса) по атому азота. Степень такого превращения зависит от природы и концентрации электрофильных реаген-
Общая характеристика реакционной способности пиридинов, хинолинов и изохинолинов 95 тов (или протонов) и основности пиридина и обычно очень высока, вплоть до полного превращения нейтрального пиридина в пиридиниевый катион. Очевидно, что положительно заряженный пиридиниевый катион гораздо в меньшей степени склонен к реакциям с электрофилами, чем нейтральный пиридин. Таким образом, электрофильная частица вынуждена атаковать либо положительно заряженный катион, либо нейтральную молекулу пиридина, концентрация которой в реакционной смеси чрезвычайно мала.
2. Все атомы углерода пиридинового цикла обеднены электронами, особенно атомы углерода в а- и у-положениях. Образование a-комплекса в результате присоединения электрофильной частицы по a-положению крайне невыгодно. Наименее дезактивировано p-положение, поскольку среди резонансных форм катиона, образующегося при присоединении электрофила по этому положению, отсутствует резонансная форма (показаны в скобках для интермедиатов, образующихся в результате атаки по положениям а и у ) с положительно заряженным атомом азота, которая наиболее нестабильна. Такая ситуация имеет прямую аналогию с ситуацией, возникающей при рассмотрении электрофильного замещения в нитробензоле и при объяснении наблюдаемого в последнем случае замещения по мета-положению.
интермедиаты, образующиеся
при атаке электрофилом по р-положению
интермедиаты, образующиеся
при атаке электрофилом по а-положению
интермедиаты, образующиеся
при атаке электрофилом по Y-положению
Заместители оказывают такое же влияние на легкость электрофильной атаки, как и в случае бензола. Сильные элекгроноакцепторные заместители приводят к еще большей инертности пиридинового цикла, в то время как активирующие заместители, такие, как амино-, гидрокси- или даже алкильные группы, облегчают электрофильное замещение и делают его возможным даже в протонированном пиридине, т. е. через образование дикатионного интермедиата. Галогенные заместители, которые ослабляют основные свойства пиридина и незначительно дезактивируют пиридиновое кольцо к реакциям с электрофилами, действуют иначе — приводят к повышению концентрации непротонирован-ного пиридина в реакционной смеси.
Пиридиновое кольцо, аналогично бензольному, устойчиво к действию окислителей. Каталитическое восстановление пиридинового цикла вдет гораздо легче, чем бензойного, особенно в кислых средах. Аналогично N-алкил- и N-арил-
пиридиниевые соли легко восстанавливаются как водородом в присутствии катализатора, так и при действии нуклеофильных восстанавливающих агентов.
Нуклеофильное замещение в ароматических соединениях протекает как двухстадийный процесс: первоначально происходит присоединение нуклеофила (Y~), а затем элиминирование отрицательно заряженной частицы (чаще всего НаГ"), причем первая из этих стадий протекает медленнее и определяет скорость процесса в целом. Это так называемый механизм SnAE (Substitution Nucleophilic Addition Elimination — замещение нуклеофильное присоединение элиминирование). Скорости замещения в различных положениях кольца можно оценить на основании рассмотрения структуры отрицательно заряженных интермедиатов (комплексов Мейзенгеймера), образующихся при присоединении нуклеофилов. При этом следует принимать во внимание, что относительная стабильность этих интермедиатов (степень делокализации отрицательного заряда) отражает относительную энергию переходных состояний, приводящих к этим интермедиатам. Например, 2- и 4-галогенонитробензолы вступают в реак-циии нуклеофильного замещения, поскольку образующиеся анионные аддукты стабилизированы в результате делокализации отрицательного заряда с участием нитрогруппы.
Электронодефицитный характер атомов углерода пиридинового цикла, особенно в положениях а и у, приводит к тому, что реакции нуклеофильного присоединения и особенно реакции нуклеофильного замещения атома галогена (или другой хорошей уходящей группы), является важным аспектом химии пиридина.
нуклеофильное замещение в а- и Y-положениях — очень важный аспект химии пиридина
Нуклеофильное замещение в пиридинах протекает по тому же механизму, что и в случае 2- и 4-галогенонитробензолов, т. е. первоначально происходит присоединение нуклеофила, а затем элиминирование галогенид-иона. Аналогично ситуации, характерной для производных бензола, присоединение нуклеофила облегчается пониженной электронной плотностью в а- и у-положениях пиридина, что усиливается наличием галогенов в качестве заместителей в этих положениях и способностью гетероатома участвовать в делокализации отрицательного заряда. Сравнение трех возможных интермедиатов наглядно демонстрирует, что участие гетероатома в делокализации отрицательного заряда невозможно при присоединении нуклеофила по p-положению. Таким образом, нуклеофильное замещение по p-положению характеризуется гораздо меньшей скоростью и для практических целей неприменимо.
интермедиаты, образующиеся
при атаке нуклеофилом по а-положению а-галогенопиридина
интермедиаты, образующиеся
при атаке нуклеофилом по у-положению у-галогенопиридина
интермедиаты, образующиеся
при атаке нуклеофилом по р-положению 0-галогенопиридина
Полезно также сравнить реакционную способность а- и у-галогенопириди-нов с реакционной способностью ацилгалогенидов и р-галоген-а,р-непредель-ных кетонов. Для тех и других также характерно легко протекающее нуклеофильное замещение по механизму присоединение — элиминирование.
Метод введения заместителей (особенно углеродсодержащих) в ароматическое кольцо, использующий реакции предварительно генерированных металлированных производных ароматических соединений с электрофильными реагентами, приобретает все более важное значение. Атомы иода и брома в любом положении пиридинового кольца могут легко обмениваться с литием при низких температурах без побочных процессов нуклеофильного замещения или присоединения с образованием пиридиллитиевых производных.
использование
RLi х низкая температура
пиридилллитиевых производных как нуклеофилов — важный метод введения электрофильных заместителей
X
В отсутствие галогенных заместителей в а- и у-положениях пиридиновый цикл менее активен в реакциях с нуклеофилами; кроме того, из-за отсутствия уходящей группы невозможно нуклеофильное замещение. Присоединение нуклеофилов, тем не менее, происходит, однако образующиеся при этом дигидропиридины требуют дальнейшего окисления для удаления «гидрид-иона» и завершения процесса замещения. Такие процессы, например с амидами металлов или металлоорганическими реагентами, протекают селективно по а-положе-нию, вероятно, потому, что первоначально образуется комплекс, включающий взаимодействие кольцевого атома азота и катиона металла, связанного с реаген-
Глава 4
том. Наиболее ценный в синтетическом плане процесс связан с присоединением металлоорганических реагентов к Ы+-пиридиниевым солям. Образующиеся при этом дигидропиридины стабильны, поскольку атом азота включен в амидный или, чаще, уретановый фрагмент.
Реакции радикального замещения в пиридинах в кислых средах используются в настоящее время для препаративных целей. Для успешной реализации такого процесса радикальная частица должна обладать нуклеофильными свойствами, например • CHjOH, алкил- или ацил-радикалы. Пример реакции радикального аминокарбонилирования пиридина представлен ниже:
hconh2 --------
КОНЦ. H2SO4, FeSO4 \ -2^ [h2nco]
conh2
Пиридины с гидроксильными заместителями в а- и у-положениях существуют в виде таутомеров с карбонильной группой — пиридонов. Тем не менее, наблюдается некоторое сходство реакционной способности пиридонов и фенолов. Так, пиридоны активированы к реакциям электрофильного замещения, причем замещение протекает по орто- и wapa-положениям относительно кислородного заместителя. Пиридоны при потере атома водорода группы NH легко образуют анионы, которые по своей структуре и реакционной способности аналогичны фенолятам; в зависимости от условий возможны реакции таких анионов как по атому кислорода, так и по атому азота.
CI
Основное отличие пиридонов от фенолов состоит в том, что первые способны под действием галогенидов фосфора и серы превращаться в соответствующие галогенопроизводные. В этом случае пиридоны реагируют аналогично амидам, и неорганические реагенты первоначально взаимодействуют с «амидным» атомом кислорода.
Пиридиновый цикл оказывает существенное влияние на алкильные заместители в а- и у-положениях. Протоны алкильных трупп в этих положениях обладают заметной подвижностью, поскольку образующийся при удалении этих протонов «енаминатный» анион стабилизирован в результате делокализации отрицательного заряда. Такое свойство алкильных групп в этих положениях черезвычайно полезно для различных химических превращений в боковой цепи пиридина.
Пиридиниевые соли, как обсуждалось выше, весьма устойчивы к действию электрофильных агентов, но при этом легко вступают в реакции с нуклеофильными реагентами. Кислотность алкильных заместителей в а- и у-положениях пиридиниевого катиона существенно выше, чем нейтрального алкилпиридина.
Me
Пиридин-Ь1-оксиды — особенно важные и полезные в синтетическом плане производные пиридина, не имеющие аналогий в ряду производных бензола. Строение N-оксидов пиридинов обеспечивает их большую склонность к реакциям электрофильного замещения и одновременно к реакциям с нуклеофилами по сравнению с самими пиридинами, что может показаться на первый взгляд удивительным. Действительно, с одной стороны, формально отрицательно заряженный атом кислорода пиридин-N-оксидов способен принимать участие в стабилизации интермедиатов реакции электрофильного замещения, а, с другой, положительно заряженный атом азота облегчает присоединение нуклеофилов.
электрофильное замещение в N-оксидах протекает легче, чем в пиридинах
нуклеофильное замещение в N-оксидах протекает легче, чем в пиридинах
Существует ряд синтетически полезных процессов, в которых N-оксидная функция используется для введения заместителей в пиридиновый цикл (преимущественно в a-положение) и впоследствии удаляется. Реакция пиридин-N-OKcn-да с тионилхлорвдом представляет собой один из примеров таких процессов
Хинолин и изохинололин — две возможные структуры, в которых бензольное кольцо аннелировано к пиридиновому. Эти две структуры дают возможность обнаружить эффекты, возникающие при сочленении одного ароматического фрагмента с другим, т. е. влияние бензольного кольца на реакционную способность пиридинового, и наоборот. Также следует рассмотреть свойства этих структур по сравнению со свойствами нафталина. Так, характерная для нафталина а-региоселектиность реакций электрофильного замещения наблюдается и в хинолине и в изохинолине — замещение проходит по положениям 5 и 8. Следует отметить, что электрофильное замещение в хинолине и изохинолине обычно включает атаку электрофильной частицей по аддукту гетероциклической молекулы с электрофилом (обычно протоном), что дезактивирует гетероцикл к реакциям с электрофилами.
Точно также, как и в случае нафталина, предпочтительность атаки электрофилом по a-положению может быть объяснена при рассмотрении возможных интермедиатов; при электрофильной атаке по положениям 5/8 хинолина и изохинолина делокализация положительного заряда возможна без нарушения ароматичности пиридинового цикла. При атаке электрофилом по положениям 6/7 делокализация положительного заряда в образующихся интермедиатах возможна только с нарушением ароматичности пиридинового фрагмента.
Таким образом, реакции хинолина и изохинолина с электрофильными реагентами протекают по бензольному кольцу, в то время как реакции с нуклеофильными реагентами — по пиридиновому. Особенно легко такие процессы проходят с
участием а- и у- положений (относительно атома азота) и, кроме того, эти положения в хинолине и изохинолине более чувствительны к атаке нуклеофилами, чем в самом пиридине. Последнее объясняется тем, что в образующихся интермедиатах полностью сохраняется ароматичность бензольного кольца. Поскольку энергия резонансной стабилизации бициклической ароматической структуры существенно меньше, чем двойная энергия стабилизации бензола или пиридина, то и потеря в энергии стабилизации при образовании промежуточных аддуктов из бициклических систем значительно ниже, чем в случае пиридина. Таким образом, рассматриваемая ситуация полностью аналогична ситуации, возникающей при сравнении реакционной способности бензола и нафталина по отношению к электрофильным агентам: скорость реакции электрофильного замещения в нафталине значительно выше, чем в бензоле, поскольку образование о-комплексов из нафталина сопровождается меньшей потерей в энергии стабилизации.
-сП
Существенные отличия от такого типичного поведения наблюдаются для положения 3 изохинолина — особая реакционная способность а-положения пиридина, которая обсуждалась выше, свойственна и для положения 1 изохинолина, но не для положения 3. Так, в случае нуклеофильного замещения в 3-гало-геноизохинолине в образующемся интермедиате невозможна делокализация отрицательного заряда без нарушения ароматичности бензольного кольца. В результате такой интермедиат значительно менее стабилен, и реакционная способность положения 3 изохинолина понижена.
Атомы галогена во всех положениях пиридина и изохинолина можно заместить, используя каталитические реакции, обычно при применении палладия(О) в качестве катализатора (подробное обсуждение в см. разд. 2.7). Реакции сочетания галогенопроизводных пиридинового ряда с алкенами (реакция Хека), алкинами, алкенильными и арильными соединениями олова и бора существенно дополняются реакциями сочетания металлоорганических (чаще оловоорганических) производных пиридина, хинолина и изохинолина с алкенил- или арилгало-генидами и трифлатами. Эта синтетическая методология черезвычайно полезна и позволяет в одну стадию проводить такие превращения, успешное осуществление которых другими методами, если и возможно, то весьма затруднительно. Два примера использования этой методологии приведены ниже:
СН2=СНСО2Ме Pd(OAc)2, Ph3P Et3N, 140*С
72%
Существует огромное многообразие методов синтеза пиридинов. Наиболее очевидный подход к построению пиридинового цикла основан на реакции 1,5-дикарбонильных соединений, предпочтительно содержащих двойные связи, с аммиаком — присоединение аммиака по обеим карбонильным группам, сопровождающееся выделением воды, приводит к образованию пиридинового цикла. 1,4-Дигидропиридины, которые легко дегидрируются в полностью ароматические системы, можно получить при взаимодействии альдегида с двумя мольными эквивалентами 1,3-дикетона (или 1,3-кетоэфира) и аммиаком. Образование гетероцикла происходит в результате последовательно протекающих альдольной конденсации, реакции Михаэля и присоединении аммиака к концевым карбонильным ipynnaM на заключительной стадии.
+ nh3
-2Н2О
Практически все методы синтеза хинолинов используют в качестве исходных соединений ариламины. Как показано на приведенной ниже общей схеме, катализируемое кислотой взаимодействие ариламина с 1,3-дикарбо-нильным соединением включает присоединение аминогруппы к одной карбонильной группе и последующее замыкание ароматического цикла в результате реакции электрофильного замещения. Другой распространенный подход к синтезу хинолинов основан на реакции альдольного типа орио-аминобензаль-дегидов (или сходных по строению кетонов) с кетонами, обладающими а-ме-тиленовой группой.
Замыкание цикла в амидах 2-арилэтиламинов приводит к образованию дигидроизохинолинов, которые легко дегидрируются в полностью ароматические соединения. Для такого замыкания цикла используется фосфорилхлорид в качестве реагента, а сам процесс циклизации представляет собой реакцию внутримолекулярного электрофильного замещения.
-Н>0
5
ПИРИДИНЫ:
РЕАКЦИИ И МЕТОДЫ СИНТЕЗА
4(У)
(₽)
6 41,^2 (а) N
пиридин
Пиридин и его простые производные представляют собой стабильные относительно инертные жидкости с сильным резким запахом, неприятным для некоторых людей. Пиридины, особенно незамещенные, широко используются в качестве растворителей и оснований в реакциях N- и О-тозилирования и N- и О-ацилирования. Пиридин и монометилпиридины (пиколины) смешиваются с водой во всех отношениях.
Пиридин, аналогично пирролу, впервые был выделен из пиролизата костей. Название «пиридин» составлено из греческого слова «пир», что означает огонь, и суффикса «идин», применяемого в то время в названиях ароматических оснований, например фенетидин, толуидин и т. д. Пиридин и простые алкилпири-дины долгое время добывались из каменноугольной смолы, в которой они содержатся в большом количестве. В последние годы для получения пиридинов используются синтетические процессы. Так, например, пиридин сам по себе в промышленных масштабах может быть получен с выходом 60—70% газофазной высокотемпературной реакцией кротонового альдегида, формальдегида, водяного пара, воздуха и аммиака на алюмосиликатном катализаторе. Процессы, используемые для получения алкилпиридинов, включают реакции ацетиленов и нитрилов на кобальтовых катализаторах.
никотинамидадениндинуклеотид (NADP) ОН
никотин
Пиридиновое кольцо играет ключевую роль в некоторых биологических процессах, наиболее важные из них — окислительно-восстановительные процессы с участием кофермента никотинамидадениндинуклеотида (NADP). Витамин ниацин (никотинамид) или соответствующая кислота необходимы для биосинтеза NADP. Пиридоксин (витамин Вб) ихрает важную роль как кофермент в трансаминировании. Высокотоксичный алкалоид никотин — основной активный компонент табака, наркотик, обладающий наибольшим из известных эффектов привыкания [1].
изониазид сульфапиридин
приальдоксим
амлодипин
Многие синтетические производные пиридина применяются в качестве лекарственных средств. Например, изониазид — основное антитуберкулезное средство, сульфапиридин — один из сульфамидных антибактериальных препаратов, приальдоксим — антидот при отравлении органическими фосфатами, амлодипин — один из 1,4-дигидропиридинов, обладающих антигипертензивными свойствами. Среди гербицидов (паракват [2]) и фунгицидов (давицил) также встречаются производные пиридина. Немертеллин, синтез которого расссмотрен в разд. 5.15.2.4, представляет собой нейротоксин, выделенный из морских червей, а эпибатидин, выделенный из южноамериканской лягушки, используется в качестве анальгетика (синтез этого соединения описан в разд. 13.18.3.6).
давицил
эпибатидин
немертеллин
5.1. РЕАКЦИИ С ЭЛЕКТРОФИЛЬНЫМИ РЕАГЕНТАМИ
5.1.1. Присоединение к атому азота
В реакциях, при которых образование связи происходит с участием неподелен-ной пары электронов атома азота пиридинового цикла, таких, как протонирование и кватернизация, пиридины ведут себя аналогично третичным алифатиче
ским или ароматическим аминам. Когда пиридин участвует в реакции как основание или нуклеофил, образуется пиридиниевый катион, в котором сохраняется ароматический секстет и атом азота приобретает формальный положительный заряд.
5.1.1.1. Протонирование атома азота
Пиридин образует кристаллические, обычно гигроскопичные соли с большинством протонных кислот. Для незамещенного пиридина в водном растворе значение рАа 5,2, что свидетельствует о том, что основность пиридина много меньше, чем основность насыщенных алифатических аминов, для которых значения рАа обычно лежат в интервале 9—11. Поскольку сродство пиридина к протону в газовой фазе очень близко к сродству к протону алифатических аминов, наблюдаемое в растворе отличие связано с относительно сильной сольватацией аммонийных алифатических катионов [3]. Такое отличие может быть связано с возможностью мезомерной делокализации положительного заряда в пиридиниевом катионе и, как следствие, с меньшей потребностью во внешней стабилизации посредством сольватации.
Электронодонорные заместители обычно увеличивают основность; так, для 2-метил-, 3-метил- и 4-метилпириДинов значения рАа 5,97, 5,68 и 6,02 соответственно. Заместители, способные как к мезомерному, так и индуктивному взаимодействию с пиридиновым кольцом, оказывают более сложное влияние на основность пиридина; так, 2-метоксипиридин — более слабое основание, чем пиридин (рАа 3,3), а 4-метоксипиридин — более сильное (рАа 6,6). Индуктивное электроноакцепторное влияние атома кислорода проявляется тем в большей степени, чем ближе расположен заместитель к атому азоту, т. е. в положении 2. Объемные заместители в положениях 2 и 6 препятствуют протонированию атома азота: значение рАа для 2,6-ди-/пре/и-бутилпиридина меньше на единицу, чем для незамещенного пиридина, а 2,6-ди(три-изопропилсилил)пиридин не растворяется даже в 6 н. соляной кислоте [4].
5.1.1.2. Нитрование по атому азота (см. также разд. 5.1.2.2)
Нитрование по атому азота пиридина протекает легко при взаимодействии производных пиридина с солями нитрония, например с тетрафторборатом нитрония [5]. Протонные нитрующие агенты, такие, как азотная кислота, разумеется, приводят к образованию продуктов N-протонирования.
Тетрафторборат 1-нитро-2,6-диметилпиридиния — одна из многочисленных N-нитропиридиниевых солей, которые используются как некислотные нитрующие агенты, характеризующиеся хорошей субстратной и региоселекгивностью. Заместители в положениях 2 и 6 стерически препятствуют резонансному сопряжению нитрохруппы с пиридиновым циклом и, как следствие, повышают реакционную способность таких соединений как доноров нитрониевого иона. Однако 2,6-дигалогеноаналоги не обладают нитрующей способностью, что связано с большими стерическими препятствиями для подхода ароматического субстрата [6].
rto2 BF4"
EtgO, 2(TC J| I
Mex N Me
NO2
PhH
MeCN, 2СГС
bf4’
5.1.1.3. Аминирование по атому азота
Аминирование по атому азота пиридина возможно при использовании солей гидроксиламин-О-сульфокислоты [7]
ИОДИД 1-аминопиридиния i _
NH2 I
H2NOSO3H K2CO3, 90 ‘С
1 68%
Н2О2
АсОН, 65 ~С
95% **
N-оксид пиридина q-
5.1.1.4. Окисление атома азота
Аналогично другим третичным аминам, пиридины гладко реагируют с надкислотами с образованием соответствующих N-оксидов, обладающих разнообразными химическими свойствами (разд. 5.14)
5.1.1.5. Сульфирование по атому азота
Реакция пиридина с триоксидом серы [8] приводит к образованию коммерчески доступного, кристаллического цвиттерионного пиридиний-1-сульфоната — комплекса пиридинсульфотриоксид. Это соединение гидролизуется горячей водой с образованием серной кислоты и пиридина (реакции этого комплекса с гидроксидами описаны в разд. 5.13.4). Пиридинсульфотриоксид используется в качестве мягкого сульфирующего агента (разд. 13.1.3 и 15.1.3) и как активирующий агент для диметилсульфоксида в реакции окисления Моффата
so3
СН2С12, 20 *С
90%
Н2О нагревание
При взаимодействии пиридина с тионилхлоридом образуется полезное в синтетическом плане соединение, которое, например, может быть превращено в пиридин-4-сульфоновую кислоту. Полагают, что процесс включает первоначальную атаку атома серы по атому азота пиридина и последующее нуклеофильное присоединение второй молекулы пиридина по положению 4 (см. разд. 5.13.3) [9].
5.1.1.6. Галогенирование по атому азота
Пиридины легко реагируют с галогенами и интергалогенидами [10] с образованием кристаллических соединеий, не подвергающихся значительной диссоциации при растворении в тетрахлорметане. Структурно коплексы пиридина с галогенами представляют собой резонансные гибриды, аналогичные существующим в тригалогенид-анионах. Трифлат 1-фторпиридиния также представляет собой кристаллическое соединение и используется в качестве электрофильного фторирующего агента [11].
Brg, CCI4 70%
Соли, образующиеся при взаимодействии пиридина с галогенами, следует отличать от трибромида пиридиния, получаемого реакцией гидробромида пиридиния с бромом. Трибромид пиридиния не содержит связи азот — галоген, но включает в себя трибромид-анион. Трибромид пиридиния — стабильное, кристаллическое коммерчески доступное соединение, используемое в качестве источника молекулярного брома, особенно в тех случаях, когда необходимы небольшие точно известные количества.
трибромид пиридиния
5.1.1.7. Ацилирование по атому азота
Галогенангидриды карбоновых и арилсульфоновых кислот быстро реагируют с пиридинами с образованием 1-ацил- и 1-арилсульфонилпиридиниевых солей в растворе; некоторые из них в определенных условиях могут быть выделены в кристаллическом виде [12]. Растворы таких соединений, обычно в избытке пиридина, используются для получения сложных эфиров и сульфонатов из соответствующих спиртов, амидов и сульфамидов из аминов. 4-Диметиламинопири-дин (DMAP) [13] широко используется (в каталитических количествах) для ак-
тивации ангидридов кислот аналогичным образом. Соль, полученная из 4-диме-тиламинопиридина и /яре/л-бутилхлорформиата, стабильна даже в водном растворе при комнатной температуре [14].
95%
аминопиридин (DMAP)
PhCOCl MeCN, 3 *С затем NaBPh4
5.1.1.8. Алкилирование по атому азота
Алкилгалогениды и алкилсульфаты легко реагируют с пиридинами, образуя четвертичные пиридиниевые соли. Также, каки в случае алифатических третичных аминов, увеличение числа заместителей при атоме азота или при атоме углерода, несущем атом галогена, приводит к увеличению доли продуктов альтернативного конкурирующего процесса элиминирования — алкена и протонированного пиридина. Так, 2,4,6-триметилпиридин (коллидин) — полезное основание, используемое в реакциях дегидрогалогенирования.
5.1.1.9. Реакции комплексообразования
Обычно пиридины в присутствии катионов металлов образуют комплексные соединения с участием неподеленной пары электронов атома азота. Для простых производных пиридина не наблюдается образования л-комплексов, аналогичных комплексу бензол — гексакарбонил хрома. В том случае, когда неподеленная электронная пара атома азота стерически экранирована, образование ^-комплексов становится возможным [15].
Сг(СО)б диоксан, кипячение
П J 75%
Me3Si N SiMe3 Me3Si
Cr(CO)3 n.Bu4N+F" THF 86% *
SiMe3
Cr(CO)3
5.1.2. Реакции замещения при атоме углерода
В большинстве случаев реакции электрофильного замещения в производных пиридина протекают гораздо труднее, чем в производных бензола. Основная причина такого поведения пиридина связана с тем, что электрофильный агент или протон преимущественно взаимодействует с атомом азота пиридина, образуя катион пиридиния, который очевидно очень устойчив к дальнейшей электрофильной атаке. Таким образом, электрофильное замещение при атоме углерода должно протекать вследствие крайне невыгодной атаки электрофилом
пиридиниевого катиона или относительно более легкой атаки электрофилом по свободному пиридиновому основанию, присутствующему в реакционной среде в крайне низкой равновесной концентрации.
Некоторые типичные реакции электрофильного замещения, например, реакции алкилирования и ацилирования по Фриделю—Крафтсу, вовсе нехарактерны для пиридина, однако следует напомнить, что такие реакции невозможны и в случае нитробензола.
5.1.2.1. Протонный обмен
Обмен Н — D по механизму электрофильного присоединения, аналогичный тому, который происходит в бензоле, в пиридине не протекает. Специальные процессы позволяют провести обмен в обоих a-положениях пиридина при действии DC1 — D2O или даже в воде при 200°С, причем ключевым интермедиатом такого обмена служит илид, образующийся при 2/6-депротонировании 1Н-пириди-ниевого катиона (см.также разд. 5.12) [16].
5.1.2.2. Нитрование
Превращение пиридина в 3-нитропиридин в результате прямого нитрования проходит с крайне низким выходом и в очень жестких условиях [17]. Введение метильных групп в пиридиновое кольцо облегчает электрофильное замещение настолько, что нитрование пиридинового цикла успешно конкурирует с окислением боковой цепи [18]. Стерическое и/или индуктивное ингибирование реакции нитрования по атому азота позволяет использовать тетрафторборат нитрония для С-нитрования; примером может служить нитрование 2,6-дихлорпири-дина [6].
KNO3, конц. H2SO4 300 -С, 24 ч
6%
NO2 bf4"
MeCN, кипячение
77%
З-Нитропиридин и некоторые замещенные 3-нитропиридины могут быть эффективно получены при использовании оксида азота(У). Первоначально образующийся нитрат N-нитропиридиния подвергается нуклеофильному присоединению диоксида серы, который используется в качестве растворителя, или последовательно добавляемого сульфит-иона с образованием 1,2-дигидропири-дина. Миграция нитрогруппы в положения 3 или 5 в результате [1,5]-сигматроп-ного сдвига и последующее элиминирование нуклеофила приводит к восстановлению ароматической системы [19].
Нитрование коллидина и его четвертичной соли протекают со сходными скоростями, что свидетельствует о том, что этот процесс проходит через предварительное образование протонной соли [20].
конц. HNO3
олеум, 100 *СМ
70%
конц. HNO3 олеум, 100 *СЖ 90%
5.1.2.3. Сульфирование
Пиридин очень устойчив к действию концентрированной серной кислоты или олеума — образование 3-сульфокислоты протекает очень медленно и с низким выходом после продолжительного выдерживания реакционной смеси при 360 “С. Однако добавление сульфата ртути(И) в каталитических количествах значительно облегчает процесс сульфирования, который протекает при менее высокой температуре. Роль катализатора не установлена; возможно, на первой стадии происходит С-меркурирование (ср. разд. 5.1.2.5) [21].
конц. H2SO4 HgSO4,220 ‘С
С-Сульфирование 2,6-ди-мре/и-бутилпиридина [22] хорошо иллюстрирует подлинную реакционную способность пиридинового цикла в реакциях электрофильного замещения. Объемные заместители эффективно препятствуют присоединению триоксида серы по атому азота пиридина, и сульфирование протекает как «нормальное» электрофильное замещение; скорость этого процесса такая же, как и скорость сульфирования нитробензола. Максимально достижимая конверсия этого процесса 50% , что связано с образованием протона по ходу реакции и его связыванием с молекулой исходного пиридина.
о-
5.1.2.4. Галогенирование
З-Бромпиридин получают с высоким выходом действием на пиридин брома в олеуме [23]. Процесс протекает, по-видимому, через образование пиридиний-1-сульфоната как реакционноспособного промежуточного соединения, поскольку бромирование не идет в 95%-ной серной кислоте. З-Хлорпиридин получается при хлорировании пиридина при 200 ’С или при 100 ’С в присутствии хлорида алюминия [24].
ci2
AICI3,100 'С
33%
Вг2
66%-ный олеум
130 ‘С
86%
Наиболее эффективный способ получения 2-бром- и 2-хлорпиридина заключается во взаимодействии пиридина с галогенами при 0—5 °C в присутствии хлорида палладия(П) [25].
5.1.2.5. Ацетоксимеркурирование
При взаимодействии пиридина с ацетатом ртути(П) при комнатной температуре образуется соль, которая при 180 *С [26] превращается в 3-ацетоксимеркурпи-ридин. Этот процесс, в котором участвует относительно слабый электрофильный агент, аналогично описанному ранее сульфированию, катализируемому сульфатом ртути, вероятно, включает атаку электрофилом по свободному пиридиновому основанию.
180 ’с
С II I затем В°ДН» NaCI
АсО HgOAc
5.1.2.6. Реакции замещения в пиридинах, содержащих активированный атом азота и кислородсодержащие заместители
См. разд. 5.10.2.1. и 5.10.3.1.
5.2. РЕАКЦИИ С ОКИСЛИТЕЛЯМИ
Пиридиновое кольцо обычно устойчиво к действию окислителей, и окисление возможно лишь в жестких условиях. Незамещенный пиридин окисляется нейтральным водным раствором перманганата калия (100 ’С, запаянная трубка) приблизительно с такой же скоростью, с какой окисляется бензол в этих условиях, причем в результате образуется диоксид углерода. В кислой среде пиридин более устойчив к действию окислителей, а в щелочной — окисление пиридина проходит быстрее, чем окисление бензола.
Ог (4 атм), KOf-Bu
DMF, 20 *С
70% *
В большинстве случаев углеродные заместители могут быть окислены с сохранением пиридинового кольца; так, алкилпиридины превращаются в соответствующие кислоты под действием ряда реагентов [27]. В некоторых случаях возможно селективное окисление. Диоксид селена окисляет алкильные группы только в а- и у-положениях, и окисление может быть остановлено на стадии образования альдегидов [28].
5.3. РЕАКЦИИ С НУКЛЕОФИЛЬНЫМИ РЕАГЕНТАМИ
Если для производных бензола и электроноизбыточных гетероциклических соединений (пиррол, фуран и т. д.) характерны реакции электрофильного замещения, то для производных пиридина наиболее характерны реакции с нуклеофильными реагентами.
Существенное отличие реакции нуклеофильного замещения атома водорода от электрофильного замещения заключается в том, что на последней стадии электрофильного замещения происходит легко протекающий процесс потери протона, а в случае нуклеофильного замещения атома водорода на последней стадии необходимо удаление гидрида-иона, для чего обычно требуется присутствие окисляющего агента. Нуклеофильное замещение атомов или групп, представляющих собой хорошие анионные уходящие группы, — простой процесс.
потеря Н*
к акцептору протона
X
электрофильное замещение
потеря Н~
к акцептору гидрида
нуклеофильное замещение
5.3.1. Нуклеофильное замещение атома водород [29]
5.3.1.1. Алкилирование и арилирование
Реакции пиридина с алкил- или ариллитиевыми производными протекают в две стадии: первоначально происходит присоединение литийорганических реагентов с образованием N-литиевых солей дигидропиридинов, которые затем превращаются в замещенные ароматические пиридиновые структуры в результате окисления (например, воздухом), диспропорционирования или потери гидрида лития [30]. Образование N-литиевых производных дигидропиридинов можно зафиксировать спектрально, некоторые из таких соединений могут быть выделены [31]. Атака литийорганическими реагентами практически всегда протекает по a-положению; в случае 3-замещенных пиридинов обычно реакция прохо-
дит по обоим свободным ос-положениям, но предпочтительнее по положению 2 [32]. Такая региоселективность возможно обусловлена тем, что при присоединении по положению 2 превращение атома С(2) в ^-гибридное состояние сопровождается возникновением меньшего напряжения в цикле.
PhLi
С препаративной точки зрения нуклеофильное алкилирование существенно упрощается при предварительной кватернизации пиридина, причем таким образом, чтобы в дальнейшем возможно было удаление N-заместителя; подобные процессы описаны в разд. 5.13.2.
5.3.1.2. Аминирование
Аминирование пиридина и родственных гетероциклических соединений, так называемая реакция Чичибабина, обычно проходит по a-положению относительно атома азота [33]. Реакция пиридина с амидом натрия сопровождается выделением водорода. Гидридный перенос и образование водорода включают взаимодействие образующегося аминопиридина, выступающего в роли кислоты, с анионным интермедиатом. Преимущественное a-замещение возможно связано с внутримолекулярным процессом нуклеофильного присоединения, которому предшествует комплексообразование с участием атома азота пиридина и катиона металла.
NaNH2 PhNMe2,100 *С
75%
перед обработкой
hT'NH Na+ + Н2
продукт реакции
Более жесткие условия необходимы для аминирования 2- и 4-алкилпириди-нов, поскольку первоначально происходит удаление протона под действием амида натрия из боковой цепи, и последующее нуклеофильное присоединение должно приводить к дианионному интермедиату [34]. Аминирование 3-алкил-пиридинов проходит селективно по положению 2 [35].
Викариозное нуклеофильное замещение (разд. 2.3.3) позволяет вводить аминогруппу в оряю-положение к нитрогруппе с использованием метоксиамина, как показано ниже [36]:
NHgOMe, ZnCI2 t-BuOK DMSO, 20‘C 87%
5.3.1.3. Гидроксилирование
Гидроксвд-ион — гораздо более слабый нуклеофил, чем амид-ион, и он атакует пиридин лишь при очень высокой температуре, что приводит к образованию 2-пиридона с низким выходом [37]. В противоположность этому реакции гидро-ксид-иона с хинолином и изохинолином (см. разд. 6.3.1.3) и пиридиниевыми солями (разд. 5.13.4) гораздо более эффективны.
5.3.2. Нуклеофильное замещение хорошо уходящих групп
Атомы галогенов, а также в некоторых случаях нитро- [38], алкоксисульфонил-ные [39] и метоксигруппы [40] в а- и у-положениях, но не в p-положении, пиридинового цикла, относительно легко замещаются широким рядом нуклеофилов. Замещение реализуется по механизму присоединения — элиминирования, облегчается наличием электроноакцепторных групп и зависит от природы уходящей 1руппы. В реакции нуклеофильного замещения у -галогенопиридины обладают большей реакционной способностью, чем соответствующие а-изомеры. Р -Производные гораздо менее склонны вступать в реакции нуклеофильного замещения, но их реакционная способность в таких реакциях все же выше, чем галогенобензолов. Фторпроизводные наиболее активны среди всех галогенопи-ридинов [41].
MeONa
МеОН, кипячение
95%
PhSH
Et3N, 100'С
93% *
Замещение атома галогена аммиаком можно осуществить при относительно низкой температуре и давлении 6 • 105- 8 • 105 кПа [42]. Нуклеофильное замещение облегчается при добавлении Aliquat* [ 43]
водн. NH3 CuSO4,140 *С
88% **
3PhCH2CN, 6t-BuOK 6% Aliquat®, 85 ’С 52%
* Хлорид трикаприлметиламмония — катализатор межфазного переноса. Aliquat — зарегистрированная торговая марка Henkel Corp. — Прим, перев.
В некоторых случаях детальное изучение процесса нуклеофильного замещения демонстрирует, что может реализоваться альтернативный механизм нуклеофильного замещения. Например, при взаимодействии либо 3-, либо 4-бромпи-ридинов со вторичными аминами в присутствии амида натрия и /лре/л-бутилата натрия образуется одна и та же смесь 3- и 4-диалкиламинопиридинов. Нуклеофильное замещение в этом случае протекает по механизму Sn(EA) (Substitution Nucleophilic Elimination Addition — замещение нуклеофильное элиминирование присоединение) [44]. В качестве промежуточного соединения в таком варианте нуклеофильного замещения образуется 3,4-дидегидропиридин. Отсутствие 2-аминопиридина среди продуктов реакции свидетельствует о большой сложности процесса образования 2,3-дидегидропиридина, который может быть получен при взаимодействии З-бром-2-хлорпиридина с бутиллитием [45] или реакцией З-триметилсилил-2-трифторметаносульфонилпиридина с фторид-ионом
5.4. РЕАКЦИИ С ОСНОВАНИЯМИ
5.4.1. Депротонирование при атоме углерода
При выдерживании пиридина при 165 ’С в системе MeONa — MeOD наблюдается Н — D-обмен всех протонов пиридинового цикла, причем обмен происходит при небольшой концентрации основания и относительные скорости обмена в положениях а: 0 : у равны 1:9,3:12 [47]. Использование системы и-бу-тиллитий — тпрети-бутилат калия эффективно для получения пиридил-2- и пи-рвдил-4-калиевых производных [48]. Некоторые производные пиридина могут быть успешно литиированы по положению 2 с использованием в качестве вспомогательного соединения гексафторацетона [49], который образует комплекс с участием неподеленной электронной пары атома азота (см. разд. 5.5.1) и тем самым устраняет ее влияние; в целом, индуктивное влияние и возможность хелатирования обеспечивают региоселективность металлирования. На практике для получения простых литиевых производных пиридина используют реакции обмена металл — галоген, однако в присутствии атомов хлора, фтора или других заместителей, способствующих ортпо-металлированию, возможно получение литиевых производных методом прямого металлирования (разд. 5.5.1).
5.5. РЕАКЦИИ С-МЕТАЛЛИРОВАННЫХ ПИРИДИНОВ
5.5.1. Литий- и магнийорганические производные
Литийорганические производные пиридинов легко получаются и их свойства типичны для металлоорганических соединений [50—52]: так, например, 3-бром-пиридин вступает в реакцию обмена металл — галоген при действии н-бутилли-тия в эфире при —78 “С. При использовании в качестве растворителя более основного тетрагидрофурана нуклеофильность алкиллитиевых реагентов настолько велика, что происходит лишь присоединение металлоорганического соединения к пиридину. Реакция обмена металл — галоген, тем не менее, может быть проведена и в тетрагидрофуране, но при более низких температурах [53]. Литийорганические производные пиридина можно получить из галогенопири-динов (в том числе и хлорпиридинов) также в результате обмена металл — галоген с использованием нафталенида лития [54]. 2-Бром-6-метилпиридин может быть превращен с соответствующее литиевое производное без депротонирования метильной хруппы [55].
61%
PhCN затем водн. HCI
Прямое региоселективное металлирование по a-положению пиридина, 2-метоксипиридина и метилтиопиридина можно осуществить, используя сложную металлирующую систему, состоящую из бутиллития и литиевой соли 2-ди-метиламиноэтанола. Процесс с участием такой системы возможно более сложный, чем простое депротонирование и, вероятно, включает стадию образования радикал-анионного интермедиата [56].
п-ВиЦ Me2N(CH2)2OU PhCH=O гексан, -78 ‘С THF, -78 'С^
80%
Обмен металл — галоген в 2,5-дибромпиридине приводит с высоким выходом исключительно к 2-бром-5-литийпиридину в результате термодинамически контролируемого процесса [57]. Можно предположить, что 2-пиридил-анион дестабилизирован электростатическим отталкиванием анионного центра и неподе-ленной пары электронов [46]; тот же самый фактор, вероятно, определяет ббльшую трудность образования 2,3-дидегидропиридина (см. разд. 5.3.2). Приведенная ниже схема иллюстрирует использованШ «амида Вайнреба»* муравьиной кислоты для введения формильной группы в пиридиновое кольцо [58]:
* Амиды Вайнреба (Weinreb amides) — К-метил-М-метоксиамиды карбоновых кислот — широко используются в органическом синтезе в ряде полезных превращений: так, например, они восстанавливаются алюмогидридом лития в соответствующие альдегиды и реагируют с литий- и магнийорганическими соединениями с образованием кетонов. — Прим, перев.
n-BuLi HCON(Me)OMe
Et2O, -78 ‘С* .уз *с -» 20 ‘С ж
60%
Монолитиирование 2,6-дибромпиридина удается осуществить при «обратном порядке смешения реагентов», т. е. при прибавлении дибромпиридина к я-бутиллитию. Другой способ получения монолитиевого производного заключается в использовании дихлорметана в качестве растворителя при литиирова-нии; вероятно, это единственный пример использования дихлорметана в качестве растворителя при литиировании [59]. Обычный вариант литиирования 2,6-дибромпиридина, но при — 90 °C, и последующее взаимодействие с объемными кремнийсодержащим электрофилом приводит исключительно к продукту монозамещения [60].
1(СН2)2С1
90% **
Галогенопиридины, особенно хлор- и, в большей степени, фторпроизводные, способны литиироваться по положению, соседнему с атомом галогена, через предварительное депротонирование. Такие превращения возможны, хотя и редки, даже для бромпиридинов [61]. Лучшие результаты при таком литиировании достигаются при использовании диизопропиламида лития в качестве литиирую-щего агента. З-Галогенопиридины литиируются этим методом по положению 4, а 2- и 4-галогенопроизводные — исключительно по р-положениям [62]. При литиировании 3-метоксипиридина с использованием в качестве литиирующего агента мезитиллития образуется 2-литийпроизводное [63]. З-Метоксиметокси-пиридин [64], 3-диизопропиламинокарбонил- [65] и З-тлре/л-бутилкарбонила-минопиридины [66] литиируются по положению 4. Литиирование производных пиридина, содержащих диметилоксазолиновую ориентирующую группу, требует использования 2,2,6,6-тетраметилпиперидида лития, в противном случае наблюдается присоединение металлоорганических соединений по положению 4. Сочетание этой реакции с окислением образующегося дигидропиридина кислородом воздуха представляет собой эффективный метод синтеза 4-алкилированных пиридинов [67]. Прямое получение магнийорганических производных пиридина требует, как показано ниже, более высокой температуры [68].
NHf-Bu
6CIMgTMP В(ОМе)3
THF, 65 *С THF, 20 *С Н2О2, NaOH
Литиирование 2- и 4-тлретл-бутилоксикарбониламинопиридинов проходит только по положению 3. Этот процесс находит применение в синтезе азаиндолов; предварительно полученное на первой стадии 3-литийорганическое произ-
водное используют для введения метильной группы в положение 3 пиридинового цикла, дальнейшее литиирование боковой цепи (разд. 5.11) обеспечивает подход к азаиндолам (разд. 17.17.7). Приведенная ниже схема иллюстрирует синтез 5-азаиндола (пирроло[3,2-с]пиридина) [69]:
‘N'
2n-BuLI NHCO2M3u thF, -30 ’С
X затем
J Ме1, '70 *С,
J 54%
Литиированные пиридины реагируют обычным образом с различными электрофильными реагентами; так, например, их можно ацилировать третичными амидами [70]:
Д-МеОСбН^о
О
^N-APra
о
NAPr2 LiTMP
DME, -78 ‘С 4-MeOC6H4CONMe2
*98%
N
Галогенные заместители, использующиеся для прямого литиирования пиридинового цикла, в дальнейшем могут быть замещены нуклеофильными реагентами [71].
LDA
Et2O, -20 ‘С HCOgEt
’46% *"
NaOMe
МеОН, кипячение 90%
Литиирование в результате обмена металл — галоген проходит селективно при наличии в молекуле ориентирующей группы [72]. В том случае, если в молекуле присутствует одновременно две ориентирующие группы, которые расположены в положениях 1,3, литиирование проходит селективно по атому углерода, расположенному между этими двумя труппами [73].
о
Атомы брома и иода в качестве заместителей в пиридиновом цикле также способствуют прямому металлированию, однако в этом случае оно сопровождается изомеризациями (аналогичными описанным в разд. 14.5.1). Как показано на приведенной ниже схеме, изомеризация приводит к образованию более стабильного литиевого производного, т. е. такого, в котором отрицательно заряженный атом углерода расположен между атомами с галогенными заместителями [74].
LDA
THF, -70 *С
При определенных условия можно провести селективное 2-литиирование N-оксидов пиридина. Один из ярких примеров — литиирование по положению 6 N-оксида 2-пивалоиламинопиридина, литиирование в этом случае проходит по положению, соседнему с группой N~O, а не с заместителем, ориентирующим в оряо-положениях. Региоселективное С(2)-литиирование 3,4-диметоксипири-дина также свидетельствует о влиянии N-оксидной группы [75].
Реактивы Гриньяра легко получаются в результате обмена галоген — металл из бром- и иодпиридинов; в качестве металлирующего агента используются изопропильные реактивы Гриньяра [76]. Следует отметить, что обмен магний — галоген в 2,5-дибромпиридине протекает аналогично обмену литий — галоген, т. е. по положению 5; из других дибромпиридинов в результате обмена также образуются мономагнийорганические соединения. Получение пиридилмагнийга-логенидов при низких температурах возможно даже в присутствии таких групп, как сложноэфирная и нитрильная. Хотя пиридилмагнийгалогениды не столь удобны в синтезе различных производних пиридина, как соответствующие литиевые производные, однако в некоторых случаях они имеют очевидные преимущества.
APrMgBr
THF, - 78 *С РЬСН=Ож
67%
%, /-РгМдВг СН2=СНСН2Вг
THF, - 40 *СГ CuCN м 85%
5.5.2. Реакции, катализируемые палладием
Галогенопиридины и пиридинилтрифлаты [77, 78] вступают в различные реакции, катализируемые комплексами палладия, такие, как реакция Хека [79], карбонилирование [80], реакции сочетания, например, с алкинами [81] или с арилборными [78,82] и циклопропилборными [83] кислотами.
Br
+ HCsCSiMe3
CI2Pd(PPh3)2, Cui Et3N,120’C
80% **
OH
CH2P(O)(O/-Pr)2
(CF3SO2)2O, Et3N CH2CI2, -78 *C
70%
B(OH)2 Pd(PPh3)4, K2CO3 THF,DMA,20*C 84%
CH2P(O)(O/-Pr);
Среди металлоорганических производных пиридина наиболее эффективно вступают в катализируемые реакции сочетания бор-, цинк- и оловоорганические соединения. Оловоорганические производные пиридина можно получить реакцией галогенопиридинов с триалкилстаннатом натрия или взаимодействием пиридиллития с хлортриметилстаннаном [84]. Оловоорганические производные пиридина вступают в реакции сочетания, например, с арилгалогенидами [85] и N-оксвдами галогенопиридинов [86].
Me3SnCI
DME, 0 *С 88%
4-Вг-С6Н4СО2Ме
CI2Pd(PPh3)2 THF, кипячение
Оловоорганические производные пиридина также находят применение в синтезе ацилпиридинов, которые, как обсуждалось ранее, не мохуг быть получены реакцией Фриделя—Крафтса. Выше приведен пример использования оловоорганических соединений пиридинового ряда в синтезе 2-лгре/л-бутилоксикар-бонилпиридина [87].
Процессы, катализируемые палладием(О), также используются для замещения атомов галогенов на азот- [88] и серасодержашие группы [89]. Такие реакции одинаково возможны для всех положений пиридинового цикла, причем без видимых преимуществ а- и у-положений (разд. 5.3.2).
SPhn-Bu3SnSPh, Pd(PPh3)4
PhMe, 100 *С_____
87%
PhNHMe, Pd(dba)3 BINAP, NaO f-Bu PhMe, 70 *C — ►
5.6. РЕАКЦИИ CO СВОБОДНЫМИ РАДИКАЛАМИ, РЕАКЦИИ ПИРИДИЛ-РАДИКАЛОВ
5.6.1. Галогенирование
При температурах диссоциации на атомы молекул брома (500 ’С) и хлора (270 °C) пиридин вступает в реакции радикального замещения с образованием 2-галогено- и 2,6-дигалогенопиридинов [90].
5.6.2. Реакции с углеродными радикалами
При реакции пиридина с фенильным радикалом также наблюдается преимущественная атака по a-положению, хотя соотношение изомерных продуктов реакции зависит от метода генерирования фенильного радикала [91]. Большая селективность фенилирования по положениям 2 и 4 наблюдается в случае пиридиниевых солей [92].
t-BuCO2H, AgNO3, водн. H2SO4, (NH^SaOg, 70 *С
pu] ,
97%
Для препаративных целей большее значение представляют реакции с нуклеофильными радикалами, такими, как НОСНг* и R2NCO, которые можно легко генерировать в мягких условиях. Такие реакции проводят с протонными солями пиридина, что связано с их более высокой реакционной способностью и большей а-селективностью радикальных реакций с их участием; процесс известен как реакция Минисци (разд. 2.4.1) [93]. Электроноакцепторные заместители в пиридиновом цикле ускоряют такие процессы.
5.6.3. Димеризация
«Окислительная» димеризация пиридина возможна в присутствии натрия и никеля несмотря на кажущиеся восстановительные условия, причем в первом случае образуется 4,4’-, а во втором 2,2-бипиридин [95]. Полагают, что каждый из процессов проходит с участием одного и того же анион-радикального интермедиата, образующегося в результате переноса электрона от металла к пиридиновому циклу. Аналогичная частица, генерированная действием диизопропиламида лития в результате одноэлекгронного переноса (SET — Single Electron Transfer), фиксируется методом спектроскопии ЭПР [96]. Образование 2,2’-бипиридина при использовании никеля, по-видимому, связано с вероятным хелатированием с поверхностью металла. Бипиридины представляют собой исходные соединения для синтеза препаратов для уничтожения сорняков, аналогичных параквату.
В более мягких условиях можно получить восстановленные димеры [97] и 1,4-дигидропиридины при наличии заместителя в положении 4 [98].
5.6.4. Пиридил-радикалы
При облучении иодпиридинов генерируются пиридинил-радикалы [99]. Пири-динил-радикалы, аналогично другим арильным радикалам, могут быть генерированы из галогенопиридинов при действии гидридов олова, и для них характерны типичные для арилрадикалов реакции, как, например, приведенная ниже циклизация [100]:
n-Bu3SnH, AIBN
PhMe, кипячение
TBDMSO,
N
Me
5.7. РЕАКЦИИ С ВОССТАНОВИТЕЛЯМИ
Пиридин и его производные гораздо легче восстанавливаются, чем производные бензола; так, например, каталитическое восстановление легко идет при обычной температуре и атмосферном давлении обычно в слабокислых средах, но также возможно в щелочных условиях при применении никелевых катализаторов [101].
Боргидрид натрия не взаимодействует с нейтральными производными пиридина, хотя восстанавливает пиридиниевые соли (разд. 5.13.1). При действии алюмогидрида лития на пиридин происходит присоединение одного гидрид-иона [102], в то время как триэтилборогидрид лития эффективно восстанавливает пиридин до пиперидина [103].
Действие на пиридин системы литий — триметилхлорсилан приводит к образованию дважды силилированного 1,4-дигвдропиридина, енаминный характер которого используется для введения алкильных групп в положение 3 при реакции с альдегидами [104].
При восстановлении пиридина натрием в жидком аммиаке в присутствии этанола образуются 1,4-дигидропиридины [105], а при действии той же восста
новительной системы на 2-пиридон — 2,3-дигидропроизводное [106]. Другие восстановительные системы металл кислота, используемые для восстановления иминиевых групп, оказываются неэффективными в случае пиридинов. Восстановление пиридинов в пиперидины легко может быть осуществленно при использовании иодида самария(П) в присутствии воды [107].
Восстановление пиридина триметилсиланом в присутствии палладия приводит к образованию 1,4-дигидро-1-триметилсилилпиридина и дисилилирован-ного димера [108]; гидросилилирование, катализируемое соединениями титана, приводит исключительно к тетрагидропиридиновому производному [109].
Ph(Me)SiH2 (cp)2TiMe2 (кат.) 80 *С
SIH(Me)(Ph)
5.8. ЭЛЕКТРОЦИКЛИЧЕСКИЕ РЕАКЦИИ (ОСНОВНОГО СОСТОЯНИЯ)
Электроциклицеские реакции с участием простых производных пиридина не известны, однако 2-пиридоны мохуг принимать участие в реакциях Дильса — Альдера, особенно при высоком давлении, как 4л-электронные компоненты [ИО].
N-Тозил-2-пиридоны с 3-алкокси- или 3-арилтиозаместителями вступают в реакции циклоприсоединения с электронодефицитными алкенами в более мягких условиях, как показано ниже [111]:
ОМе
CH2=CHNO2
СН2С12,90 ’С
3 80%
Четвертичные соли 3-гидроксипиридина при действии слабых оснований превращаются в цвиттерионные растворимые в органических растворителях соединения, для которых не мохуг быть представлены нейтральные канонические формы. Такие 3-оксидопиридиниевые соединения вступают в различные реакции диполярного присоединения, при этом в образовании новых связей участвуют атомы С(2) и С(б) [112].
5.9. ФОТОХИМИЧЕСКИЕ РЕАКЦИИ
При ультрафиолетовом облучении производные пиридина превращаются в высоко напряженные соединения, которые могут приводить к изомерам пиридина или способны реагировать с другими соединениями с образованием стабильных веществ. Из пиридинов [113] и 2-пиридонов [114] при облучении образуются 2-азабицикло[2.2.0]гексадиены и 2-азабицикло[2.2.0]гексеноны. В случае простых производных пиридина такие соединения нестабильны и термически превращаются обратно в ароматические соединения, однако в случае 2-алкилпиридинов, содержащих в алкильной группе электроноакцепторные заместители, образуются стабильные соединения в результате катализируемого основанием протонного сдвига [115]. Бициклические соединения, полученные из пиридонов, относительно стабильны; такие превращения для 4-алкокси- и 4-ацилоксипиридинов проходят с исключительно хорошими выходами.
При облучении К-метил-2-пиридона в водном растворе образуется смесь ре-гио- и стереоизомерных димеров, один из них изображен выше [116]. Схожие фотохимические реакции [4л + 4л]-циклоприсоединения [117] возможны в случае связанных пиридонов [118], как показано ниже, или при взаимодействии пиридонового цикла со связанной с ним 1,3-диеновой системой [119].
Фотоинициируемые реакции [2л + 2л]-циклоприсоединения между двумя связаными фрагментами 4-пиридона [120] также могут приводить к сложным циклическим системам с потрясающей простотой. Известны также аналогичные процессы между связью 5,6 2-пиридонов и двойной связью, содержащейся в заместителе при атоме азота [121].
Фотореакции пиридиниевых солей в водной среде приводят к образованию 6-азабицикло[3.1.0]гексен-3-олов-2 или соответствующих простых эфиров, которые склонны к регио- и стереоселективному раскрытию азиридинового цикла под действием нуклеофилов в кислых средах. Эти соединения служат исходными в синтезе производных природных соединений, модифицированных аминопентанолом [122]. При облучении 3-метоксипиридиниевых солей в нейтральной среде в качестве конечных продуктов образуются бициклические азиридины. На приведенной ниже схеме в качестве промежуточного соединения указан азабензвален как возможная альтернативная бициклическому азиридину структура [123]:
hv
МеОН^ 77%
Фотолиз N-оксидов пиридина в щелочных растворах приводит к образованию цианодиенолятов в результате раскрытия цикла.[124]:
hv (254 нм)
водн. NaOH, 2043
Замещение атома брома енолят-ионом или другими родственными анионами, имеющее относительный порядок скорости 2>3>4, протекающее по механизму SrnI (Substitution Radical Nucleophilic, мономолекулярное), включает фотоинициируемый перенос электрона с енолят-иона на гетероцикл. При этом атом брома удаляется, что приводит к пиридил-радикалу, который присоединяет енолят-ион с образованием анион-радикала продукта реакции; последующий перенос электрона поддерживает развитие цепи [125]. Аналогичное замещение атома брома гидроксид-ионом приводит к 3-гидроксипири-дину [126].
5.10. ОКСИ* И АМИНОПИРИДИНЫ
5.10.1. Строение
Все три возможных оксипиридина склонны к таутомерным превращениям, связанным с перемещением протона между атомами кислорода й азота, причем наблюдается существенное отличие в таутомерных свойствах p-изомера от а- и у-изомеров.
При нормальных условиях а- и у-изомеры существуют практически целиком в кетонной таутомерной форме и известны как пиридоны. Гидрокси-формы могут быть обнаружены в значительных количествах только в очень разбавленных растворах в неполярных растворителях типа петролейного эфира или в газовой фазе. В последнем случае 2-гидроксипиридин доминирует над кетонной формой и соотношение таутомеров составляет 2,5 : 1 [127]. Поляризованные формы предпочтительны при сольватации [128]. З-Гидроксипиридин существует в равновесии с цвиттерионной формой, причем положение равновесия зависит от природы растворителя
Все три изомерных аминопиридина существуют в амино-форме; а- и у-изо-меры склонны к поляризации, аналогичной поляризации, существующей в случае пиридонов.
5.10.2. Реакции пиридонов
5.10.2.1. Электрофильное присоединение и замещение
З-Гидроксипиридин протонируется по атому азота, значение p/fa составляет 5,2, что типично для пиридинов. Пиридоны же гораздо менее основны и, подобно амидам, протонируются по атому кислорода [129]. Реакция 2,6-диметил-4-пи-ридона с wpew-бутилбромидом приводит к образованию стабильного бромида 4-гидроксипиридиния [130].
Исключение из общей ситуации наблюдается при реакции 4-пиридона с хлорангидридами карбоновых кислот, приводящей к N-ацилированным производным. 1-Ацетил-4-пиридон в растворе находится в равновесии с 4-ацетокси-пиридином [131].
н
АсС1
EtgO, 20 ‘С
Электрофильное замещение во всех трех изомерных оксипиридинах потека-ет гораздо легче, чем в самом пиридине, и в орто- и лоро-положения относительно оксигруппы. Кислотно-катализируемый дейтерообмен в 4-пиридоне приводит к 3,5-дидейтеро-4-пиридону через С-протонирование нейтрального пиридона [132].
рКаЗ.З
рКа0.8
положения электрофильного замещения в оксипиридинах
Электрофильное замещение в присутствии кислот проходит с участием свободных пиридонов [133], однако в присутствии очень сильных кислот пиридон практичеки полностью протонирован и замещение проходит в О-протониро-ванной соли с низкой скоростью, но с той же региоселективностью [134]:
дым. HNO3 конц. H2SO4 100 ‘С* 38%
N-Menui-2-пиридон подвергается электрофильному палладированию по положению 5, что позволяет использовать модифицированную реакцию Хека для прямого введения заместителя в это положение (см. разд. 2.7.2.1) [135]:
Электрофильное замещение в 3-гидроксипиридине проходит либо по положению 2, либо по положению 6: так, нитрование приводит к З-гидрокси-2-нит-ропиридину [136], реакция Манниха также идет по положению 2 [137], а иодирование — по положению 6 [138] (следует отметить, что бромирование 2-метоксипиридина проходит по положению 5 [139]).
СН2О, Me2NH Н20,100*С
70%
(X
CH2NMe2
0H Nal, NaOCI
MeOH, 20-C
75% *
Br2, NaOAc
AcOH, 10‘C
90%
5.10.2.2. Депротонирование и реакции солей
N-Незамещенные пиридоны проявляют кислотные свойства (pJVa ~11) и при депротонировании образуют мезомерные анионы. Амбидентные анионы могут алкилироваться как по атому кислорода, так и по атому азота. Соотношение образующихся алкоксипиридинов и N-алкилпиридонов зависит от условий проведения реакции [140]. При использовании первичных галогенидов преимущественно образуются продукты N-алкилирования, а при применении вторичных алкилгалогенидов — продукты О-алкилирования [141]. Дня получения N-алкилированных 4-пиридонов используют метод, основанный на первоначальном превращении 4-пиридона в О-триметилсилильное производное [142], которое селективно алкилируют по атому азота, затем при удалении силильной группы получают Ь1-алкил-4-пиридон [102]. 2-Пиридоны обладают достаточными кислотными свойствами для их использования в реакции Мицунобу со спиртами и при этом также образуется смесь продуктов N- и О-алкилирования [143].
(Me3Si)2NH нагревани^
СН2=СН(СН2)2Вг
20 ‘С
90%
К2СО3, МеОН
(СН2)2СН=СН2
Продукт алкилирования натриевых солей 2-пиридона хлорметилтриметил-силаном используется для дальнейшего введения алкильных заместителей к атому азота [144]:
Me3SiCH2CI п-РгСНО, TBAF
DMF, 20 ‘С || THF, 20 'С
70% *4 54%
N О
CH2SiMe3 I Н
ГОН
л-Рг
Протоны в a-положении 1-метил-4-пиридона в водном растворе гидроксида натрия при 100 "С обмениваются [145] и металлирование н-бутиллитием приводит к образованию полезного с синтетической точки зрения металлоорганического производного [146]. Металлирование 1-метил-2-пиридона проходит по метильной группе [147], в то время как 2-пиридоны, содержащие карбоксильную группу при атоме азота, литиируются по положению 4 [148]. Металлированные N-метилпиридоны способны присоединяться к молекуле пиридона по типу реакции Михаэля с образованием димерных структур. Также известны примеры конденсации металлированных производных по боковой метильной группе пиридонов [149].
Me
n-BuLi
THF, НМРА, -70 *С затем СО2 затем f-BuLi
5.10.2.3. Замещение атома кислорода
Проблема превращения карбонильной группы пиридонов в уходящую группу занимает важное место в химии этих соединений. Наиболее часто используется превращение пиридона в хлорпиридин под действием оксихлорида фосфора, пентахлорида фосфора или смеси этих реагентов. Реакция, как полагают, проходит через образование дихлорфосфатного интермедиата. Превращение в бром-пиридин может быть осуществлено действием системы N-бромсукцинимид — трифенилфосфин при кипячении в диоксане [150]. Аминопиридины можно получить взаимодействием пиридонов со вторичными аминами и пентаоксидом фосфора или реакцией 2- или 4-триметилсилилоксипиридинов с вторичными аминами [142].
>NX% 85% Н
РОС13,РС15 нагревание
Для того чтобы удалить оксигруппы из пиридинового кольца, пиридоны предварительно превращают в хлорпиридины, а затем подвергают каталитическому гидрогенолизу [151]. Альтернативный подход связан с гидрогенолизом эфира, образующегося при взаимодействии пиридона с 5-хлор-1-фенилтетразолом [152].
5.10.2.4. Тио-2-пиридоны
Тио-2-пиридоны [153] при реакции с хлорангидридами карбоновых кислот в присутствии триэтиламина превращаются в 2-ацилтиопиридины. Такие тиоэфиры можно также получить при реакции 2,2’-пиридилдисульфидов с карбоновой кислотой и трифенилфосфином [154]. 2-Ацилтиопиридины гладко реагируют с реактивами Гриньяра с образованием кетонов, анион тиопиридона выступает при этом в роли уходящей группы. 2-Ацилтиопиридины также можно использовать в качестве агентов для переноса кислотного остатка на атом азота в пептидном синтезе [155] и на атом кислорода при синтезе лактонов со средним размером цикла [156].
QHgN^NHa
EtOH, кипячение n Br 47%
Ph(CH2)2COCI I Et3N
Nx4s 82%
"^1 n-BuMgBr „
I---87^-*-n-BuCO(CH2)2Ph +
N^SCOfCH^Ph
5.10.3. Реакции аминопиридинов
5.10.3.1. Электрофильное присоединение и замещение
Все изомерные аминопиридины проявляют основные свойства в большей степени, чем незамещенный пиридин, и образуют при протоноровании по кольце-
вому атому азота кристаллические соли. Производные пиридина с аминогруппами в а- и у-положенияхмоноосновны, поскольку положительный заряд делокализуется между двумя атомами азота, как в случае амидиниевого катиона, что препятствует повторному протонированию. Делокализация положительного заряда проявляется значительно в большей степени в 4-аминопиридине (рА'а 9,1), чем в 2-изомере (р& 7,2). В случае 0-изомера делокализация невозможна, и в сильнокислых средах 3-аминопиридин способен дважды протонироваться с образованием дикатиона (рКа 6,6 и —1,5) [157].
Алкилирование аминопиридинов представляет собой необратимый при комнатной температуре процесс, который приводит к кинетически контролируемому продукту реакции по кольцевому атому азота. [158]. В противоположность этому ацилирование проходит по боковой аминогруппе. Ацетиламинопиридин, вероятно, образуется в результате ряда последовательных процессов — депротонирования аминогруппы N-ациламинопиридиниевой соли, ацилирования аминогруппы и гидролитического удаления ацильной 1руппы от кольцевого атома азота при обработке реакционной смеси водой.
Как и производные бензола, электронодонорные заместители в которых облегчают электрофильное замещение, 2-аминопиридин бромируется в положение 5 в уксусной кислоте даже при комнатной температуре, причем продукт бромирования нитруется также при комнатной температуре с образованием 2-ами-но-5-бром-З-нитропиридина [159]. Хлорирование 3-аминопиридина приводит к З-амино-2-хлорпиридину [160]. Нитрование аминопирвдинов в кислых средах также идет относительно легко и для 2- и 4-изомеров проходит селективно по 0-положению. Изучение процесса нитрования диалкиламинопиридинов показало, что нитрованию подвергается протонироанный пиридин [161].
конц. HNO3
конц. H2SO4
J 50-100-С *
<4. 80%
n nh2
BtCH2OH,TsOH АсОН, кипячен^ nh2 53%
Ранее сообщалось о возможности С-алкилирования аминопиридинов в очень жестких условиях. В значительно более мягких условиях проходит алкилирование 2-аминопиридина при его взаимодействии с 1-гидроксиметилбен-
зотриазолом (разд. 26.3) в присутствии кислоты. Следует принять во внимание, что такое С-алкилирование возможно только при обратимости алкилирования по кольцевому атому азота [162]. Образующийся при таком алкилировании продукт реакции обладает всеми свойствами производных бензотриазолов, что че-резвычайно полезно при дальнейших синтетических превращениях (разд. 26.3).
5.10.3.2. Реакции аминогруппы
p-Аминопиридины при взаимодействии с азотистой кислотой обычным образом превращаются в соответствующие соли диазония. В случае же а- и у-амино-пиридинов, если не предприняты особые меры, соли диазония легко гидролизуются в соответствующие пиридоны [163] в результате быстрого присоединения воды к атому углерода, несущему диазогруппу [ 164]. Тем не менее, при тщательном соблюдении определенных условий возможно использование солей диазония как а-, так и у-аминопиридинов в реакциях нуклеофильного замещения типа реакции Зандмейера без использования медного катализатора [163,165,166].
NaNO2. HF
О ‘С -> 40 *С
95%
5.11. АЛКИЛПИРИДИНЫ
Главная особенность химических свойств алкилпиридинов состоит в способности алкильных групп, непосредственно связанных с пиридиновым циклом, де-протонироваться [167]. Скорости протонного обмена в системе метанол —• метилат натрия для 4-, 2- и 3-алкилпиридинов равны соответственно 1800, 130, 1 [168]. Сравнение значений рЛ'а, измеренных в тетрагидрофуране [169], демонстрирует, что у-изомеры обладают в большей степени кислотными свойствами, чем а-алкилпиридины, а а- и у-изомеры более сильные кислоты, чем р-изоме-ры, однако образование того или иного аниона при возможности нескольких конкурирующих процессов депротонирования существенно зависит от ряда условий. Депротонирование при действии алкиллитиевых соединений приводит к образованию а-анионов, более стабильные а-анионы образуются при использовании амидных оснований [170]. Гораздо большая склонность [171] a-и у-алкил-пиридинов к депротонированию связана с мезомерной стабилизацией соответствующих анионов с участием кольцевого атома азота, что невозможно в случае p-изомера. В последнем случае депротонированию способствует лишь индуктивное влияние кольцевого атома азота, однако при подходящих условиях депротонирование р-метильной группы все же возможно [172]. Различие в реакционной способности метильных групп в положениях 2 и 3 позволяет селективно провести превращения по первой метильной группе [173].
Образующиеся при депротонировании а- и у- алкильных групп анионы способны принимать участие в различных реакциях [174] и по своим свойствам они аналогичны енолят-анионам. Аналогичное образование анионов наблюдается при депротонировании метильных ipynn в орто- и лдрд-толуолах. Металлирование боковой цепи 2-/мрет-бутилкарбониламино-4-мстилпиридина проходит при комнатной температуре [175].
l2,20 *C
^затем DMSO, 160 *C
.. CHO
+ Me2S
LDA
THF,-78*0 x затем TMSCI ||
CH3 л-BuLi THF, -20*C tзатем MeCONMe2 85%
О
LDA/THF,-70 *C затем o-C6H10O ' —° *>
N'
,CO2Et
Me
NOg
N
Подвижность атомов водорода боковых алкильных групп четвертичных ал-килпирвдиниевых солей существенно выше, и реакции конденсации с участием продуктов депротонирования, аналогичных енаминам, проходят в значительно более мягких условиях [176]. Депротонирование боковых алкильных трупп возможно и для N-оксидов пиридинов, однако в этом случае такое депротонирование может конкурировать с депротонированием по положению 2 пиридинового цикла [177].
Возможность стабилизации пиридиновым циклом экзоциклического карбанионного центра в а- и у-положениях проявляется также в способности винил-пиридинов [178] и пиридилацетиленов присоединять нуклеофильные реагенты по типу реакции Михаэля (катализируемая солями ртути гидратация проходит противоположным образом [179]). Кроме того, известно, что 2-(пиридин-2-ил)-и 2-(пиридин-4-ил)этиловые эфиры, сульфиды или сульфоны могут служить защитными группами, легко удаляемыми при алкилировании пиридинового азота метилиодидом, приводящем к элиминированию винилпиридиниевой соли [180].
При рассмотрении реакционной способности галогеналкилпиридинов следует учитывать, что расчетные данные, а также масс-спектральные измерения свидетельствуют о существенной стабильности а-пиридилалкильных катионов вследствие взаимодействия катионного центра с копланарной неподеленной электронной парой атома азота [181].
5.12. ПИРИДИНОВЫЕ АЛЬДЕГИДЫ, КЕТОНЫ, КАРБОНОВЫЕ КИСЛОТЫ И ИХ ЭФИРЫ
Эти соединения по своей реакционной способности близки к соответствующим производным бензола, поскольку карбонильная группа мезомерно не взаимодействует с кольцевым атомом азота. Пиридин-2- (пиколиновая), пиридин-3- (никотиновая) и пиридин-4-карбоновые (изоникотиновая) кислоты немного более сильные, чем бензойная кислота, и в водных растворах существуют в цвиттерионных формах. Декарбоксилирование пиколиновой кислоты проходит относительно легко через промежуточное образование того же самого илида, что ответствен за специфический протонный обмен в а-положении пиридинового цикла, наблюдаемый в кислых средах (разд. 5.1.2.1) [182]. Взаимодействие такого илида с ароматическими или алифатичекими альдегидами известна как реакция Хэммика [183]. Четвертичные соли пиколиновой кислоты, как следует из механизма реакции, декарбоксилируются легче самой пиколиновой кислоты.[184]. Реакцию Хэммика можно осуществить при нагревании силиловых эфиров пиколиновых кислот в присутствии карбонильных соединений [185].
PhCHO, 140 ’С (-СО2)
5.13. ЧЕТВЕРТИЧНЫЕ ПИРИДИНИЕВЫЕ СОЛИ
Отличительные особенности свойств четвертичных пиридиниевых солей заключаются, во-первых, в высокой склонности к реакциям нуклеофильного присоединения и замещения по а- и у-Положениям, иногда сопровождающимся раскрытием цикла, и, во-вторых, в легком депротонировании алкильных групп в а- и у-положениях (разд. 5.11)
5.13.1. Восстановление и окисление
Окисление пиридиниевых солей [186] в пиридоны под действием щелочного раствора гексацианоферрита предположительно проходит с участием аддукта пиридиниевого катиона и гидроксид-иона, присутствующего в реакционной смеси в очень малой концентрации. З-Замещенные пиридиниевые соли превращаются в смесь 2- и 6-пиридонов: так, окисление иодида 1,3-диметилпириди-ния приводит к смеси 2- и 6-пиридонов в соотношении 9:1.
н2, Pt ЕЮН.гО’С, 1 атм
95%
OK3Fe(CN)6 водн. NaOH, 20 ’С
67%
Me 1
Каталитическое восстановление пиридиниевых солей в пиперидины проходит с исключительной легкостью. Пиридиниевые соли подвергаются также гид-ридному восстановлению при использовании комплексных гидридов металлов [187], формиатов [188] и восстановительной системы литий — жидкий аммиак [189]- При восстановлении боргвдридом натрия в присутствии протонной кислоты преимущественно образуются тетрагидропиридины аллиламинного строения, т. е. двойная связь локализована в 3,4-положении. Такой циклический аллиламин образуется в результате присоединения гидрид-иона первоначально по положению 2, протонирования енамина по 0-положению и присоединения еще одного гидрид-иона. При таком восстановлении всегда образуется некото-
рое количество полностью восстановленного соединения, и его содержание увеличивается с увеличением объема заместителя при атоме азота, поскольку это повышает вероятность первоначальной атаки гидрид-ионом по положению 4 с образованием диенамина, способного к двум последовательным процессам протонирования — присоединения гидрид-иона, описанным выше. При восстановлении 3-замещенных пиридиниевых солей образуются 3-замещенные 1,2,5,6-тетрагидропиридины. Необходимо соблюдать осторожность при разложении комплекса амин — боран, который может образовываться на заключительном этапе такого восстановления [190]. В смеси 1,4-дигидро-1-метил-и 1,2-дигидро-1-метилпиридинов, приведенной в состояние равновесия под действием сильного основания, соотношение изомеров составляет 9:1 с преобладанием 1,4-дигидропроизводного [191].
н н
N
Me
+ ЬГ (NaBH4)
Me
преимущественный продукт
N 1-
Me 1
продукт
При восстановлении N-ацил- и, в особенности, N-алкокси- или N-арилок-сикарбонилпиридиниевых солей боргидридом зафиксировано образование дигидропроизводных [192], но дальнейшего восстановления не происходит, поскольку образующийся при первоначальном присоединении гидрид-иона ена-мид в отличие от енамина не может протонироваться в условиях реакции [193]. 1,2-Дигидропроизводные, которые получают без примеси 1,4-дигидроизомеров при восстановлении в метаноле при 70 °C, можно использовать в качестве диенов в реакции Дильса — Альдера. При облучении 1,2-дигидропиридин превращается в азабицикло[2.2.0]гексан, который В результате последовательных превращений — удаления карбаматной группы, алкилирования и термической обработки — превращается в нестабильный N-алкилдигидропиридин [194].
Легкое специфическое восстановление 3-ацилпиридиниевых солей дитионитом натрия, приводящее к стабильным 3-ацил-1,4-дигидропиридинам, часто упоминается, поскольку позволяет ощутить значимость коферментной активности никотинамида. На первой стадии такого восстановления происходит присоединение атома серы дитионит-иона по положению 4 [195], как показано ниже. 1,4-Дигидропиридины обычно чувствительны к кислороду воздуха, легко окисляются до соответствующих ароматических структур; стабильность 3-ацил-1,4-дигидропиридинов связана с сопряжением между кольцевым атомом азота и боковой карбонильной группой (см. также синтез Ганча, разд. 5.15.1.2). Восстановлению дитионитом натрия в соответствующие 1,4-дигидропроизводные могут быть подвергнуты пиридиниевые соли с алкильным заместителем при атоме азота, большим, чем пропил, или, например, с бензильным заместителем [196].
Na2S2O4 водн. NaOH
5.13.2. Присоединение металлоорганических реагентов
Металлоорганические реагенты очень легко присоединяются к N-алкил-, N-арил- и, что имеет особенно важное синтетическое значение, к N-ацилпири-диниевым солям. В простейших случаях такое присоединение проходит по
a-положению и образующиеся 2-замещенные-1,2-дигидропиридины при соблюдении определенных мер предосторожности можно выделить, спектрально идентифицировать или, что более важно в синтетическом плане, легко окислить в 2-замещенные пиридиниевые соли [197].
Ме
6EtMgBr
Et2O, кипячение
70%
Ме 1
AgNO3
Большое синтетическое значение имеет прием, основанный на предварительном генерировании in situ N-ацилпиридиниевого катиона, затем последовательном превращении его в дигидропиридин, дальнейшей модификации в случае необходимости и удалении N-ацильного заместителя с образованием замещенного пиридина. Следует отметить различие в поведении N-ацилпириди-ниевых и N-алкоксикарбонилпиридиниевых солей, реакции первых с такими нуклеофильными реагентами, как спирты и амины (разд. 5.1.1.7), проходят с участием карбонильной группы.
Обычно присоединение металлоорганических реагентов к N-алкокси- или N-арилоксикарбонилпиридиниевым солям [192] проходит одновременно по положениям 2 и 4 [198], а селективное присоединение по положению 4 возможно при использовании медьорганических соединений [199]. Индол в виде нейтральной молекулы реагирует с хлоридом N-бензоилпиридиния по положению 4 [200], в то время как индолил-анион присоединяется к 1-метилпиридиниевым солям, содержащим ацильную группу в положении 3, либо по атому С(б), либо по атому С(4) в зависимости от природы используемого растворителя [201]. Высокая селективность присоединения по положению 2 обнаружена при использовании фенильных [202], алкенильных и алкинильных [203] металлоорганических реагентов, в том числе этоксикарбонилметил- [204] и алкинилсодержащих [205] оловоорганических соединений.
Дигидропиридины, получаемые описанным выше способом, можно использовать для введения заместителя в p-положение в результате ацилирования енамида [150], или в a-положение через предварительное образование 2-литийорганиче-ского производного; каждый из этих двух процессов иллюстрируется ниже [150]:
IT Н
СО2Ме
CH2=CHMgBr
CICO2Ph
f-BuOK THF, 20 ‘С
‘ Еу
.'К
Р CO2Ph.
n-BuMgCI
-23 'С
CO2Ph
с*СбНцМдВг Cui,-20’С
49% *
CO2Ph
LiNEt21THF
20 ’С
80%
CONEt2 CONEt2
N
Силилирование пиридина по атому азота мре/и-бутилдиметилсилилзрифла-том приводит к образованию соли, которая вследствие большого объема заместителя реагирует с реактивами Гриньяра исключительно по положению 4 [206]. Присоединение силиловых эфиров енолов к пиридину, катализируемое монтмориллонитом, также приводит к образованию 1-триметил сил ил-1,4-дигидро-пир идинов с ацилалкильным заместителем в положении 4 [207].
PBu(Me)2SiOSO2CF3 n-C6Hi3MgBr
CH2CI2,20 ’С Г| | THF, 20 *С г
I CF3SO3
Me iS-Bu
Me
л-СбЬЦз
Заместители в положении 4 способствуют атаке металлоорганических соединений по а-положению [208,209]; таким образом, при использовании субстратов, содержащих удаляемые блокирующие группы в положении 4, например триметилстаннильную, можно получать 2-замещенные производные пиридина, как показано ниже [210]:
С1СО2Ме
СО2Ме
Использование хиральных хлорформиатов, например, полученных из /иранс-2-(а-кумил)циклогексанола, позволяет провести диастереоселекгивное присоединение металлоорганических реагентов к 4-метоксипиридину. Введение триизопропилсилильной группы в положение 3 существенно повышает диастереоселективность присоединения. Полученный по приведенной ниже схеме многофункциональный хиральный пиперидин используется в асимметрическом синтезе природных соединений [211].
OMe
1 PhCH=CHCH=CHMgBr
'Ч^м-Ргз ciCO2R\ THF, Ph Me,-78‘C
о
81%
86% de p
Si/-Pr3
N co2r*
ОМе
SiAPr3 водн. (CQ>H)2
COZR‘
R* = (+)-транс-2-(а-кумил)циклогексил
о
о
NaOMe затем водн. (СО2Н)2
93% Rz4N.
H
ч, Вос2О NaHMDS L-селектрид Ме‘ Я Et3N, DMAP Mel r TMSCI, Nalr
он
L-селектрид NaQH
N
(+)-диеномицин С Н
R*^N' H
Присоединение некоторых нуклеофильных реагентов к N-фторпиридиние-вым солям сопровождается самопроизвольным элиминированием фторид-иона, что приводит к 2-замещенным пиридинам и исключает необходимость
заключительной стадии ароматизации. Основной недостаток такого метода состоит в том, что для получения N-фторпиридиниевых солей необходимо использовать молекулярный фтор и, кроме того, при реакции с некоторыми карбанионами выходы продуктов присоединения низкие, поскольку параллельно проходит конкурирующая реакция С-фторирования. Тем не менее использование в таких процессах силиловых эфиров енолов и стабилизированных гете-ронуклеофильных реагентов (фенолятов, азидов) достаточно эфффективно. Присоединение к N-фторпиридиниевым солям идет главным образом по а-по-ложению [212].
,OSiMe3
f2
ch2ci2
-75 -»-50 у
Of-Bu TBAF.CH2C12 -50 ,С->0,С 60%
F F
Аналогичным образом можно получить пиридиновые фосфониевые соли и фосфонаты взаимодействием соединений трехвалентного фосфора с легко доступными N-трифторметансульфонилпиридиниевыми катионами; в том случае, если уходящей группой служит трифторметансульфинатная, атака нуклеофилом проходит обычно по положению 4 [213].
Tf2o MeCN, О *С
100%
Р(ОМе)3, Nal
MeCN, 0 "С -> 20 *С 85%
SO2CF3 CF3SO3"
SO2CF3
Et3N
MeCN, 20 *С
76% *
5.13.3. Другие реакции нуклеофильного присоединения
Существуют также и другие примеры присоединения нуклеофилов к N-алкилпиридиниевым солям. Изучение процесса обратимого присоединения к иодиду З-циано-1-метилпиридиния показало, что атака нуклеофилом по а-положению кинетически предпочтительна, в то время каку-аддукт более термодинамически стабилен [214]. Аналогично в результате термодинамически контролируемого процесса присоединение нуклеофилов к катиону 1-метил-З-нитропиридиния проходит по положению 4, причем образующийся в результате такого присоединения аддукт стабилизирован вследствие сопряжения кольцевого атома азота и нитрогруппы [215]. у-Аддукгы, полученные в результате присоединения к катионам 1-метил- или 1-фенилпиридиния, который не содержит в положении 3 заместителя, способного к сопряжению, можно превратить в стабильные соединения при использовании окислителей, как показано на приведенной ниже схеме [216]:
CH3NO2, КМпОд NH3 (жидк.) 80%
5.13.4. Нуклеофильное присоединение с последующим раскрытием цикла [217]
Существует множество примеров, когда присоединение нуклеофильных реагентов по положению 2 пиридиниевых солей, обычно (хотя и не только) содержащих электроноакцепторный заместитель при атоме азота, влечет за собой раскрытие пиридинового цикла. Классический пример такого превращения — присоединение гидроксид-иона к аддукту пиридина и триоксвда серы, приводящее к образованию натриевой соли глутаконового альдегида, показанное на приведенной ниже схеме [218]:
Другой хорошо известный пример — синтез азулена с использованием бис-диметиламинопроизводного глутаконового альдегида, образующегося из хлорида 1-(2,4-динитрофенил)пиридиния (соль Цинке) при действии диметиламина с последующим удалением 2,4-динитроанилина [219]:
NaOMe 51%
Реакция соли Цинке с первичными аминами, в том числе с эфирами аминокислот, представляет собой удобный метод синтеза хиральных пиридиниевых солей [220]
(5)-а-фенилэтиламин л-ВцОН, кипячение 90%
И, наконец, еще один пример нуклеофильного присоединения, приводящего к раскрытию цикла, — реакция пиридина с бензоилхлорцдом и бензальдегидом. В этом случае образующийся в результате раскрытия цикла «гидратированный» пиридин может быть выделен [221]
PhCHO, PhCOCI 78%
Ph OCOPh
Н
водн. KOH О‘С
5.13.5. Реакции циклизации с участием a-положений или а-заместителей
Примеры циклизаций пиридиниевых солей, в которых замыкание цикла происходит с участием a-заместителя или обладающего электрофильным характером сс-положения (см. также разд. 5.1.1.8), довольно многочисленны (разд. 25.1.2, 25.2.1-25.2.3).
5.13.6. N-Дезалкилирование
Превращение N-алкил- и N-арилпиридиниевых солей в соответствующие пиридины — процесс достаточно сложный, однако в случае N-метильных солей дезалкилирование возможно при действии трифенилфосфина [222] или в результате простого нагревания иодидов [223]. Хлорид 1-трифенилметил-4-диме-тиламинопиридиния [224] и трифлат 1-триал кил сил и л пиридиния [225] представляют собой стабильные соли, которые можно выделить и использовать для О-тритилирования и О-силилирования в результате переноса тритильной или триалкилсилильной группы от положительно заряженного атома азота. Эти соли обычно используют без выделения, получая их взаимодействием 4-диметил-аминопиридина с трифенилхлорметаном или, например, с /лре/и-бутилдиме-тилхлорсиланом [226].
Пиридиниевые соли, полученные из 2,4,6-тризамещенных пиридинов взаимодействием первичных аминов с перхлоратами 2,4,6-тризамещенных пирилиевых катионов, представляют собой удобные алкилирующие агенты, поскольку заместитель при атоме азота может быть перенесен на введенный в реакцию нуклеофильный реагент [227]. Этот процесс в целом можно рассматривать как метод превращения первичных аминов в другие различные соединения.
Ph
МеСН2 BF4“
NaOAc, 100 *С 0,1 мм рт. столба
79%
МеСН2
ОАс
5.14. N-ОКСИДЫ ПИРИДИНА [228]
N-Оксиды пиридина обладают черезвычайно интересной реакционной способностью [229], существенно отличающейся от реакционной способности как самих пиридинов, так и четвертичных пиридиниевых солей.
0,65 D
5,02 D
4,25 D
Мек Ле. N
Наиболее примечательное отличие N-оксидов пиридина от самих пиридинов состоит в гораздо большей склонности первых к реакциям электрофильного нитрования. Предположительно это связано с мезомерным электронодонорным влиянием атома кислорода N-оксидного фрагмента, аналогичного тому, которое увеличивает склонность фенолов и фенолятов к таким реакциям. Подтверждением этого предположения может служить сравнительное сопоставление дипольных моментов триметиламина и соответствующего N-оксида, с одной стороны, и дипольных моментов пиридина и его N-оксида, с другой. Разность дипольных моментов во второй группы соединений, равная 2,03 D, существенно меньше, чем разность дипольных моментов в первой группы соединений, равная 4,37 D. Такое малое отличие дипольных моментов пиридина и его N-оксида свидетельствует о существенном вкладе в структуру N-оксида пиридина канонических форм, в которых кислород нейтрален, а пиридиновое кольцо отрицательно заряжено. В действительности ситуация еще более тонкая, поскольку резонансные формы, несущие положительный заряд в а- и у-положе-ниях, предполагают существование также противоположной поляризации цикла, что сказывается на облегчении реакций нуклеофильного замещения по этим положениям. Таким образом, N-оксидная группа в N-оксидах пиридина в зависимости от условий облегчает протекание реакций как электрофильного замещения, так и нуклеофильного замещения по а- и у-положениям.
ит.д.
Существует много методов превращения N-оксидов пиридина в соответствующие пиридины: такой процесс может быть осуществлен при комнатной температуре при использовании иодида самария, хлорида хрома(И), хлорида оло-ва(П) в присутствии соединений низковалентного титана, формиата аммония и палладиевого катализатора или в результате каталитического гидрирования [230]. Наиболее часто используемые методы основаны на переносе атома кислорода N-оксидов пиридина к атому трехвалентного фосфора [228] или к атому двухвалентной серы [231].
Et3O+ BF4"
CHCI3, кипячение
91%
+ Ph3PO
OEt ВРд”
5.14.1. Электрофильное присоединение и замещение
N-Оксиды пиридина протонируются и алкилируются по атому кислорода; в некоторых случаях могут быть выделены стабильные соли [232]. При взаимодействии N-алкоксипиридиниевых солей с горячим водным раствором гидроксида натрия алкоксигруппа удаляется в виде соответствующего альдегида [233].
Вг2,Т1(ОАс)з
АсОН, 60 *С
53%
дым. HNO3
конц. H2SO4,100JC 66%
Электрофильное нитрование и бромирование N-оксидов пиридина может быть селективно проведено по положению 4 [234] при реакции с самим N-окси-дом пиридина [235]. В тех случаях, когда N-оксиды пиридинов протонируются, первоначально электрофильное замещение проходит аналогично пиридину и пиридиниевым катионам по р-положению [236], в то время как меркурирование приводит к образованию продукта а-замещения [237]:
35%
HgSO4
H2SO4,170 *С
5.14.2. Нуклеофильное присоединение и замещение
Скорость нуклеофильного замещения атома галогена в а- и у-положениях N-оксида пиридина выше, чем в самом пиридине. Порядок реакционной способности заместителей (4>2>3) в ракциях нуклеофильного замещения одинаков и для пиридина, и для N-оксида пиридина; другой порядок реакционной способности обнаружен для иодидов N-метилпиридиния (2 > 4 > 3) [238].
Реактивы Гриньяра присоединяются к N-оксидам пиридина с образованием аддуктов, которые могут быть охарактеризованы при низких температурах. При комнатной температуре эти аддукты претерпевают дисротаторное раскрытие цикла, в результате которого образуются ациклические ненасыщенные оксимы. Нагревание этих оксимов в уксусном ангидриде приводит к образованию ароматических структур в результате электроциклического замыкания цикла и необратимого элиминирования молекулы уксусной кислоты [239].
Аналогичное раскрытие никла в результате нуклеофильного присоединения наблюдается и для 1-алкоксипиридиниевых катионов [240,241], однако предварительное ацилирование N-оксидов пиридина и дальнейшее взаимодействие с алкильными и арильными реактивами Гриньяра сразу приводит к образованию 2-замешенных производных пиридина [241,242]
Очень удобный способ превращения N-оксида пиридина в 2-цианопиридин основан на предварительном превращении N-оксида в силилокси- или карбаматное производное [243]. Этот метод полностью вытеснил ранее используемый способ получения 2-цианопиридина из N-алкоксипиридиниевых солей [244].
5.14.3. Перегруппировки
Существует ряд синтетически полезных перегруппировок, позволяющих превратить N-оксиды пиридинов в различные производные пиридинов, при этом модификации подвергаются как а- и у-положения, так и заместитель в а-положении.
N-Оксид 2-метилпиридина при взаимодействии с горячим уксусным ангидридом превращается в 2-ацетоксиметилпиридин; использование трифторуксусного ангидрида позволяет провести такое превращение при комнатной температуре и с меньшим количеством побочных продуктов реакции [245]. Такое же превращение с участием 2-ацетоксиметилпиридина приводит после гидролиза к пиридин-2-карбальдегиду [246]. Механизм такой перегруппировки легче всего описать с привлечением электроциклического процесса, как показано ниже [247]:
О Ас
При отсутствии заместителя в положении 2 реакции N-оксида пиридина с тионилхлоридом и уксусным ангидридом приводят к образованию 2- и 4-хлор-или 2-ацетоксипиридинов. Такие превращения реализуются в результате последовательных процессов электрофильного присоединения, нуклеофильного присоединения по а- или у-положениям и элиминирования на заключительной стадии [228]. Ниже приведена схема, иллюстрирующая возможный механизм перегруппировки, а также другие аспекты химии N-оксидов пиридина [248].
5.15. СИНТЕЗ ПИРИДИНОВ
5.15.1. Синтез кольца
Существует очень много различных методов построения пиридинового цикла.
В последующих разделах рассмотрены основные из этих методов.
5.15.1.1. Из аммиака и 1,5-дикарбонильных соединеий
При взаимодействии аммиака с 1,5-дикарбонильными соединениями образуются 1,4-дигидропиридины, которые легко окисляются в соответствующие пиридины. При использовании ненасыщенных 1,5-дикарбонильных соединений или их синтетических эквивалентов (например, солей пирилия) сразу образуются ароматические производные пиридина
1,5-Дикетоны можно получить различными способами, например, в результате реакции Михаэля енолятов и енонов (или предшественников оснований Манниха [249]), при озонолизе производных циклопентена или при взаимодействии силиловых эфиров енолов с 3-метоксиаллильными спиртами [250]. Реакция аммиака с 1,5-дикетонами проходит с отщеплением двух молекул воды с образованием бисенаминов, т. е. 1,4-дигидропиридинов, которые обычно нестабильны и легко дегидрируются в соответствующие ароматические соединения.
Необходимость окисления на заключительном этапе отпадает, если использовать вместо аммиака гидроксиламин [251], так как в этом случае 1,4-элиминирование молекуы воды приводит к ароматическому производному пиридина. Такая же стратегия используется в синтезе производимых пиридина, при котором конструирование синтетического эквивалента 1,5-дикарбонильного соединения происходит в результате тандемного процесса, включающего реакцию Михаэля аниона диметилгидразона с еноном и последующее ацилирование. Элиминирование диметиламина на заключительной стадии приводит к образованию ароматического пиридинового цикла [252]
Как ранее отмечалось, использование в реакции с аммиком ненасыщенных 1,5-дикарбонильных соединений сразу приводит к образованию ароматических производных пиридина. Разработан ряд методов синтеза ненасыщенных дикетонов, включая методы, использующие соли пирилия и 2-пироны [253] (гл. 8) в качестве их предшественников, а также алкилирование енолятов 3,3-бис(метил-тио)енонами [254].
Если один из карбонильных атомов углерода имеет степень окисления, соответствующую карбоновой кислоте (как, например, в случае 2-пирона), та же степень окисления сохраняется и в образующемся производном пиридина (2-пи-ридон) [255]. Аналогично при взаимодействии 4-пиронов (разд. 8.2) с аммиаком и первичными аминами образуются 4-пиридоны [256]. Пиридоны можно также получить при реакции аммиака и первичных аминов с бисенаминами, образую-
щимися при конденсации кетонов с двумя молекулами диметилацеталя диме-тилформамида [257]. В том случае, когда один из «карбонильных» атомов углерода включен в нитрильную группу, образуются аминопиридины [258].
DMFDMA р(1
DMF, нагревание
71%
Me2N
MeNH2
EtOH, кипячение
26%
NMe2
5.15.1.2. Из альдегида, двух молекул 1,3-дикарбонильного соединения и аммиака
Симметричные 1,4-дигидропиридины, которые легко окисляются до соответствующих ароматических соединений, можно получить при взаимодействии аммиака, альдегида и двух молекул 1,3-дикарбонильного соединения, который обязательно должен содержать метиленовую группу.
Синтез Ганча [259]
Классический вариант синтеза Ганча приводит к симметрично замещенным 1,4-дигвдропиридинам, поскольку при этом используется два эквивалента 1,3-дикарбонильного соединения. Карбонильный атом молекулы альдегида становится атомом С(4) пиридинового цикла. Последовательность промежуточных стадий синтеза Ганча точно не установлена, и, вероятно, может варьироваться от случая к случаю. Например, участие аммиака возможно как на ранних, так и на поздних стадиях процесса. Наиболее рациональная последовательность стадий включает альдольную конденсацию с последующей реакцией Михаэля, что приводит к образованию 1,5-дикарбонильного соединения in situ.
1,4-Дигидропиридины, полученные по методу Ганча, содержат в каждом p-положении заместители, способные к сопряжению, что обеспечивает их стабильность настолько, что их можно выделить и затем окислить в соответствующие ароматические производные пиридина. Классические методы дегидрирования 1,4-дигидропиридинов основаны на применении азотной или азотистой кислот; это превращение также может быть гладко осуществлено с использованием церий(1У)аммонийниграта, нитрата меди(П), нанесенного на монтмориллонит, или диоксида марганца, нанесенного на бентонит [260].
Несимметричные 1,4-дигидропиридины можно получить при проведении синтеза Ганча в две стадии, т. е. первоначально можно синтезировать продукт альдольной конденсации и затем провести его взаимодействие с аммиаком и другим 1,3-дикарбонильным соединением или енаминокетоном [261].
5.15.1.3. Из 1,3-Дикарбонильных соединений и 3-аминоенонов или 3-аминонитрилов
Производные пиридина также образуются при взаимодействии 1,3-дикарбо-нильных соединений с 3-аминоенонами или 3-аминоакрилатами; в том случае, когда вместо аминоенонов используется цианоацетамид, получаются 3-циано-2-пиридоны.
Этот метод, вероятно, наиболее удобен и полезен, поскольку позволяет получать несимметрично замещенные пиридины, используя в качестве исходных относительно простые соединения. В этом случае интермедиаты процесса также не удается выделить, поэтому точная последовательность промежуточных стадий до конца не ясна.
З-Аминоеноны и 3-аминоакрилаты можно получить прямым взаимодействием аммиака с 1,3-дикетонами и 1,3-кетоэфирами. Простейшее 1,3-дикарбо-нильное соединение — малоновый диальдегид — слишком нестабилен для это-
го синтеза пиридинов, однако вместо него можно использовать легко доступный эфир енола моноацеталя малонового диальдегида, как показано ниже [262]. Соли строения R2CH=CR'CH=N+R2, которые представляют собой винилоги амидинов, служат эквивалентами замещенных малоновых диальдегидов или кетоальдегидов [263].
N Ме
Синтез Гуарески
Использование цианацетамида в качестве азотсодержащего соединения в конденсации с 1,3-дикарбонильными соединениями приводит к образованию 3-ци-ано-2-пиридона, карбонильная и цианохруппы которого могут быть впоследствии удалены.
При введении в реакцию с 3-аминоеноном, аминоакрилатом и цианацетамидом дикарбонильного соединения, карбонильные группы которого существенно различаются по реакционной способности, можно получить только один из двух возможных изомерных пиридинов или пиридонов в результате реакции с участием наиболее электрофильного карбонильного атома углерода [264,265].
-CN
пиперидин
АсОН, нагревание
59% Me^^N^O
Н
При использовании ацетиленовых кетонов региоселективность реакции контролируется сопряженным присоединением цианацетамида [266]; аналогично в случае 3-алкоксиенонов (т. е. эфиров енолов 1,3-дикетонов) протекающая на первой стадии реакция Михаэля определяет региоселективность синтеза производных пиридина.[264, 267]. Применение H2NCOCH2C(NH2)==N+H2 С1~
вместо цианацетамида позволяет получать амиды 2-аминопиридин-З-карбоно-вых кислот [268], в то время как использование H2NCOCH2NO2 вместо цианацетамида приводит к З-нитро-2-пиридонам [269].
Успешное образование пиридинового цикла возможно также при использовании исходных соединений в более низкой степени окисления: дегидрирование может быть осуществлено либо кислородом воздуха, либо привнесенным в реакционную смесь кислородом (например, возможно использование вместо 1,3-дикарбонильного соединения а,р-ненасыщенных кетонов и альдегидов, как показано ниже) [270]:
4f-BuOK, О2
DMSO, 20 ’С
61%
5.15.1.4. С использованием реакций циклоприсоединения
Различные электроциклические процессы, сопровождающиеся последующей экструзией малых молекул, используются для синтеза производных пиридина; присоединение к оксазолам — один из таких процессов.
Разработан ряд удобных методов построения пиридонового кольца, использующих реакции бл-циклоприсоединения, в том числе, с обратными электронными требованиями. Первый из таких методов основан на присоединение диенофилов к оксазолам: в некоторых случаях атом кислорода изоксазола остается в молекуле образующегося пиридина (3-гидроксипиридина), в других — элиминируется, как это показано ниже [271]:
1,2,3- [272] и 1,2,4-Триазины вступают как азадиены в реакции циклоприсоединения с обратными электронными требованиями с енаминами; последующая экструзия молекулы азота и элиминирование молекулы амина приводят к
образованию пиридинового цикла (см. разд. 25.2.1) [273]. 1,2,4-Триазины вступают в реакции циклоприсоединения также и с другими диенофилами; так, при взаимодействии с этинилтрибутилстаннаном образуется 4-станнилпиридин [274], норборнадиен выступает в таких реакциях как эквивалент ацетилена [275]; в качестве диенов также можно использовать оксазиноны [276].
В качестве азадиенов в реакциях с диенофилами могут выступать О,О'-бис-?пре/я-бутилдиметилсилильные производные имидов; такие процессы с последующим десилилированием приводят к образованию 2-пиридонов [277].
TBDMS
TBDMSOTf Et3N
Ме02СОСС02Ме CHCI3, кипячение
DMS
5.15.1.5. С использованием термической электроциклизации
Электроциклизация 1-аза-1,3,5-триенов генерирует дигидропиридины, которые могут быть окислены в соответствующие ароматические соединения. В том случае, когда используются оксимы или производные гидразинов, в результате электроциклизации сразу образуются ароматические производные пиридинов за счет спонтанного отщепления молекул воды или амина. Этот метод особенно удобен для получения конденсированных систем, содержащих пиридиновое кольцо; некоторые примеры таких синтезов приведены ниже [278]:
5.15.1.6. Из фуранов
2-Фурфуриламины можно превратить в производные пиридинов через последовательные процессы раскрытия и замыкания цикла; таким путем, например, производные 2,5-диметокси-2,5-дигидрофурана превращены в производные 3-гидроксипиридина
Некоторые значимые методы конструирования пиридинового цикла включают процессы раскрытия фуранового цикла с последующим замыканием пиридинового. 2,5-Дигидро-2,5-диметоксифураны, содержащие аминоалкильный заместитель, используются для получения 3-гидроксипиридинов [279].
АР
СО2Ме 43%
анодное окисление
затем МНз
затем LiAIH» Me
водн. HCI ,ОМе О ’С
/-Рг'х\/ЛчсН2МН2 69%
При реакции фурфуриламина с формальдегидом [280] или ароматическим альдегидом (с предварительным введением защитной группы к атому азота и литиированием по положению 5) [281] образуются 6-замещенные 3-гидрокси-пиридины
5.15.1.7. Прочие методы
Алкилпиридины производят в промышленности с использованием сложных химических процессов, при которых часто образуются смеси продуктов. В качестве примера приведем необычный синтез Чичибабина, при котором паральдегид и гидроксид аммония взаимодействуют при 230 °C и повышенном давлении, в результате чего образуется 5-этил-2-метилпиридин с выходом 52%: на образование пиридина расходуется четыре эквивалента ацетальдегида и один эквивалент гидроксида аммония [282]. Коммерческое значение также имеет взаимодействие нитрилов с ацетиленом, катализируемое соединениями кобальта [283].
нс=сн
cpCo(cod), 14 атм, кат.
Cbz
80%
5.15.2. Примеры синтезов некоторых важных производных пиридина
5.15.2.1. Фузариновая кислота
Фузариновая кислота — продукт жизнедеятельности плесневых грибков, обладающий антибиотической и антигипертензивной активностью. Два метода синтеза этого соединения основаны на реакции циклоприсоединения: более ранний [284] — для получения 1,5-дикетона, другой [285] — для генерирования 1 -диметил амино-1,4-дигидропиридина
пиридин, кипячение
h2noh
затем SeO2
л-Ви.
Me
фузариновая [кислота
n'X4co2h
HCI, 20’С (- Me2NH) 63%
5.15.2.2. Пиридоксин
Пиридоксин — витамин Вб — был синтезирован различными методами; в одном из них, приведенном ниже, для построения цикла используется метод Гуарески [286]:
Me—О H2N
CH2OEt
CN EtOH, пиперидин кипячение
□ 81% Me—N—О
H
о
CH2OEt
Г гы °2N конц. HNO3 Ac2O, 0 ‘C
32% ме
CH2OEt
<sf.CN _________ pci5,poa3
I -C
‘N О 40%\
H \ CH2OEt
°2NK^L^CN
НО пиридоксин ]|
СН2ОН
Т 48% НВг, нагревание
^ч^СНгОН затем AgCI NaNO2
Т Н2О, нагревание ид, др *с
CH2OEt
HzN\/s^^CH2NH2
Me^^N CI
i2, Pd/Pt AcOH
40%
5.15.2.3.2- Метокси-4-метил-5-нитропиридин
2-Метокси-4-метил-5-нитропиридин —• промежуточное соединение в синтезе порфобилиногена (разд. 13.8.3.1).
NaNH2 ксилол, кипячение^ 66%
Me
O2N
конц. HNO3
конц. H2SO4, О 'С | [
95% L
NH2
7:2.5
NH2
N
5.15.2.4. Немертеллин
Полный синтез немертеллина — токсина глистов — иллюстрирует использование металлирования пиридинового цикла и образующихся металлированных производных в катализируемых палладием реакциях сочетания [287].
Упражнения
Простые упражнения для проверки усвоения материала гл. 4 и 5
(а) Каким образом пиридин взаимодействует с электрофильными реагентами, такими, как кислоты и алкилгалогениды?
(б) Какие факторы способствуют более сложному течению реакций электрофильного замещения в пиридине по сравнению с бензолом?
(в) Сравните поведение пиридина и бензола в реакциях окисления цикла и восстановления цикла.
(г) Приведите два примера реакций нуклеофильного замещения атома водорода в пиридине.
(д) Сравните реакционную способность бромбензола, 2-бромпиридина и 3-бромпи-ридина в реакциях нуклеофильного замещения атома галогена на этоксигруппу при взаимодействии с этилатом натрия.
(е) Как можно генерировать 2-литийпирцдин?
(ж) Какие соединения образуются при реакции 3-хлорпирвдина с диизопропилами-дом лития при низких температурах?
(з) Приведите основные таутомерные формы для 2-гидроксипиридина (2-пиридона), 3-гидроксипиридина и 2-аминопиридина.
(и) Каким образом можно получить 1-этил-4-пиридон из 4-пиридона без примеси изомерных продуктов реакции?
(к) Что происходит при обработке смеси 2- и 3-метилпиридинов в соотношении 1:1 0,5 экв. диизопропиламида лития и затем 0,5 экв. метилиодида?
(л) Приведите формулы ожидаемых продуктов реакции пиридина с метиловым эфиром хлоругольной кислоты и затем фениллитием.
(м) Объясните, почему в N-оксиде пиридина реакции электрофильного замещения по положению 4, а также реакции нуклеофильного замещения атома галогена в положении 4 реализуются легче, чем в самом пиридине.
(н) Приведите два важных метода синтеза производных пиридина из ациклических соединений.
(о) Какие соединения образуются в результате следующих реакций: (1) H2NCOCH2CN (цианацетамид) с МеСОСН2СОМе; (2) MeC(NH2)=CHCO2Et (этиловый эфир 3-аминокротоновой кислоты) с МеСОСН2СОМе; (3) PhCH=O, МеСОСН2СОМе и NH3?
Упражнения повышенной сложности
1. Предложите структуры продуктов следующих превращений: (a) C7H8N2O3, полученного при взаимодействии 3-этоксипиридина со смесью дымящей HNO3 и концентрированной H2SO4 при 100 *С; (б) C6H4BrNO2, полученного при взаимодействии 4-метилпиридина сначала с Вг2/Н28О4/олеум, а затем с горячим КМпО4.
2. Предложите структуру соединения C9Hi5N3, полученного взаимодействием пиридина с калиевой солью Me2N(CH2)NH2.
3. Предложите структуру продуктов следующих реакций: (а) 2-хлорпирвдина с гидразином -> C5H7N3 (7) и водой -> C5H5NO (2), (б) 4-нитропирццина с водой при 60 °C-> C5H5NO.
4. Предложите структуры соединений, образующихся в реакциях 4-хлорпиридина с метоксидом натрия -> C6H7NO (А), затем с метилиодидом —> C7Hi0INO и далее при нагревании при 185 °C -> CeH7NO, изомерное А.
5. Обработка 4-бромпиридина NaNH2 в NH3 (жидк.) дает два соединения (изомеры С5НбК2), а реакция с метоксидом приводит только к одному соединению C6H7NO. Какие соединения и в чем их различие?
6. Напишите структуры соединений, образования которых можно ожидать в результате следующих последовательных преращений: (а) 4-диизопропиламинокарбо-нилпиридин с изопропиламидом лития, затем с бензофеноном, затем с горячей кислотой -> Ci9Hi3NO2; (б) 2-хлорпиридина с изопропиламидом лития, затем с иодом -> C5H3C1NI; (в) 3-фторпирйдина с изопропиламидом лития, затем с ацетоном -> C8Hi0FNO; (г) 2-бромпиридина с бутиллитием при -78 еС, затем хлорт-риметилстаннан -> C8HI3NSn.
7. Кристаллическое твердое вещество C9HnBrN2O3 образуется при реакции 2-ме-тил-5-нитропиридина с бромацетоном, а последующая обработка NaHCO3 приводит к соединению C9H8N2O2 — предложите строение этого соединения и напишите механизм процесса.
8. Если соль C9Hi3IN+ 1~, получаемую при взаимодействии пиридина с 1,4-дииодбу-ганом, обрабатывают Bu3SnH в присутствии азобисизобутиронитрила. Образует
ся новая соль C9Hi2N+ I”, в спектре ПМР которой проявляется синглет четырех ароматических протонов. Предложите структуры обеих солей и механизм образования последней.
9. Предложите структуру соединения CeHiiNOj, образующегося из 4-метил-2-пири-дона в результате следующей последовательности превращений: облучение при 310 нм и обработка О3/МеОН/ —78 °C, затем NaBH4.
10. Предложите структуры соединений, образующихся на каждой стадии в следующих превращениях: 4-метилпиридин реагирует с NaNH2 C6HgN2, затем с NaNO2/H2SO4 при 0 °C -> 20 °С -> CgHjNO, затем с метоксидом натрия и метил-иодидом -> C7H9NO и, наконец, с KOEt/(CO2Et)2 -4 CuHi3NO4.
11. Нитрование анилина обычно невозможно, тогда как нитрование 2- и 4-аминопи-ридинов может быть легко проведено. Почему?
12. При взаимодействии 3-гидроксипирвдина с 5-бромпентеном-1 образуется кристаллическая соль CioHi4NBrO. При обработке этой соли мягким основанием образуется диполярное соединение C]0Hi3NO, которое при нагревании превращается в нейтральный неароматический изомер. Предложите структуры образующихся соединений.
13. Объясните относительно легкое декарбоксилирования пиридин-2-уксусной кислоты. Какое органическое соединение при этом образуется?
14. Предложите структуру соединения Ci6H22N2O5, образующегося при взаимодействии 4-винилпиридина с диэтилацетамццомалонатом [AcNH(CO2Et)2] и основанием.
15. Напишите структуры соединений, образующихся в следующих реакциях: (а) 2,3-ди-метилпиридин с бутиллитием, затем с дифенилдисульфидом -► Ci3Hi3NS; (б) 2,3-ди-метилпиридин с N-бромсукцинимидом, а затем с PhSH -> Ci3Hi3NS [изомерное продукту реакции (а)].
16. Предложите структуры изомерных соединений C7H6N2O (образующихся в соотношении 4:3) при взаимодействии иодметилата 3-цианопиридина со щелочным феррицианидом калия.
17. Предскажите положения, в которые будет вступать дейтерий, при взаимодействии иодида 1-бутилпиридиния с NaBD4 в EtOH; главным образом при этом образуется 1-бутил-1,2,5,6-тетрагидропиридин.
18. Предложите структуры промежуточных соединений и конечного продукта следующей последовательности превращений: пиридин взаимодействует с метилхлороформиатом и боргидридом натрия -> C7H9NO2, затем при облучении образуется изомер, у которого в спектре ЯМР присутствуют сигналы только двух олефиновых протонов.
19. При нагревании N-оксида пиридина с конц. H2SO4 и конц. HNO3 образуется соединение C5H4N2O3; при его взаимодействии с РС13, а затем с H2/Pd-C последовательно образуются соединения CsH4N2O2 и C5H6N2. Предложите структуры этих трех соединений.
20. Предложите структуру циклического соединения Ci8H2iNO4, образующегося при взаимодействии аммиака, фенилацетальдегида (РЬСНгСН=О) и 2 мольных эквивалентов метилового эфира ацетоуксусной кислоты. Каким образом полученное соединение можно превратить в пиридин?
21. 2,3-Дигидрофуран реагирует с акролеином, давая соединение C7Hi0O2, реакция этого соединения с водн. H2NOH/HC1 дает пиридин C7H9NO. Предложите структуры этих соединений.
22. Какие пиридины или пиридоны образуются в следующих реакциях: (a) H2NCOCH2CN (цианацетамид) с (7) EtCOCH2CO2Et, (2) 2-ацетилциклогекса-
ионом, (5) этилпропиолатом; (б) MeC(NH2) = CHCO2Et (этиловый эфир 3-ами-нокротоновой кислоты) с (7) бутин-З-оном-2, (2) MeCOC(CO2Et)=CHOEt?
23. При обработке натриевой соли формилацетона (МеСОСН=СНО- Na+) аммиаком образуется пиридин CgH9NO. Предложите структуру и объясните региохимию процесса.
Литература
1. «Drugs against drug», Gaskell D. Chem Brit, 1998 (December), 27.
2. Summers L. A. The bipyridinium herbicides, Academic Press, London, 1980.
3. Arnett E. M., Chawla B., Bell L., Taagepera M., Hehre Ж. J., Taft R. W. J. Am. Chem. Soc., 99,5729 (1977).
4. Corey E. J., Zheng G. Z. Tetrahedron Lett., 39,6151 (1998).
5. Olah G. A., Narang S. C., Olah J. A., Pearson R. L., Cupas C. A. J. Am. Chem. Soc., 102, 3507(1980).
6. Duffy J. L.f Laali К. K. J. Org. Chem., 56, 3006 (1991).
7. GdslR., Meuwsen A. Org. Synth., Coll. Vol. V, 1973, 43.
8. Baumgarten P. Chem. Ber., 59,1166 (1926).
9. Evans R. F, Brown H. C., Van derPlas H. C. Org. Synth., Coll. Vol. V, 1973,977.
10. Popov A. I., Rygg R. H. J. Am. Chem. Soc., 79,4622 (1957).
11. Umemoto T., Tomita K.f Kawada K. Org Synth., 69, 129 (1990).
12. King J. A,, Bryant G. L. J. Org. Chem., 57, 5136 (1992).
13. «Dialkylaminopyridines as highly active acylation catalysts» Hdfle G., Steglich W., Vorbruggen H. Angew. Chem., Int. Ed. Engl., 17, 569 (1979); “Dialkylaminopyridines: super acylation and alkylation catalysts», Scriven E. F. V. Chem. Soc. Rev., 12, 129 (1983).
14. Guibe-Jampel E.t Wakselman M.,J. Chem. Soc., Chem. Commun., 1971,267.
15. Davies S. G., Shipton M. R. J. Chem. Soc., PerkinTrans. 1,1991, 501.
16. Zoltewicz J. A., Smith C. L. J. Am. Chem. Soc., 89, 3358 (1967); Zoltewicz J. A., CrossR. E. J. Chem. Soc., PerkinTrans. 2, 1974,1363 and 1368; WerstuikN, H., Ju C. Can J. Chem., 67, 5 (1989); Zoltewicz J. A., Meyer J. D. Tetrahedron Lett., 1968, 421.
17. Den Hertog, H. J. Overhoff J., Reel. Trav. Chim. Pays-Bas, 49, 552 (1930).
18. Brown E. V., NeilR. H. J. Org. Chem., 26, 3546 (1961).
19. Bakke J. M., Ranes E. Synthesis, 1997, 281; Suzuki H, Iwaya M., Mori T. Tetrahedron Lett., 38, 5647 (1997); Bakke J. M., Ranes E. J. Chem. Soc., Perkin Trans. 1, 1997, 1919; Bakke J, M., Svensen H, Ranes E. J. Chem. Soc., Perkin Trans. 2, 1998, 2477; Bakke J. M., Ranes E., Riha J., Svensen H. Acta Cherm. Scand., 53,141 (1999); Bakke J. M.t Riha J. ibid.1356.
20. Johnson C. D., KatritzkyA. R., RidgewellB. J., Viney M. J. Chem. Soc. (B), 1967,1204.
21. McElvain S. M., Goese M. A. J. Am. Chem. Soc., 65,2233 (1943).
22. «2,6-Di-f-butylpyridine — an unusual base», Kanner B. Heterocycles, 18, 411 (1982).
23. Den Hertog H. J., den Does L. V., Laandheer C. A. Reel. Trav. Chim. Pays-Bas, 91,864 (1962).
24. Pearson D. E, Hargreave W. W., Chow J. К. T., Suthers B. R. J. Org. Chem. 26, 789 (1961).
25. Paraskewas S. Synthesis, 1980,378.
26. McCleland N. R, Wilson R. Н J. Chem. Soc., 1932,1263.
27. Bartok W., Rosenfeld D. D., Schrieshelm A. J. Org. Chem., 28, 410 (1963); Black G., Depp E., Corson В. B. J. Org. Chem., 14, 14 (1949).
28. Jerchel D., Heider J, Wagner H. Justus Liebigs Ann. Chem., 613,153 (1958).
29. Chupakhin O.N., Charushin V. N.f van derPlas H. C. G. Nucleophilic aromatic substitution of hydrogen, Academic Press, San Diego, 1994.
30. Evans J. C. W, Allen C. E H. Oig. Synth., Coll. Vol. II, 1943,517.
31. «Formation of anionic a -adducts from heterocyclic compounds: structures, rates and equilibria», Illuninati G., Stegel. E Adv. Heterocycl. Chem., 34, 305 (1983).
32. Abramovitch R. A., Glam C.-S. Canad. J. Chem., 42, 1627 (1964); Abramovich R. A., Poulton G. A. J. Chem. Soc., (B), 1969,901.
33. «Amination of heterocyclic bases by alkali amides», Lefler M, T. Org. Reactions, 1,91 (1942); Advances in the Chichibabin reaction», McGill С. K, Rappa A. Adv. Heterocycl. Chem., 44, 2, (1988); «Advances in the amination of nitrogen heterocycles», Vorbruggen H. Adv. Heterocycl. Chem., 49,117 (1990).
34. Viscardi G., Savarino P., Quagliotto P., Bami E, Bottam M. J. Heterocycl. Chem., 33, 1195(1996).
35. Abramovitch R. A., Helmer E, Saha J, G. Chem. Ind., 1964,659; Ban Y, Wdkamatsu T. ibid., 710.
36. Seko S., Miyake K. Chem. Commun, 1998,1519.
37. Chichibabin A. E. Chem. Ber. 56,1879 (1923).
38. Katada M. J. Pharm. Soc. Jpn. 67, 59 (1947) [Chem. Abs., 45, 9537 (1951)]; den Hertog H. J., Broekman F. W., Combe W. P. Reel. Trav. Chim. Pays-Bas, 70, 105 (1951).
39. Hanessian S., Kagotani M. Synthesis, 1987,409.
40. Yamanaka H, Ohba S. Heterocycles, 31,895, (1990).
41. DuPriest, M. T, Schmidt C, L., Kuzmich D., Williams S. B. J. Org. Chem, 51, 2021 (1986).
42. Hashimoto S., Otani S., Okamoto T., Matsumoto K. Heterocycles, 27,319 (1988).
43. Loupy A., Philippon N., Pigeon P., Galons H. Heterocycles, 32, 1947 (1991).
44. Jamart-Gregoire B., Leger C., Caubere P. Tetrahedron Lett., 31, 7599, (1990); «Heterynes», den Hertog H J., Van der Plas H. C. Adv. Heterocycl. Chem., 4, 121 (1965); «Heterynes», Renecke M. G. Tetrahedron, 38,427 (1982).
45. Mallet M., Queguiner G. C. R. Acad. Sci., Ser. C., 274, 719 (1972); Walters M. A., Carter P. H., Banerjee S. Synth. Commun., 22, 2829 (1992).
46. Walters M. A., Shay J. J. Synth. Commun., 27,3573 (1997).
47. ZolterwiczJ. A., Grahe G., Smith C. L. J. Am. Chem. Soc., 91,5501 (1969).
48. Verbeek J., George A. V. E., de Jong R. I. P., Brandsma L. J. Chem. Soc., Chem. Commun., 1984, 257; Verbeek J., Brandsma L. J. Org. Chem., 49, 3857 (1984).
49. Taylor S. L., Lee D. Y., Martin J. C. Oig. Chem., 48,4157 (1983).
50. French H. E, Sears K. J. Am. Chem. Soc., 73,469 (1951).
51. Ishikura M., Kamada M., Oda L, Tereshima M. Heterocycles, 23, 117 (1985).
52. Ishikura M., Ohta T, Terashima M. Chem. Pharm. Bull., 33,4755 (1985).
53. Bell A. S., Roberts. D. A. Ruddock K. S. Synthesis., 1987, 843.
54. Kondo Y., Murata N., Sakamoto T. Heterocycles, 37,1467 (1994).
55. Ishikura M., Mano T, Oda I., Terashima M. Heterocycles, 22,2471 (1984)
56. Gros P., Fort Y. Caubere P. J. Chem. Soc., Perkin Trans. 1,1997, 3597; Gros P. Fort Y ibid., 1998, 3515.
57. Parham W. E, PiccirilUR. M. J. Org. Chem., 42, 257 (1977).
58. LipshutzB. H, PfeifterS. S., Chrisman W. Tetrahedron Lett., 40, 7889 (1990).
59. Cai D., Hughes D. L., Verhoeven T. R Tetrahedron Lett., 37,2537 (1996); Paterson M. A., Mitchel J. R. J. Org. Chem., 62,8237 (1997).
60. Corey E. J., Zheng G. Z. Tetrahedron Lett., 39,6151 (1998).
61. Gu Y. G., Baybunt E. К Tetrahedron Lett., 37,2563 (1996).
62. Gribble G. W., Saulnier M. G. Heterocycles, 35, 151 (1993).
63. Commins D. L., La Munyon D. H Tetrahedron Lett., 29, 773 (1988).
64. Ronald R. C., Winkle M. R. Tetrahedron, 39,2031 (1983).
65. Epsztajn J., Berski Z., Brzezinski J. Z., Jdzwich A. Tetrahtdron Lett., 21,4739 (1980).
66. Gungor T, Marsais E, Queguiner G. Synthesis, 1982,499.
67. Meyers A. I. Gabel R. A. Heterocycles 11,133 (1978).
68. Schlecker W., Huth A., Ottow E. J. Org. Chem., 60, 8414 (1995).
69. Hands D., Bishop B., Cameron M., Edwards J. S, Cottrell L F., Wright S. H. R. Synthesis, 1996, 877.
70. Watanabe M., Shinoda E., Shimizu Y., Furukawa S., Iwao M., Kuraishi T. Tetrahedron, 43,5281 (1987).
71. Marsais E, Trecourt E, Breant P., Queguiner G. J. Heterocycl. Chem., 25, 81 (1988).
72. Bargar T. M., Wilson T, Daniel J. K. J. Heterocycl. Chem., 22,1583 (1985).
73. Epsztain J., BieniekA., Kowalska J. A. Tetrahedron, 47, 1697, (1991).
74. Guillier E, Nivoliers E, Cochennee A., Godard A., Marsais E, Queguiner G. Synth. Commun., 26,4421 (1996).
75. Mongin O., Rocca P., Thomas-dit-Dumont L., Trecourt E, Marsais E, Godard A., Queguiner G. J. Chem. Soc., Perkin Trans. 1, 1995,2503.
76. Berillon L., Lepretre A., Turck A., Pie N.t Queguiner G., Cahiez G., Knochel P. Synlett, 1998, 1359; Trecourt E, Breton G., Bonnet V., Morgin G., Marsais E, Queguiner G. Tetrahedron Lett., 40, 4339 Abardi M., Dehmel E, Knochel P. Tetrahedron Lett., 40, 7449 (1999).
77. Okita T.t Isobe M. Synlett, 1994, 589; Godard A., Rovera J.-C., Marsais E, Pie N, Queguiner G. Tetrahedron, 48,4123 (1992).
78. FuJ., Chen Y., CastelhanoA. L. Sytntett, 1998, 1408.
79. Edo K, Sakamoto T., Yamanaka H. Chem. Pharm. Bull., 27, 193 (1979).
80. Head R. A., Ibbotson A. Tetrahedron Lett., 25, 5939 (1984).
81. Sakamoto T., Shiraiwa M., Kondo Y., Yamanaka H. Synthesis, 1983, 312; Sakamoto T, Nagata H, Kondo Y., Sato K, Yamanaka H. Chem. Pharm. Bull., 32,4866 (1984).
82. Zhang H, Kwong E Y, Tian Y.f Chan K. S. J. Org. Chem., 63, 6886 (1998); Lohse O.r Thevenin P., Waldvogel E. Synlett, 1999,45.
83. Ma H, WangX., Deng V. Synth. Commun., 29, 2477 (1999).
84. Yamamoto T., YanagiA. Heterocycles, 16,1161 (1981).
85. Bailey T. R. Tetrahtdron Lett., 27,4407 (1986).
86. Yamamoto Y, Tanaka T., Yagi M., Inamoto M. Zfcterocycles, 42,189 (1996).
87. Yamamoto Y., YanagiA. Chem. Pharm. Bull., 30,2003 (1982); Yamamoto K, OuchiH, Tanako T. ibid., 43,916 (1995).
88. WagawS, BuchwaldS. L. J. Org. Chem., 61,7240 (1996).
89. Jixiang C., Crisp G. T. Synth. Commun., 22,683 (1992).
90. WibautJ. R, Nicolai J. R. Reel. Trav. Chim. Pays-Bas, 58,709; (1939); McElvain S. M., Goese M. A. J. Am. Chem. Soc., 65, 2227 (1943).
91. Elofson R. М., Gadallah F. F., Schutz К F. J. Org. Chem., 36,1526 (1971); Gurczynski M., TomasikP. Org. Prep. Proc. Int., 23,438 (1991).
92. Bonnier J. M., Court J. Bull. Soc. Chim. Fr., 1972,1834; Vismara E., Fontana F., Morini G., Serravellt M., Giordano C. J. Org. Chem., 51,4411 (1986).
93. «Recent developments of free radical substitutions of heteroaromatic bases», Minisci F., Vismara E., Fontana F. Heterocycles, 28,489 (1989).
94. «The action of metal catalysts on pyridines», Badger G. M., Basse W. H. F. Adv. Heterocycl. Chem., 2, 179 (1963); «The bipyridines», Summers L. A. Adv. Heterocycl. Chem., 35,281 (1984).
95. Basse W. Y F. Org. Synth., Coll. Vol. V, 1973,102.
96. Newkome G. R., Hager D. C. J. Org. Chem., 47, 599 (1982).
97. Nielsen A. T., Moore D. W., Muha G. M., Berry К. H. J. Oig. Chem., 29, 2175 (1964); Frank R. L., Smith P. V Org. Synth., Coll. Vol. Ill, 1955,410.
98. Atlanti P. M., Biellmann J. F., Moron J. Tetrahedron, 29,391 (1973).
99. Ryang H.-S., Sakurai H. J. Chem. Soc., Chem. Commun., 1972, 594; Ohkura K.t Terashima M., Kanaoka Y., Seki K. Chem. Pharm. Bull., 41, 1920 (1993).
100. Jones K., FiumanaA. Tetrahedron Lett., 38, 8049 (1996).
101. Lunn G., Sansome E. B. J. Org. Chem., 51,513 (1986).
102. Giam C. S., Abbott S. D. J. Am. Chem. Soc., 93,1294 (1971).
103. Blough В. E, CarrollF. Z, Tetrahedron Lett., 34,7239 (1993).
104. Tsuge O., Kanemasa S., Naritomi T., Tanaka J. Bull. Chem. Soc, Jpn., 60,1497 (1987).
105. Birch A. L, Karakhanov E. A. J. Chem. Soc., Chem. Commun., 1975,480.
106. Cuerry P., NeierR. Synthesis, 1985,485.
107. Kamochi Y., Kudo T. Heterocycles, 36, 2383 (1993).
108. Cook N. C., Lyons J. E. J. Am. Chem. Soc., 88, 3396 (1966).
109. Hao L., Harrod. J. F., Lebuis A.-M., Mu Y., Shu R., Samuel E., Woo H.-G. Angew. Chem., Int. Ed. Engl., 37,3126 (1998).
110. Heap U. Tetrahedron, 31, 77 (1975); Tomisawa H, Hongo H. Chem. Pharm. Bull., 18, 925 (1970); Matsumoto K, Ikemi-Kono Y., Uchida T., Acheson R. M. J. Chem. Soc., Chem. Commun., 1979, 1091; «Diels-Alder cycloadditions of 2-pyrones and 2-pyri-dones», Afarinkia K, Viader V., Nelson T. D., Posner G. H. Tetrahedron, 48, 9111 (1992).
111. Posner G.H., VinaderV, Afarinkia K.Y Org. Chem., 57,4088 (1992).
112. «Synthetic applications of heteroaromatic betaines with six-membered rings», Dennis N., Katritvy A. R., Tareuchi Y. Angew. Chem., Int. Ed. Engl., 15, 1 (1976); «Cycloaddition reactions of heteroaromatic six-membered rings», Katritzky A. R., Dennis N. Chem. Rev., 89, 827 (1989); Lomenzo S. A., Enmon J. L., Troyer M. C., TrudellM. L. Synth. Commun., 25,3681 (1995).
113. Joussot-Dubien J., Houdard J. Tetrahedron Lett., 1967,4389; Wilzbach К E., Rausch D. J. J. Am. Chem. Soc., 92, 2178 (1970).
114. De Seims R. C., Schleigh W. R. Tetrahedron Lett., 1972, 3563, Kaneko C., Shiba K, Fujii H, Momose Y. J. Chem. Soc., Chem. Commun., 1980,1177.
115. Ogata Y, Takagi K. J. Org. Chem., 43,944 (1978).
116. Nakamura Y, Kato T., Morita Y. J. Chem. Soc., Perkin Trans. 1,1982,1187.
117. Первое исследование см: Taylor E. C., Paudler W. W. Tetrahedron Lett., 25, 1 (1960).
118. Sieburth S., McN., Hiel G., Lin C.-H, Kuan D. P. J. Org. Chem., 59,80 (1994).
119. Sieburth S. McN., Zhang F. Tetrahedron Lett., 40, 3527 (1999).
120. Johnson В. L., Kitahara Y., Weakley T. J. R., Keana J. F. W. Tetrahedron Lett., 34,5555 (1993).
121. Somekawa K., Okuhira H, Sendayama M., Suishu T., Shimo T. J. Org. Chem., 57,5708 (1992).
122. Kaplan L.f Pavik J. W., Wilzbach KE. J. Am. Chem. Soc., 94, 3283 (1972); Ling R., Yoshida M., Mariano P. S. J. Oig. Chem., 61,4439 (1996); Ling R., Mariano P. S. ibid., 63,6072 (1998).
123. Penkett C. S.t Simpson I. D. Tetrahedron, 55,6183 (1999).
124. Buchardt O., Christensen J. J., Neilsen P. E., Koganty R. R., Finsen L., Lohse C., Becher J. Acta Chem. Scand., Ser. B, 34, 31 (1980); Lohre C., Hagedorn L., Albini A., Fasani E Tetrahedron, 44, 2591 (1988).
125. Komin A. P., Wolfe J. E J. Org. Chem., 42, 2481 (1977); Rossi R. A., de Rossi R. H., L6pezA. F J. Org. Chem., 41,3371 (1976).
126. Van der Stegen G. H. D., Poziomek E. J., Kronenberg M. E., Haavinga E. Tetrahedron Lett., 1966,6371.
127. Beak P., Fry F. S., Lee L, Steele E J. Am. Chem. Soc. 98, 171 (1976); Stefaniak L. Tetrahedron, 32,1065 (1976); BeakP., Covington J. B.t Smith S. G.t White J. M., Zeigler J. M. J. Oig. Chem., 45, 1354 (1980).
128. Bensaude O., ChevrierM., Dubois J.-E. Tetrahedron Lett., 1978, 2221.
129. SchoffnerJ. P., Bauer L., Bell C. L. J. Heterocycl. Chem., 7,479 and 487 (1970).
130. Cioffi E. A., Bailey W. F. Tetrahedron Lett., 39, 2679 (1998).
131. Flemming L, Philippides D. J. Chem. Soc. (C), 1970,2426; Effenberger E, Muck A. 0., Bessey E. Chem. Ber., 113,2086 (1980).
132. Bellingham P., Johnson C. D., KatritzkyA. R. Chem. Ind., 1965,1384.
133. Burton A. G., Halls P. J., KatritzkyA. R. J. Chem. Soc., Perkin Trans. 2,1972,1953.
134. Brignell P. J., Katritzky A. R., Tarhan H. O. J. Chem. Soc. (B), 1968,1477.
135. Itahara T, Ouseto F. Synthesis, 1984,488.
136. De Seims R. C. J. Org. Chem., 33,478 (1968).
137. StempelA., Buzzi E. C. J. Am. Chem. Soc., 71, 2969 (1949).
138. Edgar K. J., Falling S. N. J. Org. Chem., 55, 5287 (1990).
139. Windscheif P.-M. Vdgtle E Synthesis, 1994,87 (1990).
140. Komblum N., Coffey G. P. J. Org. Chem., 31, 3449 (1966); Hopkins G. C., JonakJ.P., Minnemeyer H. J., Tieckelmann H. J. Oig. Chem., 32, 4040 (1967); Dou H. J.-M., Hassanaly P., Metzger J. J. Heterocycl. Chem., 14, 321 (1977).
141. Liu H.t Ko S.-В., Josien H., Curran D. P. Tetrahedron Lett., 36, 845 (1995); Sato T., Yoshimatsu K, Otera J. Synlett, 1995,845.
142. Verbruggen H.t Krolikiewicz K. Chem. Ber., 117,1523 (1984).
143. Commins D. L., Jianhua G. Tetrahedron Lett., 35,2819 (1994).
144. KatritzkyA. R., Sengupta S. Tetrahedron Lett., 28, 5419 (1987).
145. Beak P., Bonham J. J. Am. Chem. Soc., 87,3365 (1965).
146. Meghani P., Joule J. A., J. Chem. Soc., Perkin Trans. 1,1988, 1.
147. KatritzkyA. R., GrzeskowiakN. E., Winwood D. J. Mol. Sci., 1,71 (1983).
148. Katritzky A. R., Fan W-О., Koziol A. E, Palenik G. J. Tetrahedron 43,2343 (1987).
149. Adams R., Schrecker A. IK. J. Am. Chem. Soc., 71,1186 (1949).
150. Sugimoto O., Mori M., Tanji K. Tetrahedron Lett., 40,7477 (1999).
151. Isler O., Gutmann H., Straub U., FustB., Bohni E., Studer A. Helv. Chim. Acta, 38,1033 (1945).
152. Lowe J. A., Ewing F. E., Drozda S. E. Synth. Commun., 19,3027 (1989).
153. Philips М. A., Shapiro Н. J. Chem. Soc., 1942, 584.
154. Araki М., Sakata S., Takei H., Mukaiyama T. Bull Chem. Soc. Jpn., 47, 1777 (1974); Nicolaou К. C., Claremon D. A., Papahatjis D. P. Tetrahedron Lett., 22,4647 (1981).
155. Lloyd K, Young G. T. J. Chem. Soc. (C), 1971, 2890.
156. Corey E. J., Nicolaou К. C. J. Am. Chem. Soc., 96, 5614 (1974).
157. Girault G. Coustal S., Rumpf P. Bull Soc. Chim. France, 1972, 2787; Forsythe P., Frampton F., Johnson C. D., Katritzky A. R. J., Chem. Soc., Perkin Trans. 2, 1972, 671.
158. Frampton E, Johnson C. D., KatritzkyA. R. Justus Liebigs Ann. Chem., 749,12 (1971).
159. Fox B. A., Threlfall T. L. Org. Synth., Coll. Vol V, 1973, 346.
160. V Schickh O., BinzA., Schule A. Chem. Ber., 69, 2593 (1936).
161. Burton A. G., Frampton R. D., Johnson C. D., Katritzky A. R. J. Chem. Soc., Perkin Trans. 2,1972,1940.
162. KatritzkyA. R., El-Zemity S., Lang H. J. Chem. Soc., Perkin Trans. 1,1995, 3129.
163. Kalatzis E. J. Chem. Soc., 1967,273 and 277.
164. BunnettJ. R, Singh P. J. Oig. Chem., 46,4567 (1981).
165. Allen C. F H, Thirtle J. R. Oig. Synth., Coll. Vol. Ill, 1955,136; WindscheifP.-M, Vgtle Synthesis, 1994,87.
166. Yoneda N., Fukuhara T. Tetrahedron, 52,23 (1996); Coudret C. Synth. Commun., 26, 3543 (1996).
167. «Methylpyridines and other methylazines as precursors of bicycles and polycycles», Abu-Shanab F. A., Wakefield B. J., Elnagdi M. H. Adv. Heterocycl. Chem., 68, 181 (1997).
168. White W. N., Lazdins D. J. Org. Chem., 34,2756 (1969).
169. Fraser R. R., Mansour T. S., SavardS. J. Org. Chem., 50, 3232 (1985).
170. Levine R., DimmigD. A., Kadunce W. M. J. Oig. Chem., 39, 3834 (1974); Kaiser E. M., Bartling G. J., Thomas W. R., Nichols S. B., Nash D. R. J. Org. Chem., 38,71 (1973).
171. . Beumel O. F, Smith W. N., Rybalka B. Synthesis, 1974,43.
172. Kaiser E. M., Petty J. D. Synthesis, 1975,705; Davis M. L., Wakefield B. J, Wardell J. A. Tetrahedron, 48,939 (1992).
173. Lochte H. L., Cheavers T. H. J. Am. Chem. Soc., 79, 1667 (1957); Ghera E., David Y. B., Rapoport H. J. Org. Chem., 46,2059 (1981).
174. Williams J. L. R., Adel R. E., Carlson J. M., Reynolds G. A., Borden D. G., Ford J. A. J. Org. Chem., 28,387 (1963); CassityR. P., Taylor L. T., Wolfe J. F. J. Oig. Chem., 43, 2286 (1978); Konakahara T., Takagi Y. Heterocycles, 14, 393 (1980); Konakaha-ra T, Takagi Y. Synthesis, 1979, 192; Woodward R. B., Komfield E. C. Oig. Synth., Coll. Vol. Ill, 1973,413; Feuer H., Lawrence J. P. J. Am. Chem. Soc., 91, 1856 (1969); Markovac A., Stevens C. L., Ash A. B., Hackley В. E. J. Org. Chem., 35, 841 (1970); BrederekH., Simchen G., Wahl R. Chem. Ber., 101,4048 (1968); Pasquinet E., Rocca P., Godard A., Marsais F., Quguiner G. J. Chem. Soc., Perkin Trans., 1998, 3807.
175. Ihle N. C., Krause A. E. J. Oig. Chem., 61,4810 (1996).
176. Jerchel D., Heck H. E. Justus Liebigs Ann. Chem., 613,171 (1958).
177. Abramovitch R. A., Coutts R. T., Smith E. M.'J. Org. Chem., 37, 3584 (1972); Abramovitch R. A., Smith E. M., Knaus E. E., Saha M. J. Org. Chem., 37, 1690 (1972).
178. Doering W. E., WeilR. A. N. J. Am. Chem. Soc., 69,2461 (1947) LeonardF, Pschannet. W. J. Med. Chem., 9,140 (1966).
179. Sakamoto T., Kondo Y, Shiraiwa M., Yamanaka H. Synthesis, 1984,245.
180. KatritzkyA. R., Khan G. R., Schwarz O. A. Tetrahedron Lett., 25, 1223 (1984).
181. Gozzo E C., Eberlin M. N. J. Org. Chem., 64,2188 (1999).
182. Moser R. J. Brown E. V. J. Org. Chem., 37, 3938 (1972).
183. Brown E. V., Shambhu M. B. J. Org. Chem., 36,2002 (1971); Rapoport H, Volcheck E. J. J. Am. Chem. Soc., 78,2451 (1956).
184. Quast IL, Schmitt E. Justus Liebigs Ann. Chem., 732, 43 (1970); Katrizky A. R., Faid-Allah H, M. Synthesis, 1983, 149.
185. Effenberger F.t KnigJ. Tetrahedron, 44,3281 (1988); Bohn B., Heinrich N., Vorbrggen H. Heterocycles, 37,1731 (1994).
186. Prill E. A., McElvain S. M. Org. Synth., Coll. Vol. II, 1943, 419; «Oxidative transformation of heterocyclic iminium salts», Weber H. Adv. Heterocycl. Chem., 41, 275 (1987).
187. Anderson P. S.t Kruger W. E, Lyle R. E. Tetrahedron Lett., 1965, 4011; Holik M., FerlesM. Coll. Czech. Chem. Commun., 32,3067 (1967).
188. Cervinka O., Kriz O. Coll. Chech. Chem. Commun., 30,1700 (1965).
189. De Koning A. J., Budzelaar P. H. M., Brandsma L., de Bie M. J. A., Doersma J. Tetrahedron Lett., 21,2105 (1980).
190. Gessner W.t BrossiA. Synth. Commun., 15,911 (1985).
191. Fowler F. W. J. Am. Chem. Soc., 94,5926 (1972).
192. «N-Dienyl amides and lactams. Preparation and Diels-Alder reactivity», Smith M. B. Oig. Prep. Proc. Int., 22,315 (1990).
193. Fowler F. W. J. Org. Chem., 37,1321 (1972).
194. Beeken P., Bonfiglio J. N., Hassan L, Piwinski J. J., Weinstein B., Zollo K. A., Fowler F W. J. Am. Chem. Soc., 101, 6677 (1979); Comins D. L„ Mantlo N. B. J. Oig. Chem., 51,5456 (1986).
195. Caughey W S, Schellenberg K.A.. J. Org. Chem., 31, 1978 (1966); Biellman J.-E, Callot H, J. Bull. Chem. Soc. Fr., 1968, 1154; Blankenhom G., Moore E. G. J. Am. Chem. Soc., 102,1092 (1980).
196. Wong Y. S., Marazano C., Grecco D., Das В, C. Tetrahedron Lett., 35,707 (1994).
197. Thiessen L. M., Lepoivre J. A., Alderweireldt F. C. Tetrahedron Lett., 1974, 59.
198. Comins D. L., Abdullah A. H. J. Oig. Chem., 47,4315 (1982).
199. Piers E., Soucy M. Canad. J. Chem., 52, 3563 (1974); Akiba K., Iseki K, Wada M. Tetrahedron Lett., 23, 429 (1982); Comins D. L., Mantlo N. ^.Tetrahedron Lett., 24, 3683 (1983); Comins D. L., Smith R. K, Stroud E. D. Heterocycles, 22, 339 (1984); Shiao M.-L, Shih L.-IL, Chia W.-L., Chau T.-Y Heterocycles, 32,2111 (1991).
200. Von Dobeneck H., Golt&che W. Chem.. Ber., 95,1484 (1962).
201. Lavilla R., Gotsens T., Bosch J. Synthesis, 1991,842.
202. Lyle R. E., Marshall J. L., Comins D. L. Tetrahedron Lett., 1977, 1015.
203. Yamaguchi R.> Nakazono Y., Kawanisi M. Tetrahedron Lett., 24,1801 (1983).
204. Dhar T. G, Gluchowski C. Tetrahedron Lett., 35,989 (1994).
205. Itoh T., Hasegawa IL, Nagata K, Ohsawa A. Synlett, 1994, 557.
206. Akiba K, Iseki K, Wada M. Tetrahedron Lett., 23,3935 (1982).
207. Onaka M., Ohno R.t Izumi К Tetrahedron Lett., 30, 747 (1989).
208. Fraenkel G., Cooper J. W., Fink С. M. Angew. Chem., Int. Ed. Engl., 7, 523 (1970).
209. Comins D. L., WeglarzM. A., O’ConnorS, Tetrahedron Lett., 29, 1751 (1988).
210. Comins D. L., Brown J. D. Tetrahedron Lett., 27,2219 (1986).
211. Comins D. L., Joseph S. P, Adv. Nitrogen Heterocycles, 2, 251 (1996); Comins D. L., Joseph S. P., Hong H, Al-awar R. S., Foti C. J., Zhang Y, Chen X., LaMunyon D. IL,
Weltzien М. Pure Appl. Chem., 69,477 (1997); Comins D. L.f Green G. M. Tetrahedron Lett., 40,217 (1999).
212. Kiselyov A. S., Strerowski L. J. Oig. Chem., 58, 4476 (1993); idem., J. Heterocycl. Chem., 30, 1361(1993).
213. Haase M., Goerls H., Anders E. Synthesis 1998,195.
214. DamjiS. W. H., Fyfe C. A. J. Org. Chem., 44,1757 (1979).
215. Severin T, Lerche H., BtzD. Chem. Ber., 102,2163 (1969).
216. Buurman D. J., Van derPlasH. C. Oig. Prep. Proc. Int., 20, 591 (1988).
217. «Pyridine ring nucleophilic recyclisations», Kost A. N., Gromov S. P., Sagitullin R. S., Tetrahedron, 37, 3423 (1981); «Synthesis and reactions of glutaconaldehyde and 5-amino-2,4-pentadienals», Becher J. Synthesis, 1980,589.
218. Becher J. Org. Synth., 59, 79 (1979).
219. Hafner K, Meinhardt R.-P. Org. Synth., 62,134 (1984).
220. Genisson Y.t Marazano C., Mehmandoust M., Grecco D., Das В. C. Synlett, 1992,431.
221. ReinehrD., Winkler T. Angew. Chem., Int. Ed. Engl., 20,881 (1981).
222. Kutney J. P., Greenhouse R. Synth. Commun., 1975, 119; Berg U., Gallo R., Metzger К J. Oig. Chem., 41, 2621 (1976).
223. Aumann D., Deady L. W. J. Chem. Soc., Chem. Commun., 1973, 32.
224. Bhatia A. V., ChaudhuryS. K., Hernandez O. Oig. Synth., 75,184 (1997).
225. Olah G. A,, Klumpp D. A. Synthesis, 1997,744.
226. Claudhury S. K, Hernandez O. Tetrahedron Lett., 1979,95; ibid., 99.
227. «Pyrylium mediated transformations of primary amino groupd into other functional groups», Katritzky A. R., Marson C. M.t Angew. Chem., Int. Ed. Engl., 23, 420 (1984).
228. KatritzkyA. R., Lagowski J. M. Heterocyclic N-oxides, Methuen, London, 1967; Ochiai E. Aromatic amino oxcides, Am. Elsevier, New York, 1967; AlbiniA., Pietra S. Heterocyclic N-oxides, CRC Press Wolfe Publishing, London, 1991; «Heterocyclic N-oxides and N-imides», Katrizky A. R.> Lam J. N. Heterocycles, 33,1011 (1992).
229. Rearrangements of Г-amine oxides», Oae S., Ogino K. Heterocycles, 6, 583 (1977).
230. Zhang K, Lin R. Synth. Commun., 17,329 (1987); Akita Y., Misu K, Watanabe T., Ohto A. Chem. Pharm. Bull., 24,1839 (1976), Malinowski M., Kaczmarek L. Synthesis, 1987, 1013; BalickiR., Kaczmarek L., Malinowski M. Synth. Commun., 1989,897; BalichiR. Synthesis, 1989,645.
231. Olah G. A., Arvanaghi M.t Vankar Y. D. Synthesis., 1980,660.
232. Reichardt C. Chem. Ber., 99,1769 (1966).
233. Manning R. E., Schaefer F. M. Tetrahedron Lett., 1975,213
234. Taylor E. C., Crovetti A. J. Oig. Synth., Coll. Vol. IV, 1963,654; Saito H.t Hamana M. Heterocycles, 12,475 (1970).
235. Johnson C. D., KatritzkyA. R., ShakirN., Viney M. J. Chem. Soc. (B), 1967,1213.
236. Van Amrners M, Den Hertog H. J., Haase B. Tetrahedron, 18,227 (1962).
237. Van Amrners M., Den Hertog H. J. Reel. Trav. Chim. Pays Bas, 81,124 (1962).
238. Livens M. Miller J. J. Chem. Soc., 1963, 3486; Johnson R. M. J. Chem. Soc. (C), 1966, 1058.
239. Van Bergen T. J., Kellogg R. M. J. Org. Chem, 36, 1705 (1971); Shciess P., Ringele P. Tetrahedron Lett., 1972, 311; Schiess P., Monnier C., Ringele P., Sendi E. Helv. Chim. Acta, 57, 1676 (1974).
240. SchnekenburgerJ., Heber D. Chem. Ber., 107,3408 (1974).
241. Nishiwaki N., Minakata S., Komatsu M., Ohshiro Y. Chem. Lett., 1989,773.
242. Webb Т. Я Tetrahedron Lett., 26,3190 (1985).
243. Fife W. К. J. Org. Chem., 48, 1375 (1983); Vorbrggen H, Krolikiewicz K. Synthesis, 1983, 316.
244. Feely W. E., Evanega G., Beavers E. M. Org. Synth., Coll. Vol. V, 1973,269.
245. Fontenas C., Bejan E., Ait Haddou H., Balavoine G. G. A. Synth. Commun., 25, 629 (1995).
246. Ginsberg S. Wilson I, B. J. Am. Chem. Soc., 79, 481 (1957).
247. Bodaski R., Katritzky A. R. J. Chem. Soc. (B) 1968, 831; Koenig T. J. Am. Chem. Soc., 88,4045 (1966).
248. Walters M. A., Shay J, J. Tetahedron Lett., 36,7575 (1995).
249. Gill N. S.t James К. B., Lions E, Potts К. T. J. Am. Chem. Soc., 74, 4923 (1952); KeuperR., Risch N., Flrke U., Haupt II.-J. Liebigs Ann., 1996,705; KeuperR., RishcN. Ibid, 717.
250. Duhamel P., Hennequin L., Poirier J. M., Tavel G., Vottero C. Tetrahedron, 42, 477 (1986).
251. KnoevenagelE. Justus Liebigs Ann. Chem., 281,25 (1894); Stobbe H, VollardH. Chem. Ber., 35, 3973 (1902); Stobbe H. ibid., 3978.
252. Kelly T. R., Liu H. J. Am. Chem. Soc., 107,4998 (1985).
253. Katritzky A. R., Murugan R., Sakizadeh K. J. Heterocycl. Chem., 21,1465 (1984).
254. Potts К. T. Cipullo M. J., Ralli P., Theodoridis G. J. Am. Chem. Soc., 103,3584 and 3585 (1981); Potts K. T, Ralli P., Theodoridis G. Winslow P. Org. Synth., 64, 189 (1986).
255. Wikey R. H., SlaymakerS. C. J. Am. Chem. Soc., 78, 2393 (1956); Cook P. D., Day R. T, Robins R. K. J. Heterocycl. Chem., 14,1295 (1977).
256. Bickel A. F. J. Am. Chem. Soc., 69, 1805 (1947); Campbell K. N., Ackermann J. E, Campbell В. K. J. Oig. Chem., 15,221 (1950).
257. Abdulla R. E, Fuhr К H., Williams J. C. J. Org. Chem., 44,1349 (1979).
258. Kurihara H, Mishima H. J. Heterocycl. Chem. 14,1077 (1977); Johnson E, Panetta J. P., Carlson A. A., Hunneman D. H. J. Oig. Chem., 27,2473 (1962).
259. «4-Aryldihydropyridines, a new class of highly active calcium antagonists®, Bossart E, Meyer H., WehingerE. Angew. Chem., Int. Ed. Engl., 20,762 (1981).
260. Pfister J. R. Synthesis, 1990, 689; Maquestian A., Mayence A., Eynde J.-J. V. Tetrahedron Lett., 32, 3839 (1991); Alvarez C., Delgado E, Garc’a O., Medina 5., Mrquez C. Synth. Commun., 21,619 (1991).
261. Satoh K, Ichihashi M., Okumura K. Chem. Pharm Bull., 40,912 (1992).
262. Baumgarten P., DomowA. Chem. Ber, 72,563 (1939).
263. Petrich S. A., Hicks E A., Wilkinson D. R., Tarrant J. G., Bruno S. M. Vargas M., Hosein K. N., Gupton J. T., Silorski J. A. Tetrahedron, 51,1575 (1995).
264. Henecke H. Chem. Ber., 82, 36 (1949).
265. Marietta R. P. Org. Synth., Coll. Vol. IV, 1963, 210.
266. Bohlmann E, Rahtz D. Chem. Ber., 90,2265 (1957).
267. Bottorff E. M., Jones F. G., Komfield E. C., Mann M. J. J. Am. Chem. Soc., 73,4380 (1951).
268. DomowA., Neuse E. Chem. Ber., 84,296 (1951).
269. Wai J. S. et al. J. Med. Chem., 36, 249 (1993).
270. Matsui M., Oji A., Kiramatsu K, Shibata K., Muramatsu H. J. Chem. Soc. Perkin Trans 2, 1992, 201; Jain R., Roshcngar E, Ciufolini M. A. Tetrahedron Lett., 36, 3307 (1995).
271. Naito T., Yoshikawa T., Ishikawa E, Isoda S., Omura Y., Takamura I. Chem. Pharm.
Bull., 13, 869 (1965);Кондратьева Г. Я., Хуан К.-Г. ДАН СССР, 164, 816 (1965).
272. Okatani Т., Коуата J., Suzata Y, Tagahara К. Heterocycles, 27,2213 (1988).
273. Boger D. L., Panek J. S. J. Org. Chem., 46,2179 (1981).
274. Sauer J., Heldlmann D. K. Tetrahedron Lett., 39,2549 (1998).
275. Pfller 0. C., Sauer J. Tetrahedron Lett., 39, 8821 (1998).
276. Carly P. R., Cappelle S. L., Compernolle E> Hoomaert G. J. Tetrahedron, 52, 11889 (1996); Meerpoel L., Hoomaert G. Tetrahedron Lett., 30,3183 (1989).
277. Sainte E, Serckx-Poncin B., Hesbain-Frisque A.-M., Ghosez L. J. Am. Chem. Soc., 104, 1428 (1982).
278. Germain A. L., Gilchrist T. L., Kemmitt P. D. Heterocycles 37,697 (1994); Gilchrist T. L., Healy M. A. M. Tetrahedron, 49,2543 (1993); HibinoS., Sugino E., Kuwada T., Ogura N., SatK., Choshi T. J. Oig. Chem., 57,5917 (1992).
279. Clauson-Kaas N. et al. Acta Chem. Scand., 9,1,14,23 and 30 (1955); Clauson-Kaas N., Petersen J. B., Sorensen G. O., Olsen G., Jansen G. Acta Chem. Scand., 19,1146 (1965).
280. Clauson-Kaas N.t Meister M. Acta Chem. Scand., 21,1104 (1967).
281. Barrett A. G. M., Lebold S. A. Tetrahedron Lett., 28,5791 (1987).
282. Frank R. C., Pilgrim E J., RienerE. E Org. Synth., Coll. Vol. IV, 1963,451.
283. Chelucci G., Faloni M., Giacomelli G. Synthesis, 1990, 1121; «Oiganocobaltcatalysed synthesis of pyridines», Banemann H.> Brijoux W. Adv. Heterocycl. Chem., 48, 177 (1990).
284. Chumakov Yu I., Sherstyuk V. P. Tetrahedron Lett., 1965,129.
285. Waldner A. Synth. Commun., 19,2371 (1989).
286. Harris S. A., Folkers К J. Am. Chem. Soc., 61,1245 (1939).
287. Cruskie M. P., ZoltewiczJ. A., AbboudK. A. J. Oig. Chem., 60,7491 (1995).
6
ХИНОЛИНЫ И ИЗОХИНОЛИНЫ: РЕАКЦИИ И МЕТОДЫ СИНТЕЗА
Хинолин и изохинолин представляют собой стабильные соединения, хинолин— высококипящая жидкость, изохинолин—твердое соединение с низкой температурой плавления, оба эти соединения обладают сладковатым запахом. Хинолин и изохинолин известны достаточно давно. Хинолин впервые был выделен из каменноугольной смолы в 1834 г., а изохинолин — из того же источника в 1885 г. Вскоре после выделения из каменноугольной смолы хинолин был получен при пиролитическом разложении цинхонамина — алкалоида, родственного хинину. Название «хинолин» происходит от слова «хинин», а слово «хинин» произошло в свою очередь от слова «хина» — испанского варианта местного южно-американского названия коры дерева Cinchona, содержащей хинин. Хинолиновый фрагмент содержится в некоторых антималярийных препаратах, например в хлорохине. Ципрофлоксацин — один из широко используемых антибиотиков, содержащих 4-хинолоновый фрагмент.
Очень небольшое количество производных хинолина участвует в основном метаболизме. Метоксатин — ферментный кофактор метилотрофиловых бактерий — один из немногих природных соединений хинолинового ряда. Лишь небольшое число вторичных метаболитов содержит хинолиновую структуру, в то же время фрагмент изохинолина в виде 1,2,3,4-тетрагидроструктуры широко распространен в алкалоидах, например в алкалоидах опийного мака, папаверине и морфине [1]. Эметин, содержащий два тетрагидроизохиновых фрагмента, широко применяется для лечения амебной дизентерии.
Производные хинолина были использованы в качестве первых фотографических сенсибилизаторов: цианиновый краситель [2] этиловый красный позволил сделать фотографию чувствительной не только к голубому, но и к зеленому цвету, и затем в 1904 г. при появлении пинацинола фотография стала чувствительна к красному цвету. Впоследствии тысячи сенсибилизирующих красителей были получены и исследованы, и хинолиновые красители были заменены на другие, более эффективные.
пинацианол
6.1. РЕАКЦИИ С ЭЛЕКТРОФИЛЬНЫМИ РЕАГЕНТАМИ
6.1.1. Присоединение по атому азота
Все реакции с электрофильными реагентами, характерные для пиридина (разд. 5.1.1) и связанные с предоставлением пары электронов атома азота электрофильному реагенту, свойственны также хинолину и изохинолину. В связи с этим нет необходимости в дополнительном обсуждении таких процессов. Значения рЛ^ для хинолина и изохинолина равны соответственно 4,94 и 5,4, что свидетельствует об их сопоставимой с пиридином основности. Хинолин и изохинолин аналогично пиридину образуют N-оксиды и четвертичные соли.
6.1.2. Замещение при атоме углерода
6.1.2.1. Протонный обмен
Протонирование атомов углерода бензольного кольца и протонный обмен в протонированном по атому азота хинолине требует присутствия концентрированной серной кислоты и проходит быстрее по положению С<8), нежели по положениям С(5) и С(б). Аналогичные процессы в изохинолине проходят в некоторой степени быстрее по положению Сф, чем по С(8) [3]. В присутствии кислоты меньшей силы в хинолине и изохинолине наблюдается обмен протона в а-поло-жении относительно атома азота, т. е. в положении С(2> хинолина и C(i) изохинолина. Такие процессы включают образование цвиттерионного интермедиата в результате депротонирования N-протонированного гетероцикла.
обмен по положению С(8)
+ Н+
Р обмен по положению С(2)
6.1.2.2. Нитрование (см. также разд. 6.3.1.2)
Региоселективность протонного обмена частично совпадает с региоселективно-стью нитрования. Так, при нитровании хинолина образуется смесь 5- и 8-нитро-хинолинов приблизительно в равном соотношении, в то время как нитрование изохинолина приводит исключительно к 5-нитропроизводному [4]. Нитрование хинолина и изохинолина происходит в результате атаки нитрониевого иона по N-протонированному гетероциклу.
6.1.2.3. Сульфирование
Сульфирование хинолина приводит к образованию главным образом 8-сульфо-кислоты, а аналогичный процесс в изохинолине идет по положению 5 [5]. При проведении реакции при более высоких температурах в результате термодинамического контроля образуются другие изомеры. Так, хинолин-8-сульфоновая и изохинолин-5-сульфоновая кислоты изомеризуются в 6-сульфоновые кислоты [6].
6.1.2.4. Галогенирование
Процесс замещения атома водорода в хинолине и изохинолине на атом галогена достаточно сложный, и образование того или иного продукта реакции замещения зависит от условий проведения реакции [7]. При бромировании в концентрированной серной кислоте хинолин образует смесь 5- и 8-бромпроизводных, а изохинолин в присутствии хлорида алюминия превращается в 5-бромизохино-лин [8]. Все эти процессы проходят с участием протонированных гетероциклов.
Введение атома галогена в гетероциклическое кольцо происходит в значительно более мягких условиях, причем электронная пара атома азота способствует взаимодействию с электрофилом. Так, при обработке гидрохлоридов хинолина и изохинолина бромом образуются 3-бромхинолин и 4-бромизохинолин согласно приведенной ниже схеме [9]:
6.1.2.5. Ацилирование и алкилирование
Общих методов введения углеродных заместителей в хинолины и изохинолины посредством реакций электрофильного замещения не существует. Исключение составляют некоторые реакции с участием гетероциклов, содержащих сильные электронодонорные заместители.
6.2. РЕАКЦИИ С ОКИСЛИТЕЛЯМИ
Окисление хинолина и изохинолина проходит в жестких условиях. Известны примеры атаки окислителей по обоим циклам хинолина и изохинолина, хотя обычно при окислении наблюдается разрушение бензольного кольца и образование пиридиндикарбоновых кислот [10]. Для получения пиридиндикарбальде-гидов может быть использован озонолиз [11], в этом случае также могут быть получены соответствующие дикислоты при последующей обработке продукта озонолиза пероксидом водорода [12]. Оптимальный способ получения пиридин-2,3-дикарбоновой (хинолиновой) кислоты основан на электролитическом окислении хинолина [13]. При окислении изохинолина щелочным раствором перманганата калия образуется смесь пиридин-3,4-дикарбоновой (цинхомеро-новой) и фталевой кислот [14].
6.3. РЕАКЦИИ С НУКЛЕОФИЛЬНЫМИ РЕАГЕНТАМИ
6.3.1. Нуклеофильное замещение атома водорода
Нуклеофильное замещение атома водорода идет наиболее легко в положении С(2) хинолина и Сщ изохинолина.
6.3.1.1. Алкилирование и арилирование
В результате присоединения алкильных и арильных реактивов Гриньяра и алкил- и ариллитиевых соединений к хинолинам и изохинолинам образуются соответствующие дигидропроизводные, которые можно выделить и охарактеризовать. Окисление таких аддуктов приводит к образованию замешенных ароматических производных [15].
Викариозное нуклеофильное замещение (разд. 2.3.3) позволяет вводить заместители в нитрохинолины: так, например, цианометильная и фенилсульфо-нилметильная труппы могут быть введены в ор/ло-положение к нитрогруппе в положение С(б) 5-нитрохинолина и положение С<5> 6-нитрохинолина [16].
CICH2SO2Ph
КОН, DMSO, 20 у
83% **
Особые возможности для получения хинолинов, замещенных по положению 5, открывает реакция присоединения литийорганических соединений к осмиевым комплексам хинолина [17].
6.3.1.2. Аминирование и нитрование
Реакция амида натрия с хинолином и изохинолином легко (даже при -45 °C) приводит к образованию дигидроаддуктов в результате атаки амид-ионом по положению 2 (главным образом) и по положению 4 (в меньшей степени) хинолина и по положению 1 изохинолина. 2-Аминоаддукты, образующиеся из хинолина, при повышенной температуре превращаются в 4-аминоаддукты [18]. Окисление аддуктов приводит к образованию 2- и 4-аминохинолинов [19]. Реакция изохинолина с амидом калия в жидком аммиаке при комнатной температуре приводит к 1-аминоизохинолину [20].
knh2
КНэ(жидк.), -66 у
КМпО4
-40 'С
60%
Для хинолинов и изохинолинов возможно также окислительное аминирование, причем даже в бензольное кольцо при наличии нитрогруппы, активирующей нуклеофильное присоединение [21].
no2
JL /X КМпО4
\ II I ^нз(жидк.), -33 *С
L 86%
Введение нитрогруппы в положение 1 изохинолина возможно при действии на него смеси нитрита калия, диметилсульфоксида и уксусного ангидрида [22]. На ключевой стадии этого процесса происходит нуклеофильное присоединение нитрит-аниона к предварительно образовавшейся соли с участием атома азота изохинолина и комплекса диметилсульфоксид — уксусный ангидрид
„DMSO, Ас2О KNO2, НМРА, 20 *С
[Me2SOAc]
88%
- Me2S
-АсОН
6.3.2. Гидроксилирование
Гидроксилирование хинолина и изохинолина возможно при прямом взаимодействии с гидроксидом калия при высокой температуре. Реакция сопровождается выделением водорода [23] и образованием 2-хинолона (карбостирила) и 1-изохинолона (изокарбостирила).
6.3.2. Нуклеофильное замещение атома галогена
Для реакций этого типа действует общий принцип — реакционная способность атомов галогена в бензольных кольцах хинолина и изохинолина в положении С(3) хинолина и С(4) изохинолина аналогична реакционной способности галоге-нобензолов. В то же время для атомов галогена в положениях 2 и 4 хинолина и положении 4 изохинолина характерны те же реакции с нуклеофильными реагентами, что и для а- и у-галогенопиридинов (см. разд. 5.3.2). З-Галогеноизохи-нолины по своей реакционной способности занимают промежуточное положение [24].
Особый случай — реакция относительно мало реакционноспособного 3-бромизохинолина с амидом натрия. В данном случае реализуется механизм ANRORC (Addition of Nucleophile, Ring Opening and Ring Closure присоединение нуклеофила, раскрытие цикла и замыкание цикла), что приводит к продук-
ту прямого замещения атома брома на аминогруппу, однако в аминогруппе оказывается атом азота, локализованный прежде в изохинолиновом цикле [25].
6.4. РЕАКЦИИ С ОСНОВАНИЯМИ
6.4.1. Депротонирование при атоме углерода
Прямое литиирование, т. е. депротонирование хинолина [26], требует присутствия в соседнем положении таких заместителей, как хлор, фтор или алкоксигруппа. Первый пример депротонирования шестичленных гетероциклов связан с литиированием по положению 3 2-этоксихинолина [27]. Изомерные 4- и 2-диме-тиламинокарбонилоксихинолины при взаимодействии с литиирующими агентами образуют 3-литиевые производные. 4-Пивалоиламинохинолин литиируется в лерм-положение, т. е. в положение Сф. Для 3-замещенных хинолинов характерно образование 4-литиевых производных, а не изомерных 2-литийпроизводных.
2-Литиевые производные 1-замещенных 4-хинолонов [28] и 3-литиевые производные 2-хинолонов [29] обладают обычными нуклеофильными свойствами, как показано ниже:
2.4n-BuU
THF, TMEDA, -70 (MeS)2x 90%
6.5. РЕАКЦИИ С-МЕТАЛЛИРОВАННЫХ ХИНОЛИНОВ И ИЗОХИНОЛИНОВ
6.5.1. Литийорганические производные
Получение литийорганических производных хинолина и изохинолина в результате обмена металл — галоген связано с побочными процессами нуклеофильного присоединения. Проведение реакции при низких температурах позволяет получить литийпроизводные как в пиридиновом [30], так и бензольном [31] коль-
це хинолина и по положениям 1 [30] и 4 [32] изохинолина. Для литийпроизвод-ных хинолина и изохинолина характерны реакции с электрофильными реагентами, приводящие к замещенным по атому углерода гетероциклическим соединениям. Вероятно, для литиирования по бензольному кольцу необходимо использование двух эквивалентов бутиллития, поскольку один эквивалент реагента ассоциируется с атомом азота гетероцикла, как показано ниже:
6.5.2. Цинкорганические соединения
Ниже приведен пример прямого получения и использования цинкорганиче-ских производных [33]:
6.5.3. Реакции, катализируемые палладием и никелем
Реакции сочетания различных галогенохинолинов и галогеноизохинолинов эф-фектино протекают при катализе соединениями палладия [34] и никеля [35]. Примеры таких реакций сочетания приведены ниже. Даже атом хлора в положении 2 хинолина активен в таких процессах [36]. Существенное различие наблюдается в реакционной способности атомов хлора в положенитях 1 и 3 изохинолина: 1,3-дихлоризохинолин вступает в реакцию сочетания с арилборными кислотами исключительно по положению 1 (ср. разд. 6.3.2) [37].
Вг / \/ 6 13
(НО)2в"'
Pd(PPh3)4 Г к3РО4.зн2О L II
PhMe, 100
PhMgBr ph
I NiCI2(dppp\
90%
79%
6.6. РЕАКЦИИ CO СВОБОДНЫМИ РАДИКАЛАМИ
Фенил-радикал, генерированный при разложении пероксида бензоила, присоединяется к хинолину и изохинолину с образованием смеси изомерных фснили-рованных гетероциклов. Реакции с более нуклеофильными радикалами в кислых средах характеризуются большей селективностью, (ср. разд. 2.4.1).
6.7. РЕАКЦИИ С ВОССТАНОВИТЕЛЯМИ
Для хиноина и изохинолина возможно восстановление как пиридинового цикла, так и бензольного кольца. Восстановить пиридиновый цикл до тетрагидропиридинового можно при действии цианоборгидрида натрия в кислой среде [38], бор-гидрида натрия в присутствии хлорида никеля(П) [39], боргидрвда цинка [40] или в результате каталитического гидрирования в метаноле при комнатной температуре и атмосферном давлении. Однако каталитическое гидрирование в растворе сильных кислот приводит к первоначальному селективному восстановлению бензольного кольца [41]; продолжительное гидрирование в этих условиях приводит к образованию декагидропроизводных.
H2,Pt
12н. HCI, 20 *С, 1 атм 70%
H2,Pt
МеОН, 20‘С, 1 атм.
87% **
Восстановление хинолинов и изохинолинов литием в жидком аммиаке в определенных условиях приводит к получению 1,4-дигидрохинолинов [42] и 3,4-дигидроизохинолинов [43]. Образование 1,2-дигидрохинолина [44] и 1,2-ди-гидроизохинолина [45] происходит при восстановлении алюмогидридом лития. Эти дигидроструктуры [46] легко окисляются в соответствующие ароматические соединения или превращаются в смесь тетрагидропроизводных и ароматических соединений в результате реакции диспропорционирования [47], которая наиболее легко проходит в кислых средах. Взаимодействие продуктов восстановления сразу после их образования с хлорформиатами приводит к получению стабильных уретановых дигидропроизводных [48].
Гетероциклические фрагменты четвертичных солей хинолина и изохинолина восстаналиваются особенно легко как при каталитическом гидрировании, так и при использовании боргидридных реагентов в кислых средах.
NMe
NaBH4
EtOH, 20 ‘С
* 100%
MeCN, 20*С
83% ”
Восстановление иодида 1-метилхинолиния трибутилстаннаном приводит к образованию главным образом 1,2-дигидропроизводного, которое при комнатной температуре превращается в 1,4-дигидроизомер. Восстановление этим реагентом при одновременном освещении приводит к образованию исключительно 1,4-дигидроизомера с количественным выходои [49].
6.8. ЭЛЕКТРОЦИКЛИЧЕСКИЕ РЕАКЦИИ ОСНОВНОГО СОСТОЯНИЯ
Склонность изохинолиниевых солей присоединять нуклеофильные реагенты по пиридиновому фрагменту находит отражение также в реакциях циклоприсоединения этих соединений к электроноизбыточным диенофилам, таким, как этоксиэтилен (показано выше). Обратный процесс возможен при кипячении аддукта в ацетонитриле [50]. Аналогичная реакция 4-гидрокси-2-арилизохинолиниевых солей представляет собой удобный метод синтеза функционально замещенных тетралинов [51].
6.9. ФОТОХИМИЧЕСКИЕ РЕАКЦИИ
Для хинолина и изохинолина описано небольшое число фотохимических реакций, наиболее интересные из которых связаны с перегруппировками гетероциклического фрагмента четвертичных солей. В качестве примера можно привести реакцию расширения пиридинового цикла, характерную для N-оксидов хинолина [52]. Для 2-хинолонов, так же как и для 2-пиридонов, характерна фотохимическая [2 + 2]-циклодимеризация [53].
PhH,
6.10. оксихинолины и оксиизохинолины
Хинолинолы и изохинолинолы, содержащие кислородный заместитель в любых положениях, за исключениям положений 2 и 4 в хинолине и 1 и 3 в изохинолине, аналогичны фенолу, т. е. содержат гидроксильную группу. Для них так же, как и для аналогичных производных пиридина, характерно равновесие с цвиттерионной структурой с протонированным атомом азота и депротонированным атомом кислорода. Для всех таких соединений характерны химические свойства нафтолов [54]. 8-Оксихинолин долгое время использовался в химическом анализе как хелатирующий агент особенно для катионов цинка(П), магния(И) и алюминия(Ш), а хелатный комплекс 8-оксихинолина с катионом меди(И) находит применение в качестве фунгицида.
2-Хинолон, точнее 2-(1Н)-хинолинон, 4-изохинолон и 1-изохинолон существуют практически полностью в карбонильной таутомерной форме [55], что проявляется во всех их свойствах. Гидрокситаутомер вносит существенный вклад в поляризацию структуры, как это показано ниже для 1-изохинолона. Хинолоны представляют значительный интерес в плане их использования в качестве антибактериальных препаратов [56].
1-изохинол
1-изохинолон
[2Н-1-изохинолинон]
Для 3-оксиизохинолина характерно существование двух схожих по стабильности таутомерных форм. З-Изохинолинол — доминирующая таутомерная форма для раствора в сухом эфире, 3-изохинолон предпочтителен в водных растворах. Бесцветный раствор 3-изохинолинола в эфире приобретает желтую окраску при добавлении небольшого количества метанола, что обусловлено образованием некоторого количества карбонильного таутомера. Схожая стабильность этих двух таутомерных форм является следствием взаимной компенсации двух противоположных тенденций: наличие амидного фрагмента приводит к возникновению менее энергетически выгодной хиноидной структуры в бензольном кольце, сохранение же ароматичности бензольного кольца приводит к потере амидной таутомерной формы и связанной с ней стабильности. Таким образом, для этого соединения характерно существование одновременно амидной таутомерной формы и таутомерной формы с «полноценным» бензольным кольцом [57].
3-ИЗОХИНОЛИНОЛ (бесцветный)
2Н-3-изохинолинон (желтый)
Направление атаки электрофилом в хинолонах и изохинолонах зависит от значения pH реакционной среды. При проведении реакции в сильнокислых средах реализуется атака электрофилом по предварительно образующемуся катиону: зависимость направления атаки от кислотности среды может быть наглядно продемонстрирована на примере нитрования 4-хинолона [58]. Разница в реакционной способности бензольного кольца и протонированного гетероциклического фрагмента не очень велика: так, 2-хинолон хлорируется в виде нейтральной молекулы преимущественно по положению С(б) и лишь впоследствии по положению С(з>.
Протонный обмен в 2-хинолоне, катализируемый сильными кислотами, проходит быстрее по положениям 6 и 8, а в случае 1-изохинолона — по положению 4 [59]. Такой порядок реакционной способности наблюдается и в различных реакциях электрофильного замещения, например, в реакциях формилиро-вания [60].
Депротонирование атома азота карбонильных таутомеров приводит к образованию амбидентных анионов, способных в зависимости от условий вступать в реакцию с участием как атома кислорода, так и атома азота. Для таких соединений, так же как и для пиридонов, характерно превращение в соответствующие галогенопроизводные (галогенохинолинолины и галогеноизохинолины [61]) при взаимодействии с галогенидами фосфора. Для хинолинолов и изохиноли-нолов аналогичные превращения неизвестны.
6.11. АМИНОХИНОЛИНЫ И АМИНОИЗОХИНОЛИНЫ
Аминохинолины и аминоизохинолины существуют в аминных таутомерных формах, и протонирование таких соединений проходит по кольцевому атому азота. Среди аминохинолинов существенно повышенной основностью обладает 4-аминохинолин (рКа 9,2), среди аминоизохинолинов наиболее сильное основание 6-аминопроизводное (рАГа 7,2), причем это соединение — наиболее сильное основание среди всех бензоконденсированных аминохинолинов и аминоизохинолинов.
протонированный 6-аминоизохинолин
6.12. АЛКИЛХИНОЛИНЫ И АЛКИЛИЗОХИНОЛИНЫ
Характерная для алкильных групп в а- и p-положениях пиридинового цикла кислотность проявляется также и для алкильных групп в положениях 2 [62] и 4 хинолина, в положении 1 изохинолина и в гораздо меньшей степени в положении 3 изохинолина. Реакции конденсации с участием активированных алкильных групп могут быть осуществлены при использовании для дополнительной активации как оснований, так и кислот; во втором случае реакции проходят с участием енаминов [63] или енамидов [64], а в первом случае— с участием соответствующих карбанионов [65].
(CO2Et)2
EtONa, EtOH, Et2O.
20 ‘С___________
90% CH2COCO2Et
PhCHO
Ac2O, кипячение
. 57%
CH3
Различие в реакционной способности алкильных групп можно проиллюстрировать на примере селективного окисления метильной группы в положении 2 [66], как показано ниже:
Me
6.13. ХИНОЛИН-И ИЗОХИНОЛИНКАРБОНОВЫЕ кислоты и ИХ ЭФИРЫ
Химические свойства хинолин- и изохинолинкарбоновых кислот и их эфиров мало отличаются от свойств простых бензойных кислот и их эфиров; исключение составляют только хинолин-2- и изохинолин-1-карбоновые кислоты, легко декарбоксилирующиеся через промежуточное образование илидов, которые затем могут вступать в реакции с альдегидами в качестве электрофильных агентов (реакция Хэммика [67]). Декарбоксилирование Ы-метилхинолиний-2- и N-ме-тилизохинолиний-1-карбоновых кислот и взаимодействие образующихся илидов с альдегидами возможно при более сильном нагревании [68].
со2н
со2“
6.14. ЧЕТВЕРТИЧНЫЕ ХИНОЛИНИЕВЫЕ И И30ХИН0ЛИНИЕВЫЕС0ЛИ
Самое важное свойство четвертичных хинолиниевых и изохинолиниевых солей заключается в легком присоединении к ним нуклеофильных агентов по положению 2 в хинолиниевом катионе и по положению 1 в изохинолиниевом катионе. Гидроксид-ион, гидрид-ион [69] и металлоорганические соединения легко присоединяются с образованием дигидроароматических аддуктов, которые требуют черезвычайно тщательного обращения, поскольку склонны к диспропорционированию (см. также разд. 6.7) и окислению [70].
|2, ЕЮН
Наиболее легко присоединение нуклеофильных агентов идет по положению 2 хинолиниевого катиона, при обратимости реакции возможно образование термодинамически более стабильного продукта присоединения по положению 4 вследствие наличия двойной связи, сопряженной с атомом азота [71]. Присоединить еноляты кетонов по положению 2 хинолиниевых солей можно при ультразвуковом облучении [72].
Me MeS°4
96%
водн. KCN 20 *С ,
Взаимодействие хинолина и изохинолина с боргидридом натрия в присутствии смеси уксусной кислоты и уксусного ангидрида представляет собой удобный способ получения N-ацетил-1,2-дигидропроизводных [73].
Давно известная реакция Рейссерта — это кинетически контролируемое присоединение цианид-иона к Ы+-ацилхинолиниевым и Ы+-ацилизохинолини-евым солям, в классическом варианте [74] ацилирующим агентом служит бензо-илхлорид. Соединения Рейссерта [75] обычно получают в двухфазной системе дихлорметан — вода; разработанные в последнее время способы оптимизации процесса связаны с использованием катализаторов межфазного переноса, а также ультразвукового облучения [76] и краун-эфиров [77].
69%
PhCOCI, KCN
Н CN
NaH.DMF ] затем BnCI NCOPh
Соединения Рейссерта широко используются для получения производных хинолина и изохинолина: например, депротонирование, алкилирование и удаление ацильной группы и цианогруппы приводит к замещенным гетероциклическим соединениям. N-Сульфонильные аналоги соединений Рейссерта легко отщепляют арилсульфинатную труппу, что используется для введения цианогруппы в хинолин и изохинолин [78].
TsCI, KCN
СН2С12, Н2О, 20‘С
Аллилсиланы также могут взаимодействовать с N-ацилизохинолиниевыми [79] и N-ацилхинолиниевыми [80] солями; возможно присоединение также си-лилалкенов [81] при катализе ионами серебра.
TMSC=CPh, AgOTf ciCO2Ph CI(CH2)2CI, 60 *С О’С
90%
CICO2Ph
CH2=CHCH2SiMe3
AgOTf, CH2CI2, 20ДО
N 98%
Соли Цинке изохинолинового ряда [82] легко превращаются в хиральные изо-хинолиниевые соли при реакции с хиральными аминами [83]. Нуклеофильное присоединение к таким солям отличается хорошей стереоселекгивностью [84].
] ^1 СГ PhMgBr, THF, 0 ’С_
I '+ н (на соль n-BuOSO"^
95%
Рп "ме
(и другой изомер, 87:13)
6.15. N-ОКСИДЫ ХИНОЛИНА И ИЗОХИНОЛИНА
Химические свойства N-оксидов бициклических систем аналогичны описанным ранее для N-оксидов пиридина. Дополнительно возможны реакции электрофильного замещения в бензольном кольце. Так, например, нитрование нитрующей смесью N-оксида хинолина идет по положению 5 и 8 через предварительное протонирование по атому кислорода, однако в менее кислых средах реакция проходит по положению 4 [85]. При нитровании N-оксида изохинолина образуется 5-нитропроизводное [86].
N-Оксиды хинолина и изохинолина можно превратить в 1- и 2-цианопроизводные соответственно при реакции с диэтиловым эфиром цианофосфоновой кислоты. На первой стадии этого процесса реализуется О-фосфорилирование, последующее элиминирование диэтилфосфата, вероятно, проходит через циклическое переходное состояние [87]. Триметилсилилцианид и диазобициклоун-децен также могут быть применены для осуществления такого превращения [88]. N-Оксиды хинолина и изохинолина превращаются в соответствующие алкоксисоединения при взаимодействии с эфирами хлоругольных кислот и спиртами, аналогично приведенной ниже реакции N-оксида изохинолина [89]:
6.16. МЕТОДЫ СИНТЕЗА ХИНОЛИНОВ И ИЗОХИНОЛИНОВ
6.16.1. Синтез кольца
В данном разделе расмотрены три наиболее общих подхода к синтезу хинолиновой структуры из ациклических соединений и три аналогичных подхода к изохинолинам.
6.16.1.1. Хинолины из ариламинов и 1,3-дикарбонильных соединений
Анилины при взаимодействии с 1,3-дикарбонильными соединениями образуют соединения, склонные к катализируемой кислотой циклизации
Синтез Комба
Конденсация 1,3-дикарбонильных соединений с ариламинами с высокими выходами приводит к р-аминоенонам, которые циклизуются под действием концентрированных кислот [90]. Стадия циклизации представляет собой электрофильное замещение с участием О-протонированного аминоенона, как показано ниже, с последующей потерей молекулы воды с образованием ароматических производных хинолина
МеО Ме ОН 1 МеО Ме
МеО Н J МеО
Применение этой реакции для получения 3-нитрохинолинов, не замещенных по положению 4, показано на приведенной ниже схеме [91]:
Синтез Конрада-Лимпаха-Кнорра
4-MeOC6H4NH3CI Me АсОН, PhSH (кат.^
48%
В этом методе синтеза, родственном синтезу Комба, в качестве дикарбонильных соединений используются p-кетоэфиры и в результате образуются хинолоны [92]. В реакции анилинов с эфирами р-кетокислот при комнатной температуре образуется кинетически контролируемый продукт — эфир р-аминоакриловой кислоты, циклизация которого приводит к 4-хинолону. При проведении реакции при более высокой температуре образуется анилид р-кетокислоты и его дальнейшая циклизация приводит к 2-хинолонам. Эфиры р-аминоакриловой кислоты, циклизующиеся в 4-хинолоны, также можно получить в результате реакции анилинов с эфирами ацетиленкарбоновых кислот [93] или с диэтиловым эфиром этоксиметиленмалоновой кислоты [94] [EtOCH=C(CO2 Et)2 -> -> ArNHCH=C(CO2Et)2].
При наличии электроноакцепторных групп в бензольном кольце циклизация с образованием хинолиновой структуры проходит по приведенной ниже схеме. Для циклизации необходимо сильное нагревание субстрата; механизм образования цикла, вероятно, не включает стадию электрофильной атаки бензольного кольца и скорее всего может быть представлен как электроциклизация 1,3,5-3-азатриена [95].
ЕЮН, кипячение
Ph20,250 ‘С
87% ’
6.16.1.2. Хинолины из ариламинов и а,р-ненасыщенных карбонильных соединений
Взаимодействие ариламинов с а,Р-ненасыщенными карбонильными соединениями в присутствии окислителей приводит к образованию хинолинов. Использование глицерина для получения акролеина in situ позволяет получить хинолин, не содержащий заместителей в гетероциклическом фрагменте.
Синтез Скраупа [96]
Нагревание смеси анилина, концентрированной серной кислоты, глицерина и мягкого окисляющего агента приводит в результате необычной реакции к образованию хинолина [97]. Как было показано, при этом происхлодит дегидратация глицерина, приводящая к образованию акролеина, затем анилин присоединяется к акролеину по типу сопряженного присоединения. В дальнейшем происходит катализируемая кислотой циклизация с образованием 1,2-дигидро-хинолина. Окисление на заключительном этапе приводит к ароматической структуре. В классическом варианте в качестве окислителя используется нитробензол или мышьяковая кислота; введение в реакционную смесь небольшого количества иодида натрия позволяет серной кислоте выступать в роли окислителя [12]. Синтез Скраупа наиболее пригоден для получения не замещенных по гетероциклу хинолинов [98].
‘NH2
85%
При использование замещенных карбонильных компонентов были получены подтверждения описанного выше механизма и доказано, что на первой стадии реализуется именно сопряженное присоединение анилина к непредельному карбонильному соединению, а не взаимодействие анилина с карбонильной труппой.
В некоторых случаях образование хинолинов по методу Скраупа проходит очень бурно и необходимо предпринимать меры для предотвращения такого течения реакции. Использование предварительно полученного продукта сопряженного присоединения и других окислителей (наилучшие результаты дает применение л-хлоранила) характеризуется рядом преимуществ в плане как выхода целевых соединений, так и контроля за ходом реакции [99].
Ориентация процесса замыкания цикла при синтезе Скраупа
При использовании в синтезе Скраупа л/етля-замещснных анилинов возможно образование двух изомерных хинолинов, содержащих заместители в положении 5 или 7. При наличии электронодонорных заместителей в тиетла-положении анилина замыкание цикла проходит по лора-положению, что приводит к образованию преимущественно 7-замещенных хинолинов; так, применение в синтезе Скраупа л/етла-галогенозамещенных анилинов приводит к 7-галогенозаме-щенным хинолинам. Ариламины, содержащие в л/елш-положении сильные электроноакцепторные заместители, превращаются в условиях синтеза Скраупа главным образом в 5-замещенные хинолины.
6.16.1.3. Хинолины из орто-ацилариламинов и карбонильных соединений Взаимодействие орщо-ацилариламинов с кетонами, содержащими «-метиленовую группу, приводит к образованию хинолинов
Синтез Фридлендера [100]
Конденсация ортло-ацилариламинов [101] с кетонами и альдегидами (обязательно содержащими а-метиленовую труппу), катализируемая как основаниями, так и кислотами, приводит к образованию хинолинов. Ориентация циклизации зависит от ориентации образования енола или енолята [102]. Лучшие результаты в синтезе Фридлендера достигаются при использовании в качестве карбонильной компоненты О-алкилоксимов а-метиленкетонов [103].
Для синтеза ор/ло-ацилариламинов описано использование ортло,N-дили-тийариламинов, содержащих защитную группу при атоме азота[104]. Дальнейшее развитие этого подхода позволило разработать «однореакторный» метод получения хинолинов, проиллюстрированный приведенной ниже схемой:
МеО
‘NH
COgbBu
2seoBuLi
THF, -78 *С DMF
Синтез Пфитцингера
орлю-Аминоарилальдегиды — труднодоступные соединения, поэтому в синтезе хинолинов по методу Пфитцингера в качестве предшественников таких альдегидов используются гораздо более доступные изатины (разд. 17.14.3 и 17.17.4), превращающиеся при гидролизе в ср/ло-аминоарилглиоксилат-анионы, реакция которых с кетонами приводит к хинолин-4-карбоновым кислотам [105]. Карбоксильную группу в случае необходимости можно удалить пиролизом в
присутствии оксида кальция.
6.16.1.4. Изохинолины из арилальдегидов и 2,2-диэтоксиэтиламина
Взаимодействие ароматических альдегидов с 2,2-диэтоксиэтиламином приводит к образованию иминов, которые циклизуются в изохинолины, не содержащие заместителей в гетероциклическом фрагменте
Синтез Померанца-Фрича
Синтез изохинолинов по методу Померанца—Фрича [106] обычно осуществляют в две стадии. На первой стадии проводят конденсацию арилальдегида с 2,2-диэтоксиэтиламином с образованием альдимина. Такая конденсация проходит в мягких условиях и с высоким выходом. На второй стадии альдимин циклизуют под действием сильной кислоты. В условиях циклизации возможен гидролиз имина, что снижает выход продукта циклизации. Лучшие результаты на стадии циклизации достигаются при использовании системы трифторуксусная кислота — трифторид бора [107].
Вторая стадия синтеза Померанца—Фрича аналогична процессам циклизации в синтезах Комба и Скраупа. Первоначальное протонирование способствует отщеплению молекулы этанола и образованию электрофильной частицы, впоследствии атакующей ароматическое кольцо. На заключительной стадии происходит отщепление второй молекулы этанола
Электрофильный характер циклизации объясняет, почему присутствие в арилальдегиде электронодонорных заместителей (особенно в шрс-положении к месту электрофильной атаки, что приводит к изохинолинам, содержащим заместитель в положении 7) обеспечивает лучшее протекание циклизации, а электроноакцепторные заместители затрудняют процесс.
Проблему, связанную с гидролизом иминов в условиях циклизации, можно избежать при использовании субстратов с более низкой степенью окисления и содержащих при атоме азота тозильную группу, которая способна к последующему элиминированию в виде толуолсульфиновой кислоты. Такие субстраты можно получить при восстановлении и последующем тозилировании иминов [108] или при бензилировании натриевой соли К-тозил-2,2-диметоксиэтиламина [109]. Альтернативный подход к таким соединением связан с бензилированием N-тозиламиноацеталя бензиловым спиртом в условиях реакции Мицунобу [110]. Циклизация ацеталя бензиламиноуксусного альдегида под действием хлорсульфоновой кислоты представляет собой прямой метод получения ароматических производных изохинолина [111].
Изохинолины, содержащие заместитель в положении 1, трудно получить при использовании стандартного метода Померанца—Фрича. На первой стадии синтеза таких производных изохинолина необходимо провести конденсацию арил-кетона с ацеталем аминоуксусного альдегида, однако такая реакция идет менее гладко, чем в случае ароматического альдегида. Для того чтобы избежать затруднения такого рода, предложено использовать конденсацию соответствующего бензиламина с диэтилацеталям глиоксаля для получения изомерного имина и его дальнейшую конденсацию под действием кислоты [112].
6.16.1.5. Изохинолины из арилэтиламидов
Для амидов или иминов, полученных при взаимодействии 2-арилэтиламинов с производными карбоновых кислот или альдегидами, возможно замыкание цикла, приводящее к 3,4-дигидро- или 1,2,3,4-тетрагидроизохинолинам соответственно. Последующее окисление позволяет получать таким образом ароматические производные изохинолина.
Синтез Бишлера—Напиральского [ 113]
В классическом варианте синтеза Бишлера—Напиральского амид, полученный при реакции 2-арилэтиламина с хлорангидридом или ангидридом карбоновой кислоты, циклизуется с потерей молекулы воды с образованием 3,4-ди-гидроизохинолина, который легко дегидрируется при действии палладиевого катализатора, серы или дифенилдисульфида. В качестве конденсирующих агентов обычно используют пентаоксид фосфора, фосфорилхлорид и пентахлорид фосфора. Вероятно, что в качестве интермедиата такой циклизации образутся иминохлорид [114] или иминофосфат. Иминохлорид может быть выделен, а его последующее взаимодействие с кислотами Льюиса приводит к образованию изонитрилиевых солей, которые легко циклизуются в 3,4-дигид-роизохинолины [115].
I MeCOCI
NH2 95%
И в этом случае циклизация связана с электрофильной атакой по бензольному кольцу, поэтому наилучшие результаты достигаются при наличии в бензольном кольце заместителей, активирующих электрофильное замещение. При использовании субстратов, содержащих заместители в мета-положении, образуются только 6-замещенные изохинолины.
Конденсация родственных уретанов под действием ангидрида трифторме-тансульфоновой кислоты и 4-диметиламинопиридина приводит к образованию 1-изохинолонов. Возможно эта комбинация реагентов подходит и для стандартного варианта циклизации с образованием 3,4-дигидроизохинолина [116]. Применение пентаоксида фосфора и фосфорилхлорида для циклизации уретанов ограничено субстратами, содержащими активирующие заместители в бензольном кольце [117].
Модификация Пикте—Гамса
При использовании в синтезе Бишлера-Напиральского арилэтиламинов, способных превращаться в условиях реакции в ненасыщенные соединения, сразу могут быть получены полностью ароматические производные изохинолина. Для этого амиды р-метокси- или p-гидрокси-р-ариламинов нагревают с обычно используемыми конденсирующими агентами. Не совсем ясно, происходит ли дегидратация таких амидов с образованием непредельных амидов на начальном этапе процесса или дегидратация приводит к образованию оксазолидина [118].
ОН
Ме
6.16.1.6. Изохинолины из активированных арилэтиламинов и альдегидов
Синтез Пикте-Шпенглера [119]
Арилэтиламины легко реагируют с альдегидами с образованием иминов с высокими выходами. Циклизация таких иминов, катализируемая кислотами, приводит к образованию 1,2,3,4-тетрагидроизохинолинов. Следует отметить, что цик-
лизация иминов приводит к тетрагидроизохинолинам в отличии от циклизации амидов, при которой образуются дигидропроизводные. При протонировании имина генерируется электрофильная частица, аналогичная возникающей в реакции Манниха. Поскольку электрофильность таких соединений существенно ниже электрофильности интермедиатов, образующихся при синтезе Бишлера— Напиральского, для замыкания цикла необходимо присутствие сильных активирующих заместителей, причем в определенных положениях бензольного кольца.
водн. НСНО нагревание 100%
водн. HCI 100'С
80%
Присутствие гидроксильных групп в бензольном кольце сильно активирует такие процессы; при этом замыкание цикла возможно в черезвычайно мягких «физиологических» условиях [120].
СН2Аг
Обычные приемы дегидрирования позволяют легко превратить производное тетрагидроизохинолина в полностью ароматические соединения. Более интересна возможность селективного окисления тетрагидроизохинолинов в 3,4-дигидроизохинолины с использованием перманганата калия и краун-эфи-ров [121].
6.16.1.7. Современные методы
Ряд недавно описанных синтетических подходов к хинолинам и изохинолинам основан на использовании разнообразных процессов. Например, при озонолизе индена образуется гомофталевый альдегид, который при взаимодействии с аммиаком превращается в результате замыкания цикла в полностью ароматический изохинолин [122]. Другой подход к генерированию родственного дикарбо-нильного соединения связан с литиированием по боковой цепи циклогексили-мина орт о-метил бензальдегид а с последующим ацилированием литиевого производного амидом Вайнреба [123].
Оз МеОН.-78 С затем Me2S
nh4oh rill
6,%
Другой родственный подход связан с литиированием по ортло-положению арилбромидов с целью получения ортло-бромарилальдегидов, которые впоследствии превращаются в изохинолины в результате катализируемой палладием
реакции с терминальными ацетиленами и циклизации с аммиаком [124]. Приведенная ниже схема демонстрирует использование этого подхода для получения moho-N-оксидов нафтиридина при реакции алкинилальдегидов с гидроксиламином вместо аммиака [125].
HOCPh
LDA
PdCI2(PPh3)2
Br THF,—78’С затем DMF 92% *
Br Cui, Et3N
DMF, 20 *C 67%
CHO
Подход к синтезу изохинолинов, связанный с применением 1,2-моноазаби-силидов, включает в себя реакцию Виттига и аза-реакцию Виттига с участием фталевого диальдегида [126].
сно
сно
Ph3P=NCH2P(O)(OEt)2
Л-BuLi, 20 -С г 55%
Некоторые из описанных методов синтеза хинолинов и изохинолинов связаны с одновременным образованием двух связей С—С. 2-Арилхинолины можно получить при реакции оснований Шиффа с эфирами енолов в присутствии трифлата иттербия(Ш) [127]. 2-Хлор-З-формилхинолин легко образуется при взаимодействии ацетанилида с фосфорилхлоридом и диметилформамидом [128]. Для синтеза изохинолинов также может быть использована реакция эфиров арилуксусных кислот с нитрилом и ангидридом трифторметансульфоновой кислоты [129].
СН2=С(Ме)ОМе JL
г п Yb(QTf)3. MeCN, 20 ‘С
L II 74%
X5b'XX,N<X>4Ph N Ph
х. РОС13
11 PMF, кипячение
NHAc
В синтезе 2-хинолона [130] эфир тлрянс-коричной кислоты изомеризуется при замыкания цикла.
МеО МеО
СО2Ме SnCI2 _ ____________
EtOH, 70*С кипячение
М
3 н. HCI
94% 63%
МеО
Катализируемая палладием реакция ор/ио-иодарилальдегидов с ацетиленами приводит к образованию изохинолинов, при этом происходит отщепление заместителя у атома азота [131]. Необычный способ синтеза хинолина связан с образованием на ключевой стадии связи между бензольным кольцом и атомом азота Взаимодействие оксимов 2-арилэтилкетонов с перренатом тетра-н-бутиламмо-ния приводит к образованию хинолинов. В зависимости от строения ароматиче-
ского заместителя реализуется либо механизм циклизации, включающий электрофильную атаку по орио-положению ароматического цикла, либо «лсо-заме-щение с последующей перегруппировкой [132].
PhCsCCOgEt
Ph3P, Na2CO3
DMF, 100 Х*
"Ч-Ви
Pd(OAc)2
Разработан метод синтеза хинолинов, использующий радикальную циклизацию [133]. Такой подход нашел применение в полном синтезе камптотецина [134] — антибиотика, обладающего противоопухолевой активностью. Ниже приведена последовательность, приводящая к образованию камптотецина и механизм его образования [135]:
(Me3Sn)2, освещение PhNsC~ г 95%
6.16.2. Примеры синтезов некоторых важных производных хинолина и изохинолина
6.16.2.1. Хлорохин [136]
Хлорохин представляет собой синтетический антималярийный препарат.
6.16.2.2. Папаверин [137]
Папаверин — алкалоид опийного мака, мягкий мышечный релаксант, применяемый в качестве сосудорасширяющего средства. Приведенный ниже метод синтеза папаверина иллюстрирует использование модификации Пикте—Гамса:
6.16.2.3. Метоксатин [138]
Метоксатин — кофактор ферментов бактерий, участвующий в метаболизме метанола. Приведенный ниже полный синтез этого соединения особенно интересен, поскольку включает синтез производного изатина (разд. 17.17.4) и его дальнейшие превращения:
водн. С1зССН=О H2NOH, Na2SO4
BrH2
МеСОСО2Н КОН затем МеОН H2SO4
50% **
конц. HNO2 конц. H2SO4,0 *С
CO2Me
NO2 СОгМе
СО2Ме
_ NBS
<FhC0^ r
L II J 100%ж
65%
СО2Ме
М
Упражнения
Простые упражнения для проверки усвоения материала гл. 4 и 6
(а) По каким положениям и почему идет нитрование хинолина и изохинолина?
(б) Какое положение в хинолине и изохинолине наиболее склонно к реакциям с нуклеофильными реагентами и почему?
(в) Какое положение в хинолине и изохинолине наиболее подвержено радикальной атаке?
(г) Каким путем можно селективно восстановить гетероциклический фрагмент хинолина и изохинолина?
(д) Каким путем можно превратить 4-метилхинолин в 4-этилхинолин?
(е) Каким путем можно превратить 1) изохинолин в 2-метил-1-изохинолон, 2) хинолин в 2-цианохинолин?
(ж) Каким путем можно получить 6-метокси-2,4-диэтилхинолин?
(з) Каким путем можно получить 2-этил-3-метилхинолин-4-карбоновую кислоту из анилина (см. также разд. 17.17.4)?
(и) Какой метод синтеза изохинолинового никла подходит для получения 6-метокси-изохинолина?
(к) Каким образом можно получить 7-метокси-1-фенилизохинолин из 2-(4-метокси-фенил)этил амина?
Упражнения повышенной сложности
1. Укажите структуру продуктов нитрования, образующихся с высокими выходами: (a) C16H12N2O2 из 1-бензилизохинолина; (б) С10Н8К2Оз из 6-метоксихинолина; (в) Ci0H8N2O3 из 7-метоксиизохинолина.
2. Напишите последовательность превращения хинолина в 3-бромхинолин реакцией брома в смеси СС14 — пиридин.
3. Предложите строение соединения CieHieCINО4, полученного из 1,3-дихлоризохи-нолина и NaCH(CO2Et)2.
4. Предложите строение соединения Ci5Hi8N2OS, полученного при взаимодействии 2-пивалоиламинохинолина последовательно с 3 молями н-бутиллития и затем с диметилдисульфидом.
5. Напишите механизм восстановления иодида 2-метилизохинолиния в 2-метил-1,2,3,4-тетрагидроизохинолин при взаимодействии с боргидридом натрия в этаноле.
6. Приведите структурную формулу наиболее стабильного таутомера 3-оксихиноли-на и 1-, 4- и 8-оксиизохинолинов.
7. Предложите механизм образования метилового эфира 2-метилхинолин-З-карбоновой кислоты при взаимодействии анилина с метиловым эфиром ацетоуксусной кислоты (-» СпН1зЬЮ2) и затем продукта реакции с диметилформами-дом/РООз.
8. Предложите строение хинолина, образующегося в результате следующих реакций: (а) 2-метоксианилина с диметиловым эфиром ацетилендикарбоновой кислоты при 250 °C, Ci2HhNO4; (б) при нагревании 3-хлоранилина с диэтиловым эфиром
Этоксиметиленмалоновой кислоты при 250 °C и затем нагревании с водным раствором гидроксида натрия, C10H6CINO3.
9. Предложите строение производных хинолина, полученных из (а) изатина при его взаимодействии с гидроксидом натрия и затем с ацетофеноном, С^НцЬГОг;
(б) изатина при его взаимодействии с гидроксидом калия и затем 3-хлорпирови-ноградной кислотой, CI0H7NO3; (в) из N-ацетилизатина и гидроксида натрия, C10H7NO3.
10. Предложите структуры гетероциклических соединений, полученных в результате следующих реакций: (а) 2-аминобензалвдегида и барбитуровой кислоты (разд. 7.10), Cj 1H7N3O2; (б) этиленацеталя 2-аминобензальдегида и диметилового эфира ацетиленкарбоновой кислоты, CuHuNOe; (в) 2-аминоацетофенона и 2-ацетилтиофена, ChHuNS; (г) 2-аминобензофенона и димедона, C21H19NO; (д) 2-аминопи-ридин-3-карбалвдегида и 1-фенилсульфонилацетона, C15H12N2O2S; (е) 4-амино-пиримидин-5-карбалвдегида и сс-тетралона, C15H11N3.
Литература
1. Maske «Isoquinoline alkaloids», р. 423, Stanek J., «Phthalide isoquinoline alkaloids», p. 433, Kulka M., «Bisbenzylisoquinoline alkaloids», p. 439 в книге: The Alkaloids, Chemistry and biology, Manske R.H.F. (ed.), Vol. 7, Academic Press, 1960; Lundbom J., p. 255 в книге: The Alkaloids, Chemistry and Biology, Brossi A. (ed.), Vol. 21,1983.
2. «The cyanine dyes and related compounds», в книге: The chemistry of heterocyclic compounds, Series Ed. Weissbeiger A., Vol. 18, Hamer F. M. (ed.), Wiley-Interscience, 1964.
3. Bresse! U.t KatritzkyA. R., Lea J. R. J. Chem. Soc. (B), 1971,4.
4. Austin M. Ж, Ridd J. H. J. Chem. Soc., 1963, 4204; Moodie R. B., Schofield K, Williamsin M. J. Chem. Ind. (London), 1963, 1283, Dewar M. J. S., Maitlis P. M. J. Chem. Soc., 1957, 2521.
5. BeislerJ. A. Tetrachedron, 26,1961 (1970).
6. McCasland G. E. J. Org. Chem., 11,277 (1946).
7. Butler J. C., Gordon M. J. Heterocycl. Chem., 12,1015 (1975).
8. Gordon M., Pearson D. E. J. Org. Chem., 29, 329 (1964).
9. Kress T. J., Costantino S. M. J. Heterocycl. Chem., 10,409 (1973).
10. Hoogerweiff S., van Dorp W. A. Chem. Ber., 12,747 (1889).
11. Queguiner G., Pastour P. Bull. Soc. Chem. Fr., 1968,4117.
12. O’Murcha C. Synthesis, 1989, 880.
13. Cochran J. C., Little B< F. J. Org. Chem., 26, 808 (1961).
14. Hoogerwerff S., van Dorp. W. A. Reel. Trav. Chim. Pays-Bas, 4,285 (1885).
15. Geissman T. A., ShclatterM. J., Webb I. D., Roberts J. D. J. Org. Chem., 11,741 (1946).
16. Makosza M., Kinowski A., Danikiewicz W., Mudryk B., Justus Liebigs Ann. Chem., 1986, 69-
17. Bergman B., Holmquist R., Smith R., Rosenberg E., Ciurash J., Hardcastle K, Visi M. J. Am. Chem. Soc., 120, 12818 (1998).
18. Zoltewicz J., Helmick L. S., Oestreich T. M., King R. W., Kandetzki P. E. J. Org. Chem., 38, 1947 (1973).
19. Tondys Н, van derPlasH. C., Wozniak M. J. Heterocycl. Chem., 22,353 (1985).
20. Bergstrom F. W. Justus Liebigs Ann. Chem., 515, 34 (1935); Ewing G. W., Steck E. A. J. Am. Chem. Soc., 68, 2181 (1946).
21. Wozniak M., Baranski A., Nowak K, van der Plas H. C. J. Org. Chem., 52,5643 (1987); Womiak M., Baranski A., Nowak K., Poradowska H. Justus Liebigs Ann. Chem., 1990, 653; Wozniak M., Nowak K. Justus Liebigs Ann. Chem., 1994, 355.
22. Baik W., Yun S., Rhee J. U., Russell G. A. J. Chem. Soc., Perkin Trans. 1,1996,1777.
23. Vanderwalle J. J. M., de RuiterE., Reimlinger H., Lenaers R. A. Chem. Ber., 108, 3898 (1975).
24. Simchen G., Kramer W. Chem. Ber., 102, 3666 (1969).
25. Sanders G. M., van Dijk M., den Hertog H. J. Reel. Trav. Chem. Pays-Bas, 93, 198 (1974).
26. Verbeek J., George A, V. E., de Jong R. С. P., Brandsma L. J. Chem. Soc., Chem. Commun., 1984, 257; Godard A., Jaquelin J.-M. Quegeiner G. J. Organomet. Chem., 354,273 (1988); Jacquelin J. M., Robin K, Godard A., Queguiner G. Can. J. Chem., 66, 1135 (1988), Marsais E, Godard A., Queginer G. J. Heterocycl. Chem., 26, 1589 (1989).
27. Gilman H, Reel J. A. J. Am. Chem. Soc., 73, 32 (1951).
28. Alvarez M., Salas M.r Rigat LI., de Veciana A., Joule J. A. J. Chem. Soc., Perkin Trans. 1,1992,351.
29. Fernandez M., de la Cuesta E., Avendano C. Synthesis, 1995,1362.
30. Gilman K, Soddy T. S. J. Oig. Chem., 22,565 (1957); ibid., 23,1584 (1958); PinderR. M., Burger A. J. Med. Chem., 11, 267 (1968); Ishikura M., Mono T., Oda I., Terashima M. Heterocycles, 22,2471 (1984).
31. Wommack J. B., Barbee T. G., Thoennes D. J., McDonald M. A., Pearson D. E. J. Heterocycl. Chem., 6,243 (1969).
32. Baradarani M. M., Dalton L., Heatley F, Joie J. A. J. Chem. Soc., Perkin Trans. 1,1985, 1503.
33. Prasad A. S. Stevenson T. M., Citineni J. R., Nyzam И, Knochel P. Tetrahedron, 53,7237 (1997).
34. Edo K, Sakamoto T., Yamanaka H. Chem. Pharm. Bull., 27, 193 (1979); Sakamoto T., Shiraiwa M., Kondo Y., Yamanaka H. Synthesis, 1983, 312; Ma H., WangX., DengM. Synth. Commun., 29, 2477 (1999).
35. Pridgen L. N. J. Heterocycl. Chem., 17, 1289 (1980); Tamao K, Kodama S.t Nakajima L, Kumada M., Minato A., Suzuki К Tetrahedron, 38,3347 (1982).
36. Giufolini M. A., Mitchell J. W., Roschanger F. Tetrahedron Lett., 37,8281 (1996).
37. Ford A., Sinn E., Woodward S. J. Chem. Soc., Perkin Trans. 1,1997,927.
38. Girard G. R., Bondinelli W. E., Hillegass L. M., Holden K. G., Pendleton R. G., VzinskasL J. Med. Chem., 32, 1566 (1989).
39. Nose A., Kudo T. Chem. Pharm. Bull., 32,2421 (1984).
40. Ranu В. C., Jana U., SarkarA. Synth. Commun., 28,485 (1998).
41. VierhapperF. W., ElielE. L. J. Oig. Chem., 40,2729 (1973); Patrick G. L. J. Chem. Soc., Perkin Trans. 1, 1995, 1273.
42. Birch A. J., Lehman P. G. Tetrahedron Lett., 1974, 2395.
43. Huckel W, Graner G. Chem. Ber., 90,2017 (1957).
44. Braude E. A., Hannah J., LinsteadR. J. Chem. Soc., 1960,3249.
45. Jackman L. M., Packham D. I. Chem. Ind. (London), 1955, 360.
46. «1,2-Dihyd го isoquinolines», Dyke S. F. Adv. Heterocycl. Chem., 14,279 (1972).
47. Muren J. E, Wiessman A. J. Med. Chem., 14,49 (1971).
48. Minter D. E., Stotter P. L. J. Org. Chem. 46,3965 (1981).
49. Fukuzumi S., Noura S. J. Chem. Soc., Chem. Commun., 1994,287.
50. Day F. H, Bradsher С. K., Chen N-К J. Org. Chem., 40, 1195 (1975).
51. Nicolas T. E, Franck R W. J. Org. Chem., 60,6904 (1995).
52. AlbiniA., Bettinetti G. E, Minoli G. Tetrahedron Lett., 1979,3761; idem, Org. Synth., 61, 98(1988).
53. Buchardt O. Acta Chem. Scand., 18, 1389 (1964).
54. Woodward R. B., Doering W. E. J. Am. Chem. Soc., 67,860 (1945).
55. Prister-Guillouzo G., Guimon C., Frank J., Ellison J. Katritzky A. R. Justus Libeigs Ann. Chem. 1981,366.
56. The quinolones, Andriole V. T. (ed.), Academic Press, London, 1988.
57. «3(2H)-Isoquinolones and their saturated derivatives», Hazai L. Adv. Heterocycl. Chem., 52, 155 (1991).
58. Adams A., Hey D. H J. Chem. Soc., 1949,255; Schofield К Swain T., ibid., 1367.
59. Kawazoe Y., Yoshioka Y. Chem. Pharm. Bull., 16,715 (1968).
60. Horning D. E., Lacasse G., MuchowskiJ. M. Can J. Chem., 49,2785 (1971).
61. Gabriel S., Coman J. Chem. Ber., 33,980 (1900).
62. Kanishi K, Onari Y., Goto S., Takahashi K. Chem. Lett., 1975,717.
63. Ogata Y., Kawasaki A., Hirata H. J. Chem. Soc., Perkin Trans. 2,1972, 1120.
64. Kaslow С. E, Stayner R D. J. Am. Chem. Soc., 67,1716 (1945).
65. Wislicenus W., KleisingerE. Chem. Ber., 42,1140 (1909).
66. Burger A., Modlin L, R. J. Am. Chem. Soc., 62,1079 (1940).
67. Dyson P., Hammick D. J. Chem. Soc., 1937,1724.
68. Quast H, Schmitt E. Justus Liebigs Ann. Chem., 732,43 (1970).
69. Gensler W. J., Shamasundar К T. J. Oig. Chem., 40, 123 (1975).
70. Окисление до «-оновых» соединений с использованием феррицианидов см.: Bunting J. W., Lee-Young Р. A., Norris D. J. J. Org. Chem. 43,1132 (1972); окисление Ог см: Ruchirawat S., Sunkul S., Thebtaranonth Y., Thirasasna N. Tetrahedron Lett., 1977,2335.
71. Schultz O.-E., Amschler U. Justus Liebigs Ann. Chem., 740, 192 (1970); см. также Bunting J. W., Meathrel W. G. Can J. Chem., 52, 303 91974).
72. Diaba E, Lewis-1., Grignon-Dubois M., Navarre S. J. Org. Chem., 61,4830 (1996).
73. Katayama H, Ohkoshi M., Yasue M. Chem. Pharm Bull., 28,2226 (1980).
74. Weinstock J., Boekelheide V. Oig. Synth., Coll. Vol. IV, 1963,641.
75. «Reissert compounds», Popp E D. Adv. Heterocycl. Chem., 9,1 (1968); «Developments in the chemistry of Reissert compounds (1968-1978), idem, 24,187 (1979).
76. Ezquerra J., Alvarez-Builla J. J. Chem. Cos. Chem. Cummun., 1984,54.
77. ChenevertR., LemieuzE., VoyerN. Synth. Commun., 13,1095 (1983).
78. Boger D. L., Brotherton С. E. Panek J. S., YohannesD. J. Org. Chem. 49,4056 (1984).
79. Yamaguchi R, Mochizuki K, Kozima S., Takaya H. Chem. Lett., 1994,1809.
80. Yamaguchi R., Hatano B., Nakayasu T., Kozima S. Tetrahedron Lett., 38,403 (1997).
81. Yamaguchi R., Omoto Y, Miyake M., Fuijita R Chem. Lett., 1998,547.
82. Zincke T. H, Weisspfenning G. Justus Liebigs Ann. Chem., 396,103 (1913).
83. Barbier D., Marazano C.t Das В. C, PotierP. J. Org. Chem., 63, 1767 (1998).
84. Barbier D., Marazano C., Riche C., Das В. C., Potter P. J. Org. Chem., 63, 1767 (1998).
85. Ochiai E. J. Oig. Chem., 18, 534 (1953); Yokoyama A., Ohwada T., Saito S., Shudo K. Chem. Pharm. Bull., 45,279 (1997).
86. Ochaiai E, Ikehara M. J. Pharm. Soc. Japan, 73,666 (1953).
87. Harusawa S., Hamada Y., Shiorii T. Heterocycles, 15,981 (1981).
88. MiyashitaA., Matsuda H., lijima C., Higashino T. Heterocycles, 33, 211 (1992).
89. Hayashida M., Honda H., Hamana M. Heterocycles, 31, 1325 (1990).
90. Long R., Schofield K. J. Chem. Soc., 1953, 3161; см. также Roberts E, Turner E. E. J. Chem. Soc., 1927, 1832.
91. Magnus P., Eisenbeis S. A., Fairhurst R. A., Iliadis T., Magnus N. A., Parry D. J. Am. Chem. Soc., 119,5591 (1997).
92. Lauer W. M„ Kaslow С. E. Org. Synth., Coll. Vol. Ill, 1955, 580; Reynolds G. A., Hauser C. R. ibid., 593.
93. Heindel N. D., BrodofT. A, KogelshdzJ. E. J. Heterocycl. Chem., 3,222 (1966).
94. Price C. C., Roberts R. M. Org, Synth., Coll. Vol. Ill, 1955, 272; «Aminomethylene malonates and their use in heterocyclic synthesis», Hermecz L, Kereszturi G., Vasvdri-DebreczyX., Wang J. Synthesis, 1987,482.
95. Chen B., HuangX., Wang J. Syntesis, 1987,482.
96. Маске P, X, Ф., Кулка M. «Синтез хинолинов по методу Скраупа», в сборнике: Органические реакции, т. 1, с. 100, ИЛ, М., 1954.
97. Clarke Н, Т., Davis А, Ж, Org. Synth., Coll., Vol. 1,1932, 478.
98. Mosher H S, Yanko W. H, Whitmote F. C, Org. Synth., Coll. Vol. Ill, 1955, 568.
99. SongZ., Metrzman M., Hughes D. L. J. Heterocycl. Chem., 30, 17 (1993).
100. «The Fridlander synthesis of quinolines», Cheng C.-C, Yan S.-J. Org. React., 28,37 (1982).
101. Удобный метод синтеза таких соединений см.: Okabe М., Sun R.-C. Tetrahedron., 51, 1861 (1995).
102. FehnelE. A. J. Org. Chem., 31,2899 (1966).
103. Boger D. L, Chen J.-H. J. Oig. Chem., 60,7369 (1995).
104. Ho L-S., GongL., MuchowskiJ. M. J. Oig. Chem., 56,7288 (1991).
105. Calaway P. K, Henze H. R. J. Am. Chem. Soc., 61,1355 (1939).
106. Генслер В.Д. «Синтез изохинолинов по методу Померанца—Фритша», Органические реакции, т. 6, с. 218, ИЛ, М., 1953.
107. KucznierzR., DickhautJ., LeinertH., von derSaal W. Synth. Commun., 29,1617 (1999).
108. Birch A. J., Jackson A. H, Shannon P. V. R. J. Chem. Soc., PerkinTrans. 1,1974,2185.
109. Boger D. L., Brotherton С. E., Kelley M. D. Tetrahedron, 37, 3977 (1981).
110. Garcia A.t Castedo L., Dominquez D. Synlett, 1993, 271; Larghi E. L., Kaufman T. S. Tetrahedron Lett., 38,3159 (1997).
111. KidoK., Watanabe Y. Heterocycles, 14, 1151 (1980).
112. Schlittler E, Muller J. Helv. Chim. Acta., 31,914 (1948).
113. Уэли В. M., Говиндачари Т. Р. «Синтез 3,4-дигидроизохинолинов и подобных им соединений по методу Бишлера — Наперальского», в сборнике: Органические реакции, т. 6, с. 86, ИЛ, М., 1953.
114. NagubandiS., Fodor G. J. Heterocycl. Chem.6 17,1457 (1980).
115. Ban Y., Wakamatsu T., Mori M. Heterocycles, 6, 1711 (1977).
116. Banwell M. G., Bissett B. D., Busato S., Cowden C. L, Hockless D. C. R.t Holman J. W., Reed R. W, WuA. W. J. Chem. Soc., Chem. Commun., 1995,2551.
117. WangX., Tan J., GrozingerK. Tetrahedron Lett., 39,6609 (1998).
118. Fitton A. O,, Frost J, R. Zakaria M. M.> Andrew G. J. Chem. Soc., Chem. Commun., 1973,889.
119. Уэли В. M., Говиндагари Т. Р. «Синтез тетрагидроизохинолинов и подобных им соединений по методу Пикте — Шпенглера Э, в сборнике: Огранические реакции, т. 6, с. 177, ИЛ, М., 1953.
120. Schdpf С., Salzer W. Justus Liebigs Ann. Chem., 544,1 (1940).
121. Venkov A. P., Statkova-Abeghe S. M. Tetrahedron, 52,1451 (1996).
122. Miller R. B., Firncke J. M. J. Oig. Chem., 45, 5312 (1980).
123. Flippin L. A.t MuchowskiJ. M. J. Org. Chem., 58,2631 (1993).
124. Sakamoto T., Kondo Y., Miura N., Hayashi K., Yamanaka H. Heterocycles, 24, 2311 (1986).
125. NumataA., Kondo Y, Sakamoto T. Synthesis, 1999, 306.
126. KatritzkyA. R., Jiang J., Greenhill Y. V. J. Org. Chem., 58,1987 (1993).
127. Makioka K, Shindo T., Taniguchi Y, TakakiK., Fujiwara Y. Synthesis, 1995,801.
128. Meth-Cohn O., Narine B., Tarnowski B. J. Chem. Soc., Perkin Trans. 1, 1981, 1520; Righy J. Y., Danca D. M. Tetrahedron Lett., 38,4969 (1997).
129. Martinez A. G., Fernandez A. H., VilchezD. M., Gutierrez M. L. L., Subramanian L. R. Synlett, 1993,229.
130. Holzapfel С. Ж, Dwyer C. Heterocycles, 48,215 (1998).
131. Roesch K. R., LarockR. C. J. Org. Chem., 63, 5306 (1998).
132. Kusama H., Yamashita Y., Uchiyama K, Norasaka K. Bull. Chem. Soc. Jpn., 70, 965 (1997).
133. Curran D. P., Liu H. J. Am. Chem. Soc., 113,2127 (1991).
134. Curran D. P., Josien H., Ko S.-B. Angew. Chem., Int. Ed. Engl., 34,2863 (1995).
135. Curran D. R, Liu H, Josien H., Ko S.-B. Tetrahedron, 52, 11385 (1996).
136. Surrey A. R., Hammer H. F. J. Am. Chem. Soc., 68,113 (1946).
137. Pictet A., Gams A. Chem. Ber., 42,2943 (1909).
138. GainorJ. A., Weinreb S. M. J. Org. Chem., 47,2833 (1982).
ОБЩАЯ ХАРАКТЕРИСТИКА РЕАКЦИОННОЙ СПОСОБНОСТИ СОЛЕЙ ПИРИЛИЯ И БЕНЗОПИРИЛИЯ, ПИРОНОВ И БЕНЗОПИРОНОВ
катион пирилия 2-пирон 4-пирон
катион хромилия
катион изохромилия
Катион пирилия обладает весьма интересными свойствами. Этот катион проявляет ароматический характер и, вследствие этого, как можно предположить, стабилен, тем не менее он обладает очень высокой реакционной способностью. Аналогичные свойств характерны для катиона тропилия и циклопентадиениль-ного аниона. Тот факт, что катионы пирилия легко реагируют с нуклеофильными реагентами с образованием неароматических соединений, свидетельствует лишь об их относительной стабильности; если же такие катионы не были бы ароматическими, весьма сомнительно, что они вовсе существовали бы. Перхлорат пирилия — соединение, обладающее удивительной стабильностью, он не разлагается при нагревании до температуры ниже 270 'С, в то же время легко реагирует с водой даже при комнатной температуре с образованием неароматических соединений.
Типичные реакции пирилиевого катиона
Свойства катионов пирилия лучше всего сравнивать со свойствами пиридиниевых катионов. Пирилиевые катионы не вступают в реакции электрофильного замещения; кроме того, для катионов бензопирилия также неизвестны реакции электрофильного замещения в бензольном кольце. Последний факт демонстрирует существенное отличие свойств катионов бензопирилия от свойств катионов хинолиния и изохинолиния и подчеркивает сильное дезактивирующее влияние положительно заряженного атома кислорода.
Ионы пирилия легко присоединяют нуклеофильные агенты по «-положению с образованием 1,2-дигидропиранов, дальнейшие превращения которых обычно связаны с раскрытием цикла. В действительности, все известные реакции солей пирилия связаны именно с таким характером превращений. Часто
Общая характеристика реакционной способности солей пирилия и бензопирилия 199
бывает так, что первоначальное раскрытие цикла влечет за собой спонтанное замыкание альтернативного цикла и образование в результате этого процесса бензоидной ароматической системы (в том случае, если Y содержит подвижный атом водорода, присоединенный к атому углерода) или пиридинового производного (если Y — аминохруппа).
Анализ резонансных форм катиона пирилия показывает, что в а- и у-поло-жениях катиона сосредоточен большой положительный заряд, однако практически все известные реакции присоединения нуклеофильных агентов проходят исключительно по a-положению. В этом случае уместно вспомнить влияние положительно заряженного гетероатома в пиридиновом цикле на реакционную способность а- и у-положений. Катионы пирилия более склонны к реакциям с нуклеофильными реагентами, чем катионы пиридиния, поскольку положительный заряд на атоме кислорода менее выгоден, чем положительный заряд на атоме азота. В этом случае также уместна аналогия со свойствами карбонильных соединений, поскольку нуклеофильное присоединение к катиону пирилия по своей сути родственно часто встречающимся катализируемым кислотами реакциям (О-протонированных) карбонильных групп.
сравните
R1
Возвращаясь к бензопирилиевым системам, следует отметить наличие у них совершенно аналогичных свойств — легкое присоединение нуклеофильных агентов, причем по положению гетероциклического фрагмента, соседнему с положительно заряженным атомом кислорода. Интересно взаимодействие двух изомерных бензопирилиевых систем с аммиаком; в одном случае такое взаимодействие приводит к изохинолину, а в другом не приводит к образованию хинолина. Хотя и в последнем случае присоединение аммиака все же происходит, высокая энергия процессов, приводящих к образованию хинолиновой структуры, не позволяет им осуществиться.
Пироны — кислородные аналоги пиридонов — представляют собой депро-тонированные а- и у-гидроксипирилиевые соли. Есть лишь немного поводов для того, чтобы рассматривать эти соединения как ароматические; вероятно, лучше всего рассматривать а- и у-пироны как ненасыщенные циклические лактоны и р-гидрокси-а,р-ненасыщенные кетоны соответственно. Например, 2-пирон гидролизуется щелочью так же легко, как и сложный эфир (лактон). Примечательно, что пироны превращаются в соответствующие пиридоны при взаимодействии с аммиаком, в то время как из пиридонов ни при реакции со щелочью, ни при взаимодействии с водой пироны не мыуг быть получены. Для пиронов и бензопиронов известно несколько реакций электрофильного замещения при атоме углерода, кислородный заместитель направляет атаку электрофила в орто- и лярд-положения. В этом случае также происходит электрофильное присоединение по двойной связи, что дополнительно свидетельствует в пользу неароматического характера этих соединений. Легко осуществимые реакции Дильса—Альдера с участием диеновой системы 2-пиронов еще раз подтверждают изложенное выше.
Циклизация ненасыщенных 1,5-дикарбонильных соединений приводит к образованию солей пирилия; при этом в реакционной среде должны отсутствовать какие-либо нуклеофильные агенты, способные присоединяться к катионам пирилия сразу после их образования. Замыкание цикла в 1,3,5-трикетонах, катализируемое кислотой, приводит к образованию 4-пиронов.
Бензопирилиевые соли образуются при взаимодействии фенолов с 1,3-ди-карбонильными соединениями в кислых средах, способствующих дегидратации. Аналогично реакции фенолов с эфирами 1,3-кетокислот приводят к образованию бензопиронов.
R2 ~2hhOr
R1
R3
8
КАТИОНЫ ПИРИЛИЯ, 2- И 4-ПИРОНЫ:
РЕАКЦИИ И МЕТОДЫ СИНТЕЗА
4£Y)
5[|^3 (Р)
1°
SbCI6~
2Н-пиран
4Н-пиран
2-пирон (а-пирон) [2Н-пиран-2-он]
пирилия
гексахлорантимонат (V)
4-пирон (У-пирон) [4Н-пиран-4-он]
Соли пирилия [1,2], особенно перхлораты, тетрафторбораты и гексахлорани-монаты(У), представляют собой стабильные, но весьма реакционноспособные соединения. Чаще других используются перхлораты пирилия, поскольку они умерено растворимы. При использовании перхлоратов необходимо соблюдать осторожность, так как они, особенно в сухом состоянии, склонны разлагаться со взрывом. Катионы пирилия не обнаружены в живых организмах, хотя бен-зо[/»]пирилиевые системы присутствуют в пигментах растений (разд. 9.1.6).
Почти все известные реакции пирилиевого катиона включают присоединение нуклеофильного реагента на первой стадии обычно по a-положению и лишь в редких случаях по у-положению. Особенность реакций пирилиевого катиона связана с тем, что аддукты, образующиеся в результате присоединения нуклеофилов и раскрытия цикла, склонны к последующей циклизации с образованием новых гетероциклических или карбоциклических систем (ANRORC-процессы).
Реакции прямого электрофильного или радикального замещения для таких систем не известны. Реакции окисления, аналогичные окислению пиридиниевых солей в пиридоны, также неизвестны для пирилиевых соединений.
8.1. РЕАКЦИИ КАТИОНОВ ПИРИЛИЯ
8.1.1. Реакции с электрофильными реагентами
8.1.1.1. Протонный обмен
При нагревании солей 2,4,6-трифенилпирилия в дейтероуксусной кислоте наблюдается обмен протонов в положениях 3 и 5, однако, вероятно, этот процесс не включает протонирования пирилиевого катиона, а реализуется с участием равновесной концентрации аддукта — эфира енола, образующегося в результате присоединения ацетат-иона по положению 2 [3].
8.1.1.2. Нитрование
Нитрование катиона 2,4,6-трифенилпирилия идет в бензольное кольцо [4], примеры нитрования самого пирилиевого катиона неизвестны.
8.1.2. Присоединение нуклеофильных реагентов
Нуклеофильные реагенты присоединяются к пирилиевым катионам по положению, соседнему с атомом кислорода, и обычно такие процессы аналогичны реакциям протонированных по атому кислорода карбонильных соединений.
8.1.2.1. Реакции с водой и гидроксид-ионом
Склонность катионов пирилия к присоединению нуклеофилов существенно варьируется: так, незамещенный пирилиевый катион присоединяет молекулу воды даже при 0 °C, а 2,4,6-тримстилпирилисвый катион остается неизменным в воде при 100 ’С. Присоединение гидроксид-иона во всех случаях проходит чрезвычайно легко.
Типичный пример — превращение 2-метил-4,6-дифенилпирилиевого катиона [5]. В этом случае образующийся на первой стадии 2-гидрокси-2Н-пиран, который представляет собой циклический полуацеталь енола, находится в равновесии с доминирующим ациклическим таутомером, вероятно образующимся в результате катализируемых протоном превращений, поскольку аддукт, получающийся при присоединении метоксид-иона, остается циклическим [6]. Взаимодействие таких ациклических ненасыщенных кетонов с кислотами приводит к образованию первоначального пирилиевого катиона (разд. 8.3.1).
В случае катионов пирилия, содержащих а-алкильные группы, при использовании сильной щелочи происходит замыкание альтернативного цикла и образование бензоидной структуры. Так, например, при нагревании соли 2,4,6-три-метилпирилия со щелочью в результате альдольной конденсации первоначально образующегося ациклического интермедиата получается 3,5-диметилфенол, как показано ниже [7]:
Me
водн. NaOH, нагревание
Me
8.1.2.2. Реакция с аммиаком, первичными и вторичными аминами
Реакции аммиака и первичных аминов с солями пирилия приводят к образованию пиридинов и N-алкил- и N-арил пиридиниевых солей соответственно [7а,8]. Такие превращения представляют собой удобный метод получения азотсодержащих гетероциклических соединений. Первоначально образующийся аддукт в зависимости от условий может существовать в одной из многих ациклических таутомерных форм [9]; вероятно, циклизация аминодиенонного таутомера приводит к образованию пиридинового цикла.
Me
Фводн. NH3
—
Реакция пирилиевых солей со вторичными аминами, разумеется, не может сопровождаться образованием пиридинового цикла. При наличии в a-положении пирилиевого катиона метильной группы циклизация енаминного ациклического таутомера приводит к образованию бензольной структуры, как показано на приведенной ниже схеме [7а]:
Использование в реакции с солями пирилия других реагентов, содержащих первичную аминогруппу, приводит к образованию замещенных по атому азота производных пиридина [10]. Так, например, при использовании некоторых производных гидразина могут быть получены производные N-аминопиридинов. Взаимодействие солей пирилия с гидроксиламином приводит к образованию (преимущественно) N-оксидов пиридина [1, И].
8.1.2.3. Присоединение металлоорганических реагентов
Металлоорганические соединения присоединяются по a-положению пирилиевого катиона. При наличии заместителя в этом положении присоединение проходит у-положению [12]. По положению 4 идет также присоединение органо-купратов [13]. Образующиеся при присоединении 2Н-пираны претерпевают в
дальнейшем элекгроциклическое раскрытие цикла (причем такие процессы проходят быстрее, чем превращение циклогексадиена в гексатриен [14]), приводящее к диенонам или диеналям с сохранением геометрии двойных связей.
сю;
n-BuLi
THF, -78 *С
81%
8.1.2.4. Присоединение других карбанионных реагентов
Аналогично описанному выше присоединению металлоорганических реагентов к пирилиевым катионам проходит и присоединение цианид-иона, приводящее к образованию ациклических диенонов [15]. Реакции пирилиевых катионов со стабилизированными анионами, полученными из нитрометана или 1,3-дикарбониль-ных соединений, в результате последовательно протекающих таутомерных превращений и циклизации приводят к образованию ароматических соединений [7а].
ch3no2 t-BuOK t-BuOH, 20 *С
.77%
Для получения 2,4,6-триеновых альдегидов, все двойные связи которых имеют /тфялс-конфигурацию, используют следующую последовательность реакций [16]:
8.1.3. Реакции нуклеофильного замещения
Существует немного реакций солей пирилия, которые могут быть классифицированы как реакции нуклеофильного замещения. 4-Пироны при реакции с уксусным ангидридом в результате ацилирования карбонильного атома кислорода превращаются in situ в 4-ацетоксипирилиевый катион. Для такого катиона возможно обычное нуклеофильное замещение ацетокси-группы в положении С(4) [17]. Аналогичным образом 4-пирон при реакции с фосфорилхлоридом может быть превращен в 4-хлорпирилиевый катион [1].
8.1.4. Реакции со свободными радикалами
Введение алкильного заместителя в положение 4 2,6-дизамещенных катионов пирилия можно осуществить реакцией с тетраалкилстаннанами при облучении. Первоначально образующийся аддукт окисляется в условиях реакции с образованием 4-алкилпирилиевых солей [18].
8.1.5. Реакции с восстановителями
Присоединение гидрид-иона к катионам пирилия проходит преимущественно по a-положению; образующиеся при этом 2Н-пираны быстро превращаются в ациклические соединения, которые можно выделить быстрой экстракцией органическим растворителем. В небольшом количестве образуются изомерные 4Н-пираны [19]. Одноэлектронное полярографическое восстановление пири-лиевого катиона приводит к образованию радикалов, которые димеризуются (разд. 5.6.3) [20].
8.1.6. Фотохимические реакции
На первый взгляд фотохимическое превращение 4-гидроксипирилиевого катиона в 2-пироны в кислых средах кажется необычным. В действительности такое превращение включает образование бициклического гидроксиаллильного катиона, который в дальнейшем превращается в бициклический эпоксицикло-пентенон, последующая фотохимическая трансформация которого приводит к 2-пирону, как показано ниже [21]. Проведение реакции при более высоких значениях pH позволяет получить дигидроксициклопентеноны в результате присоединения растворителя к первоначально образующемуся интермедиату [22].
8.1.7. Реакции с диенофилами, циклоприсоединение
Реакции диполярного циклоприсоединения 3-оксидопирилиевых [23] соединений весьма интересны. Формально катион 3-гидроксипирилия становится нейтральным при удалении фенольного протона, хотя не всегда такой путь может быть использован для получения 3-оксидопирилия. З-Оксидопирилиевая частица вступает в реакции циклоприсоединения с участием положений 2 и 6, аналогично 3-оксидопиридиниевым частицам (разд. 5.8).
СН2=СНСНО CDCI3,134*С (•АсОН) 69% **
3-оксидопирилий
Интересный метод генерирования диполей связан с алкилированием [24] или силилированием [25] карбонильного атома кислорода З-гидрокси-4-пиро-нов. Внутримолекулярное диполярное циклоприсоединение с участием таких диполей возможно и к неактивированной двойной связи [25]. Ниже приведен пример использования аналога койевой кислоты [койевая кислота — 5-гидро-кси-2-(гидроксиметил)-4Н-пиран-4-он] для генерирования диполя в результате метилирования по карбонильному атому кислорода и депротонированию 3-гид-роксильной группы под действием объемного основания.
8.1.8. Катионы алкилпирилия [26]
Атомы водорода алкильных трупп в а- и у-положениях пирилиевых катионов, как и следовало ожидать, обладают заметной подвижностью. Реакции конденсации с участием у-метильных групп проходят в некоторой степени быстрее, чем с участием а-метильных групп [27]. Описаны реакции конденсации катионов алкилпирилия с ароматическими альдегидами (приведена ниже) [28], триэтиловым эфиром ортомуравьиной кислоты [29] и диметилформамидом [30].
4-Me2NC6H4CH=O EtOH, кипячение _
89%
MeciO?
8.2. 2 -ПИРОНЫ И 4-ПИРОНЫ
(2Н-ПИРАН-2-ОНЫ И 4Н-ПИРАН-4-0НЫ; а-ПИРОНЫ И у-ПИРОНЫ)
8.2.1. Строение пиронов
2- и 4-Гидроксипирилиевые соли обладают свойствами сильных кислот и существуют в виде стабильных сопряженных оснований — 2- и 4-пиронов (или а- и у-пиронов). Простые 4-пироны вполне стабильные кристаллические соединения, в то время как 2-пироны гораздо менее стабильны. Незамещенный 2-пи-рон, обладающий запахом свежескошенного сена, медленно полимеризуется при хранении. Фрагмент пирона редко встречается в природных соединениях; в противоположность этому бензопироны (разд. 9.2) — кумарины и хромоны — широко распространены в природе и имеют важное значение.
8.2.2. Реакции пиронов
8.2.2.1. Реакции электрофильного присоединения и замещения
4-Пирон представляет собой слабое основание, рЛ^-0,3, при протонировании по карбонильному атому кислорода превращается, как правило, в кристаллические 4-гидроксипирилиевые соли. Взаимодействие 2,6-диметил-4-пирона с трет-бу-тилбромидом в горячем хлороформе служит удобным методом получения соответствующего иодида 4-гидрокси-2,6-диметилпирилия [31]. 2-Пироны — основания, значительно более слабые, и протонирование карбонильного атома кислорода возможно только в растворах сильных кислот; образующиеся при этом соли не удается выделить. Такие же закономерности наблюдаются при взаимодействии пиронов с алкилирующими агентами. Так, 4-пирон образует 4-метоксипирилиевые соли при взаимодействии с диметилсульфатом [32], а метилирование карбонильного атома кислорода 2-пирона требует использования соли Меервейна McO+BF4. Протонный обмен в 4-пироне, катализируемый кислотой, проходит по положениям 3 и 5, по-видимому, в результате протонирования атома углерода [33]:
При взаимодействии с бромом 2-пирон образует нестабильный аддукт, который при нагревании превращается в З-бром-2-пирон [34]. Тетрафторборат нитрония первоначально реагирует по карбонильному атому углерода, последующие превращения приводят к 5-нитро-2-пирону [35]. Примеры простых реакций электрофильного замещения в 4-пироне немногочисленны, хотя известно, что бис-диметиламинометилирование незамещенного 4-пирона проходит в чрезвычайно мягких условиях [36].
Вг2
СС14 кипячение 44%
айо2 bf4~
MeNOg, 20 ’С
О 35% *
8.2.2.2. Реакции с нуклеофильными реагентами
2-Пироны обладают свойствами ненасыщенных лактонов: так, они легко гидролизуются водными растворами щелочей. 4-Пироны также склонны к раскрытию цикла под действием оснований, но, поскольку 4-пироны можно рассматривать как винилоги лактонов, первоначальная нуклеофильная атака по положению С(2) может приводить к продукту реакции Михаэля [37].
о о
водн. Ва(ОН)г
ХСГ V“c/ Ва2+
Реакции нуклеофильных реагентов с 2-пироном могут проходить как с участием карбонильной группы, так и по положениям 4 и 6. Так, цианид-анион [38], аммиак и амины атакуют 2-пирон по положению 6, а присоединение реактивов Гриньяра идет по карбонильному атому углерода.
Присоединение реактивов Гриньяра к 4-пиронам также проходит по карбонильной группе, последующая дегидратация первоначально образующегося третичного спирта под действием минеральной кислоты обеспечивает удобный синтетический подход к 4-монозамещенным пирилиевым солям [39]. В более жестких условиях реакции 2- и 4-пиронов с металлоорганическими реагентами приводят к образованию соответственно 2,2-дизамещенных 2Н-пиранов и 4,4-дизамещенных 4Н-пиранов в результате присоединения двух молекул металлоорганического соединения [40]. Присоединение гидрид-иона к 4,6-диме-тил-2-пирону при реакции с алюмогидридом лития, в противоположность описанным выше примерам, проходит по положению С<6) [41].
Взаимодействие аммиака, первичных алифатических и ароматических аминов с 4-пиронами сопровождается образованием 4-пиридонов [42]. Такое превращение включает атаку нуклеофилом по a-положению, влекущую за собой раскрытие цикла и замыкание нового. В некоторых случаях были выделены ациклические продукты реакции, образующиеся в результате присоединения двух молекул амина, хотя вовсе не обязательно, что такие структуры служат интермедиатами при образовании пиридонов [43]. Такое же превращение может быть осуществлено в две стадии: на первой стадии проводят гидролитическое раскрытие цикла с использованием гидроксида бария (см. приведенную выше
схему) и затем в результате реакции полученной бариевой соли с хлоридом аммония образуется 4-пиридон [44].
II HO2C(CH2)2NH2
Н20,105’С о —%— о
(СН2)2СО2Н
h2noh.hci водн. NaHCOg 76%
Реакции 4-пиронов с гидразинами и гидроксиламином могут сопровождатся образованием продуктов рециклизации, т. е. замыкание нового цикла происходит с участием второго нуклеофильного гетероатома. Такие превращения приводят к пиразолам и изоксазолам соответственно. Однако в простейшем случае взаимодействие 4-пирона с гидроксиламином приводит либо к 1-гццрокси-4-пиридону, либо к N-оксиду 4-гидроксиаминопиридина [45]. В этом случае также может быть использовано первоначальное гидролитическое раскрытие пиронового цикла под действием гидроксида бария [44].
8.2.2.3. Металлоорганические производные
З-Бром-2-пирон не вступает в реакцию обмена (и не депротонируется) при взаимодействии с «-бутиллитием, однако возможно превращение такого бромпро-изводного в соответствующий купрат, нуклеофильные свойства которого значительно менее выражены, чем у типичных купратов [46]. З-Бром-2-пирон может участвовать в реакциях сочетания с оловоорганическими соединениями, катализируемыми комплексами палладия, или сам может быть превращен в оловоорганическое производное, для которого также характерны катализируемые палладием реакции сочетания [47].
45%
CH2=CHSnMe3 Вг Pd(PPh3)4 tPhMe, кипячение
(Me3Sn)2, Pd(PPh3)4 THF, кипячение
68%
8.2.2.4. Реакции циклоприсоединения [48]
Аддукт, первоначально образующийся при реакции Дильса—Альдера с участием 2-пирона в качестве диена, часто разлагается с выделением молекулы диоксида углерода и образованием нового диена, который способен присоединять вторую молекулу диенофила. Ниже приведена реакция 2-пирона с малеиновым ангидридом как типичный пример реакции Дильса—Альдера с участием 2-пирона в качестве диена. Первоначально образующийся моноаддукт может быть выделен, однако в более жестких условиях он теряет молекулу диоксида углерода и образующийся диен присоединяет вторую молекулу диенофила [49]. В том случае, когда в качестве диенофила используется производное ацетилена, например, метиловый эфир пропиоловой кислоты, в результате выделения молекулы диоксида углерода образуются производные бензола [50]. Проведение реакции при низких температурах и очень высоком давлении, а также в присутствии лан-
таноидных катализаторов может приводить к получению первичных недекар-боксилированных аддуктов [51].
Как 3- [52], так и 5-бром-2-пироны [53] обладают весьма интересными свойствами, поскольку способны выступать в качестве диенов в реакции Дильса — Альдера как с электроноизбыточными, так и с элекгронодефицитными диенофилами (показано на приведенной ниже схеме). 3-(л-Толилтио)-2-пироны также легко вступают в реакции циклоприсоединения с электронодефицитными алкенами [54]:
<^сно
20 'С, 4 дня
3QTGM
NaBH4, МеОН
85%
RSO3H
МеОН, 20X2 100% ”
,СО2Ме
НО
'"сн2он
При определенных условиях даже неактивированные алкены способны участвовать во внутримолекулярных реакциях циклоприсоединения с 3- и 5-бром-2-пиронами и с метиловым эфиром 2-пирон-З-карбоновой кислоты [55]. Такие реакции проводят либо при 100 *С, либо под давлением 1 • 10б-1,2 • 10б кПа и в присутствии хлорида цинка в качестве катализатора.:
эндо: экзо 3:1
Для 2-пиронов также характерны реакции [4тс + 6я]-циклоприсоединения с ацеталем фульвенкетена [56]. 5-Алкенил-2-пироны вступают в реакцию с диенофилами в качестве диенов, как показано ниже [57]:
Превращение 4-пиронов в соответствующие 4-имины при взаимодействии с тозилизоцианатом, возможно, включает реакцию [2 + 2]-циклоприсоединения (показано ниже), причем первоначально образующийся аддукт впоследствии разлагается с выделением молекулы диоксида углерода [44,58].
8.2.2.5. Фотохимические реакции
Кроме описанной ранее фотоинициируемой перегруппировки 4-пиронов в кислых растворах (разд. 8.1.5), следует упомянуть фотохимическую трансформацию 2-пирона в бициклический р-лактон при облучении в растворителях, не содержащих гидроксильных групп, а также его превращение в эфир ненасыщенной альдегидокислоты при облучении в присутствии метанола [59].
8.2.2.6. Реакции заместителей
4-Пироны [60] и 2-пироны [61] вступают в реакции конденсации с ароматическими альдегидами с участием метильных групп в положениях 2 и 6 соответственно. 2,6-Диметил-4-пирон можно литиирован по метильной группе, а затем литиевое производное может быть использовано для синтеза производных 4-пи-рона [62].
8.2.2.7. 2,4-Диоксипироны
2,4-Диоксипироны существуют в виде 4-гидрокситаутомеров. Такие производные легко вступают в реакции электрофильного замещения по положению С(з), т. е. по атому углерода между двумя кислородными заместителями [63]. Депротонирование алкильных групп таких соединений можно осуществить при использовании двукратного избытка сильного основания [64].
8.3. СИНТЕЗ СОЛЕЙ ПИРИЛИЯ [1,8а]
Катионы пирилия могут быть получены при циклизации 1,5-дикарбонильных соединений либо синтезированных предварительно, либо генерированных in situ.
8.3.1. Из 1,5-дикарбонильных соединений
1,5-Дикарбонильные соединения циклизуются с потерей молекулы воды, и последующее окисление промежуточных дигидрострукгур приводит к образованию катионов пирилия
Циклизация моноенолов 1,5-дикетонов приводит к образованию циклического полуацеталя, который при дегидратации превращается в эфир диенола (4Н-пиран). Для превращения последнего в катион пирилия необходимо лишь удаление гидрид-иона. 1,5-Дикетоны обычно получают in situ либо конденсацией альдегида с двумя молекулами кетона (ср. с синтезом Ганча, разд. 5.15.1.2), либо взаимодействием кетона с предварительно синтезированным непредельным кетоном («халконом», если он получен из арилалкилкетона и ароматического альдегида). В последнем случае избыток халкона используется в качестве акцептора гидрид-иона.
Ph
BFg.EtaO 75 С т 65%
Ph ВЕГ
Раньше при синтезе солей пирилия в качестве растворителя использовали уксусный ангидрид, а в качестве окислителя (акцептора гидрид-иона) — обычно хлорид железа(Ш), хотя предположительно акцептором гидрид-иона служил катион ацилия. Впоследствии в качестве акцептора гидрид-иона в таких синтезах успешно использовали 2,3-дихлор-5,6-дициано-1,4-бензохинон [65], соли 2,6-диметилпирилия и, чаще всего, трифенилметильный катион [66]. В некоторых случаях первоначально образующийся 4Н-пирон выделяют и затем уже окисляют [67].
Ph3C+SbCI6“
АсгО, 0*С-»20*С
Me 64%
Me SbCle
В том случае, когда доступен ненасыщенный дикарбонильный предшественник, нет необходимости в использовании окислителя. Получение перхлората незамещенного пирилия (потенциально взрывоопасен) при осторожной обработке глутаконового альдегида или его натриевой соли кислотой (показано на приведенной ниже схеме) относится именно к этой категории синтезов катионов пирилия [13,68].
нсю4
Et2O, МеОН, -20 *С
64% **
сю;
8.3.2. Ацилирование алкенов
Алкены могут быть дважды проацилированы хлорангидридами или ангидридами карбоновых кислот, что приводит к образованию 1,5-дикарбонильных соединений, которые затем циклизуются в катионы пирилия в результате потери молекулы воды
«Алифатическая версия» классической для ароматических соединений реакции Фриделя — Крафтса приводит в результате отщепления протона к образованию несопряженных непредельных кетонов, повторное ацилирование которых дает ненасыщенные 1,5-дикарбонильные соединения. Очевидно, что при ацилировании несимметричных алкенов возможно образование изомерных кетонов [69]. В условиях ацилирования ненасыщенные дикетоны циклизуются с потерей молекулы воды и образованием пирилиевого катиона. В качестве иллюстрации такого процесса ниже приведен пример получения 2,4,6-1риметилпи-рилиевого катиона, который наиболее стабилен и негигроскопичен в виде карбоксиметансульфонатной соли [70].
Обычно в таком синтезе в качестве предшественника алкена используется спирт, который дегидратируется in situ [71], или соответствующее галогенопроизводное [72], которое дегидрогалогенируется в условиях реакции.
8.3.3. Из 1,3-дикарбонильных соединений и кетонов
Конденсация кетонов с 1,3-дикарбонильными соединениями, катализируемая кислотой, сопровождается дегидратацией и образованием катионов пирилия
Катализируемая кислотой альдольная конденсация 1,3-дикарбонильных соединений с кетонами, обладающими а-метиленой группой, и последующая дегидратация приводят к образованию пирилиевых солей [73]. Вероятно, дегидратация с образованием непредельного дикетона происходит до образования циклического полуацеталя и отщепления второй молекулы воды. Использование бисацеталя малонового диальдегида в качестве предшественника 1,3-дикар-бонильного соединения лежит в основе одного из немногочисленных методов синтеза пирилиевых солей, не содержащих заместителей в а-положении [1].
нсю4 Ас2О, 90 *С
55% ' *
В качестве синтетических эквивалентов 1,3-дикарбонильных соединений с успехом могут быть использованы р-хлор-а,р-ненасыщенные кетоны [74] или сопряженные ацетиленовые альдегиды [75].
8.4. СИНТЕЗ 2-ПИРОНОВ
8.4.1. Из 1,3-кето(альдегидо)кислот и карбонильных соединений
Общий метод синтеза 2-пиронов основан на циклоконденсации 1,3-кето(альде-гидо)кислот с карбонильными соединениями, предоставляющими два углеродных атома в пироновый цикл
Давно известный метод получения кумалиновой кислоты при взаимодействии яблочной кислоты с горячей серной кислотой иллюстрирует этот подход к синтезу 2-пиронов. Декарбонилирование яблочной кислоты приводит in situ к образованию формилуксусной кислоты, которая одновременно выступает в дальнейшей конденсации в качестве как 1,3-альдегидокислоты, так и второй карбонильной компоненты [76]. Декарбоксилирование кумалиновой кислоты до сих пор используется как метод синтеза незамещенного 2-пирона [77].
/ ~ 7°%ъ cogn
яблочная кислота
Сопряженное присоединение енолятов к ацетиленовым кетонам [78] и эфирам ацетиленкарбоновых кислот [79] лежит в основе одной из возможных вариаций этого метода синтеза.
Na* CH(CO2Et)2 EtOH, кипячение
50%
8.4.2. Другие методы
Незамещенный 2-пирон можно получить при алкилировании бутен-3-овой кислоты в условиях реакции Принса и последующей циклизации с образованием 5,6-дигидро-2-пирона, который в результате последовательно проводимых реакций аллильного бромирования и дегидробромирования превращается в 2-пирон, как показано на приведенной ниже схеме [80]. Альтернативное бромирование [81] дигидропирона, а затем дегидробромирование приводят к образованию разделяемой смеси 3- и 5-бром-2-пиронов (разд. 8.2.2.4), важных в синтетическом плане производных 2-пирона.
сн2о
H2SO4 (кат.) АсОН, нагревание
СО2Н 38%
Br2, СН2С12 затем Е
QNBS, (PhCO2)2
ССЦ, кипячени^ Et3N^
_ О 70%
NBS. (РЬСОг)2
CCI4, кипячение
94%
Et3N
СН2С12
57%
С конструированием связи С(5)—C(q будущего пиронового цикла связан также другой метод, включающий конденсацию Кляйзена диэтилового эфира щавелевой кислоты по у-положению эфира а,р-непредельной кислоты; циклизация продукта конденсации, проходящая через предварительную енолизацию кетонного фрагмента, приводит к образованию 2-пирона [82].
Elx/VC°2Et (CO2Et)2
KOEt, 20-С J 70%
EtO2C^O
водн. HCI, 70 ’С
Ацилирование енола 1,3-кетоальдегида диэтоксифосфинилалкановыми кислотами обеспечивает построение сложноэфирного фрагмента 2-пиронового цикла. Последующее замыкание цикла возможно в результате внутримолекулярной реакции Хорнера—Эммонса [83].
Превращение глюкозамина в З-амино-2-пирон свидетельствует о возможности применения углеводов в синтезе шестичленных кислородсодержащих гетероциклических соединений [84].
Ас2О Ptv JO,t NHAc
PhCH=O NaOAc I SnCU. Ac2O
глюкозаминовая HCI. EtOH нагревание I ] [ CH2CI2, MeCN, 0 ’C
кислота 8Bo/o ► 71% 57% ►
Реакция циклоприсоединения с обратными электронными требованиями электроноизбыточных или напряженных ацетиленов к 1,3,4-оксадиазин-6-онам представляет собой метод получения 2-пиронов, поскольку первоначально образующиеся аддукты склонны к разложению с выделением молекулы азота (а не молекулы диоксида углерода) [85]. Приведенная ниже реакция циклоприсоединения этинилтрибутилстаннана приводит к образованию смеси региоизо-меров. Оловоорганические производные пиронов могут быть использованы в различных реакциях, например, для введения атомов галогенов в пироновый цикл [86].
Ph
N<^sf°HC^CSnn-Bu3
L 2 EhMeJJCLC.,
81%
CO2Me
Реакции сочетания ацетиленов с эфирами 3-иод-а,0-непредельных кислот или стрифлатами енолов эфиров р-кетокислот, катализируемые палладием (показано ниже), вне всяких сомнений, представляют собой наиболее короткий и прямой подход к 2-пиронам [87]. Циклоприсоединение (несогласованное) кетенов к силиловым эфирам енолов также обеспечивает простой и прямой путь к полезным в синтетическом отношении производным 2-пирона [88].
64% Z-Pr3Si
MeOCSi/-Pr3
Pd(0Ac)2
Na2CO3, LICI 100'С
Me
Me
SiMe3
j кипячение
+ JI 51% ** J| I
*0 MejjSiCjoMe Me3SiH2(T4O'zZ^O
8.5. СИНТЕЗ 4-ПИР0Н0В
4-Пироны образуются при катализируемой кислотой циклизации 1,3,5-трикар-бонильных соединений
Проблема конструирования 4-пиронового цикла в сущности связана с синтезом 1,3,5-трикарбонильных соединений, поскольку такие соединения легко образуют циклические полуацетали и для получения 4-пирона необходимо провести лишь дегидратацию. Для этих целей обычно применяют сильные кислоты, однако при наличии в молекуле конфигурацинно нестабильных центров рекомендуется использование системы тетрахлорметан — трифенилфосфин [89].
Известно несколько методов получения 1,3,5-трикарбонильных соединений. Синтез хелидоновой (4-пирон-2,6-дикарбоновой) кислоты [90] представляет собой общий подход, связанный с использованием двух конденсаций Кляйзена по каждой из алкильных групп алифатического кетона. Декарбоксилирование хелидоновой кислоты позволяет получать незамещенный 4-пирон [91].
(CO2Et)2 EtONa, нагревание
о
Е
О Си, тетралин водн. HCI JL 2,2'-дипиридил, нагревание п нагревание COoEt78% Л А -------------86%~*
СОгЕ! НОгС-^о^СОгН
хелидоновая кислота
Симметрично замещенные 4-пироны можно получить простым нагреванием алкановых кислот с полифосфорной кислотой [92]. Вероятно, к образованию трикарбонильного предшественника 4-пирона приводит серия реакций конденсации, родственных конденсации Кляйзена, и последущее декарбоксилирование.
ВСО2Н
Конденсация Кляйзена дианионов 1,3-дикетонов с эфирами карбоновых кислот [93] или конденсация енолятов кетонов с эфирами ацетиленкарбоновых кислот [94] также используются для получения трикарбонильных соединений
5NaH^ 4-МеСеН4СО2Ме 82%
Другая стратегия, связанная с ацилированием менее кислотного фрагмента эфиров р-кетокислот, связана с предварительной конденсацией центральной метиленовой группы с синтетическим эквивалентом формил-катиона. При такой конденсации вводится атом углерода будущего 4-пиронового цикла [95].
DMF, Me2SO4
[MeOCH=NMe2 MeSO4] СНз'
Et3N, 20‘С_____
— ►
О
\zC°20 LiN(TMS)2 PhCOCI
II -70 ‘С затем водн. НС!;
\ме2 63%
О К^СОгВ
Ph \y
Незамещенные по a-положению 4-пироны были получены аналогично при использовании енолятов метоксиметиленкетонов [96].
«Дегидроуксусная кислота» [97], впервые синтезированая в 1866 г. [98], может быть очень просто получена при конденсации Кляйзена двух молекул этилового эфира ацетоуксусной кислоты с последующей обычной циклизацией и удалением молекулы этанола на последней стадии. В современной версии само-конденсацию р-кетокислоты проводят с использованием карбонилдиимидазола в качестве конденсирующего агента [99].
NaHCO3
PhMe, кипячение
53%
Ацилирование енаминов циклических кетонов дикетеном напрямую приводит к образованию бициклических производных 4-пирона, как показано ниже [100]:
Упражнения
Простые упражнения для проверки усвоения материала гл. 7 и 8
(а) Предложите три нуклеофильных реагента, которые легко присоединяются к солям пирилия, и нарисуйте структуры образующихся при этом соединений.
(б) Некоторые производные шестичленных кислородсодержащих гетероциклов вступают в реакции [4 + 2]-циклоприсоединения; приведите три примера.
(в) Приведите механизм трансформации 2-пирона в 1-метил-2-пиридон при взаимодействии с метиламином.
(г) Каким образом можно превратить насыщенный 1,5-дикетон в соль пирилия?
(д) Каким образом 5,6-дигидро-2-пирон можно использовать для получения 2-пирона, а также 3- и 5-бром-2-пиронов.
(е) 1,3,5-Трикарбонильные соединения легко превращаются в 4-пироны. Предложите два пути получения 1,3,5-триона или синтонов для его получения.
Упражнения повышенной сложности
1. Нарисуйте последовательность превращения 2,4,6-триметилпирилия в 1-фенил-2,4,6-триметипиридиний при взаимодействии с анилином.
2. Приведите механизм, объясняющий образование 1,3,5-трифенилбензола при взаимодействии перхлората 2,4,6-трифенилпирилия с 2 мольными эквивалентами Ph3P=CH2.
3. Предложите структуры соединений, образующихся в следующих реакциях: 2-ме-тил-5-гидрокси-4-пирон взаимодействует с MeOTf -> С7Н§03+ TfO~ (соль), затем это соединение с 2,2,6,6-тетраметилпиперидином (пространственно затрудненное основание) -> СуНвОз (диполярное соединение), затем с акрилонитрилом СцНцЬЮз.
4. Предложите механизм превращения 4-пирона в 1 -фенил-4-пиридон при взаимодействии с анилином. Нарисуйте структуры соединений, образования которых
можно было бы ожидать при взаимодействии метилкумалата (5-метоксикарбо-нил-2-пирона) с бензиламином.
5. Предложите структуры солей пирилия, образующихся в следующих реакциях: (а) пинаколон (Ме3ССОМе) конденсируется с пивалоиловым альдегидом (Ме3ССН=О) с образованием СцНгоО, который затем реагируете пиноколоном в присутствии NaNH2, давая СпН32О2, затем это соединение с Ph3C+ CIO4 в уксусной кислоте образует соль пирилия; (б) циклодецен с AC2O/HCIO4; (в) PhCOMe и МеСОСН2СНО с Ас2О и НСЮ4.
6. При нагревании дегидроуксусной кислоты с конц. НС1, образуется 2,6-диметил-4-пирон с выходом 97%. Объясните это превращение.
7. Объясните образование изодегидроуксусной кислоты (этилового эфира 4,6-диме-тил-2-пирон-5-карбоновой кислоты) при взаимодействии этилового эфира ацетоуксусной кислоты с НС1.
8. Предложите структуры пиронов, образующихся в следующих реакциях: (а) РЬСОСН3 с PhC=CCO2Et в присутствии NaOEt; (б) масляная кислота с поли-фосфорной кислотой при 200°С; (в) н-ВиСОСН2СО2Н с карбонилдиимидазолом; (г) PhCOCH2COCH3 с избытком NaH, затем с метиловым эфиром 4-хлорбензой-ной кислоты; (д) СН3СОСН=СНОМе с тирет-BuOK и PhCOCl.
Литература
1. Существенная часть пионерских работ по солям пирилия румынских и русских химиков опубликована в русской химической литературе/ Обзоры см.: «Pyrylium salts. Part I. Syntheses», BalabanA. T, Schroth W., Fischer G. Adv. Heterocycl. Chem., 10,241 (1969); «Pyrylium salt. Synthesis, reactions and physical properties», Balaban A. T., Dinculescu A., Dorofeenko G. N., Fischer G. W., Koblik A. V., Mezheritskii V. V., Schroth W. Adv. Heterocycl. Chem., Suppl. 2,1982.
2. «Cycloadditions and reactions of oxa-aromatics with nucleophiles», Ohkata K, Aki-ba K.-Y Adv. Heterocycl. Chem., 65,283 (1996).
3. GardE., VasilescuA., Mateescu G. D., Balaban A. T. J. Labelled Compds., 3,193 (1967); FarcasiuD., VasilescuA., BalabanA. T. Tetrahedron, 27, 681 (1971).
4. Le Ftvre C. G., Le Fevre R. J. W. J. Chem. Soc., 1932,2894.
5. Williams A. J. Am. Chem. Soc., 93, 2733 (1971).
6. KatrizkyA. R., Brownlee R. T. C., Musumarra G. Heterocycles, 12,775 (1979).
7. (a) «Aromatic compounds from pyrylium salts», Dimroth K, Wolf К. H. Newer Metods of Preparative Organic Chemistry, Vol. 3, Academic Press, New York, 1964, p. 357; (6) Rajoharison H. G., Soltani H., Arnaud M., Roussel C., Metzger J. Synth. Commun., 10, 195(1980).
См., например, Дорофеенко Г. H., Садекова Е. И., Кузнецов Е. В. Препаративная химия солей пирилия, Ростов-на-Дону, 1972. — Прим, перев.
8. (a) «Conversion of primary amino groups into other functionality mediated by pyrylium cations», Katrizky A. R. Tetrahedron, 36, 679 (1980); (б) Toma C., Balaban A. T. Tetrahedron Suppl., 7,9 (1966).
9. Toma C., Balaban A. T. Tetrahedron Suppl., 1 (1966); Katrizky A. R., Brownlee R. T. C., Musumarra G. Tetrahedron, 36,1643 (1966),
10. Katrizky A. R., SuwinskiJ. W. Tetrahedron, 31,1549 (1975).
11. Pedersen C. L., Harrit N., Buchardt O. Acta Chem. Scand., 24,3435 (1970) Balaban A. T. Tetrahedron, 24, 3435 (1970); Balaban A. T. Tetrahedron, 24, 5059 (1958); Schmitz E. Chem. Ber., 91,1488 (1958).
12. Dumroth K., WolfK. H. Angew. Chem., 72,777 (1960).
13. FurberM., Herbert J. M., Taylor R. J. K. J. Chem. Soc., Perkin Trans. 1,1989,683.
14. Royer J., Saffieddine A., Dreuz J. Bull. Chem. Soc. Fr., 1972, 1646; Marvell E. N., Chadwick T., Caple G., Gosink G., Zimmer G. J. Org. Chem., 37,2992 (1972).
15. BalabanA. T., Nenitzescu C. D. J. Chem. Soc., 1961,3566.
16. Hemming K, Taylor R. J. K. J. Chem. Soc., Chem. Commun., 1993,1409.
17. Reynolds G. A., Van Allen J. A., Petropoulos С. C. J. Heterocycl. Chem., 7, 1061 (1970).
18. Baciocchi E., Doddi G., loele M.t Ercolani G. Tetrahedron, 49,3793 (1993).
19. Safieddine A., Royer J., Dreux J. Bull. Soc. Chim. Fr., 1972, 2510; Marvel E. N., Gosink T. J. Org. Chem., 37, 3036 (1972).
20. Farcasiu D., Balaban A. T., Bologa U. L. Heterocycles, 37,1165 (1994).
21. Barltrop J. A., Day A. C. et al. J. Am. Chem. Soc., 101,7510 (1979).
22. PavlikJ. W., Kirincich S. J., Pires R M.J. Heterocycl. Chem., 28,537 (1991): PavlikJ. W„ KeilE. B., Sullivan E. L. J. Heterocycl. Chem., 29, 1829 (1992).
23. Hedrickson J. B., Farina J. S. J. Oig. Chem., 45,3359 (1980); «Recent studies on 3-oxi-dopyrylium and its derivatives», Sammes P. G. Gazz. Chim. Ital., 116, 109 (1986).
24. Wender P. A., Mascarenas J. L. J. Oig. Chem., 56, 6267 (1991); idem, ibid., 57, 2115 (1992).
25. Rumbo A., Castedo L., Mourino A., Mascarenas J. L. J. Org. Chem., 58, 5585 (1993).
26. «Reactions of а-and p-alkyl groups in pyrylium salts and some transformations reaction products», Mezheritskii V. V.f Wasserman A. L., Dorofeenko G. N. Heterocycles, 12, 51 (1979).
27. Simalty M., Strzelecka H., Khedija H. Tetrahedron, 27,3503 (1971).
28. Dilthey W., Fischer J. Chem. Ber., 57, 1653 (1924); 27, 3503 (1971); Kelemen J., WizingerA. Helv. Chim. Acta., 45, 1918 (1962).
29. KimerH.-D., WizingerR. Helv. Chim. Acta, 44,1766 (1961).
30. Van Allan J. A., Reynolds G. A., Maier D. P., Chang S. C. J. Heterocycl. Chem., 9,1229 (1972).
31. Cioffi E. A., Bailey W. F. Tetrahedron Lett., 39,2679 (1998).
32. Baeyer A. Chem. Ber., 43,2337 (1910).
33. Beak P., Carls G. A. J. Oig. Chem., 29,2678 (1964).
34. Pirkle W. H., Dines M. J. Oig. Chem., 34,2239, (1969).
35. Pirkle W. H.t Dines M. J. Heterocycl. Chem., 6, 313 (1969).
36. Eiden F, Herdeis C. Arch. Pharm. (Weinheim), 309, 764 (1976).
37. Collie J. N., Wilsmore N. T. M. J. Chem. Soc., 1896,293.
38. Vogel G. J. Oig. Chem., 30,203 (1965).
39. Baeyer A., Piccard J. Justus Liebigs Ann. Chem., 384,208 (1911); Kobrich G. ibid., 648, 114(1961).
40. GompperR. Christmann O, Chem. Ber., 94,1784 (1961).
41. Vogel G. Chem. Ind., 1962,268.
42. Adams R., Johnson J. L. J. Am. Chem. Soc., 71, 705 (1949); Campbell K. N., Ackerman J. F., Campbell В. K. J. Oig. Chem., 15, 221 (1949); HiinigS., Kobrich G. Justus Liebegs Ann. Chem., 617, 181 (1958).
43. Borsche W.f BonaackerL Chem. Ber., 54, 2678 (1921); Van Allen J. A., Reynolds G. A., Alassi J. T., Chang S. C, Joines R. C. J. Heterocycl. Chem., 8,919 (1971).
44. Watkins W. J., Robinson G. E., Hogan P. J., Smith D. Synth. Commun., 24 1709 (1994).
45. Parisi F, Bovina P., Quilico A. Gazz. Chim. Ital., 90,903 (1960) Yates P., Jorgenson M. J,, Roy S. К Canad. J. Chem., 40,2146 (1962).
46. Posner G. H., Harrison Ж, WettlauferD. G. J. Oig. Chem., 50, 5041 (1985).
47. Liu Z, MeinwaldJ. J. Oig. Chem., 61,6693 (1996).
48. «Diels-Alder cycloadditions of 2-pyrones and 2-pyridones», Afarinkia K., Vinader V., Nelson T. D., Posner G. H. Tetrahedron, 48,9111 (1992).
49. Diels 0., Alder K, Justus Liedigs Ann. Chem., 490, 257 (1931); Goldstein M. J., Thayer G. L. J. Am. Chem., Soc., 87, 1925 (1965); Shimo T., Kataoka K, Maeda A., Somekawa K. J. Heterocycl. Chem., 29, 811 (1999).
50. Salomon R. G., Bums J, R., Dominic W. J. J. Oig. Chem., 41,2918 (1976).
51. Магкб I. E. Seres P., Swarbrick T. M. Staton I., Adams H., Tetrahedron Lett., 33,5649 (1992); Магкб I. E, Evans G. R., Seres P. Chelle I., JanouserZ. Pure Appl. Chem., 68, 113(1996).
52. Posner G. H., Nelson T. D., Kinter С. M., Afarinkia K, Tetrahedron Lett., 32, 5295 (1991).
53. Afarinkia K, Posner G. H. Tetrahedron Lett., 51, 7839 (1992).
54. Posner G. H., Nelson T. D., Kinter C. M., Johnson N. J. Oig. Chem., 57, 4083 (1992).
55. Afarinkia K, Daly N. T. Gomez-Famos S. Joshi S., Tetrahedron Lett., 38, 2369 (1997); Posner G., Hutchings R. H., Woodard В. T. Synlett, 1997,432.
56. HongB.-C, Sun S.-S. Chem. Commun., 1996,937.
57. Liu Z, MeinwaldJ. J. Oig. Chem., 61,6693 (1996).
58. Van Allen J. A., Chie Chang S, Reynolds G. A. J. Heterocycl. Chem., 11,195 (1974).
59. Corey E. J, Streith J. J. Am. Chem. Soc., 86,950 (1964); Pirkle W H, McKendry L H. J. Am. Chem. Soc., 91, 1179; (1969), Chapman O. L., McKintosh C., L. Pacansky J, J Am. Chem. Soc., 95,614 (1973).
60. Woods L. L. J. Am. Chem. Soc., 80, 1440 (1958).
61. Adam W, Saha-Moller C. R., Veit M., Welke B. Synthesis, 1994, 1133.
62. West E G., Fisher P. И, Willoughby C A. J. Oig. Chem., 55, 5936 (1990); West F. G, Amann, С. M., Fisher P. V. Tetrahedron Lett., 35,9653 (1994).
63. De March Р., Moreno-Manas М,, Pleixats R., Roca J. C. J. Heterocycl. Chem., 21,1369 (1984).
64. Groutas W. C., Huang T. L., Stanga M. A., Brubaker M. J., Moi M. K. J. Heterocycl. Chem., 22,433 (1985); Poulton G. A., Cyr T. P. Canad. J. Chem., 58,2158 (1980).
65. Carretto J., Simalty M. Tetrahedron Lett., 1973, 3445.
66. Rundel W., Chem. Ber., 102, (1969); 374 Farcasiu D., Vasilescu A., Balaban A. T. Tetrahedron, 27,681, (1971); Farcasiu D. Tetrahedron, 25,1209 (1969).
67. Undheim K.f Ostensen E. N. Acta Chem. Scand., 27, 1385 (1973).
68. KlagerE, Trager H. Chem. Ber., 86,1327 (1958).
69. Balaban A. T., Nenitzescu C. D. Justus Liebigs Ann. Chem., 625, 74 (1959), idem.
J. Chem. Soc., 1961, 3553; PraillP. E G., Whitear A. L. ibid., 3573.
70. DinculescuA., Balaban A. T. Org. Prep. Proced. Int. 14, 39 (1982).
71. Anderson A. G., Stang P. J. J. Oig. Chem., 41, 3034 (1976).
72. Balaban A. T. Oig. Prep. Proced. Int., 9,125 (1977).
73. Schroth W., Fischer G. W. Chem. Ber., 102, 1214 (1969); Dorofeenko G. N.t ShdanowJu. A., Shungijetu G. I., Kriwon W. S. W. Tetrahedron, 22, 1821 (1966).
74. Schroth W., Fischer G. W., Rottmann J. Chem. Ber., 102,1202 (1969).
75. StetterH, ReischlA. Chem. Ber., 93, 1253 (1960).
76. Wiley R. H, Smith N. R. Oig. Synth., Coll. Vol. IV, 1963,201.
77. Zimmerman H. E., Grunewald G, L., Paufler R. M. Oig. Synth., Coll. Vol. V, 1973, 982.
78. Anker R M. Cook A. H J. Chem. Soc., 1945,311.
79. El-Kholy L, Rafla E K, Soliman G. J. Chem. Soc., 1959,2588.
80. Nakagawa M., Saegusa J., Tonozuka M., Obi M., Kiuchi M., Hino T, Ban Y. Oig. Synth., Coll. Vol. VI, 1988,462.
81. Posner G., Afarinkia K., Dai H Oig. Synth., 73,231 (1994).
82. Fried J., Eldeifield R. C. J. Oig. Chem., 6, 566 (1941).
83. StellerH., Kogelnik H.-J. Synthesis, 1986,140.
84. NinA. P., de Lederkremer R. M., Vanela O. Tetrahedron, 52,12911 (1996).
85. Steglich W., Buschmann E., Gansen G., Wilschowitz L. Synthesis, 1977,252.
86. Sauer J., Heldmann D. K.t Range K.-J., Zabel M. Tetrahedron, 54, 12807 (1998).
87. Larock R. C., Han X, Doty M. J. Tetrahedron Lett., 39, 5713 (1998).
88. Ito T., Aoyama T., Shioiri T. Tetrahedron Lett., 34,6583 (1993).
89. Arimoto H, Nishiyama S., Hamamura S. Tetrahedron Lett., 31, 5491 (1990).
90. Ригель E, Цвилъгмейер Ф, в сборнике: Синтезы органических препаратов, Сб. 2, стр. 543, Издатинлит, М., 1949.
91. De Souza С., Hajikarimian К, Sheldrake Р. W. Synth. Commun., 22,755 (1992).
92. Mullock E. В., Suschitzky H J. Chem. Soc. (C), 1967,828.
93. Miles M. L, Harris T. M., Hauser C. R. Oig. Synth., Coll. Vol. V, 1973,718; Miles M. L. Hauser C. R. ibid., 721.
94. Soliman G., El-Kholy I. E.-S. J. Chem. Soc., 1954,1755.
95. McCombie S. W., Metz W. A., Nazareno D., Shankar В. B., Tagat J. J. Org. Chem., 56, 4963(1991).
96. Morgan Т, A., Ganem В, Tetrahedron Lett., 21,2773 (1980); Koreeda M., Akagi H. ibid., 1197.
97. Арндт Ф. Синтезы органических препаратов, Сб. 3, стр. 150, ИЛ, М., 1952.
98. Oppenheim A.t Precht Н. Chem. Вег., 9, 324 (1866).
99. Ohta S., Tsujimura A., Okamoto М. Chem. Pharm. Bull., 29,2762 (1981).
100. HunigS,, BenzingE., HubnerK. Chem. Ber., 94,486 (1961).
9
КАТИОНЫ БЕНЗОПИРИЛИЯ, БЕНЗОПИРОНЫ:
РЕАКЦИИ И МЕТОДЫ СИНТЕЗА
5 4
катион хромилия
(катион бензо[Ь]пирилия)
[катион 1-бензопирилия]
кумарин w
[2Н-1 -бензопиран-2-он]
катион изохромилия (катион бензо[с]пирилия) [катион 2-бензопирилия]
[ЗН-2-бензопиран-З-он]
Катионы 1-бензопирилия, кумарины и хромоны черезвычайно широко распространены в растительном мире и содержатся во многих вторичных метаболитах растений. Не последнее место среди них занимают антоцианины [1] и флавоны [2], которые известны под общим названием флавоноиды [3] и составляют основную часть пигментов лепестков цветов. Кроме того, многие производные флавонов и кумаринов [4] обладают заметным токсическим действием и другими физиологическими свойствами по отношению к животным, хотя эти соединения не принимают никакого участия в нормальном метаболизме животных. Изомерные 2-бензопирилиевые [5] системы не встречаются в природе, и лишь в немногих природных соединениях присутствует изокумариновый фрагмент [6]. Вследствие этого исследованию 2-бензопирилиевых систем посвящено гораздо меньше работ, чем исследованию изомерных им соединений.
Целая серия производных кумарина имеет важное значение в качестве лекарственных препаратов. Среди них аценокумарол, используемый в качестве антикоагулянта, и интал, применяемый при лечении бронхиальной астмы. 7-Диэтил-амино-4-метилкумарин — один из первых оптических отбеливателей [7].
аценокумарол
Процессы нуклеофильного присоединения к положительно заряженному гетероциклическому фрагменту — основной и практически единственный тип реакций, характерный для бензопирилиевых систем. Реакции электрофильного
замещения в таких бициклических системах не известны, что существенно отличает катионы бензопирилия от катионов хинолиния и изохинолиния и демонстрирует значительное электроноакцепторное и, как следствие, дезактивирующее влияние положительно заряженного атома кислорода.
Для кумаринов, хромонов и изокумаринов характерны реакции как с нуклеофильными, так и с электрофильными реагентами, во многом аналогичные реакциям хинолонов и изохинолонов.
9.1. РЕАКЦИИ КАТИОНОВ БЕНЗОПИРИЛИЯ
Исследованию свойств 1-бензопирилиевых систем посвящено гораздо большее число работ, чем исследованию свойств изомерных 2-бензопирилиевых катионов. Это связано с тем, что 1-бензопирилиевая система родственна флавилиевой (2-фенил-1-бензопирилиевой) системе, которая широко распространена в антоцианинах. Поэтому большинство исследований связано именно с флавилиевой системой. Бензопирилиевый катион так же, как и пирилиевые соли, склонен к присоединению нуклеофильных агентов по положению, соседнему с заряженным атомом кислорода.
9.1.1. Реакции с электрофильными реагентами
Простые примеры реакций электрофильного или радикального замещения как в гетероциклическом, так и в гомоциклическом фрагментах бензопирилиевого катиона неизвестны. Нитрование катионов флавилия [8] и 1-фенил-2-бензопи-рилия [5] идет по фенильному заместителю. Следует упомянуть циклизацию кумарин-4-пропионовой кислоты, которая, вероятно, представляет собой внутримолекулярный вариант реакции Фриделя-Крафтса и реализуется в результате внутримолекулярной атаки по положению С<з) протонированной по карбонильному атому кислорода форме, т. е. по 2-гидрокси-1-бензопирилиевому катиону [9].
н3РО4
120 *С
60%*
9.1.2. Реакции с окислителями
Полное окислительное разложение катионов флавилия использовалось ранее для структурного изучения природных соединений. Один из применяввшихся для этих целей процессов — реакция Байера—Виллигера, приводящая к разделению изначальной молекулы на две «половины» (после стадии гидролиза слож-ноэфирной группы), которые затем могут быть изучены поотдельности [10]. Соли флавилия окисляются до флавонов при взаимодействии с нитратом тал-лия(Ш) [11], а незамещенный катион бензопирилия может быть окислен диоксидом марганца в кумарин [12].
9.1.3. Реакции с нуклеофильными реагентами
9.1.3.1. Реакции с водой и спиртами
Вода и спирты легко присоединяются по положению 2, в некоторых случаях по положению С(4) с образованием хроменолов или их простых эфиров [13]. Получить 2Н-хроменолы в чистом виде затруднительно, поскольку они всегда находятся в равновесии с ациклическими халконами [14].
катион флавилия (катион-2-фенил-1-бензопирилия)
Для получения простых аддуктов необходимо строго контролировать условия реакции, поскольку в более жестких условиях при взаимодействии со щелочью наблюдается раскрытие цикла и последующее расщепление связи углерод — углерод в результате процессов ретро-альдольного типа. Такие превращения обратны используемым для получения катионов 1-бензопирилия (разд. 9.3.1) и ранее использовались для структурного изучения антоцианиновых пигментов цветов.
9.1.3.2. Реакции с аммиаком и аминами
Аммиак и амины присоединяются к катионам бензопирилия, и простые аддукты, образующиеся при присоединении вторичных аминов, могут быть выделены [15].
пиперидин
петролейный эфир, 0-5 *С
67%
Важно отметить, что 1-бензопирилиевые соли не удается превратить в хинолины или хинолиниевые катионы при реакции с аммиаком или первичными аминами. В противоположность этому 2-бензопирилиевые катионы легко превращаются при взаимодействии с аммиаком и первичными аминами в изохинолины и изохинолиниевые катионы соответственно [16].
9.1.3.3. Реакции с углеродсодержащими нуклеофилами
Присоединение к катионам флавилия [17] металлоорганических анионных производных, полученных из активированных ароматических соединений типа фенола [18], эфиров цианоуксусной кислоты, нитрометана [19] и димедона [20], легко проходит по положению С(4). Цианид- и азид-анионы присоединяются по положению C(i) 2-бензопирилиевого катиона [21].
CH2(CN)2
100%
Et3N, 2СГС
Силиловые эфиры енолов и аллилсиланы присоединяются по положению 2 бензопирилиевых катионов, генерированных из хромонов силилированием по атому кислорода. В случае использования силиловых эфиров а,р-ненасыщен-ных кетонов первоначально образующийся аддукт способен к дальнейшей циклизации [22].
9.1.4. Реакции с восстановителями
Каталитическое гидрирование флавилиевых солей реализуется обычно легко с образованием продукта восстановления гетероциклического фрагмента. При восстановлении катионов флавилия алюмогидридом лития образуются 4Н-хро-мены [23], однако при наличии метоксигруппы в положении 3 выделены 2Н-хромены [24]. Присоединение гидрид-иона к 2-бензопирилиевым системам идет по положению Сц) [25].
ОМе LiAlH4
Et2O
55%* p-An
9.1.5. Катионы алкилбензопирилия
Атомы водорода алкильных групп, находящихся в а- и у-положсниях бензопирилиевых систем относительно положительно заряженного атома кислорода, обладают подвижностью, что позволяет таким алкилбензопирилиевым катионам вступать в реакции конденсации альдольного типа [5,26].
сн3
9.1.6. 1 -Бензопирилиевые пигменты; антоцианины и антоцианидины
Антоцианидины — соединения, содержащие полигидроксифлавилиевый катион, — присутствуют в больших количествах в красных и синих пигментах цветков и в кожице фруктов, например винограда; кроме того, красный цвет, присущий вину, также обусловлен наличием этих соединений [27]. Антоцианидины обычно связаны с углеводами, и такие глюкозиды называют антоцианинами. Например, цианин, выделяемый в виде гидрохлорида, представляет собой антоцианин, встречающийся в лепестках красной розы (Rosa gallica) и самосеящегося мака (Papaverrhoeas), а также многих других цветов. Другой пример — хлорид малвина — также широко распространен и был выделен из альпийской примулы Primula viscosa.
В живой клетке антоцианины входят в состав более сложных структур, взаимодействующих также с другими молекулами, например флавонами [28]. Реально наблюдаемый цвет обусловлен взаимодействием антоцианинов с другими молекулами. Интересен тот факт, что простое изменение значения pH сильно изменяет электронное поглощение молекулы. Например, цианидин обладает красным цветом в кислом растворе, синим — в слабощелочном растворе и фиолетовым — при промежуточных значениях pH. Глубина окраски связана с мезо-мерной делокализацией заряда.
9.2. БЕНЗОПИРОНЫ (ХРОМОНЫ, КУМАРИНЫ И ИЗОКУМАРИНЫ)
9.2.1. Реакции с электрофильными реагентами
9.2.1.1. Присоединение к атому кислорода карбонильной группы
Присоединение протона к атому кислорода карбонильной группы приводит к образованию гидроксибензопирилиевых солей. Хромоны вступают в такие реакции гораздо легче, чем кумарины: например, пропускание газообразного хлороводорода через раствор смеси хромона и кумарина в эфире приводит к выпадению только гидрохлорида хромона ( т. е. хлорида 4-гидрокси-1 -бензопирилия) [29]. Алкилирование атома кислорода требует использования более силь-
ных алкилирующих агентов [5,30]. Легко проходит силилирование атома кислорода (разд. 9.1.3.3).
Et3O+BF4“
СН2С12,20 *С 80% **
OEt BF4“
9.2.1.2. Замещение при атоме углерода
Электрофильное замещение в кумаринах и хромонах может быть осуществлено в обоих циклах. В сильнокислых средах, например, при нитровании [31], электрофильной атаке подвергается гидроксибензопирилиевый катион, и замещение проходит по положению С(б>. В противоположность этому диметиламинометилирование хромона [32], иодирование флавона [33] и хлорметилирование кумарина [34] идет по гетероциклическому фрагменту, вероятно, с участием непро-тонированных гетероциклических систем. ( Внимание: при хлорметилировании в некоторых количествах образуется CICH2OCH2CI, обладающий канцерогенными свойствами).
Кумарин при действии брома и избытка хлорида алюминия превращается в 6-бромкумарин [35]. В отсутствие катализатора взаимодействие брома с кумарином заключается в присоединении по двойной связи гетероциклического фрагмента, а последующее элиминирование бромоводорода позволяет получить 3-бромкумарин [36]. Альтернативный метод получения 3-галогенокумаринов связан с взаимодействием кумарина с галогенидами меди(П), нанесенными на оксид алюминия [37]. Для получения 6-бромхромона в качестве бромирующего агента используется дибромизоциануровая кислота (DBI) [38]. Взаимодействие хромона с бромом при нагревании в сероуглероде в результате присоединения брома и элиминирования бромоводорода приводит к образованию 3-бромхро-мона [39].
9.2.2. Реакции с окислителями
Кумарины не обладают свойствами фенолов и достаточно стабильны к действию окислителей. Различные окислительные методы широко использовались для определения природных флавонов [40].
+ PhCO2H
н2о2,
NaOH EtOH, кипячение
О
Флавоны и изофлавоны (3-арилхромоны) при взаимодействии с диметилдиоксираном количественно превращаются в соответствующие 2,3-эпокси-ды, которые обладают значительным синтетическим потенциалом. Например, такие производные флавонов превращаются с количественным выходом в 3-гидроксифлавоны, которые распространены в природных соединениях [41].
9.2.3. Реакции с нуклеофильными реагентами
9.2.3.1. Взаимодействие с гидроксид-ионом
Кумарины (также, как и изокумарины) количественно гидролизуются с образованием желтого раствора соли соответствующей ifwc-коричной (кумариновой) кислоты, которая не удается выделить при подкислении, поскольку при этом образуется исходный лактон. Продолжительное выдерживание в щелочном растворе приводит к изомеризации и образованию соли соответствующей транс-коричной (кумаровой) кислоты
водн. NaOH
Холодный раствор гидроксида натрия обратимо превращает хромоны в соли соответствующих ациклических производных фенола в результате атаки по положению С(2). В более жестких условиях наблюдается разрушение 1,3-дике-тонного бокового фрагмента такого производного фенола (превращение, обратное конденсации Кляйзена).
9.2.3.2. Реакции с аммиаком и аминами
При реакции с аммиаком и аминами ни кумарины, ни хромоны не превращаются в соответствующие 2- и 4-хинолоны, однако при взаимодействии изокумаринов с аммиаком и аминами можно получить изохинолины [42]. Реакции хромонов со вторичными аминами включают нуклеофильную атаку по положению 2 и приводят к раскрытию гетероциклического фрагмента исходной молекулы.
Взаимодействие 3-иодхромона с имидазолом проходит через последовательные стадии присоединения — элиминирования, как показано ниже, и приводит к продукту замещения по положению С(2> [43].
Ок2со3
DMF, 80 ‘С 81%
Н
9.2.3.3. Реакции с углеродсодержащими нуклеофилами
Реактивы Гриньяра присоединяются по карбонильной группе хромонов; образующиеся в результате такого превращения хроменолы под действием кислот превращаются в соответствующие катионы 4-замещенного 1-бензопирилия [26].
Кумарины и изокумарины [16] взаимодействуют с реактивами Гриньяра аналогично сложным эфирам, в результате чего образуется смесь соединений вследствие раскрытия цикла первоначального аддукта. Ниже в качестве примера приведена реакция кумарина с метилмагнийиодидом [44]:
MeMgl Et20,0 *С
50%
Для того чтобы ввести заместитель в положение 4 хромона, необходимо его сначала превратить в бензопирилиевый катион, содержащий уходящую труппу в положении 4; так, взаимодействие хромона с уксусным ангидридом приводит к образованию 4-ацетоксибензопирилиевой соли [45].
Кумарин легко реагирует с электроноизбыточными ароматическими соединениями в присутствии фосфорилхлорида и хлорида цинка [46]. Применение хлорида цинка не всегда необходимо.
|| POCI3, ZnCI2 50%
ОМе
9.2.3.4. Металлоорганические производные
Флавоны могут быть литиированы по положению С<з) [47].
З-Бромхромоны и 4-бромкумарины успешно используются в реакциях сочетания, катализируемых палладием(О) [48].
Вг
n-BuCH=CH
Pd(OAc)2
Ph3P, K2CO3
86%
CH=CHn-Bu
K2CO3
94%
Pd(PPh3)4
9.2.3.5. Реакции с восстановителями
Кумарин и хромон при действии диборана с последующей обработкой щелочным раствором пероксида водорода превращаются в 3-гидроксихроман [49]. Каталитическое гидрирование кумарина и хромона сопровождается восстановлением двойной связи углерод — углерод гетероциклического фрагмента [50]. Вза-
имодействие обеих гетероциклических систем с алюмогидридом лития может проходить как по карбонильной труппе, так и по сопряженной с ней двойной связи, вследствие чего обычно образуется смесь продуктов восстановления. Восстановление бензопиронов амальгамой цинка в кислом растворе сопровождается образованием не замещенных по положению 4 бензопирилиевых солей [51].
ЦД1Н4 ’ EtgO
9.2.3.6. Реакции с диенофилами; реакции циклоприсоединения
Кумарины, в отличие от хромонов, выступают в качестве диенофилов в реакции Дильса—Альдера, хотя такие превращения обычно требуют относительно жестких условий [52]
Me
З-Ацилхромоны вступают в гетеро-реакцию Дильса-Альдера с эфирами енолов [53] и ацеталями кетенов [54], что свидетельствует о низком ароматическом характере пиронового цикла. Наибольшей реакционной способностью в таких реакциях обладает 3-формилхромон
Эфиры хромон-3-карбоновых кислот выступают в качестве диенофилов в реакции Дильса—Альдера при катализе кислотами Льюиса [55]
СО2Ме 0Нг=С(Ме)С(Ме)=СН2 ZnCI2, СН2С12, 20 *С
49%
Для 2-бензопиран-З-онов, образующихся в результате циклодегидратации ор/яо-формиларилуксусных кислот, характерна внутримолекулярная реакция Дильса—Альдера, показанная ниже [56]:
SO2PhJ
+16% эндо
Разложение диазокетонов, содержащих фрагмент с двойной связью, сопровождается внутримолекулярной реакцией циклоприсоединения с участием 4-оксвдоизохромилиевого катиона, как показано ниже [57]:
9.2.3.7. Фотохимические реакции
Фотохимические реакции кумарина интенсивно изучались. В отсутствие сенсибилизатора кумарин образует сын-димер «голова к голове», а в присутствии бензофенона в качестве сенсибилизатора образуется изомерный он/нм-димер [58]. сын-Димер «голова к хвосту» образуется при облучении кумарина в уксусной кислоте [59]. При фотоиндуцируемом циклоприсоединении кумарина и 3-ацил-оксикумарина в присутствии сенсибилизатора к алкенам, диметилацеталю кетена и циклопентену с низкими выходами образуются аддукты, содержащие циклобутановый фрагмент [60].
9.2.3.8. Алкилкумарины и алкилхромоны
Метильные труппы в положении 2 хромонов способны принимать участие в реакциях конденсации с альдегидами. Такие реакции нехарактерны для метильной группы в положении Ср), поскольку в этом случае невозможно депротонирование с образованием сопряженных енолятов [61].
В случае кумаринов только алкильные труппы в положении 4 обладают подвижными атомами водорода [62], однако кислотность таких алкильных трупп значительно ниже кислотности метильной группы в 2-метилхромоне [63].
9.2.3.9. Флавоновые пигменты
Флавонам, встречающимся в природе и весьма широко распространенным в растениях, присущ желтый цвет. Флавоны склонны накапливаться практически во всех частях растений, от корней до лепестков цветков.
В противоположность антоцианинам, которые представляют собой весьма реакционноспособные соединения и поэтому обладают коротким периодом жизни, гораздо более стабильные флавоны с незапамятных времен используются в качестве красителей для окрашивания шерсти в самые разнообразные оттенки желтого цвета. В качестве примера можно привести использование в недавнем прошлом для окрашивания коры североамериканского дуба Quercus velutina, так называемой кверцитроновой коры. Кверцитроновая кора содержит кверцетрин.
Соответствующий кверцетрину аглюкон — один из наиболее широко распространенных флавонов — встречается, например, в растениях Chrysanthemum и Rhododendron, конском каштане, лимонах, луке и хмеле.
9.3. СИНТЕЗ КАТИОНОВ БЕНЗОПИРИЛИЯ, ХРОМОНОВ, КУМАРИНОВ И ИЗОКУМАРИНОВ
Известно три основных подхода к синтезу 1-бензопирилиевых систем, кумаринов и хромонов, основанных на использовании в качестве исходных соединений фенолов. Изомерные катионы 2-бензопирилия и изокумариновые системы получают из ор/ио-карбокси- и орюо-формиларилацетальдегидов (гомофталево-го альдегида).
Реакция фенола с 1,3-дикарбонильными соединениями в зависимости от степени окисления дикарбонильного соединения приводит к образованию либо катиона 1-бензопирилия, либо кумарина
ор/яо-Гидроксибензальдегиды при взаимодействии с карбонильными соединениями, обладающими а-метиленовой группой, образуют 1-бензопирилиевые соли или кумарины в зависимости от строения алифатической компоненты
Аналогичные реакции ор/ло-гвдроксиарилалкилкетонов с эфирами карбоновых кислот приводят к образованию хромонов
9.3.1. Синтез 1 -бензопирилиевых систем [1 б]
9.3.1.1. Из фенолов и 1,3-дикарбонильных соединений
Простейшие реакции дикетонов с фенолами приводят к хорошим результатам только при использовании резорцина, поскольку вторая гидроксильная труппа облегчает циклизацию в результате электрофильной атаки по ароматическому циклу. При использовании несимметричных кетонов образуется смесь продуктов реакции, поэтому такой метод пригоден для получения катионов с идентичными заместителями в положениях 2 и 4 [64].. Однако в том случае, если карбонильные труппы кетонов существенно различаются по реакционной способности, возможно образование лишь одного продукта циклизации с высоким выходом [65].
АсОН, HCI
20 *С
50%
В таких реакциях для обеспечения региоселективности можно использовать кетоны ацетиленового ряда [66] и халконы, однако в последнем случае необходимо использование окислителя [67].
Для получения катионов бензопирилия, не содержащих заместителей в гетероциклическом фрагменте, используется бис-ацеталь малонового диальдегида. В этом случае первоначально образуется соединение, содержащее в гетероциклическом фрагменте эфирную и ацетальную труппу; последующее элиминиро-
вание двух молекул этанола сопровождается образованием 1-бензопирилиевого катиона [68].
9.3.1.2. Из орго-гидроксиарилальдегидов и орто-гидроксиарилкетонов
Салициловый альдегид способен конденсироваться с кетонами, содержащими а-метиленовую труппу, при катализе кислотой или основанием. При использовании в качестве катализатора основания промежуточно образующийся гидрокси-халкон может быть выделен [8], но лучшие выходы бензопирилиевых систем наблюдаются при проведении общей последовательности превращений без выделения промежуточно образующихся соединений и при использовании кислотного катализа [69]. Следует отметить, что поскольку такой подход к синтезу 1-бензо-пирилиевых систем не связан с электрофильной циклизацией, его можно использовать для синтеза катионов, не содержащих заместителей в бензольном кольце.
кон, ЕЮН кипячение 56%
конц. HCI, АсОН, кипячение
HCI АсОН, кипячение, 90%
9.3.2. Синтез кумаринов
9.3.2.1. Из фенолов и эфиров 1,3-кетокислот
Синтез Пехмана[70]
Реакции фенолов с эфирами 0-кетокислот, в том числе и циклических [71] приводят к образованию кумаринов в условиях кислотного катализа — в присутствии концентрированной серной кислоты [72], фтороводорода [73] или катионообменной смолы [74].
Наилучшие результаты при получении кумаринов по методу Пехмана достигаются при использовании активированных нуклеофильных ароматических соединений, таких, как резорцин. Вероятно, на первой стадии процесса реализуется электрофильная атака протонированной карбонильной группой кетона по ормо-положению фенола, хотя для ариловых эфиров ацетоуксусной кислоты, полученных при взаимодействии фенолов с дикетеном, также характерно замыкание кумаринового цикла [75]. Циклизация проходит с участием более электрофильной карбонильной группы. Не замещенные по гетероциклическому
фрагменту кумарины можно получить при конденсации фенолов с формилуксусной кислотой, генерируемой in situ при декарбонилировании яблочной кислоты
НО2ССН2СНОНСО2Н конц. H2SO4,120 *С -СО,-Н2О
НО'
‘ОН 79%
I HCsCCO2Me (dba)3Pd2.CHCI3
Il НС°2Н' NaOAc,20 Ч
Прямой «однореакторный» метод синтеза кумаринов основан на взаимодействии фенола с эфиром пропиоловой кислоты, катализируемом палладием(О). Каталитический цикл такого процесса, как полагают, включает промежуточное образование гидрида формилоксипалладия, который при взаимодействии с фенолом превращается в гидрид арилоксипалладия, а'последний, в свою очередь, присоединяется к алкину [76].
9.3.2.2. Из орто-гидроксибензальдегидов и ангидридов (или эфиров) кислот
Простейший метод синтеза производных кумарина представляет собой особый случай конденсации Перкина, т. е. конденсации ароматического альдегида с ангидридами кислот. ор/ио-Гидрокси-/иранс-коричные кислоты не могут служить интермедиатами такого процесса, поскольку не способны изомеризоваться в условиях реакции. В ходе реакции также не может образовываться О-ацетилсалициловый альдегид, поскольку он не конденсируется в кумарин под действием ацетата натрия [77].
Такой подход к синтезу кумаринов удалось существенно расширить и осуществить в значительно более мягких условиях при использовании дополнительно активированных эфиров карбоновых кислот. Так, конденсация метилового эфира нитроуксусной кислоты приводит к образованию 3-нитрокумаринов [78], конденсация с илидами Виттига [79] позволяет использовать в этом методе ор/ло-гидроксиарилкетоны [80], а использование эфира малоновой кислоты (или самой малоновой кислоты [81]), мало-нонитрила или замещенных ацетонитрилов на стадии конденсации Кнёве-нагеля позволяет получать таким методом эфиры 3-кумаринкарбоновых кислот [82], 3-циано-, 3-алкил- или 3-арилкумарины [83]. Эфиры кумарин-3-карбоновых кислот можно затем превратить в незамещенные по гетероциклическому фрагменту производные кумарина в результате гидролиза и декарбоксилирования [84].
Н
CN CH2(CN)2, NaHCO3 С16НззММе3Вг, 90 ‘С ||
90%
CH2(CO2Et)2, пиперидин ацетат пиперидина
U нагревание
‘ОН
81%
О
Эфиры рр/ио-гидроки-тираяс-коричных кислот используются в синтезе кумаринов; при этом одновременно вводится арильный или алкенильный заместитель в положение 4 в результате реакции Хека [85].
TIO
9.3.3. Синтез хромонов из орто-гидроксиацилбензолов
Большинство синтетических подходов к хромонам связано с предварительным получением 1-(рр/ио-гидроксифенил)-1,3-дикетонов или их предшественников, и все эти методы синтеза хромонов различаются именно способом получения необходимых 1,3-дикетонов.
3Na
ксилол, EtCO2Et
0*С-»95 *С затем АсОН
1-(ор/ио-Гидроксифенил)-1,3-дикетоны можно получить в результате конденсации Кляйзена эфиров карбоновых кислот и соответствующих алкиларил-кетонов. Для осуществления конденсации Кляйзена необходимо наличие свободной фенольной гидроксильной труппы и избытка сильного основания [86]; в качестве растворителя и одновременно основания в таких процессах может быть применен триэтиламин [87]. Синтез хромонов можно осуществить и альтернативным путем: на первой стадии проводят ацилировании фенольной гидроксильной труппы, а на второй — внутримолекулярную конденсацию Кляйзена [88]. Такой процесс известен как перегруппировка Бейкера—Венкатарамана. Ниже приведен пример использования этого процесса для синтеза незамещенного флавона [89]:
кон
пиридин, 50^С
АсОН конц. H2SO4i кипячение 63% 3
Использование в качестве основания диазобициклоундецена (DBU) позволяет осуществить синтез производного хромона без выделения промежуточно образующегося дикетона, как это показано на приведенной ниже схеме 190]:
MeOgC
DBU
пиридин,65JC
70%
Синтез этим методом хромонов, не содержащих заместителя в положении 2, требует введения формильной группы или ее эквивалента; хорошие результаты достигаются при использовании триэтилового эфира ортомуравьиной кислоты [91] или системы диметилформамид — метансульфохлорид [92].
НС(ОЕ0з
HCI, 20*С
70% *
Другой подход к синтезу хромонов, не содержащих заместителей в положении 2, связан с использованием полуэфира полухлорангидрида щавелевой кислоты; в результате образуется 2-этоксикарбонилхромон, гидролиз и декарбоксилирование которого позволяют получить желаемый результат [93]. Конденсация с диэтиловым эфиром щавелевой кислоты приводит к образованию 2,4-диоксипроизводного, которое существует в виде 4-гидроксикумарина [94]. Конденсация эфиров салициловой кислоты с эфиром карбоновой кислоты в присутствии трехкратного избытка основания также приводит к образованию 4-гидро-ксикумаринов, как показано ниже [95]:
2-Аминобензопироны образуются в результате циклизации 1-(рр/ио-гидро-ксиарил)-1,3-кетамидов [96]
Существует множество вариантов осуществления такого синтетического подхода к хромонам: например, конденсация орто-гидроксиацетофенона с реагентом Вильсмейера приводит к образованию 3-формилхромона [97], а конденсация с диметилацеталем диметилформамида и последующее взаимодействие с бромом, как показано ниже, приводит к получению 3-бромхромона [98]:
DMFDMA 100 ‘С
Brg, 0 ‘С 93%
Катализируемая основаниями конденсация ор/по-гидроксиацилбензолов с ароматическими альдегидами приводит к образованию а,0-непредельных кетонов, известных под названием «халконы» [99]. Халконы способны к циклизации в 2,3-дигидрохромоны в результате внутримолекулярной реакции Михаэля. Ди-гидрохромоны можно превратить в соответствующие хромоны различными способами, например, в результате бромирования и последующего дегидробромирования или при окислении тритильным катионом, иодом, диметилдиоксираном или диацетатом иодозобензола [100].
Еще один вариант синтеза хромонов связан с конденсацией орто-фторбен-зоилхлорида с эфирами 1,3-кетокислот [101]. Атом фтора впоследствии внутримолекулярно замещается енольным атомом кислорода, что приводит к образованию хромонового цикла
о
C^COCI ^CO2Et PhMe, 20’С
I + I затем кипячение || |
CT^Et 75%
9.3.4. Синтез хромонов из орто-гидроксиарилалкинилкетонов
ор/по-Гидроксиарилалкинилкетоны, образующиеся в результате катализируемой палладием реакции сочетания одто-гидроксиарилиодидов с терминальными ацетиленами в присутствии монооксида углерода, самопроизвольно циклизуются в условиях реакции с образованием хромонов [102]
НС=Сл-С5Нц, СО, PdCI2(PPh3)2
Et2NH, 20 атм, 120 *С____
— *
Алкиниларилкетоны, необходимые для последующей 6-эядо-диг-циклиза-ции [ЮЗ], могут быть получены предварительно и затем в мягких условиях превращены в продукты циклизации, как показано на приведенной ниже схеме. Циклизация в хромоны возможна также в результате промежуточного образования енаминокетонов при взаимодействии алкинонов с вторичными аминами. Необходимые для такой циклизации алкиноны можно получить сочетанием орто-силилоксибензоилхлоридов с терминальными ацетиленами [104].
9.3.5. Синтез катионов 2-бензопирилия
Первый синтез [105] незамещенного катиона 2-бензопирилия был связан с синтезом гомофталевого альдегида, необходимого для последующей катализируемой кислотой циклизации, приводящей к 2-бензопирилиевой системе
Большинство последующих примеров синтеза таких солей связано с получением 1,3-дизамещенных катионов 2-бензопирилия, предшественников которых синтезировали с использованием реакции Фриделя-Крафтса активированных бензилкетонов [6,106]
9.3.6. Синтез изокумаринов
Один из подходов к синтезу изокумаринов аналогичен изложенному выше подходу к синтезу 2-бензопирилиевых систем с той лишь разницей, что в качестве предшественника используется не диальдегид, а альдегидокислота [107].
ню4
н2о, ю'См
90% *
2H.HCI нагревание
68% *
Двухуглеродный фрагмент будущего гетероцикла можно ввести непосредственно в орто-положение к карбоксильной группе двумя способами: один связан с введением ацетонильнольной группы при сочетании эфиров орто-бромбензойной кислоты с бромидом л-(2-метоксиаллил)никеля [108], а второй — с таллированием бензойной кислоты по орто-положению и последующим сочетанием с алкенами в условиях катализа соединениями палладия [109]. Производные бензойной кислоты, содержащие алкинильный заместитель в орто-положении, способны циклизоваться в изокумарины под действием ацетата ртути, как показано ниже [ПО]:
>2
СНС13
“82%'^
Наиболее общий подход к синтезу изокумаринов включает реакцию сочетания ацетиленов с ррто-иодбензойной кислотой или ее метиловым эфиром [111]. В этом методе можно использовать как моно-, так и дизамещенные ацетилены, что позволяет существенно расширить круг получаемых производных изокумарина.
Pd(OAc)2 n-Bu4NCI, Na2CO3 100‘C r
72%
Родственный метод синтеза изокумаринов связан с реакцией сочетания эфиров ор/по-бромарилкарбоновых кислот с 1-три-и-бутилстаннил-2-этокси-этиленом и последующей катализируемой кислотой циклизацией продуктов сочетания. На приведенной ниже схеме показан пример такого синтеза изокумаринового цикла с использованием эфира пиридинкарбоновой кислоты [112]:
9.3.7. Примеры синтезов некоторых важных катионов бензопирилия и бензопироновых систем
9.3.7.1. Хлорид пеларгонидина
Первый пример синтеза хлорида пеларгонидина связан с использованием метилового эфира для защиты фенольной гидроксильной группы на стадии присоединения реактива Гриньяра [113]:
9.3.7.2. Апигенин
На приведенной ниже схеме представлены два различных синтетических подхода к апигенину. Современный подход связан с использованием избытка сильного основания и генерированием «полианионного» интермедиата без предварительной защиты фенольных гидроксильных групп [114].
Второй подход связан с использованием элегантной стратегии синтеза орто-гидроксиарил-1,3-дикетона, необходимого для синтеза хромонового цикла, из изоксазола как эквивалента 1,3-дикетонового фрагмента (разд. 22.8). Изокса-зол образуется в результате реакции циклоприсоединения арилнитрилоксида к три-н-бутилстаннилацетилену (разд. 22.13.1.2); получающееся при этом оловоорганическое соединение используют в реакции сочетания с арилгалогенидом, а затем связь N—О изоксазольного цикла подвергают гидрогенолизу (разд. 22.8) [115].
Упражнения
Простые упражнения для проверки ускорения материала гл. 9
(а) Какое положение (положения) бензопирилиевых ионов принимает участие в реакции с нуклеофилами, например, с водой?
(б) Каково строение антоцианиновых пигментов? Каково строение флавоновых пигментов?
(в) По какому атому идет протонирование кумарина и хромона?
(г) По какому положению кумарина и хромона проходят реакции электрофильного замещения?
(ц) Приведите примеры реакций циклоприсоединения с участием кумаринов и хромонов.
(е) Как можно получить соль 1-бензопирилия из фенола?
(ж) Как можно использовать ор/ио-гидроксибензальдегид для получения кумарина?
(з) Как можно использовать о/^ио-гидроксиарилалкилкетон для получения хромона?
Упражнения повышенной сложности
1. При нагревании смеси салицилового альдегида и хлорида 2,3-диметилбензопи-рилия в присутствии кислоты образуется продукт конденсации Ci8Hi5O2+Cr. При взаимодействии этой соли со слабым основанием (пиридином) образуется
нейтральное соединение. Предложите структурные формулы обоих соединений.
2. Этиловый эфир 2-этилхромон-З-карбоновой кислоты последовательно обрабатывают гидроксидом натрия и соляной кислотой; при этом образуется соединение СцН8О4, которое не содержит карбоксильной группы и не растворяется в разбавленном растворе щелочи. Предложите структурную формулу соединения и механизм его образования.
3. Предложите структурные формулы соединений, образующихся в результате следующих превращений: салициловый альдегид, MeOCH2CO2Na, Ас2О, нагревание -» СюНбОз, затем 1 моль PhMgBr -> RC16H14O3 и на конечной стадии НС1->С1бНпО2+СГ.
4. Предложите структурную формулу основного продукта реакции резорцина (1,3-дигидроксибензола) (а) с PhCOCH2COMe в АсОН/HCI; (б) с метиловым эфиром 2-оксоциклопентанкарбоновой кислоты и H2SO4.
Литература
1. The chemistry of plant pigments, Chichester С. O. (ed.), Academic Press, NY, 1972; «The chemistry of anthocyanins, anthocyanidins, and related flavylium salt», lacobuc-ci G, A., Sweeny J. E. Tetrahedron, 39, 3005 (1983).
2. «Naturlich vorkommende chromone», Schmid H. Fortschr. Chem. Org. Naturst., 11, 124 (1954).
3. The flavonoids, Harbome J. B., Mabry T. J., Mabry H. (eds.), Chapman and Hall, London, 1975; «Flavonoids: Chemistry and biochemistry», Morita N., Arisawa M. Heterocycles, 4,373 (1976); Flavonoids: advances in research since 1980, Habome J. B. Maiby T. J. (eds.), Chapman and Hall, London & NY, 1988.
4. «Synthesis of coumarins with 3,4-fused ring systems and ther physiological activity», Darbarwar M. Sundaramurthy V. Synthesis, 1982, 337; «Naturally occurring coumarins», Dean F. M. Fortschr. Chem. Org. Naturst., 9, 225 (1952); «Naturally occurring plant coumarins», Murray R. D. H. Fortschr. Chem. Oig. Naturst., 35,199 (1978); Murray R. D. H. Mendez J., Brown S. A. The natural coumarins: occurrence, chemistry, and biochemistry, Chichester, Wiley, 1982.
5. Большинство работ, связанных с исследованием солей бензо[с]пирилия, проведено русскими и венгерскими исследователями, см. «Benzo[c]pyrylium salts: syntheses, reactions and physical properties», Kuznetsov E. V, Shcherbakova L V. Bala-ban A. N. Adv. Heterocycl. Chem., 50,157 (1990).
6. «Isocoumarins. Developments since 1950», Barry R. D. Chem. Rev., 64, 229 (1964).
7. «Heterocycles as structural units in new optical brighteners», Dorians A., Schellham-merC.-W., Schroeder J. Angew. Chem., Int. Ed. Engl., 14,665 (1975).
8. Le Fevre R. J. J. Chem. Soc., 1929,2771.
9. HolkerJ. S E, Underwood J. G, Chem. Ind. (London), 1964, 1865.
10. JurdL. Tetrahedron, 22,2913 (1966); ibid., 24,4449 (1968).
11. Meyer-Dayan M.t Bodo B., Deschamps-Valley C., Molho D. Tetrahedron Lett., 1978,3359.
12. Degani L, Fochi R., Ann. Chim. (Rome), 58,251 (1968).
13. HillD. W., Melhuish R. R. J. Chem. Soc., 1935, 1161.
14. Jurd L. Tetrahedron, 25,2367 (1969).
15. Sutton R. J. Oig. Chem., 37, 1069 (1972).
16. Dimroth К., Odenwalder Н. Chem. Вег., 104,2984 (1971).
17. Lowenbein A. Chem. Вег., 57,1517 (1924).
18. Pomilio А. В., Muller О., Shcilling G., Weinges К. Justus Liebigs Ann. Chem., 1977, 597.
19. Krohnke E, Dichore K. Chem. Ber., 92,46 (1959).
20. JurdL. Tetrahedron, 21,3707 (1965).
21. Shcherbakova I. V., Juznetsov E. V., Yudilevich I. A. Kompan O. E.t Balaban A., T., Abolin A. H, Polykov A. V., Struchkov Yu T. Tetrahedron., 44, 6217 (1988); Le Rouz J.-P., Desbene P.-L., Cherton J.-C. J. Heterocycl. Chem., 18, 847 (1981).
22. Lee Y.-G., Ishimaru K., Iwasaki H, Okhata K., Akiba K. J. Oig. Chem., 56,2058 (1991).
23. Marathe K. G., Philbin E. M., Wheeler T. S. Chem. Ind. (London), 1962,1793.
24. Clark-Lewis J. W, Baig M. /.Aust J. Chem., 24, 2581 (1971).
25. Miiller A., Lempert-Streter M.,Karczag-Wilhelms A. J. Org. Chem., 19, 1533 (1954).
26. Heibron I. M., ZakiA. J. Chem. Soc., 1926,1902.
27. «А curious brew», Allen M. Chem. Brit., 1996 (May), 35.
28. «Structure, stability and color variation of natural anthocyanins», Goto T. Fortschr. Stacking Chem. Oig. Naturst., 52, 113, (1987); «Structure and molecular stacking of anthocyanins — flower colour variation», Goto T., Kondo T. Angew. Chem., Int. Ed. Engl., 30,17 (1987); «The chemistry of rose pigments», Eugster C. H, Marki-Fischer E. ibid., 654; «Nature*s palette», Haslam E. Chem. Brit., 1993 (Oct.), 875.
29. Wittig. G., BaugertF., Richter H. E. Justus Liebigs Ann. Chem., 446,155 (1925).
30. Meerwein H, Hinz. G., Hofmann P., Kroenigard E., Preil E., J. Prakt. Chem., 147, 257 (1937).
31. Clayton A. J. Chem. Soc., 1910,2106; Joshi P. P., Ingle T. R.t Bhide В. И J. Ind. Chem. Soc., 36, 59(1959).
32. Wiley P. F. J. Am. Chem. Soc., 74,4326 (1952).
33. Zhang. F. J., Li Y. L. Synthesis, 1993,565.
34. Dean F. M., Murray S. J. Chem. Soc., Perkin Trans. 1,1975,1706.
35. Pearson D. E., Stamper W. E., SuthersB. R. J. Oig. Chem., 28,3147 (1963).
36. Fuson R. C., Kneisley J. W., Kaiser E. W. Oig. Synth., Coll. Vol. Ill, 1955,209; Perkin W. H. Justus Liebigs Ann. Chem., 157,115 (1871).
37. Thapliyal P. C., Singh P. K., Khauna R. N. Synth. Commun., 23,2821 (1993).
38. Ellis G. P., Thomas I. L. J. Chem. Soc., Perkin Trans. 1,1973,2781.
39. Arndt F. Chem. Ber., 58, 1612 (1925).
40. Использование синглетного кислорода см.: Matsuura Т. Tetrahedron, 33, 2869 (1977).
41. Adam W., Golsch D., Hadjiarapoglou L., Patonay T. J. Oig. Chem., 56, 7292 (1991); Adam W., Hadjiarapoglou L., LevaiA. Synthesis, 1992,436.
42. Muller E. Chem. Ber., 42,423 (1909).
43. Sugita Y., Yokoe I. Heterocycles, 43,2503 (1996).
44. Shriner R. C., Sharp A. G. J. Org. Chem., 4, 575 (1939); Hepworth J. D., Livingstone R. J. Chem. Soc. (C), 1966, 2013.
45. Reynolds G. A., VanAllan J. A., Petropoulos С. C. J. Heterocycl. Chem., 7, 1061 (1970).
46. Goswami M., Chakravarty A. J. Ind. Chem. Soc. 9, 599 (1932); Michaelidis Ch., WizingerR. Helv. Chim. Acta., 34, 1761 (1951).
47. Costa A. M. B. S. R. C. S, Dean F. M., Jones M. A., Varma R. S. J. Chem. Soc., Perkin Trans. 1,1985,799.
48. Hoshino Y.t Miyaura N., Suzuki A, Bull. Chem. Soc. Jpn., 61, 3008 (1988); Yanagi T}. Oh-e E, Miyaura N., Suzuki A. ibid., 62,3892 (1989).
49. Kirkiacharian B. S., Raulais D. Bull. Soc. Chim Fr., 1970,1139.
50. Smith L. L, Denyes R. O. J. Am. Chem. Soc., 58, 304 (1936); John W., Gunther P., Schmeil M. Chem. Ber., 71,2637 (1938).
51. Eihabiri M., Figueiredo P.t Fougerousse A., Brouillard R. Tetrahedron Lett., 36, 4611 (1995).
52. Adams R.t McPhee W.D., CarlinR.B., WichsZ. W. J. Am. Chem. Soc.,65,356(1943); Adams R,, McPhee W. D., Carlin R. B. ibid., 360.
53. Ghosh С. K., Tewari N., Bhattacharya A. Synthesis, 1984,614; Courts S. J., Wallace T. W, Tetrahedron, 50, 11755 (1994).
54. Wallace T. W.t Wardell L, Li K.-D., Leeming P., Redhouse A. D. Chailand S. R, J. Chem. Soc., Perkin Trans. 1,1995,2293.
55. Ohkata K, Kubo T.t Miyamoto K, Ono M., Yamamoto J., Akiba K. Heterocycles, 38, 1483 (1994).
56. Bush E. J., Jones D. W., Ryder T. C. L. M. J. Chem. Soc., Perkin Trans., 1, 1997, 1929.
57. Plug C., Fridrichsen W.t Debaerdemaeker N. J. Prakt. Chem., 339,205 (1997).
58. Schenk G. O., von Willucki L, Krauch С. H. Chem. Ber., 95, 1409 (1962); Anet R Canad. J. Chem., 40, 1249 (1962); Hammond G. S, Stout C. A., Lamola A. A. J. Am. Chem. Soc., 86,3103 (1964).
59. Krauch С. H, Farid S., Schenk G. O. Chem. Ber., 99,625 (1966).
60. Hanifen J. W., Cohen E. Tetrahedron Lett., 1966, 1419; Kobayashi K, Suzuki M., Suginome H J. Chem. Soc., Perkin Trans. 1,1993,2837.
61. Heilbron L M,t Barnes H., Morton R. A. J. Chem. Soc., 1923,2559.
62. Archer R. A., Blanchard W. B., Day W. A., Johnson D. W., Lavagnino E. R., Ryan C. W., Baldwin J. E. J. Oig. Chem., 42, 2277 (1977).
63. Mahal H. S.t Venkataraman K. J. Chem. Soc., 1933,616.
64. Bulow C.t WagnerH. Chem. Ber., 34,1189 (1901).
65. Biilow C., Wagner H. Chem. Ber., 34, 1782 (1901); Sweeny J. C., Lacobucci G. A, Tetrahedton, 37, 1481 (1981).
66. Johnson A. W., Melhuish R. R. J. Chem. Soc., 1947,. 346.
67. Robinson R., Walker J. J. Chem. Soc., 1934,1435.
68. Bigi E, Casiraghi G., Casnati G., Sartori G. J. Heterocycl. Chem., 18, 1325 (1981).
69. Pratt D. D., Robinson R. J. Chem. Soc., 1923,745.
70. Сетна С, Пхадке P. «Реакция Пехмана», Органические реакции т. 7, с. 7, ИЛ, М., 1956.
71. Sen Н. К, Basu U. J. Ind. Chem. Soc., 5,467 (1928).
72. Рассел А., Фрай Дж. «2,6-Диоксиацетофенон», в сборнике: Синтезы органических препаратов, Сб. 3, с. 218, ИЛ., М., 1952.
73. Dann О., Mylius G. Justus Liebigs Ann. Chem., 587, (1954).
74. John E. V. O.f Istaelstam S. S. J. Oig. Chem., 26, 240 (1961).
75. Lacey R. N. J. Chem. Soc., 1954,854.
76. Trost В. M., Toste F. D. J. Am. Chem. Soc., 118,6305 (1996).
77. Crawford M., Shaw J. A. M. J. Chem. Soc., 1953, 3435.
78. Dauzonne D., Royer R. Synthesis, 1983,836.
79. Harayama T., Nakatsuka K, Nishioka H, Murakami K, Hayashida N., Ishii H. Chem. Pharm. Bull., 42,2170 (1994).
80. Mali R. S., Yadav И J. Synthesis, 1977,464.
81. Steck W. Canad. J. Chem.. 49, 2297 (1971).
82. Э. Хорнинг, М. Хорнинг, Д. Диминг «Карбэтоксикумарин», в сборнике: Синтезы органических препаратов, Сб. 4, с. 282, ИЛ, М., 1953.
83. Brufola G., Friguelli Е, Piermatti О., Pizzo F. Heterocycles, 43, 1257 (1996).
84. RouessacF., Leclerc A. Synth. Commun., 23,1147 (1993).
85. Arcadi A., Cacchi S., Fabrizi G., Marinelli E, Pace P. Synlett, 1996, 568.
86. Wiley P. E J. Am. Chem. Soc., 74, 4329 (1952); Schmutz J. Hirt R., Lauener H. Helv. Chim. Acta, 35, 1168 (1952); Mozingo R. Org. Synth., Coll. Vol. Ill, 1955, 387; Hirao L, Yamaguchi M., Hamada M. Synthesis, 1984, 1076; Banerji H, Goomer N. C. Ibid., 1980, 874.
87. Looker J. H, McMechan J. H, Mader J. W. J. Oig. Chem., 43, 2344 (1978).
88. Baker W. J. Chem. Soc., 1933, 1381; Schmid H., Banholzer K. Helv. Chim. Acta., 37, 1706 (1954).
89. Wheeler T. S. Org. Synth., Coll. Vol. IV, 1963,478.
90. Riva C., De Toma C., Donadel L., Boi C., Peunini R., Motta G., Leonardi A. Synthesis, 1997,195.
91. Becket G. J. P., Ellis G. R, Trindade M. L U. J. Chem. Res., 1978 (S) 47; (M) 0865.
92. Bass R. J. J. Chem. Soc., Chem. Commun., 1976, 78.
93. Baker W., Chadderton J., Harbome J. B., Ollis W. D. J. Chem. Soc., 1953, 1852.
94. Boyd J., Robertson A. J. Chem. Soc., 1948,174.
95. Davis S. E., Church A. C., Tummons R. C., Beam C. F. J. Heterocycl. Chem., 34,1159 (1997).
96. Morris J., Wishka D. G., Fang Y. Synth. Commun., 24,849 (1984).
97. Hamisch H. Justus Liebigs Ann. Chem., 765,8 (1972); NoharaA., Umetani T., Sanno Y. Tetrahedron, 30, 3553 (1974).
98. Gammill R. B. Synthesis, 1979,901; Chem. Pharm. Bull., 42,1697 (1994).
99. Geissman T. A., Clinton R. O. J. Am. Chem. Soc., 68,697 (1946).
100. Lorette N. B., Gage T. B., WenderS. H. J. Oig. Chem., 16, 930 (1951); Schonberg A„ Schutz G. Chem. Ber., 93, 1466 (1960); Patonay T., Cavaleiro, J. A. S., Levai A., Silva A. M. S. Heterocycl. Commun., 3,223; (1997); Bernini R., Mincione E., SanettiA., Bovicelli P., Lupatteli P. Tetrahedron Lett., 38, 465 (1997); Prakash O., NanwerM. P. J. Chem. Res (S), 1995,143, (M) 1429; Litkei G., GulacsisK., AntusA., Blask6 G. Justus Liebigs Ann. Chem., 1995,1711.
101. Coppola G. M., Dodsworth R. W. Synthesis, 1981, 5223; CreminsP. J., Hayes R, Wallace T. W. Tetrahedron, 49, 3211 (1993).
102. Torii S., Okumoto H., Xu L. H., Sadakane M., Shostakovsky M. V., Ponomaryov A. B., Kalinin V. N. Tetrahedron, 49,6773 (1993).
103. Nakataki K., Okamoto A., Saito L Tetrahedron, 52,9427 (1996).
104. Bhat A. S., Whetstone J. L., Brueggemeier R. W. Tetrahedron Lett., 40, 2469 (199).
105. Blount В. K., Robinson R. J. Chem. Soc., 1933,555.
106. Bringmann G., Jansen J. R. Justus Liebigs Ann. Chem., 1985, 2116.
107. SchonpfC., Kuhne R. Chem. Ber., 83, 390 (1950).
108. Korte D. E, Hegedus L. S., Wirth R. K. J. Org. Chem., 42, 1329 (1977).
109. Laroch R. C., Varaprath S., Lau H. H, Fellows С. E J. Am Chem. Soc., 106, 5274 (1984).
110. Larock R C, Harrison L. W. J. Am. Chem. Soc., 106,4218 (1984).
111. Liao H.-Y., Cheng C.-H. J. Org. Chem., 60, 3711 (1995); Larock R C, Yum E. K, DotyM. J., Sham К. К. C. Ibid., 3270.
112. Sakamoto Т, Kondo У., Yasuhara A., Yamanaka Н. Tetrahedron, 47, 1877 (1991).
113. WillstatterR., Zechmeister L.t Kindler W. Chem. Ber., 47,1938 (1924).
114. Nagarathnam D., Cuschman M. J. Org. Chem., 56,4884 (1991).
115. GothelfK, Thomsen I., TorssellK. B. G. Acta Chem. Scand., 46,494 (1992); Gothelf К. V, TorssellK. В. G. ibid., 48, 165 (1994); Ellemose S., Kure N., TorssellK B. G. ibid., 49, 524(1995).
10
ОБЩАЯ ХАРАКТЕРИСТИКА РЕАКЦИОННОЙ СПОСОБНОСТИ ДИАЗИНОВ: ПИРИДАЗИН, ПИРИМИДИН И ПИРАЗИН
пиразин
Диазины — пиридазин, пиримидин и пиразин — представляют собой гетероциклические соединения, содержащие два иминных атома азота, и, следовательно, все свойства, присущие пиридину (гл. 5), в еще большей степени проявляются у этих гетероциклических соединений. Два гетероатома оттягивают электронную плотность от атомов углерода, включенных в цикл, еще в большей степени, чем в пиридине. Вследствие этого незамещенные диазины еще менее склонны к реакциям электрофильного замещения, чем пиридин. Понижение электронной плотности на атомах углерода гетероциклов закономерно приводит к облегчению атаки диазинов нуклеофильными реагентами по сравнению с пиридином. Диазины в меньшей степени, чем пиридин, проявляют свойства оснований, поскольку сказывается дестабилизирующее влияние второго атома азота на катион диазиния. Тем не менее, диазины образуют соответствующие соли при реакции с алкилгалогенидами и при взаимодействии с надкислотами превращаются в соответствующие N-оксиды. Электрофильное присоединение идет только по одному атому азота, поскольку возникающий при этом положительный заряд значительно понижает нуклеофильные свойства второго атома азота.
Типичные реакции диазинов (на примере пиримидина)
нуклеофильное замещение по «-положению относительно атома азота
электрофильное присоединение по атому азота с образованием пиримидиниевых солей
Главная особенность химических свойств диазинов связана с их электронодефицитной природой, которая определяет легкость присоединения нуклеофильных реагентов к гетероциклу. В отсутствие галогенидов для завершения
процесса замещения необходимо окисление первоначально образующихся аддуктов. Галогенопроизводные диазинов, содержащие атомы галогена в а- или p-положении относительно атома азота, чрезвычайно легко вступают в реакции нуклеофильного замещения, поскольку интермедиаты таких процессов значительно стабилизированы.
Все атомы углерода во всех диазинах, за исключением атома Сф пиримидина, расположены в а- и/или в у-положениях относительно иминного атома азота; кроме того, следует учитывать, что наличие дополнительного электроноакцепторного атома азота повышает способность этих положений к реакциям нуклеофильного присоединения/замещения. Поэтому все моногалогенопроизводные диазинов более склонны к реакциям с нуклеофилами, чем 2- или 4-гало-генопиридины. 2- и 4-Галогенопиримидины обладают наибольшей реакционной способностью, поскольку образующиеся в ходе процесса анионные интермедиаты (показано ниже на примере 2-хлорпиримидина) мезомерно стабилизированы одновременно двумя атомами азота.
Несмотря на особенную склонность диазинов к реакциям нуклеофильного присоединения, С-литиирование диазинов можно осуществить в результате либо обмена металл — галоген, либо депротонирования по положению, соседнему с хлор- или алкоксизаместителем, однако такие процессы необходимо проводить при очень низкой температуре, чтобы избежать нуклеофильного присоединения литийорганических соединений.
LiTMP
THF, -70 *С
Одновременно с высокой склонностью к реакциям нуклеофильного присоединения диазины легко вступают в реакции радикального замещения Минисци. Для получения различных производных диазинов широко используются реакции сочетания, катализируемые соединениями палладия(О); один пример такой реакции приведен ниже (детально такие процессы обсуждены в разд. 2.7):
[co2Et] в кислоте
Дальнейшие аналогии с химическими свойствами пиридина, связанные с наличием электронодефицитного иминного фрагмента, проявляются в стабильности диазинов к окислительному расщеплению и в то же время в склонности к легкому восстановлению.
Хотя количественная мера ароматичности соединений всегда служит предметом дебатов, диазины, как принято считать, менее резонансно стабилизированы, чем пиридины, то есть они «менее ароматичны». Так, для всех диазинов известны примеры реакции Дильса-Альдера, в которых они принимают участие в качестве диенов. Первоначально образующиеся аддукты теряют малую молекулу, в случае пиримидина — циановодород, и превращаются в стабильные соединения.
-HCN
N-Оксиды диазинов, так же как и N-оксиды пиридинов, проявляют повышенную по сравнению с самими диазинами склонность к реакциям нуклеофильного и электрофильного замещения. На приведенной ниже схеме показана последовательность превращения N-оксида пиридазина, в которой на первой стадии происходит электрофильное нитрование, а на второй — нуклеофильное замещение с удалением нитрит-иона.
N-Оксиды диазинов обеспечивают широкие синтетические возможности для получения различных производных шестичленных гетероциклических соединений. Одна из таких полезных реакций связана с введением атома хлора в a-положение к атому азота при взаимодействии N-оксидов с галогенидами фосфора или серы. Такое превращение осуществляется в результате первоначальной атаки атома кислорода N-оксида по атому фосфора или серы. Эта реакция имеет очень большое значение, поскольку незамещенные диазины в результате двух последовательных стадий можно превратить в хлорпроизводные, которые используются в реакциях нуклеофильного замещения.
poci3i
ОР(О)С12
(OPfOJCfe
Наиболее широко изучены окси- и аминопроизводные пиримидинов, так как урацил, тимин и цитозин обнаружены в качестве оснований в ДНК и РНК. Поскольку двойная связь в таких производных диазинов с двумя кислородными заместителями аналогична енамидной двойной связи, электрофильное замещение в таких соединениях значительно облегчено; так, например, урацил можно
превратить в соответствующее бромпроизводное. Присутствия одного аминного заместителя достаточно для активирования диазинового цикла к реакциям электрофильного замещения, а при наличии двух аминных или одного аминного и одного кислородного заместителя становятся возможными реакции даже со слабыми электрофильными агентами.
[NO4r
РОС13
Диазиноны, аналогично пиридонам, при взаимодействии с галогенидами фосфора превращаются в соответствующие хлорпроизводные. Образующиеся при депротонировании атома азота анионы амбидентны, и, хотя резонансные формы, аналогичные фенолят-ионам, вносят вклад в структуру таких анионов, их реакции с электрофильными алкилирующими агентами проходят преимущественно по атому азота.
Алкильные заместители в диазиновом цикле, за исключением алкильных групп в положении 5, способны вступать в реакцию конденсации с предварительным генерированием соответствующих анионов в результате депротонирования. Как и в случае алкилпиридинов, образование таких анионов становится возможным вследствие делокализации отрицательного заряда с участием одного или двух атомов азота цикла.
Как показано ниже, любой диазин можно получить в результате комбинирования молекулы, содержащей два атома азота, с молекулой дикарбонильного соединения. В случае пиридазина источником атомов азота, очевидно, служит гидразин, который при взаимодействии с 1,4-дикарбонильными соединениями образует дигцдропиридазины, легко дегидрируемые в соответствующие арома-
тические соединения. Производные пиримидина получаются при реакции 1,3-дикарбонильных соединений с амидином (пример приведен на схеме), мочевиной (при этом образуется 2-пиримидон) или гуанидином (используется для получения 2-аминопиримидинов), причем в этом случае нет необходимости в стадии окисления.
Синтез пиразинов требует комбинации молекулы 1,2-диамина с молекулой 1,2-дикарбонильного соединения и последующего окисления, однако, если каждая из комбинируемых молекул несимметрична, образуется смесь продуктов циклизации. Димеризация 2-аминокарбонильных соединений также приводит к образованию симметрично замещенных пиразинов. Наиболее хорошо известный пример такого превращения связан с димеризацией природных аминокислот и их эфиров, приводящей к образованию дигидропиразин-2,5-дионов — «дикетопиперазинов».
11
ДИАЗИНЫ, ПИРИДАЗИНЫ, ПИРИМИДИНЫ И ПИРАЗИНЫ: РЕАКЦИИ И МЕТОДЫ СИНТЕЗА
пиридазин
пиримидин
пиразин
фталазин
хиноксалин
Все три диазина — пиридазин [1], пиримидин [2] и пиразин [3] — представляют собой устойчивые бесцветные соединения» растворимые в воде. Незамещенные диазины, в отличие от пиридина, трудно доступны и дороги, вследствие чего, редко используются в качестве исходных соединений для получения производных диазинов. Аннелирование бензольного кольца к диазиновому возможно лишь четырьмя способами, и существует лишь четыре бензодиазина: циннолин, фталазин, хиназолин и хиноксалин.
Пиридазин отличается от других диазинов поразительно высокой температурой кипения (207 °C), что на 80—90 °C выше температур кипения пиримидина (123 °C), пиразина (118 ’С) и других азинов, включая 1,3,5-триазины, температуры кипения которых лежат в интервале 114—124 °C. Такая высокая температура кипения пиридазина связана со способностью связи N—N к поляризации, что обеспечивает высокую степень диполярной ассоциации молекул в жидкости.
Наиболее важные встречающиеся в природе диазины — это пиримидиновые основания: урацил, тимин и цитозин, которые входят в состав нуклеиновых кислот [4]. Среди некоторых аналогов пиримидиновых нуклеозидов были обнаружены антивирусные агенты, такие, как идоксуридин, применяемый для лечения глазных заболеваний, вызванных вирусом Herpes, AZT — препарат, наиболее часто используемый для лечения ВИЧ, ламивудин (3-ТС), используемый одновременно для лечения гепатита В и ВИЧ-инфекций, и еще один препарат против ВИЧ-инфекций — ставудин (d4T). Пиримидиновый фрагмент содержится также в молекуле тиамина (витамин Bi) (разд. 21.11). Часто пиримидиновые циклы в нуклеиновых кислотах изображают иначе, чем в этой главе: при этом пиримидиновый цикл перемещают относительно горизонтальной оси
таким образом, что атом Np) становится «направленным» на северо-запад. Такой прием используется главным образом для того, чтобы подчеркнуть сходство пиримидинового цикла с пуринами нуклеиновых кислот (гл. 24), которые традиционно представляют таким образом, чтобы пиримидиновая часть бициклической пуриновой системы была расположена слева.
уридин тимидин
НО ОН
цитидин
Пиразиновый цикл обнаружен в аспергилловой кислоте — метаболите грибов — и в дигидроформе в люциферинах некоторых жуков, в том числе и светлячков Cypridina hilgendotfii, ответственных за хемилюминесценсию [5]. Простые метоксипиразины обусловливают аромат большинства фруктов и овощей, таких, как горох и стручковый перец, и вин [6]. Даже если эти соединения присутствуют в незначительных количествах, они обладают заметным запахом и могут быть обнаружены в концентрации 0,00001 миллионных долей. Родственные соединения, образующиеся в результате пиролиза аминокислот в процессе приготовления пищи, ответственны за аромат жареного мяса. Некоторые поли-алкилпиразины — феромоны насекомых; например, 2-этил-3,6-диметилпира-зин, представляет собой главный компонент феромона южноамериканского муравья-листоеда.
Производные пиридазинов редко встречаются в природе; среди природных соединений, содержащих пиридазиновый цикл, следует упомянуть, например,
метаболиты грибов Streptomyces, содержащие главным образом восстановленный цикл, и четвертичную соль — пиридазиномицин. Дивицин, присутствующий в качестве глюкозида в конских бобах и некоторых родственных растениях, представляет собой токсин, ответственный за «фавизм» — опасную гемолитическую реакцию у генетически предрасположенных людей (обычно проживающих в Средиземноморье). Пиперазин (гексагидропиразин) используется для лечения глистной инвазии.
пиридазиномицин
дивицин
пиперазин
Производные всех трех диазинов широко исследовались на предмет их применения в качестве синтетических лекарственных препаратов (см. также выше). К числу наиболее широко используемых для этих целей соединений диазинового ряда относятся антибактериальный препарат триметоприм, антималярийный препарат пириметамин и антигипертензивное средство гидралазин, содержащий бициклическую фталазиновую систему.
триметоприм пириметамин гидралазин
пиридат 3-гидрокси-6(1Н)-
пиразинон
Некоторые пиридазины представляют собой селективные регуляторы роста растений и используются в качестве гербицидов: например, пиридат [3-гидро-кси-6(1Н)-пиразинон] применяют для уничтожения сорняков.
11.1. РЕАКЦИИ С ЭЛЕКТРОФИЛЬНЫМИ РЕАГЕНТАМИ
11.1.1. Присоединение по атому азота [7]
11.1.1.1. Протонирование
Диазины — пиридазин (рА^ 2,3), пиримидин (рА^ 1,3) и пиразин (p A*a0,65) — главным образом одноосновные соединения, основные свойства которых значительно слабее выражены, чем у пиридина (р^ 5,2). Такое понижение основности, как полагают, главным образом связано с дестабилизацией катионов, образующихся при монопротонировании, индуктивным электроноакцепторным влиянием другого атома азота. Наибольшая в ряду диазинов основность пиридазина связана с отталкиванием электронных пар связанных атомов азота, что облегчает протонирование. В случае пиразина мезомерное взаимодействие между протонированным и нейтральным атомами азота, вероятно, дестабилизирует катион.
Н,К’-Дипротонирование — чрезвычайно сложный процесс и возможен только в присутствии очень сильной кислоты. Из трех диазинов пиридазин (рЛ’а(2) —7,1) наиболее сложно образует дикатион; вероятно, это связано с высокой энергией ассоциации двух непосредственно связанных положительно заряженных атомов. Пиримидин (рА^(2) —6,3) и пиразин (р^{2) -6,6) образуют дикатионы ненамного легче.
Заместители способны оказывать как индуктивное, так и мезомерное влияние на основность (и нуклеофильность) диазинов, однако следует быть осторожным при интерпретации значений рЛ^, так как необходимо знать наверняка, какой из двух атомов азота протонирован (см. также разд. 11.1.1.2)
11.1.1.2. Алкилирование
Диазины реагируют с алкилгалогенидами труднее, чем пиридин, с образованием четвертичных моносолей. Диалкилирование не удается осуществить при использовании алкилгалогенидов, однако с гораздо более реакционноспособными тетрафторборатами триалкилоксония могут быть получены дисоли для всех трех диазинов [8].
NEt
a 2BF*
S3O+BF<T
CI(CHg)gCI, кипячение 86%
Mel
МеОН, 20'С
85% **
Пиридазин наиболее активен в реакциях алкилирования, что также связано с взаимным отталкиванием двух неподеленных пар электронов связанных атомов азота. Такое явление известно как «a-эффект» и проявляется также, например, в большей нуклеофильности пероксида водорода по сравнению с водой.
Несимметрично замещенные диазины при алкилировании способны образовывать две изомерные четвертичные соли. На направление алкилирования в гораздо большей степени влияют стерические и индуктивные, нежели мезомер-ные эффекты заместителей. Например, 3-метилпиридазин алкилируется преимущественно по атому N(i), хотя на атоме N(2) сосредоточена ббльшая электронная плотность. Аналогично алкилирование З-метоки-6-метилпиридазина проходит по атому азота, соседнему с метильной группой, хотя, учитывая мезомерное влияние метоксшруппы, следовало бы ожидать алкилирования другого атома азота [9].
11.1.1.3. Окисление
Все три диазина реагируют с надкислотами [10] с образованием соответствующих N-оксидов. Следует соблюдать определенную осторожность при получении N-оксида пиримидина, поскольку он нестабилен в кислых средах [11]. NjN’-Ди-
оксиды наиболее легко образуются из пиразина [10], для аналогичного окисления пиридазина требуются гораздо более жесткие условия [12], а пиримидин лишь в некоторых случаях, связанных с наличием дополнительной активации, образует диоксиды с низкими выходами [13].
Региоселективность N-окисления замещенных диазинов определяется теми же факторами, что и региоселективность алкилирования (разд. 11.1.1.2): например, при окислении 3-метилпиридазина преимущественно (3:1) образуется 1-оксид [14]. Однако 4-метилпиримидин в основном окисляется по атому азота, соседнему с метильной группой [15]. Кислотность среды также оказывает влияние на региоселективность окисления: например, 3-цианопиридазин окисляется надуксусной кислотой по атому Ыщ, однако в сильнокислой среде окислению подвергается протонированный по атому N(i> гетероцикл по положению [16].
11.1.2. Замещение при атоме углерода
Известна устойчивость производных пиридина к реакциям электрофильного замещения, поэтому неудивительно, что введение второго азометинового атома азота в любое из трех возможных положений цикла в значительной мере увеличивает такую устойчивость: для диазинов или простых алкилдиазинов неизвестны реакции нитрования и сульфирования, хотя известны реакции галогенирования. Следует отметить, что положение 5 пиримидина — единственное положение во всех трех диазинах, которое не является а- или у-положением по отношению к атому азота, и оно аналогично p-положению пиридина. Диазины, содержащие электронодонорные (активирующие) группы, вступают в реакции электрофильного замещения гораздо легче (разд. 11.10.2.1 и 11.11)
11.1.2.1. Галогенирование
Хлорирование 2-метилпиразина проходит в весьма мягких условиях, и это позволяет утверждать, что в данном случае реализуется механизм присоединения — элиминирования, а не механизм классического электрофильного замещения [17]. Галогенирование пиримидина, возможно, также реализуется аналогичным образом [18].
С12
СС14> 40 *с
е7% ]
Me
11.2. РЕАКЦИИ С ОКИСЛИТЕЛЯМИ
Диазины обычно устойчивы к атаке окислителей по атомам углерода, хотя при действии щелочных окислителей происходит разрушение цикла с промежуточным образованием продуктов нуклеофильного присоединения (разд. 11.3). Алкильные заместители [19] и конденсированные ароматические циклы [20] способны окисляться до карбоксильных групп, при этом гетероциклический фрагмент остается незатронутым. Атом кислорода можно ввести в свободные положения 2 или 4 пиримидина или даже в эти оба положения при использовании различных бактерий [21]. При действии диметилдиоксирана на Ы,Ы'-диал-килурацил образуется соответствующий 5,6-диол; реакция, вероятно, проходит через образование 5,6-эпоксида[22].
Pseudomonas putida, pH 7 ксилол, 20 *С
Me 90%
11.3. РЕАКЦИИ С НУКЛЕОФИЛЬНЫМИ РЕАГЕНТАМИ
Диазины черезвычайно подвержены нуклеофильной атаке: пиримидин, например, разлагается при нагревании с водной щелочью, причем на первой стадии этого процесса происходит присоединение гидроксид-иона, а затем при взаимодействии с гидразином пиримидин превращается в пиразол.
11.3.1. Замещение атома водорода
11.3.1.1. Алкилирование и арилирование
Диазины легко реагируют с алкил- и ариллитиевыми соединениями и реактивами Гриньяра с образованием дигидроаддукгов, которые могут быть превращены в соответствующие ароматические соединения окислением перманганатом калия или 2,3-дихлор-5,6-дициано-1,4-бензохиноном. С литийорганическими соединениями пиримидины реагируют по положению С(4) [13], а пиридазины —
по положению 3, в то время как присоединение реактивов Гриньяра проходит по положению 4 [23].
n-BuLi
Et2O, 20‘С
КМпО4
Ме2СО, 20‘С
51%
Примечательно, что диазины, содержащие в качестве заместителя атом галогена или метилмеркаптогруппу, реагируют с металлоорганическими соединениями таким образом, что галоген- [24] и метилтио-заместители [25] остаются в продуктах реакции.
11.3.1.2. Аминирование
Реакция Чичибабина характерна для диазинов в гораздо меньшей степени, чем для пиридинов, и может быть осуществлена обычным образом лишь в нескольких случаях [26]. Связано это, по-видимому, с меньшим по сравнению с пиридинами ароматическим характером диазинов и, хотя первоначальное присоединение осуществляется довольно легко, последующее элиминирование гидрвд-иона, приводящее к ароматической структуре, затруднено. При использовании перманганата калия для окисления первоначально образующихся дигидроаддуктов 4-аминопиридазин, 4-аминопиримидин и 2-аминопиразин получаются с высокими выходами [27].
11.3.2. Замещение других уходящих групп
Все галогеносодержащие диазины, за исключением 5-галогенопиримидинов, легко реагируют с «мягкими» нуклеофильными агентами, такими, как амины, тиоляты и анионы производных малоновых кислот, с замещением атома галогена. Во всех случаях галогеносодержащие производные диазинов более реакцио-носпособны, чем 2-галогенопиридины; по своей реакционной способности эти соединения можно расположить в следующий ряд:
Ниже приведены примеры реакций нуклеофильного замещения атома галогена в производных диазинов [28]:
ОМе
ОМе
Cl Н2, Pd/C МеОН, водн.
98%
MeONa
МеОН, кипячение
38%
CI
<,N N
Нуклеофильное замещение атомов галогенов аммиаком [29] и аминами [30] проходит быстрее в присутствии кислот, чем в их отсутствие, поскольку протонированные диазины проявляют более высокую реакционную способность в таких процессах, чем нейтральные гетероциклы [31]. Атом галогена можно легко удалить в результате каталитического гидрогенолиза: так, например, при гидрировании 2,4-дихлорпиримидина, легко доступного из урацила, в присутствии палладиевого катализатора или при действии на него иодоводорода образуется незамещенный пиримидин [32].
Различия в реакционной способности атомов галогена в положения 2 и 4 пиримидина относительно невелики, и обсуждение селективности процесса нуклеофильного замещения в 2,4-дихлорпиримидине (важном в синтетическом плане соединения) весьма поучительны.
Me3Si(CH2)2OH, n-BuLi THF,-68 *С —»20*С 90%
MeONa
МеОН, 2о;с 90%
Реакция 2,4-дихлорпиримидина с метилатом натрия в метаноле проходит с высокой селективностью для атома в положении 4 [33], при этом взаимодействие с 2-(триметилсилил)этилатом лития также высоко региоселективно, но замещению подвергается атом хлора в положении 2 [34]. Первый результат соответствует порядку реакционной способности атомов галогена в реакциях нуклеофильного замещения [35] — атом галогена в положении 2 более реакционоспо-собен, чем в положении 4. Исключение, проявляющееся во втором примере, связано с сильной координацией лития и большей основностью атома азота N(i> в неполярном растворителе, что приводит к дополнительной активации положения 2 к нуклеофильной атаке и, вероятно, обеспечивает возможность реализации внутримолекулярного процесса. В присутствии кислот образуется смесь двух возможных метоксипроизводных приблизительно в равных количествах.
В этом случае протонирование атома N(i) повышает активность положения 2 к нуклеофильному замещению. Селективность других реакций нуклеофильного замещения зависит от природы нуклеофильного реагента и условий проведения процесса.
Такие реакции также чувствительны как к электронному, так и стерическому влиянию заместителей, присутствующих в гетероцикле, причем это влияние способно иногда приводить к полному обращению типичного порядка реакционной способности [36] также, как это наблюдается при использовании различных нуклеофильных агентов: например, замещение в 2,4-дихлорпиримидине под действием три-н-бутилстанниллития проходит по положению 2 [37]. Возможно также селективное восстановление [38].
При проведении реакций нуклеофильного замещения в пиримидинах и пуринах часто атом галогена сначала замещают третичным амином, так как образующаяся при этом соль обладает гораздо лучшей уходящей группой, чем атом галогена [39].
Me3N
PhH,20*C
96%^
NMe3 Cl*
Et4N+ CN"
CH2CI2, 20‘C
84%
Производные пиримидинов, содержащие не только атом галогена, но и электронодонорные заместители, вступают в реакции нуклеофильного замещения значительно труднее. Один пример, демонстрирующий возможность преодоления таких сложностей, связан с применением О,К-диметилгидроксиламина, обладающего очень сильными нуклеофильными свойствами; последующий гидрогенолиз образующегося при этом продукта приводит к соответствующему амину [40].
MeNHOMe.HCI
Et3N, DMF, кипячение
89% BnHN
Ас2О
затем Zn, АсОН
66% Bn(Ac)N
Возможно также замещение метансульфонильной группы (в виде метансульфинатной) во всех соответствующих производных диазинов [41]. Нуклеофильное замещение этой группы обычно проходит лучше, чем атома хлора, иногда даже настолько, что, например, реакция 3-метансульфонилпиридазина с мети-лат-ионом проходит в 90 раз быстрее, чем с 3-хлорпиридазином. Сульфинаты можно использованы в качестве катализаторов нуклеофильного замещения атома хлора; действие этого катализатора связано с промежуточным образованием соответствующего сульфона [42].
П st-д—р» ^N^NHc-CsH,, 36% ^N^SOsMe S9%
Известны примеры нуклеофильного замещения даже метоксигруппы [43]
CH2(CN)2, NaH
THF, кипячение
62%
Монозамещение в 2,6-дииодпиридазине проходит достаточно легко; применение к получаемому при этом продукту монозамещения различных катализируемых палладием процессов сочетания (см. разд. 11.5.2) обеспечивает удобный подход к синтезу 2,6-дизамещенных пиридазинов [44].
П1 Me2NH S
водн. EtOH, кипячение | 89%
<.N N
PhB(OH)2, Pd(PPh3)4
PhMe, водн. Na2CO3, кипячение | |
Для производных пиридазина, содержащих заместитель в положении 3, возможно высоко региоселективное викариозное нуклеофильное замещение. Так, образование дицианометиленового илида происходит исключительно с участием положения N(i), поскольку подход к атому N(2> стерически затруднен. Образование такого илида приводит к специфической активации пространственно затрудненного положения С(4) [45].
CICH2S02-p-Tol
СН25Огр-То1
Me KOt-Bu THF, DMF, О’С 71%
(NG)2HC'
N‘
88%
(NC)2HC"
11.4. РЕАКЦИИ С ОСНОВАНИЯМИ
11.4.1 . Депротонирование при атоме углерода
Для всех диазинов характерен обмен Н—D всех положений в системе MeONa — MeOD при 164 *С [46], причем образование промежуточного аниона, ответственного за дейтерообмен, происходит в некоторой степени быстрее, чем в случае пиридина. Это, по-видимому, связано с повышенной по сравнению с пиридином кислотностью протонов диазинов вследствие дополнительного электроноакцепторного влияния второго атома азота.
11.4.2 . Металлирование
Все три незамещенных диазина можно прометаллировать по атому углерода, соседнему с атомом азота (для пиримидина по положению 4, но не по положению
2), при использовании не обладающего нуклеофильными свойствами тетраме-тилпиперидида лития. Однако образующиеся при металлировании гетероариллитиевые производные крайне нестабильны и легко превращаются в димеры за счет присоединения к другой молекуле диазина. При кратковременном литии-ровании (в случае пиридазина и пиразина) или при добавлении электрофильных реагентов в реакционную смесь до процесса металлирования удается получить продукты превращения литийорганических производных диазинов с умеренными и даже удовлетворительными выходами [47]. Литиированный по положению 4 пиридазин можно получить в результате реакции переметаллирования соответствующего три-н-бутилстаннана н-бутиллитием. При наличии в качестве заместителей трупп, способствующих металлированию (хлор-, фтор-, метокси-, метилтио- и различные карбоксамиды), диазины легко подвергаются прямому литиированию [48], и соответствующие литиевые производные можно затем широко использовать в синтетических целях (см. разд. 11.5).
|THF,-75’С
, 4-Цбмин г рьсндч^
N 31%
4LiTMP Me3SiCI, THF THF,-75 g1 54%
SiMe3
4LFTMP THF, -75 ’С
6 мин _
11.5. РЕАКЦИИ С-МЕТАЛЛИРОВАННЫХ ДИАЗИНОВ
11.5.1. Литийорганические производные
Обычно для осуществления кинетически контролируемого металлирования замещенных диазинов используют тетраметилпипервдид лития (LiTMP) [49], в отдельных случаях при несколько более высоких температурах равновесие смещается в сторону более термодинамически стабильного аниона [50].
термодинамически контролируемый
LiTMP
THF.HMPA.-70 ‘С
CI
кинетически контролируемый
NHCOt-Bu
НО Н NHCOf-Bu
PhCHC> II ।
N^CI
LiTMP
THF, -70 ‘С
N'
63%
4LITMP
THF,-70’С
ЬГ
LiTMP
Cl -70’C затем MeCHO 65% *
Литийдиазины можно также получить в результате реакции обмена литий — галоген при использовании алкиллитиевых соединений, однако такой вариант
металлирования требует очень низких температур во избежание реакций нуклеофильного присоединения к гетероциклу [51]. Приведенные ниже примеры показывают, что 5-бромпиримидин литиируется по положению 4 при использовании диизопропиламида лития (LDA) или его можно превратить в 5-литиевое производное в результате реакции обмена с н-бутиллитием [52]. Следует отметить, что в некоторых случаях электрофильный реагент прибавляют к пиримидину до введения литиирующего агента, что свидетельствует о большей скорости обмена металл — галоген по сравнению со скоростью присоединения н-бутиллития к карбонильным соединениям [53].
Литиевые производные пиримидинов, пиразинов и пиридазинов можно превратить при взаимодействии с хлоридом цинка в соответствующие цинкорганические соединения [54], которые более стабильны и используются в различных катализируемых палладием реакциях сочетания (разд. 11.5.2). При взаимодействии 5-бромпиримидина с н-бутилмагнийбромидом было получено соответствующее магнийорганическое производное. Церийорганические соединения, использование которых в реакциях с енолизующимися кетонами приводит к лучшим результатам, чем использование литийорганических производных в тех же реакциях, также можно получить из бром- и литийпиримидинов [55].
11.5.2. Реакции, катализируемые палладием
Реакции, катализируемые комплексами палладия (и никеля), с участием галогенодиазинов и трифлатов [56] проходят обычным образом. Реакционная способность атомов хлора, расположенных в а- и у-положениях относительно атома азота, существенно выше, чем реакционная способность хлора в хлорбензоле, аналогично тому, как это наблюдается в случае пиридина. В некоторых случаях активация настолько велика, что активность атома хлора в таких реакциях превосходит активность атома брома (но не иода), хотя обычно наблюдается противоположное соотношение реакционных способностей [57]. В приведенных ниже примерах реакционная способностость атома хлора в положении 4 выше активности атома брома, хотя для достижения высокой степени селективности необходим тщательный подбор реагентов. Для реакций, катализируемых палладием, сохраняется тот же порядок реакционной способности атомов галогена в пиримидине (4>2), как и в случае реакций нуклеофильного замещения [58].
В тех случаях, когда необходимо использование в реакциях сочетания металлоорганических производных диазинов, чаще всего применяются оловоорганические соединения [59], поскольку последние можно получить без использования литийорганических производных. Изредка используются также диазиновые борные кислоты [60], но обычно получение таких кислот, содержащих соответствующий заместитель в a-положении к атому азота, затруднительно. В некоторых случаях предпочтительно использование цинкорганических производных диазинов. Ниже приведены некоторые примеры катализируемых палладием реакций для получения производных диазинов:
n-Bu6Sn2
[(n-C3H5)PdCI]2 Bu4N+F” THF, 20‘С r
SMe
11.6. РЕАКЦИИ С ВОССТАНОВИТЕЛЯМИ
Поскольку ароматичностьдиазинов меньше, чем пиридина, восстановление диазинов проходит значительно легче, чем пиридина. Пиразин и пиридазин можно восстановить в соответствующие гексагидропроизводные натрием в горячем этаноле, пиридазин в этих условиях подвергается последующему восстановительному расщеплению связи N—N.
Частичное восстановление четвертичных солей до соответствующих дигидросоединений возможно при использовании боргидридов, однако этот процесс гораздо менее изучен, чем для пиридина [61]. 1,4-Дигидропиразины можно получить при наличии либо силильных [62], либо амидных [63] заместителей при атомах азота. Все диазины также можно восстановить в соответствующие тетрагидропроизводные при наличии карбаматных защитных групп при атомах азота, что способствует стабильности и возможности выделения продуктов восстановления [64].
SiMe3 CO2SiMe3
SiMe3 CO2SiMe3
11.7. РЕАКЦИИ CO СВОБОДНЫМИ РАДИКАЛАМИ
CO2Bn
Свободные радикалы легко присоединяются к диазинам в условиях реакции Минисци [65]. Присоединение к пиримидинам часто не отличается высокой селективностью и проходит как по положению 2, так и по положению 4, однако на селективной реакции Минисци с участием 5-бромпиримидина основан крупномасштабный метод синтеза соответствующего 4-бензоилпроизводного [66], и при этом реакция по положению 5 вовсе не протекает [67]. Радикальные реакции в пиридазинс проходят селективно по положению 4 [68] даже в том случае, если положение 3 свободно. Пиразины [69] при взаимодействии со свободными радикалами образуют лишь один продукт реакции.
PhCHO, f-BuO2H F
FeSO4, водн. AcOH Н2304,0'С-»20‘С Ph 61%
f-BuCO2H, (NH4)2S2O8 AgNO3, водн. H^O4
’ 69% *
HCONH2> H2O2 FeSO4, H2SO4 ^60 -c 96% CONH2 (При конверсии 58%)
EtOjjCCOzH
Na2S2O8, AgNO3 ^.N
CH2CI2, водн. H2SO4 ||
86% 11 xjL
(при конверсии 96%) N CO2Et
Атом галогена в диазинах можно заместить по механизму SrnI (разд. 5.9), однако в случае высоко реакционноспособных галогеновых заместителях такое замещение конкурирует с замещением по механизму присоединения — элиминирования [70].
11.8. ЭЛЕКТРОЦИКЛИЧЕСКИЕ РЕАКЦИИ
Все диазины, особенно содержащие электроноакцепторные заместители, вступают в реакции Дильса-Альдера в качестве диенофилов. Внутримолекулярные электроциклические процессы реализуются наиболее легко, даже в отсутствие активирующих групп. Первоначально образующиеся аддукты впоследствии превращаются в производные бензола или пиридина в результате потери молекулы азота (пиридазиновые аддукты) или циановодорода (пиримидиновые и пиразиновые аддукты) соответственно [71], как показано на приведенных ниже примерах [72]. Синглетный кислород присоединяется к пиразину по положениям 2 и 5 [73].
1Д5-(/-Рг)3СбН3 2зо;с
91%
MeC=CNEt2 нагревание 90%
+ 2:1
ундекан, 195 *С 62%
Д ля всех диазинов характерна реакция присоединения к иминному фрагменту N-оксида бензонитрила, причем первоначально образующиеся аддукты склонны к дальнейшим превращениям [74].
11.9. N-ОКСИДЫ ДИАЗИНОВ [75]
N-Оксиды пиридазина и пиразина можно легко получить при окислении соответствующих гетероциклов; N-оксиды пиримидина трудно доступны этим методом, но образуются при циклизации [76].
BFg.EtgO
PhMe, DMF
79%
Реакции электрофильного замещения в N-оксидах пиридазина и пиразина проходят аналогично реакциям электрофильного замещения в N-оксидах пиридина [77], реакции нуклеофильного замещения сопровождаются потерей атома кислорода. Интересно отметить, что замещение нитрогруппы в p-положении по отношению к N-оксидному фрагменту проходит приблизительно с той же легкостью, что и замещение нитрогруппы ву-положении, но, несомненно, замещение в N-оксидах проходит быстрее [78], чем в соответствующих гетероциклических основаниях.
Реакции нуклеофильного замещения галогенид-ионами, цианид-ионом, углеродными нуклеофилами, такими, как енамины, ацетат-ионом (при реакции с уксусным ангидридом) с сопутствующей потерей атома кислорода протекают гладко для всех трех диазинов [79], хотя положение нуклеофильной атаки не всегда будут таким, как следовало бы ожидать по аналогии с реакциями нуклеофильного замещения в N-оксидах пиридина. Некоторые примеры таких реакций приведены ниже [13]:
N-Оксидный фрагмент также служит активирующим заместителем, обеспечивающим региоселективное литиирование [80], и повышает кислотные свойства боковых метильных групп (разд. 11.12) настолько, что становятся возможными реакции конденсации, например, с ароматическими альдегидами и амилнитритом [81].
»
0“
LiTMP
S-Bil /V THF, TMEDA П -78‘С „
11.10. ОКСИДИАЗИНЫ
Наиболее важные встречающиеся в природе производные диазинов — это пири-мидоны (урацил, тимин и цитозин), которые в виде нуклеозидов — уридин, тимидин и цитидин — служат компонентами нуклеиновых кислот. Вследствие этого огромное количество синтетических исследований было направлено на поиски антивирусных и противоопухолевых препаратов среди представителей этого класса органических соединений [82]. Среди других известных соединений пиримидонового ряда — производные барбитуровой кислоты, обладающие седативными свойствами [83].
урацил тимин цитозин барбитураты
r^r^H = барбитуровая кислота
11.10.1. Строение оксидиазинов
Все монооксидиазины, за исключением 3-гидроксипиримидина, который аналогичен 3-гидроксипиридину, существуют преимущественно в виде таутомерных карбонильных соединений и представляют собой диазиноны.
В случае диазинонов картина более сложная. В тех некоторых случаях, когда оба атома кислорода расположены в а- и у-положениях относительно атома азота, можно ожидать, что они оба могут существовать в карбонильной форме, однако в действительности один из них существует в окси-форме; хорошо известный пример — малеиновый гидразид. Это можно объяснить в данном случае невыгодным взаимодействием двух связанных непосредственно частично положительно заряженных атомов азота в дикарбонильной форме. Урацил существует в дионной форме, что подтверждается большинством характерных для него превращений [84]. Для барбитуровой кислоты характерна трикарбонильная таутомерная форма.
гидразид н Н
11.10.2. Реакции оксидиазинов
Во многих реакциях удобнее использовать галогенодиазины и алкоксидиазины вместо эквивалентных (по уровню окисления) оксидиазинов, поскольку первые обычно легче растворимы, а гидролиз на заключительном этапе позволяет получить «оновые» соединения.
11.10.2.1. Реакции с электрофильными реагентами
Дезактивирующее влияние двух атомов азота, включенных к цикл, не перекрывается активирующим влиянием одного кислородного заместителя, вследствие чего 3-пиридазиноны не вступают в реакции нитрования и галогенирования.
Среди монооксипроизводных пиримидина только 2-(1Н)-пиримидон вступает в реакцию нитрования [85]; пиразиноны, по-видимому, наиболее склонны к реакциям электрофильного замещения.
5-Гидроксипиримидин — единственный гидроксидиазин, существующий в фенольной форме, — нестабилен даже в разбавленных растворах кислот, и реакции электрофильного замещения с его участием не описаны.
АсОН кипячение 68% **
O2N
Для урацила характерны различные реакции электрофильного замещения, такие, как галогенирование, фенилсульфенилирование [86], меркурирование [87], гидрокси- и хлорметилирование [88]. Бромирование урацила, как было показано, проходит через предварительное образование бромгидринового аддукта; аналогично бромирование пиримидона-2 проходит через предварительное образование бромгидрин-гидратного комплекса [89]. Использование системы иод — пероксидисульфат тетрабутиламммония позволяет получать иодпроиз-водные оксидиазинов [90].
(СН2О)П
HCI, 80 ’С 57%
О
CIHg Hg(OAc)2
водн. 70 ’С затем NaCI
Производные урацила, содержащие при атоме N<d углеводный заместитель, можно превратить в соответствующие 5-нитропроизводные с сохранением углеводного остатка. Также возможно нитрование по положению N(3>; Npj-нитропроизводные реагируют с аминами по механизму ANRORC с замещением нитрамида и внедрением амина в качестве заместителя по положению Np). Этот прием используется для получения 15М(з)-меченных производных пиримидина [91].
(i^NH no2ococf3 II £ СН2С12, О ‘С 94%
О
йЮ2 BnNH2,K2CO3 MeCN, 80 ‘С
О "
I
©
+ H2NNO2
11,10.2.2. Реакции с нуклеофильными реагентами
Диазиноны легко вступают в реакции с нуклеофильными реагентами, причем взаимодействие обычно, за некоторым исключением [92], проходит по типу реакции Михаэля, а не в результате присоединения по карбонильной группе. Присоединение реактивов Гриньяра приводит к образованию дигидроаддуктов, а при наличии в молекуле уходящих групп возможны реакции замещения [93].
Весьма интересно взаимодействие 5-бромуридина [94], содержащего защитную группу, с цианид-ионом. В мягких условиях образуется продукт кине-заме-щения в результате последовательно протекающих реакции Михаэля и р-элими-нирования бромид-иона, однако при более высоких температурах происходит превращение 6-цианопроизводного в 5-изомер, т. е. в продукт прямого замещения атома брома на цианогруппу. 5-Цианоуридин образуется в результате повторной реакции Михаэля и последующего элиминировании 6-цианогруппы.
Аналогичная реакция с анионом фенилацетонитрила приводит к образованию производного циклопропана в результате первоначального присоединения карбаниона и последующего процесса внутримолекулярного алкилирования [95]
Присоединение гидроксид-иона к 1,3-диметилурацилу приводит к смеси Ы,Ы'-диметилмочевины и динатриевой соли формилуксусной кислоты [96]
о
NMe водн. NaOH
[ 20 'С т
500/0
Me
Способность урацила к присоединению нуклеофильных реагентов позволяет проводить необычные, на первый взгляд, трансформации при использовании бис-нуклеофильных реагентов, например мочевины, при этом последовательно реализуются стадии присоединения нуклеофила, раскрытия и замыкания циклов [97].
о
Me
EtONa
EtOH, кипячение
66% **
О
11.10.2.3. Реакции с основаниями
Подобно пиридонам, оксидиазины легко депротируруются в мягких условиях с образованием амбидентных анионов, которые можно проалкилировать в условиях межфазного катализа, главным образом по атому азота [98]. З-Пирида-зиноны в условиях межфазного катализа алкилируются исключительно по положению N(2) [99], в то время как региоселективность реакции алкилирования урацила трудно поддается контролю (см. ниже). Делокализация отрицательного заряда в N-анионе способствует в некоторых случаях С-алкилированию, как в случае реакции 6-метилурацила с формальдегидом [100] или солями диазония [101].
О л-BuBr, КОН PhH, n-BiuNBi;
73%
Алкилирование по атому кислорода также возможно, и этот процесс имеет важное значение в случае рибозидов, в которых он реализуется внутримолекулярно и способствует стереоконтролю реакций замещения в углеводном фрагменте, как в представленном ниже замещении З'-гидроксильной группы на азидную с полным сохранением конфигурации [102].
Известны также альтернативные методы N-алкилирования, включающие использование триметилфосфата [103], и алкилирование О-силилированных производных оксидиазинов. Последний метод важен для осуществления однозначного алкилирования по атому азота и особенно для введения рибозного остатка в молекулу урацила [105], поскольку обычно этот процесс вызывает некоторые стереохимические трудности, как и в случае пуринов (дальнейшее обсуждение см. разд. 24.2.1.2).
Стереоспецифическое введение остатка рибозы в молекулу урацила и других пиримидиновых оснований можно осуществить в результате первоначального введения заместителя к 5-гидроксиметильному фрагменту молекулы углевода и его последующего внутримолекулярного переноса к положению 2 [106].
С-Металлирование
С-Литиирование производных уридина изучено довольно тщательно с позиций возможности использования этого процесса для введения заместителей в положения 5 и 6. Группы, способные к хелатированию в положении 5' (гидроксиль-
ная и метокиметоксильная), способствуют литиированию по положению 6 [107], поскольку, как показано, в условиях равновесия соответствующее литиевое производное наиболее стабильно. Кинетическое литиирование по атому углерода в положении 5 возможно в том случае, когда в качестве защитной группы в углеводном фрагменте используется силилоксигруппа, обладающая слабыми хелатирующими свойствами [108]. Примечательно, что в этом случае нет необходимости в защите NH-группы, что также иллюстрируется литиированием по положению 6 производного урацила, содержащего этоксиметильный заместитель при атоме N<i) [109].
MeC(OTMS)=NTMS
CICH2OEt
CH2CI2, Bu4NI
— *
2,2 LDA
THF, -78 *C (MeS)2
89%
Защита группы NH также не обязательна при металлировании боковой цепи 6-метилпиримидинона-2 [110]
2n-BuLi
THF, TMEDA, 0 ’С
BnCI* 58%
Цинкорганические производные урацила можно получить прямым взаимодействием соответствующего галогенопроизводного с цинковой пылью. Хотя цинкорганические производные урацила вступают в реакцию, с ограниченным числом электрофильных реагентов, они находят особое применение в реакциях сочетания, катализируемых палладием [Ш] (см. также разд. 11.10.2.5)
11.10.2.4. Замещение атома кислорода
Оксидиазины, содержащие кислородный заместитель в ос-положении относительно атома азота, можно превратить в соответствующие галогено- [112] и тиопроизводные [ИЗ] с использованием тех же реагентов, которые применяются в случае 2- и 4-пиридонов, включая систему N-бромсукцинимид и трифенилфосфин [114]. Для замещения атома кислорода на атом галогена также используются реакции О-силилированных пиразинонов с трибромидом или пентахлоридом фосфора [115].
Диазиноны превращаются в соответствующие аминодиазины без промежуточного выделения галогенопроизводных (как это делают обычно) в результате различных реакций с использованием 1,2,4-триазола, как показано ниже [116]:
5-Гидроксипиримидин-2,4-дионы реагируют как кетоны по положению 5 и подвергаются конденсации Виттига, при этом образующаяся двойная связь переходит в эндоциклическое положение с образованием более стабильного изомера [117]. Барбитуровую кислоту и ее производные, содержащие заместитель в положении 5, можно превратить в соответствующие производные урацила в
результате первоначального получения 6-метансульфонильных производных и последующего каталитического гидрогенолиза [118].
11.10.2.5. Реакции, катализируемые переходными металлами
Галогеносодержащие диазиноны вступают в катализируемые палладием реакции сочетания с органическими борными кислотами и оловоорганическими соединениями, хотя сообщения о таких процессах довольно противоречивы. В некоторых случаях лучшие результаты достигаются при использованиии либо соответствующих О-силильных производных [119], либо оксида серебра [120] в качестве сореагента, однако чаще всего предпочтительно проводить такие превращения с участием алкоксидиазинов с последующим гидролизом продуктов реакций в соответствующие оксисоединения. Известны также реакции сочетания с медьорганическими соединениями [121].
CF3I, Си
НМРА, 45 *С
89%
В реакциях сочетания также используются оловоорганические производные уридина, полученные из соответствующих литийорганических производных, однако и в этом случае обычно предпочтительно использование вместо уридина соответствующих диалкоксипиримидинов [122].
СН2=СНСО2Ме
Pd(OAc)2 МеО2
MeCN, кипячение
75%
О
NMe
Ме
о
Реакция Хека возможна д ля галогеносодержащих диазинонов или их легко доступных ртутьорганических производных, однако в последнем случае используется эквимолярное количество паладиевого катализатора [123]. Поскольку урацил склонен к реакциям электрофильного замещения, для него возможно также окислительное соченание Хека (проходящее через образование паллади-рованного интермедита in situ), как показано выше [124].
11.10.2.6. Электроциклические реакции
Мезоионные оксидопиразиниевые соединения вступают в реакции циклоприсоединения [125] аналогично оксидопиридиниевым (разд. 5.8) и оксидопирили-евым соединениям (разд. 8.1.7)
Пиридазин-З-он вступает в реакции циклоприсоединения в качестве диена с диэтиловым эфиром азодикарбоновой кислоты по положениям 2 и 6, и синглетный кислород присоединяется по положениям 2 и 5 пиразинона [126]. При реакции акрилоилцианида с пиримидин-2,4-дионом удается выделить промежуточный циклоаддукт [127].
Фотохимические превращения оксипиримидинов были детально изучены, потому, что эти процессы, возможно, связаны с мутагенезом. Урацил, например, вступает в реакцию [2 + 2]-циклоприсоединия с самим собой [128] или с ви-ниленкарбонатом (1,3-диоксол-2-оном) [129]. Для урацила также характерны реакции радикального присоединил! 130], причем такие процессы, возможно, в большей степени связаны с мутагенезом.
Взаимодействие дезоксиуридина с нитрилоксидами приводит к продукту реакции электрофильного замещения, но, вероятно, его возникновение связано с
раскрытием цикла в первоначально образующемся циклоаддукте (разд. 11.8) [131].
о
ArON—0“ н | 89% з fO ArC(CI)=NOH
Et3N
THF, DMF
При облучении 2-пиримидоны [132] и 4-пиримидоны [133] превращаются в бициклические системы, а пиразины при этом изомеризуются в пиримидины [134].
о
/ту, МеОН, -18 *С
24% в равновесии отделяется от исходных
11.11. АМИНОДИАЗИНЫ
Для аминодиазинов характерно существование в амино-форме. Аминодиазины — более сильные основания, чем соответствующие незамещенные диазины и прото-нируются по одному из двух кольцевых атомов азота, что приводит к образованию двух изомерных катионов. Порядок предпочтительного протонирования кольцевых атомов азота следующий: у > а > 0 по отношению к аминогруппе. Следовательно, аминодиазины, содержащие у-аминогруппу, представляют собой наиболее сильные основания.
рКа5,7
рКаЗ,1
Перегруппировка четвертичных солей 2-аминопиримидина в присутствии щелочей представляют собой простейший вариант перегруппировки Димрота [135]. Чем больше заместитель при положительно заряженном атоме азота, тем выше скорость такой перегруппировки; несомненно, такая зависимость связана с напряжением, возникающим между заместителем и аминогруппой.
При взаимодействии с азотистой кислотой все аминодиазины [29] превращаются в соответствующие диазиноны через промежуточное образование крайне
реакционноспособных диазониевых катионов. Даже в случае 5-аминопирими-дина не наблюдается образования стабильной соли диазония, хотя 2-хлорпири-мидин может быть получен с низким выходом при диазотировании 2-аминопи-римидина в концентрированной соляной кислоте [136].
..N NaNO2
(| q конц. H2SO4, -5 ’С -> 60 ’С
65%
Введения одной аминогруппы в диазиновый цикл во многих случаях достаточно для облегчения реакций электрофильного замещения, например, галогенирования [137]; две аминогруппы активируют диазиновый цикл настолько, что становятся возможными реакции даже со слабыми электрофилами, такими, как дитиодициан (тиоцианоген)[138]. Диаминопиримидины вступают в реакции сочетания с солями диазония [139], что используется для введения третьей аминогруппы.
Вг2
Н2О, 80 *С
41% *"
NH2
Для аминооксипиримидинов [140] и аминодиоксипиримидинов [141] характерны реакции С-нитрозирования; образующиеся при последующем восстановлении 5,6-диаминопиримидины используются в синтезе пуринов (см. приведенный ниже пример и разд. 24.13.1.1) и птеридинов (разд. 11.13.4.6).
NaN°2 ли водн. АсОН ON
30 *С
84% h2n
11.12. АЛКИЛДИАЗИНЫ
Для всех алкилдиазинов, за исключением 5-алкилпиримидинов, характерны ре-, акции конденсации, проходящие через промежуточное депротонирование алкильных групп [142], аналогично тому, как это наблюдается в случае а- и у-пи-колинов. Промежуточно образующиеся анионы стабилизированы мезомерным влиянием одного или, как в случае 2- и 4-алкилпиримидинов, двух атомов азота.
С13ССН=О пиридин, 95 JC
60%
Алкильные группы в положении 4 пиримидина депротонируются значительно легче, чем алкильные группы в положении 2 [143], что обусловлено в первом случае более высокой стабильностью у-хиноидного резонансного иона.
Радикальное галогенирование боковой цепи проходит предпочтительно по алкильной группе в положении 5 пиримидина, а не по 4-алкильному заместителю; обращение такой селективности наблюдается при проведении реакции в кислых средах, что связано с протонированием пиримидинового цикла и образованием протонированного по атому азота и депротонированного по алкильной группе енаминного таутомерного интермедиата[144].
NBS, (PhCO2)2 Me
hv, ССЦ, кипячение 77% Me
11.13. ЧЕТВЕРТИЧНЫЕ АЗИНИЕВЫЕ СОЛИ
Высокая склонность диазинов к реакциям с нуклеофильными реагентами существенно повышается в случае соответствующих четвертичных солей. Присоединение металлоорганических реагентов к N-ацилиевым солям, хотя и возможно в некоторых случаях, однако примеры таких реакций ограничены по сравнению с пиридином (разд. 5.13). Так, известны примеры присоединения аллилстанна-нов [145], аллилсиланов [146] и силиловых эфиров енолов к четвертичным диа-зиниевым солям, а также реакция присоединения гидрид-иона (разд. 11.6). При присоединении к N-ацилиевым пиридазиниевым солям с хорошими выходами образуются моноаддукты в результате атаки нуклеофилом по a-положению относительно ацилированного атома азота, хотя региоселективность присоединения силильных эфиров енолов зависит от природы заместителей [147]. Пиразины в таких реакциях образуют главным образом продукты бисприсоединения, а пиримидины — исключительно продукты бисприсоединения. Для пиридазинов и пиримидинов описано получение аддуктов Рейссерта [148].
О. CH2=CHCH2Snn-Bu3 J CICO2Et, О ‘С б7%
СН2СН=СН2 rp^NCOgEt ^N'Z^CH2CH=CH2
OTsCI, Me3SiCN
A!CI3, CH2CI2, 20‘C
J ►
CN
CO2Et
Н С(Ме)2СО2Ме
zX. Me2C=C(OTMS)OMe
I |] ^CICOgEt
N
CO2Et
CH2=C(OTMS)OBn
CICO2Et______
98% **
у р-СНгСОгБл ks. xNCO2Et
11.14. СИНТЕЗ ДИАЗИНОВ
Подходы к синтезу различных изомерных диазинов, как и можно было бы ожидать, существенно отличаются друг от друга, и, поэтому будут рассмотрены каждый в отдельности.
11.14.1. Синтез пиридазинового кольца
11.14.1.1. Из 1,4-дикарбонильных соединений и гидразина
Большинство общих методов синтеза пиридазинов включает взаимодействие 1,4-дикарбонильных соединений с гидразином; в том случае, если используется насыщенный четырехуглеродный компонент, то на заключительной стадии необходимо окисление для образования ароматической структуры
Для конструирования пиридазинового цикла наиболее удобно использовать эфиры 1,4-кетокислот, которые при взаимодействии с гидразином образуют ди-гидропиридазиноны, в свою очередь легко превращающиеся в соответствующие ароматические гетероциклические соединения чаще всего в результате последовательных реакций С-бромирования и дегидробромирования [149]. В тех случаях, когда использование реакции галогенирования затруднительно, в качестве альтернативного окислителя можно применять натриевую соль 3-нитробензой-ной кислоты. 6-Арилпиридазиноны могут быть получены различными путями: либо при использовании а-аминонитрилов как скрытой формы кетонной ipyn-пы в четырехуглеродном фрагменте[150], либо при реакции ацетофенона с глиоксиловой кислотой и затем гидразином [151]. Реакция ацилирования Фриделя-Крафтса с использованием ангидрида янтарной кислоты лежит в основе другого подхода к 1,4-кетокислотам, реакция которых с гидразином также приводит к 6-арилпиридазинонам [152]. Алкилирование енаминов фенацилброми-дом приводит к 1-арил-1,4-дикетонам, которые используются в синтезе 3-арилпиридазинов [153].
OEt N2H4
EtOH, кипячение
100%
Вг2
[ АсОН, 60 X, . ^NH N
CF3Z
90%
KCN.TsOH
s морфолин CH2=CHCO2Et || кипячени^ КОН, 20°C д Чно 49%
Реакция малеинового ангидрида и гидразина напрямую приводит к гидро-ксипиридазинону [154], поскольку в используемом 1,4-дикарбонильном соеди-
нении присутствует двойная связь, то нет необходимости в стадии окисления. З-Гидроксипиридазин-6-он легко превращается в 2,6-дихлорпиридазин
о n2h4,hci
Н2О, нагревание
85%
„ОН РОС13 х нагревание fj _ м 87% *Л
89%
н2, Pd/C водн. МНз, МеОН
N
Применение насыщенных 1,4-дикетонов в таких процессах характеризуется одним недостатком: они способны реагировать с гидразином двумя путями, поэтому в одном случае такое взаимодействие приводит к дигидропиридазинам, а в другом — к N-аминопирролам. Использование ненасыщенных 1,4-дикетонов лишено такого недостатка [155]. Предшественники ненасыщенных 1,4-дикетонов — циклические ацетали — образуются при окислении производных фуранов (разд. 15.1.4) и взаимодействуют с гидразином с образованием ароматических производных пиридазина [156].
лдп Вг2» КОАс ^СН2ОАс 0,1 М H2SO4 П / им2иАСМеОН_ Г“ОМе нагревание U-0 о
МеО
СН2ОН
11.14.1.2. Реакцией циклоприсоединения 1,2,4,5-тетразина к производным ацетилена
Реакция циклоприсоединения 1,2,4,5-тетразина к производным ацетилена (или эквивалентным соединениям) приводит к пиридазинам в результате последующего элиминирования молекулы азота
Такие процессы реализуются наиболее легко, если в молекуле тетразина содержится электроноакцепторный заместитель, а использование замещенных ацетиленов, содержащих такие группы, как нитро-, триметилсилильная и три-метилстаннильная, позволяет получать разнообразные замещенные пиридазины [157], труднодоступные другими методами
Me2N
диоксан кипячение
42%
NxN<YC°2Me C2H4Br2
)| J, + PhCOCsCSiMe3 90 'C »
MeO2(/4-*N 78%
- Me2NH
Присоединение енолов кетонов и альдегидов к тетразинам, хотя и не является согласованным процессом, также приводит к пиридазинам [158].
11.14.1.3. С использованием других реакций циклоприсоединения
/1.14.1.3.1. С использованием галогеносодержащих гидразонов
Реакции ди- и тригалогенозамещенных гидразонов с эфирами енолов или енаминами в присутствии оснований приводят к образованию пиридазинов через промежуточные азадиены. Пиридазины либо сразу образуются в реакционной смеси, либо ди- или тетрагидропроизводные пиридазинов предварительно выделяют, а затем превращают в ароматические структуры при взаимодействии с основаниями [159].
11.14.1.3.2. С использованием 8,8-диоксидов тиофена
S,S-Диоксиды тиофена, содержащие объемные заместители в положениях 3 и 4, вступают в реакцию Дильса—Альдера с N-фенилтриазолиндионом с образованием диаддуктов, которые при гидролизе превращаются в 4,5-дизамещенные пиридазины [160].
к R^R . Ь aw /^Л PhMe °х // \\ + J V кипячение y-N S; 0 0 71% р*/ 'm-** Ph У rR Я f kR I R Л КОН, воздух If L \ NPh МеОН, 20JC ~n2^ ]| ез%-у R = адамант-1-ил
11.14.1. 3.3. С использованием галогенозамещенных циклопропенов
Ди-, три- и тетрагалогенозамещенные циклопропены вступают в реакцию циклоприсоединения с диазоалканами, приводящую к нестабильным пиразолинам, которые легко перегруппировываются в пиридазины с потерей молекулы гало-геноводорода. Тетрахлорциклопропен коммерчески доступен, но большинство бромсодержащих производных циклопропена можно синтезировать из винил-бромида в результате двухстадийного синтеза: на первой стадии присоединяется дибромкарбен, а затем циклопропен генерируется in situ при действии метилли-тия [161]
11.14.2. Синтез пиримидинового кольца
11.14.2. 1. Из 1,3-дикарбонильных соединений и соединений, содержащих фрагмент N-C-N
Наиболее общий подход к синтезу пиримидинового цикла включает взаимодействие 1,3-дикарбонильного соединения и соединений, содержащих фрагмент N-C-N, таких, как мочевина, аминдин или гуанидин
Выбор компонента, содержащего фрагмент N—С—N — амидина [162], гуанидина [163] или мочевины [164] ( или тиомочевины [165]), зависит от природы заместителя в положении 2 образующегося производного пиримидина. Формамид [166] и смесь ортоэфир — аммиак [167], хотя формально их нельзя отнести к числу соединений, содержащих фрагмент N—С—N, используются вместо этих соединений в таком подходе к синтезу пиримидинов. Дикарбонильные соединения можно генерировать in situ, как, например, формилуксусную кислоту (при декарбоксилировании молочной кислоты), или использовать их синтетические эквиваленты (1,1,3,3-тетраметоксипропан вместо малонового диальдегида). При использовании нитрила в качестве эквивалента карбонильного соединения образующийся заместитель содержит карбонильную группу, как показано в приведенном ниже примере [168]. При использовании 2-бром-1,1,3,3-тетраметоксипропана образуются производные 5-бромпиримидина [169], а применение триформил метан а приводит к 5-фор-милпиримидинам [170].
r° NH2
о h2n^o
55%
Н2О, - СО 0
^“яблочная кислота .Ах ! конц. H2SO4, 90 ‘С f| NH
^СН(ОМе)2 НС|
+ । г EtOH, кипячение
:Н(ОМе)2 66%
H2rr s
N^O
xCO2Et +
I + ЫН2СГ
CO2Et zAu
Н2ЬГ Н
Среди других синтетических эквивалентов 1,3-дикарбонильных соединений, успешно применяемых в синтезе пиримидинов, р-хлор-а,р-ненасыщен-ные кетоны и альдегиды [171], р-амино-а,р-ненасыщенные кетоны [172], ви-ниламидиниевые соли [173] и пропиоловая кислота, взаимодействие которой с мочевиной приводит к урацилу с выходом около 50% [174]. Реакция эфиров 1,3-кетокислот с амидинами приводит к образованию 4-пиримидонов [175]. 2-Аминомалоновый диальдегид используется для синтеза 5-аминопиримиди-нов [176]. Производные пиримидина, содержащие конденсированные циклы, например хиназолины, можно получить из ор/ио-аминонитрилов [177] и, в общем случае, из р-аминоэфиров [178].
ОМе О
NaOMe POCI3 Н2, Pd/C
| 0 NH2 МеОН, 20*С П СН2С12,40'С EtOH, NaOAc r f| V
eA +h2nAh 67% 73% 85% EtAA
Барбитуровая кислота и барбитураты образуются при реакции производных малоновой кислоты с мочевиной [179] или первичных бисамидов замещенной малоновой кислоты с диэтилкарбонатом [180].
Ж1 Е\ AO2Et
л‘Рг CO2Et
H2NCSNH2 EtONa EtOH, кипячение
90%
11.14.2. 2. Реакцией циклоприсоединения 1,3,5-диазинов к производными ацетилена
Реакции циклоприсоединения 1,3,5-триазинов к производным ацетилена (или их эквивалентам) приводят к образованию пиримидинов в результате потери молекулы циановодорода
Аза-реакция Дильса—Альдера, приводящая к пиримидинам [181], аналогична получению пиридазинов из тетразинов (см. разд. 25.2.1).
- HCN V - пирролидин Т|
^N'
11.14.2. 3. Из 3-этоксиакрилоилизоцианата и первичных аминов
Первичные амины присоединяются к изоцианатной группе 3-этоксиакрилоил-изоцианата; последующее замыкание цикла в результате внутримолекулярного замещения этоксигруппы приводит к образованию пиримидинового цикла
Производные урацила можно получить при взаимодействии первичных аминов с 3-этоксиакрилоилизоцианатами [182]. Этот метод особенно важен при использовании сложных аминов и в последние годы нашел применение в синтезе, например, карбоциклических аналогов нуклеозидов как потенциальных антивирусных агентов [183]. Циклизация промежуточно образующихся продуктов взаимодействия аминов с изоцианатами возможна в присутствии как кислот, так и оснований, и, кроме того, этот метод может быть использован в синтезе
производных тиоурацила.
Конденсация кетонов с двумя молекулами нитрила в присутствии ангидрида трифторметансульфоновой кислоты представляет собой полезный способ получения некоторых производных пиримидина, в которых заместители в положениях 2 и 4 идентичны [184].
Ме
PhCN. Tf2O
CH2CI2, 20*С
о 42% *
Ph
11.14.3. Синтез пиразинового цикла
Синтез пиразина в лабораторных условиях — достаточно сложный процесс. В промышленности пиразин получают высокотемпературной циклизацией N-гидроксиметилэтилен-1,2-диамина.
11.14.3.1. Самоконденсацией 2-аминокетонов
Симметричные пиразины образуются в результате спонтанно происходящей само-конденсации 2-аминокетонов и 2-аминоальдегидов с последующим окислением
2-Аминокарбонильные соединения, которые стабильны только в виде солей, обычно получают in situ при восстановлении 2-диазо-, 2-оксимино- или 2-ази-докетонов. Дигидропиразины, полученные таким способом, очень легко окисляются в соответствующие ароматические структуры: например, при окислении кислородом воздуха и даже при простой перегонке происходит диспропорционирование [185].
PhCH2coa^^a^
Эфиры a-аминокислот более стабильны, чем a-аминокетоны, но тем не менее подвержены легкой самоконденсации, приводящей к 2,5-дикетопипера-зинам. Хотя дикетопиперазины устойчивы к действию окислителей, ароматические производные пиразинов можно получить после первоначального превращения дикетопиперазинов в дихлор- или диалкоксидигидропиразины [186].
НэЧВП аН20-с°ГУП
ВгГ^ЙНз O^OEt 60%
СГ Н
Et3O+BF4“E
СН2С12 45% *
₽n DDQ EtCk/N Bn PhH, нагревание ц
•OB 6e% bAnAh
11.14.3.2, Из 1,2-дикарбонильных соединений и 1,2-диаминов
1,2-Дикарбонильные соединил вступают в реакцию конденсации с 1,2-диаминами с образованием цикла; в случае необходимости продукты конденсации могут быть окислены в соответствующие ароматические структуры.
Этот метод удобен для получения симметрично замещенных пиразинов [187]; при использовании несимметрично замещенных дикетонов и диаминов образуются два изомерных пиразина.
Et2o, о *с
60% *
хромит меди 300 'С
90%
Прямой синтез ароматических производных пиразина, основанный на данной методологии, требует использования 1,2-диаминоалкенов. Простые представители этого класса соединений неизвестны, однако диаминонитрил малеиновой кислоты [188] стабилен и используется для этих целей.
Ph^^O конц. HCI Ph\^.N>^zCN
Г + Ц ВОН, кипячение Т 11 Ph^O H2N'Z^'4CN 65% PK^n^CN
Использование амидов ненасыщенных а-аминокислот [189] приводит к образованию пиразинонов. Особый случай применения амида аминомалоновой кислоты в синтезе пиразинонов показан ниже [190]:
Ме
Н
В оригинальной модификации такого метода синтеза пиразинов используется 5,6-диаминоурацил как скрытый аналог ненасыщенного 1,2-диамина. В результате гидролиза образующегося продукта конденсации происходит раскрытие пиримидонового цикла и получается аминопиразинкарбоновая кислота [191]
н2о ме нагревание
69%
Ме'
О
водн. NaOH М^ NH 175 °C 1 92%
° Ме^ XN' 'NH2-
^Х^СО2Н
11.14.3.3. Синтез пиразинов через сульфиды
Симметрично 3,6-дизамещенные пиридазины с различными алкильными и арильными заместителями можно получить в результате сужения цикла, характерного для семичленных циклических сульфидов [192].
г-
11.14.4. Примеры некоторых важных синтезов диазинов
11.14.4.1. 4-Амино-5-циано-2-метилпиримидин
4-Амино-5-циано-2-метилпиримидин [193], представляет собой промежуточное соединение в синтезе тиамина (витамин Bi) (разд. 21.14.2.3)
NC
ЕЮ
CO2Et EtONa
NH EtOH, О 'С
* Л 20%
H2N XMe
О
POCI3 NC. nh нагревание
Cl NH3 NC
Г н Me0H>100 ‘Cjf
L LL 40%
^N^Me
Me
11.14.4.2. 4,6-Диамино-5-тиоформамидо-2-метилпиримидин
4,6- Диамино-5-тиоформамидо-2-метилпиримидин используется в синтезе 2-метиладенина
он CI
^.CO2Et EtONa Р0С|з /А.
| + |УН ЕЮН, 105*0 р .У ДО
CO2Et JL 87% 75О/° А
H2hi ХМе O n Me Cl N
NH2
NH3 NaNO2
МеОН, 200 *C M p N водн. HCI, 0'C
Me H2Nxl%zMe
B0AH.(NH4aSx H2N
O'C
Me
H2N‘
nh2
^^N HCS2Na
1 35%
^N^Me
H NH2 хинолин,
_ m JL нагревание
V (-HaS)
’ н I || 75% *
HgN^N-^Me
2-метил аденин
11.14.4.3. Карбоциклический бромвинилдезоксиуридин
Карбоциклический бромвинилдезоксиуридин (CarbaBVDU) представляет собой антивирусный препарат [194].
но он
но он
но он
НО но но
11.14.4.4. Коелентеразин
Коелентеразин — биолюминесцентное соединение, выделенное из медуз и находящее применение для биологического анализа, — было получено из хлор-пиразина с общим выходом 25% [195]
LiTMP
THF
затем PhCHO
88%
МпО2
THF
93%
NH3
EtOH, 120 ‘C
63%
EtSNa
DMF, 100 *0
81% ’
92%
4-MeOC6H4B(OH)2 CI2Pd(dppb), водн. Na2CO3 PhMe, EtOH, кипячение^
Ph
-N NH2 Br2, KgCOg К |f
^^-ВДЫАгР11 88% br N Jf О
N2H4, водн. KOH (CH2OH)2,240 *C 84% 5
11.14.4.5. 2,5-Диметил-З-н-пропилпиразин
Алкилпиразины можно получить в результате весьма оригинальной синтетической последовательности, включающей элекгроциклическое замыкание цикла в 1,4-диазатриенах и последующую ароматизацию в результате потери атома
кислорода, первоначально входящего в гидроксильную группу оксимного фрагмента [196].
он
I
KOf-Bu n-Pr-s^N Me CICO2Me
DMSO, 50 'С* I If Et3N, CH2CI2, 20'C
OCOgMe
PhMe, 300 *C
61% *
11.15. ПТЕРИДИНЫ
Пиразино[2,3-с0пиримидины известны как «птеридины» [197], поскольку впервые природные соединения с подобной бициклической системой были обнаружены в пигментах, таких, как ксантоптерин (желтый), содержащийся в крыльях бабочек (Lepidoptera). Впоследствии птеридиновая циклическая система была обнаружена в коферментах, использующих тетрагидрофолиевую кислоту (производное витамина фолиевой кислоты), кофакторах оксомолибдоферментах [198] и родственных ферментах, содержащих вольфрам. Птеридиновая система также присутствует в противоопухолевом препарате метотрексате.
СО2Н
молибденовый кофактор (R = Н или нуклеозид)
Н 1СН2)2СО2Н о Hl. (другие лиганды
Ji N § у атома металла не показаны)
н н н
Методы синтеза птеридиновой бициклической системы основаны на использовании двух очевидных подходов: первый заключается в достраивании пиразинового цикла к уже сформированному 4,5-диаминопиридиновому, а второй связан с аннелированием пиримидинового цикла к пиразиновому. Первый метод синтеза (синтез Исая) имеет один недостаток: конденсация гетероцикли
ческих 1,2-диаминов с 1,2-дикарбонильными соединениями обычно приводит к смеси 5/6-замещенных изомеров [199]. Образование изомеров можно избежать при использовании альтернативной стратегии (синтеза Тейлора) исходя из пиразина, которая в настоящее время получила широкое распространение [200]. Кроме того, последний подход имеет еще одно преимущество, поскольку использование для первоначального синтеза пиразинового цикла 2-цианогли-цинамида, [201] позволяет, в конечном итоге, региоселективно получать 6-заме-щенный птеридин, а наличие заместителя в положении 6—общее свойство природных птеридинов.
Упражнения
Простые упражнения для проверки усвоения материала гл. 10 и 11
(а) Почему дипротонные соли диазинов трудно образуются?
(б) Чем отличаются друг от друга уридин, тимидин и цитидин?
(в) Сравните диазины и пиридин в реакциях С-электрофильного замещения.
(г) Какие факторы способствуют и какие факторы препятствуют нуклеофильному замещению атома водорода в диазинах?
(д) Какой из хлордиазинов не вступает в реакции нуклеофильного замещения и почему?
(е) Какие предосторожности необходимы при литиировании диазинов?
(ж) Приведите по одному примеру реакций циклоприсоединения, в которых пирида-зин, пиримидин и пиразин выступают в качестве диенов или азадиенов.
(з) Каким путем можно превратить оксидиазин, содержащий кислородный заместитель в a-положении к атому азота, в следующие соединения: 1) в соответствующий хлордиазин, 2) селективно в соответствующий N-метилдиазинон и 3) в соответствующий аминодиазин без предварительного получения хлордиазина?
(и) Какое соединение образуется при взаимодействии гидразина с эфиром 1,4-кетокислоты и каким путем это соединение можно превратить в пиридазинон?
(к) Как исходя из пентан-2,4-диона можно получить следующие соединения: 1) 4,6-диметилпиримидин, 2) 4,6-диметилпиримид-2-ОН, 3) 2-амино-4,6-диме-тилпиримидин?
(л) Какое производное пиразина наиболее легко получить в результате реакции образования цикла?
Упражнения повышенной сложности
1. Какие соединения образуются на каждой стадии в следующей последовательности: (а) пиридазин-3-он взаимодействует с РОС13 (-»C4H3N2C1) и далее с NaOMe (-> C5H6N2O); (б) хлорпиразин взаимодействует с бутиламином при 120 ’С (-> C8H13N3)?
2. Каково строение следующих соединений: (a) CgH^NaS, полученного из 3-метил-тиопиридазина, и СбН8С11К2, полученого из З-хлор-6-метилпиридазина при реакции каждого с иодметаном, (б) C5H2CI2N2O, образующегося при взаимодействии 2,6-дихлорпиразина с тетраметилпиперидидом лития и затем с HCO2Et; (в) C14H12N2O2, полученного из 2,6-диметоксипиразина с тетраметилпиперидидом лития, затем с иодом и на заключительном этапе с фенилапе-тиленом в присутствии Pd(0); (г) CgH9N3 полученного при обработке 2-аминопи-римидина NaNO2/KOHU. НС1, —15 вС и затем продукта реакции Me2NH; (д) C18H14N2, полученного из З-метил-6-фенилпиридазина с РЬНС=О/Ас2О при нагревании?
3. Приведите структурные формулы промежуточных соединений и продуктов реакций в следующих последовательностях превращений: (а) хлорбензол, янтарный ангидрид и А1С13 (-> СюН9СЮ3), затем N2H4 (-> CioH9C1N20) и на заключительной стадии Вгг/АсОН (-» C10H7CIN2O); (б) 2,5-диметилфуран с бромом в метаноле (-> C8Hi4O3) затем с водным раствором кислоты и в заключение с гидразином (-» CfiHgNz); (в) 1,1-диметоксибутан-3-он с гидрокарбонатом гуанидина (-> C5H?N3); (г) этиловый эфир цианоуксусной кислоты с гуанидином в присутствии этилата натрия (-> С4НбК4О); (д) этиловый эфир цианоуксусной кислоту с мочевиной в присутствии этилата натрия (-> C4HsN3O2); (е) (ЕЮ)2СНСН2СН(ОЕ1)2/НС1/мочевина (-» C4H4N2O); (ж) МеОСН2СОМе с EtO2CH/Na (-> CsH8O3), затем с тиомочевиной (-> CgH^OS) и на заключительной стадии H2/Ni (-> C6H8N2O); (з) PhCOCH2CO2Et с EtC(=NH)NH2 (-» Ci2H12N2O); (и) PhCOCHO с MeCH(NH2)CONH2 (-> CnHwN2O).
Литература
1. «Pyridazine», TishlerM., Stanovnik B. Adv. Heterocycl. Chem., 9,211 (1968); «Recent advances in pyzidazine chemistry», ibid., 24, 263 (1979); «Advances in pyzidazine chemistry», ibid., 49,385 (1990);
2. «Taytomerism and electronic structure of biological pyrimidines», Kwiatkowski J. S., Pullman B. Adv. Heterocycl. Chem., 18,200 (1975); «Conversion of simply pyrimidines into derivatires with a carbon functional group», Sacamoto T., Yamanaka H. Heterocycles, 15,583 (1981).
3. «Recent advances in pyrazine chemistry», Cheeseman G. W., H. Werstiuk E. S. G. Adv. Heterocycl. Chem., 44,99 (1972).
4. Nucleic acids in chemistry and biology, Blackbum G. M., Gait M. J. (eds.), Oxford University Press, 1996
5. «Introduction to beetle luciferases and therir applications», Wood К V., Lam Y. A., McElvoy W. D. J. Biolumin. Chemilumin., 4,289 (1989).
6. «Odor threshold of some pyrazines», Shibamoto T. J. Food Sci., 51,1098 (1986).
7. «Reactions of annular nitrogens of azines with electoiphiles», Grimmett M. R., Keene В. R. T.
Adv. Heterocycl. Chem., 43, 127 (1988).
8. Curphey T, L., Prasad К S., J. Org. Chem., 37, 2259 (1972).
9. Lund Н, Lunde Р. Acta Chem. Scand., 21,1067 (1967).
10. Koelsch C. F., Gumprecht W. H. J. Oig. Chem., 23, 1603 (1958); Kubota T, Watanabe H. Bull. Chem. Soc. Jpn., 36, 1093 (1963).
11. Yamanaka H., Ogawa S., Sakamoto T. Heterocycles, 16,573 (1981).
12. Suzuki L, Hakodate M., Sueyoshi S., Tetrahedron Lett., 1968,1855.
13. Bredirick H, GompperR., HerlingerH. Chem. Ber., 91,2832 (1958).
14. Kano H, Ogata M., Watanabe H., Ishizuka I. Chem. Pharm. Bull., 9, 1017 (1961); Ogata M., Kano H. Ibid., 11,29 (1963).
15. Ogata M., Watanabe H, Tori К., Kano H. Tetrahedron Lett., 1964,19.
16. Sato N. J. Heterocycl. Chem., 20, 169 (1983).
17. Gainer H., Kokorudz M., Langdon W. K. J. Org. Chem., 26,2360 (1961).
18. Kress R. J., Moore L. L. J. Heterocycl. Chem, 10,153 (1973); Pews R. G. Heterocycles, 31, 109 (1990).
19. Bowman A. J. Chem. Soc., 1937, 494; KeinerA. Angew. Chem., Int. Ed. Engl., 31, 774 (1992).
20. Jones R. G., McLaughlin К. C. Oig. Synth., Coll. Vol. IV., 1963,824.
21. Gotor V., Quiros M., Liz R., Frigda J., Fernandez R- Tetrahedron, 53,6421 (1997).
22. Lupattelli P., Saladino R., Mincione E. Tetrahedron Lett., 34,6313 (1993).
23. LetsingerR. L., Lasco R. J. Oig. Chem., 21, 812 (1956).
24. Strekowski L., Harden D. B., Grubb W. B., Patterson S. E., Czarny A., Makrosz M. J., Cegla M. H, Wydra R. L. J. Heterocycl. Chem., 27, 1393 (1990).
25. Strekowski L., Harden D., Watson R. A. Synthesis, 1988,70.
26. Shreve R. N., Berg. L. J. Am. Chem. Soc. 69,2116 (1947).
27. Hara H, Van derPlas H. C., J. Heterocycl. Chem., 19,1285 (1982).
28. Kenner G. W., Reese С. B., Todd A. R. J. Chem. Soc., 1955, 855; Houminer Y. J. Oig. Chem., 50,786 (1985); Hilbert G. E, Johnson T. B. J. Am. Chem. Soc., 52,1152 (1985); Itai T., Kamiya S. Chem. Pharm. Bull., 11, 1059 (1963); Yamada T, Nobuhara Y., Shimanura H, Yoshihara K. Yamaguchi A., Ohki M. Chem. Pharm. Bull., 29, 3433 (1981).
29. Erickson A. E., Spoerri P. E. J. Am. Chem. Soc., 68,400 (1946).
30. Overberger C. G., Kogon I. C., Minin R. Oig. Synth., Coll. Vol. IV, 1963, 336.
31. Banks С. K. J. Am. Chem. Soc., 66,1127 (1944); Chapman N. B., Rees C. W. J. Chem. Soc., 1954,1190.
32. Whittaker N. J. Chem. Soc., 1953,1646; Brown D. J., Waring P. Aust. J. Chem., 26,443 (1973).
33. KatritzkyA. R., Baykut G., Rachwal S., Szafran M., Caster К. C, EylerJ. J. Chem. Soc., Perkin Trans. 2,1989,1499.
34. Acevedo O. L., Andrews R. S., Sunkel M., Cook D. P. J. Heterocycl. Chem., 31, 989 (1994).
35. Другие примеры см.: Delia T. J., Stark D., Glenn S. K. J. Heterocycl. Chem., 32,1177 (1998).
36. Yukawa M., Niiya T., Goto Y., Sakamoto T., Yoshizawa H Watanabe., A., Yamanaka H. Chem. Pharm. Bull., 37,2892 (1989).
37. Sandosham J., Undheim K. Tetrahedron, 50,275 (1994).
38. DunaiskisA., Staigers T., Keltonic T., Chappie T., Meltz C., Dugger R., Sanner M. A. Oig. Prep. Proc. Int., 27,600 (1995).
39. Klotzer W. Monatsh. Chem., 87,131 and 526 (1956).
40. Desaubry L., Wermuth C. G., Boehrer A., Marescaux C., Bourguignon J.-J. Bioorg. Med. Chem. Lett., 5, 139 (1995).
41. Brown D. J., Ford P. W. J. Chem. Soc. (C), 1967, 568; Barlin G. B., Brown W. V. J.
Chem. Soc. (В), 1967,648; idem. J. Chem. Soc. (C), 1969,921; Budesinsky Z., VavrinaJ. Coll. Czech. Chem. Commun., 37,1721 (1972); Forbes I. T., Johnson C. N., Thompson M. Synth. Commun., 23, 715 (1993).
42. Miyashita A., Suzuki Y., Ohta K., Iwamoto K., Higashito T. Heterocycles, 47,407 (1998).
43. Yamanake H., Ohba S. Heterocycles, 31, 895 (1990).
44. Draper T. L., Bailey T. R. J. Oig. Chem., 60,748 (1995).
45» Itoh T., Matsuya K, Nagata K., Okada M., Ohsawa A. 3. Chem. Soc., Chem. Commun., 1995,2067.
46. Zoltewicz J. A., Grahe G., Smith C. L. J. Am. Chem. Soc., 91, 5501 (1969).
47. Pte N., TurckA., Couture K., Queguiner G. J. Org. Chem., 60,3781 (1995).
48. «Directed metallation of я-deficient azaaromatics: strategies of functionalisation of pyridines, quinolines, and diazines», Queguiner G,, Marsais F., Snieckus V., Epsztain J. Adv. Heterocycl. Chem., 52,187 (1991).
49. Wada A., Yamamoto J., Kanatomo S. Heterocycles, 26,585 (1987); TurckA., Majovic L., Queguiner G. Synthesis, 1988, 881; Pte N,, Turck A., Bardin F., Queguiner G. J. Heterocycl. Chem., 29,467 (1992); TurckA., Pte N., TrohayD., Ndzi B., Queguiner G. Ibid., 29,699 (1992); Mattson R. J., Sloan С. P. J. Org. Chem., 55,3410 (1990); Pte N., TurckA., HeynderickxA., Queguiner G. J. Heterocycl. Chem., 31,1311 (1990); TurckA., Pie N., Mojovic L., Ndzi B., Queguiner G., Naider N., Schuller H., Heinisch G. J. Heterocycl. Chem., 32, 841 (1995); Nakamura H., Aizawa M., MuraiA. Synlett, 1996, 1015.
50. Turck A., Pie N., Mojovic L., Queguiner G. J. Heterocycl. Chem., 27,1377 (1990).
51. Gronowitz S., Roe J. Acta Chem. Scand., 19,174(1965); FrissenA. E., Marcelis. A. T.M., Buurman D. G., Pollmann С. A. M., van derPlas H. C. Tetrahedron, 45, 5611 (1989).
52. Kress T. J. J. Org. Chem., 44,208 (1976); Rho T, Abah Y. F. Synth. Commun., 24,253 (1994).
53. Taylor H. M., Jones C. D., Davenport J. D., Hirsch K. S., Kress T. J., Weaver D. 3. Med. Chem., 30, 1359 (1987).
54. Turck A., Pte N. Lepretre-Graquere A., Queguiner G. Heterocycles, 49, 205 (1998).
55. Zheng J., Undheim K. Acta Chem. Scand., 43, 816 (1989); Shimura A., Momotake A., Togo H., Yokovama M. Synthesis, 1999,495.
56. Toussaint D., Sujjert J., Wermuth C. G. Heterocycles, 38, 1273 (1994).
57. Kondo Y., Watanabe R., Sakamoto T., Yamanaka H. Chem. Pharm. Bull. 37, 2814 (1989); Thompson W. J.; Jones J, H, Lyle P. A., Thies J. E. J. Oig. Chem., 53, 2052 (1988); Solberg J., Undheim K. Acta Chem. Scand., 38, 1273 (1989).
58. Benneche T. Acta Chem. Scand., 44,927 (1990).
59. Majeed A. J., Antonsen O., Benneche T., Undheim K. Tetrahedron, 45, 993 (1989); Sandosham J., Undheim K. Acta Chem. Scand., 43,684 (1989); Heldmann D., K. Sauer J. Tetrahedron Lett., 38,5791 (1997).
60. PetersD., HomfeldtA.-B., GronowitzS. 3. Heterocycl. Chem., 27,2165 (1991), PetersD., Hdmfeldt A.-B., Gronowitz S., Johanssen N. G. ibid., 28, 529 (1991),
61. «Recent advances in the chemistry of dihydroazines», Weis A. L. Adv. Heterocycl. Chem., 38, 1 (1985).
62. Becker H. P., Neumann W. P. 3. Organomet. Chem., 37, 57 (1972); Bessenbacher C., Kaim W, Stahl T. Chem. Ber., 1989,122,933 (1989).
63. Gottlieb R., Pfleiderer W Justus Liebigs Ann. Chem., 1981,1451.
64. Russell J. R., Gamer C. D., Joule J. A. 3. Chem. Soc., Perkin Trans 1,1992,409.
65. «Advances in the synthesis of substituted pyridazines via introduction of carbon functional groups into the parent heterocycle», Heinisch G. Heterocycles, 26, 481 (1987).
66. Phillips О. A., Keshava, Murthy К. S., Fiakpui С. К, Knaus Е. Е. Can. J. Chem., 77,216 (1999).
67. Togo Н, Ishigami S., Yokoyama M. Chem. Lett., 1992,1673.
68. Samaritoni J. G., Babbitt G. J. Heterocycl. Chem., 28,583 (1991).
69. Houminer Y, Southwick E. W., Williams D. L. J. Org. Chem., 54, 640 (1989).
70. Carver D. R., Greenwood T. D., Hubbard J. S., Komin A. P., Sachdeva Y. P., Wolfe J. F. J. Oig. Chem., 48, 1180 (1983).
71. Hetero Diels-Alder metholodology in organic synthesis, Ch. 10, Academic Press, 1987; Stolle W. A. W., Firssen A. E., Marcelis A. T, M., van derPlasH. C. J. Org. Chem., 57, 3000(1992).
72. Boger D. L., Coleman R. S, J. Oig. Chem., 49, 2240 (1984); Neunhofler H., Werner G. Justus Liebigs Ann. Chem., 1974, 1190; Biedrzycki M., de Bie D. A., van derPlas H. C. Tetrahedron, 45,6211 (1989).
73. Dawson I. M., Pappin A. J., Peck C. J., Sammes P. G. J. Chem. Soc., Perkin Trans. 1, 1989,453.
74. Grassi G, Risitano F.t Foti F. Tetrahedron, 51,11855 (1995).
75. «Pyrimidine N-oxides: synthesis, structure and chemical properties», Yamanaka H, Sakamoto T., Niitsuma S. Heterocycles, 31, 923 (1990).
76. KocevarM., Mlakar B., Perdih M., Petrie A., Polanc S., Vercek B. Tetrahedron Lett., 33, 2195(1992).
77. Itai T., Natsume S. Chem. Pharm. Bull., 11, 83 (1963).
78. Sako S. Chem. Pharm. Bull., 11,261 (1963); Klein D., О DonnellE.t Gordon J. M. J. Org. Chem. 29,2623 (1964).
79. Ogata M. Chem. Pharm Bull., 11, 1522 (1963); Iwao M., Kuraishi T., J. Heterocycl. Chem., 15, 1425 (1978); Sato N. J. Heterocycl. Chem., 26, 81 (1986); Koelsch C. F, Gumprecht W. H. J. Org. Chem. 23, 1603 (1958).
80. Aoyagi Y., Maeda A.f Inoue M., Shiraishi M., Sakakibara Y.t Fukui Y, Ohta A. Heterocycles, 32,735 (1991).
81. Itai T., Sako S., Okusa G. Chem. Pharm. Bull., 11, 1146 (1963); Ogata M. ibid., 1517.
82. «AIDS-Driven nucleoside chemistry», Huryn P. M., Okabe M. Chem. Rev., 92, 1745 (1992).
83. «Recent progress in barbituric acid chemistry», Bojarski J. T, Mokrosz J. L., Barton H. J., Paluchowska Adv. Heterocycl. Chem., 38,229 (1985).
84. «Uracils: versatile starting materials in heterocyclic synthesis», Wamhoff H., Dzenis J., Hirota K. Adv. Heterocycl. Chem., 55, 129 (1982).
85. Johnson C. D., Katritzky A. R., Kingsland M., Scriven E. F. V. J. Chem. Soc. (B), 1971,1.
86. Lee С. H., Kim Y. H. Tetrahedron Lett., 32,2401 (1991).
87. Btrgstrom D. E, Ruth J. L. J. Caibohyd. Nucleosides, Nucleotides 4,257 (1977).
88. Skinner W. F.t Schelstraete M. G. M, BakerB. R. J. Org. Chem., 25,149 (1960) Delia T J., ScovillJ. P., Munslow W D., Burckhalter J. H. J. Med. Chem., 19,344 (1976).
89. Wang S. Y J. Oig. Chem., 24,11 (1959); Tee O. S, Banerjee S. Can. J. Chem., 52,451 (1974).
90. Whang J. P., Yang S. G., Kim Y H. Chem. Commun., 1997, 1355.
91. Ariza X., Bou V.t Vilarrasa J. J. Am. Chem. Soc., 117, 3665 (1995); Giziewicz J., Wnuk S. F, Robins M. J. J. Oig. Chem., 64,2149 (1999).
92. Saito I., Sugiyama H., Matsuura N. J. Am. Chem. Soc., 105,956 (1983).
93. Fateen A. K, Moustafa A. H., Kaddah A. M., Shams N. A. Synthesis, 1980, 457; Bischofberger N. Tetrahedron Lett., 30,1621 (1989).
94. Inoue Н, Ueda Т. Chem. Pharm. Bull., 26,2657 (1978).
95. Hirota K, Sajiki H, Maki Y., Inoue H.t Ueda T. J. Chem. Soc., Chem. Commun., 1989, 1659.
96. Lovett E, G., Lopkin D. J. Org. Chem., 42,2574 (1977)
97. Hirota K, Watanabe KA., Fox J. J. J. Org. Chem., 43,1193 (1978); Hirota К, Kitade Y, SagikiH, Maki Y. Heterocycles, 22, 2259 (1984).
98. Heddayatulla M. J. Heterocycl. Chem., 18, 339 (1977); Tanabe T, Yamauchi К. M., Kinoshita M. Bull. Chem. Soc. Jpn., 50, 3021 (1977).
99. Yamada T, OhkiM. Synthesis, 1981,631.
100. Cline R. E, Fink R. M., Fink K. J. Am. Chem. Soc., 81,2521 (1959).
101. Ottenheijm H, С. J., van Nispen S. P. J. M., Sinnige M. J. Tetrahedron Lett., 1976 1899.
102. Heibl J., ZbiralE., Balzarini J., De Clercq E. J. Med. Chem., 35, 3016 (1992); Verhey-den J. P. H., Wagner D., Moffatt J. G. J. Org. Chem., 36,250 (1971).
103. Yamauchi M., Konoshita M. J. Chem. Soc., Perkin Trans. 1,1973, 391.
104. Muller С. E. Tetrahedron Lett., 32,6539 (1991).
105. Lukevics E., Lablacka A. Nucleoside synthesis, organosilicon method, Ellis Horwood, London, 199Г, Matsuda A., Kurasawa Y., Watanabe K. Synthesis, 1981,748.
106. Jung M. E, Castro C. J. Org. Chem., 58, 807 (1992); Lipshutz В. H, Hayakawa H, Kato K, Lowe R. F, Stevens K. L. Synthesis, 1994, 1476.
107. Tanaka H, Hayakawa H, lijima S, Haraguchi K, Miyasaka T Tetrahedron, 41, 861 (1985).
108. Tanaka H, Nasu I.t Miyasaka T. Tetrahedron Lett., 21, 4755 (1979); Hayakawa H.t Tanaka H, Hayakawa H., Miyasaka T. ibid., 28, 87 (1987); Shimizu M. Tanaka H, Hayakawa H, Miyasaka T ibid., 31,1295 (1990); ArmstrongR. W.,Gupta S., Whelihah F. ibid., 30,2057 (1989).
109. Benhida R., Aubertin A.-M., Grierson D. S., Minneret C. Tetrahedron Lett., 37, 1031 (1996).
110. Murray T P, Hay J. V,, Portlock D. E, Wolfe L F. J. Org. Chem., 39,595 (1974).
111. Stevenson T. M., Prasad A. S. B., Citineni J. R., Knochel P. Tetrahedron Lett., 37, 8375 (1996); Prasad A.S.B. Citineni J. R., Knochel P. Tetrahedron, 49, 16711 (1997); Beril-lon L.t Wagner R., KnochelP. J. Org. Chem., 63,9117 (1998).
112. CoadP., Coad R. A., Clough S., Hyepock J., Salisbury R., Wilkins C. J. Org. Chem., 28,218 (1963); Ishikawa I, Khachatrian V E, Melik-Ohanjanian К G, Kawahara N, Mizuno Y, Ogura H Chem. Pharm. Bull., 40, 846 (1992); Goe G., L, Huss C. A., Keay J. G., Scriven E. F. V. Chem. Ind., 1987,694.
113. Fox J. J., van PraagD. J. Am. Chem. Soc., 82,486 (1960).
114. Sugimoto O., Mori M., TanJiK. Tetrahedron Lett., 40,7477 (1999).
115. Sato N, Narita N. J. Heterocycl. Chem., 36,783 (1999).
116. Reese С. B., Varaprasad С. V. N. S. J. Chem. Soc., Perkin Trans, 1994,189.
117. Hirota K, Suematsu M.t Kuwabara Y., Asao T., Senda S. J. Chem. Soc., Chem. Commun., 1981,623.
118. Candiani I., Cabri W., Bedeschi A., Martinengo T, Penco S. Heterocycles, 34, 875 (1982).
119. Peters D., HomfeldtA.-B., GronowitzS. J. Heterocycl. Chem., 28,1613 91991).
120. Malm J. Bjork P., Gronowitz S., Homfeldt A.-B. Tetrahedron Lett., 33,2199 (1992).
121. Kobayashi Y., Yamamoto K, Asai T., Nakano M., Kumadaki I. J. Chem. Soc., Perkin Trans. 1,1980.2755.
122. Palmisano G, Santagostino M. Tetrahedron, 49,2533 (1993).
123. Bergstrom D. E., Ogawa M. K. J. Am Chem. Soc., 100, 8106 (1978).
124. Hirota К., Isobe Y, Kitade Y., Maki Y. Synthesis, 1987,495.
125. Yates N. D.t Peters D. A. Beddoes R. L., Scopes D. I. C.t Joule J. A. Heterocycles, 40,331 (1995).
126. Nischio T., Nakajima N., Omote Y. Tetrahedron Lett., 22,753 (1981).
127. Zhuo J.-C., Wyler H. Helv. Chim. Acta, 76,1916 (1993).
128. «Chemical investigations of the molecular origin of biological radiation damage», Fahr E. Angew. Chem., Int. Ed. Engl. 8, 578 (1969).
129. Bergstrom D. E., Agosta W. C. Tetrahedron Lett., 1974,1087.
130. Itahara T, Ide N. Bull. Chem. Soc. Jpn., 65,2045 (1992).
131. Kim J. N., Ryu E. K. J. Org. Chem., 57, 1088 (1992).
132. Nishio T., Katahira K., Kato A., Kashima C., Omote Y. Tetrahedron Lett., 1979, 4211; Nischio T. Justus Liebigs Ann. Chem., 1992,71.
133. Hirokami S., Takahashi T.f Kurosawa K, Nagata M., Yamazaki T. J. Org. Chem., 50,166 (1985).
134. Lahmani E, IvanqffN. Tetrahedron Lett., 1967,3913.
135. Brown D. J., HoergerE., Mason S. F. J. Chem. Soc., 1955,4035; Perrin D. D., Pitman I. H. ibid., 1965,7071.
136. Kogon I. C., Minin R., Overberger C. G., Org. Coll., Vol. IV, 1963 182.
137. English J. P., Clark J. H, Clapp J. W., Seeger D., Ebel R. H. J. Am. Chem. Soc., 68,453 (1946); Sato N.t Takeuchi R. Synthesis, 1990,659.
138. Maggiolo A., Hitchings G. H. J. Am. Chem. Soc., 73,4226 (1951).
139. LythgoeB., Todd A. R., Topham A. J. Chem. Soc., 1944, 315.
140. Bergmann E, Kalmus A., Ungar-Waron H, Kwietny-Govrin H. J. Chem. Soc., 1963, 3729.
141. Miiller С. E. Synthesis, 1993,125.
142. Mizzoni R. H, Spoerri P. E. J. Am. Chem. Soc., 76,2201 (1954); Holland A. Chem. Ind., 1954, 786; Kamal M. R., Levine R., ibid., 27, 1355 (1962); Ohsawa A., Abe Y, Igeta H. Chem. Pharm. Bull., 26, 2550 (1978); Overberger C. G, Kogon I. C. J. Am. Chem. Soc., 76, 1879 (1954); BredereckH, Simchen G. Angew. Chem., 75, 1102 (1963); Sakamoto T, Yoshizawa H, Yamanaka H. Chem. Pharm. Bull., 32,2065 (1984); «Methylpyridines and other methylazines as precursors of bicycles and polycycles», Abu-Shanab F. A., Wakefield B. J., Elnagdi M. H. Adv. Heterocycl. Chem., 68,181 (1997).
143. Yamanaka H, Abe H, Sakamoto T. Chem. Pharm. Bull., 25, 3334 (1977).
144. Strekowski L., Wydra R. L., Janda L., Harden D. B. J. Org. Chem., 56, 5610 (1991).
145. Itoh T., Hasegawa H Nagata K., Matsuya Y., Ohsawa A. Heterocycles, 37, 709 (1994); Itoh T, Hasegawa H, Nagata K, Matsuya Y., Okada M., Ohsawa A. Chem. Pharm. Bull., 42,1768 (1994).
146. Itoh T, Miyazaki M., Nagata K, Ohsawa A. Heterocycles, 49,67 (1998).
147. Itoh T, Miyazaki M., Nagata K, Ohsawa A. Heterocycles, 46, 83 (1997).
148. Veeraraghavan S., Bhattacharjee D., Popp F. O. J. Heterocycl. Chem., 18, 443 (1981); Dostal W. Heinish G. Heterocycles, 24,793 (1986).
149. Overend W. G, Wiggins L. F. J. Chem. Soc., 1947,239.
150. Albright J. D., McEvoy F. J., Moran D. B. J. Heterocycl. Chem., 15, 881 (1978).
151. Coates W J., McKillopA. Synthesis, 1993, 334.
152. Steck E. A., Brundage R. P., Fletcher L. T. J. Am. Chem. Soc., 75, 1117 (1953).
153. Altomare C., Cellamare S., Summo L., CattoM., CarottiA., Thull U, Corrupt P. A., Testa B., Stoeckli-Evans H J. Med. Chem., 41, 3812, (1998).
154. Mizzoni R. H, Spoerri P. E. J. Am. Chem. Soc., 73,1873 (1951); HomingR H, Amstutz E. D. J. Oig. Chem., 20,707 (1956); Atkinson С. M., Sharpe C. J. J. Chem. Soc., 1959,3040.
155. LutzR.E., KingS. M. J. Org. Chem., 17,1519 (1952).
156. Clauson-Kaas N., Limborg F. Acta Chem. Scand., 1, 619 (1947).
157. MarcelisA. T. M., van derPlasH. C. Heterocycles, 23,683 (1985); BirkoferL., Hansel E. Chem. Ber., 114, 3154 (1981); Boger D. L., Patel M. J. Org. Chem,, 52, 1405 (1988); Sakamoto T, Funami N.f Kondo Y., Yamanaka H. Heterocycles, 32, 1387 (1991).
158. Haddadin M. J. Firsan S. J., Nader B. S. J. Org. Chem., 44,629 (1979).
159. South M. S, Jakuboski T. L,, Westmeyer M. D., Dukesherer D. R. J. Org. Chem., 61, 8921 (1996).
160. Nakayama J., Hasemi R., Yoshimura K, Sugihara K, Yamaoka S., Nakamura N. J. Oig. Chem., 63,4912 (1998).
161. AlDulayymiA. R., BairdM. S. Tetrahedron, 54, 12897 (1988); DehmlowE. V., Ud-din N. J. Chem. Res. (S), 1978,40.
162. Kenner G. W., LythgoeB., Todd A. R., Topham A. J. Chem. Soc., 1943, 388.
163. Burgess D. M. J. Oig. Chem., 21, 97 (1956); Van Allan J. A. Org. Synth., Coll. Vol. IV, 1963,245.
164. Sherman W. R., Taylor E. C. Org. Synth., Coll. Vol. IV, 1963,247.
165. FosterH.M.,SnyderH.R.Oig.Synth.,Coll.Vol.IV, 1963,638; Crosby D. G.,BerthokdR. V., Johnson H. E. ibid., Vol. V, 1973,703.
166. Bredereck H., Gompper R., Morlock G. Chem. Ber., 90, 942 (1957); Bredereck H, GompperR., HerlingerH. Chem. Ber. 91, 2832 (1958).
167. PapetA.-L., MarsuraA. Synthesis, 1993,478.
168. Davidson D., Baudisch O. J. Am. Chem. Soc., 48,2379 (1926); HuntR. R., McOmie J. F. W., Sayer E. R. J. Chem. Soc., 1959, 525; Maggiolo A., Phillips A. P., Hitchings G. H. J. Am. Chem. Soc., 73 106 (1951); Kenner G. W., Lythgoe B., Todd A. R., Topham A. J. Chem. Soc., 1943, 388.
169. Bredereck H., Effenberger F., Schweizer E. H. Chem. Ber., 95, 803 (1962).
170. Takagi K., Bajnati A., Hubert-Habert M. Bull. Soc. Chim Fr., 1990, 660.
171. Ziegenbein W., Franke W. Angew. Chem., 71, 628 (1959).
172. Bredereck H., HerlingerH., Renner]. Chem. Ber., 93,230 (I960); BredereckH, HerlingerH, Schweizer E. H. ibid., 1208; Mosti L., Menozzi G., Schenone P. J. Heterocycl. Chem., 20, 649(1983).
173. Gupton J. T, Gall J. E., RiesingerS. W., Smith S. O., Bevirt К. M., Sikorski J. A., Dahl M. L ArnoldZ. J. Heterocycl. Chem., 28, 1281 (1991).
174. De Pasquale R. J. J. Oig. Chem., 42,2185 (1977).
175. Butters M. J. Heterocycl. Chem., 29 1369 (1992).
176. Reichardt C., SchagererK. Justus Liebigs Ann. Chem., 1982, 530.
177. Ch. II in «о-Aminonitriles», Taylor E. C., McKillop A. Adv. Oig. Chem., 7,79 (1970);
178. «Heterocyclic p-enaminoesters, versatile synthons in heterocyclic synthesis», WamhoffH. Adv. Heterocycl. Chem., 38, 299 (1985).
179. Dickey J. B., Gray A. R. Oig. Synth., Coll. Vol. II, 1943,60.
180. Shimo K, Wakamatsu S. J. Oig. Chem., 24, 19 (1959).
181. Boger D. L., Schumacher J., Mullican M. D., Patel M. Panek J. S. J. Oig. Chem., 47,2673 (1982); Boger D. L., Menezes R. F. ibid., 57,4331 (1992).
182. Shaw G., WarrenerR. N. J. Chem. Soc., 1958,157.
183. Hronowski L. J. J., Szarek W. A. Can J. Chem., 63,2787 (1985).
184. Martinez A. G., Fernandez A. H, Jimenez F. M., FraileA. G., Subramanian L. R., Hanack M. J. Oig. Chem., 57,1627 (1982); Herrera A., Martinez R., Gonzalez B., Illiscas B. Martin N., Seoane C. Tetrahedron Lett., 38,4873 (1997).
185. BirkoferL. Chem. Ber., 80, 83 (1947).
186. Blake К W., Porter A. E. A., Sammes P. G. J. Chem. Soc., Perkin Trans. 1,1972, 2494.
187. Flament I., Stoll M. Helv. Chim. Acta, 50, 1754 91967).
188. RophkopfH. W.t Wohrle D., Muller R., Kossmehl G. Chem. Ber., 108, 875 (1975).
189. BranburyR. H, Griffiths D.f RivettJ. E. Heterocycles, 31, 1647 (1990).
190. Muehlmann F. L., Day A. R. J. Am. Chem. Soc., 78,242 (1956).
191. Weijlard J., TishlerM., Erickson A. E. J. Am. Chem Soc., 67, 802 (1945).
192. Nakayama J., Konishi T., Ishii A., Hoshino M. Bull. Chem. Soc. Jpn., 62,2608 (1989).
193. Todd A, R., BergelF. J. Chem. Soc., 1937,364.
194. Herdewijn P., De Clerq E., Balzarini J., Vandehaeghe H. J. Med. Chem., 28,550 (1985).
195. Jones K.r Keenan M., Hibbert E Synlett, 1996, 509; Keenan M., Jones K> Hibbert E Chem. Commun., 1997, 232.
196. Buchi G, Galindo J, J. Org. Chem., 56,2605 (1991).
197. Pteridine Chemistry, Pfleiderer W., Taylor L. C. (Eds.), Pergammon Press, London, 1964; «Pteridines. Properties, reactivities and biological significance», Pfleiderer W. J. Heterocycl. Chem., 29,583 (1992).
198. Обзор см.: J. Biol. Inoig. Chem., 2,772,773,782,786,790,797,804,810,817 (1997).
199. Waring P.f Armarego W. L. E Aust. J. Chem., 38,629 (1985).
200. Taylor E, C., Perlman К L.t Sword IP., Sequin-Frey M., Jacobi P. A. J. Am. Chem. Soc., 29,3610(1973).
201. Cook A. H., Heilbron L, Smith E. J. Chem. Soc., 1949,1440.
12
ОБЩАЯ ХАРАКТЕРИСТИКА РЕАКЦИОННОЙ СПОСОБНОСТИ
ПИРРОЛОВ, ТИОФЕНОВ И ФУРАНОВ
В этой главе рассмотрены общие принципы реакционной способности пятичленных гетероциклических соединений — пирролов, тиофенов и фуранов, а также приведен сравнительный анализ реакционной способности представителей этого класса гетероциклических соединений.
реакционной способности пиррола, фурана и тиофена
образование циклоаддуктов в реакции с диенофилами
восстановительное удаление атома серы (для тиофенов)
Общая характеристика введение заместителя в a-положение с использованием а-литиевого производного
Н
пиррил-анион введение заместителя к
атому азота пиррола с использованием пиррил-аниона
легкое электрофильное замещение преимущественно по a-положению, также легко протекающее и по (3- пол ожени
Основу химии пиррола, тиофена и фурана определяет способность этих соединений с легкостью вступать в реакции электрофильного замещения, преимущественно по a-положению. Электрофильное замещение по р-положению протекает менее легко и обычно в том случае, если a-положения заняты заместителями. На начальном этапе изучения химии гетероциклических соединений следует особо обратить внимание на существенное различие в реакционной способности пяти- и шестичленных гетероциклических соединений: первые реагируют с электрофилами легче, чем бензол, тогда как последние гораздо сложнее.
интермедиаты, образующиеся в результате атаки электрофила
по а-положению
интермедиаты, образующиеся в результате атаки электрофила по 0-положению
Региоселективность в реакциях пятичленных гетероциклических соединений с электрофилами, а также высокая реакционная способность гетероциклических соединений этого класса в таких реакциях, может быть объяснена при
рассмотрении интермедиатов Виланда (родственных переходным состояниям, ведущим к их образованию). Присоединение электрофильной частицы как по а-, так и по p-положению приводит к образованию стабилизированных катионов (показано на схеме для пиррола). Делокализация положительного заряда с участием электронов гетероатома в большей степени проявляется в интермедиатах, образующихся при атаке электрофила по a-положению, что наглядно демонстрируется большим числом низкоэнергетических резонансных форм. Следует также отметить, что в интермедиатах, образующихся при атаке электрофила по p-положению, резонансная стабилизация с участием двойной связи углерод — углерод невозможна.
При сравнении реакций с электрофилами пиррола и анилина легко обнаружить сходство их реакционных способностей
Пятичленные гетероциклические соединения не реагируют с электрофилами по гетероатому. Для начинающего изучать химию гетероциклических соединений этот факт может показаться удивительным. Действительно, как можно было бы ожидать, неподеленная электронная пара атома азота в пирроле должна легко взаимодействовать с электрофилами, как это происходит в случае пирролидина, полностью насыщенного аналога пиррола. Различие заключается в том, что присоединение электрофильной частицы по атому азота пиррола приводит к существенной потере в резонансной стабилизации — молекула превращается при таком взаимодействии в циклический бутадиен с присоединенным атомом азота и ктому же с локализованным положительным зарядом. С учетом этого аналогия с анилином теряет всякий смысл, и действительно анилины легко реагируют с простыми электрофилами (например, протоном) по атому азота. Существенное различие заключается в том, что хотя при взаимодействии электрофила с атомом азота анилина и происходит некоторая потеря в стабилизации, связанной с перекрыванием неподеленной электронной пары азота с бензоидной л-электронной системой, сама бензоидная л-система остается неизменной.
Из пятичленных гетероциклических соединений (пиррол, фуран, тиофен) пиррол наиболее подвержен реакциям с электрофилами, что связано с большей электронодонорной способностью нейтрального трехвалентного атома азота, а также с большей стабильностью положительно заряженного четырехвалентного атома азота. Этот факт находит простое подтверждение при сравнении относительной основности насыщенных аминов, сульфидов и эфиров. Ряд основности прекрасно иллюстрирует относительную реакционную способность пиррола, фурана и тиофена по отношению к атаке электрофила по атому углерода и спо-
собность соответствующего гетероатома стабилизировать образующиеся при этом интермедиаты за счет электронодонорной способности.
рКа +10,4
Количественно большую реакционную способность пиррола по сравнению с реакционными способностями фурана и тиофена можно проиллюстрировать большой скоростью реакции пиррола с катионом фенилдиазония и азотистой кислотой; ни фуран, ни тиофен в реакцию с этими электрофилами не вступают. Важно также отметить, что NjN-диметиланилин тоже легко реагирует с этими электрофильными реагентами, а анизол не реагирует.
Заместители, уже имеющиеся в пятичленном гетероциклическом кольце, так же, как и в случае замещенных бензолов, обладают определенным ориентирующим действием. Например, алкильные группы способствуют атаке электрофила по орто- и шрд-положениям, нитрогруппа — по л/едтш-положению, хотя, строго говоря, эти термины не могут быть применены в случае пятичленных гетероциклических соединений. Склонность к преимущественному замещению по «-положению доминирует над направляющим влиянием заместителей во многих случаях, а продукты реакции замещения, образование которых обусловлена таким влиянием, обычно являются минорными по сравнению с продуктами замещения по свободному a-положению. Направляющее влияние заместителей менее всего проявляется в случае фурана.
минорный преимущественный
минорный
> о/л-ориентант
мета-ориентант
А
о/л-ориентант z мета-ориентант zXxx.
г t- Jf- Z X х z
преимущественный минорный минорный преимущественный преимущественный
Существенное отличие реакций фурана с электрофильными реагентами состоит в том, что при этом иногда образуются продукты 2,5-присоединения. Образование таких продуктов инициируется первоначальной электрофильной атакой по a-положению, приводящей к обычному интермедиату Виланда, который в дальнейшем при наличии реакционноспособного нуклеофила не теряет протон, а превращается в продукт 2,5-присоединения. Обычно подбором определенных условий проведения реакции можно добиться образования «нормального» продукта а-замешения. Эта особенность реакций фурана с электрофилами связана с низкой энергией резонансной стабилизации для фурана, что и определяет меньшую склонность интермедиата, образующегося в результате первоначального присоединения электрофильной частицы к фурану, восстанавливать ароматическую систему фурана в результате потери протона.
возможно иногда образование продукта 2,5-присоединения для2 = 0
Z= NR илиЭ
Пониженный ароматический характер фурана проявляется также в большей по сравнению с другими пятичлеными гетероциклическими соединениями, такими, как пиррол и тиофен, склонности фурана вступать в реакции Дильса-Альдера в качестве диена. Пиррол и тиофен также могут участвовать в качестве диенов в реакции Дильса—Альдера, однако для успешного проведения таких реакций требуется либо повышенное давление, либо необходимо «понизить» ароматический характер цикла введением электроноакцепторной группы к атому азота пиррола.
В противоположность электронодефицитным шестичленным гетероциклическим соединениям, подобным пиридину и диазинам, для пятичленных гетероциклических соединений не характерны реакции нуклеофильного замещения, за исключением тех случаев (особенно характерных для производных фурана и тиофена), когда атом галогена расположен в орто- или лдрд-положении по отношению к нитрогруппе. Для синтеза различных производных пятичленных гетероциклических соединений этой группы широко используются различные реакции сочетания, катализируемые палладием(О), как продемонстрировано ниже (см. разд. 2.7, где детально обсуждены такие процессы).
Чрезвычайно важное значение для синтеза различных производных пиррола, тиофена и фурана имеют реакции депротонирования. Фуран и тиофен депротонируются такими сильными основаниями, как я-бутиллитий и диизо-пропиламид лития, и при этом образуется а-анион, поскольку атом водорода в этом положении обладает подвижностью вследствие индуктивного электроноакцепторного влияния гетероатома. Полученный таким образом анион способен реагировать с самыми разнообразными электрофилами с образованием а-замещенных фуранов и тиофенов. Эта методология существенно расширяет возможность использования процессов электрофильного замещения в синтезе различных производных фуранов и тиофенов, поскольку позволяет получать исключительно а-замещенные соединения, а также использовать даже слабые электрофильные реагенты. Использование металлированных N-замещенных пирролов также обеспечивает ценный синтетический подход к различным а-за-мещенным пирролам. При отсутствии заместителя при атоме азота депротонирование пиррола приводит к пиррил-аниону, который обладает нуклеофильными свойствами, и при его взаимодействии с электрофильными реагентами образуются производные индола, замещенные по атому азота.
Возможность взаимодействия электронодонорного гетероатома с положительным зарядом, локализованным в боковой цепи, особенно в a-положении цикла, обеспечивает ряд эффектов, наиболее важный из которых заключается в увеличении реакционной способности уходящей группы, расположенной в боковой цепи.
Подобное влияние гетероатома сказывается на карбонильных группах в ос-положениях; приведенные резонансные структуры объясняют в некоторой степени меньшую активность карбонильных групп в таких соединениях.
Пятичленные гетероциклические соединения гораздо менее стабильны в окислительных условиях, чем бензоидные соединения, за исключением тиофенов; вообще тиофены по своим свойствам наиболее близки к карбоароматиче-ским соединениям. Гидрирование тиофенов, в особенности с использованием никелевых катализаторов, приводит к восстановлению и удалению гетероатома. Для пирролов и фуранов известны некоторые контролируемые процессы восстановления, приводящие к образованию дигидропроизводным.
Методы синтеза пятичленных гетероциклических соединений интенсивно разрабатывались, что привело к созданию большого многообразия, в том числе и тонких, синтетических подходов. Каждый из представителей рассматриваемого класса гетероциклических соединений может быть получен из 1,4-дикарбо-нильных соединений в результате либо катализируемой кислотой циклодегидратации (в случае фурана), либо взаимодействия с аммиаком, первичными аминами или источником серы (в случае пиррола и тиофена соответственно).
R5
В качестве иллюстрации многообразия методов синтеза пятичленных гетероциклических соединений приведем три представленных ниже процесса: присоединение изонитрила к а,р-непредельному нитросоединению с последующим элиминированием азотистой кислоты; использование реакции эфиров тиогликолевой кислоты с 1,3-дикарбонильными соединениями для получения эфиров тиофен-2-карбоновых кислот; превращение изоксазола в фуран в результате реакции циклоприсоединения с последующей циклореверсией.
13
ПИРРОЛЫ:
РЕАКЦИИ И МЕТОДЫ СИНТЕЗА
н
пиррол [1Н-пиррол]
Пиррол [1] и простые алкилпирролы представляют собой бесцветные жидкости с относительно слабым запахом, напоминающим запах анилина, которые так же, как и анилины, темнеют в результате самопроизвольного окисления. Пиррол сам по себе коммерчески доступен и получается в промышленности газофазной реакцией фурана и аммиака, катализируемой оксидом алюминия. Впервые пиррол был выделен из каменноугольной смолы в 1834 г. и затем в 1857 г. получен в результате сухой перегонки костной муки; последний процесс аналогичен используемому ранее лабораторному методу синтеза пиррола, осно-ваному на сухой перегонке аммонийной соли слизевой кислоты. Само слово «пиррол» происходит от греческого «красный», это связано с тем, что пиррол придает яркую красную окраску сосновым стружкам, смоченным в концентрированной соляной кислоте.
Первоначальные исследования в области химии пиррола были связаны с деградацией двух важных пигментов: гема — пигмента крови, обеспечивающего процесс дыхания, и хлорофилла — зеленого пигмента растений, ответственного за процесс фотосинтеза [2] Разложение этих пигментов привело к получению смеси алкилпирролов. Хлорофилл и гем синтезируются в живой клетке из порфобилиногена, причем только ароматические пирролы играют черезвычайно важную роль в основном метаболизме [3,4J.
порфобилиноген
В конечном итоге все жизненные процессы на земле связаны с процессом включения атмосферного диоксида углерода в углеводы. Этот процесс, называемый фотосинтезом, требует больших энергетических затрат и источником энергии для него служит солнечный свет. На первой стадии этого сложного процесса проиходит поглощение фотона пигментами, причем в многоклеточных растениях ключевую роль на этой стадии играет хлорофилл-^. Энергия фотонов впоследствии превращается в химическую энергию, которая использу
ется для связывания атомов углерода, включенных в молекулы диоксида углерода, что в конце концов сопровождается высвобождением кислорода. Таким образом в качестве побочного продукта в этом процессе выделяется молекулярный кислород, обеспечивающий эволюцию всех аэробных организмов, в том числе и человека.
Et но2С'
н.
МеО2С"'
О хлорофилл-а
Гемоглобин переносит кислород от легких в сеть артериальных кровеносных сосудов млекопитающих и состоит из белка глобина, связанного с простатической группой — пигментом гемом. Чрезвычайно близкое структурное родство гема и хлорофилла поразительно и дает возможность предположить их общее эволюционное происхождение. В окисленном гемоглобине присутствует шестикоординированное железо(И), которое связано с атомом азота имидазольного фрагмента белка гистидина, расположенного с одной стороны плоскости макроцикла, и молекулярным кислородом, находящимся с другой стороны. Гем без железа(П) называется протопорфирином IX, а незамещенный макроцикл называется порфирином. Гем также входит в состав цитохромов [5] — ферментов, обеспечивающих перенос электронов.
центральная часть \\ -
окисленного гемоглобина n \
белок
Витамин В и [6] также представляет собой производное порфобилиногена, однако, хотя его строение родственно хлорофиллу и гему, существуют определенные отличия. Соответствующий незамещенный макроцикл называется кор-рином.
Кеторолак обладает анальгетическим и противовоспалительным действием и эквивалентен сульфату морфина по своей способности облегчать послеоперационные боли. Аторвастатин используется для понижения уровня холестерина.
13.1. РЕАКЦИИ С ЭЛЕКТРОФИЛЬНЫМИ РЕАГЕНТАМИ [7]
В то время как пиррол и его производные не склонны к реакциям нуклеофильного присоединения и замещения, они очень чувствительны к электрофильным реагентам, и реакции пирролов с такими реагентами протекают практически исключительно как реакции замещения. Незамещенный пиррол, N- и С-моно-алкилпирролы и в наименьшей степени С,С-диалкилпроизводные полимеризуются в сильнокислых средах, поэтому большинство электрофильных реагентов, использующихся в случае производных бензола, не применимы для пиррола и его алкилпроизводных. Однако при наличии в пиррольном цикле электроноакцепторных групп, препятствующих полимеризации, например, таких, какслоЖ' ноэфирная, становится возможным использование сильнокислых сред, нитрующих и сульфирующих агентов.
13.1.1. Протонирование
В растворе наблюдается обратимое присоединение протона по всем положениям пиррольного цикла. Наиболее быстро протонируется атом азота, присоединение протона по положению 2 проходит в два раза быстрее, чем по положению 3 [8]. В газовой фазе при использовании кислот умеренной силы, таких, как СЩ/ и NH4+, пиррол протонируется исключительно по атомам углерода, причем склонность к присоединению протона по положению 2 выше, чем по положению 3 [9]. Наиболее термодинамически стабильный катион — 2Н-пир-ролиевый ион — образуется при присоединении протона по положению 2 и определяемое значение рК&ддя пиррола связано именно с этим катионом. Сла
бая N-основность пиррола обусловлена отсутствием возможности для мезомер-ной делокализации положительного заряда в 1Н-пирролиевом катионе.
2Н-пирролиевый катион ЗН-пирролиевый катион (наиболее стабильный)
1Н-пирролиевый катион (наименее стабильный)
Значение рК определено для большого числа производных пиррола [10], а сам незамещенный пиррол — чрезвычайно слабое основание со значением рАа -3,8. Так, в растворе 1 н. кислоты с концентрацией пиррола 0,1 моль/л на одну протонированную молекулу пиррола приходится 5000 непротонированных молекул. Основность пиррольного цикла весьма быстро увеличивается при введении алкильных заместителей, и для 2,3,4,5-тетраметилпиррола рД равен +3,7, что соответствует полному протонированию всех молекул пиррола в вышеприведенных условиях (для сравнения pJQ анилина +4,6). Таким образом, алкильные группы оказывают необычайное стабилизирующее влияние на катионы — пирролы, содержащие мре/л-бутильные группы, при протонировании образуют
стабильные кристаллические соли [11].
стабильная кристаллическая соль
2,4-ди-трет-бутилпиррола
13.1.1. Реакции протонированных пирролов
2Н- и ЗН-Пирролиевые катионы в сущности представляют собой иминиевые ионы и, следовательно, обладают свойствами электрофилов. Эти катионы играют ключевую роль в процессах полимеризации (разд. 13.1.8) и восстановления (разд. 13.8) пирролов в присутствии кислот. При взаимодействии пирролов с гидрохлоридом гидроксиламина, сопровождающимся раскрытием цикла и образованием 1,4-диоксимов, вероятно, образуется более реакционноспособный ЗН-пирролиевый катион [12]. Для защиты аминогруппы первичных аминов могут быть превращены в 1-К-2,5-диметилпирролы (разд. 13.18.1.1), затем защитная группа может быть удалена с помощью описанной выше реакции с гидроксиламином [13].
13.1.2. Нитрование
Нитрующую смесь, применяемую для нитрования производных бензола, нельзя использовать в случае пиррола, поскольку это приводит к его полному разложению. Однако нитрование пиррола возможно при использовании ацетилнит-рата при низких температурах, причем преимущественно образуется 2-нитро-пиррол. Ацетилнитрат получают при смешивании дымящей азотной кислоты с уксусным ангидридом, и в результате образуется уксусная кислота и достигается удаление сильной минеральной кислоты. При нитрование пиррола с использованием ацетилнитрата активность положения 2 в 1,3 • 105, а положения 3 в 3 • 104 раза выше активности бензола [14].
AcONO2
АсОН, -10 *С
64%
Введение заместителя к атому азота увеличивает долю продукта нитрования по положению 3 в смеси продуктов реакции: так, введение метильного заместителя обусловливает получение смеси продуктов £- и а-нитрования в соотношении 1:3. Более объемная wpe/л-бутильная труппа приводит даже к обращению относительной реакционной способности — продукты р- и а-нитрования образуются в соотношении 4:1 [15]. Полного подавления реакции нитрования по a-положению пиррола можно достигнуть при введение к атому азотатриизопропилсилильной (TIPS) группы; использование последней чрезвычайно важно при синтезе 3-производных, так как впоследствии она может быть легко удалена [16].
Cu(NO3)2
Ас2О, 20'С
77%
SiZ-Ргз
Bu4N* F ~
THF, 20 *С
100%
13.1.3. Сульфирование и реакции с использованием других серосодержащих электрофильных реагентов
Для сульфирования пирролов используются мягкие сульфирующие агенты, не обладающие свойствами кислоты; так, комплекс пиридин — триоксид серы мягко превращает пиррол в пиррол-2-сульфонат [17].
Реакции с использованием других серосодержащих электрофильных реагентов, например сульфинилирование пиррола [18], тиоцианирование пиррола [19] и 1-фенилсульфонилпиррола [20], позволяют получать серосодержащие производные пиррола с атомом серы в более низкой степени окисления.
Катализируемая кислотой перегруппировка производных пиррола, содержащих серосодержащий заместитель в a-положении (продукт кинетически контролируемого электрофильного замещения), позволяет получать соответствующие 0-изомеры [20,21] (см. также разд. 13.1.5). Вышеприведенная схема иллюстрирует возможный механизм такого превращения, хотя в результате исследований аналогичных перегруппировок арилтиоиндолов был обнаружен более сложный характер процесса [22].
13.1.4. Галогенирование
Галогенирование пиррола протекает настолько легко, что, если специальным образом не контролировать течение реакции, образуются исключительно стабильные тетрагалогенопроизводные [23]. Попытки провести моногалогенирование простых алкилпирролов оказались безуспешными, поскольку при этом образуются чрезвычайно реакционноспособные пиррилалкилгалогениды (разд. 13.12) — продукты галогенирования боковой цепи.
2-Бром- и 2-хлорпирролы — нестабильные соединения, которые можно получить прямым галогенированием пиррола [24]. Использование 1,3-дибром-5,5-диметилгидантоина в качестве бромирующего агента приводит к образованию 2-бром- и 2,5-дибромпирролов; продукты бромирования стабилизируют
немедленным превращением в N-трет-бутил оксикарбонил ьные производные [25]. Бромирование N-wpe/и-бутилоксикарбонилпиррола с использованием N-бромсукцинимида приводит к 2,5-дибромпроизводному [26].
оч
Оу—NBr AIBN (Вос)2О /—\ r—\ NBS Г,—а
X Qthf.-78-.о-с
Н Вг Вос Вос Вос
При монобромировании и моноиодировании N-триизопропилси-лилпиррола образуются практически исключительно 3-галогенозамещенные пирролы, а использование двух эквивалентов N-бромсукцинимида позволяет получить 3,4-дибромпроизводное [16,27].
Si/-Pr3
2NBS
THF, -78 ‘С
78%
Si/-Pr3
1 NBS
THF, -78 ’CL
90% *
SiAPr3
13.1.5. Ацилирование
Прямое ацетилирование пиррола уксусным ангидридом при 200 “С приводит к образованию 2-ацетилпиррола с примесью небольшого количества 3-ацетилпи-рола; N-ацетилпиррол в этих условиях вовсе не образуется [28]. N-Ацетилпир-рол можно получить с высоким выходом при нагревании пиррола с N-ацетили-мидазолом [29]. Алкильные заместители облегчают процесс ацилирования по атому углерода: так, 2,3,4-триметилпиррол превращается в 5-ацетилпроизвод-ное даже при кипячении в уксусной кислоте. Более реакционноспособные трифторуксусный ангидрид и трихлорацетилхлорид реагируют с пирролом даже при комнатной температуре с образованием продуктов 2-ацилирования, которые в результате гидролиза или алкоголиза обеспечивают удобный синтетический подход к пиррол-2-карбоновым кислотам или их эфирам [30]. Сильные электроноакцепторные заместители (мелш-ориентирующие труппы) в ос-поло-жении пиррольного кольца склонны, изменять присущую пирролу региоселективность в реакциях электрофильного замещения — последующее замещение протекает по положению 4, а не по свободному а-положению [31].
Ацилирование пиррола в условиях реакции Вильсмейера [32,33] и особенно формилирование с использованием диметилформамида и фосфорилхлорида, нашли широкое применение [34]. Как показано ниже, фактически действующей электрофильной частицей в этом процессе служит К^-диалкилхлорметилен-
иминиевый катион [35]. В этом случае при наличии у атома азота пиррола объемного заместителя также наблюдается обращение свойственной пирролу реги-оседективности: так, форматирование N-тритилпиррола приводит к смеси а- и p-формилпроизводных в соотношении 1:2,8, в то время как при трифторацети-лировании такого производного пиррола образуется исключительно р-изомер [36]. Использование объемной N-силильной группы и последующее ее удаление позволяют получать 3-ацилпирролы [37]. Электрофильная частица, образующаяся при взаимодействии диметилформамида с фосфорилхлоридом, достаточно объемна, что способствует увеличению доли продукта формилирования по p-положению в случае N-замещенных пирролов [38]. Иминиевая соль, промежуточно образующаяся при формилированиии в условиях реакции Вильсмейе-ра, перед гидролизом может быть использована в последующей реакции электрофильного замещения в условиях реакции Фриделя-Крафтса. Поскольку иминиевый заместитель обладает сильным jwewrz-ориентирующим действием, вторичное электрофильное замещение протекает по положению 4, что приводит в конечном итоге к 2,4-диацилированным пирролам [39]. При использовании в реакции Вильсмейера циклических амидов гидролиз не происходит и образуются циклические имины [40].
Ацилирование 1-фенилсульфонилпиррола вследствие наличия электроноакцепторного заместителя при атоме азота требует более жестких условий — обычно использования кислоты Льюиса в качестве катализатора; региоселек-тивность атаки электрофила зависит от катализатора и, особенно, от ацилирующего агента [41]. При катализе более слабыми кислотами Льюиса наблюдается увеличение доли продукта a-замещения. Зависимость региоселекгивности реакции ацилирования в условиях Фриделя—Крафтса от силы используемой кислоты Льюиса наблюдается также в случае производных пиррола, содержащих электроноакцепторные (стабилизирующие) группы при атоме углерода, как, например, в случае эфиров пирролкарбоновых кислот [42]. Ацилирование 3-ацилпирролов, легко получаемых в результате гидролиза 1-фенил-сульфонил-3-ацилпиролов, приводит к образованию 2,4-диацилированных пирролов [43], а формилирование метилового эфира пиррол-2-карбоновой кислоты — к 5-формильному производному [44]. Для получения пиррол-3-карбоновой кислоты можно эффективно использовать два метода: первый за-
ключается в окислении З-ацетил-1-фенилсульфонилпиррола [45], а второй — в гидролизе 1-тритил-З-трифторацетилпиррола и последующем удалении тритильной группы.
Br2, NaOH, 10 *С
Ac Q AcCI, AICI3 Z^Me затем
Me BF3> EtgO, 20 'С п u CI(CH2)2CI, 20 *С Ии 5 н. водн. NaOH, 83% 93% **
_ N N
SO2Ph ° SO2Ph SO2Ph
78%
’№ Н
СО2н
13.1.6. Алкилирование
Моноалкилпроизводные пиррола (по атому углерода) не удается получить прямой реакцией пиррола с алкилгалогенидами как в результате катализируемого кислотой Льюиса алкилирования, так и в отсутствие катализатора. Пиррол не вступает в реакцию с метилиодидом при температурах ниже 100 “С, однако при температурах выше 150 “С в результате серии превращений образуется сложная смесь, состоящая главным образом из продуктов полимеризации и некоторого количества полиметилированных производных пиррола. Более реакционноспособный аллилбромид реагирует с пирролом при комнатной температуре, однако в результате этого взаимодействия образуется смесь различных аллилпирролов (от моно- до тетразамещенных) одновременно с продуктами олигомеризации и полимеризации. Наиболее гладко пиррол моноалкилируется сопряженными енонами, содержащими уходящую группу в р-положении [46].
PhSOCH=CHCOMe 20-С
98%
н н
13.1.7. Конденсация с альдегидами и кетонами
Конденсация пиррола с альдегидами и кетонами протекает легко при катализе кислотами, однако образующиеся при этом пирролилкарбинолы обычно не могут быть выделены, поскольку в условиях реакции конденсации происходит катализируемое кислотой отщепление молекулы воды, что приводитк образованию 2-алкилиденпирролий-катионов, высоко реакционноспособных электрофильных реагентов. Так, в случае незамещенного пиррола реакция с алифати-ческами альдегидами неминуемо приводит к образованию смол, вероятно, линейного строения. Восстановление катионных интермедиатов приводит к образованию алкилированных пирролов, причем возможно восстановление любого незамещенныго положения пиррольного цикла. Как показано ниже, ацильные и алкоксикарбонильные заместители остаются неизменными в процессе реакции [47]. Хлорметилирование пиррола, содержащего ацильные группы по положению 4, представляет собой сходный по механизму процесс [48].
Дипирролилметаны можно получить только в том случае, если вовлекаемый в реакцию пиррол содержит электроноакцепторную труппу и только одно свободное a-положение. Дипирролилметаны образуются в результате атаки на первоначально образующийся 2-алкилиденпирролий-катион второй молекулы пиррола [49].
Eto2<
МеСНО, на EtOH, 100’С 83% Me"
Н
CO2Et
/И #4
Н Me Н дипирролилметан
В специально разработанных условиях, реакцией пиррола с водным формалином в уксусной кислоте, удается получить и выделить бис(пиррол-2-ил)метан [50]; реакция пиррола с формалином в присутствии карбоната калия приводит к образованию продукта бис-гидроксиметилирования [51]. Последний в разбавленной кислоте превращается в трипирран, реакция которого с бис(гидрокси-метил)пирролом, как показано на нижеприведенной схеме, приводит к образованию порфириногена, который может быть окислен до порфирина:
Аналогичным образом реагирует ацетон, при этом с высоким выходом образуется циклический тетрамер. Образование такого циклического тетрамера возможно объясняется тем, что две геминальные метильные группы удерживают пиррольные кольца в копланарной конформации, что значительно увеличивает шансы циклизации соответствующего линейного предшественника [52].
Ме2СО, MeSO3H EtOH, кипячение
+ Н*
-Н2О
ЗМе2СО, 2 экв. пиррола
(-ЗН2О)______________
Е 88%
При конденсации пиррола с ароматическими альдегидами, содержащими электронодонорные заместители, образуются мезомерно стабилизированные катионы, причем стабилизация столь эффективна, что продукты таких конденсаций можно выделить. Образующиеся катионы окрашены: такой процесс лежит в основе классического теста Эрлиха, заключающегося в появлении интенсивно красной или фиолетовой окраски при реакции и-диметиламино-бензальдегида с производными пиррола (а также фурана и индола) с незамещенными положениями в гетероциклическом фрагменте.
Реакция %____, p-Me2NC6H4CHO
3pnZ О HCI.E1OH.20-C
90% N Н
Аналогичная конденсация пиррола с пирролилальдегидами приводит к образованию мезомерного дипиррометенового катиона, играющего ключевую роль при синтезе порфиринов. При определенных условия из такого катиона можно в результате однореакторного синтеза получить тетраарилзамещенный порфирин при наличии четырех молекул пиррола и четырех молекул ароматического альдегида [53].
13.1.8. Конденсации с иминами и иминиевыми ионами
Имины и иминиевые ионы представляют собой азотсодержащие эквиваленты карбонильных соединений и протонированных по атому кислорода карбонильных соединений и, как следствие, обладают аналогичной реакционной способ-
ностью. Реакция Манниха с участием пиррола приводит к диалкиламинометил-производным, имминиевый электрофильный реагент генерируется in situ из формальдегида, диметиламина и уксусной кислоты [54]. Существует лишь несколько примеров реакций пиррола с иминами: один из них — конденсация пиррола с 1-пирролином, выступающим в качестве реагента и растворителя одновременно [55].
СН2О, Et2NH
АсОН, 20’С
Н
Процесс полимеризации пиррола, катализируемый минеральными кислотами, представляет собой совокупность целой серии реакций Манниха. При определенных условиях пиррол может быть превращен в тример, который может быть выделен и который, вероятно, служит интермедиатом реакции полимеризации. Образование такого тримера становится понятным, если предположить, что в качестве электрофильной частицы, присоединяющейся кмоле-куле пиррола, выступает наименее стабильный, но более реакционноспособный p-протонированный катион. Промежуточно образующийся димер представляет собой енамин и обладает слишком высокой реакционной способностью, чтобы быть выделенным, в то время как тример в виде соли в дальнейшие превращения вступает медленно [56].
13.1.9. Сочетание с солями диазония [57]
Высокая реакционная способность пирролов иллюстрируется их способностью легко реагировать с солями фенилдиазония. При значениях pH ниже 8 в реакцию сочетания вступает нейтральный пиррол, и при этом образуется моноазопроизводное. При значениях pH раствора выше 10 в сочетании участвует пир-рил-анион (разд. 13.4), и реакция протекает в 108 раз быстрее. В более щелочных условиях происходит образование 2,5-бис-диазопроизводных.
13.2. РЕАКЦИИ С ОКИСЛИТЕЛЯМИ [58]
Пирролы, как правило, легко атакуются сильными окислителями и при этом часто происходит полное разложение цикла. В том случае, если гетероцикл сохраняется, практически всегда образуются производные малеинимида, даже при окислении 2- или 5-алкилзамещенных пирролов. Такое окислительное расщепление пиррольного цикла ранее имело важное значение при определении структуры порфиринов, при котором в качестве окислителей обычно использовали триоксид хрома в водной серной кислоте или дымящую азотную кислоту. Более селективно пиррол окисляется пероксидом водорода, превращаясь с высоким выходом в таутомерную смесь пиролин-2-онов (разд. 13.17.1).
Производные пиррола, содержащие кетонные и сложноэфирные группы, более устойчивы к окислительному расщеплению цикла и для них возможны реакции окисления боковой цепи: например, при использовании церийам-монийнитрата такое окисление протекает с высокими выходами и селективно по а-алкильному заместителю [59].
церрий(17)аммонийнитрат водн. THF, АсОН, 20 *С
Ме 85% ЕЮ
СНО
13.3. РЕАКЦИИ С НУКЛЕОФИЛЬНЫМИ РЕАГЕНТАМИ
Пиррол и его производные обычно не вступают в реакции присоединения или замещения с нуклеофильными реагентами, за исключением тех случаев, которые аналогичны реакциям нуклеофильного замещения, характерным для производных бензола. Ниже приведены два таких примера [60]:
no2
,--( NaOMe
И \\ МеОН, 45 *С v
\^NO2 93%
Me
____NO2 л.
Me
В синтезе кеторолака на ключевой стадии происходит внутримолекулярное нуклеофильное замещение метилсульфонильной группы, активированной кетогруппой в положении 5 [61]
13.4. РЕАКЦИИ С ОСНОВАНИЯМИ
13.4.1. Депротонирование атома азота
Кислотность атома водорода при азоте пиррола (рА’а 17,5) гораздо выше кислотности атома водорода у насыщенных аминов, например, пирролидина (рА^ ~ 44), а также анилина (рД 30,7), и имеет тот же порядок, что и кислотность 2,4-динит-роанилина. Любое сильное основание эффективно и полностью превращает N-незамещенный пиррол в соответствующий пиррил-анион. Вероятно, наиболее удобным из коммерчески доступних оснований для такого превращения может быть раствор «-бутиллития в гексане, который используется, как показано ниже, в синтезе 1-триизопропилсилилпиррола. Однако реакции по атому азота пиррола могут протекать и при меньшей равновесной концентрации пиррил-аниона, как, например, при образовании 1-хлорпиррола (в растворе) при взаимодействии с гипохлоритом натрия [62] или в синтезе l-wpewi-бутилоксикарбонил-пиррола [63].
13.4.2. Депротонирование по атому углерода
Депротонирование по атому углерода возможно только при отсутствии более подвижного атома водорода при атоме азота, т. е. в случае пирролов, замещенных по атому азота либо алкильными группами [64], либо труппами, способными к последующему удалению, такими, как фенилсульфонильная [65], карбоксильная [66], триметилсилилэтоксиметильная [67] или wpem-бу-тиламинокарбонильная [68]. Даже в отсутствие хелатного содействия литииро-ванию, которое несомненно обладает определенными особенностями, рассмотренными в дальнейшем, металлирование N-замещенных пирролов протекает по а-положению. N-Метилпиррол металлируется с поразительной легкостью и в зависимости от условий литиирования образуются 2,4- или 2,5-дилитийпроиз-водных[69]. Литиирование l-wpewi-бутил-З-н-гексилпиррола проходит по положению 5, поскольку альтернативное литиирование по положению 2 затруднено вследствие как электронных, так и стерических препятствий [70].
п-сбн13 п-Сен13
/т—/ LiTMP Me3SnCI NBS
// \\ THF,-7О'С_ THFt-70*C^ // \\ THF, -70 *С^
61% Me3Sr<XN/ 97%
Вос Вос
n-C3Hi3
13.5. РЕАКЦИИ N-МЕТАЛЛИРОВАННЫХ ПРОИЗВОДНЫХ ПИРРОЛА
13.5.1. Литий-, натрий-, калий-, магний- и цинкорганические производные
N-Металлированные производные пиррола при реакции с электрофилами превращаются в продукты замещения как по атому азота, так и по атому углеро
да. В общем случае доля продуктов N-замещения выше при более ионном характере связи металл — азот и/или при большей сольватирующей способности используемого растворителя [71]. Эти принципы легли в основу разработки многочисленных эффективных методов введения заместителя к атому азота пиррола, использующих гидроксид калия в диметилсульфоксиде [72] или бензоле в присутствии 18-краун-6 [73], этилат таллия [74], условия межфазного катализа [75] и, конечно, реакции пиррил-аниона, генерированного с использованием бутилли-тия. Соли таллия эффективно ацилируются [76] по атому азота, а соли калия используются для синтеза 1-арилсульфонильных производных [77]. N-Ацилпир-ролы можно восстановить бораном в соответствующие N-алкилпирролы [78].
N-Магниевые производные пиррола, полученные в растворе при взаимодействии N-незамещенного пиррола с алкильным реактивом Гриньяра, склонны реагировать по пиррольному атому углерода с алкилирующими и ацилирующими реагентами. При этом иногда возможно образование смеси продуктов замещения по положениям 2 и 3; продукты замещения по положению 2, образующиеся через нейтральный неароматический интермедиат, преобладают [79]. Исключительное образование продуктов a-замещения может быть достигнуто при использовании, например, эфиров бромуксусной кислоты [80] или, как показано на приведенной ниже схеме, при использовании в качестве ацилирующих агентов 2-ацилтиопиридинов [81] (разд. 5.10.2.4).
Арилирование по атому азота пиррола возможно при использовании цинк-органических производных, полученных из соответствующих литиевых производных, в реакции с арилбромидами в присутствии в качестве катализатора палладия(О) [82]. Арилирование возможно также в результате прямой реакции пиррола с арилгалогенидами в присутствии основания й палладиевого катализатора [83]
Cs2CO3, NaOf-Bu Pd(OAc)2, dppf PhMe, 120*0
87%
13.6. РЕАКЦИИ С-МЕТАЛЛИРОВАННЫХ ПРОИЗВОДНЫХ ПИРРОЛА
13.6.1. Литийорганические производные
Литийорганические соединения, полученные при литиировании N-замещен-ных пирролов, эффективно используются для введения заместителей в положе-
ние 2 пиррольного цикла, в результате как реакций с электрофильными реагентами [64-68], так и в катализируемых палладием процессов сочетания с бороорганическими соединениями [84].
Ниже приведены некоторые примеры использования удаляемых N-защитных групп в синтезе 2-замещенных производных пиррола с использованием литийорганических соединений:
н 83% SEM
SEMCI« Me3Si(CH2)2OCH2CI
/-PrCH=O 78%**
n-BuLi
90%
затем f-BuN=C=O
2 моля f-BuLi
CONHt-Bu
CH(OH)APr
CONHf-Bu
В результате обмена металл — галоген в 2-бром- и 2,5-дибром-l-wpew-бути-локсикарбонилпирролах образуются моно- и дилитийорганические соединения, которые реагируют с рядом обычных электрофильных реагентов, как показано на приведенной ниже схеме[25,26]:
Вг
SnMe3
n-BuLi Me3Sna Et2O,-75 °C 71%
Вос
2n-BuLi
THE, -70 °C СО2
70%
Вос
Литийорганическое производное, полученное в результате обмена металл — галоген из З-бром-1-триизопропилсилилпиррола, используется для введения заместителей в p-положение пиррольного цикла. Такой синтетический подход значительно дополняет используемые для синтеза p-производных пиррола реакции электрофильного замещения в 1-триизопропилпирроле (разд. 13.1.2 и 13.1.4).
13.6.2. Реакции, катализируемые палладием
Пирролилстаннаны и пирролилборные кислоты, синтезируемые обычными способами, широко используются в катализируемых палладием(О) реакциях сочетания с арилгалогенидами [85]
LDA
N 0=3=0*
Ph
Li
80%
SO2Ph
СбН4-4-С1
SO2Ph
SU‘Pr3
FBuLi
THF,-78'C^ n-l
90%
'N
Su-Pr3
39%
Snn-Bu3
B(OMe)3 PhBr, Pd(PPh3)4
затем водн. HCI [l \\______ водн. Na2CO3
,^/**B(0H)2 EtOH, PhH, кипячение SOgPh
89%
N
SU-Pr3
13.7. РЕАКЦИИ С РАДИКАЛЬНЫМИ РЕАГЕНТАМИ
Незамещенный пиррол реагирует со свободными радикалами с образованием смол, что связано, вероятно, с первоначальным отщеплением водорода. Однако для некоторых N-замещенных производных пиррола характерны препаративные реакции радикального арилирования, позволяющие получать продукты замещения по а-положению [86]. Более эффективный подход к синтезу арил-пирролов основан на использовании реакций сочетания, катализируемых переходными металлами (разд. 2.7.2.2). Реакция N-метилпиррола с электрофильным бензилокси-радикалом приводит к продуктам замещения по а-положениям [87].
O(PhCO2)2 /т-гу + /т~п
PhH, 20;с// \\ -1:1 // \\
57% \N/^0COPh PhCOO^\N/^OCOPh
Me Me Me
SO2Ph
/7~Ъ Bu3SnH, AIBN П \\ PhH, кипячение
69%
SO2Ph
Радикальное замещение водорода [88] или толилсульфонильной группы [89] в a-положении пиррола, несомненно, найдет дальнейшее развитие в будущем.
13.8. РЕАКЦИИ С ВОССТАНОВИТЕЛЯМИ
Простые пирролы не восстанавливаются при действии гидридных восстановителей, диборана и щелочного металла в спирте или жидком аммиаке. Однако пиррол легко восстанавливается в кислых средах, в этом случае восстановлению подвергается протонированный пиррол. При восстановлении образуются
2,5-дигидропирролы и небольшие количества пирролидинов в качестве побочных продуктов реакции [90]. Восстановление пирролов в пирролины [91] возможно при использованиии ряда катализаторов и наиболее легко осуществляется при наличии у атома азота электроноакцепторного заместителя. Каталитическое восстановление пирролов не сопровождается гидрогенолизом связи углерод — гетероатом и раскрытием цикла, как это происходит в случае фуранов.
Восстановление эфиров и третичных амидов пирролкарбоновых кислот в условиях реакции Берча приводит к образованию дигидропирролов. Электроноакцепторная группа при атоме азота, с одной стороны, устраняет подвижный атом водорода, а, с другой, уменьшает электронную плотность в цикле. Последующая обработка продуктов восстановления алкилгалогенидами приводит к алкилированным дигидропирролам [92].
3Na ___ СО2с-С6Нц Ме^СО2с-СбНп
(жидк.), THF NH4CI^ /=\ Н О3№ /Г\
.. C0ONG.H, 71% S^cOc-NCA \ЛНз(жидк.),ТН>Е№1^\|/
Вос Вос Adoc 72% Adoc
13.9. ЭЛЕКТРОЦИКЛИЧЕСКИЕ РЕАКЦИИ (ОСНОВНОГО СОСТОЯНИЯ)
Простые производные пиррола не вступают в реакции циклоприсоединения в качестве диенов; так, например, выдерживание пиррола с дегидробензолом приводит к лишь к образованию 2-фенилпиррола с низким выходом [93]. Однако при введении заместителей к атому азота пиррола, в особенности электроноакцепторных, склонность к таким реакциям повышается [94]: таким путем могут быть получены аддукты производных дегидробензола с 1-триметилсилил-пирролом [95]. В то время как реакция незамещенного пиррола с диметиловым эфиром ацетилендикарбоновой кислоты приводит к образованию продукта замещения по положению 2 даже при повышенном давлении [96], 1-ацетил- и 1-алкоксикарбонилпирролы в этих условиях превращаются в соответствующие циклоаддукты [97]. Циклоприсоединение в значительной степени ускоряется при проведении реакции при высоком давлении или в присутствии катализатора — хлорида алюминия [98]. N-wpe/л-Бутилоксикарбонилпиррол наиболее часто используется в качестве субстрата реакций циклоприсоединения; ниже приведен пример использования этого производного пиррола [99]:
+ ВгС=ССО2Ме
Другой прием, используемый для активации пирролов в реакциях циклоприсоединения, заключается в предварительном превращении их в осмиевые комплексы [100]. При такой активации возможны реакции даже с обычными электрофилами в мягких условиях; соответствующие аддукты образуются в результате последующего окислительного разрушения комплекса с осмием [101].
[Os(NH3)5(OTf)3].Mg
DMA, DMAc,20*C
Ме
Процесс присоединения синглетного кислорода к 1-алкил- и, особенно, 1-ацилпирролам [102], приводящий к образованию 2,3-диокса-7-азаби-цикло[2.2.1]гептанов, имеет ценное синтетическое применение. Продукты присоединения вступают в реакцию с нуклеофильными реагентами, такими, как силиловые эфиры енолов, и при содействии хлорида олова(П) превращаются в 2-замещенные пирролы. Последние можно использовать, как показано на приведенной ниже схеме, в синтезе индолов:
_через
SnCI4 о’С
69%
СО2Ме
Винилпирролы, содержащие фенилсульфонильную группу при атоме азота, вступают в реакцию Дильса—Альдера в качестве диенов [103]. Первоначально образующиеся продукты циклоприсоединения легко изомеризуются, что приводит к ароматическому пиррольному производному [104].
SO2Ph
PhMe, 120 *С 73%
Межмолекулярные реакции циклоприсоединения, в которых пиррол выступает в качестве 2л-электронной системы, крайне малочисленны, однако трициклический 6-азаиндол может быть легко получен в результате внутримолекулярной реакции 4л-электронной системы 1,2,4-триазина с пирролом (разд. 25.2.1) [105].
h2n
-I, MgSO4 68%
13.10. РЕАКЦИИ С КАРБЕНАМИ И КАРБЕНОИДАМИ
Реакция пиррола с дихлоркарбеном протекает через промежуточное образование дихлорциклопропанового интермедиата, расширение цикла в котором приводит к 3-хлорпиридину [106,107]. Существует лишь несколько сообщений о выделении стабильных аддуктов, содержащих циклопропановый фрагмент, полученных из 1-метоксикарбонилпиррола [108] и 1-ацетилпиррола [109]. Реакция 1-метилпиррола с этоксикарбонилкарбеном приводит только к продукту замещения [110].
Реакции производных пиррола, содержащих электроноакцепторный заместитель при атоме азота, с карбеноидами, генерированными из диазоалканов с использованием соединений родия(П), находят широкое синтетическое использование. Как показано на приведенной ниже схеме, присоединение винилкарбе-на приводит к образованию циклопропанового интермедиата, который в результате перегруппировки Коупа превращается в 8-азабицикло[3.2.1]октадиен — бициклический фрагмент, входящий в состав кокаина [111].
CH2=CHC(N2)CO2Me
Rh2(O2CC6Hii)4 гексан, кипячение, Аг — >.
CO2(CH2)2SiMe3
13.11. ФОТОХИМИЧЕСКИЕ РЕАКЦИИ [112]
Фотоиндуцируемая перегруппировка 2-цианопирролав 3-цианопиррол включает 1,3-сдвиг в первоначально образующемся бициклическом азиридине [ИЗ]
hv
МеОН
55%
[1,3]-сдвиг
CN
13.12. РЕАКЦИИ ПИРРИЛ-С-Х-СОЕДИНЕНИЙ
Производные пиррола такого типа, в которых X — атом галогена, гидрокси-, алкокси- или аминогруппы и особенно протонированные гидрокси- и алкокситруппы или четвертичные аммониевые труппы, легко превращаются в результате потери этой труппы в весьма реакционноспособные электрофильные частицы. Так, например, пирролилкетоны можно восстановить в соответствующие алканы при удалении гидроксильной группы в первоначально образующемся спирте (разд. 13.1.7). Четвертичные аммониевые соли, например, полученные при метилировании 2-диметиламинометилпиррола, реагируют с нуклеофилами с потерей триметилмина в результате последовательности элиминирование — присоединение [114].
водн. NaCN
100*С
64%
AcNH(EtO2C)2C Na*
EtOH, 20 *С
94%
N
NHAc
CO2Et
CO2Et
13.13. ПИРРОЛАЛЬДЕГИДЫ И ПИРРОЛКЕТОНЫ
Пирролальдегиды и пирролкетоны — стабильные соединения, не подверженные полимеризации или самоокислению. Свойства альдегидов и кетонов пиррольного ряда аналогичны свойствам ароматических карбонильных соединений, хотя в отличие от последних карбонильные производные пиррола обладают меньшей реакционной способностью. Пирролальдегиды и пирролкетоны можно рассматривать как винилоги амидов. Карбонильные соединения пиррольного ряда можно восстановить в соответствующие алкилпирролы как при использовании метода Кижнера—Вольфа, так и при восстановлении борогидри-дом натрия в результате последующего удаления гидроксильной группы из первоначально образующегося спирта [115]. Взаимодействие ацилированных 1-фе-нилсульфонилпирролов с комплексом /яре/л-бутиламин-боран представляет собой эффективный метод получения соответствующих алкильных производных пиррола [116].
р- и а-Ацилпирролы могут превращаться друг в друга в результате равновесного процесса, протекающего в кислых средах; в случае ацилпирролов, замещенных по положению 1, такое равновесие практически целиком сдвинуто в сторону 3-ацилпиррола [117].
cf3co2h 70-120 *С
1:4после7ч
13.14. ПИРРОЛКАРБОНОВЫЕ КИСЛОТЫ
Главная особенность пирролкарбоновых кислот заключается в их способности легко терять карбоксильные группы. Простое нагревание [118] пирролкарбоновых кислот сопровождается потерей диоксида углерода в результате илсо-замещения карбоксильной группы протоном [119]. Способность к легкому декарбоксилированию пирролкарбоновых кислот имеет важное препаративное значение, поскольку множество методов синтеза пиррольного цикла приводит к эфирам пирролкарбоновых кислот (например, см. разд.13.18.1.2 и 13.18.1.3).
Замещение карбоксильной группы другими электрофилами, такими, как галоген [120], нитрогруппа или катион диазония, протекает значительно легче, чем замещение атома водорода.
EtO2G Me
•г \—/
водн. NaHCO3 и и
Н
Нг, Pd/C, MgO МеОН, давление
70%
13.15. ЭФИРЫ ПИРРОЛКАРБОНОВЫХ КИСЛОТ
Реакции электрофильного замещения в этих стабильных соединениях изучены достаточно подробно. тие/ия-Направляющее влияние сложноэфирной группы доминирует над склонностью пиррола к а-замещению [121].
Сложноэфирные группы также активируют алкильные группы в реакциях галогенирования и образующиеся при галогенировании пирролилалкилгалоге-ниды нашли широкое синтетическое применение [122]. Для введения метоксигруппы в алкильный заместитель можно использовать трифлат церия(1У) в метаноле [123].
Скорости щелочного гидролиза эфиров а- и p-пирролкарбоновых кислот значительно отличаются: первые гидролизуются значительно быстрее, что, вероятно, обусловлено стабилизацией интермедиатов гидролиза внутримолекулярной водородной связью с участием кольцевого гетероатома [124].
13.16. ГАЛОГЕНОПИРРОЛЫ
Незамещенные 2-галогенопирролы — соединения крайне нестабильные. З-Га-логенопирролы, а также 2-галогенопирролкетоны и эфиры 2-галогенопиррол-карбоновых кислот вполне устойчивы. Химические превращения с участием галогенопирролов наиболее легко идут при наличии электроноакцепторных заместителей у атома азота. Свойства галогенопирролов типичны для арилгало-генидов: они инертны в реакциях нуклеофильного замещения, превращаются в литийпроизводные в результате обмена с бутиллитием и вступают в катализируемые палладием реакции сочетания [125]. Галогенопирролы подвергаются каталитическому гидрогенолизу, что позволяет использовать галогенные заместители в качестве блокирующих.
13.17. ОКСИ- И АМИНОПИРРОЛЫ
13.17.1. 2-Оксипирролы
2-0ксипирролы, если и существуют вообще, то лишь как минорные компоненты таутомерной смеси З-пирролин-2-она и 4-пирролин-2-она, находящихся в равновесном соотношении 9:1 [126].
З-пиррролин-2-он 2-гидроксипиррол 4-пирролин-2-он преобладает
В результате последовательного введения защитной группы в положение 1 и силилирования образуются 2-силилоксипирролы, которые реагируют с альдегидами с образованием замещенных З-пирролин-2-онов [127].
(Вос)2О TBDMSOTf
DMAP, MeCN 2,6-лутидин, 20 *С
80% 83%
SnCI4 Ме
Et2O, -85 *С
80%
СНО
13.17.2. З-Оксипирролы
З-Оксипирролы существуют, главным образом, в карбонильной таутомерной форме; в том случае, если в соседнем положении 2 имеется сложноэфирная группа, гидроксильный таутомер стабилизируется внутримолекулярной водородной связью [128].
13.17.3. Аминопирролы
Аминопирролы весьма нестабильны и их трудно получить [129], вследствие чего они очень мало изучены. Простые 2-аминопирролы хранятся только в растворах кислот [130].
13.18. МЕТОДЫ СИНТЕЗА ПИРРОЛОВ [7,131]
13.18.1. Синтез кольца
13.18.1.1. Из 1,4-дикарбонильных соединений и аммиака или первичных аминов [132]
1,4-Дикарбонильные соединения реагируют с аммиаком или первичными аминами с образованием пирролов
Синтез Пааля-Кнорра [ 133]
Пирролы образуются при реакции аммиака или первичных аминов с 1,4-дикар-бонильными соединениями [134] (см. также разд. 15.13.1.1). Для синтеза N-неза-мещенных пирролов вместо аммиака можно использовать гексаметилдисилазид с оксидом алюминия [135]. Образование пиррольного цикла происходит в результате последовательно реализующихся процессов нуклеофильного присоединения атома азота амина к двум карбонильным группам и элиминирования двух молекул воды. Ниже в качестве примера приведена возможная последовательность [136] таких стадий при синтезе 2,5-диметилпиррола [137 ]:
Для синтеза производных пиррола, не содержащих заместителей при атомах углерода, вместо нестабильного янтарного диальдегида используется 2,5-диме-токситетрагидрофуран (разд. 15.1.4) [138] или полученный из него 1,4-дихлор-1,4-диметоксибутан [139]. 2,5-Диметокситетрагидрофуран реагируете алифатическими и ароматическими аминами, эфирами аминокислот, арилсульфонами-дами, триметилсилилэтоксикарбонилгидразином [140] и первичными амидами с образованием соответствующих N-замещенных пирролов [141].
MeO2CCH2NH2 РдОю PhMe, 110С^
91%
СН2СО2Ме
Все еще не потерявший своего значения метод получения N-замещенных производных пиррола основан на сухой перегонке алкиламмониевых солей слизевой и сахарной кислот [142] и, вероятно, связан с промежуточным образованием 1,4-дикарбонильных соединений. В целом, процесс проходите высвобождением четырех молекул воды и двух молекул диоксида углерода и может быть представлен следующей схемой:
нагревание -2Н2О
НО2 СО2“
0Н 0Н п-ВиЙНз
n-BuNH2 г—п
-2Н2О,-2СО2 // \\
25% л-Ви
13.18.1.2. Из а-аминокарбонильных соединений и активированных кетонов а-Аминокетоны взаимодействуют с карбонильными соединениями, обладающими а-метиленовой группой, преимущественно активированной дополнительным акцепторным заместителем, как, например, в эфирах р-кетокислот
Синтез Кнорра
Широко используемый общий подход к синтезу производных пиррола связан с использованием двух компонентов: один — а-аминокарбонильное соединение, которое поставляет в будущий пиррольный цикл атом азота и атомы углерода С(2) и Ср), и второй компонент, поставляющий атомы С(4) и С(5), в котором должна быть метильная группа в a-положении к карбонильной. Синтез Кнорра эффективен только в том случае, если метиленовая группа дополнительно активирована (например, как в ацетоуксусном эфире); при этом конденсация, приводящая к пирролу, успешно конкурирует с самоконденсацией а-аминокарбонильных
соединений. Ниже в качестве иллюстрации приведен синтез 4-мстилпиррол-З-карбоновой кислоты и ее последующее превращение в 3-метилпиррол:
МеХ/О zC02Et
/ \ водн. КОН, 20’С
СО2Ме 5Э%
Ме\/C°2Et водн. КОН Д А кипячение,
n^co2h 60%
Поскольку а-аминокарбонильные соединения очень легко претерпевают самоконденсацию с образованием дигидропиразинов (разд. 11.13.3.1), их обычно получают и используют в виде солей с высвобождением соответствующих свободных оснований под действием оснований, присутствующих в реакционной смеси. Альтернативно в синтезе Кнорра используются аминокарбонильные соединения с защищенной карбонильной группой, такие, как аминоацеталь [НгКСНгСНСОЕОг], вместе с эфирами енолов 1,3-дикетонов в качестве предшественников активированных карбонильных соединений [143]
Избежать прямого использования а-аминокарбонильных соединений можно, получая их в присутствии второго компонента синтеза Кнорра. В качестве восстановителя для превращения оксиминной группы в аминную, применяют цинк в уксусной кислоте и дитионит натрия [ 144]; при этом кетонная и сложно-эфирная группы остаются незатронутыми
В классическом варианте синтеза Кнорра в качестве а-аминокарбонильной
компоненты используется аминопроизводное другой карбонильной компоненты, которое генерируется из оксиминопроизводного in situ [145]
2MeCOCH2CO2Et
Согласно предполагаемому механизму процесса, показаному на примере образования пиррола Кнорра, на первой стадии происходит образование связи N — С(2), что предполагает присоединение атома азота к более электрофильной из двух карбонильных групп второй компоненты. Аналогично образование связи С(з) — С(4) происходит с участием более электрофильной (когда возможно альтернативное течение реакции) карбонильной группы а-аминокарбонильной компоненты. Существует множество элегантных примеров применения этого подхода к синтезу производных пиррола. Интересен пример образования двух пиррольных циклов при использовании в качестве предшественника а-амино-карбонильного соединения фенилгидразона, как показано ниже [146]:
Zn
АсОН, NaOAc
115*С
35%
Современные подходы к а-аминокарбонильным соединениям основаны на реакции 2-бромкетонов с диформамидом натрия с образованием а-формамидо-кетонов [147] и на взаимодействии амидов Вайнреба N-защищенных а-амино-кислот с реактивами Гриньяра с последующим удалением N-защитной группы в присутствии второго компонента, как показано ниже [148]. Гидридное восстановление амидов Вайнреба N-защищенных а-аминокислот приводит к образованию а-аминоальдегидов, также используемых в этом подходе к синтезу производных пиррола [149].
CON(OMe)Me
избыток MeMgBr
Et2O________
95%
MeCOCH2CO2Et
Н2 (1,3 атм), Pd/C АсОН, 20 *С->80^0 64%
Бис(метилтио)нитроэтилен при взаимодействии с органическими купратами замещает одну метилтиогруппу на алкильную или арильную. Далее продукт этой реакции при взаимодействии с аминоацеталями, (в качестве предшественников а-аминокарбонильных соединений) превращается в ациклическое соединение, замыкание цикла в котором приводит к 2-замещенным 3-нитро-пирролам [150].
Енамины, образующиеся при присоединении эфиров а-аминокислот к диметиловому эфиру ацетилендикарбоновой кислоты, способны превращаться
в 3-гидроксипирролы в результате замыкания цикла по типу конденсации Кляйзена [151].
СО2Ме /-РгХ
NH2
pM%eOH,2Q:C MS°f <
ф /-Pr^'N>^'CO2Me
CO2Me Ц
NaOMe
MeOH, 20 *C 42% (2 стадии)
13.18.1.3. Из а-галогенокарбонильных соединений
Альтернативный подход к синтезу пиррольного цикла основан на комбинации двух двухуглеродных компонентов — а-галогенокарбонильного соединения и эфира р-кетокислоты и аммиака
Синтез Ганча
Этот метод синтеза пирролов представляет собой вариацию синтеза Фейста-Бенари, используемого для получения фуранов, с той лишь разницей, что для построения цикла в этом случае применяется аммиак или первичный амин. Пиррольный цикл, вероятно, образуется в результате первоначального взаимодействия аммиака (или первичного амина) с эфиром р-кетокислоты и последующего алкилирования образующегося при этом эфира аминокротоновой кислоты галогенокетоном или галэгенальдегидом [152]
CI.
,CO2Et
ВОДН. NH3 20'С—> 60
Ме^Ь 41%
13.18.1.4. Из тозилметилизоцианида и а,р-непредельных эфиров или кетонов и из изоцианоацетатов и а,р~непредельных нитросоединений
Тозилметилизоцианид-анион реагирует с эфирами, кетонами или сульфонами с потерей толуолсульфинатной группы. Изоциаоацетаты реагируют с «^-непредельными нитросоединениями с отщеплением азотистой кислоты
Синтез ван Лёйзена
Стабилизированный анион тозилметилизоцианида (TosMIC) (или бензотриа-зол-1-илметилизоцианида, BetMIC [153]) способен присоединяться по типу реакции Михаэля к ненасыщенным кетонам и эфирам непредельных кислот с последующим замыканием цикла с участием атома углерода изоцианидного фрагмента. Перенос протона и последующее отщепление толуолсульфинат-иона приводит к образованию ЗН-пиррола, который таутомерно превращается в ароматическую структуру с незамещенными положениями 2 и 5 [154]. Присоединение такого аниона к непредельным нитросоединениям приводит к образованию 2,5-незамещенных 3-нитропирролов [155].
Синтез Бартона-Зарда
Этот подход основан на сопряженном присоединении аниона этилового эфира изоцианоуксусной кислоты к а,0-непредельным нитросоединениям, которое сопровождается потерей молекулы азотистой кислоты на последней стадии и образованием этиловых эфиров пиррол-2-карбоновой кислоты, не содержащей заместителя в положении 5 [156]. Этот метод синтеза производных пиррола становится все более популярным; ниже приведен механизм образования пиррольного цикла [157], который демонстрирует сходство этого метода с рассмотренным выше синтезом ван Лёйзена. Наиболее удобный метод синтеза а,0-не-предельных нитросоединений включает в себя катализируемую основаниями конденсацию альдегидов с нитроалканами, приводящую к а-гидроксинитроал-канам. Непредельные нитросоединения также могут быть генерированы in situ в присутствии изонитрила из О-ацетил-а-гидроксинитроалканов при действии диазабициклоундекана в качестве основания [158] (см. пример в разд. 13.18.3.3).
О I \^0
Н 'NO2 57%
Д1® ЕЮ2ССН2йсГови ч THF, f-BuOH, 20’С г
Этот метод можно использовать даже в тех случаях, когда фрагмент ненасыщенного нитросоединения включен в полициклическую ароматическую систему, как это показано на приведенном ниже примере [159]:
EtO2CH2ttc~
DBU, THF, 20’С
75%
Этот подход к синтезу производных пиррола может быть распространен на а,р-непредсльные сульфоны, что значительно увеличивает практическую значимость метода. а,р-Непредельные сульфоны легко образуются, например, при присоединении фенилсульфенилхлорида к алкенам, последующем окислении атома серы и элиминировании хлороводорода на заключительной стадии. Реакция непредельных сульфонов с эфирами изоцианоуксусной кислоты и изоцианонитрилами приводит к образованию производных пиррола [160].
13.18.1.5. Из 1,3-дикарбонильных соединений и эфиров глицина [161]
1,3-Дикарбонильные соединения или их эквиваленты с той же степенью окисления при взаимодействии с эфирами глицина образуют эфиры пиррол-2-кар-боновой кислоты
Для эффективной конденсации 1,3-дикарбонильных соединений с эфирами глицина было разработано большое количество методов, но, вероятно, наиболее простой из них заключается в использовании триэтиламина в качестве основания для образования промежуточного енаминокетона, циклизация которого на второй стадии процесса приводит к производному пиррола
у-Хлориминиевые соли, получаемые аналогично приведенной ниже схеме [162], служат прекрасными синтонами для 1,3-дикарбонильных соединений и их можно использовать в реакции с эфирами глицина.
Синтез Кеннера
Процесс, аналогичный описанному выше и использующий в качестве трехуглеродного фрагмента а,р-ненасыщенные кетоны, приводит к образованию дигидропиррола, содержащего тозильную группу при атоме азота; элиминирование толуолсульфината на заключительной стадии приводит к ароматическим производным пиррола [163,164]
Et
/г-Z DBU
// X) THF, 2QJC
' + ~4%*
TsHN^0^
HO
/—POCI3
/ \ пиридин, 20 *C
73% *
Ts
DBU
PhMe, кипячение
CO2Et 85%
13.18.1.6. Из алкинов и оксидооксазолиевых солей [165]
Диполярное циклоприсоединение мезоионных оксидооксазолиевых солей к алкинам с последующим выделением молекулы диоксида углерода приводит.к образованию пиррола
При дегидратировании N-ациламинокислот генерируются азалактоны, которые существуют в равновесии с упомянутыми выше мезомерными соединениями, и именно эти соединения вступают в реакцию циклоприсоединения к алкинам, а при последующем элиминировании молекулы диоксила углерода образуются производные пиррола
13.18.2. Некоторые современные общие подходы к синтезу пиррола
13.18.2.1. Из а-ацетоксидиметилгидразонов и силиловых эфиров енолов
В присутствии хлорида титана(1У) диметилгидразоны а-ацетоксиальдеги-дов реагируют с силиловыми эфирами енолов с образованием 1-диметиламинопирролов; последующее восстановление связи N—N дает NH-пирролы [166]
•псц
CH2CI2 водн. Na2CO3
-78 *С-»20*р кипячени^.
62%
СМе
/ Na, NH3 (жидк.)
/ \\ 10 бар, 20-С
4|\f 90%
NMe2
13.18.2.2. Из альдегидов, аминов и нитроалканов
Этот подход к синтезу производных пиррола связан с катализируемой солями самария конденсацией альдольного типа нитроалканов с иминами, генерированными при взаимодействии аминов с альдегидами. Все три компоненты реакции вводятся в реакционную смесь одновременно [167].
no2
^Ме
Sml2 (кат.)
THF, 60 *С
47% *
13.18.2.3. Из 4-аминоацетиленов и из 4-аминоацетиленовых кетонов
Замыкание цикла по типу 5 эндо-диг в 4-тозиламиноацетиленах приводит к образованию дигидропирролов, элиминирование толуолсульфината из которых сопровождается образованием ароматических производных пиррола [168]
Ph-
СО2Ме
12, К2СО3
MeCN, 0 *С -» 20^С 74%
13.18.2.4. Из 2-аминокетонов через промежуточное образование алкилиденкарбенов
Получение алкилиденкарбенов из К,Ы-дизамещенных 2-аминокетонов сопровождается внедрением карбена по одному из двух заместителей при атоме азота и образованием дигидропиррольного цикла. Диоксид марганца легко окисляет такие соединения (пирролины [169]) в ароматические структуры [170].
Ph
Me3SiC(Li)N2
THF, гексан, -78 *С
73%
Me.
МпО2 д
СН2С12, кипячение // \\ 88%
13.18.3. Примеры синтезов некоторых важных производных пиррола
13.18.3.1. Порфобилиноген
Синтез порфобилиногена [171] из 2-метокси-4-метил-5-нитропиридина (разд. 5.15.2.3) представляет собой вариант синтеза Рейссерта (разд. 17.16.1.2), приводящего в данном случае к 6-азаиндолу в качестве промежуточного соединения
13.18.3.2. Октаэтилпорфирин [172]
В подходе к получению этого черызвычайно широко применяемого модельного соединения используется на первой стадии синтез Кнорра; стадии олиглмери-зации и заключительной циклизации обусловлены реакционной способностью, свойственной пирролиламмониевым солям (разд. 13.12), и легким декарбоксилированием пирролкарбоновых кислот (разд. 13.14)
13.18.3.3. Октаэтилпорфирин [173]
Альтернативный подход к синтезу октаэтилпорфирина основан на использовании метода Бартона—Зарда для получения эфира пиррол-2-карбоновой кислоты, который затем гидролизуют и декарбоксилируют
KF в EtCHsO + n-PrNO2 ffiffiMOX У-65% H0A c, Ac2O CNCH2CO2Et, DBU конц.НгЗОд, 60 X /-PrOH, THF NO2 90% *AcO NO2 89%
водн. СН2О, TsOH О2
октаэтилпорфирин
66%
NaOH (СН2ОН)2,190 *С 38%
13.18.3.4. Октаэтилгемипорфицен [174,175]
Были синтезированы все изомеры порфирина неприродного происхождения (порфицены), включающие в себя чередующиеся четыре пиррольных цикла, четыре метиновых группы и обладающие 18тс-элекгронной сопряженной системой. Приведенная ниже схема демонстрирует применение метода МакДональда [176] для построения тетрапиррола и реакции МакМюррея для замыкания макроцикла [177]:
октаэтилгемипорфицен
13.18.3.5, Бензо[1,2-Ь:4,3-Ь*]дипиррол
Для синтеза бензо[1,2-6:4,3-6']дипиррола (пирролоиндола) было разработано несколько оригинальных подходов [178], три из которых связаны с синтезом сильного противоопухолевого препарата СС-1065 [179]. В приведенном ниже подходе к таким соединениям для построения пиррольного цикла используется метод, описанный в разд. 13.18.1.4 [180]:
13.18.3.6. Эпибатидин[181]
Циклоприсоединение К-/яретл-бутилоксикарбонилпиррола к этинил-4-то-лилсульфону приводит к образованию бициклической системы; при последующем селективном восстановлении одной двойной связи и в результате сопряженного присоединения 5-литий-2-метоксипиридина к другой образуется соединение определенного стереохимического строения, из которого в результате простых химических превращений может быть получен эпиба-тидин
Упражнения
Простые упражнения для проверки усвоения материала гл. 12 и 13
(а) Почему при протонировании пиррол не протонируется по атому азота?
(б) Как исходя из пиррола можно селективно получить 2-бромпиррол, 3-бромпир-рол, 2-формилпиррол и 3-нитропиррол? (в некоторых случаях предполагается многостадийный синтез)?
(в) Какие соединения образуются в результате следующих реакций: (1) пиррол с СНзО/пирролидином/АсОН; (2) пиррол с NaH/Mel; (3) 1-триизопропилсилил-пиррол с диизопропиламидом лития и затем с МезССН=О?
(г) Как можно получить 3-литиированный пиррол?
(д) Приведите два приема, которые позволяют использовать пиррол в качестве диЪ-на в реакции Дильса-Альдера.
(е) Как можно получить пиррол-2-илацетонитрил из пиррола в две стадии?
(ж) Каков механизм легкого декарбоксилирования пирролкарбоновых кислот при нагревании?
(з) Какие методы синтеза и какие реагенты необходимо применить для получения производного пиррола, не содержащего заместителей При атомах углерода, но содержащего группу СН(Ме)СО2Ме при атоме азота?
(и) С каким соединением необходимо провести реакцию этилового эфира ацетоуксусной кислоты, чтобы получить этиловый эфир 2-метил-4,5-дифенилпиррол-2-карбоновой кислоты?
(к) С каким соединением необходимо провести реакцию тозилметилизоцианвда, чтобы получить метиловый эфир 4-этилпиррол-З-карбоновой кислоты?
(л) С каким соединением необходимо провести реакцию З-нитрогекс-З-ена, чтобы получить этиловый эфир 3,4-диэтилпиррол-2-карбоновой кислоты?
Упражнения повышенной сложности
1. Два изомерных мононитропроизводных C5H6N2O2 образуются в соотношении 6:1 при взаимодействии 2-метилпирролас Ac2O/HNOj. Каково стороение основ-ного продукта реакции?
2. Приведите структурные формулы соединений образующихся в результате следующих реакций: (а) при взаимодействии пиррола с С13ССОС1, затем полученного соединения с Вг2 и затем продукта реакции с MeONa/MeOH -> СбНбВгТЧОг; (б) при взаимодействии пиррола с диметилформамидом /РОС1з, затем продукта реакции с МеСОС1/А1С1з и на заключительной стадии с водным NaOH -> C7H7NO2; (в) при реакции 2-хлорпиррола с диметилфорами-дом/РОС1з, затем водным NaOH и затем продукта реакции с LiAlH4 -> C5H6C1N.
3. Приведите структурные формулы соединений, образующихся на конечной стадии в каждом случае при реакции пиррола с POCI3 и (а) К,К-диметилбенза-мидом; (б) N,N-диметиламидом пиррол-2-карбоновой кислоты; (в) 2-пирроли-доном и водным раствором гидроксида натрия.
4. При обработке 2-метилпиррола НС1 образуется димер, а не тример, как в случае самого пиррола (разд. 13.1.8). Предложите структурную формулу димера C10H14N2 и объясните, почему в этом случае не образуется тримера.
5. При взаимодействии 2,5-диметилпиррола с Zn/HCl образуется смесь двух изомерных продуктов реакции CeHnN. Предложите их структурные формулы.
6. (а) При нагревании 1 -метоксикарбонилпиррола с диэтиловым эфиром ацетилендикарбоновой кислоты при 160 °C образуется диэтиловый эфир 1-метоксикарбо-нилпиррол-3,4-дикарбоновой кислоты. Предложите механизм процесса и структуры образующихся интермедиатов, (б) Предложите структурную формулу соединения C11H12N2O2, образующегося при последовательном взаимодействии 1-метоксикарбонилпиррола с синглетным кислородом и затем со смесью 1-ме-тилпиррола и SnCh.
7. Предложите структурные формулы соединений, образующихся на каждой стадии при взаимодействии пиррола последовательно со следующими реагентами: (a)Me2NH/HCHO/AcOH; (б)СН31; (в) пиперидин в горячем этаноле -> Ci0Hi6N2.
8. Предложите способы получения (а) 1-пропилпиррола; (б) 1 -(тиен-2-ил)пиррола; (в) 1-фенилсульфонилпиррола из соединений, не содержащих пиррольный цикл.
9. Взаимодействие этилового эфира ацетоуксусной кислоты с HNO2 и затем с Zn/AcOH и впоследствии с пентан-2,4-дионом приводит к образованию пиррола C11H15NO3. Предложите структурную формулу пиррола, последовательность приводящую к его образованию, и способ его превращения в 2,4-диметил-З-этилпиррол.
10. Предложите способы получения следующих соединений: (а) диэтилового эфира 4-метилпиррол-2,3-дикарбоновой кислоты; (б) этилового эфира 2,4,5-триметил-пиррол-3-карбоновой кислоты; (в) этилового эфира 4-амино-2-метилпиррол-3-карбоновой кислоты; (г) этилового эфира 3,4,5-триметилпиррол-2-карбоновой кислоты.
Литература
1. «Pyrrole. From Dippel to Du Pont», Anderson H. J. J. Chem. Ed., 72, 875 (1995); Jones R. A., Bean G. P, The chemistry of pyrrole, Academic Press, New York, 1977; «Physicochemical properties of pyrroles», Jones R. A. Adv. Heterocycl. Chem., 11,383 (1970).
2. «The pyrrole pigments», Smith К. M. in: Rodd’s Chemistry of Carbon Compounds, 1977, Vol. IVB, and supplement, 1977, chs. 12.
3. «Nature’s pathways to the pigments of life», Battesby A. R. Nat. Prod. Rep., 4,77 (1987).
4. Milgram L. R. The colours of life. An introduction to the chemistry of poiphyrins and related compounds, Oxford University Press, 1997.
5. Lemberg R., Barrett J. Cytochromes, Academic Press, London and New York, 1973.
6. Vitamin B12 Zagalak B., Friedrich W. (eds.), Walter de Gruyter, Berlin and New York, 1979.
7. «The synthesis of 3-substituted pyrroles from pyrrole», Anderson H. J., Loader С. E. Synthesis, 1985,353.
8. Bean G. P. J. Chem. Soc., Chem. Commun., 1971, 421; Muir D. M., Whiting M. C. J. Chem. Soc., Perkin Trans. 2,1975,1316.
9. Nguyen V. O., Turecek E J. Mass Spectrom., 31, 1173 (1996).
10. Chiang Y, Hinman R. L., Theodoropulos 5., Whipple E. B. Tetrahedron, 23, 745 (1967).
11. GassnerR., Krumbholz E., SteuberF. W. Justus Liebigs Ann. Chem., 1981,789.
12. Findlay S. P. J. Oig. Chem., 21, 644 (1956); Garrido D. O. F, Buldain G., Frydman B, J. Org. Chem., 49,2619 (1984).
13. Breukelman S. P., Leach S. E., Meakins G. D., Tirel M. D. J. Chem. Soc., Perkin Trans. 1, 1984, 2801.
14. Cooksey A. R., Morgan K. J., Morrey D. P, Tetrahedron, 26, 5101 (1970).
15. Doddi G., Mencarelli P., RazziniA., Stegel F. J. Oig. Chem., 44, 2321 (1979).
16. Muchowski J. M.f Naef R. Helv. Chim. Acta., 67, 1168 (1984); Bray B. L., MathiesP. H., NaefR., Solas D. R., Tidwell T. T., Artis D. R., Muchowski J. M. J. Oig. Chem., 55,6317 (1990).
17. Терентьев А, П,, ШадкинаА. Изв. АН СССР, 55,227 (1947).
18. Carmona О., Greenhouse R., Landeros R., Muchowski J. M. J. Oig. Chem., 45, 5336 (1980).
19. Nair V., George T. G., NairL. G., Panicker S. B. Tetrahedron Lett., 40,1195 (1999).
20. Kakushima M., Frenette R. J. Org. Chem., 49,2025 (1984).
21. Ortiz C., Greenhouse R. Tetrahedron Lett., 26,2831 (1985).
22. HamelP., Girard Y., Atkinson J. G. J. Org. Chem., 57, 2694(1992).
23. TreibsA., Kolm H. G. Justus Liebigs Ann. Chem., 614, 176 (1958).
24. Cordell G. A. J. Org.Chem., 40, 3161 (1975); Gilow H. M., Burton D. E. ibid., 46,2221 (1981).
25. Chen W., Cava M. P. Tetrahedron Lett., 28, 6025 (1987); Chen W.t Stephenson E. K., Cava M. P,, Jackson Y. A. Oig. Synth., 70,151 (1992).
26. Martina S., Enkelmann V, Wtgner G, Schluter A.-D. Synthesis., 1991,613.
27. Kozikowski A. P., Cheng X.-M. J. Oig. Chem., 49, 3239 (1984); Shum P. W., Kozi-kowskiA. P., Tetrahedron Lett., 31,6785 (1990).
28. Anderson A. G, Exner M. M. J. Org. Chem., 42, 3952 (1977).
29. Reddy G. S. Chem. Ind., 1965,1426.
30. HarbuckJ. W., Rapoport H. J. Oig. Chem., 37,3618 (1972); Bailey D. M., Johnson R. R, Albertson N. F. Oig. Synth., Coll. Vol. VI, 1988, 618; Chadwick D. J,, Meakins G. D., Rhodes C. A. J. Chem. Res. (S), 1980,42.
31. Belanger Р. Tetrahedron Lett., 1979,2505.
32. VilsmeierA, Haack A. Chem. Вег., 60,119 (1927).
33. «The Vilsmeier reaction of fully conjugated carbocycles and heterocycles», Jones G., Stanforth S. P. Oig. React., 49,1 (1997).
34. Smith G. F. J. Chem. Soc., 1954, 3842; Silverstein R. M., RyskiwiczE. E., Willard C. Oig. Synth., Coll. Vol. IV, 1963,831; de Groot J. A., Gorter-La Roy G. M., van Koeveringe J. A., LugtenburgJ. Org. Prep. Proc. Int., 13,97 (1981).
35. Jugie G., Smith J. A. S., Martin G. J. J. Chem. Soc., Perkin Trans. 2,1975, 925.
36. Chadwick D. J., Hodgson S. T. J. Chem. Soc., Perkin Trans. 1,1983,93.
37. Simchen G,, Majchrzak M. Ж, Tetrahedron Lett., 26,5035 (1985).
38. Downie I. M, Earle M. J., Heaney H, Shuhaibar K. F. Tetrahedron, 49,4015 (1993).
39. Anderson H. J., Loader C. E., Foster A. Can. J. Chem., 58,2527 (1980).
40. Rapoport H., Castagnoli N. J. Am. Chem. Soc., 84, 2178 (1962); Oishi T, Hirama M., Sita L. R., Masamune S. Synthesis, 1991,789.
41. Rokach J,, Hamel P., Kakushima M., Smith G. M. Tetrahedron Lett., 22,4901 (1981); Kakushima M., Hamel P., Frenette R., RoKach J. J. Org. Chem., 48, 3214 (1983); Anderson H. J., Loader С. E, Xu R. X, Le N., Gogan N. J., McDonald R., Edwards L. G. Can. J. Chem., 63,896 (1985); Xiao D., Schreier J. A., Cook J. H., Seybold P. G., Ketcha D. M. Tetrahedron Lett., 37, 1523 (1996); Nicolaou L, Demopoulos V. J. J. Heterocycl. Chem., 35, 1345(1998).
42. Tani M., Ariyasu T, Nishiysama C., Hagiwara H.t Watanabe T, Yokoyama Y, Murakami Y. Chem. Pharm. Bull., 44,48 (1996).
43. Cadamuro S., Degani L, Dughera S., Fochi R., Gatti A., Piscopo L. J. Chem. Soc., Perkin Trans 1,1993,273.
44. Hong F., Zaidi J., Pang Y.-P., Cusack B., Richelson E. J. Chem. Soc., Perkin Trans. 1, 2997.
45. Cativiela C., Garcia J. I. Org. Prep. Proc. Inti., 18, 283 (1986).
46. Hayakawa K., Yodo M., Ohsuki S., Kanematsu K. J. Am. Chem. Soc., 106,6735 (1984).
47. Gregorovich В. V.,. Liang K. S. Y., Clugston D. M., MacDonald S. R. Can. J. Chem., 46, 3291 (1968).
48. Barker P. L.t Bahia C. Tetrahedron, 46, 2691 (1990).
49. Fischer, Schubert Hoppe-Seyler’s Z. Physiol. Chem., 155,88 (1926).
50. Wang О. M., Bruce D. W Synlett, 1995,1267.
51. Taniguchi S., Hasegawa H.t Nishimura M, Takahashi M. Synlett, 1999,73.
52. RothemundP., Gage C. L. J. Am. Chem. Soc., 77,3340 (1955); Corwin A H., Chivvis A. B., Storm С. B, J. Oig. Chem., 29,3702 (1964).
53. Gonsalvez A M. d’A.R., Varejao J. M. T. B., Pereira M. M. J. Heterocycl. Chem., 28, (1991).
54. Hanck A, Kutscher W Z. Physiol. Chem., 338,272 (1964).
55. Fuhlhage D. W, VanderWeifC. A, J. Am. Chem. Soc., 80,6249 (195o).
56. «The acid-catalysed polymerisation of pyrroles and indoles», Smith G. F. /-Heterocycl. Chem., 2, 287 (1963); Zhao Y, Beddoes R. L., Joule J. A. J. Chem. Res. (b„ 1997,42-43; (M), 1997,0401-0429.
57. Fischer O., Hepp E Chem. Ber., 19,2252 (1886); Butler A. R., Pogorzelec P., Shepherd P. 7. J. Chem. Soc., Perkin Trans. 2,1977,1452.
58. «The oxidation of monocyclic pyrroles», Gardini G. P. Adv. Heterocycl. Chem., 15,67 (1973).
59. Thyrann T.t Lightner D. A. Tetrahedron Lett., 36, 4345 (1995); ibid., 37, 315 (1996); Morino-Vargas A. J., Robina L, Ferndndez-Boplanos J. G., Fuentes J. ibid., 39, 9271 (1998).
60. Doddi G, Mercarelli P., Siegel E J. Chem. Soc., Chem. Commun., 1975,273; Di Lorenzo A. D.t Mercarelli R, StegelE J. Oig. Chem., 51,2125 (1986).
61. Franco E, Greenhouse R., Muchowski J. M. J. Org. Chem., 47, 1682 (1982).
62. De Rosa M. J. Oig. Chem., 47, 1008 (1982).
63. Grehn L., Ragnarsson U. Angew. Chem., Int. Ed. Engl., 23,296 (1984).
64. Brittain J. M., Jones R A., Arques J. S., Saliente T. A. Synth. Commun., 1982,231.
65. Hasan I., Marinelli E. R., Lin L.-C. C, Fowler F. Ж, Levy A. B. J. Org. Chem., 46,157; (1981); Greib J. G., Ketcha D. M, Synth. Commun., 25,2145 (1995).
66. Katritzky A. R., Akutagawa К Oig. Prep. Proc. Int., 20,585 (1988).
67. Edwards M. P., Doherty A. M., Ley S. V, Organ H. M. Tetrahedron, 42, 3723 (1986); Muchowski J. M, Solas D. R. J. Org. Chem., 49,203 (1984).
68. Gharpure M., Stoller A., Bellamy E, Fimau G., Snieckus V, Sytnhesis, 1991, 1079.
69. Chadwick D. J. J. Chem. Soc., Chem. Commun., 1974, 790; Chadwick D. J., Willby C. J. Chem. Soc., Perkin Trans. 1,1977,887; Chadwick D. J,. McKnightM. V, NgochindoR. ibid., 1982, 1343.
70. Groenedaal L., Van Loo M. E.t Vekemans J. A. J. M., MeijerE. W. Synth. Commun., 25, 1589 (1995).
71. Hobbs С. E, McMillin C. R, Papadopoulos E. P., VanderWerf C. A, J. Am. Chem. Soc., 84,43 (1962).
72. Heaney H, LeyS. V. J. Chem. Soc., Perkin Trans. 1,1973,499.
73. Santaneillo E., Farachi C, Ponti E Synthesis, 1979, 617.
74. Candy С. E, Jones R A. J. Oig. Chem., 36, 3993 (1971).
75. Jonczyk A., Makosza M. Rocz. Chem., 49, 1203 (1975); Wang N.-C, Teo K. ~E.t Anderson H. J. Can. J. Chem., 55, 4112 (1977); Hamaide T. Synth. Commun., 1990, 2913.
76. Candy С. E, Jones R A., Wright P, H. J. Chem. Soc., (C), 1970,2563.
77. Papadopoulos E. P.f Haidar N. E Tetrahedron Lett., 1968,1721.
78. D’Silva C, IqbalR Synthesis, 1996,457.
79. Skell P. S., Bean G. R J. Am Chem. Soc., 84, 4655 (1962); Bean G, P. J. Heterocycl. Chem., 2,473 (1965).
80. Schloemer G. C, Greenhouse R., Muchowski J. M. J. Org. Chem., 59, 5230 (1994).
81. Nicolau Q, Claremon D. A., Papahatjis D. P. Tetrahedron Lett., 22,4647 (1981).
82. Fillippini L., Gusmeroli M., Riva R Tetrahedron Lett., 33,1755 (1992).
83. Mann G., Hartwig J. E, Dirver M. S., Fernandez-Rivas C. J. Am. Chem. Soc., 120, 827 (1998).
84. Sotoyama T., Hara S., Suzuki A. Bull. Chem. Soc. Jpn., 52, 1865 (1979); Marinelli E. R., Levy A. B. Tetrahedron Lett., 1979, 2313; Minato A., Tamao K, Hayashi T, Suzuki K, Kumada M. Tetrahedron Lett., 22, 5319 (1981).
85. Alvarez A., Guzman A., Ruiz A., Velarde E., Muchowski J. M. J. Org. Chem., 57, 1653 (1992).
86. Rapoport H, Look M. J. Am. Chem. Soc., 75, 4605 (1953); Saeki S., Hayashi T., Hamana M. Chem. Pharm. Bull., 32, 2154 (1984); Jones К, Ho T. С T, Wilkinson J. Tetrahedron Lett., 36,6734 (1995).
87. Aiura M., Kanaoka Y. Chem. Pharm. Bull., 23,2835 (1975).
88. Aldabbagh E, Bowman W. R., Mann E. Tetrahedron Lett., 38,7937 (1997).
89. Aboutayab K., Cadick S., Jenkins K., Joshi S. Tetrahedron, 52,11329 (1996).
90. Hudson С. B., Robertson A. V. Tetrahedron Lett., 1967,4015; Ketcha D. M, Carpenter K. P., Zhou Q. J. Oig. Chem., 56, 1318 (1991).
91. Andrews L. H, McElvain S. M. J. Am. Chem. Soc., 51, 887 (1929); Kaiser H.-P., Muchowski J. M. J. Oig. Chem., 49,4203 (1984); Jejford C. W., SienkiewiczK, Thornton S. R
Helv. Chim. Acta, 78, 1511 (1995); Hext N. M., Hansen J., Blake A. J., Hibbs D. E.t Hursthouse M. B., Shishkin О. V, MascalM. J. Org. Chem., 63,6016 (1998).
92. Donohoe T. J., Guyo P. M. J. Org. Chem., 61,7664 (1996); Donohoe T. J., Guyo P. M., Beddoes R, L., Helliwell M. J. Chem. Soc., Perkin Trans. 1, 1998, 667; Donohoe T. J. Guyo P. M., Helliwell M. Tetrahedron Lett., 40,435 (1999).
93. Wittig G., ReichelB. Chem. Ber., 96,2851 (1963).
94. «Chemistry of 7-azabicyclo[2.2.1]hepta-2,5-dienes, 7-azabicyclo[2.2.1]hept-2-enes and 7- azabicyclo[2.2.IJheptanes», Chen Z., Trudell M. L. Chem. Rev., 96,1179 (1996).
95. Anderson P. S., Christy M. E, Lundell G. F, Ponticello G. S. Tetrahedron Lett., 1975, 2553.
96. Kotsuki H, Mori Y., Nishizawa H, Ochi M.t Matsuoka K, Heterocycles, 19, 1915 (1982).
97. KitzingR., Fuchs R., JoyeuxM., Prinzbach H. Helv. Chim. Acta, 51,888 (1968).
98. BansalR. C, McCulloch A. W.t MclnnesA. G. Can J. Chem., 47,2391 (1969); ibid., 48, 1472 (1970).
99. Zhang C., Trudell M. L. J. Org. Chem., 61, 7189 (1996); Pavri N. P., Trudell M. L. Tetrahedron Lett., 38,7993 (1997).
100. Hodges L. M., Harman W. D. Adv. Nitrogen Heterocycles, 3,1 (1998).
101. Gonzalez J., Koontz J. I., Hodges L. M., Nilsson K. R., Neely L. K, Myers W. H., Sabat M., Harman W. D. J. Am. Chem. Soc., 117,3405 (1995).
102. Lightner D. A., Bisacchi G. S., Norris R. D. J. Am. Chem. Soc., 98,802 (1976); Natsume M., Muratake H. Tetrahedron Lett, 1979,3477.
103. «Cycloaddition reactions with vinyl hererocycles», Sepulveda-Arques J., Abarcf-GonzalezB., Medio-Simon Adv. Heterocycl. Chem., 63,339 (1995).
104. Xiao D., Ketcha D. M. J. Heterocycl. Chem., 32,499 (1995).
105. LiJ.-H.t Snyder J. К J. Oig. Chem., 58,516 (1993).
106. Jones R. C, Reees C. W. J. Chem. Soc. (C), 1969, 2249; Gambacorta A,, Nicoletti R.f Cerrini S., Fedeli W., Gavuzzo E., Tetrahedron Lett., 1978,2349.
107. De Angelis E, Gambacorta A., Nicoletti R. Synthesis, 1976,798.
108. FowlerF. Ж Angew. Chem., Int. Ed. Engl., 10,135 (1971); idem, J. Chem. Soc., Chem. Commun, 1969, 1359.
109. Voigt J., Noltemeyer M., Reiser O. Synlett 1997,202.
110. MaryanoffB, E. J. Org. Chem., 44,4410 (1979); Pomeranz M., Rooney P. J. Org. Chem., 53,4374 (1988).
111. Davies H. M., SaikaliE., Young W, B. J. Oig. Chem., 56,5696 (1991).
112. «Photochemical reactions involving pyrroles, Parts I and II», D’Auria M. Heterocycles, 43,1305-1529 (1996).
113. Hiraoka H J. Chem. Soc., Chem. Commun., 1970, 1306; Barop J. A., Day A. C., Ward R. Ж ibid., 1978,131.
114. Herz W., TockerS. J. Am. Chem. Soc., 77, 6353 (1955); Herz W., Dittmer K, CristolS, J. ibid., 70,504(1948).
115. Greenhouse R., Ramirez C., Muchowski J. M. J. Org. Chem., 50, 2961 (1985); Schumacher D. P., HallS. S. ibid., 46,5060 (1981).
116. Ketcha D. M., Carpenter К. P., Atrinson S. T., Rajagopalan H R. Synth. Commun., 20, 1647(1990).
117. Carson J. R., Davis N. M. J. Org. Chem., 46, 839 (1980).
118. См., например: Badger G. M., Harris R. L. N., Jones R. A. Aust. J. Chem., 17, 1022 (1964); Lancaster R. E., Vander WerfC. A. J. Org. Chem., 23, 1208 (1958).
119. Dunn G. E., Lee G. К J. Can. J. Chem., 49,1032 (1971).
120. Joh Y. Seikagaku, 33,787 (1961) [Chem. Abs., 57,11144 (1962)].
121. Anderson Н. J. Lee S.-E Can. J. Chem., 43, 409 (1965).
122. Norris R. D., Lightner D. A. J. Heterocycl. Chem., 16,263 (1979).
123. Thyrann T, LightnetD. A. Tetrahedron Lett, 37, 315, (1996).
124. Khan M. K. A., Morgan K. J. Tetrahedron, 21,2197 (1965); Williams A., Salvadori G. J. Chem. Soc., Perkin Trans. 2, 1972, 883.
125. Muratake H., Tonegawa M., Natsume M. Chem., Pharm. Bull., 44, 1631 (1996).
126. Bocchi V., Chierichi L., Gardino G. P., Mondelli R. Tetrahedron, 26,4073 (1970).
127. Casiraghi G., Rassu G., Spanu P., Pinna L. J. Org. Chem., 57, 3760 (1992); idem., Tetrahedron Lett., 35, 2423 (1994); «Furan-, pyrrole-, and thiophene-based siloxydienes for synthesis of densely functionalised homochrinal compounds», Cadiraghi G.f Rassu G. Synthesis, 1995,607.
128. Momose T., Tanaka T, Yokota T., Nagamoto N., Yamada K. Chem. Pharm. Bull., 27, 1448 (1979).
129. «Synthesis of amino derivatives of five-membered heterocycles by Thorpe-Ziegler cyclisation», Granik V. G., Kadushkin A. И, Liebscher J. Adv. Heterocycl. Chem., 72, 79 (1998).
130. De Rosa M., Issac R. P., Houghton G. Tetrahedron Lett., 36,9261 (1995).
131. «Recent synthetic methods for pyrroles and pyrrolenines (2H- or 3H-pyrroles)», Patterson J. M. Synthesis, 1976, 281.
132. Bishop W. S. J. Am. Chem. Soc., 67,2261 (1945).
133. Knorr L. Chem. Ber., 17, 1635 (1884).
134. Один из нескольких методов синтеза 1,4-дикарбонильных соединений см.: Wedler C.t Schick Н. Synthesis,1992,543.
135. Rousseau В., NydeggerE., GossauerA., Bennau-Skalmowski В., Vorbffiggen H. Synthesis, 1996,1336.
136. Amamath V., Anthony D. C. Amamath K, Valentine W. M., Wetteran L. A.Graham D. G. J. Org. Chem., 56, 6924 (1991).
137. Young D. M., Allen C. F. H. Oig. Synth., Coll. Vol. II, 1943, 219.
138. ElmingN., Clauson-Kaas N. Acta Chem. Scand., 6, 867 (1952).
139. Lee S. D., Brook M. A.f Chan T. H. Tetrahedron Lett., 1983,1569; Chan T. H, Lee S. D. J. Org. Chem., 48, 3059 91983).
140. McLeod M., Boudreault N., Leblanc Y. J. Org. Chem., 61, 1180 (1996).
141. Josey A. D. Oig. Synth., Coll. Vol V, 1973,716; Jeffbrd C. W., Thornton S. R., Sienkiewicz K. Tetrahedron Lett., 35, 3905 (1994); Fang V, Levsend D., Ottenhejm H. C. J. Synth. Commun., 25, 1857 (1995).
142. McElvain S. M., BolligerK. M. Oig. Synth., Coll. Vol. 1, 1932,473.
143. Okada E., Masuda R., Hojo M., Yoshida R. Heterocycles, 34, 1435 (1992).
144. TreibsA., Schmidt R., Zinsmeister R. Chem. Ber., 90,79 (1957).
145. Fischer H. Org. Synht., Coll. Vol. II, 1943,202.
146. Quizon-ColquittD. M., Lash T. D. J. Heterocycl. Chem., 30,477 (1993).
147. Yinglin H., Hongwer H. Synthesis, 1990, 615.
148. Hamby J. M., Hodges J. C Heterocycles, 35,843 (1993).
149. KoniecznyM. T, Cushman M. Tetrahedron Lett., 33,6939 (1992).
150. Terang N., Mehta В. К, Ha H, Junjappa H Tetrahedron, 54, 12973 (1998).
151. Kolar P., TislerM. Synth. Commun., 23,1887 (1994).
152. RommiM. W., MacDonald S. F. Can. J. Chem., 48, 1689 (1970).
153. KatritzkyA. R., Cheng D., Musgrave R. P. Heterocycles, 44, 67 (1997).
154. Hoppe D. Angew. Chem., Int. Ed. Engl., 13, 789 (1974); van Leusen A. M., Siderius H., Hoogenboom В. E., van Leusen D. Tetrahedron Lett., 1972,5337; Possel O., van Leusen A. M. Heterocycles, 7, 77 (1977); Parvi N. R, Trudell M. L. J. Org. Chem., 62, 2649 (1997);
родственные процессы см.: Houwing Н. A, van Leusen А. М. J. Heterocycl. Chem., 18, 1127(1981).
155. Ono Т., Muratani Е., Ogawa Т. J. Heterocycl. Chem., 28, 2053 (1991).
156. Barton D. H. R., Kervagoret J., Zard S. Z. Tetrahedron, 46,7587 (1990).
157. BoelleJ., Shcneider R., Gerardin P., LoubinouxB. Synthesis, 1997,1451.
158. Lash T. D., Belletini J. R., Bastian J. A., Couch К. B. Synthesis, 1994,170.
159. Ono N., Hironaga H., Ono K, Kaneko S., Murashima T., Ueda T, Tsukamura C., Ogawa T. J. Chem. Soc., Perkin Trans. 1,1996,417.
160. Abel Y., Haake E., Haake G., Shcmidt W., Struve D., Walter A., Montforts F.-P. Helv. Chem. Acta, 81, 1978(1998).
161. Mataka S., Takahashi K, Tsuda Y., Tashiro M. Synthesis, 1982, 157; Walizei G. H. BreitmaierE. ibid., 1989, 337; Hombrecher H. K, Horter G. ibid., 1990,389.
162. Gupton J. T, Petrich S. A, Hicks F. A , Wilkinson D. R., Vargas M., Hosein K. N. Sikorski J. A. Heterocycles, 47,689 (1998).
163. Terry W. G., Jackson A. K, Kenner G. W., Kornis G. J. Chem. Soc., 1965,4389.
164. Lash T. D., HoehnerM. C. J. Heterocycl. Chem., 28, 1671 (1991).
165. BayerH. O., GotthardH., HuisgenR. Chem. Ber., 103,2356 (1970); HuisgenR., GotthardH., Bayer H O., Schafer F. C. ibid., 2611; Padwa A, Burgess E M., Gingrich H. L., Roush D. M. J. Org. Chem., 47,786 (1982).
166. Enders D., Maassen R., Han S.-H. Liebigs Ann., 1996,1565.
167. ShiraishiH., Nishitani T., SakaguchiS., Ishii Y J. Org. Chem., 63,6234 (1998).
168. Knight D. W., Redfern A. L., Gilmore J. Chem. Commun., 1998,2207.
169. Bonnand B., BiggD. С. H. Y. Synthesis, 194,465.
170. Ogawa H., Aoyama T., Shioiri T. Heterocycles, 42, 75 (1996).
171. Frydman B., Reil S., DespuyM. E, Rapoport H. J. Am. Chem. Soc., 91,2338 (1969).
172. Paine J. B., Kirshner W. B., Moskowitz D. W., Dolphin D. J. Org. Chem., 41,3857 (1976); Wang C.-В., Chang С. K. Synhtesis, 1979,548.
173. SesslerJ. L., MozqffariA, Johnson M. R. Org. Synth., 70,68 (1992).
174. «Novel poiphyrinoid macrocycles and their metal complexes», Vogel E. J. Heterocycl. Chem., 33,1461 (1996).
175. SesslerJ. L., Weghom S. J. Expanded, contracted, and isomeric porhpyrins, Peigamon, Oxford, 1997.
176. Arsenault G. P., Bullock E., MacDonald S. F. J. Am. Chem. Soc., 82,4384 (1960).
177. Vogel E., Broring M., Weghom S. J., Scholz P, Deponte R, Lex J., Schmickler H, Schaffner К Braslavsky S. E. Muller M., Porting S., Fowler C. J, SesslerJ. C. Angew. Chem., Int. Ed. Engl., 36,1651 (1997).
178. «СС-1065 and the duocarmycins: synthetic studies», Boger D. C., Boyce C. W., GarbaccioR. M., Goldberg J. A. Chem. Rev., 97,787 (1997).
179. «The chemistry, mode of action and biological properties of CC-1065», Reynolds V. L., McGovern J. P., Hyrley L. H. J. Antibiotics, 39, 319 (1986).
180. Carter P, Fitzjohn S., HalazyS., Magnus P. J. Am. Chem. Soc., 100,2711 (1987).
181. Giblin G. M. P, Jones C. D., Simpkins N. S. J. Chem. Soc., Perkin Trans. 1,1998,3689.
14
ТИОФЕНЫ:
РЕАКЦИИ И МЕТОДЫ СИНТЕЗА
тиофен
Простейшие тиофены [1] представляют собой устойчивые жидкости, по температуре кипения и даже по запаху сильно напоминающие бензол. Они сопровождают бензол и его производные в продуктах перегонки каменноугольной смолы. Открытие тиофена в бензольной фракции каменноугольной смолы связано с одним из классических курьезов в органической химии. В прежние времена для характеристики химических соединений широко применялись цветные реакции. Было, например, известно, что при нагревании бензола с изатином и концентрированной серной кислотой появляется синяя окраска (разд. 14.1.1.7). В 1882 г. В.Мейер читал студентам последнего курса лекцию, сопровождающуюся демонстрацией опытов. К восторгу всех присутствующих, за исключением самого профессора и особенно его ассистента, опыт не удался. При расследовании этого инцидента выяснилось, что у ассистента закончился запас коммерческого бензола и он приготовил бензол путем декарбоксилирования бензойной кислоты. Стало ясно, что цветная реакция характерна не для самого бензола, а для содержащейся в коммерческом бензоле примеси. При дальнейших исследованиях Мейеру удалось выделить эту примесь и определить как неизвестную ранее циклическую систему, которой он дал имя «тиофен» от греческих слов theion (сера) и phaino (светящийся). Впервые корень этого слова был использован для названия фенола, поскольку он был побочным продуктом при производстве светильного газа из каменноугольной смолы.
Ароматические тиофены не принимают участия в метаболизме животных; один из витаминов — биотин —- представляет собой тетрагидротиофен, однако ароматические тиофены встречаются в некоторых растениях в сочетании с ацетиленами, с которыми они связаны биогенетически. Банминт (пирантел), цен
ный антигельминтный препарат, используемый в животноводстве, — одно их тиофеновых соединений, применяемых в химиотерапии.
14.1. РЕАКЦИИ С ЭЛЕКТРОФИЛЬНЫМИ РЕАГЕНТАМИ
14.1.1. Реакции замещения по атому углерода
14.1.1.1. Протонирование
Вследствие высокой стабильности тиофенов в их реакциях электрофильного замещения могут быть успешно использованы комбинации ряда реагентов с сильными кислотами, обычно приводящие к кислотно-катализируемому разложению и полимеризации фуранов и пирролов.
Изучение катализируемого кислотами обмена на атом водорода других групп, например кремния [2] или ртути [3], показало, что скорость атаки по положению 2 примерно в 1000 раз выше, чем по положению 3 [4]. Так, для 2,5-ди-тире/л-бугилтиофена р/Га при образовании соли за счет протонирования по положению 2 составляет —10,2 [5].
Реакций протонированных тиофенов
При обработке тиофена горячей фосфорной кислотой получается тример [6], строение которого предполагает, что на первой стадии образование связи С—С вдет через а-протонированный катион
14.1.1.2. Нитрование
Нитрование тиофена следует проводить в отсутствие азотистой кислоты, которая может привести к взрыву [7]; наиболее удобно использование ацетилнитра-та [8] или тетрафторбората нитрония [9].
Наряду с преимущественным образованием 2-нитросоединения получают и 3-изомер с выходом ~ 10% [10]. Дальнейшее нитрование как 2-, так и 3-нитротиофенов [11] также приводит к образованию смесей: из 2-нитротиофена образуются эквивалентные количества 2,4- и 2,5-диншротиофенов, а из 3-изомера — в основном 2,4-динитротиофен[12]. Аналогично, предсказуемая смесь изомеров образуется при нитровании замещенных тиофенов: например, 2-метилтиофен дает
смесь 2-метил-5- и 2-метил-З-нитротиофенов [13], а 3-метилтиофен — 4-метил-2-нитро- и З-метил-2-нитротиофены [14] в соотношении 4:1 в каждом случае.
конц. HNO3, Ас2О г.—Г\
АсОН, О‘С // \\ +
70% X_/^NO2 6:1
14.1.1.3. Сульфирование
Получение тиофен-2-сульфокислоты при сульфировании серной кислотой уже давно известно [15], однако использование комплекса пиридин-сульфотри-оксид, возможно, более удобный метод [16]. 2-Хлорсульфонилирование [17] и 2-тиоцианирование [18] также достаточно эффективны.
CISO3H, РС15
20 *с______
70%
SO,7CH2CI2> 20 у Ва(ОН)2 86%
14.1.1.4. Галогенирование
Галогенирование тиофена происходит очень быстро и как при комнатной температуре, так и при —30 °C в темноте легко проходит тетразамещение [19]. Скорость галогенирования тиофена при 25 °C примерно в 108 раз больше, чем бензола [20]. Образование как 2,5-дибром- и 2,5-дихлортиофенов [21], так и 2-бром- [22] и 2-иодтиофенов [23] гладко происходит в различных контролируемых условиях. Контролируемое бромирование 3-бромтиофена дает 2,3-дибромтиофен [24].
2,3,5-Трибромирование тиофена гладко протекает в 48%-ном растворе НВг [25]. Давно известно, что при обработке полигалогенотиофенов цинком и кислотой удается селективно удалять а-галоген, что делает доступным получение 3-бромтиофена [26], а 3,4-дибромтиофен аналогично образуется при восстановлении тетрабромида [27]. Для объяснения этого процесса можно предложить следующую схему: первоначально происходит перенос электрона на атом брома, затем селективное удаление галогена таким образом, чтобы «переходный анион»
был наиболее устойчивым — обычно из а-положсния (разд. 14.4.1). При использовании боргидрида натрия из 2,3,5-трибромтиофена получают 2,3-дибромтиофен [в присутствии катализатора Pd(0)] или 2,4-дибромтиофен (без катализатора)^].
NaBH4
DMSO, 20-С
NaBH4, Pd(PPh3)4
MeCN, кипячение
83%
Моноиодирование а-замещенных тиофенов, независимо оттого, оказывают ли эти заместители активирующее или дезактивирующее влияние, идет по второму a-положению при действии иода и иодбензолдиацетата [29]. З-Алкилтио-фены можно монобромировать или моноиодировать по положению 2 при использовании N-бромсукцинимида [30] или иода в присутствии оксида ртути(П) [31] соответственно.
14.1.1.5. Ацилирование
Ацилирование по Фриделю-Крафтсу наиболее часто используется для тиофенов и обычно дает хорошие выходы в контролируемых условиях. Несмотря на то что при взаимодействии тиофена с А1С13 получаются смолы, их образования можно избежать, если добавлять катализатор к тиофену и ацилирующему агенту [32]; наиболее часто в качестве катализатора используют хлорид олова. Эффективный метод — ацилирование ангидридами, катализируемое фосфорной кислотой [33]. В реакциях с ацетил-л-толуолсульфонатами в отсутствие катализаторов с высоким выходом образуется 2-ацетилтиофен [34]. При формилировании тиофена по Вильсмейеру получают 2-формилтиофен [35]. 2-Формилпроизводное образуется также из 3-фенилтиофена в условиях реакции Вильсмейера [36].
PhN(Me)CHO /—у MeCOCI, SnCI4
J42O _POCI3,35*С // \\ PhH, 0‘С 78% 80%
В реакциях ацилирования почти всегда образуются а-замещенные соединения, однако, если оба ос-положения заняты, легко идет p-замещение. Это прекрасно иллюстрируется на примере образования изомерных бициклических кетонов, как показано ниже [37]:
CH2=CHCONMe2 (Tf)2O. (CH2CI)2, 0 -С
14.1.1.6. Алкилирование
Алкилирование проходит достаточно легко, однако редко используется в препаративной химии. Одним из примеров может служить эффективное 2,5-бис-мре/и-бутилированис тиофена [38].
14.1.1.7. Конденсация с альдегидами и кетонами
Кислотно-катализируемые реакции тиофена с альдегидами и кетонами неприменимы для получения гидроксиалкилтиофенов, так как они нестабильны в условиях реакции. Однако можно осуществить хлоралкилирование [39], а при использовании хлорида цинка даже тиофены, имеющие электроноакцепторные заместители, вступают в эту реакцию [40]. Необходимо тщательно подбирать условия, так как возможно образование как ди-2-тиенилметанов [41], так и 2,5-бис(хлорметил)тиофена [42].
НСНО, HCI
ZnCI2 CHCI3, 20 'С
Ме 93%
Реакция, представляющая особый исторический интерес, упомянутая во введении к этой главе, заключается в конденсации тиофена с изатином в концентрированной серной кислоте, в результате которой образуется смесь геометрических изомеров ивдофенина [43], обладающего глубокой синей окраской
Гидроксиалкилирование 2-формилтиофена по положению 5 происходит при взаимодействии тиофенальдегида со вторым альдегидом в присутствии иодида самария(П); ниже приведен пример, в котором в качестве второго альдегида использован 1-метилпиррол-2-альдегид [45]:
14.1.1.8. Конденсация с иминами и иминиевыми ионами
Сообщение об аминометилировании тиофена [46] было опубликовано задолго до описания наиболее общей реакции Манниха — диметиламинометилирования, которое хотя и может проводиться в обычных условиях для метокситиофенов [47], но требует использования Me2N+=CH2Cl~ (иодид известен как соль Эшенмозера) для тиофенов и алкилтиофенов [48]
36%-ная водн. НСНО/7—л Me2N=CH2 CI ~ NH NfoCI. 80 ’С// \\ MeCN, кипячение 45% 55%
NMe2
Другим подходом к введению тиофенов в реакцию с интермедиатами Манниха может служить использование тиофенборных кислот, как показано ниже; в качестве аминной компоненты можно использовать первичные ароматические амины [49].
В(ОН)2
I—/ Ph2CHNH2, НО2ССН=О // \\ СН2С12,Н2О, 20-С \s/ 92% *
СО2Н
14.1.1.9. Меркурирование
Меркурирование тиофенов идет очень легко, при этом ацетат ртути более реакционноспособен, чем хлорид [50]. Тетразамещение и легко идущее замещение атома металла на галоген также можно проводить напрямую [51].
14.1.2. Присоединение по атому серы
В отличие от пиррола и фурана, содержащих элементы II периода, атом серы тиофена может присоединять электрофильные частицы. Соли тиофения [52], хотя и не образуются эффективно из незамещенного тиофена, получают с высокими выходами из полиалкилтиофенов [53]. Атом серы в таких солях, по-видимому, тетраэдрический, т. е. для атома серы в этом случае характерна ^-гибридизация.
Me Ме
MeOSO2F м V/
80 *С NaPF6^ // \\
95% Me^xj/^Me
МеР^б"
Даже незамещенный тиофен реагирует по атому серы с карбенами, образуя выделяемые илиды тиофения, в которых атом серы определенно тетраэдрический [55]. Перегруппировка [56] бис(метоксикарбонил)метилида тиофения в 2-замещенный тиофен послужила прообразом реакции тиофена с этилдиазоацетатом [57], в результате которой, как полагают, образуется продукт присоединения карбена по двойной связи 2,3; возможно, процесс идет через первоначальную атаку по атому серы с последующей перегруппировкой S -> С<2) и образование циклопропана. В условиях кислотного катализа происходит превращение циклопропансодержащего соединения в эфир тиофен-3-уксусной кислоты [58]. Бис(метоксикарбонил)метилид 2,5-дихлортиофения используютв качестве эффективного источника карбена: простое нагревание его в алкене приводит к превращению (МеОгС^С в алкен [59].
В катализируемой родием карбеноидной реакции в конечном счете выделяют 2-замещенный тиофен; на схеме, приведенной ниже, показано, как это можно объяснить, если предположить промежуточное образование циклопропани-рованного интермедиата [60]:
Rh2(OAc)4
C6F6> 85 *С
94%'^
Неконтролируемое S-окисление тиофена приводит к образованию S,S-диоксидов, которые для самого тиофена могут быть выделены, но при окислении незамещенного тиофена при температуре выше —40 ° С получают димеры. Строение продуктов реакции окисления в значительной степени зависит от концентрации [61], и для замещенных тиофенов диоксиды обычно могут быть выделены. В качестве окислителей можно использовать надкислоты [62] или 3,3-диметилдиоксиран [63], но только в том случае, если в молекуле тиофена нет электроноакцепторных заместителей. Раствор фтора в воде (гипофтористая кислота) [64] может быть успешно использован даже при наличии в молекуле тиофена электроноакцепторных заместителей. S,S-Диоксиды представляют собой короткоживущие ароматические тиофены, которые вступают в реакцию Диль-
са-Альдера в качестве диенов; обычно происходит экструзия диоксида серы из первоначального аддукта, что приводит к последующей реакции [65], например ароматизации, как показано на приведенном ниже примере [66]:
14.2. РЕАКЦИИ С ОКИСЛИТЕЛЯМИ
Помимо S-окисления, обсужденного выше, циклическая система тиофена, если только она не содержит электронодонорных заместителей, относительно устойчива по отношению к окислителям; боковые цепочки могут быть окислены до карбоксильных групп, но обычно выходы карбоновых кислот малы.
14.3. РЕАКЦИИ С НУКЛЕОФИЛЬНЫМИ РЕАГЕНТАМИ
Нитрогруппы активируют замещение уходящих групп, таких, как галогены, аналогично тому, как это происходит в бензольном ряду. Подобные процессы широко используются в химии тиофена. Было показано, что такое нуклеофильное замещение проходит по крайней мере в 102 раз быстрее, чем у бензольных
аналогов, что можно объяснить участием атома серы в делокализации заряда в промежуточном комплексе Мезенгеймера [67]. Наличие нитрогрупп также по-
зволяет проводить викариозное нуклеофильное замещение (разд. 2.3.3), как
показано ниже [68]:
пиперидин
МеОН, 20JC NO2 высокий выход
NO2
CICH2SO2NMe2
КОН, THF
NH3 (жид к.)
n°2 81%
CH2SO2NMe2
'V^MO2
Активация, обеспечиваемая атомом серы, возможно обусловливает чрезвычайно легкое замещение атома иода в положении 2 тиофена при использовании алкил- или арилтиолов в качестве нуклеофилов [69].
20‘С
84%
Медь и соли одновалентной меди широко используются в химии тиофена в качестве катализаторов замещения атомов брома и иода, но не хлора, в простейших галогенотиофенах [70]
П Л MeONa, CuBr
(/ МеОН, 100 *С
ЬГ 83%
14.4. РЕАКЦИИ С ОСНОВАНИЯМИ
14.4.1. Депротонирование С-водорода
Монолитиирование тиофена идет по положению 2, а при использовании 2 экв. литиирующего агента легко образуется 2,5-дилитийтиофен [71]. 3-Литийтиофен по сравнению с 2-изомером нестабилен при температурах > —25 ’С в эфирном растворе, но стабилен в гексане [72]; соответствующие цинк- и магнийпроиз-водные образуются региоселекгивно даже при комнатной температуре [73].
m-CPBA
CH2CI2, 20'С »2»AgBF4
TMS 83% |
Литиирование по 0-положению тиофена при наличии свободного а-положе-ния достигается в том случае, если в положении 2 находится ор/ио-ориентирую-щий заместитель [74]. Тиофен-2-карбоновая кислота литиируется я-бутиллити-ем по положению 3, что обеспечивается содействием карбоксильной группы [75], но при использовании диизопропиламвда лития реакция идет по положению 5 [76]. 3-(Оксиалкил)тиофены, также при содействии орто-группы, литиируются по положению 2 [77]. При литиировании 2-хлор-5-метокситиофе-на образуются 4- и 3-производные в соотношении 2:1, на что следует обратить внимание [78], так как депротонирование 2- и 3-бромтиофенов под действием диизопропиламвда лития вдет по положениям 5 и 2 соответственно [79]. При формилировании по Вильсмейеру 3-изопропилтиофен превращается в 2-альде-гид, а при литиировании образуется 5-альдегвд [80].
LDA
THF, -78 *Су
CO2Et U
MSgSnCI^ COgEt 88% *Мез8
CO2Et
Образование аринов часто наблюдается при дегидрогалогенировании в присутствии оснований, однако процесс получения 3,4-двдегидротиофена инициируется фторвд-ионом; предварительное мясо-замещение одной из кремнийсодержащих групп генерирует необходимый предшественник [81].
Me3Si. SiMe3 Me3Si.
VtC Phl(OAc)2, TfOH
H 4 CH2CI2, 20-Cr И Л 53%
l(OTf)Ph
KF, 18-краун-6
CH2CI2, 20'С
31% *
14.5. РЕАКЦИИ С -МЕТАЛЛИРОВАННЫХ ТИОФЕНОВ
14.5.1. Литий- и магнийорганические производные
2-Бром- и 2-иодтиофены легко оборазуют тиенильные реактивы Гриньяра [82], в то время как 3-иодтиофен требует использования магния Рике [73]. Атомы иода как в а-, так и в 0-положениях подвергаются обмену с алкиллитием с обра
зованием литиированных тиофенов. В реакции 2,3-дибромтиофена с н-бутил-литием получают З-бромтиен-2-иллитий [83].
Тиенильные реагенты Гриньяра, а в настоящее время и литиированные тиофены широко используются в синтетической химии, что можно продемонстрировать на следующих примерах: образование гидрокситиофенов либо реакцией тиенильных реагентов Гриньяра с /ире/л-бутилпербензоатом [84], либо реакцией литиированных тиофенов напрямую с бис(триметилсилил)пероксидом [85] или через производное борной кислоты [86], а также на примерах синтеза тиофенкарбоновых кислот при реакции этих металлопроизводных с диоксидом углерода [87], получения кетонов при реакции с нитрилами [88], получения спиртов реакцией с альдегидами [73], реакции 2-литийтиофена с N-тозилазиридином [89] или синтезов тиено[3,2-6]тиофена [90] и дитиено[3,2-6:2',3'-^тиофена [91]. Некоторые из этих примеров показаны на схеме:
Mg, Et2O t-BuO2COPh
Br 73%
TsOH, 155 ‘С
Ot-Bu 93%
vBr LDA r-Z n-BuLi
(THF, 0*C (/ U THF,-70’C
£Me9S.O),
cj водн. LiOH e
дитиено(3,2- Ь]тиофен
NTs /7~7\
-20 *C 20 у // V
)r2ncho
80%
zBr HSCH2CO2Et
Fu K2CO3, DMF, 20-C
(I X 81%
\S^CHO
Я-/ n-BuLi S(SO2Ph)2
Я \) Et2O.-7Q*C^ -70'C-»0’Cr
SX 64%
57%
n-BuLi CuCI2
Et2O, кипячение 20 ‘СЦ 49%
дитиено[3,2-Ь:2’,3‘-с0тиофен
При образовании и использовании литиированных тиофенов возникают две сложности: наблюдаются катализируемая основаниями «пляска галогена» [92] и изомеризация или раскрытие цикла 3-литийтиофенов. В качестве примера пер
вого явления, кстати нашедшего хорошее практическое применение, можно привести превращение 2-бромтиофена в 3-бромтиофен при взаимодействии с амидом натрия в аммиаке [93]. Результат такого превращения определяется положением равновесия, зависящим от стабильности конечного аниона: система стремится к образованию такого аниона, в котором заряд локализован на атоме углерода, расположенном в a-положении и одновременно приближенном к атому галогена.
3-Литийтиофен можно использовать напрямую при низких температурах, однако при повышении температуры происходит раскрытие цикла. Раскрытие цикла с успехом находит применение в синтезе Z-енинов при улавливании алкил галогенидом, как показано ниже [94]:
14.5.2. Реакции, катализируемые палладием, никелем или медью
К настоящему моменту существует много примеров, включающих катализируемые нульвалентным палладием процессы сочетания с использованием галогенотиофенов, тиофенборных кислот, тиенилстаннанов и тиенилцинковых реагентов [95]. В субстратах, содержащих атом галогена как в а-, так и в p-положениях тиофена, только первый вступает в реакцию. Типичные примеры (некоторые из них приведены ниже) включают образование арилтиофенов при использовании тиофен-2- и тиофен-3-борных кислот [96] и тиофенстаннанов [24], а также напрямую из гетероцикла и арилгалогенида (в результате чаще всего получают 2-замещенные производные), образование тиенилалкинов [81,98], тиенилалкенов из тиенилгалогенидов и тиенилстаннанов [99], получение конденсированных циклических систем из бромаминотиофенов или формилтио-фенборных кислот [100], а также никель(О)-катализируемые реакции сочетания тиенилцинковых, тиенилмагниевых и тиенилмарганцевых производных, генерируемых с использованием металлов Рике [101].
Me3SL SiMe3 Me3SL I PhB(OH)2 Me3SL Ph
Y—/ l2. CF3CO2Ag У-/ Pd(PPh3)4, водн.Ма2СО3 (
THF,-78 *C ° PhMe> Me0H> кипячение Л
96%”* 77% 4 /
14.6. РЕАКЦИИ CO СВОБОДНЫМИ РАДИКАЛАМИ
Получение арилтиофенов в результате радикального замещения никогда не было особенно эффективным методом и в настоящее время вытеснено катализируемыми палладием процессами сочетания. 2-Замещенные тиофены получают при использовании арильных радикалов, генерируемых разнообразными методами [102], наиболее эффективные из которых — апротонное диазотирование [103] и фотолиз иодаренов и особенно иодогетарснов [104].
Радикалы, генерируемые разнообразными методами, используют для функционализации тиофенов и в реакциях циклизации; некоторые примеры приведены ниже [105, 106]:
СНгСН(СО2Е1)2 y<-4-C02Et
znf п-С6Н13СН=СН2 /ГЪ \
[[ Ч Мп(ОАс)3, АсОН и
90‘с \ 63% Л-С6Н13
14.7. РЕАКЦИИ С ВОССТАНОВИТЕЛЯМИ
Каталитическое восстановление тиофенового кольца или заместителей в тиофеновом цикле осложнено двумя факторами: отравлением катализатора и возможностью протекания конкурентного гидрогенолиза, восстановительного элиминирования атома серы, особенно при использовании никеля Ренея. Действительно, при использовании тиофенов в качестве темплатов, на которых строится структура, в конце синтетической последовательности часто прибегают к десульфуризации, что может служить важной синтетической стратегией (другие примеры см. разд. 14.13.2.3). Этот метод широко разрабатывается применительно к тиофеновым кислотам, где десульфуризация происходит очень легко при растворении сплава Ренея в водно-щелочном растворе кислоты [107], а также для углеводородов с длинной цепью [108] и для макроциклических кетонов [109].
N2H4, кон ЛСН2)3СО2Н
. \ Ж3О 2П-СВОДН НО<СН2,2ОНУПС М Ренея
+ V PnNOg, 20,0 нагревание // \\ н q ЮО'С
Me мег\<5<‘Ме -2 ’ —
U 5 93%
СО2Н
При обработке натрием в аммиаке также происходит расщепление кольца самого тиофена и простейших тиофенов, однако тиофен-2-карбоновая кислота и 2-ацилтиофены можно превратить в 2,5-дигидропроизводные при использовании лития в аммиаке с последующим протонированием или улавливанием ал-килгалогенидом [111]. Боковые цепи можно восстановить с помощью гидридов металлов, при этом цикл не затрагивается.
Простое насыщение кольца может быть достигнуто «ионным гидрированием» [112], т. е. смесью триалкилсилана и кислоты, обычно трифторуксусной; реакция протекает через последовательное присоединение протона, а затем «гидрида» [113] и, следовательно, требует электронодонорных заместителей для облегчения первой стадии. 2,5-Дигидросоединения образуются наряду с тетрагидропроизводными при восстановлении цинком в трифторуксусной кислоте [114].
ан зи NH4C1 /==\
// \\ NH3 (жидк.) затем CH2N2 / \
Me \/^СО2Н----------------------^\х^СО2Ме
14.8. ЭЛЕКТРОЦИКЛИЧЕСКИЕ РЕАКЦИИ (ОСНОВНОГО СОСТОЯНИЯ) [115]
Неактивированные тиофены проявляют довольно слабую склонность вступать в реакцию Дильса—Альдера в качестве 4л-компонентов; например, даже при давлении 15 кбар атм только с малеиновым ангидридом — электронодефицитным диенофильным партнером — образуется аддукт [116]. Электрофильные алкены
реагируют с тиофенами в жестких условиях [117], причем из первоначально образующихся аддуктов происходит экструзия атома серы, что приводит к замещенным бензолам.
Тем не менее как а-, так и р-метоксизамещенные тиофены реагируют с диметиловым эфиром ацетилендикарбоновой кислоты в ксилоле с образованием фталатов с умеренными выходами в результате экструзии атома серы из первоначального аддукта; при использовании в качестве растворителя уксусной кислоты получают только продукты замещения [118].
MeS ОМе
)—( МеО2СС=ССО2Ме
[/ и ксилол, кипячени^
35%
Ярко выраженная тенденция тиофен-S,S-диоксидов вступать в реакции циклоприсоединения (разд. 14.1.2) в гораздо меньшей степени свойственна тиофен-S-оксидам. Тем не менее при окислении тиофенов jw-хлорнадбензойной кислотой и трифторидом бора (без которого образуются S,S-диоксиды) в присутствии диенофила можно выделить продукты [2 + 4]-присоединения [119]. Тиофены, имеющие объемные заместители в положениях 2,5 или 3,4, могут быть превращены в устойчивые S-оксиды [120], которые вступают в реакцию циклоприсоединения, как показано ниже [121]:
ги-СРВА, BF3.Et2O
СН2С12, 20*С в
Me3Sixxc.x'SiMe3 62%
О
Me3Si
О
малеиновый ангидрид СН2С12,0 ‘С
SiMe3 99%
14.9. ФОТОХИМИЧЕСКИЕ РЕАКЦИИ
Классическая фотохимическая реакция тиофенов — изомеризация 2-арилтиофенов в 3-арилтиофены [122]. В этой реакции ароматический заместитель остается у того же углеродного атома, а эффект достигается благодаря тому, что атомы углерода Ср) и С<з) меняются местами, а атомы С(4) и С(5> остаются на своих местах, однако наблюдается распределение дейтериевой метки и детальный механизм перегруппировки все еще остается предметом для обсуждения.
Существует ряд примеров, в которых фотохимическая циклизация 1-тиенил-2-арил(или гетарил)этенов, приводящая к образованию полициклических соединений, происходит в присутствии окислителя (часто кислорода) для ароматизации циклического интермедиата, как показано ниже [123, 124]:
14.10. Х-МЕТИЛПРОИЗВОДНЫЕ ТИОФЕНА: ТЕНИЛПРОИЗВОДНЫЕ
Фрагмент тиофена, связанного с атомом углерода, называют тенил; следовательно, тенилхлорид образуется при хлорметилировании (разд. 14.1.1.7). Тенилбро-мид обычно получают радикальным замещением по боковой цепи [125], причем замещение по сс-метильной труппе предпочтительнее, чем по р-метильной [126].
2Вг2
СН2С12, -18‘С
100%
1Вг2
СН2С12, -18
76%
Аналогичная бензильным производным реакционная способность была обнаружена у тенилгалогенидов, спиртов (получаемых восстановлением альдегидов) и аминов, образующихся, например, при восстановлении оксимов. Исключение составляют 2-тенильные реагенты Гриньяра, которые обычно реагируют с образованием 3-замещенных производных, реакция идет предположительно через образование неароматического интермедиата [127]
СН2МдС1
CICO2Et
Et2O 72%*"
14.11. ТИОФЕНАЛЬДЕГИДЫ, ТИОФЕНКЕТОНЫ, ТИОФЕНКАРБОНОВЫЕ КИСЛОТЫ И ИХ ЭФИРЫ
Здесь параллели с бензольными аналогами продолжаются, и для перечисленных соединений нехарактерны какие-то особые свойства: их реакционная способность такая же, как и у бензальдегидов, кетонов, кислот и их эфиров. Например, в противоположность легкости декарбоксилирования а-кислот пиррольного и фуранового ряда, тиофен-2-карбоновые кислоты с трудом теряют диоксид углерода, однако высокотемпературное декарбоксилирование имеет препаративное значение (см. также разд. 14.13.1.2) [128].
Л-С10Н211
Оп-СюН21
Н02С^Хо/^С02Н о
Си, хинолин
200 *С г
88%
n-CioH2i
Так же как и в химии бензола, восстановление кетонов по методам Кижне-ра-Вольфа или Клемменсена широко используется для получения алкилтиофенов, окисление гипохлоритом ацетилтиофенов — удобный путь к тиофенкарбо
новым кислотам, перегруппировка Бекмана тиофеноксимов дает ациламинотиофены, а следовательно, и аминотиофены, взаимопревращения кислот и их эфиров проходят без осложнений.
14.12. ГИДРОКСИ- И АМИНОТИОФЕНЫ
14.12.1. Гидрокситиофены
Гвдрокситиофены значительно менее доступны, чем фенолы, и с ними значительно труднее работать. Ни 2-гидрокситиофен, ни его таутомер 4-тиолен-2-он не обнаружены, соединение существует в виде сопряженной енонной формы [129]. Тиофен может быть непосредственно превращен в его 2-кислородсодер-жащее производное [130].
З-тиолен-2-он 4-тиолен-2-он 2-гидрокситиофен (не обнаружен) (не обнаружен)
Присутствие алкильных заместителей стабилизирует как сами гидроксипроизводные, так и двойную связь, к которой они присоеденены. Для этих более стабильных соединений найдены альтернативные таутомерные формы: так, 5-метил-2-гидрокситиофен существует в виде смеси двух енонных таутомеров (их можно разделить фракционной перегонкой!) [131].
p-Гидрокситиофены гораздо менее устойчивы, чем а-гидрокситиофены, 3-гидрокси-2-метилтиофен существует в виде смеси гидроксильного и карбонильного таутомеров с преобладанием первого [132].
Кислотность тиоленолов (рА^ ~10) сравнима с таковой для фенолов. Анионы гидрокситиофена могут реагировать с электрофилами по атому либо кислорода, либо углерода, и, действительно, продукты взаимодействия по обоим центрам реально получены [133]. При силилировании образуются 2-силилоксипроиз-водные, которые реагируют с альдегидами в присутствии трифторида бора, как показано ниже [134]:
14.12.2. Аминотиофены
Аминотиофены гораздо менее устойчивы, чем их бензольные аналоги, если только в цикле отсутствуют другие заместители [135]. Незамещенные аминотиофены (тиофенамины) могут быть получены восстановлением нитротиофенов [136], однако в таком случае выделить их можно только в виде солей — обычно гексахлоростаннатов. Амины тиофенового ряда можно получить также с использованием перегруппировки Бекмана [137] или расщеплением по Гофману [138] в виде устойчивых ацильных производных. Большое число замещенных аминов получают нуклеофильным замещением атома галогена в нитрогалогенотиофенах. И в простых случаях, насколько это известно, и, несомненно, в случае замещенных тиофенаминов аминоформа — единственная обнаруженная форма существования [139].
14.13. СИНТЕЗЫ ТИОФЕНОВ
Промышленный способ получения тиофена заключается во взаимодействии С4- углеводорода с элементной серой в газовой фазе при 600 °C. При взаимодействии н-бутана с серой на первой стадии происходит дегидрирование бутана, а затем сера присоединяется к ненасыщенному углеводороду; дальнейшее дегидрирование приводит к ароматизации системы.
14.13.1. Синтез кольца
14.13.1.1. Из 1,4-дикарбонил ьных соединений и источника серы
1,4- Дикарбонильные соединения реагируют с источником серы с образованием тиофенов
При получении тиофенов из 1,4-дикарбонильных соединений (см. также разд. 15.13.1.1) и источника серы традиционно используют сульфиды фосфора, а позднее — реагенты Лоуссона (LR) [141] или бис(триметилсилил)сульфиды [142]. Реакция идет предположительно, но не обязательно, через образование бис(тиокетона)
При использовании 1,4-дикарбоновых кислот восстановление должно проходить до тиофенов, а не 2-/5-кислородсодержащих производных тиофена [143].
Широкое применение нашли сопряженные диины, имеющие ту же степень окисления, что и 1,4-дикарбонильные соединения, которые гладко реагируют с гидросульфидом или сульфидом в мягких условиях с образованием 3,4-незаме-щенных тиофенов. Таким же методом можно получать несимметричные 2,5-ди-замещенные тиофены [144]. Поскольку почти все природные тиофены находятся в тех частях растений, где встречаются и полиацетилены, этот лабораторный синтез кольца можно механистически связать с процессом биосинтеза.
9Na2S.9H2O
2КОН
DMSO, 55 *С
79%
14.13.1.2. Из тиодиацетатов и 1,2-дикарбонильных соединений
1,2-Дикарбонильные соединения конденсируются с тиодиацетатами (или тио-бисметиленкетонами) с образованием 2,5-дикислот (тиофен-2,5-дикетонов)
Синтез Хинсберга
Метод Хинсберга включает две последовательно протекающие альдольные конденсации 1,2-дикарбонильного соединения с диэтилтиодиацетатом. Родственные соединения эфирокислоты — получают [145] по механизму типа механизма реакции Штоббе, но чаще всего проводят гидролиз, что приводит к образованию устойчивой дикислоты.
^Апк__t-BuOK
//—ЬВиОН, 60 *С о + о 75%
МеО2С^Х /^“СО2Ме
S
Си, 300 *с, 47%
14.13.1.3. Из тиогликолятов и 1,3-дикарбонильных соединений
Тиогликоляты реагируют с 1,3-дикарбонильными соединениями (или их эквивалентами), давая эфиры тиофен-2-карбоновых кислот
В большинстве примеров подобного подхода тиогликоляты как доноры фрагмента S-С взаимодействуют с 1,3-кетоальдегидами, давая интермедиаты, которые, циклизуясь, превращаются в тиофены, как показано ниже [146]:
NaOMe
МеОН, 20 *С 27% две стадии
Алкинилкетоны реагируют с тиогликолятами с образованием похожих интермедиатов при сопряженном присоединении по тройной связи [147]
HSCH2CO2Me Cs2CO3, MgSO4
THF, 0 *C МеОН, 0 'С -» 20
84%
(EtO)2H
14.13.1.4. Из а-тиокарбонильных соединений
2-Кетотиолы присоединяются к алкенилфосфониевым ионам с образованием илидов, которые затем циклизуются по реакции Виттига, давая 2,5-дигидротиофены, которые можно дегидрировать [148]
хлоранил f-BuOH
Et'vj V,Me кипячение H^S^H 81%
14.13.1.5. Из тиодикетонов
Метод [149], в котором 3,4-связь образуется в результате внутримолекулярной пинаколиновой перегруппировки, прекрасно проиллюстрирован [150] на примере получения трициклического тиофена с двумя аннелированными циклобутановыми кольцами. Исходные соединения для этой реакции легко получаются из сульфида натрия и 2 экв. 2-бромкетона:
TiCI4, Zn
THF,-18‘С, 20 *С
36%
ОН ОН
MesCi KOr-Bu пиридин THF, -18 *С
66%
14.13.1.6. С использованием сероуглерода
Присоединение карбаниона к сероуглероду с последующим S-алкилированием приводит к 2-алкилтиотиофенам [151]. В примере, приведенном ниже, карбанион представляет собой енолят циклического 1,3-дикетона
Поистине восхитительное применение эта реакция нашла в синтезе тие-но[2,3-6]тиофена, в котором диин литиируется с образованием литийаллена, а последний затем реагирует с дисульфидом углерода [152]
f-BuLi, t-BuOK, CS2
Me3SiOCOCMe THF,-100 ‘C------g
тиено[2,3-Ь]тиофен
В случае применения енолята, полученного из малононитрила, образуются З-амино-4-цианотиофены [154]
МеСОСН2С1
DMSO, 60 *С
34%
14.13.1.7. Из тиазолов
Последовательность превращений — циклоприсоединение/циклореверсия, которая проходит при сильном нагревании тиазолов (особенно 4-фенилтиазола) с алкином, позволяет получать 2,5-незамещенные тиофены. Несмотря на то что реакция идет в жестких условиях, могут быть достигнуты прекрасные выходы [81].
Me3SiC=CSiMeg
340 *С, DBU запаянная трубка
92%
PhCN^
14.13.1.8. Из тионитроацетамидов
При S-алкилировании тионитроацетамидов 2-бромкетонами получают 2-ами-но-3-нитротиофены. На схеме, приведенной ниже, показано, что образование 3,4-связи происходит в результате внутримолекулярных взаимодействий карбонильной группы кетона с енамином /р-атомом углерода тиенола [155].
BrCH2COPh
DBU, PhH, 60 ‘C
98%
14.13.2. Примеры некоторых важных синтезов производных тиофена
14.13.2.1. Тиено[3,4-Ь]тиофен [156]
Тиено[3,4-6]тиофен получают из 3,4-дибромтиофена, причем замещение двух атомов брома происходит на отдельных стадиях: катализируемое палладием сочетание, затем литиирование в результате переметаллирования с последующим введением атома серы и внутримолекулярным присоединением к алкину.
.SiMe3
Br Br Me3SiC=CH Br.
PdCI2(PPh3)2 (кат.) У—rf л'ВиЬ
U '3 Си*» Et2NH, нагревание // \\ EtgO, -90 *С -»-20 ‘С,
Xs/ 80%
S
-30*С->0‘С Н2о 77%
80%
14.13.2.2. 2,2':5',3"-Тритиофен [157]
В последовательности превращений, приводящей к региоселективном синтезу 2,2':5’,3"-тритиофена, используется реакция диина с сульфидом для образования центрального тиофенового кольца
14.13.2.3. [6.6]Парациклофан
В этом синтезе тиофеновые циклы образуются по реакции Хинсберга; в результате гидролитического удаления атома серы образуется большой цикл, что позволяет перейти к циклофану.
о n2h4, кон (СН2ОН)2 нагревание
Ni Ренея II диоксан нагревание 81% w
Упражнения
Простые упражнения для проверки усвоения материала гл. 12 и 14
(а) Как можно получить 2-бром-, 3-бром- и 3,4-дибромтиофены?
(б) Какие соединения получаются при реакции Вильсмейера с 2-метил- и 3-метилтиофенами?
(в) Как можно превратить 2,5-диметилтиофен в S-оксид и S,S-диоксид?
(г) Какие методы следует использовать для превращения тиофена в его производные, имеющие в положении 2 следующие группы: (1) СН(ОН)-?п/>е/и-Ви; (2) (СН2)2ОН; (3) Ph?
(д) Как из тиофена можно получить н-декан?
(е) Нарисуйте структуры тиофенов, получаемых при использовании следующих комбинаций реагентов: (1) окган-3,6-дион и реагент Лоуссона; (2) диметилтиодиаце-тат [S(CH2CO2Me)2], циклопентан-1,2-дион и основание; (3) петан-2,4-дион, метилтиогликолят (HSCH2CO2Me) и основание.
Упражнения повышенной сложности
1. Предложите структуру соединения C4H3NO2S, образующегося из тиофена в результате следующих взаимодействий: с CISO3H, затем с дымящей HNO3, затем НгО/нагревание; соединение изомерно получаемому из тиофена с ацетилнит-ратом.
2. Предложите структуры основных и минорных изомерных продуктов C5H5NO3S при взаимодействии 2-метилтиофена с HNO3 /АсОН при — 20°С.
3. Какие соединения образуются при взаимодействии следующих соединений: (а) тиофен с пропионовым ангидридом в Н3РО4; (б) 3-лпре/и-бутилтиофен с PhN(Me)CHO/POCl3, затем водн. NaOH; (в) тиофен с Т1(О2ССР3)з, затем водн. KI -> C4H3IS; (г) тиофен/янтарный ангидрид/А1С1з -> C8H8O3S, затем К2Н4/КОН/нагревание -» C8Hi0O2S, затем с SOC12, затем с А1С13 -> C8H8OS.
4. По какому положению проходит депротонирование при взаимодействии 2- и 3-метокситиофенов с н-бутиллитием?
5. Предложите структуры соединений C4HBr3S и C4H2Br2S, образующихся при обработке 2,3,4,5-тетрабромтиофена магнием, затем водой, а потом полученные соединения снова обрабатывают магнием и водой.
6. Предложите структуру соединения C9H6OS2, образующегося в результате следующей последовательности взаимодействий: тиофен с н-бутиллитием, затем СО2 -> C5H4O2S, затем с тиофеном в присутствии Р4О10.
7. Установите структуру тиофенов: (a) C6H4N4S, полученного реакцией (NC)2C~C(CN)2 с H2S; (б) С8Н80бЗ, образующегося из диэтилоксалата, (EtO2CCH2)2S/NaOEt, водн. NaOH, затем Me2SO4; (в) CnHieS, образующегося из 3-ацетилциклононанона с P4S10.
Литература
1. «Recent advances in the chemistry of thiophenes», Gronowitz S. Adv. Heterocycl. Chem., 1, 1 (1963).
2. Deans F. B., Eaborn C. J. Chem. Soc., 1959, 2303; Taylor R. J. Chem. Soc. (B), 1970, 1364.
3. Steinkopf W., Kohler W. Justus Liebigs Ann. Chem., 532, 250 (1937); Schreiner H. Monatsh. Chem., 82,702 (1951).
4. Schwetlick K, Unverferth K., Mayer R. Z. Chem., 7, 58, (1967); Olsson S. Arkiv. Kemi, 32,89 (1970); BakerR., Eaborn C., TaylorR. J. Chem. Soc., PerkinTrans. 2,1972,97.
5. Carmody M R, Cook M. J., Dassanayake N. C., Katritzky A. R., Linda P., Tack R. D. Tetrahedron, 32, 1767 (1976).
6. Curtis R. E, Jones D. M., Thomas W. A. J. Chem. Soc. (C), 1971, 234.
7. Butler A. R., Hendry J. B. J. Chem. Soc. (B), 1971, 102.
8. Babasinian V. S. Org. Synth., Coll. Vol. II, 1943,466.
9. Olah G. A., Kuhn S., Mlinko A, J. Chem. Soc., 1956,4257.
10. Ostman B. Acta Chem. Scand., 22, 1687 (1968).
11. Blatt A. H, Bach S., Kresch L W. J. Org. Chem., 22,1693 (1957).
12. Ostman B. Acta Chem. Scand., 22, 2754 (1968).
13. Gronowitz S., Gjos N. Acta Chem. Scand., 21,2823 (1967).
14. Gronowitz S., Ander I. Chem. Scr., 15,20 (1980).
15. Steinkopf W., Ohse W. Justus Liebigs Ann. Chem., 437,14 (1924).
16. Терентьев А. П., Кадатский Г. M. ЖОХ, 1952,189.
17. Maccarone R, Musumarra G, Tomaselli G. A. J. Org. Chem., 39, 3286 (1974).
18. Sdderback E. Acta Chem. Scand., 8,1851 (1954).
19. Steinkopf JK, Jacob H, Penz H. Justus Liebigs Ann. Chem., 512, 136 (1934).
20. Marino G. Tetrahedron, 21, 843 (1965).
21. Muathen H. A. Tetrahedron, 52,8863 (1996).
22. Buu-Ho‘i N. P. Justus Liebigs Ann. Chem., 556, 1 (1944); Keegstra M. A., Brandsma L. Synthesis, 1988,890.
23. Minnis W. Org. Synth., Coll. Vol. II, 1943, 357; Lew H. Y., Noller C. R. ibid., Coll. Vol.
IV, 1963, 545.
24. Antolini L., Goldini E, larossiD., Mucci. A., Schenetti L. J. Chem. Soc., Perkin Trans. 1,
1997,1957.
25. Brandsma L., Verkruijsse H. D. Synth. Commun., 18, 1763 (1988).
26. Gronowitz S., Raznikiewicz T. Oig. Synth., Coll Vol. V, 1973,149; HallbergA., Liljefors S., Pedaja P. Synth. Commun., 11,25 (1981).
27. Gronowitz S Acta Chem. Scand., 13,1045 (1959).
28. Xie Y., Ng S.-С., Hor T. S. A., Chan H. S. O. J. Chem. Res. (S), 1996,150.
29. D’Auria M., Mauriello G. Tetrahedron Lett., 36, 4883 (1995).
30. Hoffmann K. J, Carlsen P. H. J. Synth. Commun., 29,1607 (1999).
31. Pearson D. £., Tour J. M. J. Org. Chem., 62, 1376 (1997).
32. Johnson J. R., May G. E. Oig. Synth., Coll. Vol. II, 1943,8; Minnis W. ibid., 520.
33. Hartough H. D., Kosak A. I. J. Am. Chem. Soc., 69, 3093 (1947).
34. Pennanen S. I. Heterocycles, 4,1021 (1976).
35. Weston A. W., Michaels R. J. Oig. Synth., Coll. Vol. IV, 1963,915; Downie I. M., Earle M. J., Heaney H, ShuhaibarK E Tetrahedron, 49,4015 (1993).
36. Finch H., Reece D. IL, Sharp J. T. J. Chem. Soc., Perkin Trans. 1,1994, 1193.
37. Baraznenok I. L., Nenadenko V. G., Balenkova E. S. Synthesis, 1997,465; Blanchard P., Brisset H Illien B., RionA., RoncaliJ. J. Org. Chem., 62,2401 (1997).
38. Kamitori Y, Hojo M., Masuda R., Izumi T., Tsukamoto S. J. Org. Chem., 49,4161 (1984).
39. Wiberg К. В., Shane Н. Е Oig. Synth., Coll Vol. 111,1955,197; Emerson W. S., Patrick T M. ibid., Coll. Vol. IV, 1963,980.
40. Janda M. Coll. Czech. Chem. Commun., 26, 1889 (1961).
41. Blick e F. E, Burckhalter J. F. J. Am. Chem., Soc., 64,477 (1942).
42. GriffingJ. M., Salisbury L. F. J. Am. Chem. Soc., 70,3416 (1948).
43. Ballantine J. A., Fenwick R. G., J. Chem. Soc. (C), 1970,2264.
44. Tormos G. V., Belmore K. A., Cava M. P. J. Am. Chem. Soc., 115, 11512 (1993).
45. YangS.-M., Fang, J.-M. J. Chem. Soc., Perkin Trans. 1,1995, 2669.
46. Hartough H. D., Meisel S. L., J. Am. Chem. Soc., 70,4018 (1948).
47. Barker J. M., Huddleston P. R., Wood M. L. Synth. Commun., 1975, 59.
48. Dowle M. D., Hayes R., Judd D. B., Williams C. N, Synthesis, 1983,73.
49. Harwood L. M., Currie G. S., Drew M. G. B., Luke R. W. A. Chem. Commun., 1996, 1953; Petasis N. A., Goodman A., Zavialov I. A. Tetrahedron., 53,16463 (1997).
50. Briscoe H. V. A., Peel J. B., Young G. W., J. Chem. Soc., 1929,2589.
51. Steinkopf W., Kohler W. Justus Liebigs Ann. Chem. Soc., 532,250 (1937).
52. «The chemistry of thiophenium salts and thiophenium ylids», Porter A. E. A. Adv.Heterocycl. Chem., 45,151 (1989).
53. Acheson R. M.t Harrison D. R. J. Chem. Soc. (C), 1970,1764; Heldeweg R. E, Hogeveen H. Tetrahedron Lett., 1974,75.
54. Hashmall J. A., Horak, V., Khoo L. E., Quicksail C. O., Sun M. К J. Am. Chem. Soc., 103,289(1981).
55. Gillespie R. J., Murray-Rust J., Murray-Rust P., Porter A. E. A. J. Chem. Soc., Chem. Commun., 1978, 83.
56. Gillespie R. J., Porter A. E. A., Willmott W. E. J. Chem. Soc., Chem.. Commun., 1978, 85.
57. Tramer G. K, Capretta A. Tetrahedron, 54, 15499 (1998); Monn J. A. et al. J. Med. Chem., 42,1027(1999).
58. Schenk G. O., Steinmetz R- Justus Liebigs Ann. Chem., 668, 19 (1963).
59. Cujfe J., Gillespie R. J., Porter A. E.. A. J. Chem. Soc., Chem. Commun., 1978,641.
60. PirrungM. C., Zhang J., Lackey K, Stemback D. D., Brown E J. Oig. Chem., 60,2112 (1995).
61. Nakayama J., Nagasawa H, Sugihara Y., Ishii A. J. Am. Chem. Soc., 119,9077 (1997).
62. Melies J. L., Backer H. J. Reel. Trav. Chim Pays-Bas, 72,314 (1953); van Tilbotg. W. J. M. Synth. Commun., 6,583 (1976); McKillop A., Kemp D. Tetrahedron, 45,3299 (1989).
63. Miyahara Y., Inazu T. Tetrahedron Lett., 31,5955 (1990).
64. Rozen S, Bareket Y J. Oig. Chem., 62, 1457 (1997).
65. Melies J. L., Reel. Trav. Chim. Pays-Bas, 71,869, (1952).
66. Nakayama J., Hiroshima A.. J. Am. Chem. Soc., 112, 7648 (1990).
67. Consiglio G., Spinelli D., Gronowitz S., Homfeldt A.-B., Maltesson B., Noto R. J. Chem. Soc., PerkinTrans. 1,1982, 625.
68. Makosza M., Kwast E. Tetrahedron, 51, 8339 (1995).
69. Lee S. B., HongJ.-L Tetrahedron Lett., 36, 8439 (1995).
70. Keegstra M. A., Peters T. H. A., Brandsma L. Synth. Commun., 20,213 (1990).
71. Chadwick D. J., Willbe C. J. Chem. Soc., Perkin Trans. 1, 1977,887; Feringa B. L., Hulst R., Rikers R., Brandsma L. Synthesis, 1988, 316; Furukawa N., Hoshino H, Shibutani T., Higaki M., Iwasaki E, Fujihara H. Heterocycles, 34, 1085 (1992).
72. Wu X, Chen T. A., Zhu L., Rieke R. D. Tetrahedron Lett., 35, 3673 (1994).
73. Rieke R. D., Kim S.-H, WuX. J. Oig. Chem., 62,6921 (1997).
74. Chadwick D. J., McKnight M. V., Ngochindo R. J. Chem. Soc., Perkin Trans. 1,1982, 1343; Chadwick D. J., Ennis D. S. Tetrahedron, 47,9901 (1991).
75. Carpenter A. J., Chadwick D. J. Tetrahedron Lett., 26, 1777(1985).
76. Knight D. W., Nott A. P. J. Chem. Soc., Perkin Trans. 1,1983,791.
77. Bures E, Spinazze P. G., Beese G., Hunt I. R., Rogers C., KeayB. A. J. Oig. Chem., 62,8741; (1997), DuPriest M. T, Zincke P. Ж, Conrow R. E., Kuzmich D., Dantanarayana A. P., SproullS. J. ibid., 9372.
78. Gronowitz S., HallbergA., Frejd T. Chem. Scr., 15, 1 (1980).
79. HallbergA., Gronowitz S. Chem. Scr., 16,42 (1980).
80. DettyM. R., Hays D. S. Heterocycles, 40,925 (1995).
81. Ye Х-S., WongH. N. C. J. Org. Chem., 62, 1940 (1997).
82. Goldberg Yu., Sturkovich R., LukevicsE. Synth. Commun., 23, 1235 (1993).
83. Spagnolo P., Zanirato P. J. Chem. Soc., Perkin Trans. 1,1996, 963.
84. Frisell C., Lawesson S.-O. Oig. Synth., Coll. Vol. V, 1973, 642.
85. Camici L., Ricci A., TaddeiM. Tetrahedron Lett., 27,5155 (1986).
86. Homfeldt A.-B. Ark. Kern., 22,211 (1964).
87. Acheson R. M., MacPhee К. E., Philpott R. G., BarltropJ. A. J. Chem. Soc., 1956,698.
88. Alvarez M., Bosch J., Granados R., Ldpez F. J. Heterocycl. Chem., 15,193 (1978).
89. Fikentscher R., Briickmann R., BetzR. Justus Liebigs Ann. Chem., 1990,113.
90. Fuller L. S., Iddon B., Smith K. A. J. Chem. Soc., Perkin Trans., 1,1997, 3465.
91. LiX.-C., Sirringhaus H, Gamier E, Holmes A. B., Moratti S. C., Feeder N., Clegg W., Teat S. J., Friend R. H. J. Am. Chem. Soc., 120, 2206 (1998).
92. «The base-catalysed halogen dance, and other reactions of aryl halides», Bunnett J. F. Acc. Chem. Res., 5, 139 (1972).
93. Brandsma L., de Jong R. L. P. Synth. Commun., 20,1697 (1990).
94. Karlsson J. O., Svensson A., Gronowitz S. J. Org. Chem., 49, 2018 (1984).
95. Melamed D., Nuckols C., FoxM. A. Tetrahedron Lett., 35,8329 (1994).
96. Gronowitz S., Peters D. Heterocycles, 30, 645 (1990).
97. Ohta A., Akita Y., Ohkuwa T, Chiba M., Fukilnaga R., MiyafujiA., Makata T., TaniN., Aoyagi Y. Heterocycles, 31,1951 (1990).
98. Pearson D. L., Tour J. M. J. Oig. Chem., 62, 1376 (1997); YeX.-S, WongH. N. C. Chem. Commun., 1996,339; NegishiE., Xu C., Tan Z., Kotora M. Heterocycles, 46,209 (1997).
99. Allred G. D., LiebskindL. S. J. Am. Chem. Soc., 118,2748 (1996); Tamao K., Nakamura K., Ishii H, Yamaguchi S., Shiro M. ibid., 12469.
100. Malm J., Rehn B., Hornfeldt A.-B., Gronowitz S. J. Heterocycl. Chem., 31, 11 (1994); Bjork P., Hornfeldt A.-B., Gronowitz S. ibid., 1161.
101. Chen 71 A., WuX., Rieke R. D. J. Am. Chem. Soc., 117,233 (1995); Rieke R. D., Kim S.-H, WuX. J. Oig. Chem., 62,6921 (1997).
102. Camazzi С. M., Leardini R., Tundo A., Tiecco M. J. Chem. Soc., Perkin Trans. 1, 1974, 271; Bartie M., Gore S. T, Mackie R. K, Tedder J. M. J. Chem. Soc., Perkin Trans. 1, 1976,1636.
103. Camaggi C.-М., Leardini R., TjeccoM., Tundo A. J. Chem. Soc. (B), 1970,1683; Vemin G., Metzger J., Parpanyi J. Org. Chem., 40, 3183 (1975).
104. Ryang H. S., Sakurai H. J. Chem. Soc., Chem. Comun., 1972, 594; Allen D. W., Buckland D. J., Hutley В. G., Oades A. C., Turner J. B. J. Chem. Soc., Perkin Trans. 1, 1977, 621; D’Auria M., De Luca E., Mauriello G., Racioppi R. Synth. Commun., 29,35 (1999).
105. Chuang С.-P., WangS.-F. Synth. Common., 24,1493 (1994); idem, Synlett, 1995,763.
106. Araneo S., Arrigoni R., Bjorsvik H.-R., Fontana E, Minisci E, Recupero F. Tetrahedron Lett., 37,7425 (1996).
107. Hansen S. Acta Chem. Scand., 8,695 (1954).
108. WynbergH., Logothetis A. J. Am. Chem. Soc., 78, 1958 (1956).
109. Gol’dfarb Ya. L., TaitsS. Z., Belen’kii L. I. Tetrahedron, 19,1851 (1963).
110. Birch S. F, McAllan D. T. J. Chem. Soc., 1951,2556.
111. Blenderman W. G., JoullU M. M., Preti G. Tetrahedron Lett., 1979, 4985; Kosugi K., Anisimov A. V, Yamamoto H., Yamashiro R., ShiraiK, Kumamoto T. Chem. Lett., 1981, 1341; Altenbach H.-J., Brauer D. J., MerhofG. F. Tetrahedron, 53,6019 (1997).
112. «Applications of ionic hydrogenation to organic synthesis», KursanovD. N., PamesZ. N., Loim N. M. Synthesis, 1974,633.
113. KursanovD. N., PamesZ. N., Bolestova G. I., Belen ’kiiL. I. Tetrahedron, 31,311 (1975).
114. Lyakhovetsky Yu., Kalinkin M., Parnes Z., Latypova E, Kursanov D. J. Chem. Soc., Chem. Commun., 1980, 766.
115. «Cycloaddition, ring-opening, and other novel reactions of thiophenes», Iddon B. Heterocycles, 20, 1127 (1983); «Cycloaddition reactions with vinyl heterocycles», Sepulveda-Arques J., Abarca-Gonzdlez B., Medio-Simon Adv. Heterocycl. Chem., 63, 339(1995).
116. Kotsuki H., Nishizawa H, Kitagawa S., Ochi M., Yamasaki N., Matsuoka К, Tokoroyama T. Bull. Chem. Soc. Ipn., 52, 544 (1979).
117. Helder R., Wynberg H. Tetrahedron Lett., 1972, 605; Kuhn H. J., Gollnick K. Chem. Ber., 106,674 (1973).
118. Corral C., Lissavetzky J., Manzanares I. Synthesis, 1997,29.
119. Li Y., Thiemann T., Sawada T, Mataka S., Tashiro M. J. Org. Chem., 62, 7926 (1997).
120. Furukawa N., Zhang S.-Z, Sato S., Higaki M. Heterocycles, 44,61 (1997).
121. Furukawa N., ZhangS.-Z., Hom E., Takahashi O., Sato S. Heterocycles, 47,793 (1998).
122. WynbergH. Acc. Chem. Res., 4,65 (1971).
123. MarzinzikA. L., Rademacher P. Synthesis, 1995,1131.
124. Sato K, Arai S., Yamagishi T. J. Heterocycl. Chem., 33, 57 (1996).
125. Campaigne E., Tullar B. F. Oig. Synth., Coll. Vol. IV, 1963, 921; Clarke J. A., Meth-Cohn O. Tetrahedron Lett., 1975,4705.
126. Nakayama J., Kawamura T, Kuroda K, Fujita A. Tetrahedron Lett., 34,5725 (1993).
127. GaertnerR. J. Am. Chem. Soc., 79,3934 (1951).
128. Merz A., Rehm C. J. Prakt. Chem., 338, 672 (1996); Cojfey M., McKellar B. R., Reinhardt B. A., Nijakowski T, Feld W. A. Synth. Commun., 26, 2205 (1996).
129- Jakobsen H. J., Larsen E. H, Lawesson S.-O. Tetrahedron, 19, 1867 (1963).
130. Allen D. W., Clench M. R., Hewson A. T, Sokmen M. J. Chem. Res. (S), 1996,242.
131. Gronowitz S., Hoffman R. A. Ark. Kemi, 15, 499 (I960), Hornfeldt A.-B. ibid., 22, 211 (1964).
132. Thorstad O., Undheim K., Cederlund B., Hornfeldt A.-B. Acta Chem. Scand., B29, 647 (1975).
133. Lantz R-, Hornfeldt A.-B. Chem. Scr., 10, 126 (1976); Hurd C. D.,Kreuz K. L. J. Am. Chem. Soc., 72, 5543 (1950).
134. Rassu G., Spanu P., Pinna L., Zanardi F., Casiraghi G. Tetrahedron Lett., 36, 1941 (1975); «Furan-, pyrrole-, and thiophene-based siloxydienes for synthesis of densely functionalised homochiral compounsd», Casiraghi G., Rassu G. Synthesis, 1995,607.
135. «Synthesis of amino derivatives of five-membered heterocycles by Thorpe-Ziegler cyclisation», Granik V. G., Kadushkin A. V, Liebscher Adv. Heterocycl. Chem., 72, 79 (1998).
136. Steinkopf W. Justus Liebigs Ann. Chem., 403,17 (1914); Steinkopf W., Hopner T. ibid., 501,174(1933).
137. Meth-Cohn O., Narine B. Synthesis, 1980, 133.
138. Campaigne E., Monroe P. A. J. Am. Chem. Soc., 76,2447 (1954).
139. BrunettE. W., Altwein D. M., McCarthy W. C. J. Heterocycl. Chem., 10,1067 (1973).
140. «The preparation of thiophens and tetrahydrothiophens», Wolf D. E., Folkers K. Org. Reactions, 6,410 (1951).
141. ShridarD. R, Jogibhukta M., Shanthon Rao P., Handa V. K. Synhesis, 1982,1061; Jones R. A., Civcir P. U. Tetrahedron, 53,11529 (1997).
142. Freeman F., Lee M. K, Lu H., WangX., Rodriguez E. J. Oig. Chem., 59,3695 (1994).
143. Feldkamp R. E, TullarB. F. Org. Synth., Coll. Vol. IV, 1963, 671.
144. Schulte К. E., Reisch J., Horner L. Chem. Ber., 95, 1943 (1962); KozJiushkov S., Hanmann T, Boese R., Knieriem B., Scheib S., Bauerle P., de Meijere A. Angew. Chem., Int. Ed. Engl., 35, 781 (1995); Alzeer J., VasellaA. Helv. Chim. Acta, 78,177 (1995).
145. Wynberg H., Kooreman H. J. J. Am. Chem. Soc., 87, 1739 (1965).
146. Taylor E. C, Dowling J, E. J. Org. Chem., 62, 1599 (1997).
147. ObrechtD., Gerber F., SprengerD., Masquelin T. Helv. Chim. Acta, 80,531 (1997).
148. McIntosh J. M., Khalil H. Can J. Chem., 53,209 (1975).
149. Nakayama J., Machida H., Saito R., Hoshino M. Tetrahedron Lett., 26, 1983 (1985).
150. Nakayama J., Kuroda K. J. Am. Chem., Soc., 115,4612 (1993).
151. Prim D., Kirsch G. Synth. Commun., 25,2449 (1995).
152. De JongR. L. P., Brandsma L. J. Chem. Soc., Chem. Commun., 1983,1056; Otsubo T.t Kono K, Hozo N., Miyamoto H., Aso K, Ogura E, Tanaka T., Sawada M. Bull. Chem. Soc.Jpn.,66,2033(1993).
153. Gewald K., RennentS, Schindler R., Schafer H. J. Prakt. Chem., 337,472 (1995).
154. Rehwald M., Gewald K, Bottcher G. Heterocycles, 45,493 (1997).
155. Reddy К. И, Rajappa S. Heterocycles, 37,347 (1994).
156. Brandsma L., Verkruijsse H. D. Synth. Commun., 20,2275 (1990).
157. Kagan J., Arora S. K, Prakesh L, Ustiinol A. Heterocycles, 20, 1341 (1983).
158. Miyahara Y, Inazu T, Yashino T. J. Org. Chem., 49,1177 (1984).
15
ФУРАНЫ:
РЕАКЦИИ И МЕТОДЫ СИНТЕЗА
фуран
Фураны [1] — летучие, довольно устойчивые соединения, обладающие приятным запахом. Сам фуран — легко доступное, слабо растворимое в воде соединение — имеет большое практическое применение в качестве предшественника широко применяемого растворителя тетрагидрофурана (ТГФ). Фуран получают декарбонилированием в газовой фазе фурфурола (2-формилфурана, фуран-2-карбоксальдегида), который производят в больших количествах действием кислот на растительное сырье, главным образом на овсяные отруби или овсяные хлопья. Таким образом он и был впервые получен в 1831 г., и его название происходит от латинского слова furfur, что означает отруби; впоследствии в 1870 г. отсюда возникло и название фуран.
периллен
аскорбиновая кислота (витамин С)
фурфурилтиол
Ароматическая система фуран, хотя и не найдена в продуктах метаболизма животных, широко распространена во вторичных метаболитах растений, особенно терпеноидах: простейший пример — периллен. Витамин С (аскорбиновая кислота) представляет собой соединение со степенью окисления тетрагидрофурана, хотя оно существует в таутомерной форме ненасыщенного лактона. Обычно соединения, содержащие тиольные группы, обладают неприятным запахом, однако аромат жареного кофе обусловлен присутствием в нем фурфу-рилтиола. Некоторые производные 5-нитрофурфурола используются в качестве химиотерапевтических препаратов, например, бактерицидный препарат нитро-фуразон (фурациллин). Один из наиболее коммерчески успешных медицинских препаратов — ранитидин — используют для лечения язвы желудка.
o2n
NNHCO.NH2
нитрофуразон
15.1. РЕАКЦИИ С ЭЛЕКТРОФИЛЬНЫМИ РЕАГЕНТАМИ
Среди трех пятичленных систем с одним гетероатомом, рассмотренных в этой книге, фуран представляет собой «наименее ароматическое» соединение и, как таковой, проявляет наибольшую склонность к реакциям присоединения. Это верно в отношении как взаимодействия с обычными электрофильными реагентами, используемыми в реакциях замещения, рассмотренных в этом разделе, так и процессов типа реакции Дильса—Альдера (разд. 15.8).
15.1.1. Протонирование
Сам фуран и простые алкилфураны относительно устойчивы кдействию водных растворов минеральных кислот, однако фуран мгновенно разлагается под действием концентрированной серной кислоты или кислот Льюиса, например хлорида алюминия. Фуран медленно реагирует с хлороводородом либо в виде концентрированного водного раствора, либо в растворителе, не содержащем гидроксильных групп. Нагревание с разбавленными минеральными кислотами вызывает гидролитическое размыкание фуранового кольца.
«-протонированный катион, приводящий к а-обмену
Р-протонированный катион
продукты
раскрытия цикла
Н
О-протонированный
катион присутствует в меньшей степени
Значение рА^ для О-протонированного фурана не определено, но, вероятно, основность его значительно ниже основности алифатических эфиров. На свету происходит катализируемое кислотами дейтерирование [2]; 3/4-дейтерофураны не обнаружены, так как, несмотря на то, что p-протонирование происходит, образующийся катион, по-видимому, очень чувствителен кдействию воды, что приводит к гидролитическому раскрытию цикла. Величина рА^ = —10 была определена д ля 2-протонирования 2,5-ди-тирети-бутилфурана, в то время как для незамещенного фурана эта величина составляет около —13 [3]. С,С-Протониро-ванный катион, устойчивый в растворе, образуется при обработке 2,5-ди-мрем-бутилфурана концентрированной серной кислотой [3,4].
15.1.1.1. Реакции протонированных фуранов
При гидролизе (или алкоголизе) фуранов первоначально образуются катионы, которые вступают с водой (или спиртами) в реакции нуклеофильного присоединения, превращаясь в ациклические 1,4-дикарбонильные соединения или их производные. Этот процесс обратен реакции, лежащей в основе одного из главных способов синтеза фуранов (разд. 15.12.1.1). Диальдегид янтарной кислоты нельзя получить из незамещенного фурана, возможно, из-за его повышенной реакционной способности в условиях гидролиза, однако некоторые алкилфураны могут быть вполне успешно превращены в 1,4-дикарбонильные соединения
и это может служить хорошим методом их синтеза; в дальнейшем из них можно получать циклопентеноны [5]. Другие пути превращения фуранов в 1,4-дикарбонильные соединения заключаются в гидролизе 2,5-диалкокситетрагидрофу-ранов (разд. 15.1.4) и в разнообразных окислительных процессах (разд. 15.2).
1,5%-ная HCI, МеОН кипячение, 1 день
водн. АсОН, НВг 100*0,7 дней
Me 90%
40%
15.1.2. Нитрование
Чувствительность фуранов не позволяет использовать концентрированную кислотную нитрующую смесь. При взаимодействии фурана или замещенных фуранов [6] с ацетилнитратом первоначально образуются неароматические аддукты, в которых образованию продуктов замещения препятствует процесс нуклеофильного присоединения ацетата к катионному интермедиату, обычно [7] по положению 5 [8]. Ароматизация с потерей уксусной кислоты, приводящая к образованию нитропроизводного, происходит под действием растворителя; наилучшие результаты достигаются при использовании слабого основания, такого, как пиридин [9]. Дальнейшее нитрование 2-нитрофурана дает 2,5-ди-нитрофуран в качестве основного продукта реакции [10].
Оконц.НМОз, Ас2О
-5‘С
и 60%
15.1.3. Сульфирование
Фуран и алкилфураны разлагаются под действием обычных сильных кислот, однако можно использовать комплекс пиридинсульфотриоксид, под действием которого происходит дизамещение фурана даже при комнатной температуре [11].
С1(СН2)2С1, 20 *С 3 дня 60%
HO3S
SO3H
15.1.4. Галогенирование
Фуран энергично реагирует с хлором и бромом при комнатной температуре с образованием полигалогенированных соединений, но не реагирует с иодом. В более контролируемых условиях можно получить 2-бромфуран [12]; реакция,
по-видимому, протекает через образование 1,4-дибром- 1,4-дигидроаддукта, поскольку такие частицы были действительно обнаружены при низкой температуре с использованием спектроскопии ПМР [13]. В реакции с бромом в диметилформамиде при комнатной температуре гладко образуются 2-бром- и 2,5-дибромфураны [14].
-НВг,
Если бромирование проводят в метаноле, то улавливание интермедиата за счет присоединения спирта по положению 5 с последующим метанолизом 2-бромида приводит к образованию 2,5-диалкокси-2,5-дигидрофуранов в виде смеси цис- и /иранс-изомеров [15], восстановление которых часто используют в синтезе 1,4-дикарбонильных соединений — незамещенное соединение эквивалентно янтарному диальдегиду [16], а нагревание с тиофенолом или фенилсульфоновой кислотой в кислой среде дает 2-серосодержащие фураны [17]. 2,5-Ди-алкокси-2,5-дигидрофураны также можно получить электрохимическим окислением в спиртовых растворителях [15, 18] или удобным окислителем — монопероксифталатом магния в метаноле [19] (см. также «Реакции с окислителями», разд. 15.2).
Вг2, МеОН
77%
Присущая фурановым ядрам высокая реакционная способность может быть продемонстрирована на примере реакции фурфурола с избытком галогена, приводящей к образованию «мукогалогеновых» кислот; мукобромная кислота реагирует с формамидом, давая 5-бромпиримидин [20]. В контролируемых же условиях метилфуроат можно непосредственно превратить в его 5-монобром- или 4,5-дибромпроизводные, гидролизом и декарбоксилированием последнего можно получить 2,3-дибромфуран [21]; при бромировании фуран-3-карбоновой кислоты образуется 5-монобромкислота [22].
5Вг2
Н2О, О *С -»нагревание
94%
мукобромная кислота
HCONH2, 185 *С 60%
15.1.5. Ацилирование
Для ацилирования фуранов по Фриделю-Крафтсу ангидридами или галогенан-гидридами карбоновых кислот обычно необходимо присутствие кислоты Льюиса (часто трифторида бора), хотя реакция с ангидридом трифторуксусной кисло-
ты не требует катализатора. Было показано, что при ацилировании фуранов в условиях катализа хлоридом алюминия a-положение проявляет реакционную способность, в 7 • 104 раз большую, чем реакционная способность 0-положения [23]. З-Алкилфураны замещаются главным образом по положению 2 [24]; 2,5-диалкилфураны могут быть проацилированы по 0-положению, хотя обычно с большим трудом.
DMF, РОС13 н ^водн.К2СОз^О ‘С ->100 ‘С 76%
Ме
(/ВиСО)2О
BF3.Et2O, 0 'С _
30% *
О
Форматирование фуранов по Вильсмейеру обеспечивает удобный подход к формилфуранам [25], хотя не меньшую роль играют легкая доступность фурфурола в качестве исходного материала, а также важны методы, включающие литиирование фуранов (разд. 15.4.1). Формилирование замещенных фуранов происходит согласно правилу предпочтительного образования а-замещенных производных, несмотря на все другие факторы; так, и 2-метилфуран, и метиловый эфир фуран-3-карбоновой кислоты [27] дают 5-альдегид, а 3-метилфуран превращается главным образом в 2-альдегид [28].
15.1.6. Алкилирование
Алкилирование фурана и его производных по Фриделю—Крафтсу обычно не проводят, так как в присутствии катализатора они полимеризуются и, кроме того, подвергаются полиалкилированию. Примеры препаративного использования реакции включают: получение 2,5-ди-тире/и-бутилфурана [29] из фурана или фуранкарбоновой кислоты [30] и изопропилирование метилфуроата с двойным замещением по положениям 3 и 4 [28].
t-BuBr
SiO2, Ыа2СОз 20 °C—» 78 ‘С 51%
CI3CCHO, ZnCI2 АсОН, 20 °C 44%
СС!3
О^/н
15.1.7. Конденсация с альдегидами и кетонами
Эти реакции катализируются кислотами; обычно образующийся в качестве интермедиата фурфуриловый спирт вступает в дальнейшие реакции, но некоторые из промежуточных спиртов, например 2-(3,3,3-трихлор-1-гидрокси)этилфуран, удается выделить. Макроцикл можно получить при конденсации с ацетоном [32] с использованием последовательности превращений, аналогичных описанным для пиррола (разд. 13.1.7).
15.1.8. Конденсация с иминами и иминиевыми солями
Ранее попытки ввести незамещенный фуран в реакцию Манниха не увенчались успехом, хотя моноалкилфураны вступают в эту реакцию обычным образом [33], однако при взаимодействии незамещенного фурана с предварительно получен-
ной иминиевой солью обычное 2-замещение идет при комнатной температуре [34].
(Me2N)2CH2
AcCI, MeCN,20*C
66%
CH2O, водн. Me2NH
Me «/o Me
Позднее использование фуранборных кислот позволило проводить реакцию Манниха с получением как а-, так и р-замещенных производных и даже использовать в реакции первичные амины [35].
Чо/^в(ОН)2
Ph2CHNH2, НО2ССН=О
СН2С12,Н2О, 20‘С
81% **
15.1.9. Меркурирование
Меркурирование происходит очень легко с замещением атома водорода или диоксида углерода в кислотах [36].
Ме
/Г“/ НдС12
И Ч водн- MeQH,20 С
95%
86%
водн. НдС12 нагревание
CO2Na
15.2. РЕАКЦИИ С ОКИСЛИТЕЛЯМИ
При электрохимическом окислении фуранов или окислении их бромом в метаноле образуются 2,5-диалкокси-2,5-дигидрофураны (разд. 15.1.4), а циклоприсоединение синглетного кислорода будет обсуждено в разд. 15.8. Реакция фурана с карбоксилатами свинца(1У) ведет к образованию 2,5-диацилокси-2,5-ди-гидрофуранов с хорошими выходами [37].
Родственные процессы приводят к получению ациклических ^-ненасыщенных 1,4-дионов в виде Е- и Z-форм при использовании таких реагентов, как бром в водном ацетоне, л-хлорпербензойная кислота или гипохлорит натрия; пример представлен ниже [30]. Даже бут-2-ен-1,4-диальдегид (малеиновый альдегид) можно получить при окислении диметилдиоксираном [38], а комплекс мочевины с пероксидом водорода в присутствии катализатора — метилтриоксида рения(УП) — окисляет фурановое кольцо с образованием цнс-ендионов [39], как показано ниже:
(H2N)2CO.H2O2
MeReO3
СН2С12, 20* С
87%
f-B
водн. NaOCI t-t-Bu HCI, CH2CI2,20* С
Л к f-Bu Мб'о'й
О
О
85%
Некоторые окислители, например тетраоксид рутения, полностью разрушают фурановое кольцо; при окислении 2-замещенного фурана только один атом углерода исходного гетероцикла удаляется в виде карбоновой кислоты, причем чувствительная функциональная группа в боковой цепи не затрагивается [40].
15.3. РЕАКЦИИ С НУКЛЕОФИЛЬНЫМИ РЕАГЕНТАМИ
Простейшие фураны не вступают в реакции присоединения или замещения с нуклеофилами. Нитрозаместители активируют замещение атома галогена так же, как и в химии бензола, и методология викариозного нуклеофильного замещения (разд. 2.3.3) также находит применение в химии фуранов [41].
CICH2SO2Ph
КОН, NH3 (жидк.)
74% **
15.4. РЕАКЦИИ С ОСНОВАНИЯМИ
15.4.1. Депротонирование С-водорода
Металлирование алкиллитием селективно идет по a-положению; действительно, металлирование фуранов — один из самых ранних примеров [42] известных в настоящее время реакций металлирования ароматического кольца. Предпочтительность а-депротонирования прекрасно иллюстрируется тем, что 3-литйй-фуран, полученный из 3-бромфурана путем обмена галоген/металл при —78 *С равновесно превращается в более устойчивый 2-литийфуран при повышении температуры до более чем —40 ’С [43]; в более жестких условиях возможно получение 2,5-дилитийпроизводных фурана [44].
Диизопропиламид лития может вызывать Сф-депротнирование 3-галогено-фуранов [45]. При взаимодействии фуранкарбоновой кислоты с двумя эквивалентами диизопропиламида лития идет селективное образование соединения, литиированного по карбоксильной группе и по положению 5 [46], в то время как при использовании «-бутиллития проявляется оряю-эффект карбоксильной группы и реакция идет по карбоксильной группе и положению 3 [47].
(MeS)2
94%
Me3SiCI
87%
Металлирование фуранов по положению 3 также было описано в случае использования таких способствующих р/яяо-литиированию заместителей, как 2-бис(диметиламино)фосфатный [48] и 2-оксазолиновый [49], а 3-гидроксиме-тильная группа активирует литиирование по положению 2 [50]. При наличии в положении 2 группы, не обладающей ориентирующим действием, литиирование идет по положению 5 и образуются 2,5-дизамещенные фураны, однако выбор условий литиирования может оказать более существенное влияние, чем рр/яо-ориентирующее действие заместителей, как показано ниже [51]:
‘О >=N
' Me
Me
78%
n-BuU
THF, НМРА,-78’С ЕН
Синтетически важное региоселективное 5-литиирование 3-формилфурана [52] может быть достигнуто в результате первоначального присоединения морфо-лида лития к альдегиду и последующего литиирования по положению 5, приводящих к образованию 2-замещенных 4-формилфуранов, как показано ниже [53]:
сно
морфолин, n-BuLi
THF, -78 ’С
15.5. РЕАКЦИИ С-МЕТАЛЛИРОВАННЫХ ФУРАНОВ
15.5.1. Литийорганические производные
Металлирование по положению 3 может быть достигнуто путем обмена ме-талл/галоген. Большая стабильность а-карбаниона проявлется в селективном монообмене в 2,3-дибромфуране атома брома в а-положении [28, 54].
Существует множество примеров использования 2- и 3-литийфуранов в реакциях с разнообразными электрофильными реагентами, такими, как альдегиды и кетоны [42,55], а также галогениды [56]. Было показано, что при обработке 2-литийфура-на хлоридом меди(П) образуется 2,2'-бифуран [57], а при взаимодействии с триал-килборанами получают бораты, дальнейшая обработка которых галогенами служит прекрасным методом введения алкильных групп в a-положение фурана [58].
Взаимодействие 3-литийфурана, наилучшим образом получаемого [59] из 3-бромфурана, с бис(триметилсилил)пероксидом позволяет напрямую синтезировать триметилсилиловый эфир 3-гидроксифурана [60]. Окислением эфиров 2-боронатов получают 2-бутенолиды (разд. 15.12.1) [61]. Фуран-2- и фуран-3-борные кислоты синтезируют путем взаимодействия соответствующих литии-рованных производных с трибутилборатом обычным способом [62].
15.5.2. Реакции сочетания, катализируемые палладием
Палладиевые катализаторы используют для введения арильных групп в фурановое кольцо [63] либо замещением атома водорода, либо через борные кислоты [64], а также для проведения алкенилирования по типу реакции Хека, опять же по положению 2 [65], через «окислительный» тип палладирования (ср. разд. 2.7.2.1).
____,В(ОН)2
Pd(PPh3)4 водн. NaHCQs, DME нагревание 81% **
При катализе палладием(О) происходит региоселективное замещение атома брома в положении 2, а не 3 [66].
n-Bu3SnCH2CH=CH2
Pd(PPh3)4, DMA, 90 *С
73% **
М
Как 3-(три-«-бутилстаниил)фураны, так и 3,4-бис(три-н-бутилстаннил)фу-раны и 3,4-бис(три-н-силил)фураны детально изучены; их использование обеспечивает широкий простор для получения разнообразных 3-замещенных и 3,4-дизамещенных фуранов, как показано ниже [67]:
SiMe3 Me3SL J PhB(OH)2, Pd(PPh3)4 Me3Si .Ph \ .Ph
l2, CF3CO2Ag У-Z Na2CO3 V-Z |2, CF3CO2Ag HC=C(CH2)2OH, Pd(PPh3)4 Y—Z
THF,-78 C* U \\ MeOH, PhMe, кипячение H \\ THF,0*C Cui, Et3N, MeCN, кипячение// \\
96% 77% 67% 100% *
77%
100%
2,3-Бис(триметилсилил)фуран в жестких условиях превращается в 2,4-изо-мер, представляющий собой ценный интермедиат для дальнейших манипуляций [68]
Me3SL SiMe3 Me3Si. MegSi. Me3Si.
У-/ 160 "C, (CF3CO)2O V-Л n-BuLi Y-n ЬАдОгССРз Vr
// \\ CF3CO2H,CCI4 // \\ гексан, THF, 20-CBnBr // \\ THF,-78'C // 1
80% ** *82% *Bn**X0Z4SiMe3 74% *
15.6. РЕАКЦИИ CO СВОБОДНЫМИ РАДИКАЛАМИ
Реакции фуранов со свободными радикалами (ср. разд. 2.4.2) в качестве применяемых в синтезах процессов изучены мало; арилирование [69] и алкилирование [70] проходят селективно при облучении. При выдерживании с дибензоилпероксидом фуран превращается в смесь стереоизомерных продуктов 1,4-присоединения.
15.7. РЕАКЦИИ С ВОССТАНОВИТЕЛЯМИ
Тетрагидрофуран получают из фурана гидрированием в присутствии никеля Ренея. Это лучший способ восстановления фурана, хотя реакция иногда сопровождается гидролитическим расщеплением связи С—О с раскрытием цикла. Большинство фуранов не удается восстановить при использовании металла в аммиаке, однако фуранкарбоновые кислоты [71] и третичные амиды [72] в этих условиях дают дигидропроизводные.
о
^О^СОгН
3Li, NH3 водн. МеОН
90%
СОгН
—< Na, водн. NH.
/-ргОИ r CH2N2
85%
15.8. ЭЛЕКТРОЦИКЛИЧЕСКИЕ РЕАКЦИИ (ОСНОВНОГО СОСТОЯНИЯ)
Фуран вступает в реакции [4 + 2]-циклоприсоединения с такими мощными диенофилами, как, например, малеиновый ангидрид [73], и эта реакция была одним из наиболее ранних описанных примеров реакции Дильса-Альдера [74]. Выделенный аддукт представляет собой экзо-изомер [75], как было показано, он является термодинамическим продуктом, тогда как эндо-изомер — кинетический продукт, а процесс циклоприсоединения легко обратим [76].
н н с=с=сх EtO2C PhH CO2Et
20 *С, 1 день
"* 87%
Фуран также вступает в реакцию циклоприсоединения с алленами [77] и с такими простейшими диенофилами, как акрилонитрил и акрилат (особенно в присутствии иодида цинка) [78], а также с эфирами малеиновой и фумаровой кислот при проведении реакции при высоком давлении [79]. Этот прием также может быть использован для заметного увеличения реакционной способности 2-метоксифурана и 2-ацетоксифурана в отношении диенофилов [80]. Катализ
кислотами Льюиса также существенно ускоряет реакции Дильса—Альдера с участием фурана [81]. При проведении реакций при высоких температурах алкины [82] и даже электроноизбыточные алкены [83] присоединяются к фурану.
Очевидно, что 2-формилфуран менее эффективен в качестве элекгроноиз-быточного диена в нормальной реакции Дильса—Альдера, чем соответствующий диметилгидразон, хотя в последнем случае образуются только производные бензола в результате раскрытия цикла [84].
Существует много примеров использования реакции Дильса—Альдера с участием фурана для построения сложных структур [85]; два наиболее ярких примера приведены ниже. В первом из них первоначально образуется аддукт Дильса-Альдера в результате взаимодействия одного из фурановых колец с диметилацетилендикарбоксилатом, а оставшаяся диенофильная двойная связь аддукта вступает затем в реакцию циклоприсоединения еще с одним фурановым кольцом [86]. Во втором примере из другой молекулы, содержащей два фурановых цикла, и соединения с двумя диенофильными двойными связями образуется сложное пентациклическое соединение, родственное природным [87].
МеОгССэССОгМе
EtgO, 20 ‘С, 3 недели
71%
О
СНС!3, 5-105 кПа, 20‘С
95%
Циклоприсоединение 2-оксиаллильных катионов [88] также широко используется для синтеза замещенных фуранов и полициклических соединений [89]. В качестве примера можно привести введение ацетилметильных групп в a-положение фурана [90].
Et3N
Описано много примеров участия фурана во внутримолекулярных реакциях Дильса-Альдера [90]. Пример, приведенный ниже, показывает, что такие реакции могут протекать в довольно мягких условиях [92]. Даже неакгивированные алкены могут вступать во внутримолекулярные реакции Дильса-Альдера с фураном [93].
CH2=CHSO2CI Et3N,THF 0*С->20*С 90%
Фураны также вступают в реакции циклоприсоединения с синглетным кислородом [94]. Эта реакция лежит в основе некоторых синтезов высокоокислен-ных соединений, например 5-гидрокси-2(5Н)-фуранонов (4-гидроксибут-2-енолидов, см. разд. 15.12), структурный фрагмент которых встречается в некоторых природных соединениях. Присоединение к 3-замещенным фуранам в присутствии пространственно затрудненных оснований [95] или к 2-триалкилси-лил-4-замещенным фуранам [96, 97] напрямую приводит к 4-замещенным 5-гидрокси-2(5Н)-фуранам, как показано ниже. 5-Замещенные фураноны также дают 5-гвдрокси-2(5Н)-фураноны с потерей альдегидного атома углерода [98]. Особенно изящным примером служит реакция 2-фуранкарбоновой кислоты, которая с количественным выходом при декарбоксилировании превращается в моноальдегид малеиновой кислоты (циклический полуацеталь 2-4-оксобут-2-еновой кислоты) [99].
Известно несколько примеров, когда винилфураны принимают участие в реакциях внутримолекулярного циклоприсоединения в качестве 4л-компонен-тов [100], как показано ниже [101]. Вообще, для таких внутримолекулярных процессов характерны низкие выходы, поскольку межмолекулярные реакции конкурируют с более вероятными внутримолекулярными, а введение объемного заместителя в a-положение молекулы способствует межмолекулярным процессам [102].
15.9. ФОТОХИМИЧЕСКИЕ РЕАКЦИИ
Циклоприсоединение диарилкетонов и некоторых альдегидов по 2,3-двойной связи проходит региоселективно и приводит к образованию оксетанодигидро-
фуранов; в условиях протонного катализа ацетальная связь расщепляется и получаются 3-замещенные фураны [103].
15.10. С-Х-ПРОИЗВОДНЫЕ ФУРАНА;
РЕАКЦИИ С УЧАСТИЕМ ЗАМЕСТИТЕЛЕЙ
При нуклеофильном замещении атома галогена в фурфурилгалогениде часто образуется смесь соединений в результате прямого замещения, с одной стороны, и замещения с нуклеофильным присоединением по положению 5, с другой [104]; второй процесс идет через образование неароматического интермедиата, который затем изомеризуется в ароматическое соединение.
В присутствии анион-стабилизирующих групп возможно депротонирование а-алкильных заместителей фурана. Образование таких анионов в боковой цепи приводит к ациклическим аллененолятам, которые в присутствии избытка ли-тиирующего агента подвергаются вторичному литиированию, как показано на приведенном ниже примере [105]:
15.11. ФУРАНКАРБОНОВЫЕ КИСЛОТЫ И ИХ ЭФИРЫ
По легкости декарбоксилирования фуранкарбоновые кислоты (и их эфиры) не предсталяют ничего необычного. Диоксид углерода легко удалаяется [106] как из а-, так и из 0-кислот, а процесс предположительно идет через образование протонированных по кольцу интермедиатов, причем декарбоксилирование аналогично таковому для 0-кетокислот, по крайней мере, в тех случаях, когда не используется медь.
MeOgC COgMe
/ГЛ Na0H
// \\ водн. EtOH, О Г
81%
НОгС COgMe СО2М©
у U Си, нагревание П и 96% Чо2
Нитрование 3-фуранкарбоновых кислот идет обычным образом по положению 5 [107]. а-Кислоты иногда подвергаются ш/со-замещению с декарбоксилированием [108]; так, например, при нитровании 2-фуранкарбоновой кислоты образуется 5-нитропроизводное с примесью 2,5-динитрофурана [109].
СО2Н СО2Н Me Ме
___/ КОНЦ. HNO3 ---/ —_/ КОНЦ. HNO3 ,-----/
О AC80.J5f.oy>. JTX\ [Г\ #4
60% О2М^О/ Хо>^С02Н 30%
15.12. ОКСИ- И АМИНОФУРАНЫ
15.12.1. Оксифураны
2-Гидроксифураны существуют, вообще говоря, в неопределимо низких концентрациях в таутомерном равновесии, содержащем формы 2(5Н)-фуранона и 2(ЗН)-фуранона. Например, ангеликовые лактоны мотуг находиться в равновесии при обработке органическими основаниями, причем более устойчив р-изо-мер; в целом химия 2-оксифуранов — это скорее всего химия ненасыщенных лактонов. В менее изученных 3-гидроксифуранах также преобладает таутомерная карбонильная форма.
Многие природные соединения [ПО] и природные душистые вещества [111] содержат фрагменты фуран-2-она, что породило большое число синтетических работ [112]. В номенклатуре этих природных соединений в основном используют название «бутенолид» и они рассматриваются как производные 4-гидроксибутено-вой кислоты, а не фурана, например, тетроновая кислота — З-гидроксибут-2-ено-
2-гидрокси-5-метилфуран а-ангеликовый р-ангеликовый
(не обнаружен) лактон лактон
тетроновая кислота
Бутенолиды могут быть превращены в фураны в результате частичного восстановления с последующей дегидратацией [113].
HC(OEt)3
SnCI4, -40 ‘С -> 10 *СГ 90%
Синтоны, используемые для построения бутенолидов, включают в себя 2-триметилсилилоксифуран [114], который реагирует с электрофилами по положению 5 фурана, и аналогичные производные олова и бора, которые реагируют с электрофилами по положению 3 за счет контроля с помощью хелатирования [116].
OTMS
Me3SiCI _ZnCI2, Et3N ** 55%“*
Sn(OTf)2
N -этилпирролИДИН Г.—г\
•78'С // \\
55% XQ/^OSnOTf
С5НцСН=О
TMEDA
-78‘С-> 20'С
95%
2-трет-Бутоксифуран, получаемый при взаимодействии 2-литийфурана с тире/и-бутилпербензоатом [117], может быть литиирован по положению 5; последующая реакция с карбонильной компонентой и гидролиз с дегидратацией приводят к образованию алкилиденбутенолидов [118].
n-BuLi
Et2O, -40 *С
n-PrCHO
--4QJg_-±
ОМЗи
TsOH кат.
0 "Cr водн. THF, 20'С H 45%
•О^° n-Pr
2-Триметилсилилфураны превращаются в бутенолиды при окислении надкислотами [119].
С10Н21
С10Н21
\--- МеСО3Н
// \\ NaOAc, CH2CI2
Sr'SiMea 91%
2-Метокси- и 2-ацетоксифураны получают из 2,5-диметокси- и 2,5-диаце-токси-2,5-дигидрофуранов (разд. 15.1.4) в результате кислотно-катализируемо-го элиминирования [120 ]. Они вступают в реакции циклоприсоединения Дильса-Альдера; образующиеся при этом аддукты затем могут быть превращены в производные бензола в процессе кислотно-катализируемого раскрытия цикла. 3,4-Дигидроксифуран не удается обнаружить в таутомерном равновесии между моноенольной и дикарбонильной формами; диметиловый эфир ведет себя как обычный фуран, легко подвергается электрофильному замещению по а-поло-жению(ям) [121], а также вступает в реакцию Дильса—Альдера [122]. 2,5-Бис(триметилсилилокси)фуран получают из янтарного ангидрида; он также легко вступает в реакцию Дильса—Альдера [123]. Как 2-, так и 3-тиолы можно получить при взаимодействии литиированных фуранов с серой; в каждом случае в таутомерном равновесии преобладает тиольная форма [124].
15.12.2. Аминофураны
В литературе опубликовано настолько мало работ, в которых описана химия аминофуранов, что трудно сделать какие-то обобщения по их реакционной способности. Это, по-видимому, обусловлено тем, что незамещенные аминофураны слишком неустойчивы и не могут быть выделены, однако 2-ациламинофура-ны, а также другие замещенные аминофураны описаны [125]. Метиловый эфир 2-аминофуран-5-карбоновой кислоты — относительно устойчивый 2-аминофу-ран, что обусловлено наличием сопряженной сложноэфирной труппы в положении 5; это соединение вступает в реакции Дильса—Альдера обычным образом (ср. разд. 15.8) [126].
Н2, Pd/CaCO3
NO2 63%
СО2Ме
НО СО2Ме
15.13. СИНТЕЗЫ ФУРАНОВ
Фурфурол и фуран, получаемый из фурфурола декарбонилированием в газовой фазе, легко доступны и используются в качестве исходного материала для синтеза многих фурановых производных. Фурфурол производят [127] из ксилозы, получаемой, в свою очередь, из пентозанов — полисахаридов, экстрагируемых из растительного сырья, например из кочерыжек кукурузных початков и рисовой шелухи. При кислотном катализе происходит, в конечном счете, потеря трех молекул воды; реакция проходит с очень хорошим выходом. Точный ход событий в этом многостадийном процессе досконально не известен, однако довольно приемлемая последовательность приведена ниже [128]. Подобным образом при дегидратационной циклизации фруктозы образуется 5-гидроксиметилфур-фурол [129].
(С5Н8О4)п пентозаны
ксилоза
Н3О+ 100 'С
-fe-
фурфурол
< - 2Н2О сно
15.13.1. Синтез кольца
Существует много методов синтеза фуранов, но большинство из них представляет собой варианты основного метода — дегидратационной циклизации 1,4-дикарбонильных соединений.
15.13.1.1. Из 1,4-дикарбонильных соединений
1,4-Дикарбонильные соединения в присутствии кислот циклизуются с отщеплением воды и образованием фуранов
Синтез Пааля - Кнорра
Наиболее широко используемым методом синтеза фуранов служит циклизация с отщеплением воды 1,4-дикарбонильных соединений, которые являются источником всех атомов углерода и атома кислорода, необходимых для построения фуранового цикла. Обычно синтез проводят в кислой неводной среде [130], благоприятствующей отщеплению воды. Процесс включает присоединение енольного кислорода одной из карбонильных групп к углеродному атому второй карбонильной группы и завершается отщеплением воды [131]
Необходимые 1,4-дикарбонильные соединения получают различными способами [132]. В качестве примеров можно привести следующие реакции: алкилирование иминов 2-алкоксиаллилгалогенидами (эквивалентами 2-галоге-нокетонов) [133], присоединение анионов 0-кетоэфиров к нитроалкенам с последующей реакцией Нефа [134] и карбонилирование ацеталей 2-замещен-ных акролеинов в присутствии родиевых катализаторов [135]. Диальдегид (в виде моноацеталя), необходимый для синтеза диэтилового эфира фуран-3,4-дикарбоновой кислоты, получают в результате двух последовательных конденсаций Кляйзена диэтилового эфира янтарной кислоты с этилформиатом, как показано ниже [136]:
HCO2Et HC(OEt)3 EtO2C CO2Et Na EtO2C. CO2Et KOHU.H2SO4Et°2? ,CO2Et
(СНаСЗДа^ »НССУЯ*. 50^ >
65% (EtO)2HC °™ (ЕОДНС У ™ I
0 H
‘О'
15.13.1.2. Из у-гидрокси-а,р-ненасыщенных карбонильных соединений у-Гидрокси-а,p-ненасыщенные карбонильные соединения претерпевают циклизацию с отщеплением воды и образованием фуранов в присутствии минеральных кислот или кислот Льюиса
В качестве простого примера можно привести реакцию окисления цис-бут-2-ен-1,4-диола, в результате которой образуется гидроксиальдегид, циклизующийся в фуран:
носн2 сн2он
К2Сг2Оу H2SO4, 90 *С 62% **
Более сложные 4-гидроксиенали и 4-гидроксиеноны получают различными способами, например, либо из алкинов [138], либо чаще из эпоксидов [139], при этом иногда нет необходимости выделять гидроксиеноны [140], либо в результате конденсации Хорнера—Вадсворта-Эммонсона р-кетофосфонатов с а-ацеток-сикетонами [141]. Ацеталь [142], эфир тиенола [143] или терминальный алкин [144] могут служить эквивалентами карбонильной группы. Некоторые из перечисленных примеров представлены ниже:
л-виЛ/°Нн2
H-ии—< катализатор
HCsCCfOEtta EtM9BrM n-BuCH=O > Линдлара 64% 'Х 82%>
CH(OEt)2
Ви / \ 3N H2SO4
CH(OEt)2 100-С
Н о 70%
Н
15.13.1.3. Из алленилкетонов
Алленилкетоны циклизуются в фураны в присутствии ионов металлов либо в условиях катализа нульвалентным металлом
Алленилкетоны, используемые для циклизации в фураны, либо легко предварительно синтезируют [145], либо генерируют in situ ацилированием силилалленов [146], либо получают в условиях катализа палладием(О) изомеризацией сопряженных [147] или несопряженных [148] алкинилкетонов. Замыкание цикла катализируют соединения серебра [142] или палладия [148,149] ацилированием силилалленов напрямую приводит к фурану [142]. В присутствии воды катализируемая двухвалентным палладием циклизация Р,у-алкинилкетонов идет предположительно через образование енола, а не аллена [149]. 1,2,3-Триенил-4-олы также циклизуются с образованием фуранов [150].
15.13.1.4. Из а-галогенокарбонильных и 1,3-дикарбонильных соединений а-Галогенокарбонильные соединения реагируют с 1,3-дикарбонильными соединениями в присутствии оснований (но не аммиака, ср. разд. 13.18.1.3) с образованием фуранов
Синтез Фейста- Бенари
Этот классический синтез основывается на первоначальной альдольной конденсации по карбонильному атому углерода 2-галогенокарбонильной компоненты. Циклизация происходит путем внутримолекулярного замещения галогена енольным атомом кислорода; в некоторых случаях [151] удается выделить промежуточно образующиеся соединения, что служит подтверждением такого механизма процесса.
выделен
Важно отличать этот синтез от алкилирования енолята 1,3-дикарбонильного соединения 2-галогенокетоном, при котором происходит замещение галогена с образованием 1,4-дикарбонильного соединения, способного к дальнейшей циклизации [152]. По-видимому, отличие заключается в более высокой реакционной способности альдегидной группы в случае реакции Фейста—Бенари.
При присоединении аниона 1,3-дикарбонильного соединения к алле-нилсульфониевой соли с последующим замещением енолятом диметил-сульфида после перемещения двойной связи в цикл образуется фуран [153].
Me 81%
NaOEt EtOH, кипячение
4-Пентиноны могут быть превращены в фураны под действием тлре/л-бути-лата калия [154] или метоксида бензилтриметиламмония [155]. Катализируемое основаниями 2-алкилирование 1,3-дикарбонильных соединений пропаргилга-логенидами с последующей циклизацией происходит in situ по типу 5-экзо-диг-процесса [156].
NaOEt EtOH, DMF 20'С
79%
15.13.1.5. Другие методы
В качестве другого использования 4-пентинонов можно привести их катализируемое палладием арилирование, приводящее in situ к циклизации с образованием 2,5-дизамещенных фуранов [157]
СН2СО2Ме
Pd(PPh3)4, К2СО3 DMF, 100 ‘С —
/л
АгНгСГ^о^^сНгСОгМе
При взаимодействии алк-3-ин-1,2-диолов с иодом происходит циклизация с образованием 3-иодфуранов, которую формально можно отнести к 5-эндо-диг-процессу [158]
/7-Ви*
l2, NaHCO3
MeCN, 20 Ч)
71% *
Замечательная изобретательность проявляется в разработке альтернативных подходов к синтезу фуранов. Например, ацилоины реагируют с «переносчиками ацетилена» [159] в одной из реакций, которая начинается с образования эфирного фрагмента; стадия циклизации проходит по типу реакции Витгига
EtOCH=CHPPh3 ВТ
NaH, 2О’С
61%
Тетроновые кислоты образуются при взаимодействии дианиона ацилоина и 1,1'-карбонилдиимидазола [160] — эквивалента фосгена.
CDI
- 7В *С
33%’
Очень полезные 3,4-бис(три-«-бутилстаннил)- [161] и 3,4-бис(триметил-силил)фураны [162] можно получить из 4-фенилоксазола в результате последовательно происходящих реакций циклоприсоединения и циклореверсии
n-Bu3SnOCSnn-Bu3
,185‘С__________
22%
Me3SiC=CSiMe3 Et3N, 250 *С 80%
15.13.2. Примеры синтезов некоторых важных производных фурана
15.13.2.1. Трис(фуранил)-18-краун-6
Трис(фуранил)-18-краун-6 был получен с использованием фурфуриловых спиртов и хлоридов [163]
(СО2Н)2
саха₽03а
15.13.2.2. Фуранеол
Фуранеол, выделенный из ананасов и земляники, обусловливает их запах и используется в пищевой промышленности и при производстве напитков [164].
Вг2 МеОН
НО^ ОН
/= OsO4, КСЮ3 \/ МеО>/ \,ОМе водн, КНСО3,45 *С / \ М
НО .0
100% Ме^00^Мей1А
фуранеол
15.13.2.3. Ранитидин
Ранитидин получают из фурфурилового спирта
Упражнения
Простые упражнения для проверки усвоения материала гл. 12 и 15
(а) Приведите три различные реакции с участием фуранов, подтверждающие относительно более низкую энергию резонанса фурана по сравнению с тиофеном и пирролом (реакции, приводящие к образованию неароматических продуктов).
(б) По какому положению происходит литиирование фурана? Как можно получить альтернативный литиированный изомер?
(в) С каким типом диенофилов фураны вступают в реакцию наиболее быстро?
(г) Какого типа соединения можно получить при взаимодействии фуранов с синглетным кислородом (Юг)?
(д) Существуют ли 2-гидроксифураны?
(е) Какой наиболее общий метод используют для синтеза кольца фуранов? Нарисуйте механизм процесса замыкания цикла.
(ж) Как можно синтезировать 3,4-бис(три-н-бутилстаннил)фуран?
Упражнения повышенной сложности
1. При гидролизе 2-метоксифурана в водном растворе кислоты образуется лактон 4-гидроксибут-2-еновой кислоты и МеОгС(СНг)2СН=О; нарисуйте последовательность превращений, включающую протонирование и взаимодействие с водой и объясняющую образование каждого из соединений.
2. Предложите структуры следующих соединений: (а) СцН8Ог, полученного при обработке 2-фенилфурана смесью диметилформамид/РОС1з, затем водным раствором основания; (б) С9Н10О4 из этилфуроата/АсгО/ЗпСЦ; (в) C5H2N2O5 из 3-ци-анофуроата с Ac2O/HNO3; (г) СиНцСЬОб из метилфуроата CCI3CHO/H2SO4.
3. При электрохимическом окислении 5-метилфурфурилового спирта в метаноле получают соединение CgHuCU, гидролиз которого дает CgHieCU; обработка кислотой последнего приводит к образованию циклического 1,2-диона СбН8Ог. Какова структура этих соединений?
4. Нарисуйте структуры всех промежуточно образующихся соединений в следующей цепочке превращений: этиловый эфир 2-метилфуран-З-карбоновой кислоты с L1AIH4, затем с SOC12, затем с L1AIH4 -> СбН8О, обработка которого Вг2 в ме
таноле, затем водой при 60 °C, затем водн. NaBH4 приводит к образованию СбНпОг.
5. Нарисуйте структуры продуктов реакции 2-литийфурана (а) с циклогексаноном и (б) с Вг(СН2)7С1.
6. Предложите структуры продуктов взаимодействия следующих соединений: (а) 3-метилфуран/диметилформамид/РОС1з, затем водн. NaOH; (б) 2,3-дибром-фуран/н-BuLi, затем Н2; (в) 3-бромфуран/диизопропиламид лития, затем СН2О -> С5Н5ВгО2; (г) фурфураль с EtOH/H+ С9Н14О3, затем с L1AIH4, затем с В(ОВи)3 и водной кислотой С5Н5ВО4; (д) З-бромфуран/BuLi/ -78 “С, затем Bu3SnCl -> Ci6H30OSn, затем с MeCOCl/PdCl2 -> СбНвО2.
7. Нарисуйте структуры продуктов следующих реакций: (а) фурфуриловый спирт с H2C=C=CHCN -> C9H9NO2; (б) 2,5-диметилфуран с СН2=СНСОМе/15 кбар; (в) фуран с 2-хлорциклопентаноном/Е1зЬ1/1лСЮ4 С9НюО2.
8. (а) Как можно получить 2-триметилсилилоксифуран? (б) Какое соединение образуется из последнего с ICH2CN/AgOCOCF3?
9. Какое соединение СцНюОз образуется в следующей последовательности превращений: 2-/пдет-бугоксифуран/я-Вии, затем PhCH-O, затем TsOH?
10. Предложите структуры фуранов, полученных в результате синтеза кольца в ходе следующих взаимодействий: (a) CH2=CHCH2MgBr/EtCH=O, затем с /л-РВА (jw-хлорпербензойная кислота), затем с СгОз/придин, затем с BF3; (б) CH2=C(Me)CH2MgCl/HC(OEt)3, затем /л-СРВА, затем с водн. Н+; (в) (MeO)2CHCH2COMe/ClCH2CO2Me/NaOMe, затем нагревание.
11. Для синтеза тетроновой кислоты используется представленная ниже последовательность превращений. Предложите структуры промежуточных соединений: метиламин добавляют к диметил ацетилендикарбоксил ату -> C7H11NO4, селективным восстановлением которого LiAlH4 получают СбНцЬЮз, который затем циклизуется в присутствии кислоты в соединение C5H7NO2, гидролиз которого в водном растворе кислоты дает тетроновую кислоту.
Литература
1. Dunlop A. Р., Peters F. N. The Furans, Reinhold, New York, 1953; «The development of the chemistry of furans, 1952-1963», Bosshard P., Eugster С. H. Adv. Heterocycl. Chem., 7,377 (1966); «Recent advances in furan chemistry. Parts 1 and 2», Dean E M. ibid., 30, 167 and 31, 237 (1982); «Regioselective syntheses of substituted furans», Hou X. L., Cheung H. Y, Hon T. K, Kwan P L., Lo T, H, TongS. K, Wong H. N. C, Tetrahedron, 54, 1955 (1998).
2. Unverferth K, Schwetlick K. J. Prakt. Chem., 312, 882 (1970); Salomaa P., Kankaan-perd A,, Nikander E., Kaipainen K., Aaltonen R. Acta Chem. Scand., 27, 153 (1973).
3. Carmody M. P., Cook M. J., Dassanayake N, L., Katritzky A. R., Linda P., Tack R. D. Tetrahedron, 32,1767 (1976).
4. Wiersum U. E., Wynberg H. Tetrahedron Lett., 1967,2951.
5. «Synthesis of 1,4-dicarbonyl compounds and cyclopentenones from furans», Piancate-lli G., DAuria M., D’Onofrio F, Synthesis, 1994, 867.
6. MichelsJ. G., Hayes K. J. J. Am. Chem. Soc., 80,1114(1958).
7. См., однако: Kolb V M., DarlingS. D., Roster D. E, Meyers C. Y J. Org. Chem., 49,1636 (1984).
8. Clauson-Kaas N., FaklstorpJ.A&ta Chem. Scand., Ser. В, 1,210 (1947); Balina G., Kesler P., Petre J., Pham D., VollmarA. J. Org. Chem., 51,3811 (1986).
9. Rinkes I. J. Reel. Trav. Chim. Pays-bas, 49,1169 (1930).
10. Doddi G., Siegel F, TanasiM. T. J. Org. Chem., 43,4303 (1978).
11. Skully J. E, Brown E. V. J. Oig. Chem., 19, 894 (1954).
12. Терентьев А. П., Беленький Л. Л., Яновская Л. А. Ж0Х, 24,1265 (1954).
13. Baciocchi E, Clementi S., Sebastiani G. V. J. Chem. Soc., Chem. Commun., 1975,875.
14. Keegstra M. A., Klomp A. J. A., Brandsma L. Synth. Commun., 20,3371 (1990).
15. Ross S. D., Finkelstein M., Uebel J. J. Org. Chem., 34,1018 (1969).
16. Burness D. M. Org. Synth., Coll. Vol. V, 1973,403.
17. Malanga C., Mannucci S., Lardicci L. Tetrahedron Lett., 39, 5615 (1998); Malanga C., Aronica L. A., Lardicci L. Synth. Commun., 26, 2317 (1996).
18. «Electrochemical oxidation of organic compounds», Weinberg N. L., Weinberg H. R. Chem. Rev., 68,449 (1968).
19. D’Annibale A., ScettriA. Tetrahedron Lett., 36,4659 (1995).
20. Kress T. J., Szymanski E. J. Heterocycl. Chem., 20,1721 (1983).
21. Chadwick D. J., Chambers J., Meakins G. D., Snowden R. L. J. Chem. Soc., Perkin Trans. 1,1973, 1766.
22. Wang E. S., Choy Y. M., WongH N. C. Tetrahedron, 52,12137 (1996).
23. Ciranni G., Clementi S. Tetrahedron Lett., 1971,3833.
24. Finan P. A., Fothergill G. A. J. Chem. Soc., 1963,2723.
25. Traynelis V. J., Miskel J. J., Sowa J. R. J. Oig. Chem., 22, 1269 (1957); Anvme I. M., Earle M. J., Heaney H, Shuhaibar К P. Tetrahedron, 49,4015 (1993).
26. Taylor D. A. H. J. Chem. Soc., 1959, 2767.
27. ZwickyG., WaserP. G., EugsterC. Я. Helv. Chim. Acta, 42,1177 (1959).
28. Chadwick D. J., Chambers J., Hargreaves H. E., Meakins G. D., Snowden R. C. J. Chem. Soc., Perkin Trans. 1, 1973,2327.
29. Kamitori Y, Hojo M., Masuda R., Izumi T., Tsukamoto S. J. Oig. Chem., 49,4161 (1984).
30. Jurczak J., Pikul S. Tetrahedron Lett., 26, 3039 (1985); Fitzpatrick J. E., Milner D. J., White R. Synth. Commun., 12,489 (1982); WilliamsP. D., Le GoffE. J. Oig. Chem., 46, 4143 (1981).
31. Willard J. R., Hamilton C. S. J. Am. Chem. Soc., 73,4805 (1951).
32. Chastrette M., Chastrette F. J. Chem. Soc., Chem. Commun., 1973, 534.
33. GillE. W., Ing. H. R. J. Chem. Soc., 1958,4728; ElielE. L., Peckham P. A. J. Am. Chem. Soc., 72, 1209 (1950).
34. Heaney H, Papageorgiou G., Wilkins R. F. Tetrahedron Lett., 29,2377 (1988).
35. Harwood L. M., Currie G. S., Drew M. G. B., Luke R. W. A. Chem. Commun., 1996, 1953; Petasis N. A., Goodman A., Zavialov I. A. Tetrahedron, 53,16463 (1997).
36. Kutney J. P., Hanssen H. W., Nair G. V. Tetrahedron, 27,3323 (1971); Buchi G., Kovats E. Sz., Enggist P., Uhde G. J. Oig. Chem., 33,1227 (1968).
37. Elming N., Clauson-Kaas N. Acta Chem. Scand., 6, 535 (1952); Trost В. M., Shi Z. J. Am. Chem. Soc., 118, 3037 (1996).
38. Adger В. M., Barrett C., Brennan J., McKervey M. A., Murray R. W. J. Chem. Soc., Chem.Commun., 1991, 1553.
39. Finlay J., McKervey M. A., Gunaratne H. O. N. Tetrahedron Lett., 39, 5651 (1998).
40. Giovannini R., Petrini M. Tetrahedron Lett., 38, 3781 (1997).
41. Makosza M., Kwast E. Tetrahedron, 51, 8339 (1995).
42. Gilman H, Breur F. J. Am. Chem. Soc., 56, 1123 (1954); Ramanathan V., Levine R. J. Oig. Chem., 27,1216 (1962).
43. Bock I., Bomowski H, Ranft A., Theis H. Tetrahedron, 46, 1199 (1990).
44. Chadwick D. J., Willbe C. J. Chem. Soc., Perkin Trans. 1, 1977,887.
45. Ly N. D., Schlosser M. Helv. Chim. Acta, 60,2085 (1997).
46. Knight D. W., Nott А. Р. J. Chem. Soc., Perkin Trans. 1,1981,1125.
47. Carpenter A. J., Chadwick D. J. Tetrahedron Lett., 26, 1777 (1985).
48. Nasman J. H, Kopola N., Pensar G. Tetrahedron Lett., 27,1391 (1986).
49. Chadwick D. J., McKnight M. V., Ngochindo R. J. Chem. Soc., Perkin Trans. 1,1982, 1343.
50. Bures E. J,, Keay B. A. Tetrahedron Lett., 29, 1247 (1988).
51. Lenoir J.-Y., Ribereau, Queguiner G. J. Chem. Soc., Perkin Trans. 1,1994,2943.
52. Hiroya K., Ogasawara K. Synlett, 1995,175.
53. Lee G. С. M., Holmes J. D., Harcourt D. A.t Garst M. E. J. Org. Chem., 57,3126 (1992).
54. Somay R., Meunier J.-M., Foumari P. Bull. Soc. Chim. Fr., 1971,990; Decroix B., Morel J., Paulmier C, Pastor P. ibid., 1972,1848.
55. Gronowitz S., Sorlin G. Acta Chem. Scand., 75,1419 (1961).
56. Bohlmann E, StdrhrF., Staffeldt J. Chem. Ber., Ill, 3146 (1978).
57. Kauffmann T., Lexy H, Kriegesmann R. Chem. Ber., 114,3667 (1981).
58. Sotoyama T,, Hara S, Suzuki A. Bull. Chem. Soc. Jpn., 52,1865 (1979); Marinelli E. R., Levy A. B. Tetrahedron Lett., 1979, 2313; Akimoto Lt Suzuki A. Synthesis, 1979, 146.
59. Fukuyama Y, Kawashima Y., Miwa T., Tokoroyama T Synthesis, 1974,443.
60. Camici L., Ricci A., Taddei M. Tetrahedron Lett., 27,5155 (1986).
61. PelterA., Rowlands M. Tetrahedron Lett., 28,1203 (1987).
62. Florentin D., Roques B. P., Fournie-Zaluski M. C. Bull. Soc. Chim. Fr., 1976,1999.
63. Ohta A., Akita Y., Ohkuwa T., Chiba M., Fukunaga R., Miyafuji A., Nakata T., Tani N., Aoyagi Y Heterocycles, 31, 1951 (1990).
64. Yang Y Synth. Commun., 19,1001 (1989).
65. Fujiwara Y.t Maruyama 0., Yoshidomi M., Taniguchi H. J. Org. Chem., 46, 851 (1981); Tsuji J., Nagashima H. Tetrahedron, 40, 2699 (1984).
66. Bach T., Kruger L. Synlett, 1998, 1185.
67. Bailey T. R. Synthesis, 1991, 242; «Regiospecific synthesis of 3,4-disubstituted furans and thiophenes», YeX.-S., YuP., WongN, C, Liebigs Ann./ReL, 1997,459.
68. Wong M. K, Leung C, Y, Wong H. N. C. Tetrahedron, 53, 3497 (1997).
69. Ayres D. C., Smith J. R., J. Chem. Soc. (C), 1968 2737; Camaggi C. M.t Leardini R., Tiecco M., Tundo A. J. Chem. Soc., (B), 1969, 1251; Maggiani A., Tubul A., Brun P. Synthesis, 1997,631.
70. Janda M., Srogi J., Stibor L, Nemec M., Vopatma P. Tetrahedron Lett., 1973,637.
71. Birch A. J., Slobbe J. Tetrahedron Lett., 1975, 627; Divanford H. R., Joullte M. M. Org. Prep. Proc. Int., 10,94 (1978); Kinoshita T., MiyanoK, Miwa T. Bull. Chem. Soc. Jpn., 48, 1865 (1975); Beddoes R. L., Lewis M. L., Gilbert P., Quayle P., Thompson S. P., WangS.f Mills К Tetrahedron Lett., 37,9119 (1996).
72. Kinoshita T., Ichinari D., Sinya J. J. Heterocycl. Chem., 33,1313 (1996).
73. Stockmann H. J. Org. Chem., 26, 2025 (1961).
74. Diels O., Alder K. Chem. Ber., 62,554 (1929).
75. Woodward R. B., Baer H. J. Am. Chem. Soc., 70,1161 (1948).
76. Lee M. W., Herndon W. C. J. Org. Chem., 43,518 (1978).
77. Kurtz P-, Gold H, Disselnkoter H. Justus Liebigs Ann. Chem., 624,1 (1959); Kozikow-skiA. P., Floyd W. C., KuniakM. P. J. Chem. Soc., Chem. Commun., 1977,582.
78. Kienzle F. Helv. Chim. Acta, 58, 1180 (1975); Brian F. Tetrahedron Lett., 23, 5299 (1982); Campbell M. M.t Kaye A. D., Sainsbury M., Yavarzadeh R. Tetrahedron , 40, 2461 (1984).
79. Dauben W. G., Gerdes J. M., Smith D. B. J. Org. Chem., 50, 2576 (1985); Rimmelin J., Jenner G., Rimmelin P. Bull. Soc. Chim., Fr., 1978, II, 461.
80. Kotsuki Н., Mori Y., Ohtsuka T.t Nishizawa H., Ochi M., Matsuoka K. Heterocycles, 26, 2347 (1987).
81. Lazio P., Lucchetti J. Tetrahedron Lett., 25,4387 (1984).
82. Eberbach W., Penroud-Argiilles M., Achenbach H., Druckrey E, Prinzbach H. Helv. Chim. Acta, 54,2579 (1971); Weis C. D. J. Org. Chem., 27, 3520 (1962).
83. Kowarski C. R.f SarelS. J. Org. Chem., 38, 117 (1973).
84. Potts К T.f Walsh E. B. J. Org. Chem., 53, 1199 (1988).
85. «Synthetic applications of furan Diels-Alder chemistry», Карре С. O., Murphree S. S., PadwaA. Tetrahedron, 53,14179 (1997).
86. LautensM., Pillion E. J. Org. Chem., 62,4418 (1997).
87. Marchionni C., Vbgel P., Roversi P. Tetrahedron Lett., 37,4149 (1996).
88. HerterR., Fohlisch B. Synthesis, 1982,976.
89. Jin S.-J., Choi J. -R., Oh J., Lee D., Cha J. K. J. Am. Chem. Soc., 117, 10914 (1995); Montana A. M., RibesS., GrimaP. M., Garcia F., Solans Y., Font-Bardia M. Tetrahedron, 53,11669(1997).
90. Mann J., Wilde P. D., Finch M. W. Tetrahedron, 45,5431 (1987).
91. Gschwend H. W., Hillman M, J., KisisB., Rodebaugh R. К J. Org. Chem., 41, 104 (1976); Parker K. A., Adamchuk M. R. Tetrahedron Lett., 1978,1689; Harwood L. M., Ishikawa T., Phillips H., Watkin D. J. Chem. Soc., Chem. Commun., 1991,527.
92. MetzP., Meiners U., Cramer E., Frohlich R., WibbelingB. W. Chem. Commun., 1996, 431; MetzP., SengD., Frohlich R., WibbelingB. Synlett, 1996,741.
93. ChoonyN., DadabhoyA., SammesP. G. Chem. Commun., 1997, 512.
94. «Photo-oxidation of furans», FeringB. C. Reel. Trav. Chim. Pays Bas, 106,469 (1987); Gorman A. A., Lovering G., Rodgers M. A. J. J. Am. Chem. Soc., 101, 3050 (1979); lesce M. R., Cermola F., Graziano M. L., Scarpati R. Synthesis, 1994,944.
95. Kernan M. R., Faulkner D. J. J. Org. Chem., 53, 2773 (1988).
96. Lee G. С. M., Syage E. T, Harcourt D. A., Holmes J. M., GarstM. E. J. Org. Chem., 56, 7007(1991).
97. Lee G. С. M., Holmes J. M., Harcourt D. A., GarstM. E. J. Org. Chem., 57,3126 (1992).
98. CotteirL., Descotes G., Eymard L., Rapp К Synthesis, 1995, 303.
99. White J. D., Carter J. P., KezarH. S. J. Org. Chem., 47,929 (1982).
100. «Cycloaddition reactions with vinyl heterocycles», Sepulveda-Arques J., Abarca-Gonzales B., Medio-Simon Adv. Heterocycl. Chem., 63, 339 (1995).
101. Cornwall P.t Dell С. P., Knight D. W. J. Chem. Soc., Perkin Trans. 1,1993,2395.
102. Avalos L. S., Benitez A., Muchowski J. M.t Romero M., Talamas F. X. Heterocycles, 45, 1795 (1997).
103. Nakano T, Rivas C., Perez C, Tori K. J. Chem. Soc., Perkin Trans. 1, 1973, 2322; Rivas C., Bolivar R. A., Cucarella M. J. Heterocycl. Chem., 19, 529 (1982); ZamojskiA., Kozluk T. J. Org. Chem., 42,1089 (1977); Jarosz S, ZamojskiA. J. Org. Chem., 44,3720 (1979).
104. Yamamoto F., Hiroyuki M., Oae S. Heterocycles, 3, 1 (1975); Divald S., Chiin M. C., Joullie M. M. J. Org. Chem., 41,2835 (1976).
105. Kuwajima L, Atsumi K., Tanaka T, Inoue T. Chem. Lett., 1979, 1239.
106. Wilson W. C., Oig. Synth. Coll. Vol. 1,1932,274; Boyd M. R., Harris T. M., Wilson B. J. Synthesis, 1971,545.
107. FerrazJ. P., Do Amaral L. J. Org. Chem., 41, 2350 (1976).
108. Rinkes I. J. Reel. Trav. Chim. Pays-Bas, 49,1118 (1930).
109. HillH. B., White G. R., J. Am. Chem. Soc., 27, 193 (1902).
110. «Natural 4-ylidenebytenolides and 4-ylidenetetronic acids», Pattenden G. Prog. Chem. Org. Nat. Prod., 35, 133 (1978).
111. «The role of heteroatomic substances in the aroma compound of food stuffs», Ohiaff G., Flament I. Prog. Chem. Org. Nat. Prod., 36,231 (1979).
112. «Recent advances in the chemistry of unsaturated lactones: Rao Y. S. Chem. Rev., 76, 625 (1976).
113. Grieco P. A., Pogonowski C. S., Burke S. J. Org. Chem., 40,542 (1975); McMurray J. E., Donovan S. F. Tetrahedron Lett., 1977,2869.
114. Yoshii E., Koizumi T, Kitatsuji E.f Kawazoe T., Kaneko T. Heterocycles, 4, 1663 (1976); «Furan-, pyrrole-, and thiophene-based siloxydienes for synthesis of densely functionalised homochiral compounds», Casiraghi G., Rassu G. Synthesis, 1995,607.
115. Jefford C. W., JaggiD., Boukouvalas J. Tetrahedron Lett., 28,4037 (1987); Jefford C. W., SledeskiA. W., Boukouvalas J. J. Chem. Soc., Chem. Commun., 1988,364; Asaoka M., Sugimura N., Takei H. Bull. Soc. Chem. Jpn., 52,1953 (1979).
116. Jefford C. W., JaggiD.t Boukouvalas J. J. Chem. Soc., Chem. Commun., 1988,1595.
117. SomayR., Neurier J.-M., Foumari P. Bull. Soc. Chim. Fr., 1971,990.
118. Kraus G. A. Sugimoto H. J. Chem. Soc., Chem. Commun., 1978,30.
119. Tanis S. P, Head D. B., Tetrahedron Lett, 40,4451 (1984).
120. D’Aleilio G. E, Williams C. J., Wilson C. L. J. Oig. Chem., 25,1028 (1960); Sherman E., Dunlop A. P. ibid., 1309.
121. Iten P. X., Hofmann A. A., Eugster С. H. Helv. Chim.Acta, 61,430 (1978).
122. Iten P. K, Hofmann A., A., Eugster С. H. Helv. Chim.Acta, 62,2202 (1979).
123. Brownbridge P, Chan T.-H. Tetrahedron Lett., 21,3423 (1980).
124. Niwa E.t Aoki H, Tanake H, Munakata K, Namiki M. Chem. Ber., 99, 3215 (1966); Cederlund B., Lantz R-, Homfeldt A.-B., Thorstad O., Undheim K. Acta Chem. Scand., B31, 198 (1977).
125. «Synthesis of amino derivatives of five-membered hetercycles by Thorpe-Ziegler cyclisation», Granik V. G., Kadushkin A. V, Liebscher Adv. Heterocycl. Chem., 72, 79 (1998).
126. Cochran J. E., Wu T., PadwaA. Tetrahedron Lett., 37,2903 (1996).
127. Adams R., Voorhees V Org. Synth., Coll. Vol. 1,1932,280 (1959).
128. Bonner W. A., Roth M. R J. Am. Chem. Soc., 81,5454 (1959); Moye C. J. Krzeminski Z. A. Austr J. Chem. 16,258 (1963); FeatherM. S, HarrisD. W., NicholsS. B. J. Oig. Chem., 37, 1606(1972).
129. Anet E. F. C. J. Chem. Ind., 1962,262.
130. Nowlin G. J. Am. Chem. Soc., 72, 5754 (1950); Traylelis V. J.t Hergennother W. L., Hanson H. T., Valicenti J. A. J. Org. Chem., 29, 123 (1964); Scott L. T., Naples J. O. Synthesis, 1973,209.
131. Amamath V., Amamath K. J. Org. Chem., 60, 301 (1995).
132. Hegedus L. S., Perry R. J. J. Oig. Chem., 50, 4955 (1985); Mackay D., Neeland E. G., Taylor N. J. ibid., 51,2351 (1986).
133. Jacobson R M., Raths R A., McDonald J. H. T. J. Oig. Chem., 42,2545 (1977); Jacobson R M.> AbbaspourA., Lahm G. P. ibid., 43,4650 (1978).
134. Boberg E, Kieso A. Justus Liebigs Ann. Chem., 626,71 (1959).
135. Botteghi C, Lardicci L., Menicagli R. J. Oig. Chem., 38,2361 (1973).
136. KornfeldE. C, Jones R. G. J. Oig. Chem., 19, 1671 (1954).
137. Clauson-Kaas N. Acta Chem. Scand., 15, 1177 (1961).
138. Seyferth H. E. Chem. Ber., 101,619 (1968).
139. Cormier R. A., Grosshans C. A., SkibbeS. L. Synth. Commun., 18,677 (1988).
140. Cormier R A., Francis M. D. Synth. Commun., 11, 365 (1981).
141. Diaz-Cortes R., Silva A. L., Maldonado L. A. Tetrahedron Lett., 38,2207 (1997).
142. Comforth J. W. J. Chem. Soc., 1958, 1310; Bumess D. M. Org. Synth., Coll. Vol. IV,
1963,649; Kotake Н, Inomata К., Kinoshita Н., Аоуата S., Sakamoto Y. Heterocycles, 10, 105 (1978).
143. GarstM. E., Spencer T. A. J. Am. Chem. Soc., 95,250 (1973).
144. Miller D. J. Chem. Soc. (C), 1969, 12; Schreurs P. H. M., de Jong A. J., Brandsma L. Reel. Trav. Chim. Pays-Bus, 95,75 (1976).
145. Marshall J. A., WangX. J. Org. Chem., 56, 960 (1991).
146. DanheiserR. L., Stoner E. J., Koyama H., Yamashita D. S. J. Am. Chem. Soc., Ill, 4407 (1989).
147. Sheng H, Lin S., Huang Y. Tetrahedron Lett., 27,4893 (1986).
148. Sheng H., Lin S., Huang Y. Synthesis, 1987, 1022.
149. Fukuda Y., Shiragami H., Utimoto K., Nozaki H. J. Org. Chem., 56,5816 (1991).
150. Marshall J. E, DuBay Ж J. J. Org. Chem., 56, 1685 (1991).
151. Bisagni E, Marquet J.-P., Bourzat J.-D., Pepin J.-J., Andre-Louisfert J. Bull. Soc. Chim. Fr., 1971,4041.
152. Dann 0., Distler H., Merkel H. Chem. Ber., 85,457 (1952).
153. Howes P.D., Stirling C. J. M. Org. Synth., 53, 1 (1973); Batty J. W., Howes P. D., Stirling C. J. M. J. Chem. Soc., Perkin Trans. 1, 1973, 65; Ojida A., Tanoue F., Tanematsu K. J. Oig. Chem., 59,5970 (1994).
154. ArcadiA., Rossi E. Tetrahedron, 54, 15253 (1998).
155. MacGee D. I., Leach J. D. Tetrahedron Lett., 38, 8129 (1997).
156. CouffignalR. Synthesis, 1978, 581.
157. CacchiS, Fabrizi G., Moro £.J. Org. Chem., 62,5327(1997).
158. BewS.P., Knight D. W. Chem. Commun., 1996,1007.
159. GarstM. E, Spencer T. A. J. Org. Chem., 39, 584 (1974).
160. JerrisP. J., Wovkulich P. M., Smith A. B. Tetrahedron Lett., 1979,4517.
161. Yang Y.t WongH. N.C. Tetrahedron, 50,9583 (1994).
162. Song Z.Z., Ho M.S., WongH.N. C. J. Org. Chem., 59, 3917(1994).
163. Timko J. M., Moore S. S., Walba D. M., Hiberty P. C., Cram D. J. J. Am. Chem. Soc., 99, 4207 (1977).
164. Bilchi G., Demole E., Thomas A. F. J. Org. Chem., 78,123 (1973).
16
ОБЩАЯ ХАРАКТЕРИСТИКА
РЕАКЦИОННОЙ СПОСОБНОСТИ ИЦДОЛОВ, БЕН30[Ь]ТИ0ФЕН0В, БЕН30[Ь]ФУРАН0В, ИЗОИНДОЛОВ, БЕНЗО[с]ТИОФЕНОВ И ИЗОБЕНЗОФУРАНОВ
индол Н бензотиофен бензофуран изоиндол бензо[с]тиофен изобензофуран [бензо[Ь]тиофен] [бензо[Ь]фуран!
Одна из наиболее важных гетероциклических систем — индол — представляет собой молекулу пиррола, к которой по связи С(2)—С<з> аннелировано бензольное кольцо. В этой главе подробно описывается химия индола, а также обсуждаются отличия между бензо[6]фуранами и бензо[/?]тиофенами, позволяющие лучше понять их химию. И, наконец, рассматриваются три гетероцикла, в которых бензольное кольцо аннелировано к пятичленному гетероциклу по 3,4-положениям.
Типичные реакции индолов
N R к индолил-анион обеспечивает Г*' возможность введения / / заместителей к кольцевому атому азота литиирование N-замещенных индолов позволяет вводить заместители в положение 2 N Г \ ЬН х\ // \ индолы —очень слабые основания; х—в термодинамическом катионе N протон находится в р-положении: z Н ЗН-индолий-катион у%+Н+ Н н очень легко идет электрофиль- ное замещение по р-положению; замещение идет по положению 2 в 3-замещенных индолах
Наиболее существенным в химии индола можно назвать легкость, с которой индолы вступают в реакции электрофильного замещения. Если сравни-
вать два цикла, из которых состоит молекула индола, то гетероцикл — более электроноизбыточный, чем бензольное кольцо, поэтому электрофил всегда атакует пятичленное кольцо за некоторыми исключениями. Из трех положений гетероциклического кольца атака по атому азота нарушила бы ароматичность пятичленного цикла и образовался бы катион с локализованным зарядом; два других положения кольца могут быть атакованы электрофилами с образованием С-замещенных производных, однако преимущественная атака идет по p-положению. Эти отличия в поведении индола по сравнению с пирролом можно объяснить, если рассмотреть интермедиаты Вэланда для двух альтернативных мест атаки.
интермедиат для Р-атакиХ+
интермедиат для а-атакиХ+
Интермедиат, образующийся при электрофильной атаке по положению 2, стабилизирован — это бензильный катион, но атом азота не может принимать участие в делокализации заряда без нарушения ароматичности бензольного кольца (резонансная форма, вклад которой ограничен, показана в круглых скобках). В наиболее стабильном интермедиате, образующемся при атаке по положению 3, заряд локализован в положении, соседнем с атомом азота, и стабилизация в значительной степени обеспечивается взаимодействием с неподеленной парой электронов атома азота.
Легкость, с которой индолы вступают в реакции электрофильного замещения по положению 3, можно проиллюстрировать на примере реакции Манниха — электрофильные частицы в таких реакциях (C=N+R2) обычно считаются «слабыми» электрофилами, однако замещение проходит легко и в мягких условиях.
[CH2=NMe2 ]
Ме2СО, АсОН
СН2О. Me2NH, АсОН
Предпочтение атаки по положению 3 настолько велико, что даже если в этом положении уже имеется заместитель, то атака все равно может идти по этому положению. Это хорошо иллюстрируется примерами, в которых реализуется возможность нуклеофильного улавливания интермедиатов Вэланда: простейший пример — реакция индола с гидросульфитом натрия:
Общая характеристика реакционной способности индолов, бензо[Ь]тиофенов и др.
NaHSO3, pH 4 (электрофил = Н+)
409
Электрофильное замещение по положению 2,3-замещенных индолов может происходить тремя способами: (1) первоначальная атака по положению 3 с последующей 1,2-миграцией в положение 2; (2) первоначальная атака по положению 3 с последующим обращением (когда это возможно), а затем (3); (3) прямая атака по положению 2. Было четко показано, что в некоторых случаях необратимого замещения действует миграционный механизм, а также тот факт, что может происходить и прямая атака по а-положению.
первоначальная р-атака, потенциально обратимая в некоторых случаях
3->2 миграция X
-Н+
конечный результат —
а-замещение
р -замещенных индолов
Индолы реагируют с сильными основаниями, теряя при этом атом водорода при азоте и превращаясь в индолил-анионы. Если в качестве противоиона присутствует ион щелочного металла, то такие соли имеют значительный ионный характер и реагируют с электрофилами по атому азота, обеспечивая таким образом практический подход к N-алкилированным (или N-ацилированным) производным индола. Индолил-анионы используют, например, для синтеза N-за-щишенных производных. N-Защищенные индолы могут депротонироваться (литиироваться) по положению 2, причем зачастую заместители при атоме азота оказывают дополнительное хелатирующее действие. Однако последнее не столь существенно, так как даже N-метилиндол литиируется по положению 2, в котором активирующее влияние электроотрицательного атома азота ощущается наиболее сильно.
Н* PhSOgCI
Реакционная способность N-магнийиндолов, которые получают замещением активного N-водорода реактивами Гриньяра, или аналогичных цинкпроиз-водных существенно отличается от таковой для соответствующих натриевых, калиевых или литиевых солей. Более выраженный ковалентный характер связи N-металл обеспечивает направление электрофильной атаки по p-положению, а не по атому азота.
Как и во всей гетероциклической химии, появление катализируемых палладием^) процессов (для детального обсуждения см. разд. 2.7.) открыло широкий простор для функционализации индолов, бензотиофенов и бензофуранов; типичный пример приведен ниже:
Наличие системы подвижных электронов в гетероциклическом кольце означает, что индолы довольно легко (само)окисляются по пятичленному циклу. Восстановление каждого из циклов может быть проведено селективно: в кислых растворах растворенные металлы атакуют гетероцикл, тогда как бензольный цикл может быть селективно восстановлен по Берчу.
Помимо того факта, что заместители в бензольном кольце индолов «нормальные», т. е. ведут себя как обычные заместители в производных бензола, особо следует обратить внимание на реакционную способность индолов, имеющих уходящие труппы в бензильном положении, особенно в положении 3 гетероцикла. Такие соединения вступают в реакции замещения крайне легко либо вследствие стабилизации положительного заряда атомом азота, либо, наоборот, в основных условиях вследствие потери индольного атома водорода. Последнее наблюдается при восстановлении 3-ацилиндолов алюмогидридом лития с образованием 3-алкилиндолов. В известном смысле 3-кетоны ведут себя подобно винилогам амидов: промежуточные соединения, образующиеся в процессе восстановления, теряют атом кислорода, превращаясь в частицы, которые, присоединяя второй гидрид-ион, образуют индолил-анион, а последний, в свою очередь, переходит в индол при обработке водой.
По сравнению с индолом бензо[/>]фураны и бензо[ЭДтиофены изучены гораздо менее полно, однако можно заметить и сходство, и некоторые отличия. Каждая из перечисленных систем вступает в реакции электрофильного замещения, но 3-региоселективность гораздо менее выражена, чем для индола, вплоть до того, что д ля бензо[/>]тиофена атака иногда идет по бензольному кольцу, а д ля бен-зо[/>]фурана предпочтительно 2-замещение. Эти отличия обусловлены существенно меньшей электронодонорной способностью атомов кислорода и серы — атом азота в молекуле индола способен вносить гораздо больший вклад в стабилизацию интермедиатов, в частности, как было показано выше, в случае 0-атаки, и, следовательно, оказывает большее влияние на региоселекгивность. В слу-
Общая характеристика реакционной способности индолов, бензо[Ь]тиофенов и др. 411 чае бензо[6]фурана очевидно, что стабилизация интермедиата при атаке по положению 2 за счет простого образования резонансной структуры преобладает над тем вкладом, который может обеспечить атом кислорода в стабилизацию положительного заряда на соседнем атоме углерода.
Кислород- и серосодержащие системы литиируются по положению 2, что согласуется с поведением фуранов, тиофенов, а также N-защищенных пирролов и индолов.
Химическое поведение изоивдола, бензо[с]тиофена и изобензофурана определяется их как бы «незавершенной» структурой бензольного кольца: все эти гетероциклы с чрезвычайной легкостью вступают в реакции циклоприсоединения по положениям 1 и 3, так как образующиеся в результате этого процесса соединения имеют нормальное бензольное кольцо. Зачастую не делается попыток выделять эти гетероциклические соединения, а их просто генерируют в присутствии диенофила, с которым желательно провести реакцию. В связи с этим для подобных соединений лишь немногие электрофильные и нуклеофильные процессы изучены в достаточной степени.
По-видимому, большинство работ проводилось по синтезу индолов, а не каких-либо конденсированных гетероциклических систем с одним гетероатомом, и, соответственно, существует много методов их синтеза; синтезы колец бензо[6]тиофенов и бензо[/>]фуранов гораздо менее разработаны. Удивительно, что синтез индола по Фишеру — реакция, которой уже более ста лет, — до сих пор широко используется: арилгидразон нагревают с кислотой, и в результате многостадийной последовательности превращений с потерей аммиака образуется ивдол
На схеме показан более современный метод получения 2,3-незамещенных индолов: о-нитротолуол нагревают с диметилацеталем диметилформамида, образующийся енамин после восстановления нитротруппы циклизуется с потерей диметиламина, давая ароматический гетероцикл
[Н]
-Me2NH
Как бензо[д]тиофены, так и бензо [6] фураны можно получить из тиофенола и фенола соответственно в результате S- или О-алкилирования ацеталем бромальдегида с последующей кислотно-катализируемой циклизацией, включающей внутримолекулярную электрофильную атаку кольца
X = О или S
17
ИНДОЛЫ: РЕАКЦИИ И
МЕТОДЫ СИНТЕЗА
индоленин [ЗН-индол]
Индол [1] и простейшие алкилиндолы — бесцветные кристаллические вещества, обладающие разнообразными запахами: запах незамещенного индола напоминает нафталин, а скатол (3-метилиндол) имеет запах фекалий. Многие простейшие индолы коммерчески доступны, и все они получены синтетическим путем: сам индол получают, например, дегидроциклизацией N-этилани-лина, осуществляемой при высокой температуре в паровой фазе. Большинство индолов вполне устойчивы на воздухе, исключение составляют только простейшие 2-алкилиндолы: 2-метилиндол легко самоокисляется даже в склянке из темно-коричневого стекла.
Слово «индол» произошло от слова Индия: еще в XVI веке из Индии начали импортировать синий краситель — индиго. При химическом расщеплении красителя были получены кислородсодержащие индолы (разд. 17.14), которые были названы индоксил и оксиндол; сам индол был впервые получен в 1866 г. перегонкой оксиндола над цинковой пылью.
Индол практически полностью существует в Ш-форме, содержание ЗН-ин-дола составляет только одну миллионную долю. ЗН-Индол генерируют в растворе, и, как оказалось, он изомеризуется в 1Н-индол в течение —100 с при комнатной температуре [2].
По-видимому, индолы — наиболее широко распространенные в природе гетероциклические соединения. Незаменимая аминокислота — триптофан — входит в состав большинства белков, а также служит биосинтетическим предшественником триптамин-, индол- и 2,3-дигидроиндолсодержащих вторичных метаболитов.
триптофан
триптамин серотонин (5-гидрокситриптамин) мелатонин
В организме животных серотонин (5-гцдрокситриптамин) играет очень важную роль нейротрансмиттера в центральной нервной, а также в сердечно-сосудистой и желудочно-кишечной системах. Структурно подобный гормон мелатонин участвует в контроле смены дневного и ночного ритмов физиологических функций.
Изучение и классификация серотониновых рецепторов позволили смоделировать и синтезировать высокоселекгивные лекарственные препараты, такие, как суматриптан для лечения мигрени, ондансетрон для подавления тошноты и рвоты, вызываемых противораковой химиотерапией и радиотерапией, и алосет-рон для лечения воспалительных процессов в кишечнике.
Производные триптофана растительного происхождения включают р-индолил-уксусную кислоту (гормон, регулирующий рост растений), а также огромное число и структурное разнообразие вторичных метаболитов — алкалоидов индольного ряда [3]. Благодаря своей потенциальной физиологической активности индольные алкалоиды нашли широкое применение в медицине, однако в большинстве случаев они вытесняются синтетическими препаратами, хотя винкристин — «димерный» индольный алкалоид — крайне важен для лечения лейкемии. Брассинин, выделенный из репы, представляет собой фитоалексин — один из целого ряда соединений, синтезируемых растениями для защиты от воздействия микроорганизмов.
брассинин
Диэтиламид лизергиновой кислоты (ЛСД) обладает печально известной физиологической активностью. Синтетическое производное р-индолилуксусной кислоты — индометацин — применяется для лечения артритов.
17.1. РЕАКЦИИ С ЭЛЕКТРОФИЛЬНЫМИ РЕАГЕНТАМИ
17.1.1. Протонирование
Индолы, так же как и пирролы, очень слабые основания: величина рА^ для индола составляет -3,5, для 3-метиливдола -4,6 и для 2-метилиндола -0,3 [4]. Это означает, что в 6 М серной кислоте на каждые две протонированные молекулы ивдола приходится одна непротонированная, тогда как 2-метилиндол оказывается почти полностью протонированным в этих условиях. С помощью УФ- и ПМР-спектроскопии было установлено образование только 3-протони-рованного катиона (ЗН-индолий-катиона) [5]; это наиболее термодинамически устойчивый катион (в противоположность 2-протонированному катиону), и заряд делокализуется между атомом азота и а-углеродным атомом. Не обнаруженный спектральными методами N-протонированный катион может образовываться, причем довольно быстро; в кинетически контролируемых условиях дейтерообмен по атому азота происходит в 400 раз быстрее, чем по атому углерода С<з> [6]. Действительно, атом водорода при азоте обменивается быстро даже при pH 7, тогда как обмен по атому С(з> в этих условиях не происходит вовсе: селективное превращение индола в 3-дейтероиндол успешно идет при обработке дейтерокислотой, а затем водой [7]. Катализируемый основаниями обмен, включающий образование индолил-аниона (разд. 17.4), также идет по атому Ср) [8].
катион, стабилизированный 2-метильной группой
1Н-индолий-катион 2Н-индолий-катион ЗН-индолий-катион (образуется наиболее (наиболее устойчивый)
быстро)
Гораздо более высокая основанность 2-метилиндола по сравнению с индолом обусловлена стабилизацией 2-метил-ЗН-индолий-катиона электронодонорным влиянием метильной группы в положении 2; 3-метилиндол имеет основность более низкую, чем индол.
Реакции протонированных индолов (см. также разд. 17.1.6 и 17.1.9)
ЗН-Ивдолий-катионы, будучи без сомнения электрофильными частицами в противоположность нейтральным индолам, в благоприятных условиях реагируют в качестве таковых. Например, незамещенный ЗН-индолий-катион присоединяет бисульфит при pH 4 в условиях кристаллизации натриевой соли ивдо-лин-2-сульфокислоты (индолин — широко используемое тривиальное название 2,3-дигидроиндола). Эта соль при растворении в воде превращается в индол, однако ее можно проацетилировать по атому азота, а полученный ацетамид можно использовать для дальнейшего галогенирования по положению 5. Последующий гидролиз с потерей бисульфита приводит к образованию 5-замещенных индолов [9].
NaHSO3 pH 4 98% *
н ACgO,7D-C <\
N SO3- Na* н Ac
н
N SOy Na+
Btg, <5 С .
затем водн. NaOH \\ // и 92% N Н
н
В сильной кислоте из N-ацилтриптофана образуется ЗН-протонированный индолий-катион, который внутримолекулярно циклизуется с участием атома азота боковой цепи [10]
17.1.2. Нитрование; реакции с другими азотсодержащими электрофилами
Незамещенный индол можно пронитровать бензоилнитратом — нитрующим агентом, не содержащим кислоты; реакции с обычными кислотными нитрующими смесями приводят к образованию веществ неустановленного строения, по-видимому, из-за катализируемой кислотами полимеризации. Этого можно избежать, если в качестве нитрующей смеси использовать смесь концентрированной азотной кислоты и уксусного ангидрида при низкой температуре — в этих условиях успешно нитруются N-алкилиндолы, а также ивдолы, имеющие при атоме азота электроноакцепторные заместители, но только не сам незамещенный индол [11]
2-Метилиндол нитруется бензоилнитратом с образованием 3-нитропроизводных [12], однако он может также гладко нитроваться смесью концентрированных азотной и серной кислот, но при этом образуются 5-нитропроизводные. Атака не идет по гетероциклу; это объясняется тем, что в данных условиях происходит исчерпывающее протонирование 2-метилиндола. Региоселективность атаки в лорд-положение по отношению к атому азота может означать, что определяющим в этом процессе является образование бисульфатного аддукта из ЗН-индолий-катиона, как показано на схеме. То, что нитрование ЗН-индолий-ка-тиона идет по положению 5, было независимо доказано с использованием подлинного 3,3-дизамещенного ЗН-индолий-катиона [13]. Если в положении 3 индола находится ацетильная группа, нитрование тетрафторборатом нитрония в присутствии хлорида олова(ГУ) идет либо по атому С<5), либо по атому в зависимости от температуры реакции [14].
Индолы быстро подвергаются электрофильному аминированию при взаимодействии с бис-(2,2,2-трихлорэтил)азодикарбоксилатом, и образующийся ацилированный гидразин разлагается в присутствии цинковой пыли, давая 3-ацил аминоиндол [15]
(CI3CCH2OCON=)2
Et2O,8 ‘С
90% *
17.1.3. Сульфирование; реакции с другими серосодержащими электрофилами
Сульфирование индола [16] по положению 3 достигается при использовании пиридинсульфотриоксида в пиридине. Грамин сульфируется в олеуме с образованием 5- и 6-сульфокислот, причем атака идет по дипротонированной (по положению 3 и атому азота боковой цепи) соли [17]. Сульфенилирование индолов также происходит быстро по положению 3 [18]. Обратимость этого процесса была доказана десульфенилированием в присутствии кислоты и улавливанием сульфенил-катиона [19], а также кислотно-катализируемой изомеризацией 3-сульфидов в 2-сульфиды [20]. Тиоцианирование идет с практически количественным выходом при использовании смеси тиоцианата аммония с церий(1У)ам-монийнитратом [21].
17.1.4. Галогенирование
З-Галогеноиндолы и в еще большей степени 2-галогеноиндолы — неустойчивые соединения и их необходимо использовать сразу же после получения. Существует много разнообразных методов 0-галогенирования индолов: использование брома или иода (в последнем случае в присутствии гидроксида калия) в диметилформамиде [22а] дает очень высокие выходы; эффективно также применение трибромида пиридиния [226]; иодирование [22в] и хлорирование [22г] необходимо проводить в щелочных растворах, причем в последнем случае, по-видимому, первоначально идет N-хлорирование с последующей перегруппировкой. Взаимодействие 3-замещенных индолов с галогенами проходит более сложно: первоначально происходит 3-галогенирование с образованием 3-гало-гено-ЗН-индола [23], однако строение конечного продукта реакции зависит от условий ее проведения, природы растворителя и других факторов. Так, нуклеофилы могут присоединяться по положению 2 к промежуточно образующимся З-галогено-ЗН-индолам и в результате последующей потери галогеноводорода давать 2-замещенные индолы в качестве конечных продуктов. Так, например, в водных растворах происходит присоединение воды с образованиеми оксиндо-лов (разд. 17.14); аналогично при присоединении метанола получаются 2-меток-сииндолы.
Прямое бромирование 3-замещенных индолов можно проводить с использованием N-бромсукцинимида в отсутствие инициаторов радикальных реакций [24]. 2-Бром- и 2-иодиндолы могут быть получены с очень хорошими выходами через а-литийпроизводные [25] (разд. 17.6.1); 2-галогеноиндолы также образуются при взаимодействии оксиндолов с фосфорилгалогенидами [26]. При бромировании метилового эфира индол-3-карбоновой кислоты получают смесь 5- и 6-бромпроизводных [27]. Получение 3-иодиндола, который мгновенно стабилизируют в виде 1-фенилсульфонилпроизводного, по-видимому, включает первоначальное N-иодирование с последующей перегруппировкой [28].
/ >----. n-BuLi LDA / Л--------(
k J! \\ THF.-78 *С l2 THF,-78 *С PhSO2CI Н \)
считая на индол
17.1.5. Ацилирование
Индол реагирует с уксусным ангидридом со значительной скоростью только при температуре выше 140 °C, давая 1,3-диацетилиндол в качестве основного продукта реакции с небольшими примесями N- и 3-ацетилиндолов; 3-ацетилиндол можно получить щелочным гидролизом реакционной смеси [29]. Первоначально атака идет по 0-положению, что подтверждается тем, что 1-ацетилиндол не подвергается С-ацетилированию, в то время как 3-ацетилиндол легко превращается в 1,3-диацетильное производное. В противоположность этому ацетилирование в присутствии ацетата натрия или 4-диметиламинопиридина [30] приводит исключительно к образованию N-ацетилиндолов, по-видимому, через индолил-анион (разд. 17.4). При взаимодействии с более реакционноспо-
собным трифторуксусным ангидридом ацилирование идет при комнатной температуре, причем в диметил формамиде — в положение 3, а в дихлорметане — по атому азота [31].
N-Ацилиндолы гидролизуются значительно быстрее, чем обычные амиды, действия водным раствором гидроксида натрия оказывается достаточным для их гидролитического расщепления. Такая лабильность обусловлена гораздо более слабым мезомерным взаимодействием карбонильной группы с атомом азота, что делает первую более электрофильной, и частично относительной стабилизацией индолил-аниона, в результате чего он становится более хорошей уходящей группой, чем амид-анион.
При простом нагревании индола с триэтилортоформиатом при 160 “С происходит алкилирование по атому азота с введением диэтоксиметильной группы (DEM), которая представляет собой прекрасную уходящую группу для защиты атома азота, поскольку позволяет проводить литиирование по положению 2 (ср. разд. 17.4.2) и легко удаляется разбавленной кислотой при комнатной температуре [32].
CH(OEt)2
Реакция Вильсмейера — наиболее эффективный способ получения 3-фор-милиндолов [33] и других 3-ацилиндолов, если вместо диметилформамида использовать третичные амиды других кислот [34]. Даже индолы, имеющие в a-положении электроноакцепторные заместители, гладко p-формилируются по реакции Вильсмейера [35].
Большое практическое значение имеет реакция индола с оксалилхлоридом, в результате которой с высоким выходом получается хлорангидрид кетокисло-
ты, который можно превратить в ряд соединений, например в триптамин; синтез серотонина также основан на применении этой реакции [36].
в м. . НО
BnNH2
затем UAIH4
затем Н2, Pd/C fj
70%
МН2
N
Н серотонин
Индолы, в р-положении которых имеется боковая цепь с карбонильной группой, подвергаются циклоацилированию с образованием циклических а-ацилиндолов [37]. Внутримолекулярная реакция Вильсмейера с использованием амидов триптамина приводит к получению иминов, а не кетонов в качестве конечного продукта реакции; для циклических иминов предпочтительнее существование именно в этой форме, чем гидролиз до амина и кетона [38].
Ацилирование 3-замещенных индолов затруднено: 2-ацетилирование может быть ускорено благодаря использованию катализа трифторидом бора [36]. При ацетилировании индолил-3-уксусной кислоты в результате последующей енол-лакгонизации образуется индол, аннелированный с 2-пироном, который можно гидролизовать в кетокислоту. Кроме того, диеновая природа 2-пирона (разд. 8.2.2.4) может быть использована, как показано ниже [39]:
Дезактивация пятичленного цикла электроноакцепторными заместителями позволяет проводить ацилирование в шестичленное кольцо. При взаимодействии 1-пивалоилиндола с хлорангидридами а-галогенокислот и хлоридом алюминия с высокими выходами образуются 6-замещенные кетоны; хлорангидри-ды простых кислот реагируют только по положению 3 [40]. Другим способом прямого введения ацильных заместителей в бензольное кольцо может служить замещение в иминиевой соли — интермедиате реакции Вильсмейера, которая замещается по положениям 5 и 6 с преобладанием продуктов 5-замещения [41]. Схема, приведенная ниже, показывает, как пивалоильная группа может быть введена в положение 1 3-(индол-3-ил)пропионовой кислоты с использованием 2 мольных эквивалентов основания, что дезактивирует гетероциклическое кольцо; последующая циклизация по Фриделю—Крафтсу идет по положению 4 [42].
(СН2)2СО2Н THF,-78’С
( затем
\ f-BuCOCI
(СН2)2СО2Н
/ AICI3, CICH2COCI
\ SOCI2, 20 *С CI(CHg)2CI, 15 Г
N*
Н
N
COf-Bu
78%
17.1.6. Алкилирование
Индолы не реагируют с алкилгалогенидами при комнатной температуре. Незамещенный индол начинает взаимодействовать с метилиодидом в диметил формамиде при температуре ~ 80 °C, и при этом в основном образуется скатол. При повышении температуры происходит дальнейшее алкилирование вплоть до образования иодида 1,2,3,3-тетраметил-ЗН-индолия
Mel
DMF, МеОН 110 ’С
Ме
иодид 1,2,3,3-тетраметил- м
ЗН-индолия Ме *
В результате перегруппировки с миграцией алкильной труппы 3,3-диалкил-ЗН-индолиевые ионы превращаются в 2,3-диалкилиндолы, как показано на схеме выше; этот процесс родствен перегруппировке Вагнера—Меервейна и известен как перегруппировка Планше [43]. По-видимому, в большинстве случаев а-алкилирование 3-замещенных индолов с помощью катионных реакций происходит именно таким путем, что было изящно подтверждено на примере реакции циклизации 4-(индол-3-ил)бутан-1-ола в 1,2,3,4-те1рагидрокарбазол в присутствии трифторида бора. Эксперимент проводили с меченным по «бензильному» положению атомом углерода в исходном соединении. Вследствие перегруппировки асимметрического спироциклического интермедиата, который образовывался в результате атаки по положению 3, получили равное распределение метки между атомами углерода C(i) и С<4) в конечном тетрагидрокарбазоле [44]. Важно отметить, что другие эксперименты доказывают, что прямая атака по положению 2 может происходить и происходит [45], особенно если это положение активировано 6-метоксигруппой [46].
В другом изящном эксперименте влияние промежуточно образующегося 3,3-дизамещенного ЗН-индолиевого интермедиата на процесс а-замещения
индола было доказано на примере циклизации мезилата оптически активного спирта в оптически неактивный продукт реакции, что возможно в результате образования ахирального спироциклического интермедиата вследствие первоначальной атаки по р-положению [47].
Индолы реагируют с эпоксидами и азиридинами в присутствии кислот Льюиса (см. разд. 17.5 о взаимодействии индолил-аниона с такими реагентами) с раскрытием трехчленного цикла и последующим 3-(2-гидроксиалкилированием) или 3-(2-аминоалкилированием) гетероцикла. Трифлат иттербия и фенилборная кислота — хорошие катализаторы д ля проведения реакций с эпоксидами при высоком давлении [48]; силикагель также служит эффективным катализатором, однако реакция идет медленно при нормальном давлении и комнатной температуре [49]. Для реакций с азиридинами, катализируемых кислотами Льюиса, могут использоваться трифлат цинка и трифторид бора [50]. Более реакционноспособные алкилирующие электрофилы реагируют при более низких температурах: так, например, реакция с диметилаллилбромидом идет при комнатной температуре [51].
17.1.7. Реакции с альдегидами и кетонами
Индолы реагируют с альдегидами и кетонами в условиях кислотного катализа, причем с простыми карбонильными соединениями первичные продукты реакции индол-3-илкарбинолы (p-индолилкарбинолы) не удается выделить, так как в кислых условиях они расщепляются с образованием З-алкилиден-ЗН-индолий катионов. В тех же условиях продукты взаимодействия с ароматическими альдегидами выделить удается [52]; при реакции 2-метилиндола с ацетоном в безводных средах получают простейшую выделяемую соль такого класса [53]. Гидроксиалкилиндолы удается выделить только в условиях, в которых дегидратация невозможна, например из реакции с диэтилоксалатом [54]. Реакция с 4-диметиламинобензальдегидом (реакция Эрлиха, см. разд. 13.1.7) приводит к получению мезомерного интенсивно окрашенного катиона.
Ме2СО
R H2SO4,0‘Cr
V-X /-Me 72%
N
З-Алкилиден-ЗН-индолий-катионы, будучи электрофилами, могут реагировать с индолом, как показано ниже на примере реакции с формальдегидом [55]. Циклические кетоны взаимодействуют с 1,2-диметилиндолом с образованием 3-циклоалкенил индолов [56].
/ X-----. водн. Cl-feO
k //\\во'с ~
95%
3-Алкилирование 2-алкил- и 2-арилиндолов происходит в результате катализируемой трифторуксусной кислотой конденсации либо с ароматическими альдегидами, либо с алифатическими кетонами в присутствии триэтилсилана для восстановления 3-(гидроксиалкил)производных [57].
O2NC6H4-2-CHO, 3Et3SiH 1,5 ЭКВ. CH2CI2, О *С
74% *
17.1.8. Реакции с а,p-ненасыщенными кетонами, нитрилами и нитросоединениями
Эти катализируемые кислотами реакции следует рассматривать как дальнейшее развитие конденсаций индолов с альдегидами и кетонами, рассмотренных в предыдущем разд. 17.1.7. В простейшем примере метилвинилкетон взаимодействует с индолом просто как сопряженный кетон (по p-положению двойной связи) [58].
О
Использование монтмориллонитовой глины — очень эффективного «кислотного» катализатора — позволяет проводить а-алкилирование р-замещенных индолов [59]; трифлат иттербия также может служить катализатором таких процессов алкилирования [60]. Этому эффективному катализу можно противопоставить реакцию окиси мезитила с 1,3-диметилиндолом в присутствии серной кислоты — электрофильная атака идет по уже замещенному p-положению с последующим внутримолекулярным нуклеофильным присоединением енольной формы кетона в боковой цепи по положению 2 [61].
Развитие этой методологии позволило синтезировать триптофаны в результате катализируемого хлоридом алюминия алкилирования иминоакрилатом, как показано ниже [62] (подобные трансформации, но биокатализируемые, см. в разд. 2.9):
_СО2Ме водн. HCI СО2Н
/^( СН2С12,0 ’С /----{
л—Z \ затем водн. КОН/ л—•/ \
\j7 \\ N<sxph МеОН, 20’С ж NH2
H H
Электрофильность нитроэтена достаточна для замещения ивдола даже в отсутствие кислотного катализа [63]; при использовании 2-диметиламино-1 -нитроэтена в трифторуксусной кислоте получают 2-(индол-3-ил)нитроэтен — реакционноспособную частицу, представляющую собой протонированный енамин, и процесс подобен конденсации Манниха [64]. Применение 3-триметилсилил-индолов с г/исо-замещением силана [65] — альтернативный метод эффективного алкилирования, позволяющий избегать кислотного катализа.
17.1.9. Реакции с иминиевыми ионами: реакция Манниха [66]
В нейтральных условиях и при низкой температуре незамещенный индол реагирует со смесью формальдегида и диметиламина по атому азота [67]; эта реакция, по-видимому, протекает при низкой равновесной концентрации индолил-ани-она. В нейтральном растворе при более высокой температуре или в уксусной кислоте происходит превращение в термодинамически более стабильное 3-за-мещенное соединение — грамин. Грамин можно получить напрямую, гладко и с высоким выходом реакцией в уксусной кислоте [68]. Реакция Манниха имеет большое практическое значение, так как не только позволяет широко варьировать электрофильные иминиевые ионы, но и сам грамин и родственные ему основания часто используют как ценные промежуточные соединения для дальнейших синтезов (разд. 17.12),
СН2О, Me2NH н2о, о *с
79%
Н2О, нагревание 93% или
АсОН, 20 *С 68%
NMe2
Н грамин
Н CH2NMe2
СН2О, Me2NH, АсОН, 20 *С->1нОСН2ММе2 CH2=NMe21
_________25^___________—__________L«22__________1
Электрофил — иминиевый ион — может быть синтезирован отдельно и выделен в кристаллическом виде, он известен как «соль Эшенмозера» (Me2N+=CH2 I") [69]. Обычно реакции с этим реакционноспособным электро-
филом проводят в неполярном растворителе. Примеры, иллюстрирующие, какие изменения может претерпевать структура иминиевого иона, включают реакцию индола с пиримидином [70], реакцию индола с бензилиденовыми производными ариламинов, катализируемую трифлатами лантаноидов [71], и димеризацию индола, катализируемую минеральными кислотами [72]. В первом примере протонированный пиримидин выступает в качестве электрофила, в последнем индол атакуется протонированным индолом, как показано ниже:
Скатол превращается в а,а*-связанный димер в кислоте; в противоположность этому 2-метиливдол не подвержен кислотно-катализируемой димеризации, что обусловлено более низкой электрофильностью 3-протонированного 2-замещенного ЗН-индолий катиона, аналогично тому, как кетоны менее реакционноспособны, чем альдегиды.
Если в качестве электрофила используют протонированный 3-броминдол, конечное элиминирование бромоводорода приводит к восстановлению ароматичности 2-замещенных индолов; пиррол (как показано на схеме) или индолы могут участвовать в процессах такого типа [73].
НВг.
В том случае, когда можно провести внутримолекулярную конденсацию, реакции Манниха и Вильсмейера широко используют для синтеза тетрагидро-р-карболинов [74] (дигидро-р-карболинов) — соединений, подобных обнаруженным во многих индольных алкалоидах (p-карболин — широко используемое тривиальное название пиридо[3,4-А] индола).
Спорным является вопрос, как происходит атака: либо непосредственно по a-положению, либо по p-положению с последующей перегруппировкой. По-видимому, существенно то, что реакция Манниха, в противоположность алки-
лированию, обсужденному в разд. 17.1.6, — процесс обратимый, который позволяет, хотя и более медленно, но напрямую осуществлять a-замещение, что принципиально важно для получения а-замещенных структур.
Было показано, что триптамины, имеющие в положении 2 карбоксильную группу, которые легко синтезировать (см. разд. 17.17.6.3), но которые с трудом декарбоксилируются, подвергаются циклоконденсации Манниха с альдегидами и кетонами с потерей диоксида углерода на последней стадии процесса [75].
Нитроны, полученные из триптаминов, легко циклизуются, и процесс может быть проведен энантиоселективно при использовании хиральных кислот Льюиса [76].
B(OPh)3, fl-BINOL
CHgClg, 20*С
17.1.10. Диазосочетание и нитрозирование
Высокая реакционная способность индола прекрасно иллюстрируется той легкостью, с которой он вступает в реакции замещения с такими слабыми электрофилами, как хлорид фенилдиазония и нитрозирующими агентами. Индолы активно реагируют с азотистой кислотой: с незамещенным индолом реакция носит сложный характер, а 2-метилиндол гладко превращается в 3-нитрозопро-изводное. Такой же результат можно получить в катализируемом основанием процессе при использовании амилнитрита в качестве источника нитрозогруппы; в тех же условиях можно однозначно провести 3-нитрозирование незамещенного индола. З-Нитрозоиндолы существуют преимущественно в оксимин-ной таутомерной форме [77]. Скатол и другие 3-замещенные индолы при взаимодействии с азотистой кислотой превращаются в относительно устойчивые N-нитрозосоединения [78]; в результате кинетических исследований на примере 2-метилиндола было показано, что N-замещение предшествует С-за-мещению. N-Нитрозоиндолы можно получить из индолов — такие соединения могут быть мутагенными при попадании в организм человека.
17.1.11. Электрофильное металлирование
17.1.11.1. Меркурирование
Индолы быстро реагируют с ацетатом ртути(П) при комнатной температуре с образованием 1,3-дизамещенных соединений [79]. Даже N-ацилиндолы замещаются в мягких условиях; полученные таким образом 3-меркурированные производные используют в реакциях катализируемого палладием сочетания [80].
17.1.11.2. Таллирование
Трифторацетат таллия легко вступает в реакцию с простейшими индолами, хотя соединений с хорошо установленным строением выделить не удается. З-Ацил-индолы, однако, подвергаются очень селективному замещению по положению 4 при наличии хелатирующего и защищающего гетероциклическое кольцо электроноакцепторного заместителя в положении 3 [81]. Образующиеся соединения служат хорошими интермедиатами для получения 4-замещенных индолов, например 4-иод- и, следовательно, 4-алкокси- [82], 4-алкенил- [82] и 4-меток-сикарбонилиндолов [83], которые синтезируют с использованием катализируемых палладием реакций сочетания. Неожиданные результаты были получены при таллировании N-ацетилиндолина — замещение идет по положению 7, что открывает простор для введения заместителей к этому углеродному атому [84] (ср. с разд. 17.17.1.8 и 17.3).
17.1.11.3. Палладирование
Даже индолы, имеющие ацильный или фенилсульфонильный заместители при атоме азота, легко палладируются при умеренных температурах, причем замещение идет по положению 3 или, если это положение занято, по положению 2. Эти металлированные соединения редко удается выделить, но они позволяют проводить реакции с акрилатами, другими алкенами (реакция Хека) или с монооксидом углерода [85] in situ [86]. Хотя электрофильное палладирование обычно требует участия в реакции одного эквивалента соединения палладия(П), введение реоксидантов, селективных в отношении Pd(0), таких, как тяре/л-бутилпер-бензоат или соединения меди(П), позволяет регенировать катализатор [87].
17.2. РЕАКЦИИ С ОКИСЛИТЕЛЯМИ
Алкилиндолы легко самоокисляются; так, например, 2,3-диэтилиндол превращается в З-гидроперокси-ЗН-индол, который может быть выделен. Обычно такие процессы сопровождаются образованием более сложных смесей в результате дальнейшего разрушения гидропероксида; при взаимодействии с синглетным кислородом также образуются гидропероксиды, но по более сложному механизму. Если молекула индола содержит в боковой цепи группу, способную к улавливанию индоленина в результате внутримолекулярного нуклеофильного присоединения, возможно образование гидропероксидов, которые удается выделить, как показано ниже на примере [88]:
О2, ftv бенгальский розовый водн. EtOH, 5 ‘С
75% **
Реагент MoOs’HMPA, известный как «МоОРН», в метаноле позволяет присоединять фрагменты метилгидропероксида к N-ацилиндолу, а этот аддукт, в свою очередь, может быть использован: например, с потерей метанола происходит превращение индола в индоксил [89].
МоО5. НМРА МеОН, 20 *С 80% *
SnCf4
CH2CI2 90% *
Расщепление связи С(2>—Ср) в индолах происходит под действием таких окислителей, как озон, перйодат натрия [90], супероксид калия [91], кислород в присутствии хлорида меди [92], а также в результате фотохимической реакции в присутствии кислорода в этанольном растворе [93]; при облучении в органической кислоте в качестве растворителя окисляются алкильные группы в положе-ниях2иЗ [94].
Эффективное превращение 3-замещенных индолов в соответствующие оксиндолы можно осуществить при использовании диметилсульфоксида в кис-
лоте; на схеме, приведенной ниже, показан возможный механизм этого процесса [95]:
17.3. РЕАКЦИИ С НУКЛЕОФИЛЬНЫМИ РЕАГЕНТАМИ (СМ. ТАКЖЕ РАЗД. 17.14.4)
Индолы, так же как пирролы и фураны, вступают только в очень немногие реакции нуклеофильного замещения. Для осуществления таких взаимодействий, как известно, необходимы определенные условия; так, например, при наличии нитрогруппы в бензольном кольце, а также в отсутствие водорода при атоме азота происходит викариозное нуклеофильное замещение (разд. 2.3.3) [96].
o2n
toiso2ch2ci
NaOH, DMSO, 20 *С
79%
СН2ОМе
сн2оме
В комплексном соединении индола с карбонилом хрома металл ассоциирован с бензольным кольцом и, следовательно, нуклеофильное присоединение идет по этому циклу, обычно по положению 4. Ниже приведен пример относительно необычной атаки нуклеофила по положению 7; такой ход реакции можно изменить и направить атаку в обычное положение 4, если использовать индол с объемной защитной группой при атоме азота [97].
Me
17.4. РЕАКЦИИ С ОСНОВАНИЯМИ
17.4.1. Депротонирование N-водорода
Так же как и в пирролах, водород при атоме азота гораздо более кислый (рАа 16,2), чем таковой в ароматических аминах, например в анилине (рАа 30,7). Под действием некоторых очень сильных оснований происходит полное превращение N-незамещенного индола в соответствующий индолил-анион; среди
таких оснований наиболее удобны гидрид натрия, w-бутиллитий или алкильные реагенты Гриньяра
н
Na<
MeMgl Et20,20 *С
+ СН4 Mg!
Наличие электроноакцепторных заместителей, особенно в р-положении, значительно повышает кислотность NH-протона; так, например, величина pKi для 3-формилиндола примерно на 5 единиц больше, чем для индола, а для а-изомера на 3 единицы больше [98].
17.4.2. Депротонирование С-водорода
Для депротонирования С-водорода необходимо отсутствие более кислого водорода при атоме азота, т. е. чтобы при атоме водорода был заместитель, подобный метилу [99], либо, если требуется, легко удаляемая группа: фенилсульфонил [100], литий карбоксилат [101] и н-бутоксикарбонил [102] — наиболее широко используемые защитные группы. Кроме того, можно рекомендовать следующие группы: диалкиламинометильную [103], триметилсилилэтоксиметильную [104] и метоксиметоксильную [105]. Очевидно, что в последнем случае N-заместитель нельзя ввести непосредственно в молекулу индола, поскольку необходимо предварительно синтезировать 1-гидроксииндол, однако он может быть удален с образованием N-гидроксииндола. Полагают, что тлре/и-бутиламинокарбонильная [106] и метоксиметоксильная группы наиболее оптимально сочетают в себе защитную и активирующую функции. Каждый из этих заместителей способствует литиированию за счет внутримолекулярного хелатирования, а в некоторых случаях за счет электроноакцепторного влияния, усиливающего внутреннюю тенденцию к металлированию по а-положению.
Введение магния в положение 2 — процесс, протекающий при комнатной температуре; полученное производное может выступать в качестве нуклеофила, а кроме того его можно напрямую использовать в катализируемых палладием реакциях сочетания [107].
CONHf-Bu
Диметиламиногруппа Грамина направляет литиирование в положение 4, если атом азота индола защищен объемной три-изо-пропилсилильной группой, однако, если при атоме азота находится метильная группа, металлирование идет обычным образом по положению 2 [108].
Ph2S2, <78 ‘С. 70%
17.5. РЕАКЦИИ N-МЕТАЛЛИРОВАННЫХ ИНДОЛОВ
ЕН, КОН 18-crown<6 PhH, 20 *С 82%
Индолил-анион существует в основном в двух мезомерных формах, что свидетельствует о делокализации заряда преимущественно между атомом азота и p-углеродным атомом. В соответствии с этим индолил-анион вступает в реакции в качестве амбидентного нуклеофила; соотношение реакций N- и p-замещения при взаимодействии с электрофилами зависит от природы ассоциированного металла, полярности растворителя и природы электрофила. Как правило, наиболее ионные натриевые и калиевые производные индола замещаются главным образом по атому азота, тогда как индолилмагнийгало-гениды — преимущественно по р-положению [109]. Однако, если реакцию с последним проводить в ГМФТА, атака идет преимущественно по атому азота, тогда как в неполярных растворителях предпочтительна атака по атому углерода [ПО]. Наиболее реакционноспособные электрофилы проявляют бблыпую тенденцию атаковать атом азота, чем менее электрофильные частицы.
Для синтеза N-алкилиндолов можно использовать 1-натрийпроизводные индола [111], генерируемые количественно, как описано выше, или реакционная смесь может содержать небольшую концентрацию индолил-анионов, получаемых по методу фазового переноса [112]; также эффективно применение метода фазового переноса для N-ацилирования [113] и N-арилсульфонилиро-вания [114] индолов (см. также разд. 17.1.4).
Индолил-Ы-реагенты Гриньяра или даже лучше их цинковые аналоги [116] реагируют по положению 3 с множеством углеродных электрофилов, таких, как альдегиды, кетоны и галогенангидриды кислот, а также, например, с 2-бромти-азолом [117]. При введении в реакционную смесь хлорида алюминия с высокими выходами образуются 3-ацилиндолы [118]. Катализируемые медью реакции индолил-П-реагентов Гриньяра с П-ти^е/п-бутоксикарбонилазиридинами также идут по положению 3 с хорошими выходами [119]. В равной мере используются
и 1-литийиндолы, причем направление атаки опять же зависит от природы электрофила [120].
Важно отметить, что когда N-металлированные 3-замещенные индолы алкилируются по атому углерода, обязательно образуется 3,3-дизамещенный ЗН-ин-дол (индоленин), который не может реароматизоваться в индол (см. разд. 17.1.6 о перегруппировках 3,3-дизамещенных индоленинов).
17.6. РЕАКЦИИ С-МЕТАЛЛИРОВАННЫХ ИНДОЛОВ
17.6.1. Литийорганические производные
Одной из наиболее удобных N-защитных групп, используемых для литиирования индолов, служит диоксид углерода [102], так как эта N-защитная ipynna вводится in situ, а затем удаляется в ходе обычного течения реакции. Этот метод используют для получения 2-галогеноиндолов [25] и для введения разнообразных заместителей при взаимодействии с подходящими электрофилами — альдегидами, кетонами, хлорформиатами и т. д.
n-BuLi Г / Д—7Х THF,-70*С / л FBuU / > \\затем С0? J/ \\ THF,-70*С у Н CO2Li б —n ] l(CHz)2l /Y-n \\ затем JI \\ 90% * jz н t 5 J
Приведенное выше селективное a-замещение проводят в присутствии различных N-зашитных/активирующих трупп [100—107,121].
t-BuLi
THF, -78 *C затем (CO2Me)2
66%
CO2t-Bu
CONHt-Bu
n-BuLi
/ /)--V THF, -78 *С
JJ \\ затем PhCOMe
64%
SO2Ph
CF3CO2H, 2Q-C
СО2Ме
О
N H
2t-BuLI
THF, -78 ‘C затем PhCHQ 87%
CO2f-BuC°2Me
Ph
н
CONHt-Bu
N H
ОН
З-Литийиндолы могут быть получены заменой атома галогена [122]; N-tnpew-бугоксиметилсилильное производное региостабильно даже при 0 ’С [123], тогда как 3-литий-1-фенилсульфониливдол изомеризуется в 2-изомер даже при температуре выше —100 ’С, хотя при этой температуре не происходит раскрытия гетероцикла и образования алкина в результате отщепления азота в виде аниона (для сравнения см. разд. 18.3) [124, 125]. Соответствующие N-фенилсульфонил-З-маг-ний- [126] и N-фенилсульфонил-З-цинкпроизводные [127] устойчивы даже при комнатной температуре: они могут быть получены из 3-иодиндола реакцией с этилмагнийбромидом и триметилцинкатом лития соответственно. З-Литиирова-ние с замещением атома водорода возможно при условии блокирования положения 2 такими орлю-ориентирующими труппами, как 2-(2-пиридил) [126] или 2-карбоксил [128]. Прямое 3-литиирование, даже в отсутствие заместителей в положении 2, удается осуществить при наличии К-ди-(7ярв7я-бутил)формильного заместителя [129]. Приведем и другие примеры процессов прямого металлирования в химии индолов: 2-литиирование 1-замещенных ивдол-3-карбоновых кислот и амидов [130] и З-гидроксиметил-1-фенил сульфонил индола [131]; 4-литиирова-ние 5-(диметилкарбамоилокси)-1-(/иретп-бутилдиметилсилил)индола и 6-литии-рование 4-замещенных 5-(диметилкарбамоилокси)-1-(/ирс/и-бутилдиметилси-лил)индолов [132].
Удивительно, что обмен металл — галоген возможен для любого броминдо-ла, имеющего атом брома в бензольном кольце и незащищенный атом азота; индол предварительно превращают в калиевую соль [133].
17.6.2. Реакции, катализируемые палладием
2-/3-Бром- и 2-/3-иодиндолы и подобные им по реакционной способности 2- и 3-трифторметилсульфонаты [134] вступают в реакции катализируемого палладием сочетания как обычные арилгалогениды. Поскольку 2- и 3-галогеноиндо-лы неустойчивы, целесообразно использовать их N-ацилпроизводные [135]. Индолы, содержащие в бензольном кольце галогены или трифлатные заместители, прекрасно вступают в реакции сочетания.
SO2Tol
СО2Ме Pd(OAc)2, Et3N
100 ‘с г
4NHAC 47%
SO2Tol
Если для проведения реакции сочетания необходимо получить элементоорганическое производное индола, предпочтение отдается борным кислотам [136], хотя можно использовать и 2-цинк- и 2-станнилпроизводные [137]. Для проведения катализируемых палладием реакций сочетания 6-бром- или 6-иодиндолов с аллил- или гетероарилоловянными соединениями не требуется защиты атома азота индола [138].
17.7. РЕАКЦИИ СО СВОБОДНЫМИ РАДИКАЛАМИ
Радикалы, такие, как бензил и гидроксил, при взаимодействии с индолами действуют неселективно, давая смесь соединений, поэтому такие реакции редко используют на практике. Однако при бензоилоксилировании N-замещенных индолов образуются бензоаты индоксила [139], т. е. происходит эффективное окисление гетероциклического кольца индола в результате 0-атаки сильным электрофильным бензоилокси-радикалом. В противоположность этому слабый электрофильный радикал, полученный из малоната, селективно реагирует по положению 2 по механизму атомного переноса [140].
Некоторые эффективные окислительные [141] и восстановительные [142] внутримолекулярные радикальные реакции присоединения также возможны. илсо-Замещение толуолсульфонильной группы трибутилстаннильным радикалом легко идет по положению 2 [143] (но не 3) как внутримолекулярное радикальное замещение [144].
2-Индолил-радикалы могут быть генерированы в стандартных условиях при взаимодействии 2-броминдола с гидридом трибутилолова [145].
17.8. РЕАКЦИИ С ВОССТАНОВИТЕЛЯМИ
Циклическая система индола не восстанавливается такими нуклеофильными агентами, как алюмогидрид лития или боргидрид натрия, однако литий в жидком аммиаке восстанавливает бензольное кольцо индола с образованием 4,7-ди-гидроиндола в качестве основного продукта реакции [146]
При восстановлении литием в присутствии триметилсилилхлорида с последующей реароматизацией образуется 4-триметилсилилиндол — промежуточное соединение, используемое для получения 4-замешенных индолов за счет электрофильного «лсо-замещения кремния [147].
п-бензохинон затем МеОН
98%
Н Ас
Восстановление гетероциклического кольца легко осуществить в кислых условиях; первоначально использовали смеси металл—кислота [148], но в настоящее время такие реакции проводят в гораздо более мягких условиях с применением относительно устойчивых к кислотам гидридов металлов, таких, как цианоборгидрид натрия. Другим удобным реагентом служит триэтилсилан в трифторуксусной кислоте; таким методом получают цис-индолины из 2,3-диза-мещенных индолов [149]. Подобные процессы восстановления протекают в результате гидридной атаки 0-протонированного индола — ЗН-индолий-катио-на [150]. При каталитическом восстановлении индола, опять же в кислой среде, первоначально образуется индолин, а в дальнейшем медленное восстановление
может привести к полному насыщению [151]. Катализируемое родием и проводимое при высоком давлении гидрирование индолов, содержащих /ире/л-буто-ксикарбонильную группу при атоме азота, приводит к гладкому образованию 2,3-^с-индолинов [152].
Н2, Pd(OH)2, BaSO4
АсОН, 60 ‘С
80%
17.9. РЕАКЦИИ С КАРБЕНАМИ
Никаких циклопропансодержащих соединений не удается выделить при взаимодействии индолов с карбенами (д ля сравнения см. разд. 13.10). В реакциях с метоксикарбонилзамещенными карбенами образуются только продукты замещения [153].
17.10. ЭЛЕКТРОЦИКЛИЧЕСКИЕ И ФОТОХИМИЧЕСКИЕ РЕАКЦИИ
Двойная связь пиррольного кольца простейших индолов может принимать участие в реакциях циклоприсоединения с диполярными 4%-компонентами [154], а также с электронодефицитными диенами (т. е. в реакциях с обратными электронными требованиями); в большинстве описанных случаев такие реакции протекают внутримолекулярно [155]. Подобные свойства проявляются и в межмолекулярном циклоприсоединении 2,3-циклоалкилиндолов к о-хинону с образованием 1,4-диоксана [156]. Введение элекгроноакцепторных заместителей увеличивает тенденцию К циклоприсоединению к электроноизбыточным диенам: З-ацетил-1-фенилсульфонилиндол, например, вступает в катализируемую хлоридом алюминия реакцию циклоприсоединения с изопреном [157], а З-нитро-1-фенилсульфонилиндол реагирует с 1-ациламинобута-1,3-диенами без участия катализатора [158].
Некоторые другие явные реакции циклоприсоединения протекают, по-ви-димому, по несогласованному пути: например, присоединение циклогекса-1,2-
диена на свету и 2,4,6-трифенилпирилия, вероятно, включает образование радикальных интермедиатов [159], а реакции 2-фенилсульфонилдиенов с индолил-магнийгалогенидами, возможно, происходят так, как это показано на схеме [160]:
Как 2-, так и 3-винилиндолы легко вступают в реакции циклоприсоединения Дильса—Альдера в качестве 4л-компонентов [161]; часто, но не всегда [162], в таких реакциях используют N-арилсульфонилиндолы, в которых взаимодействие между неподеленной парой электронов атома азота и л-системой понижено [163]. На схеме, приведенной ниже, показано, как этот процесс может быть использован для легкого построения сложного пентациклического индола [164].
Присоединенные к боковой цепи 1,2,4-триазолины служат особенно полезными «диенами», так как при их взаимодействии с индольной двойной 2,3-связью образуются карболины. Связка может либо войти в состав образующейся молекулы [165], либо разрушается in situ, как показано на приведенном ниже примере [166]. 1,2,4,5-Тетразины вступают в межмолекулярную реакцию с двойной 2,3-связью индола, первоначально образующийся аддукт теряет азот, а затем окисляется до ароматического соединения вторым эквивалентом тетразина [167].
1-Винилиндол подвергается [3,3]-сигматропной перегруппировке, давая трициклическую систему эзеролиновых алкалоидов [168]
Альтернативный подход к 4-замещенным индолам основан на ррлю-амид-ной перегруппировке Кляйзена [169]
При o/wio-эфирной перегруппировке Кляйзена индол-3-илалканолов происходит введение мигрирующей группы в положение 2 индола [170]
МеС(ОМе)3
ОН 2,4,6-Ме3С6Н2СО2Н
110-4 210'0
63%
Под действием света N-метилиндолы присоединяют диметилацетиленди-карбоксилат с образованием циклобутеноаннелированных соединений [171], и даже простые алкены вступают в реакции [2 + 2]-циклоприсоединения к N-аци-линдолам, однако механизм процесса, по-видимому, включает образование радикальных интермедиатов [172]. Другие фотохимические реакции присоединения, в результате которых получаются N-бензоилиндолины, аннелированные к четырехчленным циклам, включают присоединение как к карбонильной группе бензофенона, так и к двойной связи метилакрилата [173].
17.11. АЛКИЛИНДОЛЫ
Только а-алкильные группы индола отличаются некоторой особенной реакционной способностью. В результате многочисленных наблюдений было подтверждено, что в ряду равновесных состояний p-протонирование может привести к
образованию 2-алкилидениндолинов, и, следовательно, электрофильная атака идет по а-, а не по р-алкильной группе: например, в DC1 при 100 °C в 2,3-диме-тилиндоле происходит дейтерообмен только по 2-метильной группе
Подобное явление наблюдается и в конденсации Манниха [174], и при триф-торацетилировании [175] 1,2,3-триметилиндола по а-метильной группе
Литиирование в боковую цепь идет опять же специфично по а-заместителю, при этом первоначально образуется N-литийкарбоксилат [176], и, следовательно, даже нет необходимости в N-защитной труппе [177].
Зл-ВШ затем 2KOf-Bu Et2O, О ’С
МеВг
-70 •С
60%*"
17.12. РЕАКЦИИ С-ЗАМЕЩЕННЫХ ИНДОЛЬНЫХ СОЕДИНЕНИЙ
Грамин и особенно его четвертичные соли широко используют в качестве полупродуктов различных синтезов, так как они легкодоступны, а их диметиламинотруппа легко замещается нуклеофилами — наиболее типичны реакции с цианид- [178] и ацетамидомалонат-анионами [179].
CO2Et
NaX~CO2Et
NMe2 NHAc . ..--.
PhMe, нагревание К ] V 90% J
н
CO2Et
CO2Et водн. NaOH затем, водн. H2SO4 NHAc нагревание
80%
nh2
н
со2н
Легкое замещение аминной (аммониевой) труппы происходит в результате элиминирования, включающего потерю индольного водорода; образующийся
таким образом р-алкилидениндолин затем легко присоединяет нуклеофил и снова превращается в индол. Такой механизм был подтвержден на основе следующих наблюдений: (1) очень медленного замещения в соответствующем 1-ме-тилграмине и (2) рацемизации при реакции с замещенным Грамином, в котором атом углерода, соседний с атомом азота, содержит хиральный центр [180].
Подобная последовательность превращений происходит и при восстановлении алюмогидридом лития p-индолилкарбинолов (получаемых из соответствующих кетонов с использованием мягких восстанавливающих агентов) с образованием алкилиндолов. Такой метод удобен для синтеза 3-ал кил индолов [181]. Одностадийное превращение 3-формилиндола в 3-цианометилиндол под действием смеси цианида натрия и боргидрида натрия, по-видимому, включает подобное элиминирование с последующим восстановлением циангидрина [182].
Хотя в основном галогеналкилиндолы неустойчивы и не находят практического применения, N-ацилированные производные, гораздо более устойчивые, можно получить радикальным замещением в боковой цепи и использовать в реакциях нуклеофильного замещения [183].
SO2Ph
NBS, (PhCO2)2
CCI4, кипячение
98%
Этот раздел служит подходящим местом для включения замечательного [184] и воспроизводимого [185] мягкого превращения 2-(индол-3-ил)бромэтана в циклопропилиндоленин с потерей ароматичности гетероцикла; в работе [185] показано, что литийорганические соединения можно присоединять непосредственно к иминному фрагменту циклопропилиндоленина и при этом не проис-
ходит разрушения малого цикла.
70%
17.13. ИНДОЛКАРБОНОВЫЕ КИСЛОТЫ
Как индол-3-карбоновая [186], так и индол-2-илуксусная (а-ивдолилуксусная) кислоты легко декарбоксилируются в кипящей воде. В обоих случаях происходит отщепление диоксида углерода от находящегося в небольшой концентрации p-протонированного ЗН-индолий-катиона — процесс, аналогичный декарбоксилированию р-кетокислот. Индол-1-карбоновые кислоты также очень легко декарбоксилируются, однако они достаточно устойчивы, что позволяет их выделять и использовать в реакциях ацилирования [187]. Индол-2-карбоновые кислоты подвергаются декарбоксилированию только при нагревании в минеральной кислоте или в присутствии солей меди [188].
Декарбоксилирование индолкарбоновых кислот
Трифторацетилиндолы — полезные устойчивые эквиваленты хлорангидри-дов кислот, образующие амиды или кислоты в галоформных реакциях с амидами лития или водным основанием соответственно. Реакционная способность соединений, не замещенных по атому азота, гораздо выше таковой для N-алкил-производных, что указывает на промежуточное образование кетена в реакциях первых [189].
Хорошей иллюстрацией мезомерного взаимодействия между атомом азота индола и 3-карбонильной хруппой, делающего эту карбонильную группу подобной амидной (см. также разд. 17.12), служит селективное взаимодействие ангидридов 2,3-дикарбоновых кислот с некоторыми нуклеофилами по 2-карбо-нильной группе; индуктивный электроноакцепторный эффект кольцевого атома азота также может играть свою роль в обеспечении этой селективности [190].
17.14. ГИДРОКСИИНДОЛЫ
Индолы с гидроксильными труппами в бензольном кольце ведут себя как обычные фенолы, а поведение индолов, имеющих гидроксильные труппы в любом положении гетроцикла, совершенно иное.
17.14.1. Оксиндол
2-Гидроксииндол не существует как таковой: устойчивой формой является карбонильный таутомер, а гидрокси-таутомер обнаружить не удалось. В химическом поведении оксиндола нет ничего неожиданного: это типичный пятичленный лактам, за исключением того, что депротонирование по p-положению (рЛ'а ~ 18) происходит гораздо быстрее, чем для простых амидов, так как образующийся анион стабилизирован вкладом ароматической канонической формы индола. Этот анион может реагировать с электрофилами, такими, как алкилгалогениды и альдегиды [191,192], по p-положению, причем с последними реакция идет с дегидратацией и образованием продукта альдольной конденсации. Интересно, что положение 3 в три раза более реакционноспособно, чем положение 1 [193]. Оксиндолы могут быть эффективно окислены до изатинов (разд. 17.14.3) в результате легко идущего 3,3-дибромирования с последующим гидролизом [194]. Бромирование оксиндола N-бромсукцинимидом дает 5-броминдол [193].
При взаимодействии оксиндола с реагентом Вильсмейера эффективно образуется 2-хлор-З-формилиндол [195]. Этот бифункциональный индол имеет замечательный потенциал для дальнейшей функционализации: так, например, нуклеофильное замещение атома галогена, активированного альдегидной группой в ор/ио-положении, приводит к индолам, имеющим азотсодержащие заместители в положении 2 [196].
Среди возможных процессов сочетания по положению 2 индола назовем легкое
образование 1-фенилсульфонил-2-трифлата из 1-фенилфульфонилоксиндола [197].
минорный таутомер индоксил
17.14.2. Индоксил [198]
З-Гидроксииндол, несомненно, существует преимущественно в форме карбонильного таутомера, хотя обнаружен и минорный компонент равновесия. Индоксил, величина рА^ которого составляет 10,46 [199], имеет более кислый характер, чем оксиндол, а образующийся анион амбидентен; реакции с электрофилами идут как по атому кислорода, так и по углеродному атому [200].
'леп«%2^-
-^50%
Индоксил-анион особенно легко самоокисляется, превращаясь в известный издавна краситель индиго. Механизм этого процесса, по-видимому, включает димеризацию радикалов, образующихся при отщеплении электрона от аниона.
О-Ацетилиндоксил [201] и N-ацилиндоксилы — более устойчивые соединения, причем последние подвергаются обычным для кетонов реакциям по карбонильной труппе, таким, как реакция Витгига [202].
Ас
Ph3P=CHCO2Me PhMe, нагревание 86% **
Будучи зеркальным отражением оксиндолов, индоксилы способны конденсироваться по альдольному типу по положению 2 либо при использовании ацетата их енольной формы и основного катализатора [203], либо в виде самого индоксила в кислых или основных условиях [204]. При восстановлении боргид-ридом или дегидратации этих алкилиденовых продуктов конденсации можно получить 2-замещенные индолы.
Некоторые N-защищенные индоксилы образуются в результате замыкания кольца, как показано ниже. Пероксидное окисление N-фенилсульфонил-З-борной кислоты дает N-фенилсульфонилиндоксил, который, в свою очередь, используется в катализируемых палладием реакциях сочетания [206].
gr f-BuLi
,B(OH)2
SO2Ph
П CuBr
f CHCI3, EtOAc \ нагревание Me—-----------»
“NH
PhSO2
S02Ph
Br
PhSO2
(CF3SO2)2O
.О 2,6-ди-грег-4-
—\ метилпиридин \ 0*C->20*C ?
84%
SO2Ph
17.14.3. Изатин [207]
Изатин — устойчивое ярко-оранжевое твердое вещество, получаемое в промышленности в огромных количествах. Поскольку изатин легко подвергается чисто ароматическому замещению по положению 5, легко N-алкилируется через образование аниона и вступает в реакции, свойственные кетонам по 3-карбонильной группе, например, присоединяет енолят [208]; все это делает его очень полезным полупродуктом для синтеза индолов и других гетероциклов.
Изатины можно превратить в оксиндолы при каталитическом восстановлении в кислоте [209] либо по реакции Кижнера—Вольфа [193, 210]. З-Замещен-ные индолы можно получить в результате присоединения реактива Гриньяра по кетонной карбонильной группе с последующим восстановлением алюмогидри-дом лития образующегося амида и дегидратацией [211]. Взаимодействие изатина с трифенилфосфином дает возможность легко синтезировать реагент Витгига — 3-(трифенилфосфорилиден)оксиндол [212].
17.14.4. 1-Гидроксиндол [213]
1-Гидроксиндол может быть получен в растворе, однако попытки его очистки приводят к димеризации через образование его нитронной таутомерной формы. Тем не менее его О-алкилпроизводные устойчивы и их можно легко синтезировать [214].
ОМе
M©2SO4
К2СО3
51%
1-Гидрокси- и 1-алкоксиндолы используют для различных синтетических целей: например, литиирование 1-метоксиндола идет по положению 2, и, таким образом, в это положение можно вводить различные заместители. Наиболее важное значение имеют реакции нуклеофильного замещения, идущие с перемещением заместителя из положения 1. Одна из таких реакций приведена ниже: в результате этой реакции с использованием 1-гидроксиндола в условиях кислотного катализа происходит введение гидроксильной группы в положение 5 индола [215]. При наличии метоксигруппы в положении 1 нуклеофильная атака идет по гетероциклическому кольцу, как показано на втором приведенном ниже примере [216].
При нуклеофильном киле-замещении метоксшруппы в 1-метокси-З-формил-индоле образуется продукт 2-замещения [217]
17.15. АМИНОИНДОЛЫ
2-Аминоиндол существует преимущественно в форме ЗН-таугомера, вероятно, благодаря энергетически более выгодной резонансной структуре амидинового типа. З-Аминоиндол очень неустойчив и легко самоокисляется [218], однако его ацетамид устойчив (разд. 17.1.2). 1-Аминоиндолы можно получить прямым аминированием индолил-аниона [219].
Ph2P(O)ONH2 КОН.РМР.ббЧ) 60% **
nh2
17.16. АЗАИНДОЛЫ [220]
7-азаиндол
4-азаиндол 5-азаиндол 6-азаиндол
[пирроло[3,2-Ь]пиридин] [пирроло[3,2<]пиридин] [пирроло[2,3-с] пиридин] [пирроло[2,3-р] пиридин]
рКа (как основания) 6,94
8,26
4,59
(Моно)азаиндолы (правильнее было бы называть их пирролопиридины), в которых один атом углерода в шестичленном цикле замещен атомом азота, представляют теоретический интерес в качестве прототипов бициклических систем, в которых электроноизбыточный цикл аннелирован с электронодефицитным. Подобные простейшие системы не встречаются в природе, однако полициклические соединения, такие, как вариолины, были выделены из губок. Простейшие азаиндолы выделяют из каменноугольной смолы или получают окислительным разложением карболиновых алкалоидов. Они представляют значительный интерес для медицинской химии как изостеры индолов, особенно в качестве азатриптаминовых аналогов и даже как дидезазапурины.
₽-карболин
Азаиндолы проявляют реакционную способность, типичную для обоих компонентов системы, но в меньшей и несколько видоизмененной степени: с более низкой электронной плотностью в пятичленном цикле и с повышенной электронной плотностью в шестичленном.
Разница в значениях рА^ для протонированных по пиридиновому атому азота всех четырех родственных систем демонстрирует степень «пуш-пул»-взаимодейст-вия между двумя циклами. Например, разница в значениях рА^ 5- и 7-азаиндолов подобна (но более ярко выражена) разнице в величинах рА^ 4-аминопирицина (9,1) и 2-аминопиридина (7,2) соответственно, что частично объясняется более предпочтительным у-взаимодействием между донорной и акцепторной группами в 5-изомере. Эти отличия в еще большей степени проявляются в слабокислых растворах, таких, как растворы, используемые в реакции Манниха, где 5-азаиндол присутствует преимущественно в протонированном виде, тогда как 7-азаиндол — главным образом в виде свободного основания.
17.16.1. Реакции электрофильного замещения
Реакции с электрофильными реагентами проходят по положению 3 либо происходит присоединение к пиридиновому атому азота. Все азаиндолы гораздо более устойчивы по отношению к кислотам, чем индол (см. для сравнения разд. 17.1.1), что, без сомнения, обусловлено перемещением центра протонирования на пиридиновый атом азота, однако реакционная способность в отношении электрофильной атаки по положению 3 лишь немного ниже таковой для индолов. Бромирование и нитрование проходят чисто д ля всех четырех родственных систем [221] и более контролируемы, чем в случае индола. Реакции Манниха и Вильсмейера удается осуществить в некоторых случаях, однако если реакцию Вильсмейера провести не удается, 3-альдегид может быть получен при взаимодействии с гексамином (по-видимому, процесс идет через образование аниона азаиндола). Алкилирование в нейтральных условиях приводит к кватернизации пиридинового атома азота, а реакция с натриевыми солями дает М^-алкильные производные. Ацилирование в мягких условиях также идет по положению N(j). Приведенная ниже схема суммирует эти реакции для наиболее хорошо изученного 7-азаиндола:
Mel, 20 *С 100%
17.16.2. Реакции нуклеофильного замещения
Существует всего несколько примеров нуклеофильного замещения — замещение атомов галогенов, находящихся в а- и у-положениях по отношению к пиридиновому атому азота, которое требует либо жестких условий, либо продолжительного времени реакции. О замещении по реакции Чичибабина в литературе не сообщается. При взаимодействии 4-хлор-7-азаиндола со вторичными аминами происходит обычное замещение атома галогена, однако при реакции с первичным амином в результате перегруппировки образуется 5-азаиндол, как показано на приведенной ниже схеме [222]:
По имеющимся сведениям, реакционную способность 4-хлор-1-метил-5-азаиндола в отношении нуклеофильного замещения хлора на пиперидин [223] можно сравнить с таковой для некоторых родственных систем: для вышеупомянутого соединения она значительно меньше, чем для большинства близких бициклических систем, благодаря повышенной электронной плотности в шестичленном цикле, обусловленной донорным влиянием атома азота N(i).
Относительные скорости нуклеофильного замещения в реакции с пиперидином в Me(CH2hOH при 100 "С [224]
1-Фенилсульфонил-7-азаиндол литиируется по положению 2 диизопропил-амидом лития, литиирование азаиндола проходит по обычной схеме. Ниже приведены образование станнана и его последующее сочетание [225]:
17.17. СИНТЕЗЫ ИНДОЛОВ
17.17.1. Синтезы кольца
Индолы обычно получают из негетероциклических предшественников циклизацией подходящих замещенных производных бензола; кроме того, их можно получить из пирролов в результате построения гомоциклического ароматического кольца и дегидрированием индолинов.
Благодаря значению индолов в синтезе природных соединений и фармацевтической промышленности постоянно идет поиск новых путей получения индолов и совершенствования старых методов, которых появилось очень много со времени последнего издания этой книги. В этом разделе обсуждаются наиболее важные известные на сегодняшний день методы, наиболее часто применяемые и адаптированные [226].
17.17.1.1. Из фенилгидразонов альдегидов и кетонов
До сих пор наиболее широко используемый способ получения индолов — синтез Фишера, основанный на нагревании арилгидразонов, чаще всего с кислотой, но иногда реакцию проводят в инертном растворителе, в результате чего отщепляется аммиак и образуется индол
Синтез Фишера
Синтез Фишера [227], впервые открытый в 1883 г., заключается в катализируемой протонной кислотой или кислотой Льюиса перегруппировке фенилгидра-зона, сопровождающейся элиминированием аммиака. Получение 2-фенилин-дола иллюстрирует ход процесса в его простейшем виде [228]:
+ nh3
Во многих случаях реакцию можно осуществить простым нагреванием смеси альдегида или кетона с фенилгидразином в уксусной кислоте [229]; образование фенилгидразона и его дальнейшая перегруппировка не требуют выделения фенилгидразона. Толуолсульфокислота, катионообменные смолы и трихлорид фосфора также могут быть использованы в качестве эффективных катализаторов циклизации, которые позволяют проводить реакции при комнатной температуре [230]. Под влиянием электронодонорных заместителей в бензольном кольце скорость реакции Фишера увеличивается, тогда как электроноакцепторные заместители замедляют процесс [231], хотя даже фенилгидразоны, имеющие нитрогруппы, могут быть успешно превращены в индолы при подходящем выборе кислоты и условий, например двухфазная смесь толуола и фосфорной кислоты [232] или трифторид бора в уксусной кислоте [233]. При наличии электроноакцепторных заместителей в мета-положении к атому азота образуются примерно в равном соотношении 4- и 6-замещенные индолы; наличие электро-нодонорных заместителей, ориентированных подобным образом, позволяет получать главным образом 6-замещенные индолы [165].
Детальный механизм многоступечатой реакции Фишера до сих пор полностью не установлен, хотя существуют убедительные доказательства в пользу последовательности, приведенной ниже. Так, например, изучение процесса с помощью введения меченых атомов доказывает отщепление р-атома азота в виде аммиака, а в некоторых случаях строение промежуточных соединений было определено с использованием спектроскопии 13С-ЯМР и 15Ы-ЯМР [234]. Самая важная стадия процесса—образование углерод-углеродной связи — имеет элек-троциклический характер и аналогична кляйзеновской перегруппировке фенилаллиловых эфиров.
Подтверждением такой последовательности превращений также может служить то обстоятельство, что во многих случаях процесс индолизации может происходить термически при температуре ниже 100 °C, особенно в случаях, когда первоначально образуются енгидразины, т. е. отпадает необходимость в первой стадии — кислотно-катализируемой изомеризации в енамин [235]. Тем не менее присутствие кислоты ускоряет реакцию, и это объясняется тем, что протонирование р-атома азота, как показано, облегчает электроциклизацию.
Me Ме
74%
110*С, декалин или
CF3CO2H, 20 *С
Ме
+ MeNH2
Циклизацию Фишера можно проводить термически, но обычно требуются гораздо более высокие температуры, и в процесс может быть включен перенос протона от растворителя (часто гликоля). Однако, если использовать первоначально образованные N-трифторацетиленгидразины, термическую циклизацию можно осуществить при температуре порядка 65 °C [236]. Как показано на примере, приведенном ниже, в случае участия в реакции производных циклопентанонов промежуточно образующийся 2-аминоиндолин удается выделить при низких температурах; последующее отщепление трифторацетамида происходит легко и эффективно.
В качестве экстремального случая кислотно-катализируемой индолизации можно привести циклизацию фенилгидразонов 0-дикарбонильных соединений в концентрированной серной кислоте [237], в более слабых кислотах при взаимодействии p-кетоэфиров с гидразинами образуются только пиразолоны (разд.
22.13.1.1).
КОНЦ. H2SO4
♦5 *С
58%
Один из аспектов реакции Фишера, имеющий большое практическое значение, заключается в соотношении двух возможных индолов, образующихся при использовании несимметричных кетонов; во многих случаях получаются смеси, так как в реакции образуются оба возможных енгидразина. Очевидно, что в сильнокислых условиях предпочтительно образование наименее замещенного енгидразина [238].
АсОН 100: о
РРД ЧП • ЧП
MeSOgH, Р4О10 22:78
Из фенилгидразонов разветвленных кетонов легко образуются индоленины (ЗН-индолы); опять же следует заметить, что при проведении реакции в более слабокислой среде происходит образование более замещенного енгидразина, необходимого для получения индоленина [239]. В другом примере добавление ацетата натрия к усусной кислоте, в которой проводится реакция, способствует получению индоленина из фенилгвдразона 1-декалона [240].
Важным дополнением к синтезу Фишера может служить получение арилгид-разинов палладий-катализируемым сочетанием гидразина бензофенона с арил-галогенидами — этот способ позволяет получать более широкий кругарилгидра-зинов, чем классический метод, заключающийся в восстановлении солей арил-диазония. Арилгидразон бензофенона можно прогидролизовать до гидразина, однако даже удобнее вводить его напрямую в циклизацию Фишера с использованием обмена с кетоном. В целом весь процесс, начиная от арилгалогенида и кончая получением индола, проводится в одной колбе без выделения промежуточных соединений [241].
н
Другой путь синтеза арилгидразинов—электрофильное аминирование электроноизбыточных аренов азодикарбоксилатом [15].
В трансформациях, которые по своему механизму аналогичны реакции Фишера и также приводят к индолам, используются фенилгидроксиламины вместо фенилгидразинов, как показано ниже [242]:
СО2Вп
HOCC02Et
<-Pr2NEt, MeNO2, 20‘С 89%
CO2Bn
CO2Bn
Синтез Грандберга
Исключительно полезен синтез Грандберга, который позволяет получать триптамины из 4-галогенобутаналей или из наиболее часто используемых на практике ацеталей [243]. В этом методе атом азота, который обычно отщепляется в виде аммиака в ходе реакции Фишера, входит в состав аминоэтильной боковой цепи образующегося триптамина [244].
17.17.1.2. Из о-(2-оксоапкил)анилинов
Циклизация о-(2-оксоалкил)анилинов происходит самопроизвольно в результате внутримолекулярной конденсации с отщеплением воды. Разработано несколько новых путей генерирования таких аминокетонов — полупродуктов д ля данных реакций; прототипом служит синтез Рейсерта
Синтез Рейсерта
В классическом синтезе Рейсерта используется кислотность метильной группы, находящейся в ор/ло-положении к нитрогруппе бензольного кольца, которая
позволяет ей конденсироваться с оксалатом; затем нитрогруппу восстанавливают в аминогруппу [245].
В модифицированном синтезе Рейсерта атом азота находится уже в степени окисления анилина, но защищен мрели-бутоксикарбонильной группой, что способствует литиированию метильной (алкильной) труппы; последующая классическая реакция с оксалатом и, наконец, удаление N-защитной группы с помощью кислоты приводят опять же к образованию эфира индол-2-карбоно-вой кислоты [246]. Получить 2-незамещенные индолы можно при взаимодействии Ы,С-дилитиированных соединений с диметилформамидом [247].
N
Н
Вос
Вос
TFA . „____,
CO2Et СН2С12,20’С PhS-\ Ц \
64% (3 стадии)
CO2Et
В другом варианте синтеза Рейсерта ароматические нитросоединения конденсируют [248] с эфирами силиленолов с использованием (триметилси-лил)дифторидатрис(диметиламино)сульфония (TASF); затем неароматический нитронатный интермедиат окисляется бромом и без выделения превращается в 2-(о-нитроарил)кетон с последующим образованием индола после восстановления нитрогруппы [249].
NO2 OTf
79%
TASF, MeCN
| -78’С
,0 затем Br2,-78
b DIBALH H2, Pd/C . .
PhMe, -30 'Cr EtOH, EtOAc у Ц \ 98%
Синтез Леймгрубера-Бачо
Синтез Леймтрубера—Бачо [250] — один из наиболее широко используемых современных вариантов метода, который также основан на кислотности метильных групп в рртло-положении по отношению к ароматической нитрогруппе (или в а-, или у-положсниях в пиридине [251]), в результате чего удается ввести в будущую молекулу индола а-углеродный атом в виде енамина. Конденсация с горячим диметилацеталем диметилформамида (DMFDMA) (нет необходимости в добавлении основания) приводит к енамину, а последующее восстановление нитрогруппы, обычно проводимое в кислых средах, позволяет напрямую получать индолы, не замещенные в пятичленном цикле. Механизм этого на первый взгляд необычного процесса включает, по-видимому, ионизацию реагента на метоксид (который депротонирует ароматический метил) и электрофильный компонент МеОСН=Ы+Ме2, который соединяется с депротонированным аро-
матическим фрагментом. Было показано [252], что и трис(пиперцдин-1-ил)ме-тан и бис(диметиламино)-шреш-бугоксиметан действуют даже лучше, чем коммерчески доступный DMFDMA. Возможно использование различных замещенных производных бензола; таким образом можно синтезировать, например, эфиры индол-4- и индол-7-карбоновых кислот [253].
[ОМе.
[ Me2N=CHOMe
DMFDMA
DMF, нагревание
При восстановлении продуктов катализируемой основаниями конденсации производных о-нитробензальдегидов с нитрометаном промежуточно образуется амино-енаминное соединение, аналогичное используемому в синтезе Леймгру-бера—Бачо [254]. Для восстановления с образованием индолов традиционно используют металлы в кислотах, а также более современные реагенты, такие, как палладий на угле с формиатом аммония и муравьиной кислотой [255], железо с уксусной кислотой и силикагелем [256] или хлорид титана(Ш) [257]. Предшественники арилацетальдегида также можно генерировать по реакции Хека из винилиденкарбоната [258].
н
ch3no2 водн. КОН, EtOH
99% *
Fe, АсОН EtOH 75%
Широко используются реакции сочетания о-галогенанилинов; в этих случаях нет необходимости в стадии восстановления, хотя карбонильная компонента иногда находится в скрытой форме, как, например, в 2-этоксивинилкарбонате, что требует удаления защитной группы [259].
17.17.1.3. Из о-апкинилариламинов
Циклизацию о-алкиниланилинов можно осуществить различными методами; исходные алкиниланилины получают палладий-катализируемыми реакциями сочетания
Метод катализируемых палладием сочетаний в настоящее время позволяет легко получать арены с алкинильными заместителями в o/wzo-положении к атому азота из о-иод- и о-бромнитробензолов [260], из о-иод- и о-бром-М-ацил (или N-сульфонил) арил аминов [261] или даже сочетанием ацетиленов с самим о-иоданилином [262]. Превращение о-алкинилнитробензолов или алкиниларил-аминов в индолы можно осуществить различными способами. Первые реагируют с алкоксидами с присоединением по тройной связи и образованием нитроацеталей, а последующее восстановление нитрогруппы и гидролиз ацеталя приводят к циклизации. Прямая циклизация о-алкиниланилинов происходит просто при обработке фторидом тетрабутиламмония [263]. Альтернативно могут быть использованы соли палладия или меди: в первом случае палладийоргани-ческий интермедиат можно либо подвергнуть протолизу, либо удалить путем введения на его место подходящего заместителя в р-положенис индола [264].
Н2, Pd/C
PdCI2, CuCI2 СО, МеОН К2СОЭ
—
В катализируемых палладием циклизациях о-галогенанилинов можно также использовать дизамещенные ацетилены; при этом большая по размеру группа (или гидроксилсодержащая группа) оказывается в положении 2 индола [265].
nh2
MeCsCSiMe3, Pd(OAc)2 (кат.) • 4 Ph3P, Na2CO3, BiuNCI
DMF, 100 'C___________
98%
17.17.1.4. Из о-толуидинов
При циклоконденсации о-алкиланимидов, катализируемой основаниями, образуется индол
Синтез Маделунга
В своем первоначальном виде этот метод требовал применения очень жестких условий (обычно [266] амид натрия или /яре/п-бутоксид калия при 250—350 °C) основного катализа внутримолекулярной конденсации дезактиви-
рованной ароматической метильной труппы и оряю-ациламиногруппы, и, следовательно, метод был ограничен применением соединений, не содержащих других чувствительных заместителей. С появлением широко распространенного в настоящее время использования алкиллитиевых производных в качестве оснований эту циклоковденсацию удается проводить в гораздо более мягких условиях [267].
Модификации метода, в которых увеличивается кислотность бензильных атомов водорода, также позволяет использовать мягкие условия; одним из примеров может служить генерирование илида фосфония с последующей внутримолекулярной реакцией, подобной реакции Виттига [268], в другом варианте используется бензилсилан [269]. Применение аминосилана приводит к тому, что реакция идет одновременно и по атому азота, и по бензильному углероду [270].
, 2,2 n-BuLi СНз гексан, нагревание
‘NH SiM@3
Наконец, к этой категории методов следует отнести циклизации бензильных анионов, полученных из о-изоцианотолуолов; на приведенной ниже схеме показан простейший синтез такого рода. Этот метод синтеза очень гибкий: например, первоначальный бензильный анион, прежде чем произойдет циклизация, может быть проалкилирован галогенидами или эпоксидами, что приводит к образованию 3-замещенных индолов; кроме того, конечный N-литийиндол может быть проалкилирован по атому азота при добавлении подходящего электрофила до окончания процесса [271].
2LDA, диглим
-78‘С-*20 43
100%
Н2О
17.17.1.5. Из а-ариламинокарбонильных соединений
а-Ариламинокетон циклизуется за счет электрофильной атаки по ароматическому кольцу
Синтез Бишлера
Первоначально этот метод представлял собой обработку кислотой в жестких условия а-ариламинокетонов (получаемых из 2-галогенокетонов и ариламина) для осуществления электрофильной атаки по ароматическому кольцу, но в этих условиях часто получалась смесь продуктов реакции в результате перегруппировок [272]. В настоящее время известно, что N-ацилированные а-ариламиноке-тоны могут циклизоваться в гораздо более мягких условиях и в противоположность более ранним работам таким методом можно получать даже незамещенные в пятичленном цикле ивдолы [273].
РРА, 120 *С затем водн. КОН
64%
COCF3
17.17.1.6. Синтез из пирролов (см. также разд. 13.9)
Несколько различных подходов используется для аннелирования бензольного кольца к молекуле пиррола для получения индола [274]; наиболее исследованный путь заключается в использовании пиррола, содержащего в а-положении четырехуглеродную боковую цепь, которая способна электрофильно атаковать р-положение пиррола; одна из таких реакций приведена ниже [275]. Другой путь включает электроциклизацию 2,3-дивинилпирролов [276].
17.17.1.7. Из орто-замещенных нитроаренов
Синтез Бартоли
3CH2=CHMgBr
THF, -40 *С
62% **
В необычном, но тем не менее эффективном и чрезвычайно простом методе, известном как синтез Бартоли, opmo-замещенные нитробензолы обрабатывают 3 мольными эквивалентами винилмагнийбромида и получают 7-замещенные индолы. Метод тем эффективнее, чем больше заместитель в положении 7 [277]; предположительно первоначальная атака винилмагнийбромида идет по атому кислорода нитрогруппы с последующим отщеплением енолята магния и образованием нитрозоэквивалента исходного соединения, — по-видимому, этому способствует непланарное взаимное расположение нитротруппы и ароматической системы под действием большого по объему opmo-заместителя. Затем вторая молекула реагента Гриньяра вновь присоединяется по атому кислорода с образованием интермедиата, который подвергается [3.3]-сигматропной перегруппировке, очень похожей на ту, которая происходит в реакции Фишера, и, наконец, замыкается гетероцикл. [278].
17.17.1. 8. Из N-ариленаминов
До сих пор не ясно, каким образом происходит циклизация анилиноакрилатов и родственных систем [279] в присутствии палладия: по механизму реакции Хека или в результате электрофильного палладирования енамина.
Pd(OAc)2 (кат.) Ph3P,NaHCO3 DMF
36%
Подобную катализируемую палладем циклизацию можно использовать для получения карбазолов или карболинов (показано ниже) из моно- или дигало-генодиариламинов [280]. Исходные соединения также легко синтезируются с применением палладий-катализируемых реакций.
Pd2(dba)3, dppf NaOf-Bu, PhMe, 100’С
96% *
Pd(OAc)2 (кат.) Na2CO3, DMF, кипячение
70% *
Важным усовершенствованием метода служит взаимодействие простых а-метиленкетонов (гораздо лучше работают циклические кетоны, чем ациклические) с о-иодариламинами в условиях палладиевого катализа, позволяющее напрямую получать индолы. Проведение реакции в растворе диметилформами-да с диазобициклоокганом (DABCO) в качестве основания делает этот метод еще более успешным. Если говорить о механизме, то процесс определенно идет через образование енамина. Этот понятный и простой в исполнении метод можно использовать для синтеза индолов с функциональными группами, чувствительными к кислоте, в традиционном синтезе Фишера [281].
а1
nh2
Pd(OAc)2 (кат.), DABCO DMF, 105 'С_______
55%
17.17.1. 9. Из N-аллил-о-галогенариламинов
N-Аллил-о-галогенариламины циклизуются в различных условиях, давая как индолы, так и индолины; последние могут быть превращены в индолы дегидрированием или отщеплением галогеноводорода от подходящего промежуточного соединения [282]. Внутримолекулярная реакция Хека приводит к индолам напрямую в результате миграции первоначально образующейся экзоциклической двойной связи в гетероцикл и экзо-изомер можно выделить, если к реакционной смеси добавить соли серебра [283].
Pd(OAc)2 (кат.)
Et3N, DMF 96% **
Ариллитиевые производные, получаемые из Ы,Ы-диаллилариламинов с атомом галогена в ор/ио-положении в результате обмена с алкиллитием, циклизуются за счет присоединения к двойной связи аллильной группы, давая первоначально алкиллитиевое производное, которое при взаимодействии с электрофилом может дать индолины [284].
17.17.1.1 0. Из енаминов и л-хинонов
Синтез Неницеску
Синтез Неницеску [285] — еще один пример процесса, детальный механизм которого остается невыясненным [286], однако этот метод используют для эффективного получения некоторых 5-гидроксииндолов [287].
17.17.1.1 1. Из ариламинов
Синтез Гзссмана
Синтез Гассмана [288] позволяет получать индолы с серосодержащими заместителями, которые в случае необходимости легко подвергаются гидрогенолизу.
17.17.1.1 2. Из о-ациланилидов
Синтез Фюрштнера [289]
Этот гибкий метод основан на восстановительной циклизации о-ациланилидов в присутствии низковалентного титана — в условиях, используемых для реакции МакМюррея сочетания кетонов. В примере, приведенном ниже, исходное соединение для циклизации получают ацилированием триметилстаннилтиазола [290].
17.17.1.1 3. Из о-изоцианостиролов
Синтез Фукуяма [291 ]
о-Изоцианостиролы, легко получаемые дегидратацей соответствующих формамидов, в присутствии оловоорганических соединений подвергаются радикальной циклизации с образованием нестабильных 2-станнилиндолов; последние можно либо гидролизовать до соответствующих 2-незамещенных индолов, либо использовать без выделения д ля сочетания с арилгалогенидами, катализируемого нульвалентным палладием, как показано ниже [292].
СО2Ме
n-Bu3SnH, AIBN
MeCN, 100’С
17.17.1.1 4. Из о-хлорацетилариламинов
Синтез Сугусава
Ариламины, не имеющие защитной группы на атоме азота, ацилируются по реакции Фриделя—Крафтса селективно в ор/ло-положение к атому азота при использовании нитрилов и трифторида бора. Так, в реакции с хлорацетонитрилом образуются (о-хлорацетил)ариламины, которые после восстановления кетогруппы до степени окисления спирта циклизуются, давая индолы [293].
cich2cn
ВС13, AiCh кипячение
63%
№ВН4 диоксан, Н2О кипячение
64%
17.17.1.1 5. Циклизацией нитренов
При термолизе о-азидостиролов образуются нитрены, которые, присоединяясь к боковой цепи, дают индолы [294]. Простейшие нитрены генерируют реакцией нитросоединений с триалкилфосфитами. Метод термолиза азидов применяется для получения 2-нитроиндолов, которые недоступны другими методами [295].
NaN3 xj^X^CHO CH3NO3, КОН АсгО
НМРА, 20у II EtOH,0‘С ж пиридин, ОХ |
92% 81%
Кроме того, индолы также можно получить термолизом p-азидостиролов, но в этой реакции возможно промежуточное образование азирина [296]. Этот метод применим для аннелирования пиррольного кольца к другим, отличным от бензольного циклам, как показано ниже [297]:
/S\^CHO N3CH2CO2Et \\ // NaOEt r ' 55%
КСИЛОЛ, кипячение
91%
17.17.1.1 6. Циклизации аринов
Индолы можно синтезировать путем внутримолекулярного присоединения иминатов [298] или виниллитйя [299] к аринам. В последнем случае взаимодействие промежуточно образующегося ариллитиевого интермедиата с электрофилами приводит к получению 4-замещенных индолов
17.17.1.1 7. Из о-нитростиролов
о-Нитростиролы легко получить различными методами: (1) реакцией (о-бром-метил)нитроарена с фосфином и последующей конденсацией с альдегидом по реакции Витгига; (2) реакцией Виттига с использованием (о-нитро)арилальде-гида в качестве карбонильной компоненты; (3) катализируемой основаниями конденсацией метильной группы, находящейся в орлио-положении к ароматической нитрогруппе, с альдегидом и (4) ор/ио-нитровинилированием стирола. В катализируемом палладием процессе, механизм которого остается невыясненным, очень эффективная циклизация с образованием индолов происходит в одной колбе, но очевидно, что не в одну стадию [300].
Вг
Pd(OAc)2, СО (4 атм), Ph 3Р
Et3N, DMF, МеОН, 60 ’С
63%
17.17.1.1 8. Изиндолинов
Индолины служат полезными полупродуктами для синтеза индолов, замещенных в карбоцикле. В реакциях электрофильного замещения они ведут себя как
анилины; на приведенном ниже примере показана региоселективность 7-талли-рования N-ацетилиндолина. Индолины можно легко получить восстановлением индолов (см. разд. 17.8), и они легко окисляются вновь до индолов, например, с помощью кислорода в присутствии кобальтового катализатора (салкоми-на) [301], гипохлорита в диметилсульфиде [302], соединений Мп(Ш) [303] и Au(III) [304].
TI(O2CCF3)3 затем KI
водн. NaOH затем О2, МеОН салкомин
Представляют интерес исследования некоторых продуктов обратимого присоединения к ЗН-индолий-катионам, таких, как бисульфитный аддукт индола (разд. 17.1.1), или таких, в которых возможно внутримолекулярное нуклеофильное замещение: подобные соединения хотя и являются индолинами, но обладают степенью окисления индолов и требуют лишь слабокислой обработки для восстановления ароматичности системы [305].
CI
H2SO4
89%
СО2Ме
•”Н
NHCO2Me
Методы, основанные на катализируемых рутением конденсациях арил-аминов со спиртами, могут оказаться полезными для синтеза большого числа производных индола. Механизм реакции включает гидридный перенос с образованием альдольных интермедиатов. Процесс может быть проведен внутримолекулярно, как показано на приведенной ниже схеме [306], или межмолекулярно, например при взаимодействии анилина с триэтаноламином [307].
ci ci
Ме (НСНО)П,тритон В Zn, СаС12 ci2Ru(PPh3)3 (кат.)
DMSO, 90 'С EtOH, кипячение | PhMe, кипячение
NO2 41% W4h2 92%
17.17.2. Синтезы оксиндолов
Чаще всего это простые и прямые синтезы, в которых на стадии циклизации используют внутримолекулярное алкилирование по реакции Фриделя-Крафтса [308]. Также напрямую происходит замещение малонатом атома галогена в о-галогенонитроаренах: этим способом оксиндол получают после декарбоксилирования и восстановления нитрогруппы с самопроизвольной лактамизацией [193].
Менее общепринятый метод синтеза оксиндолов заключается во внутримо-
лекулярном введении родиевого карбеноида в соседнюю ароматическую связь
Оксиндолы также можно синтезировать катализируемой палладием конденсацией о-галогенанилидов с енолятами [310]
Pd(dba)2 (кат.) BINAP, NaOf-Bu диоксан, 100 *С 82%
17.17.3. Синтезы индоксилов
Индоксилы обычно получают из антраниловых кислот путем их алкилирования галогенуксусной кислотой с последующей циклизацией по реакции Перкина [311]. Также возможно прямое хлорацилирование анилина в ор/ло-положение к атому азота [312].
17.17.4. Синтез изатинов
Изатины легко синтезировать при взаимодействии анилина с хлоралем, образующееся соединение превращается в оксим и циклизуется в присутствии сильной кислоты [313].
водн. С1зССН=О затем H2NOH
85%
NH2
17.17.5. Синтезы 1-гидроксиндолов
При окислении индоленинов в присутствии вольфрамата натрия и пероксида водорода происходят одновременно и ароматизация, и окисление атома азота с образованием 1-гидроксиндолов [106]. 1-Гидроксиндолы также можно получить частичным восстановлением нитрогруппы нитроенаминных интермедиатов, образующихся в реакции Леймгрубера—Бачо (разд. 17.17.1.2), в присутствии цинка с последующей циклизацией [314].
Na2WO4, водн. Н2О2
20 'С
17.17.6. Примеры синтезов некоторых важных производных индола
17.17.6.1. Ондансетрон
Ондансетрон — селективный антагонист 5-гидрокситриптамина — применяется в качестве лекарственного препарата для предотвращения рвоты при химио-
17.17.6.2. Стауроспорин агликон [315]
Стауроспорин и родственные ему соединения активно исследуются как потенциальные противоопухолевые средства. В синтезе этого соединения нашли отражение различные аспекты химии гетероциклов: здесь и 2-пирон, выступающий в роли диена во внутримолекулярной реакции Дильса—Альдера, и использование изонитрила для формирования пятичленного азотсодержащего цикла.
17.17.6.3. Серотонин
Существуют различные способы синтеза серотонина. Метод, приведенный ниже на схеме [316], основан на использовании метода Фишера: необходимый фенилгидразон получают по реакции Яппа—Клингемана, в которой енол 1,3-дикарбонильного соединения взаимодействует с солью арилдиазония с последующим расщеплением 1,3-дикарбонильного фрагмента.
17.17.6.4. Хуангксинмицин [317]
В этом синтезе в качестве исходного соединения используют пиррол: промежуточно образующийся циклический кетон — вообще говоря, полезный полупродукт для получения 4-замещенных индолов, — в данном случае имеет серосодержащий заместитель и уже находится в степени окисления ароматического соединения, достаточно лишь удалить 4-хлорфениттиол.
о
SQaPh SOgPh SOsPh плюс изомер SQjPh
17.17.7. Синтезы азаиндолов (см. также разд. 5.5.1)
В большинстве случаев в синтезах азаиндолов в качестве исходных соединений используют пиридин, а сами реакции аналогичны таковым для получения индолов, которые уже обсуждались выше. Однако реакция Фишера для пиридилгид-разонов гораздо менее удобна и полезна, чем в случае фенилгидразонов; не находит широкого применения и реакция Маделунга. Наиболее успешные методы — катализируемые палладием реакции сочетания ацетиленов с аминога-логенопиридинами в виде одно- [318] или двухстадийного [319] процесса. Исходные аминогалогенопиридины обычно получают с использованием прямого металлирования.
Синтезы на основе нитропиридинов по реакции Леймгрубера— Бачо достаточно эффективны [320], однако ограничены доступностью исходных нитропиридинов — на схеме, приведенной ниже, показан синтез предшественника, необходимого для осуществления циклизации с использованием процесса вика-риозного нуклеофильного замещения [321] (см. разд. 2.3.3).
4-CI-C6H4OCH2CN
KOFBu, THF,-10 “С
ю2 83%
ch2cn
no2
Н2, Pd/C
EtOH, 20‘С, 1 атм_____
81% 5
МеО. м
(CH2)4N4 \ .ОНО
водн. АсОН / л—*
кипячение^ \\ МеНО2, NH4OAc^ NaBH4
51% 52%
Н
Н2> дс2о
64% ‘ ’
В отдельных случаях в качестве исходных соединений используют пирролы [320, 322].
Упражнения
Упражнения для проверки усвоения материала гл. 16 и 17
(а) Какова величина рЛ'а индола как основания и по какому положению происходит протонирование? Какова величина рЛ'а индола как кислоты?
(б) По какому положению индола электрофильное замещение идет быстрее всего? Приведите два примера.
(в) Каково строение промежуточных и конечных продуктов в следующей последовательности взаимодействий: индол с (СОС1)2 -> CioHi2C1N02, затем это соединение с аммиаком -» Ci0H8N2O2, затем LiAlH4 -> C10Hi2N2? Объясните механизм последнего превращения.
(г) Как можно из индола получить следующие соединения: (1) З-формилиндол; (2) 3-(2-нитрометил)индол; (3) 3-диметиламинометилиндол; (4) 1-метилин-дол?
(д) По какому положению идет депротонирование индола сильным основанием? Назовите две группы, которые можно использовать для защиты положения 1 при таком депротонировании и которые могут быть впоследствии удалены. Каким образом эти защитные группы могут быть введены к атому азота индола?
(е) Каков механизм превращения 3-диметиламинометилиндола в 3-цианометилин-дол при взаимодействии с NaCN?
(ж) Какие фенилгидразоны необходимы для проведения синтеза следующих индолов по реакции Фишера: (1) 3-метилиндола; (2) 1,2,3,4-тетрагидрокарбазола; (3) З-этил-2-метилиндола; (4) З-этил-2-фенилиндола?
(з) Как можно получить 2-фенилиндол из 2-броманилина (более чем в одну стадию)?
(и) Почему выгодно использовать индолин (2,3-дигидроиндол) для синтеза индолов?
Упражнения повышенной сложности
1. Индол вступает в реакцию со смесью Т4-метил-2-пиперидона и РОС13 с последующей обработкой NaOH, давая соединение с брутто-формулой Ci4Hi8N2O. Каково его строение?
2. Предложите структуру тетрациклического соединения с брутто-формулой Ci8Hi9NO, образующегося при обработке 3-метилиндола 2-гидрокси-3,5-диме-тилбензилхлоридом.
3. Если индольный димер (разд. 17.1.9) подвергнуть кислотной обработке в присутствии индола, образуется «тример индола» — C24H2iN3. Предложите структуру этого «тримера» (подсказка: рассмотрите, какой из двух реагентов легче протони-руется и по какому атому).
4. Как, исходя из индола и используя общий интермедиат, можно получить следующие соединения: (а) 3-индолилуксусную кислоту и (б) триптамин?
5. Что образуется при взаимодействии 5-бром-3-иод-1-фенилсульфонилиндола (а) с РЬВ(ОН)2/Р(3(РРЬз)4/водн. Na2CO3 и (б) с этилакрилатом/Рс!(ОАс)2/Р11зР/ Et3N?
6. Предложите механизм реакции и структуру образующегося из 2-формилиндола трициклического соединения с брутто-формулой CnH9N при обработке NaH и Ph3P+CH=CH2Br-.
7. При обработке З-этил-З-метил-ЗН-индола кислотой образуются два продукта, каждый из которых изомерен исходному соединению. Предложите структуры и объясните образование этих двух соединений.
8. Предложите структуру соли С^НнКг+Вг*, образующейся в следующей последовательности превращений: 2-(2-пиридил)индол реагирует сначала с я-BuLi, затем с PhSO2Cl (-> C19H14N2O2S), затем это соединение последовательно взаимодействуете /лдети-BuLi при—100 °C, а затем с этиленоксидом (-» C21H18N2O3S), водн. NaOH (-> C15H14N2O) и, наконец, с РВгз.
9. Какие соединения образуются в следующей последовательности взаимодействий: индол/н-BuLi, затем 12, затем PhSO2Cl -> C14H10INO2S, затем это соединение реагирует с диизопропиламидом лития, затем с I2 -» Q4H9I2NO2S?
10. При нагревании индол-З-ил-СНгОН с кислотой образуется ди(индол-3-ил)ме-тан. Каков механизм этого превращения?
11. Каково строение соединения с брутто-формулой СюНцТЧО, образующегося при кипячении смеси фенилгидразина и 2,3-дигидрофурана в уксусной кислоте?
12. Нарисуйте структуры азаиндолов, образующихся при обработке 2-метил-З-нит-ро- и 4-метил-З-нитропиридинов соответственно (EtO2C)2/EtONa, а затем H2/Pd-C. Оба соединения имеют одинаковые брутто-формулы CwHwWb.
13. Нагревание диметилацеталя диметилформамида с перечисленными ниже ароматическими соединениями приводит к образованию продуктов конденсации, а последующее взаимодействие с указанным реагентом дает индолы. Нарисуйте структуры соединений — продуктов конденсации и индолов: (а) 2,6-динитротолуол, затем Т1С1з -» C8H8N2; (б) 2-бензилокси-6-нитротолуол, затем H2/Pt -> -*» C15H13NO; (в) 4-метокси-2-нитротолуол, затем Нг/Pd -» C9H9NO; (г) 2,3-ди-нитро-1,4-диметилбензол, затем H2/Pd -» CI0H8N2.
Литература
1. Sundberg R. J.The chemistiy of indoles, Academic Press, New York, 1970; «Transition metals in the synthesis and functionalisation of indoles», Hegedus L. S. Angew. Chem., Int. Ed. Engl., 27, 1113 (1988); Sundberg R. J, Indoles, Academic Press, London, 1996.
2. Gut I. G.t WirzJ. Angew. Chem., Int. Ed. Engl., 33,1153 (1994).
3. «Monoterpenoid indole alkaloids» in Indoles in: The Chemistry of Heterocyclic Compounds, Series Taylor E. C. (ed.). Vol. 25, Part 4, Ed. Saxton J. E., Wiley-Interscience, 1983 and supplement, 1994.
4. Hinman R. L.t Lang. J. J. Am. Chem. Soc., 86, 3796 (1964).
5. Hinman R. L., Whipple E. B. J. Am. Chem. Soc., 84,2534 (1962).
6. Challis В. C., Milar E. M. J. Chem. Soc., Perkin Trans. 2, 1972, 1111; Muir D. M., Whiting M. C. J. Chem. Soc., Perkin Trans. 2,1975, 1316.
7. Hinman R. L., Bauman С. P. J. Org. Chem., 29,2437 (1964).
8. Challis В. C., Millar E. M. J. Chem. Soc., Perkin Trans. 2,1972, 1116.
9. Russell H. P., Harris B. J., Hood D. B. Oig. Prep. Proc. Int., 17, 391 (1985).
10. Boume G. T., Crich D., Davies J. W., Horwell D. C. J. Chem. Soc., Perkin Trans. 1,1991, 1693.
11. Pelkey E. T., Gribble G. W. Synthesis, 1997,1117.
12. Berti G., Da SettimoA., Nannipieri E. J. Chem. Soc. (C), 1968, 2145.
13. Brown K, Katritzky A. R. Tetrahedron Lett., 1964, 803.
14 Ottoni О., Cruz R., Krammer N. H Tetrahedron Lett., 40,1117 (1999).
15. Mitchell H, Leblanc Y. J.Org. Chem., 59,682 (1994).
16. Smith G. F., Taylor D, A. Tetrahedron, 29,669 (1973).
17. Fatum T. M., Anthoni U., Christophersen C., Nielsen P. H. Heterocycles, 38, 1619 (1994).
18. Raban M., Chem L.-J. J. Org. Chem., 45, 1688 (1980); Gilow H M., Brown C, S., Coeland J. N., Kelly К. E. J. Heterocycl. Chem., 28,1025 (1991).
19. HamelP., Zajac N.f Atkinson J. G., Girard Y. J. Oig. Chem., 59,6372 (1994).
20. Hamel R, Girard Y., Atkinson J. G. J. Oig. Chem., 57, 2694 (1992).
21. Nair V, George T. G., NairL. G., Panicker S, B. Tetrahedron Lett., 40,1195 (1999).
22. (a) Bocchi V, Palla G. Synthesis, 1982,1096; (6) Piers K, Meimaroglou C., Jardine R. K, Brown R. K. Canad. J. Chem., 41,2399 (1963); (в) ArnoldR. D., Nutter W. M., Stepp W. L, J. Org. Chem., 24, 117 (1959); (r) De Rosa M., Alonso J. L. T. J. Oig. Chem., 43,2639 (1978).
23. Dmitrienko G. L, Gross E. A., Vice S. F. Canad. J. Chem., 58,808 (1980).
24. Zhang P. Liu R., Cook J. M. Tetrahedron Lett., 36,3103 (1995).
25. Bergman J., Venemalm L. J. Org. Chem., 57,2495 (1992).
26. Brennan M. R., Erickson K. L., Szmalc F. S., Tansey M. J., Thornton J. M. Heterocycles, 24,2879 (1986).
27. Hirano S., Akai R.t Shinoda K, Nakatsuka S. Heterocycles, 41,255 (1995).
28. Saulnier M. G., Gribble G, IK J. Org. Chem., 47,757 (1982).
29. Saxton J. E. J. Chem. Soc., 1952,3592; Hart G., Liljegren D. R., Potts К, T.' ibid., 1961, 4267.
30. Nickisch K, Klose W.t Bohlman E Chem. Ber., 113, 2036 (1980).
31. Cipiciani A., Clementi S.t Linda P., Savelli G., Sebastiani G. V. Tetrahedron, 32, 2595 (1976).
32. GmeinerP., KraxnerL, Bollinger B. Synthesis, 1996,1196.
33. Smith G. F. J. Chem. Soc., 1954,3842; James P, N, Snyder H. R. Oig. Synth., Coll. Vol. IV, 1963,539.
34. Anthony IK C. J. Oig. Chem., 25,2049 (1960).
35. Nogrady T., Morris L. Canad. J. Chem., 47, 1999 (1969); Monge A., Aldana L, Lezamiz Fernandez-Alvarez E. Synthesis, 1984,160.
36. Specter M. E., Anthony IK C. J. Am. Chem. Soc., 76,6208 (1954).
37. Jshizumi K, Shioiri T., Yamada S. Chem. Pharm. Bull., 15, 863 (1967).
38. Spath E., Lederer E. Chem. Ber., 63, 2102 (1930).
39. «Indolo-2,3-quinodimethanes and stable analogues for regio- and stereocontrolled synthesis of [6]-anelated indoles», Pindur U., Eifanian-Abdoust H. Chem. Rev., 89, 1681 (1989).
40. Nakatsuka S., Teranishi K, Goto T. Tetrahedron Lett., 35, 2699 (1994); Teranishi K., Nakatsuka S, Goto T, Synthesis, 1994, 1018.
41. Demopoulos К J, Nicolaou I. Synthesis, 1998, 1519.
42. Teranishi K, Hayashi S, Nakatsuka S., Goto T. Tetrahedron Lett., 35, 8173 (1994).
43. Ciamician G., Plancher G. Chem. Ber., 29, 2475 (1896); Jackson A. K, Smith P. Tetrahedron, 24,2227 (1968).
44. Jackson A. H., Naidoo B., Smith P. Tetrahedron, 24,6119 (1968).
45. Casnati G., Dossena A., Pochini A. Tetrahedron Lett., 1972,5277.
46. Iyer R., Jackson A. H, Shannon P. K. R., Naidoo B. J. Chem. Soc., Perkin Trans. 2,1973, 872.
47. Ganesan A., Heathcock С. H. Tetrahedron Lett., 34,439 (1993).
48. Kotsuki H, Teraguchi M,, Shimomoto N., Ochi M. Tetrahedron Lett., 37, 3727 (1996).
49. Kotsuki H., Hayashida K, Shimanouchi T, Nishizawa H. J. Org. Chem., 61,984 (1996).
50. Sato К, Kozikowski А. Р. Tetrahedron Lett., 31, 4073 (1989); Dubois L., Mehta A., Tourette E, Dodd R. Y. J. Org. Chem., 59,434 (1994).
51. BramelyR. K, Caldwell J., Grigg R. J. Chem. Soc., PerkinTrans. 1,1973,1913; Casnati G., Franciani M., GuareschiA., Pochini A. Tetrahedron Lett., 1969,2485.
52. Burr G. O., Gortner R. A. J. Am. Chem. Soc., 46,1224 (1924).
53. Cook A. Y., MajerJ. R. J. Chem. Soc., 1944, 486; Pindur U., Flo C. Monatsh. Chem., 117, 375 (1986).
54. Pindur U., Kim M.-H. Tetrahedron, 45,6427 (1989).
55. Leete E. J. Am. Chem. Soc., 81,6023 (1959); ThesingJ. Chem. Ber., 87, 692 (1954).
56. FreterK. J. Org. Chem., 40,2525 (1975).
57. Appleton J. E, Dack K. N, Green A. D., Stelle J. Tetrahedron Lett., 34,1529 (1993).
58. Szmuszkovicz J. J. Am. Chem. Soc., 79,2819 (1957).
59. IqbalZ., Jackson A. H, Nagaraja Rao K. R. Tetrahedron Lett., 29,2577 (1988).
60. Harrington P. E, Kerr M. A. Synlett, 1996, 1047.
61. Robinson B., Smith G. F. J. Chem. Soc., 1960, 4574; Gamick R. E, Levery S. B., Le Quesne P. W. J. Oig. Chem., 43,1226 (1978).
62. Balsamini C.f Diamantini G., Duranti A., Spadoni G., Tontini A. Synthesis, 1995, 370.
63. Ranganathan D., Rao C. B.f Ranganathan S., Mehrotra A. K, Iyengar R. J. Oig. Chem., 45, 1185(1980).
64. Buchi G., Mak C.-P. J. Org. Chem., 42,1784 (1977).
65. Majchrzak M. W, Simchen G. Synthesis, 1986,956.
66. «Caibon-carbon alkylations with amines and ammonium salts», Brewster J. H, Eliel E. L. Oig. Reactions, 7,99 (1953).
67. Swaminathan S., Narisimhan K. Chem. Ber., 99, 889 (1966).
68. Kuhn H, Stein O. Chem. Ber., 70,567 (1937).
69. Kozikowski A. P., Ishida H. Heterocycles, 14,55 (1980).
70. Girke W. P. K. Chem. Ber., 112, 1 (1979).
71. Xie W., Bloomfield К M.f Jin Y., Dolney N. Y, Wang G. P. Synlett, 1999,498.
72. «The acid-catalysed polymerisation of pyrroles and indoles», Smith G. F. Adv. Heterocycl. Chem., 2,287 (1963).
73. Bocchi K, Palla G.f Tetrahedron, 40, 3251 (1984).
74. Hahn G., LudewigH Chem. Ber., 67,2031 (1934).
75. Narayanan K, Cook J. M. Tetrahedron Lett., 31,3397 (1990).
76. Kawate T., Yamada H, Matsumizu M., NishidaA., Nakagawa M. Synlett, 1997, 761.
77. Hodson H. E, Smith G. F. J. Chem. Soc., 1957,3546.
78. Bonnett R.f Holleyhead R. J. Chem. Soc., Perkin Trans. 1,1974,962.
79. Kirby G. W, Shah S. W. J. Chem. Soc., Chem. Commun., 1965, 381.
80. Harrington P. J. Hegedus E S. J. Oig. Chem., 49, 2657 (1984).
81. (a) Holins R. A., Colnaga L. A., Salim V. M., Seidl M. C. J. Heterocycl. Chem., 16, 993 (1979); (6) Somei M., Yamada E, Kunimoto M., Kaneko C. Heterocycles, 22,797 (1984).
82. Somei M., Hasegawa T., Kaneko C. Heterocycles, 20, 1983 (1983); Somei M., Yamada E, Chem. Pharm. Bull., 32,5064 (1984).
83. Yamada E, Somei M. Heterocycles, 26, 1173 (1987).
84. Somei M., Yamada E, Hamada H, Kawasaki T. Heterocycles, 29,643 (1989).
85. /taAarc 7. Chem. Lett., 1982, 1151.
86. Itahara T., Ikeda M., Sakakibara T. J. Chem. Soc., Perkin Trans. 1,1983,1361 Itahara T., Kawasaki K, Ouseto E Synthesis, 1984,236.
87. Itahara I., Ikeda M., Sakakibara T. J. Chem. Soc., Perkin Trans. 1,1983, 1361.
88. Nakagawa M., Kato S., Kataoka S., Hino T. J. Am. Chem. Soc., 707, 3136 (1979).
89. Chien С.-S., Hasegawa A., Kawasaki T., Sakamoto M. Chem. Pharm. Bull., 34,1493 (1986).
90. Dolby L. J., Booth D. L. J. Am. Chem. Soc., 88,1049 (1966).
91. Balogh-Hergovich E., Speier G. Tetrahedron Lett., 23,4473 (1982).
92. Yukimasa H, Sawai H., Takizawa T. Chem. Pharm. Bull., 27, 551 (1979).
93. Mudry C. A., FrascaA. R. Tetrahedron, 29,603 (1973).
94. Itahara T., Ouya H., Kozono K. Bull. Chem. Soc. Jpn., 55, 3861 (1982).
95. Szabo-Pusztay K, Szabd L. Synthesis, 1979,276.
96. Wojciechowski K, Makosza M., Synthesis, 1989,106.
97. «Chemistry and synthetic utility of metal-complexed indoles», Gill U S., Moriarty R. M., Ku Y Y, Butler I. R. J. Oig. Chem., 417,313 (1991).
98. Yagil G. Tetrahedron, 23, 2855 (1967); Scott W. J., Bover W. J., Bratin K, Zuman P. J. Oig. Chem., 41,1952 (1976).
99. Shirley D. A., RousselP. A. J. Am. Chem. Soc., 75, 375 (1953).
100. SundbergR. J., RussellH. F. J. Oig. Chem., 38, 3324 (1973).
101. KatritzkyA. R., Akutagawa K. Tetrahedron Lett., 26, 5935 (1985).
102. Hasan L, Marmelli E. R., Lin L.-C. C., Fowler F. W., Levy A. B. J. Org. Chem., 46,157 (1981).
103. Hlasla D. J., BellM. R. Heterocycles, 29, 849 (1989); KatritzkyA. R., Lue P., Chen. K-X J. Oig. Chem., 55, 3688 (1990).
104. Edwards M. P.f Doherty A. M., Ley S. V, Organ H. M. Tetrahedron, 42, 3723 (1986).
105. Somei M., Kobayashi T. Heterocycles, 34,1295 (1992).
106. Gharpure M., Stoller A., Bellamy F., Fimay G., Snieckus V. Synthesis, 1991,1079.
107. Kondo Y., Yoshida A., Sakamoto T. J. Chem. Soc., Perkin Trans. 1,1996,2331.
108. Iwao M. Heterocycles, 36, 29 (1993); Iwao M., Motoi O. Tetrahedron Lett., 36, 5929 (1995).
109. Nunomoto S., Kawakami Y., Yamashita Y., TakeuchiH., EguchiS. J. Chem. Soc., Perkin Trans. 1,1990, 111.
110. Reinecke M. G., Sebastian J. F., Johnson H. W., Pyun C. J. Oig. Chem., 37,3066 (1972).
111. Rubottom G. M., Chabala J. C. Synthesis, 1972, 566.
112. Barco A,, Benetti S., Pollini G. P., Baraldi P. G. Synthesis, 1976,124.
113. Illi V. O. Synthesis, 1979,387; Santaniello E, Farachi C., Ponti F. ibid., 1979,617.
114. Illi V. O. Synthesis, 1979, 136.
115. «The indole Grignard reagents», Heacock R. A., Kasparek S. Adv. Heterocycl. Chem., 10,43 (1969).
116. Bergman J., Venemalm L. Tetrahedron, 46, 6061 (1990).
117. Ayer W. A., Craw P. A.. Ma K, Miao S. Tetrahedron, 48,2919 (1992).
118. Yang С. X., Patel H. H.t Ku K-K, Shah R., Sawick D. Synth. Commun., 27, 2125 (1997).
119. Ezquerra J., Pedragal C., Lamas C., Pastor A., Alvarez P., Vaquero J. J. Tetrahedron Lett., 37,683(1996).
120. Fishwick C. W. G., Jones A. D., Mitchell M. B. Heterocycles, 32, 685 (1991); Onistschenko A., Stamm H. Chem. Ber., 122,2397 (1989).
121. KatritzkyA. R., Akutagawa K. Synth. Commun., 1988, 1151.
122. Saulnier M. G., Gribble G. W. J. Oig. Chem. 47,757 (1982).
123. Amat M., Hadida S, Sathyanarayana S., Bosch J. J. Org. Chem., 59,10 (1994).
124. Rubiralta M., Casamitjana N., Grierson D. S., Husson H.-P. Tetrahedron, 44,443 (1988).
125. Johnson D. A., Gribble G. W. Heterocycles, 24, 2127 (1986).
126. Kondo Y., Yoshida A., Sato S., Sakamoto T. Heterocycles, 42,105 (1996).
127. Kondo K, Takazawa N., Yoshida A., Sakamoto T. J. Chem. Soc., Perkin Trans. 1,1995, 1207.
128. Yokoyama K, UchidaM., Murakami У. Heterocycles, 29, 1661 (1989).
129. Klingebiel U., Luttke W., Noltemeyer M., Schmidt H G. J. Organometal. Chem., 456,41 (1993).
130. Buttery C. D.f Jones R. G., Knight D. Ж J. Chem. Soc., Perkin Trans. 1, 1993, 1425; Fisher L. E. Labadie S. S., Renter D. C., CarkR. D. J. Org. Chem., 60,6224 (1995).
131. Saulnier M. G., Gribble G. Ж Tetrahedron Lett., 24,5435 (1983).
132. Griffen E. J., Roe D. G., Snieckus V. J. Org. Chem., 60,1484 (1995).
133. Moyer M. P., Shiurba J. E, Rapoport H. J. Org. Chem., 51,5106 (1986).
134. Gribble G. Ж, Conway S. C. Synth. Commun., 22, 2129 (1992); Joseph B., MalapelB., MerourJ.-Y. ibid., 26, 3289 (1996).
135. Harrington P.J., Hegedus L. S. J. Org. Chem., 49, 2657 (1984); Arcadi A., Burini A., Cacchi S., Delmasto M., Pietroni B. Synlett, 1990,47.
136. Yang Y, Martin A. R. Heterocycles 34, 1395(1992).
137. Danieli B., Lesina G., Martinelli M., Pasarella D., Peretto L, SilvaniA. Tetrahedron, 54, 14081(1998.
138, Benhida R., Lecubin E, Fourrey J.-L., Casellanos L. R., Quintero L. Tetrahedron Lett., 40,5701 (1999).
139. Kanaoka T.} Ajura M., Hariya S. J. Org. Chem., 36,458 (1971).
140. Byers J. H., Campbell J. E., Knapp E H, Thissell J. G. Tetrahedron Lett., 40, 2677 (1999).
141. Chuang C.-P. WangS.-F. Synlett, 1995,763.
142. Ziegler F. E, Jeroncic L. O. J. Org. Chem., 56, 3479 (1991).
143. Aboutayab K., Caddick S., Jenkins K, Joshi S., Khan S. Tetrahedron, 52, 11329 (1996).
144. Caddick S., Aboutayab K, Jenkins K, West R. I. J. Chem. Soc., Perkin Trans. 1, 1996, 675.
145. Dobbs A. P, Jones K, VealK. T. Tetrahedron Lett., 36,4857 (1995).
146. O’Brien S., Smith D. С. C. J. Chem. Soc., 1960,4609; Remers Ж A., Gibs G. J., Pidoocks C., Weiss M. J. J. Org. Chem., 36, 279 (1971); Ashmore J. Ж, Helmkamp G. К Org. Prep. Proc Int., 8,223 (1976).
147. Barrett A. G. M., Dauzonne D., O’Neil I. A., Renaud A. J. Org. Chem., 49,4409 (1984).
148. Dolby L. J, Gribble G. W. J. Heterocycl. Chem., 3,124 (1966).
149. Lanzilotti A. E., Littell R., Fanshawe Ж J., McKenzie T. C., Lovell F. M. J. Org. Chem., 44,4809 (1979).
150. Gribble G. W., Hoffman J. H Synthesis, 1977,859.
151. Butula L, Kuhn R. Angew. Chem., Int. Ed. Engl., 7, 208 (1968).
152. Coulton S., Gilchrist T. L., Graham K. Tetrahedron, 53,791 (1997).
153. Gillespie R J. Porter A. E. A. J. Chem. Soc., Chem. Commun., 1979, 50.
154. Dehaen W, HassnerA. J. Org. Chem., 56, 896 (1991).
155. Benson S, C., LiJ.-H, Snyder J. К J. Org. Chem., 57, 5285 (1992).
156. Omote Y., Harada K., TomotakeA., Kashima C. Heterocycl. Chem., 21, 1841 (1984).
157. Wenkert E, Loeller P. D. R, Piettre S. R. J. Am Chem. Soc., 110, 7188 (1988).
158. Biolatto B., Kneeteman M., Mancini P. Tetrahedron Lett., 40, 3343 (1999).
159. GieselerA., Steckhan E., Wiest J., Knoch F. J. Org. Chem. 56,1405 (1991).
160. Backvall J.-E., Plobeck N. A., Juntunen S. К Tetrahedron Lett., 30,2589 (1989).
161. «Cycloaddition reactions with vinyl heterocycles», Sepulveda-Arques J.f Abarca-Gonzalez B., Medio-Simon Adv. Heterocycl. Chem., 63, 339 (1995).
162. Pindur U., Eitel M. Helv. Chem. Acta, 71, 1060 (1988); Pindur U., Eitel M., Abdoust-Houshang, E. Heterocycles, 29,11 (1989).
163. Saroja B,, Srinivasan P. C. Synthesis, 1986, 748; Eberle M. K, Shapiro M. J., Stucki R. J. Org. Chem., 52,4661 (1987).
164. Simoji Y., Saito P., Tomita K.t Morisawa Y. Heterocycles, 32, 2389 (1991).
165. Benson S. C., Lee L., Snyder J. K. Tetrahedron Lett., 37, 5061 (1996).
166. Wan Z.-K, Snyder J. K. Tetrahedron Lett., 39,2487 (1998).
167. Benson S. C, Palabrica C. A., Snyder J. K. J. Oig. Chem., 25, 4610 (1987); Daly K, NomakR., Snyder J. K. Tetrahedron Lett., 38, 8611 (1997).
168. Santos P. F., Lobo A. M., PrabhakarS. Tetrahedron Lett., 36, 8099 (1995).
169. Kawasaki T., OhtsukaH, MihiraA., Sakamoto M. Heterocycles, 47, 367 (1998).
170. RaucherS., Klein P. J. Oig. Chem.,. 51, 123 (1986).
171. Davis P. D., Neckers D. C. J. Oig. Chem., 45,456 (1980).
172. Weedon A. C., Zhang B. Synthesis, 1992,95.
173. Julian D. R., Tringham G. D. J. Chem. Soc., Chem. Commun., 1973, 13; Julian D. R., Foster R. J. Chem. Soc., Chem. Commun, 1973, 311.
174. ThesingJ., Semler G. Justus Liebigs Ann. Chem., 680,52 (1964).
175. Bailey A. S., HaxbyJ. B.., Hilton A. N., Peach J. M.f Vandrevala M. H. J. Chem. Soc., Perkin Trans. 1,1981,382.
176. KatrizkyA. R., Akutagawa K. J. Am. Chem. Soc., 108, 6808 (1986).
177. Inagaki S., Nishizawa Y, Suguira T, Ishihara H. J. Chem. Soc., Perkin Trans. 1,1990, 179; Naruse Y, Ito Y, Inagaki S. J. Oig. Chem., 56,2256 (1991).
178. ThesingJ., SchaldeF. Chem. Ber., 85, 324 (1952).
179. Howe E. E, ZambitoA. J., Snyder H. R., TischlerM. J. Am. Chem. Soc., 67,38 (1945).
180. AllbrightJ. D., Snyder H. R. J. Am. Chem. Soc., 81,2239 (1959); Baciocchi E, SchiroliA. J. Chem. Soc. (B), 1968,401.
181. Leete E. J. Am. Chem. Soc., 81, 6023 (1959); Littell R., Alien G. R. J. Oig. Chem., 38, 1504(1973).
182. Yamada F, Hashizumi T., Somei M. Heterocycles, 47, 509 (1998).
183. Nagarathnam D. J. Heterocycl. Chem., 29, 953 (1992); idem. Synthesis, 1992, 743; Zhang P., Liu R., Cook J. M. Tetrahedron Lett., 36,7411 (1995).
184. Johansen J. E., Christie B. D., Rapoport H. J. Oig. Chem., 46,4914 (1981).
185. Kraus G. A., MalpertJ. H. Synlett, 1997,107.
186. Challis В. C., Rzepa H. S., J. Chem. Soc., Perkin Trans. 2,1977,281.
187. Boger D., Patel M. J. Oig. Chem., 52,3934 (1987).
188. Casoni G., Goodman L. Canad. J. Chem., 42, 1235 (1964); Caimcross A., Roland J. R., Henderson R. M., Sheppard W. A. J. Am. Chem. Soc., 92, 3187 (1970).
189. HassingerH. L., SoilR. M., Gribble G. W. Tetrahedron Lett., 39,3095 (1998).
190. Miki Y, Tada Y., Yanase N., Hachiken H, Matsushita К Tetrahedron Lett., 37, 7753 (1996); Miki Y, Hachiken H, Sugimoto Y., Yanase N. Heterocycles, 37, 1759 (1997).
191. Wieland T, Unger O. Chem. Ber., 96,253 (1963); Elliott I. W., Rivers P. J. Oig. Chem., 29,2438 (1964); Nozoye T, Nakai T., KuboA. Chem. Pharm. Bull., 25, 196 (1977).
192. Sun L., Tran N., Tang E, Арр. H, Hirth P., McMahon G., Tang C. J. Med. Chem., 41, 2588 (1998).
193. Gruda L. Canad. J. Chem., 50, 18 (1972).
194. Giovannini E, Portmann P. Helv. Chim. Acta, 31,1375 (1948).
195. Schulte К E., Reisch J., Stoess U. Arch. Pharm (Weinheim), 305,523 (1977).
196. Comber M. F., Moody C. J. Synthesis, 1992, 731.
197. BourlotA. S., Desarbre E., MerourJ.-Y. Synthesis, 1994, 411.
198. «Five membered monoheterocyclic compounds. The indigo group», Sainsbury M., in: Campbell N. In Rodd’s Chemistry of Carbon Compounds, Vol. IVB, ch. 14, 1977 and Supplement, ch. 14,1985.
199. Capon B., KwokF-C. J. Am. Chem. Soc., Ill, 5346 (1989).
200. Etienne A. Bull Soc. Chim. France, 1948, 651.
201. Arnold R. D., Nutter W. M., Stepp W. C. J. Oig. Chem., 24,117 (1959).
202. Kawasaki Т., Nonaka Y., Uemura М., Sakamoto М. Synthesis, 1991, 701.
203. Abramovitch R. A., Marko A. M. Canad. J. Chem., 38, 131 (I960); О Sullivan W. I., Rothery E. J. Chem. Ind., 1972,849.
204. Hooper M., Pitkethly W. N. J. Chem. Soc., Perkin Trrans. 1,1972,1607.
205. Con way S. C., Gribble G. W. Heterocycles, 30,627 (1990).
206. Gribble G. W., ConwayS. C. Synth. Commun., 22,2129 (1992).
207. «The chemistry of isatin», Popp. F D. Adv. Heterocycl. Chem., 18,1 (1975).
208. Garden S. J., Torres J. C., Ferreira A. A., Silva R. B., Pinto A. C. Tetrahedron Lett., 39, 1501 (1997).
209. Muchowski J. M. Canad. J. Chem., 47, 857 (1969).
210. Jackson A. H. Chem. Ind., 1965,1652.
211. В ergman J. Acta. Chem. Scand., 25,1277 (1971).
212. Lathourakis G. E., LitinasK. E. J. Chem. Soc., Perkin Ttans. 1,1996,491.
213. «1-Hydroxyindoles», Somei A. Heterocycles, 50,1157 (1999).
214. Kawasaki T., Kodarna A., Nichida T, Shimizu K, Somei M. Heterocycles, 32, 221 (1991).
215. Somei T., Yamada E, Morikawa H. Heterocycles, 46,91 (1997).
216. Somei M., Kawasaki T., Fukui Y., Yamada E, Kobayashi T., Aoyama H., Shinmyo D. Heterocycles, 34, 1877 (1992).
217. Somei M., Yamada E, Yamamura G. Chem. Pham. Bull., 46, 191 (1998).
218. Bird C. W. J. Chem. Soc., 1965, 3490.
219. Sosnovsky G., Purgstaller K. Z. Naturforsch, 44b, 582 (1989); Klein J. T. et al. J. Med., Chem. 39,570(1996).
220. «Monoazaindole: pyrrolopyridines», Willette R. E. Adv. Heterocycl. Chem., 9, 27 (1968).
221. Прокопов А. А., Яхонтов Л. H. Химия гетероциклических соединений, 1978, 496; Yakhontov L. N., Azimov И A., Lapan E. I. Tetrahedron Lett., 1969,1909.
222. Girgis N. S., Larson S. B., Robins R. K., Cottam H. D. J. Heterocycl. Chem., 26, 317 (1989).
223. Bisagni E., Legraverend M., LhosteJ.-M. J. Org. Chem., 47,1500 (1982).
224. BourzatJ. -D., Bisagni E. Bull. Soc. Chim. Fr., 10, 511 (1973).
225. Desarbre E., CoudretS., Meheust C., MerourJ.-Y. Tetrahedron, 53,3637 (1997).
226. «Synthetically attractive indolisation procedures and new methods for the preparation of selectively substituted indoles», Pindur U., Adam R. J. Heterocycl. Chem., 25, (1988); «Recent developments in indole ring syntheiss — methodology and applications», Gribble G. W. J. Chem. Soc., Perkin Trans. 1,2000 и предыдущие статьи этой серии.
227. Robinson В. The Fischer indole synthesis, John Wiley and Sons, Chichester, New York, 1982; «Progress in the Fischer indole reaction», Hughes D. L. Oig. Prep. Proc. Int., 25, 607 (1993).
228. ShrinerR. L., Ashley W. C., Welch E. Org. Synth., Coll. Vol. Ill, 1955,725.
229. Roges С. V., Corson В. B. Org. Synth., Coll. Vol. IV, 1963, 884.
230. Murakami Y., Yokoyama Y., Miura T., Hirasawa H., Kamimura Y., Izaki M. Heterocycles, 22, 1211 (1984); Baccolini G., Marotta E. Tetrahedron, 20, 4615 (1985); Baccolini G., Dalpozzo R., Todesco P. E. J. Chem. Soc., Perkin Trans. 1, 1988,971.
231. Пржевальский H. M, Костромина JI. IO., ГранбергИ. И. Химия гетероциклических соединений, 1988,188.
232. Katritzky A. R., Rachwal S., BayyukS. Org. Prep. Proc. Int., 23, 357 (1991).
233. OckendenD. W., Schofeild K. J. Chem. Soc., 1957, 3175.
234. Douglas A. W. J. Am. Chem. Soc., 100, 6463 (1978); ibid., 101, 5676 (1979).
235. Posvic Н.г Dombro R., Ito H., Telinski T. J. Org. Chem. 39, 2575 (1974); Schiess P., GriederA. Helv. Chim. Acta, 57,2643 (1974).
236. Miyata 0., Kimura Y,, Muroya K, Hiramatsu H, Naito T. Tetrahedron Lett., 40, 3601 (1999).
237. Mills K, Al Khawaja I. K., Al-Saleh F. S., Joule J. A. J. Chem. Soc., Perkin Trans. 1, 1981, 636.
238. Zhao D., Hughes D. L., Bender D. R., De Marco A. M.t Reider P. J. J. Oig. Chem., 56, 3001 (1991).
239. PausackerK. H. J. Chem. Soc., 1950,621.
240. Brown D. W., Mahon M. E, Ninan A., Sainsbury M. J. Chem. Soc., Perkin Trans. 1, 1997,1699.
241. WagawS., YangB. H., BuchwaldS. L. J. Am. Chem. Soc., 120,6621 (1998).
242. Martin P. Helv. Chim. Acta, 67, 1647 (1984); Toyota M., Fukimoto K. J. Chem. Soc., PerkinTrans. 1,1992, 547.
243. Street L. J., Baker R., Castro J. L., Chambers M. S., Guiblin A. R., Hobbs S. C, Matas-sa U. G., Reeve A. J., Beer M. S., Middlemis D. N., Noble A. J., Stanton J, A., Scholey K, Hargreaves R. J. J. Med. Chem., 36, 1529 (1993); Castro J. L., Baker R., Guiblin A. R., Hobbs S, C., Jenkins M. R., Russell M. G. N., Beer M. S., Stanton J. A., Scholey K.t Hargreaves R. J., Graham M. I., Matassa V. G. J. Med. Chem., 37, 3023 (1994); Glenn R. C., Martin G. R., Hill A. R, Hyde R. M., Woollard P. M., Salmon J. A., Buckingham J., Robertson A. D. J. Med. Chem., 38, 3566 (1995).
244. Гранберг И. И., Боброва Н. И. Химия гетероциклических соединений, 1974,1085.
245. Noland W. Е, Baude F. J. Org. Synth., Coll. Vol. V, 1973, 567.
246. Alien D. A. Synth. Commun., 29, 447 (1999).
247. Cork R. D., Muchowski J. M, Fisher L. E, Flippin £. A, Repke D. B., Souchet M. Synthesis, 1991, 871.
248. RajanBabu T. V., Reddy G. S., Fukunage T. J. Am. Chem. Soc., 107, 5473 (1985).
249. RajanBabu T. И, ChenardB. E, Petti M. A. J. Oig. Chem, 51,1704 (1986).
250. «Leimgruber-Batcho indole synthesis», Dark R. D., Repke D. B. Heterocycles, 22, 195 (1984); BatchoA. D., Leimgruber W, Oig. Synth., Coll. Vol. 7,1980, 34.
251. Прокопов А. А., Яхонтов Л. H. Химия гетероциклических соединений, 1977,1135; Азимов В. А., Яхонтов Л. Н. Химия гетероциклических соединений, 1977, 1425; Frydman В., Red S. J., Boned J., Rapoport Н. J. Oig. Chem., 33, 3762 (1968).
252. Lloyd D. Y., Nichols D. E. Tetrahedron Lett., 24,4561 (1983); Haefliger W, Knecht H. ibid., 25,285(1984).
253. Ponticello G. S., Baldwin J. J. J. Oig. Chem., 44,4003 (1979); Kozikowski A. P., Ishida H., Chen Y.-Y. J. Org. Chem., 45, 3350 (1980); Somei M., Saida Y., Komura N. Chem. Pharm. Bull., 34,4116 (1986).
254. Rogers С. B., Blum C. A., Murphy В. P. J. Heterocycl. Chem., 24,941 (1987).
255. Rajeswari S., Drost K. J., Cava M. P. Heterocycles, 29,415 (1989).
256. SinhababuA. K, Borchardt R. T. J. Oig. Chem., 48, 3347 (1983).
257. Ijaz A. S., Patrick J. Sci Int. (Lahore), 1, 364 (1989).
258. Samizu K, Ogasawara К Heterocycles, 41, 1627 (1995).
259. Satoh M., Miyaura N, Suzuki A. Synthesis, 1987, 373; Beugelmans R., Roussi G. J. Chem. Soc., Chem. Commun, 1979, 950; Bard R. B., Bunnett J. F. J. Oig. Chem., 45, 1546 (1980); Suzuki H., Thiruvikraman 5. V., Osuka A. Synthesis, 1984, 616; Sakagami H, Ogasawara K. Heterocycles, 51, 113 (1999).
260. Sakamoto T., Kondo Y., Yamanaka H. Heterocycles, 22, 1347 (1984); Tischler A. N., Lanza T. J. Tetrahedron Lett., 27, 1653 (1986).
261. Sakamoto T., Kondo Y., Iwashita S.,Nagano T., Yamanaka H. Chem. Pharm. Bull., 36, 1305 (1988); Rudisill D. E, Stille J. K. J. Oig. Chem., 54, 5856 (1989).
262. Arcadi A., CacchiS., Marinelli F. Tetrahedron Lett., 27,6397 (1986).
263. Yasuhura A., Kanamori Y, Kaneko M., Numata A., Kondo Y., Sakamoto T. J. Chem. Soc., PerkinTrans. 1,1999, 529.
264. Kondo Y, Sakamoto T., Yamanaka H. Heterocycles, 29,1013 (1989).
265. LarockR. C., Yum E. K, Refvik M. D. J. Org. Chem., 63,7652 (1998).
266. Alien C. E H, VanAllan J. Oig. Synth., Coll. Vol. Ill, 1955, 597; Tyson F. T. ibid., 479.
267. Houlihan W. J., Parrino V A., Hike Y. J. Oig. Chem., 46,4511 (1981).
268. Eitel M., Pindur U. Synthesis, 1989, 364; Prasitpan N., Patel J. N., De Croos P. Z, StockwellB.L., Manavalan P.f KarL., Johnson M. E., Currie B. L. J. Heterocycl. Chem., 29, 335 (1992).
269. Bartoli G., Bosco M., Dalpozzo R., Todesco P. E. J. Chem. Soc., Chem. Commun., 1988, 807.
270. Smith A. B., Visnick M., Haseltine J. N., Sprengler P. A. Tetrahedron, 42, 2957 (1986).
271. Ito Y., Kobayashi K., Saegusa T. J. Am. Chem. Soc., 99, 3532 (1977); idem, J. Oig. Chem., 44, 2030 (1979); Ito Y, Kobayashi K, Seko N., Saegusa T. Bull. Chem. Soc. Jpn., 57, 73 (1984).
272. Campaigne E., Lake R. D. J. Org. Chem., 24,478 (1959).
273. NordlanderJ. E, Catalane D. B., Kotian K. D., Stevens R. M., Haky J. E. J. Oig. Chem., 46, 778 (1981); SundbergR. L, LaurinoJ. P. ibid., 49, 249 (1984).
274. Kozikowski A. P., ChengX.-M. Tetrahedron Lett., 26,4047 (1985); Yokoyama Y., SuzukiH, Matsumoto S., Sunaga Y., TaniM., Murakami Y. Chem. Pharm. Bull., 39, 2830 (1991); Natsume M., Muratake H. Tetrahedron Lett., 1979, 771; Muratake H., Natsume M. Tetrahedron Lett., 28, 2265 (1987); Yamashita A.., Scahill T. A., Toy A. ibid., 26,2969 (1985); Muratake H, Natsume M. Heterocycles, 29,771 (1989).
275. Muratake H, Natsume M. Heterocycles 29, 783 (1989).
276. Ten have R., van Leusen A. M. Tetrahedron, 54,1913 (1998).
277. Bartoli G., Palmieri G., Bosco M., Dalpozzo R. Tetrahedron Lett., 30, 2129 (1989); Dodson D., Todd A., Gilmore J. Synth. Commun., 21, 611 (1991).
278. Bosco M., Dalpozzo R., Bartoli G., Palmieri G., Petrini M. J. Chem. Soc., Perkin Trans. 2,1991,657.
279. Lida H, Yuasa Y., Kibayashi C. J. Oig. Chem., 45,2938 (1980); Sakamoto T., Nagano T, Kondo Y, Yamanaka H. Synthesis, 1990, 215.
280. Iwaki T, YasuharaA., Sakamoto T. J. Chem. Soc., Perkin Trans. 1,1999,1505.
281. Chen C., Lieberman D. R., Larsen R. D., Vehoeven T. R., ReiderP. J. J. Oig. Chem., 62, 2676 (1997).
282. Odie R, BlevinsB., RatcliffM., HegedusL. S. J. Org. Chem., 45,2709 (1980); SundbergR J., Pitts W. J. ibid., 56, 3048 (1991).
283. Sakamoto T., Kondo Y, Uchiyama M., Yamanaka H. J. Chem. Soc., Perkin Trans. 1, 1993,1941.
284. Zhang D., Liebskind L. S. J. Oig. Chem., 61,2594 (1996).
285. «The synthesis of 5-hydroxy in doles by the Nenitzescu reaction», Alien G. R Oig. React., 20, 337 (1973).
286. Kucklander U. Tetrahedron, 28, 5251 (1972).
287. Patrick J. B., Saunders E. K. Tetrahedron Lett., 1979,4009.
288. Gassman P. G., Roos J. J, Lee S. J. J. Oig. Chem., 49, 717 (1984); Gassman P. G., von Bergen T. J. Oig. Synth., Coll. Vol. VI, 1988,601.
289. «New developments in the chemistry of low-valent titanium», FurstnerA., Bogdanovic B. Angew. Chem., Int. Ed. Engl., 35, 2443 (1996).
290. FilrstnerA., Ernst A. Tetrahedron, 51, 773 (1995).
291. «Development of a novel indole synthesis and its application to natural products synthesis», Kobayashi Y., Fukuyama T. J. Heterocvcl. Chem., 35,1043 (1998).
292. Fukuyama T., Chen X, Peng G. J. Am. Chem. Soc., 116, 3127 (1994).
293. Sugasawa T, Adachi M., Sasakura K., Kitagawa A. J. Oig. Chem., 44,578 (1979); NimtzM., Haflinger G, Liebig’s Ann. Chem., 1987, 765; Sasakura K, Adachi M, Sugasawa T. Synth. Commun., 18, 265 (1988).
294. SundbergR. J., Russell H. E, Ligon W. E, Lin L. -S J. Oig. Chem., 37,719 (1972).
295. Pelkey E. T., Gribble G. W. Tetrahedron Lett., 38,5603 (1997).
296. KnittelD. Synthesis, 1985,186.
297. Galvez J. E., Garcia F. J. Heterocycl. Chem., 21, 215 (1984).
298. Caubere C, Caubere P., Lanelli S, Nardelli M., Jamart-Gregoire B. Tetrahedron, 50, 11903(1994).
299. Barluenga J., Fananas E J., Sanz R-, Fernandez Y. Tetrahedron Lett., 40, 1049 (1999).
300. Soderberg B. G, Shriver J. A. J. Oig. Chem., 62, 5838 (1997).
301. Inada A., Nakamura Y., Morita Y. Chem. Lett., 1980, 1287; Somei M., Saida Y. Heterocycles, 23,3113 (1985).
302. Kawase M., Miyake Y., Kikugawa Y. J. Chem. Soc., Perkin Trans. 1,1984, 1401.
303. Ketcha D. M. Tetrahedron Lett., 29,2151 (1988).
304. Kuehne M. E., Hall T. C. J. Org. Chem., 41,2742 (1976).
305. Hino T., TaniguchiM. J. Am. Chem. Soc., 100, 5564 (1978).
306. Tsuji Y., KotachiS., Huh K-Т., Watanabe Y. J. Org. Chem., 55,580 (1990).
307. Cho C. S., Lim H. K., Shim S. C., Kim T. J., Choi H.-J, Chem. Commun., 1998,995.
308. Abramovitch R.A., Hey D. H. J. Chem. Soc., 1954,1697; RutenbergM. W, HomingE. C.
Org. Synth., Coll. Vol. IV, 1963,620.
309. Doyle M. R, Shanklin M. S., Pho H. Q., Mahapatro S N. J. Oig. Chem., 53,1017 (1988).
310. Shaughnessy К, H, Hamann B. C., Hartwig J. F. J. Oig. Chem., 63, 6546 (1998).
311. Van Alphen J, Reel. Trav. Chim. Pays-Bas, 61, 888 (1942); Su H. С, E, Tsou К C J. Am. Chem. Soc., 82, 1187 (1960).
312. Sugasawa T., Adachi M., Sasakura K., Kitagawa A. J. Oig. Chem., 44, 578 (1979).
313. Марвел К С., Хайерс Г. С. Синтезы огранических препаратов, т. I, с. 216, — М.: ИЛ, 1949.
314. Somei М., Shoda Т. Heterocycles, 16,1523 (1981).
315. Moody С. J., Rahimtoola К. Е J. Chem. Soc., Chem. Commun., 1990,1667.
316. Abramovitch R. A., Shapiro D. J. Chem. Soc., 1956, 4589; Henecka H, Timmler H, Lorenz R., Geiger W. Chem. Ber., 90, 1060 (1957).
317. Ishibashi H, Akamatsu S, Iriyama H., Hanaoka K, Tabata T., Ikeda M. Chem. Pharm. Bull., 42, 271(1994).
318. Ujjainwalla E, Warner D. Tetrahedron Lett., 39, 5355 (1998).
319. Xu L., Lewis! R., Davidsen S. K, Summers J. B. Tetrahedron Lett., 39, 5159 (1998).
320. Mahadevan L, Rasmussen M. J. Heterocycl. Chem., 29,359 (1992).
321. Maze as D., Guillaume! G., Viaud M.-C. Heterocycles, 50,1065 (1999).
322. Dekhane M., PotierP., Dodd R, H Tetrahedron, 49, 8139 (1993).
18
БЕН30[Ь]ТИ0ФЕНЫ И
БЕН30[Ь]ФУРАНЫ:
РЕАКЦИИ И МЕТОДЫ СИНТЕЗА
бензотиофен Г \---->3 (р)
(бензотиофуран) К // \\
(тиафтен) -4 i V 2(a)
[бензо[Ь]тиофен] 7
3(₽)
2(a)
бензофуран
[бензо[Ь] фуран] 7 'о'
Бензо[Л|тиофен [1] и бензо[6]фуран [2], чаще всего называемые просто бензотиофен и бензофуран (эти названия используются далее в этой главе), представляют данной соответственно серо- и кислородсодержащие аналоги индола, но гораздо менее изученные. Кислородсодержащая система встречается в ряде природных соединений растительного и микробиологического происхождения, таких, как с 5-метоксибензофуран, оранжевые ауроны, ряд растительных пигментов, изомерных сопутствующим флавонам (разд. 9.2.3.10), усниновая кислота, желтый пигмент многих лишайников и гризеофульвин из Penicillium griseofulvum, используемый в медицине в качестве противогрибкового средства. Ралоксифен проявил активность в качестве потенциального средства для предупреждения остеопороза и профилактики заболеваемости раком молочной железы.
18.1. РЕАКЦИИ С ЭЛЕКТРОФИЛЬНЫМИ РЕАГЕНТАМИ
18.1.1. Реакции замещения по атому углерода
Электрофильное замещение в бензо[£] тиофенах и бензо[£]фуранах проходит гораздо менее региоселективно, чем в индоле (особенно это касается селективности атаки по положению 3), и атомы углерода гетероцикла обладают лишь не-
много большей реакционной способностью, чем атомы бензольного кольца. Например, при нитровании бензотиофена образуется смесь, в которой преобладает З-нитропроизводное (>50%); кроме того, эта смесь содержит 4-нитро-, 6-нитро- и 7-нитробензотиофены с выходами около 10% каждый [3]. Измерение скорости детритирования 2- и 3-тритийбензотиофенов в трифторуксусной кислоте показало, что эти скорости одинаковы для обоих положений [4]. Алкилирование бензотиофена по Фриделю—Крафтсу [5] приводит к образованию смеси 2- и 3-изомеров с преобладанием последнего, однако в других реакциях замещения, например иодирования [6] или контролируемого бромирования [7], можно говорить лишь об образовании 3-изомера; 2,3-дибромид можно селективно восстановить до 3-бромпроизводного цинком в уксусной кислоте, что, по-видимому, связано с большей стабильностью 2-аниона по сравнению с 3-анионом.
Бензофуран проявляет гораздо наименьшую склонность к замещению по положению 3: по некоторым данным, при формилировании образуется только 2-формилпроизводное [8], а нитрование азотной кислотой приводит к 2-нитро-бензофурану [9]. Однако все исследования, где было описано выделение основного продукта реакции, проводились главным образом до появления современных аналитических методов, а прежние методики не позволяли определять присутствие других минорных изомеров. В более поздних исследованиях при нитровании N2O4 в качестве основного продукта реакции был выделен 3-нитро-бензофуран с небольшой примесью 2-изомера [10]. Бензофуран реагирует с галогенами, давая продукты 2,3-присоединения [11], при этом первоначальная электрофильная атака идет по положению 2, а дальнейшее элиминирование галогеноводорода в основной среде приводит к образовнию 3-моногалогенобензофуранов с высокими выходами [12]. Реакции замещения по Фриделю—Крафтсу затруднены для незамещенных в гетероциклическом кольце бензофуранов, так как обычные катализаторы вызывают осмоление, однако существуют примеры получения 3-ацилбензофуранов при использовании в качестве катализатора FeCl3 [13].
n2o4 PhH,10*C
73%
Если в молекуле бензотиофсна уже имеется заместитель, то дальнейшее замещение происходит еще сложнее, что можно продемонстрировать на ряде примеров. С одной стороны, при нитровании 2-бромбензотиофена происходит млсо-замещение с образованием 2-нитробензотиофена, тогда как 2-хлорбензотиофен дает З-нитропроизводное [14], а при нитровании 3-бромбензотиофена с умеренным выходом образуется 2-нитробензотиофен [15]. С другой стороны, 3-карбокси- или 3-ацилбензотиофены нитруются в бензольное кольцо [16].
Бромирование [17] и реакции замещения по Фриделю—Крафтсу [18] 3- и 2-метилбензотиофенов идут по свободному положению гетероцикла; аналогично 2-бромбензотиофен дает при формилировании 3-формилпроизводное [19]. В условиях реакции Вильсмейера при умеренных температурах 3-метоксибензотиофен превращается в соответствующий 2-альдегид, тогда как при 95 "С образуется З-хлорбензотиофен-2-карбоксальдегид [20]; 6-этоксибензотиофен формилируется по положению 2 [21].
18.1.2. Реакции присоединения по атому серы в бензотиофене
Соли бензотиофения образуются при атаке по атому серы сильными алкилирующими агентами, такими, как, например, соли Меервейна [22]. В свою очередь соли бензотиофения сами действуют как сильные алкилирующие агенты с разрывом связи С—S [23].
AgPF6
CI(CH2)2Cl, о *ст
EtOH, 20‘С
При окислении по атому серы происходит образование 1,1-диоксидов, которые быстро вступают в реакции циклоприсоединения в качестве диенофилов [24] или фотодимеризуются, образуя в качестве основного продукта димер «голова-к-голове» [25].
18.2. РЕАКЦИИ С НУКЛЕОФИЛЬНЫМИ РЕАГЕНТАМИ
Галоген в положении 2 бензотиофена замещается при действии аминов в качестве нуклеофилов и, что удивительно, с гораздо большей скоростью, чем в положении 3, несмотря на то, что в последнем случае образуется интермедиат, отрицательный заряд в котором локализован в положении 2, соседнем с гетероатомом. Столь же удивительной кажется реакция, в которой при действии анионов вторичных аминов на бензотиофен образуются 2-диалкиламино-2,3-ди-гидробензотиофены [27]; присоединение первичных аминов при облучении дает З-алкиламино-2,3-дигидробензотиофены [28]. мисо-Замещение [29] атома
брома в З-бром-2-нитробензотиофене может иногда сопровождаться образованием продуктов перегруппировки [30].
пиперидин
175'С м
74%
18.3. РЕАКЦИИ С ОСНОВАНИЯМИ; РЕАКЦИОННАЯ СПОСОБНОСТЬ С-МЕТАЛЛИРОВАННЫХ БЕН30[Ь]ТИ0ФЕН0В И БЕН30[Ь]ФУРАН0В
На заре использования «-бутиллития 2-литийбензофуран получали либо из 2-бромбензофурана и w-бутиллития [31], при этом происходил обмен галоген — металл, или депротонированием бензофурана [32]. Генерирование 3-металли-рованных бензофуранов обычно приводит в результате фрагментации к 2-гид-роксифенилацетилену при комнатной температуре [28,33], однако 3-литийпро-изводные можно использовать при очень низких температурах [34].
Взаимодействие 2-литийбензофурана с арил- или алкиллитием, приводящее к раскрытию цикла, можно представить следующей последовательностью превращений, в которой карбен образуется в качестве интермедиата [35]:
При действии амида натрия на бензотиофен происходит раскрытие гетерокольца и образуется 2-этинилфенилтиол [36]. Иначе происходит раскрытие цикла бензотиофена под действием диметиламида лития с последующим улавливанием образующихся частиц с помощью метилиодида. По строению образующегося енамина можно предположить, что первоначально присоединение идет наиболее вероятно по положению 2 с последующим раскрытием цикла [37].
3-Литийбензотиофены можно генерировать и вводить в реакции с электрофилами только при низкой температуре [38]. Прямое депротонирование бензотиофенов протекает по положению, соседнему с гетероатомом в пятичленном
гетероцикле, и в соответствии с этим процесс обмена металл-галоген предпочтительно происходит в случае 2-, а не 3-галогенозамещенных соединений. Представленная ниже последовательность показывает, как это может быть использовано для получения различных производных бензотиофенов [40]. 2-Литийпроизводные могут быть использованы для дальнейшего взаимодействия с электрофилами: например, с л-толуолсульфонилцианидом образуются 2-цианопроизводные [41]. 2-Триалкилоловобензофураны [42] й бензофуран-2- [43] и бензотиофен-2-борные кислоты [44] могут вступать в катализируемые палладием реакции сочетания с ароматическими галогенидами, в последнем случае с трифлатом морфина.
18.4. РЕАКЦИИ С ОКИСЛИТЕЛЯМИ И ВОССТАНОВИТЕЛЯМИ
Гидродесульфирование бензотиофенов удобно проводить на никеле Ренея [45], и до появления современных спектральных методов эта реакция широко использовалась для определения структуры различных замещенных бензотиофенов путем перевода их в легко узнаваемые производные.
Восстановление гетероциклических колец бензофурана и бензотиофена, особенно с сохранением атома серы в последнем случае, возможно при использованию триэтилсилана в кислой среде с образованием 2,3-дипщропроизвод-ных [46]. Для получения 2,3-дигидроксипроизводных бензофурана и бензотиофена используют Pseudomonas putida [47]; применение этого микробиологического метода описано и для окисления бензотиофена по атому серы [48].
18.5. ЭЛЕКТРОЦИКЛИЧЕСКИЕ РЕАКЦИИ
Бензотиофен, аннелированный с молекулой пиридина, можно получить через 2-или 3-азиды, дающие по реакции Стаудингера илиды, которые в свою очередь вступают в реакцию конденсации аза-Витгига с непредельными альдегидами с последующей самопроизвольной электроциклизацией с дегидрированием
18.6. ОКСИ-[50] И АМИНОБЕНЗОТИОФЕНЫ И ОКСИ- И АМИНОБЕНЗОФУРАНЫ
Удобным методом получения бензотиофен-2-онов служит окисление 2-литий-производных [51]. Бензотиофен-2-он может вступать в реакцию конденсации по положению 3 с ароматическими альдегидами [52] (для сравнения — бензоти-офен-3-он реагирует по положению 2 [53]).
Как бензофуран-2-он, известный под тривиальным названием кумаранон и хорошо изученный как лактон, так и бензофуран-3-он образуют амбвдентные анионы в результате депротонирования по метиленовой группе, причем в первом случае [54] требуется более сильное основание, чем во втором [55].
Простые 2- и 3-аминопроизводные бензофурана мало известны; 2-диалкиламинобензотиофены можно получить взаимодействием бензотиофен-2-тиола со вторичными аминами [51]. Во многих случаях 2-аминобензотиофен ведет себя как обычный ароматический амин, однако диазотирование приводит непосредственно к образованию бензотиофен-2-она [56].
18.7. СИНТЕЗЫ БЕН30[Ь]ТИ0ФЕН0В И БЕНЗО[Ь]ФУРАНОВ
18.7.1. Синтез кольца
18.7.1.1. Из 2-арилтио- или 2-арилгидроксипроизводных альдегидов, кетонов или кислот
Циклизация 2-арилтио- или 2-арилоксипроизводных альдегидов, кетонов или кислот происходит в результате внутримолекулярной электрофильной атаки по ароматическому кольцу с замыканием гетероцикла и потерей молекулы воды; этот путь обычно используют для получения бензотиофенов.
Чтобы синтезировать бензотиофены [57], не замещенные в гетероциклическом фрагменте, исходят из ацеталя арилтиоацетальдегвда, который в свою очередь получают из ацеталя бромацетальдегида и тиофенола. Аналогично получают 2,3-незамещенные бензофураны [58].
Кислотно-катализируемые циклизации 2-арилтио- [59] и 2-арилгидроксике-тонов [60], а также-2-арилтио- [61] и 2-арилацетоксихлоридов [62] приводят к образованию 3-замещенных гетероциклов и 3-оксогетероциклов соответственно. Попытка синтеза 3-арилбензотиофенов таким способом часто сопровождается частичной или полной изомеризацией в 2-арилгетероцикл [63].
МеСН(С1)СОМе Ме2СО, К2СО3 нагревание 79% **
А1С13
С12СНСНС»2,65 ‘С
49% **
Циклизация О-алленил-о-иодфенолов, катализируемая нульвалентным палладием, приводит к образованию частиц, которые можно зафиксировать в виде азида [64].
Pd(PPh3)4, NaN3
DMF, 20°Сх
71%
18.7.1.2. Из 2-(о-гидроксиарил)- или 2-тиооксиарилпроизводных ацетальдегидов, кетонов или кислот
Циклодегидратация 2-(о-гидроксиарил производных) ацетальдегидов, кетонов или кислот (и в некоторых случаях S-аналогов) дает гетероциклы; этот метод особенно важен для синтеза бензофуранов.
Перегруппировкой Кляйзена аллилфениловых эфиров с последующим окислением алкенов генерируют о-гидроксиарилацетальдегиды, которые циклизуются с образованием бензофуранов в условиях кислотного катализа [65]. Также легко образуются 2-замещенные бензофураны из 2-(о-гидроксиарил)кс-тонов [66].
Использование арил-2-хлорпроп-2-енилсульфидов (или эфиров) в качестве субстратов в перегруппировке тио-Кляйзена позволяет исключить стадию окисления и дает таким образом 2-метилбензотибфены (бензофураны) [67].
конц. на 90‘С» 56%
Пропаргилариловые эфиры подвергаются перегруппировке Кляйзена, а последующее замыкание цикла приводит к образованию 2-метилбензофуранов [68]
CsF, PhNEIj кипячение^ 73% **
Другой подход к соединениям с той же степенью окисления включает в себя катализируемое палладием сочетание эфиров енолов [69]
n-CsHi3
Pd(PPh3)4 NaOH.THF, нагревание
Et затем Н2О2
4-Хлорметилкумарины могут быть превращены в бензофуран-3-уксусные кислоты в результате щелочного гидролиза лактона с последующей рециклизацией с одновременным вытеснением атома хлора фенолят-ионом [70].
18.7.1.3. Из о-ациларилокси- или о-ациларилтиоуксусных кислот (эфиров) или о-ациларилокси- или о-ациларилтиокетонов
Циклоконденсация о-ациларилокси- или о-ациларилтиоуксусных кислот (эфиров) или соответствующих кетонов приводит к образованию бициклических гетероциклов
В результате внутримолекулярной альдольной конденсации Перкина о-фор-миларилоксиуксусных кислот и эфиров арилтиоуксусных кислот образуются бензофуран [71] и эфиры бензотиофен-2-карбоновых кислот [72] соответственно, как показано ниже. о-Формил- или о-ациларилбензиловые эфиры, в которых бензильная труппа содержит электроноакцепторные заместители, легко циклизуются с образованием 2-ацилбензофуранов с использованием фторидов калия или цезия на оксиде алюминия [73].
о-Гидроксиарилальдегиды или о-гидроксиарилкетоны вступают в реакцию О-алкилирования с а-галогенокетонами, и последующая внутримолекулярная альдольная конденсация приводит к 2-ацилбензофуранам [74]
С1СН2СОМе
КОН, EtOH м
67%
Если же вместо рр/ио-карбонильной группы в соединении, участвующем в циклизации, присутствует рр/яо-нитрильная группа, образуются 3-аминогетеро-циклы: приведенный ниже пример демонстрирует, как при подходящих акиви-рующих условиях и введение тиоацетата, и циклизация происходят без выделения промежуточных соединений в одной колбе [75].
Ph
HSCH2CO2Et К2СОз, EtOH, кипячение — ►
18.7.1.4. Из О-арилкетоксимов
Элекгроциклическая перегруппировка О-арилкетоксимов дает бензофураны
Кислотно-катализируемая перегруппировка О-арилкетоксимов [76], приводящая к образованию бензофуранов, в точности соответствует перегруппировке фенилгидразонов — классическому методу синтеза индолов по Фишеру (разд. 17.16.1)
18.7.1.5. Из о-иодфенолов
С открытием методов катализа нульвалентным палладием стало возможным синтезировать фурановое кольцо бензофурана из о-иодофенола и алкинов; при этом два атома углерода при тройной связи алкина участвуют в построении фрагмента С(2>—С(з>, а наибольший заместитель алкина попадает в положение 2 [77]. Реакцию проводят на твердом носителе [78]. Сочетание с 2,5-дигидро-2,5-диметоксифураном дает метиловый эфир бензофуран-3-уксусной кислоты [79].
‘о'
ru m Ма м(0Ас)г (кат.), ,СН2СО2Ме APr2NEt> BnEtaNI
DMF, 70’С Мео
) затем BF^______
** 64%
ОМе
ОД PhCsCSi/-Pr3 if Pd(OAc)2, Na2CO3
[1 Bu4NCI, DMG, 100 *С
он 70%
При сочетании алкинов с о-метокситрифлатами образуются соединение, которое циклизуется под действием хлорида лития при нагревании в бензофураны
[80]
HCsCTMS, CI2Pd(PPh3)2 КгСОз 0НС Et3N, DMF, 90 *С г МеОН, 2(^*0 68%
88%
18.7.1.6. Синтезы с образованием бензольного кольца
6,7-Дигидробензотиофены в качестве диенов реагируют с алкинами и, как показано ниже, последующая ретро-реакция Дильса—Альдера отщепления этилена приводит к бензотиофену [81]. Аналогично силиловые эфиры енолов, полученные из 3-ацетилфурана, в результате циклоприсоединения, дают4-оксобензофураны [82].
Сочетание фурила и тиенилстаннана с 4-хлорциклобут-2-енонами [83] или присоединение фурилцериевых реагентов к моноацеталям циклобут-3-ен-1,2-дионов используется для синтеза циклобутенонов, в которых при нагревании происходит раскрытие цикла с образованием ненасыщенных кетонов; последние затем подвергаются элекгроциклизации, давая бензофураны или бензотиофены с кислородсодержащими заместителями в положении 4.
CI2Pd(PhCN)2
Р(2-фурил)з диоксан, 50 *С
18.7.1.7. Из частично восстановленных бензофуранов и бензотиофенов
Существуют определенные преимущества введения заместителей в бензольное кольцо при восстановленном гетероциклическом фрагменте с последующим дегидрированием для ароматизации.
2,3-Дигидробензотиофены могут быть окислены сульфурилхлоридом или N-хлорсукцинимидом [85]; 2,3-дихлор-5,6-дицианобензохинон используют для дегидрирования 2,3-дигидробензофуранов [86]. В примере, приведенном ниже, введение заместителя в бензольное кольцо предшествует ароматизации за счет элиминирования иодоводорода и изомеризации двойной связи для восстановления ароматичности [87].
Упражнения
Простые упражнения для проверки усвоения материала гл. 16 и 18
(а) Почему реакции электрофильного замещения для бензотиофена и бензофурана менее селективны, чем для индола?
(б) Каков принципиальный метод эффективного введения заместителей в положение 2 бензофурана и бензотиофена?
(в) Предложите два метода синтеза бензофуранов, исходя из фенола, не имеющего заместителей в ор/ио-положениях по отношению к гидроксильной группе.
(г) Каким образом салициловые альдегиды могут быть использованы для синтеза бензофуранов?
Упражнения повышенной сложности
1. Предложите структуры соединений, образующихся на каждой стадии следующей последовательности превращений: PhSH + ClCH2COCH2CO2Et (-> Ci2Hi4SO3), полифосфорная кислота, нагревание (-> Ci2Hi2SO2), затем NH3 (-> C10H9NSO), затем LiAlH4 (-> CioHnNS), затем НСО2Н/нагревание (-+ CnHuNSO), затем РОС13/нагревание -> конечное трициклическое соединение (CnH9NS).
2. Нарисуйте структуры соединений, образующихся из следующих комбинаций: (а) С13Н1бО из 2,4,5-триметилфенолас З-хлорбутан-2-оном с последующей обработкой конц. H2SO4; (б) Ci2H8O, из 7-гидрокси-8-метоксикумарина с СН2=СНСН2Вг/К2СО3 с последующим сильным нагреванием; образующийся изомер затем последовательно реагирует с О3, а затем с Н+; (в) 4-трифторме-тилфторбензол с диизопрпиламидом лития, затем диметилформамид (-> C8H4F4O), затем с HSCH2CO2Me/NaH дает CnH7F3O2S; (г) C9H7NO3 из 4-фторнитробензола с Me2C=NONa, затем нагревание с конц. НС1.
3. Установите структуры би- и трициклических гетероциклов, образующихся в ходе следующих реакций: 4-хлорфенилтиоуксусная кислота с РС13, затем А1С13 (-> CsHsCISO), затем обработка фенилгидразином в горячей АсОН Ci4H8C1NS.
Литература
1. «Recent advances in the chemistry of benzo[£>]thiophenes», Iddon B., Scrowston R, M. Adv. Heterocycl. Chem., 11, 177 (1970); «Recent advances in the chemistry of benzo[£]thiophenes», Scrowston R. M. ibid., 29,171 (1981).
2. «Recent advances in the chemistry of benzo [6] furan and its derivatives. Part I: Occurence and synthesis», Cagniant P., Cagniant D. Adv. Heterocycl. Chem., 18, 337 (1975).
3. Armstrong K. J., Martin-Smith M., Brown N, M. D., Brophy G. C, Stembell S. J. Chem. Soc. (C), 1969,1766.
4. Eabom C., Wright G. J. J. Chem. Soc. (B), 1971,2262.
5. Cooper J. Scrowston R. M. J. Chem. Soc., Perkin Trans. 1,1972,414.
6. Van Zyl G. Bredcweg C. J., Rynbrandt R. H., Neckers D. C. Can. J. Chem., 44, 2283 (1966).
7. Cherry W. H.t Davies W., Ennis В. C,, Porter Q.N. Austral. J. Chem., 20, 313 (1967); Forst K, BeckerS., Caubre P. Tetrahedron, 50, 11893 (1994).
8. Bisgani M., Buu-Ho N. P., Royer R. J. Chem. Soc., 1955, 3688.
9. V. StoermerR., Richter O. Chem. Ber., 30, 2094 (1897); v. StoermerR., KahlertB. ibid., 35,1633 (1902).
10. Kaluza F, Perold G. Chem. Ber., 88,597 (1955).
11. Okuyama T., Kunugiza K., Fueno T. Bull. Chem. Soc. Jpn., 47,1267 (1974).
12. Baciocchi E., Sebastian G. V., Ruzziconi R., J. Org. Chem., 44,28 (1979).
13. Campaigne E., Weinberg E. D., Carlson G., Neiss E. S. J. Med. Chem., 8, 136 (1965).
14. Dickinson R. P. Iddon B., Sommerville R. G. Int. J. Sulfur Chem., 8,233 (1973).
15. Bachelet J.-P., Royer R., Gatral P. Eur. J. Med. Chem. Chim. Ther., 20, 425 (1985).
16. Brophy G. С., Sternhell S., Brown N. М. D., Brown I., Armstrong K. J., Martin-Smith M. J. Chem. Soc. (C), 1970, 933; Brown L, Reid S, T., Brown N. M. S., Armstrong K. J., Martin-Smith M, Sneader W. E., Brophy G. C., Stembell S. J. Chem. Soc. (C), 1969, 2755.
17. Dickinson R. R, Iddon B. J. Chem. Soc. (C), 1971, 182.
18. Sauter E, GolserL. Monatsh. Chem., 98, 2039 (1967); Faller P., Cagniant P. Bull. Soc. Chim. Fr., 1962,30.
19. Minh T. Q., ThibautP., Christiaens E, Renson M. Tetrahedron, 28,5393 (1972).
20. Ricci A., Balucani D., Buu-Ho N. P. J. Chem. Soc. (C), 1967, 779.
21. Campaigne E., Kreighbaum W. E. J. Org. Chem., 26, 363 (1961).
22. Acheson R. M. Harrison D. R. J. Chem. Soc. (C), 1970.
23. Cotruvo J. A., Degani I. J. Chem. Soc., Chem. Commun., 1971,436.
24. Davies W. Porter Q. N. J. Chem. Soc., 1957,459.
25. Harpp D. N.t Heitner C, J. Org. Chem., 35, 3256 (1970); idem, J. Am. Chem. Soc., 94, 8179(1972).
26. Reinecke M. G., Mohr Ж В., Adickes H. Ж, de Bie D. A., van de Plas H. G, Nijdam J. J. Org. Chem., 38,1365 (1973); Chippendale К. E., Iddon B., Suschitzky H, Taylor D. S. J. Chem. Soc., Perkin Trans. 1,1974,1168.
27. Grandclaudon P., Lablache-Combier A. J. Org. Chem., 43,4379 (1978).
28. Grandclaudon P., Lablache-Combier A., Prknyi C. Tetrahedron, 29,651 (1973).
29. Guerrera E, Salerno L. J. Heterocycl. Chem., 32,591 (1995).
30. Guerrera E, Salerno L., Lamartina E, Spinelli D. J. Chem. Soc., Perkin Trans. 1,1995, 1243.
31. Gilman Ht Melstrom D. S. J. Am. Chem. Soc., 70, 1655 (1948).
32. Shirley D. A., Cameron M. D. J. Am. Chem. Soc., 72,2788 (1950).
33. Reichstein T., Baud J. Helv. Chim. Acta, 20, 892 (1937).
34. Cugnan De Sevricourt M,, Robba M. Bull. Soc. Chim. Fr., 1977,142.
35. Nguyen T., Negishi E, Tetrahedron Lett., 32, 5903 (1991).
36. Schorth W., Jordan H, SpitznerR. Tetrahedron Lett., 36,1421 (1995).
37. Beyer A. E. M. Kloosterziel H, Reel. Trav. Chim. Pays Bas, 96,178 (1977).
38. Dore G., Bonhomme M.t Robba M. Tetrahedron, 28,2553 (1972); Dickinson R. R, Iddon B. J. Chem. Soc. (C), 1970,2592.
39. Kerdesky F. A. J., Basha A. Tetrahedron Lett., 32,2003 (1991).
40. Dickinson R. P., Iddon B. J. Chem. Soc. (C), 1971,2504; Reinecke M. G., Newsom J. G.f AlmqvistK. A. Synhtesis, 1980, 327; Sura T P., MacDowellD. W. H. J. Oig. Chem., 58, 4360 (1993).
41. Nagasaki L, Suzuki Y., Iwamoto K., Higashino T., Miyashita A. Heterocycles, 46, 443 (1997).
42. Clough J. M., Mann I. S., Widdowson D. A. Tetrahedron Lett., 28,2645 (1987).
43. Blettner C. G., Knig W.A., Tenzel W., Schotten T. Synlett., 1998, 295.
44. Hedberg M. H, Johansson A. M.f Fowler C. J., Tetenius E, Hacksell U. Biorg. Med., Chem. Lett., 4, 2527 (1994).
45. Papa D.f Schwenk E, Ginsberg H. E J. Org. Chem., 14, 723 (1949).
46. Kursanov D. N., Pames Z. N., Bolestova G. I., Belen ’kii E 1. Tetrahedron, 37, 311 (1975).
47. BoydD. R, Sharma N. D., Boyle R., McMurray B. T., Evans T A., Malone J. E, Dalton H, Chima J., Sheldrake G. N. J. Chem. Soc., Chem. Commun., 1993,49.
48. Boyd D. R., Sharma N D,, Haughey S. A., Malone J. E, McMurray В. T, Sheldrake G. N., Alien С. C. R., Dalton H. Chem. Commun., 1996,2363.
49. Degl’Innocenti A., Funicello М., Scafato P., Spagnolo P., Zanirato P. J. Chem. Soc., Perkin Trans. 1,1996,2561.
50. «Chemistry ofbenzo[Z>]thiophene-2,3-dione», Rajopadnye M., Popp F. D. Heterocycles, 27, 1489(1988).
51. VesteragerN. O., Pedersen E. B., Lawesson S.-O. Tetrahedron, 29, 321 (1973).
52. Conley R. A., HeindelN. D. J. Org. Chem., 41,3743 (1976).
53. Reamonn L. S. S., O'Sullivan 1И I. J. Chem. Soc., Perkin Trans. 1, 1977, 1009.
54. Zaugg H. E., Dunnigan D. A., Michaels R. J., Swett R. J., Wang T. S., Sommers A. H., DeNet R. W. J. Oig. Chem., 26,644 (1961).
55. Auwers K., Schtte H. Chem. Ber., 52,77 (1919).
56. Stacy G. W., Villaescusa F. W.t Wollner T. E. J. Oig. Chem., 30,4074 (1965).
57. Tilak B. D. Tetrahedron, 9,76 (1960).
58. Spagnolo P., Tiecco M., Tundo A., Martelli G. J. Chem. Soc., Perkin Trans. 1, 1972, 556.
59. Dickinson R. P., Iddon B., J. Chem. Soc. (C), 1968, 2733; Chapman N. B., Clarke K., Sawhney S. N. J. Chem. Soc. (C), 1968,518.
60. Royer R, Rent L., Bull. Soc. Chim. Fr., 1970,1037.
61. Werner L. H, Schroeder D. C., Ricca S. J. Am. Chem. Soc., 79, 1675 (1957).
62. Elvidge J. A., Foster R. G. J. Chem. Soc., 1964, 981.
63. Banfield J. E, Davies W, Gamble N. W, Middleton S. J. Chem. Soc., 1956,4791.
64. Gardiner M., Grigg R., Sridharan V., YickerN. Tetrahedron Lett., 39,435 (1998).
65. De Souza N. J., Nayak P. V, Secco E. J. Heterocycl. Chem., 3,42 (1966).
66. Tinsley S. W. J. Org. Chem., 24,1197 (1959).
67. Anderson W. K., LaVoie E. J., Bottaro J. C. J. Chem. Soc., Perkin Trans. 1, 1976,1.
68. Ishii H., Ohta S., Nishioka H., Hayashida N., Harayama T. Chem. Pharm. Bull. 41,1166 (1993); Moghaddam F. M., Sharifi A., Saidi M. R. J. Chem. Res. (S), 1996, 338.
69. Satoh M., Miyaura N., Suzuki A. Synthesis, 1987, 373.
70. Fall У., Snatana L., Teijeira M., Uriarte E. Heterocycles, 41,647 (1995).
71. Burgstahler A. W., Worden L. R. Oig. Synth., Coll. Vol. V, 1973,251.
72. Bridges A. J., Lee A., Maduakor E. C., Schwartz С. E. Tetrahedron Lett., 33, 7499 (1992).
73. Hellwinkel D., GkeK. Synthesis, 1995,1135.
74. Elliott E. D. J. Am. Chem. Soc., 73,754 (1951).
75. Peinador C., Veiga M. C., VilarJ., QuintelaJ. M. Heterocycles, 38,1299 (1994).
76. Sheradsky T. Tetrahedron Lett., 1966,5225; Sheradsky T., Elgavi A. Isr. J. Chem., 6,895 (1968); Kaminsky D., Shavel J., Meltzer R. I. Tetrahedron Lett., 1967, 859.
77. Larock R. C., Yum E. K., Doty D. J., Sham К. К C. J. Oig. Chem., 60, 3270 (1995); Bishop В. C., Cottrell I. E, Hands D. Synthesis, 1997, 1315; Kundu N. G., Pal M., MahantyJ. S., De M. J. Chem. Soc., Perkin Trans. 1,1997, 2815.
78. Fancelli D., Fagnola M. C., Severino D.t Bedeschi A. Tetrahedron Lett., 38, 2311 (1997).
79. Samizu К Ogasawara K. Heterocycles, 38,1745.
80. Hiroya K., Hashimura K., Ogasawara K. Heterocycles, 38, 2463 (1994).
81. Labadie S. S. Synth. Commun., 28,2531 (1998).
82. Ben ’tez A., Herrera F. R., Romera М., Talams F. X, Muchowski J. P. J. Org. Chem., 61, 1487 (1996).
83. LiebskindL. S., Wang J. J. Org. Chem., 58, 3550 (1993).
84. Liu H., Gayo L. M., Sullivan R. W., Choi A. Y H., Morre H. W. J. Oig. Chem., 59,3284 (1994).
85. Tohma H.f Egi M., Ohtsubo M.t Watanabe H, Takizawa S.f Kita Y. Chem. Commun., 1998,173.
86. Bchi G,, Chu P.-S. J. Oig. Chem., 43, 3717 (1978); Stanetty P., Prstinger G. J. Chem. Res., 1991, (S) 78; (M) 0581.
87. Onito K., Hatakeyana T., Takeo M., Suginome H., Tokuda M, Synthesis, 1997, 23.
19
ИЗОИНДОЛЫ, БЕН30[с]ТИ0ФЕНЫ И
ИЗОБЕНЗОФУРАНЫ: РЕАКЦИИ И
МЕТОДЫ СИНТЕЗА
3,4-бензопиррол иэоиндол (2Н-ИЗОИНДОЛ)
3,4-бензотиофен изобензотиофен (бензо^тиофен)
Изоиндол [1], бензо[с]тиофен] [2] и изобензофуран [3] гораздо менее стабильны, чем изомерные им индол, бензо[6]тиофен и бензоЩфуран. Это несомненно связано с их более низкой ароматичностью, что может быть оценено качественно с учетом того, что в этих [с]-системах шестичленный цикл представляет собой не полностью бензоидную систему. Из трех незамещенных гетероциклов бензо [с]тиофен наиболее стабилен — он остается неизменным в твердом виде в течение нескольких дней при —30 “С, но в основном большинство химических превращений было проведено с замещенными гетероциклами. Нестабильность проявляется в сильной склонности к присоединению таких реагентов, в результате присоединения которых образовывалась более ароматическая система, в частности, эти гетероциклы особенно склонны к присоединению диенофилов. Поэтому нет ничего удивительного в том, что для изоиндола возможно существование в виде альтернативного таутомера (1Н-изоиндола, иногда называемого «изоиндоленином»), который имеет более полную бензоидную структуру и вносит ощутимый вклад в существующее равновесие [4]. Действительно, некоторые изоиндолы существуют в большей степени в виде таутомера с двойной связью ON, например 1,3,4,7-тетраметилизоиндол [5], однако 1-фенилизоин-дол преимущественно (~ 91%) находится в виде 2Н-таутомера [6]. Заместители в бензольном кольце оказывают влияние как на стабильность изоиндола, так и на положение таутомерного равновесия; так, например, 4,5,6,7-тетрабромизо-индол представляет собой стабильное кристаллическое соединение, существующее целиком в виде 2Н-таутомера [7]. Пивалоильный заместитель, хотя и удален от гетероциклического кольца, может также стабилизировать изоиндол [8]. Положение такого таутомерного равновесия может меняться в зависимости от природы растворителя: растворители типа диметилскульфоксида сдвигают равновесие в сторону NH-таутомера, тогда как в протонных растворителях, например в спиртах, предпочтительно существование иминного таутомера.
19.1. РЕАКЦИИ С ЭЛЕКТРОФИЛЬНЫМИ РЕАГЕНТАМИ
Изоиндолы протонируются с образованием только одного катиона [5]. Электрофильное присоединение протона происходит по такому же типу, что и замещение в этих системах, однако существует относительно небольшое число исключений, вероятнее всего, в некоторой степени обусловленное нестабильностью незамещенных изоиндолов, изобензофуранов и бензо [с]тиофенов. Изучение детритирования показало, что реакционная способность при этом электрофильном замещении для 2-метилизоиндола в 104 раз больше, чем для 1-метил-индола [9].
2-тде/п-Бутилизоиндол гораздо более стабилен, чем незамещенный гетероцикл или другие 2-замешенные изоиндолы, поэтому его реакции можно использовать как меру внутренней реакционной способности: он вступает в реакцию даже с таким слабым электрофилом, как ионы арилдиазония, и подвергается алкилированию в обоих случаях по положению 1 гетероцикла [10].
Et3O+BF4‘
СН2С12,0 ‘С
96%
PhN?BF4‘
MegCO, О *С
93% **
Интересным примером электрофильного замещения может служить превращение фталимидина (2,3-дигидро-1Н-изоиндол-1-она) в 1-бром-З-формилизо-индол в условиях реакции Вильсмейера (образование 1-бром-2Н-изоиндола должно быть первой стадией процесса) [И]. Другой простой пример — конденсация Манниха 2-метил-1-фенилизоиндола [12].
DMF, РОВгз NaOH, водн. EtOH 57%
19.2. ЭЛЕКТРОЦИКЛИЧЕСКИЕ РЕАКЦИИ
Каждая из трех систем имеет большую склонность к реакциям циклоприсоединения с диенофилами по положениям 1 и 3, приобретая в результате этого процесса стабилизирующий вклад за счет полной ароматизации шестичленного цикла: так, например, изобензофуран, мгновенно реагирует с малеиновым ангидридом при 0 °C [13]. Изобензофуран называют наиболее «реакционноспособным выделяемым диеном». Наиболее типичны случаи, когда имеют дело с невыделяемыми или чрезвычайно реакционноспособными системами, улавливаемыми диенофилами, поэтому обсуждение синтеза неизбежно должно включать рассмотрение их реакций циклоприсоединения.
Реакции наиболее стабильного 1,3-дифенилизобензофурана довольно типичны: он вступает в реакцию Дильса-Альдера с диэтиловым эфиром ацетилендикарбоновой кислоты [14] и присоединяет синглетный кислород [15]. Действительно этот коммерчески доступный изобензофуран часто используют в качестве ловушки для промежуточно образующихся алкенов и алкинов. Менее устойчивые изобензофураны генерируют и вводят в реакции in situ: наиболее ти-
пичен 1-метил-З-фенилизобензофуран [16]. Более современные методы получения изобензофуранов в растворах позволяют детально изучить скорости взаимодействия различных замещенных производных с N-метил малеинимидом [17]. Реакции Дильса—Альдера также изучены для бензо [с]тиофенов [18,19] и изоиндолов [4].
МеОгССзССОгМе
CCI4, нагревание^ 57%
19.3. ФТАЛОЦИАНИНЫ [20]
Макроциклическая система фталоцианина, формально состоящая из четырех молекул изоиндола, служит основой для большого числа синих красителей. Фталоцианин способен образовывать комплексные соединения с металлами; при этом атом металла помещается в центр молекулы, аналогично тому, как атом железа находится в центре гема.
Фталоцианины можно получить восстановительной циклизацией 2-циано-бензамида или в результате превращений, которые делают его взаимосвязь с изоиндолом более очевидной, а именно комбинацией четырех молекул 1,3-ди-иминоизоивдолина с элиминированием аммиака [21]:
фталоцианин
19.4. СИНТЕЗЫ ИЗОИНДОЛОВ, БЕН30[с]ТИ0ФЕН0В И ИЗОБЕНЗОФУРАНОВ
19.4.1. Изоиндолы
Изоиндолы можно получить из соответствующих N-замещенных изоиндолинов (1,3-дигидроизоиндолов), которые в свою очередь образуются в реакции азотсодержащих нуклеофилов с 1,2-бис(бромметил)бензолом [22]. Примерами могут служить пирролитическое элиминирование метилгидроксикарбоната из циклического гидроксил аминокарбоната [4], элиминирование, бензилового
спирта из бензилового эфира N-гидроксиизоиндолина, протекающее при гораздо более низкой температуре [23] или метансульфокислоты из соответствующего мезилата [24].
500 ‘С улавливание при 77 К
N-Замещенные изоиндолы также могут быть получены из изоиндолина в результате процесса элиминирования: так, N-оксиды способны терять воду при пирролизе [25] или, что лучше, при обработке уксусным ангидридом [26].
Синтез 1-фенилизоиндола представляет собой классический подход к построению гетероцикла: предшественник должен быть выбран таким образом, чтобы аминогруппа (первоначально защищенная в виде фталимида) находилась на расстоянии пяти углеродных атомов от карбонильной группы, при взаимодействии с которой и образуется циклический имин [6].
Более современные методы включают циклореверсии на конечных стадиях [27]; исходным соединение, как показано ниже, может служить циклоаддукт (ср. разд. 13.9) бензола и 1-метоксикарбонилпиррола:
1,3-Диарилизоиндолы можно синтезировать из 1,2-диароилбензолов реакцией с амином и восстанавливающим агентом [28]
19.4.2. Бензо[с]тиофены
Элиминирование S-оксидов из дигидробензо[с]тиофена успешно применяется, как и в случае изоиндолов, для получения бензо[с]тиофенов, в том числе и незамещенного бензо[с]тиофена [19,29]
ai2o3
PhH, 60 ‘С
100%
При аккуратном манипулировании окислительными уровнями реакция 1,4-дигидро-1,2-диароилбензолов, получаемым по реакции Дильса—Альдера из бута-1,3-диенов с 1,2-диароилалкинами, с источниками атома серы приводит к образованию бензо[с]тиофенов, причем без участия восстановителя, который потребовался бы при использовании самих 1,2-диароилбензолов. Те же аддукты Дильса—Альдера реагируют с первичными аминами, давая 2-замещенные изоиндолы
Относительно редко для построения бензаннелированных гетероциклов используют подход, при котором образование бензольного кольца происходит на последней стадии, однако бензо[с]тиофен можно получить таким образом, используя двойное алкилирование по типу реакции Фриделя—Крафтса 2,5-диза-мещенных (для предотвращения атаки по a-положению) тиофенов 1,4-дикето-ном [31].
19.4.3. Изобензофураны
Изобензофуран, образующийся при термолизе подходящего предшественника, такого, как 1,4-эпокси-1,2,3,4-тетрагидронафталина [13,32], можно выделить, используя в качестве ловушки холодный «палец». Однако эксперименты с улавливанием удобнее проводить в случае элиминирования метанола из 1-ме-токсинафталина в условиях кислотного или щелочного катализа в присутствии подходящего диенофила [33].
650 ’С
(С2Н^ 100%*
1-Метоксифталан получают частичным окислением 1,2-6«с(гидроксиме-тил)бензола гипохлоритом в метаноле, обработка его диизопропиламидом лития дает изобензофуран [34]. Условия подбирают таким образом, чтобы вслед за
элиминированием быстро следовало литиирование в кольцо; образующееся производное может далее вступать в реакцию [35].
2MeLi
ОМе 0,05/-Pr2NH THF, О *С
Ситуация с тем же уровнем окисления — дизамещенный бензол с альдегидной (кетонной функцией) в орто-положении к карбинолу, готовый к циклизации и дегидратации с образованием изобензофурана, — может быть достигнута альтернативным путем: из фталевого альдегида получают моноацеталь, а оставшуюся альдегидную группу восстанавливают [36] или используют технологию литиирования, как показано ниже [37]:
CH(OMe)2^BuL. у^'\^СН(ОМе)2
Et20,0*С MeCT'xXV TsOH, PhMe, 95 ‘С
затем CH^) (газЭ )—\н2ОН Ме02СОСС02Ме
Ме0 _ >
Этот подход можно эффектно продемонстрировать на примере «вытянутого» изобензофурана, как показано ниже [38]. Следует обратить внимание, что первое циклоприсоединение происходит с диенофилом, способным обеспечить орто-расположение карбинольной и альдегидной групп, участвующих в образовании другого фуранового цикла.
МеОН, СН(ОМе)з
Dowex-H+ UAIH4 МеОН, TsOH
нагревание THF, 20 *С нагревание
72% 83%*" 88% **
МеО2СС=ССО2Ме PhMe, Dowex-H+ нагревание
— ,
Наиболее стабильные изобензофураны — 1,3-диарилпроизводные — глубокого желтого цвета. Эти соединения получают частичным восстановлением и циклодегидратацией 1,2-диароилбензолов [39]. Как 1-моно-, так и 1,3-дизаме-щенные изобензофураны синтезируют из фталидов присоединением реактивов Гриньяра с последующим отщеплением воды [40].
PhMgBr Et2O,THF, 20 р —
-Н2О
Ph
Упражнения
Простые упражнения для проверки усвоения материала гл. 16 и 19
(а) [с]-Конденсированные гетероциклы, рассмотренные в этой главе, гораздо менее устойчивы,чем [^-конденсированные изомеры. Почему?
(б) Какие факторы предпочтительнее для 1Н-изомеров по сравнению с 2Н-изоме-рами?
(в) Какие реакции наиболее характерны для [с]-конденсированных гетероциклов, рассмотренных в этой главе? Приведите три примера типичных реакций.
(г) Опишите по одному методу синтеза кольца изоиндолов, бензо[с]тиофенов и изобензофуранов.
Упражнения повышенной сложности
1. Предложите структуры соединений, образующихся на каждой стадии в следующей последовательности превращений: (а) 1,2-бис(бромметил)-4-пивалоилбен-зол с H2NCH2OCH/ Et3N -» C16H19NO, который затем нагревают при 500 ’С с образованием Ci3H|5NO; последний улавливают с помощью N-фенилмалеини-мида -> C23H22N2O3 (каков механизм высокотемпературной реакции?); (б) фталевый альдегид реагирует последовательно сначала с 2NaHSO3, затем с McNH2, затем с 2 KCN -> CioH8N2; (в) N, N-диэтиламид бензойной кислоты реагирует сначала с w-BuLi, затем с PhCH=O, затем с кислотой -> С14НюО2; последний взаимодействует с PhMgBr, затем с кислотой -> С20Н14О и окончательно с О2/мети-леновый голубой/ Av/-50 “С -> C2oHi403; (г) фталевый ангидрид с НО(СН2)гОН / CuSO4 -> СюНюО3, который затем реагирует с NaBH4, затем с TsOH и метиловым эфиром ацетилендикарбоновой кислоты в горячем толуоле -> Ci4Hi2O5; (д) бензо[с]тиофен с малеиновым ангидридом, затем с горячим NaOH, затем с кислотой -» Ci2HeO4.
Литература
1. «Isoindoles», White J. D., Mann M. E. Adv. Heterocycl. Chem., 10, 113 (1969); «The chemistry of isoindoles», Bonnett R., North S.A, ibid., 29,341 (1982).
2. «Benzo [c] thiophenes», Iddon B. Adv. Heterocycl. Chem., 14, 331 (1972).
3. «Benzojcjfurans», Fridrichsen W. Adv. Heterocycl. Chem., 26, 135 (1980); «Isobenzofuran», Haddadin M. J. Heterocycles, 9, 865 (1978); «Progress in the chemistry of isobenzofurans; applications to the synthesis of natural products and polyaromatic hydrocarbons», Rodrigo R. Tetrahedron, 44, (1988), 2093; «Recent advances in the chemistry of benzo[c]furans and related compounds», Fridrichsen W. Adv. Heterocycl., Chem., 1999,73,1 (1999).
4. Bonnett R., Brown R. F. C., Smith R. G. J. Chem. Soc., Perkin Trans. 1,1973,1432.
5. Bender C. O,t Bonnett R. J. Chem. Soc., Chem. Commun., 1966,198.
6. VeberD. E, Lwowski W. J. Am. Chem. Soc., 86,4152 (1964).
7. Kreher R., HerdK. J, hngew. Chem., Int. Ed. Engl., 13, 739 (1974).
8. Kreher R., KohlN, Use G, Angew. Chem., Int. Ed. Engl., 21,621 (1982).
9. Laws A. P., Taylor R. J. Chem. Soc., PerkinTrans. 2,1987,591.
10. Kreher R. R, Use G. Chem. Ber., 122, 337 (1989).
11. Von Dobeneck H, Reinhard H, Deubel H, Wolkenstein D. Chem. Ber., 102, 1357 (1969).
12. Theilacker W., Kalenda H. Justus Liebigs Ann. Chem., 584, 87 (1953).
13. Wiersum U E., Mijs W. J. J. Chem. Soc., Chem. Commun., 1972,347.
14. Berson J. A. J Am. Chem. Soc., 75,1240 (1953).
15. Rio G., Scholl M.-J. J. Chem. Soc., Chem. Commun., 1975,474.
16. FaragherR., Gilchrist T. L. J. Chem. Soc., Perkin Trans. 1,1976, 336.
17. Tobia D., Rickbom B. J. Oig. Chem., 52, 2611 (1987).
18. Mayer R., Kleinert H, Richter S., Gewald K. Angew. Chem., Int. Ed. Engl., 1, 115 (1962).
19. Cava M. R, Pollack N. M., Marner A., Mitchell M. J. J. Oig. Chem., 36, 3932 (1971).
20. «Advances in the chemistry of phthalocyanines», Lever А. В. P., Hempstead M. R., Leznoff C, Liew W.t Melnik M., Nevin W. A., Seymour P. Pure Appl. Chem., 58, 1461 (1986).
21. Elvidge J. A., Linstead R. P. J. Chem. Soc., 1955,3536.
22. Bornstein J. Shields J. E. Org. Synth., Coll. Vol. V, 1973, 1064.
23. Kreher R., Seubert J. Z. Naturforsch., 20b, 75 (1966).
24. Kreher R., Herd K. J. Heterocycles, 11,409 (1978).
25. ThesingJ,, Schafer W., Melchior D. Justus Liebigs Ann. Chem., 671,119 (1964).
26. Kreher R., Seubert J. Angew. Chem., Int. Ed. Engl., 3, 639 (1964); ibid., 5, 967 (1966).
27. Priestley G. M., Warrener R. N. Tetrahedron Lett., 1972,4295; Bornstein J., Remy D. E., Shields J. E. Chem. Commun., 1972, 1149.
28. Haddadin M. J., Chelhot N. C. Tetrahedron Lett., 1973,5185.
29. Holland J. M., Jones D. W. J. Chem. Soc. (C), 1970, 536; Kreher R. R> Kalischko J., Chem. Ber., 1991,645.
30. Mann M. E., White J. D. J. Chem. Soc., Chem. Commun., 1969,420.
31. Dann O. Kokorudz M., Gropper R. Chem.Ber., 87, 140 (1954).
32. Warrener R. N. J. Am. Chem. Soc., 93,2346 (1971).
33. Mitchell R. H, Iyer V. S., Khalifa N., Mahadevan R., Venugopalan S., Weerwama S. A,, Zhou P. J. Am. Chem. Soc., 117, 1514 (1995).
34. Naito К., Rickbom В. J. Oig. Chem., 45,4061 (1980).
35. Crump S. L., Rickbom B. J. Oig. Chem., 49,304 (1984).
36. Smith J. G., Kruger G. J. Oig. Chem., 50, 5759 (1985).
37. Keay B. A., Plaumann H. P., Rajapasaka D.f Rodrigo R. Can. J. Chem., 61, 1987 (1983).
38. Tu N. P. W., Yip J. C., Dibble P. W. Synthesis, 1996,77.
39. Zajec W.W., Pichler D. E. Can. J. Chem., 44, 833 (1966); Potts К. T., Elliott A. J. Org. Prep. Proc. Int., 4, 269 (1972).
40. Newman M. S. J. Oig. Chem., 26,2630 (1961).
20
ОБЩАЯ ХАРАКТЕРИСТИКА РЕАКЦИОННОЙ СПОСОБНОСТИ 1,3- И 1,2-АЗОЛОВ
Молекулы 1,3- и 1,2-азолов содержат один гетероатом в кольце, аналогичный атому азота в пиридине (иминный атом азота), а также один гетероатом, соответствующий атому азота в пирроле, атому серы в тиофене или атому кислорода в фуране. Следовательно, их реакционная способность представляет собой «очаровательную» комбинацию и общую взаимосвязь типов реакционной способности описанных ранее в этой книге пиридинов, с одной стороны, и пирролов, тиофенов и фуранов — с другой, с отличием в электроотрицательности гетероатомов, присущей таковым в пятичленных циклах.
образование 2>илидов с депротонированием азолиевых солей
Типичные реакции 1,3-азолов электрофильное присоединение по иминному атому азота с образованием азолиевых солей
региоселективное 2-литиирование
(Z = NH)
электрофильное замещение преимущественно по положению 5
замещение по атому азота через образование имидазол ил-аниона
образование циклоаддуктов в реакции оксазолов с диенофилами
В большинстве случаев изучают одновременно 1,3- и 1,2-азолы, хотя в последних два гетероатома связаны напрямую и имеют существенное индуктивное влияние, что в значительной степени изменяет свойства. 1,2-Азолы обладают меньшей нуклеофильностью и основностью иминного атома азота по сравнению с 1,3-изо-мерами. Способность таких соединений вступать в реакции электрофильного присоединения еще раз иллюстрирует тот факт, что неподеленная электронная пара иминного атома азота не включена в ароматический секстет электронов.
Типичные реакции 1,2-азо лов
электрофильное присоединение по иминному атому азота с образованием азолиевых солей
электрофильное замещение преимущественно по положению 4
Азолы по легкости, с которой они вступают в реакции электрофильного замещения, занимают промежуточное положение между пиридинами, с одной стороны, и пирролами, тиофенами и фуранами, с другой: наличие электроноакцепторной иминной группы оказывает влияние на пятичленные ароматические гетероциклы такое же, как и в шестичленных ароматических структурах (т. е. такое же, как при сравнении бензола с пиридином, гл. 4). Порядок реакционной способности: пиррол > фуран > тиофен справедлив и для азолов, хотя наличие основного атома азота усложняет такое сравнение. Региоориентация электрофильной атаки становится более ясной при сравнении «характера» различных положений цикла: активированного в пятичленных циклах и дезактивированного подобно а- и у-положениям в пиридине.
Сравнительная реакционная способность положений в азолах
менее сильное дезактивирование дезактивировано индуктивным акцепторным «подобно» p-положению пиридина эффектом соседнего атома азота и p-положению пиррола
более сильное дезактивирование z" «подобно» a-положению пиридина4*—*’
менее сильное дезактивирование «подобно» a-положению пиррола
\\ более сильное ZN дезактивирование Z «подобно» а-положению
пиридина
«подобно» a-положению пиррола, а также «подобно» у-положению пиридина
Если электрофильное замещение проходит противоположно тому, как в пятичленных гетероциклах, то нуклеофильное замещение атома галогена идет аналогично тому, как оно проходит в пиридиновом ряду. Нуклеофильное замещение происходит быстрее всего по положению 2 в 1,3-азолах и по положению 3 в 1,2-азолах. Резонансные вклады в стабилизацию интермедиатов, образующихся в ходе такого замещения, объясняют подобную ситуацию: иминный атом азота выступает в качестве акцептора электронов, что приводит к нуклеофильной атаке именно по этим положениям.
Для получения различных производных азолов широко используют процессы, катализируемые нульвалентным палладием (детальное обсуждение см. разд. 2.7); один простой пример приведен ниже:
TBDMSOI
SO2Ph
HOCCHaOTBDMS, Pd(PPh3)4 Cui, Et3N, DMF, 80 *C y 89%
N
‘N
SO2Ph
Продолжая аналогию с реакционной способностью пиридина, следует отметить, что атомы водорода метильных трупп в положении 2 в 1,3-азолах и в положении 3 в 1,2-азолах обладают кислотным характером и могут депротонировать-
ся в присутствии сильных оснований. Кватернизация иминного атома азота существенно облегчает такое депротонирование; образующиеся енамины реагируют с электрофилами по атому углерода боковой цепи.
Литиирование проходит региоселективно по положению 2 в 1,3-азолах и по положению 5 в 1,2-азолах. Легкость, с которой 1,3-диазолиевые катионы образуют илиды (карбены) в результате 2-депротонирования, лежит в основе биологической активности пирофосфата тиамина.
Давно известно, что 1,3-азолы можно получить из компонентов, обеспечивающих два гетероатома: тиоамида или амидина и а-бромкетона. В более современных методах используются реакции аниона изонитрила с альдегидом, тиоальдегидом или имином.
R2 R2
\=О nh2 - HHal У—ы
Г \ -Нг°> JT W
R54Hal X^R’ R3-\X^R’
Для получения 1,2-азола необходима конденсация 1,3-дикарбонильного соединения с источником двух гетероатомов — гидразином или гидроксиламином. Диполярное циклоприсоединение алкинов к нитрилоксидам или нитрил-иминам приводит к образованию изоксазолов и пиразолов.
21
1,3-АЗОЛЫ - ИМИДАЗОЛЫ, ТИАЗОЛЫ И ОКСАЗОЛЫ: РЕАКЦИИ И МЕТОДЫ СИНТЕЗА
[4,5-дигидрооксазол] [1 Н-имидазол] Н
Все три 1,3-азола — имидазол [1], тиазол и оксазол [2] — представляют собой очень стабильные соединения, не подверженные самоокислению. Оксазол и тиазол — смешивающиеся с водой жидкости с пиридиноподобным запахом. Имидазол, представляющее собой твердое вещество при комнатной температуре, и 1-метилимидазол также водорастворимые соединения, но без запаха. Их температуры кипения гораздо выше (256 и 199 вС), чем для оксазола (69 вС) и тиазола (117 ”С). Это, по-видимому, обусловлено сильной диполярной ассоциацией в результате разделения зарядов в молекулах имидазола (дипольный момент имидазола составляет 5,6 Д, в то время как оксазола и тиазола — 1,4 и 1,6 Д соответственно); к тому же для незамещенного имидазола наблюдается образование межмолекулярных водородных связей. Дигидро- и тетрагидропроизводные 1,3-азолов называют имидазо-лин/имидазолидин, тиазолин/тиазолидин и оксазолин/оксазолидин соответственно.
но2с
н гистидин
Из 1,3-азолов только оксазол не участвует в основных биохимических процессах, однако существуют вторичные метаболиты (особенно в морских организмах), которые включают в себя структуру тиазола (и оксазола), например антибиотик цистотиазол А из бактерий Cyctobacterfuscus [3]. Система имидазола лежит в основе незаменимой аминокислоты гистидина, выполняющей важные функции в процессах ферментативного протонного переноса. Родственный гистидину гормон гистамин вызывает расширение сосудов и служит основным фактором в аллергических реакциях, таких, как сенная лихорадка. Тиазолиевый цикл представляет собой активный химический центр кофермента тиамина (витамина В0.
ОМе ОМе
цистотиазол А
метронидазол (СНг)гОН
Среди синтетических 1,3-азолов, используемых [4] в качестве терапевтических препаратов, можно отметить циметидин (для лечения пептических язв) и метронидазол — антибактериальное и антипротозойное средство, используемое, например, для лечения амебной дизентерии. Розиглитазон применяют при диабете, а лозартан — антагонист ангиотензина II — антигипертензивный препарат.
21.1. РЕАКЦИИ С ЭЛЕКТРОФИЛЬНЫМИ РЕАГЕНТАМИ
21.1.1. Присоединение по атому азота
21.1.1.1. Протонирование
Имидазол, тиазол и алкилоксазолы (но не сам оксазол) образуют стабильные кристаллические соли с сильными кислотами за счет протонирования атома азота N(3), известные как соли имидазолил, тиазолил и оксазолия соответственно.
Имидазол — гораздо более сильное основание (рА'а 7,1), чем тиазол (рА^2,5), оксазол (р!^ 0,8) и даже пиридин (рА^ 5,2). Это обусловлено амидиноподобным резонансом, который позволяет обоим атомам азота на равных участвовать в делокализации заряда. Относительно низкую основность оксазола можно объяснить сочетанием индуктивного влияния электроотрицательного кислорода со слабым мезомерным электронодонорным действием. 1,3-Азолы устойчивы в горячих растворах сильных кислот.
Водородные связи имидазолов
Имидазол подобно воде представляет собой как хороший донор, так и хороший акцептор водородных связей, причем иминный атом азота — донор электрон-
ной пары, а N-водород, будучи в значительной степени кислым (разд. 21.4.1), — акцептор.
I , N
Это свойство имидазола играет центральную роль в деятельности некоторых ферментов, содержащих имидазольное кольцо гистидина, например пищеварительного фермента химотрипсина, который отвечает за гидролиз амидных связей пептидов в тонкой кишке: фермент переносит «протон» из одного положения в другое, что обеспечивается амбидентным характером имидазольного ядра. На приведенной ниже схеме показано, каким образом гетероцикл позволяет протону «двигаться взад и вперед» из одного положения в другое через гетероцикл.
Таутомерия имидазолов
Незамещенным по кольцевым атомам азота имидазолам свойственны таутомерные превращения, которые становятся очевидными в случае несимметрично замещенных производных, таких, как, например, показанный ниже метилими-дазол. Эта индивидуальная особенность химии имидазола означает, что назвать это соединение просто «4-метилимидазол» было бы ошибочным, так как его молекула находится в таутомерном равновесии с 5-метилимидазолом и практически неразделима с ним. Все подобные таутомерные пары неразделимы, поэтому условились называть их, например, 4(5)-метилимвдазол. В некоторых парах один из таутомеров преобладает: например, 4(5)-нитроимидазол существует преимущественно в виде 4-нитротаутомера в соотношении 400:1.
21.1.1.2. Алкилирование по атому азота
1,3-Азолы легко кватернизуются по иминному атому азота при действии алкил-галогенидов; скорости этих реакций соотносятся следующим образом: 1-метил-имидазол : тиазол : оксазол — 900 : 15 :1 [5]. Микроволновое облучение значительно ускоряет процесс [6]. Имидазолы, содержащие незамещенную труппу NH, образуют в этом случае сначала протонированный N-алкилимидазол, кото
рый затем может депротонироваться непрореагировавшим имидазолом и вторично вступать в реакцию; это означает, что при взаимодействии с алкилгалоге-нидами образуется смесь солей имидазолил, 1-ал кил имидазолил и 1,3-диалкил-имидазолия. Использование ограниченного количества алкилирующего агента или проведение реакции в щелочном растворе [7], где алкилированию подвергается имидазолил-анион (разд. 21.4.1), может свести к минимуму все эти сложности. Гладкое образование дважды алкилированных производных возможно при реакции 1-триметилсилилимвдазола с алкилгалогенидом [8]. N-Арилирование имидазолов, особенно эффективное при использовании катализа Cu(I), проявляет некоторую региоселективность в отношении 4(5)-замещенных имидазолов: как правило, в качестве основного продукта реакции образуются 1-арил-4-замещенные имидазолы [9].
€N /г—NMe 1~ г—NMe г.—NMe г—NMe MeCI r—N
\\Ме!,20;С^ -Н1г \ Melr (/ A л PhMe, 110‘С (/ Л
НН Me Me SiMe3
94%
Phi, (CuOTf)2.PhH Mi 1,10-фенантролин, dba CS2CO3, ксилол, нагревание
Me
4.5:1
N-Алкилирование оксазолов [10] или имидазолов, содержащих фенилсульфонильную или ацильную [11] группу на атоме азота, сильно затруднено, и для проведения гладкой реакции требуется метилтрифлат или соль Меервейна. Последующий простой алкоголиз сульфониламида имидазолил дает N-заме-щенный имидазол [12]; кроме того, процесс может быть использован для превращения спиртов в карбаматы [13]. Поскольку ацилирование 4(5)-замещенных имидазолов дает стерически менее затрудненные 1-ацил-4-замещенные имидазолы, последующее алкилирование, а затем гидролитическое удаление ацильной группы позволяет получать 1,5-дизамещенные имидазолы [14]. 1,4-Дизамещенные соединения образуются при алкилировании защищенных по положению 1 5-замещенных имидазолов (см. разд. 21.6.1). Алкилирование идет по атому азота N<3) с последующим удалением N-защиты [15]. N-Тритил-имвдазолы можно проалкилировать по атому азота простыми галогенидами, а затем удалить трифенилметильную группу в кислой среде [16]. Алкилирование акрилонитрилом по реакции Михаэля обратимо, что дает возможность получать 1,5-дизамещенные имидазолы путем N-алкилирования 1-(2-цианоэтил)-4-замещенных имидазолов с последующим элиминированием акрилонитрила [17].
PhCOCI Ph водн. NaOH Ме2СО 95% *
COPh
Et3O+BF4“
CH2CI2, 20 *С затем водн. Na2COg
Другой способ контроля за направлением N-алкилирования применим для гистидина и гистамина: на первой стадии образуется циклическая мочевина в результате реакции с карбонилдиимидазолом (разд. 21.1.1.3), ускоряющая алкилирование по другому атому азота, а дальнейшее раскрытие цикла приводит к образованию Ы(1)-алкилированного производного с уретановой защитной группой [18].
В «обычных» условиях реакции Манниха имидазол превращается в N-диме-тиламинометилимидазол, предположительно в результате атаки по иминному атому азота с последующим депротонированием другого атома азота [19].
21.1.1.3. Ацилирование по атому азота
Ацилирование имидазола дает N-ацилимидазолы через стадию элиминирования протона из первоначально образующейся 1Ч(3)-ацилимидазолиевой соли [20]. Такое ацилирование чаще всего проводят с использованием молярного соотношения гетероцикл — ацилирующий агент, равного 2:1; второй моль имидазола служит для депротонирования первоначально образующейся Ы^-аиил-имидазолиевой соли.
N-Ацилимидазолы гидролизуются легче, чем N-ацилпирролы, и для этого достаточно влаги воздуха. Нуклеофильнавя атака преимущественно идет по карбонильному атому углерода: коммерчески доступный 1,Г-карбонилдиимидазол (CDI), получаемый из имидазола и фосгена, можно использовать в качестве безопасного соединения, эквивалентного фосгену, т. е. как источник О=С2+, а также для активирования кислот к образованию амидов и эфиров через N-ацилимидазол [21].
О
карбонилдиимидазол (CDI)
В качестве другого применения можно упомянуть реакцию N-ацилимидазо-лов с алюмогидридом лития при 0 ”С, приводящую к альдегидам, что предполагает у исходных соединений ту же степень окисления, что и у кислот [22]. Родственное явление — использование «имидазилатов» в качестве прекрасных уходящих групп в 8к2-реакциях [23]. Они также используются как предшественники более реакционноспособных фторсульфонатов; такие превращения были проведены в масштабах 800 кг [24].
SO2CI2 d-Bu4N* n3“
DMF, -40 ‘С (/ U PhMe, 110 *С
96% N 90%
SO2OR
«имидазилат»
ОМе
21.1.2. Замещение по атому углерода
21.1.2.1. Протонирование
В кислых растворах по схеме протонирование/депротонирование обмен водорода в положении 5 имидазола происходит в 2 раза быстрее, чем в положении 4 и в >100 раз быстрее, чем в положении 2 [25]. Достаточно полный и быстрый обмен идет при комнатной температуре по положению 2 в нейтральной или слабоосновной, но не в кислой среде [26]; оксазол и тиазол также подвергаются селективному обмену водорода в положении 2, и относительные скорости процесса уменьшаются в следущем ряду: имидазол > оксазол > тиазол [27]. Механизм этого специфического процесса включает образование на первой стадии достаточной концентрации протонной соли, затем ее Сф-депрототонирование, приводящее к промежуточному илиду, в резонансную структуру которого существенный вклад вносит карбенная форма. Согласно этому механизму четвертичные соли N-алкилимидазолов, оксазолов и тиазолов также должны подвергаться селективному обмену водорода в положении 2, что и происходит на самом деле. Особое внимание [28] уделяется тиазолиевым солям (разд. 21.10) из-за возможности тиаминоподобного действия образуемых из них илидов в роли компонентов коферментов в некоторых биологических процессах [29]. Относительные скорости обмена по илидному механизму [30] уменьшаются в ряду: оксазолий > > тиазолий > N-алкилимидазолий в примерном соотношении 105:103:10.
Полагают, что илиды по С(5) образуются при декарбоксилировании 5-карбоновых кислот, для которых легкость потери СО2 увеличивается в ряду: оксазол- > тиазол- > 1Ч-алкилимидазол-5-карбоновая кислота, однако по сравнению с декарбоксилированием 2-карбоновых кислот элиминирование СО2 из положения 5 происходит в 10б раз медленнее, что обусловлено более низкой стабильностью 5-илидов и приводящих к ним переходных состояний [31].
21.1.2.2. Нитрование
Имидазол более реакционноспособен в отношении нитрования, чем толуол, и нитрование проходит через образование соли [32]; также нитруются и алкил-имидазолы [33]. Незамещенный тиазол не вступает в реакцию нитрования даже при использовании азотной кислоты в олеуме при 160 ”С, но метилтиазолы успешно нитруются, причем преимущественно образуются 5-нитро- и в меньшем количестве 4-нитропроизводные [34]; по положению 2 атака не идет: 4,5-диметилимидазол устойчив к нитрованию. Гораздо менее реакционноспособные оксазолы не подвергаются нитрованию.
O2N конц. HNO3
1%-ный олеум, 20 *С j
90%
N* Н
N2O4, BF3 /—n
20‘С->70*0 // \\
86% O2N^XcZ^Me
О
21.1.2.3. Сульфирование
Тиазолы, менее реакционноспособные, чем имидазолы [35], сульфируются в жестких условиях, и для этого требуются высокие температуры и присутствие сульфата ртути(П) в качестве катализатора [36]; случаи сульфирования оксазола неизвестны.
О дым. H2SO4, 160‘С J/~\\ — HO3S’-*XNX н н
21.1.2.4. Галогенирование
Имидазол [37] и 1-алкилимидазолы [38] очень легко бромируются по всем трем свободным положениям цикла. 4(5)-Бромимидазол можно получить восстановлением трибромимидазола [39] путем региоселективного обмена атомов галогена в положениях 2 и 5 с последующей обработкой водой [40] или бромированием 4,4-дибромциклогекса-2,5-диеноном [41]. Хлорирование гипохлоритом в щелочном растворе приводит к образованию 4- и 5-производных [42]. Иодирование не замещенных по атому азота имидазолов в щелочном растворе, идущее, следовательно, с образованием имидазолил-аниона, может также давать продукты полного галогенирования [43]; 4,5-дииодирование имидазола проходит в холодном растворе щелочи [44].
На первый взгляд достаточно неожиданно, что бромирование имидазола в положение 2 проходит в таких относительно мягких условиях, однако следует помнить, что нейтральный имидазол, а не его протонная соль (сравните нитрование и сульфирование) подвергается атаке. Электрофильное присоединение брома по атому азота, затем присоединение брома по положению 2 и конечное элиминирование бромоводорода — такие стадии можно включить в последовательность превращений.
Br. Вг. Вг.
ОВг2 Л—N водн. №250з У—N водн. NaOCI У—N
АсОН, NaOAc, 20JC // \\ нагревание // \\ NaOH, 20/С // \\
w 78% *"Br-^\NZ^Br 58% 81%
H H H H
Тиазол не удается легко пробромировать, однако 2-метилтиазол бромирует-ся по положению 5. Если это положение занято, то замещение не происходит; так, 2,5-диметилтиазол не подвергается атаке [45].
О галогенировании простых оксазолов не сообщалось.
21.1.2.5. Ацилирование
Ацилирование по Фриделю—Крафтсу для азолов неизвестно, очевидно, из-за взаимодействия между основным атомом азота и катализаторами процесса — кислотами Льюиса. Однако возможно 2-ароилирование 1-ал кил имидазолов [46] или даже незамещенного имидазола [47] реакцией с хлорангидридами кислот в присутствии триэтиламина, и замещение проходит через образование илида N-ацилимидазолия, как показано ниже. Подобным образом можно ввести цианогруппу в положение 2 реакцией с хлоридом М-циано-4-диметиламинопири-
диния [48]. Обратная реакция 2-дезацилирования может быть осуществлена с помощью метанолиза, и ее механизм снова включает образование илида имидазолил [49].
OPhCOCI, Et3N
MeCN, 20^ 71%
Me
NCOPh
-NCOPh
COPh
COPh
Другой замечательный пример использования илидов N-ацилимидазолия демонстрирует подход к эффективному синтезу 2-формилимидазола: электрофилом, который атакует илид в данном случае, служит катион N-бензилимида-золия [50].
PhCOCI, Et3N (1 П MeCN, 20 XNX 82% Н г—N COPh HCI, МеОН д—N COPhK0HU.HCl /T"N (1 затем На Pd/C (1 нагревание/^ Л Я 91% VX / 72% СН0 PhCO Н N-"”7 Н Н N—1 Н COPh COPh
21.1.2.6. Реакции с альдегидами
Открытие млсо-замещения кремния в положении 2 тиазола в мягких условиях привело к усовершенствованию этой реакции как важного этапа на пути к получению сложных альдегидов. Дальнейшая кватернизация, восстановление гетероцикла борогидридом натрия и последующая каталитическая реакция в присутствии Hg(II) или Cu(II) приводят к деструкции тиазолидина и образованию нового гомолога альдегида, как показано ниже [51]:
RCHO
СН2С12, 20‘С TBAFr SiMe3 92%
MeOTf
MeCN, 20г*С
NMe TfO"
H ОН
СиС12, CuO NaBH4 I—NMe водн. MeCN,
0?CH CzM __________________________-
H OH (3 стадии)
21.1.2.7. Реакции с иминиевыми солями
В стандартных кислотных условиях реакции Манниха не происходит С-замеще-ния в системах имидазола (ср. разд. 21.1.1.2), тиазола или оксазола.
21.2. РЕАКЦИИ С ОКИСЛИТЕЛЯМИ
Устойчивость к окислительному разложению уменьшается в ряду: тиазол > имидазол > оксазол. 2-Замещенные тиазолы можно превратить в N-оксиды [52], однако надкислоты разрушают имидазолы; N-оксиды оксазола могут быть получены только синтезом кольца.
21.3. РЕАКЦИИ С НУКЛЕОФИЛЬНЫМИ РЕАГЕНТАМИ
21.3.1. Реакции с раскрытием цикла
1,3-Азолам не свойственны реакции пиридинового типа, в которых происходит замещение атома водорода, хотя реакция Чичибабина для 4-метилтиазола описана в литературе [53]. Существуют, однако, реакции с нуклеофилами, приводящие к раскрытию гетероцикла; так, например, фенилгидразин атакует оксазолы с образованием озазонов [54]. При взаимодействии оксазола с горячим формамидом также происходит раскрытие цикла, а последующая рециклизация дает имидазолы. Ниже приведены возможные интермедиаты этого процесса:
hconh2 нагревание
88% **
21.3.2. Реакции замещения атома галогена
Существует много примеров замещения атома галогена в положении 2, например, взаимодействие 2-галогенотиазолов с серосодержащими нуклеофилами [55] (в действительности протекает быстрее, чем для 2-галогенопиридинов), а также 2-галогено-1-замещенных имидазолов [56] и 2-хлороксазолов [57] с азотистыми нуклеофилами.
PhSNa н— N
МеОН, 20JC // \\
75% \/^SPh
PhNHMe ксилол, 155^0
Я6% **
В особом случае, если в молекуле имидазола при атоме азота находится нит-рогруппа, которая может служить уходящей группой (в виде нитрита), наблюдается кине-замещение [58]
02n
kcn /7“Й
водн. МеОН, 20/С // \\
62%
Н
21.4. РЕАКЦИИ С ОСНОВАНИЯМИ
21.4.1. Депротонирование группы NH
Величина рА^ для имидазола равна 14,2; таким образом, он представляет собой относительно более сильную кислоту, чем пиррол (рА^ 17,5), из-за увеличения делокализации заряда на втором атоме азота в имидазолил-анионе.
21.4.2. Депротонирование СН
Специфический обмен водорода в положении 2 азолов в нейтральных средах через образование илида был уже обсужден в разд. 21.1.2.1. В сильноосновных растворах депротонирование происходит путем прямого отщепления протона от нейтральной гетероциклической молекулы в положениях, соседних с атомами кислорода и серы в оксазоле и тиазоле [59], и менее легко в положении 5 в N-ме-тилимидазоле [60].
21.5. РЕАКЦИИ N-МЕТАЛЛИРОВАННЫХ ИМИДАЗОЛОВ
Соли имидазолов могут быть проалкилированы или проацилированы по атому азота. Удобный метод заключается в использовании сухих солей натрия или калия, получаемых упариванием водно-щелочных расторов [61]; очень хорошо также использовать для этих целей гидрид натрия в диметилформамцде. Если реакция обратима, как, например, в случае присоединения непредельных сопряженных карбонильных соединений, 2,4(5)-замещенный имидазол будет давать менее пространственно затрудненный 1,2,4-тризамещенный продукт присоединения, а не 1,2,5-изомер [62]. Использование 1,3,4,6,7,8-гексагидро-1-метилпиримидо[1,2-д]пиридина (MTPD) особенно эффективно для ускорения присоединения имидазолов к непредельным эфирам и нитрилам [63]
водн. КОН, NaOH
—N упаривание досуха
\\ 100 *С при 0,4 мм рт.ст.
к
н
/Г\\ O2N O2N
CH^CHCN
Me { } MTBD, 80*C
€N N 92% N
й H (CH2)2CN
N
SO2Me
Реакция Манниха для имидазолов идет по атому азота, однако полный эффект замещения наблюдается при катализируемой основаниями циклизации оснований Шиффа гистамина; в отсутствие основания циклизация не идет и, по-видимому, образуется имидазолил-анион, который внутримолекулярно реагирует с иминной группой боковой цепи [64]
PhCH=O водн. КОН, нагревание 93%
21.6. РЕАКЦИИ С-МЕТАЛЛИРОВАННЫХ 1,3-АЗОЛОВ [65]
21.6.1. Литийорганические производные
В соответствии с закономерностями обсуждаемых выше обменных процессов препаративное депротонирование оксазолов [66], тиазолов [67] и N-метилими-дазола [68] под действием сильного основания идет по положению 2 или, если это положение занято, по положению 5 [69], а литийорганические производные
затем могут быть использованы в реакциях с электрофилами. Для трансформаций, на конечных стадиях которых необходимо получить не замещенные по атому азота имидазолы, подходят разнообразные уходящие N-защитные группы, включая фенилсульфонильную [70], диметиламиносульфонильную [71], диме-тиламинометильную [72], триметилсилилэтоксиметильную [73], 1-этокси этильную [74] и тритильную [75] (см. также разд. 21.13.). Внутренняя тенденция к литиированию по положению 2, а не 5 совместно с обменом металл - галоген по положению 4 дает простор для функционализации 1,3-азолов.
Например, получают 5-замещенные имидазолы с триметилсилилэтоксиме-тильной защитной группой с сохранением, если требуется, 2-силильного заместителя, как показано ниже [77]. Все три изомерные триметилсилилимидазолы и все три изомерные триметилстаннилимидазолы получают аналогично, обеспечивая таким образом подход к дальнейшему региоселективному млсо-замеще-нию электрофилами в мягких условиях [78].
О л-BuLi r—N s-BuU водная /г—N
THF, -78 *C Me3SiCI // \\ THF, -78 *C (PhS)2 кислота // n
4NZ*-SiMe3 PhS-*\N/
SEM SEM (общий) SEM
Кроме того, литиирование триметилсилилэтоксиметил-2-фенилимидазола идет по положению 4 [79] .Обмен металл-галоген в 4(5)-бромимидазоле возможен без использования защитной группы [80].
I.
/T"N. 2/n-CPBA, Na2HPO4 Г~N. LDA Y~N
// МеОН, 20 -С // \\ THF,-78‘C NIS _ // \\
90% 44Nz'o02Ph 82% YN'zYsO2Ph
SEM SEM SEM
n-BuLi
Et2O, -78 *C
затем Me3SiCI затем Me3SnCI
Br'
n-BuLi Et2O, -78 *C
Me3Sn
Me3Sn. I
водн. HCI Y“N |2 Y— N
THF, 20-C // \\THF,20’C# \\
SiMe3 90%
65%
Хотя для оксазолов все проходит аналогично и литиирование идет по положению 2, получение 4-замещенных соединений возможно лишь для некоторых электрофилов, что можно объяснить раскрытием цикла аниона с образованием енолята, который после С-элекгрофильной атаки снова циклизуется. Данные спектроскопии ЯМР показывают, что в равновесной смеси преобладает ациклический таутомер [81]. Еноляты с раскрытым циклом можно обнаружить реакцией с хлортриметелсиланом; при термической перегруппировке енольного триметилсилилового эфира с раскрытым циклом образуется 2-триметилсилилоксазол [82].
n-BuLi THF, -75 ‘С
Раскрытия цикла оксазолов можно избежать, если использовать триметил-станнилирование [83] или первоначально получать комплекс с бором, который затем литиировать, как показано ниже [84]:
ГA bh3.thf ту
+хВнз
/Г\\ LiTMP
THF,-78 *С Ph(CH2)2CH=CL
О 84%
Цинк- [80, 85] и оловоорганические производные [86] оксазола принимают участие в процессах сочетания (см. также ниже) без раскрытия цикла.
€N л-BuLi ZnCI2 \\ THF,-78 °C ж Et2O*
21.6.2. Реакции, катализируемые палладием
Реакции сочетания N-зашищенных имидазолов, катализируемые нульвалент-ным палладием, находят широкое применение, как показано на приведенных ниже примерах [87]. Реакция сочетания для 4,5-дииодимидазола, защищенного по положению N(i) триметилсилилэтоксиметильной группой, селективно идет по атому галогена в положении 5 [88].
21.7. РЕАКЦИИ СО СВОБОДНЫМИ РАДИКАЛАМИ
Радикальное замещение в имидазоле в кислой среде идет преимущественно по положению 2 [89]. В противоположность этому внутримолекулярное алкилирование 4-формилимидазола в нейтральной среде идет по положению 5 [90]. Известно также внутримолекулярное замещение тозильной группы в положении 2 [91].
CF3CON(CH2)2 c-C6H11CO2H,AgNO3 CF3CQN(CH2)2
Н >—N водн. H2SO4, (NH4)2S2O8 Н v-
// \\9^С________________ //
39% >
Н F
онс,
21.8. РЕАКЦИИ С ВОССТАНОВИТЕЛЯМИ
Наиболее легко восстанавливаются оксазолы, причем в присутствии катализатора происходит размыкание цикла с разрывом связи С—0.1,3-Азолиевые соли, без сомнения, легче атакуются гидридными восстанавливающими реагентами: соли тиазолия превращаются в тетрагидропроизводные [92].
21.9. ЭЛЕКТРОЦИКЛИЧЕСКИЕ РЕАКЦИИ
Оксазолы легко вступают в реакции циклоприсоединения по положениям 2 и 5 аналогично фуранам (разд. 15.8), тиазолы реагируют с алкинами подобным же образом (например, см. разд. 14.13.1.7), однако существует только один пример такого циклоприсоединения в химии имидазола. Тиазол и имидазол реагируют с высокоэлектрофильными алкинами через первоначальное электрофильное присоединение по атому азота с последующей внутримолекулярной нуклеофильной циклизацией [93].
MesSiCaCC^CSiMes 210*С__________
95%
Известны реакции циклоприсоединения оксазола с алкиновыми диенофилами (последовательно идущие реакции Дильса—Альдера, ретро-Дильса—Альдера и потеря нитрила приводят к образованию фуранов), с дегидробензолом (первичный аддукт может быть выделен) [95] и типичными алкеновыми диенофилами. Первичные аддукты присоединения синглетного кислорода перегруппировываются по недостаточно установленному механизму в триамиды, которые широко используются в органическом синтезе [96]. Что касается имидазола, существует только один пример внутримолекулярного взаимодействия, в результате которого после потери циановодорода образуется пиррол [97].
220 *С
1,3,5-(АРг)эС6Н^ 70%
•HCN
Особое внимание уделяется реакциям оксазола с типичными диенофилами Дильса-Альдера [98]. Аддукты могут быть превращены в пиридины другими способами (разд. 5.15.1.4). Наличие электронодонорных заместителей в оксазолах увеличивает скорость реакции: 5-алкоксиоксазолы сравнимы по реакционной способности с типичными полностью углеродными диенами. Особенно полезные диенофилы — N-ацилоксазолоны — используют в качестве синтонов для получения 1<ис-1,2-аминоспиртов [99].
г—NAc /т-т\ 144
Термически индуцируемая перегруппировка оксазол-4-альдегидов, оксазол-4-кетонов [100] и 5-этокси-4-амидов [101] происходит при достаточно низких температурах (90—120 вС) с образованием более стабильных карбонильных соединений. В качестве интермедиатов, как полагают, образуются нитрилий-еноляты
Отдельные примеры участия 1,3-азолов в качестве 2л-компонент в процессах циклоприсоединения включают реакцию 4-нитро-2-фенилоксазола с диенами по связи 4,5 [102] и внутримолекулярное циклоприсоединение, показанное ниже на примере имидазола, которое включает взаимодействие с элекгронодефи-цитным диеном и завершается потерей циановодорода [103]
1,3,5-(/-Рг)3С6Нз кипячение
52%
При наличии сильной электроноакцепторной группы у атома азота (но гораздо менее эффективной, чем, например, метоксиметильная) 5-винилимвда-зол может участвовать в реакции циклоприсоединения в качестве 471-компонента, как показано ниже [104]:
21.10. АЛКИЛ-1,3-АЗОЛЫ
Протоны алкильных групп в положениях 21,3-азолов достаточно кислые для того, чтобы депротонироваться в сильноосновных средах [105], а также более кислые, чем в других положениях; даже содействия карбоксилатной группы в о/уио-поло-жении обычно недостаточно для преодоления внутренней тенденции к литииро-ванию метильной группы в положении 2, однако соседство третичной амидной труппы влияет на направление литиирования [106]. Металлированные по боковой цепи производные можно использовать в реакциях с электрофилами. Наличие в положении 5 нитрогруппы позволяет проводить конденсации в гораздо более мягких условиях с применением основных катализаторов [33]. Конденсация по 2-ме-тильной группе тиазолов идет в растворах органических кислот [107].
n-BuLi
THF, -78 *С
N-Ацильная группа также повышает кислотность протонов 2-метильных трупп, что позволяет проводить С-ацилирование через невыделяемый енамид [108].
Bn
PhCOCI, Et3N MeCN
СН3 97%
21.11. ЧЕТВЕРТИЧНЫЕ СОЛИ 1,3-АЗОЛОВ
Гексафторофосфат 1-бутил-З-мстилимидазолия, жидкий при комнатной температуре и устойчивый по отношению к воде, рекомендован в качестве «ионной жидкости» и, как показано, служит эквивалентом диполярного апротонного растворителя в некоторых катализируемых основаниями процессах алкилирования; продукты реакции можно легко выделить экстракцией несмешивающи-мися органическими растворителями обычным образом [109].
N-Ацилоксикарбонил-1,3-азолиевые соли, генерируемые in situ реакцией с хлороформиатами, реагируют с аллилстаннанами [110] или аллилсиланами [111], присоединяя эквивалент аллил-аниона. Аналогично силиловые эфиры енола присоединяют эквивалент енолята с образованием 2,3-дигидро-2-заме-щенных имидазолов и тиазолов [112].
CICO2Et n-Bu3SnCH2CH=CH2 Et3N, CH2CI2, О ’С
96%
г—NCO2Et водн. KjFe(CN)6 N // V. Н КОН, нагревание // \\
78%
CO2Et Н
Азолиевые соли быстро атакуются нуклеофилами, например гидроксид-
ионом, и присоединение происходит по положению 2 с последующим раскры-
тием цикла [113]
/—NMeTsO водн. NH3
// \\ 20'С JT
Ph^Xoz^Ph 96% Ph
G PhCOCI водн. NaOH 87% *
H
COPh
H NDOPh
4NCOPh H
Осторожное использование этого процесса позволяет синтезировать гетероциклы среднего размера — продукты трехстадийной последовательности превращений, а именно: присоединение гидроксид-иона ксо-иодалкилтиазоли-евым солям, раскрытие цикла и последующая повторная циклизация в результате внутримолекулярного S-алкилирования, как показано ниже на примерах образования восьмичленного цикла [114], и введение атома серы в положение 2 имидазола с использованием фенилхлортионоформиата [115]:
сно CIC(S)OPh
/Т—N I(CH2)4I л-“Й(СН2)41 водн. 1М NaOH // \\ MeCN // \\ 20С f ] Xg/ XgX |- 52% (2 стадии) J г—N водн. NaHCQj г—N // \\кипячение // \\ Me-4N2 70о/о * Me-4NZ^SH н н
Обмен водорода в положении 2 азолиевых солей по илидному механизму был обсужден в разд. 21.1.2.1. Пирофосфат тиамина участвует в некоторых биохимических процессах в качестве кофермента, и при этом характер его действия зависит от промежуточно образующихся 2-депротонированных частиц. Например, на последних стадиях ферментативного алкоголиза, когда происходит превращение глюкозы в этанол и СО2, фермент пируватдегидрогеназа превращает пируват в этаналь и СО2, затем этаналь под действием фермента алкоксидегидрогеназы переходит в этанол. Полагают, что при действии первого фермента кофермент—тиаминпирофосфат — присоединяется в виде илида по кетонной карбонильной ipynne пирувата с последующей потерей СО2 и высвобождением этаналя с выделением первоначального илида.
В лабораторных условиях соли тиазолия [хлорид 3-бензил-5-(2-гидрокси-этил)-4-метилтиазолия коммерчески доступен] используют в качестве катализаторов для бензоиновой конденсации. В противоположность цианиду, классическому катализатору для ароматических альдегидов, он позволяет проводить подобные реакции и с алифатическими альдегидами; ключевые стадии катализа ионом тиазолия при синтезе 2-гидроксикетонов показаны ниже. Такой катализатор, который также находит и другие применения, позволяет в действительности получать ацил-анионы.
Интересен тот факт, что при замене тиазолиевого цикла на оксазолиевый получают аналог тиамина, не проявляющий каталитической активности [116]; аналогично иодид 3,4-диметилоксазолия не катализирует ацилоиновую конденсацию [117]. Природа выбирает гетероциклическую систему с правильным равновесием — илиды оксазолия образуются быстрее, но из-за их более высокой стабильности не происходит дальнейшего присоединения по карбонильной группе, которое требуется для проявления каталитической активности. В соответствии с карбеноидным характером тиазолиевых илидов происходит их димеризация; димеры как таковые или при превращении их в мономеры также катализируют бензоиновую конденсацию [118].
Илид 1,3-диметилимидазолия, генерируемый при использовании гидрида натрия, позволяет вводить электрофильные заместители в положение 2 [119]. Выделяемые кристаллические карбены получают из хлоридов 1,3-бис(адаманта-нил)имидазолия [120] и 1,3,4,5-тетрафенилимидазолия [121]. Стабильный тиа-зол-2-илиден содержит метильные группы в положениях 4 и 5 и 2,6-диизопро-пилфенильный заместитель при атоме азота [122].
21.12. ГИДРОКСИ-[123,124] И АМИНО-1,3-АЗОЛЫ [125]
Амино-1,3-азолы существуют в виде амино-таутомеров, хотя 2-арилсульфонил-аминотиазолы находятся в виде имино-таутомеров [126]. 2-Амино-1,3-азолы более стабильны, чем другие изомеры. Все амино-1,3-азолы протонируются по кольцевому атому азота. Для 2-аминотиазола величина рК равна 5,39, в то время
как для 2-аминоимидазола она равна 8,46, что отражает симметрию резонансной системы гуанидинового типа для последнего.
н н н н
Амино-1,3-азолы ведут себя как обычные ариламины, например конденсируются с карбонильными соединениями, легко вступают в реакции электрофильного замещения [127] и диазотирования [128], однако 2-аминооксазолы не диазотируются, по-видимому, из-за более высокой электроноакцепторности атома кислорода.
Zn
Br2 /T“N NaNO2 Cud /T“N АсОН, /T~N
АсОН, 65 ‘С // \\ 5NHCI,-5*С_ HCL // \\ нагревание // \\
59% \sZ^NH2 29%“^ 91%
Кислородсодержащие 1,3-азолы существуют в карбонильных таутомерных формах. Такие таутомерные формы не обладают ароматическим характером, что прекрасно иллюстрируется на примере кислотно-катализируемой димеризации имидазол-2-она, который проявляет в данном процесс свойства енамида [130]
Бромирование тиазол-2-она по положению 5 также хорошо иллюстрирует относительную реакционную способность: здесь двойная связь соединена и с атомом серы, и с атомом азота, но предпочтение отдается енамидному характеру, а не эфиру тиенола, что и определяет место электрофильной атаки [131]
Вг2
СНС13, 20-С
78% * Вг
РОС!3
Et3N, 120‘С
45%
1,3-Азол-2-оны превращаются в 2-галогенопроизводные под действием галогенидов фосфора [56]. Тиазолидин-2,4-дионы дают в этих условиях дигало-генотиазолы; в присутствии диметилформамида, т. е. в условиях реакции Вильсмейера, происходит также формилирование кольца и после восстановительного элиминирования галогена в конечном счете образуется гидроксиалкильное производное тиазола [132]
РОВгз, DMF
80‘С
72%
NaBH4 Н2, Pd/C 97%* 94% ”
1,3-Азол-5-оны конденсируются по альдольному типу по положению 4 [133]. Алкилирование 1,3-азолонов может идти как по атому кислорода, давая алкилоксиазолы, так и по атому азота; например, тиазол-2-он реагирует с диазометаном с образованием 2-метокситиазола, а с метилиодидом в присутствии метоксида получают З-метилтиазол-2-он [130].
гиппуровая кислота
МеСН=О
АсгО N PhH, пиридин
95 J \\ нагревание
55°/<Г 38%
азлактон Эрленмейера
4(5)-Оксазолоны представляют собой циклические ангидриды N-ацил-а-аминокислот и их конструируют из соответствующих аминокислот. Если при атоме азота находится алкильная группа, циклизация [134] может приводить только к полностью нейтральному соединению с цвиттерионной структурой, для которой невозможно написать нейтральную каноническую форму, а только мезоионную. Мезоионные оксазолоны (названные Хьюзгеном «мюнхноны» в честь Мюнхенского университета в Германии, где они были открыты) подвергаются быстрому диполярному циклоприсоединению [135] с потерей СО2 из первоначального аддукта. Приведенные ниже примеры [136] показывают превращение мюнхнона в мезоионный тиазолон и в имидазол:
21.13. N-ОКСИДЫ 1,3-АЗОЛОВ
Химия N-оксидов азолов гораздо менее изучена, чем, например, химия N-окси-дов пиридина, в основном из-за трудностей их получения из самих азолов. Для их получения можно использовать некоторые методы, основанные на синтезе кольца, например реакцию 1,2-дикарбонилмонооксимов с иминами [137]. 1-Замещенные имидазол-3-оксиды можно превратить в нитрилы с потерей кислорода при использовании триметилсилилцианида, причем тщательный подбор растворителя уменьшает возможность образования смеси изомеров [138].
N-Оксид 1-гидроксиимидазола можно превратить в 1-бензилоксиимидазол, который литиируется по положению 2, и в результате гидрогенолиза образуются 2-замещенные 1-гидроксиимидазолы, которые, в свою очередь, можно перевести в 2-замещенный имидазол восстановлением TiCl3 [139].
сно I сно
водн. СНгО, H2NOHfi~N BnBr, KOH PCI3
МеОН, 0 *C U МеОН, кипячение CHCfa, кипячение
*" *69% *"
N n-BuLi \\THF,-78*C DMF
OH
93%
XN/-CHO
OBn OBn
21.14. СИНТЕЗЫ 1,3-АЗОЛОВ [140,141]
21.14.1. Синтез кольца
Основные методы синтеза кольца оксазола, тиазола и имидазола имеют между собой много общего.
21.14.1.1. Из а-галогенокарбонильных соединений (или их эквивалентов) и трехатомного фрагмента, поставляющего два гетероатома и атом С(2) кольца
Реакция а-галогенокарбонильного соединения и трехатомного фрагмента, обеспечивающего введение гетероатомов и атома С(2), приводит к образованию пятичленного гетероцикла; этот метод особенно важен для синтеза тиазолов
Простые примеры такой стратегии, которая в случае тиазолов известна как синтез Ганча, приведены ниже: получение 2,4-диметилтиазола, где введение гетероатомов обеспечивается тиоацетамидом [142], и 2-аминотиазола, в синтезе которого 1,2-дихлорэтиловый эфир используют в качестве синтона для получения хлорэтаналя, а гетероатомы поставляются тиомочевиной [143]. Использование тиомочевин как источников атомов серы в реакции с 2-хлорацетамидами в качестве второго фрагмента дает выход к 2,4-диаминотиазолам [144]. Превращение 1,3-дикетонов в их 2-фенилиодониевые производные и последующее взаимодействие последних с тиомочевинами позволяет получать 2-амино-5-ацилти-азолы [145]. На первой стадии такого синтеза кольца происходит S-алкилирование [146]. Приемлемым вариантом служит также использование а-диазокетона вместо а-галогенокарбонильной компоненты [147].
Н20,100*С
NH2 80% *
EtO2C
NHz ГК
При взаимодействии аммиака с сероуглеродом получают в растворе дитиокарбамат аммония, который реагирует с 2-галогенокетонами с образованием ти-азол-2-тионов [148]; аналогично метилдитиокарбамат служит компонентой для построения 2-метилтиотиазола, который можно восстановить до тиазола, обеспечивая, таким образом, подход к незамещенному гетероциклу [149]:
Незамещенный имидазол можно успешно получить из этиленацеталя бромуксусного альдегида, формамида и аммиака; эта реакция подобна замещению галогена на аммиак, происходящему на ранней стадии [150]. Эфир енола броммалонового альдегида реагирует с амидинами с образованием 5-формилимид-азолов [151]. 2-Ацетиламиноимидазолы успешно получают при взаимодействии 2-бромкетонов с N-ацетил гуанидином [152]
Незамещенный оксазол получают из его 4,5-диэфира с последующим гидролизом и декарбоксилированием. Хотя формально такой метод и попадает в эту категорию синтезов, возможно, что кольцевой атом кислорода обеспечивается 2-гидроксикетоном, а не формамидом [153]; реакция ацилоинов с формамидом может, по-видимому, служить основным методом получения оксазолов [154]. Использование цианамида дает 2-аминооксазолы [155].
21Л 4.1.2. Циклодегидратацией а-ациламинокарбонильных соединений
Циклодегидратация а-ациламинокарбонильных соединений главным образом применима для получения оксазолов, а также может быть адаптирована для
синтеза тиазола
Классический метод получения оксазолов — синтез Робинсона—Габриэля, который формально аналогичен циклодегидратации 1,4-дикарбонильных соединений, приводящей к образованию фуранов (разд. 15.13.1 Л), — заключается в кислотно-катализируемой циклизации а-ациламинокарбонильных соединений [156].
КОНЦ. H2SO4
20 *С ж 72%
-Н2О
Построение амида из аминомалононитрила и карбоновой кислоты в типичных условиях пептидного синтеза сопровождается циклизацией с образованием 5-аминооксазола in situ [157]
Синтез этилового эфира оксазол-4-карбоновой кислоты, показанный ниже, иллюстрирует более сложное использование этой стратегии [158]:
H2N CI-н^ОьРг
EtO2CCH2NH2 57%
’О/'-Рг
HCO2Et EtOK 82%Ъ
а-Ацилтиокетон циклизуется с аммиаком с образованием тиазолов [159]:
nh4oac
АсОН, нагревание
72%
В двух современных вариантах замыкания кольца в рамках этой категории синтетических методов оксазолы получают, во-первых, катализируемой основаниями циклизацией иминохлоридных производных глицина, образующихся при ацилировании этилизоцианата [160], и, во-вторых, катализируемой основаниями циклизацией 3-ациламино-2-иод-1-фенилсульфонилалкенов [161]. Еще один метод синтеза — образование 2-тозиламиноимидазолов из изонитрила [162].
CNCH2CO2Et !--N Et3N
^HnCOCI о
PhSO2Na, I2
водн. EtOAc, hv, 80'C
38%
(EtO)2HCCH2NC
ArNH2,TsN(Na)CI
CH2CI2, 20 ’C
Иминоэфиры реагируют с аминоацеталем с образованием амидинов, которые в кислоте циклизуются в 2-замещенные имидазолы [163]
CHCfeCN
NaOMe, МеОН МеО (MeO)2CHCH2NH2
•78‘С-> 20‘С, \ 80 ’С
88% (2 стадии)
НСО2Н 80'С г 99%
\NZ^CHO н
21.14.1.3. Из изонитрилов
Тозилметилизонитрил (TOSMIC) может быть использован для синтеза всех трех типов 1,3-азолов
Этот изонитрил реагирует с альдегидами с образованием аддуктов, которые при нагревании отщепляюттолуолсульфонат, давая оксазолы [164], с сероуглеродом дают 4-тозил-5-алкилтиотиазолы (в результате последующего S-алкилирования) [165] и, по аналогии с взаимодействием с альдегидами, присоединяются к N-алкиламинам [166] или N-диметиламиносульфамилиминам [167]; после элиминирования толуол-сульфоната образуются имидазолы. Аналогичный бензотриазолилметилизонитрил может служить для тех же целей и в некоторых случаях имеет преимущества [168].
К2СО3
МеОН^ 94%
t-Bu
Анионы, образующиеся из других изонитрилов, ацилируют (и трифтораци-лируют [169]) и получают соединения, которые самопроизвольно циклизуются в оксазолы [170] (тиазолы).
ma MeNC, n-BuLi
Ме^со2Ме THF>.78.C *
NHBoc 76%
NHBoc
Оказалось, что 2-изоцианоакрилаты часто образуются в качестве интермедиатов: они реагируют с аминами с образованием имидазолов, с тиолами дают тиазолы, с замещенным гидразином — 2-аминоимидазолы (как показано ниже), а с О-бензилгидроксиламином — 1-бензилоксиимидазолы [171].
NHCHO NBS Me°2C\^NHCHO POCI3, Et3N CCI4> JT СН2С12, -20 ‘С
МеО2С . NH2NHBoc Y—NSC- EtgN, DMF, 2043
;n xA 62%
NHBoc
21.14.1.4. Оксазолы из а-диазокарбонильных соединений [172]
Карбен или карбеноид, получаемый из а-диазокарбонильного соединения, циклоприсоединяется к нитрилам с образованием оксазолов с нитрильным заместителем в положении 2
Генерирование карбена (или карбеноида при использовании катализа металлами) из а-диазокарбонильного соединения в присутствии нитрила приводит к полному циклоприсоединению и образованию оксазола. Используют как а-ди-азокетоны, так и а-диазоэфиры. На примере, приведенном ниже, показано, что
в последнем случае получают оксазол с кислородсодержащим заместителем в положении 5 [173]. Точная последовательность происходящих превращений
неясна, однако можно предположить, что она включает образование нитрил-
илида в результате электрофильного присоединения карбена к атому азота
нитрильной группы.
NC. м NC
y=N2 PhCN, Rh2(OAc)4 V-N
У CHCI3, кипячение // \\
MeO^Q 35% ** MeOx'XoZ^Ph
53%
(MeO2C)2C=N2
Rh(NHCOCF3)4 MeO‘
CHCI3, кипячение
21.14.1.5. Дегидрированием
Синтез кольца тетрагидро-1,3-азолов представляет собой просто образование N,N-,N,O- или N,S-аналогов циклических ацеталей альдегидов; синтез 4,5-дигидрогетероциклов требует применения синтонов со степенью окисления кислоты, а не альдегида. Следовательно, хорошим методом получения ароматических систем может служить дегидрирование их восстановленных или частично восстановленных аналогов. Чаще всего в качестве окислителей используют пероксид никеля [174], оксид марганца(1У) [175], бромид меди(П) [176] и систему бромтрихлорметан /диазабициклоундекан [177]. На приведенном ниже примере показано получение тетрагидротиазола из метилового эфира цистеина и хирального альдегида:
СНгОМе
СН2ОМе
21.14.2. Примеры некоторых важных синтезов с участием 1,3-азолов
21.14.2.1. 4(5)-Фторгистамин
4(5)-Фторгистамин [178] получают нуклеофильным замещением уходящей группы в боковой цепи (ср. с пирролами, разд. 14.12)
НС! NH3
ВОН EtOH
55%
PhN2 pH 4 90%*
НСО2Н
Н2, Pd/C
NHa затем НС!, нагревание
EtO2C^NNHph
71%
№NO2
водн. HBF4
О’С r hv 39%
UAIH4 %- N
Et20,20‘С // \\ SOCI2
40% НОСНг-X^Z ►
H
H
NHAc
C.Na+
26%
BOH, 5 ‘C
6h. HCI 95 ‘C
21.14.2.2. Пиридоксин [179]
Этот синтез иллюстрирует использование оксазола в результате циклоприсоединения Дильса—Альдера для получения пиридина
РдОю
СНС13.
нагревание 60% *
UAIH4
Et20,20 *С
40% *
21.14.2.3. Тиамин
Впервые тиамин был получен в 1937 г. [180]. Он широко применяется в качестве пищевой добавки и в фармацевтической промышленности. В современном методе синтеза тиамина [181] используют а-кетотиол; углеродный атом амидина служит источником углерода С(2), один из атомов азота попадает в тиазольное кольцо, а другой — в аминогруппу пиримидинового заместителя.
21.14.2.4. Тиено[2,3-сГ|имидазол
Синтез тиено[2,3-с(]имидазола снова иллюстрирует селективность процесса обмена галоген — металл в имидазолах. Приведенная последовательность превращений демонстрирует использование винильной группы в качестве новой N-защитной группы и включает нуклеофильное замещение атома брома в положении 4, активированного альдегидной группой в положении 5
Вг\__.. Вг(СН2)2Вг Вг\____ В\_к.
ЕШ водн. NaOH EtMgBr EtMgBr
n.-Zf кипячение^ кипячение THF, O’C* H2Ob Et20,0 ‘C^N-формил пиперидин
N 80% N 81% Г XNX 65%
H CH=CH2 СНжСНг
те.гУУ; EZ gy-Сн ка—
CH=CH2 CH=CH2 СН=СН2 Н
2 тиено[2,3-й]имидазол
21.14.2.5. Гроссуларин-2[183]
Синтез природного конденсированного соединения гроссуларина-2 основывается на двух ключевых стадиях: литиировании по положению 5 защищенного по атому азота 2-замещенного имидазола, что позволяет вводить олово для последующего сочетания, и электроциклизации изоцианата («2-азатриена», в котором одна двойная связь представляет собой двойную связь 2,3-имидазольного фрагмента)
Упражнения
Простые упражнения для проверки усвоения материала гл. 20 и 21
(а) Расположите 1,3-азолы в порядке их основности и объясните этот порядок.
(б) Какие проблемы связаны с N-алкилированием имидазолов?
(в) С какой целью используют карбонилдиимидазол и почему?
(г) Какие факторы следует рассматривать при обсуждении электрофильного замещения в 1,3-азолах? Как они сравнимы с этой точки зрения с пирролом, тиофеном и фураном соответственно?
(д) По какому положению происходит селективное депротонирование 1,3-азолов? Как исходя из этого можно получить 5-метилтиазол из тиазола?
(е) Назовите наиболее типичный электроциклический процесс для 1,3-азолов. Какому из 1,3-азолов в наибольшей степени присуще такое превращение?
(ж) Опишите один типичный метод синтеза имидазола, тиазола и оксазола.
Упражнения повышенной сложности
1. Предложите структуры галогеносодержащих соединений, образующихся в результате следующих превращений: (а) имидазол с NaOCl -> C3H2C12N; (б) 1-ме-тилимидазол с избытком Вг2в АсОН -> C4H3Br3N2, который затем взаимодействует с EtMgBr с последующей обработкой водой -> С4Н4Вг2Ы2, который, в свою очередь, реагирует с н-BuLi, затем с (МеО)2СО СбН7ВгЫ2О2.
2. Нарисуйте структуры промежуточных и конечных продуктов следующих реакций: (а) 4-фенилоксазол нагревают с бут-1-ин-З-оном -> СбНбО2; (б) 5-этоксиоксазол нагревают с диметиловым эфиром ацетилецдикарбоновой кислоты -> СюН|2Об.
3. При нагревании циклического ацилоина с-(СН2)юСОСН(ОН) с формамидом в присутствии кислоты образуется бициклический оксазол Ci3H2iNO; какова его структура? Затем этот бициклический оксазол под действием кислорода с последующим нагреванием превращается в ациклическую цианокислоту H02C(CH2)ioCN; напишите механизм этого процесса.
4. Предложите структуры соединений, образующихся на каждой стадии следующих последовательностей превращений: 1,2-диметил-5-нитроимидазол нагревают с Me2NCH(O-wpew-Bu)2 -> C8Hi2N4O2, который затем нагревают с Ас2О -> CioHi4N403. Это соединение реагирует (а) с гуанидином [H2NC(NH2)=NH] -> ОДоКбОг и (б) с MeNHNH2 -> C9HnN5O2.
5. Напишите структуры соединений, образующихся в следующей последовательности: 1-метил имид азол/ H-BuLi/-30 ’С, затем TMSC1 -> C7Hj4N2Si, затем н-BuLi/ -30 'С, затем TMSC1 -» Ci0H22N2Si2, МеОН/ 20 ’С -> C7Hi4N2Si, который отличается от первого соединения с той же брутто-формулой.
6. Объясните следующее: 4-бром-1-метилимидазол обрабатывают w-BuLi/—78 °C, затем диметилформамидом и получают С5НбК2О. Проведение этой же реакции при 0 ’С до прибавления диметилформамида приводит к образованию изомерного продукта реакции.
7. Тиазол-2-тион реагирует с Вг(СН2)3Вг и дает в основном соль CeHgNS/Br"; предложите ее структуру и механизм образования.
8. Предложите структуры 1,3-азолов, образующихся из следующих комбинаций реагентов: (а) 1-хлорбутан-2-он с тиомочевиной; (б) тиобензамвд с хлоруксусным альдегидом; (в) тиоформамид с этилбромацетатом.
9. Напишите структуры промежуточных соединений в синтезе 3,4-бис(ацетоксиме-тил)фурана: фенацилбромид^Н4+НСО2- -» C9H7NO; полученное соединение затем нагревают с АсОСН2СС=ССН2ОАс.
10. Какие имидазолы образуются из следующих реагентов: (a) MeN=C/w-BuLi и PhC=N; (б) 2-амино-1,2-дифенилэтан и H2NC=N?
Литература
1. «Advances in imidazole chemistry», Grimmett M. R. Adv. Heterocycl. Chem., 12, 103 (1970); «Advances in imidazole chemistry», ibid., 27,241 (1980); Schofield K, Grimmett M. R., Keene B. R. T. The azoles, Cambridge University Press, 1976; Grimmett M. R. Imidazole and benzimidazole synthesis, Academic Press, London, 1997.
2. «Advances in oxazole chemistry», Lakhan R., Temai B. Adv. Heterocycl. Chem., 17, 99 (1974); «The chemistry of oxazoles», Turchi I. J., Dewar M. J. S. Chem. Rev., 75, 389 (1975); «New chemistry of oxazoles», Hassner A., Fischer B. Heterocycles, 35, 1441 (1993).
3. «Synthetic studies with natural oxazoles and thiazoles», Pattenden G. J. Heterocycl. Chem., 29,607 (1992).
4. Zimgibl L. Azoles. Antifungal active substances—syntheses and used, Wiley-VCH, 1997.
5. Deady L. W. Aust. J. Chem., 26, 1949 (1973).
6. Bogdal D., Pielichowski J., Jaskot K. Heterocycles, 45,715 (1997).
7. Baxter R. A., Spring F. S. J. Chem. Soc., 1945,232; Roe A. M. J. Chem. Soc., 1963,2195.
8. Harlow К J., Hill A. P.t Welton T. Synthesis, 1996,697.
9. Kiyomori A., Marcoux J.-F., Buchwald S. L. Tetrahedron Lett., 40, 2657 (1999).
10. Hayes F.N., Rogers B.S., OttD. GJ. Am. Chem. Soc.,77,1850 (1955);OffP.G, Hayes F.N., Kerr V. N. ibid., 78,1941 (1956).
11. Ulibarri G., ChoretN., BiggD. С. H Synthesis, 1996,1287.
12. O’Connell J.F., Rapoport H. J. Org. Chem., 57,4775 (1992).
13. Batey R. A., Yoshina-Ishii C., Taylor S. D., Santhakumar V. Tetrahedron Lett., 40,2669 (1999).
14. Olofson R. A., Kendall R. V. J. Org. Chem., 35,2246 (1970).
15. Shapiro G.,Gomez-Lor B. Heterocycles, 41, 215 (1995).
16. Daninos-Zeghal S., MourabitA. A., Ahond A,, Poupat C., PotierP. Tetrahedron, 53,7604 (1997).
17. Collman J.P., Brbning M., Fu L., Rapta M., Schwenninger R, J. Org. Chem., 63, 8084 (1998).
18. Jain R., Cohen L. A. Tetrahedron, 52,5363 (1996).
19. Katritzky A. R., Rewcastle G. W., Fan W.-Q. J. Org. Chem., 53, 5685 (1988).
20. Caplow M., Jencks W. P. Biochemistry, 1,883 (1962); Reddy G. S., Mandell L., Goldstein J. H. J. Chem. Soc., 1963,1414.
21. Morton R. C., Mangroo D., Gerber G. E. Canad. J. Chem., 66,1701 (1988).
22. «Sytheses using heterocyclic amides (azolides)», Newer Methods of Prep. Oig. Chem., 5, 61 (1968).
23. Vatele J. -M., Hanessian S. Tetrahedron, 52, 10557 (1996).
24. Chou T, S, BeckeL. M., O’Toole J. C, CarrM. A., Parker В. E. Tetrahedron Lett., 37,17 (1996).
25. Wong J. L., Keck J, H. J. Oig. Chem., 39,2398 (1974).
26. Staab Н. A., Imgartinger Н., Mannschreck A., Wu М. Т. Justus Liebigs Ann. Chem., 695, 55 (1966).
27. Staab H. A., Wu M. T., Mannschreck A., Schwalbach G. Tetrahedron Lett., 15,845 (1964); Vaughn J. D., Mughrabi Z., Wu E. C. J. Org. Chem., 35, 1141 (1970); Takeuchi Y, Yeh H. J. C., KirkK. L., Cohen L. A. J. Oig. Chem., 43,3565 (1978).
28. Olofson R. A., Landesberg J. M. J. Am. Chem. Soc., 88, 4263 (1966); Coburn R. A., LandesbergJ. M., Kemp D. S, Olofson R. A. Tetrahedron, 26, 685 (1970).
29. Breslow R. J. Am. Chem. Soc., 80, 3719 (1958); Breslow R., McNelis E. ibid., 81, 3080 (1959); KlugerR., Karimian K, Kitamura К ibid., 109,6368 (1987).
30. Haake R, BausherL. P., Miller W. B. J. Am. Chem. Soc., 91, 1113 (1969).
31. Haake R, BausherL. R, McNeal J. P. J. Am. Chem. Soc., 93,7045 (1971).
32. Austin M. W., Blackborow J. R., Ridd J. H, Smith В. V. J. Chem. Soc., 1965, 1051.
33. Katritzky A. R., Ogretir C., Tarhan H. O., Dou H. M., Metzger J. V. J. Chem. Soc., Perkin Trans. 2,1975,1614.
34. Asato G. J. Oig. Chem., 33,2544 (1968).
35. Barnes G. R., Pyman F. L. J. Chem. Soc., 1927,2711.
36. Erlenmeyer H., Kiefer H. Helv. Chim. Acta, 28,985 (1945).
37. Balaban L E., Pyman F. L. J. Chem. Soc., 1922,947; Stensid K. -E., WahlbergK., Wahren R. Acta Scand., 27,2179 (1973).
38. O'Connell J. F, ParquetteL, Yelle W. E., Wang W., Rapoport H. Synthesis, 1988,767.
39. Balaban I. E., Pyman F. L. J. Chem. Soc., 1924,1564.
40. Iddon B., Khan N. J. Chem. Soc., PerkinTrans. 1,1987,1453.
41. Calo V, Ciminale F., Lopez L., Naco F., Todesco P. E. J. Chem. Soc., Perkin Trans. 1, 1972,2567.
42. Lutz А. Ж, DeLorenzo S. J. Heterocycl. Chem., 4, 399 (1967).
43. Pauly H., Arauner E. J. Prakt. Chem., 118, 33 (1928); Grozjak M. P., Wei L. J. Oig. Chem., 56,4296(1991).
44. Naidu M. S. R., Bensusan H. B. J. Oig. Chem., 33,1307 (1968).
45. Nagasawa R J. Pharm. Soc. Jpn., 60, 433 (1940) [Chem. Abs., 34, 5450 (1940)]; Ganapathi K., KulkarniK D. Current Sci., 21,314 (1952) [Chem. Abs., 45,5150 (1951)].
46. Regel E., Biichel К. -H. Justus Liebigs Ann. Chem., 1977,145.
47. Bastiaansen L. A. M., Godefroi E. F. Synthesis, 1978, 675.
48. Whitten J. P., McCarthy T. R., Matthews D. P. Synthesis, 1988,470.
49. Antonini I., Cristalli G., Franchetti P., Grifantini M., Gulini U., Martelli S. J. Heterocycl. Chem., 15, 1201 (1978).
50. Bastiaansen L. A. M., Van Lier P. M., Godefroi E. F. Org. Synth., Coll. Vol. VII, 1990, 287.
51. «The thiazole aldehyde synthesis», DondoniA. Synthesis, 1998,1681.
52. OchiaiE., Hayashi E. J. Pharm. Soc. Jpn., 67,34 (1947) [Chem. Abs., 45, 9533 (1951)].
53. Ochiai E., Nagasawa H. Chem. Вег., 72B, 1470 (1939).
54. BrederickH., GompperR., Reich F., Gotsmann U. Chem. Ber., 93,2010 (1960).
55. Bosco M., Forlani L., Liturri V., Riccio P., Todesco P. E. J. Chem. Soc. (B), 1971, 1373; Bosco M., Liturri V, Troisi L., Forlani L., Bodesco P. E. J. Chem. Soc., Perkin Trans. 2, 1974,508.
56. De Bie D. A., van der Plas H. C. Guersten G., Reel. Trav. Chim. Pays-Bas, 90,594 (1971).
57. GompperR., EjfenbergerF. Chem. Ber., 92,1928 (1959).
58. Suwinski J., Swierczek K. Tetrahedron Lett., 39, 3331 (1998).
59. Forlani L., Magagni M., Todesco P. E. Chim. Ind. (Milan), 60, 348 (1978) [Chem. Abs., 89,179289 (1978)]; Landsberg!. M., Houk К N., Michelman J. S. J. Am. Chem. Soc., 88, 4265 (1966).
60. Takeuchi Т,, Yeh Н. J. С, Kirk К L., Cohen L. A. J. Org, Chem., 43,3565 (1978).
61. Begtrup M., Larsen P. Acta Scand., 44, 1050 (1990).
62. Bhujanga Rao A. K, S., Rao C, G., Singh В. B, Synth. Commun., 21,427 (1991); idem J. Org. Chem., 55,3702 (1990).
63. Horvath A, Tetrahedron Lett., 37,4423 (1996).
64. Stocker F. B., Fordice M. W„ Larson J. K, Thorstenson J. H. J. Org. Chem., 31, 2380 (1966).
65. «Synthesis and reactions of lithiated monocyclic azoles containing two or more heteroatoms. Patr II: Oxazoles» Iddon B. Heterocycles, 37, 1321 (1994); «Part IV: Imidazoles», Iddon B., Ngochindo R. I. ibid, 38, 2487 (1994); «PartV: Isothiazoles and thiazoles», Iddon B. ibid., 41,533 (1995).
66. Hodges J, C, Patt W, C, Conolly C, J, J. Org. Chem., 56,449 (1991).
67. Dondoni A., Mestellani A. R., Medici A.t Negrini E., Pedrini P. Synthesis, 1986, 757; Dondoni A., Fantin G., Fagagpolo M.f Medici A., Pedrini P, J. Oig. Chem., 53, 1748 (1988).
68. «Metallation and metal-halogen exchange reactions of imidazoles», Iddon B. Heterocycles, 23, 417 (1985); Ohta S., Matsukawa M., Ohashi N., Nagayama К Synthesis, 1990,78.
69. Ngochindo R. I. J. Chem. Soc., Perkin Trans. 1,1990,1645.
70. SundbergR. J. J. Heterocycl. Chem., 14,517 (1977).
71. Bell A. S., Roberts D. A.f Ruddock K. S, Tetrahedron Lett., 29,5013 (1988).
72. Lipshutz B, H, HuffB., Hagen W. Tetrahedron Lett., 29, 3411 (1988).
73. Curds N. J., Brown R. S. J. Oig. Chem., 45,4038 (1980).
74. Manoharan T, S., Brown R. S. J. Oig. Chem., 53,1107 (1988).
75. KirkK L. J. Oig. Chem., 43,4381 (1978).
76. Shapiro G., Gomez-Lor B. Heterocycles, 41, 215 (1995).
77. Vollinga R. C, Menge W. M, P. B., Timmerman H. Reel. Trav. Chim. Pays-Bas, 112,123 (1993).
78. Pinkerton P. H, Thames S. F. J. Heterocycl. Chem., 9, 67 (1972); Medici A., Pedrini P., DondoniA. J. Chem. Soc., Chem. Commun., 1981,655.
79. Phillips J. G., Fadnis L., Williams D. R, Tetrahedron Lett., 38,7835 (1997).
80. Katrizky A. R., Slawinski J. J., Brunner E, Gorun S. J. Chem. Soc., PerkinTrans. 1,1989, 1139.
81. Crowe E.f HossnerF., Hughes M, J. Tetrahedron, 52,8889 (1995).
82. Dondoni A,, Fantin G., Fogagnolo M., Medici A., Pedrini P, J. Oig. Chem., 52,3413 (1987).
83. Ham N, K, Gramer C, J., Anderson B. A. Tetrahedron Lett., 36,9453 (1995).
84. Vedejs E„ Monahan S. D. J. Oig. Chem., 61,5192 (1996).
85. Anderson B. A., Ham N. К Synthesis, 1996, 583.
86. Vedejs E., Monahan S. D. J. Org. Chem., 62,4763 (1997).
87. Cliff M. D.t Pyne S, G. Tetrahedron, 52, 13703 (1996); idem Synthesis, 1994,681.
88. Kawasaki L, Katsuma H, Nakayama Y., Yamashita M., Onto S. Heterocycles, 45, 1887 (1998).
89. Jain R., Cohen L. A., King M. M. Tetrahedron, 53,4539 (1997).
90. Aldabbagh E, Bowman W. R., Mann E. Tetrahedron Lett., 38, 7937 (1997).
91. Aldabbagh E, Bowman W. R. Tetrahedron Lett., 38,3793 (1997).
92. Clark G. M., Sykes P. J. Chem. Soc. (C), 1967,1269,1411.
93. Nbbott P. J., Acheson R. M., Eisner U.t Wiatkin D. J,, Carruthers J. R. J. Chem. Soc., Perkin Trans. 1, 1976, 1269; Huisgen R., Giese B., Huber H, Tetrahedron Lett., 1967, 1883; Acheson R. M., Vernon J. M. J. Chem. Soc., 1962,1148.
94. Ohisen S. R., Turner S. J. Chem. Soc. (C), 1971,1632; Hutton J., Potts B., Southern P. E
Synth. Commun., 9, 789 (1979); Konig H, Graf E, Webemddifer Justus Liebigs Ann. Chem., 1981, 668; Liotta D., Saindane M., Ott W. Tetrahedron Lett., 24, 2473 (1983); Kawada K, Kitagawa, Kobayashi Y. Chem. Pharm. Bull., 33, 3670 (1985).
95. Whitney S, E., Rickbom B. J. Oig. Chem., 53, 5595 (1988).
96. Wasserman H H, Gambale R. J., Pulwer M. J. Tetrahedron, 37,4059 (1981).
97. Wuonola M. A., SmallheerJ. M, Tetrahedron Lett., 33,5697 (1992).
98. «Конденсация оксазолов с диенофилами — новый метод синтеза пиридиновых оснований», Карпейский М. Я., Флорентъев В, Л. Усп. хим., 38, № 7,1244 (1969).
99. Deyrup J. A.f Gingrich Н. L. Tetrahedron Lett., 1977, 3115; Ishizuka Е, Osaki М, Ishihara Н, Kunieda Т. Heterocycles, 35,901 (1993).
100. Dewar M. J. S, Turchi I. J. J. Am. Chem. Soc., 96,6148 (1974).
101. Corrao S., MacielagM., Turchi I. J. J. Org. Chem., 55,4484 (1990).
102. Nesi R., Turchi S, Giomi D., Papaleo S, J. Chem. Soc., Chem. Commun., 1993,978.
103. Wan Z., Snyder J. K. Tetrahedron Lett., 38, 7495 (1997); Neipp С. E., Ranslow P. B., Wan Z., Snyder J. K. ibid., 38,7499 (1997).
104. Deghati P. Y F., WannerM. J., Koomen G.-J. Tetrahedron Lett., 39,4561 (1998).
105. Noyce D. S, Stowe G. T., Wong W J. Oig. Chem., 39, 2301 (1974); Lipshutz В, H, Hungate R, W. J. Oig. Chem., 46,1410 (1981); Knaus G. N, Meyers A. I. J. Oig. Chem., 39, 1189(1974).
106. CornwallP., Dell С. P., Knight D. W Tetrahedron Lett., 28,3585 (1987).
107. Van Amum S. D., Ramig K, Stepsus N. A., Dong Y, Outten R. A. Tetrahedron Lett., 37, 8659 (1996).
108. MaccoA. A., Godefroi E. E, Drouen J. J. M. J. Org. Chem., 40,252 (1975).
109. Earle M. J., McCormacP, B., Seddon K. R. Chem. Commun., 1998, 2245.
110. Itoh T., Hasegawa H, Nagata K, Ohsawa A. J. Oig. Chem., 59,1319 (1994).
111. Itoh T, Miyazaki M., Nagata K, Ohsawa A. Heterocycles, 49,67 (1998).
112. Itoh T., Miyazaki M., Nagata K., Matsuya Y., Ohsawa A. Heterocycles, 50, 667 (1999).
113. Ott D. G., Hayes E N, Kerr V. N. J. Am. Chem. Soc., 78, 1941 (1956); Ruggli P., Ratti R., Henzi E. Helv. Chim. Acta, 12,332 (1929).
114. Federsel H.-J., Glasane G., Hogstrdm C, Wiesta J., Zinko B.f Odman C. J. Oig. Chem., 60,2597 (1995).
115. Yu J., YadariJ.-C. Synlett, 1995,239.
116. Yount R. G., Metzler D. E. J. Biol. Chem., 234,738 (1959).
117. Hafferi W., Lundin R., Ingraham L. L, Biochemistry, 2, 1298 (1963).
118. Castells J., Lopez-Calahorra E, Geijo F., Perez-Dolz R., Bassedas M. J. Heterocycl. Chem., 23, 715 (1986); Teles J. H, Melder J.-P., Ebel K, Schneider R., Gehrer E, Harder W., Erode S., Enders D., Breuer K,f Raabe G. Helv. Chim. Acta, 79,61 (1996).
119. Begtrup M. J. Chem. Soc., Chem. Commun., 1975, 334.
120. Arduengo A. J.t Harlow R. L., Kline M. J. Am. Chem. Soc., 113, 361 (1991).
121. Arduengo A. J.,Goerlich J. R., Krafczyk R., Marshall-W. J. Angew. Chem., Int. Ed. Engl., 37, 1963 (1998).
122. Arduengo A. J., GoerlichJ. R., Krafczyk R., Marshall W. J. Liebigs Ann./Recueil, 1997,365.
123. «Recent advances in oxazolone chemitstry», Filler R. Adv. Heterocycl. Chem., 4, 75 (1965).
124. «The chemistry of l,3-thiazolinone/hydroxy-l,3-thiazole systems», Barrett G. C. Tetrahedron, 36,2023 (1980).
125. «4-Unsubstituted, 5-amino and 5-unsubstituted, 4-aminoimidazoles», Lythgoe D. J., Ramsden C. A. Adv. Heterocycl. Chem., 61,1 (1994).
126. Forlani L. Gazz. Chim. ltd., Ill, 159 (1981).
127. Erlenmeyer H, Kiefer H. Helv. Chim. Acta, 28, 985 (1945).
128. McLean J., Muir G. D. J. Chem. Soc., 1942, 383; Kirk K. L., Cohen L. A. J. Am. Chem. Soc., 95,4619 (1973).
129. GompperR., Christmann O. Chem. Ber., 92,1944 (1959).
130. Zigeuner G, Rauter W. Monatsh. Chem., 97, 33 (1966).
131. Klein G, PrijsB. Helv. Chim. Acta, 37,2057 (1954).
132. Kerdesky F. A, SeifL. S. Synth. Commun., 25,2639 (1995).
133. Crawford M., Little Ж T. J. Chem. Soc., 1959,729.
134. Bayer H. O. Huisgen R., Knorr R., Schafer P. C, Chem. Ber., 103,2581 (1970).
135. «Cycloaddition chemistry of anhydro-4-hydroxy-l,3-thiazolium hydroxides (thioiso-munchnones) for the synthesis of heterocycles», PadwaA., HarringS. R., HertzogD. L., Nadler W. R. Synthesis, 1994,993.
136. Huisgen R., Funke E, Gotthardt H, Panke H.-L. Chem. Ber., 104, 1532 (1971); Consonni R., Croce P. D., Ferraccioli R., La Rosa C. J. Chem. Rec., (S), 1991,188.
137. Mioston G, Gendek T., Heimgartner H. Helv. Chim. Acta, 81, 1585 (1998).
138. Alcazar J., Begtrup M., de la HozA. J. Oig. Chem., 61,6971 (1996).
139. Eriksen B. L., Vedso R, Morel S, Begtrup M. J. Oig. Chem., 63,12 (1998).
140. Уили P. X., Инглэнд Д. К, Бэр Л. К «Синтез тиазолов» в сб. Органические реакции, т. 6, с. 301, ИЛ, М., 1953.
141. Grimmett М. R. Imidazole and benzimidazole synthesis, Academic Press, 1997.
142. Шварц Дж. Синтезы органических препаратов, т. 3, с. 197, ИЛ, М., 1952.
143. Vogel’s Textbook of Practical Organic Chemistry, 4th Ed., 929.
144. FlaigR., Hartmann H. Heterocycles, 45,875 (1997).
145. Moriarty R. M., Void В. K., Duncan M. P., Ley S. G., Prakash O., Goyal S. Synthesis, 1992, 845; Kamproudi H, Spyroudis S., Tarantili P. J. Heterocycl. Chem., 33, 575 (1996).
146. Babadjamian A., Gallo R., Metzger J., Chanon M. J. Heterocycl. Chem., 13, 1205 (1976).
147. Kim Н-S., Kwon L-С., Kim O.-H. J. Heterocycle. Chem., 32,937 (1995).
148. Buchman E. R., Reims A., SarjentH. J. Oig. Chem., 6,764 (1941).
149. Brandsma L.f de Jong R. L. P., VerKruijsse H. D. Synthesis, 1985,948.
150. BrederickH, GompperR., BangertR., HerlingerH. Angew. Chem., 70,269 (1958).
151. ShilcratS. C., MakhallatiM. K, FortunakJ. M. D., Pridgen L. N. J. Org- Chem., 62,8449 (1997).
152. Litle T. L.f Webber S. E. J. Org. Chem., 59,7299 (1994).
153. Brederick H, Bangert R. Angew. Chem., Int. Ed. Engl., 1,662 (1962).
154. Brederick H, Gompper R. Chem. Ber., 87, 726 (1954); Lombardino J. G. J. Heterocycl. Chem., 10, 697 (1973); Wasserman H. H, Druckrey E. J. Am. Chem. Soc., 90, 2440 (1968).
155. CockerillA. P., Deacon A., Harrison R. G., Osborne D. J., Prime D. M., Ross W. J., Todd A., Verge J. P. Synthesis, 1976, 591.
156. Wasserman H. H, VinickF. J. J. Org. Chem., 38,2407 (1973).
157. Freeman P., Chen T., van der Linden J. B. Synthesis, 1997,861.
158. Comforth J. W., Comforth R. J. Chem. Soc., 1947,96.
159. Dubs P., StuesSi R. Synthesis, 1976,696.
160. Huang W.-S., Zhang Y.-Z., Yuan C.-Y. Synth. Commun., 26,1149 (1996).
161. Short К. M., Ziegler С. B. Tetrahedron Lett., 34,71 (1993).
162. Bissio R., Marcaccini S, Pepino R., Torroba T. J. Oig. Chem., 61,2202 (1996).
163. Galeazzi E., Guzman A., Nava J. L., Liu Y., Maddox M. C., Muchowski J. M. J. Oig. Chem., 60,1090 (1995).
164. Van Leusen A. M., Hoogenboon В. E., Siderius H. Tetrahedron Lett., 1972, 2369;
van Leusen A. M., Oldenziel О. H. ibid., 1972, 2373; Kulkami B. A., Ganesan A. Tetrahedron Lett., 40,5637 (1999).
165. Van Leusen A. M., Wildeman J. Synthesis, 1977, 501.
166. Van Leusen A. M., Wildeman L, Oldenziel О. H. J. Oig. Chem., 42, 1153 (1977).
167. Ten Have R., Huisman M., Meetsma A., Van Leusen A. M. Tetrahedron, 53, 11355 (1997).
168. KatritzkyA. R., Cheng D., Musgrave R. P. Heterocycles, 44, 67 (1997).
169. Hartman G. D., Weinstock L. M. Org. Synth., Coll. Vol. VI, 1988,620.
170. Schroder R., Schollkopf U., Blume E., Hoppe I. Justus Liebigs Ann. Chem., 1975, 533; Hamada Y., Morita S., Shioiri T. Heterocycles, 17, 321 (1982); Ohba M., Kubo H, Fujii T., Ishibashi H, Sargent M. V, Arbain D. Tetrahedron Lett., 38,6697 (1997).
171. Yamada M., Fukui T., Nunami K. Synthesis, 1995,1365.
172. Moody C. J., Doyle K. J. Progr. Heterocycl. Chem., 9,1 (1997).
173. Doyle К J., Moody C. J. Tetrahedron, 50, 3761 (1994).
174. Evans D. L., Minster D. K, Jordis U., Hecht M., MazzuA. L., Meyers A. L J. Org. Chem., 44,497 (1979).
175. Ninomiya K, Satoh H., Sugiyama T., Shinomiya M., Kuroda R. Chem. Commun., 1996, 1825; Sowinski J. A., ToogoodP. T. J. Oig. Chem., 61, 7671 (1996).
176. Barrish J. C., Singh J., Spergel S. H, Han W. C., Kissick T. P., Kronenthal D. R., Mueller R. H. J. Org. Chem., 58,4494 (1993).
177. Williams D. R., Lowder P. D., Gu Y.-G., Brooks D. A. Tetrahedron Lett., 38,331 (1997).
178. Montgomery J. A., Hewson K, Struck R. P., Sheely Y. F. J. Org. Chem., 24, 256 (1959); Kirk K. L., Cohen L. A. J. Am. Chem. Soc., 95,4619 (1973).
179. Hams E. E, Firestone R. A., Pfister K, Boettcher R. R., Cross F. J., Currie R. B., Monaco M., Peterson E. R., Renter W. J. Org. Chem., 27, 2705 (1962); Doktorova N. D., Lonova L. V., Karpeisky M. Ya., Padyukova N. Sh., Turchin К. E, Florentiev V. L. Tetrahedron, 25,3527 (1969).
180. Todd A. R., Bergel F. J. Chem. Soc., 1937,364.
181. ContantP., ForzyL., Heingartner U, Moine G. Helv. Chim. Acta, 73, 1300 (1990).
182. Hartley D. J., Iddon B. Tetrahedron Lett., 38,4647 (1997).
183. Choshi T., Yamada S, Sugino E, Kuwada T., Hibino S. J. Org. Chem., 60,5899 (1995).
22
1,2-АЗОЛЫ - ПИРАЗОЛЫ, ИЗОТИАЗОЛЫ И ИЗОКСАЗОЛ Ы:
РЕАКЦИИ И МЕТОДЫ СИНТЕЗА
пиразол 5 [1Н-лиразол]
,3
4
5^1ZN2 5<^1ZN2 X /NH
изотиазол S изоксазол О изоксазолин изоксазолидинО
[4,5-дигидроизоксазол]
По своим физическим свойствам все три 1,2-азола — пиразол [1], изотиазол [2] и изоксазол [3] — можно сравнить и противопоставить с их 1,3-изомерными двойниками. Подобно имидазолу пиразол — единственный из этих трех соединений, представляющий собой твердое вещество при комнатной температуре, — имеет высокую температуру кипения (187 °C), причем гораздо выше, чем у изотиазола и изоксазола (114 и 95 °C соответственно); это обусловлено наличием межмолекулярных водородных связей, присущих только пиразолу. Такие ассоциации, по-видимому, принимают формы димеров, тримеров и олигомеров; без сомнения, имидазол не способен образовывать димеры. Каждый из 1,2-азолов имеет запах, подобный пиридиновому, но лишь частично растворим в воде. Дигидро- и тетрагидрогетероциклы носят названия пиразолин/пиразо-лидин, изотиазолин/изотиазолидин и изоксазолин/изоксазолидин. Быстрая таутомерия, заключающаяся в перемещении атома водорода от одного атома азота к другому, так же как и в имидазоле, означает, что замещенные пиразолы неизбежно представляют собой смеси, и номенклатура этих соединений аналогична той, которая применяется для имидазолов. В качестве примера приведем 3(5)-метилпйразол:
3(5)*метилпиразол
Фенилбутазон используют для лечения тяжелых форм артрита, которым кстати страдали многие знаменитые люди и среди них Казанова, Гете и Лютер. Лефлуномид применяют в терапии автоиммунных заболеваний, таких, как прогрессирующий ревматоидный артрит. Селекоксиб — один из наиболее продаваемых препаратов из ряда селективных ингибиторов циклоксигеназы 2 (СОХ 2), который весьма перспективен в качестве противовоспалительного и анальгетического средства без нежелательных побочных эффектов, присущих другим противовоспалительным нестероидным препаратам. Существует много красителей на основе производных пиразола, один из них — пищевой краситель тартразин.
фенилбутазон
22.1. РЕАКЦИИ С ЭЛЕКТРОФИЛЬНЫМИ РЕАГЕНТАМИ
22.1.1. Присоединение по атому азота
22.1.1.1. Протонирование
Наличие связи между двумя гетероатомами приводит к значительному снижению основности, подобно тому как это наблюдается в гидразине и гидроксиламине (рЛ'д ЫНз 9,3; H2NNH2 7,9; HONH2 5,8). По этой же причине в случае 1,2-азолов величина рЛа пиразола равна 2,5, что на 4,5 меньше, чем для имидазола, а изотиазола (—0,5) и изоксазола (—3,0) — на 3 единицы ниже значений рКа их 1,3-изомеров. Более высокая основность отражает симметрию катиона с двумя эквивалентными по вкладу резонансными структурами. Несомненно, что атом кислорода оказывает гораздо большее электроноакцепторное влияние, чем атом серы.
NaH, (PhCO2)2
THF, 20‘С r Н2О^
47%
22.1.1.2. Окисление по атому азота
1-Гидроксипиразолы можно получить либо в присутствии надкислоты [4], либо в щелочных условиях [5], когда образуется пиразолил-анион, который реагирует с окисляющим агентом — дибензоилпероксидом.
22.1.1.3. Алкилирование по атому азота
1,2-Азолы гораздо труднее подвергаются кватернизации, чем их 1,3-аналоги: например, для изотиазолов требуются такие активные реагенты, как бензилга-логениды или соли Меервейна [6]. Кроме того, соли изоксазолия особенно подвержены раскрытию цикла (см. разд. 22.11). 3(5)-3амещенные пиразолы, не имеющие заместителей у атома азота, могут, вообще говоря, превращаться в два изомерных N-алкилпиразола после отщепления протона от атома азота, и здесь возникает уже следующая сложность — первоначально образующееся соединение способно подвергаться дальнейшей реакции, давая М,Ы'-дизамещенную четвертичную соль [7]. Однако кватернизация уже 1-замещенного пиразола обычно требует более жестких условий, что, без сомнения, обусловлено стери-ческими препятствиями за счет присутствия заместителя у соседнего атома азота. Микроволновое облучение повышает скорость N-алкилирования [8].
22.1.1.4. Ацилирование по атому азота
Введение ацильных [9] или фенилсульфонильных [10] групп к атому азота проводят в присутствии слабого основания, например пиридина; такие процессы идут путем ацилирования иминного атома азота с последующим депротонированием фрагмента N+—Н. Реакции ацилирования, в противоположность реакциям алкилирования, обратимы, и при этом образуется более устойчивый продукт реакции.
АсС1 пиридин, 20 *С
79%
Пиразол очень эффективно реагирует с цианамидом, давая N-производное, которое можно использовать в реакциях с первичными или вторичными аминами для получения гуанидинов [11]. Превращение пиразолилгуанидина в дважды /лре/я-бутоксикарбонил-защищенный пиразолилгуанидин позволяет использовать его для прямого синтеза защищенных гуанидинов, как показано ниже [12]:
nh2cn, hci
—71 (Boc)2O, LiH
'n THF, кипячение 69%
BocN NBoc
120;C f-BuNH
H2N^NH2 СГ BocNNBoc H
22.1.2. Реакции замещения по атому углерода
22.1.2.1. Нитрование
Пиразол [13] и изотиазол [14] напрямую подвергаются нитрованию по положению 4, а менее реакционноспособный изоксазол нитруется лишь с незначительным выходом, однако 3-метилизоксазол обладает достаточно высокой реакционной способностью и с удовлетворительным выходом нитруется по положению 4 [15]. В присутствии ацетилнитрата или при использовании смеси N2O4 с озоном [16] образуется 1-нитропиразол, но он может перегруппировываться в 4-нитропиразол в кислоте при низкой температуре [17]:
конц. HNO3, Ас2О АсОН, 20 *С v 70%
<< xNNO2 N
O2N КОНЦ. H2SO4 О'С (
80%
.N
N Н
22.1.2.2. Сульфирование
Электрофильное сульфирование изоксазола не имеет препаративного значения; как правило, таким образом проводят только замещение в бензольном замести-
теле 5-фенилизоксазола с использованием хлорсульфоновой кислоты [18]. Изотиазол [2а, 19] и пиразол [20] можно просульфировать с удовлетворительными выходами.
КОНЦ. HNO3, дым. H2SO4 О ‘С 70 ‘С г 40%
олеум
230 *С
97%*
22.1.2.3. Галогенирование
При галогенировании пиразола в контролируемых условиях образуются 4-мо-ногалогенопиразолы, например 4-иод- [21] или 4-бромпиразол [22]. При взаимодействии изотиазола [23] и изоксазола [24] с бромом опять же замещается положение 4, но с низкими выходами, однако в присутствии активирующих заместителей выходы реакций галогенирования удается повысить [25]. 3,4,5-Трибромпиразол эффективно образуется в щелочном растворе, процесс предположительно идет через образование пиразолил-аниона [26].
22.1.2.4. Ацилирование
Из трех 1,2-азолов реакции электрофильного замещения такого рода описаны только для пиразола [10, 27], причем только N-замещенные пиразолы реагируют хорошо, возможно, из-за ингибирования образования Ы+-соли.
р-То!
DMF, РОС13 90 *С затем H2Ow 33%
22.2. РЕАКЦИИ С ОКИСЛИТЕЛЯМИ
Циклическая система 1,2-азолов относительно устойчива по отношению к окислительным условиям, в которых акильные заместители, а еще более эффективно ацильные группы превращаются в карбоксильные [28]. Под действием озона происходит раскрытие кольца изоксазола [29].
22.3. РЕАКЦИИ С НУКЛЕОФИЛЬНЫМИ РЕАГЕНТАМИ
Обычно при действии нуклеофилов на 1,2-азолы замещения атома водорода не происходит, и существует лишь несколько примеров замещения уходящих групп в положении 5 [30], если в положении 4 находится активирующая кето- или подобная ей группа. Интересно, что атомы галогена в положении 3 замещаются менее легко. 4-Галогениды ведут себя как галогенобен-золы.
22.4. РЕАКЦИИ С ОСНОВАНИЯМИ
22.4.1. Депротонирование группы NH пиразола
Величина рЛ'д для отщепления N-водорода в пиразоле равна 14,2, тогда как для имидазола рЛа = 17,5, хотя здесь опять же наблюдается образование двух равных по вкладу резонансных структур
№Н
22.4.2. Депротонирование СН [31]
Пиразолы депротонируются по положению 5 только в том случае, если при атоме азота отсутствует водород; в качестве уходящих N-защитных групп могут быть использованы такие, как фенилсульфонильная [32], триметилсилилэток-симетильная [33], гидроксиметильная [34], метилсульфонильная [35] и пирролидин-1-илметильная [36]. При использовании 1-бензилоксипиразола получают 5-замещенные 1-гидроксипиразолы после удаления бензильной группы гидрогенолизом [37]. Часто применяют диметиламиносульфонильную защиту для получения 5-литийорганических соединений, которые можно превратить в цинкорганические соединения и в таком виде ввести в катализируемые нульва-лентным палладием реакции сочетания [38]. Изотиазол подвергается быстрому обмену по положению 5 в присутствии дейтерооксида натрия в диметилсульфоксиде [39].
Попытки С-депротонирования изоксазолов, имеющих атом водорода в положении 3, неизбежно приводят к раскрытию цикла с отщеплением кислорода в виде анионной уходящей группы [40]. Действительно, подобное раскрытие цикла было обнаружено впервые еще в 1891 г., когда Кляйзен открыл, что в 5-фенилизоксазоле происходит раскрытие цикла под действием этоксида натрия [41] (см. разд. 22.11 о раскрытии цикла солей изоксазолия). Подобное раскрытие цикла может происходить также у изотиазолов.
KOt-Bu
THF, -40 -С^
2-Метокси-5-фенил изоксазол литиируется по положению 4 [42] так же, как и З-амино-5-метилизоксазол, защищенный в виде /лре/л-бутоксикарбонилуре-тана, но с использованием 2 экв. я-бутиллития [43].
22.5. РЕАКЦИИ N-МЕТАЛЛИРОВАННЫХ ПИРАЗОЛОВ
N-Алкилирование можно проводить либо в растворе сильного основания [44], либо в условиях фазового переноса [45], либо в присутствии 4-диметиламино-пиридина [46] . По-видимому, в этих условиях образуется пиразолил-анион, который и подвергается алкилированию (разд. 22.4.1). Особенно эффективен метод, использующий гидрокарбонат натрия в отсутствие растворителя, но при микроволновом облучении [47].
c-C5H9Br, NaHCO3 микроволновая печь 99%
0С5Н9
BrCH2CO2Et
NaOEt, EtOH, 2(ГС
84%
Ph3CCI, DMAP ВГ\---.
пиридин, 85 ‘С П \\
63% ** X..zN
N CPh3
3(5)-Замещенные пиразолы могут образовывать соединения, изомерные получаемым в нейтральных условиях [7]:
22.6. РЕАКЦИИ С-МЕТАЛЛИРОВАННЫХ 1,2-АЗОЛОВ
При взаимодействии 5-литийизотиазолов и 5-литий-1-замещенных пиразолов с рядом электрофилов замещение идет по положению 5; ниже приведены два примера таких реакций [36,48,49]:
CO2
88%
n-BuLi
Et2O, -70 *C PhN=C=O водн, H*
79%
Ph г—Z n-BuLi (I VN THF, >70^
Важно отметить, что при обработке 4-бром-1 -фенилсульфонилпиразола я-бугиллитием происходит 5-депротонирование, а не обмен металл — галоген [32], однако 4-бром-1-трифенилметилпиразол подвергается обычному обмену, а полученные таким образом оловоорганические соединения могут вступать в катализируемые палладием реакции сочетания [46].
\--- n-BuU
(/ ^20,-70 "С
4NZ
SO2Ph
f-BuLi n-Bu3Sn
THF, Et2O
-78 *C n-Bu3SnCI
83%
Обмен металл — галоген происходит при получении З-литий-1-метилпиразола из бромпиразола [50], а при взаимодействии 4-бромпиразола с 2 экв. я-бу-тиллития образуется 1,4-дилитийпиразол, который реагирует с электрофилами обычно по положению 4 [51]. 4-Иодизотиазол может быть превращен в магний-органическое соединение, которое проявляет обычные нуклеофильные свойства реактивов Гриньяра [52]. Внутримолекулярное ацилирование с участием литиевой соли кислоты наблюдается при литиировании 2 экв. сильного основания пиразола, имеющего у атома азота заместитель с подходящей длиной цепи [53].
EtMgBr
Et2O, 30 *С
2n-BuLi
THF, -70 ’с-^сгс
r PhCHOj 67%
22.7. РЕАКЦИИ СО СВОБОДНЫМИ РАДИКАЛАМИ
Взаимодействие 1,2-азолов со свободнорадикальными реагентами до сих пор мало изучено. Процесс замещения тозильной группы в положении 5 защищенного пиразола мог бы послужить отправным пунктом для дальнейших исследований [54].
n-BugSnH, AIBN PhH, кипячение
70%
n-Bu3Sn
SO2Ph
22.8. РЕАКЦИИ С ВОССТАНОВИТЕЛЯМИ
Пиразолы относительно устойчивы к каталитическим и химическим восстановительным условиям; особенно это касается соединений, не замещенных по атому азота, хотя каталитическое восстановление может быть проведено в кис-
лых условиях [55]. Изотиазолы подвергаются восстановительной десульфуризации с раскрытием цикла при использовании никеля Ренея [56]. Каталитический гидрогенолиз связи N—О легко происходит в изоксазолах в обычных условиях катализа благородными металлами [57], и этот процесс служит ключевым в стратегии, использующей изоксазолы в качестве скрытых 1,3-дикарбонильных компонентов. Промежуточные продукты гидрогенолиза связи N—О (р-енаминоке-тоны) часто можно либо выделить как таковые, либо использовать без выделения. Такой метод раскрытия цикла дает поход к синтезу пиримидинов [58] и 3-кетокарбоксамидов, как показано ниже [59]:
h2n
—zph
П=\ NaOH н «X NHAc нагревание H2N*^o 65%
2LDA
THF,-10‘С BnCI M
*72%
Ас^О 90’С
H2, Pd/C EtOH » 91%
22.9. ЭЛЕКТРОЦИКЛИЧЕСКИЕ РЕАКЦИИ
Существуют примеры превращения 1,2-азолов в их 1,3-изомеры при облучении, хотя такие процессы не находят широкого применения. Превращение цианпи-разолов в цианимцдазолы было изучено на примере 3-циан-5-дейтерий-1-ме-тилпиразола: образующаяся при этом смесь соединений наводит на мысль о двойственном механизме процесса [60]:
/7V
MeCN
_____/Ж Г=\ 1,3-сдвиг /____' атома азота
11% Ме
Подобным образом при облучении происходит превращение многих простейших пиразолов в имидазолы [61], фенилизотиазолов [62] и метилизотиазолов [63] частично в соответствующие тиазолы, а 3,5-диарилизоксазолов в 2,5-ди-замещенные оксазолы [64]. З-Алкоксиизоксазол подвергается необычному сужению цикла под действием хлорида железа(П) с образованием эфиров азирин-карбоновых кислот [65].
FeCI2.4H2O
MeCN, 20 ;С 95%
Ph
N
СО2Ме
Представляет интерес превращение 1,2-азолов, которые имеют в положении 3 трехатомную боковую цепочку, оканчивающуюся двойной связью с гетероатомом, в изомерные системы с новым пятичленным гетероциклом [66], хотя не существует определенного мнения по поводу детального механизма этого процесса.
Не существует примеров использования 1,2-азолов в роли азадиенов в реакциях циклоприсоединения. 4-Нитроизоксазол реагирует с диенами по связи С(4)—С(5) [67], а синтез аналогов пурина основан на взаимодействии 3(5)-амино-пиразолов с электронодефицитными 1,3,5-триазинами, причем присоединение идет также по связи С(4)—С(5> пиразола, а в результате последующих отщеплений образуется ароматическое соединение [68].
22.10. АЛКИЛ ПРОИЗВОДНЫЕ 1,2-АЗОЛОВ
Метильная ipynna в положении 4 изотиазолов не обладает особой кислотностью, но довольно удивительно, что 3-метилизотиазолы также не проявляют реакционной способности, в то время как 5-метилзамещенные изотиазолы вступают в реакции конденсации [69]. Подобный эффект также наблюдается и для изоксазолов. Для изучения кислотности метильных групп в изоксазолах положение 3 блокировали для предотвращения раскрытия цикла (разд. 22.4.2), и таким образом на примере 3,5-диметилизоксала было показано, что обмен при использовании метоксида в метаноле идет по метильной группе в положении 5 в 270 раз быстрее, чем по 3-метильной труппе. Препаративное депротонирование такого изоксазола проходит исключительно по 5-метильной группе, что позволяет проводить последующие реакции с электрофилами по этому положению. Эта тенденция настолько сильна, что при взаимодействии 3,5-диметил-изоксазола с 3 экв. основания и 3 экв. метилиодида образуется только 5-трет-бутил-3-метилизоксазол, а алкилирования по 3-метильной группе не наблюдается даже в условиях конкуренции с 5-изопропильной группой, которая присутствует в предполагаемом интермедиате [70]. При проведении реакции при низкой температуре, предотвращающей раскрытие цикла, 5-метилизокса-зол может депротонироваться по 5-метильной группе, а депротонирования по положению 3, которое привело бы к раскрытию цикла, не происходит [71]. Превращение в N-оксид [72] активирует соседние метильные группы: например, последущая реакция с триметилсилилиодидом позволяет получать иодированное по боковой цепи производное [73].
СНз
Дс2О, Н2О2
I 55‘С
,СН3 3Me3Sil /Гй рмр < >* 250^
° 75%
Вп
При литиировании З-метил-5-фенилизотиазола или З-фснил-5-мстилизок-сазола наблюдается конкурентное депротонирование по боковой цепи и по положению 4 за исключением тех случаев, когда в качестве литиирующего агента используют изопропил(циклогексил)амид лития (LICA) — литиирование в этом случае идет исключительно по боковой цепи [74].
22.11. ЧЕТВЕРТИЧНЫЕ СОЛИ 1,2-АЗОЛОВ
Катализируемое основаниями раскрытие цикла солей изоксазолия происходит особенно легко, достаточно присутствия карбоксилатов щелочных металлов. Механизм процесса [75], иллюстрируемый ниже на примере деградации иоди да 2-метил-5-фенилизоксазолия под действием ацетата натрия, заключается в первоначальном 3-депротонировании с разрывом связи N—О; последующие перегруппировки приводят к образованию ацетата енола, который затем перегруппировывается в конечный кетоимид.
22.12. ОКСИ- И АМИНО-1,2-АЗОЛЫ
Только 4-гидрокси-1,2-азолы можно рассматривать как соединения, подобные фенолу [76]. 3- и 5-Гидрокси-1,2-азолы существуют преимущественно в карбонильных таутомерных формах, что обусловлено участием гетероатома в стабилизации резонансных структур; таким образом, эти соединения известны как пиразолоны, изоксазолоны и изотиазолоны, хотя для всех трех систем в зависимости от природы других заместителей в растворе наблюдается присутствие заметного количества гидроксиизомеров.
При изучении и использовании реакций 3- и 5-азолонов основное внимание уделяется их спобности реагировать с электрофилами, такими, как галогены [77] (при этом образуются 4,4-дигалогенопроизводные с избытком реагента, например 4,4-дибром-3-метилпиразол-5-он — ляря-селективный бромирующий
агент для фенолов и анилинов [78]) или нитраты [79], а также вступать в реакцию формилирования по Вильсмейеру [80]. На приведенном ниже примере показано формилирование антипирина, используемого в качестве анальгетика. Многие красители получают на основе реакции сочетания катионов арилдиазония с 5-пиразолонами по положению 4, один из таких примеров — тартазин.
Mel
МеОН, 100 *С
,Ме
NMe
U N антипирин Ph
DMF, POCI3
65 *C r водн.
80%
,Ме
NMe
‘N Ph
Пиразолоны также конденсируются с альдегидами [81] по альдольному типу или реагируют с другими электрофилами, например с сероуглеродом [82], и в обоих случаях в реакции предположительно участвует енольный таутомер или его анион. В основных растворах 3-изоксазолоны алкилируются либо по атому азота, либо по атому кислорода, и выбор основания может влиять на направление реакции [42].
кон, cs2 затем n-Bi 70%
Интригующий и одновременно простой синтез полезного бромаллена основан на окислении бромпиразола ацетатом свинца(ГУ) [83]
73%
NBS, AIBN
CHCI3, кипячение
Ме
Pb(OAc)4, BF3.Et2O
МеОН, 0'С-> 20 у
59%
Вг,
МеО2С
Амино-1,2-азолы существуют в аминной таутомерной форме. Аминопиразо-лы и аминоизотиазолы ведут себя подобно ароматическим аминам: так, например, 3(5)-аминопиразол ацетилируется по аминогруппе и легко электрофильно бромируется по положению 4 [84]. Диазотирование и последующая реакция Зандмейера позволяют получать галогенизотиазолы [52] и азидопиразолы [85].
O2N4 zNHAc zNHAc zNH2 Brx zNH2
конц.НгМЙд,0-С fib ^Acg.BaN «НДУ
5o%%•" 83% у 87%
Диазотированием 4-аминопиразолов с последующим депротонированием получают устойчивые диазопиразолы [86].
NaNO2
конц. HCI, 5 *С
2н, NaOH
85%
22.13. СИНТЕЗЫ 1,2-АЗОЛОВ [87]
22.13.1. Синтезы кольца
Существуют общие, а также уникальные методы синтеза некоторых особых 1,2-азолов, не пригодные для получения других пиразолов, изотиазолов и изоксазолов: ни реакция пропена с диоксидом серы и аммиаком при 350 ’С, которая дает незамещенный изотиазол [88] с выходом 65%, ни синтез [89] из пропаргилового альдегида и тиосульфата (схема приведена ниже) неприменимы для прямого синтеза других 1,2-азолов.
нс=ссн=о
22.13.1.1. Из 1,3-дикарбонильных соединений и гидразинов или гидроксиламина
Пиразолы и изоксазолы могут быть получены из 1,3-дикарбонильной компоненты и гидразинов или гидроксиламина соответственно
Этот наиболее широко используемый метод синтеза пиразолов и изоксазолов основан на том, что гидразины и гидроксиламин представляют собой бинуклеофилы, что позволяет им поочередно реагировать с каждой карбонильной группой 1,3-дикетона [90] или 1,3-кетоальдегида. Часто одна из карбонильных групп (особенно в случае альдегида) находится в скрытой форме: в виде эфира енола [91], ацеталя, имина [92], енамина [93] или другого синтона.
<СН(ОВ)г DMFDMA СН3-< 80‘С .
О
Me2N-
—<OEtHONH2.HCI >—l
/ OEt H2O, нагревание [/ V
ЕЮ-%а 84%
CH(OEt)2 N2H4
К 20 *С
0 66%
При использовании p-кетоэфиров образуются пиразолоны [94] или изокса-золоны [95]; аналогично в реакциях p-кетонитрилов с гидразинами получаются 3(5)-аминопиразолы [96]. Сам незамещенный 3(5)-аминопиразол синтезируют через дигидропредшественник, который получают присоединением гидразина к акрилонитрилу с последующей циклизацией [97]; гидролиз этого дигцдроин-термедиата и последующая дегидрогенизация путем отщепления л-толуолсуль-фината позволяют получать 3(5)-пиразолоны [98].
ch2=chcn
Вообще говоря, несимметричные 1,3-дикарбонильные соединения образуют смеси 1,2-азолов [76]. Иногда эту трудность удается преодолеть при использовании ацетиленовых альдегидов или кетонов, для которых сначала синтезируют гидразоны или оксимы реакцией по карбонильной группе, а уже полученные соединения циклизуются в ходе отдельной следующей стадии [99]. Незамещенный пиразол можно получить из гидразина и пропаргилового альдегида [8]. Использование в качестве 1,3-дикарбонильной компоненты р-хлор- [100], р-алкокси-[101] или р-аминоенонов [102] — другой способ влияния на региохимию процесса, который в благоприятных условиях может быть очень эффективным [103].
BnNHNH2, H2SO4 водн. EtOH, нагревание
78%
Me
/=( MeNHNH2
/ N DMSO, 20*C Ph(CH2)2^0 NH2"”"8i%..* Ph(CH2)2
Me
Если р-аминоентион, который можно получить из изоксазола гидрогенолизом с последующей реакцией образующегося р-аминокетона с осерняющим реагентом, обработать дегидрирующим агентом, например хлоранилом [104] или серой [105], циклизация приводит к образованию изотиазола
Н2, Ni мерн,..^
МеО2С. Me
P4S10, хлоранил >—
PhMe, нагревание // \\
53% * Ph-\sxN
Циклизация р-амино-а,р-ненасыщенных тиоамидов подобным же образом приводит к образованию 5-аминоизотиазолов [106]
ЁЮ2Су_уМе TsN=C=S Et°2C_________,Ме |2, пиридин В°2С\_/Ме
Et20,0 *С /=\ EtOH, 20 *С
NH2 93% NH2 83% TsN*xsxN
Окислительная циклизация оксимов халконов в присутствии бихромата тет-ракис(пиридин)кобальта(П) приводит к образованию изоксазолов [107]; существует также интересный метод синтеза изоксазолов и пиразолов из 1,3-диинов [108].
Ph Ph м II CH2SiMe3
вод£УАсОН?60-С Me3SiC^CeCSiMe3^t!t!^^
НО' 64% Ph^\nxN 73 /o
22.13.1.2. Диполярное циклоприсоединение нитрилоксидов и нитрилиминов Изоксазолы получают диполярным циклоприсоединением нитрилоксидов к алкинам, а пиразолы — взаимодействием алкинов с нитрилиминами
Нитрилоксиды (R—C=N+—О~), которые можно генерировать в результате катализируемого основаниями отщепления галогеноводорода от галогенокси-мов [RC(Hal)=NOH] или дегидратацией нитросоединений (RCH2NO2) [110], легко присоединяются к алкенам и алкинам с образованием пятичленных гетероциклов. При присоединении к алкенам получаются изоксазолины, если только алкены не содержат группу, способную отщепляться на стадии, следующей за циклоприсоединением, как показано ниже [111]; изоксазолины могут быть дегидрированы в ароматическую систему [112,113]
При циклоприсоединении нитрилоксида к алкинам напрямую образуется ароматический изоксазол. В реакциях с моноалкил- или моноарилзамещенны-ми алкинами получают 5-замещенные изоксазолы [114], а с другими монозаме-щенными алкинами образуется смесь продуктов циклоприсоединения [115].
CI
Ph l^zPh EtsN 'с V Et2O,20‘С
N
НО
OJ
MeO2CCsCH
98%
MeO2C
N
Удобный путь к 3-бромизоксазолам основан на циклоприсоединении бром-нитрилоксида [116].
СО2Ме МеО2С Вг
III r + . Br2C=NOH, КНСО3 У—/ // + [Br-C=N-6j СН2С12,20 *С ~ 'м
Ме 44% ► Ме-*\ох
При циклоприсоединении диазоалканов к алкинам образуются пиразолы; использование станнилалкинов [117] позволяет получать оловозамещенные гетероциклы, которые впоследствии можно вводить в реакции шгсо-замещения или в катализируемые нульвалентным палладием реакции сочетания.
EtO2CCHN2
г, Et2O, 20’С
HOCSnn-Bu3 ...*.—-—*
53%
Snn-Bu3
ЕЮсЛ>
EtO2C
22.13.1.3. Из оксимов и гидразонов
Взаимодействие кетоксимов, имеющих а-водородный атом, с двумя мольными эквивалентами я-бутиллития приводит к О- или С-литиированию (син по отношению к атому кислорода); при последующей реакции с диметилформамидом в качестве электрофила происходят С-формилирование и циклизация in situ с образованием 5-незамещенного изоксазола [118]. Аналогично реакция дианиона с ацилирующим агентом (эфиром [119] или амидом Вейнреба [120]) позволяет получать 5-замещенные изоксазолы.
(CH2)2Ph Н3С—л
Jn НО
2n-BuU
THF, 0 ‘Cr
(CH2)2Ph LiH2C—
Jn
. uo
DMF 0*C->20*C
91%
н e-_7Me 2n-BuLi ABuCON(Me)OMe
3 THF, 0 -С затем МЦС1
N
HO
zMe ВОДН. H2SO4
/ u THF, нагревание
xN 72% *~Bu
НО О (считая на оксим)
Замещение атома водорода в оксиме а-бромкетона алкином приводит к образованию промежуточного соединения, которое циклизуется в изоксазол при обработке слабым основанием [121]. При ацилировании дианиона трет-бутоксикарбонил гидразонов кетонов образуются пиразолы, например [122]:
К2СО3
МеОН, 20/С
80%
Необыкновенно изящный метод синтеза пиразолов, позволяющий контролировать все три заместителя, включает образование (по реакции конденсации Хорнера—Эммонса фосфата тозилгидразона с альдегидом) способного к циклизации предшественника; внутримолекулярное присоединение по реакции Михаэля с последующим отщеплением толуолсульфината, приводящее к ароматизации соединения, завершают процесс [123].
22.13.2. Примеры некоторых важных синтезов с использованием 1,2-азолов
22.13.2.1. 5-Циан-1,2,6,7,12,12Ь-гексагидроиндоло[2,3-а]хинолизин [124]
В этой последовательности превращений присоединение нитрилоксида к эфиру енола, а затем элиминирование приводят к образованию изоксазола. На примере раскрытия цикла изоксазола, сопровождающегося декарбоксилированием, показано, как гетероцикл может сужить синтоном для образования а-цианаль-дегида
22.13.2.2. З-Ацетилиндол [125]
По аналогии с селективным литиированием в положение 5 используют селективное 5-дестаннилирование 4,5-ди(три-н-бутилстаннил)изоксазола. В этой реакции используется сочетание с 2-иодбензолом; последующее гидрирова-ние/гидрогенолиз вызывает раскрытие цикла изоксазола с образованием интермедиата, который в результате отщепления воды превращается в индол
CI2Pd(PPh3)2 диоксан, NO; кипячение
n-Bu3Sn
n-Bu3Sn
n-Bu3Sn Me n-Bu3Sr<\/N
CH3NO2, PhNCO
PhH, 50 *C
водн. NH3 n’Bu3SnMe
EtOH, 150 4^
70% \ /N
(2 стадии) О
H2, Ni Ренея^
53% **
Упражнения
Простые упражнения для проверки усвоения материала гл. 20 и 22
(а) Сравните попарно 1,2- и 1,3-азолы — какие из них более основны? Почему?
(б) Почему некорректно название 3-метилпиразол?
(в) Назовите некоторые группы, которые можно использовать в качестве защитных для атома азота в пиразолах в реакциях С-литиирования.
(г) Для образования каких функциональных групп могут служить синтонами изоксазолы при разрыве в них связи N—О? Как можно разрушить связь N—О?
(д) Как 1,3-дикарбонильные соединения используются для синтезов изоксазолов и пиразолов?
(е) Опишите метод, включающий электроциклический процесс для синтеза кольца пиразола.
(ж) Опишите метод синтеза изоксазола, в котором используют оксим диалкилкетона.
Упражнения повышенной сложности
1. Предложите структуры изомерных соединений с брутто-формулой C9H7N3O2, образующиеся при взаимодействии 1-фенилпиразола (а) с конц. H2SO4/ конц. HNO3 или (б) с Ас2О/ HNO3. Объясните образование различных продуктов в зависимости от условий.
2. Нарисуйте структуры соединений, полученных при реакции 3,5-диметилизокса-зола с NaNH2, а затем (а) с н-РгВг; (б) с СО2; (в) с PhCO2Me.
3. Предложите структуры соединений, образующихся при обработке 5-метилизок-сазола SO2C12, затем полученного соединения с водн. NaOH -> C4H4CINO (не содержит цикла).
4. Нарисуйте структуры соединений, которые могли бы образоваться при взаимодействии BnNHNH2 с МеСОСН2СОСО2Ме.
5. Предложите структуры соединений, образующиеся в следующей последовательности взаимодействий: пиразол/ Me2NSO2CI/ Et3N -> С5Н9КзО28, затем полученное соединение с н-BuLi/ -70 *С, затем с TMSC1 -> CgHn^O^Si, затем с PhCH=O/CsF -> Ci2H15N3O3S.
6. Нарисуйте структуры двух соединений, которые образуются при взаимодействии гидроксиламина с PhCOCH2CH=O; предложите однозначный синтез 5-фенили-зоксазола.
7. Предложите структуры гетероциклических соединений, образующихся (а) из оксима циклогексанона с 2 экв. w-BuLi, затем с диметилформамидом -> C7H9NO; (б) из тиен-2-ил-С(=КОН)СН2Вг и Me3SiC=CLi, затем К2СО3/МеОН -> CnHisNOSSi; (в) из MeCOC(=NNHPh)Me с (EtO)2POCH2SEt/w-BuLi -» CnHi2N2.
8. Предложите структуру гетероциклического соединения с брутто-формулой C7Hi3NOSi, образующегося при взаимодействии Me3SiC=CC=CSiMe3 с гидроксиламином.
Литература
1. «Progress in pyrazole chemistry», Kost A. N.t Grandberg 1.1. Adv. Heterocycl. Chem., 6, 347 (1966); Schofield K, Grimmett M. R., Keene B. R. T. The Azole, Cambridge University Press, 1976.
2. (a) «Isothiazoles», Hubenett F, Flock F. H., Hansel W., Heinze H., Hofmann H. Angew. Chem., Int. Ed. Engl, 2, 714 (1963); (6) «Isothiazoles», Slack R., Wooldridge К R. H.
Adv. Heterocycl. Chem., 4,107 (1965); «Recent advances in the chemistry of mononuclear isothiazoles», Wooldridge K. R. H. ibid., 14, 1 [1972].
3. «Recent developments in isoxazole chemistry», Kochetkov N. K, Sokolov S. D. Adv. Heterocycl. Chem., 2, 365 (1963); «Isoxazole chemistry since 1963», Wakefield B. J., Wright D. J. ibid., 25, 147 (1979); «Synthetic reactions using isoxazole compounds», Kashima C. Heterocycles, 12,1343 (1979).
4. Begtrup M., Vedso P. J. Chem. Soc., Perkin Trans. 1,1995, 243.
5. Reuther W., Baus V. Liebig’s Ann., 1995,1563.
6. Chaplen R, SlackR., Wooldridge K. R. H. J. Chem. Soc., 1965,4577.
7. V Auwers K, Buschmann W., Heidenreich R. Justus Leibigs Ann. Chem., 435, 277 (1924).
8. Perez E., Sotelo E., Loupy A., Mocelo R., Suarez M., Perez R., Autie M. Heterocycles, 43, 539(1996).
9. Mattel R., Kratzer J. Chem. Ber., 92,2014 (1959); Williams J. К J. Oig. Chem., 29, 1377 (1964).
10. Finar I. L., Lord G. H J. Chem. Soc., 1957, 3314.
11. Bematowicz M. S., Wu K, Matsueda G. R. J. Org. Chem., 57,2497 (1992).
12. Drake B., Patek M., Lebl M. Synthesis, 1994, 579.
13. MattelR., Buchele E, Jochum P. Chem. Ber., 88, 1577 (1955).
14. Caton M. P. L., Jones D. H, Slack R., Woolridge К R. H. J. Chem. Soc., 1964,446.
15. QuilicoA., Musante C. Gazz. Chim. Ital., 71, 327 (1941).
16. Suzuki H, Nonoyama N. J. Chem. Res. (S), 1996,244.
17. Olah G. A., Narang S. C., Fung A. P. J. Org. Chem., 46,2706 (1981).
18. WoodwardR. B., Olofson R., Mayer H. J. Am. Chem. Soc., 83,1010 (1961).
19. Pain D. L., Parnell E. W. J. Chem. Soc., 1965, 7283.
20. Knorr L. Justus Liebigs Ann. Chem., 279, 188 (1894).
21. MattelR., Schafer O., Jochum P. Justus Liebigs Ann. Chem., 593, 200 (1955).
22. Lipp M., Dallacker E, Munnes S. Justus Liebigs Ann. Chem., 618,11 (1958).
23. Finley J. H., Volpp G. P. J. Heterocycl. Chem., 6,841 (1969).
24. Pino P., Piacenti E, Fatti G. Gazz. Chim. Ital., 90, 356 (1960).
25. Blount J. E, Cofien D. L., KatonakD. A. J. Org. Chem., 43,3821 (1978).
26. Jufiermans J. P. H, Habraken C. L. J. Oig. Chem., 57,4656 (1986).
27. Tojahn C. A. Chem. Ber., 55,291 (1922).
28. Benary E. Chem. Ber., 59,2198 (1926); Holland A., Slack R., Warren T. E, Buttimore J. J. Chem. Soc., 1965, 7277; QuilicoA., Stagno D’Alcontres G. Gazz. Chim. Ital., 79, 654 (1949).
29. Kashima C., Takahashi K, HosomiA. Heterocycles 37,1075 (1994).
30. DomowA., TechenbnrgH. Chem. Ber., 93,1103 (I960); Hatchard W. R. J. Oig. Chem., 29,660(1964).
31. «Synthesis and reactions of lithiated monocyclic azoles containing two or more heteroatoms. Part I: Isoxazoles», Iddon B. Heterocycles, 37, 1263 (1994); «Part III: Pyrazoles»,Cr//wne// M. R., Iddon B. ibid., 37, 2087 (1994); «Part V: Isothiazoles and thizoles», Iddon B. ibid., 41,533 (1995).
32. Heinisch G.f Holzer W., Pock S. J. Chem. Soc., Perkin Trans. 1, 1990,1829.
33. Fugina N., Holzer W., Wasicky M. Heterocycles, 34, 303 (1992).
34. Katrizky A. R., Lue P., Akutagawa K. Tetrahedron, 45,4253 (1989).
35. Effenberger E, Roos M., Ahmad R., Krebs A. Chem. Ber., 124, 1639 (1991).
36. Katritzky A. R., Rewcastle G. W, Fan W-Q. J. Oig. Chem., 53, 5685 (1988).
37. Vedso P., Begtrup M. J. Oig. Chem., 60,4995 (1995).
38. Yagi K, Ogura T., Numata A., Ishii S, Aral K. Heterocycles, 45,1463 (1997).
39. White J. A., Anderson R, С. J. Heterocycl. Chem., 6,199 (1969).
40. Hessler E. J, J. Org. Chem., 41,1828 (1976).
41. Claisen L., Stock R. Chem. Ber., 24, 130 (1891).
42. AlzeerJ., Nock N., Wassner G., Masciadri R. Tetrahedron Lett., 37, 6857 (1996).
43. Konoike T, Kando Y, Araki Y. Tetrahedron Lett., 37, 3339 (1996).
44. Jones R. G., Mann M. J., McLaughlin К. C. J. Oig. Chem., 19,1428 (1954).
45. Например: Hartshorne С. M., SteelP. J. Aust. J. Chem., 48,1587 (1995).
46. Elguero J., Jaramillo C., Pardo C. Synthesis, 1997,563.
47. Almena L, Diez-Barra E.t de la Hoz A., Ruiz J-, Sdnchez-Miagallon A. J. Heterocycl. Chem., 35, 1263 (1998).
48. Layton A. J., Lunt E. J. Chem. Soc., 1968,611.
49. Beringer M., Pry's B.f Erlenmeyer H. Helv. Chim. Acta, 49,2466 (1966).
50. Pavlik J, W., Kurzweil E. M, J. Heterocycl. Chem., 29, 1357 (1992).
51. Hahn M., Heinisch G, Holzer W., Schwarz H. J. Heterocycl. Chem., 28,1189 (1991).
52. Guilloteau F, Miginiac L. Synth. Commun., 25, 1383 (1995).
53. Larsen 5. D. Synlett, 1997,1013.
54. Caddick S., Joshi S, Synlett, 1992,805.
55. Thoms H., Schnupp J. Justus Liebigs Ann. Chem., 434, 296 (1923).
56. Adams A., Slack R. J. Chem. Soc., 1959,3061.
57. Baraldi P. G., Barco A., Benetti S., Moroder F., Polliiu G.f Simoni D. J. Oig. Chem., 48, 1297(1983).
58. Shaw G.f Sugowdz G. J. Chem. Soc., 1954,665.
59. Oster T. A., Harris T. M. J. Org. Chem., 48,4307 (1983).
60. Barltrop J. A., Day A. C., Mack A. G., Shahrisa A., Wakamatsu S. J. Chem. Soc., Chem. Commun., 1981, 604.
61. Teifenthaler H., Dorscheln W., Goth H, Schmid H. Helv. Chim. Acta, 50, 2244 (1967); Pavlik J. W., Kebede N., Bird N. R, Day A. C., Barltrop J. A. J. Org. Chem., 60, 8138 (1995).
62. Maeda M., Kawahara A., Kai M., Kojima M. Heterocycles, 3, 389 (1975).
63. Pavlik J. W., Pandit C. R., Samuel C. J., Day A. C. J. Oig. Chem., 55, 3407 (1993).
64. Singh B., Ullman E. F. J. Am. Chem. Soc., 89,6911 (1967).
65. Auricchio S., BiriA., Pastormerlo E., TruscelloA. M. Tetrahedron, 53,10911 (1997).
66. «Mononuclear heterocyclic rearrangements», Ruccia M., Vivona N, Spinelli D. Adv. Heterocycl. Chem., 29, 141 (1981).
67. Turchi S., Giomi D., Nesi R. Tetrahedron, 51,7085 (1995).
68. Dang Q., Brown B. S., Erion M. D. J. Org. Chem., 61, 5204 (1996).
69. Hofmann H. Justus Liebigs Ann. Chem., 690,147 (1965).
70. Kashima C., Yamamoto Y., Tsuda Y, Omote Y Bull. Chem. Soc. Jpn., 49,1047 (1976).
71. Xia X., Knerr G., Natale N. R. J. Heterocycl. Chem., 29,1297 (1992).
72. Parnell E. W. Tetrahedron Lett., 1970, 3941; Begtrup M., Larsen P., Vedso P. Acta Chem. Scand., 46,972 (1992).
73. Begtrup M., Vedso P. J. Chem. Soc., Perkin Trans. 1,1992, 2555.
74. Alberola A., Calvo L., Rodriquez T R., Sanudo C. J. Heterocycl. Chem., 32, 537 (1995).
75. «The reaction of isoxazolium salts with nucleophiles», Woodward R. B., Olofson R. Tetrahedron, Suppl. № 7, 7,415 (1966).
76. Naito T., Nakagawa S., Okumura J., Takahashi K, Kasai K. Bull. Chem. Soc. Jpn., 41, 959 (1968); Fagan P. J., Neident E. E, Nye M. J., O’Hare M. J, Tang W.-P. Can. J. Chem., 57, 904 (1979).
77. Westob G. Acta Chem. Scand., 6,1499 (1952).
78. MashraquiS. H, Mudalian C. D., Hariharasubrahmanian H Tetrahedron Lett., 38,4865 (1997).
79. Iseki T, Sugiura T, Yasunaga S., Nakasina M. Chem. Ber., 74,1420 (1941).
80. LedrutJ., WintemitzP., Combes G. Bull. Soc. Chim. Fr., 1961, 704.
81. Knorr L. Chem. Ber., 29,249 (1896).
82. Oliva A., Castrol., Castillo C., Leon G. Synthesis, 1991,481.
83. Gilmann T., HeckhoffS., Weeber T. Synth. Commun., 24, 2133 (1994).
84. Dorn H, DilcherH. Justus Liebigs Ann. Chem., 707, 141 (1967).
85. Morgan G. T, Reilly J. J. Chem. Soc., 1914,435.
86. Patel H. P., Tedder J. M. J. Chem. Soc., 1963,4589.
87. «Synthesis of pyrazoles and condensed pyrazoles», Makino K, Kini H. S., Kurasawa К J. Heterocycl. Chem., 36, 321 (1999).
88. HilbenettP., Flock F. H, Hofmann H. Angew. Chem., Int. Ed. Engl., 1, 508 (1962).
89. Wille E, CapellerL., Steiner A. Angew. Chem., Int. Ed. Engl., 1, 335 (1962).
90. Wiley R. H, HexnerP. E. Org. Synth., Coll Vol. IV, 1963, 351.
91. Martins M. A. P., Freitag R., Flores A. E C., Zanatta N. Synthesis, 1995,1491.
92. Hoffmann M. G. Tetrahedron, 51,9511 (1995).
93. Brederick H, Sell R., Effenberger F. Chem. Ber., 97, 3407 (1964); Dominquez E., Ibeas E., Martinez de Marigorta E., Palacios J, K, SanMartin R. J. Org. Chem., 61,5435 (1996).
94. Knorr L. Chem. Ber., 17,546 (1884).
95. Rupe H, GrunholzJ. Helv. Chim. Acta, 6, 102 (1923).
96. Longemann W., Almirante L., Caprio L. Chem. Ber., 87, 1175 (1954); Tupper D. E., Bray M, R. Synthesis, 1997, 337.
97. Dorn H, ZubekA. Org. Synth., Coll. Vol. V, 1973, 39.
98. Dorn H, ZubekA., Hilgetag G. Angew. Chem., Int. Ed. Engl., 5,665 (1966).
99. Nightingale D., Wadsworth F. J. Am. Chem. Soc., 67,416 (1945); Bowden K, JonesE. R. H. J. Chem. Soc., 1946,953.
100. Bames R. P., Dodson L. B. J. Am. Chem. Soc., 65,1585 (1943).
101. Claisen L., Chem. Ber., 59, 144 (1926).
102. Bunnelle W. H, Singam P. R., Narayanan B. A., Bradshaw-C. W., Lion J. S. Synthesis, 1997,439.
103. Alberola A., GonzAlez-Ortega A., Sdadaba L. L., Sanudo M. C. J. Chem. Soc., Perkin Trans. 1, 1998, 4061; Valduga C. J., Braibante H. S., Braibante M. E. F. J. Heterocycl. Chem., 35, 189 (1998).
104. McGregor D. N, Corbin U., SwigorJ. E., Cheney L. C. Tetrahedron, 25,389 (1969).
105. Bruno A., Purrello G. Gazz. Chim. Itai., 96,1009 (1966).
106. GoerdelerJ., Krone U. Chem. Ber., 102,2273 (1969).
107. WeiX., Fang J., Hu Y, Hu H. Synthesis, 1992, 1205.
108. BirkoferL., Richzenhain K. Chem. Ber., 112,2829 (1979).
109. Grundmann C., GrunangerP. The nitrile oxides, Springer-Verlag, Berlin and New York, 1971; «Cycloaddition reactions of nitrile oxides with alkenes», Easton C. J., Merricc C., Hughes M., Savage G. P., Simpson G. W. Adv. Heterocycl. Chem., 60, 261 (1994).
ПО. По поводу использования в этом синтезе (Вос)гО/ОМАР см.: Basel Y., HassnerA. Synthesis, 1997,309.
111. McMurray J. E. Org. Synth., Coll. Vol. VI, 1988, 592.
112. Hiraoka T, Yoshimoto M., Kishida Y. Chem. Pharm. Bull., 20, 122 (1972); Barco A., BenettiS., Pollini G. P., Baraldi P. G., Synthesis, 1977,837.
113. О дегидрировании пиразолинов с использованием «клауфена» см.: Bougrin К, Sonfiaoni М., El Yazid М. Tetrahedron Lett., 36,4065 (1995).
114. Iddon В,, Suschitzky Н., Thompson A. W., Wakefield В. J., Wright D. J. J. Chem. Res., 1978, (S) 174; (M) 2038.
115. Sasaki T., Yoshioka T. Bull. Chem. Soc. Jpn., 41, 2212 (1968); Christi M., Huisgen R., Sustmann R, Chem. Ber., 106, 3275 (1973).
116. Hanson R. N,, Mohamed F. A. J. Heterocycl. Chem., 34, 345 (1997).
117. Sakamaoto T., Shiga E, Uchiyama D., Kondo K, Yamanaka H Heterocycles, 33, 813 (1992).
118. Barber G. N., Olofson R. A. J. Org. Chem., 43, 3015 (1978).
119. He Y, Liu N.-H. Synthesis, 1994,989.
120. Nitz T. J.t VolkotsD. L., Aldous D. J.t Oglesby R. C. J. Org. Chem., 59,5828 (1994).
121. Short К. M.t Ziegler С. B. Tetrahedron Lett., 34,75 (1993).
122. Church A. C., Roller M. U., Hines M. A.t Beam C. F. Synth. Commun., 26,3659 (1996).
123. Almirante N., Cerri A., Fedrizzi G., Marazzi G., Santagostino M. Tetrahedron Lett., 39, 3287 (1998); Almirante N., Benicchio A., Cerri A., Fedrizzi G,, Marazzi G., Santagostini Synlett, 1999,299.
124. Perez C.t Janin У. L.t Grierson D. S. Tetrahedron, 52,987 (1996).
125. Uchiyama D., Yabe M., Kameyama H, Sakamoto T., Kondo Y., Yamanaka H, Heterocycles, 43,1301 (1996).
23
БЕНЗАННЕЛИРОВАННЫЕ АЗОЛЫ: РЕАКЦИИ И МЕТОДЫ СИНТЕЗА
1Н-бензимидазол бензотиазол бензоксазол 1Н-ицдазол 1,2-бензизотиазол 1,2-бензизоксазол
Существует только один способ аннелирования бензольного кольца к каждому из 1,3-азолов с образованием 1Н-бензимидазола [1], бензотиазола и бензоксазола. Индазол [2] — единственно возможная для пиразола аннелиро-ванная структура; это соединение существует в виде Ш-таутомера, а 2Н-тау-томер не обнаружен, хотя 2-замещенные 2Н-индазолы известны. Два других 1,2-азола существуют в виде двух различных изомеров: 1,2-бензизотиазол и 2,1-бензизотиазол [3] и 1,2-бензизоксазол и 2,1-бензизоксазол [4] соответственно.
1,1-Диоксид 1,2-бензизотиазолин-3(2)-она, или сахарин, — хорошо известный подсластитель, заменитель сахара. Омепразол, ингибитор протонного желудочного насоса, используется как противоязвенное средство, рисперидон применяют для лечения шизофрении, а гранисетрон — антагонист серотониновых рецепторов, снимает приступы тошноты, вызванные химиотерапией.
23.1. РЕАКЦИИ С ЭЛЕКТРОФИЛЬНЫМИ РЕАГЕНТАМИ
23.1.1. Присоединение по атому азота
23.1.1.1. Протонирование
Бензимидазол примерно на две единицы в значениях рА^ более слабое основание и несколько более сильная кислота, чем имидазол. Эта тенденция свойственна и другим бензазолам: бициклические системы — более слабые основания, чем соответствующие моноциклические, а индазол — незначительно более слабая кислота, чем пиразол.
23.1.1.2. Алкилирование по атому азота
Нейтральные гетероциклы образуют соли по атому азота при взаимодействии с алкилгалогенидами. Обычно индазолы реагируют по иминному атому азота N(2), однако алкилирование 6-метилиндазола дигидропираном в присутствии кислоты дает М(1)-тетрагидропиранильное производное [5]; также идет и Мцрацили-рование индазолов. Такие 1-замещенные соединения могут быть термодинамическими продуктами обратимого алкилирования.
дигидропиран
TsOH, CHgClg, кипячение
69%
23.1.1.3. Ацилирование по атому азота
Под действием ангидридов кислот в присутствии пиридина или в его отсутствие происходит N-ацилирование бензимидазолов, М(1)-ацилирование индазолов и К,К-диацилирование бензимидазол-2-она [6].
23.1.2. Замещение по атому углерода
Среди ряда реакций, в которых замещение идет только по атому углерода, можно выделить 2-бромирование бензимидазола N-бромсукцинимидом [7], 2-заме-щение бензотиазола бромом при 450 °C [8] и 3-нитрование индазола [9]. В основном же электрофильное нитрование и галогенирование может идти только в бензольное кольцо по положениям 5,6 или 7.
2-Бромбензотиазол может быть синтезирован при взаимодействии бензоти-азол-2-тиола с бромом [10], но обычно галогенозамещенные по гетероциклу производные получают из соответствующих кислородзамещенных гетероциклов при обработке тионил- или фосфорилхлорвдом [6].
Н Н Me
RN(Me)H,APr2NEt л-ВиОН, кипячено Br 65%
R »{CH2)2N(Me)SO2C6H4-4-NHSO2Me
Электрофильное замещение по пятичленному гетероциклу возможно в том случае, если использовать силилированные производные, как показано ниже на примерах [11]:
23.2. РЕАКЦИИ С НУКЛЕОФИЛЬНЫМИ РЕАГЕНТАМИ
Единственное положение в этих гетероциклических системах, по которому идет нуклеофильное замещение уходящей группы, — это положение в гетероциклическом кольце (один пример был приведен выше). В качестве другого примера можно привести замещение на тиольную группу при использовании тиомочевины в качестве нуклеофила, как показано ниже [12]. Эффективность процесса повышается при использовании палладия в качестве катализатора [13]; так, например, замещение в 2-хлорбензоксазоле протекает в более мягких условиях [14]
(H2N)2C=S
Как кислород-, так и серосодержащие труппы легко замещаются в бензоксазолах [15] или бензотиазолах [16] при использовании литийорганических реагентов или аминов соответственно
На способности к нуклеофильному замещению основан метод удаления бен-зотиазол-2-илсульфонамидных защитных групп — при реакции с тиолом по положению 2 гетероцикла высвобождается амин (первичный или вторичный), как показано ниже [17]:
PhSH, КОГ-Ви DMF, 20 ’С
О О
SO2 + HNR1R2
23.3. РЕАКЦИИ С ОСНОВАНИЯМИ
23.3.1. Депротонирование по атому азота
Бензимидазолил- и индазолил-анионы напрямую реагируют по атому азота с электрофильными алкилирующими агентами, хотя в последнем случае образуется смесь N(i)- и Незамещенных соединений. Например, при взаимодействии с гидроксиламин-О-сульфокислотой в соотношении 2:1 образуются 1-амино-1Н-индазол и 2-амино-2Н-индазол [18]. Приведем и другой пример: соотношение N(i)- и М(2)-этилированных производных метилового эфира индазол-3-кар-боновой кислоты может варьироваться от 1:1 до 18:1 в зависимости от природы основания и растворителя [19].
23.4. РЕАКЦИИ С-МЕТАЛЛИРОВАННЫХ ПРОИЗВОДНЫХ
23.4.1. Литийорганические производные
Бензо-1,2-азолы (блокированные или защищенные по атому азота) литиируют-ся по положению 2 гетероцикла. Это позволяет проводить реакции с обычным набором электрофилов. Ниже приведены примеры [20-22] введения атома иода (с последующей катализируемой нульвалентным палладием реакцией сочетания с борной кислотой) и кремнийсодержащего заместителя [с последующим образованием трис(бензотиазол-2-ил)фосфина]:
1,2-Бензизотиазол и 1,2-бензизоксазол не литиируются в гетероциклическое кольцо. Это, без сомнения, связано с тем, что все попытки проведения такой реакции обусловлены фрагментацией гетероцикла аналогично тому, как это происходит при нагревании индазол-3-карбоновых кислот в хинолине [23]. Однако 3-бром-индазол легко превращается в Ы,С-дилитиевое производное, поскольку депротонирование атома азота N(d делает невозможным дальнейшее раскрытие цикла [24].
23.4.2. Реакции, катализируемые палладием
Сравнительно небольшое число примеров, имеющихся на сегодняшний день, все же свидетельствует о том, что реакции сочетания бензотиазолов не менее важны, чем и в других областях химии гетероциклов: два примера, приведенные ниже, показывают использование цинкового производного бензоксазола [25] и индазолилтрифлата [26]:
23.5. РЕАКЦИИ С ВОССТАНОВИТЕЛЯМИ
Отсутствуют сведения о селективном восстановлении гетероцикла в бензо-1,3-или бензо- 1,2-азолах.
23.6. ЭЛЕКТРОЦИКЛИЧЕСКИЕ РЕАКЦИИ
2,1-Бензизотиазол и 2,1-бензизоксазол, по-видимому, не проявляют склонности к участию в реакциях циклоприсоединения в качестве азадиенов, как это можно было бы ожидать на основании сравнения с типичными реакциями изоиндолов, бензо[с]тиофенов и изобензофуранов (для сравнения см. разд. 19.2). В противоположность этому электронодефицитные 2-алкенилбензотиа-золы реагируют с электроноизбыточными алкенами как 1-аза-1,3-диены [27]:
CH2=CHOEt СН2С12, 20-С 98%
ЕЮ
23.7. ЧЕТВЕРТИЧНЫЕ СОЛИ
Бензо-1,2-азолиевые соли вступают в реакции нуклеофильного присоединения по положению 2. Например, они превращаются в соответствующие opwo-заме-щенные бензолы с потерей атома С(2) в водном растворе основания, и на первой стадии процесса, по-видимому, происходит присоединение гидроксильной труппы по положению 2 [28]. В более конструктивном варианте при разложении солей 2-(1-гидроксиалкил)бензотиазолия, которые могут быть получены с использованием 2-литийбензотиазола, высвобождается илид бензотиазолия, что позволяет синтезировать кетоны, как показано ниже [29]:
водн. К2СО3
60 ‘С
95%
Другая последовательность превращений включает 2-литиированис, взаимодействие с альдегидом, кватернизацию, присоединение по положению 2 и, наконец, раскрытие цикла образующегося дигидробензотиазола под действием соединений серебра. В данном случае гетероцикл может служить основой для синтеза а-гидроксикетонов [30]. Еноляты лития также гладко присоединяются к солям бензотиазолия [31].
n-BuLi
AgNO3 водн. MeCN, ОН 45 ‘С n-Bu V. 49% Д
(3 стадии) и
Et
Аддукты такого же типа, которые образуются в реакции Рейсерта (для сравнения см. разд. 6.14.) можно получить из бензотиазола, бензоксазола и индазола, как показано ниже [32]:
TMSCN, p-TolCOCI А1С13(кат.), СНгС12,20'С 87% *"
Соли 2,1-бензизотиазолия при гидролизе превращаются в ор/ио-аминобенз-альдегиды и их используют в качестве синтонов в синтезе хинолона, как показано ниже [33]:
CH2(CN)CO2Et пиридин,110 *С
57%
Me
23.8. ОКСИ- И АМИНО-1,3-АЗОЛЫ
Бензо-1,3-азол-2-оны существуют в карбонильной таутомерной форме, однако индазол-3-он, по крайней мере в растворе диметилсульфоксида, существует преимущественно в гидроксильной таутомерной форме [34] в противоположность 1,2-бензотиазол-З-ону, который представляет собой полностью карбонильное соединение, по крайней мере в твердом состоянии [35].
85:15 BDMSO
Возможно осуществление вполне селективного введения алкильных групп к одному из двух атомов азота в 3-гидроксииндазоле. При проведении реакции с галогенидом в нейтральном растворе, в котором, несомненно, существует иминный таутомер, присоединение идет только по атому азота Ыф [36]. В противоположность этому в основной среде анион реагирует по положению N(i> [26].
Водные растворы оснований вызывают гидролитическое раскрытие гетероцикла в бензо-1,3-азол-2-онах с образованием соответствующих opwo-замещен-ных бензолов [37]. Алкилирование в основной среде приводит преимущественно к N- и О-замещению; тионы алкилируются по тионному атому серы [38].
23.9. МЕТОДЫ СИНТЕЗА
23.9.1. Синтезы колец бензо-1,3-азолов
23.9.1.1. Из орто-замещенных аренов, заместители в которых содержат необходимые гетероатомы
Наиболее важным методом синтеза бензотиазолов, бензимидазолов и бензокса-золов служит введение атома углерода С<2) в предшественник, в котором гетероатомы в заместителях бензольного кольца находятся в ор/ло-положении друг к другу. Компонент, необходимый для этих целей, обычно содержит будущий атом углерода С(2) со степенью окисления кислоты; таких вариантов опи-
сано много.
В стандартном варианте этого метода карбоновую кислоту нагревают с орто-замещенным бензолом. Иминоэфиры реагируют при гораздо более низкой температуре [39]. Наиболее эффективным считается использование ортоэфиров с глиной KSF — этот способ применяют для синтеза всех трех незамещенных бензо-1,3-азолов [40]. Вместо кислот можно использовать ароматические или алифатические альдегиды в сочетании с нитробензолом, который играет роль окислителя в реакционной смеси [41].
X=NH, SH, ОН
HC(OEt)3, глина KSF PhMe, кипячени^
Существует два эффективных метода синтеза с использованием в качестве исходного соединения такого производное бензола, в котором фрагмент карбоновой кислоты уже введен к обоим гетероатомам. Они заключаются в превращении этих исходных в бис(силилокси)производные [42] или в простом нагревании с л-толуол сульфокислотой, как показано ниже [43]. Метод, который часто используют для синтеза исходных соединений только с одной ацильной группой, основан на перегруппировке Бекмана оксима о-гидроксиарилкетона; образующееся при этом соединение циклизуется in situ в кислой среде. Современный вариант этого синтеза представлен ниже [44]. Удобный метод получения моно-ацилированных предшественников основан на использовании смешаных ангидридов [37]. В очень мягком методе циклодегидратации о-гидроксиариламиноамидов, применяемом для синтеза бензоксазола на твердом носителе, используют стандартные условия реакции Мицунобу — трифенилфосфин и этиловый эфир азодикарбоновой кислоты [45]
aNHCOPh
OCOPh
NHMe
SH
Применение микроволнового облучения позволяет проводить реакции с амидами вместо кислот; при использовании мочевины или тиомочевины образуются 2-он(тион)производные, в присутствии сероуглерода и гидроксида калия также получают 2-тионы, а с изоцианатами (или изотиоцианатами [46]) образуются 2-ациламинопроизводные [47]. Реакции с бромцианом приводят к образованию 2-аминобензимидазолов [1Ь].
NH2 (H2N)2C=S, (СН2ОН)2 микроволновое облучение
NH2
82%
Бис(метилтио)имины (дитиокарбаматы), легко получаемые при взаимодействии ариламина с сероуглеродом и основанием, а затем с метилиодидом, реагируют с образованием 2-ариламинозамещенных гетероциклических соединений [48].
23.9.1.2. Другие методы
Наиболее важным среди альтернативных методов можно считать окислительную циклизацию ариламинотиоамидов в бензотиазолы. Основное преимущество метода заключается в том, что он не требует использования исходных сое-
568
Глава 23
динений, в которых гетероатомы в заместителях находятся в рртяо-положении друг к другу. В качестве окислителей обычно используют феррицианид калия или бром, как показано ниже [49]:
При взаимодействии N-ариламидинов с иодбензодиацетатом происходит окислительная циклизация с образованием бензимидазолов; на приведенной ниже схеме показан возможный интермедиат [50]:
Phl(OAc)2
Т PhMe, кипячение
NH2 Q5% *"
Бензотиазолы также получают из тиоанилидов с атомом фтора в мета-поло-жении (такое расположение заместителей способствует последующиму литии-рованию в орт о-положение). Процесс идет с отщеплением фторида и образованием дегидробензола, замыканием гетероцикла за счет внутримолекулярного присоединения серы и, наконец, введением заместителя в положении 7 при действии электрофила [51].
Важно отметить, что в синтезе хинолина по реакции Фридлендера (см. разд. 6.16.1.3) креатинин конденсируется с о-аминоарилальдегидами с образованием полициклических 2-аминобензимидазолов или их гетарильных аналогов, как показано ниже [52]:
креатинин
(СНгОН)г, 160 *С
23.9.2. Синтезы колец бензо-1,2-азолов
23.9.2.1. Синтез кольца 1Н-индазолов, 1,2-бензизотиазолов и 1,2-бензизоксазолов
Ранние синтезы 1,2-бензизоксазолов были основаны на циклизации оксимов о-галогенарилкетонов, стандартные условия приведены на схеме [53]. Только один геометрический изомер оксима способен к циклизации. Такой метод более применим к амидоксимам, так как два иминных геометрических изомера в
таких соединениях легко взаимопревращаются [54]. Аналогично при реакции с гидразонами образуются индазолы [55].
Ряд методов включает образование связи между двумя гетероатомами: чаще всего используют превращение ди(2-цианофенил)дисульфида в 3-хлорбензизо-тиазол в присутствии хлора [56] и в 3-аминобензизотиазолы в присутствии амидов магния, как показано на приведенной ниже схеме. При этом частично идет прямое образование гетероцикла, а частично образующееся промежуточное соединение требует окисления.
Вообще говоря, один из гетероатомов должен быть соединен с уходящей группой — гидроксильная группа оксимов как раз выступает в этой роли и легко отщепляется при протонировании [58] или ацетилировании [59]. Образование хлорсульфида служит противоположной цели [60]. Вероятно, наилучшие условия для циклизации оксимов салицилового альдегида (или о-гидроксиарилке-токсимов) — условия реакции Мицунобу [61].
NH3 EtOH
58%
DEAD, Ph3P
THF, 4 ’С
87% *
При взаимодействии арилгидразинов с хлоридом Ы-(дихлорметилен)-Ь},К-диметиламмония происходит электрофильная циклизация по ароматическому кольцу с образованием 3-аминоиндазолов, как показано ниже [62]. Синтез 1-бензил-З-гидроксииндазола нагреванием N-бензилфенилгидразина с мочевиной при 285 °C включает электрофильную циклизацию первоначально образующегося семикарбазида [2]
Ph
Cl2C=NMe2 Cl *
CH2CI2, кипячение
Ph
Классический [63], но используемый до сих пор [5,64] метод синтеза индазолов заключается в N-нитрозировании ацетанилида с последующей циклизацией по ормо-алкильной труппе, причем даже неактивированные алкильные труппы вступают в реакции. Однако в примере, приведенном ниже, opwo-заместитель содержит активирующую эфирную труппу. Последовательность превращений, по-видимому, включает промежуточное образование диазоацетата.
СО2Ме
• t-BuONO 95 ‘С
NHAC 71% *
Диазотирование антраниловой кислоты и немедленное восстановление диазотруппы служит очень простым методом получения 3-гидроксииндазола [2], а при гидролизе, диазотировании и восстановлении изатина, используемого в качестве исходного соединения, образуется индазол-3-карбоновая кислота [65]
Аккуратное применение методов литиирования позволяет синтезировать 7-замещенные бензизотиазол-S,S-диоксиды; так, использование в реакции 2 экв. литиирующего агента приводит к двум последовательным литиированиям в ормо-положение к сульфонамидной группе, причем первое приводит к замыканию цикла, а второе позволяет вводить электрофил в положение 7 [66].
2n-BuLI
THF,-80 ~С DMFr
43%
23.9.2.2. Синтезы колец 2Н-индазолов, 2,1-бензизотиазолов и 2,1-бензизоксазолов
В подходящих условиях окисления о-аминоарилкетоны [67] или о-аминоарил-эфиры [68] превращаются в 2,1-бензизоксазолы. Эта реакция циклизации может включать промежуточное образование нитрена или традиционную последовательность, подобно образованию 3-стирилпроизводных, как показано ниже:
Участие нитрена в образовании 3-замещенных 2,1-бензизоксазолов, по-видимому, более вероятно при термическом разложении о-азидоарилкетона [69], хотя возможно и образование прмежуточного соединения, в котором азид цикло присоединяется к карбонильной группе по 1,3-диполярному механизму [70].
В противоположность этому восстановление о-нитроальдегидов — очень эффективный путь к 3-незамещенным 2,1-бензизоксазолам. И цинк, и 2-бром-2-нитропропан служат необходимыми компонентами восстанавливающей смеси, хотя детальный механизм процесса до сих пор не установлен. Следует отметить сохранение галогенового заместителя в ароматическом кольце в примере, приведенном выше [71].
о-Аминотолуолы превращаются в 2,1-бензизотиазолы при взаимодействии с тионилхлоридом [72] или с N-сульфинилметансульфонамццом [73].
pci socig 'СНз л-ксилол, кипячение
NH2 30%
MeSO2N=S=O пиридин, PhH, кипячение
60%
Литература
1. (a) «The chemistry of benzimidazoles», Wright J. B. Chem. Rev., 48, 397 (1951); «Synthesis reactions and spectroscopic properties of benzimidazoles», Preston P. N. ibid., 74,279 (1974); (6) «2-Aminobenzimidazole in organic synthesis», RastogiR., Sharma S. Synthesis, 1983, 861; (в) Grimmett M. R. Imidazole and benzimidazole synthesis, Academic Press, London, 1997.
2. «Synthesis, properties and reactions of lH-indazol-3-ols and 1,2-dihydro-3H-indazol-3-ones», Baiocchi L.t Corsi G., Palazzo G. Synthesis, 1978,633.
3. «Benzisothiazoles», Davis M. Adv. Heterocycl. Chem., 14, 43 (1972); «Advances in the chemistry of benzisothiazoles and other polycyclic isothiazoles», idem, ibid., 38, 105 (1985).
4. «Benzisoxazoles (indoxazenes and anthranils)», Wiinsch К. H., Boulton A. J. Adv. Heterocycl. Chem., 8, 111 (1967).
5. Sun J.-H, Teleha C. A., Yan J.-S., Rogers J. D., Nugiel D. A. J. Org. Chem., 62, 5627 (1997).
6. Например: Harrison D., Ralph J. T., Smith A. С. B. J. Chem. Soc., 1963,2930.
7. Mistry A. G.t Smith K, Bye M. R. Tetrahedron Lett., 27,1051 (1986).
8. Sansen H. E, WibautJ. P. Reel. Trav. Chim., 56,699 (1937).
9. Cohen-Fernandes P., Habraken C. L. J. Org. Chem., 36, 3084 (1971).
10. Ellingboe J. W., Spinelli W., Winkley M. W., Nguyen T. T., Parsons R. W., Moubanak I. F., Kitzen J. M., Engen D. V., BagliJ. F. J. Med. Chem., 35,705 (1992).
11. JutziP., Gilge U. J. Heterocycl. Chem., 20,1011 (1983).
12. Harrison D., Ralph J. T. J. Chem. Soc., 1965, 3132.
13. Hong Y., Tanoury G. J., Wilkinson H. S., Bakale R. P., Wald S. A., Senanayake С. H. Tetrahedron Lett., 38,5607 (1997).
14. Yamada M., Sato Y, Kobayashi K, Konno F, Soneda T., Watanabe T. Chem. Pharm. Bull., 46,445 (1998).
15. KbvtrJ., Timor T, TompaJ. Synthesis, 1994,1124.
16. KatritzkyA. R., Chiviriga I., Cundy D. J. Heterocycles, 38,1041 (1994).
17. Wuts P. G. M., Gu R. L.t Northuis J. M., Thomas C. L. Tetrahedron Lett., 39, 9155 (1998).
18. Adams D. J. C., Bradbury S., Harwell D. C., Keating M., Rees C. W., Storr R. C. Chem. Commun., 1971,828; Kleim J. T. etal. J. Med. Chem., 39, 570 (1996).
19. Harada H, Morie T, Hirokawa Y., Terauchii H, Fugiwara L, Yoshida N., Kato S. Chem. Pharm. Bull., 43,1912(1995).
20. Например: Katritzky A. R., Drewniak-Deyrup M., Lan X, Brunner F. J. Heterocycl. Chem., 26, 829 (1989).
21. Moore S. S, Whitesides G. M. 1 Org. Chem., 47, 1489 (1982).
22. Ezquerra J., Lamas C., Pastor A., Garcia-Navio J. C., Vaquero J. J. Tetrahedron, 53, 12755 (1997).
23. Gale D. J., Wilshire J. F. K. Aust. J. Chem., 26,2683 (1973).
24. Welch W. M., Hanan С. E, Whalen W. M. Synthesis, 1992, 937.
25. Anderson B. A., Ham N. K. Synthesis, 1996, 583.
26. Gordon D. W. Synlett, 1998, 1065.
27. Sakamoto M., Nagano M., Suzuki Y., Satoh K, Tamura O. Tetrahedron, 52, 733 (1996).
28. Quast H, Schmitt E. Chem. Ber., 102,568 (1969).
29. Chikashita H, Ishihara M., Takigawa K, Itoh K. Bull. Chem. Soc. Jpn., 64, 3256 (1991).
30. Chikashita H, Ishibaba M., Ori K, Itoh K. Bull. Chem. Soc. Jpn., 61, 3637 (1988).
31. Chikashita H., Takegami N., Yanase Y., Itoh K. Bull. Chem. Soc. Jpn., 62, 3389 (1989).
32. UffB. C., Ho Y-Р., Brown D. S., Fisher L, Popp F. D., Kant J. J. Chem. Res., 1989 (S) 346, (M) 2652.
33. Davis M., Hudson M. J. J. Heterocycl. Chem., 20, 1707 (1983).
34. Ballesteros P., Elguero J., Claramunt R. M., Faure R., M. de la Concepcion Foces-Foces, Hernandez Caro F, Rousseau A. J. Chem. Soc., Perkin Trans. 2, 1986, 1677.
35. Cavaica L., GaetaniA., MangiaA., Pelizza G. Gazz. Chim. Itai., 100, 629 (1970).
36. Aran V. J., Diez-Barra E., de la Hoz A., Sdnchez-Verdu P. Heterocycles, 45, 129 (1997).
37. Quast H., Schmitt E. Chem. Ber., 102, 568 (1969).
38. Katritzky A. R., Aurrecoechea J. M., Vazquez de Miguel L. M. Heterocycles, 26, 427 (1987).
39. Costanzo M. J., MaryanoffB., E. eta!., J. Med. Chem., 39, 3039 (1996).
40. Villemm D., Hammadi M., Martin B. Synth. Commun., 26,2895 (1996).
41. Beu-Alloum A., Bakkas S., Soufiaoui M. Tetrahedron Lett., 39,4481.
42. RigoD., VallignyD., TaisneS., Couturier D. Synth. Commun., 18, 167 (1988).
43. De Luca M. R., Kerwin S. M. Tetrahedron, 53,457 (1997).
44. BhawalВ. M., Mayabhate S. P., LikhiteA. P., Deshmukh A. R. A. S. Synth. Commun., 25, 3315(1995).
45. Wang T, Hanske J. R. Tetrahedron Lett., 38, 6529 (1997).
46. Garin J,t Melendez E., Merchdn F. L., Merino P., Orduna J., Tejero T. J. Heterocycl. Chem., 28, 359(1991).
47. Khajavi M. S, Hajihadi M., Nederi R. J. Chem. Res. (S), 1996, 92; Khajavi M. S., Hajihadi M., NikpourF. ibid., 94.
48. Garin J., Meldndez E., Merchdn F. L., Ortiz D,, Tejero T, Synthesis, 1987, 368; Garin J., Melendez E., Merchdn E L., Menino P., Tejero T. Synth. Commun., 20, 2327 (1990).
49. Roe A., Tucher W. P., J. Heterocycl. Chem., 2, 148 (1965); Dreikom B. A., Unger P. J. Heterocycl. Chem., 26, 1735 (1989); Ambati N. B., Anand V., Hanumanthu P. Synth. Commun., 27,1487(1997).
50. Ramsden C. A., Rose H L. J. Chem. Soc., Perkin Trans. 1,1995, 615.
51. StanettyP., KrumpakB. J. Oig. Chem., 61, 5130 (1996).
52. Grivas S., Ronne E. J. Chem. Res. (S), 1994, 268; Ronne E., Olsson K, Grivas S. Synth. Commun., 24,1363 (1994).
53. King J. E, Durst T Can. J. Chem., 40, 882 (1962).
54. Fink D. M., Kurys В. E. Tetrahedron Lett., 37,995 (1996).
55. WalserA., Flynn T, Mason C. J. Heterocycl. Chem., 28,1121 (1991).
56. Beck J. R., YahnerJ. A. J. Oig. Chem., 43, 1604 (1978).
57. Nakamura T., Nagata H, Muto M., Saji L Synthesis, 1997,871.
58. Meth-Cohn O., Tamowski B. Synthesis, 1978,58.
59. Saunders J. C., Williamson W. R. N. J. Med. Chem., 22, 1554 (1979); McKinnon D. M., Lee К R. Can. J. Chem., 66,1405 (1988).
60. FinkD. M., Strupczewski J. T. Tetrahedron Lett., 34,6525 (1993).
61. Poissonnet G. Synth. Commun., 27,3839 (1997).
62. HervensE, Viehe H G. Angew. Chem., Int. Ed. Engl., 12,405 (1973).
63. Huisgen R., Bast К Org. Synth., Coll. Vol. V, 1973,650; Ruchardt C, Hassman V. Justus Liebigs Ann. Chem., 1980,908.
64. Yoshida T., Matsuura N., Yamamoto K, Doi M., Shimada K, Morie T, Kato S. Heterocycles, 43,2701 (1996).
65. Snyder H. R., Thompson С. B., Hinman R. L. J. Am. Chem. Soc., 74, 2009 (1952); Norman M. H, Navas E, Thompson J. B., Rigdon G. C. J. Med. Chem., 39, 4692 (1996).
66. Stanetty P., Krumpak B., Emerschitz T., Mereiter K. Tetrahedron, 53, 3615 (1997).
67. Prakarh O. Saini R. K, Singh S. P., Varma R. S. Tetrahedron Lett., 38, 3147 (1997).
68. Chauhan М. S., McKinnon D. M. Can. J. Chem., 53,1336 (1975).
69. NingR. Y., Chen W. K, Stembach L. H. J. Heterocycl. Chem., 11,125 (1974); Smalley R. K, Smith R. H, Suschitzky H. Tetrahedron Lett., 1978,2309.
70. Hall J. H, BehrR. F., ReedR. L. J. Am. Chem. Soc., 94,4952 (1972).
71, Kim В. H., Jun Y. M., Kim T. K., Lee Y. S., Baik Ж, Lee В. M. Heterocycles, 45, 235 (1997).
72. Davis M., White A. W. J. Org. Chem., 34,2985 (1969).
73. Singerman G. M. J. Heterocycl. Chem., 12,877 (1975).
24
ПУРИНЫ: РЕАКЦИИ И МЕТОДЫ СИНТЕЗА
пурин [9Н-пурин]
Н
Пурины представляют огромный интерес по ряду причин, но главная заключается в том, что совместно с некоторыми пиримидиновыми основаниями они входят в состав ДНК и РНК и, следовательно, имеют фундаментальное значение в процессах жизнедеятельности. Кроме того, нуклеозиды и нуклеотиды (см. ниже) действуют как гормоны, нейротрансмиттеры и присутствуют в некоторых коферментах. Взаимопревращение моно-, ди- и трифосфатных эфиров нуклеозидов лежит в основе переноса энергии во многих метаболических системах, а также включено во внутриклеточные связи. Их огромное биологическое значение наряду с исследованиями в области медицинской химии по поиску противоопухолевых и антивирусных (особенно анти-ВИЧ) препаратов привело к стремительному развитию химии пуринов в последние годы.
Ценные уроки можно извлечь из изучения химии пуринов, так как их реакции служат примером взаимодействия их составных частей — имидазольного и пиримидинового циклов (подобно тому, как свойства индола представляют собой модифицированную химию пиррола и бензола). Так, пурины могут подвергаться как электрофильной, так и нуклеофильной атаке по атому углерода пятичленного цикла, но исключительно нуклеофильным реакциям по атому углерода шестичленного цикла.
9Н-пурин
7Н-пурин
1Н-пурин
ЗН-пурин
Нумерация пуринового ядра отличается от нумерации, принятой для конденсированных структур, и построена так, как будто пурин — производное пиримидина. В принципе для пурина возможны четыре таутомерные формы, отличающиеся друг от друга положением атома водорода, связанного с одним из четырех кольцевых атомов азота; в кристаллическом состоянии пурин существует в виде 7Н-таутомера, однако в растворе 7Н- и 9Н-таутомеры представлены в примерно равных пропорциях; 1Н- и ЗН-таутомеры не обнаружены [1].
гипоксантин
Поскольку встречающиеся в природе пурины представляют собой амино-и/или кислородсодержащие производные, нет ничего удивительного в том, что большинство работ по химии пуринов имеет отношение к таким производным, и вследствие этого примерам простых реакций, таких, как в других главах, где они приведены как типичные, будет уделено ограниченное внимание. Изучение пуринов началось с интереса к встречающимся в природе производным, поэтому используется в основном «тривиальная» номенклатура. Нуклеозиды представляют собой производные сахаров [в основном 9-(рибозиды) или 9-(2'-дезоксирибозиды)] и пуриновых (или пиримидиновых) оснований. Например, аденозин представляет собой 9-(рибозид) аденина, который, в свою очередь, имеет тривиальное название 6-аминопурин, а нуклеотид — это 5'-фосфат (или ди-, или трифосфат) нуклеозида, например, аденозин-5'-трифосфат (АТФ).
аденозин-5'-дифосфат (АДФ)
аденозин-б'-монофосфат (АМФ)
аденозин-5'-трифосфат (АТФ)
О
„ 11
R= НО-Р-О—
ОН
о о
II II
-Р-О-Р-
I I
он он
ООО 11 11 П
R = нО-Р—О—Р—О-P—О—
I I I
он он он
Кофеин (1,3,7-триметилксантин) —- хорошо известный стимулятор, содержащийся в чае и кофе. В организмах млекопитающих конечным продуктом метаболического расщепления нуклеиновых кислот является мочевина, в то время как для птиц и рептилий — это мочевая кислота. Мочевая кислота была одним
из первых гетероциклических соединений, выделенных в чистом виде, и была получена Шееле из желчных камней в 1776 г.
ксантин
кофеин
6-Меркаптопурин используется для лечения лейкемии и других раковых заболеваний, ацикловир — антивирусное средство, используемое для лечения инфекционных заболеваний, вызываемых вирусом Herpes, а дидезоксиинозин (DDI) применяют против СПИДа.
Изостеры (т. е. молекулы с одинаковым составом, но различающиеся по строению) пуринов также имеют большое значение в медицине: аллопуринол используют для лечения подагры, а силденафил получил международную известность под торговым названием Виагра™ для лечения импотенции. Некоторые природные соединения можно рассматривать как изостеры пуринов: окса-нозин и туберсидин, оба полученные из Streptomyces, имеют антимикробную и противораковую активность.
но он
оксанозин
НО ОН
туберцидин
24.1. НУКЛЕИНОВЫЕ КИСЛОТЫ, НУКЛЕОЗИДЫ И НУКЛЕОТИДЫ [2]
Нуклеиновые кислоты представляют собой высокомолекулярные соединения, состоящие из мононуклеотидов, в которых цепи образуются за счет монофос-фатных связей между положением 5' одного нуклеозида и положением 3' другого. «Остов» цепи, таким образом, состоит из фосфатных и сахарных звеньев, к которым через регулярные интервалы присоединены пуриновые и пиримидиновые основания. Эти полимерные соединения известны как рибонуклеиновая
кислота (РНК), содержащая сахар — рибозу, и дезоксирибонуклеиновая кислота (ДНК), в которой углеводный остаток представляет собой 2-дезоксирибозу.
«•Остов» РНК: (-фосфат-сахар-фосфат-сахар-)
В, В', В*' — пуриновые и пиримидиновые основания
аденин гуанин
цитозин тимин
(только в ДНК)
урацил
ДНК содержит два пуриновых основания — гуанин и аденин, и два пиримидиновых — цитозин и тимин. В РНК тимин заменен на урацил, а в другой форме тРНК присутствуют другие формы основания, включающие небольшие количества N-алкилированных производных.
основная цепь
Единственные два сочетания, допускающие образование водородных связей: аденин/тимин (АТ) и гуанин/цитозин (ГЦ)
основная цепь
б тимин
аденин
Нуклеиновые кислоты содержатся в каждой живой клетке. ДНК служит носителем генетической информации. Это обусловлено тесной связью между двумя витками спиралей нуклеиновых кислот, которая основана на очень специфических водородных связях между адениновым (А) остатком одного витка и тиминовым (Т) остатком другого витка, который расположен строго напротив первого, а также между цитозиновым (Ц) остатком одного витка и гуаниновым (Г) остатком другого. Такое образование пар абсолютно специфично: аденин не может образовывать мультивалентные водородные связи с гуанином или цитозином, а цитозин не может образовывать связи с тимином или аденином. Изумительно, что вся наследственность и эволюция зависят от двух групп водородных связей! Генетический код для синтеза определенной аминокислоты обус
ловливается последовательностью трех оснований, Присоединенных к основной цепи, и читается по направлению 5' -+ У (например, триплет, кодирующий синтез триптофана, — ЦГГ), однако синтез большинства аминокислот кодируется более чем одним триплетом, в некоторых случаях даже до четырех, возможно также варьирование трех нуклеотидов; так, и УАУ, и УАЦ кодируют синтез тирозина. Генетическая информация передается при разделении двух витков спирали ДНК, затем происходит репликация за счет того, что на каждой старой цепи образуется новая цепь, при этом происходит связывание пар АТ и ГЦ водородными связями.
24.2. РЕАКЦИИ С ЭЛЕКТРОФИЛЬНЫМИ РЕАГЕНТАМИ
24.2.1. Присоединение по атому азота
24.2.1.1. Протонирование
Пурин представляет собой слабое основание (рА^ 2,5). С помощью спектроскопии 13С-ЯМР было установлено, что все три протонированные формы существуют в растворе, но преобладает все же катион, образующийся при N(i)-npoTo-нировании [3]. В растворе сильной кислоты образуется дикатион за счет протонирования по атому азота N(l) и по пятичленному циклу [4].
Присутствие в молекуле пурина кислородсодержащей функциональной группы не оказывает особого влияния на основность пурина: так, величина p/fa гипоксантина равна 2,0. Наличие аминогрупп повышает основность пуринового производного (рА'а аденина равна 4,2), а наличие оксогрупп уменьшает основность (рКа гуанина равна 3,3). Расположение протона именно в пятичленном гетероцикле в кристаллической протонной соли гуанина определено методом рентгеноструктурного анализа; это прекрасно иллюстрирует чрезвычайно тонкое взаимодействие заместителей и кольцевых гетероатомов, и, хотя 2-амино-труппа повышает основность пурина, это вовсе не означает, что протонирование обязательно пойдет по соседнему положению Np).
Незамещенный пурин медленно разлагается в разбавленных кислотах; так, в 1 н. серной кислоте при 100 ”С он разлагается в течение 1 ч на 10%. Устойчивость оксипуринов к разбавленным кислотам различна: например, ксантин устойчив в 1 н. серной кислоте при 100 °C, в то время как 2-оксипурин в тех же условиях полностью превращается в пиримидин за 2 ч.
водн. 1н. H2SO4 юо‘С
25%
+ НСО2Н
24.2.1.2. Алкилирование по атому азота
Как и следовало ожидать от систем, содержащих четыре атома азота, N-алки-лирование пуринов протекает довольно сложно, и в нем могут участвовать нейтральная молекула или N-анион. Пурин реагирует с метилиодидом с образованием соли 7,9-диметилпуриния [5].
Mel
МеОН, 100 *с
Me
В нейтральных условиях аденин алкилируется по атому азота N(3), а в присутствии основания происходит 7/9-замещение. Производные аденозина, с одной стороны, обычно алкилируются по положению 1, что, вероятно, обусловлено тем, что атаке по положению N(3) мешает расположенный в лери-положении заместитель— 9-рибоза. С другой стороны, атака по атому N<3) все же может происходить при внутримолекулярной кватернизации, которая представляет собой основной побочный процесс при замещении атома галогена в положении 5'.
Эффективный метод алкилирования 6-аминогрупп заключается в перегруппировке соли 1-алкиладенозиния; процесс идет по ANRORC-механизму—перегруппировка Димрота [6,7].
Другая перегруппировка по реакции Димрота позволяет ввести изотопную метку в положение 1, и в качестве исходного соединения используют аденозин, меченный по атому азота аминогруппы [8].
Me?NH
Me2NH, HI нагревание
Алкилирование кислородсодержащих пуринов, например гипоксантина, в щелочной среде идет как по амидному атому азота, так и по атому азота пятичленного цикла, и поэтому селективность процесса становится весьма проблематичной. В нейтральных условиях ксантин превращается в 7,9-диалкилиро-ванные четвертичные соли. На примере алкилирования 6-хлорпурина можно проследить зависимость направления реакции от условий ее проведения: в растворе основания замещается как положение 7, так и 9 [9], в то время как реакция с карбокатионом селективно идет атому азота N(9> [10].
Для аденинов очень удобно использовать 9-трет-бутилдиметилсилилокси-метильную защитную группу, поскольку она способствует хорошей растворимости в органических растворителях. Введение этой труппы происходит поста-дийно путем первоначального превращения аденина в 9-гидроксиметильное производное при взаимодействии с формальдегидом и основанием и последующего О-силилирования [И].
Соотношение продуктов N(9>- и М(7)-алкилирования также зависит от размера заместителя в положении 6: при наличии объемного заместителя в положении 6 алкилирование идет преимущественно по положению 9, а не 7 [12]. Соотношение это также зависит от природы алкилирующего агента: так, при использовании акцептора Михаэля, например метилакрилата, алкилирование обратимо и концентрация термодинамического продукта может возрастать [13]. Региоспецифичное 7-алкилирование может быть проведено кватернизацией 9-рибозида с последующим гидролитическим удалением углеводного остатка, как показано на схеме [14]. Алкилирование по атому азота N(7) в нуклеиновых кислотах лежит в основе механизма мутагене-за/канцерогенеза при действии некоторых природных токсинов, таких, как афлатоксин [15].
АсОН, 20 ’С нагревание
66%
В условиях, когда селективность N(7)/N{9) мала, алкилирование в положение 9 можно направить путем введения объемной защитной группы в положение 6Ц6].
BrCH2CO2Me
/-Pr2NEt, DMF, 20 *С 71%
Возвращаясь опять к вопросу о региоселекгивности, следует упомянуть также процесс рибозилирования пуринов, в котором возможно образование эпимерных соединений при связывании с атомом Г рибозы, и этот процесс часто более трудно контролировать. Многочисленные исследования показали, что различные условия оказываются эффективными в особых случаях, но таких условий, которые были бы универсальными, обнаружить не удалось [17]. В таких реакциях алкилирования обычно используют взаимодействие ацилированных или галогеносодержашихрибозидов с ртуть- [18], кремний- [17] или натрийпро-изводными [19] пурина, причем иногда может быть достигнуто стереоселектив-ное замещение атома галогена.
р-То1СО2
Другие методы, позволяющие контролировать стереохимию реакции, включают использование изопропилиденовой защитной группы, экранирующей остаток сахара [20], или анхимерного содействия бензоатной группы в положении 2' [21].
Ферментативный катализ был использован для рибозилирования пуриновых и родственных структур при реакции с 7-алкилированными нуклеозидами [22].
PhCO2 O2CPh
24.2.1.3. Ацилирование по атому азота
Пурины реагируют с ацилирующими агентами, такими, как хлороформиаты или этилпирокарбонаты [23], давая невыделяемые М+-ацилиевые соли, которые затем способны претерпевать различные превращения при присоединении нук-
леофилов, как с раскрытием цикла, так и с образованием продуктов рециклизации [24].
(EtO2C)2O
Н2О, pH 4,5
57%
(ЕЮ2С)2О
Н2О, pH 4,5
33%
CICO2Ph
водн. THF, 20 *С
24.2.1.4. Окисление по атому азота
В присутствии надкислот происходит N-окисление пуринов с образованием 1- и/или 3-оксидов в зависимости от условий [25]. Аденин и аденозин дают 1-ок-сиды, тогда как в реакции с гуанином получают 3-оксид [26]. З-Оксид незамещенного пурина может быть получен в результате окисления 6-цианопурина (по атому N(3)) с последующим гидролизом и декарбоксилированием [25]; относительно легкое отщепление диоксида углерода напоминает аналогичные процессы, которые уже обсуждались ранее для пиридин-а-кислот (разд. 5.12). И(7)-Оксид аденина можно получить при окислении Нррбензил-ЗН-аденина с последующим удалением защитной группы [27].
24.2.2. Замещение по атому углерода
Не опубликованы сообщения об обычных реакциях электрофильного ароматического замещения для пурина или его простейших алкильных производных.
24.2.2.1. Галогенирование
Незамещенный пурин легко образует Ы+-галогеновый комплекс, однако С-за-мещения при этом не происходит, в то время как производные аденозина [28], гипоксантина и ксантина [29] подвергаются фторированию [30], хлорированию и бромированию по положению 8. Возможно, замещение происходит в резуль-
тате образования солей N-галогенопуриния с последующим нуклеофильным присоединением бромид-аниона по положению 8 и отщеплением галогено-водорода.
Вг2 АсОН 100*см 80%
24.2.2.2. Нитрование
Ксантин нитруется по положению 8, хотя и в довольно жестких условиях [31]
100%-ная HNO3 АсОН, 120 *С
45%
24.2.2.3. Реакции сочетания с солями диазония
Амино- и оксипурины вступают в реакции сочетания по положению 8; реакцию следует проводить в слабощелочной среде, так как процесс, по-видимому, идет через образование аниона [32].
4-cic6h4n2 сГ кон, о-ю -с
24.3. РЕАКЦИИ СО СВОБОДНЫМИ РАДИКАЛАМИ
Пурины легко вступают в реакции с гидроксил-, алкил-, арил- и ацил-радикала-ми обычно по положению С(б) [33] или С(8) (или С(2>), если положение 6 занято. Реакция идет более эффективно и селективно по положению 8, если замещение проводить при низких значениях pH [34]. В нуклеозидах очень эффективно идет циклизация 5'-8-радикала, однако 5'-радикал можно уловить до циклизации при использовании большого избытка акрилонитрила [35].
f-BuOgCOMe bv I
[ме‘]рН1
67% **
ОМе
ОМе
24.4. РЕАКЦИИ С ОКИСЛИТЕЛЯМИ
Существует несколько довольно важных процессов окисления пуринов помимо N-окисления (разд. 24.2.1.4), но при взаимодействии с диметилдиоксираном с Хорошим выходом образуется 8-оксопроизводное; процесс, вероятно, идет через промежуточное образование 9,8- или 7,8-оксазиридина [36]. Окисление по положению 8 имеет важное значение in vivo\ например, ксантин окисляется в присутствии оксомолибдофермента — ксантиноксидазы — по механизму, который уже обсуждался.
24.5. РЕАКЦИИ С ВОССТАНОВИТЕЛЯМИ
Восстановление замещенных пуринов происходит довольно сложно, причем часто наблюдается раскрытие цикла. 1,6-Дигидропурин получают каталитическим или электрохимическим [38] восстановлением пурина, однако это соединение неустойчиво. Более стабильные производные можно получить при восстановлении в присутствии ацилирующих агентов [39]. 7/9-Четвертичные соли легко восстанавливаются боргвдридом по пятичленному циклу с образованием дигидропроизводных [40].
н2, Pt, Ас2О
20 *С, 1 ату
26%
Ас
24.6. РЕАКЦИИ С НУКЛЕОФИЛЬНЫМИ РЕАГЕНТАМИ
Реакции 2-, 6- и 8-галогенопуринов имеют очень важное значение. Галогенопу-рины можно получить из окси-, амино- или тиопуринов, а 8-изомеры также образуются при непосредственном галогенировании или через литиевые производные. Наиболее часто используются хлорпурины; бром- и иодпурины реагируют подобным же образом без каких-либо особых преимуществ; фториды более реакционноспособны.
Относительно легкое нуклеофильное замещение по механизму присоедине-ния/элиминирования (разд. 2.3.1) происходит по всем трем положениям при взаимодействии с широким кругом нуклеофилов, таких, как алкоксиды [41], сульфиды, амины, азид-, цианид- и малонат-анионы и родственные им карбанионы [42].
В 9-замещенных пуринах относительная реакционная способность различных положений изменяется в ряду 8 > 6 > 2, а в 9Н-пуринах эта последовательность несколько видоизменяется: 6 > 8 > 2; изменение реакционной способности положения 8 связано с образованием аниона в пятичленном цикле. Наоборот, в кислой среде реакционная способность положения 8 к нуклеофильному замещению увеличивается: протонирование по пятичленному циклу облегчает процесс нуклеофильного присоединения [41]. Относительную реакционную способность положений 2 и 6 можно прекрасно проиллюстрировать на примере условий реакции, требуемых для замещения соответствующего хлорида гидразином относительно активным нуклеофилом [43]. В данном случае не наблюдается аналогии между относительной позиционной реакционной способностью галогенопуринов и галогенопиримидинов (4 >2).
ВОДН. N2H4
80’С H2NHN
58%
В 2,6-дихлорпурине реакционная способность положения 6 выше, чем в 6-хлорпурине, что обусловлено индуктивным эффектом второго атома галогена: так, дигалогенид реагирует с простыми аминами при комнатной температуре, тогда как для проведения такой реакции с моногалогенидом требуется нагревание, например, в изопропиловом спирте. Если в молекуле присутствует электронодонорный заместитель, например аминшруппа, это несколько дезактивирует атом галогена к замещению и, наоборот, кислородсодержащие пурины, по-видимому, благодаря их карбонильной таутомерной структуре легко вступают в реакции нуклеофильного замещения [44].
PhNH2
водн. МеО(СН2)гОН нагревание
60%
Образованием N-аниона при депротонировании пятичленного цикла можно объяснить тот факт, что при взаимодействии 8-хлорпурина с амидом натрия образуется аденин (6-аминопурин): невозможность атаки по положению 8 позволяет идти альтернативному присоединению по положению 6, что в конечном счете и определяет строение основного продукта реакции [45].
NaNH2
NH3 (жидк.)
-30 'С
30%
Прямое превращение инозинов в 6-аминопроизводные без промежуточного образования галогенопуринов можно осуществить при нагревании со смесью пентаоксида фосфора и гидрохлорида амина [46].
Замещение атома иода можно проводить в более мягких условиях при катализе солями меди, хотя механизм участия в этом процессе соли металла не ясен [47].
TBDMSO OTBDMS
В качестве других уходящих групп можно назвать сульфоксидную [48], триф-латную [49] и арил- или алкилтиогруппы [50]. Сульфоны проявляют высокую реакционную способность в некоторых реакциях нуклеофильного замещения, а также выступают в качестве активных промежуточных соединений в катализируемых сульфинатами реакциях замещения атома галогена [51].
KCN 60 *с
(1 ч
88%
Замещение атомов галогенов можно проводить в условиях катализа аминами, например триметиламином, пиридином [52], DABCO (1,4-диазабицик-ло[2.2.2]октан) [53]. Механизм катализа включает образование интермедиата — четвертичной аммониевой соли, которая обладает большей реакционной способностью в отношении нуклеофилов, чем исходный галогенид. Этот интермедиат, если нужно, может быть выделен. Триметиламин даст наиболее реакционноспособные четвертичные соли, но использование DABCO более удобно. Относительная реакционная способность к нуклеофильному замещению по положению 6 при использовании различных аминов составляет триметиламин : DABCO : хлорин ~ 100 :10:1 [54]. Таким образом можно получить, например, циано- [55] и фторзамешенные [56] производные.
Для малоактивных нуклеофилов — ариламинов ~- можно использовать фтор в качестве уходящей группы [57] или замещение атома брома в присутствии соединений палладия [58].
Аминогруппы превращаются в хорошо уходящие группы модификацией их в 1,3,4-триазол. Изомерные триазолы образуются при взаимодействии инозина с 1,2,4-триазолом в присутствии фосфорилхлорида и триэтиламина и также служат хорошими уходящими группами [59].
Нуклеофильное ацилирование можно осуществить при использовании ароматических альдегидов и азолиевой соли в качестве катализатора [60] (см. разд. 21.11).
24.7. РЕАКЦИИ С ОСНОВАНИЯМИ
24.7.1 . Депротонирование N-водорода
Пурин (рКа 8,9) — немного более сильная кислота, чем фенол, и гораздо более сильная кислота, чем имвдазол или бензимидазол (р^ 14,2 и 12,3 соответственно). Вероятно, такая сравнительно высокая кислотность обусловлена значительной делокализацией отрицательного зарвда аниона между четырьмя атомами азота, однако алкилирование аниона (разд. 24.2.1.2) идет по пятичленному циклу, так как при атаке по положениям N<i) или N(3) образовывались бы менее ароматические структуры.
Оксипурины — еще более сильные кислоты благодаря еще более значительной делокализации с участием карбонильной группы: величины рА^ для ксантина и мочевой кислоты равны 7,5 и 5,75 соответственно.
24.7.2 . Депротонирование С-водорода
Быстрое дейтерирование пурина по атому С(8) [61] в нейтральном водном растворе при 100 °C, по-видимому, осуществляется путем 8-депротонирования катиона пуриния с образованием переходного илида (для сравнения см. об 2Н-об-мене в 1,3-азоле, разд. 21.1.2.1). 9-Алкилпурины подвергаются довольно быстрому обмену в растворе основания, включающему прямое депротонирование свободного гетероцикла.
d2o юо *с.
24.8. РЕАКЦИИ N-МЕТАЛЛИРОВАННЫХ ПУРИНОВ Эти реакции были обсуждены в разд. 24.2.1.2.
24.9. РЕАКЦИИ С-МЕТАЛЛИРОВАННЫХ ПУРИНОВ
24.9.1. Литийорганические производные
Для препаративного литиирования пуринов необходима защита положений 7/9, в таком случае литиирование идет по положению С(8) [62]. Для получения 2- или 6-литийорганических производных пуринов используют реакцию обмена атома галогена при взаимодействии с алкиллитием, однако важно поддерживать очень низкую температуру во избежание смещения равновесия в сторону образования
ствии сильного основания, такого, как диизопропиламид лития, даже при наличии N-водорода в другом цикле [64]. 8-Галогснопурины образуются при взаимодействии с различными донорами галогена с очень хорошими выходами; 8-ли-тиирование О-силилзащищенных 9-рибофуранозилпуринов можно провести при использовании примерно 3 экв. диизопропиламида лития [65].
OTBDMS
OTBDMS
При селективном 8-литиировании 6-хлорпуринорибозида с последующим взаимодействием со станнил- или силилхлоридом образуются выделяемые 2-за-мещенные соединения в результате перегруппировки 2-аниона, получаемого при повторном литиировании первоначального 8-замещенного соединения, как показано ниже на схеме [66]:
5UTMP, НМРА
THF, -70 ‘С Me3SiClr
83%
24.9.2. Реакции, катализируемые палладием
Иод- и бромпурины подвергаются обычным реакциям, катализируемым палладием [67] и никелем в стандартных условиях. Подобно другим галогеназинам хлорпурины обычно достаточно активированы для участия в катализируемых палладием реакциях, хотя в некоторых случаях может быть предпочтительнее использование никелевого катализа [68].
Реакции сочетания с 2,6-дихлорпурином идут селективно по положению 6, однако при замене атомов хлора на бром или иод замещение идет по положению 2 [69]. Аналогично ведет себя 6,8-дихлорпурин — и в данном случае большей реакционной способностью обладает атом хлора в положении 6 [70]. 8-Бромди-аминопурины после предварительного введения защитных групп с использованием силилирования вступают в обычные реакции сочетания с гетарилстанна-нами [71].
24.10. ОКСИ-И АМИНОПУРИНЫ
Этим соединениям свойственна таутомерия, и они преимущественно существуют в карбонильной и аминной формах, т. е. не отличаются от соответствующих пиримидинов и имидазолов
24.10.1. Оксипурины
24.10.1.1. Алкилирование
Подобный амидному N-водород в оксипуринах относительно кислый, эту кислотность можно понять при рассмотрении вклада в анион резонансной структуры, подобной феноляту. Алкилирование идет по атому азота, а не по атому кислорода [72].
24.10.1.2. Ацилирование
В противоположность реакциям алкилирования ацилирование и сульфонили-рование часто идут по атому кислорода. Образующиеся О-ацильные производные часто неустойчивы, но могут быть использованы; так, например, при проведении ацилирования в пиридине в качестве растворителя получают пиридиниевую соль в результате замещения ацилоксигруппы пиридином. Как
О-ацилированные пурины, так и соответствующие пиридиниевые соли могут, в свою очередь, реагировать с нуклеофилами [73], что позволяет замещать амидный атом кислорода. Этот метод служит важной альтернативой методу активации карбонильной группы путем превращения ее в галоген (см. схему ниже).
PhCO2
cf3co2
Аналогично происходит реакция с использованием силилйрующего реагента в присутсвии нужного нуклеофила: сначала идет О-силилирование, а затем — замещение силилоксигруппы [74]
(Me3Si)2NH, (NH4)2SO4
145 ’С_____________
84%
24.10.1.3. Замещение на атом хлора [75]
Это очень важная реакция в химии пурина широко используется для постадий-ного введения нуклеофилов (разд. 24.5), в том числе замещения на водород в результате химического (HI) или каталитического гидрогенолиза. Наиболее важно использование фосфорилхлорида, неразбавленного или в растворах, особенно в случае присутствия рибозы; в качестве альтернативного реагента применяют тионилхлорид. 2-Дезоксисоединения более чувствительны кдействию кислоты, и в связи с этим необходимо использование более мягких реагентов (тетрахлорметана с трифенилфосфином) для замены оксигруппы на атом хлора [76].
РОС13, PhNMe2 MeCN, EUN* СГ 85%
Синтезы аденина и гуанина из мочевой кислоты хорошо иллюстрируют селективные трансформации галогенопуринов, получаемых из предшественника — оксипурина [77]
24.10.1.4. Замещение на атом серы
Замещение на атом серы [78] возможно либо через промежуточное получение галогенопроизводного, либо напрямую с использованием сульфида фосфора
P4S10
пиридин, нагревание 64%
24.10.2. Аминопурины
24.10.2.1. Алкилирование
Алкилирование в нейтральной среде идет по кольцевому атому азота; последующая перегруппировка Димрота (разд. 24.2.1.2) этих солей приводит к образованию пуринов, алкилированных по боковой цепи. Прямое введение заместителя к атому азота в боковой цепи может быть осуществлено в результате восстановительного алкилирования [79]. Подобный метод заключается в восстановлении промежуточно образующегося выделяемого бензотриазо-лилпроизводного, что позволяет проводить реакцию в более контролируемых условиях [80].
24.10.2.2. Ацилирование
Аминопурины ведут себя точно так же, как анилины в реакциях с ангидридами и хлорангидридами кислот, хотя образующиеся амиды иногда более легко гидролизуются. Как моно-, так и диацилирование может быть использовано для создания защитных групп.
24.10.2.3. Диазотирование
Взаимодействие 2-амино- и 6-аминопуринов с азотистой кислотой происходит точно также, как для 2-аминопиридинов — в результате образуются соли диазония, но менее стабильные, чем фенилдиазониевые соли. Несмотря на это, их можно использовать для введения таких групп, как галогены [81], или, безусловно, кислорода при взаимодействии с водой с потерей атома азота. Значительно более устойчивы 8-диазониевые соли [82].
Диазотирование можно также проводить в растворах оснований, особенно в случае чувствительных к кислотам рибозидов [83]. Нуклеофильное замещение аминотруппы на гидрокситруппу можно осуществить ферментативно в присутствии аденозиндезаминазы; это полезный препаративный метод, так как он позволяет проводить очень селективную трансформацию в очень мягких условиях [84]. Химический гидролиз требует более жестких условий.
В подобной реакции с алкилнитритами образуются пуринил-радикалы, которые способны отщеплять атом галогена от галогеносодержащего растворите-
ля, и такой метод обычно предпочтителен для превращения аминопуринов в галогенопурины [85]. Аналогично при использовании диметилсульфида образуются метилтиопурины [86].
24.10.3. Тиопурины
Тиопурины получают из галогено- или оксипуринов или синтезом кольца. В противоположность оксипуринам тиопурины в щелочном растворе легко алкилируются по атому серы, а не по атому азота [87].
Вг(СН2)2ОН водн. NaOH, 20 *С
80%
Тиолы также служат исходными соединениями для получения соответствующих бромпроизводных при взаимодействии с бромом или бромистоводородной кислотой [88]. Алкилтиогруппы замещаются различными нуклеофилами, однако соответствующие сульфоны более реакционноспособны [52,89].
NaCN
©
Превращение 2,6-дитиола нуклеозида в 6-метиламиноаденозин в результате окисления диметилдиоксираном иллюстрирует некоторые поучительные моменты. Предположительными интермедиатами служат сульфиновые кислоты: 2-сульфиновая кислота отщепляет диоксид серы, оставляя атом водорода в положении 2, а нуклеофильное замещение 6-сульфиновой кислоты (или, возможно, сульфоновой кислоты после дальнейшего окисления) приводит к введению аминоц)уппы. Подобные реакции возможны для пиримидинтиолов [90].
На схеме показаны интермедиаты, образующиеся из дисульфиновой кислоты, однако не ясна последовательность следующих превращений: окисление/от-щепление диоксида серы/замещение.
24.11. АЛКИЛПУРИНЫ
Относительно мало известно о какой-либо особой реакционной способности алкильных групп алкилпуринов. Единственное, что можно сказать: их реакционная способность сравнима с таковой для ос-алкильных заместителей в пиридинах [91].
24.12. ПУРИНКАРБОНОВЫЕ КИСЛОТЫ
То же самое можно сказать и в отношении пуринкарбоновых кислот: они ведут себя подобно пиридин-ос-карбоновым кислотам и подвергаются декарбоксилированию при нагревании [92], хотя опять же очень скудна информация об этих соединениях.
24.13. СИНТЕЗЫ ПУРИНОВ
Поскольку нуклеозиды легко можно получить из природных источников, они зачастую служат исходными соединениями для получения замещенных пуринов.
24.13.1. Синтез кольца
Существует два основных подхода к построению циклической системы пурина. Категория, которую можно определить как процессы, идущие «в одной колбе», представляет собой адаптацию процессов, происходивших, возможно, в добио-
логический период, когда биологической жизни еще не существовало, когда простые молекулы, такие, как циановодород и аммиак, как полагают, соединялись с образованием первых пуринов.
24.13.1.1. Из 4,5-диаминопиримидинов
4,5-Диаминопиримидины реагируют с карбоновыми кислотами или их производными, давая пурины, причем «карбонильный» атом углерода становится атомом С(8)
Синтез Траубе
8-Незамещенные пурины образуются при нагревании 4,5-диаминопиримидинов с муравьиной кислотой [93], однако лучше использовать формамид [94] (или формамидин [95]). Реакция заключается в циклодегидратации промежуточно образующегося формамида, что обычно и происходит in situ при использовании формамида, однако применение муравьиной кислоты требует второй более жесткой стадии процесса. Таким способом может быть получен незамещенный пурин [96].
8-Замещенные пурины синтезируют подобным образом с использованием ацилирующих агентов, соответствующих высшим кислотам; в большинстве случаев амиды выделяют и затем циклизуют [97]. Исходные диаминопиримидины обычно получают реакцией сочетания моноаминопиримидина с ионом арилдиазония с последующим восстановлением или синтезом кольца [98].
4-МеОС6Н4СОС1
49% **
Предшественники 9-замещенных пуринов, для которых необходимо наличие заместителя в 4-аминогруппе пиримидина, получают при взаимодействии 4-хлорпиримидина с аминами.
0
•NH2 HN
n^nh h*n
I глюкоза
AcOH MeO(CH2)2OH нагревание 59%
глюкоза
H2N(CH2)4OH ci Et3N,n-BuOH
3aTeM
/ \ 4-CIC6H4N2+
k // водн. NaOAc, AcOH -
---------------H2N
NH
R
Cl
‘NH 91%
R
N**\a 68%
Cl
/NZ>y-N=NAr Zn ’
AcOH
ITT
HCONH2, HCO2H
Na2S2O4
100 ~C_______
89% ,, o
MeS
О
При необходимости проведения циклизации в более мягких условиях, например из-за присутствия остатка сахара, можно использовать ортоэфир [99] (часто активированный [100] уксусным ангидридом) или диацеталь эфира [101] (как показано ниже).
(ЕЮ)2СНОАс
DMF, 20 ‘С
90%
водн. NH, 150 ‘С, запаянная ампула
95%
Родственная реакция заключается в окислительной циклизации анилов, первоначально проводимая в жестких условиях, таких, как нагревание в нитробензоле [102], но в настоящее время эту реакцию проводят при более низких температурах с использованием диэтилового эфира азодикарбоновой кислоты [103]. Аминонитрозопиримидины также можно напрямую превратить в пурины (без восстановления до диамина) при взаимодействии с реагентами Виттита [104].
PhCH=O диоксан, нагревание
Е% 3
Для образования 8-оксо- или 8-тиопуринов необходимы одноуглеродные компоненты с высшей степенью окисления: для таких целей подходят мочевина и тиомочевина. При действии хлороформиата на пурин происходит раскрытие пятичленного цикла (разд. 24.2.1.3), образующиеся соединения могут быть рециклизованы в 8-оксопурины [105].
NH3
EtOH, 20’С
затем 175'С
55%
24.13.1.2. Из 5-аминоимидазол-4-карбоксамида или 5-аминоимидазол-4-карбонитрила [106]
5-Аминоимидазол-4-карбоксамид (или соответствующий нитрил) аналогично взаимодействуют с компонентами, имеющими степень окисления карбоновых кислот, с образованием пуринов, при этом «карбоксильный» атом углерода становится атомом С(2>
В процессе биосинтеза пуринов сначала образуется имидазольное кольцо из глицина и формиата, а затем уже гипоксантин и другие природные пурины. В лабораторных условиях большинство методов построения пурина на основе имидазола используют в качестве исходных производные 5-аминоимидазол-4-карбоновой кислоты, в частности ее амиды (известные под аббревиатурой AICA), которые вместе с их рибозидами коммерчески доступны из биологических источников. При использовании 5-аминоимидазол-4-карбонитрила получают 6-аминопурины, а также незамещенный аденин [107].
Превращение в 2-алкил- или 2-арилпурины требует введения одного атома углерода для построения шестичленного цикла; для этих целей обычно используют реакцию конденсации с эфирами в присутствии основания [108], хотя иногда применяют амиды [109]. При использовании изотиоцианатов получают 2-тиопурин [110].
h2n-
h2n-
0 /°
Tr-N (9fiCp)2° Нго*7Г“-N NaOMe
Л \\ CF3C°2 H, нагревание F // \\ DMF, нагревание p3C
<n2 42% N-4n2 24%
CHjp-Tol CHap-Tol
Существует несколько примеров синтеза кольца пурина, которые исходят из простейших имидазолов; например, 5-аминоимидазол обычно получают и используют in situ [111].
7-Замещенные пурины могут быть получены из оксима 5-аминоимидазол-4-альдегида после превращения его в аминоэфир и реакции с аммиаком, как показано ниже [112]:
NOH
н2, Pd/C НС(ОМе)з, EtOH кипячение^
NOH
NH3, EtOH 120*0 66% **
(3 стадии)
24.13.1.3. Реакцией циклоприсоединения
2,4,б-Трис(этоксикарбонил)-1,3,5-триазин выступает в качестве азадиена в реакции с 5-аминопиразолами с образованием изостеров пурина — пиразо-ло[3,4-^пиримидинов [ИЗ]. Поскольку 5-аминоимидазолы, необходимые для аналогичного синтеза пуринов, относительно неустойчивы, можно использовать 5-аминоимидазол-4-карбоновые кислоты: при декарбоксилировании in situ образуется требуемый диенофил [114].
DMF, 80 *С 83%
24.13.1.4. Синтезы «в одной колбе»
Вызывает изумление тот факт, что относительно сложные молекулы, такие, как пурины, могут быть получены в результате последовательных конденсаций очень простых молекул, а именно: аммиака и циановодорода. Взаимодействие этих «простых» молекул привело к образованию пуринов в природе, что, несомненно, создало дальнейшие условия для эволюции природных систем уже на основе более «сложных» пуриновых молекул. Другими словами, с большой долей вероятности можно предположить, что пурины могли включиться в процесс
зарождения жизни не только потому, что они уже существовали в природе, но еще и потому, что они обладали нужными химическими свойствами.
Аденин C5H5N5 — формально пентамер циановодорода—действительно может быть получен в лабораторных условиях реакцией аммиака с циановодородом, хотя и с невысоким выходом. Родственный и более препаративный метод основан на дегидратации формамида [115]. Незамещенный пурин также можно получить из формамида [116].
РОС13
120 ’С
HCONH2
запаянная ампула — ►
Методы, основанные на этом фундаментальном процессе, включают конденсацию одно-, двух- и трехуглеродных фрагментов, таких, как амидины, аминонитрилы и карбоксамиды, которые представляют собой интермедиаты различных стадий взаимодействия аммиака и циановодорода. В качестве промежуточных соединений обычно образуются пиримидины или имидазолы [117].
24.13.2. Примеры синтезов некоторых важных пуринов
24.13.2.1. Аристеромицин
Синтез аристеромицина [118] основан на использовании реакции замещения пиримидин-4-хлорида, что позволяет вводить аминогруппу и получать таким образом 4,5-диаминопиримидин для последующего замыкания пятичленного цикла
24.13.2.2. Аденозин
Аденозин [119] также синтезируют на основе стратегии пиримидин -> пурин. В этом синтезе фрагмент сахара также вводят на ранней стадии, но в данном случае за счет конденсации с 4-аминогруппой.
MeONa, МеОН
80%
24.13.2.3. Силденафил (Виагра™)
Синтез силденафила начинается с обычного синтеза пиразола (см. для сравнения разд. 22.13.1.1) с последующим N-метилированием и нитрованием кольца. Манипулирование с функциональными группами позволяет получить пира-зольный эквивалент AICA (разд. 24.13.1.2), из которого образуется пиримидоно-вое кольцо в результате взаимодействия с хлорангидридом замещенной бензойной кислоты.
л-Рг
л-Рг
Рг
i О водн. МгНд EtO2C*% “-62%^ EtO2C
Н
/7~/ конц. HNQ)
Ме^ЗОд Ц Ч. водн. NaOH конц. H2SO4 -------► EtO2C^\ zN 71% * H02C
Me (2 стадии)
O2N л-Рг
H2N л-Рг
SOCI2^ nh3, // \ “^H2N0C^Xnzi
Me
,СОС1
02N л-Рг
N
HjjNOC
Me
42%
(3 стадии)
H2N0C*xnz пиридин^-^^ОЕ!
Ме 88%
NaOH, H2O2 водн. EtOH
81%
Упражнения
Простые упражнения для проверки усвоения материала гл. 24
(а) Каково строение пуриновых оснований, входящих в состав ДНК и РНК?
(б) Как в результате перегруппировки Димрота можно синтезировать 6-алкиламино-пурины из 6-аминопуринов?
(в) В каком порядке изменяется реакционная способность 2-, 6- и 4-галогенопуринов по отношению к нуклеофильному замещению? Каким образом включение третичного амина в такие реакции нуклеофильного замещения облегчает их течение?
(г) По какому положению идет депротонирование 9-замещенных пуринов в присутствии сильного основания?
(д) Назовите три типа соединений, которые при взаимодействии с 4,5-диаминопири-мццином дают пурины.
(е) Как можно получить 2-тиопурин из 5-аминоимидазол-4-карбоксамида?
Упражнения повышенной сложности
1. Каково строение промежуточных соединений и конечных продуктов в следующей последовательности превращений: гуанозин-2',3',5’-триацетат реагирует с РОС13 -> C16H18CIN5O7, затем это соединение с /npew-BuONO/CHjIj -> C16H16CIIN4O7, затем NH3/MeOH -> C10H12IN5O4 и, наконец, последнее соединение с PhB(OH)2/Pd(PPh3)4/Na2CO3 -> CigHnNsC^. Как такой пурин может быть получен из AICA-рибозида в четыре стадии?
2. Предложите последовательность превращения аденозина в 8-фенйладенозин.
3. Предложите структуры и объясните следующее: аденозин реагирует с Me2SO4 -> -> CnHl5N5O4, затем это соединение с водн. НС1 -> СбН7К5 и, наконец, при действии водного NH3 на последнее соединение образуется изомер C6H7N5.
4. Нарисуйте структуры пуринов, образующихся в следующих реакциях: (а) нагревание 4,5,6-триаминопиримидина с формамидом; (б) обработка 2-метил-4,5-ди-аминопиримидин-6-она дитиоформиатом натрия, затем нагревание в хинолине.
Литература
1. Dreyfus М., Dodin G., Bensaude O.f Dubois J. E. J. Am. Chem. Soc., 97,2369 (1975).
2. Nucleic acid chemistry, Townsend L. B., Tipson R. S. (eds.), Vol. 1 and 2, Wiley-Interscience, 1978; Synthetic procedures in nucleic acid chemistry, Zofbach W. W., Tipson R. S. (eds.), Vol. 1 and 2, Wiley-Interscience, 1973; Nucleic acid in chemistry and biology, Blackbum G. M., Gait M. J. (eds.), 1996.
3. Cobum W. C., Thorpe M. C., Montgomery J, A., Hewson K. J. Oig. Chem., 30, 1110 (1965).
4. Schumacher M., GntherH. Chem. Ber., 116,2001 (1983).
5. Taylor E. C., Maki K, McKillopA. J. Oig. Chem., 34,1170 (1969).
6. Brookes P, Lawley P. D. J. Chem. Soc., 1960, 539; Carrea G., Ottolina G., Riva S.t Danieli B., Lesma G., Palmisano G. Helv. Chim. Acta, 71,762 (1988).
7. «The Dimroth rearrangement in the adenine series: a review updated», Fujii T., Itaya T. Heterocycles, 48,359 (1998).
8. Pagano A. R., Zhao H, Shallop A.f Jones R. A. J. Org. Chem., 63, 3213 (1998).
9. Montgomery J. A., Temple C. J. Am. Chem. Soc., 83,630 (1961).
10. Lewis L. R., Schneider F. H., Robins R. K. J. Oig. Chem., 26, 3837 (1961).
11. Magnin G. C., Dauvergne J., Burger A., Biellmann J.-F. Tetrahedron Lett., 37, 7833 (1996).
12. Geen G. R., Grinter T. J., Kincey P. M., Jarvest R. L. Tetrahedron, 46,6903 (1990).
13. Geem G. R., Kincey P. M., Choudary В. M. Tetrahedron Lett., 33,4609 (1992).
14. SesslerJ. L., Magda D., Furuta H. J. Oig. Chem., 57, 818 (1992).
15. IverR. S., Voehler M. W, Harris T. M. J. Am. Chem. Soc., 116, 8863 (1994).
16. Breipohl G., Will D. W., Peyman A., Vhlmann E. Tetrahedron, 53,14671 (1997).
17. Lukevics E., Zablocka A. Nucleoside syntheses, organosilicon method, Ellis Horwood, 1991 и приведенные в этой книге ссылки на литературу.
18. Baker В. R., Hewson К., Thomas Н. J., Johnson J, A. J. Org. Chem., 22, 954 (1957); Townsend L. B.f Robins R. К, Loeppky F. N., Leonard N. J. J. Am. Chem. Soc., 86,5320 (1964).
19. Kazimierczuk Z, Cottam H. B., Revankar G. R., Robins R. K. J. Am. Chem. Soc., 106, 6379 (1984); JhinganA. K, Meehan T. Synth. Commun., 22, 3129 (1992).
20. Hanna N. D., Ramasamy K., Robins R. K., Revankar G. R. J. Heterocycl. Chem., 25, 1899 (1988).
21. Imai K, Nohara A., Honjo M. Chem. Pharm. Bull., 14,1377 (1966).
22. Hennen W. J., Wong C.-H. J. Org. Chem., 54,4692 (1989).
23. Leonard N. J, McDonald J. J., Henderson R. E. L., Reichman M. E. Biochemistry, 10, 3335 (1971).
24. Pratt R. F., Kraus К. K. Tetrahedron Lett., 22, 2431 (1981).
25. Giner-Sorolla A., Gryte C., Cow M. L., Parham J. C. J. Org. Chem., 36,1228 (1971).
26. Stevens M. A., Magrath D. L, Smith H W., Brown G. B. J. Am. Chem. Soc., 80, 2755 (1958).
27. «The 7-N-oxides of purines related to nucleic acids: their chemistry, synthesis, and biological evaluation», Fujii T., Itaya T, Ogawa K. Heterocycles, 44, 573 (1997).
28. Ikehara M., Kaneko M. Tetrahedron, 26,4251 (1970).
29. Fischer E. Justus Liebigs Ann. Chem., 213,316 (1882); ibid., 221,336; Bruhns G. Chem. Ber., 23,225 (1890); Beaman A. G, Robins R. K. J. Oig. Chem., 28,2310 (1963).
30. Barrio J. R., Namavari M., Phelps M. E., Satyamurthy N. J. Am. Chem. Soc., 118,1408 (1996).
31. Mosselhi M. A., Pfleiderer W. J. Heterocycl. Chem., 30,1221 (1993).
32. Jones J. W, Robins R. K. J. Am. Chem. Soc., 82, 3773 (1960).
33. Desaubry L., Bourguignon J.-J. Tetrahedron Lett., 36, 7875 (1995).
34. Zady M. F, Wong J. L. J. Org. Chem., 44,1450 (1979).
35. Maria E. J, Fourrey J.-L., Machado A. S., Robert-Gero M. Synth. Commun., 26, 27 (1996).
36. Saladino R., Crestini C., Bernini R., Mincione E., Ciafrino R. Tetrahedron Lett., 36,2665 (1995).
37. Madyastha К M., Sridhar G. R. J. Chem. Soc., Perkin Trans. 1,1999,677.
38. Smith D. L., Elving P. J. J. Am. Chem. Soc., 84, 1412 (1962).
39. Butula I. Justus Liebigs Ann. Chem., 729, 73 (1969).
40. Hecht S. M., Adams B. L., Kozarich J. W. J. Oig. Chem., 41,2303 (1976).
41. Barlin G. B. J. Chem. Soc. (B), 1967,954.
42. Hamamichi N,, Miyasaka T. J. Heterocycl. Chem., 27, 2011 (1990); ibid., 28, 397 (1991).
43. Montgomery J. A., Holum L B. J. Am. Chem. Soc., 79,2185 (1957).
44. Focher F., Hildebrand С., Freese S., Ciarrocchi G., Noonan T., Sangalli S., Brown N.f Spadari S., Wright G. J. Med. Chem., 31, 1496 (1988).
45. Kos N. J., van der Plas H. C., van Veldhuizen A. Reel. Trav. Chim Pays-Bas, 99, 267 (1980).
46. Motawia M.S., Meldal M., Sofan M., Stein P., Pedersen E. B., Nielsen C. Synthesis, 1995, 265.
47. Nair V, Sells T. B. Tetrahedron Lett., 31,807 (1990).
48. Xu Y.-Z. Tetrahedron, 54,187 (1998).
49. Edwards C., Boche G., Steinbrecher T., ScheerS. J. Chem. Soc., Perkin Trans. 1, 1997, 1887.
50. Flaherty D., Balse P., Ki K, Moore В. M., Doughty M. B. Nucleosides and Nucleotides, 14,65 (1995).
51. Miyashita A., Suzuki Y., Ohta K., Higashino T. Heterocycles, 39,345 (1994).
52. De Napoli L., Montesarchio D., Piccialli G., Santacroce C., Varra M. J. Chem. Soc., Perkin Trans. 1,1995,15.
53. Linn J. A., McLean E. W., Kelley J. L. J. Chem. Soc., Chem. Commun., 1994, 913.
54. LembiczN. K., Grants., Clegg W., Giffin R. J., Heath S. L., GoldingB. N. J. Chem. Soc., Perkin Trans. 1, 1997, 185.
55. Herdewin P., Van Aerschot A., Pfleiderer W. Synthesis, 1989,961.
56. KiburisJ., Lester J. H. J. Chem. Soc. (C), 1971, 3942.
57. Lee H, Luna E., Hinz M., Stezowski J. J., Kiselyov A. S., Harvey R. G. J. Org. Chem., 60, 5604 (1995).
58. Lakshman M. K., Keeler J. C., Hilmer J. H., Martin J. Q. J. Am. Chem. Soc., 121,6090 (1999).
59. Miles R. W., Samano V, Robins M. J. J. Am. Chem. Soc., 117, 5951 (1995); Clivio P., Fourrey J.-L., FauvreA. J. Chem. Soc., Perkin Trans. 1, 1993, 2585.
60. Miyashita A., Suzuki Y., Iwamoto K., Higashimo T. Chem. Pharm. Bull., 46, 390 (1998).
61. Wong J. L., Keck J. H. J. Chem. Soc., Chem. Commun., 1975,125.
62. Hayakawa H., Haraguchi K., Tanaka H., Miyasaka T. Chem. Pharm. Bull., 35, 72 (1987).
63. Leonard N. J., Bryant J. D. J. Org. Chem., 44,4612 (1979).
64. Hayakawa H, Tanaka H., Sasaki K., Haraguchi K., Saitoh T, Takai E, Miyasaka T. J. Heterocycl. Chem., 26,189 (1989).
65. Nolsoe J. M. J., Gundersen L.-L., Rise F. Synth. Commun., 28,4303 (1998).
66. Kato K., Hayakawa H., Tanaka H., Kumamoto H., Shindoh S, Shuto S., Miyasaka T. J. Oig. Chem., 62,6833 (1997).
67. Matsuda A., Shinozaki M., Miyasaka T., Machida H, Abiru T. Chem. Pharm. Bull., 33, 1766 (1985); Nair V., Turner G. A. Buenger G. S, Chamberlain S. D. J. Oig. Chem., 53, 3051 (1988); Jacobson К A., Shi D., Gallo-Rodriquez C., Manning M., Miler C., Daty J. W., Neumeyer J. L., Kioriasis L., Pfleiderer W. J. Med. Chem., 36, 2639 (1993).
68. Bergstrom D. E., Reday P. A. Tetrahedron Lett., 23,4191 (1982).
69. Langli G., Gundersen L.-L., Rise F. Tetrahedron, 52,5625 (1996).
70. Nolsoe J. M. J., Gundersen L.-L., Rise F. Acta Chem. Scand., 53, 366 (1999).
71. Ozola V., Persson T., Gronowitz S, HmfeldtA.-B. J. Heterocycl. Chem., 32, 863 (1995).
72. Elion G. B. J. Oig. Chem., 27, 2478 (1962).
73. Waters T. R., Connolly B. A., Nucleosides and Mucleotides, 11, 1561 (1992); Goswani B., Kung P.-Р., Gaffney B. L., Jones R. A., Tetrahedron Lett., 31, 319 (1990).
74. Vorbiggen H., Krolikiewicz K. Justus Liebigs Ann. Chem., 1976,745.
75. Gerster J. F., Jones J. W., Robins R. K. J. Oig. Chem., 28, 945 (1963); Robins M. J., Uznanski B. Can. J. Chem., 59,2601 (1981).
76. De Napoli L., MessereA., Montesarchio D., Piccialli G., Santacroce C., Varra M. J. Chem. Soc., PerkinTrans. 1,1994,923.
77. Elion G. B., Hitchings G. H. J. Am. Chem. Soc., 78, 3508 (1956); DavolU, Lowy B. A. ibid., 73,2936(1951).
78. Beaman A. G., Robins R. K. J. Am. Chem. Soc., 83,4038 (1961).
79. Kataoka S., Isono J., Yamaji N., Kato M.f Kawada T., Imai S. Chem. Pharm. Bull., 36, 2212 (1988).
80. El-Kafrawy S. A., Zahran M. A., Pedersen E. B. Acta Chem. Scand., 53, 280 (1999).
81. Montgomery J. A., Hewson K. J. Am. Chem. Soc., 82,463 (1960).
82. Jones J, W., Robins R, К J. Am. Chem. Soc., 82, 3773 (1960).
83. MoschelR, C., Keefer L. К Tetrahedron Lett., 30,1467 (1989).
84. Orozco M., Canela E. I., Franco R. J. Oig. Chem., 55,2630 (1990).
85. Nair V, Richardson S. G. J. Oig. Chem., 45,3969 (1980); idem, Synthesis, 1982,670.
86. Nair V., Hettrick B. J. Tetrahedron, 44,7001 (1988).
87. Kikugawa K, Suehiro H„ AokiA. Chem. Pharm. Bull., 25, 2624 (1977).
88. Beaman A. G.f Gerster J. E, Robins R. K. J. Oig. Chem., 27,986 (1962).
89. Matsuda A., Nomoto Y., Ueda T. Chem. Pharm. Bull., 27,183 (1979); Wetzel R,, Eckstein F. J. Oig. Chem., 40,658 (1975); YamaneA., Matsuda A., Ueda T. Chem. Pharm. Bull., 28,150(1980).
90. Saladino R., Mlncione E., Crestini C., Mezzetti M. Tetrahedron, 52,6759 (1996).
91. Brown D. M., Giner-Sorolla A. J. Chem. Soc. (C), 1971,128.
92. Mackay L. B., Hitching? G. H. J. Am. Chem. Soc., 78,3511 (1956).
93. Tragic Chem. Ber., 33, 1371 (1900); ibid., 3035.
94. Robins R. K, Dille K. J., Willits С. H, Christensen В. E. J. Am. Chem. Soc., 75, 263 (1953).
95. Melguizo M., Nogueras M., Sanchez A. Synthesis, 1992,491.
96. Albert A., Brown D. J. J. Chem. Soc., 1954,2060.
97. Albert A., Brown D. J. J. Chem. Soc., 1954, 2066; Montgomery J. A. J. Am. Chem. Soc., 78, 1928 (1956); Young R. C., Jones M., Milliner К J., Rana К, K, Ward J. G. J. Med. Chem., 33, 2073 (1990); Elion G. B., Burgi E, Hitchings G. H. J. Am. Chem. Soc., 73, 5235 (1951).
98. Taylor E. C., Yogi O., Cheng С. C. J. Am. Chem. Soc., 81, 2442 (1959).
99. Parkanyi C.t Yuan H. L. J. Heterocycl. Chem., 27,1409 (1990).
100. Goldman L., Marsico J. W., GazzolaA. L. J. Oig. Chem., 21, 599 (1956).
101. Otji С. C., Kelly J., Ashbum D. A., Silks R. A. J. Chem. Soc., Perkin Trans. 1,1996, 595.
102. JerchelD., KrachtM., KruckerK. Justus Leibigs Ann. Chem., 590,232 (1954).
103. Nagamatsu T., Yamasaki H., Yoneda F. Heterocycles, 33, 775 (1992).
104. Senga K, Kanaztyva H, Nishigaki S. J. Chem. Soc., Chem. Commun., 1976,155.
105. Altman J., Ben-Ishai D. J. Heterocycl. Chem., 5,679 (1968).
106. «Annelation of a pyrimidine ring to an existing ring», Albert A. Adv. Heterocycl. Chem., 32,1 (1982).
107. Ferris J. P,f Orgel L. E. J. Am. Chem. Soc., 88,1074 and 3829 (1966).
108. Yamazaki A., Kimashiro I, Takenishi T. J. Oig. Chem. 32, 3258 (1967).
109. Kelley J. L., Linn J. A., SelwayJ. W. T. J. Med. Chem., 32, 218 (1989); Prasad R. N, Robins R. K. J. Am. Chem. Soc., 79,6401 (1957).
110. Imai K, Marumoto R., Kobayashi K, Yoshioka Y., Toda J., Honjo M. Chem. Pharm. Bull., 19,576(1971).
111. Al-ShaarA. Н., Gilmour D. W.t Lythgoe D. J., McClenaghan L, Ransden C, A, J. Chem. Soc., Chem. Commun., 1989,551.
112. Ostrowski S. Syntlett, 1995,253.
113. Dang Q., Brown B. S., Erion M. D. J. Oig. Chem., 61, 5204 (1996).
114. Dang Q., Liu Y., Erion M. D. J. Am. Chem. Soc., 121, 5833 (1999).
115. Ochiai M., Marumoto R., Kobayashi S., Shimazu H.t Morita K. Tetrahedron, 24, 5731 (1968).
116. Yamada H., Okamoto T Chem. Pharm. Bull., 20,623 (1972).
117. Richter E., Loeffler J. E., Taylor E. C. J. Am. Chem. Soc., 82, 3144 (1960).
118. Arita M., Adachi K, Ito Y., Sawai H., Ohno M. J. Am. Chem. Soc., 105,4049 (1983).
119. Kenner G. Ж, Tayloe С. ГИ, Todd A. R, J. Chem. Soc., 1949,1620.
25
ГЕТЕРОЦИКЛЫ, СОДЕРЖАЩИЕ УЗЛОВОЙ АТОМ
АЗОТА
Помимо биологически важных пуринов и птеридинов и большинства бензанне-лированных гетероциклов, таких, как индол, известно много других ароматических конденсированных с гетероциклическим кольцом систем и среди них наиболее важны соединения, содержащие узловой атом азота — общий для двух циклов [1]. Большинство этих систем не встречается в природе, но их широко изучают с теоретической точки зрения для получения потенциальных биологически активных аналогов, а также для других промышленных целей. Поскольку все многообразие таких соединений невозможно охватить в рамках этой главы, здесь будут рассмотрены лишь комбинации пяти- и шестичленных циклов, хотя возможны и другие варианты.
индолизин
4Н-ХИНОЛИЗИН хинолизиний
ЗН-пирролизин анион пирролизина
Среди родственных систем, имеющих узловой атом азота в качестве единственного гетероатома, только индолизин (в более ранней литературе часто называемый «пирроколином») имеет нейтральную полностью сопряженную Юл-элекгронную систему, включающую четыре пары электронов четырех двойных связей и неподеленную пару электронов атома азота, как и в индоле. 4Н-Хинолизин — неароматическое соединение, и хотя имеющийся насыщенный атом мешает сопряжению, однако катион хинолизиния, образованный формально в результате потери гидрид-ионахинолизином, обладает ароматической 10л-элскгронной системой: он полностью изоэлекгронен нафталину, а положительный заряд на атоме азота является следствием наличия заряда в ядре. Аналогично пирролизин, который уже ароматическое соединение — пиррол с а-винильным заместителем, превращаясь в анион, становится 10л-элекгрон-ной системой.
25.1. ИНДОЛИЗИНЫ [2]
Ароматический характер индолизина демонстрируется с помощью трех основных мезомерных структур, две из которых содержат пиридиниевый фрагмент, а вклад других структур (на схеме не приведены), которые не содержат ни полный пиррол, ни придиний, — менее важен.
Ароматические индолизины очень редко встречаются в природе, однако полностью восстановленные соединения (индолизидины) широко распространены, особенно в алкалоидах и типичным примером служит свайнсонин. Синтетические индолизины находят применение как красители в фотографии.
25.1.1. Реакции индолизинов
Индолизин, будучи элекгроноизбыточной системой, главным образом вступает в реакции электрофильного замещения, которые протекают так же легко, как и для индола, и идут преимущественно по положению 3, но могут также идти по положению 1. Поскольку индолизины подобны пирролам, а не пиридинам, они не вступают в реакции с нуклеофилами; кроме того, не существует примеров нуклеофильного замещения атома галогена в индолизинах.
Индолизин (рКь 3,9 [3]) — гораздо более сильное основание, чем индол (рКц —3,5), а благодаря относительной стабильности ивдолизиний-катиона он менее реакционноспособен; таким образом, индолизины устойчивы к кислот-но-катализируемой полимеризации (для сравнения см. разд. 17.1.9).
Индолизин протонируется по положению 3, а 3-метилиндолизин — главным образом (79%) по положению 1; чувствительность процесса к характеру замещения также иллюстрируется на примере 1,2,3-триметил- и 3,5-диметилиндолизи-нов, каждый из которых протонируется исключительно по положению 3. Электрофильные реакции, такие, как ацилирование [4], форматирование по реакции Вильсмейера [5] и диазосочетание [6], идут по положению 3
АсгО
АсОН, 140 *С
75%
Нитрование 2-метилиндолизина в мягких условиях приводит к образованию 3-замещенного соединения [7], тогда как реакция в сильнокислых средах идет по положению 1 [8], по-видимому, в результате атаки по катиону индолизиния
Индолизин и его простейшие алкилпроизводные чувствительны к действию света и кислорода воздуха, которые вызывают разрушение циклической системы. Каталитическое восстановление в растворе кислоты — восстановление катиона
индолизиния — приводит к образованию соли пиридиния [9], полное насыще-
ние — образование индолизвдинов — происходит при восстановлении в присут-
ствии платины [10].
Н2, Pd/C водн. НВг 85% *
Несмотря на наличие Юя-электронной ароматической системы, индолизин участвует в качестве 8л-элекгронной системы в реакции с азодикарбоновым эфиром, хотя процесс может быть многостадийным и не согласованным. При проведении реакции в присутствии благородного металла в качестве катализатора первоначально образующийся аддукт превращается в ароматический цикла-зин (разд. 25.5) [11]
5-Метилиндолизин литиируется по метильной группе боковой цепи [12], а 2-фенилиндолизин — по положению 5 [13]
THF.TMEDA
-40*0 Me3SiCI » 91%
Среди реакций функциональных производных заслуживает внимания легкость, с которой происходит отщепление карбонильных и ацильных групп при нагревании в растворах кислот, и нестабильность аминопроизводных, которые нельзя продиазотировать, но можно превратить в устойчивые ацетамиды.
25.1.2. Синтезы индолизинов [14]
Наиболее общим подходом к синтезу индолизинов служит реакция Чичибабина [15], состоящая в кватернизации 2-алкилпиридина а-галогенокарбонильным соединением с последующей катализируемой основаниями циклизацией в результате депротонирования а-метильной группы пиридиния [16], которое происходит, без сомнения, легче, когда эта метильная группа активирована [17].
PhCOCH2Br
EtOH, 20
73%
Другой полезный метод включает промежуточное образование илида пиридиния, который выступает в качестве 1,3-диполя в реакции циклоприсоединения [18]
Важная особенность реакций этого типа (которые также можно использовать для получения азаиндолизинов) состоит в следующем: исходя из логики предполагаемого механизма процесса, должен был бы образовываться дигидроиндолизин, однако в действительности получают полностью ароматическое соединение. Механизм ароматизации не ясен: она может происходить при окислении кислородом воздуха в ходе реакции или в результате гидридного переноса к другому компоненту реакционной смеси. Выделенные дигидросоединения могут быть легко ароматизованы под действием обычных реагентов, таких, как палладий на угле или хиноны. Кроме того, ароматические индолизины образуются и при взаимодействии илида с алкеном (когда следовало бы ожидать получения тетрагидропроизводных) в присутствии подходящего окислителя, такого, как хромат кобальта [19], как показано ниже [20]:
В реакции с алкинами ароматизация может проходить в результате потери НХ, когда уходящая группа присутствует в одном из реагентов [21]
Ме02СОСС02Ме PhMe, кипячени^ Me 79%
25.2. АЗАИНДОЛИЗИНЫ
Примечание: как можно видеть из приведенных выше примеров, нумерация различается в зави-
симости от числа и расположения атомов азота.
Возможно существование семи моноаза- и гораздо большого числа полиазаиндолизинов (некоторые приведены выше); действительно, соединения с более чем шестью атомами азота часто можно обнаружить в литературе. Несмотря на большую редкость таких систем в природе, азаиндолизины вызывают очень большой интерес, основанный на структурном подобии индолам и пуринам. Система имидазопиразина обнаружена в люциферине Cypridina (гл. 11). Антидепрессант тразадон служит одним из примеров большого числа азаиндолизинов, которые были получены с целью изучения их фармакологической активности. Трападил, например, служит коронарным сосудорасширяющим средством, ибудиласт используют для лечения астмы, а темозоломид применяют в качестве противоракового средства. К числу соединений, используемых в других областях, относится противогрибковый препарат пиразофос.
трапидил ибудиласт темозоламид
Все моноазаиндолизины, за исключением пирроло[1,2-£>]пиридазина, про-тонируются по второму (неузловому) атому азота, а не по атому углерода [3,22]. Алкилирование аналогично идет по атому азота, однако другие электрофильные реагенты атакуют региоселективно, подобно тому, как это происходит в самом индолизине, пятичленный цикл по положениям 1 и 3 (если в этих положениях находится атом углерода).
25.2.1. Имидазо[1,2-а]пиридин
Электрофильное замещение (галогенирование, нитрование и т. д.) в таких соединениях идет по положению С(3) или по положению С(5), если положение 3 занято [23]. Реакции ацилирования не требуют катализа [24].
Из всех изомерных хлорпроизводных реакции нуклеофильного замещения известны только д ля 5-изомера; 7-хлориндолизин, д ля которого можно было бы ожидать подобной же активации, в такие реакции не вступает [25].
NaOMe
DMF, 100 *С
54%
Катализируемый основаниями дейтерообмен идет по положениям 3 и 5 [26]; препаративное литиирование проходит по атому С(3) или, если это положение
замещено, то по положениям 5 или 8 в зависимости от наличия других заместителей [27], однако 2,6-дихлорпроизводное реагирует селективно по положению 5 даже в присутствии атома водорода у атома С(3) [28].
Аминоимидазо [1,2-а] пиридины даже более неустойчивы, чем аминоиндолизины; они существуют в виде аминотаутомеров, но 2- и 5-кислородсодержащие производные существуют в кетоформе. Последние реагируют с фосфорил-хлоридом, превращаясь в хлорпроизводные [20].
Синтез циклической системы имидазо[1,2-<з]пиридина, аналогично синтезу индолизинов (разд. 25.1.2), основан на реакции Чичибабина, но с использованием 2-аминопиридинов вместо 2-алкилпиридинов. Первоначальная реакция с галогенокетоном региоселективно идет по кольцевому атому азота, поэтому удается получать изомерно чистые соединения [29]. 2-Оксоимидазо[1,2-д]пириди-ны образуются при использовании а-бромэфира вместо а-бромкетона [30].
25.2.2. Имидазо[1,5-а]пиридины
Электрофильное замещение в этих системах опять же идет в пятичленном цикле по положению 1 или 3, если положение 1 занято [31,32]. При взаимодействии с бромом образуется 1,3-дибромпроизводное [33].
РОС1з, DMF
100‘С ж
67%
Бензоилирование представляет собой поучительный пример: в нормальных условиях С-замещение идет по положению 1, однако в присутствии триэтилами-на образуется 3-бензоилимидазо[1,5-д]пиридин [34]. Это можно объяснить, если предположить промежуточное образование илида при депротонировании первоначально получающейся Ы+-бензоильной соли (для сравнения см. разд. 21.1.2.5).
о
Пятичленный цикл разрушается относительно легко: в горячем водном растворе кислоты эти гетероциклы превращаются в 2-аминометилпиридины.
Литиирование идет точно так же, как и для индолизина, — с потерей протона 3-Н [5], однако 5-литиирование происходит при аналогичной обработке 3-этилтиопроизводного: заместитель, с одной стороны, блокирует положение 3, а с другой, — ориентирует литиирование в «^«-положение; этилтиогруппа может быть впоследствии легко удалена [35].
n-BuU
THF,-78’С* PhCH=O,
71%
Ni Ренея 65%
Имидазо[1,5-а]пиридины получают циклодегидратацией Ы-ацил-2-амино-метилпирвдинов [32]. З-Амино- [36], окси- [37] итио-производные[38] синтезируют аналогично.
25.2.3. Пиразоло[1,5-а]пиридины
DCC
PhH, PhHN нагревание ‘ 65%
CH2=NMe2 Г
CF3CO2H, СН2С12
89%
В этих системах электрофильное замещение идет по положению 3 [39], а литиирование проходит по атому С^, хотя 3-оксазолин может вторично напрямую металлироваться по положению 2, что приводит к раскрытию цикла [40], как показано ниже:
Пиразоло[1,5-а]пиридины можно получить в результате циклоприсоединения илидов N-аминопирцдиния к алкинам [41] или N-аминирования 2-алки-
нилпиридинов [42]. Интересно, что циклоприсоединение N-амино-З-бен-зилоксипиридина идет преимущественно по наиболее затрудненному положению 2 [43].
N-Имид пиридиния — илид, образующийся при отщеплении протона от иодида 1-аминопиридиния, выступает в качестве 1,3-диполя и реагирует с пропиолатом (как показано выше) или фумаратом с образованием бициклических соединений [44].
25.2.4. Триазоло- [45] и тетразолопиридины
1,2,3-Триазоло[1,5-д]пиридин теоретически может находиться в равновесии со своим диазотаутомером [46], образующимся в результате раскрытия пятичленного цикла. Хотя, в действительности, он существует в закрытой форме, его реакции отражают это потенциальное равновесие: реакция с электрофилами может идти по двум направлениям. Ацилирование и нитрование проходят обычным способом, по положению 1, а такие реагенты, как, например, бром, очень легко вызывают раскрытие цикла [47]. В водных растворах кислот также происходит раскрытие цикла и образование 2-гидроксиметилпиридина.
2-Азидоазины находятся в равновесии с конденсированными тетразолами. Положение равновесия очень чувствительно к влиянию заместителей: так, например, в случае незамещенного соединения равновесие сдвигается в сторону закрытой формы, тогда как для 6-хлорпроизводного преимущественно существует открытая форма [48].
Прямое литиирование 1,2,3-триазоло[1,5-а]пиридина легко идет по положению 7, но последующая реакция с электрофилами приводит к неожиданным результатам: например, превращение в 7-бромпроизводное затем позволяет нуклеофильно замещать атом галогена, что предусматривает в конечном итоге путь к 2,6-дизамещенным пиридинам [49]. Однако литиирование в ТГФ в качестве
растворителя приводит к образованию 7,7-связанного димера [50]. 7-Литийпро-изводные также получают при расщеплении 7-?4,М-диэтилкарбоксамида под действием н-бутиллития [51].
Вг2 сн2а2, о 'с м
р-Ап
Н ОН
СНВг2 СНО
Д— водн. AgNQj
' н ЕЮН> нагревание ||
I] 78% ** | II
р-Ап^^^^Х
Н ОН
1,2,4-Триазоло[1,5-д]пирвдин, по-видимому, устойчив к электрофильной атаке, но может литиироваться по положению 5; в противоположность этому 1,2,4-триазоло[4,3-д]пиридин легко подвергается электрофильному замещению по положению 3 [52].
n-BuLi
THF, -78 ‘Qr Br(CF2)2Br^
1,2,3-Триазоло[1,5-а]пиридины могут быть получены окислением гидразонов пиридин-2-карбоксальдегидов, вероятно, путем образования диазосоединений [53] или в результате реакций диазопереноса [54]
K3Fe(CN)6 водн. NaHCO3 100*С у 51%
TsN3, KOEt
EtOH, 20‘С
50%
Система 1,2,4-триазоло[4,3-д]пиридина может быть синтезирована в результате циклоконденсации 2-гидразинопиридинов; ниже в качестве примера приведен синтез тразодона [55]. Окислительная циклизация пиридин-2-илгидразо-нов приводит к образованию 1,2,4-триазоло[4,3-л]пиридинов [56].
,NH2 170 ‘С o^nh2
HN—N
NaH диоксан затем RCI, нагревание^ 66% 3
N—N
1,2,4-Триазоло[1,5-д]пиридины можно получить либо окислительной циклизацией амидинов [57], либо кислотно-катализируемой циклизацией амидок-симов [58] — эти методы представлены на схеме ниже:
Ph
25.2.5. Соединения, содержащие дополнительный атом азота в шестичленном цикле
Наряду с ожидаемым электрофильным замещением по положениям 1/3 (см. выше), подавляющее большинство гетероциклических соединений этого класса относительно легко подвергаются атаке нуклеофилами по шестичленному циклу [59], который представляет собой в данном случае электронодефицитный фрагмент (благодаря наличию иминных фрагментов), — очевидна аналогия с легкостью присоединения к диазинам. Некоторые соединения настолько чувствительны к нуклеофильному присоединению, что образуют «гидраты» даже при соприкосновении с влажным воздухом [46]. Поэтому препаративное литиирование может быть проведено при использовании менее нуклеофильных оснований.
Синтез циклических систем таких молекул можно проводить либо исходя из диазинов [60,61] с использованием методов, аналогичных описанным для получения азолопиридинов из пиридинов, либо с помощью различных методов из компонентов, содержащих пятичленный цикл [62,63]. Некоторые типичные методы представлены ниже:
Me3Si
TOSMIC. DBU
THF________
58%
CO2Et
-О N I
2.4.6-Ме3С6Н28Оз
HC=CCO2Et пиридин 45% **
водн. HI, водн. KOH, МеОН нагревание
82%
t-BuNC, PhCH=O hciq4, меон, 20 ;c
62%
25.3. ХИНОЛИЗИНИЕВЫЕ СОЛИ [64] И РОДСТВЕННЫЕ СОЕДИНЕНИЯ
Ион хинолизиния встречается в природе крайне редко, например, как аннели-рованный илид в алкалоиде семпервирине, однако существуют сотни индольных алкалоидов, имеющих подобную тетрациклическую систему, но с полностью восстановленным фрагментом хинолизина. Кроме того, известно множество простейших хинолизиновых алкалоидов, таких, как люпинин. Среди синтетических соединений можно назвать антиастматический препарат пемироласт, который представляет собой азааналог.
сн2он
Практически во всех реакциях ион хинолизиния ведет себя так же, как соли пиридиния: он устойчив к электрофильным атакам, но легко подвергается нуклеофильному присоединению, и первоначально образующиеся аддукты превращаются в 2-замещенные пиридины [65] в результате спонтанного элекгроциклического раскрытия цикла, однако чувствительность катиона к действию нуклеофилов невелика — подобно простейшим пиридиниевым солям он устойчив в кипящей воде.
Хиназолоны могут реагировать с электрофилами по положениям 1/3 [66] — явная аналогия с реакционной способностью пиридонов*
КОНЦ. HNOg
АсОН, 20‘С
43%
NO2
no2
Производные хинолизина обычно получают циклоконденсациями по атому азота соответствующих предшественников — производных пиридина [67]
25.4. ПИРРОЛИЗИНЫ И РОДСТВЕННЫЕ СИСТЕМЫ
Пирролизины встречаются в природе в основном в виде насыщенных или частично насыщенных пирролизидиновых алкалоидов; в качестве примера можно привести сенеционин
Относительно высокая величина р/^ (29) для депротонирования ЗН-пирро-лизина (рАГа индена 18,5) указывает на то, что образование Юл-электронного аниона пирролизина приводит лишь к незначительному увеличению стабилизации по сравнению с той, которая обычно свойственна пирролу. Он вступает в реакции как очень реакционноспособный карбанион, например, конденсируется с бензофеноном с образованием фульвеноподобного соединения [68].
n-BuLi
THF, -78 'С
Ph
Изоэлектронное замещение карбанионного атома углерода на гетероатом дает гораздо более устойчивые соединения, и такие 5,5-бициклические ароматические системы заслуживают большого внимания. В этих соединениях атом серы или кислорода может быть включен в полностью сопряженную систему, в противоположность 5,6-производным, где может быть использован только атом азота. Из-за многообразия таких систем трудно сказать что-то общее об их реакционной способности, однако электрофильное замещение, которое идет по любому из циклов, наиболее широко представлено в литературе, наряду с редким упоминанием о реакциях нуклеофильного замещения и литиирования. Некоторые типичные реакции приведены ниже [69,70]:
мо2
СН2С12, 20-С
79%
nnh2
n-BuLi
PhMe, -35 *С
BrCH2COPh
MeCN, 20
NH2 67% *
25.5. ЦИКЛАЗИНЫ
Циклазины (тривиальное название) представляют собой трициклические анне-лированные молекулы, содержащие центральный узловой атом азота и периферическую л-систему. Определение ароматичности в этих соединениях не так однозначно, как для простых бициклических молекул, которые обсуждались выше, и может потребовать более детального анализа молекулярных орбиталей.
(3.2.2)циклазин
(З.З.З)циклазин
(2.2.2)азациклазин
гексааза-аналог
(З.З.З)циклазина
Т н
(3.2.2)Циклазин представляет собой устойчивую ароматическую систему с кольцевым током, т. е. 10-электронную кольцевую л-систему (исключающую атом азота). Он устойчив к действию света и воздуха, но, в противоположность его близкому аналогу индолизину, не имеет основного характера, что определяется гораздо более слабым взаимодействием между неподеленной парой электронов атома азота и периферической л-системой. Однако (3.2.2)циклазин вступает в реакции как электроноизбыточное ароматическое соединение, легко подвергаясь электрофильному замещению.
В противоположность вышесказанному (З.З.З)циклазин не имеет ароматической резонансной стабилизации и представляет собой нестабильное и высоко
реакционноспособное соединение, проявляющее некоторый бирадикальный характер. Однако его гексааза-аналог необычайно устойчив, его стабилизация, приписываемая возмущению молекулярных орбиталей под влиянием электроотрицательных атомов, приводит к гораздо большему разделению ВЗМО и НСМО [71]. Система (2.2.2)азациклазина, имеющая мостиковую связь N—N, изоэлекгронна (3.2.2)циклазину и также стабильна.
Циклазины можно получить циклизацией бициклических предшественников: например, (3.2.2)циклазин получают в результате реакции циклоприсоединения к индолизину (разд. 25.1.1) или циклоконденсацией [72].
Упражнения
Простые упражнения для проверки усвоения материала гл. 25
(а) По какому положению(ям) идет электрофильное замещение в индолизине? Почему?
(б) По какому положению депротонируется индолизин в присутствии сильного основания?
(в) Как можно превратить 2-метилпиридин в 3-метилиндолизин?
(г) Что образуется при взаимодействии 2-аминопиридина с метилбромацетатом?
(д) Нарисуйте резонансные структуры катиона индолизиния, объясняющие положение нуклеофильного присоединения к нему.
(е) Ароматическое ли соединение пирролизин? Если да, то сколько электронов участвует в образовании ароматической тг-системы?
Упражнения повышенной сложности
1. Предложите структуру конечного монониклического продукта следующей последовательности превращений: бромид хинолизиния с LiAlH4, затем с Нг/Pd -» c9h13n.
2. Нарисуйте структуры промежуточно образующихся соединений в следующем синтезе катиона хинолизиния: 2-метилпиридин реагирует с диизопропиламидом лития, затем с Е1О(СН2)гСН=О с образованием C11H17NO2, который нагревают с HI -» C9Hi2NO+I”, далее эту соль нагревают с Ас2О -» C9Hi0NO+I~ и, наконец, нагревают с Pd/C, что приводит к образованию иодида хинолизиния.
3. Какие индолизины образуются из следующих комбинаций исходных соединений: (1) 2-пиколин (а) с ВгСНгСОМе/МаНСОз; (б) с MeCHBrCHO/NaHCO3? (2) Что получится, если 2-пиколин заменить на 2-аминопиридин?
4. Предложите структуры промежуточно образующихся соединений и конечного продукта следующей последовательности превращений: 5-метокси-2-метилпири-дин реагирует с KNH^nso-AmONO -* C7H8N2O2, затем с Zn/AcOH -> C7H10N2O и, наконец, с НСОгМе/полифосфатный эфир -> C8H8N2O.
5. При взаимодействии имидазо[1,5-о]пиридина с водн. HNOi образуется 3-(пири-дин-2-ил)-1,2,4-оксадиазол. Каков механизм этого процесса? Что образуется при взаимодействии индолизина с азотистой кислотой?
6. Предложите структуры бициклических соединений, образующихся в следующих реакциях: (а) 2-гидразинотиазол с азотистой кислотой -> C3H2N4S; (б) 2-аминотиазол с BrCH2COPh -> C11H8N2S.
Литература
1. «Heterocyclic system with bridgehead nitrogen atoms», in: The Chemistry of Heterocyclic Compounds, Vol. 15, Mosby W. L. (ed.), Series Weissberger A. (ed.) Wiley-Interscience, 1961; «Special topics in heterocyclic chemistry» in: The Chemistry of Heterocyclic Compounds, Vol. 30, Series Weissberger A., Taylor E. C. (eds.), Wiley-Interscience, 1977.
2. «The chemistry of the pyrrocolines and the octahydropyrrocolines», Borrows E. T., Holland D. O. Chem. Rev., 42, 611 (1948); «Advances in indolizine chemistry», Swinboume F. J., Hunt J. H, KHnkert G. Adv. Heterocycl. Chem., 23,103 (1978).
3. Armarego W. L. F. J. Chem. Soc., 1964,4226.
4. ScholtzM. Chem. Ber., 65,1718 (1912).
5. Rossiter E. D., Saxton J. E. J. Chem. Soc., 1953, 3654; Fuentes O., Paudler W. W. J. Heterocycl. Chem., 12,379 (1975).
6. HollandD. O., NaylerJ. H. C. J. Chem. Soc., 1955,1504.
7. Hickman J, A., Wibberiy D. G. J. Chem. Soc., Perkin Trans. 1, 1972,2954.
8. Borrows E. T, HollandD. O.f Kenyon J. J. Chem. Soc., 1946, 1077; Greet L., Ridd J. H J. Chem. Soc., Perkin Trans. 2,1979, 312.
9. Lowe O., KingL. C. J. Oig. Chem., 24,1200 (1959).
10. Walter L. A., Margohs P. J. Med. Chem., 10,498 (1967).
11. Galbraith A., Small T., Barnes R. A., Boekelheide V. J. Am. Chem. Soc., 83, 453 (1961).
12. Windgassen R. J., Saunders W. H, Boekelheide V. J. Am. Chem. Soc., 81, 1459 (1959).
13. Renard M., Gubin J. Tetrahedron Lett., 33,4433 (1992).
14. «Methods for the construction of the indolizine nucleus», Uchida T., Matsumoto К Synthesis, 1976, 209.
15. Chichibabin A. E. Chem. Ber., 60,1607 (1927).
16. Borrows E. T., HollandD. O., Kenyon J. J. Chem. Soc., 1946,1069.
17. BraggD. R., Wibberiy D. G. J. Chem. Soc., 1963, 3277.
18. Henrick C. A., Ritchie E., Taylor W. C. Aust. J. Chem., 20, 2467 (1967).
19. Wei J., Hu Y, Li T, Hu H. J. Chem. Soc., Perkin Trans. 1,1993,2487.
20. Hou J., Hu Y, Hu H Synth. Commun., 28,3397 (1998).
21. Matsumoto K, Ogasawara A., Kumura S., Hayashi N., Machiguchi T. Heterocycles, 48, 861 (1998).
22. Fraser M. J. Org. Chem., 36, 3087 (1971).
23. PaoliniJ. P., Robins R. K, J. Oig. Chem., 30,4085 (1965).
24. ChayerS., Schmitt M., Collot V., Bourgignon J.-J. Tetrahedron Lett., 39,9685 (1998).
25. PaoliniJ. P., Robins R. K. J. Heterocycl. Chem., 2,53 (1965).
26. Paudler W. W., Helmick L. H. J. Oig. Chem., 33,1087 (1968).
27. Paudler W. W., Shin H. G, J. Oig. Chem., 33, 1638 (1968); Guildford A. L, Tometzki M. A., Turner R. W. Synthesis, 1983,987.
28. Gudmundsson К. S., Drach J. С., Townsend L. В. J. Org. Chem., 62,3453 (1997).
29. ChichibabinA. Е. Chem. Вег., 57,1168 (1924); KrohnkeP., Kickhofen В., Thoma C. ibid., 88,1117(1955).
30. ChichibabinA. E. Chem. Ber., 57,2092 (1924).
31. Fuentes O., Paudler W. W. J. Heterocycl. Chem., 12,379 ( 1975).
32. Bower J. D., Ramage G. R. J. Chem. Soc., 1955,2834.
33. Paudler W. W, KuderJ. E. J. Org. Chem., 32,2430 (1967).
34. Hiasta D. J, Silbemagel M. J. Heterocycles, 48,101 (1980).
35. BlatcherP., MiddlemissD. Tetrahedron Lett., 21,2195 (1980).
36. Bourdais J., OmarA.-M. M. E. J. Heterocycl. Chem., 17,555 (1980).
37. Iwao M., Kuraishi T. J. Heterocycl. Chem., 14,993 (1977).
38. Bourdais J., Rajniakova O., Povazanec P. J. Heterocycl. Chem., 17, 1351 (1980).
39. Tanji K., Sasahara T., Suzuki J., Higashino T. Heterocycles, 35, 915 (1993); Miki K, YagiS., Hachiken H.f Ikeda M. ibid., 38,1881, (1994).
40. Miyashita A., Sato Y.> Watanabe S., Tanji K., Higashino T. Chem. Pharm. Bull., 43, 174 (1995).
41. Boekelheide V, FedorukN. A. J. Oig. Chem., 33,2062 (1968).
42. Tsuchiya T.t Sashida H, KonoshitaA. Chem. Pharm. Bull., 31,4568 (1983)
43. Miki Y., Tasaka J.f Uemura K.t Miyazeki K, Yamada J. Heterocycles, 43,2249 (1996).
44. Krischke R., Grashey R.f Huisgen R. Justus Liebigs Ann. Chem., 1977,498.
45. «The chemistry of the triazolopyridines», Jones G., SUskovic D. R. Adv. Heterocycl. Chem., 34,79 (1983).
46. Maury G.f Paugam J.-P., Paugam R. J. Heterocycl. Chem., 15,1041 (1978).
47. Jones G., SUskovic D. R. J. Chem. Soc., Perkin Trans. 1,1982,967; Jones G., Mouat D. J., Tonkinson D. J. ibid., 1985,2719.
48. «Some aspects of azido-tetrazolo isomerisation», TishlerM. Synthesis, 1973, 123.
49. Abarca B.f Ballesteros R., Jones G., MojarradE Tetrahedron Lett., 27, 3543 (1986).
50. Jones G., Pitman M. A., Lunt E.t Lythgoe D. J., Abarca B., Ballesteros R., Elmasnaouy M. Tetrahedron, 53, 8257 (1997).
51. Jones G., Mouat D. J., Pitman M. A., Lunt E., Lythgoes D. J. Tetrahedron, 51, 10969 (1995).
52. Finkelstein B. L. J. Oig. Chem., 57, 5538 (1992).
53. Bower J. D., Ramage G. R. J. Chem. Soc., 1957,4506.
54. RegitzM. Chem. Ber., 99,2918 (1966).
55. Kauffman T, VogtK, BarckS., SchuizJ. Chem. Ber., 99,2593 (1966).
56. Bourgeois P., CantegrilR., CheneA., Ge Un J., MortierJ., MoyroudJ. Synth. Commun., 23, 3195(1993).
57. Grenda V. J., Jones R. E, Gal G., SletzingerM. J. Oig. Chem., 30, 259 (1965).
58. Polanc S., Vercek B., Sek B., Stanovnik B., Tisler M. J. Oig. Chem., 39,2143 (1974).
59. Paudler W. W., Chao С. I. P., Helmick L. S. J. Heterocycl. Chem., 9,1157 (1972).
60. Rees C. W., Stephenson R. W., Storr R. C. J. Chem. Soc., Chem. Commun., 1974,941.
61. Bienayme H, Bouzid K. Angew. Chem., Int. Ed. Engl., 37,2234 (1998).
62. Minguez J. M., Castellote M. L, Vaquero J. J., Garcia-Navio J. L., Alvarez-Builla J.t Castano O. J. Org. Chem., 61,4655 (1996).
63. Minguez J> M., Vaquero J. J., Garcia-Navio J. L., Alvarez-Builla J. Tetrahedron Lett., 37, 4263 (1996).
64. «Aromatic quinolizines», Thyagarajan B. S. Adv. Heterocycl. Chem., 5, 291 (1965); «Aromatic quinolizines», Jones G. ibid., 31,1 (1982).
65. Miyadera T., OhkiE., Iwail. Chem. Pharm. Bull., 12,1344 (1964); KrdhnkeF., MdrlerD. Tetrahedron Lett., 1969, 3441.
66. Thyagarajan В. S., Gopalakrishnan P. V. Tetrahedron, 20, 105 (1964) и 21, 945 (1965); FortiL., GelmiM.L., PocarD., VaralloM. Heterocycles, 24,1401 (1986).
67. Boekelheide V, Lodge J. P. J. Am. Chem. Soc., 73, 3681 (1951); Glover E. E, Jones G. J. Chem. Soc., 1958, 3021.
68. Okamura W. H., Katz T. J. Tetrahedron, 23,2941 (1967).
69. Jones G., Ollivierre H., Fuller L. S., Young J. H. Tetrahedron, 47,2851,2861 (1991).
70. Mekonnen B., Crank G., Craig D. J. Heterocycl. Chem., 34, 589 (1997); Mekonnen B., Crank G, Tetrahedron, 53,6959 (1997).
71. FarquharD., Gough T. T., LeaverD. J. Chem. Soc., PerkinTrans. 1,1976,341.
72. Windgassen R. J., Saunders W. H., Boekelheide V. J. Am. Chem. Soc., 81,1459 (1959).
26
ГЕТЕРОЦИКЛЫ, СОДЕРЖАЩИЕ БОЛЕЕ ДВУХ ГЕТЕРОАТОМОВ
В системах, содержащих более двух гетероатомов в одном цикле, мы наблюдаем тенденцию к усилению всех свойств, описанных ранее в этой книге. В частности, наличие дополнительных гетероатомов как в шести-, так и в пятичленном циклах затрудняет электрофильное замещение и замедляет скорость электрофильного присоединения к атому азота. Кроме того, повышается склонность к реакциям нуклеофильного замещения и присоединения, а в пятичленных соединениях растет кислотность N-водорода.
Полигетероатомные циклические системы редко встречаются в природе; в качестве примера можно привести дендродоин — цитотоксическое соединение, выделенное из морских туникатов (оболочников). Однако в медицинской химии они имеют большое значение: алпразолам — средство, снимающее чувство беспокойства, ацетазоламид — ингибитор фермента карбоангидразы, используемый главным образом для лечения глаукомы, и флуконазол — противогрибковое средство.
N—N
Л V
Ac^-^Xs/^SO2NH2
ацетазоламид
флуконазол
Широко изучаются аналоги пиримидиновых нуклеозидов: 5-азацитидин применяют для лечения лейкемии, а рибавирин — противовирусный препарат, используемый для лечения легочных инфекций у младенцев. Ламотригин применяют при эпилепсии. Меламин, который при конденсации с формальдегидом образует меламиновые смолы, находит применение при производстве кухонной посуды и служит важным промышленным полупродуктом.
ламотригин меламин
26.1. ПЯТИЧЛЕННЫЕ ЦИКЛЫ
26.1.1. Азолы [1]
Нумерация триазолов указывает на взаимное расположение атомов азота, названия тетразол и пентазол недвусмысленны. 1,2,3-Триазолы удивительно
устойчивы, если принимать во внимание, что они содержат три непосредственно связанных друг с другом атома азота, однако при вакуумном пиролизе в тонком слое при 500 °C происходит потеря азота и образуются 2Н-азирины, возможно, через 1Н-изомер [2]. Бензотриазол также относительно устойчив и перегоняется в вакууме при 200 °C, хотя в ходе процесса возможен взрыв. Простейшие тетразолы также относительно устойчивы, а циклическая система пентазола известна лишь в виде арилпроизводных, которые обычно разлагаются при комнатной или даже более низкой температуре [3].
Наличие дополнительных гетероатомов делает эти системы менее основными, но более кислыми по сравнению с 1,2- и 1,3-азолами. Каждому из этих соединений свойствен такой же тип таутомерии, как и для 1,2- и 1,3-азолов (разд. 21.1.1.1), в котором таутомеры эквиваленты (не показано), но в этих системах также существуют различающиеся таутомерные формы.
1,2,3-триазол
рКа (присоединение протона) 1,2
рКа (отщепление протона) 9,4
1,2,4-триазол тетразол пентазол
рКа (присоединение протона) 2,2
рКа (отщепление протона) 10,3 рК^ (отщепление протона) 4,9
26.1.1.1. 1,2,3-Триазол [4]
1,2,3-Триазол достаточно устойчив к N-алкилированию в нейтральных условиях, однако и алкилирование, и ацилирование, включающее образование N-ани-онов, происходит легко, но при этом часто образуются смеси 1- и 2-замещенных соединений [1, 5]. При триметилсилилировании получают 2-триметилсилил-1,2,3-триазол, который может быть проалкилирован по положению N(d с образованием 1-алкилпроизводных с отщеплением триметилсилильной группы [6]. Равновесная смесь N-ацетил-!,2,3-триазолов преимущественно содержит 2-ацетилизомер [7], возможно из-за неблагоприятного взаимодействия двух ор-тло-расположенных неподеленных пар в 1-изомере, что соответствует расчетам, согласно которым 2Н-изомер более ароматичен [8]. При нагревании в сульфолане при 150 °C N-ацетильное производное превращается в оксазол, что имеет большое практическое значение [9].
Ме
+ 2:7
Me
Ph CH2N2 Y— N
,Et2O, 20 *C // V
90%
H
AgNO3, NH3 затем
Mel, CHCI3,20/C
44%
1-Метил-1,2,3-триазол бромируется по положению 4, однако 2-метилизомер менее реакционноспособен и необходимо использовать железо в качестве катализатора [10]; такая пониженная реакционная способность, вероятно, связана с наличием двух иминных фрагментов. Незамещенный 1,2,3-триазол образует 4,5-дибромпроизводное с высоким выходом при взаимодействии с бромом при 50 °C [И]. Нитрование 2-фенил-1,2,3-триазола идет в первую очередь по бензольному кольцу, азатем может происходить замещение по гетероциклу [12].
Ме Ме
конц. HNQj O2N
^H2SOt /=N\ >Nn
-----► % .NC6H4-4-NO2 <x. ,NC6H4-4-NO2
N N
Циклическая система 1,2,3-триазолов относительно устойчива к действию как окислителей, так и восстановителей, как показано ниже [13]:
CN ВОДН. KMnO4 /=N
V нагревание
N 50% N
N-Замещенные 1,2,3-триазолы могут литиироваться напрямую по атому углерода, но необходимо использование низких температур для предотвращения раскрытия цикла в результате циклореверсии [14,15].
/-—N n-BuLi
// Ч. THF- < -20 ’с
Q N -----------------►
N Ph
HOC-NU Ph
При обмене атома металла в 5-литий- 1-бензилокси-1,2,3-триазоле в реакции с иодидом цинка образуется относительно устойчивое цинковое производное, которое можно использовать в катализируемых палладием реакциях сочетания. Соответствующее оловопроизводное менее устойчиво и его можно использовать только для катализируемого палладием ацилирования [16]:
г.—N n-BuLi
П "N THF’ ~78 ’сг_2n1z-
44 NX
OBn
OBn
OBn
Как 4,5-дибром-1-метоксиметил-, так и 4,5-дибром-2-метоксиметил-1,2,3-триазол образуют 5-литийпроизводные при обмене с я-бутиллитием при —80 °C [П].
26.1.1.2. 1,2,4-Триазол [17]
Алкилирование и ацилирование обычно идет по положению N<i), что отражает более высокую нуклеофильность N—N-систем (для сравнения см. разд. 11.1.1.2). 4-Алкилпроизводные могут быть получены в результате кватернизации 1 -аце-
тил-1,2,4-триазола [18] либо через образование акрилонитрильного или крото-нонитрильного аддуктов [19] (заметим, что положения N<d и N(2> эквивалентны, если нет заместителей).
Ме3О+ BF47MeNO2
N—л Mel.NaOMe N—л AcCI N—п затем МеОН MeN—\
// \\, МеОН, 38 *С // V PhH, нагревание// V затем Na2CO3,20'С / \\
XN 65% 87/о 88%
Бромирование идет легко в щелочном растворе с образованием 3,5-дибром-1,2,4-триазола [20]. З-Монохлорпроизводное можно получить в результате термической перегруппировки N-хлоризомера [21]; аналогичный N -> С [1,5]-сиг-матропный сдвиг позволяет превращать 1-нитросоединения в 3-нитропроизводные [22].
вг
Ch N—г\
водн. КНСОз // \'
77% V
CI
нагревание
С1(СН2)2С1_
40% *
К(1)-Защищенные 1,2,4-триазолы легко литиируются по атому углерода, и образующиеся 5-литийпроизводные гораздо более устойчивы, чем литийпроиз-водные 1,2,3-триазолов [23].
3-Амино-1,2,4-триазол можно продиазотировать обычным способом: образующаяся диазониевая соль используется для получения азокрасителей и теряет азот при легко протекающих реакциях нуклеофильного замещения. Полученные таким образом бром- и нитротриазолы сами служат субстратами для нуклеофильного замещения [18, 24]. 5-Бром- и 5-нитрогруппы [25] представляют собой хорошо уходящие группы в 1-алкил-1,2,4-триазолах при взаимодействии с гетеронуклеофилами; в случае С-нуклеофилов лучшей уходящей группой служит метансульфонильная [26].
m-CPBA
CH 2CI2,20*C 73% *
CH2(CO2Me)2, У N DMF, 60 ~C NZ 58% Me
MeSNa N--Z
DMF, 20 р // Ч.
67% MeS^xN^ Me
MeO2S
NaH
(MeO2C)2HC
kN‘
Н
Окислительная десульфуризация 1,2,4-триазолтионов в присутствии азотистой кислоты представляет собой тип реакции, общий для всех других электронодефицитных азотистых гетероциклов. Процесс заключается в потере диоксида серы из промежуточно образующейся сульфокислоты [27].
,s
2-FCeH4^NxNH
водн. HNO3, кипячение 86%
-SO2
26.1.1.3. Тетразол [28]
Величины p/Sa ДЛЯ тетразола и карбоновых кислот подобны, поэтому тетразолы часто используют в качестве биоэквивалентов карбоксильной группы в биологически активных соединениях. Тетразол и его алкильные и арильные производные обычно в значительной степени разлагаются при температуре около 180 ’С, а хлор- и алкилтиопроизводные разлагаются при более низких температурах; 5-нитротетразол непредсказуемо взрывается при хранении [29].
Тетразолы алкилируются и ацилируются по положениям Ng) и N(2) в зависимости от природы заместителя в положении 5, однако возможно проведение селективного 1-алкилирования при кватернизации 2-три-н-бутилстан-нил- и 2-/ире/я-бутилпроизводных [30]. К сожалению, в последнем случае кватернизацию не удается провести с использованием алкилгалогенидов и необходимо применение алкилсульфатов или более сильных алкилирующих агентов [31].
N=N Mel N—N
ЛХ о DMSO,CHCI3.20 ‘С // \\
. _NSnn-Bu3 ---
N*' 0 58% Me
N—N f-BuOH
Ph^N‘
N—N Me2SO4
I ~ \ CHCI3,60'C
MeltxN
/ \
MeOSO3~
Ph^
ГП N
водн. HCI MeN—N 100’C / 4, 98% Ph
Замечательно то, что можно осуществить некоторые реакции С-электро-фильного замещения, такие, как бромирование [32], меркурирование [33] и даже реакцию Манниха [34] (но не нитрование), хотя механизм этих процессов отличается от обычного.
I2, АсОН ^KMnO4, H2SO4
** 55%
Me2NH.HCI, СН2О Н2О, нагревание 61%
Me
Как и следовало ожидать, благодаря индуктивным эффектам 5-бром-1-ме-тилтетразол более активен в реакциях нуклеофильного замещения, чем соответствующие галогено-1,2,4- и галогено-1,2,3-триазолы, которые, в свою очередь, обладают большей реакционной способностью, чем соответствующие галогени-мидазолы. 5-Бром-2-метилтетразол значительно менее реакционноспособен,
чем его 1-метилизомер из-за менее эффективной делокализации отрицательного заряда в промежуточно образующемся аддукте [35].
Et2Zn
N [NiCI2dppp-DIBAL-H]
// \\ THF, кипячение
\ 74%
N
5-Тетразолиловые эфиры могут быть использованы либо для активации фенолов в катализируемых никелем и палладием реакциях сочетания, как показано выше, либо для осуществления каталитического гидрогенолиза связи С-0 фенола [36].
С-Литиирование происходит легко, а образующиеся литиевые производные могут вступать в реакции с электрофилами, несмотря на сильную склонность к циклореверсии. Тетразол может выступать также в качестве рртио-ориентирую-щей группы, как это происходит при литиировании 5-фенилтетразола [37, 38]. Тетразолиловый эфир также служит рр/по-ориентантом в реакциях металлирования, но в этом случае происходит миграция тетразольного фрагмента от атома кислорода к литиированному атому углерода [39]. л-Метоксибензильная группа служит хорошей защитной группой для атома азота в реакции литиирования и, в конечном итоге, может быть удалена гидрогенолизом или окислением, как показано ниже [40]:
Me
n-BuLi
THF, -65 ’С
^5012^- [mgNChn]
67%^
+ N2
N—N
// "
HsAnxN
Me
N—N
Li-A zN
Ll N
Me
LDA
THF, 0 *C
85%
CAN N—N
водн. MeCN, 0 #C-» 20/C ^N
90% H ОН н
PMB
n-BuLi, TMEDA
THF,-78‘С э PhCH=Or Ph\ U/ 'n eo% Н%н ^B
5-Алкильные группы в 1-замещенных тетразолах можно литиировать, однако в 5-алкил-2-метилтетразоле металлирование идет по N-метильной группе [41], а 5-метил-2-тритилтетразол литиируется обычно по метильной группе боковой цепи [42]. Метиленовая группа в 5-(бензотриазолилметил)тетразоле достаточно активирована, поэтому нет необходимости в N-защитной группе — бензотриазол может впоследствии выступать в качестве уходящей группы при замещении реагентами Гриньяра, как показано ниже [43]:
2/>BuLI
THF,-78’С~»
-30 ’С
N—N
. н и и
N—N повторно N—N PhMgBr N-—N
КИПячение Jn
H Me н (^стадии)Me Me H 37% Me H
5-Аминотетразол образует соль диазония (с брутто-формулой CNg • НС1!) (ОСТОРОЖНО: ВЗРЫВООПАСНО), которую можно использовать для генерирования атомного углерода [44]! 1-Замещенные 5-аминотетразолы, по-видимому, образуют относительно устойчвые N-нитрозопроизводные.
N—N
H2nXn> н
C5HnONO HCI
120
3N2
При вакуумном пиролизе в тонком слое 5-арилтетразолы генерируют арил-карбены, а при нагревании пиримидинилфенилтетразола, как показано ниже, в кипящем декалине (180 °C) образуется нитреновый интермедиат, и нитренный атом азота затем при циклизации становится пиримидиновым атомом азота [46].
При окислении гипобромитом 5-бензиламинотетразолов образуются полезные бензилизонитрилы, как показано ниже [47]:
PhCH=O, Et3N Н2, Pd/C МеОН, 50‘С № 500psiM 80%
водн. NaOBr СН2С12, 0 *С
84%
Вп&С"
1,3,4-Оксадиазолы получаются при нагревании тетразолов с ацилирующими агентами в результате перегруппировки первоначально образующихся 2-ацил-производных [48]
N—N
(Ph(CH2)3CO)2O пиридин, 90 *С
92%
N—N
// \\
Ph^\/^(CH2)3Ph
26.1.1.4. Синтез циклической системы азолов
1,2,3-Триазолы
1,2,3-Триазолы обычно получают циклоприсоединением алкинов к азиду, однако использование некоторых алкилазидов сопряжено с риском, что ограничивает применение метода в этих случаях. Удобный способ получения 1,2,3-три-азолов, не замещенных по атому азота, основан на применении устойчивого (и относительно безопасного) триметилсилилазида [49]. Для синтеза С-незаме-
щенных 1,2,3-триазолов необходимо было бы использовать незамещенный ацетилен, но гораздо более удобен в качестве исходного соединения винилацетат или енамины или эфиры енолов в качестве эквивалентов алкинов [50,51].
t-Bu
Me3SiN3 t-BuCsCH u 'ntms
86%
CH2=CHOAc
p-AnN3
85 'Cn
71%
В результате конденсации азидов с ацильными реагентами Виттига регио-специфично образуются 1,5-дизамещенные 1,2,3-триазолы [52].
Ph3^H 4-BrC6H4N3 / PhH, нагревание
Ph***\) 90%
4-ВгС6Н4
Другие методы синтеза 1,2,3-триазолов включают процесс диазо-переноса к енаминокетонам от сульфонилазидов (или 3-диазооксиндола) [54] и реакцию тозилгидразона дихлорацетальдегида с аминами; каждый из этих методов продемонстрирован ниже [55]:
1,2,4-Триазолы
/=N PhNH2, Et3N /r~N
/ ^NHTsMeOHt40.^^ J*
СГ Cl XN
Ph
1,2,4-Триазолы получают циклодегидратацией М,Ы'-диацилгидразина с аминами, хотя часто реакция идет в жестких условиях [56]. В интересном варианте этого метода используют сгмш-триазин (1,3,5-триазин) в качестве эквивалента HN(CHO)2 [57]. Конденсации аминогуанидина с эфирами позволяют получать разнообразные 3-аминопроизводные [58].
nh2
HN—NH
ОН
N—N BnNH2,TsOH N—N
Л W PhMe, нагревание // \\
Me2hr ^% XNX
Bn
N—NH2 О'
N‘
О пиридин нагревание H2N. ZU /о
N—N
>n/^(CH2)3OH н
Ъо^н
Тетразолы
Тетразолы обычно получают при взаимодействии азида с нитрилом или активированным амидом; азид три-н-бутилолова или триметилсилилазид — в некого-
рых случаях более удобные и безопасные реагенты, чем азид-анион. Второй пример, приведенный ниже, иллюстрирует использование цианэтильной труппы в качестве удаляемой защитной труппы для амидного атома азота [59]. Другие вариации этого метода на основе нитрилов включают использование хлорида триэтиламмония (вместо хлорида аммония) во избежание возможной сублимации потенциально взрывоопасных азидов [60] и применение мицелл в качестве реакционной среды [61]. Амиды могут быть активированы либо с помощью ангидрида трифторметансульфокислоты [62], либо в результате образования тиоамидов [63], либо при использовании трифенилфосфина с азодикарбоновым эфиром; эквивалент имидохлорида способен реагировать в условиях фазового переноса [64].
NaN3 N-N
NH4CI, LiCI
EtO?C. c^jPMF.OS-g. EtO?C Д "N 81% NZ
H
2 NaN3,Tf2O мА|Н Ж
C-CgHu 72/о
TfO
N—N
О
DEAD, PPh3 Me3SiN3 THF, 20 p-ToK\NH ‘ ►
(CH2)2CN m/0
OPPh3
p-Tol
(CH2)2CN
N—N
p-Tol
(CH2)2CN
1h. NaOH водн. THF 20 X r
65% p-Tol
N—N
О
N H
Me^NH o-CgHn
О
Родственные методы применяются для получения 5-гетерозамещенных соединений: изонитрилы с N-галогеносукцинимидами и азидом образуют галогенопроизводные [65], арилизотиоцианаты с азидом дают арилтиопроизводные [66], а с изотиоцианатами получаются тиолы, как показано ниже. Тиолы могут быть превращены в 5-незамещенные тетразолы при окислении пероксидом водорода [67] или триоксидом хрома [68].
PhN=C=S
водн. NaNj
85% **
Н2О2, NH4OH
О-С________
60%
Нитрозирование амидразонов — метод, позволяющий избегать использования азидов, но с помощью этого метода возможен региоселективный синтез 1- и 2-замещенных соединений [69].
OEt
Pt/^N^ cr
MeNHNH2 пиридин, 0 у 75% *
NH phANxNH2 Me
NaNO2, водн. HCI 0-5 *C
93%
N—N
//
Me
H2NNHCHO пиридин , 95%
NNHCHO
NaNO2, водн. HCI
0-5'C r
93%
N=N N=N
PhAN>Ho —►phA^H
26.1.2. Оксадиазолы и тиадиазолы
Только один двухвалентный гетероатом может участвовать в построении пятичленного ароматического гетероцикла. В названии таких соединений нумерацию начинают от неазотного гетероатома, а положения атомов азота определяют по отношению к двухвалентному гетероатому.
//“^ О о о.
ХО хг О О 0
1,2,4*<жсадиазол 1,3,4-оксадиазол 1,2,5-оксадиаэол(фурозан) фуроксан
1,2,3-оксадиазол сидноны
1,2,3-тиадиазол 1,2,4-тиадиазол
1,3,4-тиадиазол
О
N N S 1,2,5-тиадиазол
1,2,4-[70], 1,3,4-[71] и 1,2,5-оксадиазолы хорошо известны, а система 1,2,3-оксадиазола, расчеты для которой показывают, что она относительно неустойчива по сравнению с ее ациклическим диазокетонным таутомером [72], известна только в виде бензаннелированного производного (в растворе) и в виде мезоионных соединений «сиднонов» [73], которые хорошо исследованы. «Фу-роксаны» [74], образующиеся при димеризации нитрилоксидов, также широко изучены. 1,2,3-, 1,2,4-[75], 1,3,4-[76] и 1,2,5-тиадиазолы [77] — все хорошо охарактеризованы. Данные по ароматичности, рассчитанные на основании спектров ЯМР, позволяют расположить соединения в следующем порядке
Как и в случае азолов, окса- и тиадиазолы — очень слабые основания, что обусловлено индуктивными эффектами дополнительных гетероатомов, хотя их можно кватернизовать по атому азота. По тем же причинам реакции электрофильного замещения по атому углерода практически неизвестны, за исключением некоторых реакций галогенирования и меркурирования [79]. Интригующий парадокс заключается в том, что обычно меркурирующие агенты считаются слабыми электрофилами, и тем не менее они часто успешно реагируют с электронодефицитными гетероциклами. Другое важное отличие от азолов заключается в отсутствии N-водородных атомов, поэтому реакции, протекающие через промежуточное образование N-анионов, для этих систем невозможны.
HgCl2 Me
водн. NaOAc N—/
20 *С, 1 месяц // \\
£5% CIHg'^Xo/N
l2, водн. KI
20 *С х 90%
Все эти системы чувствительны к нуклеофильным атакам, особенно оксадиазолы, которые часто претерпевают раскрытие цикла под действием водной кислоты или основания; исключение составляют случаи, когда при обоих ато
мах углерода имеются заместители. Аналогично уходящие группы обычно легко замещаются; существуют значительные отличия в реакционной способности положений: в 1,2,4-окса- и 1,2,4-тиадиазолах атом хлора в положении 5 замещается гораздо легче, чем в положении 3, что, без сомнения, обусловлено более эффективной стабилизацией образующегося в первом случае промежуточного анионного аддукта. Это далеко не полные сведения, позволяющие сравнивать относительную реакционную способность, однако некоторые данные все же доступны [80].
Относительные скорости реакции с пиперидином в этаноле
2000 64 1
В условиях основного катализа обмен протона происходит легко, но зачастую он конкурирует [81] с процессом разложения в результате циклореверсии или р-элиминирования в анионе. Прямое литиирование по атому углерода идет легко [82], однако образующиеся литиевые производные различаются по своей устойчивости, поэтому некоторые из них не находят препаративного применения [83]. Атомы водорода боковых алкильных групп обладают СН-кислотно-стью за счет того, что в депротонированных частицах происходит делокализация заряда с участием кольцевых атомов азота. В связи с этим существует интересное различие между 1,2,5-окса- и 1,2,5-тиадиазолами: в первом случае металлирование идет при взаимодействии с н-бутиллитием, а во втором — необходимо ис-пользоватыдиизопропиламид лития для предотвращения конкурентного нуклеофильного присоединения по атому серы, приводящего к раскрытию цикла [84].
N. .N
S
=, Et2Q,-110‘C
/т—водн. NaOH, 20'С л—ON N'/ VNt0 5 = 4,3 мин fl
ЧО‘ Na+
Me Me
CHoLi
СО2
67% N S
Me CH2CO2H
4-Замещенные 5-хлор-1,2,2-тиадиазолы вступают в реакции с простыми гетеронуклеофилами и при этом происходит замещение атома хлора. Однако при взаимодействии с арил- и алкиллитиевыми производными образуются алкинил-тиоэфиры в результате атаки по атому серы с последующей потерей азота и разрушением цикла. Подобное раскрытие цикла, но по другому механизму, наблюдается при обработке основанием 5-незамещенного аналога [85].
PhLi
THF, -78 ’С-> 20 ’С
88%
PhOCSPh
Обычно амины могут быть продиазотированы и превращены, например, в галогениды, но в некоторых случаях промежуточно образующиеся N-нитро-зопроизводные устойчивы и превращаются в соль диазония только при обработке сильной кислотой, что, по-видимому, обусловлено более низкой стабилизацией положительно заряженной группы, присоединенной к электронодефицитному циклу [86]
Et^O2
NaNO2 У—N
нсо2н, о *с JJ \\
80% Nxqz^NHNO
О
BF3
СС14, EtgO, -30 ‘С
70%
NaNOg м—n
водн. HCI, 5 X Ji u PhH, нагревание
NHNO 60% *
Интересный и совершенно общий тип реакций для таких циклических систем заключается во взаимопревращении циклов в результате внутримолекулярной атаки по атому азота [87].
1,2,4-Оксадиазолы используют как замаскированные амидины в тех случаях, когда подобные сильноосновные труппы несовместимы с условиями реакции — амидин легко высвобождается при гидрогенолизе, как показано ниже [88]:
\\ пиридин, кипячение
NOH ---------------
75%
p-Tol
HN—< POCI3
/ м пиридин, кипячение BnONa
O^o/N 54% 76%
p-Tol Н2, Pd/C NaH, Mel
MeHN—EtOH, EtOAc THF NH 99% * 54%
H2, Pd/C EtOH, EtOAc p-Tol
H2N-^ NH
26.1.3. Другие системы
Среди высших азасоединений только производные 1,2,3,4-тиатриазола [89] хорошо известны, но даже их алкильные производные разлагаются при О °C и даже при более низкой температуре, хотя 5-арил- и аминопроизводные обычно совершенно устойчивы. Многие другие производные, например 5-хлор- и тиопроизводные взрывоопасны. Контролируемое разложение 5-алкокси-1,2,3,4-тиатриазолов (например, 5-этоксипроизводное разлагается в эфире при 20 °C) рекомендовано в качестве наилучшего препаративного метода получения чистых алкилцианатов; при термическом разложении 5-арилпроизводных образуются соответствующие нитрилы [90]. Интересная изомеризация цикла наблюдается при взаимопревращениях аминотиатриазолов и тетразолилтиолов [91].
PhH, нагревание 51%
N—N
водн. NaOH
водн.кислота
N—N Et20,20 *С
// ('N2t-SL
00-%^
EtOC=N
тепло
N—N
< К a s
Ar = 2-O2N-C6H4
26.1.4. Синтезы кольца
26.1.4.1. 1,2,4-Оксадиазолы
1,2,4-Оксадиазолы могут быть получены при ацилировании амидоксимов [92]. Вариация этого метода позволяет проводить синтез в одной колбе из амидок-сима, органической кислоты и пептидного сочетающего агента; метод достаточно мягкий, и при использовании миндальной кислоты не происходит рацемизации [93]. 1,2,4-Оксадиазолы также можно синтезировать либо из амидов через ациламидины [94], либо в результате циклоприсоединения нитрилокси-дов к нитрилам, как показано ниже, или к О-метилоксиматам [95].
NCCH2SO2C6H4-4-CI
nh2oh h?n А
водн. EtOH, 20 *С CH2SO2Ar 69%
ho-n
EtO2CCOCI N_/CH2S°2Af
THF, нагревание ц
73% EtO2C-^oxN
Me К
NH2 Me2NC(Me)(OMe)2 NH2OH,AcOH N—/
120 ‘C_________ / NMe2 водн. диоксан, 90 *C // \\
3,5-(Ме0)2СбНз>х<Ч‘0 90% At'*x*q 71% Ar'"\/N
[phCsft-O-] 47% 1
H2NOH.HCI, NaOMe MeOH, кипячение 91%
26.1.4.2. 1,3,4-Оксадиазолы
1,3,4-Оксдциазолы получают циклодегидратацией К,1Ч'-диацилгидразинов или их эквивалентов [96]. Их также синтезируют из тетразолов (разд. 26.1.1.3) или окислительной циклизацией ацилгидразонов [97].
HN-NH2 HC(0Et)3 N—N
У' нагревание // \\
РК% 71%
Ph^N
TsNCINa
**NH нагревание
89%
О 2-фурил
26.1.4.3. 1,2,5-Оксадиазолы
1,2,5-Оксадиазолы получают дегидратацтией 1,2-бисоксимов
ас2О юо *с
87%
Ph Ph
•n' NaNO2 /—NZ Ac2O водн. HCI J 100 ♦c 80% °И (У 83%*
HU
СИДНОН
26.1.4.4. Сидноны
Сидноны обычно синтезируют дегидратацией N-нитрозо-а-аминокислот [98].
26.1.4.5. 1,2,3-Тиадиазолы
1,2,3-Тиадиазолы получают при взаимодействии гидразона, содержащего кислотную метиленовую группу, с тионилхлоридом [99]. 5-Тиолопроизводное образуется в реакции тозилгвдразона хлораля с полисульфидом, как показано ниже [100]:
но2с,
SOCI2 НОгС’
60‘С
СНз NCO2Et "^%" -
С13СН(ОН)2 + TsNHNH2 МеОН, 20 g
CI3C NHTs
S, Na2S H2O, pH 10-11, 62%
•N
NaS*
N
CI**Z'4Q| NTs
26.1.4.6. 1,2,4-Тиадиазолы
1,2,4-Тиадиазолы, содержащие одинаковые заместители в положениях 3 и 5, получают окислением тиоамидов [101]; 5-хлор-1,2,4-тиадиазолы образуются при взаимодействии амидинов с перхлорметилмеркаптаном [102].
|2, ЕЮН 77°/Tph
.Me
H2N-^+
nh2 СГ
CI3CSCI Me .Me
водн. NaOH N—MeNH2 N—<
CH2CI2,8 ‘C // W EtOH, 2o;c // W
60% * CI-"X_xN 97% MeNH-*X xN s ь
26.1.4.7. 1,3,4-Тиадиазолы
Существует много удобных общих методов получения 1,3,4-тиадиазолов, включающих циклизацию К,К'-диацилгидразинов или 1,3,4-оксадиазолов с сульфидами фосфора [103]. З-Амино-1,3,4-тиадиазолы образуются при ацилировании
тиосемикарбазидов [104], а незамещенный 1,3,4-тиадиазол получают при взаимодействии сероводорода с диметил формамидазином [105].
H2N—-NH
4^-NHEt О
HC(OEt)3
80 *С
60%
HN—N
N—N
N—N
Ph
Me2N
MeSO3H PhMe, нагревание 84%
H2S
МеОН, 2р;с
NMe2 80%
N—N
26.1.4.8. 1,2,5-Тиадиазолы
1,2,5-Тиадиазолы можно получить в результате окислительной циклизации 1,2-диаминов или аминокарбоксамидов [106]. При конденсации сульфамида [SO2(NH2)2] с 1,2-дикетонами образуются 1,2,5-тиадиазол-1,1-диоксиды [107]. Хороший общий метод синтеза заключается во взаимодействии тритиазилтри-хлорида с активированными алкенами и алкинами; этот метод также используется для аннелирования 1,2,5-тиадиазола к другим гетероциклам, таким, как пирролы. Основной недостаток метода заключается в том, что реагент коммерчески недоступен. Реакцию можно проводить путем циклоприсоединения к фрагменту N-S-N тритиазинового цикла [108].
Ph.
.Ph
N NH2 HCI
EtOH, 20*C oz ЧО
.... S2CI2
/ \ DMF, 80 *С
H2N NH2 50% 3
О
51%
26.2. ШЕСТИЧЛЕННЫЕ ЦИКЛЫ
26.2.1. Азины
кислота
Нейтральные шестичленные ароматические гетероциклы не могут содержать двухвалентных гетероатомов. Нумерация в молекулах азинов отражает относительное расположение атомов азота. 1,2,3,4-Тетразин, пентазин и гексазин неизвестны. Что касается других систем, очень мало информации существует о 1,2,3,5-тетразине, однако производные 1,3,5-триазина очень хорошо известны и доступны в больших количествах. Действительно, это один из наиболее давно известных гетероциклов: триоксипроизводное (циануровая кислота) было впервые получено в 1776 г. Шееле пиролизом мочевой кислоты.
Термическая устойчивость незамещенных систем колеблется от 1,2,3-триа-зина, который разлагается при 200 °C, до 1,3,5-триазина, который устойчив до 600 °C, — при этой температуре он разлагается с выделением циановодорода, формальным тримером которого он является.
По сравнению с диазинами индуктивные эффекты «дополнительных» атомов азота приводят к еще большей чувствительности к нуклеофильной атаке, и, как следствие этого, все незамещенные системы реагируют с водой в кислых
или основных растворах. Аналогично простые реакции электрофильного замещения не идут; некоторые на первый взгляд реакции электрофильного замещения, такие, как бромирование 1,3,5-триазина, происходят, вероятно, в результате нуклеофильного присоединения бромида к соли N+—Вг [109]. Попытки прямого N-окисления простых тетразинов под действием обычных реагентов главным образом приводят к расширению цикла, однако удовлетворительное окисление может быть осуществлено при использовании метил(трифторметил)диок-сирана [ПО].
N ^N
N
Примеры, приведенные ниже, служат иллюстрацией большинства реакций легкого нуклеофильного присоединения к полиазаазинам: реакция 1,2,4,5-тетразина с простыми аминами [111] может быть противопоставлена реакции, требующей участия амида натрия (реакция Чичибабина) для диазинов и пиридина.
жидк. NHj
Н u
NxNxf-NH2 Ph^N5,14
KMnO4 74%
n-N<^nh2
Д J
I N
Легкость присоединения по положению 5 в 1,2,4-триазинах [112] показана на примере викариозного нуклеофильного замещения (разд. 2.3.3) для 3-метил-тиопроизводных в отсутствие активирующих ipynn; родственное присоединение нитроалканов представляет собой очень полезный вариант нуклеофильного ацилирования [113]. Также показательно легкое замещение метилтиогрупп в подобных соединениях [114]. Нуклеофильное замещение метилтиогруппы в 1,2,4-триазинах и 1,2,4,5-тетразинах на алкокси- и аминогруппы происходит очень легко. Монозамещение может быть проведено в бис(метилтио)-1,2,4,5-тетразине, но при использовании метоксида необходим строжайший контроль условий реакции для предотвращения образования диметоксипроизводного [115]. Однако при реакции бис(метилтио)производного с метиллитием [116] происходит нуклеофильная атака по атому азота!
EtNO2, КОН
DMSO, 2О‘£
70%
2MeLi
THF,-78 *С
84%
HNx'N<YSMe
Mes\-NMe
NxN<5Y"OMe NaOMe, МеОН
II I г;78 ‘С -> -30 *С
MeS^N<N 72%
В химии триазинов сульфонильная группа представляет собой более хорошую уходящую группу, чем галоген, в реакциях с карбанионами [117].
NaOMe МеОН, 20 ‘С 79%
SMe PhSO2CH2CI, КОН
DMSO, 20 *С г 76%
PhSO2CH2
SMe
РЬХ%ГС1 P-TolSO2Na SO2p.To| CH (CN)C0 B NaNH Ph^N^CHfCNJCOzEt
T | DMF, 60’С || PhH, кипячение I I
74% 56% Pri'h/'N
Чувствительность 1,3,5-триазина к нуклеофильным атакам, сопровождающимся раскрытием цикла, позволяет использовать его в синтезах в качестве эквивалента формиата или формамида, особенно для получения других гетероциклов, таких, как имидазолы и триазолы [118] (разд. 26.1.1.4; 1,2,4-триазолы).
бензимидазол
Несмотря на высокую чувствительность 1,2,4-триазина к нуклеофильному присоединению, 3-замещенные 5-метокси-1,2,4-триазины можно успешно литиировать [119]
UTMP
THF.-IOO’C >2Г 74%
Реакция 1,2,3-триазина с нуклеофилами приводит обычно к раскрытию цикла в результате атаки по положению 4. Однако эфиры силиленолов реагируют с комплексом хлороформиат/1,2,3-триазин с образованием 5-замещенных 2,5-дигидро-1,2,3-триазинов, которые можно ароматизировать при использо-ваии церрий(1У)аммонийнитрата. В этом случае первоначальное присоединение идет по атому N(2), что приводит к специфической активации положения 5 [120].
Ме
CICOgCHClMe
Интересный вариант реакции Минисци представлен для 1,2,3-триазина, который неустойчив в обычных кислых условиях: в данном случае активация гетероцикла к атаке нуклеофильным радикалом происходит под действием дици-анометинилида [121].
Восстановительное удаление гидразиновых заместителей в окислительных условиях концептуально родственно окислительному отщеплению тиольных групп в других системах (нпример, разд. 26.1.1.2). В этом случае возможно промежуточное образование диимида, как показано ниже [122]:
Вероятно, наиболее полезная и общая реакция всех этих систем — это реакция Дильса—Альдера с обратными электронными требованиями с ацетиленами (или их эквивалентами), в результате которой образуются либо пиридины, либо диазины при элиминировании циановодорода или азота [123]. Иногда наблюдаются аномальные реакции по несогласованному механизму, как показано на последнем примере [124]:
CO2Et
N‘Z^N MeteCNBn2
|| I Диоксан, нагревание
Et02C^N^C02Et 95%
CO2Et
N*^N
Et°2c"^^CO2Et
Me
26.2.2. Синтезы кольца
- EtO2CCN
26.2.2.1. 1,2,3-Триазин
1,2,3-Триазин получают окислением 1-аминопиразола [125]
NiO2
АсОН, СН2С12 ох
18%
Ме_О
МеА)
H2N SMe
П
H2N
водн. NaHCO 20‘С
86%
26.2.2.2. 1,2,4-Триазины
1,2,4-Триазины образуются при конденсации амидразонов с дикетонами или галогенокетонами, как показано выше [126].
26.2.2.3. 1,3,5-Триазины
1,3,5-Триазины обычно наиболее легко получают при реакциях замещения в 2,4,6-трихлор-1,3,5-триазине, однако циклическая система может быть также синтезирована в результате реакций циклоконденсации. При тримеризации нитрилов (общий промышленный метод) или имидатов [127] образуются симметрично замещенные соединения; монозамещенные 1,3,5-триазины могут быть получены при взаимодействии имидатов с незамещенным 1,3,5-триазином [128].
СН2С1
iiu n* NaOAc
NH2Cl EtOH, 2(ГС n I
ClCHjT^OEt 69% CICH2^bTSCH2CI
Йн2 СГ ЗЮ2ЫСбН4Х^0Ме
EtOH, нагревание!
82% Ar>
Путь, позволяющий синтезировать 1,3,5-триазины с различными заместителями при каждом атоме углерода, представлен ниже — 1Ч'-ацил-М,Ы-диметил-амидин реагирует с амидином (показано) или гуанидином с образованием 1,3,5-триазина [129].
4-МеОС6Н4
MeG(0Me)2NMe2 § Т* A-MeO^CtNH^NH AN
АП-r диоксан,кипячение _ 7, 7
BnCONHa --------------- В" N Me ------------—----------- \
Bn N Me
26.2.2.4. 1,2,4,5-Тетразины
1,2,4,5-Тетразины образуются при конденсации гидразина с карбонильными
соединениями со степенью окисления кислоты и последующем окислении дигидропроизводных: таким образом синтезируют 3,6-идентично замещенные соединения, а реакции перекрестных конденсаций оказались безрезультатными
[105,130].
ВОДН. ЬуНд
100‘С у
76% *"
водн. NaNO2
АсОН, 0 -Сг
58%
26.3. БЕНЗОТРИАЗОЛЫ
Химия бензотриазола изучена подробно и в настоящее время находит широкое применение для гетероциклических [131] и общих синтезов [132]. Это обусловлено целым рядом полезных свойств бензотриазола: (1) а-карбанионы стабилизированы точно так же, как бензильное положение бензольных структур; (2) а-карбокатионы также стабилизированы; (3) бензотриазолил-анион представляет собой хорошую уходящую группу в сочетании с высокой реакционной способностью и стабильностью и поэтому удобен в применении. Последовательные комбинации свойств позволяют применять его для синтеза широкого круга соединений — некоторые примеры представлены ниже.
CH2=CHCH(OEt)2, 82 -С фторуглеводородный растворитель_______
95% *
Исходные производные бензотриазола обычно получают из незамещенного гетероцикла N-алкилированием алкилгалогенидом или реакцией с альдегидами или ацеталями, в результате чего образуется смесь 1- и 2-замещенных бензотриазолов, однако реакционная способность этих двух изомеров одинакова. Для ясности приведены реакции только для 1-замещенных соединений.
Алкилирование литиированного 1-(1-этоксипроп-2-енил)бензотриазола приводит к образованию енонов после гидролитического удаления гетероцикла; присоединение литиевых производных к циклогексанону дает 1,4-дикетон, как показано ниже на схеме [133]. При присоединении подобного аниона к метил-кротонату образуется анион, в котором происходит внутримолекулярное замещение бензотриазола и получается циклопропан [134].
В приведенном ниже примере бензотриазольный фрагмент облегчает литиирование по бензильному положению и на последней стадии выступает в качестве уходящей группы [135].
Способность бензотриазола стабилизировать катион позволяет 1-гидроксиметилбензотриазину алкилировать индол; образующеееся соединение затем литиируют, что дает возможность проводить электрофильное замещение, и далее бензотриазольный фрагмент замещается реактивом Гриньяра [136]
Анион трис(бензотриазол-1-ил)метана может присоединяться к нитробензолу по механизму викариозного нуклеофильного замещения, при котором бензотриазольный фрагмент служит одновременно для стабилизации аниона и как
уходящая группа [137]; другое применение этого соединения продемонстрировано на примере алкилирования его аниона с последующим гидролизом и превращением в кислоту [138].
CHCI3, n-Bu4NBr водн. NaOH, , кипячение
BtH----50%*HC^
КОН, PhNO2
O2N
'^-CH(Bt)2 ZnBr2, диоксан
T водн. HCI
J? 86% C\ KI
(2 стадии) °2N
n-BuLi водн. H2SO4
<THF,-78 ‘С^ВпВг^ BnC(Bt)3 THF, 50.:C^ ВпСо2н
92%
Реакционная способность бензотриазолов позволяет их использовать для получения других гетероциклических соединений в результате разнообразных реакций, приводящих к раскрытию цикла и образованию реакционноспособных интермедиатов, таких, как дегидробензолы [139], ариллитиевые производные [140] и бирадикалы, как показано ниже [141]:
BtH +
Упражнения
Упражнения повышенной сложности
1. Какие соединения образуются в следующих реакциях Дильса-Альдера: (а) 1-пирролидинилциклопентен с 1,3,5-триазином и 1,2,4-триазином; (б) 3-фенил-1,2,4,5-тетразин с 1,1-диэтоксиэтеном?
2. Тиофосген (S=CC12) реагирует с азидом натрия при низкой температуре с образованием соединения, которое не содержит азидной группы; при последующей реакции с метиламином это производное превращается в соединение с брутто-формулой C2H4N4S — каковы структуры всех соединений?
3. Что образуется при взаимодействии PhCONH2 с диметилацеталем диметил-формамида, а затем (а) с N2H4 и (б) с H2NOH?
4. 1,3,5-Триазин реагирует (а) с аминогуанидином с образованием 4-амино-1,3,4-триазола и (б) с диэтилмалонатом с образованием этилового эфира 4-гидроксипиримидин-5-карбоновой кислоты. Напишите механизмы этих превращений.
Литература
1. «Synthesis and reactions of lithiated monocyclic azoles containing two or more heteroatoms. Part VI: Triazoles, tetrazoles, oxadiazoles and thiadazoles», Grimmett M. R., Iddon B. Heterocycles. 41,1525 (1995).
2. Gilchrist T. L., Gymer G. E, Rees C. W. J. Chem. Soc., Perkin Trans. 1,1973,555; ibid., 1975,1.
3. «Pentazoles», Ugi I. Adv. Heterocycl. Chem., 3, 373 (1964).
4. «1,2,3-Triazoles», Gilchrist 71 L., Gymer G. E. Adv. Heterocycl. Chem., 16, 33 (1974).
5. Pederdsen C. Acta Chem. Scand., 13, 888 (1959).
6. Ohta S., Kawasaki I, Uemura T., Yamashita M., Yoshioka T., Yamaguchi S. Chem. Pharm. Bull., 45,1140 (1997).
7. BirkoferL., Wegner P. Chem. Ber., 100, 3485 (1967).
8. Bird C. W. Tetrahedron, 41,1409 (1985).
9. Williams E. L. Tetrahedron Lett., 33,1033 (1992).
10. Hiittel R., Welzel G, Justus Liebigs Ann. Chem., 593, 207 (1955).
11. Iddon B., Nicholas M. J. Chem. Soc., Perkin Trans. 1,1996, 1341.
12. Lynch В. M., Chan T.-L. Can. J. Chem., 41, 274 (1963).
13. Wiley R. H., HussungK. F, Moffat J. J. Org. Chem., 21,190 (1956); El-KhademH., El-ShafeiZ.M., MeshrekiM. H. J. Chem. Soc., 1961,2957.
14. Raap R Can. J. Chem., 49,1792 (1971).
15. Ghose S., Gilchrist T. L. J. Chem. Soc., Perkin Trans. 1, 1991, 775.
16. FeldingJ., Uhlmann P., Kristensen J., Vedso P., Begtrup M. Synthesis, 1998,1181.
17. «Approaches to the synthesis of l-substituted 1,2,4-triazoles», Balasubramanian M., Keay J. G, Scriven E. F. Heterocycles, 37,1951 (1994).
18. Olofson R.A., Kendall R. V. J. Oig. Chem., 35, 2246 (1970).
19. Horvath A, Synthesis, 1995, 1183.
20. Kroger C-F, Miethchen R. Chem. Ber., 100,2250 (1967).
21. Гринштейн В., Стразднина А. Химия гетероциклических соединений, 1969,1114.
22. Habraken С. L., Cohen-Fernandes Р. J. Chem. Soc., Chem. Commun., 1972, 37.
23. Anderson D. K, Sikorski J. A., Reitz D. B., Pilla L. T. J. Heterocycl. Chem., 23, 1257 (1986); Jutzi R, Gulge K. J. Oiganomet. Chem., 246, 163 (1983).
24. Browne Е. J. Aust. J. Chem., 22, 2251 (1969); Багал Л. И., Певзнер М. С., Фролов А. Н., Шелудякова Н. И. Химия гетероциклических соединений, 1970, 259; Багал Л. И., Певзнер М. С., Самаренко В. Я., Егоров А. И. Химия гетероциклических соединений, 1970, 1701.
25. Sano S., Tanba М., Nagao Y. Heterocycles, 38,481 (1994).
26. ZumbrunnA. Synthesis, 1998,1357.
27. Kane J. M., Dalton C. R., Staeger M. A., Huber E. W. J. Heterocycl. Chem., 32. 183 (1995); «Facile desulfurization of cyclic thioureas by hydrogen peroxide», Grivas S., Ronne E. Acta Chem. Scand., 49, 225 (1995).
28. «Recent advances in tetrazole chemistry», Butler R. N. Adv. Heterocycl. Chem., 21, 323 (1977).
29. Benson F. R. The high nitrogen compounds, Wiley, New York, 1984.
30. Isida T., Akiyama T., Nabika K, Sisido K, Kozima S. Bull. Chem. Soc. Jap., 46, 2176 (1973); TakachN. E, HoltE. M.,AlcockN. W, Henry R. A., Nelson J. HL Am. Chem. Soc., 102, 2968 (1980).
31. Koren A. O., Gaponik P. N., Ivashkevich O. A., Kovalyova T. B. Mendeleev Commun., 1995, 10.
32. Гапоник П. H, Григорьев Ю. В., Корен А. О. Химия гетероциклических соединений, 1988,1699.
33. Гапоник П. Н., Григорьев Ю. В., Каравай В. П. Металлорганическая химия, 1, № 4, 846 (1988).
34. Каравай В. И, Гапоник П. Н Химия гетероциклических соединений, 1985, 564.
35. Barlin G. В. J. Chem. Soc. (В), 1967, 641.
36. Johnstone R. A. W., BrigasA. E J. Chem. Soc., Chem. Commun., 1994,1923; Johnstone R. A. W., McLean Ж N. Tetrahedron Lett., 29, 5553 (1988); Henderson P., Kumar S, Rego J. A., RingsdorfH., SchuhmacherP. J. Chem. Soc., Chem. Commun., 1995, 1059.
37. Raap R. Can. J. Chem., 49, 2139 (1971).
38. Flippin L. A. Tetrahedron Lett., 32, 6857 (1991).
39. DankwardtJ. Ж J. Org. Chem., 63, 3753 (1998).
40. Satoh Y. Marcopulos N. Tetrahedron Lett., 36,1759 (1995).
41. Cheney В. V. J. Org. Chem., 59, 773 (1994).
42. Huff В. E., Le Tourneau M. E., Staszak M. A., Ward J. A. Tetrahedron Lett., 37, 3653 (1996).
43. Katritzky A. R.t Asian D., Shcherbakova I. A., Chen J., Belyakov S. A. J. Heterocycl. Chem., 33, 1107(1996).
44. Kammula S, Shevlin P. B. J. Am. Chem. Soc., 96, 7830 (1974).
45. Golden A. H, Jones M. J. Org. Chem., 61, 4460 (1996); Kumar A., Narayanan R., ShechterH ibid., 4462.
46. Kamala K, Rao P. J, Reddy К. К Bull. Chem. Soc. Jpn., 61, 3791 (1988).
47. Hoffle G., Lange B. Org. Synth., Coll. Vol. VII, 1992, 27.
48. Jursic B. S., Zdravkovski Z. Synth. Commun., 24,1575 (1994).
49. BirkoferL., WegnerP. Chem. Ber., 99, 2512 (1966).
50. Huisgen R., Mobius L., Szeimies G. Chem. Ber., 98,1138 (1965).
51. Jones H, Fordice M. W., Greenwald R. B., Hannah J., Jacobs A., Ruyle W. V, Walford G. L., Shen T Y.J. Med. Chem., 21,1100 (1978).
52. Ykman P., L Abbe G., Smets G. Tetrahedron, 27, 845 (1971).
53. Romeiro G. A., Pereira L. O. R., deSouza M. С. В. V., Ferreira V. F, Cunha A. C. Tetrahedron Lett., 38, 5103 (1997).
54. Augusti R., Kascheres C. J. Org. Chem., 58, 7079 (1993).
55. Harada K, Oda M., Matsushita A., Shirai M. Heterocycles, 48, 695 (1998).
56. Bartlett R. К., Humphrey I. R. J. Chem. Soc. (C), 1967, 1664.
57. Grundmann C., Ratz R. J. Org. Chem., 21,1037 (1956).
58. Ried W., Valentin J. Chem. Ber., 101, 2117 (1968).
59. Finnegan Ж G., Henry R. A., Lofquist R. J. Am. Chem. Soc., 80,3908 (1958); Duncia J. V,, Pierce M. E., Santella J. B. J. Oig. Chem., 56, 2395 (1991).
60. Koguro K., Oga T, Mitsui S., Orita R. Synthesis, 1998, 910.
61. Jursic B. S., LeBlanc B. W. J. Heterocycl. Chem., 35,405 (1998).
62. Thomas E. W. Synthesis, 1993,767.
63. LehnhoffS, Ugi I. Heterocycles, 40, 801 (1995).
64. Artamonova T. V., ZhivichA. B., Dubinskii M. Yu., Koldobskii G. I. Synthesis, 1996,1428.
65. Collibee W. L., Nakajima M., Anselme J.-P. J. Oig. Chem., 60,468 (1995).
66. LeBlanc B. W., Jursic B. S. Synth. Commun., 28, 3591 (1998).
67. MarkgrafJ. H., Sadighi J. P. Heterocycles, 40, 583 (1995).
68. KauerJ. C, Sheppard W. A. J. Org. Chem., 32, 3580 (1967).
69. Boivin J., Husinec S., Zard S. Z. Tetrahedron, 51, 11737 (1995).
70. «1,2,4-Oxadiazoles», Clapp L. B. Adv. Heterocycl. Chem., 20, 65 (1976).
71. «Recent advances in 1,3,4-oxadiazole chemistiy», Hetzhein A., Mockel K. Adv. Heterocycl. Chem., 7, 183 (1966).
72. Nguyen M. T, Hegarty A. P, Elguero J. Angew. Chem., Int. Ed. Engl., 24, 713 (1985).
73. «The chemistry of sydnones», Stewart F. H. C. Chem. Rev., 64, 129 (1964); Huisgen R., Grashey R., Gotthardt H, Schmidt R. Angew. Chem., Int. Ed. Entgl., 1,48 (1962).
74. «Furoxans and benofuroxans», Gasco A., Boulton A. J. Adv. Heterocycl. Chem., 29, 251 (1981); «The chemistry of furoxans», Sliwa W,, Thomas A. Heterocycles, 23,399 (1985).
75. «1,2,4-Thiadiazoles», Kurzer P. Adv. Heterocycle. Chem., 32, 285 (1982).
76. «Recent advances in the chemistry of 1,3,4-thiadiazoles», Sandstrom J. Adv. Heterocycl. Chem., 9, 165(1968).
77. «The 1,2,5-thiadiazoles», Weinstock L. M., Pollak P. I. Adv. Heterocycl. Chem., 9, 107 (1968).
78. Bak B, Nygaard L., Pedersen E. J., Rastrup-Anderson J. J. Mol. Spectrosc., 19, 283 (1966).
79. Moussebois G., Eloy F. Helv. Chim., Acta, 47, 838 (1964).
80. Alemagna A., Bacchetti T, Beltrame P. Tetrahedron, 24, 3209 (1968).
81. Olofson R. A., Michelman J. S. J. Org. Chem., 30, 1854 (1965).
82. Thomas E. W., Zimmerman D. C. Synthesis, 1985,945.
83. «Ring-opening of five-membered heteroaromatic anions», Gilchrist T. I. Adv. Heterocycl. Chem., 41,41 (1987).
84. BogerD. L., Brotherton С. E. J. Heterocycl. Chem., 18,1247 (1981).
85. Vbets M., Smet M., Dehaen W. J. Chem. Soc., Perkin Trans. 1,1999,1473.
86. GoerdelerJ., Deselaers K. Chem. Ber., 91,1025 (1958); GoerdelerJ. Rachwalsky H ibid., 93,2190 (1960); Butler R. N, Lambe T. M., Tobin J. C., Scott F. L. J. Chem. Soc., Perkin Trans. 1,1973, 1357.
87. «Ring transformations of five-membered heterocycles», Vivona N., Buscemi S., Frenna V., Cusmano G. Adv. Heterocycl. Chem., 56, 49 (1993); Cusmano G., Macaluso G., Gruttadauria M. Heterocycles, 36, 1577 (1993).
88. Bolton R. E., Coote S. J., Finch H, Lowden A., PeggN., VinaderM. V. Tetrahedron Lett., 36,4471 (1995).
89. «1,2,3,4-Thiatriazoles», Holm A. Adv. Heterocycl. Chem., 20, 145 (1976).
90. Jensen K. A., Holm A. Acta Chem. Scand., 18, 826 (1964).
91. KauerJ. C., Sheppard W. A. J. Org. Chem., 32, 3580 (1967).
92. Santilli A. A., Morris R. L. J. Heterocycl. Chem., 16, 1197 (1979).
93. Liang G. -В., FengD. D. Tetrahedron Lett., 37, 6627 (1996).
94. Lin Y., LangS. A., Lovell M. F., Perkinson N. A. J. Org. Chem., 44, 4160 (1979).
95. Neidlein R., Li S. J. Heterocycl. Chem., 33, 1943 (1966); idem., Synth. Commun., 25, 2379 (1995); Nicolaides D. N., Fylaktakidou К. C., Lilinas К. E, Papageorgiou G. K, Hadjipavlou-Litina D. J. J. Heterocycl. Chem., 35,619 (1998).
96. Ainsworth C. J. Am. Chem. Soc., 77, 1148 (1955).
97. Jedlovska E., Lesko J. Synth. Commun., 24, 1879 (1994).
98. Thoman C. J., Voaden D. J. Oig. Synth., Coll. Vol. V, 1973,962.
99. Hurd C. D., Mori R. I. J. Am. Chem. Soc., 77, 5359 (1955).
100. Harada K, Inoue T., Yoshida H. Heterocycles, 44,459 (1997).
101. Cronyn M. W., Nakagawa T. J. Am. Chem. Soc., 74, 3693 (1952).
102. GoerdelerJ., Groschopp H, Sommerlad U. Chem. Ber., 90, 182 (1957).
103. Ainsworth C. J. Am. Chem. Soc., 80, 5201 (1958).
104. Whitehead C. W., Traverse J. J. J. Am. Chem. Soc., 77, 5872 (1955); Kress T. J., Costantino S. M. J. Heterocycl. Chem., 77,607 (1980).
105. Fdhlisch B., Braun R., Schultze К W. Angew. Chem., Int. Ed. Engl., 6, 361 (1967).
106. Weinstoek L. M., Davis P., Handelsman B., TullR. J. Org. Chem., 32,2823 (1967).
107. Wright J. B. J. Org. Chem., 29, 1905 (1964).
108. Duan X.-G., Duan X.-L., Rees C. W. J. Chem. Soc., Perkin Trans. 1, 1997, 2831; Duan Х-G., Duan X.-L., Rees C. W., Yue T. -Y. ibid., 2597; Duan Х-G., Rees C. W. ibid., 2695.
109. Grundmann C., Kreutzberger A. J. Am. Chem. Soc., 77,44 (1955).
110. Adam W., van Barneveld C., Golsch D. Tetrahedron, 52,2377 (1996).
111. Counotte-Potman A., van derPlas H. C. J. Heterocycl. Chem., 18,123 (1981).
112. «Behaviour of monocyclic 1,2,4-triazines in reactions with C-, N-, O- and S-nucle-ophiles», Charushin V. N., Alexeev S. G., Chupahkin O. N., van der Plas H C. Adv. Heterocycl. Chem., 46, 76 (1989).
113. RykowskiA., Lipinska T. Synth. Commun., 26,4409 (1996); RykowskiA., Branowska D., Makosza M., van Ly P. J. Heterocycl. Chem., 33,1567 (1996).
114. Makosza M., GolinskiJ., RykowskiA. Tetrahedron Lett., 24, 3277 (1983); Paudler W. W., Chen T. -K. J. Heterocycl. Chem., 7, 767 (1970).
115. Sakya S. M., GroskopfK. K, Boger D. L., Tetrahedron Lett., 38,3805 (1997).
116. W/tes M. C. J. Heterocycl. Chem., 28,1163 (1991).
117. Konno S., Yokoyama M., Kaite A., Yamasuta L, Ogawa S., Mizugaki M., Yamanaka H. Chem. Pharm. Bull., 30,152 (1982).
118. «Synthesis with s-triazine», Grundmann C. Angew. Chem., Int. Ed. Engl., 2,309 (1963).
119. Pie N., TurckA., Queguiner G., GlassiB., Neunhoeffer H. Liebigs Ann. Chem., 1993,583.
120. Itoh T., Matsuya Y., Hasegawa H, Nagata K, Okada M., Ohsawa A. J. Chem. Soc., Perkin Trans. 1,1996,2511.
121. Nagata K., Itoh T., Okada M., Takahashi H, Ohsawa A. Heterocycles, 32, 855 (1991).
122. Chavez D. E., Hiskey M. A. J. Heterocycl. Chem. 35, 1329 (1998).
123. «Diels-Alder reactions of heterocyclic azadienes: scope and applications», Boger D. L. Chem. Rev., 86, 781 (1986); Boger D. L., Weinreb S. M.,Hetero Diels-Alder methodology in oiganic synthesis, Ch. 10, Academic Press, 1987.
124. MacorJ. E., Kuipers W., Lachicotte R. J. Chem. Commun., 1998, 983.
125. Ohsawa A., Aral H, Ohnishi H, Igeta H. J. Chem. Soc., Chem. Commun., 1981, 1174.
126. Paudler W. W., Barton J. M. J. Oig. Chem., 31,1720 (1966).
127. Schaefer F. W., Peters G. A. J. Org. Chem., 26,2778 (1961).
128. Schaefer F. W, Peters G. A. J. Org. Chem. 26,2784 (1961).
129. Chen C., Dagnino R., McCarthy J. R. J. Oig. Chem., 60, 8428 (199.*).
130. Geldard J. F, Lions F. J. Org. Chem., 30, 318 (1965).
131. «Heterocyclic synthesis with benzotriazole», KatritzkyA. R., Henderson S. A., YangB. J. Heterocycl. Chem., 35,1123 (1998).
132. «Properties and synthetic utility of N-substituted benzotriazoles», Katritzky A. R., LanX., Yang J. Z., Denisko О. V. Chem. Rev., 98,409 (1998).
133. KatritzkyA. R.,Zhang G., Jiang J. J. Org. Chem., 60, 7589 (1995).
134. KatritzkyA. R., Jiang J. J. Org. Chem., 60, 7597 (1995).
135. Katritzky A. R., Fall C. N., Li J. J. Oig. Chem., 62, 8205 (1997).
136. KatritzkyA. R., Xie L., Candy D. Synth. Commun., 25, 539 (1995).
137. KatritzkyA. R., Xie L. Tetrahedron Lett., 37, 347 (1996).
138. KatritzkyA. R., YangZ., Lam J. N. Synthesis, 1990, 666.
139. Knight D. W., Little P. B. Tetrahedron Lett., 39, 5105 (1998).
140. KatritzkyA. R., Zhang G., Jiang J., Steel P. J. J. Oig. Chem., 60, 7625 (1995).
141. Molina A., Vaquero J. J., Garcia-Navio J. L, Alvarez-Builla J., de Pascual-Teresa B., Gago F., Rodrigo M. M., Ballesteros M. J. Org. Chem., 61, 5587 (1996).
27
НАСЫЩЕННЫЕ И ЧАСТИЧНО
НЕНАСЫЩЕННЫЕ ГЕТЕРОЦИКЛИЧЕСКИЕ
СОЕДИНЕНИЯ: РЕАКЦИИ И
МЕТОДЫ СИНТЕЗА
В данной книге основное внимание уделено химии ароматических гетероциклов, однако следует упомянуть и большую группу других гетероциклов, в том числе с малыми циклами (3- и 4-членными) [1]. Насыщенные и частично ненасыщенные гетероциклические соединения в большинстве своем близки по химическим свойствам ациклическим или негетероциклическим аналогам, и поэтому нет необходимости подробно излагать здесь химию этих соединений. В этой главе мы обсуждаем в сжатой форме главным образом основные отличия этих систем — по-видимому, наиболее очевидное отличие от ароматических гетероциклов проявляется в стереохимии [2], поскольку в этих системах атомы л/Р-гибридизированы.
Насыщенные и частично ненасыщенные гетероциклы широко распространены в природе. Некоторые из них используют в качестве растворителей в химических реакциях, когда диэтиловый эфир не подходит, в основном, это тетрагидрофуран (THF) и диоксан. N-Метил пирролидон и сульфолан используют в качестве диполярных апротонных растворителей с характеристиками, подобными характеристикам диметилформамида (DMF) и диметил сульфо кси-да(ПМ8О).
4 3 диоксан |
тетрагидрофуран СУ [1,4-диоксан]1
/ \ сульфолан /
N-метилпирролидон 4 [тетрагидротиофен-4 [1-метилпирролидон]хмх ° 1,1-диоксид] ^s'
Четырехчленный 0-лактамный цикл — важный компонент пенициллиновых и цефалоспориновых антибиотиков
HO2C(H2N)CH(CH2)3CONH I1*1
цефалоспорин-G
СО2Н
СО2Н
“СН2ОАс
Эпоксиды (трехчленные насыщенные кислородсодержащие циклы) являются компонентами эпоксидных смол; кроме того, они встречаются в некоторых природных соединениях, таких, как алкалоид скопин. Эпоксиды, благодаря своей алкилирующей способности, могут быть канцерогенны (в качестве примера можно привести биологически активные метаболиты канцерогенных углеводородов), но несмотря на это они также входят в состав некоторых противоопухолевых препаратов.
Азиридины (трехчленные насыщенные азотсодержащие циклы) также являются компонентами противоопухолевых средств, таких, как митомицины. Тиираны встречаются в природе в качестве продуктов растительного происхождения, например тииран-2-карбоновая кислота, выделенная из аспарагуса.
27.1. ПЯТИ- И ШЕСТИЧЛЕННЫЕ ЦИКЛЫ
27.1.1. Пирролидины и пиперидины
пирролин пирролидин 1,2-дигидропиридин 1,4-дигидропиридин пиперидеин [2,3,4,5- пиперидин
[3,4-дигидро- тетрагидропиридин]
ан-пиррол]
Эти азотсодержащие пяти- и шестичленные системы отличаются от своих ациклических аналогов главным образом тем, что они легко дегидрируются в соответствующие гетероароматические системы. Вполне естественно, что способность ароматизоваться наиболее выражена для дигидроароматических систем; действительно, активность одного из важнейших восстановительных коферментов NADPH основана на такой тенденции, как показано ниже:
восстановленный субстрат
Дигидросоединения часто используются в качестве ценных синтетических интермедиатов; они обладают реакционной способностью, отличной от реакционной способности их гетероциклических аналогов. Например, индолины (2,3-дигидроиндолы) могут быть использованы для получения индолов [3], замещенных по бензольному кольцу, путем электрофильного замещения с последующей реароматизацией (разд. 17.16.1.8); аналогично электрофильное замещение в дигидропиридинах, невозможное для самих пиридинов, дает возможность при последующей реароматизации получать замещенные пиридины. Дегидрирование тетрагидро- и гексагидропроизводных требует гораздо более жестких условий.
Нд(ОАс)2 водн. АсОН, 150 у
78%
Вообще говоря, пиперидеины и пирролины существуют преимущественно в иминной форме, а не в таутомерной енаминной; N-алкилпроизводные не имеют альтернативы и существуют только в форме енаминов. Эти циклические имины устойчивы к гидролитическому расщеплению связи N=C в отличии от ациклических иминов, но тем не менее они легко вступают в реакции нуклеофильного присоединения По азометиновому атому углерода. Примером этому может служить тот факт, что и пиперидеин и пирролин существуют в виде тримеров, образующихся в результате нуклеофильного присоединения атома азота одной молекулы к азометиновому атому углерода другой молекулы, и т. д.
Присутствие в равновесии некоторого количества енамина проявляется при превращении пиперидеина в димер: действительно, способность этих двух систем выступать в роли как иминов, так и енаминов в конденсациях альдольного типа лежит в основе их участия в биосинтезе алкалоидов. Образующиеся в природе при окислительном дезаминировании и декарбоксилировании орнитина и лизина, они становятся фрагментами алкалоидных структур при конденсации с фрагментами других предшественников [4]. В качестве простого примера можно привести гигрин, в котором 1-пирролин в иминной форме конденсируется с ацетоацетатом или его эквивалентом.
орнитин
in vivo
Контролируемое окисление N-ацилпиперидинов и N-ацилпирролидинов может быть использовано для получения 2-алкоксипроизводных или эквивалентных им енамидов, которые представляют собой полезные синтетические интермедиаты [5]. Первые легко вступают в реакции нуклеофильного замещения в условиях катализа кислотами Льюиса, образуя интермедиаты типа Манниха, а вторые могут подвергаться электрофильному замещению по атому Ср) или присоединению по двойной связи.
Пирролидин и пиперидин — более активные нуклеофилы, чем диэтиламин, главным образом за счет того, что свободные пары электронов атома азота менее заслонены — в гетероциклах два «алкильных» заместителя при атоме азота, т. е. кольцевые атомы углерода, зафиксированы и в меньшей степени экранируют свободные электронные пары. Таким образом, приближающийся электрофил не встречает тех препятствий, которые возникают в диэтиламине из-за вращения вокруг связей С—N и С—С. Значения рЛа пирролидина (11,27) и пиперидина (11,29) характеризуют их как типичные аминные основания, и их основность немного превышает основность диэтиламина (10,98).
Пиперидины, подобно циклогексану, принимают конформацию кресла. Направление ориентации свободной пары и ориентации связанных с атомом азота заместителей (или атома водорода) в пиперидинах стало предметом многих дискуссий; некоторая путаница возникает при проведении реакций N-алки-лирования, образующиеся при этом соединения не всегда отражают заселенность основной конформации. И атом водорода, и алкильная группа при атоме азота принимают экваториальную ориентацию, хотя в последнем случае преобладание экваториального изомера незначительно [6].
Раньше строение природных соединений определяли методом их деградации. Многие алкалоиды содержат в своем составе насыщенные азотистые гетероцилы, поэтому метод деградации позволяет определить окружение атома азота, обладающего основными свойствами. В качестве классического использовался метод исчерпывающего алкилирования по Гофману. Этот метод приводит к расщеплению связей С—N гетероцикла и, в конечном итоге, к удалению атома азота; повторение процедуры требуется для удаления атома азота, первоначально входящего в цикл, а проведение третьего цикла превращений необходимо в том случае, когда два кольца содержат общий атом азота. На основании данных о строении безазо-тистых фрагментов устанавливают структуру исходного углеродного скелета.
Mel А92°
> или
КгСОз I НО’наанионо- сильное
<+ J обменной смоле Ч+> нагревание
N |~-----------► Ано------------ —
Mez Me Me Me Me Me + NMe3
27.1.2. Пираны и восстановленные фураны
2,3-дигидрофуран 2Н-пиран 4Н-пиран тетрагидропиран
3,4-Дигидро-2Н-пиран и 2,3-дигидрофуран ведут себя как эфиры енола. Первый из них широко используется для защиты спиртов [7], с которыми он быстро реагирует в условиях кислотного катализа с образованием ацеталей, устойчивых даже в сильноосновных условиях, но легко гидролизующихся до спиртов в мягких условиях в кислых растворах.
3,4-дигидро-2Н-пиран
ROH, Н*
4Н-Пиран, по-видимому, несколько менее устойчив, чем дигидропиран, но в реакции вступает подобным же образом: например, он литиируется по положению 2 и вступает в реакции Дильса—Альдера как эфир енола [8].
Гидроксилированные тетрагидрофураны и тетрагидропираны изучены достаточно подробно, так как подобные циклические системы встречаются в различных сахарах и соединениях, содержащих остатки сахаров; в качестве примеров [9] можно привести сахарозу и РНК (разд. 24.1).
Тетрагидропиран, так же как и пиперидин, принимает конформацию кресла. Один из интересных аспектов, возникающих при изучении алкоксизаме-щенных тетрагидропиранов, заключается в том, что 2-алкоксигруппа находится преимущественно в аксиальном положении (аномерный эффект [10]). Причина заключается в том, что с экваториальной ориентацией связаны невыгодные ди-поль-дипольные взаимодействия между свободными электронными парами двух атомов кислорода, и выигрыш энергии от аксиальной ориентации заместителя в положении 2 с избытком компенсирует возникающее при этом невыгодное 1,3-диаксиальное взаимодействие.
ОМе
ОМе
Глюкоза существует преимущественно в циклических полуацетальных формах, содержащих тетрагидропирановый цикл, хотя во многих химических реакциях она участвует в виде находящейся в малых концентрациях ациклической полигидроксиальдегидной формы. Преобладание циклической формы свидетельствует о стабильности, присущей насыщенным шестичленным циклам, находящимся в конформации кресла. Склонность к циклизации — общее свойство 5-гидроксиальдегидов, 5-гидроксикетонов и 5-гидроксикислот, поскольку все они легко образуют шестичленные кислородсодержащие циклы — лактолы и лактоны соответственно.
в водном растворе а:₽= 37:63
ОН а-(О)-глюкопираноза
Р-(0)-глкжопираноза
Сравнительно легко образуются и пятичленные циклы: в зависимости от условий производные глюкозы MOiyr легко образовывать формы фураноз, т. е. производные тетрагидрофурана
Ме2СО, HCI глюкоза------------:
Ме
Циклические насыщенные эфиры инертны подобно ациклическим эфирам и для разрыва связи С—О необходимы жесткие условия [И]. Эти их свойства противоположны свойствам гетероциклических систем с малыми циклами.
OAcgO, MyBf2
MeCN, 20 *С RfZ\^/OAc w 97%
27.2. ТРЕХЧЛЕННЫЕ ЦИКЛЫ
27.2.1. Трехчленные циклы с одним гетероатомом
Среди Д2-ненасыщенных трехчленных систем не известно устойчивых молекул, поскольку они обладают 4-электронной л-системой и вследствие этого антиаро-матичны [12]. 1Н-Азирины встречаются в качестве реакционноспособных интермедиатов, и имеются доказательства существования 2-тиирена в низкотемпературных матрицах [13]. Наоборот, азирины [14] — хорошо известные устойчивые соединения. S,S-Диоксиды тиирена — также устойчивые молекулы, вероятно, наиболее близкие по свойствам циклопропенонам [15]. Тем не менее химия насыщенных трехчленных гетероциклов достаточно обширна; в особенности это касается эпоксидов (оксиранов), которые представляют собой интермедиаты в основных синтезах.
.. не известен эпоксид, н эписульфид,
Z (должен быть N азирин О этиленоксид N (этиленимин) S этиленсульфид ддаромати- [2Н-азирин] [оксиран] ДА [азиридин] / \ [тииран]
чсэским >
Основное внимание уделяется развитию методов синтеза эпоксидов с высокой степенью оптической чистоты из аллильных спиртов или родственных систем (мягкое эпоксидирование по Шарплессу) (показано ниже); такие эпоксиды широко используют для синтеза сложных природных соединений в гомохираль-ной форме.
Величина p/fa азиридина (7,98) свидетельствует о том, что это более слабое основание, чем его четырехчленный аналог — азетидин (11,29), для которого эта величина представляет собой «нормальную» величину для ациклических аминов. Низкая основность наблюдается и в ряду кислородсодержащих гетероциклов, что было показано измерением их способности к образованию водородных связей. Вероятно, это объясняется напряжением, возникающим в трехчленных циклах, главным образом благодаря тому, что орбиталь их свободных пар носит в меньшей степени р-характер, чем «нормальная» 5/Р-орбиталь атомов азота или кислорода и, следовательно, удерживается более прочно. Скорость пирамидальной инверсии для «насыщенного» атома азота в азиридинах гораздо меньше, чем для простейших аминов. Это обусловлено тем, что происходит дальнейшее повышение углового напряжения при регибридизации (-> sp1) атома азота в переходном состоянии при инверсии.
Химические свойства трехчленных гетероциклов напрямую связаны с напряжением, присущим таким малым циклам. Учитывая способность гетероатома выступать в качестве уходящей группы, можно сказать, что в большинстве своем реакции идут с раскрытием цикла. Наиболее часто раскрытие эпоксидно-
го цикла наблюдается при З^-замещснии по атому углерода с участием широкого круга карбанионов и гетероатомных нуклеофилов, включающих амины [16], спирты, тионы, гидриды (LiAlH4), малонат-анион [17] и т. д. Использование протонных растворителей или О-координирующихся катионов металлов (кислот Льюиса), которые вызывают дальнейшее ослабление связи С—О, может значительно увеличивать скорость реакции. Также полезно использование катализаторов на основе оксида алюминия [18], алкоксидов титана [19] и перхлората лития [20] в сочетании с таким реагентом, как азид трибутил олова [21], который сочетает в себе свойства кислоты Льюиса (координация с BibSn) и нуклеофильную функцию (Nj-). г
'''NHBn
ОН Me2NH ^МеОН, 170~С
80%
NMe2
LiCH2CN
THF, 0 ’С
78%
CH2CN
89%^->
водн. КОН затем H2SO4 нагревание
CH2(CO2Et)2
NaOEt, EtOH
он
он
N3
При использовании более «жестких» металлоорганических нуклеофилов, таких, как алкиллитиевые производные, часто наблюдаются побочные реакции, но при их комбинации с трифторидом бора (—78 °C) реакции идут очень чисто и эффективно [22].
л-Рг о PhCO2H,Ti(Oi-Pr)4
\/U\ СН2С12,20*С
74%
PhCO2 СНгОН
О РШ
/и\ BF3.Et2O,-78’С^
84%
Региохимия раскрытия цикла определяется главным образом стерическими и в меньшей степени индуктивными и электронными эффектами. При использовании сильных кислот Льюиса или в том случае, когда образуется вы-сокостабилизированный (на начальной стадии) карбониевый ион, например, при наличии а-арильного заместителя, реакция может идти преимущественно по наиболее замещенному положению (предельный случай — сольволиз 2-фурилоксирана в нейтральном метаноле) [23]. Селективное замещение по наиболее замещенному положению даже в простых алкилэпоксидах происходит при участии аллилтиановых реагентов [24].
// \\ МеОН, 2О’С // \\ \
1оо%
МеО
,Ме THF
+ <ss>4w/Ti(0Ph)3 -78 *С->20Х
’ОН 10:1
СН2СН=СН2 1-Ме
Перегруппировка Пейна, характерная для эпоксиспиртов, представляет собой особый случай внутримолекулярного нуклеофильного раскрытия эпоксид-
с
ных циклов и имеет существенное синтетическое значение применительно к эпоксидам Шарплесса [25].
н • LiCI (кат-} A
Г—X OLl — н”7---
PhCH2OCH2 PhCH2OCH2 H
PhCu.Me2S I /^Ph
90% M 1 V'OH
PhCH2OCH2 H
Раскрытие эпоксидного цикла в результате 0-элиминирования при взаимодействии с сильными основаниями, такими, как амиды лития, или при использовании смеси триметилсилилтрифлата с диазабициклоундеканом [26] — полезный синтетический метод для получения аллильных спиртов, особенно в тех случаях, когда реакция должна быть проведена энантиоселективно [27].
(92% ее)
Относительная конфигурация эпоксидов может быть обращена при использовании цианат-анионов, возникающее при этом равновесие показано на приведенной ниже схеме [28]:
Кислотно-катализируемое раскрытие азиридиновых циклов происходит обычно довольно быстро, но простые нуклеофильные реакции в отсутствие кислотного катализа идут очень медленно, что обусловлено значительно более слабой уходящей способностью отрицательно заряженного азота, однако N-ацил- или N-фенилсульфонилазиридины обладают такой же реакционной способностью, как и эпоксиды [29]. При нуклеофильном раскрытии цикла М-нозил-(4-нитрофе-нилсульфонил)азиридинов азот со своим заместителем служит прекрасной уходящей группой, но при этом может наблюдаться потеря региоселективности [30].
Ph
£°2EtMe2CuLi ..
Е12о, о ;сМех__
98% р/ NHCO2Et
NS CH2(CN)CO2Me
/\ NaOMe, МеОН, 20'С
42%
Тиираны также могут подвергаться реакциям с раскрытием цикла при взаимодействии с нуклеофилами, такими, как амины [31], однако при использовании литиевых реагентов может наблюдаться атака и по атому серы [32]
61%
пиперидин
1.Q.Q 'С-».
78%
S n-BuLi THF, -78 *С,
Гетероатом в трехчленных гетероциклах может быть элиминирован в результате разнообразных реакций циклореверсии, например, при нитрозировании азиридинов [33] или при взаимодействии тииранов с соединениями трехвалентного фосфора
NOCI, СС14
О ‘С -> 20;С
53%
/= + N20
S
(EtO)3P
Me 155 ‘Сг
90%
Me
Ph3P=S
Аналогичное элиминирование диоксида серы наблюдается при получении алкенов по реакции Рамберга—Баклунда [34], в ходе которой в качестве переходного интермедиата генерируется эписульфон, хотя в контролируемых условиях выделение эписульфонов возможно [35].
Замещенные производные всех трех систем способны подвергаться высокостереоспецифичному согласованному термическому раскрытию цикла, при этом образуются ил иды, которые могут быть использованы (в момент образования) в реакциях [3 + 2]-циклоприсоединения, позволяющих получать пирролидины [36].
ОМе
N .. 165 АС,
/ уСОгМе ------
СО2Ме
О
Азирины с эфирной группой при иминном атоме углерода могут принимать участие в реакциях циклоприсоединения, причем иминный фрагмент выступает в роли диенофила, как показано ниже [37]:
27.2.2. Трехчленные гетероциклы с двумя гетероатомами
Диазиридины, диазирины и диоксираны представляют собой относительно устойчивые выделяемые соединения, хотя некоторые диоксираны взрывоопасны. |_|
N диазирин N О О
/—N [ЗН-диазирин] NH диазиридин NH оксазиридин Z__g диоксиран
Трехчленные гетероциклы с двумя гетероатомами обычно используются в качестве реагентов. Диазирины обычно служат источником карбена [38] — в основном они более устойчивы, чем эквивалентные изомерные диазосоединения, хотя иногда взрываются в чистом виде. Они могут быть получены окислением диазиридинов, которые в свою очередь образуются при конденсации кетонов или альдегидов с аммиаком и хлорамином [39]. Хлордиазирины, образующиеся при взаимодействии амидинов с гипохлоритом, могут вступать в реакции Sn2- или 8к2'-замещения [40].
п-Рг л-Рг ‘
NH3, NH2CI А — А к п-Рг п-Рг
n-p.cfro,-BuOH’.-30'c"2°S /N-N\ HN-NH А адгоТ А
80% п-Рг"\ /"п-Рг 51 % N—N *“HN—Nc-C6Hn
*- Н
Диметилдиоксиран представляет собой относительно сильный окислитель, но может действовать с хорошей селективностью: по реакционной способности он подобен надкислоте, но преимущество его заключается в том, что он образует нейтральный побочный продукт (ацетон). Метил(трифторметил)диоксиран — более сильный окислитель, с помощью которого может происходить внедрение кислорода по связи С—Н с сохранением конфигурации, как показано ниже [41]. Диоксираны получают при взаимодействии кетонов с реагентом OXONE® [42].
ПРИМЕЧАНИЕ, Диоксираны взрывоопасны, и их используют обычно в разбавленных растворах.
Ме ОХО/VE®, NaHCO3 водн. Ме2СО
Me .CF3
у ОХО/VE®, СН2С12
О
Оксазиридины служат реагентами для селективного переноса кислорода [43]. Реагент на основе камфоры широко используется для энантиоселективно-
го окисления енолятов [44] и других нуклеофилов. Оксазиридины получают
окислением иминов [45].
ОХОЛ/Е®
водн. К2СОЭ, 20 'С
84% **
О
JI ^Ph
Р!т
NaHMDS THF. -78’С
78% (95.4% ее)
27.3. ЧЕТЫРЕХЧЛЕННЫЕ ЦИКЛЫ
азет 3,4-дигидроазет азетидин
2Н-оксет
2Н-тиет
Производные азета известны только как неустойчивые интермедиаты реакций. Оксетан и азетидин обладают значительно меньшей реакционной способностью, чем их трехчленные аналоги (оксетан реагирует с гидрокси-анионом в 103 раз медленнее, чем оксиран), но, тем не менее, они подвергаются подобным реакциям с раскрытием цикла: например, оксетан реагирует с литийорганиче-скими реагентами [22] в присутствии трифторида бора или с купратами [46], а раскрытие азетидинового цикла происходит при нагревании с концентрированной соляной кислотой.
□о
n-Buli, BF3.Et2O
-78 'С_______
85%
л-Ви
конц. HCI
с1х^Х\х^Нз сГ
Среди четырехчленных систем наибольшее значение имеет р-лактамный цикл [47], который присутствует в пенициллиновых и цефалоспориновых антибиотиках и обусловливает их биологическую активность. р-Лактамный цикл очень легко расщепляется при атаке по карбонильному атому углерода, что представляет полную противоположность пятичленным аналогам (пирролидонам) или ациклическим амидам, которые относительно устойчивы к нуклеофильной атаке по карбонильному атому углерода. Кроме того, р-лактамы гидролизуются под действием специфического фермента р-лактамазы, в результате образования которой бактерии приобретают резистентность к подобным антибиотикам. Несмотря на то, что р-лактамный цикл легко раскрывается под действием нуклеофилов, как N-, так и С-алкилирование (по a-положению к карбонильной группе) может быть осуществлено при использовании оснований для депротонирования, возможно даже проведение реакции Виттига по «амидной» карбонильной группе без раскрытия цикла [48]. Замещение ацетоксигруппы в 4-ацетоксиазетидиноне под действием нуклеофилов представляет собой важный синтетический метод, в ходе реакции имин или иминиевый интермедиат образуется прежде, чем происходит прямое замещение [49].
EtO2C-
CO2Bn Ph PsCHCO2Et
I PhMe, нагревание
NBoc 80%
О HNBoc
co2Bn
ПОАс водн. Nar^j 20X_^ 1 87%
NBoc
,CO2Bn n-Bi^CuU
THF,-50 "C n-Bu 37% *
р-Лактоны (пропиолактоны) [50] также легко подвергаются атаке по карбонильному атому углерода; например, они особенно легко гидролизуются, кроме того, второй тип нуклеофильной атаки — З^-замещсние карбоксилата в результате атаки по положению С<4) — наблюдается под действием многих нуклеофилов [51]. Приведенный ниже пример показывает использование гомохирально-го лактона, полученного из серина:
CbzHN
27.4. МЕТАЛЛИРОВАНИЕ
Насыщенные и мононенасыщенные пяти- [52] и шестичленные циклы можно металлировать так же, как их ациклические аналоги. Однако в случае тетрагидрофурана при нагревании с н-бутиллитием образуется литиевое производное, которое подвергается циклореверсии, в результате которой генерируется этилен и литиевый енолят этаналя [53]. Этот процесс представляется наиболее удобным методом получения такого енолята, однако необходимо учитывать возможность протекания такого нежелательного побочного процесса при проведении реакций металлирования с использованием тетрагидрофурана в качестве растворителя.
Трехчленные циклы не металлируются напрямую в отсутствие анион-стаби-лизирующих заместителей, но простые литиевые производные могут быть получены реакцией обмена из соответствующих станнанов [54].
МеОСН2
CPh3 N
kSn-n-Bu3
n-BuLi
THF, -78 ‘С
PhCH=O 81%
CPh3
MeOCH2 CH(OH)Ph
Конформационно ограниченная циклическая природа дигидрофурана (и дигидропирана) приводит к аномальному течению реакции Хека. Присоединение галогенида арилпалладия происходит обычным образом, но за счет невозможности вращения вместо сын-элиминирования 0-гидрида (по отношению к арильному заместителю) идет элиминирование от атома С(4) [55]. В некоторых случаях происходит дальнейшая миграция двойной связи.
АсОНд
/ Pd(OAc)2
X) MeCN, 2043 86%
27.5. СИНТЕЗЫ КОЛЬЦА
Пяти- и шестичленные насыщенные циклы могут быть получены восстановлением соответствующих ароматических соединений, но наиболее общий метод синтеза этих систем заключается в циклизации со-замещенных аминов, спиртов или тиолов путем внутримолекулярного нуклеофильного замещения. В качестве иллюстрации можно привести скорости циклизации со-галогенами-нов, причем минимальная скорость наблюдается при образовании четырехчленных циклов, а пяти- и шестичленные циклы образуются гораздо легче [относительные скорости: 72 (3-членный цикл): 1 (4): 6000 (5): 1000 (6)] [56]. Скорость 3-экзо-тет-циклизации зависит от степени замещения атома углерода при гетероатоме: увеличение числа заместителей повышает скорость циклизации, поскольку при образовании малых циклов наблюдается уменьшение стерических затруднений по сравнению с ациклическими исходными соединениями [57].
Родственные циклизациии, в которых гетероатом присоединяется к алкену, идут через образование л-комплексов с катионами, такими, как Br+, I+, Hg+ и Pd+, и представляют собой удобные методы синтеза, поскольку они позволяют получать функционализированные по боковой цепи производные, способные к дальнейшим превращениям.
27.5.1. Насыщенные азотсодержащие гетероциклы
Существует три основных метода получения азиридинов: (1) катализируемая щелочами циклизация 2-галогенаминов или эфиров 2-гидроксиламиносульфокислоты (как показано на приведенной ниже схеме) [58], (2) присоединение к алкенам и (3) присоединение к иминам.
конц. H2SO4 40%-ный водн. NaOH Н
«с нагревание N
H2NCH2CH2OH H2NCH2CH2OSO3H-----------------
36%
Разнообразные гомохиральные азиридины легко получаются из серина [59], такие соединения можно превратить в целый ряд полифункциональных гомохи-ральных интермедиатов и производных.
Ю-уСОаВп nh2
TrCI, Et3N TsCI, пиридин CHCI3,0 *С -10 'С -> О ‘С 100% * 58%
n-PrNH2
CH2CI2, 20 *С
95%
,СО2Вп
NHTr
Азиридины можно получать из алкенов с использованием иодизоцианата [60] или азида иода [61]. Полученное в последней реакции соединение можно превратить в азиридин восстановлением или в азирин в результате элиминирования иодоводорода и пиролиза [62].
AgNCO, 12
Et20i [iNCO]
NCO
МеОН^ 72% *
^НС°2МеКОН
। МеОН
84%
N-Толилазиридины можно синтезировать напрямую из алкенов и хлорамина Т, как показано ниже [63]:
3,3TsN(CI)Na, 0,3Ph3NMeBr3
MeCN, 20 *С____________
89%
Присоединение к иминам — третий возможный метод получения азиридинов, как показано ниже [64]:
p-Tol
/=NTs +
К0Н и Л 11 + М Л м
У\ЛММе2 ЗИ NMe2
91% p-Tol Н p-Tol Y
Азирины могут быть синтезированы энантиоселективно, если они необходимы для получения природных алкалоидов, из О-тозилпроизводных оксимов 1,3-кетоэфиров; в этой реакции атом углерода выступает в качестве нуклеофильного центра и атакует атом азота с удалением тозилата [65].
О NH2OH.HCI TsCI, пиридин NOTs хинидин N
J CQzMo Na0H’ водн‘ 20 Jl^CO2Me CH2C|2« 20>c
(81% ее)
Азетидины можно получать циклизацией 3-галогенаминов, но выходы зачастую не так хороши, как при образовании азиридинов. Генерирование бифункциональных предшественников, циклизующихся затем в азетидины, возможно разными способами [66].
f-BuNH(CH2)2CH(Me)OH
Br2, Ph3P, Et3N
MeCN, 0'С-» 20‘С
80%
___-Me
I—Nt-Bu
Синтез 1-азабицикло[1.1.0]бутана, в котором атом азота входит одновременно в четырехчленный цикл и два трехчленных цикла (!), проводят по общей методике, описанной выше [67]. Реакции раскрытия цикла, одна из которых приведена ниже на схеме, приводят к образованию соединений, содержащих азетидиновый, а не азиридиновый фрагмент
Т Зп-BuLi 50%-ный водн. КОН Л С1Х________________
Вгг»ЕЮН Rr THF’ ~78 перегонка Г\~| TsCI, 20 *С 1 |
2 95% К L 3 82% ‘•—NTs
Азиридины также можно получать присоединением нитренов к алкенам [68] или с использованием агентов — «поставщиков» атома азота, аналогичных эпоксидирующим агентам [69].
РЬ(ОАс)4 СН2С12/-20оС
CF3
Для получения р-лактамов разработано много методов [47,70], включающих циклизацию соответствующих аминокислот. Наиболее широко используемые методы заключаются в сочетании двух компонентов [38, 71], которое происходит путем согласованного циклоприсоединения или по двухстадийному механизму.
z'PrX LDA PhCH=NCeH4-4-OMe /'PrS-^-ZPh
I THF, THF,20‘С_________I I
О OEt 83% О N'CsH4-4-OMe
PAc -60’C—>20 *C
O=C=N—SO2CI
o4—NSO2CI
,OAc 1 водн. NaHCO3
Na2SO3
43%
Очень близкий метод синтеза пирролидинов не требует использования бифункционализированных исходных соединений, а вторую функциональную группу вводят по реакции Гофмана-Лёффлера-Фрейтага [72], которая представляет собой радикальный процесс. Шестичленное циклическое переходное состояние приводит к образованию 1,4-галогенамина и, следовательно, пирро-
лидинов.
CI MeN(CH2)4Me
С12, водн. NaOH
MeNHlCH^e
Циклоприсоединение азометиновых илидов к алкенам — другой изящный метод синтеза пирролидинов. Необходимые 1,3-Диполи можно получить различными способами: на примере, приведенном ниже, показан один из наиболее простых методов, в котором триметилсилилметиламин, альдегид и алкен просто нагревают в тетрагидрофуране [73]:
МеО2С СО2Ме PhCH=O, BnNHCH2SIMe3 THF, кипячение___________________
81%
Особенно полезный общий метод синтеза 5-, 6- и 7-членных частично ненасыщенных гетероциклов основан на олефиновом метатезисе Граббса, применяемом для ациклических диалкениламинов; в качестве примера можно привести синтез тетрагидропиридина, как показано ниже [74]:
п РСуз
Cl* PCy3Pfl(Kab)CH2Cl2, кипячение
93%
Вос
СО2Ме
27.5.2. Насыщенные кислородсодержащие гетероциклы
Наиболее широко используемый метод синтеза эпоксидов основан на окислении алкена надкислотой [75] путем прямого одностадийного переноса атома кислорода. Алкены, содержащие большее число заместителей (алкильных), реагируют быстрее, что свидетельствует о преобладании в этих реакциях электронных, а не стерических факторов. Тем не менее, стерические факторы обеспечивают стереохимический контроль реакции эпоксидирования, а наличие групп, способных к образованию водородных связей, таких, как ОН и NH, приводит к смн-присоединению к двойной связи.
PhCO3H
Рьсн.снг
Среди других реагентов, служащих для переноса атома кислорода, наиболее важен реагент Шарплесса, который Представляет собой смесь пероксида водорода с изопропоксидом титана и алкилтартратом [76]. Этот реагент имеет сложное строение, но он быстро реагирует с алкенами, содержащими полярные группы; в качестве примера можно привести аллильные спирты, которые могут координировать атом металла. Наибольшую важность этот процесс имеет в случае использования гомохиральных эфиров винной кислоты. При этом образуется высокоупорядоченный асимметрический Центр, что в свою очередь приводит к высокой оптической индукции при образовании продукта реакции.
f-BuQjH, ТЦОЬРг^ D-диэтилтартрат
> 95% ее
Эпоксиды и оксетаны можно также получить циклизацией 1,2-(галогеногид-ринов) и 1,3-галогенос пиртов [77].
Оксетаны часто получают по реакции Патерно—Бюхи [78], в которой соединение, содержащее двойную связь углерод—углерод, циклоприсоединяется к альдегиду или кетону под действием света [79].
27.5.3* Насыщенные серосодержащие гетероциклы
Тиираны можно получать циклизацией 2-галогенотиолов, но наиболее часто используют реакцию эпоксида с тиоцианатом [80] (для сравнения см. разд. 27.2.), тиомочевиной [81], фосфинсульфидом или диметилтиоформамидом [82].
Ph3P=O
Тиетаны, тетрагидротиофены и тетрагидротиапираны можно синтезировать при взаимодействии подходящих о-дигалогенидов с сульфид-анионом
Na2S
Вг(СН2)эВг
Литература
1. Demer О. С,, Ham G. Е. Ethylenimine and other aziridines, Academic Press, 1969; «Thiiranes», Sander M. Chem. Rev,, 66,297 (1966).
2. Armarego Ж L. F. Stereochemistry of heterocyclic compounds, Parts 1 and 2, Wilcy-Interscience, New York, 1977; Riddell F. G, The conformational analysis of heterocyclic Compounds, Academic Press, 1980.
3. Inada A., Nakamaura Y., Morita Y. Chem. Lett., 1980,1287.
4. Cordell G. A, Introduction to the alkaloids. A. Biogenetic approach, Wiley-Interscience, 1981.
5. Matsumura Y, Terauchi Y., Yamamoto T., Konno T., Shono Г. Tetrahedron, 49, 8503 (1993).
6. «Conformation of piperidine and of derivatives with additional ring hetero atoms», Blackbume L D., KatrizkyA. R., Takeuchi К Acc. Chem. Res., 8,300 (1975); «N-Methyl inversion barriers in sixmembered rings», Katritzky A. R., Patel R. C., RiddellF. G. Angew. Chem., Int. Ed. Engl., 20,521 (1981).
7. Greene T W., Wuts P. G. M. Protective groups in organic synthesis, John Wiley, 1999.
8. Schlosser M., Schneider P. Angew. Chem., Int. Ed. Engl., 18,489 (1979).
9. StoddartJ. E Stereochemistry of carbohydrates, Wiley-Interscience, 1971.
10. Deslongchamps P. Stereoelectronic effects in organic chemistry, Pergamon Press, 1983.
11. Goldsmith D. J., Kennedy E., Campbell R. G. J. Org. Chem. 40, 3571 (1975).
12. Dewar M. J. S, Ramsden C. A, J. Chem. Soc., Chem,. Commun., 1973,688.
13. Torres M., Clement A., Bertie J. E, GunnigH. E., Strausz О. P. J. Org. Chem., 43, 2490 (1978).
14. «Synthesis of heterocycles via cycloadditions to 1-azirines», Anderson D. J., Hassner A. Synthesis, 1975,483; «1-Azirine ring chemistry», Nair V,, Hyup Kim K. Heterocycles, 7, 353 (1977).
15. Carpino L.f McAdams L. V, Rynbrandt R. IL, Spiewak J. W. J. Am. Chem. Soc., 93,476 (1971).
16. Taguchi T. J. Pharm. Soc. Jpn., 72,921 (1952).
17. Newman M. S., Vander WerfC A. J. Am. Chem. Soc., 67,233 (1945).
18. Posner G. IL, Rogers D. Z. J. Am. Chem. Soc., 99,8208,8214 (1977).
19. Chong J, M., Sharpless К. B, J. Org. Chem., 50, 1557 (1985).
20. Chini M., Crotti P., Macchia F. Tetrahedron Lett., 31,4661 (1990).
21. Saito S., Yamashita S., Nishikawa T., Yokoyama Y, Inaba M, Moriwake T Tetrahedron Lett., 30,4153 (1989).
22. EisM. J., Wrobel J. E, Ganem B. J. Am. Chem. Soc., 106,3693 (1984).
23. Alcaide B,, Biurran C., PlumetJ. Tetrahedron, 48,9719 (1992).
24. Tanaka T.t Inoue T., Kamei K, Murakami K, Iwata C, J. Chem. Soc., Chem. Commun., 1990,906.
25. Behrens С H., Ko S. Y, Sharpless К. В., Walker E J. J. Org. Chem., 50, 5687 (1985); Bulman Page P. C., Rayner С. M., Sutherland I. O. J. Chem. Soc., Chem. Commun., 1988,356.
26. Murata S, SuzukiM., NoyoriR. J. Am. Chem. Soc., 101,2738 (1979).
27. Asami M. Chem. Lett. 1984,829.
28. Jankowski K, Daigle J.-Y. Can. J. Chem., 49,2594 (1971).
29. Kozikowski A. P,t Ishida H., Isobe K. J. Org. Chem., 44,2788 (1979); Stamm H., Weiss R. Synthesis, 1986, 392, 395; Lehmann J., WamhoffH, Synthesis, 1973,546.
30. MalignesP. E., See M. M., Askin D., ReiderP. J, Tetrahedron Lett., 38, 5253 (1997).
31. Snyder H. R., Stewart J. M.t Ziegler J. B. J. Am. Chem. Soc., 69, 2672 (1947).
32. Trost В. M., Ziman S. D. J. Org. Chem., 38, 932 (1973).
33. Clark R. D,, Helmkamp G. K. J. Org. Chem., 29, 1316 (1964); Lee K, Kim Y. IL Synth. Commun., 29,1241 (1999).
34. «Recent developments in Ramberg-Backlund and episulfone chemistry», Taylor R. J, K, Chem. Commun., 1999,217.
35. Ewin R. A., Loughlin W. A., Pyke S, M.t Morales J. C, Taylor R. J. К Synlett, 1993,660.
36. De Shong P., Kell D. A., Sidler D. R. J. Org. Chem., 50, 2309 (1985); De Shong R, SidlerD. R.t Kell D. A., Aronson N. N. Tetrahedron Lett., 26, 3747 (1985).
37. BhullerP,, Gilchrist T. L., MaddocksP. Synthesis, 1997, 271.
38. Bonneau R., Liu M. T. H., Lapouyade R. J. Chem. Soc., Perkin Trans. 1,1989, 1547.
39. Schmitz E, Ohrne R, Chem. Ber., 95,795 (1962).
40. PadwaA., Fastman D. J. Org. Chem., 34, 2728 (1969).
41. Adam W., Asensio G., Caret R., Gonzalez-Nunez M. E., Mello R. J. Org. Chem., 57, 953 (1992).
42. Murray R. W., Jeyaraman R. J. Org. Chem., 50,2847 (1985).
43. «Applications of oxaziridines in organic sytnhesis», Davis F. A., Sheppard A. C., Tetrahedron, 45, 5703 (1989); «Asymmetric hydrozylation of enolates with N-sulfony-loxaziridines», Davis F. A., Chen. B.-C. Chem. Rev., 9,919 (1992).
44. Davis E A., Sheppard A. C., Chen В.-C., Haque M. S. J. Am. Chem. Soc., 112, 6679 (1990).
45. Towson J. C., WeismillerM. C., Lal G. S., Sheppard A. C., Davis F. A. Org. Synth., 69,158 (1990).
46. Huynh C., Derguini-Boumechal E, Linstrumelle G. Tetrahedron Lett., 20,1503 (1979).
47. The organic chemistry of p-lactams, Georg G. I. (Ed.), VCH, New York, 1993.
48. Baldwin J. E., Edwards A. J., Farthing C. N., Russell A. T. Synlett, 1993,49; Baldwin J. E, Adington R. M., Godfrey C. R. A., GollinsD. W., Smith M. L., Russel A. T. ibid., 51.
49. Clauss K, Grimm D., Prossel G. Justus Liebigs Ann. Chem., 1974,539.
50. «Recent advances in p-lactone chemistry», PommurA., PonsJ.-M. Synthesis, 1993,441.
51. Arnold L. D., Kalantar Т.Н, VederasJ. C. J. Am. Chem., Soc., 107,7105 (1985).
52. Boeckman R. K., Bruza K. J. Tetrahedron Lett., 28,4187 (1977).
53. Jung M. E, Blum R. B. Tetrahedron Lett., 28,3791 (1977).
54. Vedejs E, Moss W. O. J. Am. Chem. Soc., 115,1607 (1993).
55. Lee T. D., Daves G. D. J. Org. Chem., 48,399 (1983).
56. Galli C., Illuminati G., Mandolini L., Tamborra P. J. Am. Chem. Soc., 99,2591 (1977).
57. «Effective molarities for intramolecular reactions», Kirby A. J. Adv. Phys. Org. Chem., 17, 183 (1980).
58. Alien C. F. H, Spangler F. W., WtbsterE. R. Org. Synth., Coll. Vol. IV, 1963,433.
59. «Serine derivatives in organic synthesis», Kulkami Y. S. Aldrichimica Acta, 32,18 (1999).
60. HassnerA., LorberM. E., Heathcock C. J. Org. Chem., 32, 540 (1967).
61. Fowler F. W., HassnerA., Levy L. A. J. Am. Chem. Soc., 89, 2077 (1967); HassnerA., Fowler E И< J. Oig. Chem., 33,2686 (1968).
62. Smolinsky G. J. Org. Chem., 27, 3557 (1962).
63. Jeong J. U., Tao B., Sagasser L, Henninges H, Sharpless К. B. J. Am. Chem. Soc., 120, 6844 (1998).
64. Li A.-H, Dai L.-X., Hou X.-L. J. Chem. Soc., Perkin Trans. 1, 1996, 2725; Zhou Y.-C., LIA.-H, Hou X.-L., DaiL.-X. Tetrahedron Lett., 38,7225 (1997).
65. Verstappen M. M. H, Ariaans G. J. A., Zwannenburg B. J. Am. Chem. Soc., 118, 8491 (1996).
66. Wadsworth D. H. Org. Synth., Coll. Vol. VI, 1988, 75; Freeman J. P., Mondron P. J. Synthesis, 1974, 894; Szmuszkovicz J, Kane M. P., Laurian L. G., Chidester C. G., Scahill T. A. J. Oig. Chem., 46,3562 (1981).
67. Dave P. R. J. Org. Chem., 61, 5453 (1996); Hayashi K, Sato C., Kumagai T., Tamai S., Abe T., Nagao Y. Tetrahedron Lett., 40, 3761 (1999).
68. Nitrenes, Lwowski W. (ed.), Interscience, 1970.
69. Atkinson R. S., Coogan M. P., Cornell C. L. J. Chem. Soc., Chem. Commun., 1993,1215.
70. «Synthesis of р-lactams», MukerjeeA. K, SrivastavaR. C. Synthesis, 1973, 327.
71. Gluchowski C., Cooper L., Bergbreiter D. E., Newcomb M. J. Oig. Chem., 45,3413 (1980).
72. «Cyclisation of N-halogenated amines (The Hofmann-Loffler reaction)», Wolfi M. E. Chem. Rev., 63,55 (1963).
73. Toni S., OkumotoH., Genba A. Chem. Lett., 1996,747.
74. Rutjes E P. J. T., Schoemaker H E. Tetrahedron Lett., 38, 677 (1997).
75. СвернД., «Получение а-окисей и а-гликолей из соединений с этиленовыми свя
зями при помощи органических надкислот», в сб. Органические реакции, т. 7, с. 476, ИЛ, М., 1956; RebekJ., MarshallL., McManisJ., WolakR.]. Org. Chem., 51,1649 (1986).
76. Katsuki T, Sharpless К B. J. Am. Chem. Soc., 102, 5974 (1980); «Asymmetric epoxidation of allylic alcohols: the Sharpless reaction», Prenninger A. Synthesis, 1986, 89; «Mechanism of asymmetric epoxidation; 1. Kinetics», Woodward S. S, Finn M. G., Sharpless К. B. J. Am. Chem. Soc., 113, 106 (1991); «2. Catalyst structure», Finn M. G., Sharpless К B., ibid., 113.
77. Searles S., Gortatowski M. J. J. Am. Chem. Soc., 75, 3030 (1953).
78. Patemo E, Chieffi G. Gazz. Chim. Ital., 39, 341 (1909); Buchi G., Inman C, G., Lipinski E. S. J. Am. Chem. Soc., 76,4327 (1954).
79. Dalton J. C., Tremont S. J. Tetrahedron Lett., 1973,4025.
80. Bouda H., Borredon M. E., Delmas M., Gaset A. Synth. Commun., 17, 943 (1987); IranpoorN., Kazemi Synthesis, 1996, 821.
81. Bouda H., Borredon M. E., Delmas M., Gaset A. Synth. Commun., 19,491 (1989).
82. EttlingerM. G., J. Am. Chem. Soc., 72,4792 (1950); Chan T H., Finkenbine J. К J. Am. Chem. Soc., 94,2880 (1972); Takido T., Kobayashi K, ItabashiK Synthesis, 1986,779.
28
ГЕТЕРОЦИКЛЫ В ДЕЙСТВИИ
Гетероциклические соединения широко распространены в природе, а использование природных и синтетических гетероциклических соединений во многих коммерчески важных сферах огромно (книга «Гетероцикл в жизни и обществе» [1] охватывает лишь часть наиболее важных аспектов их применения). В предыдущих главах данной книги было упомянуто лишь небольшое количество гетероциклических соединений, имеющих важное значение в качестве медицинских препаратов. В этой заключительной главе мы хотим уделить особое внимание трем аспектам химии гетероциклов, имеющим коммерческое значение: более широкому использованию твердофазной химии для создания новых лекарственных средств; проблемам, связанным с переходом от открытия нового лекарственного средства к его производству в промышленных масштабах, и применимости гетероциклической химии к ныне применяемым или потенциальным электроактивным и родственным им материалам, т. е. использованию гетероциклов в области наук о материалах.
28.1. ТВЕРДОФАЗНЫЕ РЕАКЦИИ [2]
Реакции на твердых носителях, в которых молекула субстрата прикрепляется к нерастворимому полимерному носителю, первоначально были разработаны для синтеза пептидов, а в настоящее время находят широкое применение в общей синтетической и гетероциклической химии, особенно в комбинаторной химии.
Схема 1.
Особое преимущество химии на твердых носителях — легкость очистки конечного продукта: могут быть проведены последовательные реакции, а побочные продукты вымываются, что не требует ни экстракции, ни хроматографии, ни выделения интермедиатов. Конечный продукт реакции, таким образом, удаляется с носителя с минимальными примесями. Хотя некоторые отдельные стадии реакции могут идти медленно на твердой фазе, но в целом эти процессы достаточно быстрые, поскольку требуется лишь одно выделение. Эти особенности также делают такие реакции пригодными для автоматизации.
Схема 2.
Практически все типы реакций можно провести с использованием этого метода (с подбором подходящего носителя), включая галогенирование, литиирование, реакции, катализируемые переходными металлами, и реакции с такими агрессивными реагентами, как пентахлорид фосфора. Также успешно могут быть использованы многие стандартные методы синтеза гетероциклов.
Схема 3.
Твердые носители часто получают на основе хлорметилированных полисти-рольных смол, которые используют либо напрямую (Меррифилд) для алкилирования, либо для реакций сочетания путем образования связки, которая может быть селективно разрушена под действием кислоты или основания (например, Ванг).
НС(ОМе)з, TFA СН2С12
Me
Схема 4.
>80%
(4 стадии)
Основная проблема заключается в том, как прикрепить субстрат к полимеру: в химии ароматических углеводородов и алифатических соединений это делают с помощью функциональной группы (схемы 2 и 4), такой, как карбоновая кислота или амин, что может ограничивать выбор субстрата; в альтернативном методе используют «бесследную» связку, такую, как силан, который может быть удален, например, при отщеплении водорода от места прикрепления, но этот метод не очень удобен. В этом смысле гетероциклы имеют преимущества! Прикрепление к носителю может быть осуществлено с помощью методов [3], подобных описанным выше, а также с помощью кольцевого гетероатома, особенно атома азота в азолах [4] (схема 1) или гетероатома в случае образования гетероциклического кольца на конечной стадии процесса [5] — часто бывает легко проводить реакцию таким образом, чтобы конечная стадия циклизации (образование гетероцикла) сопровождалась одновременным отделением конечного продукта от носителя (схема 3). Атом серы представляет собой удобную связку при синтезе гетероциклов, поскольку он используется как уходящая группа (даже лучше после превращения в сульфоксвд [6] или сульфон [7]), что способствует отделению от носителя (схема 5). Для полного обсуждения реакционной способности гетероциклов, использованных в приведенных примерах, следует обращаться к предыдущим главам.
n-BuNH2 m-CPBA СН2С12^ СН2С12
Схема 5.
Другое применение твердофазной химии заключается в использовании реагентов, связанных с полимером, которые имеют некоторые преимущества в плане сведения очистки к минимуму. В качестве примера можно привести показанный ниже синтез тиазола, который включает использование, во-первых, связанного с полимером бромирующего агента, и, во-вторых, связанного с полиме-
ром основания. Несмотря на образование в ходе процесса промежуточных соединений, продукт реакции удается выделить с чистотой более 95% без необходимости какой-либо хроматографической очистки [8].
Несмотря на то, что эти методы обычно успешно используются на небольших количествах, они также имеют значительный потенциал для легкого проведения синтезов в количестве нескольких килограммов и даже при больших загрузках. Высокофункционализированные смолы могут связываться с равным по массе количеством субстрата, что позволяет минимизировать объем реакционной смеси [9].
28.2. ГЕТЕРОЦИКЛЫ В ФАРМАЦЕВТИЧЕСКОЙ ПРОМЫШЛЕННОСТИ: КРУПНОТОННАЖНЫЕ СИНТЕЗЫ
Гетероциклические соединения лежат в основе большинства медицинских пре* паратов, причем только в 1998 г. более чем 100 лекарственных препаратов были проданы на суммы от десятков до 60 миллиардов фунтов стерлингов, поэтому для химиков, работающих в фармацевтической и родственной промышленно* сти, необходимо обладать доскональными знаниями гетероциклической химии для открытия лекарственного препарата, разработки метода его получения и доведения до промышленного производства. В большинстве случаев суммарная стоимость складывается из затрат на обнаружение, развитие, тестирование и продажу, причем стоимость производства субстанции действующего лекарства составляет относительно небольшую часть конечной стоимости. Стоимость производства тщательно контролируется, поэтому синтетический путь должен быть по возможности наиболее эффективным и дешевым — обычно стоимость производства составляет от 1 до 5 тысяч фунтов стерлингов за 1 кг нового лекарственного препарата.
Требования к лабораторному получению лекарственного препарата и его производству в промышленных масштабах сильно отличаются, вследствие чего для этих целей могут использоваться совершенно различные синтетические подходы. Число стадий в синтезе определяет основную стоимость, в которую, без сомнения, входит стоимость исходных материалов и реагентов. При предварительных исследованиях стандартными требованиями являются 90%-ные выходы на каждой стадии после высокоэффективной жидкостной хроматографии или в редких случаях с очисткой кристаллизацией или перегонкой; хроматографическая очистка в промышленном многотоннажном производстве используется крайне редко.
Особые требования предъявляются к качеству конечного продукта с очень жесткими критериями для воспроизводимости степени чистоты и процентного
содержания примесей, особенно металлов. Все примеси, содержание которых составляет вплоть до 0,1%, должны быть определены и по возможности отдельно синтезированы, что создает дополнительные проблемы для химиков. Содержание примесей некоторых производных металлов, таких, как оловоорганические соединения и соединения ртути, не должно превышать следовых количеств; содержание других, например производных палладия, допустимо в очень малых количествах в зависимости от дозы.
Хотя некоторые лекарственные препараты получают с использованием оловоорганических реагентов, таких реагентов необходимо избегать, особенно на последних стадиях. Эти требования могут в значительной степени усложнить синтетические подходы к производству лекарственных средств — многие изящные и простые реакции, приведенные в этой книге, хотя и подходят для предварительных исследований на стадии открытия лекарственных средств, не могут быть использованы для промышленного производства из-за остаточных примесей таких реагентов в конечном продукте.
Необходимо также учитывать требования минимального влияния производства на окружающую среду: характер газообразных выбросов и содержание токсичных и запрещенных соединений в сточных водах. Эти факторы, следовательно, также должны приниматься во внимание при разработке промышленных синтезов лекарственных средств.
28.3. ПРИМЕНЕНИЕ В ЭЛЕКТРОНИКЕ
Важную область исследований, объединяющая технику и гетероциклическую химию, представляет собой получение электроакгивных органических материалов [10]. Применение таких материалов, которое простирается за пределы простой замены металлов, включает в себя использование их в качестве проводников, сверхпроводников, полупроводников, аккумуляторов, транзисторов, сенсоров, светоизлучающих диодов и родственных электрохромных материалов. Эта область имеет большое коммерческое значение.
Значение использования органических проводников обусловлено по существу безграничным запасом доступных материалов, оказывающих минимальное влияние на экологию и не вызывающих большинства стратегических проблем, которые могут возникнуть при применении металлов и редких элементов. Устойчивость к коррозии, воздействию воздуха и воды, легкость получения в виде очень тонких пленок и пригодность для введения в такие материалы, как ткани, — все это также имеет значительные преимущества по сравнению с использованием металлических эквивалентов.
Механизм проводимости включает электронную проводимость через длинные цепочки сопряженных молекул и/или ^-комплексные структуры. Подробное обсуждение теории проводимости выходит за рамки данной книги; в этом разделе приводятся лишь возможные области применения гетероциклических соединений.
Типы соединений, используемых в качестве органических полупроводников, включают широкий круг ненасыщенных молекул, таких, как полиацетилен и полианилин, но с коммерческой точки зрения и применительно к гетероциклической химии особое значение имеют полипиррол, политиофен и родствен
ные полимеры и л-комплексные структуры, производные тетратиафульвалена. Преимущество использования гетероциклов заключается в том, что широкий круг электроноизбыточных, электронодефицитных и смешанных систем может быть легко получен с учетом целевого назначения в зависимости от их электронных и электрических свойств [11].
28.3.1. Полипиррол и политиофен
Пиррол, тиофен и их производные могут быть подвергнуты окислительной полимеризации электрохимическим или химическим путем; например, при использовании хлорида железа(Ш) образуются главным образом 2,5-связанные полимеры. Первоначальные нейтральные полимеры не обладают проводимостью, но в результате последующего окисления они превращаются частично в катион-радикалы или дикатионы с акцептированием противоионов из реакционной смеси — процесс, известный под названием «легирования», — и таким образом получаются проводящие материалы. В других системах также возможно восстановительное легирование.
Проводящие и другие физические свойства могут быть модифицированы при использовании 3- и/или 4-замещенных производных или N-замещенных производных в случае пиррола. Противоионы могут быть введены в боковую цепь (самолегирование), как это происходит в полимере 3-(тиен-3-ил)пропан-сульфоновой кислоты. Варьирование длины боковых цепей позволяет контролировать растворимость. Смешанные полимеры, в состав которых входят, например, тиофены и пиридины, способны как к окислительному, так и восстановительному легированию.
Олиготиофены, состоящие из 27 звеньев, также полезны с точки зрения такого применения, и их получают с помощью реакций сочетания, катализируемых нульвалентным палладием, или в результате диацетиленового синтеза (разд. 14.13.2.2) [12].
28.3.2. Тетратиафульвалены (TTF)
Эти необычные гетероциклические соединения и их аналоги широко исследуются — пришлось изучить более тысячи литературных ссылок, посвященных тетратиафульваленам, прежде чем удалось обнаружить [13] данные о том, что монокристаллы TTF • TCNQ (тетратиафульвален • тетрацианохинодиметан) обладают электрической проводимостью. TTF • TCNQ кристаллизуется в виде
слоистых стопок, т. е. в стопках фрагменты плоских электронодонорных (TTF) и электроноакцепторных (TCNQ) молекул центрированы по отдельности, а не в виде перемежающихся доноров и акцепторов, как принято считать для непроводящих стопок с переносом заряда. Частичный перенос заряда между слоистыми стопками лежит в основе проводимости через стопку.
«Электроны в кристаллических «органических металлах» перемещаются по надмолекулярным орбиталям, состоящим из молекулярных орбиталей молекул, собранных в колонны» [14], хотя межмолекулярная связь, не обязательно включающая стопки, может быть вполне достаточной [15, 16]. Таким образом, «структура в какой-то мере удачного органического проводника, вероятно, диктуется двумя требованиями. Во-первых, их построенные из молекул блоки должны хорошо подходить друг к другу, чтобы электроны могли легко перемещаться из одной молекулы в другую. Во-вторых, энергетический вклад частично заполненной или открытой валентной энергетической зоны должен быть мал» [17]. Например, «для плоских молекул с делокализованными л-молекуляр-ными орбиталями необходимо существование в ваде устойчивых частиц с незамкнутыми оболочками (т. е. свободных радикалов) для того, чтобы происходило эффективное перекрывание орбиталей» [18]. Многочисленные вариации фрагментов как TTF, так и TCNQ были получены и изучены, включая селеновые и теллуровые аналоги TTF; а вместо TCNQ были использованы электронодефицитные гетероциклические соединения, такие, как тетразин. Особенно полезным оказался бис(этилендитио)-аналог TTF, известный как BEDT-TTF. Совершенно случайно было обнаружено, что благодаря своей электронодонорной способности TTF может быть использован как инициатор радикальных реакций диазониевых солей [19].
тетратиафульвален (TTF) BEDT-TTF
тетрацианохинодиметан (TCNQ)
Тетратиафульвалены могут быть получены различными способами [20], например, из 1,3-дитиол-2-тион-4,5-дитиолата — простые соли такого дианиона очень неустойчивы, но в виде цинкового комплекса или дибензоата, как показано ниже, его можно накопить для дальнейшего использования.
Большинство химических превращений TTF основано на реакциях литиирования — легко образуются даже тетралитиевые производные. Катализируе-
мне палладием реакции сочетания с использованием производных триалкил-олова [21] могут быть также проведены без особых трудностей [22].
28,3,3, Применение
Помимо прямого использования в качестве проводников и полупроводников, существуют некоторые другие интересные примеры применения. Полимеры, полученные из 3,4-этилендиокситиофена, производят в промышленности в качестве антистатических агентов, а замещенные производные находят особое применение в электрохромных устройствах, т. е. представляют собой соединения, изменяющие цвет под действием электрического тока. Электрохромные устройства могут быть использованы, например, для переключаемых подцветок и окраски стекла, а также предложены в качестве современных форм «хитрого» камуфляжа для самолетов-истребителей: контролируемый с помощью компьютера ряд электрохромных покрытий для самолетов изменяет цвет в соответствии с окружающей средой. Некоторые оригинальные покрытия содержат полипирролы, способные поглощать радарное излучение [23].
Проводимость полимеров может изменяться при поглощении паров органических паров, и на этом явлении основано устройство, восхитительно названное «электронный нос» [24]. В одной коммерческой форме содержится набор из 12 различных полимеров, таких, как полипиррол, с различным откликом на поглощение различных органических молекул; электронная обработка этих откликов дает «отпечатки пальцев» для каждого соединения, что позволяет их идентифицировать. В качестве одного из применений «электронного носа» можно привести его использование в пищевой промышленности для определения испорчен
ности продуктов или их брожения. Основное преимущество этого метода перед общепринятыми методами, такими, как газовая хроматография, заключаются в быстроте, дешевизне и простоте исполнения. В родственном методе биосенсо-ры, например, используемые для оценки уровня глюкозы, могут быть получены прикреплением ферментов к проводящим полимерным поверхностям.
Литература
1. Pozharskii A. F., Soldatenkov А. Т., Katrlzky A. R. Heterocycles in life and society, Wiley, 1997.
2. «Combinatorial synthesis — the design of compound libraries and their application to drug discovery», Terrett N. K.t Gardner M., Gordon D. W., Kobylecki R. J., Steele J. Tetrahedron, 51, 8135 (1995); «The current status of heterocyclic combinatorial libraries», Nefci A., Ostresh J. M., Houghten R. A. Chem. Rev. 97, 449 (1997); «Solid phase organic reactions. Ill (for Nov. 1996 — Dec. 1997)», и предыдущие статьи этой серии), Booth S., Hermkens P. H. H., Ottenheijm H. C. J. Rees D. C, Tetrahedron, 54, 15385 (1998); «Recent progress in solid phase heterocycle synthesis», Corbett J. W. Oig. Prep. Proc. Int., 30,489 (1998).
3. Chen C., Munoz B. Tetrahedron Lett., 39,6781 (1998).
4. NugeilD.A., Cornelius A. M., Corbett J. И< J. Org. Chem., 62,201 (1997).
5. Hu K, BaudartS., Porco J. A. J. Org. Chem., 64, 1049 (1999); Huang Ж, Scarborough R. M. Tetrahedron Lett., 40,2665 (1999).
6. Masquelin T., Meunier N., Gerber E, Rosse G. Heterocycles, 48,2489 (1998).
7. Gayo L. M., Suto M. J. Tetrahedron Lett., 38,211 (1997).
8. Habermann J., Ley S. V., Scicinski J. J., Scott J. S., Smits R., Thomas A. Ж J. Chem. Soc., Perkin Trans. 1,1999,2425.
9. Raillard S. P., Ji G., Mann A. D., Baer T. A. Org. Proc. Res. Dev., 3,177 (1999).
10. Singh Nalwa H. Handbook of organic conductive molecules and polymers, Wiley, 1997; «Polarons, bipolarons, and solitrons in conducting polumers», Bredas J. L., Street G. B. Acc. Chem. Res., 18,309 (1985); «Recent progress on conducting organic charge-transfer salts», Bryce M. R. Chem. Soc. Rev., 20,355 (1991).
11. «Heterocycle-based electroconductive polymers», Berlin A. Plastic Eng. (N.Y.) (Electrical and Optical Polymer Systems), 45, 47 (1998); «Heterocycle-based electirc conductors», Pagani G. A. Heterocycles, 37,2069 (1994), «Conjugated poly(thiophenes): synthesis, functionalisation and applications», RoncaliJ. Chem. Rev., 92,711 (1992).
12. Nakanishi H, Sumi N., Aso K, Otsubo T. J. Org. Chem., 63, 8632 (1998).
13. Ferraris J., Cowan D. O., Walatka V. V, Peristein J, H. J. Am. Chem. Soc., 95,948 (1973); Coleman L. B., Cohen M. J., Sandman D. J., Yamagishi F. G., Garito A. E, HeegerA. J. Solid State Commun., 12,1125 (1973).
14. Wudi E Acc. Chem. Res., 17,227 (1984).
15. Parkin S. S. P., Engler E. M., Schumaker R. R., LagierR., Lee V. Y., Scott J. C., Greene R. L. Phys. Rev. Lett., 50,270 (1983); Williams J. M., Beno M. A., WangH.H, Reed P.E., Azevedo L. J, SchirberJ. E. Inorg. Chem., 23, 1790 (1984).
16. Obertelli S. D, Friend R. H, Talham D. R., Kurmoo M., Day P. J. Phys.: Condens. Matter, 1, 5671 (1989); Mallah T., Hollis C., Bott S, Day P., Kurmoo M. Synth. Met., 27, A381 (1988).
17. Bechgaard K, Jerome D. Sci. Amer., 247, July, 50 (1982).
18. Cowan D. O., Wiygul P. M. Chem. Eng. News, 1986, July 21,28.
19. Fletcher R. J., Lampard C., Murphy J. A., Lewis N. J. Chem. Soc., Perkin Trans. 1,1995, 623.
20. Krief A. Tetrahedron, 42, 1209 (1986); Bryce M. R. Aldrichimica Acta 18, 73 (1985); Narita A., Pittman C. U Synthesis, 1976, 489; Wolf I., Naarmann H, MiillerK. Angew. Chem., Int. Ed. Engl., 27, 288 (1988); «The organic chemistry of l,3-dithiole-2-thione-4,5-dithiolate (DMIT)», Svenstrup N.r Becher J. Synthesis, 1995, 215; Hansen T. K., Becher J., Jorgensen T. Org. Synth., 73, 270 (1996); Meline E. L., Elsenbaumer R. L. J. Chem. Soc., Perkin Trans. 1,1998,2467.
21. lyoda M., Kuwatani Y., Ueno N., Oda M. J. Chem. Soc., Chem. Commun., 1992, 158.
22. lyoda M., Fukuda M., Yoshida M., Sasaki S. Chem. Lett., 1994, 2369; Lovell J. M., Joule J. A. J. Chem. Soc., Perkin Trans. 1,1996,2391.
23. Berlin A., Kingston R. Chem. Brit., 1999, October, 24.
24. «Towards an integrated electronic nose using conducting polymer sensors», Hatfield J. V., Neaves P., Hicks P. J., Persaud K.r Travers P. Sensors and Actuators B, 18-19, 221 (1994); «Electronic nose detects the nast niffs», CoghlanA. New Scientist, 141 (1911), 20 (1994); Gardner J. W., Bartlett P. N. Electronic noses: principles and applications, OUP, Oxford, 1999.
ПРИЛОЖЕНИЕ
Ответы на упражнения повышенной сложности
Глава 5
2 3
Глава 6
Глава 8
Глава 9
Глава 11
Глава 13
СО2Ме N
НО "--«феном -7°-7°. С-
7. gi МеО^о^ОМв MnMphS0?NH2 9. ^0^^ ЕЮгСА^ 0ЛМе
Me Ac Me 0 C02Et «в CO^t
уУу. гидролиз, / ♦ \ Л + \ + NaaS2O4
^^N^^^TeMNj^/EWHe 10. (a) dS$H3 (g) Me^4jOH СТ Ме
Н
Глава 14
Глава 15
MeHN^ MeHN^____МеНЧ_
11. МеОгС СОгМе~*’НОН/; СО2Мв"*" к
О'
Глава 17
/5SV->-(CH2)4NHMe СНгО/Н* ^=\ СН^е, CN -мтем
%VJlV /"1 IWv ) затем Mel Г (а)падролиз
1Г\Г 2. 3\V^N^/2 4‘ илНбНЖЬ
Глава 21
Глава 22
Глава 24
Глава 25
м\ u „ NO .NOH
ОМе ом» owe
Глава 26
ЕЮ
предметный указатель
Индивидуальные соединения приведены с названиями, если в тексте даны синтезы колец, полные синтезы, образование из других соединений и частные аспекты реакционной способности. Металлированные соединения приведены, если они важны в синтезе; продукты, получаемые из этих интермедиатов, не приводятся. Некая свобода в химических названиях обусловлена необходимостью помочь читателю получить химическую информацию, например, указатель дает название «индол, 2-литий-1-фенилсульфонил-», но также и (что некорректно) «индол, 2-ли-тий-1-трет-бутоксикарбонил-». Итак, в названиях превалирует гетероциклический аспект: используется «фуран, 2-этоксикабонил-», а не «этиловый эфир фуран-2-карбоновой кислоты». Противоионы (неорганические) гетероциклических катионов не приводятся: «пирилий», а не «перхлорат пирилия», пиридиниевые соли обозначены как «пиридинии» и т. д.
Аденин 527
2-метил- 292
раскрытие цикла 583
синтез кольца 600
— из мочевой кислоты 593
— из 8-хлорпурина 586
Аденин/тимин
водородные связи 578
синтез 601
Аценозин-5'-дифосфат 576
Аденозин-5'-монофосфат 576
Аденозин-5'-трифосфат 576
1-Азабицикло[ 1.1.0]буган
раскрытие цикла в азетидины 665
синтез кольца 665
2-Азабицикло[2.2.0]гексадиен 124
2-Азабицикло[2.2.0]гексенон 124
4-Азаивдол
5-метоки-, форматирование по Вильсмейе-ру467
— синтез кольца 467
номенклатура и основность 446
5-Азаиндол
номенклатура и основность 446
синтез кольца 118
--1 /ярети-бугоксикарбонил-2-метил- 467
4-хлор-, нуклеофильное замещение 448
6-Азаиндол
биопревращение в 6-азатриптофан 7
номенклатура и основность 446
синтез кольца, 1-(4-метилфенилсульфо-нил)-5-этоксикарбонил- 467
--циклогексано[Л, /]- 328
--2-этоксикарбонил-5-метокси- 341
7-Азаиндол
ацетилирование 447
бромирование 447
2-литий-1-фенилсульфонил- 448
Манниха реакция 447
N-метилирование 447
нитрование 447
номенклатура и основность 446
синтез кольца, 3-триэтилсилил-3-(2-гидро-
ксиэтил)- 467
2-триметилстанн и л-1 -фенилсул ьфонил-,
Pd(0)- сочетание 448
4-хлор-, нуклеофильное замещение 448
— превращение в 4-амино-1-фенил-5-аза-индол448
5-Азацитидин 625
Дзет 661
3,4-дигидро- 661
Азетидины 661
нуклеофильное раскрытие кольца 662
синтез кольца 664,665
Азиридины
для генерирования 1,3-диполей 659
нуклеофильное раскрытие кольца 658
синтез кольца 664
— цис-1 -(4-метилфенилсульфонил)-2-ме-тил-2,2-спиро(циклогексан) 664
---цис- и транс- 1-(4-метилфенилсульфо-нил)-2- (4-метилфенил)-2-диметиламино-карбонил- 664
---1 -трифенилметил-2-бензилоксикарбо-
нил-664
---3-фенил- 664
удаление азота — превращение в алкены 659
Азирин 656
Азирины
З-метил-З-метоксикарбонил-, синтез кольца 664
нуклеофильное раскрытие цикла 664
Азлактоны, синтез пирролов 261
1,2-Азолы
лигирование 505,534
нуклеофильное замещение, региоселектив-ность 503,543
структуры 22
физические свойства 539
электрофильное замещение 503,540
---при атоме азота 503,504
---относительная реакционая способность
39
---региоселективность 504
1,3-Азолы
азадиены в синтезе Дильса—Альдера 503 алкил-, депротонирование боковой цепи 504 литиирование 53,514—517
нуклеофильное замещение, региоселекгив-ность 504
структуры 22
физические свойства 506
электрофильное замещение 503
— при атоме азота 503
---относительная реакционная способность 39
---региоселективность 503,511
Азулен, синтез 139
Алкалоиды, биосинтез 653
N-Алкилирование 33-34, см. также индивиду-
альные гетероциклы
Алкогольдегидрогеназа 521
Аллен, 1-бром-1-метоксикарбонил- 549
Аллопуринол 577
Алосетрон 414
Алпразолам 625
Амидины в синтезе пиримидинового кольца 287-288
Амлодипин 104
Аномерный эффект 655
ANRORC-механизм 171
Антипирин 549
4-формилирование по Вильсмейеру 549
Антоцианидины 229
Антранил, см. 2,1-Бензизоксазол
Апогенин, синтез 244
Аристеромицин, синтез 601
Аскорбиновая кислота 379
Аспергилловая кислота 257
АторвазатинЗП
Ауреузин 479
Ауроны 479
Ацетальдегида енолят 662
Ацетазоламид 625
Ацетокумарол 225
Ацикловир 577
Бакера—Венкатарамана перегруппировка 240
Банминт 352
Барбитураты 272
Барбитуровая кислота 272
5-аллил-, замещение кислорода галогенами 278
реакция с фосфорилхлоридом 254
Бартоли синтез 467
Бартона метод генерации радикалов 45
Бартона—Зарда синтез 337
Бензальдегид, 4-диметиламино-, см. Эрлиха реакция
1,2-Бензизоксазол
номенклатура и нумерация 560 синтез кольца
---3-фенил- 569
---3-этил- 569
2,1 -Бензизоксазол
номенклатура и нумерация 500
синтез кольца, 7-карбокси-З-метокси- 571
---3-(пиридил-2)- 571
---З-стирил-571
---5-хлор- 571
1,2-Бензизотиазол
номенкулатура и нумерация 560
синтез кольца, 3-(пирролвдил- 1-ил)- 569
---7-формил-3-бутил-Б, S-диоксид 570
Бензимидазол
бромирование 561
2-гадогено-, нуклеофильное замещение 562
2-иод-1 -бензил-6 - (2-диметил аминоэтил)-, Рё(0)-сочетание 563
2-литий-1-бензил-6-(2-диметиламино-этил)- 563
нумерация и номенклатура 560
синтез кольца 566
---1-бензил-5-метокси-, твердофазный синтез 673
---2-циклогексил- 568
---2-этил- 566
сочетание 563
2-тиол, превращение в 2-бром- 562
- синтез кольца 567
— 2-три метил сил ил-1-метил-, «лсо-ацили-рование 562
Бензо[ 1,2-&3-#]дипиррол
дигидро-, синтез кольца 335 синтез кольца 343
2,1-Бензоизотиазол
номенклатура и нумерация 560
синтез кольца 571
---3-метил- 569
---З-этил-5-метил- 569
2,1 -Бензоизотиазол иния катионы расщепление кольца 565 эквиваленты ормо-аминоаральдегидов 565
Бензоксазол
2-литий- 564
номенклатура и нумерация 5b0
синтез кольца 566
---2-фенил- 567
— 2-этил- 567
2-фенокси, нуклеофильное замещение 562
2-хлор-, нуклеофильное замещение 562
2-хлор-, нуклеофильное замещение 562
2-цинк- 564
Бензол
ароматичность 15-16
орбитали 16
реакционная способность 15,35
структура 15-16
Бензо[6]пирилий, см. 1-Бензопирилий
Бензо[с]пирилий, см. 2-Бензопирилий
1-Бензопирилий
номенклатура и нумерация 225
4-силилокси-, присоединение енола эфира
по С(2) 228
синтез кольца, 7-гидрокси-2,4-диметил- 237
— 7-гидрокси-2,4-дифенил- 237
— 4-гидрокси-З-метил- 241
— 8-метил- 238
— 6-метил-2-фенил- 237
— 2-(4-метоксифенил)-, из кумарина 233
2-Бензопирилий
метил-, реакции по метилу 228
номенклатура и нумерация 225
3-оксид как 1,3-диполь во внутримолекуляр-
ном циклоприсоединении 235
реакция с аммиаком 199,227
синтез кольца, 6,8-диметокси-1,3-диметил-
243
3,4-Бензопиррол, см. Изоиндол
Бензотиазол, радикальное замещение 44
Бензотиазолы
аддукт Рейсерта 565
2- винил- как диен в циклоприсоединении 564
2-литий- 563
2-метилтио-, нуклеофильное замещение 562
номенклатура и нумерация 560
синтез кольца 566
— 2-(бензотаазол-2-иламино)- 567
— 2-лфет-бутил-7-метил- 568
---2-метиламино- 568
— 2-(3-фторфенил)- 568
2-сульфонамид, нуклеофильное замещение;
защита аминогруппы 562
2-триметилсилил-, imeo-гидроксиалкилиро-ваниебО
— плсо-замещение с участием фосфора 563
Бензотиазолия соли
2-(1-гидроксипроп-1-ил)-3-метил-, нуклео-
фильное присоединение 565
синтез кольца 2-циклопропил-З-метил- 567
Бензотиофен
S-алкилирование 481
восстановление 483
галогенирование 481
С-депротонирование, региоселективность 411
нитрование 480
номенклатура и нумерация 479
S-окисление 481 электрофильное замещение, региоселекгив-ность 411,479
3,4-Безнзотиофен, см. Бензо[с]тиофен Бензо[6] тиофен, см. Бензотиофен Бензо[с]тиофен
диен в реакциях Дильса—Альдера 411 номенклатура и нумерация 494
синтез из S-оксида 1,3-дигцдробензо[с]тио-фена 497
Бензотиофения катион 481
Бензотиофены
3-азидо-, с трифенилфосфином 483 амино- 484
био-2,3-гидроксилирование 73 2-юрет-бутокси- 483
2,3- дибром-, обмен металл — галоген, региоселективность 483
— нуклеофильное замещение 482 2-диметиламино- 484
S,S-диоксид, циклоприсоединение по связи 2,3481
4-иод-2-метоксикарбонил-, синтез кольца 487
литиирование 53,482
2-литий- 483
З-литий-2-аллил- 483 2-литий-З-бром- 483 3-литий-, раскрытие цикла 53,483 2-метил-, синтез кольца 486 5-метил, био-2,3-дигидроксилирование 73 окси-484 синтез кольца 484 ---4-иод-2-метоксикарбонил- 487 — 2-метил- 386 ---4- и 6-хлор-З-он- 484 ---7-этоксикарбонил-4-фенил- 488
Бензо[с]тиофены, синтез кольца 1,3-дифенил- 498 1,34,7-тетраметил- 498
Бензотриазол алкилирование 644 1-амино-, окисление по бензольному кольцу 645
1-гвдроксиметил- как алкилирующий агент 644
как уходящая группа 644
7-литий- 1-трет-бутоксикарбойил- 645 литиирование N-замещенных 645 трис(бензотриазол-1-ил)меган, кислотность 645
Бензофуран восстановление 483 галогенирование 481 С-депротонирование, региоселективность 411,482 катализируемое основаниями раскрытие цикла 482 2-литий- 482 3-литий- 482
— карбоксилирование 482
— раскрытие цикла 482
нитрование 480
номенклатура и нумерация 479
синтез кольца 486
формилирование по Вильсмейеру 480 электрофильное замещение, региоселективность 411,480
Бензо[д]фуран, см. Бензофуран
Бензо[с]фуран, см. Изобензофуран
3,4-Бензофуран, см. Изобензофуран 2Н-1-Бензофуран-2-он, см. Кумарин 1Н-2-Бензофуран-1-он, см. Изокумарин 4Н-Бензофуран-4-он, см. Изоиндол Бензофураны
амино- 484
2-литий- 482
синтез кольца, 3-азидометил- 485
---2-ацетил- 487
— — 4-ацетокси-6-изопропил-5-метил-2-триметилсилил- 489
---7-бром-2-метил- 486
---4-трет-бутилдиметилсилилокси-6,7-бис(метоксикарбонил)- 488
---6-гидрокси-З-карбоксиметил- 486
— 2,3-дигидро-2-иодметил- 489
---2-метил- 488
---2,3,4,5,7-пентаметил- 485
---2-триизопропилокси-З-фенил- 488
— окси-484
Биотин 352
Бишлера синтез 457
Бишлера—Напиральского синтез 186—187
Бора реагенты 56—61
Борные кислоты
реакции 58—61
синтез 56—57
Рб(0)-сочетание 70-71
Брассинин 414
Бромвинилдезоксиуридин 3-карбоцикличес-кий, синтез 292-293
Бромирование, см. индивидуальные гетероциклы
Бутенолиды 392-393
из фуранов 390
Галогенирование, см. индивидуальные гетероциклы
«Галогенов пляска», катализируемая основаниями 361
Ганча синтез
пиридинов 146—147
пирролов 336
тиазолов 325
Гассмана синтез 460
Гексазин 639
Гем 310
Генетический код 578
Гербициды 258
Гидразин 258
p-Гидрида элиминирование Pd-катализируемое 68
Гидрогенизация ионная 364
3-Гидрокси-(1Н)-пиразин-6-он 258
Гипоксантин 576
Гиппуровая кислота 524
Гистамин 402
Гистидин 506
метиловый эфир, реакция с карбонидди-имидазолом 510
в ферментах 508
Глутаконовый альдегид, натриевая соль 139
Глюкоза
конформации, структурная изомерия 655
реакция с ацетоном 655
Гофмана исчерпывающее метилирование 654
Гофмана—Лефлера—Фрайтага реакция 665
Грамин 424
соли, замещение азота 439-440
Грандберга синтез 452
Граниситрон 560
Гризеофульвин 479
Гроссуларин-2, синтез 531
Груббса метатезис 666
Гуанидины
N-замещение, получение с использованием пиразолов541
в синтезах пиримидинового цикла 278
Гуанин 576
синтез из мочевой кислоты 593
Гуанин/цитозин, водородные связи 578
Гуанозин 576
Гуареши синтез 148—149
Давицил 104
Деборирование 61
Дегидрирующие агенты, синтез кольца пирилия 212-213
3,4-Дегидропиридин 115
«Дегидроуксусная» кислота 218
Дезоксирибонуклеиновая кислота (ДНК) 256, 577-579
Дендродоин 625
N-Депротонирование 47, см. также индивидуальные гетероциклы
я-Дефицитные гетероциклы 18
Диазины
алкил-, депротонирование алкильной группы 282
амино-, диазотирование 282
— протонирование 281
— основность 281
- электрофильное замещение 282
галогено-, относительная реакционная способность к нуклеофилам 262—265
-------в реакциях Рд(0)-сочетания 70 инертность к электрофильному замещению
251,260
литиирование 265-266
нуклеофильное замещение 252,261—265
нуклеофильное присоединение 251—252
структура 19
физические свойства 256
электрофильное присоединение к азоту 251
Диазины, окси-
N-депротонирование 275
замещение атома кислорода галогеном 278
структура 272
Диазирвдин, номенклатура и нумерация 659
Диазирин
восстановление 660
номенклатура и нумерация 659
3-пропил-, синтез кольца 660
2-хлор-2-фенил-, разложение до карбена 660
— синтез кольца 660
Диалкиламиноалкилирование, см. реакцию Манниха для индивидуальных гетероциклов
Дивицин 195
3,4-Дигидропиран, защита гидроксильной группы 654
1,2- Дигидропираны, раскрытие цикла 198, 202-205
Дидезоксиинозин 577
Диеномицин 137
1,3- Дииминоизоиндолин 496
1,4- Дикарбонильные соединения
из 2,5-ди-гп/?е/л-бутил- 384
из 2-этил-5-метил- 384
1,5- Дикарбонильные соединения, синтез 144-145
Диметиламинометилирование, см. реакцию Манниха для индивидуальных гетероциклов
З-Диметиламинометилиндол, см. Грамин
Диметиламинопиридин 107—108
как катализатор О-силилирования и О-трита-лирования 140
Димрота перегруппировка 281, 580-581, 593-594
1,4-Диоксан 651
Диоксиран
диметил-, окисление урацила 261
номенклатура и нумерация 659
синтез кольца, 3,3-диметил- 660
З-трифторметил-З-метил-, использование для введения кислорода 660
— синтез кольца 660
в эпоксидировании 660
2,2'- и 4,4'-Дипирадилы 121-122
Дипирометан 318
Дипиррометен 319
Диполярное циклоприсоединение в синтезе кольца 87—88
Дитиено[3,2-&2',3'-«/]тиофен 361
Идоксуридин 257 Изатин
превращение в 3-трифенилфосфорилиден-оксиндол 444
реакция с трифенилфосфином 444
синтез кольца 465
Изатины
восстановление до оксиндолов 444
синтез кольца, 6,7-диметокси-5-метил- 191
7-этил-, бромирование 44
7-этил-5-бром-, N-алкилирование 444
Изобензотиофен, см. Бензо[с]тиофен
Изобензофуран
диен в реации Дильса—Альдера 496,498-499
номенклатура и нумерация 494
Изобензофураны
1,3-дифенил-, синтез 500
синтез кольца 498
— 4,5-диметокси- 499
---2-метил-З-фенил- 496
Изоиндол
как диен в реакции Дильса-Альдера 411
номенклатура и нумерация 494
синтезы 496—497
таутомерия 494
Изоиндолы
С-алкилирование 495
1-бром-, реакция Вильсмейера 495
2-/дреш-бутил-, сочетание с диазониевыми
солями 495
1-фенил-, таутомерия 497
2-этил-, синтез 497
Изокарбостирил, см. 1-Изохинолон
Изоксазол
номенклатура и нумерация 539
синтез кольца 550
Изоксазолины, расщепление цикла основаниями 548
Изоксазоло[2,3-сП пиримидин, диамино-, синтез кольца 543
Изоксазолы
алкил-, кислотность боковой цепи 547
N-алкилирование 540
восстановление, расщепление кольца
545—546
4-литий-1-трифенил метил- 545
протонирование, основность 540
из пиронов 209
превращение в 1,2,4-тиадиазолы 547
раскрытие цикла после С-протонирования
543
синтез кольца, 3,5-дифенил- 551
---5-изобутил-З-метил- 553
---5-метоксикарбонил-З-фенил- и его изо-
мер 552
---5-трибутилстаннил-З-фенил- 58
---З-фенил-5-триметилсилилметил- 553
---З-этоксикарбонил-З-этил-5-метил- 552
Изокумарин, номенклатура и нумерация 234
Изокумарины
как диены во внутримолекулярном синтезе Дильса-Альдера 234
синтез кольца, 3-лире/п-бутил-4-метил- 244
— 4-иод-З-пропил- 243
Изониазид 104
Изотиазол
номенклатура и нумерация 539
сульфирование 542
Изотиазоло[4,5-/]бензизотиазол, синтез кольца 569
Изотиазолы
алкил-, кислотность боковой цепи 547
N-алкилирование 540
амино- 549
восстановление, расщепление цикла 546
галогене-, нуклеофильное замещение 543
С-депротонирование 543
5-литий- 544
5-литий-З-фенил- 544
4-магний- 545
нитрование 541
окси-, таутомерия 548
протонирование, основность 540
синтез кольца, 4-метоксикарбонил-З-метил-5-фенил- 551
---4-этоксикарбонил-3-метил-5-(4-метил-фенилсульфонил)амино- 551
Изохинолин
алкилирование по N 167
аминирование 170
галогенирование 168-169
нитрование 168,171
номенклатура и нумерация 166
нуклеофильное алкилирование и арилиро-вание 169-170
окисление кольца 169
основность 167
протонирование 167
радикальное замещение 44,173
синтез кольца 184-185, 189
сульфирование 168
электрофильное замещение, механизм 36
— региоселективность 100
Изохинолинии 178—179
восстановление 174,178—179
2-(2,4-динитрофенил)- с хиральными ами-
нами, окисление 180
2-(1-фенилэтил)-, хиральное присоединение реактивов Гриньяра 180 циклоприсоединение енолов 174
Изохинолинкарбоновые кислоты, декарбоксилирование 178
Изохинолин-М-оксид
нитрование 180
превращение в 1-цианоизохинолин 180
Изохинолины
алкил-, депротонирование боковой цепи 177
амино-, основность 177
6-амино-5-нитро- из 5-нитроизохинолина 170
из 2-бензопирилия и аммиака 227
3-бром-, превращение в 3-аминоизохино-
лин 172
галогено-, нуклеофильное замещение галогена 171
3-гидрокси-, таутомерное равновесие 176
1,2-дигидро-, ароматизация 179
1,2-дигидро-2-бензоил-1 -циано-, синтез по
реакции Рейссерта 179
литиирование 172—173
нахождение в природе 166
нуклеофильное замещение, региоселективность 101
реакция Рейссерта 179
синтез кольца 184-185
— 3,4-дигидро-1-метил-187
— 3,4-дигидро-6-метокси-1фенил- 187
— 6,7-диметокси- 185
— 6,7-диметокс и-1,3-диметил- 187
— 1-метил- 187
— 7-метокси-1-метил- 186
---7-нитро- 188
---1,2,3,4-тетрагидро-6,7-дигидрокси-1-
(2,3-метилевдиоксифенил)- 188
---1,2,3,4-тетрагидро-6-метокси- 188
---4-этоксикарбонил-З-фенил- 190
хлор-, относительная активность при нуклео-
фильном замещении 41
1-Изохинолон
замещение О на Hal 177
синтез из изохинолина 171
Изохинолоны, структура 175-176
1-Изохинолоны
2-метил-, формилирование по Вильсмейеру 177
синтез кольца, 7-бром-3-дигидро-2-метил-187
Изохромилий, см. Бензопирилий
Имидазилаты как уходящие группы 510
Имидазол
канонические структуры 22—23
нитрование 511
номенклатура и нумерация 506
синтез кольца 523
Имидазолий
N-ацил-, нуклеофильное замещение 521
2-метил-З-ацил-, депротонирование метила 520
С-Н-обмен511, 515
раскрытие цикла 521
Имидазо[2,3-й]оксазол, 2-фенил-4-метил-
синтез кольца 620
реакция Манниха 620
Имидазол-2-он, протонирование 523
Имидазолы
алкил-, депротонирование боковой цепи 520
алкилирование по положению 5 517
амино-, диазотирование 523
— протонирование, основность 523
— 2-ацил- как азадиен 518
N-ацил-, N-алкилирование, региоселективность 509
Сэд-ацилирование
N-ацилирование 510
5-винил- как диен в реакциях циклоприсоединения 513
водородные связи 519
галогенирование 512
2-галогено-, нуклеофильное замещение 507-508
С-депротонирование 515 N-депротонирование 514 1,4-дилитий- 516
1,4-динитро-, нуклеофильное 5-замещение 514 N-защитные группы для С-депротонирова-ния516
4-иод-2-метил- 1-трифенилметил-, Pd(0)-сочетание517
2- и 5-Карбоновые кислоты, декарбоксилирование 511 кислотность 514
литиирование 53
2-литий- 1-триметилсилилэтоксиметил- 516 4-литий-1 -Триметилсилилэтоксиметил-2-фенилсульфонил- 516
5-литий-2-фенилтио-Ьтриметилсилил этоксиметил- 516
1-метансульфонил* 515
4(5)-метил-, N-арилирование 509 номенклатура замещенных 508 С-Н-обмен511
образование реактива Гриньяра 56
окси-, таутомерия 523
протонирование, основность 507
реакция Манниха 513
синтез кольца, 4-амино-5-этоксикарбонил- 530
— 2-ацетамидоциклопентано[</]- 526
----1-бутил-5-метил-4-фенил-К-оксвд 524
— 1-/ярет-бугил-5-мстил- 528
---1-/»рет-бутоксикарбониламино-4-ме-токсикарбонил-5-изобутил- 528
— 1-гидрокси- Ы(3)-оксад 525
- -1-метил-2,4,5-трифенил- 524
---1-(3-(1,2,4-триазин-2-ил)пропил)- как внутримолекулярный диенофил 519
— — 2,4,5-трибром-1 -этоксиметил-, селективное образование реактива Гриньяра 56
---1-триметилсилил-, ди-Ы-метиЛирова-ние509
---4(5)-(2-трифторацетиламино)этил-, радикальное 2-алкилирование 517
---4-формйл-, внутримолекулярное 5-ра-дикальное алкилирование 517
— 2-цинк-1-диметиламиносульфонил- 517
Имидазо[ 1,2-а] пиридин
галогенирование 612
нитрование 612
номенклатура и нумерация 611
основность 611
синтез кольца, 2,3-диметил- 613
Имидазо[1,2-с]пиридины
галогено-, нуклеофильное замещение 612 литиирование 612-613
Имидазо[ 1,5-о]пирИдины бензоилирование 613 5-литий-З-этилтио- 614 номенклатура, нумерация и основность 611 синтез кольца 614 — 3-тион- 614
— 3-фениламино- 614
формилирование по Вильсмейеру 613
Имидазо[1,5-с]пиримидин, номенклатура и нумерация 611
Имидазо[3,4-а]пиримидины, нуклеофильное присоединение 617
Индазол
N-алкилироваиие 561
номенклатура и нумерация 560 нитрование 561
3-окси-, таутомерия 565
синтез кольца, 3-(2-амино-5-иодфенил)-569
— 1-ацетил-З-метоксикарбонил- 570
— З-диэтиламино-1-фснил- 570
— 3-карбокси- 570
3-трифторметансульфонилокси-1-бензил-, Рс1(0)-сочетание 564
Индиго 443
Индоксил
аутоокисление 443 депротонирование 443 таутомерия 443
Индоксилы 1-ацетил- 443 - образование из 1-ацетилицдола 443 О-ацетил- 443
синтез кольца, 1-ацетил- 464
--1-фенилсульфонил- 443-444
--1-этил- 464
Индол
3-алкилирование бензотриазолилметанолом 644
галогенирование 418
N-депротоиирование 409,429-430 димеризация 425
С(2>-замещение, возможной механизм 408-409,421,422 история 413
канонические структуры 23 С-литиирование 51,53,418 Манниха реакция 408,424-426 меркурирование 427 нитрование 416-417 нитрозирование 426
присоединение бисульфита 409,415—416 производство 413
реакция с бис(метоксикарбонил)карбеном 436
— с диазониевыми ионами 426
— с литий- и триметилсилилхлоридом 435
- с метилвинилкетоном 423
— с нитроэтеном 424
— с формальдегидом 422-423
синтез кольца 456
структура 23
сульфенилирование 417
сульфирование 417
электрофильное замещение, региоселективность 407-409
ЗН-Ицдол 413,451
3-этил-2,3-диметил-, синтез кольца 451
Индолений, см. ЗН-Индол
Индолениний, см. ЗН-Ишюлий
Индолизин
номенклатура и нумерация 608
реакция с диэтиловым эфиром ацетилендикарбоновой кислоты 610
Индолизины
алкил-, металлирование боковой цепи 610
ароматичность 608—609
ацилирование 609
восстановление 609-610
литиирование 610
2-метил-, нитрование, региоселективность 610
нитрование 609
протонирование 609
синтез кольца, 2-фенИл- 610
- - 1-Циано-3-бейзоил-5-формилэТилена-цетатбП
- - 2-циаио-З-фенил- 660
Ивдолий (1Н, 2Н и ЗН) 415,421,435-436
ЗН-Индолий, 1,2,3,3-тетраметил-421
Индолилкарбоновые кислоты, декарбоксилирование 441
Индолин, см. Индол, 2,3-дигидро-
Ицдолины, дегидрирование в индолы 462-463
Индоло[2,3-«/]пирон как Диен в циклоприсоединении 421
Индол-Э-уксусная кислота 240
Индольные алкалоиды 414
Индольные реактивы Гриньяра 430,431-432
реакция с 2-фенилсульфонилбута-1,3-дие* ном 437
Индолы
алкил-, ацилирование по алкилу 439
- обмен в алкиле 439
2-алкилирование, механизм 421
— внутримолекулярное нитроном 426
С-алкилирование 421,423-424
N-алкилирование 431
3-ацил-, восстановление До З-алкилицдолов 410,440
N-ацил-, фотоприсоединение по связи 2,3 438
амино-, таутомерия 445
аутоокисление 428
1-бензил-, 3-нитрование 416
1-бензил-2,3-дикарбоновой кислоты ангидрид, селективные карбонильные реакции 441
3-борные кислоты 57
1-виниламино-, перегруппировка с 3-алкилированием 438
3-винилокси-2,3-дигидро-, перегруппировка с 4-алкилироВйййеМ 438
3-винилоксн-, перегруппировка с 2-алкили-рованием 438
1-гидрокси-, О-алкилирование 445
- димеризация 444
—таутомерия 445
5-гвдрокси-, трифлат, Рб(0)-сочетанив 69 - 5-гидроксиалкилирование диэтилмезокса-л атом 422
1-гвдрокси-3-(2-диметиламиноэтил)-, пере группировка в 5-гвдрокси- 445 С(2)-Депроггонйрование 430-431 N-депротонирование 409,429-430 2,3-дигидро-, дегидрирование в индолы 463, 652
4,7-дигидро- 435
2,3-дигидро- 1-ацетил-2-сульфоновая кислота, бромирование 415-416
как диенофилы с 1,2,4,5-тетразином 437
1,3-диметил-, реакция с 4-метилпент-З-ен-2-оном 423
— с метилвинилкетоном 423
2,3-диметил-, литиирование 2-метила 439 3-диметиламинометвд- 424
1-диэтоксиметил- из индола 419
N-защитные группы для С(2)-депротониро-вания430
7-иод- из индолина 463
7-иод-5-броМ-1-Тозил-, Рс1(0)-сочетание 434 1-(3-иодпроп-2-ен-1-ил)-, радикальная циклизация 434
3-(2-карбоксиэтил)-, внутримолекулярное 4-ацилированИе 421 кислотность 429-430
литиирование 52-53,432
1-литий- 432
2-литий- l-mpem-бугиламинокарбонил- 430, 433
3-литий-1-/ярет-бугиддиметилсилил- 433 2-литий-1-«ре/п-бутоксикарбонил- 433 2-ЛИТИЙ-3-ИОД-1 -фенилсульфонил- 51 5-литий- 1-калий- 434
2-литиЙ-1-карбоновая кислота, литиевая соль 432
2-литий-1-фенилсульфонил- 433 3-литий- 1-фенилсульфонил- 433 - изомеризация в 2-литий- 53 4-литий-З-диметиламино- 1-триизопропилси-лил-431
- 1-магнийиодвд-, см. Индольные реактивы Гриньяра
1-магний-5-метил-, реакция с азиридином 432
3-магний-1-фенилсульфонил- 433
1-метил-, радикальное бензоилоксилирова-ние 434
- хромкарбонильный комплекс 429 2-метил-, 3-аралкилирование 423
— 3-гидразинирование 417
— металлирование по метилу 63-64
— реакция с ацетоном 422
3-метил-, окислительное расщепление связи 2,3428
3-метил-2-(3-оксобут-1-ил)- 423
2-(4-метилфенил)сульфонил-1-1ирел1-бугок-сикарбонил-, радикальное 2- станнирование 435
2-(4-метилфенил)сульфонил-, внутримолекулярное радикальное 2-алкилирование 435 1-метокси-2-формил-, нуклеофильное 3-замещение 445
1-метокси-3-формил-4-иод-, нуклеофильное 2-замещение 445
3-нитрозо-, таутомерия 426
5-нитро-1-метоксиметил-, в ВИЗ 4-замеще-нии429
номенклатура и нумерация 407
основность 415
2-палладированный, реакция Хека 427—428
пергидро- 435—436
превращение в триптофан 424
протонирование 415
реакции с МоОРН 428
— с оксалилхлоридом 419
- с радикалами 434-435
- с сильными основаниями 429-430
— с производными дегидроаланина 423
синтез кольца, 3-ацетил- 554
---6-ацетиламино-4-метокси-2-метокси-
карбонил- 88
---7-бензилокси- 454
---4-бром- 462
---5-бром-2-(3-фенилпропил)- 456
---7-бром- 457
— 3-(2-гвдрокси-3-метоксикарбонил-2-
метил- 460
— 2-(3-гидроксипропил)- 456
— 2,3-диметил- 451
— 1,3-димеяил-4-(2-гидрокси-2-метил)-
этил-462
— 7-иод- 463
---3-метил- 457
— 1-(4-метилфенилсульфонил)-7-метил-
457
---3-метоксикарбонил-2-к-бутил-1-метан-сульфонил- 455
---3-метоксикарбонилметил- 461
---З-метоксикарбонилметил-4-метокси-
454
---3-метоксикарбонилметил-2-фенил-461
— 1-метоксикарбонил- из 1-метоксикар-бонилпиррола 327
---2-нитро- 461
---3-(тиазол-2-ил)- 460
— 2-триметилсилил-1-метил- 424
---2-триметилсилил-З-метил- 455
---1-трифторацетил-5-метил- 457
---6-трифторметил- 455
---2-фенил- 449
— 1-фенилциклопентано[6]- 450
— 6-фтор-3-(2-гидроксиэтил)- 453
— 4-хлор- 463
---7-хлор-461
---З-хлор-2-фенил- 456
---2-ЭТИЛ-451
— 2-этоксикарбонил- 453
---7-этоксикарбонил- 454
---З-этоксикарбонил-1-бензил оке икарбо-нил-452
— З-этоксикарбонил-2-метил- 451
— 5-этоксикарбонил-2-метил- 460
---2-этоксикарбонил-6-фенилтио- 453
3,3-спироциклопропан 440
таллирование 427
4,5,6,7-тетрагидро- 435
4-триметилсилил- 435
3-трифторацетил, реакция с аминами 441
3-трифторметансульфонилокси-1 -фенил-сульфонил- 444
1-фенилсульфонил-, С-депротонирование 430,433
— 3-нитрование 416
3-формил-, 4-таллирование 427
3-формил-2-(фуран-2-ил)-, форматирование 38
2-(фуран-2-ил)-, селективное формилирова-ние38
2,3-хинодиметан 90,91
4,5-хинодиметан 90
хлорирование 418
4-хлормеркуро-4-бром-1-тозил-, Pd(0)-co-
четание 427
2-цинкат-1 -фенилсульфо нил- 433
3-цинк-, Рё(0)-сочетание 61
электрофильное замещение, относительная
реакционная способность 38
Индометацин 414
Ивдофенин 356
Инозин 576
Интал225
Карбазол
1-оксо-420
4-оксо- 456
2-оксо-, 1,2,3,4,4а,9а-гексагидро-4,4,4а,9-
тетраметил- 423
синтез кольца 88
---2,2-диметил-4-оксо- 458
---9-метил- 450
1,2,3,4- тетрагидро-, образование из 3-(4-
гидроксибутил)индола 421
Карбены
стабильные, из 1,3,4,5-тетрафенилимвдазо-
л ил 522
из 1,3-бис(адамантил)имидазолия 522
а-Карболин, 9-ацетил-З-этоксикарбонил-, синтез кольца 270
Р-Карболин 446
1-бензил- 425
3,4-дигидро-1-этил- 420
1,2,3,4-тетрагидро-1.1-диметил- 408
1-фенил- 426
у-Карболин, синтез кольца 458,465
циклогексано[к,1]- 150
З-этоксикарбонил-1-метил- 420
у-Карболин, 1,2,3,4-тетрагидро-1,4-этано-,
синтез кольца 459
Карбонилдиимидазол 510
Карбостирил, см. 2-Хинолон
Кватернизация 33, см. также для индивидуальных гетероциклов
Кверцетин 236
Кверцетрин 236
Кеннера синтез 339
КеторолакЗИ
Кнорра синтез 333—334
пиррола, см. Пиррол, 3,5-бис(этоксикарбо-нил)-2,4-диметил-
Ковалентные гидраты 617
Коелентетразин, синтез 293
Комба синтез 181
Конрада — Лимпаха — Кнорра синтез 181—182
Константы спин-спинового взаимодействия 28
КорринЗЮ
Кофеин 577
Ксантин 577
Ксантоптерин 294
Ксилоза, превращение в фурфурол 394
Кумалиновая кислота
декарбоксилирование 215
синтез кольца 215
Кумаранон 484
Кумарин
алкилирование по карбонильному кислороду 230
2-арилирование 233
восстановление 234-235
номенклатура и нумерация 225
присоединение брома 230
реакция с гидроксидом, раскрытие цикла 231
— с метилмагнийиодидом 232
в реакциях циклоприсоединения 234-235 фотохимические реакции, присоединение к циклопентену 235
---димеризация 235
хлорметилирование 230
Кумариновая кислота 231
Кумарины
4-бром-, Pd(0)- сочетание 233
4,7-дигидрокси- 239
4-метил-, алкилирование по боковой цепи 235 4-пропионовая кислота, кислотно катализируемая циклизация 226
синтез кольца 238
---6-бром-4-гидрокси-3-метил- 241
— 7-гидрокси- 239
---7-гидрокси-4-метил- 238
---4-циклоалкенил- 240
---3-этоксикарбонил- 240
Кумаровая кислота 231
0-Л актами 651
превращение в 4-ацетоксиазетидиноны 662
реакции по карбонильной труппе 662
синтез кольца 665
0-Лактоны, раскрытие цикла при нуклеофильной атаке 662
Ламивудин 257
Ламотригин 625
Леймгрубер—Бачо синтез 453—454
Лефлуномид 540
Лизергиновой кислоты диэтиламид 414
Литиевые производные, превращение в Zn-, В-, Si- и Sn-реагенты 56-58
Литиирование
депротонирование, механизм 48-49 обмен галогена, механизм 50-51 пятичленные гетероциклы 51—53 позиционная селективность 52 растворители для 50
реагенты для 49
региоселективность, контролирующие факторы 48-49
шестичленные гетероциклы 54—56
Лозартан 507
Лоусона реагент 368
Лупинин618
Люциферин 257
Маделунга синтез 455-456
Манниха реакция см. индивидуальные гетероциклы
Мезенгеймера комплексы 39
Мезоионные соединения, структура 25
Меламин 625
Мелатонин 413
Меркаптопурин 577
Металлирование
по боковой цепи 63
конкурентное 48—49
орто-, направленное 49
Метоксантин 166
синтез 191
Метотрексат 294
Метринизадол 507
Менисци реакция 43—46
Митомицин С 652
Морфин 167
Мочевая кислота 577
Мочевины в синтезе кольца пиримидинов 287-288
Насыщенные гетероциклы, синтез кольца 663-667
Нафталин, длины связей 17
1,6-Нафтиридин, 1,2,3,4-тетрагидро-, синтез Оксазолы
кольца 519
Немертеллин 104
синтез 153
Неницеску синтез 460
Ниацин, см. Никотинамид
Никотин 103
Никотинамид 103
Никотинамидадениндинуклеотид 103,652
Нитрен, внедрение 88
Нитрены в синтезе циклов 88
Нитрилоксцды, диполярное присоединение 87
Нитроарены из пирилиев 204
Нитрофуразоны 379
Норборнадиен как эквивалент ацетилена в циклоприсоединении с образованием пиридина 150
Нуклеиновые кислоты 256,575
Нуклеозиды 256,575
Нуклеотиды 256,575
Нуклеофильное замещение
ароматическое, механизм 39,96-97
региоселективность 40-41
в шестичленных гетероциклах 40
Ондансетрон 414
синтез 465
Окислительное присоединение Pd-катализиру-емое 65—66
1,3,4-Оксадиазинон, 2-метоксикарбонил-5-фе-нил- как диен в синтезе 2-пиронов 217
1,2,4-Оксадиазол, синтез кольца
3-метил-5-(3,5-диметоксифенил)- 637
3-фенил-5-(2-амино-4-(2-гидроксиэтокси)-фуран-3-ил)- 637
3-(4-хлорфенилсульфонилметил)-5-этокси-карбонил- 637
1,2,5-Оксадиазолы
депротонирование цикла и раскрытие цикла 635
номенклатура и нумерация 634
синтез кольца, 3-фенил- 638
Оксазин 577
1,4- Оксазинон, 3,5-дихлор-6-фенил- в циклоприсоединении, приводящем к пиридину 150
Оксазиридин
номенклатура и нумерация 659
синтез кольца хирального 660
-----с использованием асимметрического гидроксилирования 660—661
Оксазол
нитрование 511
номенклатура и нумерация 506
Оксазолия соли
2-литий- 1-тригидроборил- 516-517
С-Н-обмен 521
раскрытие цикла 520-521
Оксазолоны
ацил- как диенофилы в циклоприсоединении 518
мезоионные 524
азадиены в циклоприсоединении 518-519 С-алкил-, депротонирование боковой цепи 520
N-алкилирование 509
4-альдегиды и 4-кетоны, изомеризация 519
ANRORC-процесс 514
галогенирование 512
2-галогено-, нуклеофильное замещение 514
С-депротонирование 515-516
2-литий-4-метил-, раскрытие цикла 516
Манниха реакция 513
С-Н-обмен 406,409
протонирование, основность 511
синтез кольца, 5-амино-4-циано-2-цик лопентил- 527
----4,5-бис(этоксикарбонил)- 526
— — 5-(1-/ирет-бутоксикарбонилами-ноэтил)- 528
----2,5-дифенил- 527
— 2-метил-5-фенилсульфонилметил- 527
----5-метокси-4-метоксикарбонил-2-(5-ме-
токси-2-фенилоксазол-4-ил)- 529
— 4-циано-5-метокси-2-фенил- 529
— 4-этоксикарбонил- 527
----4-этоксакарбонил-5-фенил- 528
— 5-это кс и- 2-цикл огексил карбон ил- 527
2-триметилсилильные производные, ипсо-замещение 59
2-триметилстаннил-4-метил-, Рё(0)-сочета-ние71
2-цинк-517
5-этокси-4-метил- 530
2Н-Оксет661
Окси- и тиадиазолы 634
амино- 636
галогене-, нуклеофильное замещение, относительная реакционная способность 635-636
меркурирование 634
относительная ароматичность 634
З-Оксвдопиридиний, диполярное циклоприсоединение 123
Оксиндол
депротонирование 442
реакции с альдегидами 442
таутомерия 442
Оксиндолы
синтез кольца, 6-фтор- 464
---1-этил-4-метил- 464
— 1-этил-6-метил- 464
---3-этил-1-метил- 464
3,3-спироциклогексан-1-метил- 464
Оксираны 657—658,667
Омепразол 560
Орнитидин 653
Октаэтилгемипорфицен, синтез кольца 343
Пааля — Кнорра синтез
пирролов 332
фуранов 394—395
Палладиевые
катализаторы 65—71
- типы реакций 65-71
комплексы, структура 65
Папаверин 167
синтез 191
Паракват 104,121
[6,6] Парациклофан, синтез 372
Патерно—Бючи реакция 667
Пейне перегруппировка 667
Пеларгонидинхлорвд, синтез 244
Пемироласт 618
Пенициллины 651,661
Пентазол, структура 626
Пентизин 639
Пентотал, синтез кольца 288
Пехманна синтез 238—239
Пигменты цветов, винограда, вина 229
Пиколины, см. Пиридины, метил-
Пикте—Гасмана синтез 187
Пикте— Шпенглера синтез 187—188
Пинацианол 167
Пиперазин 258
дикето- из аминокислот 290
Пиперидеин 652
тримеризация 653
Пиперидин
дипольный момент 18
1-метил- 134
нуклеофильность, N-алкилирование 654
основность 654
Пиперидины
конформация 654
ориентация неподеленной пары N 654
Пиразин
алкилирование по N 259
восстановление 269
номенклатура и нумерация 256
Пиразиний, 3-оксид, диполярное циклоприсоединение 280
Пиразин-Н-оксид
2-амино-, реакция с триметилсилилциани-дом 271
2,5-диметил-, реакция с фосфорилхлоридом
271
6-литий-2,5-ди-втор-бугил- 271
Пиразин-2-он, 3-фенил-, нитрование 273
Пиразины
2-амино-, диазотирование 282
2-амино-З-циано- из N-оксида 271
2-бром-5-амино-3-этоксикарбонилметил-6-метоксикарбонил-, Рё(0)-сочетание 268 2,5-диметил-, окисление боковой цепи, селективность 261
внутримолекулярное циклоприсоединение с образованием пиридинов 270
как компоненты пищевых ароматизаторов 257
2-литий- 266
2-литий-2,5-ди-в/яор-бутил-№оксвд 271
З-литий-2-хлор- 266
2-метокси-, нуклеофильное замещение 265 2-метил-, хлорирование 260
N-окисление 260
протонирование, основность 258 радикальное ацилирование 269 в реакциях циклоприсоединения 270 синтез кольца, 2-амино-5,6-диметил-3-кар-боновая кислота 291 ---2,5-дибензил- 290
— 2,5-диметил-З-пропил- 293—294
---2,3-дициано-5,6-дифенил- 291
— 2,5-диэтокси-3,6-дибензил- 290
— 2-этил-З-метил- 291
2-хлор-, нуклеофильное замещение 263
Пиразол
номенклатура и нумерация 539 синтез из пиримидина 261 сульфирование 542
Пиразол-З-он, синтез кольца 551
Пиразол-5-он 4-бром-З-метил-, окисление до аллена 549
3-метил-, 4-бромирование 549 синтез кольца, 3-метил-1-фенил- 550
Пиразоло[2,3-/>]пиридазин. синтез кольца 618
Пиразоло[ 1,5-с] пиридины 2-литий-, расщепление цикла 614 7-литий- 614
Манниха реакция 614
номенклатура и нумерация 611 синтез кольца, 2-метил- 615 — 3-этоксикарбонил- 615 форматирование по Вильсмейеру 614
Пиразолы
алкил-, кислотность боковой цепи 547—548 N-алкилирование 540,544
амино- 549
4(5)-амино- как диен в циклоприсоединении 547
С-ацилирование 542
N-ацилирование 541 восстановление 545-546 галогенирование 542 С-депротонирование 543
N-депротонирование, кислотность 543 1,4-дилитий- 436
N-защитные группы для С-депротонирова-ния 543, 545 5-литий-4-бром-1 -фенил сульфонил- 545 5-литий-1-пирролидин-1-илметил- 544 5-(4-метилфенил)сульфонил- 1-фенилсуль-фонил-, радикальное 5-станнилирование 545 нитрование 541 окси-, таутомерия 548 из 4-пиронов 209 протонирование, основность 540 реакция с цианамидом 541 синтез кольца, 3-амино- 551
— 3-бром-4-метоксикарбонил-5-метил-552
---3,5-диметил- 550
---3- и 5-метил-1-бензил- 551
---2-(тиен-2-ил)- 553
— З-трибутилстаннил-5-этоксикарбонил-
553
— 3-триметилсилилметил- 551
- — 3-формил- 550
таутомерия 539
3-фенил-1-(2-карбоксиэтил)-, внутримоле-
кулярное ацилирование 545
3-циано-1-метил-, фотохимическая изоме-
ризация, механизм 546
Пиразофос 612
2Н-Пиран 654
номенклатура и нумерация 201
4Н-Пиран 654
литиирование 655
номенклатура и нумерация 201
2Н-Пираны, 2-гидрокси-, раскрытие цикла 202
Пирвдазин
алкилирование по N 259
номенклатура и нумерация 256
нуклеофильное алкилирование 261—262
радикальное замещение 269
синтез кольца 285
Пиридазинии
1-дицианометил-З-метил-, 4-нуклеофиль-
ное присоединение 265
1-тозил-, присоединение цианида 283
1-этоксикарбонил-, селективность нуклео-
фильного присоединения 283
Пиридазин-М-оксид
2-метокси-, алкенилирование 271
нитрование 271
3- и 4-нитро-, нуклеофильное замещение 271
реакция с фосфорилхлоридом 253
Пиридин-З-он, синтез кольца
6-гидрокси- 285
6-метил- 284
б-(З-трифторметилфенил)- 281
Пирвдазиномицин 258
Пиридазины
внутримолекулярное циклоприсоединение
270
3,6-дииод-, селективное нуклеофильное замещение 265
6-диметиламино-З-иод-, Рб(0)-сочетание
265
3,6-дихлор-, литиирование 56
2-литий- 266
5-литий-4-/ирегя-бутилкарбониламино- 266
3-литий-2,6-дихлор- 266
4-литий-3,6-дихлор- 266
3-метил-, N-алкилирование, региоселективность 259
4-метил-3,6-дифенил-, синтез кольца 286
4-метокси-, реакция с малононитрилом
265
З-метокси-6-метил-, N-алкилирование, региоселективность 259
6-метокси-Ьт-оксид, реакция с енамином 271
протонирование, основность 258—259
Рейссерта аддукт 283
синтез кольца, 5-бензоил-3,6-бис(метокси-карбонил)-4-триметилсилил- 285
— З-бром-6-этоксикарбонил- 287
— 3,6-ди-тр«и-бутил- 292
— 3-гидроксиметил 285
--4,5-ди(адамант-1-ил)- 286
--4-трибутилстаннил- 268
--З-фенил-5-нитро- 285
3,4,6-трихлор-, нуклеофильное замещение
263
2-хлор- из пиридазин-№оксцда 252
—литиирование 252
3-хлор-, нуклеофильное замещение 263 4-цинк-3,6-диметокси- 268 2-этоксикарбонил- по радикальному замещению 252
Пиридат 258
Пиридин
N-алкилирование 93-95,108
С-аминирование 113
N-аминирование 106 ароматичность 18 С-ацетоксимеркурирование 111
N-ацилирование 107 восстановительная димеризация с Zn/Ac2O 122
восстановление 96,122
С-галогенирование 111
N-галогенирование 107 димеризация, реакция с натрием, никелем 121
— с триметилсиланом 123 дипольный момент 18 канонические структуры 18 литиирование 115-119
— влияние направляющих групп 116 металлирование 115-119
неподеленная пара электронов при азоте 18
С-нитрование 109—110
N-нитрование 105—106 номенклатура и нумерация 103 нуклеофильное замещение галогена 114 --механизм 96—97 --региоселективность 96-97 окисление 111
N-окисление 106
С-Н-обмен 109
образование радикалов с металлами 121 основно-катализируемый С-Н-обмен 115 основность 33-35,105 присоединение электрона 121
N-протонирование, основность 33-35,105 радикальное замещение 98, 120-121 — алкилирование 121
--ацилирование 122
--галогенирование 120
--фенилирование 121
реакция по атому азота с бензальдегидом 140
— с гексакарбонилом хрома 108
- с гексафторацетоном с последующим литиированием 115
-cLiAlH4122
— с тионилхлорвдом 107
структура 18
С-сульфирование ПО
N-сульфирование 106
фотохимическая изомеризация 124
электрофильное замещение 108-111,126-127,
129-130, 142
--влияние заместителей 95
--относительная реакционная способность 94—95
— региоселективность 94-95
электрофильное присоединение по азоту 94, 104-108
Пиридин-Ы-оксид
дипольный момент 100-101
фотохимическое раскрытие цикла 88
4-хлор-, радикальное замещение 26
Пиридин-К-оксиды 140-144
2-алкил-, превращение в 2-ацетоксиалкил-
пиридины 143
О-алкилирование 141
введение С-галогена с потерей кислорода 100
галогенирование 142
меркурирование 142
нитрование 142
нуклеофильное замещение 99
превращение в 2-цианопиридины 143
- в ацетоксипириди 144
присоединение реактивов Гриньяра 143
реакционная способность к нуклеофильному замещению 142
— к электрофильному замещению 142
сульфирование 142
удаление кислорода 141
хлор-, относительная реакционная способность к нуклеофильному замещению 40 электрофильное замещение 99
Пиридинсульфотриоксвд 106,417
превращение в перхлорат пирилия 213
раскрытие цикла под действием оснований 139
Пиридины
алкил-, депротонирование/кислотность боковой цепи 99,131-132
— окисление боковой цепи 111—112
амино-, алкилирование 130
- ацилирование 130
— диазотирование 131
— основность 129-130
- протонирование, региоселективность 130
— структура 130
2-амино-, нитрование 130
2-амино-5-метил-, диазотирование 131
2-ацилтио-, использование в синтезе кетонов 129
2-бром-, реакция с тиомочевиной 129
— Рб(0)-сочетание 69—70
3-бром-, Рс1(0)-катализируемое замещение
на азот или серу 120
- Рс1(0)-сочетание 71,120
— фотохимическое замещение галогена енолятом 125
— внутримолекулярная радикальная циклизация 122
3-бром-5-метилоксокарбонил-, Рс!(0)-соче-тание 71
5-бутил-2-карбоновая кислота, см. Фузари-
новая кислота
2-винил-, присоединение малоната по боковой цепи 133
восстановление до 1,2,3,4-тетрагидросила-ном 122
3-гидрокси-, иодирование 127
— Манниха реакция 127
2,5- дибром-, Рй(0)-сочетание, селективность 70
2,б- ди-трт-бутил-, сульфирование ПО
1,2-дигидро- 652
— 1-алкоксикарбонил- 137
— 1-метоксикарбонил-, реакция Дильса—Аль-
дера 135
1,4-дигидро- 652
— 1-алкоксикарбонил- 136
— 1-арилоксикарбонил- 136
— 3-ацил-136
— 1,4-бис(триметилсилил)- 123
3-диэтилборил- 57
4-диэтилборил- 116
2- и 4-калий- 54
2-карбоновая кислота, биоокисление до 6-пиридона 73
литиирование, влияние заместителей на региоселективность 54-55
литиевые производные 54-55
2-литий- 116
3-литий-116
4-литий- 116
З-литий-2-бром- 153
4-литий-З-бром- 189
3-литий-5-бром-2-метокси- 118
3-литий-4-юрт-бутоксикарбониламино-118
З-литийметил-4-трет-бутоксикарбонила-мино- 118
З-литий-4-хлор- 118
3-литий-2-хлор-4-иод- 119
4-лити-2-хлор-3-иод- 119
3-литий-4-хлор-2-фениламинокарбонил-118
З-магний-2-бром- 119
3-магний-2-/мрети-бутиламинокарбонил- 117 4-магний-2-хлор- 119
2-магний-5-циано-119
4-метансульфонил-, нуклеофильное замещение 41
метил-, кислотность водородов боковой цели 131-132
2-метил-, реакции по метильной группе 62-63
2-метокси-5-нитро- 113—114,
— ВНЗ по С(2) 43
нахождение в природе 103
4-нитро-, нуклеофильное замещение 41
З-нитро-6-метокси-, ВНЗ по С(2> 114 нуклеофильное С-алкилирование и арили-рование 112-113 производство 103
синтез кольца, З-гидрокси-6-изопропил-151
---З-гидрокси-2-метил- 149
---З-гидрокси-6-метил- 151
---3,5-диацетил-2,4,6-триметил- 147
---1,4-дигвдро 144-146
---1,4-дигидро-4-(3-нитрофенил)-5-эток-сикарбонил-3-этоксиэтоксикарбонил-6-ди-этоксиметил-147
---дигидропирано[3,4-Л] пиридин 270
---дигидропирано[3,4-с]пиридин 270
— 2,3-диметил-4-карбоновая кислота 149
—4-диэтиламино-5-метил-3-этоксикарбо-нил- 253
---из 1-аза-1,3,5-триенов 150
---4-метилтио-2,6-бис(пиридин-2-ил)- 145
---2-метокси-4-метил-5-нитро- 341
---1'-оксоциклопентано[с]-6-метил-2-про-пил- 145
---1,2,3,6-тетрагидро-1-лмре/д-бутоксикар-бонил-2-метоксикарбонил- 666
---3-циано-6-этоксикарбонил-2,4-диме-тил- 148
---циклопентано[д]-6-метил- 145 1,2,5,6-тетрагидро- 134
2,3,4,5-тетрагидро-, см. Пиперидеин З-трибутилстаннил-2-бром-, Рс!(0)-сочета-ние 153
2,3,6-триметил-, биоокисление до 6-монокислоты
2-триметилсилил- 58
4-триметилсилилокси-, N-алкилирование 128
2-триметилстаннил-, ылсо-замещение 59, 120
— Рб(0)-сочетание 120
4-триметилстаннил-, использование 4-заме-щенных в качестве защитной группы 137 2,3-хинодиметан 89
хлор-, относительная реакционная способность в нуклеофильном замещении 40 3-хлор- из пиррола 328
— Рс1(0)-сочетание 70
4-хлор-, нуклеофильное замещение бензотриазолом 645
4-хлор-3-иод-2,6-диметил-, селективное Рс1(0)-сочетание 70
6-хлор-2-метил-, биоокисление до кислоты
73
2-цинкат- 62
2-этинил-, гидрирование 133
Пиридиния трибромад 107
бромирующий агент в твердой фазе 674
Пиридиния ионы, структура 19
Пиридинии 108,133-140
алкил-, депротонирование боковой цепи 132 l-mpewi-бутилдиметилсилилтрифлат 137 внутримолекулярная нуклеофильная циклизация 610-611
восстановление 134-135
N-дезалкилирование 140
1-(2,4-динитрофенил)-, раскрытие цикла под действием оснований 139-140
N-имид-, дилолярное циклоприсоединение 615
2-литий- 1-трифторбори л-4-метил- 54
1-метил-, присоединение аниона нитрометана 138
— фотохимическая реакция с водой 125
1-метил-З-нитро-, присоединение малонат-аниона138
окисление 134
присоединение реактивов Гриньяра 136
1 -трифтометансульфонил-, 4-присоединение фосфина 138
1-фтор- 107
— 2-присоединение эфира енола 138
хлор-, относительная реакционная способность в нуклеофильном замещении 40
6-этил-З-метокси-1 -метил-, фотохимическая циклизация 125
Пиридиний-1-сульфонат, см. Пиридинсуль-фотриоксвд
Пиридин-4-сульфоновая кислота, натриевая соль 106-107
Пиридо[3,2-ЭДбензотиофен, синтез кольца 151
Пиридон-анионы, алкилирование 128
Пиридоны
анионы, образование при депротонировании 98
галогенирование 127
замещение кислорода на азот 129
---на галоген 129
канонические структуры 20
кислотность 126
С-металлирование 127
нитрование 127
основность 126
структура 20,126
таутомерия 20,126
электрофильное замещение, механизм 36, 127
---региоселективность 126—127
2-Пиридон, реакции с диенофилами 123
4-Пиридон, О, N-ацилирование 126
2-Пирвдоны
1,3-бис( 1 -метил-2-пиридон), фотохимическая циклизация 124
4-литий-1-литий карбоксил ат 128 — из 1-метилпиридиний иодида 134 1-метил-, электрофильное палладирование с последующей реакцией Хека 127
З-метокси-1 -тозил- в реакции Дильса—Альдера 123 4-метокси- из N-оксцда 144
синтез кольца, 4,5-бис(метоксикарбонил)-150
---З-циано-6-метил- 148
---3-циано-4-(4-метоксифенил)- 149
— 3-циано-4-этоксикарбонил-6-метил- 148 1-триметилсилилметил-, ипсо-замещение 128 4-трифлат-, Рс1(0)-сочетание 120
4-Пиридоны 1-бензоил-2,3-дигидро-2-метил-, твердофазный синтез 672
1,2- бис(4-пиридон- 1-илметил)бензол, фотохимическая циклизация 125 2-литий-1-метил- 128
синтез кольца, 1-метил-5-фенил- 146 ---из 4-пиронов 209
Пирцдо[4,3-с]-2-пирон, синтез кольца 244
Пиридоксин 103 синтез 152,530
Пирилий
ANRORC-реакции 198-199,202-203 канонические структуры 19—20,199 номенклатура и нумерация 201 нуклеофильное присоединение 198—199 присоединение гидроксида 202 — воды 202 структура 19
Пирилия перхлорат, синтез кольца 213 Пирилии восстановление цикла 205 депротонирование алкила боковой цепи 206 конденсация по алкилу боковой цепи 206 нуклеофильное присоединение 202-204 3-оксидо-, диполярное циклоприсоединение 206 превращение в нитроарены 204 — в пиридины 203 присоединение цианида 204 — нитрометан-аниона 204 — металлорганических нуклеофилов 203-204 протонный обмен 201-202 реакция с аминами 203
синтез кольца, бис(циклогексано)[ЭД[е]- 214 ---2,6-ди-тре/п-бутил-4-метил- 214 ---2,6-диметил- 213 ---2,4,6-триметил- 214 ---2,4,6-трифенил- 212
Пириметамин 258
Пиримидин
N-алкилирование 259
бромирование 260 восстановление 269 М,М'-диалкилирование 259 номенклатура и нумерация 256 реакция с гидразином 261
Пиримидин-Ы-оксид, 1(4-пиридил)-, синтез кольца 270-271
Пиримидины
5-аллил-2,4,6-трихлор-, с нуклеофилами, региоселективность 278
2-амино-, бромирование 282
—Димрота перегруппировка 282
— кватернизация 281
5-бром- 260
— радикальное замещение по С(4) 269
— из фурфурола 382
5-бром-2,4-ди-лиретк-бутокси-, Рб(0)-соче-тание 279
5-бром-2,4-дихлор-, Рс1(0)-сочетание по С(4) 268
5-бром-2-хлор-4-стирил-, Рб(0)-сочетание по С(5) 268
внутримолекулярная циклизация с образованием пиридинов 270
галоген-, Рд(0)-сочетание 279
2,4-диамино-, диазосочетание 282
4,5-диамино-, синтез кольца птеридинов 294 5,6-диамино-, синтез кольца пуринов и птеридинов 282
2,4-ди-/ирет-бутокси-5-борная кислота, Рб(0)-сочетание 268
2,4-диметил-, депротонирование метильной группы 254
4,5-диметил-, бромирование по метильной группе, региоселективность 283
2,4-дихлор-, селективность нуклеофильного замещения 263
2,4-дихлор-б-метокси-, селективность нуклеофильного замещения 264
2,4-дихлор-5-фтор-, селективность дехлорирования 264
литиирование, селективность 265-266
4-литий- 266
2-литий-З-бром- 55
4-литий-5-бром- 267
5-литий-2,4-диметокси- 266 5-литий-2,4-дихлор- 55,266 6-литий-2,4-дихлор- 55
2-метансульфонил- в нуклеофильном замещении 265
2-метансульфонил- в нуклеофильном замещении 265
2-метансульфонил-5-этоксикарбонил-, нуклеофильное замещение 270
метил-, радикальное замещение по метильной группе 283
4-метил-, депротонирование метильной группы 283
4-метокси-, нуклеофильное замещение 265 N-окисление 259—260
присоединение аллилолова и этилхлороформиата 283
протонирование, основность 258—259
радикальное алкилирование, селективность 269
синтез кольца, 2-амино-5-фенилсульфонил-
288
---4-амино-5-циано-2-метил- 292
---5-метил- 642
— циклогексано[е]- 288
---циклопентанор/]-289
2-сульфонил-, нуклеофильное замещение, расщепление кольца в твердой фазе 674 4-трибутилстаннил- 58
5-трибутилстаннил-2-метилтио-, Pd(0)-co-четание 268
2,4,6-триметил-, депротонирование метильной группы, региоселективность 283 4-фенил-, радикальное замещение 44
5-хлОр-2-метилтио-4-триметилстаннил-, Рб(0)-сочетание 268
2-хлор-, катализ триметиламином замещения С1~ 264
— нуклеофильное замещение, механизм 252
---— относительная реакционная способность 41
— Pd(0)- сочетание 70
— 6-нуклеофильное присоединение с сохранением галогена 262
4-хлор-6-бензиламино- в реакции с метоксиламином 264
2-хлор-5-фенил-4-стирил-, Рб(0)-сочетание 268
Пиримидин-2,4-дион, см. Урацил
2-Пиримидоны
4-амино-, иодирование 279
4-амино-5-иод-, Рб(0)-сочетание 279
4-арилсульфонилокси-, присоединение реактивов Гриньяра по С(б) 274
6-метил, металлирование по боковой цепи 277
синтез кольца, 2,4-диметилциклогексано[е]-
290
---2,4-дифенилциклобутано[е]- 290
2-тио-4-( 1,2,4-триазол- 1-ил)-, нуклеофиль-
ное замещение по С(4) 278
4-Пиримидоны
2-метилтио-З-бензилоксиметил-, нуклео-
фильное замещение 276
синтез кольца, 6-амино-2-метил- 288
---6-этил- 288
2,3,6- триметил-, фотохимическая изомеризация 281
2-этокси-, замещение О на S 278
6-Пиримвдоны, синтез кольца
4-гидрокси- 288
4-гидрокси-2-метил- 292
2-Пирон(а-пирон)
галогенирование 207
нитрование 207
номенклатура и нумерация 201
протонирование карбонильного О 207
реакция с аммиаком 208
синтез кольца 216
— из кумалиновой кислоты 215
структура 207
фотохимическая циклизация 211
фотохимическое раскрытие цикла 211
в циклоприсоединении 209—211
4-Пирон (у-пирон)
алкилирование по карбонильному О 207 декарбоксилированием хелидоновой кислоты 217
номенклатура и нумерация 201
протонирование карбонильного О 207
раскрытие цикла гидроксидом 208
структура 207
Пироны, канонические структуры 20
2-Пироны
5-бром-, в реакциях циклоприсоединения 210
— Рё(0)-сочетание 209
5-винил- как диен в циклоприсоединении 211
4-гидрокси-6-метил-, алкилирование по метилу боковой цепи 212
как диены 209-211
5-карбокси-, см. Кумалиновая кислота
как лактоны 208
синтез кольца, З-ацетиламино-6-ацетокси-метил- 216
--6-карбокси-5-этил- 216
— 5-метил-б-триизопропилсилилциклопен-тано[с]- 217
---4 и 5-трибутилстаннил-6-метоксикарбо-нил-3-
--фенил- 217
— 5-этил-3-метил-4-пропил- 216
--3-этоксикарбонил-4-бутил-6-метил—
215
4-Пироны
алкил-, конденсация по боковой цепи 211
2,5- диэтил-, превращение в тозилимин 211
конденсация по С(4) 205
как р-окси-а, р -ненасыщенные кетоны 200
реакция с аминами 208
— с гидразинами 209
— с гидроксиламном 209
— с реактивами Гриньяра 208
синтез кольца, 3-ацетил-2-гидрокси-6-ме-тил-219
--2,6-дикарбоновая кислота 217
--2,6-диэтил-3,5-диметил- 218
--2-(4-метилфенил)-6-фенил- 218
--6-метилциклогексано[6]- 219
--2-(3-фурил)- 218
— — З-этоксикарбонил-6-фенил- 218
фотохимические превращения в 2-пироны 206
--в циклопентаноны 206
Пиррол
алкилирование 317 ароматичность 20-21 С-ацилирование 315—317 Вильсмейера ацилирование 316 галогенирование 314-315 С-депротонирование 322 димеризация 320 дипольный момент 21 длины связей 21 канонические структуры 21 Манниха реакция 320 неподаленная пара электронов азота 21 нитрование 313 номенклатура и нумерация 309 радикальное бензоилоксилирование 325 реакция с ацетоном 319 — с гидроксиламином 312 сочетание с ArNz+ 320-321 сульфирование 313 сульфонил ирование 314 тримеризация 320 электрофильное замещение, влияние заместителей 306
---сравнение с анилином 305
------региоселективность 305 2Н-Пиррол, 3,4-дигидро-, см. Пирролин Пирролальдегиды, восстановление 302 Пирролидин 652
дипольный момент 21 нуклеофильность, N-алкилирование 654 основность 654
Пирролидины 1-метил-, основность 306 2-метокси-1-метоксикарбонил- электрохимическим окислением 653
синтез кольца, 1-бензил-3,4-бис(метокси-карбонил)-2-фенил- 666
Пиррол изин, литиирование 619
ЗН-Пирролизин, номенклатура и нумерация 619
Пирролил-анион 322 канонические структуры 47 реакции с электрофилами, региоселективность 322-323
Пирролин 652 тримеризация 653 Пирролин-2-оны 331 З-Пирролин-2-он, таутомерия 331—332 4-Пирролин-2-он, таутомерия 331 4-Пирролин-З-он, таутомерия 331 Пирролкетоны, сопряжение 330 Пирроло[1,2-с]пиразин
номенклатура и нумерация 611 синтез кольца, 7-бутил- 617 ---4-триметилсилил- 617
Пирроло[3,2-£>]пиридин, см. 4-Азаиндол Пирроло[3,2-с]пиридин, см. 5-Азаиндол Пирроло[2,3-6]пиридин, см. 7-Азаиндол Пирроло[ 1,2-с]пиримидин, 1-метил-6-(4-ме-тилфенил)сульфонил-, синтез кольца 618
Пиррольные реагенты Гриньяра, С-ацилирование 323
Пирролия катионы 312
Пирролы
алкил-, бромирование по боковой цепи 330
N-алкилирование- 322 2-аминирование 332 амино- 332
N-арилирование, Рд(0)-катализ 323
ацил- 330
N-ацилирование 322
2-(2-ацетамидо-2,2-бис(этоксикарбо-нил)этил)- 329
2-борная кислота-1-фенилсульфонил- 325
1-бутил-, синтез кольца 333
2-трет-бутилдиметилсилилокси-\-mpem-бутоксикарбонил, реакция с альдегидами 331
\-mpem -бутокси карбонил- 322
— 2- и 2,5-дибромирование 315
— как диен в циклоприсоединении 327 l-mpem-бугоксикарбонил-З-гексил-, селективное литиирование 323—324
3-винил-1-фенилсульфонил- как диен в циклоприсоединении 327 восстановительное алкилирование 317 восстановление 325—326
галоген- 331
2-гидрокси-, таутомерия 331
З-гвдрокси-1 -метил-, таутомерия 331
С-депротонирование 322
N-депротонирование 322 2,5-дигидро- 326 2,5-дигидро-3-метил-1-фенил-, дегидрирование 341
2,3-дигидро-1-метоксикарбонил- 653 2,5-дигидро-1-фенилсульфонил- 326 2,5-дилигий-1-трет-бугоксикарбонил- 324 2,5-диметил-, биоокисление до монокислоты 73
2-диметиламинометил-, замещение N на нуклеофилы 329
3,4-диметил-2-карбоновая кислота, декарбоксилирование 330
2,4-диметил-3-этил-5-этоксикарбонил-, селективное окисление 2-метильной группы 321
2,3-динитро-1-метил-, селективное нуклеофильное замещение 321
2,5-динитро-1 -метил-, нуклеофильное замещение 321
N-защитные группы для С-литиирования 322,324
2-карбоксамид-1 -трет-бугоксикарбонил-, восстановление по Берчу 326
З-карбокси-1-адамантилоксикарбонил-, восстановление по Берчу и улавливание 326 кислотность 322
2-литий, 1-тде/л-бутиламинокарбонил- 324
— l-wpem-бугоксикарбонил- 52
- 1-метил-324
— 1 -триметилсилилэтоксиметил- 324
2-литий-5-бром-1-трет-бутоксикарбонил-
324
5-литий-1-/претп-бутоксикарбонил-3-гек-сил- 322
3-литий-1-изопропилсилил- 325
2-литий-1-фенилсульфонил- 325
2-метансульфонил-, внутримолекулярное
нуклеофильное замещение 321
1-метил-, 2-аминирование 332
— осмиевый комплекс как диен в циклоприсоединении 327
— радикальное замещение 46-47
4-метил-3-этоксикарбонил-2,5-дииод-, из
2,5-дикислоты 330
1-метоксикарбонил-, реакция с синглетным кислородом 327
— в циклоприсоединении 327
основность 311—312
протонирование 311-312
реакция с альдегидами 317-318
— с карбенами 328
— с окислителями 321
— с пирролальде гидами 319
синтез кольца, З-ацетил-4-метил- 337
---3-ацетил-2-этоксикарбонил-4-метил-,
этиленацеталь 337
— 3-ацетил-5-этоксикарбонил-4-этил-2-
метил- 342
---1-бензил- 333
---3,4-бис(метоксикарбонил)-2,5-дифе-
нил-339
---3,5-бис(этоксикарбонил)-2,4-диметил-
334
---1-бутил-5-этил-2,3-диметил- 340
— — 5-бутил-3-этоксикарбонил-2,4-диме-
тил-335
---4-гидрокси-2,3-бис(метоксикарбонил)-
5-изопропил- 336
---2,3-дигидро-5-амино-4-метоксикарбо-
нил-1-тозил- 658
---2,3-дигидро-4-иод-2-метоксикарбонил-
5-фенил-1-(4-метилфенил)сульфонил- 340
---2,5-диметил- 332
---1-диметиламиноциклопентано[£]- 340
—> 3-метил-1-фенил- 341
---1-метоксикарбонилметил- 333
---З-нитро-2-бутил- 335
---3-этоксикарбонил-2,4-диметил- 334
---3-этоксикарбонил-2,5-диметил- 336
---3-этоксикарбонил-4-метил-2-карбоно-
вая кислота 334
---2-этоксикарбонил-5-(пиррол-3-ил)- 339
---2-этоксикарбонил-З-этил- 339
структура 20-21
2-(тиен-3-ил)-, селективное формилирова-ние38
2-тозил- 1-фенилсульфонил-, радикальное замещение 325
1-(3-(1,2,4-триазин-2-ил)проп- 1-ил)-, внутримолекулярное циклоприсоединение 328
3-трибугилстаннил-1 -три изопропилсил ил-325
1 -триметилсилилэтоксикарбонил-, присое-
динение карбеноида 328
5-триметилстаннил-, ыисо-бромирование
322
1-триизопропилсилил- 322
— галогенирование 315
— нитрование 313
1-триметил сил ил метил-, д/лсо-замещение 60
1-фенилсульфонил-, С-ацилирование 317
— тиоцианирование 314
физические свойства 309
2-циано-, фотохимическая изомеризация в
3-циано-329
2-цианометил- 329
электрофильное замещение, относительная
реакционная способность 37—39
Порфирин из порфириногена 318
Порфириноген, синтез кольца 318
Порфобилиноген 309
синтез 341
Приальдоксим 104
Протонирование 33-34, см. индивидуальные гетероциклы
Протопорфирин IX 310
Птеридины 282, 294-295
Птерины 294
Пурин
номенклатура и нумерация 575
разложение в кислотах 579
таутомерия 575
Пурин-2,б'-дион
8-нитрование 584
синтез кольца, 1-метил- 282
--2-тио-3-метил-8-фенил- 598
--2-тио-9-рибозил- 599
Пуринии 580
Пурин-6-он
2-амино-, диазотирование 594
синтез кольца, 8,9-диметил- 600
--2-трифторметил-9-(4-метилфенилме-
тил)- 599
Пурин-8-он, синтез кольца, б-амино-9-бензил-599
Пурины
N-алкилирование 580
— через анионы 581
— 7/9-селективность 581
амино-, N-алкилирование боковой цепи с
помощью перегруппировки Димрота 580
— диазотирование 594
— замещение N галогеном 595
2-амино-, диазотирование 594
6-амино-, алкилирование боковой цепи 594
— превращение в 6-(1,3,4-триазол-1-ил)- 588
2-арилсульфонил-, нуклеофильное замещение 587
2-ацетиламино-6-дифениламинокарбони-локси-, селективное Ы(9)-алкилирование, синтез перегруппировкой Димрота 580
6-бензиламино-2-(2-гидроксиэтил)амино-, твердофазный синтез 671
6-бром-, замещение на N с Р0(0)-катализом 588
8-бром-2,6-диамино-, Рб(0)-сочетание 591
галогенирование 583
галогено-, катализ триэтиламином 583
— нуклеофильное замещение, Си-катализ 587
— региоселективность 586
2-иод-4-амино-, нуклеофильное замещение 587
2-иод-6-амино-, Рс1(0)-сочетание 590
литиирование 589-590
8-метий-6-амино- 589
6-литий-9-(тетрагидропиран-2-ил)- 589
8-литий-9-(геграгидропиран-2-ил)- 589
8-литий-6-хлор- 590
8-литий-6-хлор-2-триметилсилил- 590
8-метил-, N-защита 593
N-окисление 583
окси-, N-алкилирование 591
— О-алкилирование и ацилирование 591-592
— О-ацилирование, катализ пиридином 592
— N-депротонирование, кислотность 591
— замена кислорода на галоген 592—593
----на азот 593
----Has 593
- реакция с фосфорилхлоридом 593
- таутомерия 591
окси- и амино-, сочетание с ArNa+ 584
N-протонирование, основность 579
реакционная способность боковой цепи 596
синтез кольца, 3-амино- 597
----6-амино-2,8-диметил- 601
----7Н-6-амино-7-метил- 600
— 6-амнно-3-метилтио-9-(зашищенный)
рибозил- 602
----7-бензил-7Н- 600
— 9-бензил-2,6-бис(этоксикарбонил)’ 600
— 2,6-диамино-8-(4-метоксифенил)- 597
----8-метил- 597
тио- 595-596
6-( 1,3,4-триазол- 1-ил)- в нуклеофильном замещении 588
2,6,8- трихлор-, реакция с нуклеофилами, региоселективность 593
6-хлор-, К1(0)-сочетание 590
— превращение в 6-бензоил- 588
6-хлор-2-амино-9-(4-гидроксибутил)- 598
6-хлор-9-рибозил- 601
Пищевые ароматизаторы 257
рКа для депротонирования пятичленных гетероциклов 47
Планше перегруппировка 421
Поли(пиррол) 676
Поли(тиофен) 676
Померанца—Фрича синтез 185
Пфитценгера синтез 184,191
Радикальное замещение
влияние растворителей 46
механизм 43
Радикалы
алкил 44—45
ацил 44-45
генерирование 44-46
гидроксиметил 46
нуклеофильные 43
электрофильные 43,46
Ралоксифен 479
Ромберга—Бэклунда реакция 659
Ранитидин 379
синтез 400
Реакция сочетания (Pd-катализируемые) 64-66,69-71
Регуляторы роста растение 258
Резонанс ароматический, энергии 17
Рейсерта реакция, см. индивидуальные гетероциклы синтез 452—453
Рибавирин 625
Рибонуклеиновые кислоты 575,577-579
Рисперидон 560
Робинсона—Габриэля синтез 527
Сахарин 560
Семпервирин618
Сенеционин 619
Серотонин 413
синтез 420,466
Сидноны
номенклатура и нумерация 634
синтез кольца 638
Силаны
реакция 58-60
синтез 56-58
Силденафтил 577
синтез 56-58
Силденафтил 577
синтез 602
Скатол, см. Индол, 3-метил-
Скопин 652
Сскраупа синтез 182-183
Sn(EA) 115
Станнаны
реакция 58-60
синтез 56-58
Ставудин(б4Т) 256
Стауроспорин-агликон, синтез 465—466
Сугасава синтез 461
Сульфапиридин 104
Сульфирование, см. индивидуальные гетероциклы
Сульфолан, см. Тетрагидротиофен-1,1-диоксид
Тартразин 540,549
Таутомерия 23-24
Твердофазные реакции 671—674
Тейлора синтез 295
Темозоламнид 612
2,2': 5',3”-Тертиофен, синтез 372
Тетрагидрофолиевая кислота 294
Тетрагидрофуран 379,577
основность 306
раскрытие цикла 662
Тетрагидрофураны
2,5-диметокси- 382
2-литий-, фрагментация никла 662
Тетрагидропиран 654
Тетрагидропираны, конформация 654—655
Тетрагидротиофен- 1,1-диоксид 651
Тетрагидротиофен, основность 306
1,2,3,4-Тетразин, номенклатура и нумерация 639
1,2,3,5-Тетразин, номенклатура и нумерация 639
1,2,4,5-Тетразин
3,6-бис(3,5-диметилпиразол- 1-ил)-, нуклеофильное замещение 642
3,6-бис(метилтио)-, нуклеофильное замещение 640
---присоединение 640
3-гидразино-6-(3,5-диметилпирадол- 1-ил)-, гидрогенолиз 642
номенклатура и нумерация 639
синтез кольца, 3,5-бис(пиридин-2-ил)- 643
Тетразол
кислотность 626
номенклатура и нумерация 626
Тетразолий анион, канонические структуры 47
Тетразолы
амино-, диазотирование 631
5-бром-1-метил-, нуклеофильное замеще-
ние 630
иодирование 629
5-литий-1-метил- 630
5-литий-1-(4-метоксифенилметил)- 630
Манниха реакция 629
синтез кольца, 5-фенил- 633
---5-фенил-1-метил- 633
---1-фенил-5-тиол- 633
---1-(2-цианоэтил)-5-(4-метилфенил)- 633
---1-цикл о гекс ил-5-метил- 633
---5-этоксикарбонилметил- 633
5-фенил-, 2-алкилирование 629
5-фенил-2-тре/я-бутил-, 4-алкилирование
629
1-фенил-5-окси-, замещаемая группа, Ni(0)
630
Тетратиафульвален 676—678
литиирование 667-668
синтез кольца 667
триметилстаннил-, Рс1(0)-сочетание 678
Тетрацианохинодиметан 677
Тетроновая кислота 390
синтез кольца 398
Тиенилгалогениды, нуклеофильное замещение 366
1,2,3-Тиадиазол литиирование 635 4-карбоновая кислота, синтез кольца 638 номенклатура и нумеризация 634
1,2,4-Тиадиазол
номенклатура и нумерация 634 синтез кольца, 3,5-дифенил- 638
---5-хлор-З-метил- 638
1,2,5-Тиадиазол
номенклатура и нумерация 634
синтез кольца 639
---3,4-дифенил-, S,S-диоксид 639
— 3-фталимидо- 639
1,3,4-Тиадиазол
номенклатура и нумерация 634
синтез кольца 638
---2-амино-5-бензил- 638
---5-фенил-2-тион- 638
---2-этиламино- 638
1,2,3-Тиадиазолы, синтез кольца 4-(4-бромфенил)-5-метил-, твердофазный синтез 672
5-тио- 638
Тиазол
нитрование 511
номенклатура и нумерация 506
синтез 523
синтез кольца 526
Тиазолии
илиды как катализаторы бензонковой конденсации 522
3-(4-иодбут-1-ил)-, раскрытие цикла 521
С-Н-обмен 521
Тиазолон мезоионный 524
Тиазол-2-он, бромирование 523
Тиазолы
N-алкилирование 508—510 амино-, галогенирование 523 — диазотирование 523
5-бром-, Pd-катализируемое карбонилирование 71
галогенирование 512
2-галогено-, нуклеофильное замещение 514
С-депротонирование 515
2,4-дибром-5-формил- из тиазолвдин-2,4-диона 523
2- и 5-карбоновые кислоты, декарбоксилирование 511
2-литий-4-бром- 516
4-метил-, биоокисление до кислоты 73 2-метил-4-циклобутил-, конденсация по ме-
тильной труппе 520
С-Н-обмен511
превращение в 5-гидроксиметилтиазол 523
протонирование, основность 511
синтез кольца, 2-амино- 526
— 2,4-диметил- 527
— 2-метилтио- 526
----4-метоксикарбонил-2-( 1 -ли/>ет-буток-сикарбониламино-2-метоксиэтил)- 529 сульфирование 512
4-триметилстаннил- 60,516
4-триметилстаннил-2-триметилсилил- 516
2-хлор-, восстановительное удаление галогена 523
2-цинк- 61
Тиамин 506
синтез 530-531
Тиаминопирофосфат 521
1,2,3,4-Тиатриазолы
амино-, взаимопревращение в тетразолил-тиолаты 637
деградация цикла 636-637
5-этокси-, превращение в этилцианат 637
Тиено[Л] изохинолин, фотохимическая циклизация в 365—366
Тиено[2,3-</]имвдазол, синтез 531
Тиено[3,2-£]пиррол, 2-этоксикарбонил-, синтез кольца 462
Тиено[2,3-6]тиено[3,2-е]пиридин, 3,5-диами-но-4-фенил-, синтез кольца 487
Тиено[2,3-6]тиофен, синтез кольца 371
Тиено[3,4-£]тиофен, синтез кольца 372
Тиено[3,4-с]хинолин, синтез кольца 71
2Н-Тиет661
Тиетан 661
Тиетаны, синтез кольца 667
Тииран 656
Тииранкарбоновая кислота 652
Тииран-S,S-оксиды, элиминирование SO2 659
Тиираны
раскрытие цикла под действием нуклеофилов 658
синтез кольца из эпоксидов и тиоцианата 667
удаление серы и превращение в алкены 658
Тимидин 257
Тимин 272,578
Тиоиндоксил, 4- и 7-хлор-, синтез кольца 485
З-Тиолен-2-он
альдольная конденсация 367
таутомерия 367
4-Тиолен-2-он, таутомерия 367
Тиомочевина в синтезе кольца пиримидинов 288
Тио-2-пиридон, S-алкилирование 129
Тио-2-пиримидон, синтез кольца 288
Тиофен
алкилирование 356
ацилирование 355
восстановление 364
галогенирование 354-355
С-депротонирование 360 дипольный момент 22 Манниха реакция 357 меркурирование 357 металлирование 51-52,360 нитрование 353—354 номенклатура и нумерация 352 открытие 352 протонирование 353 реакция с изатином 352,356 — с карбенами 358 — с малеиновым ангидридом 364—365 структура 22 сульфирование 354 тримеризация 353 хлорметилирование 356
электрофильное замещение, влияние заместителей 306
— региоселективность 304
Тиофен-S,S-диоксиды как диены в циклоприсоединении 359,365
Тиофений илцды 358 катионы 357,358
Тиофен-2-карбоновая кислота, литиирование, региоселективность 52
Тиофен-5-оксиды как диены в циклоприсоединении 284
Тозилметилизоцианцд в синтезе кольца имидазолов, тиазолов и оксазолов 528 пирролов 356-357
Трансметаллирование Рс1(0)-катализируемое 67
Тиофены
2-алкенилирование при присоединении карбенов 358
S-алкилирование 357 амино- 368 3-арилалкенил-, фотоциклизация 365-366 арилирование 2-радикальное внутримолекулярное 363 ---фотокатализируемое 363 2,5-бис(триметилсилил)- 360
3,4-бис(триметилсилил)-, «лсо-моноиоди-рование 363
— илсо-замещение 360
3-борная кислота, нсло-замещение Манниха 357
— Рб(0)-сочетание 363
3-борная кислота, 4-формил, Рд(0)-сочета-ние71
3-бром- из 2-бромтиофена 362
3-бром-2-иод-5-метил-, Рс1(0)-сочетание 362 2-лпрет-бутилдиметилсилилокси-, реакция с альдегидами 367
галогено-, нуклеофильное замещение 359 — селективное восстановительное удаление сс-галогена 355
гидрокси-, алкилирование 367
2-гидрокси-, таутомерия 367 Гриньяра реагенты 360-361
2,5-дигидро-2-карбоновая кислота 364
3,4-дидегидро-, циклоприсоединение 360
2,5-дикарбокси-3,4-дидецил-, двойное декарбоксилирование 366
2,5-дилитий- 360
2,5-димеркурирование 357
2,5-дихлорирование 354
2-иод-, Рс1(0)-катализируемое превращение в борный эфир 57
— нуклеофильное замещение 359
2-иод-З-бутил-, Рй(0)-сочетание 363
З-иод-4-триметилсилил-, Рб(0)-сочетание 363
литиирование с орто-содействием 360 3-(2-карбоксиэтил)-, региоселективное внутримолекулярное ацилирование 355 2-литий- 361
3-литий-, расщепление никла 362
2-магний- 361
3-магний- 361
5-метил-2-гидрокси-, таутомерия 367
З-натрий-2-бром- 362
2-нитро-, ВНЗ 3-замещение 359
— ВНЗ 5-замещение 42
5-нитро-2-(тиазол-2-ил)-, селективное нит-
рование 39
S-окисление 358-359, 365
окси-367
таутомерия 367
S-оксид как диен в циклоприсоединении 284
превращение в оксоциклопентано[£>]- 355
присоединение карбенов 358
реакции с нуклеофилами 359
синтез кольца, 2-ацетил-3-амино-4-циано-5-метилтио- 371
— 5-ацетил-2-метилтиооксациклогекса-
но[с]- 371
---2,5-бис(циклопропил)- 369
---3,4-бис(4-метоксифенил)-2,5-дикарбо-
новая кислота 369
— 2,5-дигидро-2-этил-5-метил- 370
— 2,5-диэтил- 369
---3-метил- 369
---2-метил-5-фенил- 368
— 3-нитро-2-(пирролвдин-1-ил)-3-фенил-372
— циклобутан[/?]циклобутан[^тиофен 370
---циклогексано[с]-2-метоксикарбонил-370
— 2-этил-5-метил- 370
2,3,4,5-тетраметил-, селективное 2-моно- и
2,5-дибромирование по боковой цепи 366
2-(тиазол-2-ил)-, селективное нитрование
39
2,3,5-трибромирование 355
2,3,5- трибром-, восстановление до 3-бром-
355
---до 2,5-дибром- 355
---до 2,3-дибром- 355
2-трибутилстаннил- 363 удаление серы гидрогенолизом 364,372
2-формил-, 5-гидроксиалкилирование 357 фотохимическая димеризация 366
2-(фуран-2-ил)-, селективное литиирование 52
электрофильное замещение, относительная реакционная способность 37
Тразадон612
синтез 616
Траубе синтез 597-598
1,2,3-Триазин
номенклатура и нумерация 639 радикальное замещение 641
реакция с тетрацианэтиленэпоксидом 641 синтез кольца 642
1,2,4-Триазин
3-метилтио-, нуклеофильное присоединение 640
- ВНЗ по С(5) 640
3-метокси-, реакции с нуклеофилами 640 номенклатура и нумерация 639
синтез кольца, 3-метилтио-5,6-диметил- 642
1,3,5-Триазин
номенклатура и нумерация 639
синтез кольца 643
---2-(3-нитрофенил)- 643
---2,4,6-трис(хлорметил)- 643
1,2,3-Триазинии, 2-(1-хлорэтил)оксикарбонил-4,6-диметил-, присоединение енолов 641
2,4-Триазины
бромирование 640
нуклеофильное замещение 3-фенилсульфо-нил-5,6-дифенил- 640
---3-хлор-5,6-дифенил- 640
5-литий-6-метокси-3-фенил- 641
1,2,3-Триазол
N-алкилирование 626
N-ацилирование 626
кислотность и основность 626 номенклатура и нумерация 626
1,2,4-Триазол
N-алкилирование 627-628 N-ацилирование 627-628 галогенирование 628 кислотность и основность 626 номенклатура и нумерация 626
1,2,3-Триазол о[ 1,5-я ]пиридин литиирование 616
номенклатура и нумерация 611 синтез кольца 616 ---3-ацетил- 616
1,2,4-Триазоло[ 1,5-а]пирцдин 5-литий- 616
номенклатура и нумерация 616 синтез кольца, 6-нитро- 617 ---2-фенил-617
электрофильное замещение 617
1,2,4- Триазоло [4,3-я] пиридин номенклатура и нумерация 611
синтез кольца, 2Н-3-он- 616
— З-фенил-617
электрофильное замещение 617
1,2,3-Триазоло[3,4-с]пиримидин, присоединение воды (ковалентная гидратация) 617
1,2,3-Триазоло[3,4-6]тиазол
1-литий- 620
4-литий- 620
1,2,3-Триазолы
2-ацил-, превращение в оксазолы 626
бромирование 627
восстановление 627
литиирование, раскрытие цикла 627
5-литий, раскрытие цикла 627
5-литий-1-бензиокси- 627
5-литий-1-фенил- 627
нитрование 627
номеклатура и нумерация 626
основность и кислотность 626
окисление 627
синтез кольца, 1-(4-метоксифенил)- 632
— 2-триметилсилил-4-трет-бутил- 632
— 1-стирилциклогексаноИ- 87
— 5-фенил-1-(4-бромфенил)- 632
2-триметилсилил-, N-ацилирование 626
2-фенил-, нитрование 627
5-цинк-1-бензилокси- 627
1,2,4-Триазолы
3-амино-, диазотирование 628
3-галогено-, синтез 628
галогенирование 628
кислотность и основность 626
литиирование 628
5-литий-1-метил-628
номенклатура и нумерация 626
синтез кольца, 2-амино-5-(3-гидроксипро-пил)- 632
— 4-бензил- 632
— 1-(3-карбокси-4-гидроксифенил)- 632
— 1-метил-632
5-триметистаннил-1-метил- 628
3-фтор-5-метансульфонил-1-метил-, селективное нуклеофильное замещение 628
3-фтор-5-нитро-1 -метил-, селективное нук-
леофильное замещение 628
1Н-3-(2-фторфенил)-4-метил-5-тион-, окислительная десульфуризация 629
З-Триметиламин-К-оксвд, дипольный момент 141
Триметоприм 258
Трипирран из 2,5-бис(гидроксиметил)- 318
Триптамин 413
внутримолекулярная реакция Манниха 408
5-гидрокси-, см. Серотонин
2-карбокси- 426
превращение в триптаминоксиндол 429
синтез кольца 452
Триптофан 413
из грамина 439
замыкание цикла атомом азота боковой цепи по С(2)416,428
защищенный 5-хлор-, синтез 463
реакция с кислородом 428
Трисфуранил-18-краун-6, синтез 399
Туберцидин 577
Урацил 272,578
бромирование 273
депротонирование 254
раскрытие цикла под действием оснований 274-275
синтез кольца 288
хлорметилирование 273
Урацилы
К(1)-алкилирование, внутримолекулярное 276
6-амино-З-метил-, нитрозиро вание 254
5-бром-1,3-диметил-, циклопропанирование 274
внутримолекулярное N-алкилирование 276 5-гидрокси-2,4-диметил-, реакция Виттига по Сф 278-279
1-дезоксирибозил- в диполярном циклоприсоединении 280
1,3-диметил- как диенофил 280
— реакция с гуанидином 275
6-литий-1-этоксиметил- 277
6-метил-, 5-гидроксиметилирование 275
6-трибутилстаннил- 279
1,3,5-триметил-, эпоксидирование 261
фотохимическая димеризация 280
фотохимическое присоединение винилен-карбаматов 280
5-фтор-, N-алкилирование через силилиро-ваиие 276
5-цинк-З-метил- 277-278
электрофильное замещение 273
Ь'(1)-этоксиметилирование 277
Уридин 257
защищенный, 2-бром-, реакция с цианидом 274
-2’-дезокси-, 5-иод-, Си-сочетание 279
---синтез кольца 289
3,6-дилитий- 277
5-литий- 277
меркурирование 273
6-трибутилстаннил-, Рё(0)-сочетание 279
5-циано- и 6-циано- из защищенного 5-бромуридина 274
Усниновая кислота 479
УФ-спектроскопия 25-28
Фейста—Бенари синтез 397
Фенантрен, 2-этоксикарбонилпирроло[3,4-Д-, синтез кольца 338
2-Фенил-1-бензопирилий, см. Флавиний
Фенилбутазон 539—540
Фенолы из солей пирилия 202
Фишера синтез 449-452
механизм 450
Флавилии
восстановление 288
окисление до флавонов 226
основно-катализируемая деградация 227
присоединение аминов 227
- воды 227
— С-нуклеофилов 228
- спиртов 227
цвет и pH 229
Флавилий
нитрование 226
реакция с анионом малонитрила 228
синтез кольца 238
Флавон
окислительная деградация 231
пигменты 236
реакция с диметиддиоксираном 231
— с малононитрилом 233
синтез кольца 240
эпоксидирование 231
Флавоны
3-гидрокси- 231
3-литий- 233
Флуконазол 625
Фолиевая кислота 294
Фотосинтез 309-310
Фридлендера синтез 184
4(5)-Фторгистидин, синтез 530
Фузариновая кислота, синтез 152
Фукуямы синтез 431
Фуран
ацилирование 382-383
восстановление 388
галогенирование 381-382
С-депротонирование 51,307,385
диметаллирование 52,385
дипольный момент 22
нитрование 381
номенклатура и нумерация 379
присоединение дибензоилпероксида 388
протонирование 380
реакция с ацетоном 383
- с диэтиловым эфиром аллен-1,3-дикарбо-новой кислоты 388
— с малеиновым ангидридом 388
- Манниха 383-384
— с 2-оксалил-катионами 389
— с радикальными реагентами 46-47,388
— с хлоралем 383
— с этиленкарбонатом 389
структура 22
сульфирование 381
формилирование по Вильсмейеру 383
фотохимическое присоединение альдегидов и кетонов 390-391
электрофильное замещение, влияние заме-тителей 306
--региоселективность 304
электрофильное палладирование 387
Фуранеол, синтез 399
Фурановые кислоты, декарбоксилирование 391—392
Фураны
алкил-, депротонирование боковой цепи и
раскрытие цикла 391
алкилирование 383
алкокси- 393
амино- 393
2-амино-5-метоксикарбонил- как диен в
циклоприсоединении 393
С(2)-арилирование, Рд(0)-катализ 387
1,1 -бис(3,5-диметилфуран-2-ил)этан, реак-
ция с диеноном 389
3,4- бис(триметилсилил)- 399
— изомеризация в 2,4-бис(триметилсилил)-388
— илсо-моноиодирование 388
3,5- бис(триметилсилил)- 1-бензил-, ипсо-2-
иодирование 388
1,3-бис(фуран-2-ил) пропан, реакция с
DMAD389
2- и 3-борные кислоты, Рс1(0)-сочетание 61, 71,384,386
2-винил- как диен в циклоприсоединении 390
внутримолекулярное циклоприсоединение винилсульфона 390
гидрокси-, таутомерия 392
2-гидрокси-5-метил-, таутомерия 392
С(2)-депротонирование 385-386
2,3-дибром-, обмен металл-галоген 387
2,3-дибром-5-метоксикарбонил-, селективное Pd(0)- сочетание 387
2,3-дигидро 654
— Рс1(0)-сочетание 663
2,5-дигидроаддукты 382
2,5-дигидро-2,5-диметокси- 382
2,3-дигидро-3-карбоновая кислота 388
2,5-дигидро-2-карбоновая кислота 388
2,5-дигвдро-2-нитро-5-ацетокси- 381 как диен в циклоприсоединении 388-390
2,5-дилитий- 52,385
2,5-диформил- 52
З-иод-4-метилсилил-, Рд(0)-сочетание 387
З-иод-4-триметилсилил-, Рс1(0)-сочетание
387
2-карбоновая кислота, С-депротонирование
385
2-литий- 385,386
2-литий-3,5-бис(триметилсилил)- 388
2-литий-5-тре/п-бутокси- 393
2-литий-2,3-дигидро- 662
3-литий- 385,387
З-литий-2-карбокси- 385
5-магний-2-этоксикарбонил- 56
меркурирование 384
2-нитро-, викариозное нуклеофильное С(3)
замещение 385
основность 380
протонирование, раскрытие цикла 380
реакция с синглетным кислородом 390 синтез кольца 395
— 3-ацетил-2,4-димстил- 398
---3,4-бис(этоксикарбонил)- 395
---2-бутил- 396
— 2,5-ди-/яре/я-бутил- 395
— 3-иод-2-бутил-5-циклогексил- 398
---2-метоксикарбонилметил-5-арилметил-
398
— циклогептано[е]- 396
— циклооктано[ЭД- 398
— 2-этил-4-метил- 396
— 2-этил-5-тиен-2-ил- 396
— 3-этоксикарбонил-2,5-диметил- 397
---З-этоксикарбонил-2-метил- 397 2-станнилокси-, реакция с альдегидом 392 2-(тиофен-2-ил)-, селективное ацилирова-
ние 38
3-трибутилстаннил-, яясо-ацилирование 387 - Рс!(0)-сочетание 387
З-метилсилил-4-фенил-, мясо-иодирование 87 2-триметилсилилокси-, превращение в буге-нолиды 393
3-триметилстаннил-, Рс3(0)-сочетание 387 2-фенилсульфонил- из 2,5-дигидро-2,5-ди-метокси 382
2-формил-, см. Фурфурол
2-формил-З-борная кислота, Рд(0)-сочета-ние 387
2,3-хинодиметан 89
З-цинкат-2-этоксикарбонил- 62
2-цинк-, Рб(0)-сочетание 69
электрофильное замещение, относительная реакционная способность 37—38,306
Фуроксаны, номенклатура и нумерация 634
Фурфурилгалогениды 391
Фурфурол 379
5-гидроксиметил-, синтез кольца 399 диметилгидразон как диен в реакциях Дильса-Альдера 389
получение из полисахаридов 394
Фюрстнера синтез 460
Халконы 237
Хека реакция 68-69
внутримолекулярная, синтез индолов 72
механизм 68
Хелидоновая кислота, см. 4-Пирон-2,6-дикарбоновая кислота
Хемилюминисценция 257
Хиназолин
номенклатура и нумерация 256
синтез кольца, 2-(4-метилфенил)-4-фенил-
645
Хиназолон, синтез кольца 619
Хиназолоны, нитрование 619
Хинин 166
ор/яо-Хинодиметаны
методы образования 89-90
относительная устойчивость/реакционная способность 88-89
Хиноксалин
6-нитро, ВНЗ по С(3) 42
номенклатура и нумерация 256
окислительная деградация бензольного кольца 261
Хинолин-4-карбоновая кислота, 2,6-диметил-3-фенокси-, синтез кольца 184
4Н-Хинолизин, номенклатура и нумерация 608
Хинолизинии
аналогия с химией пиридиниев 618
номенклатура и нумерация 608
нуклеофильное присоединение, раскрытие циклов в аддуктах 618
синтез кольца 619
Хинолин
N-алкилированйе 167
аминирование, региоселективность 170
восстановление бензольного кольца 174
— пиридинового кольца 174-175
галогенирование 168-169
гидроксилирование 171
канонические стркугуры 23
нитрование 168,171
номенклатура и нумерация 166
нуклеофильное алкилирование и арилиро-вание 169-170
— замещение 169—172
---региоселективность 101
обмен С-Н 167
окисление кольца 169
основность 167
протонирование 167
радикальное замещение 173
Рсйсерта реакция 179
синтез кольца 184
структура 23
сульфирование 168
электрофильное замещение, механизм 36
---региоселективность 100-101
Хинолинии 178-180
присоединение цианида 179
1-феноксикарбонил-, 2-присоединение ал-лилсилана 179
---ТМС-ацетилена 179
Хинолинкарбоновые кислоты, декарбоксилирование 177
Хинолин-4-карбоновые кислоты, синтез кольца 178
Хинолин-N -оксид
нитрование 180
превращение в 2-цианохинолин 180
фотохимическое расширение цикла 175
Хинолины
алкил-, депротонирование боковой цепи 177
амино-, основность 177
3-борная кислота, 2-хлор-, Рб(0)-сочетание 172
3-бром-, Рй(0)-катализируемое превращение в борный эфир 57
- Pd(O)-сочетание 173
галогено-, нуклеофильное замещение 171
1,2-дигидро-, диспропорционирование 174
1,2-дигидро-2-циано-1-тозил- по реакции
Рейсерта 179
1-изопропил- по реакции радикального за-
мещения 44
литиирование 172
5-литий- 173
2-метил-, радикальное замещение 44
4-метил, радикальное замещение 45
нахождение в природе 166
5-нитро-, в реакциях ВНЗ по С<б) 170
синтез кольца 180
---4,6-диметил- 183
---2,3-диметил-4-фенил- 184
---5,8-диметокси-2,4-диметил- 181
---7,8-диметокси-2,4-бис(метоксикарбо-
нил)-6-метил- 191
— 4-метил-2-фенил- 189
— 6-метокси-З-нитро- 181
— 2-хлор-З-формил-189
1,2,3, 4-тетрагидро-, дегидрирование до хинолина 174,652
2,3,8- триметил-, селективное окисление до 2-альдегида 178
3-триметилстаннил- 58
хлор-, относительная реакционная способность в реакциях нуклеофильного замещения 41
2-цинк-б!
3-цинк-173
2-Хинолон
1,3-дилитий- 172
синтез из хинолина 172
4-Хинолон, нитрование, механизм 176
Хинолоны, структура 175-177
2-Хинолоны, синтез кольца
6,8-диметокси-189
4-метил- 181
2-метил-6,7-метилендиокси- 190
4-Хинолоны, синтез кольца
2-метил-181
7-хлор-2-этоксикарбонил- 190
2-этил-6-нитро- 182
Хинсберга синтез 369,372
Хлорирование, см. индивидуальные гетероцикла
Хлорофилл-я 310
Хлорохин 166
синтез 190
2Н-Ххромены 228
4Н-Хромены 228
Хромилий, см. Бензопирилий
Хромон
бромирование 230
реакция Манниха 230
нитрование 230
номенклатура и нумерация 225
протонирование по карбонильному атому
кислорода 229—230
реакция с диэтиламином 232
— с диметилдиоксираном 231
экопсидирование 231
Хромоны
3-бром- 241
- Рс1(0)-сочетание 233
3-иод-, реакция с имидазолом 232
2-метил-, реакция с гидроксидом 231
3-метилкарбонил- как диенофил в реакции
Дильса-Альдера 234
2-(4-метоксифенил)-, иодирование 230
синтез кольца, 3-бром- 241
---2-диметиламино-З-метил- 241
---3-метил- 241
---2-метоксиметил- 242
---2-пентил- 240
— 2-тетрагидропиран-2-илметил- 242
---2-циклогексил-8-метоксикарбонил-3-
метил- 241
— 2-этил- 240
---З-этоксикарбонил-2-этил- 241
Хюккеля правило 15
Электронная спектроскопия 28-31
Электронодефицитные гетероциклы 18
Электроноизбыточные гетероциклы 21 Электрофильное замещение
влияние заместителей в пиридинах 37 механизм 35-39
относительные скорости 35-39
Электрофильные процессы в синтезе циклов 87-88
Эметин 167
Эпибатидин 104
синтез 344
Эписульфиды 656,658—659
Эпоксиды 656
инверсия конфигурация 658
реакции нуклеофильного раскрытия цикла 657—658
------катализ 657
------региоселективность 657
---через р-элиминирование 658 синтез кольца из галогеногидринов 667 ---использование надкислот 666
---эпоксидирование по Шарплесу 666
хиральные, синтез 667
Эрленмейера азлакгон 524
Эрлиха реакция 319,422 Этиленимин, см. Азирин Этиловый красный 167 Эшенмозера соль 357,424
«Н-ЯМРКССВ 27 ’Н-ЯМР-спекгроскория 28 ,3С-ЯМР-спекгроскопия 28 15N-ЯМ Р-спектроскопия 28
Яппа—Хлингемана синтез 466
ОГЛАВЛЕНИЕ
ПРЕДИСЛОВИЕ РЕДАКТОРА ПЕРЕВОДА.......................................... 5
ПРЕДИСЛОВИЕ К ЧЕТВЕРТОМУ ИЗДАНИЮ.................................... 8
ВВЕДЕНИЕ .......................................................
Литература........................................................... .11
СОКРАЩЕНИЯ, ИСПОЛЬЗУЕМЫЕ В КНИГЕ ................................ 13
1. СТРОЕНИЕ И СПЕКТРАЛЬНЫЕ ХАРАКТЕРИСТИКИ АРОМАТИЧЕСКИХ ГЕТЕРО-
ЦИКЛИЧЕСКИХ СОЕДИНЕНИЙ .................................... ........15
1.1. Карбоциклические ароматические системы...................... ....15
1.1.1. Строение бензолам нафталина.................................15
1.1.2. Энергия ароматического резонанса.......................... 17
1.2. Строение шестичленных гетероароматических соединений............17
1.2.1. Строение пиридина......................................... 17
1.2.2. Строение диазинов...................................... .19
1.2.3. Строение катиона пиридиния и родственных систем.......... .19
1.2.4. Строение пиридонов и пиронов ............................ 20
1.3. Строение пятичленных гетероароматических систем ............... 20
1.3.1. Строение пиррола ................................... 20
1.3.2. Строение тиофена и фурана............................. 22
1.3.3. Строение азолов .................................... 22
1.4. Строение бициклических гетероароматических соединений........... .23
1.5. Таутомерия гетероциклических систем ....................... .23
1.6. Мезоионныесоединения ....................................... 24
1.7. Некоторые спектральные свойства гетероароматических соединений . 25
1.7.1. УФ-спекгроскопия и спектроскопия в видимой области (электронная спектроскопия) ...........................................................25
1.7.2. Спектроскопия ядерного магнитного резонанса (ЯМР)......... 28
Литература................................................. 31
2. РЕАКЦИОННАЯ СПОСОБНОСТЬ АРОМАТИЧЕСКИХ ГЕТЕРОЦИКЛИЧЕСКИХ
СОЕДИНЕНИЙ ............................................... .....33
2.1. Реакции электрофильного присоединения к атому азота ............33
2.2. Реакции электрофильного замещения при атоме углерода ....... .34
2.2.1. Механизм ароматического электрофильного замещения..............35
2.2.2. Шестичленные гетероциклические соединения ......................35
2.2.3. Пятичленные гетероциклические соединения..................... .37
2.3. Реакции нуклеофильного замещения при атоме углерода ............... 39
2.3.1. Механизм реакции ароматического нуклеофильного замещения .......39
2.3.2. Шестичленные гетероциклические соединения .................... 40
2.3.3. Викариозное нуклеофильное замещение ............................41
2.4. Реакции радикального замещения при атоме углерода ................. 42
2.4.1. Реакции гетероциклических соединений с нуклеофильными радикалами. Реакция Минисци ................................................... 43
2.4.2. Реакции с электрофильными радикалами ........................ 46
2.5. Депротонирование атома азота.........................................47
2.6. Металлоорганические производные .....................................47
2.6.1. Литийорганические производные ............................ .47
2.6.2. Магнийорганические производные ............................... 56
2.6.3. Бор-, кремний- и оловоорганические реагенты.....................56
2.6.4. Цинкорганические производные.............................. 61
2.6.5. Металлирование боковой цепи шестичленных гетероциклических соединений («латеральное металлирование»)....................................62
2.6.6. Металлирование боковой цепи пятичленных гетероциклических соединений .63
2.7. Реакции, катализируемые палладием ............................... 64
2.7.1. Основные процессы с участием палладийорганических соединений ..65
2.7.2. Реакции, катализируемые палладием, в химии гетероциклических соединений 68
2.8. Окисление и восстановление гетероциклических соединений..............72
2.9. Биологические процессы в химии гетероциклических соединений..........72
Литература.......................................................... .74
3, СИНТЕЗ АРОМАТИЧЕСКИХ ГЕТЕРОЦИКЛИЧЕСКИХ СОЕДИНЕНИЙ .......................81
3.1. Типы реакций, обычно используемые для синтеза гетероциклических соединений ..81
3.2. Типичные комбинации реагентов...................................... 82
Примечания........................................................... 84
3.3. Выводы ..............................................................86
3.4. Элекгроциклические процессы в синтезе гетероциклических соединений...87
3.5. Нитрены в синтезе гетероциклических соединений ................... 88
3.6. ор/ио-Хинодиметаны в синтезе гетероциклических соединений ..........88
Литература............................................................. 91
4. ОБЩАЯ ХАРАКТЕРИСТИКА РЕАКЦИОННОЙ СПОСОБНОСТИ ПИРИДИНОВ, ХИНОЛИНОВ И ИЗОХИНОЛИНОВ .......................................... .....93
5. ПИРИДИНЫ: РЕАКЦИИ И МЕТОДЫ СИНТЕЗА......................................103
5.1. Реакции с электрофильными реагентами.............................. 104
5.1.1. Присоединение к атому азота.................................. 104
5.1.2. Реакции замещения при атоме углерода....................... 108
5.2. Реакции с окислителями..............................................111
5.3. Реакции с нуклеофильными реагентами.................................112
5.3.1. Нуклеофильное замещение атома водород ...................... 112
5.3.2. Нуклеофильное замещение хорошо уходящих групп.................114
5.4. Реакции с основаниями ......................................... 115
5.4.1. Депротонирование при атоме углерода...................... 115
5.5. Реакции С-металлированных пиридинов.................................116
5.5.1. Литий- и магнийорганические производные.......................116
5.5.2. Реакции, катализируемые палладием.............................119
•5.6. Реакции со свободными радикалами, реакции пиридил-радикалов........120
5.6.1. Галогенирование ............................................ 120
5.6.2. Реакции с углеродными радикалами ........................... 121
5.6.3. Димеризация ............................................ 121
5.6.4. Пиридил-радикалы ........................................... 122
5.7. Реакции с восстановителями..........................................122
5.8. Электроциклические реакции основного состояния......................123
5.9. Фотохимические реакции............................................ 124
5.10. Окси- и аминопиридины.......................................... 126
5.10.1. Строение......................................... .126
5.10.2. Реакции пиридонов............................................126
5.10.3. Реакции аминопиридинов.......................................129
5.11. Алкилпиридины......................................................131
5.12. Пиридиновые альдегиды, кетоны, карбоновые кислоты и их эфиры.......133
5.13. Четвертичные пиридиниевые соли.....................................133
5.13.1. Восстановление и окисление...................................134
5.13.2. Присоединение металлорганических реагентов................. 135
5.13.3. Другие реакции нуклеофильного присоединения..................138
5.13.4. Нуклеофильное присоединение с последующим раскрытием цикла....139
5.13.5. Реакции циклизации с участием а-заместителей..................140
5.13.6. N-Дезалкилирование .........................................140
5.14. N-Оксиды пиридина ............................................... 140
5.14.1. Электрофильное присоединение и замещение................... 142
5.14.2. Нуклеофильное присоединение и замещение ................. 142
5.14.3. Перегруппировки............................................ 143
5.15. Синтез пиридинов...................................................144
5.15.1. Синтез кольца.............................................. 144
5.15.2. Примеры синтезов некоторых важных производных пиридина.......152
Упражнения ..........................................................153
Литература.................................................... 156
6. ХИНОЛИНЫ И ИЗОХИНОЛИНЫ: РЕАКЦИИ И МЕТОДЫ СИНТЕЗА........................166
6.1. Реакции с электрофильными реагентами................................167
6.1.1. Присоединение по атому азота................................ 167
6.1.2. Замещение при атоме углерода............................. 167
6.2. Реакции с окислителями.............................................169
6.3. Реакции с нуклеофильными реагентами.............................. 169
6.3.1. Нуклеофильное замещение атома водорода.........................169
6.4. Реакции с основаниями............................................ 172
6.4.1. Депротонирование при атоме углерода ..........................172
6.5. Реакции С-металлированных хинолинов и изохинолинов.................172
6.5.1. Литийорганические производные............................... 172
6.5.2. Цинкорганические соединения ...................................173
6.5.3. Реакции, катализируемые палладием и никелем...................173
6.6. Реакции со свободными радикалами................................. 173
6.7. Реакции с восстановителями...........................................174
6.8. Электрониклические реакции основного состояния................... 175
6.9. Фотохимические реакции ......................................... 175
6.10. Оксихинолины и оксиизохинолины................................... 175
6.11. Аминохинолины и аминоизохинолины................................. 177
6.12. Алкилхинолины и алкилизохинолины...................................177
6.13. Хинолин- и изохинолинкарбоновые кислоты и их эфиры.................178
б.14. Четвертичные хинол иниевые и изохинолиниевые соли .............. 178
6.15. N-Оксвды хинолина и изохинолина................................. .180
6.16. Методы синтеза хинолинов и изохинолинов ....................... 180
6.16.1. Синтез кольца.................................................... 180
6.16.2. Примеры синтезов некоторых важных производных хинолина и изохинолина 190
Упражнения ...........................................................192
Литература....................................................... 193
7. ОБЩАЯ ХАРАКТЕРИСТИКА РЕАКЦИОННОЙ СПОСОБНОСТИ СОЛЕЙ ПИРИЛИЯ И БЕНЗОПИРИЛИЯ, ПИРОНОВ И БЕНЗОПИРОНОВ .....................198
8. КАТИОНЫ ПИРИЛИЯ, 2-И 4-ПИРОНЫ: РЕАКЦИИ И МЕТОДЫ СИНТЕЗА .201
8.1. Реакции катионов пирилия ..................................... 201
8.1.1. Реакции с электрофильными реагентами ..........................201
8.1.2. Присоединение нуклеофильных реагентов..........................202
8.1.3. Реакции нуклеофильного замещения...............................205
8.1.4. Реакции со свободными радикалами...............................205
8.1.5. Реакции с восстановителями.....................................205
8.1.6. Фотохимические реакции.........................................205
8.1.7. Реакции с диенофилами, циклоприсоединение......................206
8.1.8. Катионы алкилпирилия ........................................ 206
8.2. 2-Пироны и 4-пироны (2Н-пиран-2-оны и 4Н-пиран-2-оны; а-пироны иу-пироны) .207
8.2.1. Строение пиронов ..............................................207
8.2.2. Реакции пиронов ...............................................207
8.3. Синтез солей пирилия.............................................. 212
8.3.1. Из 1,5-дикарбонильных соединений...............................212
8.3.2. Ацилирование алкенов....................................... 213
8.3.3. Из 1,3-дикарбонильных соединений и кетонов....................214
8.4. Синтез 2-пиронов....................................................215
8.4.1. Из 1,3-кето(альдегидо)кислот и карбонильных соединений .......215
8.4.2. Другие методы.................................................215
8.5. Синтез 4-пиронов....................................................217
Упражнения...........................................................219
Литература...........................................................220
9. КАТИОНЫ БЕНЗОПИРИЛИЯ, БЕНЗОПИРОНЫ: РЕАКЦИИ И МЕТОДЫ СИНТЕЗА 225
9.1. Реакции катионов бензопирилия ................................... 226
9.1.1. Реакции с электрофильными реагентами .................. .226
9.1.2. Реакции с окислителями............................... .226
9.1.3. Реакции с нуклеофильными реагентами...................... .227
9.1.4. Реакции с восстановителями....................................228
9.1.5. Катионы алкилбензопирилия................................... 228
9.1.6. 1-Бензопирилиевые пигменты; антоцианины и антоцианидины.......229
9.2. Безопироны (хромоны, кумарины и изокумарины) ..................... 229
9.2.1. Реакции с электрофильными реагентами ........................... .229
9.2.2. Реакции с окислителями........................................231
9.2.3. Реакции с нуклеофильными реагентами .........................231
9.3. Синтез катионов бензопирилия, хромонов, кумаринов и изокумаринов....236
9.3.1. Синтез 1-бензопирилиевых систем...............................237
9.3.2. Синтез кумаринов............................................ 238
9.3.3. Синтез хромонов из оргио-гидроксиацилбензолов............... 240
9.3.4. Синтез хромонов из орто-гидроксиарилалкинилкетонов............242
9.3.5. Синтез катионов 2-бензопирилия.............................. 242
9.3.6. Синтез изокумаринов ..........................................243
9.3.7. Примеры синтезов некоторых важных катионов бензопирилия и бензопироновых систем ........................................................ 244
Упражнения ...................................................... .245
Литература ........................................................ .246
10. ОБЩАЯ ХАРАКТЕРИСТИКА РЕАКЦИОННОЙ СПОСОБНОСТИ ДИАЗИНОВ: ПИРИДАЗИН, ПИРИМИДИН И ПИРАЗИН.............................................251
11. ДИАЗИНЫ, ПИРИДАЗИНЫ, ПИРИМИДИНЫ И ПИРАЗИНЫ: РЕАКЦИИ И
МЕТОДЫ СИНТЕЗА..........................................................256
11.1. Реакции с электрофильными реагентами ............................ 258
11.1.1. Присоединение по атому азота ................................258
11.1.2. Замещение при атоме углерода.................................260
11.2. Реакции с окислителями ............................................261
11.3. Реакции с нуклеофильными реагентами ..............................261
11.3.1. Замещение атома водорода ....................................261
11.3.2. Замещение других уходящих групп............................ 262
11.4. Реакции с основаниями......................................... 265
11.4.1. Депротонирование при атоме углерода........................265
11.4.2. Металлирование.............................................265
11.5. Реакции С-металлированных диазинов........................ .266
11.5.1. Литийорганические производные..............................266
11.5.2. Реакции, катализируемые палладием..........................267
11.6. Реакции с восстановителями.................................... 269
11.7. Реакции со свободными радикалами.............................. 269
11.8. Электроциклические реакции........................................270
11.9. N-Оксиды диазинов............................................... 270
11.10. Оксидиазины.................................................... 272
11.10.1. Строение оксидиазинов.....................................272
11.10.2. Реакции оксидиазинов.................................. 272
11.11. Аминодиазины ............................................. 281
11.12. Алкилдиазины................................................. 282
11.13. Четвертичные азиниевые соли......................................283
11.14. Синтез диазинов............................................ 284
11.14.1. Синтез пиридазинового кольца ...................... 284
11.14.2. Синтез пиримидинового кольца..............................287
11.14.3. Синтез пиразинового цикла.................................290
11.14.4. Примеры некоторых важных синтезов диазинов................292
11.15. Птеридины........................................................294
Упражнения....................................................... 295
Литература................................................... ....296
12. ОБЩАЯ ХАРАКТЕРИСТИКА РЕАКЦИОННОЙ СПОСОБНОСТИ ПИРРОЛОВ, ТИОФЕНОВ И ФУРАНОВ........................................................304
13. ПИРРОЛЫ: РЕАКЦИИ И МЕТОДЫ СИНТЕЗА.................................. 309
13.1. Реакции с электрофильными реагентами ........................... 311
13.1.1. Протонирование.............................................311
13.1.2. Нитрование ................................................313
13.1.3. Сульфирование и реакции с использованием других серосодержащих электрофильных реагентов ...............................................313
13.1.4. Галогенирование............................................314
13.1.5. Ацилирование ............................................ 315
13.1.6. Алкилирование............................................ 317
13.1.7. Конденсация с алвдегвдами и кетонами ......................317
13.1.8. Конденсации с иминами и иминиевыми ионами .............. .319
13.1.9. Сочетание с солями диазония ............................. 320
13.2. Реакции с окислителями ....................................... 321
13.3. Реакции с нуклеофильными реагентами...............................321
13.4. Реакции с основаниями ............................................322
13.4.1. Депротонирование атома азота........................ .322
13.4.2. Депротонирование по атому углерода..........................322
13.5. Реакции N-металлированных производных пиррола ....................322
13.5.1. Литий-, натрий-, калий-, магний- и цинкорганические производные.322
13.6. Реакции С-металлированных производных пиррола.....................323
13.6.1. Литийорганические производные............................. 323
13.6.2. Реакции, катализируемые палладием......................... .325
13.7. Реакции с радикальными реагентами.................................325
13.8. Реакции с восстановителями........................................325
13.9. Электроциклические реакции (основного состояния) .................326
13.10. Реакции с карбенами и карбеноидами............................. 328
13.11. Фотохимические реакции ...................................... 328
13.12. Реакции пиррил-С-Х-соединений ............................ .329
13.13. Пирроладьдегиды и пирролкетоны............................. 329
13.14. Пирролкарбоновые кислоты................................... 330
13.15. Эфиры пирролкарбоновых кислот ................................. 330
13.16. Галогенопирролы........................................... 331
13.17. Окси- и аминопирролы ...................................... 331
13.17.1.2- Оксипирролы ........................................... 331
13.17.2.3- Оксипирролы ......................................... 332
13.17.3. Аминопирролы ............................................ 332
13.18. Методы синтеза пирролов..........................................332
13.18.1. Синтез кольца..............................................332
13.18.2. Некоторые современные общие подходы к синтезу пиррола......340
13.18.3. Примеры синтезов некоторых важных производных пиррола......341
Упражнения ....................................................... 344
Литература ................................................. 346
14. ТИОФЕНЫ: РЕАКЦИИ И МЕТОДЫ СИНТЕЗА.............................. .352
14.1. Реакции с электрофильными реагентами............................ 353
14.1.1. Реакции замещения по атому углерода.........................353
14.1.2. Присоединение по атому серы ............................ 357
14.2. Реакции с окислителями ...........................................359
14.3. Реакции с нуклеофильными реагентами........................... 359
14.4. Реакции с основаниями.............................................360
14.4.1. Депротонирование С-водорода.................................360
14.5. Реакции С-металлированных тиофенов................................360
14.5.1. Литий- и магнийорганические производные.....................360
14.5.2. Реакции, катализируемые палладием, никелем или медью . .362
14.6. Реакции со свободными радикалами ........................... 363
14.7. Реакции с восстановителями.................................... .364
14.8. Электроциклические реакции (основного состояния) ............... 364
14.9. Фотохимические реакции ......................................... 365
14.10. Х-Метилпроизводные тиофена: тенилпроизводные .............. .366
14.1 L Тиофенальдегиды, тиофенкетоны, тиофенкарбоновые кислоты и их эфиры...366
14.12. Гидрокси- и аминотиофены ...................................... 367
14.12.1. Гидрокситиофены ....................................... 367
14.12.2. Аминотиофены...............................................368
14.13. Синтезы тиофенов ............................................ 368
14.13.1. Синтез кольца.......................................... 368
14.13.2. Примеры некоторых важных синтезов производных тиофена .....372
Упражнения .........................................................373
Литература..........................................................374
15. ФУРАНЫ: РЕАКЦИИ И МЕТОДЫ СИНТЕЗА.................................... 379
15.1. Реакции с электрофильными реагентами..............................380
15.1.1. Протонирование ..................................... 380
15.1.2. Нитрование................................................ 381
15.1.3. Сульфирование...............................................381
15.1.4. Галогенирование......................................... 381
15.1.5. Ацилирование.......................................... 382
15.1.6. Алкилирование ......................................... .383
15.1.7. Конденсация с альдегидами и кетонами........................383
15.1.8. Конденсация с иминами и иминиевыми солями...................383
15.1.9. Меркурирование .............................................384
15.2. Реакции с окислителями ...........................................384
15.3. Реакции с нуклеофильными реагентами...............................385
15.4. Реакции с основаниями.............................................385
15.4.1. Депротонирование С-водорода.................................385
15.5. Реакции С-металлированных фуранов............................... 386
15.5.1. Литийорганические производные...............................386
15.5.2. Реакции сочетания, катализируемые палладием .............. 387
15.6. Реакции со свободными радикалами ............................... 388
15.7. Реакции с восстановителями.................................... 388
15.8. Электроциклические реакции (основного состояния) .................388
15.9. Фотохимические реакции ......................................... 390
15.10. С-Х-производные фурана; реакции с участием заместителей .........391
15.11. Фуранкарбоновые кислоты и их эфиры...............................391
15.12. Окси- и аминофураны..............................................392
15.12.1. Оксифураны.................................................392
15.12.2. Аминофураны................................................393
15.13. Синтезы фуранов..................................................394
15.13.1. Синтез кольца..............................................394
15.13.2. Примеры синтезов некоторых важных производных фурана.......399
Упражнения .................................................... .400
Литература.................................................... 401
16. ОБЩАЯ ХАРАКТЕРИСТИКА РЕАКЦИОННОЙ СПОСОБНОСТИ ИНДОЛОВ, БЕНЗО[6]ТИОФЕНОВ, БЕНЗО[6] ФУРАНОВ, ИЗОИНДОЛОВ, БЕНЗО [с]ТИО-ФЕНОВ И ИЗОБЕНЗОФУРАНОВ....................................................407
17. ИНДОЛЫ: РЕАКЦИИ И МЕТОДЫ СИНТЕЗА.................,.....................413
17.1. Реакции с электрофильными реагентами ......................... .415
17.1.1. Протонирование ........................................ 415
17.1.2. Нитрование; реакции с другими азотсодержащими электрофилами .416
17.1.3. Сульфирование; реакции с другими серосодержащими электрофилами......417
17.1.4. Галогенирование............................................ 418
17.1.5. Ацилирование............................................... 418
17.1.6. Алкилирование............................................ 421
17.1.7. Реакции с альдегидами и кетонами......................... 422
17.1.8. Реакции с а,р-ненасыщенными кетонами, нитрилами и нитросоединениями 423
17.1.9. Реакции с иминиевыми ионами: реакция Манниха ................424
17.1.10. Диазосочетание и нитрозирование........................... 426
17.1.11. Электрофильное металлирование...............................427
17.2. Реакции с окислителями ........................................ 428
17.3. Реакции с нуклеофильными реагентами (см. также разд. 17.14.4)......429
17.4. Реакции с основаниями........................................ 429
17.4.1. Депротонирование N-водорода................................ 429
17.4.2. Депротонирование С-водорода.............................. .430
17.5. Реакции N-металлированных индолов.............................. 431
17.6. Реакции С-металлированных индолов................................ 432
17.6.1. Литийорганические производные.............................. 432
17.6.2. Реакции, катализируемые палладием......................... .434
17.7. Реакции со свободными радикалами ..................................434
17.8. Реакции с восстановителями....................................... 435
17.9. Реакции с карбенами.............................................. 436
17.10. Элекгроциклические и фотохимические реакции ......................436
17.11. Алкилиндолы..................................................... 438
17.12. Реакции С-замещенных индольных соединений.........................439
17.13. Индолкарбоновые кислоты...........................................441
17.14. Гидроксииндолы................................................. 442
17.14.1. Оксиндол.............................................. 442
17.14.2. Индоксил ...................................................443
17.14.3. Изатин ............................................... 444
17.14.4. 1-Гидроксиндол ....................................... 444
17.15. Аминоиндолы................................................... 445
17.16. Азаиндолы .................................................. 446
17.16.1. Реакции электрофильного замещения ........................ 447
17.16.2. Реакции нуклеофильного замещения.......................... 447
17.17. Синтезы индолов............................................... 448
17.17.1. Синтезы кольца............................................ 448
17.17.2. Синтезы оксиндолов..................................... .463
17.17.3. Синтезы индоксилов........................................ 464
17.17.4. Синтез изатинов ......................................... 465
17.17.5. Синтезы 1-гидроксиндолов................................. 465
17.17.6. Примеры синтезов некоторых важных производных индола.......465
17.17.7. Синтезы азаиндолов.................................... .467
Упражнения ................................................... 468
Литература........................................................ 469
18. БЕНЗО[Й]ТИОФЕНЫ И БЕНЗООД ФУРАНЫ: РЕАКЦИИ И МЕТОДЫ СИНТЕЗА.............479
18.1. Реакции с электрофильными реагентами..............................479
18.1.1. Реакции замещения по атому углерода.........................479
18.1.2. Реакции присоединения по атому серы в бензотиофене .........481
18.2. Реакции с нуклеофильными реагентами............................. 481
18.3. Реакции с основаниями; реакционная способность С-металлированных бензо[6]-тиофенов и бензо[/>]фуранов............................................482
18.4. Реакции с окислителями и восстановителями.........................483
18.5. Электроциклические реакции .......................................483
18.6. Окси- и аминобензотиофены и окси- и аминобензофураны .............484
18.7. Синтезыбензо[5]тиофеновибензо[5]фуранов ..........................484
18.7.1. Синтез кольца........................................... 484
Упражнения ..................................................... 489
Литература...................................................... 490
19. ИЗОИЦДОЛЫ, БЕНЗО[с]ТИОФЕНЫ И ИЗОБЕНЗОФУРАНЫ: РЕАКЦИИ И МЕТОДЫ СИНТЕЗА...................................................................494
19.1. Реакции с электрофильными реагентами .............................495
19.2. Электроциклические реакции .......................................495
19.3. Фталоцианины .....................................................496
19.4. Синтезы изоиндолов, бензо [с]тиофенов и изобензофуранов ..........496
19.4.1. Изоиндолы................................................ 496
19.4.2. Бензо[с]тиофены.......................................... 497
19.4.3. Изобензофураны.................................... .498
Упражнения ...................................................... 500
Литература............................................... ,.......501
20. ОБЩАЯ ХАРАКТЕРИСТИКА РЕАКЦИОННОЙ СПОСОБНОСТИ 1,3- И 1,2-АЗОЛОВ 503
21 .1.3-АЗОЛЫ — ИМИДАЗОЛЫ, ТИАЗОЛЫ И ОКСАЗОЛЫ: РЕАКЦИИ И МЕТОДЫ СИНТЕЗА...................................................................506
21.1 . Реакции с электрофильными реагентами ............................507
21.1.1 . Присоединение по атому азота ..............................507
21.1.2 . Замещение по атому углерода.................................511
21.2 . Реакции с окислителями .........................................513
21.3 . Реакции с нуклеофильными реагентами.............................514
21.3.1 . Реакции с раскрытием цикла ............................... 514
21.3.2 . Реакции замещения атома галогена............................514
21.4 . Реакции с основаниями .......................................... 514
21.4.1 . Депротонирование группы NH.............................. 514
21.4.2 . Депротонирование СН.................................... .515
21.5 . Реакции N-металлированных имидазолов .............................515
21.6 . РеакцииС-металлированных 1,3-азолов ..............................515
21.6.1 . Литийорганические производные............................ 515
21.6.2 . Реакции, катализируемые палладием..........................517
21.7 . Реакции со свободными радикалами............................... 517
21.8 . Реакции с восстановителями.................................... 518
21.9 . Электроциклические реакции.................................. 518
21.10 . Алкил-1,3-азолы ............................................... 520
21.11 . Четвертичные соли 1,3-азолов................................... 520
21.12 . Гидрокси- и амино-1,3-азолы ................................... 522
21.13 . N-Оксиды 1,3-азолов ......................................... 524
21.14 . Синтезы 1,3-азолов ..............................................525
21.14.1 . Синтез кольца.......................................... 525
21.14.2 . Примеры некоторых важных синтезов с участием 1,3-азолов....530
Упражнения ...................................................... 532
Литература....................................................... 533
22. 1,2-АЗОЛЫ -ПИРАЗОЛЫ, ИЗОТИАЗОЛЫ И ИЗОКСАЗОЛЫ: РЕАКЦИИ И МЕТОДЫ СИНТЕЗА........................................................ ....539
22.1. Реакции с электрофильными реагентами..............................540
22.1.1. Присоединение по атому азота ............................. 540
22.1.2. Реакции замещения по атому углерода......................... .541
22.2. Реакции с окислителями............................................542
22.3. Реакции с нуклеофильными реагентами............................. 542
22.4. Реакции с основаниями......................................... 543
22.4.1. Депротонирование [руппы NH пиразола.........................543
22.4.2. Депротонирование СН....................................... 543
22.5. Реакции N-металлированных пиразолов........................... 544
22.6. РеакцииС-металлированных 1,2-азолов............................. 544
22.7. Реакции со свободными радикалами................................ 545
22.8. Реакции с восстановителями........................................545
22.9. Электроциклические реакции.................................. 546
22.10. Алкилпроизводные 1,2-азолов................................... 547
22.11. Четвертичные соли 1,2-азолов .....................................548
22.12. Окси- и амино-1,2-азолы....................................... 548
22.13. Синтезы 1,2-азолов ........................................... 550
22.13.1. Синтезы кольца .......................................... 550
22.13.2. Примеры некоторых важных синтезов с использованием 1,2-азолов.554
Упражнения ................................................. 555
Литература...................................................... 555
23. БЕНЗАННЕЛИРОВАННЫЕ АЗОЛЫ: РЕАКЦИИ И МЕТОДЫ СИНТЕЗА .................560
23.1. Реакции с электрофильными реагентами.......................... .561
23.1.1. Присоединение по атому азота ........................ 561
23.1.2. Замещение по атому углерода......................... .561
23.2. Реакции с нуклеофильными реагентами ..................... 562
23.3. Реакции с основаниями....................................... 563
23.3.1. Депротонирование по атому азота ......................... 563
23.4. Реакции С-металлированных производных........................... 563
23.4.1. Литийорганические производные................................563
23,4.2. Реакции, катализируемые палладием........................ 564
23.5. Реакции с восстановителями ............................... .564
23.6, Электроциклические реакции................................ .564
23.7. Четвертичные соли .................................... .564
23.8. Окси- и амино-1,3-азолы .................................... 565
23.9. Методы синтеза................................................ 566
23.9.1. Синтезы колец бензо-1,3-азолов......................... 566
23.9.2. Синтезы колец бензо-1,2-азолов......................... 568
Литература........................................ .........571
24. ПУРИНЫ: РЕАКЦИИ И МЕТОДЫ СШГГЕЗА ............................. 575
24.1. Нуклеиновые кислоты, нуклеозиды и нуклеотиды............... .577
24.2. Реакции с электрофильными реагентами............................ 579
24.2.1. Присоединение по атому азота...............................579
24.2.2. Замещение по атому углерода ........................... .583
24.3. Реакции со свободными радикалами.............................. 584
24.4. Реакции с окислителями ................................... .585
24.5. Реакции с восстановителями...................................... 585
24.6. Реакции с нуклеофильными реагентами ....................... .585
24.7. Реакции с основаниями...................................... 588
24.7.1. Депротонирование N-водорода.............................. .588
24.7.2. Депротонирование С-водорода.......................... 589
24.8. Реакции N-металлированных пуринов ........................... .589
24.9. Реакции С-металлированных пуринов............................. 589
24.9.1. Литийорганические производные ........................... 589
24.9.2. Реакции, катализируемые палладием........................ 590
24.10. Окси- и аминопурины..............................................591
24.10.1. Оксипурины............................................ 591
24.10.2. Аминопурины .................................... .593
24.10.3. Тиопурины ....................................... .595
24.11. Алкилпурины............................................... .596
24.12. Пуринкарбоновые кислоты.................................... .596
24.13. Синтезы пуринов........................................... 596
24.13.1. Синтез кольца................................... .596
24.13.2. Примеры синтезов некоторых важных пуринов ............. 601
Упражнения ............................................... 603
Литература ............................................... 603
25. ГЕТЕРОЦИКЛ Ы. СОДЕРЖАЩИЕ УЗЛОВОЙ АТОМ АЗОТА...........................608
25.1. Индолизины ................................................. .608
25.1.1. Реакции индолизинов..........................................609
25.1.2. Синтезы индолизинов ..................................... 610
25.2. Азаиндолизины.....................................................611
25.2.1. Имвдазо[1,2-о]пиридин...................................... 612
25.2.2. Имвдазо[1,5-п]пиридины..................................... 613
25.2.3. Пиразоло[1,5-п]пиридины ................................... 614
25.2.4. Триазол о- и тетразолопиридины....................... .615
25.2.5. Соединения, содержащие дополнительный атом азота в шестичленном цикле 617
25.3. Хинолизиниевые соли и родственные соединения......................618
25.4. Пирролизины и родственные системы.................................619
25.5. Циклазины....................................................... 620
Упражнения.................................................... ...621
Литература...........................................................622
26. ГЕТЕРОЦИКЛЫ, СОДЕРЖАЩИЕ БОЛЕЕ ДВУХ ГЕТЕРОАТОМОВ.......................625
26.1. Пятичленные циклы......................................... .625
26.1.1. Азолы................................................. 625
26.1.2. Оксадиазолы и тиадиазолы ............................... 634
26.1.3. Другие системы.......................................... 636
26.1.4. Синтезы кольца.......................................... 637
26.2. Шестичленные циклы............................................. 639
26.2.1. Азины................................................... 639
26.2.2. Синтезы кольца.......................................... 642
26.3. Бензотриазолы .............................................. 643
Упражнения........................................................ 646
Литература........................................................ 646
27. НАСЫЩЕННЫЕ И ЧАСТИЧНО НЕНАСЫЩЕННЫЕ ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ: РЕАКЦИИ И МЕТОДЫ СИНТЕЗА .................................. 651
27.1. Пяти- и шестичленные циклы..................................... .652
27.1.1. Пирролидины и пиперидины......................................652
27.1.2. Пираны и восстановленные фураны ........................ .654
27.2. Трехчленные циклы............................................. 656
27.2.1. Трехчленные циклы с одним гетероатомом.......................656
27.2.2. Трехчленные гетероциклы с двумя гетероатомами.............. 659
27.3. Четырехчленные циклы............................................ 661
27.4. Металлирование ................................................ 662
27.5. Синтезы кольца............. .....................................663
27.5.1. Насыщенные азотсодержащие гетероциклы...................... 663
27.5.2. Насыщенные кислородсодержащие гетероциклы ................ 666
27.5.3. Насыщенные серосодержащие гетероциклы.........................667
Литература....................................... ............ 667
28. ГЕТЕРОЦИКЛЫ В ДЕЙСТВИИ..............................................671
28.1. Твердофазные реакции.......................................... 671
28.2. Гетероциклы в фармацевтической промышленности: крупнотоннажные синтезы 674
28.3. Применение в электронике .......................................675
28.3.1. Полипиррол и политиофен...................................676
28.3.2. Тетратиафульвалены................................... .676
28.3.3. Применение.............................................. 678
Литература...................................................... 679
ПРИЛОЖЕНИЕ. Ответы на упражнения повышенной сложности...681
Серия: Лучший зарубежный учебник
Учебное издание
Джоуль Джон, Миллс Кейт
ХИМИЯ ГЕТЕРОЦИКЛИЧЕСКИХ СОЕДИНЕНИЙ
Заведующий редакцией канд. хим. наук Т. И. Почкаева Ведущий редактор Г. Б. Шкляева Художник П. Инфанмэ
Оригинал-макет и техническое редактирование Е. В. Денюковой
Подписано к печати 21.07.04. Формат 70x100/16. Бумага офсетная. Печать высокая. Бум. л. 22,75. Печ. л. 45,5. Уч.-изд. л. 59,0. Изд. № 3/9818.Тираж 3000 экз.
Заказ № 0413380.
Издательство «МИР»
Министерства культуры и средств массовых коммуникаций РФ.
107996, ГСП-6, Москва, 1-й Рижский пер., 2.
Диапозитивы изготовлены в издательстве «Мир»
Отпечатано в полном соответствии с качеством предоставленных диапозитивов в ОАО «Ярославский полиграфкомбинат». 150049, Ярославль, ул. Свободы, 97