Автор: Пяткін К.Д. Кривошеїн Ю.С.
Теги: медицина мікробіологія вірусологія біологія
ISBN: 5-11-003585-7
Год: 1992
Текст
"—МІКРО-
БІОЛОГІЯ
З ВІРУСОЛОГІЄЮ
ТА ІМУНОЛОГІЄЮ
Переклав з російської В. В. Клінченко
Допущено Головним /правлінням
навчальних закладів, кадрів
і науки Міністерства
охорони здоров'я України
як підручник для студентів
медичних інститутів
Київ
«Вища школа»
1992
ББК 28.4я73
П99
УДК 579(075.8)
І
Перекладено за виданням: Пяткин К. Д., Кршошеин Ю. С. Микробиоло-
гия (с внрусологией и иммунологией): Учебиик.— 4-е изд., перераб. и доп.—
М.: Медицина, 1980.— 512 с.
Рецензенти: доктор медичних наук, професор А. Д. Циганенко (Хар-
ківський медичний інститут), доктор медичних наук, професор С. О. Павлович
(Гродненський медичний інститут)
Редакція літератури з медицини і біології
Редактор /. С. Каруліна
Пяткін К. Д., Кривошеїн Ю. С.
П99 Мікробіологія з вірусологією та імунологією: Підручник /
Пер. з рос. В. В. Клінченка.— К.: Вища шк., 1992.—431 с.: іл.
1$ВИ 5-11-003585-7
Матеріал підручника подано відповідно до навчальної програми з курсу
мікробіології з вірусологією та імунологією. Порівняно з попереднім виданням
(4-те вид.— 1980 р.) російською мовою підручник доповнено новими розділа-
ми, які стосуються ВІЛ — віруса імунодефіциту людини, збудників Т-клі-
тннного лейкозу, кампілобактеріозу, хвороби Лайма та інших інфекцій. До-
опрацьовано матеріал розділів, присвячених вірусам гепатиту, пікорна- і рео-
вірусам Висвітлено проблеми генної інженерії і йіотехнології виробництва
діагностичних і лікувально-профілактичних засобів інтерферони, імуномодулятори- та Ін.Ь ,, Для студентів МЄДИЧІИХ ІНЄЗ^УтТа» — 4107020000—051 | У1 учебний ФовА і 41 .1 (1_92 168-92 । 1 БИВЛнС'--Ка І$ВМ 5-11-003585-7 © © (моноклональні антитіла, ББК 28.4я73 * І Іздательство «Медицина» , > Москва, 1980 К.Д. Пяткін, Ю. С. Кри- вошеїн, 1992, із змінами . Переклав на українську мову В. В. Клінченко, 1992
ЗМІСТ
Передмова............................................. . . . 8
Список умовних скорочень ...................................... 9
Вступ......................................................... 10
Предмет і завдання мікробіології, вірусології та імунології....10
Історичний нарис розвитку мікробіології........................11
Частина п е р ш а. ЗАГАЛЬНА МІКРОБІОЛОГІЯ............ 20
Класифікація і номенклатура мікроорганізмів..................
Систематика бактерій .......................................
Морфологія та ультраструктура бактерій .....................
Класифікація вірусів.......................................
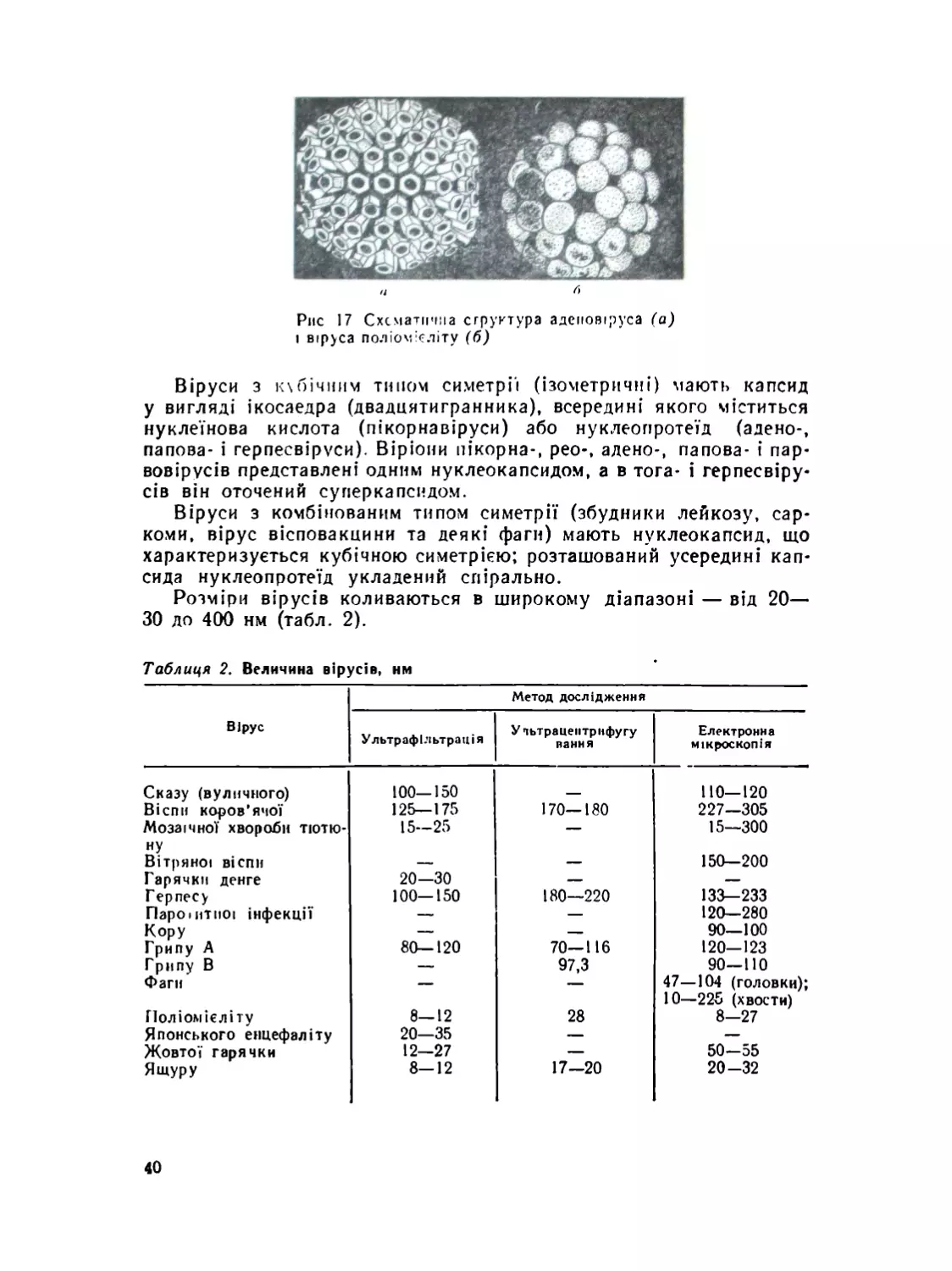
Морфологія та ультраструктура вірусів.......................
Фізіологія мікроорганізмів....................................
Хімічний склад бактерій ...................................
Хімічний склад вірусів......................................
Природа вірусів.............................................
Фізико-хімічні властивості бактерій ........................
Метаболізм бактерій.........................................
Механізм метаболізму бактерій.............................
Ферменти бактерій.......................................
Транспорт поживних речовин................................
Білковий обмін............................................
Вуглеводний обмін ........................................
Ліпідний обмін............................................
Мінеральний обмін ........................................
Практичне використання ферментативних властивостей мікро-
організмів ...............................................
Дихання бактерій............................................
Утворення мікроорганізмами пігментів........................
Свічення мікроорганізмів....................................
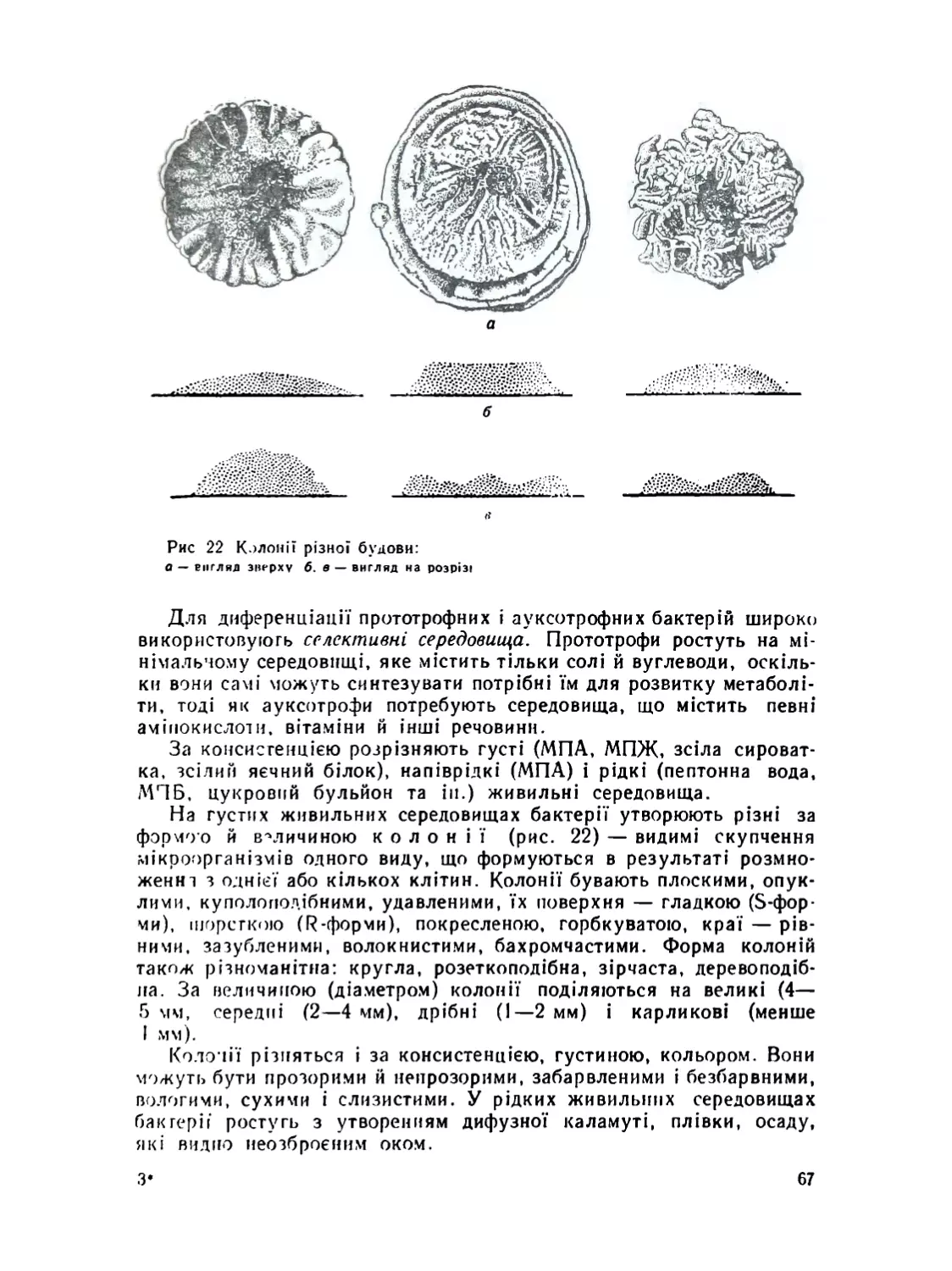
Ріст і розмноження бактерій.................................
Культивування бактерій .....................................
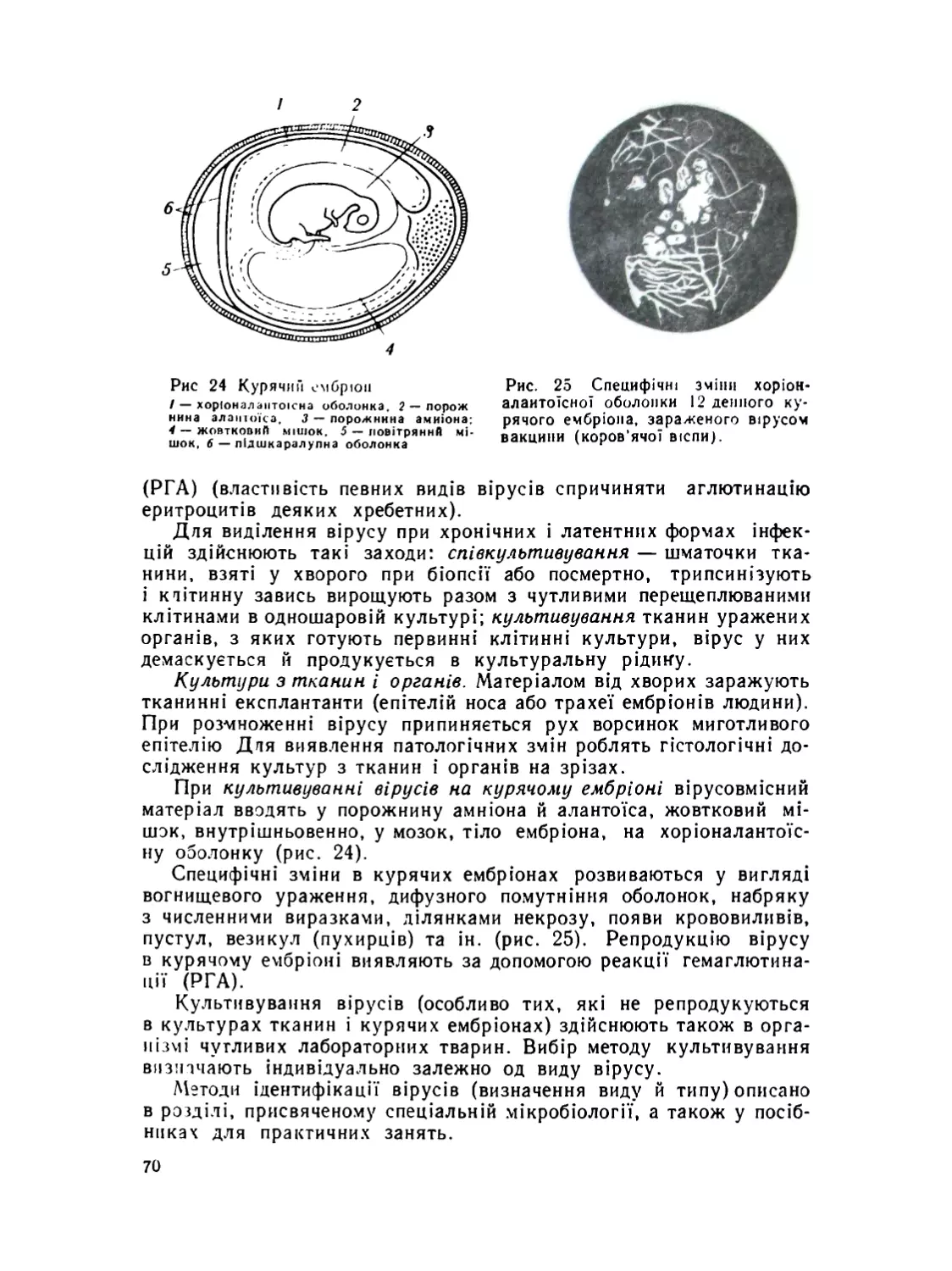
Культивування вірусів .................................. .
Поширення мікроорганізмів у природі, екологія мікроорганізмів .
Мікрофлора грунту ..........................................
Мікрофлора води ............................................
Мікрофлора повітря і предметів ужитку.......................
Мікрофлора харчових продуктів ... ..........................
Мікрофлора організму людини ................................
Віпнп навколишнього середовища на мікроорганізми . . . .
Дія фізичних факторів.....................................
20
22
23
38
38
41
41
43
44
45
46
48
49
50
51
52
54
54
55
56
59
60
61
64
69
71
73
75
77
80
84
89
89
Дія хімічних речовин .....................................
Вплив біологічних факторів................................
Генетика мікроорганізмів .....................................
Основні етапи розвитку .......................................
Мінливість основних ознак мікроорганізмів.....................
Форми мінливості мікроорганізмів..............................
Неспадкова мінливість.....................................
Спадкова мінливість.......................................
Мутації...................................................
Генетичні рекомбінації....................................
Роль цитоплазматичних генетичних структур у мінливості бак-
терій ........................................................
Практичне значення мінливості мікроорганізмів.................
Вчення про інфекції...........................................
Інфекція та інфекційний процес................................
Форми симбіозу ...............................................
Патогенність і вірулентність мікроорганізмів..................
Фактори патогенності .....................................
Механізм вірусних інфекцій .... .........
Роль макроорганізму, навколишнього середовища і соціальних
факторів у виникненні і розвитку інфекційного процесу . . .
Механізми передачі збудників інфекційних захворювань . . .
Розвиток інфекційного процесу ................................
Розповсюдження патогенних мікроорганізмів.....................
Форми прояву інфекції.........................................
Вчення про імунітет...........................................
Основні фактори захисту організму ............................
Неспецифічна резистентність ..............................
Спадковий (видовий, або природжений) імунітет.............
Набутий імунітет..........................................
Механізми імунної відповіді...............................
Антигени ...............................................
Антитіла (імуноглобуліни) ..............................
Теорії утворення антитіл ...............................
Імунологічна толерантність .
Первинні (природжені) імунодефіцити! стани................
Вторинні (набуті) імунодефіцити! стани....................
Аутоімунні процеси........................................
Форми імунітету............................................
Антибактеріальний імунітет................................
Антитоксичний імунітет ...................................
Противірусний імунітет ...................................
Протипухлинний імунітет...................................
Протипаразитарний імунітет................................
Колективний імунітет......................................
Трансплантаційний імунітет................................
Алергія ......................................................
Гіперчутливість негайного типу.............................
Анафілаксія...............................................
Сироваткова хвороба ......................................
Атопії ...................................................
92
93
96
96
97
100
100
101
102
105
ПО
114
115
115
116
118
119
124
128
131
132
133
134
137
138
138
145
145
146
149
152
156
157
158
158
159
160
160
161
161
163
164
165
165
167
167
167
169
170
Гіперчутливість уповільненого типу..............................171
Реакції імунітету............................................... 172
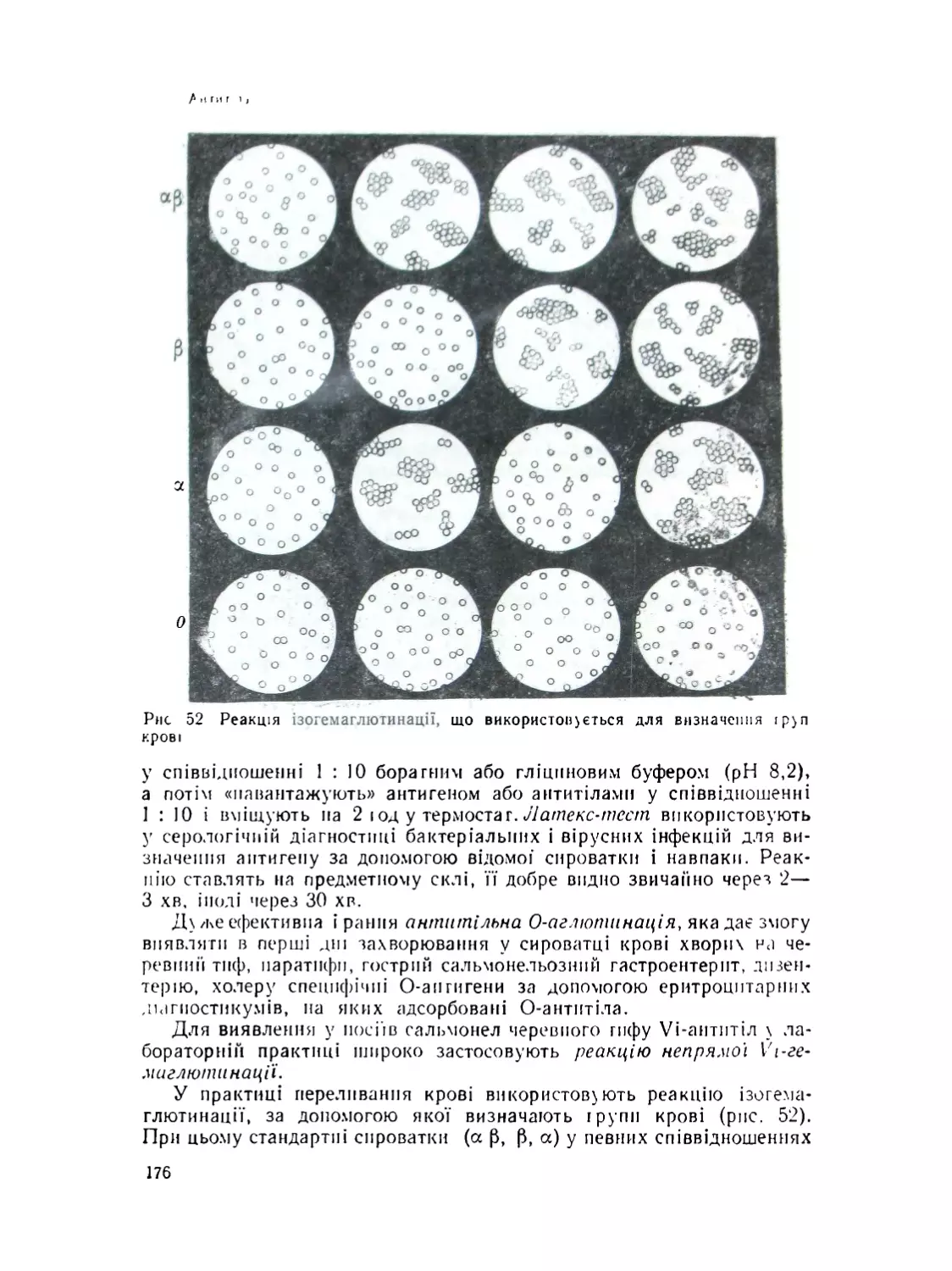
Аглютиніни й реакція аглютинації................................174
Преципітини і реакція преципітації..............................177
Антитоксини і реакція нейтралізації токсину антитоксином . . 178
Лізннн і реакції лізису.........................................179
Реакція зв’язування комплементу.................................180
Інші імунологічні реакції ......................................180
Специфічна імунотерапія та імунопрофілактика інфекційних захво-
рювань .............................................................183
Вакцинопрофілактика..........................................183
Вакцинотерапія................................................1°6
Серотерапія і серопрофілактика................................186
Хіміотерапія і хіміопрофілактика інфекційних захворювань ... 187
Хіміотерапевтичні засоби......................................187
Антибіотики ..................................................19°
Частина друга. СПЕЦІАЛЬНА МІКРОБІОЛОГІЯ ...................196
Бактерії і захворювання, що спричиняються ними у людини . . 196
Грамнегативні коки........................................196
Гонококи................................................196
Менінгококи.............................................199
Родина ЕпІегоЬасіегіасеае.................................201
Сальмонели черевного тнфу і паратифів.....................202
Збудники гострого сальмонельозного гастроентериту .... 208
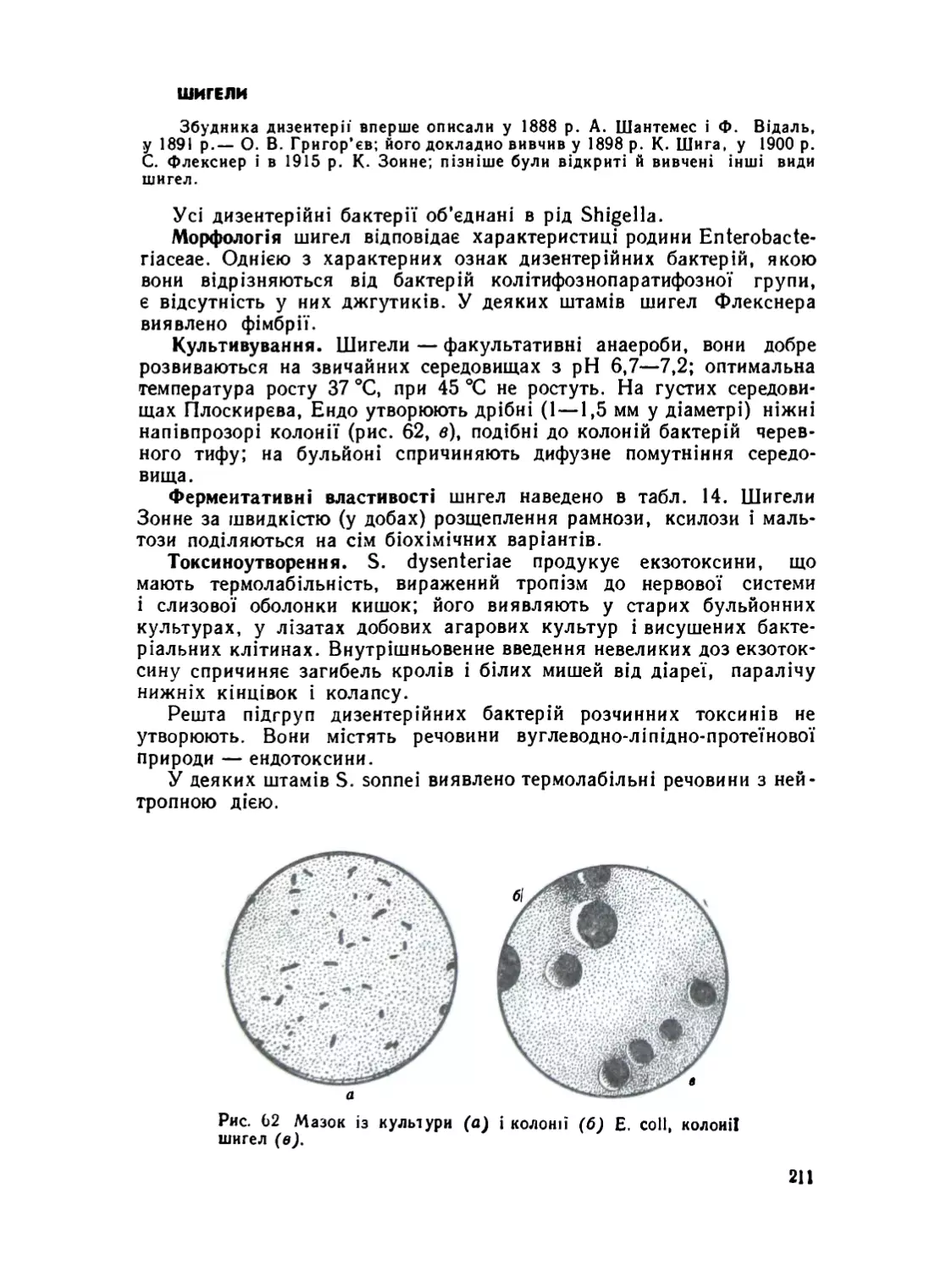
Шнгели .......................................................211
ЕзсЬегісЬіа соїі..............................................
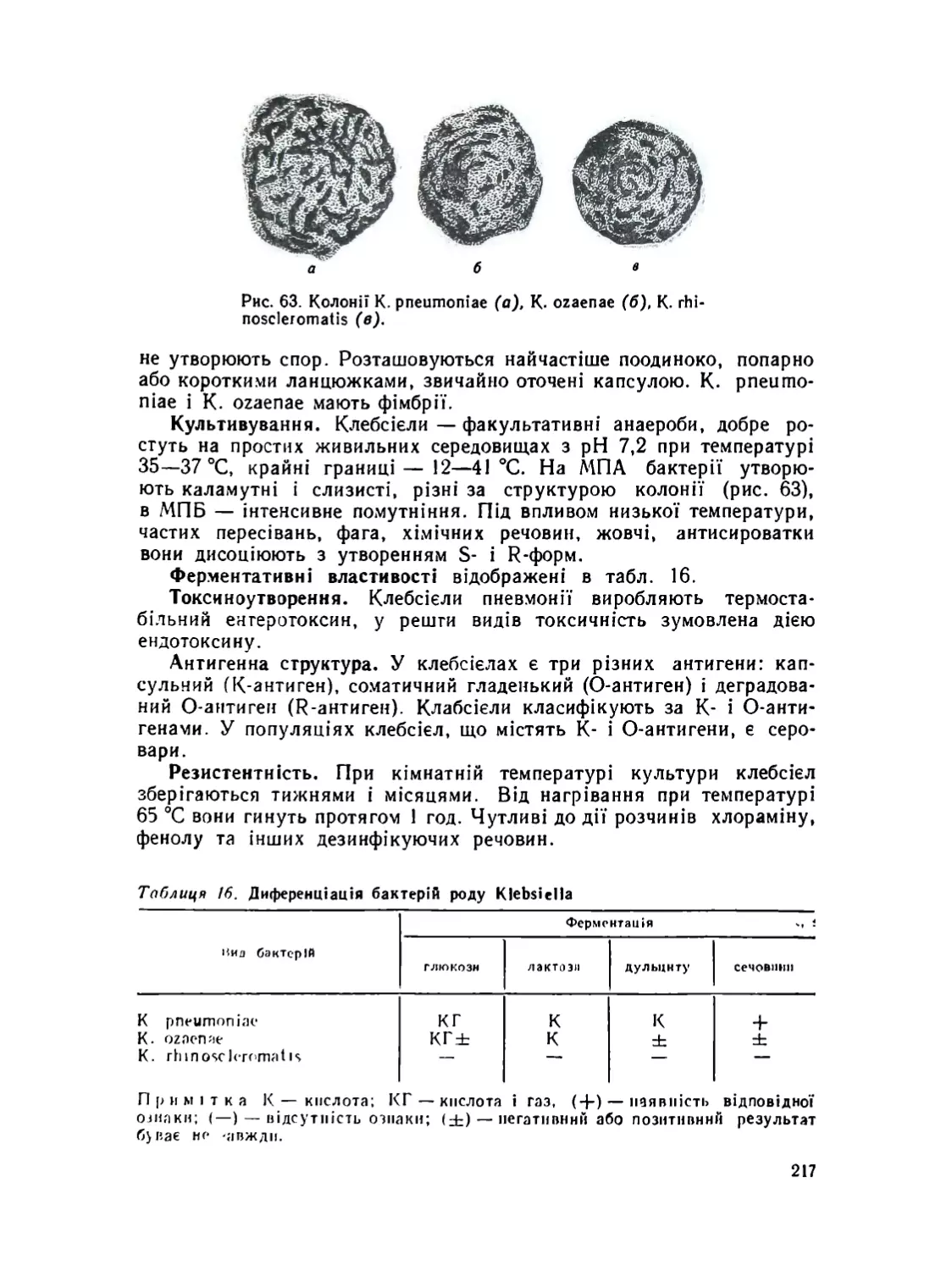
Клебсієлн ....................................................
Ентеробактер .................................................
Цитробактер ..................................................
Зеггаііа .....................................................
Протей........................................................
І єре ин її...................................................
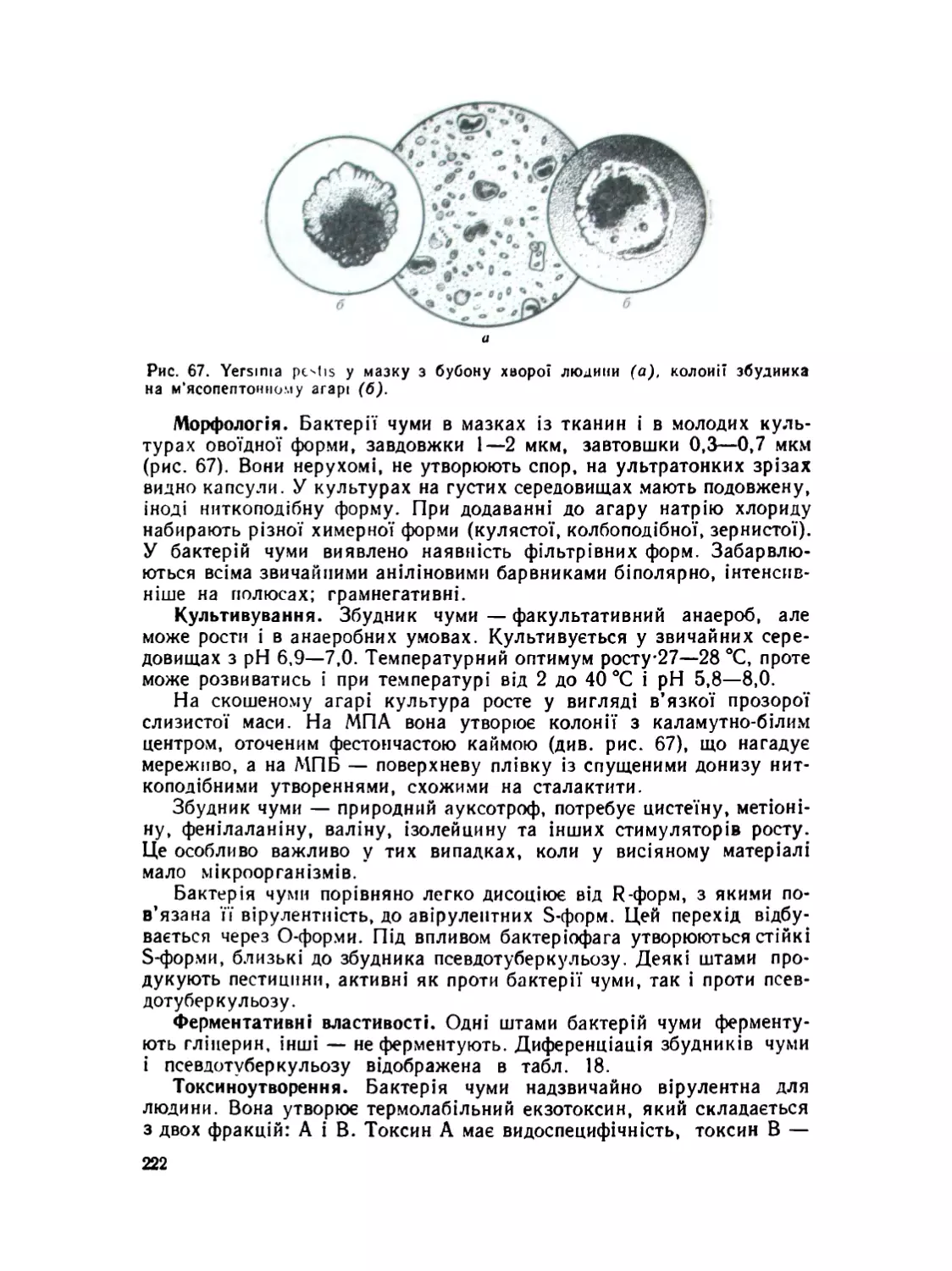
Збудник чуми ...............................................
Збудники псевдотуберкульозу та ієрсиніозу...................
Родина УіЬгіопасеае ...........................................
Холерний вібріон .............................................
Парагемолітичиий вібріон......................................
Пастерели ......................................................
Наеторіїііцз іпПиепгае........................................
Збудник м’якого шанкеру ......................................
Збудники бруцельозу і туляремії ................................
Бруцели.......................................................
Збудник туляремії.............................................
Бордетели ......................................................
Збудник коклюшу...............................................
Грампозитивні коки .............................................
Стафілококи...................................................
Стрептококи ..................................................
Патогенні аеробні бацили........................................
Збудник сибірки ..............................................
Патогенні споротворні анаероби ............................
Клостридії правця.............................................
Клостридії ботулізму..........................................
Клостридії анаеробної інфекції................................
СІозІгМіиш регїгіп^епз......................................
СіозігМіит поууі............................................
СіозігМіит зеріісит.........................................
СіозігМіит Ьізіоіуіісит.......................................
Оозігідіит діИісіІе.........................................
Патоіснні мікобактерії.................•........................
Збудники туберкульозу ........................................
Збудник лепри ................................................
Патогенні актиноміцети .........................................
Коринебактерії..................................................
Збудник дифтерії..............................................
Пропіонібактерії та еубйктерії................................
Л істерії ......................................................
ЕгузіреіоІЬгіх гЬизіораІЬіае....................................
Патогенні спірохети..........................................• .
214
216
219
219
220
220
221
221
225
226
226
230
231
231
233
234
234
237
240
240
243
243
249
256
256
262
262
21'5
269
269
270
271
27 ’
27?
274
274
281
283
?6
:С6
• 02
Збудник сифілісу...............................................
Інші патогенні ірепонеми ......................................
Патогенні лептоспіри ..........................................
Збудники поворотного тифу .....................................
Патогенні спірили .............................................
Кампілобактерії................................................
Родина Р$еи(1опіопа<іасеае.....................................
Синьогнійпа паличка ...........................................
Збудник сапу ..................................................
Збудник меліоїдозу.............................................
Бактероїди ....................................................
Збудник хвороби легіонерів.....................................
Рикетсії ......................................................
Збудник висипного тифу ....................................
Збудник ендемічного блошиного (пацюкового) висипного тифу
Збудник марсельської гарячки ..............................
Збудник північноазіатського кліщового рнкетсіозу...........
Збудник гарячки цуцугамуші . ..........
Збудник везикульозиого рикетсіозу..........................
Збудники пароксизмальних рнкетсіозів ......................
Збудник Ку-гарячки.........................................
Бартонели .................................................
Патогенні хламідії.............................................
Патогенні мікоплазми ..........................................
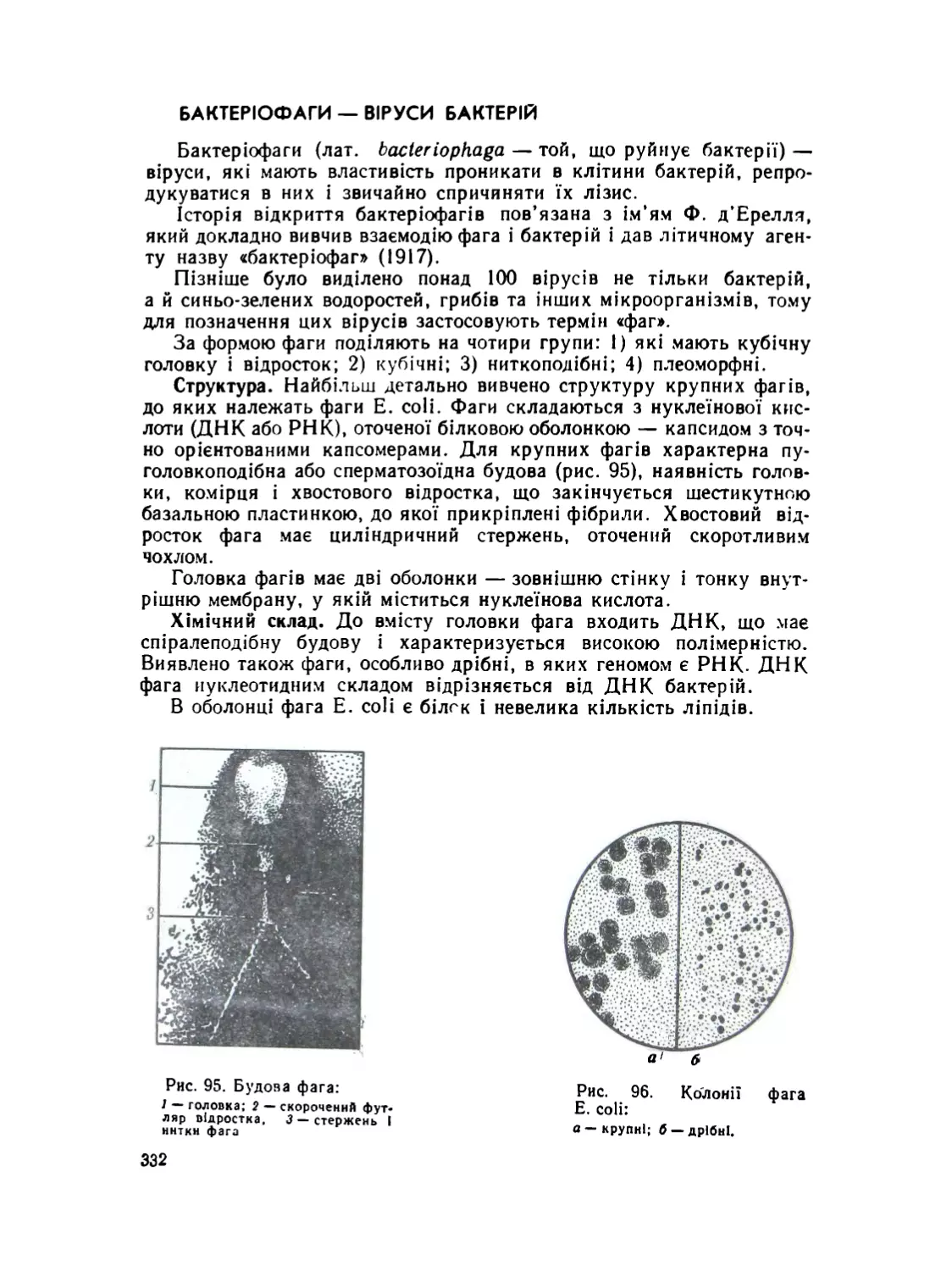
Бактеріофаги — віруси бактерій.................................
Віруси і спричинювані ними захворювання........................
Віруси, що містять дмоксирибонуклеїнову кислоту (ДНК) . . .
Поксвірусн.....................................................
Вірус натуральної віспи .................................
Герпесвіруси ..............................................
Вірус простого герпесу ..................................
Вірус вітряної віспи й оперізуючого герпесу..............
Вірус цитомегалії........................................
Аденовіруси........................................ ... .
Паповавірусн ..............................................
Гепадновіруси .............................................
Віруси, що містять рибонуклеїнову кислоту (РНК)................
Ортоміксовіруси ...........................................
Віруси грипу ............................................
Параміксовіруси ...........................................
Віруси парагрипу ........................................
Вірус хвороби Ньюкастла..................................
Респіраторно-сннцнтіальний вірус.........................
Вірус паротитної інфекції................................
Вірус кору ..............................................
Рабдовірусн ...............................................
Вірус сказу .............................................
Пікорнавіруси .............................................
Вірус поліомієліту...................................* . .
Ентеровіруси Коксакі, ЕСНО та інші.......................
Вірус гепатиту А ........................................
Астровірусн .............................................
Віруси ящуру.............................................
Кальцивіруси ..............................................
Рннові русії ..............................................
Тогавіруси.................................................
Вірус кліщового енцефаліту...............................
Вірус японського енцефаліту .............................
Вірус омської геморагічної гарячки.......................
Вірус жовтої гарячки.....................................
Вірус гарячки денге .....................................
294
298
300
303
307
ЗЛЯ
309
,309
310
312
.315
316
317
319
320
321
321
322
323
323
325
326
329
332
334
334
334
336
339
340
342
344
345
347
348
351
351
351
354
354
356
356
357
358
360
360
363
363
365
367
369
369
370
370
371
371
373
374
374
375
6
Альфавіруси.............................................
Вірус краснухи .........................................
Буньявірусн...............................................
Вірус кримської геморагічної гарячки....................
Вірус флеботомної (москітної) гарячки...................
Аренавірусн ..............................................
Вірус лімфоцитарного хоріоменінгіту.....................
Вірус Ласса.............................................
Коронавірусн .............................................
Реовіруси ................................................
Ротавіруси ...............................................
Орбівіруси ...............................................
Віруси Марбурга та Єбола................................
Збудники повільних інфекцій...............................
Ретровіруси ..............................................
Онковірусн .............................................
Вірус Т-клітинного лейкозу..............................
Вірус імунодефіциту людини (ВІЛ)........................
Патогенні грнби і захворювання, що спричиняються ними у людини
Фікоміцети....................................................
Аскоміцети ...................................................
Базидіоміцети ................................................
Дейтероміцети ................................................
Збудник споротрихозу .........................................
Збудники кандидозу ...........................................
Збудники глибоких бластомікозів...............................
Збудники гістоплазмозу........................................
Збудники хромомікозу .........................................
Найпростіші і захворювання, що спричиняються ними у людини
Джгутикові....................................................
Лейшманіі ................................................
Трипаносоми ..............................................
Трихомонади ..............................................
Лямблії...................................................
Саркодові ....................................................
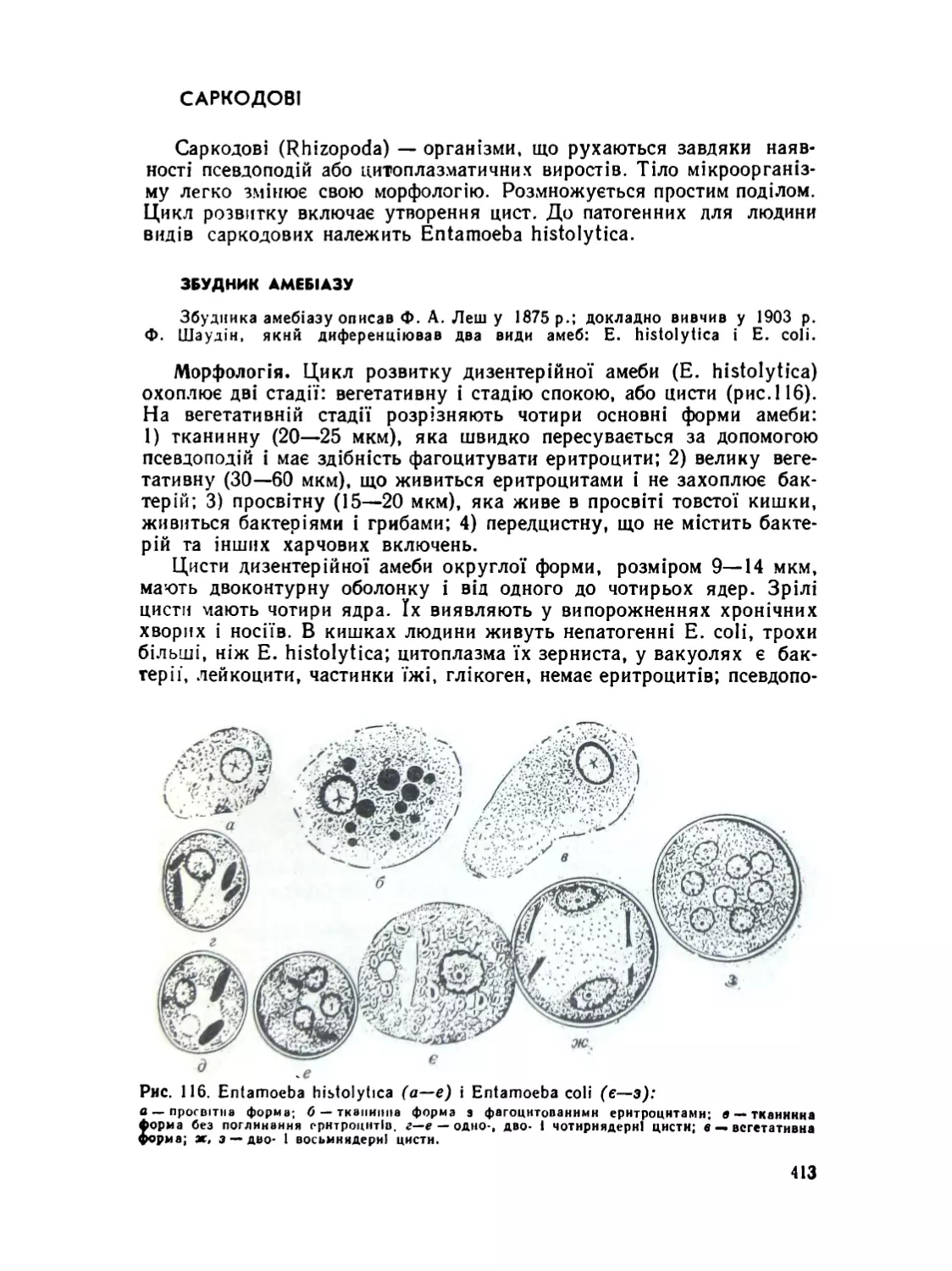
Збудник амебіазу..........................................
Споровики ....................................................
Плазмодії малярії.........................................
Кокциді!..................................................
_ Токсоплазми ................................................
Війкові (інфузорії)...........................................
Збудник балантидіазу .....................................
Мікроорганізми порожнини рота і їх роль у розвитку деяких захво-
рювань ................................................
Захворювання порожнини рота, спричинювані мікроорганізмами .
376
377
378
378
379
380
380
380
381
382
382
383
383
384
385
385
387
388
391
393
394
396
397
401
401
403
403
404
404
405
405
408
410
412
413
413
415
415
419
420
424
424
425
428
СПИСОК УМОВНИХ СКОРОЧЕНЬ
ІФА — Імуноферментний аналіз
МПА — м’ясо-пептоиний агар
МПБ — м’ясо-пептонний бульон
МПЖ — м’ясо-пептонна желатина
РА —реакція аглютинації
РГА — реакція гемаглютинації
РГадс — реакція гемадсорбції
РГГадС—реакція гальмування гемадсорбції
РГГА — реакція гальмування гемаглютинації
РГНГА — реакція гальмування непрямої гемаглютинації
РЗК — реакція зв’язування комплементу
РЗНГА — реакція зворотної непрямої гемаглютинації
РІА —радіоімунологічиий аналіз
РІФ — реакція імунофлюоресценції
РН—реакція нейтралізації
РИГА —реакція непрямої гемаглютинації
РП —реакція преципітації
РПГ — реакція преципітації в гелі
ПЕРЕДМОВА
За 10 років, що минули після виходу в світ четвертого видання
підручника, мікробіологія, вірусологія й імунологія значно попов-
нились новими даними, змінились програма і навчальні плани.
З урахуванням останніх досягнень науки до відповідних розділів
тексту включено сучасні відомості з систематики, номенклатури
і класифікації мікроорганізмів, молекулярної структури бактерій
і вірусів, які розкривають раніше невідомі механізми фізіології
мікроорганізмів, інфекційного процесу й імунітету. Висвітлена роль
генної інженерії і біотехнології у виробництві діагностичних, ліку-
вально-профілактичних засобів (моноклональні антитіла, інтерферони,
імуномодулятори га ін.).
Відображено значення мікроорганізмів у створенні і збереженні
екологічної рівноваги біосфери.
Розділ спеціальної мікробіології доповнено матеріалом, що сто-
сується вірусу імунодефіциту людини, збудників хвороби легіонерів,
кампілобактеріозу, хвороби Лайма, Т-клітинного лейкозу та ін. Пе-
рероблено розділи, присвячені вірусам гепатиту, пікорнавірусам,
реовірусам тощо.
Матеріал підручника відповідає програмі з курсу мікробіології,
вірусології та імунології; систематику й номенклатуру мікроорганіз-
мів подано за Вегдеу’з Мапиаі о( Зузіетаііс Васіегіоіо^у (1984).
Автори висловлюють глибоку вдячність за цінні вказівки при
підготовці підручника до видання професорам В. С. Кіктенку,
Г. П. Кондратенку, О. І. Коротяєву, В. К. Патратію, Г. К. Палію,
доктору медичних наук Є. К. П’яткіну, кандидатам медичних наук
Ю. М. Ачкасовій, Т. О. Сарачан, Л. В. Тишкевич, Н. І. Бризгу-
новій.
Усі побажання і критичні зауваження будуть прийняті авторами
в вдячністю.
ВСТУП
ПРЕДМЕТ І ЗАВДАННЯ МІКРОБІОЛОГІЇ, ВІРУСОЛОГІЇ
ТА ІМУНОЛОГІЇ
Мікробіологія (від грец. ШЇСГО&— дуже малий, найдрібніший,
ЬІ08 — ЖИТТЯ, І0§08 — вчення) — наука про дуже дрібні, не видимі
неозброєним оком живі істоти, названі мікроорганізмами. Вона ви-
вчає закономірності їх життя і розвитку, а також зміни, які вони
спричинюють в організмі людей, тварин і в неживій природі.
Розвиток мікробіології, як і інших наукових дисциплін, залежить
від способів виробництва, вимог практики, загального прогресу на-
уки й техніки. Відповідно до потреб суспільства мікробіологія дифе-
ренціювалась на загальну, сільськогосподарську, промислову, ме-
дичну, санітарну, ветеринарну, космічну та ін.
На основі мікробіології виникли самостійні наукові дисципліни,
такі, як вірусологія, імунологія, мікологія, паразитологія та інші,
що мають власні об’єкти і методи дослідження.
Медична мікробіологія займається питаннями систематики, но-
менклатури і класифікації патогенних для людини мікроорганізмів,
вивченням їх морфології, фізіології, генетики, ролі в етіології і па-
тогенезі інфекційних захворювань, а також розробляє методи їх
лабораторної діагностики, специфічного лікування і профілактики.
АІікробіологія як самостійна галузь знань має спеціальні мето-
ди досліджень, а також широко користується для вирішення різних
питань такими методами досліджень і методичними прийомами, як
хроматографія, спектроскопія, електрофорез, радіонуклідне дослі-
дження, люмінесцентна й електронна мікроскопія, ультрацентрифу-
гування та ін.
Провідну роль в інфекційній патології людей і тварин тепер віді-
грають вірусні захворювання, що заподіюють величезної шкоди здоро-
в’ю населення і спричинюють значні економічні збитки. Відкриття
нових вірусних інфекцій, виявлення ролі вірусів в онкогенезі потре-
бує дальшого розвитку науки про віруси — вірусології. Усе це зу-
мовлює необхідність проведення фундаментальних і прикладних до-
сліджень для розробки високоефективних методів і засобів діагно-
стики, лікування і профілактики вірусних захворювань.
10
Фундаментальні відкриття другої половини XX ст. в галузі при-
родознавства (розшифрування структури і функції генетичного коду,
механізмів синтезу білка, мінливості, індукції і репресії генів та ін.)
дали змогу розкрити раніше невідомі механізми взаємовідношень
мікроорганізмів з навколишнім середовищем і навчитися керувати їх
життєдіяльністю. Відкриття в галузі мікробіології та вірусології
створили передумови для виникнення нових наукових дисциплін —
молекулярної біології, генної інженерії, інженерної ензимології,
біотехнології. Досягнення цих наук дали змогу добути штами мікро-
організмів, що е продуцентами нових біологічно активних речовин,
лікарських і діагностичних засобів (інтерферони, інтерлейкіни, анти-
біотики, вакцини, моноклональні антитіла та ін.). Ці засоби дають
змогу проводити ефективну ранню діагностику, лікування і профілак-
тику інфекційних та інших захворювань людини.
Важливою віхою розвитку мікробіології е виникнення, становлен-
ня і розвиток імунології — однієї з провідних галузей сучасної ме-
дицини і біології. Почавшись із перших емпіричних дослідів захисту
людей від інфекційних захворювань, вона тепер займається розшиф-
руванням механізмів генетичної регуляції імунної відповіді і створен-
ням імуномодулюючих засобів. Дальший розвиток імунології —
актуальна проблема сьогоднішнього дня.
Мета і завдання медичної мікробіології, вірусології та імуноло-
гії — запобігання, зниження захворюваності і ліквідація інфекцій-
них захворювань. У нашій країні ці важливі проблеми розв’язує
розгалужена мережа санітарно-епідеміологічних станцій, бактеріоло-
гічних, вірусологічних, паразитологічних та інших спеціалізованих
лабораторій, науково-дослідних інститутів, кафедр мікробіології,
вірусології та імунології медичних інститутів, які забезпечують орга-
нізаційну, методичну, науково-дослідну і практичну роботу. Заходи,
намічені для дальшого розвитку охорони здоров’я, вселяють упевне-
ність в успішному подоланні серйозних недоліків і дальшому про-
гресі профілактичної медицини.
ІСТОРИЧНИЙ НАРИС РОЗВИТКУ МІКРОБІОЛОГІЇ
Задовго до відкриття мікроорганізмів людству були відомі про-
цеси гниття і бродіння, що спричиняються їх життєдіяльністю. Ці
процеси використовувались для виготовлення виноградних вин, кис-
лого молока,' кумису, хліба та інших продуктів.
На ранніх етапах становлення медицини лікарі і дослідники при-
роди Гіппократ (460—377 рр. до н. е.), Пліпій (23—75 рр. н. е.),
Гален (131—211 рр. н. е.) та інші висловлювали гіпотези про живу
природу (сопіа^іит уіуит) збудників інфекційних захворювань.
Авіценна (980—1037 рр. н. е.) писав у «Каноні медицини» про те,
що причиною чуми, віспи та інших хвороб є не видимі простим оком
найдрібніші живі істоти, що передаються через воду і повітря.
З розвитком фізики, хімії і медицини в епоху Відродження і в пе-
ріод промислової революції XVI—XVIII ст. у Західній Європі і Росії
почали нагромаджуватися спостереження і наукові дослідження про
11
сутність Інфекційних захворювань (Д. Фракасторо, 1478—1553;
Т. Сиденгам, 1624—1689; Д. С. Самойлович, 1744—1805, та іи.). На
початку XVII ст. завдяки успіхам оптики дослідники відкрили рані-
ше невідомий світ найдрібніших організмів.
У 1590 р. шліфувальники стекол Ганс і Захарій Янсенн сконструювали іа
збільшувальних скелець прилад, що давав змогу бачити найдрібніші предмети.
У 1609—1610 рр. Г. Галілей (1564—1642) виготовив перший простий мікро-
скоп. У 1617—1619 рр. з'явився дволінзовнй мікроскоп 8 опуклим одиночним
об’єктивом і окуляром, винахідником якого, так вважають, був фізик К. Дреб-
бель. Цей мікроскоп використовували для дослідження клітин рослинних
і тваринних тканин, а також найдрібніших жнвнх організмів.
Першим побачив і описав мікроорганізми голландський натураліст
А. Левенгук (1632—1723). Він виготовив високоякісні лупи і скон-
струював мікроскоп, що давав збільшення в 160—300 раз. У 1678 р.
А. Левенгук описав виявлених у воді, різних настоях, випорожнен-
нях, зубному нальоті «живих звіряток», яких він спостерігав за до-
помогою свого мікроскопа. У 1695 р. він видав свою працю «Таємни-
ці природи, відкриті Антоніем Левенгуком». А. Левенгук не тільки
безперечно першим виявив мікроорганізми, а й дуже ретельно зма-
лював їх.
Відкриття А. Левенгука викликали жвавий інтерес у багатьох
учених і стали поштовхом до вивчення мікросвіту. Та все ж тільки
через 150—200 років було виявлено участь мікроорганізмів у проце-
сах бродіння, гниття, кругообігу азоту, вуглецю та інших речовин
у біосфері, установлено їх роль в етіології інфекційних захворювань.
Уже на перших етапах розвитку мікробіології було зроблено спро-
би пов’язати її з практичними завданнями боротьби’з епідемічними
захворюваннями. Російський лікар Д. С. Самойлович (1744—1805)
висловив думку про те, що «чума спричиняється особливою і зовсім
незвичайною істотою». Спираючись на свій багатий досвід боротьби
з чумою, він дійшов висновку, що для запобігання цьому захворю-
ванню треба вводити в організм ослаблене заразне начало Щоб до-
вести правильність свого припущення, він самовіддано здійснив дуже
небезпечний дослід, прищепивши собі в 1771 р. заразний матеріал,
узятий від людини, яка перехворіла на бубонну форму чуми. За
глибоке вивчення чуми Д. С. Самойловича було обрано почесним
членом багатьох західноєвропейських академій.
Висловлені Д. С. Самойловичем положення про причину інфек-
ційних захворювань відіграли важливу роль у дальшій розробці
теоретичних і практичних питань профілактики чуми та багатьох
інших інфекційних захворювань.
Англійський лікар Е. Дженнер (1749—1823) у 1796 р. довів, що
прищеплення люїям збудника коров’ячої віспи захищає їх від зара-
ження натуральною віспою. Запропонований Е. Дженнером метод
вакцинації озброїв медицину могутнім засобом для успішної боротьби
з цим тяжким захворюванням.
Розвиток промислового капіталізму зумовив бурхливе зростання
природознавства і технічних наук, у тому числі мікробіології. Уже
в першій половині XIX ст. було відкрито деякі мікроорганізми —
збудники інфекційних захворювань. У 1839 р. І. Шенлейн довів,
12
Л. Пастер (1822—1895)
Р. Кох (1843-1910)
що разус (парта) спричинюється хвороботворним грибом, у 1843 р.
Д. Грубі виявив збудника грихофітії (стригучий лишай), у 1849—
1854 рр. А. Поллендер, К. Давен і Ф. А. Брауль відкрили бацилу
сибірки.
У другій половині XIX ст. з’явилися досконаліші мікроскопи,
набагато поліпшилась техніка мікроскопіювання.У вивченні мікро-
організмів почали приділяти увагу біохімічним процесам— власти-
вості їх ферментувати органічні речовини.
З ім’ям геніального французького вченого, хіміка і мікробіолога
Л. Пастера (1822—1895) пов’язані найважливіші відкриття в галузі
мікробіології. Л. Пастер блискуче підтвердив передбачення фізика
і хіміка XVII ст. Р. Бойля про те, що природу заразних хвороб зрозу-
міє той, хто пояснить природу бродіння. Л. Пастер довів ферментатив-
ну природу спиртового, молочнокислого і маслянокислого бродіння,
виявив у деяких бактерій новий (анаеробний) тип дихання. Він уста-
новив, що гниття, а також гнійні захворювання у людини спричи-
няються діяльністю певних видів мікроорганізмів.
Велике значення мають праці Л. Пастера про хвороби вина, пива,
шовковика (пебрину) та заходи боротьби з ними. Добуті ним дані
лягли в основу розвитку промислової мікробіології. Дослідження
Л. Пастера започаткували застосування профілактичних щеплень.
Він виготовив вакцини проти курячої холери, сибірки І сказу. Вихо-
дячи із спостережень про повсюдність мікроорганізмів.Л. Пастер роз-
робив методику досліджень, яка забезпечує захист живильних сере-
довищ від прямого потрапляння в них мікроорганізмів. Він довів,
що самовільного зародження живих істот не буває.
ІЗ
Праці Л. Пастера стали основою для розвитку медичної мікро-
біології. Учнями і послідовниками Л Пастера були видатні вчені
Е. Ру, А. Іерсен, Т. Рамон, Ж- Борде, Ф. д’Еррель, А. Кальметт,
Ш. Герен та ін. У Пастерівському інституті в Парижі працювали
І. І. Мечников, С. М. Виноградський, М. Ф. Г'амалія, А. М. Безред-
ка та ін.
У XIX ст. медицина збагатилась досконалими методами боротьби
з нагниванням ран. Англійський хірург Д. Лістер запровадив у хі-
рургії принцип антисептики (знезаражування ран хімічними дезин-
фікуючими засобами).
Величезне значення для медичної мікробіології мали відкриття
німецького вченого Р. Коха (1834—1910), який озброїв її новими ме-
тодами дослідження. У практику лабораторної техніки він і його учні
ввели густі поживні середовища (картопля, желатина, зсіла сироват-
ка, м’ясо-пептонний агар), анілінові барвники,почали застосовувати
імерсійну систему, конденсор Аббе, мікрофотографування. Завдяки
удосконаленню техніки і методики мікробіологічних досліджень
Р. Кох остаточно довів етіологію сибірки і холери, відкрив збудників
туберкульозу, виготував із туберкульозних мікобактерій туберкулін.
За відкриття збудника туберкульозу Р. Кох у 1905 р. був відзначе-
ний Нобелівською премією.
Р. Кох докладно вивчив ранову інфекцію, розробив спосіб виді-
лення в чистій культурі патогенних бактерій. Учнями Р. Коха були
К. Еберт, Г. Гаффкі, Ф. Леффлер, С. Кітазато і багато інших. Успі-
хи медичної мікробіології у з’ясуванні етіології інфекційних захво-
рювань зумовили необхідність вивчення захисних реакдій організму
на дію інфекційних агентів. У розробку цього дуже важливого для
теорії і практики питання великий внесок зробив видатний росій-
ський учений І. І. Мечников (1845—1916).
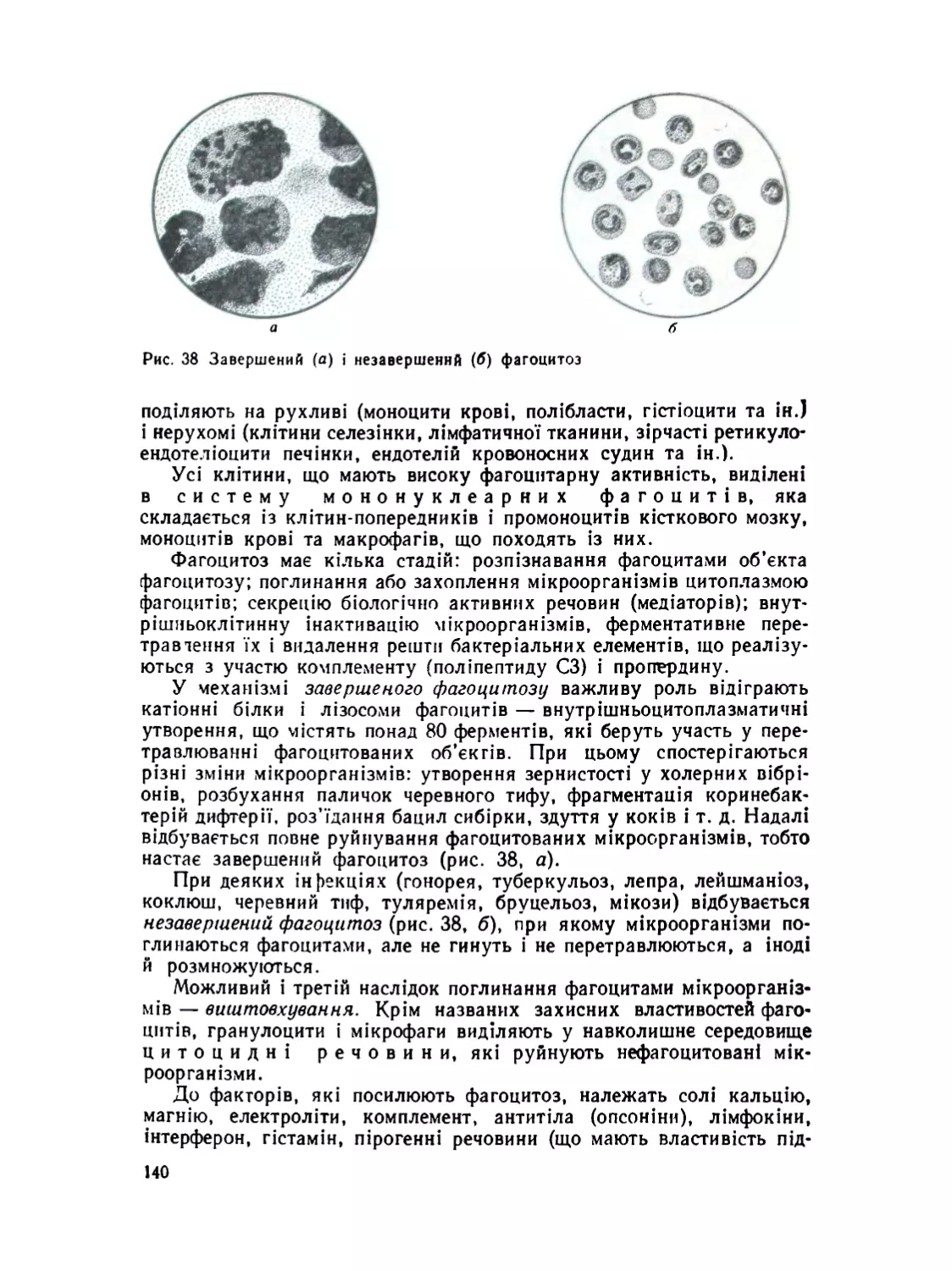
Класичні праці І. І. Мечникова лягли в основу вчення про фа-
гоцитоз і визначили новий етап у розвитку медицини. В результаті
багаторічних досліджень І. І. Мечников відкрив і вивчив процес
внутрішньоклітинного травлення у деяких тварин, що здійснюється
клітинами мезодермального походження. Проведений ним у 1882 р.
дослід над прозорими личинками морських зірок показав, що мезодер-
мальні клітини захищали тіло цих тварин від введених у них сто-
ронніх речовин. Ці спостереження дали підстави припустити, що
подібні клітини (лейкоцити, клітини селезінки, кісткового мозку
та ін.) виконують функцію захисту від хвороботворних мікроорга-
нізмів, які проникли в організм тварин або людини. Мезодермальні
клітини, що мають захисні властивості. І. І. Мечников назвав фаго-
цитами. Фагоцитарна теорія була викладена ним у 1883 р. на VII з’їз-
ді російських природознавців і лікарів в Одесі.
Учення про фагоцитоз стало основою для розуміння сутності запалення.
І. І. Мечннков довів, що запалення є активною реакцією проти хвороботворних
агентів і що ця реакція забезпечує стійкість організму, яка сформувалася
в процесі еволюційного розвитку тварнн і людини.
І. І. Мечннков і Л. Пастер заклали початок учення про антагонізм мікро-
організмів, яке пізніше було використане при виготовленні антибіотиків. Разом
ізафранцузькнм мікробіологом Є. Ру в 1903 р. І. 1. Мечников розробив метод
14
І. І. Мечннков (1845—1916) П. Ерліх (1854—1915)
відтворення експериментального сифілісу. І. І. Мечннков був організатором
першої в Росії бактеріологічної станції в Одесі. Він створив велику школу
мікробіологів (Г. М. Габрнчевськнй, А. М. Безредка, І. Г. Савченко, Л. О. Тара-
севич, М. Ф. Гамалія, Д. К. Заболотний, М- Я. і Ф- Я. Чистович та ін.).
Прогресивна наукова і громадська діяльність І. І. Мечннкова накликала
на нього переслідування з боку царського уряду. Учений із світовим ім’ям
у розквіті енл змушений був покинути батьківщину. Протягом 28 років (1888—
1916), до кінця свого життя, він працював у Парижі в Пастерівському
інституті.
І. І. Мечннков був яскравим виразником наукової думки, ученнм-патрі-
отом. Перебуваючи в Парижі, він залишався російським підданим і часто при-
їжджав у Росію з науковою метою, сприяючи розвиткові вітчизняної медичної
науки.
Вивчення І. І. Мечниковим проблем фагоцитозу сприяло появі
праць ряду вчених (П. Ерліх, Р. Пфейффер, Ж- Борде та ін.), у яких
було доведено, що в захисних реакціях організму певну роль віді-
грають особливі речовини сироватки крові — антитіла, які вироб-
ляються спеціальними клітинами під впливом мікроорганізмів і про-
дуктів їх життєдіяльності.
У 1888 р. французькі вчені Е. Ру та А. Ієрсен довели, що збудник дифтерії
продукує біологічну отруту (токсин), і з’ясували її значення в розвитку захво-
рювання. У 1890 р. лауреат Нобелівської премії німецький учений Е. Берінг
і японський дослідник С. Кітазато повторними введеннями тваринам невеликим
доз правцевого і дифтерійного токсину добули відповідні імунні сироватки.
Е. Ру у Франції (в Пастерівському інституті), Я. Ю- Бардах (1893) і Г. М. Габ-
рнчевськнй (1894) у Росії внготовилн протидифтерійну сироватку і застосували
її для лікування дітей, хворнх на дифтерію.
Ці відкриття стали основою для виготовлення лікувальних сироваток про-
ти ботулізму, анаеробної інфекції, отрути змій те їй.
Одночасно з І. І. Мечниковим механізм несприйнятливості до Інфекційним
захворювань внвчав визначний німецький дослідник П. Ерліх (1854—1915),
який створив теорію гуморального Імунітету, навколо якої точилась тривала
15
1 вперта боротьба думок, що поділила вчених на два табори: прихильників
П. Ерліха та його супротивників на чолі з 1. 1. Мечниковнм
Ця полеміка викликала широкий інтерес до проблеми імунітету, зумовила
здійснення численних досліджень у цій галузі і призвела до важливих прак-
тичних результатів: було розроблено досконаліші лабораторні методи діагно-
стики інфекційних захворювань, добуто вакцини проти черевного тифу, холе-
ри, чумн та ін. Завдяки широкій дискусії і численним дослідженням було до-
ведено, що несприйнятливість до інфекційних захворювань залежить як від
клітннннх, так і від гуморальних факторів. У 1908 р за розробку вчення про
імунітет 1. І. Мечникову і П. Ерліху присуджено Нобелівську премію.
Великі заслуги в розвитку медичної мікробіології належать
ученим, які відкрили збудників багатьох інфекційних захворювань
(див. розділи «Спеціальної мікробіології»).
У XX ст. зроблено дуже важливі відкриття в галузі специфічної' профі-
лактики інфекційних захворювань. У 1924—1925 рр. Г. Рамон розробив метод
виготовлення анатоксинів (знешкоджених формаліном токсинів), за допомогою
яких почали успішно робити щеплення проти дифтерії і правця. Було виготов-
лено вакцинні препарати з живих, але ослаблених збудників проти туберку-
льозу та інших захворювань.
На високу оцінку заслуговують праці, що дали змогу відкрити сальвар-
сан (П. Ерліх), бактеріофаги (Ф. д’Еррель), сульфаніламідні препарати
(Г. Домагк та ін.), пеніцилін (А. Флемінг, Е. Чейн, Г. Флорі), стрептоміцин
(3. Баксман, А. Шатц, Е. Бугі) та інші лікарські засоби, завдяки застосуван-
ню яких сучасна медицина досягла величезних успіхів.
Новим етапом у формуванні мікробіології слід вважати розвиток
генетики мікроорганізмів, в результаті чого було з’ясовано механіз-
ми обміну генетичним матеріалом у бактерій (Дж. Ледерберг, Г Бідл,
Е. Тейтум та ін.).
Генетика бактерій і вірусів відіграла незаперечну роль у виник-
ненні молекулярної біології, найважливішим завданням якої є ви-
вчення атомно-молекулярної структури білка,нуклеїнових кислот
та інших біополімерів, проявів життєдіяльності організмів у їх
найпростішій елементарній формі на рівні молекул.
Значними досягненнями XX ст. е виділення в самостійні наукові
дисциптічи вірусології та імунології, висунення й обгрунтування
проблеми ліквідації (ерадикації) інфекційних захворювань, практич-
на реалізація наукових досліджень у галузі біотехнології мікробіоло-
гічного синтезу білка та інших органічних сполук.
Прогрес мікробіології сприяв дальшому розвиткові епідеміології,
хірургії, гігієни та інших наук.
Початок розвитку мікробіології в Росії пов’язаний з іменами чу-
дового лікаря і вченого Д. С. Самойловича, а також видатного біоло-
га-експериментатора, лікаря-мікробіолога М. М. Тереховського
(1740—1796). У праці «Про наливковий хаос Ліннея» (1775) він довів,
що нагрівання поживних субстратів призводить до загибелі наявних
у них живих організмів, які він назвав «наливальними амалькулями».
Він спростував теорію про самовільне зародження мікроорганізмів
із неорганічних речовин і висунув положення про їх занесення із-
зовні.
Значний внесок у розвиток мікробіології зробив Л. С. Ценков-
ський (1822—1887), який виявив схожість бактерій з ціанобактері-
ями. У 1883 р. він одержав високоефективну стійку вакцину, яку
16
С. М. Внноградськнй (1856- 195”)
Я. й. Іваповський (1864—1920)
протягом більш як 60 років використовували в нашій країні для про-
філактики сибірки серед сільськогосподарських тварин. Л. С. Цен-
ковський довів, що утворення при цукроварінні слизуватої маси
(клеку) зумовлене Ееисопозіос тезепіегоібез, і розробив спосіб іа-
побігання цьому шкідливому процесові при виробництві цукру.
Наприкінці XIX ст. сформувалась сільськогосподарська мікро-
біологія, засновником якої був С. М. Внноградськнй (1856—1953).
Його дослідження можна з цілковитим правом віднести до найваж-
ливіших досягнень сільськогосподарської науки і практики. У 1890 р.
він відкрив нітрифікуючі бактерії і вивчив їх значення в кругообігу
азоту в природі. С. М. Виноградський і М. Бейерінк (1851 — 1931)
виявили азотфіксуючі бактерії.
Важливу роль відіграли вітчизняні вчені у розвитку медичної
протозоології. Ф. О. Леш (1840—1903) виявив у 1875 р. у випорож-
неннях хворого на дизентерію амеби, які Ф. Шаудін ідентифікував
як ЕпіатоеЬа соїі і ЕпіатоеЬа Ііізіоіуііса. У 1898 р. П. Ф. Боров-
ський (1863—1932) відкрив збудника шкірного лейшманіозу.
Основоположником вчення про віруси е мікробіолог Д. Й. Іва-
новський (1864—1920). Працюючи в Нікітському ботанічному саду
над вивченням мозаїчної хвороби тютюну, що заподіювала величезної
шкоди тютюновим плантаціям, він у 1892 р. довів, що це захво-
рювання спричинюється вірусом, який має високу заразливість і
яскраво виражену специфічну дію. Це відкриття показало, що поряд
з клітинними формами існують живі системи, які невидимі у звичай-
ному світловому мікроскопі, ПрОХОЛЯИк. чепез дрібнопористі фільтри
і не мають клітинної структури.
17
Через 6 років після відкриття Д. Й. Іваиовського М- Бейєрінк підтвердив
дані, добуті російським ученим. Завдяки дослідженням Д. Й. Іваиовського,
Ф. Леффлер і П. Фрош у 1897 р. виявили вірусну етіологію ящуру, а пізніше
було відкрито і вивчено збудників багатьох вірусних захворювань людини,
тварин і рослин.
М. Ф. Гамалія (1859—1949) заснував у 1896 р. (разом з І, І. Меч-
ннковим) першу в Росії бактеріологічну і другу в світі пастерівську
станцію, відкрив у 1888 р. парахолерний вібріон (УіЬгіо теізсЬпі-
коуіі), запропонував протихолерну вакцину, в 1918 р. організував
виробництво противіспяної вакцини. Дослідження М. Ф. Гамалії
присвячені вивченню інфекції та імунітету, мінливості бактерій,
профілактиці холери, висипного тифу, натуральної віспи, чуми та
інших захворювань.
Розквіт мікробіології' мав благотворний вплив на розвиток учення про
інфекційні захворювання. Мікробіологічні методи почали широко використо-
вувати при вивченні питань, що стосуються локалізації' збудників в організмі,
шляхів передачі епідемічних захворювань та способів боротьби з ними.
Значна заслуга в розвитку вчення про інфекційні захворювання належить
багатьом вітчизняним дослідникам, діяльність яких характеризується гуман-
ністю і прикладами самопожертви як у науці, так і в практиці. Винятковий ге-
роїзм проявили І О. Демннськнй, М. О. Лебедєв, А. І. Турчинович-Внжннке-
внч, 1. В. Мамонтов та інші, які заразились під час роботи, пов’язаної з ви-
вченням чуми, і загинули.
Г. М. Мінх та Й. й. Мочутковський у дослідах на собі довели за-
рази ість поворотного і висипного тифу і дійшли правильного виснов-
ку, що ці захворювання передаються кровососними комахами.
Основоположникові московської мікробіологічної школи Г. Н. Габ-
рпчевському (1860—1907) належать праці з дослідження скарлатини,
Д’і |)геоіі, чуми та інших інфекцій. Він організував у Москві вироб-
Д. К. Заболотний (1866-1929)
ництво протидифтерійної сиро-
ватки й успішно застосував її
для лікування дітей, хворих
на дифтерію.
Заслуженою славою оточене
ім’я українського вченого
Д. К-Заболотного (1866—1929),
який разом з В. К- Високовичем
вивчав епідеміологію чуми.
Він довів лікувальну дію про-
тичумної сироватки, науково
обгрунтував епідеміологічну
роль бабаків (тарбаганів) в утво-
ренні природних вогнищ чуми,
виявив літичну дію на трепо-
неми сироваток, хворих на
сифіліс.
До видатних вітчизняних
учених належать Є. І. Марци-
новський, який присвятив свої
дослідження боротьбі з маля-
рією, лейшманіозом, кліщовим
18
поворотним тифом, бруцельозом, москітною гарячкою; Л. О. Та-
расевич, який вивчав механізм дії ферментів фагоцитів,
ефективність профілактичних щеплень проти туберкульозу, ме-
тоди боротьби з висипним тифом та іншими хворобами; І. Г. Савчен-
ко, який досліджував імунітет при сибірці, холері й поворотному
тифі, скарлатині та інших інфекційних захворюваннях, брав актив-
ну участь у заходах з профілактики епідемічних захворювань.
Видатними вченими в галузі медичної мікробіології, вірусології
та імунології були Л. О. Зільбер (1894—1966), який із співробітни-
ками відкрив вірус кліщового енцефаліту і розробив метод профілак-
тики цього захворювання, дослідив механізм вірусної трансформації
нормальних клітин у злоякісні; 3. В. Єрмольєва (1898—1974), яка
присвятила свою наукову діяльність питанням бактеріофагії, профі-
лактики холери, вивченню нових антибіотиків; П. Ф. Здродовський
(1890—1976), який зробив великий внесок у вивчення мікробіології
та імунології малярії, бруцельозу, менінгококової інфекції, дифтерії,
природно-вогнищевих рикетсіозів та інших захворювань; В. Д. Ти-
маков (1905—1977), основні наукові праці якого присвячено розроб-
ці засобів і методів профілактики інфекційних захворювань, пробле-
мам генетики мікроорганізмів, теоретичної і прикладної імунології,
ролі Ь-форм бактерій і мікоплазм в інфекційній патології людей.
Відомі своїми дослідженнями в галузі вірусології, розробкою
більш ефективних вакцин проти віспи, поліомієліту, кору, паротит-
ної інфекції та інших проблем М. А. Морозов, М. П. Чумаков,
В. Д. Соловйов, О. О. Смородинцев, В. М. Жданов та інші вчені.
Частина перша
ЗАГАЛЬНА МІКРОБІОЛОГІЯ
КЛАСИФІКАЦІЯ І НОМЕНКЛАТУРА МІКРООРГАНІЗМІВ
- Мікроорганізми — найбільш ранні представники живих істот
на Землі, що з’явилися 3,5—3,8 млрд років тому. Деяких із них
виявляють і в наші дні у найдавніших геологічних відкладеннях.
Проблема походження й еволюції мікроорганізмів надзвичайно
складна. Одні дослідники вважали, що мікроорганізми — первинні
ж ізі істоти; на думку інших, їм передували неклітинні форми орга-
нізмів (археобіонти, фотобіонти, протобіонти та ін.).
Після відкриття у XVII ст. А. Левенгуком мікроскопічних жи-
вих істот минуло майже два століття, протягом яких був нагромадже-
ний великий фактичний матеріал, що показав їх відмінність від тва-
рин і рослин. Це дало змогу Е. Геккелю в 1866 р. виділити водоро-
сті, гриби, найпростіші І бактерії у самостійне царство Ргоіізіа
(першоістоти).
Згідно з класифікацією К- Лемана та Р. Неймана, усі мікроорга-
нізми за морфологією було поділено на три родини: Соссасеае, Васіе-
гіасеае, Зрігіїїасеае. У міру нагромадження нових наукових даних
про мікроорганізми ця класифікація зазнала істотних змін і була
значно доповнена, проте і в зміненому вигляді вона не могла задо-
вольнити мікробіологів, тому створювались більш досконалі і су-
часні класифікації.
В основі сучасної класифікації мікроорганізмів лежить розта-
шування їх за таксономічними категоріями (таксонами) на основі
схожості споріднених ознак. Номенклатура — це система назв так-
сономічних категорій відповідно до міжнародних правил.
Чим більше відомостей є про мікроорганізми, тим точніше їх мож-
на віднести до відповідної таксономічної категорії. Вивчення за до-
помогою сучасних метотів морфології, біохімії, фізіології, генетики
бактерій дає змогу дістати нові дані, що використовуються для вдо-
сконалення існуючої класифікації.
Великого поширення набули методи геносистематики і числової
(нумеричної) таксономії.
В основу геносистематики покладено визначення подібності і від-
мінності ДНК бактерій. Ступінь їх спорідненості визначається за
подібністю вмісту в молекулі ДНК нуклеотиду гуаніну і цитозину
(Г 4- Ц). Розроблено також методи молекулярної гібридизації ДНК,
з’ясування нуклеотидної послідовності генів, за допомогою яких
20
можна визначити спорідненість у межах виду. Мікроорганізми від-
носять до одного виду, якщо гомологія ДНК досягає 80—90 %. При
цьому враховують і інші критерії подібності (морфологічні, біохіміч-
ні, фізіологічні тощо).
Числова таксономія визначає спорідненість між мікроорганізмами
за подібністю численних характеристик. Це математичний метод
класифікації, який набрав поширення з розвитком комп’ютерної
техніки. Чим більше ознак відомо про мікроорганізми, тим достовір-
нішим буде коефіцієнт подібності. Мікроорганізми, що мають 90 %
подібності, відносять до одного виду; 70 % — до іншого.
Перелічені методи мають відносні границі точності, тому пара-
лельно обов’язково треба враховувати й інші критерії подібності.
Найефективнішим методом таксономії є поєднання геносистема-
тики і числової таксономії з класичними методами, що враховують
морфологію, біохімію, фізіологію та інші властивості бактеріальної
клітини.
У 1923 р. Д. Бергі склав перший міжнародний визначник бак-
терій. Наступні видання (1938—1974) визначника під назвою «Вег-
£еу’з Мапиаі оі ОеіегпііпаНуе Васіегіо1о°у» були підготовлені Між-
народним комітетом систематики бактерій.
Відповідно до нового кодексу номенклатури бактерій, що діє
з 1 січня 1980 р., запроваджено такі міжнародні класифікаційні ка-
тегорії царства Ргосагуоіае: Розділ — Клас — Порядок — Роди-
на — Рід — Вид. Основною номенклатурною одиницею є вид.
За сучасними даними, вид бактерій розглядають як сукупність
популяцій, що мають такі властивості: 1) спільне походження;
2) пристосованість до певного середовища життя; 3) подібність обмі-
ну речовин та характеру міжвидових відношень; 4) наявність подіб-
ного генетичного апарату, морфологічних та фізіологічних ознак.
Для визначення Виду мікроорганізму спочатку систематизують
основні його ознаки (морфологія, рухливість, спороутворення, біо-
хімічні та інші властивості), а потім за ними ототожнюють (ідентифі-
кують) мікроорганізм і знаходять за визначником його місце в кла-
сифікації бактерій.
У мікробіології, як і в біології, для визначення видів бактерій
прийнято подвійну (бінарну) номенклатуру, яка характеризується
тим, що кожен вид має родову і видову назви. Родову назву пишуть
з великої літери, видову — з малої. Так, наприклад, гноєрідний ста-
філокок називається ЗіарИуІососснз аигеиз, коринебактерія диф-
терії— СогупеЬасіегіит бірітіїїегіае, мікобактерія туберкульозу —
МусоЬасіегіит (иЬегсиїозіз, бацила сибірки — ВасіІІиз апіЬгасіз,
ктостриіії правця—СІозігідіит іеіапі, бліда трепонема — Тгеро-
пеша раїїідит та ін.
Якщо при вивченні виділених бактерій виявляють відхилення від
типових винових властивостей, то таку культуру розглядають як
підвид.
Є також інфрапідвидовий поділ, що грунтується на відмінності
за якимись незначними спадковими властивостями: антигенними —
серовар, морфологічними — морфовар, хімічними — хемовар, біохі-
21
мічними або фізіологічними — біовар, патогенністю— патовар, від-
ношенні до фагів — фаговар
З розвитком генетики і селекції мікроорганізмів запроваджено
поняття популяції — елементарної еволюційної одиниці (структури)
групи особин певного виду. Клон — ие сукупність особин, що похо-
дять від однієї клітини.
Під терміном «штам» розуміють культуру бактерій, виділену
з організму людини або тварини і з зовнішнього середовища.
Мішаними культурами називають суміш неоднорідних мікроорга-
нізмів, виділених із природних субстратів (нестерильних порожнин,
тканин організму, харчових продуктів, води, повітря, грунту, змивів
із предметів). Чисті культури — це мікроорганізми одного виду або
підвиду.
СИСТЕМАТИКА БАКТЕРІЙ
У 1984 р. вийшло в світ нове видання систематики бактерій Вег-
£еу’з Мапиаі о( Зузіетаїіо Васіегіоіо^у, у підготовці якого брали
участь 124 вчених із 14 країн світу. У ньому більш детально і повно
подано відомості про мікроорганізми загального, медичного або про-
мислового значення, їх нумеричну таксономію, а також генетичний,
серологічний і хемотаксономічний методи дослідження більшості най-
важливіших патогенних для людини і тварин видів.Викладено основи
номенклатури бактерій та принципи їх ідентифікації, дано екологічну
характеристику (місця існування, ніші), наведено рецепти середовищ
для виділення культур деяких груп бактерій. Подано основні дані
з генетики, фаго- і серотипування, бактеріоцинотипування мікро-
організмів, резистентності їх до антибіотиків, патогенності для лю-
дини і тварин, перелічено основні фактори патогенності, а також
інші властивості.
У І томі посібника наведено грамиегативиі аероби й анаероби, які поді-
ляються на 11 груп.
Група 1. Спірохети: родина ЗрігосИаеіасеае (роди ЗрігосИаеіа, Сгізїізрі-
га, Тгеропета, Воггеїіа), родина Ьеріозрігасеае (рід Ьеріозріга), інші організми.
Група 2. Аеробні (мікроаерофільиі, рухливі, спіралеподібні), вібрі-
оноподібиі бактерії (роди ЗрігіПигп, СатруїоЬасіег, ВдеІІоуіЬгіо, Агозрігіі-
іит, УатрігоуіЬгіо та ін.).
Група 3. Нерухомі (або рідко рухливі) зігнуті бактерії: родина
Зрігозогпасеае (роди Зрігозота, Кипеїіа, ЙесіоЬасіПиз та ін.).
Група 4. Аеробні палички і коки: родина Рзеисіотопасіасеае, Агоіо-
Ьасіегіасеае, КЬігоЬіасеае, Меіїїуіососсасеае, НаїоЬасіегіасеае, АсеіоЬасіегі-
асеае, Ье^іопеПасеае, Иеіззегіасеае (роди РІауоЬасіегіипі, Аісаіі^епез, Вгисеїіа,
Вогііеіеііа, Егапсізеїіа та ін.).
Група 5. Факультативно анаеробні палички: родини ЕпіегоЬасіе-
гіасеае, УіЬгіопасеае, Разіеигеїіасеае (роди Разіеигеііа, НаеторЬііиз, Асііпо-
ЬасіІІиз, Ргоіеиз, Ргоуісіепсіа, Могеапеїіа та ін.).
Група 6. Васіегоідасеае (роди ВасіегоЙез, РизоЬасіегіит, Ьеріоігі-
сіїіа та ін.; усього 13 родів).
Група 7. Бактерії, які розщеплюють сульфат і відновлюють сірку
(роди ОезиИиготопаз, безиіїоуіЬгіо, Оезиїїососсиз та ін.; усього 7 родів).
Група 8. Анаеробні грамиегативиі коки. Родина І. УеіІІопеПасеае
(роди УеіПопеПа, Асіаатіпососсиз, Ме^азрЬаега).
Група 9. Рикетсії і хламідії: порядки Кіскеіізіаіез, СЬІатудіаІез.
22
Г р у п « 10. Мікоплазми: родина Мусоріазтаіасеае (роди Мусоріазта,
Цгеаріазта), АсЬоІерІазтасеае (рід АсЬоІерІазта), Зрігоріазгааіасеае (рід 5рі-
горіазта) та ін. _
Група 11. Ендосямбіонтв —бактерії, то живуть на найпростіших
комахах, грибах, безхребетних.
У II томі (Гігшіспіез) дано характеристику грамнозитнвним бактеріям.
Група 12. Родина Місгососсасеае, роди Місгососсш, Зіошаіососсох,
БіарЬуІососсаз; 10 родів (без родин): Зігеріососоїз, Ееосоповйє, Ребіососсш,
Реріососспз, Реріоиігеріососсиз, Загсша та ін.
Група 13. Роди Васіїїоз, СІозігібіиш та ін.
Група 14. Роди ЕасІоЬасіІІиз, Ьізіегіа, ЕгузіреІоіЬгіх та ін.
Група 15. Роди СогупеЬасіегіш, РгоріопіЬасіегішп, Асііпошусеіез,
ВИїдоЬасіегіиш.
Група 16. Родина МусоЬасіегіасеае, рід МусоЬасіегінт.
Г р у п а 17. Некордіоформні бактерії, роди Ьіосагіііа, Рзеп<кнюсаг<ііа та ін.
До ПІ тому входять археобактерії*, ціанобактерії** і решта грамвега-
тивних видів, до IV тому — актиноміцети.
Бактеріальна таксономія, що розпочиналась в основному як
інтуїтивний процес, тепер е цілком об’єктивною в результаті розвитку
кількісних методів. Можна з певністю стверджувати, що класифіка-
ція бактерій, наведена в останньому виданні визначника, найближ-
чим часом буде перероблена у зв’язку з появою нових даних про
мікроорганізми.
Класифікацію бактерій із зазначенням родів і видів подано у від-
повідних розділах спеціальної мікробіологи.
МОРФОЛОГІЯ ТА УЛЬТРАСТРУКТУРА БАКТЕРІЙ
Бактерії (грец. Ьасіегіа — паличка) — це в основному одно-
клітинні організми, що не мають хлорофілу. Величину бактерій вимі-
рюють у мікрометрах (мкм), вона дуже варіює. Більшість патогенних
бактерій мають розміри 0,2—10 мкм. Серед сапрофітів трапляються,
велетенські бактерії, що досягають 55—125 мкм.
За формою бактерії поділяють на кулясті, або коки, паличкопо-
дібні (бактерії, бацили і клостридїї), звивисті (вібріони, спірили,
спірохети) і ниткоподібні (хламідобактерії).
Коки (грец. соссиз — зерно) — кулясті мікроорганізми правиль-
ної сферичної, еліпсоподібної, бобовидяої або ланцетоподібної форми
(рис. 1). За розташуванням, характером поділу та біологічними вла-
стивостями розрізняють мікрококи, диплококи, стрептококи, тетра-
коки, сарцнни і стафілококи. Середній діаметр коків — 0,5—1,5 мкм.
Мікрококи (грец. тісго$ — маленький) характеризуються оди-
ночним, парним або безладним розташуванням клітин. Це сапрофіти,
які існують у воді, повітрі (М. Іиіеиз. М. ГО5ЄП5. М. уагіапзта ін.).
Диплококи (грец. Ліріооі — подвійний) поділяються в одній пло-
щині й утворюють парні коки, з’єднані по дві особини. До диплоко-
* До археобактерій віднесені метанотворні. галофільві і териоаяхсфільн: мік-
роорганізми, що відрізняються від івшвх прокаріотів примітивним характером
стінок, мембран, а також хімічним складом і метаболізмом, відсутністю пеятждо-
глікану
** Ціанобактерії належать до справжніх прокаріотів, раніше їх возаачалв
терміном «синьо-зелені водорості».
ІЗ
Рис. 1. Кулясті бактерії:
а —мікрококи; б —диплококи; • — стрептококи; « —тетракоки; д — сарцннн; в — стафіло-
коки
ків належать менінгокок — збудник менінгококової інфекції і гоно-
кок — збудник гонореї і бленореї.
Стрептококи (грец. ьігеріоз — зігнутий, звивистий) поділяються
в одній площині, розташовуються ланцюжками різної довжини.
Є патогенні для людини стрептококи, які спричинюють в основному
гнійно-запальні захворювання.
Тетракоки (грец. іеіга — чотири) поділяються у двох взаємно
перпендикулярних площинах, розташовуються по чотири особини.
Дуже рідко є збудниками захворювань у людини.
Сарцини (лат. загсіпа — тюк, пакет) — кокові форми, які поді-
ляються у трьох взаємно перпендикулярних площинах і мають
вигляд тюків по 8, 16 клітин і більше. Вони часто трапляються в по-
вітрі. Патогенних для людини видів сарцин не виявлено.
Стафі юкоки (грец. зіарКуІе — гроно) — коки, що поділя-
ються в різних площинах, розташовуються неправильними скупчен-
нями. Мають властивість спричиняти гнійно-запальні захворювання
різних органів у тварин і людини.
б
Рис. 2 Паличкоподібні бактерії:
а — днплобактерії; б — бактерії з округленими, загостреними, обрубаними
б потовщеними кінцями; в — палички різної форми І стрептобактерІТ.
24
Паличкоподібні (циліндричні) бактерії (рис. 2) поділяються на
власне бактерії, бацили і клостридії. Довжина паличкоподібних бак-
терій І—10 мкм, товщина —0,5—2 мкм.
До власне бактерій належать паличкоподібні мікроорганізми,
які не утворюють спор (ешерихії, збудники черевного тифу,паратифів,
дизентерії, дифтерії, туберкульозу та ін.).
Бацили (лат. Ьасіїїиз — паличка) і клостридії (лат. сіозіег —
веретено) здебільшого утворюють спори (збудники правця, сибірки,
ботулізму та ін.).
Паличкоподібні бактерії бувають з округленими (більшість
паличок), загостреними (фузобактерії) та обрубаними (збудники си-
бірки) кінцями.
Трапляються бактерії з булавоподібними стовщеннями на кінцях
(збудник дифтерії), деякі види можуть утворювати розгалуження
у вигляді бокових виростів (мікобактерії туберкульозу і лепри).
За взаємним розташуванням паличкоподібні форми поділяються
на три групи: 1) днплобактерії і диплобацили, які розмішуються
парами по довжині (бактерії пневмонії); 2) стрептобактерії (збудник
м’якого шанкеру) і стрептобацили (збудник сибірки) — ланцюжком;
3) бактерії і бацили, що розташовуються без певної системи (біль-
шість паличкоподібних форм).
Загальна кількість паличкоподібних бактерій значно більша,
ніж кокоподібних.
Звивисті бактерії (рис. 3). До цієї групи належать вібріони, спі-
рили і спірохети.
Вібріони (лат. оіЬго —звиватися) — клітини, вигин яких дорів-
ню- 1'4 завитка спіралі, мають вигляд коми. Типовими представни-
ками цього роду є холерний вібріон — збудник холери і водні вібрі-
они, що населяють багато водойм.
Спірили (лат. зріга — завиток) — звивисті бактерії, що мають
вигини з одним або кількома обертами спіралі. До патогенних нале-
жать ЗрігіІІит тіпог — збудник содоку, що передається через укуо
пацюків та інших гризунів; СатруїоЬасіег )е]ипі — спричинює у тва-
рин і людини захворювання кишок і сечостатевих органів.
Спірохети — бактерії штопороподібної форми, завширшки 0,3—
1,5 мкм, завдовжки 7—500 мкм (рис. 4). До них належать збудники
сифілісу, поворотного тифу, лептоспірозу, а також деякі непатогенні
для людини бактерії.
Ниткоподібні бактерії (сіркобактерії, залізобактерії) —насель-
ники водойм. До них належать актиноміцети, що мають вигляд роз-
галужених ниток; їх міцелій (рис. 5) довжиною 100—600 мкм і тов-
щиною 0,5—1,2 мкм.
Рис. З Звивисті бактерії: а
в —вібріони; б — спірили
25
26
Рве. 6. Поліморфізм рикет-
сій:
а, г — дрібні паличкоподібні;
6 — ниткоподібні, в — кокопо-
дібні.
Рис. 7. Мусоріазта Ьотіпіз.
Крім названих основних форм, виявлено бактерії трикутної, зір-
коподібної, кільцеподібної форм.
Мікроорганізми характеризуються поліморфізмом — різ-
номанітністю їх форм і розмірів залежно од віку та стадії розвитку,
що зумовлюється їх індивідуальною мінливістю. Вони дуже пластичні
і легко змінюються під впливом різних факторів: температури, по-
живного середовища, концентрації солей, кислотності, продуктів
метаболізму, дезинфікуючих агентів, лікарських засобів, інгібіторів
організму та ін.
Особливо часто поліморфізм у бактерій проявляється при культи-
вуванні їх у штучних середовищах. В результаті реакцій бактерій
на дію фізичних і хімічних компонентів поживного субстрату утво-
рюються різні за формою і величиною клітини: дуже збільшені, роз-
дуті, кулясті, колбоподібні або ниткоподібні (рис. 6), а також фільт-
рівні форми. Такі зміни морфології бактерій пов’язані з порушенням
або синтезу стінки бактерій, або механізму регуляції їх клітинного
поділу. Залежно від сили та глибини діяння на бактеріальну клі-
тину зміни можуть бути спадковими і неспадковими. До бактерій
із спадково зміненим синтезом клітинної стінки належать мікоплазми
(рис. 7).
Властивість мікроорганізмів змінюватись під впливом різних
факторів навколишнього середовища враховують у лабораторній
діагностиці інфекційних захворювань, при виготовленні біологіч-
них препаратів, що застосовуються з профілактичною і лікувальною
метою.
Повніше це питання висвітлено в розділі «Генетика мікроорга-
нізмів'».
За своєю структурою бактеоіі (прокаріоти) істотно відрізняються
від клітин рослин і тварин (еукаріотн).
Прокаріоти — гаплоїдні організми, які звичайно містять
один геном, не мають мітохондрій і комплексу Гольджі, їм не вла-
стивий амебоподібний рух. Складаються з нуклеоїду, цитоплазми
з різними включеннями, оболонки та інших структур (рис. 8). Ультра-
27
Рис 8 Схематичне зображення
будови бактеріальної клітини:
/ —капсула, З — клітинна стінка)
З — клітинна перегородка. 4 — джгу-
тик; б — цитоплазматична мембрана;
б — нуклеоїд; 7 —рибосоми: 8 —
включений; 9 — плааміди; 10 —
спора.
структуру бактерій вивчають за допомогою електронно-мікроскопіч-
них і хімічних досліджень.
Нуклеоїд прокаріотів складається із замкнутих у кільце подвій-
них ниток ДНК, не відмежований від цитоплазми якоюсь мембраною
і не зв’язаний з основним протеїном бактеріальної клітини.
Нуклеоїд бактерій має дифузний характер, локалізований у цен-
тральній частині цитоплазми клітини, перебуває в контакті з цито-
плазматичною мембраною, мезосомами і полісомами (рис. 9). На різ-
них етапах розвитку бактеріальної клітини ДНК нуклеоїду може
бути у вигляді ниток, тяжів, вузликуватої або тонкої сітки чи гру-
бих скупчень.
У клітинах бактерій у фазі спокою є один нуклеоїд, у фазі, що
передує поділові,— два, у логарифмічній — чотири і більше.
У клітин, що активно ростуть, бактеріальний нуклеоїд має такий
самий коефіцієнт заломлення світла, як і цитоплазма. Співвідношен-
ня геномної речовини і цитоплазми коливається в межах 1:2 —
1 : 10. Виявити нуклеоїд можна за допомогою мікрохімічної реакції
Робіпоу — Фельгена на ДНК, флюоресцентної мікроскопії забарвле-
них флюорохромами препаратів бактерій, а також електронною мік-
роскопією ультратонких зрізів.
Цитоплазма бактерій являє собою дисперсну суміш колоїдів, що
складається з води, білків, вуглеводів, ліпідів, мінеральних сполук
та інших речовин. При старінні культури дисперсність цитоплазми
бактерій змінюється, вона стає пористою, в ній утворюються вакуолі,
наповнені клітинним соком.
Цитоплазма бактерій нерухома, має високу щільність, містить
дрібні зерна діаметром 10—§0 нм, що складаються з 60 % РНК
і 40 % протеїну. Такі зерна дістали назву рибосом. Вони дуже важ-
ливі структури для життєдіяльності бактерій. Із кількох рибосом
утворюються полісоми. Рибосоми і полісоми прикріплені до мембран
і фібрилярннх структур. У цитоплазмі, крім нуклеоїду, є цитоплазма-
тичні генетичні структури у вигляді невеликих молекул ДНК —
плазміди, які детермінують синтез різних речовин.
У цитоплазмі бактерій є включення: гранули волютину, ліпопро-
теїдні тільця, глікоген, гранульоза, скупчення пігменту, краплини
сірки, кальцію гідрокарбонат та ін.
Гранули волютину забарвлюються інтенсивніше, ніж цито-
плазма бактеріальної клітини, містять метафосфати; вони дуже
28
Рис. 9. Васіїїиз зиЬііІіз:
І — нуклеоїд 2, і — клітинна
стінка; 3 — цитоплазматична
мембрана. 4 — мезосома; 6 —
клітинна переюродка.
Рис. 10. Оболонка бактерій
(УіЬгіо сіюіегае):
/ — клітинна стінка; 2 — цито-
плазматична мембрана.
щільні для потоку електронів. Величина гранул волютину 0,1 —
0,5 мкм.
Уперше волютин було виявлено у Зрігіїїит уоіиіапз (звідси його
назва), потім у СогупеЬасіегіит дірЬіИегіае (див. форзац, рис. І)
і багатьох інших видів бактерій. Наявність гранул волютину беруть
до уваги при лабораторній діагностиці дифтерії.
Ліпопротеїдні тільця у вигляді краплин жиру досить часто трап-
ляються в деяких бацил і спірил. Вони зникають при голодуванні
клітин і з’являються, коли бактерії ростуть на поживних середови-
щах, що містять багато вуглеводів. Наявність їх у цитоплазмі ви-
являють забарвленням Суданом або фуксином.
Біологічне значення гранул волютину і л іпопротеїдних включень
полягає в тому, що вони є запасним поживним матеріалом.
До внутрішньоклітинних включень належать глікоген і гранульо-
за, які виявляють за допомогою обробки розчином Ліоголя* гліко-
ген забарвлюється у червонувато-коричневий колір, гранульоза —
в сіоо-сипій Зерна глікогену виразно виявляються в аеробних бацил,
гранульоза — часто трапляється у маслянокислих бактерій,особливо
С1оз(гі(Ііілп ресііпоуогит. До складу клітин деяких бактерій входять
кристалоїдні включення білкової природи, які виявились дуже
отруйними для комах.
У цитоплазмі сіркобактерій (Ве££ІаІоа), які окислюють сірково-
день, сіпка відклалається у вигляді краплин колоїдальної структу-
ри, має енергетичне значення та бере участь в анаеробному дегідру-
ванні.
Цитоплазма сіркобактерій із ролу Асілготаїіипі містить зс/ на
аморфного кальцію гідрокарбонату, фізіочої Ічне значення яких поки
що не з’ясоване.
У ції гоп іазмі б іктерій є вакуочі що скла іаються з різних розчи-
нених у гшіі речовин і оточені мембраною (тонопласт) тіпопротеїд-
ного походження. Кількість вакуоль коливається в межах 6—10,
29
а в період активного росту збільшується до 20. Одні дослідники роз-
глядають їх як ділянки, де відкладаються шкідливі продукти метабо-
лізму (екзотоксини), інші відводять їм функцію додаткових фермен-
тів дихання. Можливо, виникнення вакуолів можна пояснити над-
мірною кількістю води.
У цитоплазмі мікобактерій, стрептококів, протею, актиноміцетів,
клогтридій та інших мікроорганізмів е рапідосоми, або мікротрубоч-
ки. У мікобактерій вони виконують функцію пересування ковзанням
по густом ' субстрату. Мікротрубочки бактерій за структурою і роз-
мірами схожі на мікротрубочки найпростіших, рослин і тварин.
” Оболонка бактерій складається з цитоплазматичної мембрани,
клітинної стінки і капсульного шару, що перетворюється у деяких
видів у справжню капсулу.
Цитоплазматична мембрана прилягає до внутрішньої поверхні
клітинної стінки бактерії (рис. 10). Товщина мембрани 5—7,5 нм.
Вона являє собою складне утворення з трьох шарів: ліпідного,
протеїнового і полісахаридного. До складу цитоплазматичної мембра-
ни входять білки, фосфоліпіди, ліпопротеїн, невелика кількість
вуглеводів та інших сполук. Цитоплазматична мембрана виконує
функцію роздільної перегородки, через неї за допомогою ферментів
(пермеаз) невпинно здійснюється активний транспорт різних речо-
вин, потрібних для життєдіяльності бактерій. У цитоплазматичній
мембрані локалізовані високочутливі рецептори, за допомогою яких
бактерії розпізнають і обробляють сигнали, що надходять із навко-
лишнього середовища, диференціюють поживні речовини та різні
антибактеріальні сполуки. На поверхні цитоплазматичної мембрани
є активні ферментні системи, що беруть участь у синтезі білка, ток-
синів, ферментів, нуклеїнових кислот та інших речовин, а також
в окислювальному фосфорилюванні.
У цитоплазматичній мембрані відбуваються сотні різноманітних
і взаємопов’язаних реакцій. У перепонках лізосом є дихальні фер-
менти, які транспортують електрони. При вдавлюванні (інвагінації)
у бік цитоплазми цитоплазматична мембрана утворює мезосоми
(див. р іс. 9, 4}, які відіграють певну роль у формуванні клітинних
стінок і поділові. З цитоплазматичною мембраною пов’язані такі
властивості бактеріальної клітини, як осмотичний тиск, непроник-
ність'для багатьох речовин, бар’єрна функція між клітиною і зов-
нішнім середовищем.
Клітинна стінка бактерій товщиною 10—35 нм має шарувату бу-
дову. Основним матеріалом клітинної стінки бактерій є глікопептид-
ний шар — пептидоглікан (муреїн), зв’язаний з ліпопроте-
їдами, фосфоліпідами і ліпополісахаридами.
Відповідно до особливостей забарвлення за Грамом усі бактерії
поділяють на грампозитивні і грамнегативні (див. форзац, рис. II).
Цій ознаці надають великого значення в сучасній таксономії.
У клітинній стінці грампозитивних бактерій є шар глікопептидів
з тейхоєвою кислотою, локалізованою ближче до поверхні. Однією
з головних функцій тейхоєвої кислоти є зв’язування іонів магнію
і збереження високої концентрації катіонів на поверхні клітинної
ЗО
стінки. Іони магнію зумовлюють стабільність як клітинних, так і
зв’язаних з мембраною ферментів. Пептидоглікан, маючи ригідні
властивості, надає бактеріям певної форми.
До складу деяких грампозитивних бактерій входять полісахариди
(маноза, галактоза, арабіноза та ін.). У грамнегативних бактерій
стінка складається із трьох полімерів: зовнішнього (полісахаридного)
і внутрішнього (глікопептидного).
У грампозитивних бактеріях вміст пептидоглікану становить
близько 90 % матеріалу клітинної стінки, у грамнегативних —
5-20 %.
Клітинна стінка є в бактерій, актиноміцетів, ціанобактерій, ри-
кетсій; її немає у спірохет, міксобактерій і мікоплазм. Завдяки на-
явності щільної клітинної стінки бактерії можуть зберігати певну
форму. Вона захищає бактерії від шкідливого впливу факторів навко-
лишнього середовища, бере участь у рості й поділі клітини. Клітинну
стінку можна відокремити від цитоплазматичної мембрани і мати її
в чистому вигляді.
Цитоплазма деяких грампозитивних бактерій може бути звіль-
нена від клітинної стінки руйнуванням її лізоцимом. Бактерії, ціл-
ком позбавлені клітинної стінки, називають протопластами;
вони мають кулясту форму, можуть ділитися, дихати, синтезувати
білки, нуклеїнові кислоти, ферменти й утворювати спори.
Поряд із подібністю до бактерій протопласти мають і низку істот-
них відмінностей. Вони —дуже нестійкі структури, чутливі до змін
осмотичного тиску, механічних діянь та аерації, не можуть синтезу-
вати складові частини клітинної стінки, не піддаються інфікуванню
вірусами бактерій (фагами) і нездатні активно рухатись.
При частковому розчиненні клітинної стінки під впливом лізо-
циму або інших факторів паличкоподібні (переважно грамнега-
тивні) клітини перетворюються у сферичні тіла, що дістали назву
сферопластів.
До протопластів відносять Ь-форми бактерій. Морфологічно
вони являють собою крупні кулясті і ниткоподібні плазматичні
структури Ці форми бактерій утворюються в результаті пригнічення
синтезу клітинної стінки, що веде до порушення координації між ро
стом і поділом клітини; найчастіше це буває під впливом пеніциліну.
Розрізняють стабільні і нестабільні Ь-форми бактерій. Нестабільні
Ь-форми на відміну від стабільних можуть утворювати клітинну стін-
ку після припинення дії трансформуючого агента. Стабільні Ь-форми
за своїми властивостями дуже подібні до мікоплазм.
Капсульний шар (капсула). Під впливом різних факторів сере-
довища деякі мікроорганізми можуть відкладати на поверхні свого
тіла навколо клітинної стінки товстий слизовий шар, що дістав назву
капсудьного (капсули) (рис. 11). Він складається з полісахаридів,
глікоіаміногліканів (мукополісахаридів) або поліпептидів.
Залежно від особливостей мікроорганізмів та складу поживного
середовища хімічний склад каиссл може бути різним. У деяких
штамів стрептококів вони складаються з полімерів глюкози і фрукто-
зи, у 8. рпептопіае — із суміші подімепів гпюкозн, галактози і глю-
1
Риє. 11. Схема
будови капсуль-
но! бактерії:
/—гпдоплаїма. 2 —
екіоплазма, Я —
слиіпстиіі шар. або
куронової кислоти, у В. апіЬгасіз — із поліглута-
мінової кислоти. У зв’язку з високим вмістом води
капсула слабко забарвлюється барвниками.
Капсулоутворення вважають пристосувальною
функцією бактерій. Патогенні капсульні мікроорга-
нізми стійкіші проти фагоцитозу, дії інших захисних
факторів організму і зовнішнього середовища.Кап-
сула захищає клітину від проникнення бактеріальних
вірусів (фагів). Вона не є необхідною частиною клі-
тини. За допомогою ферментів капсульний ша р можна
видалити, не завдаючи шкоди бактеріям, хоч при
цьому їх патогенність знижується.
У деяких видів бактерій з речовиною капсули
пов’язана їх серологічна специфічність, що визна-
чається наявністю комплексу полісахаридів.
В одних мікроорганізмів (8. рпеигпопіае, В. апіЬгасіз, С. регГгіп-
£ЄП5) капсула утворюється тільки в організмі тварини або людини,
в інших (клебсієли пневмонії, озени і риносклероми) — як в орга-
нізмі, так і поза ним. Дєякі бактерії (стафілококи, стрептококи, ко-
ринебактерії дифтерії та ін.) утворюють мікрокапсулу, що
виявляється за допомогою електронного мікроскопа у вигляді міц-
но пов’язаних з клітинною стінкою мікрофібрил, які складаються
з глікозаміногліканів (мукополісахаридів).
Потенціальну здатність до утворення мікрокапсули мають біль-
шість мікроорганізмів, особливо при культивуванні їх у поживних
середовищах, що містять багато вуглеводів. Для сапрофітних бакте-
рій (лейконосток) характерне утворення капсули, Спільної для ба-
гатьох особин. Такі скупчення мікроорганізмів, що містяться в
спільній капсулі, називають зоогл е я ми.
Дня виявлення капсул застосовують спеціальні методи обробки
бактерій. Це роблять з діагностичною метою.
Джгутики. Рухомі бактерії поділяються на повзаючі (ковзаючі)
і плаваючі.
Повзаючі бактерії повільно пересуваються (повзуть) по опорній
поверхні в результаті хвилеподібних скорочень тіла, які спричи-
нюють періодичну зміну форми клітини.
До них належать Мухососсиз, Вея£іаіоа,
ТЬ іоїЬгіх.
Плаваючі бактерії вільно пересуваються
в рідкому середовищі. Вони мають джгу-
тики, тобто утвори у вигляді тонких ниток
(рис. 12) товщиною 0,02 — 0,06 мкм і дов-
жиною 6—9 мкм, а в деяких спірил —80—
—90 мкм.
Джгутики складаються з білкових ре-
човин типу флагеліну, який належить до
класу скоротних білків (кератин, міозин,
фібриноген), але значною мірою відрізня-
ється від білків тіла бактерій. У речовині
Рис 12. Джгутики у Ргоіеиз
уиІ£агІ8 в електронному мі-
кроскопі.
32
а б в г
Рис. 13. Джгутикові форми бактерій:
а — монотрихи. б — амфітрнхн; в — лофотрнхн; г — пернтрнхн.
джгутиків виявлено лізин, аспарагінову і глутамінову кислоти, ала-
нін та інші амінокислоти. Джгутики зв’язані з тілом бактеріальної
клітини за допомогою двох дисків: зовнішній міститься в клітинній
сгінці, внутрішній — у цитоплазматичній мембрані.
Наявність джгутиків у бактерій виявляють визначенням рухли-
вості бактерій, мікроскопіюванням у темному полі, застосуванням
особливих методів обробки їх протравами, адсорбції на поверхні
клітин бактерій різних речовин і барвників, а також за допомогою
електронної мікроскопії. Останній метод дав змогу виявити спірале-
подібну форму і гвинтоподібну будову джгутиків. Осьова нитка
джгутика складається з перевитих дуже тоненьких ниток, покритих
білковим чохлом.
За розташуванням джгутиків рухливі (плаваючі) бактерії поді-
ляють на чотири групи (рис. 13): монотрихи — з одним джгу-
тиком на кінці (холерний вібріон, синьогнійна паличка); амфі-
т р и х и — що мають два полярно розташовані джгутики або по пуч-
ку джгутиків на обох кінцях (Зрігіїїиш уоіиіапз):; лофотри-
х и — мають по пучку джгутиків на одному кінці (паличка синьо-
зеленого молока, А1са1і£епе5 Гаесаііз); перитри х и — мають
джгутики по всій поверхні тіла (Е. соїі, сальмонели черевного тифу,
паратифів А і В).
Наведена класифікація умовна. За допомогою електронної мік-
роскопії виявлено, що в деяких монотрихів джгутик міститься не на
кінці тіла, а в місці переходу бокової поверхні до полюса. Доведено,
що бактерії, які раніше вважалися монотрихами, мають по кілька
джгутиків. Самостійне існування амфітрихів заперечується; вважа-
ють, що амфітрих являє собою дві, що не повністю поділилися, клі-
тини із джгутиками на дистальних кінцях.
Джгутики — це основний локомоторний органоїд бактерій. В ре-
зультаті їх енергійного руху, що нагадує обертання штопора, рідина
переміщується уздовж джгутиків, і бактерії розвивають швидкість
близько 50 мкм/с. Механізм скорочення не зовсім ясний. Вважають,
що білок чохла, який оточує джгутик, утворює з флагеліном двоком-
понентну систему, яка скорочується на зразок актоміозину. Можливо,
що скоротлива функція джгутиків зумовлена існуванням двох кон-
фігурацій молекул флагеліну, які різняться складом аміно-
кислот
Характер руху бактерій залежить від кількості джгутиків, віку
і властивостей культури, температури, наявності хімічних речовин
33
Рис. 14. Фімбрії 8Ьі-
£е11а Пехпегі в елект-
ронному мікроскопі.
та інших факторів. Найбільшу рухливість
мають монотрихи (60 мкм/с).
Рухливі бактерії здатні до таксису,
спрямованого (орієнтованого) переміщення.
Залежно від факторів, під впливом яких від-
бувається рух, розрізняють хемотаксис, аеротак-
сис і фототаксис.
Рухливість бактерій вивчають методами
висячої або роздавленої краплини. Визначення
рухливості використовують у лабораторній
практиці для ідентифікації холерних вібріо-
нів, бактерій черевного тифу, паратифів
та ін.
Хоч наявність джгутиків і е видовою озна-
кою, однак вони не завжди життєво необхідні,
єбезджгутикові варіанти рухливих видів бак-
терій.
Ворсинки (фімбрії), війки. У різних видів бактерій є ворсинки
(рис. 14), які значно коротші і тонші від джгутиків. Вони покри-
вають тіло клітини. Кількість ворсинок в однієї особини досягає
100—400, довжина їх 0,3—1 мкм, ширина — 0,01 мкм.
Ворсинки поділяються на типи. Ворсинки 1-го (загального) типу
є в багатьох видів бактерій, здатних до адгезії. За допомогою адге-
зинів (структурні утвори на поверхні клітин бактерій) бактерії при-
кріплюються до клітин тварин і людини.
Ворсинки 2-го типу, або тлі, виявляють в ентеробактерій, ней-
серій, гемофільних видів, стрептококів групи А, коринебактерій та
ін. Пілі, так само як і джгутики, не є обов’язковими структурами
клітин бактерій. Найбільший інтерес становлять Г-пілі, всередині
яких є канал; через нього в процесі кон’югації генетичний матеріал
передається від донора до реципієнта (див. «Кон’югація бактерій»).
Можливо, що пілі є рецепторними ділянками для деяких РНК-
вмісних вірусів.
У багатьох бактерій на поверхні тіла є переплетення довгих
полісахаридних волокон, які утворюють глікокалікс (грец. саііх —
оболонка), що складається з декстринів і леванів.
У стрептококів (грампозитивні бактерії) є зовнішній шар проте-
їнових ворсинок, що називається М-протеїном, який відіграє важли-
ву роль у процесах взаємовідношення бактерій і макроорганізму.
У деяких паличкоподібних форм поверхня клітин покрита виро-
стами, шипами.
Крім активної рухливості за допомогою джгутиків або в резуль-
таті скорочення тіла, мікроорганізми здатні до молекулярного,
пасивного (броунівського) руху, що є результатом теплового руху
молекул навколишнього середовища.
Спори і спороутворення. Спори (ендоспори) — утвори круглої або
овальної форми. Формування спор —це одна із стадій циклу роз-
витку певних мікроорганізмів, вироблена в процесі еволюції у бо-
ротьбі за збереження виду. При спороутворенні відбувається дифе-
34
ренціація клітини: зникнення компонентів вегетативної форми й
утворення нових структур. Спороутворення властиве деяким, пере-
важно паличкоподібним, мікроорганізмам (бацили і клостридії).
До них належать збудники сибірки, правця, анаеробної інфекції,
ботулізму і сапрофіти, які живуть у грунті, воді. Порівняно рідко
спори утворюються у коків (Загсіпа Іиіеа, Загсіпа игеа) та звиви-
стих форм (ОезиїїоУІЬгіо).
Утворюються спори у зовнішньому середовищі (грунт, живильне
середовище). Цього не буває в тканинах людини і тварин. У процесі
спороутворення розрізняють чотири послідовні стадії: 1) підготов-
чу; 2) стадію передспори; 3) утворення оболонки; 4) дозрівання.
Коли бацили потрапляють у несприятливі умови, в клітині
настають структурні зміни. В одній із ділянок клітини цитоплазма
з частиною нуклеоїду ущільнюється й утворюється передспорова
мембрана, яка потім покривається твердою, слабко проникною бага-
тошаровою оболонкою. Решта клітини поступово відмирає, і формує-
ться зріла спора, що становить приблизно 1/10 материнської клітини.
Цей процес спороутворення закінчується протягом 18—20 год.
Спори характеризуються значною заломлюваністю світла і при
бактеріоскопічному дослідженні у незабарвленому стані мають
вигляд блискучих зерен; вони погано забарвлюються. Внаслідок
наявності твердої багатошарової оболонки, що має пластинчасту бу-
дову, мінімальної кількості вільної води і високого вмісту кальцію,
ліпідів та піколінової кислоти спори мають підвищену стійкість до
дії факторів навколишнього середовища і можуть довго (десятки
років) зберігатися в несприятливих умовах. Спори деяких бацил
витримують кип’ятіння і дію високих концентрацій дезинфікуючих
речовин. Вони гинуть від дії насиченої пари при температурі 115—
125 °С, а також під впливом температури 150—170 °С у повітряному
стерилізаторі.
Потрапляючи в сприятливі умови, спори проростають і перетво-
рюються у вегетативні форми. При цьому вони набухають, збільшу-
ються, вміст води у них зростає, пронеси обміну посилюються, і спори
починають добре забарвлюватися аніліновими барвниками 3 обо-
лонки на полюсі, у центрі або між полюсом і центром виступає про-
росток, який витягується в паличку. Звичайно проростання йде
значно швидше (протягом 4—5 год), ніж утворення спор.
Проростають спори послідовно: у стадії активації з’являються
мембрани, які оточують протопласт; у стадії справжнього проростан-
ня втрачається чіткість шарів, які оточують протопласт, і в останній
стадії формується клітинна стінка. У заключній стадії росту настає
період біосинтезу, що завершується поділом клітини.
Спороутворення у бацил і клостридій не є функцією розмноження,
оскільки в більшості паличкоподібних форм утворюється тільки по
одній спорі. В актиноміцетів утворення спор (екзоспор) виконує
функції не тільки збереження виду в несприятливих умовах, а й роз-
множення.
У тілі бацил і клостридій спори можуть розташовуватись: а) цен-
тра іьно (збудник сибірки); б) субтермінально — ближче до кінця
35
Таблиця /. Класифікація вірусів людини І тварин
Родина Підродина РІД Представники типів
Рохуігісіае ДНК-г СЬогсіорохуігІ- еномщ віруси ОгІЬорохуігіг Вірус вісповакиинн
НегрезуігМае пае АІрІїаЬегрезуІ- Рагарохуігиз Ауірохуігиз СаргірохУІгиа Ьерогірохуііиі Зиірохуігиз Орф-вірус Вірус віспи птахів Вірус овинн (віспи овець* Вірус МІКСОМН Вірус норцини (віспи СВНИ» Й) Віруси герпесу (віруси
Нерасіпау їгісіае гіпае ВеіаЬегрезуігі- пае (Запила Ітегрезуі- гіпае - простою гер іесу, типи 2) Вірус цитомегали лю- дини Вірус герпесу людини Вірус гепатиту В лю-
ігісіоу ігісіае Ігі (іоу ігиз дини Віруси райдужки комах
Асіепоуігісіае Рапауігиз Мазіасіепоуігиз Віруси жа . Аденовіруси людини
РароУауігМае Ауіасіепоуігия Раріїїотауігиз (41 тип) Те саме Вірус папіломи кролів
Рагуоуігігіае Роїуотауігиз Рагуоуігш (папіломи Шоупа) Вірус полюмн мишей Вірус Кілхема (вірус
КеоУІгідае РНК-г Оерепдоуігиз •еномні віруси Оепзоуігиз НеоУІгиз пацюків Кілхема) Адеиоасоційованнн вірує типу 1 Парвовіруси комах Реовіруси типів 1—3
То£ауігі()ае ОгЬіуігиз Коіауігиз РЬуіогеоуігиз Рі]! V ігиз Суіоріазтіс роїу- Ьесігозіз УІгиз егоир АІрЬауігиз Вірус синього язика овець Ротавіруси людини і тварин Рановий вірус Вірус хвороби Фіджі Вірус цитоплазматич- ного поліецрозу Віруси Сиидбіс, лісу
КиЬІУІгиз Резііуігиз Семліки, Чикуигуиья, східного і західного кінського енцефаломіє- літів, венесуельського кінського енцефаломіе- літу
36
П родовження табл. 1
Родина ПІдродниа РІД Представники типів
Науіуігідае Віруси КЛІЩОВОГО і японського енцефалі- тів, віруси жовтої га- рячки, гарячки деиге, гарячки Західного Ні- лу, енцефаліту Сент- Луїс, енцефаліту доли- ни Муррея Вірус краснухи Вірус діареї корів (ві- рус мукозної хвороби)
Согопауігідае — Согопауігиз Коронавірус людини
РагагщхосігіЗае Рагатіхоуігиз МогЬіІІіуігиз РЬеитоуігиз Віруси Сендай, пара- грипу людини (типи 1—4), паротиту Вірус кору Респіраторно-сиитиці- альиий вірус
КЬаЬдоу іг і дає ОгіЬотууігідае Випуауігідае Агепауігідае - Уезісиїоуігиз Ьуззауігиз ІпГІиепгаУІгиз А, В ІпПиепгауігиз С ВапуаУігиз Агепауігиз Вірус везикулярного стоматиту Вірус сказу Віруси грипу типів А і В Вірус грипу типу С Вірус Буиьямвера Вірус Ласса
Кеігоуігідае ОпсоУігіпае Зритауігіпае Ьепііуігіпае Група онковіру- сів типів В, С Онковіруси ссавців Онковіруси пта- хів Вірус раку молочних залоз мишей Онковіруси мавп, котів, мишей, пацюків, морсь- ких свинок, людини Вірус пташиного мієло- бластозу Пінливий вірус людини Пінливий вірус мавп Бичачий і котячий син- тиціальиий віруси Віруси вісни меді овець, віруси імуноде- фіциту людини типів 1,2
Рісогпауігідае Епіегоуігиз Сагдіоуігиз КЬіпоуігиз АрЬіоуігиз Віруси поліомієліту людини типів 1—3, інші ентеровірусн Вірус гепатиту А (єн- теровірус 72) Вірус енцефаломюкар- диту, вірус Менго Рпиовірусп людини Вірус ящура
Саі і сі V і гісіае Саіісіуігиз Вірус везикулярної ек- зантеми свиней, каліци- віруси людини
37
(збудники ботулізму, анаеробної інфекції та ін.); в) термінально —
на кінці (збудник правця) (див. форзац, рис. III, є).
В окремих видів споротвориих мікроорганізмів (клостридій)
діаметр спор перевищує діаметр бактеріальної клітини. При субтер-
мінальній локалізації спор такі особини стають веретеноподібними.
До них належать клостридії маслянокислого бродіння (С. Ьиіугісиш)
та ін. У клостридії правця діаметр спори перевищує її ширину, але
розміщується спора на кінці, внаслідок чого мікроорганізм за формою
нагадує барабанну паличку.
Здатність мікроорганізмів до спороутворення використовується
в їх систематиці, а також при виборі методів знезаражування пред-
метів, приміщень, харчових продуктів, різних виробів. В результаті
частого пересівання на свіже середовище або культивування при ви-
сокій температурі ця здатність може бути втраченою.
Методи дослідження споротвориих мікроорганізмів наведені
в розділі, присвяченому спеціальній мікробіології, і в практичних
посібниках.
КЛАСИФІКАЦІЯ ВІРУСІВ
Віруси включені до особливої групи (царство Уіга) неклітинних
форм життя, що мають власний геном і можуть відтворюватися в клі-
тинах усіх видів організмів. Це облігатні внутрішньоклітинні пара-
зити людини, тварин, комах, рослин, грибів і бактерій, вони не ма-
ють білковосинтезуючої, ферментативної й енергетичної систем.
За даними Міжнародного комітету з таксономії вірусів (1982),
відомо 17 родин ДНК-геномних і 42 родини РНК-геномних, із них
тільки 6 родин ДНК-геномних і 11 родин РНК-геномних вірусів ма-
ють значення в медицині та ветеринарії.
В основу класифікації вірусів (табл. 1) покладено такі властиво-
сті: тип нуклеїнової кислоти, вміст її у віріоні (у відсотках), кіль-
кість ниток у ній, відносну молекулярну масу, а також особливості
будови вірусів, їх репродукції тощо.
МОРФОЛОГІЯ ТА УЛЬТРАСТРУКТУРА ВІРУСІВ
За формою віруси поділяють на сферичні (віруси грипу — рис. 15,
паротитної інфекції, кору, лейкозу курей і мишей та ін.), паличкопо-
дібні (збудники мозаїчної хвороби тютюну — рис. 16, картоплі та
ін.), кубоїдальні віруси вісповакцини, натуральної віспи, папіломи
людини і тварин, аденовіруси — рис. 17, ентеровіруси, реовіруси
та ін.) і сперматозоїди і (віруси бактерій — фаги, див. рис. 95).
У 1975 р. виявлено зіркоподібні віруси, або астровіруси (грец.
азігоп — зірка), які спричинюють гострий гастроентерит у тварин
і людей.
Віріон складається з центрально розташованої нуклеїнової кис-
лоти (ДНК або РНК) або відповідного нуклеопротеїду, оточеного од-
нією або двома оболонками.
38
Перша оболонка, в якій
міститься нуклеїнова кисло-
та, дістала назву капсида
(лат. сарза — вмістилище).
У капсиді є білкові субоди-
ниці, що повторюються,—
капсомери — видимі в
електронний мікроскоп моно-
мери (див. рис. 19), які скла-
даються з однієї або кількох
білкових молекул. Кількість
структурних капсомерів у
капсиді певного вірусу стала
(у вірусу поліомієліту — 60,
аденовірусу — 252, вірусу
тютюнової мозаїки — 2130
і т. д.).
Структура, що містить
нуклеїнову кислоту і капсид,
називається нуклеокап-
сидом. Наявність такого
Рис. 15. Схематична структура віріона
грипу:
/ — гемаглютинін; 2 — иейрамінідаза. З — по-
двійний ліпідний шар; 4— мембранний білок
(М) 5 — рнбонуклеопротеїд (РНП).
нуклеокапсиду характерна
для віріону простих вірусів, у складних вірусів нуклеокапсид
віріону покритий зовнішньою ліпідовмісною оболонкою.
Зовнішня оболонка — суперкапсид — складається з дво-
шарової ліпідної або білкової мембрани. У суперкапсид занурені
вірусспецифічні вуглеводовмісні білки — глікопротеїди, які утворю-
ють на оболонці виступи — шипи.
Капсомери розміщуються в певному порядку, залежно від харак-
теру якого розрізняють три групи вірусів: із спіральним, кубічним
і комбінованим типами симетрії.
Віруси із спіральним типом симетрії мають нуклеокапсид трубча-
стої форми і складаються з нуклеїнової кислоти, оточеної тісно при-
лягаючими капсомерами. До них належить вірус тютюнової мозаїки.
Віріони РНК-вмісних вірусів тварин складаються з нуклеокапсиду,
що має вигляд сферичного утвору.
Рис 16 Вірус мозаїчної хнороби іюгюпу (а) і кристали цього
вірусу (б) в електронному мікроскопі.
ЗІ
Рис 17 Схематична структура адеповіруса (а)
і віруса поліомієліту (б)
Віруси з кубічним типом симетрії (ізометричні) мають капсид
у вигляді ікосаедра (двадцятигранника), всередині якого міститься
нуклеїнова кислота (пікорнавіруси) або нуклеопротеїд (адено-,
пайова- і герпесвіруси). Віріони пікорна-, рео-, адено-, папова- і пар-
вовірусів представлені одним нуклеокапсидом, а в тога- і герпесвіру-
сів він оточений суперкапсндом.
Віруси з комбінованим типом симетрії (збудники лейкозу, сар-
коми, вірус вісповакцини та деякі фаги) мають нуклеокапсид, що
характеризується кубічною симетрією; розташований усередині кап-
сида нуклеопротеїд укладений спірально.
Розміри вірусів коливаються в широкому діапазоні — від 20—
ЗО до 400 нм (табл. 2).
Таблиця 2. Величина вірусів, нм
Вірус Метод дослідження
Ультрафільтрація У пьтрацентрнфугу ванн я Електронна мікроскопія
Сказу (вуличного) 100—150 110—120
Віспи коров’ячої 125—175 170—180 227—305
Мозаїчної хвороби тютю- 15-25 — 15—300
ну Вітряної віспи 150-200
Гарячки денге 20—30 — —
Г ерпесу 100—150 180—220 133-233
Пароіитиоі інфекції — — 120—280
Кору — — 90—100
Грипу А 80-120 70-116 120—123
Грипу В — 97,3 90—110
Фаги — — 47—104 (головки); 10—225 (хвости)
Поліомієліту 8-12 28 8—27
Японського енцефаліту 20—35 — —
Жовтої гарячки 12-27 — 50-55
Ящуру 8—12 17—20 20-32
40
ФІЗІОЛОГІЯ МІКРООРГАНІЗМІВ
У зв’язку з швидким розвитком генетики, біофізики, біохімії та
електронної мікроскопії стало можливим дослідження фізіологічних
процесів у бактерій з використанням фізико-хімічних і фізіологіч-
них методів. Глибокий аналіз даних, що стосуються морфології і фі-
зіології бактерій, показав, що за структурою і біохімічними реакці-
ями це складні організми. Бактерії досить швидко пристосовуються
до різних умов середовища існування завдяки наявності в них адап-
тивних ферментів, які активуються під впливом субстратів навко-
лишнього середовища. Усі їх життєві процеси детермінуються гена-
ми, які забезпечують саморегуляцію на молекулярному, субклітин-
ному і клітинному рівнях.
ХІМІЧНИЙ СКЛАД БАКТЕРІЙ
Бактеріальна клітина складається з органогенів — азоту, вугле-
цю, кисню, водню. На азот припадає 8—15 % сухого залишку, на
вуглець — 45—55, кисень — ЗО, водень — 6—8 %.
Із різних елементів та їх сполук мікроорганізми синтезують біл-
ки, нуклеопротеїди, ферменти, вуглеводи, ліпіди, гліцидоліпідні,
гліцидоліпідно-протеїдні комплекси, вітаміни та ін.
Вода. Вміст води в цитоплазмі більшості видів бактерій коли-
вається від 75 % (Е. соїі) до 85 % (коринебактерія дифтерії, мікобак-
терії туберкульозу, холерний вібріон). У спорах бацил і клостридій
концентрація води становить 40—50 %.
Вода міститься в цитоплазмі у вільному стані або зв’язана з ін-
шими складовими компонентами. Зв'язана вода — структурний еле-
мент цитоплазми, тому не може бути розчинником. Вільна вода є дис-
персним середовищем для колоїдів і розчинником для кристалічних
речовин, джерелом водневих і гідроксильних іонів та учасником хі-
мічних реакцій. Наприклад, гідролітичні процеси розщеплення біл-
ків, вуглеводів і ліпідів відбуваються в результаті приєднання до
них води. Важливу роль відіграє вода і в процесі дихання бактері-
альної клітини.
Сухий залишок. Органічна частина сухої речовини бактерій скла-
дається з білків, нуклеїнових кислот, вуглеводів, ліпідів та інших
сполук.
Білки. Білок, розподілений у цитоплазмі, цитоплазматичній
мембрані та інших клітинних структурах, становить 50—80 % сухої
речовини бактеріальної клітини.
До складу білків входять нуклеопротеїди, простетичною
групою яких є нуклеїнові кислоти. Другою складовою частиною біл-
ків цитоплазми є л іпопротеїди. Простетичною групою у них
служать жири (ліпіди) і жироподібні речовини (ліпоїди). Ліпопроте-
їди містяться всередині клітини у вигляді включень напіврідкої кон-
систенції. На поверхні цитоплазми ліпопротеїди утворюють мембра-
ну, яка регулює надходження речовин усередину бактеріальної клі-
тини.
41
До білків належать ферменти (ензими), що відіграють важ-
ливу роль у життєдіяльності мікроорганізмів. Білкова частина фер-
менту (апофермент) зумовлює специфічність його дії, простетична
група здійснює хімічну реакцію. У ряді випадків простетичні групи
неміцно зв’язані з білком і легко від нього відокремлюються, а де-
які можуть вступати у зв’язок з різними білками. Такі вільно існу-
ючі небілкові каталізатори біохімічних перетворень дістали назву
коферментів (коензимів).
До другої групи ферментів як активна частина входять гемінові
похідні. До неї належать окислювальні ферменти.
Нуклеїнові кислоти. Вміст нуклеїнових кислот у бактеріальній
клітині залежить від виду бактерій, живильного середовища і ста-
новить у середньому 10—ЗО % сухого залишку.
Відомі три типи рибонуклеїнової кислоти: рибосомальна (рРНК),
транспортна (тРНК) і матрична (мРНК). Рибосомальна РНК вхо-
дить до складу рибосом, транспортна — переносить амінокислоти до
рибосом, матрична — забезпечує послідовність включення амінокис-
лот у молекулу поліпептидного ланцюга.
ДНК — це довгий полімер-полінуклеоїд з відносною молекуляр-
ною масою близько І О9 і довжиною в межах І мм. Геном бактеріаль-
ної клітини містить приблизно 6 млн пар основ. Один ген скла-
дається в середньому з 5—10 тис. пар основ, а кількість генів —
у межах 300—600.
Кожен нуклеотид складається з азотистої основи, залишку дезо-
ксирибози і фосфатної групи, за допомогою якої нуклеотиди з’єдну-
ються між собою (див. рис. 20). У складі нуклеотиду є одна з азо-
тистих основ: аденін або гуанін (пурини), тимін або цитозин (пірамі-
дний). Молекула ДНК складається із двох комплементарних ниток,
які утворюють спіраль. Аденін однієї молекули міститься в парі з ти-
міном іншої, а гуанін поєднується з цитозином. Послідовність чоти-
рьох азотистих основ по всій довжині молекули ДНК несе інформа-
цію, яка реалізується в результаті транскрипції.
Кількісна і якісна різноманітність білків та їх комплексів обу-
мовлює видову специфічність мікроорганізмів.
Вуглеводи. Вміст вуглеводів у бактеріальній клітині становить
12—18 % сухого залишку. До них належать: багатоатомні спирти
оліго- і поліозиди; нейтральні оліго- і поліозиди, до яких входять
ІЧ-ацетиламіногрупи; кислі поліозиди; оліго- і поліозиди, що містять
сіалову кислоту.
Основна маса вуглеводів — це полісахаридний комплекс у віль-
ному або зв’язаному з білками і ліпідами стані, що є в оболонках
бактеріальних клітин і слизистому шарі. У деяких бактерій у цито-
плазмі є порівняно багато включень, що нагадують за своїм хіміч-
ним складом глікоген або крохмаль.
Полісахариди. До групи безазотистих сполук відносять полісаха-
риди капсул 8. рпеитопіае 2, 3, 8-го сероварів; вони є полімерами
альцобінової кислоти і при повному гідролізі розпадаються на глю-
козу і глюкуронову кислоту. Полісахариди інших бактерій являють
собою декстрини, левани (фруктозани), целюлозу.
42
Деякі бактерії мають гексозаміни, що розпадаються при гідро-
лізі на моно-, аміносахариди й амінокислоти (8. рпептопіае, кори-
небактерії дифтерії, мікобактерії туберкульозу та ін.).
При кислотному гідролізі полісахаридів утворюються галактоза,
глюкоза, фруктоза (левульоза) та інші моносахариди. Від полісаха-
ридних фракцій залежить антигенна специфічність мікроорганізмів,
яка має велике значення в лабораторній діагностиці, виготовленні
вакцин, лікувальних та діагностичних сироваток.
Ліпіди У бактеріях, які не містять жиру у вигляді включень,
ліпіди становлять близько 10 % сухого залишку (у коринебактерій
дифтерії — 5 %). Кількість ліпідів у бактерій, що мають включення
жиру, досягає 40 % (мікобактерії туберкульозу). Ліпіди бактерій
складаються з вільних жирних кислот (26—28 %), нейтральних жи-
рів, восків і фосфоліпідів.
Ліпіди бактерій черевного тифу — це вільні жирні кислоти (паль-
мітинова, стеаринова, масляна, капронова та ін.).
У мікобактерій туберкульозу виділені туберкулостеаринова,
оксистеаринова, пальмітостеаринова, фтієнова і фтіоїдна кислоти, із
коринебактерій дифтерії — дифтеринова.
Нейтральні ліпіди бактерій складаються з ефірів жирних кислот
і вуглеводів. Кількість гліцерину й стеарину становить 2,5—12,5 %
загального вмісту ліпідів.
Мікобактерії туберкульозу містять 12—15 % зв’язаних ліпідів,
що складаються з вуглеводу і міколової кислоти. У них багато вос-
ку, при омилюванні якого утворюється до 84 %високомолекулярних
жирних оксикислот, що характеризуються дуже високою стійкістю
до дії мінеральних кислот, спиртів і лугів.
Кількість фосфатидів у ліпідах бактерій коливається від 0,4 до
6,5 % сухого залишку. При гідролізі фосфатидів утворюються жирні
кислоти, полісахариди і суміші гліцерофосфорної кислоти й холіну.
Хімічний склад бактеріальної клітини залежить від речовин,
що входять до живильного середовища, характеру обміну та умов
навколишнього середовища.
Мінеральні речовини. До складу бактерій входять неорганічні
речовини (фосфор, сірка, натрій, магній, калій, кальцій, залізо,
силіцій, хлор та ін.), мікроелементи (молібден, кобальт, бор, марга-
нець, цинк, мідь та ін.). Загальний вміст мінеральних речовин у бак-
теріях, вирощених на звичайних живильних середовищах, коливає-
ться в межах 2—14 % їх сухої маси.
ХІМІЧНИЙ СКЛАД ВІРУСІВ
Нуклеїнові кислоти. Віруси містять один із двох типів нуклеїно-
вих кислот — ДНК або РНК. Такий поділ вірусів відносний, бо всі
ДНК-геномні віруси можуть індукувати утворення вірусспецифічної
(комплементарної) РНК, аРНК-геномні (ретровіруси) — комплемен-
тарної ДНК.
Співвідношення нуклеїнових кислот з іншими компонентами ві-
ріона коливається від 1 % (вірус грипу) до 40 % (фаг Е. соїі).
У табл. З наведені дані про хімічний склад деяких вірусів.
43
Таблиця 3. Хімічний склад деяких вірусів, %
Вірус Білки Нуклеїнова кислота Вуглеводи Ліпіди
ДНК РНК
Герпесу 70 6,5 — —
Аденовіруси 87 12—14 — — —
Ортом іксовіруси 70 — 0,8—0,9 5—9 18—37
Ентеровіруси 70—80 — 20—30 — —
Білки вірусів побудовані із звичайних 16—20 Ь-амінокислот.
Амінокислоти розташовані в певній послідовності і зв’язані своїми
С- і М-аміногрупами; тип і кількість їх характерні для кожного
вірусу.
У вірусів є структурні і регуляторні гени (гени-регулятори, гени-
оператори, гени-активатори, гени-репресори). Геноми РНК-вмісних
і дрібних ДНК-вмісних вірусів мають, очевидно, тільки структурні
гени. Кількість генів у РНК-геиомних вірусів коливається в межах
5—15 (у вірусу поліоми — 3 гени, вірусу поліомієліту — 5).
РНК-геномні і дрібні ДНК-геномні віруси не мають дубльова-
них генів, але в них виявлено ділянки олігонуклеотидних послідов-
ностей, що повторюються. У вірусів виявлено генетичні структури —
шизони (грец. зсНіга — розщеплювати), які кодують поліпептиди
(шизо.мери). У деяких вірусів бактерій (фагів) один ген може коду-
вати два білки. У буньявірусів, реовірусів, міксовірусів виявлено
гени, що складаються з кількох фрагментів.
Кінцеві С- і М-групи амінокислот вірусних поліпептидних лан-
цюгів замасковані, завдяки чому вони не піддаються дії протеаз
клітин хазяїна. Це важливе захисне пристосування вірусів, набуте
ними в процесі еволюції, наділяє їх властивостями облігатних внут-
рішньоклітинних паразитів.
У деяких вірусів виявлено ферменти, за допомогою яких вони
репродукуються в клітинах рослин і тварин. Так, наприклад, у ві-
русу грипу А виявлено нейрамінідазу і транскриптазу, у вірусів
паротитної інфекції, парагрипу — вірусні гемолізини, у вірусу міє-
лобластозу і збудника лейкозу птахів — АТФ-азу, дефосфорилюючу
АТФ, у фагів — лізоцим і фосфатазу, у РНК-вмісних онкогенних
вірусів — зворотну транскриптазу, протеїнкіназу, у ДНК-вмісних—
ліпазу та інші ферменти.
ПРИРОДА ВІРУСІВ
Питання про походження вірусів є предметом численних дослі-
джень і теоретичних дискусій. Одні вчені вважають віруси нащад-
ками давніх неклітинних форм живих паразитичних систем, які
функціонально тісно зв’язані з клітиною хазяїна, але розвиваються
самостійно й генетично незалежно від них. Вважають, що наявність
різних нуклеїнових кислот відображує еволюцію вимерлих доклітин-
них форм від односпіральної РНК до двоспіральної ДНК. На думку
44
інших дослідників, віруси виникли з одноклітинних організмів, ЯКІ
в результаті регресивної еволюції втратили білковосинтезуючі систе-
ми і стали тільки внутрішньоклітинними паразитами. Відповідно
до третьої точки зору, віруси походять із клітинних елементів, що
стали автономними системами. Ця гіпотеза пояснює різноманітність
генетичного матеріалу вірусів, оскільки серед складових частин клі-
тини виявляються всі структури, з якими можуть бути споріднені
віруси (ДНК, РНК, плазміди і т. д.).
Одним з основних питань, що мають методологічне значення,
є питання про те, чи можна вважати віруси живими системами.
Незважаючи на відмінність вірусів у будові, хімічному складі,
генетичному апараті від прокаріотів та еукаріотів, їм, як і іншим
живим системам, властиві здатність до еволюції, саморепродукції,
мінливості, передачі генетичної інформації (горизонтально і верти-
кально), а також специфічність взаємодії з клітинами хазяїнів, адап-
тація до середовища, в якому вони живуть, циркуляція в природі
зі зміною хазяїнів та ін.
До проникнення в клітини віруси поводять себе як молекули ве-
летенських розмірів, а в клітинах стають живими системами, що
можуть репродукуватися і передавати свої властивості спадково.
Віруси існують у природі у двох формах: позаклітинній — ві-
ріон і внутрішньоклітинній — вегетативній (репродукуючій).
Деякі види вірусів (збудника поліомієліту, тютюнової мозаїки
та ін.) можуть кристалізуватись.
ФІЗИКО-ХІМІЧНІ ВЛАСТИВОСТІ БАКТЕРІЙ
Щі явність бактерій у середньому становить 1,055.
В’язкість цитоплазми бактерій коливається в широких діапазо-
нах, перевищуючи в’язкість води в 3—800 раз і більше. Різні фізичні
і хімічні діяння спричинюють спочатку оборотну, а потім необорот-
ну коагуляцію цитоплазми, підвищують в’язкість і збільшують
забарвлюваність бактеріальних тіл.
Внутрішньоклітинний осмотичний тиск у бактерій у два рази ниж-
чий, ніж у клітин вищих тварин: у грамнегативних бактерій у 3—
5 раз вищий, ніж у грампозитивних. У старих клітинах грамнега-
тивних бактерій він становить 196,1—294,2 кПа (2—3 атм), у моло-
дих культурах Е соїі досягає 1086,2—1473 кПа (12—15 атм).
Бактерії, іцо потребують високого осмотичного тиску, називають
осмофільними.
Проникність клітин бактерій вища, ніж у клітин тварин. Одним
бактеріям потрібно 0,3 % натрію хлориду, іншим (що населяють
моря і солоні озера) — 3—25 %. Більшість патогенних бактерій роз-
вивається в живильних середовищах, що містять 0,5 % натрію хло-
риду. Ці дані використовують у практиці приготування живильних
середовищ, до яких для ізотонічності додають певну кількість нат-
рію хлориду.
У гіпертонічних розчинах натрію хлориду або глюкози цитоплаз-
ма бактерій обезводнюється і вони гинуть (плазмоліз). На цьому прин»
46
ципі грунтуються методи консервування харчових продуктів (засо-
лювання м’яса, риби, овочів, приготування варення, зацукрених
фруктів тощо)
У гіпотонічних розчинах клітинна стінка розривається (бакте-
ріоліз або плазмоптиз) і вміст клітини виходить у навколишнє сере-
довище Бактеріоліз може бути спонтанним та індукованим.
У слабких нейтральних розчинах натрію хлориду більшість бак-
терій має негативний електричний заряд (у спірохет позитивний).
У вільно завислому стані у водному нейтральному середовищі бак-
терії під впливом електричного струму рухаються до анода. Отже,
бактерії мають негативний електрокінетичний потенціал. Зависі бак-
терій — не, як правило, електронегативні колоїди, і вони можуть
бути осаджені багатьма неспецифічними агентами (основними барв-
никами), а також кислотами в ізоелектричиій точці з електрокіне-
тичним потенціалом, який дорівнює нулю.
МЕТАБОЛІЗМ БАКТЕРІЙ
Усім організмам властивий невпинний обмін речовин з навко-
лишнім середовищем. Для здійснення процесів живлення і розмно-
ження потрібна наявність поживних матеріалів, з яких бактерії
синтезують складові частини свого тіла і дістають внаслідок окислен-
ня і відновлення різних речовин потрібну енергію. Джерелами
енергії для бактерій є сонячне світло, неорганічні й органічні речо-
вини.
За характером використання джерела енергії розрізняють три
групи бактерій.
Фототрофи як джерело енергії використовують сонячне світло,
літотрофи (аутотрофи) — неорганічний вуглець, органотрофи
(гетеротрофи) — органічний вуглець (вуглеводи, жирні кислоти).
Літотрофи (грец. І Поз — камінь, ігорке — живлення) дістають
енергію від окислення неорганічних речовин (водень, окис вуглецю,
метан, аміак, сполуки заліза, марганцю, сірки). Вони відіграють
вакливу роль у кругообігу речовин у природі.
Разом з тим літотрофи справляють і шкідливий вплив: руйнують
будівельні матеріали (бетон, скло, гуму, емаль та ін.), спричинюють
корозію металів, піддають руйнуванню близько 10 % усіх запасів
нафти і значною мірою знижують її якість.
До хемолітотрофів належать бактерії, що населяють гарячі дже-
рела. їх виявляють на дні океанів, у надсолоних озерах, на скелях
гірських вершин, у пісках пустель.
Найважливіші об’єкти для медичної мікробіології — органотро-
фи, їх поділяють на сапрофітів і паразитів.
Сапрофіти в процесі своєї життєдіяльності використовують орга-
нічні речовини, які є в навколишньому середовищі. До них відно-
сять більшість видів бактерій, що населяють нашу планету.
Паразити —це порівняно невелика група мікроорганізмів (0,1 %),
які пристосувалися в ході еволюції до паразитичного способу життя;
вони живляться за рахунок органічних сполук тварин і людини.
46
Поділ органотрофних мікроорганізмів на сапрофітів й паразитів
не абсолютний, бо не завжди можна чітко розмежувати ці підгрупи.
Окремі види патогенних для людини бактерій можуть існувати
в навколишньому середовищі як сапрофіти, і, навпаки, деякі сапро-
фіти за несприятливих умов можуть спричиняти у людей і тварин
різні захворювання.
Більшість бактерій розвивається тільки в складних середови-
щах, що містять пептон (продукт ферментативного розщеплення м’яса
та інших білкових субстратів), м’ясний екстракт і подібні до них
продукти біологічного походження.
Органотрофні організми на відміну від літотрофних потребують
органічних сполук, що мають асиметрично розташований атом вугле-
цю. Проте останнім часом доведено, що окремі види органотрофних
бактерій, найпростіших, грибів засвоюють діоксид вуглецю й аміак,
синтезуючи з них складні вуглеводи й амінокислоти. Так, наприклад,
Е. соїі добре росте на синтетичному живильному середовищі, що
містить ЙН4СІ, М§804, КН2РО4, МаНРО4, глюкозу і воду.
Наведені дані підтверджують припущення, що абсолютних орга-
нотрофів немає. Засвоєння діоксиду вуглецю, як доведено, не є мо-
нополією зелених рослин і пурпурних сіркобактерій, воно спостері-
гається і серед багатьох органотрофів; цю властивість мають і па-
тогенні види.
Постає питання: які організми з’явилися раніше — літотрофні
чи органотрофні? С. М. Виноградський, В. Л. Омелянський.Б. Найт
і інші вважають первинними організмами літотрофні бактерії.
О. І. Опарін, І. І. Сорокін, М. Д. Ієрусалимський та інші дотриму-
ються думки, що першими живими істотами були органотрофи, які
живляться органічними речовинами. Виходячи з цієї концепції,
вважають, що спочатку з’явилися анаероби — мікроорганізми, які
живуть у безкисневому середовищі, оскільки в атмосфері Землі
в той час майже не було кисню, збільшення концентрації якого було
пов’язане з інтенсивним розвитком зелених рослин. В процесі ево-
люції утворились літотрофні мікроорганізми, які почали використо-
вувати кисень, щоб мати потрібну для них енергію. Отже, аеробний
тип дихання властивий пізнішому періодові розвитку мікроорга-
нізмів.
Фактори росту. Поряд з пептонами, вуглеводами, жирними кисло-
тами й неорганічними елементами бактерії потребують спеціальних
речовин —факторів росту, що відіграють роль каталізаторів біохі-
мічних процесів клітини і е структурними одиницями при утворенні
деяких ферментів.
Одні бактерії не потребують добавляння до поживного середо-
вища вітамінів, оскільки самі можуть синтезувати їх, інші — погано
ростуть або зовсім не культивуються (наприклад, гемолітичні стреп-
тококи) в безвітамінних середовищах. Так, НаеторЬіІиз іпііиепгае
погребує для свого росту складних речовин, які є в крові: Х-фактора
(гомін) і ¥-фактора (коеизим ферменту дегідрази).
До вітамінів і вітаміноподібних речовин, які потрібні для роз-
витку бактерій, належать біотин, тіамін (вітамін В^, рибофлавін
47
(вітамін В2), пантотенова кислота (вітамін В2), холін (вітамін В4),
нікотинова і фолієва кислоти і їх похідні, піридоксин (вітамін В„),
ціанокобаламін (вітамін В12) та його похідні — кобамідиі кофермен-
ти, а також параамінобеизойна кислота (Н,), нікотинова кислота,
В-алаиін.
Факторами росту є також пурини, піримідини, жирні кислоти
та інші речовини.
Концентрація факторів росту в живильному середовищі виража-
ється в мікрограмах, потреба в них коливається в межах 0,1 —
10 мкг/мл. Надлишок вітамінів затримує ріст мікроорганізмів.
Мікрофлора кишок відіграє певну роль у безпосередньому забез-
печенні вітамінами людини і тварин. Багато мікроорганізмів беруть
участь у вітамінному обміні рослин, у збагаченні вітамінами харчо-
вих продуктів та у виробництві вітамінів. Тепер усі мікроорганізми
щодо їх здатності синтезувати фактори росту порівняно добре вивче-
ні і класифіковані завдяки використанню синтетичних середовищ
з точним вмістом кожного інгредієнта.
Значення неорганічних речовин у живленні бактерій. Калій має
каталітичну дію, активує ферментні системи бактерій; кальцій бере
участь у нітрифікації, фіксації азоту грунтовим мікроорганізмом
(азотобактером), утворенні желатинази.
велике значення в життєдіяльності бактерій мають фосфор,
сірка, магній, залізо. Доведено, що залізо є в дихальних ферментах
і виконує функцію каталізатора окислювальних процесів; воно — не-
обхідний елемент хімічного складу мікобактерій туберкульозу, ко-
ринебактерій дифтерії, Е. соїі та ін. Вміст фосфору в бактеріях ко-
ливається від 1,5 до 4,5 % сухого залишку; у мікобактерій його
значно більше.
Іони заліза, цинку, магнію, міді та інших мікроелементів віді-
грають важливу роль в утворенні актиноміцетами антибіотиків. Іони
магнію, марганцю активують ДНК-азу гемолітичного стрептокока.
Мікроелементи входять до складу активних груп деяких фер-
ментів.
МЕХАНІЗМ МЕТАБОЛІЗМУ БАКТЕРІЯ
Бактеріальна клітина використовує поживні субстрати для син-
тезу складових частин свого тіла, ферментів, пігментів, факторів
росту, токсинів, відкладання резервного матеріалу й утворення енер-
гії, за рахунок якої вона існує.
Метаболізм бактерій охоплює два протилежних і разом з тим єди-
них процеси: конструктивний і енергетичний обмін речовин.
Конструктивний обмін речовин відбувається з вбиранням вільної
енергії. Для цього типу обміну витрачається порівняно мало пожив-
ного матеріалу, що споживається клітиною. Енергетичний обмін ре-
човин забезпечує перетворення енергії у форму, доступну для за-
своєння її клітиною. На здійснення цього процесу витрачається ве-
личезна маса поживних субстратів. Продукти неповного окислення
субстрату потрібні для бактерій не тільки як джерело енергії, а й як
матеріал для побудови їх клітин.
43
ФЕРМЕНТИ БАКТЕРІЙ
Ферменти—біологічні каталізатори високомолекулярної струк-
тури, що виробляються живою клітиною. Вони мають білкову при-
роду, строго специфічні і відіграють дуже важливу роль в обміні
речовин мікроорганізмів. Специфічність їх пов’язана з активними
центрами, що утворюються групою амінокислот.
Ферменти бактеріального походження мають різноманітну дію
і високу активність. їх широко застосовують у промисловості,
сільському господарстві, медицині, і вони поступово витісняють фер-
ментні препарати, які дістають із вищих рослин і тварин.
За допомогою амілази, що продукується плісеневими грибами,
оцукрюється крохмаль, який використовується в пивоварінні, спир-
товому виробництві, хлібопеченні. Протеїнази, які виробляються
мікроорганізмами, застосовують для видалення волосяного покриву
з шкур тварин, м’якшення шкір, зняття желатинового шару з кіно-
плівки при її регенерації, хімічної чистки одягу; ферменти, що гід-
ролізують клітковину, сприяють кращому засвоєнню тваринами
грубих кормів.
Завдяки застосуванню бактеріальних ферментів у медичній про-
мисловості дістають алкалоїди, полісахариди, стероїди (гідрокорти
зон, преднізон, преднізолон та ін.).
Бактерії відіграють важливу роль при обробці каучуку, бавовни,
шовку, кави, тютюну; під їх впливом відбуваються процеси, які
істотно змінюють у потрібному напрямі названі речовини.
Мікроорганізми мають надзвичайно високу синтезуючу власти-
вість. Сумарна маса бактеріальної цитоплазми на Землі значно пере-
вищує масу цитоплазми тварин. Біохімічна діяльність мікроорганіз-
мів має не менше загальнобіологічне значення, ніж фотосинтез.
Припинення існування мікроорганізмів неминуче спричинило б
загибель рослин і тварин.
Ферменти забезпечують засвоєння деякими мікроорганізмами ме-
тану, бутану, інших вуглеводнів і синтез із них складних органіч-
них сполук. На основі реалізації ферментативної властивості
дріжджів, що культивуються на відходах нафти (парафінах), у спеці-
альних промислового типу установках дістають білково-вітамінні
концентрати (БВК), які використовують у тваринництві як цінну
поживну речовину, що її добавляють до грубих кормів.
Одні ферменти виділяються бактеріальною клітиною у навколиш-
нє середовище (екзоферменти) для розщеплення складного колоїд-
ного поживного субстрату, інші — містяться всередині клітини (ен-
доферменти).
Розрізняють конструктивні ферменти (ліпази, карбогідрази, про-
теїнази, оксидази та ін.), які постійно перебувають у клітині неза-
лежно від умов її існування та наявності каталізованого субстрату,
і індуктивні, або адаптивні (пеніциліназа, декарбоксилаза амінокис-
лот, лужна фосфатаза, Р-галактозидаза та ін.), що синтезуються,
коли є потреба в них; вони виникають тільки в присутності відповід-
ного субстрату.
49
Синтез індуктивних ферментів відбувається внаслідок присутності
у клітинах вільних амінокислот і за участю наявних у бактеріях
готових білків.
Для нормального розвитку і функціонування типової бактері-
альної клітини потрібно 1000—4000 ферментів, які забезпечують
активний транспорт поживних речовин у клітину з навколишнього
середовища, регулюють перетворення енергії у клітині, здійснюють
біосинтез амінокислот і нуклеотидів, білка і нуклеїнових кислот,
реплікацію із сегрегацією нуклеоїдного апарату, цитогенез, біосин-
тез ліпідів.
ТРАНСПОРТ ПОЖИВНИХ РЕЧОВИН
Вбирання клітинами поживних речовин—досить складний про-
цес. Одноклітинним найпростішим властивий голозойний тип
живлення, що характеризується заковтуванням твердих части-
нок їжі, перетравлюванням і перетворенням їх у розчинні сполуки.
Бактеріям, водоростям, грибам, рослинам властивий галофіт-
ний тип живлення; вони вбирають поживні речовини
в розчиненому вигляді.
Проте ця відмінність неістотна, оскільки клітини найпростіших,
так само як і рослинних організмів, використовують розчинні у воді
або клітинному соку поживні субстрати, а багато які бактерії і гри-
би можуть засвоювати тверді поживні речовини, попередньо розщеп-
люючи їх зовнішнім перетравлюванням за допомогою екзоферментів.
При дифузії розчинена речовина переміщується із зони високої
концентрації за межами тіла бактеріальної клітини в організм бакте-
рій доти, доки концентрація не стане однаковою.
Проходження розчинника через цитоплазматичну мембрану бак-
терій із зони нижчої концентрації розчиненої речовини в зону вищої
концентрації відбувається в результаті осмосу. Градієнт концентрації
й осмотичні сили, що діють з обох боків цитоплазматичної мембра-
ни, дуже різноманітні і залежать від різниці концентрації багатьох
речовин, які є в клітині і поживному середовищі. Перенесення роз-
чинених речовин із живильного середовища в клітину може здійсню-
ватися втягненням їх разом з розчинником при умові достатньої
пористості цитоплазматичної мембрани.
Рис. 18. Схема будови цито-
плазматичної мембрани.
Цитоплазматична мембрана скла-
дається з ліпідних і білкових моле-
кул, розташованих у певній послідов-
ності (рис. 18). Заряджені групи
молекул своїми кінцями спрямовані
до поверхні мембрани. На зарядже-
них кінцях адсорбовані шари білка,
що складаються з білкових ланцюгів
і утворюють сплетення на зовнішній
і внутрішній поверхнях цитоплазма-
тичної мембрани. Висока вибірна
властивість, що дає змогу клітинам
60
бактерій відрізняти одні речовини від інших, пов’язана з наявністю
ферментних систем, локалізованих на поверхні клітин. Завдяки дії
цих ферментів нерозчинні в цитоплазматичній мембрані речовини
стають розчинними.
Цитоплазматична мембрана відіграє важливу роль у метаболізмі
бактерій. Вона має властивість швидко змінювати свою проникність
для різних речовин і тим самим регулювати надходження їх у клі-
тину і розподіл у ній, а також впливати на хід реакцій, у яких ці
речовини беруть участь.
У процесі живлення бактерій розрізняють пасивне й активне
перенесення різних речовин та іонів. При пасивному перенесенні
потік речовин рухається відповідно до різниці концентрацій або
електрохімічних потенціалів. Активне перенесення речовин відбува-
ється внаслідок генерованої в клітині енергії за типом «біологічних
насосів».
У регулюванні найважливіших біологічних процесів першорядну
роль відіграють універсальні циклічні нуклеотиди, а також іони
калію, натрію, кальцію, магнію, перенесення яких відбувається вна-
слідок різниці в зарядах поверхні цитоплазматичної мембрани й ото-
чуючого мікроорганізми середовища, причому роль перенощиків,
як вважають, виконують жиророзчинні речовини X і У; при цьому
утворюються сполуки з іонами калію і натрію (КХ і №¥), які
можуть дифундувати через оболонки клітин. Із цитоплазматичної
мембрани деяких мікроорганізмів виділено білки, які беруть участь
у транспортуванні амінокислот, а також білкові системи, відпові-
дальні за перенесення деяких цукрів взагалі і глюкози зокрема.
БІЛКОВИЙ ОБМІН
Мікроорганізми для свого живлення, росту й життєдіяльності
потребують різних амінокислот. Кількість потрібних амінокислот
може бути різною. Наприклад, сальмонела черевного тифу потребує
однієї амінокислоти — триптофану, для інших мікроорганізмів по-
трібно дві амінокислоти і більше. Є також мікроорганізми (напри-
клад, Ьеисопозіос шезепіегоідез), для росту яких потрібно 17—
18 амінокислот.
Багато які з бактерій втратили здатність синтезувати амінокисло-
ти. Звичайно ті види, яким потрібні вітаміни, потребують і готових
амінокислот. Для деяких мікроорганізмів потрібні, крім амінокислот
і вітамінів, також речовини, що несуть функцію стимуляторів росту
(олеїнова і оцтова кислоти, пуринові і піримідинові основи, нуклеїно-
ві кислоти).
Білковий обмін у бактерій відбувається у дві фази: розщеплення
і синтезу. Первинне розщеплення до стадії пептонів відбувається під
впливом екзопротеази, що виділяється бактеріальною клітиною у жи-
вильному середовищі. Вторинне розщеплення настає завдяки дії
ендопротеази, яка властива всім бактеріям і міститься всередині
їх тіла.
Амінокислоти, що утворюються під впливом ендопротеази,
можуть зазнавати дезамінування з утворенням аміаку та
51
Х-кетокислоти або спирту, вуглекислого газу й аміаку (дріжджі)
або Х-оксикислоти й аміаку (молочнокислі бактерії) і т. д.
Виділяють відновне, гідролітичне, внутрішньомолекулярне, окис-
лювальне дезамінування (ЯСН.\Н2—СООН—1/202-> ВСОСООН +
+ NN3).
В результаті розщеплення амінокислот реакція середовища стає
лужною внаслідок утворення слабкої кислоти й аміаку.
Поряд із дезамінуванням дуже поширене явище декарбокси-
л у в а н н я, особливо серед гнильних бактерій: КСНМН,—СООН -*
-> КСН2МНа+ СО2. При декарбоксилуванні гістидину утворюється
гістамін, орнітину — путресиин, лізину — кадаверин, тирозину —
тирамін.
Деякі бактерії виробляють фермент триптофаназу, під впливом
якої утворюється індол; на його виявленні грунтується бактеріоло-
гічна діагностика. Утворення індолу звичайно спостерігається в умо-
вах голодування.
Поряд з реакціями розщеплення білків відбуваються й процеси
їх синтезу. Для побудови білків бактерій потрібні амінокислоти.
Бактеріальні клітини задовольняють потреби в амінокислотах под-
війним шляхом: одні мікроорганізми дістають їх у готовому вигляді,
інші — синтезують із простих сполук азоту. Амінокислоти утворю-
ються внаслідок приєднання до вуглецевого кістяка майбутньої
амінокислоти; при цьому утворюються дикарбонові амінокислоти —
аспарагінова і глутамінова. Інші амінокислоти утворюються внаслі-
док трансамінування або переамінування:
КСНМН2—СООН 4- НООС -* СО —СООН — ЯСО — СООН 4-
4- НООС — СНГ4Н2— СООН. Обов’язковою властивістю бактерій
є здатність синтезувати незамінні амінокислоти (метіонін, триптофан,
лізин).
Синтез білка відбувається під впливом первинної інформації,
що здійснюється ДНК, з дуже великою швидкістю. Так, у Е. соіі
з періодом генерації ЗО хв реплікація ДНК відбувається з швидкістю
5 • 103 нуклеотидів за 1 с. Одночасно з реплікацією ДНК відбува-
ються процеси транскрипції і трансляції. Швидкість біосинтезу ри-
босомальної РНК досягає 6,7 • 104 нуклеотидів за 1 с. Клітини
Е. соіі у певних стадіях росту синтезують протягом 1 с 500—4000 мо-
лекул білка.
Певну роль у білковому обміні відіграють регуляторні гени:
гени-активатори, які посилюють транскрипцію, і гени-репресори,
що пригнічують її. Білковий обмін тісно пов’язаний з вуглеводним.
Для побудови азотистих сполук використовується піровиноградна
кислота, а дикарбонові кислоти є активними посередниками в біо-
синтезі амінокислот.
ВУГЛЕВОДНИЙ ОБМІН
Вуглеводи розщеплюються за участю ферментів, які здійсню-
ють гідроліз крохмалю до утворення глюкози і мальтози. Амі-
лаза є в багатьох видів бактерій: сінній, дифтерійній паличках,
52
збуднику сибірки, холерному вібріоні, стрептококах. Наявність
цього ферменту забезпечує створення в клітині резервного матеріалу
у вигляді полісахаридів. Деякі бактерії, які мають фермент целю-
лозу, що розщеплює клітковину, можуть ферментувати рослинні
камеді — складні полісахариди (наприклад, агар, який дістають із
морських рослин, широко використовують для виготовлення густих
живильних середовищ). Завдяки дії ферменту пектинази відбуваєть-
ся розщеплення пектину, пектинової кислоти льону або конопель.
Дисахариди, що надійшли в середину тіла бактерії під впливом
мальтази, сахарази, лактази, зазнають гідролізу і розщеплюються
на моносахариди, які потім зброджуються. Полі- і дисахариди мо-
жуть розщеплюватись на моносахариди і внаслідок фосфорол і-
з у. При гідролізі і фосфоролізі полі- і дисахаридів вуглецевий лан-
цюг молекули вуглеводу не розривається і цей процес не супрово-
диться вивільненням енергії.
Бродіння характеризується розривом ланцюга молекули
вуглеводу і вивільненням значної кількості енергії. Процесів бродіння
зазнають моносахариди, зв’язані з фосфорною кислотою. До моле-
кули вуглеводу приєднуються дві молекули фосфорної кислоти,ви-
никає низка гексозодифосфорних кислот, які розпадаються з роз-
ривом шестивуглецевого ланцюга і з утворенням двох фосфотріоз:
фосфогліцерииового альдегіду і фосфодіоксиацетону.
В результаті послідовних реакцій відновлюється кодегідраза;
піровиноградна кислота, що утворюється при цьому, внаслідок окис-
люзатьчого декарбоксилування перетворюється в оцтовий альдегід,
який, одержуючи водень од відновленої кодегідрази, переходить
у спирт.
Окислювальне дезамінування амінокислот супроводиться утво-
ренням кетокислот, у тому числі піровиноградної кислоти, окислення
якої спричинює поступове вивільнення енергії, що використовуєть-
ся організмом. Кінцевими продуктами такого розпаду є вода і вуг-
лекислий газ.
Різні види бактерій розкладають піровиноградну кислоту різно-
манітними реакціями з неоднаковою кількістю продуктів бродіння.
Кишково-тифозні бактерії при зброджуванні однієї молекули глюко-
зи розщеплюють її на дві молекули піровиноградної кислоти, з яких
потім утворюються молочна, оцтова і мурашина кислоти. У таких
випадках кажуть про зброджування вуглеводів з утворенням
кислот.
2СНЯ-СО-СООН + Н2О -> сня-снон-соон + СН3—СООН + соа
Піровиноградна Молочна кислота Оцтова кислота
кислота
СН3-СО-СООН + Н2О-> СН3—СООН + нсоон
Піровиноградна Оцтова Мурашина
кислота кислота кислота
Розщеплення вуглеводів супроводиться утворенням кислої реак-
ції, розщеплення білків — лужної. Отже, в процесі еволюції бакте-
рії, які спричинюють бродіння, пристосувались до життя при кис-
лій реакції, а гнильні — при лужній. Проявлення біологічного анта-
ВЗ
гонізму бродильних і гнильних мікроорганізмів відіграє важливу
роль у природі й практиці людини. Бродильні процеси запобігають
загниванню силосу, заквашених овочів, молочних продуктів.
Деякі види бактерій (Е. соїі, сальмонели паратифів А і В та ін.)
зброджують вуглеводи з утворенням кислоти і газу, що е дуже цін-
ною диференціальною ознакою. Газ при цьому утворюється внаслі-
док розкладання мурашиної кислоти на вуглекислий газ і водень:
НСООН -> Н2+ СО2.
Синтез вуглеводів здійснюється двома шляхами: фосфосин-
тезу (зелені і пурпурні бактерії, що містять пігменти типу хлоро-
філу) і хемосинтезу (більшість видів бактерій).
Хлорофіл бактерій за своїм хімічним складом подібний до хлоро-
філу зелених рослин, але на відміну від нього має властивість вби-
рати деяке проміння інфрачервоного спектра: це складний комплекс
з каротидними пігментами, що містять 75 % білка, близько 20 %
ліпідів і 5 % хлорофілу. У процесі фотосинтезу в одних пурпурних
сіркобактерій відновлюється вуглекислий газ воднем Н,8, в інших —
воднем деяких органічних речовин.
Хемосинтез відбувається асиміляцією вуглецю з вуглекислого
газу внаслідок окислення певних мінеральних речовин; деякі види
бактерій для асиміляції вуглекислого газу використовують молеку-
лярний водень, який окислюють до води.
ЛІПІДНИЙ ОБМІН
Незважаючи на те що ліпіди не належать до головних компонен-
тів поживного субстрату, вони мають певне значення з життєдіяль-
ності бактерій, зокрема наділяють мікроорганізми високою стійкі-
стю до дії шкідливих факторів навколишнього середовища. Ліпіди
бактерій характеризуються різноманітністю структури і функції.
Більшість видів бактерій засвоює гліцерин, який є для них дже-
релом енергії і пластичного матеріалу для побудови структур бакте-
ріальної клітини. Мікобактерії туберкульозу та інші кислотостійкі
види використовують гліцерин для синтезу ліпідів. Включення ліпі-
дів у клітинах бактерій є резервним поживним матеріалом.
Основні процеси обміну здійснюються за допомогою ліпази та
інших ліполітичних ферментів, міцно зв’язаних з цитоплазмою бак-
теріальної клітини. Важливу роль у розщепленні ліпідів відіграють
коензим А, тіолова група Р-меркаптоетиламіну.
Як джерело вуглецю для синтезу ліпідів численні бактерії вико-
ристовують метіонін. Міколова кислота ліпідів коринебактерій син-
тезується в бактеріальній клітині конденсуванням двох молекул паль-
мітинової кислоти і відновленням проміжного Р-ефіру. Так відбу-
вається синтез міколової кислоти у мікобактерій.
МІНЕРАЛЬНИЙ ОБМІН
Для синтезу компонентів бактеріальної клітини, крім азоту й вуг-
лецю, мікроорганізмам потрібні зольні елементи (сірка, фосфор,
калій, кальцій) і мікроелементи (бор, молібден, цинк, марганець,
кобальт, нікель, мідь, йод, бром та ін.).
Б4
Одним із найважливіших елементів, що входять до складу цито-
плазми бактерій, е сірка, яка бере участь у синтетичних реакціях
у вигляді сульфгідрильної групи (Я—8Н). Ця відновлена форма
сірки має високу реактивність і легко піддається дегідруванню з на-
ступним перетворенням у групу Я—8—8—Я, а потім у складніші
сполуки, що відновлюються при гідруванні. Завдяки такому проце-
сові регулюється окислювально-відновний потенціал у цитоплазмі
мікроорганізмів. Відновлення сульфату відбувається так: 8О4->
-> 8ОЯ-»- 8О2-> 80 Н28.
Деякі види (сіркобактерії, тіонові бактерії) засвоюють відновле-
ні сполуки сірки. Патогенні бактерії використовують сірку у вигля-
ді сульфгідрильної групи (Я—8Н).
Фосфор є в нуклеїнових кислотах, багатьох ферментах, різних
фосфоліпідах та інших органічних сполуках у формі Р2О6; він не
вступає у безпосереднє з’єднання з вуглецем, а утворює зв’язки
через атоми кисню. У ході окислювальних процесів вивільняється
енергія, акумульована в цитоплазмі клітин бактерій. Важливу роль
в енергетичному обміні відіграють аденозинтрифосфорна (АТФ) й аде-
нозинді£ос£орна (АДФ) кислоти. Перша багата на енергію (заря-
джена), друга — бідна на енергію (розряджена).
Фосфор входить до складу найважливіших сполук цитоплазми
(нуклеопротеїди, фосфоліпіди, простетичні групи більшості двоком-
понентних ферментів). Вміст фосфору у вигляді Р2О5 в сухій речо-
вині бактерій становить 5 %.
Для нормального розвитку мікроорганізмів потрібні катіони й
аніони багатьох металів (магній, кальцій, калій, залізо та ін.), які
беруть участь у синтезі клітинної речовини. Залізо входить до складу
гемінів, іцо є простетичними групами ряду ферментів (цитохроми).
Нестача або надмір заліза у живильному середовищі впливає на
інтенсивність продукції екзотоксину коринебактеріями дифтерії.
Активізація генів токсигенності контролюється репресорами бактері-
альної клітини, вироблення яких індукується високою концентра-
цією заліза. Молібден і бор потрібні для азотфіксуючих бактерій.
ПРАКТИЧНЕ ВИКОРИСТАННЯ ФЕРМЕНТАТИВНИХ
ВЛАСТИВОСТЕЙ МІКРООРГАНІЗМІВ
Широке й науково обгрунтоване застосування мікробіологічних
процесів у технології бродильного виробництва, обробці льону,
шкур тварин, землеробстві, консервуванні багатьох харчових про-
дуктів стало можливим тільки з другої половини XIX ст. Із важ-
ливих потреб промисловості, що бурхливо розвивалась, особливо
переробки продуктів сільського господарства, випливала потреба
глибокого вивчення біохімічних процесів. Відкриття, зроблені в цій
галузі Л. Пастером, були значною мірою підготовлені розвитком
промисловості, органічної хімії та інших наук.
Мікроорганізми беруть участь у кругообігу азоту (гниття), вугле-
цю (бродіння), сірки, фосфору, заліза та інших елементів, що мають
важливе значення в життєдіяльності організмів. Завдяки фермента-
тивним процесам утворилися лікувальні грязі і ропн.
55
Мікроорганізми застосовують як індикатори для виявлення про-
цесів гідролізу в морях і океанах, визначення потреб грунту в добри-
вах, точної кількості вітамінів, амінокислот та інших речовин, що не
піддаються виявленню хімічними аналітичними методами.
Певні види мікроорганізмів синтезують антибіотики, ферменти,
гормони, вітаміни, амінокислоти, що використовуються в медицині,
ветеринарії і сільському господарстві. Освоєно мікробіологічний син-
тез білків за допомогою спеціальних видів дріжджів.
Деякі грунтові бактерії мають властивість знешкоджувати (руй-
нувати) певні пестициди, що застосовуються для боротьби з шкідли-
вими для сільськогосподарських рослин комахами. Водневі бактерії
можуть бути використані для виробництва кормового білкЗ вирощу-
ванням на сечовині або амонії сульфату. Окремі види бактерій
застосовують для боротьби з утворенням метану в шахтах.
Великого значення надають специфічній ферментативній власти-
вості патогенних бактерій, на основі якої визначають видову належ-
ність збудників. Багато які бактерії ферментують вуглеводи з утво-
ренням кислоти або кислоти і газу, а білки — з утворенням індолу,
аміаку, сірководню та ін. Ферментативні особливості мікроорганіз-
мів використовують при вивченні мікрофлори грунту, води і повітря.
ДИХАННЯ БАКТЕРІЙ
Як відомо, атмосферне повітря містить приблизно 78 % азоту,
20 % кисню і 0,03—0,09 % вуглекислого газу. Газоподібний азот
використовується тільки азотфіксуючими бактеріями, СОа— єдине
джерело вуглецю — утилізується літотрофними бактеріями. Кисень
відіграє дуже важливу роль у метаболізмі більшості видів бактерій.
Дихання бактерій — це складний процес, що супроводиться ви-
діленням енергії, потрібної мікроорганізмам для синтезу різних орга-
нічних сполук.
Процеси дихання у бактерій є довгим ланцюгом послідовних окис-
лювально-відновних реакцій з участю багатьох ферментативних
систем, які здійснюють перенесення електрона від системи з найбіль-
шим негативним потенціалом до системи з найбільшим позитивним
потенціалом. При поступовому і дробному вивільненні енергії ди-
хання і при проміжному перенесенні водню підвищується активність
реакції клітини. Біохімічні механізми дихання докладніше описано
в підручниках біологічної хімії.
Уявлення про дихання як процес біологічного окислення органіч-
них речовин киснем зазнало значних змін у зв’язку з відкриттям ана-
еробних бактерій, які не можуть існувати в присутності кисню.
Л. Пастер довів, що енергія, потрібна для життєдіяльності деяких
видів бактерій, утворюється в процесі бродіння.
Усі бактерії за типом дихання поділяються на облігатні аероби,
мікроаерофіли, факультативні анаероби та облігатні анаероби.
Облігатні аероби (бруцели, мікрококи, мікобактерії туберкульо-
зу та ін.), які розвиваються, коли в атмосфері є 20 % кисню, ростуть
на поверхні рідких або густих поживних середовищ, містять фермен-
66
ти, за допомогою яких здійснюється перенесення водню від окислю-
ваного субстрату до кисню повітря.
Мікроаерофіли (актиноміцети, лептоспіри та ін.) потребують знач-
но менше кисню; висока концентрація кисню хоч і не вбиває бакте-
рій, але загримує їх ріст.
Факультативні анаероби (більшість патогенних і сапрофітних
видів) можуть розмножуватися як при наявності, так і при відсут-
ності молекулярного кисню.
Облігатні анаероби (клосгридії правця, анаеробної інфекції, бо-
тулізму та ін.) — це бактерії, для яких наявність молекулярного
кисню шкідлива, бо він затримує ріст.
Причиною шкідливої дії на бактерії молекулярного кисню є утво-
рення перекису водню (Н2О2). Аеробні бактерії розщеплюють його
за допомогою каталази, в анаеробів цього ферменту немає.
У процесі дихання аеробні бактерії окислюють різні органічні
речовини (вуглеводи, білки, жири, спирти, органічні кислоти та
інші сполуки). При повному окисленні граммолекули глюкози ви-
вільняється певна кількість тепла, що відповідає запасу потенці-
альної енергії, яка була акумульована в молекулі вуглеводу при фо-
тосинтезі його в зелених рослинах із вуглекислого газу і води.
При неповному (частковому) аеробному окисленні виділяється
відповідно до ступеня окислення менше енергії.
Типовим представником факультативних анаеробів є Е. соїі,
яка у вуглеводному середовищі спочатку розвивається як анаероб,
розщеплюючи вуглеводи бродінням, потім починає споживати кисень
і росте як аероб, окислюючи продукти бродіння (молочна кислота)
до вуглекислого газу І води. Факультативні анаероби мають значні
переваги, але вони можуть жити як у кисневих, так і в безкисневих
умовах.
Дихання анаеробів відбувається за допомогою ферментації суб-
страту з утворенням невеликої кількості енергії. При бродінні однієї
граммолекули глюкози утворюється значно менше енергії, ніж при
аеробному диханні.
Механізм анаеробного дихання полягає ось у чому. Якщо окис-
люваним субстратом є вуглеводи, то вони попередньо розщеплюються
за допомогою ферментів. Наприклад, глюкоза зазнає фосфорилювання
з участю АТФ і АДФ, в результаті утворюється гексозодифосфат.який
під дією ферменту альдолази розщеплюється на дві частини: фосфо-
гліцериновий альдегід і фосфодіоксиацетон. Останній під впливом
оксиізомерази перетворюється у фосфогліцериновий альдегід; надалі
в результаті кількох послідовних реакцій утворюється піровино-
градна кислота. На цій стадії анаеробна фаза перетворення вуглецю
закінчується. Подальші етапи перетворень характеризуються специ-
фічністю і завершуються утворенням кінцевих продуктів. До анаероб-
них процесів належить спиртове бродіння, що здійснюється дріжджа-
ми, молочнокисле, яке спричинюється лактобактеріями, і маслянокис-
ле, що зумовлюється маслянокислими клострндіями.
Наявність облігатних анаеробів пояснює значну пристосовува-
ність живих істот і повноту кругообігу речовин у природі.
57
Дихають бактерії з участю ферментів типу оксидаз і дегідраз, які
мають виражену специфічність дії. Оксидазний і дегідразннй процеси
дихання тісно зв’язані між собою, доповнюючи один одного, але ра-
зом із тим різні як щодо біологічної ролі, так і щодо ферментів, які
здійснюють ці реакції.
Оксидазний тест використовують для диференціації різних родин
і родів мікроорганізмів. До оксидазно-позитивних бактерій віднесені
нейсерії, синьогнійна паличка та ін., до оксидазно-негативних —
ентеробактерії.
інтенсивність процесів аеробного дихання залежить од віку куль-
тури мікроорганізмів, температури і поживних субстратів. Культу-
ри, що активно ростуть, споживають за І год 2500—5000 мм3 кисню
на 1 мг сухої речовини бактерій, тоді як голодуючі або цілком по-
збавлені азотистого живлення—тільки 10—150 мм*
Таким чином, суть енергетичного метаболізму полягав в одержанні
енергії, яка утворюється в процесі прямого біологічного окислення
речовин воднем повітря або дегідруванням — відніманням від суб-
страту електрона водню. Перенесення електрона супроводиться ви-
вільненням енергії, яка утилізується клітиною за допомогою АДФ
та АТФ. У тварин цей процес відбувається в мітохондріях, у бакте-
рій — у мезосомах (аналоги мітохондрій).
У процесі біологічного окислення анаеробним дегідруванням один
із коферментів дегідрогенази піровиноградної кислоти — нікотин-
амідаденінцінуклеотид (НАД) віднімає водень від субстрату, в ре-
зультаті чого утворюється НАД • Н2, який віддає водень наступно-
му коферменту дегідрогенази — флавінаденозиндінуклеотиду (ФАД),
що перетворюється у ФАД • Н2. У аеробів електрон водню від
ФАД • Н2 переноситься на систему цитохромів, що є білковими моле-
кулами, які з’єднані з хімічним угрупованням — гемом. Гем містить
атом заліза, що має властивість поперемінно окислюватись і віднов-
люватись (Е2+ — Е3+). Електрон передається системою цитохромів
цитохромоксидазі, при цьому електрон і протон водню середовища
зв’язуються киснем повітря.
При анаеробному дегідруванні кінцевими акцепторами водню
можуть бути вуглець, азот, сірка, які відновлюються до СН4,
МНЯ, Н28.
При фосфорилюванні глюкоза розщеплюється на дві тріози,
кожна з яких складається з трьох атомів вуглецю. Одна з них, від-
щеплюючи залишок фосфорної кислоти, перетворюється у пірови-
ноградну кислоту. Цей ферментативний процес за схемою Ембдена—
Мейєргофа відбувається в 9 етапів.
Аероби (мікрококи, бруцели, мікобактерії туберкульозу та ін.)
містять три цитохроми (а, в, с); факультативні анаероби (Е. соіі,
черевнотифозна, дизентерійна бактерії, стрептококи та ін.) мають
один або два цитохроми; анаероби не мають цитохромів.
Анаероби можуть розмножуватись і в тому разі, коли в середови-
щі е кисень, який не вбиває бактерій, а тільки припиняє їх життє-
діяльність; анаероби ростуть і при добавлянні до середовища віднов-
ників. Ця дія властива глюкозі та іншим редукуючим речовинам.
58
Одним із факторів, від якого залежать окислювально-відновні
реакції у живильному середовищі, е окислювально-відновний потен-
ціал, що виражає кількісну характеристику ступеня аеробності. Він
стає мінімальним при насиченні середовища воднем і максимальним
при насиченні середовища киснем. М. Кларк запропонував величину
окислювально-відновного потенціалу позначати гН2—від’ємний лога-
рифм парціального тиску газоподібного водню. Ця величина характе-
ризує насичення середовища киснем або воднем. Діапазон гН2 від
0 до 42,6 характеризує всі ступені насичення водного розчину воднем
і киснем. Аероби ростуть у межах гН2 14—20 і більше, факульта-
тивні анаероби — 0—20 і більше, анаероби — від 0 до 12.
При високому окислювально-відновному потенціалі настає інак-
тивація життєво важливих ферментів. Анаероби при цьому втрачають
здатність до нормального живлення, до конструктивних процесів
і гинуть від голоду, а не від отруєння їх киснем або Н2О2. Анаероби
характеризуються дуже вираженою властивістю пристосовувати сере-
довище до своїх потреб. Засіяні культури анаеробів, перш ніж по-
чати розмножуватись, знижують гН2 з 20—22 до 1—5. Такі самі
властивості мають і аероби. Вони захищають себе від надлишку кис-
ню відновним бар’єром.
Регулюючи окислювально-відновні потенціали живильного сере-
довища, можна створити умови для росту анаеробів у присутності
кисню зниженням гН2, а також культивувати аероби в анаеробних
умовах підвищенням гН2 середовища. При відмиранні культури бак-
терій, лізисі її фагом або діянні на неї лізоцимом окислювально-від-
носний потенціал різко знижується.
При виготовленні живильних середовищ беруть до уваги не тільки
склад поживного субстрату, енергетичний матеріал і активну реак-
цію середовища (рН), а й її окислювально-відновний потенціал
(гН2).
УТВОРЕННЯ МІКРООРГАНІЗМАМИ ПІГМЕНТІВ
Деякі види бактерій і грибів, які живуть у грунті, воді і повітрі,
можуть виробляти пігменти. Колонії (скупчення клітин бактерій)
піг.ментотворних видів на густих середовищах забарвлюються в чер-
воний (Зеггаііа тагсезсепз, актиноміцети, дріжджі), рожевий (роже-
вий мікрокок), золотистий (золотистий стафілокок), білий (білий ста-
філокок), синій (синьогнійна бактерія), фіолетовий (хромобактер
фіолетовий), чорний і бурий (дріжджі і гриби), жовтий або оранже-
вий (мікобактерії туберкульозу) колір. Колонії сарцин забарвлю-
ються у жовтий, лимонний, золотистий колір. Деякі мікроорганізми
виробляють два пігменти і більше.
Пігменти утворюються при достатньому доступі кисню, темпера-
турі 20—25 °С і в більшості видів при розсіяному сонячному світлі.
Пігменти поділяються на розчинні у воді і спирті (синьогнійна
бактерія, бактерії синьо-зеленого молока) і нерозчинні (азотобактер,
чорні і бурі пігменти дріжджів і плісені), а також на хромопарні (що
надходять у зовнішнє середовище), та хромофорні (які є в цитоплазмі,
вакуолях і оболонці).
59
Утворення пігментів мікроорганізмами має певне фізіологічне
значення. Вважають, що пігменти виконують у процесі дихання
функцію акцептора водню, забезпечують захист мікроорганізмів від
природного ультрафіолетового випромінювання, беруть участь у ре-
акціях синтезу, а також мають антибіотичну дію.
У цитоплазматичній мембрані галобактерій є бактеріородопсин —
білок, що складається з 248 амінокислот і зв’язаної з ними молекули
ретиналю (світлочутливий компонент зорових пігментів тварин).
У мембрані галобактерій бактероіородопсин виконує особливий без-
хлорофільний тип фотосинтезу.
СВІЧЕННЯ МІКРООРГАНІЗМІВ
Свічення (люмінесценція) є своєрідною формою вивільнення
енергії при окислювальних процесах. Чим більший приплив кисню
до бактерій, тим інтенсивніше свічення.
Свічення м’яса, луски риб та інших об’єктів було помічено ще
Арістотелем (384—322 рр. до н. е.). Іноді світні мікроорганізми про-
никають у тіло і м’язи дрібних ракоподібних, зумовлюючи яскраве
свічення цих тварин уночі на березі моря. Виявлено світні терміти,
мурахи і павуки. Вважають, що джерелом світла є світні бактерії.
У деяких риб є спеціальні органи для удержання світних бактерій
(симбіонти), які є джерелом світла. Світяться і деякі гриби, що жи-
вуть у старих пеньках та корінні дерев; у нічну пору світяться осінні
опеньки.
На початку XX ст. X. Моліш запропонував використати світні
бактерії для <безпечних ламп», що застосовуються в порохових по-
гребах. Світні бактерії — дуже чутливі індикатори для виявлення
молекулярного кисню. М. Бейєрнік застосовував світні бактерії як
індикатор при вивченні виділення кисню в процесі фотосинтезу.
Світні бактерії дістали назву фотобактерій. До них нале-
жить велика група фізіологічно подібних, але морфологічно різних
мікроорганізмів (коки, палички, вібріони), вони є грамнегативними
або грампроміжними, що не утворюють спор, аеробами. Більшість
видів фотобактерій виділені з морської води; вони не спричинюють
гниття, хоч добре ростуть на рибних і м’ясних субстратах, культиву-
ються у звичайних середовищах.
Оптимальна температура для росту і свічення більшості фотобак-
терій приблизно 15—18 °С. Деякі види добре розвиваються і при
температурі ЗО—37 °С та концентрації натрію хлориду близько 3 %,
але е бактерії, які світяться, коли в середовищі є 0,5—0,6 % МаСІ.
Світловипромінююча система бактерій властива неушкодженим
живим клітинам. Зменшення концентрації натрію хлориду в сере-
довищі, добівляння сульфаніламідних препаратів, осмотичний цито-
ліз, механічне розтирання, звукові коливання, повільний аутоліз,
екстракція різними розчинниками призводять до порушення як вла-
стивості світитися, так і життєздатності клітини. Удалось добути
екстракти мікроорганізмів, які випромінюють світло в темному при-
міщенні. Із деяких екстрактів виділено люциферин і фермент люци-
феразу.
60
Типовим представником фотогенних видів мікроорганізмів е РЬо-
іоЬасіегіит рНозрНогеит — нерухома коковидна бактерія, яка не
розріджує желатину, розвивається при 28 °С; при температурі понад
ЗО °С ріст її припиняється. Патогенних для людини видів у групі
фотобактерій не виявлено.
Ароматотворні мікроорганізми. Деякі бактерії мають властивість
виділяти леткі речовини (оцто-етиловий і оцто-аміловий ефіри),
які вони виробляють у процесі життєдіяльності.
Ароматичні властивості вин, молочних продуктів, грунту, сіна
та інших речовин зумовлені діяльністю деяких видів мікроорганіз-
мів. До ароматотворних бактерій належить Ьеисопозіос сгетогіз,
що використовується в молочній промисловості для ароматизування
молочних продуктів, особливо масла.
РІСТ І РОЗМНОЖЕННЯ БАКТЕРІЙ
Ріст бактерій означає збільшення їх маси в результаті синтезу
клітинного матеріалу.
Розмноження бактерій — властивість їх самовідтворюватись,
збільшуючи кількість особин на одиницю об’єму.
Бактерії розмножуються простим поперечним поділом (вегетатив-
не розмноження) (рис. 19), який відбувається в різних площинах
з формуванням різних поєднань клітин (грона, ланцюжки, парні
з’єднання, тюки та ін.), брунькуванням, а також внаслідок розщеп-
лення сегментованих ниток, утворення клітин, подібних до спор,
продукування найдрібніших рухливих конідій.
Актиноміцети розмножуються переважно спороутворенням.
У процесі поділу бактерій відбувається реплікація (подвоєння)
ДНК (рис. 20), при цьому розриваються водневі зв’язки і синтезу-
ються дві нитки ДНК. Надалі однониткові ДНК в дочірніх клітинах
з’єднуються водневими зв’язками і знову утворюються двониткові
ДНК, які здійснюють генетичну інформацію. Реплікація ДНК має
напівконсервативний характер, оскільки при її поділі зберігається
атомна ідентичність кожної нитки; у новосинтезованих молекулах
ДНК одна нитка стара, тоді як друга — нова, комплементарна.
Швидкість оеплікацїї ДНК залежить від температури та складу
живильного середовища. Якщо при температурі 37 °С ДНК Е. соіі
реплікується у звичайному середовищі за 40 хв, то у збагаченому
живильному середовищі клітини можуть подвоїтись за 20 хв.
Поперечний поділ бактерій не зводиться до процесу розділення
однієї материнської клітини на дві рівноцінні дочірні клітини. Після
певної кількості генерацій клітини старіють і гинуть.
Розрізняють три типи поділу клітин бактерій: І) випереджаючий
поділ, що призводить до утворення багатоклітинних паличок і ко-
ків; 2) синхронний, при якому розділення і поділ нуклеоїду супро-
водиться утворенням одноклітинних організмів; 3) з випереджаючим
поділом нуклеоїду, що зумовлює утворення багатонуклеоїдних бак-
терій.
61
Рис 19. Ультратонкий зріз клітини
Е соїі, що поділяється.
Рис. 20. Реплікація ДНК бактерій:
а. г — старі няткя; б, в — нові няткя.
Під впливом речовин і факторів, які зменшують поверхневий на-
тяг (мила, солі жовчних кислот, глюкоза, сахароза, деякі амінокис-
лоти, ультрафіолетове випромінювання, пеніцилін), бактерії ростуть,
припиняючи поділ, що й призводить до утворення довгих ниток.
Швидкість розмноження бактерій у популяції різна. Вона зале-
жить од виду і віку культури, живильного середовища, температу-
ри, концентрації вуглекислого газу та багатьох інших факторів.
За сприятливих умов період до появи 1-ї генерації (покоління)
у Сіо^ігісііит регГгіп^епз, Бігеріососсиз Іасііз становить 15 хв, тоді
як для клітин культур тканин ссавців — 1 добу. Отже, бактерії роз-
множуються майже в 100 раз швидше, ніж клітини культури тканин.
Збільшення кількості клітин виражають так: 1—2—4—8—16—
32.../V—кількість клітин; 0—1—2—3—4—5...Л— кількість генерацій.
Загальна кількість бактерій через п генерацій становитиме
2п на кожну клітину посівного матеріалу. Якщо вихідну кількість
бактерій, внесених у живильне середовище, вважати однією особи-
ною, а час одного подвоєння взяти ЗО хв, то за добу, як показують
розрахунки, загальна кількість бактерій повинна становити М —
249. При поділі через кожні 20 хв через 36 год маса мікроорганізмів
становитиме близько 400 т. Термофільні види розмножуються ще
швидше. Однак і в природних, і в штучних умовах бактерії розмно-
жуються значно повільніше, бо розмноження обмежується дією низ-
ки факторів зовнішнього середовища.
Бактерії розмножуються за певними закономірностями, що ви-
вчаються за допомогою математичної обробки із складанням рівнянь
і побудовою графічних кривих, визначення динаміки концентрації
бактеріальних клітин у різних стадіях росту, особливо в експоненці-
альній фазі (див. далі), в якій культура має найбільшу хімічну і біо-
логічну активність.
62
Рис. 21. Графік розмноження бактерій (римськими
цифрами позначено основні фази розмноження).
Розрізняють культури періодичні, неперервні і синхронні. Періо-
дичні культури характеризуються вираженою циклічністю розвитку.
На рис. 21 схематично зображено графік розмноження періодичної
культури бактерій.
Виділяють вісім основних фаз розмноження бактерій.
Вихідна стаціонарна фаза — це час від моменту висівання бакте-
рій до початку їх росту. У цій фазі кількість живих бактерій може
навіть зменшуватись. Тривалість її 1—2 год.
Фаза затримки розмноження характеризується підвищенням швид-
кості збільшення розміру бактерій (швидкості росту) і слабким роз-
множенням. Фази І і II звичайно об’єднують в одну лаг-фазу.
Експоненціальна (логарифмічна} фаза характеризується тим, що
логарифм кількості клітин збільшується лінійно залежно від часу,
клітини поділяються з максимальною сталою швидкістю. У цій фазі
бактерії мають найбільшу біохімічну і біологічну активність, міні-
мальну резистентність до факторів зовнішнього середовища. Трива-
лість цієї фази 5—6 год.
Фаза негативного прискорення, під час якої швидкість розмно-
ження бактерій перестає бути максимальною, кількість особин, що
поділяються, зменшується; триває близько 2 год.
Стаціонарна фаза максимуму, коли кількість нових бактерій
майже дорівнює кількості відмерлих; тривалість її 2 год.
Фаза прискорення загибелі, протягом якої настає порушення рів-
новаги між стаціонарною фазою і швидкістю загибелі бактерій;
триває 3 год.
Фаза логарифмічної загибелі, коли особини відмирають із сталою
швидкістю; триває близько 5 год.
Фаза зменшення швидкості відмирання — особини, що залиша-
ються живими, переходять у стан спокою; тривалість цієї фази та-
кож близько 5 год.
Тривалість окремих фаз наведена умовно, оскільки вона може
варіювати залежно од виду бактерій. Так, наприклад, Е. соїі ді-
литься через кожні 20—ЗО хв, сальмонели черевного тифу — через
23 хв, патогенні стрептококи — через ЗО хв, коринебактерії — через
34 хв, мікобактерії туберкульозу — через кожні 18 год.
Вміст ТНИ і ппбосом V бактерій впливає на швидкість розмно-
ження і залежить від умов культивування. Неперервні культури
63
характеризуються тим, шо вони весь час залишаються в одному й то-
му самому стані, наприклад у стадії експоненціального росту. Це е
наслідком неперервного поновлення середовища (метод проточного
культивування). У синхронній культурі більша частина клітин попу-
ляції поділяється одночасно.
На різних стадіях нормального циклу індивідуального розвитку
бактерії мають властивість змінюватись. Цикл розвитку залежить
від природи організмів, складності їх форм і послідовності в роз-
витку.
Найпростіший цикл розвитку характерний для кокоподібннх
бактерій. Він зводиться в них до росту клітини та її наступного по-
ділу.
Паличкоподібні безспорові бактерії мають цикл розвитку, подіб-
ний до циклу розвитку коків: молоді клітини в міру росту збільшу-
ються, досягають максимуму й потім поділяються поперечним
способом на дві дочірні клітини, які проходять той самий цикл.
У бацил і клостридій до циклу розвитку за певних умов включається
спороутворення.
Хламідобактерії мають складніший цикл розвитку: клітини їх
перетворюються у довгі нитки, деякі з них утворюють спеціальні
органи розмноження — гонідії, які надалі проростають і дають по-
чаток новим клітинам і ниткам.
Цикл розвитку актиноміцетів має дві стадії: 1) вегетативного ро-
сту, для якої характерне утворення міцелію; 2) плодоношення з утво-
ренням спор, які формуються на спіральних або прямих вітках —
спороносцях.
Міксобактерії характеризуються порівняно складним циклом
розвитку: вегетативні клітини паличкоподібної форми змінюються
в них овальними або кулястими мікроцистами; клітини утворюють
плодові тіла з особливою будовою плодоносців.
КУЛЬТИВУВАННЯ БАКТЕРІЙ
У лабораторних умовах бактерії вирощують на живильних сере-
довищах. Велике значення для росту й розмноження бактерій мають
температурні умови. Щодо температурного режиму всі мікроорганіз-
ми поділяються на психрофільні (холодолюбні), мезофільні (середні),
термофільні (теплолюбні) (табл. 4). Бактерії можуть розмножуватись
у широкому діапазоні температур — від 0 °С до 90 °С.
Таблиця 4. Диференціація мікроорганізмів щодо температурного режиму
Мікроорганізми Температурні границі розмноження, °С Місце Існування
Психрофільні 0—20 Водоймища холодних морів та океанів, грунт полярних регіонів і зон вічної мерзлоти
Мезофільні 20—45 Організм тварин і людини
Термофільні 45-70 Верхні шари грунту, гарячі джерела, гній, торф, відходи бавовни
64
Велике значення для життєдіяльності бактерій має рН середо,
вища. Кожен вид мікроорганізмів у процесі еволюції пристосувався
до існування в певних межах рН. Вважають, що рН впливає на ак*
тивність ферментів. Залежно від рН слабкі кислоти в кислому сере-
довищі перебувають у вигляді молекул, а в лужному — у вигляді
іонів. Сапрофіти можуть жити в умовах з дуже широким діапазоном
рН — від 2 до 8,5. Патогенні види мікроорганізмів ростуть при рН
6—8 (табл. 5).
Таблиця 5. Оптимальні показники рН середовища культивування патогенних
мікроорганізмів
Мікроорганізми ,и | Мікроорганізми рН
Холерний вібріон 7,6—8,0 Сірептококи 7,2-7,6
Клостридіі правця 7,0—7,5 Менінгококи 7,2—7,5
» ботулізму 7,4—7,6 Гонококи 7,2—7,6
Коринебактерії дифтерії 7,2—7,6 Збудник чумн 6,9-7,0
Мікобактерії туберкульозу 5,8—8,0 > туляремії 6,7—7,4
Лептоспіри 7,2—7,4 Бруцели 6,8—7,2
Стафілококи 7,2—7,4 Сальмонели черевного тифу 6,8—7,2
Поживні середовища повинні бути легкозасвоюваними, з певним
складом азотистих речовин, вуглеводів, вітамінів і відповідною кон-
центрацією солей, ізотонічними, стерильними, мати буферні власти-
вості, оптимальну в’язкість і певний окислювально-відновний по-
тенціал.
Мікроорганізми, які потребують високих концентрацій солей,
називають галофільними. Вони поширені в морях, океанах, солоних
озерах. До них належать деякі патогенні для людини види (УіЬгіо
рагаїїаетоіуіісиз та ін.).
Протягом усієї історії мікробіології живильні середовища посту-
пово вдосконалювались. У допастерівський період як середовища для
вирощування мікроорганізмів застосовували тільки настої і відвари.
Л. Пастер і К. Негелі запровадили в практику культивування без-
білкові середовища.
Р. Кох і Ф. Леффлер для вирощування бактерій використовували
м’ясну воду, пептон і натрію хлорид. Це середовище являє собою
м’ясо-пептонний бульйон (МПБ), з якого готують м’ясо-пептонний
агар (МИ А), додаючи І—2 % агару.
Агар — твердий волокнистий матеріал, який добувають із деяких
водоростей. У водних розчинах він утворює густий гель (холодець).
Агар складається з 70—75 % полісахаридів, 2—3 % білків та інших
азотовмісних речовин, 2—4 % золи. Основними компонентами агару
є вчсокомолекулярні речовини — агароза н агаропептин. Агар роз-
чиняється у воді при нагріванні і захолоняє при кімнатній темпера-
турі Його випускають у вигляді безбарвних пластинок або порошку.
Завдяки властивості агару надавати поживному субстрату при охо-
лодженні консистенції густого гелю і високій стійкості до фермента-
3 1.44 5 Ь5
тивної дії мікроорганізмів його широко застосовують при виготовлен-
ні напіврідких, густих і сухих поживних середовищ.
Розроблено методику виготовлення синтетичного полімерного ма-
теріалу, що використовується для приготування густих поживних
середовищ і з успіхом замінює природний дефіцитний агар.
Поживні середовища поділяють на чотири основні групи: уні-
версальні, спеціальні, вибіркові (елективні) і диференціально-діаг-
ностичні.
Універсальні середовища (МПБ, МПА) містять поживні речо-
вини, в присутності яких ростуть багато видів патогенних і непато-
генних бактерій
Спеціальні середовища застосовують для вирощування бактерій,
які не розмножуються на універсальних середовищах. До них нале-
жать кров’яний агар, сироватковий агар, сироватковий бульйон та ін.
Вибіркові (елективні) середовища характеризуються тим, що
в них добре розвиваються тільки певні види бактерій і погано або
зовсім не ростуть інші види. Так, наприклад, лужна лептонна вода
і лужний МПБ є елективними середовищами для холерного вібріона.
Поживні середовиїца, що містять певні концентрації пеніциліну або
інших антибіотиків, елективні для стійких до цих антибіотиків шта-
мів і разом з тим селективні для ангибіотикочутлияих культур.
Диференціально-діагностичні середовища, в свою мері у, поділя-
ють на три групи: 1) середовища для виявлення протеолітичної вла-
стивості мікроорганізмів (м’ясо-пептонний желатин, або МПЖ, та
ін.); 2) середовища для визначення ферментації вуглеводів (Гісса,
Олькеницького та ін.) і для диференціації бактерій, які ферментують
і не ферментують лактозу (Ендо, Дригальського, ПлоСкирєва та ін.);
3) середовища для визначення гемолітичної здатності (кров’яний
агар).
Використовують і інші диференціально-діагностичні середовища,
про які згадується в розділі, присвяченому спеціальній мікробіоло-
гії, і в посібниках для практичних занять.
Крім того, у лабораторній практиці застосовують консервуючі
середовища, призначені для первинного висівання і транспортування
досліджуваного матеріалу; вони запобігають відмиранню патогенних
видів бактерій і сприяють пригніченню сапрофітів. До таких середо-
вищ належать гліцеринова суміш, що складається з 2 частин 0,85 %
розчину натрію хлориду, 1 частини гліцерину й 1 частини 15—20 %
розчину натрію фосфату, а також гліцериновий консервант із солями
літію, гіпертонічний розчин натрію хлориду та ін.
Багато живильних середовищ випускають у вигляді порошку.
Вони зручні в роботі, стійкі й дуже ефективні.
Для культивування бактерій широко застосовують безбілкові
середовища, в яких добре ростуть багато органотрофних, у тому числі
патогенних видів бактерій. До цих середовищ входить багато ком-
понентів.
Культивування в синтетичних середовищах з використанням ме-
тоду мічених атомів дає змогу детальніше диференціювати бактерії за
характером їх біосинтезу.
66
Рис 22 Колонії різної будови:
а — вигляд зверху б. в — вигляд на розрізі
Для диференціації прототрофних і ауксотрофних бактерій широко
використовують селективні середовища. Прототрофи ростуть на мі-
німальному середовищі, яке містить тільки солі й вуглеводи, оскіль-
ки вони самі можуть синтезувати потрібні їм для розвитку метаболі-
ти, тоді як ауксотрофи потребують середовища, що містить певні
амінокислоти, вітаміни й інші речовини.
За консистенцією розрізняють густі (МПА, МПЖ, зсіла сироват-
ка, зсілий яєчний білок), напіврідкі (МПА) і рідкі (лептонна вода,
МПБ, цукровий бульйон та ін.) живильні середовища.
На густих живильних середовищах бактерії утворюють різні за
формно й величиною колонії (рис. 22) — видимі скупчення
мікроорганізмів одного виду, що формуються в результаті розмно-
женні з однієї або кількох клітин. Колонії бувають плоскими, опук-
лими, куполоподібними, удавленими, їх поверхня — гладкою (8-фор-
ми), шорсткою (І?-форми), покресленою, горбкуватою, краї — рів-
ними. зазубленими, волокнистими, бахромчастими. Форма колоній
також різноманітна: кругла, розеткоподібна, зірчаста, деревоподіб-
на. За величиною (діаметром) колонії поділяються на великі (4—
5 мм, середні (2—4 мм), дрібні (І—2 мм) і карликові (менше
І мм).
Колонії різняться і за консистенцією, густиною, кольором. Вони
можуть бути прозорими й непрозорими, забарвленими і безбарвними,
вологими, сухими і слизистими. У рідких живильних середовищах
бактерії ростуть з утворенням дифузної каламуті, плівки, осаду,
які видно неозброєним оком.
з*
67
У лабораторних умовах бактерії вирощують у пробірках, чашках
Петрі, у флаконах.
В інститутах, які виготовляюіь вакцини й сироватки, мікроорга-
нізми культивують глибинним способом, що дає змогу раціональніше
використовувати поживний субстрат і одержувати бактеріальну масу
у великій кількості. Культури вирощують у реакторах з великим
об’ємом поживного середовища. Аерування досягають пропусканням
струменя повітря через товщу середовища. Метод аерування вико-
ристовують і для лабораторних досліджень з метою швидкого виро-
щування аеробних бактерій та вивчення деяких процесів обміну
речовин.
Для забезпечення росту бактерій в експоненціальній фазі вико-
ристовують два культиватори: хемостат і турбідостат, за допомогою
яких забезпечується постійне надходження живильного середовища
в посудину; швидкість росту бактерій прямо пропорційна швидкості
надходження середовища. Вона виражається формулою
де ДХ — приріст біомаси за проміжок часу Д/. Надходження сере-
довища точніше контролюється за допомогою фотоелектричного ме-
ханізму
В умовах лабораторії анаероби вирощують у стаціонарних анаеро-
статах збо портативних мікроанаеростатах з розрідженням повітря
до 1—8 мм збо в вакуум-ексикаторах.
Кучьтивування анаеробів можливе в умовах заміщення кисню
атмосферним азотом або іншим інертним газом. Анаеробні умови
можна ствооити і простішими способами: за допомогою1 вазелінового
масла, яке вмі цують шаром поверх живильного середовища, або ви-
сіванням матеріалу в товщу агару Застосовують спеціальні скляні
трубки, які заповнюють МПА і запаюють на кінцях. Вирощують
анаероби звичайно в середовищах Кітта — Тароцці, Вільсона —
Блеоа та ін.
Дня культивування патогенних спірохет застосову-
ють особпиві живильні середовища, що містять нативні білки (си-
роватка крові, кров), шматочки свіжих органів і тканин (нирки кро-
ля, мозкова тканина курей), синтетичні поживні середовища, які
складаються з набору певних амінокислот.
Рикетсії — облігатні внутрішньоклітинні паразити, розмно-
жуються в тканинах із зниженим метаболізмом. їх культивують у ку-
рячих ембріонах за Коксом. Матеріал, що містить рикетсії, вводять
у порожнину жовткового мішка. Заражені яйця вміщують в інку-
батор при температурі 36—37 °С на 6—7 діб.
Для одержання великої кількості рикетсій інтраназально зара-
жують білих мишей, у легенях яких вони нагромаджуються.
Методи культивування рикетсій використовують при виготовлен-
ні висипнотифозної вакцини і антигенів для серологічної діагностики
рикетсіозу.
68
, КУЛЬТИВУВАННЯ ВІРУСІВ
Розмноження (репродукція) вірусів докорінно відрізняється від
розмноження бактерій і відбувається за диз’юнктивним (лат. Ліз-
Іипсіиз — роз’єднаний) типом. При цьому складові частини вірусу
(нуклеїнова кислота, білок та ін.) синтезуються в клітині окремо
відповідно до інформації, закодованої в нуклеїновій кислоті вірусу,
з наступним самоскладанням віріона. Батьківський віріон, як такий,
у процесі репродукції вірусу зникає. За один цикл розвитку з однієї
вірусної частинки утворюється 102, а за три цикли — 106 віріонів.
Длч культивування вірусів найбільше застосовують одношарові
культури трипсинізованих клітин (обробку трипсином провадять
для зруйнування міжклітинних зв’язків і роз’єднання клітин).
Клітинні культури — це штами клітин нормальних тканин люди-
ни (А-1, РЬ, РИ, ППЧ), тварин (СМЦ — серце мавп циномольгус,
НМС—нирки морської свинки), тканин злоякісних пухлин (Неіа,
Нер-1, Нер-2, КВ, Оеігоіі-6 та ін.) їх ріст підтримується в лабора-
торіях послі ювними пасажами. Так, наприклад, культура клітин
Неіа (рис. 23), добута в 1950 р.,до сьогодні пройшла тисячі генерацій
і використовується в усіх вірусологічних лабораторіях світу.
Для підтримування життєдіяльності клітин використовують жи-
вильні середовища (199, Ігла та ін.), що містять повний набір речо-
вин, необхідних для росту клітин поза організмом (амінокислоти,
вуглеводи, вітаміни та ін.), а також мають певний сольовий склад
і рН. Культури клітин вирощують у старанно контрольованих умо-
вах з використанням стандартних живильних середовищ, чистих біо-
логічно активних речовин.
У заражених культурах тканини одні віруси проявляють свою
цитопатичну дію протягом кількох діб (віруси віспи, поліомієліту
та ін.), інші — через 1—2 тижні (аденовіруси, віруси парагрипу та
ін.) залежно від кількості віріонів та властивостей клітин. Цитопа-
тичиа дія полягає у різних змінах морфології клітин: пікнозі ядер,
утворенні симпластів (велетенські багатоядерні клітини), повній
деструкції моношару.
Наявність вірусу в культурі тканини
можна виявити за утворенням бляшок на
клітинному моношарі, покритому напіврід-
ким агаром, у складі якого є поживне
середовище і барвник нейтральний черво-
ний. У ділянках розмноження вірусу
з’являються бляшки дегенерованих клітин
у вигляді прозорих плям на червоному тлі
середовища
Крім того, віруси в заражених клітинах
спричинюють утворення внутрішньоклі-
тинних включень, реакцію гемадсорбції
(РГадс) (властивість клітин, інфікованих
вірусами, фіксувати на своїй поверхні
еритроцити) і реакцію гемаглютинації
Рис 23. Культура тканини
Неіа.
69
Рис 24 Курячий ембріон
/ — хоріоналаїїтоісна оболонка. 2 — порож
нина алантоїса, 3 — порожнина амніона:
1 — жовтковий мішок. 5 — повітряний мі-
шок, 6 — підшкаралупна оболонка
Рис. 25 Специфічні зміни хоріон-
алаитоісноі оболонки 12 денного ку-
рячого ембріона, зараженого вірусом
вакцини (коров’ячої віспи).
(РГА) (властивість певних видів вірусів спричиняти аглютинацію
еритроцитів деяких хребетних).
Для виділення вірусу при хронічних і латентних формах інфек-
цій здійснюють такі заходи: співкультивування — шматочки тка-
нини, взяті у хворого при біопсії або посмертно, трипсинізують
і клітинну завись вирощують разом з чутливими перещеплюваними
клітинами в одношаровій культурі; культивування тканин уражених
органів, з яких готують первинні клітинні культури, вірус у них
демаскується й продукується в культуральну рідину.
Культури з тканин і органів. Матеріалом від хворих заражують
тканинні експлантанти (епітелій носа або трахеї ембріонів людини).
При розмноженні вірусу припиняється рух ворсинок миготливого
епітелію Для виявлення патологічних змін роблять гістологічні до-
слідження культур з тканин і органів на зрізах.
При культивуванні вірусів на курячому ембріоні вірусовмісний
матеріал вводять у порожнину амніона й алантоїса, жовтковий мі-
шок, внутрішньовенно, у мозок, тіло ембріона, на хоріоналантоїс-
ну оболонку (рис. 24).
Специфічні зміни в курячих ембріонах розвиваються у вигляді
вогнищевого ураження, дифузного помутніння оболонок, набряку
з численними виразками, ділянками некрозу, появи крововиливів,
пустул, везикул (пухирців) та ін. (рис. 25). Репродукцію вірусу
в курячому ембріоні виявляють за допомогою реакції гемаглютина-
ції (РГА).
Культивування вірусів (особливо тих, які не репродукуються
в культурах тканин і курячих ембріонах) здійснюють також в орга-
нізмі чутливих лабораторних тварин. Вибір методу культивування
визначають індивідуально залежно од виду вірусу.
Методи ідентифікації вірусів (визначення виду й типу) описано
в розділі, присвяченому спеціальній мікробіології, а також у посіб-
никах для практичних занять.
70
ПОШИРЕННЯ МІКРООРГАНІЗМІВ У природі, екологія'
МІКРООРГАНІЗМІВ
Мікроорганізми повсюдно поширені у навколишньому середо-
вищі. Вони є в грунті, воді, повітрі, на рослинах, харчових продук-
тах, предметах, в організмі людини і тварин. На відміну від рослин
і тварин, мікроорганізми можуть використовувати в процесах мета-
болізму метан, водень, молекулярний азот, окис вуглецю і перетво-
рювати їх у сполуки, що засвоюються рослинами і тваринами. Так,
наприклад, гнильні мікроорганізми, розщеплюючи загиблі рослини
і трупи тварин, повертають в атмосферу 90 % вуглекислого газу, який
поглинається рослинами.
У кругообігу азоту (рис. 26) беруть участь азотфіксуючі бактерії
родів РІіігоЬіит, АгоіоЬасіег, деякі актиноміцети, синьо-зелені водо-
рості та ін. У грунті відбуваються процеси амоніфікації (гниття біл-
ків з утворенням аміаку) і нітрифікації (окислення солей амонію
в азотнокислі сполуки, що забезпечує рослини легко засвоюваними
сполуками азоту); під впливом денітрифікуючих бактерій (Рзеисіо-
шопаз Пиогезсепз, Рзеисіопіопаз зіиігегі, Рзеисіопіопаз аеги^іпоза
та ін.) здійснюється денітрифікація — розкладання азотно- й азо-
тистокислих солей з виділенням вільного азоту, в результаті чого збе-
рігається рівновага між вмістом молекулярного азоту в атмосфері
і зв’язаним азотом грунту, рослин і тварин.
Процеси розпаду безазотистих речовин називаються бродінням.
Розрізняють бродіння спиртове (ЗассЬагошусез сегеуізіае, ЗассЬаго-
тусез еііірзоісіез та ін.), маслянокисле (СІозігісііит Ьиіугісит,СІозЬ
гідіит Іасііз та ін.), молочнокисле (ЬасіоЬасіІІиз Ьиі^агісиз, 8ігер-
іососсиз Іасііз та ін.) і бродіння пептинових речовин (Р1а\гоЬасіегіит
ресііпоуогит та ін.). Названі реакції беруть участь у кругообігу вуг-
лецю (рис. 27).
Кругообіг сірки, фосфору і заліза здійснюється сіркобактеріями,
залізобактеріями та іншими видами мікроорганізмів.
Ферментативна активність мікроорганізмів забезпечує звільнення
поверхні Землі від загиблих рослин і тварин, а також від екскре-
ментів тварин і людини; вони мінера-
лізуються з утворенням вуглекислого
газу, аміаку, води, азотистої, азотної,
сірчаної і фосфорної кислот, що вико-
ристовуються в природі для синтезу
складних органічних сполук.
Як показник загального рівня бакте-
ріального обсіменіння грунту, води, по-
вітря, харчових продуктів, оточуючих
предметів використовують мікробне
число (загальна кількість мікроорга-
нізмів в 1 мл досліджуваної рідини, і г
твердої речовини, 1 м3 повітря, на 1 м2
поверхні площі досліджуваного об’єкта
Рис. 26. Схема кругообігу азоту.
71
Рис. 27. Схема кругообігу вуглецю
або субстрату), яке визначають методом прямого підрахунку під
мікроскопом або за допомогою мембранних фільтрів (див. посібники
для практичних занять).
Загальний рівень бактеріального забруднення і кількість сані-
тарно-показових мікроорганізмів (бактерії групи кишкових паличок,
ентерококи, стафілококи, стрептококи, термофіли) є непрямими
показниками ймовірності потрапляння у навколишнє середовище
патогенних видів.
Мікрофлору навколишнього середовища вивчає санітарна мікро-
біологія, завданнями якої є: розробка методів мікробіологічних і ві-
русологічних досліджень грунту, води, повітря, предметів побуту,
харчових продуктів та ін.; вивчення джерел забруднення навколиш-
нього середовища мікрофлорою, що становить небезпеку для людини;
дослідження життєдіяльності мікроорганізмів у навколишньому сере-
довищі, особливо в умовах його хімічного і біологічного забруднення;
визначення нормативів для гігієнічної оцінки об’єктів навколишньо-
го середовища, в тому числі харчових продуктів (за мікробіологіч-
ними показниками); обгрунтування заходів для оздоровлення об’-
єктів навколишнього середовища і контроль за ефективністю їх
виконання (якість водопостачання, робота підприємств харчової
промисловості і громадського харчування, знезаражування стічних
вод, покидьків та ін.).
Результатом науково-технічного прогресу, інтенсивність якого
за останні ЗО—40'років різко зросла, є значне забруднення біосфери
промисловими відходами, пестицидами, вихлопними газами сучасних
72
транспортних засобів та іншими токсичними речовинами, що при-
зводить до зниження опірності організму людей до інфекційних і со-
матичних захворювань. Надмірні концентрації оксиду еірки і сполук
азоту (азотна кислота, аміак, суміші окислів азоту) зумовлюють ви-
никнення кислотних дощів і кислотного туману, шкідливих для здо-
ров’я людини; неухильно підвищується вміст в атмосфері діоксиду
вуглецю, особливо в промислових регіонах. У зв’язку з цим велику
увагу приділяють охороні навколишньої біосфери від хімічного та
біологічного забруднення і систематичному здійсненню санітарного
контролю за об’єктами навколишнього середовища (грунт, вода, по-
вітря).
Актуальними для'вивчення є соціальні наслідки науково-технічнс-
го прогресу, його вплив на соціальне середовище, в якому живе
людина.
Складні взаємозв’язки мікроорганізмів із середовищем, які зу-
мовлюють їх розмноження, розвиток і виживання, вивчає спеціальна
біологічна наука екологія. Розрізняють екологію популяцій і еколо-
гію угруповань. Вивчення екології мікроорганізмів є основою для
розуміння явищ паразитизму, механізму виникнення зоонозних за-
хворювань, особливо тих, що характеризуються природною вогнище-
вістю, а також для розробки практичних заходів у боротьбі з різ-
ними інфекційними захворюваннями.
МІКРОФЛОРА ГРУНТУ
Учення про грунт створили С. М. Виноградський, В. В. Доку-
чаєв, П. А. Костичев, В. Р. Вільямс та інші вчені. Родючість грунту
залежить не тільки від наявності неорганічних та органічних речо-
вин, а й від різних видів мікроорганізмів, що зумовлюють якісний
склад грунту. У грунті є необхідні для розвитку бактерій поживні ре-
човини і волога, внаслідок чого їх кількість в 1 г грунту досягає
величезних кількостей: від 200 млн у глинястому грунті до 5 млрд
у чорноземному. В 1 г орного шару грунту міститься 1—10 млрд
бактерій.
Мікрофлора родючого грунту складається з популяцій водоростей,
актиноміцетів, нітрифікуючих, денітрифікуючих, целюлозорозкла-
даючих бактерій, сіркобактерій, пігментних мікроорганізмів, грибів
і найпростіших. Особливо велике значення мають азотфіксуючі бак-
терії, які можуть жити не тільки в коренях бобових, а й на тютю-
нових рослинах. У збагаченні грунту азотом важливу роль відігра-
ють синьо-зелені водорості. Ступінь обсіменіння грунту мікроорганіз-
мами залежить від його характеру та хімічного складу (табл. 6).
Найбільше (1 000 000 в 1 мм3) бактерій у верхньому шарі грунту—
на глибині 5—15 см. У глибоких шарах (1,5—6 м) трапляються
одиничні особини; їх виявлено і в артезіанській воді. У родовищах наф-
ти живуть нафтові бактерії. Живлячись парафінами (відходи нафти),
вони перетворюють частину нафти в густу асфальтоподібну масу, вна-
слідок утворення якої закупорюються природні резервуари нафти.
В орному шарі окультуреного грунту товщиною 15 см на площі 1 га
може бути 5—6 т бактеріальної маси.
73
Таблиця 6. Загальна кількість мікроорганізмів і спор у різних грунтах,
визначена методом прямого підрахунку
Вид грунту Кількість мікроорганізмів Кількість спор в І г
Підзол глинястий 801 10’ 0,004 10*
Л існнй 1219-10’ 0 012 10е
Чорнозем 4771- 10’ 0,1-1,8-10’
Піщаний 2854 10’ 0,2—0.4- 10е
Світлозем 2661-10’ 0,7. 10’
Сипкі піски 904 10’ 0,6-1,2 10’
Сірозем 896-10’ 1,0-1,5-10’
Обсіменіння грунту мікроорганізмами залежить від ступеня за-
бруднення його фекаліями і сечею, а також від характеру обробітку
та удобрення. Наприклад, в орному шарі грунту в 2,5 раза більше
мікроорганізмів, ніж у лісовому. У грунті довго зберігаються спори
сапрофітів (В. сегеиз, В. тпе£аіегіитп та ін.).
Патогенні, що не утворюють спор, бактерії внаслідок нестачі
потрібних поживних речовин, а також в результаті згубної дії світ-
ла, висихання, бактерій-антагоністів і фагів зберігаються у грунті
від кількох діб до кількох місяців
У здійсненні профілактичних заходів санітарна мікробіологія
враховує віастивість багатьох видів грунтових бактерій (В. зиЬііІіз.
В. Ьгєуіз, В. ІЬегторЬіІиз та ін.) пригнічувати ріст і розмноження
патогенних і умовно-патогенних мікроорганізмів.
Звичайно грунт є несприятливим середовищем для більшості
патогенних видів бактерій, вірусів, грибів, найпростіших. Проте
як фактор передачі низки збудників інфекційних захворювань він
відіграє важливу роль. Тривалість збереження деяких патогенних бак-
терій показана в табл. 7. У грунті довго залишаються життєздатними
спори бацил сибірки, клостридії правця, анаеробної інфекції, боту-
лізму і багатьох грунтових мікроорганізмів. Так, наприклад, ба-
цили сибірки, потрапляючи в грунт, перетворюються в спори, які
зберігаються в ньому протягом багатьох років. У каштанових і чор-
Таблиця 7. Тривалість збереження
в грунті патогенних бактерій
Бактерії Середній строк. ДНІ
Сальмонели черевного тифу 14—21
Шпгелн 10—35
Холерний вібріон класичний 7—14
Ель-Тор 28
Мікобактерії туберкульозу 90
Бруцели 3—21
Збудник чуми 3
» туляремії 10
ноземних грунтах за сприятли-
вих умов спори здійснюють пов-
ний цикл розвитку: влітку вони
проростають у вегетативні фор-
ми, а потім знову утворюють
спори.
У грунті живуть різні гризу-
ни, на яких паразитують пере-
нощики збудників чуми, туля-
ремії, москітної, геморагічної
гарячки, енцефаліту, зоонозного
шкірного лейшманіозу і т. д.
У грунті проходять певну
74
стадію цисти найпростіших (амеб, балантидіїв та ін.). Особли-
во велика роль грунту в розповсюдженні гельмінтозів (аскаридозу,
трихоцефальозу, анкілостомідозу та ін.). У грунті живуть гриби,
які спричиняють аліментарно-токсичну алейкію, ерготизм, аспергі-
льоз, пеніциліоз, гістоплазмоз, хромомікоз та ін.
Виживання в грунті ентеровірусів коливається в широких межах
(15—90 діб), воно залежить од виду грунту, його вологості, темпера-
тури. Ентеровіруси довго зберігаються на овочах, вирощених на ді-
лянках, зрошуваних стічними водами. Доведено, що сирі овочі з по-
лів зрошування можуть бути фактором зараження в результаті по-
трапляння ентеровірусів на їх поверхню. Ентеровіруси були виділені
в 5,8 % випадків із грунтів і в 8 % — з овочів. їх виявляли в полив-
них стічних водах, осаді стічних вод, грунті полів зрошування і зми-
вах з овочів, вирощених на зрошуваних ділянках.
У зв’язку з цим треба робити систематичні санітарно-вірусологіч-
ні дослідження грунту, поливних стічних вод і продукції землероб-
ських полів зрошування на наявність у них ентеровірусів.
Важливим показником санітарного стану грунту є загальна кіль-
кість наявних у ньому сапрофітів, термофільних мікроорганізмів,
ентеробактерій (Е. сої і, протей), анаеробів (С. рег1гіп£еп8 та ін ).
Грунт вважають чистим, якщо його колі-титр* становить 1,0 і вище,
титр С. регїгіп£епз — 0,01 і вище, а кількість термофільних бактерій
в 1 г досягає 100—1000. За епідеміологічними показаннями грунт
досліджують на наявність патогенних мікроорганізмів (сальмонели,
шигелн, ентеровіруси), спор клостридій правця, ботулізму, сибірки,
гістоплазм та ін.
Для мікробіологічного дослідження грунту, заселеного найрізно-
манітнішою мікрофлорою, використовують селективні методи, за
допомогою яких можна виявляти численні види бактерій, що потре-
бують певного поживного субстрату.
У зв’язку з певною епідеміологічною роллю грунту як фактора
розповсюдження деяких інфекційних захворювань тварин і людини
санітарно-протиепідемічна практика охоплює здійснення комплексу
заходів, спрямованих на захист грунту від забруднення та інфіку-
вання його патогенними видами мікроорганізмів.
МІКРОФЛОРА ВОДИ
До аеробних мікроорганізмів, що живуть у воді, належать Рзеидо-
шопаз Пиогезселз, Місгососсиз гозеиз та ін. Анаеробні бактерії у воді
трапляються дуже рідко.
У мулистих відкладеннях океанів, морів, боліт, гарячих міне-
ральних джерел, нафтових свердловин та інших місцях, позбавлених
кисню, існують найстародавніші живі істоти нашої планети — мета-
нотворні бактерії, які для своєї життєдіяльності використовують
водень і вуглекислий газ.
* Колі-титр — найменший об'єм у мілілітрах (або маса в грамах) дослі-
джуваного матеріалу, в якому виявляють Е. соїі.
75
Хемолітотрофи було виявлено в чорних гейзерах, де ТИСК води
досягає 2533,1 кПа (259 атм). їх легко вирощувати в штучних умо-
вах при температурі 480 °С і тискові 26 851,1 кПа (265 атм).
Мікрофлора води річок залежить від ступеня їх біологічного за-
бруднення та якості очистки стічних вод, які спускають у русла
річок.
Мікроорганізми дуже поширені також у водах морів і океанів,
де їх виявляли на різних глибинах (3700—10 000 м). До них належать
галобактерії (рід НаїоЬасіегіит) і галококи (рід Наїососсиз), які
адаптувались до існування в умовах високих концентрацій солей.
Галобактерії і галококи — хеморганотрофи, аероби, плеоморфні мік-
роорганізми, утворюють пігменти різного кольору, індол, сірководень,
оксидазу, каталазу, розріджують желатину.
Із морської води прибережної зони систематично висіваються
галофільні вібріони — V. рагаїїаетоіуіісиз, V. ап§і1оІуіісиз, які
спричинють у людей гострий гастроентерит, що виникає в результаті
вживання у їжу малосольної риби, а також недостатньо термічно
оброблених креветок і мідій.
Ступінь обсіменіння води організмами прийнято виражати с а-
п р о б н і с т ю, під якою розуміють сукупність живих істот, які
живуть у водах з великим скупченням тварин або рослинних решток.
Розрізняють чотири зони сапробності.
Полісапробна зона — дуже забруднена вода, бідна на
кисень і багата на органічні сполуки. Кількість бактерій в 1 мл до-
сягає 1 мти і більше, переважають Е. соіі та анаеробні бактерії, які
спричинюоть процеси гниття і бродіння.
У мезосапробній зоні (зона помірного' забруднення)
мінералізуються органічні речовини з інтенсивним окисленням і ви-
раженою нітрифікацією. Кількість бактерій в 1 мл становить сотні
тисяч.
Олігосапробна зона характерна для чистої води.
Кількість бактерій у ній незначна, в 1 мл налічується кілька десят-
ків або сотень:; Е. соіі у цій зоні немає.
Катаробна зона — зона дуже чистої води (особливо
в осінньо-зимовий період), вона розташована вдалині від населених
пунктів і берегів.
Залежно від інтенсивності забруднення водойм у них можуть бути
і певний час зберігатись життєздатними патогенні бактерії. Так,
наприклад, у водопровідній, морській, річковій і колодязній воді
сальмонели можуть бути від 2 діб до 3 місяців, шигели — 5—9 діб,
лептоспіри — 7—150 діб. Холерний вібріон Ель-Тор виживає у воді
річок, морів протягом кількох місяців, збудник туляремії — від
кількох діб до 3 місяців.
Водопровідну воду вважають придатною для споживання, якщо
загальна кількість бактерій в 1 мл дорівнює 100, сумнівною — при
100—159, забрудненою — при 500 і більше. У воді колодязів і від-
критих водойм кількість бактерій в 1 мл не повинна перевищувати
1000. Крім того, якість води визначають за наявністю в ній Е. соіі.
Показник біологічного забруднення води оцінюють за колі-ін-
76
дексом і колі-тнтром. Водопровідна вода повинна мати колі-індекс
у межах 2—3, а колі-титр — 300. Для води шахтних колодязів до-
пустимі колі-індекс не більше 10, а колі-титр не менше 100.
Оскільки 8. їаесаііз постійно живе у кишках людини й теплокров-
них тварин і має високу стійкість проти температурних коливань та
інших факторів навколишнього середовища, кількість його поряд
з колі-титром і колі-індексом є показником ступеня біологічного за-
бруднення води, стічних вод, грунту й інших об’єктів.
Вода — могутній фактор передачі збудників багатьох інфекцій-
них захворювань: черевного тифу, сальмонельозного гастроентериту,
холери, дизентерії, лептоспірозу, туляремії, кампілобактеріозу,
амебіазу, ентеровірусних інфекцій (поліомієліт, гепатит А та ін.).
Дуже забруднюються річки і моря стічними водами, в яких
багато органічних речовин, що призводить не тільки до тривалого ви-
живання, а й до значного нагромадження ентеробактерій і вібріонів.
Ентеровіруси найчастіше виділяються з води влітку і восени, коли
частість вірссоносійства збільшується в 2—3 рази порівняно з осін-
ньо-зимовим періодом. Масивне і тривале виділення ентеровірусів із
кишок хворих і вірусоносіїв зумовлює значне обсіменіння господар-
сько-побутових стічних вод (ЗО—85 %). Ентеровіруси виявляли у во-
доймах, особливо при колі-титрі 0,1 і нижче. їх знаходили і в питній
во ті, яка пройшла відповідну очистку і знезараження. Тривалість
виживання ентеровірусів у воді коливається в широких межах —
від 11 до 870 діб. Вона залежить від багатьох факторів: температури
води, ступеня її забрудненості бактеріальною мікрофлорою, концен-
трації внесеного вірусу та ін. Ентеровіруси довго зберігаються і
в морській воді (від 10 до 74 діб).
Вододжерела інфікуються в результаті потрапляння в них не-
очищених стічних вод інфекційних і ветеринарних лікарень, каналі-
заційних вод; відкриті вододжерела забруднюються в результаті
викидів річкових суден, потрапляння зливових вод, екскрементів
тварин і людей, трупів загиблих тварин.
Під час купання в невеликих ставках і басейнах з нехлорованою
водою можливе зараження людей лептоспірозом, кон’юнктивітом,
що спричинюється хламідіями, стафілодермією, епідермією.
Методи взяття проб, визначення мікробного числа, виявлення
бактерій кишкової групи та ентеровірусів описані в посібниках для
практичних занять і спеціальних методичних інструкціях.
У зв’язку із значною санітарно-епідеміологічною роллю води ви-
никла потреба в розробці прискорених методів виявлення (індикації)
у воді Е. соїі, патогенних бактерій та ентеровірусів.
Знезараження води, інфікованої патогенними бактеріями і токси-
нами, робиться хімічними методами з наступним кип’ятінням.
МІКРОФЛОРА ПОВІТРЯ І ПРЕДМЕТІВ УЖИТКУ
Мікрофлора повітря дуже різноманітна. Склад її залежить від
ступеня забрудненості повітря мінеральними й органічними зави-
сями, температури, осадів, характеру місцевості, вологості та інших
77
факторів. Чим вища концентрація у повітрі пилу, газів, кіптяви, тим
більше в ньому бактерій. Кожна частинка пилу або диму може ад-
сорбувати їх на своїй поверхні.
Над поверхнею гір, арктичних морів, океанів мікроорганізми
трапляються рідко.
Мікрофлора повітря складається із найрізноманітніших видів
мікроорганізмів, які надходять у нього з грунту, рослин і живих
організмів У повітрі часто трапляються пігментні сапрофітні бакте-
рії (мікрококи, різні сарцини), В зиЬНІіз, В. те£аіегіиіп, В. сегеиз,
актиноміцети, плісеневі, дріжджові гриби та ін.
Кількість бактерій у повітрі коливається у великих діапазонах
від кількох особин до багатьох десятків тисяч екземплярів в 1 м3.
Так, наприклад, у повітрі Арктики міститься 2—3 особини на 20 м3;
у промислових містах в І см3 повітря виявляється величезна кількість
бактерій. У лісі, особливо хвойному, бактерій у повітрі дуже мало,
бо на них згубно діють леткі речовини рослин — фітонциди, що мають
бактерицидні властивості. Над Москвою на висоті 500 м в 1 м3 по-
вітря було виявлено 1100—2700 бактерій, тоді як на висоті 2000 м —
від 500 до 700. Спороносні види і плісеневі гриби було виявлено на
висоті 20 км. Деякі мікроорганізми виявляють і на висоті 61—77 км.
В 1 г пилу є до І млн бактерій.
Залежно від пори року якісний і кількісний склад мікрофлори
повітря змінюється. Якщо взяти загальну кількість мікроорганізмів
у повітрі взимку за 1, то весною вона становитиме 1,7, влітку — 2,
восени — 1,2.
Для повітря закритих приміщень санітарними показовими мікро-
організмами є стафілококи, зеленячі стрептококи, а про пряму епі-
деміологічну небезпеку роблять висновок за кількістю гемолітичних
стрептококів і стафілококів.
Загальна кількість бактерій в операційному відділенні до почат-
ку операції не повинна перевищувати 500 в 1 м8 повітря, а після опе-
рації — 1000; патогенних стафілококів і стрептококів не повинно ви-
являтися в 250 л повітря. У повітрі операційних пологових будинків
(відділень) до початку роботи допускається не більше 20 колоній са-
профітів, що утворилися при осіданні бактерій повітря на чашці
з МПА протягом ЗО хв.
Ультрафіолетове опромінювання згубно діє на мікроорга-
нізми, але якщо останні адсорбовані на частинках пилу або інших
речовин, то бактерицидна дія ультрафіолетового випромінювання
неефективна.
Кількість мікроорганізмів у робочих і жилих приміщеннях тісно
пов’язана з санітарно-гігієнічним режимом. При скупченні людей,
поганій вентиляції, слабкому природному освітленні, неправильному
прибиранні приміщень кількість мікроорганізмів значно збільшуєть-
ся. Сухе прибирання, рідке миття підлоги, використання брудних
ганчірок і щіток, сушіння їх у тому ж приміщенні створюють сприят-
ливі умови для нагромадження в повітрі мікроорганізмів.
Віруси можуть розповсюджуватися повітряно-пиловим і повітря-
но-краплинним шляхом. При чханні, кашлі, розмові хвора людина
78
виділяє у навколишнє середовище на відстань І—1,5 м і більше разом
з краплинками слизу, мокротиння патогенні віруси.
Мікроорганізми, що є в повітрі, можуть бути у трьох фазах бак-
теріального аерозолю — краплинній, краплинно-ядерній і пиловій.
Під аерозолем розуміють фізичну систему із дрібних твердих або рід-
ких часточок, що зависли в газовому середовищі.
Лодина вдихає за добу в середньому 12 000—14 000 л повітря,
причому 99,8 % мікроорганізмів, що є в ньому, затримуються в ди-
хальних шляхах. Бактеріальний аерозоль (до 60 000 краплин різного
розміру), що утворюється природним шляхом у просторі носової
частини глотки, при чханні і кашлі виділяється в повітря.
Найбільше бактерій виділяється при чханні, менше — при кашлі,
ще менше — при розмові. Характер бактеріального аерозолю зале-
жить від в’язкості секрету, що виділяється з дихальних шляхів. Рід-
кий секрет подрібнюється на менші краплинки легше, ніж в’язкий.
Біля бактеріовиділювача утворюється найбільш концентрований
аерозоль, що складається з бактеріальних краплин розміром від 1 до
2000 мкм. Величина основної маси краплин коливається від 2 до
100 мкм. Крупні краплини величиною від 100 до 2000 мкм виділя-
ються на відстань 2—3 м і більше і швидко осідають. Дрібні крап-
линки бактеріального аерозолю (І—10 мкм) можуть довго (протягом
кількох годин і діб) бути в завислому стані.
Повітря — несприятливе середовище для бактерій і вірусів.
Відсутність поживних речовин, вологи, оптимальної температури,
згубна дія сонячного проміння і висушування не створюють умов для
їх збереження. Однак і порівняно короткого перебуванням мікроорга-
нізмів у повітрі цілком досить для того, щоб зумовити передачу пато-
генних видів мікроорганізмів від хворих осіб здоровим. Через по-
вітря можуть передаватися разом з краплинами слизу й мокротиння
при чханні, кашлі, розмові збудники хвороб — скарлатини, дифтерії,
коклюшу, стафілококової, стрептококової і менінгококової інфекцій,
ангіни, туберкульозу, гострого сальмонельозного гастроентериту,
грипу, кору, натуральної і вітряної віспи, герпесу, епідемічного па-
ротиту, краснухи, аденовірусних та інших захворювань. Повітряно-
пиловим шляхом розповсюджуються спори сибірки, правця, гісто-
плазмозу, грибів, збудники Ку-гарячки, орнітозу та ін.
Лабораторні дослідження повітря роблять для визначення кіль-
кісного і якісного складу його мікрофлори. Розроблено прискорені
методи виявлення (індикації) мікроорганізмів у навколишньому сере-
довищі (грунті, повітрі, воді).
Проби для вірусологічного дослідження повітря беруть за допо-
могою вловлюючої рідини (цукровий бульйон або гідролізат лакто-
альбуміну), якою заражують курячі ембріони (для виділення вірусу
грипу) або клітини культури Неіа (для виявлення аденовірусів).
Ідентифікацію виділених вірусів роблять за загальноприйнятою
методикою.
Дтя знезараження повітря закритих приміщень (лікарень, дитя-
чих закладів), у яких скупчено багато людей, використовують ульт-
рафіолетове, кварцове опромінювання, бактерицидну пару й аеро-
79
золі дезинфікуючих речовин, фільтрування повітря через різні мате-
ріали, інтенсифікацію процесів обміну повітря в приміщеннях та
інші способи, які забезпечують усунення або зменшення можливості
розповсюдження збудників вірусних інфекцій аерогенним шляхом
Бактерицидну дію мають аерозолі ряду хімічних речовин: три-
етиленгліколю, молочної кислоти, гексилрезорцииу, суміші ефірних
масел, перокснду водню та ін. Однак широке використання цих за-
собів обмежується їх побічною дією на організм людини; деякі з них
мають токсичні й алергізуючі властивості. Для знезаражування по-
вітря боксів приймальних відділень в інфекційних стаціонарах, дитя-
чих лікувально-профілактичних закладів, бактеріологічних лабора-
торій і для дезинфекції повітря санітарного транспорту може бути
використаний перекис водню.
Певне значення в розповсюдженні збудників бактеріальних і ві-
русних інфекцій, особливо в дитячих колективах, мають предмети
вжитку. Для дітей характерна підвищена сприйнятливість до бага-
тьох захворювань, у них немає достатніх навичок у додержанні пра-
вил особистої гігієни, вони часто беруть у рот іграшки та різні пред-
мети, на поверхні яких можуть бути патогенні й умовно-патогенні
мікроорганізми.
Не тільки бактерії, а й віруси порівняно довго (від 1 до 80 діб)
зберігаються на поверхні багатьох предметів. Тривалість збереження
мікроорганізмів на предметах ужитку залежить від вологості повітря,
температури і дії світла.
Дослідження змивів або зіскобів з предметів ужитку (столи, іг-
рашки, посуд, столики для сповивання, обідні столи, кухонний ін-
вентар та ін.) роблять за епідеміологічними показаннями. Виявлен-
ня у них санітарно-показових та умовно-патогенних мікроорганізмів
і мінімальних кількостей ентеровірусів та респіраторних вірусів
свідчить про неблагополучний стан обстежуваного закладу.
Виділення ентеровірусів і респіраторних вірусів із різних об’-
єктів навколишнього середовища (грунт, вода, повітря, предмети)
роблять за допомогою зараження курячих ембріонів і первинних
культур тканин; добуті культури ідентифікують за допомогою РГА
РН, РЗК.
Предмети вжитку знезаражують фізичними і хімічними методами
(кип’ятіння, миття гарячою водою, ультрафіолетове опромінювання,
обробка перекисом водню, розчинами хлораміну, гексилрезорцнну).
МІКРОФЛОРА ХАРЧОВИХ ПРОДУКТІВ
Вміст у харчових продуктах білків, вуглеводів, вітамінів та ін-
ших поживних речовин сприяє не тільки збереженню, а й розмно-
женню різних мікроорганізмів. У молочнокислих і добутих за допо-
могою бродіння харчових продуктах є багато бактерій, які надають
їм смакових якостей і певної консистенції (специфічна мікрофлора).
Крім того, у продуктах можуть бути мікроорганізми або їх спори,
що потрапили з навколишнього середовища (неспецифічна мікро-
флора).
80
Розмноження деяких мікроорганізмів призводить до непридат-
ності для споживання харчових продуктів: 25 % вироблюваних у сві-
ті продуктів не доходить до споживача в результаті їх псування, зу-
мовленого життєдіяльністю мікроорганізмів.
В окремих випадках можливе обсіменіння харчових продуктів
сальмонелами, шигелами, стафілококами, клострндіямн ботулізму,
Е. соїі, В. сегеиз, С. регїгіп&еп5 та іншими бактеріями, які спричиню-
ють виникнення у людей інфекцій (черевний тиф, паратифи А і В,
дизентерія, гострий сальмонельозний гастроентерит, холера, тубер-
кульоз, кампілобактеріоз та ін.) і харчових отруєнь, які поділяють на
харчові токсикоінфекції, токсикози й отруєння мішаної етіології.
До харчових токсикоінфекцій відносять захворювання, зумовлені
споживанням їжі, інфікованої великою кількістю бактерій (10®—10е
на 1 г і більше).
Токсикози спричинюються токсинами, що продукуються різними
мікроорганізмами — клостридіями ботулізму, стафілококами та ін.
Причиною харчових отруєнь може бути вживання в їжу деяких
видів патогенних грибів (Ризагіигп, аспергіли, базидоміцетн). Доклад-
ніше ці захворювання описані у відповідних розділах спеціальної
мікробіології.
Молоко може бути інфіковане мікобактеріями туберкульозу би-
чачого типу, сальмонелами, бруцелами, СохіеІІа Ьигпеііі, патогенни-
ми стрептококами й стафілококами, ентеровірусамн, вірусом кліщо-
вого енцефаліту. У процесі транспортування, розливання та обробки
обслуговуючий персонал може інфікувати молоко і молочні продукти
сальмонелами, ентеровірусамн.
М’ясо інфікується в результаті захворювання тварин і птиці,
а також під час забою, розробки, неправильного зберігання і транс-
портування туш. Звичайно у м’ясі виявляють С. регГгіп£еп5, В. се-
геи$, ентеробактерії, стрептококи, протей та ін. Найчастіше м’ясо
і м’ясні продукти, особливо фарш, інфікуються в процесі їх обробки,
при потраплянні бактерій з поверхні м’ясорубки, рук і кухонних
предметів (обробні дошки, колоди).
Риба заражується найрізноманітнішими видами мікроорганізмів,
що потрапляють із води, луски, кишок, а також з рук осіб, які об-
робляють рибну продукцію, і з різних предметів (ножі, столи, дошки,
палуба та ін.). Найнебезпечнішими мікроорганізмами є клостридії
ботулізму, які виділяють у консервованих продуктах екзотоксин,
а також парагемолітичні вібріони. Прн порушенні санітарних режи-
мів у рибі й устрицях виявляють сальмонели черевного тнфу, шиге-
ли Флекснера, а в деяких випадках — холерні вібріони Ель-Тор,
парагемолітичні вібріони, віруси гепатиту А.
Обсіменіння овочів і фруктів шигелами, сальмонелами, холер-
ними вібріонами, ентеровірусамн та іншими бактеріями відбувається
при потраплянні їх із грунту і з рук людей, які беруть участь
у їх збиранні, упаковуванні, транспортуванні і реалізації в торго-
вельних закладах. Неправильно консервовані овочі (томати), гриби
та інші продукти іноді є причиною ботулізму.
81
У яйця досить часто проникає різна, в тому числі патогенна,
мікрофлора (сальмонели, гриби, актиноміцети), а в яєчний порошок —
стафілококи.
Хлібо-булочні вироби порівняно рідко є сприятливим середови-
щем для розмноження патогенних мікроорганізмів. Тільки вироби,
виготовлені з перезимувалого в полі зерна, спричинюють аліментар-
но-токсичну алейкію, зумовлену патогенними грибами з роду Еиза-
гіит.
З усіх агентів, які спричинюють харчові отруєння в людей,
70 % припадає на патогенні бактерії. Особливу небезпеку становлять
сальмонели, стафілококи, стрептококи, які, розмножуючись і нагро-
маджуючись у харчових продуктах, не призводять до зміни їх орга-
нолептичних властивостей.
Якість бі тьшості харчових продуктів в колишньому СРСР нормува-
лась державними стандартами (ГОСТ) або тимчасовими технічними
умовами (ТТУ).Ці нормативні документи діють до заміни їх держав-
ними стандартами України.
Мікробіологічні дослідження харчових продуктів роблять за
таких умов: 1) у плановому порядку для контролю за додержанням
санітарно-гігієнічного режиму в процесі їх приготування, зберігання
й реалізації, особливо тих продуктів, які не піддають термічній об-
робці; 2) в разі сумніву щодо якості продуктів; 3) при виникненні
харчових отруєнь або захворювань, які пов’язують із споживанням
продуктів харчування.
Основним завданням мікробіологічного дослідження харчового
продукту є визначення загальної кількості мікроорганізмів, а також
виявлення санітарно-показових видів. Для більшості харчових про-
дуктів, як і для води, санітарно-показовим мікроорганізмом є Е. соіі,
у деяких харчових продуктах визначають наявність протею, сальмо-
нел, аеробних і анаеробних мікроорганізмів, а також їх токсинів.
Взяття проб і дальше санітарно-бактеріологічне дослідження
точно регламентовані інструкціями, викладеними у відповідних
ГОСТах.
Санітарно-бактеріологічне дослідження молока і молочних про-
дуктів передбачає визначення загального бактеріального обсіменіння
(мікробне число) іколі-титру. У молочнокислих продуктах (кефір,
м’які та тверді сири та ін.) мікробне число не визначають.
У молочних продуктах повинні бути тільки специфічні для цього
продукту мікроорганізми: молочнокислі бактерії, дріжджі (кисле
молоко, ряжанка, кумис та ін.).
Допустиме мікробне число в різних молочних продуктах коли-
вається від 500 (пастеризовані і варені дитячі суміші) до 300 000 (ко-
ров’яче молоко у флягах і цистернах). Пастеризоване молоко в пляш-
ках і пакетах повинне мати мікробне число 75 000, морозиво —
250 000, згущене молоко — 50 000, молоко коров’яче сухе — 50 000
в 1 мл (табл. 8).
Колі-титр більшості молочних продуктів лежить у межах 0,1—0,3,
і тільки для дитячих сухих молочних сумішей він повинен станови-
ти не менше 1,0.
82
Таблиця 8. Мікробіологічні показники молока і молочних продуктів
Продукт Допустима кількість бактерій в і мл або в 1 г Колі-титр
Пастеризоване молоко з.о
в пляшках 75 000
в пакетах 150 000 0.3
Молоко у флягах і цистернах Пастеризовані вершкн 300 000 0,3
в пляшках 100 000 3,0
в пакетах 200 000 0,3
у флягах 300 000 0.3
Кефір 0,3
Кисле молоко О.з
Консервовані продукти
Вершки згущені з цукром
Какао із згчщеннм молоком і цукром
Кава натуральна із згущеним молоком і цукром
Згущене незбиране молоко з цукром
Сухе незбиране молоко
Сухе знежирене молоко
Вершкн сухі і вершки сухі з цукром
Сухі молочні суміші для дітей
Морозиво
Масло
солодковерш кове
кисловершкове
35 000 0,3
35 000 0,3
35 000 0,3
50 000 0,3
50 000—70 000 0,1
50 000—1о0 000 0,1
50 000—100 000 0,1
25 000 1.0
100 000 0,3
10000 0,1
Не обмежено 0,1
Оскільки молоко й молочні продукти можуть бути фактором пере-
дачі збудників низки інфекційних захворювань (сальмонельозу, бру-
цельозу, туберкульозу, Ку-гарячки та ін.), індикація їх робиться за
допомогою спеціальних методів, викладених у відповідних ГОСТах.
Виявлення патогенних мікроорганізмів у молочних продуктах неза-
перечно свідчить про їх непридатність до споживання.
Санітарно-бактеріологічне дослідження м’яса і м’ясних продук-
тів передбачає визначення загальної кількості мікроорганізмів в І г
продукту, а також наявності Е. соїі, вульгарного протею, сальмо-
нел, анаеробів.
Згідно з прийнятими тимчасовими нормами, допустиме мікробне
число для смаженого м’яса має бути меншим від 500, ковбаси вареної
і холодцю м'ясного — менше 1000. Наявність патогенних і гнильних
мікроорганізмів є показником непридатності цих продуктів до вжи-
вання.
Санітарно-бактеріологічному дослідженню піддають також кон-
сервовані харчові продукти — м’ясні, м’ясо-рослинні, рибні, овочеві,
фруктові.
Методи мікробіологічного дослідження консервованих харчових
продуктів передбачають виявлення аеробних і анаеробних мікроорга-
нізмів, а також ботуліпічного токсину. За епідеміологічними пока-
заннями консервовані харчові продукти досліджують на наявність
83
сільмонел, патогенних стафілококів, протею, присутність яких свід-
чить про недоброякісність і непридатність цих продуктів до вживання
впускається наявність у консервованих харчових продуктах
іенатогенних споротвориих мікроорганізмів при відсутності бомбажу
і нормальній органолептичній якості продукту.
Мікробіологічне дослідження виробів із риби, овочів і яєць роб-
лять, як правило, при виникненні харчового отруєння або в разі
захворювань людей. Метою його є виявлення за допомогою загально-
прийнятих методів патогенних, умовно-патогенних бактерій або їх
токсинів.
Санітарно-бактеріологічному дослідженню можуть бути піддані
рештки їжі, харчові продукти, блювотні маси, промивні води, випо-
рожнення, кров, слиз, змнвн і зіскоби, а також трупний матеріал.
Профілактика харчових токснкоінфекцій та інших захворювань,
що передаються через харчові продукти, зводиться до додержання
санітарно-гігієнічних правил їх виготовлення, зберігання, транспор-
тування і реалізації. Обов’язкове також неухильне додержання тех-
нології виготовлення харчових продуктів, особливо у консервованому
вигляді.
Небажаними сполуками в продуктах рослинного походження вва-
жають нітрати, які під впливом життєдіяльності бактерій можуть пе-
ретворюватись у нітрити й нітрозаміни, що справляють токсичну й
канцерогенну дію на організм людини.
Вживання продуктів харчування (м’яса тварин і птиці), що мі-
стять залишкову кількість кормових і особливо медичних антибіоти-
ків або їх дериватів, сприяє розвиткові у людей алергічних реакцій,
зміні біологічних властивостей низки патогенних мікроорганізмів —
збудників інфекційних захворювань, набуванню резистентності до
застосовуваних лікарських засобів.
Захист харчових продуктів від бактеріальної мікрофлори забезпе-
чується різними заходами: запобіганням потраплянню бактерій
у харчові продукти; обробкою у-випромінюванням; зберіганням
продуктів при низьких температурах (у холодильниках): висушу-
ванням (ізюм, яєчний порошок, сухе молоко, м’ясо); стерилізацією;
солінням (зануренням м’яса і рнби у розсоли або втиранням у по-
верхню продукту натрію хлориду); вміщенням продуктів у розчини
з високою концентрацією цукру; коптінням (при цьому дим, що мі-
стить леткі бактерицидні речовини, адсорбується м’ясом або рибою);
добавлянням деяких хімічних консервантів (пропіонат кальцію,
двоокис сірки та ін.) у концентраціях, безпечних для здоров’я лю-
дини; консервуванням в результаті скисання (квашена капуста, ма-
ринади та ін.). Крім того, до заходів, які запобігають токсикоін-
фекціям, належать боротьба з перенощиками збудників кишкових
інфекцій, а також санітарно-освітня робота серед населення.
МІКРОФЛОРА ОРГАНІЗМУ ЛЮДИНИ
Мікрофлора організму людини є результатом взаємного присто-
сування мікроорганізмів і макроорганізму в процесі еволюції. Біль-
ша частина бактерій постійної мікрофлори організму людини присто-
84
сувалась до життя у певних його відділах. Крім того, є мікроорга-
нізми, що становлять непостійну (випадкову) мікрофлору.
Із розвитком вірусології і вдосконаленням вірусологічної техніки
розширились уявлення про мікрофлору організму людини. Доведе-
но, що не тільки відкриті порожнини, а й тканини людського орга-
нізму заселені персистуючимн вірусами, які виділяються у навко-
лишнє середовище з молоком, слиною, мокротинням, потом, сечею,
калом.
Мікрофлора шкіри. На поверхні шкіри живуть сардини, плісеневі
І дріжджові гриби, непатогенні коринебактерії та умовно-патогенні
бактерії (стафілококи, стрептококи). Живлення їх забезпечується
виділеннями жирових і сальних залоз, відмерлими клітинами і про-
дуктами розпаду. На поверхні шкіри в однієї людини виявляли від
85 млн до 1 млрд особин мікроорганізмів.
При стиканні тіла людини з грунтом її одяг і шкіра обсіменяються
спорами різних видів мікроорганізмів (клостридії правця, анаероб-
ної інфекції та ін.). Найчастіше забруднюються відкриті частини люд-
ського тіла, головним чином руки. На їх поверхні виявляють Е. соїіі
стафілококи, стрептококи, плісеневі, дріжджові і недосконалі
гриби, спори аеробних і анаеробних бацил.
Порушення санітарно-гігієнічного режиму, нормальних умов пра-
ці і побуту людей нерідко є причиною виникнення гнійних захво-
рюзань шкіри або мікозів.
Мікрзфюра порожнини рота. У порожнині рота є сприятливі умо-
ви дія життя мікроорганізмів. Слина — важливий поживний суб-
страт. У ній є амінокислоти, білки, ліпіди, вуглеводи, неорганічні
речовини.
Чеоез кілька годин після народження дитннн бактерії можуть
розмножуватися в порожнині рота, і через кілька діб там виявляють
окремі види стрептококів, нейсерій, актиноміцетів, лактобактерій
та ін. Кількісний і якісний склад мікрофлори порожнини рота зале-
жать віт хаоактеру харчування та віку дитини.
У порожнині рота постійно живе 8. заііуагіиз, якому властивий
тропізм до поверхні органів порожнини рота, особливо багато його
на поверхні язика.
Більшість видів мікроорганізмів порожнини рота — аероби й фа-
культативні анаероби. Під час прорізування зубів з’являються облї-
гатні грамнегативні анаероби. У збереженні мікроорганізмів у по-
рожнині рота важливу роль відіграють глікопротеїди слини, які
зумовлюоть нагромадження певних бактерій на поверхні зубів,
що прорізуються.
Роль мікроорганізмів у розвитку захворювань зубів розглядаєть-
ся у відповідному розділі спеціальної мікробіології (див с. 425).
Мікрофлора шлунка і кишок. При нормальній функції шлунка
мікрофлори в ньому немає або вона нечисленна (ІО3—10е в І г). Шлун-
ковий сік є захисним бар’єром, який запобігає проникненню у кишки
патогенних і умовно-патогенних видів мікроорганізмів. Проте сту-
пінь кислотності шлункового соку не завжди сталий, він залежить
від характеру їжі та кількості споживаної людиною води. Із рота
85
в шлунок разом з їжею надходять молочнокислі бактерії, 8агсіпа
уелігісиїиз, ВасіІІиз зиЬНІіз, дріжджі та ін.; у деяких випадках мож-
ливе проникнення в шлунок, а потім і в кишки збудниківдизентерії,
черевного тифу, паратифів, холерних вібріонів та інших патогенних
видів.
У мікрофлорі дванадцятипалої кишки (ІО3—104 в 1 г) порівняно
рідко виявляють 8. (аесаііз, гриби та інші види. Порівняно мало
(ІО3—106 в І г) є бактерій і в тонкій кишці. У товстій кишці дуже ба-
гато мікроорганізмів (10й в І г). Близько 1/3 сухої маси фекалій де-
яких видів тварин складається з мікробної маси. За добу доросла
людина виділяє разом з екскрементами близько 17 трильйонів мікро-
організмів.
З віком мікрофлора кишок людини зазнає істотних змін. Травний
канал новонароджених у перші години життя стерильний. Протягом
першої доби його заселяє випадкова мікрофлора з навколишнього
середовища, головним чином при годівлі грудним молоком. Надалі
в кишечнику новонароджених установлюється специфічна мікрофло-
ра, що складається з молочнокислих бактерій (біфідобактерія, Ьас-
іоЬасіІІиз асісІорЬіІиз). їй властивий антагонізм до багатьох пато-
генних і умовно-патогенних видів, які можуть спричиняти порушення
функції кишок у грудних дітей. Однак уже на 3—5-ту добу життя
в кишках грудних дітей можна виявити Е. соїі й ентерококи, кіль-
кість яких різко зростає при переході на мішане вигодовування.
У складі мікрофлори кишок дорослих людей виявлено понад
250 видів мікроорганізмів. Основну масу (96—99 %) становлять
анаеробні бактерії (біфідобактерії, бактероїди). Факультативно ана-
еробна мікрофлора представлена Е. соїі, лактобацилами й ентеро-
коками; на них припадає близько І—4 % усієї кишкової мікрофлори.
Менш як 0,01—0,001 % становить так звана залишкова мікрофлора
(ЗіарЬуІососсиз, Сіозігісііит, Ргоіеиз, дріжджі).
Доведено, що в кишках постійно живе СІозігідіиш регїгіпеепз,
яка виробляє травні ферменти; Е. соїі та інші види бактерій проду-
кують необхідні для людського організму вітаміни (тіамін, рибофла-
він, ціанокобаламін та ін.). Бактерії-антагоністи (ацидофільна, бол-
гарська бактерії, актиноміцети та ін.) перешкоджають розвиткові
патогенних видів, які можуть проникнути в кишки з інфікованою
їжею, повітрям і водою.
У кишках людини поряд з не патогенними виявлено патогенні се-
ровари Е. соїі, які мають властивість спричиняти у дітей молодшого
віку тяжкі гнійно-септичні захворювання, а в дорослих — дизенте-
рієподібні колі-інфекції, гнійно-запальні ураження.
Анаеробні, що не утворюють спор, грамнегативні види мікроорга-
нізмів — бактероїди виявлено при гострому апендициті, післяполого-
вій інфекції, абсцесах легень, септнцеміях різної етіології, інфекцій-
них ускладненнях після операцій у черевній порожнині, запальних
процесах у шлунку, кишках, дихальних шляхах і на шкірі.
І. І. Мечннков розглядав деякі види бактерій кишок як шкідливі,
що спричинюють хронічні отруєння. Як метод боротьби з шкід-
ливою мікрофлорою він запропонував введення в кишки молочно-
86
кислих патичок (болгарська бактерія), що мають антагоністичні
властивості.
У кишках живе багато ентеровірусів, які тривалий час залиша-
ються у здорових лодей у латентному стані. За несприятливих умов
вони в асоціації з деякими видами бактерій зумовлюють виникнення
найрізноманітніших щодо клінічного перебігу захворювань.
Мікрофлора дихальних шляхів. Разом з повітрям людина вдихає
велічезну кількість частинок пилу й адсорбованих на них мікроорга-
нізмів. Дослідним штихом доведено, що кількість мікроорганізмів
у повітрі, яке ми вдихаємо, у 200—500 раз більша, ніж у тому, яке
видихаємо. Більшість їх затримується у порожнині носа і лише не-
велика частина проникає в бронхи. Кінцеві розгалуження бронхів
і альвеоли легень звичайно стерильні. У верхніх дихальних шляхах
(носова частина глотки, зів) є кілька відносно постійних видів бак-
терій (стафілококи, стрептококи, непатогенні коринебактерії, пепто-
коки та ін.).
Поч ослабленні захисних сил організму в результаті охолоджен-
ня, взснажзаня, нестачі вітамінів бактерії, які постійно перебува-
ють у дихальних шляхах, стають здатними спричиняти гострі респі-
раторні захворюзання, ангіну, пневмонію, бронхіт та ін. Слизова
оболонка носа продукує муцин і лізоцим, які мають захисну дію.
У порожнині носа є й секреторні антитіла (див. с. 155). Однак, не-
зважаючи на це, мікрофлора порожнини носа відносно стала — ге-
молітичний. або носовий, мікрокок, непатогенні коринебактерії,
стафілококи, стрептококи, сапоофітні грамнегативні диплококи,
капсульні грамнегативні бактерії, НаеторЬіІиз іпПиепгае, протей
та ін Коім бактеріальної мікрофлори, у дихальних шляхах протягом
тривалого часу можуть зберігатися, не спричиняючи патологічних
процесів, багато вірусів, зокрема аденовіруси.
Мікрофлора піхви. У перші дві доби після народження піхва
дівчаток стерильна. Іноді в ній є невелика кількість грампозитивних
бактерій і коків. З 2—5 діб життя закріплюється кокова мікрофлора,
яка зберігається до періоду статевого дозрівання, потім її заміняють
молочнокислі бактерії (ЬасіоЬасі!Іи$ асісіоріїіІиз, ЬасіоЬасіІІиз сазеі,
ЬасіоЬасіІІиз Гегтепіит та ін.).
Під час менструального циклу вміст піхви стає лужним, що сприяє
розвиткові кокової мікрофлори. У період статевого життя мікрофло-
ра піхви змінюється, з’являється багато мікроорганізмів, внесених
іззовні. Значних змін зазнає характер мікрофлори піхви при гіне-
кологічних захворюваннях і після абортів.
Вміст піхви здорової жінки має відносно високу концентрацію
глюкози і глікогену, низький вміст амілази і білків та рН 4,7, при
якому всі види бактерій, крім молочнокислих, не можуть розви-
ватися.
Кисле середовище піхви залежить від функції яєчників, достат-
ньої кількості глікогену, який під впливом молочнокислих бактерій
піхви перетворюється в моно- і дісахариди, а потім у молочну кис-
лоту.
87
Залежно од вмісту лейкоцитів і бактерій розрізняють чотири сту-
пені чистоти піхвового вмісту; І і II ступені чистоти бувають у здо-
рових жінок і характеризуються кислою реакцією (рН 4,1—5,5),
наявністю молочнокислих бактерій і невеликої кількості лейкоцитів
та грампозитивних диплококів; III і IV ступені чистоти бувають
у жінок з запальним процесом у піхві, прн цьому спостерігається
збільшення кількості лейкоцитів і різноманітної мікрофлори, змен-
шення або цілковита відсутність молочнокислих бактерій, слабкокис-
ла або слабколужна реакція вмісту.
Бактерії піхви мають антагоністичні властивості, що відіграє за-
хисну роль, однак ці властивості можуть порушуватись при шкідли-
вій дії лікарських засобів (антибіотики, сульфаніламідні препарати,
етакридину лактат, осарсол, калію перманганат та ін.), де яких
молочнокислі бактерії більш чутливі, ніж інша мікрофлора.
Мікрофлора сечових шляхів. У чоловіків у передній частині сечо-
випускного каналу знаходяться стафілококи, непатогенні коринебак-
терії, грамнегативні непатогенні бактерії. На зовнішніх статевих ор-
ганах, а також у сечі у чоловіків і жінок трапляються МусоЬасіегіит
5те£таіі$, мікоплазми.
Сечовипускний канал жінок звичайно стерильний; інколи у ньому
може бути невелика кількість непатогенних коків.
Мікрофлора кон’юнктиви складається із стафілококів, СогупеЬас-
іегіит ХЄГО5І5, мікоплазм та ін. При ослабленні імунітету, порушенні
зору, гіповітамінозах мікроорганізми, що звичайно живуть на кон’юн-
ктиві, можуть стати відносно патогенними й спричиняти різні захво-
рювання (кон’юнктивіт, блефарит та інші процеси).
Кількісний і якісний склад мікрофлори кон’юнктиви залежить
від ступеня бактерицидності слізної рідини, в якій є фермент лізо-
цим і секреторний імуноглобулін А.
Значення нормальної мікрофлори. Мікрофлора організму людини
непостійна, видовий склад її варіює залежно од віку, харчування та
стану макроорганізму. Глибоких змін зазнає мікрофлора організму
людини при різних захворюваннях.
Порушення видового складу нормальної мікрофлори під впливом
інфекційних і соматичних захворювань, а також у результаті три-
валого й нераціонального використання антибіотиків призводить до
стану дисбактеріозу, який характеризується зміною співвід-
ношення різних видів бактерій, різким зниженням кількості біфідо-
бактеріїї, збільшенням кількості стафілококів, у тому числі гемолі-
тичних, Сапсіісіа, гемолітичних Е. соїі, зниженням засвоюваності
продуктів травлення, пригніченням ферментативних процесів, роз-
щепленням фізіологічних секретів. При зміні звичайного місця життя
мікроорганізмів можуть розвиватись різні ускладнення: диспепсія,
токснкоінфекція, гнійно-запальні процеси, гострі респіраторні захво-
рювання, пневмонія, кандндоз та ін.
Про існування гнотобіотів — тварин (птахів), організм яких віль-
ний від мікрофлори або є носієм тільки певних видів мікроорганіз-
мів, було відомо ще в минулому столітті. Гнотобіоти поділяються на
кілька груп: монобіоти (цілком вільні від мікрофлори), дибіоти (зара-
дь
жені одним видом мікроорганізмів) і полібіоти (що мають у своєму
організмі кілька видів мікроорганізмів).
Тепер розвивається нова галузь біології — гнотобіологія, яка
вивчає життя макроорганізмів, вільних від мікрофлори. У спеціаль-
них камерах вигодовуванням стерильною їжею вирощено гнотобіотних
курчат, пацюків, морських свинок та інших тварин.
Гнотобіоги привернули увагу вчених у зв’язку з потребою глиб-
іюго вивчення ролі нормальної мікрофлори в механізмах інфекційної
літології та імунітету. У гнотобіотів порівняно із звичайними тва-
ринами збільшена сліпа кишка, недорозвинена лімфоїдна тканина,
у них менша маса внутрішніх органів, об’єм крові, менше води у тка-
нинах й антитіл у сироватці крові.
Гнотобіологія дає змогу точніше з’ясувати роль нормальної
мікрофлори в процесах синтезу вітамінів, амінокислот, прояві при-
родженого й набутого імунітету, пригнічення інших видів мікроорга-
нізмів, внесених іззовні, в тому числі патогенних та умовно-патоген-
них, визначити характер взаємодії бактерій і вірусів. Великого зна-
чення налається гнотобіології при вивченні умов життя людний і
тварин у космосі.
ВПЛИВ НАВКОЛИШНЬОГО СЕРЕДОВИЩА
НА МІКРООРГАНІЗМИ
ДІЯ ФІЗИЧНИХ ФАКТОРІВ
Температура. Низькі температури бактерії витримують порівняно
легко. Культури мікроорганізмів у замороженому вигляді зберіга-
ються в лабораторних умовах більш як 80 років. Виділено життє-
здатний мікроорганізм із товщі льодовиків, вік яких 12 000 років.
Холерний вібріон не гине при температурі —32 °С; деякі види
бактерій зберігають життєздатність при температурі рідкого повітря
(—190 °С), рідкого водню (—253 °С). Коринебактерії дифтерії перено-
сять заморожування протягом 3 місяців. Сальмонели черевного тифу
довго живуть у кризі. Спори бацил витримують температуру —250 °С
протягом 3 діб. Багато вірусів стійкі до низьких температур. Так,
наприклад, вірус японського енцефаліту в 10% зависі мозку не зни-
жує своєї патогенності при —70° С протягом року, збудники грипу
при —70 °С — протягом 6 місяців, вірус Коксакі при —40°С — більш
як 1,5 року.
Низькі температури припиняють процеси гниття і бродіння. На
цьому принципі грунтується використання в практиці льодовень,
льохів і холодильних установок для зберігання харчових продуктів.
Окремі патогенні види мікроорганізмів (менінгокок, гонокок та
ін.) дуже чутливі до низьких температур. При нетривалій дії охоло-
дження термолабільні мікроорганізми досить швидко гинуть. Цю
обставину враховують у лабораторній діагностиці: матеріали, що до-
сліджуються на менінгіт або гонорею, доставляють у лабораорію
захищеними від охолодження.
При низьких температурах сп< вільнюються процеси обміну речо-
вин, бактерії відмирають внаслідок старіння і голодування, клітини
їх руйнуються під впливом підвищення токсичності іонів.
Згубно діють на бактерії високі температури. Більшість аспоро-
генних бактерій гине при температурі 58—60 °С через ЗО—60 хв,
при 100 °С — протягом 2—3 хв.
Силікатні бактерії зберігаються життєздатними після діяння на
них нагрівання до 160 °С.
Спори бацил і клостридій більш стійкі, ніж вегетативні форми.
Вони витримують кип’ятіння від кількох хвилин до 3 год, але ги-
нуть від діяння сухого жару при температурі 160—170 °С протягом
60—90 хв; нагрівання при 120 °С під тиском пари 2026,5 кПа (2 атм)
вбиває їх за 20—ЗО хв.
Індивідуальні і видові коливання стійкості бактерій до високих
температур мають досить широкий діапазон.
В основі бактерицидної дії високих температур лежать ушкоджен-
ня рибосом, руйнування третинної структури білків і цитоплазма-
тичних мембран, порушення осмотичного бар’єру. Високі температу-
ри досить швидко зумовлюють руйнування багатьох вірусів.
Віруси гепатиту А, поліомієліту та інші довго зберігаються у во-
ді, у випорожненнях хворих або носіїв, стійкі до нагрівання
при температурі 60 °С і діяння малих концентрацій хлору
у воді.
Висушування. Стійкість мікроорганізмів до висушування різна.
Чутливі цо висушування гонококи, менінгококи, трепонеми, лепто-
спірп, гемофільні бактерії, фаги. Холерний вібріон не гине під
впливом висушування 2 доби, шигели — 7, чумна паличка — 8,
дифтерійна — ЗО, черевнотифозна — 70, стафілококи і мікобактерії
туберкульозу —90 діб. Висохле мокротиння хворих на туберкульоз
залишається заразним 10 місяців, спори бацил сибірки зберігаються
до 10 років, плісеневих грибів — 20 років.
Висушування супроводиться обезводненням цитоплазми і денату-
рацією білків бактерій.
Одним із методів консервування харчових продуктів є сублі-
мація— обезводнення при низькій температурі і високому ваку-
умі, яке супроводиться випаровуванням води, швидким охолоджен-
ням і заморожуванням. Крига, що утворилася в продукті, легко суб-
лімується, минаючи рідку фазу. Тривалість збереження харчових
продуктів понад 2 роки. Сублімаційне сушіння забезпечує збережен-
ня всіх цукрів, вітамінів, ферментів та інших компонентів.
Висушування у вакуумі при низькій температурі не вбиває
бактерії і віруси. Цей метод збереження культур використовують
у виробництві стабільних і з тривалим строком зберігання живих
вакцин проти туберкульозу, чуми, туляремії та інших захво-
рювань.
Промениста енергія. Різні види випромінювання мають бактери-
цидну або стерилізуючу дію. До них належать ультрафіолетове, рент-
генівське, альфа-, бета-, гамма- і нейтронне. Найбільш виражену
бактерицидну дію має пряме сонячне проміння.
90
Ультрафіолетове опромінювання спричиняє утворення перекисів,
що діють на мікроорганізми як окислювачі, пошкоджує молекули
ДНК в результаті появи піримідинових димерів.
Досвід використання короткохвильового випромінювання для
дезинфекції палат, знезаражування інфікованого матеріалу, консер-
вхвання харчових продуктів, приготування вакцин, обробки примі-
щень операційних, пологових палат і т. д. показав, що воно має дуже
в ісоку бактерицидну дію. Під впливом ультрафіолетового випромі-
нювання з довжиною хвилі 260—300 мкм відбувається швидка інак-
т івація вірусів. При цьому ультрафіолетове випромінювання погли-
нається нуклеїновою кислотою вірусів.
Віруси порівняно з бактеріями менш стійкі проти дії рентгенів-
ського та альфа-випромінювання; бета-випромінювання має більш
виражену віруліцидність. У невеликих дозах альфа-, бета-, гамма-
випромінювання сприяє життєдіяльності вірусів, а в великих —
має згубну дію. Віруси, патогенні для тварин, інактивуються від дії
внпоомінювання 11 352—72 240 мКл/кг (44 000—280 000 Р). Високу
стійкість проти іонізуючого випромінювання мають тіонові бактерії,
які живуть у покладах уранових руд. Деякі види бактерій виявляли
у воді атомних реакторів при дозі іонізуючого випромінювання
20 000—30 000 грей (Дж/кг).
Іонізуюче випромінювання може бути використане у практиці
стерилізації харчових продуктів. Цей метод холодної стерилізації
має низку переваг: він не змінює якості продукту на відміну від тепло-
вої стерилізації, при якій настає денатурація його складових частин
(білки, полісахариди, вітаміни). Променеву стерилізацію можна за-
стосовувати для обробки біологічних препаратів (вакцин, сироваток,
фагів та ін.).
Становить інтерес феномен фотореактивації, який поля-
гає в тому, що бактерії, попередньо опромінені видимим світлом,
стають більш стійкими проти дії ультрафіолетового проміння. Як-
що ж після обробки ультрафіолетовим промінням завись Е. соїі
опромінити видимим світлом, настає значний ріст бактерій при висі-
ванні на живильні середовища (механізм цього феномена розглядаєть-
ся на с. 103).
Високий тиск, ультразвук, механічний струс. Дію високого атмо-
сферного тиску — 10 132,5 — 91 192,5 кПа (100—900 атм) на глиби-
ні морів і океанів 1000—10 000 м бактерії переносять легко. Дріжджі
зберігають свою життєздатність при тискові 50 662,5 кПа (500 атм).
Деякі бактерії, дріжджі, плісені витримують тиск 303 975 кПа
(3000 атм), фітопатогенні віруси — 506 625 кПа (5000 атм).
Ультразвук має бактерицидні властивості, що використовують
для стерилізації харчових продуктів, виготовлення вакцин і дезнн
фекції предметів Механізм бактерицидної дії ультразвуку полягає
в тому, іцо в цитоплазмі бактерій, які містяться у водному середови-
щі, хтворюється кавітаційна порожнина, що заповнюється парою
рідини; у бульбашці виникає тиск до 1 013 250 кПа (10 000 атм), що
призводить до руйнування цитоплазматичних структур бактеріальної
91
клітини. Можливо, що в каиігаціиішх порожнинах, які при цьому
утворюються, виникають в і^окореактивпі гідроксильні радикали.
Певне значення у знезаражуванні повітря надається аероіоні-
з а ц і ї. Негативно заряджені іони згубно діють на бактерії.
Ефективна й електрогідравлічна бактерицидна дія на мікроорга-
нізми, що виникає під впливом фничних і хімічних явищ в резуль-
таті високого тиску, кавітаційних процесів, ударних хвиль та іоніза-
ції, ультрафіолетового й ультразвукового випромінювання, імпульс-
ного магнітного поля. Це може бути використано для знешкодження
стічних вод, дегельмінтизації' гною, стерилізації молока, різних со-
ків, харчових продуктів, а також у виробництві інактивованих вак-
цин, антигенів, для обробки кормових і пивних дріжджів.
ДІЯ ХІМІЧНИХ РЕЧОВИН
Залежно від фізико-хімічного складу середовища, концентрації,
тривалості контакту, температури хімічні речовини по-різному впли-
вають на мікроорганізми. У малих дозах вони діють як подразники,
а в бактерицидних концентраціях паралізують життєдіяльність бак-
терій.
За дією на бактерії бактерицидні хімічні речовини поділяють на
поверхнево-активні, феноли та їх похідні, барвники, солі важких
металів, окислювачі і групу формальдегіду.
Поверхнево-активиі речовини, або детергенти, можуть нагрома-
джуватись на поверхні розділяння фаз і спричиняти різке зниження
поверхневого натягу, що призводить до порушення нормального функ-
ціонування клітинної стінки і цитоплазматичної мембрани. До бак-
терицидних речовин з поверхнево-активною дією належать жирні
кислоти, в тому числі і мила, які спричинюють ушкодження тільки
клітинної стінки і не проникають у клітину. Широко використову-
ються синтетичні детергенти, які краще розчиняються у воді.
Фенол, крезол та їх похідні спершу ушкоджують клітинну стінку,
а потім і білки клітини. Деякі речовини цієї групи пригнічують функ-
цію коферменту (дифосфопіридиннуклеотиду), який бере участь
у дегідруванні глюкози і молочної кислоти.
Барвники мають властивість затримувати ріст бактерій. В основі
їх дії лежить виражена спорідненість із фосфорнокислими групами
нуклеопротеїдів. До барвників з бактерицидними властивостями нале-
жать брильянтовий зелений, риванол, трипафлавін, акрифлавін та ін.
Солі важких металів (свинець, мідь, цинк, срібло, ртуть) спри-
чинюють коагуляцію білків клітини. При взаємодії солі важкого
металу з білком утворюються альбумінат металу і вільна кислота
(К-СООН 4- А§МО8— СООАй 4- НМО8).
Деякі метали (срібло, золото, мідь, цинк, олово, свинець та ін.)
мають ол і год и на м і чн у д і ю (бактерицидна властивість). Так, на-
приклад, посуд із срібла, посріблені предмети, посріблений пісок при
контакті з водою надають їй бактерицидних властивостей щодо бага-
тьох видів бактерій. Механізм олігодинамічної дії полягає в тому,
що позитивно заряджені іони металів адсорбуються негативно заря-
92
дженою поверхнею бактерій і змінюють проникність їх цитоплазма-
тичної мембрани. Можливо, що при цьому порушується живлення
і розмноження бактерій. Віруси також дуже чутливі до солей важких
металів, під впливом яких вони необоротно інактивуються.
Окислювачі діють на сульфгідрильні групи активних білків; силь-
ніші окислювачі шкідливо впливають і на інші групи (фенольні, тіо-
етилові, індольні й амінні). До окислювачів належать хлор, який діє
на дегідразу, гідролазу, амілазу, протеазу бактерій, внаслідок чого
його широко використовують для знезаражування води, а також хлор-
не вапно і хлорамін, що застосовуються для дезинфекції. Як антибак-
теріальний засіб у медицині з успіхом застосовують йод у вигляді
спиртового розчину, який не тільки окислює активні групи білків
цитоплазми бактерій, а й спричинює їх денатурацію.
У зв’язку з можливою побічною дією йоду рекомендується застосо-
вувати в хірургічній практиці хлоргексидин, який має високу анти-
бактеріальну активність щодо як грампозитивних, так і грамнегатив-
них мікроорганізмів. Його використовують для обробки рук персо-
налу, шкіри, операційного поля хворих, яких оперують, для дезин-
фекції інструментів, катетерів, апаратів інгаляційного наркозу.
Хлоргексидин застосовують для лікування гнійних ран, промивання
операційних ран і порожнин.
Окислювальні властивості, крім названих речовин, мають калію
перманганат, перекис водню та ін.
Багато видів вірусів стійкі проти дії ефіру, хлороформу, етило-
вого і метилового спирту, ефірних масел. Майже всі віруси довго
зберігаються в розчинах гліцерину Рінгера, Тіроде. Віруси руйну-
ються під впливом №ОН, КОН, а також хлораміну, хлорного
вапна, хлору, інших окислювачів.
Формальдегід застосовують у вигляді 37—40 % розчину, що ді-
став назву формаліну. Його бактерицидна дія, як вважають, пояс-
нюється тим, що він приєднується до аміногруп білків і спричинює
їх денатурацію. Формальдегід убиває як вегетативні форми, так і спо-
ри мікроорганізмів. Його застосовують для знешкоджування дифте-
рійного, правцевого та інших екзотоксинів, в результаті чого вони
перетворюються в анатоксини (див. с. 184). Крім формальдегіду, ал-
кілюючу дію має етиленоксид (газ), який застосовують для дезинфек-
ції різних поверхонь.
ВПЛИВ БІОЛОГІЧНИХ ФАКТОРІВ
У природних умовах мікроорганізми є складовою частиною біоце-
нозу (сукупності рослин і тварин, які населяють ділянку середовища
існування з більш чи менш однорідними умовами життя).
Бактерії перебувають у природі в асоціаціях, між якими точиться
невпинна боротьба за існування. Одні види, що пристосувались до
відповідного середовища, мають більш виражені антагоністичні вла-
стивості щодо інших видів, які потрапляють у нове середовище існу-
вання. Так, наприклад, молочнокислі бактерії мають антагоністичні
властивості щодо збудників дизентерії, чумн та ін. Синьогнійна бак-
93
терія пригнічує ріст шигел, сальмонел, бацил сибірки, холерного
вібріона, збудників чуми, сапу, стафілококів, менінгококів та ін.
Особливо сильні антагоністичні властивості мають мікроорганізми,
які постійно живуть у людському організмі: Е. соїі, 8. (аесаііз,
молочнокислі бактерії', актиноміцети, мікроорганізми шкіри, носової
частини глотки та ін.
Тепер доведена можливість антагоністичних взаємин між пато-
іенними штамами одного й того самого виду мікроорганізмів. Такі
властивості мають деякі штами Е. соїі, стрептококи пневмонії, саль-
монели, шигели, стафілококи та ін., які продукують бактеріо-
цини.
У певних умовах існування мікроорганізмів антагонізм виникає
в результаті нестачі поживних речовин, і тоді одні види змушені жи-
витися за рахунок інших. Так, наприклад, паразитичні бактерії
ВсіеІІоуіЬгіо Ьасіегіоуогиз мають властивість проникати у деякі грам-
негативні і грампозитивні бактерії, розмножуватися в них і руйнува-
ти їх. Бактерії-ендосимбіонти, які живуть на найпростіших, комахах,
грибах, безхребетних і членистоногих, дуже поширені в природі
(грунт, морська вода, випорожнення); вони відіграють важливу роль
в елімінації з навколишнього середовища патогенних і умовно-пато-
генних видів (сальмонели, Е. соїі та ін.).
Антагоністичні взаємини виявлено й серед вірусів, коли один ві-
рус захищає організм від проникнення в нього іншого вірусу. У віру-
сології це явище дістало назву інтерференції вірусів.
Між різними групами мікроорганізмів є кілька типів взаємовід-
ношень: симбіоз, метабіоз, сателізм, синергізм, антагонізм.
Симбіоз — це співжиття мікроорганізмів різних видів; разом вони
розвиваються краще, ніж кожен із них зокрема. Іноді пристосованість
організмів один до одного так поглиблюється, що вони втрачають
здатність існувати нарізно (співжиття грибів і синьо-зелених водо-
ростей, азотфіксуючих і целюлозоруйнівних бактерій, бульбочкових
бактерій і бобових рослин, різних грибів і коренів рослин, дріждже-
подібних грибів і лямблій). Найтиповіший симбіоз (симбіогенез) ви-
явлено у лишайників.
Однією з форм симбіозу є вірогенія — співіснування деяких бак-
терій, дріжджів і найпростіших з вірусами.
Метабіоз — такий тип взаємовідношень, коли продукти життє-
діяльності одного виду є джерелом живлення іншого виду (напри-
клад, нітрифікуючі й амоніфікуючі бактерії).
При сателізмі один із співчленів — він називається сприяючим
мікроорганізмом — стимулює ріст другого співчлена (деякі дріжджі
і сарцини, що продукують амінокислоти, вітаміни й інші речовини,
сприяють росту більш вибагливих до поживних середовищ видів).
Синергізм характеризується посиленням фізіологічних функцій
у членів асоціації (дріжджі і молочнокислі бактерії, фузобактерії і
борелії).
При антагонізмі відбувається боротьба мікроорганізмів різних
видів за кисень, поживні речовини і місце існування. Бактерії, гриби,
вищі рослини виробляють речовини, що дістали назви антибіоти-
94
к і в, які згубно діють на інші мікроорганізми (див. с. 190). їх широко
застосовують у лікуванні багатьох інфекційних захворювань.
Важливу роль у знешкоджуванні зовнішнього середовища від
патогенних мікроорганізмів внаслідок антагонізму відіграють ф а г и
(віруси бактерій), дуже поширені у грунті і воді, і фітонциди —
леткі речовини багатьох рослин.
Методи знезаражування біологічних об’єктів. Фізичні, хімічні
і біологічні методи широко застосовують у боротьбі з шкідливими мік-
роорганізмами (стерилізація, пастеризація, дезинфекція), перенощи-
ками збудників інфекційних захворювань (дезинсекція) і гризунами,
які є джерелом патогенних мікроорганізмів (дератизація).
Стерилізація (повне звільнення від мікроорганізмів) найширше
використовується не тільки в мікробіологічній, а й у повсякденній
медичній практиці. Для цього застосовують прожарювання на вогні
(нікелеві або платинові петлі, голки, предметні і покривні стекла,
шпателі та ін.); кип’ятіння (шприци, інструментарій, скляний і мета-
левий посуд та ін.), при якому гинуть вегетативні форми бактерій,
віруси, але спори бацил, клостридій і грибів звичайно зберігаються;
повітряну стерилізацію (обробка сухого посуду — чашок Петрі,
пробірок, піпеток та ін., обгорнутих папером, при температурі 160—
170 °С протягом 45—60 хв).
Деякі живильні середовища, розчини вуглеводів та ін. стерилі-
зують текучою парою при температурі 100 °С роздрібнено — три
доби підряд по 30 хв; заразний матеріал, заражений посуд, поживні
серздовища, що не містять нативного білка і вуглеводів, прилади з гу-
мовими частинами та ін. стерилізують парою під тиском у паровому
стерилізаторі при температурі 120 °С протягом 15—20 хв.
У ряді випадків застосовують ультрафіолетове опромінювання
(бактерицидні лампи) для знезаражування повітря і поверхонь різ-
них приміщень (стін, підлоги, стелі бактеріологічних лабораторій),
преіметів і обладнання, води, харчових продуктів та ін.
Якщо розчини (середовища), що підлягають стерилізації, руйну-
ються від нагрівання, використовують бактеріальні фільтри різних
систем, за допомогою яких звільняють розчини від бактерій, найпро-
стіших, грибів. Для консервування живильних середовищ, вакцин,
лікувальних і діагностичних сироваток використовують хімічні ре-
човини (хлороформ, толуол, ефір, фенол, формалін, спирт та ін.).
Пастеризацію (звільнення харчових продуктів від вегетативних
форм патогенних і умовно-патогенних мікроорганізмів) широко вико-
ристовують для знешкоджування молока прогріванням його при темпе-
ратурі 65 °С протягом ЗО хв, 72—75 °С—протягом 15—30 с, 85—
90 °С — миттєво з наступним охолодженням. Надійним критерієм
ефективності пастеризації є фосфатазний тест: наявність фосфатазної
активності свідчить про неповну пастеризацію або про домішку сирого
молока. Щоб запобігти розвиткові шкідливих мікроорганізмів, які
окислюють плодові соки, вино, пиво, також застосовують пастериза-
цію, що не руйнує вітаміни і не позбавляє напої смакових якостей.
Велике значення у практичній медицині має антисептика
(комплекс лікувально-профілактичних заходів, спрямованих на
95
знищення мікроорганізмів у рані або в організмі в цілому). Ще у 1865 р.
М. 1. Пирогов підкреслював необхідність знищення джерела госпі-
тальної інфекції і застосовував для боротьби з нагниванням ран хлор-
ну воду, нітрат срібла, йод та інші антисептичні речовини. У 1867 р.
Д. Лістер як антисептичний засіб широко застосовував фенол.
Учення про антисептику відіграло позитивну роль у розвитку хі-
рургії. Практичне застосування мікробіології в хірургії привело до
зменшення кількості післяопераційних ускладнень, гангренозних
процесів і значною мірою зумовило зниження смертності в хірургіч-
них відділеннях.
У 1897 р. Е. Бергман запровадив у практику хірургії асепти-
ку — систему заходів, спрямованих на запобігання потраплянню
в рану мікроорганізмів. Для цього використовують стерилізацію
хірургічного інструментарію і шовного матеріалу, обробку рук хірур-
га перед операцією, поверхні шкіри в ділянці операційного поля,
а також дезинфекцію повітря і предметів операційної.
Методи дезинфгкції, дезинсекції, дератизації, дезодорації (усу-
нення неприємних запахів) розглядаються в розділі загальної епіде-
міології інфекційних захворювань.
ГЕНЕТИКА МІКРООРГАНІЗМІВ
ОСНОВНІ ЕТАПИ РОЗВИТКУ
Розвиткові вчення про генетику бактерій і вірусів передували
відкриття законів спадковості і мінливості організмів та методів ке-
рування ними: Г. Мендель (1865), Т. Морган (1910), М. І. Вавилов,
М. К. Кольцов, С. С. Четвериков та інші вчені (20—30-ті рр. XX ст.).
У 1944 р. О. Ейвері, К. Мак-Леод і М. Мак-Карті довели, що ре-
човиною, що відповідає за передачу спадкових детермінант у бакте-
рій, є ДНК. Це дало змогу вивчити механізми перенесення генетичного
матеріалу при трансформації, трансдукції і кон’югації.
У 1953 р. Дж. Уотсон, Ф. Крік і М. Уїлкінсон розшифрували
структуру молекули ДНК і розкрили генетичний код, завдяки якому
виявлено закономірність механізмів синтезу білків усіх живих
істот. За цю роботу автори були відзначені у 1962 р. Нобелівською
премією.
Великою подією в генетиці є відкриття, зроблене в 1970 р. Д. Бал-
тімором, С. Міцутані, Г. Тьоміним, які довели, що вірусна РНК може
бути матрицею для синтезу ДНК за допомогою особливого фермен-
ту — ревертази (зворотна транскриптаза), яка призводить до перепи-
сування інформації з РНК на ДНК. Спочатку утворюється двониткова
молекула, одна нитка якої складається з РНК, а друга — з ДНК.
Надалі на однонитковін ДНК відбувається синтез комплементарної
нитки ДНК, виникає двониткова ДНК, яка може включатися в геном
клітини.
Генетична інформація передається від РНК до ДНК не тільки
в РНК-вмісних вірусах, а й у бактеріях. Зворотна транскрипція,
очевидно, забезпечує організм додатковим генетичним матеріалом.
96
Додаткові гени, що утворилися, можуть «умонтовуватись» у геном
бактерій або залишатися в них у вигляді плазмідних елементів, які
синтезують різні білки.
МІНЛИВІСТЬ ОСНОВНИХ ОЗНАК МІКРООРГАНІЗМІВ
Мінливість морфології. При діянні фізичних, хімічних та біоло-
гічних факторів деякі бактерії набирають форми великих куль, стов-
щених ниток, колбоподібних утворів, розгалужень, що нагадують
міцелій грибів. Оцтовокислі бактерії при діянні температури 41 °С
легко утворюють дуже довгі, набухлі нитки; культивування таких
бактерій при звичайній для них температурі супроводиться появою
типових паличкоподібних форм. М. Ф. Гамалія назвав таке явище
гетероморфізмом. Суть його полягає у пристосуванні бакте-
рій до незвичайних умов існування.
Гетероморфізм легко виникає під впливом солей літію, фага,
сульфаніламідних препаратів, антибіотиків, різних видів випроміню-
вання, дії магнітних полів, а також багатьох інших факторів. Явище
гетероморфізму порівняно часто буває при старінні культури. На
рис. 28 показані колбоподібні, ниткоподібні, дріжджеподібні і коко-
подібні форми дифтерійних коринебактерій. Найкраще виражена
мінливість морфологічних форм у мікоплазм та Ь-форм бактерій.
Дуже поширене явище внутрішньовидового поліморфізму серед
рослинного світу М. І. Вавилов назвав законом гомоло-
гічних рядів у спадковій мінливості. Суть його полягає
в тому, що однакові ознаки час від часу проявляються у деяких різ-
новидів або рас, що беруть початок від одного й того самого виду,
і рідше у потомстві віддалених видів. Було доведено, що генетично
близькі види і роди характеризуються подібними і паралельними ря-
дами спадкових форм. Закон гомологічних рядів може застосовува-
тись і до мікроорганізмів: бактерій, аскоміцетів, базидіоміцетів, водо-
ростей і найпростіших.
Паралельна мінливість є одним із доказів повторності циклів
мінливості у різних родинах і родах. Мімікрія (наслідування
Рис 28 Коринебактерії дифтерії:
а — колбоиодібиі, б — ниткоподібні; в — дріжджеподібні, є — кокоиодібні.
4 1.445
97
одних видів іншим у формі та забарвленні) і конвергенція
(подібність в ознаках) розглядаються як загальне явище повторності
форм, характерне для всього органічного світу і мікроорганізмів
особливо. У деяких збудників захворювань виявлено спільні з клі-
тинами тварин і людини структури.
Мінливості зазнає і низка інших ознак мікроорганізмів — спо-
рідненість з барвниками, утворення джгутиків, війок, спор, капсул.
Слід зазначити, що будь-яка зміна морфологічних ознак супроводить-
ся зміною і фізіології мікроорганізмів, тому поділ типів мінливості
бактерій на морфологічні, культуральні, ферментативні, біологічні
і т. д. умовний. Така мінливість може бути спадковою або неспадковою
(модифікаційною).
Мінливість культуральннх властивостей. Поряд з морфологічними
відхиленнями у бактерій також часто спостерігаються зміни і культу-
ральних властивостей. При висіванні на густе живильне середовище
чистої культури утворюються колонії двох основних типів: І) гла-
денькі, або 8-форми (англ. $тооІН — гладенький); 2) шорсткі, К-фор-
ми (англ. гоидН — шорсткий). Між цими типами колоній є перехідні,
нестійкі, найчастіше О-форми. Відмінності між 8- і К-формами не обме-
жуються тільки структурою колоній, вони охоплюють і інші ознаки.
Така спадкова мінливість дістала назву дисоціації.
У деяких випадках спостерігається утворення дочірніх карлико-
вих О-, р- і Ь-колоній.
Мінливість потреби в метаболітах. Під впливом антибіотиків і хі-
мічних речовин, рентгенівського, ультрафіолетового випромінювання
та інших факторів у деяких бактерій виникає потреба в певних аміно-
кислотах — факторах росту, яких не потребували вихідні культури.
Штами, які для свого розвитку потребують спеціальних речовин,
називають ауксотрофами, на відміну од вихідних штамів —
прототрофів. Ауксотрофи відрізняються від прототрофів тим,
що в них частина метаболічних процесів блокована і вони не можуть
синтезувати потрібні їм метаболіти.
Мінливість ферментативних функцій. Добавляння в поживне се-
редовище певної речовини може спричинити активацію ферменту,
який до цього був у латентному стані. Індукцію біосинтезу ферменту
р-галактозидази у Е. соіі можна відтворити культивуванням цієї
бактерії в присутності лактози. Здатність до індукції визначається
дерепресією генів і наявністю індукуючого фактора у зовнішньому
середовищі.
Під впливом відповідного метаболіту (індуктора або репресора)
відбувається індукція або репресія синтезу певного ферменту. Ці
процеси підлягають генетичному контролю, завдяки чому клітина
включенням і виключенням синтезу ферментів регулює свою фізіоло-
гічну активність адекватно умовам навколишнього середовища.
Мінливість біологічних властивостей. Під впливом різних факто-
рів ступінь патогенності хвороботворних видів мікроорганізмів може
змінюватись. Зниження патогенності при збереженні властивості
спричиняти імунітет було помічено давно, але відтворити такі вла-
стивості вперше удалось Л. Пастеру. На цьому принципі грунтується
98
утворення змінених форм патогенних видів мікроорганізмів, названих
спочатку атенуйованими (ослабленими), а потім живими вакцинами.
У 1881 р. Л. Пастер розробив метод виготовлення живої вакцини
проти сибірки. Він дістав її діянням підвищеної температури (42—
43 °С) на культуру бацили сибірки протягом 12—24 діб, в результаті
чого бацили втрачали властивість спричиняти захворювання у тварин
при підшкірному введенні, але зберігали свої імуногенні властивості.
Як тепер доведено, при утворенні вакцинного штаму бацил під впли-
вом температури 42—43 °С настає інактивація плазміди, що детермі-
нує продукцію сибіркового токсину.
У 1883 р. вітчизняний учений Л. С. Ценковський, використовуючи
пастерівський принцип, створив живу вакцину, що складається із за-
висі спор ослаблених бацил сибірки.
У 1885 р. Л. Пастер за допомогою 133 послідовних заражень у мо-
зок кролів домігся зміни властивостей збудника сказу, в результаті
чого збудник виявився нешкідливим при підшкірному введенні і ра-
зом з тим здатним запобігати розвиткові захворювання в осіб, уку-
шених скаженими тваринами. Добутий вірус Л. Пастер назвав фіксо-
ваним (уігиз Гіхе).
У 1919 р. А. Кальметту і Ш. Герену у Франції вдалося значно
знизити патогенність мікобактерій туберкульозу бичачого типу три-
валими пасажами на картопляному середовищі з жовчю і гліцерином
при температурі 38 °С. Пересівання робилося через кожні 14 діб
протягом 13 років. Добутий при цьому ослаблений штам мікобактерій
туберкульозу бичачого типу було названо вакциною БЦЖ (ВС<3 —
Васіїїе Саїтеііе—Риегіп), яку з успіхом застосовують для щеплення
людей проти туберкульозу.
Пізніше було добуто вакцинні штами проти жовтої гарячки,
туляремії, поліомієліту, епідемічного паротиту, чуми та інших
захворювань.
У процесі зниження патогенності бактерій настає глибока (спад-
кова) зміна їх хімічного складу: у мікобактерій туберкульозу змен-
шується вміст ліпідів, у збудника чуми —білка, у збудника туляре-
мії — глюкозаміну і знижується властивість ліпідів до комплексо-
утворення.
Віруси, як і бактерії, мають властивість під дією різних факторів
(азотиста кислота, гідроксиламін, бромзаміщені основи, підвищення
температури, зниження рН середовища, ультразвук, ультрафіолетове
опромінювання, нуклеази та ін.) втрачати цілком або частково свою
патогенність і зберігати імуногенні властивості. На цьому принципі
грунтуються сучасні методи виготовлення вакцинних штамів проти
ряду вірусних захворювань: поліомієліту, кору та ін.
В результаті впливу на мікроорганізми магнітних полів змінюються
швидкість росту, процес поділу, морфологія, культуральні і біохі-
мічні властивості.
Відомі гібридні варіанти вірусу поліомієліту, що містять нуклеїно-
ву кислоту одного типу, а білкову оболонку іншого типу і навіть ін-
шого виду вірусів. Добуто рекомбінаити вірусів грипу А, що містять
гемаглютинін від одного батька, а нейраміиідазу — від іншого. Вп-
99
явлено гібридні форми вірусів, що складаються з вірусних нуклеїно-
вих кислот і клітинних білків господаря. Такі гібриди (псевдовіруси)
мають типові інфекційні властивості і можуть репродукуватись.
У зв’язку із змінами біосфери і широким застосуванням антибак-
теріальних препаратів інтенсивність еволюційних процесів мікро-
організмів помітно прискорюється. Зміна середовища спричинює зміну
метаболізму мікроорганізмів, збільшує мутабельність, збагачує
генофонд, прискорює пристосувальні реакції популяції.
ФОРМИ МІНЛИВОСТІ МІКРООРГАНІЗМІВ
Мінливість мікроорганізмів поділяють на неспадкову (модифіка-
ційну), зумовлену неоднорідністю умов розвитку особин одного гено-
типу, і спадкову, що спричинюється мутаціями і генетичними реком-
бінаціями генів.
НЕСПАДКОВА МІНЛИВІСТЬ
Мінливість, що виникає під впливом факторів навколишнього
середовища і не діє на генетичний апарат, дістала назву модифікації.
В еволюційному процесі вона відіграє підпорядковану роль.
Нестача кальцію в середовищі спричинює підвищення спороутво-
рення і слизистий ріст у бацил сибірки. Зменшення вмісту кисию
призводить до зниження ступеня пігментації у мікобактерій туберку-
льозу. Гліперин й аланін зумовлюють поліморфізм у холерних вібрі-
онів. Мікроорганізми можуть тимчасово змінювати свою фермента-
тивну властивість.
Під впливом пеніциліну, імунної сироватки, фага, хімічних речо-
вин окремі види бактерій можуть втрачати клітинну стінку і перетво-
рюватися в Ь-форми (стабільні і нестабільні). Бактеріальна клітина
набирає форми кулі, у ній з’являються вакуолі, дрібні і крупні зерна.
Після припинення дії Ь-трансформуючого фактора настає реверсія
нестабільних Ь-форм до вихідного типу і клітина набирає типової фор-
ми. Стабільні Ь-форми зберігаються у багатьох генераціях, вони вини-
кають в результаті спадкової мінливості.
Модифікації не порушують нормальної рівноваги фізіологічних
процесів, а також відповідності між організмом і середовищем. Моди-
фікації — це адаптивні реакції на зовнішні подразники, які регулярно
повторюються в нормальних умовах життя.
Особливо різко виражені у мікроорганізмів процеси пристосування
до нетривалих відхилень від звичайних умов середовища існування.
Такі відхилення можуть бути циклічними при сезонних кліматичних
змінах і суто випадковими. Вони призводять до пригнічення або акти-
вації контрольованих генами процесів, що не могли відбуватися за
попередніх умов середовища. Структура генетичного апарату при
цьому не змінюється.
100
Спадкова мінливість у бактерій настає в результаті зміни генетич-
них структур. На відміну від рослин і тварин бактерії є переважно
гаплоїдними організмами; вони маютьодин геном (сукупність генів гап-
лоїдного набору хромосом, що контролюють фенотип організму й ус-
падковуються в поколіннях) і поєднують у собі функції гамети й
особини. Віруси також належать до типових гаплоїдних систем.
Біохімічною одиницею спадковості є г е н, що являє собою ділянку
ДНК. У гені зашифрована послідовність амінокислот у поліпептид-
ному ланцюжку, він контролює окрему ознаку особини. Відрізок
геному, що здійснює тільки одну функцію, С. Бензер назвав ц и с т р о-
н о м. Тепер добуто дані, які виключають суперечності щодо визна-
чення гена як корпускулярної або функціональної одиниці. При елек-
тронно-мікроскопічному дослідженні не виявлено точної границі між
окремими генами, тому між геном і цистроном немає принципової
різниці. Багато генів у ДНК розташовані в порядку, що відповідає
біохімічним процесам. Отже, гени розглядаються як одиниці фун-
кціонування спадкового матеріалу еукаріотів, прокаріотів і ДНК-
вмісних вірусів.
У реалізації генетичної інформації посередником між ДНК і
білком є РНК. За допомогою РНК-полімерази відбувається транскрип-
ція (переписування) інформації з ДНК на РНК.
В результаті транскрипції молекула РНК зазнає процесингу (роз-
різування) і сплайсингу (зшивання). Із середини транскрипту вида-
ляються короткі (некодуючі) пептидні ланцюжки (інтрони), а довгі
ділянки (екзони) з’єднуються одна з одною і кодують певні поліпептиди.
У РНК-вмісних вірусів генетична функція здійснюється РНК без
участі ДНК. У пікорнавірусів геном представлений у вигляді ліній-
ної молекули, в ортоміксовірусів він складається з кількох сегментів
РНК. Ізольовані РНК пікорна- і тогавірусів мають інфекційні вла-
стивості, інші РНК-віруси не мають цих властивостей.
Генетичний матеріал поділяють на структурні гени, гени-регуля-
тори, гени-оператори та ін.
Рис 29 Структура оперону.
ГР — іенрегуляїор, ГО — ген-оператор, СГі, СГ» — структурні гени. Р — рспрссор активний,
Р, — рспрссор неактивний. (С) — субстрат, АК — амінокислота, Б,, Б, — білки (кінцеві про
дукти), іРНК — Інформаційна РНК, тРИК — транспортна РНК.
101
Структурний ген зумовлює синтез певного білка (білка-
ферменту, білка-гормоиу, білка-антитіла). В результаті мутації струк-
турного гена утворюється білок зміненого складу.
Ген- регулятор визначає синтез білкової молекули, що
дістала назву репресора, який пригнічує діяльність структурних ге-
нів при відсутності субстрату; коли є субстрат, репресор тимчасово
інактивується, і структурні гени, звільнені від його контролю, почи-
нають функціонувати, утворюється білок-фермент і т. д.
Для функціонування генів оперону важливий промотор —
ділянка молекули ДНК, що є нуклеотидною послідовністю, з якою
зв’язується РНК-полімераза.
Ген-оператор — це посередник між геном-регулятором
і всією групою структурних генів. Ген-оператор розташований поряд
із структурними генами. Ділянку геному, яка об’єднує ген-оператор
і структурні гени, називають опероном (рис. 29).
Спадкова мінливість у бактерій проявляється у вигляді мутацій і
рекомбінацій.
МУТАЦІЇ
Мутації — це стійкі спадкові зміни (морфологічні, культуральні,
біохімічні, біологічні та ін.) властивостей мікроорганізму, не пов’я-
зані з рекомбінаційним процесом.
Розрізняють нуклеоїдні мутації — спадкові зміни, що відбува-
ються в нуклеоїді, і цитоплазматичні — що виникають у ДНК цито-
плазми — плазмідах.
При мутаціях можуть бути випадання або добавляння однієї
основи або невеликої групи основ у молекулі ДНК,' а також зміна
послідовності нуклеотидів ДНК.
Розрізняють два типи змін пари основ: т р а н з и ц і ї, коли пу-
ринова основа в одній із ниток ДНК замінюється іншим пурином,
а пірпмідинова — іншим піримідином, і т р а н с в е р с і ї, при яких
НА Т Ц А Т Ц А Т Ц А ТЦАТЦАТЦАТЦА Т
-1—1 і । і । І І І І І і І І І І І І І І і
Ц А ТІЦА Т
Г Ц А
Т Ц А
Т Ц А
т Ц А
Т Ц А
Т Ц А
Ц А ТІ Ц А Т
Ц А ТІЦА Т
Г Ц А
ІС+)
Ц Т Ц
|(-)
Інформація відновлена
Ц А Т
Ц А Т
А Т Ц
А Т Ц
А Т Ц
Т Ц А
Ц А Т
Ц А Т
Рис ЗО Точкова мутація:
а — ген дикого типу; б — Добавлено основу, в — видалено основу; є — добавлено ос-
нову, видалено основу (А — аденін, Г — гуанін, Т —тіамін, Ц — цитозин).
102
пурин замішується піримідином або навпаки. Мінливості зазнає
низка ознак: ауксотрофність за амінокислотами, пуринами, піримі-
динами, вітамінами, чутливість або резистентність до антибіотиків,
сульфаніламідних препаратів, фага, ферментативна властивість та ін.
Бактеріальні мутації поділяють на спонтанні, що виникають під
впливом зовнішніх факторів, без втручання експериментатора, й ін-
дуковані, що настають внаслідок обробки бактеріальної популяції
мутагенними агентами (іонізуюче випромінювання, температурні,
хімічні та інші діяння).
Є великі і малі (або точкові) мутації. До великих належать мута-
ції, що характеризуються випаданням великої ділянки гена. Точкові
мутації (рис. ЗО) відбуваються всередині самого гена та являють собою
заміну, вставку, випадання однієї пари азотистих основ ДНК. Великі
мутації супроводяться розривами напівнуклеотидних ниток, що при-
зводить до дезинтеграції всіх систем бактеріальної клітини. При точ-
кових мутаціях може відбуватися спонтанна й індукована реверсія,
яка приводить до відновлення втраченої ознаки, тоді як великі мута-
ції, як правило, летальні.
Важливу роль в еволюції молекули відіграють нейтральні мута-
ції, для яких характерні переривчасті зміни, що настають за тривалий
період часу.
Практичний інтерес становлять мутації у бактерій на рівні попу-
ляцій. При відносній селекції культури, що містить
107 пеніциліночутливих клітин і 10 пеніцилінрезистентних, після
трьох пересівань • кількість пеніцилінрезистентних клітин збіль-
шується в 100 раз. При абсолютній селекції вирощуван-
ня культури в середовищі, яке містить пеніцилін, призводить до за-
гибелі всіх пеніциліночутливих клітин, і після одного пересівання
100 % особин стають пеніцилінрезистентними.
Частість спонтанних мутацій у бактерій лежить у межах 1 • 10-іа—
1 • 10-5 У деяких мікроорганізмів (Е. соіі, 8. іурЬі та ін.) є гени,
які мають стабільність до мутагенних діянь, але змінюються в при-
родних умовах, що, очевидно, є важливим фактором у процесі дивер-
генції ентеробактерій.
У мікроорганізмів часто спостерігається відновлення функціону
вання гена, інактивованого попередньою мутацією. Такі зміни, які
називаються су пресор ними мутаціями, можуть відбу-
ватися як у межах зміненого гена (внутрішньогенна), так і за його-
межами (позагенна).
Під втивом ультрафіолетового випромінювання утворюються
два хімічних зв’язки між пірнмідиновлмн основами, розташованими
поряд в одній нитці ДНК, виникають тимінові димери, які блокмоть
нормальну реплікацію ДНК, що спричинює припинення поділу бак-
терій. Фотореактиванія видимим світлом здійснюється активацією
ферменту, за допомогою якого розриваються тимінові днмерн По-
шкодження в структурі ДНК, що настають під впливом \льтрафіоле-
тового випромінювання, а також різних хімічних сполук, можуть бути
усунуті за допомогою системи репарації (вічновленпя): вона охоплює
комплекс ферментів, які виявляють пошкодження, вирізуюіь Н011ІК0-
103
джену ділянку нитки нуклеоїду і заміщують його комплементарною
непошкодженою ниткою. Репаративні процеси можуть здійснюватися
також рекомбінаційною заміною пошкодженої ділянки нуклеоїду
непошкодженою.
Процеси репарації дуже поширені серед бактерій, вони контро-
люються особливими генами і є важливим фактором в еволюції мікро-
організмів. Репаративна реплікація ДНК може бути відтворена
в результаті заміни тимінових димерів 5-бромурацилом та іншими азо-
тистими основами.
Для виявлення мутантів використовують різні методи. У тих
випадках, коли піддану дії мутагенів мікробну популяцію розрізня-
ють за культуральними ознаками, такі мутанти диференціюють за
розмірами, формою, структурою і кольором колоній. Мутації біохі-
мічних властивостей виявляють за допомогою мінімальних середо-
вищ, у яких є тільки солі й вуглеводи. При біохімічних мутаціях від-
бувається перехід від прототрофного до ауксотрофного типу живлення.
Прототрофи можуть рости на мінімальному середовищі, оскільки
вони самі можуть синтезувати необхідні для їх розвитку метаболіти —
амінокислоти, вітаміни, нуклеїнові кислоти та ін., тоді як ауксотрофи
потребують певних середовищ, що містять необхідні для них мета-
боліти.
При переході від ауксотрофного типу живлення до прототрофного
кажуть про зворотну мутацію.
Для виділення мутантних клітин у популяції використовують різні
тести і методи: метод Ньюкомба, флуктуаційний тест Луріа — Дель-
брюка, метод відбитків Ледербергів та ін.
Найбільш демонстративним є метод відбитків Ледербергів
(рис. Зі). Бактерії, піддані діянню мутагену, висівають на чашку
Петрі з повноцінним живильним середовищем. Потім готують чаш-
ку Петрі з мінімальним живильним середовищем, на яку пересі-
вають колонії, що виросли на повноцінному живильному середо-
вищі. Пересівають за допомогою печаток, покритих оксамитом,
що мають діаметр чашки Петрі. На мінімальному живильному се-
редовищі виростають тільки прототрофи. Порівнюючи колонії на
двох чашках, визначають колонії ауксотрофних мутантів на повно-
цінному живильному середовищі. Потім виділяють чисту культуру
мутантів і визначають їх потребу в одному з метаболітів.
Для виявлення зворотних біохімічних мутацій — від ауксо-
трофного до прототрофного типу живлення — застосовують селек-
Вихідна чашка
(живильний агар)
тивні середовища, на яких
ростуть клітини певного
генотипу. При висіванні
Е. сої і, які потребують
біотину, на середовище,
позбавлене його, можна ви-
явити мутанти, що віднов-
люють властивість синте-
Рис ЗІ. Використання методу відбитків для зувати біотин. Отже, СЄ-
редовище, позбавлене біо-
виділеиня фагостійких мутантів.
104
тину, непридатне для росту клітин, добутих у результаті прямої
мутації, і є селективним для виявлення зворотної мутації. Ме-
тодом селективних середовищ виявляють мутанти, резистентні до
антибактеріальних препаратів, для чого досліджувану культуру висі-
вають на середовище, яке містить якийсь антибіотик (пеніцилін, стреп-
томіцин та ін.). При цьому всі чутливі до цього препарату клітини
гинуть, а стійкі виживають і в результаті розмноження утворюють
колонії.
Найістотнішими ознаками мінливості у вірусів є вірулентність
(хвороботворність), характер і розмір бляшок, що утворюються
на культурі тканин, ушкодження на хоріоналантоїсній оболонці
курячих ембріонів, утворення температурно-чутливих (Тз) мутантів.
Частість мутацій у вірусів у природних умовах коливається в ши-
роких діапазонах — від 1 • 102 до 1 • 107.
Висока швидкість репродукції вірусів зумовлює швидку зміну
поколінь, появу нових штамів збудників, які можуть спричиняти
епідемії і пандемії. Добре вивчені мутації у вірусів грипу А. У ряді
випадків у вірусний геном включається генетичний матеріал хазя-
їна, що спричиняє зміну структури і функції віріона.
ГЕНЕТИЧНІ РЕКОМБІНАЦІЇ
До цієї групи мінливості належать рекомбінації генів, що
відбуваються внаслідок трансформації, трансдукції і кон’югації.
Генетичні рекомбінації бактерій і вірусів зумовлюють виникнення
рекомбінантів з ознаками обох батьків: основний набір генів ре-
ципієнта і певна частина генів донора.
Рекомбінаційна мінливість детермінується спеціальними фер-
ментами і гес-генами. Звичайно у більшості штамів з різною специ-
фічністю проникаюча в реципієнтну клітину ДНК донора швидко
елімінується. У бактерій, що вступили в рекомбінацію, генетичні
фрагменти від донора (екзогеноти) і реципієнта (ендогеноти) спаро-
вуються і рекомбінуються в результаті розривів і возз’єднань.
Процес завершується утворенням рекомбінативної гаплоїдної клі-
тини.
Поряд з класичною рекомбінацією у бактерій виявлено «неза-
конну», при якій не потрібно значної гомології (відповідності)
ДНК взаємодіючих генетичних систем, вона відбувається в резуль-
таті участі невеликих фрагментів ДНК транслоціюючих елементів,
які можуть переміщуватися з одного реплікону в інший.
В еволюційному процесі рекомбінації виконують підлеглу роль,
а головним джерелом елементарного еволюційного матеріалу є
мутації.
Трансформація — передача генетичного матеріалу від донора
реципієнту за допомогою ізольованої ДНК.
Бактеріальні клітини, що можуть трансформуватися, назива-
ються компетентними. Вони синтезують специфічний білок, який
зв’язує ДНК. Перша фаза трансформації — адсорбція ДНК —
здійснюється за допомогою цього білка. Потім компетентна клітина
105
вбирає адсорбовану на її поверхні ДНК. Процес вбирання ДНК
супроводиться руйнуванням еизонуклеазами однієї з її ниток до
монопуклеотидів. Друга нитка не руйнується і вбирається кліти-
ною. Одиониткова ДНК зв’язується із специфічним білком кліти-
ни, який захищає її від дальшого діяння нуклеаз.
Наступною фазою трансформації є з’єднання ДНК донора з хро-
мосомою реципієнта, в якому беруть участь водневі зв’язки і ДНК-
зв’язуючий білок. Потім настає власне рекомбінація обох ДНК,
коли фрагмент молекул донора включається в хромосому реци-
пієнта 3 утворенням ковалентних зв’язків І ВИТІСНЄННЯіМ гомологіч-
ної ділянки ДНК реципієнта.
Фенотипове вираження ознаки, добутої від донорської ДНК під
час трансформації, відбувається тільки після включення її до
хромосоми клігпни-реципієнта.
На різних видах грампозитивних і грамнегативних мікроорга-
нізмів (стрептококи, сінна паличка, НаешорЬіІиз іпііиепгае, ме-
нінгококи та ін.) доведено, що при трансформації від донора реци-
пієнтові можуть передаватися гени, які детермінують резистент-
ність до антибіотиків, фаголізабельність та інші властивості. Транс-
формуюча активність ДНК дуже висока. Її контакту з досліджу-
ваною культурою протягом 10 — 15 хв цілком досить, щоб покла-
сти початок мінливості, яка завершується через 2 год.
На рис. 32 наочно показаний механізм трансформації бактерій
під впливом гетерологічної для клітини ДНК, яка містить новий
фрагмент ДНК, у нашому прикладі — В результаті трансфор-
мації вихідний і новий нуклеоїди виявляються неоднаковими-
У фізі ауторепродукції клітина має дві нитки нуклеоїду і вона
диплоїдна. Проте часткова диплоїдність у бактерій дуже корот-
кочасна, потім відбувається процес розходження старої і нової
Рис. 32. Механізм трансформації:
/ — клітина з генотипом АБВГдЕЖЗК; 2. З — проникнення ДНК першої клітини в клітину в
генотипом АБВГДЕЖЗК.; 4. 5 —виникнення клітин з неоднаковими иуклеоїдами: 6 — дипло-
їдна клітина а двома різними иуклеоїдами; 7— утворення клітини з генотипом АБВГдЕЖЗК.
106
Оболонка фага 12 3
Рис. 33. Механізм трансдукції:
1 — клітяна з генотипом абвгдежзк. в яку проникла ДНК фага; 2 — розподіл иуклеоіду бак-
терії й утворення частинок фага; 3 — захоплення частинками фага фрагментів иуклеоіду
бактерії, лізис бактеріальної клітини; 4 — проникнення комплексу фаг-частннка иуклеоіду
вгс); 5 — ауторепродукаїя в клітині бактерії власного иуклеоіду і фрагмента з клітини /.
внесеного фагом; (—подвійне перехрещення між вуклеоідом і гомологічними фрагментами
негомологічного иуклеоіду; 7 — клітина з векросовервнмн вуклеоідом і фрагментом негомо-
логічиого иуклеоіду; 8 — клітина з кросовірннмн хромосомою і фрагментом негомологічного
иуклеоіду; 9 — клітина, вуклеоіди якої набули ген *г» під впливом генетичного матеріалу
з фрагмента негомологічного иуклеоіду, внесеного фагом.
ниток ДНК, клітини переходять у гаплоїдну фазу, причому одна
містить попередній склад ДНК нуклеоїду (АБВГДЕЖЗ), друга —
новий (АБВГДЕЖЗ).
Під впливом підвищеної температури, ультрафіолетового випро-
мінювання, ДНК-ази, хімічних мутагенів трансформуюча власти-
вість ДНК дуже знижується; при цьому зменшується і кількість
трансформантів. Обробка трансформуючої ДНК азотистою кисло-
тою призводить до швидкої втрати її трансформуючої активності.
Частість трансформації В. зиЬііІіз вдавалося підвищити дода-
ванням у середовище неорганічного фосфату. Введення альбуміну
з реципієнтною культурою 8. рпеишопіае, яка зростає, також під-
вищувало кількість трансформантів. Оптимальною для трансфор-
мації температурою в період контакту ДНК і клітини вважають
29—32 °С.
Трансдукція— це перенесення бактеріофагом генетичного ма-
теріалу від бактерії-донора до бактерії-реципієнта. Трансдукція
відбувається як у грамнегативних, так і в грампозитивних бактерій.
У феномені трансдукції беруть участь бактерія-донор, трансдуку-
ючий фаг і бактерія-реципієнт (рис. 33).
Мзханізм трансдукції полягає ось у чому. В процесі репродук-
ції деяких помірних фагів невеликі фрагменти ДНК бактерій-
донорів включаються в геном фага, який переносить їх у бактерії-
реципієнти. Різні спадкові маркери звичайно траисду куються не-
залежно один від одного. Розрізняють три типи трансдукції: не-
специфічну (генералізоваиу), специфічну (локалізовану) й абортивну.
При неспецифічній трансдукції можливе
перенесення будь-якого маркера або кількох маркерів. Частість
трансдукції цього типу лежить у межах ІО-4— 10-7 на одну час-
тинку фага. Трансдукція певного маркера може здійснюватись
незалежно від інших маркерів, якщо вони ие зв’язані з трансду-
куючим маркером. Частість трансдукції можна підвищити поперед-
нім діянням на трансдукуючі фагочастинки ультрафіолетовим про-
мінням.
Є група дефектних фагів (наприклад, фаги X), які можуть
трансдукувати тільки певні гени, розташовані поряд з місцем
ВКЛЮ4ЄННЯ геному фага у нуклеоїд бактерій. Трансдукція, що
здійснюються такими дефектними фагами, дістала назву специ-
фічної; у цьому разі передається тісно зчеплена група генів,
яка контролює певні ознаки.
Для абортивної трансдукції характерною особ-
ливістю є те, що внесений фагом фрагмент нуклеоїду не вклю-
чається в нуклеоїд реципієнта; він локалізується в цитоплазмі
і під час поділу передається тільки одній клітині, друга дочірня
клітина має генетичний апарат реципієнта. При абортивній транс-
дукції, наприклад, передається ген, який детермінує утворення
джгутиків. Абортивна трансдукція трапляється в 10 раз частіше,
ніж трансдукція, що супроводиться інтеграцією генетичного мате-
ріалу донора і реципієнта.
Трансдукція за своїм механізмом подібна до трансформації.
Різниця полягає в тому, що трансформацію можна припинити за
допомогою ферменту ДНК-ази, тоді як на трансдукцію ДНК-аза
не впливає.
Кон'югація. Передача генетичного матеріалу від однієї клітини
іншій безпосереднім контактом дістала назву кон’югації (рис. 34),
що являє собою генетичну інтеграцію — редукований статевий
процес. Доведено, що передача генетичного матеріалу від клітини-
донора клітині-реципієнту відбувається в певному напрямі і здійс-
нюється з відомою частістю. Потрібною умовою для кон’югації
має бути наявність у донора специфічного фактора плодючості —
Р-тазміди, або Р-фактора (фактор фертильності; ГегііШу — пло-
дючість).
У грамнегативних бактерій виявлено статеві ворсинки —
Р-пілі (довгі тонкі білкові трубочки), що контролюються Р-фак-
тором. Через Р-пілі при кон’югації від-
бувається перенесення генетичного мате-
ріалу.
Клітини, що відіграють роль донора,
позначають Р+, а ті, які виконують
функції реципієнта, —Р-. Схрещування
Р+ і Р" зумовлює плодючість, а Р' і
Р~ — безплідність. Вважають, що в ци-
Рис. 34. Кон’югація Е. соїі топлазмі кожної клітини Р+ є не одна,
(електронна мікроскопія). а кілька частинок цього фактора.
108
Рис 35 Схема кон’югації Нїг-бактерій із джгутиками з Р'-бактеріями без джгу-
тиків.
При переході з інтегрованого у вільний стан Р-фактор може
несгн й окремі гени нуклеоїду. Такий фактор називають Реак-
тором. Добре вивчений Реактор, який контролює утилізацію
лактози (Р1 Іас) та деякі інші ознаки.
Поряд з Р+-клітинами добуто штам Нїг (Ні£Іі Ггециепсу ої ге-
сошіипаііоп), який характеризується високою частістю рекомбіна-
ції (10-1—і о-4).
У Р+-клітинах Р-фактор міститься в ізольованому від нуклео-
їду стані і є цитоплазматичною структурою; чутливий до акриднну
оранжевого; у НГг-донорах Р-фактор інтегрований з генами нук-
леоїду, він нечутливий до акридину оранжевого. Нуклеоїд Р+-
донорів має кільцеву (неперервну) структуру, а Ніг-донорів —
лінійну.
При кон’югації переноситься не весь нуклеоїд, а тільки певні
його частини.
Гени Нїг-допора переносяться в клітину реципієнта в різний
час (рис. 35). Це доведено за допомогою штучного переривання
кон’югації і наступного виявлення рекомбінантів.
Фрагмент нуклеоїду НГг-клітини включається в геном реципієнт-
ної клітини (Р-); при цьому утворюється неповна зигота (мерознгота),
що містить весь геном реципієнта і частину геному донора. Під час
кон’югації здійснюється реплікація нуклеоїду Ніг-клітини, одна нит-
ка залишається в клітині донора, а друга переходить у нуклеоїд ре-
ципієнта. Потім кожна з цих ниток добудовується комплементарною
ниткою. Рекомбінанти виникають після кількох поділів тільки з ре-
ципієнтних (жіночих) клітин.
Кон’югація, як і інші рекомбінації, може відбуватись не тільки
між штамами одного й того самого виду, а й між клітинами різних
видів, що спричиняє утворення змінених штамів, які дістали назву
міжвидових рекомбінантів.
Рекомбінації бувають і в вірусів. Найчастіше вони виникають
у РНК-геномних вірусів (ортоміксо-, рео-, ретровіруси) й у всіх
ДНК-геномних вірусів з двонитковою ДНК.
Схожою на рекомбінацію вважають кросреактивацію,
коли один із вірусів, що бере участь у кросреактивації, використову-
ють у нативному вигляді, а другий інактивують частковим руйнуван-
ням генетичного матеріалу за допомогою ультрафіолетового опромі-
нювання або слабкого нагрівання. Таким способом добуто рекомбінан-
ти вірусу грипу і вірусу віспи.
При одночасному розмноженні у клітині кількох вірусів можуть
з’являтися віріони, що містять повний геном одного,батьківського
штаму геному іншого вірусу, тобто утворюються гетерозиго-
т и. Якщо частина чужорідного генетичного матеріалу міститься
всередині капсиду іншого неспорідненого вірусу, виникає транс-
капсидація.
РОЛЬ ЦИТОПЛАЗМАТИЧНИХ ГЕНЕТИЧНИХ СТРУКТУР
У МІНЛИВОСТІ БАКТЕРІЙ
Генетичні властивості мають як ДНК нуклеоїду, так і ДНК цито-
плазми, яка здійснює генетичну функцію незалежно від ДНК нуклео-
їду. Цитоплазматична ДНК може утворювати відповідну їй РНК.
Поза хромосоми і генетичні елементи бактерій, що відрізняються
від нуклеоїдного апарату відносною автономністю реплікації і висо-
кою трансмісивністю в процесі генетичного обміну, дістали назву
плазмід. До плазмід належать геном помірного фага і низка факто-
рів— фертильності (Р-фактор), резистентності до лікарських засобів
(К-фактор), гемолітичний (Ніу-фактор), ентеротоксигенний (ЕпЬ
фактор), уреазний (ІІге-фактор), бактеріоциногенності та ін.
Плазміди характеризуються спільними ознаками і властивостями.
Вони складаються з окремих ділянок ДНК циклічної (замкнутої)
структури, здатних до автономного поділу, мають інфекційність,
грансмісивність, спричиняють імунітет до суперінфекції гомологіч-
ною плазмідою.
ПО
Геном помірного фага поводить себе як нормальний плазмідний
компонент бактеріальної клітини і відтворюється синхронно з від-
творенням геному бактерії. Стан лізогенії зумовлює низку змін у лі-
зогенних бактерій. Утворення екзотоксинів коринебактеріями дифте-
рії, ЗіарЬуІососсиз аигеиз та ін. індукується генами помірних фагів.
Ентеротоксини Е. соіі також детермінуються генами плазмід. Багато
які гени (іга-гени) плазмід грамнегативних бактерій переносяться
в процесі кон’югації. Фаги мають спільні властивості з плазмідами,
можуть рекомбінуватися між собою, що дає підстави вважати наяв-
ність тісного еволюційного зв’язку між фагами і плазмідами.
Фактор фертильності (Г-фактор) може бути в автономному стані,
в якому й продукується незалежно від нуклеоїду бактерії, і в інтегро-
ваному, локалізованому на бактеріальному нуклеоїді, і відтворюється
разом із ним.
Фактор резистентності до лікарських засобів (К-фактор) має не
тільки внутрішньовидову, а й міжвидову трансмісивність. До К-фак-
тора входять гени резистентності до певних антибактеріальних препа-
ратів і фактор перенесення КТЕ (Кезізіапсе ігапзГег Гасіог), що вико-
нує передачу детермінанти резистентності. Цей комплекс може бути
дисоційований (розчленований) на окремі структури. Виявлено К-
фактор, який має 6—9 генів резистентності, вони можуть передавати-
ся кон’югацією.
Клінічне значення К-фактора бактерій з кожним роком зростає.
Так, гонококи стали абсолютно резистентними до пеніциліну; у Н. іпї-
Іиепхае виявлено високу резистентність до ампіциліну, тетрацикліну,
хлорамфеніколу. Приблизно у 60—90 % грамнегативних бактерій
резистентність пов’язана з трансмісивним К-фактором плазмід. У ду-
же великій кількості випадків резистентність до антибіотиків у віру-
лентних стафілококів та інших грампозитивних бактерій зумовлена
К-факторами, які не можуть переноситися внаслідок кон’югації,
але можуть передаватися за допомогою трансдукуючих фагів.
Стаціонари інфекційних і соматичних відділень є величезним ре-
зервуаром К-факторів, що передаються від однієї особини іншій вна-
слідок кон’югації (кон’югативні штами). Комбінуючись один з одним,
вони утворюють нові варіанти детермінант резистентності, що спричи-
няє нагромаїження К-факторів, які циркулюють у лікарняних умовах.
Багато штамів стафілококів, виділених у стаціонарах, мають фер-
мент пеніциліназу ф-лактамазу), яка руйнує молекули пеніциліну.
Фактор бактеріоциногенності являє собою плазміди, які детермі-
нують синтез білкових інгібіторів (речовин, що пригнічують або за-
тримують перебіг фізіологічних і фізико-хімічних процесів), які
характеризуються вузьким діапазоном інгібіторної активності щодо
бактерій різних видів: у Е. соіі — коліцини, холерних вібріонів —
вібріонний, коринебактерій дифтерії — коринецини, збудників чу-
ми — пестицини, стафілококів — стафілоцини і т. д. Передаються
вони кон’югацією при спільному культивуванні бактеріоциногенних
і небактеріоциногенних штамів. Особини, які синтезують бактеріоци-
ни, наділяють популяцію, представниками якої вони є, селективними
перевагами.
ПІ
Механізм дії бактеріоцинів на клітини остаточно не вивчений. Га-
дають, що вони адсорбують на рецепторах чутливих до них клітин,
порушують процеси синтезу, що призводить до загибелі клітин. Бак-
теріоцини спричиняють різке порушення метаболізму бактерій При
взаємодії небактеріоциногенних патогенних бактерій з бактеріоцино-
генною нормальною мікрофлорою кишок пригнічуються патогенні
штами. Отже, бактеріоциногенність нормальної мікрофлори кишок
спричиняє підвищення резистентності макроорганізму до бактеріаль-
них інфекцій кишкової групи.
У зв’язку із значним поширенням інгібіторів, що продукуються
бактеріями, доцільно використовувати деякі бактеріоцини з лікуваль-
ною метою.
Плазміди відіграють певну роль в еволюції бактерій. Природне
середовище існування кишкових бактерій у зв’язку з безконтрольним
застосуванням антибіотиків та інших антибактеріальних препаратів
невпинно змінюється, що зумовлює як протистояння цим несприятли-
вим умовам виникнення в популяціях селективного процесу з підви-
щенням частості резистентності до лікарських засобів.
Під діянням різних факторів плазміди, в свою чергу, зазнають му-
тацій, які зумовлюють інтенсивне формування атиповості багатьох
збудників інфекційних захворювань бактеріальної етіології.
Плазміди елімінуються (видаляються) під впливом ультрафіоле-
тового випромінювання, акридинових барвників, солей важких мета-
лів. Ця властивість може бути використана в боротьбі з лікарською
стійкістю, пов’язаною з наявністю К-фактора.
Певну роль у механізмах спадкової мінливості відіграють відкриті
останнім часом в ДНК прокаріотів та еукаріотів генетичні елементи —
транспозони. На відміну від плазмід вони не мають властиво-
сті до реплікації, але можуть переміщуватися від однієї ділянки ДНК
(реплікону) до іншої, в результаті чого виникають мутації генетичного
матеріалу — делеції, інверсії, дуплікації. Транспозони містять гени,
які детермінують ферменти транспозиції, і гени, що контролюють син-
тез ферментів, які інактивують або модифікують молекули антибіоти-
ків. У транспозонів виявлено гени, які зумовлюють синтез термоста-
більного ентеротоксину, і гени розщеплення лактози.
Завдяки виникненню мутацій, рекомбінацій та інтеграцій весь
час підтримується гетерогенність популяцій усіх таксономічних груп
організмів, забезпечується невпинний еволюційний процес.
Генетичний аналіз побудований на використанні методів генетич»
них рекомбінацій (трансдукції і кон’югації). Проводиться для визна-
чення локалізації генів у нуклеоїді (генетичне картування) і побудови
генетичних карт. Схрещувані штами мікроорганізмів відрізняються
один від одного низкою ознак, які позначають першими літерами від-
повідного слова. Властивість синтезувати необхідні метаболіти або
ферментувати ті чи інші вуглеводи позначають відповідними символа-
ми із знаком плюс (+), а відсутність цієї властивості — символами
із знаком мінус (—). Індексом з позначають чутливість, а індексом
г — стійкість проти антибіотиків і фагів.
112
Генетичний аналіз можна продемонструвати на прикладі схрещу-
вання двох штамів Е. соїі К-12, умовно позначених А і Б. Штам А не
може синтезувати біотин (В) і метіонін (М), штам Б не синтезує треонін
(Т), лейцин (Б) і тіамін (вітамін Ві). Виходячи з цього їх можна вира-
зити як Т+Б+В*М"В(А) і Т-Е-В;ЛГВ+ (Б). Якщо обидва штами чут-
ливі (з) до фага ТІ або обидва стійкі (г) до нього, то всі рекомбінантп,
як і батьківські штами, будуть у першому випадку ТІ5, а в другому
—ТИ.При схрещуванні Т+Б+В[М"В"ТГ і Т"Б"В1М+Т1і утворюється
75 % рекомбінантів з ознакою ТИ вихідного типу А і 25 % ре-
комбінантів з ознакою ТИ вихідного штаму Б; при схрещуванні
Т+Е+В*М"В~Т1$ і Т"Б"В1 "М+В +ТИ 64% рекомбінантів несуть
ознаку ТИ типу А, а 36 % —ознаку ТИ типу Б.
Для генетичного аналізу крім властивості до синтезу необхідних
метаболітів і ферментації низки вуглеводів використовують такі спад-
кові ознаки, як чутливість до фага, антибіотиків або токсичних речо-
вин. Використання генетичного аналізу дає змогу побудувати гене-
тичні карти Є. соїі (рис. 36) та інших мікроорганізмів.
113
ПРАКТИЧНЕ ЗНАЧЕННЯ МІНЛИВОСТІ МІКРООРГАНІЗМІВ
За допомогою генетичних методів добуто спеціальні культури
мікроорганізмів, що використовуються в технології виготовлення
харчових продуктів, виробництві анатоксинів, вакцин, антибіотиків,
вітамінів. Так, наприклад, з індукованих мутантів з наступною селек-
цією їх було виділено штами-продуценти антибіотиків, продуктивність
яких у 200—1000 раз вища від вихідних. Продуцент лізину дає в
400 раз більший вихід цієї амінокислоти, ніж дикий (природний)
штам.
Як мутагенні фактори використовують ультрафіолетове, рентге-
нівське і у-випромінювання, швидкі нейтрони, етиленічін, діетил-
сульфат та ін. В результаті багаторазового діяння мутагенів і ступін-
частого відбору добуто найпродуктивніші мутанти мікроорганізмів,
що застосовуються у виробництві антибіотиків. Метод генетичних ре-
комбінацій патогенних і непатогенних видів бактерій дає змогу мати
високоімуногенні вакцинні штамн.
Велике значення у народному господарстві мають гібереліни —
біологічно активні речовини, що стимулюють ріст і розвиток корис-
них для людини рослин. Під дією мутагенних агентів створено штамн,
які дають підвищену продукцію гібереліну порівняно з вихідними.
Блискучі перспективи для сільського господарства, біології і ме-
дицини відкриваються у зв’язку з розробкою і вдосконаленням мето-
дів г е н н о ї і клітинної і н ж е н е р і ї, за допомогою
яких доведена можливість передачі не тільки природних генів живих
істот, а й штучно синтезованих, які кодують синтез імуноглобулінів,
інтерферонів, гормону росту, інсуліну, інтерлейкінів,'антигенів віру-
сів гепатиту В, грипу, герпесу, що, імплантовані в різні клітини, де-
термінують синтез відповідних білків.
Методами мікробіологічного синтезу виробляють у великій кіль-
кості кормовий білок, антибіотики і вітаміни, ферменти, амінокисло-
ти, бактеріальні добрива, засоби захисту рослин від шкідників, лі-
кувально-профілактичні препарати (кристалічна глюкоза, ксиліт,
простагландини, інсулін, інтерфероногени, інтерферон, високоактив-
ні, тобто очищені від домішок, вакцини, імуностимулятори, гормони,
нуклеази та ін.).
За допомогою генної інженерії у вірус вісповакцини введені анти-
гени вірусів гепатиту В, герпесу, грипу. Вважають можливим виго-
товлення таким способом кількох асоційованих противірусних пре-
паратів.
У зв’язку з невпинним збільшенням частості резистентності до
різних антибактеріальних препаратів у практиці терапії при інфек-
ційних захворюваннях систематично перевіряють чутливість пато-
генних бактерій до застосовуваних лікарських засобів.
Особливої актуальності набуває селекція патогенних бактерій із
зниженою вірулентністю, що відбувається під впливом величезної
кількості лікарських засобів. Внаслідок слабкої вірулентності багато
збудників захворювань втрачають властивість виробляти імунітет,
що призводить до формування латентних (прихованих) форм інфек-
114
цій, які характеризуються хронічним перебігом, рецидивами, важко
піддаються клінічній і лабораторній діагностиці, специфічній тера-
пії і профілактиці.
Важливу роль у розвитку атипових форм інфекційних захворю-
вань відіграють Е-форми бактерій, що виникають у результаті мінли-
вості вихідних видів збудників.
Розробка прискорених методів виявлення змінених патогенних
бактерій, пошуки ефективних засобів лікування і запобігання спри-
чинюваним ними захворюванням є актуальними завданнями медичної
мікробіології.
ВЧЕННЯ ПРО ІНФЕКЦІЇ
ІНФЕКЦІЯ ТА ІНФЕКЦІЙНИЙ ПРОЦЕС
Під терміном «інфекція» (лат. іпїесііо — зараження) розуміють
сукупність біологічних процесів, що відбуваються в макроорганізмі
при проникненні в нього патогенних або умовно-патогенних агентів
незалежно від того, спричинить це розвиток явного або прихованого
патологічного процесу чи призведе тільки до тимчасового носійства
або тривалого персистування збудника.
Інфекційний процес — це взаємодія, що історично
склалася, сприйнятливого людського організму і патогенного мікро-
організму в певних умовах навколишнього і соціального середовища,
крайнім виявом якого є інфекційне захворювання.
З біологічної точки зору інфекційний процес є різновидом парази-
тизму: у боротьбу вступають два живих організми, пристосованих
до різних умов середовища існування.
Інфекційні захворювання розглядають як явища, що охоплюють
біологічний і соціальний фактори. Так, наприклад, механізми пере-
дачі інфекційних захворювань, їх тяжкість, кінець зумовлюються
головним чином соціальними умовами життя людей. Від інших захво-
рювань інфекційні відрізняються тим, що вони спричиняються живи-
ми збудниками, характеризуються контагіозиістю (заразливістю),
наявністю прихованого періоду, специфічними реакціями організму
на збудник і виробленням імунітету.
У зв’язку з розвитком генетики тепер значно розширилось понят-
тя про інфекційний агент. У багатьох видів патогенних бактерій
інфекційні властивості детерміновані високомолекулярними цито-
плазматичними структурами, що містять ДНК (плазміди), а також
нуклеїновими кислотами пухлинних (онкогенних) вірусів, які можуть
здійснювати генетичну інформацію, властиву відповідним вірусам.
Отже, поряд із захворюваннями, при яких інфекційний процес спри-
чиняється живими істотами, доведено існування інфекцій, що розви-
ваються на молекулярному рівні і характеризуються властивістю
передаватися не тільки через зовнішнє середовище, а й від батьків до
нащадків.
Походження патогенних мікроорганізмів та інфекційних захво-
рювань сягає в глиб століть. В результаті зміни генетичного матері-
115
іду утворились численні види мікроорганізмів, у тому числі йпато.
генні, здатні за певних умов спричиняти різні захворювання. Еволю-
ція пий процес відбувався між популяціями мікроорганізмів та їх
хазяїнами. Інфекційні захворювання виникли в результаті таких
основних напрямів розвитку: І) еволюції патогенних агентів предків
людини одночасно з еволюцією реакцій їх хазяїнів; 2) виникнення па-
тогенних властивостей у непатогенних для людини видів (Е соїі);
3) пристосування сапрофітів до паразитування в організмі людини
(збудники холери, дерматомікозів); 4) адаптації до організму людини
паразитів свійських і синантропних тварин (збудники багатьох саль-
монельозів, рикетсіозів, віспи); 5) набуття організмом людини чут-
ливості до паразитів диких тварин (збудники лейшманіозів, жовтої
гарячки, ендемічного поворотного тифу).
Вважають, що найдавнішими бактеріями є коки. їх виявлено у вап-
няках протеозойської ери, у кам’яному вугіллі палеозойської ери.
У процесі еволюції деякі види кокових форм набули здатності до пара-
зитичного способу життя. Поява патогенних коків належить до перм-
ського геологічного періоду. У відкладах цієї формації Землі було
виявлено глибокі зміни кісток плазунів. Можливо, що деякі з цих
змін були наслідком захворювань, спричинених патогенними видами
коків.
Більш імовірно, що з водних сапрофітних і вільноживучих вібрі-
онів утворились патогенні види. Між водними і холерними вібріона-
ми є проміжні форми.
Походження мікобактерій туберкульозу також належить до да-
лекого періоду. В процесі еволюції як туберкульоз, так і ного збуд-
ники зазнали значних змін. Про це свідчить той факт, що відомі тепер
види і різновиди мікобактерій є паразитами різних видів тварин,
які далеко стоять одні від одних: теплокровних (птахи, гризуни, ве-
лика рогата худоба, людина) і холоднокровних (риби, змії, черепахи,
жаби).
Із популяцій паразитів свійських і синантропних тварин або пара-
зитів диких тварин виникли нові таксономічні групи, які адаптува-
лись до організму людини, набули здатності спричиняти у неї різні
інфекційні захворювання.
ФОРМИ СИМБІОЗУ
За характером взаємовідношень з рослинним і тваринним світом
мікроорганізми поділяють на дві групи: сапрофіти і паразити. До
сапрофітів відносять мікроорганізми, що не мають властивості спри-
чиняти захворювання. Групу паразитів становлять види, які присто-
сувалися до життя за рахунок організмів рослин, тварин і людини.
Співжиття мікроорганізму з макроорганізмом, або симбіоз, трап-
ляється в кількох формах.
Коменсалізм — симбіоз організмів, прн якому один із них живе
за рахунок іншого, не завдаючи йому шкоди. До мікроорганізмів-
коменсалів належить переважна більшість представників нормальної
мікрофлори організму людини.
116
Мутуалізм — така форма симбіозу, при якій обидва зв’язаних
один з одним організми мають із свого співжиття взаємну вигоду.
Наприклад, симбіоз бульбочкових бактерій з бобовими рослинами
характеризується типовим мутуалізмом. Бульбочкові бактерії жи-
вуть у коренях рослин, а бобові рослини, в свою чергу, використову-
ють для живлення азотисті сполуки, що виробляються бактеріями
з атмосферного азоту.
Типовим прикладом мутуалізму можуть бути численні лишайники
(арктичний оленячий мох та ін.), що складаються з зеленої або синьо-
зеленої водорості і гриба — аскоміцету або базидіоміцету. Водорості
синтезують поживні речовини (фотосинтез), а гриби виконують захис-
ну функцію і забезпечують водорості водою та мінеральними солями.
Деякі види бактерій із групи кишкової мікрофлори перебувають
у симбіозі з організмами тварин, у яких вони існують. Ці мікроорга-
нізми-мутуалісти живляться рештками їжі, що надходять у нижні
відділи кишечника, а продуковані ними вітаміни використовуються
тваринами для біокаталітичних реакцій.
Паразитизм — симбіоз, при якому один організм (паразит) живе
за рахунок іншого (хазяїна) і завдає йому шкоди. Деякі мікроорганіз-
ми-паразити спричиняють інфекційні захворювання рослин і тварин.
Хвороботворні види мікроорганізмів називаються патоген-
ними. В процесі свого еволюційного розвитку вони пристосувались
до паразитичного типу живлення у тканинах і рідинах тваринного
організму. Сприйнятливий інфікований організм відповідає на про-
никнення патогенного мікроорганізму неспецифічними і специфіч-
ними біологічними реакціями, які виражаються в атипових або типо-
вих проявах захворювання, а також у найрізноманітніших захисних
пристосуваннях.
У свій час Я. Генле (1878), а потім Р. Кох (1882) сформулювали
три умови, за яких мікроорганізм може бути визнаний збудником
захворювання: 1) мікроорганізм-збудник має виявлятися в усіх ви-
падках при цьому захворюванні і не траплятися ні в здорових, ні
у хворих на інші захворювання; 2) мікроорганізм-збудник повинен
бути виділений з організму хворого в чистій культурі; 3) чиста куль-
туоа виділеного мікроорганізму повинна спричиняти те саме захво-
рювання у сприйнятливих тварин. Тепер ця тріада значною мірою
втрати па своє значення.
Для виникнення і розвитку інфекційного процесу потрібні три
лайки: І) наявність патогенного мікроорганізму; 2) проникнення його
у сприйнятливий макроорганізм; 3) певні умови середовища, в якому
відбувається взаємодія мікро- та макроорганізму.
Взаємовідношення збудника із сприйнятливим макроорганізмом
відбуваються у складних умовах паразитоценозу, тобто в різних спів-
відношеннях з іншими бактеріями, вірусами, грибами і найпрості-
шими. Наслідки проникнення в організм людини патогенних видів
залежать не тільки від реактивності макроорганізму, а й від нормаль-
ної мікрофлори тіла людини, яка може проявляти себе як антагоні-
стично, так і синергетично.
117
Поряд із патогенними є порівняно велика група мікроорганізмів,
що дістали назву умовно-патогенних; вони живуть на
шкірі, в кишках, дихальних шляхах, сечостатевих органах. За нор-
мальних фізіологічних умов життя умовно-патогенні бактерії не
спричиняють захворювань, але при перевтомі організму, перегрі-
ванні, охолодженні, інтоксикації, діянні іонізуючого випромінювання,
зниженні природної резистентності вони стають здатними спричиняти
низку аутоінфекцій.
ПАТОГЕННІСТЬ І ВІРУЛЕНТНІСТЬ МІКРООРГАНІЗМІВ
Патогенність — це потенціальна здатність певних видів мікро-
організмів спричиняти інфекційний процес. Патогенність харак-
теризується складним комплексом хвороботворних властивостей по-
пуляцій паразитів, що сформувалися в процесі боротьби за існування
і пристосувалися до паразитування в популяціях хазяїнів — рослин,
тварин і людини. Патогенність є видовою ознакою хвороботворних
мікроорганізмів.
Більшість патогенних мікроорганізмів характеризується специ-
фічністю дії: кожен вид звичайно може спричиняти певне інфекційне
захворювання.
Специфічність інфекційного процесу — важлива ознака, що про-
являється в локалізації збудників, вибірності ураження органів і тка-
нин, клінічній картині захворювання, механізмах виділення мікро-
організмів з організму хазяїна, формуванні імунітету. Особливості
кожного збудника враховують при розробці методів клінічної і ла-
бораторної діагностики, терапії та профілактики інфекційних захво-
рювань.
У специфічності патогенних мікроорганізмів і властивості спричи-
няти захворювання у певних видів хазяїнів важливу роль відіграють
екологічні фактори, що історично склалися, які забезпечують зако-
номірний характер передачі збудника з організму одного індивідуума
в інший.
Вірулентність — це ступінь патогенності певної культури (ва-
ріанта, штаму). Вірулентність е показником якісної, індивідуальної
(штамової) ознаки патогенного мікроорганізму. Вірулентність пато-
генних видів змінюється під впливом природних умов. Її можна під-
вищити послідовними пасажами через сприйнятливих лабораторних
тварин, а також за допомогою трансформації, трансдукції. Ослаблен-
ня вірулентності буває при діянні на мікроорганізми різних факто-
рів: захисних сил організму, антибактеріальних препаратів, високої
температури, імунних сироваток, дезинфікуючих речовин, пересі-
вання з одного живильного середовища на інше і т. д. Штучне зни-
ження вірулентності патогенних мікроорганізмів широко використо-
вують при виготовленні вакцин, що застосовуються для специфічної
профілактики низки інфекційних захворювань.
Вірулентність мікроорганізмів тісно пов’язана з генетичною фун-
кцією, при зміні якої вірулентність втрачається і не поновлюється,
а імуногенна властивість зберігається.
118
Певну роль у формуванні вірулентності патогенних та умови» •-
патогенних бактерій відіграють плазміди, що поділяються на групи.
До І групи віднесено плазміди, які кодують фактори патогенності
(плазміди адгезинів ентеробактерій, ентеротоксинів, гемолізинів,
бацили сибірки, ієрсиній та ін.). До II групи включені плазміди,
що сприяють інвазійності збудників (деякі штами шигел, ешерихій,
сальмонел). До III групи входять плазміди, які несуть певні ділянки
генетичного апарату непатогенних бактерій і формують авірулентні
варіанти; IV група плазмід має гени, що редукують патогенні ознаки
(деякі штами ієрсиній, вібріонів, шигел).
Для характеристики патогенних мікроорганізмів використовують
такі одиниці вірулентності: 01т (Оозіз Іеіаііз тіпіта) — найменша
доза збудника, яка спричиняє за певний строк загибель близько
80 % відповідних лабораторних тварин: Осі (Оозіз сегіе Іеіаііз) —
доза, яка призводить до загибелі 100 % узятих для досліду тварин;
005о (Оозіз Іеіаііз іпесііа) — доза, що вбиває половину заражених
тварин, вона найбільше задовольняє вимоги, забезпечує найменшу
помилку в оцінці вірулентності патогенних бактерій і може бути
об’єктивним критерієм.
Певна кількість патогенних бактерій, що може спричинити інфек-
ційне захворювання, дістала назву інфікуючої дози (Ю) патогенного
мікроорганізму. Так, наприклад, у дослідах на добровольцях дове-
дено, що інфікуюча доза ентеропатогенних Е. соїі 0124 становить
ІО8 особин, сальмонел черевного тифу — 105 (при дозі 107 захворює
50 %і заражених волонтерів), холерного вібріона — 10е— 1011, 8.
сіузепіегіае — 10—100 клітин бактерій.
Введена доза мікроорганізмів має неабияке значення в розвитку
інфекційного процесу, тривалості інкубаційного періоду, тяжкості
і резутьтату захворювання.
ФАКТОРИ ПАТОГЕННОСТІ
До основних факторів патогенності відносять токсиноутворення,
адгезивність, колонізацію, інвазивність (інвазійність) — здатність
протистояти дії клітинних і гуморальних механізмів захисту та ін.
Токсиноутворення — властивість мікроорганізмів продукувати
токсичні речовини. За характером утворення бактеріальні токсини
поділяють на екзо- й ендотоксини (табл. 9).
Більша частина бактеріальних токсинів каталізує певні хімічні
процеси, руйнує життєво важливі сполуки, спричиняє патогенну дію
в дуже малих дозах, має прихований період дії, пригнічує захисні
функції тканин. Деякі бактеріальні токсини мають властивості ле-
цигинази С. Так, наприклад, С. регігіпцепз продукує а-гемолізин,
що має властивості ферменту (цинкметалоензимфосфоліпазн), який
може розщеплювати лецитин на фосфорилхолін і диглінерид.
Некроз м’язової тканини спричиняється комбінованим діянням
лецитииази, колагенази і муцинази. Колагеназа і муциназа руйнують
сполучну тканину, що входить до складу м’язів, а лецитнназа роз-
чиняє лецитин мембран м’язових волокон. Гемоліз прн анаеробній
119
Таблиця 9. Порі анальна характеристика основних властивосте* еязотоисяніи
І ендотоксинів
Екзотоксини Ендотоксини
Складаються з білкових речовин, мають власгивості ферментів, деякі до'уто в кристалічному стані Легко секретують з клітини у навко- лишнє середовище Високотоксичні, характеризуються вибір- ковим ураженням деяких органів і тка- нин Термолабільні (деякі термосіабільні) Під діянням формаліну (0,3—0,4 %) і температури 38—50 °С переходять в анатоксини Складаю іься з гл іцидол іпіднопротеї- нових комплексів, гліцидоліпідних і полісахаридних специфічних сполук Міцно зв’язані з тілом бактеріальної клі гпни Ченш токсичні, вибіркова дія вира- жена слабко Термостабільні Під діянням формаліну і температури частково знешкоджуються
інфекції відбувається в результаті лізису лецитину строми еритро-
цитів.
Некротизуюча дія токсинів має для збудника важливе пристосу-
вальне значення: по-перше, токсини перетворюють живу й реактивну
тканину у нешкідливий субстрат для патогенного мікроорганізму;
по-друге, некротизована тканина захищає більшість бактерій від
діяння захисних реакцій макроорганізму.
Силу діяння токсинів визначають на чутливих лабораторних
тваринах за 01т, ЬО50. Наприклад, 01т дифтерійного токсину —
це мінімальна його кількість, підшкірне введення якої морській
свинці масою 250 г спричинює її гибель на 4-ту добу. В 1 мг дифте-
рійного токсину міститься 10 000 Оіт для морської свинки; в 1 мг
правцевого токсину — 200 000 Оіт для білої миші; в 1 мг ботулініч-
ного токсину кількість Оіт для морської свинки коливається залеж-
но від серовару збудника від 60 000 до 1 000 000.
Правцевий, ботулінічний і дифтерійний токсини добуто в очище-
ному й кристалічному вигляді. Очищають їх різними методами: коагу-
ляцією в ізоелектричній точці, багаторазовим переосаджуванням
три хлороцтовою кислотою при низькій температурі і рН 4,0, висолю-
ванням амонію сульфатом, адсорбцією різними речовинами. Очищені
токсини характеризуються вищою токсичністю для чутливих лабора-
торних тварин.
До екзотоксинів відносять токсини, що продукуються збудниками
ботулізму, правця, анаеробної інфекції, дифтерії, коклюшу, чуми,
холери, сибірки, деякими видами шигел, стафілококів і гемолітичних
стрептококів, синьогнійної палички, парагемолітичного вібріона.
Механізм токсиноутворення останнім часом вивчено доклад-
ніше. Доведено, що в одних видів бактерій (С. дірИіИегіае, 8. аигеиз
та ін.) детермінанти токсигенності (іох+-ген) локалізовані в ДНК по-
мірного фага, в інших (Е. соїі) — у ЕпЬ, Ніу-плазмідах. У С. Ьізіо-
Іуіісит, С. поу]і токсиноутворення пов’язане з генами, локалізованими
в ДНК помірного фага, і генами, що відповідальні за спороутворення;
120
а в V. сЬоІегае іох+-ген інтегрований з генами, які детермінують
засвоєння амінокислот.
Тепер відомо вже понад 60 білкових екзотоксинів бактерій, які
поділяють на три класи.
Клас А — екзотоксини, що секретуються у навколишнє сере-
довище: холероген (V. сЬоІегае), гемолізин (V. рагаЬаетоІуіісиз),
а-, 6-. ^-гемолізини (8. аигеиз), гістотоксин, дермонекротизин
(С. сіірЬіЬегіае), а, б-гемолізини, а-, е-токсини (С. регїгіп£еп5), на-
бряковий і летальний токсини (В. апіЬгасіз) та ін.
Клас В — екзотоксини, які частково секретуються і частково
зв’язані з бактеріальною клітиною: лабільний токсин (В. регіиззіз),
а-токсин (С. поуіі), тетаноспазмін (С. іеіапі). нейротоксин (С. Ьоіи-
Ііпит).
Клас С — екзотоксини, зв’язані з бактеріальною клітиною:
ентеротоксин (8. сіузепіегіае), А і В токсини (¥. резііз) .
Токсигенність не є обов’язковою видовою ознакою, оскільки всі
відомі токсигенні бактерії можуть існувати, не продукуючи екзоток-
син. Активність іох+-генів контролюється репресорами бактеріаль-
ної клітини, вироблення яких індукується деякими речовинами жи-
вильного середовища.
Діяння екзотоксинів зумовлюється певними частинами молекули
білка — активними центрами, що являють собою аміногрупи токси-
нів. блокування яких формаліном призводить до втрати токсичності.
Екзотоксини характеризуються різко вираженою токсичністю,
діють на споийчятливий організм у малих дозах. Деякі з них ма-
ють властивості ферментів, що діють на потрібні для нормальної ді-
яльності клітин речовини. Від моменту введення екзотоксину в орга-
нізм тваоини до початку захворювання минає період, що коливається
від кількох годин до кількох діб. Екзотоксини мають вибіркову дію
на окремі органи і тканини організму. Дифтерійний токсин спричиняє
некооз гканин у місці введення, ушкодження надниркових залоз
і м’яза сеоця, правцевий токсин діє на рухові нервові клітини.
При парентеральному введенні екзотоксинів в організм вони
спричиняють утворення в крові специфічних речовин (антитоксинів),
які можуть нейтралізувати ці самі токсини.
За хімічною структурою екзотоксини належать до речовин білко-
вої природи. Вони малостійкі проти дії світла, кисню і високої
температури (руйнуються при 60—80 °С протягом 10—60 хв). Ботулі-
нічний, стафілококовий та інші екзотоксини термостабільні, витри-
мують кип’ятіння протягом кількох хвилин, у висушеному стані
більш стійкі проти дії високої температури, світла і кисню; додаван-
ня до токсинів сахарози також підвищує їх стійкість проти нагрі-
вання. Під дією 0,3—0,4 % формаліну і температури 38—30 °С диф-
терійний екзотоксин протягом ЗО діб втрачає свої токсичні властиво-
сті і перетворюється в анатоксин.
Одні екзотоксини (дифтерійний, правцевий та анаеробної інфек-
ції) інактнвуються під впливом травних ферментів, внаслідок чого
вони нешкідливі при введенні їх через рот; інші (ботулінічний, ток-
сини С. регГгіпбепз і патогенних стафілококів) не руйнуються в
121
шлунку і кишках І спричиняють отруєння організму при перораль-
ному введенні.
Екзотоксини мають властивість спричиняти явище потенціюван-
ня, коли під впливом суміші токсинів настає більш виражена інтокси-
кація організму. Особливо виразно проявляється потенціююча дія
токсинів клостридій анаеробної інфекції, правил і стафілококів,
коринебактерій дифтерії і стафілококів.
Токсини деяких бактерій (стафілококів, стрептококів та ін.)
спричиняють гемоліз Стрептококовий гемолізин звільняється з клі-
тин при аутолізі. Внутрішньовенне введення його морським свинкам
спричиняє летальний кінець. При підшкірній аплікації у малих
дозах токсин зумовлює вироблення в організмі антитіл; інактивується
холестерином, пепсином, папаїном, трипсином.
Бактерії, які продукують на кров’яному агарі а-гемолізин, спри-
чиняють утворення зелених або темно-зелених колоній в результаті
гематометаморфози заліза еритроцитів.
При вирощуванні бактерій, що виробляють ^-гемолізини, навколо
колоній утворюються прозорі зони гемолізу, оскільки цей токсин
розчиняє еритроцити.
Низка патогенних мікроорганізмів синтезують у-гемолізин, який
спричиняє гемоліз еритроцитів кроля, людини, морської свинки і ха-
рактеризується невисокою стійкістю проти нагрівання.
Виявлено також о-гемолізин, який руйнує еритроцити людини
і деяких тварин. Його виділяють, наприклад, патогенні штами ста-
філококів.
До позаклітинних ферментів патогенних бактерій належать к о -
лагеназа — вона руйнує колаген і сприяє поширенню в тканині
С. рег(гіп£еп5 та ін.; коагулаза — сприяє зсіданню плазми
крові, полегшує проникнення бактерій у тканини, спричиняє відкла-
дання фібрину на поверхні стафілококів і тим самим утруднює їх
фагоцитоз і лізис; стрептокіназа — активує протеолітичний
фермент плазми крові, посилює проникнення стрептококів у тканини.
Стафіло- і стрептококи виробляють лейкоцидини, які
руйнують поліморфно-ядерні лейкоцити.
Бактерії пневмонії, озени, риносклероми, протей, континенталь-
ні штами збудника чуми і багато інших продукують фермент у р е а-
з у, який гідролізує аміди кислот з утворенням аміаку.
Токсичні властивості мають багато амінокислотних декарбо-
ксилаз, що утворюються збудниками анаеробної інфекції та
іншими бактеріями.
Типовими ферментами-токсинами єлецитинази. «Лепитиназа
А є в отруті змій, бджіл і скорпіонів, лепитиназа В — у рослинах,
лецитиназа С — у багатьох патогенних мікроорганізмів, зокрема
у збудників анаеробної інфекції.
Збудники черевного тифу, паратифів, гонореї та багато інших
патогенних грамнегативних бактерій не продукують екзотоксини,
вони містять ендотоксини, які міцніше зв’язані з тілом бактеріальної
клітини, менш токсичні, уражують організм у великих дозах: прихо-
ваний період у них звичайно триває години, вибіркова дія виражена
122
слабко. Вони термостійкі: деякі ендотоксини витримують кип’ятіння
і повітряну стерилізацію при температурі 120 °С протягом ЗО хв, під
впливом формаліну і високої температури знешкоджуються частково.
Головним компонентом ендотоксину є полісахариди клітинної
стінки грамнегативних бактерій. Токсичність їх пов’язана з ліпідною
частиною ліпополісахаридів. Ендотоксини мають пірогенну й ад’ю-
вантну дію, спричиняють лейкопенію з переходом у лейкоцитоз,
підвішують неспецифічний імунітет і гормональну активність.
Ендотоксини зумовлюють порушення обміну речовин внаслідок
пригнічення окислювального циклу трикарбонових кислот.
Як місцеві, так і загальні прояви інтоксикації супроводяться
морфологічними змінами клітин крові, складу білків, ферментів,
імунологічними (утворення антитіл) і загальноклінічними (підвищен-
ня температури тіла) порушеннями, розладом функції нервової систе-
ми, органів дихання, кровообігу та ін.
Адгезивність — це властивість мікроорганізмів фіксуватися на
поверхнях клітин організму хазяїна. Вона зумовлена особливими
органелами — адгезинами, які властиві як ауксотрофам, так і гетеро-
трофам. Адгезивність є одним із факторів, які визначають поведінку
мікроорганізмів у популяції, а також детермінують здатність гетеро-
трофів переходити до паразитичного способу існування в певних
умовах.
У різних мікроорганізмів адгезини морфологічно відрізняються
одні від одних. У лактобацил вони представлені війками діаметром від
0,02 до 0,06 мкм і довжиною 1 мкм, у ешерихій — фімбріями або фібри-
лами діаметром від 2 до 7 нм і довжиною від 1 до 7 мкм.
Процес адгезії — це складна фізико-хімічна реакція. За неспеци-
фічною фазою — наближення до клітин макроорганізму — настає
специфічна, коли адгезини мікроорганізму специфічно зв’язуються
з рецепторами клітини-мішені або з макромолекулами, що їх покри-
вають. Такі властивості має фібринектин, який вистилає зовнішню
поверхню різних видів клітин у тварин.
До факторів патогенності відносять колонізацію, яка за механізмом
близька до адгезії. Вона характерна для ешерихій і зумовлює їх прн-
кріпдення до епітеліальних клітин стінки кишок. Колонізація бакте-
рій відбувається за рахунок поверхневих білкових антигенів (К88,
К99, 987 Р, СГА/І, СЕА/ІІ), зв’язаних з фімбріями (пілі), синтез
яких генетично детепмінований.
Патогенним мікроорганізмам властива інвазивність, зумовлена
факторами розповсюдження. У глиб тканини мікроорганізми прони-
кають внаслідок продукування ними ферментів типу гіалуронідазн,
яка поз'цеплюе основну речовину сподучноїтканини— гіалуронову
кис доту, нейраміпідази, яка відщеплює сіалові кислоти, плазміну,
що розщеплює фібрин, та ін.
Фактори розповсюдження детермінуються бактеріальними генами,
характеризуються високою активністю, діють у дуже малих лозах,
мають вдастивості ферментів.
Патогенні мікрооргані імп мають механізми захисту від дії гумо-
ральних і клітинних факторів імунітету — антитіл, фагоцитозу
123
(цив. с. 139). Так, наприклад, джгутики рухливих бактерій перешко-
джають їх контакту з фагоцитами. Особлива роль у захисті мікроорга-
нізмів від дії різних факторів належить капсульній речовині. Деякі
патогенні бактерії (Васіїїиз апііігасіз, Вігеріососсиз рпеитопіае,
СІозігідіит регїгіп£еп8 та ін.) мають властивість утворювати капсулу
в організмі тварин і людини. Клебсіели риносклероми, озени, пневмонії
продукують капсулу як в організмі, так і на живильних середовищах.
Капсулоутворення забезпечує стійкість мікроорганізмів проти
фагоцитозу й антитіл, збільшує їх інвазивність. Наприклад, капсуль-
ні бацили сибірки не зазнають фагоцитозу, тоді як безкапсульні варі-
анти легко фагоцитуються. Більш висока вірулентність капсульних
мікроорганізмів пов’язана з токсичними речовинами, що є в капсулі.
За хімічним складом капсульна речовина в одних видів мікро-
організмів складається із складних полісахаридів (8. рпеитопіае),
в інших — із протеїнів (В. апіИгасіз).
Деякі патогенні види мікроорганізмів виділяють речовини, які
пригнічують захисні сили організму й посилюють їх вірулентність.
Вони дістали назву агресииів. Самі по собі при введенні тваринам агре-
сини нешкідливі, але при додаванні їх до несмертельної дози мікро-
організмів розвивається тяжкий інфекційний процес, що нерідко за-
кінчується загибеллю тварини.
Очевидно, агресини — це не одна, а кілька різних речовин, які
утворюються в процесі життєдіяльності патогенних мікроорганізмів,
з’єднання поверхневих структур бактеріальних клітин, продукти роз-
щеплення ДНК, РНК та ін.
Вірулентність патогенних мікроорганізмів пов’язана і з іншими
факторами.
Із наведених даних видно, що патогенність і вірулентність мікро-
організмів визначаються багатьма генетично детермінованими біоло-
гічними факторами: екзо- й ендотоксинами, адгезинами, факторами
колонізації, ферментами патогенності та іншими, що дає їм змогу ви-
живати в умовах середовища макроорганізму, які невпинно змі-
нюються.
Діапазон вірулентності досить широкий — від абсолютного пара-
зитизму до сапрофітизму. Патогенні види мікроорганізмів можуть
тривалий час співіснувати з макроорганізмом у вигляді латентних
(прихованих) форм або персистирування.
МЕХАНІЗМ ВІРУСНИХ ІНФЕКЦІЙ
Взаємодія вірусу і клітини хазяїна проходить такі стадії (рис. 37):
1) адсорбція віріона на поверхні клітини; 2) проникнення віріона або
його нуклеїнової кислоти в клітину; 3) вивільнення вірусного геному
(депротеїнізація); 4) синтез ранніх вірусних білків; 5) біосинтез ком-
понентів віріона (нуклеїнова кислота і структурні білки); 6) форму-
вання (самоскладання) віріонів; 7) вихід віріонів із клітини.
Адсорбція вірусу зумовлена двома механізмами: 1) неспецифіч-
ним — утриманням віріона на поверхні клітини електростатичними
і ван-дер-ваальсовими силами; 2) специфічним — взаємодією рецеп-
124
тора вірусу з відповідними
рецепторами клітини, що за-
безпечує міцне прикріплення
вірусу.
У клітину вірус проникає
внаслідок віропексису, в ос-
нові якого лежать ті самі
механізми, що й при піноци-
тозі і фагоцитозі (див. с. 141).
У деяких вірусів усередину
клітини проникає тільки нук-
леїнова кислота або нуклео-
капсид.
Депротеїнізація зумовлена
дією протеаз, що містяться
всередині клітини, і закінчу-
ється вивільненням вірусного
геному нуклеїнової кислоти
вірусу.
Функціонування геному
ДНК-вмісних вірусів роз-
починається із синтезу ран-
ньої інформаційної РНК і
ранніх білків, потрібних для
Рис. 37. Взаємодія вірусу із сприйнятливою
клітиною:
а — адсорбція віріона; б — проникнення оіріона в
клітину І звільнення його від білкової оболонки;
« — репродукція віріонів; г — вихід зрілих віріонів
із клітини.
наступної реплікації ДНК. Терміном «ранні» позначають молекули,
що синтезуються до реплікації ДНК. Рання транскрипція зумовлює-
ться клітинними РНК-полімеразами, а реплікація ДНК здійснюється
клітинними (лапова-, адено-, парвовіруси) або вірусними (віруси
віспи, герпесу) ДНК-полімеразами. На матриці ДНК, що реплікує-
ться, відбувається синтез пізніх білків, які утворюються після по-
чатку реплікації.
У вірусів, що містять двониткову РНК, компоненти формуються
подібним чином. Рання транскрипція у них здійснюється завдяки
ферменту віріона — РНК-залежній РНК-полімеразі.
Віруси з однонитковою РНК за характером синтезу білків поді-
ляються на дві групи. У представників першої групи (пікорна-, то-
гавіруси) РНК має інформаційні властивості і спрямовує синтез спе-
цифічних білків; до другої групи належать віруси (ортоміксо-, пара-
міксо-, рабдовіруси та ін.), РНК яких не інформаційна, а є тільки
матрицею для її синтезу.
Особливим способом реплікації характеризуються РНК-вмісні
віруси, що входять до родини ретровірусів. У них є особливий фер-
мент — РНК-залежна ДНК-полімераза, за допомогою якої на матри-
ці віріонпої РНК синтезується ДНК-провірус кільцевої форми. Цей
провірус проникає у клітинну хромосому і транскрибується клітинною
РНК-потімеразою так само, як і звичайні клітинні гени. РНК, що при
цьому утворюється, спрямовує синтез вірусних білків і водночас є
вір іонною РНК.
125
Зв’язування інформаційної РНК з рибосомами є початковим ета-
пом транскрипції, при цьому синтез клітинних білків припиняється.
Вірусний геном кодує синтез двох класів білків: структурних, що
входять до складу віріонів нащадків, і неструктурних, які забезпе-
чують процес репродукції. У складних вірусів групи віспи утворює-
ться до ЗО структурних білків, зв’язаних з вірусним геном і з вірус-
ними оболонками. Серед білків вірусних оболонок є вірусні рецепто-
ри, які впізнають специфічні угруповання на поверхні клітини, і фер-
менти, що взаємодіють з цими угрупованнями. Білки вірусних оболо-
нок руйнуються в клітині або на її поверхні, і після їх видалення
вірусний геном здійснює свою функцію.
Самоскладання вірусів відбувається після того, як концентрація
нуклеїнових кислот і білка досягає критичного рівня. У простих
вірусів це суто фізико-хімічний процес. У вірусів, що мають зовніш-
ню оболонку, віріони формуються на клітинних мембранах, компонен-
ти яких стають компонентами зовнішньої оболонки віріона.
Остання стадія взаємодії — вихід віріонів із клітини — відбу-
вається по-різному і залежить від структури, біології вірусу,взаємо-
відношень з клітиною хазяїна і т. д. Віріони можуть вивільнятися
з клітини внаслідок її лізису (розчинення, розпаду), зумовленого ак-
тивацією лізосом. Вихід віріонів відбрунькуванням не супроводиться
загибеллю клітини, але призводить до ушкодження клітинних мем-
бран.
Час, потрібний для здійснення повного циклу репродукції віру-
сів, коливається від 5—6 год (віруси грипу, віспи та ін.) до кількох
діб (віруси кору, поліоми, аденовіруси та ін.). В результаті інфіку-
вання чутливої клітини однією вірусною частинкою.віріони, що утво-
рюються, можуть інфікувати нові клітини і здійснювати у них описа-
ний вище цикл репродукції.
Віруси здатні до агрегації — скупчення віріонів у міжклітинних
просторах. У багатьох вірусів виявлено мультиплоїдні віріони, що
містять більш як по одному геному, іноді навіть різні клони (гетеро-
зиготи).
Розрізняють гостру, хронічну і латентну вірусну інфекції.
Тривале збереження вірусу в організмі хазяїна пов’язане з утво-
ренням імунних комплексів, інтеграцією геному вірусу з геномом
клітин хазяїна.
Виявлено групу повільних інфекцій (куру, ВІЛ-інфекція, хвороба
Якоба—Крейтцфельда та ін.), інкубаційний період у яких триває
кілька років.
У клітинах, інфікованих вірусами, порушується метаболізм, в ре-
зультаті чого змінюється структура всіх компонентів нуклеїнових
кислот, білків, ліпідів, вуглеводів, ферментів, неорганічних сполук.
Ці порушення зумовлені не тільки впливом нуклеїнової кислоти віру-
су на генетичний апарат клітини, а й дією ферментів і токсичних вірус-
них білків.
Багато вірусів (збудники кору, вітряної віспи, паротиту, вірус-
ного гепатиту, жовтої гарячки, краснухи, коксакивіруси та ін.)спри-
чиняють у клітинах хазяїна ушкодження хромосомного апарату
126
розриви, фрагментацію, розпилення на дуже дрібні частинки, анеупло-
ідію (відсутність окремих хромосом або надмірна кількість їх у гено-
мі). Гадають, що ці зміни відбуваються в результаті безпосереднього
проникнення нуклеїнової кислоти вірусу у хромосоми і пов’язані
з мутаційною дією вірусів і продуктів порушеного вірусом метаболіз-
му клітини.
Ушкодження клітин, зумовлені вірусом, можуть призвести до від-
далених наслідків: 1) стимуляції спадкових мутацій, що призводять
до виникнення специфічних клонів; 2) утворення популяцій, з яких
формуються пухлинні клітини; 3) підвищення частості хромосомних
аберацій, зокрема трисомії по 21-й хромосомі (хвороба Дауна).
Розрізняють три типи вірусної інфекції.
Автономний тип характеризується тим, що вірус реплікується не-
залежно від реплікації клітинного геному.
Інтеграційний тип спостерігається у ретровірусів і помірних фагів;
при цьому обов’язковою умовою є інтеграція вірусного і клітинного
геномів. Інтеграційний тип можливий і при деяких формах хронічної
інфекції, яка спричиняється лапова-, герпес- і аденовірусами.
Мішаний тип (автономно-інтеграційний) буває при наявності двох
або більше інфекційних процесів, при цьому можливі кілька варіан-
тів: а) інтерференція (один вірус пригнічує репродукцію другого або
пригнічується репродукція обох вірусів); б) комплементація (один
вірус посилює репродукцію другого); в) екзальтація (один вірус поси-
лює репродукцію другого неспорідненого вірусу, який може розмно-
жуватися самостійно); г) фенотипове змішування (взаємний обмін
структурними білками вірусів); д) зміна біологічних властивостей
(виникнення рекомбінантів, фенотипово мішаних віріонів, псевдо-
вірусів).
Хронічну вірусну інфекцію поділяють на дві основні форми:
І) безумовно хронічну, при якій усі клітини містять і виділяють вірус,
але при цьому не гинуть; 2) умовно-хронічну, в процесі якої в частини
клітин розвивається гостра вірусна інфекція.
Латентна форма інфекції, що характеризується тривалим безсимп-
томним пецсистируванням вірусу, буває при герпесі, лімфоцитарному
хоріомечінгіті та ін.
Вивчення хронічних і латентних інфекцій показало, що розвиток
їх не може бути зумовлений якимсь одним, спільним для всіх вірусів
механізмом Виникнення їх пов’язане з неповноцінними (дефектними)
віріонами або наявністю в клітинах різних інгібіторів.
Виявлено і вивчено найдрібніші структури, що складаються з РНК
у вигляді коротких, замкнутих молекул, які містять 360 нуклеотнчів
без білкової оболонки — в і р о ї д и, що уражують у тропічних
країнах томати, картоплю, кокосові пальми, цитрусові. Гадають, що
віроїди спричиняють захворювання у людини і тварин з ураженням
центральної нервової системи типу синдрому Якоба — Крейтцфельда
та інших повільних вірусних інфекцій. Виникнення повільних інфек-
цій пов’язують з біологічними особливостями агентів, які уражують
центральну нервову систему, а також із нездатністю організму відпо-
відаїи на проникнення збудника повноцінною імунною реакцією.
127
Відкрито і вивчаються інфекційні агенти, що не мають нуклеїнових
кислот (ДНК або РНК),— п р і о н и.
Таким чином, механізм вірусних інфекцій зумовлений взаємодією
(конкуренцією) двох генетичних систем: вірусної і клітинної, чим
паразитизм вірусів істотно відрізняється від паразитизму патогенних
бактерій. Для вірусів як неклітинних форм життя характерною озна-
кою є паразитизм на молекулярному рівні. Позаклітинний віріон
біологічно інертний.
Вірусна інфекція може закінчитися утворенням нових віріонів
(продуктивна інфекція), загибеллю або припиненням репродукції
віріонів (абортивна інфекція), взаємним пристосуванням вірусу і клі-
тини (вірогенія), розвитком неопластичного процесу, при якому спо-
стерігаються інтенсивний ріст і розмноження клітин (онкогенна фун-
кція вірусів).
РОЛЬ МАКРООРГАНІЗМУ, НАВКОЛИШНЬОГО СЕРЕДОВИЩА
І СОЦІАЛЬНИХ ФАКТОРІВ У ВИНИКНЕННІ І РОЗВИТКУ
ІНФЕКЦІЙНОГО ПРОЦЕСУ
Виникнення інфекційного процесу залежить від реактивності
людського організму, якості і кількості збудника, наявності необхід-
них для життєдіяльності збудника речовин, стану імунітету, впливу
навколишнього середовища та соціальних факторів. Залежно від
співвідношень цих факторів інфекційний процес може закінчитися
загибеллю збудника, загибеллю хазяїна або встановленням взаємної
адаптації між організмом хазяїна і паразитом.
Проникнення в організм збудника не завжди спричиняє розвиток
захворювання, у багатьох випадках воно обмежується короткочасним
інфікуванням без клінічних проявів або відносно тривалим носій-
ством (стрептококи, аденовіруси, ентеровіруси та ін.).
Реактивність організму людини, його імунологічна готовність
знешкодити патогенний мікроорганізм тісно пов’язані із зовнішнім
середовищем, умовами життя, характером праці і харчування, сані-
тарно-гігієнічним і загальним культурним рівнем та багатьма іншими
факторами. Стан макроорганізму, його резистентність мають вирі-
шальне значення у виникненні, перебігу та кінці інфекційного захво-
рювання.
Певний вплив на сприйнятливість організму до інфекції мають
стать і вік. Під час менструації, вагітності і родів жіночий організм
стає більш чутливим, а отже, й більш сприйнятливим до інфекції,
особливо стафілококової і стрептококової.
Стійкість проти багатьох інфекційних захворювань у дітей віком
до 6 місяців пов’язана із слабким розвитком у них центральної нерво-
вої системи, а також із наявністю імунітету, що передається від мате-
рі. Разом з тим виявлено, що до деяких інфекцій (дизентерія, стафі-
лококові, стрептококові захворювання, коліентерит та ін.) діти більш
сприйнятливі, ніж дорослі. Різна вікова резистентність до інфекцій-
128
них захворювань залежить від характеру обміну речовин, функції
ендокринних залоз та особливостей імунітету.
На підвищення сприйнятливості до інфекційних захворювань
впливають такі фактори, як характер харчування (загальне голоду-
вання, нестача білків, жирів, вуглеводів, вітамінів, мікроелементів),
перевтома, охолодження, санітарно-гігієнічні умови праці і побуту,
а також різні соматичні захворювання, хронічні отруєння і порушення
діяльності центральної нервової системи.
Загальне голодування може призвести до загострення туберкульо-
зу, дизентерії, фурункульозу та інших захворювань. В результаті
голодування втрачається не тільки індивідуальний, а й видовий іму-
нітет. Зниження резистентності у тварин спостерігається не тільки
внаслідок загального голодування, а й від нестачі окремих складових
частин їжі: білків, жирів, вуглеводів. Голодування супроводиться
порушенням білкового обміну, що призводить до зменшення синтезу
імуноглобулінів (антитіл), зниження активності фагоцитів.
Виникненню сприйнятливості до інфекційних захворювань знач-
ною мірою сприяють гіповітамінози. Нестача ретинолу (вітамін А)
зумовлює пригнічення фагоцитозу, розвиток запалення кон'юнктиви,
ксерофтальмії, уражень шкіри, бронхопневмонії, гострих респіра-
торних захворювань. Нестача аскорбінової кислоти (вітаміну С) зни-
жує опірність до туберкульозу, дифтерії, стрептококових, стафілоко-
кових та інших інфекцій.
При багатьох інфекційних захворюваннях в результаті згубної
дії лікарських засобів на нормальну кишкову мікрофлору, яка забез-
печує органіїм вітамінами групи В, розвиваються гіповітаміноз
і дисбактеріоз.
Дефіцит заліза, кальцію, магнію, міді, цинку, йоду, марганцю,
бору, кобальту, молібдену призводить до порушення обміну речовин,
зниження опірності організму і підвищення сприйнятливості до
інфекційних захворювань.
У малих кількостях мікроелементи можуть збільшувати захисні
властивості макроорганізму, зокрема фагоцитарну активність лей-
коцитів. Вони нормалізують порушені біохімічні процеси, сприяють
виробленню антитіл, синтезові комплементу, мають дезинтоксика-
ційну дію.
Фізична і розумова перевтома, як наслідок нераціонального роз-
поділу робочого часу і порушення режиму життя, спричиняє ослаб-
лення захисних механізмів проти багатьох інфекційних захворю-
вань.
Охолодження знижує стійкість організму до діяння патогенних
і умовно-патогенних мікроорганізмів, сприяє розвиткові пневмонії,
гострих респіраторних та інших захворювань. Так, наприклад, у ку-
рей охолодження спричиняє порушення видового імунітету до си-
бірки; пінгвіни при підвищенні температури навколишнього сере-
довища гинуть від аутоінфекції, що спричиняється аспергілами. Охо-
лодженим. а також перегрівання тіла тварин порушує біокаталітичні
реакції, ослаблює організм і знижує імунітет до інфекційних захво-
рювань Відомо, наприклад, що гострі респіраторні захворювання
5 і-п: І»
найчастіше спостерігаються в осінньо-зимовий період, а колі-енте-
рити — в літній.
Дія сонячного проміння на організм залежить від довжини хви-
лі, інтенсивності і тривалості аплікацій. Сонячне проміння сприятли-
во діє на організм і значною мірою підвищує резистентність до інфек-
ційних захворювань. Однак тривале й інтенсивне опромінювання
в ряді випадків знижує стійкість людського організму до деяких па-
тогенних мікроорганізмів. Наприклад, рецидиви малярії у людей,
інфікованих плазмодіями, зумовлені дією інтенсивного сонячного
випромінювання.
Негативний вплив на макроорганізм мають забруднення атмосфер-
ного повітря, хімічні і фізичні фактори, до яких людина за короткий
період науково-технічної революції виявилась еволюційно непідго-
товленою, в результаті чого порушуються неспецифічні і специфічні
захисні системи.
Велике значення в порушенні опірності організму має дія іоні-
зуючої радіації. Доведено, що невеликі дози рентгенівського проміння
підвищують резистентність тварин до різних захворювань, а підвищені
дози знижують її, сприяють активації нормальної мікрофлори, роз-
виткові бактеріемії і септицемії При цьому порушується проник-
ність слизових оболонок, зменшується їх бар’єрна властивість, різ-
ко знижуються функції лімфоїано-макрофагальної системи і захисні
властивості крові.
Незадовільні санітарно-гігієнічні умови праці і побуту несприят-
ливо впливають на організм людини. Незважаючи на те що на кожну
людину припадає понад 2 млн т повітря, в результаті інтенсивного
забруднення його у великих містах і промислових центрах значно
зроспа кількість людей, уражених хронічними захворюваннями ди-
хальних шляхів (пневмонія, рак легень, емфізема, астма та ін.).
Нестача кисню в приміщенні, надлишок вуглекислого газу та інших
шкідливих газів спричиняють хронічне отруєння, сприяють розвитко-
ві туберкульозу. Наявність у повітрі пилу, в якому багато силіка-
тів, призводить до порушення цілості слизової оболонки дихальних
шляхів і збільшення можливості інфікування різними мікроорганіз-
мами, сприяє виникненню туберкульозу, актиномікозу, аспергільозу,
хронічної пневмонії, алергічних та інших захворювань.
Поряд із зовнішніми факторами на сприйнятливість до інфекцій-
них хвороб дуже впливають різні соматичні захворювання (діабет та
інші розлади функції ендокринних залоз, захворювання органів
кровообігу, печінки, нирок, хронічні отруєння алкоголем, нікоти-
ном тощо).
Велике значення у збереженні сталості внутрішнього середовища
організму має гіпофізарно-адреналова система, стимуляція якої
виникає під впливом різних подразників: механічної травми, висо-
ких і низьких температур, ультрафіолетового й іонізуючого випро-
мінювання, діяння мікроорганізмів та ін.
На особливу увагу заслуговує порушення діяльності центральної
нервової системи. Психічні розлади знижують регулювальну функцію
центральної нервової системи. Під час різних народних лих (війна,
130
голод, землетрус, повінь) інфекційні захворювання набувають масово-
го поширення, супроводяться високою смертністю та інвалідністю.
В еру науково-технічного прогресу слід ураховувати вплив на
евоноцію патогенних мікроорганізмів (бактерій, вірусів, грибів, най-
простіших) соціальних факторів. Забруднення навколишнього сере-
довища, інтенсивне застосування лікарських засобів, вакцин, урба-
нізація із значною скупченістю населення у великих містах, розвиток
усіх видів транспортних засобів, господарське освоєння нових тери-
торій, створення індустріального тваринництва, широке використання
в промисловості і сільському господарстві атомної енергії призводять
до зміни екологічних систем, включення в епідемічний процес раніше
не відомих збудників, зміни шляхів їх циркуляції, порушення реак-
тивності і сприйнятливості організму людини, підвищення резистент-
ності до лікарських препаратів не тільки у бактерій, а й у вірусів,
грибів, найпростіших.
Інфекційний процес проявляється в єдності біологічних і соціаль-
них факторів. Рівень захворюваності, тяжкість клінічного перебігу
захворювання і смертність прямо залежать від дії основних економіч-
них законів суспільних формацій.
МЕХАНІЗМИ ПЕРЕДАЧІ ЗБУДНИКІВ ІНФЕКЦІЙНИХ
ЗАХВОРЮВАНЬ
У процесі еволюції патогенні мікроорганізми виробили здатність
різними шляхами проникати в організм людини і вибірково уражувати
певні тканини й органи. Для кожного збудника характерний свій
механізм передачі, який зумовіює його локалізацію. Специфічні не
тільки ппяхн проникнення патогенних мікроорганізмів, а й механізми
виділення їх з організму. Ці особливості збудників інфекційних за-
хворювань ураховують при здійсненні протиепідемічних і профілак-
тичних заходів.
Тепер відомо понад 6000 агентів, які можуть спричиняти інфек-
ційні іахворювання людніш. Оскільки кількість патогенних видів
порівняно велика, то виникла потреба згрупувати всі інфекційні за-
хворювання за певним принципом.
В основу класифікації інфекційних захворювань у медичній мік-
робіології покладено етіологічний принцип, що грунтується на спе-
цифічності дії патогенних мікроорганізмів.
У нашій країні прийнята класифікація Л. В. Громашевського.
Воші базується на механізмі передачі збудника від джерела інфекції
сприйнятливому людському організмові. П. Є. Йолкін і В М. Жла-
нов доповнили її тим. що кожну нозологічну групу поділяли на два
ряди <і н т р о п о іГо'з и — захворювання, властиві людині, і з о-
о н о пі - і.іхворюванпч тварин, до яких сприйнятлива і людина.
Ві (нові цю до цієї класифікації, усі ін^кпійні захворювання по-
ліі.чю пі п’ять груп: І) кишкові інфекції; 2) інфекції дихальних
ипяхів. 3) кров’яні інфекції; 4) інфекції шкіри; 5) інфекції з різними
механізмами передачі.
131
До карантинних (конвенційних, особливо небезпечних) інфек-
ційних захворювань людини належать натуральна віспа, чума, хо-
лера, жовта гарячка; щодо цих інфекцій діють міжнародні правила
санітарної охорони кордонів (територій).
Міжнародна класифікація інфекційних захворювань (1980) мас
два розділи
Інфекційні і паразитарні хвороби: кишкові інфекції; туберкульоз,
бактеріальні зоонози; інші бактеріальні інфекції; поліомієліт та інші
ентеровірусні хвороби центральної нервової системи; вірусні хворо-
би, що супроводяться висипами; вірусні хвороби, які передаються
членистоногими; інші вірусні хвороби; рикетсіози та інші хвороби,
що передаються членистоногими, сифіліс та інші хвороби, що спри-
чиняються спірохетами; мікози; гельмінтози; інші інфекційні і пара-
зитарні хвороби; віддалені наслідки інфекційних і паразитарних
хвороб.
Хвороби органів дихання: гострі респіраторні інфекції; інші
хвороби верхніх дихальних шляхів; пневмонія і грип; хронічна
обтурацінна хвороба легень і споріднені стани; пневмоконіози та
інші хвороби легень, які спричиняються зовнішніми агентами; інші
хвороби органів дихання.
РОЗВИТОК ІНФЕКЦІЙНОГО ПРОЦЕСУ
У розвитку інфекційного процесу виділяють такі періоди: інку-
баційний, продромальннй, основних проявів захворювання, згасання
захворювання і видужання (реконвалесценції).
З моменту проникнення патогенного агента до появи перших
ознак захворювання минає певний проміжок часу, що дістав назву
інкубаційного періоду, тривалість якого неоднакова при різних захво-
рюваннях Вона коливається від кількох годин (холера, токсикоіпфек-
ції, чума) до кількох місяців і років (лейшманіоз, лепра) Тривалість
інкубаційного періоду залежить від ступеня загальної резистентно-
сті і специфічного імунітету організму людини, його реактивності,
сенсибілізації (підвищена чутливість), впливу шкідливих факторів
навколишнього середовища та соціальних умов життя, лози і вірулент-
ності збудника
Піл час інкубаційного періоду відбуваються розмноження і нако-
пичення мікроорганізмів та їх токсинів, нашарування виникаючих
подразнень, підвищення реактивності організму людини до збудника
та його токсинів. Зараження може закінчитись розвитком захворю-
вання. У тих випадках, коли організм виявляється здатним активно
мобілізувати свої захисні сили і знешкодити збудник, що проник
у нього, захворювання не виникає.
При деяких захворюваннях за інкубаційним настає продромальний
період (період провісників хвороби), під час якого звичайно немає
характерних для цього захворювання симптомів і розвиваються неспе-
цифічні, спільні для багатьох хвороб ознаки (нездужання, зниження
апетиту, слабкість, іноді субфебрильна температура тіла), за винят-
132
ком кору (черооні плями на слизовій оболонці рота, плями Філатова),
натуральної віспи (продромальннй висип на обличчі і кінцівках).
У період основних проявів захворювання інфекційний процес,
досягнувши найвищої інтенсивності, тримається на цьому рівні пев-
ний час, неоднаковий при різних інфекціях.
Найтиповіїинмн ознаками інфекційного захворювання є гарячка,
запалення, ураження центральної і вегетативної нервової системи.
Крім того, спостерігаються функціональні й органічні порушення
функцій органів кровообігу, дихання, травлення, сечових органів,
а при деяких Інфекціях — зміни шкірн у вигляді різних висипів.
У період згасання захворювання за сприятливого перебігу воно
переходить V період видужання, причому в одних випадках захворю-
вання закінчується кризою— швидким зниженням температури
тіла, яке супроводиться потовиділенням і нерідко явищами судинного
колапсу: в Інших випадках видужання характеризується лізи-
сом— поступовим зниженням температури тіла й ослабленням явищ
захворювання.
Період видужання коливається від кількох діб (кір, вітряна віс-
па та ін.) до кількох тижнів (вірусний гепатит, бруцельоз та ін.).
При багатьох інфекційних захворюваннях клінічне видужання не
збігається в часі із звільненням реконвалесиента від збудника. У ряді
випадків можливий розвиток загострень захворювання, рецидивів,
ускладнень, вторинних інфекцій.
РОЗПОВСЮДЖЕННЯ ПАТОГЕННИХ МІКРООРГАНІЗМІВ
У ході розвитку інфекційного процесу бактерії з первинного вогни-
ща можуть надходити в кров і розноситись по всьому організму. Такий
стан називають бактеріемією, а прн вірусних захворюваннях—
вірусемією. Бактеріемія буває прн черевному тифі, паратифах,
бруцельозі та інших захворюваннях; вірусемія спостерігається при
дуже багатьох інфекціях вірусної етіології.
При деяких інфекційних захворюваннях (сибірка, чума, гнійні
інфекції та ін.) може виникнути стан сепсису, або септицемія
(лат. тгріісиетіа — гнилокрів’я), із заселенням бактеріями багатьох
органів і тканин організму. Сепсис характеризується не тільки наяв-
нісію в органах і тканинах патогенних організмів і бактеріальних
токсинів, а й реактивними явищами, що супроводяться запаленням
і дегенерацією клітин. Характерною рисою сепсису є те. що він має
одні й ті самі клінічні прояви незалежно од виду збудника, що утруд-
нює діагностику захворювання за клінічним перебігом. Септичний
процес, який розвивається з утворенням гнійних вогнищ у різних
органах і тканинах, називається септико піємією.
Токснгенні бактерії (збудники дифтерії, правця, анаеробної ін-
фекції. ботулізму, стафілококи, стрептококи та ін.) зумовлюють стан
т о к с н н е м і І.
Патогенез інфекційного процесу (механізм виникнення і розвитку
Захворювання) залежить не тільки від маси бактеріальних тіл і токси-
нів, а й від фізіологічного стану макроорганізму.
ізз
ФОГМИ ПГОЯВУ ІНФЕКЦІЇ
Залежно під промнім Інфекції поділяють на гострі І хронічні,
явні І нрихоиииі, мішані первинні І вторинні. Гострі Інфекції (грип,
иір, скарлатина, висишшй І поворотний тиф) характеризуються ран»
товим по'ївіком І порівняно короткочасним перебігом. Вірусні Інфек-
ції супроводиться пакопичепням вірусу, загибеллю Інфікованих
КЛІТИН.
До хронічних Інфекцій відносять малярію, туберкульоз, лепру,
сифіліс, бруцельоз, имебіиі, токсоили«мол тл Ін. Для них характерний
тривалий перебіг Із збереженням збудників у клітинах, тканинах
І органах.
Деякі Інфекційні ьіхнорюванпя можуть мати прихований перебіг,
без клінічних пр<>»ніи Такі форми Інфекції називають латентними,
при них збудник тривалий час може бути в тканинах або органах,
не спричиняючи клінічно виражених реакцій макроорганізму. Хро-
нічні І латентні форми Інфекцій, очевидно, відіграють основну роль
у збереженні збудників у міжеиїдемічний період.
Ііе їсиміїтомпв форма ігіґ]к*і<!ііґ дістали назву Іііаиирантної; при
ній немає клінічних оміак І разом з зим гбудник розмножується.
Інапаринтна форма Інфекції — це зихіюрюваїгни, яке у певні ороки
закінчується видужанням І зникненням збудники з організму.
Особливою категорією латентної Інфекції е п е р с и с т н р у в а н-
н я (лаг. регяіьіо — постійно бути, залишитися), харлктернзуєтги'я
тривалим збереженням ібудггика н оріагіНмІ людини (віруси гепатиту
В, герпесу, краснухи, мікобактерії туберкульозу, токсоплазми, плаз-
модії малярії ги Ін.).
В органіімі птахів І кнжипін нерснсгешіїи забезпечує переміщення
адиіпогніних до них хазяїнів збудників І розповсюдження їх па вели-
че ніі території під час сезонних міграцій. В результаті тривалого
персистируваиня вірусів виробляються антитіла проти деяких збуд-
никІн, якими людина повторно І багаторазово Інфікується, але не за»
хворюе. Іноді нсрсін чеинія призводить до мінливості штамів збудпи»
ків або всієї популяції. У ряді випадків гіерсистируючі віруси сири»
чипшогь дуже тяжкі форми захворювань центральної нервової системи
І носгвикцинальні ускладнення. Тривале иерсистируввння вірусу
грипу в організмі людини може бути причиною розвитку хвороби,
яка ііигллуе тремтячий параліч (хворобу ПаркІнсопа). Персистируваиня
багатьох патогенних агентів пов'язане з недостатнім рівнем імунітету,
При Інфікуванні не одним видом збудника, а двома І більше,
кажуть про мі шини Інфекцію (кір I скарлатина, кір І туберкульоз).
Мішані Інфекції становлять приблизно ПО % усіх інфекційних захво-
рювань. .Наборигорна діагностика I лікування їх пов'язані Із значни-
ми труднощами. Для їх рошізнавяшія потрібне застосування вірусо-
лог Ічпих I бактеріологічних методів дослідження.
Заслуговують на увагу вірусно-бактеріальні Інфекції. При бага-
тьох Інфекційних захворюваннях одночасно виявляють бактерії І ві-
руси. Часто поєднуються при мішаних Інфекціях стрептококи І віруси,
менінгококи І віруси, стафілококи І віруси, ентеробактерії й ентеро-
ІМ
віруси, мікоплазми й віруси, при гострій пневмонії у дітей — віруси
грипу, парагрипу, аденовіруси, патогенні, умовно-патогенні бактерії
та ін. У біоценозі мішаних вірусно-бактеріальних інфекцій важливу
роль відіграє властивість вірусів вибірково адсорбуватися на бакте-
ріях й утворювати стійкі асоціації, які зумовлюють своєрідні і складні
реакції клітин, тканин та органів макроорганізму. Вірусно-бактері-
альні інфекції, як правило, мають більш тяжкий перебіг і найчастіше
зумовлюють летальне закінчення.
Між гонококами і піхвовими трихомонадами, дизентерійними
амебами і стрептококами виявлено взаємовідношення за типом біо-
ценозу.
У ряді випадків організм, який переніс одну інфекцію, стає спри-
йнятливішим до інших. Так, наприклад, після грипу або кору роз-
вивається пневмонія, після віспи —стафілококова .інфекція. У таких
випадках ідеться про вторинну інфекцію.
Розрізняють вогнищеву й генералізовану інфекцію. При зараженні
стафілококом інфекційний процес може зумовити фурункульоз, якщо ж
збудник проникає в кров, розвивається сепсис. Чергування вогнище-
вої і генералізованої інфекції буває при туберкульозі, сифілісі.
Однією з форм взаємовідношень між збудником і організмом лю-
дини або тварини без клінічних проявів захворювання є носій-
с т в о патогенних мікроорганізмів. Можливість носійства збудників
інфекції доведена лише в організмі з низьким рівнем імунітету. За
специфічністю дії носійство має багато спільного з інфекційним про-
цесом. При одних інфекційних захворюваннях виробляється напру-
жений і тривалий постінфекційний імунітет, що виключає носійство
(натуральна і вітряна віспа та ін.), при інших — слабко напружений
постінфекційний імунітет, що зумовлює збереження збудника в орга-
нізмі у формі носійства (черевний тиф, паратифи, дизентерія, амебіаз,
скарлатина, дифтерія, менінгіт та ін.).
Носійство розглядають як особливу форму імунологічної толерант-
ності організму (див. с. 157). Виходячи з цього положення, носіїв
лікують введенням в організм препаратів, які стимулюють вироб-
лення імунітету в бажаному напрямі.
Велике практичне значення має носійство збудників вірусних
інфекцій. Носійство вірусів герпесу і ретровірусів триває все життя,
у період загострення віруси герпесу можуть передаватися горизон-
тально — від хворого здоровим.
Важливу роль у боротьбі з носійством відіграє підбір і застосу-
вання активних мікроорганізмів — антагоністів нормальної мікрофлори
з вираженою властивістю пригнічувати розвиток патогенних видів.
Носійство тривалістю до 3 місяців вважають гострим, а понад цей
строк — хронічним. Тривале носійство (роками й десятиліттями)
описане при черевному тифі, паратифах А і В. Можливе носійство
і в здорових осіб, які контактували з хворими на дифтерію, менінгіт,
черевний тиф, холеру, амебіаз і поліомієліт.
Реінфекція — повторне зараження тим же видом мікроорга-
нізмів, який спричинив захворювання (гонорея, сифіліс та ін.), що за-
вершилося видужанням.
135
СуперінфекиІя — повторне зараження організму, в якого
не закінчилось основне захворювання. Суперінфекція може бути при
багатьох інфекційних захворюваннях з гострим і хронічним пере-
бігом.
Рецидив — повернення симптомів того самого захворювання
(поворотний, черевний тиф, паратифи та ін.). Певне значення у ви-
никненні рецидивів має низький рівень імунологічної активності
організму в період захворювання і видужання.
За характером зараження інфекційні захворювання поділяються
на екзо- й ендогенні. При екзогенних інфекціях збудник проникає
в макроорганізм іззовні — від хворих і носіїв, а також через заражені
харчові продукти, воду, предмети, повітря, грунт і т. д. Ендогенні
захворювання, або аутоінфекції, виникають в результаті активування
власних мікроорганізмів (мікрофлора шкіри, слизових оболонок,
дихальних шляхів, травного каналу, сечостатевих органів, кон’юнк-
тиви), порушення відносної сталості внутрішнього середовища мак-
роорганізму, впливу зовнішніх факторів та соціальних умов.
Стан аутоінфекції — дуже поширене явище. Так, мікрофлора
верхніх дихальних шляхів при переохолодженні організму може
спричинити запальні процеси. Досить часто спостерігається розвиток
герпесу, вірус якого в організмі за звичайних умов неактивний, але
при охолодженні, менструації, порушенні режиму харчування може
спричинити інфекційний процес. Певну роль в активації нормальної
мікрофлори відіграє променева хвороба, що супроводиться явищами
бактеріемії. Опромінювання призводить до зниження бактерицидних
властивостей крові, зменшення вироблення антитіл, пригнічення
фагоцитарної активності, зниження опірності організму.
У ряді випадків до аутоінфекцій можуть бути віднесені назофарин-
гіт, ангіна, апендицит, кон’юнктивіт, гнійні ураження шкіри (пусту-
ли), отит, холецистит, остеомієліт та ін.
При туберкульозі первинне зараження є екзогенним, але збудник
може тривалий час бути в організмі, не спричиняючи захворювання;
при виникненні несприятливих для макроорганізму умов прихована,
латентна, форма захворювання переходить у явну, типову, спричи-
няючи рецидиви.
Розповсюдження інфекційних захворювань. За характером розпо-
всюдження інфекційні захворювання можуть бути спорадич-
ними (окремі випадки інфекції, що спостерігаються у місцевості
протягом певного відрізка часу). При значному перевищенні рівня за-
хворюваності на інфекцію, яка звичайно спостерігається на певній
території, кажуть про епідемію (або епіозоотію серед тварин).
У тих випадках, коли епідемія досягає надзвичайно великих розмірів
у тій чи іншій країні або охоплює цілі країни і навіть континенти,
її називають пандемією. У середньовіччя не раз спостерігались
пандемії чуми. З 1817 по 1925 р.було шість па йдем і й холери, а з 1961—
1963 рр. почалась сьома пандемія цього захворювання. У 1918—1919рр.
усі країни світу охопила пандемія грипу (іспанка), під час якої пере-
хворіло понад 500 млн і загинуло 20 млн чоловік. Наступна дуже ве-
лика пандемія грипу була в 1957 р., коли перехворіло в усьому світі
136
1 млрд. чоловік. У 1972—1973 рр. вірус грипу спричинив ще одну
пандемію, яка охопила 2,5 млрд чоловік.
Грізне вірусне захворювання — ВІЛ-інфекція, або СНІД, охоплює
останнім часом населення багатьох країн світу. Захворювання наби-
рає характеру пандемії, супроводиться високою летальністю (40—
50 %), уражує головним чином людей віком 30—40 років.
Особливою формою розповсюдження інфекційних захворювань є
ендемія, коли в якійсь місцевості постійно спостерігається захво-
рюваність на певну інфекцію (жовта гарячка, кліщові і комарині
енцефаліти, кліщові рикетсіози, геморагічні гарячки, лейшманіози,
флеботомна гарячка, туляремія, амебіаз та ін.). На противагу енде-
мічним захворюванням є екзотичні інфекції, які завозяться з інших
країн (холера, малярія та ін.).
Захворюваність на деякі інфекції, особливо вірусні, може періодич-
но (через кілька років) зростати. Періодичність епідемій пояснюється
мінливістю антигенної структури збудника, головним чином в резуль-
таті мутацій, а також зміною імунної групи населення неімунною.
Захворюваність на якусь інфекцію визначається кількістю захво-
рілих протягом року на 10 000 або 100 000 чоловік населення; смерт-
ність — кількістю померлих від цього захворювання на 100 000 чо-
ловік населення; летальність — кількістю померлих на 100 захворі-
лих, виражається у відсотках.
Захворюваність на різні інфекції протягом останніх 60—65 років
різко знизилась. Серед причин смертності інфекційні захворювання
посідають п’яте місце після порушень функції органів кровообігу,
злоякісних пухлин, ураження судин мозку і захворювань органів
дихання. Однак за поширеністю інфекційні захворювання посідають
друге місце після порушень функції органів кровообігу.
Беручи до уваги потребу розумного використання досягнень
науки і техніки для розробки ефективних методів і засобів боротьби
з інфекційними захворюваннями, створення умов праці і побуту, які
забезпечують збереження здоров’я населення і збільшення тривалості
життя, XXVI сесія Генеральної Асамблеї ООН у 1972 р. прийняла
рішення про заборону розробки, виробництва і нагромадження бак-
теріологічної (біологічної) зброї.
ВЧЕННЯ ПРО ІМУНІТЕТ
Під терміном «імунітет» (від лат. іттипііаз — звільнення, позбав-
лення чогось) розуміють несприйнятливість (резистентність) організ-
му до інфекційних і неінфекційних агентів, яким властива генетична
гетерогенність. Організми тварин і людини дуже точно диференціюють
«своє» і «чуже», завдяки чому забезпечується захист не тільки від
проникнення патогенних мікроорганізмів, а й від чужорідних білків,
полісахаридів, ліпополісахаридів та інших речовин.
Наука, яка вивчає питання імунітету, називається Імунологією;
це самостійна наукова дисципліна, що розглядає широке коло біоло-
гічних явищ. Виділяють інфекційну і пеінфекційпу імунологію.
137
Інфекційна Імунологія вивчає механізми несприйнятливості до
інфекційних захворювань; роль клітинних і гуморальних факторів
у формуванні імунітету, молекулярну структуру і біосинтез антитіл,
будову їх активних центрів, хімічну структуру лімфоцитів, макрофа-
гів та їх взаємодію; розробляє і вдосконалює специфічні методи тера-
пії, діагностики і профілактики інфекційних захворювань.
До неінфекційної імунології відносять імуногенетику,
яка виявляє закономірності успадкування антигенів клітин і тканин,
здійснює генетичний контроль імунних реакцій; імуноморфоло-
гію, що досліджує імунологічні прояви на субклітинному, клітин-
ному і тканинному рівнях; трансплантаційну імуноло-
г і ю, яка вивчає імунологічну несумісність тканин, механізми від-
торгнення трансплантантів, шляхи подолання тканинної несумісності;
імунопатологію, яка визначає роль імунних механізмів
у виникненні і розвитку низки захворювань; і м у но ге м а то л о-
г і ю, яка досліджує закономірності успадкування хвороб крові; і м у-
нологію онтогенезу, яка розкриває імунологічні меха-
нізми в процесі індивідуального розвитку і генетичної сталості внут-
рішнього середовища організму.
ОСНОВНІ ФАКТОРИ ЗАХИСТУ ОРГАНІЗМУ
Фактори захисту організму від інфекційних агентів та інших
чужорідних речовин поділяють на неспецифічні і специфічні.
До неспецифічних факторів належать механічні, фізико-хімічні,
клітинні, гуморальні, а також фізіологічні захисні реакції, які за-
безпечують збереження сталості внутрішнього середовища і віднов-
лення порушених функцій макроорганізму.
Неспецифічним фактором захисту є природжений (видовий, або
спадковий) імунітет — несприйнятливість організму до певних пато-
генних агентів, яка передається спадково і властива певному виду.
Набутий імунітет належить до специфічних факторів захисту від
генетично чужорідних субстанцій (антигенів); здійснюється імунною
системою організму.
НЕСПЕЦИФІЧНА РЕЗИСТЕНТНІСТЬ
Неспецифічна резистентність організму зумовлена такими факто-
рами захисту, як бар’єрна функція шкіри, слизових оболонок, лімфа-
тичних вузлів, бактерицидні речовини рідин організму (слина,сиро-
ватка крові та ін.), видільна функція, температурна реакція та ін.
Чужорідні тіла і речовини знешкоджуються в основному механічними
або фізико-хімічними діяннями.
Першим захисним бар'єром на шляху проникнення бактерій в орга-
нізм є шкіра. У нормальному, неушкодженому стані її захисна фун-
кція реалізується за допомогою пов’язаних між собою гормональних
і клітинних механізмів. Гормони шкіри активізують Т-лімфоцити,
які руйнують гетерогенні речовини (бактерії, віруси, онкогени).
Шкіра здорової людини згубно діє на низку бактерій (гемолітичний
138
стрептокок, сальмонели черевного тифу, паратифів та ін.). Кисле
середовище поту пов’язане з наявністю в ньому оцтової, молочної,
жирних кислот, що мають бактерицидну дію на багато мікроорганіз-
мів. Миття рук сприяє не тільки механічному видаленню мікроорга-
нізмів з поверхні шкіри, а й збільшенню її бактерицидних властиво-
востей.
Захисні функції мають слизові оболонки очей, носа, рота, шлунка
та інших органів. Подібно до шкіри, антибактеріальні функції слизо-
вих оболонок зумовлені непроникністю їх для різних мікроорганізмів
і бактерицидним діянням секретів. У слізній рідині, мокротинні,
слині, крові, молоці, тканинах і органах є лізоцим, що являє
собою ацетилмурамідазу, а також секреторний імуногло-
б у л і н А. Бактерії, які проникають у слизові оболонки, невпинно
знищуються дією лізоциму. Носовий слиз бактерицидний для бага-
тьох збудників. Нестача лізоциму у слізній рідині призводить до
ураження рогівки; загоєння ран при зализуванні їх тваринами пов’я-
зане із внесенням у них лізоциму.
Є й інші інгібітори, що виробляються клітинами органів і тканин
і мають властивість пригнічувати мікроорганізми. Певне значення
у неспецифічній резистентності має гіалуронова кислота,
яка запобігає проникненню збудників у тканини й органи. Дуже вира-
жені бактерицидні властивості щодо багатьох збудників, особливо
мікроорганізмів, які спричиняють кишкові інфекції і харчові токсико-
інфекції, має шлунковий сік.
Якщо мікроорганізм долає бар’єр, створений шкірою і слизовими
оболонками, захисну функцію виконують лімфатичні вузли, в яких
затримуються і знешкоджуються патогенні бактерії. У лімфатичних
вузлах розвивається запалення, що згубно діє на збудників
інфекційних захворювань.
Запальна реакція характеризується вивільненням із тканин різ-
них речовин (лейкотоксини, лейкопенічний фактор, гістамін, серотонін
та ін.), під впливом яких активуються лейкоцити; скупчення їх у зоні
запалення призводить до утворення захисного валу, який не дає роз-
повсюджуватись бактеріям у тканині, крові й органах. Запалення
зумовлює підвищення температури тіла, виникнення ацидозу й гіпок-
сії, що згубно діють на мікроорганізми.
Могутнім механізмом, що призводить до звільнення організму
від чужорідних живих тіл і речовин, є ендоцитоз, який поділяють на
три типи: фагоцитоз, піноцитоз, ендоцитоз, опосередкований рецепто-
рами (див. рис. 39).
Фагоцитоз належить до найдавніших форм захисту організму
і являє собою активне поглинання й перетравлювання клітинами
живих або вбитих мікроорганізмів чи інших сторонніх частинок,
що потрапили до нього.
І. І. Мечников та його учні довели, що фагоцитоз дуже поширений
у природі. Клітини, які можуть здійснювати фагоцитоз, І. І.Мечников
поіітив на м і к р о- і макрофаги.
До мікрофагів віднесені гранулоцити (нейтрофільні і еозинофіль-
ні); вони першими проникають у вогнище запалення. Макрофаги
139
а
Рис. 38 Завершений (а) і незавершений (б) фагоцитоз
б
поділяють на рухливі (моноцити крові, полібласти, гістіоцити та ін.)
і нерухомі (клітини селезінки, лімфатичної тканини, зірчасті ретикуло-
ендотеліоцити печінки, ендотелій кровоносних судин та ін.).
Усі клітини, що мають високу фагоцитарну активність, виділені
в систему мононуклеарних фагоцитів, яка
складається із клітин-попередників і промоноцитів кісткового мозку,
моноцитів крові та макрофагів, що походять із них.
Фагоцитоз має кілька стадій: розпізнавання фагоцитами об’єкта
фагоцитозу; поглинання або захоплення мікроорганізмів цитоплазмою
фагоцитів; секрецію біологічно активних речовин (медіаторів); внут-
рішньоклітинну інактивацію мікроорганізмів, ферментативне пере-
травлення їх і видалення решти бактеріальних елементів, що реалізу-
ються з участю комплементу (поліпептиду СЗ) і проггердину.
У механізмі завершеного фагоцитозу важливу роль відіграють
катіонні білки і лізосоми фагоцитів — внутрішньоцитоплазматичні
утворення, що містять понад 80 ферментів, які беруть участь у пере-
травлюванні фагоцитованих об’єктів. При цьому спостерігаються
різні зміни мікроорганізмів: утворення зернистості у холерних вібрі-
онів, розбухання паличок черевного тифу, фрагментація коринебак-
терій дифтерії, роз’їдання бацил сибірки, здуття у коків і т. д. Надалі
відбувається повне руйнування фагоцитованих мікроорганізмів, тобто
настає завершений фагоцитоз (рис. 38, а).
При деяких інфекціях (гонорея, туберкульоз, лепра, лейшманіоз,
коклюш, черевний тиф, туляремія, бруцельоз, мікози) відбувається
незавершений фагоцитоз (рис. 38, б), при якому мікроорганізми по-
глинаються фагоцитами, але не гинуть і не перетравлюються, а іноді
й розмножуються.
Можливий і третій наслідок поглинання фагоцитами мікроорганіз-
мів — виштовхування. Крім названих захисних властивостей фаго-
цитів, гранулоцити і мікрофаги виділяють у навколишнє середовище
цитоцидні речовини, які руйнують нефагоцитовані мік-
роорганізми.
До факторів, які посилюють фагоцитоз, належать солі кальцію,
магнію, електроліти, комплемент, антитіла (опсоніни), лімфокіни,
інтерферон, гістамін, пірогенні речовини (що мають властивість під-
140
Рис. 39. Схематичне зображення типів ендоцитозу. При фагоцитозі (ліворуч)
цитоплазматична мембрана (1) клітини зв’нзуе крупну частинку, наприклад
бактерію, обволікуе її і втягує всередину клітини. При піноцитозі (в центрі) крап-
лина позаклітинної рідини оточується ділянкою цитоплазматичної мембрани, що
потім «відбруньковується:», стаючи везикулою. У ній міститься ця рідина з роз-
чиненими речовинами Опосередкований рецепторами ендоцитоз (праворуч) є
специфічним захопленням клітинами макромолекул або частинок: ліганд (2)
зв’язується із специфічним рецептором (3). що ініціює втягування ділянки цито-
плазматичної мембрани, яка несе комплекс ліганд — рецептор При цьому утво-
рюються везикули, і ліганд, що міститься в них, виявляєтьсн всередині клітини.
(За А. Дотрі— Варса, X. Ф. Лодіш, 1988).
вищуваги температуру тканин і всього організму). В імунному орга-
нізмі фагоцитоз відбувається активніше, ніж у неімунному.
Токсини і капсульні речовини бактерій, лейкоцидин, муцини,
агресини, кортикостероїди, серотонін, аміназин, деякі десенсибілізу-
ючі речовини, холестерин, хінін, алкалоїди пригнічують фагоцитоз.
Піноцитоз — поглинання клітиною із навколишнього середовища
краплинок рідини або розчинів колоїдних речовин. Він можливий
у найпростіших (амеби), клітин різних тканин тварин і людини
(рис. 39)
Ендоцитоз, опосередкований рецепторами, відрізняється од фаго-
цитозу і піноцитозу тим, що сорбовані на клітинній поверхні речови-
ни транспортуються і залишаються у везикулі всередині клітини,
а рецептори, які їх зв’язують, знову з’являються на поверхні цито-
плазми клітин і виконують свої функції (див. рис. 39)
Видільна функція нирок, дихальних шляхів, шлунка, кишок,
молочних, слинних і потових залоз, а також інших органів є проявом
неспецифічної резистентності, сприяє звільненню організму від різних
шкідливих факторів.
Могутню антитоксичну функцію має печінка, де окисленням,
відновленням, метилюванням та іншими хімічними реакціями зне-
шкоджуються токсичні речовини, що надходять в організм із навко-
лишнього середовища.
При багатьох інфекційних захворюваннях виникає розлад крово-
обігу внаслідок порушення тонусу артеріол і зумовленого ним різкого
зниження кров’яного тиску. Рефлекторне підвищення кров’яного
тиску — захисний механізм, спрямований не на знешкодження мікро-
організмів або їх токсинів, а на відновлення порушеного тонусу кро-
воносних судин.
141
До неспецифічних захисних реакцій організму можна віднести
стрес. Фактори, які спричиняють стрес, Г. Сельє назвав с т р е с о-
р а м и. Ними можуть бути високі і низькі температури, ультрафіоле-
тове й іонізуюче випромінювання, патогенні мікроорганізми, їх
токсини та інші агенти, що мають властивість спричиняти подразнення
організму.
Адаптаційний синдром може бути генералізованим і місцевим.
Він зумовлений дією гіпофізарно-адренокортикальної системи, яка
функціонально зв’язана з вегетативною нервовою системою. Під впли-
вом загального або місцевого стресора гіпофіз починає посилено виді-
ляти кортикотропін, який стимулює функцію надниркових залоз —
посилює виділення ними протизапального гормону типу кортизону,
що знижує реактивність сполучної тканини, пригнічує захисно-за-
пальну реакцію і вироблення антитіл плазматичними клітинами;
гіпофіз виділяє також гормон соматотропін, який, навпаки, підвищує
реактивність сполучної тканини, активує запальний процес.
Деякі захисні функції організму регулюються олігопепти-
д а м и (ендорфіни, енкефаліни) — біологічно активними речовинами
ендогенного походження, які виробляються клітинами мозку, підви-
щують стійкість до патогенних мікроорганізмів, збільшують ефек-
тивність вакцин і пригнічують онкогенез.
Доведено існування стану ареактивності клітин,
під впливом якої відбуваються складні й різноманітні зміни, спрямо-
вані на підтримання нормального рівня кровообігу, дихання, тепло-
обміну та інших функцій організму. Однією з причин ареактивності
є відсутність на поверхні клітин рецепторів, які мають властивість
взаємодіяти з патогенним агентом.
Певне значення у здійсненні захисних реакцій макроорганізму на-
дається інтерференції бактерій — взаємодії, при якій
один вид бактерій пригнічує репродукцію іншого виду і перебіг спри-
чинюваного ним інфекційного процесу. Доведено, що при зараженні
бруцелами у тварин розвивається несприйнятливість до бацил сибірки.
Інтерференція є між бруцелами і бактеріями туляремії, мікобактері-
ями туберкульозу і збудниками чуми, мікобактеріями туберкульозу
і бацилами сибірки. Можливо, при інтерференції бактерій блокуються
най чутливіші клітини тканин, що створює несприятливі умови для
існування одного з мікроорганізмів.
Під інтерференцією вірусів розуміють антагоні-
стичну або інгібіторну дію одного вірусу або його компонентів на
репродукцію іншого вірусу. Перший вірус називають інтерферуючим,
другий — інтерферованим. Механізм інтерференції пояснюється кон-
куренцією між ними за клітинні рецептори, внутрішньоклітинні суб-
страти, а також блокуванням функції РНК вірусу, що інтерферується.
Інтерференція може бути гомологічною, коли вона відбувається
між штамами одного й того самого вірусу, і гетерологічною, якщо
взаємодіють віруси різних видів. Інтерференція можлива між інфек-
ційними й онкогеннимн вірусами, між вірусами і хламідіями, віру-
сами і рикетсіями.
142
Гомологічна і гетерологічна інтерференція — дуже поширене яви-
ще, вона спостерігається і при взаємодії вакцинних атенуйованих
штамів з вірусами грипу, поліомієліту, сказу та інших захворювань.
Важливу роль у захисних реакціях організму при вірусних,
бактеріальних інфекціях і злоякісних пухлинах відіграє інтерферон,
відкритий у 1957 р. Л. Айзексом та І. Лінденманом. Це глікопротеїд
з молекулярною масою 20—ЗО кілодальтон, не чутливий до діяння
нуклеази і ліпази, стійкий проти коливань рН; інактивується протеолі-
тичними ферментами—трипсином і пепсином. Інтерферон синтезує-
ться лімфоцитами, макрофагами, клітинами лімфатичних вузлів, ха-
рактеризується вираженою видовою специфічністю.
Людський інтерферон поділяють на три імунологічно різних типи—
а-, 0- і у-; а-інтерферон (лейкоцитарний) виробляється переважно
лімфоцитами крові і лімфобластами; 0-інтерферон (фібробластний)
добуто із клітин сполучної тканини; у-інтерферон (імунний) синтезує-
ться імунокомпетентними Т-клітинами.
Лімфоцитарний і фібробластний інтерферони віднесені до інтерфе-
рону І типу, а імунний—до II типу. Вони різняться антигенними
властивостями і стійкістю до рН середовища. Інтерферон І типу стій-
кий до рН 2,0, а інтерферон II типу нестійкий.
В умовах іп уііго інтерферон репродукується як у первинних,
диплоїдних, так і в перещеплюваних клітинах фібробластичного й епі-
теліального типу.
Індукторами синтезу інтерферону (інтерфероногенами) є віруси,
бактерії, найпростіші, ендотоксини, екстракти грибів і рослин, синте-
тичні сполуки, анатоксини та ін. Утворення інтерферону може бути
посилене діянням у- і ультрафіолетового випромінювання, різними
лікарськими засобами (вітаміни, гормони, антибіотики та ін.).
Синтез інтерферону відбувається поетапно: під впливом індукторів
у клітинах пригнічуються гени інтерферону, потім відбувається
транскрипція і трансляція. Гени інтерферону людини локалізовані
в 2, 5, 9 і 13-й хромосомах; антивірусна активність інтерферону —
у 16 і 21-й хромосомах клітин організму людини.
Інтерферон пригнічує репродукцію вірусів, ріст і розмноження
хламідій, рикетсій, бактерій, грибів, найпростіших, пухлинних клі-
тин; він має антитоксичну дію і цитотоксичну активність, стимулює
фагоцитоз, пригнічує гіперчутливість уповільненого типу.
Активність інтерферону визначають через 78 год після зараження
клітин вірусами за результатами цитопатичної дії у пр< бірках або за
даними пригнічення бляшок (негативних колоній вірусу за Дулбекко).
Сучасні способи виробництва інтерферону дають змогу мати достат-
ню кількість дуже ефективного засобу лікування при вірусних, бак-
теріальних інфекційних захворюваннях, злоякісних пухлинах, а та-
кож їх запобігання. За допомогою генної інженерії синтезований ген
інтерферону людини вводиться у клітини бактерій (Е. сої і, В. зиЬііІ із
та ін.), дріжджові клітини, які стають його продуцентами.
Певну роль у неспецифічній резистентності організму людини віді-
грає нормальна мікрофлора, яка в одних випадках про-
являє себе щодо патогенних мікроорганізмів як антагоніст, в інших —
143
як синергіст. Наприклад, молочнокислі бактерії підтримують кисле
середовище піхви у жінок і тим самим забезпечують елімінацію випад-
кової мікрофлори, у тому числі стафілококів, стрептококів тощо.
Численні інгібітори, що е в різних тканинах і органах, генетично
детерміновані і передаються з покоління в покоління. Вони наділя-
ють організм захисною дією проти збудників та їх токсичних ре-
човин.
Гуморальні неспецифічні фактори резистентності є пізнішою фор-
мою захисту, властивою хребетним. Згубно діє на бактерії сироватка
крові. Бактерицидну речовину свіжої нормальної сироватки крові
спочатку назвали комплементом (лат. сотріетепіит — доповнення).
У зв’язку з тим що комплемент розчиняє деякі види бактерій і клі-
тин, його іноді називають лізином (а-лізин). Комплемент — складний
комплекс білків, який є у свіжій сироватці крові тварин і людини.
Він складається з десяти фракцій — Сі, С2...С10, кожна з них має
певну властивість: бере участь у специфічних імунологічних реакціях,
спричиняє лізис бактерій, еритроцитів, посилює фагоцитоз, запалення.
Найбільше комплементу виявлено у сироватці крові морської свинки.
При інкубації сироватки крові при температурі 56 °С протягом ЗО хв
комплемент інактивується; він також чутливий до діяння світла, лугів
і кислот.
Могутнім неспецифічним фактором захисту організму є система
пропердину. Це глобулін сироватки крові всіх ссавців, що мі-
стять окремі компоненти комплементу (С2, СЗ) та іони магнію. Він
є фактором природного імунітету, знешкоджує багато бактерій і віру-
сів, стимулює фагоцитоз.
Бактерицидні властивості щодо низки мікроорганізмів (бацили
сибірки, збудники правця, ботулізму, анаеробної інфекції, дифтерії,
стафілококи, стрептококи, бруцели та ін.) має р-л і з и н, що є термо-
стійкою фракцією нормальної сироватки крові, яка руйнується від
діяння температури 63—70 °С та ультрафіолетового випромінювання.
3 еритроцитів людини виділено речовину — еритрин, яка ха-
рактеризується бактерицидною дією щодо бактерій дифтерії.
Із крові людей з підвищеною температурою тіла виділено Х-л і-
зин, який розчиняє головним чином грамнегативні мікроорганізми
(менінгококи, деякі сальмонели) і меншою мірою — грампозитивні.
Х-лізин діє без участі комплементу, термостабільний (витримує тем-
пературу 68—100 °С).
Бактерицидні властивості мають л е й к і н и — термостабільні
речовини (руйнуються при температурі 75—80 °С), що вивільняються
з лейкоцитів. Лейкіни знешкоджують як грампозитивні, так і грамне-
гативні бактерії.
До неспецифічних захисних гуморальних факторів організму
людини слід віднести С-р еактивний білок. У сироватці
крові здорових людей його небагато, але його вміст значно зростає
у хворих із запальними, неопластичними і некротичними процесами.
Бактерицидні властивості мають складові частини сечі, секрет
передміхурової залози, екстракти ізтканини печінки, мозку, селезінки
та інших органів і тканин.
144
Таким чином, сукупність анатомо-фізіологічних особливостей
організму забезпечує певний ступінь стійкості, утому числі несприйнят-
ливість до деяких мікроорганізмів. Характерною особливістю
цієї форми резистентності є відсутність специфічності.
Неспецифічна резистентність є могутньою системою захисних
реакцій, що забезпечують збереження сталості внутрішнього середо-
вища макроорганізму (гомеостазу), на основі яких у процесі еволюції
сформувалися видовий і набутий імунітет.
СПАДКОВИЙ (ВИДОВИЙ, АБО ПРИРОДЖЕНИЙ) ІМУНІТЕТ
Природжений імунітет — це неспецифічна резистентність, що
властива тому чи іншому виду тварин або людині і передається спад-
ково з покоління в покоління. Прикладом спадкового імунітету може
бути несприйнятливість людей до чуми рогатої худоби, собак, курячої
холери, інфекційної анемії коней. З іншого боку, тварини не хворіють
на багато інфекцій людини — черевний тиф, скарлатину, вітряну віс-
пу, сифіліс, кір та ін.
Спадковий імунітет залежить від фізіологічних та біологічних
особливостей того чи іншого виду організмів, що сформувались у про-
цесі природного відбору, мінливості й генетичної адаптації до умов
зовнішнього середовища.
Помічено, що висока сприйнятливість до інфекційних захворю-
вань бактеріальної і вірусної етіології буває серед видів тварин,їх
популяцій (або у людей), що не зустрічаються з цим збудником в ре-
зультаті екологічної або географічної ізоляції.
Ступінь напруженості спадкового імунітету може бути абсолют-
ним і відносним. Так, наприклад, в організмі пацюків клітини не
мають рецепторів до дифтерійного, а в риб і ящірок — до правцевого
токсину, внаслідок чого вони абсолютно несприйнятливі до названих
токсинів. Імунітет деяких тварин до збудників інфекційних захво-
рювань можна підвищити зміною температури тіла, діянням на орга-
нізм гормонами, імунодепресантами, рентгенівським опромінюван-
ням. Так, якщо в курей знизити, а в жаб підвищити температуру тіла,
то вони стають чутливими до бацил сибірки. У цьому разі кажуть про
відносну несприйнятливість.
Механізм імунітету до інфекційних захворювань грунтується
на відсутності в клітинах організму рецепторів і субстратів, потріб-
них для адсорбції і розмноження збудника, наявності речовин, які
блокують репродукцію патогенних агентів, та властивості макроорга-
нізму синтезувати різні інгібітори у відповідь на проникнення пато-
генних мікроорганізмів.
НАБУТИЙ ІМУНІТЕТ
Численними спостереженнями ще в далеку давнину було встановлено, що
люди, які перенесли чуму, не заражались при доглнді за хворими, ураженими
цим захворюванням.
У різних країнах великого значення надавалось профілактичним заходам,
у тому числі щепленням проти деяких захворювань. Так, жителі Африки з дав-
145
шх-давеи успішно застосовували вакцинацію проти отрути змій; створювали
штучний імунітет проти епідемічного поворотного тифу,епізоотичної плевро-
пневмонії рогатої худоби.
У Китаї за 2000 років до и е. щепили дітей проти віспи. У ряді країн Схо-
ду робили насічки на шкірі передпліччя і вводили в них висушені і розтерті
на порошок віспяні кірочки. У деяких народів Кавказу було прийнято робити
уколи голками, намоченими у віспяному заразному матеріалі.
Проте народні способи відтворення несприйнятливості до інфекційних
захворювань зараженням нерідко ставали причиною виникнення типових за-
хворювань та різного роду ускладнень
Серед населення Англії, Франції, Німеччини для запобігання натуральній
віспі був звичай доручати дітям із подряпинами на шкірі рук доїти корів,
уражених коров’ячою віспою.
Багаторічні спостереження і вивчення Е. Джениером несприйнятливості
до натуральної віспи осіб, які перехворіли на коров'ячу віспу, привели до від-
криття ним у 1796 р. методу віспощеплення, який з 1798 р. почали застосо-
вувати в Англії, а потім і в інших країнах.
У другій половині XIX ст. Л. Пастер і його учні винайшли метод ослаб-
лення збудників курячої холери, сибірки і сказу і довели можливість застосу-
вання цих ослаблених бактерій, що дістали назву вакцин, для специфічної
імунізації, або вакцинації.
Набутий імунітет поділяють на природний і штучний. Природний
імунітет, у свою чергу, поділяють на: 1) активно набутий в результаті
перенесеної, клінічно вираженої або латентної інфекції чи багатора-
зового інфікування без клінічно вираженого захворювання; 2) пасив-
но набутий у немовлят внаслідок передачі антитіл від матері через пла-
центу та з грудним молоком.
Штучно набутий імунітет відтворюється активною або пасивною
імунізацією (див. с. 184).
Набутий імунітет спадково не передається. Він формується щодо
конкретного виду збудника в результаті контакту з ним, тобто він
цілком специфічний.
МЕХАНІЗМИ ІМУННОЇ ВІДПОВІДІ
Відповіддю імунної системи організму на введення генетично чу-
жорідних субстацій (антигенів) є продукція антитіл — імуноглобулі-
нів, що виробляються імунокомпетентними клітинами лімфоїдних
органів.
Лімфоїдні органи поділяються на первинні (центральні) — загру-
динна залоза, кістковий мозок, фабрицієва сумка (у птахів) і вторинні
(периферичні) — селезінка, лімфатичні вузли, одиночні (солітарні)
лімфатичні фолікули слизової оболонки товстої кишки та ін.
Головним компонентом імунної системи організму є лімфоїдна
стовбурна клітина, що генерує утворення клітин-попередників Т-лім-
фоцитів (Т-клітин, тимусзалежних лімфоцитів) і В-лімфоцитів (В-клі-
тин, бурсоцитів), з яких розвиваються популяції імунокомпетентних
Т- і В-лімфоцитів (рис. 40). На Т-клітини припадає 55—60 % загаль-
ної кількості лімфоцитів периферичної крові, на В-клітини — 25—
ЗО %; 10—20 % лімфоцитів не мають ознак Т- або В-лімфоцитів.
Тривалість життя Т-лімфоцитів — місяці і роки, В-лімфоцитів —
кілька діб або тижнів. Клітини-попередники Т-лімфоцитів диференці-
юються у загрудинній залозі. Місцем диференціації клітин-попередни-
146
Рис. 40. Схематичне зображення розвитку імунної відповіді в організмі.
ків В-лімфоцитів у людини є периферичні лімфоїдні органи,у птахів —
фабрицієва сумка (див. рис. 40).
У процесі диференціації клітин-попередників утворюються субпо-
пуляції Т-лімфоцитів: Т-хелпери, Т-супресори, Т-кілери, а також
В-лімфоцитів — клони плазматичних клітин, які продукують імуно-
глобуліни різних класів. Т- і В-лімфоцити різняться між собою мор-
фологічно, вони мають специфічні рецептори, які розпізнають відпо-
відні антигени. Виділено низку клітин, що не можуть бути віднесені до
Т- і В-лімфоцитів, вони дістали назву нульових клітин (Ь-, К-, МК-клі-
тини).
Т- і В-лімфоцити, що пройшли диференціацію, заселяють вторинні
(периферичні) лімфоїдні органи, займаючи у них точно визначені
зони: Т-лімфоцити — Т-зони у периферичних лімфоїдних органах
(паракортикальна зона лімфатичних вузлів, лімфатичні періартеріаль-
ні піхви селезінки, інтрамедулярні простори лімфоїдних фолікулів
слизової оболонки кишок), В-лімфоцити — В-зони (грудна лімфатична
протока, лімфатичні вузли, селезінка, кістковий мозок).
У розвитку імунної відповіді організму на антиген беруть участь
три типи клітин: Т-, В-лімфоцити і макрофаги.
Макрофаги трапляються майже в усіх органах і тканинах (кров,
сполучна тканина, кістковий мозок, печінка, легені, селезінка та
ін.). Вони виробляють лізоцим, інтерферон, цитотоксини, фактори
комплементу (С2, СЗ, С4, С5) та інші речовини.
Першими з цих клітин вступають у контакт з антигеном макрофаги,
переробляючи його на форму, доступну для Т- і В-лімфоцитів. Більша
частина захопленого макрофагами антигену гідролізується, менша,
яка несе антигенну детермінанту, виходить на клітинну поверхню.
Макрофаги, захопивши і переробивши антиген, вступають у кон-
такт (кооперацію) з Т- і В-лімфоцитами, передаючи їм інформацію,
потрібну для здійснення імуногенезу (рис. 41).
Система Т-лімфоцитів забезпечуєкліишнний'імунітет при більшості
вірусних інфекцій, туберкульозі, лепрі, бруцельозі, туляремії, під-
147
Рнс. 41. Взаємодія Т-, В-лімфоцитів і мак-
рофага (М):
а—д — етапи взаємодії.
випіену чутливість упо-
вільненого типу, транс-
плантаційний і протипух-
линний імунітет, імуноло-
гічну толерантність. У ре-
алізації індукції і розвит-
ку імунних реакцій важ-
ливу роль відіграють ін-
терлейкіни і фактори, що
активують макрофаги.
Система В-лімфоцитів
здійснює гуморальний
імунітет проти більшості
бактеріальних інфекцій,
антитоксичний імунітет.
підвищену чутливість негайного типу, атопії та низку аутоімунних
станів.
Антитілотворні клітини виникають із В-лімфоцитів; інші клітини
імунної системи (Т-лімфоцити і макрофаги) — допоміжні, вони кон-
тролюють і регулюють процес утворення антитіл.
Клітинний імунітет характеризується специфічністю і реалізуєть-
ся Т-лімфоцитами. Центральним органом клітинного імунітету є ти-
мус, у якому за допомогою його гормонів відбувається «навчання»
Т-лімфоцитів, що розпізнають антиген, і Т-лімфоцитів, що беруть
участь у знешкоджуванні антигенів. Виявлено чотири фази клітинного
імунітету: 1) зв’язування антигену Т-лімфоцитами; 2) проліферація
Т-лімфоцитів; 3) синтез медіаторів; 4) цитотоксичний ефект.
У клітинному імунітеті беруть участь три субпопуляції клітин
Т-системи: 1) Т-кілери, які детермінують розвиток гіперчутливості
сповільненої дії і трансплантаційний імунітет; 2) Т-хелпери, які допо-
магають В-лімфоцитам трансформуватися в антитілотворні клітини;
3) Т-супресори, які відповідають за розвиток імунологічної толерантно-
сті і продукцію медіаторів (фактор, що пригнічує міграцію макрофагів;
фактор цитотоксичності макрофагів; бластогенні фактори; нейропепти-
ди; хемотаксичні фактори; лімфотоксин; інтерлейкіни 1—III; інтер-
ферон та ін.). Т-лімфоцити, що секретують лімфокіни, регулюють
розвиток і активацію імунокомпетентних клітин. Найважливішою
і заключною ланкою клітинного імунітету є цитотоксичний ефект лім-
фоцитів, що здійснюється за допомогою лімфотоксину.
Цитотоксичні Т-клітини і природні кілери (паіигаї кіііегз) при-
кріплюються до клітин-мішеней (клітини злоякісних пухлин і кліти-
ни, заражені вірусами), виділяють у їх мембрану спеціальний білок
(перфорин), який у присутності іонів кальцію утворює пори діамет-
ром 5—20 нм, через них вміст клітин-мішеней (вода і солі) витікає,
що й призводить до їх загибелі. Такий стан названо е к з о ц и-
і о з о м.
Система В-лімфоцитів складається із трьох основних груп:
1) В-лімфоцитів — попередників антитілотворних клітин, які за
допомогою Т-лімфоцитів (Т-кілерів) забезпечують інтенсивне ви-
148
роблення антитіл; 2) В-супресорів, що є в кістковому мозку, селе-
зінці і лімфатичних вузлах і разом з Т-супресорами відповідають
за розвиток імунологічної толерантності (пригнічують розмножен-
ня і перетворення В-лімфоцитів і Т-лімфоцитів у клітини-ефектори
гуморального і клітинного імунітету); 3) В-кілерів, які, взаємодію-
чи з Рс-фрагментами антитіл (І&6), фіксованих на клітинах транс-
плантата, спричиняють руйнування останніх.
Захисна дія гуморального і клітинного імунітету може проявитися
окремо або одночасно. Так, наприклад, при вірусних захворюваннях,
туберкульозі, лепрі провідну роль відіграє клітинний імунітет, при
правцю, анаеробній інфекції — гуморальний, при дизентерії, гострих
сальмонельозних гастроентеритах — гуморальний і клітинний.
Виявлено і порівняно добре вивчено адоптивний імунітет, який
відтворюється перенесенням лімфоїдної тканини в інтактний організм.
Варіантом адоптивного імунітету є трансфер-реакція, яка
виникає при перенесенні імунних лейкоцитів, сенсибілізованих щодо
антигенів організму. Трансфер-фактор виділений з імунних лейкоци-
тів. При введенні його в організм через 2—7 діб розвивається гіпер-
чутливість уповільненого типу, яка зберігається протягом кількох
місяців.
Функціональна активність Т- і В-лімфоцитів контролюється ге-
нами, зчепленими з головним комплексом гістосумісності МНС (англ.
та}ог НізІосотраІіЬіІііу сотріех), які дають змогу розпізнавати
«своє» і «чуже» і здійснюють імунологічний «нагляд» в організмі.
Усі форми імунологічних реакцій індукуються речовинами, що
дістали назву антигенів.
Антигени
Антигенами називають органічні речовини (білки, поліпептиди,
полісахариди, високомолекулярні нуклеїнові кислоти, комплекси біл-
ків з ліпідами або полісахаридами), які при введенні в організм (під-
шкірно, внутрішньошкірно, нашкірно, у слизові оболонки, внутріш-
ньом’язово, внутрішньоочеревинно, внутрішньовенно, через рот) мо-
жуть спричиняти в ньому розвиток специфічних імунологічних реак-
цій. Антигени характеризуються двома основними властивостями:
1) спричиняють утворення антитіл (антигенність) або сенсибілізацію
лімфоцитів; 2) вступають у взаємодію з відповідними антитілами (анти-
генна специфічність) або сенсибілізованими лімфоцитами.
Антигени характеризуються чужорідністю, імуногенною специфіч-
ністю, колоїдною структурою, розчинністю у рідинах організму.
Розщеплення білка до пептонів, амінокислот, а також денатурація
його в результаті фізичної і хімічної дії призводить до втрати ним
антигенної властивості, а введення у білкову молекулу різних радика-
лів— до втрати видової специфічності. Речовини, що складаються
з лівообертаючих ізомерів амінокислот, спричиняють утворення анти-
тіл, тоді як комплекси, побудовані з правообертаючих ізомерів аміно-
кислот, не мають антигенних функцій.
149
Антигенні властивості мають токсини рослин (рицин, робіи, абрин,
кортин та ін.) і тварин (отрути змій, павуків, скорпіонів, фаланг,
каракуртів, бджіл), ферменти, нативні чужорідні білки, різні клі-
тинні елементи тканин і органів, бактерії та їх токсини, рикетсії,
віруси.
Антигени поділяють на повноцінні і неповноцінні (гаптени).
Повноцінні антигени— речовини, що мають чужорідну інформацію
(білки, сироватки крові, бактерії та їх токсини, рикетсії, віруси, клі-
тинні елементи крові), які спричиняють утворення антитіл або сенси-
білізацію лімфоцитів в організмі і реагують з ними як іп уіуо, так і іп
уііго.
Неповноцінні антигени, або гаптени, не спричиняють утворення
антитіл або сенсибілізації лімфоцитів. До гаптенів належать ліпіди,
стероїди та інші речовини. Додавання до гаптенів навіть незначної
кількості білка, що дістав назву шлепер (нім. хНІеррег — провідник),
надає їм властивостей повноцінних антигенів.
Усі природні білки характеризуються антигенною специфічністю,
яка визначається амінокислотною послідовністю, вторинною і третин-
ною структурою білкової молекули і найбільшою мірою поверхнево
розташованими групами — антигенними детермінантами. Білки, що
належать різним видам тварин, рослин, бактерій, рикетсій і вірусів
(видові антигени), можуть бути диференційовані за допомогою імуноло-
гічних реакцій.
Імунологічна специфічність антигенів пов’язана з детермінантною
групою, що розташована на поверхні антигену у вигляді однієї або
кількох активних ділянок. Детермінантну групу можна виділити
у відносно чистому вигляді, що дає змогу значно підвищити ефектив-
ність вакцинних препаратів.
Антигенна видова специфічність бактерій пов’язана з наявністю
в їх клітинах особливих комплексів полісахаридів.
Поряд з видовими антигенами в особин одного й того самого виду
виявлено групові антигени, що дають змогу, наприклад, поділяти
людей за групами крові, а бактерії — за серогрупами.
У багатьох мікроорганізмів у структурі клітин виявлено антигени,
спільні з антигенами тканин людини. Так, доведена наявність антиге-
нів, спільних для еритроцитів людини і стафілококів, стрептококів,
бактерій чуми, Е. соіі, сальмонел, шигел, вірусів віспи, грнпу та інших
збудників інфекційних захворювань. Такий стан може бути наслідком
антигенної мімікрії або повторень типів біосинтезу у дуже віддалених
видів. Коли антигенні структури хазяїна і збудника подібні між
собою, макроорганізм не може виробляти повноцінний імунітет, у та-
ких випадках захворювання має більш тяжкий перебіг.
Є гетерогенні, або гетерологічні, антигени, виявлені в еритроцитах
у морських свинок, собак, котів, коней, курей, риб, черепах,
але яких немає у кролів, пацюків, качок, мавп і людини. При імуніза-
ції кроля екстрактом з органів морської свинки в його сироватці
крові з’являються антитіла, що реагують не тільки з екстрактом із
цих органів, а й з еритроцитами барана. Отже, в органах морської
свинки й еритроцитах барана є спільний гетерогенний антиген. Це
150
явище пояснюється наявністю близьких за своїм складом ліпідних або
полісахаридних фракцій у різних видів тварин, рослин і мікроорга-
нізмів.
Названі дані відображують закон гомологічних рядів Вавилова
і дуже поширену якісну й кількісну генетичну гетерогенність поліпеп-
тидів у популяціях усіх живих систем планети.
Ізоантигени є в еритроцитах та інших клітинах в індивідуумів
цього виду і наділяють їх генетичним поліморфізмом. Ізоантигени
системи АВО відкрив в еритроцитах людини К. Ландштейнер. Еритро-
цити людини мають рецептори А (група А), В (група В), обидва рецеп-
тори (група АВ) або не мають рецепторів А і В (група О). На поверхні
еритроцитів групи О є також рецептор Н і група О, які позначають як
О(Н).
Рецептори еритроцитів АВО (Н) виявлено не тільки на поверхні
еритроцитів і клітин різних тканин, а й у деяких секретах — слізній
рідині, грудному молоці, спермі, слині, шлунковому соку та ін.
Виявлено антигени еритроцитів М, N. /^N8, ОиИу, Кеіі, Кідд,
ЬиіЬегап та ін., а також резус-фактор.
Різні групи крові було виявлено не тільки в людини, а й у’тварин —
людиноподібних мавп, овець, свиней, коней, котів, собак, кролів,
пацюків, мишей, курей, голубів, риб.
Антигени обов’язково визначають при переливанні крові, а
також трансплантації органів і тканин.
Аутоантигени — речовини, що мають властивість імунізувати
організм, з якого їх добуто. До них належать кришталик ока, сперма,
паращитовидні залози, тканина сім’яних залоз, центральної нервової
системи. За звичайних умов тканина цих органів не стикається з імун-
ною системою організму, тому антитіла до них не утворюються. Однак
при ушкодженні цих тканин аутоантигени можуть всмоктуватись
у кров і спричиняти утворення антитіл, які ушкоджують відповідні
клітини.
У деяких випадках антигенних властивостей можуть набувати шкі-
ра, тканини інших органів (нирок, печінки, легень), змінені під впли-
вом фізичних або хімічних факторів.
Аутоантигени можуть виникати під впливом охолодження, опро-
мінювання, лікарських засобів, вірусних інфекцій, бактеріальних
білків, токсинів та інших факторів.
Антигенна структура бактеріальної клітини. Бактерії — складний
комплекс антигенів, до якого входять високомолекулярні сполуки
білкової природи, біологічно активні специфічні полісахариди та інші
хімічні сполуки. До складу специфічних бактеріальних полісахаридів
входять амінопохідні цукрів, залишки моносахаридів, спиртів
тощо.
У рухливих бактерій розрізняють Н-а н т и г е н и (джгутикові) —
термолабільні, протеїнові, що руйнуються при температурі 56—80 °С,
і О-а н т и г е н и (соматичні) — термостабільні, які складаються
з ліпосахаридів і білка, входять до складу клітинної стінки грамнега-
тивних бактерій (рис. 42) і витримують нагрівання до 80—100 °С.
161
Рис 42 Схематичне зображення антигенної
структури бактеріальної клітини:
І — Оаитиіен; 1— VI іигиген, 3 — джгутики (Н-аити-
ген), 4 — К аигиген
Із вірулентних штамів сальмонел
черевного тифу було виділено відносно
термостабільний полісахаридний комп-
лекс, названий Уі-а нтигеном.
У 8. рпеитопіае, клебсієл пневмонії,
озени, риносклероми антигенна специ-
фічність пов’язана з речовинами капсу-
ли. Капсульні антигени
складаються із складних полісахаридів,
які дають змогу диференціювати бак-
терії на серовари. Так, наприклад, у 8.
рпеитопіае є понад 85 сероварів. У
£• соїі виявлено поверхневі (капсульні) К-антнгени, які е в клітин-
ній стінці і капсулі. За ступенем стійкості проти високої температури
їх поділяють на термолабільні (Ь, В) і термостабільні (А, М).
Повний соматичний антиген бактерій у 8-формі містить полісаха-
ридний гаптен, зумовлює видову специфічність; при переході бактерій
того самого виду в К-форму вони втрачають специфічний полісахарид
і не мають вираженої видової специфічності. Ці особливості антиген-
ної структури беруть до уваги в серологічній діагностиці інфекційних
захворювань, при виробництві вакцин і сироваток.
У бактерій виявлено протективні антигени, які
спричиняють вироблення специфічних антитіл, що знешкоджують
одну з патогенних функцій збудника. їх виявлено в ексудаті карбунку-
ла при сибірці. їх добувають при культивуванні бацил сибірки на тка-
нинах тварин і спеціальних синтетичних живильних середовищах.
Протективні антигени належать до атоксичних термолабільних про-
теїнів, вони мають виражені захисні властивості і можуть бути вико-
ристані для імунізації проти деяких інфекційних захворювань, зокре-
ма сибірки і чуми. Подібні антигени було виявлено у збудників коклю-
шу, бруцельозу, туляремії.
Бактеріальним токсинам також властиві функції антигенів. Екзо-
токсини розглядають як позаклітинні антигени. В результаті обробки
формаліном і діяння температури екзотоксини (анатоксини) втрачають
свої токсичні властивості і майже цілком зберігають антигенні
функції.
Антигенні властивості мають фімбрії, цитоплазматична мембрана,
цитоплазма, ферменти бактерій, рибосоми і ДНК.
Антитіла (імуноглобуліни)
Антитілами називають складні специфічні білки, що утворюються
клітинами лімфоїдних органів хребетних при введенні антигенів
і мають властивість вступати з ними у специфічний зв’язок. Антитіла
з’являються у сироватці крові тварин і людини після перенесеного
152
явного чи прихованого інфекційного захворювання. Антитіла форму-
ються також при імунізації живими (ослабленими), вбитими бакте-
ріями, рикетсіями, вірусами, токсинами, анатоксинами та іншими
антигенами.
Антитіла — це імуноглобуліни сироватки крові людини і тварин;
на них припадає 25 % усіх сироваткових білків.
Імуноглобуліни також виявляють у сироватці крові людини і тва-
рин, які не перехворіли на інфекційні захворювання і не піддавались
імунізації. Вважають, що імуноглобуліни утворюються під впливом
нормальної мікрофлори в процесі розвитку організму. Наприклад,
через відсутність нормальних імуноглобулінів молоді отруйні змії
деяких видів чутливі до власної отрути; у дорослих змій є нормальні
імуноглобуліни, які нейтралізують їх власну отруту.
До нормальних антитіл належать ізогемаглютиніни
(див. рис. 52), які утворюються без попереднього введення антигену:
у людей з групою крові А у сироватці є Р-аглютиніни, а в осіб з гру-
пою крові О—а- і Р-аглютиніни. їх використовують для визначення
групи крові.
Імуноглобуліни до одного й того самого антигену, що продуку-
ються в крові різних видів тварин, так само як і відповідні нормальні
глобуліни, неоднакові за своїм хімічним складом.
Виділено імуноглобуліни різних класів і підкласів, вивчена їх
будова, розмір молекул, активні центри.
За фізико-хімічними властивостями імуноглобуліни поділяють на
п’ять класів: І§М, І£б, І§А, І&Е, І&О (табл. 10).
Таблиця 10. Фізико-хімічиа характеристика імуноглобулінів
Клас імуно- глобулін Ів Рівень у крові, г/л Молекулярна Константа седиментації Вміст вугле- водів, % Вміст ланцю- гів (Н 1 Ь)
ис 6—15 1,5-10» 7 3 2Н2Ь
І?М 0,5-1,8 9-Ю6 19 12 5Н5Ь
ІЄА 1-5 1.7-106 7-13 12 2Н2Ь
ІЄЕ 2-10-5—2.Ю-4 1,9-105 7,4—11 12 2Н2Ь
ІйО 3.10-3—4.10-г 1,8-10» 7 12 2 Н2Ь
Молекула імуноглобуліну складається з двох пар неідентичних
поліпелтидних ланцюгів: однієї пари важких — Н (англ. кеаоу)
і однієї пари легких — Ь (англ. (рис. 43).
Рис. 43. Структура молекули
імуноглобуліну:
II — важкі ланцюги; 1. — легкі лап
цюги Ас активні центри, В — паріа
бі лана ділянка; 5 — 5 — дисульфід-
* / 5
Миіііиіі-і-
Важкі і легкі ланцюги побудовані з пептидів (доменів), що віді-
грають важливу роль у структурі і функції антитіл. 1_- і Н-ланцюги
з’єднуються дисульфідними зв’язками (містками). Більшість молекул
антитіл складаються з димерів (ЬН)2, менша частина — з полімерів
(ЬН)2П- При діянні на антитіла папаїном вони розпадаються на три
фрагменти: Еаь—одновалентний, що активно сполучається з антиге-
ном; Ес — який не взаємодіє з антигеном і складається з С-кінцевих
ділянок важких ланцюгів; Е<і — ділянку важкого ланцюга, що вхо-
дить до Раь-фрагмента.
Активні центри (Еаь-фрагменти) антитіл — це порожнини, що
утворюються легкими і важкими ланцюгами, які специфічно реагують
з антигенними детермінантами. Більшість імуноглобулінів (І§6,
І^А, І§Е) мають два активних центри (бівалентні, повні). Виявлено
антитіла з одним центром (моновалентні, неповні, блокуючі).
Специфічність активних центрів визначається послідовністю амі-
нокислот у кінцевих, або варіабельних, ділянках важких і легких
ланцюгів. Друга частина молекули імуноглобуліну (Ес-фрагмент)
здійснює фіксацію комплементу на комплексі антиген — антитіло.
З’ясовано генетичні механізми, що зумовлюють різноманітність
імуноглобулінів певних класів. Виявлено варіанти імуноглобулінів,
або а л о т и п и.
Будова імуноглобулінів контролюється двома групами генів, ло-
калізованих у різних локусах: одна група генів контролює синтез
важких ланцюгів, друга—легких. Будову варіабельних ділянок
детермінують У-гени, а стабільної ділянки активного центра молекули
імуноглобуліну — С-гени.
Імуноглобуліни класу О (Ц6) (рис. 44) становлять основну масу
(близько 75 %) імуноглобулінів нормальної сироватки крові люди-
ни, легко проходять через плаценту. Вони найактивніше зв’язують
розчинні антигени бактерій, екзотоксини, віруси. На основі анти-
генних відмінностей Н-ланцюгів І£б поділяють на 4 підкласи: І§61
І£б2, І£бЗ, Ій64.
Рис. 45. Будова молекули І^М.
154
Імуиоглобуліни класу М (І§М) (рис. 45) першими з’являються після
імунізації або антигенної стимуляції, діють на грамнегативні бакте-
рії, що проникли в кров, активізують фагоцитоз. Вони становлять
близько 10 % імуноглобулінів нормальної сироватки крові людини
й утворюються в ембріональному періоді. Високий ВМІСТ І£М свід-
чить про внутрішньоутробну інфекцію. Вони в багато раз активніші
ВІД І£б, оскільки містять близько 10 активних центрів.
Імуиоглобуліни класу А (І^А) поділяють на два варіанти: І§АС —
сироватковий і І§А8 —секреторний, які відрізняються один від одного
фізико-хімічними властивостями, місцем синтезу і виконуваною
функцією.
Секреторний І^А виробляється лімфоїдними клітинами слизових
оболонок дихальних шляхів, порожнини рота, кишок, сечових шля-
хів; є в молозиві, слині, слізній рідині, слизу кишок, поту. Він вико-
нує захисну функцію при кишкових і респіраторних інфекціях, зне-
шкоджуючи бактерії, віруси; має виражену бактерицидність, опсоні-
зуючу дію. Сироваткові І§А знешкоджують бактерії і їх токсини, що
проникли в кров. Однак за силою дії І§АС слабші, ніж І§А8. На І^АС
припадає 10—15 %.
Імуиоглобуліни класу Е (І§Е) — сенсибілізуючі антитіла (реагіни);
вони не проходять через плаценту, мають властивість приєднуватись
за допомогою Рс-фрагмента до тканинних базофілів, відіграють важ-
ливу роль у розвитку алергічних реакцій негайного типу (анафілак-
сія, бронхіальна астма, алергічний риніт, атопічна екзема та ін.).
Функцію до кінця не з’ясовано. Вважають, що вони зумов-
люють низку алергічних станів при захворюваннях щитовидної
залози. До цього класу належать антитіла проти пеніциліну, інсуліну,
ДНК та інших антигенів. виявлено на поверхні В-лімфоцитів
у крові з судин пупкового канатика і на клітинах при лімфобластному
лейкозі. Вони не фіксують комплемент, не проходять через плаценту.
Вміст збільшується при деяких захворюваннях шкіри. І§Е і
становлять близько 0,2 %.
Велике значення у продукції імуноглобулінів має спадкова зумов-
леність вираженості імунної відповіді. В організмів різних генотипів
один і той самий антиген спричиняє імунну відповідь різної сили —
від нуля до дуже високого рівня.
Ознака вираженості імунної відповіді успадковується як домінант-
на, не зчеплена з статтю. Ступінь вираженості імунної відповіді кодує-
ться Іг—імунореактивними генами (англ. іттипе гезропзе §епев),
що визначають кількість синтезованих антитіл проти тих чи інших
антигенів. Виявлено понад 20 Іг-генів. В утворенні антитіл певну роль
відіграють також структурні гени, від яких залежить виникнення
активних центрів антитіл, що мають специфічність і є складовою ча-
стиною імуноглобулінів.
Динаміка вироблення антитіл, їх накопичення і зникнення мають
певні характеристики; при цьому розрізняють первинну і вторинну
імунну відповідь.
Первинна імунна відповідь характеризується появою антитіл
через 1—4 доби після антигенного подразнення — індуктивна фаза;
155
потім настає продуктивна фаза — період логарифмічного зростання
антитіл, що закінчується періодом максимуму (5—15-та доба), коли їх
кількість у крові досягає найвищого рівня. Через 2—3 місяці і пізніше
концентрація антитіл у крові зменшується (період зниження).
У разі повторної імунізації через 2—4 тижні і навіть кілька міся-
ців і років організм може відповісти на дію гомологічного і навіть
гетерологічного антигену посиленим виробленням імуноглобулінів.
Ця реакція дістала назву вторинної імунологічної відповіді', вона
грунтується на імунологічній пам’яті.
Імунологічна пам'ять. В імунізованому організмі, а також в орга-
нізмі, що переніс інфекційне захворювання, але потім втратив здат-
ність зберігати антитіла, під впливом специфічних і неспецифічних
подразників підвищується титр імуноглобулінів у сироватці крові.
Клітини пам’яті — частина довгоживучнх В- і Т-лімфоцитів,
стимульованих цим антигеном, які після 2—3 поділів переходять
у стан спокою. Стимульовані антигеном лімфоцити, тривалий час
перебуваючи в організмі, зберігають властивість розпізнавати анти-
ген, який їх сенсибілізував, і негайно включаються в імунну відповідь.
Виходячи із вивчених імунологічних закономірностей, у практиці
імунізації людей проти інфекційних захворювань і гіперімунізації
великих тварин для вироблення лікувальних сироваток широко за-
стосовують метод ревакцинації — повторного введення антигенів,
які підвищують імунологічну активність.
Останнім часом успішно розроблено (Г. Келер, К. Мільштейн,
1975) методи добування моноклональних антитіл за допомогою гібри-
дом — клітинних гібридів нормальних лімфоцитів імунізованих тва-
рин з культивованими у живильному середовищі клітинами мієломних
штамів. Ця поаня в 1984 р. була відзначена Нобелівською премією.
Гібридоми продукують цілком специфічні моноклональні антитіла,
що використовуються як діагностичні, лікувальні і профілактичні
препарати. Моноклональні антитіла добуто проти вірусів, бактерій,
найпростіших, злоякісних пухлин та ін.
Теорії утворення антитіл
Протягом більш як 100 років ведуться дослідження для пояснення
механізму синтезу антитіл. Запропоновано теорії прямої матриці
(Гауровітца — Полінга), непрямої матриці (Бернета — Феннера), при-
родної селекції (Ерне), клонально-селекційна (Бернета), репресії
і депресії генів (Сцілларда) та їх варіанти.
Найбільш прийнятною вважають теорію японського вченого С. Те-
негави, згідно з якою із мезенхімальних клітин в результаті генних
варіацій утворюється багато клонів лімфоїдних або імунологічно
компетентних клітин, які можуть реагувати з різними антигенами або
їх детермінантами. Отже, продуценти антитіл мають специфічні, за-
кодовані в хромосомах, рецептори, кожен із них продукує тільки
один вид антитіл, який зв’язується з відповідним антигеном. Цей про-
цес спонукає В-лімфоцити до проліферації, диференціації і вироблен-
ім
ня великої кількості антитіл (108), що переходять з поверхні клітин
у кров.
Якщо зникає весь клон лімфоцитів, які продукують антитіла саме
до цього антигену, виникає імунологічна толерантність, що підтри-
мується наявністю антигену в організмі.
Робота С. Тенегави, виконана на клітинному, субклітинному, моле-
кулярному рівні експериментальних досліджень, пояснила механізм
інтенсивного збільшення кількості антитіл до будь-якого антигену
і була відзначена Нобелівською премією за 1987 р.
ІМУНОЛОГІЧНА ТОЛЕРАНТНІСТЬ
] мунологічна толерантність (лат. Іоіегапііа — здатність перено-
сити, переносимість) — відсутність імунної відповіді організму на
певний антиген. Відносно інших антигенів такий організм має власти-
вість виробляти антитіла й відповідати клітинними імунними реак-
ціями.
Імунологічна толерантність виникає в разі контакту організму
з цим антигеном в ембріональному періоді. Цей період називають пе-
ріодом адаптації. Він може тривати і після народження, якщо в орга-
нізмі весь час є антиген, до якого виникла толерантність. З виве-
денням з організму антигену толерантність до нього зникає.
Імунологічну толерантність поділяють на природну й індуковану.
Природна толерантність може виникнути не тільки до типових
антигенів, а й до аутоантигенів, алергенів, пухлинних і транспланта-
ційних антигенів.
Індукована імунологічна толерантність детермінується деякими
лікарськими засобами (антилімфоцитарна сироватка, циклофосфан,
імуран, азотіоприн, метотрексат, преднізолон та ін.), які пригнічу-
ють вироблення антитіл.
Відповідальні за розвиток імунологічної толерантності Т- і В-супре-
сори. За допомогою рецепторів вони розпізнають певні антигени. В-
супресори запобігають трансформації В-лімфоцитів у плазматичні
клітини, які синтезують антитіла до цього антигену; Т-супресори
позбавляють Т-лімфоцити властивості перетворюватись у клітини
(Т-кілери) із специфічною спрямованістю проти відповідних чужо-
рідних клітин.
Антигени, які спричиняють імунологічну толерантність, дістали
назву толерогенів; ними найчастіше можуть бути сироваткові білки
(альбуміни або глобуліни). Толерантний організм вважає «своїм»
чужорідний матеріал і не відповідає на нього імунними реакціями.
Необхідною умовою для підтримування толерантності є персистенція
антигену в організмі.
Імунологічна толерантність може бути втрачена в результаті вида-
лення антигену, що є в організмі, а також при введенні імунної си-
роватки проти антигенів, якими була індукована толерантність.
Вивчення механізмів імунологічної толерантності озброїло прак-
тичну медицину методами відтворення її для пригнічення реакції
157
імунної системи при трансплантації (пересаджуванні) органів. За
відкриття імунологічної толерантності Ф. Бернет і П. Медавар були
відзначені в 1964 р. Нобелівською премією.
ПЕРВИННІ (ПРИРОДЖЕНІЇ ІМУНОДЕФІЦИТИ! СТАНИ
Трапляються випадки природженої нездатності організму синте-
зувати імуиоглобуліни — агамаглобулінемія. Імунологічна недостат-
ність первинного походження характеризується нездатністю вироб-
ляти антитіла в результаті випадання або різкого зниження функці-
ональної активності лімфоїдної системи.
Особи з імунологічною недостатністю часто хворіють на інфекції
з тяжким перебігом. Відомо понад 20 імунодефіцитних станів, які по-
діляють на три великі групи: 1) комбіновані, з ураженням клітинної
і гуморальної систем імунітету; 2) з переважним порушенням клітин-
ного імунітету; 3) з порушенням продукції антитіл (дефект В-системи
імунітету).
Одним із природжених дефектів системи мононуклеарних фагоцитів
(нездатність фагоцитів перетравлювати захоплені мікроорганізми)
є синдром парадоксів, який полягає в тому, що діти, уражені цією
хворобою, дуже піддаються інфікуванню маловірулентними стафі-
лококами, кишковими паличками, грибами та іншими мікроорганіз-
мами при наявності високої стійкості проти вірулентних стрептококів,
менінгококів.
Природжені імунодефіцити і стани успадковуються переважно
за рецесивним типом.
Виявлено аутосомно-рецесивну форму комбінованої імунологічної
недостатності (атаксія-телеангіектазія, або синдром Луї-Бар), при
якій глибоко порушені функції Т- і В-систем імунітету, вона зчеплена
з статтю (хворіють хлопчики) і є наслідком порушення білкового
обміну.
В осіб з імунологічною недостатністю відзначено різке підвищення
(у 10—50 раз) частості злоякісних пухлин. Щоб запобігти розвиткові
природжених імунодефіцитних станів, застосовують трансплантацію
кісткового мозку, пересадку Т-лімфоцитів або загрудинної залози,
введення фактора перенесення у-глобулінів, плазми крові, утриму-
вання дітей у стерильних ізольованих боксах.
ВТОРИННІ (НАБУТІЇ ІМУНОДЕФІЦИТИ! СТАНИ
Вони виникають після перенесених інфекційних захворювань
(грип, кір і багато інших), а також тяжких запальних і токсичних
процесів, гельмінтозів та інших паразитарних інвазій, травм, дефі-
циту білків, у тому числі імуноглобулінів, сильних і тривалих крово-
теч, нестачі вітамінів, діяння іонізуючого випромінювання, вживання
великих доз лікарських засобів та інших факторів. У новонароджених
внаслідок слабкої активності імунологічної системи може виникнути
транзиторна імунологічна недостатність.
158
До діяння іонізуючого випромінювання дуже чутливі Т- і В-лім-
фоцити, в яких при цьому швидко настають глибокі структурні зміни
і порушується їх захисна функція проти дії інфекційних агентів,
розвитку злоякісних пухлин. Для вибору найбільш раціональних ме-
тодів терапії і профілактики потрібне проведення старанної клінічної
і генетичної діагностики променевої хвороби, введення у-глобулінів,
антибіотиків для пригнічення збудників інфекційних захворювань.
У 1983 р. виявлено, що набута імунна недостатність може бути
спричинена ретровірусом, який уражує Т-лімфоцити, що відіграють
вирішальну роль у захисті організму людини. В результаті розвиває-
ться ВІЛ-інфекція, або синдром набутого імунодефіциту (СНІД) —
тяжке захворювання, що закінчується смертю.
У разі надлишку високоочищених полісахаридів або білкових
антигенів, введених в організм, настає імунологічний параліч. Орга-
нізм втрачає здатність імунізуватися явно вакцинуючими дозами і стає
толерантним. При цьому настає блокада лімфоїдно-макрофагальної
системи.
При частому введенні антигену розвивається імунізаторне гальму-
вання, при якому організм не відповідає на дію антигену дальшим вироб-
ленням імунітету. При одночасному введенні в організм сильного і слаб-
кого антигенів може виникати пригнічення відповіді на слабкий антиген.
На утворення антитіл дуже впливають харчування, іонізуюче
випромінювання, продукція гормонів, охолодження і перегрівання,
інтоксикація. При голодуванні або неповноцінному білковому хар-
чуванні продукція антитіл знижується. Стан стресу зумовлює різке зни-
ження загальної резистентності організму. У ряді випадків вироблення
антитіл до збудників інфекційних захворювань знижується під впли-
вом антибіотиків, що застосовуються на ранніх стадіях захворювання.
АУТО1МУННІ ПРОЦЕСИ
У життєдіяльності людського організму важливу роль віді гра-
ють природні (нормальні) протитканинні аутоантитіла, що мають
властивість знешкоджувати і зв’язувати продукти розпаду й метабо-
лізму клітин. З віком концентрація аутоантитіл у крові і тканинах
збільшується.
При розмноженні в клітинах нервової системи вірусів поліомієліту,
кліщового енцефаліту, деяких штамів вірусу герпесу та ін. утворю-
ються проміжні (вірусіндуковані) антигени, які спричиняють синтез
аутоантитіл. Реакція цих антитіл з антигенами нормальної нервової
тканини зумовлює її глибоке ушкодження.
При старінні різко знижується імунологічна активність лімфоїдної
тканини, настає дефіцит Т- і В-лімфоцитів, значно підвищується ча-
стість мутацій імунокомпетентних клітин, у них з’являється агресив-
ність проти нормальних систем.
Ушкодження тканин виникають в результаті утворення у великій
кількості розчинних комплексів антиген — антитіло. До них відне-
сено хвороби імунних комплексів (імунокомплексні): інфекційний
ендокардит, гломерулонефрит, системний червоний вовчак, ревмато-
169
їдний артрит та інші аутоімунні захворювання. Аутоімунний харак-
тер мають також деякі гемолітичні анемії і тромбоцитопенії.
Генетична зумовленість аутоімунної відповіді в патології лю-
дини визначає родинні випадки захворювання, розподіл їх за статтю
і віком. У монозиготних близнюків буває більш високий ступінь кон-
кордантності за цими ознаками, ніж у дизиготних. Аутоімунний про-
цес індукується клітинною (сенсибілізовані клітини лімфоїдного ряду)
і гуморальною (сироваткові антитіла) імунною системою.
Імунологічні реакції, що відбуваються у вагітнит жінок, мають
значення в розвитку безплідності, невиношування вагітності, гемолі-
тичної хвороби новонароджених, коли настає невідповідність плода
й організму матері щодо еритроиитарних, лейкоцитарних, тканин-
них та інших антигенів.
Аутоімунні реакції виникають також в результаті реакцій між
ідіотипами (антигенними детермінантами, розташованими у варіабель-
них ділянках поліпептидних ланцюгів антитіл, й антиідіотнповими
антитілами).
Клітинні і гуморальні захисні реакції — це ефективна система,
яка забезпечує збереження сталості внутрішнього середовища макро-
організму. Вони проявляються на молекулярному, клітинному й орга-
нізмовому рівнях, що наділяє їх широким діапазоном дії на пато-
генні агенти.
Незважаючи на важливу роль клітинного і гуморального імуні-
тету, стан несприйнятливості не вичерпується цими формами за-
хисту. Несприйнятливість до інфекційних агентів може проявлятися
без участі фагоцитозу й антитіл. Помічено, що діти, уражені агамагло-
булінемією, іноді порівняно легко переносять кір, видужують і по-
вторно не хворіють. У ряді випадків високий рівень антитії не захи-
щає організм від захворювання. Явища незавершеного фагоцитозу
і тривалого носійства патогенних бактерій свідчать про те, що клі-
тинні і гуморальні форми імунітету не завжди можуть забезпечити
той складний процес несприйнятливості, який потрібний для захисту
організму вищих тварин і людини.
ФОРМИ ІМУНІТЕТУ
Залежно від того, проти яких агентів спрямовані захисні сили мак-
роорганізму, імунітет поділяють на антибактеріальний і антитоксич-
ний, противіоусний і протипаразитарний. Такий поділ імунітету ні
в якому разі не виключає єдності всіх захисних реакцій та їх взаємо-
зв’язку. Абсолютно автономних форм імунітету не існує, усі вони
взаємозв’язані і проявляють свою захисну дію в цілісному організмі
й за участю всіх систем.
АНТИБАКТЕРІАЛЬНИЙ ІМУНІТЕТ
При активній реакції імунної системи зараження не призводить
до розвитку захворювання. У крові і лімфоїдно-макрофагальній систе-
мі бактерії зазнають діяння клітинних і гуморальних факторів.
160
Стерильний і нестерильний (інфекційний) імунітет. Під стериль-
ним імунітетом розуміють стан несприйнятливості, при якому орга-
нізм цілком звільняється від збудника. До такої несприйнятливості
відносять імунітет після кору, коклюшу, натуральної віспи тощо.
При бруцельозі, туберкульозі, лепрі, сифілісі та інших тривалих
інфекціях відносна несприйнятливість зумовлена наявністю в орга-
нізмі протягом певного проміжку часу збудників інфекційних захво-
рювань. Такий імунітет називають нестерильним (інфекційним, де-
пресійним). При хронічних захворюваннях внаслідок тривалого пере-
бування збудників інфекції в організмі буває відносний імунітет до
повторного зараження й імунітет до загострення наявної інфекції.
Водночас із розвитком інфекційного процесу виникають і форму-
ються специфічні захисні реакції. Через стадію нестерильного іму-
нітету різної тривалості проходить розвиток захисних реакцій, які
завершуються утворенням стерильного імунітету.
АНТИТОКСИЧНИЙ ІМУНІТЕТ
При захворюваннях, збудники яких продукують екзотоксини,
формується антитоксичний імунітет. Знешкоджування екзотоксинів
відбувається головним чином нейтралізацією їх антитоксинами.
У практиці імунізації проти дифтерії і правця антитоксичний іму-
нітет відтворюють введенням анатоксинів, а специфічне лікування
хворих на дифтерію, правець, ботулізм, анаеробну й стафілококову
інфекції проводять відповідними антитоксичними сироватками і
у-глобулінами.
Токсини й анатоксини стимулюють синтез імунного інтерферону,
що має антибактеріальну й антитоксичну дію. Антитоксичний імунітет
не можна зводити тільки до реакції нейтралізації. На зараження ток-
сигенними бактеріями організм, як правило, відповідає виробленням
захисних механізмів, спрямованих як проти токсину, так і проти
збудника.
ПРОТИВІРУСНИЙ ІМУНІТЕТ
Захисні реакції організму при вірусних інфекціях мають багато
спільного з несприйнятливістю до бактерій, але разом з тим у них
є й деякі особливості.
Усі противірусні захисні реакції організму поділяються на неспе-
цифічні і специфічні.
Неспецифічні захисні реакції. До них передусім належить вироб-
лення інтерферону, який виявляється в місцях репродукції вірусів
(у легенях при грипі, у тканині мозку при енцефаліті, у шкірі прн
введенні вірусу вісповакцини), звідки надходить у кров, розноситься
по всьому організму і запобігає ураженню клітин, які не мали кон-
такту з вірусом.
Крім того, неспецифічна противірусна резистентність забезпечує-
ться інгібіторами вірусної активності — білковими речовинами нор-
мальної нативної сироватки крові і оскретів слизових оболонок:
6 1-445
161
термостабільними (а-інгібіторами), які блокують гемаглютинуючі
властивості вірусів, і термолабільними (^-інгібіторами), що мають
антигемаглютинуючу і віруснейтралізуючу дію. При інфекції, спричи-
неній вірусом грипу А, виділено термостабільні інгібітори з нейтра-
лізуючою й антигемаглютинуючою властивостями. Доведена наяв-
ність у людей термостабільних інгібіторів кишкових вірусів, аденові-
русів та ін.
При взаємодії інгібіторів вірусної активності з вірусом спочатку
утворюється оборотний нейтральний комплекс (вірус + інгібітор),
з якого можна реактивувати вірус, потім настає процес інактивації
блокованого вірусу.
Слизові оболонки верхніх дихальних шляхів виділяють секрети,
які також мають антигемаглютинуючу і віруснейтралізуючу ак-
тивність.
Вміст інгібіторів вірусної активності коливається залежно од віку
(менше у дітей і більше у дорослих), пори року (знижується у весняні
місяці і зростає влітку).
Виведення вірусів відбувається також через нирки і миготливий
епітелій верхніх дихальних шляхів в результаті утворення скупчень
вірусів (цитоплазматичні включення) і відшнуровування уражених
ділянок цитоплазми.
Важливу роль в інактивації вірусів і стимуляції противірусних
захисних реакцій відіграє підвищення температури тіла, яке призво-
дить до прямого гальмування репродукції вірусів усередині клітини,
посилення індукції різного роду інгібіторів та інтерферону, а також
прискорення обміну речовин.
Підвищена сприйнятливість до вірусних інфекцій може бути зу-
мовлена гормональними факторами, порушенням харчування, стре-
сом, травмами, що призводять до зниження захисних сил організму.
Одним із факторів противірусного захисту є фагоцитоз. При ві-
русних інфекціях він має особливості у зв’язку з малими розмірами
збудників, а також властивість багатьох вірусів (кору, герпесу та ін.)
репродукуватися всередині лейкоцитів. Віруси, що репродукуються
в лейкоцитах, виявляються резистентними до руйнівної дії ферментних
систем клітини, тобто фагоцитоз має при цьому незавершений харак-
тер. Віруси також захищені від знешкоджуючої дії інгібіторів, тем-
ператури, інтерферону й антитіл. З другого боку, незавершений фаго-
цитоз при вірусних інфекціях можна розглядати як позитивне явище,
оскільки віруси і їх токсичні речовини, перебуваючи в ізольованому
стані, не діють шкідливо на нові групи чутливих клітин. Фагоциту-
ватися можуть також різні клітини організму, що заражені вірусами
і зазнали часткової деструкції. Макрофаги органів і тканин звіль-
няють організм від вірусів. Клітинні захисні реакції підвищуються
при наявності інтерферону і комплементу.
У механізмі набутого імунітету важливу роль відіграють антитіла,
що виробляються під впливом вірусних антигенів.
Антигенні властивості мають білки, глікопротеїди і ліпопротеїди,
ферменти і токсичні речовини, що входять до складу віріона. Віруси,
що характеризуються простою будовою (віруси поліомієліту, Кокса-
162
кі, ЕСНО), містять 1—2 антигени; складні за будовою (віруси віспи,
грипу та ін.) мають кілька антигенів. Антигени, що входять до складу
вірусів, визначають їх родову, видову, типову і штамову специфічність.
Деякі віруси містять речовини, ідентичні антигенним компонентам
клітин, в яких вони репродукуються. Так, у вірусів е видоспецифічні,
групові і гетерогенні антигени клітин хазяїна. Склад клітинних анти-
генів у вірусів несталий; при переході їх до іншого хазяїна відбуває-
ться швидка зміна набору цих антигенів.
Активність участі того чи іншого класу імуноглобулінів у захис-
них реакціях багато в чому зумовлена механізмом проникнення збуд-
ника в організм. Якщо він проникає через слизові оболонки, в першу
чергу виробляються І^А, потім І§М і трохи пізніше І£(л. В разі про-
никнення вірусу в кров або через ушкоджену шкіру організм відпові-
дає продукцією І£М І І£(л.
Антитіла мають на віріони віруснейтралізуючу дію. У реакції
нейтралізації вірус втрачає здатність приєднуватись до рецепторів
чутливих клітин. Утворений комплекс вірус — антитіло приєднує
комплемент, завдяки чому запобігається розвитку вірусемії; збудник
затримується у лімфатичних вузлах, селезінці та інших лімфоїдних
органах і під дією макрофагів і ферментів руйнується. Антитіла, з’єдна-
ні з комплементом, можуть спричиняти лізис вірусних агентів.
Специфічні захисні реакції організму пов’язані з участю сенсибілі-
зованих Т-лімфоцитів, які не мають віруліцидної дії, не диференцію-
ються в клітини, що виробляють відповідні антитіла, а руйнують зара-
жені вірусами клітини за допомогою лімфотоксинів. Вивільнені ві-
ріони надходять у міжклітинний простір, де зазнають прямої дії
антитіл, інгібіторів і температурного фактора.
Захисні реакції проти вірусів здійснюються на молекулярному,
клітинному й організмовому рівні.
Постінфекційний противірусний імунітет може спостерігатися
протягом кількох років (грип та ін.) або ж протягом усього життя
(кір, жовта гарячка, вітряна віспа та ін.).
Поствакцинальний імунітет, що відтворюється живими і вбитими
вакцинами, триває від кількох місяців (вакцинація проти чуми та ін.)
до кількох років (вакцинація проти віспи, поліомієліту, жовтої га-
рячки іа ін.).
Штучний пасивний імунітет зумовлений циркуляцією в крові
антитіл, введених разом із сироваткою крові або у-глобуліном; його
тривалість становить кілька тижнів.
ПРОТИПУХЛИННИЙ ІМУНІТЕТ
У тварин і людини при виникненні пухлин розвивається резистент-
ність до них, яка недостатня для повного пригнічення трансформова-
них клітин. На поверхні пухлинних клітин з’являються мембранні
специфічні антигени, що розпізнаються імунною системою хазяїна.
Клітино зумовлений імунітет супроводиться накопиченням Т-кі-
лерів, сенсибілізованих проти пухлинних клітин і здатних руйнувати
або припиняти їх проліферацію.
б* 163
Пухлинні антигени стимулюють також утворення специфічних
антитіл, що мають цитотоксичність. Проте деякі антитіла або ком-
плекси антитіло — антиген не тільки позбавлені захисної дії, а на-
віть посилюють ріст пухлини. Приєднання антитіл або комплексу
антиген — антитіло до антигенів пухлинних клітин блокує їх розпі-
знавання і відторгнення Т лімфоцитами. У забезпеченні протипух-
линного захисту великого значення надається усуненню імунологічної
толерантності.
Протипухлинну дію мають макрофаги, лімфокіни, інтерлейкіни
І і II, інтерферон, які стимулюють активність макрофагів і лімфоцитів,
а також моноклональні антитіла, які не руйнують пухлинні клітини,
але, очевидно, активують лімфоцити, макрофаги, систему компле-
менту.
ПРОТИПАРАЗИТАРНИЙ ІМУНІТЕТ
Механізми розвитку несприйнятливості до патогенних найпрості-
ших різні. Вироблення імунітету залежить від локалізації паразита.
Одні з них живуть у тканинах (трипаносоми, лейшманії, плазмодії
малярії), інші—у просвіті кишок (ЕпіатоеЬа ЬізіоІуНса), треті —
в просвіті кишок і в тканинах (кишкові балантидії, кокцидії, гель-
мінти).
Для найпростіших характерна стадійна специфічність імунної
відповіді. У них може бути від 2 до 7 стадій, кожній із яких властивий
певний характер паразитування. Імунітет, що утворився проти однієї
субпопуляції, не приводить до несприйнятливості до' всіх популяцій
виду.
Велике значення в протипаразитарному захисті має протективннй
імунітет, в реалізації якого беруть участь лімфоцити Т- і В-снстем.
Коли патогенні найпростіші проникають у кров і внутрішні орга-
ни, спочатку утворюються І£М, а потім І§0. Під впливом лікарських
засобів титр антитіл у реконвалесцентів різко знижується.
Захисна дія антитіл при паразитарних захворюваннях проявляє-
ться по-різному. При малярії антитіла до мерозоїтів спричиняють їх
нейтралізацію або блокування проникнення в еритроцити. У ряді
випадків антитіла не мають здатності інактивувати збудника, але
спричиняють у нього зміни поверхневих антигенів, що дає змогу пара-
зитові уникнути діяння на нього антитіл.
Одна з причин слабкого розвитку імунітету до патогенних най-
простіших — наявність у них антигенів, спільних з тканинами орга-
нізму хазяїна. Імунні комплекси антиген — антитіло зумовлюють
накопичення у плазмі гістаміну, серотоніну та інших біологічно
активних речовин.
Клітинний імунітет, зумовлений Т-системою лімфоцитів, найбільш
виражений при токсоплазмозі, лейшманіозі, хронічних формах амери-
канського трипаносомозу.
Протипаразитарний імунітет супроводиться підвищеною актив-
ністю фагоцитів, які за допомогою опсонінів та інших антитіл погли-
164
мають і перетравлюють дрібних паразитів; крупні паразити імобілі-
зуються ними в тканинах при спільній дії багатьох клітин.
Звичайно спочатку на проникнення найпростіших реагують мік-
рофаги, потім у боротьбу з паразитом вступають макрофаги, дія яких
ефективніша. Кількість захисних клітин різко зростає, і це в ряді
випадків є показником інфікованості організму тим чи іншим видом
паразита.
Незважаючи на спільність природних імунних реакцій при пара-
зитарних і бактеріальних інфекціях, проблема вакцинації проти пара-
зитарних захворювань і досі не розв’язана. Тільки для запобігання
шкірному лейшманіозу в ендемічних вогнищах застосовують вакцину,
добуту М. І. Латишевим.
Ведуться інтенсивні пошуки для розробки методів специфічної
профілактики малярії, американського трипаносомозу, токсоплазмозу,
оскільки загальні заходи не дають потрібних результатів.
Відомості про імунітет проти патогенних грибів наводяться в спе-
ціальній частині мікробіології (див. с. 391).
КОЛЕКТИВНИЙ ІМУНІТЕТ
Колективний імунітет створюється в результаті планомірної іму-
нізації населення. Правильно організована специфічна профілактика
кору, поліомієліту, дифтерії, коклюшу, правця, туберкульозу забезпе-
чує значне зниження захворюваності і летальності.
Зайдяки систематичній вакцинації населення проти віспи протягом
багатьох років підтримується міцний штучний імунітет, що пере-
шкоджає як появі захворювання, так і існуванню вірусу віспи. Заходи
для профілактики віспи створенням штучного імунітету, що здійсню-
ються з 1958 р. Всесвітньою організацією охорони здоров’я, успішно
виконані. В результаті вдалося добитись повної ліквідації натураль-
ної віспи.
ТРАНСПЛАНТАЦІЙНИЙ ІМУНІТЕТ
У зв’язку з розвитком хірургічної техніки в галузі трансплантації
органів і тканин значних зусиль докладається для пошуків засобів,
за допомогою яких можна пригнічувати захисні реакції, спрямовані
на руйнування трансплантатів (шкіра, нирки, печінка, серце та ін.)
і препаратів крові при гемотрансфузіях.
Трансплантаційний імунітет пояснюється тим, що трансплантат
генетично відрізняється від тканин і органів реципієнта, тобто тка-
нина, що вводиться, генетично чужорідна. Імунологічна несумісність
зумовлюється клітинними й гуморальними реакціями організму.
Синтез трансплантаційних антигенів детермінується генетичними
структурами, які дістали назву локусів гістосумісності — НЬА (Ни-
тап Ьеисосуіе Апіі£еп$). НЬА-система є головною системою тканинної
сумісності людини. Головний локус гістосумісності у людини містить-
ся в 6-й парі хромосом. У ньому є два тісно зв’язаних і серологічно ви-
значених локуси (НЬА-сублокуси): 80-1 (ЬА) і 80-2 (4). До офіційної
165
номенклатури ВООЗ включено 22 основних локуси гістосумісності
люди ні (НЕА І. НЕА 22), а також 73 додаткових локуси (УУ І...УУ
73). Найбільше значення мають чотири локуси: НЬА-А, НЕА-В,
НЕА-С, НЕА-О. Антигени гістосумісності, що кодуються генами локу-
сів НЬА-А, НЕА-В, НЕА-С, визначаються серологічно, а антигени,
які контролюються генами локусу НЕ-О, виявляють за допомогою
лімфоцитів При спільному культивуванні лімфоцитів периферичної
крові індивідуумів, що генетично різняться, через 24—72 год Т-лім-
фоцити трансформуються у бластні форми, які можуть синтезувати
ДНК і ділитись. Найінтенсивніше виражена бласттрансформація
у несумісних індивідуумів, у монозиготних близнюків її немає.
Трансплантаційний імунітет зумовлюється головним чином клі-
тинною реакцією за типом сповільненої гіперчутливості. Сенсибілізо-
вані лімфоцити справляють цитопатогенну дію на клітини, що різнять-
ся одним або кількома генами.
Навколо трансплантата і в стінках судин скупчується багато лім-
фоцитів і лімфоцитоподібних клітин, макрофагів і плазматичних клі-
тин, потім відбуваються інфільтрація лімфоцитами (Т-кілерами, клі-
тинами з Т-популяції, що атакують трансплантат), закупорка судин
трансплантата і загибель його в результаті ішемії.
Успіх трансплантацій залежить від біологічної (біохімічної, іму-
нологічної) сумісності тканин або органів донора і реципієнта, які
в генетичному відношенні повинні бути ідентичними. Повна суміс-
ність клітин тканин можлива тільки між однояйцевими близнюками
і між тваринами чистих ліній, виведених близько спорідненим
схрещуванням.
Запобігти розвиткові трансплантаційного імунітету можна пригні-
ченням активності імунної системи організму введенням антиметабо-
літів (меркаптопурин та ін.), гормонів надниркової залози (кортизон),
діянням рентгенівського опромінювання. Однак подібні заходи часто
призводять до тяжких ускладнень.
Для пригнічення трансплантаційної реакції ефективне викори-
стання антилімфоцитарних цитотоксичних сироваток, циклосерину
А. При аналізі випадків трансплантації серця спеціалісти дійшли вис-
новку, що тканини реципієнта і донора не повинні різнитися більш
ніж двома групами генів, при більшій несумісності ймовірність від-
торгнення дуже висока.
Основними вимогами при пересаджуванні органів і тканин є пов-
ний збіг груп крові донора й реципієнта, максимальна відповідність
локусів гістосумісності, старанне запобігання розвиткові інфекційних
захворювань та різних ускладнень, пов’язаних із застосуванням лі-
карських засобів, що мають імунодепресивну дію.
Реакція трансплантата проти хазяїна. При введенні новонаро-
дженим або ембріонам лімфоїдних клітин дорослих особин розвиває-
ться рант-хвороба (англ. гипі сИзеазе — хвороба низькоросло-
сті). У ембріонів вона є наслідком незрілості імунної системи або її
ушкодження, а в дорослих — результатом генетичної нездатності ре-
агувати на трансплантат. Рант-хвороба — це імунологічна депресія,
тобто різке пригнічення імунологічної реактивності реципієнта.
166
Для пригнічення реакції трансплантата проти хазяїна застосо-
вують специфічні (антилімфоцитарні) імунні сироватки, що вибірково
ушкоджують Т-клітини, а також антиглобулінові сироватки, які
блокують імуноглобулінові рецептори Т-лімфоцитів.
АЛЕРГІЯ
Імунні реакції макроорганізму на речовини, що несуть чужорідну
інформацію, можуть зумовлювати стан як несприйнятливості, так і
підвищеної чутливості.
Змінену під впливом патогенних макроорганізмів, токсинів, лі-
карських засобів та інших речовин реактивність організму К. Пірке
назвав алергією (грец. аііоз— інший, егдоп — дія). Алергія виникає
в результаті порушення звичайного перебігу загальних або місцевих
захисних реакцій, найчастіше при повторному надходженні антиге-
нів в організм. Реакції ці можуть бути підвищені порівняно з нормою
(гіперергія), знижені (гіпергія) або їх може зовсім не бути (анергія).
Алергічні реакції поділяють на гіперчутливість негайного типу
і гіперчутливість уповільненого типу, хоч точну межу між ними ви-
значити важко.
Гіперчутливість негайного типу пов’язана з В-системою імунітету,
гіперчутливість уповільненого типу — з Т-системою.
ГІПЕРЧУТЛИВІСТЬ НЕГАЙНОГО ТИПУ
До гіперчутливості негайного типу відносять анафілаксію, сиро-
ваткову хворобу, атопії та ін. Гіперчутливість негайного типу про-
являється незабаром після введення антигену. У розвитку її бере
участь реакція антиген — антитіло в тканинах і рідких тканинних
середовищах. Гіперчутливість негайного типу може передаватися від
однієї тварини до іншої пасивним способом, тобто при введенні імунної
сироватки сенсибілізованих тварин. У більшості випадків стан гіпер-
чутливості негайного типу можна зняти десенсибілізацією.
Анафілаксія
Однією з форм зміненої реактивності є анафілаксія (лат. апа —
проти, рКуІахіз — захист) — стан підвищеної чутливості організму,
спричинений повторним введенням антигенів (сироваток, антибіоти-
ків та ін.) Анафілаксію відкрив і вивчив Ш. Ріше, дослідження якого
в 1913 р. були відзначені Нобелівською премією.
Першу дозу антигену, яка спричиняє підвищену чутливість, нази-
вають сенсибілізуючою (лат. зепзіЬИііаз — чутливість), другу дозу,
від введення якої розвивається анафілаксія,— вирішальною. Сенси-
білізуючу дозу вводять тваринам підшкірно, внутрішньоочеревинно,
внутрішньовенно, внутрішньосериево, вирішальну — внутрішньо-
венно або внутрішньосериево і в більшій кількості, ніж сенсибілізу-
ючу. Стан підвищеної чутливості у тварин розвивається не відразу
167
після введення антигену, а через певний (інкубаційний) період (8—
21 день).
Основну роль у механізмі анафілаксії в людини відіграє реакція
антигейів з антитілами (І^Е), що мають цитофільність до тканинних
базофілів (тучних клітин). Повторне введення антигену зумовлює
з’єднання його з антитілом иа поверхні клітин, що приводить до
утворення біологічно активних речовин — медіаторів (гістамін, аце-
тилхолін, серотонін, брадикінін та ін.) і спричиняє розвиток патоло-
гічного процесу: зниження дисперсності гуморального середовища,
закупорку капілярів, подразнення нервових закінчень, зміни обмін-
них процесів і порушення життєдіяльності клітин.
Антитіла (І^Е) можуть сполучатися з антигенами як на поверхні
клітин, так і в крові, де утворюється багато розчинного комплексу
антиген — антитіло, який може фіксувати комплемент. Різні прояви
клінічних форм анафілаксії у різних видів тварин залежать від швид-
кості вивільнення медіаторів, їх кількості і неоднакової чутливості
до них органів і тканин.
Найбільш демонстративно клінічна картина анафілаксії відтво-
рюється у морських свинок. Якщо попередньо сенсибілізувати мор-
ську свинку підшкірним введенням 0,01 мл кінської сироватки, а по-
тім через 8—21 день внутрішньосерцево ввести їй 0,1—0,5 мл тієї ж
сироватки, то в неї розвивається картина анафілактичного шоку.
Через 1—2 хв після повторного введення сироватки у морської свинки
виникає неспокій, її шерсть стає скуйовдженою; тварина чухає лап-
ками ніс, у неї спостерігається мимовільне виділення сечі і калу, чхан-
ня, різка ядуха, тонічні і клонічні судороги, сповільнене й утруднене
дихання. Через 5—10 хв тварина гине від асфіксії при явищах зни-
ження температури тіла, зменшення кількості комплементу і зниження
зсідання крові. На розтині виявляють емфізему легень внаслідок
спазму м’язів бронхів, незсідання крові, гіперемію і крововиливи
у слизовій оболонці шлунка, кишок та в інших органах.
У людей анафілактичний шок виникає внаслідок повторного вве-
дення (через кілька хвилин — діб) гетерогенних імунних сироваток
при лікуванні хворих на різні інфекційні захворювання (дифтерія,
правець, сибірка, анаеробна інфекція), притому антибіотиків (пені-
цилін та ін.). Настає ядуха, частішає пульс, знижується артеріальний
тиск, температура тіла, з’являються судороги, спазм бронхів, набря-
ки, біль у суглобах, висипи на тілі та ін. У деяких випадках шок при-
зводить до летального кінця.
У розвитку гіперчутливості негайного типу певне значення має
спадковий фактор (схильність до алергійних захворювань, яка пере-
дається за рецесивним типом).
Частість розвитку гіперчутливості негайного типу залежить
од віку людей, інтенсивності синтезу білка і продукції антитіл. У но-
вонароджених і дітей грудного віку внаслідок слабкого розвитку нер-
вової та інших систем організму вона проявляється менш інтенсивно;
у віці від Iі/, року до періоду статевого дозрівання буває значно ча-
стіше і з важчим перебігом; у дорослих схильність до алергічних захво-
рювань знижується і в похилому віці стає незначною.
168
Місцевий прояв анафілаксії. Багаторазові, з 6-денними інтервалами
підшкірні ін’єкції антигену (сироватки) кролям спричиняють після
5—6-го введення інфільтрат і некроз шкіри (реакція, або феномен,
Артюса). Місцева анафілаксія розвивається від введення й інших
антигенів (бактерії, токсини, антибіотики і т. д.), які можуть сполу-
чатися з І§Е.
Анафілаксію можна створити у сенсибілізованих тварин і на окре-
мих ізольованих органах (реакція Шультца — Дейла) з гладенькою
м’язовою тканиною (матка, кишки та ін.).
Пасивна анафілаксія. Підвищену чутливість відтворюють в ін-
тактних морських свинок пасивним способом, тобто ін’єкцією імунної
сироватки сенсибілізованих тварин. Стан сенсибілізації у них настає
не відразу, а через 24 год при підшкірному, через 12 год при внутріш-
ньоочеревинному й через 4 год при внутрішньовенному введенні; під-
вищена чутливість зберігається у тварин від 3—4 тижнів до 2 мі-
сяців.
Десенсибілізація. Якщо вирішальна доза не спричинила анафі-
лаксії, то тварина втрачає підвищену чутливість до цього антигену,
десенсибілізується на 2—3 тижні, а потім знову стає чутливою, іноді
ще більше. Десенсибілізація настає і після перенесеної анафілаксії.
Специфічний, простий і дуже ефективний метод десенсибілізації
дробним введенням антигену (сироватки) запропонував О. М. Безред-
ка (1907). Введені роздрібнені невеликі дози антигену (сироватки)
зв’язують циркулюючі в крові ЦЕ і тим самим запобігають утворенню
у високих концентраціях гістаміну та інших токсичних речовин, які
спричиняють анафілактичний шок.
Розвиткові анафілаксії можна запобігти введенням у гіперчутли-
вий організм (з 7-денними інтервалами) невеликих кількостей високо-
молекулярного антигену, при цьому в сироватці крові з’являються
блокуючі антитіла (І£б), які взаємодіють з антигеном і запобігають
реакції І§Е з тканинними базофілами.
Для лікування анафілактичного шоку застосовують введення
кисню, штучне дихання, лікарські засоби — адреналін, кордіамін,
кортикостероїди, антигістамінні препарати; в разі пеніцнлінового
шоку — антишокову терапію і введення пеніцилінази.
Сироваткова хвороба
Сироваткова хвороба виникає через 8—12 діб після одноразової о
первинного введення звичайно великих доз (10 мл і більше) імунної
(лікувальної) сироватки. Введення сироватки за методом Безредкп не
запобігає розвиткові сироваткової хвороби. У ряді випадків у сенси-
білізованих людей сироваткова хвороба розвивається досить пшінко
після введення сироватки і нагадує анафілаксію.
Сироваткова хвороба характеризується появою дрібного висипу,
який супроводиться сильним свербежем, підвищенням температури
тіла, набряклістю, болем у суглобах, збільшенням лімфатичних вуз-
лів, порушенням функції органів кровообігу, змінами в крові (спо-
169
чатку лейкоцитоз, потім лейкопенія і відносний лімфоцитоз). Через
кілька діб захворювання закінчується видужанням.
В основі механізму розвитку сироваткової хвороби й анафілаксії
лежить взаємодія антигену й циркулюючих у крові антитіл
Після повторного введення головним чином антитоксичних сироваток,
які в даному разі виконують функцію антигенів, утворюються цито-
тропні антитіла ІцЕ, здатні фіксуватися на поверхні тканинних базо-
філів і вивільняти медіатори (гістамін, серотонін та ін.)
Щоб запобігти сироватковій хворобі, треба вводити витримані або
попередньо прогріті при температурі 56 °С протягом 1/2—1 год ліку-
вальні сироватки, а також застосовувати сироватки, очищені від ба-
ластних білкових фракцій та імуноглобулінів. Такі методи обробки
лікувальних сироваток знижують їх побічну дію. Лікування при
сироватковій хворобі проводиться антигістамінними препаратами.
Атопії
Одним із видів гіперчутливості негайного типу є атопії (грец.
аіороз — незвичайний, дивний), що являють собою генетично детермі-
новану схильність до патологічних імунних реакцій у відповідь на
дію подразників (алергенів), які для більшості людей (80—90 %)
нешкідливі.
Атопії зумовлені появою в окремих людей антитіл (ІрЕ) з шкірно-
сенсибілізуючою активністю. Фіксовані на клітинах різних органів
і тканин І&Е вступають у реакцію з алергенами (атопенами), і в ре-
зультаті утворення медіаторів розвивається клінічний прояв атопії.
Форма алергічної реакції залежить від того, де утворюється і ло-
калізується комплекс антиген — антитіло. Якщо антиген вступає
у реакцію з антитілом в шкірі, виникає кропив'янка; у верхніх дихаль-
них шляхах — алергічний риніт, у слизовій оболонці ока — кон’юнк-
тивіт, у слизовій оболонці бронхів — бронхіальна астма.
У патогенезі атопічних реакцій важливе значення має спадкова
схильність, що реалізується за допомогою алельних генів Н і Ь (ге-
нотип НН — здоровий, НН — алергічний).
Понад 10 % населення земної кулі уражені атопією. У половини
хворих в анамнезі є аналогічне захворювання батьків. Атопічні ре-
акції піддаються гіпосенсибілізації.
Атопени (алергени) поділяють на побутові й епідермальні (пил
пухових перин, подушок, епідерміс шкіри, шерсть свійських тварин
та ін.), виробничі (бібліотечний пил, пил шерсті, бавовни, деякі барв-
ники, мила, лаки, деревина, вибухові й синтетичні речовини та ін.),
рослинні (пилок квітуючих лучних трав, садових і кімнатних рослин),
харчові (яйця, полуниці, раки, цитрусові, кава, шоколад та ін.), лі-
карські (ацетилсаліцилова кислота, антибіотики і сульфаніламідні
препарати).
Діагностика атопій провадиться за клінічними ознаками і лабора-
торними даними (шкірні алергічні проби, виявлення антитіл до алер-
генів).
170
Лікування і профілактика спрямовані на припинення контакту
з алергенами, введення (внутрішньошкірне, нашкірне, пероральне,
інгаляційне, в слизові оболонки і кон’юнктиву) хворим зростаючих
доз алергену, до якого виявлена підвищена чутливість, відтворення
толерантності за допомогою толергенів; в разі відсутності ефекту від
гіпосенсибілізації призначають антигістамінні препарати (бронхолі-
тики та ін.).
ГІПЕРЧУТЛИВІСТЬ УПОВІЛЬНЕНОГО ТИПУ
Основну роль у розвитку гіперчутливості уповільненого типу віді-
грають Т-лімфоцити і медіатори; значення специфічних антитіл не
таке істотне.
Стан гіперчутливості уповільненого типу може бути переданий
іншому організмові, але не за допомогою сироватки крові, а адоптив-
но — введенням йому лімфоїдних клітин сенсибілізованого орга-
нізму.
Сенсибілізовані Т-лімфоцити несуть на своїй поверхні рецептори,
специфічні до конкретного антигену, завдяки яким вони зв’язуються
з чужорідним антигеном і руйнують його як за допомогою своїх фер-
ментів, так і виробленням особливих гуморальних речовин — лімфо-
кінів, які виконують роль додаткових ефекторів клітинного імунітету.
Деякі типи лімфокінів можуть здійснювати мобілізацію клітин іншої
специфічності (гранулоцити, макрофаги) і включати їх у реакції
клітинного імунітету. Властивість пригнічувати гіперчутливість упо-
вільненого типу має інтерферон.
До гіперчутливості уповільненого типу належать інфекційна і кон-
тактна алергія, аутоалергічні реакції, реакції при трансплан-
тації.
Морфологічним субстратом низки алергічних реакцій уповільне-
ного типу є значна інфільтрація уражених ділянок Т-лімфоцитами.
При контактному дерматиті вона відбувається у поверхневому шарі
шкіри, при туберкуліновій реакції — у глибоких шарах шкіри і під-
шкірній клітковині часто у вигляді утворення гранулем.
Інфекційна алергія, що буває при туберкульозі, лепрі, сапі, бру-
цельозі, туляремії, актиномікозі, сифілісі, дерматомікозах, токсо-
плазмозі та ін., довго (роками) зберігається після видужання.
Алергічні реакції широко використовують у діагностиці низки ін-
фекційних захворювань у вигляді шкірних проб (іп уіуо, іноді іп
уііго), реакцій бласттрансформації лімфоцитів, специфічного розет-
коутворенпя, ушкодження нейтрофільннх гранулоцитів та ін.
Алергія й імунітет. З цього питання є дві точки зору: прихильники
першої розцінюють алергію як стан, швидше шкідливий для орга-
нізму, ніж корисний; згідно з другою, імунітет протиставляють
алергії, але приписують їй додаткову захисну роль в інфекційному
процесі.
У ряді випадків при великій дозі антигену і високому рівні чут-
ливості алергічні реакції супроводяться некрозом тканини. При ту-
беркульозі легень утворюються каверни. У хворих на сифіліс роз-
І7І
ви вагаться деструктивні зміни кісток, судин і нервової тканини. Стреп-
тококові захворювання призводять до ревматичних уражень серця.
Алергічний фактор значною мірою обтяжує перебіг багатьох тяжких,
з хронічним перебігом інфекційних захворювань (бруцельоз, сап,
актиномікоз та ін.).
Проте, незважаючи на безумовно шкідливі наслідки алергії, не
можна заперечувати її захисної функції, зумовленої підвищенням
ефективності клітинного імунітету. Відомо, що латентна інфекція ту-
беркульозними мікобактеріями надає організмові підвищеної стійкості
до розвитку клінічно вираженого туберкульозу. На цьому принципі
побудована сучасна активна імунізація проти туберкульозу, яка
приводить до підвищення реактивності організму, розвитку продук-
тивного запалення, утворення гранулем і локалізації збудника на об-
меженій ділянці, запобігання генералізації процесу. Захисна роль
алергічної реакції проявляється нетільки проти патогенних мікроорга-
нізмів, а й проти екзотоксинів завдяки інтенсивному зв’язуванню їх
клітинами запаленої тканини.
Для лікування хворих і профілактики розвитку алергічних ре-
акцій певне значення мають такі заходи: виявлення алергенів і при-
пинення контакту з ними (харчові продукти, лікарські засоби, побу-
тові, виробничі та інші алергени); іноді доцільна зміна місця мешкання
або роботи хворого. Досить добрі результати дає застосування гор-
мональних препаратів (АКТГ та ін.), які пригнічують процес утво-
рення антитіл.
Для зниження сприйнятливості організму хворим проводять гі-
погенсибілізацію тим алергеном, до якого є підвищена чутливість.
При цьому утворюються неповні (одновалентні) антитіла, що фіксу-
ють алергени і тим самим запобігають взаємодії їх з двовалентними
антитілами. При захворюваннях, які супроводяться виробленням
клітинами великої кількості гістаміну та інших медіаторів, доцільно
призначати антигістамінні препарати (димедрол, дипразин, супрастин).
РЕАКЦІЇ ІМУНІТЕТУ
Взаємодія молекули антигену з антитілом або його активним цен-
тром (Раь-фрагментом) супроводиться зміною просторової структури
антигену, в результаті взаємної специфічної комплементарності
зв’язок антитіла й антигену міцно удержується ван-дер-ваальсовими
силами міжмолекулярного простору.
В утворенні комплексу антиген — антитіло розрізняють дві фази —
специфічну й неспецифічну. У першій, специфічній, фазі детермінантна
група антигену або гаптену з’єднується з активним центром антитіла.
Агрегати, що складаються з антитіл і антигенів, втрачають розчин-
ність в ізотонічних розчинах і випадають в осад — друга, неспецифіч-
на, фаза.
Антитіла мають два (І§(3) і більше (І§М) активних центрів, які за
своєю будовою (конфігурацією) комплементарні детермінантним гру-
пам антигену (рис. 46).
172
Рис. 46. Схема з’єднання антигену з ан-
титілом.
Рнс. 47. Оптимальне співвідношення ан-
тигену (а) й антитіла (б).
Якщо в реакції антитіла з антигеном беруть участь низькодисперс-
ні антигени (бактерії, клітини), спостерігається феномен, або реакція,
аглютинації (РА); при взаємодії антитіл з високодисперсними антиге-
нами (полісахариди, білки та їх комплекси) утворюються преципітати
(флокуляти). У реакції преципітації (РП) завдяки полівалентній
природі антигену й антитіла утворюються гратчасті структури,
будова яких залежить від кількісного співвідношення антигену й ан-
титіла (рис. 47—49).
Коли до комплексу антиген — антитіло приєднується комплемент,
відбувається реакція зв’язування комплементу (РЗК).
Взаємодія антитіла з антигеном може зумовлювати нейтралізацію
токсину антитоксином (РН), активацію системи комплементу, реакцію
негайної гіперчутливості.
Антитіла, що належать до класів І&А і І§Е, не мають властивості
спричинювати РП, РА, РЗК.
У ряді випадків з’єднання антитіла з антигеном може бути неміц-
ним; оборотність комплексу антиген—антитіло відбувається в результа-
ті конформаційних змін молекули антитіла, при надлишку антигену або
зменшенні спорідненості між антигеном і антитілом, а також під впли-
вом зовнішніх факторів (температура, кислотність середовища та ін.).
Усі імунологічні реакції поділяють на моно- й полісистемні.
Рис 48 Будова комплексу антиген — Рис. 49 Різні кількісні співвідношення
аиіипло при надлишку вмісту анти- між молекулами антигену (а) й антнті-
тіла. ла (б)
173
Аглютиніни й реакція аглютинації
Аглютиніни — антитіла, що мають властивість спричиняти скле-
ювання відповідних бактерій, еритроцитів, лейкоцитів, тромбоцитів,
клітин тканин, корпускулярних хімічних часточок з адсорбованими
на них антигенами або антитілами з утворенням конгломератів (аїлю-
тииатів), видимих неозброєним оком.
Додавання відповідних імунних сироваток до зависі бактерій
спричиняє їх аглютинацію (рис 50) і випадання в оса і у вигляді
пластівців або зерен. В реакції аглютинації (моносистемній, прямій,
двокомпонентній) беруть участь антитіло (аглютинін) і корпускуляр-
ний антиген (аілютиноген); вони взаємод'югь у певних кількісних
співвідношеннях і при наявності електроліту (0,85 % розчин натрію
хлориду).
РА бактерій з відповідними аглютинуючимп сироватками харак-
теризується специфічністю. Проте може траплятися групова аглютина-
ція, тобто склеювання близьких, споріднених мікроорганізмів, хоч
і в слабших розведеннях сироватки Схематично це можна зобразити
так: бактерія А містить аглютиногени а, Ь, с, бактерія В — Ь, с, сі,
бактерія С — с, б, е, а в сироватках крові імунізованих тварин утво-
рюються відповідні їм аглютиніни:
Вид бактерій
А
В
С
Антигени
(аглютиногени)
а, Ь, с
Ь, с, сі
с, д, е
Антитіла
(аглютиніни)
аі, Ь1, сі
ьі, сі, аі
сі, (11,' еі
Різноманітність антигенів у бактеріальних клітинах закономірна
й віюбражує закон гомологічних рядів внутрішньовидової і міжвидо-
вої мінливості бактерій. При імунізації тварини бактеріями одного
виду утворюються аглютиніни не тільки до цього виду, а й до інших
споріднених видів, що мають спільні антигени.
Рис 50 Реакція аглютина-
ції лсптоспір у темному полі
мікроскопа
Рис. 51. Реакція аглютинації:
а — джгутикова, 6 — соматична.
174
Для виявлення специфічних аглютинінів у сироватках крові тва-
рин, імунізованих складним комплексом антигенів бактеріальної
клітини, застосовують метод адсорбції аглютинінів (реакція висна-
ження Кастеллані).
За допомогою методу адсорбції аглютинінів вивчають також анти-
генну структуру бактерій; крім того, його використовують для при-
готування специфічних аглютинуючих і лікувальних сироваток,
вакцин і діагностикумів. Аглютинуючі сироватки, добуті методом
адсорбції аглютинінів, називають монорецепторними. Вони
дають змогу точніше визначати видову залежність низки збудників
інфекційних захворювань.
При імунізації тварин рухливими бактеріями, що містять джгути-
кові (Н) і соматичні (О) антигени, у них виробляються відповідно
Н- і О-аглютиніни. Джгутикові аглютиніни спричиняють швидше
склеювання бактерій у вигляді пухких пластівців (рис. 51, а), сома-
тичні аглютиніни порівняно повільно утворюють конгломерати бакте-
рій у вигляді дрібних зерен (рис. 51, б). На цій підставі Н-аглютинація
називається крупнопластівцевою, а О-аглютинація — дрібнозер-
нистою.
Бактерії, що містять Уі-антиген, слабко або зовсім не аглютинують-
ся О-сироватками, але добре аглютинуються Уі-сироватками. Це до-
водить, що О- і Уі-антигени, так само як О- і Уі-антитіла, мають різну
структуру.
При здійсненні РА треба враховувати феномен затримки аглюти-
нації. Це буває як при занадто великих, так і при малих концентра-
ціях імунної сироватки, взятої для РА. Цей феномен властивий усім
реакціям імунітету і має враховуватись при лабораторній діагно-
стиці інфекційних захворювань.
РА широко застосовують для серологічної діагностики черевного
тифу, паратифів А і В (реакція Відаля), бруцельозу (реакція Райта),
висипного тифу (реакція з рикетсіями Провачека), туляремії, лепто-
спірозу та інших захворювань, коли за допомогою відомих бактерій
(діагностикумів) визначають у сироватці крові хворих відповідні
аглютиніни.
РА використовують для ідентифікації виділених у хворих людей
і тварин мікроорганізмів із застосуванням заздалегідь відомих аглюти-
нуючих сироваток.
Крім прямої аглютинації, у практиці діагностики Інфекційних за-
хворювань застосовують також реакцію непрямої гемаглютинації
(РИГА), сутність якої полягає в тому, що антиген, який використо-
вується для проведення РА з сироватками крові хворих, попередньо
адсорбований на поверхні еритроцитів барана. Зокрема, РИГА засто-
совують при діагностиці черевного, висипного тифу і паратифів, ту-
беркульозу, токсоплазмозу та ін. Для здійснення РИГА можна вико-
ристати спеціальні еритроцитарні діагностикуми (завись формалізова-
них еритроцитів, «навантажених» антигенами або антитілами).
Як адсорбенти антигенів використовують частинки (0,79—0,31 мкм)
латексу (проміжний продукт каучуку), що випускаються спеціально
для серологічних досліджень. Завись частинок латексу розводять
175
Рис 52 Реакція ізогемаглютинації, що використовується для визначення іруп
крові
у співвідношенні 1:10 борагним або гліцпновим буфером (рН 8,2),
а потім «навантажують» антигеном або антитілами у співвідношенні
1 : 10 і вміщують па 2 і од у термостат. Латекс-тест використовують
у серологічній діагностиці бактеріальних і вірусних інфекцій для ви-
значення антигену за допомогою відомої сироватки і навпаки. Реак-
цію ставлять на предметному склі, її добре видно звичайно через 2—
З хв, іноді через ЗО хв.
Д\ же ефективна і рання антитільна О-агліопиінація, яка дає змогу
виявляти в перші дні захворювання у сироватці крові хворих на че-
ревний тиф, паратифи, гострий сальмонельозний гастроентерит, дизен-
терію, холеру специфічні О-апгигени за допомогою ернтроцитарних
діагностнкумів, на яких адсорбовані О-антптіла.
Для виявлення у носіїв сальмонел черевного тифу Уі-антитіл \ ла-
бораторній практиці широко застосовують реакцію непрямої V{-ге-
маглютинації.
У практиці переливання крові використовують реакцію ізогема-
глютинації, за допомогою якої визначають групи крові (рис. 52).
При цьому стандартні сироватки (а [3, р, а) у певних співвідношеннях
176
змішують з досліджуваною кров’ю і через 5 хв визначають результати
реакції.
Методики оригінальних і прискорених реакцій аглютинацій наве-
дено в посібнику для практичних занять.
Преципітини і реакція преципітації
Преципітинами називаються антитіла, які спричиняють при кон-
такті з специфічним антигеном утворення дрібного осаду (преципі-
тату).
Реакція преципітації (РП) — взаємодія розчинного антигену (пре-
ципітиногену) й антитіла (преципітину) в присутності електроліту
(0,85 % розчин натрію хлориду).
РП має високу чутливість і специфічність. Вона дає змогу виявити
антиген (преципітиноген) у розведенні 1 : 1 000 000 і 1 : 10 000 000.
Як преципітиногени можуть бути використані білки тваринного, рос-
линного і бактеріального походження: кров, сироватка крові, екстрак-
ти з різних органів і тканин, харчових продуктів білкового похо-
дження (м’ясо, риба, молоко), фільтрати культур мікроорганізмів або
тканин, уражених ними. Преципітиногени збудників сибірки, чуми,
туляремії термостійкі. Деякі преципітиногени витримують нагрівання
до температури 120—180 °С.
Відомо понад 20 модифікацій РП, які поділяють на кілька груп:
РП у пробірках, капілярах, на предметних стеклах, фільтрувальному
папері, ацетагцелюлозній плівці, в гелі та ін.
РП використовують у діагностиці сибірки, туляремії, віспи та ін.,
а також при вивченні антигенної структури деяких груп бактерій.
У судовій медицині за допомогою РП визначають видову належність
плям крові, сперми; в санітарній експертизі виявляють домішки мо-
лока одного виду тварини у молоці іншого виду, добавляння штучного
меду до натурального, фальсифікацію м’ясних, рибних, борошняних
виробів і т. д. У біології РП застосовують для встановлення генетич-
них зв’язків близьких між собою видів тварин, рослин, мікроорга-
нізмів.
Найбільше застосування дістала
РП у діагностиці сибірки (реакція
Деколи) для виявлення антигену бацил
цього захворювання в екстрактах з
органів тварин, шкіри, шерсті, волос-
ся, а також для контролю вироблю-
ваної продукції: кожушків, хутряних
комірів, помазків для гоління та
інших виробів. Цю реакцію назива-
ють реакцією терліопреципііпаціі,
оскільки екстракт, іцо підлягає
дослідженню, попередньо кип’ятять,
а потім фільтруюіь і нашаровують
па препи п і і уючу сибіркову сироватку
(рис. 53, и).
Рис 53 Реакц і іірсцппііаціі
а— у пробірці, б —у гелі, в — ІМіїїо-
електрофорез.
177
РП (кільцепреципітації) використовують для діагностики чуми
і туляремії при дослідженні екстрактів, виготовлених із внутрішніх
органів (селезінка, печінка) трупів диких гризунів.
У спеціальних лабораторіях е набір пренипітуючих видоспецифіч-
них сироваток, які виготовляють імунізацією тварин відповідними
антигенами (преципітиногенами).
Титром преципітуючої сироватки називають те найбільше розве-
дення антигену (преципітиногену), при якому спостерігається яскраво
виражена РП. Для реакції використовують нерозведену пренипітуючу
сироватку. Це зумовлено тим, що дисперсність преципітуючої сиро-
ватки менша, ніж преципітиногену, тому, щоб мати оптимальні кіль-
кісні співвідношення частинок діючих інгредієнтів, розводять не сиро-
ватку, а антиген.
Для диференціації антитіл проти різних антигенів використовують
реакцію преципітації в гелі (РПГ) (рис. 53, б). Після нашарування
розчинів антигену й антисироватки в лунки, зроблені в агарі, через
12—24 год виникають легко помітні лінії преципітації, причому кожна
специфічна пара антиген — антитіло має свою лінію. Дуже ефектив-
ними методами є імунорадіографія та імуноелектрофорез. За допо-
могою імуноелектрофорезу в різних комплексах виявлено раніше не
відомі антигенні фракції. Він дає змогу виявляти патологічні зміни
в сироватці крові хворих людей (рис. 53, в). Методика прискорених
реакцій преципітації наводиться в посібнику для практичних занять.
Антитоксини і реакція нейтралізації токсину
антитоксином
Антитоксини — це антитіла, що мають властивість взаємодіяти
з відповідними токсинами і нейтралізувати їх.
Як уже зазначалось, властивість виробляти екзотоксини мають
понад 60 видів мікроорганізмів.
Для реакції нейтралізації (РН) токсину антитоксином потрібні
певні умови: кількісні співвідношення, відповідний час взаємодії та
оптимальна температура. В основі нейтралізації токсину антитокси-
ном лежить моносистемна, пряма, двокомпонентна фізико-хімічна
реакція. Зовнішнім проявом з’єднання токсину з антитоксином в умо-
вах досліду іп уііго є феномен флокуляції — помутніння в пробірці
з сумішшю токсину й антитоксину. Феномен флокуляції є специфіч-
ною реакцією, використовується у виробництві антитоксичних сирова-
ток для визначення ступеня їх активності або сили дії.
За одиницю вимірювання сили дії антитоксичної сироватки взято
міжнародну одиницю (МО) — дозу антитоксичної сироватки, яка
може нейтралізувати певну кількість 01 т токсину. Зразки (еталони)
таких сироваток, висушених ліофілізанією, зберігаються в спеціаль-
них лабораторіях стандартизації біологічних препаратів.
Реакція між токсином й антитоксином відбувається за типом склад-
них співвідношень, що обчислюються за спеціальними рівняннями
адсорбційних ізотерм.
178
Лікувальна дія антитоксичних сироваток залежить не тільки від
їх активності, кількості міжнародних одиниць в 1 мл, а й звідності
(«жадібності») — швидкості, повноти й міцності з’єднання токсину
з антитоксином.
Методи виготовлення і титрування антитоксичних сироваток.
Антитоксичні сироватки дістають гіперімунізацією тварин (коней) наро-
стаючими дозами анатоксинів, а потім екзотоксинів. Після закінчення
повного курсу імунізації в крові тварин визначають кількість анти-
токсинів, потім роблять часткове або повне кровопускання, кров зби-
рають у бутлі, в яких вона зсідається, і над згустком з’являється
прозора жовтувата рідина — сироватка.
Добуту сироватку перевіряють на стерильність, апірогенність
(препарат не повинен спричиняти підвищення температури тіла у тва-
рин при парентеральному введенні) і установлюють її титр, тобто ви-
значають кількість міжнародних одиниць в 1 мл.
Титрують антитоксичні сироватки за допомогою певних стандартів
токсинів на тваринах (морських свинках, білих мишах, кролях) вве-
денням їм суміші відповідної кількості стандартного токсину і різних
доз випробовуваної сироватки (іп уіуо), а також методом флокуляції
(іп уИго). Основні відомості з цього питання є в посібнику для прак-
тичних занять.
Антитоксичні сироватки застосовують з лікувальною і профілак-
тичною метою при правці, ботулізмі, анаеробній інфекції, дифтерії,
укусі змій.
Лізини і реакції лізису
Лізинами називають специфічні антитіла, які спричиняють розчи-
нення бактерій, клітин рослин і тварин. Лізис бактерій відбувається
за участю двох інгредієнтів: специфічного антитіла, яке є в імунній
сироватці, і неспецифічної речовини будь-якої нормальної й імунної
сироватки — комплементу.
Лізини мають властивість розчиняти бактерії (рис. 54), трепонеми,
лептоспіри (бактеріолізини), а також спричиняти глибокі порушення
структури еритроцитів (гемолізини), лейкоцитів та інших клітин (ци-
толізини). Вони мають усі основні властивості антитіл, але діють на
антиген тільки в присутності комплементу.
Реакція лізису моносистемна, непряма, трикомпонентна. У зв’язку
з нестійкістю комплементу в реакціях лізису використовують кон-
Рис. 54. Послідовні фази лізису (а, б, в) холерних вібріонів.
179
сервований комплемент, найчастіше сироватку крові морської свинки.
Консервують комплемент добавлянням натрію хлориду в концентра-
ції до 10 %, або 4 % борної кислоти, або 5 % натрію сульфату, а та-
кож висушуванням при низькій температурі у вакуумі (ліофілізація).
При імунізації кролів зависсю еритроцитів барана у них в крові
накопичуються антитіла, що мають властивість змінювати еритроцити,
в результаті чого адсорбційний зв’язок між гемоглобіном і стромою
еритроцитів порушується, гемоглобін легко проникає з еритроцитів
в оточуючу рідину і вона забарвлюється в рожевий колір. Нагрівання
імунної сироватки при температурі 56 °С протягом ЗО хв супроводить-
ся втратою її гемолітичних властивостей внаслідок інактивування
комплементу, а добавляння свіжої сироватки крові тварини, навіть
неімунізованої, знову відновлює гемолітичні властивості імунної
сироватки. Якщо в пробірку вмістити у відповідних кількісних спів-
відношеннях гемолітичну сироватку (антитіло), еритроцити барана
(антиген) і комплемент, то протягом кількох хвилин суміш із каламут-
но-червоної стає рожевою (лаковою).
Реакція гемолізу має яскраво виражену специфічність. Її викори-
стовують як індикатор для реакції зв’язування комплементу.
Реакція зв'язування комплементу
Специфічна взаємодія антитіла й антигену супроводиться адсорб-
цією комплементу. У зв’язку з тим що процес адсорбції комплементу
комплексом антиген — антитіло не можна спостерігати візуально,
як індикатор у цю реакцію введена гемолітична система, що складає-
ться із зависі еритроцитів і відповідної гемолітичної сироватки, за
допомогою якої виявляють зв’язування комплементу (див. форзац,
рис. IV).
У РЗК використовують дві системи: 1) антиген + антитіло +
+ комплемент; 2) завись еритроцитів + гемолітична сироватка. РЗК
має високу специфічність і виражену чутливість. За механізмом дії
ця реакція непряма, п’ятикомпонентна, гетерологічна. РЗК відбу-
вається у дві фази: у першій фазі антиген взаємодіє з антитілом (вза-
ємна адсорбція), у другій — комплемент зв’язується комплексом
антиген — антитіло.
РЗК застосовують у діагностиці сифілісу (реакція Вассермана),
висипного тифу, Ку-гарячки та інших рикетсіозів, а також багатьох
вірусних захворювань. Розроблено модифікації РЗК, що використо-
вуються для визначення як антитіл, так і антигенів у крові хворих.
Підготовка, титрування інгредієнтів і методика здійснення реакції
повніше наведені в посібнику для практичних занять.
Інші імунологічні реакції
Реакція з неповними (блокуючими) антитілами. Неповні антитіла
(непреципітуючі, блокуючі, аглютиноїди) можуть з’єднуватися з від-
повідними антигенами, але без утворення іп уііго феноменів преципіта-
ції, аглютинації та ін. Спочатку в людини було виявлено неповні ан-
180
титіла до резус-антигену*, потім їх виявили при вірусних, рикетсіоз-
них і бактеріальних інфекціях, а також при різних патологічних ста-
нах, аутоімунних процесах, гемолітичній анемії. На відміну від зви-
чайних (повних) антитіл вони більш стійкі до нагрівання, значно легше
проникають через плаценту. До них належать резус-аглютиніни,
непреципітуючі термолабільні антитіла, а також антитіла, виявлені
в людей з різними алергічними станами, а також у хворих на систем-
ний вовчок, інфекційний поліартрит. Неповні аглютиніни і гемаглюти-
ніни виявлено при імунізації тварин капсульним антигеном збудни-
ків чуми. їх було виявлено у сироватці крові хворих на дизентерію,
тиф, бруцельоз у титрах, які перевищують титри повних антитіл
у 4—32 рази, а в сироватці крові тварин, імунізованих холерною
вакциною,— у 4—7 раз.
Найбільший інтерес становлять аглютиніни до резус-антигенів
еритроцитів дітей, уражених гемолітичною хворобою новонароджених,
яка зумовлена наявністю в еритроцитах резус-фактора, успадкованого
від батька. Проникаючи в кров резус-негативної матері, резус-фактор
спричиняє утворення резус-аглютинінів, що надалі надходять через
плаценту у кров плода і спричиняють у нього аглютинацію еритроци-
тів. Гемолітична хвороба є наслідком несумісності крові матері і плода
щодо резус-фактора.
Резус-фактор може спричиняти утворення повних і неповних
аглютинінів, які в сольовому розчині не спричиняють реакції аглюти-
нації. Для виявлення неповних аглютинінів у крові в резус-негатив-
них вагітних жінок застосовують реакцію Кумбса (рис. 55). Для ви-
явлення сорбованих на еритроцитах аглютинінів до них добавляють
антиглобулінову сироватку, що має властивість спричиняти аглютина-
цію сенсибілізованих еритроцитів. Молекула антиглобуліну з’єднує-
ться з двома молекулами неповних аглютинінів, фіксованих на двох
різних еритроцитах, завдяки чому і відбувається реакція аглютинації
(полісистемна, гетерологічна).
У прямій реакції Кумбса (див. рис. 55, а) за допомогою антпгло-
буліну визначають наявність антитіл, зв’язаних з еритроцитами;
у непрямій реакції (див. рис. 55, б) виявляють вільні неповні антитіла
* Антиген еритроцитів мавп виду Масасиз гііезиз, який виявлено також
в еритроцитах людини.
181
за допомогою адсорбції їх із сироватки крові на нормальних еритро-
цитах, бактеріях або рикетсіях з наступним добавлянням анти-у-гло-
буліну.
Реакція опсонізації. Опсонінами (грец. орзоп. — їжа) називають
антитіла нормальних та імунних сироваток крові, які змінюють мік-
роорганізми і готують їх до більш інтенсивного фагоцитування. Під
впливом опсонінів змінюється поверхня мікроорганізмів, зокрема їх
електричний потенціал, внаслідок чого вони легко піддаються фагоци-
тозу. Опсоніни зумовлюють специфічну сенсибілізацію, підвищену
чутливість бактерій до фагоцитозу.
Опсоніни складаються з термолабільних речовин сироватки крові,
до яких входить фракція комплементу (С36), і термостабільних, що
містять І§6.
Спочатку в першій фазі реакції опсонізації відбувається опсоніза-
ція частинок, у другій — їх прикріплення до поверхні фагоцнтованих
клітин.
Ступінь активності опсонінів прийнято виражати опсонічним
індексом, який є відношенням фагоцитарного показника імунної
сироватки до фагоцитарного показника сироватки крові здорової
людини. Фагоцитарним показником називається частка від ділення
кількості бактерій, поглинутих 100 фагоцитами, на кількість фагоци-
тів. Опсонічний індекс має бути більшим від 1,0.
Реакція іммобілізації — моносистемна, непряма, трикомпонентна.
При захворюваннях, що спричиняються патогенними трепонемами,
у крові хворих людей утворюються антитіла, які припиняють рух
трепонем і призводять їх до загибелі. Іммобілізуюча дія антитіл здій-
снюється в присутності комплементу, зв’язування якого не відбуває-
ться або спостерігається в обмеженій мірі. Прояв реакції іммобіліза-
ції можливий не тільки щодо трепонем, а й щодо інших мікроорганіз-
мів (збудник амебіазу, деякі рухливі бактерії та ін.).
Реакція імунного прилипання відбувається за участю антитіла
і комплементу, в присутності яких мікроорганізми стають липкими,
склеюються не тільки між собою, а і з лейкоцитами, еритроцитами,
тромбоцитами, дріжджами та іншими мікроорганізмами. Реакція
імунного прилипання використовується в практиці порівняно рідко.
Реакція нейтралізації вірусів за допомогою специфічних антитіл
застосовується для виявлення вірусу або противірусних антитіл
у крові хворих людей або тварин. Звичайно її проводять на тваринах
або в культурі тканини. Якщо сироватка специфічна, то вона захи-
щає тварину од вірусної інфекції або оберігає клітини культури тка-
нини від цитопатичної дії вірусу.
Реакція з флюоресціюючимн антитілами полісистемна, непряма,
гетерологічна. У діагностиці інфекційних захворювань широко за-
стосовують реакції прямої і непрямої імунофлюоресценції (РІФ).
Для цього використовують антитіла, мічені флюоресцентним барвни-
ком — ізоціанатом флюоресцеїну. З’єднуючись з антигеном, вони
утворюють комплекс, який при діянні ультрафіолетового випромі-
нювання дає яскраво-жовте свічення. При прямій РІФ взаємодія
відбувається між антигеном і специфічними антитілами, попередньо
182
обробленими флюоресціюючими барвниками. При непрямій РІФ
спочатку зв’язують антиген із звичайним (неміченим) антитілом,
потім цей комплекс (антиген — антитіло) обробляють міченим анти-у-
глобуліном, який з’єднується з ним. Комплекс антиген — антитіло —
антиглобулін, що утворюється, легко виявляють у люмінесцентному
мікроскопі.
Імуноферментннй аналіз (ІФА) — це взаємодія антигену з антиті-
лом, хімічно зв’язаним з ферментом (пероксидаза хріну або лужна
фосфатаза). Комплекс антиген — антитіло, що утворюється, набуває
ферментативної активності і розщеплює відповідний субстрат з появою
забарвлювання і люмінесцентним ефектом.
Розрізняють прямий і непрямий ІФА. За допомогою прямого ІФА
визначають наявність антигену, непрямий метод використовують для
виявлення антитіл (до комплексу антиген — антитіло проти якого-
небудь антигену добавляють мічений ферментом антиглобулін проти
першої імунної сироватки і хромогенний субстрат).
Видимим ефектом позитивної реакції є темно-коричневе забарвлен-
ня в результаті з’єднання антиглобулінової сироватки, що несе іму-
ноферментний комплекс, з імуноглобуліном досліджуваної сироватки
крові. Якщо досліджуваний антиген не відповідає імунній сироватці,
то імуноферментннй комплекс не утворюється, колірної реакції не
настає.
Є кілька модифікацій ІФА. Найпоширенішою вважають твердофа-
зову, при якій антиген виявляють за допомогою антитіл, приєднаних
до поверхні полістерових пробірок (лунок).
ІФА — простий і доступний для звичайних лабораторій метод.
Він дає змогу виявляти антитіла або антигени при різних захворю-
ваннях людини.
Радіоімунологічннй метод (РІА). Для цього методу використову-
ють стандартну кількість антисироватки проти досліджуваного анти-
гену і стандартну кількість цього антигену, міченого радіонуклідом.
70—80 % міченого антигену зв’язується антитілами з утворенням ра-
діоактивного преципітату. При введенні до цієї системи субстрату,
який досліджують на присутність цього антигену, відбувається конку-
ренція з міченим антигеном, і радіоактивність преципітату знижує-
ться; чим більше антигену в досліджуваному матеріалі, тим менша
радіоактивність преципітату.
Докладніше методику застосування ІФА (РЕМА) та РІА викладе-
но в посібнику для практичних занять.
СПЕЦИФІЧНА ІМУНОТЕРАПІЯ ТА ІМУНОПРОФІЛАКТИКА
ІНФЕКЦІЙНИХ ЗАХВОРЮВАНЬ
ВАКЦИНОПРОФІЛАКТИКА
Вакцинами називають препарати, що застосовуються для активної
імунізації людей і тварин з метою специфічної профілактики і терапії
інфекційних захворювань. Термін «вакцина» походить від противіспя-
183
ного препарату, виготовленого Е. Дженнером із вірусу, який спричи-
няє віспу у корів (лат. оассіпа — коров’яча).
До вакцинних препаратів ставляться дуже високі вимоги. Щороку
в світі вакцинації піддають 1,5 млрд чоловік (1/3 населення).
Розрізняють такі види вакцин: 1) із живих збудників з ослабленою
вірулентністю; 2) з убитих корпускулярних патогенних мікроорганіз-
мів (бактерій, рикетсій і вірусів); 3) анатоксини; 4) із продуктів хі-
мічного розщеплення бактерій (хімічні); 5) комбіновані (асоційовані).
До вакцин із живих збудників, або живих вакцин, належать вак-
цини проти віспи, сибірки, сказу, туберкульозу, чуми, туляремії,
жовтої гарячки, поліомієліту, епідемічного паротиту, грипу, кору
та ін.
Методи виготовлення деяких живих вакцин наведені в розділі «Ге-
нетика мікроорганізмів» та у відповідних розділах спеціальної мікро-
біології.
Для збільшення тривалості зберігання без утрати імуногенних
властивостей тепер багато препаратів випускають у висушеному ви-
гляді. Висушування провадять у вакуумі при низькій темпера-
турі.
До недоліків живих вакцин належать введення в організм прищеп-
лених нуклеїнових кислот, тобто чужорідного генетичного матеріалу;
здатність вакцинних штамів вірусів до персистирування, яка часто
виявляється, а також можливість виникнення ускладнень при засто-
суванні вірусних атенуйованих штамів. Останнім часом ширше засто-
совують інактивовані вакцини проти грипу, поліомієліту, сказу,
кліщового та японського енцефаліту, а також проти туляремії,
сибірки та ін.
До вакцин з убитих патогенних мікроорганізмів (нагріванням,
обробкою спиртом, формаліном та ін.) належать черевнотифозна,
паратифозна, холерна, коклюшна, вакцини проти грипу, лептоспіро-
зів та ін. Для їх виготовлення підбирають спеціальні штами з досить
високими імуногенними властивостями. Перевагами інактивованих
вакцин є можливість використання кількох антигенів, стабільність,
безпечність і швидкість виготовлення.
Анатоксини виготовляють із екзотоксинів відповідних збудників
обробкою їх 0,3—0,4 % формаліном і витримуванням при температурі
38—40 °С протягом 3—4 тижнів. Широко застосовують дифтерійний,
правцевий, стафілококовий і холерний анатоксини. Добуто анатоксини
проти ботулізму, анаеробної інфекції. Ці препарати випускають в очи-
щеному вигляді: їх звільняють від баластних речовин і адсорбують на
гідраті окису алюмінію. Анатоксини спричиняють вироблення анти-
токсинів, які нейтралізують екзотоксини, але не діють згубно на збуд-
ників інфекцій.
Хімічні, або молекулярні, вакцини — це препарати, що склада-
ються не з цільних клітин бактерій, а з хімічних комплексів (протек-
тивних антигенів патогенних видів бактерій), добутих за допомогою
спеціальних методів обробки зависі культури. Так, наприклад, для
профілактики черевного тифу і правця застосовують хімічну сорбовану
вакцину з О- і Уі-антигенів черевнотифозних бактерій та очищеного
184
концентрованого правцевого анатоксину. Бактеріальні антигени і
правцевий анатоксин адсорбовані на гідроокису алюмінію.
Найбільш перспективні комбіновані (асоційовані) полівакцини,
що складаються з різних антигенів, за допомогою яких можна буде
відтворити антибактеріальний, антитоксичний і противірусний іму-
нітет.
Хімічні вакцини довго зберігаються, вони менш реактогенні,
не мають сенсибілізуючу та іншу побічну дію на організм і дають
змогу значно ширше використовувати асоційовані варіанти різних
антигенів.
У практиці специфічної профілактики інфекційних захворювань
використовують моновакцини (віспяну, антирабічну, туберкульозну
та ін.), дивакцини (дифтерійно-правцевий анатоксин), тривакцини
(коклюшно-дифтерійно-правцеву) і тетравакцини (проти черевного
тифу, паратифів А і В та правця).
Вакцини вводять в організм нашкірно, підшкірно, внутрішньо-
шкірно, через рот, на слизову оболонку носа, зіва. Через певний про-
міжок часу після введення (від кількох діб до кількох тижнів) ство-
рюється активний імунітет.
Вакцини виготовляють на спеціальних біофабриках, у виробничих
інститутах вакцин і сироваток або в окремих лабораторіях при на-
уково-дослідних інститутах. Виготовлені препарати піддають місцевому
й державному контролю.
Вакцинацію провадять з урахуванням епідеміологічної обстановки
і медичних протипоказань. До протипоказань належать гострі запаль-
ні захворювання, недавно перенесені гострі інфекції, хронічні інфек-
ції (туберкульоз, малярія), пороки серця, тяжкі ураження внутрішніх
органів, вагітність у другій половині, перші місяці годування груддю,
алергічні стани (бронхіальна астма, підвищена чутливість до якихось
харчових продуктів) та ін.
Умови зберігання, строки придатності вакцин і сироваток зазна-
чають на етикетках, методика застосування їх описується в спеці-
альних інструкціях, що вкладаються у коробки з флаконами або
ампулами.
Ефективність вакцинації залежить від природи та якості вакцини,
правильності її ведення, точності додержання дозування та інтервалів
між ін’єкціями, а також від стану людей, яких вакцинують.
Щеплення забезпечують міцний імунітет проти віспи, жовтої га-
рячки, поліомієліту, туляремії.
Розробляють і вивчають вакцини проти гонореї, менінгококової
і стрептококової інфекцій, лепри, трахоми, орнітозу, низки рпкет-
сіозів та ентеровірусних захворювань, малярії, вірусного гепатиту В,
ВІЛ-інфекції (СНІДу) та інших захворювань.
Вакцинація населення в нашій країні регламентується санітар-
ним законодавством і здійснюється медичними закладами в плановому
порядку.
Завданням найближчих років є подальше вдосконалювання методів
специфічної профілактики інфекційних захворювань з метою ство-
рення нових і поліпшення існуючих вакцинних препаратів, зокрема
185
виготовлення штучних вакцин з ділянок молекул антигенів, які ви-
значають розвиток імунної відповіді
ВАКЦИНОТЕРАПІЯ
Для лікування хворих з тривалим перебігом інфекційних захво-
рювань (хронічна гонорея, бруцельоз, дизентерія та ін.) застосовують
вакцини з убитих мікроорганізмів, анатоксини, екстракти із стафі-
лококів. Ефективне використання з лікувальною метою стафілоко-
кового анатоксину, полівалентної стафілококової і стрептококової,
гонококової, протибруцельозної, протидизеитерійиої вакцин і вак-
цини проти гострого розсіяного енцефаломіеліту і розсіяного скле-
розу.
Комплексна імуноантибіотикотерапія дає добрі результати при
стафілококових інфекціях, бруцельозі, орнітозі, актиномікозі, ентери-
тах, які спричиняються патогенними сероварами Е. соїі та ін.
У деяких випадках застосовують аутовакцини, виготовлені з мік-
роорганізмів, виділених у хворих.
Для підвищення реактивності організму, активації функцій орга-
нів і систем як засіб неспецифічної терапії при запальних захворюван-
нях очей, статевих органів у жінок, сифілісі нервової системи, екземі,
хронічній стрептодермії, мікозах, різних формах туберкульозу та
багатьох інших захворюваннях рекомендується застосування бакте-
ріального полісахариду — пірогеналу. Механізм його дії полягає
у збільшенні проникності стінок капілярів та основної речовини спо-
лучної тканини, стимуляції функції гіпофізарно-адреналової систе-
ми, посиленні синтезу білка в організмі, пригніченні процесів утво-
рення фібробластів із молодих клітин сполучної тканини, зменшенні
розвитку рубцевої тканини.
Добрий лікувальний ефект дає застосування продигіозану, добу-
того з ЗеггаНа щагзезсепз. Він активує фактори імунологічної реак-
тивності, підвищує ефективність антибіотикотерапії, сприяє розсмок-
туванню запальних вогнищ.
СЕРОТЕРАПІЯ І СЕРОПРОФІЛАКТИКА
Лікувальні і профілактичні сироватки випускають в очищеному
вигляді. їх обробка охоплює осадження глобулінів амонію сульфатом,
фракціонування, ультрацентрифугування, електрофорез, фермента-
тивний гідроліз, хроматографію, ультрафільтрацію, осадження в гра-
дієнті густини, що дає змогу видаляти до 80 % баластних білків. Такі
сироватки мають добрі лікувальні і профілактичні властивості, менш
виражену токсичну та алергічну дію.
Сироватки поділяють на антитоксичні й антибактеріальні. До
антитоксичних сироваток належать протидифтерійна, протиботулі-
нічна, протиправцева, проти анаеробної інфекції, укусу змій. їх при-
значають відповідно до діючих інструкцій, дози сироваток вимірю-
ють у міжнародних одиницях (МО).
186
Антибактеріальні і противірусні сироватки застосовують у вигляді
глобулінів та імуноглобулінів (у-глобуліни). Це сироватки проти
сибірки, чуми, натуральної віспи, сказу, кору, поліомієліту, гепатиту
А, скарлатини та ін.
Імуноглобуліни дістають методом фракціонування сиро-
ваткових білків за допомогою спиртоводних сумішей при температурі
нижче 0 °С. Розділяння білкових фракцій грунтується на їх різній
розчинності при зміні концентрації спирту, рН і вмісту електролітів.
Розроблено методи, які дають змогу мати стабільні, електрофоретично
чисті препарати імуноглобуліну.
Імуноглобуліни, добуті з крові людийи, використовують для
профілактики кору, поліомієліту, коклюшу, гепатиту А, паротит-
ної інфекції, вітряної віспи, скарлатини, натуральної віспи та
інших інфекцій. У ряді випадків імуноглобуліни можуть мати побічну
дію. Застосування імуноглобулінів обмежене в дітей, схильних до
алергічних реакцій або уражених алергічними захворюваннями,
а також у дітей з вираженими реакціями на попереднє введення пре-
парату.
Останнім часом випускають специфічні імуноглобуліни направле-
ної дії. їх виготовляють із сироватки крові донорів, імунізованих
проти цих інфекцій. Такі імуноглобуліни містять більш високий титр
антитіл.
Для лікування хворих, уражених тяжкими бактеріально-септич-
ними і вірусними захворюваннями у гострій фазі, а також при гіпо-,
агаммаглобулінеміях та хірургічних ускладненнях внутрішньовенно
вводять імуноглобулін сироватки крові здорової людини, що містить
головним чином і має знижені антикомплементарні властивості;
його готують із венозної або плацентарної крові здорових породіль.
До імунопрепаратів відносять альбумін і протеїн, що застосову-
ються при лікуванні хворих з тривалими гнійними процесами; гісто-
глобулін (комплекс у-глобуліну і гістаміну), що має антиалергічну
дію; фібринолізин, який спричиняє лізис згустків фібрину; амінокро-
він (розчин амінокислот і низькомолекулярних пептидів), що має
дезинтоксикаційну дію і застосовується при захворюваннях шлунка
і кишок.
ХІМІОТЕРАПІЯ І ХІМІОПРОФІЛАКТИКА ІНФЕКЦІЙНИХ
ЗАХВОРЮВАНЬ
ХІМІОТЕРАПЕВТИЧНІ ЗАСОБИ
У медичній практиці для лікування хворих на інфекційні захво-
рювання і в ряді випадків з профілактичною метою застосовують різні
відносно нешкідливі для макроорганізму хімічні речовини, що згубно
діють на патогенні мікроорганізми.
Хіміотерапевтичні засоби у вигляді народних засобів давно були
відомі і використовувались для лікування різних захворювань. Так.
індійці Перу відкрили лікувальну дію хінної кори. У XVII ст. хінна
кора була завезена в Європу. Жителі Бразілії з успіхом застосову-
187
вали корінь іпекакуани при амебіазі. Широкого розповсюдження на-
брала ртуть як засіб для лікування хворих иа сифіліс.
Основи сучасної хіміотерапії були закладені П. Ерліхом і
Д. Л. Романовським, які сформулювали її головні наукові принципи
і зміст.
П. Ерліх розробив основи синтезу лікарських засобів хімічними
варіаціями; він дістав метиленовий синій, похідні миш’яку — саль-
варсан, неосальварсан. Дальший розвиток хімії дав змогу добути
нові лікарські засоби.
Хіміотерапевтичні засоби повинні мати максимальну терапевтичну
ефективність і мінімальну токсичність для організму.
Для оцінки якості хіміотерапевтичних засобів П. Ерліх запрова-
див хіміотерапевтичний індекс, що є відношенням максимальної
дози, що переноситься, до мінімальної лікувальної дози:
Максимальна доза, що переноситься (ОТ — Оозіз ІоІегапНа)
Мінімальна лікувальна доза (ОС — Оозіз сигаііуа)
Хіміотерапевтичний індекс повинен бути не менше 3.
Хіміотерапевтичні засоби мають бактерицидну і бактеріостатичну
дію. Адсорбуючись збудником, вони руйнують його життєво важливі
структури, інактивують ферменти, порушують функції нуклеїнових
кислот, пригнічують біохімічні процеси мікроорганізмів.
Хімічні бактерицидні речовини мають властивості антагоністів,
з’єднуються з білковими апоферментами, коферментами, перешко-
джають з’єднанню їх з нормальним субстратом. У хімічних антагоні-
стах енергетичних процесів є токсичні продукти ферментів дихання
(окис вуглецю, ціаніди) та окислювального фосфорилювання (динітро-
фенол); хімічні антагоністи біосинтетичних процесів мають у своєму
складі аналоги будівельних блоків білка (амінокислоти) і нуклеїнових
кислот (нуклеотиди), які можуть запобігти включенню нормальних
метаболітів до складу синтезованого білка або заміщати нормальний
метаболіт у макромолекулі і тим самим порушувати її функцію.
Бактеріостатична дія хімічних речовин може бути припинена
видаленням їх із бактеріальної клітини відмиванням, нейтралізацією
або добавлянням речовини, яка запобігає її з’єднанню з клітинним
компонентом.
Препарати для лікування інфекційних захворювань включають
такі основні групи.
Препарати ми ш’я к у (новарсенол, міарсенол, осарсол та
ін.) вводять при трипаносомозі, амебіазі, балантидіазі, содоку та
інших захворюваннях.
Препарати вісмуту (основний нітрат вісмуту, ксеро-
форм, бійохінол та ін.) застосовують при ентероколітах, сифілісі.
Препарати сурми (калій винносурм’янокислий, солю-
сурмін та ін.) використовують для терапії хворих на лейшманіоз,
пахвинний лімфогранулематоз.
Препарати ртуті (ртуті оксиціанід, ртуті монохлорид,
каломель, ртутна сіра мазь, що містить металічну ртуть, та ін.) при-
значають як антисептичні засоби при гнійних запальних процесах.
188
Препарати акридину (етакридину лактат, трипафла-
він, акрицид та ін.) застосовують як зовнішній антисептичний засіб
при гнійно-запальних процесах.
До протималярійних засобів відносять більш як
ЗО препаратів: хінгамін, хіноцид та ін.
Сульфаніламідні препарати. Впровадження в
практику сульфаніламідних препаратів (стрептоцид, етазол, норсуль-
фазол, сульфадимезин, фталазол, сульгін, сульфацил-натрій, сульфа-
диметоксин та ін.) ознаменувало переворот у хіміотерапії при бакте-
ріальних інфекціях. За одержання сульфаніламідних препаратів
Г. Домагк був відзначений у 1939 р. Нобелівською премією.
Сульфаніламідні препарати дають добрий лікувальний ефект
при інфекціях, що спричиняються грампозитивними і грамнегативними
бактеріями та деякими найпростішими,— скарлатині, бешисі, ангіні,
пневмонії, дизентерії, анаеробній інфекції, гонореї, циститі, венерич-
ному лімфогранулематозі, орнітозі, трахомі, бленореї новонародже-
них, лепрі та багатьох інших.
Похідні нітрофурану (фурацилін, фурадонін, фура-
гін) застосовують для лікування захворювань, що спричиняються
грампозитивними бактеріями, деякими крупними вірусами, трихомо-
надами і лямбліями.
Протитуберкульозні препарати — тіоацетазон,
фтивазид, ізоніазид, етіонамід, салюзид, натрію парааміносаліцилат
(ПАСК) та ін. використовують для лікування хворих на туберкульоз.
Похідні хіноксаліну (хіноксидин, діоксидин та ін.)
ефективно діють при низці бактеріальних інфекцій.
Противірусні препарати. Досі лікарських засобів
проти багатьох вірусних інфекцій ще не винайдено. Це пояснюється
біологічними особливостями вірусів як облігатних внутрішньоклі-
тинних паразитів, діяти на які треба інакше, ніж на бактерії та інші
мікроорганізми.
До протигрипозних препаратів належить ре-
мантадип; до против і спяннх — метисазон, левамізол. Для
профілактики рецидивів герпесу застосовують левамізол,
для лікування герпетичних уражень очей використову-
ють препарат місцевої дії — ідоксуридин (кереппд).
Інтерферон — це лікувальний і профілактичний засіб при грипі
та інших вірусних респіраторних захворюваннях. Для створення у си-
роватці крові мінімальної концентрації препарату його вводять із
розрахунку 100 000—200 000 ОД на і кг маси тіла пацієнта, звичайно
1—3 млн ОД на ін’єкцію.
При лікуванні деяких вірусних захворювань призначають дезокси-
рибонуклеазу і рибонуклеазу, які мають властивість руйнувати нукле-
їнові кислоти вірусів, що несуть функції інфекційних агентів. Так,
місцеве застосування дезоксирибонуклеази у вигляді крапель ефектив-
не при кератиті, що спричиняється аденовірусами. Проте нуклеази
не завжди дають терапевтичний ефект, бо нуклеїнові кислоти вірусів
захищені від дії ферменту білковою оболонкою.
189
Застосовують хімічні препарати, що діють на репродукцію віру-
сів: метисазон (віспа), аникловір (герпес), азидотимідин (ВІЛ). В експе-
рименті на тваринах доведена ефективність при вірусних інфекціях
гуанідину (пікорнавіруси), аналогів глутаміну (пікорнавіруси, тога-
віруси), аналогів тимідину (віруси герпесу, вісповакцини) та ін.
Протипухлинні препарати. До таких засобів належать азотисті
аналоги іприту (дегранол, допан, ембіхін, новембіхін, циклофосфан),
антиметаболіти (антипурини, антипіридинн, гормони, фторурацил,
цитозар, метотрексат та ін.). Ці препарати не позбавлені побічної
дії. Деякі з ннх пригнічують кровотворну систему, спричиняють
мутації здорових клітин.
АНТИБІОТИКИ
Антибіотики (лат. апііЬіоІіса — засіб проти бактерій) є різнови-
дом хіміотерапевтичних препаратів. Антибіотики — хімічні речо-
вини біологічного (мікроорганізмового) походження і їх напівсинте-
тичні похідні, які пригнічують розвиток патогенних мікроорганізмів,
а в ряді випадків затримують ріст злоякісних новоутворень.
Антагоністичні взаємовідношення між мікроорганізмами різних
видів уперше спостерігав Л. Пастер у 1887 р. Він довів, що бацили
сибірки швидко гинуть у мішаних культурах з гнильними мікроорга-
нізмами й охарактеризував це явище як боротьбу за існування.
Перший антибіотик бактеріального походження, застосований як
антисептичний засіб, було одержано з синьогнійної палички Р. Емме-
ріхом та О. Левом. Цей препарат дістав назву піоціанази. Однак
вчення про антибіотики було започатковане лиш у 1929 р., коли
А. Флемінг довів, що фільтрат бульйонної культури плісеневого
гриба РепісіІІіит поїаіит (див. рис. 57, а) має антибактеріальні
властивості. У 1940 р. Е. Чейн і Г. Флорі виготовили відносно стій-
кий препарат пеніциліну. За відкриття і застосування пеніциліну
в медицині А. Флемінг, Е. Чейн і Г. Флорі в 1945 р. були відзначені
Нобелівською премією.
Дальший розвиток цієї проблеми пов’язаний з працями 3. Ваксма-
на з співробітниками (1944), які відкрили стрептоміцин, Б. П Токіна
(1951), котрий виділив антибактеріальні речовини з рослин — фі-
тонциди, а також інших дослідників, що збагатили сучасну медичну
практику численними препаратами, широко застосовуваними для
лікування при інфекційних захворюваннях.
Антибіотики виготовляють спеціальними методами, що застосо-
вуються в медичній промисловості. Для виробництва природних анти-
біотиків використовують штами — продуценти грибів, актиноміцетів,
бактерій, які засівають у живильний субстрат. Через певний час їх
росту антибіотики екстрагують у ферментаторах, очищають і концен-
трують, перевіряють на нешкідливість і активність.
Механізм дії антибактеріальних препаратів проявляється на клі-
тинному й субклітинному рівні; він може бути виражений у вигляді
гальмування синтезу полімерів клітинної стінки (пеніциліни, цефало-
спорини, циклосерин та ін.), порушення біосинтезу білка (тетрациклі-
190
Рис 56. Затримка росту
стафілококів під вп тиком
пеніциліну (а), левоміцети-
ну (б), стрептоміцин) (в),
тетрацикліну (г).
Рис 57 Продуценти пеніциліну — Репісії-
Ііит поіаіит (а) і Репісіїїіит сЬгузоеепит
(б).
ни, хлорамфенікол, стрептоміцин та ін.), пригнічення синтезу цито-
плазматичної мембрани (поліміксини, амфотерицин В, ністатин та
ін.); пригнічення синтезу нуклеїнових кислот (рифампіцин).
Протипухлинні антибіотики затримують синтез нуклеїнових кислот
(ДНК і РНК) пухлинних клітин, позбавляють їх репараційних вла-
стивостей.
За типом взаємодії з бактеріальними клітинами антибіотики поді-
ляють на бактеріостатичні (тетрацикліни, левоміцетин та ін.) і бакте-
рицидні (пеніциліни, ристоміцин та ін.) Кожен антибіотик характери-
зується певним антибактеріальним спектром дії; для визначення чут-
ливості бактерій до антибіотиків використовують спеціальні диски
(рис. 56) Деякі антибіотики інактивуються в присутності білкових
речовин тваринних і рослинних тканин. Тільки невелика група їх дає
значний антибактеріальний ефект, що слабшає в присутності білко-
вих речовин тваринних тканин, і разом з тим не є токсичною (у певних
концентраціях) для людини.
Активність антибіотиків виражається в міжнародних одиницях
(ОД); І ОД — це активність 1 мкг чистого препарату антибіотиків.
Наприклад, за 1 ОД пеніциліну вважають найменшу кількість пре-
парату, що пригнічує ріст еталонного штаму стафілокока в 50 мл
живильного середовища. Одиниця дії (ОД) відповідає активності
0,6 мкг хімічно чистої кристалічної натрієвої солі бензилпені-
циліну
Останнім часом широко застосовується метод визначення актив-
ності антибіотиків за масою препарату. Концентрація як сухих пре-
паратів, гак і розчинів виражається кількістю мікрограмів активної
речовини в І г препарату або в 1 мл розчину.
Антибіотики, що випускаються в нашій країні, поділяють на пре-
парати групи пеніциліну (пеніцилін, біцилін, ампіцилін, ампіокс,
карбеніцилін, мікроцид та ін.), цефалоспорини (цефалоридин, цефа-
лексин, цефаюлін), тетрацикліни (тетрациклін, окснтетрациклін,
хлортеграциклін, метациклін, доксициклін), групи стрептоміцину
191
(стрептоміцин, дигідрострептоміцин та
Дг ін.), антибіотики-аміноглікозиди (нео-
я я мінин, моиоміцин, канаміцин, гента-
£ я міцин, тобраміцин, амікацин та ін.),
антибІ°тики'маКР0Л,Ди (еритроміцин,
л Ші & в ерициклін, олеандоміцин, олететрин та
/а Аи У/ідг я ін.), групи левоміцетину (левоміцетин,
8 а синтоміцин та ін.), рифаміцини (рифа-
’ 1 міцин 8У, рифампіцин), протигрибкові
)/ антибіотики (ністатин, леворин, амфоте-
рицин В, амфоглюкамін, мікогептин),
а також антибіотики різних груп (лійко*
у міцин, ристоміцнн, полімікснн, граміци-
дин та ін.) і протипухлинні антибіотики
(оливоміцин, рубоміцин, карміноміцин,
у адріаміцин, брунеоміцин та ін.).
Я Пеніциліни продукуються різ-
’’ ними видами плісеневого гриба пеніци-
Рис. 58. Продуцент стрептомі- ліуму — Репісіїїіит поіаіит (рис. 57,
цнпу — зігеріотусеч егузеиз. а), Репісіїїіит сЬгузо^епит (рис. 57, б)
та ін. Його випускають у вигляді натріє-
вої, калієвої, новокаїнової і дибензилетилендіамінової (біцилін) солей
бензилпеніциліну. Він добре розчиняється у воді, розчини його не-
стійкі. У хімічному відношенні є дипептидом, що складається з диме-
тилцистеїну й ацетилсерину.
Пеніциліни застосовують при стафілококових, -стрептококових,
менінгококових захворюваннях, анаеробній інфекції, гонореї, сифілісі,
лептоспірозі, сибірці та інших захворюваннях.
До препаратів пеніциліну відносять біцилін-1, біцилін-3, біцилін-5,
що являють собою лікарські форми пеніциліну тривалої дії, які за-
безпечують необхідну терапевтичну концентрацію пеніциліну в крові.
Продуктом життєдіяльності Репісіїїіит §гІ8ео!иІуит є гризеофуль-
він. Його призначають для лікування хворих на трихофітію, мікро-
спорію, епідермофітію, фавус.
Препарати пеніциліну вибірково гальмують формування поліме-
рів клітинної стінки бактерій, пригнічують активність ферменту,
який каталізує утворення зв’язку між пентапептидами пептидогліка-
нів, що веде до порушення синтезу клітинної стінки і загибелі бакте-
рій внаслідок осмотичного шоку. За відповідних умов дія пеніциліну
призводить до появи Ь-форм бактерій.
Цефалоспорини, що продукуються грибами роду СерЬа-
Іозрогіит, схожі на пеніциліни, мають бактерицидну дію, активні
проти грам позитивних і грамнегативних бактерій, резистентні до
0-лактамаз. Добрий ефект препарат дає при лікуванні інфекцій
дихальних і сечостатевих органів.
Стрептоміцин добутий з актиноміцетів (Зігеріотусез §гі-
зеиз та ін.) (рис. 58). Він характеризується бактеріостатичними вла-
стивостями щодо грамнегативних і грампозитивних патогенних мікро-
192
організмів. Стрептоміцин ефективний при туберкульозі, туберкульоз-
ному менінгіті, чумі, туляремії та ін.
Стрептоміцин гальмує включення деяких амінокислот до синтезу
білків, перенесення амінокислот у пептидний ланцюг, руйнує фермент
бактерій, за участю якого піровиноградна кислота включається до
циклу трикарбонових кислот з’єднанням її з щавлевооцтовою кисло-
тою, пригнічує діяльність біотинвмісних ферментів, що каталізують
приєднання вуглекислого газу до карбонових кислот, порушує зчиту-
вання генетичного коду, в результаті замість аланину включається
лейцин.
Левоміцетин (хлорамфенікол) добутий з культу-
ральної рідини штаму ЗІгеріошусез уепегиеііае, виділеного з грунту
тропічної зони Південної Америки. Дає добрий лікувальний ефект при
черевному тифі, паратифах А і В. Препарат є інгібітором біосинтезу
білка бактерій — блокує утворення пептидного зв’язку.
Левоміцетин добре розчиняється в ліпідах і легко проникає через
гематоенцефалітичний бар’єр, має лікувальну дію при захворюваннях
центральної нервової системи, у тому числі і злоякісних пухлинах,
тоді як пеніцилін та інші препарати проникають погано або зовсім не
проникають через гематоенцефалітичний бар’єр.
Тетрацикліни (тетрациклін, хлортетрациклін, окситетра-
циклін). Тепер застосовують напівсинтетичні тетрацикліни (морфо-
циклін, метациклін, або рондоміцин, доксициклін, або вібраміцин,
та ін.), які мають широкий спектр дії, пригнічують багато видів грам-
позитивних, грамнегативних і кислотостійких мікроорганізмів. Крім
того, препарати тетрацикліну пригнічують розвиток багатьох рикетсій
і деяких найпростіших. їх рекомендують застосовувати для лікування
хворих на холеру, пневмонію, підгострий септичний ендокардит,
амебіаз, дизентерію, коклюш, гонорею, захворювання сечостатевих
шляхів, при висипному тифі та інших рикетсіозах, нагнійних
процесах.
Еритроміцин (із групи макролідів) виділений із Зігеріошу-
сез егуіИгеиз. Застосовують при стрептококових захворюваннях. До
еритроміцину також дуже чутливі дифтерійні коринебактерії, міко-
плазми, хламідії трахоми.
Л і н к о м і ц и н добуто з культуральної рідини Зігеріотусез
Іілсоїпіепяіз, він затримує життєдіяльність грампозитивних коків,
особливо стафілококів при остеомієліті.
Ністатин добуто з культуральної рідини Зігеріошусез поиг-
8еі. Пригнічує ріст багатьох патогенних грибів, нетоксичний при за-
стосуванні всередину. Широко застосовують при лікуванні кандидозу.
Канаміцин — антибіотик, що продукується Зігеріошусез
капатусеіісиз. За своєю дією на грампозитивні і грамнегативні бакте-
рії близький до стрептоміцину. Канаміцин рекомендують при ліку-
ванні хворих на туберкульоз, у яких збудник став стійким до протиту-
беркульозних хіміопрепаратів та антибіотиків. Його призначають
/•ля лікування захворювань, спричинених резистентними штамами
сіафілококів, сибірки, гонореї, гострих і хронічних форм інфекції
сечових шляхів.
7 1-445
193
Ристоміцин добуто з Ргоасііпотусез Ггисііуегі уаг. гізіо-
тусіпі, має властивість пригнічувати біосинтез клітинної стінки
грампозитивних коків (стафіло- і стрептококів), у тому числі і рези-
стентних до інших антибіотиків. Його застосовують при септицемії,
ендокардитах, пневмонії, остеомієліті, ентероколітах та ін.
Циклосерин продукується $ігеріотпусе« Іауепсіиіае та інши-
ми актиноміцетами. Ефективний при лікуванні хворих на туберкульоз.
Л е в о р и н, що виділяється Зігеріотусез ієуогіз, використовує-
ться при лікуванні поверхневих і глибоких кандидозів.
Амфотерний н, що продукується Зігеріотусез посіозит,
так само як і амфоглюкамін, активний щодо дріжджоподібних грибів,
збудників глибоких і системних мікозів, зокрема гістоплазмозу,
хромікозу, споротрихозу.
Серед інших антибіотиків на велику увагу заслуговують препара-
ти групи рифампіцину, а також нові аміноглікозиди (геитаміцин,
тобраміцин, сизоміцин та ін.).
П о л і м і к с и н и (В, М) утворюються Васіііиз роїугпуха,
мають бактерицидну дію проти грамнегативних бактерій.
Поліміксин М рекомендується застосовувати при кволому пере-
бігу місцевих процесів (інфіковані опіки, пролежні, некротичні ви-
разки та ін.) у вигляді мазей; добрий результат мають при лікуванні
хворих на інфекції, спричинені синьогнійною паличкою і клебсієла-
ми. Поліміксин В призначають при менінгіті, спричиненому синьо-
гнійною паличкою.
Напівсинтетичні антибіотики. До таких антибіотиків напежать
пеніциліни, виготовлені на основі 6-амінопенішілінової кислот (ме-
тицилін, оксацилін, диклоксацилін, ампіцилін, ампіокс та інші пені-
циліназостійкі препарати); цефалоспорини, добуті з основи — 7-амі-
ноцефалоспоранової кислоти (цефазолін, цефалоридин та ін.). Напів-
синтетичні пеніциліни і цефалоспорини призначають при захворюван-
нях, спричинених стафілококами, стійкими до пеніциліну, а також при
інших інфекціях.
Широкий спектр бактеріостатичної дії має доксицилін (похідне
окситетрацикліну), ефективний щодо грампозитивних і грамнегатив-
них бактерій.
До протипухлинних антибіотиків належать карміноміцин, оливомі-
цин, брунеоміцин, адріаміцин та ін., які застосовують для лікування
різних форм злоякісних захворювань.
Препарати аитрациклінового ряду (рубоміцин, карміноміцин,
адріаміцин, оливоміцин, брунеоміцин та ін.) утворюють комплекси
з ДНК пухлинних клітин і пригнічують її матричну актив-
ність.
Резистентність мікроорганізмів до антибіотиків. Одним із наслід-
ків лікування антибіотиками є селекція резистентних до них форм
мікроорганізмів, чому запобігти дуже важко. Велику небезпеку стано-
вить розповсюдження антибіотикостійких стафілококів, які спричи-
няють тяжкі форми, особливо у дітей, септицемії, пневмонії, коліту,
різні післяопераційні ускладнення, остеомієліт, стійкий фурункульоз
та інші гнійно-запальні процеси.
194
Застосування антибіотиків з широким спектром дії може призвести
до різних форм дисбактеріозу, розвитку захворювань, зумовлених
стійкими до антибіотиків штамами протея, синьогнійної палички,
грибами.
У процесі мінливості в організмі хазяїна віруси виробляють стій-
кість проти інтерферону, ремантадину, а також інших хіміопрепа-
ратів.
Побічна дія антибіотиків. Доведено, що стрептоміцин та інші амі-
ноглікозиди можуть мати ото- і нефротоксичну дію; тетрацикліни
спричиняють ураження печінки, левоміцетин має токсичну дію на
кровотворні органи. При введенні пеніциліну і стрептоміцину можуть
розвиватися різні алергічні реакції, іноді в тяжкій формі. Найбільш
грізним ускладненням є анафілактичний шок від застосування пені-
циліну.
До алергічних реакцій, пов’язаних із застосуванням лікарських
засобів, належить контактний дерматит. Захворювання спричиняє-
ться дією стрептоміцину, спостерігається у медичних працівників і
хворих, які тривалий час приймають цей препарат.
Антибактеріальні засоби можуть спричиняти порушення генетич-
ного апарату клітин макроорганізму, зумовлювати хромосомні абера-
ції; деякі з цих препаратів мають тератогенну дію, що призводить до
виникнення виродливостей плода внаслідок приймання препаратів
жінками у перші дні вагітності.
Під впливом антимікробних агентів порушується імунна відповідь;
в результаті швидкого видалення антигенів організм втрачає здат-
ність виробляти імунітет.
Антибактеріальні засоби є причиною утворення численних ва-
ріантів мікроорганізмів із слабко вираженою патогенністю (атипові,
фільтрівні штами і Ь-форми), які призводять до формування латентних
форм інфекцій з рецидивами і загостреннями.
У зв’язку з великим розповсюдженням резистентних до антибіоти-
ків бактерій рекомендується застосовувати комбіноване лікування
з використанням нових препаратів, до яких ще не сформувалась
стійкість збудників інфекційних захворювань.
Із нових поколінь напівсинтетичних лікарських засобів, які знач-
но підвищують антибактеріальну активність і мають менш виражену
побічну дію, слід виділити цефалоспорини.
Вважається доцільним не призначати антибіотики при легких
формах дизентерії, коліентеритів та інших захворювань, а також з про-
філактичною метою при хірургічних втручаннях, за винятком тих
випадків, коли будь-яка інфекція становить небезпеку для життя хво-
рого, що оперується.
Щоб запобігти циркуляції К-плазмід, які детермінують резистент-
ність до антибіотиків, або зменшити її, розробляють препарати, що
елімінують К-плазміди або блокують їх реплікацію
7*
Частина друга
СПЕЦІАЛЬНА МІКРОБІОЛОГІЯ
БАКТЕРІЇ І ЗАХВОРЮВАННЯ, ЩО СПРИЧИНЯЮТЬСЯ
НИМИ У ЛЮДИНИ
На підставі істотних відмінностей у структурі і хімічному складі
клітинних стінок і відповідно до нової систематики бактерій Бергі
(Вег^еу’з Мапиаі оі Зузіетаїіс Васіегіоіо^у, 1984) в спеціальній ча-
стині підручника дається окремий опис грамнегативних (Сгасіїісиїез)
і грампозитивних (Ріппісиїез) бактерій.
ГРАМНЕГАТИВНІ КОКИ
До грамнегативних коків належать різні щодо механізму зара-
ження та локалізації патогенні види, які спричиняють гонорею і бле-
норею, менінгококову інфекцію, а також звичайно непатогенні ана-
еробні вейлонели, за морфологією подібні до гонококів. Вміст пепти-
доглікапу у грамнегативних бактеріях коливається в межах 5—20 %.
гонококи
Збудник гонореї і бленореї (ІЧеіззегіа єопоггЬоеае) був виявлений у 1879 р.
А. Ненсером у гнійних виділеннях. У чистій культурі збудник був виявлений
і докладно вивчений Е. Бумом у 1885 р. Гонококи входять до родини Иеіззе-
гіасеае. роду Гмеїззегіа.
Рис. 59. Менінгококи (а) та їх
колонії (б), гонококи (в) та їх
колонії (г) иа сироватковому
агарі.
Морфологія. Гонокок — диплокок
завдовжки 1,25 мкм, діаметром 0,7—0,8
мкм. Це парний, бобовидний кок, що
розташовується внутрішньоклітинно
(рис. 59, в) і позаклітинно, не утворює
спор, не має джгутиків; при негативному
забарвленні виявляється капсула.
Гонококи характеризуються полімор-
фізмом. Вони порівняно швидко зміню-
ються під впливом лікарських засобів,
втрачають свою типову морфологію,
стають крупними, іноді грампозитивними
і розташовуються поза клітинами; під
впливом пеніциліну можуть утворювати
Ь-форми.
196
При хронічному перебігові захворювання відбувається аутоліз
гонококів з виникненням змінених, неоднакових за величиною і фор-
мою клітин гонококів (форми Аша). Схильність гонококів до морфоло-
гічної мінливості слід ураховувати в лабораторній діагностиці.
Культивування. Гонокок — аероб або факультативний анаероб.
Не росте на звичайних середовищах, добре культивується в середо-
вищах, що містять білок людини (кров, сироватка) з рН у межах 7,2—
7,6. Оптимальна температура росту 35—36 °С, не розвивається при
температурі 25 і 42 °С.
Найбільш придатними для росту гонококів середовищами є сироват-
ковий агар і середовище Бейлі. Для пригнічення супровідної мікро-
флори до живильних середовищ добавляють поліміксин або ристомі-
цин. На густих середовищах колонії гонококів прозорі, круглі (див.
рис. 59, г), 1—3 мм у діаметрі. За величиною розрізняють дрібні
(ТІ, Т2) і крупні (ТЗ і Т4) колонії: особини із дрібних колоній мають
фімбрії, за допомогою яких вони прикріплюються до поверхні епіте-
ліальних клітин слизових оболонок людини, і більш вірулентні.
Ферментативні властивості. У біохімічному відношенні гонокок
малоактивний, не має протеолітичної активності, ферментує глюкозу
з утворенням кислоти, дає позитивну реакцію на цитохромоксидазу.
Токсиноутворення. Гонокок не продукує екзотоксин; в результаті
руйнування бактерійних тіл утворюється ендотоксин, токсичний для
людини та експериментальних тварин.
Антигенна структура. Гонококи містять два антигенних комплекси:
протеїновий, спільний з білковими антигенами менінгокока і 8. рпеи-
шопіае, і полісахаридний, за якими їх поділяють на Ібсероварів.
Резистентність. Гонококи дуже чутливі до охолодження. Вони
не переносять висихання, хоч у товстому шарі гною і на вологих пред-
метах зберігаються у зовнішньому середовищі до 24 год. При темпе-
ратурі 56 °С гинуть протягом 5 хв, від дії нітрату срібла 1 : 1000
і 1 % фенолу — протягом кількох хвилин.
Патогенність для тварин. Гонокок не патогенний для тварин,
внутрішньоочеревинне введення культури білим мишам призводить
до летального кінця від інтоксикації, але не відтворює типову гоно-
рейну інфекцію.
Патогенез захворювання у людини. Джерелом інфекції є хвора
на гонорею людина. Захворювання передається статевим шляхом,
іноді через предмети вжитку (пелюшки, губки, рушники та ін.).
Шляхи проникнення збудника — слизова оболонка сечовипускного
каналу, а в жінок, крім того, і слизова оболонка шийки матки, висте-
лена циліндричним епітелієм.
За допомогою фімбрій гонококи прикріплюються до клітин епітелію
слизових оболонок сечовипускного каналу, шийки матки, піхви,
прямої кишки, а при орально-генітальному зараженні — і слизової
оболонки порожнини рота.
Гонорея характеризується гострим гнійним запаленням сечостате-
вих органів. У жінок уражуються шийка матки, маткові труби,
яєчники, у дівчаток — вульва, переддвер’я піхви і піхва, у чолові-
ків — сечовипускний канал, сім’яні міхурці, передміхурова залоза,
197
оричому захворювання може набувати хронічного перебігу. Із шийки
матки гонококи можуть проникнути в пряму кишку. До екстрагені-
тальних форм інфекції належать ендокардит, менінгіт, артрит, сто-
матит, бленорея, септицемія.
Нерідко у хворих жінок поряд з гонококами виявляють і піхвові
трихомонади; у фагосомах останніх є гонококи, захищені мембранами
від дії лікарських засобів.
Уретрит, подібний за клінічними проявами до гонорейного, може
спричинятися стафілококами, Е. соїі та іншими мікроорганізмами.
Збудниками бленореї в ЗО % випадків можуть бути стрептококи,
Е. соїі, хламідії та ін.
Імунітет. Перенесене захворювання не залишає несприйнятливості,
природженого імунітету немає У сироватках хворих можна виявити
імуиоглобуліни (аглютиніни, преципітини, опсоніни і комплемент-
зв’язуючі антитіла), але вони не забезпечують захисту організму від
повторного зараження і захворювання. Фагоцитоз при гонореї неза-
вершений.
Лабораторна діагностика. Для бактеріоскопічного дослідження
беруть виділення сечовипускного каналу, піхви, вульви, шийки матки,
передміхурової залози, прямої кишки, кон’юнктиви, а також осад
і нитки сечі, сперму. Мазки забарвлюють за Грамом (див. форзац,
рис. II, в) і метиленовим синім за Леффлером (див. форзац, рис. III, г).
Бактеріоскопія мазків нерідко не дає змоги поставити діагноз,
оскільки в досліджуваному матеріалі можуть бути інші грамнегатив-
ні анаеробні бактерії з роду УеіІІопеІІа, подібні до гонококів. Най-
більш специфічними є методи імунофлюоресценції (прямої і непрямої).
При прямому методі виділені мікроорганізми обробляють флюоресцію-
ючими антитілами проти гонококів; при непрямому методі використо-
вують відому культуру гонококів, оброблену сироваткою крові хво-
рого; комплекс антитіла з антигеном при позитивному результаті
після додавання флюоресціюючої антисироватки стає видимим.
Якщо бактеріоскопія не дає змоги поставити діагноз, вдаються до
виділення культури. Для цього досліджуваний матеріал (гній, виді-
лення кон’юнктиви, осад сечі і т. д.) висівають на спеціальні живильні
середовища. При хронічній і ускладненій формах гонореї роблять
РЗК на холоді, РИГА, внутрішньошкірну алергічну пробу.
Лікування. Хворим на гонорею призначають антибіотики (біцилін-
6, метацилін, напівсинтетичні тетрацикліни) і сульфаніламідні пре-
парати пролонгованої дії. Проти гонококів, які продукують пеніцилі-
назу, застосовують спектиноміцин (аміноциклічний антибіотик для
внутрішньом’язового введення). При ускладненнях вводять полівак-
цину й аутовакцину, а також застосовують піротерапію (введення пі-
рогеналу або чужорідних протеїнів), аутогемотерапію.
Профілактика полягає у підвищенні загального культурно-гігієніч-
ного рівня життя, виховній і санітарно-освітній роботі серед населен-
ня. Велике значення в боротьбі з гонореєю мають раннє виявлення
джерел зараження і контактів, ефективне лікування хворих.
Останнім часом розроблені і застосовуються засоби для індивіду-
альної профілактики гонореї (хлоргексидин, мірамістін та ін.).
198
Щоб запобігти бленореї, усім новонародженим у кон’юнктиваль-
ний мішок вводять І—2 краплі 2 % розчину нітрату срібла. У ряді
випадків (у недоношених дітей) розчин нітрату срібла не дає позитив-
ного результату. Добрий ефект мають від введення у кон’юнктивальний
мішок 1—2 крапель 3 % масляного розчину пеніциліну. Гонококи
гинуть протягом 15—ЗО хв. Крім того, краї повік промивають розчи-
нами перманганату калію, борної кислоти, сульфацилу натрію.
Незважаючи на застосування ефективних антибіотиків, захворю-
ваність на гонорею в усіх країнах світу має тенденцію до зростання.
Збільшилась і кількість ускладнень: бленорея V новонароджених,
вульвовагініти у дітей, сальпінгіти і безплідність у жінок.
Причинами зростання захворюваності на гонорею є соціальні
фактори (проституція, гомосексуалізм та ін.), не досить повна реєстра-
ція хворих, неповноцінне лікування, формування резистентності до
пеніциліну, детермінованої плазмідними генами, які кодують вироб-
лення бета-лактамази.
МЕНІНГОКОКИ
Менінгокок (№І58егіа тепіп^ііідіз) виділив із спинномозкової рідини хво-
рих на менінгіт і докладно вивчив у 1887 р. А. Вейксельбаум. Менінгокок нале-
жить до родини І^еіззегіасеае, роду №Ї55егіа.
Морфологія. Менінгокок — парний кок 0,6—1 мкм у діаметрі,
бобовидної форми, нагадує кавові зерна. Парні коки з’єднані між
собою по довгій осі угнутими сторонами, зовнішні сторони коків
опуклі. Менінгококи не утворюють спор, не мають джгутиків, у чистих
культурах розташовуються тетрадами, у гнійному вмісті знаходяться
найчастіше всередині (див. рис. 59, а) і рідше — поза лейкоцитами.
У менінгококів є фімбрії, за допомогою яких вони прикріплюються
до клітин слизової оболонки.
Більшість штамів у свіжих культурах оточена капсулою.
У мазках із культури трапляються дрібні і дуже крупні коки,
розташовані поодинці, попарно і по чотири. Менінгококи можуть змі-
нювати не тільки свою форму, а й ставлення до забарвлення за Гра-
мом; у мазках серед грамнегативних диплококів з’являються і грам-
позитивні клітини.
Культивування. Менінгокок — аероб або факультативний анаероб,
не росте на звичайних середовищах, добре культивується при рН 7,2—
7,4 на середовищах з добавлянням сироватки крові, оптимальна тем-
пература росту 36—37 °С, при 22 °С не розвивається. На густих сере-
довищах утворює ніжні прозорі колонії розміром 2—3 мм (див.
рис. 59, б), на сироватковому бульйоні — каламуть і осад на дні,
через 3—4 дні на поверхні середовища з’являється плівка.
Ферментативні властивості. Менінгококи ферментують глюкозу
і мальтозу з утворенням кислоти, мають оксидазну активність, не
відновлюють нітрати (табл. II).
Токсиноутворення. Менінгокок продукує токсичні речовини, що
мають віасгивості екзо- й ендотоксинів; при руйнуванні бактеріаль-
них тії вивільняється сильний ендотоксин — ліпополісахарид, що
сприяє інвазійності менінгококів серогрупи А.
Таблиця 11 Диференціація бактерій роду йеіїїегіа і ВгапНатеІІа
Вид бактерій Ферментація Р»дукумиия
глюкози мальтози сахарози N0, N0,
N. копоггЬоеае + __ __
N. тепіп^іІІСІІ5 -|- — — ±
N. зісса -|- + —
В. саІаггЬаІіз — — — + +
Примітка. (+) — наявність відповідної ознаки; (—) — відсутність ознаки;
(±) — непостійна наявність ознаки.
Менінгококи легко піддаються аутолізу, який супроводиться нако-
пиченням токсину в середовищі.
Антигенна структура. У менінгококах е три фракції: вуглеводнева,
спільна для всіх менінгококів, протеїнова, виявлена у гонококів і
8. рпеитопіае (3 серовари), і полісахаридна, з якою пов’язана спе-
цифічність менінгококів.
Розрізняють до 9 серогруп менінгококів: А, В, С, О, X, V, 2,
АУ-135, 29Е, з яких тільки перші три (А, В, С) домінуючі.
У багатьох європейських країнах найбільша захворюваність зу-
мовлена менінгококами серогрупи В, до якої належить 16 серо-
варів.
Резистентність. Менінгокок — слабкостійкий мікроорганізм. Від
висихання він гине через кілька годин, від нагрівання при температурі
60 °С — через 10 хв, 80 °С — через 2 хв; при діянні ] % фенолу від-
мирання культури настає через 1 хв. Менінгокок дуже чутливий до
низьких температур, тому доставляти матеріал на дослідження слід
в умовах, які забезпечують захист менінгокока від охолодження.
Патогенність для тварин. У природних умовах тварини несприйнят-
ливі до менінгокока. При субдуральному введенні менінгокока можна
відтворити захворювання у мавп і кролів; інтраплевральне і внут-
рішньоочеревинне зараження морських свинок і мишей призводить
до загибелі тварин від інтоксикації.
Патогенез захворювання у людини. Джерелом захворювання є хво-
рі і носії, інфекція розповсюджується повітряно-краплинним шляхом.
Найтиповіші клінічні форми менінгококової інфекції — ринофарингіт,
септичний менінгіт, менінгококемія. Первинною локалізацією збуд-
ника є носова частина глотки, звідки мікроорганізм проникає у лімфа-
тичні судини і кров.
Менінгококи спричиняють гнійне запалення оболонок головного
і спинного мозку. Іноді розвивається первинна вогнищева або частко-
ва пневмонія.
Спинномозкова рідина хворих на менінгококову інфекцію кала-
мутна, у ній багато лейкоцитів, при пункції внаслідок високого тиску
витікає цівкою.
У ряді випадків розвивається менінгококемія, при якій менінго-
коки виявляють у крові, ендокарді, суглобах, легенях; виникають
гарячка, геморагії на шкірі і слизових оболонках.
200
Хворіють головним чином діти віком 1—5 років. Летальність до
застосування антибіотиків і сульфаніламідних препаратів була дуже
високою (50—60 %).
Менінгококова інфекція характеризується сезонністю (зимовий пе-
ріод) і циклічністю (епідемії повторюються через певні інтервали
в кілька років).
Запалення оболонок спинного мозку, крім менінгококів, може бути
спричинене стрептококами, стафілококами, гемофільними бактері-
ями, мікобактеріями туберкульозу, кишковою паличкою, деякими
вірусами.
Імунітет. Природний імунітет у людей дуже виражений, набутий,
виникає в результаті не тільки перенесеного захворювання, а й при-
родної імунізації в процесі носійства менінгококів. Постінфекційний
імунітет супроводиться виробленням бактеріоцинів, аглютинінів,
преципітинів, опсонінів і комплементзв’язуючих антитіл. Повторні
захворювання трапляються рідко.
Лабораторна діагностика. Об’єктами досліджень можуть бути
спинномозкова рідина, виділення носової частини глотки, кров, органи
трупів.
Застосовують такі види досліджень: 1) бактеріоскопію осаду спин-
номозкової рідини; 2) висівання осаду спинномозкової рідини, крові
або виділень носової частини глотки на кров’яний чи сироватковий
агар або ристоміцинове середовище з вивченням виділених культур
за допомогою оксидазного тесту, визначенням їх ферментативних і се-
рологічних ознак і з наступною диференціацією менінгококів з ката-
ральним мікрококом (ВгапЬатеІІа саікаггЬаІіз) і сапрофітами глотки
методом флюоресценції; 3) постановка РП із спинномозковою ріди-
ною, РН, РИГА із сироватками крові хворих; 4) визначення бактеріо
цинів (менінгоцинів) у виділених культурах серогруп В і С для вияв-
лення джерел інфекції; 5) ІФА.
Лікування. Застосовують антибіотики (рифампіцин, пеніцилін та
ін.), гамма-глобулін людської крові. Проводять також дезинтокси-
кацію (сольові розчини, глюкоза, плазма крові та ін.).
Профілактика забезпечується здійсненням загальних санітарно-
протиепідемічних заходів (рання діагностика, госпіталізація хворих,
санація носіїв, карантин у дитячих закладах), додержанням санітар-
но-гігієнічного режиму на підприємствах, в установах, громадських
і житлових приміщеннях, а також зменшенням скупченості людей.
Ведуться випробування протименінгококової вакцини, добутої
із серогруп А, В, С, яка містить очищені специфічні полісахариди.
РОДИНА ЕМТЕКОВАСТЕКІАСЕАЕ
До родини ЕпіегоЬасіегіасеае входять 14 родів: ЗаІтпопеІІа, ЗЬі-
£еІІа та ін. Бактерії цієї родини — це грамнегативні палички 0,3—
1 мкм завширшки й 1—6 мкм завдовжки. Вони не утворюють спор,
не мають оксидази, відновлюють нітрати в нітрити, ферментують глю-
козу з утворенням або без утворення газу, рухливі (перитрихи) або
нерухомі, добре ростуть на звичайних середовищах, факультативні
анаероби.
204
ОЬ»і 4актер?й жхттйчо жжгуть } ю&сжак лкевг»» (£. «ір.
і®е. — тількж частьовю дід «к алжзфвжмЕи».
Ффмеягтатияиа здатність » них різка: Е. евіі вирівняється мд
сальм >аел черевного тв|л. .сараг »1 з А. В та іагжх бактерій аіеі
бІЛЬСЗ ЬС.»Ж.ЄНО»С. 6м>ХІМІ'*ЖЯЕ> <КТ2ЯЯЇГЗО.
Деякі вида бактерій мають фімбрії. за жяюнюпж, яках вовк яя«-
•Г • ^ -. - • і - •- 'І . --.
бактерій вродусують б>ктк?.-_<-^ лолйияв та Іь _: викозпють
селективну раль % екологічному балансі. Вважакть. вже беруть
; ; іг . • . _ -
Імунітет ср< ейтеробактео-хл^гі ілфеядаях лнгхяізфекжійщкж (гу-
моральний і клітина?.*'
_ .- :
баг.-:'чу:'г здійсакиот* за ^заакажг: рухливістю. Зермектакіею
г.т.'^ь^г. гх.лглу..л ~~'Л метаболізмом, гтвореЕихм інльлу . г^р-
юузодяю. а також >і і тлгеимима =_*_іі-7?-:зхтгкг, а:
в еероиаттічиах реакціях із зізерех візомама взсгзсзеаяфсчгжмм.
гр^тюсог^иі хямю! і тзлосоегифсЧамші аглюпк^.зочжзс? емровгтяіама.
Нижче розтля-^ються лежкі щ>езгта=н>» родів 5аІ-
гатпеїіа, Ь'.^.х, ЕзгікгісЬіа. КЗеЬиеіІа. Ргзієді, Уегж^а, які
ма»ть лайб^і^дн: зиачеши для мед.чно: м:кробіиг:,-г~
САЛЬМОНЕЛИ ЧЕРЕВНОГО ТИКУ ПАРАТИФ*
36?'маі червмогс таф? Г^аіясаеііа гижр-ті } .5*1 ; »’ Е5еу-
ЇСЖ. їхзілєжжі у -.і~:і хультг?; і 1 «.*4 : Г- Гаффіі Ш- -.~гг ?. Баг^-іл
і Г [Воттмиолер мазала етівжяію хзратж** В ЗІІ^заеїІа хгіасіїаяеііеги,
-. і: :< ?Ї .:: — . • : -. . "т і ; ії
До роду сальмонел входять 65 груп (понад 2000 сфозарін; Саль-
монели паразжтуїоп» в організмі азійських і дакях тзарнн. птахів,
риб. репгнлїй; деякі з них татоге?:-:: і дія лзсдани.
Міжнародний номенклатурний компег рід сальмонел аахілжв на
п’ять підродів. Підрід І охоало= більшу частину патогенних для
лохини сальмонел серологічних груп А, В, С, В, Е.
Чзррзаогія зідоовідає загальній характеристиці родини Епіего-
ЬаДегізееае (диз. форзац, рис. ПІ. г, рис. 60). Більша частина штамів
рухлива, кількість джгутиків у них коливається від 3 до 20: можливо,
що джгутика утворюють різну кількість пучків.
Рас. 60 Мазок із культури (а), ^іітвел з джгугкїамз 15), коло-
нії (в) 5. ІурЬі.
292
Сальмонели паратифів за
формою, величиною, характе-
ром джгутиків і тннкторіаль-
ними властивостями не відріз-
няються від черевнотифозних
(рис. 61).
Культивування. Черевно-
тифозні і паратифозні саль-
монели—факультативні анае-
роби, оптимальна температура
їх росту 37 °С, але можуть
рости й при температурі
15—41 °С. Культивуються на
звичайних середовищах при
рН 6,8 7,2 .На МПА черевно- рнс Колонії 5. рагаїурНі (а) і 5 зсЬоЬ
тифозна сальмонела утворює Ітнеііегі (б); мазок із культури 5. епіегіїі-
напівпрозорі ніжні колонії сііз (в).
(див. рис. 60, в). На скоше-
ному агарі через 18—20 год з’являється вологий прозорий
наліт без пігменту, у МПБ — рівномірне помутніння.
На середовищах Плоскирєва й Ендо сальмонели черевного тифу
і паратифів утворюють напівпрозорі, безбарвні або блідо-рожеві ко-
лонії (див. форзац, рис. V), на вісмут-сульфітагарі — чорні блискучі.
При цьому колонії сальмонел паратифу А (див. рис. 61, а) подібні до
черевнотифозних (див. рис. 60, в).
Колонії сальмонел паратифу В (8. зсЬоіітиеІІегі) товщі, після
добового росту в термостаті і наступного витримування протягом
кількох днів при кімнатній температурі по периферії їх виникають
слизисті валики (див. рис. 61, б), що є характерною культуральною
диференціальною ознакою.
Ферментативні властивості. Сальмонели паратифів А і В фермен-
тують вуглеводи з утворенням кислоти і газу (табл. 12); вони відріз-
Таблиця 12. Диференціація бактерій роду ЗаІптопеІІа і Е. соіі
Вид бактерій Фермснтап ія Утворення
толі -а арабі ко“| ма літу този сір- ковод ню індолу
8. Іурін к±: к к к
5. рагаіуріті — — кг кг кг кг — —
5. ^сітої і тне! 1 егт кг* кг* кг кг кг кг -|- —
8. іурітітигтнт — — кг кг кг кг -(- —
5. сііоіегие-чнз КГ* кг± — кі кг кг —
8. спісгії кіі» КГі кг* кг* кг кг кг +
8. ІіігзсМеІтіі і кг кг* кг* кг кг кг —
Е. соіі кг КГ* кг* кг кг кг — +
Примітка. К — утворення кислоти, 1<Г— створення кислоти і газу; (-{-) —
нллвиісч, ні літові дної опіикп; (—) —відсутність відповідної ознаки; (±)—не-
постійна наявність ознаки.
203
няються від сальмонел черевного тифу й за іншими ознаками. У при-
родних умовах черевнотифозні сальмонели трапляються у вигляді
двох біохімічних варіантів: ксилозопозигивних і ксилозонегатив-
них.
У процесі дисоціації сальмонели черевного тифу переходять із
8-форм у К-форми, причому цей перехід супроводиться втратою сома-
тичного О-антигену, найбільш повноцінного в імуногенному від-
ношенні.
Токсиноутворення. Сальмонели черевного тифу містять у своєму
складі вуглеводно-ліпідно-протеїнові комплекси. Ендотоксин термо-
стабільний, витримує температуру 120 °С протягом ЗО хв, характери-
зується високою специфічністю. Із сальмонел черевного тифу виді-
лений і ентеротоксин.
Антигенна структура. Черевнотифозні сальмонели мають Н-, О-,
Уі-антигени, які спричиняють в організмі вироблення відповідних
аглютинінів; Н-аглютиніни зумовлюють аглютинацію у вигляді
крупних пластівців, О- і Уі-аглютиніни—дрібнозернисту.
Джгутиковий Н-антиген неоднорідний, він складається з двох фаз: першої,
або специфічної, фази, що аглютинується специфічною видовою сироваткою,
і другої, або неспецифічної, яка аглютинується не тільки видовою, а й групо-
вою сироваткою. Сальмонели, що мають дві фази Н-антнгену, називаються
двофазними на відміну від монофазних, які мають тільки специфічний Н-ан-
тиген.
О-антиген руйнується від дії формаліну, але не змінюється під
впливом слабких розчинів фенолу. Н-антиген, навпаки, не змінюється
під впливом формаліну, але руйнується від діяння фенолу.
Уі- і О-антигени розташовані на поверхні бактеріальної клітини.
Наявність Уі-антигену перешкоджає аглютинації сальмонел О-сиро-
ватками, втрата Уі-антигену супроводиться відновленням О-аглютина-
бельності. Черевнотифозні сальмонели, що містять Уі-антиген, не
аглютинуються О-сироватками. Виснаженням Н- і О-антигенами че-
ревнотифозних сироваток, добутих імунізацією тварин свіжовиділе-
нимії сальмонелами, можна дістати Уі-аглютинуючу сироватку.
Ф. Кауфман і Н. Уайт класифікували тифопаратифозні сальмонели
за антигенною структурою на кілька груп (табл. 13).
По відношенню до Уі-фага у черевнотифозних, паратифозних саль-
монел груп А і В виявлено фаговари. Сальмонели, в яких немає
Уі-антигену, не тнпуються Уі-фагами.
Резистентність. У кризі черевнотифозні і паратифозні А і В саль-
монели зберігаються протягом кількох місяців, у грунті, забруднено-
му випорожненнями і сечею хворих або носіїв,— до 3 місяців, у маслі,
сирі, м’ясі, хлібі — 1—3 місяці, у грунті, фекаліях і воді — кілька
тижнів, на овочах і фруктах — 6—10 діб. У висохлих фекаліях мо-
жуть зберігатися довго.
Сальмонели черевного тифу і паратифів чутливі до нагрівання:
при температурі 56 °С вони гинуть протягом 45—60 хв, при кип’ятін-
ні — за кілька секунд. Діяння звичайних дезинфікуючих речовин
фенолу, хлорного вапна і хлораміну призводить до загибелі цих бак-
терій через кілька хвилин. Наявність у воді активного хлору в кіль-
204
Таблиця 13. Серологічна класифікація бактерій роду Заігпопеііа
Група 1 вид (серовар) Антигенна структура
Соматичний антиген Джгутиковий антиген
Фаза перша | Фаза друга
Група А
5. рагаїуріїі і, 2, 12 а (1, 5)
Група В
5. зсНоНтиеІІегі 1, 4, 5, 12 Ь 1, 2
5. аЬопу 1, 4, 5, 12 Ь (е, п, X)
8. Іуріїітигіит 1, 4, 5, 12 1 1, 2
8. сіегЬу 1, 1 (5). 12 і. 6 (1, 2)
5. аіапіеу 1, 4(5), 12, 27 д 1, 2
8. Неі<ЗеІЬег£ 1, 4 (5), 12 г І. 2
5. аЬогІиз-едиіпа 4, 12 — Є, П, X
5. аЬогііі5-о\'Ь 4, 12 с 1. 6
5. аЬог(из-ЬоУІ5 1, 4, 12, 27 Ь Є, П, X
Група С (1, 2)
5. Ніг&сЬГеІсііі 6, 7, Уі с 1, 5
5. сіюіегаезиіз 6, 7 с 1, 5
5. іуріїізиіз 6, 7 с 1, 5
5. Ніотзоп 6, 7 к 1, 5
8. сіиечзеїсіогі 6, 8 г4, г24 —
5. пехурогі 6, 8 е, Н 1, 2
5. аІЬапу (8), 20 г4, г24 —
Група О (1)
8. ІурНі 9, 12, Уі сі —
8. епіегііісііз 1,9, 12 Є. т (М)
5. сІиЬІіп 1, 9, 12 6, Р
5. Г05ІОС 1, 9, 12 6. Р. и —
8. тозсоху 1, 9, 12 6. Я —
5. §аІІіпагит 1, 9, 12 —
Група Е (1, 3)
8. Іопсіоп 3, ю 1, V 1, 6
8. апаіит 3, 10 е, к 1, 6
8. НаггізопЬигз (3), (15), 34 210 1, 6
кості 0,5—1 мг на 1 л забезпечує надійне знешкодження води щодо
черевнотифозних і паратифозних сальмонел.
Патогенність для тварин. У природних умовах тварини на черев-
ний тиф не хворіють. Отже, це захворювання антропонозне. При
парентеральному введенні сальмонел у тварин розвивається септице-
мія й інтоксикація, при пероральному зараженні захворювання не
настає.
Патогенез захворювання у людини. Первинним місцем локалізації
збудників є травний канал; заражується людина перорально (інфіку-
юча доза в межах 100 000 особин).
Патогенез черевного тифу характеризується циклічністю і роз-
витком характерних патофізіологічних змін.
205
Після проникнення черевнотифозних сальмонел у кишки людини
минає певний строк (7—28 діб), протягом якого розвиваються запальні
явища в одиночних і групових лімфатичних фолікулах нижнього
відділу тонкої кишки.
Наприкінці інкубаційного періоду сальмонели з лімфатичного
апарату тонкої кишки проникають у грудну лімфатичну протоку,
а потім у кров, розвивається стан бактеріемії, при якій настає гемато-
генне занесення збудника в лімфатичні вузли, селезінку, кістковий
мозок, печінку та інші органи. Цей період триває близько 7 діб
На 2-му тижні захворювання в пейєрових бляшках накопичуються
ендотоксини, вони всмоктуються в кров, що призводить до розвитку
інтоксикації. Загальна картина захворювання характеризується
розладом терморегуляції, порушенням функції органів кровообігу,
центральної і вегетативної нервової системи та іншими змінами.
На 3-му тижні захворювання із жовчних проток і кишкових крипт
сальмонели надходять у великій кількості в кишки, частина з них
виділяється разом з випорожненнями назовні, а частина проникає
знову в одиночні і групові лімфатичні фолікули, сенсибілізовані під
впливом первинного діяння на них сальмонел. В результаті розвиває-
ться стан гіпергії з утворенням виразкових процесів. Найяскравіше
виражені зміни виникають у ділянці лімфатичних фолікулів, в ре-
зультаті чого можлива перфорація (прорив) кишки і розвиток пери-
тоніту.
Починаючи з 2-го тижня захворювання під впливом сальмонел
відбувається утворення антитіл і посилення фагоцитарної реакції,
які досягають максимуму на 5—6-му тижні.
Клінічне видужання і звільнення організму від патогенних бакте-
рій не збігаються. Протягом перших тижнів після видужання значна
частина реконвалесцентів залишаються носіями, у 3—5 % перехворі-
лих носійство триває багато місяців і роками, іноді все життя. Основ-
ними причинами носійства є низький рівень постінфекційного імуніте-
ту, наявність запального процесу в жовчному міхурі (холецистит) і пе-
чінці, де сальмонели можуть зберігатися і розмножуватися. Ти-
фопаратифозні сальмонели можуть уражувати нирки і сечовий міхур,
спричиняти явища пієліту або циститу, що й зумовлює виділення бак-
терій із сечею.
Варіабельність перебігу черевного тифу від тяжких форм, що при-
зводять до летального кінця, до легких амбулаторних не дає змоги за
клінічними ознаками диференціювати черевний тиф з паратифами та
іншими захворюваннями. Вирішальне значення в діагностиці цих
інфекцій належить лабораторним методам досліджень.
Тепер черевний тиф з епідемічного захворювання став спорадич-
ним, характеризується легшим перебігом, рідко дає ускладнення і ле-
тальний кінець.
Захворювання, спричинені тифозними і паратифозними сальмоне-
лами, дуже схожі за клінічною картиною. Інкубаційний період і три-
валість захворювання при паратифах трохи коротші, ніж при черев-
ному тифі.
206
Імунітет. В осіб, які перенесли черевний тиф і паратифи, вироб-
ляється відносно стійкий імунітет, іноді можливі рецидиви і повторні
захворювання. Застосування з лікувальною метою антибіотиків при-
зводить до зниження імуногенних функцій збудників, які втрачають
О- і Уі-антигени.
Лабораторна діагностика черевного тифу і паратифів грунтується
на патогенезі цих захворювань.
Виділення гемо культури. У перші дні захворювання на тифопа-
ратифи спостерігається бактеріемія, тому для виділення культури ви-
сівають кров у жовчний бульйон або середовище Рапопорта; посіви
вміщують у термостат при температурі 37 °С, потім на 3—5—7-му добу
роблять пересівання на одне з диференціальних середовищ (Плоски-
рєва, Ендо або вісмут-сульфітагар).
Оптимальні результати дає висівання кількох колоній на середо-
вище Олькеницького, що містить глюкозу, лактозу, сахарозу; на цьому
середовищі сальмонели паратифів ферментують глюкозу з утворенням
кислоти і газу.
Виділену культуру ідентифікують за ферментативними власти-
востями (див. табл. 12) і результатом РА; останню ставлять спочатку на
склі з полівалентною сальмонельозною сироваткою, що містить аглю-
тиніни до специфічних антигенів груп А, В, С, О, Е, а потім з гру-
повими сироватками, визначаючи належність досліджуваної культури
до серогрупи і серовару.
Серологічні реакції. На 2-му тижні захворювання у крові нагро-
маджується достатня кількість аглютинінів, наявність яких виявля-
ють реакцією Відаля. Її ставлять з черевнотифозними і па-
ратифозними А- і В-діагностикумами. Слід мати на увазі можливість
низького титру реакції в осіб, які вживали антибіотики.
Реакція Відаля може бути позитивною не тільки у хворих, а й у
тих, які перехворіли, та прищеплених, тому для постановки її засто-
совують діагностикуми з О- і Н-антигенів; у прищеплених і перехворі-
лих тривалий час зберігаються Н-аглютиніни, у хворих в розпалі
захворювання виявляються О-аглютиніни.
При черевному тифі і паратифах реакція Відаля може іноді мати
груповий характер, оскільки в сироватці крові хворого є аглютиніни
не тільки проти специфічних, а й групових антигенів, що трапляються
і в інших бактерій. Щоб мати достовірніші результати, V хворих по-
вторно беруть кров через 5—6 днів, ставлять реакцію Відаля і вияв-
ляють наростання титру аглютинінів. Оптимальні результати дає
РИГА з еритроцитарними О-, Н- і Уі-діагностикумами.
Застосовують і такі імунологічні методи дослідження сироватки
крові хворих, як виявлення імуноглобулінів (А, М, 6), загальної
бактерицидності і титру бактерійних антитіл сироватки крові, а також
антигільну реакцію аглютинації.
Виділення копро- й уринокультур. Висівають випорожнення і сечу
в жовчний бульйон, на середовища Мюллера і Плоскирєва або вісмут-
сульфітагар протягом усього захворювання. Методика ідентифікації
така сама, як і при дослідженні крові.
207
Дослідження води на наявність тифопаратифозних бактерій про-
водять фільтруванням великих обсягів (2—3 л) через мембранні філь-
три, які потім вміщують на чашки з вісмут-сульфітагаром. Якщое
сальмонели, через 1—2 доби утворюються колонії чорного кольору.
Лікування. Хворим на черевний тиф і паратифи призначають лево-
міцетин, ампіцилін, нітрофуранові препарати, застосування яких
значно знижує тяжкість захворювання і зменшує його тривалість.
Тепер летальність при черевному тифі знизилась до 0,2—0,5 %.
Дуже важкою проблемою є санація носіїв тифозних і паратифозних
сальмонел.
Профілактика. Загальні заходи зводяться до знищення джерел
інфекції шляхом своєчасної діагностики, госпіталізації хворих, дезин-
фекції у вогнищах, виявлення і лікування носіїв. Велике значення
у профілактиці черевного тифу і паратифів мають знешкоджування
води, охорона вододжерел від забруднення, систематична і високоякіс-
на очистка території населених пунктів, боротьба з мухами, захист від
них продуктів і води, додержання санітарно-гігієнічних вимог, пере-
вірка на носійство працівників харчоблоків (за епідеміологічними
показаннями).
Для специфічної профілактики тифопаратифозних захворювань
застосовують вакцинацію. Вакцини готують у різних варіантах:
проти черевного тифу (моновакцина), проти черевного тифу і паратифу
В (дивакцина), проти черевного тифу, паратифів А і В (тривакцина).
Добрі результати дає також застосування асоційованої адсорбо-
ваної вакцини, яка містить О- і Уі-антигени бактерій черевного тифу,
паратифу В, а також концентрований очищений і сорбований правце-
вий анатоксин. Усі антигени, що входять до цієї вакцини, адсорбовані
на гідраті окису алюмінію. Застосовують також тифозну спиртову
вакцину, збагачену Уі-антигеном.
Добуто нову нереактогенну вакцину, яка складається з Уі-анти-
гену черевнотифозних сальмонел. Вона має високу ефективність і за-
стосовується для імунізації як дорослих, так і дітей дошкільного
віку. ><
Вакцинацію роблять у плановому порядку і за епідеміологічними
показаннями, згідно з інструкціями і спеціальними вказівками сані-
тарно-протиепідемічної служби.
Для профілактики черевного тифу особам, які живуть разом з хво-
рим або користуються харчовими продуктами і водою, зараженими
або підозрілими на зараженість сальмонелами черевного тифу, призна-
чають сухий черевнотифозний фаг у вигляді таблеток.
ЗБУДНИКИ ГОСТРОГО САЛЬМОНЕЛЬОЗНОГО ГАСТРОЕНТЕРИТУ
До роду Заітпопеїіа входить понад 400 сероварів, які спричиняють
у людини гострий сальмонельозний гастроентерит.
У 1885 р. у США Д. Сальмон виділив $. сЬоІегаезиіз, яку довгий час помил-
ково вважали збудником чуми свиней. Пізніше було виявлено, що вона є су-
путником збудника цього захворювання, а в людини зумовлює токсикоінфек-
цію. У 1888 р. А. Гартнер під час спалаху токснкоінфекції в Саксонії висіяв
із м’яса вимушено забитої корови і селезінки померлої людини $. епіегііісііз.
208
Вона виявилась патогенною для мншей, морських свинок, кролів, овець і кіз.
У 1896 р. у Бреславлі К. Кенше і в 1898 р. в Ертрику Ж- Нобель при харчо*
вих отруєннях виявили й добули в чистій культурі $. іурНітигіит. У наступні
роки було відкрито і вивчено багато інших видів сероварів сальмонел.
Морфологія. Відповідає загальній характеристиці родини Епіего-
Ьасіегіасеае (див. рис. 61, в; с. 201). Сальмонели, крім 8. риііогитп,
8. £а11іпагитп, рухливі, перитрихи.
Культивування. Сальмонели — факультативні анаероби, оптимум
їх росту 37 °С, добре ростуть на звичайних живильних середовищах.
Ферментативні властивості. Збудники сальмонельозного гастро-
ентериту не розріджують желатину, не продукують індол, більшість
видів виділяє сірководень, ферментує глюкозу, маніт з утворенням
кислоти і газу.
Токсиноутворення. Хвороботворне діяння на організм тварин і лю-
дини зумовлене ендотоксинами й ентеротоксинами, що виділяються
сальмонелами.
Антигенна структура. За характеристикою О-антигену, як уже
зазначалось, усі сальмонели поділяються на групи і види (див.
табл. 13).
Резистентність. Сальмонели порівняно стійкі до діяння високої
температури (60—75 °С), великих концентрацій натрію хлориду та
деяких кислот. Не гинуть у 8—10 % розчині оцтової кислоти протя-
гом 18 год. Ендотоксини сальмонел можуть довго зберігатися і після
варіння м’яса у товщі великих шматків або при недостатньому просма-
жуванні в котлетах та інших виробах. Характерною особливістю хар-
чових продуктів, засіяних сальмонелами, є відсутність змін, які ви-
яв іяють органолептично.
Патогенність для тварин. Збудники сальмонельозу спричиняють
паратиф у телят, тиф і паратиф у поросят, тиф у курей і білий понос
у курчат, мишачий і пацючий тиф, ентерит у великої рогатої худоби.
Морські птахи (чайки, баклани) часто є носіями сальмонел. Із експе-
риментальних тварин найбільш сприйнятливі до деяких сальмонел
(8. іурЬітигіит, 8. сйоїегаезиіз, 8. епіегііісііз та ін.) білі миші, в яких
і при ентеральному, і при парентеральному зараженні розвивається
септицемія.
Патогенез захворювання у людини. Основним джерелом зараження
людей є тварини і птахи, хворі на сальмонельоз. У ряді країн Європи
було зареєстровано великі спалахи сальмонельозу в результаті
зараження від свійських тварин, а також від споживання курячих
яєць.
У дорослих інтоксикація настає через кілька годин після зара-
ження. У шлунку і кишках, а також у крові відбувається руйнування
сальмонел, що проникли разом з їжею (м’ясні страви, холодець, ковба-
си, овочі), в результаті чого утворюється багато ендотоксину. Доведена
також висока інвазивність сальмонел; у перші години захворювання,
як правило, виникає стан бактеріемії. Близько 2—3 % перехворілих
залишаються носіями сальмонел.
Виявлено випадки сальмонельозу, при якому джерелами заражен-
ня були хворі, носії серед дорослих і дітей. Найчастіше уражуються
209
новонароджені і недоношені діти. Останнім часом реєструються спа-
лахи сальмонельозу в дитячих закладах, родильних будинках, сома-
тичних відділеннях педіатричних клінік, інфекційних стаціонарах.
У дітей сальмонельоз має перебіг у вигляді диспепсії, коліту (ентеро-
коліту), що нерідко супроводяться явищами септицемії і бактеріемії;
у ряді випадків захворювання набуває затяжного або хронічного
характеру. У дітей раннього віку штами сальмонел виділяються із
випорожнень і слизу носової частини глотки з однаковою частістю.
Сальмонельоз — зоонозно-антропонозне захворювання. У людей
клінічно виражені форми сальмонельозу спричиняють 8 ІурЬііпи-
гіилі, 8. сИоІегаезиіз, 8. ИеідеІЬеге, 8. епіеті(ідіз, 8. апаіит, З.пемг-
рогі, 8. детЬу, 8. уіґсііоу.
Імунітет. При сальмонельозах імунітет малонапружений і корот-
кочасний. У крові реконвалесцентів на 2-му тижні з’являються аглю-
тиніни в невеликих титрах (І : 50 — 1 : 400, рідше — до І : 800).
Лабораторна діагностика. Матеріалом для дослідження є випо-
рожнення, блювотні маси, промивні води, кров, сеча, органи трупів,
рештки їжі, старанно зібрані змиви з предметів.
Дослідження роблять так. Спочатку збудника сальмонельозу
висівають на ті самі живильні середовища, які використовуються
для діагностики черевного тифу і паратифів А і В, потім визначають
культуральні, серологічні і біологічні властивості виділених культур.
Біологічну пробу ставлять не тільки з культурами, а і з рештками їжі,
що спричинила отруєння. До ранніх методів діагностики належить
антитільна реакція аглютинації. З.іурйіпшгіипі піддаються фаготи-
пуванню.
Для ретроспективного діагнозу на 8—10-й день’захворювання
досліджують кров реконвалесцентів на наявність аглютинінів за допо-
могою реакції Відаля з діагностикумами основних видів збудників
харчових токсикоінфекцій.
Лікування полягає в промиванні шлунка, парентеральному вве-
денні глюкози й ізотонічного розчину натрію хлориду, призначенні
за показаннями антибактеріальних препаратів (левоміцетин, поліва-
лентний бактеріофаг).
Профілактика сальмонельозу забезпечується ветеринарно-сані-
тарним наглядом за станом худоби, забійних майданчиків, підпри-
ємств м’ясної і рибної промисловості, лабораторним контролем м’ясної
продукції, що випускається в продаж, стерилізацією умовно придат-
ного м’яса. До обов’язків медико-санітарної служби входить виявлен-
ня носіїв серед працівників харчових підприємств, їдалень та інших
харчоблоків, контроль за неухильним додержанням санітарного ре-
жиму на харчових підприємствах, у магазинах, їдальнях, на скла-
дах, проведення санітарно-освітньої роботи серед населення, санація
носіїв із реконвалесцентів сальмонельозним фагом.
При здійсненні профілактичних заходів треба враховувати, що
крім сальмонел харчові токсикоінфекції можуть бути спричинені
стафілококами, стрептококами й умовно-патогенними бактеріями
(Ргоіеиз, ЕзсЬегісЬіа та ін.).
210
ШИГЕЛИ
Збудника дизентерії вперше описали у 1888 р. А. Шантемес і Ф. Відаль,
у 1891 р.— О. В. Григор'єв; його докладно вивчив у 1898 р. К. Шига, у 1900 р.
С. Флексиер і в 1915 р. К. Зонне; пізніше були відкриті й вивчені інші види
шигел.
Усі дизентерійні бактерії об’єднані в рід 8ЬІ£е11а.
Морфологія шигел відповідає характеристиці родини ЕпіегоЬасіе-
гіасеае. Однією з характерних ознак дизентерійних бактерій, якою
вони відрізняються від бактерій колітифознопаратифозної групи,
є відсутність у них джгутиків. У деяких штамів шигел Флекснера
виявлено фімбрії.
Культивування. Шигели — факультативні анаероби, вони добре
розвиваються на звичайних середовищах з рН 6,7—7,2; оптимальна
температура росту 37 °С, при 45 °С не ростуть. На густих середови-
щах Плоскирєва, Ендо утворюють дрібні (1 —1,5 мм у діаметрі) ніжні
напівпрозорі колонії (рис. 62, в), подібні до колоній бактерій черев-
ного тифу; на бульйоні спричиняють дифузне помутніння середо-
вища.
Ферментативні властивості шнгел наведено в табл. 14. Шигели
Зонне за швидкістю (у добах) розщеплення рамнози, ксилози і маль-
този поділяються на сім біохімічних варіантів.
Токсиноутворення. 8. сіузепіегіае продукує екзотоксини, що
мають термолабільність, виражений тропізм до нервової системи
і слизової оболонки кишок; його виявляють у старих бульйонних
культурах, у лізатах добових агарових культур і висушених бакте-
ріальних клітинах. Внутрішньовенне введення невеликих доз екзоток-
сину спричиняє загибель кролів і білих мишей від діареї, паралічу
нижніх кінцівок і колапсу.
Решта підгруп дизентерійних бактерій розчинних токсинів не
утворюють. Вони містять речовини вуглеводно-ліпідно-протеїнової
природи — ендотоксини.
У деяких штамів 8. зоппеі виявлено термолабільні речовини з ней-
тронною дією.
Рис. 62 Мазок із культури (а) і колонії (6) Е. соіі, колонії
шигел (в).
211
Таблиця 14. Біохімічні властивості бактерій роду $ЬІ£еіІа
Підгрупа, вид Лактози Ферментація луїл'іюді имя ІНІОЛу кснлувавия Орні тхну
кози дуль миту сахаро,и
А—5. ііузепіегіае + —
В—5. Пехпегі — +
С—8. Ьоудіі — "І" +
0—8. 50ППЄІ + (повіль- но) -Ь (повіль- но) +
П р н м і т к а, (+) — ферментація вуглеводів, утворення індолу, дека-
рбоксиловаїюї каталази; (—)—відсутність ферментації вуглеводів, утворення
індолу, орнітину, (±) —слабке утворення індолу, декарбоксилування орнітину,
ферментація вуглеводів.
Таблиця 15. Класифікація Антигенна структура. Шигели
бактерій роду ЗЬіееііа________ містять соматичні О- і поверхневі
Підгрупа, вид Серовар Під- серо- вар К-антигени. Класифікація. Усі бактерії роду 8ЬІ£еІ1а поділяють на чотири підгру-
А — 8. дузеп- іегіае 1-10 пи: А, В, С і В (табл. 15). Резистентність. Дизентерійні бак-
В — 8. Пехпегі 1 2 3 4 5 6 Х-уагіапі ¥-уагіапі 1а 1Ь 2а 2Ь За ЗЬ 4а 4Ь 5а 5Ь терії можуть зберігатися у зовніш- ньому середовищі (на предметах, посуді, у прісній і морській воді, на поверхні грошових знаків, на овочах, фруктах) протягом 5—14 діб. Пряме сонячне світло, 1 % розчин фенолу вбивають їх через ЗО хв, температура 60 °С— через 10 — 20 хв. Шигели швидко гинуть від дії
С — 8. Ьоудіі 1—15 розчинів хлораміну і хлорного вапна.
0 — 8. зоппеі — Найчутливіші до фізичних і хімічних факторів 8. сіузепіегіае і порівняно резистентні—8. зоппеі.
Патогенність для тварин. До шигел в умовах розплідників спри-
йнятливі мавпи, які заражуються від хворих людей або носіїв, у ряді
випадків вони можуть бути джерелом інфікування обслуговуючого
персоналу розплідників і зоопарків, проте епідеміологічна роль мавп
невелика.
При парентеральному зараженні кролів у них розвивається інток-
сикація, яка призводить до летального кінця.
Патогенез захворювання у людини. Джерелами інфекції є особи,
хворі на гостру і хронічну дизентерію, а також носії. Зараження від-
бувається фекально-оральним шляхом при вживанні інфікованих
харчових продуктів (особливо молока, води), побутовим шляхом
(через домашніх мух, різні предмети, засіяні шигелами, брудні руки).
Дизентерійні бактерії локалізуються в клітинах слизової оболонки
212
і підслизового шару товстої кишки, де розмножуються звичайно без
проникнення в кров. Інтоксикація організму зумовлюється всмокту-
ванням токсинів шигел через слизову оболонку, головним чином тов-
стої кишки.
Особливо тяжкий перебіг має дизентерія, спричинена 8. бузепіегіае,
дуже поширеною в тропічних і субтропічних країнах. Захворювання
супроводиться явищами загальної інтоксикації і глибоким уражен-
ням слизової оболонки товстої кишки, утворенням набряку, розвит-
ком гіперемії і кривавого поносу. Перебіг хвороби обтяжується на-
явністю в організмі лямблій і гельмінтів, які є співчленами паразито-
ценозу при дизентерії.
Імунітет. Після перенесеної дизентерії виробляється дуже слабкий
і короткочасний групоспецифічний імунітет. Тому можливе повтор-
не і багаторазове виникнення захворювання, що іноді переходить
у хронічну форму.
Лабораторна діагностика. Результативність лабораторних дослі-
джень багато в чому залежить від правильності взяття випорожнень,
висівання їх на елективно-диференціальне середовище (Плоскирєва,
Ендо) біля ліжка хворого з наступним відправленням у лабораторію.
8. бузепіегіае культивують на середовищі Ендо.
Виділену чисту культуру ідентифікують за біохімічними і серо-
логічними властивостями.
Серологічні реакції, що застосовуються для діагностики дизен-
терії, грунтуються на виявленні антитіл до збудника при вивченні
парних сироваток крові хворих. Антитіла виявляють на 5—8-му добу
захворювання. Найбільше їх утворюється на 2—3-му тижні.
Для скорочення строків дослідження використовують РИГА
з еритроцитарними діагностикумами із шигел Зонне і Флекснера,
імунофлюоресцентний метод, який дає змогу виявляти антиген шигел
у сироватці крові хворих і в мазках ізг випорожнень або колоній за
допомогою специфічної сироватки, обробленої флюорохромами.
Лікування передбачає застосування бактеріальних препаратів
(біфікол, біфідумбактерин, дизентерійна вакцина Чорнохвостова),
переливання плазми, здійснення дезинтоксикаційних заходів віднов-
лення порушеного водно-електролітного обміну, точно диференційо-
ване призначення антибіотиків широкого спектра дії (вітациклін,
морфоциклін), сульфаніламідних препаратів (фталазол, сульгінта ін.).
Профілактика забезпечується здійсненням комплексу загальних
заходів: 1) захистом води, харчових продуктів (особливо молочних)
від інфікування збудниками дизентерії; 2) ранньою лабораторною
діагностикою; 3) госпіталізацією або ізоляцією хворих удома з до-
держанням відповідного режиму; 4) старанною дезинфекцією вогнищ
захворювання; 5) повноцінним лікуванням хворих; 6) наглядом за
вогнищами захворювання і здійсненням у них профілактичних захо-
дів; 7) додержанням санітарно-гігієнічних режимів у дитячих закла-
дах, житлових і робочих приміщеннях, на підприємствах харчової
промисловості, у їдальнях і магазинах.
Ведуться випробування протидизентерійних живих вакцин, при-
значених для перорального введення.
213
Е5СНЕКІСНІА СОМ
Мікроорганізм виділив із випорожнень Т. Ешеріх у 1885 р Крім Е. соіі
до роду ЕісИегісЬіа належить Е. Ьіаііае (сапрофіт), до яких входять кілька
серогруп, що диференціюються за культуральннми, біохімічними й антигенними
ознаками.
Е, соіі — насельник товстої кишки людини і ссавців, е також у ки-
шечнику птахів, риб, рептилій, амфібій і комах. Виділяючись у ве-
ликій кількості з випорожненнями, завжди є у навколишньому сере-
довищі (грунт, вода, предмети).
Морфологія Е. соіі відповідає характеристиці, даній представни-
кам родини ЕпіегоЬасіегіасеае (див. форзац, рис. V, а; рис. 62, а),
відзначається поліморфізмом.
На поверхні клітин є фімбрії, на яких адсорбуються деякі фаги;
мікрокапсула не завжди виразно виражена.
Культивування. Е. соіі — факультативний анаероб, оптимум росту
при 30—37 °С, рН 7,2—7,5, добре розмножується при кімнатній тем-
пературі на звичайних середовищах, росте в діапазоні температур
10—45 °С у перші 2 доби. Ешерихії холоднокровних культивуються
при температурі 22—37 °С, при 42—43 °С ріст їх затримується.
На МПА розвивається у вигляді слабковипуклих напівпрозорих
сіруватих колоній (див. рис. 62, б), в МПБ спричиняє дифузне помут-
ніння з утворенням осаду.
Ферментативні властивості. Е. соіі утворює індол, як правило,
сірководень, відновлює нітрати в нітрити, фіерментує з утворенням
кислоти і газу лактозу, глюкозу, мальтозу, маніт тй низку інших
вуглеводів (див. табл. 12).
Є варіанти Е. соіі, які ферментують сахарозу, не утворюють індолу,
не мають джгутиків, не ферментують лактозу.
Токсиноутворення. Е. соіі — умовно-патогенні бактерії. Деякі
штами можуть мати ентеротоксигенність і гемолітичну дію, що детер-
мінуються плазмідами (Епі, Ніу). Відомі термостабільний і термола-
більний ентеротоксини і чотири типи гемолізинів. Етеротоксигенні
штами Е. соіі мають антигени адгезії, або фактори колонізації, за
допомогою яких вони прикріплюються до клітин епітелію кишок.
Термолабільні нейротропні екзотоксини накопичуються у буль-
йонних культурах на 2—4-ту добу росту, тоді як ендотоксини з’явля-
ються після 20-добового культивування в результаті руйнування
клітин.
Антигенна структура. Ешерихії мають О-, К- і Н-антигени. О-анти-
ген (соматичний) термостабільний, не руйнується при температурі
120 °С (витримує кип’ятіння і стерилізацію сухою парою); К-антиген
поверхневий, соматичний, являє собою комплекс термолабільних
(Ь, В) і термостабільних (А і М) антигенів; Н-антиген (джгутиковий)
термолабільний. За характером О-антнгену ешерихії поділяють на
серогрупи і серовари.
На основі антигенної структури кожна серогрупа позначається
формулою із зазначенням антигену та його різновиду, виража-
214
ється арабською цифрою. Наприклад, серогрупа 0111 має формулу
0111 : К58 : Н2.
Серед Е. соїі виявлено фаговари і коліциновари, які використову-
ють у лабораторній діагностиці для додаткової характеристики виді-
лених штамів.
Резистентність. Е. соїі у зовнішньому середовищі зберігається
протягом кількох тижнів і навіть місяців. Вона стійкіша проти ді-
яння фізичних і хімічних факторів зовнішнього середовища, ніж саль-
монели і шигелн. Е. соїі порівняно швидко гине при дії всіх дезинфі-
куючих засобів. Діяння температури 55 °С спричиняє її загибель через
60 хв, а 60 °С — через 15 хв.
Е. соїі використовують як тест-об’єкт прн оцінці методів дезинфек-
ції і дезинфікуючих речовин, а також прн титруванні деяких анти-
біотиків.
Патогенність для тварин. Деякі серогрупи Е. соїі спричиняють
тяжкі захворювання з дуже високою смертністю у телят-сисунців.
При парентеральному введенні ентеропатогенних культур кролям,
морським свинкам, білим мишам у них розвивається токсико-септнч-
ний процес, що призводить до загибелі тварин.
Патогенез захворювання у людини. Зараження настає від хворих
дітей або носіїв фекально-оральннм і повітряно-краплинним шляхом.
Збудниками кишкової інфекції (колі-ентериту) у дітей, особливо в пер-
ші місяці життя, можуть бути Е. соїі з О-груп 25, 26, 44, 55, 86, 91,
111,114,119,125. 126, 127, 128, 141, 146 та ін. До збудників дизентеріє-
подібних захворювань належать Е. соїі з О-груп 23, 28, 32, 115, 124,
136, 143, 144, 151 («Крим») та ін. Виникнення холероподібного гастро-
ентериту пов’язують з Е. соїі з О-груп 0, 15, 25, 78, 148 та ін., які
утворюють термолабільні і термостабільні ентеротоксини; серогрупи
2, 6, 7, 11, 15, 75 досить часто уражують сечові шляхи.
Патологічний процес розвивається у тонкій кишці, на яку діють
переважно термолабільні токсичні речовини.
У дорослих Е. соїі може спричиняти ешерихіози (перитоніт, менін-
гіт, ентерит, цистит, пієліт, пієлонефрит, ангіохоліт, сальпінгоофо-
рит, апендицит, отит, післяродовий сепсис та ін.). Перевтома, висна-
ження сприяють розвиткові захворювань, зумовлених Е. соїі. У ряді
випадків кишкова паличка є причиною харчових токсикоінфекцій.
Імунітет. В осіб, які перенесли кишкову колі-інфекцію,
виробляється групоспецифічний слабконапружений імунітет. У се-
рогруп Е. соїі не спостерігається перехресного імунітету, внаслі-
док чого можливі повторні захворювання. Багато штамів Е. соїі
синтезують антибіотичні речовини — коліцини, активні щодо пато-
генних видів кишкової групи. Крім того, Е. соїі та інші нормальні
насельники кишок синтезують вітаміни групи В, філохінони (К2),
токофероли (Е), необхідні для людини. Пригнічення нормальної мік-
рофлори кишок, значною частиною :-:кої є Е. соїі, може призвести до
тяжкого хронічного захворювання — дисбактеріозу.
Лабораторна діагностика. Матеріалом для лабораторної діагно-
стики колі-ентеритів та інших колі-іпфекцій є випорожнення хворих,
215
виділення із зіва і носа, трупний матеріал (кров, жовч, печінка, селе-
зінка, легені, вміст тонкої і товстої кишок, гній).
Досліджувальпий матеріал висівають на густі живильні середо-
вища (Ендо та ін.; див. форзац, рис. V, а); для виділення бактерій
тифопаратпфозної і дизентерійної груп роблять посів на середовище
Плоскирєва і вісмут-еульфітагар. Коли є підозра на септичний процес,
сіють кров для збагачення в бульйон, а потім висівають на густе се-
редовище. Виділені чисті культури ідентифікують за морфологіч-
ними, культуральними, біохімічними і серологічними властивостями.
Належність виділених ешерихій до відповідних О-груп визнача-
ють у РА з ОК-і О-сироватками після руйнування кип’ятінням К-ан-
тигену досліджуваної культури.
Для прискореної ідентифікації виділених культур або досліджу-
ваного матеріалу застосовують РІФ з використанням групоспецифіч-
них мічених сироваток, яка дає змогу мати попередню відповідь через
1—2 год.
Серологічну діагностику колі-ентериту здійснюють застосуванням
РИГА. Позитивним результатом вважають наростання титру антитіл
у динаміці захворювання.
Лікування при колі-ентеритах та інших формах колі-інфекцій поля-
гає у призначенні біологічних препаратів (колі-аутовакцин, колі-
бактерину, лактобактерину, біфіколу, біфідумбактерину), здійсненні
дезинтосикаційних заходів. При ураженні сечових шляхів застосо-
вують антибіотики (напівсинтетичні тетрацикліни), левоміцетин, ніт-
рофуранові препарати.
Профілактика. Для запобігання колі-інфекціям особливо важливі
раннє виявлення хворих, їх госпіталізація і раціональне лікування.
Треба систематично обстежувати працівників дитячих закладів і ма-
терів дітей, хворих на диспепсію. Велике значення у профілактиці
колі-ентеритів мають додержання санітарно-гігієнічного режиму в ди-
тячих закладах, на молочних кухнях, у родильних будинках, захист
води і харчових продуктів від забруднення фекаліями, боротьба з му-
хами, систематичне підвищення санітарно-гігієнічної культури насе-
лення. Профілактика дизентерієподібних захворювань та інших еше-
рихіозів забезпечується здійсненням загальних санітарно-гігієнічних
заходів.
Санітарно-показове значення Е. соіі. Виявлення Е. соіі вико-
ристовують як санітарний показник біологічного забруднення води,
продуктів, грунту, напоїв, предметів, рук. Ступінь забруднення води,
грунту, харчових продуктів визначають за колі-індексом або колі-
титром.
КЛЕБСІЄЛИ
Рід КІеЬзіеІІа (за ім’ям німецького бактеріолога Е. Клебса) охоп-
лює бактерії, які утворюють капсули як в організмі, так і на живиль-
них середовищах.
Морфологія. Клебсієли — товсті короткі палички завдовжки 0,6—
6 мкм і завширшки 0,3—1,0 мкм з округленими кінцями, нерухомі,
216
Рис. 63. Колонії К. рпеитопіае (а), К. огаепае (б), К. гізі-
позсіеготаїіз (в).
не утворюють спор. Розташовуються найчастіше поодиноко, попарно
або короткими ланцюжками, звичайно оточені капсулою. К. рпеито-
піае і К. охаепае мають фімбрії.
Культивування. Клебсієли — факультативні анаероби, добре ро-
стуть на простих живильних середовищах з рН 7,2 при температурі
35—37 °С, крайні границі — 12—41 °С. На МПА бактерії утворю-
ють каламутні і слизисті, різні за структурою колонії (рис. 63),
в МПБ — інтенсивне помутніння. Під впливом низької температури,
частих пересівань, фага, хімічних речовин, жовчі, антисироватки
вони дисоціюють з утворенням 8- і К-форм.
Ферментативні властивості відображені в табл. 16.
Токсиноутворення. Клебсієли пневмонії виробляють термоста-
більний енгеротоксин, у решти видів токсичність зумовлена дією
ендотоксину.
Антигенна структура. У клебсієлах є три різних антигени: кап-
сульний (К-антиген), соматичний гладенький (О-антиген) і деградова-
ний О-антиген (К-антиген). Клабсієли класифікують за К- і О-анти-
генами. У популяціях клебсієл, що містять К- і О-антигени, є серо-
вари.
Резистентність. При кімнатній температурі культури клебсієл
зберігаються тижнями і місяцями. Від нагрівання при температурі
65 °С вони гинуть протягом 1 год. Чутливі до дії розчинів хлораміну,
фенолу та інших дезинфікуючих речовин.
Таблиця 16. Диференціація бактерій роду КІеЬзіеІІа
Вид бактерій Ферментація 1
ГЛЮКОЗИ лактози дульцнту сечовини
К рпеитопіае кг к к +
К. огаепае кг± к
К. гЬіпозсІеготаїїз — — — —
Примітка К — кислота; КГ — ознаки; (—) — відсутність ознаки; б>ває не -авжди. •кислота і газ, (4-) —наявність відповідної (±) — негативний або позитивний результат
217
Рис 64 Колонії (а) і 3 годинна культу-
ра (б) К. рпеитопіае.
Рнс 65 Чиста культура
К- огаепае
Патогенність для тварин. Із експериментальних тварин найспри-
йнятливіші білі миші, які при явищах септицемії гинуть через 24—
48 год після парентерального зараження У препаратах із тканин внут-
рішніх органів і в крові виявляють багато капсульних бактерій Па-
тогенність клебсієл пов’язана з наявністю капсули: бактерії, які
втратили здатність до капсулоутворення, стають непатогенними і при
введенні в організм тварини швидко зазнають фагоцитозу.
Клебсієли пневмонії. Бактерії цього виду добре ростуть на гу-
стих середовищах з утворенням каламутних слизистих колонія
(рис. 64); виявлено кілька біоварів і сероварів. При зараженні мор-
ських свинок і білих мишей виникає септицемія. Збудників виявля-
ють у крові і тканинах: найбільш вірулентні серовари 1, 2, 3.
У людини клебсієли пневмонії можуть спричиняти пневмонію
(бронхопневмонію) з ураженням однієї або кількох часток легені,
іноді з виникненням зливних вогнищ і абсцесів легень. їх нерідко
виявляють у носовій частині глотки і кишках у здорових людей.
У деяких випадках бактерії пневмонії спричиняють менінгіт, апенди-
цит, у дітей — септицемію, піємію, мастоїдит, цистит та інші захво-
рювання; трапляються як збудники запальних процесів у сечостате-
вій системі і при мішаній інфекції.
Клебсієли озени (рис. 65) спричиняють хронічне ураження верхніх
дихальних шляхів (гортань, трахея), атрофію навколоносових пазух
і носових раковин, виділення в’язкого секрету, що підсихає з утво-
ренням твердих кірок, які
утруднюють дихання і створюють
різкий неприємний запах.
Озена поширена в Іспанії,
Індії, Китаї, Японії, спорадично
зустрічається в нашій країні.
Клебсієли склероми (рис. 66)
зумовлюють розвиток хронічного
гранулематозного або атрофічно-
го процесу в слизовій оболонці
носа, глотки, гортані, трахеї,
Рис. 66. К. гЬіпозеІеготаІіз:
а — 3-годннна культура: б — колонії 18-го-
218
бронхів з утворенням інфільтратів, які закінчуються рубцю-
ванням.
Клебсієли склероми можна виявити в інфекційних гранулемах
у вигляді коротких капсульних особин, що локалізуються всередині
і поза клітиною.
Склерома — слабкоконтагіозне хронічне захворювання. Трапляє-
ться в Центральній Америці й Індонезії та інших країнах; за-
реєстровано також у Білорусі, західній частині України. Лікуванню
піддається важко, потребує тривалого застосування комплексних
методів терапії.
Імунітет. При захворюваннях, спричинених патогенними клебсі-
ями, імунітет слабконапружений. У крові осіб, уражених озеною і
риносклеромою, виявляють аглютиніни і комплементзв’язуючі антиті-
ла, захисна роль яких незначна.
Лабораторна діагностика має три етапи: 1) бактеріоскопічне дослі-
дження мазків із мокротиння (при пневмонії), слизу з носа (при озені),
гранулематозної тканини (при риносклеромі), при цьому у хворих на
риносклерому виявляють багато своєрідних гігантських клітин Міку-
ліча, в желатиноподібній цитоплазмі яких містяться капсульні бакте-
рії; 2) виділення чистої культури та її ідентифікація за культураль-
ними, біохімічними, фаголізабельними і серологічними ознаками;
3) застосування РЗК з сироватками хворих і соматичним антигеном.
Лікування. Застосовують антибіотики (левоміцетин, канаміцин,
гентаміцин), призначають також вакцинотерапію.
Профілактика забезпечується виявленням ранніх форм риносклеро-
ми й озенн, лікуванням і запобіганням можливості зараження здоро-
вих людей від хворих.
ЕНТ ЕРО Б АКТ ЕР
Рід ЕпіегоЬасіег охоплює чотири види: Е. сіоасае, Е. £ег£оуіае,
Е. аего£епе$. Е. заказакі, що належать до коліподібних бактерій. Вони
рухливі, перитрихи, варіабельні в біохімічному відношенні, на гу-
стих середовищах утворюють слизисті колонії. Живуть у кишках
людини і тварин, їх виявляють у стічних водах, грунті, воді, харчо-
вих продуктах, іноді в сечі, гною та іншому матеріалі від хворих із
вторинними захворюваннями. Крім Е. £ег£оуіае, усі види вважаються
непатогенними для людини.
ЦИТРОБАКТЕР
До роду СіігоЬасіег входять С. Ггеипсіі, С. ашаїопаіісиз, С. сііуєг-
зиз. Це рухливі палички, перитрихи, ростуть на звичайних середови-
щах, як джерело вуглецю можуть використовувати цитрати. Вони
постійно живуть у кишках здорових людей. їх виявляють у випорож-
неннях, сечі, воді, продуктах та інших об’єктах зовнішнього середо-
вища. Деякі серовари бактерій виділяють при лабораторних дослі-
дженнях у хворих на ентерит, уретрит, холецистит, отит. В осіб із
зниженими захисними реакціями, а також у тих, котрі перенесли
219
хірургічне втручання, ці бактерії можуть спричиняти септицемію.
Останнім часом коліподібні бактерії досить часто є причиною різних
ускладнень — внутрішньолікарняних інфекцій, менінгіту у новона-
роджених.
5ЕЙЯАТІА МАКСЕЗСЕМ5
Бактерія є грамнегативною паличкою, перитрихом, звичайно са-
профітом. Дуже поширена у навколишньому середовищі (грунт, по-
вітря, харчові продукти). Утворює червоний пігмент (продигіозин),
має виражену стійкість проти багатьох антибіотиків. Цей рід бакте-
рій має кілька біоварів і сероварів. 8. тагсезсепз легко передається
від однієї людини до іншої, непігментовані варіанти часто виявляють
у повітрі лікарняних палат; може бути внесена в організм хворих, що
перебувають у стаціонарі, при катетеризації та інших маніпуляціях.
Ідентифікують 8. тагсезсепз за біохімічними ознаками (повільно фер-
ментує лактозу), антигенними властивостями, пігментоутворенням та
чутливістю до антибіотиків (гентаміцину, карбеніцину, канаміцину).
ПРОТЕЯ
Протей (Ргоіеиз) виділений Г. Хаузером у 1885 р. До групи протея вклю-
чені роди Ргоіеиз, Ргоуісіепсіа, Мог§апе11а та ін.
Морфологія. Протей — це поліморфна грамнегативна паличка
1—3 мкм завдовжки й 0,4—0,8 мкм завширшки. Розташовується по-
парно або ланцюжками, спор і капул не утворює, рухлива, перитрих
(див. рис. 12).
Культивування. Бактерії із групи протеїв — факультативні ана-
ероби. Добре ростуть на звичайних живильних середовищах. Опти-
мальна температура росту 25—37 °С (10—43 °С). На МПА утворю-
ють два види колоній. Н-форма колоній має вигляд «роїння» з утво-
ренням дочірніх відростків; це типова форма росту. За несприятливих
умов (наявність у середовищі фенолу, жовчних солей, акридинових
сполук) утворюються О-форми колоній, крупні, з рівними краями.
При висіванні в конденсаційну воду (за методом Шукевича) на по-
верхні живильного середовища з’являється тонкий вологий наліт
голубувато-димчастого кольору. У МПБ спричиняє рівномірне помут-
ніння з випаданням осаду.
Ферментативні властивості відображені в табл. 17.
Антигенна структура. Крім зазначених видів, відомі Х-штами:
ОХ-19, ОХ-2, ОХ-К, що мають спільні О-антигени з деякими рикет-
сіями, які спричиняють висипний тиф. Так, Ргоіеиз ОХ-19 тривалий
час використовувався як антиген для виявлення антитіл у сироватках
хворих на висипний тиф (реакція Вейля — Фелікса).
Резистентність. Палички протея порівняно стійкі проти фізичних
факторів, при температурі 60 °С зберігаються протягом 1 год, витри-
мують низькі температури, дію 10—12 % розчину натрію хлориду,
риванолу.
220
Таблиця 17. Диференціація бактерій роду Ргоіеиз
Патогенез захворювання у людини. Протей живе в кишках людини,
деякі його види виявляють у воді, грунті, харчових продуктах. Пато-
генність бактерій визначається ендотоксином, що вивільняється при
руйнуванні бактеріальних клітин. Захворювання має вигляд харчо-
вих токсикоінфекцій, диспепсії у дітей, гнійних процесів у дорослих —
отит, цистит, кон’юнктивіт. При рановій інфекції протей виявляють
разом із стафілококами, кишковою, синьогнійною паличками та ін-
шими мікроорганізмами.
Лабораторна діагностика здійснюється так само, як і при інших
кишкових інфекціях.
Лікування полягає у призначенні антибіотиків (канаміцину, гента-
міцину, карбеніциліну та ін.).
Профілактика полягає в захисті води і продуктів харчування від
забруднення випорожненнями і гнійними виділеннями.
ІЄРСИНІІ
До роду Уегзіпіа входять три види бактерій — ¥. резііз, ¥. рзеидо-
іиЬегсиІозіз, ¥. епіегосоШіса. Це овоїдні або паличкоподібні клітини
розміром 0,5—1,0 і 1—2 мкм, які не утворюють спор. Добре ростуть
на звичайних середовищах; оптимальна температура росту ЗО—37 °С,
але можуть розвиватись і в діапазоні від —2 до + 45 °С. Ферменту-
ють низку вуглеводів.
Збудник чуми
Збудник чуми — Уегзіпіа резііз — відкрив французький мікробіолог
А. Іерсен у 1894 р.
Чума — дуже давие інфекційне природно-вогнищеве зоонозио-антропоноз-
ие захворювання шо належить до групи карантинних (конвенційних).
У XIV ст. від чуми («чорної смерті») загинуло поиад 20 млн. жителів Європи.
Тепер у різних країнах світу трапляються поодинокі випадки захворювання
на чуму За даними ВООЗ, протягом 1971 — І980 рр. у 50 країнах світу було
зареєстровано 15 289 хворих иа чуму, летальність становила 7.9 %.
Захворюваність на чуму характеризується циклічністю (чергуванням під-
несень і спадів).
221
Рис. 67. Уегзіпіа рєЧіз у мазку з бубону хворої людини (а), колонії збудника
на м’ясопептонному агарі (б).
Морфологія. Бактерії чуми в мазках із тканин і в молодих куль-
турах овоїдної форми, завдовжки 1—2 мкм, завтовшки 0,3—0,7 мкм
(рис. 67). Вони нерухомі, не утворюють спор, на ультратонких зрізах
видно капсули. У культурах на густих середовищах мають подовжену,
іноді ниткоподібну форму. При додаванні до агару натрію хлориду
набирають різної химерної форми (кулястої, колбоподібної, зернистої).
У бактерій чуми виявлено наявність фільтрівних форм. Забарвлю-
ються всіма звичайними аніліновими барвниками біполярно, інтенсив-
ніше на полюсах; грамнегативні.
Культивування. Збудник чуми — факультативний анаероб, але
може рости і в анаеробних умовах. Культивується у звичайних сере-
довищах з рН 6,9—7,0. Температурний оптимум росту-27—28 °С, проте
може розвиватись і при температурі від 2 до 40 °С і рН 5,8—8,0.
На скошеному агарі культура росте у вигляді в’язкої прозорої
слизистої маси. На МПА вона утворює колонії з каламутно-білим
центром, оточеним фестончастою каймою (див. рис. 67), що нагадує
мереживо, а на МПБ — поверхневу плівку із спущеними донизу нит-
коподібними утвореннями, схожими на сталактити.
Збудник чуми — природний ауксотроф, потребує цистеїну, метіоні-
ну, фенілаланіну, валіну, ізолейцину та інших стимуляторів росту.
Це особливо важливо у тих випадках, коли у висіяному матеріалі
мало мікроорганізмів.
Бактерія чуми порівняно легко дисоціює від К-форм, з якими по-
в’язана її вірулентність, до авірулептних 8-форм. Цей перехід відбу-
вається через О-форми. Під впливом бактеріофага утворюються стійкі
8-форми, близькі до збудника псевдотуберкульозу. Деякі штами про-
дукують пестицини, активні як проти бактерії чуми, так і проти псев-
дотуберкульозу.
Ферментативні властивості. Одні штами бактерій чуми ферменту-
ють гліцерин, інші — не ферментують. Диференціація збудників чуми
і псевдотуберкульозу відображена в табл. 18.
Токсиноутворення. Бактерія чуми надзвичайно вірулентна для
людини. Вона утворює термолабільний екзотоксин, який складається
з двох фракцій: А і В. Токсин А має видоспецифічність, токсин В —
222
Таблиця 18. Диференціація бактерій роду Уегзіпіа
Вид бактерій Ферментація вуглеводів у
1 адоиїту арабі пози 1 ч і сорбіту 1
¥. РЄ5ІІ5 ± +
У. рзеидоіиЬегсиїозі&і — -|- -|- — — —
У. епіегосо) і і іса — — + + + + —
Примітка. <+) — наявність відповідної ознаки; (—) — відсутність ознаки;
(±) — непостійна наявність ознаки.
спільний для збудника чуми і псевдотуберкульозу. Крім того, бакте-
рії чуми спричиняють гемоліз еритроцитів і розчинення фібрину.
Континентальні штами продукують уреазу.
Антигенна структура. Збудник чуми має кілька антигенів, із них
найбільш вивчені О-, Р1-, Т-, XV-, У-термолабільні антигени.
У клітинах вірулентних бактерій чуми міститься термостабіль-
ний соматичний антиген, високотоксичний для мишей і пацюків, який
під дією формаліну переходить в анатоксин, а також гемолізини та
інші токсичні речовини. Методом преципітації в агарі у збудника чуми
виявлено антигени, спільні з псевдотуберкульозними, кишково-тифоз-
ними, дизентерійними й еритроцитами людини О-групи.
Резистентність. Збудник чуми витримує низькі температури, при
температурі 0 °С не гине протягом 6 місяців, на одязі залишається
живим 5—6 місяців, у стерильному грунті і в молоці — 90 діб, іга
зерні і в трупах — 50, у воді — ЗО, у гною з бубонів — 20—30, мок-
ротинні — 10, овочах і фруктах — 6—11, хлібі — 4 доби. У бактерій
чуми виявлено штами, резистентні одночасно до кількох антибіотиків.
Збудник чуми дуже чутливий до висихання і дії високої темпера-
тури, кип’ятіння вбиває його протягом 1 хв, нагрівання до 60 °С —
за 1 год; від дії 5 % розчину фенолу гине через 5—10 хв, 5 % розчину
лізолу — через 2—10 хв.
Патогенність для тварин. Сприйнятливі до чуми гризуни: чорний
і сірий пацюки, миші, ховрахи, гребенчукові (тамарискові) піщанки,
бабаки (тарбагани) Кількість видів гризунів, які спонтанно хворі-
ють на чуму, перевищує 200. Крім того, 19 видів гризунів сприйнятли-
ві до чуми при експериментальному зараженні.
Патогенез захворювання у людини. Збудник чуми проникає в ор-
ганізм людини через ушкоджену шкіру (іноді слизові оболонки) при
роботі з інфікованим матеріалом, зніманні шкур з гризунів. При леге-
невій формі бактерії чуми передаються повітряно-краплинним шля-
хом з мокротинням при кашлі і розмові хворої людини.
Інкубаційний період триває 3—6 діб, іноді — кілька годин, у ряді
випадків — до 8—9 діб. Залежно від локалізації збудника, реактив-
ності органі іму. вірулентності мікроорганізму, ступеня клітинного
і гуморального імунітету в людини може спостерігатися шкірна,
223
бубонна, первинно-септична, вторинно-септична, первинно-легенева,
вторинно-легенева форми чуми.
Починається чума раптово, без продромального періоду: настають
трясучий озноб, сильний головний біль і запаморочення, обличчя
стає блідим із синюшним відтінком і виразом страждання (жаху) —
Гасіез резііса. Кожній формі чуми властиві специфічні клінічні ознаки.
Летальність до застосування стрептоміцину була дуже високою (40 —
90 %).
Імунітет. Після перенесеного захворювання виробляється стійкий
і тривалий імунітет, зумовлений переважно фагоцитарною активністю
лімфоцитів і макрофагів. Істотну роль в індукуванні імунітету відіграє
протективний антиген.
Лабораторна діагностика. Дослідження роблять у спеціальних
лабораторіях у протичумних костюмах з неухильним додержанням ре-
жиму. Залежно від клінічної форми і локалізації збудника об’єктами
дослідження можуть бути вміст бубону при бубонній формі, виділення
виразки при шкірній формі, слиз із зіва і мокротиння при легеневій
формі, кров при септичній формі, патологоанатомічний матеріал
(органи, кров, вміст лімфатичних вузлів, легені), трупи гризунів,
блохи, вода, харчові продукти, повітря та ін.
Лабораторна діагностика включає кілька етапів: 1) бактеріоскопію
мазків, фіксованих у суміші Никифорова, забарвлених за Грамом і ме-
тиленовим синім за Леффлером; 2) висівання досліджуваного матері-
алу на живильні середовища, виділення чистої культури та її іденти-
фікація; для пригнічення супровідної мікрофлори до 100 мл МПА до-
дають 1 мл 2,5 % розчину сульфіту натрію й 1 мл насиченого спирто-
вого розчину генціанового фіолетового, розведеною в пропорції
1 : 100 дистильованою водою, а для знешкодження чумного фага
в культуру перед висіванням вносять 0,1 мл антифагової сироватки;
3) біологічну пробу на морських свинках з виділеною чистою культу-
рою, а також з матеріалом, з якого важко добути культуру. В остан-
ньому випадку досліджуваний матеріал у вигляді густої зависі вти-
рають морським свинкам у виголену ділянку шкіри на животі. За
наявності чумних бактерій тварина гине на 5—7-му добу. Для приско-
рення діагнозу заражених морських свинок на 2—3-тю добу вбивають
і з їх органів виділяють культуру мікроорганізмів чуми.
Ідентифікують бактерії чуми на підставі визначення морфологіч-
них, культуральних, ферментативних, фаголізабельних, аглютина-
бельних властивостей. Виділену культуру диференціюють із збудни-
ком псевдотуберкульозу (див. табл. 18). Вирішальне значення в діаг-
ностиці чуми має біопроба.
При дослідженні матеріалу загнилих трупів гризунів застосову-
ють реакцію термопреципітації. В епізоотичних вогнищах для вияв-
лення антитіл у сироватках тварин використовують ІФА.
З огляду на важливість екстреного розпізнавання чуми розроблено
прискорені методи лабораторної діагностики цього захворювання,
вони опйсані в практичних посібниках.
Лікування. Ефективним засобом лікування хворих на чуму є стреп-
томіцин, який здебільшого дає добрі результати і при легеневих фор-
824
мах захворювання. Результативне також призначення стрептоміцину
з хлорамфеніколом. Крім того, застосовують протичумний гамма-
глобулін {'специфічний фаг. При ускладненнях, спричинених коковою
мікрофлорою, рекомендується введення пеніциліну, сульфаніламід-
них препаратів.
Профілактика. До загальних профілактичних заходів належать:
1) рання діагностика чуми, особливо перших випадків; 2) негайна ізо-
ляція, госпіталізація хворих і запровадження карантину; для осіб,
які були в контакті з хворими, карантин призначають строком на
6 діб і розпочинають профілактичне лікування стрептоміцином;
3) обсервація (ізоляція окремих осіб або груп осіб, що підозрюються
на контакт з інфікованим матеріалом, щоденний обхід дворів, дворазо-
ве термометрування і нагляд на час можливого інкубаційного періоду);
4) проведення у вогнищах старанної дезинфекції, дезинсекції і дерати-
зації; 5) індивідуальний захист медичного персоналу, профілактичне
введення стрептоміцину і вакцинація; 6) виконання вимог міжнарод-
них конвенцій щодо профілактики чуми (дератизація і дезинсекція
кораблів, літаків, поїздів, а в разі потреби — обов’язковий карантин
для пасажирів); 7) забезпечення охорони кордонів країни від зане-
сення чуми.
Специфічну профілактику проводять живою вакциною ЕУ. її
випускають у сухому вигляді, застосовують підшкірно, внутрішньо-
шкірно, нашкірно одноразово або дворазово. Тривалість імунітету —
в межах року. Залежно від епідеміологічної обстановки через 6 або
12 місяців роблять ревакцинацію. Ефективність вакцинації неви-
сока.
Збудники псевдотуберкульозу та ісрсиніозу
До роду Уегзіпіа крім ¥. резііз належать також збудники псевдо-
туберкульозу (V. рзеисіоіиЬегсиїозіз) й ієрснніозу (V. епіегосоїіііса)-
Обидва види рухливі, уражують тварин, від яких передаються людині.
Псевдотуберкульоз і ієрсиніоз трапляються в ЗО країнах світу серед
дорослих і дітей у вигляді епідемічних спалахів або спорадичних
випадків. Природним джерелом інфекції є дикі і синантропні гризуни.
Зараження настає аліментарним шляхом через харчові продукти
і воду, інфіковані виділеннями хворих тварин. Захворювання харак-
теризується головним болем, слабкістю, блюванням, болем у животі,
гарячкою, висипом різної морфології, гіперемією слизової оболонки
порожнини рота і глотки.
Лабораторну діагностику проводять виділенням збудника із ви-
порожнень хворих та його ідентифікацією за біохімічними властиво-
стями, фаголізисом, а також виявленням антитіл у сироватці крові
хворих за допомогою РА і непрямої РГА.
Для лікування застосовують напівсинтетичні препарати тетрацик-
ліну, левоміцетину, патогенетичні засоби.
Профілактика полягає у проведенні дератизації, захисті харчових
продуктів і води від гризунів, додержанні санітарно-гігієнічного ре-
жиму на підприємствах громадського харчування, у їдальнях, на
продовольчих складах та ін.
8 1.445
225
РОДИНА УІВРІОКАСЕАЕ
ХОЛЕРНИЙ ВІБРІОН
Збудниками холери прийнято вважати бювар класичного холерного віб-
ріона, описаний уперше в 1854 р. Ф. Пачіні і докладно досліджений Р. Ко-
хсм у 1883 р., та бювар холерного вібріона Ель-Тор, виділений від померлого
хворого Ф Готшліхом у 1906 р. До родини УіЬгіопасеае, крім холерного віб-
ріона, належить V. теІзсЬпісоуіІ, який спричиняє у птахів понос, у людей —
гастроентерит.
Холера — дуже давня інфекція. Епідемічним вогнищем іі е Індія. У пе-
ріод з 1817 по 1926 р. було шість пандемій холери; у 1961 р. почалася сьома
пандемія. У 1970 р. випадки холери спостерігались на півдні України (Одеса).
Летальність від холери в минулому була висока (50—60 %), останнім
часом, за даними ВООЗ вона становить близько 1 %
Морфологія. Холерний вібріон має форму зігнутої палички зав-
довжки 1,5—3,0 мкм, завтовшки 0,3 мкм (рис. 68, а); дуже рухливий,
звичайно монотрих, не утворює спор і капсул, грамнегативний.
Холерні вібріони мінливі під впливом фізичних, хімічних і біоло-
гічних факторів. На штучних середовищах і в старих культурах вони
можуть набувати форм зерен, куль, колбоподібних утворень, пали-
чок, спіралей, утворювати Ь-форми; при пересіванні на свіжі сере-
довища вібріони переходять у вихідні форми.
Раніше розрізняли два біоваоа холерного вібріона — класичний
та Ель-Тор. Істотної різниці в структурі цих вібріонів не виявлено,
тому згідно з останнім виданням визначника бактерій Бергі (1984)
вважають, що збудник холери має один штам.
Культивування. Холерні вібріони — факультативні анаероби; тем-
пературний оптимум росту 18—37 °С; крайні грайниі 14—42 °С;
добре розвиваються при рН 7,2—8,6, на густих середовищах утворю-
ють прозорі, що мають голубуватий відтінок, опуклі дископодібні
колонії з рівними краями. На лужному бульйоні і лептонній воді
через 6 год росту з’являється ніжна плівка.
Холерні вібріони дисоціюють із 3-форми в Р-форму. Цей мута-
ційний процес супроводиться глибокими змінами антигенної струк-
тури.
Ферментативні властивості. Холерні вібріони розріджують зсілу
сироватку, желатину, утворюють індол, аміак, ферментують сахарозу
і манозу з утворенням кислоти, не ферментують у перші 48 год лакто-
Рис. 68. Холерний вібріон:
а — чиста культура; б — вібріони а джгутн-
зу й арабінозу; постійно спричи-
няють зсідання молока, мають
лізин-орнітин-декарбоксилазну й
оксидазну активність.
За властивістю ферментувати
манозу, арабінозу й сахарозу Б.
Хейберг поділив вібріони на
хемовари; холерні вібріони на-
лежать до І хемовару.
Токсиноутворення. Збудники
холери виділяють екзотоксин
(холероген), що має ентероток.
226
спчну дію і відіграє важливу роль у патогенезі холери; сильну
токсичну дію має й ендотоксин. Холерні вібріони утворюють
плазмін, гіалуронідазу, клостридіопептидазу А (колагеназу), муци-
назу, фосфоліпазу (леиитиназу), протеїнази, нейрамінідазу. Остання
спричиняє відщеплення нейрамінової кислоти, що є на поверхні
клітин слизової оболонки кишок.
Антигенна структура. Холерні вібріони мають термостабільні
О-антигени (соматичні) і термолабільні Н-антигени (джгутикові).
О-антнгену властиві видова і типова специфічність, Н-антиген неспе-
цифічний, спільний для всього роду УіЬгіо. Вібріони поділені на
О-підгрупи, яких налічується понад 60. Холерні вібріони нале-
жать до О1-підгрупи. У вібріонів збудників холери цієї підгрупи
розрізняють три О-антигени (А, В, С), за комбінацією яких виділяють
три серовари — Отава (АВ), Інаба (АС) і Гікошима (АВС).
У хворих і вібріоносіїв виявлено вібріони (НАГ-вібріони), які не
аглютинуються, їх природу остаточно не визначено. Гадають, що
вони є наслідком мінливості холерних вібріонів. Ці форми дістали
назву НАГ-вібріонів, вони схожі на холерні за морфологічними,
культуральними і біохімічними ознаками, не мають спільних із ними
О- та Н-антигенів. НАГ-вібріони досить часто виділяють із води та
інших об’єктів зовнішнього середовища.
Резистентність. Холерні вібріони довго зберігаються при низь-
ких температурах; у випорожненнях вони виживають до 5 місяців,
у грунті — 2 місяці, в устрицях, крабах, креветках, на поверхні риб
і в їх кишках — від 1 до 40 діб, у воді — кілька діб. Вібріони мо-
жуть зберігатися понад 4 тижні в морській і річковій воді, 1—10 діб —
на продуктах, 4—5 діб — у кишечнику мух. За сприятливих умов
можливе розмноження вібріонів холери у водоймах, у мулі.
Холерні вібріони малостійкі до дії сонячного світла, висушування.
При температурі 100 °С вони гинуть миттєво, при 80 °С — протягом
5 хв. Дуже чутливі до дії дезинфікуючих речовин, кислот, шлунко-
вого соку (в розчині соляної кислоти 1 : 10 000 гинуть за 1 хв).
Патогенність для тварин. У природних умовах тварини на холеру
не хворіють. Вчутрішньоочеревинне введення культури кролям і мор-
ським свинкам супроводиться загальним токсикозом, перитонітом,
який призводить до загибелі тварин.
Патогенез захворювання в людини. Холерні вібріони передаються
від хворих і носіїв через їжу, воду, мух і брудні руки. Зараження
можливе при купанні у водоймах, полосканні морською водою горла,
вживанні у їжу креветок, устриць, риби, інфікованих збудниками
холери.
/Мікроорганізми проникають через порожнину рота в тонку кишку.
Кислий вміст шлунка звичайно є несприятливим середовищем для
холерних вібріонів, але в ряді випадків цей бар’єр порушується вна-
слідок дії різних факторів, які нейтралізують або знижують бакте-
рицидні властивості шлункового соку.
Завдяки лужному середовищу і достатку продуктів розпаду біл-
ків у кишках створюються сприятливі умови для розмноження холер-
них вібріонів, яким властива адгезивність. Вироблюваний ними енте-
8'
227
ротоксин (холероген) активізує фермент аденілциклазу в клітинах
епітелію тонкої кишки, підвищує продукцію аденозинмонофосфату,
який призводить до зміни механізму проникності епітеліальних клітин,
що й зумовлює розвиток профузного поносу. Швидка дегідратація
супроводиться втратою електролітів, зокрема солей калію і натрію.
Тривалість інкубаційного періоду при холері становить від кіль-
кох годин до 6 діб (у середньому 2—3 доби).
У розвитку захворювання розрізняють кілька етапів: холерний
ентерит (холерний поиос, або діарея) тривалістю 1—2 доби який у ча-
стини хворих іакіичуеться видужанням; холерний гастроенте-
рит, при якому сильний понос і багаторазове блювання призводять до збез-
воднення організму хворих, що спричиняє зниження температури тіла, різке
зменшення вмісту в крові мінеральних і білкових речовин, появу судорог;
випорожнення нагадують рисовий відвар; холерний алгід, коли з'яв-
ляється ціаноз, голос стає хрипким, іноді настає цілковита афонія, темпера-
тура тіла знижується до 35,5—34 °С, розвиваються різке ослаблення діяль-
ності серця внаслідок підвищення в’язкості крові, затримка сечовипускання.
У ряді випадків виникає холерна кома, що призводить до прострації
і смерті.
Можлива дуже тяжка скоротечиа форма холери (суха холера), яка при
відсутності поносу і блювання в результаті різкої інтоксикації закінчується
смертю.
Останніми роками у 80—90% випадків і більше виникнення холери
спостерігаються стерті і легкі форми захворювання. Тяжкі форми
з летальним кінцем трапляються в осіб з різними соматичними захво-
рюваннями. які знижують загальну резистентність організму і бар’єр-
ну функцію шлунка, а також у людей похилого віку.
Імунітет. В осіб, які перенесли холеру, розвивається міцний анти-
інфекційний {антитоксичний та антибактеріальний) імунітет, пов’я-
заний з наявністю в крові антитоксинів, лізинів, вібріоцинів (І§А),
аглютинінів, опсонінів і з фагоцитарною активністю макрофагів.
У природному фізіологічному механізмі захисту важливу роль віді-
грає нормальна функція шлунка, вміст якого бактерицидний щодо
холерного вібріона. Іноді після видужання реконвалесиенти протя-
гом 3—4 тижнів стають носіями холерних вібріонів.
Лабораторна діагностика. Дослідження ведуть при запровадженні
в лабораторії суворого режиму з додержанням загальних правил
під час роботи з особливо небезпечними (карантинними) інфекціями.
Для дослідження беруть випорожнення,
блювотні маси, органи трупа, воду, предме-
ти, у деяких випадках — харчові про-
дукти. Узяття і доставку матеріалу на
дослідження також роблять з додержанням
певних правил.
Лабораторна діагностика включає
кілька етапів.
Перший етап — бактеріоскопічне дос-
лідження мазків із випорожнень, забарв-
лених за Грамом і водним розчином
фуксину, в яких у хворих виявляються
холерні вібріони (рис. 69). Бактеріоскопія
Рис. 69. Холерний вібріон
(мазок із випорожнень).
228
в темному полі дає змогу мати попередню (сигнальну) відповідь про-
тягом кількох хвилин при умові обстеження в ранній стадії.
Другий етап — висівання випорожнень хворого в 1 % лептонну
воду, на лужний МЛА або бактоагар ТСВ. Через 6 год після культи-
вування при температурі 37 °С у лептонній воді видно ріст вібріонів
у вигляді ніжної плівки, що прилипає до скла. Мазки з плівки за-
барвлюють за Грамом, вирослу культуру вивчають на рухливість,
ставлять РА на предметному склі із специфічною аглютинуючою
О-сироваткою, розведеною 1 : 100, потім роблять пересівання з пеп-
тонної води на густі середовища для виділення чистої культури. Якщо
в лептонній воді вібріонів не виявляють, то краплину з її поверхне-
вого шару пересівають у другу лептонну воду. У ряді випадків та-
кими пересіваннями досягають збільшення бактеріальної маси ві-
бріонів. Добуту культуру вібріонів на густих середовищах досліджу-
ють на рухливість, аглютинабельні властивості і відсівають на ско-
шений агар. _
На третьому етапі дослідження для остаточної ідентифікації став-
лять розгорнуту РА із специфічною О-сироваткою і типоспепифіч-
ними сироватками Огава й Інаба, визначають ферментативні властиво-
сті (розщеплення манози, сахарози, фаголізабельність) (табл. 19).
Таблиця 19. Біохімічні властивості холерного вібріона
Нива Ферментація А глютини* ці я куря- чих ерит- роцитів Лізис соеонфіч- вмна фага- и підгру гти 0-1 Аглютн- нааія О- хазер ва- ми сиро- ватками Чут» вість» ООЛІМЇК- сниу
саігрози иавозе грабіввзя
УіЬгіо сЬоІегае к к - - + -Г
Примітна. К — ферментація вуглеводів з утЕоренням кислоти; (4-) — наяв-
ність відповідної ознаки; (—) — відсутність ознаки; (±) — непостійна наявність
ознаки.
Диференціація холерного вібріона грунтується на його фаго-
лізабельннх властивостях: холерний вібріон лізирується фагом
04.
У деяких випадках для діагностику холери використовують серо-
логічні методи — реакцію аглютинації і визначення вібріопидних
антитіл.
До прискорених методів лабораторної діагностики холери нале-
жать реакція іммобілізації, реакція аглютинапїї в темному полі,
реакція імунофлюоресиенпії та інші, які є орієнтовними і потребують
проведення повного бактеріологічного дослідження.
Лікування. Дуже велике значення має боротьба із збезводненням,
гіпопротеїнемією, порушенням обміну речовин, наслідками токсикозу,
яка здійснюється введенням сольових розчинів натрію і калію, плазми
або сухої сироватки, глюкози, застосуванням зігрівальних ванн,
препаратів, які стимулюють функцію органів кровообігу. Крім того,
229
призначають спочатку внутрішньовенно, а потім перорально напів-
синтетичні тетрацикліни, сигмаміцин, левоміцетин.
Профілактика. У вогнищі холери необхідне проведення таких
заходів:
— виявлення перших випадків холери, старанний облік хво-
рих і негайне інформування вищестоящих органів охорони здоров’я;
— ізоляція і госпіталізація за особливими правилами хворих
і носіїв, обсервація і лабораторне обстеження контактних осіб;
— поточна і заключна дезинфекція у відділенні для хворих на
холеру і в вогнищі;
— охорона джерел водопостачання, посилення санітарного нагля-
ду за харчоблоками, боротьба з мухами; у зв’язку з можливістю роз-
множення холерних вібріонів у різних водоймах за сприятливих умов
(температура, наявність живильних субстратів) потрібний система-
тичний бактеріологічний контроль за водоймами, особливо в літню
пору в місцях масового відпочинку населення;
— неухильне додержання правил особистої гігієни, кип’ятіння
або старанне хлорування води, знезаражування посуду;
— специфічна профілактика — імунізація холерною моновакци-
ною або холерним анатоксином Виготовлено ефективну хімічну біва-
лентну вакцину, що складається з О-антигену сероварів Огава й Інаба
та холерного анатоксину. Вона ареактивна, застосовується перораль-
но. Тим, хто контактував з хворими або підозрілими на холеру, роб-
лять хіміопрофілактику прийманням усередину препаратів тетрацик-
ліну.
Головним у профілактиці холери є здійснення .загальних проти-
епідемічних заходів, а імунізацію розглядають як допоміжний засіб,
бо тривалість поствакцинального імунітету не перевищує 6 місяців.
ПАРАГЕМОЛІТИЧНИЙ ВІБРІОН
УіЬгіо рагаЬаетоІуіісия відкритий у 1963 р. японськими вченими Р. Сака-
вакі та ін. Природним резервуаром вібріона є морська вода біля узбережжя
Японії Виділений у морських риб і ракоподібних, виявляють його і в випо-
рожненнях людей, хворих иа гострий ентерит. Останнім часом пара гемолітич-
ний вібріон трапляється, крім Японії, і в інших країнах.
Ідентифіковані два біовари вібріона: рагаЬаетоІуіісиз і ап§іпо1у-
іісиз За О-антнгеном парагемолітичний вібріон містить 12 сероварів.
Парагемолітичний вібріон — збудник токсикоінфекцій. Харчові
отруєння виникають в осіб, які споживають сирі морські продукти.
Штами парагемолітичного вібріона, що висіваються в людей,
спричиняють лізис еритроцитів і цитопатичну дію в культурах тканин
і клітин людини, тоді як штами, виділені з продуктів моря і морської
води, не мають цих властивостей і непостійно ферментують сахарозу
й арабінозу.
Принципи лікування і профілактики такі самі, як і при інших
токсикоінфекціях.
230
ПАСТЕРЕЛИ
До родини Разіеигеїіасеае входять бактерії родів Разіегеїіа, Асііпі-
Ьасіїіиз, НаеторЬіІиз, багдпегеїіа.
Рід Разіегеїіа ділиться на біовари Р. таИосіда, Р. £а11іпагит
та ін.
До роду АсііпоЬасіПиз входять А. зиіз, А. сарзиіаіиз, А. 1і§пеігезіі
та ін.
До роду НаеторЬіІиз віднесені Н. іпПиепгае з п’ятьма біоварами,
Н. §е§піз, Н. рагазиіз, Н. йисгеу.
До роду багбпегеїіа входить Н. уа^іпаїіз.
Найбільше значення має Н. іпПиепгае.
НАЄМ0РНІШ5 ІМЕЕ11ЕІЧ2АЕ
У 1889 р. М. 1. Афанасьев і в 1892 р. Р. Пфейфер та С. Кітазато виявили
під час пандемії грипу в мокротинні хворих дуже дрібні грамнегативні бакте-
рії, які поиад 40 років помилково вважали збудниками грипу. Пізніше було
доведено що ня паличка — супутник грипозних захворювань і збудник го-
стрих респіраторних та вторинних інфекцій.
Морфологія. НаеторЬіІиз іпПиепгае — дрібні паличкоподібні бак-
терії з округленими кінцями 0,5—2 мкм завдовжки і 0,2—0,3 мкм
завширшки (рис. 70, а), нерухомі, не продукують спор; вірулентні
гладенькі форми утворюють капсулу, грамнегативні. Порівняно добре
забарвлюються слабким розчином фуксину, інтенсивніше на полюсах.
Н. іпПиепгае мають поліморфізм. Іноді вони бувають ниткопо-
дібної форми з кулястим і веретеноподібним здуттям.
Культивування. Н. іпПиепгае — аероб і факультативний анаероб.
Не росте на звичайних живильних середовищах, добре розмножується
на кров’яному, агарі з рН 7,3—7,5 при температурі 37 °С (крайні
границі росту 25—43 °С). Через добу на середовищі з’являються дрібні
прозорі колонії (рис. 70, б), схожі на краплинки роси. У кров’яному
бульйоні бактерії розвиваються у вигляді білих пластівців або легкої
каламуті
На кип’яченому агарі з кров’ю (шоко-
ладний агар) росте з утворенням крупних
прозорих плоских колоній. За формою ко-
лоній бактерії поділяються на два типи:
гладенькі (типові) і шорсткі (атипові).
На штучних середовищах Н. іпПиепгае
розвивається при наявності двох факторів:
так званого X-фактора (гемін), термолабіль-
ного, що не руйнується при нагріванні до
120 °С, і У-фактора (коензимнікотинамі-
даденіндинуклеотид), який є в крові,
свіжій картоплі, тваринних і рослинних
тканинах та в багатьох бактеріях.
Ферментативні властивості. Н. іпПие-
пгае відновлюють нітрати в нітрити;
Рис 70. Чиста культура (а)
і колонії (б) НаеторЬіІиз
ІпПиепгае.
231
гладенькі (типові) штами бактерій утворюють індол; фер-
ментує з утворенням кислоти глюкозу і сахарозу, непостійно — галак-
тозу, фруктозу, мальтозу і ксилозу. Розрізняють п’ять біоварів
Н. іпПиепгае.
Токсиноугворення. Н. ІпПиепгае не продукує екзотоксин, пато-
генна дія її зумовлюється ендотоксином, що утворюється в результаті
розпаду бактерій.
Антигенна структура. Гладенькі (вірулентні) форми бактерій
містять серовари, що визначаються рН сироваток з капсульною речо-
виною. Шорсткі атипові штами гетерогенні. Н. іпПиепгае мають шість
сероварів.
Резистентність. Поза організмом Н. іпПиепгае зберігаються не-
довго, чутливі до фізичних і хімічних факторів, швидко гинуть від
дії температури 55 °С, сонячного випромінювання, висушування і де-
зинфікуючих речовин.
Патогенність для тварин. У піддослідних тварин (білі миші), за-
ражених культурами Н. іпПиепгае, розвивається стан інтоксикації.
У кров бактерії звичайно не проникають.
Патогенез захворювання у людини. В організмі людини Н. іпПи-
епгае (капсульна) локалізується в слизовій оболонці верхніх дихаль-
них шляхів і бронхів, розташовується поза- і внутрішньоклітинно.
Ослаблення загальних імунобіологічних захисних властивостей
організму в результаті різкого охолодження і під впливом вірусу
грипу зумовлю’ активацію ряду мікроорганізмів, які постійно пере-
бувають в носовій частині глотки і зіві. При цьому Н. іпПиепгае
разом з іншими мікроорганізмами (стафілококи, стрептококи, аденові-
руси та ін.) спричиняє гостре запалення верхніх дихальних шляхів
або гостру респіраторну вірусну інфекцію (ГРВІ), що виникає під
впливом охолодження. Крім того, можуть розвиватись ангіна, бронхіт,
пневмонія, отит, менінгіт та інші запальні захворювання, а також
різні ускладнення після інфекційних захворювань, особливо у дітей.
Імунітет. Несприйнятливість до гострих респіраторних інфекцій
залежить від стану загальнофізіологічних захисних механізмів, здат-
ності організму витримувати різкі коливання температури, вологості
та інші зміни зовнішнього'середовища. Певну роль відіграють сиро-
ваткові антитіла до капсульного антигену.
Лабораторна діагностика. Матеріалом для дослідження є мокро-
тиння і слиз із порожнини носа. Виділення слизової оболонки мигда-
ликів і носової частини глотки беруть за допомогою ватного тампона.
Готують мазки з мокротиння, забарвлюють їх фуксином протягом
5—10 хв; ідентифікують бактерії в патологічному матеріалі за допо-
могою РІФ. Потім гнійні грудочки мокротиння, відмиті в 0,85 %
розчині натрію хлориду, висівають на кров’яний агар, «шоколадний»
агар або на середовище Левінталя. Висівати можна методом «кашльо-
вих» пластинок (під час кашлю перед ротом хворого на відстані 5—
8 см тримають відкриту чашку з середовищем). Посіви вирощують при
температурі 37 °С. Для пригнічення кокової мікрофлори в чашки до-
дають 15—25 ОД пеніциліну. Виділену культуру диференціюють з бак-
теріями коклюшу за біохімічними та антигенними властивостями.
232
Лікування. Призначають антибіотики в комбінації з сульфаніламід-
ними препаратами.
Профілактика полягає у запобіганні охолодженню, загартовуванні
організму, систематичних фізичних тренуваннях. Велике значення
мають повноцінне харчування з вмістом достатньої кількості вітамі-
нів, додержання санітарно-гігієнічних умов праці та побуту.
ЗБУДНИК М'ЯКОГО ШАНКЕРУ
Бактерія м’якого шанкеру (НаеторЬіІиз бисгеу) була відкрита О. В. Пе-
терсеном у 1887 р., докладно описана А. Дюкреєм у 1889 р. і вивчена П. Унна-
в 1892 р. Ті включено до родини Разгеигеїіасеае.
Морфологія. Бактерії м’якого шанкеру овальної форми, завдовжки 1,5—
2 мкм, завширшки 0,5 мкм. У мазках із виразки розташовуються групами або
довгими ланиюжками, не утворюють спор, капсул і джгутиків, грамнегативні,
інтенсивніше забарвлюються на полюсах.
Культивування. Збудник м’якого шанкеру — факультативний анаероб.
Не росте на звичайних середовищах, культивується на кров’яному агарі при
температурі 37 °С і рН 7,2—7,8, на шоколадному агарі, бульйоні Мартена
з 20 % дефібрннованої крові і на середовищі що складається з 1 частини 5 %
гліцеринового агару й 4 частин рідкого яєчного середовища. На кров’яному
агарі утворює дрібні кулясті окремі колонії діаметром 1—2 мм, має гемофіль-
ні властивості.
Ферментативні властивості. У збудника м’якого шанкеру немає протеолі-
тичних властивостей, він ферментує з утворенням кислоти глюкозу, лактозу,
сахарозу, маніт.
Токсиноутворення Екзотоксин не продукує. Патологічні зміни зумовлю-
ються дією ендотоксину.
Антигенна структура і класифікація не розроблені. Збудник м’якого шан-
керу слід диференціювати з НаеторЬіІиз уаріпаїіз (рід багдпегеїіа), яку ви-
являють при неспецифічних вагінітах й уретритах. Остання грамваріабельна,
вона — факультативний анаероб, не росте на звичайних діагностичних сере-
довищах, розвивається иа телуритовому середовищі.
Резистентність. Бактерія м’якого шанкеру чутлива до різних факторів
зовнішнього середовища гине при діянні температури 55 °С (протягом 15 хв)
і слабких розчинів дезинфікуючих речовин.
Патогенність для тварин. До збудника м’якого шанкеру сприйнятливі мав-
пи, в яких розвивається легка форма захворювання. Морські свинки і кролі
зараженню не піддаються.
Патогенез захворювання у людини. М’який шанкер — венеричне захворю-
вання, що передається статевим шляхом. Джерелом зараження є людина, ура-
жена гострою або хронічною формою захворювання. За даними ВООЗ, м’який
шанкер становить близько 10 % усіх випадків венеричних захворювань.
Мікроорганізм розмножується у шкірі або слизовій оболонці статевих
органів. У місці проникнення збудника виникає запалення, потім утворюєть-
ся болісна виразка м’якої консистенції з гнійними виділеннями і підритими
краями. Проникнення збудника у сусідні ділянки спричиняє утворення мно-
жинних виразок, в результаті ураження лімфатичних судин розвиваються лім-
фангоїт і лімфаденіт. Якщо виразок немає, збудник може бути в слизовій
оболонці піхви, шийки матки, сечовипускного каналу.
Імунітет. Перенесене захворювання не приводить до розвитку імунітету
хоч і спричиняє утворення в організмі комплементзв’язуючих антитіл і су-
проводиться розвитком алергії.
Лабораторна діагностика включає такі етапи: І) бактеріоскопію виділень
із глибоких шарів виразки, забарвлення мазків метиленовим синім і за Грамом;
при бактеріоскопії мазків легко виявляються довгі ланцюжки грампегатнвпнх
бакіерій; 2) висівання виділень па кров’яний агар виділення чистої культури
та її ідентифікація за допомогою РА і з специфічною сироваткою; 3) застосуван-
ня алергічної реакції (внутрішньошкірної проби) з антигеном із бактерії м’я-
233
кого шанкеру; на місці введення антигену через 24—28 год з’являється папула
Із зоною запалення.
Лікування проводять сульфаніламідними препаратами й антибіотиками
(пеніцилін, напівсинтетичні тетрацикліни, левоміцетин).
Профілактика забезпечується соціальними перетвореннями, які зумовлюють
підвищення загального культурного і гігієнічного рівня населення. У нашій
країні це захворювання ліквідоване.
ЗБУДНИКИ БРУЦЕЛЬОЗУ І ТУЛЯРЕМІЇ
Бруцельоз і туляремія — дуже поширені зоонози і захворювання,
тобто вони трапляються у тварин і в людини. За даними ВООЗ.до
групи зоонозів входять понад 150 інфекційних та інвазійних нозоло-
гічних форм — чума, сибірка, лептоспіроз, ендемічні рикетсіози,
орнітоз, сказ, кпііцовий і комариний енцефаліт, багато гельмінтозів
та ін.
БРУЦЕЛИ
У 1886 р. Д. Брюс виявив збудника бруцельозу в селезінці померлої люди-
ни, в 1887 р. він дістав його в чистій культурі. У 1896 р. Б. Банг довів, що
етіологія інфекційного аборту великої рогатої худоби пов’язана з бруцелами.
У 1914 р. Дж. Траум виділив від свиней бруцелу, яка спричиняє в них інфек-
ційний аборт. У 1953—1957, 1966 рр. було виявлено й інші види мікроорга-
нізмів, які входять до роду ВгисеІІа.
Бруцели поділяють на шість видів (табл. 20). Описані біовари
трьох основних видів бруцел — В. шеШепзіз, В. аЬогіиз, В. зигз.
Таблиця 20. Диференціація різних видів бруцел та їх біоварів
Вид бруцел
В. теІПепзіз
В. аЬогіиз
В. ЗЦІЗ
В. пеоіотае
В. ОУІЗ
В. сапіз
Примітка: (-(-)—наявність відповідної ознаки; (—)—відсутність ознаки.
234
Морфологія. Бруцели — дрібні мік-
роорганізми 0,6—1,5 мкм завдовжки
й 0,5—0,7 мкм завширшки (рис. 71).
Розташовуються окремими особинами,
парами або невеликими групами. Бру-
цели дрібної і великої рогатої худоби
мають форму коків і кокобактерій,
бруцели свиней — форму паличок. Вони
грамнегативні, нерухомі, не утворюють
спор і капсул (деякі штами іноді проду-
кують капсули).
Культивування. Бруцели — строгі Рис. 71. Чиста культура (а)
аероби, при висіванні матеріалу від 1 колонії (б) В. теїііепііз.
хворого розвиваються повільно — протягом 3—10 діб, іноді
ріст починається на 15-ту і навіть на 30-ту добу. Культивують
бруцели при рН середовища 6,6—7,4. Оптимальна температура росту
37 °С, крайні границі 20—40 °С.
Бруцели добре ростуть у присутності тіаміну, ніацину і біотину
(фактори росту), можуть рости у звичайних середовищах, печінковому
агарі і печінковому бульйоні, але найбільш підходящими є сироват-
ково-декстрозний кров’яний і триптозно-сироватковий агар, а також
агар із картопляного настою з сироваткою; рідкі середовища скла-
даються з тих самих компонентів, але без агару. На печінковому агарі
колонії бруцел круглі, гладенькі (див. рис. 71, б), з білуватим або
перламутровим відтінком, на печінковому бульйоні вони дають помут-
ніння в результаті випадання слизистого осаду. Бруцели добре куль-
тивуються в жирових (незапліднених) яйцях, жовтковому мішку 10—
12-денних курячих зародків.
Ріст В. аЬогіиз у першій генерації відбувається, як правило,
в присутності 5—10 % діоксиду вуглецю, який є для них фактором
росту.
Для виділення бруцел використовують селективні середовища,
що містять певні барвники й антибіотики.
У бруцел виявлено явище дисоціації із 8-форм у К-форми. Знай-
дено і Ь-форми, які виникають під впливом антибіотиків і мають вира-
жену здібність до адаптації, можуть порівняно легко пристосуватись
до росту в живильних середовищах, на яких не культивувались у пер-
ших генераціях.
Довге тримання бруцел на живильних середовищах призводить до
значного зменшення їх вірулентності і втрати Уі-антигену.
Ферментативні властивості. Бруцели не розріджують желатину,
не розщепляють білки. Деякі види продукують сірководень, руйну-
ють сечовину й аспарагін, відновлюють нітрати в нітрити, гідролізу-
ють білки, пептони й амінокислоти з утворенням аміаку та сірковод-
ню (див. табл. 20).
Токсиноутворення. Бруцели не продукують екзотоксин. В резуль-
таті розпаду бактерій утворюється ендотоксин, що має специфічні алер-
генні властивості і може використовуватись при здійсненні алергічних
шкірних проб. Бруцели виробляють гіалуронідазу, уреазу, каталазу.
Антигенна структура. Збудники бруцельозу містять антигени
А, М і К- У бруцел дрібної рогатої худоби переважає антиген М, у бру-
цел великої рогатої худоби — антиген А. Антигени мозаїчно розта-
шовані на поверхні клітин. Бруцели мають антиген, спільний з бакте-
рією туляремії і холерним вібріоном. Крім О-антигену, бруцели мають
додатковий термолабільний \/і-антиген. Роздільна імунізація Уі- та
О-антигенами не забезпечує повного захисту тварин віл зараження,
тоді як одночасна імунізація всіма антигенами дає добрі результати.
Змінені бруцели, що не піддаються ідентифікації загальноприй-
нятими методами, диференціюють за допомогою Уі-аглютинуючих си-
роваток і бруцельозного фага.
Резистентність. Бруцели довго зберігаються при низькій темпе-
ратурі. У грунті, сечі, випорожненнях тварин, гною, сінній потерті,
висівках бруцели виживають до 4*/2 місяця, у кризі, в снігу, маслі
і бринзі — до 4 місяців, у вовні овець — 3—4 місяці, в пилу — ЗО діб,
м’ясі — 20 діб.
Від дії температури 60 °С бруцели гинуть протягом ЗО хв, від
кип’ятіння — за кілька секунд. Збудники бруцельозу дуже чутливі
до дезинфікуючих засобів —фенолу, креоліну, формаліну, хлорного
вапна, хлораміну та ін. Найкращі результати дає застосування 1%
розчину соляної кислоти в поєднанні з 8% розчином натрію хлориду.
Патогенність для тварин. До бруцел сприйнятливі дрібна і велика
рогата худоба (кози, вівці, корови), свині, північні олені, лами, коні,
верблюди, а також собаки, які охороняють овець і поїдають плоди та
плаценту при абортах, коти, гризуни (пацюки, миші, ховрахи, хом’я-
ки, кролі, полівки, норки та ін.).
Заразні виділення хворих тварин (сеча, випорожнення, навколо-
плідні води і піхвовий слиз), молоко, особливо козине й овече, молочні
продукти.
З експериментальних тварин сприйнятливі до бруцел морські
свинки; вони хворіють протягом 3 місяців і гинуть при явищах ура-
ження кісток, суглобів, хрящів, очей.
Патогенез захворювання у людини. Люди заражуються бруцельо-
зом від тварин (кози, вівці, корови, свині, олені), причому основна
роль в епідеміології цього захворювання належить дрібній рогатій
худобі (кози і вівці).
Інфікування відбувається найчастіше аліментарним шляхом через
молоко і молочні продукти від заражених тварин, а також через шкіру
і слизові оболонки. Заражуються головним чином ветеринарний і зоо-
технічний персонал, чабани, працівники молочно-товарних ферм,
бринзоварень, м’ясокомбінатів та ін. В умовах сільського господар-
ства захворювання на бруцельоз мають сезонний характер — їх буває
більше в період отелення овець і кіз (березень — травень).
Інкубаційний період триває 1—3 тижні, іноді — кілька місяців.
Із місць первинної локалізації бруцели проникають у клітини моно-
нуклеарних фагоцитів, в яких вони розмножуються, а потім надхо-
дять у течію крові, спричиняючи стан тривалої бактеріемії. Далі збуд-
ники гематогенним шляхом розносяться по всьому організму, зумов-
люючи поліморфну симптоматику (періостит, артрит, орхіт і т. д.).
236
Для бруцельозу людей і тварин характерний розвиток у перші дні
захворювання стану гіперчутливості сповільненого типу, що збері-
гається протягом усього періоду хвороби й залишається тривалий
час після видужання.
Імунітет. У тих, що перехворіли, виникає підвищена неспецифіч-
на стійкість проти повторного зараження. В основі інфекційного і
постінфекційного імунітету при бруцельозі лежить активність макро-
фагів і Т-лімфоцитів (клітинний імунітет); особливо важливу роль
відіграють фагоцитоз і стан алергії, які перешкоджають розповсюд-
женню бруцел в організмі.
У знешкоджуванні бруцел беруть участь і гуморальні фактори
(аглютиніни, комплементзв’язуючі речовини і неповні антитіла),
шо мають властивість блокувати збудників бруцельозу, а також фаг,
який з’являється в період видужання.
Лабораторна діагностика. Матеріалом для бактеріологічного до-
слідження є кров, спинномозкова і синовіальна рідини, випорожнення,
сеча хворих людей (для виділення збудника), молоко і молочні про-
дукти, сироватка крові хворого (для виявлення аглютинінів). Виді-
лення культур роблять у спеціальних лабораторіях. Вирощування
триває до 3—4 тижнів і більше. Для культивування В. аЬогіиз вико-
ристовують живильне середовище, що містить 2—10 % діоксиду вугле-
цю. Для виділення чистої культури та її ідентифікації через кожні
4—5 діб роблять висівання на скошений агар.
З 10—12-го дня захворювання у крові хворих накопичується до-
статня кількість аглютинінів, які виявляють у РА — розгорнутій
в пробірках (Райта) і пластинчастій — на склі (Хаддлсона). Такі
реакції з нерозведеною кров’ю на склі використовують головним чином
при масових обстеженнях на бруцельоз.
Для виявлення стану алергії з 15—20-го дня захворювання і пізні-
ше застосовують алергічну пробу Бюрне з фільтратом 3—4-тижневої
бульйонної культури (бруцелін). Використовують також РЗК, РИГА,
РІФ; для виявлення неповних антитіл — реакцію Кумбса.
Лікування. Хворим на бруцельоз призначають напівсинтетичні
тетрацикліни, рифампіцин. При хронічних формах захворювання
ефективні вакцинотерапія і введення бруцеліну. Для запобігання
рецидивам рекомендується застосовувати протибруцельозний гамма-
глобулін.
Профілактика забезпечується здійсненням разом з ветроинарнимн
організаціями комплексу загальних і спеціальних заходів.
Специфічним методом профілактики в населених пунктах, неспри-
ятливих щодо бруцельозу, є імунізація населення живою вакциною.
У зв’язку з тим що така вакцина має побічні дії, розроблена і випро-
бовується хімічна вакцина, що складається з біл ково-по лісах арид-
ного комплексу клітинних стінок бруцел.
ЗБУДНИК ТУЛЯРЕМІЇ
Збудника туляремії (ГгапсізеІІа ІиІагеп$і$) відкрили в 1912 р. Г. Мак-Кой
І М Чепін, а докладніше вивчив його Е. франсіс.
№
Рис 72 Чиста культура (а) і
колонії (б) збудника туляремії
Морфологія. Бактерії туляремії —
дуже дрібні кокоподібні і паличкоподіб-
ні клітини (рис. 72, а) розміром 0,2—
0,7 мкм. У старих культурах зберіга-
югься кокоподібні форми, бактерії
нерухомі, характеризуються поліхро-
мазією (інтенсивніше забарвлюються
на кінцях), грамнегативні, в організмі
тварин утворюють ніжну капсулу. Бак-
теріям туляремії властивий поліморфізм.
Культивування. Збудник туляремії —
аероб, не росте на звичайних середови-
щах, добре розвивається при температурі
37 °С у середовищах, багатих на
вітаміни, наприклад у жовтковому середовищі, що складається
з 60 частин жовтка і 40 частин 0,85% розчину натрію хлориду,
прн рН середовища 6,7—7,4. Посіви витримують у термостаті 2—14 діб.
Бактерії туляремії розмножуються на цистиновому агарі, що містить
0,05—0,1 % цистину й 1 % глюкози. Колонії бактерій туляремії
(рис. 72, б) молочно-білого кольору.
Збудник туляремії можна вирощувати на середовищах з мозковою,
селезінковою, печінковою тканинами, екстрактами серця, пивними
дріжджами, рибним борошном, тобто тих, що містять вітаміни, потріб-
ні для росту бактерій. Оптимальним е синтетичне рідке середовище,
що містить амінокислоти (аргінін, цистеїн, лейцин, гістидин та ін.),
пантетонат кальцію, іони магнію, глюкозу, солі натрію хлориду,
магнію сульфату, тіамін. Щоб середовище було густим, до нього до-
дають агар. Бактерії туляремії також добре ростуть у жовтковому
мішку курячого ембріона.
При культивуванні в штучних умовах бактерії туляремії втрача-
ють оболонковий, або К-антиген, з яким пов’язані їх вірулентність
та імуногенність.
Ферментативні властивості. Бактерії туляремії розщеплюють біл-
ки з появою сірководню, не виділяють індол, ферментують з утво-
ренням кислоти глюкозу, мальтозу, левульозу, манозу, непостійно —
декстрин, гліцерин. Біохімічні властивості нестабільні, змінюються
порівняно швидко.
Токсиноутворення. Екзотоксину у бактерій туляремії не виявлено.
Вірулентність їх пов’язана з Уі-антигеном.
Антигенна структура. Прн серологічній діагностиці бактерій туля-
ремії і бруцел треба враховувати спільність їх антигенів у реакції
аглютинації.
Культури в К-формі, що містять тільки О-антиген, авірулентні і
не мають імуногенних властивостей. Типовим е 8-варіант, в якому
е Уі- й О-антигени. Проміжні 8К-форми містять О-антиген і меншою
мірою Уі-антиген. Із них готують живі вакцини.
Серед бактерій туляремії розрізняють три підвиди: 1) голарктич-
ний (Європа, Азія, Північна Америка); 2) неарктичний (Північна
Америка); 3) середньоазіатський (у тугейних вогнищах річок Ілі,
238
Чу, Амудар’ї). Характерна для цих підвидів кількісна відмінність
вмісту окремих жирних кислот (деканова, тетрадеканова, тетр а коза-
кова), що може бути використано як додатковий критерій ідентифі-
кації виділених штамів.
Резистентність. У зерні збудник туляремії зберігається 130 діб,
у воді і трупах гризунів — 90, в печеному хлібі — 20, у грунті —
10 діб, при низьких температурах — більш як 3 місяці.
Від діяння 3 % розчину лізолу, крезолу, мильио-крезолового
розчину, формаліну і спирту бактерії туляремії гинуть протягом
кількох хвилин, при нагріванні до температури 60 °С — через 10—
15 хв, під впливом прямого сонячного випромінювання — через
ЗО хв.
Патогенність для тварин. До бактерій туляремії сприйнятливі
водяна і звичайна полівки, сірі пацюки, лісові і хатні миші, зайці,
ховрахи, бурундуки, хом’яки, ондатри, піщанки, кроти, землерийки
та ін.; із свійських тварин — верблюди, вівці, коти, собаки, свині,
із лабораторних гварнн — морські свинки і білі миші.
Збудник туляремії характеризується поліадаптивністю: він при-
стосувався більш ніж до 140 видів хребетних і 100 видів членистоно-
гих, які можуть передавати туляремійну інфекцію, але найбільше
епідеміологічне значення мають водяна і звичайна полівки, миші,
ондатри, а з перенощиків — гедзі, кліщі, комари, мокриці.
Патогенез захворювання у людини. Зараження туляремією відбу-
вається аліментарним і повітряно-пиловим способами. Збудник може
проникати через шкіру і слизові оболонки, а також при укусі члени-
стоногих і комах (кліщі, гедзі, комарі та ін.).
Бактерії туляремії локалізуються в шкірі, на слизових оболонках,
у лімфатичних вузлах, дихальних шляхах, шлунку, кишках та ін-
ших органах, спричиняючи відповідні клінічні форми захворюван-
ня — бубонну, виразково-бубонну, очну, ангінозно-бубонну, абдомі-
нальну, або кишкову, легеневу й генералізовану, або первинно-сеп-
тичну. При кожній формі спостерігається ураження лімфатичних
вузлів.
Летальність від туляремії останнім часом невисока. У зв’язку
з широким застосуванням антибіотиків у більшості випадків захво-
рювання закінчується видужанням.
Імунітет після перенесеного захворювання стійкий і тривалий, за
характером — клітинний і гуморальний.
Лабораторна діагностика. Внаслідок спільності симптомів з чу-
мою, сибіркою, черевним і висипним тифом, грипом, малярією, бру-
цельозом основна роль у диференціації туляремії з іншими захворю-
ваннями належить лабораторним методам дослідження.
На 3—5-ту добу захворювання роблять внутрішньошкірну або
нашкірну пробу з тулярином. Алергічні проби бувають позитивними
у реконвалесцентів і прищеплених, що треба мати на увазі при дифе-
ренціації туляремії з іншими захворюваннями.
На другому тижні захворювання у крові хворих накопичуються
аглютиніни, для виявлення яких ставлять РА кров'яно-краплинним
і об’ємним способами. У ряді випадків РА може бути позитивною
239
з діагностикумом із бруцел внаслідок спільності їх антигенів з бакте-
ріями туляремії. Використовують також РИГА, ІФА, які чутливіші,
ніж РА.
Для виділення збудника досліджуваний матеріал висівають у спе-
ціальні живильні середовища, однак результативність такого методу
невелика. Звичайно матеріалом від хворих (пунктат із бубону, зіскоб
із виразки, виділення кон’юнктиви, наліт зі зіва, мокротиння, кров)
заражають білих мишей або морських свинок.
Біологічну пробу ставлять у спеціальних лабораторіях з додер-
жанням установленого режиму. Коли в досліджуваному матеріалі е
бактерії туляремії, експериментальні тварини гинуть на 4—12-ту добу,
їх розтинають і з внутрішніх органів роблять мазки-відбитки і ви-
сівають на зсіле яєчне середовище. Добуту культуру піддають бакте-
ріоскопічному, бактеріологічному і біологічному дослідженню. Якщо
при першому зараженні морської свинки виділити культуру не вда-
лось, емульсією з органів цієї тварини заражують іншу морську свин-
ку і т. д.
Лабораторна діагностика туляремії у гризунів включає бактеріо-
скопію мазків-відбитків з органів, РП (термопреципітації), РІФ,
біологічні проби. Досліджують також воду, харчові продукти, члени-
стоногих кровососів за допомогою біологічних проб.
Лікування. Призначають антибіотики (гентаміцин, стрептоміцин,
левоміцин), вакцину з убитих бактерій туляремії.
Профілактика полягає у здійсненні загальних протиепідемічних
заходів у вогнищах (боротьба з гризунами, перенощиками) та імуніза-
ції людей за епідеміологічними показаннями.
Специфічна профілактика проводиться живою вакциною, а також
інактпвованою, виготовленою з протективного антигену. Вакцину
випускають у сухому вигляді. Застосовують нашкірно одноразово.
Тривалість поствакцинального імунітету 3—6 років. Завдяки широ-
ким комплексним заходам, імунізації людей, які живуть у зоні при-
родних вогнищ, захворюваність на туляремію знизилась до поодино-
ких випадків.
БОРДЕТЕЛИ
До роду ВогсіеіеІІа входять В. регіиззіз і В. рагарегіиззіз.
ЗБУДНИК КОКЛЮШУ
Воггіеіеііа регіиззіз виділили від хворих на коклюш у 1906 р. Ж- Бордо
і О. Жаигу.
Морфологія. Збудник коклюшу має вигляд дрібних нерухомих
овальних паличок (рис. 73, а) розмірами 0,2—0,3 і 0,5—1 мкм, які
слабко забарвлюються звичайними аніліновими барвниками (інтенсив-
ніше на кінцях клітин), грамнегативні. На ультратонких зрізах
добре видно капсулоподібну оболонку, включення волютину, в ді-
лянці нуклеоїду — вакуолі.
240
Культивування. Бактерії коклюшу не
ростуть на простих середовищах, добре
культивуються при 35 — 37 °С (границі
росту 20 і 38 °С) в аеробних умовах на
гліцериново-картопляному або кров’ якому
агарі з рН 6,8 — 7,4, утворюючи дрібні й
опуклі (рис. 73, б) блискучі колонії, що на-
гадують краплинки ртуті. Колонії бактерій
коклюшу бувають зернистими й гладень-
кими. У кров’яному бульйоні ці бактерії
утворюють каламуть і невеликий осад.
На казеїново-вугільному агаровому се-
редовищі бактерії коклюшу розвиваються
і без добавляння крові.
Рис. 73. Колонії (а) і чиста
культура (б) збудника кок-
люшу.
Культури бактерій коклюшу, адаптовані до росту на простому
агарі, втрачають імунологічну специфічність, гемолітичні, дермато-
некротичні, інвазійні, імуногенні та інші властивості.
Бактерії коклюшу, що культивуються в середовищах без крові,
дисоціюють на чотири фази: перші дві фази є вірулентною культу-
рою, третя і четверта фази — невірулентною.
Колонії першої і другої фаз (8-форми) дрібні (1—2 мм), з рівними
краями, випуклі. Колонії третьої і четвертої фаз (К-форми) крупні
(З—4 мм), плоскі, блискучі.
Ферментативні властивості. Бордетели не ферментують білки,
вуглеводи, сечовину.
Токсиноутворення. Збудник коклюшу утворює термолабільний
екзотоксин, який спричиняє у кролів і морських свинок геморагічний
набряк, некроз і появу виразок; продукує фактори, що стимулюють
лімфоцитоз.
Бактерії коклюшу мають властивість коагулювати плазму крові
кроля, барана, теляти і людини.
Антигенна структура. Бактерії роду ВопіеіеІІа містять загальний
термостабільний соматичний О-антиген і різні специфічні аглютино-
гени. У бордетел виявлено 14 антигенних компонентів (факторів).
Фактор 7 — родовий, спільний для всіх бордетел; фактор 1 властивий
В. регІиззіз, фактор 14 — В. рагарегіїизіз, фактор 12 — В. ЬгопсЬізер-
ііса; інші трапляються в різних комбінаціях.
Резистентність. Збудник коклюшу дуже чутливий до різних аген-
тів. Від діяння прямого сонячного випромінювання він гине протягом
1 год, при температурі 56 °С — через 10—15 хв; 3 % розчин фенолу
або лізолу вбиває його порівняно швидко.
Патогенність для тварин. У природних умовах тварини неспри-
йнятливі до збудника коклюшу. В експериментальних дослідженнях
удавалось відтворити коклюш у мавп і молодих собак з виділенням
культури із бронхів.
Патогенез захворювання у людини. Інфекція розповсюджується
повітряно-краплинним шляхом. Найбільш небезпечні в епідеміоло-
гічному відношенні хворі в катаральному періоді. Роль різних пред-
метів, що оточують хворого, через нестійкість бактерій коклюшу до
241
дії факторів зовнішнього середовища незначна. Джерелами зара-
ження можуть бути хворі з атиповими клінічними ^юрмами захворю-
вання, а також здорові люди, що стали тимчасовими носіями бактерій
коклюшу.
Інкубаційний період триває 5—9 діб. Захворювання характери-
зується типовими симптомами і циклічністю перебігу (три періоди):
катаральний період триває близько 2 тижнів; конвульсивний (су-
дорожний) період супроводиться приступами кашлю при нормальній
температурі тіла і триває 4—6 тижнів; період згасання (завершення)
триває 2—3 тижні.
Бактерії коклюшу проникають в організм через верхні дихальні
шляхи і розмножуються в їх слизовій оболонці; у кров вони не по-
трапляють. Екзотоксини, що виділяються паличкою коклюшу, спри-
чиняють катаральне запалення слизової оболонки трахеї і бронхів,
подразнюють її рецептори й зумовлюють неперервний потік імпульсів
у центральну нервову систему, створюючи стійке вогнище збудження.
Приступи кашлю виникають під впливом як специфічних (екзотоксини
коклюшних бактерій), так і неспецифічних (звук, ін’єкції, огляд і
т. д.) подразників. При виникненні сильніших центрів збудження
домінантне вогнище згасає, приступи припиняються. Захворюван-
ня нерідко дає ускладнення (ларингіт, бронхіт, бронхопневмо-
нія).
Імунітет. Після перенесеної інфекції виробляється міцний і три-
валий імунітет, зумовлений накопиченням антитоксинів, аглютинінів,
преципітинів, комплементзв’язуючих антитіл.
Перехресного імунітету між В. регіиззіз, В. рагарегіиззіз і В. Ьгоп-
сііізерііса не спостерігається.
Лабораторна діагностика. Об’єктом дослідження є мокротиння
хворих або виділення слизової оболонки носової частини глотки.
Матеріал беруть спеціальними тампонами. Мокротиння висівають на
середовище Борде—Жангу, молочно-кров’яний агар, гідролізатно-
казеїнове, казеїново-вугільне середовища та ін. Для пригнічення
росту сторонньої мікрофлори додають антибіотики (пеніцилін та ін.).
Добрі результати дає висівання методом «кашльових» пластинок.
Через 2—5 діб росту на середовищі Борде — Жангу з’являються типові
дрібні, опуклі, блискучі колонії, що нагадують перламутр або крап-
лини ртуті. Виділену чисту культуру ідентифікують за морфологіч-
ними, культуральними, біохімічними та антигенними властивостями
(табл. 21).
З 2-го тижня захворювання ставлять РА і РЗК, за допомогою яких
виявляють випадки коклюшу не тільки з типовими, а і з атиповими
клінічними проявами.
Лікування включає призначення антибіотиків (еритроміцину, ле-
воміцетину), гамма-глобуліну, вітамінів. Потрібні часте провітрю-
вання приміщення, прогулянки.
Профілактика полягає в ранньому виявленні й ізоляції дітей, хво-
рих на коклюш. Поточну дезинфекцію хімічними засобами з огляду на
незначну стійкість збудника не застосовують. Контактним ослабленим
дітям з профілактичною метою вводять гамма-глобулін.
242
Таблиця 21. Диференціація бактерій коклюшу, паракоклюшу і ВогбеіеІІа ЬгопсЬі-
аерііса
Вид бактерій І* О « = Й = = Зміна лакмусового молока || Утворення
уре- ази ПІГ- ту анійгенних факторів
1 12 14
В. регіиззіз - Лужна реакція на 12 — 14-ту добу - - - 4- - -
В. рагарегіиззіз — Лужна реакція на 2 —4-ту добу 4- 4- 4- — — 4-
В. ЬгопсЬізерііса + — 4- 4- 4- — 4- —
Примітна. (+) —наявність відповідної ознаки; (—) — відсутність ознаки.
Специфічна профілактика полягає в імунізації дітей адсорбованою
коклюшно-дифтерійно-правцевою вакциною (АКДП-вакцина; рос.
АКДС-вакцина). Розроблені і вивчаються ефективніші препарати,
виготовлені з компонентів оболонок бактеріальних клітин (стінки і ци-
топлазматичної мембрани).
ГРАМПОЗИТИВНІ КОКИ
Грампозитивні коки (стафіло- і стрептококи) спричиняють у лю-
дини і тварин запальні процеси, що супроводяться утворенням гною,
тому їх називають гноєтворними (піогенними) коками. Деякі види
стрептококів (збудники скарлатини, гострого ревматизму та ін.)
зумовлюють розвиток гнійного запалення.
У грампозитивних коків вміст пептидоглікану становить близько
90 % матеріалу клітинної стінки.
СТАФІЛОКОКИ
Стафілокок (ЗіарЬуІососсиз аигеиз) виявив Р. Кох (1878), виділив із гною
фурункула Л. Пастер (1880), грунтовно вивчив Ф. Розепбах (1884). Стафіло-
коки входять до родини Місгососсасеае.
Морфологія. Стафілококи сферичної
форми, діаметром 0,8—1,0 (0,5—1,5) мкм,
розташовуються у вигляді неправиль-
них безсистемних скупчень (рис.74, а).
У мазках із культури і гною утворюються
короткі ланцюжки, іноді представлені
парними й одиночними коками. Стафі-
лококи не мають джгутиків, не проду-
кують спор, деякі штами утворюють
капсулу, грампозитивні.
Культивування. Стафілококи — фа-
культативні анаероби. Вони добре
розвиваються на звичайних живильних
середовищах з рН 7,2—7,4 при темпе-
рне 74. Чиста культура (а)
колонії (б) стафілокока.
243
рагурі 37 °С (граниш* діапазону росту — 10— 45 °С). При кімна-
тній температурі, широкій аерації і розсіяному світлі
стафілококи виробляють золотисті, білі, лимонно-жовті та
інші пігменти, що є липохромами. Найбільш інтенсивно пігменти
утворюються на молочному агарі і картоплі при температурі 20—
25 °С.
На МПА стафілококи ростуть у вигляді випуклих колоній з рів-
ними краями діаметром 1—4 мм (див. рис. 74, б). При бактеріоскопіч-
ному дослідженні колонії мають грубозернисту структуру і твердий
центр, непрозорі. Колір їх залежить від вироблюваного мікроорганіз-
мом пігменту. Крім типових 8-форм, стафілококи можуть утворювати
К-, О- і Ь-форми колоній.
При рості на МПБ стафілококи спричиняють дифузне помутніння
з наступним випаданням осаду. У деяких випадках при достатній
аерації стафілококи утворюють на поверхні бульйону плівку. На
желатині (звичайно через 1—2 доби) за ходом уколу можна помітити
поряд із значним ростом розрідження середовища, яке на 4—5-ту добу
набуває вигляду лійки, наповненої рідиною. На кров’яному агарі
патогенні стафілококи спричиняють гемоліз. Найбільш чутливі до
стафілококового гематоксину еритроцити кроля і барана.
Ферментативні властивості стафілококів наведено у табл. 22.
Примітка. 5 — чутливий; К — резистентний; (+) — наявність відповідної
ознаки: (—)—відсутність ознаки.
Токсиноутворення. Стафілококи синтезують понад 25 білків,
токсинів і ферментів патогенності; а-, 0-, б-, у-гемолізини характе-
ризуються гемолітичною і дерматонекротичною дією. У фільтратах
бульйонних культур деяких стафілококів виявляють ентеротоксин,
який при потраплянні з їжею у травний канал спричиняє харчову
токсикоінфекцію.
Серед стафілококів є токсигенні штами, що характеризуються лізо-
генністю, яка зумовлена іох + генами, локалізованими в ДНК по-
мірного фага.
Стафілококи виділяють ексфоліатини, які зумовлюють стафіло-
кокове імпетиго у дітей і пухирчатку у новонароджених; лейкоцидин,
який руйнує лейкоцити, спричиняє загибель кровотворних клітин
244
кісткового мозку і нервових клітин. Крім того, стафілококи мають
властивість коагулювати плазму крові. Ознака плазмокоагуляції є
порівняно стабільною і використовується для диференціації патогенних
видів стафілококів з непатогенними. Коагулаза термостійка. Її можна
виділити з бульйонної культури стафілококів.
Стафілококи продукують фібринолізин, добавляння якого до
згустка крові через 1—2 доби спричиняє його розчинення. Стафіло-
коки виробляють фермент гіалуронідазу, яка руйнує гіалуронову
кислоту, що входить до складу сполучної тканини.
Коагулазу, плазмін (фібринолізин), фосфоліпазу (лецитиназу),
гіалуронідазу, дезоксирибонуклеазу, протеїназу, ліпазу і фосфатазу
відносять до групи ферментів патогенності. Лецитиназа руйнує леци-
тин, що входить до складу оболонок еритроцитів людини, барана,
кроля. У стафілококових культурах виявлено також антикоагулянт,
що не дає зсідатись крові; цей антикоагулянт утворюється у запаль-
них ексудатах, які виникають при стафілококових захворюваннях.
У фільтоагах стафілококових культур виявлено гемаглютиніни, що
зумовлоогь склеювання еритроцитів кролів.
Вірулентні стафілококи пригнічують фагоцитарну активність лей-
коцитів.
Багато штамів стафілококів виробляють пеніциліназу (ф-лакта-
мазу), яка руйнує пеніциліни.
Стафілококовий екзотоксин, знешкоджений 0,3—0,5 % формалі-
ном при температурі 37 °С протягом 7—28 діб, при парентеральному
введенні людям і тваринам зумовлює синтез специфічного анти-
токсину.
Антигенна структура. Із культур стафілококів добуто протеїни
і полісахариди. Протеїн А добуто з клітинної стінки патогенних шта-
мів, виділених у хворих на септицемію, фурункульоз, остеомієліт,
гострий кон’юнктивіт та ін.
Полісахариди мають дуже виражену специфічність і дають змогу
поділити стафілококи на серовари; вони навіть у розведенні
1 : 1 033 033 дають чітко виражену РП. Білковий антиген спільний
для всіх видів і сероварів стафілококів.
Вивчено й ідентифіковано 4 біовари 8. ерідегшісііз, а також нові
варіанти коагулазонегативних стафілококів, виділених від хворих на
кон’юнктивіт, цистит, піодермію, септицемію та ін.
Резистентність. Стафілококи характеризуються порівняно висо-
кою стійкістю. У висушеному стані вони зберігаються понад 6 місяців,
у пилу — 50—100 діб. Повторне заморожування і розморожування
не вбиває стафілококів. Вони витримують діяння прямого сонячного
випромінювання протягом багатьох годин, нагрівання при темпера-
турі 70 °С — понад 1 год. При температурі 80 °С вони гинуть через
10—60 хв, при 100 °С — миттєво; 50 % розчин фенолу вбиває стафі-
лококи протягом 15—30 хв. Стафілококи дуже чутливі до деяких ані-
лінових барвників, особливо до брильянтового зеленого, який успіш-
но застосовують при лікуванні поверхневих гнійних уражень шкіри.
Стафілококи мають високу резистентність до антибактеріальних пре-
паратів; 70—80 % із них стійкі одночасно проти 4—5 речовин. У них
245
виявлено перехресну резистентність до антибіотиків групи макролідів
(еритроміцину, олеандоміцину та ін.).
Патогенність для тварин. До стафілококів чутливі коні, велика
і дрібна рогата худоба, свині, з експериментальних тварин — кролі,
білі миші, кошенята.
При внуїрішньошкірному введенні кролям культури патогенних
стафілококів розвивається запалення і потім некроз шкіри, в разі
внутрішньовенного зараження фільтратом стафілококових культур
виникає картина гострого отруєння і тварина гине за кілька хвилин
при явищах рухового збудження, розладу дихання, судорог, паралічу
задніх кінцівок; іноді бувають понос і мимовільне виділення сечі.
При пероральному або внутрішньоочеревинному зараженні коше-
нят ентеротоксигенними стафілококами або токсинами у тварин
з’являються блювання, понос, слабкість. Ентеротоксин відрізняється
від інших фракцій стафілококового токсину своєю термостійкістю.
Він витримує нагрівання при температурі 100 °С протягом ЗО хв.
Патогенез захворювань у людини. Стафілококи проникають в орга-
нізм людини через шкіру і слизові оболонки, повітряно-краплинним
і повітряно-пиловим шляхами. Зараження зумовлено звичайно не
одним, а двома або кількома різновидами.
У патогенезі захворювань, спричинюваних стафілококами, певну
роль відіграють як екзотоксин, так і бактеріальні клітини.
У розвитку стафілококових захворювань має значення і стан
алергії сповільненого типу, яка в ряді випадків є причиною дуже тяж-
ких, що не піддаються лікуванню, клінічних форм стафілококової
інфекції. Практично в усіх органах і тканинах організму людини
спостерігаються запальні процеси, зумовлені стафілококами. До
них належать гідроаденіт, абсцес, панарицій, блефарит, фурункульоз
(карбункульоз), періостит, мастит, остеомієліт, фолікуліт, сикоз,
дерматит, екзема, хронічна піодермія, перитоніт, менінгіт, апендицит,
холецистит, пневмонія, ентероколіт, токсикоінфекція, піоміозит,
кон’юнктивіт і епідемічна пухирчатка новонароджених (пемфігоїд
новонароджених).
Доведено, що 8. заргорЬуіісиз досить часто спричиняє у молодих
жінок гостре запалення сечових шляхів.
Розвиткові гнійних процесів у шкірі та її придатках сприяють цук-
ровий діабет, фенілкеїонурія, авітамінози, аліментарна дистрофія,
гіпергідроз, дрібні травми шкіри професійного характеру, подраз-
нення її хімічними речовинами.
У ряді випадків стафілококи зумовлюють виникнення вторинних
захворювань при віспі, грипі, травмах, а також розвиток післяопера-
ційних нагнивань. Особливо тяжкими захворюваннями є стафілоко-
ковий сепсис і стафілококова пневмонія у дітей.
При споживанні харчових продуктів (сир, свіжий сир, молоко,
торти, тістечка, морозиво та ін.), засіяних патогенними стафілокока-
ми, виникають токсикоінфекції. Найшвидше токсиноутворення від-
бувається в молоці, молочній суміші, заварному кремі, м’ясному
фарші, рибних консервах -та інших продуктах. Можливий розвиток
мішаних інфекцій (зумовлених стафілококами разом із стрептококами):
246
дифтерії, туберкульозу, актиномікозу, ангіни, грипу, парагрнпозних
та інших респіраторних захворювань.
У зв’язку з широким використанням антибактеріальних препара-
тів, і особливо антибіотиків, які зумовлюють селекцію резистентних
штамів, стались значні зміни тяжкості і ступеня поширеності стафі-
лококових уражень. В усіх країнах світу зростає кількість цих захво-
рювань, внутрішньолікарняних заражень в акушерських, хірургіч-
них і дитячих стаціонарах, збільшується носійство серед медичного
персоналу і населення. Реєструються випадки зараження стафілоко-
ками дітей з розвитком у них везикуло-пустульозної стафілодермії,
імпетиго, епідемічної пухирчатки, інфільтратів, абсцесів, кон’юнкти-
віту, назофарингіту, отиту, пневмонії та інших захворювань.
Виявлено швидке виникнення резистентності стафілококів до хі-
міотерапевтичних засобів (передусім — до антибіотиків), зумовленої
розповсюдженням серед бактерій Н-плазмід, що мають властивість
трансмісивності. Висока концентрація лікарських засобів в організмі
призводить до істотного порушення мікрофлори і формування стійких
штамів із більш вираженою вірулентністю, а також Ь-форм стафіло-
коків.
Імунітет. Несприйнятливість при стафілококових захворюваннях
пов’язана з фагоцитозом, наявністю антитіл (антитоксини, преципі-
тини, опсоніни, аглютиніни) й інтерференцією непатогенних і пато-
генних штамів.
Запальний процес зумовлює затримку стафілококів на місці про-
никнення й утруднює їх розповсюдження по всьому організму. У вог-
нищі запалення стафілококи зазнають фагоцитозу. Нейтралізація
стафілококового токсину антитоксином — важливий момент розвит-
ку імунітету. Внаслідок проникності капілярів антитоксин потрапляє
з крові в зону запалення і нейтралізує утворений стафілококами
токсин.
Характерною для стафілококових захворювань є схильність їх
до хронічного кволого перебігу і рецидивування. Ця особливість
дає змогу твердити, що постінфекційний імунітет при стафілококових
ураженнях характеризується слабкою напруженістю й нетрива-
лістю.
Однією з причин низького рівня імунітету є наявність в органах
І тканинах людей спільних із стафілококами антигенів (антигени мі-
мікрії), що зумовлює стан імунологічної толерантності до стафілоко-
ків та їх токсинів і тим самим сприяє розмноженню збудника в орга-
нізмі хворих.
Лабораторна діагностика. Як об’єкти дослідження можуть бути
використані гній, виділення слизових оболонок, мокротиння, сеча,
кров, харчові продукти (сир, свіжий сир, молоко, тістечка, торти,
креми та ін.), блювотні маси, промивні води шлунка і випорожнення.
Мета дослідження — виявлення патогенних стафілококів. У зв’яз-
ку з великим поширенням непатогенних штамів матеріал для дослі-
дження беруть з додержанням певних правил.
Лабораторне дослідження (бактеріоскопічне, бактеріологічне і біо-
логічне) охоплює виявлення типових морфологічних, культуральних,
247
біохімічних властивостей виділених стафілококів (див. табл. 22),
а також визначення їх вірулентності. Для цього готують із гною мазки
і забарвлюють їх за Грамом; гній висівають на жовтково-сольовий,
молочно-сольовий, кров’яний агар і МПА з кристалічним фіолетовим.
Прн септицемії кров висівають у цукровий бульйон; виділену чисту
культуру досліджують на гемолітичну, плазмокоагулюючу, фосфолі-
пазну і гіалуронідазну здатність, вірулентність, а також на характер
пігменту.
Для виявлення джерел інфекції, зокрема причини септичних спала-
хів у родильних будинках, харчових токсикоінфекцій, внутрішньо-
лікарняних стафілококових захворювань застосовують фаготнпуван-
ня стафілококів за допомогою стандартних фагів, поділених на 4 гру-
пи: І —29, 52, 52А, 79, 80; II - ЗА, СЗ, 55, 71; III — 42Е, 47, 53,
54, 75, 77, 83А, 84, 85; IV — мішану (81, 94, 95, 96).
З метою раціональної терапії виділені культури випробовують
на чутливість до антибіотиків. Методики дослідження описані в прак-
тичних посібниках.
При харчових токсикоінфекціях добуту культуру стафілокока
висівають на спеціальне середовище для одержання стафілококового
ентеротоксину.
У тих випадках, коли виявити збудника не вдається (при остеоміє-
літі, септикопіємії та ін.), досліджують сироватку крові хворих
на наявність антитоксинів.
Дуже чутливим методом е ІФА.
Лікування. При стафілококових інфекціях застосовують антибіоти-
ки і сульфаніламідні препарати. Крім того, треба усунути явища
інтоксикації і підвищити імунобіологічні захисні сили організму (вве-
дення глюкози, плазми, серцевих глікозидів, переливання крові).
При хронічних гнійних стафілококових процесах показана спе-
цифічна терапія: стафілококова полівалентна вакцина, аутовакциии,
стафілококовий анатоксин, антитоксична сироватка, антистафілоко-
кова плазма, стафілококовий гамма-глобулін.
Для боротьби з стафілококами, стійкими до антибіотиків і сульфа-
ніламідних препаратів, застосовують напівсинтетичні похідні пені-
циліну і тетрацикліну.
Профілактика. До загальних профілактичних заходів належать
оздоровлення умов праці і побуту, усунення авітамінозу, неухильне
додержання санітарно-гігієнічних вимог у родильних будинках,
хірургічних відділеннях, дитячих закладах, запобігання травматизму
на виробництві, особливо на консервних заводах, а також виконання
правил особистої гігієни.
У стаціонарах (хірургічні відділення, родильні будинки) треба
систематично робити дезинфекції і бактеріологічне обстеження пер-
соналу на носійство стафілококів.
На промислових підприємствах для профілактики піодермії за-
стосовують захисні мазі і пасти. Для обробки ран, крім спиртових
розчинів йоду та анілінових барвників, широко застосовують рідини,
які висихають протягом 1—2 хв й утворюють еластичну плівку, що
захищає ранову поверхню від забруднення й інфікування. При знач-
248
них опіках хворі перебувають у м’яких (еластичних) ізоляторах, які
захищають ушкоджені ділянки шкіри від проникнення в неї мікрофло-
ри зовнішнього середовища.
У деяких випадках для осіб, що зазнають ризику травматизації
або інфікування стафілококами, рекомендується специфічна профілак-
тика імунізацією стафілококовим анатоксином або асоційованим пре-
паратом (анатоксин + бактеріальний антиген).
Іноді пригнічення патогенних стафілококів ефективне при відтво-
ренні бактеріальної інтерференції — введенні хворим непатогенних
штамів стафілококів, які можуть припиняти розвиток патогенних.
СТРЕПТОКОКИ
Патогенний стрептокок (Зігеріососсиз руо^епез) виявили в тканинах при
бешисі та ранових інфекціях Т. Більрот (1874), при сепсисі — Л. Пастер із
співробітниками (1880), виділив із гною ф. Розенбах (1884). Стрептококи на-
лежать до родини Зігеріососсасеае.
Морфологія. Стрептококи — бактерії сферичної або овальної фор-
ми розміром 0,6—1 мкм, розташовуються парами, ланцюжками або
скупченнями (рис. 75, а), нерухомі, не утворюють спор, грампозитивні.
На ультратонких зрізах препаратів видно мікрокапсули.
Культивування. Стрептококи—факультативні анаероби, деякі
різновиди — анаероби, оптимальна температура їх росту 37 °С, край-
ні границі — 10—45 °С. На МПА ріст слабковиражений, добре куль-
тивуються на цукровому, кров’яному, сироватковому агарі та МПБ
при рН середовища 7,2—7,6. На густих середовищах утворюють дрібні
(0,5—1 мкм), каламутні, сіруваті або сірувато-білі, зернисті, нерізко
окреслені колонії (рис. 75, б). На кров’яному агарі залежно од виду
стрептококи можуть спричиняти навколо колоній 0-гемоліз (прозора
зона) або а-гемотіз (зелена зона) внаслідок перетворення гемоглобіну
в метгемогтобін. Деякі види стрептококів не дають гемолізу (у-неге-
молітичні) На цукровому бульйоні ростуть з утворенням пристінко-
вого і придонного дрібнозернистого осаду, рідко призводять до помут-
ніння бульйону.
Ферментативні властивості відображені в табл. 23.
Токснноутворення. Патогенні стрептококи утворюють різні за
своєю дією екзотоксини:
Рис 75 Стрептококи
° —У мазку а гною, б — па кров'яному агарі; в —у мазку з буль-
йонної культури.
249
Таблиця 23. Диференціація ріаних видів стрептококів
Вид бактерій Утворення гемолізину (і н Розщеплення
X £ 3 1 а
о </) 1
5. руО£ЄПЄ5 + + + — __ __ + _р
8. ециізітіїіз + + — 1 — ± +
8. 5аП£11І5 — — — — — — — +
8. рпеитопіае + — — — — н н н н
8. Іаесаііз — __ —
8. а^аіасіїсае — — 4- — — н + — +
Примітка. (+) — 90 — 100 % штамів позитивні; (—) — 90 — Ю0 % негативні;
(±) — деякі штами позитивні, деякі — негативні; Н- неднференіїійовані.
— гемолізин (гемотоксин, О- і 8-стрептолізин), що зумовлює руй-
нування еритроцитів, тромбоцитів, макрофагів і спричиняє при внут-
рішньовенному введенні кролям гемоглобінемію і гематурію;
— лейкоцидин, який руйнує лейкоцити; трапляється в дуже віру-
лентних штамів, знешкоджується при температурі 70 °С;
— летальний (діалізабельний), який призводить при внутрішньо-
шкірному введенні кролям до некрозу і має некротичну дію і щодо
інших тканин (особливо клітин печінки); при внутрішньовенному
введенні зумовлює швидку загибель кролів і білих мишей;
— еритрогенний термостабільний, що має властивість спричиняти
запальну реакцію шкіри у людей, у крові яких немає антитоксинів;
— а-гемолізин, який секретується у живильне середовище.
Деякі вірулентні штами стрептококів групи А продукують кардіо-
гепатичний токсин і нефротоксин, який зумовлює розвиток гострого
гломерулонефриту. Вважають, що токсиноутворення пов’язане з лі-
зогенністю стрептококів.
Крім того, патогенні стрептококи утворюють ферменти патогенно-
сті: гіалуронідазу, завдяки дії якої збудник проникає в тканини й ор-
гани ураженого організму тварини, а також дезоксирибонуклеазу,
рибонуклеазу, нейрамінідазу, протеїназу, стрептоліазу, амілазу, лі-
пазу і дифосфопіридиннуклеотидазу.
Хвороботворні властивості стрептококів зумовлені не тільки екзо-
токсином і ферментами патогенності, а й ендотоксинами, що характери-
зуються термостабільністю.
Антигенна структура. В основу вивчення антигенної будови стреп-
тококів покладено дані серологічних досліджень, зокрема реакції
преципітації з екстрактом з осаду бульйонної культури.
Стрептококи містять М-антиген (білок), з яким пов’язані їх віру-
лентність та імуногенність; Т-білок, що складається з О-, К- і [--анти-
генів, яким властива варіантна специфічність; С-антиген — полісаха-
рид, спільний для всієї групи гемолітичних стрептококів; Р-антиген,
спільний для гемолітичних стрептококів і стафілококів.
Деякі стрептококи групи А і С синтезують екстрацелюлярні антиге-
ни (токсини); О-стрептолізин є протеїном; 8-стрептолізин складається
250
з ліпідно-протеїнового комплексу, обидва вони спричиняють гемоліз.
За допомогою реакції преципітації, яка виявляє групоспецифічні
вуглеводи, стрептококи поділені на 20 груп, що позначаються вели-
кими латинськими літерами: А, В, С, О, Е, Е, 6, Н, К, Ь, М, N...7.
Для медичної мікробіології важливі 6 видів, коротка характеристика
яких наведена в табл. 23.
Найбільше значення в інфекційній патології має група А, до якої
входять 66 М-сероварів гемолітичного стрептокока. Ці серовари стреп-
тококів спричиняють Р-гемоліз, утворюють розчинний токсин, не
ростуть в 40 % жовчному бульйоні і на жовчно-кров’яному агарі,
ферментують лактозу, саліцин, трегалозу, не ферментують сорбіт,
гліцерин, часто розщепляють маніт і дуже рідко — рафінозу й інулін,
їх виявляють при ангіні, скарлатині, бешисі та інших запальних
процесах.
До умовно-патогенних видів стрептококів належать а-гемолітичні
стрептококи із групи А (8. тпіііз, 8. заііуагіиз, 8. зап^иіз та ін.),
а також 8. Гаесаііз із групи О і стрептококи групи В.
До родини 8ігеріососсасеае включені 8. рпеитопіае, 8. Гаесаііз.
8ігеріососсиз рпеитопіае (за попередньою класифікацією — пнев-
мококи) — ланцетоподібні або трохи подовжені коки, що досягають
у діаметрі 0,5—1,26 мкм. Розташовуються парами, іноді одиничними
особинами або короткими ланцюжками. В організмі людини і тварин
мають капсулу (див. форзац, рис. III, а), грампозитивні, молоді і старі
культури грамнегативні, нерухомі, не утворюють спор.
Стрептококи пневмонії є факультативними анаеробами, оптимальна
температура їх росту 37 °С, крайні границі — 28—42 °С. На звичайних
середовищах культивуються погано. На сироватковому або кров’я-
ному агарі з рН 7,2—7,6 ростуть у вигляді дрібних колоній діамет-
ром І мм. На кров’яному агарі колонії дрібні, округлі, соковиті,
з а-гемолізом (зелена зона). На цукровому бульйоні утворюють кала-
муть і осад.
При рості на штучних середовищах капсул у стрептококів звичай-
но немає, але додавання тваринного білка до рідкого середовища
сприяє їх утворенню.
До виду 8. рпеитопіае належать 85 сероварів, що аглютинуються
тільки відповідними сироватками.
Захворювання на пневмонію спостерігаються у молодняка сіль-
ськогосподарських тварин: телят, поросят, ягнят. З експерименталь-
них тварин найбільш сприйнятливі білі миші, морські свинки і кролі.
У людини 8. рпеитопіае (серовари І, 2, 3, 4, 6, 8, 9, 12, 14, 18,
19, 23, 25, 51, 56) найчастіше спричиняють пневмонію, яка характери-
зується гострим перебігом і циклічністю. Вони можуть спричинити
септицемію, менінгіт, артрит, ендокардит, отит, перитоніт, риніт,
гайморит, повзучу виразку рогівки, ангіну, гостру респіраторну
інфекцію.
Зігеріососсиз [аесаііз (ентерококи) — це поліморфні, овоїдні клі-
тини. розташовані парами або короткими ланцюжками. Деякі коки
мають овальну або ланцетоподібну форму. Діаметр їх 0,5—1 мкм.
Є штами, які містять К-антигени (капсульні).
251
На густих середовищах 8. Гаесаііз розвиваються з формуванням
колоній з гладенькими краями. У цукровому бульйоні ростуть з утво-
ренням помутніння й осаду. Деякі штами мають активну рухливість,
продукують жовтий пігмент, виробляють фібринолізин. Температур-
ний діапазон їх росту лежить у межах 10—45 °С; бактерії стійкі до
дії високої температури (ЗО хв при 60 °С). Ростуть у бульйоні з вмі-
стом 6,5 % натрію хлориду при рН 9,6, а також на кров’яному агарі
з додаванням 40 % жовчі або еквівалентної кількості жовчних солей.
8. Гаесаііз живуть у кишках людини і теплокровних тварин, мають
антагоністичні властивості щодо дизентерійних, черевнотифозних і
паратифозних бактерій, а також до кишкової палички. У дітей кіль-
кість їх у кишках переважає порівняно з кишковою паличкою. їх
виявляють при захворюваннях дванадцятипалої кишки, жовчного
міхура, сечових шляхів. Виявлення їх у воді, стічних водах, харчо-
вих продуктах е одним із критеріїв фекального забруднення.
Для медичної мікробіології важливі а-зеленячі стрептококи (8. ч'ігі-
<іап$), які постійно перебувають у порожнині рота і глотці здорових людей.
На кров’яному агарі вони спричиняють позеленіння середовища, звичайно
ферментують рафінозу, ие ферментують маиіт. Мають слабку вірулентність
для людини і тварин. Зеленячі стрептококи виявляють при гнійних і запаль-
них ураженнях зубів і ясен, вони спричиняють підгострив ендокардит, оче-
видно, беруть участь і в розвитку карієсу зубів.
Анаеробні стрептококи (Реріозігеріососсиз апаегоЬіиз, Реріозігеріососсиз
Іапсеоіаіиз та ін.) є збудниками тяжких післяродових септичних захворювань
(пуерперальннй сепсис); їх виділяють при різних гнійних і гангренозних ура-
женнях, що характеризуються гнильним запахом.
Резистентність. Стрептококи можуть довго витримувати низькі
температури, стійкі до висушування, у гною і мокротинні зберіга-
ються місяцями. При температурі 70 °С вони гинуть протягом і год.
Фенол (3—5 % розчин) убиває стрептококи через 15 хв.
Патогенність для тварин. До патогенних стрептококів сприйнят-
ливі рогата худоба, коні, свині, собаки, птиця, з експериментальних
тварин — кролі і білі миші.
Патогенез захворювання у людини. Патогенез стрептококової
інфекції визначається дією бактерій та їх екзотоксину. Велике зна-
чення у виникненні і розвиткові стрептококового процесу має попе-
редня сенсибілізація. Такі захворювання, як ендокардит, поліартрит,
гайморит, хронічний тонзиліт, бешиха, пов’язані з станом організму,
його зміненою реактивністю, яка в ряді випадків довго зберігається
і е основною умовою розвитку стрептококових інфекцій з хронічним
перебігом.
Екзогенне зараження стрептококами (від хворих
людей, тварин, а також інфікованими продуктами і предметами) настає
через порушені шкіру і слизові оболонки, а ще при проникненні стреп-
тококів у кишки разом з їжею. Основний шлях зараження повітряно-
краплинний.
Реріососсиз пі§ег, Реріососсиз азассЬагоІуіісиз та інші звичайно
умовно-патогенні для людини; живуть на слизовій оболонні порож-
нини рота, у кишках, сечостатевих органах. В ослаблених людей та
осіб, уражених хронічними захворюваннями, можуть спричиняти
різні ускладнення.
252
Ендогенне інфікування умовно-патогенними стреп-
тококами, що живуть у людському організмі, можливе в результаті
ослаблення природної опірності організму. При цьому виникають
гнійні запальні процеси: стрептодермія, абсцес, флегмона, лімфаденіт,
лімфангоїт, цистит, пієліт, холецистит, перитоніт, фарингіт та ін.
Захворювання, зумовлені стрептококами, поділяють на нагнійні
і ненагнійні. До нагнійних належать гостра респіраторна інфекція,
пневмонія, бешиха, стрептодермія, ангіна. Потрапляючи у кров’яне
русло, стрептококи зумовлюють тяжкий септичний процес. Вони ча-
стіше, ніж інші бактерії, є збудниками післяродового сепсису.
До групи ненагнійних захворювань входять скарлатина, ревматизм
та ін.
Стрептококи спричиняють вторинну інфекцію при дифтерії, віспі,
коклюші, кору та інших захворюваннях. У розвитку хронічного тон-
зиліту поряд із стрептококами певну роль відіграють і аденовіруси.
У воєнну пору при тяжких травмах стрептококи проникають у рани
й спричиняють розвиток абсцесів, флегмон, травматичного сепсису.
Імунітет. Постінфекційний імунітет при стрептококових захво-
рюваннях характеризується слабкою напруженістю і нетривалістю.
В результаті сенсибілізації організму розвиваються рецидиви бешихи,
часті ангіни, дерматит, періостит, остеомієліт. Це пояснюється, з од-
ного боку, слабкою імуногенною здатністю стрептококів унаслідок
спільності їх антигенів з антигенами органів і тканин макроорганізму,
високим вмістом у них алергенів, а з другого — наявністю великої к іль-
кості сероварів стрептококів при відсутності перехресного імунітету.
При стрептококових захворюваннях імунітет антиінфекційний.
Він пов’язаний з антитоксичним і антибактеріальним факторами.
Антитоксин нейтралізує стрептококовий токсин і сприяє разом з комп-
лементом, опсонінами та іншими антитілами підвищенню фагоцитозу.
Лабораторна діагностика. Матеріалом для дослідження є вміст
гнійних вогнищ, виділення ранової поверхні, запальний ексудат, наліт
з піднебінних мигдаликів, кров, сеча, харчові продукти. Так само,
як і при стафілококових інфекціях, роблять бактеріоскопію мазків із
гною, висівання досліджуваного матеріалу на чашки з кров’яним ага-
ром (коли є підозра на сепсис, кров сіють на цукровий бульйон) з на-
ступним виділенням чистої культури та її ідентифікацією, визначають
вірулентність бактерій при внутрішньошкірній ін’єкції кролям їх
зависі і встановлюють токсигенність при внутрішньошкірному введен-
ні кролені фільтрату бульйонної культури. Ідентифікацію групи і се-
ровару виділеного стрептокока можна робити за допомогою флюорес-
ціюючих антитіл. Серологічна діагностика охоплює виявлення в сиро-
ватці крові хворих титру анти-О-стрептолізину, антистрептогіалуро-
нідази, а також дезоксирибонуклеази.
Лікування. При стрептококових інфекціях звичайно застосовують
пеніцилін; коли є протипоказання (алергія до пеніциліну), признача-
ють еритроміцин. При хронічних процесах рекомендується вакцино-
терапія (ауто- і полівакциною).
Профілактика. Важливими умовами запобігання стрептококовим за-
хворюванням є загальні санітарно-гігієнічні заходи па підприємствах,
253
у дитячих закладах, родильних будинках, хірургічних відділен-
нях, додержання санітарно-гігієнічних норм при виробництві хар-
чових продуктів, па сільськогосподарських роботах, у побуті, а та-
кож підвищення загального культурного рівня населення та додер-
жання особистої гігієни.
Внаслідок спільності антигенних структур стрептококів і макро-
організму, слабкої імуногенної здатності стрептококів та наявності
серед них сероварів, що мають властивість спричиняти перехресний
імунітет, специфічну профілактику стрептококових захворювань ще
не розроблено. Вивчаються вакцини, виготовлені з М-білкових фрак-
цій стрептококів. В Англії і СІНА застосовують полівалентну вакцину
проти стрептококових пневмоній.
Роль стрептококів в етіології скарла-
тини. Вважають, що скарлатину спричиняють Р-гемолітичні лізо-
генні стрептококи А-групи, які мають М-антиген і продукують еритро-
генний екзотоксин.
Люди заражуються повітряно-краплинним шляхом. Джерелом ін-
фекції є хворі на скарлатину і носії. У деяких випадках збудник про-
никає в організм через ушкоджену шкіру і слизові оболонки статевих
органів. Таку скарлатину називають екстрабукальною, або екстра-
фарингеальною (ранова, опікова, хірургічна, післяродова). Крім того,
збудник скарлатини може передаватися через предмети (посуд, іграш-
ки, книги та ін.) та інфіковані харчові продукти (молоко). Велике
значення в епідеміології скарлатини мають хворі з атиповими недіаг-
ностованими формами. Хворіють на скарлатину звичайно діти віком від
І до 8 років.
У патогенезі скарлатини поряд з екзотоксином стрептококів певну
роль відіграють алергени бактерій.
Перший період захворювання характеризується переважно інток-
сикацією, другий — розвитком септичних та алергічних процесів.
У перехворілих на скарлатину виробляється порівняно стійкий
імунітет. Однак можливі повторні випадки захворювання.
Доказом провідної ролі антитоксичного імунітету при скарлатині
є наявність прямого зв’язку між внутрішньошкірною позитивною
реакцією Діка і сприйнятливістю до скарлатини.
Скарлатину діагностують в основному за клінічною картиною
та епідеміологічними даними. Іноді використовують метод виділення
гемолітичних стрептококів та їх типування. У ряді випадків ставлять
реакцію Діка з термолабільною фракцією токсину: перехід позитивної
реакції в негативну при повторному введенні токсину до певної міри
підтверджує діагноз скарлатини.
Внутрішньошкірне введення 0,1 мл антитоксину в зоні ін’єкції
під час висипання спричиняє погашення висипу (реакція Шультца —
Чарлтона). Реакції Діка і Шультца — Чарлтона використовують
рідко.
Хворим на скарлатину призначають препарати групи пеніциліну і
сульфаніламідні (норсульфазол та ін.), а такожгамма-глобулін крові.
Профілактика полягає в ранній діагностиці, ізоляції хворих та
госпіталізації за епідемічними і клінічними показаннями, старанному
254
гігієнічному прибиранні приміщення і провітрюванні, додержанні
режиму в інфекційних лікарнях (відділеннях), розосередженні дітей,
які перебували в дитячих закладах, де траплялись випадки скарла-
тини. Ослабленим дітям, що контактували з хворими, вводять 1,5—
З мл імуноглобуліну сироватки крові людини.
У зв’язку з великою кількістю сероварів гемолітичних стрептоко-
ків групи А, наявністю спільних антигенів у стрептококів і клітин
організму людини специфічну масову профілактику скарлатини у ді-
тей не проводять.
Роль стрептокока в етіології ревматизму.
Вважають, що ревматизм спричиняється 0-гемолітичними стрепто-
коками групи А. У хворих на ревматизм цей вид стрептококів досить
часто виділяють із зіва і крові, а в сироватці крові виявляють антиті-
ла — антистрептолізини, антистрептогіалуронідазу й антитіла до
М-протеїну гемолітичного стрептокока.
У патогенезі ревматизму важливу роль відіграє алергізація орга-
нізму в результаті повторного надходження антигенів — екзо- й ендо-
токсинів стрептокока й утворення аутоантигенів — комплексів спо-
лук токсинів стрептококів з компонентами білків тканин та крові хво-
рих. Утворення комплексу антиген — антитіло призводить до ушко-
дження основної речовини сполучної тканини, звільнення біологічно
активних речовин (гістаміну та ін.) і розвитку запальної реакції.
Для першої стадії захворювання характерна наявність тонзиліту
і фарингіту, потім настають гострий період і первинна сенсибілізація,
за якими з’являється стан підвищеної чутливості (ревматичний полі-
артрит, ураження міокарда і клапанів серця), що супроводиться ауто-
сенсибілізацією і рецидивами.
Постінфекційний імунітет характеризується слабкою напруже-
ністю і нетривалістю, чим і пояснюється хронічний рецидивуючий
перебіг захворювання.
Лабораторна діагностика грунтується на виділенні гемолітичного
стрептокока і встановленні в динаміці підвищення титрів антистрепто-
лізину, антифібринолізину, антигіалуронідази.
Лікування хворих на ревматизм полягає у здійсненні комплексу
заходів, спрямованих на десенсибілізацію організму, ліквідацію
запальних процесів, відновлення загальної реактивності, порушених
функцій, на боротьбу з вогнищевою інфекцією призначенням препара-
тів пеніциліну пролонгованої дії.
Найвища захворюваність па ревматизм спостерігається у жовтні —
листопаді і березні — квітні. У ці ж місяці буває і найвища захво-
рюваність на гострий і хронічний тонзиліт, фарингіт, ангіну, гострі
респіраторні інфекції.
Профілактика зводиться до запобігання стрептококовим і вірусним
інфекціям, підвищення резистентності організму, створення сприят-
ливих умов на підприємствах і в побуті. Крім того, усім хворим та
особам з підвищеним ризиком захворювання на ревматизм треба на-
весні і восени проводити профілактичний курс лікування препаратами
пеніциліну.
255
ПАТОГЕННІ АЕРОБНІ БАЦИЛИ
ЗБУДНИК СИБІРКИ
У Росії ие захворювання дістало назву снбіркя у зв’язку з великою епі-
демією на Уралі в 1786—1788 рр., описаною С С. Андрієвським, який само-
варажеииям довів у 1788 р. інфекційну природу сибірки та зоонозннй характер
її розповсюдження (від хворих тварин здоровим, а також людині).
Збудника сибірки (Васііііі'5 апііігасіз) описали А. Поллендер у 1849 р.,
К Давеи у 1850 р. і Ф Брауль у 1854 р Учення про сибірку було створене
Р. Кохом (1876), Л Пастером (1881) і Л С. Цеиковським (1883) В апіЬгасіз
належать до родини ВасіІІасеае.
Морфологія. Бацили сибірки грампозитивні, крупні, 3—10 мкм зав-
довжки й 1—1,5 мкм завширшки. Розташовуються в організмі парами
або короткими ланцюжками, на живильних середовищах утворюють
довгі ланцюжки (рис. 76, а). Кінці бацил у забарвлених препаратах
мають вигляд обрубаних або злегка увігнутих, нагадуючи бамбукову
палицю з колінчастими зчленуваннями.
Бацили снбірки нерухомі, поза організмом утворюють спори оваль-
ної форми, розташовані центрально, не перевищуючи поперечник клі-
тини. Спороутворення найбільш інтенсивне в присутності кисню і при
температурі ЗО—40 °С. Воно втрачається в організмі тварин і людини
і не відбувається при температурі понад 43 °С і нижче 15 °С.
Доведено, що за сприятливих умов (у каштанових і чорноземних
грунтах) у теплу пору року спори можуть переходити у вегетативні
форми і з настанням осені знову перетворюватись у спори.
В організмі тварин і людини бацили сибірки утворюють капсули,
що оточують як окремі особини, так і ті, які розташовані ланцюжками
(рис. 76, в). Капсули утворюються і в тому разі, коли бацили ростуть
на живильних середовищах, що містять кров, сироватку, яєчний білок
або тканину мозку. У капсулі є специфічні протеїни. Бацили сибірки
забарвлюються всіма аніліновими барвниками, грампозитивні.
Культивування. Збудник сибірки — аероб і факультативний ана-
ероб, оптимальна температура росту 37—38 °С, крайні границі 12
і 45 °С, добре розвивається на звичайних середовищах при рН 7,2—
7,6.
На МПА утворює шорсткі (К) колонії з нерівними краями
(рис. 76, б), що нагадують кучері або левову гриву. Гладенькі 8-фор-
Рис. 76 Бацили сибірки:
о —мазок Із культури з спорами, б — будова краю колонії; в —
мазок з органів трупа.
256
Рис. 77. Ріст В. апІИгасіз на желатині стовпчиком.
ми слабковірулентні або невірулентні, не утворю-
ють капсул в організмі. Втрата капсули також
супроводиться втратою вірулентності.
Коли бацили сибірки ростуть в МПБ, на дні
пробірки або флакона з’являється осад, який нага-
дує жмутик вати, а бульйон залишається прозорим.
При переході колоній із К-форми в 8-форму
бацили сибірки втрачають здатність розташовува-
тись у мазках ланцюжками; утворюються кокопо-
дібчі, диплобацилярні форми або скупчення бацил.
Культивування при температурі 42,5 °С зумовлює
утворення ниткоподібних слабковірулентних форм, які не утворюють
спор На з пеніциліном спостерігається розпал бацил на окремі
кульки, розташовані у вигляді намиста («перлинне намисто»).
Ферментативні властивості. Бацили сибірки містять ферменти —
дегідразу, ліпазу, амілазу, пероксидазу, каталазу. При висіванні
стовпчиком у желатину бацили ростуть у вигляді ялинки, переверну-
тої верхівкою донизу (рис. 77), причому желатина розріджується на
окремі шари. Бацили сибірки повільно розріджують зсілу сироватку,
утворюють аміак, сірководень, поступово відновлюють нітрати в ніт-
рити, зсідають і пептонізують молоко, ферментують з утворенням кис-
лоти глюкозу, сахарозу, мальтозу та інші вуглеводи (табл. 24).
Таблиця 24. Диференціація бацил сибірки, антракоідів і грунтових бацил
Вид бактерій Рухли- вість У х 5с Характер росту
на будьПо- и і з кров'ю у лакмусовій молоч ній сироватці Патогенність
шей ськнх X
В. апііігасіз Немає + Немає гемолізу Почервоніння + + +
В, апіИгасоіФез Слабка — Гемоліз Посиніння 4- — ——
В. зиЬІіІіз Активна — Те саме Те саме 4- 4- —
В. текаіегіит Помірна — Немає гемолізу — — —
В. сегеиз уаг. тусо- іФез Слабка Те саме
Примітка. (Ч-) — наявність капсули; (—) —відсутність капсули; (±) — не-
постійна наявність капсули
Токсиноутворення. Збудник сибірки при рості на напівсинтетич-
ному середовищі виділяє в культуральну рідину протеїновий ком-
плекс екзотоксину, що містить летальний токсин, набряковий фактор
і антиген, який індукує продукцію неповних антитіл.
Антигенна структура. Бацила сибірки містить капсульний (проте-
їновий) і соматичний (полісахаридний) антигени. Полісахаридний
антиген є в клітинній стінці мікроорганізму, протеїновий — у капсу-
лі, яка зумовлює антифагоцитарну активність.
9
257
Соматичний полісахаридний антиген, що складається з а-г.тюко-
заміну, галактози і залишків оцтової кислоти, термостійкий Проти
цього антигенного комплексу захисні антитіла не продукуються. Він
довго зберігається в культурах, у зовнішньому середовищі та сек-
ційному матеріалі. На виявленні полісахаридного антигену грунтує-
ться реакція термопреципітації (реакція Асколі). Добутий при кип’я-
тінні зараженого матеріалу сибірковий екстракт містить полісахарид-
ну (термостійку) фракцію, яка при взаємодії з пренипітуючою сиро-
ваткою зумовлює РП.
Капсула містить протеїноподібну речовину поліпептид, до складу
якої входить поліглутамінова кислота.
Збудник сибірки в організмі тварин і на середовищах, що містять
екстракти тканин або плазму, виробляє особливого роду (протектив-
ний) антиген, що являє собою атоксичний термолабільний протеїн
з дуже вираженою імунізуючою властивістю.
У бацил сибірки, антракоїдів, псевдосибіркових бацил і споро-
творних сапрофітів є спільний антиген — гаптен, який спричиняє
вироблення неповних антитіл.
Резистентність. Бацили сибірки в запаяних ампулах зберігаються
до 40, а спори — до 65 років; в сухому стані, а також у грунті збері-
гають життєздатність протягом кількох десятиріч; вони стійкі протидії
дезинфікуючих речовин. Вегетативні форми при температурі 55 °С
гинуть за 40 хв, при кип’ятінні — за 1—2 хв. Спори термостійкі,
витримують кип’ятіння протягом 15—20 хв, від стерилізації парою
при ПО °С гинуть протягом 5—10 хв, при діянні І % розчину форма-
ліну і 10 % розчину їдкого натру руйнуються через 2 год. При дослі-
дженні гниючих трупів тварин можна досить часто виявити порожні
капсули (тіні) мікроорганізмів, позбавлені цитоплазми.
Патогенність для тварин. Із свійських тварин до сибірки сприйнят-
ливі вівці, корови, коні, олені, верблюди і свині. Тварини найчасті-
ше заражуються перорально, поглинаючи разом з кормом спори збуд-
ників; місце локалізації бацил — кишки. У ряді випадків зараження
настає через кровососних комах (гедзі, мухи-жигалки).
Із лабораторних тварин найбільш сприйнятливі білі миші, потім
морські свинки, кролі, які після зараження гинуть на 2—4-ту добу.
На місці введення бацил утворюються набряк, крововиливи; внутріш-
ні органи (особливо селезінка) застійні, збільшені, розвивається сеп-
тицемія. Внаслідок анти коагулюючої дії бацил сибірки кров загиблих
тварин не зсідається, вона густа, чорно-червоного кольору (звідси й
назва апіНгах — вугілля).
Патогенез захворювання в людини. Сибірка — типове зоонозне
захворювання. Люди заражуються від хворих тварин, а також через
предмети і вироби з інфікованої сировини (кожушки, хутряні рука-
виці, коміри, шапки, пензлі для гоління та ін.); у літню пору зара-
ження можливе при укусі кровососних комах. Сибірка проявляється
втрьох основних клінічних формах: шкірній, легеневій і кишковій.
При шкірній формі місцем проникнення збудника є ушкоджена
шкіра, головним чином відкритих частин тіла (обличчя, шия, кисті
рук, передпліччя). У місці локалізації збудника утворюється сибір-
258
ковнй карбункул. Хворіють переважно люди, які контактують з хво-
рими тваринами і тваринною сировиною, зараженою бацилами сибір-
ки, а також ті, хто користується виробами з шкур і шерсті тварин,
уражених сибіркою.
При легеневій формі зараження настає аерогенним шляхом під
час роботи з матеріалом, інфікованим спорами сибірки. Захворювання
має перебіг за типом тяжкої бронхопневмонії. Бацили виділяються
з мокротинням.
Кишкова форма сибірки виникає в результаті вживання в їжу
м’яса хворих тварин, при цьому спостерігається дуже тяжке ураження
слизової оболонки кишок з крововиливами і вогнищами некрозу. Ба-
цили виділяються з випорожненнями.
Шкірна форма сибірки реєструється спорадично, кишкова — дуже
рідко, легенева форма у зв’язку із здійсненням заходів щодо охорони
праці майже не трапляється.
В ослаблених і виснажених людей, а також у хворих з будь-якою
клінічною формою захворювання може розвинутись сибіркова септи-
цемія.
Імунітет. При сибірці імунітет антиінфекційний і залежить від
наявності протективних антитіл, що продукуються організмом у від-
повідь на комплекс екзотоксину. Під впливом захисних антитіл віру-
лентні сибіркові бацили знешкоджуються фагоцитарною реакцією.
У сироватці крові осіб, які перехворіли на сибірку, виявляють ре-
човини, здатні руйнувати капсульну субстанцію сибіркових бацил,
нейтралізувати агресини і токсини (летальний фактор).
Лабораторна діагностика. При шкірній формі сибірки досліджу-
ють ексудат карбункула, який беруть із товщі набряку на границі із
здоровою тканиною, при легеневій — мокротиння, при кишковій —
випорожнення і сечу, при септицемії — кров.
Патологічний матеріал мікроскопіюють, мазки забарвлюють за
Грамом і Романовським — Гімзою. Виявлення характерних щодо мор-
фології капсульних бацил, розташованих ланцюжками, дає змогу по-
ставити попередній діагноз сибірки.
Для виділення чистої культури досліджувані об’єкти висівають
на чашки з МПА і в пробірки з МПБ. Потім за характером росту,
морфологією та біохімічними властивостями ідентифікують виділену
культуру з іншими подібними за морфологією мікроорганізмами
(табл. 25). Для виявлення капсулоутворення застосовують сироват-
ково-кров’яні середовища. Додатково рекомендується застосовувати
люмінесцентно-серологічну пробу і тест «перлинного намиста» (виро-
щування культури на середовищі з пеніциліном).
Експериментальних тварин (білих мишей, морських свинок, кро-
лів) заражують патологічним матеріалом, а також виділеною з нього
чистою культурою. Збудник сибірки спричиняє загибель білих мншей
через 24—48 год, морських свинок — на 2—3-тю добу. У крові і у внут-
рішніх органах при бактеріоскопії мазків виявляють бацил сибірки,
оточених капсулою (див. форзац, рис. III, б).
Застосовують також прискорену біологічну пробу, яка полягає
ось у чому. Добуту культуру, що потребує ідентифікації, вводять
9’
259
5 Таблиця 25. Диференціація різних видів патогенних споротворних анаеробів
Вид бакгер їй Характер росту Ферментація вуглеводів
на кров якому пластинча- стому агарі І 2 в жела ТИНІ вому се- редовищі £ І 2 Зі 2 | І і ч
С. іеіапі + Ніжний мереживний ріст у вигляді дрібних пучків; гладенькі прозорі коло- нії у вигляді росинок Слаб- ке зсі- дання Повільне розрі- дження Почор- ніння -
С. Ьоіиііпигп Шорсткі (сірі), випуклі в центрі колоній з порі- заними краями і зоною гемолізу; мають двокон- турні відростки Те саме Розрі- дження Те саме + +
С. регігіп- 8ЄП5 Круглі соковиті колонії, спочатку сіруваті, потім оливкові і зелені з зоною гемолізу Бурх- ливе зсі- дання Те саме Немає змін + +
С. поууі + Як у С. Ьоіиііпит Зсі- дання Те саме ± - + + - - ± - -
С. зеріісит + Ніжні мереживні звнті нитки, завитки із зоною гемолізу Те саме Повільне розрі- дження + + + — -1- + +
С. Ьіьіоіу- сит + Дрібні, гладенькі, схожі на росинки, колонії без гемолізу Повна пепто- ніза- ція Сильне розрідже- ння і йо- му гніпня Почор- ніння
С. діГГїсіїе + Те саме Те саме Те саме Те саме + + +
П р и м і т к а . (+) — наявність відповідної ознак:!*, (—) — відсутність ознаки; (±) — непостійна наявність ознаки.
внутрішньоочеревинно білим мишам і через кілька годин після зара-
ження роблять мазки із перитонеального вмісту. Виявлення у мазках
типових капсульних бацил дозволяє дати остаточну відповідь про
результати біологічної проби.
В разі потреби встановити ретроспективний діагноз сибірки у ви-
падках з негативним результатом бактеріоскопічного і бактеріологіч-
ного дослідження ставлять алергічну пробу.
Трупний матеріал, шкіряну і хутрову сировину, з якої важко
виділити бацили сибірки, піддають серологічному дослідженню за до-
помогою реакції термопреципітації (реакції Асколі) (рис. 78).
При лабораторній діагностиці сибірки слід пам’ятати про мікро-
організми, біологічно близькі до В. апііігасіз (див. табл. 25), спорові
аероби, дуже поширені в природі, В. сегеиз (рис. 79), В. тееаіегіит
та ін.
Для диференціації бацил сибірки з антракоїдами та іншими подіб-
ними споротворними аеробами застосовують фагодіагностику. Специ-
фічний фаг лізирує тільки культури сибірки.
Лікування. Комплексна терапія хворих на сибірку спрямована
як проти токсину, так і проти бацил і полягає в своєчасному внутріш-
ньом’язовому введенні протисибіркового глобуліну (ЗО—50 мл) та
антибіотиків (пеніциліну, еритроміцину, напівсинтетичних тетрацик-
лінів).
Профілактика. Загальні заходи для запобігання сибірці здійс-
нюють разом з ветеринарною службою; до них входять своєчасне
виявлення, ізоляція і лікування хворих тварин, старанна дезинфек-
ція приміщень, території, на якій вони були, і всіх предметів, з якими
вони контактували, а також переорювання випасів.
Трупи тварин, що загинули від сибірки, спалюють або закопують
у спеціально відведеному місці (скотомогильнику) на глибину не менш
як 2 м і засипають хлорним вапном. Крім того, ветеринарна служба за-
безпечує запобіжні заходи: недопущення в їжу м’яса тварин, хворих
на сибірку, а також старанний контроль за випуском та реалізацією
шкіряних і хутряних виробів із тваринної сировини.
Для специфічної профілактики в нашій країні використовують
добуту із безкапсульних бапил сибірки вакцину СТІ, що є зависсю
авірулентних живих спор вакцинних штамів. Її застосовують для
імунізації як свійських тварин, так і людей. В І мл вакцини, призначе-
ної для нашкірного застосування, міститься 4 млрд мікробних тіл,
261
у вакцині для підшкірного введення — 100 млн. Введення вакцини
СТІ досить швидко створює імунітет тривалістю понад рік. Вакцину-
ють людей, які працюють на підприємствах, де обробляють тваринну
сировину (шкіри, вовна), на м’ясокомбінатах, у колгоспах і радгоспах,
де трапляються захворювання на сибірку.
Особам, що мали контакт з матеріалом, інфікованим бацилами си-
бірки (при обробці туш і вживанні в їжу м’яса тварин, уражених
сибіркою), щодня протягом 3—5 діб вводять внутрішньом’язово 20—
25 мл протисибіркового глобуліну в поєднанні з пеніциліном.
В Англії застосовують хімічну сибіркову вакцину, що складається
з протективного антигену (фільтрату безкапсульних непротеолітичних
сибіркових штамів, вирощених на синтетичних або напівсинтетичних
середовищах), у США для імунізації людей використовують анатоксин
(токсоїд).
У нашій країні завдяки систематичним профілактичним заходам
ветеринарної і медичної служб випадки захворювання на сибірку трап-
ляються дуже рідко.
До роду ВасіІІиз належить В. сегеиз, яка може рости і розмно-
жуватись у харчових продуктах, продукувати ентеротоксин, гемолі-
зин, ферменти патогенності і спричиняти харчові отруєння у людей.
ПАТОГЕННІ СПОРОТВОРНІ АНАЕРОБИ
Патогенні споротворні анаероби належать до родини ВасіІІасеае,
роду СІозігісііитп. До них входять збудники правця, ботулізму, ана-
еробної інфекції (табл. 25). Це крупні поліморфні грампозитивні ба-
цили; деякі види рухливі (перитрихи), у зовнішньому середовищі утво-
рюють сферичні або овальні спори, розташовані термінально (палич-
ка правця) або субтермінально (збудники анаеробної інфекції); за ве-
личиною спори іноді набагато перевищують товщину клітини; хемо-
органотрофи. Більшість штамів ростуть в анаеробних умовах і мають
різну ферментативну активність. Патогенні види анаеробів продуку-
ють екзотоксини, вони постійно живуть у кишках тварин і людини,
з випорожненнями яких виділяються у зовнішнє середовище; у ви-
гляді спор довго (роками) зберігаються в грунті, морській і прісній
воді.
КЛОСТРИДІЇ ПРАВЦЯ
У 1884 р. А. Ніколайєр відкрив збудника правця. Чисту культуру добув
у 1889 р. С. Кітазато.
Морфологія. Сіозігісііитп іеіапі — пряма рухлива паличка зав-
довжки 2,4—5 мкм і завширшки 0,5—1,1 мкм. Має включення у вигля-
ді зерен, розташованих на кінцях і центрально; перитрих, утворює
стійкі спори кулястої форми, які розташовані на кінці і надають мік-
роорганізму вигляду барабанної палички (рис. 80, а). Не утворює кап-
сули, грампозитивна (див. форзац, рис. III, є).
Культивування. Клостридії правця — строгі анаероби. На цук-
ровому або кров’яному агарі (рН 7,0—7,9) ростуть при температурі
262
Рис. 80. Клостридії правця з кінцевими спорами (а) і ко-
лонії збудника в агарі стовпчиком (б).
37 °С (границі росту— 14 і 45 °С) у вигляді
ніжних нальотів з компактним центром і нит-
коподібними відростками по периферії; іноді
навколо колоній утворюється зона гемолізу.
Збудник правця спричиняє почорніння мозкового
середовища і вісмутсульфітагару. При висіванні
уколом у стовпчик агару спостерігається ріст у
вигляді ялинки або пензлика з появою ніжних
колоній (рис. 80, б). Середовище Кітта—Тароц-
ці внаслідок розщеплення білків мутніє з утво-
ренням газу і своєрідного запаху при культи-
вуванні.
Ферментативні властивості відображені в
табл. 25.
1 (
>1
Токсиноутворення. Збудник правця виробляє надзвичайно силь-
ний екзотоксин, який складається із двох фракцій: тетаноспазміну,
що уражує клітини нервової тканини і спричиняє спазматичне скоро-
чення м’язів, і тетанолізину, який розчиняє еритроцити. Тетаноспаз-
мін належить до класу частково секретованих, частково зв’язаних
з клітиною екзотоксинів.
Антигенна структура. Клостридії правця серологічно неоднорідні,
відомо 10 сероварів. Усі вони продукують ідентичні екзотоксини. Серо-
вари 1, 3, 6, 7 мають виражену специфічність. Рухливі штами містять
Н-аптиген, нерухомі —тільки О-антиген. Поділ клостридій правця на
серовари роблять за Н-антигеном, а на серогрупи — за О-антигеном.
Резистентність. Вегетативні форми збудника правця гинуть при
температурі 60—70 °С протягом ЗО хв і досить швидко знешкоджуються
від дії всіх дезинфікуючих речовин. Спори клостридій правця мають
велику стійкість. Вони довго зберігаються у грунті і на різних пред-
метах, витримують кип’ятіння протягом 10—90 хв, а спори деяких
штамів — 1—3 год; 5 % розчин фенолу спричиняє їх загибель через
8—10 год, 1 % розчин формаліну — через 6 год; дію прямого соняч-
ного випромінювання спори витримують 3—5 діб.
Патогенність для тварин. У природних умовах на правець хворі-
ють коні, дрібна рогата худоба. Багато тварин є носіями збудника
правця. З експериментальних тварин до клостридій правця сприйнят-
ливі білі миші, морські свинки, пацюки, кролі і хом’яки.
Патогенез захворювання у людини. Джерелом збудника є тварини
і люди, які виділяють клостридії з випорожненнями в грунт. Спори
клостридій правця виявляють у грунті в 20—80 % досліджених проб,
у деяких випадках — у 100 %. Особливо багатий на спори угноєний
грунт. Вони можуть розноситись разом з пилом, проникати в житло,
потрапляти на верхній одяг, білизну, взуття та інші предмети.
Захворюваність па правець пов’язана з травматизмом воєнного
і мирного часу. Інкубаційний період 4—14 діб.
Близько 2/3 захворілих становлять особи, зайняті в сільському
господарстві, понад 1/3 — діти віком 1 —15 років. Більше половини
263
захворювань на правець виникає в результаті поранень ніг лопатою,
цвяхом, стернею під час роботи в полі, на городі.
У новонароджених збудник інфекції може проникати через пуп-
ковий канатик, у породіль — через слизову оболонку матки.
На місці проникнення спори клостридій перетворюються у веге-
тативні форми, які виділяють екзотоксин. У ряді випадків правець
супроводиться розвитком бактеріемії.
Правцевий токсин надходить у кров і гематогенним шляхом розпов-
сю їжується по всьому організму, зумовлюючи послідовне подразнення
периферичних нервових закінчень і рухових центрів спинного мозку.
Захворювання починається із судорожних скорочень м’язів у
місці проникнення збудника, потім настає тонічне скорочення жу-
вальних (трнзм), мімічних (гізиз запіопісиз) і потиличних м’язів;
далі у процес втягуються м’язи шиї, спини (орізіоіопиз) і кінцівок.
Розвивається клінічна картина низхідного правця. Смерть настає від
асфіксії і порушення функції органів кровообігу, травної системи
та ін. Летальність становить 35—70 %.
Імунітет. Постінфекційний імунітет при правцю переважно анти-
токсичний, слабконапружений; можливе повторне захворювання.
Лабораторна діагностика. Звичайно проводиться в рідкісних
випадках у зв’язку з вираженою клінічною картиною захворювання.
Систематичному дослідженню піддають об’єкти, що мають епідеміоло-
гічне значення (грунт, пил, перев’язувальні матеріали, препарати для
парентерального введення).
Для виявлення інфікованості клостридіями правця або їх спорами
ран, перев’язувального матеріалу і препаратів, призначених для па-
рентерального введення, роблять бактеріоскопічне дослідження на
наявність мікроорганізмів, морфологічно схожих на С. іеіапі, висі-
вають у флакони або пробірки з живильним середовищем. Через
2—10 діб культивування при температурі 35 °С визначають токсин на
мишах. Коли є клостридії правця, у заражених мишей на 1—3-тю
добу розвивається правець і тварини гинуть. У мишей, до яких засто-
совано токсин з протиправцевою сироваткою, правця не виникає.
У тих випадках, коли при первинному висіванні правцевий токсин
не було виявлено, а при бактеріоскопічному дослідженні виявлено
мікроорганізми, схожі за морфологією на збудник правця, вихідну
культуру висівають у конденсаційну воду зсілої сироватки. Через
24 год в анаеробних умовах з’являється тонкий наліт по всій поверхні
середовища. Через 4—5 діб культурою, добутою з рідкого живильного
середовища, заражують лабораторних тварин.
Для виявлення екзотоксину в екстрактах із досліджуваного мате-
ріалу застосовують біологічну пробу. Центрифугат або фільтрат
(0,5—1 мл) вводять внутрішньом’язово двом білим мишам. Таку саму
кількість фільтрату змішують з антитоксичною сироваткою, залиша-
ють суміш на 40 хв при кімнатній температурі і вводять двом мишам по
0,75 або 1,5 мл. Якщо у фільтраті є токсин, через 2—4 доби перші дві
миші загинуть, другі (контрольні) залишаться живими.
Лікування. Антитоксичну протиправцеву сироватку (50 000—
100 000 МО) вводять внутрішньом’язово. Більш ефективне застосу-
264
вання гамма-глобуліну крові людей, імунізованих проти правця. За-
стосовують також антибіотики (пеніцилін, цефалоспорини).
Щоб запобігти розвиткові правця при травмах, проводять хірургіч-
ну обробку ран, вводять 0,5 мл анатоксину і 3000—10 000 МО анти-
токсичної сироватки; в разі тяжкої травми протиправцеву сироватку
доцільно призначати і прищепленим особам. Повну дозу сироватки
вводять після попередньої внутрішньошкірної проби на чутливість
організму до кінського білка (методика дробного введення сироватки
описана в інструкції, що додається до кожної ампули).
Дуже важливим заходом вважають застосування полісистемної
комплексної терапії, спрямованої на відновлення порушених функцій
організму.
Хворих госпіталізують в окремі палати реанімаційного відді-
лення, де забезпечується режим, який виключає зовнішні подразники
(шум, світло), призначають препарати, що зменшують приступи судо-
рог або повністю запобігають їм (нейролептики, транквілізатори,
хлоралгідрат, курареподібні препарати), а також засоби для підтри-
мання функції органів кровообігу, здійснюють оксигенотерапію та
інші необхідні заходи. В результаті такої терапії летальність у до-
рослих знизилась до 17—18%, а в новонароджених—більш ніж
у два рази.
При повторній легкій травмі (не пізніше 14-ї доби) вторинне вве-
дення протиправцевої сироватки після першої профілактичної дози не
рекомендується, оскільки є небезпека розвитку сироваткової хвороби
або анафілактичного шоку.
Профілактика полягає в запобіганні травмам на виробництві і
в побуті.
Активну імунізацію роблять правцевим анатоксином; для специ-
фічної профілактики правця у дітей використовують коклюшно-
дифтерійно-правцеву вакцину, асоційований дифтерійно-правцевий
анатоксин, хімічну сорбовану тифозно-паратифозно-правцеву вак-
цину.
Щеплення роблять усім дітям з З місяців життя, сільським жите-
лям певних районів (за епідеміологічними показаннями), будівель-
никам, лісозаготівникам, робітникам водопровідних і очисних споруд,
підприємств для переробки торфу, працівникам залізничного транс-
порту. Надалі через 1,5—2 роки, 6 і 11 років проводять ревакци-
націю.
Відтворенням активного антитоксичного імунітету у матерів і па-
сивного імунітету у новонароджених у більшості країн Європи досяг-
нуто повного запобігання правцю у новонароджених.
КЛОСТРИДІЇ БОТУЛІЗМУ
Збудник ботулізму Сіозігідіит Ьоіиііпит відкритий у Голландії Ван-
Ерменгемом у 1896 р. Його виділили з шинки, що стала джерелом масового
отруєння, і внутрішніх органів померлих в результаті отруєння людей.
У Західній Європі ботулізм у минулому був пов’язаний із споживанням
ковбасних виробів, в Америці — овочевих консервів, у Росії — красної риби
та грибів домашнього консервування.
265
Рис 81 Чиста культура (а) і гли-
бинні колонії (б) С Ьоіиііпит
Морфологія. Збудник ботулізму —
крупна поліморфна паличка з округ-
леними кінцями завдовжки 4,4—8,6
мкм і завширшки 0,8—1,3 мкм, яка
іноді утворює короткі форми або
довгі питки; слабкорухлива, має від
4 до ЗО джгутиків; у зовнішньому
середовищі продукує овальні спори,
які розташовані субтермінально і на-
дають мікроорганізмові вигляду теніс-
ної ракетки (рис. 81); грампозитивна.
Культивування. Клостридії боту-
лізму — строгі анаероби, оптимальна
температура росту для сероварів А,
В.С, О, ЕЗО—40 °С, сероваруЕ—(+25—37 °С), серовару О — (+30—
37 °С). Культивуються»на звичайних середовищах (рН 7,3—7,6),
краще ростуть у м’ясній або мозковій кашці, яка при цьому темні-
шає; культури мають гострий запах згірклого масла.
На глюкозокров’яному агарі Цейслера клостридії ботулізму роз-
виваються у вигляді колоній неправильної форми з відростками
(рис. 81, б) або тонкими ниткоподібними відгалуженнями; навколо
колоній утворюються зони гемолізу.
При висіванні в агар стовпчиком колонії нагадують жмутики вати
або є компактними скупченнями з ниткоподібними відростками.
На желатині збудники ботулізму утворюють круглі прозорі коло-
нії, оточені невеликими зонами розрідження; надалі колонії стають
каламутними, бурими, з’являються відростки у вигляді шипів.
У печінковому бульйоні клостридії спочатку ростуть з утворенням
каламуті, потім з’являється компактний осад на дні, і рідина просвіт-
люється
Ферментативні властивості. Клостридії ботулізму (серовари А
і В) мають лецитиназну активність, розщепляють у рідкому середо-
вищі шматочки тканин і яєчний білок, розріджують желатину, утво-
рюють сірководень, аміак, леткі аміни, кетони, алкоголі, оцтову,
масляну і молочну кислоти, пептонізують молоко і ферментують вугле-
води з виділенням кислоти і газу (див. табл. 25).
Токсиноутворення. Збудник ботулізму продукує екзотоксин (ней-
ротоксин), в 1 мг якого понад 20 млн смертельних доз для мишей.
Токсиноутворення відбувається за сприятливих умов у культурах
і харчових продуктах (м’ясні, рибні, овочеві), а також в організмі
тварин і людини. Вміст 6—8% натрію хлориду перешкоджає розмно-
женню мікроорганізмів і накопиченню токсину.
Ботулінічний екзотоксин на відміну від правцевого стійкий до
дії шлункового соку і всмоктується незміненим. Екзотоксин серовару
Е активується трипсином, в результаті чого його біологічна активність
у кишках зростає в багато разів. Очищений токсин збудника ботулізму
серовару А в 1 мг містить 10—100 млн Оіт для білих мишей. Екзоток-
син ботулізму добуто в кристалічному стані, за силою дії він переви-
щує всі відомі досі біологічні отрути.
266
Антигенна структура. Доведена наявність семи сероварів збудника
ботулізму: А, В, С (СІ, С2), О, Е, Е, 6. Найбільш виражену токсичну
дію на організм людини мають серовари А, В, Е. Кожен серовар ха-
рактеризується специфічною імуногенністю. Серовари С, О, Е рідко
спричиняють захворювання в людини. О-антиген спільний для всіх
сероварів.
Резистентність. Вегетативні форми збудника гинуть при темпера-
турі 80 °С за ЗО хв, спори витримують кип’ятіння від 1,5 до 6 год,
при температурі 115 °С вони гинуть за 5—40 хв, при 120 °С — за
3—22 хв. У великих шматках м’яса, у посудинах великої місткості
вони можуть залишатися життєздатними і після стерилізації парою
при температурі 120 °С протягом 15 хв. У 5 % розчині фенолу спори
зберігаються близько доби, у культурах—до року. Ботулінічний
екзотоксин руйнується при кип’ятінні протягом 10—15 хв, стійкий
до дії сонячного випромінювання, високих концентрацій натрію хло-
риду, до заморожування; довго (6—8 місяців) зберігається у воді,
в консервах. Усі серовари ботулінічного токсину у воді знешкоджу-
ються під дією хлору, йоду і калію перманганату, особливо ефективне
перехлорування води.
Патогенність для тварин. До токсину збудника ботулізму серова-
рів С і О чутливі коні, велика і дрібна рогата худоба, норки,птахи;
з експериментальних тварин до всіх сероварів сприйнятливі морські
свинки, білі миші, коти, кролі, собаки.
Патогенез захворювання у людини. Отруєння настає в результаті
вживання в їжу м’ясних продуктів, овочевих і рибних консервів,
солоної і копченої красної риби та інших продуктів, інфікованих
збудниками ботулізму. Найчастіше причиною захворювання на боту-
лізм є консервовані гриби домашнього приготування. У США описані
випадки ботулізму у дітей в результаті вживання в їжу меду.
Спори клостридіїв ботулізму виявляють не тільки в культивова-
ному, а й у необробленому грунті. їх знаходять також у мулі і в мор-
ській воді, на овочах і фруктах, у кишках здорових тварин, свіжої
красної риби.
Патологічний процес зумовлюється екзотоксином, який всмоктує-
ться через кишки, надходить у кров, уражує ядра довгастого мозку,
органи кровообігу і м’язи.
Раніше вважали, що ботулізм зумовлений тільки дією екзотоксину.
Але описано випадки ботулізму, що виникає в результаті проникан-
ня спор у ранову поверхню, де вони перетворюються у вегетативні
форми, розмножуються і продукують екзотоксин. Тепер доведено, що
клостридії виявляються в різних внутрішніх органах людей, які за-
гинули від ботулізму.
Інкубаційний період при ботулізмі триває від 2 год до 10 діб, най-
частіше 18—24 год, характеризується появою кволості, сухості
в роті, запаморочення, головного болю, іноді блювання, паралічів
очних м’язів, порушення акомодації, птозу, розширення зіниць,
двоїння в очах, утруднення при ковтанні, афонії і глухоти. Леталь-
ність дуже висока (40—60 %), смерть настає від паралічу дихання.
267
Імунітет. У людини висока чутливість до екзотоксину. Перенесене
захворювання не іалишає стійкого антитоксичного імунітету.
Лабораторна діагностика. Об’єктами дослідження є залишки їжі,
що зумовила отруєння, кров, сеча, блювотні маси, промивні води,
випорожнення, із трупного матеріалу — вміст шлунка, відрізки
тонких і товстих кишок, лімфатичні вузли, головний і спинний мозок.
Для виявлення токсину вводять підшкірно або внутрішньоочере-
винно білим мишам або морським свинкам фільтрат бульйонних куль-
тур, кров, сечу хворих або витяжки із залишків їжі, причому мате-
ріал, яким заражують одну з двох груп контрольних тварин, нагрі-
вають на водяній бані при температурі 100 °С протягом ЗО хв.
Крім того, трьом піддослідним тваринам вводять відповідно фільт-
рат і антитоксичну сироватку А, фільтрат і антитоксичну сироватку В,
фільтрат і антитоксичну сироватку Е. Тварини, яким було введено
нагрітий матеріал і суміш, нейтралізовану антитоксином, не гинуть.
Досліджуваний матеріал засівають на живильне середовище Кіт-
та — Тароцці. Половину пробірок з посівами для звільнення від
сторонньої аспорогенної мікрофлори прогрівають при температурі
80 °С протягом 20 хв і створюють анаеробні умови. Виділену чисту
культуру ідентифікують за культуральними, біохімічними і токсиген-
ними властивостями.
Застосовують також метод визначення фагоцитарного показника,
який значно знижується при наявності токсину, і реакцію непрямої
гемаглютинації.
Лікування. Хворим на ботулізм промивають шлунок розчином
калію перманганату. Внутрішньом’язово (внутрішньовенно або в спин-
номозковий канал) дробно вводять полівалентну сироватку трьох
сероварів збудника, а також моновалентні сироватки сероварів А, Е
(по 10 000 МО) і сироватку серовару В (5000 МО); якщо стан хворого
не кращає, повторні ін’єкції сироватки роблять через 5—10 год у тих
самих дозах.
Усім іншим особам, які вживали їжу, що стала причиною захво-
рювання хоча б однієї людини, сироватку призначають з профілактич-
ною метою — по 1000 або 2000 МО кожного серовару. Для вироблен-
ня активного імунітету поряд із сироваткою вводять і ботулінічний
анатоксин по 0,5 мл кожного серовару триразово, з інтервалом 3—
5 діб.
Призначають пеніцилін, препарати тетрацикліну, які змінюють
дифузійні і дисперсні властивості екзотоксинів.
Для патогенетичного лікування застосовують дезинтоксикаційні
засоби, препарати кристалоїдів (трисоль, дисоль) і колоїдів (гемодез
та ін.), оксигенотерапію та штучну вентиляцію легень.
Профілактика. Велике значення в запобіганні ботулізму має до-
держання технології обробки продуктів на підприємствах харчової
промисловості, особливо виготовлення консервів із м’яса, риби та
овочів, а також копчення і соління риби, виготовлення ковбасних
виробів. Дуже небезпечно споживати рибні продукти домашнього
копчення і соління, а також консервовані гриби, низькокислотні кон-
серви (огірки, перець, баклажани, абрикосовий компот та ін.).
268
М’ясо і рибу рекомендується піддавати тепловій обробці невели-
кими шматками; недопустимо зберігати продукти (окости, балики)
великим обсягом і багатошарово, не слід виготовляти консерви ма-
сою понад 0,5 кг. Клостридії ботулізму, що збереглися після стериліза-
ції, спричиняють здуття бляшанок (бомбаж). Вміст їх має запах
згірклого масла. Такі консерви не можна пускати в продаж, вони
підлягають вилученню і старанному дослідженню. Рибу треба со-
лити в міцному сольовому розчині (тузлук) з концентрацією натрію
хлориду не нижче 10 %. Консерви зберігають у холодному
МІСЦІ.
Завдяки вдосконаленню технологічних процесів обробки і кон-
сервування харчових продуктів, додержанню санітарно-гігієнічних
правил і неухильному державному і санітарному контролю за вироб-
ництвом, зберіганням і реалізацією харчових продуктів ботулізм
у нашій країні став рідкісним захворюванням.
КЛОСТРИДІЇ АНАЕРОБНОЇ ІНФЕКЦІЇ
Анаеробна інфекція (газова гангрена) — захворювання поліетіоло-
гічного характеру. Вона зумовлюється діянням кількох видів збудни-
ків із роду СІозігісііитп в асоціації з різними аеробними мікроорганіз-
мами (патогенні стафілококи і стрептококи).
Спори клостридіїв стійкі до дії факторів зовнішнього середовища,
у грунті вони зберігаються 20—25 років, витримують кип’ятіння від
10—15 хв до 1 год, знешкоджуються 5 % розчином формаліну, кам’я-
новугільним дьогтем.
До збудників анаеробної інфекції належать С. регГгіп^епз, С. по-
ууі, С. зерііситп, С. Ьізіоіуііситп, С. сііИісіїе.
До непатогенних клостридіїв, що відіграють роль у патогенезі
захворювання тільки в поєднанні з патогенними мікроорганізмами,
належать С. аегоГоеіісіит, С. іегііит, С. зрого^епез та ін. Перші чо-
тири патогенних види можуть спричиняти анаеробну інфекцію кожний
зокрема, але звичайно захворювання виникає при певному поєднанні
кількох співчленів паразитоценозу. Менш патогенні і непатогенні види
клостридіїв самі по собі не спричиняють захворювання, але вони
руйнують тканини, знижують окислювально-відновний потенціал
і тим самим створюють сприятливі анаеробні умови для розвитку
патогенних видів.
СІозігШіит регїгіп£еп$
Збудника відкрили в 1892 р. М. Уелчем і Г. Неттал Цей мікроорганізм —
нормальний насельник кишок у людей і тварин. Поза організмом зберігається
роками у вигляді спор. Майже постійно є в грунті. Під час першої світової
війни його виявляли в 70—80 % усіх випадків анаеробної інфекції, а під час
другої світової війни — у 91 —100 %.
Морфологія. С. регїгіп£?епз — товста поліморфна нерухома паличка з
округленими кінцями завдовжки 3—9 мкм і завширшки 0,9—1,3 мкм (рис. 82, а).
В організмі тварин і людини утворює капсулу, у зовнішньому середови-
щі — овальної форми спору, що розташована субтермінально 1 перевищує по-
269
Рис 82 Чиста культура (а) і колонії (б) СІ. регїпп-
£ЄП5.
перечник самого мікроорганізму. Збудник забарвлюється всіма аніліновими
барвниками, грампозитнвний.
Культивування. С регігіпдепз росте в усіх жнвнльннх середовищах, що
застосовуються для культивування анаеробів (рН 6,0—8.0). Оптимальна тем-
пература для росту 35—37 °С (крайні границі — 16 і 50 °С).
У середовищі Кітта — Тароцці дає рівномірну каламуть із значним виді-
ленням газу. В глибині агару стовпчиком колонії мають вигляд дисків або
сочевичок (рис. 82, б). На кров’яному агарі з глюкозою утворює гладенькі
дископодібні колонії сірого кольору з рівними краями і підвищенням у центрі.
Ферментативні властивості показані в табл. 25.
Токсиноутворення. Збудник продукує складний за антигенним і хімічним
складом токсин, що включає кілька фракцій: а-гемолізину, 0-гемолізнну,
0-токснну (некротоксину), є-токсину (нейротокснну) та ентеротоксину, С. рет-
Їгіп£еп5 утворює протеїназу, плазмін, колагеназу, гіалуронідазу, ненраміні-
дазу. дезоксирибонуклеазу.
Антигенна структура. С реґігіпцепх має шість сероварів: А, В, С, О,
Е, Р, які різняться між собою серологічно і специфічністю своїх токсинів
Серовар А живе в кишках людини в природних умовах і є збудником ана-
еробної інфекції, коли проникає парентеральним шляхом; серовар О спричиняє
інфекційну ентеротоксемію у людей і тварин; серовар Е — некротичний енте-
рит у людей.
Патогенність для тварин. З експериментальних тварин сприйнятливі мор-
ські свинки, кролі, голуби, миші. На розтині заражених тварин, що загинули,
у місці введення утворюється набряк, помітне розплавлення тканини, скуп-
чення газу, в крові майже завжди виявляють клостридії. С. регїгіп£еп$ пато-
генна для свійських тварин, спричиняє у них низку тяжких захворювань.
СІозігісІіит поууі
Збудника відкрив Ф. Нові в 1894 р. Етіологічну роль йо го довели в 1915 р.
М. Вайнберг і К. Сеген. Щодо частості виникнення анаеробна інфекція займає
друге місце; у грунті виявляють у 64 % випадків.
Морфологія. С. поууі — крупна поліморфна паличка з округленими кінця-
ми завдовжки 4,7—22,5 мкм, завширшки 1,4—2,5 мкм. Часто розташовується
короткими ланцюжками (рис. 83, а), рухлива, перитрих, має до 20 джгутиків;
у зовнішньому середовищі утворює овальні спори, розташовані звичайно суб-
термінально, в організмі тварин і людини капсул не продукує, забарвлюється
грампоаитивно.
Культивування. С. поууі — строгий анаероб. Оптимальна температура
росту 37—45 °С (крайні границі — 15 і 50 °С), рН 7,8. У середовищі Кітта —
Тароцці росте з накопиченням газу, випаданням осаду і просвітленням сере-
довища. На глюкозокров’яному агарі утворює шорсткі колонії з трохи підня-
270
Рнс. 83 Чиста культура (а)
і глибинні колонії (б)
С. поеуі.
Рнс. 84. Чиста культура (а) і глибинні
колонії (б) С. зеріісит.
тнм центром і бахромчастими краями з зонами гемолізу (рис. 83, б). У посіві
в агарі стовпчиком розвивається у вигляді пластівчастих колоній з компакт-
ним центром і тонкими нитками, що відходять від нього.
Ферментативні властивості збудника показані в табл. 25.
Антигенна структура. С. поууі має чотири сероварн: А, В, С, В, із них
тільки серовар А є збудником анаеробної інфекції у людини.
Токсиноутворення. С. поууі серовар А продукує а, у, б, є-токснни, се-
ровар В — а-, Р-, £-, тртокснн; серовар С слабкотокснгенннй, у культурах
виділяє активний гемолізин, що має властивості фосфоліпази.
Патогенність для тварин. Прн підшкірному введенні культури кролям,
білим мишам, морським свинкам, голубам виникає драглистий, желеподібний
набряк, звичайно без пухирців газу. На розтині набрякла тканина безбарвна
або трохи гіперемійована, помітна незначна зміна м’язів.
С1о$(гісііит $ерІісит
Збудник виділений у 1877 р. Л. Пастером і Ж- Жубером із крові корови.
У 1881 р. Р. Кох довів, що цей мікроорганізм спричиняє злоякісний набряк.
У грунті трапляється у 80 % досліджуваних проб.
Морфологія. Клостридії поліморфні, довжина їх коливається від 3,1 до
14,1 мкм, товщина — від 1,1 до 1,6 мкм, трапляються і ниткоподібні форми до
50 мкм завдовжки (рис. 84, а). Мікроорганізми рухливі, пернтрихн, в організмі
тварин не продукують капсул, спори їх розташовуються центрально або
субге р м і на.'і ь по, грампозитивні
Кутьт нвунання. Клостридії злоякісного набряку —строгі анаероби, тем-
пературний оптимум росту 37—45 °С, рН середовища 7,6 Добре розвива-
ються ь ЧІ1Б і на МПА з додаванням 0,5 % розчину глюкози. На глюкозо-
кров’яному агарі утворюють сушльнин ніжний наліт у вигляді химерно пере-
плетених ниток на тлі гемолізу. В агарі стовпчиком колонії мають вигляд клуб-
ків вовни (рнс. 84, б). У бульйоні спричиняють рівномірне помутніння з на-
сіепним випаданням пухкого білуватого слизистого осаду.
Ферментативні властивості С. черіісигп показані в табл 25.
Токсиноутворення. Збудник злоякісного набряку виробляє летальний
екзотоксин, який некротнзує токсин, гемотоксин, гіалуронідазу, иейраміиі-
даз^. колагеназу
Гемолітичні властивості проявляються щодо еритроцитів людини, коней,
барана, кроля і морської свинки.
Антигенна структура. За допомогою РА у С ^еріісит виявлено шість
сероварів на основі відмінностей Н-аитигеиів Має спільні антигени з С. сітаи-
уоєі, яка спричиняє анаеробну інфекцію у тварин.
27»
Патогенність для іварин. Із свійських тварин сприйнятливі комі, вівці,
свині, велика рогата худоба Заражені морські свинки гинуть через 18—
48 год У мазках-відбитках із зрізів печінки загиблих тварни можна виявити
довгі зігнуті ннткн, що складаються з С зеріісит.
СІозігісІІигп Ьізіоіуіісит
Збудник виділений у 1916 р. М. Вайнбергом та Е. Сегеном. Це грампози-
тивна, рухлива паличка завдовжки 1,6—3 мкм і діаметром 0,6—1 мкм, утво-
рює овальні спори, розташовані субтермінально. С. Ьізіоіуіісит має власти-
вість продукувати колагеназу, иротеїназу і діалізабельний токсин, які роз-
плавляють тканини зараженого організму. При внутрішньовенному введенні
тваринам екзотоксин спричиняє лізис 0-клітин підшлункової залози, в резуль-
таті чого швидко настає смерть
СІозігісііит сііНісіІе
Грампозитивні палички завдовжки 3,1—6,4 мкм і завширшки 1,3—
1,6 мкм, рухливі, перитрихи, спори овальної форми, розташовані термінально.
На живильних середовищах ростуть при температурі 30—37 (25—45 °С).
Культуральні і ферментативні властивості показані в табл. 25.
С. діИісіІе утворює токсин А (ентеротокснн) і токсин В (цитотоксин), які
спричиняють геморагії у сліпій кишці.
Після тривалого перорального приймання антибактеріальних препаратів
у кишках людини, інфікованої С. діИісіІе, утворюються резистентні штами, що
продукують некротнзуючнй екзотоксин, який спричиняє псевдомембранозний
коліт із тяжким перебігом.
Патогенез захворювання у людини. Анаеробна інфекція характери-
зується різноманітністю клінічних проявів, які залежать від кількості
патогенних анаеробних видів та їх супутників — непатогенних або
умовно-патогенних анаеробних і аеробних бактерій у‘певних асоціаціях,
що відображують складний процес паразитоценозу, характер рани,
імунологічний стан організму.
Для розвитку збудників анаеробної інфекції, що проникли в орга-
нізм, потрібні некроз або ушкодження тканини, а також стан анаеро-
біозу, зумовлений наявністю некротизованих клітин ураженої ділянки
та аеробної мікрофлори. Надалі некроз здорової тканини спричиняють
патогенні анаероби. Цей процес особливо інтенсивно розвивається
у м’язовій тканині, що містить багато глікогену. Перша фаза інфек-
ційного процесу характеризується утворенням набряку, друга — ган-
греною м’язової і сполучної тканин.
Екзотоксини, що продукуються клостридіями анаеробної інфекції,
крім руйнування м’язової і сполучної тканин зумовлюють явища ін-
токсикації. Екзотоксини збудників анаеробної інфекції мають потен-
ціюючу дію.
В результаті звуження судин під дією токсинів, набряку і газо-
утворення шкіра стає блідою і блискучою, а потім бронзовою, темпе-
ратура її в уражених тканинах знижується. Глибоких змін зазнають
підшкірна жирова клітковина, м’язова і сполучна тканини, розви-
ваються дегенеративні зміни внутрішніх органів.
У патогенезі анаеробної інфекції важливу роль відіграють і збуд-
ники анаеробної інфекції, що мають високу інвазійність. Велике зна-
чення у розвитку захворювання має стан реактивності макроорганізму
(травма, супровідні захворювання і т. д.).
£72
Токсикоінфекції або інтоксикації, пов’язані з уживанням харчо-
вих продуктів (бринза, молоко, свіжий сир, ковбаса, риба та ін.),
сильно інфікованих С. рег(гіп£еп$, характеризуються коротким інку-
баційним періодом (2—6 год), поносом, блюванням, головним болем,
нормальною або підвищеною (до 38 °С) температурою тіла, ознобом,
слабкістю діяльності серця, судорогами литкових м’язів. Крім того,
можуть розвинутись плеврит, холецистит, гангренозний апендицит,
сепсис та ін.
Імунітет. При анаеробній інфекції несприйнятливість пов’язана
головним чином з наявністю антитоксинів до збудників ранової інфек-
ції, що найчастіше трапляються. При достатній кількості антитоксину,
наприклад проти а-токсину С. регігіп£еп$, лецитиназна активність
цього збудника анаеробної інфекції цілком зникає.
Реакція між токсином і антитоксином значною мірою залежись
від наявності лецитину, який є субстратом для діяння токсину. До-
давання антитоксину через деякий проміжок часу після взаємодії ток-
сину з лецитином не приводить до нейтралізації лецитинази і лише
трохи сповільнює реакцію. Певну роль відіграє й антибактеріальний
фактор, оскільки в патогенезі анаеробної інфекції має значення і стан
бактеріемії.
Лабораторна діагностика. Об’єктами дослідження є шматочки ура-
женої і некротизованої тканини, випіт при набряках, перев’язуваль-
ний і шовний матеріал (хірургічний шовк, кетгут), одяг, грунт та ін.
Дослідження ведуть етапами: 1) мікроскопія виділень із рани для
виявлення клостридіїв і капсул у С. регігіп^елз; 2) виділення чистої
культури та її ідентифікація щодо морфології клостридіїв, капсуло-
утворення, рухливості, зсідання молока, розрідження желатини, фер-
ментації вуглеводів (див. табл. 25); 3) зараження білих мишей фільтра-
тами бульйонної культури або кров’ю хворих для виявлення токсину;
4) нейтралізація токсину антитоксином у дослідах на білих мишах.
Лікування і профілактика передбачають такі заходи: 1) хірур-
гічну обробку ран; 2) раннє введення з профілактичною метою полі-
вапентної антитоксичної очищеної або концентрованої сироватки «Діа-
ферм-3» проти С. регГгіп£еп$, С. поууі та С. зеріісит по 10 000 МО,
з лікувальною метою дозу сироватки збільшують у 5 раз (по 50 000
МО кожного серовару); 3) застосування для боротьби з рановою інфек-
цією антибіотиків, антистафілококової плазми, антисгафілококового
гамма-глобуліну.
Лікування тільки антитоксичною сироваткою в ряді випадків не
дає потрібного ефекту, тоді як комплексне застосування антитоксич-
ної сироватки й антибіотиків, які змінюють дисперсійні і дифузні
властивості екзотоксинів, значно знижує летальність.
Профілактика псевдомембранозного коліту полягає у припиненні
введення антибіотиків з селекціонуючими властивостями.
Як додаткові терапевтичні засоби застосовують оксигенотерапію,
переливання крові, введення інгібіторів протеолітичних ферментів
(протеаз), препаратів, які нормалізують обмін речовин.
Методи специфічної активної профілактики ще в стадії роз-
робки.
273
ПАТОГЕННІ МІКОБАКТЕРІЇ
До роду МусоЬасіегіигп родини МусоЬасіегіасеае належать бакте-
рії, що характеризуються здатністю до розгалуження, кислото-,
спирто- і лугостійкістю (збудники туберкульозу, лепри), і низка кис-
лотостійких сапрофітів, виявлених в організмі людини, холоднокров-
них, а також на різних злаках, у грунті, гною, молоці, маслі та ін.
ЗБУДНИКИ ТУБЕРКУЛЬОЗУ
Мікобактерії туберкульозу (МусоЬасіегіигп іиЬегсиїозіз) людини відкрив
у 1882 р. Р. Кох. Цей же вчений розробив питання патогенезу й імунітету.
Важливою подією було виготовлення живої вакцини проти туберкульозу,
завдяки чому стало можливим широке здійснення специфічної профілактики.
Введення у практику антибіотиків та інших протитуберкульозних препаратів
озброїло сучасну медицину могутніми засобами боротьби з туберкульозом.
Морфологія. Мікобактерії туберкульозу — тонкі прямі або трохи
зігнуті палички завдовжки 1—4 мкм і завширшки 0,3—0,6 мкм, іноді
з незначним здуттям на кінцях, нерухомі, грампозитивні, не утворю-
ють спор і капсул, поліморфні (див. форзац, рис. VI, а). Виявлено
паличкоподібні, ниткоподібні, гіллясті, кокоподібні, фільтрівні та
Ь-форми мікобактерій. У зв’язку з високим вмістом міколової кисло-
ти мікобактерії туберкульозу погано забарвлюються звичайними ме-
тодами, але добре — за Цілем — Нельсеном (див. форзац, рис. VI, в).
Основними особливостями збудників туберкульозу — М. ІиЬег-
сиіозіз, М. аігісапз (проміжний вид) і М. Ьоуіз — е кислотостійкість
і повільний ріст на живильних середовищах. Кислотостійкість пояс-
нюється наявністю у туберкульозних мікобактерій великої кількості
міколової кислоти і ліпідів.
Доведено існування фільтрівних форм туберкульозних мікобакте-
рій; при введенні в організм морської свинки вони перетворюються
у типові кислотостійкі і видимі в світловий мікроскоп бактерії, які
можуть спричиняти генералізований інфекційний процес. Виявлено
також абацнлярні С-форми (дрібні утворення), які здебільшого вини-
кають за несприятливих умов. Цитоплазма молодих культур гомогенна,
старих — зерниста.
Серед туберкульозних мікобактерій є зернисті кислотоподатливі
форми, які забарвлюються за Грамом у фіолетовий колір,— зерна
Аіуха і кислотостійкі фрагменти мікобактерій туберкульозу — осколки
Шпленгера.
Культивування. Мікобактерії туберкульозу — аероби, оптимальна
температура їх росту 37 °С, крайні температурні границі 24—42 °С,
реакція середовища майже нейтральна (рН 6,4—7,0), можуть рости
при діапазоні рН 6,0—8,0. Збудник туберкульозу росте на елективних
середовищах: зсілій сироватці крові, гліцериновому агарі, гліцерино-
вій картоплі, у гліцериновому бульйоні та яєчних середовищах (Пет-
рова, Петраньяні, Дерсе, Левенштейна — Йєнсена, Виноградова
та ін.). їх можна культивувати в синтетичному середовищі Сотена,
що містить аспарагін, гліцерин, цитрат заліза, фосфат калію та інші
речовини.
274
Мікобактерії туберкульозу потребують відповідної концентрації
вітамінів (біотин, нікотинова кислота, рибофлавін та ін.). На гліце-
риновому (2—3 %) агарі ледь помітний ріст їх спостерігається через
8—10 діб після висівання, а через 2—3 тижні утворюється сухий наліт
блідо-жовтого кольору. Оптимальний ріст (на 6—8-му добу) мікобак-
терії туберкульозу спостерігається на яєчному середовищі Петрова,
що складається з яєчного жовтка, м’ясного екстракту, агару, гліце-
рину та генціанового фіолетового.
На густих живильних середовищах утворюються шорсткі підви-
щені густі колонії з потовщеною або зморшкуватою поверхнею і тон-
кими нерівними краями. У гліцериновому (4—5 %) агарі мікобактерії
туберкульозу через 10—15 діб утворюють тонку ніжну плівку, яка
поступово потовщується, стає ламкою, набираючи горбисто-зморшкува-
того вигляду і жовтуватого кольору; бульйон залишається прозорим.
Колонії мікобактерій туберкульозу дисоціюють із типових К-форм
в атипові 8-форми. Окремі штами в старих культурах виробляють
жовтий пігмент.
Хімічна структура. Мікобактерії туберкульозу складаються з ту-
беркулополісахаридів, які надають їм властивостей антигенів або
гаптенів; туберкулопротеїнів, що беруть участь в імунних процесах
та алергічних реакціях; туберкулоліпідів і восків, що локалізовані
в клітинних стінках і відповідають за високу резистентність до фізич-
них та хімічних діянь і вірулентність, забезпечують захист мікобакте-
рій від фагоцитозу, повільний ріст у живильних середовищах і кисло-
тостійкість. За розчинністю в органічних речовинах воски поділяють
на 4 фракції (А, В, С, О), що містять ефіри, міколову кислоту та інші
компоненти. Із них на особливу увагу заслуговує корд-фактор (трега-
лоза-6, диміколат), який не має імуногенності, але виконує функцію
гаптену, зумовлює вірулентність, склеювання мікобактерій та їх
ріст у вигляді кіс і джгутиків. Корд-фактор мікобактерій туберкульо-
зу руйнує мітохондрії клітин інфікованого організму, порушує фун-
кцію дихання і фосфорилювання, пригнічує міграцію лейкоцитів,
спричиняє утворення хронічних гранулем.
Ферментативні властивості. У мікобактерій туберкульозу виявлено
протеолітичні ферменти, які розщепляють білок у лужному і кислому
середовищах: вони ферментують алкоголь, гліцерин і численні вугле-
води, лецитин, фосфатиди, сечовину, мають редукуючу властивість,
розщепляють оливкову, касторову олію тощо.
Токсиноутворення. Мікобактерії туберкульозу не продукують ек-
зотоксин. Вони містять токсичні речовини, що вивільняються при
розпаді клітин.
Р. Кох у 1890 р. добув із туберкульозних мікобактерій туберкулін.
Є кілька препаратів туберкуліну. Старий туберкулін Коха — ЛТК (АІЬІи-
Ьегсиїіп Косії) —фільтрат 6—8-тнжневої культури мікобактерій у гліцерино-
вому бульйоні, згущеному до 1/10 початкового об’єму. Новий туберкулін Ко-
ха — висушені мікобактерії’ туберкульозу, розтерті в 50 % гліцерині до утво-
рення гомогенної маси. Туберкулін із мікобактерій бичачого виду містить про-
теїни, жирні кислоти, ліпіди, нейтральні жири, кристалічний алкоголь. Крім
того, є препарати туберкуліну, вільного від баластних речовин,— РРБ (Ригі-
Гіес! Ргоіеіп Оегіуа(іуе) і РТ (Ригіїісаіит ТиЬегсиїіпит).
275
Велике значення в патогенезі туберкульозу мають жирні кислоти
(масляна, пальмітинова, туберкулостеаринова, олеїнова), вони сприя-
ють сирнистому переродженню, рошадові клітинних елементів, спри-
чиняють блокаду ферментів (ліпази, протеази).
У невеликих дозах туберкулін не спричиняє змін у здорових мор-
ських свинок; при введенні 0,1 мл стандартного препарату 50 % мор-
ських свинок, хворих на туберкульоз, гинуть.
Токсин мікобактерій туберкульозу складається з альбумінів і нук-
леопротеїдів. Із вірулентних мікобактерій туберкульозу виділено
фосфатиди, які можуть спричиняти характерні зміни у кролів. Най-
більш активна із фосфатидів фтіонова кислота.
При кип’ятінні з вазеліновим маслом із мікобактерій туберкульозу
добуто дуже токсичні речовини, які в тисячних частках міліграма згуб-
но діють на морських свинок.
Вірулентні мікобактерії на відміну від невірулентних містять бага-
то полісахаридних компонентів.
Антигенна структура. Реакціями аглютинації і зв’язування ком-
плементу доведено, що людський вид мікобактерій серологічно не
відрізняється від бичачого і мишачого видів. Антигени мікобактерій
туберкульозу спричиняють вироблення у низьких титрах аглютинінів,
опсонінів, преципітинів і комплементзв’язуючих антитіл. Високомоле-
кулярний туберкулін при діянні на інфікований туберкульозом
організм спричиняє місцеву, вогнищеву і загальну алергічну
реакції.
Антиген мікобактерій туберкульозу містить протеїни, ліпіди,
особливо багато в ньому фосфатидів і полісахаридів.
Туберкулін широко використовують для відтворення алергічної
проби, за допомогою якої визначають зараженість мікобактеріями
туберкульозу.
Виявлено атипові кислотостійкі мікобактерії, які утворюються
під впливом антибактеріальної терапії і захисних механізмів інфіко-
ваного макроорганізму.
Резистентність. Збудники туберкульозу порівняно з іншими бак-
теріями, які не утворюють спор, більш стійкі проти дії зовнішніх
факторів.
У проточній воді мікобактерії туберкульозу зберігаються понад
12 місяців, у вершковому маслі — 8 місяців, сирі — 6,6 місяця,грунті
і гною — до 6 місяців, на аркушах книг — понад 3 місяці, у висуше-
ному мокротинні — 2 місяці, шлунковому соку — 6 год. Вони легко
знешкоджуються при температурі 100—120 °С, чутливі до сонячного
випромінювання.
Патогенність для тварин. Туберкульоз — інфекція, дуже поши-
рена серед великої рогатої худоби, курей, індиків та ін.; рідше хво-
ріють свині, дрібна рогата худоба.
Щодо людського виду мікобактерій туберкульозу досить стійка
велика і дрібна рогата худоба, дуже чутливі морські свинки, зара-
ження яких звичайно закінчується генералізованою інфекцією і за-
гибеллю тварин; при зараженні кролів розвивається хронічний тубер-
кульоз.
276
Бичачий вид мікобактерій туберкульозу патогенний для багатьох
видів свійських ссавців (корови, вівці, кози, свині, коні, коти, собаки)
і диких тварин. Кролі, морські свинки при зараженні захворюють на
гострий туберкульоз.
Велика і, рідше, дрібна рогата худоба може хворіти на паратубер-
кульоз (хронічний специфічний гіпертрофічний ентерит), що спричи-
няється М. рагаіиЬегсиїозіз.
Збудник мікобактеріозу — М. ауіит — спричиняє захворювання
у курей, індиків, цесарок, павичів, фазанів, голубів, а також водо-
плавної птиці. У природних умовах можуть заражатися збудником
мікобактеріозу і хворіти свійські тварини (коні, свині, кози, рідше
велика рогата худоба), а в деяких випадках і люди.
З експериментальних тварин до збудника мікобактеріозу дуже
сприйнятливі кролі, які при зараженні малими дозами захворюють
на генералізований мікобактеріоз. Морські свинки порівняно стійкі;
підшкірне введення культури спричиняє у них ураження лімфатич-
них вузлів з утворенням вогнищ сирнистого (казеозного) некрозу.
Мишачий вид мікобактерій туберкульозу дуже патогенний для полі-
вок. У кролів і морських свинок при штучному зараженні цим видом
мікобактерій розвивається хронічний туберкульозний процес.
Патогенез захворювання у людини. У людей туберкульоз спричи-
няється двома основними видами мікобактерій (табл. 26) — людським
(М. ІиЬегсиІозіз) і бичачим (М. Ьоуі$). Найчастіше (понад 90 % випад-
ків) зараження відбувається М. іиЬегсиїозіз і тільки в 3—5 % випад-
ків — М. Ьоуіз.
Таблиця 26. Диференціація основних видів мікобактерій
Вид бактерій У творення Спричинювані захворювання
і пірацнна- мідазн ніацнну
М. ІиЬегсиІОБІз М. Ьоуіб М. Іергае + + 1 + + + Туберкульоз у людини, людиноподіб- них мавп, тварин, які контактують з хворою людиною Туберкульоз у свійських і диких тварин, людини і людиноподібних мавп Лепра у людини
Примітка. (+) — наявність відлові дної ознаки; (—) — відсутність ознаки.
Зараження туберкульозом відбувається повітряно-краплинним
і повітряно-пиловим шляхом, іноді перорально (при вживанні харчо-
вих продуктів, інфікованих мікобактеріями туберкульозу), через
шкіру і слизові оболонки; можливе також внутрішньоутробне інфіку-
вання плода через плаценту.
При аерогенному зараженні первинне інфекційне вогнище розви-
вається в легенях, а при аліментарному — у брижових лімфатичних
вузлах. При низькій опірності організму і за несприятливих умов
277
праці та побуту з місця первинної локалізації збудник може розповсю-
джуватись по всьому організму і спричиняти генералізовану інфекцію.
Найхарактерніший ексудативний тип ураження, прн якому спостеріга-
ються гостра запальна реакція, розвиток набряку, скупчення навколо міко-
бактерій поліморфно-ядерних лейкоцитів і моноцитів Звичайно процес закін-
чується видужанням, але іноді в легеневій тканині утворюються ділянки
некрозу.
Продуктивний тип запалення характеризується утворенням гранулем, що
складаються із скупчень крупних багатоядерних гігантських клітин, які мі-
стять мікобактерії туберкульозу, а також епітеліодних клітин, фібробластів,
лімфоцитів і моноцитів. В результаті по периферії гранулеми розвивається
фіброзна тканина, а центральна зона зазнає сирнистого некрозу. Таке вогнище
ураження називають туберкульозним горбком, він може прориватися в просвіт
бронха, після чого утворюється порожнина (каверна), яка заповнюється фіб-
розною тканиною або обвапновується.
Інкубаційний період при туберкульозі порівняно тривалий — від
кількох тижнів до кількох років.
За сприятливих умов життя і якщо немає обтяжливих факторів
первинний туберкульоз характеризується доброякісним перебігом
і звичайно закінчується розсмоктуванням і рубцюванням вогнищ сир-
нистого некрозу, навколо яких утворюється сполучнотканинна кап-
сула, що просочується солями кальцію. Проте доброякісний кінець
первинного інфекційного вогнища не завершується повним звільнен-
ням організму від збудників. Близько 80 % людей інфіковані міко-
бактеріями туберкульозу, але на туберкульоз не захворюють.Частість
інфікованості людей залежить від рівня захворюваності, соціальних
умов та організації лікувальних і профілактичних заходів, що здій-
снюються органами охорони здоров’я.
У лімфатичних вузлах, інших тканинах та органах первинного
інфекційного вогнища мікобактерії туберкульозу зберігаються багато
років, іноді протягом усього життя. Для інфікованих осіб характерна,
з одного боку, наявність відносного імунітету, а з другого — потен-
ціально прихованої форми туберкульозу, яка може активізуватися
під впливом інших інфекційних захворювань, психічних і фізичних
травм.
При діянні лікарських засобів та імунобіологічних факторів
організму досить часто утворюються Ь-форми, що мають властивість
зазнавати реверсії у типові мікобактерії.
У ряді випадків в раніше не інфікованих і не прищеплених осіб
первинний туберкульоз має досить тяжкий перебіг і дає порівняно
високу летальність, особливо при масивному зараженні в результаті
контакту з хворими — видільниками вірулентних мікобактерій.
Вторинний туберкульоз (ендогенна інфекція) спричиняється міко-
бактеріями, що збереглися у первинному вогнищі, характеризується
утворенням хронічних вогнищ ураження у вигляді туберкульозних
горбків, казеозного некрозу і фіброзу.
Серед осіб, що зазнали екзогенної суперінфекції, захворюваність
на вторинний туберкульоз зростає в 3—5 раз. Перебіг захворювання
більш тяжкий, ніж при загостренні первинного туберкульозу. В разі
вторинного туберкульозного процесу утворюються нові вогнища в лім-
278
фатичній системі, підвищуються сенсибілізація і сумація подразнень,
що виникли в результаті дії на організи патогенних мікобактерій.
Найбільш сприйнятливі до інфекції особи похилого і старечого віку.
Туберкульоз характеризується різноманітністю клінічних форм,
анатомічних змін, компенсаторних процесів та закінчення. Можлива
генералізація туберкульозного процесу з ураженням сечостатевих
органів, кісток, суглобів, мозкових оболонок, шкіри, очей.
Поряд з типовими патогенними видами мікобактерій туберкульозу
(М. іиЬегсиІозіз, М. Ьоуіз) виділені і вивчені умовно-патогенні міко-
бактерії. До них належать М. капзазіі (спричиняють хронічний тубер-
кульоз легень, дисемінований туберкульозний процес, ураження
суглобів, нирок, мозкових оболонок, шкіри), М. іпігасеїІиіаге (ура-
ження лімфатичних вузлів, нирок, суглобів, мозкових оболонок і шкі-
ри); М. зіпііае та М. ауіит (ураження легень); М. згиі^иі (ураження
легень, лімфатичних вузлів, шкіри); М. хепорі (ураження сечостатевих
органів і шкіри); М. иісегапз і М. тагіпит (хронічне ураження шкіри);
М. зегоГиІІасеит (ураження лімфатичних вузлів у дітей, рідше ура-
ження легень).
Умовно-патогенні мікобактерії характеризуються вираженим по-
ліморфізмом. Розпізнавання їх грунтується на виділенні культури та
диференціації її за всіма ознаками.
Імунітет. Людина має природну резистентність до туберкульозної
інфекції. Доведено, що з усіх інфікованих (близько 80 % усього дорос-
лого населення віком понад 20 років) захворюють не більше 10 %,
причому тільки 5 % — безпосередньо після інфікування.
Імунітет при туберкульозі нестерильний, його в широких масшта-
бах відтворюють штучним способом (введення вакцини БЦЖ). Набу-
тий імунітет є наслідком активації Т-лімфоцитів за допомогою антиге-
нів мікобактерій туберкульозу. При вакцинації БЦЖ і під впливом
антигенів мікобактерій туберкульозу настає проліферація Т-лімфоци-
тів, виділення лімфокінів (інтерлейкін 3 та ін.), інтерферону, утво-
рення медіаторів клітинного імунітету, що має провідну/роль у фор-
муванні опірності організму до туберкульозної інфекції; макрофаги
продукують монокіни, інтерлейкін 1, фактор С8Р (соїоііузіітиіаіігу),
які активують Т-лімфоцити.
У сироватці крові хворих на туберкульоз можна виявити аглюти-
ніни, преципітини, опсоніни, лізини і комплементзв’язуючі антитіла,
хоч наявність їх не свідчить про напруженість імунітету. Фагоцитарна
реакція також не визначає стану несприйнятливості, оскільки фаго-
цитоз при туберкульозі нерідко незавершений. Внаслідок внутрішньо-
клітинної локалізації мікобактерії туберкульозу захищені від дії
інгібіторів інфікованої туберкульозом людини і лікарських засобів.
Певну роль у формуванні імунітету відіграє інтерференція між
мікобактеріями туберкульозу, штамами БЦЖ та іншими невірулент-
ними мікобактеріями, здатними блокувати чутливість клітин тканин
і органів до вірулентних мікобактерій.
Певне значення має і генетичний фактор. Роль алергії в розвитку
імунітету точно не визначена, з цього приводу є різні точки зору
(див. с. 171).
279
Лабораторна діагностика. Мікроскопія мазків. Матеріалом для до
слідження е мокротиння або гній, спинномозкова рідина або плевраль-
ний випіт, сеча, випорожнення, пунктат лімфатичних вузлів та ін.
Приготовані мазки забарвлюють за методом Ціля — Нельсена (див.
форзац, рис. VI, в). Для накопичення мікобактерій мокротиння оброб-
ляють методами збагачення. Добрі результати дає люмінесцентна
мікроскопія з аураміном.
Для виділення чистої культури оброблене мокротиння, гній, за-
вись паренхіматозних органів від трупів та інші матеріали висівають
на одне з названих вище живильних середовищ. Інструкція ВООЗ ре-
комендує як стандартне середовище для первинного вирощування
мікобактерій туберкульозу яєчне середовище Левенштейна —
Йєнсена.
Застосовують також метод мікрокультур Прайса, який дає змогу
дістати культуру мікобактерій туберкульозу в коротші строки. Віру-
лентні мікобактерії через 2—3, максимум через 7—10 діб, у мікро-
культурах утворюють звиті тяжі (див. форзац, рис. VI, б).
Виділені мікобактерії туберкульозу випробовують на чутливість
до лікарських засобів, які додають у рідкі або густі живильні сере-
довища в різних концентраціях.
Біологічний метод. При зараженні морських свинок на місці вве-
дення матеріалу утворюється інфільтрат, збільшуються лімфатичні
вузли, розвивається генералізований туберкульоз; смерть тварин
настає через 1—Р/2 місяця. На розтині у внутрішніх органах ви-
являють численні туберкульозні горбки. На 5—10-ту добу після зара-
ження досліджують пунктат із лімфатичних вузлів на наявність міко-
бактерій туберкульозу, з 3—4-го тижня зараженим тваринам став-
лять туберкулінову пробу. Атипові штами і Ь-форми мікобактерій
непатогенні для морських свинок.
РЗК при легеневій хронічній формі туберкульозу позитивна
у 80 %, при туберкульозі шкіри — у 20—25 % і в здорових людей —
у 5—10 % випадків.
РИГА з еритроцитами барана, навантаженими полісахаридом із
мікобактерій туберкульозу або туберкуліном, дає змогу виявити спе-
цифічні антитіла у сироватці крові хворих на туберкульоз.
Внутріиіньоіикірну туберкулінову пробу Манту застосовують
для визначення інфіковаиості населення мікобактеріями туберкульозу,
відбору осіб, що підлягають вакцинації БЦЖ, установлення її ефек-
тивності та оцінки перебігу туберкульозного процесу.
Лікування. Застосовують протитуберкульозні хіміотерапевтичні
препарати. Найбільш ефективні з них становлять групу І (ізоніазид,
етамбутол, стрептоміцин, рифампіцин, протіонамід та ін.). При засто-
суванні цих препаратів внаслідок їх токсичності треба здійснювати
медичний контроль, особливо у вагітних жінок і дітей. Лікування
тривале (не менше року).
Комплекс лікувальних заходів охоплює десенсибілізацію організ-
му туберкуліном та іншими препаратами, а також раціональне харчу-
вання, вітаміно- й аеротерапію, лікувальну фізкультуру, курортне
лікування. В окремих випадках доцільне хірургічне втручання.
280
Профілактика забезпечується ранньою діагностикою, своєчасним
виявіенням хворих на атипові форми туберкульозу, диспансеризацією
населення, знезаражуванням молока і м’яса хворих тварин і здій-
сненням соціальних заходів (поліпшення умов праці і побуту насе-
лення, підвищення його матеріального і культурного рівня). І
Велике значення для профілактики іуберкульозу має активна
імунізація людей, яка зумовлює значне зменшення захворюваності,
зниження тяжкості перебігу хвороби і летальності. В результаті
активної імунізації знижується чутливість організму до дії мікобакте-
рій туберкульозу і продуктів їх розщеплення, стимулюються пронеси
фіксування і знешкодження збудника, підвищується біохімічна ак-
тивність тканин і посилюється вироблення антибактеріальних речовин.
Імунізація зумовлює створення клітинного (інфекційного) імунітету.
Дтя активної імунізації застосовують спеціальну суху вакцину
БЦЖ, яку вводять новонародженим (на 5—7-й день життя) внутріш-
ньошкірно у ділянку зовнішньої поверхні лівого плеча. Ревакцинацію
роблять у 7, 11—12, 16—17 років і 22—23 роки. Поствакпинальний
імунітет розвивається через 3—4 тижні і зберігається від 1—1х/2року
до 15 років.
ЗБУДНИК ЛЕПРИ
Збудника лепри — МусоЬасіегіит Іергае — описав у 1874 р. Г. Гансеи.
Морфологія. Мікобактерії лепри — внутрішньоклітинні паразити, мають
багато спільних властивостей з мікобактеріями туберкульозу. Це прямі або
злегка зігнуті палички, іноді трапляються форми з булавоподібним здуттям
і зернисті. Довжина мікобактерій лепри 1—8 мкм, ширина 0,3—0,5 мкм. У клі-
тинах розташовуються найчастіше групами у вигляді пачок сигар або скуп-
ченнями у вигляді куль.
Знебарвлюються легше, ніж мікобактерії туберкульозу, нерухомі, не утво-
рюють спор і капсул, грампозитивні.
Мікобактерії лепри .мають поліморфізм. Серед типових особин трапляють-
ся довгі, короткі і тонкі мікроорганізми, а також крупніші, здуті, зігнуті, роз-
галужені, сегментовані, дегенеративні (розпадаються на зерна). Сферичні фор-
ми оточені оболонкою, деякі з цих куль містять велику кількість паличок
і дрібних кокоподібиих утворень.
За хімічним складом мікобактерії лепри схожі на мікобактерії туберкульо-
зу. Кількість ліпідів у них коливається в межах 9,6—18,6 %. Крім міколової
кислоти, вони містять лепрозинову оксикислоту, вільні жирні кислоти, віск
(лепрозин), алкоголі, полісахариди.
Культивування. Збудник лепри не росте на живильних середовищах, що
застосовуються для вирощування мікобактерій туберкульозу.
У 1969—1977 рр. американські вчені розробили метод культивування
мікобактерій лепри в організмі армаднл (дев’ятипоясних броненосців). У тварин
після зараження патологічним матеріалом, узятим від людей, хворих на лепру,
утворюється величезна кількість типових гранулем. Внаслідок порівняно не-
високої (ЗО—35 °С) температури тіла армадил у них пригнічует. ся клітинний
імунітет проти мікобактерій лепри Введення'шматочків лепром у колоїдних
мішечках у черевну порожнину тварин спричиняє утворення найрізноманітні-
ших форм мікобактерій лепрн (капсульні, зернисті, кокові, спороиодібні,
паличкоподібні, ниткоподібні, Ь-формн).
Ферментативні властивості. Виявлено дифенолоксидазу, що бере участь
у розмноженні мікобактерій лепри, дихальні ферменти (пероксидаза, цптохро-
моксидаза, дегідрогеназа та ін )
Токсиноутворения. Мікобактерії лепри екзотоксин не продукують. Оче.
видно, вони утворюють ендотоксин і алергени. Труднощі вивчення токсино.
281
утворення пов'язані з тим, шо протягом більш як 100 років не було виявлено
експериментальної тварини, чутливої до мікобактерія лепри.
Антигенна структура і класифікація. У мікобактерій лепри виявлено два
бактеріальних аитиіени: термостабільний (полісахарид) і термолабільний
(протеїн) з вираженою специфічністю.
Резистентність мікобактерій лепрн дуже висока. У трупах людей вони збе-
рігаються тривалий час. Поза людським організмом життєздатність їх швидко
втрачається.
Патогенність для тварин. Відомі лепроподібні захворювання у пацюків,
буйволів, деяких видів птахів, що істотно відрізняються від лепри у людини.
Експериментальні тварини порівняно легко заражуються після опромінювання
і видалення загрудииної залози.
Досить докладно вивчено лепру пацюків, яку спричиняють М. Іергаети-
гіит. У пацюків захворювання має хронічний перебіг з ураженням лімфатич-
них вузлів, шкіри, внутрішніх органів, утворенням інфільтратів, виразок,
випаданням шерсті. При лікуванні лепри пацюків ефективні протитуберкульоз-
ні препарати. Це ,.ає підс.ави вважати, що М. Іергае в генетичному відношенні
близька до мікобактерій туберкульозу і паратуберкульозу.
Патогенез захворювання у людини. Джерело інфекції — хвора людина.
Збудник лепри передається повітряно-краплинним шляхом, зараження відбу-
вається через носову частину глотки, ушкоджену шкіру, предмети. Однак інфі-
кування настає головним чином при тісному й тривалому спілкуванні здорових
осіб з хворими на лепру.
Мікобактерії лепри, потрапивши в організм через шкіру і слизові обо-
лонки, проникають у клітини різних органів і тканин, потім вони потрапля-
ють у лімфатичні і кровоносні судини й поступово дисемінують. При високій
резистентності організму мікобактерії лепрн здебільшого гинуть. У ряді ви-
падків інфікування призводить до розвитку латентної форми лепри, яка за-
лежно від опірності організму може тривати протягом усього життя і, як
правило, закінчується загибеллю збудника. Однак за несприятливих умов жит-
тя таких людей латентна форма переходить в активну, що призводить до роз-
витку захворювання. Інкубаційний період триває від 3—5 до 20—35 років.
Захворювання має хронічний перебіг.
За клінічними проявами лепру поділяють на три типи: лепроматозний, ту-
беркульозний, неднференційованнй.
Лепроматозний тип характеризується мінімальною опірністю організму
проти наявності, розмноження і розповсюдження збудника, а також постійною
присутністю мікобактерій у місцях ураження.
Туберкульозний тип відзначається високою опірністю організму проти
розмноження і розповсюдження мікобактерій лепри. У місцях ураження міко-
бактерій не виявляють або їх дуже мало тільки в період реактивного стану.
Внутрішиьошкіриа алергічна проба (реакція Міцуди) звичайно позитивна.
Недиференційований тип (невизиачеиа група) характеризується різною
опірністю організму з тенденцією до резистентності. При бактеріоскопічному
дослідженні мікобактерії лепри виявляють ие завжди.
Імунітет. За механізмом розвитку імунітет при лепрі схожий на імунітет
при туберкульозі і є клітинним. У процесі захворювання розвивається алер-
гічний стан.
В осіб з високою опірністю мікобактерії лепри фагоцитуються гістіоци-
тами, в яких вони порівняно швидко руйнуються. У таких випадках перебіг
лепри відбувається за доброякісним туберкульозним типом.
В осіб з низькою опірністю організму мікобактерії лепри розмножуються
у величезній кількості навіть у фагоцитах (незавершений фагоцитоа). У таких
хворих збудник розповсюджується по всьому організму. Розвивається тяжкий
лепроматозний тип захворювання.
При недиференційоваиому типі лепри опірність організму може змінюва-
тись від високої до низької. Відносно доброякісні ураження можуть тривати
роками, при зниженні опірності організму захворювання переходить у лепро-
матозний тип з великим вмістом мікобактерій в органах і тканинах. При поси-
ленні імунітету захворювання набуває туберкульозного типу.
282
Імунітет при лепрі пов’язаний із загальним станом макроорганізму.
У більшості випадків лепра поширена серед малозабезпеченого населення
з низьким культурним рівнем. Найбільш сприйнятливі до лепри діти.
Лабораторна діагностика. Для дослідження беруть зіскоб із слизової обо-
лонки иоса (з обох боків носової перегородки), вміст лепроматозиих вузлів
шкіри, мокротиння, виділення з виразок: у період гарячки досліджують кров.
Основним методом діагностики лепри є мікроскопічне дослідження. Мазки за-
барвлюють за методом Ціля—Нельсена.
У ряді випадків роблять біопсію лепроматозиих ділянок і пункцію лімфа-
тичних вузлів. Мікобактерії лепри розташовуються скупченнями у вигляді
пачок сигар, а в препаратах із порожнини иоса — иа зразок червоних кульок.
Для диференціації лепри з туберкульозом морських сзииок заражують
зависсю патологічного матеріалу в 0,85 % розчині натрію хлориду. В разі
туберкульозного ураження тварини досить часто захворюють і гинуть. До міко-
бактерій лепри морські свинки несприйнятливі. Для діагностики лепри вико-
ристовують РЗК і РИГА.
Внутрішньошкірну лепроміиову пробу вважають позитивною, якщо через
48—72 год на місці введення 0,1 мл лепроміну з’являються еритема і невели-
ка папула (рання реакція). До кінця першого тижня захворювання вони ціл-
ком зникають або проявляється пізня реакція, при якій через 10—14 діб на
місці ін’єкції утворюється вузличок, що досягає иа 30-й день 1—2 см і_некро-
тизується в центрі. Алергічна проба діагностичного значення не має, її вико-
ристовують для визначення клінічного типу лепрн і прогнозу.
Лікування полягає в призначенні сульфоиових препаратів (діафенілсуль-
фону, сблюсульфоиу, ацедапсоиу, димоцифоиу і діуцифону). На додаток до
основних препаратів призначають антибіотики — рнфампіции, етіонамід, про-
тіонамід, лампрен.
Механізм дії сульфонів полягає в конкурентному антагонізмі з параамі-
нобензойною кислотою, активації лізисом макрофагів; етіоиамід і протіонамід
є інгібіторами синтезу міколових кислот, порушують утворення клітинної
стінки мікобактерій лепри.
Крім того, рекомендується застосовувати десенсибілізуючі засоби і корти-
костероїди (кортизон, преднізолон), імуно- і вітамінотерапію.
Профілактика. Хворих на лепру ізолюють у лепрозоріях до клінічного
вилікування при постійному нагляді. Проводять систематичне епідеміологіч-
не обстеження ендемічних вогнищ. Членів сім’ї хворого иа лепру не рідше як
один раз на рік піддають спеціальному лікарському оглядові. Дітей, народже-
них хворою иа лепру матір’ю, ізолюють від неї і вигодовують штучно. Здоро-
вих дітей від хворих батьків вміщують у дитячі будинки або віддають на вихо-
вання родичам і обстежуть ие рідше двох раз на рік.
Лепра —спорадичне захворювання, реєструються поодинокі випадки
її у деяких регіонах. За даними ВООЗ, в усіх країнах світу в 1986 р. на-
лічувалось 1 млн хворих на лепру, із них найбільше в Азіїгта Африці.
Висока захворюваність на лепру спонукає до пошуків методів специфічної
профілактики цього захворювання. Подають надію результати від імунізації
дітей в ендемічних районах вакциною БЦЖ.
ПАТОГЕННІ АКТИНОМІЦЕТИ
Актиноміцети (грец. асііз — промінь, тусез — гриб) — одноклі-
тинні грампозитивні мікроорганізми, що входять до родини Асііпоту-
сеіасеае, Зігеріотусеіасеае. До родини Асііпотусеіасеае входять
370 видів, але тільки деякі з них є збудниками актиномікозу. До па-
тогенних актиноміцетів належать А. Ьоуіз, виявлений у 1877 р. К. Гар-
цом, і А. ізгаіііі, виділений у 1891 р. І. Ізраїлем від хворих на актино-
мікоз.
В актиноміцетів, як і в бактерій, генетичну функцію виконує
нуклеоїд.
283
Морфологія. У нитках міцелію (див.
рис. 5, а) є зерна хроматину.
Розмножуються актиноміцети пророс-
танням спор (лив. рис. 5, б), прикріплених
на спороносцях (див. рис. 5, в), простим
діленням, перешнуруванням і бруньку-
ванням.
Багато видів актиноміцетів мають вла-
стивість виробляти антибіотики.
Культивування. Актиноміцети — фа-
культативні анаероби, добре розвивають-
ся при температурі 25—ЗО °С (оптимальна
температура 35—37 °С) на звичайних сере-
довищах з рН 4,4—9,0. Вони кислотостій-
Рис. 85. Друзи патогенних
актиноміцетів.
кі, у свіжих культурах утворюють зернистість. На густих середовищах
одні види ростуть з утворенням твердих гладеньких колоній, інші
мають складчасті горбкуваті кірковидні, бархатисті, пухнасті або
борошнисті колонії, які зростаються з середовищем і з трудом зні-
маються петлею; вони можуть бути безбарвними або пігментованими
(сині, фіолетові, червоні, жовті, оранжеві, зелені і т. д.).
На густих живильних середовищах актиноміцети часто утворюють
повітряний міцелій, на кінцях якого розвиваються спори, що надають
колоніям певного забарвлення.
Питання про токсиноутворения спірне. Вважають, що патогенні
актиноміцети містять ендотоксин.
Антигенна структура. Асііпотпусез Ьоуіз належить до серогрупи
В, Асііпотусез ізгаіііі — до серогрупи О; в обох видів виявлено
серовари 1 і 2, що ідентифікуються за допомогою флюоресніюючих
антитіл.
Резистентність. Актиноміцети—дуже стійкі мікроорганізми. Вони
витримують температуру 60 °С протягом 1 год, довго зберігаються
у висушеному стані. Особливо резистентні спорн.
Патогенність для тварин. Патогенні актиноміцети уражують
велику рогату худобу, рідше — свиней, коней. Захворювання має
хронічний перебіг з утворенням запальних вогнищ і фістул.
Патогенез захворювання у людини. Джерелом зараження можуть
бути велика і дрібна рогата худоба, коні, свині, собаки, кролі, дикі
тварини, а також деякі об’єкти зовнішнього середовища (грунт,
рослини, повітря, різні відходи зернових культур). Актиномікоз
може розвинутися в результаті ендогенної інфекції в разі проникнен-
ня збудника із травного каналу. Виникненню захворювання сприяють
жування зерна злаків, наявність травм шкіри і слизової оболонки
порожнини рота, каріозні зуби.
Проникнувши в організм, збудник розповсюджується по сполуч-
нотканинних і міжм’язових прошарках, а також гематогенним і лім-
фогенним шляхом. Інфекційний процес супроводиться утворенням
інфільтратів, гнійних вогнищ, фістул, що відкриваються назовні або
всередину організму. Спочатку на місці локалізації збудника вини-
284
кають тверді флегмоноподібні інфільтрати, шкіра стає синьо-багровою
потім інфільтрати розм’якшуються і некротизуються з виділенням
гною з неприємним запахом. У гною виявляють зерна (друзи), що
складаються з ниток актиноміцетів (рис. 85). До дії патогенних акти-
номіцетів майже завжди приєднується вторинна піогенна інфекція.
За клінічним проявом розрізняють актиномікоз шийно-щелепно-
лицьовий, шкірний, шкірно-м’язовий, кістково-м’язовий, лімфатич-
них вузлів, торакальний, абдомінальний, центральної нервової систе-
ми, генералізованнй та ін.
Імунітет. В результаті перенесеного захворювання несприйнят-
ливість не виникає, можливі повторні випадки захворювання. У хво-
рих і перехворілих людей і тварин у крові утворюються аглютиніни,
преципітини, комплементзв’язуючі антитіла. В міру прогресування
захворювання розвивається алергічний стан.
Лабораторна діагностика має кілька етапів: дослідження незабар-
влених і забарвлених препаратів гною на наявність друз; висівання
гною в цукровий бульйон (рН 6.8), цукровий агар або середовище
Сабуро, культивування в аеробних і анаеробних умовах при темпера-
турі 35—37'С, виділення чистої культури та її ідентифікація (табл. 27);
РЗК із сироватками крові хворих; алергічна внутрішньошкірна проба
з екстрактами з актиноміцетів.
Таблиця 27. Диференціація патогенних видів актиноміцетів
Вид актиноміцетів Форма коло- нів Гідроліз крохмалю Ферментац ія Чут іиність до
арабінози 1 рнбозн і 2 рафіїюзи і= ц
А. Ьоуія 5 + ± 1 _|_
А. ізгаіііі К ± +1 + + -і- +
Примітка. (+) — наявність відповідної ознаки; (—) — відсутність ознаки;
(±) — непостійна наявність ознаки; 8—гладенька; К—шорстка.
Лікування. Призначають актинолізати, актиноміцетну полівалент-
ну вакцину, антибіотики і сульфаніламідні препарати, препарати
йоду; іноді застосовують рентгенотерапію і хірургічне втручання.
Профілактика полягає в додержанні особистої гігієни й усуненні
факторів, що сприяють розвиткові захворювання, особливо травм
шкіри і слизових оболонок, а також у санації порожнини рота і зіва,
догляді за зубами, митті рук.
До патогенинх актиноміцетів належать деякі види роду Мосаггііа, зокрема
N. азіегоісіеч, яка при бактеріоскопії має тонкий розгалужений міцелій, що роз-
падаться на паличкоподібні і кокоподібні елементи; росте в аеробних умовах,
утворює зморшкуваті зернисті колонії жовтого або темно-оранжевої о кольору.
N. ачіегоігісз живе в грунті; зараження насгае повітряно-пиловим шляхом
і в речу іьтан проникнення актиноміцетів в ушкоджену шкіру. Крім людини,
хворішії. велика рогата худоба, копі, собаки, котн, мавпи, иоркн, видри та
інші тварини У людини N. а<>1егоі<іе.$ спричиняє нокардіоз — хронічне грану-
’іематочне ураження легень, шкіри, лімфатичних вузлів, мозку та його оболонок,
нирок Якщо місцем проникнення актиноміцетів є шкіра стопи, розвивається
285
лііиетома стопи (мадурська хвороба), що проявляється утворенням абсцесів
і множинних фістул
Лабораторна діагностика полягає в бактеріоскопії мокротиння, спинно-
мозкової рідини, сечі, ексудатів і гнійних виділень, виділенні та ідентифіка-
ції культур, добутих на середовищі Сабуро або кров'яному агарі.
Лікування. Призначають сульфаніламідні препарати в комбінаті з ампі-
циліном або триметопримом.
КОРИНЕБАКТЕРІЇ
До роду СогупеЬасіегіиш належать грампозитивні бактерії з була-
воподібним стовщенням на кінцях; вони поділяються на види, пато-
генні для людини і тварин, патогенні для рослин і непатогенні.
До патогенних видів коринебактерій належить збудник дифтерії.
Раніше дифтерія була грізним захворюванням у дітей, яке часто при-
зводило до летального кінця. Завдяки запровадженню обов’язкової
імунізації проти цієї інфекції захворюваність на дифтерію тепер зни-
зилась до поодиноких випадків і летальний кінець спостерігається
дуже рідко.
ЗБУДНИК ДИФТЕРІЇ
Відкриттю збудника дифтерії передували широкі клінічні, патологомор-
фологічні, епідеміологічні та експериментальні дослідження, які значною мі-
рою підготували грунт для його виявлення (Е. Клебс, 1883), виділення в чи-
стій культурі (Ф. Леффлер, 1884), виготовлення токсину (Е. Ру і А. Ієрсен,
1888), антитоксичної сироватки (Е. Берінг, С. Кітазато, 1890; Е. Ру, 1894)
і дифтерійного анатоксину (Г. Рамои, 1923).
Морфологія. СогупеЬасіегіит сіірМЬегіае (лат. согупа — булава,
дірЬіІіега — плівка, шкіра) — прямі або трохи зігнуті палички (див.
форзац, рис. І) завдовжки І—8 мкм і завширшки 0,3—0,8 мкм, полі-
морфні, грампозитивні, краще забарвлюються біля полюсів, на яких
розташовані метахроматичні гранули (зерна Бебеша — Ернста, полі-
метафосфати). У коринебактерій дифтерії є на кінцях булавоподібні
стовщення; іноді з’являються гіллясті і ниткоподібні форми, а також
майже кокоподібні і дріжджоподібні. У мазках вони розташовуються
під кутом, набуваючи вигляду розчепірених пальців, не утворюють
спор, капсул і джгутиків.
У коринебактерій дифтерії виявлено фімбрії або подібні до них
утвори, що надають мікроорганізмам адгезивної активності.
На ультратонкнх зрізах клітинна стінка має два шари: внутрішній
осміофільний і зовнішній, що утворює мікрокапсулу. У період макси-
мального виділення екзотоксину видно мембранні структури у вигляді
оргаяел, овалів, кілець. Цитоплазма гранулярна. Нуклеоїд заповнений
тонкими осміофільними фібрилами. Метахроматичні гранули склада-
ються із твердих зернистих утворів, оточених мембраною. При ста-
рінні цитоплазма коринебактерій дифтерії набуває «зебровидної»
(смугастої), що нерівномірно забарвлюється, форми.
Культивування. Збудник дифтерії — аероб або факультативний
анаероб, оптимальна температура росту 37 °С (крайні границі 15
і 40 °С), рН середовища 7,2—7,6; добре культивується на середови-
286
щах, що містять білок (зсіла
сироватка крові, кров’яний
агар, сироватковий агар),
а також на цукровому бульйо-
ні. На середовищі Ру (зсіла
сироватка крові коня) і се-
редовищі Леффлера (три час-
тини бичачої сироватки й од-
а б
на частина цукрового бульйо- рис. 86 Колонії коринебактерій дифтерії:
ну) коринебактерії дифте- а-8гауі5. 6-ШІІІ5.
рії розвиваються протягом 16—18 с, ріст їх нагадує шагреневу шкіру,
колонії між собою не зливаються.
За культуральними властивостями коринебактерії дифтерії поді-
ляються на біовари §гауІ5 і тіїіз.
Коринебактерії £гауі$ на телуритовому агарі, що містить дефібри-
новану кров і телурит калію, утворюють крупні шорсткі (Р-форми)
розеткоподібні колонії (рис. 86, а) чорного або сірого кольору. Вони
ферментують декстрин, крохмаль і глікоген, у бульйоні утворюють
поверхневу плівку і зернистий осад, звичайно високотоксичні і мають
більш виражені інвазивні властивості.
Коринебактерії гпіііз на телуровому агарі ростуть з утворенням
темних гладеньких (8-форми) блискучих колоній (рис. 86, б). Вони
не ферментують крохмаль і глікоген, непостійно ферментують дек-
стрин, спричиняють гемоліз еритроцитів усіх видів тварин, у бульйо-
ні даюгь дифузне помутніння, менш токсичні та інвазивні.
Ферментативні властивості. Коринебактерії дифтерії не зсідають
мотоко, не розкладають сечовину, не виділяють індол, слабко утво-
рюють сірководень, відновлюють нітрати в нітрити, а також телурит
калію до металу, внаслідок чого колонії збудника дифтерії на телу-
ровому агарі стають чорними або сірими. Коринебактерії дифтерії
ферментують глюкозу і мальтозу, непостійно — галактозу, крохмаль,
декстрин, гліцерин.
Токсиноутворення. Коринебактерії дифтерії продукують у буль-
йонних культурах сильні екзотоксини (гістотоксип, дер.монекротпзпн,
гемолізин). Токсигенність коринебактерій пов’язана з лізогенністю
(наявністю у токсигенних штамах помірних фагів — профагів). Кла-
сичним міжнародний еталонний штам Парк-Вільямс 8 — продуцент
екзотоксину — також лізогепний і понад 85 років зберігає власти-
вість токсиноутворення. Генетичні детермінанти токспгенності (іох+-
гени) локалізовані в геномі профага, інтегрованого з нуклеоїдом
коринебактерій дифтерії.
Дифтерійний екзотоксин складається із двох (А і В) поліпептнднпх
ланшоїів, з’єднаних дисульфідннм містком. Під впливом відновних
агеніів розпіепляюіься дисульфідні зв’язки, що з’єднують А- і В-лап-
цюги \ ланцюг переходить у цитоплазму, а В-лапцюг залишається
в мембоаиі епдосоми і спричиняє зв’язування токсину з рецепторами
на поверхні клітин.
Токсиїенпі штами коринебактерій дифтерії поряд з лізогенністю
характеризуються вираженою дегідрогепазпою і ненра.міпідазною
287
активністю. У коринебактерій дифтерії виявлено гліколіпіди, що
містять коринеміколову і корннеміколенову кислоти, які характери-
зуються властивостями корд-фактора.
Дифтерійний токсин нестійкий, легко руйнується під впливом
температури, світла і кисню повітря, але порівняно резистентний до
діяння ультразвуку. Після додавання до токсину 0,3—0,4 % форма-
ліну і наступного витримування при температурі 38—40 °С протягом
3—4 тижнів він перетворюється в анатоксин, який має біль-
шу стійкість щодо фізичних і хімічних дій, чим вихідний ток-
син.
Коринебактерії дифтерії продукують бактеріоцинн (кориненини),
що надають їм деяких селективних переваг.
Антигенна структура. За допомогою реакції аглютинації у збуд-
ника дифтерії виявлено 11 сероварів.
Токсини, що утворюються різними штамами £гауіз і тіііз, не
мають специфічності і повністю нейтралізуються стандартним дифте-
рійним антитоксином.
Доведено, що в коринебактерій дифтерії є варіантоспецифічні
термолабільні поверхневі білкові антигени (К-антигени) і групоспе-
цифічні термостабільні соматичні полісахаридні антигени.
Серед коринебактерій розрізняють 15 фаговарів, за допомогою
яких виявляють джерела інфекції: фаговари враховують також при
ідентифікації виділених культур.
Резистентність. Коринебактерії дифтерії порівняно стійкі до впли-
ву факторів зовнішнього середовища. На зсілій сироватці вони зали-
шаються життєздатними близько року, при кімнатній температурі —
до 2 місяців, на дитячих іграшках — кілька діб. Коринебактерії
довго зберігаються у плівках хворих на дифтерію. Від дії темпера-
тури 60 °С і 1 % розчину фенолу збудник дифтерії гине протягом
10 хв.
Патогенність для тварин. У природних умовах вірулентні корине-
бактерії дифтерії виявлено у коней, корів, собак, інфікованих, оче-
видно, від людей — хворих на дифтерію і носіїв. Проте свійські тва-
рини не р джерелом зараження людини.
Із лабораторних тварин найбільш сприйнятливі морські свинки
і кролі. При зараженні культурою або токсином коринебактерій
у них розвивається типова картина токснкоінфекції з утворенням на
місці введення запалення, набряку, некрозу. Внутрішні органи гіпере-
мійовані, у надниркових залозах спостерігаються крововиливи. Доза
0,06 мкг токсину вбиває морську свинку масою 250 г.
Патогенез захворювання у людини. Джерелом інфекції є хворі
на дифтерію і носії. Захворювання передається повітряно-краплин-
ним шляхом, іноді з частинками пилу; можлива передача через різні
предмети (іграшки, посуд, книги, рушники, хустки і т. д.), харчові
продукти (молоко, різні холодні страви та ін.), інфіковані коринебак-
теріями дифтерії.
Важливу роль в епідеміології дифтерії відіграють носії, у серед-
ньому кількість їх серед реконвалесцентів і здорових осіб становить
3—5 %.
288
Найвища захворюваність на дифтерію буває восени, що пояснює-
ться збільшенням скупченості дітей у цю пору року і зниженням
опірності організму під впливом охолодження.
Провідну роль у патогенезі дифтерії відіграє гістотоксин, який
блокує синтез білків у клітинах організму хворих, інактнвує фермент
трансферазу, відповідальну за утворення поліпептидного ланцюга.
Завдяки наявності дифузного фактора, що контролюється бакте-
ріальними генами, коринебактерії дифтерії мають властивість прони-
кати в органи і тканини хворих людей. Бактеріемія буває в осіб з по-
рушеним імунологічним станом. Дифузійний фактор являє собою гіалу-
ронідазу, що має властивість розщепляти гіалуронову кислоту. До
факторів інвазійності належать нейрамінідаза, некротичний фактор,
плазмін.
Певне значення у розвитку дифтерії має адгезія, завдяки якій
збудник дифтерії адсорбується на рецепторах не тільки клітин сли-
зових оболонок і шкіри, а й інших органів і тканин.
У клініці й експерименті на тваринах доведено вплив на розвиток
захворювання патогенних стафілококів і стрептококів, які продуку-
ють токсини і фактори інвазійності, що значною мірою посилює тяж-
кість інфекції.
У людини на місці проникнення збудника дифтерії (ніс, зів, трахея,
кон’юнктива, шкіра, зовнішні статеві органи, ранова поверхня) утво-
рюються плівки, що мають багато коринебактерій дифтерії та інших
мікроорганізмів. Продукований збудником дифтерії екзотоксин спри-
чиняє некроз і дифтеричне запалення слизових оболонок або шкіри;
усмоктуючись, він уражує нервові клітини, міокард і паренхіматозні
органи, зумовлює явища вираженої інтоксикації. Глибокі зміни від-
буваються в міокарді, судинах, надниркових залозах, а також у цен-
тратьчій і периферичній нервовій системі.
За локалізацією процесу найчастіше спостерігаються дифтерія
зіва і дифтерійний круп, потім дифтерія носа. Порівняно рідко трап-
ляється дифтерія шкіри, очей, вух, зовнішніх статевих органів. На
дифтерію зіва припадає понад 90 % усіх випадків захворювань, друге
місце займає дифтерія носа.
Імунітет. При дифтерії несприйнятливість залежить головним чи-
ном від вмісту в крові антитоксину. Клітинні реакції забезпечують
захист організму від збудника, який не піддається знешкодженню
дією антитоксину. Доведена роль опсонінів, які посилюють фагоци-
тоз. Хемотаксичні фактори, фракції комплементу сприяють розвит-
кові запальної реакції, відбувається активація макрофагів, які здій-
снюють внутрішньоклітинне перетравлювання. Імунітет при дифтерії
має антиінфекційний (антитоксичний і антибактеріальний) характер.
Наявність протидифтерійного антитоксичного імунітету виявляють яа
допомогою реакції Шіка. При цьому вводять у передпліччя внутріїлньошкірпо
1/40 01 т токсину для морської свинки н об’ємі 0,2 мл. В разі позитивної реак-
ції, яка свідчить про відсутність антитоксичного Імунітету, на місці введення
через 24 -48 год з’являються гіперемія і припухлість діаметром до 2 см. По-
зитиви;! реакція Шіка спостерігається при відсутності анінтокснну або не-
вначпій кількості його в сироватці крові.
Ю 1-445
28і)
У зв’язку з тим що дифтерійний екзотоксин спричиняє стан сенсибіліза-
ції й зумовлює у багатьох дітей розвиток тяжких ускладнень, раніше широко
застосовувану реакцію Шіка тепер використовують обмежено
Для визначення кількості антитоксинів у крові рекомендована
РИГА з еритроцитами, сенсибілізованими дифтерійним анатоксином.
Найбільш сприйнятливі до дифтерії діти віком 1—4 років. Остан-
нім часом виявлено відносне збільшення захворюваності серед до-
рослих.
Лабораторна діагностика. Об’єктом дослідження є виділення зіва,
носа, іноді вульви (зовнішніх статевих органів), очей, шкіри, які бе-
руть стерильним ватним тампоном.
Матеріал, призначений для дослідження, висівають на спеціальні
середовища — зсілу сироватку крові, кров’яний телуритовий агар
тощо. Через 12—24—48 год культивування роблять бактеріоскопію
мазків. За результатами мікроскопії дають попередню відповідь.
Коринебактерії дифтерії не завжди бувають морфологічно типо-
вими У ряді випадків збудник набуває форми коротких паличок
із слабко вираженою зернистістю, розташованих не під кутом, а без-
ладно. Найчастіше помилки бувають у тих випадках, коли досліджен-
ня обмежується тільки методом бактеріоскопії. Трапляється, що кори-
небактеріями дифтерії помилково вважають інші види або непатогенні
коринебактерії, схожі на дифтерійні. Крім того, гранули волютину
утворюються не завжди і, отже, ця ознака не абсолютна. Найбільш
вагомим, але не єдиним критерієм диференціації патогенних корине-
бактерій є токсиноутворення. Тому лабораторну діагностику дифтерії
здійснюють виділенням чистої культури й ідентифікацією її за куль-
туральними, біохімічними, серологічними й токсигенними озна-
ками (табл. 28).
Таблиця 28. Диференціація різних видів СогулеЬасіегішп
Вид бактерій її м II Ферментація сахарози Патогенність для людини і тварин
С. бірИіИегіае + + ± + Патогенний для людини, спричиняє дифтерію
С. ХЄГО5І8 — ± + — Непатогенний для людини, живе в кон’юнктиві
С. рзеидобірИіИе- гісит Непатогенний для людини, живе в слизовій оболонці носової частини глотки
Примітка. (-{-) — наявність відповідної ознаки; (—) — відсутність ознаки;
(±) — непостійна наявність ознаки.
Диференціацію токсигенних і нетоксигенних штамів коринебак-
терій дифтерії провадять шляхом підшкірного або внутрішньошкір-
ного зараження морських свинок або методом преципітації в агарі.
Останній спосіб порівняно доступний і може бути застосований у будь-
290
Рис. 87. Утворення преципіта-
тів токсигенними культурами
коринебактерій дифтерії.
коринебактерій дифтерії)
якій лабораторії. Він грунтується на
властивості дифтерійного екзотоксину
вступати у сполуку з антитоксином і
утворювати преципітати у вигляді стріл-
вусиків (рис. 87). Токсигенність можна
виявляти зараженням моношарових
клітин, чутливих до екзотоксину кори-
небактерій дифтерії.
Виявити дифтерійний екзотоксин
можна в ІФА за допомогою моноклональ-
них антитіл із набору «Дифтерія-моно-
зим» (див. «Посібник для практичних
занять із мікробіології»).
Для виявлення імуноглобулінів
клас\ Сі до бактеріального антигену
(мембранного білка клітинних стінок
використовують ІФА.
Слід пам’ятати, що лабораторні дослідження є підтвердженням
клінічного діагнозу дифтерії. Тому, коли є переконливі дані, ліку-
вання призначають негайно, не чекаючи результатів лабораторної
діагностики.
Лікування. Після встановлення клінічного діагнозу хворим на
дифтерію вводять антитоксичну дифтерійну сироватку (10 000—
20 000 МО при формах середньої тяжкості і ЗО 000—50 000 МО при
тяжких формах захворювання), антибіотики (пеніцилін еритроміцин)
і сульфаніламідні препарати. Антибіотики змінюють дисперсійні і ди-
фузійні властивості екзотоксинів коринебактерій дифтерії, стафіло-
кока і стрептококів і тим самим знижують їх токсичну дію.
Для підвищення імунобіологічного стану організму — вироблен-
ня власного антитоксину — рекомендується вводити дифтерійний ана-
токсин. Для лікування носіїв призначають антибіотики. Добрі ре-
зультати дає застосування еритроміцину в поєднанні з аскорбіновою
кислотою (вітаміном С).
Профілактика полягає в ранній діагностиці інфекції, негайній
госпіталізації хворих, повноцінній дезинфекції приміщення і предме-
тів, виявленні носіїв.
В епідемічному вогнищі, де було виявлено випадки дифтерії, про-
тягом 7 діб ведуть медичний нагляд. У ряді зарубіжних країн усім
особам, контактним щодо дифтерії, вводять 1000 МО дифтерійного
імуноглобуліну.
Специфічну профілактику здійснюють активною імунізацією.
Є кілька видів вакцин, використовуваних для специфічної профілак-
тики дифтерії' адсорбований дифтерійний анатоксин (АД-аиатокснн);
адсорбований дифтерійно-правцевий анатоксин (АДП-анатоксии; рос.
АДС-ана токсин); адсорбована коклюшно-днфтеріппо-правцева вакци-
на (ХК.ІІ І-вакцнпа; рос. АКДС-вакцина). Усі три препарати застосо-
вуюгь я ідпо з інструкціями.
О ЦІ.їм з істотних недоліків специфічної профілактики дифтерії є те,
що заі тої ування анатоксину призводить до створення антитоксичного
10*
291
Імунітету, зумовленого головним чином нейтралізацією екзотоксину,
а не ушкодженням збудника захворювання, і не запобігає носійству
токсигенних і нетоксигенних коринебактерій у прищеплених дітей.
У зв’язку з необхідністю відтворення у прищеплених одноча но гу-
морального і клітинного імунітету, який забезпечує нейтралізацію
екзотоксину і пригнічення збудника захворювання, доцільно вести
дальші наукові пошуки для створення такого антигену, який би за-
безпечував вироблення антиінфекційного імунітету проти дифтерії.
ПРОПІОНІБАКТЕРІЇ ТА ЕУБАКТЕРіІ
Таксономічно пропіонібакіерії належать до актииоміиеіоподібннх мікро-
організмів, родини РгоріопіЬасІегіасеае, до якої входять рід РгоріопіЬасіегіьт
і рід ЕиЬасіегіині (36 видів). Пропіонібактерії — грампозитивні, звичайно не-
рухомі, не у.ворюють спор, плеоморфиі палички морфологічно схожі на кори-
небактерії Розташовуються поодинокими особинами, парами короікими
ланцюжками або невеликими скупченнями іноді мають вигляд латинських
літер V і ¥
Представники роду пропіонібактерій є хемоорганотрофами-анаеробами,
ростуть при температурі 25°, 30° і 45° С на живильних середовищах, що містять
білок (кров’яний агар та ін.), розщеплюють вуглеводи і пептони з утворенням
пропіоновоі, оцтової та інших кислот.
Пропіонібактерії виявляють у грунті, воді, молочних продуктах, иа шкірі,
в кишках і сечостатевих органах тварин і людей Деякі види пропіонібактерій
патогенні або умовно-па югенні для людини. Так, Р. ауідигп виділена з крові,
гною при інфікованих ранах, підщелепних абсцесах: Р аспеч (патогенна
для мишей і морських свинок) виявлена в людей на шкірі, у змісті кишок,
виділеннях ран, у крові, гною, прн абсцесах. В разі хронічних форм інфекції
пропіонібактерії повторно висівають із крові, кісткового мозку, іноді в асо-
ціації з іншими бактеріями. У дорослих у сироватці крові у високих іитрах
виявлено антитіла проти Р. аспез; Р. ^тапиіозіз виділена із вмісту кишок та
абсцесів.
Деякі види еубактерій (Е. гесіаіе, Е. піігоеепез, Е. тіїіпііогте) виявлено
при гнійних процесах, у виділеннях із операційних ран, вмісті абсцесів мозку,
легенях, порожнині рота, кишках, (х виявляють прн гострому і підгострому
апендициті, сальпінгіті, перитоніті, хронічному фурункульозі, ендокардиті,
гастриті, тонзиліті та інших ураженнях.
Для вирощування пропіонібактерій живильні середовища збагачують
5 % вуглекислого газу. Ідентифікація виділених культур здійснюється за мор-
фологічними, біохімічними, серологічними властивостями і фаготипуваниям.
Для лікування захворювань, що спричиняються пропіонібактеріямн, за-
стосовують антибіотики (препарати пеніциліну, тетрацикліну, еритроміцин,
рифампін та ін.).
ЛІСТЕРІЇ
Збудник лістеріозу (Ьізіегіа топосу1о£епе$) відкритий у 1924 р. Е. Мюр-
реєм із співробітниками. У 1940 р. Дж. Пірі, виділивши цей мікроорганізм
у панюкоподібннх гризунів, назвав його лістеріею.
Морфологія. Лістерії — дрібні, трохи викривлені кокоподібні бактерії
завдовжки 0,5—2 мкм і завширшки 0,4—0,5 мкм, рухливі, з полярними джгу-
тиками, грампозитивні. Розташовуються поодинці або парами, у мазках з ор-
ганів — нерідко під кутом у формі римської цифри V. іноді у вигляді ланцюж-
ка, довгастих паличок і довгих ниток; спор і капсул не утворюють.
Культивування. Лістерії — факультативні анаероби, розвиваються при
температурі 37 °С на звичайних середовищах при рН 7,0—7,2. На густих жи-
вильних середовищах ростуть у вигляді дрібних, плоских, гладеньких блис-
292
кучих колоній білуватого кольору з перламутровим відтінком; на печінковому
агарі колонії мають слизисту консистенцію. У бульйоні лістерії спричиняють
незначне помутніння середовища з появою слизистого осаду. На кров’яному
агарі навколо колоній утворюється вузька зона гемолізу.
5-формн лістерій фаголізабельні, К-форми фагорезистентні. За допомогою
фаголізнсу виявлено 9 фаговарів лістерій.
Ферментативні властивості. Лакмусове молоко в присутності лістерій
червоніє але не зсідається Лістерії не виділяють індол і сірководень, не від-
новлюють нітрати в нітрити, не розріджують желатину; ферментують з утво-
ренням кислоти без газу глюкозу, фруктозу, трегалозу, непостійно і повіль-
но — мальтозу, лактозу, сахарозу та ін.
Токсиноутворення. Лістерії виділяють в культуральну рідину термолабіль-
ний гемолізин, який спричиняє в результаті активації цистеїном гемоліз ери-
троцитів голуба, кроля, морської свинки, коня, а також ліполітичннй фактор,
що зумовлює цитоліз культури макрофагів. При розпаді бактеріальних клітин
вивільняється ендотоксин, який призводить до характерних змін в організмі
тварин і людини.
Антигенна структура. Лістерії мають 8 сероварів, два з них (1-й і 4-й)
трапляються найчастіше. Перший основний серовар виділений від гризунів;
другий — від жуйних тварин (великої рогатої худоби). Крім того, ці серовари
висіяні і від інших тварин, птахів і людини. Вони мають соматичні (О) і джгу-
тикові (Н) антигени. Соматичні антигени містять термостабільні фракції і ва-
ріабельний антиген; джгутикові антигени чутливі до дії формаліну
Резистентність. Лістерії чутливі щодо факторів зовнішнього середовища.
У висушеному стані вони зберігають свої патогенні властивості протягом 7 ро-
ків. Резистентні до заморожування, витримують діяння температури 55 °С
протягом 60 хв, 58 °С — ЗО хв. Гинуть від кип’ятіння через 3 хв, від діяння
температури 70 °С — через 20 хв; на них згубно впливають 0,5 і 1 % розчини
формаліну 5 % розчин фенолу та інші дезинфікуючі засоби.
Патогенність для тварин. У природних умовах на лістеріоз хворіють ве-
лика і дрібна рогата худоба, коні, свині, кролі, кури, голуби. Трапляється
це захворювання серед хатніх і польових мишей, диких пацюків, які, ймовір-
но, і є основним резервуаром збудника в природних умовах.
З експериментальних тварин найбільш сприйнятливі до інфекції кролі,
морські свинки і миші; при внутрішньомозковому зараженні у них виникає
сепсис, який через 1—4 доби призводить до загибелі; при затяжному перебігу
розвивається менінгоенцефаліт Лабораторні тварини хворіють і п ри підшкір-
ному, виутрішньом’язовому, інтраназальному зараженні.
Патогенез захворювання у людини. Лістеріоз — зоонозне захворювання.
Людина заражується при вживанні води і харчових продуктів, забруднених
фекаліями тварин Можливе зараження і при укусі кліщів в ензоотичних вогни-
щах лістеріозу, а також аерогенним і контактним шляхами. Збудник проникає
в організм через ушкоджену шкіру або слизову оболонку порожнини рота, но-
сової частини глотки, слизову оболонку травного каналу.
Захворювання характеризується сепсисом (гострим і хронічним), явищами
менінгоениефаліту, який у багатьох випадках призводить до летального кіпця,
особливо у новонароджених і в осіб з травмою головного мозку. Поряд з тяж-
кими клінічними проявами трапляються легкі форми захворювання і иосійство.
У патогенезі лістеріозу надають значення насиченню всього організму або
окремих тканин та органів ендотоксином збудника, який інтенсивно розмно-
жується в організмі інфікованих тварин і людей.
Найчастіше при лістеріозі уражуються лімфатичні вузли, центральна нер-
вова система і внутрішні органи новонароджених.
У людини основними формами лістеріозу є ангінозно-ссптнчна і нервова-
Перша звичайно закінчується видужанням. Прн другій формі в ряді випадків
настає смерть. Крім названих основних форм, у людини трапляються септико-
гранулематозна (у плодів і новонароджених), тифоїдна й окозалозиста форми
лістеріозу.
У хворих на лімфому й осіб з імунодефіцит ними станами лістеріоз може
виникати як вторинне захворювання.
293
Імунітет. У тварин, які перенесли лістеріоз, виробляється несприйнятли-
вість. У крові людей, хворих на лістеріоз, виявляють аглютиніни, преципітини
і комплементзв'язуючі антитіла, які при лабораторному дослідженні не про-
являють антибактеріальної дії. Гіперімунна сироватка лікувальних властиво-
стей не має
Лабораторна діагностика робиться за допомогою виділення культури лі-
стерій із крові хворих При дослідженні трупного матеріалу беруть шматочки
тканини мозку, печінки, селезінки і висівають на глюкозо-снроватковий буль-
йон. Крім того, заражують експериментальних тварин, зокрема білих мишей;
добрі результати дає кон’юнктивальна проба на морській свинці: через 2 доби
після внесення в кон'юнктивальний мішок краплини добової бульйонної куль-
тури лістерій у тварини розвивається гнійний кон’юнктивіт.
Серологічна діагностика полягає в застосуванні РА, яка буває позитив-
ною у розведенні сироватки крові хворих від 1 : 250 до 1 : 5000. Застосовують
також РП. РЗК і РИГА.
Лікування проводять антибіотиками, сульфаніламідними препаратами
і дезинфікуючими розчинами
Профілактика забезпечується здійсненням разом з ветеринарною службою
загальних санітарно-гігієнічних заходів, лабораторним контролем м'яса, що
надходить у продаж, систематичним наглядом за станом свійських тварин,
своєчасним виявленням ензоотій серед гризунів, захистом свійських тварин
від зараження гризунами.
ЕКУЗІРЕкОТНКІХ КНиЗЮРАТНІАЕ
ЕгузіреіоІЬгіх гИизіораІЬіае спричиняє у людини ураження шкірн (ери-
зипелоїд) в результаті інфікування її при контакті з рибою, молюсками, м’я-
сом свиней, птиці, в організмі яких є цей дуже поширений у природі збудник.
Захворювання характеризується і появою болю, набряку, застійної еритеми
в місці локалізації збудника. Постінфекційний імунітет не виробляється, вна-
слідок чого досить часто виникають рецидиви, іноді розвивається ендокардит.
Лабораторна діагностика полягає у виділенні культури та її ідентифікації;
на відміну від лістерій ЕгузіреІоіЬгіх гЬичіораПііае нерухомий, не ферментує
саліцин і непатогенний для морських свинок, цілком специфічний щодо
антигенної структури. Лікування полягає в призначенні антибіотиків (препа-
ратів пеніциліну).
Профілактика забезпечується додержанням санітарно-гігієнічних режимів
працівниками м’ясокомбінатів і птахоферм.
ПАТОГЕННІ СПІРОХЕТИ
До родин ЗрігосЬеіасеае і Ееріозрігасеае входять сапрофіти і па-
тогенні види бактерій. До сапрофітів належать ЗрігосЬаеіа (див.
рис. 4, а) і Сгі$іі$ріга (див. рис. 4, д), що е крупними клітинами роз-
міром 200—500 мкм із загостреними або тупими кінцями (див. рис. 4);
деякі з ннх мають крипти (хвилясті гребені). Патогенні спірохети
живуть на мертвих субстратах, у забруднених водоймах, у кишечнику
холоднокровних тварин; у природних умовах живуть і непатогенні
лептоспіри. За Романовськнм — Гімзою ці бактерії забарвлюються
у синій колір.
До патогенних спірохет належать три роди: Тгеропеша, Воггеїіа,
Ьеріозріга.
ЗБУДНИК СИФІЛІСУ
Тгеропета раїїісіит відкрили в 1905 р. Ф. Шаудін і Е. Гофман. Стара
назва збудника — бліда спірохета — зумовлена тим, що мікроорганізм погано
забарвлюється аніліновими барвниками.
294
Морфологія. Т. раїїісІипГ—тонкі
клітини спіралеподібної форми з 12—
14 завитками (рис. 88). Вони не
мають видимої в мікроскоп осьової
нитки або осьового гребеня- Кіпці
трепонем загострені або округлені.
Довжина їх 10—13 мкм, ширина —
0,1—0,18 мкм.
При електронній мікроскопії поз-
довжніх і поперечних ультратонких
зрізів збудника сифілісу добре вид-
но тришарову зовнішню мембрану,
під якою розташовані базальні
тіла; до них прикріплені ниткопо-
Рнс. 88. Тгеропета раїїідит у
темному полі мікроскопа.
дібні утвори—фібрили діаметром 17 нм. На кожному кінці
клітини є по три фібрили. У цитоплазмі бактерій є рибосоми, вакуоля
нуклеоїду і мезосоми. Розмножуються бактерії поперечним діленням.
Трепонеми рухливі (їм властиві обертовий, поступальний, зги-
нальний і хвилеподібний рухи), погано сприймають барвники, грам-
негативні. За методом Романовського — Гімзи забарвлюються у блідо-
рожевий колір, що пояснюється низьким вмістом нуклеопротеідів
(див. форзац, рис. III, ж).
Під впливом факторів зовнішнього середовища і лікарських за-
собів трепонеми в ряді випадків згортаються в клубки, утворюючи
цисти, покриті непроникною муциноподібною оболонкою. Цисти мо-
жуть тривалий час бути в організмі хворого в латентному стані, за
сприятливих умов вони перетворюються в зерна, а потім у типові спі-
ралеподібні трепонеми. Цистоутворення — одна з форм захисту тре-
понем. яка дає змогу їм протистояти дії лікарських засобів, що при-
значаються хворим на сифіліс. Бліді трепонеми можуть утворювати
Ь-форми. Цисти і Ь-форми трепонем більш стійкі до дії факторів зов-
нішнього і внутрішнього середовищ.
Культивування. Бліда трепонема—дуже вибагливий мікроорга-
нізм. Вона не росте у звичайних середовищах, розвивається при тем-
пературі 35 °С в анаеробних умовах у середовищах, що містять нир-
кову або мозкову тканину; крайні температурні границі росту —
34—40 °С. Добре розвивається бліда трепонема на хоріопалантоїсній
тканині курячою зародка, в сироватці крові кролів з додаванням
шматочків мозкової тканини під шаром вазелінового масла.
Тривале культивування трепонем призводить до втрати ними віру-
лентності. Такі культури, адаптовані до живильного середовища,
називаються культуральними, на відміну від тканинних культур,
що мають властивості патогенності і зберігаються в лабораторних
умовах за допомогою пасажів на кролях. Культуральні штамп збуд-
ника сифілісу різняться між собою рядом ознак: зміною рН середо-
вища, ступенем анаеробіозу, іпдолоутворенням, продукуванням сір-
ководню, ставленням до вуглеводів Багато культуральннх штамів
спричиняють гемоліз еритроцитів людини, барана, коня, кроля,
морської свинки.
295
Антигенна структура. Серологічні варіанти блідої трепонеми не
виявлено. Збудник сифілісу містить полісахаридний, ліпідний і про-
теїновий комплекси з дуже складними антигенними властивостями.
Резисгенгність. При низьких температурах (на холоді) бліда тре-
понема довго зберігається в гомогенатах уражених тканин. Від дії
температури 45—48 °С вона гине через 1 год, 55 °С — через 15 хв.
Чутлива до важких металів (ртуть, вісмут, миш’як), кислот, дії дезин-
фікуючих засобів та висушування.
Патогенність для тварин. У природних умовах у кролів може ви-
никати захворювання (кролячий сифіліс), яке спричиняється Тге-
ропета сапісоїа, що морфологічно не відрізняється від Т. раїї ісіи т.
Бліда трепонема малопатогенна для тварин, за винятком мавп.
Досягнуто позитивного результату при зараженні кролів у рогівку
ока або яєчко. За допомогою експериментального сифілісу вивчено
питання імунітету, специфічної хіміотерапії і культивування блідої
трепонеми.
Патогенез захворювання у людини. Джерелом інфекції є людина,
хвора на сифіліс. Захворювання передається при прямому контакті,
переважно (у 93 % випадків) статевим шляхом, іноді через посуд та
інші предмети. Можлива передача інфекції через плаценту (приро-
джений сифіліс). Первинною локалізацією збудника є слизові обо-
лонки статевих органів, порожнини рота, шкіра. У місці проникнення
в організм бліді трепонеми розмножуються і спричиняють низку
проліферативних і деструктивних змін.
Сифіліс класифікують на первинний, вторинний, третинний, при-
хований, вісцеральний і сифіліс нервової системи (прогресивний пара-
ліч, сухотка спинного мозку).
Первинний сифіліс розвивається після інкубаційного періоду тривалістю
від 2 тижнів до 3 місяців (звичайно 21—24 дні). Характеризується утворенням
первинної сифіломи — твердого інфільтрату з поверхневою ерозією або вираз-
кою на місці проникнення трепонеми. При цьому збільшуються і стають твер-
дими регіонарні лімфатичні вузли — розвивається сифілітичний лімфаденіт.
Тривалість першої стадії захворювання близько 6 тижнів. Первинний сифіліс
поділяють на серонегативннй, серопознтивний і прихований, природжений.
При вторинному періоді з’являються висипи на шкірі і слизових оболон-
ках, розвиваються специфічні процеси у внутрішніх органах, у кістковій, пе-
риферичній і центральній нервовій системі. Тривалість цього періоду 2—3 ро-
ки, іноді більше. Вторинний сифіліс може бути свіжим, рецидивним і при-
хованим.
Прн третинному сифілісі в шкірі, підшкірній клітковині, внутрішніх ор-
ганах і т. д. утворюються папули, горбки, гуми, або гумозні інфільтрати,
здатні до розпаду. Цей період триває кілька років. Третинний сифіліс також
може бути в активній і прихованій формах.
У деяких випадках через 9—10 років настає ураження центральної
нервової системи (прогресивний параліч) або спинного мозку (спинна
сухотка), при якому бліді трепонеми у великій кількості локалізу-
ються в тканині мозку, зумовлюючи глибокі органічні і функціональ-
ні зміни.
Імунітет при сифілісі інфекційний і характеризується клітинними
захисними реакціями, що зумовлюють утворення гранулеми і фікса-
296
цію трепонем. У формуванні інфекційного імунітету беруть участь
як спіралеподібні трепонеми, так і цисти.
В результаті перенесеного захворювання виробляються два види
антитіл: неспецифічні і специфічні (протитрепонемні). Неспецифічні
антитіла (І§М і І§А) продукуються в організмі всіх хворих на сифіліс,
але не мають захисної дії. Специфічні (протитрепонемні) антитіла
(І£(л) виробляються під впливом протеїнових антигенів збудника
сифілісу. Можливі вторинне зараження і розвиток захворювання
в осіб, які перенесли сифіліс.
Для сифілісу характерний стан інфекційної алергії, що виявляє-
ться внутрішньошкірною пробою, введенням люетину, виготовле-
ного з культур блідої трепонеми або з уражених тканин. Зниження
реактивності буває в період первинного сифілісу (твердий шанкер);
підвищення її спостерігається в пізні періоди і характеризується гли-
бокими змінами в органах і тканинах хворого.
Лабораторна діагностика. В усіх стадіях захворювання роблять
бактеріоскопічне дослідження виділень виразок, ерозій, папул або
пунктатів із регіонарних лімфатичних вузлів. Матеріал досліджують
у темному полі і мазках, забарвлених за Романовським — Гімзою,
за Буррі, срібленням, а також за допомогою РІФ.
Бліду трепонему треба диференціювати з непатогенними пред-
ставниками цього роду, які живуть на зовнішніх статевих органах
(Т. геїгіп§епз, Т. рЬа^едепіз) і в порожнині рота (Т. тасгодепііиш,
Т. депіісоїа, Т. огаїе), вони значно грубіші і різняться характером
руху за кількістю завитків. При дослідженні у темному полі збудник
сифілісу виявляють майже у 100 % хворих.
Велике значення в діагностиці серопозитивного сифілісу мають
реакція Вассермана й осадові реакції.
Реакція Вассермана подібна до реакції Борде—Жангу, при якій
відбувається адсорбція комплементу специфічним комплексом анти-
ген — антитіло. У реакції Вассермана антигеном може бути як спе-
цифічний протеїновий комплекс, добутий із культур блідої трепонеми,
органів плода, зараженого сифілісом, так і неспецифічний кардіолі-
підний, узятий із м’язової тканини бичачого серця. Реакцію Вассер-
мана ставлять з двома-трьома антигенами і обов’язково доповнюють
двома осадовими реакціями (Кана і Закса — Вітебського, або цито-
холевою).
Реакція Вассермана (у сукупності з клінічними даними й осадо-
вими реакціями) є методом контролю за якістю лікування. Після лі-
кування хворих з первинним і вторинним серопозитивним сифілісом
вона стає негативною через 1х/2—2 місяці. При третинному сифілісі
може довго (1—2 роки і більше) залишатись позитивною. Однак нега-
тивна реакція Вассермана — не єдиний критерій вилікування від
сифілісу.
Реакція Вассермана може бути позитивною (неспецифічною)
під час вагітності (починаючи з 8 місяців) і після родів, при малярії,
туберкульозі, деяких вірусних і протозойних захворюваннях, лепрі,
пемфігусі, лептоспірозі, новоутвореннях, під час менструації, після
наркозу, вживання напередодні взяття крові для дослідження алко-
297
голю, жирної їжі, лікарських засобів, введення чужорідних сиро-
ваток та ін.
Неспецифічні позитивні реакції Вассермана при повторних дослі-
дженнях, які роблять дво-або триразово через 10—15 діб, стають не-
гативними.
Для діагностики сифілісу широко використовують осадові реак-
ції Кана і Закса — Вітебського (цитохолева). Сироватку крові змі-
шують з ліпідним антигеном із м’язової тканини бичачого серця, до
суміші додають 0,6 % холестерину. В разі позитивної реакції через
10 хв випадають дрібні зерна або пластівці, при негативній з’являє-
ться рівномірна каламуть.
Для виявлення протитрепонемних антитіл у сироватці крові хворих
з природженим сифілісом ставлять непряму реакцію імунофлюорес-
ценції; при цьому використовують інактивовані бліді трепонеми,
сироватку крові хворого, попередньо оброблену культуральними тре-
понемами для адсорбції неспецифічних антитіл, і мічений людський
антиглобулін.
Добрі результати дає застосування реакції іммобілізації, яку
ставлять із сироваткою крові хворих на сифіліс і тканинними блідими
трепонемами, взятими з яєчка заражених кролів.
При первинному сифілісі та деяких інших формах захворювання
роблять РЗК і РИГА із специфічним протеїновим антигеном із тка-
нинних і культуральних трепонем, оброблених ультразвуком.
Лікування. Застосовують пеніцилін, препарати вісмуту і йоду,
які забезпечують вилікування у 95 % хворих. У стадії прогресивного
паралічу призначають пірогенал у комбінації з пеніциліном і біохі-
нолом.
Дітям, народженим від матерів, хворих на сифіліс або які не за-
кінчили лікування, призначають профілактичну терапію. Лікують
хворих точно за існуючими інструкціями.
Профілактика полягає у своєчасній діагностиці сифілісу, повно-
цінному лікуванні, санітарно-освітній роботі серед населення.
ІНШІ ПАТОГЕННІ ТРЕПОНЕМИ
До цієї групи входять збудники тропічних трепонематозів — фрам-
безії, беджелі і пінти. Трапляються у багатьох країнах Африки,
Південно-Східної Азії, Центральної Америки, в Австралії та ін.
Збудник фрамбезії. Фрамбезія — хронічне захворювання,
що має багато спільного з сифілісом, але передається позастатевим
шляхом.
Морфологія. Збудник — Тгеропета регіепиа — схожий на бліду
трепонему, завдовжки 7—20 мкм, спіралеподібної форми, на тілі має
від 6 до ЗО завитків, рухливий. Швидко гине поза макроорганізмом,
патогенний для мавп, кролів, пацюків і хом’ячків.
Патогенез. Т. регіепиа передається від хворої людини здоровій
при прямому контакті або через предмети домашнього вжитку — посуд,
рушники, білизну та ін. Захворювання дуже поширене в сільській
місцевості, переважно серед дітей. Збудник потрапляє в найменші
298
ушкодження шкіри і слизових оболонок. На місці проникнення збуд-
ника через 3—6 тижнів розвивається фрамбезома (піанома) — папула,
на місці якої надалі з’являється м’яка на дотик кратероподібна вираз-
ка (І стадія). Через 1—3 місяці настає генералізація процесу, з’явля-
ються різні висипи (II стадія). Для III стадії, що починається через
10—15 років, характерні дистрофічні процеси в шкірі і кістках.
Лабораторна діагностика фрамбезії і сифілісу схожі. Збудник
виявляють при мікроскопії виділень із виразок і взятих для біопсії
тканин. Використовують реакцію Вассермана із специфічним антиге-
ном, осадові реакції і реакцію іммобілізації рухливості трепонем.
Профілактика і лікування. Специфічної профілактики немає,
основні заходи — ізоляція хворих і додержання санітарно-гігієніч-
них вимог. Лікують препаратами пеніциліну.
Збудник беджелю — Тгеропета Ье]*е1, за морфологією і фізіоло-
гією вона не відрізняється від блідої трепонеми, тому дехто вважає її
підвидом Т. раїїідиш. Проте, на думку більшості авторів, беджель —
самостійне захворювання, а не різновид сифілісу.
Патогенез захворювання той самий, що й при сифілісі і фрамбезії.
Розповсюджується в основному побутовим шляхом. Захворювання
має кілька стадій. Після інкубаційного періоду (2—5 тижнів) у першій
стадії з’являється висип на шкірі і слизових оболонках, потім,через
1—3 роки, уражуються підшкірна клітковина, кістки, суглоби, при-
чому зміни в них подібні до змін при сифілісі.
Лабораторна діагностика включає виявлення трепонем при мікро-
скопії у темному полі виділень ранніх елементів висипу, а також
серологічні дослідження, аналогічні тим, що застосовуються при си-
філісі і фрамбезії.
Профілактика і лікування. Специфічної профілактики немає.
Лікування проводять антибіотиками (препаратами пеніциліну,
тетрацикліну та ін.).
Збудник пінти—Тгеропета сагаіеит — за морфологічними
і біологічними ознаками схожий на збудник сифілісу і фрамбезії.
Патогенез. Захворювання передається побутовим шляхом. Не
виключена передача збудника комахами (мошка, комарі, блощиці).
Інкубаційний період 1—3 тижні. На місці проникнення збудника утво-
рюється папула, навколо якої з’являються дрібні утвори, що злива-
ються з первинним вогнищем. Така картина характерна для первинної
стадії, і триває вона кілька місяців (до року). Генералізація процесу,
що проявляється множинними висипами, свідчить про перехід захво-
рювання у вторинну стадію. Для третинної стадії характерний розви-
ток депігментації і гіперпігмеитації ділянок шкіри і посивіння
волосся.
Лабораторна діагностика грунтується на виявленні трепонем
у матеріалі, взятому з уражених ділянок шкіри, а також на резуль-
татах серологічних реакцій — Вассермана, іммобілізації рухливості
трепонем, осадових.
Профілактика і лікування, як і прн решті трепонематозів, поля-
гають у виявленні і лікуванні хворих, санітарно-освітній роботі,
призначанні антибіотиків (пеніцилін, тетрациклін та ін.)
ПАТОГЕННІ ЛЕПТОСПІРИ
Патогенні лептоспіри — Ьеріозріга (грец. Іеріоз— довгий, тон-
кий) є збудниками зоонозних захворювань. Вони входять до родини
Ьеріозріглсеае. Лептоспіроз спричиняється Ьеріозріга іпіегго^апз.
Морфологія. Лептоспіри — мікроорганізми з 12—18 дрібними пер-
винними завитками, які щільно приляїають один до одного. Нагаду-
ють пружину з загнутими і стовщеними кінцями. На кінцях лептоспір
є вторинні завитки, що надають їм 8- або С-подібної форми. Є також
безгачкові штами лептоспір. Довжина лептоспір 7—14 (іноді 20—ЗО)
мкм, товщина 0,06—0,15 (0,25—0,3) мкм. Вони рухливі, роблять обер-
тові й поступальні рухи.
При електронно-мікроскопічному дослідженні структури лептоспір
(рис. 89) доведено, що вони складаються з осьової нитки, цитоплазма-
тичного циліндра, рівномірно закрученого навколо ригідної осьової
нитки, поперечних кілець і багатошарової оболонки. Вважають, що
осьова нитка складається із двох відрізків, які зближуються в цен-
тральній частині іептоспіри На поверхні цитоплазматичного циліндра
при спеціальній обробці виявляють мікрофібрили, цитоплазма дрібно-
гранулярна, у старих культурах є вакуолі. Нуклеоїд розташований
ексцентрично, має тонкі, безладно розташовані фібрили ДНК.
Морфологічно патогенні і сапрофітні лептоспіри не відрізняються
одні від одних, вони різняться лише за складом клітинних жирних
кислот: у патогенних видів більш високий рівень олеїнової, у сапро-
фітних штамів — міристинової кислоти.
Лептоспіри грамнегативні, за Романовським — Гімзою забарвлю-
ються V блідо-рожевий колір їх можна виявити за методом Буррі або
сріблення за Морозовим. Лептоспіри слабко заломляють світло.
Під впливом живильного середовища, підвищеної температури
і при тривалому культивуванні можуть з’являтися атипові форми леп-
тоспір.
Культивування. Лептоспіри — хемоорганотрофи, облігатні аероби,
ростуть при температурі 28—29 °С у рідких і напіврідких живильних
середовищах (безсироваткове середовище Ферворта — Вольєра та ін.).
Ріст лептоспір на рідких живильних середовищах виявляється
на 7—10-ту добу, і його виявляють при перегляді краплини середо-
вища у темному полі: середовище не каламутніє.
Рис. 89 Лептоспіри в електронно-
му мікроскопі.
Рис. 90. Лептоспіри в темному полі
мікроскопа.
300
Лептоспірн розмножуються І не ГУСТИХ живильних середовищах,
що містять сироватку крові кроля (10 Ч), суміш Зеренсена. І Ч агар
І днстльовану полу. Колонії з’нвлйютьсн на 4—6-му лобу.
Ферментативні властивості лептоспір достовірно не визначені;
можливо, ферменти містяться в кількості, що важко виявляється у зви-
чайнії) діагностичній практиці.
Антигенна структура. До патогенних лептоспір (Е. Іпіеггокап?)
входять 19 серогруп І понад 200 сероварів: в нашій країні трапляється
20 серопарів. що належать до ІЗ серогруп.
Токсиноутворенни. Лептоспірн не продукують екзотоксин. Токсич-
ні речовини є тільки в живих лептоспірах, які паразитують в орга-
нізмі людини І тварин.
Резистентність, У волі лептоспірн виживають 5—10 діб, у грун-
ті — 2 доби. В харчових продуктах (молоко, вершкове масло, хліб
та ін.) життєздатність лептоспір не перевищує кількох годин. Лепто-
спірн довго зберігаються при низькій температурі (мінус 70 — мінус
90 V). дуже чутливі до висихання, дії кислот, при температурі
66 V гинуть через 30 хп. Швидко розчиняються у жовчних кис-
лотах
Патогенність для тварин. У природних умовах резервуаром леп-
тоснір є ссавці Із загону гризунів, комахоїдних, сумчастих, парно-
копитних і хижаків.
У вогнищах лептоспірозу найбільше епідеміологічне значення
мають хом'яки, миші, пацюки та Ін., які виділяють .лептоспірн у зов-
нішнє середовище з‘сечею І випорожненнями. Ураженість цих тварин
лептоспірозом може досягати 30—60 Ч і більше. Лептоспіроз реє-
струють також серед свиней, великої І дрібної рогатої худоби, собак
I т а
Із лабораторних тпарин найбільш чутливі до лептоспірозу золо-
тисті хом'яки, морські спинки І кролі-сисунці. Захворювання у цих
тварин спричиняють спіжовиділсні штами лептоспір деяких серогруп.
Лабораторні штами лептоспір звичайно втрачають спою вірулент-
ність.
Патогенез захворювання у людини. Лептоспірозом людина вара-
жується через воду, Інфіковану хворими тваринами або носіями леп-
тоспір (купання, пиття води, виконання різних робіт у водоймах)
Інфікування людей лептоспірозом можливе також І при догляді аа
хворою худобою. Збудники лептоспірозу проникають в організм лю-
дини через травний канал, ушкоджену шкіру І слизові оболонки.
Інкубаційний період триває 5—6 діб І характеризується високою
температурою тіла, загальною слабкістю, сильними головним І м'я-
ловим болями та гіперемією облнччя. Жовтяниця буває приблизно
у 10 Ч хворих.
Велике значення а патогенезі лептоспірозу має стаи бактеріемії,
яка розвивається я перших днів захворювання. Наприкінці першою
тижня лептоспірн концентруються а печінці, селезінці, лімфатичних
в\тп\. кістковому мозку. Піл впливом токсичних речовин, що утво-
рюються а результаті розпаду лептоспір, розвиваються паренхіматоз-
не І жирове переродження печінки, виникають вогнищеві крововиливи
ЖМ
у селезінці і явища 'геморагічного нефриту. За останні 20 років
у ряді країн летальність від лептоспірозу збільшилась до 4,3—
14,8 %.
імунітет. В результаті перенесеного захворювання виникає стійкий
специфічний імунітет, механізм якого пов’язаний з наявністю антитіл.
Антитіла з’являються на кінець 5—6-ї доби захворювання, досяга-
ють до 3—4-го тижня високих титрів (І : 10 000— І : 100 000) і мо-
жуть зберігатися кілька років, що дає змогу ставити діагноз ретро-
спективно.
Лабораторна діагностика включає пряму бактеріоскопію у темному
полі (рис. 90) роздавленої краплини цитратної крові, спинномозкової
рідини, сечі, зависі органів трупів і виділення гемо- та уринокуль-
тури.
Кров хворого (8—10 мл), взяту до 4—5-ї доби захворювання, висі-
вають по 0,5—І мл у кілька пробірок з рідким живильним середови-
щем, які вміщують у термостат при температурі 28 °С. Одержання
гемокультури є надійним методом лабораторної діагностики лептоспі-
розу. Для виділення укринокультури на 2—3-му тижні захворювання
засівають сечу (по 0,5 мл на пробірку).
Наступним етапом дослідження є проведення реакції мікроаглю-
тинації (див. рис. 50) із сироваткою крові хворого або видужуючого
і живою культурою еталонних штамів лептоспір різних серогруп.
Реакцію ставлять у невеликих об’ємах (4—6 краплин) суміші культу-
ри і досліджуваної сироватки крові. Результати реакції мікроаглюти-
нації враховують у темному полі після перебування суміші в термо-
статі при температурі 37 °С протягом 2 год. При одноразовому дослі-
дженні діагностичне значення має позитивна реакція в титрі І : 100
і вище. У сумнівних випадках рекомендується повторне проведення
реакції через 7—10 діб.
Крім названих методів, для діагностики лептоспірозу застосовують
РЗК і біологічну пробу — зараження молодих морських свинок кро-
в’ю хворого (3—5 мл внутрішньоочеревинно). Через 2—3 доби після
зараження досліджують ексудат черевної порожнини морської свинки
на наявність лептоспір (мікроскопія в темному полі і висівання на
живильні середовища). Біологічна проба є найбільш раннім методом
лабораторної діагностики лептоспірозу.
Лікування. Хворим на лептоспіроз призначають пеніцилін, тетра-
цикліни, протилептоспірозний глобулін і дезинтоксикаційні засоби
(глюкоза, препарати крові).
Профілактика визначається характером лептоспірозного вогнища.
У природному вогнищі лептоспірозу, де захворювання людей пов’я-
зані з роботою в заражених водоймах або з використанням інфікованої
води для пиття і господарсько-побутових потреб, слід не допускати
контактів людей із зараженою водою (заборона купання, використан-
ня для пиття і побутових потреб некип’яченої води та ін.). Для лікві-
дації природних вогнищ лептоспірозу застосовують осушення боліт
та інші меліоративні заходи. У сільських вогнищах лептоспірозу здій-
снюють оздоровлення тварин (виявлення, ізоляція і лікування хворих
тварин, вакцинація, запровадження карантину та ін.). Серед населен-
302
ня ведуть санітарно-освітню роботу, впорядковують місця для заби-
рання води, купання людей і тварин тощо.
У міських вогнищах лептоспірозу як профілактичні заходи засто-
совують дератизацію і захищають харчові продукти від пацюків.
Осіб, які працюють у вогнищах інфекції, піддають вакцинації. Лепто-
спірозна вакцина, що застосовується нині, є зависсю вбитих нагрі-
ванням лептоспір кількох серологічних груп.
ЗБУДНИКИ ПОВОРОТНОГО ТИФУ
Залежно від характеру перенощиків виділяють епідемічний пово-
ротний тиф, що передається вошами, й ендемічний, при якому перено-
щиками є кліщі.
Збудники поворотного тифу — борелії (Воггеїіа) відрізняються
від трепонем наявністю крупних пологих нерівномірних завитків,
кількість яких коливається від 3 до 10 (див. рис. 4, а). Епідемічний
поворотний тиф спричиняється В. гесиггепііз. Збудником епідемічного
(кліщового) поворотного тифу можуть бути різні види патогенних
борелій — В. диНопі, В. регзіса, В. саисазіса, В. ІаіузсЬеигі та ін.
Збудник епідемічного поворотного тифу відкритий
О. Обермайєром у 1868 р.
Морфологія. Борелії епідемічного поворотного тифу — В. гесиг-
гепііз — тонкі спіралеподібні мікроорганізми завдовжки 8—18 мкм
і завширшки 0,3—0,6 мкм, мають 3—8 завитків; кінці борелій заго-
стрені (рис. 91). Борелії епідемічного поворотного тифу рухливі, грам-
негативні, забарвлюються за методом Романовського — Гімзи в си-
ньо-фіолетовий колір. Мікроструктура їх така сама, як і лептоспір.
У старих культурах борелій утворюються цистоподібні форми у ви-
гляді згорнутого цитоплазматичного циліндра.
Культивування. Збудник вирощують в анаеробних умовах на жи-
вильних середовищах з рН 7,2—7,4, що містять сироватку крові,
шматочки тканин або органів, і в курячих ембріонах. Кров хворого
(1—2 краплини) висівають у живильні середовища, заливають вазелі-
новим маслом і вміщують в термостат при температурі 37 °С. Культури
борелій зберігають свої вірулентні властивості протягом кількох років.
Резистентність. При кімнатній темпера-
турі в рідких середовищах (у запаяних
скляних трубках) збудник поворотного
тифу зберігається 14 діб, при заморожу-
ванні — 8, при температурі 0 °С — 3 доби.
Від дії температури 45—48 °С збудник гине
протягом ЗО хв.
Патогенність для тварин. У природних
умовах тварини на поворотний тиф не хво-
ріють. В експерименті з великим трудом
вдається заразити пацюків, білих мишей
і мавп.
Патогенез захворювання в людини.
У 1874 р. Г. Н. Мінх, а в 1881 р.
Рис 91. Борелії епідемічно-
го поворотного тифу.
303
І. І. Мечников дослідами на собі довели, що кров людей, хворих на
епідемічний поворотний тиф, заразна. Ці дані були підтверджені експе-
риментально в 1912—1914 рр. Ш. Ніколем, Е. Консеєм та ін Джерело
інфекції — хвора на епідемічний поворотний тиф людина, переіющик—
одежна воша (Ресіісиїиз Ьитализ). При кровоссанні борелії потрапля-
ють у кишечник воші, розмножуються вони в гемолімфі. Через 5—
12 діб воша при укусі може інфікувати людину. В організм людини
борелії проникають в результаті втирання гемолімфи роздавлених
вошей. Період, протягом якого воші можуть заразити людину, відпо-
відає тривалості їх життя (25—40 діб). Трансоваріальної передачі
борелій у вошей немає. Епідемічний поворотний тиф найчастіше вини-
кає в зимову пору року.
Збудник поворотного тифу розмножується в тканинах лі.мфоїдно-
макрофагальної системи. На кінець інкубаційного періоду він про-
никає у великій кількості в кров, де під впливом її бактерицидних
речовин частково гине. Ендотоксин, що утворюється, зумовлює
ураження центральної нервової системи, розвиток токсикозу, гарячки,
функціональних порушень, дистрофії органів і тканин. Ендотоксин
уражує кровоносну систему, сприяє розвиткові інфарктів і некрозів
у селезінці і печінці.
Під впливом антитіл і внаслідок навантаження борелій тромбоци-
тами виникають складні агрегати, які затримуються в капілярах внут-
рішніх органів. Під дією лізинів і фагоцитів збудники руйнуються.
Борелії, що містяться в глибоких тканинах і центральній нервовій си-
стемі, внаслідок варіабельності генів набувають стійкості до нового
середовища свого життя і змінюються в антигенному відношенні,
в результаті чого на них не діють антитіла, що утворились при пер-
шому приступі. Розмноження нового різновиду борелій зумовлює
чергові приступи захворювання, кількість яких коливається від 3 до
5; вони тривають доти, поки організм не знешкодить усі раси збудника.
Захворювання характеризується високою температурою тіла (39—
40 °С), нудотою, блюванням, збільшенням селезінки. При першому
приступі гарячка тримається 6—7 діб, потім температура тіла різко
спадає, настає період апірексії або ремісії протягом 5—7 діб. Трива-
лість кожного наступного приступу зменшується, а період апірексії
подовжується.
імунітет нестійкий і нетривалий, характеризується наявністю
антитіл (аглютиніни, лізини, тромбоцитобарини, які спричиняють
феномен навантаження Рікенберга — Брусіна).
Лабораторна діагностика. Для виявлення збудника захворювання
досліджують товсту краплину і мазки крові, взяті під час приступу
(забарвлення за методом Романовського — Гімзи, фуксином, за Бур-
рі). Краплини крові вивчають у темному полі для визначення рухли-
вості борелій. У період апірексії борелій визначають методом збага-
чення: 8—10 мл крові хворого піддають зсіданню, сироватку відсмок-
тують і центрифугують при 3000 об/хв протягом 45—60 хв, потім з оса-
ду на дні пробірки і краплини сироватки крові роблять товсті мазки,
висушують на повітрі, фіксують сумішшю Никифорова, забарвлюють
за Романовським — Гімзою і вивчають під мікроскопом.
304
Крім того, в період апірексії можна ставити серологічну пробу.
На предметному склі змішують краплину сироватки крові хворого,
який переніс приступ поворотного тифу, з краплиною крові хворого,
яка містить збудник, накривають покривним склом і вміщують у тер-
мостат. Через 30—60 хв борелії під впливом антитіл втрачають рухли-
вість і гинуть.
Для проведення імунологічної реакції Рікенберга — Брусіна си-
роватку крові хворого змішують з цитратною плазмою крові морської
свинки в однакових об’ємах. До трьох об’ємів цієї суміші додають
один об’єм культури борелій, суміш старанно перемішують в гостро-
кінцевих пробірках, вміщують у термостат на 15 хв при температурі
37 °С, потім з дна беруть піпеткою краплину суміші,переносять її на
предметне скло, накривають покривним склом і досліджують у тем-
ному полі з імерсійним об’єктивом. Коли є специфічні антитіла, тром-
боцити морської свинки адсорбуються на поверхні тіла борелій і не
дають їм рухатись (борелії «навантажуються» тромбоцитами).
Для диференціації епідемічного й ендемічного поворотного тифу
використовують біологічний метод: морській свинці вводять 3—5 мл
крові хворого; за наявності епідемічного поворотного тифу тварина
не захворює.
Виявлення борелій у товстій краплині крові і мазках у період га-
рячкового стану є вирішальним у діагностиці епідемічного поворот-
ного тифу.
Лікування полягає у призначенні антибіотиків — пеніциліну, лево-
міцетину, еритроміцину, напівсинтетичних препаратів тетрацикліну.
Профілактика. Захворюваність на поворотний тиф набирає епі-
демічного характеру в періоди народного лиха (війна, голод).
Підвищення матеріального і культурного рівня життя населення,
здійснення протиепідемічних заходів, своєчасна діагностика захворю-
вання, госпіталізація хворих, медичний нагляд за вогнищами обумо-
вили ліквідацію епідемічного поворотного тифу в нашій країні.
Збудник ендемічного поворотного тифу. Один із збудни-
ків захворювання — В. диііопі — виявлений у крові хворих у 1904 р.
Р. Россом Потім були описані В. регзіса (Е. П. Джунковський, 1913)
та інші види борелій — В. ІаіузсЬеин, В. сансазіса, які можуть спри-
чиняти ендемічний поворотний тиф.
Морфологія. Борелії ендемічного поворотного тифу схожі на збуд-
ників епідемічного поворотного тифу.
Культивування проводять у середовищі Гельтцера, яке складає-
ться з нагрітої до 56—58 °С сироватки крові кроля і однакового об’є-
му ізотонічного розчину натрію хлориду з шматочками зсілого білка
курячого яйця.
Антигенна структура. Відомо кілька варіантів борелій, патоген-
них для людини і тварин. Диференціація їх за серологічними власти-
востями та морфологічними ознаками неможлива; більш результатив-
ний у цьому відношенні біологічний метод.
Резистентність. У збудників ендемічного поворотного тифу рези-
стентність майже така сама, як і в борелій епідемічного поворотного
тифу.
305
Патогенність для тварин. У природних умовах збудники ендеміч-
ного поворотного тифу паразитують в організмі диких гризунів і ко-
махоїдних, від яких вони потрапляють в організм кліщів роду От і Пі-
доріте. Із експериментальних тварин сприйнятливі до борелій кліщо-
вого поворотного тифу морські свинки, білі миші і пацюки.
Патогенез захворювання у людини. За патогенезом і клінічною
картиною захворювання схоже на епідемічний поворотний тиф. Трап-
ляється захворюваність на ендемічний поворотний тиф у Середній Азії,
Закавказзі, на Північному Кавказі, в Казахстані, Херсонській обла-
сті. Найчастіше виникає в теплу пору року, переважно навесні.
Біотопом кліщів є нори, тріщини в грунті, печери, сміття глинобит-
них будівель, сараїв, гроти, в яких збудник циркулює від диких ссав-
ців до кліщів і навпаки. Кліщі паразитують на гризунах, які стають
джерелом інфекції.
Проникнення борелій у яйцепроводи і яйця кліщів зумовлює мож-
ливість трансоваріальної передачі збудника. Зараженість кліща збері-
гається протягом усього його життя (понад 10 років). Людина зара-
жується при укусі кліща. На місці укусу утворюється папула (пер-
винний афект).
Захворювання характеризується приступами гарячки тривалістю
І—2 доби; кількість приступів може бути 5—7—9 і більше.тривалість
ремісій — від кількох годин до 6—8 діб.
Імунітет. У населення ендемічних районів імунітет виникає
в ранньому дитинстві, про що свідчить виявлення антитіл у сироватці
крові місцевих жителів. Хворіють головним чином приїжджі.
Лабораторна діагностика. Роблять бактеріоскопію товстої крап-
лини і мазків крові для виявлення борелій.
При експериментальному зараженні морських свинок (введенням
0,5—1 мл крові підшкірно або І—2 краплин у кон’юнктиву ока)
захворювання настає через 5—7 діб; у крові знаходять велику кіль-
кість борелій (борелії ендемічного поворотного тифу для морських
свинок непатогенні). При внутрішньоочеревинному зараженні білих
мишей борелії виявляють у крові через 48 год.
Лікування. Хворим призначають ампіцилін, левоміцетин, напів-
синтетичні препарати тетрацикліну.
Профілактика полягає у здійсненні заходів для знищення кліщів
і гризунів, ранній діагностиці захворювання, госпіталізації хворих
і додержанні особистої профілактики (захист людей від нападу кліщів).
Крім середньоазіатського, описано близько 20 самостійних нозо-
логічних одиниць ендемічного поворотного тифу (іспанський, бал-
канський, іранський, індійський, африканський, північноамерикан-
ський та ін.), які спричиняються окремими сероварами борелій. За-
хворювання на ендемічний поворотний тиф різної етіології трапля-
ються в багатьох країнах світу.
Збудная хвороба Лайма (Воггеїіа Ьиг§(іогїегі) виділений із крові»
шкіри і спинномозкової рідини людей у 1982 р. у США. Борелії грамиегативиі,
довжина їх ЗО мкм, діаметр 0,18—0,25 мкм; мають 7 завитків.
Хвороба Лайма характеризується природною вогиищевістю, передається
іксодовими кліщами, що паразитують иа свійських і диких тваринах, поширена
306
у США, у багатьох країнах Європи, в Австралії, Африці, Китаї, Японії і в на-
шій країні.
У перебігу захворювання виділяють три стадії. У першій стадії через
2—30 діб після укусу кліщем Іходез дапітіпі на тілі хворої людини з’являєть-
ся мігруюча еритема, настають почуття втомленості, гарячка, озноб, головний
біль, біль у спині. У 25—50 % хворих спостерігаються вторинні висипи.
У другій стадії бувають неврологічні розлади і мігруючий біль у кістках
і м’язах, іноді — порушення діяльності серця тривалістю від 3 діб до 6 тиж-
нів. На третій стадії захворювання у 60 % хворих виникає артрит, що три-
ває кілька тижнів; найбільш уразливі колінні суглоби.
В усіх стадіях захворювання є ознаки ураження нервової системи: голов-
ний біль, біль у ділянці шиї, сонливість, провали пам’яті, швидка зміна
настрою.
Лабораторна діагностика грунтується на бактеріоскопії мазків у темному
полі, реакції імунофлюоресценції, виділенні чистої культури борелій.
Лікування проводять антибіотиками (пеніцилін, тетрациклін, еритроміцин,
цефалоспорин), під впливом яких настає тимчасове загострення — реакція
Ярнша — Герксгеймера, що виникає в результаті з’єднання антигенів борелій,
антитіл і комплементу.
Профілактика полягає в додержанні заходів обережності в ендемічних
районах, де є перенощнки збудника — іксодові кліщі. Найбільша активність
кліщів буває у червні — вересні. У цей період особливо важливо забезпечити
захист дітей від укусу кліщами.
ПАТОГЕННІ СПІРИЛИ
Представником патогенних спірил є збудник содоку — ЗрігіПит тіпог,
що належить до родини Зрігіііасеае, роду ЗрігіІІит (рис. 92, а).
Морфологія. Спірили содоку — короткі товсті (З—5 мкм завдовжки й 0,2—
0,5 мкм завширшки) рухливі мікроорганізми, що мають пучок джгутиків на
кожному кінці (рис. 92, б). Вони грамнегативні, за Романовським — Гімзою
забарвлюються в рожевувато-фіолетовий колір.
Культивування і токсиноутворення. Патогенні спірили на штучних жи-
вильних середовищах не культивуються; вони слабко розвиваються лише в ге-
молізованій крові кролів, з великим трудом їх вдається зберегти протягом
кількох днів у згустку людської крові при температурі 37 °С. Розчинного ток-
сину спірили ие продукують, усі патологічні зміни, що спричиняються спіри-
лами, зумовлені ендотоксином.
Патогенність для тварин. Спірили содоку патогенні для білих мишей,
пацюків, морських свинок. їх можна виявити у хворих котів і собак.
Збудник локалізується в місці укусу пацюка, де він спричиняє виникнен-
ня запального вогнища, ураження лімфатичних вузлів і може гематогенним
шляхом проникати у внутрішні органи (нирки, надниркові залози, печінку,
яєчники, мозкові оболонки).
Патогенез захворювання в людини. Захворювання характеризується рап-
товим початком, підвищенням температури тіла до 39—41 °С, ботем у місці
укусу іноді утворенням інфільтра-
тів і виразок Гарячковий період
триває 3—5 діб, потім настає період
апірексії; через 2—Здоби температу-
ра тіла знову підвищується. Кіль-
кість приступів коливається в межах
4—10. Після другого або третього
приступу з’являється поліморфний
висип, розвиваються міозити, арт-
рити, запалення слизових оболонок
порожнини рота і кон’юнктиви.
Імунітет вивчений недостатньо.
У сироватці крові хворих і виду-
жуючих виявлено лізини і комп-
лементзв’язуючі антитіла.
Рис 92. ЗрігіІІит тіпог:
а — у темному полі мікроскопа; б — Із
джгутиками на кінцях.
307
Лабораторна діагностика охоплює бактеріоскопічне дослідження виділень
із запального вогнища (місце укусу) в темному полі й експериментальне зара-
ження тварин (морська свинка, біла миша) вмістом уражених лімфатичних
вузлів. У хворих тварин у крові і в ексудаті черевної порожнини з’являються
спірили.
Лікування проводять антибіотиками (пеніцилін, напівсинтетичні препарати
тетрацикліну).
Профілактика полягає у здійсненні загальних заходів дератизації й до-
держанні правил особистої гігієни.
КАМПІЛОБАКТЕРІЇ
До патогенних кампілобактерій, що входять до родини Зрігіїїасеае, роду
СатруІоЬасіег, віднесені С. ]е]ипі, С. соіі, С. іеіиз та інші види і підвиди,
які паразитують в організмі тварин і людини.
Морфологія. Кампілобактерії — тонкі, грамнегативні, рухливі, не утво-
рюють спор, спірально зігнуті палички, що мають по одному джгутику на од-
ному або на обох кінцях. Довжина їх 0,5—8 мкм, ширина — 0,2—0,5 мкм.
Збудники кампілобактеріозу —мікроаерофільні анаероби, що культиву-
ються у напіврідких і густих середовищах при температурі 25 °С (42—45 °С).
У біохімічному відношенні малоактивні. Чутливі до хлорамфеиіколу та інших
антибіотиків.
Патогенність для тварин. Кампілобактерії патогенні для телят, корів,
овець та інших тварин, передаються статевим шляхом; їх виявляють у піхвово-
му вмісті і в плаценті у корів, у сім’ї бугаїв, а також у тканинах абортованих
плодів великої рогатої худоби. Сприйнятливі до кампілобактерій морські
свинки і курячі ембріони. Деякі різновиди кампілобактерій спричиняють
аборти у корів, овець, свиней, їх виділяють із кишок і жовчного міхура, із
плаценти і вмісту шлунка плода абортованих овець. Кампілобактерії мають
адгезнвні н інвазнвні властивості, містять ендотоксин.
Патогенез захворювання у людини. Збудника кампілобактеріозу виявля-
ють у порожнині рота, кишках і в статевих органах людини. Люди заражують-
ся в результаті прямого контакту (статевим шляхом), через воду і харчові про-
дукти, можливе зараження плода під час родів. Інкубаційний період триває
в середньому 5 діб (2—10 діб). Типовими клінічними проявами є ознаки гастро-
ентериту: понос, біль у животі, блювання, незначне підвищення температури
тіла, головний біль, у вагітних жінок — можливі аборт, передчасні роди.
Останнім часом кампілобактеріоз набув значного поширення, в ряді країн
світу були епідемічні (водні, харчові) спалахи. Найвища захворюваність серед
осіб із зниженою резистентністю, дітей і людей похилого віку.
Лабораторна діагностика. У зв’язку з тим що клінічна картина захворю-
вання не має характерних ознак, діагноз може грунтуватися тільки на під-
ставі результатів лабораторного дослідження, до якого входять висівання крові
для виявлення бактеріемії, висівання випорожнень, плацентарної і навколо-
плідної рідини, виділень піхвн, вмісту абсцесів та іншого матеріалу. Висі-
вають у тверді й напіврідкі середовища (кров’яний агар, шоколадний агар І
тіогліколятний бульйон), культивують при температурі 25—37 °С в атмосфері,
що містить 10—15 % СОа. Виділені культури ідентифікують. Крім того, у си-
роватці крові хворих і видужуючих виявляють лізини і комплементзв’язуючі
антитіла, заражують курячі ембріони або морських свнпок.
Лікування проводять антибіотиками (ампіцилін, левоміцетин, напівсинте-
тичні препарати тетрацикліну, гентаміцин та ін ).
Профілактика здійснюється додержанням особистої гігієни під час догляду
за тваринами, захистом води і харчових продуктів від інфікування їх кампіло-
бактеріями хворих свійських тварин (телят, корів, овець, свиней).
ЯОй
РОДИНА Р5ЕІЮОМОМАОАСЕАЕ
СИНЬОГНІЙНА ПАЛИЧКА
Синьогнійна паличка — Рзеидотопаз аегіщіпоза — виявлена А. Люкке
в 1862 р. Віднесена до родини Рзеидотопадасеае, роду Рзеидотопая.
Морфологія. Синьогнійна паличка — поліморфна грамнегативна
рухлива бактерія, монотрих; іноді трапляються клітини з двома
і більшою кількістю полярних джгутиків. Довжина синьогнійної
палички 1,5—3 мкм, ширина 0,5—0,8 мкм. У мазках розташовуються
поодинокими особинами або короткими ланцюжками.
Культивування. Синьогнійна паличка — облігатний аероб. Опти-
мальна температура росту 37 °С, але може розвиватись і при 4—41 °С.
На МПА утворює круглі плоскі слизисті колонії, в МПБ — каламуть
з наступним випаданням осаду. Більшість штамів синьогнійної палич-
ки продукує пігмент піоціанін, який має синій колір у нейтральному
або лужному середовищі і червоний колір — у кислому середовищі.
Є штами, які утворюють пігмент темно-червоного кольору.
Ферментативні властивості. Синьогнійна паличка ферментує з ут-
воренням кислоти глюкозу, галактозу, арабінозу, ксилозу, не утво-
рює індолу, слабко продукує сірководень, розріджує желатину і зсілу
сироватку, виділяє гемолізин. Має антагоністичну дію, продукує
піоніаназу (піокластин) — антибіотик, який уперше виготовив
у 1889 р. Р. Еммеріх.
Токсиноутворення. Синьогнійна паличка продукує екзотоксин
(позаклітинний фермент — протеазу), який спричиняє структурні
іміни ендотелію судин, пригнічує синтез білка в клітинах печінки,
уражує мітохондрії. Вона виробляє гемолізини, лейкоцидин, ліполі-
:ахаридний ендотоксин, що надає збудникові антигенної специфіч-
юсті.
Антигенна структура. Р. аеги^епоза поділяють на кілька серогруп
і штамів. Деякі штами Р. аеги^епоза можуть передавати з К-плазмі-
дами детермінанти резистентності до Е. соїі і навпаки.
Резистентність. При температурі 60 °С синьогнійна паличка гине
протягом І год, чутлива до дії дезинфікуючих засобів, поліміксину,
неоміцину.
Патогенез захворювання в людини. В природних умовах синьо-
гнійна паличка живе в грунті, воді, рослинах (салата, банани, тютюн,
цибуля, цукрова тростина), нерідко її виявляють при опіках, у виді-
леннях із ран і сечовипускного каналу. Вона є збудником внутріш-
ньолікарняної синьогнійної інфекції. У людини спричиняє місцеві
і загальні гнійні процеси: отит, пієліт, цистит, кератит, менінгоенце-
фаліт, септицемію, перитоніт, інфікує поверхні ран і опіків. Особливо
чутливі до синьогнійної інфекції діти дошкільного віку й ослаблені
зсоби. У хворих з ураженням синьогнійною паличкою гній і марлеві
пов’язки забарвлюються в синьо-зелений колір.
Лабораторна діагностика полягає у виділенні чистої культури та
Гї ідентифікації. Ознакою, що найлегше помічається, в виявлення
309
піоиіаніну (лужну культуру обробляють хлороформом; коли е синьо-
гнійна паличка, середовище забарвлюється в синій колір).
Збудник, виділяючись із гноєм і випорожненнями від хворих,
може інфікувати харчові продукти, воду, грунт, різні предмети, які,
в свою чергу, е факторами передачі його людині.
Лікування хворих проводять антибіотиками (карбеніциліном, полі-
міксинами, гентаміцином).
Профілактика забезпечується неухильним додержанням лікарня-
ного режиму і виконанням санітарно-гігієнічних правил. У США хво-
рих з великими опіками лікують вакциною, виготовленою з інактиво-
ваних синьогнійних бактерій.
ЗБУДНИК САПУ
Збудника сапу (Рзеїпіотопаз таїїеі) відкрили Ф. Леффлер і 3. Шютц
у 1882 р. У людини його вперше виявив М. П. Васильєв у 1883 р.; входить до
родини Рзеисіотопабасеае.
Морфологія. Збудник сапу — тонкі прямі або трохи зігнуті палички за-
вдовжки 1,5—5 мкм, завширшки 0,5—0,8 мкм. Він поліморфний; у клітинах
часто утворюються сегменти, що містять полі-р-гідроксибутирати, які являють
собою резервний живильний матеріал; е нерухомі і рухливі штами. Трапля-
ються ниткоподібні форми завдовжки 8—12 мкм. Бактерії сапу ие утворюють
спор і капсул, грамнегативні, інтенсивніше сприймають барвник при дода-
ванні до нього лугу або кислоти. Короткі форми забарвлюються иа полюсах.
Культивування. Бактерії сапу — факультативні анаероби. Оптимальна
температура їх росту 37 °С, крайні границі 20—45 °С. Культивуються иа зви-
чайних середовищах, але краще ростуть иа зсілій сироватці крові або гліцери-
новому агарі при рН середовища 6,4—6,8. Колонії сірувато-білого кольору,
трохи прозорі, слизистої консистенції з вологою поверхнею. На бульйоні ро-
стуть з помутнінням або осадом на дні,на картопляному середовищі дають буй-
ний ріст з прозорим медоподібним нальотом яитарно-корнчневого кольору.
Ферментативні властивості подано в табл. 29.
Таблиця 29. Диференціація Р. таїїеі І Р. рзеидотаНеї
Вид Рухливість у Ферментація Розрідження Потреба в ернтритолі
1 з І зсілої си- роватки крові
Р. таїїеі _|_
Р. рзешіотаїїеі + — + +
Примітки. (+) —наявність відповідної ознаки; (—)—відсутність ознаки;
(±) — непостійна наявність ознаки.
Токсииоутворення. Бактерії сапу не продукують розчинного токсину. Вони
містять ендотоксин. Одним із продуктів розпаду є малеїн, що має яскраво
виражену алергічну дію.
Антигенна структура. Виділено два різновиди, або антигенні групи, бак-
терій сапу. Перша містить антиген, спільний для бактерій сапу й меліоідозу,
друга має антиген, властивий тільки бактеріям сапу. Крім того, із бактерій
сапу було виділено специфічний видовий полісахарид і неспецифічний иуклео-
протеїд.
Резистентність. Бактерія сапу зберігається в гниючому матеріалі 2—3 тиж-
ні, витримує висушування протягом 14 діб; малостійка проти дії високої тем-
310
ператури й антисептиків; 5 % розчин хлорного вапна і 2 % розчин формаліну
вбивають ії протягом 1 год.
Патогенність для тварин. На сап хворіють коні, віслюки і мули. Описано
випадки захворювання на сап хижих звірів: лева, леопарда, барса, рисі, сте-
пового кота. Тварини, хворі на сап, підлягають знищенню.
З експериментальних тварин сприйнятливі морські свинки, коти, сірі
миші. При зараженні морських свинок на місці введення збудника з’являються
припухлість, розм’якшення, некроз з утворенням виразок і вузликів у внут-
рішніх органах.
Прн виутрішньоочеревиниому зараженні морських свинок (самців) на 2—
3-й день виникає гнійне запалення оболонок яєчка, з’являються припухлість
і гіперемія (феномен Штрауса). При зараженні сірих мишей у них розвивається
септицемія.
Патогенез захворювання у людини. Основним джерелом інфекції є тварини,
хворі на сап. Зараження настає в результаті контакту з тваринами, їх виді-
леннями, а також через інфіковані збрую, відра, мішки, корм, воду. Захворю-
ють найчастіше конюхи, їздові, ветеринари, працівники лабораторій. Сап на-
лежить до зооиозних інфекцій. Хвороба в людини буває гострою і хронічною.
Збудник проникає в організм через садна на шкірі, слизову оболонку носа,
кон’юнктиву, а також перорально й аерогенно через верхні дихальні шляхи.
При гострій формі інфекції на місці проникнення збудника виникає при-
пухлість і утворюється вузличок, який розпадається з розвитком виразки.
Надалі з’являються запалення регіонарних лімфатичних вузлів, пустульозний
висип на шкірі і слизових оболонках, розвиваються пустули (гноячки) у м’я-
зах або в підшкірній клітковині.
Іноді уражуються суглоби, слизова оболонка носа, шкіра обличчя; буває
висока температура тіла, загальна слабкість.
У ряді випадків захворювання закінчується септицемією. На розтині ви-
являють вогнища гнійного характеру в легенях, селезінці, печінці, кістковому
мозку і в слинних залозах.
При хронічній формі сапу виникають місцеві гранулеми з утворенням вира-
зок з неправильними й ущільненими краями. Захворювання триває кілька мі-
сяців і супроводиться рецидивами. Видужання настає тільки в половині випад-
ків. Сап супроводиться вираженою алергією.
Імунітет. У першій фазі захворювання імунітет інфекційний (иестериль-
ний). Друга фаза закінчується повним клінічним і біологічним вилікуванням,
при якому настає стан стерильного імунітету. У крові тварин і людини утво-
рюються аглютиніни, комплементзв’язуючі антитіла.
Лабораторна діагностика. Бактеріоскопічиому дослідженню піддають ви-
ділення виразок, слизової оболонки носа, пунктат лімфатичних вузлів, вміст
абсцесів. Виявлення схожих на збудник сапу бактерій є попереднім етапом ла-
бораторної діагностики. Висівання патологічного матеріалу на зсілу сироватку
крові або картоплю, гліцериновий бульйон, виділення чистої культури дуже
рідко завершується позитивним результатом. Точнішим методом діагностики
сапу є зараження досліджуваним матеріалом або виділеною культурою лабо-
раторних тварин — самців морських свинок виутрішньоочеревинно, сірих ми-
шей або котів під шкіру потилиці.
Для серологічної діагностики застосовують РЗК — основний метод ви-
явлення сапу у тварин.
Лікування. Застосовують напівсинтетичні препарати тетрацикліну в ком-
бінації з сульфаніламідними препаратами (норсульфазол) і стрептоміцином,
здійснюють дезинтокснканію. При хронічних формах сапу рекомендується
аутовакцинотерапія.
Профілактика полягає в ранньому розпізнаванні захворювання серед ко-
ней за допомогою малеїнової проби та серологічних реакцій. У ветеринарній
практиці з профілактичною метою застосовують імунізацію тварин спеці-
альною вакциною.
Хвора людина як джерело розповсюдження сапу не становить значної не-
безпеки. Проте ізоляція хворого і дезинфекція приміщення обов’язкові.
У нашій країні сап серед людей останнім часом не трапляється. Вій спо-
стерігається в країнах Африки, Азії та Америки.
311
ЗБУДНИК МЕЛІОЇДОЗУ
Збудника меліоїдозу (Рзеигіотопач рзеисіота Пеі) відкрили в 1912 р.
А. Уайтмор і К. Крішиасвамі; входить до родини Р$еи<1отопа<1асеае.
Морфологія. Бактерія меліоідозу — коротка, рухлива (лофотрих), зігнута,
зерниста паличка з округленими кінцями, завдовжки 1,5 мкм і завширшки
0,8 мкм. Не утворює спор і капсул, схожа на збудник сапу. У мазках бактерії
мелюїдозу розташовуються одиничними особинами і короткими ланцюжками.
Характерними ознаками для иих є наявність гранул полі-0-гідроксибутирату
як внутрішньоклітинного резервного живильного матеріалу.
Бактерії меліоідозу грамнегативні, забарвлюються за Ромаиовським —
Гімзою, а також усіма аніліновими барвниками біполярно і стають схожими иа
бактерії чуми. При повторних висіваннях рухливість і біполярність бактерій
меліоїдозу втрачаються.
Культивування. Збудник меліоїдозу може рости в аеробних і анаеробних
умовах. Оптимальна температура росту 37 °С, крайні границі 4—42 °С. Куль-
тивуєтьсяіу звичайних середовищах при рН 6,8—7,2. На зсілій сироватці крові і
в гліцериновому агарі розвивається у вигляді білуватих,гладеньких, сокови-
тих, блискучих колоній, які надалі стають сухими й плоскими. Від бактерій
сапу відрізняється рухливістю, здатністю розріджувати желатину й потребою
в еритритоді.При старінні в колоніях настають зміни у вигляді зморшкуватості
й ослизнення. Гемолітичних властивостей бактерії меліоїдозу не мають.
На 5 % гліцериновому агарі через 48 год після висівання видно сухі,
зморшкуваті колонії. У МПА через 1 добу утворюються гладенькі колонії,
через 2—3 доби вони стають шорсткими й плоскими, иа 4—7-му добу з’являє-
ться пігмент жовтувато-коричневого кольору. При рості в МПБ спочатку настав
легке помутніння, яке потім посилюється. На картопляному середовищі з’яв-
ляється пігмент кремового кольору.
Ферментативні властивості показані в табл. 29.
Токсиноутворення. Збудник меліоїдозу не виділяє екзотоксину, він проду-
кує кілька фракцій ендотоксину: слабку термостабільну, яка спричиняє у тва-
рин еритему на місці введення, і дві сильні термолабільні. Одна з иих зумовлює
геморагічні і некротичні ураження, друга спричиняє летальний кінець у тва-
рин без виражених змій шкіри і тканин у місці ін’єкції.
Антигенна структура. Збудник меліоїдозу має Н-антиген (джгутиковий)
і О-антиген (соматичний), який спільний з антигенами бактерій сапу та деяких
сальмонел і, отже, не має специфічності. Виявлено також М- і К-антигени, які
теж належать до соматичних і аглютинуються відповідними сироватками.
М-антиген перешкоджає аглютинації з О- і К-сирозатками. К-антиген затримує
аглютинацію О-сироваткою.
Із старих культур бактерій меліоїдозу виділено специфічний фаг. Дифе-
ренційовано два типи фага: північнов’єтиамський і південнов’етнамський.
Резистентність. Збудник меліоїдозу довго зберігається у зовнішньому сере-
довищі, не втрачаючи своєї вірулентності. На гліцериновому агарі він не
втрачає патогенності протягом 8 років. При зараженні морських свинок через
2—3 тижні спричиняє смертельний кінець. Стійкий до висушування, у грунті
зберігається близько місяця. У питній воді залишається вірулентним 44доби,
у грунті — ЗО, у трупному матеріалі гризунів — 8 діб. Швидко гине при кип’я-
тінні; І % розчин фенолу й 0,1 % розчин формаліну вбивають його протягом
24 год.
Патогенність для тварин. До збудника меліоїдозу сприйнятливі пацюки,
миші, котн, собаки, коні, дрібна рогата худоба, мавпи, з експериментальних
тварин — морські свинки, кролі, білі пацюки, миші.Захворювання характери-
зується септицемією і виникненням множинних абсцесів у лімфатичних вузлах,
печінці, селезінці, легенях (септикопіемія); у самців морських свинок утво-
рюється орхіт.
Патогенез захворювання у людини. Меліоїдоз —аоонозна інфекція, що на-
гадує за клінічною картиною сап.
Меліоїдоз спостерігається у пацюків на Малайському архіпелазі,в Китаї,
Бірмі, Індії, Австралії, Центральній і Південній Америці, Європі. Захворю-
вання у пацюків має хронічний перебіг і призводить їх до загибелі. У природних
312
умовах меліоїдоз трапляється у вигляді епізоотії серед гризунів (дикі пацюки,
миші), у котів, собак, свиней (при поїданні трупів гризунів), великої і дрібної
рогатої худоби.
Захворювання у людини трапляється рідко, виникає в ендемічних щодо
цієї інфекції районах і, як правило, призводить до летального кінця.
Р. рзеидотаііеі виділяється з організму хворих тварин з виділеннями сли-
зової оболонки носа, гнійно-слизистими виділеннями виразок шкіри, а також
з мокротинням і фекаліями. При цьому інфікуванню піддаються територія,
житлові приміщення, харчові продукти та інші об’єкти.
Людина заражується при вживанні їжі, інфікованої гризунами. Резерву-
аром і перенощиком збудника можуть бути пацюкові блохи, комарі.
Захворювання має перебіг загального септичного у гострій, підгострій
І хронічній формах.Гостра форма характеризується високою температурою тіла,
сильним головним і м’язовим болями, ядухою, блюванням, поносом, лейкоци-
тозом; потім розвиваються абсцеси у м’язах і гнійні пустули на шкірі. Звичай-
но на 5—10-ту добу настає смерть.
При підгострій формі меліоїдозу переважають гнійні процеси в різних
органах і тканинах: абсцес легені, гнійний орхіт, міозит, остеомієліт з появою
множинних фістул; іноді розвивається менінгіт. Через 3—4 тижні хворий гине.
При хронічній формі меліоїдозу утворюються множинні виразки на шкірі
сідниць. Захворювання триває кілька місяців і призводить до летального
кінця.
Меліоїдоз у гострій формі схожий на легеневу і септицемічну форми чуми,
гострий сап, черевний тиф, коматозну форму малярії. Хронічний меліоїдоз
треба диференціювати з третинним сифілісом,туберкульозом шкіри,хронічним
сапом, бруцельозом, мікозами шкіри і кісток.
Імунітет не вивчено. Ймовірно, в процесі захворювання він не виробляє-
ться ні в тварин, ні в людини.
Лабораторна діагностика робиться висіванням крові, гною, трупного мате-
ріалу на живильні середовища, виділенням чистої культури та її ідентифіка-
цією за культуральними, ферментативними та біологічними властивостями.
При зараженні морських свинок у слизові оболонки розвиваються гнійний
кон’юнктивіт, риніт і вагініт з утворенням виразок, значно підвищується
температура тіла, збільшуються і нагнивають лімфатичні вузли; на 6—8-му
добу тварини гинуть.
При шкірному зараженні на місці введення збудника утворюється при-
пухлість, через 2—3 доби виникає некроз, утворюється виразка з підритими
краями, збільшуються, нагнивають і стають твердими лімфатичні вузли, у внут-
рішніх органах з’являються піемічні вогнища; смерть настає на 20-ту добу.
При зараженні у черевну порожнину розвивається перитоніт, у самців
виникає орхіт (феномен Штрауса).
На розтині трупів тварин в усіх внутрішніх органах виявляють вузлички —
ділянки сирнистого (казеозного) некрозу, збільшення печінки і селезінки. По-
дібні зміни спостерігаються також у легенях, нирках, сечовому і жовчному
міхурах, у підшкірній клітковині, кістках, м’язах.
Збудник меліоїдозу розвивається на живильних середовищах швидше,
ніж бактерія сапу; через 48 год він утворює складчасті колонії.
РА з сироваткою крові хворих у розведенні 1 : 160 діагностична.
Більш специфічна РИГА, яку ставлять з еритроцитами людини, сенсибі-
лізованими екстрактами з культур збудника меліоїдозу.
Лікування. Застосовують великі дози сульфаніламідних препаратів (нор-
сульфазол, сульфазин), а для пригнічення супровідної мікрофлори, яка може
стати патогенною, призначають масивні дози антибіотиків (пеніцилін, левомі-
цетин, стрептоміцин та ін.). Значно ефективніше комбіноване застосування
антибіотиків і сульфаніламідних препаратів (хлорамфенікол + сульфадіазин,
хлорамфенікол -}- тетрациклін та інші поєднання).
Профілактика. Людей, хворих на меліоїдоз, госпіталізують. У вогнищі
роблять дезнифекцію, дезинсекцію І дератизацію з використанням крнснду,
барію гідрокарбонату, пасток і капканів.
Крім того, потрібні систематичний нагляд за ендемічними вогнищами,
своєчасне виявлення епізоотії, захист харчових продуктів і складів продо-
313
вольства, водо джерел від пацюків І мишей, віваріїв від проникнення диких
гризунів. Хворих тварин знищують, трупи їх спалюють або закопують на спе-
ціальних скотомогильниках.
БАКТЕРОЇДИ
Певну роль в інфекційній патології відіграють грамнегативні ана-
еробні бактерії, що належать до родини Васіегоісіасаеа. Це дрібні,
що не утворюють спор, нерухомі або рухливі палички з пери-
трихіальними джгутиками, хемоорганотрофи, облігатні анаероби.
Добре ростуть на звичайних середовищах при температурі 37 °С і
рН 7,0—8,6.
Рід Васіегоідез — велика група плеоморфних облігатних анаеро-
бів з округленими кінцями, розташовуються парами або короткими
ланцюжками; деякі штами утворюють капсулу, звичайно ферменту-
ють глюкозу. Багато бактероїдів живе у кишках людини, значно
рідше їх виявляють у дихальних шляхах і сечостатевих органах.
Вони також знайдені у різних порожнинах в людини і тварин. Деякі
види патогенні, спричиняють інфекційні процеси головним чином
в осіб, інфікованих патогенними й умовно-патогенними клостридіями.
Більша частина штамів зумовлює розвиток абсцесів у черевній порож-
нині, легенях, ендокардит.
Із 22 бактерій роду Васіегоідез найчастіше виділяють від хворих
В. Ігаоіііз і В. те1апіпо£епіси5.
В. (га£і1із — поліморфна паличка. Добре росте в присутності
жовчі, у живильних середовищах, що містять ескулін, продукує
пігмент темного кольору, чутлива до еритроміцину і рифампіну, мет-
ронідазолу, резистентна до пеніциліну, канаміцину. Слабко фермен-
тує глюкозу, мальтозу, лактозу, не ферментує маніт; на кров’яному
або сироватковому агарі утворює трохи вгнуті колонії, на цукровому
бульйоні дає помутніння й осад; більшість штамів не мають гемолі-
тичної дії. Мікроорганізм розвивається при температурі 25—45 °С
і рН 7—8,5. Виділений із вмісту нижніх відділів товстої кишки.
В. їга£І1І8 виявляють при виразках шкіри, абсцесах, апен-
дициті, перитоніті, інфекційному ендокардиті, циститі. Патогенні
штами при лабораторній діагностиці у зв’язку з їх вираженим облі-
гатним анаеробіозом виявляються з трудом. Для їх культивування
в неодмінно анаеробних умовах використовують середовища, в яких
є кров.
В. теїапіпо^епісиз росте при температурі 24 °С і рН 8,5, через
48 год росту утворює колонії темно-коричневого кольору, якіфлюорес-
ціюють під дією ультрафіолетового випромінювання. У цукровому
бульйоні дає помутніння з випаданням осаду, слабко ферментує глю-
козу, галактозу, крохмаль, не ферментує маніт. Диференціюють мік-
роорганізм з іншими видами бактерій за відновленням нітратів у ніт-
рити, утворенням індолу, розрідженням желатини та ферментацією
вуглеводів.
В. теїапіпо^епісиз виділяють із сечі і випорожнень. її виявляють
також при інфекціях порожнини рота, м'яких тканин, дихальних
314
шляхів, сечостатевих органів і кишок. Патогенність цієї палички зви-
чайно проявляється в асоціації з іншими видами мікроорганізмів.
Деякі види бактерій із роду ЕизоЬасіегіит, родини Васіегоібасаеа
також можуть спричиняти в людини гнійні і гангренозні процеси.
Так, Е. писіеаіит виявлено при інфекційних процесах у порожнині
рота, верхніх дихальних шляхах, у порожнині плеври, виділеннях
із ран; Е. ^опісііаїогтапз — при інфекціях дихальних шляхів і сечо-
статевих органів, кишок; Е. тогШегит виділено з абсцесів печінки,
прямої кишки, із крові при септицемії, ізпунктатів при гнійному плев-
риті, із сечовипускного каналу, порожнини рота, травного каналу та
випорожнень; Е. ріаиіі найчастіше виявляють у порожнині рота,
її роль в інфекційній патології висвітлено в розділі «Мікробіологія
порожнини рота».
ЗБУДНИК ХВОРОБИ ЛЕГІОНЕРІВ
Захворювання описане в 1976 р. в м. Філадельфії (США). Його було ви-
явлено серед легіонерів та членів їх сімей. Збудником захворювання вияви-
лась бактерія, виділена з тканини легені хворих людей у 1977 р. Мак-Лейдом
і К. Шепардом. Вона дістала назву Ье&іопе11а рпеиторЬіІІа і віднесена до ро-
дини Ье^іопеІІасеае.
Морфологія. Ь. рпеиторЬіІІа — паличка з загостреними кінцями завдовж-
ки 2—3 мкм (іноді 50 мкм) і завширшки 0,3—0,4 мкм; грамнегативна, не утво-
рює спор і капсул.
Культивування. Мікроорганізм росте на агарі Мюллера — Хінтона і в ву-
гільно-дріжджовому середовищі з додаванням пірофосфату заліза та [.-цис-
теїну. На густому середовищі на 3—4-ту добу росту утворюється колонія з піг-
ментом коричневого кольору, що дифундує в агар.
Антигенна структура і токсиноутворення. Із вірулентних штамів Ь. рпеи-
гпорЬіІІа виділено кілька антигенів,у тому числі типоспецифічний, термола-
більний, що має гемолітичну і токсичну дію иа лабораторних тварин.
Патогенез захворювання у людини. Зараження відбувається аерогенним
шляхом. У ряді випадків спалахи захворювання пов’язують з перебуванням
людей у приміщеннях, куди повітря надходило через несправні системи кон-
диціювання. В окремих випадках збудник був виділений із води, яку викори-
стовують для системи кондиціювання повітря. Механізм передачі інфекції від
людини до людини не встановлено. Отже, ймовірним резервуаром збудника є
зовнішнє середовище (грунт, екологічні ніші міських промислових ландшафтів
і, можливо, вода).
Інкубаційний період триває 2—10 діб. Характерними симптомами захво-
рювання є нездужання, головний біль, біль у м’язах; иа 2—3-тю добу підвищує-
ться температура тіла до 39—40 °С, з’являються озноб, нежить, сухий кашель,
ядуха, біль у животі, хрипи в легенях, іноді шлунково-кишкові кровотечі.
Летальність досягає 7—19 %, під час спалахів — 15—20 %.
На розтині трупів виявляється картина часткової, рідше часточкової пнев-
монії. Збудник локалізується в некротичному клітинному детриті як внутоіш-
ньо-, так і позаклітинно; має пневмотропиість.
Імунітет клітинний і гуморальний. Буває значне підвищення тнтру анти-
тіл (у 4 рази і більше) у період між гострою стадією і реконвалесценцією (иа
З—5-му тижні).
Лабораторна діагностика охоплює виділення збудника із пунктату плеври;
виявлення Ь рпеиторЬіІІа методом прямої імуиофлюоресиеннії; постановку
непрямої імуиофлюоресненції з антигеном збудника; ІФА (для виявлення анти-
гену в сечі)
Лікування проводять антибіотиками (еритроміцин,пеніцилін, рнфампіцнн)
І патогенетичними засобами.
315
Профілактика. У зв’язку з тим шо джерело інфекції точно не визначене,
заходи загальної І специфічної профілактики не розроблені. Хвороба легіоне*
рів спостерігалась у США, Англії, Іспанії, Австралії, Канаді, Ізраїлі. Гол-
ландії, Югославії, Франції, Норвегії, ФРН, Швеції, Швейцарії. За період
1965—1982 рр. було виявлено більш як 200 спалахів і поиад 1000 спорадичних
випадків захворювань. У нашій країні також зареєстровано як окремі випад-
ки, так і спалахи аахворювания, шо пов’язують з інфікованою водою замкну-
тих систем охолодження, кондиціонерів, душових, плавальних басейнів, ма-
сажних ваии. Близько 70 % захворювань припадає на літній період
РИКЕТСІЇ
Рикетсії (Кіскеіізіа) — це поліморфні мікроорганізми (див.
рис. 6), живуть і розмножуються тільки в клітинах (цитоплазмі і ядрі)
тканин тварин, людини й перенощиків. Рикетсії не утворюють спор
і капсул, нерухомі, добре забарвлюються за Романовським — Гім-
зою, Цілем — Нельсеном, грамнегативні.
За допомогою електронної мікроскопії і цитохімічних досліджень
у рикетсій виявлено наявність нуклеоїду, внутрішньої оболонки
(6 нм) і зовнішньої, що складається із трьох шарів. У цитоплазмі ри-
кетсій виявлено гранули типу рибосом величиною 20—70 нм і вакуоле-
подібні структури діаметром 6—8 нм.
Рикетсії розмножуються діленням кокоподібних і паличкоподіб-
них форм з утворенням гомогенних популяцій, а також в результаті
дроблення ниткоподібних форм з наступним розвитком кокоподібних
і паличкоподібних утворів.
Таблиця ЗО. Види рикетсій, патогенних для людини, і захворювання, що ними
спричиняються
Види рикетсій ПереИОІЦИКИ Захворювання в людини
Кіскеіізіа ргочіаіекіі » іурЬі » сапала » гіскеНзіі » зіЬігіса » сопогіі з аизігаїіз » асагі Одежна воша Пацюкові блохи і во- ші людини Блохи і воші люди- ни Іксодові кліщі Те саме Л В Гамазові кліщі Епідемічний висипний тиф, хвороба Брілла Ендемічний блошиний гиф Плямиста гарячка Скелястих гір Те саме Півиічноазіатський кліщовий рикетсіоз (кліщова тифозна півиічноазіатська гарячка) Марсельська, або середземно- морська, гарячка Австралійський кліщовий рн- кетсіоз Везикульозний (вісповидиий)
» І5иІ$и£шпи$Ьі КосЬаІішасеа циіпіапа Сохіеііа Ьцгпеїіі Червоноті якові кліщі Одежна вошв Іксодові кліщі Цуцугамуші (гарячка цуцуга- муші) Окопна (траншейна, волинсь- ка, п’ятиденна) гарячка Ку-гаряч ка
316
Більша частина рикетсій належить до непатогенних мікроорганіз-
мів. Близько 50 різних видів рикетсій виявлено в кишках і слинних
залозах попелиць, клопів, кліщів.
Патогенні рикетсії із родини Кіскеїізіасеае поділені на три роди:
КіскеНзіа, Сохіеііа, КосЬаІітае, вони уражують різні види тварин і
людину. Захворювання, що спричиняються рикетсіями, мають назву
рикетсіозів (табл. ЗО).
ЗБУДНИК ВИСИПНОГО ТИФУ
У 1909—1910 рр. Г. Ріккетс і Р. Уайлер виявили в крові хворих иа мек-
сиканський висипний тиф («табардило») і в заражених вошах нерухомі дрібні
біполярні мікроорганізми. У 1913 р. чеський учений С. Провачек виявив
у плазмі крові і в лейкоцитах людей, хворих на висипний тиф, овальні і дов-
гасті тільця, які добре забарвлюються за Романовським — Гімзою. У 1916 р.
Г. X- Роша-Ліма иа підставі своїх багаторічних досліджень дійшов висновку,
що висипний тиф спричиняють дрібні поліморфні мікроорганізми, які ВИ-
ЯВЛЯЮТЬ у крові хворих і в кишечнику заражених вошей.
Морфологія. Рикетсії Провачека (Ріскеїізіа рго^агекіі) — гантеле-
подібні мікроорганізми (рис. 93). Середні розміри їх 0,3—0,6 мкм,
максимальні — 0,8—4 мкм. Вони добре забарвлюються феноловим
фуксином у червоний колір.
При електронній мікроскопії (рис. 93, б) у рикетсій Провачека
виявлено мікрокапсулу товщиною 10—12 нм, клітинну стінку і цито-
плазматичну мембрану. Цитоплазма заповнена рибосомами і осміофоб-
ннми ділянками нуклеоїду з фібрилами ДНК.
Культивування. Рикетсії добре розмножуються при температурі
25 °С у жовтковому мішку курячого ембріона. Застосовують і інші
методи культивування.
Токсиноутворення. Рикетсії містять у своєму складі термолабіль-
ний токсин, який руйнується при температурі 66 °С. Внутрішньооче-
ревинне або внутрішньовенне введення білим мишам зависі рикетсій
спричиняє у них через 2—24 год гостру інтоксикацію із смертельним
кінцем.
Антигенна структура. Рикетсії мають два антигени: термолабільний,
специфічний для рикетсій Провачека, і термостабільний, спільний
Рис. 93. Рикетсії Провачека у світловому (а) і в електронному
(б) мікроскопі.
317
для рикетсій Провачека й ендемічного блошиного тифу. Розчинні
антигени рикетсій схожі на антигени деяких бактерій. У 1916 р.
Е. Вейль і А. Фелікс виділили з сечі хворих на висипний тиф Ргоіеиз
0X19, який має властивість аглютинуватися в присутності сироватки
крові хворих на висипний тиф і реконвалесцентів. Виявилось, що
протей має спільний з рикетсіями полісахаридний гаптен. Для дифе-
ренціальної діагностики рикетсіозів використовують і інші штами
протея (0X2, ОХК, ОХЬ).
Резистентність. У висушених і непошкоджених вошах рикетсії
зберігаються до ЗО діб, а в сухих фекаліях вошей — до 6 діб. Від дії
температури 50 °С рикетсії гинуть за 15 хв, 56 °С — за 10 хв, 80 °С —
за 1 хв і 100 °С — за ЗО с. Бактерицидну дію на рикетсії Провачека
мають усі дезинфікуючі засоби (0,5 % розчин фенолу, 0,25 % розчин
формаліну та ін.).
Патогенність для тварин. До рикетсій Провачека сприйнятливі
мавпи, морські свинки, білі миші. У мавп можна відтворити висипний
тиф, схожий за клінічною картиною на висипний тиф у людини.
У морських свинок при внутрішньоочеревинному зараженні кров’ю
висипнотифозних хворих через 8—12 діб розвивається гарячка (тем-
пература тіла підвищується на 1—1,5 °С); збудник виявляють у крові,
внутрішніх органах, особливо багато його нагромаджується в мозку.
У білих мишей, заражених інтраназально під ефірним наркозом, роз-
вивається пневмонія.
Па гогенез захворювання у людини. У 1876 р. О. О. Мочутковський
дослідами на собі вперше довів заразність крові людей, хворих на
висипний тиф. Він висловив припущення, що висипний тиф переда-
ють кровососні комахи. У 1909 р. Ш. Ніколь із співавторами підтвер-
див це положення на мавпах і довів, що висипний тиф передається
через одежну вошу (Ребісиїиз Ьитапиз).
Джерело інфекції — хвора людина, перенощик — одежна воша.
Насмоктавшись крові висипнотифозного хворого, одежна воша на
З—10, найчастіше на 4—5-ту добу стає заразною. Рикетсії розвива-
ються при температурі ЗО °С у клітинах епітелію слизової оболонки
кишечника вошей; в результаті нагромадження рикетсій клітини руй-
нуються, і збудники разом з випорожненнями потрапляють на шкіру,
одяг.
Зараження висипним тифом настає не через укус вошей, а при
втиранні рикетсій, які виділяються при дефекації або роздавлюванні
вошей і проникають у садна, подряпини шкіри та слизових оболонок.
Трансоваріальної передачі рикетсій вошами не відбувається.
Рикетсії Провачека спричиняють у людей висипний тиф, для якого
характерні гарячка і розеольозно-петехіальний висип.
Висипний тиф належить до кров’яних інфекцій. Збудник захво-
рювання в період гарячки міститься в крові, у лейкоцитах, ендотелії
судин шкіри, мозку та інших органів.
Множинний тромбоз капілярів призводить до порушення живлен-
ня тканини, загибелі клітин, особливо центральної нервової системи.
Імунітет. Після перенесеного захворювання формується стійкий
клітинний і гуморальний імунітет. Повторні випадки висипного тифу
318
є рецидивами захворювання. Таку форму висипного тифу називають
хворобою Брілла; рецидиви настають в результаті різних несприят-
ливих дій (інфекційні або інші захворювання, хірургічне втручання,
переохолодження, психічні і фізичні травми, перевтома, голод та ін.)
на організм, який протягом тривалого часу був носієм рикетсій
у стані персистування.
При первинному висипному тифі виробляються головним чином
І&М, при рецидивуючому (хвороба Брілла) — І£(3.
Лабораторна діагностика. В основу лабораторної діагностики по-
кладені серологічні методи дослідження: РА з рикетсіями Провачека
(мікроаглютинація на склі і розгорнута в пробірках), РЗК, РИГА,
РІФ.
Треба враховувати, що у хворих, які вживали антибіотики, РА
можлива з низьким титром без наступного його наростання.
Лікування. Із введенням у практику терапії хворих на висипний
тиф препаратів тетрацикліну, левоміцетину летальність знизилась до
поодиноких випадків і останнім часом зовсім не реєструється. Сульфа-
ніламідні препарати протипоказані, оскільки вони посилюють ріст
рикетсій.
Профілактика охоплює: 1) ранню діагностику, ізоляцію і госпіталі-
зацію хворих; 2) санітарну обробку у вогнищі (дезинсекція); 3) нагляд
за особами, які контактували з хворим; систематичне здійснення
заходів для ліквідації вошивості серед населення і підвищення його
санітарної культури; 4) вакцинацію населення, для якої використо-
вується хімічна висипнотифозна вакцина, виготовлена з очищених
і концентрованих поверхневих антигенів рикетсій Провачека.
Завдяки здійсненню профілактичних заходів епідемічний висип-
ний тиф ліквідований на більшій частині нашої країни.
ЗБУДНИК ЕНДЕМІЧНОГО БЛОШИНОГО (ПАЦЮКОВОГО)
ВИСИПНОГО ТИФУ
Ріскеїізіа ІурЬі відкритий у 1928 р. X. Музером.
Морфологія і культивування. Рикетсії ендемічного висипного тифу
(див. форзац, рис. VII, а) менш поліморфні, ніж рикетсії Провачека;
розміри їх 0.35—1,3 мкм. Культивують їх у курячих ембріонах, вони
довго зберігаються у зовнішньому середовищі, особливо у висуше-
ному стані.
Патогенність для тварин. Мавпи і кролі відносно стійкі до рикет-
сій цього виду. У морських свинок (самців) при зараженні їх у кон’юн-
ктиву ока, слизову оболонку носа і порожнини рота з’являється
гарячка; найхарактерніший симптом — рикетсіозний періорхіт (скро-
тальний феномен), який розвивається при внутрішньоочеревинному
зараженні. Дуже чутливі до КіскеКзіа ІурЬі пацюки і миші.
Патогенез захворювання у людини. Основним джерелом збудника
в природі є пацюки і миші, які інфікуються одні від одних блохами,
вошами, можливо, й кліщами, а також перорально.
Люди заражуються ендемічним блошиним тифом від гризунів.
Збудник проникає в організм через слизові оболонки очей, носа,
319
порожнини рота, ушкоджену шкіру, через дихальні шляхи, а також
разом з харчовими продуктами, інфікованими сечею хворих гризу-
нів, втиранням фекалій заражених бліх у шкіру при розчухуванні.
Зараження людини можливе при укусі пацюкового кліща Вдеіопуз-
зиз Ьасоіі.
Захворюваність на блошиний висипний тиф серед людей звичайно
має ендемічний і спорадичний характер. У деяких випадках залежно
від епізоотичного стану можуть виникати місцеві спалахи.
Захворювання характеризується сезонністю, найбільше випадків
припадає на серпень — листопад (період збільшення кількості й ак-
тивності гризунів). Прояви ендемічного блошиного тифу багато в чому
схожі на прояви епідемічного тифу. Спостерігаються гарячка, виснп на
обличчі, грудях, животі, спині, долонях, підошвах, який спочатку
має розеольозний, а потім папульозний характер; іноді він буває
петехіальний.
Імунітет. Після перенесеного захворювання розвивається порів-
няно стійкий імунітет, перехресний з імунітетом прн епідемічному
висипному тифі.
Лабораторна діагностика. Для диференціації з епідемічним висип-
ним тифом паралельно ставлять РА або РЗК з відповідними антиге-
нами, а також внутрішньоочеревинно заражують самців морських
свинок для відтворення скротального феномену (рикетсіозний періор-
хіт).
Лікування хворих на ендемічний блошиний тиф проводять лево-
міцетином.
Профілактика цього рикетсіозу полягає в систематичному зни-
щенні пацюків і мишей, запобіганні проникненню гризунів у порти
з прибуваючих суден, захисті харчових продуктів від пацюків, зни-
щенні пацюкових бліх, вошей і кліщів.
У деяких випадках роблять вакцинацію людей, які живуть в енде-
мічних районах.
ЗБУДНИК МАРСЕЛЬСЬКОЇ ГАРЯЧКИ
КіскеНзіа сопогі уперше описана в 1910 р. А. Конором і А. Брухом.
Морфологія і культивування. Рикетсії мають паличкоподібну
форму, поліморфні. Довжина їх 1—1,75 мкм, ширина 0,3—0,4 мкм.
Добре культивуються на переживаючих тканинах курячого ембріона.
До рикетсій марсельської гарячки чутливі мавпи, морські свинки,
кролі, пацюки, миші, ховрахи.
Патогенез захворювання у людини. Марсельська гарячка характе-
ризується ендемічністю і сезонністю (літній період). Передається прн
укусі кліщів КЬірісерЬаІиз зап^иіпеиз, які паразитують на собаках.
Зараження можливе через кон’юнктиву очей втиранням рикетсій
у слизові оболонки.
Захворювання проявляється наявністю висипу, який спочатку
має розеольозний або макульозний характер, далі стає макуло-папу-
льозним, іноді з утворенням вторинних петехій. У більшості випад-
ків марсельська гарячка має доброякісний перебіг, без рецидивів.
320
Лабораторна діагностика охоплює РЗК з сироватками крові хворих
і рикетсіями марсельської гарячки (найбільш специфічна реакція);
виділення рикетсій із крові хворих, шкіри, розеол і з кліщів, знятих
з собак. Кров або розтертих у ступці кліщів вводять внутрішньоочере-
винно самцям морських свинок. Заражених тварин досліджують на
наявність рикетсій у мезотелії уражених піхвових оболонок яєчок.
Внутрішньоядерне розташування рикетсій підтверджує діагноз за-
хворювання.
Лікування проводять левоміцетином.
Профілактика. В ендемічних районах усіх дворових і мисливських
собак беруть на облік і систематично обробляють дезинсектицидними
препаратами у вигляді мазей; місця їх утримання піддають дезин-
секції; бродячих собак знищують.
ЗБУДНИК ПІВНІЧНОАЗІАТСЬКОГО КЛІЩОВОГО РИКЕТСІОЗУ
У 1938 р. П. Ф. Здродовський, Є. М. Голіневнч, М. К. Кронтовський та
ін. вивчили рикетсіози в ендемічних вогнищах Західного, Центрального і Схід-
ного Сибіру, на Далекому Сході, в Середній Азії і в Монголії.
Морфологія і культивування. Збудник північноазіатського кліщового ри-
кетсіозу КіскеНзіа зіЬігіса морфологічно схожий на рикетсії марсельської га-
рячки, має паличкоподібну форму, іноді трапляється у вигляді ниткоподібних
грубих утворів. При електронній мікроскопії виявлено джгутикоподібні утво-
ри 10—12 нм завтовшки і 0,3—3 мкм завдовжки. К. зіЬігіса культивується
в переживаючих тканинах курячих ембріонів, локалізується в ядрах уражених
клітин тканин та органів.
Рикетсії патогенні для мавп, морських свинок, кролів, пацюків, мишей.
Патогенез захворювання в людини. Збудник передається кліщем родів
Оегтасепіог, НаеторЬузаІіз, які паразитують на свійських і великих диких
тваринах і найбільш активні звичайно навесні. У цей період вони можуть напа-
дати на людину і заражати її. Максимум захворювань припадає на травень,
сезонність квітень — жовтень. Уражується переважно сільське населення.
У хворих на північноазіатський рикетсіоз збільшуються лімфатичні вуз-
ли, на грудях, спині і внутрішніх поверхнях кінцівок з’являється розеольоз-
ннй і папульозний висип з геморагіями. Внсип може також бути на обличчі,
долонях і підошвах; він зберігається і після зниження температури тіла, а на
його місці залишається пігментація.Спостерігається кон’юнктивіт. Захворю-
вання має доброякісний перебіг, без рецидивів.
Лабораторна діагностика. Звичайно використовують РЗК з сироваткою
крові хворих та антигеном із Р. зіЬігіса. Діагностичний титр комплементзв’я-
зуючих антитіл невисокий (1 : 20 — 1 : 200). Позитивна реакція буває, як
правило на 11-ту добу захворювання.
У спеціальних лабораторіях роблять виділення збудника виутрішньооче-
ревинним зараженням самців морських свинок кров’ю хворих, узятою в ранній
період захворювання. У тварин з’являються гарячка і запалення яєчка (скро-
тальний феномен), що супроводяться накопиченням рикетсій у його оболонках.
Лікують напівсинтетичними препаратами тетрацикліну, левоміцетином.
Профілактика полягає в індивідуальному захисті людей від нападу клі-
щів, а також здійсненні комплексу заходів, спрямованих на знищення кліщів,
що паразитують на свійських тваринах, дезинфекції постійних і тимчасових
житлових приміщень.
ЗБУДНИК ГАРЯЧКИ ЦУЦУГАМУШІ
Захворювання відоме дуже давно, рикетсіозну природу його довів у
1930 р. М Нагайо із співавторами.
Морфологія і культивування. Збудник гарячки цуцугамуші — Ріскеіізіа
Виїзицатизкі — дрібні поліморфні нерухомі бактерієподібні утвори, схожі на
11 1-445
321
Інші рикетсії кліщової групи; паразитує внутрішньоклітинно. Величина ри-
кетсій варіабельна: 0,3—0,5 мкм завширшки й 0,8—2 мкм завдовжки. У маз-
ках-відбитках, забарвлених за Романовським — Гімзою, рикетсії мають пур-
пурний колір і розташовуються в цитоплазмі мононуклеариих клітин; грам-
иегатнвиі. В електронному мікроскопі виразно видно поверхневу оболонку
І розсіяні в цитоплазмі гранули.
Рикетсії цуцугамуші розмножуються в культурах ткаиии ссавців, у хо-
ріоналантоісній оболонці, жовтковому мішку, агарових тканинних культурах.
Вони утворюють токсин, введення якого білим мишам спричиняє їх загибель
через кілька годин.
Рикетсії цуцугамуші відносно лабільні до впливу факторів зовнішнього
середовища, але довго зберігаються при температурі —70 °С; стійкі проти
висушування.
Патогенез захворювання в людини. У природних умовах збудник містить-
ся в організмі мишей-полівок та різних видів пацюків. Переиощиками є черво-
нотілкові кліщі (ТготЬісиїа акатизЬі, ТготЬісиІа зсЬиеИпегі), у личинковій
стадії спостерігається трансоваріальна передача рикетсій. До рикетсій цунуга-
муші сприйнятливі мавпи, кролі, морські свинки, миші, пацюки, хом’яки,
в яких при зараженні розвиваються характерні клінічні прояви і виявляються
властиві цій інфекції патологоморфологічиі зміни. Зараження людини відбу-
вається при нападі заражених личинок червонотілкових кліщів.
Захворювання супроводиться гарячкою, що триває 2—3 тижні; иа тлі га-
рячки з’являється макульозний або макулопапульозний висип. У місці про-
никнення збудника утворюється невелика виразка, покрита темною кіркою
(струп); розвивається регіонарний аденіт. У тяжких випадках уражуються сер-
цево-судинна і центральна нервова система, часто бувають ускладнення (пнев-
монія). Летальність до застосування антибіотиків була високою: від 8 до 60 %.
Хвора людина не заразна. Гарячка цуцугамуші поширена в Південно-Схід-
ній Азії.
Імунітет типоспецифічний; після перенесеного захворювання несприйнят-
ливість до цього типу або штаму рикетсій зберігається протягом кількох років.
При зараженні іншими штамами рикетсій бувають повторні випадки захво-
рювання.
Лабораторна діагностика передбачає РА з протеєм ОХК, яка досить часто
буває позитивною наприкінці 2-го тижня захворювання внаслідок нагромаджен-
ня аглютинінів у крові хворих на гарячку цуцугамуші. У період гарячки кров’ю
хворих заражують внутрішньоочеревинно білих мишей; якщо в крові хворих
є рикетсії, більшість заражених тварин гине протягом 2 тижнів. На розтині
виявляють характерні зміни у внутрішніх органах і наявність збудника в ек-
судаті.
Лікування проводять антибіотиками тетрациклінового ряду.
Профілактика полягає у здійсненні заходів для знищення кліщів, а також
захисті людини від їх нападу.
ЗБУДНИК ВЕЗИКУЛЬОЗНОГО РИКЕТСІОЗУ
Ріскеїізіа а сап описаний Р. Хюбиером, У. Джеллінсоном, К. Померенцем
у 1946 р. Перенощик — АПосіегтапуззиз хап^иіпеиз.
Везикульозннй (вісповидиий) рикетсіоз — загальне інфекційне захворю-
вання з інкубаційним періодом тривалістю 10—12 діб. Характеризується га-
рячкою, появою на 3—4-ту добу рясного везикульозно-папульозного висипу,
що нагадує висип при вітряній віспі.
Рикетсії виявляють у крові хворих у період гарячки. Вони високопато-
гениі для білих і сірих мишей, морських свинок, білих, сірих і бавовникових
пацюків. Культивуються иа курячих ембріонах; ці рикетсії — внутрішньо-
клітинні і позакл ітинні паразити, легко розмножуються в легенях білих мишей
при інтраназальному зараженні.
Для діагностики застосовують РЗК з очищеним і високоактивним антиге-
ном із рикетсій. Захворювання трапляється в США, Африці і в нашій країні
(Донбас).
322
Резервуаром інфекції є хатні миші і сірі пацюки. Перенощики (гамазові
кліщі) можуть передавати захворювання трансоваріально, внаслідок чого
вони теж є резервуаром інфекцій у природі.
Профілактика везикульозного рикетсіозу така сама, як і ендемічного
блошиного тнфу (знищення гризунів, застосування інсектицидів для знищення
кліщів).
ЗБУДНИКИ ПАРОКСИЗМАЛЬНИХ РИКЕТСІОЗІВ
Збудник окопної (волинської, або п’ятиденної) гарячки —
КосИаІітае диіпіапа (А. Клінке, 1917) — позаклітинний паразнт кишечника
вошей. Резервуар інфекції — хвора людина; перенощнк — одежна воша.
Волинська, або п’ятиденна, гарячка — епідемічне захворювання, пов’я-
зане з вошивістю населення. Захворювання не супроводиться висипом, про-
являється болем у кишках і кістках та рецидивуючою гарячкою. Лабораторну
діагностику не розроблено.
Значні спалахи волинської гарячки були на фронтах під час другої світової
війни. Захворювання може повсюдно траплятися у вогнищах вошивості, але
не завжди його розпізнають.
Збудник кліщового пароксизмального рикетсіозу — Косіїаіі-
тае диіпіапа. Джерелом інфекції є кліщі і гризуни, перенощиком — іксо-
дові кліщі (іхосіез гісіпиз).
ЗБУДНИК КУ-ГАРЯЧКИ
У 1937 р. в Австралії серед робітників скотобоєнь Е. Деррік виявив захво-
рювання, що дістало назву Ку-гарячки (від початкової літери англійського сло-
ва (^иегі — неясний, невизначений). У 1939 р. Ф. Бернет збудника Ку-гарячки
виділив із крові і сечі хворих.
Ку-гарячка трапляється в багатьох країнах світу, з 1948 р. реєструється
в ряді районів нашої країни.
Морфологія. Збудник захворювання — Сохіеі 1а Ьигпеіі — дрібн і
(0,25—0,5 мкм) ланцетоподібні мікроорганізми (рис. 94), що складаються
з оболонки, цитоплазми і нуклеоїду. Він може бути кокоподібним,
овоїдним, паличкоподібним, ниткоподібним (1 —1,6 мкм); виявлено
і фільтрівні форми. Рикетсії Бернета нерухомі, грамнегативні, добре
забарвлюються за Романовським — Гімзою, Здродовським.
Культивування. Вирощують рикетсії Бернета за методом Кокса
при температурі 35 °С у жовтковому мішку курячого ембріона, в якому
відбувається нагромадження великої кіль-
кості збудника, що використовується для
приготування як діагностикума, так і
вакцинних препаратів.
Ферментативних властивостей рикетсії
Бернета не мають. Наявність токсину в
них не доведена, проте вони містять алер-
гени і сенсибілізують організм з утворен-
ням васкулітів і гранулем.
Резистентність. Рикетсії Ку-гарячки
довго зберігаються у зовнішньому середо-
вищі: у стерильній водопровідній воді —
160 діб, у незбираному стерильному
коров’ячому молоці при кімнатній темпе- Рис 94. Збудник Ку-гарячкн.
1Г
323
ратурі—125 діб. Пастеризація молока їх не вбиває. Рикетсії виявляли
в свіжому сирі, кефірі та інших молочних продуктах. У свіжому м’ясі
заражених тварин при температурі 4 °С рикетсії Ку-гарячки зберіга-
ють життєздатність ЗО діб, у замороженому вигляді — ще довше.
Збудник Ку-гарячки витримує дію ультрафіолетового випромінюван-
ня протягом 1—5 год, низьких температур — кілька місяців. Рикетсії
Бернета стійкі до дії шлункового соку, ефіру, толуолу, хлороформу, не
гинуть у молоці від нагрівання до температури 90 °С понад годину, в
сухих фекаліях кліщів виживають 19,5 місяця, у висохлій сечі і кро-
ві хворих тварин — від кількох тижнівдо 6 місяців; в 1 % розчині
фенолу — протягом доби, в 0,5 % розчині формаліну — 4 доби.
Патогенність для тварин. У вогнищах Ку-гарячки збудник зна-
ходили у великої і дрібної рогатої худоби, собак, коней, віслюків,
мулів, птахів, кліщів. Захворювання характеризується природною
вогнищевістю, воно зоонозне. Тварини виділяють збудник з молоком,
сечею, плацентою, навколоплідною рідиною і випорожненнями.
В експерименті морських свинок заражують введенням внутріш-
ньоочеревинно 3—6 мл крові, взятої у хворих на висоті гарячки.
У заражених тварин через 5—13 діб розвивається гарячка, яка три-
ває 1—6 діб. Захворювання найчастіше закінчується видужанням.
Для експериментального відтворення інфекції можуть бути вико-
ристані миші, білі пацюки, хом’яки, кролі.
Патогенез захворювання в людини. Іксодові кліщі виділяють з фе-
каліями величезну кількість збудників, які можуть надходити в орга-
нізм разом з їжею, водою, повітряно-пиловим шляхом і через ушкодже-
ну шкіру при укусі. Доведено зв’язок захворювання з роботою на
бойнях, на підприємствах м’ясної промисловості, молочних фермах.
Люди заражуються при обробці шерсті, під час перебування поблизу
скотних дворів і молочних ферм, при вживанні сирого молока і молоч-
них продуктів від хворих тварин. Захворювання найчастіше буває
у квітні — травні. Хвора людина може виділяти рикетсії з мокротин-
ням, яке треба знешкоджувати. Потрапляючи в організм людини,
рикетсії Бернета проникають у клітини тканин та органів лімфоїдно-
макрофагальної системи, кров і лімфу. Фагоцитовані рикетсії не лі-
зируються (незавершений фагоцитоз), вони розмножуються в лейко-
цитах і спричиняють септицемію.
Ку-гарячка характеризується поліморфізмом клінічних проявів.
Виділяють три форми захворювання: пневмонічну, гарячкову, або
грипозну, й менінго-енцефалітичну; кожна з них має ряд особливо-
стей. Захворювання розвивається раптово, після інкубаційного пе-
ріоду тривалістю 7—28 діб. Характеризується різким підвищенням
температури тіла — до 38—40 °С, яке супроводиться ознобом, силь-
ним головним болем, міалгією, слабкістю і безсонням. Летального
кінця, як правило, не буває або ж він спостерігається дуже рідко.
Імунітет. В результаті перенесеного захворювання виникає міцний
і тривалий постінфекційний імунітет.
Лабораторна діагностика. РА із специфічним антигеном, пригото-
ваним із культур рикетсій, стає позитивною з 2-го тижня захворюван-
ня; максимальні титри з’являються на 3—5-му тижні. Позитивна
324
реакція у розведенні сироватки крові хворих людей 1:8 — 1 : 16
підтверджує діагноз захворювання. Використання реакції аглютина-
ції з сироватками крові тварин має певне значення для з’ясування рет-
роспективним способом можливих джерел Ку-гарячки. Реакцію треба
ставити в динаміці для диференціації типового захворювання від ви-
падків реконвалесценції, латентної інфекції.
Застосовують також РЗК із специфічним антигеном рикетсій Бер-
нета й алергічну шкірну пробу.
Лікування. Застосовують антибіотики (препарати тетрацикліну,
левоміцетину) і патогенетичні засоби (серцеві глікозиди, переливання
крові або плазми крові).
Профілактика зводиться до здійснення систематичної дезинфек-
ції приміщень для великої рогатої худоби, особливо в період отелен-
ня й окоту. Молоко від заражених тварин кип’ятять, оскільки при
пастеризації рикетсії Бернета не знешкоджуються. Хворих людей
госпіталізують, їхні виділення знешкоджують.
У районах з високою захворюваністю проводять імунізацію на-
селення вакциною з рикетсій Бернета.
Короткі відомості про інші рикетсії і рикетсіози, які рідко трап-
ляються в нашій країні, наведені в табл. ЗО.
БАРТОНЕЛИ
Морфологія. Бартонели—дрібні, грамнегативні, поліморфні мік-
роорганізми, що мають вигляд прямих або зігнутих паличок 0,25—
0,5 мкм завширшки й 1—2 мкм завдовжки. Усередині еритроцитів
бартонели розташовуються по кілька особин, іноді вони з’єднуються
в ланцюжки й утворюють літеру V. За Романовським — Гімзою за-
барвлюються у темно-голубий колір. При електронній мікроскопії
у бартонел виявлено джгутики. Культивуються бартонели на кров’я-
ному агарі, алантоїсній рідині курячого ембріона, що розвивається.
Оптимальна температура росту 28—37 °С.
Патогенність для тварин. Деякі види бартонел патогенні для
полівок, пацюків та інших гризунів (морські свинки), великої рогатої
худоби, собак та ін.
Збудником бартонельозу є Вагіопеїіа Ьасіїїі(огтіз. Захворювання
характеризується ураженням еритроцитів і клітин селезінки, лімфа-
тичних вузлів, печінки, кісткового мозку, ендотелію судин і майже
всіх внутрішніх органів.
Патогенез захворювання в людини. Джерелом інфекції є хворий на
бартонельоз або носій, перенощиком — москіти РЬІеЬоіотнз. Імо-
вірно, резервуаром бартонел можуть бути гризуни і свійські тварини.
Бартонельоз поширений головним чином серед населення, що живе
в дуже поганих санітарних умовах, у тісному контакті з свійськими
тваринами і гризунами (гірські райони Південної Америки). Інкуба-
ційний період триває від І до 40 діб, температура тіла підвищується
до 39—40 °С і тримається на такому рівні протягом 10—30 діб. Основ-
ними симптомами захворювання е головний біль, різкий біль у м’язах.
325
суглобах. Кількість еритроцитів зменшується до І — 2 • 10* в 1 л,
гемоглобіну — до 2—3 ммоль/л. Через І—2 місяці після першої стадії
захворювання, яка супроводиться гемолітичною анемією, настає
друга, під час якої з’являються бородавки, що нагадують такі при
фрамбезії. У першій стадії захворювання летальність досягає 10—
40 %, у другій стадії летального кінця не спостерігається.
Імунітет. Після перенесеного захворювання розвивається стійкий
імунітет.
Лабораторна діагностика. Захворювання розпізнають на підставі
характерної клінічної картини (гарячковий стан з розвитком гемолі-
тичної анемії в першій стадії і поява бородавок у другій стадії). У го-
строму періоді досліджують мазки крові, забарвлені за Романов-
ським — Гімзою, висівають кров на сироватковий агар Ногуші, став-
лять РА з сироваткою крові хворих (діагностичний титр 1 : 20).
Лікування проводять антибіотиками (хлорамфенікол, пеніцилін),
які знешкоджують не тільки бартонели, а й мікроорганізми, що спри-
чиняють вторинну інфекцію. Добрі результати дає гемотрансфузія,
яка прискорює процес видужання й підвищує резистентність макро-
організму до вторинної інфекції.
Профілактика полягає у знищенні москітів і захисті людей від їх
укусів, а також у поліпшенні санітарних умов праці й побуту.
ПАТОГЕННІ ХЛАМІДІТ
До роду СЬІатусііа, родини СЬІатусііасеае належать збудники
трахоми, кон’юнктивіту (бленореї з включеннями), пахвинного лім-
фогранулематозу (венеричного лімфогранулематозу, хвороби Ніко-
ла — Февра), орнітозу. Хламідії мають схожий цикл розвитку, спіль-
ний груповий антиген, однаковий хімічний склад. Вони містять
ДНК і РНК, нуклеопротеїди, ліпіди й вуглеводи.
У циклі розвитку хламідій є три стадії. На першій стадії це дрібні
(0,2—0,4 мкм) елементарні тіла, оточені тришаровою оболонкою, що
містять у компактному стані генетичний матеріал нуклеоїду і рибосоми;
на другій стадії — це первинні крупні (0,8—1,5 мкм) тіла, що мають
фібрили нуклеоїду і рибосомальні елементи, покриті тонкою оболон-
кою; розмножуються діленням; дочірні клітини реорганізовуються
в елементарні тіла, які можуть міститися позаклітинно й проникати
в інші клітини. Третя стадія розвитку хламідій проміжна (транзи-
сторна) між первинними й елементарними тілами. Дрібні (елементарні)
тіла мають інфекційні властивості, крупні (первинні) тіла виконують
вегетативну функцію. Ріст, розмноження й дозрівання хламідій за-
вершуються протягом 40 год.
Збудник трахоми — СЬІатусііа ІгасЬотаііз — кокоподібної
форми (див. форзац, рис. VII, г), за Романовським — Гімзою забар-
влюється у голубий або фіолетовий колір, паразитує в цитоплазмі
клітин епітелію кон’юнктиви і рогової оболонки ока людини. При до-
слідженні ультратонких зрізів в електронному мікроскопі у цитоплазмі
уражених клітин виявлено мікроколонії крупних первинних і про-
міжних тіл хламідій, оточених везикулярною мембраною, які нага-
326
дують включення, описані в 1907 р. С. Провачеком і Л. Хальберштед-
тером.
До збудника трахоми чутливі мавпи, в яких при зараженні
в кон’юнктиву розвивається експериментальна трахома, схожа на за-
хворювання в людини; деякі штами можуть розмножуватись у легенях
мишей і морських свинок, заражених інтраназально, а також при
підшкірному зараженні морських свинок й інтрацеребрально у мишей.
Резервуар збудника — хвора на трахому людина. Захворювання
в людей призводить до розвитку блефарокератокон’юнктивіту. При
цьому виникають хронічне запалення сполучної оболонки очей (ко-
н’юнктиви), гіперплазія тканини й гіпертрофія фолікулів, що мають
вигляд прозорих зерен. Далі настає рубцювання фолікулів.
Трахома передається при контакті з хворими (через одежу, руш-
ник, брудні руки, прн вмиванні у спільному тазу), може також пере-
даватися мухами.
Лабораторна діагностика здійснюється виявленням включень у клі-
тинах епітелію кон’юнктиви за допомогою бактеріоскопії, забарвлення
за Романовським — Гімзою, РІФ, зараження курячих ембріонів.
Лікування проводять антибіотиками (препарати тетрацикліну,
еритроміцин) і сульфаніламідними препаратами.
Профілактика. Заходами для запобігання трахомі є своєчасна діаг-
ностика і повноцінне лікування хворих, диспансерне обслуговування
вогнищ, оздоровлення умов праці і побуту, підвищення матеріального
і культурного рівня життя населення.
Дуже висока захворюваність на трахому в Індії та інших країнах
Азії, в Африці. На трахому хворіють 500 млн людей, які живуть у кра-
їнах, що розвиваються; вона — основна причина сліпоти у 2 млн
чоловік.
Збудник кон'юнктивіту з включеннями, або бленореї
з включеннями,— деякі штами Сітіатусііа ІгасЬотаНз. Захворюван-
ня протікає з явищами інфільтрації кон’юнктиви, особливо нижньої
повіки. Тривалість гострої фази 10—16 діб, але помітна інфільтрація
зберігається протягом 2—3 місяців і більше. Джерелом зараження
є матері, в яких збудник зберігається в сечостатевих органах і пере-
дається під час родів новонародженим.
Дорослі заражуються під час купання в невеликих ставках і ба-
сейнах з нехлорованою водою. Захворювання проявляється у них
у вигляді гострого фолікулярного кон’юнктивіту і триває близько року.
Лабораторна діагностика полягає в таких самих заходах, як і при
трахомі — виявленні в уражених клітинах включень.
Лікування проводять сульфаніламідними препаратами й антибіоти-
ками. Введення нітрату срібла для профілактики гонорейної бленореї
не запобігає розвиткові кон’юнктивіту з включеннями.
Збудник пахвинного лімфогранулематозу — СМатуА\г Ігасіїо-
піаііь (див. форзац, рис. VII, в). Морфологія, цикл розвитку та інші властивості
вбудннка такі самі, як у інших видів хламідій.
Захворювання передається статевим шляхом, трапляється в країнах з тро-
пічним кліматом. У нашій країні випадків захворювання не зареєстровано.
Хламідп цьою виду можуть також спричиняти уретрит, проктит, артрит.
327
Лабораторна аіаіиостиаа проводигьси та допомогою бактеріоскопії а об*
ьобиою маїиіа «4 І'омаіюн< пани Гімтою Діаі им тичив іиачеиик маа РЗК
Вииориї гоауіогь іакоа* анугрішиїюмотковв іаражаинк біли* мишей, о дай*
роївнаагір я мяиіиііг Ь <мергельним кіпцем
ЛІауааииа. !*> то*оауюгь аигибіогики (препарати тетрацикліну, пеиіни*
дій) і і'ульфлиЬіеміДіїї препарати
Збудник орнітолу - СШату'Ій рхІНасі - « причиняє захво-
рювання у багвгьох НИДІИ І1ГИХІИ, Морфологія І <ПО<Іб роїмножеиии
тині «амі, як І н усіх представників роду СІ)Ілпіу<ІІк. У матках-
відбитках об» і|іі там і орівнів мікрооріиііі тми роїгвіїювуюгжя у ви-
рл нд І скупчень, оточених не іикулнрною мембраною їх можи а вияви-
ти при «абирвлешіІ ід І’оммионсі.ким — ІІмюю у клітинах лімфоїдио-
мдкрор.налі.иоі снсіемн або ііотиклітинно прн їх розрниі (диб. форіан,
рис. VII, б).
Хл.ІМІДІІ орнітозу рОІНИВДЮТЬСЯ н жовтковому мішку курячих
ембріонів або н органі імі білих мишей, а також у культурі тканин
І в клітинах пухлин при температурі 30‘С.
Хшімідії орні то іу мають два антигени: термостабільний, спільний
для груші ориігоіу - исигакоіу - лімфогранулематозу, І тгрмола-
більшії), що руйнується при температурі 60 "С і містить білкову суб-
станцію.
Резистентність хлвмідій дуже висока. Вони іберіїиють житіє ідлт-
міси, при температурі -70 “С протягом 2 років. Інфіковані тканини
при іемиепагурі 4 ЛС іалишаються заразними протягом кількох тиж-
нів. ХламідІЇ чугливі до дії звичайшіх дезинфікуючих розчинів (хлор-
аміну). 11игріїїаинії при температурі 00—70 °С вбиває їх протягом
10-15 хп.
До збудника ориігоіу сприйнятливі більш як 100 видів диких
I свійських птахів (папуги, голуби та Ін.), а також білі миші, нанижи,
морські свинки, кролі, мавші. Різні штамп СіїІашутііа ряіііасі спричи-
ни ют ь іігіптікоі, орнітоз, пневмонію в телят, овець, кіз, саиней, ко-
ней; поліартрит у телят, овець, свиней; плацентит I аборт у овець;
ентерит у телят; кон'юнктивіти у морських свинок, телят I овець;
енцефаліт у сумчастих пацюків й еинефаломієліт у телят. У папуг
зихнорютіиин характери чується нажитно, ентеритом і звичайно .закін-
чується легально. Захворювання, які еппнчніїне С. рМІіаеІ, сиостері-
гпіогьси в Південній Америці, Австралії та Інших країнах.
Патогенез захворювання в людини. В організмі людини збудник
надходить у кров І спричиняє бактеріемію, яка триває протягом тижня,
а Іноді й більше, У гкашінах І органах відбувається складний цикл
розпитку збудника, який зумовлює порушення клітинного метаболії-
му, розвиток І птокенк яці і й алергії. Для орнітозу характерне аіішік-
неиші шісіімоііічпосо іюгшица без ядухи, кашлю І болю в грудній
клітці. У розпалі захшіїноваїїпн прн рентгенологічному дослідженні
ви я ил яю п, картину крайової часточкової бронхопневмонії; розсмок-
тується ексудат повільно,
Джерела інфекції - птахи (хворі або носії) -- свійські І дикі
голуби, качки, кури, Індики, Дорослі птахи видужують, а значна
частина молодняка гниє. Збудник виділяється з екскрементами, від
яких заражуються здорові птахи і люди. Зараження тварин можливе
внутрішньоутробно, при статевому контакті й укусі кровососними
комахами.
Людина заражується звичайно аерогенним шляхом при вдиханні
інфікованого пилу або пуху, а також при потрошінні птиці, чищенні
кліток та догляді за птицею, що супроводиться забрудненням рук
і потраплянням збудника на слизові оболонки. Не виключена мож-
ливість зараження від хворих людей і повітряно-краплинним
шляхом.
Імунітет після перенесеного захворювання нетривалий. Бувають
повторні випадки захворювання, особливо серед працівників лабора-
торій. Механізм захисту організму пов’язаний із наявністю антитіл.
Лабораторна діагностика. Збудник виявляють у перші дні захво-
рювання в мокротинні і крові. У крові він зберігається близько 5—
7 діб, у мокротинні — близько 21 доби. Хламідії виділяються з мок-
ротинням протягом 8 років. При дослідженні трупного матеріалу мік-
роорганізм було виділено з тканин легені, селезінки, ексудату.
Для розпізнавання орнітозу застосовують бактеріоскопію, РЗК
з парними сироватками крові. Хламідії можна виділити з крові й мок-
ротиння хворих людей внутрішньомозковим зараженням білих мишей.
Збудник орнітозу виявляють у препаратах із тканини селезінки, пе-
чінки і в зрізах мозку лабораторних тварин, заражених внутрішньо-
очеревинним способом. Виділення збудника можливе і при зараженні
курячих ембріонів у жовтковий мішок. Добрі результати дає алергічна
шкірна проба з орнітином і РІФ.
Лікування проводять напівсинтетичними препаратами тетрациклі-
ну; при хронічних формах захворювання рекомендується вакциноте-
рапія.
Профілактика полягає в ранній діагностиці, ізоляції і госпіталіза-
ції хворих в інфекційні лікарні (в окремі палати або бокси). Обслуго-
вуючий персонал повинен носити маски, регулярно дезинфікувати
руки 0,5% розчином хлораміну. Виписувати хворих із стаціонару слід
тільки після повного вилікування. У вогнищі роблять дезинфекцію
приміщення й особистих речей хворого, мокротиння хворих знезара-
жують 4 % розчином хлораміну, 5 % розчином хлорного вапна,
0.5 % розчином лугу (КОН, ИаОН), 5 % розчином лізолу. Хворих
птахів знищують, а місця їх перебування дезинфікують. У зв’язку
з високим ураженням орнітозом голубів потрібні старанний санітар-
но-ветеринарний контроль, обмеження або повна заборона розведення
голубів у містах, поблизу птахівницьких господарств.
ПАТОГЕННІ МІКОПЛАЗМИ
Мікоплазми належать до класу МоІІісиіез, родин Мусоріазшаіа-
сеае, Асіїоіоріазтаіасеае, Зрігоріазтасеае.
Уперше мікоплазми Л. Пастер виявив при вивченні збудника плевропнев-
монії великої рогатої худоби, однак виділити їх у той час у чистій культурі
на звичайних живильних середовищах і виявити у світловому мікроскопі не
було можливості. У 1898 р. Е. Нокар і Е. Ру довели, що збудник пленропнев-
329
монії може розвиватися иа складних живильних середовищах, які яе містять
клітин культур тканини, а У. Ельфорд за допомогою спеціальних фільтрів ви-
значив розміри цього мікроорганізму.
Мікоплазми виявлено в грунті, стічних водах, на різних субстра-
тах в організмі тварин і людини. Є патогенні і непатогенні види.
Морфологія. Мікоплазми—дрібні поліморфні бактерії (див.
рис. 7) розміром 0,3—0,8 мкм, не утворюють спор, нерухомі, грамне-
гативні. Форма їх може бути яйцевидною, кокобацилярною, нитко-
подібною, гіллястою. У пізній фазі росту утворюються ланцюжки
кокоподібних тілець. Мікоплазми не мають клітинної стінки, покриті
тришаровою цитоплазматичною мембраною завтовшки 7,5—10 нм;
у цитоплазмі є ДНК і РНК, рибосоми та інші клітинні компоненти,
в яких наявний холестерин. Мікоплазми краще забарвлюються за
Романовським — Гімзою.
Культивування. Більшість видів мікоплазм — факультативні ана-
ероби. Для їх росту потрібні білки, стерини, фосфоліпіди, глікопротеї-
ди (муцин), а також пуринові і піримідинові основи. На густих сере-
довищах ростуть у вигляді характерних колоній з ущільненим, що
вростає в середовище, центром і ніжним ажурним краєм; через З—
5 діб інкубації вони іноді стають крупними (1,5—2 мкм), але найча-
стіше їх важко побачити неозброєним оком. На кров’яному агарі
навколо колоній є зона гемолізу. У бульйоні мікоплазми розвивають-
ся з утворенням помутніння і дрібнозернистого осаду.
Культивують мікоплазми при температурі 36—37 °С (крайні гра-
ниці 22—41 °С) на живильних середовищах з рН 7, що містять сиро-
ватку крові, з утворенням дуже дрібних колоній.
Додавання до живильного середовища холестеролу або інших сте-
ролів, екстрактів дріжджів прискорює ріст мікоплазми. Вони можуть
культивуватись і в середовищах, в яких немає сироватки крові, але
при наявності 0,02 % гемоглобіну й 0,01 % цистеїну. Мікоплазми доб-
ре розмножуються в хоріоналантоїсній оболонці курячого ембріона.
Ферментативні властивості. Процеси метаболізму у мікоплазм
дуже варіабельні. Протеолітичних властивостей вони не мають, хоч
відомо кілька видів, які розріджують желатину і зсідають сироватку
крові; більша частина штамів ферментує глюкозу, деякі з них утво-
рюють аргіназу, фосфатазу.
Антигенна структура. Мікоплазми мають видову специфічність.
До родини Мусоріазшаіасеае входять два роди (Мусоріазта, йгеаріаз-
та), що включають 50 видів, із них найважливіше медичне значення
мають М. рпеитопіае, М. Ьотіпіз і М. игеаіуіісит.
Токсиноутворения. Із мікоплазм виділено гемолізин і термостабіль-
ний ендотоксин.
Резистентність. Більшість штамів мікоплазм гине при температурі
45—55 °С протягом 15 хв. Мікоплазми дуже чутливі до всіх дезинфі-
куючих речовин, до висушування, ультразвуку та інших фізичних
діянь, стійкі до пеніциліну, ампіциліну, метициліну, цефалоспоринів,
чутливі до еритроміцину та інших макролідів.
Патогенність для тварин. Мікоплазми (М. тусоідез) спричиняють
плевропневмонію у великої рогатої худоби. Деякі варіанти цього виду
330
бактерій є збудниками плевропневмонії у кіз. Мікоплазми виявляють
при запальних процесах у овець, кіз, свиней, гризунів, птахів. М. Ьо-
тіпіз при підшкірному зараженні мишей спричиняє локалізовані
абсцеси.
Патогенез захворювання в людини. Патогенні мікоплазми ура-
жують органи дихання, кровообігу, сечостатеву і центральну нервову
системи.
М. рпеитопіае, виділену в 1944 р. М. Ітоном із мокротиння хворих
людей, протягом 18 років на підставі фільтрівності помилково відно-
сили до вірусів. Вона спричиняє гострі респіраторні інфекції (риніт,
бронхіт, бронхіоліт, іноді круп) і вогнищеву (атипову) пневмонію.
Уражуються головним чином діти віком 3—7 років. Захворювання,
що спричиняються мікоплазмами, характеризуються затяжним пере-
бігом і супроводяться ускладненнями (запалення середнього вуха,
емфізема легень та ін.). Серед ізольованих або напівізольованих груп
дитячого і дорослого населення спостерігаються епідемічні спалахи.
М. Ьотіпіз виявляють при запальних процесах у зовнішніх стате-
вих органах, неспецифічному уретриті, простатиті, негонококовому
артриті, трихомонадоподібних ураженнях, ендокардиті, септичних
захворюваннях та ін. Імовірно, ця мікоплазма дуже поширена серед
тварин і людей, але її виявити дуже важко; вона має умовну пато-
генність і спричиняє захворювання в людини при різкому зниженні
загальної резистентності організму.
11. игеаіуіісит найчастіше виділяється від хворих при неспецифіч-
ному негонококовому уретриті і в здорових осіб, які контактували
з хворими.
Імунітет. У великої рогатої худоби, овець, кіз після перенесеної
плевропневмонії залишається стійкий і тривалий імунітет. Питання
імунітету при захворюваннях людини не вивчено. Імовірно, його ви-
никнення пов’язане із загальною резистентністю організму, а також
із виробленням інгібіторів росту мікоплазм, аглютинінів, преципіти-
нів, комплементзв’язуючих антитіл.
Лабораторна діагностика. Виділення мікоплазм роблять звичайно
у гострому періоді захворювання висіванням мокротиння, виділень
слизової оболонки носової частини глотки, зіва, сечовипускного ка-
налу на спеціальні живильні середовища. Ідентифікують вирослі
культури вивченням культуральних властивостей, ферментативної і ге-
молітичної активності, визначенням видової належності за допомогою
специфічних антисироваток у реакціях інгібінії росту.
Використовують серологічні методи дослідження (РЗК, РИГА)
з парними сироватками крові хворих, узятими з інтервалом 3—4 тиж-
ні, що дає змогу поставити діагноз ретроспективно.
Розроблено метод експрес-діагностики за допомогою Р1Ф.
Лікування проводять напівсинтетичними препаратами тетрациклі-
ну, левоміцетином, еритроміцином.
Профілактика зводиться до збереження на високому рівні загаль-
ної резистентності організму людей. У США для специфічної профі-
лактики атипових пневмоній застосовують вакцину з убитих міко-
плазм.
331
БАКТЕРІОФАГИ — ВІРУСИ БАКТЕРІЙ
Бактеріофаги (лат. ЬасІегіорКа^а — той, що руйнує бактерії) —
віруси, які мають властивість проникати в клітини бактерій, репро-
дукуватися в них і звичайно спричиняти їх лізис.
Історія відкриття бактеріофагів пов’язана з ім’ям Ф. д’Ерелля,
який докладно вивчив взаємодію фага і бактерій і дав літичному аген-
ту назву «бактеріофаг» (1917).
Пізніше було виділено понад 100 вірусів не тільки бактерій,
а й синьо-зелених водоростей, грибів та інших мікроорганізмів, тому
для позначення цих вірусів застосовують термін «фаг».
За формою фаги поділяють на чотири групи: І) які мають кубічну
головку і відросток; 2) кубічні; 3) ниткоподібні; 4) плеоморфні.
Структура. Найбільш детально вивчено структуру крупних фагів,
до яких належать фаги Е. соіі. Фаги складаються з нуклеїнової кис-
лоти (ДНК або РНК), оточеної білковою оболонкою — капсидом з точ-
но орієнтованими капсомерами. Для крупних фагів характерна пу-
головкоподібна або сперматозоїдна будова (рис. 95), наявність голов-
ки, комірця і хвостового відростка, що закінчується шестикутною
базальною пластинкою, до якої прикріплені фібрили. Хвостовий від-
росток фага має циліндричний стержень, оточений скоротливим
чохлом.
Головка фагів має дві оболонки — зовнішню стінку і тонку внут-
рішню мембрану, у якій міститься нуклеїнова кислота.
Хімічний склад. До вмісту головки фага входить ДНК, що має
спіралеподібну будову і характеризується високою полімерністю.
Виявлено також фаги, особливо дрібні, в яких геномом є РНК. ДНК
фага иуклеотидним складом відрізняється від ДНК бактерій.
В оболонці фага Е. соіі є білск і невелика кількість ліпідів.
Рис. 95. Будова фага:
1 — головка; 2 — скорочений фут-
ляр відростка. З—стержень І
Рис. 96. Колонії фага
Е. соіі:
а - крупні; б —дрібні.
332
Резистентність. Фаги витримують тиск до 6,1 -10е кПа (6000 атм),
стійкі до дії іонізуючого випромінювання, зберігають свою активність
при рН від 2,5 до 8,5. У запаяних ампулах фаги не втрачають своїх
літичних властивостей протягом 5—6 і навіть 12—13 років, порів-
няно довго зберігаються в гліцерині. Фаги швидко гинуть при кип’я-
тінні, дії кислот, ультрафіолетового випромінювання, хімічних
дезинфікуючих речовин.
Деякі сполуки (тимол, хлороформ) і ферментні отрути (ніанід,
флорид, динітрофенол) не впливають на фаги, але спричиняють заги-
бель бактерій або затримують їх ріст. Ці препарати використовують
для збереження фагів у культурах і знищення бактерій, актиноміце-
тів і грибів.
За специфічністю дії розрізняють поліфаги, які лізирують спорід-
нені бактерії; монофаги, що лізирують бактерії одного виду; і фаги,
які спричиняють лізис певних бактерій даного виду, що дає змогу
поділити бактерії на фаговари.
Явище бактеріофагії (взаємодія фага з бактеріями) легко спостері-
гати як у рідких, так і на густих живильних середовищах. Якщо в чаш-
ку з густим живильним середовищем засіяти культуру і нанести кіль-
ка краплин відповідного фага високої концентрації, то на місці вне-
сення фага росту не буде.
При додаванні до культури меншої концентрації фага утворюються
вільні від росту бактерій ділянки (бляшки фага) (рис. 96), які вини-
кають в результаті руйнування бактерій тільки в тих місцях, куди
потрапили корпускули фага.
За механізмом взаємодії з клітинами бактерій фаги поділяють на
вірулентні і помірні.
Феномен бактеріофагії, що спричиняється вірулентними фагами,
проявляється послідовно у вигляді основних фаз: адсорбції, проник-
нення в клітину, репродукції І виділення фагів.
Адсорбція фага на поверхні бактеріальної клітини є результатом
взаємодії аміногрупи білків, локалізованих у периферичній частині
хвоста фага, І негативно заряджених карбоксильних груп на поверхні
клітин бактерій. Розрізняють оборотну і необоротну фази адсорбції.
Оборотна фаза характеризується тим, що фіксовані частинки фага
можна відокремити від клітини енергійним помішуванням, струшу-
ванням або різким зменшенням концентрації іонів. Звільнені при цьому
частинки фага зберігають свою життєздатність. Адсорбція залежить
від складу, температури і в’язкості середовища. У дистильованій
воді адсорбції фага не відбувається; наявність двовалентних катіонів
(Са*2 І Мд*2) стимулює процес адсорбції. До стимуляторів адсорбції
належать триптофан, ізолейцин.
За фазою оборотної адсорбції настає необоротна, коли фаг не
відокремлюється від тіла бактерії. Завдяки наявності ферменту типу
лізоциму фаг утворює отвір у стінні клітини І проникає в тіло бак-
терії.
У хвостовому відростку фага є скоротливий механізм (циліндрич-
ний стержень, оточений скоротливим чохлом), за допомогою якого
ДНК ін’єктується у параплазматичиий простір між клітинною стін-
333
Рис. 97. Схема основних етапів взаємодії фага з бак-
теріальною клітиною:
а. б — проникнення нуклеїнової слоти фага а бактерію, в —
репліхація нуклеїнової кислоти фага утворення структур*
них фаговнх білків, і — саноскладаккн часта кок фага. о —
вихід фагів
коюбактерій і цитоплазматичною мембраною.
У більшості випадків тільки ДНК фага пере-
ливається в бактеріальну клітину, а оболонка
фага (капсид) залишається іззовні.
Після проникнення ДНК фага в бакте-
ріальну клітину у ній відбувається синтез
«ранніх» ферментів, які забезпечують низку
складних реакцій, необхідних для біосинтезу
фагової ДНК. Формування «ранніх» фер-
ментів контролюється й індукується відповід-
ним генетичним апаратом фага. У клітині
з’являється інформаційна РНК, яка є компле-
ментарною фаговій ДНК. Синтез нитки ДНК
здійснюється за допомогою клітинної ДНК-
полімерази. Утворення «ранніх» ферментів
змінюється синтезом білка вірусу на рибосо-
мах і полісомах бактерій; потім фагові час-
тинки спонтанно складаються, клітина руй-
нується, і фаги виділяються у зовнішнє
середовище (рис. 97).
Помірні фаги є типовими плазмідами (див. с. ПО). При зараженні
бактерій помірними фагами частина популяцій клітин виживає
і стає лізогенною. При цьому спостерігаються такі фази взаємодії:
адсорбція, проникнення в клітину, інтеграція. У лізогенних бакте-
ріях ДНК фага інтегрується в ДНК клітини, і помірний фаг перетво-
рюється в профаг, який не має літичної дії. Лізогенні бактерії ста-
ють носіями фага і на тривалий час набувають до нього імунітету.
Цей зв’язок міцний і руйнується при діянні на лізогенну бактерію
індукуючих агентів — ультрафіолетового випромінювання, іонізу-
ючої радіації і хімічних мутагенів. Під впливом цих факторів профаг
може переходити з інтегрованого в автономний стан. Бактерії в та-
кому разі втрачають стан лізогенності.
Лізогенізація бактерій супроводиться зміною їх біологічних вла-
стивостей. Так, наприклад, нетоксигенні штами коринебактерій
дифтерії в результаті лізогенізації перетворюються у токсигенні.
Детермінанти токсигенності (іох+-гени), що є в геномі профага, транс-
дукцією можуть передаватися нетоксигенним штамам. За допомогою
помірних фагів можуть передаватися інші гени — резистентності до
лікарських засобів, ферментативної активності, синтезу антигенів та
ін. Зміна властивостей бактерій під впливом профага дістала назву
фагової конверсії. Можливо, завдяки їй більш інтенсив-
но утворюються нові біовари і серовари бактерій, особливо серед
родин ЕпіегоЬасіегіасеае і УіЬгіопасеае.
334
Помірні фаги широко використовують як модель для вивчення
питань генетики, за допомогою якої можна точніше диференціювати
процеси мінливості і спадковості. їх застосовують у генній інженерії
як вектори для передачі генів еукаріот прокаріотам і створення
штамів продуцентів біологічно активних речовин, що використову-
ються в біотехнології (інтерферон, інсулін, інтерлейкіни та ін.).
Поширення фагів у природі. Фаги є в грунті, воді, стічних водах
і т. д. Специфічні фаги було знайдено в кишках тварин, птахів, лю-
дини, у їх виділеннях. Фаги виділено з молока, овочів, фруктів.
У воді річок, морів і стічних водах досить часто е багато фагів
різних бактерій, у тому числі ешерихій, холерних вібріонів, сальмо-
нел черевного тифу, паратифів, шигел та ін. Джерелами фагів пато-
генних мікроорганізмів є хворі люди і тварини, носії, реконвалесцен-
ти. Від хворих людей фаги можуть виділятися із вмістом кишок, се-
чею, їх виявляли в мокротинні, слині, гною, виділеннях слизової
оболонки носа і т. д. Особливо багато фагів виділяється в період ви-
дужування.
Добування фагів І визначення їх активності. Фаги дістають дода-
ванням їх до бульйонних культур, вирощених у спеціальних культива-
торах. За цей час відбуваються репродукція фагів і лізис бактерій.
Фаги витримують при температурі 37 °С одну добу, потім бульйон,
в якому є фаги, фільтрують і перевіряють фільтрат на чистоту, сте-
рильність. нешкідливість і активність фагів (силу дії).
Практичне використання в медицині. Ураховуючи механізм літич-
ної дії фагів, раніше їх призначали з профілактичною і лікувальною
метою при дизентерії, черевному тифі і паратифах, холері, чумі,
анаеробних, стафілококових, стрептококових та інших інфекціях.
У зв’язку із впровадженням у практику антибіотиків і сульфаніл-
амідних препаратів фаготерапію інфекційних захворювань тепер не
застосовують, а фагопрофілактику здійснюють за епідемічними пока-
заннями тільки при дизентерії і черевному тифі.
Фаги широко використовують в індикації мікроорганізмів. Метод
фаготипування дає змогу визначати фаговар бактерій і таким чином
виявляти джерела інфекції. Реакція наростання титру фага свідчить
про інфіковаиість збудниками досліджуваних матеріалів, предметів
зовнішнього середовища, води і харчових продуктів.
ВІРУСИ І СПРИЧИНЮВАНІ НИМИ ЗАХВОРЮВАННЯ
ВІРУСИ, ЩО МІСТЯТЬ ДЕЗОКСИРИБОНУКЛЕЇНОВУ
КИСЛОТУ (ДНК)
ПОКСВІРУСИ
До родини Рохуігніае (від англ. рох — виразка) належать збудники
віспи людини, ссавців (корів, овець, мавп, верблюдів, коней, свиней,
кролів) і птахів, пустульозного дерматиту овець І кіз, напульозного
стоматиту рогатої худоби, міксоми кролів, а також віруси сктромелії,
що уражують мишей І пацюків, та контагіозного молюска людини.
335
Вірус натуральної віспи
Вірус натуральної віспи належить до роду ОгПіорохуігиз (від грец.
огікоь — прямий) Незважаючи на те що натуральна віспа відома з давніх*
давен (понад 3000 років до и е ) і була дуже поширена в багатьох країнах сві-
ту, етіологія цього захворювання остаточно з’ясована тільки на початку
XX ст. Збудник натуральної віспи вперше виявив Дж Б’юст у 1886 р.
У 1892 р Г Гуарніері знайшов у гістологічних зрізах рогівки кроля, зараже-
ного віспяним матеріалом, внутрішньоклітинні включення величиною від
1—4 до 10 мкм кулястої або серпоподібної форми (рнс 98) У1906р Е Пашен,
застосувавши спеціальний метод забарвлювання, знайшов у вмісті пухирців
вірусні корпускули.
Морфологія. Вірус віспи має складну будову, цеглиноподібну
форму з округленими кутами Це найкрупніший вірус тварин. Розмі-
ри його 170—450 нм. Він складається з нуклеоїду, що має форму дво-
вгнутої лінзи, покритого тришаровою оболонкою. Від зовнішнього
осміофільного шару оболонки відходять ворсинки. З протилежних
боків нуклеоїду під оболонкою є два бокових тіла (рис. 99).
Культивування. Вірус натуральної віспи добре розвивається в ку-
рячих ембріонах через 48—72 год після зараження, спричиняючи
утворення на хоріоналантоїсній оболонці дрібних білих твердих,
різко відмежованих від оточуючої тканини точкових уражень. Вірус
культивується на первинних і перещеплюваних клітинних культурах
людини, мавпи, вівці та інших тварин, у яких через 24—72 год після
зараження виявляють виражену цитопатичну дію, що проявляється
округленням і збільшенням клітин.
Хімічний склад. Віріон містить двониткову ДНК лінійної струк-
тури (7 % маси віріона), понад ЗО білків (4 %), вуглеводи (3 %),
ліпіди. Виявлено більш як 10 ферментів (нуклеази, кінази, протеази).
Антигенна структура. У вірусу натуральної віспи є спільні анти-
гени з вірусом вакцини. Розрізняють чотири антигени: розчинні Ь
(термолабільний) і 8 (термостабільний), нуклеопротеїдний (\ТР) і X-
гемаглютинін. Вірус віспи має спільні антигени з еритроцитами груп
А і АВ.
Резистентність. Збудник натуральної віспи стійкий проти дії ефі-
ру, висихання. У висушених віспяних кірочках і в 50 % гліцерині
зберігається місяцями, легко витримує низьку температуру. Вірус
Рис. 98. Тільця Гуариієрі.
Рис. 99 Вірус наг}ральної
віспи в електронному мікро-
скопі.
336
чутливий до дії світла, при температурі 100 °С гине в одну мить, 3 %
розчини хлораміну, фенолу, лізолу інактивують вірус через ЗО хв,
а 1 % розчин хлорного вапна — через 1 год; інактивується при дії
калію перманганату.
Патогенність для тварин. До вірусу натуральної віспи чутливі
мавпи; при введенні їм вірусу внутрішньошкірно або в яєчка з’явля-
ються специфічні висипи на шкірі, розвивається орхіт, іноді настає
генералізація процесу. У кролів і морських свинок виникають не-
значні місцеві ураження, а в новонароджених білих мишей при зара-
женні в мозок розвивається віспяний енцефаліт.
У природних умовах мавпи хворіють на віспу, що спричиняється
віспяним ортопоксвірусом, який відрізняється од вірусу натуральної
віспи біологічно і генетично. В екваторіальних країнах Африки за-
реєстровано випадки зараження людей мавпячою віспою. Виявлено
поодинокі випадки передачі в кількох пасажах вірусу віспи мавп від
хворих людей здоровим.
У мавп виявлено поксвірус (вірус Яба), що продукує в них добро-
якісні пухлини, які можуть виникати і в людей.
У жителів Кенії виявлено гарячкове захворювання з появою однієї
віспини, яке спричиняється поксвірусом, названим вірусом Тана.
Можливо, що він передається людям при прямому контакті комарами.
Вірус патогенний для мавп.
У ряді африканських країн один із віспяних ортопоксвірусів
уражує верблюдів з високою смертністю, зниженням продукції молока
і зменшенням ваги тварин. У людей віспа, що спричиняється цим
видом ортопоксвірусу, трапляється надзвичайно рідко.
Патогенез захворювання в людини. Джерело інфекції — хвора
людина. Зараження віспою відбувається повітряно-краплинним і по-
вітряно-пиловим шляхами, а також при контакті з заразним мате-
ріалом. Збудник передається під час розмови, кашлю, чхання, через
частинки пилу та предмети (одяг, білизна, посуд).
Інкубаційний період триває 8—18 діб. Під час захворювання в
крові виявляють вірус з різко вираженими дерматотропними власти-
востями. Він уражує також слизові оболонки, різні тканини й органи.
Поряд з вірусомією нерідко спостерігається і бактеріемія, спричинена
стрептококами і стафілококами.
Для натуральної віспи характерні гарячка, висип, утворення на
шкірі пустул і рубців. Після продромального періоду і зниження тем-
ператури тіла на обличчі, тулубі і кінцівках з’являється справжній
висип; спершу він має папульозний характер, потім перетворюється
у везикульозний і пустульозний. Віспяні везикули багатокамерні,
з прозорим вмістом і перламутровим блиском, що надає їм вигляду
перлин, оточені червоним вузьким обідком. Віспяні пустули мають
на верхівці кратероподібні вдавлення.
У стадії нагнивання приєднується вторинна (стафілококова і стреп-
тококова) інфекція. У більшості перехворілих на місці глибоких пус-
тул утворюються рубці.
В осіб з групами крові А і АВ натуральна віспа має більш тяж-
кий перебіг, смертельний кінець; поствакцинальні ускладнення
337
бувають частіше, постінфекційний і поствакцинальний імунітет слаб-
кого напруження.
До легких форм натуральної віспи належить в а р і о л о ї д, що
характеризується коротшим перебігом, відсутністю висипу або га-
рячки.
Аластрим — самостійне захворювання, схоже на натуральну
віспу. Має перебіг як легка форма натуральної віспи і меншу конта-
гіозність. Папульозно-везикульозний висип утворюється в основному
на обличчі і кінцівках, цикл його розвитку коротший, ніж при нату-
ральній віспі. Віспяні везикули не мають кратероподібних удавлень
на верхівці, і при відпаданні кірочок рубців не залишається. Леталь-
ність низька — до 1 %. У нашій країні цього захворювання не трап-
лялось .
Імунітет. У більшості людей, які хворіли на натуральну віспу,
залишається стійкий імунітет. Повторні випадки захворювання трап-
ляються дуже рідко.
Імунітет при віспі клітинний (тканинний) і гуморальний. Під впли-
вом вироблюваного клітинами інтерферону припиняється розмножен-
ня вірусу в шкірі і слизових оболонках.
У крові перехворілих і вакцинованих можна виявити аглютиніни,
комплементзв’язуючі, віруснейтралізуючі антитіла, а також преципі-
тини і лізини.
Лабораторна діагностика грунтується на застосуванні вірусоско-
пічного, вірусологічного і серологічного методів дослідження.
Вірусоскопія полягає у виявленні тілець Пашена в мазках, при-
готованих із вмісту везикул і пустул, забарвлених срібленням або
оброблених люмінесціюючими барвниками (примуліном) При пере-
гляді їх у люмінесцентному мікроскопі вірусні частинки легко дифе-
ренціюються за яскравістю та характером свічення. Добрі результати
дає електронна мікроскопія вмісту віспяних везикул.
Дуже поширені методи імунофлюоресценції для визначення специ'
фічного антигену в мазках-відбитках з елементів висипу і виділень
носової частини глотки.
Вірусологічне дослідження роблять для виділення вірусу на
хоріоналантоїсній оболонці курячого ембріона і в культурах тканин,
з також для ідентифікації за допомогою специфічних сироваток
В РЗК. РТГадс, РІФ.
Для серологічної діагностики віспи застосовують РТГА, РЗК,
РН на курячих ембріонах і тканинних культурах.
Специфічний антиген можна виявити у змісті везикул і в кірочках
за допомогою гіперімунних сироваток крові тварин в РТГА, РЗК,
РН, РІА, РПГ, а також РОНГА з використанням еритроцитів барана,
сенсибілізованих противіспяними антитілами.
У диференціації натуральної віспи з генералізованою вакциною,
аластримом, вітряною віспою враховують характер висипу, черго-
вість появи і зникнення його елементів, поліморфізм, особливості,
властиві збудникам перелічених захворювань при культивуванні
в культурі клітин і курячих ембріонах, лабораторні дані.
338
Лікування. У перші дні захворювання застосовують противіспя-
ний імуноглобулін, добутий з крові людей, спеціально ревакцинова-
них проти натуральної віспи. При розвитку вторинної інфекції при-
значають антибіотики (пеніцилін, левоміцетин).
Профілактика охоплює заходи для запобігання завезенню нату-
ральної віспи в країну, ранню діагностику, госпіталізацію хворих,,
дезинфекцію у вогнищі, а також своєчасне проведення щеплень.
Щеплення віспи було відоме за багато років до нашої ери в Китаї і Єгипті.
З давніх-давен в Індії, Ірані, Грузії щеплення проти віспи робили за допомо-
гою варіоляції (введення вмісту віспяних пухирців хворої людини), яка
у XVIII ст. була запроваджена в країнах Європи. Проте варіоляція нерідка
призводила до зараження іншими захворюваннями.
Переворот у боротьбі з натуральною віспою був пов’язаний з відкриттям
Е. Дженнера, який помітив, що в англійських селян, котрі доїли корів, хво-
рих на коров’ячу віспу, утворюються на руках віспяні пухирці, які через кіль-
ка днів нагнивають, підсихають і рубцюються. Люди, які перенесли коров’ячу
віспу, не хворіли на натуральну віспу або переносили її в легкій формі.
Е. Дженнер вивчав це питання протягом 25 років, зібрав великий матеріал,
здійснив численні спостереження, а в 1796 р. провів публічний дослід. Він
узяв вміст пустули в селянки, ураженої коров’ячою віспою, і прищепив на руку
восьмирічному хлопчикові. Через іу місяця Дженнер ввів прищепленій ди-
тині вміст пустули хворого на натуральну віспу, і клопчик при цьому не за*
хворів. Через кілька місяців дитину заразили вдруге — і вона виявилась не-
сприйнятливою.
У 1801р. лікар Є. О. Мухін першим у Росії зробив щеплення за Джен-
иером.
Після зробленого Е. Дженнером відкриття тривалий час матеріалом для
щеплення був вміст віспяних пухирців прищеплених дітей; щеплення робили
«гуманізованою лімфою». Проте така вакцина не була безпечною, оскільки
іноді призводила до зараження бешихою та іншими захворюваннями. У 1842 р.
А. Негрі вдосконалив метод Дженнера, він запропонував використовувати
вакцину, добуту нашкірним зараженням телят. У 1866 р. О. Мюллер застосу-
вав для консервування вірусу вакцини гліцерин.
Вірус коров’ячої віспи, що використовується для приготування
віспяної вакцини, має антигени, спільні з вірусом натуральної віспи
і спричиняє в людини стійкий імунітет.
Противіспяну вакцину дістають за допомогою штучного нашкір-
ного зараження телят (дермальна вакцина), або зараженням вірусом
натуральної віспи курячих ембріонів (ововакцина), або вирощуванням
вірусу вакцини в культурі клітин (тканинна вакцина). Для профілак-
тики натуральної віспи разом з противіспяною вакциною вводять
метисазон (марборан).
У 1980 р. ВООЗ оголосила про повну ліквідацію цього захворю-
вання в усьому світі, у зв’язку з чим щеплення проти віспи були припи-
нені. Однак у разі виникнення небезпеки розповсюдження натураль-
ної віспи заклади ВООЗ готові в будь-який момент ужити всіх необ-
хідних заходів, є постійні запаси противіспяної вакцини для вакцина-
ції 200 млн чоловік.
ГЕРПЕСВІРУСИ
Родина герпесвірусів (від грец. Негрез — повзучий) поділяється
на три підродини: а-герпесвіруси (віруси простого герпесу типів 1 і 2,
віруси вітряної віспи — оперізуючого лишаю і герпесвіруси тварин);
339
0-герпесвіруси (цитомегаловіруси); у-герпесвіруси (вірус Епштейна —
Барр, герпесвіруси мавп). Віруси родини Негрезуігібае (близько
50 видів) є збудниками герпесу звичайного, вітряної віспи й оперізу-
ючого герпесу в людини, а також низки захворювань тварин і птахів,
вони індукують розвиток пухлин або асоціюють з ними.
Вірус простого герпесу
Інфекційну природу простого герпесу внявнв у 1912 р. У. Грютер. Віруо
простого герпесу (Негрезуігиз) є одним із найбільш поширених у людей.
Морфологія. Вірус простого герпесу складається з нуклеоїду,
що являє собою авониткову ДНК, капсида і зовнішньої ліпопротеїд-
ної оболонки. Капсид містить 162 капсомери і має форму ікосаедра.
Розмір віріонів 150—200 нм.
Культивування. Вірус герпесу культивується в хоріоналантоїсній
оболонці курячого ембріона, спричиняючи утворення запально-некро-
тичних вогнищ. Добре розвивається в культурі ембріональної легене-
вої і ниркової тканин людини. В інфікованих клітинах формуються
внутрішньоклітинні включення, утворюються симпласти.
Антигенна структура і класифікація. Вірус герпесу містить кілька
антигенів, що складаються із внутрішніх і зовнішніх білків. Спільні
антигени (§В і £□) і типоспецифічний (§С) антиген зв’язані з глікопро-
теїлами вірусів. Диференціюють їх за допомогою РІФ, РЗК і РН.
Резистентність вірусу невисока. Він гине від висушування при
температурі 90 °С протягом ЗО хв, чутливий до дії 0,5 % розчину фор-
маліну, 1 % розчину фенолу, калію перманганату, ефіру, хлороформу,
алкоголю та інших дезинфікуючих речовин. Довго зберігається в 50 %
розчині гліцерину, при низьких температурах і у висушеному стані.
Патогенність для тварин. До вірусів звичайного герпесу чутливі
кролі, морські свинки, миші, хом’яки, собаки, мавпи, коні, корови,
свині На 4—7-му добу після зараження в експериментальних тварин
розвивається гарячка, спостерігаються парези, які призводять до
летального кінця. Вірус виділяється із мозку, крові, кон’юнктиви.
Вірус герпесу В активно циркулює серед мавп, зелених мавп, макак-
резусів, макак-циномольгусів.
Патогенез захворювання в людини. Первинне зараження вірусом
простого герпесу відбувається контактним або повітряно-краплинним
шляхом у ранньому дитинстві. Доведена можливість зараження ста-
тевим шляхом, внутрішньоутробно або під час родів. В організмі
людини вірус розмножується у тканинах екто- й ендодермального
походження; розвивається клінічна картина захворювання у вигляді
гарячки з появою герпетичних пухирців (везикул), що розташову-
ються на границі шкіри і слизових оболонок — на губах, носі, під
язиком, на внутрішній поверхні губ, щік, на статевих органах; іноді
виникають гострий герпетичний гінгівостоматит, герпетичні екзема,
кератит, енцефаліт.
Вірус простого герпесу типу 2 призводить до розвитку геніталь-
ного герпесу і герпесу новонароджених. Висловлюють припущення
340
про участь вірусу герпесу типу 2 в розвитку раку шийки матки
у жінок.
За показниками смертності герпетичні інфекції займають друге
місце після грипу.
Клінічне видужання не приводить до звільнення од вірусу: він
зберігається в організмі протягом усього життя, періодично зумов-
люючи рецидиви захворювання. Вірус простого герпесу може довго
бути в трійчастому вузлі, вузлах задніх корінців спинного мозку у ви-
гляді двониткових кільцевих форм ДНК. Активація вірусу і рециди-
ви виникають при різних стресових ситуаціях, якими можуть бути
інфекційні захворювання (малярія, грип, пневмонія, менінгіт), а та-
кож травми, інтоксикації, охолодження, психічні розлади, менстру-
ація та інші порушення нормального стану організму. Внутрішньо-
утробне зараження призводить до розвитку патологічних процесів
у плода.
Імунітет. Новонароджені і діти грудного віку (до 6 місяців) рідко
хворіють на герпес. Це зумовлено наявністю материнських антитіл,
ареактивністю клітин дитячого організму, завдяки чому інфекція
має безсимптомний перебіг. Вірус простого герпесу є слабким індук-
тором інтерферону, постінфекційний імунітет не виробляється, вна-
слідок чого й виникають тривале носійство вірусів і можливі реци-
диви захворювання. В інфікованих вірусом герпесу людей утворю-
ються віруснейтралізуючі, комплементзв’язуючі, преципітуючі анти-
тіла, в присутності яких вірус зберігається в латентному стані в клі-
тинах нервової системи.
Лабораторна діагностика. Визначити діагноз захворювання за
клінічними ознаками не становить труднощів. Застосовують вірусоло-
гічне і серологічне дослідження.
Для експрес-діагностики готують мазки-відбитки з уражених
ділянок шкіри і слизових оболонок, мазки із спинномозкової рідини
забарвлюють за Ро.мановським — Гімзою і досліджують у світловому
мікроскопі на наявність гігантських багатоядерних клітин з внутріш-
ньоядерними включеннями. У цих клітинах також визначають спе-
цифічний антиген за допомогою гіперімунних сироваток крові тварин
у РІФ та ІФА.
Віоус виділяють зараженням тканинних культур (клітин нирок
кроля, ембріона людини, Неіа та ін ), а також хоріоналантоїсної
оболонки курячого ембріона. Для вірусу герпесу звичайного харак-
терні гігантські внутрішньоядерні включення, наявність специфіч-
ного антигену. При введенні вмісту везикул у рогівку кроля, мор-
ської свинки, мишей, пацюків легко відтворюється кератит, при зара-
женні в мозок — енцефаліт, при внутрішньоочеревинному введенні
мишам-сисунцям — паралічі і летальний кінець. Однак виявлення
вірусу не може бути критерієм для розпізнавання захворювання, ос-
кільки вірусоносійство дуже поширене серед дорослих (70—
90 %).
Серологічна діагностика грунтується на виявленні за допомогою
РЗК, РН, РІФ і ІФА наростання в чотири рази титру специфічних
антитіл у крові хворих в динаміці захворювання.
341
Лікування. Терапевтичний ефект дає застосування інтерферону
у вигляді примочок, полоскань, ін’єкцій, введення пірогеналу, гіста-
глобуліну або протикорового імуноглобуліну, дезоксирибонуклеази,
а також використання мазей — флореналю і теброфену. Для ліку-
вання і запобігання рецидивам герпетичиого кератиту вводять у кон’юн-
ктивиий мішок інтерфероногени (мегазин) і протигерпетичну вакцину.
Ефективне також застосування при герпетичних ураженнях очей,
шкіри і зовнішніх статевих органів антиметаболітів, зокрема ідоксу-
ридину, керациду, трифгорметилдезоксуридину, пізарину. Для ліку-
вання герпетичиого енцефаліту використовують відарабін (аденінара-
бінозид). Антигерпетичні властивості має ацикловір (аниклогуанізин),
який вибірково пригнічує реплікацію ДНК вірусу, не ушкоджуючи
ДНК нормальних клітин різних тканин організму тварин і людини.
При тривалому застосуванні виникають мутанти вірусу, резистентні
до ацикловіру.
Профілактика рецидивів герпетичної інфекції полягає в імунізації
інактивованою формаліном вакциною, що складається із штамів ві-
русу герпесу 1 і 2-го типів.
Вірус вітряної віспи й оперізуючого герпесу
Вітряна віспа й оперізуючий герпес спричиняються вірусом, що
належить до роду Негрезуігиз.
Морфологія. Вірус має типову структуру герпесвірусів. Віріон
його ікосаедральної форми, капсид містить 162 капсомери. Діаметр
віріона 150—200 нм.
Культивування. Вірус не розмножується в курячих ембріонах,
але може репродукуватися в культурах ембріональної тканини лю-
дини і мавп. Репродукція вірусу відбувається в ядрі. Сусідні клітини
інфікуються контактним шляхом, тому цитопатична дія має вогнище-
вий характер і розвивається повільно.
Антигенна структура. Збудники оперізуючого герпесу і вітряної
віспи — це два варіанти одного й того самого вірусу.
Резистентність. Вірус протягом місяця зберігає життєздатність
у гліцерині; у зовнішньому середовищі нестійкий і швидко гине.
Патогенність для тварин. У природних умовах сприйнятливі тіль-
ки люди. Тварини не хворіють.
Патогенез захворювання в людини. Вітряна віспа найчастіше вини-
кає у дітей віком до 10 років. Джерелом інфекції є хворий на вітряну
віспу. Збудник передається повітряно-краплинним шляхом і локалі-
зується первинно в клітинах верхніх дихальних шляхів, потім він
потрапляє в кров і розноситься по всьому організму, що призводить
до виникнення захворювання.
При вітряній віспі уражуються шкіра, слизові оболонки, парен-
хіматозні органи, головний мозок. Епітеліальні клітини зазнають
дистрофії і гинуть. В уражених клітинах можна виявити внутрішньо-
ядерні еозинофільні включення. Некроз епітеліальних клітин і на-
копичення міжтканинної рідини зумовлюють утворення пухирців —
342
везикул. При вітряній віспі висип на шкірі поліморфний, везикули
однокамерні на відміну від таких при натуральній віспі.
Після інкубаційного періоду тривалістю 2—3 тижні у хворих
підвищується температура тіла, з’являються озноб, загальна слаб-
кість, втрата апетиту, іноді блювання і понос. За 1—2 доби до виник-
нення справжнього висипу досить часто з’являється скарлатинопо-
дібний або кореподібний висип, який зникає через кілька годин або
І—2 доби. Для вітряної віспи характерне утворення на слизовій обо-
лонці порожнини рота і зіва везикул, а потім виразок. Поява справж-
нього висипу супроводиться підвищенням температури тіла,свербежем
і відбувається в кілька етапів; розвиток елементів висипу нерівномір-
ний. На 5-ту добу захворювання висипи припиняються. У дорослих
вітряна віспа має більш тяжкий перебіг.
Ураження вітряною віспою жінок у перші 3 місяці вагітності
може призвести до розвитку у плода різних аномалій. Захворювання
на вітряну віспу в наступні місяці вагітності не призводить до тера-
тогенного ефекту, але дитина може народитися з висипом на тілі або
можливе його виникнення в перші дні після народження.
Оперізуючий герпес (оперізуючий лишай) в основному
буває у дорослих. Вважають, що причиною його виникнення є акти-
вація збудника, який перебуває в організмі в латентному стані, під
дією різних стресових факторів. Активований вірус по нервових стов-
бурах досягає шкіри, в клітинах якої він репродукується, спричиня-
ючи розвиток везикул, таких самих, як і при вітряній віспі, але лока-
лізованих па обмеженій поверхні, найчастіше за ходом міжреберних
нервів Захворювання супроводиться палінням, свербежем і неврал-
гією. іноді підвищенням температури тіла. Везикули наповнені про-
зорою рідиною, висипи поліморфні. У ряді випадків висип зливає-
ться і нагадує суцільну стрічку.
Після перенесеного захворювання виникають тривалі невралгії,
параліч лицьового нерва та ін. Оперізуючий герпес може давати дисе-
мінацію з ураженням внутрішніх органів, наприклад легені, призво-
дячи до розвитку тяжкої пневмонії. Він може бути причиною вітря-
ної віспи у дитини.
Імунітет. Після перенесеної вітряної віспи несприйнятливість
розвивається досить швидко і зберігається протягом усього життя.
Повторні випадки захворювання бувають дуже рідко. У крові рекон-
валесцентів виявляють комплементзв’язуючі антитіла й аглютиніни
проти вірусу вітряної віспи, оперізуючого герпесу.
Лабораторна діагностика. Розпізнавання вітряної віспи та опері-
зуючого герпесу звичайно грунтується на клінічних проявах та епіде-
міологічних даних. Лабораторні методи дослідження охоплюють ві-
русоскопію вмісту везикул і виявлення внутрішньоядерних включень
при дослідженні мазків-відбитків. Специфічний антиген виявляють за
допомогою РІФ, РЗК та ІФА.
Для виділення вірусу використовують тканинні культури ембріона
людини (найчутливіша культура клітин щитовидної залози), які
заражують рідиною з везикул і змивами з носової частини глотки
хворих. Можна використовувати клітини нирок мавп, кролів та
343
інших тварин. Характерний повільний розвиток цитопатичного ефекту.
У ядрах клітин виявляються включення. Ідентифікацію виділеного
вірусу роблять за допомогою РЗК, РІФ, РН, ІФА.
Серологічну діагностику здійснюють за допомогою РН у культурі
клітин, ІФА, РЗК.
Лікування і профілактика. Ділянки шкіри, покриті висипом, зма-
щують 1 % спиртовим розчином брильянтового зеленого або 10 %
розчином калію перманганату. Добрих результатів досягнуто при лі-
куванні хворих на вітряну віспу й особливо на специфічну пневмонію
аденінарабінозидом. Хворих не госпіталізують, їх залишають удома
до відпадіння кірок.
Дітям, що були в контакті з хворим на вітряну віспу, вводять іму-
ноглобулін або сироватку крові дорослих, їх не допускають протягом
З тижнів у дитячі заклади. Імуноглобулін, добутий від перехворілих
на вітряну віспу, полегшує перебіг оперізуючого герпесу, але не за-
побігає зараженню. Разом з тим імуноглобулін, добутий від людей,
які перехворіли на оперізуючий герпес, може захистити дітей від за-
раження вітряною віспою. Випробовується жива вакцина з ослабле-
ного штаму вірусу вітряної віспи.
Лікують хворих при оперізуючому герпесі інтерфероном, а для
усунення болю призначають знеболюючі лікарські засоби, новокаїно-
ву блокаду, в окремих випадках преднізолон.
Щоб запобігти розвитку вторинної інфекції, застосовують напів-
синтетичні препарати тетрацикліну, пеніцилін.
Вірус цитомегапії
Вірус цитомегалії (Суіоше£аІоуіги5) належить до роду Негрезуігиз.
У людини, мавп, морських свинок і мишей він спричиняє ураження
слинних залоз.
Морфологія і культивування. У слині, осаді сечі, спинномозковій
рідині і в різних органах хворих людей можна виявити клітини,
в ядрах яких є крупні включення (8—10 мкм). Морфологічно вірус
цитомегалії схожий на вірус герпесу. Є кілька серотипів. Репроду-
кується вірус у клітинних культурах, особливо чутливі фібробласти
ембріона людини, диплоїдні клітини легень. Цитопатична дія виявля-
ється через 5—20 діб після зараження у вигляді виникнення гігант-
ських клітин, що мають внутрішньоядерні включення.
Патогенез захворювання в людини. Зараження настає через слину.
Захворювання проявляється ураженням слинних залоз, має легкий
перебіг і закінчується видужанням або ж набуває генералізованого
характеру, проявляється жовтяницею, еритробластозом, збільшен-
ням печінки і селезінки і призводить до летального кінця.
Вертикальна передача вірусу від матері плоду, особливо в першо-
му триместрі вагітності, призводить до передчасного переривання ва-
гітності, мертвонародження, природжених аномалій у плода у ви-
гляді ураження головного і спинного мозку, внутрішніх органів,
а також до розвитку інтерстиціальної пневмонії.
344
Лабораторна діагностика грунтується на виявленні в уражених
тканинах, осаді сечі, слині, біопсійному матеріалі гігантських клітин
з внутрішньоядерними включеннями. Вірус виділяють зараженням
культур клітин фібробластів і диплоїдних культур клітин легень ем-
бріона людини.
Внаслідок того, що антитіла до вірусу цитомегалії виявляють
у 80 % людей старших за 75 років, для серологічної діагностики ви-
користовують парні сироватки крові, в яких визначають наростання
титру антитіл у динаміці розвитку захворювання за допомогою РН,
РЗК, РИГА, РІФ, ІФА та РІА.
Лікування. Застосовують інтерферон, левамізол, ацикловар та
інші лікарські засоби. Специфічну профілактику проводять живою
моно- і дивакциною (у поєднанні з вакциною проти краснухи).
АДЕНОВІРУСИ
Рис 100 Нормальні клітини культури
тканин нирок ембріона люлипи (а) і змі-
нені в результаті цитопатичпої дії адено-
вірусів (б).
Назва «аденовіруси» пов’язана з тнм, що представники цієї групи вірусів
уперше були виділені з аденоїдів і піднебінних мигдаликів і в культурах клі-
тин спричиняли дегенерацію (ДО — асіепоісі (іекепегаііоп). Відкриті в 1953 р.
У. Роу з співробітниками і включені до групи вірусів, які перебувають у ла-
тентному стані в організмі у більшості людей. Аденовіруси є збудниками
інфекційних захворювань дихальних шляхів та інших органів у людини, мавп,
рогатої худоби, собак, мишей і птахів.
Родину Адепоуігісіае поділяють на два роди: Мазіасіепоуігиз —
аденовіруси людини і ссавців та Ауіадепоуігиз — аденовіруси птахів.
Відомо понад 90 серотипів аденовірусів, 41 із яких виділений від
людей.
Морфологія. Аденовіруси складаються з двониткової ДНК, покри-
тої капсидом з 252 капсомерами. Віріон має кубічний ікосаедральний
тип симетрії, діаметр його 70—80 нм.
Культивування. Аденовіруси людини розвиваються в первинних
і перещеплюваних клітинних культурах. Найчутливіші клітини Неіа,
НВ, Нер-2, на яких порівняно
виразно виявляється цитопатич-
на дія, що розвивається через
24—86 год (рис. 100, б). Одні
аденовіруси спричиняють су-
цільну дегенерацію клітин мо-
ношару, інші — утворюють вог-
нищеві ураження в центрі
моношару і по його периферії.
Іноді при репродукції адено-
вірусів у тканинних культурах
паралельно спостерігається роз-
виток у ядрах клітин дрібних
віріонів розміром 22—24 нм, що
мають ікосаедральний тип симет-
рії. Вони дістали назву аденоа-
соційованих вірусів, є дефект-
345
ними вірусами і розмножуються тільки в тих клітинних культурах,
в яких є їх «помічники».
Антигенна структура. В аденовірусів виділено чотири розчинних
антигени: А-антиген — груповий, спільний для всіх серотипів; В-ан-
тиген—токсичний, який зумовлює цитопатичну дію в культурі
тканини і пригнічує активність інтерферону; С-антиген — типоспеци-
фічний, який сприяє адсорбції аденовірусів на еритроцитах мавпи або
пацюка та їх аглютинації; Р-антиген—внутрішній, нестійкий, що
звільняється при розпаді вірусів.
За гемаглютиніном аденовіруси людей поділяються на три підгрупи
(А, В, С), що мають різну властивість аглютинувати еритроцити па-
цюків і макак-резусів.
Резистентність. Аденовіруси легко витримують триразове заморо-
жування і відтавання, стійкі до ліофільного методу висушування, не-
чутливі до ефіру; гинуть при температурі 56 °С через 5 хв.
Патогенність для тварин. У звичайних умовах зараження тварини
стійкі проти аденовірусів людини; деякі серотипи (12, 18, 31 та ін.)
аденовірусів мають онкогенні властивості для тварин.
Патогенез захворювання в людини. Аденовіруси передаються по-
вітряно-краплинним шляхом, спричиняють гострі респіраторні інфек-
ції, пневмонію, контагіозний риніт, фарингокон’юнктивальну гарячку,
епідемічний кератокон’юнктивіт, гострий катаральний фолікулярний
і плівчастий кон’юнктивіт, гастроентероколіт. Серотипи 3, 4, 6 спри-
чиняють захворювання органів дихання, серотипи 8 і 19 — епіде-
мічний кератокон’юнктивіт; серотипи 2 і 3 — фарингокон’юнктиваль-
ну гарячку, що характеризується вираженими катаральними явища-
ми й утворенням плівок на кон’юнктиві, в результаті чого захворю-
вання нерідко помилково вважають дифтерією очей. У дітей серотипи
11 і 21 можуть спричиняти гострий геморагічний цистит. Прямої за-
лежності клінічної картини захворювання від серотипу збудника не
виявлено. Один і той самий тип аденовірусу може бути причиною
найрізноманітніших форм захворювання, і, навпаки, різні серотипи
можуть зумовлювати одне й те саме захворювання.
Імунітет пов’язаний з наявністю віруснейтралізуючих антитіл,
що виробляються під впливом гострої і латентної інфекції. У біль-
шості новонароджених є пасивний імунітет, який втрачається на
6-му місяці життя. Найбільша сприйнятливість у віці від бмісяцівдо
5 років. У дітей старших 5 років є антитіла, тому вони рідко хворіють
на аденовірусні інфекції. Імунітет має типоспецифічннй харак-
тер.
Лабораторна діагностика. У клітинах епітелію слизової оболонки
верхніх дихальних шляхів за допомогою РІФ, ІФА і РІА можна ви-
явити специфічний антиген. Розроблено методи молекулярної гібриди-
зації для виявлення ДНК аденовірусів. Виділяють вірус від хворого
на перещеплюваних культурах клітин (Неіа, КВ, Нер-2 та ін.) та
ідентифікують його за допомогою специфічних імунних сироваток
крові з РЗК і РН.
Для виявлення специфічних антитіл у сироватці крові хворих
застосовують серологічні методи дослідження (РЗК, РН і РГГА із
346
стандартними специфічними аденовірусними антигенами). Наростання
титру антитіл у парних сироватках крові не менш як у чотири рази
підтверджує діагноз захворювання.
Лікування і профілактика. При ураженнях очей застосовують де-
зоксирибонуклеазу, інтерферон, оксолін. Є спостереження позитив-
ного впливу імунізації дорослих і дітей живими вакцинами, виготов-
леними з 4-го і 7-го серотипів аденовірусів.
ПАПОВАВІРУСИ
До родини Рароуауігійае (назва походить від перших складів назв трьох
онкогенних вірусів: ра — вірусу папіломи людей, кролів, собак і корів, ро —
вірусу поліоми мишей, уа — вакуолізуючого вірусу мавп —8У 40) входять
віруси, які спричиняють латентну і хронічну форми інфекції.
До роду папіломавірусів (Раріїїотачігиз) належать 9 типів вірусів борода-
вок людини (звичайних, плоских, підошовних, гострокінцевих та ін.), 5 типів
вірусів оленів, собак, коней, кіз, овець, пацюків, які спричиняють доброякісні
пухлини, шо можуть перероджуватися в злоякісні.
Морфологія і резистентність. Розміри паповавірусів 45—55 нм.
Капсид складається з 72 капсомерів. Геном являє собою циклічну
двониткову ДНК, яка детермінує інфекційні і трансформуючі фун-
кції. Віруси термостабільні (витримують нагрівання до температури
50 °С протягом 1 год), стійкі в кислому середовищі (до рН 3,0), деякі
види мають гемаглютинуючу активність. До паповавірусів входять два
роди: папіломавіруси і поліомавіруси.
Патогенез захворювання в людини. Зараження відбувається від
людини до людини, через предмети домашнього вжитку, розчухи. Мож-
ливі випадки захворювання серед членів родини і спалахи серед шко-
лярів.
Папіломи локалізуються на шкірі, слизових оболонках порожнини
рота, носа, приносових пазух, глотки, голосових зв’язок, ниркових
мисок, сечоводів і сечового міхура. Вони невеликих розмірів (1—2 см
у діаметрі), тверді або м’які на дотик, на тонкій довгій або короткій
ніжці. Поверхня шкіри або слизової оболонки покрита сосочковими
розростаннями. Папіломи шкіри обличчя і слизових оболонок можуть
спричиняти косметичні дефекти, порушення функцій фонації і ди-
хання, відтікання сечі, що призводить до утворення виразок у сечо-
вому міхурі. У вірусів папіломи виявлено чотири серологічних типи;
злоякісне переродження найчастіше буває в осіб, заражених чет-
вертим серотипом.
Лікування папілом проводять електрокоагуляцією, діатермокоагу-
ляцією, заморожуванням рідким азотом та ін.
Поліомавіруси (Роїуотауігнз) уражують мишей, мавп (ЗУ 40),
кролів, людей. Поліомавіруси людини (ВК, ІС) виявлено в 1971 р.
Вони дуже поширені, у 70 % дорослих людей виявлено антитіла до
цих вірусів. Зараження настає в ранньому дитинстві. У дорослих
людей віруси містяться в тканині мозку і в сечових шляхах у латент-
3 47
йому стані, вони активуються при зниженні імунітету в результаті
хронічних захворювань, природжених дефектів, вагітності, хіміотера-
пії. Поліомавіруси репродукуються в ядрах інфікованих клітин.
ГЕПАДНОВІРУСИ
До родннн гепадновірусів (Нерасіпауігідае) належать вірус гепатиту В і ві-
руси гепатиту звірів і птахів.
Термін <вірусннй гепатит» раніше об’єднував два самостійні інфекційні
захворювання — гепатит А (інфекційний гепатит) і гепатит В (сироватковий
гепатит), збудники яких за своїми властивостями віднесені до різних таксоно-
мічних груп.
Припущення про вірусну природу гепатиту висловив у 1908 р. Мак-До-
нальд, а також у 1937 р. Дж. Фіндді і Ф. Мак-Коллум при аналізі спалаху
жовтяниці після імунізації солдатів США проти жовтої гарячки. Потім воно
було підтверджене дослідженнями на добровольцях у 1943—1945 рр. Д. Ка-
меронсм, Ф. Мак-Коллумом 1 В. Хевенсом.
Морфологія. Збудник гепатиту В складається з нуклеоїду і зов-
нішньої оболонки. Віріони, або так звані часточки Дейна, виявляють
у сироватці крові хворих на гепатит В і носіїв. Вони сферичної форми,
розміром 42—45 нм. Геном вірусу — це двониткова циркулярна ДНК,
одна з ниток якої має дефект. ДНК оточена мембраною і зовнішньою
ліпопротеїдною оболонкою. До складу вірусу входить фермент ДНК-
залежна полімераза, яка добудовує в організмі дефектну нитку ДНК
до повної.
Антигенна структура. Зовнішня оболонка вірусу гепатиту В скла-
дається з вірусних і клітинних білків, вона тотожна поверхневому
НВз-антигену, який раніше називався австралійським. НВз-антиген
синтезується у великій кількості, коли немає синтезу нуклеїнової кис-
лоти вірусу, і може циркулювати в крові самостійно, а не в складі
віріонів. У вірусу гепатиту В виявлено також антигени НВе (інфек-
ційний) і НВс (серцевинний). При переході захворювання в хронічну
форму спостерігається збільшення в крові НВе-антигену. У вірусу
гепатиту В виявлено кілька серотипів —а, д, у, або г та їх комбіна-
цій — а<і\у, аде, аум/, ауг; із них три перші відіграють роль у захво-
рюванні людей.
Резистентність. Вірус гепатиту В стійкий до факторів зовнішнього
середовища, ультрафіолетового випромінювання і слабких розчинів
дезинфікуючих речовин (формаліну, хлораміну, фенолу, ефіру, детер-
гентів). Стійкість збільшується, якщо вірус міститься в сироватці
крові. Протягом кількох хвилин витримує температуру вище 60 °С,
при 100 °С інфекційна здатність вірусу частково втрачається через
10 хв, але повна інактивація настає лиш через ЗО—40 хв.
Культивування. Вірус гепатиту В репродукується в органах і тка-
нинах мавп шимпанзе, а також в органних культурах і гепатоцитах
ембріона людини.
Патогенність для тварин. Вірус гепатиту В дуже поширений серед
мавп шимпанзе, у 25 % із них виявлено антитіла до НВ$-антигену.
Усі серотипи вірусу гепатиту В в результаті тривалої адаптації
спричиняють у шимпанзе безжовтяничні форми захворювання.
348
Патогенез захворювання в людини. Джерелом інфекції є хворі
люди і носії. На земній кулі налічується понад 200 млн носіїв вірусу
гепатиту В. Збудника виявлено в крові, сечі, поті, слині, кров’яни-
стих виділеннях під час менструації, вмісті піхви, а також інших сек-
ретах і виділеннях. Основний шлях передачі інфекції — парентераль-
ний, при користуванні погано простерилізованим медичним інструмен-
тарієм (шприци, голки, скальпелі, зуболікарські інструменти та ін.).
Інфікуююча доза для людини — 0,0001 мл плазми або крові.
Найбільший відсоток зараження спостерігається при переливанні
крові та її препаратів. Доведена можливість зараження статевим
і побутовим шляхами (зубні щітки, ножиці, бритви і т. д.), верти-
кально (від матері до плода), при проходженні плода через родові
шляхи, а також через молоко матері.
Випадки захворювання на вірусний гепатит В спостерігаються
протягом усього року; частість їх залежить не від сезону, а від про-
ведення масової імунізації шприцами багаторазового користування
або погано простерилізованими голками.
Медичні працівники хворіють на гепатит у 4—20 раз частіше вна-
слідок контакту з матеріалом, інфікованим вірусом, під час прове-
дення лікувально-діагностичних медичних процедур і маніпуляцій.
Інкубаційний період тривалий — від 50 до 180 діб. Потрапивши
в організм, вірус гепатиту розмножується в регіонарних лімфатичних
вузлах, потім розвивається вірусемія. Вірус, що проник у кров і лім-
фу, спричиняє гострий дифузний гепатит, який супроводиться ура-
женням паренхіми і строми печінки, порушенням її дезинтоксикацій-
ної функції. Спостерігаються порушення вуглеводного, пігментного
і білкового обміну, електролітного балансу, зниження окислювально-
відновної властивості і збільшення кількості деяких ферментів сиро-
ватки крові: альдолаз, трансфераз. Різко знижується бар’єрна фун-
кція печінки, що спричиняє розвиток вторинних токсичних явищ
і проникнення в організм вірусних та бактеріальних агентів. Розви-
ваються некробіотнчні процеси, що призводять до аутоімунних реак-
цій і стану гіперчутливості сповільненого типу.
Щороку у світі захворюють на вірусний гепатит понад 5 млн чоло-
вік і близько 822 000 чоловік помирають від цього захворювання. Ви-
сунуто гіпотезу про інтеграційний механізм гепатиту В. Вона перед-
бачає можливість як автономної репродукції вірусу, так і інтеграції
його геному з геномом клітини печінки. Це призводить до розвитку
хронічної інфекції, найчастіше до латентного носійства вірусу або
НВч-ангнгену в крові.
Доведено зв’язок між розвитком гепатиту, цирозу і первинного раку
печінки, що підтверджується виявленням в організмі хворих НВз-
аптнгену.
В етіології і патогенезі гепатиту В бере участь вірус гепатиту Е>
(малий дефектний РНК-вірус). який не має власної оболонки (раніше
він називався б-аптнгепом). Патогенна дія вірусу гепатиту Ь про-
являється в тих випадках, коли він одягається в оболонку вірусу ге-
пагніу В. При цьому вірус має пекрозогепну дію на гепатоцнтп, що
349
обтяжує перебіг захворювання і нерідко призводить до летального
кінця.
Імунітет після перенесеного захворювання клітинний і гумо-
ральний, тривалий і напружений, але не виключає розвитку хроніч-
них форм гепатиту (5—10 %).
Лабораторна діагностика. Для розпізнавання вірусного гепатиту
В визначають наявність у сироватці крові хворих НВз-антигену за
допомогою РПГ, РИГА, зустрічного імуноелектроосмофорезу, РІА,
ІФА.
Треба враховувати, що НВз-антиген виявляють тільки в 50—70 %
хворих; він зберігається в організмі перехворілих на вірусний гепа-
тит протягом багатьох місяців, а також його виявляють при хронічній
і безсимптомній формах інфекції. Можливе також виявлення у хворих
НВе- і НВс-антигенів.
У сироватці крові деяких хворих на вірусний гепатит В за допо-
могою ІФА, а також РИГА, в якій застосовують еритроцити з адсор-
бованим на них високоочищеннм НВз-антн геном, виявляють специфіч-
ні антитіла до НВз-антигену, а також анти-НВе-та антн-НВс-анти-
тіла.
Визначення антигенів вірусу гепатиту В й антитіл до них має не
тільки діагностичне, а й прогностичне значення. Для інкубаційного
періоду характерна наявність у крові НВз-антигену, який зберігає-
ться протягом 2—5 місяців, а при хронічному перебігові інфекції —
значно довше. У гострому періоді захворювання з’являються НВс-
і НВе-антигенн, останній циркулює в сироватці крові 1—7 тижнів,
причому наявність його в перші 3 тижні захворювання прогностично
несприятлива. Стадія ранньої реконвалесценції характеризується
зникненням із сироватки крові НВс- і НВе-антигенів і появою в ній
антн-НВс-антитіл (у зростаючих титрах), можуть з’явитися анти-НВе-
антитіла. У стадії пізньої реконвалесценції в сироватці крові виявля-
ють антитіла до всіх трьох антигенів вірусу гепатиту В.
Хронічний агресивний гепатит В характеризується циркуляцією
в крові НВс- і НВе-антигенів, високими титрами анти-НВс-І§М (що
свідчить про реплікацію вірусу).
Для діагностики вірусного гепатиту використовують також визна-
чення функціональних проб печінки (білірубін і холестерин крові),
виявлення активності альдолази, трансаміназ та ін.
Лікування полягає в додержанні постільного режиму, висококало-
рійної, багатої на вуглеводи і білки дієти, введенні сумішей із неза-
мінних амінокислот, вітамінів, глікостероїдів, інтерферону.
Профілактика гепатиту В забезпечується старанною стерилізацією
медичного інструментарію, застосуванням інструментів одноразового
користування, систематичним контролем донорської крові на наяв-
ність у ній НВз-антигену.
Щоб запобігти гепатиту В, розроблено, випробовують і застосо-
вують вбиту вакцину з НВз-антигену, добутого з плазми носіїв, а також
генно-інженерну вакцину, що складається з поліпептидів НВз-анти-
гену.
350
ВІРУСИ, ЩО МІСТЯТЬ РИБОНУКЛЕЇНОВУ КИСЛОТУ (РНК)
РНК-вмісні віруси мають різноманітні структуру і хімічний склад:
від простих, що складаються з нуклеопротеїду і 3—5 генів (пікорна-
віруси та ін.), до складно побудованих, які містять десятки генів ї
мають різні білки й ензими (віруси грипу, парагрипу та ін.). До РНК-
вмісних вірусів належить група онковірусів (ретровіруси), спричиня-
ючих злоякісні новоутворення у тварин і птахів.
ОРТОМІКСОВІРУСИ
До родини ОгіЬошухоуігідае належать віруси грипу людини, тва-
рин і птахів, класичної чуми птахів та ін. Усі вони споріднені з глі-
козамінопротеогліканами уражуваних клітин, звідки й пішла назва
«міксовіруси» (лат. тухотаіозиз — слизистий).
Віруси грипу
Вірусну етіологію грипу довели в 1933 р. У. Сміт, К. Ендрюс і П. Лейдлоу.
Відкритий ними вірус був позначений як вірус грипу А. У 1940 р. Т. Френсіс
і Т. Меджілл виявили вірус грипу В, а в 1947 р. Р. Тейлор — вірус грипу С.
Морфологія. Вірус грипу (ОгіЬотухоуігиз) має округлу або оваль-
ну форму, діаметр 80—120 нм. Геномом є однонитчаста РНК. Нуклео-
капсид — спіральний тяж рибонуклеопротеїду, покритий зовнішньою
ліпідно-вуглеводно-протеїновою оболонкою. Білки вірусу склада-
ються з різноманітних поліпептидів, що зв’язані з нуклеокапсидом та
з зовнішньою оболонкою.
До складу оболонки вірусу грипу входять гемаглютинін і нейрамі-
нідаза. Вони розташовані у вигляді шипів і зумовлюють проникнення
вірусу в клітини хазяїна та його антигенну специфічність. Вірус мі-
стить також фермент РНК-полімеразу.
Ліпіди і вуглеводи взаємозв’язані з вірусними білками, їх синтез
і специфічність залежать від геному клітини.
Антигенна структура. Розрізняють трн типи вірусу грипу: А, В, С.
Вони містять внутрішні антигени — нуклеопротеїд (Е1Р), полімеразні
білки (Р1, Р2, РЗ), матриксний білок (М) і зовнішні—гемаглютинін
(Н) і нейрамінідазу (М) (див. рис. 15). N9 і М є типоспецифічними анти-
генами, спільними для всіх вірусів грипу А; Н і N визначають підтип
вірусу.
Віруси грипу спричиняють аглютинацію еритроцитів більш ніж
ЗО видів тварин. Гемаглютинін і нейрамінідаза неоднорідні. У вірусів
грипу людини виділено чотири гемаглютиніни (НО, НІ, Н2, НЗ) і дві
нейра.мінідази (N1 і N2). Доведено, що основна роль у виробленні іму-
нітету належить гемаглютиніну і нейрамінідазі, які зазнають істот-
них змін. Спостерігаються два види мінливості гемаглютиніну і нейра-
мінідази: 1) дрейф (мала мінливість) — кількісна зміна, зумовлена
точковими мутаціями в генах, що відбувається з інтервалом 3—4 роки
і призводить до утворення стійких до інгібіторів організму варіантів;
351
2) шифт (глибока мінливість) —якісна зміна гемаглютиніну і нейрамї.
нідази в результаті повної зміни кодуючих генів, яка відбувається
з періодичністю 10—18 років і, як правило, призводить до пандемії.
Вірус грипу В уражує тільки людей, іноді виникають епідемії;
у тварин віруси цього типу не виділено.
Вірус типу С спричиняє спорадичні респіраторні захворювання;
також уражує тільки людину.
Культивування. Віруси грипу культивують в амніотичній і аланто-
їсній оболонках курячих ембріонів, первинно трипсинізованнх куль-
турах нирок мавп, ембріона людина та ін.; віріони накопичуються
у великій кількості через 48—72 год. Вірус типу В активно репроду-
кується в культурах нирок мавп, спричиняючи виражену цитопатичну
дію.
Резистентність. При кімнатній температурі вірус грипу інактнвує-
ться через кілька годин, при нагріванні до температури 65 °С гине
через 5—10 хв. Дуже чутливий до висушування, швидко руйнується
в кислому і лужному середовищах, легко знешкоджується під впливом
ефіру, дезоксихолату натрію, а також усіх дезинфікуючих речовин:
хлорного вапна, хлораміну, формаліну та ін. Згубно діють на вірус
грипу ультрафіолетове випромінювання та ультразвук. Стійкий до
дії гліцерину, в якому не втрачає своєї активності протягом 3 мі-
сяців.
Патогенність для тварин. Під час епідемій віруси грипу людини
можуть адаптуватися до багатьох видів свійських тварин (свині, со-
баки, коні, корови), свійської і дикої птиці, але епідеміологічну роль
їх для людини вивчено недостатньо. Під час спалахів грипу серед лю-
дей збільшується титр антитіл у тварин. Можливо, тварини і птахи
є важливою ланкою у природній циркуляції вірусу грипу в природі.
З експериментальних тварин найбільш сприйнятливі до вірусу
грипу африканські тхори. Через 2 доби після зараження у них підви-
щується температура тіла, розвиваються явища запалення верхніх
дихальних шляхів, бувають виділення з носа секрету гнійного ха-
рактеру, чхання.
Патогенез захворювання в людини. Вірус грипу передається по-
вітряно-краплинним шляхом при чханні, кашлі, розмові. Грипу вла-
стива висока контагіозність.
Інкубаційний період звичайно триває 1—3 доби, іноді кілька го-
дин. Потрапивши в організм сприйнятливої людини через носову ча-
стину глотки, вірус грипу проникає в клітини епітелію слизової обо-
лонки верхніх дихальних шляхів. Через 8 год після потрапляння од-
нієї вірусної часточки у верхні дихальні шляхи кількість вірусного
потомства досягає 103, а через 24 год — 1027. Вірус проникає в кров
і розноситься по всьому організму. Важлива роль у розвитку захво-
рювання належить інтоксикації, яка зумовлена потраплянням у кров
вірусу і токсичних продуктів. Розвиваються пригнічення кровотво-
рення й імунної системи, лейкопенія.
Ушкоджений миготливий епітелій дихальних шляхів втрачає свою
захисну функцію внаслідок злущування війок, що призводить до
проникнення в слизову оболонку вторинної бактеріальної флори
.352
(стрептококи, стафілококи, НаеторЬіІиз іпПиепзае, мікоплазми та
ін.), яка спричиняє ускладнення (бронхіт, пневмонія, плеврит, енце-
фаліт, грипозний менінгіт, отит).
Крім того, грип спричиняє загострення хронічних захворювань
(туберкульоз) і значно знижує імунітет щодо низки інфекцій. Вва-
жають, що в патогенезі грипу має місце алергічний компонент, який
збільшує тяжкість захворювання.
Імунітет постінфекційний, зумовлений секреторними антитілами
(їй А8), що утворюються клітинами слизової оболонки верхніх ди-
хальних шляхів, а також антитілами до гемаглютиніну і нейрамініда-
зи, які порівняно швидко з’являються у високих титрах у хворих на
грип. Імунітет має типо- і штамоспецифічний характер і забезпечує
несприйнятливість людей до вірусу грипу типу А протягом 1—2 років,
до вірусу грипу типу В — 3—5 років, до вірусу грипу типу С, оче-
видно, протягом усього життя.
Захист організму од вірусу грипу також забезпечується неспеци-
фічними факторами — активністю лімфоїдно-макрофагальної системи,
інтерфероном, термостабільними і термолабільними інгібіторами та
іншими речовинами сироватки крові.
Лабораторна діагностика охоплює експрес-діагностику, а також
вірусотогічне і серологічне дослідження. Експрес-діагностика грипу
грунтується на виявленні специфічного вірусного антигену в дослі-
джуваному матеріалі (змиви, виділення носової частини глотки, мазки-
відбитки) за допомогою прямої і непрямої РІФ, а також РЗНГА і
РЕМА.
Вірусологічне дослідження робиться з метою виділення вірусу
та його ідентифікації. При цьому змивами з носової частини глотки
(до яких для пригнічення бактеріальної мікрофлори додають анти-
біотики або піддають їх ультрацентрифугуванню) заражують 9—
11-денні курячі ембріони або клітинні культури (ембріона людини,
нирок мавпи та ін.). Після культивування протягом 3—4 діб вірус
грипу виявляють в алантоїсній і амніотичній рідинах курячого ем-
бріона за допомогою РГА (див. форзац, рис. VIII), а в тканинних
культурах — РГадс.
Ідентифікують вірус за допомогою РГГА, РН і РІФ з використан-
ням специфічних імунних сироваток.
Серологічна діагностика передбачає виявлення наростання титру
специфічних антитіл у сироватці крові хворих у динаміці захворю-
вання за допомогою РГГА, РЗК та РН і РЕМА. Для проведення
цих реакцій кров беруть у перші дні захворювання і в період видужу-
вання. У перехворілих на грип людей титр антитіл зростає в чотири
рази і більше.
Лікування. Застосовують комплексну терапію, спрямовану на
пригнічення репродукції вірусу грипу в організмі і нейтралізацію
токсинів Добрі результати дає введення у перші дні захворювання
протигрипозного донорського імучоглобуліну, сухої протигрипозної
сироватки, інтерферону, а також застосування препарату ремантадн-
ну. Щоб запобігти розвиткові ускладнень, призначають антибіотики
в поєднанні з сульфаніламідними препаратами.
12 (.445
353
Профілактика. Для специфічно? профілактики грипу застосовують
живу і вбиту вакииии. У нашій країні використовують живу вакцину,
що містить ослаблені віруси грипу А і В, яку вводять іитраиазально.
Добуто живу грипозну вакцину для перорального введення, що дає
змогу застосовувати її для імунізації дітей.
І пакти кована формаліном грипозна ареактивна вакнина з високою
концентрацією вірусу дає змогу створювати високоиапружеиий іму-
нітет у дорослих і дітей.
Розроблено субодиничиу вакцину, що містить очищені гемаглю-
тиніни і нейрамінідазу. Вона меиш реактогениа й тому рекомендуєть-
ся для застосування у дітей молодшого шкільного віку і людей похи-
лого віку, уражених хронічними захворюваннями.
Для індивідуальної профілактики використовують інтерферон,
рибовірии (віразол), оксоліиову мазь та інші препарати.
Протигрипозні заходи поки що не можуть вважатися достатньо
ефективними. Щороку грип і гострі респіраторні інфекції у нашій
країні уражують понад ЗО мли чоловік, а економічна шкода, заподі-
яна цим захворюванням, становить близько 3,5 млрд карбованців
на рік.
Останніми роками розроблена і здійснюється комплексна програма
наукових досліджень грипу.
ПАРАМІКСОВІРУСИ
До родини Рагатухоуігігіае входять три роди вірусів: Рагатухо-
уігиз, МогЬПІіуігиз, Рпеитоуігиз, які е збудниками парагрипу, паро-
титної ін/Ьткції, кору, гострих респіраторних захворювань у лю-
дей, а також низки інфекційних захворювань у тварин (чума собак,
великої рогатої худоби, псевдочума та ін.).
Віруси мають сферичну форму, діаметр їх 150—300 нм. Вони най-
крупніші з РНК-вмісних вірусів. Нуклеоїд оточений ліпідно-вугле-
водно-протеїновою оболонкою. Нуклеокапсид має спіральну симетрію.
Параміксовірусам властиві гемаглютинуюча, гемолітична і нейрамі-
нідазна активність, здатність утворювати синцитій у клітинних куль-
турах і еозинофільні цитоплазматичні включення; в антигенному від-
ношенні ці віруси характеризуються різноманітністю.
Віруси парагрипу
Віруси парагрипу людини спричиняють ураження дихальних
шляхів. Вони виділені у США Р. Чаноком у 1956 р.; належать до роду
Рагатухоуігиз, до якого, крім вірусів парагрипу людини, входять
віруси паротитної інфекції, Сеидай, хвороби Ньюкастла.
Морфологія цілком відповідає описаній вище характеристиці
родини параміксовірусів.
Культивування. Віруси парагрипу не репродукуються в курячих
ембріонах, добре розвиваються на тканинних культурах ниркового
епітелію мавп і ембріона людини, а також на фібробластах людського
364
ембріона. Характер ЦПД, що спостерігається в клітинних культурах,
може бути різним — від розрідження пласта клітин до утворення сим-
пластів і залежить від типу вірусу. Можливо також утворення в ци-
топлазмі клітин ацидофільних включень. При внесенні в культуральну
рідину еритроцитів вони прилипають до поверхні клітин, які містять
вірус (феномен гемадсорбції). Доведено, що віруси парагрипу людини
можуть спричиняти хронічну інфекцію клітинних культур.
Антигенна структура. У вірусів парагрипу людини виявлено два
антигени: $-антиген, який розчиняється і зв’язаний з рибонуклеопро-
теїдом, і У-антиген — комплекс структурно різних білків, що містять-
ся в ліпопротеїдній оболонці вірусу.
Віруси парагрипу поділяються на чотири самостійних типи. Тип 1
спричиняє у дітей круп, фарингіт, бронхіоліт або пневмонію: тип 2
зумовлює ларинготрахеобронхіт або гостре респіраторне захворюван-
ня: тип 3 (гемадсорбуючий вірус) і тип 4 (штам М-25) виділені в дітей,
уражених крупом і пневмонією.
У складі вірусів парагрипу є антигени, властиві клітинам-хазяїнам.
Віруси аглютинують еоитроцити морської свинки, курки, людини.
Резистентність. Віруси парагрипу чутливі до ефіру; досить швидко
гинуть від нагрівання та дії дезинфікуючих засобів.
Патогенність для тварин. Віруси парагрипу людини в природних
і лабораторних умовах слабко патогенні для тварин; можуть спричи-
няти безсимптомну інфекцію з розмноженням вірусу у верхніх ди-
хальних шляхах і накопиченням антитіл.
Патогенез захворювання в людини. Зараження відбувається по-
вітряно-краплинним шляхом. Інкубаційний період триває 3—6 діб.
Віруси парагрипу розмножуються в епітеліальних клітинах слизової
оболонки верхніх дихальних шляхів, зумовлюють деструкцію епіте-
лію, запальний процес і нерідко набряк гортані. Накопичені віруси
і продукти розпаду клітин проникають у кров, зумовлюючи загальну
інтоксикацію організму. В результаті деструкції епітелію порушує-
ться захисний бар’єр, що сприяє проникненню бактеріальної флори
і розвитку ускладнень.
Віруси парагрипу найчастіше уражують дітей,спричиняючи у них
фарингіт, бронхіоліт, ларинготрахеобронхіт, круп, пневмонію. У до-
рослих віруси парагрипу спричиняють легкі форми ураження ди-
хальних шляхів. Віруси парагрипу звичайно перебувають в асоціації
з вірусом грипу та аденовірусами.
Лабораторна діагностика здійснюється вірусологічними, сероло-
гічними методами, а також імунофлюоресценцією. Для виділення
вірусу використовують одношарові культури з нирок мавп або ембрі-
онів людини. Наявність вірусу в культурі тканини визначають гемад-
сорбиією. Ідентифікують виділені штами за допомогою РН, РТГадс
в культурі тканини. Для серологічної діагностики парагрипозних
захворювань застосовують РГГА, РЗК з парними сироватками крові
хворих Виявити вірусний антиген у клітинах епітелію слизової обо-
лонки верхніх дихальних шляхів можливо за допомогою РІФ та ІФА
з типоспенифічними міченими сироватками крові.
Специфічної профілактики і лікування немає.
12'
355
Вірус хвороби Ньюкастла
До парагрипозиих захворювань належить кон’юнктивіт, який спричияяєть-
ся вірусом хвороби Ньюкастла Вірус виділений у 1927 р. Т Дойлом під час
епізоотії курей поблизу м Ньюкастл він має всі ознаки, характерні для яара-
міксовірусів Вірюни містять гемаглютинін, нейраміиідазу, гемолізин Вірус
аглютинує еритроцити різних видів тварин і птахів (курей, індиків, голубів),
культивується в курячих ембріонах, культурі курячих фібробластів
Вірус спричиняє пневмоенцефаліт у курчат і парагрип у дорослої птиці
(кури, фазани, цесарки, індики) У людей він зумовлює розвиток кон’юнкти-
віту — професійного захворювання працівників птахофабрик
Лабораторна діагностика охоплює виділення й ідентифікацію вірусу,
застосування серологічних реакцій. Для профілактики захворювань серед
птнці застосовують живі вакцини з ослаблених штамів вірусу.
Респіраторно-синцитіальний вірус
Вірус виділений у США в 1956 р. Дж. Моррісом від мавп, потім від дітей
з захворюваннями верхніх дихальних шляхів. Назва його (Р8 — Резрігаїогу
зупсуііаі) зумовлена тим, що при розмноженні вірусу в клітинних культурах
утворюється синцитій клітин — сітчаста тканина.
Морфологія. РЗ-вірус належить до роду Рпеитоуігиз. Діаметр
віріона 100—200 нм, він чутливий до ефіру і нестійкий до заморожу-
вання, інактивується при температурі 56 °С протягом 30—40 хв. На
відміну від інших параміксовірусів К8-вірус не містить гемаглютиніну
і нейрамінідчзи.
Культивування. Р8-вірус не розмножується в курячих ембріонах,
непатогенний для лабораторних тварин. Він культивується на пере-
щеплюваних лініях клітин пухлинних і нормальних тканин людини,
штамах диплоїдних клітин людини, а також первинних культурах
нирок мавп Цитопатична дія проявляється на 3—6-й день після зара-
ження у вигляді виникнення округлих клітин з підвищеною промене-
заломлюваністю, симпластів і відросткових клітин, зв’язаних між
собою цитоплазматичними відростками (синцитій).
Патогенез захворювання в людини. КЗ-вірус спричиняє гострі
респіраторні захворювання, бронхіт, пневмонію, риніт. Інкубаційний
період триває 4—9 діб, тривалість захворювання — 5—6 діб. Захво-
рювання набувають характеру ендемічних спалахів тривалістю 2—
З місяці. Вони звичайно бувають у дитячих колективах у зимово-вес-
няний період. На відміну від парагрипозних захворювань, що мають
ендемічний характер і розвиваються кілька раз на рік, епідемії, які
спричиняються Р8-вірусамн, повторюються щороку.
Лабораторна діагностика. Експрес-діагностика полягає у виявлен-
ні специфічного антигену у виділеннях носової частини глотки за
допомогою РІФ і багатоядерних клітин та синцитію в епітелії слизо-
вих оболонок бронхів.
Вірусологічну діагностику здійснюють зараженням клітин Неіа,
Нер-2, КВ, ЕЬ, первинних і перещеплюваних клітин ембріона людини
і морської свинки досліджуваним матеріалом. Через 24—48 год після
зараження з’являються гігантські багатоядерні клітини і синцитій,
що містять цитоплазматичні включення. Для ідентифікації вірусу
використовують РІФ, РН у культурі клітин та РЗК.
356
Серологічну діагностику роблять із сироватками крові хворих
V РЗК і РН в культурі тканини.
Специфічного лікування і профілактики не розроблено.
Вірус паротитної інфекції
Збудник належить до роду Рагатухоуігиз; він був відкритий К. Джонсо-
ном та Е. Гудпасчуром у 1934 р.
Морфологія. В електронному мікроскопі віруси мають куполопо-
дібну неправильну форму. Розміри віріона 150—170 нм у діаметрі.
Культивування. Вірус репродукується в курячих ембріонах. Сві-
жовидіпені штами вірусу добре розвиваються у первинних ниркових
культурах людського ембріона. Цнтопатична дія характеризується
утворенням багатоядерних клітин.
Антигенна структура. Вірус паротитної інфекції не має серологіч-
них ваоіантів, він містить два антигени: 8-антиген, розчинний, зв’я-
заний з рибонуклеопротеоїдом, і У-антиген, що складається з по-
верхневих вірусних структур.
Вірус паротитної інфекції має гемаглютинуючі властивості щодо
еритроцитів людини, мавп, барана, коня, курей, гусей, качок та ін.
Резисгентність. Вірус зберігається при низьких температурах
(—25° і —70 °С) роками, малостійкий до дії фізичних і хімічних фак-
торів. Він гине при температурі 55—60 °С протягом 22 хв, швидко
інактивується ультрафіолетовим випромінюванням, руйнується від
дії 0,1 % розчину формаліну, 1 % розчину лізолу, 50 % спирту або
ефіру.
Патогенність для тварин. У природних умовах вірус паротитної
інфекції не спричиняє захворювань у тварин. При експериментально-
му зараженні він уражує деякі породи мавп; при цьому виникає за-
хворювання, схоже на епідемічний паротит у людей. Вірус може бути
адаптований до деяких тварин (хом’яки, білі миші, білі пацюки),
при зараженні в мозок одноденних сисунців у них розвивається тяж-
кий енцефаліт, що закінчується смертю.
Патогенез захворювання в людини. Вірус паротитної інфекції
передається повітряно-краплинним шляхом, а також через предмети,
інфіковані слиною хворого. Інкубаційний період 14—21 доба. Захво-
рювання характеризується гарячкою, запаленням привушних, язико-
вих і підщелепних слинних залоз. Хворіють головним чином діти.
Паротитна інфекція (свинка) — дуже контагіозне захворювання,
але у 50 % заражених воно не має симптомів. У тяжких випадках
виникає вірусемія. Крім слинних залоз, вірус проникає в інші орга-
ни і спричиняє ураження центральної нервової системи. Як усклад-
нення можуть розвиватися поліневрит, парези лицьового нерва, пору-
шення функцій органів слуху і зору, орхіт у підлітків і дорослих.
Імунітет. Постінфекційний імунітет стійкий, зберігається протя-
гом усього життя. У сироватці крові з’являються антитіла, які зв’я-
зують комплемент і спричиняють гальмування реакції гемаглюти-
нації.
357
Лабораторна діагностика здійснюється виділенням вірусу з сечі,
слини, нейтральної нервової системи зараженням 7—8-денних куря-
чих ембріонів і культур клітин з наступною ідентифікацією вірусу
в РГГА, РІФ, РН, РЗК, РГГзде. Серологічну діагностику роблять
в РЗК, РТГА з сироватками крові хворого. Антитіла виявляються
через тиждень від початку захворювання, титр їх наростає інтенсивно.
Найкращі результати дає дослідження парних сироваток крові.
Лікування. Хворим вво ія іь гамма-глобулін, який полегшує перебір
захворювання.
Профілактика. У США і нашій країні розроблена і застосовується
жива вакцина, яка створює такий самий імунітет, як і після природ-
ного інфікування. Її вводять дітям віком понад 1 рік, а також дорос-
лим, які не хворіли па паротитну інфекцію. Часто її використовують
у поєднанні з вакцинами проти кору і краснухи.
Вірус кору
Вірусна природа кору доведена в 1911 р. Т. Андерсеном і Дж. Гольдбер-
гом. Вірус виділили в 1954 р. Дж. Ендерс і Т. Піблс. Він належить до роду
МогЬіІІіУігиз.
Морфологія. Розміри вірусу 120—250 нм. Нуклеокапсид має
спіральний тип симетрії. Віріон характеризується гемаглютннуючими
властивостями, не містить нейрамінідази.
Культивування проводять на одношарових культурах ниркового
епітелію людини, мавп, собак, на культурі клітин амніону людини.
Цитопатична дія характеризується формуванням симпластів (багато-
ядерні клітини) і еозинофільними включеннями в цитоплазмі і ядрі.
Антигенна структура. Серед штамів вірусу кору виявлені антигени
зовнішньої оболонки (У-антиген), гемаглютинін, мембранний білок.
Найбільшу імуногенність має гемаглютинін.
Резистентність. Збудник кору швидко гине при температурі 58 °С,
стійкий до низьких температур (—70 °С). Поза організмом вірус кору
зберігається не більше ЗО хв. Дуже чутливий до дії сонячного випро-
мінювання, у зв’язку з цим дезинфекцію при кору не роблять.
Патогенність для тварин. У природних умовах тварини на кір
не хворіють. Удалось відтворити захворювання у мавп.
Патогенез захворювання в людини. Єдиним джерелом інфекції
є хвора людина. Загальна тривалість заразного періоду 8—10 діб:
з 1-го дня продромального періоду і до 4—5-го дня від появи висипу.
Вірус проникає в організм через слизову оболонку верхніх ди-
хальних шляхів, потім потрапляє в кров, уражує тканини дихальних
шляхів. Захворювання характеризується вірусемією, гарячкою, виси-
пом. Найчастіше хворіють діти. Проте можливе виникнення кору і в
дорослих, які раніше на нього не хворіли.
Найвища захворюваність на кір буває взимку, скупченість людей
сприяє її підвищенню.
Захворювання на кір супроводиться зниженням імунітету до
грипу, туберкульозу, дифтерії, коклюшу, скарлатини та інших
358
інфекцій. Внаслідок зміни імунологічної реактивності, розвитку алер-
гії досить часто виникають найрізноманітніші ускладнення, що спри-
чиняються як вірусом кору, так і вторинною бактеріальною
флорою.
У дітей, яким з профілактичною метою вводили гамма-глобулін,
кір має легку (мітиговану) форму.
Після перенесеного кору в окремих випадках вірус не зникає
з організму перехворілого, а, очевидно, персистирує в клітинах моз-
кової тканини і в лімфатичних вузлах. Іноді розвивається демієліні-
зуючий енцефаліт. Такий довго персистируючий вірус може активу-
ватися і спричинити розвиток підгострого склерозуючого паненцефа-
літу, що призводить звичайно до летального кінця. Персистування
вірусу наділяє організм імунітетом проти кору.
Вірус кору може проникнути через плаценту, інфікувати плід
і спричинити мертвонародженість або виродливості у новонароджених.
Імунітет. Після перенесеного кору розвивається стійкий і трива-
лий імунітет Повторні випадки захворювання майже не трапляють-
ся. Інфіковані вірусом клітини організму людини продукують інтер-
ферон, рівень якого через 1—2 доби після зараження досягає макси-
муму.
Під впливом макрофагів вірус розщеплюється з утворенням анти-
гену, що стимулює до активної дії Т-клітини і монокіни (у-інтерферон
і інтерлейкін-1) Активовані Т-клітини виробляють лімфокіни (інтер-
лейкін-2), відбувається розмноження Т-клітин (цитотоксичних, су-
пресорних і холперних). На 7-му добу після зараження цитотоксичні
Т-клітини лізирують клітини, інфіковані вірусом кору. На цій стадії
досить часто захворювання припиняється. У реконвалесцентів клі-
тини пам’яті, що збереглися, зумовлюють швидкий розвиток імунної
відповіді при повторному потраплянні в організм антигену вірусу
кору. Т-клітини потрібні для вироблення В-клітинами антитіл двох
класів — І§М і І§6.
Лабораторна діагностика. Розпізнавання кору грунтується на
клінічних проявах та епідеміологічних даних. Одним із методів ла-
бораторної діагностики є риноцитологічне дослідження за допомогою
люмінесцентної мікроскопії мазків-відбитків із слизової оболонки
носа, в яких виявляють гігантські клітини овальної або неправильної
форми; усеоедині клітин містяться включення, які флюоресціюють
яскраво-червоним кольором при обробці препаратів акридином оран-
жевим. Методом РІФ у клітинах виявляють специфічний вірусний
антиген.
Для виділення вірусу від хворих беруть кров із пальця (0,5 мл),
змиви з носової частини глотки і сечу. Заражують первинні культури
з клітин нирок мавп та амніону людини. Виявити вірус у заражених
клітинних культурах удається іноді тільки через 1 — 1г/а місяця. Виді-
лення вірусу від хворого можливе тільки в продромальному періоді
або в перший день появи висипу. Застосовують також дослідження
парних сироваток крові з метою виявлення наростання титру антитіл.
Антитіла проти вірусу кору можна виявити в РН цитопатичної
дії в тканинних культурах, а також у РЗК, РГГА.
359
Лікування. Специфічного лікування немає. При ускладненнях,
спричинених вторинною інфекцією, призначають антибіотики (пені-
цилін та ін.).
Профілактика. Для серологічної профілактики кору використо-
вують імуноглобулін (протикоровий гамма-глобулін) у кількості 1,5
або 3 мл, добутий із донорської або плацентарної сироватки крові.
Імуноглобулін неефгктивний при введенні пізніше 7-го дня інкубацій-
ного періоду. Тривалість пасивного імунітету ЗО діб. При повторному
контакті з хворим на кір дитині знову вводять імуноглобулін. Вве-
дення цього препарату звичайно не запобігає розвиткові захворю-
вання, а тільки відсуває його строк, значною мірою пом’якшує його
тяжкість і відвертає летальний кінець.
Для специфічної профілактики кору в нашій країні застосовується
протикорова жива вакцина із штаму Ленінград-16. Її вводять під-
шкірно одноразово. Це значно знижує захворюваність. Випробовує-
ться асоційована вакцина проти паротитної інфекції, кору і крас-
нухи.
РАБДОВІРУСИ
До родини КЬаЬсіоуігісіае належать віруси сказу, везикулярного
стоматиту та багато інших вірусів тварин і комах (понад 40 видів).
Вірус сказу
У 1892 р. В. Бабеш і в 1903 р. А. Негрі описали специфічні включення
у клітинах мозку тварин, що загинули від сказу. Ці включення дістали назву
тілець Бабеша — Негрі. Вірусну етіологію сказу довів у 1903 р. П. Ремленж.
Специфічну профілактику розробив Л. Пастер.
Збудник сказу належить до роду Ьуззауігиз (грец. Іузза—водобо-
язнь). Він вибірково уражує нервову систему, виділяється із слиною.
Морфологія. Вірус сказу має кулясту форму з одним плоским і дру-
гим закругленим кінцем, довжина його 180—200 нм, ширина 75—
80 нм. Він покритий оболонкою, що складається з глікопротеїду і глі-
коліпідів, які зумовлюють гемаглютинуючі властивості вірусу.
У складі віріона виявлено ферменти протеїнкінази і РНК-полімерази.
Тільця Бабеша — Негрі розташовуються в цитоплазмі нервових клі-
тин та їх відростків, мають круглу, овальну, багатокутну форму, роз-
міри їх 0,5—25 мкм; вони добре забарвлюються кислими барвниками
в рубіново-червоний колір (див. форзац, рис. III, з).
Культивування. Вірус сказу розвивається у мозковій тканині
мишей, овець, а також курчат, кролів, морських свинок, білих па-
цюків. Деякі штами вірусу репродукуються в первинних культурах
клітин нирок хом’яка, ембріона овець, телят, а також у курячих
ембріонах. Вірус сказу адаптується до культур тканин різних видів
тварин.
Антигенна структура. Вірус сказу не має відособлених різновидів
і типів. Збудник захворювання, який циркулює серед тварин, нази-
вається вуличним. В результаті тривалих пасажів його через мозок
360
кролів Л. Пастеру вдалося знизити тривалість інкубаційного періоду
і підвищити його інфекційний титр. Такий вірус назвали фіксова-
ним. Антигенні властивості вуличного і фіксованого вірусів сказу
виявились ідентичними. Фіксований вірус слабкопатогенний або
зовсім непатогенний для людини. Його використовують для антирабіч-
ннх щеплень.
Резистентність. Вірус сказу стійкий до дії низьких температур
-і гліцерину; довго зберігається в нервовій тканині, іноді і після смер-
ті тварини. Інактивується при кип’ятінні протягом 2 хв, при темпера-
турі 60 °С— протягом 10—15 хв; гине при дії прямого сонячного та
ультрафіолетового випромінювання розчинів фенолу, лізолу та інших
дезинфікуючих засобів; чутливий до ефіру.
Патогенність для тварин. На сказ найчастіше хворіють собаки,
вовки, лисиці, кажани, скунси, рідше — рогата худоба, коні, свині,
олені, коти, пацюки, птахи. Вірус передається через укуси хворих на
сказ тварин, при потраплянні слини хворих тварин на садна або
подряпини шкіри, слизові оболонки.
Останнім часом активізувались природні вогнища сказу в нашій
країні та інших європейських країнах, у США, Південній Америці,
Індії та ін.
Патогенез захворювання в людини. Період від моменту зараження
до початку захворювання триває 15—45 діб, іноді 3 місяці, у деяких
випадках понад рік. Тривалість інкубаційного періоду залежить від
кількості і вірулентності вірусу, внесеного під час укусу, локалізації
укусу, характеру ушкоджень тканини.
У продромальному періоді буває тягнучий біль у місці укусу і за
ходом нервових стовбурів, іноді спостерігаються припухлість і почер-
воніння рубців, потім з’являються нудота, пітливість, субфебрильна
температура, головний біль, сухість у роті, зниження апетиту, обкла-
ценісгь язика. Далі розвивається підвищена чутливість до зорових
і слухових подразників, продро.мальні явища посилюються, і захво-
рювання переходить у стан виражених клінічних приступів.
Із місця проникнення (рана, садно) вірус сказу розповсюджується
по перпневральннх просторах нервових стовбурів у центральну нерво-
ву систему.
Найбільше вірусу концентрується в гіпокампі, довгастому мозку,
мозочку, ядрах черепних нервів, симпатичних гангліях і в попереко-
вій частині спинного мозку. В результаті ураження цих життєво важ-
ливих відділів нервової системи розвиваються пароксизми — підви-
щена рефлекторна збудливість, посилене виділення слини і поту,
судороги, особливо м’язів, які забезпечують акти ковтання і дихання.
Смерть настає протягом перших 5—7 діб захворювання при явищах
аеро- і гідрофобії, паралічів і судорог.
Імунітет. І Іостінфекційного імунітету при сказі не виявлено,
оскільки випадків видужання від сказу достовірно не доведено. Меха-
нізм набутого (поствакципальпого) імунітету пов’язаний з утворен-
ням віруснейтралізуючпх антитіл. У поствакцинальному імунітеті
відіграє роль також інтерференція вуличного вірусу й антигенів вак-
цинних препаратів.
361
Лабораторна діагностика. Гістологічний метод грунтується на пост-
мортальному виявленні тілець Бабеша — Негрі у мазках-відбитках
зрізів мозку (в клітинах гіпокампу) і слинних залоз, забарвлених за
Романовським — Гімзою, Мапном, Туревичем та ін.
Метод імунофлюоресценції спрямований на виявлення антигену
в мазках-відбитках зрізів мозку або слинних залоз загиблих людей
і тварин або у відбитках рогівки ока (прижиттєвий тест). Цей метод
чутливіший і швидший порівняно з іншими методами.
Біологічний метод застосовують для виділення вірусу сказу із
тканини мозку, слинних залоз трупів або слини (прижиттєвий тест)
внутрішньомозковим зараженням мишей-сисунців або молодих мишей.
Через 2—3 тижні у тварин розвиваються паралічі.
Серологічна діагностика. Для виявлення антитіл під час захво-
рювання використовують РН, РЗК, РІФ, РЕМА.
Лікування охоплює старанне промивання рани водою з милом, не-
гайне очищення її від забруднення і обробку дезинфікуючими розчи-
нами (спирт, спиртовий розчин йоду, 2—5 % розчин формаліну, оцет
та ін.), введення антирабічного імуноглобуліну, антирабічної вак-
цини.
Профілактика забезпечується здійсненням комплексу загальних
і специфічних заходів. До них належать: 1) знищення скажених тва-
рин, бродячих собак, реєстрація домашніх собак, ношення ними на-
мордників, заборона ввезення собак із місць, ендемічних щодо сказу,
систематичне проведення санітарно-освітньої роботи; 2) щеплення
антирабічною вакциною людей, укушених скаженими або підозрі-
лими на сказ тваринами; 3) обов’язкова профілактична вакцинація
всіх зареєстрованих собак.
Поствакцинальний імунітет розвивається через 2 тижні і зберігає-
ться протягом 6 місяців. Ефективне застосування антирабічного іму-
ноглобуліну, добутого гіперімунізацією коней фіксованим вірусом,
і гомологічного імуноглобуліну із сироватки крові людей, імунізова-
них проти сказу. Імуноглобулін знешкоджує вірус вуличного сказу і
запобігає розвиткові поствакцинального енцефаліту. Його слід вво-
дити не пізніше як через 72 год після укусу.
Коли призначають курс антирабічних щеплень, треба враховувати
ступінь, локалізацію і характер інфікування (укус, ослинення). Ка-
тегорично забороняється робити щеплення людям без достатніх пока-
зань. Введення фіксованого вірусу, хоч і рідко, може спричинити дуже
тяжкі ускладнення, а іноді навіть призвести до летального кінця.
До ускладнень антирабічних щеплень фіксованим вірусом нале-
жать паралітичний сказ, енцефаломієліт, алергічний енцефаломієліт.
Перші два захворювання трапляються дуже рідко і закінчуються
смертю. Алергічний енцефаломієліт має різні симптоми менінгіту,
енцефаліту, міозиту, полірадикуліту і поліневриту з парезами і пара-
лічами.
У нашій країні, а також в США й Франції ведуть дослідження,
спрямовані на виготовлення інактивованої вакцини, яка не спричиняє
ускладнень. Випускається вітчизняна інактивована культуральна
неконцентрована вакцина, виготовлена на культурі клітин нирки хо-
362
м’яка, і суха, не повністю інактивована антирабічна вакцина типу
Фермі, виготовлена з мозку однорічних овець, заражених фіксованим
вірусом сказу.
ПІКОРНАВІРУСИ
До родини Рісогпауігісіае входять чотири роди: Епіегоуігиз (поліо-
вірус, віруси Коксакі й ЕСНО, ентеровіруси 68—72, поліовіруси
мишей, свиней, ентеровіруси корів, віруси комах); КЬіпоуігиз (рино-
віруси людини, корів, коней); Агітіоуігиз (віруси ящуру тварин,
які іноді виділяють і в людей); Сагбіоуігиз (вірус енцефаломіокардиту
тварин, який іноді виділяють і в людей). Усередині родів є серотипи,
кількість яких становить близько 200.
Пікорнавіруси (лат. рісо — маленький, гпа — РНК) — дрібні ві-
руси діаметром близько 17—ЗО нм. Капсид їх ікосаедральної форми.
Вони не мають зовнішньої оболонки, не містять ліпідів і вуглеводів,
не інкорпорують у свої структури антигени клітин, в яких вони культи-
вуються, стійкі до ефіру і дезоксихолату натрію.
Вірус поліомієліту
У 1908—1909 рр. к. Ландштсннер і Е. Поппср доьелп вірусну стюлої не
поліомієліту зараженням мавп емульсією спинного мозку людини, яка померла
від поліомієліту. У мавп були відтворені типові явища поліомієліту з кволими
паралічами. У 1949 р. Д. Ендерс показав, що вірус може розмножуватись у
культурі тканини.
Морфологія. Вірус поліомієліту (Роііоуіпіз) (див. рис. 17, 6)
розміром ЗО нм має форму ікосаедра. Він складається з білкового кап-
сиду, що містить 60 сферичних субодиниць (капсомерів). У складі
поліовірусів немає ліпідів, внаслідок чого вони не чутливі до дії ефіру,
дезоксихолату натрію.
Оболонка вірусу поліомієліту містить 4 білки (VI, У2, УЗ, У4),
у трьох із них (VI, У2, УЗ) молекула білка має серцевину, яка утво-
рює р-шар.
Вірус поліомієліту добуто в кристалічному вигляді. Інфекційні
властивості вірусу пов’язані з рибонуклеїновою кислотою.
Культивування. Поліовірус розмножується в культурі клітин ни-
рок мавп, ембріона людини, клітин Неіа, диплоїдних клітин людини та
іп. Вірус має виражену цитонатогеину активність. Цитопатнчна дія
супроводиться деструкцією й утворенням зернистості в інфікованих
клітинах.
Антигенна структура. Є три серотипи поліовірусів, які чітко різня-
ться в РН. У період епідемічних спалахів найчастіше виділяють тип 1
(65—95 %), на типи II і III припадає 5—35 %.
Резистентність. Поліовірус у воді при кімнатній температурі збе-
рігається понад 100 діб, у молоці — до 90 діб, у випорожненнях при
низьких температурах — понад 6 місяців, у стічних водах — кілька
місяців. Стійкнй до дії 0,5—І % розчинів фенолу, ефіру й детергентів,
363
протягом кількох тижнів зберігається при рН 3,8—8,5. Поліовірус чут-
ливий до розчинів хлорного вапна, хлораміну, формаліну, калію пер-
манганату, перекису водню; кип’ятіння і у-проміння вбивають його
дуже швидко.
Патогенність для тварин. При інтрацеребральному, інтраспіналь-
иому і піднкірному зараженні поліовіруси спричиняють поліомієліт
у шимпанзе, макак-резусів, зелених мавп.
До вірусу типу 2 чутливі бавовникові пацюки і білі миші. Тварини
захворюоть на 3—8-му добу після зараження, у них виникають кволі
паралічі м’язів кінцівок і спини.
Патогенез захворювання в людини. Джерело інфекції — хворі на
поліомієліт (з клінічно вираженими, стертими й атиповими формами)
і вірусоносії. Взажаоть, що захворюють тільки 10 % із тих людей,
що заразилися, причому лише в 0,1—1 % із них розвиваються паралі-
тичні форми поліомієліту.
Попіовірус виділяють хворі і перехворілі на поліомієліт протягом
2—7 тижнів, іноді ло 4 місяців. Збудник передається від хворого або
носія здоровим людям аліментарним шляхом, через брудні руки, за-
ражені харчові продукти і воду, предмети догляду, натільну і постіль-
ну білизну, а в літню й осінню пору — через мух. Можіива передача
за типом повітряно-краплинних інфекцій.
Потрапивши в організм людини, поліовірус спочатку розмножує-
ться в клітинах слизової оболонки носової частини глотки, кишок і
звідси з течією крові потрапляє у спинний мозок. Поліовірусу власти-
вий виражений нейтротропізм, він спричиняє дегенеративно-запаль-
ний процес у передніх рогах спинного мозку і сірій речовині підкір-
кових відділів головного мозку.
У слизу носової частини глотки і в мигдаликах збудник можна ви-
явити приблизно за добу до підвищення температури тіла і протягом
3—10 діб після початку захворювання.
За клінічним перебігом виділяють три фази поліомієліту: абортив-
ну, непаралітичну і паралітичну. Абортивні, стерті і безсимптомні
форми поліомієліту особливо часто трапляються в осіб, які оточують
хворого, що становлять найбільшу небезпеку як нерозпізнані джерела
інфекції.
На поліомієліт хворіють переважно діти віком від 4 місяців до
5 років. У період епідемічних спалахів захворювання може виникати
і в дітей старших 5 років, а також серед дорослих.
Тяжкість перебігу захворювання (розвиток необоротних паралі-
тичних форм) залежить і від стану організму хворого, його генетич-
них особливостей, зокрема від структури і функції гістолокусів
(НЬ-АЗ, НЬ-7А).
Імунітет постінфекційний, дуже напружений і довічний.
Можливі повторні випадки захворювання на поліомієліт, спричи-
нені вірусом іншого типу. Несприйнятливість пов’язана з наявністю
віруснейтралізуючих антитіл і клітинних факторів, які продукують
секреторні імуноглобуліни А. Гуморальний імунітет типоспецифічний.
Лабораторна діагностика здійснюється виділенням та ідентифіка-
цією вірусу, застосуванням РЗК, РН.
364
Досліджуваним матеріалом (випорожнення, змиви з носової ча-
стини глотки), суспендованим і обробленим антибіотиками для пригні-
чення бактеріальної мікрофлори, заражують культури клітин нирок
мавп, ембріона людини, клітин Неіа, тестикулярні культури та ін.
Репродукцію вірусу визначають за цнтопатичною дією, спостережува-
ною в культурі тканини. Ідентифікують поліовірус РН цитопатичної
дії в культурі тканини за допомогою специфічних сироваток крові.
При поліомієліті у крові хворих з’являються комплементзв’язуючі
і віруснейтралізуючі антитіла, наростання титру яких у динаміці
захворювання дає змогу не тільки поставити діагноз, а й визначити тип
поліовірусу.
Лікування охоплює застосування симптоматичних засобів і здій-
снення заходів для усунення контрактур, деформацій.
Профілактика. Специфічна профілактика поліомієліту здійснюється
за допомогою вакцин Солка і Сейбіна. Вакцина Солка — це інакти-
вований формаліном поліовірус типів І, II і III, який вводять внутріш-
ньом’язово. Вона спричиняє вироблення гуморальних антитіл і ство-
рює захист проти паралітичного поліомієліту, але не запобігає репро-
дукції вірусу в клітинах слизової оболонки шлунка і кишок. Вакцина
Сейбіна — жива вакцина, що містить атенуйовані, мутантні штами
усіх трьох типів поліовірусу. Її випускають у драже або в рідкому
вигляді і застосовують перорально. Вакцинні штами вірусу репроду-
куються в клітинах слизової оболонки кишок, спричиняючи вироблен-
ня не тільки гуморальних антитіл, а й копроантитіл (І^А), які запобі-
гають репродукції диких штамів вірусу поліомієліту в кишках.
Тепер у нашій країні застосовується жива вакцина, удосконалена
М. П. Чумаковим та О. О.Смородинцевим, яка забезпечує вироблення
імунітету у 85—95 % прищеплених. Її вводять дітям віком 3 місяці,
а ревакцинацію роблять у 1—2, 2—3 роки, 7—8 і 15—16 років.
Специфічна пасивна профілактика полягає у введенні імуноглобу-
ліну, крові батьків або сироватки крові здорових людей усім дітям
віком до 7 років, які контактували з хворими на поліомієліт, а за ме-
дичними показаннями — і дітям старшого віку. Строк дії пасивної
імунізації — три тижні.
Масова вакцинація поряд з іншими профілактичними заходами дала
змогу ліквідувати поліомієліт як епідемічне захворювання на тери-
торії нашої країни.
Ентеровіруси Коксакі, ЕСНО та інші
Захворювання, спричинені вірусами Коксакі (Сохзаскі-уігиз), уперше ви-
явили в 1948 р. Г. Долдорф і Г. Сіклс у містечку Коксакі (США) серед дітей,
уражених паралічами та іншими захворюваннями, що нагадують поліомієліт.
Віруси ЕСНО (Епіегіс суіораіЬойепіс Ьитап огрЬап уігиз) — кишкові цнтопа-
тогенні віруси людини відкрили Дж. Ендерс із співробітниками в 1941 р.
Морфологія. Розміри вірусів Коксакі — 28 нм, вірусів ЕСНО —
15—ЗО нм. Вони мають форму ікосаедра, кубічний тип симетрії.
Культивування. Віруси розвиваються в культурах тканин (клітини
нирок мавп і людини, фібробласти ембріона людини та ін.).
365
Антигенна структура. Віруси Коксакі поділяють на дві групи —
А і В, які об’єднують різні в імунологічному відношенні типи. До
групи вірусів Коксакі А входять 24 серотипи, В — 6 серотипів. Віруси
ЕСНО мають 34 серотипи, ентеровіруси людини — 5 серотипів
(з 68-го по 72-й).
Резистентність. Віруси Коксакі і ЕСНО мають відносно високу
стійкість, не втрачають життєздатності в замороженому стані при
температурі —70 °С, у гліцерині, в сироватці крові коня при кімнат-
ній температурі — протягом 70 діб, у холодильнику — понад рік.
Віруси Коксакі стійкі проти різних концентрацій водневих іонів,
зберігаються при рН 4,0—8,0 близько 24 год, при температурі 50—
55 С гинуть через 30 хв; стійкі до дії ефіру, 70 % етилового спирту,
5 % розчину лізолу, але луже чутливі до розчинів соляної кислоти
або формальдегіду.
Патогенність для тварин. Ентеровіруси Коксакі А при різних
шляхах введення спричиняють у мишей-сисунців кволі паралічі кін-
цівок і міопатію, віруси Коксакі В зумовлюють спастичні паралічі
у новонароджених мишей. Деякі типи вірусів Коксакі А можуть
уражувати дорослих мишей, бавовникових пацюків, мавп. Ентеровіру-
си ЕСНО не патогенні для мишей та інших тварин.
Патогенез захворювання в людини. Ентеровіруси Коксакі і ЕСНО
дуже поширені. їх виділяють хворі з випорожненнями і виділеннями
з носової частини глотки. Люди заражуються фекально-оральним
шляхом. Етеровіруси виявляють у стічних водах, їх можуть перено-
сити мухи. Захворювання найчастіше бувають улітку і рано восени.
Доведено носійство вірусів Коксакі. Уражуються люди будь-яких
віку і статі, переважно діти. Клінічна картина захворювання варіа-
бельна. Є кілька клінічних форм ентеровірусних інфекцій.
Асептичний серозний менінгіт (Коксакі А 4, 7, 9; Коксакі В 1—6; ЕСНО
2—9, 12, 14, 16 та ін.) характеризується підвищенням температури тіла, незду-
жанням, сильним головним болем, нудотою і болем у животі, ригідністю по-
тиличних м’язів, блюванням. Захворювання триває 1—3 тижні.
Триденна гарячка (Коксакі А 2, 4, 9, 16; Коксакі В 4; ЕСНО 9) проявля-
ється підвищенням температури тіла до 38—39 °С, болями в животі, горлі,
надочеревииній ділянці, гіперемією обличчя, зіва, ін’єкцією склер і кон’юнк-
тиви.
Епідемічна плевродинія, або борнхольмська хвороба (віруси Коксакі В1,
В5), характеризується гарячкою, що триває 2—4 доби, головним болем і болем
у горлі при ковтанні, у м’язах грудей, живота, кінцівок.
При герпангіні (Коксакі А 2, 6, 8, 10) бувають підвищення температури
тіла до 40,5 °С тривалістю 1—4 доби, втрата апетиту, утруднення ковтання
і біль у горлі. Слизова оболонка глотки гіперемійована і покрита чітко відме-
жованими папулами.
Для бостонської (епідемічної) екзантеми (віруси Коксакі А 2, 3, 4, 6, 8,
10, 16, ЕСНО 9) типовими ознаками є 3—4-денна гарячка, озноб, сильний го-
ловний біль у дорослих і біль у животі в дітей, висип на шкірі, що нагадує
внснп при краснусі, везикули і маленькі виразки на слизовій оболонці
глотки.
Асептичний міокардит (Коксакі В 2, 3, 4) спостерігається серед новонаро-
джених і дітей віком до 3 років. Летальність дуже висока — 70—80 %.
Серед дітей у родильних будниках можуть бути спалахи енцефаломіеліту
новонароджених (Коксакі В 3, 5) з тяжким перебігом, високою летальністю
й ентеровірусною діареєю.
366
Ентеровіруси (Коксакі й ЕСНО) можуть спричиняти гострий геморагічний
кон'юнктивіт (гни 70), недифтерійний круп, врило- і поліомівлітонодібні за-
хворювання (тип. 71).
Імунітет. І Іереиесепе захворювання залишає напружений типоспе-
цііфічний імунітет. Несприйнятливість формується і при латентних
формах епгеровірусних інфекцій, особливо серед старших вікових
груп населення.
Лабораторна діагностика. Для виділення вірусів досліджуваним
матеріалом (кал, змиви і мазок із зіва, кров, органи трупа, подрібнені,
суспендовані і оброблені анпібіотіїкамп для пригнічення бактеріаль-
ної мікрофлори) заражують клітинні культури (нирок мавп, амніону
людини, ІІеін, Нер-2 та іп.) і мншей-снсупців. Віруси Коксакі А,
В й ВСНО диференціюють щодо властивості розмножуватися тільки
в певних клітинних культурах, остаточну їх ідентифікацію роблять за
допомогою РН із сумішами типових сироваток крові і непрямого ме-
тоду ІФ.
Серологічну діагностику захворювань, спричинених вірусами Кок-
сакі й ЕСНО. проводять з парними сироватками крові. Наявність
антитіл у сироватці крові хворих визначають у РН, РЗК на клітин-
них культурах або мишах-снсунцях.
Лікування. Специфічної терапії не розроблено. Застосовують пато-
генетичні і симптоматичні засоби.
Профілактика. Розповсюдженню ентеровіруеннх захворювань спри-
яють перегрівання, переохолодження, інфікування бактеріальною
мікро|)’іороіо та іп., тому, щоб запобігти їм, треба здійснювати загальні
санітарно-гігієнічні заходи, як і при кишкових інфекціях.
Вірус гепатиту А
У 1983 р. збудник гепатиту А віднесений до родини Рісогпауігісіае
(еитеровірус 72).
Епідемічний, або вірусний, гепатит відомий дуже давно. Він описаний Гіп-
пократом ик заразна форма жовтяниці, а також іншими лікарями під різними
назвами: катаральна жовтяниця, паренхіматозний гепатит, ендемічна жовтяни-
ця та їй На Інфекційну природу цього захворювання указав С. П. Боткін
у 1891 р
Протягом багатьох років збудник вірусного гепатиту \ залишався нероз-
шифрованим. Виділено багато патогенних агентів, яким печінково припису-
вані сіІологічну роль при інфекційному гепатиті, І тільки останнім часом
добу ю достовірні дані.
Морфологія. Вірус гепатиту А виявляють у фекаліях, плазмі
кроні, жовчі і у вмісгі шлунка хворих на гепатит наприкінці інкуба-
ційного періоду і в гострій стадії захворювання. Вірус має сферичну
форму, розміри його 27—32 нм, тип нуклеїнової кислоти — одноннт-
кон.і РНК.
Культивування. Вірус гепатиту А розмножується в організмі пів-
....... мавп мармозет і шимпанзе; він довго зберігає*
ться в клітинах печінки.
367
Резистентність. Вірус гепатиту витримує нагрівання при темпера-
турі 60 °С протягом І—2 год, дію 10 % розчину ефіру, 0,5—1 % фе-
нолу, 1—2 % розчину хлораміну; довго зберігається на холоді, у фе-
каліях, сечі хворих і вірусоносіїв; при температурі 100 °С інактивує-
ться протягом 5 хв.
Антигенна структура. У вірусу гепатиту А виявлено 4 білки (УР1,
УР2, УРЗ і УР4). Відомий один вірусоспецифічний антиген, зв’язаний
з капсидними білками. Виявлено два серотипи вірусу, які не дають
перехресного імунітету.
Патогенність для тварин. Вірус гепатиту А патогенний для мавп.
Доведено, що він передається від людини мавпам шимпанзе. Вважа-
ють, що є природні вогнища захворювання в африканських країнах.
Патогенез захворювання в людини. Джерелами вірусу гепатиту А
є хворі люди й вірусоносії; особливо важливу епідеміологічну роль
відіграють хворі з легкими (безжовтяничними) формами захворювання.
Вірус є у випорожненнях, сечі й крові хворих. Механізм зараження
гепатитом А такий самий, як і при кишкових інфекціях. Збудник від
хворих і вірусоносіїв передається здоровим людям переважно фе-
кально-оральним шляхом — через інфіковані випорожнення і воду,
харчові продукти, а також через мух (механічні перенощики вірусу).
Описано значні епідемії, пов’язані з фекальним забрудненням джерел
водопостачання.
Передаватись вірус може й парентеральним шляхом при проведенні
щеплень і різних ін’єкцій. В окремих випадках зараження може від-
буватись повітряно-краплинним шляхом і при безпосередньому кон-
такті з хворими та вірусоносіями. Гепатит А спостерігається переваж-
но у дітей (понад 60 % усіх хворих); найвища захворюваність буває
в осінньо-зимову пору.
При гепатиті А інкубаційний період триває 15—45 діб, характери-
зується жовтяницею, болем у печінці, субфебрильною температурою
тіла. Загальна тривалість захворювання Р/а—2 місяці. Є стерті форми
гепатиту.
Імунітет. В результаті перенесеного вірусного гепатиту А, а та-
кож інапарантної інфекції виробляється міцний і тривалий постінфек-
ційний імунітет. У крові перехворілих на гепатит А є антитіла, які
можуть знешкоджувати вірус. Істотна роль у резистентності організ-
му до вірусу гепатиту А належить неспецифічним факторам —інтерфе-
рону, комплементу та ін.
Лабораторна діагностика охоплює виявлення вірусного антигену
у випорожненнях за допомогою ІЕМ, ІФА й РИГА, дослідження пар-
них сироваток крові для визначення збільшення титрів антитіл, імунну
електронну мікроскопію для виявлення вірусу в досліджуваному ма-
теріалі.
Лікування. Специфічної терапії немає.
Профілактика вірусного гепатиту А полягає в ізоляції хворих,
нагляді за особами, які контактували з ними, дезинфекції у вогни-
щах, знезаражуванні випорожнень, мокротиння хворих і реконвалес-
центів. Дітям віком від 3 місяців до 10 років з профілактичною метою
вводять імуноглобулін, що сприяє зниженню захворюваності і змен-
368
шенню тяжкості перебігу гепатиту. Тривалість імунітету — від 6 мі-
сяців до року. Ведуться дослідження для виготовлення живої вак-
цини з атенуйованих штамів вірусу, а також генно-інженерної вак-
цини.
Астровіруси
До родини пікорнавірусів віднесені астровіруси, виділені в 1975—1976 рр.
із калу дітей, хворих на гастроентерит. їх виявляли і в тварин (велика рогата
худоба, олені, свині, вівці, собаки, коти). Розміри астровірусів 26—ЗО нм.
Вони округлої форми, близько 10 % дрсліджених частинок мають зіркоподібну
конфігурацію (5- або 6-променеву). Віруси містять одиониткову РНК з моле-
кулярною масою 2,7 • 10е. За попередніми даними, астровіруси близькі до
ентеровірусів і риновірусів.
У новонароджених і грудних дітей астровіруси спричиняють гостру
діарею.
Культивують їх у трипсинізованих клітинах нирок ембріона людини,
виявляють методом імуноелектронної мікроскопії.
Захворювання, що спричиняються астровірусами, зареєстровані у Велико-
британії, Франції, ФРН, Норвегії, Австралії, а також у нашій країні.
Виявлення сироваткових антитіл методом непрямої імунофлюоресценції
свідчить про значне розповсюдження астровірусу серед населення. У дітей
віком до 6 місяців антитіла виявляли в 45 %, а віком 5—10 років — у 75 % ви-
падків.
Віруси ящуру
У 1897 р. Ф. Леффлер і П. Фрош довели, що вміст везикул (пухирців) прн
ящурі проходить через бактеріальні фільтри, зберігаючи свою вірулентність.
Вірус належить до роду АрЬіоУІгиз родини Рісогпауігідае.
Морфологія. Розміри вірусу 22—ЗО нм; він утворює еозинофільні внутріш-
ньоклітинні включення.
Культивування. Вірус розмножується в культурах клітин епітелію язика
телят і великої рогатої худоби і в культурах нирок тварин; він інтенсивно
репродукується у мозковій тканині 7—10-денннх мишей.
Антигенна структура. Збудник ящуру серологічно неоднорідний. Відомі
сім серотипів вірусу ящуру: А, О, С, Азія 1, 8АТ-1, 8АТ-2, 8АТ-3, кожен із
них має кілька антигенних варіантів. В Європі поширені в основному віруси
типів А, О, С, в Африці 8АТ-1, 8АТ-2, 8АТ-3.
Резистентність. Вірус ящуру стійкий до дії факторів зовнішнього середо-
вища. У виділеннях хворих тварин він зберігається протягом 2 місяців, на
шерсті їх — до 2 тижнів; у м’ясі інфікованих тварин — 2—3 доби. Чутливий до
дезинфікуючих речовин, формаліну і лугів.
Патогенність для тварин. Ящур — висококонтагіозне інфекційне захво-
рювання великої рогатої худоби, овець, кіз, свиней.
Патогенез захворювання в людини. Зараження людини відбувається через
вміст везикул, молоко, слину, сечу, різні предмети догляду за тваринами. Вірус
проникає через травний канал або ушкоджені слизові оболонки та шкіру.
Хворіють головним чяном діти, які споживають сире молоко від корів, хворих
на ящур. Вірус з місця первинної локалізації проникає в кров і спричиняє
стан вірусемії, афтозні ураження слизової оболонки порожнини рота і шкіри.
Лабораторна діагностика. Експрес-діагностика спрямована на виявлення
специфічного антигену у мазках із вмісту везикул, афтозних уражень у РІФ
з гомологічними сироватками крові до ендемічного серотипу вірусу. Щоб
виявити ящур, вмістом везикул або виділеннями з афт (виразок) заражують
морських свинок у шкіру підошви. Через 1—4 доби у ннх підвищується темпе-
ратура тіла, з’являються везикули на підошві зараженої кінцівки і слизовій
оболонці порожнини рота. Виділення вірусу роблять на мишах-сисунцях і в
культурах тканин, для ідентифікації застосовують реакцію імунофлюорес-
ценції.
369
Серологічну діагностику здійснюють за допомогою РН, РЗК з парними си-
роватками крові хворих, узятої з інтервалами 4—6 діб, і серотипом вірусу
ящуру, який циркулює в регіоні.
Імунітет тнпоспецнфічний, пов’язаний з наявністю віруснейтралізуючих
ан гитіл.
Лікування. Рекомендуються щадна дієта, обробка виразок 4 % розчи-
ном срібла нітрату. Прн гнійних ускладненнях призначають пеніцилін, поло-
скання рота розчинами етакридину лактату або калію перманганату
Профілактика забезпечується додержанням санітарно-гігієнічних правил
(кип’ятіння молока, захист рук і обличчя при догляді за тваринами). У вете-
ринарній практиці застосовують протнящурну інактивовану вакцину, яку вво-
дять одноразово великій рогатій худобі у загрозливих щодо ящуру господар-
ствах.
КАЛЬЦНВІРУСИ
Кальцнвіруси (родина СаІісіУІгідае) мають сферичну або поліедральну
форму, розміри їх 20—30 нм. Капснд складається з 32 капсомерів, РНК віру-
сів одноннткова, несегментована. Дуже чутливі до нагрівання, прн температу-
рі 50 °С інактнвуються проіягом ЗО хв. Спричиняють захворювання у свиней
(везикулярна екзантема), ластоногих (спонтанні аборти у морських левів і ко-
тиків), котів (респіраторні інфекції). У людини кальцнвіруси (вірус Норфольк)
виявляли при гострому гастроентериті у дітей і дорослих.
РИНОВІРУСИ
Вірусна природа заразної нежиті (контагіозний риніт, соттоп
соИ) була відома більш як 60 років тому, але культивування вірусу
стало можливим тільки в 1960 р. Риновіруси виділено віл хворих на
гостру нежить, у первинних культурах клітин нирок ембріона людини
і диплоїдних клітин людини, а також у культурах нирок мавп.
Морфологія, культивування, антигенна структура. Віруси віднесе-
ні до роду КЬіпоуігиз. Розміри їх 25—ЗО нм. Відомі дві групи ринові-
русів — Н і М. Штами Н (Ьитпап) розмножуються тільки в культурі
клітин нирок ембріона людини, штами М (тпопкеу) — у культурі клі-
тин нирок мавп. Виділено 115 серотипів риновірусів. Риновірус серо-
типу 14 схожий на вірус поліомієліту.
За розмірами, стійкістю до ефіру, непатогенністю для мишей-си-
сунців та інших тварин риновіруси схожі на віруси ЕСНО, за меха-
нізмами передачі — на віруси, які уражують верхні дихальні шляхи.
Патогенез захворювання в людини. Риновіруси локалізуються
в клітинах епітелію слизової оболонки носа, спричиняючи заразний
нежить, а в дітей — бронхіт і бронхопневмонію. Люди з низьким вмі-
стом антитіл у крові сприйнятливі до інфекції, яку спричиняють рино-
віруси; при високому титрі антитіл — стійкі.
Лабораторна діагностика грунтується на виділенні вірусів із
виділень слизової оболонки носа зараженням культури клітин нирок
ембріона людини або диплоїдних клітин людини з наступною ідентифі-
кацією їх за допомогою РН. Використовують також метод визначення
вірусного антигену в РІФ.
Лікування і профілактика. Специфічної терапії не розроблено. За-
стосовують інтерферон. Планується виготовлення комбінованої вак-
цини проти великої групи респіраторних захворювань.
370
ТОГАВІРУСИ
До родини То^ауігісіае входять 4 роди (АІрЬауігиз, Еіауіуігиз,
КиЬіуігиз, Резііуігиз) і 90 видів вірусів. Назву То£ауігісІае (від лат.
(о§а — плащ) дано вірусам, які мають ліпопротеїнову оболонку, що
складається з ліпідів клітин хазяїна і вірусоспецифічних поліпепти-
дів. Тогавіруси сферичної форми, розміром 40—70 нм, геном скла-
дається з однониткової РНК, віріон має ізометричний нуклеокапсид.
Усі альфавіруси і більшість флавірусів є в природі в організмі бага-
тьох хребетних і передаються членистоногими (зоонози). У людей
вони спричиняють тяжкі захворювання — кліщовий, японський енце-
фаліт, жовту гарячку, різні види геморагічної гарячки та ін.
Вірус кліщового енцефаліту
Захворювання було виявлене в 1934 р. А. Г. Пановнм, збудника йогр від-
крив у 1937 р. Л. О. Зільбер із співробітниками. Питання епідеміології і при-
родної вогнищевості цієї інфекції вивчені Є. Н. Павловськнм із співавторами.
Вірус кліщового енцефаліту належить до родини То£ауігісІае,
роду Еіауіуігиз.
Морфологія. Вірус має сферичну форму, розмір його 45 нм. Ну-
клеокапсид покритий ліпопротеїновою оболонкою з ворсинками.
Геном є однонитковою РНК.
Культивування. Збудник репродукується в різних тканинних куль-
турах, у курячому ембріоні та організмі білих мишей.
Вірус кліщового енцефаліту має цитопатичну дію на клітини нир-
кової тканини ембріона свині, а також на деякі перещеплювані куль-
тури тканин, спричиняє явища дегенерації цитоплазми, пікнозу і за-
гибелі ядер клітин. У багатьох видах тканинних культур активно
розмножується без цитопатичної дії.
Антигенна структура. Є кілька різновидів вірусу кліщового енцефа-
літу. Штами вірусу, виділені від хворих людей і перенощиків у різних
районах нашої країни і в країнах Європи, мають деякі відмінності
в антигенній структурі. На вірус кліщового енцефаліту імунологічно
схожі віруси шотландського кліщового енцефаліту, омської геморагіч-
ної гарячки та ін.
У суперкапсидній оболонці і нуклеокапсиді є структурні білки
(УЗ, VI, У2). Основний функціональний білок оболонки — глікопро-
теїд УЗ, який виконує типоспецифічну функцію, стимулює продукцію
віруснейтралізуючих антитіл і антигемаглютинінів.
Резистентність. У 50 % гліцерині вірус зберігається 70 діб, в 1 %
розчині лізолу — 3 хв, в ефірі й ацетоні—3 доби; від дії температури
60—70 °С гине через 10—15 хв.
Патогенність для тварин. У природних умовах джерелами вірусу є
їжаки, кроти, полівки, бурундуки, білки і споріднені з ними види
гризунів, зайці, дрозди, рябчики та багато інших диких тварин і пта-
хів (близько 130 видів), які на енцефаліт не хворіють, алеє тривалими
вірусоносіями. Переиощики вірусу кліщового енцефаліту — іксодові
371
кліщі (Іхосіез регзііісаіиз, Іхогіеч гісіпиз), в яких виявлено і трансова-
ріальний шлях передачі.
Кліщовий енцефаліт характеризується природною вогнищевістю.
Зони природних вогнищ охоплюють великі території Росії, Каїахстану,
Білорусії, України та ін. У природних вогнищах 10—12 % кліщів
заражені вірусом енцефаліту.
Із піддослідних тварин до вірусу кліщового енцефаліту сприйнят-
ливі миші при інтрацеребральному, підшкірному й інтраназальному
зараженні, а також мавпи.
Патогенез захворювання в людини. Кліщовий енцефаліт — зооноз не
захворювання, яке передається від тварин людині через укуси кліщів
і молоко кіз, інфікованих вірусом Людина, хвора на кліщовий енце-
фаліт, не є джерелом інфекції. Збудник, потрапляючи в організм,
спочатку розмножується в підшкірній клітковині, а потім проникає
в кров, виникає вірусемія. Вірус характеризується тропізмом щодо
центральної нервової системи (ядра мозкового стовбура і передні
роги шийної частини спинного мозку), розвивається менінгоенцефало-
мієліт. Летальність становить 1,5—26 %. У 20—25 % хворих наста-
ють органічні ураження центральної нервової системи. Кліщовий
енцефаліт проявляється гарячкою, сонливістю, що змінюється безсон-
ням, порушенням чутливості, рухової здатності, менінгіальними яви-
щами; до його ускладнень належать атрофічні паралічі м’язів пояса
верхніх кінцівок, шиї. Захворювання супроводиться розвитком алер-
гії сповільненого типу.
Поряд з типовою менінгіальною й вогнищевими формами кліщового
енцефаліту в людей, що живуть у районах природних вогнищ інфек-
ції, досить часто спостерігається безсимптомний перебіг.
Імунітет. Природна несприйнятливість пов’язана з наявністю
в організмі людей термолабільних інгібіторів, утворенням клітинами
інтерферону та іншими захисними механізмами.
Після перенесеного захворювання виробляється стійкий імунітет,
який зберігається протягом усього життя. В ендемічних щодо кліщо-
вого енцефаліту районах він може набуватися в результаті стертої
безсимптомної форми інфекції.
Лабораторна діагностика проводиться вірусологічним і серологіч-
ним методами. Для виділення вірусу заражують досліджуваним мате-
ріалом (кров, спинномозкова рідина, тканина мозку померлого від
енцефаліту) білих мишей і клітинні культури. Ідентифікують вірус за
допомогою РН із стандартною типовою сироваткою на мишах і клі-
тинних культурах; широко використовують також РІФ, ІФА.
Антитіла, що утворюються в процесі захворювання, виявляють
за допомогою РН. РЗК, РГГА, РИГА, РІФ, ІФА, РІМ, які ставлять
з парними сироватками крові хворого, взятими з інтервалом 2—3тижні.
Лікування полягає у внутрішньом’язовому введенні протягом 2—
Здіб або через добу 3—6 мл протиенцефалітного людського імуноглобу-
ліну. Застосовують також сироватку «Диаферм», вироблену гіперіму-
нізацією коней, та інтерферон.
Профілактика. Неспецифічна профілактика охоплює заходи для
захисту людей від нападу іксодових кліщів, знищення кліщів на свій-
372
ських тваринах, кип’ятіння молока. Специфічну профілактику здій-
снюють введенням інактивованої культуральної вакцини проти клі-
щового енцефаліту. Добрі результати дає індивідуальна профілакти-
ка— введення протиенцефалітного імуноглобуліну в кількості 1,5—
З мл.
Вірус японського енцефаліту
У 1934 р. М. Хаяші виявив вірусну природу японського енцефаліту. Захво-
рювання трапляється в Японії, Кореї, Китаї, Таїланді, на о. Тайвань, в на-
шій країні (у безлісних малозаселених районах з великою кількістю озер
і боліт). Захворювання характеризується сезонністю (серпень — вересень).
Збудник захворювання належить до роду Еіауіуігиз.
Морфологія, культивування, резистентність. Розміри вірусу 40—
50 нм. Вірус розмножується в курячих ембріонах і культурах клітин,
маючи цитопатичну дію. Характеризується слабкою стійкістю до дії
високих і низьких температур та дезинфікуючих речовин.
Патогенність для тварин. До вірусу японського енцефаліту чут-
ливі білі миші, пацюки, хом’яки, а також мавпи, деякі свійські тва-
рини і птиця.
Патогенез захворювання в людини. Збудник передається через уку-
си комарів Сиіех і Аесіез. Носіями вірусу є пацюки, багато свійських
і диких тварин, пгахи з родини горобиних.
Японський енцефаліт характеризується ураженням центральної
нервової системи, переважно мозкового стовбура і базальних ядер
кори великого мозку. Летальність дуже висока, в Японії вона дося-
гала 60 %, під час епідемічних спалахів на Далекому Сході (Примор-
ський край) — 25—53 %.
В результаті перенесеного захворювання виробляється стійкий
імунітет. Ускладнень у вигляді паралічів, які бувають при кліщовому
енцефаліті, не виявлено.
Крім тяжких форм захворювання, можливі легкі і навіть безсим-
птомні, які супроводяться підвищенням титру антитіл у крові людей.
В ендемічних вогнищах відбувається невпинна циркуляція вірусу
серед тварин і комарів.
В організмі заражених комарів вірус зберігається протягом усього
життя; доведена трансоваріальна передача збудника захворювання
комарами. При температурі 27—ЗО °С в о.рганізмі комара накопичує-
ться велика кількість вірусів; при температурі нижче 20 °С розвиток
вірусу затримується.
Діагноз грунтується на клінічних, епідеміологічних і лаборатор-
них даних.
Лабораторна діагностика проводиться виділенням вірусу з крові,
лімфи хворих і тканини мозку померлих від енцефаліту людей з на-
ступною ідентифікацією збудника в РН, РЗК, РГГА.
Лікування полягає в застосуванні гіперімунної кінської сироватки
крові або гамма-глобуліну, а також імуноглобуліну, добутого з крові
людей, які живуть у природних вогнищах японського енцефаліту.
373
Профілактика забезпечується заходами для захисту людей від укусів
комарів і проведенням імунізації культуральною вакциною, інактиво-
ваною формаліном.
Вірус омської геморагічної гарячки
Збудника відкрив М. П. Чумаков із співавторами в 1947 р.
Морфологія. За морфологією, біологічними й антигенними власти-
востями близький до збудника кліщового енцефаліту, шотландського
енцефаліту овець та деяких інших вірусів. Належить до роду Еіауі-
уігиз. Розмір вірусу 40 нм. Має велику адаптаційну здатність до різ-
них органів і тканин.
Патогенність для тварин, культивування. До вірусу чутливі мав-
пи, морські свинки, коти, полівки, ондатри, білі миші, які легкозара-
жуються при будь-якому способі введення. Культивується в організмі
білих мишей, яких заражують у мозок, а також у курячих ембріонах.
У перещеплюваних культурах тканини (Неіа, СМЦ та ін.) вірус має
слабку цитопатичну дію.
Патогенез захворювання в людини. Імовірним резервуаром збудни-
ка в природних умовах є мишовидні гризуни та дикі тварини. Пере-
нощик — кліщ Оегтасепіог рісіиз; він може бути й резервуаром,
оскільки вірус передається трансоваріально. Природна вогнищевість
доведена в лісостепових районах Омської області.
Людина заражується при укусі кліщів. Захворювання може пере-
даватись також повітряно-пиловим і аліментарним шляхами.
Лабораторна діагностика грунтується на виділенні вірусу та іден-
тифікації його в РН і РЗК, а також на виявленні наростання титру
антитіл при дослідженні парних сироваток крові.
Лікування проводять специфічною сироваткою.
Профілактика охоплює здійснення заходів для захисту людей від
укусів кліщів та імунізацію вакциною проти кліщового енцефаліту.
Близькі до вірусу кліщового енцефаліту віруси Повассан (Канада),
Лангат (Малайзія), шотландського кліщового енцефаліту (Велико-
британія), хвороби К’ясанурського лісу (Індія).
Вірус жовтої гарячки
Припущення про інфекційну природу захворювання висловив у 1881 р.
кубінськнй лікар К- Фінлей. Вірус жовтої гарячки відкрили в 1901 р. амери-
канські дослідники У. Рід, Дж. Кералл. Він належить до роду Ріауіуігиз.
Морфологія. Вірус кулястої форми, розміром 40 нм.Геном єоднонитковою
РНК, яка покрита білком і зовнішньою оболонкою, що містить ліпіди й ліпо-
протеїди. __
Культивування. Збудник розвивається у мозковій і тестикуляр'ній ткани-
нах білих мншей і мавп макак-резусів, у культурі тканини нирок мавп або
свині, а також в культурі подрібненого мишачого ембріона та у курячому ем-
бріоні. Вірус проявляє цитопатичну дію.
Резистентність. Вірус стійкий до дії низьких температур, зберіїається
у 80 % гліцерині, на льоду до 3 місяців, у замороженому стані — більше року,
у висушеному вигляді — 12 років. Чутливий до нагрівання — гине при темпе-
ратурі 55—65 °С протягом 10 хв; дуже швидко руйнується від дії 0,5 % розчи-
ну формаліну та інших дезинфікуючих речопни
374
Патогенність для тварин. У природних вогнищах збудник жовтої гарячки
паразитує в організмі понад 27 видів тварин (мавпи, опосуми, армадили та ін.).
З експериментальних тварин сприйнятливі європейські їжаки, білі миші,
макаки-резуси та ін. Вірус передається від однієї тварини іншій через комарів
із роду Аебез, що живуть у дуплах дерев або на поверхні грунту тропічних
лісів. Інфіковані комарі стають заразними через 4—18 діб і зберігають вірус
протягом усього життя (70—116 діб).
Патогенез захворювання в людини. При антропонозній (міській) епідеміч-
ній формі захворювання вірус жовтої гарячки передається здоровій людині
від хворих людей через комарів А. ае£уріі, А. зітрзопі, А. саіориз, А. аГгі-
сапз. Основним перенощнком вважають А. аебуріі. Xі
Ендемічною (сільською) природно-вогнищевою формою жовтої гарячки
люди заражуються від диких тварин і гризунів при укусах комарів. Захво-
рювання трапляється переважно серед осіб, які працюють у лісі. Збудник про-
никає в клітини регіонарних лімфатичних вузлів, потім надходить у кров,
печінку, селезінку, кістковий мозок. У крові людей вірус виявляють протягом
перших 5 діб захворювання, надалі він локалізується у лімфатичних вузлах.
Вірус спричиняє дегенеративне, некротичне й жирове переродження клітин
печінки, нирок, селезінки, зумовлює крововилив у внутрішні органи (шлунок,
плевра, слизова оболонка кишок). Основними клінічними ознаками жовтої
гарячки є жовтяниця, геморагії та інтенсивна альбумінурія.
Інкубаційний період триває 3—6 діб. Захворювання починається раптово
і має циклічний перебіг. Можуть спостерігатись безснмптомні, доброякісні,
злоякісні і блискавичні форми захворювання. При швидко прогресуючій формі
настає кома печінкового або уремічного характеру, що призводить до леталь-
ного кінця. Можливі ускладнення у вигляді абсцесів, паротиту, пневмонії,
множинних уражень шкіри, іноді гангрени, міокардиту.
Імунітет пов'язаний з наявністю в крові віруснейтралізуючнх антитіл,
які утворюються на 5-ту добу захворювання. З часом титр антитіл знижується
і зберігається на низькому рівні багато років після видужання. Люди, які
перехворіли на жовту гарячку, набувають стійкого довічного імунітету.
Лабораторна діагностика охоплює виділення вірусу від хворих,визначення
специфічних антитіл у крові хворих і перехворілих, гістологічні дослідження
печінки у випадках з летальним кінцем. Для виділення вірусу заражують білнх
мишей, у яких через 7—20 діб розвиваються симптоми енцефаліту. Для вияв-
лення наростання титру антитіл ставлять РН, РГГА, РЗК з парними сироват-
ками крові хворого.
Лікування. Специфічної терапії немає. В разі приєднання вторинної бак-
теріальної інфекції призначають антибіотики.
Профілактика. До загальних заходів належать винищування комарів,
захист від ннх, дезннсекція всіх видів транспорту, що прибуває з ендемічних
районів. Найефективнішим заходом профілактики є активна імунізація живою
вакциною. Для щеплень використовують два вакцинних штамн: американський
(штам 17), виділений М. Тайлором при паснруванні вірусу жовтої гарячки
в культурі тканини, і французький (штам Дакар), добутий при внутрішньомоз-
ковнх пасажах вірусу на білих мишах. Завдяки широкому застосуванню для
імунізації французького штаму вакцини захворюваність на жовту гарячку
в Екваторіальній Африці майже повністю ліквідована. Вогнища жовтої гаряч-
ки є в Південній Америці і Західній Африці. У Європі, Азії і Австралії випад-
ків жовтої гарячки не зареєстровано. У нашій країні застосовується вакцина
із штаму 17Д, добута пасируванням на курячих ембріонах. Нею вакцинують
людей, які виїжджають в країни, де є природні вогнища жовтої гарячки.
Вірус гарячки денге
Збудник відкритий в 1907 р. П. Ашберном і Ч. Крейгом; належить до роду
РІауіуігиз. Гарячка денге ендемічна для районів з тропічним і субтропічним
кліматом.
Морфологія. Розміри вірусу 30—40 нм, він має чотири антигенних типи.
375
Культивування. Збудник гарячки денге розмножується в курячих ембрі-
онах, культурах тканнн нирок мавп, ембріона людини, хом’яків і перещеплю-
ваних лініях клітин Неіа, КВ, ВНК-21 та ін.
Резистентність. Прн температурі —70 °С і в висушеному стані вірус збе-
рігається протягом 5 років, у сироватці крові хворих при кімнатній температу-
рі залишається життєздатним близько 2 місяців. Під дією світла, ультрафіоле-
тового випромінювання та 0,05 % розчину формаліну збудник гине дуже швид-
ко, нестійкий до нагрівання У слабких розведеннях жовчі (І : 10, 1 : 5) ін-
вктнвується протягом 5 хв. <
Патогенність для тварин. Для лабораторних тварин вірус малопатогенннй.
Адаптований вірус спричиняє загибель білих мишей, у яких розвиваються па-
ралічі. У морських свинок настає вірусемія. При зараженні макак-резусів
звичайно спостерігається легка форма захворювання.
Патогенез захворювання в людини. Вірус має токсичну дію. Він уражує
нейрони головного і спинного мозку, спричиняє дегенеративні зміни клітни
печінки, ннрок, серця, геморагічні ураження центральної нервової снстемн,
м’язів, шкірн, ендокарда, перикарда, слизової оболонки шлунка, кншок, оче-
ревини. Глибокі порушення настають у дрібних кровоносних судинах (набу-
хання ендотелію, пернваскулярний набряк та інфільтрація одноядернимн клі-
тинами).
Джерело інфекції — хворі иа гарячку денге. Зараження настає при укусі
комарів А. аеяуріі, А. аІЬорісіиз та ін., які, насмоктавшись крові хворого,
через 8—12 діб прн температурі зовнішнього середовища 22 °С можуть переда-
вати вірус. При температурі 16 °С збудник в організмі комара не розвивається.
Зараженість комарів зберігається протягом 174 діб.
Прн класичній гарячці денге інкубаційний період становить 2—15 діб,
у середньому 5—8 діб. Захворювання досить часто розпочинається з раптового
ознобу, головного болю, сильного болю в суглобах і м’язах, у ділянці очних
яблук, підвищення температури тіла (39—40 °С). Обличчя багрове, склери
ін’єктовані, у деяких хворих з’являється внсип у вигляді еритеми. Через
1—4 доби настає ремісія. Температура тіла різко знижується, з’являється
аалнвний піт. Після цього розвивається другий приступ, що характеризується
підвищенням температури тіла й основними симптомами першого приступу.
На тілі з’являється макуло-папульозний або скарлатнноподібннй внсип, який
тримається не більше 3—4 діб. Загальна тривалість захворювання 4—5 діб.
Прн геморагічній гарячці денге у клініці переважають явища геморагіч-
ного діатезу — носова, легенева, шлунково-кишкова кровотеча, петехіальннй
геморагічний висип: на 3—7-му добу захворювання може розвинутись шок.
Вважають, що патогенез захворювання пов’язаний із сенсибілізацією організ-
му людини вірусом гарячки денге. Геморагічний синдром — відповідь орга-
нізму на повторне інфікування його вірусом.
Імунітет. Після перенесеного захворювання виробляється несприйнятли-
вість тривалістю до 2 років.
Лабораторна діагностика. Розпізнавання захворювання грунтується на
клінічних, епідеміологічних і лабораторних даних. У перші дні захворювання
вірус виділяють із крові, якою заражують мншей-снсунців (у мозок); виявля-
ють наростання тнтру специфічних антитіл у парних сироватках за допомогою
Лікування. Специфічної терапії не розроблено, застосовують симптоматичні
васобн; прн вторинних бактеріальних ускладненнях призначають антибіотики.
Профілактика гарячки денге зводиться до ізоляції хворих, виключення
доступу до ннх перенощнка, винищування комарів. Щоб запобігти занесенню
інфекції в країни, не ендемічні щодо цього захворювання, здійснюють каран-
тинні заходи. Специфічна профілактика ще в стадії розробки.
Альфавіруси
Представники роду АірИауігиз спричиняють захворювання, що мають пере-
біг з явищами енцефаліту, гарячкою і нерідко з висипом. Віріони їх сферичної
форми, розміром 60—70 нм; молекулярна маса 5 • 10е. Нуклеокапсид містить-
ся в ліпопротеїновій оболонці, геном — однониткова лінійна РНК.
376
Патогенні для людини шість видів альфавірусів (Ньонг-ньонг, Чи-
кунгунья та ін). Перенощнкамн є комарі родів Аедез ае§урІі, АпорЬеіез
і Сиіех.
У нашій країні із альфавірусів поширені віруси Кизилагач, Снндбіс та
ін. Вірус, антигенно спорідненим з вірусом Синдбіс, є збудником карельської
гарячки, що супроводиться висипом і набуває хронічного перебігу. Перено-
щики — комарі Сиіех, Аедез, Мапзопіа, АпорЬеіез, Наето§о£и8 та ін. Епіде-
мічним спалахам серед людей передують епізоотії серед диких птахів, потім
серед синантропних і сільськогосподарських тварин.
Вірус краснухи
Збудник краснухи виділений у 1961 р. П. Паркменом із співробітниками
та Т. Уеллергом і Ф. Навої.
Вірус належить до родини То£ауігіс1ае, роду КиЬіуігиз.
Морфологія, резистентність. Віріони мають сферичну форму, діа-
метр їх 50—70 нм. Вірус інактивується при температурі 56 °С протя-
гом 60 хв. Довго зберігається при температурі 3—4 °С, особливо в за-
мороженому стані. Чутливий до ультрафіолетового випромінювання,
формаліну, ефіру.
Культивування. Вірус репродукується в цитоплазмі клітин нирок
зелених мавп, кролів, хом’яків, у культурі клітин амніону людини,
а також перещеплюваних клітин ВНК-21 або РК.
Патогенність для тварин. Вірус краснухи патогенний для макак-ре-
зусів, кролів, хом’яків, курячих ембріонів.
Патогенез захворювання в людини. Джерелом зараження є хворі
на краснуху в продромальному періоді і в перші 5 діб після появи
висипу. Зараження настає повітряно-краплинним шляхом. Найбільш
сприйнятливі діти віком 2—14 років. Описано епідемічні спалахи
серед військовослужбовців США.
Інкубаційний період триває 15—21 добу. З місця первинної лока-
лізації вірус проникає в кров, лімфатичні вузли, кишки, плаценту.
Найхарактерніші ознаки захворювання — висип і запалення лімфа-
тичних вузлів. У період появи висипу температура тіла підвищується
до 38 аС. У дорослих краснуха має тяжчий, ніж у дітей, перебіг.
Спостерігаються висока температура тіла (39 °С), сильний головний
біль, біль у м’язах шиї. Як ускладнення можуть розвиватися енцефа-
літ, енцефаломієліт. У вагітних жінок вірус краснухи спричиняє різні
аномалії розвитку плода (мікроцефалія, глухота, пороки серця, ката-
ракта та ін.).
Імунітет, що розвивається в результаті перенесеного захворю-
вання, стійкий і довічний. Несприйнятливість формується і при ати-
пових формах краснухи або інфікуванні без наступного захворювання
(стан персистирування), в результаті чого у більшості населення віком
понад 15 років є імунітет.
Лабораторна діагностика здійснюється виділенням вірусу із
слизової оболонки верхніх дихальних шляхів, крові, сечі, калу при
зараженні ними після відповідної обробки чутливих культур тканин
(РК 13, Уего, 8ігк та ін.). Ідентифікують виділений вірус за допомогою
РН, РЗК, РГГА. Антигени вірусу краснухи в цитоплазмі клітин
37’
виявляють методом РІФ. Серологічну діагностику краснухи роблять
аа допомогою РГГА, РН, РІФ, ІФА та РІЛ.
Лікування симптоматичне — введення імуноглобуліну з донор-
ської крові, хоч ефективність його невисока.
Профілактика полягає в ізоляції хворих протягом 5 діб від почат-
ку появи висипу, запобіганні контакту вагітних жінок з хворими на
краснуху. Усім вагітним жінкам, які контактували з хворими, для
запобігання ураженню плода рекомендується введення імупоглобулі-
ну. У США і Бельгії проводять активну імунізацію проти краснухи
живою вакциною, яка має високу ефективність; вакцину такого роду
випробовують і в нашій країні.
БУНЬЯВІРУСИ
До родини Випуауігісіае (назва походить від місцевості Буньямве-
ра в Африці) входять 4 роди вірусів: Випуауігиз, РЬІеЬоуігиз, К’аігіуі-
ги$, Ііикиуігиз.
Більш як 50 буньявірусів спричиняють у людини різні види
гарячки, енцефаліт та ін.
Віріони цієї родини мають сферичну форму, покриті ліпопротеїно-
вою оболонкою; розміри їх 90—100 нм. Нуклеокапсид фрагментова-
ний. Антигенна структура складна.
Природними хазяїнами є багато видів хребетних тварин і члени-
стоногі. Буньявіруси розмножуються в клітинних культурах тканин
хребетних і птахів; передаються членистоногими (комарі, кліщі).
До складу родини входять віруси кримської геморагічної гарячки,
москітних гарячок та іп.
Вірус кримської геморагічної гарячки
Збудник виділений у Криму в 1944 р. М. 1. Чумаковим із крові хворих
людей і кліщів. Пізніше було доведено, що вірус поширений у ряді країн
Європи (Болгарія, Угорщина, Югославія), Азії (південь нашої країни, Іран,
Індія, Пакистан), Афрнкн (Заїр, Нігерія, Уганда, Кенія, Сенегал). Останнім
часом захворювання дістало назву кримсько-конголезької геморагічної гаряч-
ки, а схожі віруси віднесені до групи иайробівірусів.
Морфологія. Вірус належить до родини Випуауігісіае, роду ІІики-
уігиз. Має сферичну форму, розміри його 90—105 нм.
Культивування. Вірус погано розмножується в культурах тканин,
проявляє цитопатичну дію тільки після адаптації до них. Для куль-
тивування використовують клітинні культури нирок свині, мавп,
печінки свині та ін.
Патогенність для тварин. До вірусу сприйнятливі коти, білі ми-
ші, молоді пацюки, кролі і макаки-резуси.
Патогенез захворювання в людини. Джерелом інфекції є дикі тва-
рини (зайці, кози, мишовидні гризуни), велика рогата худоба. Пере-
нощики — кліщі роду Нуаіотпа (понад 20 видів). Зараження людини
настає при укусах кліщів або внаслідок контакту з кров’ю хворої
людини або тварини.
378
Захворювання в людини проявляється гарячкою, порушенням
кровообігу з множинними крововиливами у внутрішні органи і по-
рожнини тіла (шлунка і кишок), вогнищевими крововиливами в легені
і геморагічним висипом на шкірі.
Діагностика робиться на основі клінічних та епідеміологічних да-
них. Лабораторна діагностика утруднена. Використовують методи
внутрішньомозкового зараження мишей-сисунців, сисунців білих
пацюків, виділення вірусу на чутливих культурах тканини, ідентифі-
кацію вірусу за допомогою РІФ, РЗК, РН. Для серологічної діагно-
стики застосовують ті реакції, які дають змогу виявити антитіла після
перенесеного захворювання.
Лікування і профілактика. Хворим на кримську геморагічну гаряч-
ку вводять гамма-глобулін або сироватку крові реконвалесцентів. Щоб
запобігти захворюванню, здійснюють заходи для захисту від нападу
кліщів і потрапляння крові хворого на шкіру і слизові оболонки.
Вірус флеботомної (москітної) гарячки
Збудника виявили Р. Дерр, К. Франк і С. Тауссіг у 1909 р.
Морфологія, культивування. Вірус входить до родини Внпуауігі-
дае, роду СІикиуігиз. Розміри його ЗО—40 нм. При температурі 56 °С
руйнується через 10 хв, у гліцерині зберігається близько 2 тижнів.
Лабораторні тварини до вірусу нечутливі. Вірус можна вирощувати
на хоріоналантоїсній оболонці курячих ембріонів, у культурі
тканин.
Патогенез захворювання в людини. Перенощиком захворювання є
РНІеЬоіотнз рараіазіі. У тілі москіта вірус проходить певний цикл
розвитку, передається трансоваріальним шляхом. Москіти стають
заразними на 7-му добу після укусу ними хворої людини. Нападають
на людей уночі, вдень ховаються в закритих приміщеннях, руїнах,
щебені. Личинки москітів зберігаються в темних вогких місцях, бага-
тих на органічні речовини, у норах тварин.
У країнах, розташованих на узбережжі Середземного моря, в Ін-
дії, Африці, Центральній і Південній Америці, а також на півдні на-
шої країни захворювання описане під назвою «гарячка папатачі».
Воно характеризується підвищенням температури тіла, болем у ділян-
ці лоба і очних ямок, у м’язах, палінням в очах, гіперемією кон’юнк-
тиви. Захворювання триває 3 доби, після чого протягом кількох діб
спостерігаються слабкість, розбитість. Москітна гарячка закінчується
видужанням.
Імунітет. Несприйнятливість наростає повільно. Після повторної
інфекції формується стійкий імунітет.
Лабораторна діагностика москітної гарячки схожа на діагностику
кримської геморагічної гарячки.
Профілактика. Боротьба з москітами здійснюється застосуванням
інсектицидів і загальносанітарними заходами (очистка дворів і жит-
лових приміщень від сміття). В результаті планомірних і активних
заходів захворювання иа москітну гарячку в нашій країні зведені до
поодиноких випадків.
379
АРЕНАВІРУСИ
До родини Агепауігісіае входять дві групи вірусів, об’єднаних у рід Агепа-
уігив (11 видів). До першої групи включені збудники лімфоцитарного хорю-
меиінгіту, гарячок Ласса і Мозамбік, до другої — 8 вірусів, виділених у Північ-
ній і Південній Америці (Хунін, Мачупо та ін )
Аренавіруси мають переважно округлу форму, покриті твердою оболон-
кою, розміри їх 1І0—130 нм. Легко інактнвуються ефіром, хлороформом,
дезоксихолатом натрію, а також при нагріванні і під впливом кислого середо*
вища, довго зберігаються при температурі —70 °С.
До аренавірусів чутливі гризуни, особливо новонароджені білі миші,
хом’яки та ін. Віруси добре розмножуються в культурах клітин нирок афри-
канських зелених мавп (Уего), Неіа, фібробластах курячого ембріона та ін.
Вірус лімфоцитарного хоріоменінгіту
Вірус відкрили К. Армстроиг і Р. Ліллі в 1934 р. Належить до родини
Агепауігісіае.
Морфологія, резистентність. Вірус має зовнішню оболонку; усередині ві-
ріона є електронно-оптично тверді гранули.
Збудник інактивується при температурі 56 °С протягом 20—60 хв, руй-
нується під дією ефіру, мертіолату; у гліцерино-буферній суміші при темпера-
турі 4 °С зберігається кілька місяців, висушений у вакуумі — кілька років
Культивування, патогенність для тварин. Вірус культивується в тканин-
них культурах і курячих ембріонах. У клітинах культур його виявляють за
допомогою флуоресцентних антитіл у цитоплазмі, іноді — в мембрані ядра.
При електронно-мікроскопічному дослідженні на поверхні цитоплазми видно
зрілі віріони з гранулами. Цитопатична дія яскраво виражена в клітинах
ембріонів мишей, курей, амніону ембріона людини і культурі тканини КВ
Із лабораторних тварин до вірусу сприйнятливі морські свинки, пацюки,
мавпи.
Патогенез захворювання в людини. Люди заражуються від мишовидних
гризунів (сірі миші, полівки, лісові миші та ін.) через перенощнків — гама-
зових кліщів (АПодегтапуззцз зц^пиіпецз, Ьуролуззиз Ьасоїі), а також аеро-
генним шляхом при вдиханні висохлих виділень мишей.
Інкубаційний період триває 7—13 діб, потім температура тіла підвищуєть-
ся до 39 °С і більше, з’являються сильний головний біль, озноб, блювання;
иа 3—4-ту добу захворювання уражуються мозкові оболонки (хоріоменінгіт,
менінгоенцефаліт). Перебіг захворювання може бути схожим на грип. При за-
хворюванні вагітних вірус може проникати через плаценту і спричиняти ви-
родливості плода.
Імунітет постінфекційний, пов’язаний з наявністю гуморальних факторів.
Лабораторна діагностика проводиться зараженням білих мишей спинно-
мозковою рідиною або іоюв’ю хворих у перші дні захворювання. Ідентифіку-
ють вірус за допомогою РЗК, РН і РІФ з використанням еталонних сироваток.
Для виявлення антитіл у парних сироватках крові ставлять РЗК, РН, РІФ,
Лікування симптоматичне; специфічної терапії не розроблено.
Профілактика. Основними заходами для запобігання захворюванню є дера-
тизація і старанний контроль за лабораторними тваринами.
Вірус Ласса
Вірус виділений у 1970 р. Дж. Казалсом і С. Баклі від хворих на гарячку
в населеному пункті Ласса (Нігерія). Аналогічне захворювання виявлено і в
інших африканських країнах.
Морфологія. Вірус Ласса належить до родини АгепауігіЗае. Діаметр вірі-
онів 110—130 им, у зовнішній оболонці їх є ліпіди.
Культивування, патогенність для тварин. Вірус культивується на пере-
щеплюваній лінії клітин Уего, проявляючи на 4-ту добу цитопатичну дію. Ла-
380
бораториі тварини (білі миші, морські свинки) при внутрішньомозковому
і виутрішньоочеревинному зараженні гинуть.
Патогенез захворювання в людини. Джерелом і резервуаром вірусу в при-
роді є африканські патоки і миші. При внутрішньолікарняннх спалахах збуд-
ник захворювання передається від хворих людей здоровим повітряно-краплин-
ним шляхом або через інфіковані предмети. Після інкубаційного періоду
тривалістю 7—17 діб з’являється озноб, підвищується температура тіла, вини-
кають головний біль, кволість, сонливість. Спостерігаються міозит, виразковий
фарингіт, міокардит, пневмонія, плеврит та ін. Летальність висока — 30 —50 %.
У тих, хто перехворів, утворюються специфічні антивірусні антитіла, які
зберігаються в організмі протягом 5—7 років.
Лабораторну діагностику здійснюють виділенням вірусу на культурі клі-
тин Уего. Ідентифікують вірус за допомогою непрямої РІФ і РН. Серологічна
діагностика дає змогу поставити ретроспективний діагноз, оскільки антитіла
в РЗК виявляються більш ніж через 50 діб від початку захворювання; титр їх
низький (1 : 16). Найефективніші непряма РІФ, ІФА і РІА, вони бувають
позитивними на 7—10-ту добу захворювання.
Лікування проводять сироваткою крові реконвалесцентів, при ускладнен-
нях застосовують напівсинтетичні препарати тетрацикліну.
Профілактика полягає в захисті житла, предметів домашнього вжитку,
продуктів харчування від забруднення сечею і випорожненнями гризунів, не-
ухильному додержанні санітарного режиму в лікарнях, нагляді за особами,
які контактують з хворими на гарячку Ласса; здійснюють також дератизаційні
ваходи.
КОРОНАВІРУСИ
До родини Согопауігісіае входять збудники гострих респіраторних вірус-
них інфекцій і гастроентериту в людини, тварин і птахів (13 видів).
Морфологія. Віріони мають округлу, овальну форму, діаметр їх 50—220 нм;
оточені гліколіпідною оболонкою, покритою іззовні виступами, що склада-
ються з тонкої шийки і грушовидної головки, які надають віріону форми со-
нячної корони під час сонячного затемнення. Репродукуються в цитоплазмі
клітин, вивільняються брунькуванням через ендоплазматичну сітку.
Патогенез захворювання в людини. Респіраторні віруси передаються по-
вітряно-краплинним шляхом. Джерелами інфекції є хворі з гострою і прихо-
ваною формами захворювання.
У дорослих виникає ураження верхніх дихальних шляхів з явищами
загального нездужання, головним болем, ознобом, катаральним ринітом і рино-
фарингітом із значними слизистим або слизисто-гнійним виділеннями. Захво-
рювання звичайно ие супроводиться підвищенням температури тіла. У дітей
основним симптомом є профузиа нежить, спостерігаються запалення слизової
оболонки носової частини глотки, кашель, гарячка, головний біль. У дорослих
і в дітей захворювання нерідко ускладнюється пневмонією.
Іноді коронавірусна інфекція поєднується з іншими захворюваннями вірус-
ної і бактеріальної етіології; мішана інфекція більш тяжка і триваліша, особ-
ливо у дітей
Лабораторна діагностика полягає у виявленні антигену в клітинах епітелію
слизової оболонки иоса і носової частини глотки за допомогою флуоресціюючих
антитіл; виділенні вірусу в органних культурах; виявленні наростання титру
антитіл у парних сироватках крові.
Лікування симптоматичне; дітям вводять гамма-глобуліи дорослих до-
норів.
Профілактика така сама, як і при грипі та іишнх гострих респіраторних
вірусних захворюваннях.
Кишкові коронавіруси спричиняють гастроентерит, особливо серед обслу-
говуючого персоналу лікарень і дитячих закладів.
381
РЕОВІРУСИ
Родина Кеоуігігіае (гео — гезрігаїогу епіегіс огрЬапз) охоплює три роди ві-
русів — Реоуігиз, Роіауігиа, ОгЬіуігия.
Морфологія. У реовірусів зовнішньої оболонки немає, капсид складається
з 92 капсомерів; у арбовірусів і ротавірусів він налічує 39 капсомерів. Віріони
мають сферичну форму, Гх діаметр 60 —80 нм, мають двониткову РНК.
Резистентність. Віруси відносно стійкі до дії фізичних і хімічних факторів,
зберігаються при температурі 4 °С протягом 2 місяців. Інактивуються від дії
70 % етилового спирту і 3 % розчину формаліну.
Культивування. Реовіруси розмножуються на культурі клітин нирок мавп,
фібробластів ембріона людини, а також на перещеплюваних лініях клітин
СМЦ та ін.
Антигенна структура. До роду Кеоуігцз входять три серотипи вірусів
ссавців, усі вони мають гемаглютинуючі властивості щодо еритроцитів корів,
баранів і людини груп \ АВ, О (Н), В. Розмножуються в перещеплюваних
і первинних клітинних культурах.
Патогенність для тварин. Реовіруси патогенні для дикнх і лабораторних
мишей, великої рогатої худоби, мавп, птахів. Містять тнпо- і групоспецифіч-
ні антигени, які ідентифікують у РН, РЗК.
Патогенез захворювання в людини. Реовіруси поширені повсюдно, пере-
даються повітряно-краплинним, контактним шляхами, через травний канал.
У дітей реовіруси спричиняють ураження дихальних шляхів, центральної нер-
вової системи, гастроентерит («жирний» понос), екзантему, гепатит. У дорослих
реовірус типу 1 виявляється у верхніх дихальних шляхах при респіраторних
захворюваннях. У дітей реовіруси виділені з крові, тканини легень і мозку.
Лабораторна діагностика робиться виділенням вірусу із слизу носової ча-
стини глотки, випорожнень і серологічною ідентифікацією за допомогою РЗК,
РГГА. РН.
Лікування симптоматичне.
Профілактика полягає у здійсненні звичайних санітарно-протиепідемічних
заходів.
РОТАВІРУСИ
Віруси роду Коіауігиз (лат. гоіа — колесо) відкрив у 1973 р. Т. Флюетт.
Морфологія. В електронному мікроскопі ротавіруси нагадують дрібні
коліщатка з товстою втулкою, короткими спицями і чітко окресленим обідком.
Капсид має двошарову структуру, оточений псевдооболоикою, яка, ймовірно,
складається з компонентів клітин хазяїна. Розміри вірусів 60—65 нм.
Антигенна структура. Розрізняють 4 серотипи ротавірусів, з яких най-
частіше трапляється тип 2. Віріони покриті подвійним капсидом, що містить
типоспецифічний антиген, який має гемаглютинуючу активність, і рецептори,
відповідальні за інфекціозність. Внутрішня оболонка капсида складається із
32 трубкоподібних капсомерів, що несуть групоспецнфічні антигени, спільні
для всіх ротавірусів. Геном ротавірусів складається із двониткової РНК-
Культивування. Ротавіруси розмножуються в епітелії слизової оболонки
верхньої третини тонкої кишки; після адаптації вони можуть репродукуватися
в культурі тканини (первинні або вторинні культури клітин нирок зелених
мавп).
Резистентність. Ротавіруси стійкі до ефіру і детергентів, зберігають свою
життєздатність при температурі 50 °С протягом години, швидко знешкоджують-
ся при температурі 100 °С, а також дії всіх дезинфікуючих препаратів.
Патогенез захворювання в людини. Джерелом інфекції є хворі з гострою
і безсимптомною формами захворювання. Зараження настає фекально-оральним
шляхом. Найчастіше уражуються діти грудного і дошкільного віку. Діти стар-
шого віку і дорослі хворіють рідко. У середніх широтах ротавірусний гастроен-
терит найчастіше буває взимку, хоч окремі випадки і групові захворювання
можуть реєструватися протягом усього року.
382
Ротавірусн спричиняють у дітей гострий гастроентерит (дитячий понос):
збудникам властивий тропізм до епітелію слизової оболонки травного каналу.
Інкубаційний період звичайно триває 24 юд (2—4 доби), потім підвищується
температура тіла, з'являються блювання і понос. Ротавірусп дуже поширені.
У 90 % дітей у 6-річному віці виявляють антитіла до ротавірусів ^1цМ).
В результаті перенесеного захворювання несприйнятливості не виникає,
очевидно, х зв’язку з наявністю великої кількості серотипів, між якими немає
перехресного імунітету.
Лабораторне діагностика зводиться до електронно-мікроскопічного дослі-
дження випорожнень 1 виявлення в них вірусних частинок, в також визначення
антигену за допомогою РІА й ІФА. Як ретроспективний метод використо-
вують РЗК для внянлення наростання титру антитіл, а також РН, РГГА.
Лікування симптоматичне. Дуже важливим є усунення порушень водно-
сольового балансу.
Профілактика полягає в додержанні гігієнічного режиму при догляді за
хворими в інфекційних 1 неінфекційннх стаціонарах. Специфічної терапії 1
профілактики не розроблено.
ОРБІВІРУСН
Віруси містять капсомери, які мають форму кілець (лат. огійі — кільце).
Капсид Ікосаедральної симетрії. Рід орбівірусів охоплює 16 серологічних
підгруп.
Орбівірусн розмножуються в організмі комах І передаються ними росли-
нам або тваринам. У людини орбівірусн спричиняють легкі гарячкові аахво-
рюваиня, а в тварин тяжкі Інфекції: хворобу синього язика овець, африкан-
ську хворобу коией та Ін.
Віруси Марбурга та Ебола
Хворобу Марбурга було виявлено в 1967 р. у ФРН і Югославії. Люди
□вразилися в результаті контакту з тканинами зелених мавп, доставлених
з Уганди. Виявлено випвдкн передачі вірусу від хворих людей здоровим (від
госпіталізованих хворих обслуговуючому медичному персоналу). Випадки
вахворюваїїия з високою летальністю (понад 80 %) були в Південній Африці,
Кенії, Судані.
Вірус Марбурга, виділений від хворих людей, схожий аа морфологічними
властивостями нв вірус Ебола (назву дано за місцем його виявлення поблизу
річкн Ебол), виділений у 1976 р. в Заїрі.
Морфологія. Віруси Марбурга та Ебола віднесені до родннн Рііоуіґідає.
Вони поліморфні, мають паличкоподібну І ниткоподібну форму, складаються
б однониткової РНК, оточеної рнбопротеїновою оболонкою. Розміри їх 790—
970 нм.
Резистентність. Віруси чутливі до ефіру, формалІпу, фенолу, детергентів,
Інактивуюгься при температурі 66 °С протягом 60 хв.
Патогенез захворювання в людини. Природного резерпуара вірусів не ви-
явлено. Людина і мавпи, очевидно, є проміжними хазяїнами, для яких абудннкп
хвороб Марбурга та Ебола дуже вірулентні. Із експериментальних тварин
чутливі до вірусів морські свинки. Зараження настає в результаті тісного І три-
валого контакту з хворими. Кров хворих людей дуже ааразив. Вірус довго
зберігається в слині, сечі, спермі хворих.
Інкубаційний період у людини триває 3 — 10 діб. Захворювання харакігрн-
дується високою температурою тіла, головним болем, блюнвииим, болем
у м’язах, геморагіями, поносом, летаргією. Виникають крововиливи а шлу-
нок, кишки, сечові органи, розвиваються гепатит, ііаіікреатні, орхіт, міо-
кардит, пневмонія. Летальність височи (ЗО- 80 %). Смерть настає иа 8—ІО-ту
добу.
Лабораторна діагностика поляїає в проведенні віруголоїІчних дослі-
джень у добре оснащених лабораторіях я додержанням суворою режиму. Ві-
рус виділяють зараженням досліджуняіінм матеріалом морських свіишк або
ЗВЗ
культури клітин, а також виявленням специфічних вірусиях антигенів. Крім
того, проводять електронну мікроскопію патологічного матеріалу, ставлять серо-
логічні реакції (РЗК, РІФ, РН).
Лікування полягає у відновленні порушеного водно-електролітного обмі-
ну і функції нирок, переливанні хворим плазми крові реконвалесцеитів.
Профілактика в стадії розробки.
ЗБУДНИКИ ПОВІЛЬНИХ ІНФЕКЦІЙ
Деякі інфекційні захворювання людини і тварин характеризуються
хронічним прогресуючим перебігом і нерідко призводять до леталь-
ного кінця. Виділено й ідентифіковано агенти, які спричиняють під-
гострий склерозуючий паненцефаліт, прогресуючу багатовогнищеву
лейкоенцефалопатію, а також збудники куру, кортикостріоспінальної
дегенерації (хвороби Крейтцфельда — Якоба), вілюйського еннефало-
мієліту та інших захворювань.
Фактори, що зумовлюють розвиток інфекцій з повільним перебі-
гом, остаточно не з’ясовані. Гадають, що ці захворювання можуть
виникати в результаті порушення імунологічної реактивності, яка су-
проводиться слабкою продукцією антитіл або виробленням антитіл,
не здатних нейтралізувати вірус. Можливо, що інфекційні агенти,
які довго персистирують в організмі, спричиняють проліферативні
внутрішньоклітинні процеси, наслідком яких є розвиток захворювань
з повільним перебігом у людей і тварин.
Із багатьох запропонованих гіпотез про природу збудників повільних
інфекцій заслуговують иа увагу дані американських учених, які відкрили
інфекційні властивості у пріонів —дуже дрібних білкових агентів, шо в 100 раз
менші від найдрібніших вірусів. Молекули пріонів утворюють скупчення (аг-
регати) у вигляді паличок завдовжки 100—200 нм і діаметром 10—20 нм; вони
не містять нуклеїнових кислот (ДНК або РНК), мають антигенні властивості.
В експерименті на мишах і хом’яках пріони спричиняють інфекційний процес.
Припускають, що гени, які кодують реплікацію пріонів, містяться в геномі
клітин хазяїнів.
Підгострий склерозуючий паненцефаліт розвивається в результаті
корової інфекції, що спричиняється дефектним варіантом вірусу кору.
Захворювання характеризується різноманітними симптомами, зумов-
леними ураженням нервової системи (розростання волокнистої глії в бі-
лій речовині мозку, демієлінізація і жирове переродження нервових
клітин). Спостерігаються головний біль, запаморочення, дратливість,
зниження пам’яті та інтелекту. У молодих людей через кілька місяців
на тлі кахексії внаслідок ураження життєво важливих органів настає
летальний кінець. В осіб зрілого й похилого віку захворювання має
хронічний перебіг з ремісіями. У сироватці крові хворих накопичу-
ються специфічні протикорові антитіла в титрах до 1 : 16 000.
Прогресуюча багатовогнищееа лейкоенцефалопатія супроводиться
ураженням мієлінотворних клітин центральної нервової системи,
в результаті чого порушується її моторна функція. Збудник виявляють
у тканині мозку при електронній мікроскопії. Як правило, прогре-
суюча багатовогнищева лейкоенцефалопатія розвивається у людей з
імунодефіцитними станами при лімфогранулематозі, міліарному ту-
384
беркульозі, лейкемії, системному червоному вовчаку та ін. Нерідко
захворюзання виникає в результаті імунодепресивної терапії, напри-
клад при пересаджуванні внутрішніх органів. У сироватці крові хво-
рих виявляють антитіла до паповавірусів.
Куру — ендемічне захворювання людини, характеризується тяж-
кими розладами функції центральної нервової системи. Трапляється
на островах Нової Гвінеї і пов’язане з канібалічними ритуалами місце-
вих племен. Інфекційну природу захворювання доведено завдяки
успішному відтворенню його у шимпанзе введенням суспензії голов-
ного мозку померлих від куру людей. Прн гістологічному дослідженні
секційного матеріалу від людей і мавп виявлено губкоподібне ура-
ження сірої речовини мозку з дегенерацією нервових клітин.
Інкубаційний період триває 5—10 років, після чого з’являються
перші ознаки захворювання — порушення ходи, збудження, швидка
стомлюваність, потім приєднуються розлади координації рухів.
Смерть настає через 1—2 роки.
Кортикостріоспінальна дегенерація, або хвороба Крейтцфельда—
Якоба, характеризується дегенеративними змінами в центральній
нервовій системі, які призводять до розвитку судорог, атаксії, пору-
шення зору, чутливості та ін.
Віл ойський енцефаломієліт проявляється ураженням центральної
нервової системи. Трапляється в корінних жителів Якутії. Захворю-
вання може мати гострий і хронічний перебіг з ураженням окорухових
нервів, психічними розладами. Хронічна форма триває від кількох
місяців до 1—4 і навіть 10 років. Смерть настає від виражених трофіч-
них порушень і висхідного уросепсису.
До повільних інфекцій відносять також природжену краснуху, розсіяний
склероз, аміотрофічний боковий склероз і хворобу Паркінсона.
Інфекції з повільним перебігом спостерігаються серед тварин (скрепи,
вісна, меді, алеутська хвороба норок, інфекційний хоріоменінгіт, трансмісивна
енцелофалопатія норок, інфекційна анемія коней та ін.).
РЕТРОВІРУСИ
Характерною властивістю ретровірусів, що належать до родини
Кєігоуігісіае, є їх здатність до зворотної транскрипції — синтезу
ДНК на матриці віріонної РНК. Цей процес зумовлений наявністю у їх
складі ферменту зворотної транскриптази (ревертази). Родину Кеіго-
уігісіае поділяють на три підродини: Опсоуігіпае, Еепііуігіпае і 8ри-
шауігіпае.
Онковіруси
Найчисленнішу за видовим складом підродину Опсоуігіпае пред-
ставляють РНК-вмісні онкогенні віруси. Виділяють три типи он-
ковірусів — С, В і В. Найбільш поширені онковіруси типу С (їх ви-
явлено у рептилій, птахів, ссавців, а також у людини); тип В виявлено
у мишей і морських свинок, тип В — у мавп.
13 1-44Б
385
Онковіруси типу С є збудниками лейкозів і сарком у птахів, ми-
шей, котів, мавп, великої рогатої худоби і, можливо, інших
тварин.
Морфологія. Онковіруси сферичної форми, покриті ліпопрогеїно-
вою оболонкою, що має ворсинки. Діаметр вірусів 80—і00 нм Усере-
дині віріона міститься спіральний нуклеопротеїд. Геном у вигляді
однониткової РНК, складається із двох копій, містить 4 капсидних
поліпептиди і 2 глікопротеїдні оболонки
Культивування. Онковіруси культивують на тваринах і клітинних
культурах. Процес репродукції має кілька етапів: адсорбцію, про-
никнення, депротеїнізацію й утворення віріонів. Заражені клітини
не гинуть, а трансформуються: утворюються вогнища проліферу ючих
клітин з перетворенням їх у пухлинні.
Однією з умов трансформації клітин вважають інтеграцію геному
опкогенного вірусу в геном клітини з наступною транскрипцією (утво-
рення вірусспецифічиої РНК) і трансляцією (синтез вірусспецифічип X
білків), потім утворюється пухлинна клітина.
Механізм вірусного онкогенезу. Трансформація нормальних клі-
тин у пухлинні відбувається в результаті інтеграції вірусного і клі-
тинного геномів. Інтеграція геному РНК-вмісних онкогенних вірусів
є складним процесом, вякомубере участь фермент (зворотна транскрип-
таза РНК-геномних вірусів). За допомогою транскриптази на мат-
риці РНК вірусу синтезується комплементарна їй ДНК, яка набуває
кільцевої форми й інтегрується в ДНК клітини.
У складі закріпленого вірусного геному є гени, що називаються
опкогенами. Гадають, що онкогени РНК-вмісних пухлинотворних
вірусів — це регуляторні клітинні гени, які випадково включаються
до складу вірусного геному. У нормі їх діяльність регулюється клі-
тинними механізмами. Ця регуляція порушується, якщо гени функці-
онують у складі вірусного геному. Онкогени вірусів спричиняють
утворення пухлинного білка, що спотворює нормальну регуляцію
поділу клітин, і клітина трансформується в пухлинну.
У трансформованих клітинах порушений процес передачі інформа-
ції з їх поверхні на ядерний апарат, збільшений синтез ДНК, втра-
чається здатність до контактного гальмування, настає різка зміна ад-
гезивних властивостей, посилюється мітотична активність, що при-
зводить до інтенсивного росту й розмноження ЦИХ клітин.
Трансформація нормальних клітин у пухлинні може бути спричи-
нена клітинними онкогенами без участі вірусів. У стані спокою клі-
тинні онкогени нешкідливі, але під впливом канцерогенів (іонізуюче
випромінювання, хімічні речовини та ін.) вони активуються і можуть
призводити до перетворення нормальної клітини в пухлинну. Гада-
ють, що онкогени онковірусів є копіями клітинних генів. Запропоно-
вано позначати їх одним і тим самим символом, вірусні онкогени ма-
лими літерами (у-аЬ1), а клітинні — великими (У-АВЬ).
Вірусний геном реплікується і функціонує як складова частина
геному клітини. Припускають, що в місці з’єднання геномів відбу-
вається розрізання, а потім зшивання кінців вірусної і клітинної
ДНК.
386
Гіпотеза клітинного онкогенезу дуже переконливо підтверджується від-
криттям мобільних генів (див. с. 97). Якщо мобільний генетичний елемент
при переміщенні виявиться поряд з онкогеном, останній може включити його
в активну роботу щодо трансформації нормальних клітин у пухлинні.
Такі гени було виявлено в ДНК деяких видів ссявців, птахів 1 мушки дро-
зофіли І названо протоонкогенвмн. Відомо близько 20 різних протоонкогс-
нів. Вони локалізовані в кожній клітині людини І тварин.
Під впливом активуючих факторів у протоонкогепів може змінюватись
структура, в результаті чого вони стають онкогенамн, які перетворюють нор-
мальну клітину в пухлинну.
Трансформація нормальної клітини в пухлинну відбувається внаслідок акти-
вації не одного, а двох і більше оикогеиів.
Імунітет. Організм людини наділений могутнім природним імуні-
тетом, який може запобігати трансформації нормальних клітин у пух-
линні. Несприйнятливість до злоякісних пухлин зумовлюється клі-
тинними й гуморальними захисними реакціями макроорганізму.
Захисні реакції організму проти пухлин здійснюються Т-лімфоцп-
тами й антитілами. Накопичення Т-кілерів, сенсибілізованих до пух-
линних клітин, спричиняє руйнування цих клітин або припинення
їх росту і розмноження. В осіб, уражених імунологічною недостат-
ністю, а також у підданих імунодепресивній терапії, частість злоякіс-
них пухлин зростає в ЗО—50 раз; у дітей з первинними імуподефіцпт-
ними станами, спричиненими ушкодженням Т-спстеми, ймовірність
утворення пухлин підвищується в 100 раз.
Превентивна властивість проти пухлинних антитіл не завжди про-
являється позитивно, іноді антитіла закривають антигенні детермі-
нанти пухлинних клітин і роблять їх недоступними для ціітопатичиої
дії Т-кілерів, настає блокування їх розпізнавання і відторгнення. Ве-
лике значення в забезпеченні протипухлинного захисту має усунення
імунологічної толерантності.
Імунологічна діагносіика новоутворень у людини грунтується на
виявленні пухлинних антигенів або антитіл. Деякі форми злоякісних
пухлин (первинний рак печінки, рак прямої кишки та ін.) розпізна-
ють виявленням ембріональних антигенів — а-фегоііротеїпів. Роз-
роблено метод індикації антигенів за допомогою моиоклоиальиііх
антитіл (див. с. 156).
Лікування. Використовують моноклональпі антитіла, навантажені
високотоксичними для клітин речовинами — імупотоксипамії або
цитостатиками, іцо мають властивість ушкоджувати лише пухлинні
клітини і тим самим припиняти злоякісний процес.
Вірус Т-клІтинного лейкозу
Особливу групу у підродині опковірусів становлячі» Тлімфотроипі
ретровіруси людини, ПТЬУ (Питай Т-сеІІ Іушріїоігоріс уіпі?»), від-
криті В. Галло в 1978 — 1981 рр. Це перші віруси, для яких доведена їх
пряма участь у виникнеппі злоякісних пухлин у людини. До них на-
лежать збудники Т-клігинпого лейко іу дорослих (ПТІ.У I) І волос лі о*
клітинного лейкозу (ПТІ.У-2).
Доведено, що віруси НТІ.У-І І ПТЬУ-2 спричиняють ірапс(|юрми-
цію нормальних клііии у пухлинні порушенням реї улягорпнх проце-
сів під впливом білка Р24, який кодується іепом 1а(.
ЗК/
ІЗ-
Вірус Імунодефіциту людини (ВІЛ)
ВІЛ спричиняє у людей захворювання, що дістало назву ВІЛ-ія-
фекції, або синдрому набутого імунодефіциту (СНІД).
Перші випадки ВІЛ-інфекціі виявлено й описано в 1981 р у США серед
гомосексуалістів Через рік захворювання було зареєстроване в Європі і иа інших
континентах Тепер захворюваність иа ВІЛ-іифекнію і віруслносійство уже
є в більшості країн світу.
Збудника виділили з культури Т-лімфоцитів хворих иа СНІД у 1983 р.
незалежно один від одного Л. Монтаньє (Франція) і Р. Галло (США), і його
було позначено як ЬАУ (ІутрЬагіепораІЬу аззосіаіед уігиз — вірус, що спри-
чиняє лімфаденопатію) або НТЬУ-З.
За рішенням Міжнародного комітету з таксономії вірусів у 1986 р.
збудник ВІЛ-інфекціі дістав назву НІУ (Ьитап іттипосІеГісіепсу
уігиз), в українській транскрипції — ВІЛ (вірус імунодефіциту
людини).
Морфологія. ВІЛ — типовий ретровірус, що має складну будову
і хімічний склад (рис. 101).
Віріон ВІЛ сферичної форми, діаметр його 100—120 нм. Геном ві-
русу складається з двох ниток РНК, асоційованої з ферментом зво-
ротною транскриптазою. Зовнішня оболонка віріона містить подвій-
ний шар ліпідів і глікопротеїдів.
Геном ВІЛ складається із 9213 нуклеотидів і містить 7 різних ге-
нів. Ген епу кодує білки оболонки (£Р 41, £Р 120),ген — білки
серцевини (р!7, р24, р!5), ген рої — зворотну транскриптазу, ендо-
нуклеазу і вірусоспецифічну протеазу, а гени іаі, (гз/агі — регулятор-
ні бііки; функції генів 3 ог( і зог до кінця не з’ясовані.
На кінцях геному ВІЛ розташовані ділянки ЬТК, що складаються
з 638 пар нуклеотиіів, які регулюють експресію вірусних генів
і швидкість синтезу РНК та білків.
Рис. 101. Морфологія і структура ві-
ріона ВІЛ:
І —зворотна транскрнптаза, 2 — РНК; З —
іпідна мембрана.
Культивування. ВІЛ репроду-
кується в нормальних лімфоцитах,
може розмножуватись в організмі
мавп шимпанзе з розвитком у них
захворювання. Пошуки добування
культур клітин показали можли-
вість використання фітогемаглю-
тиніну, який стимулює виділення
фактора росту Т-клітин (інтерлей-
кін 1). Активовані Т-клітини секре-
тують інтерлейкін 2, під впливом
якого вдається підтримувати роз-
множення їх протягом тривалого
часу; Т-лімфоцити кілерів диферен-
ціюються на два підкласи зрілих
лімфоцитів: Т4 і Т8, які виконують
різні функції в імунній системі.
Резистентність. Нагрівання ві-
русовмісних рідин при температурі
56 °С протягом ЗО хв знешкоджує
388
ВІЛ. Часткова інактивація вірусу відбувається під впливом іонізую-
чого випромінювання в дозі 2500 грей (2,5 • ІО6 рад), а також ультра-
фіолетового випромінювання. Збудник гине від дії ацетону, ефіру,
етанолу та інших дезинфікуючих речовин.
Антигенна структура. ВІЛ характеризується генетичною варіабель-
ністю. Виявлено генотипи ВІЛ-1, ВІЛ-2. Збудник ВІЛ-інфекції має
багато різних варіантів структурних білків, що різняться рядом вла-
стивостей: одні штами уражують Т-клітини, інші — макрофаги. В ор-
ганізмі однієї й тієї самої людини, зараженої вірусом, може бути вод-
ночас кілька штамів вірусу, дуже схожих між собою за генетичною
структурою.
Патогенність для тварин. Добуті дані дають змогу припустити,
що джерелом виникнення ВІЛ-інфекції є Т-лімфотропний вірус
(НТЬУ-3), який паразитує на африканських зелених мавпах.
Його було виділено від мавп у 1985 р. М. Ессенсом і Ф. Канкі.
Доведено, що НТЬУ-НІ непатогенний для свого звичайного хазяїна.
Відкрито групу проміжних форм вірусу, які можуть спричиняти за-
раження в людини. У крові людей виявлено антитіла проти багатьох
вірусів африканських мавп, ці антитіла реагують з ВІЛ. На підставі
добутих даних Р. Галло вважає, що ВІЛ були заражені багато видів
приматів Старого Світу, а потім перенесені у Північну, Центральну
і Південну Америку. Подібні до ВІЛ віруси виявлено у котів і вели-
кої рогатої худоби.
Патогенез захворювання в людини. Зараження відбувається під
час статевого контакту, медичних маніпуляцій (використання забруд-
нених ін’єкційних голок, інших інструментів), при переливанні
інфікованої крові та її препаратів; можлива передача інфекції від
зараженої матері дитині до, під час і відразу після родів. Найбільше
хворих на ВІЛ-інфекцію серед гомосексуалістів і наркоманів, хворих
на гемофілію, для лікування яких застосовувався концентрат факто-
рів крові VIII і IX, реципієнтів крові, жінок, які мали інтимні зв’яз-
ки з чоловіками, хворими на ВІЛ-інфекцію, дітей батьків, що входять
до групи ризику зараження. ВІЛ не передається через їжу, воду,
неушкоджену шкіру.
Білок вірусної оболонки §г 120 (глікопротеоїд) міцно зв’язується
з рецептором клітинної поверхні — мембранним білком (антигеном
СП4). У місці контакту вірусу з клітинними рецепторами в мембрані
клітини утворюється заглиблення, потім замкнута везикула, в якій
є віріон.
Після проникнення ВІЛ у клітини хазяїна вірусний фермент
(зворотна транскриптаза) синтезує на матриці РНК відповідну їй
ДНК, яка проникає в ядро клітини і включається в хромосомну ДНК
хазяїна.
Проникати в клітину ВІЛ може прямим злиттям вірусної і клітин-
ної мембран з утворенням синтипію. Клітина, заражена вірусом, зу-
стрічається із здоровою клітиною, що має на своїй поверхні антиген
СП4; при розмноженні цієї клітини вірус передається потомству.
У групах ризику в 7—14 % вірусоносіїв розвивається ВІЛ-іи-
фекція; у 23—26 % виникають СНІД-подібні комплекси; у 60—70 %
ЛЧЗ
протягом 2—5 років буває носійство без виражених ознак захворю-
вання.
Усі клінічні прояви ВІЛ-інфекції зумовлені дефіцитом Т-клі-
тинного імунітету. Після інкубаційного періоду (від 3 тижнів до 5—
7 років) збільшуються шийні, пахвинні, ліктьові і пахвові лімфатич-
ні вузли; з’являються тяжка пневмонія, що спричиняється Рпеипіо-
сузііз сагіпі, пухлини (саркома Капоші), тривалий понос, гарячковий
стан, захворювання, спричинені умовно-патогенними бактеріями, гри-
бами, найпростішими, гельмінтами, вірусами; спостерігається прогре-
суюче зниження маси тіла. У ЗО % хворих настає ураження централь-
ної нервової системи (абсцес мозку, енцефаліт, менінгіт, недоумство,
розсіяний склероз). Розвивається виснаження; смерть настає від ви-
падкових захворювань. Летальність становить 40—50 %, але ймовір-
ність смертельного кінця досягає 100 %.
Лабораторна діагностика охоплює індикацію ВІЛ та його компо-
нентів у матеріалі від хворих, виявлення противірусних антитіл і спе-
цифічних змін в імунній системі. Матеріал для дослідження — кров,
сперма, грудне молоко, спинномозкова рідина, органи трупа.
Для виявлення вірусу застосовують електронну мікроскопію або
імунну електронну мікроскопію.
Культивування і накопичення вірусу роблять на спеціальних кло-
нах Т-клітин або введенням досліджуваного матеріалу африканським
зеленим мавпам з наступним виявленням зворотної транскриптази і
типуванням виділеного вірусу в серологічних реакціях ІФА, РІФ,
РІА та ін.
Серологічне дослідження дає змогу виявити антитіла в крові хво-
рих і носіїв за допомогою РІФ, ІФА, РІА, імуноблотингу та інших
реакцій.
Застосування клініко-імунологічних тестів дає змогу визначити:
І) наявність у мазках крові деформованих Т-клітин, що набувають
деревовидної форми і втрачають захисні імунологічні функції, а та-
кож їх загибель; 2) зменшення кількості Т4-хелперів на І мкм крові
(менше 400); 3) зміну співвідношення Т4-хелперів і Т8-супресорів (мен-
ше 0,6); 4) абсолютну анергію на алергени.
Обстежують на СНІД і СНІД-асоційовані інфекції хворих з тяж-
ким перебігом пневмонії, тривалим поносом, гарячковим станом, зло-
якісними пухлинами типу саркоми Капоші, ураженням центральної
нервової системи (абсцес мозку, енцефаліт, менінгіт) та іншими за-
хворюваннями, спричиненими умовно-патогенними мікроорганіз-
мами.
Крім того, обстеженню підлягають групи людей підвищеного ри-
зику зараження: гомосексуалісти, наркомани, повії, реципієнти,
хворі на гемофілію з дефіцитом факторів крові VIII і IX.
Лікування. Терапевтичний ефект дають азидотимідин, дидезокси-
цитидин, декстронсульфат, імуновір, сурамін, рабіварин. Застосо-
вують протипухлинні і протиінфекційні засоби, імуномодулятори, які
нормалізують систему Т-клітинного імунітету (гормони загрудинної
залози, фактори росту, інтерферон, левамізол, ізокринозин, інтерлей-
кін 2, фузидієва кислота, Т-активін та ін.).
390
Профілактика. Комітет експертів ВООЗ рекомендує проведення
медичного контролю в групах ризику (гомосексуалісти, наркомани),
виявлення хворих на СНІД, організацію в усіх країнах клінічної і ла-
бораторної діагностики захворювань, схожих за перебігом на СНІД.
Особи з позитивними серологічними реакціями потребують старанного
обстеження. Специфічна профілактика ще в стадії розробки.
ПАТОГЕННІ ГРИБИ І ЗАХВОРЮВАННЯ,
ЩО СПРИЧИНЯЮТЬСЯ НИМИ У людини
Систематика. Гриби віднесені до рослинних гетеротрофних нефото-
синтезуючих організмів-еукаріотів, що не мають хлорофілу. Тип гри-
бів (Еипчі з. Мусеіез) налічує понад 100 000 видів, об’єднаних у класи
2у£отпусоііпа (зигоміцети), Азсотусоііпа (аскоміцети), Вазідіотусо-
іпа (базидіоміцети), □еиіеготусоїіпа (дейтероміцети, незавершені
гриби), які, в свою чергу, поділяються на підкласи, порядки, родини,
роди, види; усередині останніх є шгами. Серед грибів трапляються
сапрофіти, паразити і факультативні паразити рослин, тварин і лю-
дини. Бтизько 100 видів грибів можуть спричиняти захворювання
в лодей або тварин.
Біологія. Форма клітин у молодих культур кругла, яйцевидна
або здовжена, у зрілих — грушовидна, булавоподібна, веретенопо-
дібна, амебоподібна.
За будовою гриби схожі на водорості, вони мають диференційоване
ядро (одне або кілька), клітинну стінку і цитоплазматичну мембрану.
Цитоплазма у молодих культур гомогенна, у зрілих — зерниста, в ци-
топлазмі є мітохондрії, комплекс Гольджі, вакуолі, різні включення
(глікоген, волютин, ліпіди, кристали органічних солей, пігменти).
Основним структурним компонентом клітин грибів є міцелій, по-
будований із розгалужених безбарвних ниток (гіф) завдовжки 4 —
70 мкм і діаметром 1—10 мкм. В одних видів грибів міцелій із нероз-
членозаної клітини (Мисог), в інших (вищих грибів) багатоклітинний;
у дріжджоподібних грибів (Сапсіісіа) є псевдоміцелій. Ріжки утво-
рюють склероцій у вигляді міцного сплетення гіф міцелію.
Морфологія клітинних елементів грибів дуже різноманітна, особ-
ливо в культурах на різних живильних середовищах; тканинні форми
патогенних грибів менш поліморфні, вони значно відрізняються від
культуральних, що враховують при лабораторній діагностиці мі-
козів.
Гриби розмножуються поділом, проростанням, брунькуванням
і спороносінням. Найчастішою формою розмноження є проростання,
яке супроводиться випинанням стінки і протопласту за ходом або по
боках міцелію. Паросток відмежовується від материнської клітини
перегородкою, потім утворюється гілляста грибниця. Досить часто
гриби розмножуються брунькуванням.
Спороутворення є засобом не тільки розмноження, а й розповсю-
дження грибів у зовнішньому середовищі. Спори поділяються на
зовнішні і внутрішні. Зовнішні, або екзосиори, утворюються ІЬЗ
грибниці, по боках або на кінцях їі міцелію. Епдоспорн у іавсршеїшх
З') І
грибів є результатом статевого процесу, дозрівають вони в асках
(аскоміцети), спорангіях (мукор та ін.).
У незавершених грибів е талоспори, які утворюються внаслідок
перетворення окремих гілочок міцелію в спеціальні спори (артроспори,
бластоспори, конідії, алейрії, геміспори).
Культивування робиться в аеробних умовах при температурі 22—
37 °С на живильних середовищах, що містять азотисті і вуглецьвмісні
речовини; найбільш сприятливим рН е 6,0—6,5, але патогенні гриби
можуть рости і при ширшому діапазоні рН — від 3,0 до 10,0.
Гриби мають більший набір ферментів, за допомогою яких вони
розщепляють білки, вуглеводи, ліпіди. Патогенні гриби потребують
різних факторів росту (вітаміни, амінокислоти), мінеральних речовин
і мікроелементів (цинк, кобальт, солі заліза, нагрію, магнію, міді,
фосфору).
За характером росту на агарових живильних середовищах патогенні гриби
поділяють на кілька типів: шкірясті, гладенькі, твердої консистенції; пухна-
сті, пухкі, ватоподібної консистенції; бархатисто-ворсисті, покриті дуже корот-
ким густим міцелієм; крихкі, плівчасті, що нагадують ламкий картон, густо-
борошнисті при спороутворенні та ін.
На рідких середовищах багато видів грибів ростуть з утворенням
повгтеподібного осаду на дні і пристінково.
Гриби виробляють пігменти різного кольору: білі, жовті, корич-
неві, чорні, сині, зелені, червоні, малинові та ін., які диференціюють
на розчинні у воді і розчинні у спирті, ацетоні, дихлоретані, чотири-
хлористому вуглеці. Продукування пігменту тканинними формами
грибів у патологічному матеріалі трапляється тільки у збудників
хромомікозу.
Токсиноутворення. Деякі види патогенних грибів мають власти-
вість продукувати екзотоксини (Ризагіит £гатіпіагит), афлатоксини
(окремі види аспергіл), ліпотоксол (Еизагіит зрогоігісЬіеІІа), а біль-
шість грибів має ендотоксини.
Патогенез захворювання в людини. За сприятливих умов патогенні
гриби у вигляді спор або фрагментів міцелію проникають у тканини
і потім розмножуються. Інкубаційний період триває від кількох діб
до кількох місяців. Найчастіше ушкоджуються шкіра, волосся і нігті
(дерматофітії); легені (кандидоз, бластомікоз, плісеневі мікози);
слизові оболонки (кандидоз, риноспоридоз); лімфоїдно-макрофагальна
система і внутрішні органи (гістоплазмоз); лімфатичні вузли, шкіра
(споротрихоз). При деяких .мікозах уражуються шкіра і внутрішні
органи, розвиваються генералізовані процеси.
Певну роль у розвитку мікозів відіграють привертаючі (патогене-
тичні) фактори. Дерматофітія уражує головним чином дітей дошкіль-
ного і шкітьчого віку; до кандидозів найбільш сприйнятливі ново-
народжені і діти раннього віку. Порушення обміну речовин, наявність
аномалій розвитку, зумовлених гормональними розладами, недоно-
шеність плода сприяють виникненню кандидозів.
До умов, які сприяють розвиткові мікозів, належать гіпо- й авіта-
міноз, дисбактеріоз, гіпергідроз (надмірна пітливість), перенесені
гострі і хронічні захворювання крові, злоякісні пухлини, специфічна
392
сежпбитзашя аісля переяесеягх мікозів, траввп. оєо&єево ии хр>
жийяозі, споротряхозі, верашоаальва аатпбюгвютеракія ^и рі>
них йифекиійнях захворгавааяях.
Ьдімігет проявляється у вмгляді-яесвеялфгаого захкту, оз реалі-
зується клпанддмд а гужюальажма фактора». Шківа залягає орга-
нізм від прон^кзення патогенвих грибів; піт. ліезїххяі речова» іжгі-
бгторяо діють на збудників мікозів. Аитафуигажжкмм властивосте»
характеризуються антитіла. які забезпечують спеяафгаий імунітет.
що виробляється від впливом антигенів.
Особливістю антигенних властивостей патогенних грабів є те.
що вони часто мають груповий характер, в результаті чого серологіч-
ні реакції можуть бути позитивними як на антигени збудника, так і на
антигени інших споріднених грибів, що знижує їх діагностичне зна-
чення. Найкраще вивчено при мікозах аглютинінв. арециппинж і ком-
цлементзв’язуючі антитіла; останні мають більш виражену специфіч-
ність- _
'Майже всі мікози супроводяться розвитком специфічної алерпі,
яка здебільшого має захисний характер. Повторні захворювання в здер-
гізованому організмі мають легший перебіг і доброякісну форму.
За характером первинної локалізації патогенних грибів, патогене-
зом і клінічними проявами виділяють чотири групи мікозів: І) кера-
томікозя (різнобарвний лишай, вузлувата трихоспорія); 2) дерма-
тофітію (епідермофітія стоп, руброснкоз, трихофгпі. мікроспорії);
3) кандндоз (поверхневий, хронічний, вісцеральний); 4) глибокі мі-
кози (бластомікози, гістоплазмоз, кокцндюїдоз, споротрнхоз).
Нижче наводяться короткі відомості про основні групи пато-
генних грибів.
ФІКОМІЦЕТИ
Фікоміцети — гриби з несептнрованнм міцелієм. До класу фікомі-
цетів входить рід Мисог, або головчаста плісень (рис. 102). Тіло муко-
рових грибів складається з міцелію у вигляді дуже розгалуженої клі-
тин, від якої відходять плодоносні гіфи — спорангієносці з кулястим
розширенням нагорі — спорангіями, наповненими ендоспорами, що
виконують функцію розмноження. Мукорові гриби розмножуються
також статевим шляхом. Вони дуже поширені в природі, їх часто ви-
являють на хлібі, овочах, вологих поверхнях предметів, у гною.
Рве. 102. Мисог.
Рис. 103. АїригцІІІиа,
грунті, воді. Більш як 15 патогенних видів мукорових грибів можуть
спричиняти у людини мукоромікози; ураження легень і печінки, що за
клінічним перебігом подібні до туберкульозу, а також кератит, отомі-
коз, вульвовагініг, дерматомікоз, загальний інфекційний процес.
АСКОМІЦЕТИ
Аскоміцети — сумчасті гриби з багатоклітинним міцелієм При
статевому процесі розмножуються аскоспорами (спорами, які розви-
ваються в особливих сумках — асках); безстатеве розмноження здій-
снюється конідіями (екзоспорами, які виконують функцію безстате-
вого розмноження у багатьох грибів).
До класу аскоміцетів віднесено рід АзрегбіІІиз. Гриби цього роду
мають розчленований (септируваний) міцелій і одноклітинний конідіє-
носець; на його верхньому кінці віялоподібно розміщена низка корот-
ких стеригм, від яких ланцюжками відшнуровуються спори — коні-
дії (рис. 103).
При мікроскопічному дослідженні аспергілів розташування екзо-
спор у плодоносній частині нагадує струминки води, що виливається
з лійки, звідки й назва — лійкова плісень. Типовим видом аспергі-
лів є Азрег^іііиз пі£ег, який дуже поширений у природі; він живе на
вологих предметах, у хлібі, варенні. До патогенних й умовно-пато-
генних видів належать А. (иті^аіиз, А. Пауиз, А. пі^ег та ін. Описано
більш як 40 видів, виділених у хворих з різними клінічними формами
аспергільозу.
У людини аспергіли уражують шкіру тулуба, рук і ніг, зовнішньо-
го слухового проходу, приносові пазухи, легені, бронхи, рогівку ока,
іноді кістки та інші органи і тканини. Захворювання на аспергільоз
найчастіше трапляється у робітників борошномельної промисловості
та ін. У ряді випадків можуть розвиватись тяжкі форми асперіільозу
з високою летальністю в хірургічних та онкологічних відділеннях
у хворих із зниженою опірністю та порушеною імунологічною реактив-
ністю організму.
Деякі види патогенних плісеней продукують афлатоксин, що має
високу токсичність і канцерогенну дію.
До класу аскоміцетів відносять рід РепісіІІіиш. Міцелій і конідієно-
сець у них багатоклітинні, плодоносне тіло має вигляд пензлика
Рис. 104 РспісіІІшт:
в —міцелій і коїіідіепоссць; б — плодоносне тіло.
394
Рис. 105. Дріжджі:
а—пекарські; б —кормові; в — пивні; г—ви-
ноградні.
застосовують у терапії багатьох
(рис 104). У верхній частині
конідієносець розгалужений, на
кінцях його утворюються стериг-
ми, від яких відшнуровуються
чоткоподїбні ряди конідій. Цей
рід гриба дуже поширений у
природі. Його виявляють у кор-
К'лх, молочних продуктах, на
ьологнх предметах, старих шкі-
рах, у чорнилі, варенні. Типовим
видом е Репісіїїіит §гаисит.
Спеціальні штами грибів
(Репісіїїіит поіаіит та ін.)
використовують для виготовлен-
ня пеніциліну, який широко
інфекційних захворювань.
Більш як ЗО видів Репісіїїіит патогенні для людини. Вони спричи-
няють пеніцильози — ураження шкіри, нігтів, органа слуху, верхніх
дихальних шляхів і легень, а також генералізовану інфекцію з утво-
ренням вогнищ у внутрішніх органах. Патогенними видами вважають
Р. сгизіасеит, Р. £Іаисит, Р. пі§ег та ін.
Лабораторна діагностика мукоромікозів, аспергільозів, пеніци-
льозів охоплює мікроскопічне дослідження патологічного матеріалу,
висівання його на прості живильні середовища або на середовище
Сабуро і культивування при температурі 25—28 °С. Гриби ідентифі-
кують за характером колоній за допомогою мікроскопії вирослої
культури, а також за ферментативною активністю, пігментоутворен-
ням, РЗК та результатом алергічних проб.
Для лікування застосовують ністатин, амфотерицин В, мікогептин,
амфоглюкамін, аутовакцини.
До класу Азсотусоііпа, порядку ЗассЬаготусеіаІез' (первинно-
сумчасті гриби) входять дріжджі, що являють собою клітини оваль-
ної, кулястої і паличкоподібної форми (рис. 105). Дріжджові клітини
мають двоконтурну оболонку і добре диференційоване ядро. Цито-
плазма їх гомогенна, тонкозернистої будови, має включення (глікоген,
волютин, ліпіди) і вакуолі, а також нитчасті тільця — хондріосо-
ми, які беруть участь у процесах синтезу, що відбуваються
в клітині.
Дріжджі розмножуються брунькуванням, поділом, спороутворен-
ням, деякі види — статевим шляхом. При брунькуванні від материн-
ської клітини відокремлюються дочірні, які перетворюються в само-
стійні особини.
В разі недостатнього живлення у деяких видів дріжджів усередині
клітин утворюються ендоспори в кількості 2, 4, 8, 16. Дріжджова клі-
тина, що утворює аскоспори, називається аском (сумкою), а споро-
творні дріжджі — аскоміцетами.
Багато видів і різновидів цього роду дріжджів мають властивість
зброджувати різні вуглеводи. їх широко використовують у пивовар-
ній, виноробній промисловості та хлібопеченні. Добре відомими пред-
395
ставниками таких дріжджів є БасеЬлготусез сегегізіае, БассЬаготу-
сез еПірзоідез.
Найпоширенішою групою аскоміцетів є ріжки (СІауісерз ригри-
геа), що розвиваються на злаках (житі, пшениці). Аскоспори у за-
в’язі рослин під час їх цвітіння проростають у міцелій. Гіфи утво-
рюють склероцій у вигляді темно-фіолетового ріжка, який виростає
в колоску замість зерен. У ріжках є алкалоїд корнутин, сфацелінова
й ерготинова кислоти, які спричиняють у людини і тварин при вжи-
ванні в їжу разом із житнім хлібом дуже тяжкі ураження, що мають
назву «злі корчі».
Профілактика цього захворювання полягає в недопущенні до
переробки злаків, в яких є ріжки (жита, пшениці).
БАЗИДІОМІЦЕТИ
Базидіоміцети — гриби з багатоклітинним міцелієм (більш як
20 000 видів). Розмножуються переважно статевим шляхом — базидіо-
спорами (базидії-органи розмноження, в яких утворюється певна кіль-
кість спор, звичайно чотири). Більшість базидіоміцетів живе на пере-
гнійному грунті, на рослинних рештках. Деякі види є паразитами дерев.
їстівні 150 видів шапкових грибів, причому тільки 32 з цих
видів придатні для заготівлі. У їжу вживають їх плодові тіла,
які в побуті називають грибами. Отруйні 25 видів шапкових грибів:
бліда поганка, мухомор червоний, мухомор пантерний, опеньок не-
справжній (червоний) та ін.
Токсичними продуктами блідої поганки є циклопептиди (похідні
індолу) —фалоїдин, фалмі, фелоцидин, фалізин і аманітоксини. Вони
швидко всмоктуються в шлунку і кишках, нагромаджуються в пе-
чійці, нирках і через 6—30 год після споживання справляють цито-
токсичну дію: ушкоджують мітохондрії, лізосоми, пригнічують окис-
лювальне фосфорилювання, синтез нуклеїнових кислот (ДНК і
РНК), глікогену і білка. Розвиваються явища гострого гастроентериту
(біль у животі, нестримне блювання, діарея), з’являються домішки
крові у випорожненнях, настає загальна слабкість, порушується вод-
но-електролітний баланс, бувають судороги, потім збільшується пе-
чінка, виникають жовтяниця, азотемія. Особливо тяжкий перебіг має
отруєння у дітей, у них розвивається гостра атрофія печінки, яка не-
рідко призводить до летального кінця.
Мухомори містять алкалоїд мускарин, який уражує парасимпатич-
ний відділ вегетативної нервової системи; у хворих з’являються спазми
непокресленої (гладенької) м’язової тканини, сльозотеча, сильне пото-
виділення, яке легко усувають введенням атропіну.
Умовно-отруйні гриби — сморжі, несправжні (червоні) опеньки і
сироїжки — спричиняють гострий гастроентерит, що розвивається
через 2—3 год після їх споживання. На відміну від абсолютно отруйних
умовно-отруйні гриби легко знешкоджують кип’ятінням.
Гастроентерит може виникати при споживанні їстівних неотруй-
них грибів, інфікованих при неправильному приготуванні або збері-
ганні сальмонелами, стафілококами, клостридіями ботулізму.
С96
При отруєнні грибами застосовують промивання шлунка, вводять
дезинтоксикаційні засоби. Щоб запобігти отруєнням, треба старанно
сортувати їстівні гриби, правильно готувати і консервувати їх.
ДЕЙТЕРОМІЦЕТИ
Дейтероміцети — незавершені гриби, що мають багатоклітинний
міцелій, але не мають ні сумчастого, ні базидіального спороносіння,
а лише конідії. Розмноження безстатеве.
З медичного погляду становить інтерес збудник аліментарно-
токсичної алейкії— Еизагіит зрогоігіскііеі 1а, який зумовлює ін-
токсикацію в людини і свійських тварин при вживанні в їжу перезиму-
валих у полі зернових культур.
Токсичні речовини, що утворюються грибами Еизагіит, є комплек-
сом хімічних сполук, з яких провідну роль в інтоксикації відіграє
токсичний стерол — ліпотоксол. Вони стійкі при зберіганні, не руй-
нуються в продуктах під час термічної обробки та бродіння.
Тривалість інкубаційного періоду залежить від ступеня інтоксика-
ції і коливається від кількох хвилин до кількох годин від моменту
вживання в їжу продуктів, виготовлених із зараженого зерна.
Лабораторна діагностика алейкії охоплює клінічне дослідження
крові, визначення токсичності зерна методом тонкошарової хромато-
графії на селікагелі, біологічну шкірну пробу на кролях і згодовуван-
ня голубам досліджуваного зерна.
Лікування патогенетичне, для боротьби з вторинною інфекцією
призначають антибіотики і сульфаніламідні препарати.
Рік. 108 Мі-
ПСЛІ II І коло
III і Гркісгпіо-
рііуіон Пос-
сочіїїп
Рис. 109. Ко-
лонії ТгісЬо-
рііуіоп мгііо-
ІС 1111.
397
Профілактика полягає в недопущенні вживання в їжу перезиму-
валого в полі зерна і виготовлених із нього продуктів.
До дейтероміцетів належить велика група дерматоміцетів, із яких
найважливіше значення мають збудники трихофітії, мікроспорії, епі-
дермофітії та фавусу.
Збудники поверхневоїтрихофітії — ТгісЬорЬуІоп уіоіасеит
та ін. (близько 20 видів) характеризуються наявністю тонких, корот-
ких, гіллястих, сегментованих ниток міцелію; у старих культурах
міцелій ширший, чоткоподібний, містить хламідоспори. На середови-
щі Сабуро ростуть з утворенням куполоподібних, шкірястих, матових
колоній (рис. 106) з вологою і нерідко блискучою поверхнею; вони
можуть бути гладенькими і зморшкуватими, з радіальними борозен-
ками; за кольором — фіолетові, чорні, рожеві, малиново-червоні.
До роду ТгісЬорЬуіоп відносять Т. іопзигапз, Т. зоибапепзе, Т. гиЬгипі.
Збудник глибокої трихофітії — ТгісЬорЬуіоп тепіа^горНу-
іез — має довгий септнрований міцелій, круглі алейрії (алейроспори,
що утворюються внаслідок цитоплазматичної конденсації міцелію),
розташовані скупченнями і по боках міцелію, містить невелику кіль-
кість спіралей, завитків і тупокінцевих веретен. На живильному
середовищі росте з утворенням пухнастих білосніжних колоній з рів-
ною і куполоподібною поверхнею. Досить часто утворюється порошко-
подібний гіпсовидний наліт; можливе жовтувате і рожевувате забарв-
лення пушку.
Збудник мікроспорії — Місгозрогит сапіз — в культурах на
живильному середовищі має вигляд великих гострокінцевих веретен
з 5—12 камерами і зубчастою оболонкою; міцелій гриба має ракетопо-
дібний характер. На середовищі Сабуро утворює білі або злегка жовту-
ваті пухнасті колонії, іноді з радіальними або концентричними боро-
зенками (рис. 107).
Збудник епідермофітії — ЕрідегторЬуіоп Поссозит — має
септировапий міцелій (рис. 108), багато веретен, розташованих група-
ми по 5—7 на одній нитці у вигляді пучка бананів; конідій не має.
У культурі утворює бархатисто-борошнисті складчасті і горбкуваті
колонії жовтувато-сірого, іноді зеленуватого кольору.
Збудник фавусу — ТгісЬорЬуіоп зскоепіеіпі — характеризує-
ться тим, що кінці міцелію за формою нагадують роги оленя, канделяб-
ри, булаву. Розмножується за допомогою хламідоспор; у борошни-
стих колоніях на боках міцелію добре виражені алейрії. При культи-
вуванні на середовищі Сабуро утворюються сухі зморшкуваті купо-
лоподібні сморжоподібні колонії (рис. 109) сіро-жовтого або коричне-
вого кольору з восковидною і борошнистою поверхнею. У нашій країні
трапляються лиш поодинокі випадки захворювання на фавус.
Ферментативні властивості дерматоміцетів різноманітні і здебіль-
шого несталі, тому визначення ферментативної активності не може
бути використане в лабораторній діагностиці. Дерматоміцети не про-
дукують екзотоксинів, вони містять ендотоксини і є алергенами, які
спричиняють стан підвищеної чутливості організму, і особливо шкіри.
Дерматоміцети не мають видоспецифічних антигенних властивостей,
у них немає сероварів.
398
У патологічному матеріалі поза організмом дерматоміцети збері-
гаються до 4 років, у лусочках — більш як 6 місяців. Відносно стійкі
до дії високих і низьких температур та хімічних речовин; знешкоджу-
ються кип’ятінням протягом 15—30 хв.
Дерматоміцети поділяються на антропофільні, що уражують тіль-
ки людину (Т. уіоіасеит, М. (егти^іпеиз, Т. зсЬоепІеіпі та ін.), і зоо-
фільні, які паразитують в організмі людини і тварин (Т. тепіа^горЬу-
іез, Т. уеггисозипі, М. сапіз та ін.).
Джерело інфекції — хворі люди і тварини (коти, собаки, коні,
рогата худоба та ін.). Зараження настає в результаті безпосереднього
контакту здорових людей з хворими в родині, перукарнях, лазнях,
басейнах, душових, при користуванні речами хворих (рушник, одяг,
головний убір, щітка для волосся, гребінець і т. д.), а також при кон-
такті з хворими тваринами.
Для трихофітії характерне ураження шкіри волосистої частини
голови, а також кистей і нігтів. Волосся обламується біля поверхні
шкіри, причому у волосяних фолікулах помітні їх залишки у вигляді
чорних цяток. Збудник розташовується як усередині, так і на поверхні
волосин. На шкірі з’являються рожевувато-червоні лускаті плями.
Розвиткові хронічної трихофітії сприяють розлади ендокринної систе-
ми, гіповітаміноз, зниження загальної резистентності організму.
При мікроспорії уражуються волосся, шкіра, рідше — нігті;
волосся обламується і покривається білими чохлами. Збудник прони-
кає всередину волосини і розташовується по всій її довжині.
Епідермофітія проявляється ураженням шкіри, особливо в між-
тальцьових проміжках, стоп, кистей, нігтів. Запалення шкірнсупро-
зодиться утворенням екзематозних вогнищ, стовщень і тріщин нігтів.
Зторинні висипи (епідермофітиди) мають алергічне походження.
При фавусі уражуються волосся, шкіра волосистої частини голо-
ш (з випаданням волосся), нігті. Уражене волосся стає сірим, втрачає
блиск й еластичність; на шкірі голови утворюються жовтого кольору
щитки, які зливаються в суцільну кірку, що має нерідко мишачий
запах. Ураження нігтів розпочинається з вільних країв у вигляді плям
жовтого кольору, нігті стають бляклими, стовщеними, крихкими,
легко розшаровуються і кришаться.
Дерматоміцети можуть спричиняти і загальне ураження організму
з висипом на шкірі і гарячкою. Генералізований шкірний висип має
назву трихофітиду, мікроспориду, фавіду. У ряді випадків удається
виділити гриби із крові.
Несприйнятливість до дерматоміцетів зумовлена реактивним ста-
ном макроорганізму. Антитіла не мають яскраво вираженої специфіч-
ності. Постінфекційний імунітет не напружений і відносний.
Лабораторна діагностика здійснюється так. Для мікроскопічного
дослідження уражені волосини або лусочки шкіри (нігтів) уміщують
на предметне скло у краплину 10—20 % розчину КОН або №ОН;
препарат злегка підігрівають до появи пари, потім накривають по-
кривним склом і вивчають при малому збільшенні.
У разі трихофітії клітини гриба в ураженій волосині мають розмір
4—5 мкм, розташовані ланцюжками і цілком заповнюють луковицю
399
а
о л 5
' >
г'.' Ь \'®'і
О'
~ ,3
О> .
З '*
© і
Рис. 110. Дерматоміцети в ураженому волоссі:
а — ТгісЬорЬуІоп, зсЬоепІеІпі, б — ТгісЬорЬуіоп уіоіасеиш; в — Місгоірогит сапіз.
волосини (рис. ПО, б). У лусочках шкіри і нігтів добре видно нитки
міцелію, які нерідко звиті або розгалужені, септирувані; у нігтьових
лусочках — скупчення округлих прямокутних спор. При мікроспорії
навколо ураженої волосини утворюється чохол, або муфта, що скла
дається з округлих спор розміром 2—3 мкм, розташованих у вигляді
мозаїки (рис. ПО, а). Усередині волосини виразно видно септирувані,
дихотомічно розгалужені нитки міцелію, що легко виявляються прі
ліомінесцентній мікроскопїї.
При фавусі гриби розташовуються у вигляді окремих ниток міце
лію завтовшки 3—5 мкм; членики мають прямокутну форму, у товщі
волосини утворюються пухирці повітря, краплинки жиру (рис. 110, в)
у лусочках шкіри, нігтів добре видно міцелій, ланцюжки із спор.
Чисту культуру виділяють висіванням досліджуваного матеріалу
на середовище Сабуро або середовище Сабуро з 2 % дріжджовим лі-
затом і метиленовим синім. Для звільнення від сторонньої флори во-
лосину подрібнюють препарувальними голками і кладуть на кілька
хвилин на нагріте предметне скло.
При діагностиці захворювань шкіри і слизових оболонок, що
спричиняються грибами, треба звертати увагу на можливість наяв-
ності в обстежуваних хворих СНІДу, захворюваність на який дуже
велика і з кожним роком зростає.
Лікування полягає у призначенні йодистих препаратів, гризео-
фульвіну з вітамінами, протизапальних теплих місцевих ванночок,
примочок із 3 % розчину борної кислоти, десенсибілізуючих засобів,
пірогеналу.
Профілактику здійснюють старанним лікуванням хворих, контро-
лем за видужуванням, медичним наглядом за санітарно-гігієнічним
станом перукарень, лазень, душових, басейнів для плавання, санпро-
пускників, спортивних майданчиків, ветеринарним наглядом за тва-
400
ринами, своєчасним виявленням, ізоляцією
і лікуванням хворих тварин, систематич-
ним проведенням санітарно-освітньої роботи
серед населення.
ЗБУДНИК СПОРОТРИХОЗУ
Збудник споротрихозу — ЗрогоіЬгіх
зсЬепскіі — має септирований міцелій. Від
гіф відходять бокові гілочки, по боках і на
кінцях яких одиночно або групами розта-
шовуються конідії (рис. 111). Споротрикс
росте на звичайних середовищах (рН 6,5),
краще культивується на середовищі Сабуро
при температурі 25—28 °С. Ріст повільний,
насті, гладенькі або мозковндні, досить часто пігментовані.
Ряс 111. Міцелій ЗрогоІЬгіх
зсЬспскіі.
Колонії шкірясті, пух-
Збудник проникає в організм при пораненні, через садна шкіри
у підшкірну клітковину і лімфатичні вузли, утворює дрібні гуми
в глотці, м’язах, синовіальних оболонках, а також спричиняє абсцеси
кісток, суглобів, м’язів і внутрішніх органів.
Лабораторну діагностику здійснюють мікроскопічним дослідженням
патологічного матеріалу (гній, зрізи при біопсії), узятого у хворого.
При позитивному результаті виявляють гриби у вигляді овоїдних ті-
лець розміром 1 х 1 — 1 X 3 мкм. Висіванням матеріалу на сере-
довище Сабуро виділяють чисту культуру. У сироватках крові хво-
рих виявляють комплементзв’язуючі антитіла, аглютиніни в титрі
1 : 200 — 1 : 500, а також преципітини й опсоніни.
При внутрішньошкірному введенні споротрихозного алергену,
(екстракт із культур убитого гриба) спостерігають алергічну реакцію
що нагадує реакцію на туберкулін у хворих на туберкульоз. Споро-
трикс патогенний для тварин. При підшкірному введенні мишам, па-
цюкам, морським свинкам у них розвиваються гранулематозні ура-
ження внутрішніх органів.
Лікування проводять амфотерицином В, ністатином, леворином,
мікогептином, препаратами йоду, вакцинами, аутовакцинами.
Профілактика забезпечується додержанням санітарно-гігієнічного
режиму (утримання тіла в чистоті, запобігання травмам шкіри і сли-
зових оболонок).
ЗБУДНИКИ КАНДИДОЗУ
До збудників кандидозу належать дріжджоподібні гриби з роду
Сапсіісіа Це одноклітинні організми (рис. 112), які розмножуються
брунькуванням; конідій і аскосиор не утворюють, справжнього міце-
лію не мають; псевдомінелій без перегородок, виникає в результаті
послідовного або кінцевого брунькування.
Із 80 видів грибів роду Сап<1 ісіа близько 20 патогенні для людини.
Це округлі, овоїдні або довгасті клітини; розмножуються переважно
14 І-445
401
багатополюсним брунькуванням: ут-
ворюють псевдоміцелій у вигляді
ланцюжків довгастих клітин. У пато-
логії людини найбільше значення
мають С. аІЬісапз і С ігоркаїїз лю-
дини ці гриби виявляють на слизових
оболонках порожнини рота, шлчнка,
кишок, сечостатевих органів. Іноді
вони трапляються на фруктах, ово-
чах та інших харчових продуктах,
у стічних водах лазень, у змивах з
а б предметів у їдальнях, на посуді іт. п.
Рис. 112. Міцелій (а) і колонії Кандидози виникають в ослабле-
(6) Сапдіда аІЬісапз. них дітей, розвиткові їх сприяють
незадовільні умови зовнішнього середовища (підвищення вологості,
мацерація шкіри, тривалий контакт під час роботи з фруктами й ово-
чами, що містять цукор, та ін.). Можливе інфікування при поганій
дезинфекції ванн.
Заслуговують на увагу кандидози, пов’язані з нераціональним за-
стосуванням антибіотиків, що зумовлює глибокі порушення симбіозу
нормальної мікрофлори і призводить до дисбактеріозу. Стан дисбакте-
ріозу сприяє інтенсивному розмноженню і розповсюдженню деяких
співчленів біоценозу кишок, слизових оболонок і переходу їх із са-
профітичного стану в умовно-патогенні і патогенні форми. Прн цьому
розвиваються як місцеві, так і загальні ураження.
Дріжджеподібні гриби уражують міжпальцьові складки шкіри
кистей і стоп, шкіру пахових і пахвинних ділянок, нігті і павколоніг-
тьові валики, слизові оболонки губ і куточків рота, зіва, стравоходу,
іноді піхви з утворенням білих плівок. При кандидозах уражуються
також шлунок і кишки, органи дихання, сечостатева, іноді нерво-
ва система. Бувають кандидозні ураження жовчних шляхів,
зубів.
У ряді випадків збудник кандидозу спричиняє септицемію, що має
хронічний перебіг і характеризується втягненням у патологічний про-
цес нирок, легеневої тканини та інших органів. Описано кандидозні
ураження шкіри зовнішнього слухового проходу, кератокон’юнкти-
віт. Особливо тяжкий перебіг мають кандидози у хворих на діабет,
а також в осіб з авітамінозом і гормональними розладами.
Лікування. Для успішної терапії кандидозів треба усунути дисбак-
теріоз, відмінити антибіотики широкого спектру дії і призначити
спеціальні антибіотики (леворин, ністатин, амфоглюкамін, мікогеп-
тин), сульфадимезин. Застосовують аутовакцинотерапію введенням
убитих вакцин, виготовлених із культур Сапдіда, виділених саме від
цього хворого.
Профілактика полягає у виявленні й усуненні джерел зараження
і розповсюдження інфекції, ізоляції хворих, здійсненні загальносані-
тарних <аходів (дезинфекпія у вогнищах захворювань і в місцях най-
більшої концентрації дріжджеподібних грибів).
402
ЗБУДНИКИ ГЛИБОКИХ БЛАСТОМІКОЗІВ
До збудників глибоких мікозів належать гриби з родів
Віазіотусез, Нізіоріазта, РНіаІорІюга та іи.
Сгур(ососси$ пео[огтапз спричиняє у людини крипто-
кокоз — глибокий системний хронічний бластомікоз типу
Буссе — Бушке. У гною, мокротинні, спинномозковій рідині
і тканинах хворих виявляють круглі й овальні дріжджові
клітини діаметром 5—20 мкм. На середовищі Сабуро крип-
токок росте у вигляді сметаноподібних колоній, які спочат-
ку білі, а потім стають кремовими й коричневими.
Уражуються легені, мозок і мозкові оболонки, кишки,
шкіра, підшкірна клітковина, лімфатичні вузли, кістки. Ле-
тальність дуже висока. Криптококоз трапляється в Європі
й Америці серед сільськогосподарських робітників, скотарів.
Віазіотусез ЛегтаНИЛіз - збудник північноамерикан-
ського бластомікозу (хвороби Джілкрайста — Стокса), при
Рис. 113. Мі-
целій і коло-
нії Віазіоту-
сез дегтаіі-
іідіз.
мікроскопії культури має вигляд крупних, що брунькую-
ться, клітин діаметром 2—5 мкм; міцелій у нього сегмен-
тований. гіллястий, з конідіями по боках. На кров’яному
агарі прн температурі 37 °С утворює білі вологі сальні
м’які зморшкуваті колонії дріжджового типу, на середови-
щі Сабуро при температурі 25 °С — білі пухнасті колонії
(рис. 113), які потім стають коричневими; дріжджові і мі-
целіальні форми (культуральний диморфізм) використовують у диференціальній
діагностиці.
Північноамериканський бластомікоз характеризується хронічним перебі-
гом й ураженням шкіри обличчя, рук, сідниць; порівняно рідко уражуються
внутрішні органи.
РагасоссіЛіоЛез Ьгазіїіепзіз має вигляд крупних клітин з множинними
бруньками на поверхні; на кров’яному агарі утворює мозковидні колонії. На
агарі Сабуро розвивається з утворенням білих бархатистих колоній; пізніше
вони стають опуклими, горбкуватими й коричневими. Це збудник парококци-
діоїдозу (південноамериканський бластомікоз), що належить до тяжких
хронічних захворювань з гранулематозним ураженням шкіри, слизових
оболонок, лімфатичних вузлів і внутрішніх органів.
Лабораторна діагностика охоплює мікроскопію, вивчення культуральних,
біохімічних властивостей виділених грибів, алергічні проби.
Дія розпізнавання глибоких і особливо небезпечних мікозів використо-
вують біологічний метод — зараження кролів, морських свинок, пацюків,
котів, собак; найкращих результатів досягнуто в дослідах иа лінійних
мишах і золотистих хом’ячках.
Лікування проводять мікогептииом, амфоглюкаміном.
Профілактика полягає в ізоляції хворих з локалізацією процесу в леге-
нях, обробці приміщень, стаціонарів, де перебувають хворі, поточній і за-
ключній дезиифекції та додержанні правил особистої гігієни.
ЗБУДНИКИ ГІСТОПЛАЗМОЗУ
До роду Нізіоріазта, родини Нізіоріазтаіасеае відносять Н. сарзніа-
іит — збудник американського гістоплазмозу та його варіант — Н. іінЬо-
зіі — збудник африканського гістоплазмозу.
У паразитичній фазі клітини Н. сарзиіаіит округлої форми, розміром
1—4 мкм, оточені світлою, що ие забарвлюється, зоною; клітини Н. сІнЬозіі
крупніші, до 10 мкм у діаметрі. У сапрофічнін фазі (в грунті, культурі) гісто-
плазми утворюють міцелій з мікрокоиідіями (2,5—3 мкм) і шипуваті хламі-
доспори (7—15 мкм). На середовищі Сабуро при температурі 25—ЗО °С
дають білі пухнасті колонії міцеліального типу, па кров’яному агарі при
рН 7,2—7,6 і температурі 37 °С — білі вологі дріжджеподібні колонії.
1
403
Роботу з культурою гістоплазм ведуть в умовах суворого режиму, при-
йнятого для особливо небезпечних інфекцій.
Гістоплазмоз відносять до природно-вогнищевих захворювань, люди
І тварини заражуються аерогенним шляхом (при вдиханні пилу із спорами гіс-
топлазм). Від хворих людей і тварин захворювання не передається Хво-
ріють головним чином жителі сільської місцевості, а також особи, що контак-
тують з грунтом, пилом. Гістоплазми вибірково проникають у клітини лім-
фоідно-макрофагальиоі системи, а потім руйнують їх, при ньому утворюються
вогнища некрозу в різних органах і тканинах (особливо в легенях, селезінці
та ін ) із значною петрифікацією, що зумовлює їх морфологічну подібність до
вогнищ туберкульозу. Клінічно захворювання проявляється у вигляді пер-
винного, у 80 % випадків безсимптомиого, і вторинного, дисеміиоваиого, дуже
тяжкого і часто смертельного гістоплазмозу.
Імунітет у перехворілих на гістоплазмоз тривалий. У сироватці крові
хворих утворюються аглютиніни, преципітини, комплемеитзв’язуючі антитіла,
а також буває яскраво виражена специфічна сенсибілізація.
Лабораторна діагностика грунтується иа виявленні в патологічному мате-
ріалі — мокротинні, гною, а при хронічній дисеміноваиій формі — у крові,
сечі і спинномозковій рідині внутрішньоклітинно розташованих гістоплазм.
Для виділення культури досліджуваний матеріал висівають на середовище Са-
буро, кров’яний агар, потім ідентифікують за морфологічними ознаками
і даними біологічної проби иа мишах. Для виявлення алергічного стану став-
лять виутрішиьошкіриу пробу з гістоплазміном. Із серологічних реакцій
найбільш ефективні РН, РЗК.
Лікування проводять сульфазииом, амфотерицииом В, мікогептииом,
амфоглюкаміиом, гамма-глобуліном, застосовують переливання крові,
еритроцитної маси.
Профілактика здійснюється знезаражуванням грунту у дворах, парках,
иа дитячих майданчиках, у таборах. Під час роботи в печерах ендемічних ра-
йонів треба користуватися респіраторами. Велике значення має боротьба
з гризунами. Певну роль у розповсюдженні збудників гістоплазмозу віді-
грають кажани, які живуть у печерах, а також птахи.
Специфічна профілактика ще в стадії розробки. Вивчаються вакцини
для імунізації населення, яке живе в ендемічних районах. Потреба одержання
вакцин зумовлена значним поширенням гістоплазмозу в Північній і Південній
Америці, Африці, Азії, Австралії.
ЗБУДНИКИ ХРОМОМІКОЗУ
До родини Ветаііасеае, роду РЬіаІорЬога належать РЬіаІорЬога
уеггисоза та інші види, що мають властивість спричиняти хронічне
захворювання — хромомікоз.
Збудники хромомікозу мають темно-зелений або чорний септи-
руваний міцелій; розмножуються конідіями і фіалоспорами. На
густих середовищах колонії випуклі, пухнасті або бархатисті, ми-
шачого кольору, іноді з радіальними або концентричними борозен-
ками, живуть у грунті, стійкі до висушування та інсоляції.
Хромомікоз у людини може мати вузликову, пухлиноподібну,
верукозну і гіпертрофічну форми. Патологічні зміни локалізую-
ться на кінцівках, головним чином нижніх (гомілки, стегна); вони
являють собою бородавчасті папіломатозні розростання, що покри-
ваються кірками, дрібні і крупні абсцеси, гранулематозні вогнища.
Хромомікоз поширений у країнах з тропічним кліматом, але
останнім часом він реєструється в районах з помірним кліматом і
північних регіонах. Зараженню сприяють травми шкіри рослинним
матеріалом та іншими субстратами рослин. Хвора людина не заразна.
404
Природного імунітету в людини немає, імунні реакції виражені
слабко; спостерігається фагоцитоз грибів крупними багатоядерними
клітинами.
Лабораторна діагностика проводиться мікроскопією патологічного
матеріалу — гною, зіскобу ураженої тканини, біопсованих клаптиків
у краплині 10 % лугу або в розчині спирту з гліцерином (однакові
об’єми). Культури збудників хромомікозу досить легко виділити на
звичайних для грибів живильних субстратах. Ідентифікують на під-
ставі морфобіологічних ознак, характеру спороносіння. Використо-
вують також серологічні реакції: РП, РЗК.
Лікування проводять амфотерицином В і мікогептином.
Профілактика полягає в запобіганні травмам у робітників, зайня-
тих у сільськогосподарському виробництві, а також у деревообробній,
целюлозно-паперовій і меблевій промисловості. Ранову поверхню
ділянок шкіри, забруднену грунтом або рослинними матеріалами,
обробляють антисептиками.
НАЙПРОСТІШІ І ЗАХВОРЮВАННЯ, ЩО СПРИЧИНЯЮТЬСЯ
НИМИ У людини
Систематика найпростіших грунтується на способах руху, роз-
множення та циклах розвитку. Найпростіші належать до світу Апіта-
Ііа, відсвіту Ргоіохоа. Виділяють 4 класи найпростіших: джгутикові,
саркодові, споровики і війкові.
Найпростіші живуть у морях, океанах, прісних водах, грунті.
Патогенні види найпростіших пристосувались до життя в організмі
тварин і людини, вивченням їх займається медична протозоологія.
Клітини найпростіших — самостійні особини, які виконують усі
функції тваринного організму. У них складні цикли розвитку. Розмі-
ри їх коливаються від 3 до 150 мкм. Органоїдами руху є несправжні
ніжки, джгутики, війки. Найпростіші мають травні і скоротливі ва-
куолі, що забезпечують саморегуляцію, виділення і дихання. Жив-
ляться вони заковтуванням (за голозойним типом) або осмотичним
всмоктуванням. Основні відомості про найпростіші викладено в під-
ручниках з біології.
Найпростіші — одноклітинні еукаріоти, більш високоорганізова-
ні, ніж бактерії. Вони мають цитоплазму, диференційоване ядро, різну
за оптичними властивостями оболонку і примітивні органоїди.
Найпростіші розмножуються простим і множинним поділом, ста-
тевим шляхом, а також поєднанням статевого і безстатевого (плазмо-
дії малярії). Амеби, лямблії і балантидії можуть утворювати цисти —
стійкіші форми існування особин.
Представники деяких видів найпростіших мають двоє і більше
ядер.
Резистентність вегетативних форм невисока. У зовнішньому сере-
довищі патогенні види відмирають порівняно швидко. Цисти амеб,
лямблій і балантидіїв довго зберігаються, не втрачаючи своїх біоло-
гічних властивостей.
До патогенних найпростіших належать збудники лейшманіозу,
403
трипаносомозу, трихомонозу, лямбліозу, амебіазу, малярії, кокци-
діозу, ізоспорозу, токсоплазмозу, балантидіозу.
ДЖГУТИКОВІ
Джгутикові (2оота$Н§орЬога) — це організми, які пересуваються
за допомогою одного або кількох довгих джгутиків. Форма тіла у них
овальна, довгаста або куляста. Розмножуються паразити найчастіше
поздовжнім поділом і рідше — статевим шляхом. Основними представ-
никами є лейшманії, трихомонади, трипаносоми, лямблії.
ЛЕЙШМАНІЇ
Лейшманії входять до класу джгутикових. Розрізняють дві основні форми
лейшманіозу — шкірну і вісцеральну. Збудника шкірного лейшманіозу від-
крив П. Ф Боровський у 1898 р. при вивченні пендинської виразки в Турке-
стані. У і903 р. У. Лейшмаи і Ш. Донован виявили збудника вісцерального
лейшманіозу — індійського кала-азара.
Морфологія. У життєвому циклі лейшманії проходять дві стадії
розвитку: амастигот (безджгутикову), при якій лейшманії парази-
тують у макрофагах та інших фагоцитуючих клітинах шкіри, слизо-
вих оболонках, селезінці, печінці, кістковому мозку і лімфатичних
вузлах організму хребетних, і промастигот (джгутикову), коли най-
простіші локалізуються в просвіті кишок перенощика. Поверхня тіла
амастигот покрита тонкою оболонкою; довжина їх 2—6 мкм, ширина —
2—3 мкм (див. форзац, рис. VII, е). У цитоплазмі є велике ядро круглої
або овальної форми, паличкоподібний блефаропласт із залишком джу-
тика та вакуолі. При забарвленні за Романовським — Гімзою
цитоплазма набуває блакитного, ядро — яскраво-червоного, блефаро-
пласг — темно-червоного кольору. В організмі безхребетних (москіти)
і в культурах клітин утворюються промастиготи, які досягають 20 мкм
у довжину і 3 мкм у ширину.
Культивування. Лейшманії вирощують у культурі клітин (макрофа-
гів) при температурі 37 °С, на агарі з дефібринованою кров’ю кроля
(середовище МММ-агар), на якому вони розмножуються при темпера-
турі 18—22 °С і розташовуються у вигляді розетки.
Патогенність для тварин. Джерелом інфекції збудника зоонозного
лейшманіозу є піщайка, ховрахи та інші гризуни пустельних місце-
востей; шкірно-слизистого лейшманіозу, що трапляється в Централь-
ній та Південній Америці,— дикі тварини і гризуни.
При експериментальному зараженні патогенні лейшманії уражу-
ють мавп, собак, котів, гризунів (мишей, хом’яків, ховрахів, піщанок,
білок), кролів, морських свинок. Паразити спричиняють генералізова-
ну інфекцію, і їх виявляють у селезінці, печінці і кістковому мозку
гварин.
Збудник шкірного лейшманіозу. Патогенез захворювання
в людини. Лейшманіоз у людей зареєстрований у 76 країнах світу.
В Середній Азії, Закавказзі трапляються дві форми шкірного лей-
шманіозу, що спричиняються Ь. ігоріса.
406
Збудником зоонозного шкірного лейшманіозу є Ь. ігоріса уагіоіа
тарг. Лейшманіоз, що спричиняється цим видом лейшманій, дістав
назву також сільського, гостронекротизуючого, пустельного, мокну-
чого. Джерелом збудника зоонозного шкірного лейшманіозу є гризу-
ни (піщанки, пацюки, хатні миші та ін.); перенощики — москіти
з роду РЬІеЬоіотиз.
Зоонозний шкірний лейшманіоз характеризується порівняно корот-
ким інкубаційним періодом (від 1—2 тижнів до 1,5—2 місяців), після
чого на шкірі з’являються папули (лейшманіоми) з виразками. Краї
виразок пухкі, обриси нерівні. Навколо лейшманіом утворюються
горбки, що є результатом дисемінації збудника. Рубцювання настає
через 3—6 місяців. Якщо лейшманії проникають у лімфатичні шляхи,
розвивається лімфангіїт і, рідше, регіонарний лімфаденіт.
Збудник антропонозного шкірного лейшманіозу—Ь. ігоріса уаг.
тпіпог. Лейшманіоз, зумовлений цим видом найпростіших, назива-
ють також міським, який пізно вкривається виразками, сухим.
Основне джерело інфекції — хворі на хронічну форму лейшмані-
озу. Зараження здійснюється перенощиком — москітом роду РІіІеЬо-
іотия.
Інкубаційний період тривалий (2—3 місяці і більше). На відкри-
тих частинах тіла — шкірі обличчя, шиї, рук, ніг — з’являються
поодинокі або множинні сверблячі папули, що поступово переходять
у вузлики, які перетворюються у безболісні виразки. Вони покрива-
ються буро-червоними кірочками, після зняття яких виявляється
вкрита виразками поверхня, вистелена пухкою грануляційною тка-
ниною з великою кількістю лейшманій. Захворювання триває близько
року, іноді—до 2—10 років.
Імунітет. Після перенесеного захворювання виробляються неспри-
йнятливість протягом кількох років і сенсибілізація до лейшманіозно-
го алергену. В осіб, які перехворіли на зоонозний шкірний лейшманіоз,
несприйнятливість розвивається і до антропонозного лейшманіозу
що свідчить про антигенну близькість збудників і використовується
для специфічної профілактики шкірного лейшманіозу.
Лабораторна діагностика охоплює виявлення лейшманій у грануля-
ційній тканині, висівання на агар з дефібринованою кров’ю (ККі\’-
агар) і застосування серологічних реакцій (РЗК, РІФ).
Лікування. Призначають мапакрин у вигляді ін’єкцій у товщу па-
пули. Коли лейшманіоми вкриті виразками, для пригнічення вториьг
ної інфекції призначають антибактеріальні препарати (норсульфазол
і пеніцилін).
Профілактика. Боротьба з шкірним лейшманіозом передбачає за-
гальні заходи (рання діагностика, знищення інфікованих лейшманіями
собак, гризунів, москітів). Особам, що прибули у вогнища лейшмані-
озу, прищеплюють живу культуру лейшманій, яку вводять у верхню
частину стегна або плеча.
Імунізація створює стійкий імунітет. Вакцина складається із
зависі штамів живих культуральних форм (промастнгот) збудника
зоонозного шкірного лейшманіозу.
40/
Різновидом шкірного лейшманіозу е шкірно-слизистий (еспуидія), який
характеризується природною вогнищевістю, трапляється в Центральній Аме-
риці і в усіх країнах Південної Америки (крім Чілі). Спричиняється Ь. Ьгазі-
Iііепзіа. Переношик — москіти роду Еиіготуіа.
Другим різновидом природно-вогнищевого шкірного лейшманіозу е су-
данський, або иодуляриий, збудник його — Б. пііопіса.
Лікують ці види шкірного лейшманіозу препаратами сурмя. В разі
бактеріальних ускладнень призначають антибіотики і сульфаніламідні пре-
парати. Профілактика полягає у знищенні москітів і захисті від иих. Щеплень
не роблять.
Збудник вісцерального лейшманіозу. Патогенез захворю-
вання в людини. Вісцеральний лейшманіоз (кара-азар) спричиняється
Ь. допоуапі. Джерелом інфекції є хворі люди з явними або прихова-
ними формами лейшманіозу і свійські тварини (собаки, коти), інфіко-
вані лейшманіями. Інкубаційний період триває від кількох тижнів до
2—3 місяців, потім розвивається гарячка з тривалими ремісіями,
встановлюється постійна помірно підвищена температура тіла, збіль-
шуються селезінка і печінка, розвивається прогресуюча анемія. Іноді
з’являються виразки в кишках, уражуються бронхи і легені, вини-
кають набряки і крововиливи у внутрішніх органах, слизових обо-
лонках і шкірі; шкіра стає темною (чорна гарячка).
Захворювання має хронічний характер, триває протягом багатьох
років. Летальність у минулому становила 70—80 %, тепер — 2—ЗО %.
Для вісцерального лейшманіозу характерна природна вогнищевість.
Трапляється в Індії, Китаї, країнах Центральної Африки. Вісце-
ральний лейшманіоз реєструється в Середній Азії, на півдні Ка-
захстану, в Закавказзі. Передається трансмісивним шляхом через
укуси москітів.
Імунітет після перенесеного вісцерального лейшманіозу досить
стійкий. Повторні випадки захворювання не спостерігаються.
Лабораторна діагностика. Матеріалом для дослідження є пунктат
кісткового мозку; у деяких випадках — пунктат печінки і лімфатич-
них вузлів. Для виявлення амастигот мазки забарвлюють за Романов-
ським — Гімзою. Досліджуваний матеріал висівають на агар з дефіб-
ринованою кров’ю (ЦЦМ-агар), після чого застосовують РИГА і РІФ.
Лікування проводять солюсурміном, глюкантимом, пентостамом,
уреастибаміном.
Профілактика полягає в ранній діагностиці, своєчасному лікуван-
ні хворих, а також у боротьбі з гризунами, знищенні москітів і собак,
інфікованих лейшманіями.
ТРИПАНОСОМИ
Збудники трипаносомозу — трипаносоми — належать до класу джгути-
кових. Розрізняють дві форми трипаносомозу — африканський (сониа хворо-
ба) й американський (хвороба Шагаса).
Збудниками африканського трипаносомозу є два близьких між собою ви-
ди — Тгурапозота ^атЬіепзе (Дж. Даттон, 1902) і Тгурапозота гЬосІезіепзе
(Феитем, 1910).
Збудник американського трипаносомозу — Тгурапозота (ЗсЬігоІгурапит)
сгисі — відкритий у 1909 р. в Бразілії М. Шагасом.
408
Морфологія. Збудники трипаносомозу мають вигляд веретеноподібних
клітин з іидуліруючою мембраною і загостреними джгутиками иа кінцях
(див. форзац, рис. VII, д). Трипаносоми рухливі, довжина їх 25—40 мкм,
ширина — 20 мкм. Цитоплазма забарвлюється за Ромаиовським — Гімзою
у голубий колір, ядро, блефаропласт і джгутики — у червоний.
Культивування проводять у середовищі, що складається з розчину Рін-
гера і цитратпої крові людини, а також на агарі з дефіброваною кров’ю кроля
(NNN-3^).
Патогенність для тварин. Деякі види трипаносом патогенні для більшо-
сті свійських і лабораторних тварин; збудники розмножуються в крові,
внутрішніх органах і в кістковому мозку. Від сонної хвороби щороку ги-
нуть сотні тисяч голів великої рогатої худоби.
На півдні нашої країни трапляються різновиди трипаносомозу у тварин —
су-ауру у верблюдів (збудник — Т. еуапсі, перенощики — гедзі) і паруваль-
на хвороба в коней і віслюків (збудник — Т. еяиірегдигп).
Збудник африканського трипаносомозу. Патогенез захворюван-
ня в людини. Африканський трипаносомоз — трансмісивне захворювання;
передається через укус кровососних мух. Трипаносоми заражують рогату ху-
добу, диких травоїдних тварин, які є джерелом інфікування людини.
Захворювання характеризується кахексією, анемією, гарячкою, набряком
мозку, хронічним лептоменінгітом, ураженням нирок. Хвороба хронічна,
триває місяцями і навіть роками; приступи гарячки чергуються з періода-
ми позірного видужання. Потім настає депресія, розвивається прогресуюча
сонливість і хворий впадає у стан коми. Кількість паразитів у крові незнач-
на; трипаносоми є в тканинах, особливо м’язах, у спинномозковій рідині.
Інфекція дуже часто закінчується смертю. Захворювання трапляється
в країнах Західної Африки; в нашій країні не спостерігається, оскільки у фау-
ні країни немає переиощика.
Імунітет. В результаті перенесеного захворювання в крові утворюються
антитіла — трипанолізиии, тромбоцитобарини (феномен навантаження Рік-
кеиберга — Брусика), комплементзв’язуючі та іи. Не виключається і роль
фагоцитозу. Постінфекційний і поствакцинальний імунітет не забезпечує за-
хисту організму у зв’язку з швидкою мінливістю антигенної структури трипа-
носом, у яких є варіабельні поверхневі глікопротеїди, що кодуються різними
генами.
Лабораторна діагностика охоплює: 1) мікроскопіюваиня мазків і товстої
краплини крові (під час приступів гарячки), а також мазків із пунктату
збільшених лімфатичних вузлів; 2) дослідження в летаргічному періоді
спинномозкової рідини, в якій виявляють підвищену кількість білка і клітин
крові (лімфоцитів), а іноді й трипаносом.
Лікування. Застосовують аитрипол, сурамін, пентамідин. У другому
періоді захворювання (летаргічному) призначають 2—3 курси терапії препа-
ратами миш’яку (меларсопрол, трипарсамід), які вводять внутрішньовенно.
Профілактика забезпечується здійсненням комплексу заходів, до якого
входять виявлення і лікування хворих, захист населення від укусів крово-
сосних мух цеце застосуванням відлякуючих засобів (диметилфталат та ін.),
винищення мух —переиощиків збудника інфекції, введення здоровим людям
атринолу для попередження розвитку захворювання.
Збудник американського трипаносомозу. Патогенез захворювання
у людини. Особливо чутливі до цієї форми трипаносомозу діти. Захворювання
природно-вогнищеве, передається через укуси різних видів триатомовнх кло-
пів. Резервуаром збудника є дикі тварини — броненосці, опосуми, гризуни,
мавпи.
У немовлят захворювання через кілька днів після укусу нерідко призво-
дить до летального кінця. У дітей старших року захворювання має підгострив
перебіг. У дорослих захворювання супроводиться підвищенням температури ті-
ла, появою набряків обличчя, збільшенням щитовидної залози, лімфатичних
вузлів, селезінки І печінки. У деяких осіб зараження ие призводить до явного
клінічного захворювання. При хронічних формах американського трипаносо-
мозу спостерігаються ендокринні розлади — мікседема, бронзове забарвлення
шкіри й інфантилізм. Трипаносоми можна виивити у периферичній крові, але
409
розмножуються вони не в крові, а в клітинах покресленої поперечносмугастої
м’язової тканини і центральної нервової системи.
Лабораторна діагностика охоплює: 1) дослідження в гострому періоді крові
хворих у мазках або товстій краплині; 2) зараження морських свинок 5—10 мл
крові хворого (трипаносомами можна легко заразити різних свійських і диких
тварин).
Лікування. Застосовують похідні нітрофурану, у гострій і хронічній ста-
діях використовують лампіт (ніфутримукс, Вауег 2502). Обнадійливі резуль-
тати добуто при випробуванні 7-нітроімідазолу (рафоніл).
Профілактика. Полягає у знищенні клопів — перенощнків збудників ін-
фекції В ендемічних вогнищах здійснюють хіміопрофілактику пентаміднном.
Робляться спроби виготовлення вакцин проти трипаносомозу.
Американським трипаносомозом (хвороба Шагаса) у Північній і Південній
Америці уражено кілька мільйонів чоловік; летальність висока, у перехворілих
буває кардіопатія.
ТРИХОМОНАДИ
В організмі людини паразитують піхвова (ТгісЬотопаз уа^іпаїіз)
і кишкова (ТгісЬотопаз Ьотіпіз) трихомонади, що належать до класу
джгутикових.
Збудник урогенітального трихомонозу — Тгісіїотопаз уа-
§іпа!із. Морфологія. Піхвова трихомонада овально-грушовидної фор-
ми, розміром 7—ЗО мкм. Тіло її складається з тонкозернистої прото-
плазми з численними вакуолями. Іззовні вона має тонку оболонку —
перипласт, у передній частині тіла якої є щілина гачкоподібної фор-
ми — цитостома, що виконує функції ротового отвору. У передній
частині тіла трихомонади міститься ядро з 5—6 ядерцями, а поряд
з ним — блефоропласт, від якого розпочинається пряма осьова нитка
аксонем. Це пружний тяж, що виконує функцію кістяка, розташований
усередині протоплазматичного тіла по довгій осі, виступаючи у вигля-
ді шипа. Піхвова трихомонада, як і Т. іпіезііпаїіз (рис. 114), має
4 джгутики й ундулюочу мембрану, за допомогою яких вона пересу-
вається.
Культивування. Т. уа§іпа1І8 розвивається на штучних живильних
середовищах при температурі 36,5—37 °С.
Рис. 114. ТгісЬотопаз іпіезііпаїіз:
а— вцд спереду; 6 — вид ззаду; в, г — вид збоку.
410
Резистентність. Піхвові трихомонади малостійкі до змін темпера-
тури, сонячного випромінювання. Вони гинуть при висиханні і дії
антисептичних розчинів (1 % хлораміну, 1 % карболової кислоти та
ін.) протягом кількох секунд.
Патогенез захворювання в людини. Піхвова трихомонада парази-
тує у людини. Зараження настає в основному статевим шляхом, мож-
ливе інфікування здорових осіб через предмети туалету, якими кори-
стувався хворий.
Після інкубаційного періоду (в середньому 10 днів) у чоловіків
розвивається уретрит, який з самого початку набирає торпідного (кво-
лого) перебігу. У жінок трихомоноз проявляється ураженням сечо-
випускного каналу, піхви і каналу шийки матки.
Імунітет після перенесеного захворювання не розвивається.
Лабораторна діагностика. Основним методом дослідження є мікро-
скопія нативних і забарвлених препаратів, приготованих із виділень
сечостатевих шляхів. Використовують забарвлення за Романовським—
Гімзою, Грамом, Лейшманом, а також 0,5—1 % водним розчином ме-
тиленового синього.
Застосовують культуральний метод — висівання на штучні жи-
вильні середовища, особливо при безсимптомних і латентних формах
і для визначення вилікованості хворих.
Лікування. Ефективним засобом лікування трихомонозу є метро-
нідазол (трихопол, флагіл).
Профілактика полягає в додержанні особистої гігієни. Специфіч-
них заходів для запобігання трихомонозу не розроблено. Основне —
заходи загальної профілактики.
Збудник кишкового трихомонозу — ТгісЬотопаз Іютіпіз.
Морфологія. За будовою та іншими властивостями кишкова трихомо-
нада схожа на піхвову, але значно менша за неї, її розміри — 7—
15 мкм.
Патогенез захворювання. Зараження здорових людей відбувається
фекально-оральним шляхом (з водою, їжею). Збудник паразитує у тов-
стій кишці людини. Вважають, що кишкова трихомонада не призво-
дить до виникнення захворювання, а є лише супровідною різних
патологічних процесів у кишках, породжених іншими причинами.
Лабораторна діагностика полягає в дослідженні калу для вияв-
лення вегетативних форм кишкової трихомонади.
Лікування. Застосовують метронідазол (трихопол), трнхомопа-
цид, осарсол, ятрен, сульфазин, борну кислоту.
Профілактика полягає у здійсненні загальних заходів, як і при
інших кишкових захворюваннях, спричинених найпростішим.
Профілактика трихомонозу, який спричиняється Т. іпіезііпаїіз,
така сама, як і кишкових інфекцій, а заходи для запобігання сечо-
статевому трихомонозу ті самі, що й при венеричних захворюван-
нях.
411
Рис. 115 Лямблії (а, б) в стадії поділу
ЛЯМБЛІЇ
До класу джгутикових на-
лежать лямблії; найпоширені-
шим типом їх є збудник лямб-
ліозу— ЬатЬІіа іпіезііпаїіз,
відкрита Д. Лямблем у 1859 р.
Морфологія. Лямблія — дво-
бічний симетричний організм гру -
шовидної форми з витягнутим заднім кінцем і двома симетрично розта-
шованими ядрами. Тіло паразита має довжину 10—28 мкм і ширину
8—12 мкм. На тупому кінці лямблії є дископодібне удавлення — своє-
рідний присосок, за допомогою якого вона прикріплюється до поверхні
епітелію кишок. По середній лінії тіла паразита проходять дві опорні
нитки; рухається паразит за допомогою чотирьох пар джгутиків
(рис. 115). Лямблії утворюють цисти овальної форми завдовжки 10—
14 мкм і завширшки 7,5—9 мкм, що мають по двоє або четверо
ядер.
Культивування. Ростуть на середовищах, до яких входять екстракти
дріжджоподібних грибів.
Патогенність для тварин. Лямблії виявлено у синантропних гри-
зунів, собак, котів, овець, кіз, кролів, коней, великої рогатої худоби
та ін. Проте вони виявились неідентичними лямбліям, які паразитують
в організмі людини.
Патогенез захворювання в людини. Джерелом зараження є лю-
дина, яка виділяє цисти разом із випорожненнями. Після проникнен-
ня цист у кишки їх хітинова оболонка розчиняється. Вегетативні форми
лямблій розмножуються у порожній кишці, проникають у дванадцяти-
палу кишку і жовчний міхур. Розвиткові лямблій сприяють запальні
процеси в слизовій оболонці кишок, що буває при дизентерії, гельмін-
тозах, а також наявність у кишковій флорі грибів. Розвиваються
хронічне запалення дванадцятипалої і тонкої кишок, що зумовлює
диспепсичні розлади (нудота, згага, зниження кислотності), загальне
виснаження. Досить часто розвиваються холецистит, гепатит, стан під-
вищеної чутливості до алергенів лямблій.
Імунітет не вивчено. Даних щодо постінфекційного імунітету не-
має. Доведено, що в процесі захворювання розвивається стан
алергії.
Лабораторна діагностика здійснюється мікроскопічним досліджен-
ням дуоденального вмісту або випорожнень на наявність вегетативних
форм і цист.
Лікування. Застосовують фуразолідон, амінохілол, метронідазол
(трихопол) усередину і в розчині для промивання дванадцятипалої
кишки. При мішаній інфекції рекомендується комплексне лікування
з урахуванням характеру співчленів паразитоценозу (дегельмінтиза-
ція, протидизентерійні препарати і засоби для лікування міко-
зів).
Профілактика така сама, як і при кишкових інфекціях. При цьому
слід ураховувати високу інвазійність лямблій.
412
САРКОДОВІ
Саркодові (КЬігоросІа) — організми, що рухаються завдяки наяв-
ності псевдоподій або цитоплазматичних виростів. Тіло мікроорганіз-
му легко змінює свою морфологію. Розмножується простим поділом.
Цикл розвитку включає утворення цист. До патогенних для людини
видів саркодових належить ЕпІатоеЬа Ьізіоіуііса.
ЗБУДНИК АМЕБІАЗУ
Збудника амебіазу описав Ф. А. Леш у 1875 р.; докладно вивчив у 1903 р.
Ф. Шаудін, який диференціював два види амеб: Є. Ьізіоіуііса і Є. соїі.
Морфологія. Цикл розвитку дизентерійної амеби (Е. Ьізіоіуііса)
охоплює дві стадії: вегетативну і стадію спокою, або цисти (рис.116).
На вегетативній стадії розрізняють чотири основні форми амеби:
1) тканинну (20—25 мкм), яка швидко пересувається за допомогою
псевдоподій і має здібність фагоцитувати еритроцити; 2) велику веге-
тативну (30—60 мкм), що живиться еритроцитами і не захоплює бак-
терій; 3) просвітку (15—20 мкм), яка живе в просвіті товстої кишки,
живиться бактеріями і грибами; 4) передцистну, що не містить бакте-
рій та інших харчових включень.
Цисти дизентерійної амеби округлої форми, розміром 9—14 мкм,
мають двоконтурну оболонку і від одного до чотирьох ядер. Зрілі
цисти мають чотири ядра. їх виявляють у випорожненнях хронічних
хворих і носіїв. В кишках людини живуть непатогенні Е. соїі, трохи
більші, ніж Е. Ьізіоіуііса; цитоплазма їх зерниста, у вакуолях є бак-
терії, лейкоцити, частинки їжі, глікоген, немає еритроцитів; псевдопо-
Рис. 116. ЕпІатоеЬа Ьіьіоіуііса (а—е) і ЕпІатоеЬа соїі (є—з):
а — просвітня форма; 6 — тканинна форма з фагоцнтованнмн еритроцитами; в — тканинна
Іорма без поглинання еритроцитів, г—е — одно-, дво- 1 чотнрнядерні цисти; в — вегетативна
врма; ж, з — дво- 1 восьмнидериї цисти.
413
дії спостерігаються рідко, цисти крупніші і мають вісім ядер
(рис. 116, ж, з)
Культивування. Збудник амебіазу росте при температурі 34 °С
на середовищі Павлової (500 мл дистильованої води, 4,25 г ХаСІ,
0,3 г №2НРО4, 0,5 г КН2РО4; суміш розливають у пробірки по
9,5 мл і в кожну пробірку додають по 0,5 мл кінської сироватки й по
1 петлі крохмалю); добре росте в культурі тканин.
Резистентність. Цисти збудника амебіазу довго зберігаються у воді,
що й зумовлює в ряді випадків розвиток водних спалахів захворю-
вання; стійкі проти дії хлору, соляної кислоти у високих концентра-
ціях (6,2 %), кислого вмісту шлункового соку. У випорожненнях
хворих і в грунті цисти залишаються життєздатними 5—ЗО діб, легко
витримують низькі температури. Разом з тим вони чутливі до виси-
хання.
Патогенність для тварин. У природних умовах на амебіаз хворіють
пацюки і мавпи, які в ряді випадків є джерелом зараження людей.
При зараженні кошенят і собак рег гесіиш виникають типові дизенте-
рієподібні ураження прямої кишки, а також абсцеси печінки (поза-
кишкова форма амебіазу). Однією з оптимальних моделей експеримен-
тального амебіазу є зараження білих пацюків.
Патогенез захворювання в людини. Основним джерелом інфекції
є хворі на хронічну і гостру рецидивуючу форми амебіазу, реконва-
лесценти — цистовиділювачі та носії цист, які щодня виділяють з ка-
лом понад ЗО млн цист. Зараження настає при заковтуванні цист, які
є у воді, харчових продуктах, забруднених фекаліями. Цитоносійство
виявляють у середньому в 20 % здорового населення. Амебіазом ура-
жено 10 % населення земної кулі. Захворювання трапляється в усіх
країнах; спостерігається в Закавказзі, Середній Азії і на Далекому
Сході.
Амебіаз має гостру і хронічну форми, супроводиться ураженням
товстої кишки, в основному сліпої і поперечної ободової. Випорож-
нення хворих мають вигляд малинового желе, рівномірно просоченого
кров’ю; дефекація близько ЗО раз на добу, виникає обезводнювання
організму.
Розвивається запальний набряк, стінки кишки вкриваються ви-
разками, починається некроз і гангренозний розпад навколишніх
тканин; амеби проникають у слизову оболонку, підслизовий і м’я-
зовий шари стінки кишки, у судини кишок і по гілках ворітної вени
можуть досягати печінки.
Ускладненнями амебіазу можуть бути абсцеси і некроз печінки,
іноді абсцеси легень і мозку. У деяких випадках амеби потрапляють
у велике коло кровообігу, і тоді може уражуватись будь-який орган.
Імунітет. У людей є порівняно виражена природжена несприйнят-
ливість до амебіазу, про що свідчить значне поширення цистоносій-
ства (5—30 % і більше) без наступного розвитку захворювання. Га-
дають, що несприйнятливість пов’язана із станом нестерильного іму-
нітету. Велике значення мають резистентність тканин стінки кишки
і властивість макроорганізму нейтралізувати токсичну дію співчленів
паразитоценозу.
414
Лабораторна діагностика. Мікроскопічне дослідження свіжих ви-
порожнень хворого для виявлення в них Е. Ьізіоіуііса роблять з ви-
користанням нагрівального столика. При мікроскопічному дослі-
дженні калу на наявність у ньому цист і зерен глікогену до нього
додають розчин Люголя.
Виявлення патогенних амеб можливе і при гістологічному дослі-
дженні тканин (забарвлення метиленовим синім, сафроніном, гемато-
ксилін-еозином, залізним гематоксиліном).
Роблять висівання і виділення культур з наступною ідентифіка-
цією їх. У разі негативних результатів дослідження калу і позакиш-
кового амебіазу ставлять реакції непрямої гемаглютинації, аглютина-
ції латексу, подвійної дифузії в агаровому гелі і зустрічного імуно-
електрофорезу.
Експериментальний амебіаз відтворюють зараженням кошенят
або білих пацюків, у яких розвивається типова картина захворю-
вання. і
Лікування. Застосовують еметину гідрохлорид і метронідазол
(трихопол), а також хініофон (ятрен) і хінгамін (делагін, резохін,
хлорохін). Для діяння на бактеріальну мікрофлору, яка обтяжує аме-
біаз, призначають напівсинтетичні препарати тетрацикліну, пені-
цилін.
Профілактика полягає в госпіталізації, старанному лікуванні хво-
рих. Важливими заходами є забезпечення населених пунктів добро-
якісною водою і каналізаційною системою, систематичне обстеження
працівників харчоблоків на цистоносійство, підвищення санітарно-
гігієнічного рівня життя населення. Розробляють методи специфічної
профілактики амебіазу у вогнищах його значного поширення.
СПОРОВИКИ
До класу споровиків (Зрогогоеа) належать плазмодії — збудники
малярії людини, тварин і птахів, кокцидії — збудники кокцидіозу
й ізоспорозу, токсоплазми, які спричиняють токсоплазмоз у тварин
і людини. Споровики не мають спеціальних органів пересування; роз-
множуються статевим і безстатевим шляхом.
ПЛАЗМОДІЇ МАЛЯРІЇ
Плазмодії малярії належать до класу Зрогогоеа, роду Ріазтосііит.
Мають властивість уражувати еритроцити та інші клітини хребетних.
У 1880 р. А Лаверан відкрив збудника чотириденної малярії (Р. та-
іагіае), 1890 р. В. Грассі і Р. Фелетті —збудника триденної малярії
(Р. уіуах), у 1897 р. У. Уелч — збудника тропічної малярії (Р. Гаїєі-
рагнт), а в 1922 р. Ж- Стівено — збудника малярії овале (Р. оуаіе).
Морфологія (рис. 117). Наймолодші форми малярійного плазмо-
дія — мерозоїти виникають в результаті поділу (мерулянії)
зрілого шизонта. Вони мають круглу або овальну форму і невеликі
розміри (1—2 мкм). Мерозоїти складаються з цитоплазми і ядра, їм
415
ф О їй ф ф < >
«ф ® в і • Ф < • •
>ф Ф 4 Ф Ф Ф 4* К Г
Рис 117. Морфологія збудників малярії:
а—Р. уіувх; 6 — Р. таїагіае, а — Р. Іа1с1р-ігі.т.
не властиві амебоподібні рухи. Цитоплазма забарвлюється за Рома-
новським — Гімзою в голубий, ядро — у червоний колір.
Кільцеподібний трофозоїт утворюється на наступному етапі роз-
витку малярійного плазмодія, коли мерозоїт проникає в еритроцит.
При цьому паразит збільшується в об’ємі, у цитоплазмі його з’являєть-
ся вакуоля. На цій стадії малярійний плазмодій має нерівні обриси
і нагадує перстень.
Амебовидний трофозоїт рухається в межах еритро-
цита за рахунок появи псевдоподій. У процесі росту трофозоїт збіль-
шується, у його цитоплазмі накопичується пігмент (у вигляді темно-
бурих плям) — продукт розщеплення гемоглобіну.
Зрілий трофозоїт (шизонт) має округлу цитоплазму
і втягнуті псевдоподії, займає майже весь еритроцит. У цій стадії
відбувається меруляція — поділ ядра і цитоплазми з утворенням за-
лежно од виду паразита 6—24 мерозоїтів. Пігмент скупчується в центрі
у вигляді компактного утворення. Наприкінці процесу меруляції
еритроцити руйнуються, і мерозоїти потрапляють у плазму крові;
одні з них проникають в еритроцити, інші (більшість) гинуть під впли-
вом імунних факторів організму.
За рекомендацією ВООЗ (1963), безстатеві форми паразита з не-
поділеним ядром називають трофозоїтами, аз моменту поділу
ядра — шизонтами.
Гаметоцити (гамонти, гамети) — статеві форми ма-
лярійних плазмодіїв, які поділяються на жіночі — макрогаметоцити
(розмірами 12—14 мкм, містять великі зерна пігменту, ядра невеликі,
компактні, забарвлюються у червоний колір і розташовуються біля
краю клітин) і чоловічі — мікрогаметоцити (менші за величиною,
цитоплазма забарвлюється блідіше, ядра крупніші, злегка дифузні,
розташовуються в центрі).
Цикли розвитку. Плазмодії мають безстатевий і статевий цикли
розвитку (рис. 118). Безстатевий цикл розвитку паразита відбуваєть-
ся в організмі людини і називається шизогонією. При укусі людини
самицею комара роду Апоріїеіез, зараженою збудниками малярії,
разом із слиною комахи в кров людини потрапляють плазмодії малярії
у вигляді ниткоподібних клітин — спорозоїтів. Вони проникають
у клітини печінки та інших органів і тканин організму людини. Ця
стадія називається позаеритроцитарною (екзоеритроцитарною). У клі-
тинах печінки спорозоїти стають округлими й досягають певної ве-
416
створенням мерозоїтів, які
Рве. П8 Жвттєвя* цикл розвжтту
малярійній плазмодіїв:
личини, тобто проходять ста-
дії тканинного трофозоїту і
тканинного шизонту- Надалі
вони поділяються з утворен-
ням великої кількості меро-
зоїтів. У Р. Гаїсірагип) відбу-
вається один, а в Р. уіудх —
два цикли тканинної шизого-
нії. У період тканинних цик-
лів розвитку малярійних
паразитів в інфікованих лю-
дей не буває клінічних про-
явів захворювання.
Деякі з мерозоїтів прони-
кають в еритроцити, де вони
проходять стадії кільцеподіб-
ного, амебоподібного і зрі-
лого трофозоїту, після чого
настає стадія поділу — меруляція з
знову проникають в еритроцити і повторюють свій цикл розвитку.
На певному етапі мерозоїти перетворюються в статеві форми —
макро- і мікрогаметоцити; при потраплянні їх у шлунок комара відбу-
вається злиття (копуляція) макро- і мікрогаметоцитів, в результаті
чого утворюється рухлива форма — зигота, або оокінета, яка заглиб-
люється в стінку шлунка комара і перетворюється в ооцпсту.
Розвиток малярійного плазмодія в організмі комара (спорогонія)
залежно од виду збудника і навколишньої температури триває в серед-
ньому 7—9, іноді 7—45 діб. Дозріла ооцнста досягає в діаметрі 60 мкм
і наповнена спорозоїтами. Оболонка ооцисти розривається, і спорозо-
їти потрапляють у порожнину тіла комара, накопичуються в клітинах
слинних залоз і при укусі проникають в організм людини, де здій-
снюються позаеритроцитарна (тканинна) шизогонія в клітинах печінки
й еритроцитарна шизогонія.
Для розвитку паразита в організмі комара потрібна оптимальна
температура ЗО °С; при температурі нижче 16—17 °С процес заплід-
нення (злиття мікро- й макрогаметоцнтів) і проникнення оокінегн
в стінку шлунка комара не відбувається. При температурі 25 °С роз-
виток спорозоїтів у Р. уіуах завершується через 10, у РЛаІсірагиш —
через 14, у Р. шаіагіае — через 18 діб. Температура нижче 0 V при-
зводить до загибелі паразитів в організмі комара, але при температурі
4—10 °С їх життєздатність зберігається. Заражений комар є джерелом
інфекції протягом місяця. Траисоваріальної передачі малярійних плаз-
модіїв у комарів немає.
Культивування. Збудники малярії розвиваються в живильних се-
редовищах, що містять кров з глюкозою, а також у штучному середо-
417
вищі, до якого входять метіонін, ізолейцин, рибофлавін, парааміно-
бензойна і пантотенова кислоти.
Патогенність для тварин. Тепер виявлено понад 50 видів малярій-
них плазмодіїв, які спричиняють захворювання у тварин і птахів.
Р. кпоміезі, Р. косЬі, Р. іппиі, Р. Ьгазіїіепзіз та ін. патогенні для мавп;
Р. баїїілагит, Р. Іаіах та ін. спричиняють малярію у птахів; на маля-
рію хворіють амфібії і рептилії.
Перенощиками плазмодіїв малярії у тварин і птахів е комарі родів
Сиіех, Аесіез, Мапзопіа, Апоріїеіез та ін.
Патогенез захворювання в людини. Малярія — антропонозна інфек-
ція (резервуаром збудників є людина), передається членистоногими
(комарами роду Апоріїеіез), характеризується природною ендем ічні-
стю. Збудники можуть передаватися через укус комара, від матері
плоду — через плаценту і при парентеральному введенні інфікованої
крові.
Тривалість інкубаційного періоду при триденній малярії коливає-
ться від Юдібдо 11 місяців, при чотириденній малярії він становить
21—42 доби, при тропічній — 9—16 діб. На півночі інкубаційний пе-
ріод при триденній малярії триває від 9 до 11 місяців, на півдні —
10—18 діб.
Приступ малярії виникає як відповідь організму на надходження
в кров білкових речовин, що утворюються при розпаді еритроцитів
і мерозоїтів. Повторні приступи призводять до сенсибілізації організ-
му і розвитку тяжкої клінічної картини малярії.
Механізми пізніх рецидивів малярії остаточно не з’ясовано. Га-
дають, що вони зумовлені активізацією у весняний період спорозоїтів,
які збереглися в латентному стані у тканинних клітинах.
Захворювання супроводиться типовою для кожної форми малярії
гарячкою, патологічною картиною крові (гемоглобін перетворюється
в глобін), збільшенням селезінки і розвитком анемії, а також різними
ускладненнями (меланоз внутрішніх органів і тканин, геморагічний
синдром, нефропатія, енцефалопатія та ін.).
Імунітет. Головну роль у розвитку імунітету відіграють клітинні
фактори (фагоцитоз малярійних плазмодіїв макрофагами). У крові
хворих виявляють антитіла (цитолітичні, комплементзв’язуючі).
Природжена несприйнятливість до триденної малярії у жителів
Західної Африки пов’язана з відсутністю в їх еритроцитах ізоантиге-
нів ОаИу, що виконують функцію рецепторів щодо мерозоїтів
Р. уіуах.
Однією з форм природного (генетичного) імунітету при малярії
вважають серповидноклітинність еритроцитів. Ця форма анемії спосте-
рігається у гетерозиготних осіб, еритроцити яких мають тенденцію
набирати серповидноклітинної форми. У таких еритроцитах плазмодії
тропічної малярії гинуть. Серповидноклітинність — дуже поширене
(15—20 %) явище серед населення Центральної Африки; діти, які
перехворіли малярією, у віці 9—14 років стають несприйнятливими до
повторних заражень.
При малярії можливі тривалі періоди (до 40 років) прихованого
позаеритроцитарного паразитоносійства. Під впливом різних зовніш-
418
ніх факторів (інсоляція, охолодження, травма, вакцинація, скоромину-
ча інфекція) тимчасове благополуччя порушується, і виникають ре-
цидиви малярії.
Лабораторна діагностика охоплює мікроскопію товстої краплини
і мазків крові, забарвлених за Романовським — Гімзою, і визначення
виду збудника. Використовують серологічні методи — РИГА, РЗК,
ІФА, РІФ, РІА. Для визначення епідемічного стану населення в енде-
мічних щодо малярії районах застосовують імунодіагностику (вияв-
лення імуноглобулінів М і 6).
Лікування і профілактика. Потрібні своєчасне і повне виявлення
хворих на малярію, повноцінне комбіноване лікування їх із застосу-
ванням хінгаміну (хлорохіну, резохіну, хіноциду) та інших препа-
ратів.
У країнах з високою захворюваністю на малярію добрі результати
добуто при застосуванні хінгаміну в комбінації з гематоцидним препа-
ратом (хлорохіном або примахіном). Виявлено штами малярійних
плазмодіїв, стійких до хініну та інших протималярійних препаратів.
Усім, хто хворів на малярію, через рік після перенесеного захво-
рювання роблять профілактику.
Розробляється протималярійна генно-інженерна вакцина.
До заходів для запобігання розповсюдженню малярії входять ви-
нищування комарів роду Апоркеїез у житлових і господарських при-
міщеннях двічі за сезон за допомогою інсектицидів (гексахлоран та
ін.) і знищення їх личинок у водоймах (місцях виплоду) біологічним
методом (розведення риб-гамбузій, що живляться личинками комарів),
а також застосуванням біологічних (бактокумицид) та інсектицидних
препаратів.
З 1955 р. за програмами ВООЗ в усіх країнах здійснюються широкі захо*
ди для зниження захворюваності на малярію. У 1971 р. всього було зареєстро-
вано 52,5 тис. хворих, летальність становила 6 %. За останні роки малярія
знову стала епідемічною інфекцією в місцях, де вона раніше вважалась лікві-
дованою. У багатьох районах Азії й Африки це захворювання дуже поширене
і супроводиться високою летальністю.
Однією з причин зниження ефективності заходів для запобігання малярії
і зростання захворюваності останнім часом вважають появу інсектицидорези-
стентних особин комарів і лікарсько-стійких видів малярійних плазмодіїв.
КОКЦИДИ
Кокцндіі — збудники кокцидіозу та ізоспорозу — інвазійного захворю-
вання, що спричиняється патогенними найпростішими з класу Зрогогоа: Ио$ро-
га Ьеііі, Ізозрога Ьотіпіз, які паразитують у клітинах епітелію тонкої кишки
людини, де відбувається повний життєвий цикл розвитку (шизогонія і спорого-
нія) з утворенням ооцист, що виділяються з випорожненнями у навколишнє
середовище.
Морфологія і цикл розвитку. Ооцнсти завдовжки 20—ЗО мкм і завширшки
12—16 мкм, мають 2—12 споробластів або 2 спороцисти, кожна з яких містить
4 спорозонти.
У І. Ьотіпіз шизогонія відбувається у м’язах великої рогатої худоби або
свиней; крупні цисти з великою кількістю мерозоїтів потрапляють з м’ясом
тварин у кишки людини, де відбувається стадія спорогонії з утворенням дрібні-
ших ооцист.
419
Патогенез захворювання в людини. Через тиждень після потрапляння ооцяст
। організм людини у неї з’являються гарячка, стомлюванісгь, загальна слаб-
кість, діарея і біль у животі, рідкі випорожнення з домішкою слизу, Іноді
чрові, 4—6 раз і більше на добу. Гострі прояви захворювання збігаються з пе-
оіодом шизогонії і тривають близько двох тижнів. Під час спорогонії у випо-
рожненнях з’являються ооцнсти, які виділяються протягом ВІД кількох діб до
I місяця. Захворювання триває близько місяця і звичайно закінчується виду-
жанням.
Клінічно виражена форма кокцидіозу найчастіше буває у дітей. Хронічні
форми захворювань можуть виникати при поганих санітарно-гігієнічних умовах
і незадовільному харчуванні.
Лабораторна діагностика грунтується на виявленні у свіжовнділеному
калі незрілих ооцнст І. Ьеііі або зрілих ооцист і спороцист 1. Иогпіпіз.
Лікування симптоматичне і загальнозміцнююче, вітамінотерапія. Застосо-
вують препарати вісмуту, у тяжких і затяжних випадках — хлорндин і суль-
фазин.
Профілактика — своєчасне виявлення і повноцінне лікування хворнх,
додержання санітарно-гігієнічного режиму. Кокцидоз ендемічний для деяких
країн Південної Африки, Південної Америки та островів Тихого океану. Були
випадки захворювання в Голландії, США, а також у нашій країні.
ТОКСОПЛАЗМИ
Збудник токсоплазмозу — Тохоріазгпа £оп<1і1 — виділений у гризунаСіепоб-
Ьасііііз ^опбіі у 1908 р. в Алжірі Ш. Ніколем 1 Л. Маисо. У наступні роки
цей паразит було виявлено у різних видів свійських і диких тварин. Він на-
лежить до кокцидій, класу споровиків.
Морфологія. Т. £опсііі має форму півмісяця, груші, овала; кінці її
іноді загострені, довжина 4—7 мкм і ширина 5 мкм. При забарвлю-
ванні за методом Романовського — Гімзи цитоплазма стає голубою,
а ядро — рубіново-червоним (див. форзац, рис. IX).
За допомогою електронної мікроскопії на поверхні тіла токсо-
плазм виявлено мікротрубочки, які виконують опорну і рухову функ-
ції. Мікротрубочки відходять від коноїда, що є органелою, тісно зв’я-
заною з поверхневими структурами токсоплазми.
Цитоплазма вегетативної форми токсоплазми дрібнозерниста, мі-
стить багато вакуоль, розташованих поблизу цитоплазматичної мем-
брани, мембранні канальці і цистерни, що несуть рибосоми і полірибо-
соми, мітохондрії з двошаровими мембранами, ядро сферичної або
овальної форми.
Збудник розміщується вільно або всередині різних клітин системи
мононуклеарних фагоцитів нервової тканини, печінки, у плаценті та
ін. У процесі розмноження токсоплазм у вакуолях макрофагів утво-
рюються скупчення псевдоцист, що не мають власних оболонок, які
заповнюють цитоплазму клітин хазяїна і надалі руйнують їх. При
переході захворювання в хронічну форму з’являються справжні цисти,
покриті власною оболонкою.
Процес розвитку токсоплазм має статевий і безстатевий цикли роз-
витку. Статевий цикл відбувається в організмі основних хазяїнів —
представників родини кошачих, зокрема домашніх котів. Після зара-
ження частина паразитів проникає в клітини епітелію кишок, де
відбувається процес шизогонії (безстатеве розмноження) з утворенням
4—ЗО мерозоїтів, покритих двома тришаровими мембранами. Через
420
кілька циклів розмноження (на 3—15-й день зараження) утворюються
мікро- і макрогаметоцити, в результаті злиття яких формується ооои-
сга; зона відторгається з клітин епітелію тонкої кишки і разом з ви-
порожненнями кота надходить у зовнішнє середовище. Усередині
ооцисти є дві спороцисти з чотирма довгастими зігнутими спорозоїта-
ми, які проникають у клітини епітелію кишок сприйнятливих до пара-
зита свійських і диких тварин і птахів. Розмножуючись у кишках,
паразит потрапляє з течією крові в інші органи. У процесі множин-
ного поділу виникають мерозоїти, які започатковують утворення веге-
тативних форм, а також цист.
Культивування. Токсоплазми ростуть у курячих ембріонах, що
розвиваються. Звичайно краплину перитонеального ексудату мишей,
заражених токсоплазмами, вводять у курячий ембріон; заражений
ембріон гине на 5—6-й день. Токсоплазми розмножуються в спеціаль-
них культурах тканин при температурі 37—39 °С. Добрий ріст буває
в обертових пробірках, що містять тканини ембріонів мишей і людини.
Для культивування токсоплазм використовують морських свинок,
мишей, кролів, ховрахів, хом’яків. При внутрішньоочеревинному
зараженні лабораторних тварин токсоплазми виявляють у вакуолях
макрофагів у вигляді окремих особин або невеликих груп; надалі
токсоплазми траптяються позаклітинно. У макрофагах паразіпи
розмножуються вчутріштім брунькуванням з утворенням двох дочір-
ніх клітин(ендозоїти). Ядро набуває гантелеподібної або підковопо-
дібної форми. З’являються мембранні структури дочірніх клітин, по-
тім оболонка материнської клітини розривається і вивільняються
дві дочірні клітини.
Резистентність. Токсоплазми малостійкі до дії факторів зовнішньо-
го середовища (висока температура, висихання, опромінення) і дезин-
фікуючих речовин. Вони довго зберігаються тільки в організмі свій-
ських та диких тварин і членистоногих. При низьких температурах
токсоплазми залишаються життєздатними від кількох хвилин до кіль-
кох діб; нагрівання при температурі 45—60 °С призводить до їх заги-
белі протягом 5—15 хв.
Патогенність для тварин. Токсоплазми патогенні для багатьох
видів свійських і диких тварин та птахів. їх виявлено у собак, котів,
свиней, овець, кролів, морських свинок, зайців, ховрахів, пацюків,
мишей, полівок, мавп, а також у деяких птахів (голубів, курей, глуха-
рів, тетеруків).
Щодо контагіозності і вірулентності токсоплазми мають штамоспе-
цифічність, варіантів у них не виявлено. Збудником усіх форм токсо-
плазму в людей і тварин більшість дослідників вважають один вид —
Т. £ОПСІІІ.
У свійських тварин захворювання проявляється у вигляді гаряч-
ки, розладу дихання, діареї, паралічів нервової системи, передчасних
родів, абортів, яловості. На розтині у загиблих тварин виявляють пнев-
монію, виразки кишок, некротичні вогнища в печінці, збільшення лім-
фатичних вузлів, наявність ексудату.
Патогенез захворювання в людини. Токсоплазмоз — дуже поши-
рене захворювання. Трапляється в усіх країнах. Токсоплазмами інва-
421
зійовано 1/4—1/3 населення земної кулі, найбільша зараженість спо-
стерігається у Центральній Африці і Південній Америці (60—90 %).
Людина заражуеться від собак, особливо тих, яких тримають у роз-
плідниках, від котів, овець та інших тварин.
Найчастіше зараження настає аліментарним шляхом при вживанні
в їжу м’яса, молока, молочних продуктів від хворих на токсоплазмоз
тварин, сирих яєць від ураженої захворюванням птиці, а також воли,
інфікованої токсоплазмами. У деяких випадках збудники можуть
проникнути в організм тварин і людей при укусі членистоногих (кліщі,
одежні воші) і кровососних комах, які є механічними перенощикамн.
Зараження може статись повітряно-краплинним і повітряно-пиловим
шляхом через ушкоджену шкіру і слизові оболонки (порожнини рота,
дихальних шляхів, піхви, кон’юнктиви). Можливий трансплацентар-
ний шлях зараження. Описано випадки інфікування працівників
лабораторій, акушерів, гінекологів і хірургів, які стикаються з кро-
в’ю хворих або заразним матеріалом.
Токсоплазмоз може бути природженим і набутим. Характерними
ознаками природженого токсоплазмозу є висока (39—40 °С) або суб-
фебрильна температура тіла, гідро- або мікроцефалія, наявність вог-
нищ звапнування у головному мозку, ураження органа зору (хоріоре-
тиніт), цироз печінки, збільшення селезінки, пневмонія, ентероколіт,
нефрит, гепатит.
У тих випадках, коли захворювання не призводить до летального
кінця, у дітей залишаються необоротні зміни в центральній нервовій си-
стемі, внутрішніх органах, кістках скелета, що стає причиною глибоких
порушень фізичного і психічного розвитку і призводить до олігофренії,
шизофренії, епілепсії та ін.
При безсимптомному токсоплазмозі у матері в перші 3 місяці вагіт-
ності заражуеться плід, що призводить до аборту або мертвонаро-
дження.
У дорослих токсоплазмоз може проявлятись у вигляді плямисто-
папульозного висипу, що покриває все тіло, за винятком долонь,
підошов і волосистої частини голови. Досить часто бувають пневмонія,
ентероколіт, нефрит, гепатит, висока або субфебрильна температура
тіла. У багатьох хворих розвиваються ураження очей (хоріоїдит,
перифлебіт судин сітківки, неврит зорового нерва та ін.). Набутий
токсоплазмоз характеризується різноманітністю клінічних форм. При-
ховані форми виявляються тільки за допомогою серологічних реакцій.
Досить часто захворювання має хронічну форму з проявами алергії.
Антитіла, що виробляються організмом, не забезпечують захисту від
збудника.
Імунітет постінфекційний, слабко напружений, нестерильний;
титри антитіл у сироватці крові і молоці хворих матерів невисокі.
Лабораторна діагностика. Мікроскопічне дослідження проводять
для виявлення токсоплазм у рідинах або тканинах хворих людей
і тварин. Із центрифугатів спинномозкової рідини, плеврального ексу-
дату роблять мазки і забарвлюють їх за Романовським — Гімзою;
при пневмонії досліджують мокротиння, у деяких випадках роблять
бактеріоскопію кісткового мозку і біопсованих лімфатичних вузлів;
422
із трупного матеріалу досліджують як рідини, так і тканини печінки,
головного і спинного мозку, селезінки, легень та інших органів.
Біологічні проби на токсоплазмоз роблять зараженням кров’ю,
спинномозковою рідиною, емульсією із шматочків тканини у мозок або
очеревину сприйнятливих тварин — білих мишей, пацюків, морських
свинок, кролів, ховрахів, голубів. У заражених тварин звичайно роз-
вивається гостре захворювання; миші гинуть на 7—10-у добу. З З—
4-ї доби після зараження у черевній порожнині починає нагромаджу-
ватись багато ексудату і токсоплазм; паразитів виявляють у різних
органах і тканинах, зокрема у тканині мозку. У разі негативних ре-
зультатів пасирування роблять 3—4 рази. За зараженими мишами
наглядають протягом 2 тижнів, за морськими свинками — 6 тижнів.
Найбільш ефективним і специфічним методом лабораторної діаг-
ностики є серологічне дослідження. Використовують РЗК, РІФ,
РИГА, реакцію з барвником Себіна — Фельдмана.
Алергічна внутрішньошкірна проба з токсоплазмом малоспецифіч-
на. Позитивний результат розглядають як орієнтовну вказівку на ін-
фікованість організму токсоплазмами, проте він не дає можливості
оцінити активність процесу. Результати проби враховують через
43 год; розміри еритеми мають бути в межах 10 х 10 мм. У дітей
віком до 2 років, в ослаблених осіб із зів’ялою шкірою і в старих людей
шкірну пробу не роблять, бо вона часто буває негативною.
Лікування. Застосовують хлоридин у поєднанні з сульфаніламід-
ними препаратами (сульфадимезин та ін.) відповідно до інструкції для
лікування токсоплазмозу; добрі результати бувають при застосуванні
хінгаміну.
Профілактика. Весь комплекс заходів для попередження токсо-
плазмозу здійснюють спільно з ветеринарною службою. Якщо в райо-
нах з природною вогнищевістю є захворювання на токсоплазмоз, зни-
щують диких тварин, виявляють хворих і носіїв серед свійських тва-
рин, ізолюють їх і лікують. Найбільшу небезпеку становлять бродя-
чі собаки і коти, яких треба знищувати.
М’ясо хворих тварин і птиці з підозрою на наявність токсоплазм
під/іають старанній термічній обробці, молоко кип’ятять, яйця варять
протягом 5 хв. У місцях, де є випадки захворювання на токсоплазмоз,
роблять систематичну дератизацію для знищення пацюків і хатніх
мишей. Трупи свійських і диких тварин, що загинули від токсоплазмо-
зу, «бливають гасом або іншими дезинфікуючими речовинами і зако-
пують на глибину не менш як 1,5 м у спеціальних скотомогиль-
никах.
Серед населення ведуть санітарно-освітню роботу для роз’яснення
правил особистої гігієни (миття рук перед їдою, після стикання з тва-
ринами і продуктами тваринного походження). Обов’язкова достатня
тривалість термічної обробки м’ясних продуктів (особливо печінки).
Важливе епідеміологічне значення має запобігання контактам лю-
дей, особливо вагітних жінок, з фекаліями котів.
Велику увагу приділяють попередженню заражень професійного
характеру у працівників ветеринарної служби, боєнь, м’ясокомбіна-
тів, тваринницьких ферм, птахофабрик, доярок, мисливців па промис-
423
лових диких тварин, працівників лабораторій. Осіб цих професій
треба періодично обстежувати і в разі виявлення серед них хворих
проводити повний курс лікування.
Робляться спроби виготовити вакцинні препарати проти токсо-
плазмозу.
Для профілактики природженого токсоплазмозу жінок, у яких
в анамнезі є мимовільні аборти, передчасні роди, мертвонародження,
а також народження дітей з виродливостями, піддають лабораторному
обстеженню на токсоплазмоз.
ВІЙКОВІ (ІНФУЗОРІЇ)
Війкові (Сеііаіа, яеи Іпїизогіа) пересуваються за допомогою війок,
мають ротовий і вихідний отвори. Патогенний для людини вид— Ва-
Іапіісііит соїі.
ЗБУДНИК БАЛАНТИДІАЗУ
В. соїі — єдина паразитична інфузорія людини з класу Кіпеіо-
Гга^тіпоріїогеае. У людини спричиняє балантидіаз. Відкрита в 1857 р.
шведським лікарем П. Мальмстеном.
Морфологія. Розміри тіла балантидії (трофозоїт) можуть бути
різними— завдовжки від 50—70 до 200 мкм, завширшки від 40 до
70 мкм.
Тіло балантидії (рис. 119) несиметричне, овальної форми, вкрите
війками, передній кінець більш загострений, ніж задній, є ротовий
отвір (перистом), що веде в короткий стравохід; біля рота розташовані
крупні війки. Коло заднього кінця тіла є анальна пора — цитопіг.
Під пелікулою (оболонкою) міститься тонкий шар альвеолярної екто-
плазми. У зернистій ендоплазмі є ниркоподібний макронуклеус з гу-
стим скупченням хроматину й кількома ядерцями; на вгнутій по-
верхні вміщується мікронуклеус, є дві скоротливі вакуолі. Розмно-
жуються балантидії поперечним поділом.
Рис. 119. Ваіапіі-
сііит соїі.
У кишках людини трофозоїт балантидії ін-
цистується, покривається двошаровою оболон-
кою, під якою зникає війковий покрив. Діаметр
цист 30—60 мкм.
Культивування проводиться в спеціальних
середовищах (МПБ, розведений у 5 раз 0,85 %
розчином натрію хлориду з кінською сироваткою
крові і рисовим крохмалем). Додавання до сере-
довища антибіотиків дає змогу мати культури
балантидіїв вільні від бактеріальної мікрофлори.
Патогенність для тварин. Сприйнятливі до
балантидіазу свійські і дикі свині, мавпи.
Патогенез захворювання в людини. Зара-
ження настає від свійських свиней, у кишках
яких паразитує збудник. В організм людини
424
потрапляють головним чином цисти. Не виключається можливість
проникнення і рухливих (вегетативні форми) балантидіїв, оскільки
вони мають високу стійкість і можуть витримувати дію шлункового
соку протягом 12 год. Паразит може проникати у кровоносні і лімфа-
тичні судини, у м’язову оболонку шлунка.
Балантидії уражують товсту кишку з утворенням виразок і абсце-
сів, спричиняють коліт з кров’ю і слизом у калі. Захворювання супро-
водиться втратою апетиту, головним болем, виснаженням і в окремих
випадках призводить до летального кінця. Буває і безсимптомне пара-
зитоносійство.
Імунітет. Люди мають високу природну резистентність до баланти-
діазу. Механізм розвитку імунітету не вивчено.
Лабораторна діагностика. Для дослідження беруть свіжовиділе-
ний кал хворих. При мікроскопії нефіксованих мазків трофозоїти ви-
являють у вигляді дуже рухливих крупних клітин. Цисти в організмі
людини утворюються рідко і в невеликій кількості, діагностичного
значення не мають.
Лікування. Застосовують хініофон, еметину гідрохлорид, окситет-
рациклін, роблять клізми з нітрату хініну або нітрату срібла.
Профілактика забезпечується здійсненням санітарно-гігієнічних
заходів (захист продуктів і води від забруднення випорожненнями
свиней і додержання правил гігієни при догляді за ними).
МІКРООРГАНІЗМИ ПОРОЖНИНИ РОТА І ЇХ РОЛЬ
У РОЗВИТКУ ДЕЯКИХ ЗАХВОРЮВАНЬ
Порожнина рота є сприятливим середовищем існування для бага-
тьох видів мікроорганізмів. У ній є достатня кількість поживних
речовин, оптимальна температура, слабколужна реакція, стала воло-
гість, що створює сприятливі умови для розмноження мікроорга-
нізмів.
Мікрофлора порожнини рота — це складний природний динаміч-
ний біоценоз постійних і змінних популяцій.
У новонародженого в порожнині рота є мікроорганізми, що по-
трапили туди з родових шляхів матері. У перші тижні життя дитини
порожнину рота заселяють різні мікроорганізми з навколишнього
середовища, харчових продуктів — лактобактерії, грнби роду Сапсіісіа,
нейсерії, стрептококи.
Поява зубів приводить до якісної і кількісної зміни мікрофлори
порожнини рота, створюються умови для розмноження анаеробів у
проміжках між зубами, зубояснових карманах.
В міру розвитку організму, змін в ендокринній, імунній системах,
характері харчування змінюється і склад мікрофлори порожнини
рота.
У порожнині рота дорослої людини виявляють близько 160 видів
мікроорганізмів. Серед них розрізняють аутохтонні, специфічні для
порожнини рота постійні види, і алохтонні, що потрапляють з інших
ділянок організму і навколишнього середовища разом з їжею, водою
і повітрям.
425
Розподіл мікроорганізмів у порожнині рота нерівномірний, що
пов’язано з її анатомо-фізіологічними особливостями. Багато мікро-
організмів виявляють у ділянці шийки зубів, у проміжках між зубами
та в інших ділянках порожнини рота, малодоступних для обмиван-
ня слиною, дії ферменту лізоциму і секреторного імуноглобуліну А,
які є в слині і мокротинні.
Основну масу мікроорганізмів порожнини рота становлять грам-
позитивні і грамнегативні коки та паличкоподібні бактерії, актиномі-
цети, спірохети, мікоплазми. Багато які з них умовно-патогенні,
а також патогенні, що беруть участь у розвитку захворювань порож-
нини рота.
Коки в порожнині рота представлені стрептококами: Бігеріососсиз
заііуагіит, 8. зап^иіз, 8. тиіапз, 8. тіііз, 8. Гаесаііз. Це група мало-
вірулентних зеленячих стрептококів, які розкладають різні вуглеводи
з утворенням молочної та інших органічних кислот.
Мутантний варіант 8. заііуагіиз, який постійно перебуває в порож-
нині рота, продукує нерозчинний у воді біополімер, який складається
з глюкози і декстрину, він сприяє прикріпленню (адгезії, колонізації)
бактерій до поверхні зуба, утворенню зубних бляшок.
8. тіііз накопичується переважно в щілинах між яснами і поверх-
нею зуба, а 8. їаесаііз міститься в яснових борозенках.
Перебувають в порожнині рота також і пептококи (Реріососсиз
азассЬагоІуіісиз, Р. Іапсеоіаіиз та ін.), яких виявляють при різних
місцевих патологічних процесах, в асоціаціях з фузобактеріями і спі-
рохетами; особливо багато їх у яснових борозенках. Ці бактерії ак-
тивно розкладають пептони й амінокислоти і слабко діють на вугле-
води.
Грамнегативні анаеробні коки з роду УеІІопеІІа постійно живуть
у порожнині рота. Вони беруть участь в утворенні зубного нальоту,
але можуть мати і протикаріозну дію. Це зумовлено тим, що вейлонели
розкладають лактат, піруват ацетат та інші продукти обміну вугле-
водів до СО2 і НаО, які, підвищуючи рН середовища, пригнічують
ріст інших мікроорганізмів порожнини рота.
Паличкоподібні грампозитивні і грамнегативні бактерії представ-
лені родами ЬасіоЬасііІиз, Васіегоідез, ЕизоЬасіегіит та ін.
Лактобактерії (ЬасіоЬасіІІиз сазеі) при розкладанні вуглеводів
утворюють велику кількість молочної кислоти, яка сприяє розвит-
кові карієсу зубів.
Бактероїди (Васіегоідез те1апіпо£епісиз, В. їга£ІІіз, В. £іп§іуа-
Ііз — строгі анаероби, вони розкладають глюкозу з утворенням су-
міші кислот, продукують колагеназу, фібринолізин, гіалуронідазу та
інші протеолітичні ферменти. В. птеіапіпо£епісиз постійно є в яснових
карманах у дорослих, спричиняючи захворювання пародонта.
Фузобактерії (ЕизоЬасіегіит ріаиіі, Е. регіосіепііситп, Е. писіеаіит)
є аутохтонною (постійною) мікрофлорою порожнини рота. Можуть
утворювати з пептону і глюкози молочну кислоту. Часто виділяються
разом із спірохетами.
Спірохети порожнини рота представлені трепонемами, борелія.ми
і лептоспірами. Найбільше трепонем (Тгеропеша тасгодепНит,
426
Т. огаїе, Т. бепіісоїа, Т. уіпсепіі, Т. Ьиссаііз) трапляється в ясновнх
карманах. В асоціації між собою, а також із фузобактеріями спричи-
няють розвиток виразково-некротичного стоматиту Венсана.
Актиноміцети (Асііпошусез уізсозцз, А. ізгаеііі) постійно є на
слизовій оболонці порожнини рота, беруть участь в утворенні зубного
каменю і зубного нальоту. Разом з іншими мікроорганізмами можуть
зумовлювати розвиток карієсу зубів і захворювань пародонта.
У складі мікрофлори порожнини рота також є лептотрихч, про-
піонобактерії, коринебактерії, мікоплазми та інші мікроорганізми,
кількість яких зростає при різних захворюваннях зубів і пародонта.
Зубний наліт. У біохімічних процесах, що відбуваються
в емалі, особливо важливе значення має структура м’якого зубного
нальоту — пелікули. У нормі зубний наліт має близько 80 % води,
зв’язаної з білком, 20 % глікопротеїдів, 1—2 % декстрину, кальцій,
фосфор, калій, натрій, фтор, фосфатази, протеази, колагеназн, гіалу-
ронідазу та інші ферменти, в основному бактеріального походження.
Колонії різних видів мікроорганізмів, що становлять основну масу
пелікули, містяться в органічному матриксі, який складається з глі-
копротеїдів слини, білків і частково з позаклітинних полісахаридів
бактерій. Участь мікроорганізмів в утворенні пелікули не обов’язкова,
але присутність їх активізує весь процес.
Позаклітинні полісахариди бактерій впливають на мікрофлору
зубного нальоту, збільшують його кислотний_склад і тим самим підви-
щують розчинність емалі зубів, знижуючи її резистентність.
Бактерії пелікули і слини синтезують із сахарози, що надходить
у порожнину рота з їжею, біополімери, які започатковують утворення
зубних бляшок.
Зубні бляшки — це скупчення бактерій у матриксі орга-
нічних речовин, що складаються з білків і полісахаридів, які щільно
прикріплені до поверхні зуба. Першою стадією утворення зубної
бляшки є формування пелікули. Процес адгезії різних мікроорганіз-
мів (коки, паличкоподібні, спірохети) на поверхні зубів відбувається
протягом кількох годин, кількість бактеріальних клітин швидко
збільшується, вони утворюють скупчення — «кукурудзяні качани».
На початку утворення зубної бляшки превалюють аеробні мікроорга-
нізми (стрептококи, коринебактерії, актиноміцети), які створюють
умови для розвитку строгих анаеробів.
Різні зубні бляшки в порожнині рота можуть мати різну мікрофло-
ру. Це свідчить про те, що кожна зубна бляшка формується векологіч-
пій ніші з своєю динамічною мікрофлорою.
Певне значення в утворенні зубних бляшок має кількість вугле-
водів, які є в харчових продуктах. Розщеплення бактеріями вугле-
водів і азотистих речовин призводить до утворення молочної, оцтової,
пропіонової, мурашиної та інших органічних кислот, що беруть участь
в утворенні зубних бляшок.
Отже, утворення зубного нальоту і зубних бляшок — складний
динамічний процес, у якому мікроорганізми відіграють провідну
роль.
427
ЗАХВОРЮВАННЯ ПОРОЖНИНИ РОТА, СПРИЧИНЮВАНІ
МІКРООРГАНІЗМАМИ
Карієс зубів — патологічний процес у твердих і м’яких тканинах
зуба, що супроводиться запальними явищами і призводить до утво-
рення дефекту у вигляді порожнини.
Етіологію цього захворювання і досі остаточно не з’ясовано.
Одні вчені вважають, що в основі карієсу зубів лежить порушення
мінерального обміну в емалі, інші надають великого значення поси-
ленню протеолітичних реакцій у тканинах зуба, які призводять до
збіднення їх на білки, особливо амінокислоти (лізин, аргінін) і тіамін
(вітамін Вг). Надмірний вміст у їжі вуглеводів (сахарози) супрово-
диться процесом бродіння з утворенням молочної, масляної та оцто-
вої кислот, які призводять до демінералізації зуба.
При недодержанні правил гігієни порожнини рота зубний наліт
стовщується внаслідок розмноження постійно населяючих порожни-
ну рота мікроорганізмів і приєднання нових бактерій. Цьому сприяє
наявність глікопротеїдів і декстринів. Структура зубного нальоту має
велике значення у розвитку карієсу; на її основі формується складна
екологічна система. Звичайна мікрофлора порожнини рота (гриби,
стрептококи, стафілококи та ін.), що має протеолітичну дію, розмно-
жується в пелікулі, а надалі вона розчиняється, і бактерії по емале-
вих пластинках і проміжках між емалевими призмами можуть про-
никнути в глиб емалі у напрямі до дентину. Розм’якшену емаль роз-
чиняють ферменти бактерій, і утворюється каріозна порожнина.
Каріозний процес у дентині поширюється швидше, ніж в емалі.
Це пояснюється тим, що в дентині менше неорганічних речовин (солей
вапна) У канальцях (трубочках) дентину закладені відростки одонто-
бластів з малозвапнованою основною речовиною дентину, яка є спри-
ятливим середовищем для розмноження мікроорганізмів, що прони-
кають за ходом канальців (трубочок) дентину в напрямі до пульпи.
Під впливом токсинів бактерій змінюються дентннні волокна, які
набувають темного кольору при забарвлюванні гематоксилін-еози-
ном. У результаті декальцинації основної речовини дентину кислотами
виникають структурні порушення, утворюються тріщини (щілинні
простори), які заповнюються детритом і бактеріальною масою.
Мікроорганізми, що проникли до пульпи, призводять до ушко-
дження одонтобластів з наступною атрофією їх. Повільніше форму-
вання карієсу коренів зуба пояснюється тим, що у змертвілій пульпі
сповільнюються розмноження і просування мікроорганізмів унаслідок
гнильних процесів, які відбуваються в лужному середовищі.
Головними агентами в утворенні карієсу є 8. тиіапз, 8. запдиіз,
життєдіяльність яких залежить від середовища, в якому вони живуть.
Якщо в їжі немає сахарози або її мало, названих мікроорганізмів
у зубному нальоті менше; а при підвищенні концентрації сахарози
в їжі вони швидко розмножуються і накопичуються.
У розвитку карієсу певне значення має слиновиділення. В осіб із
зниженим виділенням слини підвищується захворюваність на карієо.
428
Як уже зазначалося, слина запобігає збільшенню зубного нальоту,
регулює розчинність кальцію і фосфатів емалі, є буферним механізмом
у кислотоутворенні в нальоті, містить секреторні імуиоглобуліни
класу А, які знижують інтенсивність каріозного процесу гладенької
поверхні зубів.
Отже, процес карієсу визначається багатьма факторами: наявністю
певної мікрофлори, складом їжі, слиновиділенням, відстанню між зу-
бами, а також генетичними, гуморальними та іншими факторами.
Посиленню карієсу зубів сприяє надмірний вміст у питній воді
фтору (понад 1 мг/л), який порушує обмінні процеси. При цьому роз-
вивається флюороз зубів — емаль втрачає твердість, стає крихкою,
ділянки емалі і дентинуТвідламуються.
Залежно від швидкості перебігу каріозного процесу розрізняють
гострий і хронічний карієс, останній найчастіше буває у зрілому віці.
Лікування. Застосовують антибактеріальні препарати (пеніцилін,
лінкоміцин, хлоргексидин та ін.). Деякі з цих лікарських засобів
додають у жувальну гумку і в рідини для полоскання рота. Однак
тривале застосування антибактеріальних засобів призводить до
збільшення лікарсько-резистентних штамів мікрофлори порожнини
рота, іноді до дисбактеріозу. Найефективнішим із застосовуваних за-
собів є хлоргексидин, який знижує загальну концентрацію мікрофлори
порожнини рота, пригнічує ріст і розмноження каріогенних видів бак-
терій, зв’язується з гідрокінатитом емалі і має пролонговану дію.
Профілактика полягає у здійсненні загальних і місцевих заходів.
Один із найважливіших факторів запобігання карієсу — забезпе-
чення раціонального (збалансованого) харчування, тобто певного
кількісного співвідношення в їжі білків, вуглеводів, жирів, міне-
ральних солей і вітамінів. Велике значення мають солі кальцію,
фосфору, вітаміни (ретинол, аскорбінова кислота, тіамін, ергокальци-
ферол), ультрафіолетове опромінювання, особливо для жінок під час
вагітності для нормального розвитку і формування організму дитини
та її зубощелепної системи.
Як протикаріозні заходи рекомендуються використання 75 %
фтористої пасти; обробка зубів у школярів фтористим лаком і ремо-
дентом, що містить багато мікро- і макроелементів; використання жу-
вальної гумки з ферментами (лактатдегідрогеназа й інвертаза), які
розчиняють зубний наліт; регулярне чищення зубів; планова санація
порожнини рота, вживання твердої їжі, яка сприяє самоочищенню
зубів і рота й тонізує жувальний апарат. До профілактичних заходів
належить також видалення зубного нальоту і каменю,які є основними
факторами у виникненні карієсу гладенької поверхні зубів і періо-
донта. Чищення зубів щіткою в поєднанні з іншими механічними за-
собами (полоскання) забезпечує звільнення зубів від бактерій.
Ведуться дослідження для відтворення специфічного імунітету до
8. заііуагіиз створенням вакцини. Антитіла, що утворюються, пере-
шкоджають мікроорганізмам прикріплюватись до поверхні зубів і за-
побігають утворенню нальоту.
Періодонтит — запалення м’яких і твердих тканин, які оточують
зуб, що спричиняє порушення прикріплення до нього колагенових
429
волокон. У цьому процесі, на думку більшості дослідників, основну
роль відіграють мікроорганізми, які проникають у періодонт по ка-
налу зуба з вогнища запалення пульпи, між стінкою альвеоли і коре-
нем зуба при пародонтозі, а також при загальній гематогенній інфекції.
Тверді тканини зуба руйнуються з участю мікроорганізмів, що
призводять до запалення пульпи (пульпіт) та її некрозу, а потім —
до запалення тканин, які оточують корінь зуба, тому періодонтит
досить часто є ускладненням пульпіту. Коли ексудат витікає через
канал кореня, розвивається хронічна форма періодонтиту; якщо утво-
рюється пробка, що закриває канал кореня зуба і порушує витікання
ексудату з періодонта, створюються умови для розвитку гострого
періодонтиту. Під впливом токсичних речовин, які надходять із по-
рожнини зуба, виникають гіперемія і набухання тканини, потім у пе-
ріодонт проникають мікроорганізми, запальний процес набирає гній-
ного характеру і призводить до розплавлення періодонтальних зв’я-
зок і рухливості зуба.
Якщо протягом тривалого часу тканина ясен зазнає дії зростаючих
скупчень зубного нальоту, то вона руйнується під впливом різних
видів бактерій і продуктів їх обміну (ферменти, токсини). Так, на-
приклад, Васіегоісіез теїапіпо^епісиз продукує колагеназу, яка
руйнує колаген — основний білковий компонент тканини періодонта.
Цей мікроорганізм разом з дифтероїдами, фузобактеріями виробляє
протеолітичні ферменти, які беруть участь у розвитку періодонтиту.
Під впливом гіалуронідази відбувається гідроліз гіалуронової кисло-
ти — глікозаміноглікану сполучної тканини, що є в періодонті Дру-
гим глікозаміногліканом, що є в кісткових хрящах та інших сполучних
елементах, є хондроїтинсульфатаза, яка продукується бактеріями
родів Уеіііопеїіа, Тгеропета, Васіегоісіез. Вона має властивість інду-
кувати запалення, дегранулювання мастоцитів, фагоцитоз, вивільняти
лізосомні ферменти з клітин вогнищ запалення сполучної тканини.
Ендотоксини цих бактерій стимулюють збільшення кількості мак-
рофагів у ясновій борозенці, що беруть участь у фагоцитозі, і вивіль-
нення лізосомних ферментів, які ушкоджують тканину періо-
донта .
У виникненні періодонтиту беруть участь ейконели (Еікепеїіа
соггегіепз), грамнегативні, умовно-патогенні бактерії, що є представ-
никами нормальної мікрофлори порожнини рота і верхніх дихальних
шляхів і можуть в асоціації із стрептококами, стафілококами та ін-
шими мікроорганізмами спричиняти різні запальні процеси в порож-
нині рота. Особливо тяжкий перебіг (іноді з летальним кінцем) має
періодонтит у людей похилого віку, уражених хронічними й соматич-
ними захворюваннями. При зниженні захисних сил організму періо-
донтит може ускладнюватись періоститом і остеомієлітом щелепи.
Лікування передбачає створення відтікання, механічну й анти-
септичну обробку каріозної порожнини, порожнини зуба, каналу
кореня зуба бактерицидними пастами або фосфат-цементом, застосу-
вання діатермокоагуляції, ультразвуку, антибіотиків та ін.
Гінгівіт — запалення слизової оболонки ясен; може бути травма-
тичним, інфекційним, алергічним.
Інфекційний гінгівіт спричиняється мікроорганізмами, які є в зуб-
430
йому нальоті. У виникненні виразково-некротичного гінгівіту беруть
участь фузобактерії, спірохети (ЕизоЬасіегіит ріаиіі, Тгеропета уіп-
сепіі та ін.), віруси, які зумовлюють гострий запальний процес, що
супроводиться різкою гіперемією ясен, утворенням ділянок некрозу.
В етіології гінгівітів певну роль відіграють стафілококи, негемолітнч-
ні стрептококи, пептококи, вейлонели, актиноміцети, бактероїди.
Лікування комплексне, передбачає протизапальні і дезинфіку-
ючі засоби (перекис водню, кортикостероїди), десенсибілізуючі пре-
парати.
Профілактика полягає в додержанні особистої гігієни порожнини
рота, усуненні факторів, які спричиняють запальні процеси, санації
порожнини рота.
Пародонтоз (альвеолярна піорея) — захворювання тканин, що
оточують зуб, супроводиться розсмоктуванням кісткової тканини зуб-
них альвеол, гінгівітом. Пародонтозом уражені близько 50 % людей
віком за ЗО років.
Основними проявами пародонтозу є гінгівіт та альвеолярна гноє-
теча. У виникненні захворювання великого значення надають пору-
шенню живлення тканин пародонта, яке призводить до руйнування
зв’язкового апарату зуба і заміщення його грануляціями, рухливості
й випадання зуба. При гнійно-запальних процесах у щелепно-лицьо-
вій ділянці найчастіше виявляють стафілококи (ЗО—60 %), стрепто-
коки (15—35 %), при гнійних процесах — стафілококи (ЗО—50 %).
Певну роль у патогенезі пародонтозу відіграють перенесені раніше
інфекції (грип, ангіна, кір, скарлатина, дифтерія та ін.),сенсибілізація
організму різними алергенами, гіповітамінози та інші захворювання,
які спричиняють ушкодження дрібних судин.
Прогресуванню пародонтозу сприяє хронічний одонтогенний за-
пальний процес, який зумовлює постійне всмоктування продуктів
життєдіяльності бактерій, що локалізуються у яснових карманах,
розвиток запалення регіонарних лімфатичних вузлів і стан алергії.
Навколозубні запальні процеси при хронічному перицементиті
і пародонтозі є прихованими вогнищами інфекції, джерелами постій-
ного інфікування та інтоксикації організму хворого. Вони зумовлю-
ють стан хроніосепсису і підтримують перебіг ревматизму,хронічного
і септичного ендокардиту, захворювань нирок та інших органів.
Для лікування гострої одонтогеиної інфекції застосовують гіпер-
баричну оксигенізацію, ультрафіолетове опромінювання, хіміотера-
пію, протизапальні засоби, санацію порожнини рота.
Стоматит — запалення слизової оболонки порожнини рота. Спри-
чиняється хімічними, механічними, термічними факторами, лікар-
ськими засобами та біологічними агентами (бактерії, гриби, віруси).
Розрізняють катаральний і виразково-гангренозний стоматит.
У розвитку катарального стоматиту як вторинні етіологічні фактори
беруть участь і мікроорганізми. Виразково-гангренозний стоматит
виникає при недостатньому харчуванні У вогнищах запалення ви-
являють фузобактерії і трепонеми Венсана.
Лікування проводять препаратами пеніциліну, тетрацикліну,
аскорбіновою кислотою і вітамінами групи В.
431
Навчальне видання
Пяткін Кирил Дмитрович
Кривоше'ін Юрій Семенович
МІКРОБІОЛОГІЯ З ВІРУСОЛОГІЄЮ
І ІМУНОЛОГІЄЮ
Оправа художника Є Г Рцбльова
Художній редактор С. В. Аннєнков
Технічний редактор 0. В. Козлітіна
Коректор Н. А. Дарда
Здано до набору 30.09 91. Підписано до друку 28 07.92. Формат 60X90'/,,. Папір друк.
Вид? Л«.^ Фарбовідб. 27.25. Обл.-вид. арк. 32.16+0.23 Форз.
Видавництво «Вища школа», 252054. Київ-54. вул. Гоголівська, 7
Книжкова ф-ка їм. М. В. Фрунае, 310057, ХаркІв-57, вул. Донець-Закаожевського. 6/8.