Автор: Преч Э. Бюльманн Ф. Аффольтер К.
Теги: органическая химия химия органические соединения переводная литература издательство мир методы в химии спетральные данные таблицы данных
ISBN: 5-94774-572-0
Год: 2006
ОПРЕДЕЛЕНИЕ СТРОЕНИЯ
ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
ТАБЛИЦЫ СПЕКТРАЛЬНЫХ ДАННЫХ
E. Pretsch, Р. BOIImann, С. Affolter
STRUCTURE DETERMINATION
OF ORGANIC COMPOUNDS
Tables of Spectral Data
Third Completely Revised and Enlarged English Edition
Springer
Э. Преч, Ф. Бюльманн, К. Аффольтер
ОПРЕДЕЛЕНИЕ СТРОЕНИЯ
ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
Таблицы спектральных данных
Перевод с английского
канд. хим. наук Б. Н. Тарасевича
Москва
Издательство «Мир»
БИНОМ. Лаборатория знаний
2006
УДК 547
ББК 24.23я2
П71
Преч Э.
П71 Определение строения органических соединений. Таблицы
спектральных данных / Э. Преч, Ф. Бюльманн, К. Аффоль-
тер. — Пер. с англ. — М.: Мир; БИНОМ. Лаборатория знаний,
2006. — 438 с.: ил. — (Методы в химии)
ISBN 5-94774-572-0 (Бином. ЛЗ)
ISBN 5-03-003586-9 (Мир)
ISBN 3-540-67815-8 (англ.)
Справочное издание, написанное специалистами из Швейцарии
и Японии и выдержавшее за рубежом несколько переизданий, посвяще-
но одному из важнейших разделов современной органической химии —
определению строения органических соединений. Главная роль в реше-
нии подобных задач принадлежит спектроскопическим методам анали-
за. Книга содержит представительную подборку спектральных данных
(ЯМР 13 С, ЯМР *Н, ИК спектроскопия, масс-спектрометрия, спектро-
скопия в видимой и УФ областях). Материал представлен в удобной,
наглядной форме. Таблицы включают необходимые комментарии.
Для химиков-органиков и специалистов в смежных областях науки,
а также для аспирантов, дипломников и студентов, избравших своей
специальностью органическую химию.
УДК 547
ББК 24.23я2
Редакция литературы по химии
ISBN 5-94774-572-0 (Бином. ЛЗ)
ISBN 5-03-003586-9 (Мир)
ISBN 3-540-67815-8 (англ.)
Translation from English language
edition: Structure Determination of
Organic Compounds by E. Pretsch,
P. Biihlmann, C. Affolter
Copyright © Springer-Verlag Berlin Heideberg 2000.
Springer-Verlag is a company
in the BertelsmannSpringer publishing
group
All Rights Reserved
© Перевод на русский язык,
«Мир», 2006
Предисловие
В то время как современные методики ядерного магнитного резонанса и
масс-спектрометрии изменяют приемы обработки результатов измерений, зна-
чительно расширяя возможности этих методов, такие основные параметры, как
химические сдвиги, константы спин-спинового взаимодействия и пути фраг-
ментации остаются неизменными. Этим объясняется продолжающийся успех
ранних изданий книги. Поскольку за прошедшие годы объем эксперименталь-
ных данных значительно увеличился, мы решили подготовить совершенно но-
вую рукопись. Главная концепция в ней остается прежней — обеспечить пред-
ставительный, хотя и ограниченный набор справочных данных, необходимых
для интерпретации спектров ЯМР 13С, ЯМР 1Н, ИК, масс-спектров, УФ и ви-
димых спектров. В то же время книга подверглась ряду изменений. Количество
справочного материала было почти удвоено (особенно для масс-спектрометрии
и ИК), а расположение и отбор данных для разных спектроскопических мето-
дов теперь строго следуют одной схеме.
К сожалению, среди нас больше нет наших учителей и коллег профессо-
ров Вильгельма Симона и Томаса Клерка, а профессор Джозеф Сейбл ушел
в отставку. Они внесли неоценимый вклад в разработку концепции книги и в
ее более ранние издания. Мы благодарны многочисленным коллегам, которые
оказывали разнообразную помощь в завершении рукописи. В особом долгу мы
находимся перед д-ром Доротеей Вегманн за тщательную проверку и исправ-
ление многочисленных ошибок и несоответствий, которые были в первых вер-
сиях. Мы благодарны д-ру Ричу Ноченмуссу (Высшая политехническая школа,
Цюрих) за представленные масс-спектры MALDI матричных материалов, д-ру
Кикуко Хайямизу за ее помощь в работе с базой данных Национального инсти-
тута материалов и химических исследований (Япония), профессору Бернгарду
Яуну и д-ру Мартину Бадерчеру (Высшая политехническая школа, Цюрих) за
критическое прочтение отдельных частей рукописи.
Несмотря на большие усилия по исправлению ошибок и многочисленные
проверки, весьма вероятно, что некоторые погрешности и неточности еще оста-
лись. Нам хотелось бы призвать наших читателей к контактам с комментари-
ями и предложениями по любым проблемам, возникающим при использова-
нии книги или предлагаемых программ по следующим адресам: проф. Егпб
Pretch, Laboratry of Organic Chemistry, CH 8092 Zurich, Switzerland, e-mail:
pretsch@org.chem.ethz.ch, или проф. Philippe Biihlmann, Department of Chemistry,
University of Minnesota, 207 Pleasant St., SE, Minneapolis, MN 55455, USA,
e-mail: buhlmann@chem.umn.edu.
Цюрих и Токио, август 2000
1 Введение
1.1 Содержание и структура книги
Предлагаемый справочный материал служит для интерпретации молекуляр-
ных спектров при установлении и подтверждении структуры органических со-
единений. В книге представлены таблицы данных, спектры и эмпирические
корреляции в спектроскопии ядерного магнитного резонанса (ЯМР) 13С и 1Н,
в инфракрасной спектроскопии (ИК), масс-спектрометрии (МС) и спектроско-
пии в ультрафиолетовой (УФ) и видимой областях. Она должна рассматри-
ваться в качестве дополнения к учебникам или руководствам по отдельным
методам спектроскопии. При использовании этой книги для интерпретации
спектров от читателя требуется знакомство только с основами методов, однако
книга построена таким образом, что может служить в качестве справочника и
для опытных специалистов.
В гл. 2 и 3 содержатся обзорные и комбинированные таблицы наиболее важ-
ных спектроскопических характеристик структурных элементов. В то время
как материал в гл. 2 расположен в соответствии с различными методами спек-
троскопии, в гл. 3 для каждого структурного элемента сгруппирована спек-
троскопическая информация, полученная разными методами. Эти две главы
помогут читателям, менее подготовленным в области интерпретации спектров,
идентифицировать классы структурных элементов (функциональные группы)
в исследуемых пробах. В следующих четырех главах представлены данные
по ЯМР (13С и ХН) и ИК спектрам, а также масс-спектрам. Этот материал
расположен в стандартной последовательности в соответствии с типами соеди-
нений. Представленные данные относятся к разным углеродным скелетам (ал-
кильным, алкенильным, алкинильным, алициклическим, ароматическим, гете-
роароматическим), к наиболее важным заместителям (галогенам, кислороду с
одинарной связью, азоту, сере, карбонильной группе) и некоторым конкретным
классам соединений (разделы “Другие соединения” и “Природные соединения”).
Наконец, для каждого метода представлены подборки спектров стандартных
растворителей, вспомогательных веществ (таких как матрицы или стандарты)
и обычно наблюдаемых примесей. Не только строгий порядок расположения
данных, но так же и метки на краях страниц помогают быстро находить инфор-
мацию по различным спектроскопическим методам. Хотя в настоящее время
роль спектроскопии в УФ и видимой областях для оценки структуры невелика,
ее значение может возрасти с появлением новых более совершенных методов
анализа. Кроме того, данные, представленные в гл. 8, полезны при разработке
оптических сенсоров и широко применяемых в хроматографии и электрофоре-
зе датчиков в УФ и видимой областях.
Поскольку значительная часть табличных данных получена либо в резуль-
тате наших собственных измерений, либо на основании обработки большого
массива литературных данных, обширные ссылки на опубликованные источни-
1.1. Содержание и структура книги
7
ки в книгу не включены. Всюду, где возможно, приведенные данные относятся
к стандартным методикам и условиям измерений. Например, если не указан
растворитель, то химические сдвиги в ЯМР измерены в дейтерохлороформе
или четыреххлористом углероде, а ИК спектры измерены в таких неполярных
растворителях, как хлороформ или сероуглерод. Масс-спектры зарегистриро-
ваны при ионизации электронным ударом при 70 эВ.
Хотя в основном структура предыдущих изданий сохранена, в это издание
введены многочисленные дополнения. В результате общий объем данных уве-
личился более чем вдвое. Раздел масс-спектрометрии (МС) полностью обнов-
лен и содержит уникальное собрание правил фрагментации различных классов
соединений. Новой особенностью являются прототипы ИК спектров для каж-
дого класса органических соединений с указанием аналитически значимых по-
лос поглощения. Комбинированные таблицы, по сравнению с более ранними
изданиями, расширены и размещены в двух главах: в первой — в соответствии
с положением полос, а во второй — по классам органических соединений.
8
1. Введение
1.2 Сокращения и символы
al alk alken APT алифатический алкильный алкенильный Attached Proton Test, тест на количество присоединенных протонов
ar as ax comb COSY ароматический асимметричный аксиальный комбинационная (составная) частота Correlation SpectroscopY, корреляционная ^-спектроскопия ЯМР
d DEPT дублет Distorsionless Enhancement by Polarization Transfer, усиление без искажений с помощью переноса поляризации
eq FAB Frag gem Hal INEPT экваториальный Fast Atom Bombardment — бомбардировка быстрыми ядрами фрагмент геминальный галоген Insensitive Nuclei Enhanced by Polarization Transfer, низкочувствительные ядра, усиленные с помощью переноса поляризации
ip J m+- m/z oop sh st sy vic ДМС МЛДИ плоскостное колебание константа спин-спинового взаимодействия (ССВ) молекулярный ион-радикал отношение массы к заряду внеплоскостное колебание плечо полосы валентное колебание симметричный вицинальный диметилсульфоксид матричная лазерная десорбционная ионизация (MALDI — matrix assisted laser desorbtion ionization mass spectra)
CCB TMC 7 § ё e V спин-спиновое взаимодействие тетраметилсилан скелетное колебание ЯМР: химический сдвиг ИК: деформационное колебание коэффициент молярного поглощения частота
2 Обзорные таблицы
2.1 Общие сведения
2.1.1 Определение числа эквивалентов двойных связей
из молекулярной формулы1
Общее уравнение:
2 + Eni(vi-2)
эквиваленты двойных связей =---!— -------
ni — число атомов элемента i в молекулярной формуле
Vj — формальная валентность элемента i
Краткая форма:
Для соединений, содержащих только С, Н, О, N, S и галогены, предлагается
следующий быстрый и простой способ расчета числа эквивалентов двойных
связей:
1. О и двухвалентная S удаляются из молекулярной формулы.
2. Галогены замещаются атомами водорода.
3. Трехвалентный N замещается группой СН.
4. Полученная молекулярная формула углеводорода СПНХ сравнивается с
молекулярной формулой насыщенного углеводорода СпН2п+2- Каждый
эквивалент двойной связи уменьшает число атомов водорода на 2:
2п + 2 — х
эквиваленты двойных связей =--------
1 В отечественной литературе эту величину называют степенью ненасыщенности. —
Прим. пер.
10 2. Обзорные таблицы
2.1.2 Свойства некоторых ядер
Изотоп Естест- Спи- Резонанс- Относи- Относи- Электричес-
венное новое ная часто- тельная тельная кий квадру-
содер- кван- та [МГц] чувстви- чувстви- польный
жание товое при тельность тельность момент
[%] число I 2,35 Тесла ядра при естест- венном со- держании [е • 10-24 см2]
*н 99,985 1/2 100,0 1 1
2Н 0,015 1 15,4 9,6 • 10~3 1,5 • 10“6 2,8 • 10“3
3Н 0,000 1/2 106,7 1,2 0
10В 19,58 3 10,7 2,0 10~2 3,9 • 10~3 7,4 10“2
пв 80,42 3/2 32,1 1,6 • 10-1 1,3 • ю-1 3,6 10“2
13с 1,108 1/2 25,1 1,6 10~2 1,8 10~4
14N 99,635 1 7,3 1,0 10“3 1,0 10“3 1,9 • 10~2
15N 0,365 1/2 10,1 1,0 10“3 3,8 • 10“6
17О 0,037 5/2 13,6 2,9 • 10-2 1,1 • 10~5 -2,6 • 10“2
19р 100,000 1/2 94,1 8,3 • IO"1 8,3 -10“1
31р 100,000 1/2 40,5 6,6 • 10“2 6,6 10-2
33S 0,76 3/2 7,6 2,3 • 10“3 1,7 • 10“5 -6,4 10“2
117Sn 7,61 1/2 35,6 4,5 • 10“2 3,4 • 10“3
119Sn 8,58 1/2 37,3 5,2 10“2 4,4 • 10“3
195Pt 33,8 1/2 21,5 9,9 КГ3 3,4 10“3
i"Hg 16,84 1/2 17,8 5,7 10~3 9,5 • 10“4
207pb 22,6 1/2 20,9 9,2 10“3 2,1 10“4
2.2. Спектроскопия ЯМР 13С 11
2.2 Спектроскопия ЯМР 13С
Области химических сдвигов б для атомов углерода в разном хи-
мическом окружении {6 в м. д. относительно ТМС. Обозначения атомов
углерода: Q для СН3, Т для СН2, D для CH, S для С)
240 220 200 180 160 140 120 100 80 60 40 20 0 м. д.
н3с-с- н3с-с=х Н3С-С«Х "а
H3c-S- Fi
-с-сн2-с- Т
—C-CH2-S- ЕЕ1
Йсн-9- D
Н3С-СОХ; X = С, О, N 1 Н
-с=с- D,S
СН3С1 1 о
Jc'CH-s- D
h3c-n' Q
\|/ \|/ о а Я а о /к /|\ S
-ССН2СОХ; X = С, О, N Т
Г^СНСОХ; X = С, О, N г Е]
-c-ch2-n' EEJ
М/ \1/ а а Я а и /|\ 1 S
-С-СН2С1 0
|§:ch-n' D
ЭС...СОХ; X = С, О, N эс. cs S
н3с-о-
5C.-.NC эс'асе S
1с;сн'с1 D
h3c-no2 SI
240 220 200 180 160 140 120 100 80 60 40 20 0 м. д.
12 2. Обзорные таблицы
240 220 200 180 160 140 120 100 80 60 40 20 0 м. д.
-C-CHg-O- [ т"
С >
-c-ch2-no2 с т
- \|/ о о 0 ии /1\ л\ S
j£:ch-no2 II 1
1 w du /1\ /1\ с S 1
XI/ \|/ о о Л О /1' о м с S
н:с=сС н L т
Х=любой заместитель D
S
। । оо о /\ Т, D, О
^С-Х; X = любой заместитель S
/=С,Х N С X = любой заместитель *-с LI
- C-N J
с=^х Nt X = любой заместитель
II D, S
г>— >>N >>N 0
а,(3-ненасыщ. СОХ; X=O,N,C1 Е
а,Р-ненасыщ. СООН Е
-С-СОХ; X = О, N, С1 । D
-с-соон О
а,Р-ненасыщ. СОН Е 1
-С-CSX; X = О, N г_
а,Р-ненасыщ. Х'С=О 0
-с-сно °1
1с'с=о II
Sc:c=s S —
240 220 200 180 160 140 120 100 80 60 40 20 0 м. д.
2.2. Спектроскопия ЯМР 13С 13
Химические сдвиги ядер 13 С карбонильных групп (6 в м. д. относитель-
но ТМС)
R R-CHO R-СОСНз R-COOH R-COQ-
-Н 197,0 199,7 166,3 171,3
-СН3 200,5 206,7 176,9 182,6
—СН2СН3 202,7 207,6 180,4 185,1
-СН(СН3)2 204,6 211,8 184,1
-С(СН3)3 205,6 213,5 185,9 188,6
—н-С8Н17 202,6 207,9 180,7 183,1
-СН2С1 193,3 200,1 173,7 175,9
-СНС12 193,6 170,4 171,8
-СС13 176,9 186,3 167,1 167,6
—циклогексил 204,7 209,4 182,1 185,4
-сн=сн2 194,4 197,5 171,7 174,5
-с=сн 176,8 156,5
—фенил 192,0 196,9 172,6 177,6
R R-СООСНз r-conh2 R-COOCO—R R-COC1
-н 161,6 167,6 158,5
-сн3 171,3 173,4 167,4 170,4
-СН2СН3 173,3 177,2 170,3 174,7
-СН(СН3)2 177,4 172,8 178,0
-С(СН3)з 178,8 180,9 173,9 180,3
—н-С8Н17 174,4 176,3 169,4 173,8
-СН2С1 167,8 168,3 162,1 167,7
-СНС12 165,1 157,6 165,5
-СС1з 162,5 154,1
—циклогексил 175,3 177,3 176,3
-СН=СН2 166,5 168,3 165,6
-с=сн 153,4
—фенил 166,8 169,7 162,8 168,0
14 2. Обзорные таблицы
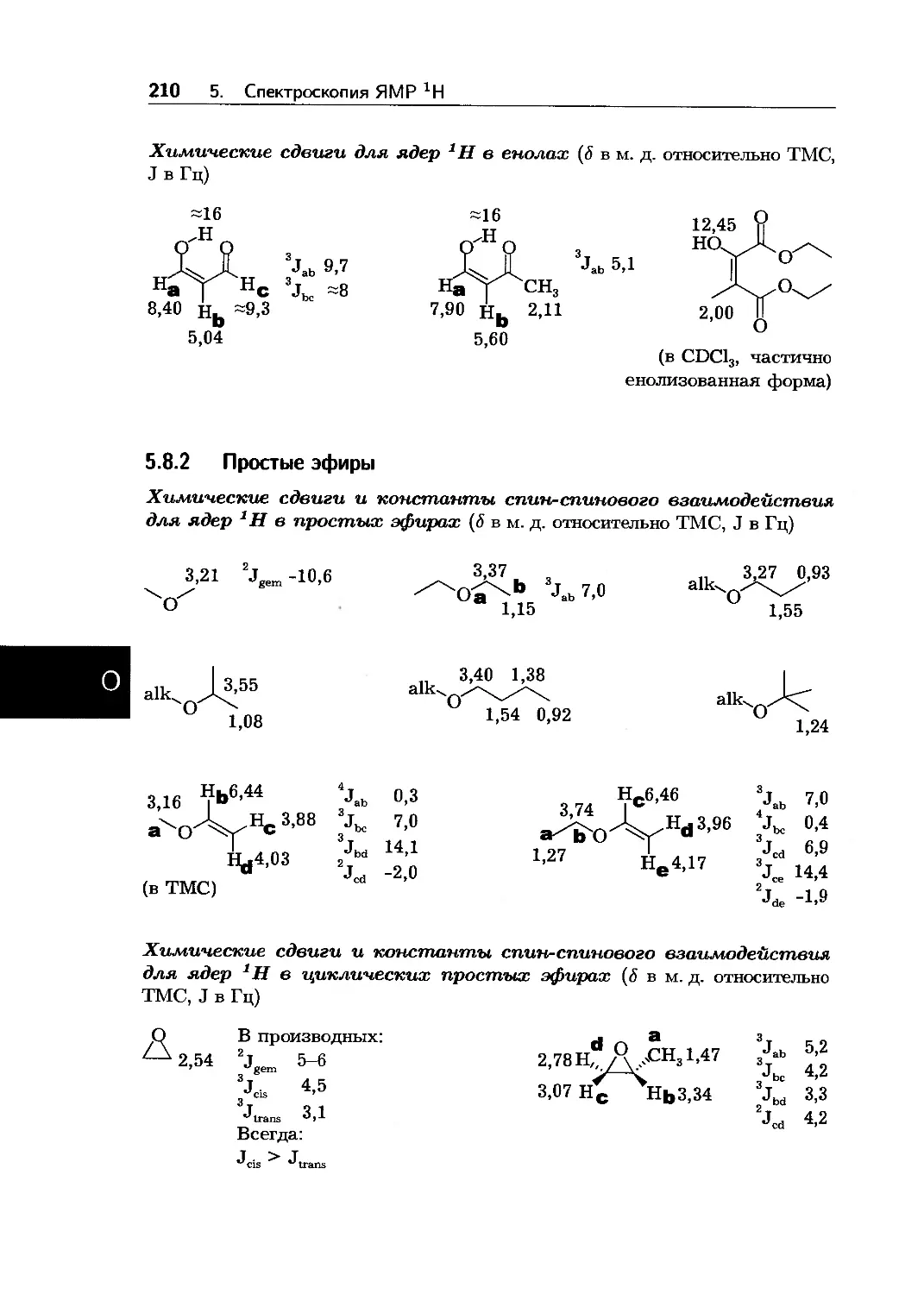
2.3 Спектроскопия ЯМР гН
Области химических сдвигов для ядер 1Н в различном химическом
окружении (5 в м. д. относительно ТМС)
14 13 12 11 10 9 8 7 6 5 4 3 2 1 0 м. д.
д
1 ✓ -с-г^
жон
н3с-<5-
К
HS-C-
Се
5£:сн-с-
НзС;с=с^
н^"'сёсс
?g:cH-c-c
,я H3C-S^ Н3С-С^
ИзС^О
/ о, , H3C-N4 ;с-сн2-с-
н2с:®“ нгс3с=сс
-С-СН20 -
ЭС 'Р эс'сн-с;
ЭС'СН\-Д
|£:ch-n' -c-ch2-n'
14 13 12 11 10 9 8 7 6 5 4 3 2 1 0 м. д.
2.3. Спектроскопия ЯМР 1Н 15
14 13 12 11 10 9 8 7 6 5 4 3 2 1 C M. Д.
H3C-N-CO
0 иг С-С— -С; И\ И2С'С=О
। С— -c-ch2-n-co h2c:s
Ъс-сн2-0
н С~'с=о НгС;С=О 1
HS-Q
н3с-оч
о. а zc ch2 s4 zc-ch2-nx к:
h2c:n>
С-СН2-С1 -с-сн2-ох IE JI
о н3с.од □I
н2с;|1 и JI
СУсщч^ I JI
ОСН2О й'с1Н<со IE JI
Ох I M
1^с=с^ L
О'0112-5' IE JI
^ch2-n н2с:^ C JI
д
>С'СН2'О°- 5С:СН“°х C JI
|^:сн-а
H2c":gc^ ^cifci c
ХснР"
-C-CH2-NO2 '^:CIbNO2 □
14 13 12 11 10 9 8 7 6 5 4 3 2 1 0 м. д.
16 2. Обзорные таблицы
14 13 12 11 10 9 8 7 6 5 4 3 2 1 0 м. д.
^2^-СНг-а
н2с:°3
H2c:gZ
О"он
h2s:9 Z ч,—
Zg:cibo4 ci-ch2-n' 1
^2^-CH2-Ov
^:ch-o-c; 1
ZO-CH2X
-N-CO H
Zo-CH2C1
H; гетероаром. CH c
,„.H. x- ,..H. О N O' О
... r- гетероаром. NH
О чЛн
-C=N'OH
-CHO
-COOH ^^1
14 13 12 11 10 9 8 7 6 5 4 3 2 1 0 м. д.
2.4. ИК спектроскопия 17
2.4 ИК спектроскопия
Диапазоны волновых чисел для важнейших полос поглощения в ИК
области
3500 3000 2500 2000
1500 1000 500 см
о—Н st EJ — — — — tj—
+ MM
N-H. N-H st
=с—Н st
-С—Н st
-С-Н st
S-H st
B-Hst
X=Y st
X=Y=Z st
P—H st 1
Si—H st
C=O st
C=N st
C=C st 1 1
N=O st
NO2 st ГИ 1И~
N-H8
B-о st
C-N st
C—F st
S=O st
C-O st | «И
P=O st
C=S st
P—О st
N-O st
=C-H 8
COOH 8 П
S—О st У"1
3500 3000 2500 2000
1500 1000 500 см’
18 2. Обзорные таблицы
Диапазоны волновых чисел для полос поглощения карбонильных групп
в ИК области (в см~1)
2.4. И К спектроскопия 19
1900 1850 1 800 1 750 1 700 1 650 1600 1 550 см'
О a]A)-c*C
О х-сАэ'81 о=° о 1 н — ——
hnanh о^Аэ 3 по лос 'Ь I
О час зю 2 ПС л ОС ы
о а1ЛО'аг
о<*0*О
о xAQ-al
Н>=о М
0к> 0*О —
О Х^ Л C^al j
® О ^с-^н
О О akAAal
О °'C'C''C'U'O'al
О аАо'а’
О al'O^O-3' 1
о al*O'tl'S'al
о ^сАыН-а!
0k> Ok) 1 1
о аГ^Н
О O^NH
р р аГЫ
рх о <Э-а1
оАД*О Н
1900 1850 1800 1750 1700 1650 1600 1550 см
20 2. Обзорные таблицы
1! )00 If 50 If 100 17 50 17 00 16 50 16 00 15 50 см >0 см1
«Y о ф
о alxAs,ar
о о аЛсАаг
О аАон (ДимеР) 1
О с-сЛо^ IJ
о аг О
о о аААа.
О °<-с,С.-сАо,а1 (сложный эфир)
О akO^NH-al
О О аА4 '“'‘al
О aAal
>=О Я Я
О о (сложный ЭФИР) 11
о о с. и и 'С ОН аг ОН
О akOAS'al Е и
О аАн С 11
О Сг„А V Н С 11
О О '“‘с'“'сг'а1 (кетон) № 11
о ar^'al
о и NH2 (в растворе)
О ^NH (в растворе)
о akS^NH-al гни
Л NH (6-членные и более крупные циклы)
о С'<Аа1 СИ
/=\ о=< >о Г Т 2=1 ^^О
1900 18 50 18 00 17 50 17 00 1650 16 30 15£
2.4. И К спектроскопия 21
1900 1850 1800 1750 1700 1650 1600 1 550 см'
О ^*NH (в Растворе)
1
о
о аг^аг □I
и, 'и О=< ,и и’ □I
° rN5 Л L >=° HN NH NH :
О
о—нон С-'сЛон □1
о ar'SANH-ar Е1
О akS^NH-ar П
О О aAAal п
О ar.gA.g,al п
О akgJkg,al п
0 ^NH., (тв.) []
оя'о О-Н--О | al^^^O'* al'^x^'al il □
J
О .Ло® L J
о о аЛо©
1900 1850 1800 1 750 1 700 1650 1 600 1 550 см
22 2. Обзорные таблицы
2.5 Масс-спектрометрия
2.5.1 Средние массы встречающихся в природе элементов, точные
массы ядер изотопов и относительная распространенность
изотопов (в % по отношению к наиболее распространенному
изотопу) [1-3]
Элемент Элемент
Изотоп Масса Отн. распр. Изотоп Масса Отн. распр.
Н 1,00795“ F 18,998403
!Н 1,007825 1006 19р 18,998403 100
2Н 2,014101 0,0115
(в воде) Ne 20,1798“
20Ne 19,992402 100b
Не 4,002602“ 21Ne 20,993847 0,30
3Не 3,016029 0,000137 22Ne 21,991386 10,22
4Не 4,002603 100 (в воздухе)
(в воздухе)
Na 22,989769
Li 6,941“ 23Na 22,989769 100
6Li 6,015122 8,21е
7Li 7,016004 100 Mg 24,3051
24 Mg 23,985042 100
Be 9,012182 25 Mg 24,985837 12,66
9Be 9,012182 100 26Mg 25,982593 13,94
В 10,812“ Al 26,981538
10в 10,012937 24,8Ь 27 Al 26,981538 100
пв 11,009306 100
Si 28,0855“
с 12,0108“ 28Si 27,976927
12с 12,000000 100 29Si 28,976495 5,0778
1зс 13,003355 1,08 30Si 29,973770 3,3473
N 14,00675“ P 30,973762
14n 14,003070 100 31p 30,973762 100
15n 15,000109 0,369
S 32,067“
о 15,9994“ 32s 31,972071 100
16о 15,994915 100 33s 32,971459 0,80
17о 16,999132 0,038 34S 33,967867 4,52
18о 17,999116 0,205 36S 35,967081 0,02
2.5. Масс-спектрометрия 23
Элемент Изотоп Масса Отн. pacnp. Элемент Изотоп Масса Отн. pacnp.
С1 35,4528 Мп 54,938050
35С1 34,968853 100b 55Мп 54,938050 100
37С1 36,965903 31,96
Fe 55,845
Аг 39,948“ 54Fe 53,939615 6,370
36 Аг 35,967546 0,3379 56Fe 55,934942 100
38 Аг 37,962776 0,0635 57Fe 56,935399 2,309
40 Аг 39,962383 100 58Fe 57,933280 0,307
(в воздухе)
Co 58,933200“
К 39,0983 59Co 58,933200 100
39к 38,963706 100
4°К 39,963999 0,0125 Ni 58,6934
41к 40,961826 7,2167 58Ni 57,935348 100
e°Ni 59,930791 38,5198
Са 40,078 61 Ni 60,931060 1,6744
40Са 39,962591 100 62Ni 61,928349 5,3388
42Са 41,958618 0,667 64Ni 63,927970 1,3596
43Са 42,958769 0,139
44Са 43,955481 2,152 Cu 63,546
46Са 45,953693 0,004 63 Cu 62,929601 100
48Са 47,952534 0,193 65Cu 64,927794 44,57
Sc 44,955910 Zn 65,39
45Sc 44,955910 100 64Zn 63,929147 100
66 Zn 65,926037 57,37
Ti 47,867 67 Zn 66,927131 8,43
46Ti 45,952629 11,19 68Zn 67,924848 38,56
47Ti 46,951764 10,09 70Zn 69,925325 1,27
48Ti 47,947947 100
49Ti 48,947871 7,34 Ga 69,723
50Ti 49,944792 7,03 69Ga 68,925581 100b
71Ga 70,924705 66,367
V 50,9415
50y 49,947163 0,250 Ge 72,61
Sly 50,943964 100 70Ge 69,924250 56,44
72 Ge 71,922076 75,91
Cr 51,9962 73Ge 72,923459 21,31
5°Cr 49,946050 5,187 74Ge 73,921178 100
52Cr 51,940512 100 76Ge 75,921403 20,98
53Cr 52,940654 11,339
54Cr 53,938885 2,823 As 74,921596
75 As 74,921596 100
24 2. Обзорные таблицы
Элемент Элемент
Изотоп Масса Отн. pacnp. Изотоп Масса Отн. pacnp.
Se 78,96 Mo 95,94
74Se 73,922477 1,79 92Mo 91,906810 61,50
76Se 75,919214 18,89 94Mo 93,905088 38,33
77 Se 76,919915 15,38 95Mo 94,905841 65,98
78Se 77,917310 47,91 96Mo 95,904679 69,13
80Se 79,916522 100 97Mo 96,906021 39,58
82Se 81,916700 17,60 98Mo 97,905408 100
100Mo 99,907478 39,91
Br 79,904
79Br 78,918338 100 Ru 101,07
81 Br 80,916291 97,28 96Ru 95,907599 17,56
98Ru 97,905288 5,93
Kr 83,80 "Ru 98,905939 40,44
78Kr 77,920387 0,61b 100Ru 99,904229 39,94
80Kr 79,916378 4,00 101Ru 100,905582 54,07
82Kr 81,913485 20,32 102Ru 101,904350 100
83Kr 82,914136 20,16 104Ru 103,905430 59,02
84 Kr 83,911507 100
86 Kr 85,910610 30,35 Rh 102,905504
(в воздухе) 103Rh 102,905504 100
Rb 85,4678 Pd 106,42
85Rb 84,911789 100 102Pd 101,905608 3,73
87Rb 86,909183 38,56 104Pd 103,904036 40,76
l°5pd 104,905084 81,71
Sr 87,62“ 106pd 105,903484 100
84Sr 83,913425 0,68 108Pd 107,903894 96,82
86Sr 85,909262 11,94 IWpd 109,905151 42,88
87Sr 86,908879 8,48
88Sr 87,905614 100 Ag 107,8682
107 Ag 106,905094 100
Y 88,905848 109 Ag 108,904756 92,90
89y 88,905848 100
Cd 112,412
Zr 91,224 106 Cd 105,906459 4,35
90 Zr 89,904704 100 108Cd 107,904184 3,10
91Zr 90,905645 21,81 110Cd 109,903006 43,47
92Zr 91,905040 33,33 ulCd 110,904182 44,55
94Zr 93,906316 33,78 112Cd 111,902757 83,99
96 Zr 95,908276 5,44 113Cd 112,904401 42,53
114Cd 113,903358 100
Nb 92,906378 116Cd 115,904755 26,07
93Nb 92,906378 100
2.5. Масс-спектрометрия 25
Элемент Элемент
Изотоп Масса Отн. распр. Изотоп Масса Отн. распр.
In 114,818 Cs 132,905447
1131п 112,904061 4,48 133Cs 132,905447 100
115In 114,903879 100
Ba 137,328
Sn 118,711 130Ba 129,906311 0,148
112Sn 111,904822 2,98 132Ba 131,905056 0,141
114Sn 113,902782 2,03 134Ва 133,904503 3,371
115Sn 114,903346 1,04 135 Ва 134,905683 9,194
116Sn 115,901744 44,63 136Ва 135,904570 10,954
117Sn 116,902954 23,57 137Ва 136,905821 15,666
118Sn 117,901606 74,34 138Ва 137,905241 100
119Sn 118,903309 26,37
120Sn 119,902197 100 La 138,9055
121Sn 121,903440 14,21 138La 137,907107 0,090
124Sn 123,905275 17,77 139La 138,906348 100
Sb 121,760 Се 140,116
121Sb 120,903818 100 136Се 135,907145 0,209
123Sb 122,904216 74,79 138Се 137,905991 0,284
140Се 139,905434 100
Те 127,60 142Се 141,909240 12,565
120Te 119,904021 0,26
122Te 121,903047 7,48 Рг 140,907648
123Te 122,904273 2,61 141Рг 140,907648 100
124Te 123,902819 13,91
125Te 124,904425 20,75 Nd 144,24
12бТе 125,903306 55,28 142Nd 141,907719 100
128Te 127,904461 93,13 143Nd 142,909810 44,9
130Te 129,906223 100 144Nd 143,910083 87,5
145Nd 144,912569 30,5
I 126,904468 146Nd 145,913112 63,2
127j 126,904468 100 148Nd 147,916889 21,0
150Nd 149,920887 20,6
Xe 131,29
124Xe 123,905896 0,ЗЗь Sm 150,36
126Xe 125,904270 0,33 144Sm 143,911995 11,48
128Xe 127,903530 7,14 147 Sm 146,914893 56,04
129Xe 128,904779 98,33 148Sm 147,914818 42,02
130Xe 129,903508 15,17 149Sm 148,917180 51,66
131Xe 130,905082 78,77 150Sm 149,917271 27,59
132Xe 131,904154 100 152Sm 151,919728 100
134Xe 133,905395 38,82 154Sm 153,922205 85,05
136Xe 135,907221 32,99
26 2. Обзорные таблицы
Элемент Изотоп Масса Отн. pacnp. Элемент Изотоп Масса Отн. pacnp.
Ей 151,964 171 Yb 170,936322 44,86
151Еи 150,919846 91,61 172Yb 171,936378 68,58
153Eu 152,921226 100 173Yb 172,938207 50,68
174Yb 173,938858 100
Gd 157,25 176Yb 175,942568 40,09
152Gd 151,919788 0,81
154Gd 153,920862 8,78 Lu 174,967
155Gd 154,922619 59,58 175Lu 174,940768 100
156Gd 155,922120 82,41 176Lu 175,942682 2,66
157Gd 156,923957 63,00
158Gd 157,924101 100 Hf 178,49
160Gd 159,927051 88,00 174Hf 173,940040 0,46
176Hf 175,941402 14,99
Tb 158,925343 177Hf 176,943220 53,02
i59Tb 158,925343 100 178Hf 177,943698 77,77
179Hf 178,944815 38,83
Dy 162,50 180Hf 179,946549 100
156Dy 155,924279 0,21
158 Dy 157,924405 0,35 Ta 180,9479
160Dy 159,925194 8,30 180Ta 179,947466 0,012
161Dy 160,926930 67,10 181Ta 180,947996 100
162Dy 161,926795 90,53
163Dy 162,928728 88,36 W 183,84
164Dy 163,929171 100 180W 179,946707 0,40
181,948206 86,49
Ho 164,930319 182,950224 46,70
165Ho 164,930319 100 184^y 183,950933 100
185,954362 93,79
Er 167,26
162Er 161,928775 0,42 Re 186,207
164 Er 163,929197 4,79 185 Re 184,952956 59,74
166Er 165,930290 100 187Re 186,955751 100
167Er 166,932045 68,22
168Er 167,932368 79,69 Os 190,23
170Er 169,935460 44,42 184Os 183,952491 0,05
1860s 185,953838 3,90
Tin 168,934211 187Os 186,955748 4,81
169Tm 168,934211 100 188Os 187,955836 32,47
189Os 188,958145 39,60
Yb 173,04 190Os 189,958445 64,39
168Yb 167,933894 0,41 192Os 191,961479 100
170Yb 169,934759 9,55
2.5. Масс-спектрометрия 27
Элемент Изотоп Масса Отн. pacnp. Элемент Изотоп Масса Отн. pacnp.
1г 192,217 204Hg 203,973476 23,00
1911г 190,960591 59,49
193 Jj. 192,962924 100 Т1 204,3833
203 202,972329 41,892
Pt 195,078 205 rpj 204,974412 100
190pt 189,959931 0,041
192 Pt 191,961035 2,311 Pb 207,2“
194Pt 193,962664 97,443 204Pb 203,973029 2,7
195Pt 194,964774 100 206Pb 205,974449 46,0
196Pt 195,964935 74,610 2°7pb 206,975881 42,2
198Pt 197,967876 21,172 208Pb 207,976636 100
Au 196,966552 Bi 208,980383
197 Au 196,966552 100 209Bi 208,980383 100
Hg 200,59 Th 232,038050
196Hg 195,965815 0,50 232Th 232,038050 100
198Hg 197,966752 33,39
199Hg 198,968262 56,50 U 238,0289
200Hg 199,968309 77,36 234u 234,040946 0,0055d
201 Hg 200,970285 44,14 235jj 235,043923 0,73
202Hg 201,970626 100 238jj 238,050783 100
“ Колебания изотопного состава природных материалов не позволяют дать бо-
лее точное значение.
ь Продаваемые реактивы могут существенно отличаться по изотопному соста-
ву, если они подвергались изотопному разделению по неизвестной технологии
или недостаточно аккуратно.
с Материалы, обедненные 6Li, служат сырьем для лабораторных реактивов и,
как известно, содержат от 2,0007 до 7,672 атомных процентов 6Li. Содержа-
ние 6 Li в природных объектах находится в верхней части данного интервала.
Средние атомные массы изменяются в пределах от 6,939 до 6,996; если тре-
буется более точная величина, она должна быть определена для конкретного
материала.
d Материалы, обедненные 235U, служат сырьем для лабораторных реактивов.
28 2. Обзорные таблицы
2.5.2 Диапазоны распространенности природных изотопов
некоторых элементов [3]
Элемент Диапазон Элемент Диапазон Элемент Диапазон
Изотоп распр. (ат. %) Изотоп распр. (ат. %) Изотоп распр. (ат. %)
Н Si Се
!Н 99,9816-99,9975 28Si 92,21-92,25 136Се 0,186-0,185
2Н 0,0184-0,0025 29Si 4,69-4,67 138Се 0,254-0,251
30Si 3,10-3,08 140 Се 88,449-88,446
Не 142Се 11,114-11,114
3Не 4,6 • 10-8-0,0041 s
4Не 100-99,9959 32s 94,537-95,261 Nd
33s 0,787-0,731 142Nd 27,30-26,80
Li 34s 4,655-3,993 143Nd 12,32-12,12
6Li 7,21-7,71 36s 0,021-0,015 144Nd 23,97-23,795
7 Li 92,79-92,29 145Nd 8,35-8,23
Cl 146Nd 17,35-17,06
В 33 Cl 75,64-75,86 148Nd 5,78-5,66
юв 18,927-20,337 37 Cl 24,36-24,14 150Nd 5,69-5,53
nB 81,073-79,663
Ca Hf
С 40Ca 96,982-96,880 174Hf 0,1621-0,1619
12c 98,85-99,02 42Ca 0,656-0,640 176Hf 5,271-5,206
13c 1,15-0,98 43Ca 0,146-0,131 177Hf 18,606-18,593
44Ca 2,130-2,057 178Hf 27,297-27,278
N 46Ca 0,0046 0,0031 179Hf 13,630-13,619
14N 99,890-99,652 48Ca 0,200-0,179 180Hf 35,100-35,076
15N 0,411 0,348
V Pb
О 50y 0,2502-0,2487 204Pb 1,65-1,04
16O 99,7384-99,7756 51y 99,7513-99,7498 2°6pb 27,48-20,84
17o 0,0399-0,0367 2°7pb 23,65-17,62
18o 0,2217-0,1877 Cu 208Pb 56,21-51,28
63 Cu 69,24-68,98
Ne 65Cu 31,02-30,76 и
20Ne 90,514-88,47 234u 0,0059-0,0050
21Ne 1,71-0,266 Sr 235U 0,7202-0,7198
22Ne 9,96-9,20 84Sr 0,58-0,55 238 p 99,2752-99,2739
86Sr 9,99-9,75
87 Sr 7,14-6,94
88Sr 82,75-82,29
2.5. Масс-спектрометрия 29
2.5.3 Изотопный состав элементов, встречающихся в природе
н 1 He 4 Li 7 Be 9 В 11 C 12
N О F Ne Na Mg
14 16 19 20 23 24
А1 Si P S Cl Ar
27 28 31 32 . 35 40
К Ca Sc Ti V Cr
39 40 45 48 51 52
Мп Fe Co Ni Cu Zn
55 56 59 । 58 I 63 1 1 64
Ga 1 Ge As Se Br Kr
69 1 74 75 I 80 79 1 84
Rb Sr Y Zr Nb II M°
I 85 88 89 1 1 90 93
Ru Rh Pd Ag I Cd In
102 103 I | 106 107 II 1 114 115
Sn Sb Те I 1 Xe Cs
120 121 I 130 127 1 132 133
Ba La Ce Pr 1 1 Nd 1 Sm
138 139 140 141 llll 142 llll 1 152
Eu 1 Gd Tb ll Dy Ho ll Er
153 158 159 164 165 1 166
Tm 1 Yb Lu 1 Hf Ta I W
169 III 1 174 175 III 180 181 ll 184
Re Os Ir 1 1 Pt Au I Hg
187 ill 192 1 193 195 197 ll 1 202
T1 Pb Bi Th U
205 J 208 209 232 238
Масса наиболее распространенного изотопа помещена под символом элемента.
Пик самого легкого изотопа показан на левом конце оси х.
30 2. Обзорные таблицы
2.5.4 Вычисление распределения изотопов
Характерные распределения интенсивностей пиков, возникающие из комбина-
ции двух и более полиизотопных элементов, можно вычислить на основании
данных по относительной распространенности разных изотопов. Следующее
полиномиальное выражение дает распределение изотопов в полиизотопной мо-
лекуле:
{рпА° + раА.<т“~т^ + .. р х
(рлА° + Pj2A.^~m^ + . .р х
где PiX — относительное содержание .т-го изотопа элемента г, mix — масса .т-го
изотопа элемента г, показатель степени пг означает число атомов элемента г
в молекуле. Расширение этого полинома за счет введения величин ргх и т1Х
для всех изотопов 1,2,3,... элементов данной молекулы приводит к
выражению, которое представляет распределение изотопов:
г/ д А ° + WrA? + wsAs + wtrf + ...,
где величины Wg, wr, ws, Wt, представляют собой относительное содержа-
ние ионов М+’, [М + г]+', [М + s]+’, [М + t]+‘ соответственно. Использова-
ние позволяет определять величины г, s, t,... просто расширением
общего полинома. Численная величина для А, которая не имеет смысла, не
нужна.
Например, для СВггСЬ приведенное выше уравнение приобретает следу-
ющий вид:
При достаточном разрешении величины — тц) и (mJX — т-ц) отли-
чаются друг от друга. Это приводит к очень сложной картине изотопного рас-
пределения даже в случае малых молекул. Так, благодаря существованию 12С,
13С, 79Вг, 81Вг, 35С1 и 37С1 для СВггОг возникает 18 сигналов. Однако в реаль-
ных экспериментах из-за ограниченного разрешения многие пары — тц)
и (mjX — т71) в пределах точности эксперимента становятся неразрешимыми,
что приводит к уменьшению числа отдельных пиков. Например, при единич-
ном разрешении получается, что (msiBr — 7П7эВг) = (гпз7С1 — masci) = 2. Следо-
вательно, выражение для ВгС1 приобретает вид:
{р79ВгА° +psiBrA2} х (рз5С1А° +рз7С1А2} =
р79ВгР35С1А° 4- (рТ9Вгр37С1 +р81Вгрз5С1)А2 + р37С1Р81 ВгА4.
2.5. Масс-спектрометрия 31
Отсюда видно, что при единичном разрешении ВгС1 дает только три пика (М+‘,
[М 4- 2]+', [М + 4]+’), а не четыре, как можно ожидать при очень высоком
разрешении.
Часто вклад изотопов с низким содержанием можно не учитывать без по-
тери точности. Например, влияние 2Н на картину изотопного распределения
обычно незначительно. Аналогично, при анализе серии [М + 2п]+', характер-
ной для галогенов, серы и кремния, на участие 13С можно не обращать вни-
мание. Однако в случае больших молекул изотопами с малым содержанием
пренебрегать нельзя. Например, в масс-спектре фуллерена (Сео) наряду с пи-
ками М+' (относительная интенсивность 100%) и [М + 1]+' (66,72%) наблюда-
ются довольно интенсивные пики [М + 2]+’ (21,89%), [М + 3]+' (4,71%) и даже
[М + 4]+- (0,75%).
Как показано выше, типичные изотопные распределения можно рассчи-
тать вручную, применяя общее уравнение без учета изотопов с низким при-
родным содержанием. Данную процедуру можно легко осуществить с помощью
обычного программного обеспечения, позволяющего проводить простые вычис-
ления. Кроме того, доступны удобные программы, содержащие необходимые
данные о природном содержании изотопов и их массах. Поскольку применение
приведенного выше уравнения для систем с 1000 и более полиизотопных атомов
приводит к чрезмерным затратам времени на вычисления, были разработаны
несколько более сложные, но более эффективные алгоритмы [4]. На следующих
страницах представлены типичные картины изотопных распределений.
32 2. Обзорные таблицы
2.5.5 Изотопные распределения для различных комбинаций
хлора, брома, серы и кремния
Эле- менты Масса Относит. содерж. Эле- менты Масса Относит, содерж. Эле- менты Масса Относит. содерж.
Ch 35 100 Вп 79 100 Si 32 100
37 31,98 81 97,88 33 0,79
34 4,43
С12 70 100 Вг2 158 51,09 S2 64 100
72 63,96 160 100 65 1,58
74 10,23 162 48,93 66 8,87
68 0,24
С13 105 100 Вг3 237 34,05 S3 96 100
107 95,93 239 100 97 2,37
109 30,67 241 97,89 98 13,31
111 3,27 243 31,94 99 0,21
100 0,66
С14 140 77,96 Вг4 316 17,40 S4 128 100
142 100 318 68,09 129 3,16
144 47,82 320 100 130 17,76
146 10,19 322 65,26 131 0,42
148 0,82 324 15,96 132 1,27
С15 175 62,53 Вг5 395 10,43 S5 160 100
177 100 397 51,09 161 3,94
179 63,94 399 100 162 22,22
181 20,45 401 97,94 163 0,70
183 3,28 403 47,89 164 2,08
185 0,21 405 9,38 166 0,11
С16 210 52,12 Вг6 474 5,32 S6 192 100
212 100 476 31,26 193 4,73
214 79,95 478 76,62 194 26,68
216 34,08 480 100 195 1,05
218 8,21 482 73,38 196 3,09
220 1,05 484 28,73 198 0,20
222 0,06 486 4,68
Si! 28 100 Si2 56 100 Sis 84 100
29 5,06 57 10,13 85 15,19
30 3,36 58 6,98 86 10,85
59 0,34 87 1,03
60 0,11 88 0,36
2.5. Масс-спектрометрия 33
Эле- менты Масса Относит, содерж. Эле- менты Масса Относит, содерж. Эле- менты Масса Относит, содерж.
CliBrj 114 76,70 CliBr2 193 43,83 СЬВгз 272 26,15
116 100 195 100 274 85,22
118 24,46 197 69,83 276 100
199 13,66 278 48,90
280 7,86
CliBr4 351 14,26 С12ВГ! 149 61,35 С12Вг2 228 38,35
353 60,41 151 100 230 100
355 100 153 45,67 232 89,63
357 79,93 155 6,38 234 31,89
359 30,39 236 3,90
361 4,25
С13ВГ1 184 51,12 С13Вг2 263 31,35 CLtBri 219 43,79
186 100 265 92,01 221 100
188 65,22 267 100 223 83,86
190 17,73 269 50,01 225 33,42
192 1,74 271 11,70 227 6,93
273 1,03 229 0,48
Cl4Br2 298 24,14 С14Вг3 377 13,63 С14Вг4 456 7,43
300 78,63 379 57,78 458 38,40
302 100 381 100 460 83,70
304 63,54 383 91,19 462 100
306 21,54 385 47,13 464 71,37
308 3,73 387 14,03 466 31,11
310 0,26 389 2,22 468 8,10
391 0,13 470 1,16
CliSi 67 100 CliS2 99 100 Cl2Si 102 100
68 0,79 100 1,58 103 0,79
69 36,41 101 40,85 104 68,39
70 0,25 102 0.57 105 0,50
71 1,44 103 3,08 106 13,08
108 0,47
C12S2 134 100 Cl3Si 137 99,64 C13S2 169 95,42
135 1,58 138 0,79 170 1,51
136 72,82 139 100 171 100
137 1,08 140 0,75 172 1,51
138 16,14 141 34,82 173 37,62
139 0,21 142 0,24 174 0,53
140 1,06 143 4,63 175 5,94
145 0,15 177 0,35
34 2. Обзорные таблицы
Эле- менты Масса Относит, содерж. Эле- менты Масса Относит, содерж. Эле- менты Масса Относит, содерж.
ChSii 63 100 Cl2Sii 98 100 Cl3Si! 133 100
64 5,06 99 5,06 134 5,06
65 35,34 100 67,32 135 99,30
66 1,62 101 3,24 136 4,86
67 1,07 102 12,38 137 33,90
103 0,52 138 1,55
104 0,34 139 4,30
2.5.6 Изотопные распределения для комбинаций хлора и брома
Вг Вг2
’1 । 160
Расстояние
между
сигналами
2 единицы
। । । । । ।
С1 С1Вг С1Вг2
35 J 116 । 195 _ J
Вг3
239
Вг4
320
Вг5
399
J___
СуЗп,
471
С12 С12Вг С12Вг
70 1 122 1. 230
2
CL.Br;
390
С12Вг3
311
С13 С13Вг С13Вг2 С13Вг
105 I _L L 1 186 -L— L. 1 267 1 .L LL 346
3
С13Вг,
427
С14 С14Вг С14Вг2 С14Вг3 С14Вг4
.122 L । 221 1 .L2 1 462
С15
177
С15Вг2
337
ClsBr3
418
С15Вг
256
Расстояние между сигналами составляет 2 единицы массы, комбинации самых
легких изотопов изображены на левом конце оси х. Масса, соответствующая
самому интенсивному сигналу, указана под символом элемента. Точные значе-
ния интенсивностей для многих из этих комбинаций см. в разд. 2.5.5.
2.5. Масс-спектрометрия 35
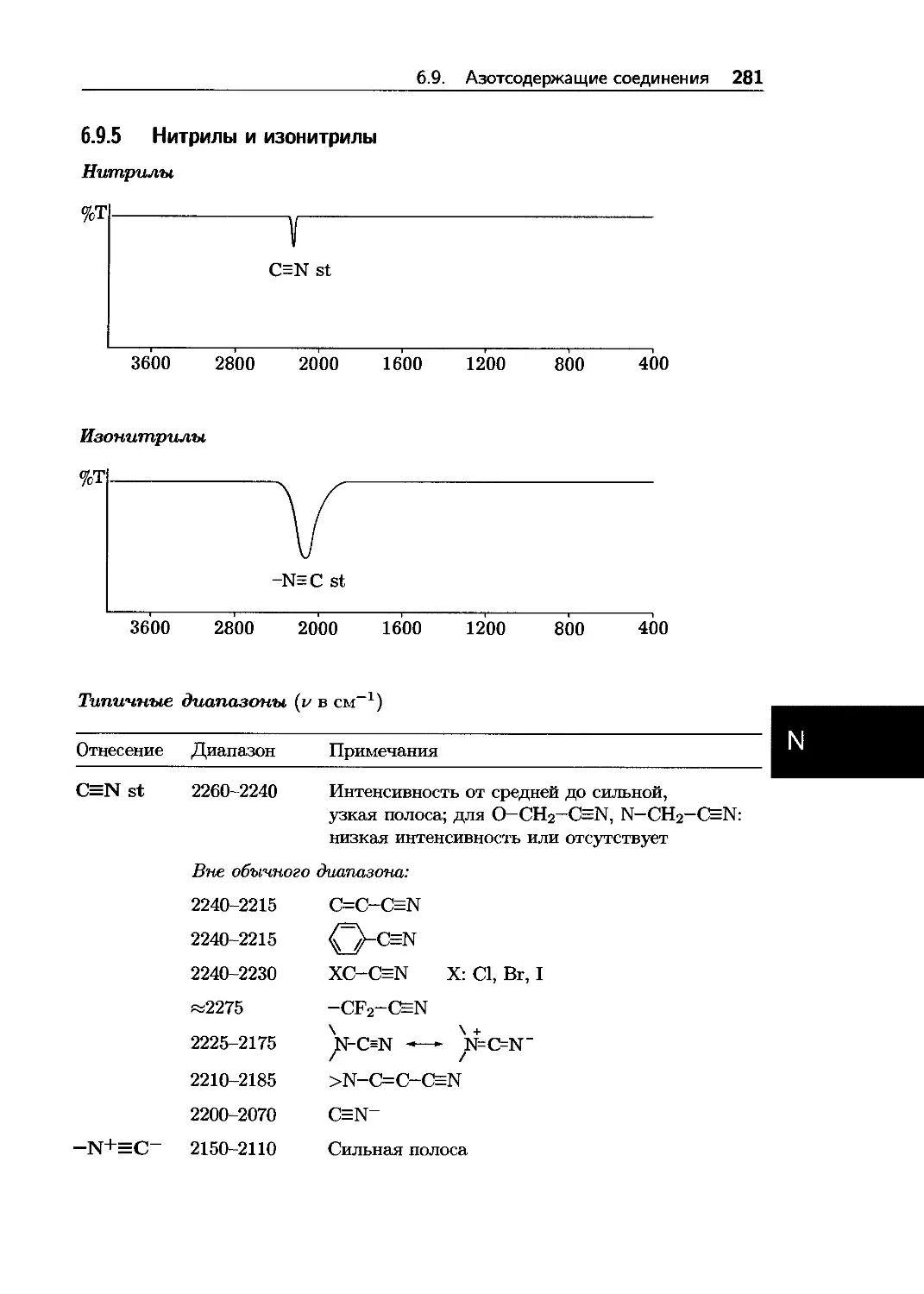
2.5.7 Признаки присутствия гетероатомов
В масс-спектрах низкого разрешения часто наблюдаются характерные изотоп-
ные распределения, специфические массы осколочных ионов и характерные
разности масс (Дт) между массой молекулярного иона (М+’) и массами оско-
лочных ионов (Frag+) или между массами фрагментных ионов. Масс-спектры
высокого разрешения могут быть использованы для подтверждения элемент-
ного состава при условии, что разрешение достаточно для распознавания аль-
тернативных составов. Тандемная масс-спектрометрия (часто обозначаемая
МС/МС) используется для идентификации характерных для гетероатомов по-
терь массы исходного молекулярного или осколочных ионов.
Признаки О: Дш 17 от М+’ для соединений, не содержащих N Дш 18 от М+' Дш 18 от Frag+, особенно в алифатических соединениях Дш 28, 29 от М+’ для ароматических соединений Дш 28 от Frag+ для ароматических соединений m/z 15, относительно интенсивный m/z 19 m/z 31,45,59,73,...+ (14)n m/z 32,46,60,74,... +(14)n m/z 33,47,61,75,... + (14)n для 2x0 при отсутствии S m/z 69 для ароматических соединений с двумя кислородными заместителями в .мета-положении
Признаки N: нечетная масса М+’ (указывает на нечетное число атомов N в М+’) Большое число осколочных ионов с четными массами Дт 17 от М+’ или Frag+ для соединений, не содержащих О Дт 27 от М+’ или Frag+ для ароматических соединений или нитрилов Дт 30, 46 от Frag+ для нитросоединений m/z 30,44,58,72,... + (14)п для алифатических соединений
Признаки S: Изотопный пик [М + 2]+’ 5% от М+’ Дт 33, 34, 47, 48, 64, 65 от М+’ Дт 34, 48, 64 от Frag+ m/z 33, 34, 35 m/z 45 в соединениях, не содержащих 0 m/z 47,61,75,89,... + (14)п за исключением соединений с 2 х 0 m/z 48,64 для S-оксидов
36 2. Обзорные таблицы
Признаки F: Дт 19, 20, 50 от М+’ Дт 20 от Frag+ m/z 20 m/z 57 без m/z 55 в ароматических соединениях
Признаки С1: Изотопный пик [М + 2]+’ 33% от М+’ Дт 35, 36 от М+’ Дт 36 от Frag+ m/z 35/37, 36/38, 49/51
Признаки Вг: Изотопный пик [М + 2]+‘ 98% от М+’ Дт 79, 80 от М+’ Дт 80 от Frag+ m/z 79/81, 80/82
Признаки I: Изотопный пик [М + 1]+’ с очень низкой интенсивностью при относительно высокой массе Дт 127 от М+‘ Дт 127, 128 от Frag+ m/z 127, 128, 254
Признаки Р: m/z 47 в соединениях, не содержащих S или 2x0 m/z 99 без изотопного пика при m/z 100 в алкил фосфатах
2.5. Масс-спектрометрия 37
2.5.8 Правила для определения относительной
молекулярной массы (Мг)
Молекулярный ион (М+‘) определяют как ион, в состав которого входят наи-
более распространенные изотопы образующих молекулу элементов. Интересно,
что самые легкие изотопы большинства элементов, которые часто присутству-
ют в органических соединениях и в обычных солях (Н, С, N, О, F, Si, Р, S,
Cl, As, Br, I, Na, Mg, Al, К, Са, Rb, Cs), одновременно являются и самыми
распространенными. Исключение составляют В, Li, Se, Sr и Ba.
Молекулярный ион М+‘ всегда сопровождается изотопными пиками. Их
относительные интенсивности зависят от числа и типа присутствующих эле-
ментов и их природных изотопных распределений. Интенсивность пика
[М+‘ + 1] показывает максимальное число атомов углерода (Стах) в соответ-
ствии со следующим соотношением:
Стах = юо [м+- + 1]/(1,1 [м+-]).
[М+‘ + 2] и более высокие массы показывают число и тип элементов, у кото-
рых есть относительно распространенный изотоп с массовым числом на две
единицы выше (например S, Si, Cl, Br).
М+’ всегда является четным числом, если молекула содержит только те
элементы, для которых и атомная масса, и валентность или четные, или нечет-
ные (как Н, С, О, S, Si, Р, F, Cl, Br, I). В присутствии других элементов М+’
становится нечетным числом, кроме случая, когда в молекуле содержится чет-
ное число ядер одного элемента (это относится к N, 13С, 2Н).
М+' может давать осколочные ионы с массами, которые отличаются от
массы молекулярного иона на величины Дт, имеющие химический смысл.
Неприемлемы с химической точки зрения разности от Дт = 3 (при отсут-
ствии Дт = 1) до Дт = 14, от Дт = 21 (при отсутствии Дт = 1) до Дт = 24,
Дт = 37,38 и все Дт, меньшие, чем масса элемента из характеристического
изотопного распределения, в случаях, когда изотопное распределение не со-
храняется в осколочном ионе.
Молекулярный ион соединения М+’ должен содержать все элементы (и мак-
симальное число каждого), которые присутствуют в осколочных ионах.
Если ионизация осуществляется электронным ударом, то М+’ появляется
при наиболее низком потенциале. Если чистый образец попадает в ионный
источник через молекулярный натекатель, то М+' показывает ту же скорость
эффузии, что и осколочные ионы. Интенсивность пика М+’ пропорциональна
давлению пробы в ионном источнике.
Для полярных соединений пик [М + Н]+" часто наблюдается в масс-спект-
рах, полученных не только бомбардировкой быстрыми атомами и химической
ионизацией при атмосферном давлении, но также при ионизации электронным
ударом. В последнем случае интенсивность пика [М + Н]+‘ изменяется пропор-
ционально квадрату давления пробы в ионном источнике.
При отсутствии сигнала для М+' молекулярная масса должна иметь ве-
личину, которая согласуется с потерями массы Дт для всех наблюдаемых в
спектре осколочных ионов.
38 2. Обзорные таблицы
2.5.9 Гомологические серии масс как признаки типа структуры
Некоторые последовательности интенсивностей пиков в области низких масс
и одиночные сигналы часто характеризуют конкретный тип соединений. Рас-
пределение интенсивностей для таких серий ионов обычно образует гладкую
кривую. Резкие изменения на этой кривой (максимумы и минимумы) струк-
турно значимы. Типы соединений, для которых данный ион или серия ионов
наиболее характерны, выделены в таблице курсивом.
Массовое чис- ло m/z Элементный состав Типы соед инений
12 + 14m CnH2n-2 алкены, моноциклоалканы, алкины, дие- ны, циклоалкены, полициклические али- циклы, циклические спирты
13 + 14m CnH2n-1 алканы, алкены, моноциклоалканы, алки- ны, диены, циклоалкены, полицикличе- ские алициклы, спирты, алкильные про- стые эфиры, циклические спирты, цикло- алканоны, алифатические кислоты, слож- ные эфиры, лактоны, тиолы, сульфиды, гликоли, эфиры гликолей, алкилхлориды
СпН2п-зО циклоалканоны
14 + 14m cnH2n алканы, алкены, моноциклоалканы, поли- циклические алициклы, спирты, алкиль- ные простые эфиры, тиолы, сульфиды, ал- килхлориды
CnH2n-2U циклоалканоны
15 + 14m (Л1Н211+1 алканы, алкены, моноциклоалканы, ал- кины, диены, циклоалкены, полицикли- ческие алициклы, алканоны, алканали, гликоли, эфиры гликолей, алкилхлориды, хлорангидриды кислот
CnH2n_iO алканоны, алканали, циклические спирты, хлорангидриды кислот
16 + 14m cnH2no алканоны, алканали
CnH2n+2N алкиламины, алифатические амиды
CnH2nNO алифатические амиды
17 + 14m спн2п+1о спирты, алкильные простые эфиры, али- фатические кислоты, сложные эфиры, лактоны, гликоли, эфиры гликолей
СпЩп- 1O2 алифатические кислоты, сложные эфиры, лактоны
18 + 14m cnH2no2 алифатические кислоты, сложные эфиры,
лактоны
2.5. Масс-спектрометрия 39
Массовое чис- ло m/z Элементный состав Типы соединений
19 + 14m О Q О Q в в в в ИИ НН to to to to в в в в t t ± + ИО оо to to спирты, алкильные эфиры алифатические кислоты, сложные эфиры, лактоны гликоли, эфиры гликолей тиолы, сульфиды
20 + 14m CsHg + CnH2n CnH2n+2O2 cnH2n+2s алкилбензолы гликоли, эфиры гликолей тиолы, сульфиды
21 + 14m C7H7 + CnH2n C7H5O CnH2nCl CnH2nCOCl алкилбензолы арилкетоны алкилхлориды хлорангидриды кислот
22 + 14m C6H6N + CnH2n CnH2n—6 алкиланилины полициклические алициклы
23 + 14m CnH2n-5 полициклические алициклы
24 + 14m CnH2n—4 полициклические алициклы
25 + 14m СпН2п-з алкины, диены, циклоалкены, полицикли- ческие алициклы
39,52±1,64±1, 76±2,91±1 cnHn±1 алкилбензолы, ароматические углеводоро- ды, фенолы, арильные простые эфиры, арилкетоны
40 2. Обзорные таблицы
2.5.10 Масс-спектрометрические корреляционные таблицы
Замечание. В формулах второй колонки, если это имеет химический смысл,
группы СН2, СНз, СН3О и О2 можно заменить на атомы N, О, Р и S соответ-
ственно (М — молекулярная масса).
Масса Ион Образующийся ион и состав нейтрального осколка Элементы структуры или тип соединения
1 • [М+1]+, [М-1]- особенно в спектрах FAB, в кото- рых проявляется М±1 даже для умеренноосновных и кислых соеди- нений, но интенсивный пик М+‘ встречается редко без М±1
7 Li+- [М+7]+ в спектрах FAB в присутствии Li+
[М-7]" в спектрах FAB в присутствии ор- ганических солей Li+
12 с+-
13 СН+
14 СН+-, N+, N++, СО++
15 сн+ [М-15]4” (СНз) нехарактерный; интенсивный: метил, TV-этил амины
16 О+-, NH+, [М-16]+- (СНд) метил (редко)
оГ (О) нитросоединения, сульфоны, эпок- сиды, TV-оксиды
(NH2) первичные амины
17 ОН+, NH+- [М-17]4” (ОН) кислоты (особенно ароматичес- кие), гидроксиламины, TV-оксиды, нитросоединения, сульфоксиды, третичные спирты
(NH3) первичные амины
18 н2о+-, NH+ [М—18]+‘ (Н2О) нехарактерный; интенсивный: спирты, некоторые кислоты, аль- дегиды, кетоны, лактоны, цикли- ческие простые эфиры
признак О
2.5. Масс-спектрометрия 41
Масса Ион Образующийся ион и состав нейтрального осколка Элементы структуры или тип соединения
19 Н3О+, F+ [М-19]4” (F) фториды признак F
20 HF+-, Аг++, ch2cn++ [М—20]4” (HF) фториды признак F
21 С2Н2О++
22 СО++
23 Na+’ [М+23]+ в спектрах FAB в присутствии Na+; иногда сильный сигнал, даже если Na+ находится в виде примеси
[М-23]" в спектрах FAB органических со- лей Na+
24 CJ-
25 С2Н+ [М-25]4” (С2Н) терминальный ацетиленил
26 С2н+’, CN+ [М-26]4” (С2н2) ароматические соединения
(CN) нитрилы
27 с2н+ HCN+- [М-27]4” (С2Н3) терминальный винил, некоторые этиловые сложные эфиры и АГ-этиламиды, этилфосфаты
(HCN) ароматический N, нитрилы
28 с2н+-, СО4”, N+-, HCNH+ [М-28]4” (С2Н4) нехарактерный; интенсивный: цик- логексены, этиловые сложные эфи- ры, пропилкетоны, пропилзаме- щенные ароматические соед инения
(СО) ароматический О, хиноны, лак- тоны, лактамы, ненасыщенные циклические кетоны, аллильные альдегиды
(N2) диазосоединения; воздух (интен- сивность в 3,7 раза больше, чем для Oj', m/z 32)
29 с2н+ СНО+ [М-29]4” (С2н5) (СНО) нехарактерный; интенсивный: этил фенолы, фураны, альдегиды
42 2. Обзорные таблицы
Масса Ион Образующийся ион и состав нейтрального осколка Элементы структуры или тип соединения
30 сн2о+-, ch2nh+, NO+, С2Н+', BF+-, [М-30]+‘ (С2Н6) (СН2О) (NO) этилалканы, полиметильные соединения циклические простые эфиры, лактоны, первичные спирты нитро- и нитрозосоединения
31 сн3о+, CH3NH+-, CF+, N2H+ [М-31]+' (СН3О) (CH3NH2) (N2H3) метиловые сложные эфиры, метиловые простые эфиры, первичные спирты TV-метиламины гидразиды
32 OJ-, СН3ОН+-, n2h+; S+- [М-32]+- (О2) (СН3ОН) (S) циклические пероксиды; воздух (интенсивность в 3,7 раза мень- ше, чем для Njm/z 28) метиловые сложные эфиры, метиловые простые эфиры сульфиды (появляется с изотоп- ным сигналом для 34S)
33 CH3OHj, SH+, CH2F+ [M-33J+- (SH) (СН3 + Н2О) (CH2F) нехарактерный (вместе с изотоп- ным сигналом 34S) признак S нехарактерный; признак О фторметил
34 SH+- [М—34]+' (SH2) (ОН + ОН) нехарактерный (вместе с изотоп- ным сигналом 34 S) признак S нитросоединения
35 SH|, Cl+ [М-35]+’ (С1) (ОН + Н2О) хлорсодержащие соединения (вместе с изотопным сигналом 37С1) нитросоединения признак 2x0
36 HC1+-, c£ ]М-36]+' (НС1) (Н2О + Н2О) хлорсодержащие соединения признак 2x0
37 C3H+ 37C1+ хлорсодержащие соединения (вместе с изотопным сигналом 35С1)
38 c3H+-
2.5. Масс-спектрометрия 43
Масса Ион Образующийся ион и состав нейтрального осколка Элементы структуры или тип соединения
39 40 с3н+ К+ с3н+", ch2cn+, Аг+‘ [M-39J+- (С3Н3) [М+39]+ [М-39]- [М—40]+' (CH2CN) ароматические соединения проявляется в спектрах FAB в присутствии К+; иногда силь- ный сигнал, даже если К+ нахо- дится в виде примеси проявляется в спектрах ГАВ органических солей К+ метилцианид
41 СзН+ CH3CN+- [М-41]+- (С3Н5) (CH3CN) алициклические (особенно поли- алициклические) соединения, алкены 2-метил-Ь)-ароматические, А-метиланилины
42 С3н+-, С2Н2О+", CON+, c2h4n+ [М-42]+- (С3Нб) (С2Н2О) нехарактерный; интенсивный: пропиловые сложные эфиры, бу- тилкетоны, бутилароматические соединения, метилциклогексены ацетаты (особенно енолы), ацетамиды, циклогексеноны, а,/3-ненасы1ценные кетоны
43 с3н+ С2Н3О+, CONH+- [М-43]+- (С3Н7) (СН3СО) нехарактерный; интенсивный: пропильные поизводные, али- циклические соединения, цик- лоалканоны, циклоалкиламины, циклоаканолы, бутиларомати- ческие соединения метилкетоны, ацетаты, метиловые ароматические простые эфиры
44 COJ-, c2h6n+, С2Н4О+-, CS+-, С3н+-, CH4Si+- [М—44]+" (С3Н8) (C2H6N) (С2Н4О) (СО2) пропилалканы А,А-диметиламины, А-этиламины циклоалканолы, циклические простые эфиры, этиленкетали, алифатические альдегиды (пере- группировка Мак-Лафферти) ангидриды, лактоны, карбоновые кислоты
44 2. Обзорные таблицы
Масса Ион Образующийся ион и состав нейтрального осколка Элементы структуры или тип соединения
45 с2н5о+, C2H7N+-, CHS+ (одно- временно с изотопным сигналом для 34S) признак О признак S [M-45J+- (С2Н5О) (СНО2) (C2H7N) этиловые сложные эфиры, эти- ловые простые эфиры, лактоны, этилсульфонаты, этилсульфоны карбоновые кислоты 7У,7У-диметиламины, TV-этиламины
46 с2н5он+-, NOJ [M-46J+- (С2НбО) (Н2О + С2Н4) (Н2О + СО) (NO2) этиловые сложные эфиры, эти- ловые простые эфиры, этилсуль- фонаты первичные спирты карбоновые кислоты нитросоединения
47 CH3S+, СС1+, с2н5он+, СН(ОН)+, РО+ признак 2x0 признак S признак Р [M-47J+- (CH3S) метилсульфиды (вместе с изо- топным сигналом для 34 S)
48 CH3SH+-, СНС1+-, SO+- [М—48]+" (CH4S) (SO) метилсульфиды сульфоксиды, сульфоны, суль- фонаты (вместе с изотопным сигналом для 34S)
49 СН2С1+, CH3SHj- [М-49]+‘ (СН2С1) хлорметил (вместе с соответ- ствующим сигналом для 37 С1)
50 С4Н+’, СН3С1+-, CF+- [М-50]+- (CF2) трифторметилароматические и перфторалициклические соеди- нения
51 С4н+, CHFJ
52 С4н+-
53 с4н+
2.5. Масс-спектрометрия 45
Масса Ион Образующийся ион и состав нейтрального осколка Элементы структуры или тип соединения
54 с4н+-, [M-54J+- (С4Нб) циклогексены
C2H4CN+ (C2H4CN) этилцианид
55 с4н+, С3Н3О+ [М-55]+- (С4Н7) нехарактерный; интенсивный: алициклические соединения, бутиловые сложные эфиры, TV-бу тил амиды
56 С4н+-, С3Н4О+- [M-56J+- (С4Н8) (С3Н4О) бутиловые сложные эфиры, TV-бути ламиды, пентилкетоны, циклогексены, тетралины, пентилароматические соединения метилциклогексеноны, /3-тетралоны
57 с4н+, [М-57]+- (С4Н9) нехарактерный
С3Н5О+, c3h2f+ (С3Н5О) этилкетоны
58 c3h8n+, [М-58]+- (С4Н10) алканы
С3Н6О+- признак N признак О (С3Н6О) о-мети л ал канал и, метилкетоны, изопропилиденгликоли
59 С3Н7О+, C2H5NO+- [М-59]+- (С3Н7О) пропиловые сложные и простые эфиры
признак О (С2Н3О2) (C3H9N) метиловые сложные эфиры амины, амиды
60 С2н4о+-, CH2NOJ, [М-60]+- (С3Н8О) пропиловые сложные и простые эфиры
c2h6no+ (С2Н4О2) ацетаты
признак О (СН3ОН + СО) метиловые сложные эфиры
61 с2н5о£, [М-61]+-
c2H5s+ (С2Н5О2) гликоли, этиленкетали
признак 2 х признак S О (C2H5S) этилсульфиды (вместе с изотоп- ным сигналом для 34 S)
62 с2н6о+\ [М-62]+-
С2Н3С1+- (С2Н6О2) (C2H6S) метоксиметильные простые эфи- ры, этиленгликоли, этиленкетали этилсульфиды (вместе с изотоп- ным сигналом для 34 S)
46 2. Обзорные таблицы
Масса Ион Образующийся ион и состав нейтрального осколка Элементы структуры или тип соединения
63 С5н+, [М-63]+-
С2Н4С1+, (С2Н4С1) хлорэтил
СОС1+ (СО + С1) хлорангидриды кислот
64 С5н+-, SO+-, [М-64]+- (SO2) сульфоны, сульфонаты
sr (S2) дисульфиды (вместе с изотоп- ным сигналом для 34S)
65 с5н+ Н2РО+ [М-65]+- (S2H) дисульфиды (вместе с изотоп-
(SO2H) ным сигналом для 34S)
66 С5н+-, S2H2 [М-66]+- (С5Н6) циклопентены
дисульфиды (вместе с изотоп- ным сигналом для 34S)
67 с5н+, [М-67]+-
C4H3O+ (С4Н3О) фурилкетоны
68 с5н+\ [М-68]+- (С5Н8) циклогексены, тетралины
С4Н4О+-, C3H6CN+ (С4Н4О) циклогексеноны, /3-тетралоны
69 с5н+, [M-69J+- (С5Н9) алициклические соединения,
С4Н5О+, алкены
С3НО+, CF+ (CF3) трифторметил
70 с5н+- алканы, алкены, алицикли- ческие соединения
С4Н6О+- циклоалканоны
c4h8n+ пирролидины
Масса Ион Тип соединений
71 С5н+ С4Н7О+ алканы, более крупные алкильные группы алканоны, алканали, тетрагидрофураны
72 С4Н8О+- C4Hi0N+ алканоны, алканали признак О алифатические амины признак N пергалогенированные бензолы
73 С4Н9О+ С3н5о+ C3H9Si+ спирты, простые и сложные эфиры признак О кислоты, сложные эфиры, лактоны триметилсилильные соединения
2.5. Масс-спектрометрия 47
Масса Ион Тип соединений
74 с4н10о+- С3н6о+- простые эфиры метиловые сложные эфиры карбоновых кислот, а-метилкарбоновые кислоты
75 с3н7о+ C3H7S+ C2H7SiO+ метилацетали, гликоли признак 2x0 сульфиды, тиолы (вместе с изотопным сигналом для 34S) признак S триметилсилилоксильные соединения
76 С6н+- ароматические соединения
77 с6н+ С3Н6С1+ ароматические соединения хлорсодержащие соединения
78 с6н+- c5h4n+ С3Н7С1+- ароматические соединения пиридины хлорсодержащие соединения
79 с6н+ C5H5N+- Вг+ ароматические соединения с заместителями, содержащими Н пиридины, пирролы бромсодержащие соединения (вместе с изотопным сигналом для 81 Вг)
80 с6н+- С5Н4О+- НВг+- c5h6n+ циклогексены, полициклические алициклы циклопентеноны бромсодержащие соединения пирролы, пиридины
81 с6н+ С5Н5О+ 81Вг+ циклогексаны, циклогексенилы, диены фураны, пираны бромсодержащие соединения (вместе с изотопным сигналом для 79Вг)
82 с6н+0- С5НбО+- c5h8n+ c4h6n+- CC1J- циклогексаны циклопентеноны, дигидропираны тетрагидропиридины пиразолы, имидазолы хлорсодержащие соединения (вместе с изотопными сигналами m/z 84 и 86)
83 с6н+ С5Н7О+ алкены, алициклические соединения, монозамещенные алканы циклоалканоны
84 C5Hi0N+ пиперидины, TV-метилпирролидины
48 2. Обзорные таблицы
Масса Ион Тип соединений
85 с6н+ С5Н9О+ CC1F+ алканы алканоны, алканали, тетрагидропираны, производные жирных кислот фторхлоралканы (вместе с изотопным сигналом m/z 87)
86 С5н10о+- c5h12n+ алканоны, алканали алифатические амины признак N
87 С5НпО+ С4Н7О+ спирты, простые и сложные эфиры признак О сложные эфиры, кислоты
88 с4н8о+- этиловые сложные эфиры карбоновых кислот, а-метил-метильные сложные эфиры, а-С2-карбоновые кислоты
89 С4Н9О+ C4H9S+ диолы, эфиры гликолей признак 2x0 сульфиды, (вместе с изотопным сигналом для 34S)
90 С7н+- дизамещенные ароматические соединения
91 с7н+ С4Н8С1+ ароматические соединения алкилхлориды
92 С7н+- C6H6N+ алкилбензолы алкилпиридины
93 С6Н5О+ C6H7N+- СН2Вг+ фенолы, производные фенолов анилины бромсодержащие соединения
94 С6Н6О+- C5H4NO+ сложные и простые эфиры фенолов пиррилкетоны, производные пиридона
95 с5н3о£ фурилкетоны
96 С7н+- алициклические соединения
97 С7н+ с6н9о+ C5H5S+ алициклические соединения, алкены циклоалканоны алкилтиофены (вместе с изотопным сигналом для 34S)
98 c6h12n+ TV-алкилпиперидины
2.5. Масс-спектрометрия 49
Масса Ион Тип соединений
99 с7н+ с6нпо+ с5н7о+ Н4РО+ алканы алканоны этиленкетали алкил фосфаты
104 с8н+- С7Н4О+- производные тетралина, фенилэтильные производные дизамещенные а-кетобензолы
105 с8н+ С7Н5О+ c6h5n+ алкилароматические соединения производные бензоила производные диазофенила
106 c7h8n+ алкиланилины
111 C5H3OS+ производные тиофеноила (вместе с изотопным сигналом для 34S)
115 с9н+ c6Hno+ с5н7о+ ароматические соединения сложные эфиры диэфиры
119 с9н+ С8Н7О+ c2f+ c7h5no+- алкилароматические соединения толилкетоны перфторэтилпроизводные фенилкарбаматы
120 С7Н4О+ C8Hi0N+ 7-бензопироны, производные салициловой кислоты пиридины, анилины
121 C8H9O+ и с7н5о+ производные гидроксибензола
127 С10н+ С6н7о+ C6H6NC1+- 1+ нафталины ненасыщенные д иэфиры хлорированные ароматические TV-гетероциклы иодсодержащие соединения
128 С1он+- C6H5OC1+- HI+- нафталины хлорпроизводные гидроксибензола иодсодержащие соединения
130 c9h8n+ С9Н6О+- ХИНОЛИНЫ, индолы нафтохиноны
50 2. Обзорные таблицы
Масса Ион Тип соединений
131 СюН+ тетралины
c5h7s+ кетали тиоэтилена (вместе с изотопным сигналом для 34 S)
c3F+ перфторалкильные производные
135 C4H8Br+ алкилбромиды
141 C11H+ нафталины
142 c10h8n+ ХИНОЛИНЫ
149 c8H5o+ фталаты
152 c12H+- дифенильные ароматические соединения
165 c13h+ производные дифенилметана (флуоренил-катион)
167 c8h7o+ фталаты
205 c12H13o+ фталаты
223 c12H15o+ фталаты
2.5.11 Литература
[1] Moss G. Р., “Atomic weights of the elements”, Pure Appl. Chem., 71, 1593
(1999).
[2] Audi G., Wapstra A. H., “The 1995 update to the atomic mass evaluation”,
Nucl. Phys., A595, 409 (1995). Atomic Mass Data Center, world wide web
site, <http://csnwww.in2p3.fr>.
[3] Rosman K. J. R., Taylor P. D. P., “Isotopic compositions of the elements 1997”,
Pure Appl. Chem., 70, 217 (1998).
[4] Kubinyi H., “Calculation of isotope distributions in mass spectrometry. A trivial
solution for a non-trivial problem”, Anal. Chim. Acta, 247, 107 (1991).
2.6. Спектроскопия в УФ и видимой областях 51
2.6 Спектроскопия в УФ и видимой областях
Полосы поглощения в УФ и видимой областях соединений разных
типов (А — алкил или Н; R — алкил: sh — плечо)
Тип соед. Переход (1g е)
200 300 400 500 600 700 нм
<чд л->л* (3-4)
л—>с* (3,6) 1
R-C1 я->с* (2,4) 1
A s А л-»л* (3,7-4)
R-ОН п-а* (2,5) 1
R'O'R п-°* (3,5) 1
R. „ (3-4) ЪГ п-л* (1-2) 1
Rtr. я-wt* (2) Н п-л* (0,9-1,4) 1 1
R-NH2 п—>а* (3,5)
R_SH п^°* <3’2> К Ь п—»а* (2,2 sh) 1
s n-»c* (3-3,6) R R n—»a* (2-3 sh) '
S R n-»o* (3-4) R S n^c* (26)
R-Br n—»a* (2,5)
*>=O п-л* (1,7)
R>=O n—»л* (1,7) RO U
R>=O n—»л* (1,8) R2N ° ' ’ 1
jL л—>л* (~4) A^T^O п-+л* (1-2) A
A A A^Y^fA л—»л* (3,9-4,4) A A
H л-»л* (4,2-4,8) ' 'n= 1-7
1-14 (4,3-5,2)
200 300 400 500 600 700 нм
52 2. Обзорные таблицы
° Самый длинноволновый максимум поглощения.
3 Комбинированные таблицы
3.1 Алканы, циклоалканы
Отнесение Спектральный диапазон Комментарии
СНз 5-35 м. д. СНз, СН2, СН и С можно отличить на осно- ЯМР 13С
СН2 5-45 м. д. вании многоимпульсных экспериментов (DEPT,
СН 25-60 м. д. APT), подавления спин-спинового взаимодей-
С 30-60 м. д. ствия, двумерных корреляционных спектров СН или на основе измерения времен релаксации. Меньшие величины хим. сдвигов для трехчлен- ных циклов
СНз 0,8—1,2 м. д. ЯМР XN
СН2 СН 1,1-1,8 м. д. 1,1-1,8 м. д. Меньшие величины хим. сдвигов для трехчлен- ных циклов
CH st СНз 5 as СН2 S 3000-2840 см"1 «1460 см-1 «1460 см"1 Более высокие частоты для трехчленных циклов ИК
СНз д sy «1380 см"1 Две полосы для геминальных метильных групп
СН2 7 770-720 см"1 В С~(CH2)n—С при п 4 около 720 см-1
Молекуляр- ный ион Фрагменты Перегруп- m/z 14п + 2 Слабый в н-алканах МС Очень слабый в изоалканах н-Алканы: локальные максимумы в распределе- нии интенсивностей при 14п + 1, плавное изменение интенсивности пиков, минимум при [М—15]+. Изоалканы: локальные максимумы при 14п + 1, распределение интенсивности пиков: нерегуляр- ное (относительные максимумы обусловлены фрагментацией в точках разветвления с сохране- нием зарядов на наиболее замещенных атомах С) н-Алканы: нехарактерны
пировки m/z 14п m/z 14п — 2 Изоалканы: элиминирование алканов Моноциклоалканы: элиминирование алканов Нет поглощения выше 200 нм УФ
54 3. Комбинированные таблицы
3.2 Алкены, циклоалкены
Отнесение
ЯМР 13С С=С
С-(С=С)
Спектральный
диапазон_______
100-150 м.д.
10- 60 м. д.
Комментарии
Значительное различие между
Z- и Е-изомерами:
С X С Н
ЯМР гН Н-(С=С)
СНз-(С=С)
СН2-(С=С)
4,5-6,5 м. д.
«1,7 м.д.
«2,0 м. д.
Н X
Константы ССВ |J|: геминальная 0-3 Гц,
цис 5-12 Гц, транс 12-18 Гц
Константы ССВ 3Jch2-ch=c ~ 7 Гц
В циклах | J| меньше:
п=2 «0,5 Гц,
п=3 «1,5 Гц,
п=4 «4,0 Гц
Дальние константы ССВ 4Jhc-c=ch
0-2 Гц
ИК Н-С(=С) st 3100- 3000 см"1
С=С st 1690 1635 см-1
Н-С(=С) 5 оор 1000-675 см"1
СН2-(С=С) д 1440 см"1
мс Молекуляр- m/z 14п
ный ион m/z 14п — 2
Фрагменты 14п — 1
14п —3
Алкены: умеренная интенсивность
Моноциклоалкены: средняя
интенсивность
Для алкенов локальные максимумы
Для моноциклических алкенов локальные
УФ
Перегруппи-
ровки
максимумы
Двойные связи обычно не локализуются
Для н-алкенов не характерны
Характерны для:
(см. примечание на с. 55)
Циклогексены:
ретрореакция Дильса-Альдера
С=С тг —♦ тг* <210 нм (1gе 3-4)
(С=С)2 тг ~* тг* 215-280 нм
(1g е 3,5-4,5 нм)
Изолированные двойные связи; для высо-
козамещенных двойных связей часто на-
блюдается “хвост” поглощения
3.3. Алкины 55
3.3 Алкины
Отнесение Спектральный диапазон Комментарии
С=С 65-85 м. д. Константа ССВ 2JHc=13c ~ 50 Гц часто приводит к неожиданным знакам сигналов в спектрах DEPT 13С ЯМР
С-(С=С) 0-30 м. д.
Н-(СНС) 1,5-3,0 м. д. Константы ССВ |J( 4Jch-c=ch ~ 3 Гц 5Jch-c=c-ch « 3 Гц ’Н ЯМР
СН3-(С=С) СН2-(С=С) СН-(С=С) «1,8 м. д. «2,2 м. д. «2,6 м. д.
Н-С(=С) st С=С st 3340-3250 см"1 2260-2100 см"1 Узкая, интенсивная Иногда очень слабая ИК
Молекулярный ион Слабый, в алкинах-1 до С7 часто отсут- ствует мс
Фрагменты и прегруппировки Различаются по интенсивности для алка- нов и ароматических соединений
С=С 7Г —+ 7Г* <210 нм (1g £ 3,7-4,0) Край поглощения, часто несколько слабых полос <240 нм УФ
Примечание. Принятые авторами изображения переноса электронной плотнос-
ти не всегда согласуются с обозначениями, принятыми в других изданиях. —
Прим, перев.
56 3. Комбинированные таблицы
3.4 Ароматические углеводороды
Отнесение Спектральный диапазон Комментарии
ЯМР 13с ar С 120 150 м.д. Те же диапазоны для полицикли-
ar СН al С-(С аг) 110-130 м.д. 10-60 м. д. ческих ароматических углеводородов
ЯМР гн Н-(С аг) 6,5-7,5 м. д. В полициклических ароматических углеводородах до «9 м.д. Константы ССВ: 3ЛОрто 7 Гц, 4 J мета « 2 Гц, 3Jnapa < 1 Гц
СН3-(С аг) «2,3 м. д. Линии часто уширены из-за дальнего
СН2-(С аг) СН-(С аг) «2,6 м. д. «2,9 м. д. ССВ с ароматическими протонами
ИК ar С—Н st 3080-3030 см"1 Часто несколько слабых полос
comb 2000-1650 см"1 Очень слабая
аг С—С st «1600 см-1 «1500 см"1 «1450 см"1 Часто расщеплены, иногда наблюдаются не все три полосы
ar С—Н <5 оор 900-650 см"1 Сильная, часто несколько полос
мс Молекулярный ион Сильный, часто основной пик
Фрагменты m/z 39, 50-53, 63-65, 75-78 [М-26]+-, [М-39]+ бензильный распад Часто возникают двухзарядные осколочные ионы ^Л-СНМ m/z 90-92
ftm/z 127
Перегруппировки
m/z 152, 153
УФ
:200—210 нм (1g е « 4)
«260 нм (1g е « 2,4)
В бензоле
и алкилбензолах
3.5. Ароматические гетероциклические соединения 57
3.5 Ароматические гетероциклические
соединения
Отнесение
Спектральный
диапазон
Комментарии
агС-Х
ar С-С
Н-(С аг)
120-160 м. д.
100-150 м.д.
6-9 м. д.
13С ЯМР
ХН ЯМР
Константы ССВ в 6-членных циклах
близки к соответствующим значениям
для ароматических углеводородов;
в 5-членных гетероароматических
циклах они меньше
H-(N аг) 7-14 м. д. Сильно зависит от растворителя, обычно широкий
ar С—Н st аг N—Н st 3100-3000 см-1 3500-2800 см-1 Часто несколько слабых полос
аг С—С st -1600 см"1 -1500 см"1 -1450 см-1 Часто расщеплены, иногда наблюдаются не все три полосы
аг С—Н <5 оор Молекулярный ион 1000-650 см"1 Часто несколько сильных полос Сильный, часто основной пик
Фрагменты m/z 39, 50-53, 63-65, 75-78 Часто двухзарядные осколочные ионы
[М—26]+", [М-39]+
распад
бензильного типа
Перегруппировки
ИК
мс
Потеря HCN (N-гетероароматические
соединения)
Потеря СО (О-гетероароматические
соединения)
Потеря CS (S-гетероароматические
соединения)
m/z 45 [CHS] +
См. спектры стандартных соединений в УФ и видимой областях, разд. 8.5.3.
УФ
58 3. Комбинированные таблицы
3.6 Галогенсодержащие соединения
Отнесение Спектральный диапазон Комментарии
ЯМР 13С al C-F 70-100 м. д. CF3: «115 м. д.
(C)=C-F 125-175 м.д. ССВ с 19F (содержание изотопа 100%;
C=(C-F) 65-115 м. д. I = 1/2): 1JCF 100-300 Гц; 2JCf 10-40 Гц;
ar C—F 135-165 м.д. 3Jcf 5-10 Гц; 4Jcf 0-5 Гц
ar C-(C-F) 105-135 м. д.
al C-Cl 30-60 м. д.
(C)=C-C1 100-150 м.д.
C=(C-C1) 100-155 м.д.
ar C-Cl 120-150 м.д.
al C—Br 10-45 м. д.
(C)=C—Br 90-140 м. д.
C=(C—Br) 90-140 м. д.
ar C—Br 110-140 м.д.
al C-I (-20)-(+30) м.д.
(C)=C-I 60-110 м. д.
C=(C-I) 120-150 м.д.
ar С—I 85-115 м.д.
ЯМР гн -ch2-f «4,3 м. д. ССВ с 19F (содержание изотопа 100%; I = 1/2): 2JHF 40-80 Гц; 3JHF 0-50 Гц; 4Jhf 0-5 Гц
-CH2-C1 «3,5 м. д.
—CH2—Br «3,4 м. д.
-CH2-I «3,1 м. д. Алкены: геминальные протоны сильно дезэкранированы всеми галогенами; вицинальные протоны экранированы атомами F и дезэкранированы другими
галогенами
Ароматические соединения: экраниро- вание атомами F в о- и п-положениях, С1 и Вг оказывают малое влияние; I дезэкранирует в о- и экранирует
в At-положении
ИК C-F st 1400-1000 см*1 Интенсивные полосы
C-Cl st < 850 см-1
C—Br st < 700 см"1
C-I st < 600 см-1
З.б. Галогенсодержащие соединения 59
Отнесение Спектральный диапазон Комментарии
Молекулярный ион В случае насыщенных алифатических МС галогенсодержащих соединений часто слабый, в полигалогенированных соединениях часто отсутствует Характерное изотопное распределение для CI и Вг
Фрагменты m/z 69 [М—50]+’ или [Frag—50]+ CF3 cf2 ч > R— С- -hal > R- "С—hal
Перегруппировки [М—20]+‘ [М-36]+- Элиминирование HF Элиминирование НС1
Галоген sj 280 нм п—>тг* (lge~2,5) Для С—I; для С—Вг и С—С1, как правило, УФ наблюдается только край полосы погло- щения, для С—F поглощения нет
60 3. Комбинированные таблицы
3.7 Кислородсодержащие соединения
3.7.1 Спирты и фенолы
Отнесение Спектральный диапазон Комментарии
ЯМР 13С al С-ОН 50-100 м. д. Смещение по сравнению с соответствую- щим сигналом С—Н «4-50 м. д.
al С-(С-ОН) 10-60 м. д. Едва ли есть сдвиг по сравнению с С-(С-СН3)
al С-(С-С-ОН) 10-60 м. д. Смещение по сравнению с сигналом С-(С-С-СНз) «-5 м.д.
аг С-ОН 135-155 м. д. Смещение по сравнению с сигналом С—Н «+25 м. д.
аг С-(С-ОН) 100-130 м. д. Смещение по сравнению с сигналом С-(С-Н): орто «—13 м. д., мета «4-1 м.д., пара «—8 м. д.
ЯМР 'Н al С-ОН 0,5-5 м. д.
аг С-ОН 5-8 м. д.
-сн2-он 3,5-4,0 м. д.
-СН-ОН 3,8-4,2 м. д.
аг СН-(С-ОН) 6,5-7,0 м. д.
Положение и форма сигнала сильно
зависят от условий эксперимента
Для С-ароматических соединений сдвиг
по сравнению с сигналом CH—(С—Н):
орто «—0,6 м.д., мета «—0,1 м.д.,
пара «—0,5 м. д.
ИК О-Н st 3650 3200 см"1
С-О(Н) st 1260-970 см-1
МС Молекулярный ион
Положение и форма полосы зависят от
степени ассоциации; часто наблюдаются
разные полосы для связанных
Н-связями и свободных ОН-групп
Интенсивная полоса
Алифатические соединения: слабые сиг-
налы, у первичных и высокоразветвлен-
ных спиртов часто отсутствуют; в этом
случае пики с наиболее высокими масса-
ми обусловлены [М—18]+’ или [М—15]+
Ароматические соединения:
интенсивный сигнал
3.7. Кислородсодержащие соединения 61
Отнесение Спектральный диапазон Комментарии
Фрагменты Алифатические соединения: m/z 31, 45, 59,... [М-18]+• [М—33]+ [М-46]+- Первичные: m/z 31 > m/z 45 ~ m/z 59 Вторичные и третичные: локальные максимумы из-за а-распада: R + • - R* + R-CH-OH * R-CH=OH
Перегруппировки
Ароматические
соединения:
[аг—О]+’
[М—28]+' (СО)
[M-29J+ (СНО)
Обычно сопровождаются пиками,
связанными с перегруппировками
Алифатические соединения: отщепле-
ние Н2О от М+- и продуктов а-распада;
за отщеплением Н2О следует отщепле-
ние алкена
Ненасыщенные соединения:
виниловые спирты: спектры похожи
на спектры кетонов
аллиловые спирты: сигналы специфич-
ны, отщепление альдегидов
Ароматические соединения:
opmo-эффект с соответствующими заме-
стителями
-Y-Z: -CO-OR, -C-hal, -O-R и род-
ственные соединения
Алифатические соединения: нет погло- УФ
щения выше 200 нм
Ароматические соединения: в щелочном
растворе смещение в длинноволновую
область и увеличение интенсивности из-
за депротонирования
62 3. Комбинированные таблицы
3.7.2 Простые эфиры
Отнесение Спектральный диапазон Комментарии
ЯМР 13С al С-О 50-100 м. д. Оксираны: вне обычного диапазона
al С-(С-О) 10-60 м. д. Едва ли есть сдвиг по сравнению с С-(С-СН3)
al С—(С—С-О) 10-60 м. д. Смещение по сравнению с сигналом С-(С-С-СНз) «-5 м.д.
о-с-о 85-110 м. д.
(С)=С-О 115-165 м. д. Смещение по сравнению с сигналом (С)=С-С «4-15 м.д.
С=(С-О) 70-120 м. д. Смещение по сравнению с сигналом С=(С-С) «-30 м.д.
аг С-О 135-155 м.д. Смещение по сравнению с сигналом С—Н «4-25 м. д.
аг С—(С—О) 100-130 м. д. Смещение по сравнению с сигналом С—(С—Н): орто яа—15 м. д., мета «4-1 м.д., пара «—8 м.д.
ЯМР н сн3-о 3,3-4,0 м. д. Синглет
сн2-о 3,4-4,2 м.д.
о-сн2-о 4,5-6,0 м.д.
сн-о 3,5-4,3 м. д.
СН-(О)з «5-6 м. д.
Н—С(О)=С 5,7-7,5 м. д. Смещение по сравнению с сигналом Н-С(Н)=С «4-1,2 м.д.
Н-С(=С-О) 3,5-5,0 м. д. Смещение по сравнению с сигналом Н-С(=С-Н) «-1 м.д.
аг СН-(С-О) 6,6-7,6 м. д.
ИК Н-С(-О) st 2880-2815 см"1 Для СН3-О и СН2—О; близкий диапазон для аминов
Н-СН(-О)2 st 2880-2750 см"1 Две полосы
С—О—С st as 1310-1000 см"1 Интенсивная, иногда две полосы
мс Молекулярный Алифатические соединения:
ИОН слабые сигналы,
склонность к протонированию
Ароматические соединения:
сильные сигналы
3.7. Кислородсодержащие соединения 63
Отнесение Спектральный диапазон Комментарии
Фрагменты Алифатические: m/z 31, 45, 59,... [M-18J+- [М-33]+ [М-46]-*- Основной пик для алифатических простых эфиров, как правило, возникает из-за раз- рыва связи, соседней с простой эфирной группой: ,+• “Hi* + Rj— С—О—Кз J ► C=O-R2 или из-за гетеролитического разрыва связи С—0, особенно в простых полиэфирах: ,+. -Rj-O* R-O-Rs] i—► R2+
МС
Перегруп-
пировки
Арилалкиловые простые эфиры:
преимущественная потеря алкильной цепи
Диариловые простые эфиры:
преимущественная потеря группы СО (28)
из М+' и/или [М—Н]+, а так же:
аг— О-раг2
Алифатические соединения:
элиминирование спирта
Арилэтиловые и другие арилалкиловые
простые эфиры: элиминирование алкена
с образованием фенола:
Алифатические соединения:
выше 200 нм поглощения нет
Ароматические соединения:
смещение в область более длинных волн
и увеличение интенсивности из-за простой
эфирной группы
УФ
64 3. Комбинированные таблицы
3.8 Азотсодержащие соединения
3.8.1 Амины
Отнесение Спектральный диапазон Комментарии
ЯМР 13С al C-N 25-80 м. д. Смещение по сравнению с сигналом С—Н от «4-20 м. д. до «4-30 м. д.
al C-(C-N) 10-60 м. д. Смещение по сравнению с сигналом С-(С-С) «4-2 м.д.
al C-(C-C-N) 10-60 м. д. Смещение по сравнению с сигналом С-(С-С-С) «-2 м.д.
(C)=C-N 120-170 м.д. Смещение по сравнению с сигналом (С)=С-С «4-20 м.д.
C=(C—N) 75-125 м. д. Смещение по сравнению с сигналом С=(С-С) «-25 м. д.
ar C-N 130-150 м. д. Смещение по сравнению с сигналом С—Н «4-20 м. д.
ar C-(C-N) 100-130 м. д. Смещение по сравнению с сигналом С—(С—Н): орто «—15 м.д., мета «4-1 м.д., пара «—10 м.д.
ЯМР 1Н alC-NH 0,5-4,0 м.д.
arC-NH 2,5-5,0 м.д.
al или ar N+H 6,0-9,0 м. д.
СН3-N 2,3-3,1 м.д.
ch2-n 2,5-3,5 м.д.
CH-N 3,0-3,7 м. д.
CH-N+ 3,2-4,0 м. д.
ar СН- (C-N) 6,0-7,5 м. д.
Часто широкий
Синглет
Для С-ароматических соединений
смещение по сравнению с сигналом
СН—(С—Н): орто «—0,8 м.д.,
мета «—0,2 м.д., пара «—0,7 м.д.
ar CH-(C-N+) 7,5-8,0 м. д.
Для С-ароматических соединений
смещение по сравнению с сигналом
СН—(С—Н): орто «4-0,7 м.д.,
мета «4-0,4 м.д., пара «4-0,3 м.д.
3.8. Азотсодержащие соединения 65
Отнесение Спектральный диапазон Комментарии
N-H st 3500 3200 см"1 Положение зависит от степени ассоциации, для свободных NH и связанных Н-связями часто разные полосы; для NH2 всегда не менее двух полос
N+-H st 3000 2000 см"1 Широкая, похожая на полосу СООН, но более структурированная полоса
N-H 6 1650-1550 см"1 Слабая или отсутствует
N+-H <5 1600-1460 см"1 Часто слабая
H-C(-N) st 2850-2750 см”1 Для CH3(-N) и СН2(—N); близкий диапазон для простых эфиров
Молекулярный Нечетное массовое число для нечетного
ион числа атомов N Алифатические соединения: слабый сигнал, склонность к протонированию Ароматические соединения: интенсивный сигнал, склонности к протонированию нет, часто имеет значение пик [М+Н]+
Фрагменты Алифатические: Основной пик алифатических аминов, как
m/z 30, 44, 58,... правило, возникает при разрыве следую-
щей за аминогруппой связи
RK -1+. -R • R\ +
zn-ch2-r3J —Д=СН2
R2 R-2
ИК
Перегруп-
Элиминирование алкенов после аминного
пировки
распада:
+
Rj—NH=CH2
Алифатические соединения:
нет максимумов поглощения выше 200 нм
Ароматические соединения:
в кислой среде смещение поглощения
в область более коротких волн
с уменьшением интенсивности
УФ
66 3. Комбинированные таблицы
3.8.2 Нитросоединения
Отнесение Спектральный диапазон Комментарии
ЯМР 13 С al C-NO2 55—110 м.д. Смещение по сравнению с сигналом С—Н «+50 м. д.
al C-(C-NO2) 10-50 м. д. Смещение по сравнению с сигналом С-(С-С) «-6 м.д.
al C-(CCNO2) 10-60 м. д. Смещение по сравнению с сигналом С-(С-С-С) «-2 м.д.
ar C-NO2 130-150 м. д. Смещение по сравнению с сигналом С—Н «4-20 м. д.
ar C-(C-NO2) 120-140 м. д. Смещения по сравнению с сигналом С—(С—Н): орто «—5 м.д., мета «4-1 м.д., пара «4-6 м.д.
ЯМР al CH- NO2 4,2—4,6 м. д.
ar CH-(C-NO2) 7,5-8,5 м. д. Для С-ароматических соединений смещение по сравнению с сигналом CH—(С—Н): орто «4-1 м.д., мета «4-0,3 м.д., пара «4-0,4 м.д.
ИК NO2 st as 1660-1490 см”1 От интенсивной до очень интенсивной
NO2 st sy 1390-1260 см”1 От интенсивной до очень интенсивной
мс Молекулярный ион Фрагменты Перегруппи- ровки [М-16]+‘, [М-46]+ m/z 30, [М-17]+, [М—30]+, [М—47]+' Нечетное массовое число для нечетного числа атомов N Алифатические соединения: слабый сигнал или отсутствует Ароматические соединения: интенсивный сигнал
УФ «275 нм (1g £ < 2) «350 нм (1g £ « 2) Алифатические соединения Ароматические соединения
3.9. Тиолы и сульфиды 67
3.9 Тиолы и сульфиды
Отнесение Спектральный диапазон Комментарии
alC-S ar C-S 5-60 м. д. 120-140 м. д. По сравнению со связями С—С заметного смещения нет 13С ЯМР
al C-SH arC-SH al СН—S ar CH-S 1,0-2,0 м.д. 2,0-4,0 м. д. 2,0-3,2 м. д. 7,0 7,5 м.д. Вицинальная константа ССВ J к 5 9 Гц гН ЯМР
S-Hst 2600-2540 см"1 Часто слабая полоса ИК
Молекулярный ион Изотопный пик 34S при [М+2]+’ ~ 4,5% Алифатические соединения: интенсивность выше, чем для соответствующих спиртов и простых эфиров мс
Фрагменты m/z 47, 61, 75,... Сульфидный распад:
"14-. — Ro R,—S-CH2-R2] R —S=CH2
Перегруппи- ровки m/z 34, 35, 48 [М-33]+, [М-34]+- Элиминирование алкена после сульфидного распада
< 225 нм (1g е 3-4) 220-250 нм (1g е 2-3) В алифатических соединениях УФ
68 3. Комбинированные таблицы
3.10 Карбон и л содержащие соединения
3.10.1 Альдегиды
Отнесение Спектральный диапазон Комментарии
ЯМР 13С СНО al С-(СНО) al С-(С-СНО) (С)=С-(СНО) С=(С-СНО) аг С-(СНО) 190-205 м.д. 30-70 м. д. 5-50 м. д. 110-160 м.д. 110-160 м. д. 120-150 м.д. Константа ССВ 1 Лен ~172 Гц Константа ССВ 2Лсн 20-50 Гц Смещение по сравнению с сигналом С-(С-СНз) ю-10м.д.
ЯМР ХН Н-(С=О) al СН-(СНО) СН=СН-(СНО) аг СН-(С-СНО) 9,0-10,5 м. д. 2,0-2,5 м. д. 5,5-7,0 м. д. 7,2-8,0 м. д. 3Лнн 0-3 Гц 3Лнн ~ 8 Гц Для С-ароматических соединений смещение по сравнению с сигналом CH—(С—Н): орто —4-0,6 м.д., мета яа+0,2 м.д., пара —4-0,3 м.д.
ИК comb С=О st 2900-2700 см-1 1765-1645 см-1 Две слабые полосы Алифатические соединения: -1730 см"1 Сопряженные структуры: »1690 см-1
мс Молекулярный ион Алифатические соединения: умеренная интенсивность Ароматические соединения: интенсивный сигнал
Фрагменты [М-1]+ [М-29]+ Для алифатических альдегидов значимы до С7
Перегруппи- m/z 44, [М-44]+- Алифатические альдегиды
УФ
270-310 нм (1g е ю 1)
207 нм (1g £ — 4)
250 нм (1g £ > 3)
Насыщенные альдегиды
а,/3-Ненасыщенные альдегиды
Ароматические альдегиды
П —> 7Г*
3.10. Карбонилсодержащие соединения 69
3.10.2 Кетоны
Отнесение Спектральный Комментарии
диапазон ____________
с=о al С-(С=О) al С-(С-С=О) (С)=С-(С=О) С=(С-С=О) аг С-(С=О) 195-220 м. д. 25-70 м. д. 5-50 м. д. 105-160 м.д. 105-160 м.д. 120-150 м.д. Смещение по сравнению с сигналом С-(С-СНз) «-6 м.д. 13C ЯМР
al СН-(С=О) СН=СН-(С=О) 2,0-3,6 м. д. 5,5-7,0 м. д. CH—СО—al 2,0-2,6 м.д. СН-СО-аг 2,5-3,6 м.д. 7H ЯМР
аг СН-(С-ОО) 7,2-8,0 м.д. Для С-ароматических соединений смещение по сравнению с сигналом CH—(С—Н): орто «+0,6 м.д., мета «+0,1 м.д., пара «+0,2 м.д.
С=О st 1775-1650 см-1 Алифатические соединения: «1715 см-1 Циклические соединения: размер цикла 6: «1715 см-1 размер цикла < 6: 1750 см-1 Сопряженные структуры: «1690-1665 см”1 ИК
Молекулярный ион Фрагменты Алифатические соединения: умеренная интенсивность Ароматические соединения: интенсивный сигнал Расщепление кетонов ° К* R —* Ric°+. . R2co+, r2 мс
m/z 44, [М—44]+’
Перегруппи-
ровки
Алифатические кетоны
70 3. Комбинированные таблицы
УФ
Отнесение Спектральный диапазон Комментарии
Р Ч 1 1 * * < 200 нм (1g е 3-4) 250-300 нм (1g е 1-2) 215 нм (1g е « 4) 245 нм (1g £ > 3) Насыщенные кетоны о,/3-Ненасыщенные кетоны Ароматические кетоны
3.10.3 Карбоновые кислоты
Отнесение Спектральный диапазон Комментарии
ЯМР 13 С СООН al С-(СООН) 170-185 м. д. 25-70 м. д. В СОО- смещение по сравнению с сигналом СООН от 0 до +8 м. д.
al С-(С-СООН) (С)=С-(СООН) С=(С-СООН) аг С-(СООН) 5-50 м. д. 105 160 м. д. 105-160 м. д. 120-150 м.д. Смещение по сравнению с сигналом С-(С-СНз) «-6 м.д.
ЯМР гН СООН al СН-(СООН) СН=СН-(СООН) 10,0-13,0 м. д. 2,0-2,6 м. д. 5,2-7,5 м. д. Положение и форма сигнала сильно зависят от условий эксперимента
аг СН-(С-СООН) 7,2-8,0 м. д. Для С-ароматических соединений смещение по сравнению с сигналами СН—(С—Н): орто «+0,8 м.д., мета «+0,2 м.д., пара «+0,3 м.д.
ИК СОО-Н st 3550-2500 см"1 Широкая полоса
С=О st 1800-1650 см'1 Алифатические соединения: «1715 см-1 Сопряженные структуры: «1695 см-1 Для СОО- две полосы: 1580 и 1420 см-1
СО—ОН ё оор «920 см-1 Для димеров
мс Молекулярный ион Алифатические соединения: умеренные сигналы, интенсивные
для длинных цепей, склонность
к протонированию
Ароматические соединения:
интенсивные сигналы
3.10. Карбонилсодержащие соединения 71
Отнесение Спектральный диапазон Комментарии
Фрагменты [М-17] + Интенсивные сигналы
[М—45] + для ароматических кислот
Перегруппи- m/z 60, 61 Алифатические кислоты
ровки [М-18]4- Алифатические кислоты Opmo-эффект в ароматических кислотах:
X: СН2,
О,
N,
S и т. д.
МС
<220 нм (1g г 1-2)
>193 нм (1g £ « 4)
>230 нм (1g £ > 3)
Насыщенные кислоты
а,/3-Ненасыщенные кислоты
Ароматические кислоты
УФ
3.10.4 Сложные эфиры и лактоны
Отнесение Спектральный диапазон Комментарии
COOR al C-(COOR) 165-180 м.д. 20-70 м. д. Смещение по сравнению с СООН: ЯМР 13С от —5 до —10 м.д.
al С-(С—COOR) 5-50 м. д. Смещение по сравнению с сигналом С-(С-СНз) «-6 м.д.
al C-(OCOR) (C)=C-(COOR) C=(C—COOR) (C)=C—(OCOR) C=(C—OCOR) ar C—(COOR) ar C—(OCOR) 50-100 м. д. 105-160 м.д. 105-160 м. д. 100-150 м.д. 80-130 м. д. 120-150 м.д. 100-160 м.д. Смещение по сравнению с сигналом С—(ОН) от +2 до +10 м.д.
al CH—(COOR) 2,0-2,5 м. д. CH3COOR «2,0 м. д.; CH2COOR ЯМР гН «2,3 м.д.; CHCOOR «2,5 м.д.
al CH—(OCOR) 3,5-5,3 м. д. CH3OCOR «3,5-3,9 м.д. CH2OCOR «4,0-4,5 м.д. CHOCOR «4,8-5,3 м.д.
72 3. Комбинированные таблицы
Отнесение Спектральный Комментарии
диапазон
ЯМР 'н СН=СН—(COOR) 5,2-7,5 м. д. Смещение по сравнению с сигналом СН=СН—Н: геминальный «4-0,8 м.д., цис «4-1,1 м.д., транс «4-0,5 м.д.
С=СН—(OCOR) 6,0-8,0 м. д. Смещение по сравнению с сигналом
CH=C-(OCOR) 4,5-6,0 м. д. СН=СН—Н: геминальный «4-2,1 м.д., цис «—0,4 м.д., транс «—0,6 м.д.
аг CH-(C-COOR) 7,5-8,5 м. д. Для С-ароматических соединений смещение по сравнению с сигналом СН—(С—Н): орто «4-0,7 м.д., мета «4-0,1 м.д., пара «4-0,2 м.д.
ar CH-(C-OCOR) 6,8-7,5 м. д. Для С-ароматических соединений смещение по сравнению с сигналом СН—(С—Н): орто «—0,2 м.д., мета «0 м.д., пара «—0,1 м.д.
ИК С=О st 1745-1730 см"1 Интенсивная полоса; диапазон для алифатических сложных эфиров Более высокие волновые числа для hal-C-COO, СОО-С=С, СОО-аг и лактонов с малыми циклами Более низкие волновые числа для С=С—COOR и ar—COOR
С-О st 1330 1050 см”1 Обычно две полосы, хотя бы одна из них
интенсивная
мс Молекулярный Алифатические сложные эфиры:
ИОН слабые, склонность к протонированию Алифатические лактоны: сигналы от средних до слабых, склонность к протонированию Ароматические сложные эфиры и лактоны: интенсивный сигнал
Фрагменты [M-RO]+ Сложные эфиры
[M-ROCO]+ Сложные эфиры Лактоны: потеря ^-заместителей (присоединенных к эфирному атому С), декарбонилирование, для ароматичес- ких лактонов также двойное декарбони-
лирование
3.10. Карбон илсодержащие соединения 73
Отнесение Спектральный диапазон Комментарии
Перегруп- Элиминирование алкена из спиртового МС
пировки остатка
-^О
И2
Rj-CH=CH2 + r2-cooh
Элиминирование спиртовой боковой
цепи с двойным переносом водорода
(для спиртов > Сг)
Rl COOR2
Элиминирование алкильной цепи
кислотного фрагмента в виде алкена
-RrCH=CH2
Элиминирование спирта из
opmo-замещенных ароматических сложных
эфиров
Лактоны
[М-18]4”
<220 нм (1g е 1-2)
>193 нм (1g е ~ 4)
>230 нм (1g е > 3)
Алифатические сложные эфиры
сц/З-Ненасыщенные сложные эфиры
Ароматические сложные эфиры
УФ
74 3. Комбинированные таблицы
3.10.5 Амиды карбоновых кислот и лактамы
Отнесение Спектральный диапазон Комментарии
ЯМР 13С CONR2 al C-(CONR2) 165-180 м.д. 20-70 м.д.
al C-(C-CONR2) 5-50 м. д. Смещение по сравнению с сигналом С-(С-СНз) «-6 м.д.
al C-(NCOR) 25-80 м.д. Смещение по сравнению с сигналом C-(NH) « от -1 до —2 м.д.
C=C-(CONR2) ar C-(CONR2) ar C-(NCOR) 105-160 м.д. 120-150 м.д. 110-150 м.д.
ЯМР CONH 5-10 м. д. Часто широкий или очень широкий сигнал; расщепление из-за ССВ в Н—N—С—Н часто наблюдается только на сигнале СН
al CH-(CONR2) al CH—(NCOR) 2,0-2,5 м. д. 2,7-4,8 м.д. CH3NCOR «2,7-3,0 м.д. CH2NCOR «3,1-3,5 м.д. CHNCOR «3,8-4,8 м.д.
CH=CH-(CONR2) 5,2-7,5 м. д. Смещение по сравнению с сигналом СН=СН—Н: геминальный ~+1,4 м.д., цис «-|-1,0 м.д., транс «4-0,5 м.д.
C=CH—(NCOR) CH=C—(NCOR) 6,0-8,0 м. д. 4,5-6,0 м. д. Смещение по сравнению с сигналом СН=СН—Н: геминальный «4-2,1 м.д., цис «—0,6 м.д., транс «—0,7 м.д.
ar CH-C(CONR2) 7,5-8,5 м. д. Для С-ароматических соединений смещение по сравнению с сигналом CH—(С—Н): орто «4-0,6 м.д., мета «4-0,1 м.д., пара «4-0,2 м.д.
ar CH-C(NCOR) 6,8-7,5 м. д. Для С-ароматических соединений
смещение по сравнению с сигналом
CH—(С—Н): орто «О м.д.,
мета «О м.д., пара « от 0 до —0,3 м.д.
3.10. Карбонилсодержащие соединения 75
Отнесение Спектральный диапазон Комментарии
N-Hst 3500 3100 см"1 Положение и форма зависят от степени
С=0 st 1700-1650 см”1 ассоциации, для свободных NH и связан- ных Н-связями часто разные полосы; для NH2 всегда хотя бы две полосы Интенсивная полоса, область частот для
(амид I) N—Н <5 и 1630-1510 см”1 амидов, ё- и больших лактамов, более высокие волновые числа для (3- и у-лактамов Часто интенсивная полоса, отсутствует
N—С—О st sy (амид II) Молекулярный ион Фрагменты Перегруппи- ровки П —> 7Г* [М-18]+- <220 нм (1g £ 1-2) у третичных амидов и лактамов Алифатические амиды: средняя интенсивность, склонность к протонированию Ароматические амиды: интенсивный сигнал Амиды: расщепление с обеих сторон карбонильной группы с последующей потерей СО; большое число фрагментов с четными массами Лактамы: потеря «-заместителя, потеря СО Амиды: элиминирование аминного остатка, элиминирование алкена из аминного или кислотного остатка по аналогии со сложными эфирами Лактамы Алифатические амиды и лактамы
ИК
мс
УФ
4 Спектроскопия ЯМР 13С
4.1 Алканы
4.1.1 Химические сдвиги
Химические сдвиги ядер 13 С в алканах (6 в м. д. относительно ТМС)
-2,3 7,3 СН4 Н3С—СНз 22,8 34,8 14,2 32,2 14,2 10,У 13,и 24,1 I 250 15,4 24,8 32,0 22,3 31,3 тС 27,7 I- 11,8 1 30,1 29,5 23,1 32,1 14,1
23,1
32,4 14,1
29,5 22,8
78 4. Спектроскопия ЯМР 13С
Химические сдвиги ядер 13 С метильных групп (6 в м. д. относительно
ТМС)
Заместитель X <5сн3-х Заместитель X <5сн3-х
-Н -2,3 —2-фурил 13,7
С - СН3 7,3 —2-тиенил 14,7
-СН2СН3 15,4 —2-пирролил 11,8
- СН(СН3)2 24,1 —2-индолил 13,4
-С(СН3)3 31,3 —3-индолил 9,8
- (СН2)6СН3 14,1 —4-индолил 21,6
—СН2-фенил 15,7 —5-индолил 21,5
-ch2f 15,8 —6-индолил 21,7
-СН2С1 18,7 —7-индолил 16,6
—СН2Вг 19,1 Н —F 71,6
-СН21 20,4 а -С1 25,6
-СНС12 31,6 1 -Вт 9,6
—СНВг2 31,8 -I -24,0
-СС1з 46,3 о -ОН 50,2
-СВг3 49,4 - ОСН3 60,9
-СН2ОН 18,2 -ОСН2СН3 57,6
-СН2ОСН3 14,7 -ОСН(СН3)2 54,9
-СН2ОСН2СН3 15,4 —ОС(СН3)3 49,4
-СН2ОСН=СН2 14,6 -ОСН2СН=СН2 57,4
—СН2О-фенил 14,9 —О-циклогексил 55,1
-СН2ОСОСН3 14,4 -ОСН=СН2 52,5
-ch2nh2 19,0 —О-фенил 54,8
-ch2nhch3 14,3 -ОСОСНз 51,5
-CH2N(CH3)2 12,8 —ОСО-циклогексил 51,2
-ch2no2 12,3 -ОСОСН=СН2 51,5
-CH2SH 19,7 —ОСО-фенил 51,8
-CH2SO2CH3 6,7 -ОСООСН3 54,9
-CH2SO3H 8,0 —О8О2-4-толил 56,3
-CH2CHO 5,2 -OSO2OCH3 59,1
-CH2COCH3 7,0 N -nh2 28,3
-CH2COOH 9,6 -nh+ 26,5
—циклопентил 20,5 —NHCH3 38,2
—циклогексил 23,1 —NH-циклогексил 33,5
-сн=сн2 18,7 —NH-фенил 30,2
—C=CH 3,7 -N(CH3)2 47,5
—фенил 21,4 —/V-ПИр [)ОЛИД ИНИЛ 42,7
—1-нафтил 19,1 —N-пиперидинил 47,7
—2-нафтил 21,5 —М(СН3)фенил 39,9
—2-пиридил 24,2 —N-пирролил 35,9
—3-пиридил 18,0 —ДД имидазолил 32,2
—4-пиридил 20,6 —Д’-пиразолил 38,4
4.1. Алканы 79
Заместитель X <5ch3-x Заместитель X <5сн3-х
—ЛГ-индолил 32,1 о -сно 31,2
-NHCOCH3 26,1 || - СОСНз 30,7
-N(CH3)CHO 31,5; 36,5 С -СОСН2СН3 27,5
-N(CH3)COCH3 35,0; 38,0 /\ -СОСС13 21,1
-NO2 61,2 -сосн=сн2 25,7
-CN 1,7 —СО-циклогексил 27,6
-NC 26,8 —СО-фенил 25,7
—NCS 29,1 -соон 21,7
S -SH 6,5 -СОО- 24,4
-SCH3 19,3 -СООСНз 20,6
S-w-CgHiY 15,5 -СООСОСНз 21,8
—S- фенил 15,6 -conh2 22,3
-SSCH3 22,0 -CON(CH3)2 21,5
-SOCH3 40,1 -COSH 32,6
-SO2CH3 42,6 -COSCH3 30,2
-SO2CH2CH3 39,3 -СОСОСНз 23,2
-SO2C1 52,6 -COCI 33,6
-SO3H 39,6 -COBr 39,1
—SO3Na 41,1 -COSi(CH3)3 35,7
80 4. Спектроскопия ЯМР 13С
Химические сдвиги ядер 13 С в монозамещенных алканах
(ё в м. д. относительно ТМС)
Заместитель Метил -СНз Этил -СН2 -СНз Пропил-1
-сн2 -сн2 -СНз
—н -2,3 7,3 7,3 15,4 15,9 15,4
С -сн=сн2 18,7 27,4 13,4 36,2 22,4 13,6
-С=СН 3,7 12,3 13,8 20,6 22,2 13,4
—фенил 21,4 29,1 15,8 38,3 24,8 13,8
Н —F 71,6 80,1 15,8 85,2 23,6 9,2
а -С1 25,6 39,9 18,9 46,8 26,3 11,6
1 -Вт 9,6 27,6 19,4 35,6 26,4 13,0
-I -24,0 -1,6 20,6 9,1 27,0 15,3
о -ОН 50,2 57,8 18,2 64,2 25,9 10,3
-ОСН3 60,9 67,7 14,7 74,5 23,2 10,5
-ОСН2СН3 57,6 66,0 15,4 72,5 23,2 10,7
-ОСН(СН3)2 54,9
—ОС(СН3)3 49,4 56,8 16,4
—О-фенил 54,8 63,2 14,9 69,4 22,8 10,6
-ОСОСНз 51,5 60,4 14,4 66,2 22,4 10,5
—ОСО-фенил 51,8 60,8 14,4 66,4 22,2 10,5
—О8О2-4-толил 56,3 66,9 14,7 72,2 22,3 10,0
N -nh2 28,3 36,9 19,0 44,6 27,4 11,5
—NHCH3 38,2 45,9 14,3 54,0 23,2 12,5
-N(CH3)2 47,6 53,6 12,8 61,8 20,6 11,9
—NHCOCH3 26,1 34,4 14,6 40,7 22,5 ИД
-no2 61,2 70,8 12,3 77,4 21,2 10,8
—CN 1,7 10,8 10,6 19,3 19,0 13,3
-NC 26,8 36,4 15,3 43,4 22,9 11,0
S -SH 6,5 19,1 19,7 26,4 27,6 12,6
-SCH3 19,3
-SSCH3 22,0 31,8 14,7
-SOCH3 40,1
-SO2CH3 42,6 48,2 6,7 56,3 16,3 13,0
-SO2C1 52,6 60,2 9,1 67,1 18,4 12,1
-SO2OH 39,6 46,7 8,0 53,7 18,8 13,7
О -CHO 31,3 36,7 5,2 45,7 15,7 13,3
- COCH3 30,7 35,2 7,0 45,2 17,5 13,5
с —СО-фенил 25,7 31,7 8,3 40,4 17,7 13,8
Л -СООН 21,7 28,5 9,6 36,2 18,7 13,7
-СООСН3 20,6 27,2 9,2 35,6 18,9 13,8
-conh2 22,3 29,0 9,7
-coci 33,6 41,0 9,3 48,9 18,8 13,0
4.1. Алканы 81
Химические сдвиги ядер 13 С в монозамещенных жение) (5 в м. д. относительно ТМС) алканах (продол-
Заместитель Изопропил mpem-Бутил
-CH -ch3 -С - CH3
—н 15,9 15,4 25,0 24,1
С -сн=сн2 32,3 22,1 33,8 29,4
-с=сн 20,3 22,8 27,4 31,1
—фенил 34,3 24,0 34,6 31,4
Н —F 87,3 22,6 93,5 28,3
а -С1 53,7 27,3 66,7 34,6
1 -Вг 44,8 28,5 62,1 36,4
-I 20,9 31,2 43,0 40,4
о -ОН 64,0 25,3 68,9 31,2
- ОСНз -ОСН2СН3 72,6 21,4 72,7 72,6 27,0 27,7
-ОСН(СН3)2 68,5 23,0 73,0 28,5
- ОС(СНз)з —О-фенил 63,5 69,3 25,2 22,0 76,3 33,8
-ОСОСНз 67,5 21,9 79,9 28,1
—ОСО-фенил 68,2 21,9 80,7 28,2
N -nh2 43,0 26,5 47,2 32,9
—NHCH3 50,5 22,5 50,4 28,2
—N(CH3)2 55,5 18,7 53,6 25,4
-NHCOCH3 40,5 22,3 49,9 28,6
-no2 78,8 20,8 85,2 26,9
—CN 19,8 19,9 28,1 28,5
—NC 45,5 23,4 54,0 30,7
S -SH -SCH2CH3 29,9 34,4 27,4 23,4 41,1 35,0
-SO2CH3 53,5 15,2 57,6 22,7
-SO2C1 67,6 17,1 74,2 24,5
-SO2OH 52,9 16,8 55,9 25,0
О -CHO 41,1 15,5 42,4 23,4
II -COCH3 41,6 18,2 44,3 26,5
с —СО-фенил 35,2 19,1 43,5 27,9
Л -COOH 34,1 18,8 38,7 27,1
-COOCH3 34,1 19,1 38,7 27,3
-conh2 34,9 19,5 38,6 27,6
-coci 46,5 19,0 49,4 27,1
82 4. Спектроскопия ЯМР 13С
Химические сдвиги ядер 13С в 1-замещенных н-октанах (<5 в м. д. относительно ТМС)
Заместитель 1 -сн2 2 -сн2 - 3 -сн2 4 -сн2 5 -сн2 6 -сн2 7 —сн2 8 -СН3
—Н 14,1 22,8 32,1 29,5 29,5 32,1 22,8 14,1
С -сн=сн2 34,5 «29,6 я «29,6 «29,6 «29,6 32,2 23,0 13,9
—фенил 36,2 31,7 ₽ «29,6 «29,6 «29,6 32,1 22,8 14,1
Н —F 84,2 30,6 25,3 29,3 29,3 31,9 22,7 14,1
а -С1 45,1 32,8 27,0 29,0 29,2 31,9 22,8 14,1
1 —Вг 33,8 33,0 28,3 28,8 29,2 31,8 22,7 14,1
-I 6,9 33,7 30,6 28,6 29,1 31,8 22,6 14,1
О -он 63,1 32,9 25,9 29,5 29,4 31,9 22,8 14,1
—O-w-CgHi? 71,1 30,0 26,3 29,6 29,4 32,0 22,8 14,1
-ONO 68,3 29,2 26,0 29,3 29,3 31,9 22,7 14,0
N -NH2 42,4 34,1 27,0 29,6 29,4 31,9 22,7 14,1
-N(CH3)2 60,1 29,5* р «27,9* «27,7* 29,7* 32,0 22,8 14,4
-no2 75,8 26,2 27,9 «29,6 «29,6 31,4 22,6 14,0
-CN 17,2 25,5 я «29,9 «29,9 «29,9 31,8 22,7 14,0
S -SH 24,7 34,2 28,5 29,2 29,1 31,9 22,7 14,1
-SCH3 34,5 29,0 29,4 29,4 29,4 31,9 22,8 14,1
- SO-H-C8H17 52,6 «29,1 я «29,1 «29,1 «29,1 31,8 22,7 14,1
о -CHO 44,0 22,2 я «29,3 «29,3 «29,3 31,9 22,7 14,1
|| -СОСНз 43,7 24,1 я «29,5 «29,5 «29,5 32,0 22,8 14,1
С —СО-фенил 38,6 24,4 29,5 29,5 29,5 31,9 22,7 14,0
/\ -СООН 34,2 24,8 я «29,3 «29,3 «29,3 31,9 22,7 14,1
-COOCH3 34,2 25,1 29,3 29,3 29,3 31,9 22,8 14,1
-conh2 35,5 25,4 29,1 29,1 29,1 31,6 22,3 14,0
-COCI 47,2 25,1 28,5 29,1 29,1 31,8 22,7 14,1
* Отнесение ненадежно
4.1. Алканы 83
Оценка величин химических сдвигов ядер 13 С в алифатических со-
единениях (д в м. д. относительно ТМС)
Химические сдвиги сигналов ар3-гибридизованных атомов углерода можно оце-
нить с помощью правил аддитивности, используя в качестве исходного значе-
ния величину химического сдвига сигнала метана (—2,3 м. д.) и инкременты
заместителей в а-, /3-, 7- и 5-положениях (см. следующие стр.). Некоторые
заместители занимают два положения. Так, в представленном ниже примере
четвертичный атом углерода С находится в 5-положении относительно ато-
ма углерода а, в то время как ар3-гибридизованный атом кислорода /3-СОО
группы занимает 7-положение. Эта простая линейная модель нуждается в кор-
ректировке в случае сильного разветвления на рассматриваемом атоме С и
(или) на соседних атомах (стерические поправки S). Такие поправки нужны
для заместителей с изменяющейся разветвленностью, т. е. с разным числом
непосредственно связанных атомов водорода. В таблице инкрементов они от-
мечены звездочкой (*). В том случае, если 7-заместители находятся в стери-
чески фиксированном положении, необходимы дополнительные поправочные
коэффициенты (конформационные поправки К).
Выполненные с помощью этого правила аддитивности оценки значений хи-
мических сдвигов отличаются обычно менее чем на 4 м. д. от эксперименталь-
ных величин. Большие расхождения можно ожидать для сильноразветвленных
систем (особенно для четвертичных атомов углерода). Для атомов углерода,
связанных с несколькими атомами галогена, кислорода и(или) другими сильно
дезэкрапирующими заместителями, необходимы дополнительные поправки [1].
Без таких поправок отклонения могут быть столь велики, что это правило ста-
нет бесполезно.
Пример: Оценка химических сдвигов для TV-mpem-бутоксикарбонилаланина
Н О
а исходное значение -2,3 ь исходное значение -2,3
1 а-С 9,1 1 а-С 9,1
1 а-СООН 20,1 1 /3-СООН 2,0
1 a-NH 28,3 1 /3-NH 11,3
1 /3-СОО 2,0 1 7-СОО -2,8
1 5-С 0,3 1 8(первичный, 3) -1,1
1 8(третичный, 2) -3,7 расчет 16,2
расчет 53,8 эксперимент 17,3
эксперимент 49,0
С исходное значение -2,3 d исходное значение -2,3
3 а-С 27,3 1 а-С 9,1
1 а-ОСО 56,5 2/3-С 18,8
1 7-NH -5,1 1 /3-ОСО 6,5
1 5-С 0,3 1 5-NH 0,0
3 8(четвертичный, 1) -4,5 1 8(первичный, 4) -3,4
расчет 72,2 расчет 28,7
эксперимент 78,1 эксперимент 28,1
84 4. Спектроскопия ЯМР 13С
Оценка величин химических сдвигов ядер 13 С в алифатических
соединениях (<5 в м. д. относительно ТМС)
<5 = -2,3 + £zi + £Sj + £Kk
• j k
Заместитель Инкремент Z, для заместителей в положении 5
а /? 7
-Н 0,0 0,0 0,0 0,0
-с<* 9,1 9,4 -2,5 0,3
-с*=с 19,5 6,9 -2,1 0,4
-с=с- 4,4 5,6 -3,4 -0,6
—фенил 22,1 9,3 -2,6 0,3
Н —F 70,1 7,8 -6,8 0,0
а -С1 31,0 10,0 -5,1 -0,5
1 -Вт 18,9 11,0 -3,8 -0,7
-I -7,2 10,9 -1,5 -0,9
о -о-* 49,0 10,1 -6,2 0,3
-ОСО- 56,5 6,5 -6,0 0,0
-0N0 54,3 6,1 -6,5 -0,5
N -NC* 28,3 11,3 -5,1 0,0
-N+<:; 30,7 5,4 -7,2 -1,4
-NHj 26,0 7,5 -4,6 0,0
- no2 61,6 3,1 -4,6 -1,0
-CN 3,1 2,4 -3,3 -0,5
—NC 31,5 7,6 -3,0 0,0
s -s*- 10,6 И,4 -3,6 -0,4
-SCO- 17,0 6,5 -3,1 0,0
-s*o- 31,1 7,0 -3,5 0,5
—s*o2— 30,3 7,0 -3,7 0,3
-SO2C1 54,5 3,4 -3,0 0,0
-SCN 23,0 9,7 -3,0 0,0
о -CHO 29,9 -0,6 -2,7 0,0
II -co- 22,5 3,0 -3,0 0,0
С -COOH 20,1 2,0 -2,8 0,0
/\ -COO- 24,5 3,5 -2,5 0,0
-coo- 22,6 2,0 -2,8 0,0
-CO-N< 22,0 2,6 -3,2 -0,4
-coci 33,1 2,3 -3,6 0,0
-C=NOH син 11,7 0,6 -1,8 0,0
—C=NOH анти 16,1 4,3 -1,5 0,0
-CS-N< 33,1 7,7 -2,5 0,6
—Sn -5,2 4,0 -0,3 0,0
4.1. Алканы 85
Стерические поправки S
Наблюдаемое ядро 13С S для указанного числа заместителей на а-атоме“
1 2 3 4
первичный (СНз) 0,0 0,0 -1,1 -3,4
вторичный (СН2) 0,0 0,0 -2,5 -6,0
третичный (СН) 0,0 -3,7 -8,5 -10,0
четвертичный (С) -1,5 -8,0 -10,0 -12,5
а Для применения к каждому из соседних атомов, которые могут иметь пере-
менное число неводородных заместителей (отмечены звездочкой (*) в таблице
инкрементов).
Конформационные поправки К для у-заместителей
Конформация К
Ж синперипланарная /Дд -4,0
£ х синклинальная JkSk -1,0
С антиклинальная ДДЛ 0,0
с антиперипланарная 2,0
X не фиксирована 0,0
Можно также использовать химические сдвиги стандартного соединения в ка-
честве исходных величин, если его структура близка к структуре, предполага-
емой для изучаемого вещества. Инкременты, соответствующие структурным
элементам, отсутствующим в стандартном веществе, затем добавляются к ис-
ходной величине, а соответствующие величины для структурных элементов,
которые присутствуют в стандарте, но отсутствуют в изучаемом веществе, вы-
читаются.
86 4. Спектроскопия ЯМР 13С
Пример: Оценка химических сдвигов для атомов углерода а и b в N-mpem-
бутоксикарбонилаланине с использованием химических сдвигов валина в ка-
честве исходных величин (а' и Ь').
Изучаемое соединение: Стандарт:
исходное значение 61,6 Ь исходное значение 30,2
1 /3-СОО 2,0 1 7-СОО -2,8
1 5-С 0,3 1 8(первичный, 3) -1Д
1 S (третичный, 2) -3,7 - 2 а-С -18,2
- 2/J-C -18,8 — 1 S (третичный, 3) 9,5
— 1 8(третичный, 3) 9,5 расчет 17,6
расчет 50,9 эксперимент 17,3
эксперимент 49,0
4.1.2 Константы спин-спинового взаимодействия
Константы спин-спинового взаимодействия 13С-1 Н
Взаимодействие через одну связь (Мен в Гц)
Константа спин-спипового взаимодействия 13С-1Н, имеющая в метане величи-
ну 125 Гц, в присутствии электроотрицательных заместителей увеличивается,
и ее можно оценить, используя следующее правило аддитивности:
Jch Z1Z2Z3 = 125,0 + 52Zi
Заместитель Инкременты Z, Заместитель Инкременты Zi
-Н 0,0 -Вт 27,0
- СН3 1,0 -I 26,0
- С(СН3)з -3,0 -ОН 18,0
-СН2С1 3,0 —О-фенил 18,0
—СН2Вг 3,0 -nh2 8,0
-СН21 7,0 -NHCH3 7,0
-СНС12 6,0 -N(CH3)2 6,0
-СС1з 9,0 -CN 11,0
-с=с 7,0 -SOCH3 13,0
—фенил 1,0 -сно 2,0
—F 24,0 - СОСНз -1,0
-С1 27,0 -соон 5,5
Пример: Оценка величины константы спин-спинового взаимодействия 13С-1Н
в СНС13: J = 125,0 + 3 х 27,0 = 206,0 Гц (эксп.: 209,0 Гц)
4.1. Алканы 87
Взаимодействие через две и более связей (|Jch| в Гц)
Константы спип-спинового взаимодействия можно оценить с помощью соот-
ветствующих констант 1Н-1Н [2]:
2Jch 1-6
3Jch 0-10
Jch ~ 0,62 JHh
1Н-СН2—13СН3 4,5
1Н—СН2~СН2~ 13СН3 5,8
Константы спин-спинового взаимодействия 13С-1Н через три связи зависят от
двугранного угла так же, как константы для вицинальных протонов 1Н-1Н
(см. разд. 5.1):
« 9
Константы спин-спинового взаимодействия 13С—13С (|Jcc| в Гц)
Н3С-СН3 1J 34,6
JJab 34,6
b d
2Jac 4,6
3Jad 4,6
Jbd
/О.
а Ь
2Jab 2,4
2Jab 16,1
2Jab 0,5
2Jac 4,9
Константы спин-спинового взаимодействия 13C-13C через три связи зависят от
двугранного угла так же, как константы для вицинальных протонов 1Н-1 Н (см.
разд. 5.1) и константы 13С-1Н. Максимальные величины «4-6 Гц наблюдаются
для двугранных углов 0° и 180°, а минимальные величины около 0 Гц для
двугранных углов 90°.
4.1.3 Литература
[1] Fiirst A., Pretsch Е., Robien W., “A comprehensive parameter set for the pre-
diction of the 13C NMR chemical shifts of sp3-hybridized carbon atoms in
organic compounds”, Anal. Chim. Acta, 233, 213 (1990).
[2] Marshall J. L., Carbon-carbon and carbon-proton NMR couplings, Ver lag Che-
mie International, Deerfield Beach, FL, 1983.
88 4. Спектроскопия ЯМР 13С
4.2 Алкены
4.2.1 Химические сдвиги
Химические сдвиги ядер 13 С в алкенах (5 в м. д. относительно ТМС)
Типичный диапазон химических сдвигов для ядер 13С двойных связей С=С
80-160 м. д.; для соединений с О- и N-заместителями наблюдается более ши-
рокий интервал 40-210 м.д. Для ненасыщенных ациклических углеводородов
химические сдвиги можно предсказать с высокой точностью (см. ниже). Для
оценки химических сдвигов ядер 13 С во всех других замещенных алкенах мож-
но использовать эффекты заместителей, представленные для химических сдви-
гов в винильных группах. Однако, поскольку зависимые от конфигурации
параметры недоступны, оцениваемые таким способом величины химических
сдвигов менее точны, чем в случае ненасыщенных ациклических углеводоро-
дов.
Химические сдвиги ядер 13С в «р3-гибридизованных атомах углерода в ви-
цинальном положении по отношению к двойным связям могут быть оценены
при помощи правила аддитивности, представленного на с. 84. Конформаци-
онные поправки К для 7-заместителей в цис- и транс-дизамещенных алкенах
отличаются на 6 м. д., из-за того что положение этих заместителей фиксирова-
но двойной связью.
Оценка химических сдвигов ядер 13 С в sp2-гибридизованных атомах
углерода в ненасыщенных ациклических углеводородах (б в м. д. отно-
сительно ТМС)
С-С-С-С'=С-С-С-С
7' 0' а1 ) а 0 7
Исходная величина: 123,3
Инкременты для заместителей при атоме С:
при рассматриваемом атоме (С) при соседнем атоме (С')
а 10,6 а’ -7,9
0 4,9 0' -1,8
7 -1,5 7' 1,5
Стерические поправки:
• для каждой пары цис-а, «'-заместителей -1,1
• для пары геминальных а,«-заместителей -4,8
• для пары геминальных а',«'-заместителей 2,5
• если имеются /3-заместители (один или более) 2,3
4.2. Алкены 89
Пример: Оценка химических сдвигов в цис-4-метил-2-пентене
а b
а исходная величина
1 а-С
1 а'-С
2/3’-С
цис-а,о'
расчет
эксперимент
123,3
10,6
—7,9
-3,6
-1,1
121,3
121,8
исходная величина 123,3
1 а-С 10,6
2 /3-С 9,8
1 а’-С -7,9
цис-а,а’ -1,1
1 /3-заместитель 2,3
расчет 137,0
эксперимент 138,8
Влияние заместителей на химические сдвиги ядер 13 С винилъных
соединений (6 в м. д. относительно ТМС)
X
сн=сн2 <5Ci = 123,3 + Zj
1 2
Заместитель X Z1 z2 Заместитель X Z1 z2
-Н 0,0 0,0 О -ОН 25,7 -35,3
С -СН3 12,9 -7,4 -ОСНз 29,4 -38,9
-СН2СН3 17,2 -9,8 -ОСН2СН3 28,8 -37,1
-СН2СН2СН3 15,7 -8,8 -О(СН2)зСН3 28,1 -40,4
-СН(СН3)2 22,7 -12,0 -ОСОСНз 18,4 -26,7
-(СН2)3 14,6 -8,9 N -N(CH3)2 28,0* -32,0*
-С(СН3)з 26,0 -14,8 -N+(CH3)3 19,8 -10,6
-СН2С1 10,2 -6,0 —TV-пирролидонил 6,5 -29,2
—СН2Вг 10,9 -4,5 -no2 22,3 -0,9
-СН21 14,2 -4,0 —CN -15,1 14,2
-СН2ОН 14,2 -8,4 —NC -3,9 -2,7
-СН2ОСН2СН3 12,3 -8,8 S -SCH2CH3 9,0 -12,8
-сн=сн2 13,6 -7,0 -SO2CH=CH2 14,3 7,9
-GECH -6,0 5,9 о -CHO 15,3 14,5
—фенил 12,5 -11,0 II -COCH3 13,8 4,7
н -F 24,9 -34,3 C -COOH 5,0 9,8
а -С1 2,8 -6,1 A -COOCOCH3 6,3 7,0
1 —Вг -8,6 -0,9 -COCI 8,1 14,0
-I -38,1 7,0 -Si(CH3)3 16,9 6,7
-SiCl3 8,7 16,1
* Расчетные величины
90 4. Спектроскопия ЯМР 13С
Величины, приведенные на предыдущей странице, могут быть также использо-
ваны для оценки химических сдвигов ядер 13 С в зр2-гибридизованных атомах
углерода в алкенах, содержащих более одного заместителя (дне-транс-конфи-
гурация не рассматривается):
с=с
Пример: Оценка химических сдвигов для 1-бром-1-пропена
а b Вг-С=С-СН,
н Н
исходная вел. 123,3 ь исходная вел. 123,3
Zi(Br) -8,6 Z2(Br) -0,9
z2(CH3) —7,4 Z1(CH3) 12,9
расчет 107,3 расчет 135,3
эксперимент 108,9 (цис) эксперимент 129,4 (цис)
104,7 (транс) 132,7 (транс)
Следующие примеры показывают несколько большие различия между изме-
ренными и рассчитанными (в круглых скобках) химическими сдвигами. Обыч-
но это можно ожидать, когда присутствуют несколько заместителей, сильно
взаимодействующих с тг-электронами двойной связи.
NCa bN(CH3)2 а 39,1 На ь N(CH3)2 а 69,2
с=с (29,1) с=с (59,3)
NC N(CH3)2 b 171,0 н N(CH3)2 b 163,0
(207,7) (179,3)
Hva b,N°2 а 151,0 на Ь/ОСН3 а 54,7
с=с (150,4) ,с=с (45,5)
(H3C)2N н b 111,4 н осн3 b 167,9
(113,6) (182,1)
Химические сдвиги ядер 13 С в цис- и транс-дизамещенных алкенах
(<5 в м.д. относительно ТМС)
Заместитель R R R Н Н R Н Н R
- СН3 123,3 124,5
- СН2СН3 131,2 131,3
-С1 118,1 119,9
-Вг 116,4 109,4
-I 96,5 79,4
-CN 120,8 120,2
-ОСН3 130,3 135,2
-соон 130,4 134,2
-СООСНз 130,1 133,5
4.2. Алкены 91
Химические сдвиги ядер 13 С енолов (5 в м. д. относительно ТМС)
Связанный с енольной ОН-группой атом углерода сильно дезэкранирован, так
что его сигнал находится близко от сигнала карбонильного углерода. Другой
атом углерода сильно экранирован.
Енол: Кетон:
а с с 22,5 9 9а 28,5 190,5 Ь 201)1 99,0 а Ь С с 56,6
а. . а с ПМ ь 1 1 с d ° е е 28,3 а а 28,3 32,8 Ь 31)0 46,2 Г ”1 с 54)2 191,1 d 203)6 103,3 в е е 57,3
Химические сдвиги ядер 13 С в алифатических диенах (5 в м. д. отно-
сительно ТМС)
Сопряженные диены
. а 136,9 а b 116,3
Аллены
213,5 74,8 сн2=с=сн2
Оценку химических сдвигов вр2-гибридизованных атомов углерода в замещен-
ных алленах см. в [1].
92 4. Спектроскопия ЯМР 13С
Химические сдвиги ядер 13 С в замещенных алленах (J в м. д. относи-
тельно ТМС)
р а b с
*^С=С=С.
R2 ''н
Ri r2 Из а Ь с
-н -н —н 74,8 213,5 74,8
-СНз -н -н 84,4 210,4 74,1
- СНз -СНз -н 93,4 207,3 72,1
-СНз -н -СНз 85,4 207,1 85,4
- СН2СН3 -н -н 91,7 208,9 75,3
-С(СН3)з -С(СНз)з -н 119,6 207,0 75,8
-сн=сн2 -н -н 93,9 211,4 75,1
-Снсн -н -н 74,8 217,7 77,3
—фенил -н -н 94,4 210,0 78,8
—F -н -н 129,8 200,2 93,9
-С1 -н -н 88,8 207,9 84,5
—Вг -н -н 72,7 207,6 83,8
-I -н —н 35,3 208,0 78,3
- ОСН3 -н -н 123,1 202,0 90,3
-N(CH3)2 -н -н 113,1 204,2 85,5
-CN -н -н 67,4 218,7 80,7
-SCH3 -н -н 90,0 206,1 81,3
-соон -н -н 88,1 217,7 80,0
4.2.2 Константы спин-спинового взаимодействия
Константы спин-спинового взаимодействия 13С-1Н (|Jch| в Гц)
Взаимодействие через одну связь
СН2=СН2
Чен 156,4
СН2=С=СН2 Чен 167,8
Взаимодействие через две связи (типичный диапазон: 0-16)
Чен -2,4
Н Н
>= 13с' Чен 6,9
С1 Н
Правило аддитивности для оценки Чен в алкенах см. в [2].
4.2. Алкены 93
Взаимодействие через три связи
В алкенах константы спин-спинового транс-взаимодействия 1 2 3Н—С=С—13С все-
гда больше, чем соответствующие цис-константы, поэтому в случае одновре-
менного присутствия обоих изомеров отнесение возможно, см. [3].
a 13C H CH3 3J *^ac 3J Jbc 7,6 12,6 a H X ,c= H b 13ch3 c \ Cl 3J *^ac 3J Jbc 4,1 8,1
;c=q
H H
b
a 13е H COOH \ / 3J Jac 7,6 a H 13е COOH / 3J *^ac 7,6
c=c / \ 3J dbc 14,1 c= / c 3J dbc 14,1
H H b a 13е H COOH X / 3J Jab 7,7 H b CH3 4 CH3 13е COOH / 3J Jab 6,9
c=c / IT 3jc 7,4 c / =s 3J 13,2
CH3 CH3 H CH3 v ac
b a b
Константы спин-спинового взаимодействия 13С-13С (|хЛсс| в Гц)
CH2=CH2 •lec 67,6 c a b/CH3 CH2=C H 4b 4c 70,0 41,9
4b 68,8
1 _ b 4c 53,7
CH2=C=CH2 Jcc 98,7 a^^d c 4c
4d 9,0
4.2.3 Литература
[1] Janssen R. Н. А. М., Lousberg R. J. J. Ch., de Bie M. J. A., “An additivity rela-
tion for carbon-13 chemical shifts in substituted allenes”, J. R. Neth. Chem.
Soc., 100, 85 (1981).
[2] Vogeli U., Herz D., von Philipsbom W., “Geminal C,H spin coupling in substi-
tuted alkenes”, Org. Magn. Reson., 13, 200 (1980).
[3] Vogeli U., von Philipsbom W., “Vicinal C,H spin coupling in substituted alke-
nes. Stereochemical significance and structural effects”, Org. Magn. Reson., 7,
617 (1975).
94 4. Спектроскопия ЯМР 13С
4.3 Алкины
4.3.1 Химические сдвиги
Химические сдвиги ядер 13 С в алкинах (5 в м. д. относительно ТМС)
а b
х-с^с-н
Заместитель X а Ь
—н 71,9 71,9
С -СНз 80,4 68,3
-СН2СН3 85,5 67,1
-СН2СН2СН3 84,0 68,7
-СН2СН2СН2СН3 83,0 66,0
- СН(СН3)2 89,2 67,6
- С(СН3)з 92,6 66,8
—циклогексил 88,7 68,3
-СН2ОН 83,0 73,8
-СН=СН2 82,8 80,0
-С=С-СН3 68,8 64,7
—фенил 84,6 78,3
О -ОСН2СН3 90,9 26,5
S -SCH2CH3 72,6 81,4
о -сно 81,8 83,1
|| - СОСНз 81,9 78,1
С -СООН 74,0 78,6
/\ -СООСНз 74,8 75,6
Правило аддитивности для расчета химических сдвигов sp- гибридизированных
атомов углерода в алкинах см. в [1].
4.3. Алкины 95
4.3.2 Константы спин-спинового взаимодействия
Константы спин-спинового взаимодействия 13 С-1 Н (| Jch I в Гц) [2]
a b c H-13C =C-H 249 Jbc 49,3 (в замещенных ацетиленах: 40—60)
a b c de H-C^C-CH3 2Jac 50,1 3Jad 3,4 1 2Jce -10,4 3Jbe 4,7
a be CH.-C=C-CH:i 2Jab -10,3 3Jac 4,3
В случае ацетиленов результаты многоимпульсных экспериментов (DEPT,
INEPT, SEFT или APT) для определения числа протонов, присоединенных к
атому углерода, необходимо тщательно анализировать. Из-за необычно боль-
ших констант спин-спинового взаимодействия 13С ХН через одну и две связи
знаки сигналов могут оказываться противоположными ожидаемым.
Константы спин-спинового взаимодействия 13С-13С (|1 Лес I в Гц) [2]
H-C=C-H 'Jcc a b c 4 190,3 171,5 H-C=C-C=C-H ij“ 1534
4.3.3 Литература
[1] Hobold W., Radeglia R., Klose D., “Inkrementen-Berechnung von 13C-chemi-
schen Verschiebungen in n-Alkinen”, J. Prakt. Chem., 318, 519 (1976).
[2] Hayamizu K., Yamamoto 0., “13C,1H Spin coupling constants of dimethylace-
tylene”, Org. Magn. Reson., 13, 460 (1980).
96 4. Спектроскопия ЯМР 13С
4.4 Алициклические соединения
4.4.1 Химические сдвиги
Насыщенные моноциклические соединения (6 в м. д. относительно ТМС)
Химические сдвиги ядер 13 С в монозамещенных циклопропанах
(<5 в м. д. относительно ТМС) [1]
Заместитель X а Ь другие
-Н -2,8 -2,8
С -СНз 4,9 5,6 СН3 19,4
-СН2СН3 12,8 4,1 СН2 27,8, СНз 13,6
-СН2СН2СН2СН3 10,9 4,4 1-СН2 34,7, 2-СН2 32,0
- С(СНз)з 22,7 0,3 С 29,3, СНз 28,2
-СН2С1 13,6 5,5 СН2 50,3
-СН2ОН 12,7 2,2 СН2 66,5
-сн=сн2 14,7 6,6 СН 142,4, СН2 111,5
—фенил 15,3 9,2 С 143,9, СН 125,3-128,2
Н -С1 27,3 8,9
а —Вт 14,2 9,1
1 -I -20,1 10,4
О -он 45,7 6,8
N -NH2 24,0 7,4
-no2 54,3 11,7
—CN -4,5 6,2 CN 121,5
О -сно 22,7 7,4 СО 202,1
|| - СОСНз 20,1 9,6 СО 207,3, СН3 29,1
С -СООН 12,7 8,9 СО 181,6
/\ -СООСНз 12,2 7,7 СО 174,7, СНз 51,1
4.4. Алициклические соединения 97
Химические сдвиги ядер 13 С в монозамещенных циклопентанах
(<5 в м. д. относительно ТМС) [2]
Заместитель X a b c Другие
-Н 25,5 25,5 25,5
С -СН3 34,8 34,8 25,4 CH3 21,4
-СН2СН3 42,3 32,6 25,4 CH2 29,2, CH3 13,2
- СН(СНз)2 47,4 30,0 24,7 CH 33,9, CH3 21,7
-С(СН3)з 50,3 26,5 25,1 C 32,5, CH3 27,6
-сн2он 41,2 28,3 24,5 CH2 67,0
Н -F 95,5 32,8 22,5 1JCf 173,5, 2JCf 22,1, 3JCF < 1,5
а -С1 61,8 37,5 23,3
1 -Вг 53,1 38,4 23,7
-I 28,7 40,7 24,9
О -ОН 72,5 34,5 22,7
- ОСН3 82,2 31,4 23,1 CH3 56,0
-ОСОСНз 77,7 33,8 24,9 CO 170,8, CH3 21,7
N -NH2 52,5 35,5 23,0
-no2 87,0 32,6 24,8
-CN 27,0 30,5 24,2 CN 123,4
S -SH 38,3 37,7 24,6
-COOH 43,0 29,2 25,1 CO 183,8
98 4. Спектроскопия ЯМР 13С
Химические сдвиги ядер 11 'С в монозамещенных циклогексанах
С экваториальным и аксиальным расположением заместителей
(«5 в м. д. относительно ТМС) X
с ь« С dZ"~ ^а
Заместитель X а b с d а Ь с d
-Н 27,1 27,1 27,1 27,1 27,1 27,1 27,1 27,1
С -СНз 33,2 36,0 27,1 27,0 28,4 32,4 20,6 26,9
- СН2СН3 40,1 33,4 26,9 27,2 35,5 30,0 21,4 27,1
-СН2СН2СН3 40,0 33,6 26,6 26,9
- СН(СН3)2 44,6 30,0 26,8 27,3 41,1 30,2 21,6 27,1
-СН2СН2СН2СН3 38,4 34,1 27,1 27,3
-С(СН3)з 48,8 28,1 27,7 27,1
—циклогексил 44,3 30,8 27,4 27,4
-сн=сн2 42,1 32,3 26,0 27,1 37,0 30,0 21,2 27,1
-СНСН 28,7 32,1 25,2 24,4 28,0 30,0 21,2 25,7
—фенил 45,1 34,9 27,4 26,7
Н —F 91,0 32,8 23,6 25,3 88,1 30,1 19,8 25,0
а -С1 59,8 37,4 26,1 25,4 60,1 33,9 20,4 26,0
1 —Вг 52,4 38,3 27,3 25,6 55,4 34,9 21,5 26,4
-I 31,2 40,1 28,3 25,4 38,3 36,0 22,8 26,1
о -ОН 70,4 35,8 25,1 26,3 65,5 33,2 20,5 27,1
- ОСНз 79,2 32,2 24,5 26,4 74,9 30,0 21,1 26,6
-ОСОСНз 72,3 32,2 24,4 26,1
—ОСО-фенил 72,8 31,5 24,1 24,7 69,0 29,3 20,3 24,7
-OSi(CH3)3 70,5 36,0 24,7 25,0 66,1 33,1 19,8 25,0
N -nh2 51,1 37,6 25,8 26,3 47,4 33,8 20,0 27,1
-NHCH3 58,7 32,7 25,7 26,8
-N(CH3)2 64,3 29,2 26,5 26,9
-nh+ci- 51,8 32,2 24,8 25,2
—N=C=N—циклогексил 55,7 35,0 24,8 25,5
-no2 84,6 31,4 24,7 25,5
-N3 59,5 31,5 24,5 24,5 56,8 29,0 20,1 25,2
-CN 28,0 29,6 24,6 25,1 26,4 27,4 21,9 25,0
-NC 51,9 33,7 24,4 25,2 50,3 30,5 20,1 25,2
-NCS 55,3 33,9 24,5 24,8 50,3 30,5 20,1 25,2
S -SH 38,3 38,1 26,6 25,3 35,9 33,1 19,4 25,7
О -CHO 50,1 26,0 25,2 26,1 46,4 24,7 22,7 27,1
II -COCH3 51,5 29,0 26,6 26,3
с -COOH 43,7 29,6 26,2 26,6
л -COO- 47,2 30,9 26,9 26,9
-COOCH3 43,4 29,6 26,0 26,4 39,1 27,7 24,1 26,7
-COCI 55,4 29,7 25,5 25,9
4.4. Алициклические соединения 99
Оценка химических сдвигов ядер 13 С в алициклических соединениях
(<5 в м. д. относительно ТМС)
Для расчета химических сдвигов 8р3-гибридизованных атомов углерода в али-
циклических соединениях можно использовать химический сдвиг исходного со-
единения (например, 22,9 для циклобутана, 25,6 для циклопентана и 27,1 для
циклогексана) и те же инкременты, что и для алканов (см. разд. 4.1). Правиль-
ное использование конформационных поправок К (с. 85) особенно важно для
циклогексанов с аксиальными и экваториальными заместителями. Правило ад-
дитивности нельзя применять для расчета химических сдвигов в замещенных
циклопропанах.
Химические сдвиги ядер 13 С в ненасыщенных алициклических
соединениях (<5 в м. д. относительно ТМС)
2,3
108,7
137,2
31,4
130,8
32,8
23,3
132,7
132,7
41,6
124,9
134,3
152,6
123,4
126,1
124,6
/=\ 134,1
/ \ 129,8
^^123,3
28,8
транс
131,5
100 4. Спектроскопия ЯМР 13С
Химические сдвиги ядер 13 С в конденсированных алициклических
соединениях (<5 в м. д. относительно ТМС)
28,1 33,3
" 24,6
22,9
23,8
Н
Н
44,0
Н
32,2
37,9
28,5
47,3
143,5
i23,6 | 39>1
124,5 ПО 133,8
126,1
120,9 * 132,1
144,7
136,8
4.4. Алициклические соединения 101
4.4.2 Константы спин-спинового взаимодействия
Константы спин-спинового взаимодействия 13 С-1 Н
Взаимодействие через одну связи (рЛсн| в Гц)
Л 160
134
Взаимодействие через
две связи (|2Jch| в Гц)
Л 2-6
3,5
Взаимодействие через
три связи (|3Jch| в Гц)
Константы спин-спинового взаимодействия 13С-13С (|хЛсс| в Гц)
Л 1JCC 12,4
а b с
|>^СН3
1Jab 13,4
1Jbc 44,0
1JCC 32,7
4.4.3 Литература
[1] RolN.C., Clague A. D. Н., “13С NMR Spectroscopy of cyclopropane deriva-
tives”, Org. Magn. Reson., 16, 187 (1981).
[2] Schneider H.-J., Nguyen-Ba N., Thomas F., “Force field and 13 C NMR investi-
gations of substituted cyclopentanes. A concept for the adaption of 13C NMR
shifts to varying torsional arrangements in flexible conformers”, Tetrahedron,
38, 2327 (1982).
102 4. Спектроскопия ЯМР 13С
4.5 Ароматические углеводороды
4.5.1 Химические сдвиги
Химические сдвиги ядер 13 С в ароматических углеводородах (6 в м. д.
относительно ТМС) [1]
131,8
135,2
119,7
140,1
137,4
123,9
137,4
143,5
123,6 | 39Д
124,5
126,1 .
120,9 | 132,1
144,7
29,2 134,7
, ' 123,9 127,5
lui
127,5
127,5
128,7 129,7
140,0
124,3
127,9
128,4 127,4
4.5. Ароматические углеводороды 103
Влияние заместителей на химические сдвиги ядер 13 С в моноза-
мещенных бензолах (в м. д. относительно ТМС)
3 2
<5Ci = 128,5 + Z,
Заместитель X Z1 z2 z3 z4
-Н 0,0 0,0 0,0 0,0
С -СН3 9,2 0,7 -o,i -3,0
- СН2СН3 11,7 -0,6 -o,i -2,8
-СН2СН2СН3 10,3 -0,2 0,1 -2,7
-СН(СН3)2 20,2 -2,2 -0,3
-СН2СН2СН2СН3 10,9 -0,2 -0,2
-С(СН3)з 18,6 -3,3 -0,4 -зд|Я1М11||
—циклопропил 15,1 -3,3 -0,6 -3,бК2^Н
—циклопентил 17,8 -1,5 -0,4 -2,9
—циклогексил 16,3 -1,8 -0,3 -2,8
—1-адамантил 22,2 -2,9 -0,5 -3,1
-CH2F 8,5 -0,7 0,4 0,5
- CF3 2,5 -3,2 0,3 3,3
-СН2С1 9,3 0,3 0,2 0,0
-СНС12 11,9 -2,4 0,1 1,2
-СС13 16,3 -1,7 -o,i 1,8
—СН2Вг 9,5 0,7 0,3 0,2
-СН21 10,5 0,0 0,0 -0,9
-СН2ОН 12,4 -1,2 0,2 -1,1
-СН2ОСН3 8,7 -0,9 -o,i -0,9
-CH2NH2 14,9 -1,4 -0,2 -2,0
-ch2nhch3 12,6 -0,3 -0,3 -1,8
-CH2N(CH3)2 7,8 0,5 -0,3 -1,5
-ch2no2 2,2 2,2 2,2 1,2
-ch2cn 1,6 0,5 -0,8 -0,7
-CH2SH 12,5 -0,6 0,0 -1,6
-CH2SCH3 9,8 0,4 -o,i -1,6
-CH2S(O)CH3 0,8 1,5 0,4 -0,2
-CH2SO2CH3 -o,i 2,1 0,6 0,6
-CH2CHO 7,4 1,3 0,5 -1,1
-CH2COCH3 5,8 0,8 0,1 -1,6
-CH2COOH 6,5 1,4 0,4 -1,2
—CH2Li 32,2 -22,0 -0,4 -24,3
-CH=CH2 8,9 -2,3 -o,i -0,8
-C(CH3)=CH2 12,6 -3,1 -0,4 -1,2
-CHCH -6,2 3,6 -0,4 -0,3
—фенил 8,1 -1,1 0,5 -1,1
104 4. Спектроскопия ЯМР 13С
Заместитель X Zi z2 Z3 z4
—2-пиридил 11,2 -1,4 0,5 -1,4
—4-пиридил 9,6 -1,6 0,5 0,5
Н —F 33,6 -13,0 1,6 -4,4
а -С1 5,3 0,4 1,4 -1,9
1 —Вг -5,4 3,3 2,2 -1,0
-I -31,2 8,9 1,6 -1,1
О -ОН 28,8 -12,8 1,4 -7,4
—ONa 39,6 -8,2 1,9 -13,6
-ОСН3 33,5 -14,4 1,0 -7,7
-ОСН=СН2 28,2 -11,5 0,7 -5,8
—О—фенил 27,6 -11,2 -0,3 -6,9
-ОСОСНз 22,4 -7,1 0,4 -3,2
-OSi(CH3)3 26,8 -8,4 0,9 -7,1
—ОРО(О—фенил) 2 21,9 -8,4 1,2 -3,0
-OCN 25,0 -12,7 2,6 -1,0
N -NH2 18,2 -13,4 0,8 -10,0
-NHCH3 15,0 -16,2 0,8 -11,6
-N(CH3)2 16,0 -15,4 0,9 -10,5
—NH—фенил 14,7 -10,6 0,9 -10,5
—ЬГ(фенил)2 13,1 -7,0 0,9 -5,6
-nh+ 0,1 -5,8 2,2 2,2
-NH+CH(CH3)2 5,5 -4,1 1,1 0,7
- N+(CH3)3 19,5 -7,3 2,5 2,4
-N(O)(CH3)2 26,2 -8,4 0,8 0,6
-NHCOCH3 9,7 -8,1 0,2 -4,4
-NHOH 21,5 -13,1 -2,2 -5,3
-nhnh2 22,8 -16,5 0,5 -9,6
—N(NO)CH3 13,7 -9,4 0,9 -1,3
—N=CH—фенил 24,7 -6,5 1,3 -1,5
—N=NCH3 22,2 -6,2 0,5 -3,0
-NO 37,4 -7,6 0,8 7,1
-no2 19,9 -4,9 0,9 6,1
-CN -16,0 3,5 0,7 4,3
-NC -1,8 -2,2 1,4 0,9
-NCO 5,1 -3,7 1,1 -2,8
-NCS 3,0 -2,7 1,3 -1,0
-N+=N -12,7 6,0 5,7 16,0
S -SH 4,0 0,7 0,3 -3,2
-SCH3 10,0 -1,9 0,2 -3,6
-SC(CH3)3 4,5 9,0 -0,3 0,0
-S(CH3)+ -1,0 3,1 2,2 6,3
-SCH=CH2 5,8 2,0 0,2 -1,8
—S—фенил 7,3 2,5 0,6 -1,5
—S—S—фенил 7,5 -1,3 0,8 -1,1
4.5. Ароматические углеводороды 105
Заместитель X Zi Z2 Z3 Z4
-S(O)CH3 17,6 -5,0 1,1 2,4
-SO2CH3 12,3 -1,4 0,8 5,1
-SO2OH 15,0 -2,2 1,3 3,8
-SO2OCH3 6,4 -0,6 1,5 5,9
-so2f 4,6 0,0 1,5 7,5
-SO2C1 15,6 -1,7 1,2 6,8
-SO2NH2 10,8 -3,0 0,3 3,2
-SCN -3,7 2,5 2,2 2,2
О -CHO 8,2 1,2 0,5 5,8
II -COCH3 8,9 0,1 -0,1 4,4
C —COCF3 -5,6 1,8 0,7 6,7
Д -COC=CH 7,4 1,0 0,0 5,9
—CO—фенил 9,3 1,6 -о,з 3,7
-СООН 2,1 1,6 -0,1 5,2
-COONa 9,7 4,6 2,2 4,6
-COOCH3 2,0 1,2 -0,1 4,3
-conh2 5,0 -1,2 0,1 3,4
-CON(CH3)2 6,0 -1,5 -0,2 1,0
-COF 4,2 1,6 -0,7 5,3
-COCI 4,7 2,7 0,3 6,6
-COSH 6,2 -0,6 0,2 5,4
-CH=NCH3 8,8 0,5 0,1 2,3
—CS—фенил 18,7 1,0 -0,6 2,4
—CS—(1-пиперидил) 15,0 -3,1 -0,2 -0,2
-Li -43,2 -12,7 2,4 3,1
—MgBr -35,8 -11,4 2,7 4,0
Si -SiH3 -0,5 7,3 -0,4 1,3
-SiH2CH3 4,8 6,3 -0,5 1,0
-Si(CH3)3 11,6 4,9 -0,7 0,4
—81(фенил)3 5,8 7,9 -0,6 1 1
-SiCl3 3,0 4,6 0,1 4,2
—Ge(CH3)3 13,7 4,5 -0,5 -0,2
—Sn(CH3)3 13,2 7,2 -0,4 -0,4
—Pb(CH3)3 20,1 8,0 -0,1 -1,0
P —P(CH3)2 13,6 1,6 -0,6 -1,0
—Р(фенил)2 8,9 5,2 0,0 0,1
-Р+(фенил)2СН3 -9,7 5,2 2,0 6,7
-PO(CH3)2 2,5 1,1 0,1 3,0
—РО(фенил)2 5,8 3,9 -0,1 3,0
-РО(ОН)2 -1,9 3,6 1,5 5,6
-РО(ОСН2СН3)2 1,6 3,6 -0,2 3,4
-PS(CH3)2 6,7 2,0 0,2 2,9
-PS(OCH2CH3)2 6,1 2,8 -0,4 3,4
—AsH2 1,7 7,9 0,8 0,0
106 4. Спектроскопия ЯМР 13С
Заместитель X Z1 z2 z3 Z4
—As (фенил) 2 11,1 5,0 0,1 -o,i
—AsO(OH)2 3,8 1,6 0,8 4,5
—SeCH=CH2 0,7 4,7 0,4 -1,4
-SeCN -5,3 5,1 2,9 2,1
—8Ь(фенил)2 9,8 7,7 0,3 0,0
—Hg—фенил ' 41,6 9,3 -0,9 -1,6
-HgCl 22,5 8,0 -0,6 -0,9
Влияние заместителей в положении 1 на химические сдвиги ядер
13 С в монозамещенных нафталинах (в м. д, относительно ТМС)
X 8 Q ] 1 для X: H <5C1 = 128,0 <5c2 = 125,9 <5Ce = 133,6
7r 6^ 5 WY W №
Заместитель X C-l C-2 C-3 C-4 C-5 C-6 C-7 C-8 C-9 C-10
C -CH3 6,0 0,5 0,6 -1,8 0,3 - -0,7 -0,5 -4,1 -1,1 -0,2
- C(CH3)3 17,9 -2,8 -0,9 -0,6 1,6 - -1,4 -1,4 -1,2 -1,6 2,2
—CH2Br 4,0 1,1 -0,9 1,3 0,5 - -0,1 0,3 -4,6 -2,8 0,1
-CH2OH 8,2 -0,9 -0,6 0,1 0,5 - -0,3 0,1 -4,5 -2,6 0,0
—CF3 -1,3 -1,8 5,0 1,0 0,8 2,0 -3,4 1,0 -3,9
H —F 31,5 -16,1 0,1 -3,8 0,1 1,4 0,7 -7,1 -9,3 2,1
a -Cl 3,9 0,2 -0,2 -0,9 0,2 3,1 0,8 -3,6 -2,8 1,0
1 -Br -5,4 3,6 -0,2 -0,5 -0,1 0,4 1,0 -1,3 -2,0 0,6
-I -28,4 12,3 1,7 1,7 1,4 1,6 2,6 4,4 1,3 1,3
О -OH 23,5 -17,2 -0,1 -7,3 -0,4 0,5 0,3 -6,6 -9,3 1,0
-OCH3 27,3 -22,3 -0,2 -7,9 -0,7 0,3 -0,9 -6,1 -8,1 0,8
-OCOCH3 18,6 -7,9 -0,6 -2,1 0,0 0,4 0,4 -6,9 -6,9 0,9
N -NH2 14,0 -16,5 0,3 -9,3 0,3 - -0,3 -1,3 -7,3 -10,2 0,6
-N(CH3)2 23,7 -11,2 0,6 -4,6 1,0 0,4 -0,3 -3,2 -3,9 2,1
-nh+ -3,8 -4,6 -0,9 3,4 1,4 2,1 2,8 -9,0 -7,4 1,2
-no2 18,5 -2,1 -2,0 6,5 0,5 1,3 3,4 -5,1 -8,7 0,6
—CN -19,2 5,1 -2,4 3,8 -0,7 0,2 1,2 -4,5 -2,8 -2,2
О -CHO 2,9 10,8 -1,4 6,7 0,2 0,6 2,7 -3,5 -3,6 -0,3
II -COCH3 6,9 2,9 -1,7 4,9 0,3 0,4 2,0 -2,0 -3,5 0,2
C -COOH -1,5 3,6 -2,4 4,3 -0,6 - -0,9 0,6 -3,2 -3,2 -0,8
/\ -COOCH3 -0,9 4,5 -1,2 5,4 0,7 0,5 1,9 -1,8 -1,9 0,5
-CON(CH3)2 6,8 -2,1 -0,8 0,9 0,4 0,4 1,0 0,1 -4,1 -0,2
-COCI 1,2 10,6 -0,5 9,3 1,9 2,1 4,5 -2,1 -2,1 1,0
-Si(CH3)3 9,8 5,1 -0,4 1,7 1,2 - -0,8 -0,7 0,1 3,8 0,2
4.5. Ароматические углеводороды 107
Влияние заместителей в положении 2 на химические сдвиги ядер
13С в монозамещенных нафталинах (в м. д. относительно ТМС)
для X: Н
<5С1 = 128,0
<5с2 = 125,9
<5Ся = 133,6
Заместитель X С-1 С-2 С-3 С-4 С-5 С-6 С-7 С-8 С-9 С-10
С -СН3 -1,3 9,3 2,0 -0,8 -0,5 -1,1 -0,2 -0,6 -0,1 -2,0
-С(СН3)з -3,3 22,5 -3,0 -0,4 0,0 -0,7 -0,2 -0,6 0,4 -1,3
-СН2Вг -1,7 9,0 1,9 -0,4 -0,5 0,7 0,3 0,6 -0,6 -0,7
-СН2ОН -2,7 12,3 -4,4 -0,1 -0,4* -0,2* 0,1* -0,2* -0,3 -0,8
-CF3 -2,0 -4,2 1,1* 0,1* 2,4* 1,5 1,1 -1,1 1,3
Н —F -17,0 34,9 -9,6 2,4 0,0 -0,7 1,1 -0,6 0,7 -3,0
а -С1 — 1,4 5,7 0,8 1,5 -0,2 0,2 1,1 -1,1 0,7 -1,9
1 -Вг 1,8 -6,2 3,1 1,5 -0,3 0,2 0,8 -1,1 -2,0 0,7
-I 9,2 -34,1 9,0 2,3 0,5 1,3 1,5 -0,6 2,1 -0,8
О -он -18,6 27,3 -8,3 1,8 -0,3 -2,4 0,5 -1,7 0,9 -4,7
-ОСН3 -22,2 31,8 -7,1 1,5 -0,3 -2,2 0,5 -1,2 1,0 -4,3
-ОСОСНз -9,5 22,5 -4,8 1,3 -0,4 -0,3 0,6 -0,4 0,1 -2,2
N -NH2 -20,6 16,7 -8,9 -0,2 -1,6 -4,8 -0,9 -3,5 -0,1 -7,0
-N(CH3)2 -21,1 23,6 -8,8 1,2 0,0 -3,4 0,7 -1,1 2,4 -5,9
-nh+ -5,9 -0,3 -6,5 3,2 0,2 2,3 2,0 0,2 0,1 -0,3
-no2 -3,4 20,0 -6,7 1,7 0,1 4,0 2,2 2,1 -1,1 2,4
-CN 5,8 -16,7 0,1 1,0 -0,2 3,0 1,6 0,2 -1,6 0,7
о -сно 6,2 7,9 -3,6 0,8 -0,3 2,9 0,9 1,8 2,4 -1,4
|| -СОСНз 1,9 8,3 -2,2 0,2 -0,4 2,3 0,7 1,4 1,8 -1,3
С -COOH 2,7 2,4 -0,6 0,2 -0,3 2,4 0,9 1,3 -1,3 1,5
/\ -СООСНз 3,0 1,8 -0,5 0,2 -од 2,4 0,9 1,4 -1,0 1,9
-СОС1 2,5 9,1 -0,7 0,2* -0,4 2,2* 0,8 1,2 -1,4
-Si(CH3)3 5,8 11,9 3,9 -1,0 0,1 0,3 -0,2 0,1 -0,5 0,2
* Отнесение ненадежно.
108 4. Спектроскопия ЯМР 13С
Оценка химических сдвигов ядер 19 С в полизамещенных бензолах и
нафталинах
Химические сдвиги сигналов ядер 13С в полизамещенных бензолах и нафта-
линах можно рассчитать с учетом эффектов заместителей в соответствующих
монозамещенных углеводородах.
Пример: Оценка химических сдвигов для 3,5-димети л нитробензо л а
СН3
С-1 Исходная величина 128,5 С-2 Исходная величина 128,5
Zi(NO2) 19,9 Z2(NO2) -4,9
2 Z3(CH3) -0,2 Z2(CH3) 0,7
Расчет 148,2 Z4(CH3) -3,0
Эксперимент 148,5 Расчет 121,3
Эксперимент 121,7
С-3 Исходная величина 128,5 С-4 Исходная величина 128,5
Z1(CH3) 9,2 2 Z2(CH3) 1,4
Z3(CH3) -o,i Z4(NO2) 6,1
z3(NO2) 0,9 Расчет 136,0
Расчет 138,5 Эксперимент 136,2
Эксперимент 139,6
Большее расхождение между рассчитанными и экспериментальными величи-
нами следует ожидать, если заместители находятся в орто-положении или если
одновременно присутствуют сильные электронодонорные и электроноакцеп-
торные группы.
4.5.2 Константы спин-спинового взаимодействия
Константы спин-спинового взаимодействия 19С-1Н (|J| в Гц)
На ^VHb 2Jc^ Н 2JcaHb 4Jc“H<= Hd 4jCaHd В бензоле: В производных: 159,0 1,0 1-4 7,6 7-10 -1,3
4.5. Ароматические углеводороды 109
Константы спин-спинового взаимодействия 13С-19С (|'Jcc| в Гц)
'Jab 57,0 aCH3 'Jab 44,2
2Jac 2,5 2Jac 3,1
3Jad 10,0 3Jad 3,8
Md 4Jae 0,9
e
4.5.3 Литература
[1] Hansen Р. Е., “13С NMR of polycyclic aromatic hydrocarbons. A review”, Org.
Magn. Reson., 12, 109 (1979).
110 4. Спектроскопия ЯМР 13С
4.6 Гетероароматические соединения
4.6.1 Химические сдвиги
Химические сдвиги ядер 19 С в гетероароматических соединениях
(д в м. д. относительно ТМС)
О109’9 < > 143,0 О О107’7 < >118,0 N Н о126’4 < >124,9 S О128,8 < >131,0 Se
N—л.125,4 150,6 <q> 138,1 N—л 122,3 136,2< /122,3 N Н N—л143,2 152,7>118,6 S О137’6 < >126,2 Те
150,0 ц—л 100,5 Nx /158,9 О 133,Зу^—Л 104,7 Nx >133,3 N Н 157,Оу^—л123,4 N^> 147,8 ^47,3 N >135,8 S
N-N ^147,9 N Н N-^147,4 147,4\ „N N Н Л130’4 К N гГ н ^143’3 N^N Н
HN-x120,1 134,6 4®> N Н 109,0 НК^Лзб.О N н н5дВ126'8 N /—ДОЗ,4 N@> 138,5 N
135,9 148,4 146,0 135,6 125,7
в этаноле в ДМСО
0126,5
151’4
166,5
4.6. Гетероароматические соединения 111
Влияние заместителей на химические сдвиги ядер 13 С в моноза-
мещенных пиридинах (в м. д. относительно ТМС)
4
<$0-2 = 149,8 4- Zi>2
<5с-з = 123,7 + Zi>3
<5с.4 = 135,9 + Zi;4
бс-5 = 123,7 + Zi;5
<$c-6 — 149,8 + Zi>6
Заместитель в поло- жении 2 или 6 z22 = Zee Z23 — Zes Z24 = Zg4 Z25 = Z63 Z26 = Z62
-Н 0,0 0,0 0,0 0,0 0,0
С -СН3 8,6 -0,5 0,3 -3,0 -0,7
-СН2СН3 13,7 -1,7 0,4 -2,8 -0,6
-сн=сн2 5,9 -1,3 1,1 -2,5 -0,3
—фенил 7,7 -1,6 0,8 -3,2 0,2
Н -F 13,9 -14,0 5,4 -2,5 -2,0
а -С1 1,8 0,8 2,8 -1,4 0,0
1 —Вг -7,5 4,6 2,6 -1,1 0,5
-I -31,6 11,3 1,7 -0,8 1,0
О -он 15,5 -3,6 -1,1 -17,0 -8,2
-ОСН3 14,3 -12,7 2,6 -7,1 -2,9
—О—фенил 13,9 -12,2 3,5 -5,3 -2,0
-ОСОСНз 7,6 -7,3 3,4 -1,8 -1,6
N -NH2 8,4 -15,1 1,8 -9,7 -1,6
-NHCH3 10,9 -16,2 1,5 -11,3 -1,3
-N(CH3)2 9,6 -17,9 1,2 -12,3 -1,9
-NHCOCH3 1,4 -9,8 2,6 -3,9 -2,1
-no2 6,9 -5,7 3,9 5,4 -0,8
—CN -15,8 4,8 1,1 3,2 1,4
S -SH 30,4 10,7 2,1 -10,6 -12,1
-SCH3 10,2 -4,6 0,0 -2,2 -0,5
-S(=O)CH3 16,2 -4,4 2,2 0,9 -0,2
-S(=O)2CH3 8,5 -2,6 2,4 3,7 0,3
О -CHO 3,0 -2,0 1,2 4,2 0,4
II -COCH3 3,8 -2,1 0,9 3,4 -0,8
C -COOH -3,7 0,0 2,5 4,2 -1,7
/\ -COOCH3 -1,7 1,5 1,1 3,3 0,0
-conh2 -0,3 -1,2 1,4 2,8 -1,5
-Si(CH3)3 18,6 5,0 -2,0 -1,1 0,3
-Sn(CH3)3 23,3 7,6 -2,7 -1,7 0,6
-Pb(CH3)3 33,4 9,2 -2,6 -2,3 1,1
112 4. Спектроскопия ЯМР 13С
Заместитель в поло- жении 3 или 5 Z32 — Z56 Z33 = Z55 Z34 — Z54 Z35 = Z53 Zse = Z52
—Н 0,0 0,0 0,0 0,0 0,0
С -СНз 1,3 8,9 0,0 -0,9 -2,3
- СН2СН3 -0,4 15,4 -0,8 -0,5 -2,7
—фенил -1,4 12,8 -1,8 -0,3 -1,3
Н —F -11,5 36,1 -13,2 0,8 -3,9
а -С1 -0,3 8,1 -0,4 0,6 -1,4
1 —Вг 2,1 -2,7 2,7 1,1 -0,9
-I 7,1 -28,5 8,9 2,3 0,3
О -ОН -10,7 31,3 -12,4 1,2 -8,6
- ОСНз -12,5 31,5 -15,9 0,1 -8,4
-ОСОСНз -6,5 23,4 -7,0 -o,i -3,2
N -NH2 -11,9 21,4 -14,4 0,8 -10,8
-13,6 23,1 -18,2 0,6 -11,9
^^№1 -N(CH3)2 -14,0 23,3 -17,1 0,1 -11,6
-on 3,6 -13,8 4,2 0,5 4,2
S -SH -12,8 26,1 -11,3 7,3 -2,8
-SCH3 -13,6 24,6 -11,7 10,6 -3,0
О -CHO 2,4 7,8 -0,2 0,5 5,4
II -COCH3 3,5 8,5 -0,7 -0,2 0,0
С -COOH -6,4 13,0 11,1 4,3 -6,0
A -COOCH3 -0,6 1,0 -0,5 -1,8 1,8
-conh2 2,7 5,9 1,1 1,2 -1,5
-Si(CH3)3 2,7 9,1 3,0 -2,3 -1,2
—Ge(CH3)3 3,9 12,8 4,2 -0,4 -o,i
—Sn(CH3)3 5,9 13,0 7,1 0,1 -0,3
- Sn(H-C4H9)3 6,6 12,6 7,7 0,0 -0,4
—РЬ(н-С4Н9)3 7,1 21,7 8,5 0,9 -1,8
4.6. Гетероароматические соединения 113
Заместитель в положении 4 Z42 = Z46 Z43 = Z45 Z44
-Н 0,0 0,0 0,0
С -СН3 0,5 0,7 10,6
-СН2СН3 -o,i -0,5 16,8
-СН(СН3)2 0,4 -1,9 21,2
- С(СН3)з 0,9 -2,6 23,9
-сн=сн2 0,3 -3,0 8,4
—фенил 0,4 -2,2 12,2
Н -F 2,7 -11,9 32,8
а -Вг 3,0 3,3 -3,2
1 -I 0,2 9,1 -30,8
О -ОСН3 0,9 -13,9 29,0
-ОСОСНз 1,7 -6,7 23,9
N -NH2 0,7 -13,8 19,3
—NHCH3 0,5 -15,9
-N(CH3)2 0,6 -16,3
-CN 2,1 2,1 -15,9
S —SH -16,9 5,9 54,3
-SCH3 0,1 -3,3 14,6
о -CHO 1,7 -0,7 5,3
II - СОСНз 1,6 -2,7 6,6
С -СООСНз 1,0 -0,8 1,4
Л -conh2 0,4 -0,9 6,2
-Si(CH3)3 -2,8 2,4 11,9
—Ge(CH3)3 -1,1 4,4 16,8
—Sn(CH3)3 -1,1 7,3 16,2
- Pb(CH3)3 -0,5 9,1 24,6
114 4. Спектроскопия ЯМР 13С
Оценка химических сдвигов ядер 13 С в полизамещенных пиридинах
Химические сдвиги ядер 13 С в полизамещенных пиридинах можно рассчитать
с учетом эффектов заместителей в монозамещенном исходном соединении.
Пример: Оценка химических сдвигов для 2-амино-5-метилпиридина
С-2 Исходная величина
Z22(NH3)
Z52(CH3)_________
Расчет
Эксперимент
С-4 Исходная величина
Z24(NH2)
Z54(CH3)__________
Расчет
Эксперимент 138,6
149,8
8,4
-2,3
155,9
156,9
135,9
1,8
0,0
137,7
С-3 Исходная величина 123,7
Z23(NH2) -15,1
Z53(CH3) -0,9
Расчет 107,7
Эксперимент 108,4
С-5 Исходная величина 123,7
Z25(NH2) -9,7
Z55(CH3) 8,9
Расчет 122,9
Эксперимент 122,5
С-6 Исходная величина 149,8
Z26(NH2) -1,6
Z56(CH3) 1,3
Расчет 149,5
Эксперимент 147,6
Большее расхождение между рассчитанными и экспериментальными величи-
нами следует ожидать для заместителей в орто-положении и если одновремен-
но присутствуют сильные электронодонорные и электроноакцепторные груп-
пы. Кроме того, большое влияние на химические сдвиги ядер 13 С оказывает
таутомерия и образование цвиттер-ионов.
4.6. Гетероароматические соединения 115
Химические сдвиги ядер 13 С в конденсированных ароматических
гетероциклах (6 в м. д. относительно ТМС)
121 6 127,9 ГГСч Ю6.9 123,2[^ |Г \\ , „ 1 /145,0 124,бЧ^Л-о Ш-8 155,5 1 ол с 127,6 123 8 139,8 12°£/ 102,1 124,0 119’6ПГЛ124Л 124’3Г ГЛ 126,4 121,7 124,44^Ss 111,0 j Н 122,6 изд g 135,5
120,5 1,40’1 125,4[^|Г'1^ ’ | /152,6 124,4 ^Л'о 110>8 150,0 122,I*1,52’6 122,9^444 , с l251*r^4^Nx 1 |1 \>141,5 I25-1 Г |Г \\155>5 122,94><>N 125,8*^T>S/ 115,4 I н 122,7*100 0 137,9
194 ч 122,2 147,1 123’0ПрК 1зо,бЧ>Л-о 109,9 1627 133,4 12°лГЛр> 125,8^4x1 N 110,0 1 н 139,9
124 4 1Ю,4 / 155,3 120,0^^ 131,1 114>7 156,1 122,1 1/34’51Л211- 144,5 124,1 128,6 Л/Tn 121>6 161,5
111,2 144’4 127,2^^4^4 1 I/O 11 л q 145,5 123,4^^ 121>6 1/55’2 1 Г /N 129 126,8^>Sn iZy,U[ Г ,S 108’8 ' СН3 33,7 133,1 3
119.6
117,2
110,5
125,6
133,4
99,5
113,0
154,9
129 0 I?®’7
izy.u , 10()
115,6
N
Н
142,1 N
148,9
* Отнесение ненадежно.
116 4. Спектроскопия ЯМР 13С
128,0
135,5
126,9
148,1
128,5
151,0
125,2
142,8
126,7
141,7
* Отнесение ненадежно.
4.6. Гетероароматические соединения 117
4.6.2 Константы спин-спинового взаимодействия
Константы спин-спинового взаимодействия 13С-1 Н (|J| в Гц)
СаНа
ад,
175
202
т
JCaHa
1т
JCbHb
169
183
^сана 206
Ь\/а ^ьнь 189
Н
Ь/Г~^ JcaHa I86
a\ Л *j 177
H
Г/ \\ JcaHa 1^4
Nx ,N
H
т
JcaHa
209
tfiHa
’j
dCbHb
*j
dQHc
161
163
178
Константы спин-спинового взаимодействия ,3C-lsC (|Jccl в Гц)
118 4. Спектроскопия ЯМР 13С
4.7 Галогенсодержащие соединения
Правила аддитивности для расчета химических сдвигов ядер 13С для различ-
ных углеродных скелетов можно применять к тем галогеналканам, у которых
не более одного атома галогена у данного атома углерода. Во всех других слу-
чаях простые линейные модели не работают, но для галогенметанов и их про-
изводных есть соответствующие поправочные коэффициенты [1, 2].
4.7.1 Фторсодержащие соединения
Природный фтор на 100% содержит ядра 19F, которые имеют спиновое кван-
товое число I = 1/2. Сигналы атомов углерода расщепляются взаимодействием
с ядрами 19F на расстояниях вплоть до четырех связей.
Химические сдвиги ядер 13 С и константы спин-спинового взаимо-
действия 19F-13C для фторсодержащих соединений {6 в м. д. относи-
тельно ТМС, |J| в Гц)
71,6 109,0 116,4 CH3F JCF 161,9 CH,F, JCF 234,8 CHF. JrF 274,3 118,5 CF4 Jcf 259,2
JCF 19,5 2 15,8 23,6 JcF Z’ < /F ,F 22,6 80,1 9,2 85,2 t JCF 6,7 JrF 163,3 1 28,3 \/F "J 93,5
4JCF~0 2Jcf 18,3 116’2 14,1 31,9 29,3 30,6 CF3-CFS 22,7 29,3 25,3 84,2 2 CF 3JCF 6,2 ‘jCF 164,8 JcF 48,1 2Jcf 24,8 88^ 147,7 lJCT 267,2
lJCF 177 ’Jcp 239 78,9 108,1 CERzOH CHF2\^OH П 173,5 И 167,2 ° 2Jcf 22 ° 2Jcf 28 lJCF 283,2 115,0 CF3VOH К 163,0 ° 2Jcf 43,6
4.7. Галогенсодержащие соединения 119
F 1
I 91,0; JCF 171
32,8; 2Jcf 22
23,6; 3JCF 5
25,3; 4Jcf ~ 0
F 1
I 163,3; Jcp 245,1
115,5; 2Jcf 21,0
130,1; 3JCF 7,8
124,1; 4Jcf 3,2
CH2F84’9; 1jcf
J^137,0; 2Jcf
|1127,8; 3JCF i
^128,9; 4Jcf
129,0; 5Jcf 3
. 166
17
6
1
rr
124,5;
131,0;
125,3;
128,8;
*JCF 272
2Jcf 32
3Jcf4
JCF 1
5
131,8; JCF = 0
F !
6168,7; JCF 261,8
111,8; 2Jcf 16,1
152,5; 3JCF 6,4
122,7; 2Jcf 17,7
124,5; JCF 4,3< р^дд ’jCF 255,1
145,9; 4Jcf 3,7 4ST 138,3; 2JCF 22,5
141,3; 3JCF 7,5
109,7; 2JCT 37,6
121,2; 4JCT 4,2
147,8; 3JCF 14,9
F
163,7; 'jCF 236,3
Hal
Оценка химических сдвигов ядер 13 С в линейных перфторалканах
(<5 в м. д. относительно ТМС) [3]
6 = 124,8 + Zj
Инкременты Zi для заместителей CF2 или CF3 в положении:
a /3 7
-8,6 1,8 0,5
Пример: Оценка химических сдвигов в перфторбутане
cf2 zcf3
F3CZ 4CF2
CF3 Исходная величина 124,8
1 a CF2 -8,6
i /3cf2 1,8
17CF3 0,5
Расчет 118,5
Эксперимент 118,5
CF2 Исходная величина 124,8
1 a CF3 -8,6
1 Q CF2 -8,6
1/3 CF3 1,8
Расчет 109,4
Эксперимент 109,3
120 4. Спектроскопия ЯМР 13С
Hal
4.7.2 Хлорсодержащие соединения
Химические сдвиги ядер 13 С в хлорсодержащих соединениях
(5 в м. д. относительно ТМС)
25,6 СН3С1 54,0 СН2С12 77,2 CHC13 96,1 CC14
18,9 26,3 27,3 34,6
\^С1 </Cl </Cl
39,9 11,6 46,8 1 53,7 \ 66,7
31,6 51,7 46,3 105,3
\/С1 ^/\/С1 <,C1
' 69,3 Cl 96,2 Cl CC13-CC13
Cl Cl
117,2 Cl 119,9
113,3 =< 127,1 Cl\ /С1 d
126,1 Cl 118,1
С1,
С1
117,6 'С1
С1 С1
)=(121,3
С1 С1
40,7
СН,С1\ .ОН
Y173.7
О
63,7
CHCU .ОН
Y170.4
О
88,9
СС13 ОН
П 167,0
О
59,8
37,4
26,1
25,4
С1
I 133,8
128,9
129,9
126,6
СН2С1 46,2
137,8
f|| 128,8
128,7
128,5
СНС12 71,9
140,4
126,1
128,6
129,7
СС13 97,7
1^-144,8
126,8
128,4
130,3
124,3
148,4
135,5
122,3
149,8
138,7
124,5
N f Cl
151,6
4.7. Галогенсодержащие соединения 121
4.7.3 Бромсодержащие соединения
Химические сдвиги ядер 13 С в бромсодержащих соединениях
(<5 в м. д. относительно ТМС)
9,6 21,4
12,1
-28,7
СН3Вг СН2Вг2
СНВг3 СВг4
27,6
26,4 „
.Вг
13,0 35,6
31,8
Вг
„ 40>!
Вг
32,4
Вг^^'
Вг
49,4
\/Вг
31,5 Г^Вг
Вг
53,4
СВг3— СВг3
122,4
<^Br
114,7
Вт
127,2 =( 97,0
Вг
Вг
116,4
109,4
Вг^/ВГ
Hal
Вг Вг
Вг Вг
)=( 93,7
Вг Вг
25,9
СН2Вг ЛН
Т172,0
О
31,3
СНВг... .он
Y169.7
О
52,4
38,3
27,3
25,6
Вг
123,1
131,8
130,7
127,5
СН2Вг 33,4
138,0
129,2
128,8
128,7
Вг
1^- 132,7
р |1127,0
152,8
124,8
148,9
138,6
/Вг
138,5
122,6
150,3
142,3
122 4. Спектроскопия ЯМР 13С
4.7.4 Иодсодержащие соединения
Химические сдвиги ядер 13 С в иодсодермсащих соединениях (6 в м. д.
относительно ТМС)
-24,0
СН31
-54,0
СН212
-139,9
СШ3
-292,5
С14
-1,6
27,0
15,3 9,1
130,3
96,5
85,2
Hal
25,4
127,4
СН21 5,9
7^138,5
р|1128,5
4^128,5
127,6
105,1
132,8
150,0
126,0
150,1
144,8
137,6
122,9
150,8
118,2
4.7.5 Литература
[1] Somayajulu G. R., Kennedy J. R., Vickrey T. M., Zwolinski B. J., “Carbon-13
chemical shifts for 70 halomethanes”, J. Magn. Reson., 33, 559 (1979).
[2] Furst A., Robien W., Pretsch E., “A comprehensive parameter set for the pre-
diction of the 13C NMR chemical shifts of sp3-hybridized carbon atoms in
organic compounds”, Anal. Chim. Acta, 233, 213 (1990).
[3] Ovenall D. W., Chang J. J., “Carbon-13 NMR of fluorinated compounds using
wide-band fluorine decoupling”, J. Magn. Reson., 25, 361 (1977).
4.8. Спирты, простые эфиры и родственные соединения 123
4.8 Спирты, простые эфиры
и родственные соединения
4.8.1 Спирты
Химические сдвиги ядер 13 С в алифатических спиртах (5 в м. д.
относительно ТМС)
50,2
СН3ОН
18,2
57,8
25,9
25,3
15,2 36,0
20,3 62,9
31,2
10,3 64,2
23,8 33,6
15,3 29,4 63,2
14,2 31,9 32,9
23,0 25,8 62,1
23,2 39,2 23,5
26,2 73,3
14,3 39,4 30,5
19,2 ОН 72,2
Химические сдвиги ядер 13 С в алифатических гликолях и полиолах
(<5 в м. д. относительно ТМС)
36,4
60,2
68,2 а, 72,7 Ь?Н
Х^ОН
18,7 а, 23,0 ь, 67,7 а, 71,6 ь
а в CDC13, ь в D2O
66,0
но'х"Ч<?Н
он 91,2
76,1 72,9
66,1 V ?н
/к /Оь
но
он' он'
74,3 74,5
ОН
83,3
ОН
124 4. Спектроскопия ЯМР 13С
Химические сдвиги ядер 13 С в спиртах (<5 в м. д. относительно ТМС)
125,1
CF3^JOH
61,4
1|J|cf 278 Гц
2|J|cf 35 Гц
99,1
ССТз^^ОН
75,9
63,4
ОН
114,9 137,5
---- 50,0
73,8 83,0
65,1 <
|х 140,9
A I27’3
4^128,7
127,4
Химические сдвиги ядер 13 С в енолах (<5 в м. д. относительно ТМС)
ОН
88,0 149,0
190,5 II J190,5
22,5 99,0 22,5
О О
U II 201,1
56,6 28,5
103,3
57,3
4.8. Спирты, простые эфиры и родственные соединения 125
4.8.2 Простые эфиры
Химические сдвиги ядер 13 С в простых эфирах (6 в м. д. относительно
ТМС)
60,9
с<
57,6 67,7
59,1 74,5 10,5
59,1 73,4 20,5
32,9 15,0
72,7
27,0
О'
72,3 58,4
52,5 152,7
84,4
57,4 73,1 116,4
134,4
О'"'
26,4
55,1
32,2
24,5
120,8
26,5
Химические сдвиги ядер 13 С в циклических эфирах (5 в м. д. относи- тельно ТМС)
о ^39,5 О < > 72,6 22,9 /°\ 68,4 ' 26,5 69,5 1\^27,7 24,9
67,6 ,68,1 1^°^ 68,5
и Н 146,7 27,0
а 145,6 > 68,6 98,4 28,5 , 75,3 126,3 144,1 гГ°> 64,8 99,4 22,6 19,4 А141,1 101,1
126 4. Спектроскопия ЯМР 13С
Химические сдвиги ядер 13 С в ацеталях,
(<5 в м. д. относительно ТМС)
кеталях и ортоэфирах
О— 53,7 99,9 95,0
109,9 \ 24,9\Г/О— 48,1 о/хо
'ey— 64,5
108,8 *47’8
121’8 ^100’7
94,8
0^0
67,5
27,5
51,1
121,0
—О I 0—50,4
—О <Э—
О
4.9. Азотсодержащие соединения 127
4.9 Азотсодержащие соединения
4.9.1 Амины
Химические сдвиги ядер 13 С в аминах (б в м. д. относительно ТМС) и
их смещения, вызванные протонированием атома азота (в скобках:
^гидрохлорид амина ^амин, измеренные В D2O)
Протонирование аминов приводит к экранированию ядер 13 С в вицинальном
положении по отношению к азоту. Вызванные этим экранированием измене-
ния химических сдвигов составляют — 2 м. д. для «-углеродного атома, от —3
до —4 м.д. для /3-углерода, от —0,5 до —1,0 для 7-углерода. Чаще всего исклю-
чения возникают в разветвленных системах: третичные и четвертичные атомы
углерода в «-положении обычно дезэкранируются при протонировании азота
(А<5 от +0,5 до 9 м.д.) [1].
28,3
(-1,8)
CH3-NH2
38,2
(-2,0)
\
/NH
47,6
(-1,2)
\
/N—
19,0 ^NH2
(-5,0) 36,9
(-0,2)
15,7 44,5
(-3,2) (-0,6)
12,9 51,4
(-1,7) (+1,3)
27,4
(-5,4)
></NH2
11,5 44,6
(-0,4) (-1,8)
12,0
10,9
26,5
(-4,9)
\.NH2
I 43,0
1 (+2,2)
32,9
(-4,7)
\/NH2
'"747,2
(+5,7)
128 4. Спектроскопия ЯМР 13С
14,3
45,9 35,2
(-0,4) (-1,8)
23,2
(-2,9) Н
12,5 54,0 36,1
(-0,9) (-2,1) (-2,0)
22,5
(-3,1) Н
50,5 I 33,9
(+1,9) (-2,5)
28,2
(-1,2) H
N,
50,4
(+6,6)
28,5
(-2,7)
12,8
(-2Д) J
53,6 44,6
(+0,5) (-1,3)
20,6
11,9 61,8 45,2
(-0,8) (-1,6) (-1,2)
18,7
(-1,3)
55,5 40,9
(+3,8) (-0,8)
25,4
(-0,8)
53,6
(+8,9)
38,7
(+0,2)
(-3,0;
-2,7*)
36,6
(-1,3;
-0,5*)
'Xn"^x-/N^46,1
I 57,2 (_1>0;
(-2,6; -0,2*)
-2,3*)
113,6 139,9
* Дважды протони-
рованная форма.
* Дважды протони-
рованная форма.
64,2
(-5,4)
/kl^NH2
44,6
(-1,9)
NH2
I 51,1 (+0,7)
Г|37,6 (-5,4)
^^>25,8 (-1,0)
26,3 (-1,1)
33,5 (-1,5)
XNH
158,7 (+0,6)
К ] 32,7 (-2,7)
25,7 (-0,3)
26,8 (-0,7)
41,1 (-0,7)
164,3 (+2,4)
kk 29,2 (-1,6)
k_J 26,5 (-0,9)
26,9 (-1,2)
NH,
1 146,7
115,1
129,3
118,5
30,2
4NH
1149,9
0112,3
4^129,3
116,9
4.9. Азотсодержащие соединения 129
H2N 46,3
1143,4
О127,1
128,3
126,5
118,0
122,9
Химические сдвиги ядер 13 С в циклических аминах (<5 в м. д. относи-
тельно ТМС)
4.9.2 Нитро- и нитрозосоединения
Химические сдвиги ядер 13 С в нитро- и нитрозосоединениях
(6 в м. д. относительно ТМС)
61,2
CH3NO2
12,3
\/NO2
70,8
21,2
10,8 77,4
20,8
13,3 29,6
19,8 75,6
28,6 18,7
14,0 31,4 «29,6 26,2
22,6 «29,6 27,9 75,8
130 4. Спектроскопия ЯМР 13С
N
25,5
no2
1148,4
^=>1123,6
129,4
134,6
NO
1 165,9
120,8
х^ 129,3
135,5
4.9.3 Нитрозамины и нитрамины
Химические
ТМС)
сдвиги ядер 13 С в нитрозаминах (5 в м. д. относительно
32,1 О
\ //
N—N
39,9
11,5 38,4 о
\ //
/N—N
14,5 47,0
Химические сдвиги ядер 13 С в нитраминах {6 в м. д. относительно
ТМС)
32,5
CH3NH-NO2
41,5 NO2 СН 40,0
CH3N >-NO2
NO. rnz
4.9.4 Имины и оксимы
Химические сдвиги ядер 13 С в иминах (<5 в м. д. относительно ТМС)
128,6 129,0 1Q7 q
/--\ J. «5 < , «5
130,8 f V^C=N—
\—/ H
153,2
4.9. Азотсодержащие соединения 131
Химические сдвиги ядер 13 С в оксимах (<5 в м. д. относительно ТМС)
/ОН
147,8 )=N
Н
/ОН
148,2/=N
15,0
15,0\ /ОН
155,4 >=N
21,7
32,3
26,3
24,6
4.9.5 Гидразоны и карбодиимиды
Химические сдвиги ядер 13 С в гидразонах (6 в м. д. относительно ТМС)
18,0
25,1
22’6ч 167,2
19 7
33,! | 470
14,2
Химические сдвиги ядер 13 С в карбодиимидах (ё в м. д. относительно
ТМС)
55,7
132 4. Спектроскопия ЯМР 13С
4.9.6 Нитрилы и изонитрилы
Химические сдвиги ядер 13 С в нитрилах (б в м. д. относительно ТМС)
1,7 117,4
CH3CN
10,6 120>8
\^CN
10,8
19,0*
13,3 19,3*
* Отнесение ненадежно.
19,9 123>7
\/CN
|19,8
13,2 21,9
\ /CN
16,8 27,4
110,5
NC^/CN
8,6
137,5 117,2
107,8
Химические сдвиги ядер 13 С в изонитрилах (б в м. д. относительно
ТМС, I J|cn в Гц)
Из-за симметричного распределения электронов вокруг атома азота спин-спи-
новое взаимодействие 13C-14N в спектрах ядер 13С нитрилов может прояв-
ляться в виде триплетов с распределением интенсивностей 1:1:1 (спиновое
квантовое число атома 14N: 1=1, его природное содержание 99,6%).
2J 7,5 *J 5,8
26,8 158,2
CH3NC
sJ«0 ‘J 5,3
15,3 156,8
\/NC
36,4
2J 6,5
SJ s 0 5,0
120,6 165,7
<^NC
119,4
2J 11,7
165,7 lJ 5,2
NC
Д126.7 *J 13,2
|1 126,3 2J ~ 0
129,9 3J « 0
129,4 4J = 0
4.9. Азотсодержащие соединения 133
4.9.7 Изоцианаты, тиоцианаты и изотиоцианаты
Химические сдвиги ядер 13 С в изоцианатах (6 в м. д. относительно
ТМС)
26,3 121,5
CH3NCO
13 6 34 2 125 (широкий
сигнал)
20,4 43,3
110,7 124>2
^/NCO
124,7
Химические сдвиги ядер 13 С в тиоцианатах и изотиоцианатах
(<5 в м. д. относительно ТМС)
15,4
111,8
SCN
133,3
SCN"
29,3 128,7
CH3NCS
то т 131 (широкий
i.M NCS сигнал)
28,7
20,0 45,0
4.9.8 Литература
[1] Sameski J. Е., Surprenant Н. L., Molen F. К., Reilley Ch. N., “Chemical shifts
and protonation shifts in carbon-13 nuclear magnetic resonance studies of
aqueous amines”, Anal. Chem., 47, 2116 (1975).
N
134 4. Спектроскопия ЯМР 13С
4.10 Серосодержащие функциональные группы
4.10.1 Тиолы
Химические сдвиги ядер 13С в тиолах (<5 в м. д. относительно ТМС)
6,5
CH3SH
12,0 35,7
21,0 23,7
12,6 26,4
22,2 33,9
14,0 30,6 24,6
14,0 31,4 34,1
22,6 28,1 24,7
28,7
28,1 38,8
64,2
ho^sh
27,3
28,8 <
lx'141,0
А127’9
128,5
126,8
SH
125,3
4.10.2 Сульфиды
Химические сдвиги ядер 13С в сульфидах (<5 в м. д. относительно ТМС)
4.10. Серосодержащие функциональные группы 135
15,5 34,1 22,0
31,4 13,7
25,4 132,3
14,2 110,5
---у 72,6 81,4
S—=
127,0
Химические сдеиги ядер 13С в циклических сульфидах (6 в м. д. отно-
сительно ТМС)
27,9<S^| 69,2
26,4
69,7
136 4. Спектроскопия ЯМР 13С
4.10.3 Дисульфиды и сульфониевые соли
Химические сдвиги ядер 13 С в дисульфидах и сулъфониевых солях
(<5 в м. д. относительно ТМС)
4.10.4 Сульфоксиды и сульфоны
Химические сдвиги ядер 13С в сульфоксидах и сульфонах (<5 в м. д. относительно ТМС)
40,1 СК / 43,9
ff О 42,6 О о 37Д J^53,5 /о !5.2 127,6 °к//° 129,3 |f^\ [Г4, 133,2^^ 141,6^ 54,3 ’ А VJ25 4 А123’5 Э’* 129,6 130,9 39,3 48,2 40,3 56,3 13,0 /о 6>7 /о 16’3 34,2 I/57’6 V (/ 51,1 €) О 22-7 ' 22,7
4.10. Серосодержащие функциональные группы 137
4.10.5 Сульфокислоты, сульфиновые кислоты и их производные
Химические сдвиги ядер 13 С в сульфокислотах, сулъфиновых кис-
лотах и их производных (б в м. д. относительно ТМС)
39,6
CH3SO3H
8,0
^SO3H
46,7
18,8
13,7 53,7
16,8
\,.SO3H
| 52,9
25,0
\/SO3H
--455,9
52,6 9,1 18,4
CH3SO2C1 ^SO2C1 ^^SO2C1
60,2 12,1 67,1
17,1
\.SO2C1
|67,6
24,5
42,7
О 13,7
48,7
Xs-
сГо 18.2
?н
SO2
I 143,5
126,3
129,8
132,3
О
SO2
И34,9
^1127,9
130,0
134,4
91
SO2
1144,1
126,8
129,7
135,3
Fh2
SO2
I 139,3
125,5
128,8
131,7
4.10.6 Производные сернистой
Химические сдвиги ядер 13 С в производных сернистой
лот (б в м. д. относительно ТМС)
серной кислот
серной кис-
и
и
15,4
58,3
26,0
57,1
59,1 //\\
О О
14,5
69,6 //\\
%'с
О О
S
138 4. Спектроскопия ЯМР 13С
4.10.7 Серосодержащие карбонильные соединения
Химические сдвиги ядер 13 С в серосодержащих карбонильных
соединениях (ё в м. д. относительно ТМС)
Химические сдвиги ядер 13С в тиокарбонильных группах примерно на 30 м. д.
превышают соответствующие величины для карбонильных соединений:
<5c=s « 1,5<5с=о - 57,5
Дезэкранирование карбонильных групп тиокарбоновых кислот и их эфиров
приводит к смещению сигналов примерно на 20 м. д. по сравнению с соответ-
ствующими кислородными соединениями.
S П 278,4 -*Т^ЗЗ,0 1 53,7' О II 28,4 22,2 30,1 194 1 32,1 13,6 1 / 44,3 I 32,7 N 199,4| 42,3 ° 9 А „ „ 11,3 32,6 ^ SH 30,2-^ 194,5 195,4 S S 20,6 А 39,2 33,3^ NH2 234,1 205,6 202,1 s^nh2 1140,1 [l^ 128,1 128,8 132,1
4.11. Карбонилсодержащие соединения 139
4.11 Карбонилсодержащие соединения
4.11.1 Альдегиды
Правило аддитивности для оценки химических сдвигов ядер 13 С
в карбонильной группе альдегидов (<5 в м. д. относительно ТМС)
<5с=о = 193,0 + ' Zi
i
-С/,-Са-СНО
Заместитель i ZQ Z/з
-с< 6,5 2,6
-сн=сн2 -0,8 0,0
-сн=сн-сн3 0,2 0,0
—фенил -1,2 0,0
Химические сдвиги ядер 13 С в альдегидах (6 в м. д. относительно ТМС)
197,0 31,3 200,5 5, СНг=О CHj-CHO 15,5 204>6 13,8 24,3 201>3 <^СНО I41’1 22,4 43,6 194,4 176,8 сно =^СНО =/ 83,1 81,8 137,8 138,6 2 202,7 15 7 201,6 \^/СНО /<^/СНС) 36,7 13,3 45,7 23 4 205,6 95,3 176,9 </СНО CClg-CHO 42,4 204,7 192,0 СНО СНО 1 50,1 1 136,7 26,1 129,7 25,2 к^> 129,0 25,2 134,3
140 4. Спектроскопия ЯМР 13С
4.11.2 Кетоны
Правило аддитивности для оценки химических сдвигов ядер 13 С
в карбонильной группе кетонов (6 в м. д. относительно ТМС)
<5с=о = 193,0 +52 Zj
-Ср-Са-С-Са-Ср-
Заместитель i ZQ %
-с< 6,5 2,6
-сн=сн2 -0,8 0,0
-сн=сн-сн3 0,2 0,0
—фенил -1,2 0,0
Химические сдвиги ядер 13 С в алифатических кетонах (<5 в м. д.
относительно ТМС)
206,7 Q 30,7 207,6 9 7П 206,6 9 17. ll 1 ,U 11 -1 • 97 5 ' ’ 35,2 29,3 45,2 13,5
211,8 9 18,2 206,8 ^^^31^9J4,0 213,5 ^265
27,5 1 41,6 29,4 43,5 23,8 24,5
.О^.О 215,1 17,8 218,0 "х? 28,6
1 35,5 1 1 38,0 \ 11 45,6
Химические сдвиги ядер 13 С в галогенсодержащих кетонах (<5 в м. д.
относительно ТМС)
203,5 9
25,1 84,9
187,5 О И5,6
4.11. Карбонилсодержащие соединения 141
27,2 49,4
186,3 О 96,5
21,1
pci
Cl
199,0
27,0 35,5
115,6
Авг
PBr
23,! br
187,5 О
Cl Cl
Химические сдвиги ядер 13 С в ненасыщенных и алициклических
кетонах (<5 в м. д. относительно ТМС)
25,7 137,1
81,9 78,1
128,4
132,9
Химические сдвиги ядер 13 С в дикетонах (<5 в м. д. относительно ТМС)
Енольную форму см. в разд. 4.8.
142 4. Спектроскопия ЯМР 13С
Химические сдвиги ядер 13 С в циклических кетонах и хинонах
(<5 в м. д. относительно ТМС)
Д 208,9
<Q> 47,8
9,9
23,4
о 11155,1 158,3 34,0^ Д209,8 134,2
29,1 165,3
Н187,0
[Q136,4
о
180,4
130,8
139,7
4.11.3 Карбоновые кислоты и карбоксилаты
Правило аддитивности для оценки химических сдвигов ядер 13 С
в карбоксильной группе (6 в м. д. относительно ТМС)
<5с=о - 166,0 + £Zi
-C7-C/3-CQ-COOH
Заместитель i ZQ Z/з z7
-С< -сн=сн2 11,0 5,0 3,0 -1,0
—фенил 6,0 1,0
4.11. Карбонилсодержащие соединения 143
Химические сдвиги ядер 13 С в карбоновых кислотах (<5 в м. д. относи-
тельно ТМС)
166,3
н-соон
21,7 176,9
сн3-соон
9 6 180,4
\ .СООН
28,5
18,7 179,4
/\^СООН
13,7 36,2
18,8 184>1
\.СООН
| 34,1
14,2 27,7
180,6
СООН
22,7 34,8
27,1 185-9
<.СООН
"438,7
171,7
СООН
133,1 128,3
156,5
^=—СООН
78,6 74,0
182,1
26,6
172,6
СООН
JL130,6
^1 130,1
133,7
115,0 163,0
CF3-СООН
40,7 173,7
СН2С1—СООН
63,7 170,4
СНС12-СООН
160,1
СООН
СООН
169,2
СООН
40,9 <(
СООН
173,9
.СООН
28,9 Г
^СООН
166,1
СООН
СООН
88,9 167,1
СС13-СООН
166,6
.СООН
134,2Г|
НООС
Химические сдвиги ядер 13 С в карбоксилат-анионах (<5 в м. д. относи-
тельно ТМС; если не указан растворитель, измерения спектров выполнены в
воде)
171,3
Н-СОО"
24,4 182,6
20,8* 177,6*
СН3— СОО-
Растворитель
CDCL
11,1 185,1
10,6* 181,3*
х^.СОО
31,5
28,4*
Растворитель
СОС13/ДМСО
188,6
СОО-
174,5
___/СОО’
126,7 134,3
45,0 175,9
СН2С1-СОО_
СОО 185,4
U7,2
| 30,9
26,9
26,9
65,6 171,8
CHCL.-COO"
СОО- 177,6
Д138,2
133Д
130,7
133,1
96,2 167,6_
cci3-coo-
144 4. Спектроскопия ЯМР 13С
4.11.4 Сложные эфиры и лактоны
Правило аддитивности для расчета химических сдвигов ядер 13 С
в карбонильных группах сложных эфиров (ё в м. д. относительно ТМС)
<5с=о = 166,0 + 52 Z> i -C7-C/3-CQ-COO-CQ/-
Заместитель i 3 N ci N tS)
-с< -сн=сн2 —фенил 11,0 3,0 -1,0 -5,0 5,0 -9,0 6,0 1,0 -8,0
Химические сдвиги ядер 13 С в сложных эфирах уксусной кислоты
(<5 в м. д. относительно ТМС)
171^
20,6 °
170J^ ^60Д
20,9 ° 14,4
170Д^ J^67,5
21,3 ° 21,9
22,3 28,1
72,3
Химические сдвиги ядер 13 С в метиловых сложных эфирах (<5 в м. д.
относительно ТМС)
161,6П
\П 49,1
н^тЛ
171’У> 51,5
20,6 °
13,8 35,6
23,9 34,9
173,4
’ О
15,1 28,5\П 51,6
26,4
4.11. Карбонилсодержащие соединения 145
165,1П
\П 54’2
74°'
С1 64,1
С1
162,5П
55,7
Ск-Пк u
Cl 89,6
166,5_
/О С1 Е
51,5
128,8
О<^°\51,8
166,8^130,5
f|^l 129,7
128,4
132,8
52,1
74,6
152,3
53,6
Химические сдвиги ядер 13 С в лактонах (6 в м. д. относительно ТМС)
О О О
ТТ 168,6 П 178,1 Д171,2
oQ 39,1 27,8 lj 29’2
58,7 68,8 22,3 69,3 19,1
22,3
106,0
* Отнесение ненадежно.
146 4. Спектроскопия ЯМР 13С
4.11.5 Амиды и лактамы
Правило аддитивности для расчета химических сдвигов ядер 13 С
в карбонильных группах амидов (<5 в м. д. относительно ТМС)
<5с=о = 165,0 +
i
О Са-С/з-
-C^C/j-CaJ-N^
са>-с^
Заместитель i ZQ Z/з z7 ZQ/ Zp'
-с^ 7,7 4,5 -0,7 -1,5 -0,3
-сн=сн2 3,3
—фенил 4,7 -4,5
Химические сдвиги ядер 13С в амидах (<5 в м.д. относительно ТМС)
Формамиды 167,6 о 163,3 о St St /24,8 Н NH, Н N Н ~ 90% 161,8О 164, 9q + ч Н N с Н NH Н 14,6 1 36,9<16,Е = 90% = 10% Первичные и вторичные ацетамиды 173,4 п 171,7,, 177,0* 22,3 NHa 22,7 ] * В воде. 166,5О 162,6 о - Nt Nt / 31,5 ’ Н NH Н N 1 28-2 1 36,5 = 10% 162,6q St 36,7 H^N'X^'12,8 ! «414 9 171.0o 26,1 34,4 3 22,8 H 14,6
4.11. Карбонилсодержащие соединения 147
Третичные алифатические амиды
170,0о
170,1 о
Химические сдвиги ядер 13 С в лактамах (<5 в м. д. относительно ТМС)
О А 179,4 О II 175,5 О II 171,9
HIST У 30,3 HN 127,6 31,5
42,4 20,8 49,5 147,6 42,0 20,9 22,3
34,4^ О П 169,4 У”] 32,3 HN 165,0 >1 120,8 О X177-5 36,5
49,9 \А 21,6 23,3 136,1 АА 142,0 106,6 42, о( .>23,2 29,9* 30,7*
* Отнесение ненадежно.
148 4. Спектроскопия ЯМР 13С
4.11.6 Другие карбонилсодержащие соединения
Химические сдвиги ядер 13 С в галогенангидридах
карбоновых кислот {8 в м. д. относительно ТМС)
О
jtl70,4
^С1
33,6
о
К165’7
^Вг
39,1
О
Д158,9
ч
О
9,3 1(174,7
41,0
137,3 j?1656
131,4
176,3
25,9
168,0
Химические сдвиги ядер 13 С в ангидридах карбоновых кислот
(<5 в м. д. относительно ТМС)
158,5
167,4
170,9 27,4
169,6 37,2 13,4
о
136,1
131,1О
163,1
о
о
о
4.11. Карбонилсодержащие соединения 149
Химические сдвиги ядер 13 С в имидах карбоновых кислот
(ё в м. д. относительно ТМС)
171,6 Н
24,1
О О
173Л 1 31,3
О
135,5
О
Л 173,0
I NH
Химические сдвиги ядер 13 С в производных карбоновых кислот
(<5 в м. д. относительно ТМС)
СО 181,3
СО2 124,2
9_
СОз 168,2
CS2 192,8
156,5
155,9 30,9 13,6
226,2
65,1,0 156,7
Lo>o
68,1
AO 148,7
21,7 \ >=O
60,7
° 163,5
h2n nh2
9 165,4
HN 38,5
S 193,9
JT N 43,0
45,0
О 156,7
NXV35'6
H 157,8 14,7
22,5
150 4. Спектроскопия ЯМР 13С
4.12 Другие соединения
4.12.1 Производные элементов IV группы
Химические сдвиги и константы спин-спинового взаимодействия
ядер 13С в производных элементов IV группы (<5 в м. д. относительно
ТМС, IJ| в Гц)
I 0,0
—Si—
I -3,6
—Ge-
Другие
соед.
I -9,3
—Sn-
I -4,2
16,2 9>1
,SiC
Cl
26,7 16,6
129,6 | ^2-°
138,7
5,0 f^?CO—
CO—21,6
4 7
’ 169,0
4.12. Другие соединения 151
4.12.2 Фосфорорганические соединения
Химические сдвиги ядер 13 С и константы спин-спинового взаимо-
действия 31Р-13 С в алифатических фосфорорганических соедине-
ниях (<5 в м.д. относительно ТМС, |J| в Гц)
3J 11 ‘j 12
24,5 32,6 ij 1(
14;4
13,9 28,3 I
4J О 2J 14
*2 1
J 12,5 J 10,9
126,0; *J 12
130,8 <^РН2
2J 20
3J 10 2J 14
27,0 28,9
10,7 \
*J 55 /
3J 11 \j44
^3^42^9
13,7 25,1
4J 0 2J 14
12,3; 4J 49
26’3
J 5 —У \-
3J 11 4J 20
24,7 33,6 o
I
14,0 24,8 Ox 53,4
4J0 2J16 2.T’l!
48,8
4J 143 o 61,4; 2J 7
19’/—P-O"^ 16,5
6,6 3j 6
2 J 7
O4 /OJj 12
Г
33,9
2J 19
Другие
соед.
152 4. Спектроскопия ЯМР 13С
3J16‘J54 ij54 3Л6 \151 /214’9
23,9 34,61 20 8 24,0 30,9 „ R ПТ J4
I ’ | 00,0 / ^т>—с
13,6 24,8 1 4J 0 2J 4 13,6 4J0 24,6 L 2J 4
Химические сдвиги ядер 13с и константы спин-спинового взаимо-
действия 31Р-13 С в ароматических фосфорорганических соедине-
ниях (<5 в м. д. относительно ТМС, |J| в Гц)
3 J 20 J 12 J 7 133,6 137,2^^ 128,4^ \ , ( V 4j о 128,5 О II НО-Р-ОН Ь- 133,0; J 182 130,5; 2J 9 / 128,1; 3J 15 130,5; 4J 0 4J 0 3J 7 2J 4 129,5 124,1 151,5 >==/ J 10 J 104 3J12 132,3 135,6 132,3 X ' 11,4; *J 145 /О- ^o'% J 4 J П 129>! J 150,4 H ,\ 2J 8 125’ 4т П Зт к 2J 8 JU J 5 129,7 120,1 J59»4
4.12. Другие соединения 153
Химические сдвиги ядер 13С и константы спин-спинового взаимо-
действия 31Р-13С в фосфоранах (<5 в м.д. относительно ТМС, |J| в Гц)
4.12.3 Металлоорганические соединения
Химические сдвиги ядер 13С и константы спин-спинового взаимо-
действия в некоторых металлоорганических соединениях (<5 в м. д.
относительно ТМС, |J| в Гц)
134,8
Другие
соед.
2J 85 3J 104
137,4 128,3
‘j 1275
199
(взаимодействие с ядрами Hg)
154 4. Спектроскопия ЯМР 13С
4.13 Природные соединения
4.13.1 Аминокислоты
Химические сдвиги ядер
ТМС; растворитель — вода)
13С в аминокислотах (6 в м.д. относительно
41,5 + А/ОН H3N П171 2 О (pH 0,45) 42,8 O" ^173,6 (pH 4,53) 46,0 h2n-V° £182,7 (pH 12,01)
+H3N^3^/°H +tt 38,8 __ H3N^/<.O 39,3 HaN^/A/O"
32,2 ^175,7 34,8 £179,4 41,6 £182,7
(pH 0,49) (pH 5,03) (pH 12,56)
16,5 17,5 21,7
+ J\.OH H3N/ |fl74,0 50,1 ° (pH 0,43) и^/^ТГш.о 51,9 ° (pH 4,96) H2N/Af° / И 185,7 52,7 ° (pH 12,52)
18,0 18,5 17,8 19,2 17^9 20,3
30,з| + А .ОН H3N/ [fi72,9 59,8 О (pH 3,0) 30,з| +„ KTA .o’ H3N/ П 175,4 61,9 ° (pH 5,64) 32,9] A .O" H2N/ [fl84,l 63,2 О (pH 12,60)
22,1 21,8 22,5
Природ, соед. 25,11 40,1 22,7 +H3Ny>f'2,H 3 / H174,0 52,8 ° 25,11 „ A\22,9 40,7 \ + A^ o- 25,б1 A\23,7 45,5 \ A.o_ H2N/ П 185,4 55,9 °
+H3N / [fi76,3 54,4 °
(pH 0,37) (pH 7,00) (pH 13,00)
4.13. Природные соединения 155
12,1
(pH 0,28)
12,4
15,9 1 25,6
37,1
^xO”
H3N/ П175,0
60,9 О
(pH 6,04)
12,3
(pH 12,84)
.ОН
60,4 Г
H3N/f[171,3
56,0 О
(pH 1,12)
ОН
.ОН
61,2Г
H3N/
57,5
(pH 6,05)
П 173,2
О
.ОН
62,9 |
57,8 °
(pH 9,28)
НО 20’2
66,з|
он
11171,7
59,8 °
(pH 1,36)
HO^Ji*’6
66,9|
+ А /О
H3N/ rfl 73,6
61,5 °
(pH 5,87)
НО.^
68’1о-
^/Т177,3
62,1 °
(pH 9,27)
.SH
25,1 \
Л .ОН
H3N/ [fl71,9
55,9 О
(pH 1,75)
ОН
.SH
25,51
3N/lT173,l
56,7 °
/SH
32,0
H,N'
(pH 5,14)
xO”
182,1
60,7 °
(pH 11,02)
c/15,2
О
31,0^ 304
H3N/ni75,3
55,3 °
О
54,7 О
(в D2O)
Природ,
соед.
156 4. Спектроскопия ЯМР 13С
130,7 131,1f<;il129,5 -145L I] 37,5| +H3N/H175,0 57,3 ° 117,5 130,5/^к^/ОН /1381 Н 156,3 37’Х^ +H3N/O175,0 57,3 °
О 174,411 35,оГ^ОН , -"к /ОН H3N/ Т172.0 50,6 ° (pH 0,41) О 178,7|| 37,8jQ °? +НзЫ/П175,5 53,5 ° (pH 6,73) О 181,3 II 44,5£"°: H2N /0183,4 55,3 ° (pH 12,73)
О^/ОН |172,4 26,1|^ 30,7 /к /он H3N/ 1Т172,6 53,4 ° (pH 0,32) Ск/ОН |182,4 28,2f 34,7 + >\/О’ H3N/ 0175,8 56,0 ° (pH 6,95) О О" ]184,0 33,0С^ 35,3 J\/O' H2N/ [J 183,9 57,2 ° (pH 12,51)
+H3N. 402 28,1р 24,0 к /ОН +H3N/ [fl 72,8 53,7 О (pH 0,46) +H3N\ 40,3 28,7А4’0 H2N/[fi75,3 55,5 О (pH 5,02) H2N^ 419 33,3£ 29,4 H2N/|{184,6 57,2 О (pH 13,53)
NH3 NH3 1 lfH2
Природ. соед. 40,5^ 30,5< >27,6 ) 22,6 40,5^> 27,7 31’1 22’- 41,8 к зз,о 35 Y 23’6
+Т1. т А ,ОН НзМ/П173,2 54,0 О (pH 0,50) H2N/IT175,8 55,9 О (pH 6,03) H2N/V184,6 57,3 О (pH 13,85)
4.13. Природные соединения 157
+Н2ЬК нь xnh2 157,8 441,5
28,0Г / 24,9
. ЮН
HN / гГ
3 / П 172,8
53,9 О
(pH 1,33)
55,4 О
(pH 7,87)
56,6 °
(pH 11,52)
24,4 29,4
/ \б1,0ОН
173
Н2 О
(pH 1,27)
24,8 30,0
(pH 7,26)
24,8 30,0
/ \б2,4п”
47’2^N'\f 175,8
Н О
(pH 9,8)
127,7 53,6
(pH 1,74)
117,7 NHt
137.2g t M У"4’8
133,1 55,7
(pH 7,82)
133,5 56,1
(pH 9,21)
137,3
(в D2O, насыщ., 80 °C)
Природ,
соед.
158 4. Спектроскопия ЯМР 13С
4.13.2 Углеводы
Химические сдвиги ядер 13 С в моносахаридах (<5 в м. д. относительно
ТМС)
Рибоза
94,3
ОН 70>8 ОН
68,2 63,8,
Н
69,7
ОН 71,9
ОН
94,7
НО 62)1
97,1
83,8 у__у '"ОН
НсЛ t'C)H
70,8 71,7
нсП t'bn
71,2 76,0
100,4
ОН 69,2 О^ 56 7
НО-Л/О\ 103,1
84,6 \__/ ''О— 55,5
шЬ t't)H
69,8 71,1
ОН 710 103,1
НО-д^о О— 55,3
83,(Ц / 108,°
Hd't t''OH
70,9 74,3
Природ,
соед.
Глюкоза
76,7 1 ОН 96,7
75.1
4.13. Природные соединения 159
Фруктоза
69,4
70,5
в воде и ДМСО следы
99,1 ОН
в воде - 75%; в ДМСО - 25%
61,9 105-5
НО ’
63,8
. ОН
82,2 "ОН
НсЯ !Ън
77,0 82,9
НО
81,6
л 63>6
НО * ‘ он
75,4 76,4
63,2 Ю2,6
Р.кон
в воде — 4%; в ДМСО — 20%
в воде - 21%; в ДМСО - 55%
Константы спин-спинового взаимодействия 13 С1 Н
через одну связь (1Лсн в Гц)
OR
’jCH 169-171
’jCH 158-162
Природ,
соед.
160 4. Спектроскопия ЯМР 13С
4.13.3 Нуклеотиды и нуклеозиды
Химические сдвиги ядер 13С в нуклеотидах и нуклеозидах (ё в м. д.
относительно ТМС)
(в ДМСО)
(в ДМСО/вода, 1:2)
О
11,9 ТГ165,0
^li NH
107,в|| Т151.6
137,8 NX)
Н
(в D2O)
101,7
140,6
НО^60,6
НО. 60,8
84,4 Ку 87,6
69,8]—| 73,5
ОНОН
ОН
ОНОН
(в D2O)
(в D2O)
(в D2O)
Природ,
соед.
(в ДМСО)
119,6
NH
-А160-0
н \ N NH2
162,2
(в D2O)
4.13. Природные соединения 161
119,6 №*2
152,6
136,1 <( J
f \N'
NH
Д153,8
nh2
N"
онон
(в ДМСО)
HO 61,6 151,5
85,5 ry 86,7
70,61—| 73,9
OHOH
(в ДМСО)
он
(в D2O)
//Il
138,5 \ H 1д54,6
N N NH2
(b D2O)
Природ,
соед.
162 4. Спектроскопия ЯМР 13С
4.13.4 Стероиды
Химические сдвиги ядер 13 С в стероидах (6 в м. д. относительно ТМС)
Природ,
соед.
4.14. Спектры растворителей и стандартных соединений 163
4.14 Спектры растворителей
и стандартных соединений
4.14.1 Спектры ЯМР 13С обычных дейтерированных растворителей
(125 МГц, ё вм. д. относительно ТМС)
Ацетон-ф>
206,0
_JL 7
31 30 29 I I
200 180 160 140 120 100 80 60 40 20 0
Ацетонитрил-йз
118,3
1 I 1 1 I I.
2 1 j!
! I----1-Т--Г--1--1--1-1--->--1--1--1--1--1--1--1--1--1--1--1---г
200 180 160 140 120 100 80 60 40 20 0
Бензол-йб
129 128 127
1 1 Т I I I 1 I 1---------------------1 I 1-----1----1--1----Г~~—I----1---1----1--Г
200 180 160 140 120 100 80 60 40 20 0
Бромоформ-d
J1L
1 I ' ' ' I ' '
11 10
200 180 160 140 120 100 80 60 40 20 0
Хлороформ-d
J1L
। 1 । 1 1 ।
78 77 76
77,0
Раствор.
200 180 160 140 120 100 80 60 40 20 0
164 4. Спектроскопия ЯМР 13С
Циклогексан-с/]2
' ' I ' ' ' ' I ' '
27 26
200 180 160 140 120 100 80 60 40 20 0
Диметилсульфоксид-йб
JL 395
40 39 I
, —...............- — ------------------------------- ----- --..- 1
200 180 160 140 120 100 80 60 40 20 0
Метанол-ф
200 180 160 140 120 100 80 60 40 20 0
Метанол-си
49,0
50 49 48
—I---1---1-----1--1----1--1----1--1----1--1---1----1--1---1---1---1---1---1----1--г
200 180 160 140 120 100 80 60 40 20 0
Пиридин-с/й
200 180 160 140 120 100 80 60 40 20 0
Тетрагидрофур ан-dg
200 180 160 140 120 100 80 60 40 20 0
Раствор.
4.14. Спектры растворителей и стандартных соединений 165
4.14.2 Спектры ЯМР 13С вторичных стандартов
Химические сдвиги ядер 13С в спектрах ЯМР обычно измеряют относитель-
но положения сигнала тетраметилсилана (ТМС), который добавляют в ка-
честве внутреннего стандарта. В тех случаях, когда ТМС недостаточно рас-
творим в образце, рекомендуется использовать капилляры с ТМС в качестве
внешних стандартов. Из-за разницы в величине объемной восприимчивости
локальные магнитные поля в области растворителя и стандарта различаются,
поэтому положение сигнала стандарта необходимо корректировать. Для рас-
твора в D2O в цилиндрической ампуле и ТМС в капилляре величины поправок
составляют +0,68 и —0,34 м. д. для сверхпроводящего магнита и электромагни-
та соответственно. Эти величины необходимо вычесть из химических сдвигов
относительно внешнего стандарта ТМС, если положение его сигнала приня-
то за 0,00 м. д. Другой путь состоит в использовании вторичных стандартов
с группами (CH3)3SiCH2. Ниже представлены спектры растворов в D2O двух
вторичных стандартов при рабочей частоте 125 МГц с ТМС в качестве внеш-
него стандарта. Химические сдвиги представлены в м. д. относительно ТМС с
корректировкой на различие в величине объемной восприимчивости раствора
и стандарта. В результате сигнал внешнего стандарта ТМС появляется при
0,68 м.д.
Натриевая соль 3-(триметилсилил)-1-пропансульфокислоты
(4,4-диметил-4-силапентан-1-сульфонат натрия; ДСС)
0,68 ТМС
(внешний стандарт)
Н,С. < I * 3
£i~^^SO3Na 551
Н3С 19,8 15,8
I----1---1----1----1----1----1----1---1----1----1----1----1---1----1----1----|----1----1---1----1----г
200 180 160 140 120 100 80 60 40 20 0
Натриевая соль 2,2,3,3-В4-3-(триметилсилил)пропионовой кислоты
„ H^DD |
H3C'Si X I 0,68 ТМС
Н3С DD COONa (внешний стандарт)
186,3 187 ' 186 33 32 31 13 12 31,9 12,7
—.... ---» —........ - .. .. ............................................-1-
I--1---1---1--1---1--1---F--1---1--1---1--1---1---1--1---1--1---1--1---1---Г
200 180 160 140 120 100 80 60 40 20 0
Раствор.
166 4. Спектроскопия ЯМР 13С
4.14.3 Спектр ЯМР 13С смеси обычных
недейтерированных растворителей
Этот спектр ЯМР 13С с полным подавлением спин-спинового взаимодействия
с протонами (125 МГц, ё в м. д. относительно ТМС) раствора смеси 20 обыч-
ных растворителей в CDCI3 (0,05 0,4 об. %) можно использовать для иденти-
фикации примесей растворителей. Химические сдвиги сигналов, помеченных
звездочкой (*), могут изменяться в пределах нескольких м. д., если в раство-
ре содержатся вещества с функциональными группами, способными к образо-
ванию водородных связей. ДМФА диыетилформамид, ТГФ — тетрагидрофу-
ран, моноглим — диметиловый эфир этиленгликоля.
149,9* пиридин
этилацетат ДМФА
206,8* ацетон 192,6 CS2 171,1 162,5
Г ..-X «НИ ,.**«* W ..... ..МЧЛ ч jИI.» A44.V4W.. Л .....
210 205 200 195 190 185 180 175 170 165 160 155 150 145 140
пиридин 129Д толуол
136 0 128,4, 128,3 толуол, бензол
125,3 толуол
толуол | 123,8 пиридин
’ I I I 116,3* ацетонитрил
140 135 130 125 120 115 110 105 100
CDC13 77,1*
CIICL, 77,3*
(верхняя
часть
сигнала
не пока-
96,2* СС14
95 90 85
53,4 СН2С1.
метанол
50.7*
60,4 этилацетат
59,1* этанол
71,9 моноглим
ТГФ 68,0
67,1 диоксан
65,9 диэтиловый
эфир
ДМФА 31,3 27,0 циклогексан
22,7 гексан 15,3 диэтиловый эфир
21,4 толуол 14,2 этилацетат pg ацетонитрил
Раствор.
5 Спектроскопия ЯМР rH
5.1 Алканы
5.1.1 Химические сдвиги
Химические сдвиги ядер 1Н в алканах (<5 в м. д. относительно ТМС,
J в Гц)
СН4 0,23 Jgem-12,4
СН3 0,86
СН3
СНз 0,91 Jvic 7,4
СН2 1,33
СН3
СН3 0,89 Jvic 6,8
JCH 1,74
СНз чсн3
СН3 а 0,91
СН3Ь 1,31
СН2с
СНз В
Jab 7,3
2Jbb’ -12,4
Jbc 5,7
3Jbc' 8,5
В длинноцепочечных алканах из-за эффектов второго порядка метильные груп-
пы около 0,8 м. д. обычно проявляются в виде искаженного триплета:
168 5. Спектроскопия ЯМР 1Н
Химические сдвиги ядер 1Н в монозамещенных алканах (<5 в м. д.
относительно ТМС)
Заместитель Метил -CH3 Этил -сн2 Пропил -сн2 -сн3
-сн2 -СН3
-Н 0,23 0,86 0,86 0,91 1,33 0,91
С -сн=сн2 1,71 2,00 1,00 2,02 1,43 0,91
-CfeCH 1,80 2,16 1,15 2,10 1,50 0,97
—фенил 2,35 2,63 1,21 2,59 1,65 0,95
Н —F 4,27 4,36 1,24 4,30 1,68 0,97
а -С1 3,06 3,47 1,33 3,47 1,81 1,06
1 - Вт 2,69 3,37 1,66 3,35 1,89 1,06
-I 2,16 3,16 1,88 3,16 1,88 1,03
О -ОН 3,39 3,59 1,18 3,49 1,53 0,93
—О—алкил 3,24 3,37 1,15 3,27 1,55 0,93
-осн=сн2 3,16 3,66 1,21
—О—фенил 3,73 3,98 1,38 3,86 1,70 1,05
-ОСОСНз 3,67 4,12 1,26 4,02 1,65 0,95
—ОСО—фенил 3,88 4,37 1,38 4,25 1,76 1,07
—OSO2—4—толил 3,70 4,07 1,30 3,94 1,60 0,95
N -NH2 2,47 2,74 1,10 2,61 1,43 0,93
-NHCH3 2,3
-N(CH3)2 2,31 2,32 1,06
—NHCOCH3 2,79 3,26 1,14 3,18 1,55 0,96
-no2 4,29 4,37 1,58 4,28 2,01 1,03
-CN 1,98 2,35 1,31 2,29 1,71 1,11
-NC 2,85 3,39 1,28
S -SH 2,00 2,44 1,31 2,50 1,63 0,99
—S—алкил 2,09 2,49 1,25 2,43 1,59 0,98
—SS—алкил 2,30 2,67 1,35 2,63 1,71 1,03
-SOCH3 2,50
-SO2CH3 2,84 2,94 2,80
о -CHO 2,20 2,46 1,13 2,42 1,67 0,97
|| - СОСНз 2,09 2,47 1,05 2,32 1,56 0,93
С —CO—фенил 2,55 2,92 1,18 2,86 1,72 1,02
/\ -СООН 2,10 2,36 1,16 2,31 1,68 1,00
-СООСН3 2,01 2,32 1,15 2,22 1,65 0,98
-conh2 2,02 2,23 1,13 2,19 1,68 0,99
-COCI 2,66 2,93 1,24 2,87 1,74 1,00
5.1. Алканы 169
Химические сдвиги ядер 1Н в моно замещенных алканах (продолже-
ние) (5 в м. д. относительно ТМС)
Заместитель Изопропил Бутил -CH2 -CH2 mpem-Бутил
-CH -CH3 -сн2 -CH3 -CH3
-Н 1,33 0,91 0,91 1,31 1,31 0,91 0,89
С -сн=сн2 2,06 «1,5 «1,2 0,90 1,02
-С=СН 2,59 1,15 2,18 1,52 1,41 0,92 1,22
—фенил 2,89 1,25 2,61 1,60 1,34 0,93 1,32
Н -F 4,34 1,65 0,95 1,34
а -С1 4,14 1,55 3,42 1,68 1,41 0,92 1,60
1 -Вг 4,21 1,73 1,76
-I 4,24 1,89 3,20 1,80 1,42 0,93 1,95
О -ОН 3,94 1,16 3,63 1,53 1,39 0,94 1,22
—О—алкил 3,55 1,08 3,40 1,54 1,38 0,92 1,24
-осн=сн2 4,06 1,23 3,68 1,61 1,39 0,94
—О—фенил 4,51 1,31 3,94 1,76 1,47 0,97
-ОСОСНз 4,99 1,23 4,06 1,60 1,39 0,94 1,45
—ОСО—фенил 5,22 1,37 1,58
—OSO2—4—толил 4,70 1,25 4,03 1,62 1,36 0,88
N -NH2 3,07 1,03 2,68 1,43 1,33 0,92 1,15
-NHCOCH3 4,01 1,13 3,21 1,49 1,35 0,92 1,28
-no2 4,44 1,53 4,47 2,07 1,50 1,07 1,59
-CN 2,67 1,35 2,34 1,63 1,50 0,96 1,37
-NC 3,87 1,45 1,44
S -SH 3,16 1,34 2,52 1,59 1,43 0,92 1,43
—S—алкил 2,93 1,25 2,49 1,56 1,42 0,92 1,39
—SS—алкил 2,69 1,64 1,42 0,93 1,32
-SO2CH3 3,13 1,41 1,44
О -CHO 2,39 1,13 2,42 1,59 1,35 0,93 1,07
II -COCH3 2,54 1,08 1,12
С —CO—фенил 3,58 1,22 2,95 1,72 1,41 0,96
/\ -COOH 2,56 1,21 2,35 1,62 1,39 0,93 1,23
-COOCH3 2,56 1Д7 2,31 1,61 1,33 0,92 1,20
-conh2 2,44 1,18 2,22 1,60 1,37 0,93 1,22
-COCI 2,97 1,31 2,88 1,67 1,40 0,93
170 5. Спектроскопия ЯМР 1Н
Оценка химических сдвигов ядер 1Н в алифатических соединениях
(<5 в м. д. относительно ТМС) [1]
СНз <5сн3х = 0,86 + ZQ
<5ch3cxyz = 0,86 + 57 Z/jj
СН2 <5сн2 = 1,37 + 57 Zat + J?
i j
СН <5сн = l,50 + 52Z“.
i J
Заместитель (X,Y, Z) CH3 CH2 CH
Zq ZQ Z73 ZQ Z/3
-с 0,00 0,05 0,00 -0,04 0,17 -0,01
-с=с 0,85 0,20 0,63 0,00 0,68 0,03
-esc- 0,94 0,32 0,70 0,13 1,04
—фенил 1,49 0,38 1,22 0,29 1,28 0,38
Н —F 3,41 0,41 2,76 0,16 1,83 0,27
а —С1 2,20 0,63 2,05 0,24 1,98 0,31
1 —Вг 1,83 0,83 1,97 0,46 1,94 0,41
-I 1,30 1,02 1,80 0,53 2,02 0,15
О -ОН 2,53 0,25 2,20 0,15 1,73 0,08
-о-с 2,38 0,25 2,04 0,13 1,35 0,32
-ос=с 2,64 0,36 2,63 0,33
—О—фенил 2,87 0,47 2,61 0,38 2,20 0,50
-О(С=О)- 2,81 0,44 2,83 0,24 2,47 0,59
N —N 1,61 0,14 1,32 0,22 1,13 0,23
-N+ 2,44 0,39 1,91 0,40 1,78 0,56
-N(C=O)- 1,88 0,34 1,63 0,22 2,10 0,62
-no2 3,43 0,65 3,08 0,58 2,31
-CN 1,12 0,45 1,08 0,33 1,00
-NCS 2,51 0,54 2,27 2,14
s -s- 1Д4 0,45 1,23 0,26 1,06 0,31
-SCO- 1,41 0,37 1,54 0,63 1,31 0,19
-S(=O)- 1,64 0,36 1,25
-S(=O)2- 1,98 0,42 2,08 0,52 1,50
-SCN 1,75 0,66 1,62 1,64
О -CHO 1,34 0,21 1,07 0,29 0,86 0,22
II -co- 1,23 0,20 1,12 0,24
С -COOH 1,22 0,23 0,90 0,23 0,87 0,32
/\ -coo- 1,15 0,28 0,92 0,35 0,83 0,63
-CO-N 1,16 0,28 0,94
-COCI 1,94 1,51
Другие подходы см. в [2]
5.1. Алканы 171
Химические сдвиги ядер 1Н в алканах с ароматическими замести-
телями (<5 в м. д. относительно ТМС)
СН3 2,05
/г/
ch^N'N
2,79
।
Н
СН3 2,21
2,18 СН;
СН3 2J4
СН3 2,55
2,47 СН3
СН3 3,60
172 5. Спектроскопия ЯМР 1Н
5.1.2 Константы спин-спинового взаимодействия
Геминальные константы спин-спинового взаимодействия (2Лнн
в Гц)
2Лнсн от -8 до -18 Гц
Электроотрицательные заместители приводят к уменьшению | J|gemj в то время
как двойная или тройная связь, следующая за группой СН2, вызывает ее уве-
личение. Последний эффект проявляется наиболее сильно, если одна из связей
С—Н направлена параллельно оси тг-орбиталей.
Соединение Jgem Соединение Jgem
СН4 -12,4 СН3СОСН3 -14,9
СН3С1 -10,8 СНзСООН -14,5
СН2С12 -7,5 CH3CN -16,9
СНзОН -10,8 CH2(CN)2 -20,3
ОсНз -14,3 Q-g;CN -18,5
Вицинальные константы спин-спинового взаимодействия (3Лнн
в Гц)
Конформация не фиксирована: 3Лнн ~ 7
Конформация фиксирована: 3Лнн 0-18
Влияние заместителей на вицинальные константы спин-спинового
взаимодействия
Соединение Jvic Соединение Jvic Соединение Jvic
CH3CH-F2 4,5 CH3CH2-OH 6,9 CH3CH2-CN 7,6
CH3CH-C12 6,1 (CH3CH2)3O+BF4- 7,2 (CH3CH2)2S 7,4
ch3ch2-f 6,9 (CH3CH2)3N 7,1 CH3CH2-Li 8,4
CH3CH2-C1 7,2
5.1. Алканы 173
Вицинальные константы спин-спинового взаимодействия сильно зависят от
двугранного угла 9? (уравнение Карплуса):
J = J° cos2 9? — 0,3 0° 99 90°
J = J180 cos2 v _ 0)3 90° < 9? < 180°
Такое же соотношение между торсионным углом и вицинальной константой
сохраняется для замещенных алканов, если используются соответствующие
значения для J0 и J180. Эти граничные величины зависят от электроотрица-
тельности и ориентации заместителей, гибридизациии атомов углерода, длин
связей и валентных углов.
Дальние константы спин-спинового взаимодействия (|Л|нн в Гц)
Константы спин-спинового взаимодействия более чем через три связи (даль-
нее взаимодействие) в алканах обычно меньше 1 Гц, поэтому они не наблю-
даются в рутинных одномерных (1D) спектрах ЯМР. Однако эти величины
значительно превышают 1 Гц для фиксированных конформаций (например, в
конденсированных алициклических системах, см. разд. 5.4) и в ненасыщенных
соединениях (см. разд. 5.2). Они также достаточно велики в том случае, когда
электроотрицательные заместители расположены между взаимодействующи-
ми группами, как например:
4Лнн 0,7
5.1.3 Литература
[1] Burgin Schaller R., Arnold C., Pretsch E., “New parameters for predicting 'H
NMR chemical shifts of protons attached to carbon atoms”, Anal. Chim. Acta,
312, 95 (1995).
[2] Friedrich E., Runkle K. G., “Empirical NMR chemical shift correlations for
methyl and methylene protons”, J. Chem. Educ., 61, 830 (1984).
174 5. Спектроскопия ЯМР гН
5.2 Алкены
5.2.1 Замещенные этилены
Химические сдвиги и константы спин-спинового взаимодействия
ядер 1Н в алкенах (<5 в м. д. относительно ТМС, J в Гц)
н Н 5,28 ' Jgem 2,5 4,88 Hfc /Ha 5,73 3Jab 10,0
Зт . UC1S 11,6 / Ц d 3Jac 16,8
н Н Зт trans 19,1 4,97 H c CH3 1,72 3Jad 6,4
2Jbc 2,1
4Jbd -1,3
4Jcd -1,8
ь 4Jab -1,7 н_ 5,37 3 T •^ab 10,9
СНз На 5,55 зт Jac 15,1 / 4Jac -1,8
=Л d 3Jad 6,5 СНз CH3 1,54 3Jad 6,8
Нс СН3 1,58 5T Jbd 1,6 c d 5Jcd 1,2
4,87 Hb На5,78 3Jab 10,3 4JM -1,3
/=Ц d е 3Jac 17.2 4Jcd -1,7
4,94 Нс СН2-СН3 3Jad 6,2
2,00 1,00 2Jbc 2,0
Геминальные и вицинальные константы
спин-спинового взаимо-
действия в алкенах (J в Гц)
Константы спин-спинового взаимодействия сильно зависят от электроотрица-
тельности заместителей (см. табл, на с. 176, 177). Они уменьшаются с ростом
электроотрицательности заместителей и увеличением их числа. Такая же зако-
номерность существует для геминальных констант с учетом их знака, но не для
их абсолютных величин, так как Jgenl может быть положительной или отри-
цательной. Хотя области вицинальных цис- и транс-констант перекрываются,
соотношение Jtrans > Jcis всегда сохраняется для данных заместителей.
Типичные интервалы значений
Jgem от -4 до 4
Jcis от 4 до 12
Jtrans ОТ 14 ДО 19
5.2. Алкены 175
Взаимодействие на расстоянии более трех связей в алкенах (даль-
нее взаимодействие) (J в Гц)
Аллильное взаимодействие
цисоидное:
Jab ОТ -3,0 до +2,0
трансоидное: Jac от —3,5 до +2,5
В ациклических системах соотношение |ЛЦИсоид| > |Лтрансоид| обычно сохраня-
ется. Величины констант спин-спинового взаимодействия зависят от конфор-
мации. Наибольшие абсолютные величины наблюдаются, если связь С—Н за-
местителей перекрывается с тг-электронами (</> = 0):
V Jab Jac
0° -3,0 -3,5
90° +1,8 +2,2
180° -3,0 -3,5
270° 0,0 0,8
Гомоаллильное взаимодействие
цисоидное:
трансоидное:
|J|ab 0-3
|J|ac 0-3
Аллильные и гомоаллильные взаимодействия с метильными группами часто
сравнимы: 4Лн-с=с-сн3 ~ 5Лсн3-с=с-сн3-
В ациклических системах соотношение |Л|цисоид < |Л|трансоид обычно сохраня-
ется. Большие величины констант спин-спинового взаимодействия обычно на-
блюдаются в циклических системах.
Jab 5-11
Jab
0-7
X : CH, N
R: любой заместитель
X : О, NH
R: любой заместитель
176 5. Спектроскопия ЯМР 1Н
Xumw ядер 1 J в Гц) ческие сдвиги и константы спин-спинового взаимодействия Н в монозамещенных этиленах (<5 в м. д. относительно ТМС, НС На
нь X
Заместитель X На нь нс Jab Jac Jbc Другие
-Н 5,28 5,28 5,28 19,1 11,6 2,5
С -СНз 5,73 4,97 4,88 16,8 10,0 2,1 СН3 1,72
-СН2СН=СН2 5,71 4,95 4,92 16,9 10,3 2,2 СН2 2,72
—СН2—фенил 5,89 5,01 5,00 17,0 10,0 1,9 СН2 3,19
—циклопропил 5,32 5,04 4,84 17,1 10,4 1,8
—циклогексил 5,79 4,95 4,88 17,6 10,5 1,9
-ch2f 5,89 5,24 5,12 17,2 10,6 1,5 СН2 4,69
- CF3 5,90 5,85 5,56 17,5 ИД 0,2
-СН2С1 5,93 5,30 5,17 16,9 10,1 1,3 СН2 3,91
—СН2Вг 5,99 5,29 5,11 16,8 10,0 1,2 СН2 3,87
-СН21 6,04 5,23 5,95 16,5 9,7 1,3 СН2 3,82
-СН2ОН 5,98 5,26 5,12 17,4 10,5 1,7 СН2 4,12
-ch2nh2 5,97 5,15 5,04 17,3 10,4 1,7 СН2 3,29
-ch2no2 6,11 5,46 5,49 16,7 10,7 0,8 СН2 4,93
-сн=с=сн2 6,31 5,19 4,99 17,2 10,1 1,6
—С=С—СН3 5,62 5,39 5,24 17,0 ИД 2,3
—фенил 6,72 5,72 5,20 17,9 11,1 1.0
—2-нафтил 6,87 5,86 5,32
—2-Л4-КСИЛИЛ 6,65 5,22 5,48 17,9 11,4 2,1 СНз 2,27
—2-нитрофенил 7,19 5,68 5,45 17,4 10,7 1,1
—3-нитрофенил 6,74 5,86 5,42 17,5 10,9 0,4
—4-нитрофенил 6,77 5,90 5,48 17,4 10,9 0,8
—2-пиридил 6,84 6,22 5,45 18,5 11,3 1,4
—4-пиридил 6,61 5,91 5,42 17,6 10,8 0,7
Н —F 6,17 4,37 4,03 12,8 4,7 -3,2
а -С1 6,26 5,48 5,39 14,5 7,5 -1,4
1 -Вг 6,44 5,84 5,97 14,9 7,1 -1,9
-I 6,53 6,57 6,23 15,9 7,8 -1,5
О -он 6,45 4,18 3,82
- ОСН3 6,44 4,03 3,88 14,1 7,0 -2,0 СНз 3,16
-ОСН2СН3 6,46 4,17 3,96 14,4 6,9 -1,9
-осн=сн2 6,49 4,52 4,21 14,0 6,4 -1,8
—О—фенил 6,64 4,74 4,40 13,7 6,1 -1,6
-осно 7,33 4,96 4,66 13,9 6,4 -1,7 СНО 8,07
-ОСОСНз 7,28 4,88 4,56 14,1 6,3 -1,6 СН3 2,13
-ососн=сн2 7,39 4,96 4,62 14,2 6,4 -1,6
—ОСО—фенил 7,52 5,04 4,67 13,8 6,3 -1,7
-ОРО(ОСН2СН3)2 6,58 4,91 4,59 13,8 6,0 -2,1
5.2. Алкены 177
Заместитель X Ha Hb Hc Jab Jac Jbc Другие
N -NH2 «6,05 «4,04 «3,99
-N+(CH3)3Br- 6,50 5,76 5,54 15,1 8,2 -4,3
—NHCOCH3 «7,33 «4,53 «4,68
-no2 7,12 6,55 5,87 14,6 7,0 1,4
-CN 5,73 6,20 6,07 17,9 11,8 0 9
-NC 5,90 5,58 5,35 15,6 8,6 -0,5
—NCO 6,12 5,01 4,77 15,2 7,6 -o,i
S -SCH3 6,35 4,84 5,08 16,4 10,3 -0,3 CH3 2,12
—S—фенил 6,53 5,32 5,32 16,7 9,6 -0,2
-S(O)CH3 6,77 6,08 5,92 16,7 9,8 -0,6 CH3 2,61
-SO2CH3 6,76 6,43 6,14 16,5 10,0 -0,5 CH3 2,96
-SO2CH=CH2 6,67 6,41 6,17 16,4 10,0 -0,6
-SO2OH 6,73 6,41 6,13 16,8 10,2 -1,2
-SO2OCH3 6,57 6,43 6,22 16,9 10,1 -0,6 CH3 3,85
-SO2NH2 6,93 6,17 5,98 16,3 10,0 0,0 NH2 6,7
—SO2NH— фенил 6,56 6,18 5,86 16,7 10,1 -0,3 NH 9,07
- sf5 6,63 5,96 5,64 16,6 9,8 0,4
-SCN 6,19 5,66 5,70
О -сно 6,26 6,11 6,26 17,4 10,0 1,0 CHO 9,51
II - СОСНз 6,30 6,27 5,90 18,7 10,7 1,3 CH3 2,25
с -сосн=сн2 6,67 6,28 5,82 17,9 11,0 1,4
/\ —СО—фенил 7,20 6,52 5,81 17,7 9,9 2,3
-СООН 6,15 6,53 5,95 17,2 10,5 1,8 COOH 12,08
-СООСНз 6,14 6,40 5,83 17,4 10,6 1,5 CH3 3,76
-conh2 6,48 6,17 5,71 17,3 7,9 5,0 NH2 7,55
-CON(CH3)2 6,64 6,12 5,55 17,0 9,8 3,4
-COF 6,14 6,60 6,25 17,3 10,7 0,8
-COCI 6,35 6,63 6,16 17,4 10,6 0,2
P -P(CH3)2 6,23 5,39 5,51 18,3 11,8 2,0 CH3 0,95
-P(CH=CH2)2 6,16 5,59 5,64 18,4 11,8 2,0
-PC12 7,48 6,64 6,68 18,6 11,7 0,4
—РО(фенил)2 6,72 6,25 6,21 18,9 12,9 1,8
-PSC12 6,42 6,13 5,90 17,5 11,0 0,3
-PS(CH3)2 6,60 6,26 6,14 17,9 11,8 1,8
—Р8(фенил)2 6,82 6,34 6,17 17,9 11,7 1,6
-Li 23,9 19,3 7,1
-MgCl 6,68 5,57 6,20 23,0 17,6 7,5
—MgBr 6,67 5,51 6,15 23,3 17,7 7,6
-Si(CH3)3 6,11 5,63 5,88 20,2 14,6 3,8 CH3 0,06
-Sn(CH=CH2)3 6,39 5,75 6,21 20,7 13,4 3,1
-Pb(CH=CH2)3 6,70 5,46 6,19 19,8 12,2 2,1
—HgBr 6,45 5,52 5,92 18,7 11,9 3,1
178 5. Спектроскопия ЯМР ХН
Оценка химических сдвигов ядер 1Н в замещенных этиленах
(<5 в м. д. относительно ТМС)
Reis Н
<5с=сн 5,25 Zgem 4- ZcjS 4~ Ztrans
Заместитель R Zgem Zeis Jtrans
—Н 0,00 0,00 0,00
С —алкил 0,45 -0,22 -0,28
—алкильный цикл1 0,69 -0,25 -0,28
—СН2—ароматический заместитель 1,05 -0,29 -0,32
-СН2Х, X: F, С1, Вт 0,70 0,11 -0,04
—chf2 0,66 0,32 0,21
- CF3 0,66 0,61 0,32
-СН2О 0,64 -0,01 -0,02
-ch2n 0,58 -0,10 -0,08
-ch2cn 0,69 -0,08 -0,06
-CH2S 0,71 -0,13 -0,22
-CH2CO 0,69 -0,08 -0,06
-c=c 1,00 -0,09 -0,23
—C=C сопряженная2 1,24 0,02 -0,05
-c=c 0,47 0,38 0,12
—ароматический 1,38 0,36 -0,07
—ароматический, фиксированный3 1,60 -0,05
—ароматический, о-замещенный 1,65 0,19 0,09
Н -F 1,54 -0,40 -1,02
а -С1 1,08 0,18 0,13
1 —Вг 1,07 0,45 0,55
-I 1Д4 0,81 0,88
О -ОС (sp3) 1,22 -1,07 -1,21
-ОС (sp2) 1,21 -0,60 -1,00
-ОСО- 2,11 -0,35 -0,64
-ОРО(ОСН2СН3)2 1,33 -0,34 -0,66
N —NR2; R: Н, С (sp3) 0,80 -1,26 -1,21
—NR—; R: С (sp2) 1,17 -0,53 -0,99
-NCO-R 2,08 -0,57 -0,72
—N=N—фенил 2,39 1,11 0,67
—no2 1,87 1,30 0,62
-CN 0,27 0,75 0,55
5.2. Алкены 179
Заместитель R Zgem Z cis ^trans
s -s- 1,11 -0,29 -0,13
—so— 1,27 0,67 0,41
-so2- 1,55 1,16 0,93
-SCO— 1,41 0,06
-SCN 0,94 0,45 0,41
-sf5 1,68 0,61 0,49
о -CHO 1,02 0,95 1,17
II -co- 1,10 1,12 0,87
C —CO—сопряженная2 1,06 0,91 0,74
/\ -COOH 0,97 1,41 0,71
—COOH сопряженная2 0,80 0,98 0,32
-COOR 0,80 1,18 0,55
—COOR сопряженная2 0,78 1,01 0,46
-CON 1,37 0,98 0,46
-COCI 1,11 1,46 1,01
-PO(OCH2CH3)2 0,66 0,88 0,67
1) Инкремент для “алкильного цикла” следует использовать в том случае, если заме-
ститель и двойная связь являются частью циклической структуры.
2) Инкремент “сопряженная” следует использовать в том случае, если или двойная
связь, или заместитель сопряжены с другими заместителями.
3) Инкремент “ароматический, фиксированный” следует использовать в том случае,
если двойная связь, сопряженная с ароматическим кольцом, является частью кон-
денсированной ароматической системы (как в 1,2-дигидронафталине).
Химические сдвиги ядер 1Н в замещенных изобутенах (<5 в м. д. от-
носительно ТМС)
1,70 CH3 4,63 H 1,68 CH3 5,13 H 1,80 CH3 5,17 H
CH3 H CH3 1,62 CH3 1,88 V
1,75 5,78 1,65 6,79 1,91 5,63
CH3 H CH3 H CH3 H
>—-< У <
CH3 Br CH3 OCOCH3 CH3 CHO
1,75 1,65 2,11
1,86 5,97 1,84 5,62 1,97 6,01
H CH3 H CH3 H
СЩ )—* >=<
CH3 Xcoch3 CH3 COOCH3 CH3 COCI
2,06 2,12 2,12
180 5. Спектроскопия ЯМР 1Н
Химические сдвиги ядер 1Н в енолах (6 в м. д. относительно ТМС,
J в Гц)
=16
„н
О О
Jab 9,7
Jbc ~8
5.2.2 Диены
[l Jab 5,1
7,90 Hg у^СНз 2,11
Hb
5,60
Химические сдвиги и константы спин-спинового взаимодействия
ядер 1Н в сопряженных диенах (6 в м. д. о тносительно ТМС, J в Гц)
5,06 6,27 3 т ^ab 10,2 4,86 6,21 5,61 3Jab 10,2 5Jbf 0,7
Ь н я н f 3Jac 17,1 b Ha Hf 3Jac 16,9 4Jcd -0,8
н -н 3jad -LI А 10,4 :h3 3jad 10,3 5T П 4 i 71 Jae ’ 4Jaf -0,8 6Jce -0,7
Нс Hd е 4т Jae 4т ^af -0,9 -0,8 Hc Hd 5Jcf 0,7 4Jde -1,6
5,16 2 т •^Ьс 1,8 4,98 5,98 2Jbc 1,9 3Jdf 15,1
5Jbe 1,3 4Jbd -0,8 3Jef 6,6
5Jbf 0,6 6Jbe -0,7
5jcf 0,7
6,59 1,72 3Jab 10,2 2 Jbc 2,1 5Jce 0,7
Ь Та СН3 f 3Jac 16,9 4Jbd -0,8 6Jcf -0,6
5,03 Н, 3Jad 10,9 5Jbe -0,7 3Jde 10,8
н_ н Х1е 5,45 d 4Jae 5jaf -1,1 0,2 6Jbf 0,7 4Jcd -0,8 4Jdf -1,8 3Jef 7,0
5,11 5,92
Химические сдвиги и константы спин-спинового взаимодействия
ядер 1Н в алленах (<5 в м. д. относительно ТМС, J в Гц)
4,67 2Jab -9 4,89 1,56 5 t Jab 3,2
H TT \ / a 4 Jac “6 Hb zCH3a 6Jac 0
£=C=C C \ xc=c= C 3Jad 6,8
йс H. C D CH3 4 4Jbd -6,4
5.3. Алкины 181
5.3 Алкины
5.3.1 Химические сдвиги и константы спин-спинового
взаимодействия
Химические сдвиги и константы спин-спинового взаимодействия
для ядер 1Н в алкинах (6 в м. д. относительно ТМС, J в Гц)
1,80 1,80 1,80
Н ~ Н Н ZH—СН3 4Jh,ch3 2,9
1,91 2,15 1,12 4Jab 2,6
Н 2^- а - СН2-СН3 Ь с 5 Jac 0
3Jbc 7,4
1,15
2,59 уСН3
= СИ
хсн3
1,74
СНз СНз l5J|ab 2,7
а b
1,77 2,13 1,11
сн3 —-сн2-сн3
а b
|Чь 2,5
5,34 4Jab 2,0
2,93 НЬ / 5,99 5 Jac 1,0
Н а у-нс 6Jad 3Jbc 0,6 10,5
CH3d 4jbd 1,6
1,85 3Jcd 6,5
2,93 7,42 7,23 5Jab 0,28
d7 24 6T -0,11
11 —— a 7Jad 0,22
Ь с
1,7-2,4
Н—7^----R
2,7-3,4
Н-—
1,3
Н——-—О —алкил
2,1-3,3 О
алкил
182 5. Спектроскопия ЯМР ХН
5.4 Алициклические соединения
Химические сдвиги и константы спин-спинового взаимодействия
для ядер 1Н в насыщенных алициклических углеводородах (<5 в м. д.
относительно ТМС, J в Гц)
0,20 в производных:
2 j •'gem -4,3 •Igem от -3 до -9
3J . •'CIS 9,0 3J • •'cis от 6 до 12
3 T •'trans 5,6 3 T •'trans Всегда: от 2 до 9
Jcis > Jfrans
В производных:
2т
•'gem
3J
•'cis
3 т
и trans
1,94
В производных:
2Т ugem от -10 до -17
3J • ^cis от 4 до 12
Зт и trans от 2 до 10
4 J . ucis =0
4 т J trans «-1
1,51
от -8 до -18
от 5 до 10
от 5 до 10
01 44 В производных:
•Igem ОТ -11 ДО -14
•lax,ах от 8 до 13
При -100 °C Зт „„й
^eq,ax ОТ 2 ДО 6
Нах 1Д 3Jeq,eq ОТ 2 ДО 5
Heq 1,6 Обычно:
a o,92
В производных:
3Jab от 1,5 до 2,0
3Jbc от 0,5 до 1,5
•leq.ax я Jeq,eq 4" 1
с ь 5,95 2Jgem -13,7
d — a 2,57 3jab 1>0
4Jac -0,3
•lad,cis 1,8
•lad,trans 4,6
3Jbc 2,8
d c 5,66 e/ \ b 2,27 2j •'gem,a •lab,cis -12,8 9,3 4Jbd *1 be,cis -2,3 2,1 d c 6>43 4 b 6,28 3Jab 4Jac 1,3 -1,5
X,.-' a 3 T u ab,trans 5,7 •1 be, trans 3,0 a 3Jbc 5,0
1,79 2 т Jgem,b -16,1 3Jcd 5,8 2,80 4Jbd 1,1
3Jbc 2,3 5Jbe 2,0
3Jcd 1,9
6,53 3jab 54 4jbc -°’2 А u
е<\)Ь 6,22 5Jac 0,5 4Jbd -0,4 ХХЬо.бЭ 3^ я10
Y 5Jad 1,4 4Jbe 2,0 \^с1,96 3Jbc 1,5
Hd Нс 5>85 Ъае 113 2jcd 04 d
3Jaf 2,0 1,65
5.4. Алициклические соединения 183
а 5,67 3Jab 9 7
2,08 Ь 5,79 4jac 1,0
C 5Jad 1Д
d 3jbc 5,1
3Jab =10
Jbc 3,7
!Jab 11,2 5Jcg -0,6
Jac 0,8 3Jde 6,7
!Jbc 5,5 4Jdf 0
!Jcd 8,9 5jdg 0
Jcf 0 2 т J gem,e -13,0
b 5,56
c 2,11
dl,5
1,5
3Jab «10
3Jbc 5,3
a b
ОС 5,79
d 5,59
1,47 f e 2,14
3Jab 11,3
4Jac -0,6
5Jad 0,5
3Jbc 4,1
1,44
J 1,4 1,2 4j4,6n -0,5
Jl,5n -0,3 4J4,6x 0,7
Jl,5x 0,2 3J4,7a 2,1
! т Jl,6n 0,1 3j4,7s 1,6
Jf,6x 4,7 2 -г J5n,5x -12,8
ljl,7a 1,2 3 T J5n,6n 9,1
!j1,7s 1,6 3 T J5n,6x 4,7
J3n,3x -17,6 4 т J5n,7a -o,i
!j3n,4 0 4 t J5n,7s 2Д
lj3n,7a 4,2 3 T J5x,6n 4,6
lj3n,7a 4,2 3j5x,6x 12,1
!j3x,4 4,8 2j6n,6x -12,3
lJ3x,5x 2,3 4j6n,7a -o,i
5 T J4,5n 0,1 4j6n,7s 2,3
J4,5x 4,3 2j7a,7s -10,2
184 5. Спектроскопия ЯМР ГН
В конденсированных алициклических соединениях часто наблюдается спин-
спиновое взаимодействие через четыре или более связей. Такие дальние взаи-
модействия особенно велики при w-образном расположении связей между дву-
мя взаимодействующими протонами.
4 Jac » 7
4Jad> 4Jbd e О
Сигнал метильной группы уширен
из-за дальнего взаимодействия
Химические сдвиги и константы спин-спинового взаимодействия
для ядер ‘Не монозамещенных циклопропанах (<5 в м. д. относительно
ТМС, J в Гц)
Заместитель X На Hb,d Нс,е 3Jab 31 '’ас 2Jbc 3Jbd 3Jbe 31 ''се
-Н 0,20 0,20 0,20 9,0 5,6 -4,3 9,0 5,6 9,0
С -сн=сн2 2,36 0,64 0,34 8,2 4,9 -4,5 9,3 6,2 9,0
—фенил 1,71 2,65 2,83 9,5 6,3 -4,5 9,5 5,2 8,9
Н —F 4,32 0,69 0,27 5,9 2,4 -6,7 10,8 7,7 12,0
а -С1 2,55 0,87 0,74 7,0 3,6 -6,0 10,3 7,1 10,6
1 —Вг 2,83 0,96 0,81 7,1 3,8 -6,1 10,2 7,0 10,5
-I 2,31 1,04 0,76 7,5 4,4 -5,9 9,9 6,6 10,0
О -он 3,35 0,59 0,34 6,2 2,9 -5,4 10,3 6,8 10,9
N -NH2 2,23 0,32 0,20 6,6 3,6 -4,3 9,7 6,2 9,9
-CN 1,36 0,94 0,93 8,4 5,1 -4,7 9,2 7,1 9,5
О —СО—циклопропил 1,70 0,56 1,02 7,9 4,6 -3,5 9,1 7,0 9,5
|| -СООН 1,59 0,91 1,05 8,0 4,6 -4,0 9,3 7,1 9,7
С -СООСНз 1,95 0,81 0,85 8,0 4,6 -3,4 8,8 6,9 9,6
/\ -COF 1,66 1,20 1,11 8,0 4,6 -4,5 10,1 7,5 9,3
-СОС1 2,11 1,18 1,28 7,9 4,4 -4,5 9,2 7,6 10,0
-Li -2,53 0,43 -0,12 10,3 9,1 -1,6 7,7 3,2 6,5
—В (циклопропил) 2 -0,25 0,66 0,61 8,9 5,8 -3,3 8,2 5,9 8,4
—Hg—циклопропил 0,00 0,75 0,47 9,6 6,9 -3,7 8,5 4,8 7,9
5.4. Алициклические соединения 185
Химические сдвиги ядер 1Н в монозамещенных циклогексанах
с аксиальным и экваториальным расположением заместителей
(6 в м. д. относительно ТМС)
Заместитель R la 2а 2е За Зе 1е 2а 2е За Зе
—D 1Д2 1,12 1,60 1,12 1,60 1,60 1,12 1,60 1,12 1,60
С -СН3 1,27 0,81 1,57 1,15 1,60 1,93 1,37 1,40 1,39 1,34
—фенил 2,47 2,98
Н -С1 3,63 4,34 1,7
а — Вт 3,81 4,62
1 -I 3,98 4,72
О -ОН 3,38 1,09 1,78 1,19 1,61 3,89 1,35 1,58 1,58 1,33
-ОСОСНз 4,46 4,98 1,47 2,3
N -NH2 2,52 3,15
-NHCH3 2,08 2,70
-NO2 4,23 2,2 1,9 4,43 1,6 2,6
S -SH 2,57 0,7 1,3 3,43 1,5 1,9
186 5. Спектроскопия ЯМР 4Н
5.5 Ароматические углеводороды
Химические сдвиги и константы спин-спинового взаимодействия
для ядер 1Н в ароматических углеводородах (<5 в м.д. относительно
ТМС, J в Гц)
В производных: 7,67 В производных:
3J ^орто 6,5-8,5 h а 3Jab 8-9 5Jae «0,9
41 ^мета 1,0-3,0 ^^1Ь7,32 4 Jac 1-2 6Jaf ' «-0,1
51 Jnapa 0,0-1,0 5Jad «1 5 Jag «0,2
е d 3Jbc 5-7 4Jah ' «—0,5
7Jbf «0,3
6Jbg «0,1
В производных:
3Jab 8,5-9,5
4Jac 0,8-1,5
5Jad 0,6 0,9
5Jae «0,8
3Jbc 6,5-8,0
4Jde «0,4
Ь7,61
3Jab
4Jac
5Jad
3Jbc
4Jbd
3Jcd
В производных:
;9
8,4
1,2
0,7
7,2
1,3
8,1
3Jef'
CH,a2,35 4Jab -0,7 5Jbe 0,6 CH3 a 3,73 5Jab «0,8 4Jbf 2,7
5Jac 0,3 4Jbf 2,0 1 o 3Jbc 8,3 3Jcd 7,4
'%b7,06 6Jad -0,6 3Jcd 7,5 4Jbd 1,0 4Jce 1,8
^C7,14 3Jbc 7,7 4Jce 1,5 f [|^lb 6,77 5Jbe 0,4
d 7,04 4Jbd 1,3 7,15
d 6,82
В обычных спектрах слабые дальние спин-спиновые взаимодействия между
ароматическими протонами и алифатическими заместителями не разреша-
ются. Тем не менее вызываемое ими уширение линий легко обнаруживается
(если в спектре имеется сигнал для сравнения, например, от другой метиль-
ной группы или от ароматических протонов в спиновой системе АА'ХХ') и
помогает при отнесении сигналов. Для подтверждения отнесения можно ис-
пользовать эксперимент с подавлением спин-спинового взаимодействия (суже-
ние линий при слабом облучении на частоте взаимодействующего протона) или
эксперимент COSY.
5.5. Ароматические углеводороды 187
СН3 1,21
СН2 2,63
А7*12
7,20
7,09
СНз /СН3 1,25
СН 2,89
7,13
7,18
7,08
fH3 1,32
СНз- С- СНз
7,28
7,18
7,05
3Jab
4Jac
5Jad
3Jbc
5,8
2,0
0,7
2,0
7,01 2,85
d 7,46
4Jab 1,5
5Jac 0
6Jad 0,5
3Jbc 6,7
%d 1,2
3Jcd 8,1
d 7,79
4Jab 0
5 Jac 0
6Jad 0
3Jbc 7
4Jbd 0,6
3Jcd 8
188 5. Спектроскопия ЯМР ХН
Влияние заместителей на химические сдвиги ядер 1Н в монозаме-
щенных бензолах (<5 в м. д. относительно ТМС)
3 2
<5Hi = 7,26 + Z,
Заместитель X z2 z3 z4
-н 0,00 0,00 0,00
С -СНз -0,20 -0,12 -0,21
- СН2СН3 -0,14 -0,05 -0,18
- СН(СН3)2 -0,13 -0,08 -0,18
- С(СН3)з 0,03 -0,08 -0,20
- CF3 0,19 -0,07 0,00
-СС13 0,55 -0,07 -0,09
-СН2ОН -0,07 -0,07 -0,07
-сн=сн2 0,04 -0,05 -0,12
—СН=СН— фенил (транс) 0,16 0,00 -0,15
-с=сн 0,16 -0,03 -0,02
—С=С—фенил 0,20 -0,04 -0,07
—фенил 0,22 0,06 -0,04
—2-пиридил 0,73 0,09 0,02
Н —F -0,29 -0,02 -0,23
а -С1 0,01 -0,06 -0,12
1 —Вг 0,17 -0,11 -0,06
-I 0,38 -0,23 -0,01
О -он -0,53 -0,17 -0,44
- ОСН3 -0,49 -0,11 -0,44
-ОСН2СН=СН2 -0,45 -0,13 -0,43
—О—фенил -0,34 -0,04 -0,28
-ОСОСНз -0,19 -0,03 -0,19
—ОСО—фенил -0,11 0,07 -0,10
-OSO2CH3 -0,05 0,07 -0,01
N -NH2 -0,80 -0,25 -0,64
—NHCH3 -0,83 -0,22 -0,68
-N(CH3)2 -0,67 -0,18 -0,66
-N+(CH3)3I- 0,72 0,40 0,34
-NHCOCH3 0,38 -0,02 -0,26
-nhnh2 -0,60 -0,08 -0,55
—N=N— фенил 0,67 0,20 0,20
-NO 0,55 0,29 0,35
-no2 0,93 0,26 0,39
-CN 0,25 0,18 0,30
-NCS -0,11 0,04 -0,02
5.5. Ароматические углеводороды 189
Заместитель X z2 z3 z4
S -SH -0,08 -0,16 -0,22
-SCH3 -0,08 -0,10 -0,24
—S—фенил -0,06 -0,20 -0,26
—S—S—фенил 0,24 0,02 -0,06
-SO2CH3 0,68 0,35 0,39
-SO2OCH3 0,68 0,34 0,36
-SO2C1 0,68 0,23 0,34
-SO2NH2 0,59 0,32 0,32
о -сно 0,61 0,25 0,35
II -СОСНз 0,60 0,11 0,19
С -СОСН2СН3 0,63 0,08 0,18
/\ —СО—фенил 0,44 0,10 0,19
—СО— (2-пиридил) 0,86 0,11 0,20
-СООН 0,87 0,21 0,34
-СООСН(СН3)2 0,73 0,11 0,20
—СОО—фенил 0,88 0,15 0,25
-conh2 0,69 0,18 0,25
-COF 0,71 0,21 0,38
-COCI 0,81 0,21 0,37
—COBr 0,77 0,21 0,38
—CH=N—фенил 0,64 0,24 0,24
-Li 0,77 0,26 -0,29
-MgBr 0,40 -0,19 -0,26
—Mg—фенил -0,49 0,18 0,25
-Si(CH3)3 0,19 0,00 0,00
—81(фенил)2С1 0,32 0,07 0,12
—SiCl3 0,52 «0,2 «0,2
—РЬ(фенил)2С1 0,68 0,28 0,11
P —P (фенил) 2 -0,02 -0,33 -0,33
-PO(OCH3)2 0,46 0,14 0,22
—Zn—фенил -0,36 0,02 0,05
—Hg—фенил 0,00 0,00 -0,20
190 5. Спектроскопия ЯМР 1Н
Влияние заместителей в положении 1 на химические сдвиги ядер
1Н в монозамещенных нафталинах (в м. д. относительно ТМС)
8 О 5 X ^Hi, <5н4 1 <5н5 , <^н8: 7,67 <5н2,<5н3,<5н6,<5н7: 7,32
сч со Для X: Н
Заместитель X Н-2 Н-3 Н-4 Н-5 Н-6 Н-7 Н-8
С -СН3 —СН2СН3 -0,22 0,01 -0,13 0,08 -0,16 0,03 -0,03 0,17 -0,03 0,14 -0,01 0,17 0,10 0,38
-СН2С=СН 0,25 -0,07 -0,06 0,00 0,03 0,13 0,69
-СН2С1 0,13 0,01 0,09 0,13 0,14 0,20 0,42
-СРз Н —F 0,67 -0,22 0,15 0,01 0,18 -0,11 0,23 0,13 0,23 0,15* 0,29 0,17* 0,52 0,42
а -С1 0,17 -0,04 -0,02 0,07 0,11 0,16 0,54
1 —Вг 0,38 -0,09 0,03 0,05 0,11 0,19 0,51
-I 0,10 -0,48 0,18 -0,20 -0,07 -0,02 0,27
О -ОН -0,68 -0,15 -0,36 0,01 0,03 0,06 0,41
- ОСН3 -0,68 -0,09 -0,38 -0,01 0,04 0,03 0,50
-ОСОСНз -0,15 0,11 -0,10 0,03 -0,07 0,07 0,16
N -NH2 -0,77 -0,17 -0,51 -0,06 -0,02 -0,01 -0,01
-N(CH3)2 -0,30 0,03 -0,19 0,11 0,13 0,10 0,55
-NHCOCH3 0,40 0,17 0,05 0,26 0,20 0,24 0,44
-no2 0,80 0,14 0,19 0,33 0,21 0,32 0,72
-NCO -0,29 -0,15 -0,19 -0,03 0,05 0,03 0,24
-CN 0,48 0,12 0,30 0,16 0,22 0,29 0,51
О -СНО 0,44 0,10 0,21 0,06 0,14 0,23 1,52
II -СОСНз 0,38 -0,07 0,10 0,01 0,04 0,13 1,08
С -СООН 1,11 0,23 0,42 0,24 0,25 0,34 1,43
/\ -СООСНз 0,80 0,05 0,22 0,08 0,10 0,20 1,30
-СОС1 1Д7 0,17 0,37 0,17 0,21 0,30 1,04
* Отнесение ненадежно.
5.5. Ароматические углеводороды 191
Влияние заместителей в положении 2 на химические сдвиги ядер
1Н в монозамещенных нафталинах (в м. д. относительно ТМС)
Для X: Н
<$Hi, <$н4, <5н5 , <5н8 : 7,67
<5н2,6ц3 > <5н6 > <5н7 : 7,32
Заместитель X H-l Н-3 Н-4 Н-5 Н-6 Н-7 Н-8
С -СН3 -0,21 -0,14 -0,06 0,01 -0,04 -0,01 -0,03
—СН2СН3 -0,05 0,02 0,09 0,12 0,08 0,12 0,10
- СН(СНз)2 -0,07 0,01 0,05 0,07 0,04 0,06 0,07
-сн=сн2 0,06 0,30 0,11 0,11 0,10 0,12 0,11
-СРз 0,45 0,30 0,23 0,25 0,22
—С1 0,13 0,08 0,07 0,12 0,13 0,15 0,05
-Вг 0,23 0,14 -0,09 -0,08 0,05 0,07 0,01
О -он -0,69 -0,35 -0,05 -0,04 -0,11 -0,02 -0,14
- ОСНз -0,70 -0,28 -0,07 -0,03 -0,11 0,00 -0,07
-ОСОСНз -0,19 -0,14 0,01 0,06 -0,04 0,11 0,08
N -NH2 -0,88 -0,56 -0,16 -0,12 -0,23 -0,09 -0,23
-N(CH3)2 -0,90 -0,33 -0,13 -0,12 -0,23 -0,08 -0,16
—NHCOCH3 0,50 0,14 0,07 0,06 0,07 0,10 0,08
-no2 0,98 0,82 0,18 0,18 0,28 0,24 0,26
-CN 0,51 0,25 0,20 0,19 0,31 0,26 0,19
о -CHO 0,62 0,61 0,23 0,21 0,30 0,24 0,29
II -COCH3 0,76 0,69 0,19 0,17 0,25 0,21 0,26
C -COOH 1,00 0,73 0,37 0,36 0,36 0,32 0,48
/\ -СООСНз 0,83 0,66 0,09 0,09 0,15 0,11 0,17
-COCI 1,02 0,74 0,39 0,49 0,32 0,37 0,37
192 5. Спектроскопия ЯМР 2Н
5.6 Гетероароматические соединения
Неконденсированные гетероароматические соединения
5.6.1
Химические сдвиги и константы спин-спинового взаимодействия
для ядер 1Н в гетероароматических соединениях (<5 в м. д.
тельно ТМС, |J| в Гц)
относи-
с Ь6,30 d< >а7,38 О 3J 4jab 4at •J ad 1,8 0,9 1,5 C,—,b6,05 d< /a6,62 N Jab 2,6 Де 1-3 Jad 2,1 C. .b6,96 d\ /a7,20 S 3J 4J .^ac Jad 4,8 1,0 2,8
3J bn 3,4 He8 Jae 2,6 Jbe 3,5
DC (широкий) X 3,5
Jbe 2,3
С.—.Ь7,12 d< >а7,70 3J 4J 4 aC 5,4 1,1 N—л b 7,09 eQ.7.69 ^Jab 0,8 Jac 0,5 4 _ л N^b7,13 eOa>.13 3J 4УЬ зтас 1-2 1-2
Se 3J- T 2,5 3,6 7,95 ° Jbe 0,0 ’•70 Hd IM Jbe ~1
dbc (величины J в производных)
7,98 N-лЬ C^f^a 8,88 S 7,41 3J 4F 3Г Jbc 3,2 1,9 0,0 8,15 6 28 N. >a О 8,39 1’7 Jae 0,3 Jbe 1,8 7,55 6Л>5 cMb KAT?a7,55 N Hd 13,7 3J 43Ь з ac Jbe 2,1 0,0 2,1
(в CS2)
8.56 c, b7,26 3T 4TSb 4,7 O\8’19 /T^7’75
N. >a8,72 3Jac Jbe <0,4 1,7 N4 XN О N4n"n H12
N-N < 8,27 N /у-^8,58 N _N S HN—\b7>6 cOa’.e n z* N ^ae Jad+Jbd 3J 1,4 4,4 2,4
H13,5 8)6 Hd Jcd
~12
(в H2SO4)
5.6. Гетероароматические соединения 193
7J>4 в ДМСО:
<1||^Ь7’25 а 8’59 Зт кп
ДА 8,60 Ь7-38 19
N С 7,75 А
(в CDCL) 4Jad 0,9
Jae 0,4
Jbe 7,6
Jbd 1,6
В произ- водных: 4-6 0-2,5 Ф О- 9,04 С © ,Ь8,50 Ja 9,23 3J Jab А Jad J 6,0 1,6 0,8 1,0
0-2,5 N Н 3 ae Jbe 7,9
0-0,6 7-9 (в CD3CN) 4J Jbd 1,4
0,5-2
7,32 3J 6,5
Л 4J 11
drf^1b7,40 A
П I A 8,8
eU <Ja8,19 4j io
3J“ 1,y
I X 7,7
О X 2,1
(в ацетоне)
b7,55
a9,24
3J
4J
8J
3Jad
T
Jbe
4,9
2,0
3,5
8,4
7,22
3J
4J
b7,83 57е
a8,26 3j
*J
•j
J cd
5,3
J
Ь7,3б4 ab
Д ac
а8,78 4т
a ad
5,0
2,5
0
1,5
8,24 3Jab 6,8
Пь’'34
8,98d< Ja8,43 3Jbc 4,9
N 5
I Л 1-0
о jcd 0
b
a 8,63
c
d
йЬ8,11
a 8,44
JN
I
3J
5*;ab
4J
4Jd
Jbc
4,1
0,8
0,6
0,4
b 9,48
a 8,84
194 5. Спектроскопия ЯМР ХН
Влияние заместителей на химические сдвиги ядер 1Н в монозаме-
щенных фуранах (в м. д. относительно ТМС)
<Ун-2 = 7,38 + Zi,2
<5н-з = 6,30 + Zi,3
<5н-4 = 6,30 + Zi?4
<5н-5 = 7,38 + Zi;5
Заместитель в положении 2 или 5 в положении 3 или 4
^23 Z54 Z24 Z53 Z25 Z52 Z32 Z45 Z34 Z43 Z35 Z42
-Н 0,00 0,00 0,00 0,00 0,00 0,00
С -СН3 -0,42 -0,12 -0,17 -0,27 -0,17 -0,15
-СН2ОН -0,11 -0,05 -0,08
-ch2nh2 -0,24 -0,06 -0,10
-сн=снсно 0,70 0,35 0,42
—Вг -0,02 0,03 -0,01
-I 0,12 -0,13 -0,01 -0,13 0,04 -0,22
О -ОСНз -1,34 -0,23 -0,68 -0,46 -0,28 -0,37
N -NO2 1,21 0,55 0,51
-CN 0,85 0,32 0,28 0,45 0,22 -0,02
S -SCH3 -0,12 -0,06 -0,09 -0,18 -0,05 -0,15
-SCN 0,40 0,06 0,10 0,19 0,19 0,03
О -сно 0,93 0,31 0,34 0,48 0,37 -0,07
|| -СОСНз 0,81 0,23 0,19 0,46 0,36 -0,12
С -СОСРз 1,34 0,50 0,64
/\ -СООН 0,94 0,33 0,41 0,89 0,54 0,36
-СООСНз 0,85 0,22 0,25 0,45 0,33 -0,14
-СОС1 1,20 0,39 0,48
5.6. Гетероароматические соединения 195
Влияние заместителей на химические сдвиги ядер 1Н в монозаме-
щенных пирролах (в м. д. относительно ТМС)
<5н-1 « 8 широкий, зависит от растворителя
<5н-2 = 6,62 + Zii2
< $н-з = 6,05 + Zi,3
< $Н-4 — 6,05 + Zj,4
< 5н-5 = 6,62 + Zi)5
Заместитель в положении 1 Z12 Z15 Z13 Z14
-н 0,00 0,00
-СНз -0,25 -0,13
- СН2СН3 -0,16 -0,12
—СН2—фенил -0,12 -0,04
—фенил 0,33 0,14
- СОСНз 0,56 0,12
—СО—фенил 0,57 0,18
Заместитель в положении 2 или 5 в положении 3 или 4
Z23 Z54 Z24 Z53 Z25 Z52 Z32 Z45 Z34 Z43 Z35 Z42
-Н 0,00 0,00 0,00 0,00 0,00 0,00
С -СН3 -0,33 -0,16 -0,26 -0,34 -0,20 -0,20
N -NO2 1,06 0,24 0,43 1,04 0,70 0,13
-CN 0,83 0,23 0,51
S -SCH3 0,18 0,05 0,10
-SCN 0,48 0,10 0,28
О -сно 0,93 0,27 0,61
|| -СОСНз 0,78 0,10 0,44 0,79 0,63 0,15
С -СООСНз 0,79 0,13 0,29 0,90 0,73 0,16
196 5. Спектроскопия ЯМР ХН
Влияние заместителей на химические сдвиги ядер 1Н в монозаме-
щенных тиофенах (в м. д. относительно ТМС)
<5н-2 — 7,20 + Zj,2
<$н-з = 6,96 + Zi>3
<5н-4 = 6,96 + Zjt4
<^н-5 — 7,20 + Zii5
Заместитель в положении 2 Z23 Z24 Z54 Z53 или 5 Z25 Z52 в положении 3 Z32 Z34 Z45 Z43 или 4 Z35 Z42
—Н 0,00 0,00 0,00 0,00 0,00 0,00
С -СНз -0,36 -0,24 -0,29 -0,45 -0,22 -0,14
-С=СН 0,15 -0,16 -0,12
Н -С1 -0,25 -0,22 -0,22 -0,22 -0,11 -0,03
а —Вг -0,05 -0,27 -0,11 -0,12 -0,08 -0,10
1 -I 0,13 -0,33 0,01 0,06 0,00 -0,19
О -ОН* -0,72 0,59 -3,10
- ОСН3 -0,94 -0,43 -0,82 -1,10 -0,38 -0,20
N -NH2 -0,95 -0,45 -0,85 -1,25 -0,53 -0,25
-no2 0,82 -0,03 0,30 0,95 0,60 0,03
-CN 0,47 0,00 0,28 0,63 0,20 0,15
S -SH 0,00 -0,20 -0,07 -0,22 -0,20 -0,10
-SCH3 -0,03 -0,18 -0,05 -0,33 -0,10 -0,03
-SO2CH3 1,03 0,20 0,79 0,96 0,48 0,46
-SO2C1 0,73 0,06 0,45
-SCN 0,30 -0,05 0,28 0,25 0,05 0,05
о -CHO 0,65 0,10 0,45 0,79 0,45 0,03
II —COCH3 0,57 0,00 0,28 0,68 0,47 -0,02
C -COOH 0,80 0,08 0,40 0,99 0,48 0,24
/\ -COOCH3 0,70 -0,05 0,20 0,78 0,47 -0,05
-COCI 0,88 0,06 0,44 1,05 0,50 0,03
* Присутствует в кетонной форме.
5.6. Гетероароматические соединения 197
Влияние заместителей на химические сдвиги ядер 1Н в монозаме-
щенных пиридинах (в м.д. относительно ТМС; растворитель: ДМСО)
<5н-2 — 8,59 + Zij2
<5н-з = 7,38 +
<5н-4 — 7,75 Т Zj,4
<$н-5 — 7,38 + Zj,5
<$H-6 = 8,59 + Zii6
Заместитель в положении 2 или 6 Z23 ^65 Z24 Zg4 Z25 2бз N N 05 Ю to 05
-н 0,00 0,00 0,00 0,00
С -СНз -0,11 -0,01 -0,16 0,08
-СН2СН3 -0,09 -0,08 -0,15 0,03
—СН2—фенил 0,12 -0,08 -0,20 0,02
-СН2ОН 0,37 0,30 0,02 0,06
-ch2nh2 0,20 0,07 -0,09 0,05
-CH2S-h-C3H7 0,04 -0,08 -0,26 -0,06
—CH2SO2—фенил «0 «-0,3 «0 -0,2
-сн=сн2 0,11 -0,14 -0,11 0,04
—фенил 0,16 -0,28 -0,40 -0,03
—2-пиридил 1,12 -0,09 -0,26 0,00
Н —F -0,10 0,40 0,12 -0,13
а -С1 0,32 0,29 0,29 0,20
1 -Вт 0,41 0,17 0,19 0,02
О -ОН -0,7 0,0 -1,0 -0,9
—0—Н--С4Н9 -0,53 -0,03 -0,49 -0,32
N -NH2 -0,68 -0,31 -0,78 -0,48
-NHCOCH3 0,94 0,16 -0,20 -0,10
-NHCOOCH2CH3 0,59 0,07 -0,24 -0,21
-nhno2 0,34 0,31 -0,03 -0,41
-no2 1,09 0,67 0,74 0,26
-CN 0,88 0,38 0,55 0,39
S -SCH3 -0,09 -0,11 -0,29 -0,11
О -CHO 0,93 0,42 0,50 0,44
II -COCH3 0,82 0,37 0,39 0,28
С —CO—фенил 0,62 0,55 0,32 0,28
/\ -СООН 0,97 0,43 0,48 0,42
-COO-H-C4H9 0,86 0,39 0,35 0,35
-conh2 1,05 0,47 0,43 0,30
-csnh2 1,41 0,37 0,33 0,25
—CH=NOH 0,40 0,28 0,01 0,16
198 5. Спектроскопия ЯМР ХН
Заместитель в положении 3 или 5 в положении 4
Z32 Z34 Z35 Z36 Z42 Z43
Z56 Z54 Z53 Z52 Z46 Z45
-н 0,00 0,00 0,00 0,00 0,00 0,00
С -СНз -0,02 -0,06 -0,09 -0,02 0,01 -0,10
—СН2—фенил 0,00 -0,15
-СН2ОН 0,11 0,15 0,04 -0,04 0,07 0,14
-ch2nh2 0,16 0,13 0,04 0,00 0,01 0,03
-CH2S-h-C3H7 -0,06 -0,13
—CH2SO2—фенил -0,24 -0,15 -0,22 0,01 -0,09 -0,18
-сн=сн2 0,12 0,13
-сн=сн-соон 0,45 0,52 0,34 0,17
Н —F -0,01 0,00 0,14 -0,10 -0,07 -0,03
а -С1 0,20 0,24 0,19 0,09 0,00 0,05
1 —Вг 0,20 0,43 0,34 0,18 0,09 0,35
О -он -0,03 -0,37 0,15 -0,24
- ОСН3 0,02 -0,29
N -NH2 -0,06 -0,49 0,02 -0,36 -0,15 -0,74
—NHCOCH3 0,37 0,50 0,06 -0,16 -0,05 0,31
-CN 0,63 0,72 0,43 0,50 0,46 0,62
S —SCH2—фенил -0,02 0,04
—S—фенил 0,05 -0,16
-SO3H 0,70 1,14 0,81 0,70
О -СНО 0,45 0,42 0,12 0,20 0,47 0,58
|| -СОСНз 0,72 0,68 0,30 0,37 0,40 0,58
С —СО—фенил 0,47 0,54 0,37 0,34 0,36 0,40
/\ -СООСНз 0,62 0,60 0,23 0,34
-COO-H-C4H9 0,34 0,54
-csnh2 0,68 0,67 0,24 0,26 0,35 0,68
—CH=NOH 0,39 0,43 0,19 0,15 0,24 0,37
5.6. Гетероароматические соединения 199
5.6.2 Конденсированные гетероароматические соединения
Химические сдвиги ядер 1Н в конденсированных гетероароматичес-
ких соединениях (<5 в м. д. относительно ТМС, |J| в Гц)
7,49 3Jab 2,5 4Jce 1,2
7,13dr c b 6,66 3 Jac, 6Jad, 6Jae, 5Jaf 0 5Jcf 0,8
| J>a7,52 4 Jbe, 5jbd, ^Jbe: 0 3Jde 7,3
7,19e^ 5Jbf 0,9 4Jdf 0,9
7,42 3Jcd 7,9 3Jef 8,4
7,55 3Jab 3,1 4Jce 1,2
6,99 dr c b6,45 5j dac, ^Jad, 6jae, 3Jaf: 0 5Jcf 0,9
d ya 7,26 Jag 2,5 5Jcg 0,8
7,09 eL t Hg 10,1 4 Jbe, 5Jbd, 6Jbe: 0 3Jde
7,40 5jbf 0,7 4Jdf
4jbg 2,0 3Jef
3Jcd 7,8 6Jdg, 5Jeg, 4Jfg: 0
7,83 3Jab 5,5 4Jce 1,1
A b7,34 7,36d 3 Jac, 6jad, 6Jae, ^Jaf: 0 5Jcf 0,9
I II )>a 7,44 4 Jbe 5jbd, 6jbe: 0 3Jde 7,2
7,34 —s f 'Jbf 0,8 4Jdf 1,0
7,88 3Jcd 8,0 3Jef 8,0
7,77 h 5Jab 0,2 4Jbd 1,0
7,41cr 6Jac "ОД 5 Jbe 0,7
7,41dl> d G a 8,42 6Jad 0,4 5Jae 0,0 3Jcd 4Jce 7,4 1,2
7,67 3Jbc 8,2 3Jde 8,3
7,70
5 Jab, 6Jac, 6Jad, 5Jae: 0
3jbc> 3jde 8,2
4Jbd, 4Jce 1,4
5Jbe 0,7
3Jcd 7Д
200 5. Спектроскопия ЯМР гН
8,08 5Jab 0,1 4Jbd 1,1
b 6Jac -0,2 3Jbe 0,6
7,57c^>r' a 9,26 6Jad 0,4 3Jcd 7,2
7,50dk5;/A "S7 5Jae 0,1 4Jce 1,1
e 8,14 3Jbc 8,2 3Jde 8,2
7,85 7,20cr<?::?4' a 8,20 ""xx 4Jab, 3Jac, 6jad: 0 5Jae 0,8 3Jbe 3Jcd A — 1,0 7,0
N 3Jbc 7,8 T dce 1,2
7,34d^A e H 12,4 4Jbd 1,2 3Jde 7,9
7,60
3Jab 9,3
4 Jac 1,2
5Jad 0,9
3Jbc 6,4
3Jab
4Jac
5Jad
8,3
1,0
0,9
7,96
a
7,52Ьг<:::>'''т^Ч
I
d
3Jab
4Jac
3Jad
3Jbc
9,2
1,0
0,8
~6
7,25
d c 6,28
6,50 e
6,31f
g ® 7,14
7,76
b 6,64
3Jab 2,7 5JCg 1,0
4Jac 1,2 3Jde 9,0
4Jad 0,5 4Jdf 1,0
dae> 3Jaf, 4 5Jag: 0 3Jdg 1,2
3Jbc 3,9 3Jef 6,4
3Jbd> 6Jbe, 5jbg: 0 4jeg 1,0
6Jbf 4Jcd, 0,5 3Jce> 6Jcf: 0 3Jfg 6,8
6,97 d
6,62e
8,39
3Jab 2,2
5Jac 0
6Jad 0,5
6Jae, 3Jaf: 0
4Jbc,3Jbd> ^Ье: 0
5Jbf 0,9
3Jcd 8,9
4Jce 1,2
5Jcf 1,0
3Jde 7,0
4Jdf i,o
3Jef 6,9
5.6. Гетероароматические соединения 201
7,03dp^^4
6,65 eL
7,51
с
Ь7,48
f а 7,48
8,09
4b 1,0 4Jce 1,0
> T 6 T 5т . Fj Jac> dad> dae- u 5 Jcf 1,0
lJaf 0,7 3Jde 6,8
Jbc, Jbd> ^Jbe, 5Jbf- 0 4Jdf 1,2
’jcd 9,3 3Jef 6,9
6,52
3Jab 7,9
4Jac 1,5
5Jad 0,4
3Jbc 7,9
7,63 7,80
c b
7,22 d a 6,45
7,45еЦкоЛо
7,20
3Jab 9,8
3Jcd 8,5
4Jce 2,0
5Jcf 0,0
3Jde 8,6
4Jdf 1,8
3Jef 8,5
Ь6,34
a 7,88
7,47
3Jab 6,1
3Jcd 8,0
4Jce 1,8
5Jcf 0,5
3Jde 7,0
4Jdf 1,1
3Jef 8,4
7,19
6,42
3Jab 7,8
4Jac 1,3
5Jad 1Д
3Jbc 7,1
7,68
d
7,43©^^
7,61
g
8,05
8,00
c
^4 b 7,26
-N^a8,81
3Jab 4,3
4c 1,8
3Jbc 8,3
5Jcg 0,8
3Jde 8,2
4Jdf 1,6
5Jdg 0,5
3Jef 6,8
4Jeg 1,1
3Jfg 8,2
202 5. Спектроскопия ЯМР 4Н
7,74 3Jab 6,0
d c 4Jac 1,1
;O 9 8,75 ""^b7,27 -N-^a8,57 I О 3Jbe 8,5
7,71 7,50
d с
7,57er^>><^4 Ь 8,45
7,50ff
9 а
7,87 9,15
4Jab 0,8
5Jac 0
5Jad <0,5
3Jbc 6,0
5Jcg 0,8
3Jde 8,7
4Jdf 1Д
5Jdg 0,9
3Jef 7,0
4Jeg 1,3
3Jfg 8,2
8,77
4Jab 1,7
Jbe 7,0
!Jab 5,7 3Jde 6,9
’Jbf 0,8 4jdf 1,3
!Jcd 7,8 3Jef 8,6
^Jce 1,5
’Jef 0,8
4Jab 0 3Jde 6,9
5Jbf 0,5 4 5Jdf 1,2
3Jcd 7,9 3Jef 8,5
4Jce 1,2
5Jcf 0,8
3Jab 1,8
3Jcd 8,4
4Jce 1,6
5Jcf 0,6
3Jde 6,9
5.6. Гетероароматические соединения 203
Чс 0,4
3Jcd 8,2
4Jce 1,2
5Jrf 0,6
3Jde 6,8
d 7,84
с 7,23
Ь7,35
а 7,48
3Jab 8,5
4Jac 0,9
5Jad 0,6
3Jbc 7,3
4Jbd 1,3
3Jcd 7,6
е 8,08
d 7,16
с 7,36
Н Ь7,49
а ю,3
Jae 0,7
3Jbc 8,2
4Jbd 0,9
5Jbe 0,7
3Jcd 7,2
4Jce 1,2
3Jde 7,8
9,09
d8,19
с 7,64
Ь7,89
а 8,22
3Jab 9,0
4Jac 1,2
5Jad 0,6
5Jae 0,9
3Jbc 6,6
4Jbd 1,4
3Jcd 8,2
4Jde 0,4
а 7,50
3Jab 8,4
4Jac 1,1
5Jad 0,5
3Jbc 7,1
4Jbd 1,8
3Jcd 8,0
О
N
Н
ап,70
е8,27
d7,27
С7,74
Ь7,57
Че 0,4
3Jbc 8,6
4Jbd 1,0
5Jbe 0,4
3Jcd 7,0
4Jce 1,4
3Jde 8,2
204 5. Спектроскопия ЯМР ХН
5.7 Галогенсодержащие соединения
5.7.1 Фторсодержащие соединения
Природный фтор на 100% состоит из ядер 19F, для которых спиновое квантовое
число I = 1/2. Сигналы ядер 'Н расщепляются взаимодействием с ядрами 19F
на расстоянии до четырех связей.
Химические сдвиги и константы спин-спинового взаимодействия
для ядер 1Н во фторсодермсагцих соединениях (<5 в м. д. относительно
ТМС, J в Гц)
4,10
CH3F 2Jhf 46,4
5,45
CH2F2 2Jhf 50,2
6,25
CHF3 2JHP 79,2
Hal
2JaF 46,4
\^F 3JbF 25,2
a Хь 6,9
1-7 Ь'Х'^ Та 6,1 Хк 57,3 JbF 20,9
F Хь 4,5
4,37 H b F 2JaF 84,7 3Jab 12,8
Ж X 20,1 X 4,7
4,03 H H-6,17 3JcF 52,4 2Jbc -3,2
V» о
1.57 3JHF 15,0
H — F
0,69
0.27 Hb
J
Hi
e Hd
Ha
4,32
X 64,5 3Jab 5,9
3JbF 9,9 3Jac 2,4
X 21,0 2Jbc -6,7
3Jbd 10,8
Xe 7,7
X 12,0
7,03
3JaF 8,9 3Jab 8,4
4 4
4JbF 5,7 4Jac 1,1
X 0,2 sJad 0,4
4c 2,7
X 7,5
Xa 1.8
4JaF -0,8 3Jab 7,9
sJbF 0,8 4Jac 1,2
XF -0,7 sJad 0,6
X 2’°
X 7,6
Xa 1-3
CH3 Взаимодейст-
1 вия с CH3:
4-F X 2,5
X 0,0
X !>5
X 2,2
5.7. Галогенсодержащие соединения 205
5.7.2 Хлорсодержащие соединения
Химические сдвиги и константы спин-спинового
для ядер 1Н в
ТМС, J в Гц)
хлорсодермсащих соединениях (<5 в
взаимодействия
м. д. относительно
3,06 5,33
СН3С1 СН2С12
7,24
СНС13
1,33
з
3,47
2,07
Ч-ci
I 5,89
С1
3J 6,1
3,67
Л. /С1
3J 6,8
1,81
1,06 3,47
0,92 1,68
1,41 3,42
3J 6,4
5.48 H^C1
5,39 Hc 1^6,26
Чь 14,5
4c 7,5
4c -1.4
Hal
1,78
Н Cl
0.87 3Jab 7,0
0.74Н >С1 ’J" W
e J„ -6.0
'Ha 2,55 3Jbd 10,3
e Че 7,1
Че Ю.6
X
ег|4а 7,27
d7,20
c
7,14
Чь 8,1
Че 1.1
Ча 0,5
/ae 2,3
Jbe 7,5
4a 1,7
CC1.
7,17
a7,81
b7,19
3J
4ab
"ac
5 J
4J
"ac
4c
4a
8,1
1,1
0,5
2,4
7,5
1,4
206 5. Спектроскопия ЯМР ХН
5.7.3 Бромсодержащие соединения
Химические сдвиги и константы спин-спинового взаимодействия
для ядер 1Н в бромсодержащих соединениях (<5 в м. д. относительно
ТМС, J в Гц)
Hal
2,69 4,94 6,82
CH3Br CH2Br2 CHBr3
2,47 „
ВГ 3J 6,4
5,86
Вг
1,06
1,89 „
\/Вг
3,35
3,37
5,1
5,97НС 1^6,44
X 14,9
X 7,1
X -1,9
2,33
И — -Br
г
°,96 3jab 7,1
H J” Br X 3,8
с [V Jbc -6,1
Ha 2,83 3Jbd 10,2
e Hd X 7,0
X 10,5
vac »
X 0,5
X 2,2
X 7,4
X 1,8
5.7. Галогенсодержащие соединения 207
5.7.4 Иодсодержащие соединения
Химические сдвиги и константы спин-спинового взаимодействия
для ядер 1Н в иодсодержащих соединениях (<5 в м. д. относительно ТМС,
J в Гц)
2,16 3,90 4,91
CH3I CH2I2 CHI3
1,88
\ Л
3,16
I
3J 7,0
1,88
Л
1,03 3,16
0,93 1,80
I
1,42 3,20
1,95
6,57 Hk I 4b 15,9
) ( 3Jae 7,8
6,23HC Ha X -1,5
6,53
2,06
И - = I
Hal
1,04 Bb 3J dab 3J 7,5 4,4
0,76 H* < Л vac 2 •
c Jbc -5,9
H1 < на2,31 3J Jbd 9,9
e Hd 3J 6,6
J **ce 10,0
а 7,64
Ь7,03
7,25
3J
Jab
4ad
**ac
3J
Vе
Jbd
7,9
1,1
0,5
1,9
7,5
1,8
208 5. Спектроскопия ЯМР ХН
5.8 Спирты, простые эфиры
и родственные соединения
5.8.1 Спирты
Химические сдвиги и константы спин-спинового взаимодействия
для ядер 1Н в спиртах (ё в м. д. относительно ТМС, J в Гц)
Алифатические и алициклические спирты:
Фенолы:
0,5-3,0 (в ДМСО: 4-6)
4,0-8,0 (в ДМСО: 8-12)
Водородные связи сильно дезэкранируют протоны гидроксильных групп. По-
ложение сигнала может сильно зависеть от условий эксперимента. Если со-
единение содержит несколько типов гидроксильных протонов (—ОН, —СООН,
НгО), то из-за быстрого обмена обычно наблюдается только один сигнал в
среднем положении. В диметилсульфоксиде (ДМСО) в качестве растворителя
этот обмен, как правило, происходит так медленно, что наблюдаются изолиро-
ванные сигналы. В этом случае химические сдвиги гидроксильных протонов
характеристичны. Если проба содержит сильные кислоты или амины в каче-
стве оснований, то скорость обмена увеличивается и в ДМСО, что в усредняет
положение сигнала. Промежуточная скорость обмена часто приводит к очень
широким сигналам, распространяющимся на несколько м. д., в рутинных спек-
трах иногда сигнал становится неразличимым.
В результате быстрого межмолекулярного обмена гидроксильных прото-
нов их спин-спиновое взаимодействие с протонами на соседних атомах углерода
обычно не наблюдается. В очень чистых (свободных от кислот) растворах или в
ДМСО обмен замедляется, и можно наблюдать взаимодействия Н—О—С—Н. Их
зависимость от конформации аналогична той, что показывает взаимодействие
Н—С—С—Н (разд. 5.1). В случае быстрого вращения 3Jhoch ~ 5 Гц. В цикло-
гексанолах константы вицинального взаимодействия для аксиальных гидрок-
сильных протонов (3,0-4,2 Гц) ниже, чем для для экваториальных (4,2-5,7 Гц).
3,39 3,9 в ДМСО:
СН3ОНа 3Jab 5,2
(в CDC13)
ig 2,61 жидкость: в ДМСО:
c\zOHa ба 5,27 8а 4,5
3 59 8ь 3’66
8С 1,19
(в CDC13) 3j 4,8
ч ab ’
6,9
1,53 2-26
/х^ОН
0,93 3,49
(в CDC13)
5.8. Спирты, простые эфиры и родственные соединения 209
1,16 2,16
Ь\-ОН
а| 3,94
(в CDC13)
Чь 6,2
жидкость:
8а 4,07
8Ь1,23
1 22 2,01
ОН
(в СВС13)
(в ДМСО)
(в ДМСО)
С1
С1
ОН 2,96
4,15
(в CDC13)
8ОН в ДМСО: 6,8
6,4
С-ОН
(в ДМСО)
0,59
0,34 Нь
Н4 ЮН
Н< на
е Hd 3,35
3J
Jab
3J
*^ac
2J
3 bc
I
3 bd
T
3 be
J
*^ce
6,2
2,9
-5,4
10,3
6,8
10,9
1,88
ЦС Jib2,20
1,63 I»V7)H
1,41 Hd/г H_4,12
Hg'Hf
Чь 7,0
Че 8,1
4d 0
Че -1.1
Че ’И.»
4d 7,9
Че 2,3
Ч£ 5,2
Ча Ю.4
Че 9,7
4f -0,9
4g 0
Че -11,0
1,45
1,90 ОН
Н Г 3,73
Для производных
в ДМСО: 1,36 _
X 4 о л 5
°он | ' | 1,67
Ч,он 4,2-5,7 1,46 Н \ Н 1,42
1,17
Для производных
в ДМСО:
8ОН 3,8-42
Ч,он 3,042
ОН «5*
аб.73
Ь7,09
6,82
(в СС14)
’з«.
т
Jad
Че
Че
4d
8,2
1,1
0,5
2,7
7,4
1,7
(в ДМСО)
* в ДМСО: 8ОН 9,3
210 5. Спектроскопия ЯМР 1Н
Химические сдвиги для ядер 1Н в енолах (6 в м. д. относительно ТМС,
J в Гц)
(в CDC13, частично
енолизованная форма)
5.8.2 Простые эфиры
Химические сдвиги и константы спин-спинового взаимодействия
для ядер 1Н в простых эфирах (6 в м. д. относительно ТМС, J в Гц)
9
Jgem -10,6
Q 47
\ь7,0
1,15
3,40 1,38
alk^
1,54 0,92
3,16 >6’44
а\АЛ3-88
1^4,03
(в ТМС)
Чъ 0-3
X 7,0
3Jbd 14,1
2Jcd -2,0
Не6,46
3)74 1 Н Ч Qfi
а^о"АН*»3’96
1>27 Не4,17
Зт
фс
з cd
J
се
2Т
Jde
7,0
0,4
6,9
14,4
-1,9
Химические сдвиги и константы спин-спинового взаимодействия
для ядер 1Н в циклических простых эфирах (<5 в м.д. относительно
ТМС, J в Гц)
2,54
В производных:
А 5’6
Jeis 4’5
Зт Qi
‘’trans "i1
Всегда:
2,78 Н,*А'СНз I-4?
3,07 H^Tib3,34
3J
з ab
Т
з Ьс
Т
2М
Jed
5,2
4,2
3,3
4,2
5.8. Спирты, простые эфиры и родственные соединения 211
а 4,73
Ь 2,72
2т
’'a.gem
2J
b.gem
3J
*^cis
3J
v trans
Uc
-5,8
-11,0
8,7
6,6
<0,3
1,59
3,65
1,59
03,67
2,87
N
H 1,92
3,88
2,57
б.гга^Ча^го ЛаЬ-'18 J’3 d/°>a4,63 ’ M 4-“‘“ Л ^=45,89 4“ ** J. 2,5 J ad,cis 4,82 2,53 4. о K 4J 4 6 J. , 2,6 Jad,trans ba 7 2 3Jcd 2,6 3Jbc 6,3
0
a 6,34
b4,64
3,96e
1,85<*
3J
Jab
4J
Jac
X
Xd
6,2
2,0
3,8
0,6
3J
Jab
4Jae
X
X
7,0
1,7
1,5
3,4
3J
Jab
4J
Jac
5 J
Jad
Xd
Xd
5,0
2,4
1,2
6,3
1,5
9,4
X 6,0
X 0.3
4Jad 2,7
4Jbc 1.1
212 5. Спектроскопия ЯМР ХН
Химические сдвиги и константы спин-спинового взаимодействия
для ядер 1Н в ароматических простых эфирах (<5 в м. д. относительно
ТМС, J в Гц)
/аь «0,8
X 8,3
X i.o
Jbe 0,4
X 2,7
X 7,4
Jee 1,8
6,98
Химические сдвиги и константы спин-спинового взаимодействия
для ядер 1Н в ацеталях, кеталях и ортоэфирах (6 в м. д. относительно
ТМС, J в Гц)
Ь а 3,9
2т _7 5
^a.gem *’°
X.eis 7,3
X, trans 6,0
6,81
5.9. Азотсодержащие соединения 213
5.9 Азотсодержащие соединения
5.9.1 Амины
Аминные и аммониевые протоны (S в м. д. относительно ТМС, |J| в Гц)
Химические сдвиги протонов аминогруппы в зависимости от растворителя,
концентрации и образования водородной связи находятся в интервале от 0,5 до
5м.д. Сигналы аммониевых протонов появляются в интервале от 6 до 9 м.д.:
alk—NH2 1
(alk)2—NH J
0,5-4,0
alk-NHj
(alk)2-NHj >
(alk)3-NH+
6-9
Спин-спиновое взаимодействие аминных протонов с вицинальными атомами
Н обычно не наблюдается в алифатических аминах из-за быстрого межмоле-
кулярного обмена. Однако в случае фрагментов =С—NH—СН (для енаминов,
ароматических аминов, амидов и т. д.) скорость обмена меньше и часто наблю-
дается расщепление. Спин-спиновое взаимодействие во фрагменте Н—С—N—Н
зависит от конформации так же, как в фрагменте Н— С— С—Н (см. разд. 5.1).
Для групп N—СНз и N—СН2, 3Jhcnh ~ 5-6.
В кислой среде (например, в трифторуксусной кислоте в качестве раство-
рителя) обмен аммониевых протонов замедляется до такой степени, что вици-
нальное взаимодействие Н—N+—С—Н становится, как правило, наблюдаемым.
В других средах сигналы обычно уширены из-за промежуточных скоростей
обмена.
Сигналы аминных и, особенно, аммониевых протонов часто дополнительно
уширены, из-за того что взаимодействие 14N—гН снимается за счет квадруполь-
ной релаксации 14N (спиновое квантовое число 1=1, природное содержание
99,6%, 1 Jnh ~ 60) только частично. Такое уширение сигнала не влияет на ви-
цинальное взаимодействие Н—С—N—Н, и для соседних атомов водорода можно
наблюдать узкие мультиплеты. В высокосимметричных соединениях аммония
214 5. Спектроскопия ЯМР ХН
квадрупольная релаксация происходит медленно, и спин-спиновое взаимодей-
ствие с 14N приводит к триплетам с равной интенсивностью линий.
NH4 'jNH 52,8
2JaN 0.5
3JbN 1.6
JcN 0,0
Химические сдвиги и константы спин-спинового взаимодействия
для ядер 1Н в аминах (5 в м. д. относительно ТМС, J в Гц)
2,47 —2,3
CH,NH, (CH,),NH
О с. * О' Z
2,31 \ет -11,7
(CH3)3N
3 3
(CH3)4N+
2,74
Н 3,06
1,00
2,86
3,27 1,27
(в D2O)
1,43
0,93 2,61
1,50 Hl,90
0,91 2,56
0,92 1,43 1,77
1,33 2,68
0,32 3Jab 6,6
Нь з
0,20 HaJ" .NH, 1,59 2;ас
С IX Jbc -4,3
На 2,23 Jbd 9,7
е Jbe 6,2
Jed 9,9
5.9. Азотсодержащие соединения 215
2,30
1>04 Н 2,42
Н I х
1,62 0,91
IjjT 1,89
1,16Щ н
1,73 1,24
УН2
еГ|>а6,46
d^k^b7,01
с
6,62
Jab 8-0
Jae 1Д
5Jad 0,5
^ае 2,5
3Jbc 7,4
4Jbd 1.6
/2-78 Jab
3.55 HN 4Tab
6 Jae
a 6,43 4Jad
b 7,04 3Jae
C Jbe
6,58 4Jbd
8,2
1,1
0,4
2,5
7,3
1,7
8NH в ДМСО: 7,32
3J
Jab
T
4Jad
*^ae
Xc
Xd
8,4
1,0
0,4
2,8
7,3
1,8
N
Химические сдвиги и константы спин-спинового взаимодействия
для ядер 1Н в циклических аминах (<5 в м. д. относительно ТМС, J в Гц)
Н0,9
Ь Да 1,61
V =1
Xb.cls =6
Зт =4
v ab,trans
Н2,38
2,23
Н1,84
1,5
12,25
Hl,92
N.
>2,87
.ОЛ,67
2,27
N> 2,37
nJ2,88
Н2,12
216 5. Спектроскопия ЯМР 1Н
5.9.2 Нитро- и нитрозосоединения
Химические сдвиги и константы спин-спинового взаимодействия
для ядер 1Н в нитро- и нитрозосоединениях (й в м.д. относительно
ТМС, J в Гц)
4,29 1,58
CH3NO2 \^NOS
4,37
2,01
1,03 4,28
1,53
\,NO2
|4,44
1,07 2,07
1,50 4,47
Ъ-4,91
<2 2,26, 2,12
1,88, 1,70
6,55 7,12 Зт Jab 11,8
<Ha Зт •'ас 17,9
Хс 0,9
Нс no2
5,87
8,4
1,2
0,4
2,4
7,5
1,5
7,9
1,3
0,6
2,0
7,4
1,4
5.9.3 Нитрозамины, азо- и азоксисоединения
Химические сдвиги и константы спин-спинового взаимодействия
для ядер 1Н в нитрозаминах, азо- и азоксисоединениях (8 в м.д. от-
носительно ТМС, J в Гц)
Обычно:
8щис < йТранс
Йцис > Йтранс
для протонов а-СНз,
а-СНг и /3-С'Нз
для протонов а-СН
2,96 ,
\ Л
N—N
3,76
5.9. Азотсодержащие соединения 217
3,7
\
N=N
4,16
\+=N
О’ \
3,16
1,48 V
N+=N
° ?V1,28
5.9.4 Имины, оксимы, гидразоны и азины
Химические сдвиги и константы спин-спинового взаимодействия
для ядер 1Н в иминах, оксимах, гидразонах и азинах (6 в м.д. отно-
сительно ТМС)
8,40
3,4
6,8-7,9
На
^=N- ОН 7-10
alk
г
ua,syn
г
ua.anti
7,2-8,6
На
)=N- ОН 7-10
аг
ua.syn ua,anti
7,52 Н 7ОН 9,9
^=N
1,83
/ОН 9,9
>N
6,92 Н
В альдоксимах и кетоксимах разница между химическими сдвигами syn и anti
протонов в а-СНг-группах, Д<5 = <5syn — <5anti, зависит от двугранного угла
^H-C-C=N;
<р д<$
0° 1
60° 0
115° -0,3
N
218 5- Спектроскопия ЯМР 4Н
6,1-7,7
Н\Э
alk NH-ar
Н
Н 7,89
2,03
5.9.5 Нитрилы и изонитрилы
Химические сдвиги и константы спин-спинового взаимодействия
для ядер 1Н в нитрилах (6 в м. д. относительно ТМС, J в Гц)
1,98 1,31
CH3CN \/CN Jv.c 7j6
2,35
0,96 1,63 CN
1,50 2,34
N
Хь 7.0
3Jbc 7,4
C a 4Jac -0,05
1,11 2,29
6,07 5,73
He CN
Jab И.8
X 17.9
Jbe 0,9
6,20
0,94
0,93 Hb
e Hd 1,36
Jab 8,4
Jae 5,1
Jbe -4,7
3Jbd 9,2
X 7,1
X 9,5
7,8
1,3
0,7
1,8
7,7
1,3
Химические сдвиги и константы спин-спинового взаимодействия
для ядер 1Н в изонитрилах (ё в м.д. относительно ТМС, J в Гц)
Из-за симметричного распределения электронов вокруг атома N квадруполь-
ная релаксация ядер азота происходит так медленно, что взаимодействие
14N-XH становится наблюдаемым и проявляется в виде триплета с относитель-
ными интенсивностями линий 1:1:1 (спиновое квантовое число 14N 1 = 1;
природное содержание 99,6%):
С— C-14NC lJlaN 1-8-2.8
н2 Н2 |j|bN 1>5_3)5
5.9. Азотсодержащие соединения 219
2,85 2JaN 2,3
CH3NC
1,28 3J v ab 7,3 1,45 3J Jab 7,0
b \/NC 2J JaN 2,0 b\NC 2J JaN 1,8
a 3J JbN 2,4 a | 3,87 3J JbN 2,6
3,89
1,44
a \ /NC 3JaN 1,4
5,35 5,90 3J Jab 8,6 2J JaN 2,3
Hb Ha 3J Jac 15,6 3J JbN 6,1
H 5,58 NC 2J Jbc -0,5 3J JcN 3,1
5.9.6 Цианаты, изоцианаты, тиоцианаты и изотиоцианаты
Химические сдвиги и константы спин-спинового взаимодействия
для ядер 1Н в цианатах, изоцианатах, тиоцианатах и изотиоци-
анатах (6 в м.д. относительно ТМС, J в Гц)
1,45
\^OCN
4,54
3,02
CH3NCO
3,37
1,63
„NCO
1,29
\ .NCO
0,99 3,26
3,72
4,77 6,12 3j 7)6
Hb/Ha 3j-152
H NCO Jbc -0,1
5,01
2,61
CH3SCN
1,52
2,98
3,37
CH3NCS
1,40
3,64
NCS
7,24
220 5. Спектроскопия ЯМР 1Н
5.10 Серосодержащие функциональные группы
5.10.1 Тиолы
Химические сдвиги и константы спин-спинового взаимодействия
для ядер 1Н в тиолах (6 в м.д. относительно ТМС, J в Гц)
Типичные диапазоны химических сдвигов протона группы SH:
alk-SH 1-2
Обмен с другими протонами SH, ОН, NH или СООН обычно настолько мед-
ленный, что химический сдвиг характеристичен и вицинальное взаимодействие
с протонами SH становится наблюдаемым (5-9 Гц в алифатических системах
с быстрым вращением).
2,00 1,26 3Jab 7,4
CH3SH
b а
(в бензоле)
2,44
0,99 2,50
34 1>56
\bxSH_
[з,16
3Jab 5,7
0,92 1,59
1,43 2,52
2,68
1,22Н 1,75 Н1.34
40
7,18
7,10
С
7,04
Чь
Jae
5J
Jad
T
Jbc
4Jbd
7,9
1,2
0,6
2,1
7,5
1,5
5.10. Серосодержащие функциональные группы 221
5.10.2 Сульфиды
Химические сдвиги и константы спин-спинового взаимодействия
для ядер 1Н в сульфидах (6 в м.д. относительно ТМС, J в Гц)
Химические сдвиги и константы спин-спинового взаимодействия
для ядер 1Н в циклических сульфидах (S в м.д. относительно ТМС,
J в Гц)
S
1 2,27
2т
•’gem
т
^cis
Зт
v trans
о
7,2
5,7
2т
•’a,gem
I
^b.gem
Зт
"abjCis
3J
v ab,trans
4J
~ ac.cis
4J
ac,trans
-8,7
-11,7
8,9
6,3
1,2
-0,2
3,67
^5,81
2,57
LoJ3,88
6,06 d< >a3,08 9,2
\\ / Jbc 2,5
5,48 c b2,62 4jm 2,2
X 6,1
[/S^|4,2 -5,8 3,19
=5,8^C~5,8
—5,8
222 5. Спектроскопия ЯМР *Н
5.10.3 Дисульфиды и соли сульфокислот
Химические сдвиги и константы спин-спинового взаимодействия
для ядер 1Н в дисульфидах и солях сульфокислот (ё в м.д. относи-
тельно ТМС, J в Гц)
alk
2,63 1,03
5.10.4 Сульфоксиды и сульфоны
Химические сдвиги и константы спин-спинового взаимодействия
для ядер 1Н в сульфоксидах и сульфонах (ё в м.д. относительно ТМС,
J в Гц)
5.10. Серосодержащие функциональные группы 223
5.10.5 Сульфокислоты, сульфиновые, сернистая, серная кислоты
и их производные
Химические сдвиги и константы спин-спинового взаимодействия
для ядер 1Н в сульфокислотах, сулъфиновых, сернистой, серной
кислотах и их производных (А в м.д. относительно ТМС, J в Гц)
11-12
alk—SO2—ОН
3,0
СН3—SO2-O-alk
2,68
2,5 7СН3
СН3—SO-N
СН3
3,6
СН—SO2-C1
7,62
\ъ 8-0
X 1,2
X 0,6
Хе 2,0
Хе 7,6
X 1,4
Jac 1-2
Xd 0,5
Jae 2,2
Xe 7,5
Jbd 1,3
3,58
3,97
b,b’ 4,03
°^a 1,26
2J
Jbb'
3J
3 ab
T
Jab'
-10,3
6,7
6,9
0'%''
s
5.10.6 Производные тиокарбоновых кислот
Химические сдвиги и константы спин-спинового взаимодействия
для ядер 1Н в производных тиокарбоновых кислот (8 в м.д. относи-
тельно ТМС, |J| в Гц)
2,30
2,27
О
A 3Jab 5,0
4,29 С Ь 7,84 Jbc 2,8
6,4
224 5. Спектроскопия ЯМР *Н
5.11 Карбонилсодержащие соединения
5.11.1 Альдегиды
Химические сдвиги и константы спин-спинового взаимодействия
для ядер ‘Не альдегидах (<5 в м.д. относительно ТМС, J в Гц)
Типичные диапазоны химических сдвигов и констант ССВ альдегидных про-
тонов:
alk-CHO 9,0-10,1 Хс 0-3
alken-CHO 9,0-10,1 Хс ~ 8
СНО 9,5-10,5
о: 10,2-10,5
т, р: 9,5-10,2
9,60
СН2=О 2|J|gem 42,4
2,20 9,80
Ь а 3
СН3-СНО Jab 3,0
1,13 9>79
\Ь/СНО
2,46 Я
Чь 14
с=х
1,67 9,74
3Jab 2,0
0,97 2,42
9,57
СНО
а
3Т 11
Jab
1,07 9>48
\ /СНО
6,26 6,26 \ь =8,0 °^на1()’()() 4Jab —0,2 3J Jbc 7,7
Цс нь 4Jac =0,3 Jae 0 4J Jbd 1,3
J ad =0Д f г^^Ь7,87 6J Jad 0,1 X 0,6
Hd 6,11 /=О на 9,51 е1^^с7,51 d 5J Jae 0,4-1,0 % 3Jcd 1,8 7,5
7,61 4Jce 1,3
5.11. Карбонилсодержащие соединения 225
5.11.2 Кетоны
Химические сдвиги и константы спин-спинового взаимодействия
для ядер 1Н в кетонах (5 в м.д. относительно ТМС, J в Гц)
2,14 2,47
1,98 2,32 0,85
Чь 0,5
(в бензоле)
в CDC13: с 1,56
d 0,93
1,8
226 5. Спектроскопия ЯМР 1Н
7 47 3,13
* Отнесение ненадежно.
Химические сдвиги ядер 1Н в дикетонах (6 в м.д. относительно ТМС)
3,62 2,17
Для енольной формы,
см. разд. 5.8.1.
Дальние константы спин-спинового взаимодействия в кетонах
(|J| в Гц)
Часто для фиксированных конформаций можно наблюдать спин-спиновое вза-
имодействие через группу С=О, если соответствующий фрагмент имеет
W-образную форму.
Хь 0-0,5
С=Х
5.11.3 Карбоновые кислоты и карбоксилаты
Химические сдвиги карбоксильных протонов (<5 в м.д. относительно
ТМС, J в Гц)
Положение сигнала СООН зависит от растворителя, концентрации и присут-
ствия других протонов, способных к обмену. Промежуточные скорости обмена
с другими протонами могут вызывать сильное уширение линий, которые ино-
гда становятся недоступными для наблюдения.
8,06 11,0 2,10 11,42
Н-СООН СН3-СООН
1,16
11,73
СООН
COONa
2,36
2,18
(в D2O)
5.11. Карбонилсодержащие соединения 227
1,68 И.51
^х^-СООН
1,00 2,31
121 И-88
к /СООН
| 2,56
0,93 1,62 11,96
1,39 2,35
1,23 11,49
х^СООН
11,19
СООН
3,45 <
СООН
12,2
.СООН
2,43 Г
^СООН
(в ДМСО)
Чъ 10.5
Че 17,2
Хс 1.8
СООН -12,5
а 8,13
Ь7,47
7,60
Зт
4аь
Ча
т
4ьс
Jbd
7,9
1,4
0,6
1,8
7,5
1,3
5.11.4 Сложные эфиры и лактоны
Химические сдвиги и константы спин-спинового взаимодействия
для ядер 1Н в сложных эфирах алифатических карбоновых кислот
(б в м. д. относительно ТМС, J в Гц)
3,76
.СН3
о Ь
Vlab 0,8
О НЬ7,32
ПЛПХ.НС4,69
±13 О j
8,03 Hfj 5;01
V 0,7 3J Jbc 6,4
’Jac 1,6 3Jbd 13,9
’Jad 0,8 Jed -1,7
с=х
4,02 0,95
2,05
2,02 1,23
2,04 1,60 0,94
228 5. Спектроскопия ЯМР 1Н
Сложные эфиры борной, азотной и серной кислот см. в разд. 5.12.
Химические сдвиги и константы спин-спинового взаимодействия
для ядер ‘Не алкильных сложных эфирах (<5 в м.д. относительно ТМС,
J в Гц)
О
Чь Ю.6
Че 17,4
Чс 1.5
5.11. Карбонилсодержащие соединения 229
Химические сдвиги и константы спин-спинового взаимодействия
для ядер 1Н в лактонах (S в м.д. относительно ТМС, J в Гц)
4,29
4,28 HfH<| 2,23
Чъ -17,5
3Jac 9,5
3Jad 6,9
Че 0,3
4Jaf -0,5
4d -12,7
Че 7,9
4f 6,3
4 -8,8
1,6
3J
Jbc
4d
4d
9,4
1,5
1,3
6,3
2,4
5,0
5.11.5 Амиды и лактамы
Амидные протоны (S в м. д. относительно ТМС, J в Гц)
NH2
5-7
R: alk,
аг
^alk
NH
6-8,5
R: alk,
ar
R: alk,
ar
7,5-9,5
Ширина линий
Сигналы протонов NH часто уширены из-за того, что взаимодействие 14N-1H
только частично снимается квадрупольной релаксацией 14N (спиновое кванто-
вое число 1=1; 1 Jnh ~ 60). Другой причиной уширения сигналов в первичных
амидах является заторможенное вращение вокруг связи СО—NH. При медлен-
ном вращении химические сдвиги двух протонов в первичных амидах разли-
чаются примерно на 0,5-1 м. д.
Вицинальное спин-спиновое взаимодействие H—C—N—H
Из-за медленного межмолекулярного обмена амидных протонов обычно мож-
но наблюдать их взаимодействие с соседними атомами водорода. Расщепле-
ние сигнала группы С—Н четко наблюдается даже в тех случаях, когда сиг-
нал протона NH широкий и бесструктурный. Спин-спиновое взаимодействие
Н—С—N—Н зависит от конформации так же, как в фрагменте Н—С—С—Н (см.
разд. 5.1). Для групп N-CH3 и N-CH2: 3Jhcnh « 7.
230 5. Спектроскопия ЯМР ХН
Третичные алкиламиды
Вращение вокруг связи СО—N обычно происходит так медленно, что в случае
разных заместителей при атоме азота для двух конформеров наблюдаются два
разных сигнала. Обычно выполняются следующие соотношения:
для NCH3, NCH2CH3 и NCH(CH3)2
для NCH(CH3)2, и NC(CH3)3
для NCH2
’цис к О Стране к О
’транс к О Оцис к О
’цис к О Стране к О
Формамиды (6 в м.д. относительно ТМС, |J| в Гц)
В более устойчивой конформации монозамещенных формамидов заместитель
находится в цис-положении относительно карбонильного кислорода. В более
устойчивой конформации несимметричных дизамещенных формамидов боль-
ший по размеру заместитель занимает транс-положение по отношению к кар-
бонильному кислороду.
О
2,74
И
8,1 Н 7,9
«90%
8’1 1 2,88
«10%
9 2,88
с
На I
8,02 1 ь
2,97
Чь
Чс
Ацетамиды (<5 в м.д. относительно ТМС, J в Гц)
В монозамещенных ацетамидах наблюдаются только конформеры с цис-рас-
положением заместителя по отношению к карбонильному кислороду. В диза-
мещенных ацетамидах в более устойчивом конформере больший по размеру
заместитель находится в цис-положении по отношению к карбонильному кис-
лороду.
1,98 Н Ь
6,4
Чь 4,8
О 3,26
Ла
1,98 НЬ 1Д4
6,7
Чь 5,9
3J8 0,96
N
2,0 Н 1,55
5.11. Карбонилсодержащие соединения 231
3,21 1,35
1,98 Н 1,49 0,92
7,05
=2,0 Н 1,28
7,3
О
JV3’02 0Д
2.08 | Л. 0,5
1,15
=40%
<1 3Jab 8,2
О , 2
Л| Jac
JJb7,24 5т ns
j,l H a jae 2,4
7164 X 7,4
X 1,5
3,46 1,97
Химические сдвиги ядер 1H в лактамах {6 в м.д. относительно ТМС)
3,20
О
7,67 Hj/j 2,29 3jab °’8
3,40 2,12
3,41 2,05
8,13 HN
Чъ 2,2
3,17
232 5. Спектроскопия ЯМР 1Н
5.11.6 Другие карбонилсодержащие соединения
Химические сдвиги ядер 1Н в галогенангидридах карбоновых кислот
(5 в м.д. относительно ТМС, J в Гц)
О
2,66
Зт
Jbc
10,6
17,4
0,2
Химические сдвиги ядер 1Н в ангидридах карбоновых кислот
(6 в м. д. относительно ТМС)
с=х
5.11. Карбонилсодержащие соединения 233
Химические сдвиги ядер 1Н в имидах карбоновых кислот (6 в м.д.
относительно ТМС)
Н
8-12 (широкий)
2,97
3,48 2,36
Химические сдвиги ядер 1Н в производных угольной кислоты
(<5 в м. д. относительно ТМС)
0—3,8
П 4,13 1,2-1,7
1,2-1,7 0,93
5,16
С=Х
4,14
3,0
Н 1,5
6
5,5
234 5. Спектроскопия ЯМР гН
5.12 Другие соединения
5.12.1 Соединения кремния
Химические сдвиги и константы спин-спинового взаимодействия
для ядер 1Н в силанах и силанолах (<5 в м.д. относительно ТМС, J в Гц)
R Для R: Н, SiX3: 2-4 от -150 до -380
r—Si-jj 2-6 другие: 3-6 Природное содержание 29Si 4,7%,
J, "Si-сателлиты"
На 3,20 H-Si-H । н ь СН3 0,19 H-Si-H 3,58 н а *JaSi -202,5 ЧЬ 4,7 b CH3 0,14 H-Si-H 3,83 । a CH3 xJaSi -202,5 7,7 Jab 4,3
XJaSi -202,5
Ь <рнз 0,08 CH3-Si-H 4,00 3 । а сн3 *JaSi -190 9Нз °,00 \Si 7,5 CH3-Si-CH3 3Jab 3,8 СН3 2JaSi 5,5 4,35 H Ha H-Si-N-Si-H H 1 H снзь 2,63 xJaSi -209,4 4Jab o,3
0,42 0,79 1Д4
сн3 <рн3 <рн3
СН3—Si-Cl Cb-^i-Cl Cl-^i-Cl
СН3 СН3 Cl
Другие
соед.
5,88
Нь
6,11
Ня
/ \./СН3
Нс sVCH30,06
5,63 СН3
14,6
Jac 20,2
7,5
1,4
0,7
1,4
7,5
1,2
5.12. Другие соединения 235
Атом водорода в силанольной группе способен к обмену с D2O. Медленный
межмолекулярный обмен может наблюдаться в ДМСО в качестве растворите-
ля, поэтому в группе Н— Si— ОН обнаруживается вицинальное взаимодействие.
R
I
R-Si- ОН 2-7
I
R
' 3Т 1 я
CH3-Si-H Jab
ОН 4,42
Ь
(в ДМСО)
5.12.2 Соединения фосфора
Химические сдвиги и константы спин-спинового взаимодействия
для ядер 1Н в фосфинах и фосфониевых соединениях (<5 в м.д. относи-
тельно ТМС, | J| в Гц)
1,79 XJ 184,9
а
РН3
0,98 2,63 Х, 186,4
b а 2J 41
сн--рн- >£ t
1,06 X 191,6
GH„CH3 2JbP 3,6
H b a 3Jab 7,7
3,13
0,97 2,1
СН 3 СН3
। а
СН3
al,20 2JaP 13,7 2,52 2Jap 12,8
| b0,96 ? Jbp 0,5 3 ДА 1810
L Jab 7-6 | Ь Чь 7,6
> T_ 1,28
I ’
Химические сдвиги и константы спин-спинового взаимодействия
для ядер 1Н в фосфиноксидах и фосфинсулъфидах (ё в м.д. относи-
тельно ТМС, | J| в Гц)
Другие
соед.
2т
аГ65 зтаР
\ JbP
' Зт
Ь1,Ю аЬ
11,9
16,3
7,8
О
6,25
,6,72
НЬ
6,21
2JaP 25,9
Чр 41,8
3JcP 22,3
3Jab 12,9
3Jae 18.9
2Jbc 1.8
236 5. Спектроскопия ЯМР ХН
1,85 2JaP 4,4 1,74 2JaP 13,0
СНз-Р-СНза^ьр 14,3 СН3—Р—СН3
1 1 а
нь СНз
7,06
а 1,81
ЫД7
2jaP
3JbP
Зт .
11,3
18,1
7,5
ДНЬ6,6О
I у——Н 6,14
1,78 a J , С
Hd
6,26
2JaP 13,5
2JbP 25,9
3JcP 45,3
3JdP 25,4
3Jbc 11,8
3Jbd 17,9
2Jcd 1,8
2JaP 24,9
3JbP 47,0
3Jcp 25,5
3Jab H,7
3Jac 17,9
2Jbc 1-6
Химические сдвиги и константы спин-спинового взаимодействия
ядер 1Н в производных фосфонистой и фосфористой кислот (6 в
м. д. относительно ТМС, |J| в Гц)
Другие
соед.
2JaP 9,7
3JbP 9,5
4JcP 6,0
1,10
8,7
8,0
1,0
7,0
1,18
(в СС14)
3,49
3JaP 8,0
4JbP 0,6
3Jab 7,1
3JaP 10,8
I I a 2,43
I
/N\
3JaP 8,9
5.12. Другие соединения 237
Химические сдвиги и константы спин-спинового взаимодействия
ядер 1Н в производных фосфоновой и фосфорной кислот (<5 в м. д.
относительно ТМС, J в Гц)
3,66
о^ь
а-Р=О 17,3
1,43 6 3jbp 11,0
3,65
1,72 О"'©
а -г>—q
1,06
2JaP-18,0
3JbP 19,5
3JcP 10,0
3Jab 7,5
7,40 7,72 3j
/Ц
C\\ // r=O5jcP
7>48УС °\ >
4Jac
5Jad
4Jae
3Jbc
4Jbd
13,3
4,1
1,2
7,7
1,4
0,6
1,6
7,6
1,4
3,78a
~^O
—O-P=O
I
JaP H,0
1,29 4,04
b a
3JaP 8,5
4JbP 0,7
3Jab =7
1,28 4,06
b a
3Jap 10,0
4Jbp 0,7
3Jab ~7
Химические сдвиги и константы спин-спинового взаимодействия
ядер 1Н в илидах фосфора (<5 в м. д. относительно ТМС, J в Гц)
15,9
3,6
Другие
соед.
238 5. Спектроскопия ЯМР *Н
5.12.3 Другие соединения
Химические сдвиги и константы спин-спинового взаимодействия
ядер 1Н в различных соединениях (д в м. д. относительно ТМС)
Li—СНз -1,32 (в бензоле) -1,74 (в эфире) Na+ ХО— 3,5 / Ф-вФ \ о-в \=/ 1
°' ° 1,39 0,71 СНз сн3-^ь-сн3 СНз (в ДМСО) О ,4,3 II / О=С1-О II о / 'о- fф 7,20 Чф 6,94 6,80 (в ДМСО) Ч / 4,2 6 15 6,67 3 N-О \Ь ,na 3Jac 23 з 6" 2Jbc 7,6 Нс MgBr 5,51 \ /1,00 6,19 6,70 Зт 12>2 \ Н\Ь /На 3Jac 19,8 ~фФ,70 HPb-л 2jbc 2Д °-72 0,13 7,40 7,44 ^Н3 7,24 CH3-Ge-CH3 СНз
5.13. Природные соединения 239
5.13 Природные соединения
5.13.1 Аминокислоты
Химические сдвиги и константы спин-спинового взаимодействия
ядер 1Н в аминокислотах (<5 в м. д. относительно ТМС; J в Гц, раствори-
тель: трифторуксусная кислота (CF3COOH) или D2O) [1]
7 47 4,28
+H3N ^°Н 3jab 5,7
О
(в CF3COOH)
3,58
+H3N Y
О
(в D2O)
1,86
7,41
а
+H3N
4,49 °
(в CF3COOH)
7,33
d 1,25
С 2,60
, \ /ОН
H3N
4,32 О
3Jab
3Jbc
3Jcd
5,7
4,2
6,9
(в CF3COOH)
91,11
. |е~2 3Jab 5,5
7,38С’dr<2^f 1,10 -6,7
a он Jbd ~6,7
+H3N bV 3Jeg 6,1
4,28 о 3Jef 5,7
(в CF3COOH)
H<
“H3N ЬП
4,65 о
7,70
4,51
4,56
OH
3Jab -6
3Jbc 4,0*
3Jbd 4,0*
2Jcd -13,5
3Jab 5,5
3Jbc 3,6
3Jcd 7,0
3Jce 6,1
3Jcf 8,4
2Jef -13,6
3Jeg 7,0
3Jfg 7,0
91,10
1,55
е, f 1,70
ОН
1,21 d
2,28 с
+H3N
7,35 4’41°
(в CF3COOH)
d 1,67
, С 4,82
’63« 1 он
+H3N ^b 'lfOH
4,44 О
H<
3Jab
3Jbc
3Jcd
5,5
4,5
6,5
(в CF3COOH)
(в CF3COOH)
* Среднее значение
Природ,
соед.
240 5. Спектроскопия ЯМР ХН
Природ,
соед.
3Jab 3Jbc 5,3 5,0* f 2,2T3Jab s з^Ьс 5,5 7,7
+тт „ А/ОН Jbd п 5,0* 2,50 c, dJe 2,96 „bd 4,4
H3N Jed -15,5 2,65 Г Jcd -15,7
а 4,680 3Jce 9,1* J\/OH 3Jce 6,5*
7,58 3Jde 9,1* +H3N^y 3Jde 6,5*
(В CF3COOH) 7,73 4’67° (B CF3COOH)
* Среднее значение
* Среднее значение
=7,45
е=7'45 3Jbc 8,5
3Jba 4,5
2Jcd -14,5
" 4,66 О
7,33
(в CF3COOH)
3,55 О A 3Jab 5,1
7,73 СГ ^OH 3Jbc 4,7
+ a Л . .OH
+H3N b Y
4,76 0
(в CF3COOH)
h 6,97 3jab 5,8
NH + Jbc 5,6*
3,38 gk f 2,00 2Jbd Jcd 5,6* —-15,0
2,26 c J e~l,8 3Jce 6,0*
2,35 d< 3Jde 6,0*
1 a A .OH 3jfg -6,0
H3N ь f Jgh -6,0
4,52 О
(в CF3COOH)
* Среднее значение
7,27
е
3,34 С
3,60 d <
7,4 а 1
+H3N ю''|
4,64 6
7,03
ОН
3Jbc 8,5
3Jbd 4,5
2Jed -15,0
3Jef 8,5
(в CF3COOH)
2,55 с
2,63 d
7,71 а
+H3N'b
4,60
е 3,01
ОН
О
ОН
3Jab 5,5
3Jbc 5,6*
3Jbd 5,6*
2Jcd -15,5
3Jce 6,2*
3Jde 6,2*
(в CF3COOH)
* Среднее значение
i 6,19 i 6,19 3Jab 5,5
+H2N^ .nh2 3Jbc 5,3*
3Jbd 5,3*
6,50 hHN, 3,43 2Jcd =-15,0
2,25 C Je~2,00 3Jce -6*
2,34 dr'' f =2,08 Jcf =6*
Yb rOH 3Jde 3jdf =6* =6*
4,46 0 3Jeg 6,5*
„Jfg 6,5*
On CFo! rOOHI Ah 5,3
* Среднее значение
5.13. Природные соединения 241
2,06 d Ь2,42 3Jab 8,5
2,04 е , С2.14 3Jac 6,5
3,46 У Уон 2Jbc -13,5
3,39 g 'ьгЯУд Н2 \ О 3Jbd 3Jbe 7,5 5,5
4,33 4Jbf -0,4
(в D2O, pH 2,0) 4jbg 0,0
3Jcd 5,5
3Jce 7,5
2Jde -13,0
3Jdf 5,5
:>g 7,5
3Jef 7,5
3T 9 eg 5,5
Jfg -11,0
1,63 d b 1,96
1,60 е
3,04 f
2,95 g
3,74
(в D2O, pH 7,0)
3Jab
3Jac
2Jbc
3Jbd
3Jbe
4Jbf
4Jbg
3Jcd
3Jce
2Jde
3Jdf
3Jdg
3Jef
3j
9 eg
Jfg
8,4
6,2
-13,5
7,6
5,4
-0,4
0,0
5,6
7,8
-13,0
5,7
7,9
7,9
5,7
-11,0
1,07 d bl,45 3Jab 8,6
1,05 e , C1.04 3Jac 6,6
2,36 f < У/°’ 2Jbc -12,0
2,08 g 'N H \ 0 3Jbd 3Jbe 8,1 5,9
2,81 4Jbf -0,6
(в D2O, pH 13,0) o^bg 0,0
3Jcd 6,7
3Jce 8,5
2Jde -11,0
3Jdf 5,5
3Jdg 8,1
3Jef 7,7
3T 9Jeg 5,7
Jfg -10,5
HO
=5 d
3,9* e
3,9* f
b2,95
C2.56
OH
О
8,60 g
8,00 h
3Jab 8,2
3Jac 10,4
2Jbc -15,0
3Jbd <2
3Jcd 4,2
(в CF3COOH)
* Среднее значение
(в CF3COOH)
Природ,
соед.
(в CF3COOH)
242 5. Спектроскопия ЯМР ХН
5.13.2 Углеводы [2-4]
3,93
3,61 н
но
но х _____________
3,43 н I ОН 4 58
| 3,23 ’
3,32
(в D2O)
ОН
—3,7
-3,7 Н
НО
но 5,20
=3,
f 3,52 ОН
—3,7
(в D2O)
Глюкоза
3>75J . I 4,45*
з,бокх н s335
3,30g J
4,81*hHO ° a 6,54'
HO ,4 _ OH
f e *OHb4,51
4,81* 3,37 C d
3,13 4 g|*
в d2o
3Jbc 7,8
3Jce 9,5
3j J eg 9,5
3T • Jgi 9,5
% 2,8
3Jik 5,7
2Jjk -12,8
В ДМСО
3Jab 6,5
3Jcd 4,5-6
3Jef 4,5-6
3Jgh 4,5-6
41 5,5
41 6,0
(в D2O, внутренний стандарт — ацетон, 8 = 2,12)
* в ДМСО
Природ,
соед.
3>72J ч I 4,34*
?Н \ 3,72
<^*>О
V-"^Ab5,09
е *ОН1
4,61* з,61 с |ОНаб,18*
’ 3,41
4,42*
4,74* h НО
В D2O В ДМСО
3Jbc 3,6 3Jab 4,5
3Jce 9,5 3Jcd 6,8
3J J eg 9,5 3Jef 4,8
3J Jgl 9,5 3Jgh 5,5
Jij 2,8 TJjl 5,7
3Jik 5,7 3Jkl 6,2
2Jjk -12,8
(в D2O, внутренний стандарт — ацетон, 8 = 2,12)
* в ДМСО
5.13. Природные соединения 243
Фруктоза
3,77, 3,41 ’ а
к, I YmOH 4,48
Л^СГ/о, С 3,39, 3,25
3,62hAv>^OH
ГНСЦ d е 4,23
НО| \ ч
4,32 j t ' 3’55
9 *
4,38 3)58
(в ДМСО, 25% p-D)
В ДМСО В ДМСО 8 в В2О
(при 70 °C) (при 25 °C) (75% ₽-D)
2Jbc -И.З 3Jab 7,4 b 3,68
3Jdf 10,1 Jac 5,4 C 3,53
3Jfh 4,0 3Jde 6,8 d 3,76
3Jhk 1,9 3Jfg 5,8 f 3,86
3Jhl 1,6 3Jhi 3,8 h 3,96
2Jki -12,1 k 4,00
1 3,68
3,52, 3,40
3,72 3,77
3Jde 5,0
3Jef 3,0
2 Jfg -11,6
3,48, 3,37
“-л’а.он
3,53 eY /ч^ОН
а» Ь3,40
НО* *ОН 3,23
а с
3,79 3,80
2 Jab -П-0
3Jcd 7-1
3Jde 5,9
3Jef 2,3
3Jeg 3,6
2 Jfg -11,3
(в ДМСО, 20% a-D)
Константы ССВ при 70 °C
Ориентировочные величины
(в ДМСО, 55% ₽-D)
Константы ССВ при 70 °C
5.13.3 Нуклеотиды и нуклеозиды
(в D2O)
О
5,47 а 11,02
7,41b % Ао
НС
10,82
(в ДМСО)
3Jab 7,5
3Jbc 5,7
Природ,
соед.
244 5. Спектроскопия ЯМР ХН
ОНОН
%Ь 7-6
3Jcd 5,2
%е 5,1
3Jef 5,1
(в D2O)
(в ДМСО)
(в ДМСО)
5.13. Природные соединения 245
5.13.4 Литература
5,31
(в ДМСО)
[1] Вак В., Dambmann С., Nicolaisen F., Pedersen Е. J., Bhacca N. S., “Proton
magnetic resonance at 220 MHz of amino acids”, J. Mol. Spectrosc., 26, 78
(1968).
[2] Gillet B., Nicole D., Delpuech J.-J., Gross B., “High field nuclear magnetic re-
sonance spectra of hydroxyl protons of aldoses and ketoses”, Org. Magn. Reson.,
17, 28 (1981).
[3] Jaseja M., Perlin A. S., Dais P., “Two-dimensional NMR spectral study of the
tautomeric equilibria of D-fructose and related compounds”, Magn. Reson.
Chem., 28, 283 (1990).
[4] Altona C., Haasnoot C. A. G., “Prediction of anti and gauche vicinal proton-
proton coupling constants in carbohydrates: a simple additivity rule for pyra-
nose rings”, Org. Magn. Reson., 13, 417 (1980).
Природ,
соед.
246 5. Спектроскопия ЯМР 1Н
5.14 Спектры растворителей
и стандартных соединений
5.14.1 Спектры ЯМР ]Н обычных дейтерированных растворителей
(500 МГц; «1000 точек на 1 м.д.; <5 в м.д. относительно ТМС)
Ацетон-de
JL
। .... =2,8 (Н2О)
2,10 2,05 2,00 ц
2,05
। 1 1 1 । 1 1 1 । 1 1 1 1 ।
10 9 8 7
1 1 • ' 1 1 | ' 1 I 1 Т—>' 1 | 1 1 1
5 4 3 2
Т"1
0
Ацетонитрил-</з
г 1 1 1 1 I ' 11' 1 I 1
10 9 8
...А
_______2,00 1,95 1,90
। 1 1 । 1 1 1 1 । 1 1 1 1 । 1 1 1 ।
7 6 5 4 3
2,09 (Н2О)
1 1 I 1 1 1 ' I '
2 1
т-1
0
Бензол-de
7,16
। 1 1 1 1 । 11 1 1 । 1 1 1 1 । 1 1 11 । 1 1 11 j 1 1 1 1 । 1 1 1 1 । । 1 1 1 । 1 1 1 ' । ' ' ' ' । ।
10 9876543210
Бромоформ-d
6,84
Г '• 1 1 Г"т~г 1 1 | 1-Г-1 I I I I I I I I I I I I I .1 I । ... ! .I I ! I I I I ! I I I I I I
10 9876543210
Хлороформ-d
7,26
Раствор.
I 1 1 1 ' I ' 1 ' 1 I 1 1 ' ' Г~г'1 1 1 I
10 9 8 7 6
1,55 (Н2О)
__________________________I___________
.......................................
5 4 3 2 1 0
5.14. Спектры растворителей и стандартных соединений 247
Диметилсульфоксид-йб
Мета нол- d 1
Метанол-^
___________________________3,353,363’25
I ' 1 ' I 1 1 ' 1 I"1".1 |i ' 1 ... ’-т~
10 9876543210
Пиридин-ds
8,73 7,21
7,58
| 4,91 (Н2О)
I I Г—г I I | ' I -T~T I I , I I I I I 1 I.Г I I I I I I I I , I I
10 9876543210
Тетра гидрофуран-dg
Раствор.
248 5. Спектроскопия ЯМР *Н
Вода-й2
0,68 ТМС
(внешний
4,80 стандарт)
_____________________I.........
I |~г~' 'Т' 1 ~г ' I т"........ | I I ' I | I I , I | I I I I -|-i Т . । I , | I I . | । । .
10 9876543210
5.14.2 Спектры ЯМР *Н вторичных стандартов
Химические сдвиги ядер !Н в спектрах ЯМР обычно измеряют относитель-
но положения сигнала введенного в образец внутреннего стандарта — тетраме-
тилсилана (ТМС). Если ТМС недостаточно растворим, можно использовать
капилляр с ТМС в качестве внешнего стандарта. В этом случае из-за разли-
чия объемных восприимчивостей локальные магнитные поля в растворителе
и стандарте различаются, поэтому положение сигнала стандарта необходимо
корректировать. Для раствора в D2O в цилиндрической ампуле и чистого ТМС
в капилляре поправки составляют +0,68 и —0,34м.д. для сверхпроводящего
магнита и электромагнита соответственно. Эти величины необходимо вычесть
из химических сдвигов относительно внешнего стандарта ТМС, если положе-
ние его сигнала принято за 0,00 м. д. Можно также использовать вторичные
стандарты с группами (СН3)з81СН2. Ниже представлены спектры растворов в
D2O двух вторичных стандартов при рабочей частоте 500 МГц с ТМС в каче-
стве внешнего стандарта. Химические сдвиги представлены в м. д. относитель-
но ТМС с поправкой на различие в объемных восприимчивостях D2O и ТМС.
В результате сигнал внешнего стандарта ТМС располагается при 0,68 м. д.
Натриевая соль 3-(триметилсилил)-1-пропансульфокислоты
(4,4-диметил-4-силапентан-1-сульфонат натрия; ДСС)
JL
| I г I I Г I I
3,0 2,9
। 1 1 1 । ' ' 1 ।
10 9 8
Н С РНз
3 'SUx~x^SO3Na
Н3б
4,80 HDO
I 2,93
0,68 TMC
(внешний
стандарт)
1,78
-_______iAl
0,02
' I 1 ' 1 ' I 1 ' 1 I 1 ! ........... | ।
7 6 5 4 3
Натриевая соль 2,2,3,3-В4-3-(триметилсилил)пропионовой кислоты
Раствор.
H3Cdd
Н,сЛ х
•V'COONa
D D
4,80 HDO
0,68 ТМС
(внешний
стандарт)
0,00
I I I . I I .-т I .-р , . -Г- j | | , I . | | ,
10 9876543210
5.14. Спектры растворителей и стандартных соединений 249
5.14.3 Спектр ЯМР 1Н смеси обычных
недейтерированных растворителей
Для идентификации возможных примесей ниже представлен ЯМР 1Н спектр
(500 МГц, <5 в м.д. относительно ТМС) смеси 18 распространенных раствори-
телей в CDCI3 (0,05-0,4 об. %). Там, где сигналы нескольких растворителей пе-
рекрываются, на врезках показаны сигналы для индивидуальных соединений
из отдельно зарегистрированных спектров. Пики на этих врезках маркированы
химическими сдвигами в соответствии со шкалой химических сдвигов главного
спектра, однако их величины могут различаться в пределах 0,03 м. д. Сигна-
лы, положение которых меняется в широких пределах, помечены *. ТГФ —
тетрагидрофуран; моноглим —диметиловый эфир этиленгликоля.
пиридин
8,61
8,8 8,7 8,6 8,5 8,4
диметилформамид
8,01
пиридин
7,67
8,3 8,2 8,1 8,0 7,9
7,8 7,7 7,6
3 диоксан 3,70 этилацетат 4,11 ' ' ' танол 3,71* Диэтиловый 3,4 ।. эфир 3,48 моноглим i 3, L А. ™ л 1 ' зд" XI з-46 1 7* метанол ?9 моноглим ,
44 4^3 4Д 4Д 4^0 3^9 3^8 3,7 з'б 3^5 диметил- диметил- диметил- сульфоксид формамид формамид 2 60 толуол 2,96 2,88 ’ 2>35 к \ 1 А 34 з^з 3,2 ацетон этил- 2,16 ацетат । 2,04
3^2 ЗД з'о 2^9 2^ 2,7 24 2,5 2,4 2,3 ’"-'Т' 2,2 2,1 2,0
1,98
ацетонитрил
гексан 1,26 л циклогексан
1,43
1,23 этанол
1,20 диэти-
ловый эфир
1,26 этил-
Дд^цетат
1,85 ТГФ ^7 ,
1 1.3 1.2
~т~г-г 0,88 гексан
1.2 лА»
1,2 лМлАд I»2
Раствор.
2,0 С9 С8 1J L6 1^5 1Д ГЗ 1Д 1Д 1Д 0^9 0^8
6 И К спектроскопия
6.1 Алканы
Типичные диапазоны (и в см
Отнесение Диапазон Примечания
C-Hst 3000-2840 Часто несколько полос переменной интенсивности Вне обычного диапазона 2850-2815 СН3—О, простые метиловые эфиры 2880-2830 СН2—О, простые эфиры 2880-2835, О—СН2—О, диоксиметилен 2780-2750 «2820 О—СН—О, в ацеталях слабая 3050-3000 |^О, 2900-2800, СН=О, в альдегидах расщепление за счет 2780-2750 резонанса Ферми 2820-2780 СН3—N, СН2—N; амины 3100-3050, 3035-2995 3100-3050, Г ] в циклогексанах слабая, comb, около 2700 3035-2995 3080-2900 CH-hal st
252 6. ИК спектроскопия
Отнесение Диапазон Примечания
СНз 8 as 1470-1430 Средняя, совпадает с СН2 8
Вне обычного диапазона
1440-1400 СН3—С=О, метилкетоны, ацетали сн3-с=с
СН2 S 1475-1450 Средняя, совпадает с СН3 8 as
Вне обычного диапазона
«1440 СН2-С=С сн2-с=с
«1425 сн2-с=о, ch2-c=n, СН2-Х (X: hal, NO2, S, Р)
СН3 6 sy 1395-1365 Средняя. Две полосы в соединениях с геминальными метильными группами:
«1385, «1370 «1385, «1365 «1390, «1365 СН(СН3)2, равная интенсивность (7: 1175-1140, две полосы) С(СНз)2, 1385 слабее, чем 1365 (7: 1220-1190, часто две полосы) С(СН3)з, равной интенсивности, иногда три полосы (7: 1250-1200, две полосы) N(CHs)2, нет двух полос Спектры твердой пробы: иногда две полосы даже при отсутствии геминальных метильных групп
Вне обычного диапазона
1325-1310 1330-1290 1310-1280 1275-1260 СН3 7 1250-800 SO2-CH3 S—СН3, сульфиды Р- СНз Si—СНз, сильная, узкая Переменная интенсивность, практического значения не имеет Сильная полоса в соединениях с геминальными метильными группами:
1175-1140 1220-1190 1250-1200 СН(СНз)2, две полосы С(СН3)2, обычно две полосы С(СНз)3, две полосы, часто не разрешены
Вне обычного диапазона
«765 «855, «800 «840, «765 SiCH3 Si(CH3)2 Si(CH3)3
6.1. Алканы 253
Отнесение Диапазон Примечания
СН2 7 770-720 Средняя, иногда две полосы С-(СН2)П-С для п > 4 при «720; для п < 4 при более высоких волновых числах; в циклогексанах при «890, более слабая Вне обычного диапазона
1060-800 Циклоалканы, многочисленные полосы, ненадежные
C-D st 2200-2080 Обычно при изотопном замещении L /1/тх + 1/niL' t'x L "х ьу + l/mL на L':
254 6. И К спектроскопия
6.2 Алкены
6.2.1 Алкены с одной двойной связью
11
обертон! I
=сн2 \1
I С=С st С=С-Н 8 оор
C-Hst
3600 2800 2000 1600 1200 800 400
Типичные диапазоны {у в см т)
Отнесение Диапазон Примечания
=CH2 st 3095-3075 Часто несколько полос средней интенсивности
=СН st 3040-3010 Часто несколько полос средней интенсивности CH st в ароматических соединениях и трехчлен- ных циклах попадают в этот же интервал
В циклических соединениях:
«3075 |^>
«3060 □
«3045
«3020 l^j]
=СН 6 ip 1420-1290 Практического значения не имеет
=СН 6 оор 1005-675 Ряд полос
В этой области также:
ar СН 8 оор, С-О-С 7 и C-N-C 7
в насыщенных гетероциклах,
ОН 8 оор в карбоновых кислотах, NH 7, NO st,
SO st, СН2 7, CF st, СС1 st
6.2. Алкены 255
Отнесение Диапазон Примечания
Более узкие интервалы:
С=С С=С-С=О C=C-OR С=С-О-С=О .
сн=сн2 1005-985 «980 «960 «950
920-900 «960 «815 «870 '
(с обертоном 1850-1800) «810
с=сн2 900-880 «940 «795
(с обертоном 1850-1780) «810
\Н
990-960 «975 «960 «950
н\ н н
725-675 «820
Я1 840-800 «820
С=С st 1690-1635 Переменная интенсивность, слабая в случае высокосимметричных соединений, сильная для N—С=С и О-С=С
Более узкие интервалы:
1650-1635 СН=СН2
1660-1640 С=СН2 \ /н
1690-1665 /=\ Слабая Н х Н Н
1665-1635
1690-1660 \ Н >=/ Слабая, часто отсутствует
1690-1650 Слабая, часто отсутствует
Вне обычного диапазона:
Понижена С=С—X, где X: О, N, S, интенсивность повышена;
до «1590 в виниловых простых эфирах из-за поворотной изомерии часто две полосы
256 6. ПК спектроскопия
Частота понижается при сопряжении с:
с=с «*1650 «*1600 «*1630
с=с «*1600 <^| «*1640
C=N «*1620 «*1640
с=о «*1630
Примеры (у в см 1)
1645
994
912
1647
889
669
1682
972
963
1670
968
,С1
1650
709
1667
825
С1
1575
826
761
1595
848
714
С1 ,С1
С1
1587
929
835
780
жидкость: СС14: /~ 1655
О— \ 1610 1634 _Г~^ 1592
1608 =< 958
987 964 U 793
810 943
1663
1660
1670
1652
937
925
1673
6
С
О
с
1663
1628
1650
О
6.2. Алкены 257
1662
с=с
1830 1800
1621 \\ 1621
987 941
818 899
=/СНО
^СООСНз
1607
(2270)
1618
(1704)
1637
(1735)
1636
,CN
1645
1612
\ 1618
==/=О (1684)
1635
1615
(1730)
(1706)
6.2.2 Аллены
Отнесение Диапазон Примечания
(С=С)=С-Н st 3050-2950
С=С=С st as 1950-1930 Сильная, две полосы в X—С=С=СН2, если X не алкильный заместитель
Напряжение цикла увеличивает частоту: [>=С=СН2 «2020
С=С=С st sy 1075-1060 Слабая, отсутствует при высокосиммет- ричном замещении
(С=С)=СН2 6 оор «850 Сильная, слабый обертон при «1700
258 6. И К спектроскопия
6.3 Алкины
Типичные диапазоны (у в см х)
Отнесение Диапазон Примечания
=С—Н st 3340-3250 Сильная, резкая; в той же области проявляются
ОН st, NH st
С=С st 2260-2100 Слабая, узкая
Вне обычного диапазона:
R—С=С—Н; в низкочастотном конце указанного
диапазона
R—С=С—R; обычно 2 полосы (резонанс Ферми),
часто отсутствует в симметричных структурах
Более узкие интервалы:
«2120 С-СЙС-Н
«2220 С-СнС-С
«2240 С—С=С—CN
«2240 С-С&С-СООН
«2240, С-С=С-СООСН3
«2140
В этом же диапазоне: C=Z st, X=Y=Z st, Si—Н st
=C~H <5 700-600 Сильная, широкая;
обертон при 1370-1220 (широкий, слабый)
6.4. Алициклические соединения 259
6.4 Алициклические соединения
Циклические алканы
3600 2800 2000 1600 1200 800 400
Циклические алкены
%Т
3600 2800 2000 1600 1200 800 400
Другие колебания подобны колебаниям в нециклических алкенах и цикличес-
ких алканах.
Типичные диапазоны (р в см х)
Отнесение Диапазон Примечания
С-Н st 3090-2860 Сильная
Н-С-Н <5 1470-1430 Слабая
С=С st 1780-1610 Переменная в зависимости от размера цикла и замещения
Крутильные и веерные колебания групп СН2, так же как и валентные колеба-
ния С—С, незначительно отличаются от соответствующих колебаний в нецик-
лических соединениях и имеют ограниченное значение для идентификации.
260 б. ПК спектроскопия
Примеры {у в см *)
3090 3019 2933 1434 2974 — 2896 1450 r--\ 2951 / 2871 1455
2920 2933 /—к 2941
2860 ( ) 2865 [ ] 1471
1447 > 1462 k \ / 1451
-1640 [ >= =1780 j^>= =1650
1 -1570 ।Z =1640 У =1680
-1690 ^2^ =1610 ^4^ =1660
А -1660 =1670 =1690
-1570 ^j] =1650 ( J =1675
=1650 Г J =1665 -1670
1615
6.5. Ароматические углеводороды 261
6.5 Ароматические углеводороды
скелетные § оор
колебания
3600 2800 2000 1600 1200 800 400
Типичные диапазоны (у в см х)
Отнесение Диапазон Примечания
arC-H st 3080-3030
Часто много полос; в этом же диапазоне СН st
в алкенах и малых циклах
агС-С 1625-1575
Средняя, часто две по-
лосы; в производных
бензола с центром сим-
метрии в кольце обычно
слабая
В этом мое диапазоне: С=С st, C=N st, С=О st, N=O st,
С—С в гетероциклах, NH <5
1525-1475
Средняя, часто две полосы:
Слабая в:
В этом же диапазоне: С=О st, N=O st, С—С в гетероциклах,
B-N st, СН3 ё, СН2 ё, NH ё
comb 2000-1650
Очень слабая, используется для определения
типа замещения в 6-членных ароматических
циклах
В этом же диапазоне: С=О st, В—Н- • В st, N+—Н st, Н2О ё
262 б. И К спектроскопия
Отнесение Диапазон Примечания
агС-Н 6 ip 1250-950 Много полос переменной интенсивности; практического значения не имеют
агС—Н д оор 900-650 Сильные полосы одна или более; полезна для определения типа замещения в 6-членных ароматических циклах
В этом же диапазоне: =С—Н ё оор, С—0—С 7 и С—N—С 7
в насыщенных гетероциклах, ОН ё оор
в карбоновых кислотах, NH ё, N—О st, S—О st,
СН2 7, С-F ё, C-Cl st
Определение типа замещения в 6-членных ароматических циклах:
положение и форма полос в зависимости от числа соседних атомов
водорода (у в см-1)
Эти полосы нельзя использовать в случае циклических систем с сильносопря-
женными заместителями, например С=0, N02, C=N.
Составные
частоты,
обертоны
Тип замещения; Составные
СН ё оор, частоты,
аг С—С 7 обертоны
Тип замещения;
СН ё оор,
аг С—С 7
моно-
2000 1600
«900
770-730
710-690
2000 1600
2000 1600
JU-ДИ-
900-860
865-810
810-750
725-680
2000 1600
о-ди-
770—735
вгщ-три-
800-770
720-685
780-760
Г
л
1,2,4-три-
900-860
860-800
730-690
2000 1600
2000 1600
п- ди-
860-780
6.5. Ароматические углеводороды 263
Составные Тип замещения; Составные Тип замещения;
частоты, СН б оор, частоты, СН б оор,
обертоны аг С—С 7 обертоны аг С—С 7
зпг 1,2,3,4-тетра- 1,3,5-три-
1 860-780 900-840 850-800 730-675
2000 1600
2000 1600
г 1,2,3,5-тетра- 900-840 i г 1,2,4,5-тетра- 900-840
2000 1600
2000 1600
пента-
900-840
гекса-
Примеры (у в см J)
3080 /Ч/ 3021 3086
3040 |l J 1945
1968 1862
1818 1808
1739
3080 3040 1927
1915 l| T 1887
J 1845 ^^ОН 1764
1775
264 б. И К спектроскопия
6.6 Гетероароматические соединения
Характеристические полосы поглощения (р в см J)
Пирролы
скелетные
колебания
3600 2800 2000 1600 1200 800 400
Типичные диапазоны (у в см х)
Отнесение Диапазон Примечания
N-H st 34503200 Средняя, узкая полоса; смещается при образовании водородных связей
Обертоны 2100-1800 Слабая, характеристическая полоса
Цикл, 7 1610-1360 Сильные, узкие полосы
С-Н 8 1000-700 Сильная, широкая полоса; использование для идентификации затруднено
С-Н st 3100 3000 Средняя, узкая полоса
СО-С st 1190-990 Средняя или сильная полоса; переменная интенсивность
6.6. Гетероароматические соединения 265
5-членные ароматические гетероциклы:
Q У н О S
NH st свободная 3500-3400
NH st, связанная Н-связыо 3400 2800
CH st «3100 «3100 «3100
Цикл, 7: переменная интенсивность, 1610-1560 1590-1560 1535-1515
обычно несколько полос 1510-1475 1540-1500 1455-1410
СН ё оор: обычно сильная 990-725 770-710 935-700
266 6. ИК спектроскопия
6.7 Галогенсодержащие соединения
6.7.1 Фторсодержащие соединения
Типичные диапазоны (р в см х)
Отнесение Диапазон Примечания
C-F st 1400-1000 Сильная, часто более одной полосы (поворотные изомеры), часто не разрешены Более узкие интервалы: 1100-1000 al CF2 (FC-H st: 3080-2990) 1150-1000 al CF2 1350-1100 al CF3 1350-1150 C=CF «1745 C=CF2 st 1250-1100 ar CF В этом же диапазоне: сильные полосы для С—О st, NO2 st sym, C=S st, S=O st
cf2 780 680 Средняя или слабая полоса, отнесение ненадежно
CF3 780-680 (С-F б?)
S-F st 815-755 Сильная полоса
P—F st 1110-760
Si—F st 980-820
B-F st 1500-800
6.7. Галогенсодержащие соединения 267
6.7.2 Хлорсодержащие соединения
Типичные диапазоны (у в см х)
Отнесение Диапазон Примечания
C-Cl st 1100-1020 Сильная, узкая или средней ширины; в хлорсодержащих ароматических соединениях 1 830-<600 Сильная, часто широкая полоса (поворотные изомеры), отсутствует в хлорсодержащих ароматических соединениях
С-С1 б 400-280 Полоса средней интенсивности и ширины
Р-Cl st <600
Si—Cl st <625
В—Cl st 1100-650
Характеристические скелетные колебания в дизамещенных галогенбензолах:
X орто мета пара
R С1 1055-1035 1080-1075 1095-1090
Вг 1045-1030 1075-1065 1075-1070
1060-1055
268 6. И К спектроскопия
%т
6.7.3 Бромсодержащие соединения
С-Br st
3600 2800 2000 1600 1200 800 400
Hal
Типичные диапазоны (р в см х)
Отнесение Диапазон Примечания
С—Br st 1080-1000 Сильная, узкая или средней ширины; в бромсодержащих ароматических соединениях
700-500 Сильная, средней ширины; отсутствует в бромсодержащих ароматических соединениях
С—Вг 6 350-250 Полоса средней интенсивности и ширины
6.7.4 Иодсодержащие соединения
%т
и
C-I st
3600 2800 2000 1600 1200 800 400
Типичные диапазоны (и в см х)
Отнесение Диапазон Примечания
C-I st 650-450 Сильные, две или более полос
C-I 8 300-50 Полоса средней интенсивности и ширины
6.8. Спирты, простые эфиры и родственные соединения 269
6.8 Спирты, простые эфиры
и родственные соединения
6.8.1 Спирты и фенолы
Спирты
Фенолы
Типичные диапазоны (р в см х)
О
Отнесение Диапазон Примечания
О—Н st 3650 3200 Полоса переменной интенсивности
Более узкие интервалы:
3650-3590 Свободная группа ОН, узкая полоса
3550-3450 Связанная водородной связью группа ОН,
широкая полоса
3500-3200 Группы ОН в полимерных структурах; широкие,
часто много полос
Вне обычного диапазона:
3200-2500 Енолы, хелаты; часто очень широкая полоса
В этом же диапазоне: NH st, =СН st («3300, узкая), Н2О
О-Н 8 ip 1450-1200 Средней интенсивности, практического значения
не имеет
270 б. ИК спектроскопия
Отнесение Диапазон Примечания
С-О st 1260-970 Сильная, часто две полосы
Более узкие интервалы:
1075-1000 сн2-он
1125-1000 СН-ОН
1210-1100 с-он
1275-1150 аг С-ОН
В этом же диапазоне: полосы для С—F st, С—N st, N—О st,
О—Н 8 оор <700 P-О st, C=S st, S=O st, P=O st, Si-0 st, Si-H 8 Средней интенсивности, практического значения не имеет
Примеры (у в см г)
'''он 3250 1430 1075 1050 ^JDH 3335 1350
ОН 3215 1368 3450 1370
1220 1260
1195
3290
1430
1020
3460
1315
1237
1210
6.8.2 Простые эфиры, ацетали, кетали
В ацеталях и кеталях полосы валентных колебаний С—О расщеплены на 3,
а иногда даже на 4 и 5 компонент.
В ацеталях проявляется дополнительная полоса особых колебаний С—Н 8.
Частота колебаний С—Н st особенно низкая: ОСН3 st 2850-2815; ОСН2 st
2880-2835.
6.8. Спирты, простые эфиры и родственные соединения 271
Типичные диапазоны (у в см х)
Отнесение Диапазон Примечания
С—О—С st as 1310-1000 Сильная полоса, иногда расщеплена Более узкие интервалы для нециклических простых эфиров 1150-1085 СН2-О-СН2 1170-1115 СН—О—СН, полоса часто расщеплена 1225-1180 С=С—О-а1С 1275-1200 arC-O-alC Более узкие интервалы для циклических простых эфиров 1280 sy О 870 as ZA «1030 sy Р «980 as «1070 sy «915 as \_7 «1235 [I [Л I «1100 as «815 sy L^J 1 «950 О^О кетали, ацетали: от 4 до 5 полос «925 [1 Г > 1024, 1086 as «880 sy LU J О «800 [ О В аЦеталях: st СН, «2820 слабая полоса
С—О—С st sym 1055-870 Сильная полоса, иногда несколько полос
Более узкие интервалы для нециклических простых эфиров: 1125-1080 С=С—О—а1С, полоса средней интенсивности 1075-1020 агС—О—а1С, полоса средней интенсивности В этом же диапазоне: сильные полосы для С—О st, С—F st, С—N st, N—О st, Р—О st, C=S st, S=O st, P=O st, Si—О st, Si—H 6
272 6. ИК спектроскопия
Примеры (у в см х)
О'
1136
935
917
1225
1218
1211
1003
1250
1040
1188
1138
1111
1046
1172
1132
1077
1057
1038
%Т
6.8.3 Эпоксиды
C-Hst
цикл st as
цикл б
цикл st sy
3600 2800 2000 1600 1200 800 400
Типичные диапазоны (у в см х)
Отнесение Диапазон Примечания
С-Н st 3050-2990 Частота выше, чем обычно наблюдаемая в алканах
цикл st as 1280-1230 Переменная интенсивность
цикл st sy 950-815 Переменная интенсивность
цикл, 6 880-750 Переменная интенсивность
Примеры (у в см х)
О 1280
ZA 870
1230 sy
885 as
845 б
о°
1260 sy
890 as
780 б
6.8. Спирты, простые эфиры и родственные соединения 273
6.8.4 Пероксиды и гидропероксиды
%т
0-0 st
С-О-О st
3600 2800 2000 1600 1200 800 400
Типичные диапазоны (у в см т)
Отнесение Диапазон Примечания
О-О-Н st 3450-3200 Переменная интенсивность
Более узкие интервалы:
«3450 Свободные группы ООН; при образовании Н-связей на 30 см-1 выше, чем в соответству- ющих спиртах
С—О—О st В этом же 12001000 диапазоне: ОН st, NH st, =СН st, Н2О Сильная полоса, примерно на 20 см-1 ниже, ' чем в соответствующих спиртах О
В этом же диапазоне: сильные полосы для С—О st, С—F st, С—N st, N—О st, Р—О st, C=S st, S=O st, P=O st, Si-O st, Si-H 5
О—О st 1000-800 Средняя или слабая полоса, часто две полосы, отнесение ненадежно
Также 1760-1745 С=О st в надкислотах
1820-1770 С=О st в диацилпероксидах (две полосы)
Примеры (у в см т)
1017
880
1070
1060
943
0-0 1100
274 6. ИК спектроскопия
6.9 Азотсодержащие соединения
6.9.1 Амины и родственные соединения
Первичные амины
Вторичные амины
Аммоний
6.9. Азотсодержащие соединения 275
Типичные диапазоны (гвсм *)
Отнесение Диапазон Примечания NH2 st 3500-3300 Переменная интенсивность, обычно 2 узкие полосы, Др = 65-75 При образовании Н-связи более низкие волновые числа (<3200) и уширение полосы. Свободная и Н-связанная формы часто наблюдаются одновременно. В первичных ароматических аминах дополнительная составная частота при «3200 В этом же диапазоне: полосы ОН st, =СН st NH st 3450-3300 Только одна полоса переменной интенсивности При образовании Н-связи более низкие волновые числа (<3200) и уширение полосы. Свободная и Н-связанная формы часто наблюдаются одновременно. В этом же диапазоне: полосы ОН st, =СН st, Н2О NH3 st 3000-2000 Средняя, широкая, высокоструктурированная полоса 3000-2700 Главный максимум; составная частота «2000 NHJ st 3000-2000 Средняя, широкая, высокоструктурированная полоса 3000-2700 Главный максимум NH+ st 3000-2000 Средняя, широкая, высокоструктурированная полоса
2700-2250 Главный максимум В этом же диапазоне: полосы для ОН st, NH st, СН st, SH st, PH st, SiH st, BH st, X=Y=Z st, X=Y st NH2 8 1650-1590 Средняя или слабая полоса NH 6 1650-1550 Слабая полоса NH3 6 1600-1460 Средняя, часто более одной полосы; в алифатических аминах слабая NH2 6 1600-1460 Средняя, часто более одной полосы; в алифатических аминах слабая NH+ 6 1600-1460 Средняя, часто более одной полосы; в алифатических аминах слабая С—N st 1400-1000 Полоса средней интенсивности, практического значения не имеет NH2 6 850-700 Средняя или слабая; 2 полосы в первичных аминах NH 8 850-700 Средняя или слабая полоса P-N-C st 1110-930 N
770-680
276 6. ИК спектроскопия
Примеры ( CH3-NH2 v в см T) 3470 3360 1622 3357 3278 3200 sh 1605 h2n x^NH2 3356 3274 3175 1650
H 3279 nh2 3487 HN^ 3416
A 3405 3386
H [M fl 1 1322
т |l J 1266
6.9.2 Нитро- и нитрозосоединения
Нитросоединения
N
%T
NO2 st as NO2 st sy
3600 2800 2000 1600 1200 800 400
Нитрозосое динения
%T
C-N st C-N st
N=O st N=O st
3600 2800 2000 1600 1200 800 400
6.9. Азотсодержащие соединения 277
Типичные диапазоны (и в см х)
Отнесение Диапазон Примечания
NO2 st as NO2 st sy Цикл <5 N=O st C-N st N-N st 1660-1490 Очень сильная полоса средней ширины Более узкие интервалы: 1660-1625 О—NO2, нитраты 1570-1540 С—NO2, алифатические нитросоединения 1560-1490 С—NO2, ароматические нитросоединения 1630-1530 N—NO2, нитрамины 1390-1260 Сильная полоса, средней ширины Более узкие интервалы: 1285-1270 О—NO2, нитраты 1390-1340 С—NO2, алифатические нитросоединения 1360-1310 С—NO2, ароматические нитросоединения; часто две полосы 1315-1260 N—NO2, нитрамины В нитратах также: «870 N—О st, сильная полоса «760 NO2 7 «700 NO2 8 760-705 Сильная полоса; видоизмененное деформационное колебание ароматического кольца 1680-1450 Очень сильная полоса в мономерах 1420-1250 Очень сильная полоса в димерах Более узкие интервалы: 1680-1650 С—NO (нитриты) транс-, 1625-1610 цис 1585-1540 С—NO, алифатические С-нитрозосоединения 1510-1490 С—NO, ароматические С-нитрозосоединения «1450 N—NO, N-нитрозосоединения В нитритах также: 3300-3200, составная частота «2500, 2300-2250 «800 N—О st транс-, цис: очень слабая полоса «600 О—NO 8 транс-, цис: «650 «850 С—NO, алифатические С-нитрозосоединения; взаимодействует с другими колебаниями «1100 С—NO, ароматичские С-нитрозосоединения «1040 TV-нитрозосоединения
N
278 6. ИК спектроскопия
Примеры (у в см х)
CH,-NO 1564
842
NO
1506
1110
810
NO
1497
1112
858
\ 1524
/“n°2 1359
851
1527
1351
853
720
aNO2
NH2
1506
1351
1261
873
748
6.9.3 Имины и оксимы
Имины
C=N st
3600 2800 2000 1600 1200 800 400
Оксимы
6.9. Азотсодержащие соединения 279
Типичные диапазоны (и в см т)
Отнесение Диапазон Примечания
C=N st 1690-1520 Обычно сильная полоса Более узкие интервалы: «1670 R-CH=N-R' R, R': al «1645 R—CH=N—R' R или R': сопряженные «1630 R—CH=N—R' R, R': сопряженные «1655 R R, R', R": al «1645 ^=N R: сопряженный «1635 R" XR' R, R': сопряженные «1555 Q N—О *”T ПМ,Ха // \ /J при «1655 C=O
«1645 «1625 R’ R': al /—NH „ nl -c', R, R - сопряженные к
ОН st ОН S N—О st k,8.5-i58o r>=n ““ TT ' ' при 1540-1515 в: H2N R v 1670-1600 CH=N—N=CH RQ Дополнительные полосы: 1690-1645 )=NH NH st: «3300, RO C-O st: «1325, «1100 RO Дополнительные полосы: 1680-1635 )=NH2 NHj st: «3000 RO NHj 5: 1590-1540 2050-2000 C=C=N: Кетимины, очень сильная, иногда 1580-1520 Оксимы хинонов: С=О st 1680-1620 1685-1650 Алифатические оксимы 1645-1650 Ароматические оксимы 1690-1645 О—C=N 1640-1605 S-C=N 1640-1580 S-S- C=N 3600-2700 Сильная полоса Более узкие интервалы: «3600 Свободная группа 3300-3100 Н-связанная группа, широкая полоса «2700 Оксимы хинонов, более одной полосы 1475-1315 Практического значения не имеет 1050-400 Практического значения не имеет R )=Nx RHN R две полосы
N
280 6. ИК спектроскопия
Примеры (v в см ')
К
1667
NH
1603
1637
.Ьк 1675
1672 (тв.)
1662 (газ)
ОН 1684
%Т
6.9.4 Азосоединения
N=N st
3600 2800 2000 1600 1200 800
400
Типичные диапазоны (и в см г)
N
Отнесение Диапазон
N=N st 1500-1400
1480-1450
1335-1315
Примечания
Очень слабая полоса, отсутствует в соединениях
с высокой симметрией
О
\ /
N=N
st as
St sy
4450
1050
S
\ /
N=N
о
N=N
о х
Более узкие интервалы:
Алифатические (транс)
Алифатические (цис)
1410-1175
Димеры С-нитрозосоединений
1290-1175
1425-1385,
1345 1320
13001250
«1410, «1395
Ароматические (транс)
Ароматические (цис)
6.9. Азотсодержащие соединения 281
6.9.5 Нитрилы и изонитрилы
Нитрилы
CHN st
3600 2800 2000 1600 1200 800 400
Изонитрилы
%Т
-NEC st
3600 2800 2000 1600 1200 800
400
Типичные диапазоны (у в см т)
Отнесение Диапазон Примечания
C=N st 2260-2240 Интенсивность от средней до сильной,
узкая полоса; для О—CH2—C=N, N—СН2—C=N:
низкая интенсивность или отсутствует
Вне обычного диапазона:
2240-2215
2240-2215
2240-2230
«2275
2225-2175
2210-2185
2200-2070
2150-2110
C=C-CeN
OC=N
ХС—C=N X: Cl, Br, I
-CF2-CeN
X \ +
^N-C=N —— N=C=N-
>N-C=C-C=N
ChN-
Сильная полоса
282 6. ИК спектроскопия
Отнесение Диапазон Примечания
-N+=N 2310-2130 В этом же Полоса средней интенсивности, частота зависит от аниона диапазоне: С=С st, X=Y=Z st as, NH+ st, PH st, POH st, SiH st, BH st
Примеры (1/ в cm
>-CN 2222
NC^-CN 2273
NCy^CN 2257 2222
NC CN
NaCN, KCN 2080-2070 AgCN 2178
NH2-CN 2268
6.9.6 Диазосоединения
Отнесение Диапазон Примечания
N+=N st 2310-2130 Полоса средней интенсивности, частота зависит от аниона
c=n+=n- 2050-2010 Очень сильная полоса Более узкие интервалы: 2050-2035 R-CB=N+=N - R: al или аг 2035-2010 R2-C=N+=N- R: al или аг Вне обычного диапазона: С=О st «1645 (R: al) 2100-2050 R-CO-C=N+=N- StS.^^1615 C=N+=N_ st sy: «1350, сильная 2180-2010 O=^2)=N =N- C=O st 1655-1560
6.9. Азотсодержащие соединения 283
6.9.7 Цианаты и изоцианаты
Цианаты
C=N st С-О st
3600 2800 2000 1600 1200 800 400
Изоцианаты
%T
-N=C=O st as
-N=C=O st sy
3600 2800 2000 1600 1200 800 400
Типичные диапазоны (p в см
Отнесение Диапазон Примечания
OC=N st 2260-2130 Интенсивность от средней до сильной
2220-2130 (OC=N)_
1335-1290 (OC^N)- st sy
С-О st 1200-1080 Сильная полоса
N=C=O st as 2280-2230 Сильная, узкая полоса
«2300 -cf2nco
N=C=O st sy 1450-1380 Слабая полоса
Вне обычного диапазона:
2222 2233 (N=C=D)-
284 б. ИК спектроскопия
Примеры (и в см *)
CH3NCO 2265
^NCO 2256
(1629 С=С)
NCO 2280
NCO
2270
2267
NCO
2246
6.9.8 Тиоцианаты и изотиоцианаты
Тиоцианаты
Изотиоцианаты
6.9. Азотсодержащие соединения 285
Типичные диапазоны (у в см х)
Отнесение Диапазон Примечания
SC=N st 2170-2130 Средняя, узкая полоса
2090-2020 (SC=N)-
С—S st 750-550 Часто две полосы
N=C=S st as 2200-2050 Очень сильная, обычно 2 полосы, резонанс Ферми
N=C=S st sy 950-650
«950 al -N=C=S
700-650 аг -N=C=S
Вне обычного диапазона:
2090-2020 (N=C=S)“
C-N st 1090-1075
Примеры (р в см г)
CH3NCS чистое в-во: 2206 2114 в СС14: /-"\^NCS 2173 I 2221 2097 2106 2068 2077
NCS
2105
2062
чистое в-во: 2090
в СС14: 2065
в СНС13:2112
286 6. ИК спектроскопия
6.10 Серосодержащие функциональные группы
6.10.1 Тиолы и сульфиды
S-Hst
Л/ \г
СН2 и СН3 5
C-S st
3600 2800 2000 1600 1200 800 400 Типичные диапазоны (а в см-1) Отнесение Диапазон Примечания S—Н st 2600-2540 Часто слабая, узкая полоса S—Н S 915-800 Слабая, практического значения не имеет С—S st 710-570 Слабая, широкая, практического значения не имеет S—S st «500 Слабая, практического значения не имеет Также «2880 (S—)СН3 st as «2860 (S—)СН2 st as «1430 (S-)CH3 <5 as 1330-1290 (S-)CH3 6 sy «1425 (S-)CH2 6 815-755 S—F st, сильная полоса «630 S-N st в S—N=O 725-550 S—С в S—C^N, часто две полосы
s
Примеры (а в см х)
2950
698
668
641
2525
6.10. Серосодержащие функциональные группы 287
6.10.2 Сульфоксиды и сульфоны
Сульфоксиды
S=O st
3600 2800 2000 1600 1200 800 400
Сульфоны
%T
SO2 st as^^^^S-O st
SO2 st sy
3600 2800 2000 1600 1200 800 400
Типичные диапазоны (p в см x)
Отнесение Диапазон Примечания
S=O st 1225-980 Сильная, иногда несколько полос Более узкие интервалы: 1060-1015 R-SO-R «1100 R-SO-OH S-0 st 870-810
«1135
R-SO-OR
OH st свободная группа «3700,
связанная Н-связью «2900, «2500
S-0 st 740-720, 710-690
1225-1195 RO-SO-OR
«1135
R-SO-C1
«1030, «980
«1100, «1050
R-SO2
R=SO
N=SO: «1250, «1135
288 б. ИК спектроскопия
s
Отнесение Диапазон Примечания
\ st as / *О st sy 1420-1000 Очень сильная полоса Более узкие интервалы: 1370-1290, R-SO2-R 1170-1110 1375-1350, R-SO2-OR 1185-1165 «1340, «1150 R-SO2-SR 1415-1390, RO-SO2-OR 1200-1185 1365-1315, R-SO2-N 1180-1150 N-H st: 3330-3250; N-H 6: «1570; S-N st: 910-900 1410-1375, R- SO2-hal 1205-1170 1355-1340, R—SO2—ОН О—H st, Н-связанная: 1165-1150 « 2900, «2400 гидратированная форма: 2800-1650, широкая полоса 1250-1140, R-SO3 1070-1030 1315-1220, RO-SO3 1140-1050
S—О st 870-690 Полоса переменной интенсивности, в сульфидах слабая
6.10. Серосодержащие функциональные группы 289
6.10.3 Производные тиокарбонильных соединений
Типичные диапазоны (р в см т)
Отнесение Диапазон Примечания
C=S st 1275—1030 Сильная, узкая полоса Более узкие интервалы: 1075-1030 Тиокетоны 1210-1080 Сложные тиоэфиры
«1215 Дитиокарбоновые кислоты SH st: «2550 SH 5: «860
1125-1075 Фторангидриды тиокарбоновых кислот перфторированные: 1130-1105
1100-1065 Хлорангидриды тиокарбоновых кислот перхлорированные: 1100-1075
1140-1090 Тиоамиды и тиолактамы C-N st: 1535-1520 NH 6: 1380-1300
Также 750-580 P=S st
6.10.4 Производные тиокарбоновых кислот
Тритиокарбонаты
%т
S-Hst
C=S st
3600 2800 2000 1600 1200 800 400
290 б. И К спектроскопия
Ксантаты
%T
S-Hst
СОС st >s st
COC st sy
3600 2800 2000 1600 1200 800 400
Тиокарбонаты
C=S st
3600 2800 2000 1600 1200 800 400
Тиомочевины
C=S st
s
3600 2800 2000 1600 1200 800 400
Типичные диапазоны (у в см х)
Отнесение Диапазон Примечания
S-H st 2560-2510 2600-2500 Слабая, узкая полоса в тритиокарбонатах Слабая, узкая полоса в ксантатах
C=S st 1100-1020 1070-1000 1250-1180 1400-1100 Очень сильная полоса в тритиокабонатах Сильная полоса в ксантатах Сильная полоса в тиокарбонатах Сильная полоса в тиомочевинах
СОС st as 1260-1140 Сильная полоса в ксантатах
COC st sy 1150-1090 Полоса от сильной до средней интенсивности в ксантатах
Примеры (у в см х)
в ССЦ:
1719
в СС14:
1718
1677
1640
6.10, Серосодержащие функциональные группы 291
в CCI4:
1653
в CCI4*
1757
S S
чистое
вещество:
1076
тверд.:
1058
в СС14:
1083
1079
в CCI4:
1662
HS
газ:
2593
2548
чистое
вещество:
2470
S
в CS2:
2562
2522
О'
тверд.:
1212
тверд.:
1234
тверд.:
1400
тверд.:
ИЗО
тверд.:
1131
292 6. И К спектроскопия
6.11 Карбонилсодержащие соединения
6.11.1 Альдегиды
Типичные диапазоны (у в см ')
Отнесение Диапазон Примечания
С—Н comb 2900 2800 Слабая полоса, резонанс Ферми с С—Н <5 при «1390
С=О st 2780-2680 Для крайнего положения С—Н S только одна полоса Более узкие интервалы: 2830-2810, Алифатические соединения 2720-2690 2830-2810, Ароматические соединения, для о-замещения 2750-2720 часто более высокая частота В этом же диапазоне: циклогексаны при «2700, слабая полоса 1765-1645 Сильная полоса
С-Н 6 Более узкие интервалы: 1740-1720 Алифатические соединения 1765-1730 а-Галогенсодержащие алифатические соединения 1710-1685 Ароматические соединения 1695-1660 ct,ДНенасыщенные ароматические соединения 1670-1645 С внутримолекулярными Н-связями 1390 Слабая полоса, практического значения не имеет
6.11. Карбонилсодержащие соединения 293
Примеры (у в см х)
СН3СНО 1748
СС13СНО 1760
1742
1700
в СС14:
1717
в СНС]3:
1710
%т
6.11.2 Кетоны
C-Ost
3600 2800 2000 1600 1200 800
400
Типичные диапазоны (у в см х)
Отнесение Диапазон Примечания |
С=О st 1775-1650 Сильная полоса
Более узкие интервалы:
«1715 Алифатические, разветвление в «-положении смещает полосу в область низких частот: О О «1695 ~1685
«1775-1705 Циклические, v уменьшается с увеличением размера цикла
|см. след, стр.]
294 б. ИК спектроскопия
Отнесение Диапазон Примечания ° ? «1775 —1750 ° А «1715 ^2^ «1705
Сопряженные «1675 о-Д-Ненасыщенные, часто 2 полосы (поворотные изомеры)
1650-1600 С=С st О
«1695 £>—al
«1665 аД;7,ФНенасыщенные; а,/3;а'Д'-ненасыщенные
«1670 [>-2-с=с
«1690 Арилкетоны Q
«1675 [Д—А аг
«1665 Диарилкетоны с N или О в тг-положении: частота понижается до «1600
а- Галоген- Полоса смещается в область более высоких волновых чисел в
замещенные зависимости от величины двугранного угла р между С=0 и
кетоны: С—hal; наибольший эффект для р = 0°, для р = 90° эффекта
нет.
Максимальные
смещения: а-хлор «25 а-бром «20 сца-дихлор «45 о-иод «0 а,о/-дихлор «45 а,а-дифтор «60 перфтор «90
а-Дикетоны «1720 «1775, 1 «1760 «1760 «1730 «1675 «1680 «1675 ДДикетоны: «1720 «1650 «1615 Алифати ческие Алифатические 5-членные циклы Алифатические 6-членные циклы Алифатические енолы, С=С st: «1650 Ароматические о-Хиноны с пери-ОН-группами: «1675, «1630 Кетоформа, иногда две полосы Енольная форма Енол с внутримолекулярной Н-связью, С=С st: «1600 сильная полоса
6.11. Карбонилсодержащие соединения 295
Отнесение Диапазон Примечания
7-дикетоны «1675 Как в монокетонах тг-Хиноны, с перп-ОН-группами: «1675, «1630:
С=С=О st as 2155-2130 С=С st: «1600 Очень сильная полоса
Примеры (у в см х)
1691
1697
s-транс
s-цис
1690
1707
s-транс s-цис
1724 (кетонная
форма)
1608 (енольная
форма)
1590
1630
1607
296 б. И К спектроскопия
с=х
1675
1678
6.11.3 Карбоновые кислоты
Карбоновые кислоты
%Т
О-Н st
(свободная)
Н-связью)
С=О st
О-Н 8 ip
О-Н 8 оор
3600 2800 2000 1600 1200 800
400
Карбоксилат-анионы
%Т
i .................
V COO’st sy
COO st as
3600 2800 2000 1600 1200 800
400
6.11. Карбонилсодержащие соединения 297
Типичные диапазоны (у в см *)
Отнесение Диапазон Примечания
СОО-Н st 3550-2500 Переменная интенсивность
Более узкие интервалы:
3550-3500 Свободная группа, узкая полоса только в силь- норазбавленных растворах
3300-2500 Связанная Н-связью группа, широкая полоса, часто более одной полосы
В этом диапазоне также ОН st, NH st, CH st, SiH st,
SH st, PH st
С=О st 1800 1650 Сильная полоса
1800 1740 Свободные группы (также в дикарбоновых кислотах)
1740-1650 Н-связанные (димер, также в дикарбоновых кислотах)
Более узкие интервалы: для С=О, связанных Н-связью:
1725-1700 al-COOH
1715-1690 С=С-СООН
1700 1680 аг-СООН
1740-1720 hal-C-COOH
1670-1650 Внутримолекулярная Н-связь
ОС-ОН st, С-ОН <5 1440-1210 Практического значения не имеет
ОС—ОН 6 оор 960-880 Полоса средней интенсивности, обычно широ- кая (только в димерах), в этом же диапазоне: =СН <5, ar СН ё, NH 6
(COO)- st as 1610-1550 Очень сильная полоса; в а-галогенкарбоксила- тах вблизи высокочастотного края диапазона; в соединениях, содержащих более одного о-га- логена, вне обычного диапазона; в полипепти- дах при «1575
(COO)- st sy 1450-1400 Сильная полоса, практического значения । не имеет, в полипептидах при «1470
(COO)- 6 «775 Формиаты, слабая полоса
«925 Ацетаты 1
«680 Бензоаты
«600 CF3COO-
Примеры bcm *)
О чистое в-во: С ) чистое в-во: О в СС14:
If'OH 1727 Л <он 1759 >Лон 1704
В СС14: 1718 I тверд, в-во:
1756 в СС14: 1686
1724 1768
С = Х
1717
298 б. И К спектроскопия
С=Х
ОН
чистое
вещество:
1700
в СС14:
1694
чистое
вещество:
1725
О
чистое
вещество:
1730
О ^У^О- nj£ тверд.: 1605
о тверд.:
ноу^он 1650
о
ОН
тверд.:
1690
в СС14:
1730
в СНС13:
1706
тверд.:
1667
в СС14:
1696
в СНС13:
1661
О "у^он nj£ тверд.: 1740 о КОН о в СС14: 1788 1725
о о тверд.: о тверд.:
НО'^^'ОН 1735 1703 П О Х'-'АОН 1724
в СС14:
1750
тверд.:
1690
5)Н тверд.:
1690
и ОН
тверд.:
1693
в СС14:
1696
6.11.4 Сложные эфиры и лактоны
6.11. Карбонилсодержащие соединения 299
Типичные диапазоны (и в см L)
Отнесение Диапазон Примечания
С=О st 1790-1650 Сильная полоса Более узкие интервалы: 1750 1735 Алифатические сложные эфиры
Сопря- 1730-1710 «,/3-Ненасыщенные сложные эфиры
женные 1730-1715 Ароматические сложные эфиры
сложные 1690-1670 С внутримолекулярными Н-связями
эфиры 1790-1740 «1760 о-Галогенпроизводные сложных эфиров Виниловые сложные эфиры, С=С st: 1690-1650,
Диэфиры
Кетоэфиры
сильная полоса
«1760 Сложные эфиры фенолов
«1735 Сложные эфиры фенолов и ароматических кислот
Как в соответствующих сложных моноэфирах
1755-1725 а-Кетоэфиры, обычно одна полоса
«1750 (кетон) /З-Кетоэфиры, кетоформа
«1735 (сложный эфир)
1650 /З-Кетоэфиры, енольная форма, С=С st: ; сильная полоса «1630,
1740, 1715 7-Кетоэфиры, псевдоэфиры: «1770
«1840
Лактоны
«1735
«1750 (дополнительная
полоса при «1780, если
«-положение свободно)
|| 1
1760 Г 1 «1720
О 'О
С-О st
С—О st as
1330-1050
II J «1730 (часто
О" О две полосы)
2 полосы: st as, очень сильная полоса с большей
частотой; st sy, сильная полоса с меньшей частотой
Более узкие интервалы:
«1185 Формиаты, пропионаты, высшие алифатические сложные эфиры
«1240 Ацетаты
«1210 Виниловые сложные эфиры, фенольные сложные эфиры
«1180 7-Лактоны, 5-лактоны
«1165 Метиловые сложные эфиры алифатических кислот
В этом же диапазоне: сильные полосы для С-F st, С—N st, N—О st, Р—О st, С—S st, S=O st, Р=О st, Si—О st, Si-H <5
300 б. И К спектроскопия
Примеры (у в см х)
X 1730
1787
1747
1726
1730
(1658)
(1638)
1724
1752
(1675)
1725
сложный
эфир: 1704
кетон: 1690
енол: 1645
1774
1754
1760
1742
О
1734
О
ОН О
1766
1746
О
1684
6.11. Карбон илсодержащие соединения 301
6.11.5 Амиды и лактамы
Первичные амиды
%т
w
NH2 st С.=О st
3600 2800 2000 1600 1200 800 400
Типичные диапазоны (р в см х)
Отнесение Диапазон Примечания
N—Н st 3500-3100 Полоса средней интенсивности, в первичных
амидах две полосы, в белках несколько полос
Более узкие интервалы:
3500-3400 Свободная группа
3350-3100 Связанная Н-связью
«3350, «3180 В первичных амидах обычно две полосы
302 б. ИК спектроскопия
Отнесение Диапазон Примечания
«3200, В лактамах обычно две полосы
«3100
«3200 Моногидразиды
«3100 Дигпдразиды
«3250 Имиды
В этом :ж:е. диапазоне: ОН st, =CII st («3300, узкая полоса),
Н2О
С=О st (амид I) 1740-1630 Обычно сильная полоса
Более узкие интервалы:
«1690 NH2C=O свободные амиды, с Н-связью «1650
«1685 NHC=O свободные амиды, с Н-связью «1660
«1650 NC=O свободные амиды, с Н-связью «1650
«1745 Лактамы с 4-членным циклом
«1700 Лактамы с 5-членным циклом
«1650 Лактамы с 6-, 7-членными циклами
«1670 А 1оногидразиды
«1600 Дигидразиды
1740-1670 Имиды
«1750, Имиды с 5-членным циклом, 2 полосы
1700 1655 1630 Полипе птиды
«1690 Изоциаиураты, с ароматическим замещением при «1770
«1720
1755 sh Трифторацетамиды
NH S и 1630- 1510 Обычно сильная полоса,
N—С=О st sy Более узкие отсутствует в лактамах интервалы:
(амид II) «1610 NH2C=O свободная, с Н-связью «1630
с=х «1530 NHC=O, с Н-связью «1540
1560-1510 Полипептиды
«1555 Т рифторацетамиды
C-N st (?) «1100 nh2c=o
«1250 NHC=O
«1330 Лактамы
NH S ip «1150 NH2C=O
«1465 Лактамы
NH S oop 750 600 nh2c=o
«700 NHC=O
«800 Лактамы
6.11. Карбонилсодержащие соединения 303
Примеры (у в см *)
О
Н N'
Н
чистое
вещество:
1672
в СНС13:
1709
чистое
вещество:
1672
О
ЛгГ
I
чистое
вещество:
1670
в СНС13:
1673
тверд.:
1631
в СНС13:
1679
О
^N'
Н
в СС14:
1690
О
в СС14:
1647
тверд.:
1677
в CS2:
1675
1650
тверд.:
1656
в СНС13:
1678
тверд.:
1658
в СНС13:
1691
в СС14:
1705
в СС14:
1667
чистое
вещество:
1700
1625
1540
тверд.:
1628
1595
тверд.:
1631
1584
О О
тверд.:
1734
1505
тверд.:
1736
1706
1689
тверд.:
1771
1698
в СС14:
1753
1727
304 6. И К спектроскоп ия
тверд.: /Р в СНС13: /Я в ССЦ:
1760 1783 г~^ 1742
1690 | N-Br 1733 < NH 1730
в СС14: 1721 V О о 1718
1705
тверд.: О тверд.: О в СНС13:
1718 1774 1772
1670 [ |Г nh 1749 [ rN- 1712
в СС14: 1729, 1686 о 1724 в СНС13: 1778 1735 о
тверд.:
1790
1735
6.11.6 Ангидриды кислот
C=Ostsy C=Ostas
3600 2800 2000 1600 1200 800 400
6.11. Карбонилсодержащие соединения 305
Типичные диапазоны (у в см х)
Отнесение Диапазон Примечания
С=О st sy 1870-1770 Сильная полоса
С=О st as 1800-1720 Сильная полоса Более узкие интервалы: «1820, «1760 Линейные ангидриды, полоса с большей частотой интенсивнее «1850, «1775 5-Членный цикл, полоса с меньшей частотой интенсивнее «1800, «1760 6-Членный цикл, полоса с меньшей частотой интенсивнее
С-О-С st 1300-900 «1040 «920 Сильная, несколько полос Линейные ангидриды Циклические ангидриды
Примеры (у в см х)
1780
1725
1810
1740
1045
1040
1790
1727
1035
1015
995
1865
1782
920
1803
1743
1859
1789
1845
1780
1850
1800
900
1840
1810
1760
912
1802
1761
1802
1761
306 6. ИК спектроскопия
6.11.7 Галогенангидриды кислот
Типичные диапазоны (и в см х)
Отнесение Диапазон Примечания
С=О st 1820-1750 в хлорангидридах сильная, узкая или средней ширины полоса, в бромангидридах и иодангид- ридах при более низкой частоте
1900 1870 во фторангидридах сильная, узкая или средней ширины полоса, в хлор- и бромангидридах аро- матических кислот дополнительная полоса при «1725
С-СО st 1000-800 1000-900 al, отнесение ненадежно 900-800 аг, отнесение ненадежно
С—hal st 1200-500 1200-800 F 750-500 С1 700-500 Вг 600-500 I
6.11. Карбонилсодержащие соединения 307
6.11.8 Производные карбоновых кислот
Производные карбоновых кислот
C=Ost
3600 2800 2000 1600 1200 800 400
Карбаматы
N-Hst
\ / V у N-CO-O st sy
V N-CO-O st as
COst
3600 2800 2000 1600 1200 800 400
Мочевины
CO st
3600 2800 2000 1600 1200 800 400
Типичные диапазоны (у в см х)
Отнесение Диапазон Примечания
С=О st 1820-1740 Сильная полоса в производных карбоновых кислот
1750-1680 1690-1620 С—О st as 1260-1150 Сильная полоса в карбаматах Сильная полоса в мочевинах Сильная полоса в производных карбоновых
кислот
308 б. ИК спектроскопия
Отнесение Диапазон Примечания
N-H st 3500 3250 Полосы средней интенсивности в карбаматах, две полосы для NH2, одна полоса для NH
3500 3200 Полосы средней интенсивности в мочевинах, две полосы для NH2
N-H <5 1650-1500 Полоса средней интенсивности в карбаматах
NH2 <5 1650-1600 Полоса средней интенсивности в мочевинах
N—СО—О st as 1270-1210 Полоса средней интенсивности в карбаматах
N—CO—О st sy 1050-850 Слабая полоса в карбаматах
C-N-H <5 1600 1500 Слабая полоса в мочевинах
Примеры (р в см х)
в СНС13:
1725
в СС14:
1727
О
в СНС13:
1684
о тверд.: о в СС14: О в СС^:
H2N Г) кш 1690 О АГА 1758 в СНС13: S. 1748
1751
о в СС14: О в СС14: о в СС14:
'Лх 1786 Л 1822 1748 1 1662
О в СС14: о в СС14: о 11 в СС14:
о" 1719 1653 1757
о в СС14 S чистое S тверд.:
А. 1718 \ Дх У' вещество: Ас 1058
1677 S S 1076 S S в СС14:
1640 1083
1079
0 тверд.: о тверд.: О тверд.:
д 1679 JJ 1645 А 1656
H2N' nh2 1627 N NH, н 1567 N NH2 1 1610
1418 1 1511
6.11. Карбонилсодержащие соединения 309
тверд.:
1667
1634
N NH
О
тверд.: Q тверд.:
1622 х. Д . 1645
1580 Y V 1560
1530 1497
в СНС13: СНС13:
1663 1548 1675
HN NH
в CCL4:
1735
1718
А
HN NH
тверд.:
1650
тверд.:
1776
1697
тверд.:
1712
1676
тверд.:
1748
1706
HN NH
тверд.:
1767
1695
NH чистое NH тверд.
Акт. вещество: А 1767
N 1 1600 HN_NH 1681 1621
газ:
2593
2548
чистое
вещество:
2470
в CS2:
2562
2522
тверд.:
1212
тверд.:
1234
S тверд.:
А 1400
H2N^NH2
S тверд.:
'Л' 1130
I I
тверд.:
1131
310 б. ИК спектроскопия
6.12 Другие соединения
6.12.1 Соединения кремния
%т
V
Si-Hst
Si-H8
3600 2800 2000 1600 1200 800 400
Типичные диапазоны (у в см х)
Отнесение Диапазон Примечания Si—Н st 2250-2090 Средняя интенсивность Более узкие интервалы: 2160-2090 R3Si—Н; для R так же, как и для Н, для SiH3 две полосы «2250 hal-Si-H 2220-2120 (Si-O)Si-H Si—Н <5 1010-700 Обычно 2 сильные широкие полосы (Si—)СН3 <5 as «1410 Слабая полоса (Si—)СН3 <5 sy 1275-1260 Очень сильная, узкая полоса, типичная для SiCH3, не расщепляется в случае Si(CH3)2 (Si—)СН3 7 860-760 «765 SiCH3 «855, «800 Si(CH3)2 I «840, «765 Si(CH3)3 Si-O st 1110-1000, 900- <600
Другие соед.
1110-1000, Si-O-C 850-800 1090-1030, Si—O—Si <650 900-800 Si-OH 3700-3200 Si-OH st «1030 Si-OH 6
6.12. Другие соединения 311
Отнесение Диапазон Примечания
Si—С st 850-650
Si—N st 1250-830
Более узкие интервалы:
950-830 Si-N-Si
«3400 Si2NH st
950-830 N-Si-N
1250-1100 Si—NH2
«3570, «3390 SiN-H2 st
«1540 Si-NH2 S
Si-F st 980-820
Более узкие интервалы:
920-820 Si-F
945-870 Si—F2, 2 полосы
980-860 Si—F3, 2 полосы
Si-Cl st <625
6.12.2 Соединения фосфора
Фосфины
Другие
соед.
%т
Р-Н st -СН3 и Р-Н 8 P-Cst
-СН2СН3
3600 2800 2000 1600 1200 800 400
312 б. И К спектроскопия
Типичные диапазоны (у в см х)
Отнесение Диапазон Примечания
Р-Н st 2440-2275 Обычно одна полоса, от слабой до средней, в КзРН+ очень широкая
РО-Н st 2700-2650 Очень широкая, слабая полоса
РОН comb 2300 2250 Очень широкая, слабая полоса
1740-1600 Дополнительная полоса в О=Р—ОН (димер?)
Р—О st 1260-855
Более узкие интервалы:
1050-970, Р—О—С al st; сильная полоса и часто слабая
830-740 высокочастотная и низкочастотная полоса соответственно
1260 1160 Р—О—С ar st
995-915 P(V)
875-855 P(III)
1100-940 Р—ОН st, широкая полоса, для Р(ОН)2 часто две полосы
980-900 Р—О-Р st
Р=О st 1300-960 Сильная полоса
Более узкие интервалы:
1190 1150 НзР=О, такая же частота для R: Н
1265-1200 R2(R'O)P=O, такая же частота для R: Н
1280 1240 R(R'O)2P=O, такая же частота для R: Н
1300-1260 (RO)3P=O
1220 1150 R(HO)2P=O
1250-990 R(HO)PO2 , более одной полосы
1125-970, 1000-960 RP0f“
1205-1090 R2(HO)P=O
1200 1090, 1090-995 R2PO2
—1250 RO(HO)2P=O
1230-1210, 1030-1020 RO(HO)PO2
1140 1050, 1010-970 ropq2-
1250-1210 (RO)2(HO)P=O
1285-1120, 1120-1050 (RO)2PO2-
1220 1170 R(RO)(HO)P=O
1245-1150, 1110-1050 R(RO)PO2
6.12. Другие соединения 313
Отнесение Диапазон Примечания
1240-1205 R 9 9 R R О R
1310-1260 RO-p p'OR RCr'CT'OR
«1195 HO^ $OH R'^O'^OR
«1275 RO.§ 4>OR r2n o nr2 R^ RO^O^OR
1265-1250
«1300, «1240 RCkS &NR2 RO' 'O NR2
«1250 О О ROji Д/OR Ж Ж НО О ОН
«1235 R2N £ ^nr2 RX о NR2
1265-1240 R2(X)P=O, X: F, Cl, Br
1365-1260 R(X)2P=O, X: F, Cl, Br
1330-1280 (RO)2(X)P=O, X: F, Cl, Br
1365-1260 RO(X)2P=O, X: F, Cl, Br
P=N 1500-1170
Р-ОН 6 «1280 Слабая полоса, практического значения
не имеет
Р-С st 800-700 Интенсивность меняется в широких пределах, практического значения не имеет
Р-Н <5 1090-910 Интенсивная, для (RO)2HP=O очень
интенсивная полоса
P-N-C st P=N—al st 1110-930, 770-680 1500-1230 Другие соед.
P=N—ar st 1390-1300
P=N—C=O st 1370-1310
P=N-PR2 st 1295-1170
P=S st 750-580 Интенсивность изменяется в широких пределах
P—S st <600
(Р-)СНз 6 sy 1310-1280
314 б. И К спектроскопия
Отнесение Диапазон Примечания
P-F st 905-760
pf2 1110-800 Более одной полосы
Р-Cl st <600
6.12.3 Соединения бора
Типичные диапазоны (у в см х)
Отнесение Диапазон Примечания
В-Н st 2640-2200 Сильная полоса
2200-1540 В—Н- • В, более одной полосы
В—О st 1380-1310 Очень сильная полоса
«1500 Галогеноксиды бора
Другие ВО-Н st 3300-3200 Очень широкая полоса
соед. В—N st 1550-1330 Очень сильная полоса
В-С st 1240-620 Сильная полоса, 2 полосы, если замещение сильно асимметричное
B-F st 1500-800
В—Cl st 1100-650
6.13. Аминокислоты 315
6.13 Аминокислоты
Типичные диапазоны (у в см х)
Отнесение Диапазон Примечания
N-H st 3400-2000 Обычно интенсивная, широкая,
О-Н st сильно структурированная полоса
Более узкие интервалы:
3100-2000 Цвиттер-ионы, характерная форма края полосы при 2200-2000
3350-2000 Г идрохлориды
3400-3200 Соли Na+
NIl+ 6 as 1660-1590 Слабая полоса, для гидрохлоридов около низкочастотного предела
NH+ 6 sy 1550-1480 Средняя интенсивность
COO- st as 1760 1595 Сильная полоса
Более узкие интервалы: Природ.
«1595 Цвиттер-ионы соед.
1755-1700 Гидрохлориды, в «-аминокислотах: 1760-1730
«1595 Соли Na+
316 6. ИК спектроскопия
6.14 Растворители, иммерсионные среды
и примеси
6.14.1 ИК спектры обычных растворителей
Низкое пропускание в областях поглощения растворителя может приводить
к искажениям. При интерпретации спектров эти области нужно исключать.
На следующих рисунках эти участки спектров отмечены темными полосами.
Хлороформ: кювета 0,2 мм
^100
§ 80
S 60
S 40
4000 3500 3000 2500 2000 1800 1600 1400 1200 1000 800 600
Хлороформ: кювета 1 мм
£ЯЮ0-г-----------------
ф
s
к
св
«
к
С
4000 3500 3000 2500 2000 1800 1600 1400 1200 1000 800 600
Четыреххлористый углерод: кювета 0,2 мм
£Я100
Четыреххлористый углерод: кювета 1 мм
^100
§ 80
« 60
S 40
on
4000 3500 3000 2500 2000 1800 1600 1400 1200 1000 800 600
Раствор.
6.14. Растворители, иммерсионные среды и примеси 317
Сероуглерод: кювета 0,2 мм
^100
Сероуглерод: кювета 1 мм
^100
6.14.2 И К спектры иммерсионных сред
Из-за трудности приготовления таблеток и тонких пленок минерального масла
воспроизводимой толщины полосы поглощения этих матриц (для суспензий)
всегда налагаются на спектр пробы.
Минеральное масло (нуйол): толщина 10 мкм
100
4000 3500 3000 2500 2000 1800 1600 1400 1200 1000 800 600
Бромид калия: таблетка
t£100
ф
S
«
св
К
с
о
Q.
80-
60-
40-
20-
0-
4000 3500 3000 2500 2000 1800 1600 1400 1200 1000 800 600
Раствор.
318 6. ИК спектроскопия
6.14.3 Полосы мешающих примесей в ИК спектрах
Следы воды в четыреххлористом углероде или хлороформе могут проявляться
в виде двух полос вблизи 3700 и 3600 см-1 и одной полосы в области 1600 см-1.
При повышении концентрации воды наблюдается широкая полоса около
3450 см-1. Пары воды проявляются в виде многочисленных узких полос между
2000 и 1280 см'1. При более высоких концентрациях они могут снижать чув-
ствительность детектора и проявляться в виде плеча на крутом склоне силь-
ного сигнала.
Растворенный диоксид углерода дает полосу поглощения при 2325 см-1.
В содержащих амины и следы воды растворах СОг может образовывать кар-
бонаты, которые ведут к появлению неожиданных полос протонированных
N-содержащих групп. В плохо сбалансированных двухлучевых инструментах
газообразный СО2 может давать две полосы приблизительно около 2360 и
2335 см-1, а также одну полосу при 667 см-1.
Хлороформ, насыщенный водой: кювета толщиной 0,2 мм
100
§ 80
Й 60
S 40
on
4000 3500 3000 2500 2000 1800 1600 1400 1200 1000 800 600
Пары
100
g 80
® 60
Й 40
в 20
О г,
4000 3500 3000 2500 2000 1800 1600 1400 1200 1000 800 600
Доступные полимерные материалы часто содержат в качестве пластификато-
ров фталаты, которые могут быть обнаружены в кажущихся чистыми пробах
и проявляться в виде полосы при 1725 см'1. Присутствие фталатов подтвер-
ждается масс-спектрами (m/z 149). В химических процессах фталаты могут
превращаться во фталевый ангидрид, который дает полосу при 1755 см'1.
Другими часто встречающимися загрязнителями являются силиконовые
смазки, из-за которых появляется полоса около 1625 см'1 и широкий сигнал в
области от 1100 до 1000 см'1.
Раствор.
Масс-спектрометрия
7.1 Алканы [1]
7.1.1 Неразветвленные алканы [2, 3]
Фрагментация. Алкильные фрагменты большего размера (с Сп>4) образуются
главным образом при прямом распаде. Их дегидрогенирование сопровождает-
ся перегруппировками с участием атомов Н и скелета. Алкильные фрагмен-
ты меньшего размера (от Сг до С4) образуются при вторичном распаде более
крупных алкильных фрагментов. Одновременно происходит элиминирование
групп из середины цепи (и рекомбинация ее концов).
Серии ионов. Последовательности пиков, соответствующие CnH2n+i (m/z 29,
43, 57, 71,...), сопровождаются сигналами CnH2n-i (m/z 27, 41, 55, 69,...) и
CnH2n (m/z 28, 42, 56, 70,...) меньшей интенсивности.
Интенсивности. Максимум интенсивности находится при m/z 43 или 57; при
увеличении масс интенсивность локальных максимумов плавно уменьшается,
минимум при [М—15]+.
Молекулярный ион. Сигнал средней интенсивности.
7.1.2 Разветвленные алканы
Фрагментация. В большинстве случаев наблюдается простое расщепление свя-
зи преимущественно у узловых атомов С, на которых в основном остается по-
ложительный заряд. При этом происходят многочисленные миграции атомов Н
и перегруппировки скелета, что делает невозможной специфическую локали-
зацию тяжелых изотопов.
R* +' -R3H R1 +’ -R3 “
Ъ=СНЕ2 <— CH-CH2R2 —► R1-CH-CI I2R2
H R3
Серии ионов. Последовательности пиков, соответствующие CnH2n+i (m/z 29,
43, 57, 71,...), сопровождаются сигналами CnH2n-i (m/z 27, 41, 55, 69,...) и
CnH2n (28, 42, 56, 70,...) меньшей интенсивности.
320 7. Масс-спектрометрия
Интенсивности. Локальные максимумы интенсивности соответствуют массам
фрагментов, которые образуются в результате разрыва связей при атомах С
с разветвлениями, если там локализован заряд. Эта закономерность наблюда-
ется в обоих рядах CnH2n+i и СпНгп (в последнем часто в более характерном
виде).
Молекулярный ион. Интенсивность сигнала уменьшается с увеличением степе-
ни разветвленности. В сильноразветвленных системах М+' не наблюдается.
7.1.3 Литература
[1] Bursey J. Т., Bursey М. М., Kingston D. G., “Intramolecular hydrogen transfer
in mass spectra. 1. Rearrangements in aliphatic hydrocarbons and aromatic
compounds”, Chem. Rev., 73, 191 (1973).
[2] Levsen K., Heimbach H., Shaw G. J., Milne G. W. A., “Isomerization of hydro-
carbon ions. VIII. The electron impact induced decomposition of n-dodecane”,
Org. Mass Spectrom., 12, 663 (1977).
[3] Lavanchy A., Houriet R., Gaumann T., “The mass spectrometric fragmentation
of zi-alkanes”, Org. Mass Spectrom., 14, 79 (1979).
7.2. Алкены 321
7.2 Алкены [1-4]
7.2.1 Неразветвленные алкены
Фрагментация. Преобладает отщепление алкильных остатков и нейтральных
алкенов. Можно определить положение высокозамещенных двойных связей,
так как в этом случае элиминирование алкенов является специфической реак-
цией типа перегруппировки Мак-Лафферти. В других случаях для определе-
ния положения двойных связей можно использовать либо такие производные,
как эпоксиды и гликоли, либо методики с низкой энергией ионизации. Влия-
ние разветвлений цепи менее характерно, чем в изоалканах. Сходные спектры
имеют алициклические соединения.
Серии ионов. Последовательности пиков, соответствующие CnH2n-i (m/z 41,
55, 69, 83,...), сопровождаются сигналами алкильных и алкеновых ионов
CnH2n+i (m/z 43, 57, 71, 85,...) и СПН2П (m/z 42, 56, 70, 84,...) обычно меньшей
интенсивности.
С=С
Интенсивности. Преобладающие максимумы в области более низких масс око-
ло С4. Локальные максимумы четных масс возникают в результате элимини-
рования алкенов в случае высокозамещенной двойной связи.
Молекулярный ион. Пик имеет существенную величину, но не обязательно ин-
тенсивный.
7.2.2 Разветвленные алкены
Фрагментация. Высокозамещенные двойные связи перемещаются труднее, чем
незамещенные, что ведет к специфическому отщеплению алкена по типу пере-
групировки Мак-Лафферти и существенному локальному максимуму интен-
сивности, соответствующему СПН2П (см. схему). Последний позволяет опре-
делять положение двойной связи. В случае незамещенных двойных связей на-
дежное определение их положения невозможно, наблюдаются только умеренно
полезные эффекты разветвления. Положение разветвлений легче устанавлива-
ется после восстановления до алканов (непосредственно в хроматомасс-спектро-
метре газом-носителем Н2 над нагретой Pt в качестве катализатора).
(см. примечание на с. 55)
Серии ионов. Наблюдаются максимумы алкенового типа (CnH2n_i, m/z 41, 55,
69, 83,...), сопровождаемые менее интенсивными пиками алкильных фрагмен-
322 7. Масс-спектрометрия
тов CnH2n+i (m/z 43, 57, 71, 85,...) в области низких масс и более интенсив-
ными пиками алкенильных ионов CnH2n (m/z 42, 56, 70, 84,...).
Интенсивности. Наблюдаются интенсивные пики в области низких масс. Для
диагностики важны локальные максимумы четных масс, часто в области более
высоких масс.
Молекулярный ион. Обычно имеет значительную величину.
7.2.3 Полиены и полиины
Фрагментация. Спектры алифатических соединений с несколькими тройными
и/или двойными связями имеют сходство со спектрами ароматических углево-
дородов.
Серии ионов. Очень похожи на серии ионов в ароматических соединениях, но в
полиенах и полиинах обычно возникают фрагменты с более высоким содержа-
нием водорода, чем в ароматических соединениях (m/z 54, 55, 66, 67, 79, 80).
Интенсивности. Сходны с распределением интенсивностей пиков для аромат
тических соединений.
Молекулярный ион. Обычно интенсивный пик, как и в ароматических соеди-
нениях.
7.2.4 Литература
[1] Loudon A. G., Maccoll A., “The mass spectrometry of the double bond”. In:
The Chemistry of Alkenes; J. Zabicky, Ed.; Interscience, London, 1970; p. 327.
[2] Bursey J. T., Bursey M. M., Kingston D. G., “Intramolecular hydrogen transfer
in mass spectra. 1. Rearrangements in aliphatic hydrocarbons and aromatic
compounds”, Chem. Rev., 73, 191 (1973).
[3] Jensen N. J., Gross M. L., “Localization of double bonds”. Mass Spectrom. Rev.,
6, 497 (1987).
[4] Dass C., “Ion-molecule reactions of [ketene]+’ as a diagnostic probe for distin-
guishing isomeric alkenes, alkynes, and dienes: A study of the C4H8 and CjHj
isomeric hydrocarbons”, Org. Mass Spectrom., 28, 940 (1993).
7.3. Алкины 323
7.3 Алкины [1]
7.3.1 Алифатические алкины
Фрагментация. Склонность к отщеплению неацетиленовых Н’ от М+'. Значи-
тельные перегруппировки (включая последовательные перегруппировки Мак-
Лафферти по тройной связи) ведут к нехарактеристическому распаду:
Продукты перегруппировки с m/z 82 и 96 доминируют в неразветвленных ал-
кинах с Сп>8- Происходит последовательная потеря метильных радикалов. Как
правило, определение положения тройной связи ненадежно, за исключением
производных (как в аддуктах этиленгликоля [1], см. схему).
R1
С НОСН2СН2ОН
III ---------►
с
R2
rV
*"--o/ch2r2
R2
Г х 1
Серии ионов. Заметные пики СпН2П-з (m/z 25, 39, 53, 67, 81,...), сопровож-
дающиеся пиками СпН2п-1 (m/z 41, 55, 69, 83,...) и пиками алкильных ионов
СпН2п+1 (m/z 43, 57, 71, 85,...). Иногда наблюдаются максимумы с четными
массами CnH2n-2 (m/z 26, 40, 54, 68, 82,...).
Интенсивности. Интенсивные пики в основном в области более низких масс.
Молекулярный ион. Пик слабый или совсем отсутствует в спектрах молекул
малого размера, значительный в спектрах более крупных молекул. Обычно
присутствует пик [М—1]+. В монозамещенных ацетиленах обычно более ин-
тенсивный, чем М+-.
7.3.2 Литература
[1] Lifshitz С., Mandelbaum A., “Mass spectrometry of acetylenes”. In: The Che-
mistry of the Carbon-Carbon Triple Bond; S. Patai, Ed.; Wiley, New York,
1978; p. 157.
324 7. Масс-спектрометрия
7.4 Алициклические углеводороды [1]
7.4.1 Циклопропаны [2, 3]
Фрагментация. Обычно спектры циклопропанов и алкенов очень похожи, так
как при энергии ионизации 70 эВ кольцо легко изомеризуется в соответствую-
щие алкенильные катион-радикалы.
кДж/моль
42
с3н^+н-
205
Координата реакции
Фрагментация преимущественно происходит по узловым атомам С. Преоб-
ладает потеря алкильных остатков и нейтральных алкенов. Кольцо в моно-
замещенных циклопропанах раскрывается исключительно по 1,2-, но не по
2,3-связи. Первоначально образующаяся двойная связь находится предпочти-
тельно (для R = ОСНз) или исключительно (для R = Н, alk, СООСН3)
в /3,7-положении (даже для СООСН3, где а,/3-ненасыщенность термодинами-
чески более выгодна).
3
Молекулярные ионы циклопропилцианида, аллилцианида, метакрилонитрила
и пиррола перегруппировываются в один общий ион-радикал, наиболее веро-
ятно, пиррол [4].
Серии ионов. Последовательность максимумов, соответствующая СпН2П-1
(m/z 41, 55, 69, 83,...), сопровождается пиками алкильных и алкенильных
ионов типа СпН2п+1 (m/z 43, 57, 71, 85,...) и CnH2n (m/z 42, 56, 70, 84,...)
обычно меньшей интенсивности.
Интенсивности. Преобладают пики в области низких масс, преимущественно
около С4. Локальные максимумы с четной массой появляются в результате
элиминирования алкена, если возникает высокозамещенная двойная связь.
Молекулярный ион. Сигнал заметный, но не обязательно интенсивный.
7.4. Алициклические углеводороды 325
7.4.2 Насыщенные моноциклические углеводороды [5]
Фрагментация. Преимущественная первичная фрагментация происходит по
связям с узловыми атомами С с последующим отщеплением алкильных остат-
ков и алкенов.
Серии ионов. Последовательности сигналов, соответствующие CnH2n-i (m/z 41,
55, 69, 83,...), сопровождаются сигналами CnH2n+i (m/z 43, 57, 71, 85,...) и
CnH2n (m/z 42, 56, 70, 84,...) меньшей интенсивности. Из-за сходства этих
сигналов с алкеновыми сериями их надежное распознавание обычно затруд-
нено.
Интенсивности. Полное распределение пиков имеет максимум в области более
низких масс около С4 или С5. Локальные максимумы могут возникать из-за
эффектов разветвления.
Молекулярный ион. Сигнал значимый, обычно имеет среднюю интенсивность.
7.4.3 Полициклические алициклы
Фрагментация. Наиболее важный первичный распад рядом с атомами С с
сильным разветвлением, в дальнейшем происходят миграция водорода и слож-
ная фрагментация.
Серии ионов. При увеличении числа колец положение сигналов ненасыщен-
ных углеводородных фрагментов в области более высоких m/z смещается от
CnH2n—j (m/z 41, 55, 69, 83,...) до CnH2n_3 (m/z 39, 53, 67, 81,...) и СпН2п_5
(m/z 51, 65, 79, 93,...). Обычно максимумы в области более низких m/z при-
надлежат частицам с более низкой степенью ненасыщенности, чем у частиц,
чьи сигналы находятся в области более высоких m/z.
Интенсивности. Главные максимумы распределены равномерно, интенсив-
ность несколько выше в области высоких масс или молекулярного иона М+’.
Молекулярный ион. Интенсивный пик.
7.4.4 Циклогексены
Фрагментация. Потеря больших заместителей, а также ретрореакция Дильса-
Альдера приводят к появлению максимумов с четными массами с одним или
двумя эквивалентами двойных связей CnH2n (m/z 42, 56, 70, 84,...) и СпН2п_2
(m/z 40, 54, 68, 82,...), если продукт этой реакции не этилен. Несколько неожи-
данно основной пик циклогексена наблюдается при [М—15]+ .
326 7. Масс-спектрометрия
В результате ретрореакции Дильса-Альдера часто образуется заметное коли-
чество фрагментов циклогексенов и 1,4-циклогексадиенов:
Миграция двойной связи до распада может произойти или не произойти. Воз-
можно преобладание и других путей фрагментации. Таким образом, надеж-
ное определение положения двойной связи в производных циклогексена неиз-
вестной структуры не всегда возможно. Например, основной пик в спектре
1,2-диметилциклогексена находится при m/z 68, а не при ожидаемой величине
m/z 82.
Серии ионов. Фрагменты ненасыщенных углеводородов в области более высо-
ких m/z смещены относительно циклогексановых фрагментов на две единицы
массы к СпН2п-з (m/z 39, 53, 67, 81,...). Обычно максимумы в области низких
значений m/z относятся к фрагментам с меньшей степенью ненасыщенности,
чем максимумы в области более высоких m/z.
Интенсивности. Интенсивные пики равномерно распределены по всему
спектру.
Молекулярный ион. Пик средней интенсивности (около 40% в циклогексене).
7.4.5 Литература
[1] Bursey J. Т., Bursey М. М., Kingston D. G., “Intramolecular hydrogen transfer
in mass spectra. 1. Rearrangements in aliphatic hydrocarbons and aromatic
compounds”, Chem. Rev., 73, 191 (1973).
[2] Schwarz H., “The chemistry of ionized cyclopropanes in the gas phase”. In: The
Chemistry of the Cyclopropyl Group; Z. Rappoport, Ed.; Wiley, Chichester,
1987; p. 173.
[3] Collins J. R., Gallup G. A., “Energy surfaces in the cyclopropane radical ion
and the photo-electron spectrum of cyclopropane”, J. Am. Chem. Soc., 104,
1530 (1982).
[4] Willet G. D., Baer T., “Thermochemistry and dissociation dynamics of state-
selected C4H4X ions. 3. C4HsN+”, J. Am. Chem. Soc., 102, 6774 (1980).
[5] Brittain E. F. H., Wells С. H. J., Paisley H. M., “Mass spectra of cyclobutanes
and cyclohexanes of molecular formula J- Chem. Soc. B, 304 (1968).
7.5. Ароматические углеводороды 327
7.5 Ароматические углеводороды [1-4]
7.5.1 Ароматические углеводороды
Фрагментация. Соединения проявляют слабую склонность к фрагментации.
Происходит элиминирование Н‘ с последующей потерей Нг, что приводит к
пикам [М—1]+, [М—3]+, [М—5]+ с убывающей интенсивностью. В конденсиро-
ванных ароматических соединениях преобладающим фрагментом может быть
[М—2]+‘. Последующая типичная фрагментация состоит в отщеплении ацети-
лена (Am 26) и С3Н3 (Дт 39). В чистых ароматических соединениях часто
происходит элиминирование СН3. В случае бифенильных соединений обычно
наблюдаются ионы бифенилена (m/z 152) и, если имеется подходящая группа
СНг, флуорена (m/z 165).
Серии ионов. Наблюдаются пики СПНП и CnHnj_] (m/z 39, 51-53, 63—65,
75-77,...), в случае полициклических ароматических соединений происходит
постепенное изменение в сторону образования более ненасыщенных ионов.
Часто возникают двухзарядные ионы, их количество увеличивается по мере
увеличения числа тг-электронных систем.
Интенсивности. Наблюдаются малоинтенсивные пики фрагментов. Распре-
деление интенсивностей двухзарядных ионов не совпадает с распределением
интенсивностей для соответствующих однозарядных ионов.
Молекулярный ион. Интенсивный пик.
7.5.2 Алкилзамещенные ароматические углеводороды
Фрагментация. Преимущественная потеря алкильных групп при бензильном
распаде с последующим элиминированием алкенов.
При низком разрешении этилбензил и /3-фенилэтил изобарны бензоилу
(m/z 105). В отличие от бензоила, в масс-спектре присутствуют также продук-
328 7. Масс-спектрометрия
ты дегидрогенирования (m/z 104, 103) и протонированный бензол (m/z 79),
если m/z 105 относится к углеводородному остатку.
Серии ионов. Фрагменты ароматических углеводородов СПНП и CnHn±i (m/z 39,
51-53, 63-65, 75-77,...) проявляются в области более низких масс.
Интенсивности. Интенсивные пики находятся преимущественно в области вы-
соких масс. Максимумы возникают в результате бензильного распада.
Молекулярный ион. Сильный или средний сигнал.
7.5.3 Литература
[1] Bursey J. Т., Bursey М. М., Kingston D. G., “Intramolecular hydrogen transfer
in mass spectra. 1. Rearrangements in aliphatic hydrocarbons and aromatic
compounds”, Chem. Rev., 73, 191 (1973).
[2] Schonfeld W., “Fragmentation diagrams for elucidation of decomposition re-
actions of organic compounds. 1. Aromatic hydrocarbons” (in German), Org.
Mass Spectrom., 10, 321 (1975).
[3] Lifshitz C., “Tropylium ion formation from toluene: Solution of an old problem
in organic mass spectrometry”, Acc. Chem. Res., 27, 138 (1994).
[4] Buchanan M. V., Olerich B., “Differentiation of polycyclic aromatic hydrocar-
bons using electron-capture negative chemical ionization”, Org. Mass Spec-
trom., 19, 486 (1984).
7.6. Гетероароматические соединения 329
7.6 Гетероароматические соединения [1, 2]
7.6.1 Общая характеристика
Фрагментация. Большинство ароматических фрагментов образуется в резуль-
тате специфического элиминирования, включающего гетероатомы, т. е. проис-
ходит элиминирование групп HCN, СО, СНО, CS, и CHS от молекулярного
иона М+' и HCN, СО, CS от осколков молекулы. В случае алкилзамещенных
гетероароматических соединений происходят распад бензильного типа, пере-
группировки Мак-Лафферти в случае заместителей с Cn>i и специфические
перегруппировки с участием гетероатомов, особенно в азотсодержащих арома-
тических гетероциклах.
Серии ионов. Если имеется необходимое число атомов С, то в области более
низких масс появляются ароматические углеводородные фрагменты СПНП и
CnHn±1 (m/z 39, 51-53, 63-65,...). (Например, в пиразине таких фрагментов
нет.) Наблюдаются ионы, содержащие гетероатомы, например HCN+’ (m/z 27),
CH3CNH+ (m/z 42), CS+‘ (m/z 44).
Интенсивности. Интенсивные пики находятся преимущественно в области
больших масс.
Молекулярный ион. Обычно интенсивный сигнал. В алкилзамещенных гетеро-
ароматических соединениях часто возникает [М—1]+.
7.6.2 Фураны [3]
Фрагментация. От М+' может отщепляться кислород вместе с соседним С в
виде СНО (Дт 29). Пик СН3СО+ (m/z 43) может наблюдаться в 2- и 6-метил-
фуранах (основной пик в 2,5-диметилфуранах). Как в метиловых аромати-
ческих эфирах, ион [М—43]+ является результатом двухстадийного процесса:
(М+‘—СН3—СО). В фуранах с алкильными заместителями (Cn>i) происходит
распад бензильного типа (образуется ион пирилия С5Н5О1, m/z 81) с после-
дующей потерей СО.
Серии ионов. Главным образом фрагменты ароматических углеводородов СПНП
и CnHn±1 (m/z 39, 51-53, 63-65,...).
Интенсивности. Интенсивные пики в основном в области больших масс. Пики
осколочных ионов обычно сильнее, чем в простых ароматических углеводо-
родах.
Молекулярный ион. Интенсивный сигнал. Нет выраженной склонности к про-
тонированию. Сигнал [М-1]+ обычно очень сильный в метилфуранах.
330 7. Масс-спектрометрия
7.6.3 Тиофены [4]
Фрагментация. Молекулярный ион М+’ может терять серу вместе с соседним
атомом С в виде CHS (Am 45) или CS (Am 44). Для тиофенов с алкильными
заместителями (Cn>i) типичен распад бензильного типа с последующей поте-
рей CS (Am 44). Протонированный тиофен (m/z 85) — характерный продукт
распада моноалкилированных тиофенов.
Серии ионов. Фрагменты ароматических углеводородов СПНП и CnHn±i
(m/z 39, 51-53, 63-65,...). Кроме изотопного пика (М+2), на присутствие серы
указывают сигналы m/z 44 и 45 (CS+‘ и CHS+).
Интенсивности. Преобладают пики М+' и продуктов распада бензильного
типа.
Молекулярный ион. Интенсивный сигнал. Характерный для серы изотопный
сигнал ([М+2]+' соответствует 4,4% от М+’). Заметной склонности к протони-
рованию нет. Обычно пик [М—1]+ очень интенсивный в метилтиофенах.
7.6.4 Пирролы [5]
Фрагментация. Элиминирование HCN из М+’ и из фрагментов. В метилпир-
ролах преобладает [М—1]+. В С- и N-алкилпирролах происходит распад бен-
зильного типа независимо от перегруппировок с участием атомов Н.
Серии ионов. Фрагменты ароматических углеводородов СПНП и CnHn±i
(m/z 39, 51-53, 63-65,...).
Интенсивности. Преобладают пики М+‘ и продуктов распада бензильного
типа.
Молекулярный ион. Интенсивный сигнал (нечетные массы для нечетного числа
атомов N в молекуле). Отсутствует склонность к протонированию. В метилза-
мещенных пирролах преобладает [М—1]+.
7.6.5 Пиридины
Фрагментация. Характерно элиминирование HCN (Ат 27) из фрагментов и
образование ионов НгСЫ4- (m/z 28). Другими реакциями в 2- и 6-метилпи-
ридинах являются элиминирование CH3CN (Ат 41) и образование CHsCNH+
(m/z 42). Бензильный распад доминирует для 3-алкилпиридинов, сильный для
4-алкилпиридинов и слабый для 2-алкилпиридинов. В 2- и 6-алкилпиридинах
происходят типичные перегруппировки с участием атома N.
Для 2- и 4-алкилпиридинов важны перегруппировки Мак-Лафферти:
7.6. Гетероароматические соединения 331
Внутримолекулярное N-алкилирование в 2-алкилпиридинах:
Серии ионов. Фрагменты ароматических углеводородов CnHn, CnHn+i и
CnHn±1N (m/z 39-41, 51-54, 63-67, 75-80,...).
Интенсивности. Преобладают пики М+’ или, если это возможно, продуктов
распада бензильного типа.
Молекулярный ион. Сильный сигнал, кроме случаев, когда возможен распад
типа бензильного. Нечетная масса для нечетного числа атомов N в молеку-
ле. Склонность к протонированию отсутствует. Обычно присутствует сигнал
[М—1]+, в алкилзамещенных пиридинах интенсивный.
7.6.6 N-оксиды пиридинов и хинолинов
Фрагментация. Пик переменной интенсивности [М—О]+', вероятно, возника-
ет из-за термического распада. К N-оксидам хинолина относятся фрагменты
[М—СО]+’ и, если на соседнем атоме С присутствует алкильная группа, фраг-
менты [М—ОН|+. Если алкильная или арильная группы находятся в сосед-
них положениях, то происходят перегруппировки с образованием содержащего
фрагмент N—О кольца.
Серии ионов. Как и в случае соответствующих гетероароматических соедине-
ний, наблюдаются фрагменты ароматических углеводородов CnHn, CnHn±i и
CnHn±iN (m/z 39, 51-54, 63-67, 75-80,...).
Интенсивности. Преобладают пики М+’ и продуктов распада бензильного
типа.
Молекулярный ион. Интенсивный сигнал, за исключением случая, когда из-за
условий эксперимента или возможного распада бензильного типа доминируют
ионы [М—О]+’. Нечетная масса для нечетного числа атомов N в молекуле.
Склонность к протонированию отсутствует.
7.6.7 Пиридазины и пиримидины
Фрагментация. Потеря молекулами пиридазинов N2 и CH2N' дает пик М—28.
Элиминирование N2H’ (особенно важное для метилпиридазинов) приводит к
сигналу [М—29]+ . В N-оксидах пиридазинов последовательно теряются NO’ и
HCN. В пиримидинах происходит последовательная потеря двух молекул HCN
332 7. Масс-спектрометрия
(Am 27). В 2-, 4- и 6-метилпиримидинах отщепляется группа CH3CN (Ат 41)
и образуется ион СНзСГШ+ (m/z 42).
Серии ионов. Фрагменты ароматических углеводородов (CnHn, CnHn±i) и для
пиримидинов CnHn±jN в области низких масс (m/z 39, 51-53).
Интенсивности. Преобладает пик М+’.
Молекулярный ион. Интенсивный сигнал. Склонность к протонированию от-
сутствует. В пиримидинах обычно наблюдается [М—1]+.
7.6.8 Пиразины
Фрагментация. Последовательная потеря двух молекул HCN (Ат 27). Метил-
пнразины теряют CH3CN (Am 41) с образованием CH3CNH+ (m/z 42).
Серии ионов. В спектре нет признаков ароматичности.
Интенсивности. Преобладает пик М+’.
Молекулярный ион. Интенсивный сигнал. Склонность к протонированию от-
сутствует. Обычно наблюдается [М—1]+; в алкилзамещенных (Cn>i) пиразинах
этот пик может быть интенсивнее, чем пик М+’.
7.6.9 Индолы
Фрагментация. Подобна фрагментации в пирроле; элиминирование HCN
(Ат 27) от М+’ и от фрагментов. H2CN' (Am 28) отщепляется от М+‘ по
одно- или двухстадийному механизму. В метилзамещенных индолах преобла-
дает [М—1] + . В N-метилиндолах имеется интенсивный пик [М—15]+. В С- и
N-алкилиндолах распад бензильного типа с переносом или без переноса Н (не
характеристичен).
Серии ионов. Серии ароматических ионов.
Интенсивности. Преобладающий максимум в области более высоких масс.
Молекулярный ион. Интенсивный пик. Склонность к протонированию отсут-
ствует. В метилзамещенных индолах интенсивный сигнал [М—1]+.
7.6.10 Хинолины и изохинолины
Фрагментация. Подобна фрагментации в пиридине: HCN (Am 27) отщепля-
ется от М+‘, [М—1] + и фрагментов. В метилхинолинах и изохинолинах про-
исходит также элиминирование CH3CN (Ат 41). В алкилзамещенных (Cn>i)
хинолинах преобладает бензильный распад, за исключением тех случаев, когда
может играть роль соседний атом N. Для 2-, 8-алкилхинолинов и 1-, 3-алкил-
изохинолинов см. перегруппировки для пиридинов.
Серии ионов. Фрагменты ароматических углеводородов CnHn, CnHn±i и
CnHn±1N (m/z 39-41, 51-54, 63-67, 75-80,...).
Интенсивности. Преобладает пик М+' или, если это возможно, пики продук-
тов распада бензильного типа.
Молекулярный ион. Интенсивный пик, за исключением тех соединений, где
возможен распад бензильного типа. Нечетные массы для нечетного числа ато-
мов N в молекуле. Склонность к протонированию отсутствует. Обычно при-
сутствует пик [М—1]+, в алкилзамещенных хинолинах интенсивный.
7.6. Гетероароматические соединения 333
Перегруппировки в 8-алкилхинолинах:
7.6.11 Циннолин, фталазин, хиназолин, хиноксалин
Фрагментация. Подобна фрагментации в моноциклических гетероароматиче-
ских пиридазине, пиримидине и пиразине. Для пиридазина, циннолина и фта-
лазина характерно элиминирование от их алкильных производных Ng (Am 28)
и N2H' (Am 29). Фталазин дважды теряет HCN (Am 27).
Серии ионов. Фрагменты ароматических углеводородов CnHn, CnHn+i и
CnHn±iN (m/z 39-41, 51-54, 63-67, 75-80,...).
Интенсивности. Доминирует пик М+’ или, если возможно, пики продуктов
распада бензильного типа.
Молекулярный ион. Интенсивный сигнал, за исключением соединений, в кото-
рых возможен распад бензильного типа. Нечетные массы для нечетного числа
атомов N в молекуле. Склонность к протонированию отсутствует. Обычно при-
сутствует пик [М—1]+, в алкилзамещенных соединениях интенсивный.
7.6.12 Литература
[1] Porter Q. N., Mass Spectrometry of Heterocyclic Compounds, 2nd ed., Wiley,
New York, 1985.
[2] Kingston D. G. I., Hobrock B. W., Bursey M. M., Bursey J. T., “Intramolecular
hydrogen transfer in mass spectra. III. Rearrangements involving the loss of
small neutral molecules”, Chem. Rev., 75, 693 (1975).
[3] Spilker R., Grutzmacher H.-F., “Isomerization and fragmentation of methyl-
furan ions and pyran ions in the gas phase”, Org. Mass Spectrom., 21, 459
(1986).
[4] Riepe W., Zander M., “Mass-spectrometric fragmentation behavior of thiophene
benzologs”, Org. Mass Spectrom., 14, 455 (1979).
[5] Budzikiewicz H., DjerassiD., Jackson A. H., Kenner G.W., Newmann D. J.,
Wilson J. M.. “Mass spectra of monocyclic derivatives of pyrrole”, J. Chem.
Soc., 1949 (1964).
334 7. Масс-спектрометрия
7.7 Галогенсодержащие соединения [1-3]
7.7.1 Насыщенные галогенсодержащие алифатические соединения
Фрагментация. Потеря радикала галогена (I > Br > Cl > F) с последующим
элиминированием алкенов. Отрыв алкильного радикала и дальнейшее отщеп-
ление кислоты НХ. Потеря кислоты НХ с образованием алкенового катион-
радикала.
Hal
alkene4"
r-ch2-x
-НХ
R— СН2
-R'
-RCH2
СН2=Х+
х+
Имеет значение для F и С1.
С последующим элиминированием
алкена; имеет значение для Вг и F.
Относится к F- и Cl-содержащим
соединениям с промежутчной длиной
цепи и с а-разветвлениями.
Слабые, но характерные
признаки галогена.
Слабые, но характерные
признаки галогена.
Серии ионов. Преобладающие углеводородные фрагменты относятся главным
образом к алкенильным (CnH2n_i) в случае F и С1, смешанным алкильным
(CnH2n+i) и алкенильным для Вт и в основном к алкильным фрагментам
(CnH2n+i) для I.
Интенсивности. Интенсивные пики в основном в области низких масс. Харак-
терные максимумы для С1 и Вг дает фрагмент C^H^X (m/z 91/93 и 135/137
соответственно), который имеет циклическую структуру:
m/z 91,93 для Х=С1
m/z 135,137 для Х=Вг
Алкильные заместители в цепи понижают интенсивность пика этого фрагмен-
та. Если его интенсивность велика, то для [М— Х]+ мала. В случае иодалканов
обычно можно зарегистрировать некоторое количество 1+ и HI+’ с m/z 127 и
128.
Молекулярный ион. Интенсивный пик для малых алканов с возрастающей ин-
тенсивностью в ряду F, Cl, Вг, I. Интенсивность быстро падает по мере уве-
личения массы радикала и его разветвленности. Пренебрежимо мал для F и
С1 в случае н-алкильных цепей более длинных, чем пентил, а для Вг и I — чем
гептил и нонил соответственно. Низкая склонность к протонированию. Наблю-
дается характерное распределение изотопных пиков для С1 и Вг. Иод можно
идентифицировать по его высокой массе; обращает на себя внимание малая
интенсивность сигналов 13С иона М+‘ и его фрагментов.
7.7. Галогенсодержащие соединения 335
7.7.2 Полигалогеналканы
Фрагментация. Если несколько атомов галогена связаны с одним атомом уг-
лерода, то предпочтительная фрагментация происходит по связи С—С. Часто
основным пиком является CF3 (m/z 69) в терминально перфторированных ал-
канах или CHCI2 (m/z 83, 85, 87) в терминально дихлорированных соединени-
ях. Кроме обычной потери X’ и НХ часто происходит элиминирование Х2. Мо-
жет происходить взаимный обмен атомов галогена. Например, для CF3CFCI2
доминирует (около 60%) сигнал с m/z 85 (CF2CI).
Серии ионов. Большая часть фрагментов является алкилгалогенидными и ал-
кенилгалогенидными группами, которые легко обнаруживаются на основании
изотопных сигналов в случае С1 и Вг.
Интенсивности. Интенсивные пики в основном в области низких масс.
Молекулярный ион. Слабый сигнал, уменьшается при увеличении числа атомов
галогена. Отсутствует в спектрах многих полигалогенированных соединений.
7.7.3 Ароматические галогенсодержащие соединения
Фрагментация. Последовательная потеря радикалов галогена и/или кислоты
НХ. В пергалогенированных ароматических соединениях процессы распада до-
ходят до С* , с х от 1 до 6 (m/z 12, 24, 36, 48, 60, 72). В случае алкильных за-
местителей (Cn>i) основной пик возникает в результате бензильного распада.
При ином замещении в ароматическом кольце сигнал m/z 57 служит призна-
ком F (СзН2Р+). Происходит отщепление CF2 (Ат 50) от присоединенных к
ароматическому кольцу групп CF3 (от М+' или от фрагментов).
Серии ионов. Фрагменты ароматических углеводородов CnHn, CnHn_i и
CnHn_2 (m/z 39, 51-53, 63-65, 75-77,...). В области высоких масс-~Сп(Н,Х)п.
Интенсивности. Преобладают пики в области М+'.
Молекулярный ион. Обычно очень интенсивный пик. Характерные изотопные
сигналы для С1 и Вг.
Hal
7.7.4 Литература
[1] Loudon A. G., “Mass spectrometry and the carbon-halogen bond”. In: The Che-
mistry of the Carbon-Halogen Bond; S. Patai, Ed.; Wiley, New York, 1973;
p. 223.
[2] Kingston D. G. I., Hobrock B. W., Bursey M. M., Bursey J. T., “Intramolecular
hydrogen transfer in mass spectra. III. Rearrangements involving the loss of
small neutral molecules”, Chem. Rev., 75, 693 (1975).
[3] Miller J. M., Jones T. R. B., “The mass spectra of azides and halides”. In: The
Chemistry of Functional Groups, SuppL D; S. Patai, Z. Rappoport, Eds.; Wiley,
New York, 1983; p. 75.
336 7. Масс-спектрометрия
7.8 Спирты, простые эфиры и
родственные соединения [1, 2]
7.8.1 Алифатические спирты [3]
Фрагментация. Элиминирование воды из иона М+' и из фрагментов. Соответ-
ствующие сильные пики для первичных спиртов. Если алифатический атом
Н может участвовать в 6-членном переходном состоянии, то в 90% изученных
случаев он участвует в элиминировании воды. Если группа СН2СН2 связана
с несущим кислород атомом С, то за отщеплением воды часто следует потеря
молекулы этилена. Элиминирование воды преобладает для длинноцепочечных
спиртов, что делает их спектры похожими на спектры алкенов.
Разрыв связей, которые следуют за несущим гидроксильную группу атомом
углерода, приводит к образованию оксониевых ионов и элиминированию воды
и алкенов. Часто преобладает а-распад. Обычно его значение возрастает с уве-
личением разветвленности на а-углеродном атоме. Чем крупнее заместитель,
тем легче он отрывается.
[СНгОН]-1" (m/z 31) для первичных
1 . спиртов (R1, R2 = Н)
2 » +• - R3 R + [30 + R1]+ (m/z 45, 59, 73,...) для
Я> ОН С—ОН вторичных спиртов (R2 = Н)
R3 R2 [29 + R1 + R2]+ (m/z 59, 73, 87,...)
для третичных спиртов
Последовательное элиминирование Н2О и алкена в длинноцепочечных первич-
ных спиртах приводит к появлению пиков [М—46]+’, [М—74]+', [М—102]+’,....
Серии фрагментов [М—15]+, [М—18]+' и [М—33]+ часто наблюдаются в спек-
трах разветвленных спиртов.
Серии ионов. Преобладают последовательности ионов алкенов CnH2n-i (m/z 41,
55, 69,...), CnH2n (m/z 42, 56, 70,...), сопровождающиеся более слабыми пи-
ками CnH2n+iO (m/z 31, 45, 59,...) с одним или большим числом локальных
максимумов в последней серии (m/z 31 преобладает в первичных спиртах).
Интенсивности. Основные пики в области более низких масс относятся к
ионам алкильного и алкенового типов с более слабыми максимумами ионов
типа СпН2п+1О.
Молекулярный ион. Сигнал обычно слабый, часто отсутствует, особенно в тре-
тичных и длинноцепочечных спиртах. Непрямое определение М+’ возможно из
фрагментов [М—15]+, [М—18]+’ и [М—33]+. [М+1]+ часто имеет значительную
величину. В первичных и вторичных спиртах может также наблюдаться пик
[М—1]+. Иногда появляется пик [М—2]+' из-за окисления пробы до карбониль-
ных соединений в процессе ввода.
334 7. Масс-спектрометрия
7.7 Галогенсодержащие соединения [1-3]
7.7.1 Насыщенные галогенсодержащие алифатические соединения
Фрагментация. Потеря радикала галогена (I > Br > Cl > F) с последующим
элиминированием алкенов. Отрыв алкильного радикала и дальнейшее отщеп-
ление кислоты НХ. Потеря кислоты НХ с образованием алкенового катион-
радикала.
Hal
alkene4"
r-ch2-x
-НХ
R— СН2
-R'
-RCH2
СН2=Х+
х+
Имеет значение для F и С1.
С последующим элиминированием
алкена; имеет значение для Вг и F.
Относится к F- и Cl-содержащим
соединениям с промежутчной длиной
цепи и с а-разветвлениями.
Слабые, но характерные
признаки галогена.
Слабые, но характерные
признаки галогена.
Серии ионов. Преобладающие углеводородные фрагменты относятся главным
образом к алкенильным (CnH2n-i) в случае F и С1, смешанным алкильным
(CnH2n+i) и алкенильным для Вт и в основном к алкильным фрагментам
(CnH2n+i) для I.
Интенсивности. Интенсивные пики в основном в области низких масс. Харак-
терные максимумы для С1 и Вг дает фрагмент СЩвХ (m/z 91/93 и 135/137
соответственно), который имеет циклическую структуру:
m/z 91,93 для Х=С1
m/z 135,137 для Х=Вг
Алкильные заместители в цепи понижают интенсивность пика этого фрагмен-
та. Если его интенсивность велика, то для [М— Х]+ мала. В случае иодалканов
обычно можно зарегистрировать некоторое количество 1+ и HI+’ с m/z 127 и
128.
Молекулярный ион. Интенсивный пик для малых алканов с возрастающей ин-
тенсивностью в ряду F, Cl, Вг, I. Интенсивность быстро падает по мере уве-
личения массы радикала и его разветвленности. Пренебрежимо мал для F и
С1 в случае н-алкильных цепей более длинных, чем пентил, а для Вг и I — чем
гептил и нонил соответственно. Низкая склонность к протонированию. Наблю-
дается характерное распределение изотопных пиков для С1 и Вг. Иод можно
идентифицировать по его высокой массе; обращает на себя внимание малая
интенсивность сигналов 13С иона М+‘ и его фрагментов.
338 7. Масс-спектрометрия
7.8.5 Алифатические гидропероксиды [4]
Фрагментация. Преобладает отрыв гидропероксидного радикала НО2 (Am 33),
особенно когда образуется третичный карбокатион. Важную роль играет поте-
ря Н2О2 (Ат 34), Н2О (Ат 18), НО’ (Ат 17) и О (Ат 16) (расположены в
порядке уменьшения массы).
Серии ионов. Главным образом насыщенные и ненасыщенные фрагменты
CnH2n+i (m/z 43, 57, 71,...) и CnH2n-i (m/z 41, 55, 69,...). Всегда присут-
ствуют указывающие на кислород фрагменты m/z 31 и их гомологи.
Интенсивности. Интенсивные пики преимущественно в области более низких
масс.
Молекулярный ион. Слабый сигнал.
7.8.6 Фенолы
Фрагментация. Декарбонилирование (Ат 28) и потеря СНО’ (Ат 29) с после-
дующим элиминированием ацетилена. В алкильных производных важны пики
[М—1]+ и, если присутствует не менее двух алкильных атомов углерода (диме-
тил или этил), [М—15]+. Элиминирование групп СО из основных фрагментов.
Пик [М—18]+' в основном проявляется в орто-алкилфенолах. В производных с
более длинной алкильной цепью в процессах фрагментации преобладают1 бен-
зильный распад и элиминирование алкена (перегруппировка Мак-Лафферти).
Затем фрагменты теряют СО (Ат 28).
Серии ионов. Фрагменты ароматических углеводородов СПНП и CnHn±i (m/z 39,
51-53, 63-65, 75-77,...). Обычно присутствует незначительный пик m/z 55
(С3Н3О). Пик m/z 69 (О=ССН=С=О) характерен для 1,3-дигидроксильного
замещения.
Интенсивности. Преобладают пики в области высоких масс.
Молекулярный ион. Преобладает; склонность к образованию [М+Н]+ отсут-
ствует. Пик [М—1]+ слабый.
7.8.7 Бензиловые спирты
Фрагментация. Потеря Н’ и последующее элиминирование СО (Ат 28) при-
водят к протонированной молекуле бензола, от которой в дальнейшем отрыва-
ется Нг.
Н -И’
, -Н2 .
с6н^ с6н£
М+‘ (80%)
(M-l]+(65%)
m/z 79
(100%)
m/z 77
(65%)
Второе важное направление фрагментации - элиминирование ОН’ (Ат 17) с
образованием тропилий-катиона:
7.8. Спирты, простые эфиры и родственные соединения 339
М+' (80%) [М-17]+, С7Н^ , m/z 91 (25%)
Серии ионов. Фрагменты ароматических углеводородов СПНП и CnHn±i (m/z 39,
51-53, 63-65, 75-77,...).
Интенсивности. Доминируют пики перечисленных выше продуктов фрагмен-
тации. Для бензилового спирта интенсивности понижаются в последователь-
ности [М—29]+, М+-, [М-1]+, [М-31]+, [М-17]+.
Молекулярный ион. Интенсивный пик.
7.8.8 Алифатические простые эфиры [5, 6]
Фрагментация. Гомолитический разрыв следующей за атомом О связи С—С
приводит к кислородсодержащим фрагментам. Преимущественно разрывается
связь около наиболее замещенного атома С с отрывом самой крупной алкиль-
ной группы.
R1 O=CH-R2
R1 ^o-ch-r2
CnH2n+1O+, m/z 31, 45, 59,...
За этим гомолизом происходит элиминирование алкенов, карбонильных групп
или, что имеет меньшее значение, воды.
Н
R1 О=СН- R2
- r1ch=ch2
--------►
HO=CHR2
[30+R2]+
-r2ch=o
R1 Go=ch-r2
+
R1CH2CH2
m/z 29, 43, 57,...
о
Конкурирующим процессом, особенно при увеличении молекулярной массы,
является гетеролитический разрыв связи при атоме О, приводящий к сильным
сигналам алкильных ионов. Чем крупнее и чем более разветвлены алкильные
остатки, тем более предпочтительным является их отрыв. Основной пик часто
возникает при гетеролитическом разрыве связи С—О.
^СНгСНгО'
R2
НС +
R3 m/z 29, 43, 57,...
В противоположность процессу отщепления воды от спиртов, миграция водо-
рода при элиминировании RCH2CH2OH из простых эфиров не является ха-
рактеристической.
340 7. Масс-спектрометрия
r2 -R>CH2CH2OH 2
R °J< 3
н R m/z 28, 42, 56,...
Серии ионов. Алкильные фрагменты CnH2n+i (m/z 29, 43, 57,...) с максиму-
мами, возникающими из-за разрыва связи С—О. Алкенильные серии CnHjn
(m/z 28, 42, 56,...) появляются из-за элиминирования спирта. Кислородсодер-
жащие фрагменты CnH2n+iO (m/z 31, 45, 59,...) имеют максимумы, связанные
с разрывом следующей за кислородом связи С—С.
Интенсивности. Интенсивные пики расположены главным образом в области
низких масс.
Молекулярный ион. Заметный или слабый пик. Его интенсивность уменьшает-
ся по мере увеличения длины цепи и разветвленности.
7.8.9 Ненасыщенные простые эфиры [7]
Фрагментация виниловых и ацетиленовых простых эфиров. Преобладание го-
молитического разрыва следующей за атомом кислорода с насыщенной сто-
роны алкильной связи С—С приводит к образованию С3Н5СН (m/z 57) для
виниловых и СзНдО+ (m/z 55) для ацетиленовых простых эфиров первич-
ных алифатических спиртов. В случае алкильных (Cn>s) виниловых эфиров
отщепление этанола происходит после тройной миграции водорода. В винило-
вых простых эфирах при отщеплении после перегруппировки водорода СНг
винильной группы преимущественно образуется ион [М—15]+.
Фрагментация аллиловых простых эфиров. Гетеролиз обеих связей С—О, ве-
дущий к сильным пикам катиона С3Н5 (m/z 41) и алкильных ионов (m/z 29,
43, 57,...). При неспецифической миграции Н от алкильного остатка образует-
ся ионизированный аллиловый спирт (m/z 58). В аллиловых и пропаргиловых
простых эфирах следующая за атомом кислорода связь С—С алкенильной груп-
пы не разрывается. В этом случае потеря винила или этинила не наблюдается.
Серии ионов. CnH2nO (m/z 44, 58, 72,...) для алкенилалкиловых простых эфи-
ров и CnH2n_2O (m/z 42, 56, 70,...) для диалкениловых простых эфиров. Име-
ются сигналы ненасыщенных алифатических (CnH2n-i; m/z 41, 55, 69,...), на-
сыщенных алифатических и ненасыщенных кислородсодержащих фрагментов
(СпН2п+1 и СпН^-лО; m/z 43, 57, 71,...).
Интенсивности. Интенсивные пики располагаются главным образом в обла
сти низких масс.
Молекулярный ион. Интенсивность сигнала от слабой до средней, очень слабый
сигнал в случае ацетиленовых простых эфиров.
7.8. Спирты, простые эфиры и родственные соединения 341
7.8.10 Алкильные циклоалкильные простые эфиры
Фрагментация метиловых эфиров циклоалканолов с Ск>з- После первичного
распада следующей за атомом О связи С—С в цикле образуется значительное
количество фрагментов СНзОСН=СН^" (m/z 58) и СНзО=СНСН=СН^ для
алициклов с Ck>4, (m/z 71, подвергается перегруппировке подобно циклоал-
канолам). Потеря метанола приводит к углеводородным фрагментам СпН2П-2
(m/z 54, 68, 82,...).
Фрагментация этиловых и более тяжелых алкильных простых эфиров цик-
лоалканолов с Ск>з- Элиминирование алкена приводит к протонированному
циклоалканолу (m/z 72, 86, 100,...), а гетеролитический разрыв связи С—О
дает основные циклоалкильные ионы (m/z 69, 83,...).
Серии ионов. Кроме уже упомянутой фрагментации, возникают главным об-
разом ненасыщенные углеводородные фрагменты (CnH2n-i, m/z 27, 41, 55,
69,...).
Интенсивности. В спектре доминируют сигналы вышеупомянутых фраг-
ментов.
Молекулярный ион. Слабый или средний сигнал.
7.8.11 Циклические простые эфиры
Фрагментация. Первичный разрыв цикла по следующим за атомом О связям
С—С с дальнейшей потерей СН2О (Ат 30), Н2О (Ат 18) или алкила (Ат 15,
29,...). Элиминирование Н' дает ион [М—1]+, а последующее элиминирование
СО (Ат 28) дает [М—29]“*“. В случае «-замещенных производных преобладает
потеря заместителей с последующим элиминированием воды. В случае двух
a-заместителей образуются ацильные радикалы.
О
+•
Г <СН2)п
^(СН2)П
|-RCHO
+
’п
+
Серии ионов. Преобладают ионы алкенового типа. Сигналы насыщенных кис-
лородсодержащих фрагментов слабые (m/z 31, 45,...).
Интенсивности. Интенсивные пики равномерно распределены во всем диапа-
зоне масс.
Молекулярный ион. Сигнал часто интенсивный, но иногда слабый, особенно в
а-замещенных соединениях. Интенсивность пика [М—1]+ обычно сравнима с
интенсивностью пика М+’, если нет «-заместителей.
342 7. Масс-спектрометрия
7.8.12 Алифатические эпоксиды [8]
Фрагментация. Самая значительная первичная фрагментация происходит при
разрыве следующей за атомом О связи С—С (о-распад), что вызывает сложные
процессы деградации путем далеко идущих разнообразных вторичных пере-
группировок. Продукты распада позволяют методом масс-спектрометрии усга-
новить положение двойных связей после эпоксидирования.
В результате раскрытия цикла при фрагментации происходит как о-распад,
так и /3-распад.
-СН2К
m/z 57
у-Распад является наиболее важным механизмом фрагментации, особенно в
терминальных эпоксидах:
m/z 71
В основном в терминальных эпоксидных соединениях происходят перегруппи-
ровки с элиминированием алкена, что формально приводит к частицам
alkene—ОН4" (СПН2ПО, m/z 44, 58, 72,...) и alkene4" (СПН2П, m/z 28, 42, 56,...):
НОСН2СН=СН2
сн2=снон
rch2ch=ch2
В нетерминальных эпоксидах происходит трансаннулярный разрыв с перено-
сом Н и элиминированием алкенильного радикала, что приводит к фрагментам
CnH2n+iO (m/z 45, 59, 73,...):
-Алкенил' +
------► if-CHOH
Серии ионов. Смешанные, характеристических нет.
Интенсивности. Интенсивные пики в основном в области низких масс.
Молекулярный ион. Обычно слабый сигнал.
7.8. Спирты, простые эфиры и родственные соединения 343
7.8.13 Метоксибензолы
Фрагментация. Потеря метильного радикала с последующим декарбонилиро-
ванием приводит к образованию иона [М—43]+; элиминирование формальде-
гида (Дт 30) из М+‘ или из первичных фрагментов.
Серии ионов. Фрагменты ароматических углеводородов СПНП и CnHn±i
(m/z 39, 51-53, 63-65, 75-77,...).
Интенсивности. Интенсивные пики в области М+’.
Молекулярный ион. Интенсивный пик.
7.8.14 Алкиларильные простые эфиры [9]
Фрагментация. Обычно преобладает элиминирование алкенов с образованием
иона соответствующего фенола (нехарактерная миграция водорода) и после-
дующим декарбонилированием. В случае арилметиловых эфиров происходит
потеря СНгО от М+‘ или от первичных фрагментов, а также элиминирование
СН’(, за которым следует декарбонилирование.
Серии ионов. В основном фрагменты ароматических углеводородов СПНП и
CnHn±i (m/z 39, 51-53, 63-65, 75-77,...).
Интенсивности. Обычно максимум приходится на соответствующий фенол.
В противном случае интенсивные пики располагаются в области высоких и
средних масс.
Молекулярный ион. Интенсивный сигнал.
7.8.15 Ароматические простые эфиры
Фрагментация. От молекулярного иона М+’ отрываются Н’ (Дт 1), СО
(Дт 28) и СНО' (Дт 29). Разрыв связи С—О и декарбонилирование продуктов
распада с последующим дегидрогенированием.
Серии ионов. Фрагменты ароматических углеводородов СПНП и СпНп-щ
(m/z 39, 51-53, 63-65, 75-77,...).
Интенсивности. Интенсивные пики обычно в области М+'.
Молекулярный ион. Интенсивный сигнал.
7.8.16 Алифатические пероксиды [4]
Фрагментация. Происходит элиминирование алкенов с образованием гидро-
пероксидных катион-радикалов и элиминирование гидропероксида с образова-
нием алкеновых катион-радикалов (преобладает, если присутствуют большие
алкильные группы). За элиминированием алкена может следовать потеря ОН’,
приводящая к продуктам, которые формально соответствуют тем, что получа-
лись бы при разрыве связи О—О, который, вероятно, не является одностадий-
ным процессом (см. схему).
344 7. Масс-спектрометрия
-CH2=CHR2 R^Oa-
-------► Тй <PH
н
-ОН' R^CH^H
** [30+R1]+
+ Н
-R1OOH
В циклических пероксидах может происходить элиминирование О’
или О2. В mpem-бутиловых пероксидах преимущественно отщепляется
mpem-бутил—ОО' с образованием иона [М—89]+.
Серии ионов. Преобладают насыщенные и ненасыщенные фрагменты (СпН2п-|-ь
m/z 29, 43, 57,..., CnH2n_i, m/z 27, 41, 55,...) и алкенильные ионы (СПН2П,
m/z 28, 42, 56,...). Фрагмент с m/z 31 и иногда его гомологи указывают на
присутствие кислорода.
Интенсивности. Интенсивные пики находятся в области малых масс.
Молекулярный ион. Сигнал от слабого до среднего.
7.8.17 Литература
[1]
Kingston D. G. I., Bursey J. Т., Bursey М. М., “Intramolecular hydrogen trans-
fer in mass spectra. II. The McLafferty rearrangement and related reactions”,
Chem. Rev., 74, 215 (1974).
Kingston D. G. I., Hobrock B. W., Bursey M. M., Bursey J. T., “Intramolecular
hydrogen transfer in mass spectra. III. Rearrangements involving the loss of
small neutral molecules”, Chem. Rev., 75, 693 (1975).
[3] Cooks R. B., “The mass spectra of hydroxyl compounds”. In: The Chemistry of
the Hydroxyl Group, Part 2; S. Patai, Ed.; Wiley, New York, 1971; p. 1045.
[4] Schwarz H., Schiebel H. M., “Mass spectrometry of organic peroxides”. In: The
Chemistry of Functional Groups, Peroxides; S. Patai, Ed.; Wiley, New York,
1983; p. 105.
[5] van de Sande С. C., “The mass spectra of ethers and sulfides”. In: The Chemistry
of Ethers, Crown Ethers, Hydroxyl Groups and Their Sulfur Analogues,
Suppl. E; S. Patai, Ed.; Wiley, New York, 1980; p. 299.
[6] Bernasek S. L., Cooks R. G., “The /З-cleavage reaction in ethers”, Org. Mass
Spectrom., 3, 127 (1970).
[7] Morizur J. P., Djerassi C., “Mass spectrometric fragmentation of unsaturated
ethers”, Org. Mass Spectrom., 5, 895 (1971).
[8] Porter Q. N., “Mass Spectrometry of Heterocyclic Compounds”, 2nd ed.; Wiley,
New York, 1985.
[9] Sozzi G., Audier H. E., Morgues P., Millet A., “Alkyl phenyl ether radical ca-
tions in the gas phase: A reaction model”, Org. Mass Spectrom., 22, 746 (1987).
7.9. Азотсодержащие соединения 345
7.9 Азотсодержащие соединения [1, 2]
7.9.1 Насыщенные алифатические амины [3]
Фрагментация. Преобладает потеря алкильных остатков при разрыве связи
С—С, следующей за атомом N (“N-распад”). Более крупные заместители от-
щепляются в первую очередь. Если присутствуют у-Н, происходит элимини-
рование алкенов в результате реакций типа перегруппировки Мак-Лафферти.
В противном случае происходит неспецифический перенос Н на атом N.
Элиминирование NH3, RNH2, и RR'NH от первичных, вторичных и третич-
ных аминов соответственно пренебрежимо мало за исключением некоторых
полифункциональных соединений (например, диаминов и фенилфеноксизаме-
щенных аминов).
Серии ионов. Фрагменты типа CnH2n+2N с четными массами (m/z 30, 44, 58,
72, 86,...).
Интенсивности. Основные пики находятся в области низких масс. Преобла-
дает основной пик "N-распада” при для
[например, m/z 30 для m/z 44 для
RCH2NHCH3, m/z 58 для RCH2N(CH3)2 и m/z 86 для ПСН2К(СН2СНз)2).
Наблюдается локальный максимум при m/z 86 (CsH^N-1-) для a-alk-NHa (про-
тонированный пиперидин, 6-членный цикл).
Молекулярный ион. Обычно сигнал слабый или отсутствует, особенно если за-
мещен а-атом С. Интенсивность сигнала уменьшается при увеличении моле-
кулярной массы. Наблюдается склонность к протонированию с образованием
[М+Н]+.
7.9.2 Циклоалкиламины
Фрагментация. Самой важной первичной реакцией является разрыв кольца по
соседней с атомом N связи с последующей миграцией Н и потерей алкильного
остатка. Происходит частичное элиминирование амина R1R2NH.
346 7. Масс-спектрометрия
Серии ионов. Фрагменты типа CnH2nN с четной массой (m/z 42, 56, 70, 84,...).
Интенсивности. Интенсивные локальные максимумы равномерно распределе-
ны во всему диапазону масс.
Молекулярный ион. Сигнал обычно имеет значительную интенсивность.
7.9.3 Циклические амины
Фрагментация. Преобладающей первичной реакцией является разрыв следу-
ющей за атомом азота связи С—С, что приводит к потере расположенного за
атомом азота заместителя или к раскрытию цикла. За раскрытием цикла про-
исходит миграция атома Н и потеря алкенов или алкильных групп. Основной
первичной фрагментацией для замещенных циклических аминов является от-
N
щепление заместителей от следующего за азотом атома С.
.. +
[>—N=CH2
m/z 70 (14%)
+•
ch3-n=ch2
m/z 43 (34%)
CH3-N=CH2
m/z 44 (43%)
NH2=CH2
m/z 30 (52%)
Серии ионов. Фрагменты с четными массами CnH2nN (m/z 42, 56, 70, 84,...),
CnH2n+2N (m/z 30, 44, 58,...) и фрагменты с нечетными массами CnH2n+iN
(m/z 43, 57, 71, 85,...).
7.9. Азотсодержащие соединения 347
Интенсивности. Интенсивные пики равномерно распределены по всему диапа-
зону масс, если нет заместителей у следующего за азотом атома С. В противном
случае преобладают максимумы, обусловленные потерей этих заместителей.
Молекулярный ион. Интенсивный сигнал, если нет заместителей при следую-
щем за N атоме С; в противном случае слабый. Склонность к образованию
иона [М—Н]+.
7.9.4 Пиперазины
Фрагментация. Как и в случае циклических аминов, преобладает первичный
разрыв цикла по следующим за атомом N связям С—С.
Серии ионов. Фрагменты с четными массами CnH2nN (m/z 42, 56, 70, 84,...),
CnH2n+2N (m/z 30, 44, 58,...) и с нечетными массами CnH2n+iN (m/z 43, 57,
71, 85,...).
Интенсивности. Интенсивные пики равномерно распределены по всему диа-
пазону масс, если нет заместителей у следующего за N атома С. В противном
случае преобладают максимумы, обусловленные отрывом этих заместителей.
Молекулярный ион. Интенсивный сигнал, если нет заместителей при следую-
щем за азотом атоме С; в противном случае слабый. Склонность к образованию
иона [М—Н]+.
7.9.5 Ароматические амины
Фрагментация. Преобладает разрыв алкильной связи при атоме С, связан-
ном с атомом N (“N-распад”), с последующим элиминированием алкена, если
присутствуют алифатические заместители С2. В противном случае происхо-
дит потеря Н‘ из молекул первичных и вторичных анилинов и бензиламинов.
Из М+' или из фрагментов теряется HCN. Локальный максимум при m/z 42
типичен для диметиламиногруппы, связанной с ароматическим циклом.
Серии ионов. Фрагменты ароматических углеводородов (СПНП и CnHn±i;
m/z 39, 51-53, 63-65, 75-77,...).
Интенсивности. Преобладают максимумы, обусловленные “N-распадом”, с по-
следующей потерей алкена, если присутствуют алифатические заместители с
С„>1.
Молекулярный ион. Интенсивный сигнал, если нет алифатических замести-
телей с более чем одним атомом углерода, в противном случае средний или
слабый. Нет склонности к протонированию. В первичных и вторичных арома-
тических аминах и бензиламинах важное значение имеет пик [М—Н]+.
7.9.6 Алифатические нитросоединения
Фрагментация. Происходит потеря NO‘ (Am 30), NO2 (Am 46) и HNO2
(Am 47), появляется некоторое количество фрагментов с m/z 30 как признак
присутствия N.
Серии ионов. Образуются алкильные и алкенильные фрагменты СпН2П+1
(m/z 43, 57, 71,...) и CnH2n-i (m/z 41, 55, 69,...).
348 7. Масс-спектрометрия
Интенсивности. Преобладают пики в области низких масс.
Молекулярный ион. Пик слабый или отсутствует.
7.9.7 Ароматические нитросоединения
Фрагментация. Молекулярный ион М+' или главные продукты распада теря-
ют О (Дт 16), NO' (Дт 30, с последующим элиминированием СО, Дт 28) и
NO2 (Дт 46). Происходит глубокая перегруппировка функциональной группы
до нитрозоэфира.
Серии ионов. Фрагменты ароматических углеводородов СПНП и CnHn±i
(m/z 39, 51-53, 63-65, 75-77,...).
Интенсивности. Интенсивные пики главным образом в области высоких масс.
Молекулярный ион. Интенсивный пик.
7.9.8 Диазосоединения [4, 5]
Ион диазония. Из-за низкой летучести диазосоединений в их масс-спектрах
с ионизацией электронным ударом наблюдаются продукты термического раз-
ложения. Они образуются при потере N2 (например, хлорзамещенные арома-
тические соединения образуются из соответствующих хлоридов диазония). Из
цвиттер-иона орто-карбоксилата фенилдиазония в результате димеризации по-
лучается бифенилен.
Диазометан и его производные. Интенсивный сигнал М+’, за исключением слу-
чаев, когда происходит каталитическое разложение исследуемого соединения
на металлических поверхностях системы напуска. Потеря N2 является преоб-
ладающей реакцией для диазометана и диазокетонов.
7.9.9 Азобензолы
Фрагментация. Основной пик возникает в результате разрыва связи рядом с
азогруппой с последующей потерей N2.
Серии ионов. Фрагменты ароматических углеводородов СПНП и СПНП±1
(m/z 39, 51-53, 63-65, 75-77,...).
Интенсивности. Преобладают сигналы М+' и продуктов азораспада.
Молекулярный ион. Интенсивный пик.
7.9.10 Алифатические азиды [6]
Фрагментация. В большинстве случаев преобладают фрагменты [М—42]+ (эли-
минирование N3) или [М—28]+’ (элиминирование N2). Вид спектров характерен
для соответствующих алифатических соединений.
Серии ионов. Серии алифатических углеводородов.
7.9. Азотсодержащие соединения 349
Интенсивности. Как и в алифатических соединениях, преобладают пики в
области низких масс.
Молекулярный ион. Сигнал отсутствует или слабый. Нечетная масса для нечет-
ного числа атомов N в молекуле.
7.9.11 Ароматические азиды [7]
Фрагментация. В большинстве случаев основной пик [М—28]+’ (элиминирова-
ние N2). Следующая стадия — элиминирование HCN (Дт 27), ацетилена
(Дш 26) или, если в кольце имеется заместитель X, Х‘ или НХ.
▼ -HCN или С2Н2
m/z 36-39
N
Серии ионов. Фрагменты ароматических углеводородов (СПНП и CnHn±i;
m/z 39, 51-53, 63-65, 75-77,...).
Интенсивности. Преобладают пики в области высоких масс, наиболее интен-
сивные сигналы: [М—28]+' (элиминирование N2) и [М—55]+' (элиминирование
N2 и HCN).
Молекулярный ион. Слабый сигнал. Нечетная масса для нечетного числа ато-
мов N в молекуле.
7.9.12 Алифатические нитрилы [4]
Фрагментация. Элиминирование алкильных радикалов с образованием ионов
(CH2)nCN+ (m/z 40, 54, 68,...). Перегруппировка Мак-Лафферти приводит к
CR2=C=NH+‘ (m/z 41 для R = Н). В большинстве случаев разрыв связи С—CN
и элиминирование HCN происходят в незначительной степени. Если присут-
ствуют другие функциональные группы, то в ненасыщенных цианидах проис-
ходят сложные перегруппировки.
350 7. Масс-спектрометрия
Серии ионов. Пики насыщенных и ненасыщенных ионов преимущественно в
области малых масс (CnH2n+i и CnH2n-i; m/z 29, 43, 57,... и 27, 41, 55,...).
Соответствующие частице CnH2n-iN продукты перегруппировки вносят знаг
чительный вклад в серию ионов m/z 41, 55, 69,.... В случае алкильных цепей
с Сп>5 преобладает (CH2)nCN+ (т. е. CnH2n-2N, m/z 82, 96, ПО,..., вероятно,
с циклической структурой).
Интенсивности. Интенсивные пики дают упомянутые выше ионы.
Молекулярный ион. Сигнал слабый или отсутствует. Пики [М+Н]+ и [М—Н]+
обычно более интенсивные, чем пик М+'. В некоторых алифатических нитри-
лах [М+2Н|+‘ имеет такую же интенсивность, как и М+’. Нечетная масса для
нечетного числа атомов N в молекуле.
7.9.13 Ароматические нитрилы
Фрагментация. Последовательное элиминирование HCN и ацетилена.
Серии ионов. Образуются фрагменты ароматических углеводородов СПНП и
CnHn±1 (m/z 39, 51-53, 63-65, 75-77,...).
Интенсивности. Интенсивные пики в области М+.
Молекулярный ион. Доминирует по интенсивности, часто основной пик. В про-
тивоположность алифатическим и бензильным нитрилам, сигнал [М—1]+ обыч-
но не имеет значения. Нечетная масса для нечетного числа атомов N в моле-
куле.
7.9.14 Алифатические изонитрилы (R—NC)
Фрагментация. Обычно спектры похожи на спектры соответствующих нитри-
лов. Самые важные отличия связаны с потерей радикала CN’ (Дт 26) и более
вероятным отщеплением HCN (Дт 27). Дальнейшая фрагментация состоите
элиминировании алкильных радикалов с образованием ионов (CH2)nCN+ и в
перегруппировке Мак-Лафферти с образованием CR.2=N=CH+’ (m/z 41, если
R = H).
Серии ионов. Сигналы насыщенных и ненасыщенных алифатических ионов
(CnH2n+i, m/z 29, 43, 57,... и CnH2n-i; m/z 27, 41, 55,...) преимущественно в
области низких масс. Продукты перегруппировки, соответствующие частицам
CnH2n-iN, вносят значительный вклад в серию ионов с m/z 41, 55, 69,....
Интенсивности. Интенсивные пики в области низких масс.
Молекулярный ион. Слабый сигнал, интенсивность уменьшается при увеличе-
нии длины цепи и степени разветвленности. Пики [М+Н]+ и [М—Н|+ могут
быть более интенсивными, чем М+’. Нечетная масса для нечетного числа ато-
мов N в молекуле.
7.9.15 Ароматические изонитрилы (R—NC) [4]
Фрагментация. Преобладает потеря HCN ([М—27]+’). В метилфенил- и бен-
зилизоцианидах образуется также ион изоцианотропилий [М—1]+, который в
дальнейшем теряет HCN с образованием [М—28]+.
7.9. Азотсодержащие соединения 351
Серии ионов. Фрагменты ароматических углеводородов СПНП и CnHn±i (m/z 39,
51-53, 63-65, 75-77,...).
Интенсивности. Интенсивные пики в области высоких масс.
Молекулярный ион. Преобладающий сигнал. Для фенилизоцианида основной
пик. Нечетная масса для нечетного числа атомов N в молекуле.
7.9.16 Алифатические цианаты (R—OCN) [8]
Фрагментация. Спектры часто похожи на спектры соответствующих изоци-
анатов. При разрыве следующей за атомом О связи С—С заряд остается на
CH2OCN (m/z 56) в случае цианатов с короткими алкильными цепочками и
преимущественно на алкильном заместителе, если в нем имеется цепь Сп>2
(m/z 29, 43, 57,...). Разрыв связи С—О с миграцией Н приводит к HCNO4"
(m/z 43) или alkene4" (m/z 42, 56, 70,...). В случае цианатов с заместителями
Сп>5 отщепление алкена приводит к образованию частиц с m/z 99.
Серии ионов. Насыщенные и ненасыщенные катионы (СпН2П-м, m/z 29, 43,
57,... и CnH2n-i, m/z 27, 41, 55,...). Алкенильные катион-радикалы (СПН2П,
m/z 42, 56, 70,...) образуются вместе с изобарными ионами состава CnH2nNCO.
Интенсивности. Интенсивные пики в основном в области низких масс.
Молекулярный ион. Обычно сигнал слабый или отсутствует. Пик [М—Н]+ часто
более интенсивный. Нечетная масса для нечетного числа атомов N в молекуле.
7.9.17 Ароматические цианаты (R—OCN) [8]
Фрагментация. Потеря OCN' (Дт 42) или, в меньшей степени, СО с последу-
ющим элиминированием HCN (Дт 28 и 27).
N
Серии ионов. Фрагменты ароматических углеводородов СПНП и CnHn±i
(m/z 39, 51-53, 63-65, 75-77,...).
Интенсивности. Интенсивные пики в области высоких масс.
Молекулярный ион. Интенсивный пик. Нечетная масса для нечетного числа
атомов N в молекуле.
7.9.18 Алифатические изоцианаты (R—NCO) [8]
Фрагментация. Спектры часто очень похожи на спектры соответствующих
цианатов. При разрыве следующей за атомом N связи С—С заряд остается на
CH2NCO (m/z 56) в случае изоцианатов с короткими алкильными цепочка-
ми и на алкильном заместителе для соединений с цепочками Cn>2 (m/z 29,
43, 57,...). При разрыве связи С—N с переносом Н образуются ионы HCNO4"
(m/z 43) или alkene4" (m/z 42, 56, 70,...). В случае изоцианатов с заместите-
лями Сп>5 элиминирование алкена приводит к частицам с m/z 99.
352 7. Масс-спектрометрия
m/z 99
Серии ионов. Насыщенные и ненасыщенные катионы (CnH2n+i, m/z 29, 43,
57,... и CnH2n-1, m/z 27, 41, 55,...). Алкенильные катион-радикалы (СПН2П,
m/z 42, 56,70...) возникают вместе с изобарными ионами состава CnH2nOCN.
Интенсивности. Интенсивные пики в основном в области низких масс.
Молекулярный ион. Обычно сигнал слабый или отсутствует. Пик [М—Н]+ часто
более интенсивный. Нечетная масса для нечетного числа атомов N в молекуле.
7.9.19 Ароматические изоцианаты (R—NCO) [8]
Фрагментация. Последовательное элиминирование СО (Am 28) и HCN
(Am 27). В противоположность ароматическим цианатам, практически отсут-
ствует элиминирование NCO' (Ат 42).
Серии ионов. Фрагменты ароматических углеводородов СПНП и CnHn±i
(m/z 39, 51-53, 63-65, 75-77,...).
Интенсивности. Интенсивные пики в области высоких масс.
Молекулярный ион. Преобладает; основной пик для фенилизоцианата. Нечет-
ная масса для нечетного числа атомов N в молекуле.
7.9.20 Алифатические тиоцианаты (R—SCN) [8]
Фрагментация. Элиминирование HCN (Ат 27) с последующей потерей ал-
кильной группы. Разрыв следующей за SCN связи С—С несущественен, кроме
случаев тиоцианатов с короткими алкильными цепочками.
Серии ионов. Насыщенные и ненасыщенные катионы (CnH2n+i, m/z 29, 43,
57,... и CnH2n-1, m/z 27, 41, 55,...).
Интенсивности. Интенсивные пики в области низких масс.
Молекулярный ион. Слабый сигнал. Уменьшается с увеличением длины цепи
и степени разветвления; отсутствует в спектре гексилтиоцианата. Нечетная
масса для нечетного числа атомов N в молекуле. Обнаруживаются оба пика
[М+Н]+ и [М-Н]+.
7.9. Азотсодержащие соединения 353
Наблюдаются характерный для 34S изотопный пик [М+2]+‘ и пики [Frag4-2]+
для S-содержащих фрагментов (4,4% на атом S относительно М+').
7.9.21 Ароматические тиоцианаты (R—SCN) [8]
Фрагментация. Самый важный процесс — элиминирование SCN' (Дт 58).
Кроме того, происходит потеря CN" (Дт 26), HCN (Дт 27) и CS (Дт 44).
Серии ионов. Фрагменты ароматических углеводородов СПНП и CnHn±i
(m/z 39, 51-53, 63-65, 75-77,...). Слабый сигнал m/z 45 (CHS+) указывает
на серу.
Интенсивности. Интенсивные пики в области высоких масс.
Молекулярный ион. Преобладает; в фенилизоцианате основной пик. Нечетная
масса для нечетного числа атомов N в молекуле. Наблюдаются характерный
для 34S изотопный пик [М+2]+‘ и пики [Frag+2]+ для S-содержащих фрагмен-
тов (4,4% на атом S относительно М+').
7.9.22 Алифатические изотиоцианаты (R—NCS) [8]
Фрагментация. Разрыв следующей за группой NCS связи С—С приводит к
образованию фрагмента с m/z 72 (CH2NCS) или его гомологов, если а-атом
С замещен. Потеря алкильного остатка с сопутствующей двойной миграцией
водорода дает протонированную функциональную группу (m/z 60). В присут-
ствии алкильной цепи с Сп>4 теряется фрагмент SH‘ (Дт 33). В случае алкиль-
ных цепей Сп>5 потеря алкена приводит к фрагментам с m/z 115; возможно,
механизм тот же, что и для изоцианатов.
Серии ионов. В основном насыщенные и ненасыщенные катионы (СпН2п+1,
m/z 29, 43, 57,... и CnH2n-i, m/z 27, 41, 55,...). Сигнал для фрагмента
CH2NCS+ (m/z 72) или его гомологов (m/z 86, 100, 114,...), если а-атом С
замещен.
N
Интенсивности. Интенсивные пики преимущественно в области низких масс.
Молекулярный ион. Сигнал от средней интенсивности до малой, уменьшает-
ся при увеличении длины цепи или ее разветвленности. Более интенсивный,
чем у соответствующих тиоцианатов; 1% для гексадецилизотиоцианата. Важ-
ны оба пика [М+Н]+ и [М—Н]+. Нечетная масса для нечетного числа атомов N
в молекуле. Наблюдаются характерный для 34S изотопный пик [М+2]+‘ и пики
[Frag+2]+ для S-содержащих фрагментов (4,4% на атом S относительно М+').
7.9.23 Ароматические изотиоцианаты (R—NCS) [8]
Фрагментация. Преобладает отрыв NCS' (Дт 58). В противоположность аро-
матическим тиоцианатам, потеря HCN (Дт 27) или CS (Дт 44) приводит к
очень слабым сигналам фрагментов.
Серии ионов. Фрагменты ароматических углеводородов СПНП и CnHn±i (m/z 39,
51-53, 63-65, 75-77,...). Слабый сигнал при m/z 45 (CHS+) указывает на при-
сутствие серы.
354 7. Масс-спектрометрия
Интенсивности. Интенсивные пики в области высоких масс.
Молекулярный ион. Преобладает; для фенилизоцианата основной пик. Нечет-
ная масса для нечетного числа атомов N в молекуле. Наблюдаются харак-
терный для 34S изотопный пик [М+2]+‘ и пики [Frag4-2]+ для S-содержащих
фрагментов (4,4% на атом S относительно М+').
7.9.24 Литература
[1] Schwarz Н., Levsen К., “The chemistry of ionized amino, nitroso and nitro
compounds in the gas phase”. In: The Chemistry of the Amino, Nitroso and
Nitro Compounds and Their Derivatives; S. Patai, Ed.; Wiley, New York, 1982;
p. 85.
[2] Kingston D. G. I., Hobrock B. W., Bursey M. M., Bursey J. T., “Intramolecular
hydrogen transfer in mass spectra. III. Rearrangements involving the loss of
small neutral molecules”, Chem. Rev., 75, 693 (1975).
[3] Bowen R. D., “The chemistry of CnH2n+2N+ ions”, Mass Spectrom. Rev., 10,
225 (1991).
[4] Zeller К.-P., “Mass spectra of cyano, isocyano and diazo compounds”. In: The
Chemistry of Functional Groups, Suppl. C; S. Patai, Z. Rappoport Eds.; Wiley,
Chichester, 1983; p. 57.
[5] Thomas C. W., Levsen L. L., “Electron-impact spectra of 2-diazoacetophe-
nones”, Org. Mass. Spectrom., 13, 39 (1978).
[6] Miller J. M., Jones T. R. B., “The mass spectra of azides and halides”. In: The
Chemistry of Functional Groups, Suppl. D; S. Patai, Z. Rappoport Eds.; Wiley,
Chichester, 1983; p. 75.
[7] Abramovitch R. A., KybaE.P., ScrivenE.F., “Mass spectrometry of aryl
azides”, J. Org. Chem., 36, 3796 (1971).
[8] Jensen K. A., Schroll G., “Mass spectra of cyanates, isocyanates, and related
compounds”. In: The Chemistry of Cyanates and Their Thio Derivatives;
S. Patai, Ed.; Wiley, Chichester, 1977, p. 274.
7.10. Серосодержащие функциональные группы 355
7.10 Серосодержащие функциональные
группы [1]
7.10.1 Алифатические тиолы [2]
Фрагментация. Элиминирование H2S (Дт 34 или SH, Дт 33, в случае вто-
ричных тиолов) с дальнейшей потерей алкенов; последовательное отщепление
этилена в случае неразветвленных тиолов. Разрыв связи а,(3-С—С (следующей
за группой SH) приводит к образованию СНгЗН4- (m/z 47). Нужно отметить,
что этот фрагмент наблюдается также в спектрах вторичных и третичных
тиолов. Атом серы стабилизирует такой фрагмент хуже, чем азот, но лучше,
чем кислород. Разрыв следующих связей С—С приводит к появлению сигналов
с m/z 61, 75 и 89. В спектрах вторичных и третичных тиолов наблюдаются
фрагменты, образующиеся при потере самых больших а-алкильных групп.
Серий ионов. Преобладают последовательности алкенильных фрагментов
(СпН2п-1 m/z 41, 55, 69,...) и алифатических фрагментов меньшего разме-
ра (CnH2n+i m/z 43, 57, 71,...). Серосодержащие алифатические фрагменты
CnH2n+iS (m/z 47, 61, 75, 89,...). Часто появляются значимые указывающие на
присутствие серы сигналы следующих фрагментов: HS+, H2S4”, HsS+ и CHS+
(m/z 33, 34, 35 и 45).
Интенсивности. Более интенсивные пики в области низких масс; в основ-
ном относятся к алкеновым фрагментам. Наблюдаются характерные локаль-
ные максимумы серосодержащих фрагментов CnH2n+iS (m/z 47, 61, 75, 89,...).
В н-алкильных тиолах интенсивность пика с m/z 61 составляет примерно по-
ловину интенсивности пика с m/z 47; сигнал при m/z 89 интенсивнее сигнала
при m/z 75, по-видимому, из-за его стабилизации за счет циклизации.
Молекулярный ион. Относительно интенсивный сигнал, за исключением выс-
ших третичных тиолов. Наблюдаются характерный для 34S изотопный пик
[М+2]+’ и пики [Frag+2]+ для S-содержащих фрагментов (4,4% на атом S от-
носительно М+').
7.10.2 Ароматические тиолы [2]
Фрагментация. Элиминирование группы CS от М+" и [М—1]+ с образованием
[М—44]+’ и [М—45]+. Элиминирование SH от М+' дает пик [М—33]+.
Серии ионов. Кроме ароматических фрагментов СПНП и CnHn-|-i (m/z 39, 51-53,
63-65, 75-77,...), характерен ион HCS+ (m/z 45).
Интенсивности. Интенсивные пики в области высоких масс.
Молекулярный ион. Обычно преобладает; в случае тиофенола основной пик.
Обычно интенсивный сигнал [М—1]+. Наблюдаются характерный для 34S изо-
топный пик [М+2]+' и пики [Frag+2]+ для S-содержащих фрагментов (4,4% на
атом S относительно М+')-
356 7. Масс-спектрометрия
7.10.3 Алифатические сульфиды [1]
Фрагментация. Потеря алкильных радикалов при разрыве следующей за ато-
мом S связи С—С (отщепляется преимущественно самая крупная группа) и
связи С—S с последующим элиминированием алкена и H2S. Элиминирование
алкена из М+' приводит к образованию ионов соответствующего тиола. В про-
тивоположность тиолам и циклическим сульфидам, от М+' ни H2S, ни HS' не
отщепляются.
+•
Alk-SH - Alkene
C-R
/
R
-AlkS'
+ 1
S-C-R
Alk7 R
~ -R^ — A ITcono
___Alk-S=CR2 —2 > HS=CR2
- CR3
Alk-S+
+ - Alkene + .
Alk-S^J -------► H—S^j
m/z 61
Обычно миграция H нехарактеристична. Перенос вторичного Н преобладает
над переносом первичного Н.
Серии ионов. Серосодержащие алифатические фрагменты CnH2n+iS (m/z 47,
61, 75, 89,...). Углеводородные фрагменты могут преобладать в случае суль-
фидов с длинными алкильными цепочками.
Интенсивности. Интенсивные пики в области низких масс. Имеются характер-
ные локальные максимумы серосодержащих фрагментов: CnH2n+iS (m/z 47,
61, 75, 89,...).
Молекулярный ион. Обычно интенсивный сигнал. Наблюдаются характерный
для 34 S изотопный пик [М-4-2]и пики [Frag+2]+ для S-содержащих фрагмен-
тов (4,4% на атом S относительно М+').
7.10.4 Алкилвинилсульфиды
Фрагментация. Отрыв алкильных радикалов (Am 15, 29, 43,...). После трой-
ной миграции Н отщепляется тиоэтанол (Ат 62). Преобладает фрагмент с
m/z 60 (СНзСН=8+‘), сопровождаемый фрагментом с m/z 61 (CHsCH2S+).
Серии ионов. Серосодержащие ненасыщенные алифатические фрагменты
CnH2n_iS (m/z 45, 59, 73,...). Ненасыщенные углеводородные ионы СпНгп
(m/z 42, 56, 70,...) и CnH2n-2 (m/z 40, 54, 68,...).
Интенсивности. Интенсивные пики равномерно распределены по всему диа-
пазону масс.
Молекулярный ион. Сигнал средней интенсивности. Наблюдаются характер-
ный для 34S изотопный пик [М+2]+‘ и пики [Frag+2]+ для S-содержащих фраг-
ментов (4,4% на атом S относительно М+’).
7.10. Серосодержащие функциональные группы 357
7.10.5 Циклические сульфиды [3]
Фрагментация. Первоначальный разрыв следующей за атомом серы связи
С—С с последующей перегруппировкой и элиминированием СН3 (основной пик
для тетрагидротиопирана) и С2Н5. В спектре тетрагидротиофена пик [М—1]+
также значителен. От М+’ отщепляются HS', H2S и С2Н4.
Серии ионов. Серосодержащие алифатические фрагменты с одной степенью
ненасыщенности CnH2n_iS (m/z 45, 59, 73, 87, 101,...), преобладает m/z 87.
Интенсивности. Распределение интенсивностей пиков имеет максимум в об-
ласти низких масс из-за S-содержащих фрагментов CnH2n-iS (m/z 45, 59, 73,
87,...).
Молекулярный ион. Очень интенсивный сигнал. Наблюдаются характерный
для 34 S изотопный пик [М+2]+‘ и пики [Frag+2]+ для S-содержащих фрагмен-
тов (4,4% на атом S относительно М+‘).
7.10.6 Ароматические сульфиды [2]
Фрагментация. От М+’ отщепляются CS (Ат 44) и HS (Ат 33).
Серии ионов. Кроме ароматических фрагментов СПНП и CnHn±i (m/z 39, 51-53,
63—65, 75-77,...), характерен ион HCS+ (m/z 45).
Интенсивности. Интенсивные пики в основном в области высоких масс.
Молекулярный ион. Интенсивный пик. Наблюдаются характерный для 34S изо-
топный пик [М+2]+' и пики [Frag+2]+ для S-содержащих фрагментов (4,4% на
атом S относительно М+’).
7.10.7 Дисульфиды
Фрагментация. Потеря RSS’, приводящая к появлению алкильных катионов,
и отщепление алкена с образованием RSSH+". Разрыв связи S—S с миграцией Н
или без нее ведет к образованию RS+, [RS—Н]+' и [RS—2Н]+. Потеря одного
или двух атомов S с атомами Н или без них является обычным процессом в
циклических, ненасыщенных и ароматических дисульфидах.
Серии ионов. В насыщенных алифатических дисульфидах наблюдается харак-
теристическая серия H2S2 и его алкильных гомологов (m/z 66, 80, 94,...).
Интенсивности. Переменные.
Молекулярный ион. Обычно интенсивный пик. Наблюдаются характерный для
34S изотопный пик [М+2]+‘ и пики [Frag+2]+ для S-содержащих фрагментов
(4,4% на атом S относительно М+").
358 7. Масс-спектрометрия
7.10.8 Алифатические сульфоксиды [4, 5]
Фрагментация. Большинство фрагментов возникает после перегруппировки с
неспецифической миграцией Н на атом О с последующим элиминированием
ОН’ и образованием [М—17]+ или элиминированием алкена и образованием
[М—алкен]4”. Далее происходит отщепление групп ОН’, SOH’ (дающее ионы
alk+) или радикалов alk’ (приводящее к CH2=S—ОН+, m/z 63).
R-CH2 -^^SOH’ - CH2=S-OH
m/z 29, 43, 57 m/z 63
Серии ионов. Характеристический ион с m/z 63 (CH2=S—ОН+), а также ал-
кильные и алкенильные фрагменты CnH2n+i (m/z 29, 43, 57, 71,...) и CnH2n_i
(m/z 27, 41, 55, 69,...).
Интенсивности. Интенсивные пики равномерно распределены по всему диа-
пазону масс.
Молекулярный ион. Сигнал средней интенсивности. Наблюдаются характер-
ный для 34S изотопный пик [М+2]+’ и пики [Frag+2]+ для S-содержащих фраг-
ментов (4,4% на атом S относительно М+’).
7.10.9 Алкиларил- и диарилсульфоксиды [4, 5]
Фрагментация. Большинство фрагментов метиларилсульфоксидов возникает
после превращения в CH3S—О—аг+’ в результате элиминирования частиц CH2S
(с образованием фенола, [М—46]+’), СО (с образованием [М—28]+’) и СН3 (с об-
разованием [М—15]+). Последний ион теряет СО и образуется тиапиранильный
катион (m/z 97, если аг = фенил).
m/z 97
7.10. Серосодержащие функциональные группы 359
Скелетная перегруппировка не имеет отношения к фрагментации более тя-
желых арилалкилсульфоксидов. В этом случае доминируют прямой разрыв
связей С—S и перегруппировки Мак-Лафферти.
В диарилсульфоксидах происходит элиминирование групп SO (с образованием
[М—48]+'), О, ОН' и СОН' (с образованием [М—16]+', [М—17]+ и [М—29]+).
После перегруппировки до сульфенатов фрагментация по связи S—О приводит
к образованию ионов ar—S+ и аг—О+, которые в дальнейшем теряют соответ-
ственно CS и СО, что приводит к образованию C5Hj (m/z 65).
Серии ионов. Кроме ионов, перечисленных в разделе “Фрагментация”, наряду
с О- и S-содержащими ионами, образуются ароматические фрагменты СПНП и
CnHn±1 (m/z 39, 51-53, 63-65, 75-77,...).
Интенсивности. Интенсивные пики в основном в области высоких масс.
Молекулярный ион. Очень интенсивный пик. Наблюдаются характерный для
34S изотопный пик [М+2]+‘ и пики [Frag+2]+ для S-содержащих фрагментов
(4,4% на атом S относительно М+').
7.10.10 Алифатические сульфоны [4, 5]
Фрагментация. Разрыв связи S—С, заряд остается на любом из образующих-
ся фрагментов. Миграция одного или двух протонов приводит к образованию
RS(O)OH+' и RS(OH)+.
Вероятность миграции двух Н увеличивается с увеличением длины цепи. Если
один из заместителей ненасыщенный, то перегруппировка приводит к
В.8(О)О-алкену и фрагментации связи S—О с образованием иона RSO+'.
Серии ионов. Преобладают алифатические фрагменты CnH2n+i (m/z 29, 43,
57,...) и CnH2n_i (m/z 27, 41, 55,...). Обычно можно наблюдать один зна-
чительный фрагмент, соответствующий alk— S(O)OH+' (из серии m/z 80, 94,
108,...) или alk— S(OH)2 (из серии m/z 81, 95, 109,...).
Интенсивности. Интенсивные пики в основном от алифатических фрагментов
в области низких масс.
360 7. Масс-спектрометрия
Молекулярный ион. Сигнал слабый. Наблюдаются характерный для 34S изо-
топный пик [М+2]+' и пики [Frag+2]+ для S-содержащих фрагментов (4,4% на
атом S относительно М+‘).
О
H9c4-s
он
m/z 122
H9c4-sx
он
m/z 123 (70%)
Ох zOH
s+ .
-CH^CHEt Н9С/ g
- ОН' + Р
---► H9C4-S
-с4н7-
m/z 161
-с2н5-
Н9С4 С4Н9
- C4H9SOi/ m/z 178
-С4н9
С4н?
0-1
11
н9с4—s—
о
m/z 149
Q. „О
m/z 57 (100%) m/z 121
7.10.11 Циклические сульфоны [4]
Фрагментация. Преобладает элиминирование SO2 (Am 64, с последующей по-
терей СНз), HSO2 (Ат 65, с последующей потерей С2Н4) или CH2SO2 (Am 78).
Наблюдается слабый пик фрагмента [М—17]+, возникающего из-за элимини-
рования ОН'.
Серии ионов. В основном фрагменты ненасыщенных углеводородов CnH2n_i
(m/z 27, 41, 55,...).
Интенсивности. Интенсивные пики в области низких масс.
Молекулярный ион. Сигнал умеренной интенсивности. Наблюдаются характер-
ный для 34S изотопный пик [М+2]+‘ и пики [Frag+2]+ для S-содержащих фраг-
ментов (4,4% на атом S относительно М+').
7.10.12 Алкиларилсульфоны [4]
Фрагментация. Происходит изомеризация М+" в ar— OS(=O)alk и образование
феноксильного иона или фенольного катион-радикала с переносом Н. Мигра-
ция арильной группы зависит от типа заместителей, она облегчается электро-
нодонорными и затрудняется электроноакцепторными заместителями в коль-
це. В основном в замещенных или ненасыщенных алкильных производных про-
исходит изомеризация в ar—S(=O)O—alk(en) и образование ar—S=O+ (m/z 125,
если аг — фенил). Миграция одного или двух Н дает ar—S(O)OH+' и ar—S(OH)2-
Вероятность двойной миграции Н увеличивается с увеличением длины цепи.
В некоторых производных доминирует элиминирование SO2 из М+’. Замести-
тели X алкильной группы могут мигрировать к арильной группе с образова-
нием ионов X—ar—S=O+.
Серии ионов. Ароматические фрагменты СПНП и CnHn±i (m/z 39, 51-53,
63-65, 75-77,...), а также S- и О-содержащие ароматические фрагменты с бо-
лее высокими массами.
7.10. Серосодержащие функциональные группы 361
Интенсивности. Интенсивные пики в основном в области высоких масс.
Молекулярный ион. Интенсивный сигнал. Наблюдаются характерный для 34S
изотопный пик [М+2]+’ и пики [Frag4-2]+ для S-содержащих фрагментов (4,4%
на атом S относительно М+").
7.10.13 Диарилсульфоны [4, 5]
Фрагментация. Преобладают ароматические фрагменты типа аг—О+ и ar—SO+
(m/z 125, если аг —фенил), образующиеся в результате миграции одной из
арильных групп. Сигнал иона ar—SO2 незначительный; пик аг+ интенсивный.
Наблюдаются возникающие из-за элиминирования SO2, ЗОгН' и SO2H2 малые
фрагменты (Дт 64, 65 и 66 соответственно). В случае алкильных замести-
телей в орто-положении образуются [М—ОН]+ и [М—Н2О]4” с последующим
элиминированием SO.
Серии ионов. Ароматические фрагменты СПНП и CnHn±1 (m/z 39, 51-53,
63-65, 75 77,...), а также S- и О-содержащие ароматические фрагменты с более
высокими массами. Обычно сигнал ar—SO+ (m/z 125, если аг — фенил) очень
интенсивный.
Интенсивности. Интенсивные пики в основном в области высоких масс.
Молекулярный ион. Интенсивный сигнал. Наблюдаются характерный для 34S
изотопный пик [М+2]+‘ и пики [Frag+2]+ для S-содержащих фрагментов (4,4%
на атом S относительно М+').
7.10.14 Ароматические сульфокислоты [6]
Фрагментация. Самый значительный фрагмент [М—Н80з]+ (Дт 81) образу-
ется в результате двухстадийного процесса. На первой стадии элиминирование
ОН' приводит к образованию осколочного иона [М—ОН]+ (Дт 17), дающему
слабый пик. Если в орто-положении присутствует алкильная группа, то вмес-
то [М—81]+ образуется [М—H2SO3]4" (Дт 82). Другие важные фрагменты —
[M-SO2]+' (Дт 64), [M-HSO2]+ (Дт 65) и [M-SO3]+' (Дт 80).
Серии ионов. Образуются ароматические фрагменты СПНП и CnHn±1 (m/z 39,
51-53, 63-65, 75-77,...) и О-содержащие ароматические фрагменты с более
высокими массами.
Интенсивности. Интенсивные пики главным образом в области высоких масс.
Молекулярный ион. Очень интенсивный сигнал. Наблюдаются характерный
для 34S изотопный пик [М+2]+' и пики [Frag+2]+ для S-содержащих фрагмен-
тов (4,4% на атом S относительно М+').
7.10.15 Сложные эфиры алкилсульфоновых кислот [6]
Фрагментация. Потеря алкильной группы при разрыве связи С—О с одно-
временной двойной миграцией Н приводят к образованию иона протониро-
ванной сульфокислоты (m/z 97 для метансульфонатов), который затем теря-
ет воду. При разрыве связи S—О теряется алкоксильный остаток. Образова-
ние алкенильного иона из молекулы алкилсульфоната при перегруппировке
362 7. Масс-спектрометрия
Мак-Лафферти. В спектрах ароматических сложных эфиров преобладают фе-
ноксильный ион и фенольные катион-радикалы.
Серии ионов. В алифатических сложных эфирах помимо RSOsH^ и RSOJ
(m/z 97 и 79 для метансульфонатов) в основном образуются алкеновые фраг-
менты. В спектрах ароматических сложных эфиров наблюдаются ароматиче-
ские фрагменты СПНП и CnHn±i (m/z 39, 51-53, 63-65, 75-77,...), а также
О-содержащие ароматические фрагменты с более высокими массами.
Интенсивности. Интенсивные пики в области низких масс.
Молекулярный ион. В алкиловых сложных эфирах пренебрежимо малая или
низкая интенсивность сигнала. Наблюдаются характерный для 34S изотопный
пик [М+2]+‘ и [Frag+2]+ для S-содержащих фрагментов (4,4% на атом S отно-
сительно М+‘).
7.10.16 Сложные эфиры арилсульфоновых кислот [6]
Фрагментация. Преобладают фрагменты, возникающие при разрыве связи
S—О, при этом образуется ион ar—SO^, который теряет SO2 (m/z 155 и 91
в случае п-толуолсульфонатов). В алкилсульфонатах с более длинными це-
пями двукратная миграция Н дает протонированную кислоту (m/z 173 для
п-толуолсульфонатов).
Серии ионов. Ароматические фрагменты СПНП и CnHn±i (m/z 39, 51-53, 63-65,
75-77,...).
Интенсивности. Интенсивные пики в основном в области высоких масс.
Молекулярный ион. Средний или слабый сигнал. Наблюдаются характерный
для 34S изотопный пик [М+2]+‘ и пики [Frag+2]+ для S-содержащих фрагмен-
тов (4,4% на атом S относительно М+‘).
7.10.17 Ароматические сульфамиды [6]
Фрагментация. В N-алкиламидах преимущественно разрывается следующая
за атомом N связь С—С. В N-ариламидах помимо [М—SO2]4” и [М—Н8Ог]+
образуются ионы ar—SOJ и ar'—NH+.
C6Hg- (100%)
Серии ионов. Типичные для тозильной группы ионы с m/z 155, 91 и 65.
Молекулярный ион. В ариламидах М+" преобладает.
7.10. Серосодержащие функциональные группы 363
7.10.18 Сложные S-эфиры тиокарбоновых кислот [7]
В противоположность сложным эфирам элиминирование алкильного радикала
из тиольного положения является основным процессом. От тиоэфиров с более
длинными алкильными цепями отщепляется этиленсульфид. Сложные эфиры
ароматических дитиокарбоновых кислот обычно распадаются в две стадии до
арильного катиона.
7.10.19 Литература
[1] van de Sande С. С., “The mass spectra of ethers and sulphides”. In: The Che-
mistry of Ethers, Crown Ethers, Hydroxyl Groups and Their Sulfur Analogues,
Suppl. E; S. Patai, Ed.; Wiley, Chichester, 1980; p. 299.
[2]
[3]
Lifshitz C., Zaretskii Z. V., “The mass spectra of thiols”. In: The Chemistry of
the Thiol Group, Part 1; S. Patai, Ed.; Wiley, London, 1974; p. 325.
Porter Q. N., “Mass Spectrometry of Heterocyclic Compounds”, 2nd ed.; Wiley:
New York, 1985.
s
[4] Pihlaja K., “Mass spectra of sulfoxides and sulfones”. In: The Chemistry of
Sulphones and Sulphoxides; S. Patai, Z. Rappoport, C. G. Stirling, Eds.; Wiley,
Chichester, 1988; p. 125.
[5] Хмельницкий P. А., Ефремов Ю. А., “Перегруппировочные процессы в
сульфоксидах и сульфонах, индуцированные электронным ударом”, Успе-
хи химии, 46, 83 (1977).
[6] Fornarini S., “Mass Spectrometry of sulfonic acids and their derivatives”. In:
The Chemistry of Sulphonic Acid Esters and their Derivatives, S. Patai, Z. Rap-
poport, Eds.; Wiley, Chichester, 1991; p. 73.
[7] Tomer К. B., Djerassi C., “Mass Spectrometry in structural and stereochemical
problems. CCXXV. Sulfur migration in [M—С2Щ]+ of S-ethyl thiobenzoate”,
Org. Mass Spectrom., 7, 771 (1973).
364 7. Масс-спектрометрия
7.11 Карбонилсодержащие соединения [1-4]
7.11.1 Алифатические альдегиды [5]
Фрагментация. Разрыв следующей за группой СО связи. Фрагментация угле-
водородной цепи похожа на фрагментацию в соответствующих алканах. Пере-
группировка Мак-Лафферти с локализацией заряда на любом конце молекулы
приводит к образованию CnH^ (m/z 28, 42, 56,...) и, часто в меньшей степе-
ни, CnH2nO+- (m/z 44, 58, 72,...). Хотя бы один продукт (часто оба) имеет
значение. Иногда происходит элиминирование воды из молекулярного иона с
образованием [М—18]+’.
Серии ионов. Преобладают последовательности осколочных ионов CnH2n+i и
СпН2п_1О (в обоих случаях m/z 29, 43, 57,...). Более слабые пики у серии
СпНгп-х (m/z 41, 55, 69,...) и продуктов перегруппировки CnH2n (m/z 28, 42,
56,...).
Интенсивности. Интенсивные пики сконцентрированы в области низких масс.
Локальные максимумы пиков четных масс обусловлены реакциями типа Мак-
Лафферти ([М—44]+" в случае незамещенного в а-положении альдегида).
Молекулярный ион. Сигнал интенсивный только для молекул с низкой моле-
кулярной массой; очень слабый для Сп>9. Пик [М—1]+ может быть более зна-
чимым, чем М+'.
7.11.2 Ненасыщенные алифатические альдегиды
Фрагментация. Разрыв следующей за СО связи ведет к образованию [М—1]+
(пик более интенсивный, чем у насыщенных альдегидов), [М—29]+ и фрагмента
с m/z 29. Если 7-водородные атомы присоединены к двойной, связи или если
имеется двойная связь в а,/3-положении, то перегруппировка Мак-Лафферти
не происходит.
Серии ионов. Наблюдаются последовательности CnH2n~i и СпН2п-зО (в обоих
случаях m/z 41, 55, 69,...).
Молекулярный ион. Сигнал более интенсивный, чем в насыщенных альдегидах.
Обычно имеет значение пик [М—1]+.
7.11.3 Ароматические альдегиды
Фрагментация. Характерная потеря Н' приводит к образованию соответству-
ющего бензоильного иона [М—1]+, а последующее декарбонилирование дает
фенильный ион [М—1—28]+, пик которого менее интенсивный. В небольшой
степени происходит декарбонилирование молекулярного иона с образованием
частицы [М—28]+'. Имеется слабый сигнал с m/z 29 (СНО+).
Серии ионов. Фрагменты ароматических углеводородов СПНП и СПНП±1
(m/z 39, 51 53, 63-65, 75-77,...).
Интенсивности. Интенсивные пики преимущественно в области молекуляр-
ного иона.
Молекулярный ион. Обычно сигнал хорошо заметен. Пик [М—1]+ интенсивный.
7.11. Карбонилсодержащие соединения 365
7.11.4 Алифатические кетоны
Фрагментация. Разрыв следующей за СО связи — самый важный первичный
процесс. Заряд может оставаться на любом фрагменте. Затем ацильные ионы
теряют СО. Перегруппировка Мак-Лафферти приводит к образованию ионов
CnH2nO+- (m/z 58, 72, 86,...). Если обе алкильные цепи содержат 7-Н-атомы,
то происходят последовательные перегруппировки. Кето-енольная таутомерия
продукта первой перегруппировки не является обязательным условием для
протекания второй перегруппировки. Кислород иногда обнаруживается по сла-
бым сигналам [М—18]+' и пикам с m/z 31, 45, 59. Фрагментация углеводородной
цепи похожа на фрагментацию в соответствующих алканах.
Серии ионов. Преобладают последовательности осколочных ионов CnH2n+i и
СпН2п-1О (в обоих случаях m/z 29, 43, 57,...), причем максимумы возника-
ют в результате расщепления рядом с группой СО, образуются ацильные ио-
ны и продукты их декарбонилирования. Фрагменты серии CnH2n-i (m/z 41,
55, 69,...) имеют пики меньшей интенсивности. При элиминировании алкена
(перегруппировка Мак-Лафферти) возникают максимумы с четными массами
CnH2nO (m/z 58, 72, 86,...). Если присутствует незамещенная а-СН2-группа,
то пик m/z 43 (СНзСО+) обычно интенсивный.
Интенсивности. Интенсивные пики преимущественно в области низких масс.
Молекулярный ион. Относительно интенсивный сигнал, слабый в случае али-
фатических кетонов с длинными и разветвленными алкильными цепочками.
7.11.5 Ненасыщенные кетоны
Фрагментация. Разрыв следующей за группой СО связи преимущественно с
насыщенной стороны — наиболее важное направление первичной фрагмента-
ции. Ацильный ион затем теряет СО. Перегруппировка Мак-Лафферти не
происходит ни в случае ненасыщенных заместителей в а,/3-положении, ни в
том случае, когда имеется только 7-атом водорода, присоединенный к атому
углерода с двойной связью.
Молекулярный ион. Относительно интенсивный сигнал.
7.11.6 Алициклические кетоны
Фрагментация. Главное направление первичной фрагментации — разрыв сле-
дующей за группой СО связи с последующей потерей алкильного остатка.
- CH2CH2CH2R2
m/z 55
(для R1 = Н)
366 7. Масс-спектрометрия
В результате процессов типа перегруппировки Мак-Лафферти происходит зна-
чительное элиминирование более объемистых алкильных групп в виде алкенов
из положений 2 или 6. Поскольку перегруппировка очень выгодна, в ней могут
участвовать даже ароматические атомы Н. В случае циклогексанонов возмож-
на последовательная ретро-реакция Дильса -Альдера:
- сн2=сн2
m/z 70
Кислород иногда проявляется в виде слабого сигнала [М—18]+’.
Серии ионов. Последовательности алкеновых фрагментов типа CnH2n-i или
СпН2п_3О (в обоих случаях m/z 41, 55, 69,...), максимумы возникают в ре-
зультате потери алкильного остатка после раскрытия кольца рядом с карбо-
нильной группой и переноса Н. Заметные максимумы с четной массой возни-
кают при элиминировании заместителей в положении 2 или 6 в виде алкенов
при стерически предпочтительных перегруппировках Мак-Лафферти.
Интенсивности. В общем случае более интенсивные пики в области низких
масс или распределение основных пиков во всему диапазону масс. Главные
направления фрагментации сопровождаются локальными максимумами.
Молекулярный ион. Интенсивный сигнал.
7.11.7 Ароматические кетоны
Фрагментация. Преобладает о-распад с образованием бензоильного иона с
последующим декарбонилированием, приводящим к фенильному иону с пи-
ком меньшей интенсивности. o-Распад ацетофенона дает ацетильный катион
(m/z 43). Максимумы с четной массой возникают при элиминировании алкена
в результате перегруппировки Мак-Лафферти. В диарилкетонах происходит
элиминирование СО в результате скелетных перегруппировок.
Серии ионов. Фрагменты ароматических углеводородов СПНП и CnHn±i
(m/z 39, 51-53, 63-65, 75-77,...).
Интенсивности. Интенсивные пики преимущественно в области молекуляр-
ного иона.
Молекулярный ион. Интенсивный сигнал.
7.11.8 Алифатические карбоновые кислоты
Фрагментация. Разрыв связи С—СО приводит к частицам с m/z 45 и [М—45]+.
Потеря ОН’ приводит к [М—17]+; после этого может происходит ь декарбонили-
рование. Разрыв 7-связи (относительно СО) ведет к +СН2СН2СООН (m/z 73),
если на а- и /3-атомах С нет разветвлений. Потеря Н‘ (не карбоксильного)
ведет к [М—1]+. Элиминирование воды дает [М—18]+’, если алкильная группа
состоит по крайней мере из четырех атомов С; далее может происходить декар-
7.11. Карбонилсодержащие соединения 367
бонилирование. Если нет а-заместителя, то перегруппировка Мак-Лафферти
приводит к частицам с m/z 60 (в случае уксусной кислоты).
Серии ионов. Насыщенные и ненасыщенные ионы в основном в области низких
масс (CnH2n+i и СпН2п-1, m/z 29, 43, 57,... и 27, 41, 55,...). В алифатиче-
ских кислотах с длинными цепями наблюдаются серии CnH2n-iO2 (m/z 59, 73,
87,...) с максимумами для п — 3,7,11,15,... (m/z 73, 129, 185, 241,...). Макси-
мумы с четными массами CnH2nO2 (m/z 60, 74, 88,...) возникают в результате
перегруппировок Мак-Лафферти.
Интенсивности. Интенсивные пики обусловлены упомянутыми выше ионами.
Молекулярный ион. Обычно сигнал удается зарегистрировать. Легко протони-
руется до [М+Н]+.
7.11.9 Ароматические карбоновые кислоты
Фрагментация. Потеря ОН’ приводит к появлению иона [М—17]+, последую-
щее декарбонилирование (Дт 28) дает фюнильный ион, сигнал которого менее
интенсивный. Если присутствует opmo-заместитель, содержащий способный к
переносу атом Н, то происходит элиминирование воды и образование [М—18]+’.
Некоторые кислоты претерпевают декарбоксилирование (Дт 44). Ион М+’ те-
ряет СО (Дт 28).
m/z 118 для X = СН2
m/z 119 для X = NH
m/z 120 для X = О
Серии ионов. Фрагменты ароматических углеводородов СПНП и CnHn±i
(m/z 39, 51-53, 63-65, 75-77,...).
Интенсивности. Интенсивные пики преимущественно в области молекуляр-
ного иона.
Молекулярный ион. Интенсивный сигнал.
7.11.10 Ангидриды карбоновых кислот
Фрагментация. В случае линейных ангидридов наблюдаются интенсивные пи-
ки ацильных ионов, образующихся при разрыве следующей за карбонильной
группой связи. В случае циклических ангидридов максимумы возникают в ре-
зультате декарбоксилирования (Дт 44) с последующим декарбонилированием.
Молекулярный ион. Сигнал слабый или отсутствует (особенно в линейных али-
фатических ангидридах), легко происходит протонирование до [М+Н]+. Отно-
сительно сильный сигнал для фталевых ангидридов.
7.11.11 Насыщенные алифатические сложные эфиры
Фрагментация. Преобладает разрыв соседних с карбонильной группой связей,
ведущий к alk—СО+ (m/z 43, 57, 71,...; интенсивность сигналов уменьшается
с увеличением длины алкильной цепи) с последующим декарбонилированием.
При фрагментации образуются серии COOR+ (m/z 59, 73, 87,...) и alk+ (m/z
368 7. Масс-спектрометрия
15, 29, 43,...). При элиминировании спирта образуется CnH2n_2O (m/z 42, 56,
70,...) с последующим декарбонилированием (Ат 28) или отщеплением кете-
на (Am 42). Отщепление алкена со стороны кислотного остатка посредством
перегруппировки Мак-Лафферти с образованием CnH2nO2 (m/z 60, 74, 88,...).
Алкильная группа большего размера участвует в перегруппировке, если имеет-
ся несколько атомов Н в 7-положении. В следующем примере альтернативный
процесс, приводящий к [М—С2Н4]+’, можно не учитывать.
Неспецифические миграции атомов Н со стороны спиртовой группы (от М+>
или продукта перегруппировки Мак-Лафферти) приводят к СпН2пО2 и к соот-
ветствующему алкену CnH2n (m/z 28, 42, 56,...). В метиловых эфирах кислот
с длинными цепями максимумам соответствуют ионы [(СН2)2+4ПСООСНз]+
(m/z 87, 143, 199,...). В случае сложных эфиров более тяжелых спиртов (по
крайней мере Сз) происходит двойной перенос Н с образованием протониро-
ванной кислоты CnH2n+iO2 (m/z 61, 75, 89,...). о-Замещенные сложные эфи-
ры могут терять заместитель, а затем через алкоксильную перегруппировку
и СО (Ат 28). /3-Замещенные сложные эфиры в аналогичной реакции могут
отщеплять кетен (Ат 42).
В фюрмиатах, кроме обычных реакций сложных эфиров, можно наблюдать
специфические перегруппировки.
-СО,-R2 .О Н
------► Н ЛГ
R1
(m/z 31 для R1 = Н)
Серии ионов. Для связанных со сложноэфирным кислородом алкильных групп
(за исключением метиловых сложных эфиров) образуется серия CnH2n+i
(m/z 29, 43, 57,...). CnH2n_i (m/z 27, 41, 55,...). В случае метиловых сложных
эфиров кислот с длинными цепями для серии CnH2n_iO2 (m/z 59, 73, 87,...)
наблюдаются максимумы при п = 4,8,12,... (m/z 87, 143, 199,...). Максиму-
мы с четными массами в серии CnH2nO2 (m/z 60, 74, 88,...) возникают при
элиминировании алкена в результате перегруппировок Мак-Лафферти с обеих
сторон от карбоксильной группы. Серия CnH2n (m/z 28, 42, 56,...) соответ-
ствует продуктам переноса Н со стороны спиртовой группы.
Интенсивности. Интенсивные пики вышеупомянутых ионов находятся в об-
ласти низких масс.
Молекулярный ион. Сигнал часто имеет низкую интенсивность. Легко прото-
нируется до [М+Н]+.
7.11. Карбонилсодержащие соединения 369
7.11.12 Ненасыщенные сложные эфиры
а,/3-Ненасыщенные сложные эфиры. Основной путь фрагментации — потеря
alk—О+‘ с последующим элиминированием С=О. Потеря ^-заместителя при-
водит к 6-членному оксониевому циклу:
^^С)СН3
^Jd +
m/z 113
Существует значительное различие между изомерами Z и Е длинноцепных
о,/3-ненасыщенных сложных эфиров: в случае Z-изомеров происходит одно-
кратный перенос Н, в случае Е-изомеров сложных эфиров — двукратный пере-
нос Н (приводящий к протонированным кислотам).
/3,у-Ненасыщенные сложные эфиры. По сравнению с о,/3-ненасыщенными
сложными эфирами наблюдается небольшое качественное, но значительное ко-
личественное различие.
у ,ё-Ненасыщенные сложные эфиры. Происходит потеря спирта в виде радика-
ла R' с последующим отщеплением кетена.
Алифатические енольные и ароматические сложные эфиры. Образуется
alk—СО+ (m/z 43, 57, 71,...). Отщепляется кетен с образованием енол/феноль-
ного катион-радикала. Перегруппировка в основном происходит через 4-член-
ное переходное состояние, но есть и другие пути.
-RCH=C=O
[М-42]4”для R=H
7.11.13 Сложные эфиры ароматических кислот
Фрагментация. Преобладает потеря RO' с образованием бензоильного иона,
затем происходит декарбонилирование (Дт 28) и потеря ацетилена (Дт 26).
Этиловые эфиры также отщепляют С2Н4 (Дт 28) с образованием кислот-
ного катион-радикала, который в дальнейшем теряет ОН', давая бензоиль-
ный ион. В более тяжелых алкиловых сложных эфирах кроме кислоты об-
разуется протонированная кислота (в результате двойного переноса протона).
В opmo-замещенных ароматических сложных эфирах с о-водородным атомом
на заместителе от М+‘ отщепляется спирт. В случае алкилфталатов (кроме ди-
метилфталата) отщепляется алкенил с образованием протонированного слож-
ного эфира кислоты с последующими элиминированием алкена от другой эфир-
ной группы и затем воды, в результате образуется протонированный ион ан-
гидрида, который дает основной пик с m/z 149.
370 7. Масс-спектрометрия
Серии ионов. Фрагменты ароматических углеводородов СПНП и CnHn±i
(m/z 39, 51-53, 63-65, 75-77,.. .)•
Интенсивности. Заметный максимум в области массы бензоильного иона и
продукта его декарбонилирования.
Молекулярный ион. Обычно интенсивный сигнал.
7.11.14 Лактоны
Фрагментация. Наиболее важная реакция — потеря заместителей (или Н‘) от
связанного с О атома С с последующим декарбонилированием (Дт 28), де-
карбоксилированием (Дт 44, в основном в случае малых молекул) и элимини-
рованием кетена (Дт 42). Декарбоксилирование М+’ редко бывает значитель-
ным. При первичном разрыве кольца конкурируют реакции нескольких типов.
Для ароматических лактонов наблюдаются максимумы, обусловленные двумя
последовательными декарбонилированиями.
Серии ионов. Специфических серий ионов нет. Важным фрагментом часто яв-
ляется ацетильный ион (m/z 43).
Интенсивности. Максимумы соответствуют фрагментам, возникающим при
потере заместителей у атома С рядом с О. В противном случае интенсивные
пики равномерно распределены по всему диапазону масс.
Молекулярный ион. В алифатических лактонах обычно сигнал низкой интен-
сивности, легко протонируется с образованием [М+Н]+. В случае ароматиче-
ских лактонов пик интенсивный.
7.11.15 Алифатические амиды
Фрагментация. Элиминирование алкена со стороны кислотного остатка в ре-
зультате перегруппировки Мак-Лафферти дает соответствующий катион-раг
дикал ацетамида. Потеря алкенов со стороны амина дает ион дезалкилирован-
ного амида; часто двойной перенос Н приводит к протонированному дезалки-
лированному амидному иону. Разрыв связей с обеих сторон от карбонильной
группы. Соседние с атомом N связи С—С и связь /3,7-С—С (относительно N,
см. схему) также претерпевают разрыв.
-СН2С=О
Дт42 Н
m/z 44
Разрываются связи /3-С (см. схему) и 7-С со стороны кислотного остатка.
7.11. Карбонилсодержащие соединения 371
Серии ионов. Фрагменты с четной массой, соответствующие CnH2nNO (m/z 44,
58, 72,...) возникают при разрыве следующей за СО связи со стороны кислот-
ного остатка. Фрагменты с нечетной массой (во вторичных и третичных ами-
дах) CnH2n-iO (m/z 43, 57, 71,...) образуются при разрыве следующей за СО
связи со стороны аминного остатка.
Интенсивности. Общее распределение интенсивностей имеет максимум в об-
ласти низких масс. Локальные максимумы дают продукты перегруппировки
Мак-Лафферти и 7-распада.
Молекулярный ион. Интенсивность сигнала значительная. Сильная склонность
к протонированию с образованием [М+Н]+.
7.11.16 Амиды ароматических карбоновых кислот
Фрагментация. Максимальные пики у амидов ароматических кислот возника-
ют в результате разрыва амидной связи с образованием бензоильного иона и
последующего декарбонилирования (Дт 28).
Серии ионов. Фрагменты ароматических углеводородов СПНП и CnHn±i
(m/z 39, 51-53, 63-65, 75-77,...).
Интенсивности. Интенсивные пики в основном в области молекулярного иона.
Молекулярный ион. Интенсивный сигнал. В NjN-двузамещенных анилидах пик
[М—Н]+ имеет значительную интенсивность, в монозамещенных производных
он более слабый и отсутствует в спектре бензамида. Он образуется исключи-
тельно при потере орто-атомов Н ароматического кольца.
7.11.17 Анилиды
Форманилиды. Потеря СО (Дт 28) приводит к образованию катион-радикала
анилина с последующим элиминированием HCN (Дт 27).
Ацетанилиды. Элиминирование кетена с образованием катион-радикала ани-
лина (часто основной пик) с последующим элиминированием HCN (Дт 27) и
образованием катиона ацетила (m/z 43).
Трихлорацетанилиды. Преобладает потеря CCI3 (Дт 117).
Анилид пивалиновой кислоты. Кроме реакций, аналогичных происходящим
в ацетанилидах (образование катион-радикала анилина, Дт 84), при элими-
нировании HNCO (Дт 43) происходит образование трет-бутилбензольного
катион-радикала.
7.11.18 Лактамы
Фрагментация. Разрыв связи С—С, соседней с атомом N. Разрыв связи СО—N
с последующей потерей СО (Дт 28) или дальнейший разрыв следующей за
N связи С—С с образованием иона аммония. В 2-пирролидоне и 2-пиперидоне
наблюдается сильный пик с m/z 30 ([CH2=NH2]+). Основной пик в 2-пиридоне
возникает при элиминировании СО (Дт 28).
372 7. Масс-спектрометрия
2-Пиперидон:
m/z 55
Молекулярный ион. Часто поддается наблюдению; сигнал более интенсивный,
чем у соответствующих лактонов.
7.11. Карбон и лсодержащие соединения 373
7.11.19 Имиды
Насыщенные ациклические имиды. Последовательное элиминирование СО
(Дт 28) и алкоксигрупп:
-СН3О-
+
—C<N—
m/z 56
Элиминирование кетена:
+‘ -СНз
HO-C=N—
m/z 58
Если цепь заместителя атома N достаточно длинная, то происходит разрыв
следующей за атомом N связи С—С с переносом или без переноса Н.
Циклические имиды. Спектры насыщенных циклических имидов почти иден-
тичны спектрам соответствующих дикетонов. В сукцинимиде происходит от-
рыв HNCO (Дт 43) с последующим элиминированием СО (Дт 28). В арома-
тических циклических имидах происходит миграция ароила и отрыв СОг-
с=х
Дибензоиламин. Потеря СО с образованием N-фенилбензамида:
m/z 105
374 7. Масс-спектрометрия
7.11.20 Литература
[1] Bowie J. Н., “Mass spectrometry of carbonyl compounds”. In: The Chemistry
of the Carbonyl Group, vol. 2; J. Zabicky, Ed.; Wiley-Interscience, London,
1970; p. 277.
[2] Tam S. W., “Mass spectra of acid derivatives”. In: The Chemistry of Acid
Derivatives, Part 1; S. Patai, Ed.; Wiley, Chichester, 1979.
[3] Kingston D. G. L, Bursey J. T., Bursey M. M., “Intramolecular hydrogen trans-
fer in mass spectra. II. The McLafferty rearrangement and related reactions”,
Chem. Rev., 74, 215 (1974).
[4] Kingston D. G. L, Hobrock B. W., Bursey M. M., Bursey J. T., “Intramolecular
hydrogen transfer in mass spectra. III. Rearrangements involving the loss of
small neutral molecules”, Chem. Rev., 75, 693 (1975).
[5] Harrison A. G., “High-resolution mass spectra of aliphatic aldehydes”, Org.
Mass Spectrom., 3, 549 (1970).
7.12. Другие соединения 375
7.12 Другие соединения
7.12.1 Триалкилсилиловые простые эфиры [1, 2]
Фрагментация. Потеря присоединенной к атому Si алкильной группы (отры-
вается преимущественно группа большего размера). Разрыв соседней с ато-
мом О связи С—С с последующим элиминированием алкена. Потеря алкок-
сигруппы, затем отщепление алкена. Отщепление триалкилсиланола. Катион
Иг Si—OR' имеет склонность к электрофильной атаке, и даже на больших рас-
стояниях свободные электронные пары и тг-электронные центры выталкивают
нейтральные фрагменты из внутренних областей молекулы посредством пере-
группировки:
Вт—
-С(СН3)3-
------►
Am 57
-(СН2)10О
ДМ 156
/
Вг—Si +
\
Серии ионов. [CnH2n+3OSi]+ (m/z 75, 89,103,117,...). [CnH2n+3Si]+ (m/z 45, 59,
73, 87,...). Иногда возникают максимумы с четными массами из-за отщепления
триалкилсиланола.
Молекулярный ион. Сигнал М+’ часто имеет низкую интенсивность или отсут-
ствует, легко происходит протонирование до [М+Н]+. Характерное изотопное
распределение, соответствующее 28Si, 29Si и 30Si (см. разд. 2.5.5).
7.12.2 Алкилфосфаты [3]
Фрагментация. Максимумы возникают из-за потери алкенильной группы мо-
лекулярным ионом М+’ через двойной перенос Н с последующим элиминиро-
ванием алкена и образованием протонированной фосфорной кислоты (m/z 99).
Серии ионов. РО+ (m/z 47), Н2РО2 (m/z 65), Н2РО3 (m/z 81) часто исполь-
зуют в качестве неспецифических индикаторов фосфора.
Молекулярный ион. Сигнал М+‘ поддается наблюдению.
Другие
соед.
7.12.3 Алифатические фосфины и фосфиноксиды
Серии ионов. Максимумы ионов серии [СпН2п+зР]+ (m/z 48, 62, 76, 90,...),
возникающих из-за элиминирования алкена.
Молекулярный ион. Сигнал М+’ поддается наблюдению.
376 7. Масс-спектрометрия
7.12.4 Ароматические фосфины и фосфиноксиды
Фрагментация. Наблюдаются максимумы, связанные
с потерей арильной группы, последующее элими-
нирование Нг приводит к 9-фосфафлуоренильному
иону (m/z 183).
Молекулярный ион. Сигнал М+’ интенсивный, ион легко
теряет Н’ с образованием [М—1]+.
m/z 183
7.12.5 Литература
[1] Kingston D. G. I., Hobrock В. W., Bursey М. М., Bursey J. Т., “Intramolecular
hydrogen transfer in mass spectra. III. Rearrangements involving the loss of
small neutral molecules”, Chem. Rev., 75, 693 (1975).
[2] Schwarz H., “Positive and negative ion chemistry of silicon-containing molecules
in the gas phase”. In: The Chemistry of Organic Silicon Compounds; S. Patai,
Z. Rappoport, Eds.; Wiley, Chichester, 1989; p. 445.
[3] Kingston D. G. I., Bursey J. T., Bursey M. M., “Intramolecular hydrogen trans-
fer in mass spectra. II. The McLafferty rearrangement and related reactions”,
Chem. Rev., 74, 215 (1974).
Другие
соед.
7.13. Масс-спектры 377
7.13 Масс-спектры обычных растворителей
и вспомогательных веществ
7.13.1 Масс-спектры обычных растворителей
с ионизацией электронным ударом
Метка {50} показывает, что шкала интенсивностей обрывается на 50% отно-
сительной интенсивности и разделена с интервалом 10%. В этих случаях для
приведения к 100% высоту основного пика нужно удвоить. Во всех спектрах
представлены только положительные ионы.
Вода {50} Метанол Ацетонитрил
Т 18 I ' I Г- I II Г - 1 1 31 —1 1 1 1 Г-“1 1 41 —г 1 Г-
Этанол {50} Диметиловый эфир Ацетон {50}
31 : id| 45 и 2 15 9 Iй—Г 45 1 1 Г 1 -1 “I 43 15 1 27 - Д, <4 60 1 1 т 1
Уксусная кислота Этиленгликоль {50} Фуран
] 43 ] 31 39
60 68
15
43
1 j 29 , , г , J5 j, Г 62 il L. рШ—I -J1 1' 1 — I -) - 4% , ,
Пентан
А,А-Диметилформамид
Тетрагидрофуран {50}
43
Раствор.
378 7. Масс-спектрометрия
Метилацетат {50}
Сероуглерод {50}
15 28
43
74
59
u-X
Диэтиловый эфир
76
Бензол {50}
Пиридин
Бензол-de {50}
84
Циклогексан
Хлористый метилен
57
Тетраметилсилан {50}
Этилацетат {50}
43
Диоксан-1,4 {50}
28
88
58
73
43
88
Диметилгликоль {50}
45
Диизопропиловый эфир {50}
45
27
59
I 69
4-4-
87
102
Толуол
97^^51 55„л
15 27 I 51 . 74
91
Бутилацетат {50}
43 56
Раствор.
7.13. Масс-спектры 379
Хлороформ
83
Хлороформ-d
84
118
Тетрахлорэтилен
Четыреххлористый углерод
119
129
94
35 j7 59 82 |, ]
7" I ' *] 1 ।—Ц I1 | I*11 I *| I I T*'* I—г
166
Дибутилфталат [25] (часто присутствует в виде примеси,
поскольку используется как пластификатор в полимерах)
п 149
29 41 57 7fi 191 I 203 223
I. , . J 65 76 93105121 168182 | [ 278
I —I| М 11 .1—j Л 1 11 | II—| t.bfl 1 [ 1|1»—J—u-j |l . j j I» j | *'" '| 1 I I '"'1
Диоктилфталат (часто присутствует в виде примеси,
поскольку используется как пластификатор в полимерах)
п 149
57
^ЭЗ1 ?У3132
I1 г |‘‘ |“ г I1 I
167
279
Л-
Гептакозафтортрибутиламин (реагент для калибровки)
219
69 114131
ЮО 1150181
264 414 502
314 |426^64| 538
Ifl'l1, ih'l'l'f I'Jl 'Г|'|111| 1 n‘>*| > A l-l1! *1 I
576
Л.
614
Раствор.
380 7. Масс-спектрометрия
7.13.2 Масс-спектры FAB обычных матриц и веществ для калибровки
В масс-спектрах с ионизацией бомбардировкой быстрыми атомами (FAB) обыч-
но наблюдаются протонированные или депротонированные молекулярные
ионы [MiH]2*2 и протонированные кластеры [Mn+XmiH]2*2 (n,m = 0,1,2,...)
молекул исследуемого вещества и матрицы X. Если в образце присутствуют хо-
тя бы следы солей металлов, то в масс-спектрах положительных ионов появля-
ются кластеры типа [Мп+Хт+катион металла]4-. Обычно встречаются ионные
аддукты натрия (23 а.е.м) и калия (39 а.е.м.). Природа кластеров часто рас-
крывается благодаря тому, что их сигналы располагаются через определенные
интервалы.
Соединения, используемые для калибровки масс-спектров FAB по-
ложительных ионов
Ультрамарк 1621 (также ошибочно называемое “перфторалкилфосфазин”)
20- 0 - 1890 1470 .л Li L i.... 1. L 1570 1622 1. । L Li i 1 1 RQ N OR RO-F -P-OR K: CH2(CF2)nH 1722 V n=2’4’6”" 7 . Rd OR 1922
13 00 14'00 1б'оо 1б'оо i?bo 1800 1900
20- 0 978 Ю78 654 766 866 878 . 1 1 Ll 90 1 2 90
100n 50- 0 - 7( 51 31 . 1,1 )0 t 9J u 800 15 228 113 166 213 . 1 .... 1 .... 1 .... 1 >1 1 1 1 1 . 1 1 1 1 900 1000 1100 249 j 322 442 i 200 "'" 542 1300
( i ' 16o 260 ' '360 '460 '560 ббо'
Полиэтиленгликоль 400 (часто используется в качестве внутреннего стандарта
для определения m/z с высоким разрешением)
3,0-] 1,5-i 503 547 1 591 mr 1 635 679 723
v,U”| 5( 1 ЛЛ—, ' 1 1 ' r 4 ] | I | 1 l‘ 1 I | I | 1 1 | 1 | I | I . r !-! 4 1 | t 1 1 I | )0 550 600 650 700 750 800 850 900 950 1000
Раствор. 50- Л- 45 89 133 5‘ . . .’3,l in 327 371 415 459 219 283 Г I I I , ll 1 .. J . . , 1 . ; . .1 1 . L . l . . .
г -1-f 1 I 1 1 1 4 p I - 1 1 1 1 1 1 1 1
0 50 100 150 200 250 300 350 400 450 500
7.13. Масс-спектры 381
Полиэтиленгликоль 600 (часто используется в качестве внутреннего стандарта
для определения m/z с высоким разрешением)
1,0т 0,5- 503 547 591 635 679 723 767 1 ‘ 811 855
U,U "1 5 do 550 600 650 700 750 800 850 900 950 1000
100т 50- п_ 45 89 л3 г 0,8- 133 177 ; 219 к. 1 II 283 327 371 ।, у । и J 415 459
3 50 100 150 200 250 300 350 400 450 500
CsI (Cs+, 132,9; I , 126,9) в глицерине (образование [глицеринт—Hn+Csp+Iq]+)
5,0ц
: 576,8 652,5 708 7
• 540,9 616,7 668,9 744,6 800,8 836,6876 5 928 7
о,о4....L।4 i1'i и ............”1 ,
500 550 600 650 700 750 800 850 900 950 1000
100ц
50-
0--
0
57,0 45,0 75,0 л v 4, х 4 , 93,1 -т-r-, 132,9 185,1 . .1 225,0 392,7 44Я Q 277,1317,0 356,8 409,0 ’484,8 ..... ,,.1 , . Д | . , | , , . , | 1, ,
П' 11 ' I 11| 1 1 1 *1 | 1 1 1 । [ .. | । , 4| ' , , , 1 , , и, ।
50 100 150 200 250 300 350 400 450 500
Соединения, используемые в качестве матриц в масс-спектрах FAB
положительных ионов
З-Нитробензиловый спирт (Мг 153)
2,0-
1,0-
0,0 4— —-г-
500 550
100
596 813
600 650 700
766
750 800 850 900
950 1000
50
1 136 154
- 39517789107 i 289 307 5- 460
1 к ’ 1 • ' -1 ’ 4' ' ' । 1 1 1 - '‘Г 1 1
200
350
250 300
0
0 50 100 150
400 450 500
Глии 3,0-1 ;ерин (Мг 92 )
1,5т 553 645 737 829 921
и,и | 5 D0 ! j 550 600 1 ''I 1 1 1 650 700 750 800 850 900 950 1000
100т 93 185 277
50т 0 45 3775 л J J 10- 369 .1 461
50 100 150 200 2 50 300 350 400 450 500
Раствор.
382 7. Масс-спектрометрия
Тиоглицерин (Мг 108. Отметим m/z 23 (Na+), 131 ([M+Na]+), 239 ([2M+Na]+).
Подобным образом малые примеси К+ дают сигналы с m/z 39, 147, 255)
6,0“
3,0Н
о,о-г*
500
100
50
0
0 50 100 150 200 250 300 350 400 450 500
Дитиотреит/дитиоэритрит (HSCH^CHOH^CH^SH; Мг 154)
3,07
1,5“ ,
0,04—
500
1007
50-
0- —
541
550
800 850 900 950 1000
600 650 700 750
- дс 57 1 .^.д. 73 L 91 109 1иоо 1Ч1 165 199 217 325 239 279 307, Л , ,L. г-!
525 569 613 657
...L...1"-' Д
650 700
119
103 135,155
550 600
85
750 800 850 900
309
950 1000
10- 259
. , .4
391
461
0 50 100 150 200 250 300 350 400 450 500
1,4,7,10,13,16-Гексаоксациклооктадекан (18-краун-6, Мг 264. Используется в ка-
честве добавки; связывает ионы металлов и восстанавливает [М+ион металла]+
преимущественно до [М+Н]+, что может быть важным для образцов со спо-
собным к обмену Н+, например пептидов [1])
2,0ч
1,(Н
о,о-|—
500
1007
50-
о4—
0 50 100 150 200 250 300 350 400 450 500
2-Нитрофенилоктиловый эфир (Мг 251)
5,07
2,57 503
0,0-|н*-
500
1007
50-
0“-
о
527
Ji 789
|....| 1 1 ' ' | ' . " ""I. | ' V | ' ' ' | ' ' ' |
550 600 650 700 750 800 850 900 950 1000
45 87 219
31 59 I 265
J j . T, Ф , 221, Д............................................
550
43
29 I
,.г,
600 650
57 ,„„140
700
735
’'г- । • । ‘ I
750 800 850 900
950 1000
50 100 150
252
2212351
' I*' Г1'
200 250
10-
333 364
471486
300 350 400 450 500
Раствор.
7.13. Масс-спектры 383
Триэтаноламин (Мг 149)
1,0-
0,5 т
0,0 4-
500
100-1
50 7
0-4-г
0 50 100 150 200 250 300
Сульфолан (Мг 120) [2]
Ю-i
5-
597
' I " '
550 600
118
30 45 56 74
650
132
150
700
194
750 800 850
4-
267
281
307
601
900
400
950 1000
448
500
0 1
500 550
100-1
50-
41 55
600
105
650
121
700 750 800 850 900 950 1000
241
о,,41 55 166
27 I 1 87 I 151 I
225
286
481
0
0 50 100 150 200 250 300 350 400 450 500
Бромид гексадецилпиридиния (Мг 385; гексадецилпиридиний = 304) в 2-нитро-
бензиловом спирте
10 1
5 -
690
608
0 4-г
500
50-]
25 -
550
43
29 ||
55
600 650 700 750
80 80 J
93 120
| ,148 176 204
800 850 900 950 1000
304
о ,.,д г....-i .........
О 50 100 150 200 250 300 400 500
Соединения, используемые для калибровки масс-спектров FAB от-
рицательных ионов
Полиэтиленгликоль-400 (часто используется в качестве стандарта в масс-спект-
рах высокого разрешения)
Раствор.
384 7. Масс-спектрометрия
Полиэтиленгликоль-600 (часто используется в качестве внутреннего стандарта
в масс-спектрах высокого разрешения)
100-1
50-
0-
501 545 589 633
721 765
। -к । “i у Д
809
500 550 600 650 700 750 800
853
'I |^ । *i
850
897 941
*1 г |"»
900 950
1000
100-1
50т
О--
105
193
149
0 50 100 150 200
250 300 350 400 450 500
Ультрамарк 1621 (ошибочно называемое также “перфторалкилфосфазин”)
80-| 1306
40-
1300
1406 1506
1400 1500
RO -кт OR
RO-P'4?-OR R: CH2(CF2)nH
1606 N.p--N n = 2, 4, 6 ...
I 1706 RO>>R
1 L ROOR 1806 190
,-h--f-1-1>—I-1-1--1-1--1-
1600 1700 1800 1900
0 J , L,
1106 1206
692 760 860 894 960 1006 1 1294
700 800 900 1000 1100 1200 1300
100 -n
5019
0
243
124163 298 398 492 498 5g2
100 200 300 400 500 600
KI (K+, 39,0; I , 126,9 ) в глицерине (образование [глицеринт—Hn+Kp-|-Iq] )
624,5 790,4 956,2
_ 588,6 I 754,5 L 92°.4 Il
г -fill' Ij-'Л | |”l llrlll" l'“|
5( 100- 50- )0 550 600 59>° 91,0 j. Д ..jJk 1 650 700 750 800 850 900 950 1000 126,9 292,8 458 6 198,9 226,9 256,9 3i9>o 392,8 422>8
50 100 150 200 250 300 350 400 450 500
7.13. Масс-спектры 385
Соединения, используемые в качестве матриц в масс-спектрах
FAB отрицательных ионов
З-Нитробензиловый спирт (Мг 153)
100ц
SO-
612
о-н
500
100ц
550
765
50-
46
600 650 700 750
I 153
168 199
122 138
О Т—1*'| I1 |5
О 50 100
150
800 850 900
306
I 352
» |Г f l-l /'I . —T~I ]
200 250 300 350 400 450 500
950 1000
459
Глицерин (Mr 92)
100->
SO-
551
ОН~г
500
100ц
643
735
50-
0--
0
550 600
91
650 700
183
800
275
850 900
950 1000
59 71
“rJ'
50 100 150 200 250 300 350 400 450 500
750
50-i
30-
I 10 — I
T Г* I "Г I 1 | I I I I p‘1 -Д
367
459
Тиоглицерин (Мг 108)
100-1
50-
0
100
50
1 1 > 1 1 1 > 500 550 1 1 | 1 1 1 1 | 1 1 1 600 650 1 1 1 700 1 1 1 1 750 1 1 ! | 1 1 800 I 1 । 1 । 1 1 1 850 900 .ilii.il 950 1000
- - - 32 I 64 |‘*|* |4'-| "14j' 89 107 139 179 k f.Д . 'г 197 ' I" » 287 Ал 377 1 1 1 1 1 '' 1 467 , । 1 । । । । 1
О
О 50 100 150 200 250 300 350 400 450 500
1,4,7,10,13,16-Гексаоксациклооктадекан (18-краун-6, Мг 264)
100-1
SO-
525
о4-г
500
100ц
623
50-
31
550 600 650 700 750 800 850 900
43
58
| 85 105 147 193 237 263 279 305 359
950 1000
497
0 АЧ '!< । । И .....1 * I 1
0 50 100 150 200 250 300 350 400 450 500
Раствор.
386 7. Масс-спектрометрия
2-Нитрофенилоктиловый эфир (Мг 251)
100п
50- 502 1 . 518
и-
500 550 600 650 700 750 800 850 900 950 1000
100- 50- 2 46 122 11 L ДТЕ 138 153 J...... 235 251 266 1 297 . Ж —. 4 . . J , „ а. . 470
и ’Т’ ' 1 > 1 1 > 1 1 1 ' ' I"’"1 I
0 50 100 150 200 250 300 350 400 450 500
Раствор бромида гексадецилпиридиния в 2-нитробензиловом спирте (Мг 385;
гексадецилпиридиний = 304; увеличивает детектирующую способность и вос-
станавливает аддукты ионов металлов в пробе [3])
100т
50т
0 "С I *f" I.... Г Г-Т—f 1 I1 'I !*• Г | г
500 550 600 650 700
100т 79
50- 25
0 1^. , .‘I Г'].Г 'Г I I |‘ I 'l I | I
0 50 100 150 200
845
750 800 850 900 950 1000
462
250 300 350 400 450 500
7.13.3 Масс-спектры МЛДИ обычных матриц
В масс-спектрах с матричной лазерной десорбционной ионизацией (МЛДИ,
MALDI) обычно наблюдаются протонированные и депротонированные моле-
кулярные ионы [MiH]2*2 и протонированные кластеры [Mn+XmiH]2*2 (n,m =
0,1,2,...) молекул пробы и матрицы X. Если в пробе имеются хотя бы сле-
ды солей металлов, то в масс-спектрах с положительной ионизацией появля-
ются кластеры типа [Мп+Хт+катион металла]+. Наиболее часто встречаются
аддукты ионов натрия (23 а.е.м) и калия (39 а.е.м). Природа кластеров часто
обнаруживается по регулярности интервалов, с которыми проявляются в спек-
трах их пики [4].
Соединения, используемые в качестве матриц в масс-спектрах
МЛДИ положительных ионов
З-Аминохинолин (Мг 144)
145
I_______________________Л___________и______________________________
| I I | | -[-Г1 I I | 1 I ! I ] I I I Г [1111 | I I I I | I I I I | I I I I | ГГ I I | 1 I I I | I I I I | I I I I | I I I I | -I I I I | I I I I | I Г Г Г |
0 50 100 150 200 250 300 350 400 450 500 550 600 650 700 750 800
Раствор.
7.13. Масс-спектры 387
а-Циано-4-гидроксикоричная кислота (Мг 189; m/z 212, [M+Na]+)
102 1 ^Y^COOH 90 CN 212 i 379
I I I I I I I , ТТ| ITI I p I l”’| | I I I I | I I I I pi ГТ1 |TI I Г| I IT I | ГЧ I !]•! I Г1 | I I I I | I I I 1 | I I I I | I I I I ] I , I I j
0 50 100 150 200 250 300 350 400 450 500 550 600 650 700 750 800
2,5-Дигидроксибензойная кислота (Mr 154; m/z 177, [M+Na]+; m/z 193,
[M+K]+)
0 50 100 150 200 250 300 350 400 450 500 550 600 650 700 750 800
2,6-Дигидроксиацетофенон (Mr 152; m/z 175, [M+Na]+; m/z 191, [M+K]+;
m/z 365, [2M+Na+K-H]+?)
0 50 100 150 200 250 300 350 400 450 500 550 600 650 700 750 800
Дитранол (Mr 226)
I " 111 1'111 i 1" i1 b 1 г k i i ” 11 11 11 • 1 г 1 i' 'b г i1 1 i • г i
0 50 100 150 200 250 300 350 400 450 500 550 600 650 700 750 800
Феруловая кислота (4-гидрокси-З-метоксикоричная кислота; Mr 194)
0 50 100 150 200 250 300 350 400 450 500 550 600 650 700 750 800
Раствор.
388 7. Масс-спектрометрия
Синапиновая кислота (3,5-диметокси-4-гидроксикоричная кислота; Мг 224;
m/z 471, [2M+Na]+)
О 50 100 150 200 250 300 350 400 450 500 550 600 650 700 750 800
Соединения, используемые в качестве матриц в масс-спектрах
МЛДИ отрицательных ионов
З-Аминохинолин (Мг 144)
| I I I I | 7 I I I | I I I I | I I I Г] I Г 1 I | Г I 1 I | 1 I I I | I I I I | I I 'I 1 '] I 1 I I | I 7 7 Г] Т1 Т IТ ] I I I I ] I I I I | 1 I I I | I I I I |
0 50 100 150 200 250 300 350 400 450 500 550 600 650 700 750 800
<т-Циано-4-гидроксикоричная кислота (Мг 189; m/z 399, [2M+Na—2Н] )
144
290 333
377 399
| Г I I I | Г'Т "I I | I I I I | 1 I Г I | I Ч Г I |-|-ГТ—Г~| Г I I I | ГТТТ] I I 1 I [ I I I I | I I I I | I I I I | I Г I I |'I fl I I' I ГТТ"рТТГ~|
0 50 100 150 200 250 300 350 400 450 500 550 600 650 700 750 800
2,5-Дигидроксибензойная кислота (Мг 154)
153
। I 1 । 1 । । l l I | I । ттр т । 1 [ 1 । । । । । । । । [т-l l г । । । гт j11 т т । ] । । । । [ 1 । । 1 । । 1 । । । । । । । । । । । । । । । । । । । । Г'Г'|
0 50 100 150 200 250 300 350 400 450 500 550 600 650 700 750 800
2,6-Дигидроксиацетофенон (Мг 152; m/z 325, [2M+Na—2Н] )
НО О
[ I I I I I I I I I [|-ГГ Г[ I I I I [ 1 I I I | I I I I р I I I |1Г Т1|1 I II [ 7'1 Т'Г'| I I М | I I I I | I 11 I | I I I I | И I I | I I I I |
0 50 100 150 200 250 300 350 400 450 500 550 600 650 700 750 800
Раствор.
7.13. Масс-спектры 389
Дитранол (Мг 226)
О 50 100 150 200 250 300 350 400 450 500 550 600 650 700 750 800
Феруловая кислота (4-гидрокси-З-метоксикоричная кислота; Мг 194)
Г' " ' I " Г| I " " I " " Г 1 1 1 I " " I " " ! " " I " " I " " I " " I " " I " " I 1 " 'I " " I " " I
0 50 100 150 200 250 300 350 400 450 500 550 600 650 700 750 800
Синапиновая кислота (3,5-диметокси-4-гидроксикоричная кислота; Мг 224)
| 1 1 1 1 | 1 1 1 1 | I 1 1 1 I 1 1 I I I I ' 1 1 | I I I I I I I I I | I I I I Р I | I I I I I I ITI | I I I I | I I I 1 | I I I 1 | 1 I I I | I I I I |
О 50 100 150 200 250 300 350 400 450 500 550 600 650 700 750 800
7.13.4 Литература
[1] Orlando R., “Analysis of peptides contaminated with alkali-metal salts by fast
atom bombardment mass spectrometry using crown ethers”, Anal. Chem., 64,
332 (1992).
[2] Singh P. K., Field L., Sweetman B., “Organic disulfides and related substances”,
J. Org. Chem., 53, 2608 (1988).
[3] Huang Z.-H., Shyong B.-J., Gage D. A., Noon K. R., Allison J., “A-Alkylnico-
tinium halides: a class of cationic matrix additives for enhancing the sensitivity
in negative ion fast-atom bombardment mass spectrometry of polyanionic ana-
lytes”, J. Am. Soc. Mass Spectrom., 5, 928 (1994).
[4] Ashcroft A. E., “Ionization in Organic Mass Spectrometry, RSC Analytical
Spectroscopy Monographs”, The Royal Society of Chemistry, Cambridge, 1997.
Раствор.
8 Спектроскопия в УФ
и видимой областях
8.1 Соотношение между длиной волны
поглощаемого света и воспринимаемым
цветом
Длина волны [ Поглощаемый свет Воспринимаемый цвет (пропускаемый)
нм] Соответствующий цвет
400 фиолетовый желто-зеленый
425 СИНИЙ желтый
450 глубой оранжевый
490 голубовато-зеленый красный
510 зеленый багровый
530 желто-зеленый фиолетовый
550 желтый СИНИЙ
590 оранжевый голубой
640 красный голубовато-зеленый
730 багровый зеленый
8.2 Поглощение простых хромофоров
в УФ и видимой областях
Хромофор Соединение Переход ^шах £тах Растворитель
с-н СН4 а —> а* 122 большой газ
С-С СНз-СНз 0-^0* 135 большой газ
С=С СН2=СН2 7Г —> 7Г* 162 15000 гептан
(СНз)2С=С(СН3)2 7Г —> 7Г* 196 11500 гептан
С=С=С сн2=с=сн2 170 4000
227 630
С=С сн=сн 173 6000 газ
н-С5Нц-С=С—СНз 178 10000 гексан
196 2000
222 160
С-С1 СН3С1 П~><7* 173 200 гексан
С—Вг Н-СЗН7ВГ 208 300 гексан
С-1 сн31 П —> <7* 259 400 гексан
392 8. Спектроскопия в УФ и видимой областях
Хромофор Соединение Переход Атах £тах Растворитель
с-о CH3OH n - CH3OCH3 n - <7* 177 - <7* 184 200 2500 гексан газ
C-N (C2H5)2NH n - <7* 193 2500 гексан
(CH3)3N n — <7* 199 4000 гексан
C=N r 265 15 вода
H2N NH2 • HC1
(CH3)2C=NOH 193 2000 этанол
(CH3)2C=NONa 265 200 этанол
N=N CH3-N=N-CH3 340 16 этанол
N=O (СНз)зС-NO 300 100 эфир
665 20
(CH3)3C-NO2 276 27 этанол
H-C4H9-O-NO 218 1050 этанол
313-384 20-40 этанол
c2h5-o-no2 260 15 этанол
C=N CH3CN <190
X=Y=Z c2h5-n=c=s 250 1200 гексан
c2h5-n=c=n-c2h5 230 4000
270 25
c-s CH3SH n —> <7* 195 1800 газ
n -> 0* 235 180
C2H5-S-C2H5 n —> <7* 194 4500 газ
n - - <7* 225 1800
C2H5-S-S-C2H5 n —> <7* 194 5500 гексан
n - <7* 250 380
c=s (CH3)2C=S 460 маленький
/ S=s 495 маленький этанол
c=o (CH3)2C=O n —> <7* 166 16000 газ
7Г —> 7Г* 189 900 гексан
n —> 7Г* 279 15 гексан
CH3COOH n —> 7Г* 200 50 газ
CH3COONa n —> 7Г* 210 150 вода
CH3COOC2H5 n —> 7Г* 210 50 газ
CH3CONH2 n —» 7t* 220 63 вода
0
c5” 191 15200 CH3CN
0
c=c=o (C2H5)2C=C=O 227 360
375 20
8.3. Поглощение сопряженных алкенов в УФ и видимой областях 393
8.3 Поглощение сопряженных алкенов
в УФ и видимой областях
8.3.1 Поглощение диенов и полиенов в УФ области
Полоса 7г-тг*-перехода в соединениях с сопряженными двойными связями про-
является выше «200 нм с характерной интенсивностью порядка lg Е « 4. Поло-
жение максимума поглощения можно оценить по правилу Вудворда-Физера.
Для кросс-сопряженных систем вычисляется положение самой длинноволно-
вой полосы.
Правило Вудворда-Физера для оценки положения полосы тг-тг*-пере-
хода (Лтах в нм)
Исходная система
ациклическая
217
гетероаннулярная
214
гомоаннулярная
253
Инкременты для каждой дополнительной сопряженной двойной связи +30
для каждой экзоцикли-
ческой двойной связи
для каждого заместителя
алкильный заместитель
С1
Вг
О-алкил
ОСОСНз
N (алкил)г
S-алкил
+5
+5
+5
+5
+6
0
+60
+30
Поправка на растворитель
:0
394 8. Спектроскопия в УФ и видимой областях
Пример. Оценка положения максимума поглощения для
исходная величина (гомоаннулярная) 253
1 дополнительная сопряженная двойная связь 30
1 экзоциклическая двойная связь 5
3 алкильных заместителя 15
1 группа ОСОСНз 0
расчет 303
эксперимент 306
8.3.2 Поглощение а,/3-ненасыщенных карбонильных соединений в
УФ области [Поглощение а,/3-ненасыщенных карбонильных
соединений в УФ области]
Полоса 7г-7г*-перехода в «^-ненасыщенных карбонильных соединениях про-
является выше »200 нм с характерными интенсивностями порядка 1g е ~ 4.
Положение максимума можно оценить по расширенному правилу Вудворда.
Для кросс-сопряженных систем вычисляется положение самой длинноволно-
вой полосы.
Расширенное правило Вудворда для оценки положения полосы
7г -тг* -перехода (Атах в нм)
Исходная система
.О
X: алкил 215
X:Н 207
X: ОН 193
X: О-алкил 193
215
202
8.3. Поглощение сопряженных алкенов в УФ и видимой областях 395
Инкременты для каждой дополнительной +30
сопряженной двойной связи для каждой экзоциклической двойной связи /-> +5 ( с=с
для каждой гомоаннулярной диеновой системы +39
Для каждого заместителя на системе двойных связей а Инкремент (3 7 5 и далее
Алкильный заместитель +10 +12 +18 +18
С1 +15 +12
Вг +25 +30
ОН +35 +30 +50
О—алкил +35 +30 +17 +31
О-СОСНз +6 +6 +6 +6
S-алкил +85
N (алкил) 2 +95
Поправки на растворитель Растворитель Поправка
вода -8
гексан +11
циклогексан +11
хлороформ +1
метанол 0
этанол 0
диэтиловый эфир +7
диоксан +5
Пример. Оценка максимума поглощения в этиловом спирте для
исходная величина 215
2 дополнительные сопряженные двойные связи 60
экзоциклическая двойная связь 5
гомоаннулярная диеновая система 39
1 Д алкильный заместитель 12
3 дополнительных алкильных заместителя 54
поправка на растворитель 0
расчет 385
эксперимент 388
396 8. Спектроскопия в УФ и видимой областях
8.4 Поглощение ароматических соединений
в УФ и видимой областях
8.4.1 Поглощение монозамещенных бензолов в УФ области
Типичные диапазоны поглощения для монозамещенных бензолов
Переход ^тах £
7Г —> 7г* (разрешенный) 180 230 2000-10000
7Г —+ 7Г* (запрещенный) 250-290 100-2000
7Г —> 7Г* (делокализованный ароматическим 220-250 10000-30000
кольцом заместитель, К-полоса) п —» 7Г* (заместитель со свободной электрон- ной парой, R-полоса) 275-350 10-100
Характерные примеры поглощения монозамещенных бензолов
7Г —> _ * 7Г 7Г —> 7Г* 7Г —> 7Г* П —> 7Г*
Заместитель R (разрешен.) (запрещен.) (К-полоса) (R-полоса)
(растворитель) ^тах Е \пах £ \пах £ ^шах £
—Н (циклогексан) 198 8000 255 230
—СНз (гексан) 208 7900 262 230
—СН=СН2 (этанол) 282 450 244 12000
—С=СН (гексан) 278 650 236 12500
—С1 (этанол) 210 7500 257 170
-ОН (вода) 211 6200 270 1450
—О- (вода) 235 9400 287 2600
-NH2 (вода) 230 8600 280 1430
—NHg (вода) 203 7500 254 160
—NO2 (гексан) 208 9800 270 800 251 9000 322 150
213 8100
—CN (вода) 271 1000 224 13000
—СНО (гексан) 280 1400 242 14000 «330 «60
—СОСНз (этанол) 278 1100 243 13000 319 50
—СООН (вода) 202 8000 270 800 230 10000
8.4. Поглощение ароматических соединений в УФ и видимой областях 397
8.4.2 Поглощение замещенных бензолов в УФ области
Оценка положения максимума поглощения для разрешенных пере-
ходов в полизамещенных бензолах (Amax в нм, 1g е ~ 4)
Исходная величина: 203,5
Заместитель Инкремент [нм]
-СНз 3,0
-С1 6,0
-Вг 6,5
-ОН 7,0
-О" 31,5
-ОСН3 13,5
-nh2 26,5
-NHCOCH3 38,5
-NO2 65,0
-CN 20,5
-сно 46,0
- СОСНз 42,0
-СООН 25,5
398 8. Спектроскопия в УФ и видимой областях
8.4.3 Поглощение ароматических карбонильных соединений в УФ
области
Правила Скотта для оценки положения К-полосы (растворитель: эта-
нол; Атах в нм, е: 10000-30000)
Исходная система:
250
230
246
230
Инкременты
Заместитель орто мета пара
—алкил 3 3 10
—циклоалкил 3 3 10
—С1 0 0 10
-Вг 2 2 15
-ОН 7 7 25
—О—алкил 7 7 25
-о- 11 20 78
-nh2 13 13 58
-N(CH3)2 20 20 85
-NHCOCH3 20 20 45
Пример. Оценка положения абсорбционного максимума (К-полоса) для
исходная величина 246
орто-циклоалкил 3
пара-О-алкил 25
расчет 274
эксперимент 276
8.5. Стандартные спектры в УФ и видимой областях 399
8.5 Стандартные спектры в УФ
и видимой областях
8.5.1 Спектры алкенов и алкинов в УФ и видимой областях
400 8. Спектроскопия в УФ и видимой областях
8.5.2 Спектры ароматических соединений в УФ и видимой областях
8.5. Стандартные спектры в УФ и видимой областях 401
402 8. Спектроскопия в УФ и видимой областях
8.5. Стандартные спектры в УФ и видимой областях 403
404 8. Спектроскопия в УФ и видимой областях
1g е
0-------1---1" ' 'Г--1---1---1----| | ... |--1---г
200 300 400 X, нм
} ---I--I--Г-1--1--I--I-I--1--]-I--Т--I-Г
200 300 400 К нм
8.5. Стандартные спектры в УФ и видимой областях 405
8.5.3 Спектры ароматических гетероциклических соединении в УФ и
видимой областях
406 8. Спектроскопия в УФ и видимой областях
0--
200
| ! I , I | I I-------!--Г
300 400 1, нм
8.5. Стандартные спектры в УФ и видимой областях 407
8.5.4 Спектры разных соединений в УФ и видимой областях
408 8. Спектроскопия в УФ и видимой областях
8.5. Стандартные спектры в УФ и видимой областях 409
8.5.5 Спектры нуклеотидов в УФ и видимой областях
410 8. Спектроскопия в УФ и видимой областях
8.6 Поглощение обычных растворителей в УФ
и видимой областях
В таблице представлено краевое поглощение Aend некоторых обычных раство-
рителей, указана длина волны, при которой растворитель поглощает 80% па-
дающего света (Aend в нм, толщина кюветы 1 см, в канале сравнения — вода).
Растворитель -^end Растворитель ^end
Ацетон 335 Этилацетат 205
Ацетонитрил 190 Гептан 195
Бензол 285 Гексан 195
Сероуглерод 380 Метанол 205
Четыреххлористый углерод 265 Пентан 200
Хлороформ 245 Пропанол-2 205
Циклогексан 210 Пиридин 305
Хлористый метилен 230 Тетрагидрофуран 230
Диэтиловый эфир 210 Толуол 285
Диоксан-1,4 215 2,2,4-Т римети лпентан 210
Этанол 205 Ксилол 290
Предметный указатель
Адамантан 100, 183 — полициклические 38, 39, 43, 47,
Аденин 160, 244, 409 100, 325
Аденозин 161, 244 Алканы 11, 14, 38, 45, 46, 48, 49, 53, 77,
7-Азаиндол 115 167, 251, 319, 391
Азетидин 129, 215 галогензамещенные 334
Азиды монозамещенные 80, 168, 169
алифатические 348 неразветвленные 319
ароматические 349 полигалогеналканы 335
Азины 217 полициклические 38, 39, 43, 47,
Азиридины 14, 129, 215 100, 325
Азобензолы 217, 348, 402 разветвленные 319
Азоксисоединения 216, 280 с ароматическими заместителями 171
Азометан 217 циклические 38, 43, 46, 48, 53, 96,
Азосоединения 216, 280 182, 253, 259, 324
Азотной кислоты эфиры 84, 277, 392 Алкены 11, 14, 38, 43, 46-48, 51, 54, 88,
Азотсодержащие соединения 35, 64, 174, 252, 254, 321, 391
127, 213, 274, 345 неразветвленные 321
Азулен 102 разветвленные 321
Акридин 116, 203, 407 сопряженные 393
Акрилат-ион 143 циклические 38, 39, 259
Акрилальдегид 139, 224 Алкины 11, 17, 38, 39, 41, 51, 55, 94,
Акриловая кислота 143, 227, 257 181, 252, 258, 323, 391
фторангидрид 232 алифатические 323
хлорангидрид 148, 232 Аллены 91, 92, 180, 257, 391
Акрилоизонитрил 132 Аллиламин 128
Акрилоилфторид 232 Аллилцианид 324
Акрилоилхлорид 148, 232 Аллильные
Акрилонитрил 132, 218, 257 альдегиды 41
Аланин 154, 239, 298 метиловые эфиры 125
р- Аланин 154 простые эфиры 340
Алифатические соединения спирты 124, 337
диены 91, 180 Аллофанаты 309
соединения фосфора 151, 235 Альдегиды 12, 20, 38, 40, 41, 46, 48, 51,
спирты 123, 208, 336 68, 139, 224, 251, 292, 364
Алициклические алифатические 43
кетоны 38, 41, 141, 142, 225, 226, 365 аллильные 41
спирты 337 ароматические 364
Алициклические соединения 38, 43, 46, а- метил- 45
48, 96, 182, 253, 259, 324 а,^в-ненасыщенные 394
— конденсированные 100 Альдимины 130, 217, 279
412 Предметный указатель
Альдоксимы 12, 131, 217
Амиды карбоновых кислот 12, 13,
15, 16, 38, 45, 51, 74, 146,
229, 301
алифатических 370
алкильные третичные 230
ароматических 371
вторичные 301
первичные 301
третичные 301
Аминокислоты 21, 154, 239, 315
З-Аминохинолин 386, 388
Амины 11-14, 38, 40, 43-45, 51, 64, 127,
214, 251, 274, 318, 392
алифатические 46, 48, 275, 345
алкенилзамещенные 257
ароматические 347
бензильные 347
вторичные 274
метильные 42
первичные 274, 275
сдвиги сигналов
из-за протонирования 127
циклические 129, 215, 346
циклоалкильные 345
Аммиак
ион 214
протоны 213
соединения 14, 127, 213, 274
Ангидриды карбоновых кислот 13, 19,
148, 232, 304, 367
циклические 19
5-а-Андростан 162
5-/3-Андростан 162
Анизол 125, 186, 212, 272, 401
Анилиды 371
Анилины 12, 39, 43, 48, 49, 128, 215,
396, 401
алкилзамещенные 49
Антрахинон 296
Антрацен 102, 186, 404
Аргинин 157, 240
Ароматические
простые эфиры 125, 212, 343
соединения фосфора 152
углеводороды (арены) 12-16, 39, 41,
43, 47-49, 52, 56, 102. 186, 261, 327
— конденсированные 52, 56, 327
Аспарагиновая кислота 156, 240
Аценафтен 102, 187
Аценафтилен 102, 187
NjN-Ацетали 15
О,О-Ацетали 16, 126, 212, 251, 252,
270, 271
метил- 47
О,S-Ацетали 16
Ацетальдегид 139, 224, 293
Ацетальдоксим 217, 280
Ацетамиды 43, 146, 230
Ацетанилиды 371
Ацетат-ион 143
Ацетаты 43, 45, 297, 299
Ацетилацетон 124, 141, 226, 295
Ацетилбромид 148, 232
Ь1-Ацетил-7-бутиролактам 233
Ь1-Ацетил-7-валеролактам 233
Ацетилен 94, 95, 181
Ацетилиодид 148
N-Ацетилпирролидин 231
Ацетилхлорид 148, 232
Ацетоизонитрил 132
Ацетон 87, 140, 166, 225, 249, 377, 410
диметилгидразон 131
Ацетон-de 163, 246
Ацетонитрил 132, 166, 218, 249,
377, 410
Ацетонитрил-d.e 163, 246
Ацетофенон 141, 225, 295, 366, 396, 403
Ацилбромиды 306
Ацилгалогениды 148, 232, 306
Ацилиодиды 306
N-Ацилпиперидин 231
Ацилфториды 306
Ацилхлориды 12, 13, 38, 46, 52, 306
Бензальдегиды 139, 224, 293, 396,
398, 403
Бензантрацен 404
Бензиламин 129
Предметный указатель 413
Бензиламины 347
Бензилбромид 121
Бензилвинилсульфид 135
N-Бензилиденанилин 130, 217
N-Бензилиденметиламин 130, 217
Бензилиодид 122
Бензилмеркаптан 134, 286
Бензилфторид 119
Бензилхлорид 120
Бензильная группа 14
Бензильные спирты 124, 209, 270, 338
Бензимидазол 115, 199
Бензоат-ион 143
Бензоаты 297
1.4-Бензодиоксин 201
1,3-Бензодиоксолан 126, 212
1,4-Бензодитиин 201
Бензоизонитрил 132
Бензоила соединения 47
Бензоилхлорид 148, 232
Бензойная кислота 143, 227, 298,
396, 403
замещенная 396
сложные эфиры 396
Бензойный ангидрид 148, 305
2,1,3-Бензоксадиазол 115, 200
Бензоксазол(ы) 115, 199
Бензол 102, 108, 166, 186, 249, 263, 378,
396, 400, 410
Бензол-de 163, 246, 378
Бензол-1,3-диол 124
Бензолсульфонамид 137, 223, 362
Бензолсульфонилхлорид 137, 223
Бензолсульфоновая кислота 137, 223
метиловый эфир 223
Бензолтиол 134, 220
Бензолы 12, 14-16, 39, 43, 48, 49, 52
галогензамещенные 267
замещенные 397
монозамещенные 103, 188, 396
пергалогенированные 46
Бензонитрил 132, 218, 281, 396, 402
Бензо-7-пироны 51
2,1,3-Бензотиадиазол 115, 200
Бензотиазол 115, 200
Бензо[6]тиофен 115, 199
Бензотриазол 200
Бензофенон 141, 225, 295, 403
Бензо[6]фуран 115, 199
1,2-Бензохинон 142, 296, 403
1,4-Бензохинон 142, 226, 296, 403
Бензохиноны 20, 41, 142, 294, 295
Бис(трет-бутилтио)метан 135
Бис(изопропилокси)метилфосфин 236
2,2-Бис(этилтио)пропан 135
Бифенилы 327, 400
Бицикло[3.1.0]гексан 100
Бицикло[4.1.0]гептан 100
Бицикло[4.3.0]нонан 100
Бицикло[2.2.2]октан 100
Бицикло[3.3.0]октан 100
Бицикло[4.2.0]октан 100
Бомбардировка быстрыми атомами
(FAB) в масс-спектрометрии 380
Бора соединения 17, 153, 184, 238, 314
Бораны 17, 314
Бораты 17, 314
Борной кислоты эфиры 314
Бромалканы 334
Бромацетилен 206
Бромацетон 141
Бромбензолы 121, 206, 267
Бромиды 32, 34, 36, 47, 48, 51, 58, 121,
206, 268, 391
алифатические 50, 334
ароматические 268, 335
Бромметан 121, 206
Бромоформ 121, 206, 407
Бромоформ-d 163, 246
Бромпиридины 121
Бромпропаны 121, 206
N-Бромсукцинимид 233, 304
Бромуксусная кислота 121
Бромциклогексан 121, 206
Бромциклопропан 96, 206
Бромэтан 121, 206
Бромэтилен 121, 206
1,3-Бутадиен 91, 93, 180
Бутадиин 95
Бутан 77, 167
414 Предметный указатель
2,3-Бутандион 141
Бутановая (масляная) кислота 143, 227
ангидрид 148, 305
1-Бутанол 87, 123, 270
2-Бутанон 140
1-Бутантиол 134, 220
Бутены 174
Бутиламин 214
mpem-Бутиламин 127
N-Бутилацетамид 231
N-mpem-Бутилацетамид 147, 231
Бутилацетат 227, 300
трет-Бутилацетат 144, 227
трет-Бутилбензол 187
трет-Бутилбромид 121, 206
трет-Бутилдиметиламин 128
Бутилдиметилфосфин 151
Бутилдиметилфосфинсульфид 152
mpem-Бутилдисульфиды 222
Бутилдихлорфосфин 151
Бутилизотиоцианат 133, 285
Бутилизоцианат 133
mpem-Бутилиодид 122, 207
Бутилметилкетоны 140
Бутилметиловые эфиры 125
Бутилметилсульфиды 135, 221
трет-Бутилметилсульфон 136
mpem-Бутиловый спирт 123, 209
S-Бутилтиоацетат 138
трет-Бутилфторид 118, 204
трет-Бутилхлорид 120, 205
mpem-Бутилцианид 132, 218
Бутильная группа 169
mpem-Бутильная группа 81, 169
Бутины 95, 181
Бутиральдегиды 139, 224
7-Бутиролактам 147, 231
7-Бутиролактон 145, 229, 299
Бутиронитрил 132
Валериановая кислота 143, 227
Валериановый альдегид 139
<5-Валеролактам 147, 231
<5-Валеролактон 145, 229
Валеронитрил 132, 218, 282
Валин 154, 239
Винилацетат 228
Винилбромид 206
Винилизоцианат 133, 219, 284
Винилизоцианид 219
Винилиодид 207
Виниловый спирт 124
Винилсульфиды 356
Винилформиат 227
Винилфосфин 151
Винилфторид 118, 204
Винилхлорид 120, 205
Винилэтиловый эфир 210
Винилэтилсульфид 135
Винильные простые эфиры 255,
256, 340
Винильные соединения 39, 89
Вода 318, 377
Вода-^г 248
Водородные связи 13, 208
Галобороксины 314
Галогениды 11, 12, 13, 15, 16, 32, 58,
118, 204, 266, 334
алифатические 334
ароматические 335
Гексабромэтан 121
Гексадецилпиридиния бромид 383, 386
Гексан 77, 166, 249, 378, 411
2,5-Гександион 141
Гексанолы 123
2-Гексанон 140
1-Гексантиол 134
Гексафторэтан 118
Гексахлорацетон 141, 295
Гексахлорэтан 120
Гептан 77, 411
Германия соединения 105, 112, 113,
150, 238
Гетероароматические соединения 12,
57, 110, 192, 264, 329
Гидразиды 42, 302
Гидразины 188
Предметный указатель 415
Гидразоны 131, 217
Гидроксиламины 38
N-Гидроксипиридиния хлорид 110
4-Гидроксипролин 157, 241
Гидропероксиды 273
алифатические 338
Гидрохлориды 315
Гистидин 157, 241
Гликоли 38, 39, 45, 47, 123
вицинальные 337
этиленгликоль 45
Глицерин 123, 385
эфиры 38, 39, 48
Глицин 154, 239
Глутаминовая кислота 156, 240
Глюкоза 158, 242
Гомологические серии масс 38
Гуанидины 309
Гуанидиний-ион 392
Гуанин 160, 410
Гуанозин 161, 244
2-Дезоксиаденозин 161, 245
2-Дезоксигуанозин 161, 245
Декалины 100
Диазен-К-оксиды 216, 280
Диазен-ЬГ-сульфиды 280
Диазосоединения 39, 282, 348, 392
Диазофенилпроизводные 49
Диацетамид 149
Диацетил 141, 226
М,К-Диацетилметиламин 149
Дибенз[ а. /г] антрацен 405
Дибензо- 1,4-диоксин 116
Дибензоиламин 373
Дибензотиофен 116
Дибензофуран 116, 203
1,1-Дибромацетон 141
Дибромуксусная кислота 121
Дибромэтаны 121, 206
1,1-Дибромэтилен 121
транс- 1,2-Дибромэтилен 121
цкс-1,2-Дибром этилен 121
Ди-трет-бутилдиазен-1-оксид 217
Дибутилкарбонат 149, 233
Ди-трет-бутилкетон 140
Дибутилсульфид 134
Ди-ттгреттг-бутилсульфид 134
Дибутилсульфон 360
Ди-третп-бутилсульфон 222
Ди-третп-бутилтиокетон 138
гидразон 131
Дибутилфталат 379
Дивинилкетон 225, 295
Дивиниловый эфир 272
Дигидразиды 302
9,10-Дигидроантрацен 102, 187
2,6-Дигидроксиацетофенон 387, 388
2,5-Дигидроксибензойная кислота
387, 388
3,4-Дигидро-2Л-пиран 125
2,3-Дигидротиофен 221
2,5-Дигидротиофен 135, 221
9,10-Дигидрофенантрен 102, 187
Дигидрофураны 125, 211
Диглим 166, 249
Диены 38, 39, 47, 51, 180, 393, 399
алифатические 91, 180
сопряженные 91, 180
Диизопропиламин 214
Диизопропилкарбодиимид 131
Диизопропилкетон 140, 293
Диизопропилнитрозамин 130, 216
Диизопропилсульфид 134
Дииодметан 122, 207
1,1-Дииодэтан 207
1,2-Дииодэтан 122, 207
транс-1,2-Дииодэтилен 122
цмс-1,2-Дииодэтилен 122
Дикетоны 16, 18, 19, 141, 294
Дильса-Альдера ретро-реакция
325, 366
Димедон 124
Диметилазин 218
Диметиламин 127, 214
NjN-Диметиланилин 128
N,N-Диметилацетамид 147, 231
Диметилацетилендикарбоксилат 145
3,3-Диметил-2-бутанон 140
416 Предметный указатель
Диметилбутилфосфонит 151
Диметилвинилфосфинсульфид 236
Диметилгликоль 378
Диметилдисульфид 408
1,3-Диметил-2-имидазолидинон 149
Диметилкарбонат 149, 233
Диметилмалеат 145
Диметилмалонат 145
Диметилметилфосфонат 237
1,3-Диметилмочевина 233
Диметилнитрозамин 130, 216
Диметиловый эфир 87, 125, 210
Диметилоксалат 145
2,4-Диметил-З-пентанон 140
2,2-Диметил-1-пропанол 123
2,2-Диметил-1-пропантиол 134
Диметилсилан 234
Диметилсиланол 235
Диметилсукцинат 145
Диметилсульфат 137, 223
Диметилсульфид 134, 221
NjN-Диметилсульфинамид 223
Диметилсульфит 223
Диметилсульфоксид (ДМСО) 136, 166,
222, 249
Диметилсульфоксид-de 164, 247
Диметилсульфон 136, 222
N,N-Диметилтиоацетамид 138
Диметилтритиокарбонат 149
Диметилфенилфосфонат 237
NjN-Диметилформамид 87, 146, 166,
230, 249, 303, 377
Диметилфосфин 235
Диметилфосфинсульфид 236
Диметилфумарат 145
4,4-Диметил-2,5-циклогексадиен-1-он
142
5,5-Диметил-1,3-циклогександион 124
Диметилциклогексиламин 128
Диметилциклогексилфосфин 151
Ь^ЬГ-Диметилэтилендиамин 128
Диметилэтилфосфонат 237
Диметоксиметан 126, 212
2,2-Диметоксипропан 126
Динеопентилсульфид 134
N,N-Динитрометиламин 130
1,3-Диоксан 212, 271
1,4-Диоксан 125, 166, 211, 249, 271,
378, 410
1,3,2-Диоксатианоксид 137
1,3,2-Диоксатиоландиоксид 223
1,3-Диоксолан 126, 212
Диоктилфталат 379
Диолы 48
Дипропиламин 127, 214
ЬГ,Н-Дипропилацетамид 147
Дипропилнитрозамин 130
Дипропилсульфид 134
Дисульфиды 46, 51, 80, 81, 104, 136,
167, 168, 189, 222, 286, 357, 392
1,2- Дитиан 222
1,3- Дитиан 135
1,4- Дитиан 135
1,3-Дитиетан 135
Дитиокарбонаты 291, 308
Дитиокислоты 289
1,3-Дитиолан 135
Дитиотреит/дитиоэритрит 382
Дитранол 387, 389
Дифениламин 129, 402
Дифенилвинилфосфиноксид 235
Дифенилвинилфосфинсульфид 236
Дифенилдисульфид 136, 222
Дифенилметилфосфонат 152
Дифениловый эфир 125, 212, 401
Дифенилсиланол 235
Дифенилсульфид 135, 221
Дифенилсульфоксид 359
Дифенилсульфон 136
Дифторметан 118
Дифторуксусная кислота 118
1,1-Дифторэтан 204
Дихлорацетат-ион 143
1,1-Дихлорацетон 141
Дихлордиметилсилан 234
Дихлорметан 120, 205, 410
а,а-Дихлортолуол 120
Дихлоруксусная кислота 120, 143
Дихлорэтаны 120, 205
1,1-Дихлорэтилен 120
Предметный указатель 417
цггс-1,2-Дихлорэтилен 120
Дициклогексилкарбодиимид 131
Диэтаноламин 128
Диэтиламин 127, 214
NjN-Диэтилацетамид 147
1Я,Ь1-Диэтилбутирамид 147
Диэтилдисульфид 136
Диэтилкетон 140
1,3-Диэтилмочевина 233
Диэтилнитрозамин 130
Диэтиловый эфир 166, 210, 249, 273,
378, 410
Диэтилсульфат 137
Диэтилсульфид 134
Диэтилсульфит 137, 223
NjN-Диэтилформамид 146
Диэтилэтилфосфонат 151
Диэтилфталат 300
Диэфиры 49
ненасыщенные 49
Енамины 257
Еноловые сложные эфиры 369
Енолы 124, 210, 269
Жирных кислот производные 48
Изобутан 167
Изобутены 179
Изобутиральдегид 139, 224, 293
Изобутиронитрил 132, 218, 282
Изоксазол 110, 192
Изолейцин 155, 239
Изомасляная кислота 143
Изопропанол 123, 209
Изопропиламин 127, 214
N-Изопропилацетамид 147, 231
Изопропилацетат 144, 227
Изопропилбензоат 228
Изопропилбензол 187
Изопропилдиметиламин 128
Изопропилизоцианат 219
Изопропилметилкетон 140, 225
Изопропилметилсульфон 136
Изопропилфенилкетон 225
N-Изопропилформамид 230
Изопропильная группа 81, 169
Изотиазол 110, 192
Изотиоцианаты 133, 219, 284, 353, 392
Изотопы
распределение для Cl, Вт, S и Si
32, 34
распространенность 22, 28
расчет распределения изотопов 30
Изохинолин 116, 202, 407
Изохинолин-И-оксид 202
Изохинолины 332
Изоцианаты 133, 219, 283
алифатические 351
ароматические 352
Изоцианиды (изонитрилы)
132, 218, 281
алифатические 350
ароматические 350
Изоцианураты 302
Имидазол 47, 110, 117, 192
Имидазолид-анион 110
Имидазолий-катион 110, 192
Имидазоло[1.2-а]пиридин 201
Имиды 18, 19, 149, 233, 302, 373, 392
циклические 18, 19, 373
Имины 12, 130, 217, 278
Иммерсионные среды 317
Индазол 115, 200
Индан 100, 102, 187
1-Инданон 226
Инден 100, 102, 187
Индолизин 115, 200
Индолы 47, 115, 199, 332, 407
Иодалканы 334
Иодацетилен 207
Иодбензол(ы) 122, 207, 267, 401
1-Иодбутан 207
Йодиды 36, 49, 52, 58, 122, 207, 268, 391
алифатические 334
ароматические 335
Иодметан 122, 207
418 Предметный указатель
Иодпирвдины 122
Иодпропаны 122, 207
Иодциклогексан 122, 207
Иодциклопропан 96, 207
Иодэтан 122, 207
Иодэтилен 122, 207
Калибровочные соединения
для масс-спектрометрии 380
Калия бромид 317
е-Капролактон 145
Карбазол 116, 203
Карбаматы 19, 20, 149, 233, 307, 308
фенилкарбамат 49
Карбодиимиды 98, 131, 392
Карбоксилат-анионы 19, 142, 143, 226,
296, 392
Карбонат-ион 149
Карбонильные группы 13-15
Карбонильные соединения 68, 139, 224,
292, 364, 392
а,/3-ненасыщенные 394
Карбоновые кислоты 11-16, 18, 19,
38-40, 44, 46, 51, 70, 142, 143, 226,
296, 392
алифатические 366
ароматические 367
а-метилзамещенные 47
а,/3-ненасыщенные 392
Карбоновых кислот производные
13, 16, 18, 19,149, 233, 291, 307, 308
Карплуса уравнение 173
Катехол 263, 270
Кетали 16, 43, 126, 212, 270, 271
тиоэтиленкеталь 50
этиленкетали 45, 49
Кетены 295, 392
Кетимины 130, 279, 280
Кето-енольная таутомерия 365
Кетоксимы 16, 131, 217, 280
Кетоны 12-15, 17, 19, 38-41, 43, 46, 48,
49, 51, 69, 140, 225, 293
алифатические 226, 365
алкилфенильные 398
ароматические 366
галогенированные 140
метильные 252
ненасыщенные 141, 365
а,/3-ненасыщенные 394
циклические 38, 41, 47, 48, 141, 142,
225, 226, 365
этильные 45
Кетоэфиры (сложные) 299
Конденсированные соединения
алициклические 100
ароматические 52, 56, 327
гетероароматические 115, 199
Коронен 405
Краевое поглощение 410
18-Краун-6 382, 385
Кремния соединения 17, 43, 46, 47, 79,
89, 105-107, 111-113, 177, 189, 234,
310, 375
Кротоновая кислота 298, 400
эфиры 300
Кротоновый альдегид 293, 399
Ксантаты 290, 291
Ксантон 203
Ксилол 410
Ксилоза 242
Кубан 100
Кумарин 201
Лактамы 19, 20, 41, 74, 146, 147, 229,
231, 301, 302, 371
Лактоны 18, 19, 38—42, 44, 46, 71, 145,
229, 298, 370
Лейцин 154, 239
Лизин 156, 240
Лимонная кислота 409
Лития тетраметилборат 153
Мак-Лафферти перегруппировка
321, 323, 329, 331, 337, 338, 344,
345, 349, 350, 359, 361, 364-368, 370
Малеинимид 149
Малеиновый ангидрид 148, 232, 305
Предметный указатель 419
Малоновая кислота 143, 227, 298
Малононитрил 132
Масло минеральное (нуйол) 317
Масс-спектрометрия 319
Масс-спектры с матричной лазерной
десорбционной ионизацией
(МЛДИ, MALDI) 386
2-Меркаптоэтанол 134
Метакрилонитрил 324
Металлоорганические соединения
153, 238
Метан 77, 167
Метанол 123, 166, 208, 249, 377, 410
Метанол-di 164, 247
Метанол-<Д 164, 247
Метансульфокислота 137
эфир 223
Метансульфохлорид 137, 223
Метантиол 134, 220
N-Метилазетидин 129
Метилазин 218
N-Метилазиридин 129
Метилакрилат 145, 228
Метиламин 127, 214, 276
N-Метиланилин 128, 215
N-Метилацетамид 146, 230
Метилацетат 144, 227
Метилбензоат 145, 228, 300
Метилбензолсульфонат 137
1-Метилбензотриазол 115
2-Метилбутан 77
З-Метил-2-бутанон 140
Метил-трет-бутиламин 128
З-Метил-1-бутин 181
Метилбутират 144, 228
N-Метил-т-бутиролактам 231
Метилвалерат 144, 228
К-Метил-5-валеролактам 231
Метилвинилкетон 141, 225
Метилвиниловый эфир 125, 210
Метилвинилсульфид 221
Метилвинилсульфоксид 222
Метилвинилсульфон 222
Метилдисульфиды 222
Метилдитиоацетат 138
Метилдихлорацетат 145
Метилендиоксигруппа 251
Метиленфторид 204
Метиленхлорид 378
Метиленциклопентадиен 99
Метилизобутират 144, 228
Метилизопропиламин 128
Метилизопропиловый эфир 125
Метилизотиоцианат 133, 219, 285
Метилизоцианат 133, 219, 284
Метилизоцианид 219
Метиллитий 153, 238
Метилметантиосульфинат 137
Метилметантиосульфонат 137
4-Метилморфолин 215
Метилнитрат 238
2-Метил-2-нитропропан 129, 216
Метиловые сложные эфиры 144
Метилоксиран 210
Метилперхлорат 238
Метилпивалат 144, 228
1-Метилпиперазин 215
1-Метилпиперидин 129, 215
N-Метилпиридиния иодид 110
N-Метилпирролидин 129
2-Метилпропан 77
2-Метил-2-пропансульфокислота 137
хлорангидрид 137
2-Метил-2-пропантиол 134
Метилпропиламин 128
2-Метил-2-пропилизоцианид 219
Метилпропилкетон 140, 225
диметилгцдразон 131
Метилпропиловый эфир 225
Метилпропилсульфон 136
1Ч-Метил-/3-пропиолактам 231
Метилпропиолат 145
Метилпропионат 144, 228
Метилсилан 234
Ы-Метил-Н-силиламиносилан 234
N-Метилсукцинимид 149
Метилсульфиды 44, 252
S-Метилтиоацетат 138
Метилтиоцианат 219
Метилтрихлорацетат 145
420 Предметный указатель
Метилфенилдиазен 217
Метилфенилсульфоксид 136, 222, 358
Метилфенилсульфон 222
N-Метилформамид 146, 230, 303
Метилформиат 144, 227
Метилфосфин 235
N-Метилфталимид 149
Метилхлорацетат 145
Метилциклогексанкарбоксилат 144
Метилциклогексиламин 128, 215
Метилциклогексилкетон 141
Метилциклогексиловый эфир 125
Метилциклопропан 101
Метилциклопропилкетон 96, 141
Метилэтиламин 128
Метилэтилкетон 140, 225
Метилэтиловый эфир 125
Метилэтилсульфид 221
Метилэтилсульфон 136, 222
Метилэтинилкетон 141
Метильная группа 78, 80, 168
Метионин 155
Молекулярная масса, определение 37
Молочная кислота 298
Моносахариды 158, 242
Морфолин 125, 129, 211, 215
Мочевины 21, 149, 233, 307, 308
Муравьиная кислота 143, 226, 297
ангидрид 148
эфиры 13
Мышьяка соединения 105, 153
Надкислоты 273
Натрия пропионат 226
Натрия тетрафенилборат 238
Нафталины 49, 50, 102, 186, 404
монозамегценные 106, 107,
190, 191
Нафтацен 404
1,4-Нафтохинон 142, 296
Нафтохиноны 49
Неопентан 77
Нитрамины 130, 277
Нитраты 84, 277, 392
Нитрилы 12, 41, 43, 45,
132, 218, 252, 281,
324, 392
алифатические 349
ароматические 350
З-Нитробензиловый спирт 381, 385
Нитробензол 130, 216, 278, 396
1-Нитробутан 129, 216
2-Нитробутан 129
N-Нитродиметиламин 130
Нитрозамины 130, 216
Нитрозобензол 130, 216, 278, 402
Нитрозосоединения 17, 42, 52, 129,
216, 392
Нитрометан 11, 129, 216, 408
N-Нитрометиламин 130
1-Нитрооктан 129
Нитропропаны 129, 216
Нитросоединения 11, 12, 15, 40,
42, 44, 66, 129, 216,
276, 392
алифатические 347
ароматические 348
2-Нитрофенилоктиловый эфир
382, 386
2-Нитрофенол 209
Нитроциклогексан 130, 216
Нитроциклопентан 216
Нитроэтан 129, 216
Нитроэтилен 216
Норборнадиен 100
Норборнан 100
Норборнен 100
Норкамфора 183
Нуклеотиды 409
и нуклеозиды 160, 243
Овален 405
Озониды 273
Оксазол 110, 192
1,3-Оксатиан 135
1,4-Оксатиан 135, 221
Оксетан 125, 211
N-Оксиды 38
Предметный указатель 421
Оксимы 16, 131, 217, 278, 392
алифатические 279
ароматические 279
Оксираны 14, 40, 41, 125, 210, 251, 256,
260, 271, 272
Октан 77
н-Октаны монозамещенные 82
Олова соединения 84, 105, 111-113,
150, 177
Орнитин 156
Ортоэфиры 16, 126, 212
1,3-Пентадиен 180
Пента(изопропилокси)фосфоран 153
Пентан 77, 377, 410
2,4-Пентандион 124, 141, 226
1-Пентанол 123
Пентаноны 140
1-Пентантиол 134
Пентаэритрит 123
З-Пентен-1-ин 181
2-Пентин 181
Пергидроазепин 129
Перилен 405
Пероксиды 273
алифатические 343
циклические 42
Перфторалканы 119
Перфторалкилпроизводные 50
Пивалат-ион 143
Пивалиновая кислота 143, 227, 297
Пивалиновый альдегид 139, 224
Пиперазины 129, 347
Пиперидины 47, 129, 215
N-алкилзамещенные 46
2-Пиперидон 371, 372
Пиразин 110, 193, 329, 332
N-оксид 193
Пиразол ид-анион ПО
Пиразолий-катион ПО
Пиразоло [1.5- а] пиридин 200
Пиразолы 47, ПО, 117, 192
4/7-Пиран 125, 211
2Я-Пиран-2-он 145, 229
2Н-Пиран-2-тион 223
Пираны 47
Пирен 102, 405
Пиридазин(ы) 110, 193, 331, 406
N-оксиды 193, 331
Пиридин ПО, 117, 166, 193, 249,
406, 410
N-оксид ПО, 193, 331
Пиридин-ds 164, 247
Пиридиний-ион 110, 193
Пиридины 12, 47, 49, 111, 114, 197, 330
алкилзамещенные 48
2-Пиридон 372
Пиридина производные 47
Пиримидин ПО, 193, 331, 406
Пировиноградная кислота 298
Пироны 211
Пиррилкетоны 50
Пиррол(ы) 47, ПО, 117, 192, 195, 264,
265, 324, 330, 406
Пирролидин(ы) 46, 129, 215
2-Пирролидон 372
Полиены 51, 322, 393
Полиины 322
Полиолы 123
Полипептиды 297, 302
Полиэтиленгликоль 380, 381, 383
Признаки гетероатомов
в масс-спектрометрии 35
Примеси распространенные
(проявление в ЯМР) 166, 249
Прогестерон 162
Пролин 157, 241
Пропан 77, 87, 167
Пропандиолы 123
1,3-Пропандитиол 220
1-Пропанол 123, 208
2-Пропанол 123, 410
1,3-Пропансультон 223
Пропансульфокислота 137
Пропансульфонитрилхлориды 137
Пропантиолы 134, 220
Пропаргиловый спирт 124
Пропиламин 127, 214
N-Пропилацетамид 147, 230
422 Предметный указатель
Пропилацетат 227
Пропилен 93, 174
Пропиленкарбонат 149
N-Пропилиденизопропиламин 130
2-Пропилизотиоцианат 219
Пропилизоцианат 219
2-Пропилизоцианид 219
2-Пропилтиоцианат 219
Пропильная группа 80, 168
Пропин 95, 181
Пропиоизонитрил 132, 219
/З-Пропиолактон 145, 229, 299
Пропиоловая (пропаргиловая)
кислота 143
Пропиоловый альдегид 139
Пропионат-ион 143
Пропионаты 299
Пропионитрил 132, 218
Пропионовая кислота 143, 226
ангидрид 148
хлорангидрид 148
Пропионовый альдегид 139, 224
Протонирование аминов 127
Протоны
амидные 229
аминные 213
аммиака 213
групп SH, химические сдвиги 220
карбоксильные 226
Пурин 115, 200
Растворители 163, 246, 249, 316,
377, 410
Релаксация квадрупольная 213
Рибоза 158
Ртути соединения 105, 152, 177, 184,
189, 329
Салициловая кислота 298
производные 49
Салициловый альдегид 293
Свинца соединения 105, 111-113, 150,
177, 189, 238
Селена соединения 105
Селенациклопентадиен ПО, 192
Серин 155, 239
Сернистой кислоты производные
137, 223
Серной кислоты производные 137, 223
Серосодержащие соединения 32, 35, 42,
44, 45, 47, 279, 280, 284, 308, 329,
352, 353, 392
Силан(ы) 17, 46, 234, 252, 310
Силанолы 234
Силильные простые эфиры 375
Силоксаны 310
Синапиновая кислота 388, 389
Сопряженные алкены 393
диены 91, 180
D-Сорбитол 123
Спектроскопия
ЯМР 13С 77
ЯМР ХН 167
ИК 251
УФ/видимая 391
Спин-спиновое взаимодействие
в аллильной группе 175
вицинальное 172, 174
геминальное 172, 174
гомоаллильное 175
дальнее в кетонах 226
с протонами ОН 208
с протонами SH 220
H-C-N-H 229
14N-xH 218, 229
Спиновое квантовое число 10
Спиро[4.5]декан 100
Спиро[5.5]ундекан 100
Спирты 12, 14, 17, 38-40, 46, 48, 51, 60,
123, 208, 269, 336, 392
алифатические 123, 208, 336
алициклические 36, 41, 337
многоатомные 123
ненасыщенные 337
первичные 42, 44, 336
третичные 40
Стероиды 162
транс-Стильбен 400
Предметный указатель 423
Стирен 257, 263, 396, 400
Сукцинимид 149, 233, 303, 409
Сукцинонитрил 132
Сульфамиды 288
ароматические 362
Сульфаты 137
Сульфиды 15-17, 38, 39, 42,
47, 51, 67, 134, 221,
286, 392
алифатические 356
ароматические 357
циклические 135, 221, 357
Сульфинаты 287
Сульфиновые кислоты 137, 223, 287
эфиры 287
Сульфоксиды 38, 42, 136, 222, 287
алифатические 358
арилсодержащие 358
Сульфолан 136, 383
3-Сульфолен 222
Сульфонаты 44, 46, 288
этилзамещенные 44
Сульфониевые соли 136, 222
Сульфоновые кислоты 137, 223, 361
эфиры 288, 361, 362
Сульфоны 40, 44, 46, 136, 222,
287, 288
алифатические 359
арилсодержащие 360, 361
циклические 360
Сурьмы соединения 105, 153
Твистан 100
Теллурациклопентадиен 110
Терефталевая кислота 298
Тестостерон 162
Тетрабромэтилен 121
Тетрабутиламмоний-ион 214
Тетрабутилфосфония иодид 151
Тетравинилсилан 150
1,1,2,3-Тетрагидроксипропан 123
1,2,3,4-Тетрагидронафталин
100, 102, 187
Тетрагидропиран 48, 125, 211
Тетрагидротиапиран 357
Тетрагидротиофен 357
Тетрагидрофуран-de 164, 247
Тетрагидрофураны 46, 125, 166, 211,
249, 271, 377, 410
1,2,4,5-Тетразин 110
Тетразол 110
Тетралины 46, 49, 50
а-Тетралон 226
Тетраметиламмоний-ион 127, 214
Тетраметилгерман 150, 238
NjNjN'jN'-TeTpaMeiwiMoneBHHa 149
Тетраметилолово 150
Тетраметилортокарбонат 126, 212
2,2,4,4-Тетраметил-З-пентанон 140
Тетраметилсвинец 150
Тетраметилсилан 150, 234, 378
N, N, N' ,Ы'-Тетрамети лтиомочевина 149
Тетраметилфосфония иодид 151
М,М,М',1Ч'-Тетраметилэтилендиамин 128
Тетрапропиламмоний-ион 127
Тетрафениларсония хлорид 153
Тетрафенилгерман 150
Тетрафенилолово 150
Тетрафенилсвинец 150
Тетрафенилсилан 150
Тетрахлорэтилен 120
Тетраэтиламмоний-ион 127, 214
Тетраэтилфосфония иодид 151, 235
1,2,3-Тиадиазол 110
1,2,5-Тиадиазол 192
Тиазол 110, 192
Тиаиран 135, 221
Тиан 135, 221
Тиетан 135, 221
Тимидин 160, 244
Тимин 160, 243
Тиоамиды 84, 138, 289
Тиоанизол 135, 221
Тиоацетали 15
Тиоацетамид 138, 409
Тиобензамид 138
Тиоглицерин 382, 385
Тиокарбамиды 138, 289
Тиокарбонаты 290, 291, 308
424 Предметный указатель
Т иокарбонильные
группы 138
соединения 289, 392
Тиокарбоновые кислоты 138
производные 223
фторангидриды 289
хлорангидриды 289
S-эфиры 138, 223, 363
Тиокетоны 12, 138, 289
1,4-Тиоксан 125, 211
Тиолактамы 289
Тиолан 135, 221
оксид 136, 222
Тиолы (меркаптаны) 15, 17, 38, 39,
47, 51, 67, 134, 220, 286, 392
алифатические 355
ароматические 355
Тиомочевины 148, 290, 291, 309
2Н-Тиопиран 221
4Й-Тиопиран 221
Тиосульфоновой кислоты эфир 288
Тиоугольной кислоты производные 289
Тиоуксусная кислота 138, 223
Тиофенол 402
5Я-Тиофен-2-он 223
Тиофены 110, 117, 192, 196, 265,
329, 406
алкилзамещенные 46
Тиоцианат-анион 133
Тиоцианаты 133, 219, 284, 285
алифатические 352
ароматические 353
неорганические 408
Тиоэтиленкетали 48
Тиоэфиры простые 15-17, 38, 39,
42, 47, 51, 67, 134, 221,
286, 392
алифатические 356
ароматические 357
виниловые 356
метиловые 42, 252
циклические 135, 221, 357
этиловые 43
Тиоэфиры сложные 138, 223,
289, 363
Тирозин 156, 240
Толуол 109, 166, 186, 249, 263, 378, 396,
400, 410
п-Толуолсульфонаты 362
Треонин 155, 239
1,2,4-Триазин 193
1,3,5-Триазин 110, 193, 406
1,2,3-Триазол 110, 117
1,2,4-Триазол 110, 117
1,2,5-Триазол 192
1,3,4-Триазол 110, 192
1,1,1-Трибромацетон 141
1,1,1-Трибромэтан 121
Трибромэтилен 121
Трибутилфосфат 151
Трибу тилфосфит 151
Трибутилфосфин 151
Трибутилфосфиноксид 151
Трибутилфосфинсульфид 151
Тригидроксиметан 123
Трииодметан 122, 207
Триметиламин 127, 214
Триметилацетонитрил 132, 218
Триметилборан 153
Триметилборат 238
Триметилвинилсилан 150, 234
Триметилдитиофосфат 152
Триметилиндий 152
Триметилортоформиат 126, 212
2,2,4-Триметилпентан 410
Триметилсилан 234
Триметилсилилоксильные
соединения 47
3- (Тримети лсилил)- 1-пропансульфонат
натрия (DSS) 165, 248
2,2,3,3-D4-3- (Т риметилсилил)пропионат
натрия 165, 248
Триметилсилильные
соединения 46
Триметилсульфония иодид 136, 222
Триметилфениламмоний-ион 215
Триметилфосфат 237
Триметилфосфин 235
Триметилфосфинсульфид 236
Триметилфосфит 151, 236
Предметный указатель 425
1,3,5-Триоксан 126
Трипропиламин 127
Триптофан 157, 241
Трис(диметиламино) фосфин 151
Трис(диметиламино)фосфит 236
1,3,5-Тритиан 221
Тритиокарбонаты 148, 233,
289-291, 308
Трифениламин 129
Трифениларсан 153
Трифенилвисмут 153
Трифенилметанол 209
Трифенилсурьма 153
Трифенилфосфат 152
Трифенилфосфин 152
Трифенилфосфиноксид 152
Трифенилфосфит 152
Трифторацетаты 302
1,1,1-Трифторацетон 140
Трифторметан 118, 204
Т рифторметильная
группа 44, 46, 335
а,а,а-Трифтортолуол 119, 204
Трифторуксусная кислота 118, 143
2,2,2-Трифторэтанол 124
Трихлорацетальдегид 139, 293
Трихлорацетат-ион 143
1,1,1-Трихлорацетон 141
Трихлорметилсилан 234
Трихлорпропилсилан 150
а,а,а-Трихлортолуол 120, 205
Трихлоруксусная кислота 120, 143
1,1,1-Трихлорэтан 120
2,2,2-Трихлорэтанол 124, 209
Трихлорэтилен 120
Триэтаноламин 128, 383
Триэтиламин 127, 214, 408
Триэтилортоформиат 126, 212
Триэтилфосфат 151
Триэтилфосфин 235
Триэтилфосфиноксид 235
Триэтилфосфинсульфид 236
Триэтилфосфит 236
Триэтоксифосфинсульфид 237
Тропилий-ион 328, 338
Углеводы 158, 242
Углерода
диоксид 149, 318
дисульфид 149, 166, 317, 378, 410
монооксид 149
тетрабромид 121
тетраиодид 122
тетрафторид 118
тетрахлорид 120, 166, 316, 318,
379, 410
Уксусная кислота 143, 226, 297,
377, 409
ангидрид 148, 232, 305
сложные эфиры 144
Ультрамарк 380, 384
Урацил 160, 243, 409
Уретаны 16, 18, 149, 233, 307, 308
фенилуретан 47
Уридин 160
Феназин 116
Фенантрен 102, 186, 404
Фенилаланин 156, 240
N-Фенилацетамид 147, 231, 303
Фенилацетат 144, 228, 300
Фенилацетилен 181
Фенилизотиоцианат 219, 285
N-Фенилметансульфамид 223
Фенилпропилкетон 225
N-Фенилформамид 230
Фенилфосфоновая кислота 152
Феноксазин 116, 203
Феноксатин 116
Фенол 124, 209, 270, 396, 401
производные 48
эфиры простые 48
— сложные 48
Фенолы 17, 39, 48, 60, 269, 338
Феноляты 396, 401
Фенотиазин 116
Ферми резонанс 251, 258, 285, 292
Феруловая кислота 387, 389
Флуорен 102, 187, 327
Формальдегид 139, 224
426 Предметный указатель
Формамиды 146, 230, 303
Форманилиды 371
Формиат-ион 143
Формиаты 297, 299, 368
Фосфаны 17
Фосфаты 17, 312
алкилфосфаты 49, 375
этилфосфат 41
Фосфин(ы) 151, 235, 311. 375
Фосфиновая кислота
ангидриды 313
эфиры 312
Фосфиноксид 235, 375
Фосфинсульфид 235
Фосфонистой кислоты производные 236
Фосфония соединения 151, 235
Фосфоновая кислота
производные 151, 237, 312
эфиры 312
Фосфора илиды 237
Фосфора соединения 17, 36, 41, 44, 49,
151, 235, 252, 289, 311, 375, 376
алифатические 151, 235
ароматические 152
Фосфораны 153
Фосфорная кислота
ангидриды 313
производные 151, 237
эфиры 312
Фруктоза 159, 243
Фталазин 116, 203, 333
Фталаты (сложные эфиры) 50, 318,
369, 379
Фталевая кислота 298
ангидрид 148, 232, 305, 367
Фталимид 304
Фторалканы 334
Фторацетилен 204
Фторацетон 140
Фторбензол 119, 204
Фториды 17, 35, 41, 42, 44, 49, 58, 118,
204, 266, 379
алифатические 334
ароматические 335
Фторметан 118, 204
1-Фтороктан 118
Фторпиридины 119
Фторпропаны 118
Фторуксусная кислота 118
Фторциклогексан 119
Фторциклопропан 204
Фторэтан 118, 204
Фторэтилен 118, 204
Фуллерен 102
Фульвен 99, 182, 260
Фуразан 192
Фуран 110, 117, 192, 377, 406
5Я-Фуран-2-он 229
Фураны 41, 47, 194, 264, 265, 329
Фуриловые кетоны 46, 48
Хиназолин 116, 202, 333
Хиноксалин 116, 202, 333
Хинолин 116, 201, 407
N-оксид 202, 331
Хинолины 49, 50, 332
Хиноноксимы 279
Хиноны 20, 41, 142, 294 296, 403
Хлоралканы 12, 15, 16, 38, 48, 334
Хлорацетат-ион 143
Хлорацетилен 205
Хлорацетон 141
Хлорбензолы 120, 205, 263, 267,
396, 401
1-Хлорбутан 205
Хлориды 12, 15, 16, 30, 32, 33, 39, 42,
44, 46, 47, 52, 58, 120, 205, 267,
379, 391
алифатические 12, 15, 16, 38, 48,
58, 334
ароматические 267, 335
Хлорметан 120, 205
Хлороформ 120, 166, 205, 249, 316, 318,
379, 407, 410
Хлороформ-d 163, 246, 379
Хлорпиридины 120
Хлорпропаны 120, 205
Хлортриметилсилан 234
Хлортрифенилсилан 234
Предметный указатель 427
Хлоруксусная кислота 120, 143 Хлорциклогексан 120 Хлорциклопропан 96, 205 Хлорэтан 120, 205 Хлорэтилен 120, 205 Холестерин 162 Хризен 404 Хромой 201 Циклогексанкарбонилхлорид 148 Циклогексанкарбоновая кислота 143 Циклогексанол 124, 209, 270 Циклогексанон 142, 225, 294 замещенный 366 Циклогексанонитрил 132 Циклогексантиол 134, 220 Циклогексаны 47, 98, 185, 251, 260 Циклогексен(ы) 41, 45, 46, 54, 99, 182, 354, 260, 325
Цвиттер-ионы 315 Цианаты 219, 283 алифатические 351 ароматические 351 Цианиды 12, 41, 43, 45, 132. 218, 252, 281, 282, 324, 392 алифатические 349 ароматические 350 а-Циано-4-гидроксикоричная кислота 387, 388 Циклические алканы 38, 43, 46, 48, 53, 96, 182, 253, 259, 324 алкены 38, 39, 54, 259 амины 129, 215, 346 кетоны 38, 41, 141, 142, 225, 226, 365 простые эфмры 40, 42, 125, 210, 341 сульфиды 135, 221, 357 Циклоалканолы 38, 43, 337 Циклоалканоны 38, 41, 47, 48, 141. Циклоалканы 38, 43, 46, 48, 53, 96, 182, 253, 259, 324 Циклоалкены 38, 39, 54, 259 1,2-Циклобутандион 226 Циклобутанол 209 Циклобутанон 142, 225, 294 Циклобутаны 96, 101, 182, 260 Циклобутены 99, 182, 254, 260 Циклогексадиены 99, 183, 325 Циклогексан 101, 166, 182, 249, 378, 411 Циклогексан-d12 164, 247 1,3-Циклогександион 226 Циклогексанкарбальдегид 139 Циклогексанкарбоксилат-ион 143 2-Циклогексен-1-он 142, 295 Циклогексиламин 128, 214 N-Циклогексилацетамид 147 Циклогексилацетат 144 Циклогептан 96 Циклогептанон 142, 294 Циклогептатриен 99, 183 Циклогептен 99, 183 1,3-Циклооктадиен 183 1,5-Циклооктадиен 99 Циклооктатетраен 99 Циклооктен 99, 183 Циклопентадиен 99, 183 Циклопентан(ы) 97, 101, 182, 260 Циклопентанон 142, 225, 294 2-Циклопентен-1-он 142 Циклопентены 46, 99, 182 Циклопропанол 96, 209 Циклопропанон 225 Циклопропаны 14, 53, 96, 101, 182, 184, 251, 256, 257, 260, 324 Циклопропенон 142 Циклопропены 99, 182, 254, 260 Циклопропиламин 96,214 Цинка соединения 189 Циннолин 116, 202, 333 Цистеин 155, 240 Цистин 155 Цистидин 160, 244 Цитозин 160, 243, 409 Щавелевая кислота 143, 298 Элементы группы IV 150 Элементы, распределение по изотопам 29
428 Предметный указатель
Эпоксиды 14, 40, 51, 125, 210, 251, 256,
260, 271, 272
алифатические 342
Этан 77, 87, 167
1,2-Этандитиол 134
Этанол 123, 166, 208, 249, 377, 410
Этаноламин 128
Этансульфонилхлорид 137
Этантиол 134, 220, 408
Этилакрилат 228
Этиламин 127, 214
N-Этилацетамид 146, 230
Этилацетат 144, 166, 227, 249, 378, 410
Этилбензоат 228
Этилбензол 187
Этилдисульфиды 222
Этилен 92, 93, 174
Этиленгликоль 123, 377
диметиловый эфир 125
Этиленкарбонат 149, 233
Этиленоксид 272
Этиленсульфид 135, 221
Этилентритиокарбонат 233
Этилены монозамещенные 176
N-Этилиден-трет-бутиламин 130
Этилидентрифенилфосфоран 153
Этилизотиоцианат 219
Этилизоцианат 219, 284
Этилизоцианид 132, 219
Этил-Ы-метилкарбамат 149, 233
Этилмочевина 233
Этилнитрит 238
Этилсульфиды 45
Этилсульфоны 44
Этилтиоцианат 133, 219
Этилтиоэтин 135
Этилтриацетил силан 150
Этилтрифторацетат 228
Этилфенилкетон 225
N-Этилформамид 146
Этилцианат 219
Этильная группа 80, 168
Эфиры дитиокарбоновых кислот
138, 363
Эфиры карбоновых кислот 15, 16,
18-21, 38, 39, 46, 48, 49, 71, 144,
227, 298, 392
ароматические 71, 369
виниловые 299
метиловые 42, 45, 47, 144, 299
насыщенных кислот 367
ненасыщенных кислот 368
а,/3-ненасыщенных кислот 71, 394
пропиловые 43, 45
фениловые 48, 299
этиловые 41, 44, 48
Эфиры простые 15-17, 38, 39, 46-48,
51, 62, 125, 210, 251, 269, 270, 392
алифатические 38, 339
алкенилзамещенные 257
алкиларильные 343
алкилциклоалкильные 341
аллильные 340
ароматические 125, 212, 343
виниловые 340
метиловые 42, 251
ненасыщенные 340
пропиловые 45
силильные 375
фенола 48
циклические 40, 42, 125, 210, 341
этиловые 44
этинильные 340
Янтарная кислота 143, 227, 298
ангидрид 148, 232, 305
Оглавление
Предисловие 5
1 Введение 6
1.1 Содержание и структура книги................................. 6
1.2 Сокращения и символы......................................... 8
2 Обзорные таблицы 9
2.1 Общие сведения............................................... 9
2.1.1 Определение числа эквивалентов двойных связей из мо-
лекулярной формулы...................................... 9
2.1.2 Свойства некоторых ядер............................... 10
2.2 Спектроскопия ЯМР 13С....................................... 11
2.3 Спектроскопия ЯМР 1Н........................................ 14
2.4 ИК спектроскопия............................................ 17
2.5 Масс-спектрометрия ......................................... 22
2.5.1 Средние массы встречающихся в природе элементов, точ-
ные массы ядер изотопов и относительная распростра-
ненность изотопов (в % по отношению к наиболее рас-
пространенному изотопу) ............................... 22
2.5.2 Диапазоны распространенности природных изотопов
некоторых элементов.................................... 28
2.5.3 Изотопный состав элементов, встречающихся в природе . 29
2.5.4 Вычисление распределения изотопов.................... 30
2.5.5 Изотопные распределения для различных комбинаций
хлора, брома, серы и кремния........................ 32
2.5.6 Изотопные распределения для комбинаций хлора и брома 34
2.5.7 Признаки присутствия гетероатомов.................... 35
2.5.8 Правила для определения относительной
молекулярной массы (Мг)............................. 37
2.5.9 Гомологические серии масс как признаки типа структуры 38
2.5.10 Масс-спектрометрические корреляционные таблицы.... 40
2.5.11 Литература........................................... 50
2.6 Спектроскопия в УФ и видимой областях ...................... 51
3 Комбинированные таблицы 53
3.1 Алканы, циклоалканы......................................... 53
430 Оглавление
3.2 Алкены, циклоалкены.................................... 54
3.3 Алкины................................................. 55
3.4 Ароматические углеводороды............................. 56
3.5 Ароматические гетероциклические соединения ............ 57
3.6 Галогенсодержащие соединения........................... 58
3.7 Кислородсодержащие соединения.......................... 60
3.7.1 Спирты и фенолы................................. 60
3.7.2 Простые эфиры................................... 62
3.8 Азотсодержащие соединения.............................. 64
3.8.1 Амины........................................... 64
3.8.2 Нитросоединения................................. 66
3.9 Тиолы и сульфиды....................................... 67
3.10 Карбонилсодержащие соединения......................... 68
3.10.1 Альдегиды ...................................... 68
3.10.2 Кетоны ......................................... 69
3.10.3 Карбоновые кислоты.............................. 70
3.10.4 Сложные эфиры и лактоны......................... 71
3.10.5 Амиды карбоновых кислот и лактамы............... 74
4 Спектроскопия ЯМР 13С 77
4.1 Алканы ................................................ 77
4.1.1 Химические сдвиги............................... 77
4.1.2 Константы спин-спинового взаимодействия......... 86
4.1.3 Литература...................................... 87
4.2 Алкены................................................. 88
4.2.1 Химические сдвиги............................... 88
4.2.2 Константы спин-спинового взаимодействия......... 92
4.2.3 Литература...................................... 93
4.3 Алкины................................................. 94
4.3.1 Химические сдвиги............................... 94
4.3.2 Константы спин-спинового взаимодействия......... 95
4.3.3 Литература...................................... 95
4.4 Алициклические соединения.............................. 96
4.4.1 Химические сдвиги............................... 96
4.4.2 Константы спин-спинового взаимодействия.........101
4.4.3 Литература......................................101
4.5 Ароматические углеводороды.............................102
4.5.1 Химические сдвиги...............................102
4.5.2 Константы спин-спинового взаимодействия........ 108
Оглавление 431
4.5.3 Литература..................................... 109
4.6 Гетероароматические соединения.........................110
4.6.1 Химические сдвиги.............................. 110
4.6.2 Константы спин-спинового взаимодействия........ 117
4.7 Галогенсодержащие соединения.......................... 118
4.7.1 Фторсодержащие соединения...................... 118
4.7.2 Хлорсодержащие соединения...................... 120
4.7.3 Бромсодержащие соединения.......................121
4.7.4 Иодсодержащие соединения....................... 122
4.7.5 Литература......................................122
4.8 Спирты, простые эфиры и родственные соединения.........123
4.8.1 Спирты..........................................123
4.8.2 Простые эфиры...................................125
4.9 Азотсодержащие соединения..............................127
4.9.1 Амины...........................................127
4.9.2 Нитро- и нитрозосоединения .................... 129
4.9.3 Нитрозамины и нитрамины........................ 130
4.9.4 Имины и оксимы................................. 130
4.9.5 Гидразоны и карбодиимиды....................... 131
4.9.6 Нитрилы и изонитрилы............................132
4.9.7 Изоцианаты, тиоцианаты и изотиоцианаты ........ 133
4.9.8 Литература......................................133
4.10 Серосодержащие функциональные группы..................134
4.10.1 Тиолы...........................................134
4.10.2 Сульфиды........................................134
4.10.3 Дисульфиды и сульфониевые соли .................136
4.10.4 Сульфоксиды и сульфоны..........................136
4.10.5 Сульфокислоты, сульфиновые кислоты и их производные 137
4.10.6 Производные сернистой и серной кислот.......... 137
4.10.7 Серосодержащие карбонильные соединения..........138
4.11 Карбонил содержащие соединения....................... 139
4.11.1 Альдегиды ......................................139
4.11.2 Кетоны .........................................140
4.11.3 Карбоновые кислоты и карбоксилаты...............142
4.11.4 Сложные эфиры и лактоны........................ 144
4.11.5 Амиды и лактамы................................ 146
4.11.6 Другие карбонилсодержащие соединения........... 148
4.12 Другие соединения.................................... 150
4.12.1 Производные элементов IV группы................ 150
432 Оглавление
4.12.2 Фосфорорганические соединения...................151
4.12.3 Металлоорганические соединения................. 153
4.13 Природные соединения...................................154
4.13.1 Аминокислоты....................................154
4.13.2 Углеводы........................................158
4.13.3 Нуклеотиды и нуклеозиды........................ 160
4.13.4 Стероиды....................................... 162
4.14 Спектры растворителей и стандартных соединений.........163
4.14.1 Спектры ЯМР 13С обычных дейтерированных раствори-
телей ...............................................163
4.14.2 Спектры ЯМР 13С вторичных стандартов........... 165
4.14.3 Спектр ЯМР 13С смеси обычных недейтерированных рас-
творителей ..........................................166
5 Спектроскопия ЯМР ’ Н 167
5.1 Алканы ................................................167
5.1.1 Химические сдвиги...............................167
5.1.2 Константы спин-спинового взаимодействия.........172
5.1.3 Литература..................................... 173
5.2 Алкены................................................ 174
5.2.1 Замещенные этилены............................. 174
5.2.2 Диены...........................................180
5.3 Алкины.................................................181
5.3.1 Химические сдвиги и константы спин-спинового взаимо-
действия 181
5.4 Алициклические соединения............................. 182
5.5 Ароматические углеводороды............................ 186
5.6 Гетероароматические соединения........................ 192
5.6.1 Неконденсированные гетероароматические соединения... 192
5.6.2 Конденсированные гетероароматические соединения..199
5.7 Галогенсодержащие соединения...........................204
5.7.1 Фторсодержащие соединения.......................204
5.7.2 Хлорсодержащие соединения.......................205
5.7.3 Бромсодержащие соединения.......................206
5.7.4 Иодсодержащие соединения .......................207
5.8 Спирты, простые эфиры и родственные соединения.........208
5.8.1 Спирты..........................................208
5.8.2 Простые эфиры...................................210
5.9 Азотсодержащие соединения..............................213
Оглавление 433
5.9.1 Амины.............................................213
5.9.2 Нитро- и нитрозосоединения .......................216
5.9.3 Нитрозамины, азо- и азоксисоединения..............216
5.9.4 Имины, оксимы, гидразоны и азины..................217
5.9.5 Нитрилы и изонитрилы..............................218
5.9.6 Цианаты, изоцианаты, тиоцианаты и изотиоцианаты...219
5.10 Серосодержащие функциональные группы....................220
5.10.1 Тиолы.............................................220
5.10.2 Сульфиды..........................................221
5.10.3 Дисульфиды и соли сульфокислот....................222
5.10.4 Сульфоксиды и сульфоны............................222
5.10.5 Сульфокислоты, сульфиновые, сернистая, серная кисло-
ты и их производные ....................................223
5.10.6 Производные тиокарбоновых кислот..................223
5.11 Карбонилсодержащие соединения...........................224
5.11.1 Альдегиды.........................................224
5.11.2 Кетоны ...........................................225
5.11.3 Карбоновые кислоты и карбоксилаты.................226
5.11.4 Сложные эфиры и лактоны...........................227
5.11.5 Амиды и лактамы...................................229
5.11.6 Другие карбонилсодержащие соединения..............232
5.12 Другие соединения.......................................234
5.12.1 Соединения кремния................................234
5.12.2 Соединения фосфора................................235
5.12.3 Другие соединения.................................238
5.13 Природные соединения....................................239
5.13.1 Аминокислоты......................................239
5.13.2 Углеводы..........................................242
5.13.3 Нуклеотиды и нуклеозиды...........................243
5.13.4 Литература........................................245
5.14 Спектры растворителей и стандартных соединений..........246
5.14.1 Спектры ЯМР ХН обычных дейтерированных раствори-
телей ..................................................246
5.14.2 Спектры ЯМР ХН вторичных стандартов ..............248
5.14.3 Спектр ЯМР ХН смеси обычных недейтерированных рас-
творителей .............................................249
434 Оглавление
6 ИК спектроскопия 251
6.1 Алканы ...............................................251
6.2 Алкены................................................254
6.2.1 Алкены с одной двойной связью..................254
6.2.2 Аллены.........................................257
6.3 Алкины................................................258
6.4 Алициклические соединения.............................259
6.5 Ароматические углеводороды............................261
6.6 Гетероароматические соединения........................264
6.7 Галогенсодержащие соединения..........................266
6.7.1 Фторсодержащие соединения......................266
6.7.2 Хлорсодержащие соединения......................267
6.7.3 Бромсодержащие соединения......................268
6.7.4 Иодсодержащие соединения.......................268
6.8 Спирты, простые эфиры и родственные соединения........269
6.8.1 Спирты и фенолы................................269
6.8.2 Простые эфиры, ацетали, кетали.................270
6.8.3 Эпоксиды.......................................272
6.8.4 Пероксиды и гидропероксиды.....................273
6.9 Азотсодержащие соединения.............................274
6.9.1 Амины и родственные соединения.................274
6.9.2 Нитро- и нитрозосоединения ....................276
6.9.3 Имины и оксимы.................................278
6.9.4 Азосоединения..................................280
6.9 5 Нитрилы и изонитрилы...........................281
6.9.6 Диазосоединения................................282
6.9.7 Цианаты и изоцианаты...........................283
6.9.8 Тиоцианаты и изотиоцианаты.....................284
6.10 Серосодержащие функциональные группы.................286
6.10.1 Тиолы и сульфиды...............................286
6.10.2 Сульфоксиды и сульфоны.........................287
6.10.3 Производные тиокарбонильных соединений.........289
6.10.4 Производные тиокарбоновых кислот...............289
6.11 Карбонилсодержащие соединения........................292
6.11.1 Альдегиды......................................292
6.11.2 Кетоны ........................................293
6.11.3 Карбоновые кислоты.............................296
6.11.4 Сложные эфиры и лактоны........................298
6.11.5 Амиды и лактамы................................301
Оглавление 435
6.11.6 Ангидриды кислот................................304
6.11.7 Галогенангидриды кислот.........................306
6.11.8 Производные карбоновых кислот...................307
6.12 Другие соединения.....................................310
6.12.1 Соединения кремния..............................310
6.12.2 Соединения фосфора..............................311
6.12.3 Соединения бора.................................314
6.13 Аминокислоты..........................................315
6.14 Растворители, иммерсионные среды и примеси............316
6.14.1 ИК спектры обычных растворителей................316
6.14.2 ИК спектры иммерсионных сред....................317
6.14.3 Полосы мешающих примесей в ИК спектрах..........318
7 Масс-спектрометрия 319
7.1 Алканы ................................................319
7.1.1 Неразветвленные алканы..........................319
7.1.2 Разветвленные алканы............................319
7.1.3 Литература......................................320
7.2 Алкены.................................................321
7.2.1 Неразветвленные алкены..........................321
7.2.2 Разветвленные алкены............................321
7.2.3 Полиены и полиины ..............................322
7.2.4 Литература......................................322
7.3 Алкины.................................................323
7.3.1 Алифатические алкины............................323
7.3.2 Литература......................................323
7.4 Алициклические углеводороды............................324
7.4.1 Циклопропаны....................................324
7.4.2 Насыщенные моноциклические углеводороды.........325
7.4.3 Полициклические алициклы........................325
7.4.4 Циклогексены....................................325
7.4.5 Литература......................................326
7.5 Ароматические углеводороды.............................327
7.5.1 Ароматические углеводороды......................327
7.5.2 Алкилзамещенные ароматические углеводороды......327
7.5.3 Литература......................................328
7.6 Гетероароматические соединения.........................329
7.6.1 Общая характеристика............................329
7.6.2 Фураны..........................................329
436 Оглавление
7.6.3 Тиофены .......................................330
7.6.4 Пирролы........................................330
7.6.5 Пиридины.......................................330
7.6.6 N-оксиды пиридинов и хинолинов.................331
7.6.7 Пиридазины и пиримидины .......................331
7.6.8 Пиразины ......................................332
7.6.9 Индолы.........................................332
7.6.10 Хинолины и изохинолины.........................332
7.6.11 Циннолин, фталазин, хиназолин, хиноксалин......333
7.6.12 Литература.....................................333
7.7 Галогенсодержащие соединения..........................334
7.7.1 Насыщенные галогенсодержащие алифатические соеди-
нения..................................................334
7.7.2 Полигалогеналканы..............................335
7.7.3 Ароматические галогенсодержащие соединения.....335
7.7.4 Литература.....................................335
7.8 Спирты, простые эфиры и родственные соединения........336
7.8.1 Алифатические спирты...........................336
7.8.2 Алициклические спирты..........................337
7.8.3 Ненасыщенные алифатические спирты..............337
7.8.4 Вицинальные гликоли............................337
7.8.5 Алифатические гидропероксиды...................338
7.8.6 Фенолы.........................................338
7.8.7 Бензиловые спирты..............................338
7.8.8 Алифатические простые эфиры....................339
7.8.9 Ненасыщенные простые эфиры.....................340
7.8.10 Алкильные циклоалкильные простые эфиры.........341
7.8.11 Циклические простые эфиры......................341
7.8.12 Алифатические эпоксиды.........................342
7.8.13 Метоксибензолы.................................343
7.8.14 Алкиларильные простые эфиры ...................343
7.8.15 Ароматические простые эфиры....................343
7.8.16 Алифатические пероксиды........................343
7.8.17 Литература.....................................344
7.9 Азотсодержащие соединения.............................345
7.9.1 Насыщенные алифатические амины.................345
7.9.2 Циклоалкиламины................................345
7.9.3 Циклические амины .............................346
7.9.4 Пиперазины.....................................347
Оглавление 437
7.9.5 Ароматические амины............................347
7.9.6 Алифатические нитросоединения..................347
7.9.7 Ароматические нитросоединения..................348
7.9.8 Диазосоединения................................348
7.9.9 Азобензолы.....................................348
7.9.10 Алифатические азиды............................348
7.9.11 Ароматические азиды............................349
7.9.12 Алифатические нитрилы..........................349
7.9.13 Ароматические нитрилы..........................350
7.9.14 Алифатические изонитрилы (R— NC)...............350
7.9.15 Ароматические изонитрилы (R—NC)................350
7.9.16 Алифатические цианаты (R—OCN)..................351
7.9.17 Ароматические цианаты (R—OCN) .................351
7.9.18 Алифатические изоцианаты (R— NCO)..............351
7.9.19 Ароматические изоцианаты (R— NCO) .............352
7.9.20 Алифатические тиоцианаты (R— SCN) .............352
7.9.21 Ароматические тиоцианаты (R—SCN)...............353
7.9.22 Алифатические изотиоцианаты (R—NCS)............353
7.9.23 Ароматические изотиоцианаты (R— NCS)...........353
7.9.24 Литература.....................................354
7.10 Серосодержащие функциональные группы...................355
7.10.1 Алифатические тиолы............................355
7.10.2 Ароматические тиолы............................355
7.10.3 Алифатические сульфиды.........................356
7.10.4 Алкилвинилсульфиды.............................356
7.10.5 Циклические сульфиды ..........................357
7.10.6 Ароматические сульфиды.........................357
7.10.7 Дисульфиды.....................................357
7.10.8 Алифатические сульфоксиды......................358
7.10.9 Алкиларил- и диарилсульфоксиды.................358
7.10.10 Алифатические сульфоны.........................359
7.10.11 Циклические сульфоны...........................360
7.10.12 Алкиларилсульфоны..............................360
7.10.13 Диарилсульфоны.................................361
7.10.14 Ароматические сульфокислоты....................361
7.10.15 Сложные эфиры алкилсульфоновых кислот .........361
7.10.16 Сложные эфиры арилсульфоновых кислот...........362
7.10.17 Ароматические сульфамиды.......................362
7.10.18 Сложные S-эфиры тиокарбоновых кислот...........363
438 Оглавление
7.10.19 Литература......................................363
7.11 Карбонил содержащие соединения..........................364
7.11.1 Алифатические альдегиды.........................364
7.11.2 Ненасыщенные алифатические альдегиды............364
7.11.3 Ароматические альдегиды.........................364
7.11.4 Алифатические кетоны............................365
7.11.5 Ненасыщенные кетоны.............................365
7.11.6 Алициклические кетоны...........................365
7.11.7 Ароматические кетоны............................366
7.11.8 Алифатические карбоновые кислоты................366
7.11.9 Ароматические карбоновые кислоты................367
7.11.10 Ангидриды карбоновых кислот.....................367
7.11.11 Насыщенные алифатические сложные эфиры .........367
7.11.12 Ненасыщенные сложные эфиры......................369
7.11.13 Сложные эфиры ароматических кислот..............369
7.11.14 Лактоны.........................................370
7.11.15 Алифатические амиды.............................370
7.11.16 Амиды ароматических карбоновых кислот...........371
7.11.17 Анилиды.........................................371
7.11.18 Лактамы.........................................371
7.11.19 Имиды...........................................373
7.11.20 Литература......................................374
7.12 Другие соединения.......................................375
7.12.1 Триалкилсилиловые простые эфиры.................375
7.12.2 Алкилфосфаты....................................375
7.12.3 Алифатические фосфины и фосфиноксиды............375
7.12.4 Ароматические фосфины и фосфиноксиды ...........376
7.12.5 Литература......................................376
7.13 Масс-спектры обычных растворителей и вспомогательных
веществ.....................................................377
7.13.1 Масс-спектры обычных растворителей с ионизацией элек-
тронным ударом 377
7.13.2 Масс-спектры FAB обычных матриц и веществ для ка-
либровки 380
7.13.3 Масс-спектры МЛДИ обычных матриц.............386
7.13.4 Литература...................................389
Оглавление 439
8 Спектроскопия в УФ и видимой областях 391
8.1 Соотношение между длиной волны поглощаемого света и воспри-
нимаемым цветом .............................................391
8.2 Поглощение простых хромофоров в УФ и видимой областях....391
8.3 Поглощение сопряженных алкенов в УФ и видимой областях...393
8.3.1 Поглощение диенов и полиенов в УФ области ........393
8.3.2 Поглощение а,/?-ненасыщенных карбонильных соедине-
ний в УФ области........................................394
8.4 Поглощение ароматических соединений в УФ и видимой областях 396
8.4.1 Поглощение монозамещенных бензолов в УФ области.... 396
8.4.2 Поглощение замещенных бензолов в УФ области........397
8.4.3 Поглощение ароматических карбонильных соединений в
УФ области .............................................398
8.5 Стандартные спектры в УФ и видимой областях.............399
8.5.1 Спектры алкенов и алкинов в УФ и видимой областях... 399
8.5.2 Спектры ароматических соединений в УФ и видимой об-
ластях..................................................400
8.5.3 Спектры ароматических гетероциклических соединений
в УФ и видимой областях.................................405
8.5.4 Спектры разных соединений в УФ и видимой областях .. 407
8.5.5 Спектры нуклеотидов в УФ и видимой областях.......409
8.6 Поглощение обычных растворителей в УФ и видимой областях... 410
Предметный указатель
411
Справочное издание
Преч Эрнё, Бюльманн Филипп, Аффольтер Кристиан
ОПРЕДЕЛЕНИЕ СТРОЕНИЯ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
Таблицы спектральных данных
Зав. редакцией канд. хим. наук Т. И. Почкаева
Ведущий редактор канд. хим. наук Е. Э. Григорьева
Художник Ф. Инфантэ
Оригинал-макет подготовлен В. Н. Титаренко в пакете ЬХЩХ 2е
с использованием кириллических шрифтов семейства LH
Подписано к печати 19.07.06. Формат 70 х 100/16.
Бумага офсетная. Печать офсетная. Усл. печ. л. 35,75.
Изд.№ 3/9914. Тираж 1500 экз. Заказ 4622
Издательство «Мир»
Министерства культуры и массовых коммуникаций РФ
107996, ГСП-6, Москва, 1-й Рижский пер., 2
Издательство «БИНОМ. Лаборатория знаний»
Адрес для переписки: 119071, Москва, а/я 32
Телефон (499) 157-1902,
e-mail: Lbz@aha.ru, http://www.Lbz.ru
При участии ООО «ПФ «Сашко»
Отпечатано в ОАО «ИПК «Ульяновский Дом печати»
432980, г. Ульяновск, ул. Гончарова, 14
CUI
Э. Преч, Ф. Бюльманн, К. Аффольтер
ОПРЕДЕЛЕНИЕ СТРОЕНИЯ
ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ