Автор: Ратинов В.Б. Розенберг Т.И.
Теги: строительство строительные материалы
ISBN: 5-274-00566-7
Год: 1989
Текст
В. Б. Ратинов,
Т И. Розенберг
ДОБАВКИ
В БЕТОН
2-е издание, переработанное и дополненное
С)_________________
Q X ;р.,
су; нл' ’
Москва
Стройиздат
1989
Ратинов В.Б., Розенберг Т.И. Добавки в бетон. - 2-е
изд., перераб. и доп. М.: Стройиздат, 1989. 188 с.: ил.
ISBN 5-274-00566-7
Изложены физико-химические основы механизма действия
добавок в бетоны. Рассмотрены реакции между добавками и
составляющими цемента или цементного камня. Дан анализ
процессов, влияющих па технологические свойства бетонной
смеси и твердение бетона в присутствии добавок. Приведены
классификация добавок по механизму их действия на процес-
сы гидратанионного твердения минеральных вяжущих веществ,
составы и области рационального применения эффективных
индивидуальных и комплексных добавок, вводимых в бетоны,
твердеющие при температуре ниже 0°С, в нормально-влажных
условиях и при тепловлажностной обработке до 100°С с учетом
влияния добавок на структурно- и физико-механические свой-
ства беюна и его долговечность. Издание 1-е вышло в 1973 г.
Для научных и инженерно-технических работников, занятых
в промышленности строительных материалов, стройиндустрии и
в строительстве.
Табл. 16, рис. 54, список лит.: 134 назв.
Печатается но решению секции литературы по строительным
материалам редакционною совета СТройиздата
Рецензент — В Г. батраков, лауреат Государственной премии
СССР, д-р 1ехн. наук, профессор (НИИЖБ)
3306000000- 210
Р----------------------124-89
047(01) - 89
ISBN 5-274-00566-7
©Стройиздат, 1973
©Стройиздат, 1989, с изме-
нениями
ПРЕДИСЛОВИЕ
Со времени выхода в свет первого издания книги прошло
1 5 лет. За этот казалось бы небольшой срок популярность доба-
вок настолько возросла, что без них нельзя представить теперь
современное бетоноведение. В СССР сейчас с добавками ежегод-
но укладывают около 100 млн. м3,т.е. почти 40%, монолитного
и сборного бетона и желззобегона. Однако это не предел: в
Австралии, США, ФРГ, Японии объем производства бетона с
добавками составляет 60- 80 %. Следует отметить, что по приме-
нению противс морозных добавок мы занимаем ведущее поло-
жение в мире.
Введение добавок один из самых технологичных, гибких,
доступных и универсальных способов улучшения всех свойств
бетонных смесей и бетонов и придания им новых, нехарактер-
ных для них, а также снижения трудозатрат, расхода цемента,
экономии тепло- и электроэнергии, совершенствования техно-
логии, повышения производигельности предприятий стройин-
дустрии и т. д.
В разнитии исследований и прикладных работ в этой перс-
пективной области, находящейся на стыке между технологией,
химией и строительством, принимают участие многие ученые и
специалисты. Их усилия сосредоточены, главным образом,
на модернизации способов получения и очистки, расширении
номенклатуры, исследовании свойств и механизма действия
органических и комплексных добавок, а также на разработке
таких технологических приемов ведения строительных работ,
в которых в максимальной мере учитывались бы особенности,
присущие бетонным смесям и бетонам с орт аттическими добав-
ками.
Естественно, первое издание книги "Добавки в бетон”
(1973 г.) уже тте могло удовлетворить инженеров и научных
сотрудников, занятых исследованием, получением и примене-
нием орт эпических добавок и их производных. Соответственно
мы полностью переработали эту часть книги.
Номенклатура и теория действия добавок электролитов —
индивидуальных и мио окомпонентных за истекшие 15 лет
изменилась в меньшей степени. Кроме того, на шестом, седьмом
и восьмом Международных конгрессах но химии цемента, мно-
гочисленных конференциях, симпозиумах и семинарах представ-
ления о механизме гидратации цемента и влиянии добавок элек-
тролитов на эти процессы развивались достаточно успешно. Это
3
позволило нам сократить отдельные разделы первой главы кни-
ги и лишь несколько дополнить остальные, посвященные пробле-
ме использования добавок электролитов и комплексных доба-
вок на их основе.
Поскольку до сих пор в литературе преобладает строитель-
по-гехноло! ический подход к проблеме добавок в бетоны, мы
стремились сохранить те же принципы и ту же теоретическую
направленность материала, которая характеризовала первое
издание книги; основной акцент в ней сделан на углубленное
рассмотрение физико-химических основ механизма действия
добавок с привлечением (там, где это возможно) строгих
аналитических зависимостей в области кинетики параллельно
и последовательно протекающих процессов и на построение
научной классификации по механизму влияния добавок на мо-
но- и полиминеральные вяжущие вещества и продукты их гидра-
тации.
Мы пе включили в книгу некоторые основные положения,
подробно изложенные в других монографиях, а также те вопро-
сы, которые могут составить основу отдельной книги (мы наме-
тили только их контуры).
Считаем своим приятным долгом поблагодарить всех тех,
кто творчески сотрудничал с нами в исследовании и применении
добавок в бетоны, а В.Г. Батракова — за рецензирование книги
и полезные советы.
Глава 1. СОСТАВ ЦЕМЕНТНОГО КАМНЯ.
МЕХАНИЗМ И КИНЕТИКА ГИДРАТАЦИИ
ПРИ ТВЕРДЕНИИ ВЯЖУЩИХ ВЕЩЕСТВ
Развитие представлений о механизме действия добавок не-
разрывно связано с прогрессом в области теории гидратации и
твердения минеральных вяжущих веществ. По существу, это
две стороны общей проблемы, так как результаты изучения
добавок в бетоны служат экспериментальной основой для
теоретической разработки вопросов твердения вяжущих, а на-
дежные данные о механизме гидратации и твердения цемента
помогают находить оптимальные решения при использовании
уже известных добавок, расширять сферы их применения в
строительстве и изыскивать новые высокоэффективные до-
бавки.
Проблему гидратации при твердении минеральных вяжущих
материалов обычно рассматривают в двух аспектах: термоди-
намическом с примыкающим к нему кристаллохимическим и
кинетическом. Первый из них охватывает такие вопросы, как
состав и термодинамические свойства исходных неустойчивых
фаз, а также промежуточных и конечных продуктов их гидра-
тации, второй — механизм гидратации при твердении вяжущих.
Так как последнее направление разработано менее подробно,
мы отводим ему больше места, а изложение термодинамических
и кристаллохимических основ гидратации сведем к рассмотре-
нию лишь промежуточных и конечных продуктов фазовых
превращений, характерных для взаимодействия цемента с во-
дой, т. е. к фазовому составу цементного камня в бетоне.
1.1. ФАЗОВЫЙ СОСТАВ ЦЕМЕНТНОГО КАМНЯ
В БЕТОНЕ
Известно, что портландцементный клинкер состоит из четы-
рех основных фаз: алита, условно* ЗСаО SiO2(C3S), белита
2СаО SiO2 (|3 • C2S), трехкальциевого алюмината ЗСаО •
А12О3 (С3 А) и четырехкальциевого алюмоферрита 4СаО
• А12О3 • Ге20з (C4AF). Шлакопортландцемент за счет шлако-
вой составляющей содержит, кроме того, псевдоволластонит
СаО • SiO2 (CS), монтичеллит СаО • MgO SiO2 (CMS), анортит
*В действительности, C3S - твердый раствор на основе трехкальцие-
вого силиката, содержащий также А1 2Оз и MgO (AM). Общая формула
CS4Si6AM [96].
5
СаО • ALO3 2SiO2 (C'AS3), геленит 2CaO A12O3 • SiO2
• (C2AS) иокерманиг 2CaO • MgO 2SiO2 (C2MS2).
В глиноземистый цемент в качестве основного минерала
входит монокальцисвый алюминат СаО А12О3(СА); кроме
того, он может содержать как менее, так и более основные
алюминаты кальция: СаО • 2А12О3 (СА2) и 5СаО 2А12О3 (CSA3)
СОО1ВСГС1ВСПНО*.
при гидратации белита и алита — наиболее важных фаз норт-
ландцемсшного клинкера — реакция протекает по схеме
2Ca3SiOs + 6Н2О Ca3Si2O7 31120 + ЗСа(ОН)2.
Близкие по составу**, удельной поверхности (S & 300м2/г)
и, особенно, по рентгеновским и электронно-микроскопическим
характеристикам гидросиликаты кальция образуются и при
гидратации белита.
Однако правильнее представить продукты реакции в виде
гидросиликатов обшей формулы х СаО - SiO2 у Н2Ос пере-
менным молярным отношением х = СаО / SiO2 и у =H2O/SiO2.
Исследования показали, что образующиеся в системе СаО
SiO2 Н2О при температуре до 100°С фазы можно рассмат-
ривать как состоящие из гидросиликатов двух типов: CSH
(I) с х = 0,8. . .1,5, структура которых имеет вид деформи-
рованной фольги, и CSH (II) с х > 1,5 и волокнистой гофри-
рованной структурой.
Значение у для них изменяется от 1 до 1,7 или, если учесть
возможность адсорбции воды на гидрофильной поверхности
гидросиликатов кальция и их высокую удельную поверхность,
то фактическое молекулярное отношение кристаллизацион-
ной воды Н2О / SiO2 у них несколько меньше единицы.
С ростом температуры и концентрации Са(ОН)2 в жидкой
фазе основность гидросиликатов кальция имеет тенденцию к
некоторому повышению. Однако, по-видимому, между ними
нет принципиальной разницы: отличаясь степенью закристал-
лизованное™, основностью и базальными межплоскостными
расстояниями они представляют собой семейство тобермори-
товых (или тоберморитоподобных) фаз.
Имеется иная точка зрения, согласно которой существова-
ние гидросиликатов кальция переменной основности обуслов-
лено образованием тесных смесей из CSH (I) и CSH (11). Нако-
нец, имеются указания, что основность гидросиликатов каль-
ция уменьшается в процессе гидратации C3S и C2S, очевидно,
* Помимо этих фаз в состав глиноземистого цемента входит двух-
кальциевый силикат, геленит и другие менее важные в данном случае
минералы, в частности, двухкальциевый феррит и С4А1?.
**Соотношение СаО : SiO2 в этом случае близко к 1,65.
вследшвис изменения концентрации шдрокеида кальция в
жидкой фазе.
Важность изучения продуктов взаимодействия с водой сили-
катных фаз цемента обусловлена тем, что гидросиликаты каль-
ция — основные носители прочности цементного кампя в бето-
не; а алит и белит — преобладающие фазы поргландцементного
клинкера.
Отметим также, что частицы гидроксида кальция, возникаю-
щие при гидратации (3 = С2 S и особенно C3S, не влияют сколько-
нибудь существенно на механические показатели цементного
камня. Однако наличие гидроксида кальция в твердой фазе
и то, что C3S при взаимодействии с водой образует растворы,
сильно пересыщенные по отношению к Са(ОН)2, в большой
мере определяет pH среды и соответственно устойчивость гид-
ратных соединений, в известной мере — их основность, а равно
и основность двойных солей, кристаллизующихся в присут-
ствии ряда добавок.
При гидратации трехкальциевого алюмината реакция проте-
кает но схеме:
— с2дпв —>
С3А
—* ( 4А11| 9 *
Сэл11бкубич
согласно которой в качестве метастабилытой фазы возникает
не гексагональный гексагидрат, а смесь двух- и четырехкальцие-
вого гидроалюмината с почти идентичными кристаллохимиче-
скими характеристиками. Таким образом, согласно современ-
ным представлениям, -ексагидрат гидроалюмината кальция
существует только в форме стабильного кубического соедине-
ния, которое при 275°С теряет 4, 5 из 6 молекул воды.
Что касается метастабилытых продуктов гидратации С3А,
то четырехкальциевый текса тональный гидроалюминат, как
установлено, существует в виде двух полигипньтх разновидно-
стей, которые содержат при комнатной температуре и 100 %-й
относительной влажности воздуха 19 молекул кристаллизаци-
онной воды. Однако чисть из них связаны менее прочно, чем
остальные, поэтому при относительной влажности воздуха от
12 до 81 С4АН19 переходит в С4АН13. Двухкальциевый
гексагональный гидроалюминат также имеет, очевидно, две или
три политиппые разновидности.
Поскольку число молекул воды у метастабильных гексагональных
гидроалюмиттатов кальция изменяется в том интервале температур и
при той относительной влажности среды, которые характерны для экс-
плуатации бетонов с добавками, мы в дальнейшем изложении будем
придерживаться менее конкретного обозначения, а именно С4Аа<? и
С2А aq, 11с указывая точно количество содержащейся в них кристалли-
зационной воды.
При гидратации С4АБ помимо уже указанных гидроалюмина-
тов кальция образуются гидроферриты кальция разной основ-
б
7
ноши. При исследовании модельных систем удалось выделить
гексагональный четырехкальциевый гидроферрит кальция
C4FH, з, соответствующий C4AHi3*. Имеются данные об обра-
зовании из C4AF двух- и монокальциевого гидроферритов
кальция: C2Faq и CFffq.
В зависимое!» oi копценIрации 1идроксида кальция могут
образоваться два типа кубических соединений в ряду гидро-
алюмоферритов кальция: для ненасыщенного раствора
Са(ОН)2 общей формулы С3(хА, j^F)H6 с промежуточной
плохо закристаллизованной гексагональной формой гидро-
алюмоферрита кальция и для насыщенных растворов форму-
лы С3 (0,5А, O,5F)I16 с промежуточной гексагональной фор-
мой С4 (0,5А, 0,5F) Н, 4, образующейся при 5—50°С.
Продукты гидратации шлакопортландцемента, если коли-
чество в них шлака невелико, почти не отличаются по составу
oi перечисленных продуктов гидратации портландцемента.
При увеличении содержания шлака в вяжущем отмечается
тенденция к образованию более низкоосновных гидросиликатов
кальция и к уменьшению количества гидроксида кальция в
цементном камне бетонов на их основе.
Аналогичная в общих чертах картина наблюдается и при
гидратации нуццолановых портландцементов: для них харак-
терно наличие гидросиликатов кальция с несколько понижен-
ной основностью и уменьшение потенциальной щелочности,
хотя pH поровой жидкости может быть л 12. Отличия пуццо-
лановых портландцементов от портландцементов без кислых
гидравлических добавок обусловлены, как известно, взаимо-
действием последних с гидроксидом кальция, выделяющимся
при 1идра1ации алига
В продуктах гидратации глиноземистого цемента его гидро-
алюминаты в зависимости от температуры могут быть представ-
лены одно- и двухкальциевыми гидроалюминатами: СаО • А12О3-
ЮН2О (при температуре ниже 12°С) и 2СаО А12О3 -9Н2О —
при более высокой температуре, а также гелем гидроксида
алюминия. Кроме того, выкристаллизовывается С4АН, 3 и как
вторичный продукт — С3АН6 кубический.
Особый интерес представляют продукты взаимодействия
портландцементного клинкера с гипсом. Гипс можно рассматри-
вать и как неотъемлемую составную часть портландцемента, и
как добавку к портландцементному клинкеру, вводимую на
стадаи изготовления цемента для придания ему определенных
свойств. Как известно, добавка гипса была предложена одной
из первых и, безусловно, должна считаться наиболее распро-
страненной уже потому, чго ее введение в цемент считается
обязательным.
* Гидроферриты кальция в известном смысле близки к гидроалюми-
натам и могу! образовывать с ними твердые растворы
При затворении цемента водой в результате реакции между
С3А и гипсом в качестве первого, а иногда и единственною
соединения образуется высокосульфатная форма гидросульфо-
алюмината кальция ЗСтО • А12О3 • 3CaSO4 31Н2О (сокра-
щенно ГСАК-3). При недостатке гипса по стехиометрии реак-
ции и налииии непрореатировавитето С3А трехсульфагная фор-
ма со временем может перейти в низкосульфатную форму
гидросульфоалюмината ка."ьция ЗСаО А12О3 • CaS04 • 12Н2О
(ГСАК-1), изоморфную с С4АН13 и образующую с ним либо
твердый раствор, либо механическую смесь. Особенно легко
ГСАК-3 переходит в ГСАК-1 при нормальной температуре в
белитовом цементе по схеме:
ЗСаО-А12О3 3CaSO4 - 31Н2О + 2(ЗСаО А12О3) +
+ 5Н2О~*-3(ЗСаО • Д12О3 CaS04 1211,0).
В отличие or ГСАК-1 ГСАК-3 не стабилен при повышенной
температуре, поэтому при нагревании ГСАК-3 или переходит
в ГСАК-1, или при отсутствии С3А происходит его термиче-
ская диссоциация с одновременным выделением сульфата
кальция
ЗСаО • А12О3 3CaSO4 • 31Н2О ЗСаО А12О3 CaSO4
• 12H2O + 2CaSO4 • 2Н2О+ 15Н2О,
причем в зависимости от температуры образуется либо гипс, ли-
бо полугидрат сульфата кальция, либо ангидрит ГСАК-3
и ГСАК-1 образуются также при гидратации в присутствии
гипса С А — основного минерала глиноземистого цемента.
Известны близкие к ГСАК-3 и ГСАК-1 двойные соли-гидра-
ты, образовавшиеся при взаимодействии в воде некоторых
сульфатов с C4AF портландцементного клинкера. Однако
состав этих соединений окончательно не установлен, хотя из-
вестны способы их синтеза [103] . Некоторые авторы утверж-
дают, что кристаллизуются ГСАК-3 и высокосульфатная фор-
ма гидросульфоферрита кальция — ГСФК-3, аналогичная
ГСАК-3, но не дающая с ним твердых растворов, другие — что
образуются только твердые растворы этих соединений, в ко-
торых отношение между А12О3 и Fe2O3 зависит от состава
исходных фаз [20, 98] .
По поводу же существующих форм моносульфоферрита
кальция ЗСаО Fe2O3 • CaS04 aq (ГСФК-1), аналогичного
ГСАК-1, разногласий нет [97]. Считают, что при комнатной
температуреГСФК-1 может быть в двух формах: с 11 — 12 и с
13—14 молекулами воды. Их базальные межплоскостные рас-
стояния соответственно равны 0,898 и 1,04 нм. Форма с 11 — 12
8
молекулами воды получается из формы с 13 14 молекулами
при высушивании в условиях относительной влажности 55 %
Имеются также данные о том, что ГСФК-1 не образует твердых
растворов с C4F«/ и при взаимодействии с гипсом не превра-
щается в ГСФК-3 [103] , однако для окончательных выводов
требуются дальнейшие исследования.
Знание фазового состава продуктов гидратации C4AF и про-
дуктов его взаимодействия с гипсом необходимо, так как
обнаружено [20], что гидроферриты, гидросульфоферриты и
гидросульфоалюмоферриты кальция оказывают значительное
влияние на сульфатостойкость бетона.
Фазовый состав цементного камня на границе с ним и за-
полнителем близок к составу камня вдали от границы, та исклю-
чением зоны его контакта с карбонатным заполнителем. Есть
данные [55] о том, что в этом случае образуется гидрокарбо-
алюминат кальция — ЗСаО • А1гО3 СаСО3 aq, относящийся к
ряду двойных солей типа ГСАК-1.
1.2. ОСНОВЫ МЕХАНИЗМА И КИНЕТИКИ ПРОЦЕССА
ГИДРАТАЦИИ ПРИ ТВЕРДЕНИИ МИНЕРАЛЬНЫХ ВЯЖУЩИХ
ВЕЩЕСТВ
За два последних десятилетия доминирующими стали гак
называемые ’’кристаллизационные” или иначе ’’сквозьраст-
ворные” представления о процессах гидратации вяжущих ве-
ществ. Они заключаются в растворении исходных метасгабиль-
ных вяжущих веществ, которые образуют растворы, пересы-
щенные относительно термодинамически более устойчивых
в этих условиях гидратных новообразований. Эти гидратные
новообразования характеризуются меньшей растворимостью
и выкристаллизовываются из таких пересыщенных растворов.
Под выкристаллизовыванием понимают выделение из пере-
сыщенных растворов гидратных фаз независимо от степени
упорядоченности и дисперсности как их самих, гак и исходных
вяжущих веществ, состав которых обязательно отличается от
состава продуктов гидратации.
Если понятие ’’растворимость” для термодинамически устой-
чивых конечных продуктов гидратации применимо без всяких
оговорок, то его распространение на метастабильные исходные
вяжущие вещества требует специального обоснования и пояс-
нений. Под их растворимостью мы понимаем ту максимально
возможную (хотя и не всегда достижимую с помощью прямого
опыта) концентрацию, которая соответствует насыщению раст-
вора по отношению к вяжущему; значение Ср связано с изме-
нением свободной энергии при растворении А /•’ соотношением
10
б'р = exp
A / - sc
RT
(ID
me ф = RT In/; / — коэффициеш активности.
Необходимо MciKo разграничить принципиальную возмож-
ность применения >акой равновесной характеристики как раст-
воримость к неустойчивому в условиях гидратационного твер-
дения вяжущему веществу (с оговоркой относительно рассмот-
рения растворимости мшасзабильной фазы*) от методических
затруднений в ее определении, вызванных прежде всего тем,
'ио одновременно m pacmopa кристаллизуется термодинами-
чески устойчивое, в данном случае гидратное, новообразование.
Т рудности
в определении
СР
клинкерных минералов обус-
ловлены тем, что при их взаимодействии с водой новая фаза
может начать выделяться еще до достижения раствором кон-
центрации, отвечающей растворимости исходного соединения.
В результате из единицы объема раствора за единицу времени
на кристаллизацию гидратных новообразований может расходо-
ваться больше материала, чем поступать вследствие растворе-
ния вяжущих веществ, и их непосредственно измеряемая в
растворе концентрация не достигнет значения
(это обстоя-
Р
1ельс1во приводило даже к отрицанию существования понятия
"растворимость" вяжущих материалов).
Исследования показали, что зги затруднения преодолимы.
Были разработаны три независимые группы теоретически обо-
снованных методов определения Ср мономинеральных вяжу-
щих. Методы первой группы основаны на более сильном тормо-
жении стадии кристаллизации новообразований, чем раство-
рения исходной фазы, второй — на исключении из общего про-
цесса стадии кристаллизации и применении для измерения
растворимости уравнений типа (1.6) [68, 69]; третьей — на
совместном решении уравнений для растворения вяжущего
и кристаллизации новообразований из пересыщенных раство-
ров с учетом уравнения материального баланса [68] .
Полученные данные сведены в табл. 1, в которой приведены
и коэффициенты диффузии и диффузионные потоки, измерен-
ные методом вращающегося диска [68] .
Из табл. 1 следует, что по растворимости, коэффициентам
диффузии и по скорости растворения мономинеральныс вяжу-
щие вещества весьма отличаются друг от друга, причем по
изменению скорости растворения они располагаются в последо-
вательности, соответствующей известным данным [57] по
кинетике их гидратации.
* Иногда ее называют также мстасгабияьной растворимое! ью.
II
1.3. КИНЕТИКА ПРОТЕКАНИЯ ПРОЦЕССОВ РАСТВОРЕНИЯ
ВЯЖУЩИХ ВЕЩЕСТВ И КРИСТАЛЛИЗАЦИИ НОВООБРАЗОВАНИЙ
ИЗ ПЕРЕСЫЩЕННЫХ РАСТВОРОВ
Растворение вяжущих — сложный процесс, состоящий из
последовательно протекающих стадий: подвода вещества к по-
верхности зерен, собственно реакции на границе раздела фаз и
швода продуктов реакции в обьеме раствора.
В общем виде скорость растворения вещества с единицы
поверхности v можно записать следующим образом:
С
\ fk + lf& ’
(1.2)
где к — константа скорости растворения; (3 — коэффициент массопере-
дачи, /3 = Д/6.
Возможны два предельных случая: (3<£к и j3»k. При (3« к
(г. е. если диффузионное сопротивление (З*1 значительно больше
кинетического сопротивления к-1) весь процесс лимитируется
шадией переноса вещества, как самой медленной, т. е. процесс
протекает в диффузионной области. Тогда
V = 0С
(1-3)
или диффузионный поток вещества П через единицу поверхно-
сти равен:
ас
П = —Д— , (1.4)
dx
где знак ’’минус” указывает, что поток направлен в сторону, противопо-
ложную возрастанию концентрации.
Таким образом, для случая диффузионного контроля за
процессом обязательно наличие градиента концентрации ^С/дх
(или АС / Ах), т. е. концентрация вещества у поверхности,
отвечающая его растворимости Ср, должна быть больше, чем
концентрация вещества в объеме Су.
В случае (3» к кинетическое сопротивление к-1 много
больше диффузионного J3-1 и процесс лимитирует стадия хи-
мической реакции на границе как самая медленная. Тогда
v ~кС
U-5)
и градиент концентрации отсутствует, так как С — Ст.
Кроме предельных случаев возможны промежуточные, когда
значения диффузионного и кинетического сопротивлений сопо-
13
ставимы друг с другом, и процесс растворения вяжущих ве-
ществ протекает в так называемой смешанной области. При
этом оказывается справедливым уравнение (1.2), в котором
значение концентрации вещества в объеме раствора' С' бшь-
ше, чем в первом, и меньше, чем во втором случае (Ст <с’т <С ^).
Экспериментально доказано, что в реальных условиях твер-
дения процессы растворения минеральных вяжущих веществ
при температуре ~ 10— 100°С протекают во внешней диф-
фузионной области; об этом помимо градиента концентрации
свидетельствует зависимость скорости растворения от пере-
мешивания [67] и низкое значение энергии активации про-
цесса Е.
При этом возможны два механизма переноса растворенного
вещества: только молекулярной диффузией и; и совместно
диффузией и конвекцией.
При молекулярном переносе вещества уравнение (1.4)
можно преобразовать с использованием критериев подобия
следующим образом:
dm Nu D NuZ)
(Ср-Сг)=-э— ЛС'
dr 2г । 2г
(16)
где Nu = pd/D - безразмерный критерий Нуссельга; г - характеристи-
ческий радиус частиц вяжущего; АС] — недосыщеиие.
Критерий Нуссельта, характеризующий массопередачу, в
свою очередь зависит от определяющих крюериев Рейнольдса
(Re) и Прандтля (Рг), критерий Рейнольдса определяет ха-
рактер потока вещества, а критерий Прандтля характеризует
физико-химические свойства флюидной фазы :
Re = г/2/- /и (1.7) и Рг = £)/н,
(1.8)
где и — скорость; и — кинематическая вязкость.
При Re ~ 0 Nu = const = Nu0, причем для частиц неправиль
ной формы, имеющих пространственную симметрию, близкую
к сферической, Nu0 — 2.
При изучении кинетики растворения частиц, взвешенных по-
током, в условиях конвективной диффузии следует также
использовать зависимости (1.6) — (1.8), но с поправкой на
относительную скорость Дотн, равную:
"отн иг ип
(1.9)
где и и пульсационная скорость соответственно частиц и потока
Тогда формулу (1.7) можно записать в следующем виде:
Re=(i//. г/п) 2r / р = woTH 2г / р . (1.10)
Установлено [49], что с возрастанием радиуса частиц г
уменьшается их пульсационная скорость «п и растет нотн;
еоо1вегсгвенно величина Re растет в степени более 1. Следова-
1елыю, для частиц, взвешенных потоком, с достаточным прибли-
жением можно считать, что
Nu ~Re°'5~ г , (1.1 1)
а значит, становится понятным важное обстоятельство: слабая
зависимость скорости растворения частиц твердой фазы от их
размеров.
В [48] установлено, что для случая переноса растворенного
вещества диффузией и конвекцией в известное уравнение
v = dm/dT=(DS / 6) (Ср -Ст)
(112)
коэффициент диффузии D входит в степени 2/3, причем это
положение носит общий характер и справедливо для частиц
различной формы: сферических, удлиненных и др. Соответствен-
но изменяется значение и размерность толщины диффузион-
ного слоя 6 в лом уравнении.
Таким образом, для количественной оценки скорости раст-
ворения вяжущих веществ необходимо знать их кинетические
(коэффициент диффузии) и равновесные (растворимость)
характеристики процесса.
Кристаллизация новообразований также может рассматри-
ваться как сложный, последовательно протекающий процесс
образования и роста кристаллов гидратов из пересыщенных
растворов.
Зародыши новой фазы — центры кристаллизации возникают
в результате флуктуаций плотности. Вероятность возникнове-
ния зародышей новой фазы в единице объема за единицу вре-
мени а зависит от высоты энергетического барьера А/7макс и
описывается известной формулой
Г Д F )
а=Лехр|——J , (1.13)
которая после соответствующих преобразований приводится к
виду:
[ 47К2ко3
а = Л ехр |
(1.14)
15
где А — иредэкспоиенциальный множитель, учитывающий энергию акти-
вации процесса - U (А'е'и'кт')- у - коэффициент формы частицы,
для сферы 7 = 4/Зтт); И — молекулярный объем; о — свободная по-
верхностная энергия (межфазовая ->чергия); R - газовая постоянная;
ПП - произведение пересыщения, г. с. произведение концентраций (точ-
нее, активностей), имеющихся в растворе ионов; ПР — равновесное с
гидратами произведение растворимостей (активностей) ионов.
Для недиссоциированных или малодиссоциированных ве-
ществ отношение ПП/ПР С’/С„ , т. е. заменяется известным
выражением для степени пересыщения.
Анализ уравнения (1.14) показывает, что скорость возник-
новения зародышей новой фазы тем выше, чем меньше молеку-
лярный объем новообразований Ук и его свободная поверх-
ностная энергия о на границе кристалл—раствор, выше абсолют-
ная температура Т и больше отношение ПП/ПР. Кроме того, на
склонность пересыщенного раствора к спонтанной кристаллиза-
ции влияет также предэкспоненциальный множитель А.
К доступным методам управления процессами образования
зародышей относится, например, изменение температуры пере-
сыщения ПП/ПР, которое можно регулировать введением доба-
вок электролитов, изменяющих растворимость вяжущего.
Возникновение зародышей кристаллизации — энергетически
невыгодный процесс. Его протекание существенно облегчается
наличием границ раздела фаз (в нашем случае — крупного и,
особенно, мелкого заполнителя), причем в тем большей сте-
пени, чем ближе по своим кристаллохимическими параметрам
материал ’’подкладки” к новой фазе, так как при этом систе-
матически уменьшается коэффициент поверхностного натяже-
ния на границе раздела между подкладкой и новой фазой [62] .
Структурообразующая роль песка, в частности дополнитель-
но измельченного, может быть также объяснена тем, что он
облегчает работу образования зародышей кристаллизации.
В предельном случае, когда подложкой служит материал, поч-
ти изоморфный с кристаллизующимся, коэффициент поверх-
ностного натяжения между ними близок нулю. Соответственно
практически полностью исключается и возможность возникно-
вения в этих условиях трехмерных зародышей новой фазы,
так как энергетически несравненно более выгодным стано-
вится их рост.
Процесс роста кристаллов путем непосредственного присое-
динения к трехмерному зародышу новой фазы ионов или мо-
лекул из раствора маловероятен, так как при этом свободная
энергия системы не уменьшается, а увеличивается. Следова-
тельно, такая молекула, ’’осевшая” на грань зародыша, неус-
тойчива и стремится снова перейти в раствор. Устойчивым бу-
дет только присоединившийся к трехмерному новообразо-
ванию двухмерный плоский зародыш определенных ’’критиче-
ских” размеров [62], состоящий из скопления молекул
С-
(ионов). Толщина его соответствует мономолекулярному
слою, а длина ребра (критический радиус) такого зародыша
вычисляется по известной формуле Томсона (Кельвина).
Таким образом, рост кристаллов происходит путем присое-
динения к трехмерному зародышу двухмерных. Линейная
скорость роста грани кристалла dl/dr описывается форму-
лой*
dl/dr =/liexp ] — Bi
(RT)2\nC/C0
(1.15)
где <7] — поверхностная энергия; — коэффициент, учитывающий
периметр двухмерного зародыша и его молекулярный объем.
Вероятность образования двухмерных зародышей, исходя
из формулы (1,15), значительно выше, чем трехмерных.
Еще более выгодным в энергетическом отношении оказыва-
ется рост кристаллов путем присоединения двухмерных заро-
дышей к месту выхода дислокации. Вероятность роста крис-
1 аилов при этом будет большей, чем в случае совершенной
структуры подкладки, так как при наличии дислокации на
поверхности кристалла появляется увеличенная поверхность
закрепления.
Отметим также, что возникновение зародышей — стадия,
протекающая в кинетической области, обычно не продолжи-
тельно и в силу энергетической невыгодности быстро перехо-
дит в стадию роста кристаллов. Последняя в условиях, исклю-
чающих интенсивное перемешивание раствора, протекает в
диффузионной области (кроме небольшого начального участка
кинетической кривой линейного роста кристаллов, непосред-
ственно примыкающего к участку, характеризующему стадию
образования зародышей) [67, 69] .
Следовательно, кинетику кристаллизации на протяжении
почти всего периода гидратационного твердения вяжущих
удается описать уравнениями, аналогичными зависимостям
(1.6) — (1.12) для скорости растворения минеральных вяжу-
щих веществ, естественно, с заменой в них недосыщения
ACj = Ср — Ст пересыщением
Д Сг — Ст — Со
(1.16)
те С’о — равновесная растворимость термодинамически устойчивой
новой фазы — гидрага (поскольку движущей силой процесса роста крис-
таллов служит градиент концентрации dC2 / dx2).
*Вывод уравнения (1.15) в общих чертах аналогичен выводу уравне-
ния (1.14).
Рис. 1. Обработка по уравнению
(1.17) опытных данных по кристал-
лизации гидратов из пересыщенных
растворов
• — C3S; v то же + моноэта-
воламин; о — jS-CjS; а - го же +
+ моноэтанола мин; х — полу гидра-
та сульфата кальция;
A12CSO4) з + Са (ОН) 2
0 1 2 3 4 5 6 Ат
Процесс роста кристаллов протекает в диффузионной об-
ласти, о чем свидетельствуют требуемая теорией зависимость
между скоростью процесса и интенсивностью перемешивания,
низкая энергия активации процесса, а также то обстоятельст-
во, что кинетику процесса удается описать уравнением, выве-
денным для случая кристаллизации веществ в диффузионной
области [ 104] .
Это уравнение после интегрирования имеет следующий вид:
А? = In
f $ \-В + I/2 я ’
+ х/З < arc tg--f=-----------’ >
( V3/4 6
где Лт - безразмерное время; В — относительное пересыщение,
В - (С - Со) I (С - Со),
' т и макс и
здесь Смакс ~ исходная максимальная концентрация вещества в раст-
воре;
,_______ 2/3
А = ЗК VTVF7(CMaKC-C0) , (I IS)
где К — константа, связанная с коэффициентом диффузии; 7 - коэф-
фициент, учитывающий форму кристалла; р - плотность кристалла.
18
Экспериментальные данные зависимости А? от В, как по-
казано на рис. 1, хорошо ложатся па безразмерную 5-образную
теоретическую кривую, а из табл. 2 следует, что значение А в
уравнениях (1.17) и (1.18) мало изменяется при введении
добавки моноэтаноламина в количестве 10'3 — 10"4 моль/л.
Эю также указывает на то, чю процесс роста повой фазы из
пересыщенных растворов протекает в диффузионной области
(70)
Таблица 2. Кинетика крис|аллнзации веществ из пересыщенных
растворов
Время отбора пробьц мни Концентрация веществ А, мин
С 104 моль/л
Пересыщение создано алитом
0 13.8
120 11.7 0,012
165 11 6 0,012
180 10,9 0,013
195 10,3 0,013
227 9 0,013
240 8,8 0,013
258 8,7 0,012
270 8,2 0,012
Пересыщение создано алитом с добавкой моноэтаноламина
(С— 10-3 - 10-4 моль/л
0 1 1,7
95 1 1,4 0.01
120 1 1,4 0,008
180 10,2 0,01
240 9,7 0,009
270 8,3 0,01
Пересыщение создано белитом
0 15,7
1 15(1 15,2 0.0014
25 60 11,8 0,001
2655 11,2 0,0011
2785 10,8 0,0011
2845 10,8 0,001
2940 7,3 0,0008
Пересыщение создано при сливании растворов
A12(SO4)3 и Са (ОН)2
0 34
24 23,1 0,092
27 18.7 0,099
30 15 0,099
33 10,9 0,1
36 10.2 0,097
39 7,8 0,098
42 6,1 0,098
45 5,1 0,097
19
1.4. КАЧЕСТВЕННЫЕ И КОЛИЧЕСТВЕННЫЕ ЗАКОНОМЕРНОСТИ
КИНЕТИКИ ГИДРАТАЦИИ ПРИ ТВЕРДЕНИИ
МИНЕРАЛЬНЫХ ВЯЖУЩИХ ВЕЩЕСТВ
Раздельное рассмотрение процессов растворения исходных
фаз и кристаллизации новообразований из пересыщенных раст-
воров показывает, что вскоре после затворения вяжущих водой
и в течение длительного времени эти процесс! i протекают в
диффузионной облает. Процессы же спонтанно! о возникнове-
ния зародышей новой фазы (как, возможно, и начальная стадия
роста кристаллов при их массовой кристаллизации), протекаю-
щие в кинетической области, непродолжительны, а масса об-
разующихся при этом центров мала.
Следовательно, скорость интегрального процесса гидратации
вяжущих в любой момент времени опредсляшся скоростью
того из последовательно протекающих составляющих его про-
цессов растворения вяжущих и кристаллизации конечных фаз,
который протекает медленнее другого.
Это позволяет, во-первых, предложить феноменологическое
деление минеральных вяжущих веществ по кинетическим осо-
бенностям их гидратации и, во-вторых, вывести основное урав-
нение кинетики их гидратации при твердении.
Решая первую задачу, напомним, что, как показано на рис. 2,
концентрация вяжущих в растворе всегда проходит через мак-
симум, причем может рассматриваться как промежуточная
стадия последовательно протекающего процесса гидратации.
Следовательно, по изменению во времени концентрации исход-
ного вяжущего, растворенного в жидкой фазе, удается опреде-
лить, когда и какой из процессов — растворение вяжущего или
выделение новообразований — как самый медленный лимити-
рует весь ход гидратации в целом.
Оказалось, что все минеральные вяжущие материалы можно
разделить на два типа: быстротвердеющие (например, полу-
гидрат сульфата кальция) и медленнотвердеющие (силикатные
составляющие портландцемента). Для быстротвердеющих вя-
жущих, скорость растворения которых весьма велика, в течение
достаточно длительного срока (до 20—30 % всего времени
гидратации) скорость процесса лимитирует кристаллизация
новой фазы [72] .
Об этом свидетельствует наличие пДато на кривой У рис. 2,
высота которого, в данном случае соответствующая раствори-
мости вяжущего, не зависит от водотвердого отношения да-
же при его значительном изменении [65].
Процесс растворения для подобных вяжущих становится ли-
митирующим лишь после того, как их концентрация* в раст-
воре начинает снижаться (при этом количество связывающегося
*Естественно, в виде соответствующих ионов.
Рис. 2. Кинетика изменения концент-
рации вещества в растворе
1 — полугидрат сульфата кальция;
2 — двухкальциевый силикат
С • 10, МОЛь/Л Со SO^
С'Ю^ /лоль,/л Со? Sc 0^
О 10 100 1000 z, лил
в результате кристаллизации вещества за единицу времени
превосходит количество вещества, поступающего в жидкую
фазу за то же время вследствие растворения исходного вяжу-
щего) .
Для медленнотвердеющих вяжущих максимум на кривой
изменения концентрации (кривая 2 рис. 2), отвечающий ус-
ловию ^Смакс / dr = 0, достигается за время т0 «• тГИДр> т- е-
несоизмеримо раньше, чем завершается процесс гидратации
основной массы вяжущего. Эго означает, что на протяжении
почти всего основного периода гидратации кинетику этого
процесса лимитирует стадия растворения вяжущего, как самая
медленная, а сам процесс растворения протекает в диффузион-
ной области.
Максимум концентрации вещества в жидкой фазе для мед-
леннотвердеющих вяжущих, как правило, не соответствует их
растворимости. Во всяком случае никогда нельзя быть уверен-
ным в том, что достигнута та инвариантная концентрация моно-
минерального вяжущего, которая отвечает растворимости
этой метастабильной фазы.
Аналогичный вывод может быть сделан и для быстротвер-
деющих вяжущих после того, как суммарная скорость связы-
вания ионов при кристаллизации новой фазы заметно превысит
скорость перехода вещества в раствор за счет растворения
исходной фазы, причем как и для медленнотвердеющих вяжу-
щих на поздних стадиях гидратации соблюдается зависимость
ст«ср-
Особенности процессов гидратации вяжущих двух типов
необходимо учитывать потому, что в их кинетике имеются не-
которые количественные (но отнюдь не качественные) отличия.
Так, для быстротвердеющих вяжущих достаточное приближе-
ние дает известное теоретическое уравнение А.Н. Колмогоро-
ва, выведенное в предположении, что кристаллизация идет
из жидкой фазы, причем скорость зарождения центров и линей-
ная скорость их роста остаются все время постоянными и крис-
таллы растут с одинаковой скоростью по всем направлениям,
сохраняя до момента контакта с другими кристаллами сфери-
ческую форму.
Рис. 3. Обработка по уравнению (1,19)
опытных данных по кинетике гидрата-
ции
о, х. □ , а , О — гипсовых вя-
жущих разных партий; • — то же, с
добавкой лигносульфоната (ОСТ) ; V —
то же, с добавкой хлорида кальция;
© — то же, с добавкой гипса
Как показано на рис. 3, выполняется условие
19)
где V -объем, закристаллизовавшийся за время г; Ио - начальный
т з
объем; а — вероятность образования зародышей кристаллизации в 1 см
незакристаллизовавшегося объема за единицу времени; X — линейная
скорость роста кристаллов, K—dl/dr.
Значение кристаллизационного параметра аХ3 в этом урав-
нении можно определить графически после его логарифмиро-
вания, причем а расшифровывается с учетом уравнения (1.14),
а X — с помощью уравнений (1.6) и (1.16), т. е. оба эти пара-
метра, как было доказано [65], имеют определенный физичес-
кий смысл. В дальнейшем будет показано, что и эффект от вве-
дения добавок в вяжущие вещества первого типа удается учесть
количественно при использовании приведенных уравнений.
Об этом же свидетельствуют и данные рис. 3.
Для вяжущих второго типа вывод основного уравнения ки-
нетики их гидратации должен быть иным [69] ; в первом при-
ближении можно пренебречь стадией возникновения зароды-
шей новой фазы и не учитывать ее в уравнении материального
баланса.
Запишем уравнение для массы вяжущего и новообразо-
вания тг (в пересчете на сухое вещество):
mi 2 =71,2Р1,2М,2/31,2 , П.20)
где э — коэффициент формы, частиц (71 =71); Pi,2 — плотность исход-
ной и конечной фаз; Л1>2 - число частиц этих фаз; /1>2 - их характе-
ристический размер.
22
Обозначим массу частиц исходной и конечной фаз в момент
начала отсчета т0 (т0 « т) через га,^ и w1>0- Тогда уравнение
материального баланса при концентрации вещества в жидкой
фазе Ст в произвольный момент времени запишется в виде
('"1.т‘т1,0^('и2.т ’ m2,0^+ Ст= const. О-21)
Примем, что исходное вяжущее не гидратировано (m2j0 =
~ 0) и процесс гидратации идет без привнесенной извне затрав-
ки, т. е. Л'2,о = 0. Кроме того, известно, что изменение концент-
рации вещества практически не отражается на значении его
коэффициента диффузии.
Эго позволяет несколько упростить аналитическое решение
задачи. Процессы гидратации вяжущих с точки зрения их мас-
сопереноса, как и процесс их растворения (см. выше), можно
несколько условно разделить на два этапа. На первом (ранняя
стадия) перенос вещества осуществляется конвекцией и диф-
фузией, так как на этом этапе сказывается влияние предшест-
вующего перемешивания цементного теста и экзотермического
эффекта при гидратации его составляющих. На втором этапе,
I. с. на более поздней стадии гидратационного твердения, когда
структурный каркас в основном уже сформировался и тепло-
выделение протекает неинтенсивно, перенос вещества близок
только к молекулярному.
Для первого этапа легко перейти от скорости растворения
вяжущих (dmt / dr) и роста новой фазы, выраженной в изме-
нении се массы, к линейной скорости растворения вяжущих
1/3 2/3
dtn. / d-r-dl,/dT = A,(D (1.22)
и роста новообразований
1/3 2/3
dm2 Id^dl2jd7= A2(D I p2)(CT-C2). (1.23)
Проинтегрируем уравнения (1.22) и (1.23) при условии
/12РЧ£>2^3 = const. (1-24)
1 огда:
h о = А,рГ' D2'3 f (С - Ct)d7 ; (1.25)
%
h - /2,0 = A2p2-lI^13 J (С ' C2)dr. (1-26)
г
После вычитания из одного уравнения второго с учетом
(1.20) получим
-- (W1 1/3 - Wl'/o3 ) - -- U«2/3 - <0 ) =
kr . L- >
= -LP/3(G -C2)r,
2/3
где к । 2 =<onst TV, 2 .
(127)
(1.28)
Аналогичным образом для второго этапа гидратации после
интегрирования уравнений типа (1.25) и (1.26) для растворе-
ния исходной и роста конечной фаз при
Nu Dp,“J = const
получим
-- (ш/3 - ГНцо3 ) - 7~7 (w22/3 -w22,o3)s
кх ^2
-С2)т ,
(1.29)
(1.30)
гдекЬ2 = Nuft2/3 7,/3Луз = const А1'3. (1-31)
Уравнения (1.27) и (1.30) весьма интересны. Прежде всего
в них не фигурирует значение концентрации вещества в про-
извольный момент времени Ст, исключенное в результате вычи-
тания одного уравнения из другого. Таким образом, кинетику
гидратации вяжущих по уравнениям (1.27) и (1.30) можно
рассчитывать, зная лишь растворимость метастабильной фазы
Ср и новообразования С2> а также коэффициент их диффу-
зии D. Эти характеристики удается определить в независимых
опытах, в частности, с разбавленными суспензиями или с дис-
ками.
Следовательно, весьма важно то, что в уравнения (1.27)
и (1.30) входят показатели, определяемые путем анализа как
твердой фазы в цементном тесте и даже в бетонной смеси, так
и жидкой фазы в разбавленных системах (термодинамические
и диффузионные характеристики).
Наконец, как уже указывалось, вскоре после затворения
вяжущих веществ водой процесс твердения лимитирует стадия
их растворения. Это позволяет рассматривать уравнения кинети-
ки meрдения вяжущих с точки зрения контролирующего фак-
тора и еще больше повышает значение таких показателей, как
коэффициенты диффузии и растворимость исходных метаста-
бильных продуктов.
Трудности решения уравнений (1-27) и (1.30) обусловлены
в основном тем, что пока еще не представляется возможным
точно определить количество зародышей новой фазы N2 и их
размеры / 2,0; вызывает осложнение и вычисление Л) и /1 для
исходных продуктов в связи с-их полидисперсностью.
Однако эти и некоторые другие затруднения удается пре-
одолеть, если использовать приближенные решения. Нами найде-
ны таковые для первого этапа твердения вяжущих, протекаю-
щего в области конвективной диффузии [69] . Известно, что
размеры новообразований цементного камня при непродол-
жительном твердении вяжущих лежат в пределах 10-9 — 5 *
Н0е м против 10"6 — 5 I0"5 м для зерен исходного материала.
При I | » / 2
Л’, 1/3 « N2il3 , (1.32)
что позволяет пренебречь вторым членом в левой части урав-
нения (1.27).
Трудности, встречающиеся при описании кинетики гидрата-
ции и твердения мономинеральных вяжущих и особенно поли-
минеральных цементов, в значительной мере обусловлены
процессами пленкообразования. На эти процессы удается актив-
но влиять с помощью добавок.
Механизм формирования пленок из гидратных новообразо-
ваний на зернах вяжущих также удается понять, используя
представления о растворении исходной и выделении конечной
фазы из пересыщенных растворов. По нашим данным, подоб-
ные пленки могут возникнуть только этим путем [66]. От-
сюда вытекает и другое положение — рассматриваемые фазово-
выраженные пленки, хотя и экранируют зерна вяжущих, затор-
маживая их гидратацию, однако место их первичного образо-
вания — раствор вблизи поверхности вяжущего, но не сама
эта поверхность.
Таким образом, фазово-выраженные пленки могут возни-
кать на различном расстоянии от зерен вяжущих — вплоть
до очень близких, причем этот фактор, как и свойства самих
пленок, во многом определяет темп гидратации и твердения
цемента. Это вызвано тем, что по обе стороны пленки из ново-
образований (главным образом ГСАК-3), неплотно прилегаю-
щей к зерну вяжущего, создается разность концентраций.
Характер влияния пленок можно определить исходя из
того, что обычно (хотя и не всегда) этот процесс начинается
при суммарной скорости растворения вяжущего превос-
25
ходящей скорость кристаллизации новообразований vs, при-
чем неравенство
*! > v2 > О,
(1.33)
означает, что за начало отсчета нужно принять не момент за-
творения вяжущего водой, а несколько более поздний мо-
мент времени (т 0), когда процесс кристаллизации
пленкообразующего вещества уже начался. Кроме того, при
расчете необходимо принять во внимание практически полное
отсутствие готовых центров кристаллизации ~ С*) (их
наличие привело бы к уменьшению экранирующего действия
пленок). Как правило, при образовании пленок пересыщение
весьма велико, поскольку Ср» CQ.
Условие (1.33) ограничено естественными требованиями:
вяжущее не должно успеть полностью раствориться до начала
интенсивного пленкообразования и толщина пленок должна
быть меньше радиуса зерна исходного материала — иначе ни-
какого экранирования не произойдет.
Следовательно, процесс формирования пленок на зернах
вяжущего носит сложный, противоречивый характер, посколь-
ку чем сильнее проявляется экранирование, тем быстрее на-
блюдается торможение дальнейшего взаимодействия зерна
вяжущего со средой, в том числе и приводящее к пленкооб-
разованию, т. е. процесс образования пленок, начинаясь при
условии (1.33), завершается при противоположном условии:
°<^<^ (1.34)
(такому переходу способствует также уменьшение доступной
поверхности исходной фазы Sj).
Если сопоставить процесс гидратации вяжущих, идущий с
образованием хорошо экранирующих пленок, с аналогичным
процессом, но протекающим с очень слабым пленкообразова-
нием*, то для первого характерны следующие кинетические
особенности: момент времени, при котором достигается пере-
ход от неравенства (1.33) к неравенству (1.34) достигается
раньше, а значение максимальной концентрации вяжущего в
растворе Смакс уменьшается; после момента времени, когда
выполняются условия
И = Vi и de / <1т — 0, (1.35)
* Далее будет показано, какими путями удайся реализовать эти
случаи.
отношение скоростей kj/k, снижается тем быстрее, чем пол-
нее проявляется тормозящее гидратацию действие пленок.
Прорывы пленок могут быть выявлены не только по интен-
сификации процессов гидратации вяжущих и упрочнению ма-
териала, но и по появлению пиков на кинетической кривой
изменения концентрации вещества в жидкой фазе, как след-
ствию колебаний значения отношения v2 / Kj .
Таким образом, возможность возникновения пленок на
поверхности вяжущих веществ, их экранирующая способность
и долговечность в большой степени зависят от соотношения
между скоростями растворения исходной и кристаллизации
конечной фаз, абсолютных скоростей этих процессов, способ-
ности пленок растворяться в среде, с которой они контактиру-
ют, а также от их структурно-механических свойств, которые
определяются толщиной, прочностью и эластичностью пленки,
связанными с ее составом и кинетическими факторами ее об-
разования.
Обычно при прочих равных условиях мелкокристалличе-
ские пленки менее проницаемы и более прочны, чем крупно-
кристаллические. По данным электронно-микроскопических
исследований, хорошо экранирующие пленки образуются от
поверхности подложки на столь близком расстоянии, что их
трудно механически отделить от грани, причем мелкие крис-
1аллики своей удлиненной осью располагаются параллельно
поверхности подложки. В отличие от этого, проницаемая плен-
ка состоит из губчатой массы неориентированных более круп-
ных кристалликов, механически легко отделяемой от под-
ложки — зерен вяжущего.
Наконец, обязательное условие достаточно полного экрани-
рования новообразованиями исходной фазы — соблюдение
неравенства
^/^>>, (136>
гце VR и — соответственно молекулярный обьем исходной и ко-
нрчнои фаз*.
Невыполнение этого услсвия означает отсутствие сплошной
пленки из новообразований на зернах вяжущих [66] .
Естественно, что неравенство (1.36) справедливо лишь в
гом случае, если материалом пленки служат новообразования,
выкристаллизовывающиеся из пересыщенных растворов, об-
ра юванных растворяющимся мономинеральным вяжущим.
Иля полиминеральных цементов и для смешанных вяжущих
•Молекулярный обьем-(-)отиошение молекулярной массы вещест-
ва М к его плотности р.
27
в присутствии химически взаимодействующих с ними добавок
это условие неприменимо.
Знание закономерностей формирования пленок позволяет в
некоторых случаях количественно учесть их экранирующее
действие при анализе кинетики гидратации моно- и полимине-
ральных вяжущих материалов.
По-видимому, прежде всего нленкообразовапием объясняет-
ся юг факт, что при резко различной скорости гидратации
отдельных клинкерных минералов скорости их гидратации в
цементе близки.
В связи со сложным характером процессов гидратации це-
ментов в бетоне для их описания нередко пользуются эмпи-
рическими уравнениями, общим недостатком которых явля-
ется невозможность проведения с их помощью теоретического
анализа процессов гидратации вяжущих материалов.
Таким образом, кристаллизационный механизм гидратаци-
онного твердения вяжущих, предусматривающий растворение
исходной и выделение конечной фазы из пересыщенного раст-
вора, позволяет описать кинетику их гидратации и выявить в
каждом конкретном случае лимитирующую стадию процесса.
Это особенно важно при изучении влияния добавок, гак как
с их помощью удается в широком интервале изменять ско-
рость гидратации цемента.
Практическая важность этих вопросов определяется тем,
что прочность бетона (при прочих равных условиях) возраста-
ет с увеличением степени гидратации цемента. Именно поэто-
му введение электролитов — сильных ускорителей гидратации
позволяет сократить в 2—3 раза (в зависимости от дозировки
и состава выбранной добавки) время до распалубки бетонных
и железобетонных изделий, а также достижения ими критиче-
ской прочности (последнее, в свою очередь, открывает пути
интенсификации тепловлажностной обработки путем исполь-
зования более жестких режимов прогрева изделий); умень-
шить продолжительность изотермического прогрева изделий
или при одинаковой длительности термообработки снизить
температуру их изотермического прогрева; сэкономить 5—8 %
цемента; ускорить набор бетоном прочности после его тепло-
влажностной обработки; не менее чем на 5 % снизить расход
тепло- и электроэнергии. В результате применение подобных
добавок обеспечивает повышение производительности заво-
дов сборного железобетона на 20—40 % и существенный тех-
нико-экономический эффект.
При введении этих добавок совместно с пластификаторами
и особенно с суперпластификаторами перечисленные техноло-
гические и строительно-технические показатели можно улуч-
шить, кроме того, появляются некоторые новые преимуще-
ства. Так, за счет сильного снижения водоцементногс отноше-
ния резко возрастает непроницаемость бетона, что при норма-
28
тивной толщине защитного слоя бетона над арматурой умень-
шает опасность ее коррозии под действием введенных электро-
литов. (Некоторые добавки, например хлориды, агрессивны
в отношении стали.)
Знание механизма действия добавок-электролитов на кине-
1ику гидратации цемента и твердения бетона открывает еще
одну важную возможность: с помощью таких добавок удается
смоделировав ситуацию, возникающую при затворении бетон-
ной смеси минерализованной или морской водой.
Актуальность этой проблемы объясняется тем, что в неко-
юрых районах СССР ощущается хроническая нехватка пресной
воды. Выходом из положения оказывается использование
засоленной воды, в том числе морской, при изготовлении бето-
нов, например в Прикаспни На эти случаи можно перенести
все важнейшие выводы, вытекающие из теории и практики
использования добавок-электролитов, а также их сочетаний
с добавками других классов.
1.5. УРОВНИ СТРУКТУРЫ И ЭНЕРГИЯ СВЯЗИ МЕЖДУ
СОСТАВЛЯЮЩИМИ ЦЕМЕНТНОГО КАМНЯ В БЕТОНЕ
В предыдущей главе основное внимание мы уделили лишь
процессу гидратации вяжущих как основе твердения бетонной
смеси и образования цементного камня. Рассмотрим теперь
условия формирования капиллярно-пористых тел с точки зре-
ния характера возникающих при этом связей и их прочности, а
также проследим за ролью масштабного фактора в синтезе
прочности цементного камня в бетоне.
Как известно, структура цементного камня представлена
твердой фазой и поровым пространством, заполненным жид-
костью или газом, причем важнейшие свойства бетона зависят
о г физических и физико-химических характеристик и каркаса,
и порового пространства. Следовательно, целесообразно такое
совместное рассмотрение капиллярно-пористого цементного
камня в бетоне, которое позволит одновременно учесть фор-
мирование как его твердой фазы, так и порового простран-
ства. Это предполагает общность подхода к ним, построенного
по единому достаточно строгому признаку. Крайне желательно,
чтобы одновременно с помощью выбранного признака учиты-
вались и дефекты структуры твердой фазы цементного камня,
or которых зависят физико-механические и деформативиые
свойства бетона. Наконец, важно, чтобы выбранная классифи-
кация по возможности позволяла рассматривать процессы,
протекающие при становлении структуры цементного камня,
и в кинетическом аспекте.
Наиболее логично в качестве основы для подобной система-
тизации выбрать линейные размеры капилляров, пор и эле-
29
ментов каркаса. Вместе с тем, если известно несколько клас-
сификаций бетонов, основанных на различиях в их поровой
структуре [51, 70, 115], то классификации твердой фазы це-
ментного камня, построенной по принципу дисперсности час-
тиц, нет. Поэтому в развитие представления об уровнях струк-
туры, предложенного для оценки коррозионной стойкости
бетона, мы рекомендуем следующую общую градацию капил-
ляров и структурного каркаса с учетом дефектов в последнем.
Надмолекулярный уровень дисперсности; D- 2 10® - 4
109 м-‘ (10~9 <1 <5 • 10'9м)*.
Несмотря на весьма узкий интервал изменения /, первый
уровень дисперсности твердой фазы очень важен, так как он
включает в себя размеры частиц, отвечающие устойчивым трех-
мерным зародышам. Этим и определяется низшая граница
надмолекулярного уровня: частицы меньшего размера не спо-
собны к самостоятельному существованию, т. е. вероятность
их распада выше, чем вероятность дальнейшего роста. Вместе
с тем частицы этого уровня должны обладать свойствами фа-
зы, т. е. иметь в ширину не менее трех элементарных ячеек.
Твердые частицы, относящиеся по дисперности к надмолеку-
лярному уровню, при различном фазовом и химическом сос-
таве объединяются общим признаком — чрезвычайно разви-
той поверхностью и, как следствие этого, отсутствием посто-
янного значения межфазовой энергии ог, которая зависит от
их размеров
су = о(1 - щ / /), (1.37)
где о — межфазовая энергия бесконечно большой частицы, т. е. частицы,
для которой значение межфаэовой энергии перестает зависеть от ее раз-
мера; а 1 — константа.
Для таких частиц не выполняется известное уравнение Том-
сона-Кельвина:
, 2Мо
RTpln С/С^
где г ' — критический радиус частицы; М — молекулярная масса; R —
газовая постоянная; Т — абсолютная температура; р — плрзность; С и
Соо - соответственно растворимость частиц радиусами г и бесконеч-
но большого.
Следовательно, верхняя граница надмолекулярного уровня
также имеет вполне определенный физический смысл: она со-
ответствует такой дисперности частиц, при которой о,, для них
"Дисперсность D, как известно, связана с характеристическим разме-
ром частицI зависимостью £> = 1 / /.
(1.38)
30
перестает зависеть оз их размера, т. е. о = о. и справедливо
уравнение (1.38).
Однако абсолютное значение I для верхнего предела дис-
персности, как и для нижнего, нельзя обозначить какой-то
одной цифрой*, оно зависит от кристаллохимических особен-
ностей и физических параметров образующихся фаз. Так, из-
вестно, что гидросиликаты кальция нередко растут только в
направлении цепей главных валентностей, поэтому их эквива-
лентный размер для надмолекулярного уровня соответству-
ет не максимальной длине, а ширине этих гидратов, состав-
ляющей в случае трех слоев 3 нм (толщина элементарной ячей-
ки равна ~ 1 нм).
Выделение надмолекулярного уровня в самостоятельный
при изучении структурообразования, на наш взгляд, необхо-
димо потрем основным причинам: во-первых, этот уровень
дисперсности соответствует самой начальной стадии формиро-
вания первичного каркаса будущей структуры цементного
камня, протекающей в объеме коагуляционной структуры
свежего цементного теста. При этом непрерывный структурный
каркас еще может не образоваться, однако уже имеются от-
дельные контакты между возникшими или уже растущими
частицами новой фазы. Во-вторых, в надмолекулярный уровень
дисперсности точно вписывается дисперсность ’’пор геля” (по
терминологии [60]), занимающих около 28 % объема твер-
дой фазы [60, 99]. Форма этих пор чаще всего щелевидная,
поэтому можно учитывать либо минимальное расстояние между
формирующими их стенками, либо средний эквивалентный
размер, который составляет примерно 1,5—4 нм.
При этом энергия связи с твердой поверхностью основного
количества воды, находящейся в порах геля, сопоставима с
энергией связи конституционной воды в высокогидратных
новообразованиях цементного камня (адсорбированный моно-
слой или не очень сильно отличающийся от него второй слой).
Даже если принять для усредненного диаметра пор геля h зна-
чение 3—4 нм, то и тогда вода в них находится под столь силь-
ным влиянием поля сил стенок, что ее средняя плотность,
электропроводность, вязкость, температура замерзания и неко-
торые другие показатели будут отличаться от таковых для сво-
бодной воды. Соответственно при этом не удается использо-
вать ни уравнения Кельвина (при замене в нем отношения
концентраций С/С^ давлениями пара р/р^ ), ни уравнения
Лапласа
Др=2о/г. (1.39)
*5то замечание справедливо также для верхних и нижних пределов
остальных уровней дисперсности.
31
В-третьих, надмолекулярному уровню соответствует ширина
дислокаций, которые, как и другие несовершенства структуры,
в сильной степени влияют на физико-механические свойства и
ползучесть бетона (точечные дефекты, например, вакансии или
дырки, имеющие размеры атомов или молекул, находятся
вне этого уровня). Благодаря введению градации надмолеку-
лярного уровня удается полнее учесть влияние добавок, осо-
бенно сильно проявляющееся именно в условиях становления
структуры цементного камня в бетоне.
Субмикроскопический уровень: D = 107 — 2- I08 м'1 (5 х
х10'9 < I < 10’7 м). Как видно, дисперсность твердой фазы,
относящейся ко второму уровню, отвечает частицам коллоид-
ных размеров (10-9 — 10" м), если не считать той ес части,
которая отнесена нами к надмолекулярному уровню.
Во второй уровень попадает основная масса гидратных ново-
образований, слагающих структуру цементного камня*, в том
числе и в зоне его контакта с заполнителями и арматурой.
Этой же дисперсностью обладают отдельные оставшиеся в це-
ментном камне нс полностью нрогидратированные зерна вя-
жущих.
Существенно, что и среднее статистическое расстояние меж-
ду дислокациями и некоторыми другими дефектами в твердой
фазе цементного камня также соответствует этому уровню
дисперности. Как известно [60, 99, 115, 116] , и размеры значи-
тельной части капилляров, причем тех, которые преимуществен-
но определяют газо- и водопроницаемость бетона, также лежат
в пределах 5 10~9 — 10~7 м**.
Важность этого уровня дисперсности для теории и практики
очевидна. Именно на этом уровне в полной мере проявляются
особенности коагуляционного, условно-коагуляционного и
кристаллизационного структурообразования, а также форми-
руется поровое пространство цементного камня. Частицы ука-
занной дисперсности обладают всеми основными хорошо извест-
ными свойствами коллоидных частиц: способностью к броунов-
скому движению, ближней и дальней коагуляции, полупрони-
цаемостью, приводящей к осмотическим явлениям [7, 115]
и т. д.
С позиций формирования структуры цементного камня
наиболее характерные различия между этим и предыдущим
уровнем заключаются в том, что на надмолекулярном уровне
идет, главным образом, возникновение зародышей новой фазы,
причем эти процессы протекают в кинетической области, а на
субмикроскопическом уровне в основнсм идет реет новой
фазы, причем с диффузионным контролем за процессом.
*С оговоркой, что длина волокнистых гидросиликатов кальция значи-
тельно превышает их толщину.
** Нередко их называют микропорами, не выделяя отдельно поры
геля.
Как уже говорилось, верхняя граница субмикроскопическо-
го уровня для твердых частиц имеет достаточно строгий фи-
зический смысл; напомним, что для нее уравнение Кельвина
неприемлемо, но уже по другой причине, чем та, которая ука-
зывалась при рассмотрении предыдущего уровня: в данном
случае растворимость С частиц больших размеров достигает
равновесного значения Стс , т. е. С/С«, = 1 и lgC/C«> = 0.
Точно также физически обоснован выбор предельного зна-
чения диаметра капилляров цементного камня, попадающих
в субмикроскопический уровень. Во-первых, при h > 10'7 м
и нормальном барометрическом давлении теряется способ-
ность к массовой капиллярной конденсации влаги, т. е. влага
может заполнять капилляры только при ее непосредственном
соприкосновении с капиллярно-пористым телом*. Во-вторых,
при /1, близком к 10~7м,механизм переноса газов через капил-
ляры меняется [51] (длина свободного пробега молекул газа
при атмосферном давлении составляет примерно 0,6 • 10-7 м).
Кроме того, при h > 10'7 м, как показали экспериментальные
исследования [51], значения поверхностного натяжения воды о
и ее вязкости в гидрофильных капиллярах с диаметром h
> 10'7 м соответствуют табличным данным для свободной
воды. В отличие от этого, при меньшем значении h начинает
сказываться силовое поле стенок капилляров и указанные
параметры воды могут измениться.
Добавки в бетон оказывают влияние и на субмикроскопи-
ческом уровне дисперсности частиц, хотя очевидно, что их дей-
ствие началось раньше.
Микроскопический уровень: D= 104 — 107 м-1 (10-7 <1 <
С 10~4 м). В отличие от двух предыдущих уровней установле-
ние верхнего предела размеров частиц твердой фазы для этого
уровня носит весьма условный характер, хотя и оправдано
практическими соображениями: к нему отнесен весь спектр
частиц вяжущих, включая самые крупные фракции, и некото-
рые новообразования: гидроксид кальция, составляющий око-
ло 15 % общей массы твердой фазы цементного камня, гипс,
основные соли, например гидроксихлориды кальция, карбонат
кальция и некоторые другие соединения. Кроме того, частица-
ми этих размеров характеризуется ряд продуктов, вызываю-
щих физическую коррозию бетона и кристаллизующихся в его
порах, а также выделяющихся на его поверхности в виде высо-
лов при введении отдельных добавок. По своим размерам
к этому уровню относятся и дефекты структуры, возникающие
в бетоне в виде микротрещин при термическом напряжении,
усадке, под давлением продуктов коррозии арматуры и це-
ментного камня, при работе конструкции под статической и
* Как известно, обычно капилляры имеют переменный по длине диа-
метр, поэтому речь идет о его некоторой усредненной величине.
2- .82
33
динамической нагрузкой и т. д. При этом нужно учитывать
концентрацию напряжений в микрообъемах бетона вблиш
заполнителей.
Наконец, в третий уровень вписываются диаметры макро-
капилляров, для которых, в отличие от твердых частиц, мак-
симально возможные размеры можно установить достаточно
строго; поры с таким усредненным диаметром (/ < 1(Г4 м)
принадлежат к категории капилляров* при высоте бетонных
изделий порядка I м.
Поровое пространство цементного камня на микроскопи-
ческом уровне** заполнено не только жидкой, но и газовой
фазой — защемленным воздухом, а при введении газообра-
эуютцих добавок — и другими газами. Таким образом, поро-
вое пространство обычно представлено помимо пор геля и
чередующихся с ними микрокапилляров также пересекаю-
щими их воздушными полостями. В первом приближении
можно принять, что в цементном камне субмикро- и микро-
капилляры (в указанном выше смысле этого слова) сообща-
ются друг с другом как непосредственно, так и посредством
’’пор геля”, т. е. капилляров надмолекулярного размера (’’изо-
лированные” капилляры), и прерываются условно-замкну-
тыми порами, в том числе и заполненными газовой фазой.
При этом доля пересекающихся друг с другом капилляров
растет, а доля условно-замкнутых пор уменьшается с увели-
чением В/Ц.
Влияние добавок в бетон сказывается на микроскопическом
уровне преимущественно не непосредственно, а косвенно, так
как добавки влияют на структурно-механические свойства
цементного камня на более высоких уровнях дисперсности.
Кроме того, добавки могут изменить в бетоне соотношение
между пересекающими друг друга и ’’условно-изолированны-
ми” капиллярами, сообщающимися между собой благодаря
наличию пор геля.
Макроскопический уровень: D < 104 м~‘ (/ > 10 м)
характерен для бетона с мелким и крупным заполнителем в
его составе и для изделий из него. Ему соответствуют макро-
неоднородности и макродефекты, проявляющиеся, в частно-
сти, в существовании масштабного фактора при механических
испытаниях бетона.
К макроскопическому уровню относятся и размеры круп-
ных воздушных пузырьков, каверн и раковин в бетоне, обра-
*В капиллярных порах поверхность жидкости принимает форму,
обусловленную силами поверхностного натяжения и почти не искажен-
ную силами тяжести.
** Естественно, что речь идет о среднем эффективном диаметре пор,
так как из рассмотрения исключается адсорбционно-связанная вода
монослоя (частично, полислоев), не участвующая в процессе фильтрации.
зующихся например, при некачественном уплотнении бетонной
смеси. Для них, естественно, нс пригодно уравнение Лапласа.
Их число и диаметр можно значительно уменьшить с помощью
добавок, в частности пластифицирующих.
Таким образом, предлагаемая классификация позволяет с
единых позиций рассмотреть структуру цементного камня и
текстуру бетона с учетом их порового пространства.
Проанализируем теперь с учетом уровней дисперности обра-
зование цементного камня в бетоне, в том числе и с добав-
ками. На первом этапе, начиная с первых минут после затворе-
ния цемента водой (когда процессы гидратационного твердения
еще только начинаются), для цементного теста, растворной и
бетонной смеси характерна преимущественно коагуляционная
структура с обязательными для нее прослойками дисперсион-
ной среды, причем равновесное значение толщины этих про-
слоек, как и продолжительность сохранения подобной струк-
туры, в большой мере зависит от применяемых добавок (по-
верхностно-активные вещества обычно удлиняют период су-
ществования подобных структур, электролиты — сокращают
его).
В дальнейшем, по мере развития процессов гидратации,
на фоне коагуляционной структуры возникают, а затем начи-
нают доминировать условно-коагуляционные и кристаллиза-
ционные* структуры, причем их относительный вклад в общее
структурообразование зависит, помимо вида цемента и соста-
ва бетона, также от химической природы и концентрации доба-
вок. По-видимому, при прочих равных условиях для бетонов
на мономинеральных вяжущих (например, гипсовых) более
существенную роль могут играть кристаллизационные, а на
полиминеральных цементах — условно-коагуляционные струк-
туры. Однако ни при каких условиях механические и дефор-
мационные свойства бетонов зрелого возраста не могут опре-
деляться законами коагуляционного структурообразования.
Анализ образующихся структур с позиций уровней дисперс-
ности показывает, что условно-коагуляционная и кристаллн*
зационная структуры формируются вначале на надмолекуляр-
ном (образование зародышей новой фазы), а затем на суб-
микроскопическом уровне на стадии роста кристаллов и по-
явления первичного каркаса. Если же говорить о контактных
поверхностях, — а именно они и определяют характер и проч-
ность связей в цементном камне и бетоне, — то они занимают
лишь часть площади новообразований, а условно-коагуляцион-
ные контакты в первом приближении можно рассматривать
как точечные.
Существенно также, что условно-коагуляционные и кристал-
лизационные структуры упрочняются в процессе гидратацион-
*Или,в более общем виде, кристаллизационно-конденсационные.
34
35
него твердения часто путем увеличения площади контакта
между частицами вследствие выделения из пересыщенных
растворов в этой зоне двухмерных зародышей. Подобное на-
ращивание ”шва”, приводящее к упрочнению структуры, про-
исходит потому, что участки, непосредственно примыкающие к
контактным поверхностям, в силу их геометрических особен-
ностей и по некоторым другим причинам (см. выше) становят-
ся энергетически наиболее выгодными для предпочтительного
роста здесь новой фазы.
Таким образом, если твердая фаза цементного камня в бе-
тоне по своей дисперсности относится преимущественно к над-
молекулярному и субмикроскопическому уровням, а участвую-
щие в ней исходные фазы и наиболее крупные гидратные ново-
образования даже к микроскопическому уровню, то основные
реакции и процессы, приводящие к формированию структуры и
обусловливающие ее прочность и деформативность, протекают
на молекулярном уровне, т. е. лежат вне перечисленных уровней
дисперсности.
Из этого обстоятельства вытекают два важных вывода:
во-первых, изучение механизма действия добавок нужно начи-
нать не с уровней структур твердения, а с молекулярного уров-
ня (т. е. уровня, отвечающего процессам и реакциям между мо-
лекулами и ионами). Во-вторых, совершенно очевидно, что
невозможно ’’перескочить” от реакций и процессов, протекаю-
щих на молекулярном уровне и приводящих к образованию
твердого капиллярно-пористого тела, непосредственно к проч-
ности цементного камня и тем более бетона, измеряемой на
образцах макроскопических размеров, минуя при этом проме-
жуточные уровни дисперсности, т. е. не учитывая всевозможные
дефекты структуры бетона.
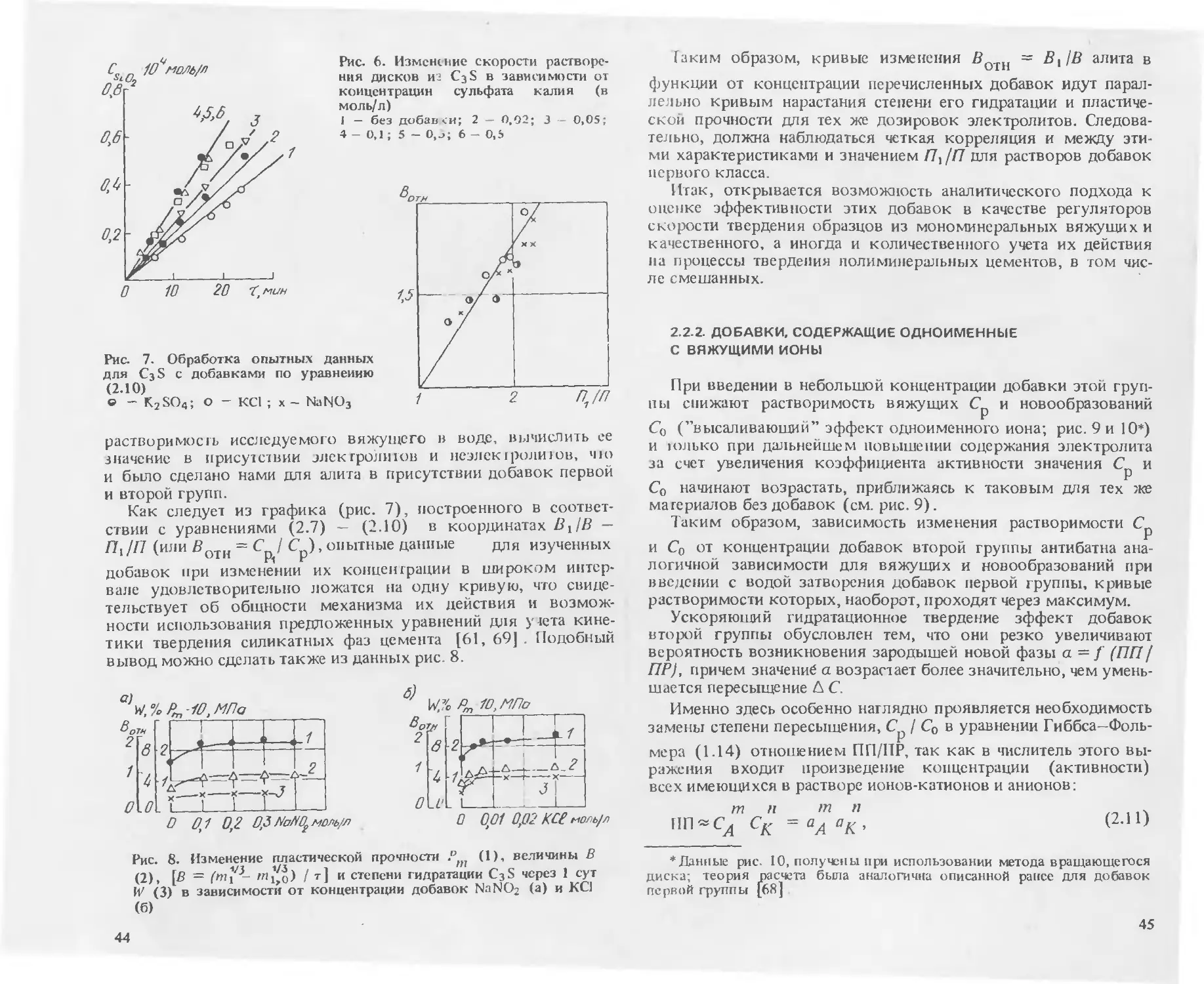
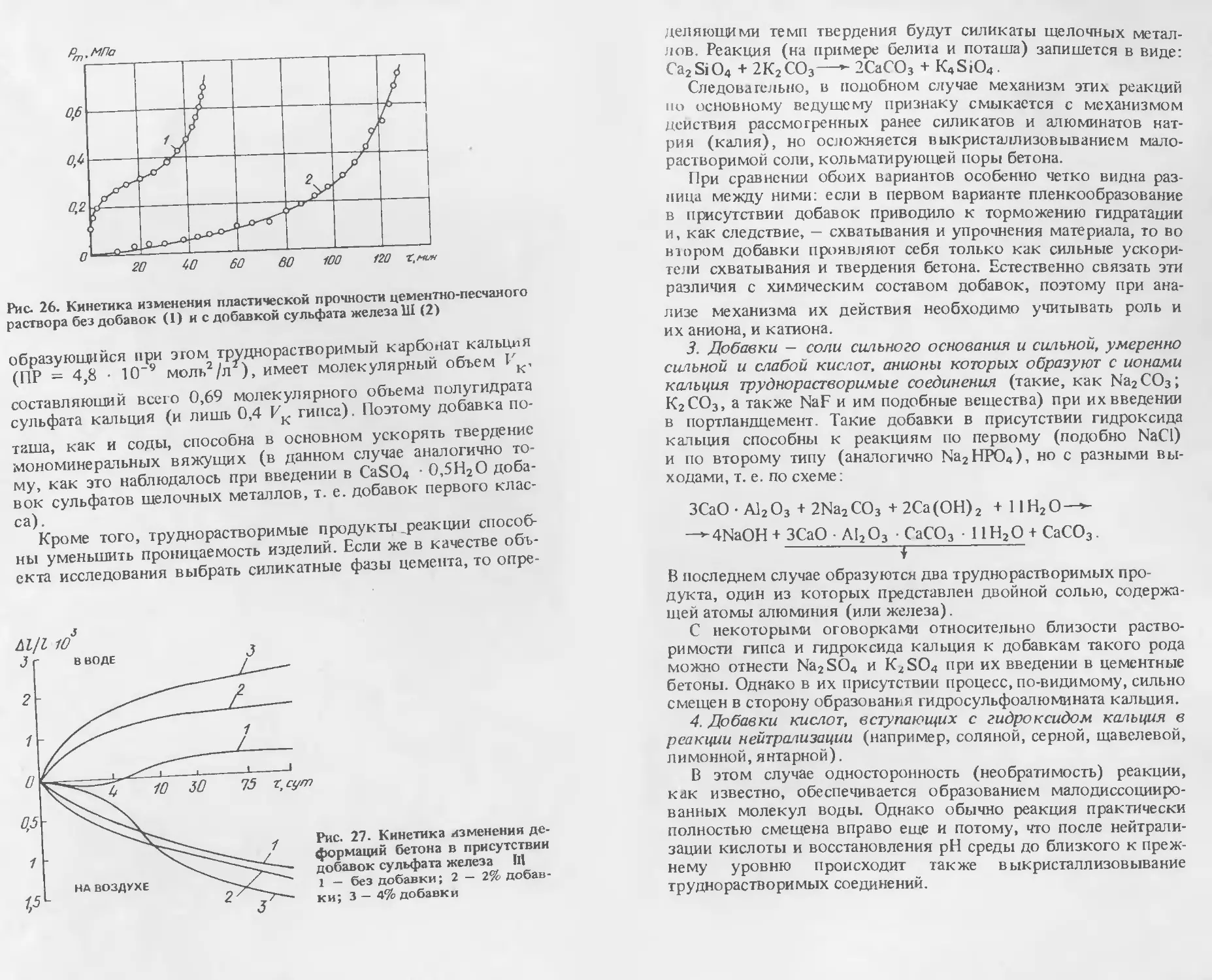
Глава 2. КЛАССИФИКАЦИЯ ДОБАВОК В БЕТОН
И МЕХАНИЗМ ИХ ДЕЙСТВИЯ
2.1. ОСНОВНЫЕ ПРИНЦИПЫ ПОСТРОЕНИЯ КЛАССИФИКАЦИИ
ДОБАВОК
В основу систематизации кладется разделение индивидуаль-
ных добавок на классы по механизму действия на процессы
твердения минеральных вяжущих веществ в бетонах с даль-
нейшей дифференциацией по группам. Далее все добавки в
зависимости от состава подразделяются на индивидуальные и
комплексные. Комплексные добавки рассматриваются как
сочетания индивидуальных. Таким образом, классификация
комплексных добавок не носит самостоятельного характера,
а является производной от основной.
При использовании подобного принципа систематизации
добавок в бетоны возникают опасения, не придется ли при
этом в какой-то мере поступиться сведениями об их техноло-
гическом эффекте. Чтобы исключить подобную возможность,
мы одновременно будем указывать, как влияют добавки того
или иного класса не только на процессы твердения, но и на дру-
гие важные строительно-технические и структурно- и физико-
механические свойства бетона. Это не только снимет основные
возражения, которые могли бы быть выдвинуты против пред-
лагаемой систематизации добавок, но, наоборот, сделает более
очевидными ее преимущество перед другими (например, осно-
ванными на технологических отличиях в действии добавок или
на различии в их рецептуре) вследствие большей общности и
универсальности подхода к задаче и ее научной обоснованности.
Следует оговориться, то если для мономинеральных вяжу-
щих веществ классификация добавок по механизму их действия
может быть однозначной, то для полиминеральных такая воз-
можность часто затруднительна, особенно если речь идет о
добавках электролитов Это объясняется тем, что алюминий-
и кремнийсодержащие составляющие портландцементного клин-
кера весьма резко отличаются по своей способности к взаимо-
действию с добавками электролитов: С3А и C4AF — склонны
к реакциям присоединения с образованием соответствующих
двойных солей-гидратов*; C3S и (3-С2 S — не склонны к реакци-
ям присоединения с этими добавками, вводимыми в обыч-
ных для них дозировках** (аналогичные в целом соображения
* Гидро сульфо-, гидро хлор-, гидронитроалю мииатов кальция и др.
**Тем самым мы исключаем пока из рассмотрения реакции между
добавками и продуктами гидратации силикатных фаз цемента с образо-
ванием оксисолей типа гидрокси хлоридов кальция.
37
можно высказать и относительно способности к образованию
двойных солей гидратов при взаимодействии с добавками
алюминатных и силикатных фаз шлаков).
Поэтому одна и та же добавка по ее влиянию на разные
фазы цемента может быть отнесена к различным классам. Од-
нако такое же положение наблюдается и при использовании
других принципов построения систематизации добавок, причем
в данном случае оно не только не затрудняет их изучение, но,
напротив, облегчает задачу, шире раскрывая многообразие
действия добавок на процессы твердения и структурно-меха-
нические свойства бетонов. Более того, учет влияния добавки
на разные фазы цемента позволяет определить, какой из ас-
пектов механизма действия этой добавки нревалируе> на раз-
ных стадиях гидратации вяжущих и как влияет состав послед-
них, температура, водоцементное отношение и другие гехноло
гические факторы на эффективность добавки, т. е. приблизить-
ся к сознательному управлению процессами твердения бетонов
с помощью добавок, количественному учету их роли в структу-
рообразовании и подбору новых эффективных индивидуальных
добавок и их композиций.
Все индивидуальные добавки исходя из механизма их дейст-
вия на процессы гидратационного твердения вяжущих в бетонах
можно разделить на четыре класса: добавки, изменяющие раст-
воримость минеральных вяжущих материалов и не вступающие
с ними в химическую реакцию; добавки, реагирующие с вяжу-
щими материалами с образованием трудно растворимых или ма-
ло диссоциированных соединений; добавки — готовые центры
кристаллизации (’’затравки”), добавки поверхностно-активных
веществ (ПАВ), адсорбирующихся на зернах вяжущих и гидрат-
ных новообразованиях*.
2.2. ДОБАВКИ ПЕРВОГО КЛАССА - ЭЛЕКТРОЛИТЫ,
ИЗМЕНЯЮЩИЕ РАСТВОРИМОСТЬ ВЯЖУЩИХ ВЕЩЕСТВ
Хотелось бы сразу же предостеречь от довольно распрост-
раненного мнения, будто электролиты проявляют себя, главным
образом, как добавки второго класса, вследствие того, что
почти все они образуют с С3А и C4AF двойные соли-гидраты и
в то же время их влияние на химически индифферентные в этом
отношении силикатные фазы цемента, обусловленное лишь
изменением метастабильной растворимости последних и их
новообразований, обычно имеет второстепенное значение и мо-
жет доминировать лишь для крайне ограниченного числа доба-
вок.
♦В связи с многообразием механизма действия органических ПАВ
на вяжущие вещества и продукты их гидратации следует специально
обосновать выбор принципов их систематизации. Это будет сделано
нами позже.
38
Рис. 4. Изменение растворимо-
ent гипса и мета ста Сильно го по-
лучидрата сульфата кальцин и из-
менение коэффициента скоро-
сти его твердения т / т в
К Кп
зависимости от концентрации по-
варенной соли
На самом деле к добавкам, механизм действия которых в
большой мере определяется их воздействием на C3S и (3-C2S це-
мента, принадлежат многие сильные и слабые электролиты, в
юм числе соли, гидролизующиеся с повышением pH среды,
щелочи, а также неэлектролиты. Таким образом, хотя в цементе
эффект действия добавок первого класса часто маскируется
тем, что те же вещества в отношении алюминийсодержащих
фаз цемента выступают как добавки второго класса, добавки
первого класса играют очень важную роль в интенсификации
процессов гидратационного твердения моно- и полиминеральных
вяжущих, причем их эффект должен считаться универсальным.
Поскольку взаимодействие алюминийсодержащих фаз цемента
даже с весьма активными добавками растянуто во времени,
частично все добавки электролитов более или менее продол-
жительно сохраняются в жидкой фазе цементного теста и изме-
няют растворимость алита и белита, если только они не вступают
в химические реакции с продуктами их гидратации.
Кроме того, некоторые добавки (электролиты и неэлектро-
лит) практически не взаимодействуют ни с алюминатными и
алюмоферригными, ни с силикатными фазами цемента и поэто-
му влияют на его твердение только как добавки первого класса.
В основе действия электролитов—добавок первого класса
лежит повышение или понижение ими растворимости исходного
вяжущего и конечных продуктов его гидратации вследствие
изменения ионной силы раствора (рис. 4).
Отметим, что в таких растворах сложным образом проявля-
ется взаимное электростатическое притяжение и отталкивание
гидратированных (сольватированных) ионов, создающих ион-
ную атмосферу, причем энергия их взаимодействия, а отсюда
и свойства растворов зависят от концентрации электролита и
величины заряда входящих в его состав ионов. Для термо ди-
намического учета электростатических взаимодействий исполь-
зуют представления об активности а* и коэффициенте актив-
ности /электролита, которые выражаются уравнением:
39
a~—fC (2.1)
Для бесконечно разбавленных растворов, как и для мало-
растворимых веществ, f = 1 — const и активность равна кон-
центрации электролита С. С увеличением концентрации зна-
чение / сначала убывает, а затем воэрасгает. Следовательно, с
помощью коэффициента активности удается вычислить ра-
боту против сил, отклоняющих раствор от идеального состоя-
ния.
Итак, зная концентрацию и коэффициент активности электро-
лита, можно вычислить его активность и определить свойства
раствора электролита. При этом весьма важно найти универ-
сальные закономерности, не зависящие от природы введенного
вещества. Такой путь и открывает использование данных об
ионной силе раствора I, под которой понимают величину, равную
полусумме произведений концентрации каждого иона С- на
квадрат числа его зарядов (валентности) Z-, взятых для всех
ионов, содержащихся в растворе, т. е.
1
1 = (2.2)
Было доказано, что в разбавленных растворах с одинако-
вой ионной силой коэффициенты активности всех диссоцииру-
ющих на ионы веществ не зависят от природы и концентрации
данного вещества, но зависят от числа и валентности его ионов.
В работе [81] на примере твердения гипсовых вяжущих
предложена методика определения коэффициента активности и
растворимости новообразований в растворах, пересыщенных
собственными ионами и ионами посторонних электролитов,
учитывающая влияние ионной силы раствора. Хорошее совпа-
дение результатов опытов с расчетными данными позволяет
считать, что при оценке влияния добавок первого класса необ-
ходимо учитывать изменение ими ионной силы раствора. При
этом все добавки целесообразно разделить на две группы:
не содержащие и содержащие одноименные с вяжущими ионы,
а для проведения количественных расчетов отдельно рассмот-
реть добавки, действующие на быстротверцеющие и медленно-
твердеющие вяжущие (вяжущие первого и второго типа, см.
гл.1).
2.2.1. Добавки, не содержащие одноименных
с вяжущим ионов
Эффект от введения таких добавок удается оценить не толь-
ко качественно, но в ряде случаев и количественно.
Для вяжущих первого типа, например гипсовых, гидратаци-
опное твердение которых в течение достаточно длительного
срока в долях от общей продолжительности этого процесса
лимитирует стадия кристаллизации как самая медленная, в
качестве исходного можно использовать уравнение (1.19).
Д1Я момента практически полного завершения процесса гид-
ратации (ут / v0 = 0,99) это уравнение запишется в виде
тк = 1,45 / УТх7. (2.3)
Зависимость (2.3) удобна для расчетов: значение ее левой
части (т — время до конца кристаллизации гипса) при от-
сутствии и наличии добавок можно определять эксперимен-
тально, например, из данных по кинетике тепловыделения,
упрочнения или скорости прохождения волн ультразвука, а
величину, пропорциональную кристаллизационному парамет-
ру а\3, входящему в правую ее часть, вычислить из опытов
по измерению концентрации сульфата кальция в разные мо-
менты времени. Анализ уравнений (1.14) и (1.19) показыва-
ет, что вероятность возникновения зародышей новой фазы
в единице объема за единицу времени составляет
а ~ [1g2 ПП/ПР]'1 , (2.4)
где ПП — произведение концентрации ионов, обеспечиваемое раство-
ряющимся вяжущим; ПР - произведение растворимости (активности)
гидратных новообразований.
Как видно из рис. 2, добавки первого класса в одном и
юм же направлении и в примерно одинаковой мере изменяют
растворимость и метастабильной исходной, и устойчивой ко-
нечной фаз. Следовательно, исходное значение а и тем более
al/4. входящее в формулу (1.19), в их присутствии сохранится
на почти постоянном уровне, т. е.
1'4 !/4
а 1 ~ а доб. - const- <2-5)
В отличие от этого линейная скорость роста кристаллов, про-
порциональная пересыщению ДС = С - Со> существенно зави-
р
сит от концентрации добавок, о чем также свидетельствуют
кривые рис. 4. Тогда уравнение (2.3) с учетом (1.16) и (2.5)
можно записать в следующем виде:
41
40
Рис. 5. Обработка по уравнению (2.6) опытных данных по кинетике
твердения полугидрата сульфата кальция с добавками
I - С2Н5ОН; 2 - NH4Cf и NH4CNS; 3 - NjCI; 4 - KBr ; 5 - KCI ;
6 - K.NO3
закономерности кииезики зидратации ализа и белит, в юм
числе при введении добавок первого класса.
Воспользуемся этим уравнением при дополнительном ус-
ловии (1.32), т. е. для ранних стадий взаимодействия C3S и
C2S с водой и с растворами добавок первого класса. Это оз-
начает, что в уравнении (1.27) можно пренебречь вторым чле-
ном в его левой части, т. е. записать его приближенно как
1/3 1/3 2/3
Ш1 — ш1<0 - -kiD (Ci — С2) т const т . (2.7)
Поскольку для силикатных
висимость (2.7) преобразуется:
1/3 1/3
('"1 - wi,o ) / “ А,
2/3
Но. как известно, ktD С^П
фаз цемента С, С2, то за-
, 2/3
О Су. (2.8)
(2-9)
где 11 — поток вещества, который можно измерить проводя опыты,
например со спрессованными из C3S дисками, вращая их с заданной
скоростью н условиях управляемой и регулируемой конвекции [48,
г,ч!
тк =1,45/ const 1 I X3/4 = const' 1 /AC3/4 (2.6)
На рис. 5 кривые построены по опытным данным в соот-
ветствии с предлагаемым нами уравнением. Как видно, выра-
жение (2.6) пригодно для количественного описания и ускоряю-
щего, и замедляющего эффекта действия добавок: сильных и
слабых электролитов (в том числе понижающих pH среды)
в широком интервале изменения их концентрации (от 0,1 до
5 моль/л), соответственно изменяющих процесс твердения вя-
жущих примерно от 5-кратного ускорения до 4-крагпого за-
медления.
Обращает на себя внимание и тот факт, что уравнение (2.6)
правильно передает и замедляющее твердение действие неэлект-
ролитов, в частности этилового спирта, понижающего раство-
римость и метастабильного полугидрата сульфата кальция,
и стабильного гипса. Таким образом, уравнения (1.19) и (2.6)
позволяют описать кинетику гидратации и твердения вяжущих
первого типа независимо от того, по каким причинам измени-
лось пересыщение АС, а также возросло оно или понизилось.
Это обстоятельство представляется весьма существенным.
Для вяжущих второго типа, кинетика твердения которых по-
давляюще большую часть времени с момента затворения опре-
деляется стадией растворения вяжущих как самой ме/шенпой,
удобнее воспользоваться уравнением (1.27), сражающим
Обозначим выражение (/п, — «iIj0 ) / т Для C3S с
добавкой через Hi, для C3S без добавки - через И, а их отно-
шение — через #от11- Соответственно потоки вещества при
растворении дисков из C3S в растворе добавки и в воде обо-
значим через ГЦ и П. Тогда, если выведенные нами ранее
уравнения верны, должно выполняться условие: Вотн ~ /7 т //7
(2.10) для любых добавок первого класса.
Величины, входящие в уравнение (2.10), определяли экс-
периментально: В и Bi — обычным методом в концентрирован-
ных пастах (В/Ц = 0,32); П и /71 в опытах с дисками, вращаю-
щимися в воде и растворах добавок [69] .
На рис. 6 представлены кривые кинетики изменения кон-
центрации силикатных ионов (в пересчете на SiO2), получен-
ные при вращении дисков с постоянной скоростью в раство-
рах добавок при комнатной температуре. Если принять, что
коэффициент молекулярной диффузии растворенного алита
1) во всех исследуемых средах практически неизменен, то,
зная угловой коэффициент кривых, можно вычислить величи-
ну потока ГЦ , а имея значение П для алита в чистой воде,
1Ц/ГЦ а значит и отношение BJB. Решая эту же задачу отно-
сительно мета стабильной растворимости вяжущего С в при-
р
cvictbuh добавок С можно определить ее изменение как в
сюропу увеличения, так и уменьшения. Это позволяет, зная
42
43
Рис. 6. Изменение скорости растворе-
ния дисков из C3S в зависимости от
концентрации сульфата калия (в
моль/л)
I — без добавеи; 2 — 0.02; 3 0,05;
4 - 0,1 , 5 - 0,а; 6 - 0,5
Рис.
Для
(2.10)
о - K2SO4; О - КС1 ; X - NaNO3
данных
7. Обработка опытных
C3S с добавками по уравнению
растворимость исследуемого вяжущего в воде, вычислить ее
значение в присутствии элекгролшов и неэлекцтолитов, чю
и было сделано нами для алита в присутствии добавок первой
и второй групп.
Как следует из графика (рис. 7), построенного в соответ-
ствии с уравнениями (2.7) — (2.10) в координатах BJB —
njn (или fiOTH = Ср / Ср), опытные данные для изученных
добавок при изменении их концентрации в широком интер-
вале удовлетворительно ложатся на одну кривую, что свиде-
тельствует об общности механизма их действия и возмож-
ности использования предложенных уравнений для уюта кине-
тики твердения силикатных фаз цемента [61, 69] . Подобный
вывод можно сделать также из данных рис. 8.
Рис. 8. Изменение пластической прочности Р (1), величины В
(2), [5 = / т] и степени гидратации C3S через 1 сут
!У (3) в зависимости от концентрации добавок NaNO2 (а) и КС!
(б)
Таким образом, кривые изменения Яотн = BJB алита в
функции от концентрации перечисленных добавок идут парал-
лельно кривым нарастания степени его гидратации и пластиче-
ской прочности для тех же дозировок электролитов. Следова-
тельно, должна наблюдаться четкая корреляция и между эти-
ми характеристиками и значением 77) /77 для растворов добавок
первого класса.
Итак, открывается возможность аналитического подхода к
оценке эффективности этих добавок в качестве регуляторов
скорости твердения образцов из мономинеральных вяжущих и
качественного, а иногда и количественного учета их действия
на процессы твердения лолиминеральных цементов, в том чис-
ле смешанных.
2.2.2. ДОБАВКИ, СОДЕРЖАЩИЕ ОДНОИМЕННЫЕ
С ВЯЖУЩИМИ ИОНЫ
При введении в небольшой концентрации добавки этой груп-
пы снижают растворимость вяжущих Ср и новообразований
Со (’’высаливающии” эффект одноименного иона; рис. 9 и 10*)
и только при дальнейшем повышении содержания электролита
за счет увеличения коэффициента активности значения Ср и
Со начинают возрастать, приближаясь к таковым для тех же
материалов без добавок (см. рис. 9).
Таким образом, зависимость изменения растворимости Ср
и Со от концентрации добавок второй группы антибатна ана-
логичной зависимости для вяжущих и новообразований при
введении с водой затворения добавок первой группы, кривые
растворимости которых, наоборот, проходят через максимум.
Ускоряющий гидратационное твердение эффект добавок
второй группы обусловлен тем, что они резко увеличивают
вероятность возникновения зародышей новой фазы a— f (ПП /
ПР), причем значение а возрастает более значительно, чем умень-
шается пересыщение Д С.
Именно здесь особенно наглядно проявляется необходимость
замены степени пересыщения, Ср / Со в уравнении Гиббса—Фоль-
мера (1.14) отношением ПП/ПР, так как в числитель этого вы-
ражения входит произведение концентрации (активности)
всех имеющихся в растворе ионов-катионов и анионов:
т н т и
т^СА Ск =аАак,
(2.Н)
* Данные рис. 10, получены при использовании метода вращающегося
диска; теория расчета была аналогична описанной рапсе для добавок
первой группы [68]
45
44
Рис. 9. Изменение растворимости
метастабильного полугидрата суль-
фата кальция, стабильного гипса и
коэффициента скорости твердения
тк I 7к в зависимости от концент-
рации сульфата натрия
О>
0,05 0,1 Сое "0г ,г-юль/л
б)
J/Jo
1»
оу-
0,05 0,091aS.О^моль/л
--Г-—- Т----1-----(—
в том числе и ионов, поставляемых добавкой, а в знаменатель —
произведение растворимости новообразований, не зависящее
от концентрации добавки, поскольку ПР = const. Очевидно,
введение добавок второй группы должно сильнее интенсифици-
ровать процессы твердения вяжущих первого типа, что и под-
твердилось экспериментально. Однако и для силикатных фаз
цемента (вяжущие второго типа) добавки, содержащие одно-
именные с ними ионы, например хлорид, нитрат и нитрит каль-
ция, являются тоже хорошими ускорителями твердения. Это
можно обьяспить двумя причинами: во-первых, клинкерные
минералы, кинетика гидратации которых в значительной мерс
определяется стадией растворения, тем не менее весьма ’’чув-
ствительны” к ускорению акта возникневения зародышей но-
вой фазы, что следует учитывать при интенсификации про-
цессов твердения цементных бетонов. Во-вторых, при введе-
нии подобных добавок сверх определенного количества воз-
можна их реакция с гидроксидом кальция с образованием со-
ответствующих двойных солей, благодаря чему п вышаетсч
растворимость Са(ОН)2, C3S и $-С2 S [85, 86, 88] .
К числу добавок второй группы принадлежит и шкая обя-
зательная составляющая цемента, как гипс. Однако его влия-
ние на кинетику гидрашции силикатных фаз невелико, так
как, во-первых, его предельная концентрация в жидкой фазе
ниже 0,2 % (в связи с присутствием одноименных с ним ионов
кальция) и, во-вторых, после расходования гипса на образо-
вание гидросульфоалюмината кальция его содержание в норо-
вой жидкости становится еще в 2 раза меньше. Практически
важно, что разные добавки второй группы при их введении в
концентрации, обеспечивающей одинаковую ионную силу раст-
вора, оказываются практически равноценными ускорителями
гидратации и твердения не только индивидуальных силикатных
фаз (табл. 3), но и клинкеров, и цементов
Рис. 10. Изменение относитель-
ного значении растворимости
метастабильного C3S в зависи-
мости от концентрации хло-
рида (а) или гипса С• 10 (б)
Таблица 3. Степень гидратации алита (в % по массе сухого вещества) н присутствии добавок
Добавка Ионная сила Время, сут
1 | 3 1 ’ 1 28
8,5 12.9 14.1 16,1
Гипс* — 9.8 14,1 15,7 17,3
ИНК 3 15.9 18,7 20 21,1
Call 2 3 16 18,6 20 21.2
*5 % но массе алита
В двух последних случаях необходимо принимать во внима-
ние ’’действующую” концентрацию добавки (т. е. ту ее часть,
которая к данному моменту времени не прореагировала с алю-
минийсодержащими фазами портландцементного клинкера).
Таким образом, удается назначать дозировки известных доба-
вок, предвидеть эффективность некоторых новых и моделиро-
вать их влияние на процессы схватывания и твердения бетон-
нои смеси. Подобный же эффект характерен и для действия
добавок второй группы на быстротвердеющие вяжущие: вве-
денные в эквинормальной концентрации, они в одинаковой
мере изменяли скорость твердения разных партий гипсобетона
независимо от его дисперсности и нормальной водопотребпости.
Кинетику твердения гипсовых вяжущих в присутствии добавок
второй группы также удалось описать с помощью уравнения,
вытекающего из зависимости (1.19).
Кроме отличии, существует и много общего в механизме
действия добавок первой и второй групп на кинетику гидрата-
ции вяжущих и твердения бетонной смеси в их присутствии,
что и оправдывает их объединение в один класс. Прежде всего,
добавки обеих групп воздействуют на вяжущие на молекуляр-
ном уровне, т. е. влияют либо на процесс возникновения заро-
/тышей новой фазы, либо на скорость роста кристаллов, нахо-
дясь в растворе в виде ионов или молекул. Таким образом,
хотя в их присутствии и может изменяться относительная роль
процессов, протекающих на надмолекулярном или субмикро-
46
47
скопическом уровнях, а средние размеры частиц цементного
камня, как и распределение нор по размерам за счет введения
добавок, могут сильно сместиться в область более высокой
дисперсности (известно, что проницаемость бетона при введе-
нии добавок нередко уменьшается в 10 раз), сами добавки
непосредственного вклада в структуру цементного камня обыч-
но не вносят. Следовательно, исключается и опасность каких-
либо побочных эффектов, связанных с появлением в бетоне
новых фаз.
Кроме того, изменяя ионную силу раствора, добавки первого
класса (первой или второй групп) должны обладать и дейст-
вительно характеризуются универсальностью действия*. Для
вяжущих первого типа ускоряющий и замедляющий твердение
эффект от введения добавок первой и второй групп удалось
описать одним уравнением, учитывающим и образование заро-
дышей новой фазы (через параметр, включающий отношение
ПП/ПР),и рост кристаллов (через значение А С= Ср - Со) [108]
Это уравнение в безразмерном билогарифмическом виде
может быть представлено как отношение
ig тк/ тк0 = К!Ко > <2-12)
где ть / ту - уже инцестный нам коэффициент ускорения или замедле-
к к0
ния твердения (определяемый по времени до конца кристаллизации вя-
жущего) :
К =Vlg (ПП/ПР), Ьс = Vlg (САСК / ПР) (Ср - Со) - (2.13)
для вяжущего в Присутствии добавок, Kq — то же, для вяжущею при
отсутствии добавок.
На рис. 11 показано, что экспериментальные данные по до-
бавкам — неэлектролитам (этиловый спирт) и электролитам:
слабым (NH40H) и сильным - солям натрия и аммония, в том
числе содержащим одноименные с гипсом сульфаг-ионы, -
ложатся на одну кривую, а по добавкам первой и второй групп—
солям калия — на другую. Очевидно, наличие двух кривых
можно объяснить тем, что, как было доказано, ионы натрия и
аммония в воде окружены гидратными оболочками, т. е. имеют
положительную гидратацию, тогда как ион калия имеет отри-
цательную гидратацию и поэтому иную подвижность.
*Под термином ’’универсальность” в данном случае понимается спо-
собность добавок в одинаковое число раз изменять скорость гидратацион-
ного твердения вяжущих различного помола, чистоты, времени магазн-
нирования, а также бетонов на них разного состава, затворенных неоди-
наковым количеством воды и на различных заполнителях — при условии
приведения концентрации добавки не к массе вяжущего, а к массе воды
затворения.
Рис. II. Изменение логариф-
ма коэффициента скорости
твердения полугидрата суль-
фата кальция т / т в
К Кп
зависимости от отношения
А/А'о в присутствии разных
добавок
J
К
2
1,5
1
О,В
0,6
0,2
К* Но*
o-NHCl
х -HoBr
о -NoCi
О-KBr
о-СгН50Н
ч-NH^OH
^-No^
• -KJ
------1--1--1 1—1. J-J-1__L_l III I
0,3 O/tOfiOfi Ofi 1 1,2 1,51,7 2 2,5 5 K/Ko
Эти вопросы можно отнести к категории структурных аспек-
тов действия электролитов — добавок первого класса на воду,
изменяющих ее структуру. Они представляют несомненный
научный и практический интерес и поэтому привлекают внима-
ние специалистов.
Установлено заметное влияние радиуса ионов — катионов и
анионов — на эффективность действия ряда солей при их ис-
пользовании в качестве добавок [91] . Успешно применен
также критерий, учитывающий соотношение между радиусами
ионов, для оценки эффективности ряда добавок и их ’’ранжи-
рования” по этим признакам. По-видимому, это направление,
обещающее возможность некоторых количественных или полу-
количественных расчетов и прогноза ускоряющего действия
добавок-электролитов, будет развиваться [92] .
Для силикатных фаз цемента в присутствии добавок обеих
групп первого класса также были найдены некоторые общие
зависимости, основанные на изложенном выше механизме
их гидратации. Так, для ранних стадий гидратации алита уда-
лось установить, что кинетика этого процесса в присутствии
добавок второй группы количественно передается уравнением
(2.7), справедливым и для добавок первой группы (рис. 12).
48
49
Рис. 12. Кинетика изменении mj'o Для
C3S
I — без добавки; 2 0,01; 3 0.05; 4 — 0,1;
5 — О, I 5 моль/л хлорида кальция
Рис. 13. Изменение пластической прочности
Рт (I), В = (т\п~ wl?oJ) / т (2) и степени
гидратации C3S через 1 сут IV (3) в зависи-
мости от концентрации хлорида кальция
Однако, судя по кривым рис. 13, при введении добавок второй
группы гидратация алита протекает с индукционным периодом,
продолжительность которого возрастает с увеличением кон-
центрации электролита; этой задержки начальной стадии твер-
дения не наблюдалось при использовании добавок первой
группы.
При сопоставлении данных рис. 7, 8 и 13 прослеживается
та же корреляционная связь между сгепенью гидратации, пласти-
ческой прочностью и /?отн Для алита в присутствии добавок
второй группы, какая была зафиксирована раньше при ею за-
творении добавками первой группы. Наконец, для всех добавок
первого класса независимо от того, к какой группе они принад-
лежат, характерен "порог” эффектов! ости, под которым мы
подразумеваем ту предельную концентрацию добавки, которая
обеспечивает максимальное ускорение или замедление тверде-
ния бетонной смеси.
Рассматривая добавки второй группы, нельзя обойти мол-
чанием их сильное ускоряющее действие и на такое в опреде-
ленном смысле уникальное природное вяжущее вещество,
как ангидрит CaS04. Уникальность этого мопомипсралытого
вяжущего заключается именно в том, что оно при комнатной
температуре метастабильно и поэтому обеспечивает пересыще-
ние относительно термодинамически устойчивого в этих усло-
виях гипса CaSO4 2Н;0. Однако вследствие очень низкого
пычения пересыщения (растворимость ме1астабилытой фазы
ангидрита С = 2,9, следовательно, пересыщение АС = 2,9-2 =
“ 0,9) скорость гидратации ангидрита тоже мала и даже вве-
дение добавок первой группы первого класса обычно не может
существенно повысить ее. Скорошь гидра ыционного твердения
ангидрита удается значительно увеличить вводя добавкисуль-
|раюв, причем наиболее эффективны сульфаты с многовалент-
ным катионом железа (II), в большей мере, железа (III), алю-
миния, а также их двойные соли-квасцы. Аналогично дейст-
вуют эти и некоторые другие сульфаты и на искусственный
аналог природного ангидрита, получаемый обжигом гипса
при 350-8000С[96] .
По-видимому, при анализе причин сильного ускоряющего
гидратацию ангидрита действии рассмотренных добавок следу-
CI учитывать и их "высаливающий” эффект, и ионную силу
раствора, и структурные аспекты влияния катионов и анионов
на воду, изменяющие ее подвижность, и некоторые кристалло-
химические аспекты.
Ангидритовые вяжущие представляли раньше преимущест-
венно научный интерес, однозначно подтверждая правильность
кристаллизационного механизма гидратации (ангидрит с пози-
ций гидратации отличается от полугидрата сульфата кальция в
основном только величиной пересыщения и соответственно рез-
ко различной кинетикой процесса). Однако в последние годы
они нашли широкое применение, например, при производстве
самонивелирующихся стяжек для полов, причем успех был
обеспечен их использованием с добавками ускорителей и су-
нериластофика торов. Кроме того, ангидритовые вяжущие
можно получать и из фосфогипса — отхода производства фос-
форной кислоты (около 20 млн т в год).
К интересным в практическом и нетравиальным в научном
о । ношении выводам привело нас термодинамическое рассмот-
рение цейс Iвия добавок первого класса и при их использова-
нии в условиях температур ниже 0°С и выше эвтектической.
I сгественно, что при этом речь идет о таких добавках, которые
имеют достаточно низкую эвтектическую температуру и могут
быть использованы в качестве противоморозных при их введе-
нии в больших дозах. Следует подчеркнуть, что в силу общности
подхода, присущего термодинамике, выявленные нами законо-
мерности можно с некоторыми поправками распространить
и па добавки второго класса, а также на комплексные на осно-
ве добавок первых двух классов.
Рассмотрим равновесие в системе ”соль--вода” для разных
icMiicparyp (рис. 14). Пусть состав раствора и температура
отвечают точке х' на диаграмме. При понижении температуры
51
50
, Рис. 14. Диаграмма равновесия в
X системе ”соль-вода”
до точки А никаких изменений в составе раствора не произой-
дет. Однако при дальнейшем снижении температуры, вследст-
вие того, что ниже точки А из раствора выделится чистый лед,
раствор становится все более концентрированным, а точка А
’’спускается” ио кривой от АЬЕ вправо. Соответственно будет
расти количество льда, повышаться концешрация раствора
и уменьшаться его общее количество. Согласно ’’правилу ры-
чага” отношение количеств раствора и льда при каждой темпе-
ратуре равно отношению отрезков сх и xb на горизонтальной
прямой (см. рис. 14) вплоть до достижения зшектической
точки Е. В этой точке, т. е. при температуре 73, в твердую фазу
выпадает эвтектика: соль и раствор.
Следовательно, при любой температуре выше Т3 в рассмат-
риваемой системе обязательно сохраняется некоторое количе-
ство жидкой фазы — водного раствора соли (или другого инди-
видуального вещества, а также их смесей), концентрация кото-
рого гем выше, чем ближе температура к эвтектической.
Для таких изменяющихся во времени систем, как цемент-
ные материалы, гидратирующиеся в присутствии добавок,
законы классической термодинамики неприемлемы. Однако
термодинамический подход становится возможным при выпол-
нении следующих дополнительных условий:
если введенная добавка химически не взаимодействует
с вяжущим. Именно поэтому мы рассматриваем задачу при-
менительно к добавкам первого класса, от которых требуется
лишь, чтобы их эвтектическая температура была достаточно
низка. Трудности в практической реализации этой задачи за-
ключаются в том, что большинство добавок, принадлежащих
к первому классу по их влиянию на основные - силикатные
фазы цемента, относится ко второму классу по их воздейст-
вию на алюминийсодержащие фазы. Ниже будет показано.
каким образом удается справиться с подобным затруднением;
если температура бетона снижена до —10°С или, еще лучше,
до -20°С. При этом процессы гидратации цемента в присут-
ствии добавок протекают очень медленно; соответственно рас-
тянуто во времени и изменение поровой структуры цементного
камня. Следовательно, в подобных условиях для сравнительно
небольших периодов времени можно в первом приближении
принять, что анализируемая система находится в квазиравно-
всспом состоянии и к ней применим термодинамический подход.
Возвратимся опять к рис. 14 и рассмотрим задачу для сече-
ния, отвечающего температуре выше 'Г3. Поскольку в системе
’’соль- вода” содержится некоторое количество водного раство-
ра, то цемент способен к гидратации.
По при этом возрастает концентрация соли в жидкой фазе,
что приводит к нарушению равновесия. Для его восстановления
при постоянной температуре должно произойти плавление части
льда. Это, в свою очередь, обеспечивает продолжающуюся гидра-
тацию цемента, что опять в том же направлении нарушает равно-
весие и т. д. — вплоть до почти полного плавления льда в изо-
термических условиях. Полнота плавления льда зависит от
выбранной добавки, ее концентрации, температуры и степени
। идратации цемента к моменту начала отсчета.
Однако доказан и многократно подтвержден эксперименталь-
но [87] факт постепенного плавления льда в подобных усло-
виях или же сохранение постоянства льдистости при понижении
1емпературы бетона.
Мы уже подчеркивали, что одно и то же вещество для си-
ликатных фаз цемента играет роль добавок первого класса, а
для алюминатных — второго. Это тем более справедливо в
данном случае, поскольку противоморозные добавки вводят
в повышенных дозах; кроме того, при низкой температуре
облегчается их способность к взаимодействию с гидроксидом
кальция с образованием соответствующих гидроксисолей.
Тем не менее и для таких неравновесных, в принципе, систем
возможен аналогичный подход, но при дополнительном усло-
вии: рассмотрение бетона с добавками следует начинать с того
момента времени, когда процесс образования этих гидроксисо-
лей и двойных солей-гидратов практически полностью завер-
шится.
Такой принцип был использован нами в опытах с противо-
морозной добавкой, содержащей нитрат кальция и мочевину
(НКМ) (табл. 4). Если принять за момент начала отсчета 7-су-
точный возраст бетона, то действительно со временем коли-
чество льда в бетоне монотонно убывает (опыты проводили с
использованием двух независимых методов контроля за содер-
жанием льда). Таким образом, эксперимент полностью под-
твердил теоретический прогноз [87] .
53
52
При рассмотрении материалов обращают на себя внимание
еще два факта, также находящихся в хорошем соответствии с
теорией. Первый из них: в бетоне, возраст которого меньше
7 сут, количество льда возрастало. Это объясняется гем, что
в течение первой недели происходило связывание чаши до-
бавки, — прежде всего ее неорганической составляющей, — в
соответствующие гидроксинитрат и гидро нитроалю ми на г каль-
ция. В результате концентрация добавки в поровой жидкости
убывала, а количество льда возрастало, причем продолжающая-
ся гидратация цемента и уход части воды на образование основ-
ных и двойных солей-гидратов не обеспечивали полную компен-
сацию снижения концентрации добавки.
Второй факт, хотя непосредственно и не вытекающий из
данных табл. 4, но тем не менее не вызывающий сомнения и
подтвержденный нами в независимых опытах: при продолжаю-
щейся гидратации цемента в изотермических (в первом при-
ближении) условиях низких доэвтектических температур ис-
кусственный камень в бетоне становится все более микропо-
ристым и, следовательно, на жидкости в более тонких капил-
лярах можно распространить известное уравнение Кельвина
(1.38) с заменой в нем степени пересыщения С/С^ на Р/Рт ,
где Р и Р^ — давление паров воды над капилляром с радиусом
Таблица 4. Количество льда в бетонах, затворенных 25%-м раствором
НКМ (I : 1), твердевших при температуре -20°С
В/Ц Возраст бетона, сут Влажность, % Количество льда, % Количество гидратной влаги, %
общая свободная, опреде- ленная ме- тодом СВЧ опреде- ленное ме- тодом СВЧ опреде- ленное ка- калори- метриче- ским ме- тодом
0,36 0 13,4 13,4 —. — -
1 9,2 3,6 5,6 — 4,2
3 9 2,9 6,1 — 4,4
6 8,6 2,3 6,3 — 4,8
9 8,4 2,2 6,2 — 5
12 8 2,2 5,8 — 5,4
15 7,5 2,2 5,3 — 5,9
28 6 2,2 3,8 — 7,4
0,6 0 13,4 13,4 — — —
1 9,8 — — 6,6 3,6
3 9,5 3,7 5,8 — 3,9
6 9,2 2,9 6,3 5,2 4,2
9 8,8 2,5 6,3 — 4,6
12 8,4 2,4 6 4,9 5
15 8,2 2,2 6 — 5,2
28 6,5 2,2 4,3 3,4 6,9
'Исследования с помощью калориметрического метода показали отсут
ствис льда в бетоне, твердевшем в течение 40 сут при температуре -20°С.
г и над капилляром с бесконечно большим радиусом (плоская
поверхность мениска). Таким образом, в более тонких капил-
лярах при 7'= const льдистость уменьшится.
Итак, противоморозные добавки первого класса действуют
в 1<>м же направлении, что и уменьшение радиуса капилляров:
они способс1вук>т сохранению воды в поровом пространстве и
благодаря этому обеспечивают продолжающуюся гидратацию
цемента при низких температурах. Более того, в очень тонких
капиллярах в соответствии с уравнение^! Кельвина снижается
и эвтектическая температура добавки первого класса. Нако-
нец, рассмотренные добавки, ухудшая структуру льда (он при-
обретает непрочную чешуйчатую структуру), снижают опасность
разрушения при попеременном замораживании — оттаивании
беюна. Это положение также было подтверждено многочислен-
ными экспериментами.
В дальнейшем будет показано, что особого внимания в по-
добных условиях заслуживают комплексные добавки.
Значение добавок первого класса многообразно и прояв-
ляется в широком диапазоне температур — от характерных
для тепловлажностной обработки бетона до зимнего без-
обогревного бетонирования при —25. . .—30°С.
Хотя в число добавок первого класса входят представители
самых различных химических соединений, механизм их влия-
ния на процессы твердения вяжущих сходен; эффективность
добавок этого класса как ускорителей, гак и замедлителей
твердения удается описать количественно, а полученные ре-
зультаты использовать в производственных условиях при вы-
боре добавок и назначении их концентрации.
2.3. ДОБАВКИ ВТОРОГО КЛАССА, РЕАГИРУЮЩИЕ
С ВЯЖУЩИМИ ВЕЩЕСТВАМИ С ОБРАЗОВАНИЕМ
ТРУДНОРАСТВОРИМЫХ ИЛИ МАЛОДИССОЦИИРОВАННЫХ
СОЕДИНЕНИЙ
Добавки второго класса весьма многочисленны и оказывают
существенное влияние на процессы гидратационного твердения
цемента. По существу, почти все электролиты в определенных
условиях (например, при повышении их концентрации или из-
менении температуры) могут химически взаимодействовать с
составляющими портландцементного клинкера или продуктами
его гидратации, причем даже те из них, которые были отнесены
ранее к добавкам первого класса в силу того, что они медленно
peai ируют с С3А и C4AF. Кроме того, по принципу участия в
реакции с вяжущими или продуктами их гидратации к добав-
кам второго класса следует причислить спирты, амины и орга-
нические кислоты. Таким образом, в общей систематике добав-
ки второго класса наиболее представительны. Поэтому их
55
54
дифференциацию следует провести весьма тщательно, выбрав
для этой цели признаки, связанные как с типом химического
взаимодействия, так и с влиянием продуктов реакции на про-
цессы 1вердения и структурно-механические свойства бетона.
По-видимому, этому требованию отвечает деление добавок вто-
рого класса на две группы — добавки, участвующие с вяжущими
или продуктами их гидратации в реакциях присоединения и в
обменных реакциях.
Каждую из этих групп дополнительно дифференцируем на
две подгруппы по тому, образуются ли при взаимодействии
добавок с вяжущими и продуктами их гидратации трудно-
растворимые вещества или малодиссоциированные молеку-
лярные комплексы. Необходимость деления добавок второго
класса на подгруппы вызвана тем, что твердые продукты ре-
акции, осаждаясь на вяжущих в вице пленок или кольмагируя
поры бетона, оказывают благодаря этому вторичному эффек-
ту существенное влияние на кинетику твердения и другие важ-
ные показатели бетона.
Из рассмотрения исключаются добавки, участвующие в
окислительно-восстановительных реакциях (эти реакции ле-
жат, например, в основе газообразования в ячеистых бетонах),
так как их влияние на процессы гидратационного твердения
вяжущих определяются не самим изменением валентности
элемента или зарядом иона, а их последующим участием в
реакциях присоединения либо обмена. Однако некоторые из
окисляющихся добавок будут проанализированы в связи с
особенностями их взаимодействия с составляющими цемент-
ного камня.
2.3.1. Добавки первой группы, вступающие
с вяжущими веществами в реакции присоединения
В эту группу входят такие популярные электролиты, как
хлории-и нитрат капьпия
Уже указывалось, что и гипс с С3А и C4AF участвует в ре-
акциях присоединения, протекающих в условиях диссоциации
вводимой соли и перешедшего в раствор вяжущего вещества
на ионы и выкристаллизовывания гидросульфоалюминага
либо гидросульфоалгомоферрита кальция из пересыщенных
растворов. Следовательно, и гипс относится' к числу добавок
первой группы.
При взаимодействии добавок второю класса и комплекс-
ных с минералами портландцементного клинкера получается
ряд новых соединений. В основном это двойные соли-гидраты.
Как известно, соли кальция с алюминийсодержащими фазами
цемента, в частности с трехкальциевым алюминатом, образу-
ют двойные соединения двух типов:
1) 2СаО • А12 03 СаХ2 - 10 — 12 Н2 О;
2) ЗСаО А12О3 ЗСаХ2 • 14 - 32Н2О,
где X - однозарядный анион.
При наличии в твердой фазе соединений, поставляющих
гидроксид кальция, подобные продукты могут образовывать и
соли калия и натрия, однако эта реакция замедляется накопле-
нием в растворе гидроксида калия и натрия, образующихся в
результате обменной реакции-
Саэ (А103)2 + пСа (ОН)2 + 2н NaX + m Н2О
= ЗСа3 (АЮз ) г • п СаХ2 • т Н2 О + 2м NaOH,
где п = 1 илн 3; т = 10 12 или hi = 14. .32.
Оба типа двойных солей кристаллизуются в гексагональной
сисэеме. Близкие по составу и свойствам двойные соли-гидраты
выкристаллизовываются и при взаимодействии этих добавок
с C4AF клинкера.
Кроме того, добавки второго класса (первой и второй групп)
в определенных условиях реагируют с гидроксидом кальция
цементного камня с образованием гидроксисолей типа
Са(ОН)2 • СаХ2а^. Поэтому целесообразно рассмотреть их сос-
тав и основные свойства — преимущественно к ристаллохими-
ческие и термодинамические (растворимость, равновесные
коннешрации и др.).
Свойства и состав гидросульфоалюминага кальция трех-
сульфатной формы (ГСАК-3) описаны в [47, 57,96] , ГСАК-3
имеет природный аналог — минерал эттрингит. По данным
одних исследователей, содержит 31—32 молекулы воды, по
данным других, — 30. Подвергается ступенчатой дегидратации:
при 60°С содержание воды снижается до 20 молекул, при
1 10°С — до 8, при 145° — до 6 и при 200°С — до 2.
Кривые дифференциального термического анализа (ДТА)
ГСАК-3 характеризуются одним эндотермическим пиком в
пределах 150-160°С. Кристаллы ГСАК-3 гексагональные,
иглообразные, оптически одноосные, отрицательные, с прямым
погасанием, отрицательным удлинением: Ng = 1,464; =
= 1,456; плотность 1,73 т/м3. Размеры элементарной ячейки
его кристаллической решетки: а = 1,124 нм, с = 2,145 нм.
Имеет дифракционные эффекты, соответствующие следующим
мсжплоскостным расстояниям: 0,98 нм — сильный; 0,56,0,385,
0,276, 0,255, 0,219, 0,214 нм - средние, 0,465, 0,359, 0,323,
0,268, 0,26, 0,24, 0,1939, 0,1848, 0,1659, 0,1615, 0,1665 нм -
слабые.
56 /и pL &
CaSO*
Грехсульфатная форма
гидросульфоалюмината
кальция образуется как
из разбавленных раство-
ров сульфата алюминия,
1идроксида кальция, гип-
са, трехкальциевого алю-
мината, так и при взаимо-
действии гипса с трех-
кальциевым алюминатом.
Система СаО—А12О3-
-CaSO^-F^O достаточно
подробно исследовала
[96] . Диаграммы состоя-
ния этой системы в облас-
CoS04
Рис. 16. Равновесная диаграмма обра-
зования твердых фаз в системе СаО-
- \l2O3-CaSO4-H2O
Т эттрингит;
трехкальциевого алюмината;
гель гидроксида алюминия;
гипс; Y — гидроксид кальция
гексагидрат
Ш
ТУ
пр п СоО
г} 1 2 J 4 5 6 7 * ?
ти стабильной и мстаста-
бильной кристаллизации
[82, 88] представлены на
рис. 15, 16. Интересно
сравнить их между собой.
В метастабильной области
при отношении CaSO4 :
. А12О3 больше 3 (экспо-
зиция 1 сут) образуется
высокосульфатпая форма
гидросульфоалюмипата
кальция. Если это отноше-
ние меньше 3, но больше
1, образуются смеси с пре-
обладанием трехсульфат-
ной формы и некоторым
количеством моносуль-
фатной формы гидро-
сульфоалюмипата каль-
ция или твердыми раство
Рис. 15. Диаграмма состояния систе-
мы СаО-А12О3 - CaSO4-H2O в об-
ласти метастабильной кристаллизации
через 1 и 14 сут
I—14 данные Д’анса и Эйка; I - об-
ласть образования эттрингита; II
область образования геля гидроксида
алюминия; Ш — область образования
моносульфоалюмината кальция; /1 —
гексагидрат трехкальциевого алюми-
ната; т — V — четырехкальциевый
гидроалюминат; d - v — гидроксид
кальцин; о - г — гипс; •, о, х , о
наши данные: • — эттрингит; о —
моносульфоалюминат кальция; х —
четырехкальциевый гидроалюмннат;
О — совместное присутствие моно-
сульфоалюмината кальция и эттрин-
гита; — эттрингит и совместное
присутствие или твердые растворы
моносульфоалюмината кальция и че-
тырехкальциевого гидроалюмината
Термодинамические расчеты показывают, что наиболее пред-
почтительно в системе CaO-Al2O3-CaSO4-H2O образование
грехсульфатной формы гидросульфоалюмината кальция.
В воде эю1 гидросульфоалюминат растворяется инконгру-
еппю с выделением гидроксида алюминия. Его растворимость
в расчете на А12О3 равняется 0,017 г/л. В растворе гидроксида
кальция концентрации от 0,027 до 0,15 г/л (в пересчете на
СаО) гидросульфоалюминат растворяется конгруентно. В этом
случае растворимость его при различной концентрации Са(ОН)2
составляет:
СаО, г/л. . 0,056 0,112 0,168 0,224
СГСАК-3, г/п .0,225 0,165 0,105 0,08
0,67 1,08
0,03 0,024
с растворами суль-
ГСАК-3 может существовать в контакте
фата и нитрата натрия, хлорида кальция и некоторыми другими
веществами, но разлагается в присутствии карбоната и сульфата
магния. Позднее был обнаружен также метастабильный натрий-
содержащий гидросульфоалюминат кальция СаО • 0,9А12О3
- 0,5Na20 • 1,1 SO3 Н2О, образование которого возможно
" с четыпехкальциевым гидроалюминатом. Точюпри введении в белито-алюминатные цементы более 2 % сульфата
полученные^через 1 сут, и участок 1 диаграммы Д’Айса и ЭиьНагрия [44].
получеппше к _ Свойства и состав гидросульфоалюмината — низкосульфат-
соответствуют одна другой. участок, на котором обной формы (ГСАК-1) изучены достаточно подробно [20,102].
При небольшом количестве 1 1 фцаЛЮМИНата кадь На кривых ДТА наблюдаются эндотермические пики в области
разуется моносульфатная форм Р твердые раство 100, 200—220 и 300 -320°С и экзотермический — при 800°С.
ция, четырехкальциевыи гидроалюмина и исчезает па ста В отличие от ГСАК-3 ГСАК-i термически устойчив. Кристал-
ры, опускается с течением вРемс’1Л мССТО шесшводному трсцлиэуется в виде гексагональных пластинок, кристаллы опти-
бильной диаграмме Джонса, усту стабильной двойно)чески одноосные, отрицательные, удлинение положительное;
кальциевому алюмин^яе^1^1СОКОСульфатная форма гидрспогасание прямое; Ng = 1,504; Np = 1,488; плотность 1,95 т/м3.
сульфо1’ХХеХьадяГСАК-3. 2оР9О1Тнм КрИСТаЛЛИЧеСКОЙ Решетки: ° = °’885 нм> с =
59
58
Для ГСАК характерны следующие дифракционные эффекты,
соответствующие межплоскостным расстояниям: 0,89 и
0,45 им - сильные, 0,399, 0,287, 0,242, 0,235, 0,218, 0,206, 0,19
и 0,1819 нм — средние.
В главе 1 были описаны близкие по составу и свойствам
ГСАК-1 и ГСАК-3 соединения, в которых атомы алюминия пол-
ностью или частично замещены атомами железа.
В виде метастабильного продукта ГСАК-1 образуется в сис-
теме СаО—А12О3 -CaS04 —Н2О при отношении CaS04 : А12О3 <
< 3. Синтез этого соединения описан в [20] .
Моносульфатная форма гидросульфоалюмината образует
непрерывный ряд твердых растворов с четырехкальписвым
гидроалюминатом. Растворимость в воде в расчете па Л12О3
составляет 0,039 г/л. В растворах сульфатов и хлоридов каль-
ция и натрия ГСАК-1 переходит в трехсульфатпую форму
ГСАК-3.
Свойства и состав гидрохлоралюмината кальция — низко-
хлоридной формы (ГХАК) ЗСаО • А12О3 • СаС12 ЮН20 изу-
чали многие авторы [98, 102].
На термограмме ГХАК имеются эндотермические (160,
330, 810°С) и экзотермический (680°С) эффекты. ГХАК крис-
таллизуется в виде гексагональных пластинок; кристаллы оп-
тически одноосные, отрицательные, удлинение положительное:
АС = 1,550;/V = 1,535.
О Р
Дэя рентгенограммы ГХАК характерны следующие дифрак-
ционные эффекты, соответствующие межплоскостным рас-
стояниям: 0,791 и 0,394 нм — сильные; 0,381, 0,228, 0,232 и
0,2152 нм — средние; 0,271, 0,261, 0,256, 0,244 и 0,199 нм —
слабые. ГХАК образуется как из разбавленных растворов,
содержащих гидроксид, алюминаты и хлорид кальция, так
и из трехкальциевого алюмината и других алюминийсодер-
жащих минералов иортландцементного клинкера и растворов
хлорида кальция вплоть до 4,5А концентрации. Более медлен-
но и в небольших количествах гидрохлоралюминат кальция
образуется при взаимодействии алюминатов кальция с хлори-
дами калия и натрия при избытке гидроксида кальция в
растворе.
Свойства и состав гидрохлоралюмината кальция треххлорид-
иой формы (ГХАК-3) ЗСаО • А12О3 • ЗСаС12 дН2О изучали в
работах [88, 89] .
По данным [98], для треххлоридной формы гидрохлоралю-
мината кальция на термограмме отмечается эффект при 160°С,
на рентгенограмме имеются дифракционные эффекты, соответ-
ствующие межплоскостным расстояниям. 0,366 и 0,255 нм —
сильные, 0,514, 0,308 и 0,177 нм - средние; 0,483 и 0,404 нм -
слабые. Образуется при действии СаС12, начиная с 4,5 А' концент-
рации, на трехкальциевый алюминат при температуре от 20
до —15°С.
Рис. 17. Термограмма высоконит-
ратной формы гидронитроалюми-
ната кальция
1 температура печи, 2 — термо-
грамма^ 3 — дериватограмма;
4 — изменение массы
Свойства и состав гидронитроалюмината кальция, низко-
нитратной формы (ГНАК) ЗСаО • А12О3 - Ca(NO3)2 • ЮН20
описаны в работах [47, 96].
Для ГНАК характерны эндотермические эффекты на термо-
граммах при 140, 280, 560, 800°С. Кристаллизуется в виде
гексагональных пластинок, кристаллы одноосные, в воде слабо-
отрицательные, в иммерсионных жидкостях резкоположитель-
ные: Ng = 1,532; N = 1,502.
На рентгенограммах ГНАК имеются дифракционные эффек-
ты: 0,87 и 0,432 нм — сильные, 0,386, 0,304, 0,284, 0,249 и
0,239 нм - средние, 0,274, 0,229, 0,215, 0,209, 0,197 и 0,187 нм -
слабые. ГНАК образуется как из разбавленных растворов
алюмината, нитрата и гидроксида кальция, так и при действии
растворов азотно-кислого кальция концентрации до 1,22 моль/л
на трехкальциевый алюминат. Растворимость в воде 0,085 г/л
по А12О3.
Свойства и состав гидроиитроалюмината кальция трехнит-
ратной формы (ГНАК-3) ЗСаО • А12О3 -3Ca(NO3)2 • 16-18Н2О
были впервые описаны в работах [84, 85] .
Термограмма ГНАК-3 представлена на рис. 17, рентгено-
графические характеристики приведены в табл. 5.
ГНАК-3 может быть получен при взаимодействии трехкаль-
циевого алюмината с раствором нитрата кальция, начиная с
концентрации 1,22 моль/л, как при +20°С, так и при темпера-
туре ниже 0°С.
Свойства и состав гидрокарбоалюмината кальция (ГНАК)
ЗСаО А12О3 • СаСО3 • 10—12Н2О [98, 102] уже были описаны
61
60
Таблица 5. Рентгенограмма ГНАК-3
Межплоскостные расстояния, нм Сравнительная интенсивность дифракционных пиков, % Межплоскостные расстояния, нм Сравнительная интенсивность дифракцион- ных инков, %
0.8 100 0.247 5
0.495 30 0,232 65
0,47 50 0,196 15
0,42 30 0.185 30
0,402 15 0,176 20
0,364 70 0.1656 10
0,323 17 0 1616 7
0.312 25 0 1592 10
0,292 60 0,1548 10
0,268 40 0,1548 10
в связи с формированием контактной зоны в бетоне на гра-
нице между цементом, цементным камнем и карбонатным
заполнителем. Возможно его образование при использовании
добавок поташа, особенно в ’’холодных’’ бетонах, когда кон-
центрация этой добавки весьма велика.
На термограммах ГНЛК наблюдаются эндотермические эф
фекты при 230 и 840°С. Рентгенограммы фиксируют дифрак
ционные максимумы при 0,376 и 0,767 нм (точнее, группу ли-
ний с варьирующим значением от 0,749 до 0,78 нм).
Близкие по составу и свойствам двойные соли-гидраты
образуются и при реакции описанных добавок с C4AF.
Свойства и состав других двойных солей-гидратов. Кроме
перечисленных двойных солей (называемых иногда комплекс-
ными) описаны и другие, близкие к ним по составу и природе.
Из них наибольшее значение имеет гидронитриалюминат каль-
ция (ГНиАК) ЗСаО • А12О3 • Ca(NO2)2 • лН2О [31]
К сожалению, надежные термодинамические, рентгеновские
и кристаллохимические характеристики для него отсутствуют.
Судя по косвенным данным, в том числе кинетическим, о кото-
рых будет сказано ниже, растворимость гидронитриалюмината
кальция должна превосходить растворимость однотипных с
ним гидрохлор- н гидронитриалюминатов кальция
Имеются сведения об образовании гидрофтор-, гидробром-,
гидройод-, гидроацетоалюминатов кальция [’25] и некоторых
других аналогичных соединений.
С гидроксидом кальция соли кальция образуют двойные
соли типа гидроксисолей.
Свойства и состав оксихлоридов кальция изучали в работах
[17, 521. Для системы Са(ОН)2 — СаС12 — Н2О характерно об-
разование оксихлоридов двух типов: СаО СаС12 -нН20 (низ-
коосновная форма); по данным [17] , п — 2, по данным [52] ,
п - 1, и ЗСаО • СаС12 • 15Н2О (высокоосновная форма).
62
Рис. 18. Изотермы растворимо-
сти гидроксида кальция в хло-
риде кальция при температуре
5° (1) и 30°С (2). Са 6—СаС12 •
• 6Н2О; Са 6 + 4а - СаС12 • 61ЬО+
+ а СаС1 2 • 4Н2О
Нонвариантная точка ЗСаО СаС12 • 15Н2О + СаО • СаС12 •
Н20 + Са(ОН)2 + раствор + пар находится при 48°С. Для нее
установлен состав растворной фазы: 0,8% Са (ОН) 2 и 32%СаС12
[52].
На рис. 18 представлены изотермы растворимости гидрокси-
да кальция в хлориде кальция. По одним данным, это соеди-
нение кристаллизуется в виде гексагональных призм и пласти-
нок: Ng = 1,628, TV = 1,623, по другим, — показатели прелом-
ления: Ng = 1,638, Np = 1,634.
Высокоосновная форма гидроксихлорида кальция кристал-
лизуется в виде игл и призм в ромбической сингонии; Ng —
= 1,546, Nm = 1,536, Л-р = 1,48.
Согласно [17], состав оксихлорида кальция ЗСаО • СаС12 •
14Н2О с Ng = 1,558, Nm = 1,544, = 1,487. Это соединение
устойчиво до 38,9°С в 329?>м растворе хлорида кальция. На
термограмме имеются эндотермические эффекты при 50 и
110°С (дегидратация гидроксихлорида кальция) и 540°С (де-
гидратация Са(ОН)2).
63
Рис. 19. Изотерма раствори-
мости гидроксида кальция
в растворе нитрата кальции
при 20°С
По нашим данным, для этого соединения харакюрны сле-
дующие дифракционные эффекты на рентгенограммах, соот-
ветствующие межплоскостным расстояниьм: 0,81 нм — очень
сильный; 0,41 нм — сильный, 0,2748 нм средний, 0,3341 и
0,22 им слабые.
Свойства и состав гидроксинитратов кальция. Низкооснов-
ная форма гидроксинитрата кальция СаО • Ca(NO3)2 • ЗН2О
образуется при 25°С в интервале концентраций нитрата каль-
ция 45,3 57,7 %. Изотермы растворимости гидроксида каль-
ция в растворе нитрата кальция даны на рис. 19.
В [84, 85] определены также кристаллооптические и рент-
генографические характеристики гидроксинитрата кальция
CaO-Ca(NO3)2 -ЗН2О. Это соединение образуется в виде удлинен-
ных иглообразных кристаллов с прямым погасанием, отрица-
тельным удлинением и сильным двулучепреломлением (в
поляризованном свете кристаллы обладают яркой окраской):
Ng = 1,591; Лр = 1,510. Рентгеновские данные представлены
в табл. 6.
Высокоосновная форма гидроксинитрата кальция [ЗСаО
• Ca(NO3)2 - 14-16Н2О], по данным [84, 85], образуется в
интервале концентрации азотно-кислого кальция 20—45 %
при температуре —6. . .—20°С. Продукт представляет собой
блестящие игольчатые кристаллы размером до 1 мм, неустой-
чивые при положительной температуре. Влажный осадок раз-
лагается на гидроксид кальция и раствор азотно-кислого каль-
ция. Сухие, хорошо промытые ацетоном и высушенные пото-
ком воздуха кристаллы не разлагаются, однако в них проис-
ходят некоторые изменения: они мутнеют, теряют часть воды.
Кристаллы обладают слабым двулучепреломлением (поля-
ризационная окраска серая), положительным удлинением,
прямым погасанием: Ng = 1,505; N = 1,480. После хранения
на воздухе в них появляются сферические пустоты, удлинение
меняется на отрицательное. Данные рентгеновских исследова-
ний гидроксинитратов кальция приведены в табл. 7.
В интервале температур от —6 до —20°С при концентрации
литрата кальция выше 45% образуется низкоосновная форма
оксинитрата кальция состава СаО Ca(NO3)j • ЗН2О.
Свойства и состав гидроксинитрита кальция СаО Ca(NO2)2 -
(3—3,5)Н2О были впервые описаны в [86]. Взаимодействие
64
1аблица 6. Рентгенограмма СаО • Ca(N0j)2 • ЗН2О
МсЖШЮСКОСТНЫС расстояния, нм Высхпа дифрак- ционных. ников. % Мсжплоскосгныс расстояния, нм Высота дифрак- ционных пиков, %
0.79 30 0,245 0,5
0.679 40 0,242 2
0,6 30 0.2314 90
0.389 40 0.221 100
0.364 1 0.201 25
0.342 j 0.191 1
0,329 100 0,1897 1
0.301 2 0,1731 2-3
0.279 30 0.1664 2
0.267 1
Таблица?. Pein ivuoi рамма ЗСаО CalNOjlj 14— I6H2O
Межплоскостныс расстояния, нм Высо|а дифракционных ников, 'А
0,92 120
0.46 100
0,307 50
0.237 1
0,233 2
0,23 10
0,201 2
0,197 2
0,185 10
0,1537 5
с Са(ОН)2 нитрита кальция при изменении его концентрации от
19,5 до 40 % в интервале температур от —10 до +2Q°C приводит
к образованию лишь одного соединения — низкоосновной
формы оксинитрита кальция состава СаО • Ca(NO2)2 • (3 -
3,5)Н2О. Кристаллы обладают прямым погасанием, отрицатель-
ным удлинением, сильным двулучепреломлением (яркая поля-
ризационная окраска): = 1,525; = 1,416. Рентгеновские
характеристики представлены в табл. 8.
Рассмотрим основные закономерности образования трудно-
растворимых солей-гидратов при реакциях индивидуальных
добавок второго класса с алюминийсодержащими фазами
нортландцементного клинкера. Характерно, что молекулярный
объем перечисленных двойных солей больше молекулярного
объема вяжущего, при взаимодействии с которым они кристал-
лизуются, т с. всегда справедливо неравенство (1.36). Это
. 3 182
65
Таблица 8. Рентгенограмма СаО • Са (М)2)2 (3-3.5)НгО
М с Ж11 л о ск ост н ые расстояния. им Высота дифракци- онных ПИКОВ. f/c Межплоскостныс расстояния, им Высота дифрак- ционных ников 7
0,72 42 0,27 27
0,62 100 0,257 25
0,51 54 0,244 20
0,448 8 0,218 16
0,422 7 0,209 3
0,378 48 0.205 6
0,349 6 0,203 14
0,327 5 0,19 37 8
0,307 35 0,1927 9
0,297 6 0,1867 5
0,293 8 0,(836 6
0,277 5 0.161 1 5
означает, что при определенных условиях продукты реакции
С3А и C4AF с такими добавками могут формировать на зернах
вяжущих фазово-выраженные экранирующие пленки.
Опытные данные свидетельствуют, что эта возможность дей-
ствительно реализуется. Так, образованием пленок можно объ-
яснить появление индукционного периода на ранней стадии
твердения бетонной смеси при введении хлорида кальция, а
также влияние гипса на твердение портландцементного клин-
кера.
Формирование на зернах вяжущих пленок из двойных солей
гидратов подтверждается и тем, что кинетику их выкристалли-
зовывания удается описать уравнением, выведенным с учетом
торможения реакции ее продуктами. Из многих возможных
уравнений, учитывающих пленкообразование, мы используем
лишь одно, предусматривающее некоторую проницаемость
пленок, экранирующих вяжущее.
Следовательно, в течение всего времени взаимодействия
добавки с С3 А и C4AF возможны последовательно протекающие
процессы ее диффузии к поверхности зерен вяжущего, реакции
с алюминийсодержащими фазами клинкера и отвод тон части
продуктов реакций, которая не участвует в формиронаниии
пленки, за пределы последней. Для этого случая Б.В. Дроздовым
предложено выражение, отличающееся от обычного уравнения
первого порядка вторым членом, учитывающим пленкообразо-
вание с помощью коэффициента торможения (1. Это уравнение,
решенное относительно константы скорости реакции А. имеет
вид:
к = (1 / т) In б’о / (С'о~С’х) рСх/т, (2.14)
где Со - начальная концентрация добавки; С - концентрация добавки,
израсходованной на образование новой фазы к моменту времени Г;
66
Co C^ — C^ — концентрация оставшейся части добавки к эзому момек-
i> времени.
Подробнее уравнение Б.В. Дроздова анализируется в [36].
Величины к и (3 удобно находить графически (рис. 20) при
обрабопсе опытных данных в координатах „
/т - In Со / (Со - СА.)-
Зпачспнс к можно вычислить по отрезку, отсекаемому при
экстраполяции экспериментальной прямой на ось ординат,
значение (3 из углового коэффициента этой прямой к оси
абсцисс.
Опыты по изучению кинетики образования гидрохлор-,
тидропигро- и гидронитриалюмината кальция заключались в
анализе поровой жидкости цементною камня в разные мо-
мент 1>т времени на содержание ’’свободных” хлорида, нитрата
и нигрита кальция с параллельными термографическим, петро-
графическим и рентгеновским анализами твердой фазы для
идентификации этих двойных солей-гидратов.
Как показано на рис. 20 и в табл. 9, коэффициенты тормо-
жения дня всех перечисленных солей близки. Это свидетельст-
вует о том, что по экранирующей способности выкристаллизо-
вывающиеся двойные соли почти тождественны друг другу,
очевидно, вследствие их кристаллохимической близости. Од-
нако коэффициент торможения изменяется примерно вдвое
при увеличении концентрации добавки электролита во столько
же раз (с 0,5 до 1 моль/л). Это можно объяснить тем, что с
ростом концентрации добавки изменяются скорость форми-
рования, дисперсность двойных солей и, как следствие, их
экранирующая способность.
Таким образом, еще раз подтверждается большая чувст-
визелыюегь процессов, приводящих к пленкообразованию
па зернах вяжущих, к изменению внешних факторов.
Таблица 9. Константы скоростей (в мин'1) и коэффициенты тормо-
жения (в моль-1 ) реакции образования i идрохлор-, 1 идронитро- и гидро-
низ риалюмината кальция в пасгахи цементном камне [36]
Добив Коп- Клинкер
к а ILCHI-
ра белитоалюмо- белитоалю- алитоалюмо- аяигоалюми-
ция фе рритн ый мина гный ферритный ватный
no- бан- ки, моль/ /л к 103 Р А 103 13 к • 103 а к 103 Р
(а(. 1 •» 1 J 1,3 1 1.1 0.7 1.1 1.6 1,1
Са( 12 0.5 1 2.6 1 2.2 0,8 , 1.9 1,6 -2
( а(NO3) 2 0.5 1 • 10’3 3.2 । >о~3 2.5 2 IO’3 2 1 10 32.5
С а(NO2) 2 0.5 ЗЮ”4 2 3 10'4 2 3 I0"4 2 3 10 2
67
Рис. 20. Обработка ко уравнению (2.14)
опытных данных по кинетике образо-
вании
а — гидрохлоралюмината кальция; б -
гвдроннтроалюмината кальндя; в
гадронитриалюмината кальция
В соответствии с требованиями теории, на значениях к в
пределах ошибки опыта практически не сказываются на хи-
мико-минералогический состав использованных клинкеров,
ни концейтрация добавки Следовательно, при изучении во
времени реакции добавок электролитов с составляющими
цементного клинкера, осложненной пленкообразованием,
уравнение (2.14) обеспечивает необходимую универсальность
68
получаемых данных. Уравнение (2.14) пригодно и в некото-
рых других случаях, в том числе и для количественной оценки
действия комплексных добавок
Константы скорости образования гидрохлор-, гидронитро-
и 1 идронитриалюмината кальция относятся друг к другу при-
мерно как 1 :1СГ3 : Ю^.Из этого вытекает весьма важный для
практики вывод: из грех анализируемых добавок СаС12;
Са(\'О3)2 и Ca(NO2)2 максимально долго будет сохраняться
в норовой жидкости нигрит кальция и наименее продолжи-
тельное время — хлорид кальция. Соответственно этому они
влияют и на гидратационное твердение основных силикатных
фа т цемента.
Этим объясняется и установленный в [35] факт, что на
ранней стадии твердения добавки СаС12; Ca(NO3)2 и Ca(NO2)2
в эквимолярных концентрациях в примерно одинаковой сте-
пени ускоряют гидратацию силикатных фаз цемента, а в даль-
нейшем этот эффект оказывается большим при введении нитри-
та и нитрата кальция. Сказанное подтверждают данные рентге-
новского анализа* (определялось уменьшение содержания
исходных силикатных фаз при гидратации алитового среднеалю-
мипатного цемента в присутствии указанных добавок).
Очевидно, ускоряющее гидратацию C3S и 0-C2S действие
добавок хлорида, нитрата и нитрита кальция тем ниже, чем
меньше в данный момент их концентрация в жидкой фазе,
зависящая в свою очередь от химической активности электро-
лита. Поскольку хлорид кальция, находящийся в поровой
жилкости, быстрее других расходуется на образование гидро-
хлоралюмината кальция, его влияние на силикатные фазы со
временем ослабевает в большей степени, чем влияние нитрата
и особенно нитрита кальция.
Поэтому становятся ясными принципы подбора добавок,
обладающих длительным последействием на основные фазы
нор1ландцемента — C3S и 0-C2S: константы скорости реакции
к для них должны иметь возможно минимальное значение,
коэффициент торможения |3 также должен быть невысоким.
В первом приближении в качестве эталона подобной добавки
можно рассматривать нитрит кальция.
Аналогичный подход пригоден и для оценки эффективности
добавок, обеспечивающих продолжительное антикоррозионное
влияние на стальную арматуру независимо от того, участвуют
ли они в формировании фазово-выраженных пленок или нет.
Хотя добавки гипса также относятся к первой группе вто-
рого класса, специфичность их действия на С3А и C4AF порт-
ландце ментного клинкера заключается в том, что эта добавка
* Измерения, как и раньте, были выполнены па дифрактоме
с никелевым катодом и СиК a-излучением трубки.
ре У РС-50 И
69
вводится в твердом виде. При этом скорость образования
ГСАК-3 может лимитироваться не стадией химической реак-
ции, а значительно более медленной стадиен растворения гипса
протекающей с диффузионным контролем. Кроме гою, по-
скольку растворимость гипса Со = 2 г/л, а в присутствии одно-
именных с ним ионов кальция — еще ниже, т<> скорость образо-
вания ГСАК-3, зависящая от пересыщения, г*ожег быть меньше
скорости кристаллизации гидрохлоралюмината кальция за счет
большой концентрации введенного в бетонную смесь раствора
хлорида кальция (табл. 10).
Таблица 10. Расчет кинетики кристаллизации тттдрогзльфоалюмннага
кальция но уравнению реакции первого порядка
Время отбора пробы, мин С0/Сл 1g СО)СЛ к 102, мни 1
12 1,42 0 15 1,25
15 1,545 0,19 1.26
21 1 835 0,26 1.25
27 2,2 0,34 1,26
33 2,62 0,42 1,26
Тем не менее для кинетики выкристаллизовывания ГСАК-3
характерны те же основные зависимости, чго и для других
перечисленных двойных солей-гидратов [65] , включая воз-
можность использования для описания кинетики его образова-
ния уравнение (2,14).
Пересыщение создавали изменением концентрации гидро-
ксида кальция при его сливании с раствором сульфата алюми
ния, поэтому данные обрабатывали но уравнению (2.14) без
второго члена, учитывающего пленкообразование.
К общим признакам добавок первой группы второго клас-
са следует отнести то, что они могут быть практически полно-
стью или в значительной мере связанными в соответствующие
двойные соли-гидраты, растворимость и произведение раство-
римости (ПР) которых малы. По величине ПР наиболее рас-
пространенные из этих двойных солей располагаются в последо-
вательности. ГСАК-3 < ГХАК < ГНАК, что и определяет пол-
ноту сохранения катиона и аниона добавки в жидкой фазе це-
ментного камня.
Таким образом, добавки, участвующие в реакциях присоеди-
нения с образованием трудиорасгворимых двойных солеи-
гидратов, обладают важными общими свойствами, чго тозво-
лило не только выделить их в самостоятельную группу но и
описать их действие теоретически обоснованными уравнениями
учитывающими пленкообразующую способность этих солей.
70
Кроме того, в отличие от добавок первого класса, добавки
второго класса непосредственно принимают участие в форми-
ровании цементного ками», откладываясь в виде пленок, коль-
матнруя поры или ’’вписываясь” в структуру материала нарав-
не с другими фазами. При этом они, как и другие составляющие
цементного камня в бетоне, проходят все основные уровни
дисперсности: надмолекулярный на стадии зарождения двой-
ных солей-1 идратов, субмикросконический, а некоторые — даже
микроскопический. Следовательно, для них оказываются спра-
ведливыми многие положения об уровнях структур.
До сих пор мы анализировали в основном действие на С3А
и C4AF добавок хлорида, ншрата и нитрита кальция, приво-
дящих к образованию низкохлоридной, иизконитратной и низ-
конитритной форм соответствующих двойных солей. Однако,
как указывалось, при введении в бетон значительных количеств
добавок образуются также ЗСаО А12О3 • ЗСаС^т/ и ЗСаО
А12О3 • 3Ca(NO3)2 «/. Можно полагать, что и для них ока-
жутся справедливыми количественные зависимости и качествен-
ные закономерности, которые характерны для соединений типа
ЗСаО • А12О3 • СаХ2 пН2О, но окончательное заключение об
этом может быть сделано лишь после экспериментальной про-
верки.
Определенный научный и практический интерес представля-
ют добавки хлорида, нитрата и нитрита кальция при их участии
в реакциях присоединения с гидроксидом кальция, идущих на
примере хлорида кальция по схеме Са(ОН)2 + СаС12 + 2Н2О —
Са(ОН)2 СаС12 2Н2О или ЗСа(ОН)2 + CaCI2 + 11Н2 О —
— ЗСа(ОИ)2 СаС12 • 11П2О.
При этом образуются соответственно низко- и высокооснов-
ная форма гидроксихлорида кальция. Аналогично кристалли-
зуется гидроксинитрат кальция [условно СаО Ca(NO3)2 •
• ЗН2О] и, как удалось недавно показащ [86] , его высоко-
основная форма ЗСаО • Ca(NO3)214-16Н2О и гидроксинитрит
кальция СаО • Ca(NO2)23—3,5Н2О
Данных по кинетике кристаллизации перечисленных гидро-
ксисолей, необходимых для количественных расчетов, на се-
юдня недостаточно. Однако их качественное сопоставление
возможно, причем это приводит к весьма любопытным резуль-
татам. Поскольку в гидратирующемся цементе одновременно
содержатся и алюминатные фазы, и гидроксид кальция, реак-
цию с ними добавок второго класса первой группы можно
рассматривать как параллельную, т. е.
СаД,
— +ЗСа(ОН)2 + »,Н2О — ЗСа(ОН)2 • СаЛ2 ii,H2O
ЗСаО Л12О3 + 10Н20 — ЗСаО А12О3 СаЛ2 ЮН2О,
71
где .Y — анионы (Cl , NO3 . NO2 и некоюрые другие): — 13-16
Напомним, что речь идет о концентрации веществ в жидкой
фазе. В зависимости от содержания добавки или гидроксида
кальция в поровой жидкости возможна кристаллизация и дру-
гих двойных солей, например высокохлоридпой и высоконит-
ратнон форм гидрохлор- и гидронитроалюмината кальция:
ГХАК-3 и ГНАК-3, а также соответствующих низкоосновных
гидроксисолей.
В наиболее общем виде ло уравнение реакции удобно пере-
писать следующим образом:
—>- +/лСа(О11)2 + р 112О—-/и Са(ОН) 2 оСаЛ'2 /Я12О
н'СаУ2 ЗСаО • А120э+</Н2О~*г • ЗСаО • А12О3 •
• /1'СаХ2 • q Н2О,
где и:, г. р и <7 могут в зависимости от состава образующихся двой-
ных солейчидратов принимать различные значения.
Поскольку анализ действия многих добавок - индивидуаль-
ных и, особенно, комплексных — будет проведен на основе
представлений о последовательно и параллельно протекающих
реакциях, необходимо вкратце рассмотреть кинетические осо-
бенности последних.
Известно, что параллельными называют реакции, в которых
исходное вещество реагирует двумя и более независимыми
способами. В отличие от последовательных, скорость таких
конкурентных реакций определяется скоростью самой быстрой
стадии.
Так, если обозначить для схемы:
скорость первой реакции и,, второй — v2 и третьей - и при-
нять, Ч1о все эти реакции по веществу .1 имеют первый порядок,
го их отношение для случая СD*
♦Подробнее эти реакции рассмотрены в главе 3
72
И1 : V2 I ^3 ~ I ’• ^2 • ^з >
(2.15)
где А !, кг и А3 — константы скорости реакции.
Следовательно, и выходы продуктов параллельно протекаю-
щих реакций будут относиться друг к другу как константы
скоростей или как скорости этих реакций. Это приводит к
следующим важным для наших задач выводам: во-первых,
если Koiiciaina скоросш и скорость одной из реакций намного
больше других, то в первом приближении остальными можно
пренебречь. Однако при отсутствии других осложняющих реак-
ций или процессов (например, пленкообразования) принци-
пиально возможно одновременное протекание (хотя и с разны-
ми скоростями) всех параллельных реакций — независимо от
соотношения между константами их скоростей. Во-вторых,
поскольку общая скорость реакции зависит не только от кон-
центрации в жидкой фазе вещества А, но и от концентрации
других участников реакции, а они могут сильно отличаться
друг от друга, то в расчетах, касающихся выходов реакции,
следует принимать это во внимание.
Теоретический анализ показывает, что после того, как один
из компонентов смеси веществ, характеризующийся самым
большим выходом реакции, практически полностью прореаги-
рует, его место займет другой, в соответствии со значением
его константы скорости и т. д. Иными словами, в подобной
ситуации при исследовании добавок следует учитывать реаль-
ность их ’’эстафетного” действия, что представляется весьма
существенным.
Проанализируем с учетом изложенного условия протека-
ния параллельных реакций для перечисленных конкретных
добавок.
Как уже указывалось, в простейшем случае для параллель-
ных реакций первого порядка при одинаковой концентрации в
жидкой фазе С3А и Са(ОН)2, выходы продуктов реакции
|>лСа(ОН)2 и'СаХ2 /?Н2О] и [г -ЗСаО АкОз -n'Ca%2 -</Н2О] ,
относятся друг к другу как константы их скоростей.
Следовательно, возможны рассуждения и ”от обратного”,
т. е. если экспериментально установлен факт одновременного
выкристаллизовывания сопоставимых количеств указанных
труднорастворимых продуктов реакции и доказано, что кине-
тика этих процессов описывается уравнениями реакций перво-
го порядка (первый порядок наиболее характерен для гетеро-
генных взаимодействий), то можно сделать вывод — их кон-
станты скоростей близки.
Кроме того, как видно из зависимости
3- 182
73
[Ci] / [C2] = А, /А-2 ,
(2.16)
какими бы ни были отношения к J к2, никогда нельзя утверж-
дать, что образуется только один тип продуктов реакций. В
действи!ельности можно лишь говорить о преимущественном
выкристаллизовывании тех из них, концентрация или констан-
та скорости образования которых значительно выше, чем у
других соединений, если только обеспечиваются гсрмодина-
мические условия, необходимые для образования всех анали-
зируемых двойных солей-гидратов*.
Выводы, вытекающие из анализа уравнения (2.16), оказы-
ваются справедливыми и в случае, если параллельные реакции
имеют неодинаковый порядок. Однако при этом в правой части
уравнения (2.16) вместо отношения kjk2 фигурируют кон-
станты скоростей, деленные на концентрацию веществ в сте-
пени, на единицу меньшей, чем порядок реакции.
Ранее было показано, что в определенном диапазоне темпе-
ратур и концентраций для системы СаО-Са Х2 —Н2О наблюда-
ется образование гидроксисолей. Известно также, что при этих
же параметрах происходит взаимодействие добавок типа СаЛ2 с
алюминийсодержащими фазами портландцементного клинкера.
Таким образом, можно констатировать, что некоторое время
может существовать область температур и концентраций доба-
вок в бетоны, когда одновременно могут образовываться
оксисоли и соли типа ЗСаО - А12О3 С&Х2 нН2О. С помощью
представлений о протекании параллельных реакций удается
оценить и тот экспериментально зафиксированный факт, что
при затворении растворами хлорида или нитрата кальция бе-
литаалюминатного клинкера скорость кристаллизации ГХАК
или ГНАК соответственно выше, чем при введении этих же
добавок в алитоалюминатные клинкеры. Подобный феномен
можно объяснить тем, что из-за малого содержания в белито-
вом клинкере C3S реакция, приводящая к возникновению
двойных солей, протекает по схеме ЗСаО А12О3 + СаА2 +ЮН2О
-* ЗСаО • А12О3 • Са%2 • ЮН2О, где X = СГhj и NO7-
В отличие от этого, в клинкере, богатом алигом, обеспе-
чивающим длительное пересыщение поровой жидкости гидро-
ксидом кальция, возможны следующие параллельные реак-
ции :
ЗСаО • А12О3 + п Н2О
> + Са(ОН)2-*ЗСаО А12О3 Са(ОН)2-
«Н2О - (С4Аот/)
4 + СаУ2 — ЗСаО • А12 О3 Ca.V2 10Н2 О
•Мы не рассматриваем сейчас равновесие в изучаемых системах, при
котором состав конечных продуктов будет соответствовать диаграмме
равновесия.
74
При этом количества образующихся конечных продуктов
относятся друг к другу как скорости реакций Vj и и2, которые
в свою очередь (для реакций первого порядка) пропорцио-
нальны концентрациям в растворе участвующих в реакции
молекул (ионов), т.е.
_________________~ ~ Л|ССа(ОН)2
[ГХАК или ГНАК] v2 ^2^СаХ2
где и к2 - константы скорости реакции.
С этой схемой согласуется и то, что даже через 28 сут после
введения в алитоалюминатный клинкер добавки электролита,
в нем остается около 30% непрореагировавшего С3А, тогда
как в белитоалюминатном клинкере линии С3А к тому же
сроку практически не обнаруживаются. Естественно связать
это с повышенным экранирующим эффектом пленок в первом
из сравниваемых клинкеров. С другой стороны, более высокая
cieneiib гидратации алитоалюминатного клинкера, определяемая
ио количеству химически связанной воды, косвенно указывает
на возможность параллельной реакции, так как С4А aq содер-
жит больше молекул кристаллизационной воды (13—19), чем
гидрохлор- или гидронитроалюминат кальция.
Тот факт, что при этом в составе цементного камня фик-
сируются сопоставимые количества двойных солей, свидетельст-
вует о близости их кинетических констант. Однако точное
экспериментальное определение последних — дело будущего.
По-видимому, с этих же позиций следует подойти и к анализу
одновременного образования ГХАК-1 и ГХАК-3, а также
ГНАК-1 и ГНАК-3.
Напомним, что реакции присоединения характерны не только
для цемента, но и для других вяжущих: гидроксисоли образуют-
ся и при затворении хлоридом кальция и некоторыми другими
электролитами оксидов магния и кальция.
Итак, механизм действия добавок первой группы второго
класса удается достаточно хорошо понять, а кинетику их взаи-
модействия с вяжущими и продуктами их гидратации — во
мно1их случаях описать количественно на основе представлений
о !етерогенных реакциях, протекающих с торможением их
продуктами, а также о параллельно идущих реакциях и про-
цессах.
Отдельного рассмотрения заслуживает структурный — крис-
таллохимический аспект действия добавок второго класса,
особенно четко прослеживающийся при их введении в повы-
шенных дозах, что характерно для противоморозных добавок.
Этот аспект действия добавок был обнаружен нами при изу-
чении таких распространенных добавок, как хлорид и нитрат
75
Рис. 21. Зависимость прочности при сжатии
цементного камня от степени 1идрата-
ции а, алитовой составляющей портланд-
цемента
о — без добавок; х — с добавками НКМ и
ННХКМ
кальция, а также комплексных добавок на их основе, т. е.
он носит достаточно общий характер. Суть его заключается
в том, что при повышенной дозировке добавок второго клас-
са [например, СаС12, Ca(NO3)3 и их комбинаций] образуются
заметные количества игольчатых кристаллов гидроксихлоридов
и гидроксинитратов кальция — при реакции хлорида или нитра-
та кальция с гидроксидом кальция, выделяющимся при гидра-
тации алита, а также соответственно двойных солей — гидро-
хлор- или гидронитроалюминатов кальция — при взаимодейст-
вии добавок с C3AhC4AF.
Эти игольчатые кристаллы повышают плотность, а главное
микроармируют цементный камень. Положительное влияние
микроармирования хорошо прослеживается экспериментально.
Образцы цементного теста с добавками второго класса и без
них анализировали для определения степени гидратации в них
алита. Одновременно определяли прочность цементного камня
при сжатии. Оказалось, что в координатах ’’степень гидратации
алита” — ’’прочность” все опытные данные ложатся на две кри-
вые: одну для цементного камня без добавок, дру!ую — с
добавками (рис. 21). Эта последняя кривая расположена вы-
ше контрольной, причем особенно заметно различие между
ними на участке, соответствующем сравнительно невысокой
степени гидратации алита.
Полученный эффект нельзя объяснить ни аддитивным харак-
тером влияния двойных солей и гидроксисслей на прочность
цементного камня, поскольку их прочность невелика и ниже
прочности структур твердения гидросиликатсв кальция, ни ус-
коряющим твердение действием добавок, так как на кривых
76
отложена удельная прочность образцов, т. е. их прочность, от-
несенная к степени гидратации алита.
Следовательно, главная причина повышенной прочности
образцов с исследованными добавками обусловлена тем, что
в соответствии с механизмом действия добавок второго клас-
са происходит быстрое образование первичного структурного
каркаса из игольчатых двойных солей — гидратов и гидроксисо-
лей, обрастающего затем гидросиликатами кальция.
Как показывает рис. 21, для прироста прочности контроль-
ных образцов до 10 МПа требуется около 50 % алита, а для
образцов с добавками — всего 30 %. Итак, добавки электроли-
тов второго класса позволяют более рационально использовать
главную — алитовую составляющую цемента вследствие пере-
распределения доли участия силикатных фаз в формировании
структурного каркаса и в его обрастании (алитовая состав-
ляющая вносит основной вклад в прочность камня). Соответ-
ственно при сравнении кривых 7 и 2 на рис. 21 при одинаковой
степени гидратации алита оказалось, что в присутствии добавок
прочность образцов примерно на 10 МПа выше, чем контроль-
ных в широком интервале степени гидратации алита — от 30 до
80% [28, 87].
Естественно, что в связи с обрастанием гидросиликатами
кальция матрицы из двойных солей и гидроксисолей повыша-
ется и непроницаемость бетона в результате большей микропо-
рисгости структуры цементного камня.
Вторая подгруппа добавок первой группы отличается от
рассмотренных. Их основные отличительные особенности — об-
ра ование ими с составляющими цемента и продуктами их гид-
ратации молекулярных комплексов*, а не труднорастворимых
двойных солей-гидратов и невозможность по этой причине в
присутствии таких добавок формирования фазовых пленок
на зернах вяжущих.
Следовательно, представители добавок этой подгруппы,
связывая продукты гидратации цемента, т. е. исключая их из
участия в ионных реакциях, должны ускорять твердение бетон-
ной смеси (если только в основе их действия не лежит иной
механизм, оказывающий на вяжущие противоположное влия-
ние, например, адсорбция). Подобные добавки второй подгруп-
пы могут привести также к повышению растворимости мета-
стабильных фаз.
Число используемых добавок, о которых достоверно извест-
но, что по механизму действия они принадлежат ко второй
подгруппе первой группы, невелико. Это — карбамид и ам-
миак, реагирующие с гидроксидом кальция с образова-
* Речь идет об образовании в растворе комплексных ионов за счет
донорно-акцепторных связей.
77
Рис. 22. Кинетика растворения C3S в 2(Жиом растворе карбамида, про-
кипяченном в течение 5 мин
I - В/Т = 500; Г = +0,1°С; 2 - В/Т = 500, Г = +0,4°С; 3 - В/Т = 500;
t — —2°С; а — изменение концентрации кремнекислоты (в пересчете на
S>O2); б — изменение концентрации гидроксида кальция (в пересчете на
СаО) ; в — изменение молярного отношения концентрации гидроксида
кальция к концентрации кремнекислоты
нием комплексных солей, Са2 + 2 ОН' + «CO(NH2)2 -+
[CanCO(NH2)2] 2 + 20Н', где п = 1.. .4. По-видимому, к ним от-
носятся и некоторые амины, их производные и близкие к ним
соединения, что делает эти добавки в бетон весьма перспектив-
ными.
На рис. 22 показано, что в присутствии карбамида раствори-
мость трехкальциевого силиката растет. При этом соотношение
между ионами кальция и силикатными ионами в растворе в
течение некоторого времени сохраняется на уровне, близком
к 3, а затем возрастает [87]. Возможно, что в основе необычно
сильного повышения растворимости гипса в растворах хлорида
аммония также лежит комплексообразование. Использование
этих реакций может оказаться эффективным способом управ-
ления процессами твердения бетонов и заслуживает внимания.
С точки зрения представлений об уровнях структуры и о
реакциях образования молекулярных комплексов можно ска-
зать примерно то же, что говорилось раньше о добавках перво-
го класса: они вносят вклад в структурообразовапие через
изменение кинетики гидратации вяжущих, но не вследствие
их непосредственного участия в формировании цементного
78
камня. Следовательно, в этом отношении они ближе к добав-
кам первой подгруппы первого класса, чем второго.
Примечательно, что, поскольку в реакциях образования
• руднорастворимых твердых гидроксисолей и молекулярных
комплексов участвует гидроксид кальция (естественно, в
ионизированном виде), эти реакции также можно рассматри-
вав как параллельные, протекающие по схеме (на примере
введения хлорида кальция и карбамида) :
ЗСа(ОН)2 “* +СаС12 + aq ЗСа (0Н)2 СаС12 aq
J -* +3/1С0 (NH2) 2 — 3 [СанСО (NH2 )2 ] (ОН) 2.
Таким образом, и в данном случае знание таких кинети-
ческих характеристик, как константы скоростей реакции при
кристаллизации перечисленных веществ или их коэффициен-
ты молекулярной диффузии (для случая диффузионного конт-
роля за процессом), позволит в дальнейшем рассчитать выходы
конечных продуктов. Сейчас можно лишь констатировать, что
принципиально возможно одновременное образование и трудно-
растворимых двойных солей, и молекулярных комплексов,
что делает изучение и тех, и других весьма важным и перспек-
тивным.
2.3.2. Добавки второй группы, вступающие с вяжущими
веществами в обменные реакции
Добавки второй группы второго класса — самые распрост-
раненные и многочисленные, а многостадийные реакции, в
которых они участвуют, наиболее разнообразны. По особенно-
стям протекания реакций с их участием эти добавки можно
разделить на шесть основных типов. Подчеркнем, что, хотя
все добавки в одну группу объединяет участие в обменных
реакциях, технологический эффект от введения большинства
добавок второй группы обусловлен не только (а часто даже
не столько) этими реакциями, сколько другими, протекающими
вслед за обменными или параллельно с ними.
С учетом указанных дополнений мы предлагаем следующую
дифференциацию добавок второй группы.
1. Добавки - соли сильного основания и сильной или слабой
кислоты: NaCl, КО, NaNO2, KNO3, CH3COONa, NaN’Ch и т. д.
Для них характерно то, что во взаимодействие с алю-
минийсодержащими фазами цементного камня и портланд-
цементного клинкера в присутствии гидроксида кальция (вы-
деляющегося при гидратации алита) вступают только их анионы,
тогда как катионы сохраняются в поровой жидкости. Уравнение
79
реакции для этого типа добавок запишем в ионной форме* (на
примере поваренной соли).
4Са2 + 2А1О3 ~ + 2Na*+2СГ + 2ОН +ЮН2О~~
— Са3(А1О3)2СаС12 • 10Н2 О + 2Na* + 20Н'.
Как видно, в механизме действия добавок второй и первой
групп много общего, например, при введении в бетонную смесь
тех и других в составе продуктов реакции могут оказаться
одни и те же труднорастворимые двойные соли. Следовательно,
для таких добавок справедливы и основные закономерности
образования подобных продуктов реакции. Однако го обстоя-
тельство, что для добавок второй группы характерно протека-
ние обменных реакций, вносит новые элементы в кинетику
твердения бетонов. Прежде всего, если при реакциях присоеди-
нения анион и катион добавки связываются в труднораствори-
мые двойные соли или молекулярные комплексы в стехио-
метрических отношениях, то в результате обменных реакций
добавок первого типа в поровой жидкости концентрация ионов
щелочных металлов постоянна. Поэтому даже если труднсраст-
воримые продукты реакции добавок первой и второй групп
тождественны, то их экранирующая способность обычно неоди-
накова. Это объясняется тем, что в реакции образования .двой-
ной соли, в частности гидрохлоралюмината кальция, не участ-
вуют катионы добавки, а недостающие ионы кальция постав-
ляет гидратирующийся алит. Запишем реакцию между C3S и
какой-либо добавкой второй группы, например поваренной
солью, в молекулярной форме с учетом того что она протека-
ет последовательно:
2 |ЗСаО • SiO2] + 6Н2О ^Ca3Si2O2 +ЗСа(ЭН)2 ;
ЗСа (ОН) 2 + 3 [ЗСаО • А12 О3) + 6NaCl + 30Н2 О -*
—- 3 [ЗСаО • А12О3 • СаС12 - ЮН2О] + 6NaOH.
Поскольку скорость образования конечного продукта при по-
следовательно идущих реакциях определяется скоростью са-
мой медленной из них, то может оказаться, что лимитирующей
в течение некоторого срока будет реакция гидратации алита,
протекающая с диффузионным контролем.
Этим отчасти можно объяснить тот факт, что выкристаллизо-
вывание гидрохлоралюмината кальция при введении в бетон-
ную смесь добавок поваренной соли нли гидронитриалюмината
кальция при введении нитрита натрия протекает медленнее,
*Ионы кальция для реакции ’’поставляют” и С3А и C4AI , и гидрати-
рующийся алит; последний обеспечивает и гидроксильные ионы в стехио-
метрическом отношении к ионам кальция
80
чем кристаллизация аналогичных солей при добавлении со-
ответствующих солей кальция. Помимо этого нужно учесть
также, что присутствие одноименных гидроксильных ионов
несколько подавляе! гидратацию и гидролиз алита, а также
сдвигает равновесие рассмотренной реакции влево, значительно
уменьшая выход конечных продуктов.
Однако в присутствии подобных добавок в то же время
протекают и реакции, способствующие ускорению гидратаци-
онного твердения силикатных фаз. Так, если в ранее рассмот-
ренных реакциях присоединения участвовали алюминийсодер-
жащие фазы портландцементного клинкера или гидроксид каль-
ция, то в обменные вовлечены и те, и другие.
Следовательно, добавки второй группы первого тина могут
влиять па кинетику твердения C3S и (3-C2S не только через
изменение ионной силы раствора, но и непосредственно вслед-
ствие снижения в поровой жидкости концентрации ионов каль-
ция, выделяющихся при гидратации силикатных фаз цемента.
Таким образом, скорость всего процесса образования двой-
ной соли в присутствии добавок первого типа может лимити-
роваться стадией гидратации алита; добавка влияет на эту
стадию, изменяя ее скорость. В этом также проявляется специ-
фика действия подобных добавок. При их изучении необходи-
мо учитывать, что в связи с высоким значением pH поровой
жидкости увеличивается опасность щелочной коррозии запол-
нителя, а при наличии найтрий-ионов возможно образование
высолов на поверхности изделий и конструкций. Кроме того,
нужно учитывать также влияние, оказываемое остающимися
в растворе ионами на кинетику формирования и свойства пле-
нок иэ труднорастворимых солей. Аналогичная ситуация возни-
кает и при введении в бетонную смесь других добавок второй
группы, например алюмината или силиката натрия (см. ниже),
т. е. она весьма характерна для добавок этой группы.
2 Добавки - гидролизующиеся соли сильного основания и
слабой кислоты, не способные к образованию двойных солей,
подобных гидрохлор- или гидроацетоалюминату кальция, но вы-
кристаллизовывающиеся в результате реакции обмена в виде
труднорастворимых твердых продуктов.
В связи с высокой химической активностью алюминийсо-
держащих фаз цемента число таких добавок невелико, однако
они хорошо известны и доступны. Это — NaA102, Na2SiO3 и
K2SiO3. В ионном виде реакции, в которых участвуют эти
добавки (на примере алюмината натрия), можно записать так*.
‘Вопрос о структуре алюминатных ионов до сих пор не может счи-
таться решенным окончательно; одни полагают, что в щелочном растворе
содержатся анионы метаалюминиевой,_другие — ортоалюминисвой кис-
лот, в частности, в форме [Л1 (ОН)
81
2Na*+2АЮ2 + 4Ca2++ 80H”+ 1IH2O-----*
—*Ca3 (А10з)2 ' Ca(OH)2 • 13H2O + 2Na++ 20Н~
Важнейшая особенность действия подобных добавок — образо-
вание гидроалюминатов или гидросиликатов кальция, близких
по составу и свойствам к тем, которые возникают при гидрата-
ции портландцемента. Таким образом, они участвуют в форми-
ровании структуры цементного камня, не внося в него никаких
’’чужеродных” твердых фаз. Следовательно, эффект действия
подобных добавок при значительном содержании алита в це-
ментах мало зависит от их химико-минералогического состава.
Однако одновременно с указанными гидратными соединения-
ми образуются щелочи, которые остаются в поровой жидкости
и оказывают определенное влияние на процессы твердения бе-
тонов, причем не всегда желательное. Помимо их влияния на
силикатные фазы цемента и продукты его гидратации, а также
щелочной коррозии активного кремнеземного заполнителя
при введении в бетон подобных веществ нужно считаться с
изменением в их присутствии растворимости гидроалюми-
натов и гидросульфоалюмината кальция, что может неблаго-
приятно сказаться на долговечности бетона (по имеющимся
данным, значения произведения растворимости гидросульфо-
алюмината кальция в растворах щелочей примерно в 10 раз
больше, чем в воде).
На скорость гидратации алюминийсодержащих фаз цемента
они влияют примерно так же, как и на скорость гидратации
силикатных фаз (естественно, если не учитывать влияние одно-
именного алюминатного иона, т. е. рассматривать в данном слу-
чае действие на алюминатные фазы силиката калия).
Итак, в результате взаимодействия добавок второго типа
с цементом в жидкой фазе быстро накапливаются ионы II 3SiO4,'
Н28Ю42*и алюминатные ионы. После обычно непродолжитель-
ного индукционного периода (наличие которого, однако, доста-
точно характерно для твердения бетонных смесей с добавками
этого типа) начинается выкристаллизовывание кристаллогидра-
тов высокой дисперсности, образующих гель, который захваты-
вает в свои ячейки большое количество жидкой фазы и вслед-
ствие этого вызывает быстрое схватывание и последующее
интенсивное упрочнение цементного камня.
Состав геля зависит от аниона добавки: при введении си-
ликатов натрия или калия гель состоит преимущественно из
гидросиликатов кальция, а алюминат натрия способствует
образованию смешанного геля из гидроалюминатов и 1идро-
силикатов кальция. При этом соотношение между последними
во многом определяется количеством вводимой добавки и
степенью ее гидролиза.
82
Термодинамические расчеты, а также данные рентгеновского,
юрмографического и петрографического анализов подтвер-
дили описанную схему. Следовательно, для добавок второго
типа характерны убывающая во времени концентрация аниона,
участвующего в реакции образования труднорастворимого
соединения, и неизменная концентрация катиона, оказываю-
щею преимущественно физико-химическое влияние на процес-
сы гидратационного твердения вяжущих (он увеличивает ион-
ную силу раствора, понижает благодаря росту pH растворимость
гидроксида кальция и изменяет кинетику кристаллизации
новых фаз). Следует при введении солей натрия учитывать
также возможность высолообразования.
В результате этих реакций и процессов обычно значительно
ускоряются схватывание и твердение цемента. Такой характер
действия добавок четко прослеживается на пластограммах
(рис. 23).
Однако данные по кинетике твердения бетонов с подобными
добавками свидетельствуют, что в более поздние сроки (свыше
1 мес) их прочность нередко более низкая, чем у эталона (бе-
тона без добавки); имеются также сведения о понижении моро-
зостойкости бетона при введении в него значительных коли-
честв солей щелочных материалов, что должно приниматься
во внимание при их назначении.
Отрицательные эффекты, вызванные действием добавок
второго типа, удается исключить при введении в бетон метал-
лов, проявляющих амфотерные свойства, например железа,
алюминия (или его сплава с кремнием), так как в результате
окислительно-восстановительных реакций эти металлы обра-
зуют в бетоне соответственно гидроферриты, гидроалюминаты
и гидросиликаты кальция без одновременного обогащения
жидкой фазы щелочными ионами*.
2А1 + ЗСа(ОН)2 + 6Н2О — Са3 (Д1О3)26Н2О + 3H2t ;
Si + 2Са (ОН) 2 + дН2 О — 2СаО • SiO2нН2О + 2Н21.
Подобные добавки широко используются в качестве газо-
образующих в ячеистых бетонах, причем иногда их вводят в
тяжелые или легкие бетоны для повышения морозостойкости
изделий. В принципе, если в этом возникнет необходимость,
объем газовых полостей в бетоне при введении таких добавок
может быть уменьшен, например, путем изменения реологи-
ческих свойств бетонной смеси и сроков ее схватывания.
До сих пор мы рассматривали лишь добавки второго типа,
вводимые в портландцемент. Если использовать такие мономи-
неральные вяжущие, как CaSC>4 0,5Н2О, а также C3S и
‘Реакция может идти и до образования других гидроалюминатов и
гидросиликатов кальция.
83
Рис. 23. Кинетика изменения плас-
тической прочности растворных
образцов
I — без добавки; 2 — с добавкой
2% поташа; 3 — то же, 59' NaOH;
4 -- то же, 2% NaAIO2
P-C2S, то число добавок второго типа расширится. Правда,
при введении таких добавок в эти мономинер мы возникаю-
щие труднорастворимые продукты не всегда будут тождествен-
ны гидратным новообразованиям твердеющего цементного
вяжущего и соответственно возрастет роль пленкообразоваиия
и кольматации пор в процессе твердения изучаемых составов.
При этом добавки могут или вызывать формирование фазово-
выраженных экранирующих пленок на частицах вяжущего,
или твердение вяжущего не будет сопровождаться образованием
экранирующих пленок, в частности, потому, что молекулярный
объем новообразований меньше, чем молекулярный объем ис-
ходной фазы [согласно уравнению (1.36)], и поэтому продукты
реакции добавки с вяжущими и новообразованиями в основном
откладываются в поровом пространстве цементного камня,
кольматируя поры.
К добавкам, действующим по первому варианту, можно
причислить, например, фосфат натрия при затворении его раст-
ворами индивидуальных силикатных фаз цемента или гипсовых
вяжущих (с поправкой на то, что фосфат натрия — соль кислоты
средней силы), а к добавкам, действующим по второму вари-
анту, - поташ, соду, сульфид натрия и некоторые другие*. До-
бавка фосфата натрия, реагируя с вяжущим, образует трудно-
растворимый двузамещенный фосфат кальция, откладываю-
щийся в зависимости от ряда факторов в виде пленок разной
плотности и проницаемости, и поэтому может быть использована
в качестве модельной (напомним, что пленкообразование весьма
характерно для многих других добавок второй группы).
^Небезынтересно, что мстил- и этилсиликонаты натрия в общих чер-
тах взаимодействуют с гидроксидом кальция, выделяющимся при гид-
ратации алита, по близкой схеме. Одиако по ведущему признаку - гидро-
фобизации ими бетона - они отнесены к четвертому классу добавок и
будут рассмотрены позднее.
Как видно из уравнения реакции, CaS04 + Na2HPO4 + 21I2O-*-
-> СаНР04 • 2Н2О + Na2SO4, одновременно с пленками из
труднорастворимого фосфата кальция (С = 0,2 г/л) в поровой
жидкости оказывается сульфат натрия.
Существенно, что его влияние проявляется не только при
формировании пленки, но и на более позднем этапе, когда об-
разовавшаяся пленка экранирует зерна вяжущих. При этом
сульфат натрия, как и любой другой сильный электролит, не
содержащий одноименных с материалом пленки нонов, повы-
шает до известного предела (зависящего от его концентрации)
растворимость, а следовательно, проницаемость и долговеч-
ность пленки*. Кроме тоге, сульфат натрия ускоряет твердение
полугидрата сульфата кальция. В результате максимальное тор-
можение скорости твердения вяжущего в этом (как и в дру-
гих) случаях будет достигнуто при введении фосфата натрия в
такой концентрации, которая обеспечит наиболее удачное соот-
ношение в данных условиях между толщиной и плотностью
пленки. Отклонения от оптимума в сторону большего или мень-
шего количества добавки должны ухудшить зго соотношение
и снизить экранирующее действие пленок.
На рис. 24 приведены типичные данные, подтверждающие
экстремальную зависимость замедляющего влияния динатрий-
фосфата на процессы твердения гипсовых вяжущих. Коэффи-
циент торможения показывает, во сколько раз возросло время
до конца кристаллизации полугидрата сульфата кальция при
введении динатрийфосфата [66] .
Аналогичный эффект (изменение проницаемости пленки
в зависимости от концентрации и продолжительности его кон-
такта с сульфатом натрия или аммония) был получен и при
воздействии на C3S и 0-C2S динатрий- и диаммонийфосфата
[66].
Реакции при этом протекали с выделением на зернах C3S
и (3-C2S фосфата кальция переменного состава**. В остальном .
принципиальная схема реакции была аналогична рассмотрен-
ной ранее для гипсовых вяжущих.
Опыты проводили следующим образом: суспензию C3S
и (3-С2 S в водном растворе добавки взбалтывали в течение
разного срока, затем твердую фазу извлекали, отмывали раст-
вором фосфата кальция и спиртом, высушивали эфиром и
помещали в дистиллированную воду для определения кинети-
ки последующих фазовых превращений. Оказалось, что и в
этом случае экранирующая способность пленок зависела от
* В результате увеличения ионной силы раствора подобно тому, как
добавки первой группы первого класса влияли на твердение вяжущих.
**Из-за высокого pH поровой жидкости могут образоваться и средние
соли кальция.
Рис. 24. Зависимость коэффициента
торможения скорости твердения полу-
гидрата сульфата кальция от концент-
рации фосфата натрия при различной
удельной поверхности вяжущего (по
ПСХ-2)
1 - 5 = 590 м2/кг; 2 - S =770 м /кг,
3—5 =480 м /кг
времени предварительного контакта C3S и 0-C2S с раствора-
ми динатрийфосфата, что могло быть обусловлено главным
образом агрессивным воздействием на них среды.
Образование экранирующих пленок из двузамещенного
фосфата кальция на гидратирующихся силикатных фазах порт-
ландце ментного клинкера иллюстрирует рис. 25.
Положение о том, что тормозящий твердение эффект пленок
в большой мере определяется их толщиной и соотношением
между нею и диаметром зерен вяжущих остается в силе и при
пленкообразовании з присутствии добавок. В обычных поли-
дисперсных вяжущих следует принимать во внимание как
усредненное значение радиуса зерен, так и распределение зерен
по размерам, причем при необходимости обеспечить наиболее
сильное торможение процесса в присутствии добавок второй
Рис. 25. Кинетика фазовых превращений в воде C3S (1)h0-C2S (2)
I и 2 - C3S и fl-CjS, не подвергшиеся обработке; 1' 2'- то же, подверг-
шиеся предварительной обработке в 1%-м растворе диаммоиийфосфата
1 руины нужно стремиться к использованию вяжущего с мини-
мальным содержанием наиболее тонких фракций. Значительное
пересыщение, обеспечивающее высокую скорость образования
новой фазы на надмолекулярном уровне, — условие совер-
шенно необходимое (хотя и недостаточное) для хорошего
пленкообразования. Здесь мы еще раз встречаемся с необхо-
димостью учитывать при оценке экранирующей способности
пленки уровни структуры и последовательность перехода от
надмолекулярного к субмикроскопическому, а иногда - микро-
скопическому уровню. Требование к соотношению между раз-
мерами зерен вяжущего и диаметром пленки исходя из струк-
турного фактора можно сформулировать так: наиболее жела-
тельно, чтобы размеры исходной фазы относились бы к микро-
скопическому, а конечной — к субмикроскопическому уровню
(при этом диаметр пор пленки может быть отнесен к надмо-
лекулярному и, частично, к субмикроскопическому уровню).
Естественно, что экранирующий эффект будет наблюдаться
и при меньших различиях между диаметром зерна и толщиной
пленки, но особенно значителен он будет при выполнении сфор-
мулированных требований.
Опыт (рис. 26, 27) полностью подтверждает этот вывод
[65] : в зависимости от удельной поверхности (а следователь-
но, эффективного диаметра частиц) коэффициент торможения
т/то может изменяться в весьма широких пределах. Максималь-
ное значение т1т0 (кривая 3) было получено для гипсовых
вяжущих, содержащих, но данным седиментомегрического
анализа, наименьшее количество частиц диаметром до 5 мкм,
соответствующих обычно достигаемой толщине пленки двуза-
мещенного фосфата кальция.
Разумеется, коэффициент торможения добавками процессов
твердения вяжущих зависит и от габитуса поверхности зерен,
кристаллографической близости материала пленок с новообра-
зованиями — продуктами гидратации вяжущих и т. д. В этом
отношении рассмотренная модельная система особенно инте-
ресна, так как двузамешенный фосфат кальция изоморфен с
гипсом и, кроме того, имеет одинаковые с ним молекулярный
объем и плотность. Следовательно, если бы не формирование
пленок на зернах гипсовых вяжущих, то СаНРО4 • 2Н2О должен
был бы как затравка ускорять их твердение. Для полиминераль-
ных цементов по понятным причинам отмеченные закономер-
ности пленкообразования можно рассматривать в основном
лишь в качественном плане.
В качестве примера добавок того же типа, действующих по
второму варианту (преимущественная кольматация пор трудно-
растворимыми продуктами реакции), рассмотрим взаимодейст-
вие поташа с гипсовыми вяжущими или силикатами кальция
CaSO4 + К2СО3—*• СаСО3 + K2SO4. Расчет показывает, что
87
Рт.МПо
Рис. 26. Кинетика изменения пластической прочности цементно-песчаного
раствора без добавок (1) и с добавкой сульфата железа Ш (2)
образующийся при этом труднорастворимый карбонат кальция
(ПР — 4,8 Ю-9 моль2 /л2), имеет молекулярный объем 1'к,
составляющий всего 0,69 молекулярного обьема полугидрата
сульфата кальция (и лишь 0,4 VK гипса). Поэтому добавка по-
таша, как и соды, способна в основном ускорять твердение
мономинеральных вяжущих (в данном случае аналогично то-
му, как это наблюдалось при введении в CaS04 • 0,5Н20 доба-
вок сульфатов щелочных металлов, т. е. добавок первого клас-
са) .
Кроме того, труднорастворимые продукты реакции способ-
ны уменьшить проницаемость изделий. Если же в качестве объ-
екта исследования выбрать силикатные фазы цемента, то опре-
деляющими темп твердения будут силикаты щелочных метал-
лов. Реакция (на примере белита и поташа) запишется в виде-
Ca2SiO4 + 2К2СО3—*-2СаСО3 + K4SiO4.
Следовательно, в подобном случае механизм этих реакций
по основному ведущему признаку смыкается с механизмом
действия рассмотренных ранее силикатов и алюминатов нат-
рия (калия), но осложняется выкристаллизовыванием мало-
растворимой соли, кольматирующей поры бетона.
При сравнении обоих вариантов особенно четко видна раз-
ница между ними: если в первом варианте пленкообразование
в присутствии добавок приводило к торможению гидратации
и, как следствие, — схватывания и упрочнения материала, то во
втором добавки проявляют себя только как сильные ускори-
тели схватывания и твердения бетона. Естественно связать эти
различия с химическим составом добавок, поэтому при ана-
лизе механизма их действия необходимо учитывать роль и
их аниона, и катиона.
3. Добавки - соли сильного основания и сильной, умеренно
сильной и слабой кислот, анионы которых образуют с ионами
кальция труднорастворимые соединения (такие, как Na2CO3;
К2СО3, а также NaF и им подобные вещества) при их введении
в портландцемент Такие добавки в присутствии гидроксида
кальция способны к реакциям по первому (подобно NaCl)
и по второму типу (аналогично Na2HPO4), но с разными вы-
ходами, т. е. по схеме:
ЗСаО • А12 О3 + 2Na2 СО3 + 2Са (ОН) 2 + 1 1Н2 О
-*4NaOH + ЗСаО • А12О3 • СаСО3 • 11Н2О + СаСО3.
Т
В последнем случае образуются два трудно растворимых про-
дукта, один из которых представлен двойной солью, содержа-
щей атомы алюминия (или железа).
С некоторыми оговорками относительно близости раство-
римости гипса и гидроксида кальция к добавкам такого рода
можно отнести Na2SO4 и K2SO4 при их введении в цементные
бетоны. Однако в их присутствии процесс, по-видимому, сильно
смещен в сторону образования гидросульфоалюмината кальция.
4. Добавки кислот, вступающих с гидроксидом кальция в
реакции нейтрализации (например, соляной, серной, щавелевой,
лимонной, янтарной).
В этом случае односторонность (необратимость) реакции,
как известно, обеспечивается образованием малодиссоцииро-
ванных молекул воды. Однако обычно реакция практически
полностью смещена вправо еще и потому, что после нейтрали-
зации кислоты и восстановления pH среды до близкого к преж-
нему уровню происходит также выкристаллизовывание
труднорастворимых соединений.
Таким образом, основное отличие рассмотренной реакции
от реакций первых трех типов заключается лишь в ее первой
стадии — нейтрализации кислоты гидроксидом кальция с об-
разованием соответствующих солей. Однако, как и в • -
рассмотренных случаев, вторичные реакции, приводят
образованию пленок или кольматации пор, могут иметь г лю
щее значение при выборе добавок. Здесь также удается диф-
ференцировать добавки кислот по способности их аниона к
образованию с€3Аи C4AF клинкера солей-гидратов типа гидро-
хлор- или гидросульфоалюмината кальция при введении в бе-
тонную смесь НС1 и Н2 SO4 или с гидроксидом кальция — труд-
норастворимых солей, например фосфата или щавелево-кисло-
го кальция — при использовании в качестве добавок соответ-
ственно ортофосфорной или щавелевой кислоты.
Знание механизма действия добавок второй i руины позво-
ляет эффективно использовать их в фактических целях,
для обработки поверхностных слоев изделий с целью повы
их непроницаемость и механические характеристики ис
зуют так называемые флюаты, к числу которых относ
фтористоводородная кислота и ее растворимые соли, те.,
бавки, действующие по описанному механизму. Близкий эф;
фект можно ожидать и от обработки поверхностного слоя
тона щавелевой кислотой. ол
5. Добавки — соли сильной кислоты и слабого основании
(например, азотно-кислые, соляно-кислые и серно-кислые сц:
ли аммония, железа (II) и железа (HI), алюминия, цинка и.
т. д. [79]).
Учитывая широкие возможности производства и использо-
вания добавок этого типа, постараемся подробно проанализи-
ровать механизм их действия с тем, чтобы объективно оце-1
нить ожидаемую эффективность их применения и определить'
области их рационального использования.
Как известно, в воде добавки — соли аммония подвергаются
гидролизу, протекающему по схеме:
NH4 + + H2O^rNH4OH + Н+.
В отношении подобных добавок сохраняется в силе все ска-
занное ранее по поводу механизма действия кислот, включая
последующие реакции их анионов. Новым моментом является
дополнительное влияние слабого основания — гидроксида
аммония, способного к комплексообразованию с ионами
кальция.
К более сложным и перспективным относятся добавки —
соли двух- и особенно трехвалентных металлов. Гидролиз
подобных солей [на примере солей железа (III)] протекает
ступенчато и сопровождается увеличением кислотности вслед-
ствие образования полностью диссоциированной сильной кис-
лоты:
• Fe3* + H2O^r [Fe(OH)]2++ Н* ,
•и
t,.,£Fe(OH)]2+ + H2O^[Fe(OH)2]++H+;
3) [Fe(OH)2]++ Н2О=±Те(ОН)3 + H+
или суммарно Fe3'+ ЗН2О*^ Fe(OH)3 + 3Ht
Кроме того, на стадиях 1 и 2 образуются основные .соли,
а на последней — труднорастворимые гидроксиды металлов,
способные коль матировать поры и уплотнять бетон.
Итак, общим признаком таких добавок является их спо-
собность к реакциям нейтрализации.
Сильное подкисление раствора в результате гидролиза и
’♦зование при этом гидроксида металлов существенно сказы-
'£я на кинетике гидратационного твердения цемента и его
♦Вых превращений и на составе новообразований цементно-
камня — особенно в раннем возрасте [напомним, что pH
%-го раствора Fe2(SO4)3 при 20°С приблизительно равно
шице] . В таких условиях невозможно возникновение соеди-
ний, характерных для твердеющего цемента, а происходит
♦менная реакция добавки с гидроксидом кальция с образо-
<нием аморфного гидроксида железа (на примере сульфата
келеза) Fe2 (SO4)3 + ЗСа(ОН)2 + 6Н2О = 2Fe(OH)3 + 3CaSO4
2I12O.
Термодинамические расчеты показали, что равновесие реак-
1ии достигается при pH = 7,51. При этом изобарно-изотерми-
юский потенциал реакции достигает больших значений
(-504,8 кДж/моль) [72] .
Однако в силу низкого значения произведения раствори-
мости Fe(OH)3 его образование происходит до протекания
указанной реакции обмена; pH, при котором Fe(OH)3 начи-
нает осаждаться (например, для раствора Fe2(SO4)3 0,5%-й
онцентрации), по подсчетам [72, 83] , составляет 2,12 и еще
олее снижается с увеличением активной концентрации иона
е3+ в растворе.
Следовательно, в данном случае гидроксид железа образу-
тс>‘ с первого момента контакта раствора добавки с Йемен-
ом, а затем в осадок выпадает гипс-двугидрат. Безусловно,
что оба процесса в связи с быстрым насыщением жидкой фазы
гидроксильными ионами протекают практически одновременно.
В результате образования аморфного гидроксида железа
♦ачальная пластическая прочность Р повышается и зависит
ак от концентрации раствора, так и от вида аниона добавки
i см рис. 26). Так, при введении в бетонную смесь добавок
90
91
Fe2 (S04)3 или FeCl3 образуются соответственно CaSO4 2H2O
и СаС12 [в результате реакции добавок с Са(ОН)2], оказыва-
ющие различное влияние на начальную пластическую прочность
этой смеси.
Гипс, выкристаллизование которого при введении сульфата
железа возможно и при низком pH, участвует в структурооб-
разовании на ранней стадии твердения бетона, тогда как в кис-
лой среде при добавлении FeCl3 или Fe(NO3)3 гидрохлор-
и гидронигроалюминаты кальция нс образуются.
Повышенная концентрация водородных ионов (точ::е<1
ионов гидроксония) способствует увеличению Р еще и потому,
что высокодиспсрсный гидроксид жслсэа, выделяющийся в
кислой среде, размещается между зернами цемента. При эюм
увеличивается число контактных связей, обеспечивающих
прочность системы. Кроме того, частицы гидроксида железа
образуют структурированные гелеобразные агрегаты, в ячей-
ках которых иммобилизируется жидкая фаза. В результате
пластическая прочность пасты в целом возрастает, несмотря на
то, что в этот период упрочнения структуры вследсгвие гидра-
тационного твердения вяжущего еще не происходит.
Опытные данные свидетельствуют, что сульфат железа в
ранние сроки увеличивает количество химически связанной во-
ды и повышает тепловыделение [72, 83] ; это обусловлено
увеличением скорости гидратации цемента (см. рис. 27).
В результате гелеобразного характера новообразований*
усадка бетона в начальное время несколько повышается (0.2—
0,4% за 1 сут), повышается также набухание при водном хра-
нении образцов (рис. 28).
Таким образом, хотя реакция нейтрализации в бетонной
смеси протекает весьма интенсивно и уже через несколько
минут щелочность жидкой фазы достигает pH = 12,5 (рис. 29),
но вследствие низкого значения pH в момент контакта цемента
с раствором добавки (как и до этого) мы имеем дело с гетеро-
генным процессом, что сильно сказывается на скорости реакции
и на некоторых свойствах бетона.
В последующем, когда щелочность поровой жидкости дости-
гает обычного для нее значения (pH ^12), становятся возмож-
ными реакции, протекающие с участием как аниона добаь'кч,
так и в некоторых случаях и его катиона (в зависимое in от
валентности последнего). Если катион обладает основными
свойствами (например, в соединениях типа FeS04 или FeCl2),
то гидроксид сохраняется в бетоне неопределенно долго**,если
* Не только за счет гидроксида железа, но и вследствие ускорения
гидратации составляющих цемента, а также последующего образования
гидроферритов кальция и двойных солей, молекулы которых содержат
атомы железа типа гидросульфоалюмоферритов кальция.
•*При условии, что железо (II) не окисляется кислородом воздуха до
железа (III).
92
Рис. 28. Кинетика гидратации цемент-
ного теста
I - без добавки; 2 — с добавкой 2%
сульфата железа III; 3 — то же, 4%;
4 - то же, 6%
же катион обладает амфотерными свойствами (трехвалентное
железо или алюминий), то он в щелочной среде превращается
в соответствующий кислородсодержащий анион.
Интересно при этом сопоставить между собой поведение в
бетоне аналогичных соединений железа (Ш) и алюминия. Так
как в момент затворения цемент контактирует с кислыми
растворами, то вначале различия в природе А13 и Fe3 за-
метно не проявляются. Однако при повышении pH среды раз-
ница в поведении катионов Fe3+ и А13+ становится все более
ощутимой, так как растворение А1(0Н)3 начинается уже при
pH = 7,5, а при pH = 11 гидроксид алюминия полностью пере-
ходит в соответствующий алюминат, тогда как ранее образо-
вавшийся Fe(OH)3 переходит в труднорастворимый гидрофер-
рит кальция при более высокой щелочности среды в результа-
те протекания ионной реакции Са2+ + 2Fe3++ 80H~-»-Ca(FeO2)i
• нН2О + (4 —л)Н2О или ЗСа2* + 2Fe3+ + 120Н~-^ЗСаО •
Fe2O3 - 6Н2О.
------—-----
Итак, образование гидроферритов кальция — сложный много-
стадийный процесс, включающий как их выпадение в осадок
по приведенной выше схеме, так и растворение гидроксида
железа (Ш). По-видимому, вначале кинетика этого гетероген-
ного процесса определяется скоростью выделения гидрофер-
ритов кальция из пересыщенного по отношению к ним раство-
ра; в дальнейшем лимитирующей может стать скорость раство-
рения Fe(OH)3.
. Вследствие того, что часть катиона добавки связывается
в труднорастворимый высокодисперсный гидроферрит каль-
ция, который, как и гидрогель гидроксида железа, способен
кольматировать поры цементного камня, непроницаемость
бетона при введении в него солей железа (III) увеличивается.
Повышению непроницаемости бетонов способствуют также
реакции анионов изучаемых добавок с химически активными
алюминий- и железосодержащими фазами портландцемента,
в результате которых образуются труднорастворимые двойные
93
pH /
Об 16 zy
Рис. 29. Влияние добавки сульфата желе-
за - 1>1 на кинетику изменения pH цемгнт-
ного теста
1 — без добавки; 2 — 2% добавки; 3 то
же, 6%
соли-гидраты. Кроме того, при соответствующе» щелочности
среды железо (Ш) из добавки или цемента (в обоих случаях
атомы железа входят в состав аниона) может замещать либо
часть алюминия в этих соединениях, образуя гидросульфо-,
гидрохлор- или гидронитроалюмоферриты кальция, либо об-
разовывать изоморфные с ними гидросульфо-, гидрохлор-
и гидронитроферриты кальция, не содержащие заметных ко-
личеств алюминия.
Таким образом, катион исследуемых добавок может участ-
вовать в следующих параллельных реакциях [на примере
Fe2 (S04)3]:
Fe3+
—Ca(FeO2)2 -aq (или Ca3(FeO3)2 aq~)
— ЗСаО A12O3 • Fe2O3 • 3CaSO4 31H2O
—*3CaO • Fe2O3 • 3CaSO4 •31H2O*,
причем первоначальный выход каждой реакции определяется
ее относительной скоростью**, а конечные соотношения между
новообразованиями — их термодинамическими характерис-
тиками: растворимостью, произведением растворимости,
pH и др.
Отсутствие в литературе этих термодинамических данных
делает невозможным пока количественную оценку указанных
зависимостей. Однако результаты петрографических исследова-
ний модельных систем [72] (в том числе полученные путем
сливания соответствующих растворов) с параллельным хими-
ческим и рентгеновским анализами донной фазы (табл, il)
качественно подтвердили правильность описанной схемы и
возможность превращений во времени одних из образующихся
веществ в другие.
Таким образом, трансформация гидроксида железа в гидро-
феррит кальция — гетерогенный многостадийный процесс,
скорость которого сравнительно невелика. Поэтому было
* Гидросульфоферрит кальция может образоваться нс только в резуль-
тате реакции между добавкой Fc2 (SO4)3 и гидроксидом кальция
**Т.е. отношением скорости этой реакции к скорости самой медленной
из них.
94
Таблица 11. Кинетика изменения фазового состава новообразований
при воздействии сульфата железа (III) на гидроксид кальция
Время от качала опыта Система Fe2(SO4)3 — Са (ОН)2 - Н2О
показатель преломле- ния фазовый состав новообразований
30 с ~ 1, Ге(ОН)3 п Н2О
1,523, 1 532 CaS04 2Н2О
1 ч 1,523; Гипс с включением соединений железа
1,532 1,665 ЗСаО Ге2О3 6Н2О
3 сут 1,493 ЗСаО. 1«е2О3 3CaSO4 31Н2О
1,523, 1,532 CaSO4 2Н2О
1,665 ЗСаО Fe2O3 6Н2О
предложено [83] осуществлять указанные реакции раньше,
до затворения бетонной смеси, т. е. вынести их из бетонной
смеси в емкость для хранения добавки. Для этого в водный
раствор добавки вводят гидроксид кальция или цемент в ко-
личестве, необходимом для получения гидроферрита кальция.
Затем суспензию перемешивают и в таком виде применяют.
Одновременно раствор добавки нейтрализуется, что уменьшает
опасность коррозии емкостей, коммуникаций, дозаторов и
бетономешалок.
В практическом отношении соли железа как добавки инте-
ресны тем, что, помимо увеличения непроницаемости бетона
за счет кольматации пор и улучшения структуры цементного
камня, они повышают деформативность бетона (в этом прояв-
ляется положительное влияние железосодержащих аниона либо
катиона) и его долговечность, а при введении добавок сульфата
железа (рис. 30) также и его сульфатостойкость (прежде всего
вследствие образования гидросульфоалюмината, гидросульфо-
алюмоферрита и возможно гидросульфоферрита кальция).
Сильное ускорение схватывания бетонной смеси и твердения
бетона с добавками этого типа (включая соли алюминия) позво-
лило рекомендовать их для применения в набрызг-бетонах.
Однако при практическом использовании добавок пятого
типа необходимо принимать во внимание кислую реакцию их
водных растворов.
Пониженное значение pH жидкой фазы, обеспечиваемое
подобными добавками, положительно сказывается на поведе-
нии так называемых ’’лежалых” цементов, активность которых
понижена вследствие карбонизации и возможно поверхностной
гидратации. Хотя способность улучшать технологические свой-
ства бетонной смеси, а впоследствии строительно-технические
95
Рис. 30. Кинетика изменения от-
носительной прочности бетона в
10%-м растворе сульфата натрия
I — бетон без добавки; 2 - с до-
бавкой 2% сульфата железа Ш;
3 - то же, 4%
показатели бетона на лежалых цементах присуща и ряду других
добавок электролитов, для солей слабого основания и сильной
кислоты она наиболее характерна.
Кроме того, при взаимодействии добавок пятого типа с
вяжущими или продуктами их гидратации мо.ут проявляться
особенности, присущие добавкам всех перечисленных выше
типов.
6 Добавки, способные к образованию с кальции-ио нами
прочных молекулярных комплексов или комплексных ионов.
К ним относится, например, натриевая соль зтилендиаминтетра-
уксусной кислоты (трилон Б), реагирующая с ионами кальция
с образованием трилоната кальция [в кислой области эта же
соль взаимодействует с ионами алюминия (при pH ~ 5) и же-
леза (pH х 2)]. Хотя неизвестно о широком применении
подобных веществ в качестве добавок в бетоны, сам факт
возможности подобных реакций позволяет предполагать, что
этот эффект удалось бы использовать для регулирования про-
цессов твердения вяжущих.
Если подойти к оценке добавок второй группы с позиций
уровней структуры, то и в этом они близки к добавкам пер-
вой группы; отметим также, что комплексообразующие добав-
ки второй группы по роли в формировании структур твердения
также сходны с соответствующими добавками первой груп-
пы. Следовательно, добавки второго класса могут быть оценены
с единых позиций в отношении их влияния на структуру цемент-
ного камня и текстуру бетона. Кроме того, уже сейчас ясны
основные закономерности протекания важнейших реакций и
процессов между добавками и вяжущими или продуктами их
гидратации; удается учесть также побочные эффекты и объяс-
нить их источники.
В результате становится возможным описать кинетику фазо-
вых превращений в твердеющем цементном тесте, а также пред-
усмотреть качественное влияние этих добавок на процессы
твердения бетонной смеси и свойства бетонов. В этом, а также
в обоснованном подборе новых перспективных добавок в
бетоны и их научной систематизации мы видим главную цель
теоретического изучения добавок
96
24. ДОБАВКИ ТРЕТЬЕГО КЛАССА - ГОТОВЫЕ ЦЕНТРЫ
КРИСТАЛЛИЗАЦИИ (КРИСТАЛЛИЧЕСКИЕ
ЗАТРАВКИ)
Влияние добавок третьего класса на процессы твердения
вяжущих поддается качественному теоретическому анализу.
Как известно, из всех этапов процесса кристаллизации наиболее
затруднительно возникновение новой фазы из пересыщенного
раствора. Кристаллические затравки облегчают выделение но-
вой фазы из пересыщенных растворов и поэтому их введение
целесообразно прежде всего тогда, когда скорость процесса
кристаллизации новообразований определяет скорость твер-
дения вяжущего. Следовательно, прямой ускоряющий тверде-
ние эффект от применения затравок зависит от типа вяжущего:
если оно принадлежит к первому типу (CaSO4-0,5Н2О).ско-
рость процесса твердения которого в течение достаточно дли-
тельного периода времени (по отношению ко всему времени
твердения) лимитируется стадией кристаллизации как самой
медленной, то затравки выступают как сильные ускорители,
если же оно принадлежит ко второму типу (как, например,
составляющие цемента, процесс твердения которых вскоре
после их затворения водой лимитирует стадии растворения
исходной фазы, на которую добавки — готовые центры кристал-
лизации непосредственно не влияют), то их введение не может
заметно ускорить процесс твердения.
Эксперимент полностью подтвердил эти теоретические пред-
положения. Затравки гипса CaSO4 • 2Н2О к полугидрату суль-
фата кальция известны и широко используются в качестве
хороших ускорителей его гидратациоиного твердения* тогда
как гоберморит почти не изменил кинетику превращений в
воде двухкальциевого гидросиликата, которая изучалась путем
анализа твердой и жидкой фаз, трехкальциевый гидроалюми-
пат — кинетику гидратации С3А, а добавка гидросульфоалюми-
ната кальция — кинетику его образования из С’з А и гипса.
Аналогичные данные были получены и при введении затравок
из гидросиликатов кальция и С3АН6 на процессы твердения
цементов, хотя имеются указания об эффективности введения
добавок третьего класса в цементные бетоны [15] .
В полном соответствии с теорией находятся и результаты
многочисленных опытов по введению затравок в гипсовые вя-
жущие [65, 66] , порог их эффективности зависит от дисперс-
ности затравки: чем тоньше ее помол, тем меньше концентра-
ция, обеспечивающая максимальное ускорение процесса схва-
тывания и твердения гипсовых вяжущих.
*В качестве сильного ускорители твердения полугидрата сульфата
кальция может быть использован и изоморфный с гипсом двузамещенный
фосфат кальция СаИРО4 2Н2О
97
Рис. 31. Кинетика твердения полугид-
рата сульфата кальция с добавкой дву-
гидрата сульфата кальция (1). и без до-
бавки (2)
Порог эффективности характерен и для добавок других
(в частности, первого) классов. Если, однако, для электроли-
тов кривая изменения скорости гидратации от концентрации
добавки носит экстремальный характер, то при введении за-
травок после достижения порога эффективности дальнейшего
изменения скорости процесса не происходит. Это можно было
предвидеть, так как указанное положение вытекает из теории
действия добавок третьего класса: они ускоряют стадию крис-
таллизации так сильно, что она перестает лимитировать весь
процесс твердения вяжущего. При этом твердение вяжущего
первого типа ускоряется только благодаря облегчению возник-
новения новой фазы, а не ее роста. На рис. 31 показано, что в
присутствии затравок темп упрочнения гипсобетона не изме-
няется: сокращается лишь продолжительность начальной стадии
процесса. Такая закономерность вообще типична для механизма
действия готовых центров кристаллизации.
Экспериментальные и теоретические данные совпадают и при
анализе влияния добавок на прочность вяжущих первого типа.
Мы уже подчеркивали, что формирование цементного камня,
начинаясь на надмолекулярном уровне, для основных фаз
завершается на субмикроскопическом и лишь для некоторых
новообразований (например, гидроксида кальция, не вносящего
серьезного вклада в прочность бетона), — на микроскопическом
уровне.
Введение затравок, дисперсность которых находится в об-
ласти субмикроскопического или микроскопического уровня,
резко снижает вероятность флуктуационного возникновения
зародышей кристаллизации из гомогенной фазы, поскольку
при этом превалирует рост кристаллов на внесенных извне
готовых центрах. Следовательно, ухудшаются условия форми-
рования структур вследствие уменьшения поверхности кон-
98
гик iob между частицами, в том числе условно-коагуляцион-
ных и кристаллизационных. В результате прочность бетонов на
’’быстротвердеющих” вяжущих первого типа с затравками
снижается: малоощутимо при невысоких и значительно при
больших дозах затравок.
Однако эта общая зависимость может иногда не соблюдаться,
что не только не противоречит теории, но, наоборот, подтверж-
дает ее. Речь идет о тех сравнительно редких случаях, когда
затравки, например, могут частично снять внутренние напря-
жения и или перераспределить их.
Итак, добавки — готовые центры кристаллизации или не
могут заметно ускорить процессы твердения вяжущих (когда
речь идет об основных составляющих нортландцеменгного
клинкера), или, ускоряя процесс твердения полугидрата суль-
<I>aia кальция, снижают конечную прочность материала.
Иные результаты получаются вследствие косвенного дей-
ствия этих добавок. Так, в ряде случаев наблюдается ускоряю-
щий эффект от введения в портландцемент добавок гидросуль-
фоалюмината кальция [71] • Механизм действия частиц ।
ГСАК-3 в этом случае заключается в том, что на них как на
готовых центрах кристаллизации преимущественно осаждается
выкристаллизовывающийся из жидкой фазы гидросульфоалю-
минат кальция, в связи с чем уменьшается его экранирующее
действие. Как следствие, процесс твердения цемента в бетоне
ускоряется благодаря более быстрой гидратации его силикат-
ных фаз (в основном алита). При этом может быть достигнута
и большая прочность бетона.
Правильность предложенной схемы побочного действия доба-
вок гидросульфоалюминага кальция ГСАК-3 к портландцемен-
ту подтверждается данными по кинетике гидратации его сили-
катных фаз, полученными рентгеновским методом, и изменению
состава жидкой фазы суспензии из этого же цемента.
Эксперимент показал, что введение ГСАК-3, особенно сов-
местно с гипсом, ускоряет гидратацию силикатных фаз цемента
(рис. 32), хотя для этих фаз он, имея совершенно иные кристал-
лохимические параметры, не может служить затравкой. При
этом кинетика изменения концентрации силикатных ионов в
растворе также носит иной характер*.
Следовательно, добавки — готовые центры кристаллизации
удается дифференцировать по ускоряющему (прямому или
косвенному) действию на процессы гидратационного твердения
вяжущих, т. е. по влиянию на скорость кристаллизации основ-
ной структурообразующей фазы или на условия выкристалли-
зовывания пленок, а значит, и на их экранирующую способность.
’Добавка ГСАК-3 была выбрана нами как индивидуальная и удобная
в методическом отношении.
99
Рис. 32. Кинетика изменения концентрации силикатных ионов при
твердении портландцемента
I — без добавки; 2, 3, 4 — соответственно 3, 8 и 12% тоберморита;
5 — 8% тоберморита + 4% гидросульфоалюмината кальция; 6 — 8%
тоберморита + 6% ГСАК-3; 7 — 10% ГСАК-3
Таким образом, эффективность добавок третьего класса мо-
жет быть повышена за счет их косвенного действия на бетоны,
если одновременно каким-либо физическим методом, например
мокрым помолом, удалять пленки [71].
Поскольку, однако, добавки — готовые центры кристаллиза-
ции при введении в ’’медленнотвердеющие” вяжущие второго
типа влияют, главным образом, на пленкообразование, их ус-
коряющий твердение эффект неустойчив, не одинаков для
цементов разного химико-минералогического состава и плохо
воспроизводим даже для бетонов на цементах одною и того же
состава и возраста. Это не означает, что добавки третьего клас
са бесперспективны; их применение может быть целесообраз-
ным в комбинации с другими добавками Очень сильное из-
мельчение также повышает эффективность таких добавок.
Они могут успешно использоваться в сочетании с физическими
методами ускорения процессов твердения, при этом результат
может быть неаддитивным.
Кроме того, как уже отмечалось, они как ускорители твер-
дения приносят пользу при их введении в вяжущие первого
типа, причем в зависимости от темпера!уры, наличия добавок
электролитов и ПАВ и некоторых других факторов отдельные
вяжущие в принципе могут быть отнесены к одному или к
другому типу. Следовательно, открывается перспектива ис-
100
пользования затравок и для индикации — выявления контро-
лирующей стадии при гидратационном твердении вяжущих в
конкретных условиях и последующего обоснованного выбора
оптимальных добавок к ним.
Сравнительно недавно в СССР получены интересные резуль-
таты при использовании нового типа добавок — ’’крентов”
(кристаллических ингредиентов). Чаще всего это сульфато-
содержащие твердые вещества, вводимые на стадии приготов-
ления цемента. Именно поэтому мы из-за ограниченности объема
книги вынуждены отказаться от их рассмотрения, хотя вопросы
механизма и технологического эффекта действия этих добавок
в целом изучены.
2.5. ДОБАВКИ ЧЕТВЕРТОГО КЛАССА - ОРГАНИЧЕСКИЕ
ПОВЕРХНОСТНО-АКТИВНЫЕ ВЕЩЕСТВА
Органические поверхностно-активные вещества (ПАВ), пред-
ложенные в качестве добавок позднее, чем электролиты, быстро
и чрезвычайно успешно вошли в мировую строительную прак-
тику. В СССР выпускается более сорока официально зарегистри-
рованных органических добавок в бетоны и растворы, на кото-
рые имеются ГОСТы или Технические условия, не считая крем-
нийорганических соединений. Интенсивно ведутся работы по
расширению их номенклатуры и областей применения.
Органические добавки используют в качестве пластифика-
торов (наиболее эффективные из них, полученные в основном
синтетическим путем, называют суперпластификаторами) для
удлинения сроков схватывания и ранних стадий гидратации
цемента и его экономии, повышения непроницаемости и проч-
ности бетона, его однородности и долговечности, улучшения
адгезии цементного камня с заполнителем, как воздуховов-
лекающие, микропенообразующие, гидрофобизирующие, бак-
терицидные, ускорители схватывания цемента и твердения бе-
тона и в некоторых других целях.
Большинство известных добавок в бетоны или целиком
состоят из органических продуктов, или последние входят
составной частью в комплексные добавки. Столь большая
популярность ПАВ вполне понятна: они значительно изменяют
своисгва бетонов, а иногда и придают ему некоторые новые
особенности при введении в малых концентрациях (обычно
в количестве десятых долей процента).
Число работ, посвященных исследованию таких добавок,
отнесенных нами в четвертый класс, весьма велико, В основ-
ных чертах механизм действия этих добавок достаточно ясен,
К сожалению, не разработана еще количественная теория, по-
зволяющая выразить эффект от введения ПАВ в аналитической
форме Это в большей мере затрудняет уточнение теоретических
101
вопросов, приводит к необходимости в каждом отдельном
случае и для любой новой добавки, в том числе близкой по
химической природе к хорошо изученным ранее, эмпирическим
путем подбирать ее дозировки и оценивать степень влияния на
физико- и структурно-механические свойства бетона.
2.5.1. Выбор классификации добавок четвертого класса
111ирота номенклатуры ПАВ вызвала необходимость их клас-
сификации. Помимо признаков, позволивших определить место
ПАВ в общей систематизации добавок, имеются и попытки их
дополнительной дифференциации как в рамках существующих
классификаций, так и вне последних.
Особого внимания заслуживают четыре из них. Первая делит
все ПАВ на ионогенные и неионогенные. Ионогенные могут
быть анионактивными, т. е. диссоциирующими в воде или в вод-
ных растворах на поверхностно-активный анион, в состав кото-
рого входит и углеводородная часть молекулы, и неактивный
катион: сахараты кальция, СДБ, сульфанол и др., а также ка-
тионактивными, диссоциирующими на поверхностно-активный
катион при неактивном анионе, например ка-
тапин и ряд других азотсодержащих ПАВ. К числу неионогенных
ПАВ* принадлежат полиолы, полиэтиленгликолевые эфиры
алкилфенолов: ОП-7, ОП-Ю и некоторые другие, полученные
в результате реакции оксида этилена и смеси моно- и диал
килфенолов. Однако накопленного материала еще недостаточ-
но для использования этой дополнительной градации ПАВ
в целях их рациональной классификации.
Возможна и другая классификация органических добавок —
по их влиянию на процессы структурообразования. В этом слу-
чае все добавки предложено делить на три группы [18].
К числу структурообразователей принадлежат обычно поли-
меры с большой молекулярной массой около 100000, содер-
жащие полярные функциональные группы в алифатической
части цепи макромолекул. К ним относятся карбоксилсодержа-
щие полимеры, полиамиды и др.
Пластификаторы, которые, ускоряя взаимодействие цемента
с жидкой фазой в момент их контакта, тормозят затем после-
дующую гидратацию. Соответственно замедляются и процессы
твердения цемента в их присутствии. Среди них поли-электро-
литы конденсационного типа с полярными группами у аромати-
ческого кольца в основной цепи молекулы, например водораст-
воримый полимер (ВРП).
*3а счет водородных связей они иногда мотут слабо диссоцииро-
вать; тогда их относят к катионактивным ПАВ.
02
Пластификаторы, которые ускоряют гидратацию цемента
н не снижают начальную прочность цементного камня незави-
симо от их концентрации (около 0,03-1%). В их число входят
нолиэлектролиты конденсационного типа с полярными груп-
пами у кольца и с третичным жирно-ароматическим азотом в
основной цепи макромолекулы.
Несомненное достоинство такой классификации — она позво-
ляет проследить связь между составом ПАВ и основными эф-
фектами их действия тта структурно-механические свойства
цементного теста и камня. Иными словами, открываются пути
направленного синтеза добавок ПАВ. Кроме того, через эти
тависимости удается иногда выйти на механизм действия ор-
т аттических добавок в зависимости от их природы.
Однако эта систематизация ПАВ, как и любая другая, не
решает всех задач. В частности, она не совсем вписывается
в принятое нами деление добавок других классов, построен-
ное по механизму их действия на минеральные вяжущие и
продукты их гидратации. Так, если считать главным, как это
сделано в [18], влияние ПАВ на процессы структурообразо-
вания, то ведущим признаком становится различие в соста-
ве полимерных соединений, тогда как для выбранных нами
критериев более характерно нахождение общих признаков,
присущих добавкам разной химической породы. Поэтому
мы, в полной мере оценивая перспективность рассматривае-
мой систематизации ПАВ и учитывая Некоторые вытекаю-
щие из нее следствия, не смогли положить ее в основу деления
органических добавок.
Иные принципы заложены при систематизации добавок ор-
ганических веществ по механизму их взаимодействия с це-
ментом или продуктами их гидратации [32, 33] . При внима-
тельном ее рассмотрении удается обнаружить определенное
сходство между этом классификацией и предложенной нами,
(’□гласно этой классификации, все органические вещества
делятся па три класса: 1) химически взаимодействующие с
минералами цемента или цементного камня; 2) адсорбцион-
но-взаимодействующие с твердой фазой и 3) не взаимодейст-
вующие и не адсорбирующиеся. Первый класс делится на три ।
подкласса: по тому, образуют ли они труднорастворимые,
растворимые соединения, влияющие на ход процессов гидрата-
ции или структурообразование, или продукты их реакции с
компонентами цементного камня изменяют его структуру и
свойства. Первый подкласс дополнительно делят на две груп-
пы по тому, выделяются ли трудно растворимые вещества на
твердой фазе в виде пленки или в объеме жидкой фазы. Вто-
рой класс состоит из двух подклассов: адсорбирующихся не-
обратимо и обратимо и, наконец, третий — из гидрофилизируто-
щих и гидрофобиэирующих.
103
Подобная близость классификаций знаменательна: она еще
раз свидетельствует о том, что механизм действия добавок мо-
жет служить той серьезной основой, с помощью которой уда-
ется сопоставлять между собой вещества разной тцн роды и
даже в чем-то объединять их. Иными словами, этот принцип
позволяет находить аналогии между действ тем добавок, состав
которых различен (например, к добавкам первою к тасса мы
отнесли сильные электролиты и спирты, второго с щи силь-
ных и слабых кислот, в том числе органических).
Однако можно обнаружить и различил в механизме дейст-
вия добавок казалось бы близкой природа. Общность между
предложенной нами классификации добавок особептк первых
двух классов - и анализируемой классифиь ацией по механизму
взаимодействия с цементом или продуктами гидрата1, ии [32,
33], заключается в том, что в эту последнюю логически впи-
сывается и определение эффектов от внедрения добавэк. Ана-
логичная возможность существует и при использовании нашей
классификации добавок по механизму их действия.
Однако, как и любая другая классифи сация органических
добавок в бетон, и эта классификация не вободна от некото-
рых недостатков. По нашему мнению, гидрофилизир/ющие и
гидрофобизирующие вещества, которым в анализируемой
классификации [32, 33] отведено очень скромное место в
третьем — наименее представительном классе добавок, в дейст-
вительности чрезвычайно представительны >г способны участво-
вать и в химических взаимодействиях, и I адсорбции и хемо-
сорбции.
Более того, мы считаем, что при построении классификации
добавок четвертого класса но механизму их действия на про-
цессы гидратационного твердения минеральных вяжущих ве-
ществ можно все органические соединения делить на гидрофи-
лизируюшие и гидрофобизирующие, т. е. использовать эту ха-
рактеристику как основу научной классификации органиче-
ских добавок*.
В рамках подобного деления открывается возможность
обосновать также эффект от введения добавок четвертого
класса на технологические свойства цементного теста и бетон-
ной (растворной) смеси, а также на структурно- :т физико-
механические свойства бетонов.
При этом удастся с единых позиций оценить влияние т идро-
филизирующих и гидрофобизирутощих ПА), на бетоны из порт-
ландцемента как без минеральных добавок, так и из цемента
с добавками, прежде всего, шлаков, зол т. микрокремнезема,
масштабы применения которых значительны и в пер-пективе
будут возрастать.
* Некоторые ПАВ могут обладать смешанны! .и функциями, однако
чаще всего при их введении в бегов превалирует к кой либо один эффект.
104
Если минеральные добавки сравнительно малоактивны и
их гранулометрические состав близок к таковому дли тторт-
тандцемента, ю обычно тффект от введения добавок четвер-
ило класса выше, чем при их введении в составы на чистом
портландцементе. Эю объясняется гем, что минеральные ком-
поненты смешанною цемента не столь интенсивно взаимодейст-
в> чн с водой, как к тикер, и как бы "разбавляют" цемент,
снижая особенно в ранние сроки количество гидратных ново
образований, на которых сорбируются ПАВ. Наиболее четко
такая зависимость прослеживается при работе с высокоалюми-
н.нными цементами, гак как iидроаяюмина 1ы кальция, сор-
бируя или хемосорбируя ПАВ, существенно уменьшают их
действующую” котщентратило, остающуюся титя адсорбции
на С—S-H-фазс.
Иногда подобная зависимость оказывается менее отчетли-
вой, однако чаще всего даже в неблагоприятных условиях
малоактивные минеральные добавки не влияют сколько-
нибудь заметным образом на эффективность ПАВ.
В отличие от .этого при введении добавок четвертою клас-
са в цементные системы с высокодисперсными минеральными
составляющими, обладающими к тому же значительной гид-
равлической активностью, например с микрокремнеземом или
некоторыми видами золы-уноса сухого отбора, следует при-
нимать во внимание, что часть ПАВ может сорбироваться на
этих очень активных минеральных компонентах. Как следст-
вие для получения такого же технологического эффекта от
применения ПАВ, какой обеспечивается при их введении в
’’бездобавочный” портландцемент, дозировка ПАВ должна
быть увеличена — иначе эффект снижается, что зафиксировано
при работе с пластифицирующими и воздухововлекающими
ПАВ.
2.5.2. Добавки первой группы — гидрофилизирующие
Число добавок первой группы очень велико. Наибольшей
известностью пользуются анионактивныс ПАВ: лигносульфо-
наты щелочных (Na, К), щелочно-земельных металлов (Са,
реже Mg), и аммония, в том числе модифицированные, напри
мер с помощью аминов, тидроксикарбоновые кислоты и их
соли, соли многоосновных кислот, например адипиновой (бу-
тилдикарбоновая кислота), углеводы и их производные, по-
лучаемые или как побочные и попутные продукты различных
производств или из таких продуктов, а также синтетические
шионактивные вещества, получаемые конденсацией с фор-
мальдегидом нафталин- или меламинсульфокислоты. Чаще
всего степень их поликонденсации п = 4. . .10 и выше.
1 .1 тез
105
Все эти добавки водорастворимы; это позволяет вводить
их с водой затворения в бетонную смесь, причем при необхо-
димости в повышенной против обычной дозировке — 1 2 %.
К aiiiioiuiKiHBiii.iM гндрофилнзнрующим веществам отно-
сятся фенольные [31 и некоторые водорастворимые смолы
ТЭГ-1 и ДЭГ-1. Их основное назначение, обеспечиваемое бла-
годаря введению в повышенной дозе, — повышение непрони-
цаемости бетона.
Популярность добавок первой группы, выпускаемых в
твердом, или, что более характерно, в жидком виде, опреде-
ляется той важной ролью, которую они ит рают в технологии
бетона и железобетона. Основное их назначение — пластифици-
рующее действие, позволяющее снизить водонотребность, а
также замедление сроков схватывания цемента и ранних стадий
твердения бетона. Последний эффект представляет интерес
для гидротехнического, сельского, дорожного строительства,
например при необходимости транспортирования и укладки
бетонной смеси в районах с сухим жарким климатом.
О щако более универсальная и часто более важная функция
перечисленных аниопактивных гидрофилизирующих добавок -
их пластифицирующее действие, которое может быть реализо-
вано непосредственно в повышение подвижности бетонной или
растворной смеси при одинаковом или близком с эталоном
В/Ц либо в другие эффекты, обеспечиваемые за счет снижения
их водопогребности.
Интерес во всем мире к комплексу этих задач, всегда счи-
тавшихся актуальными, особенно возрос с 70-х годов, когда
стали известны результаты исследования и применения пере-
численных ранее синтетических аниопактивных добавок наф-
зализз- и мсламипформальдегидпого тина сунерпласгифика-
горов. Можно без преувеличения сказан., чзо ли добавки позво
лили в известном смысле революционизирован. 1С.хнологию
монолитного и сборного безозза и жслсзобе она; они оказались
очень эффективны также для гипсовых и смешанных вяжущих
и бетонов из них.
Чтобы яснее представить действие этих добавок, приведем
усредненные сравнительные показатели основных характерис-
тик, обеспечиваемых за счет введения и пластификаторов, и
суперпластификаторов [10, 11,34, 105] .
Пластифицирующее действие. При неизменных В Ц и проч-
ности бетона осадка конуса бетонной смеси возрасчаез в при-
сутствии сунерпластификатора с 20—30 для смеси без добавки
до 200—220 мм — против 100 120 мм при введении пласти-
фикатора.
Водопотрсбность и прочность. При одинаковых расходе
цемента и подвижности бетонной смеси ее водопотрсбность
уменьшается (ззо сравнению с составом без добавки) лри вве-
дении сунерпластификатора на 20—25 %, нласгш|зпкагора
J06
hi ]0 12%. В результате прочность бетона
нормально-влажного хранения повышается
40 50 и 20 25%.
в возрасте 28 сут
соответственно на
Расход цемента. При неизменных кинетике твердения и
прочности бетона в возрасте 28 сут нормально-влажною хра-
нения расход цемента снижается при введении суперттластифи-
каторана ~ 20%, пластификатора ~6—10%*. !
Необходимо отметить также весьма существенную особен-
ность, отличающую суттерпластификаторы от обычных пласти-
фицирующих ПАВ: последние за редким исключением одно-
временно выступают и как замедлители схватывания и ран-
них стадий гидратациониого твердения цементов, в том числе
и при пониженном В/Ц, тогда как супернластификаторы не-
существенно изменяют эти показатели в ’’литых" бетонных
смесях и тем более при их использовании для получения высо-
копрочного бетона.
Причины этих различий разные химическая природа, мо-
лекулярная масса этих добавок, характер кривых их молеку-
лярно-массового распределения и, как следствие, иные хими-
ческие и физико-химические свойства.
Однако при этом ни в коем случае не следует сбрасывать
со счета и ’’чистоту” синтетических добавок по основному —
активному веществу. Дело в том, что, как уже отмечалось,
пластифицирующие добавки получают из попутных или побоч-
ных продуктов лесохимии, целлюлозно-бумажной, химической
и нефтехимической промышленности, агрохимии и др. Естест-
венно поэтому, что они содержат обычно большое количество
органических соединений, сильно отличающихся по составу и
молекулярной массе. Так, молекулярная масса технических
лит посульфонагов (ЛСТ) составляет в среднем 20000—30000 с
фракциями от ~ 300 500 до 100000. Кроме того, встречаются
и парши ЛСТ с "редуцирующими” веществами сахарами,
оказывающими заметное побочное действие.
Строение молекул лигносульфонатов показано на рис. 33.
Такая неоднородность ПАВ приводит к двум основным неже-
лательным моментам**. Первый заключается в том, что наряду
с веществами, обладающими достаточно высоким пластифици-
рующим действием, в таких добавках содержится немало ве-
ществ, слабо или практически совсем не пластифицирующих
'Мы не останавливаемся па технологических приемах и особенностях
проектирования бетона с суперпластификаторами, бла и) даря которым
удастся обеспечить эти эффекты, и не обсуждаем их экономическую
целесообразность - они подробно изложены во многих работах Отметим
лишь, что подобные результаты могут быть и более значительными.
I ак, снижение водоио! ребности может составить 30 %, а прочность бетона
к 28 сут нормального хранения достичь 100—120 МПа.
*' Свойства подобных добавок нередко нестабильны, что также затруд-
|1яс1 работу с ними.
107
О)
НО.
Рис. 33. Структура лигносульфоната натрия (а), натровой соли поли-
метнленполннафталинсульфокислоты (супернластификатора нафталнн-
формальдегидного типа) (б) н продукта конденсации сульфированного
меламина с формальдегидом (суперпластификатора меламииформаль-
дсгндного типа) (в)
бетонные смеси. В результате для получения пластифицирую-
щего эффекта, подобного пластифицирующему действию син-
тетических добавок-суперпластификаторов, дозировку этих
побочных и попутных органических про,туктов приходится
существенно увеличивать. При этом все большее значение при-
обретает второй нежелательный момент — наличие в таких до-
бавках веществ, оказывающих побочное действие, даже если
это действие в некоторых случаях нельзя отнести к отрицатель-
ному. Чаще всего это — воздухововлечение, а также замедле-
ние схватывания и ранних стадий гидратацт и цемента, которые
с увеличением количества добавки усиливаются.
При рассмотрении комплексных добавок будет показано,
каким образом удается нивелировать эти побочные эффекты.
Очевидно, что синтетические вещества обладают в этом отно-
шении явным преимуществом перед добавками из попутных
108
продуктов, используемых в качестве пластифицирующих
тем более, что и суперпластификаторам можно придать при
необходимости способность сильно удлинять сроки схваты-
вания и процессы гидратации цемента используя их в комп-
лексе с другими веществами.
Вместе с тем наши эксперименты и анализ литературных
данных показывает, что в механизме действия суперпластифика-
торов синтетического происхождения и пластификаторов,
получаемых из побочных и попутных продуктов различных
производств, много общего. Однако до сих пор нет единого
мнения по этому вопросу.
Наиболее достоверными считаются следующие основные
процессы, обеспечивающие пластифицирующее действие ана-
лизируемых ПАВ (при этом в ряде случаев удается объяс-
нить и замедляющее действие таких добавок на гидратацию
цемента, его индивидуальных фаз и других минеральных вя-
жущих веществ).
Моно- или поли молекулярная адсорбция ПАВ на поверх-
ности главным образом гидратных новообразовании. Во-пер-
вых, уменьшается межфазовая энергия и облегчается дезаг-
регация (дефлокуляция) частиц. При этом высвобождается
большая часть иммобилизованной воды: эта вода и обеспечи-
вает пластифицирующий эффект [II, 13, 32, 34, 109]. Во-вто-
рых, сами эти адсорбционные слои способны сглаживать микро-
шероховатости частиц, уменьшая коэффициент трения между
ними.
По величине и характеру адсорбции пластифицирующие
добавки, в частности лигносульфонаты, и суперпластификаторы
нафталин- и меламинформальдегидного типа резко отличаются
друг от друга: если пластификаторы сильно снижают поверх-
ностное натяжение о2 1 на границе ’’жидкость—воздух” (рис. 34)
и поэтому один из их побочных эффектов — умеренное воздухо-
вовлечение, то суперпластификаторы почти не изменяют значе-
ние и21, но сильно снижают межфазовую энергию на границе
’’твердая фаза—жидкость” (о}2).
Как следствие, суперпластификаторы указанных типов,
во-первых, практически не вовлекают воздух (продукт конден-
сации сульфированного меламина с формальдегидом даже спо-
собен к небольшому понижению воздухововлечения) и, во-вто-
рых, действуют как хорошие дезагрегирующие добавки. Этот
эффект можно проследить по данным седиментометрического
анализа [102] : суперпластификатор существенно увеличивает
долю мелких частиц. Увеличение действующей поверхности
цемента повышает скорость его гидратации, компенсируя тем
самым возможное замедляющее влияние суперпластификато-
ров на эти процессы, связанное с их другими эффектами. Таким
образом, это обстоятельство может быть одной из главных
причин введения суперпластификаторов в бетонную смесь
4 182
109
Рис. 34. Изменение поверхност-
ного натяжении uj । в зависимости
от концентрации лигносульфоната
натрия (15 и суперпластифика-
тора иафталинформальде! идпого
типа (2)
в значительных дозах — в несколько раз превышающих приня-
тые для пластифицирующих добавок — без опасения за сколько-
нибудь заметное изменение сроков схватывания и кинетики
ранней гидратации цемента. Обычно оптимальная дозировка
суперпластификаторов 0,4—0,8% по массе цемента, тогда как
пластификаторов, например ЛСТ,—0,15—0,3%.
Отметим также некоторые особенности в характере адсорб-
ции лигносульфонатов, гидроксикарбоновых кислот и их солей
и многоосновных органических кислот: они имеют большое
количество различных функциональных групп, в основном:
-С< , , -ОН, -сСГ , -БОзНидр.,
^0- ^ОН ’
сравнительно равномерно распределенных по длине основной
цепи перечисленных соединений. В результате такие ПАВ, адсор-
бируясь функциональными группами преимущественно на
гидратных новообразованиях, располагаются ’’плашмя”—вдоль
поверхности твердой фазы (а не в виде частокола, характерного
для резко асимметричных молекул гидрофобизирующих доба-
вок). Кроме того, часть таких функциональных групп остается
’’свободной”; она-то и гидрофилизирует цементное тесто или
бетонную (растворную) смесь, улучшая ее смачивание водой.
Сказанное в известной мере можно распространить и на
суперпластификаторы меламин- и нефталинформальдегидного
типа с поправкой на большую регулярность их строения и за-
данный состав (см. рис. 32).
Итак, при принципиальной общности адсорбционных процес-
сов необходимо подчеркнуть существенные различия между
ними для пластифицирующих добавок, получаемых из побоч-
ных и попутных продуктов различных производств, и синтети-
ческих суперпластификаторов меламин- и нафталинфсрмаль-
дегидного типа, причем эти различия могут существенно по-
влиять и на технологические характеристики бетонных сме-
сей, и на строительно-технические свойства бетонов.
ПО
Чрезвычайно важный аспект адсорбции ПАВ - как пласти-
фицирующих, так и суперпластификаторов - их модифицирую-
щее влияние на морфологию 1идратных фаз [37, 101, 108, 109,
III]. Эют эффект, весьма четко прослеживающийся при микро-
скопических исследованиях, может быть обусловлен несколь-
кими причинами. Главная из них - влияние НЛВ на морфоло-
1 ию зародышей кристаллизации и растущих кристаллов. Это
обусловлено тем, что в результате адсорбции тормозится рост
кристаллов и, следовательно, структура цементного камня
становится более дисперсной, часто рентгеноаморфной или пло-
хо закристаллизованной.
Кроме того, сорбируясь преимущественно на наиболее ак-
тивных гранях, добавки ПАВ изменяют форму гидратных фаз:
они становятся короче и тоньше, изменяется и их анизометрия.
Вследствие этого ослабевают микроармирующие функции
таких новообразований (см. выше), что особенно отчетливо
прослеживается в отношении игольчатых кристаллов эттрин-
гита, соответственно высвобождается и жидкая фаза, обычно
захватываемая игольчатым эттрингитом.
Наконец, экранируя зародыши кристаллизации, добавки
ПАВ тормозят их рост и тем самым способствуют повышению
действующего пересыщения, что в свою очередь приводит к
формированию более дисперсных структур. Этот вопрос нужда-
ется в некотором разъяснении. Напомним, что если вводить
ПАВ в небольших концентрациях, то их влияние на процессы
гидратации носит преимущественно кинетический характер.
Это означает, что такие добавки принципиально не могут из-
менить растворимость ни исходных вяжущих, ни новообра-
зований, как не в состоянии обеспечить кристаллизацию иных
продуктов, отличающихся от тех, которые образуются в от-
сутствии ПАВ*. Тем более интересно, что с помощью подоб-
ных добавок удается иногда весьма существенным образом
изменить не только величину действующего пересыщения,
но и продолжительность его поддержания на высоком уров-
не, вплоть до такого, который отвечает растворимости мета-
стабильной фазы — вяжущего, даже изменить количественное
соотношение между выкристаллизовывающимися гидратами.
Увеличение действующего пересыщения объясняется тем,
что ПАВ различным образом влияют на процессы растворения
исходной и возникновения новой фазы. Как было показано
[67, 68], кинетика растворения вяжущего, подчиняющаяся
законам диффузии, изменяется относительно слабо. Незна-
чительно снижается и скорость роста кристаллов, поскольку
этот процесс также идет с диффузионным контролем. В от-
личие от этого, на стадию (акт) зарождения новой фазы, про-
*Мы не рассматривали сейчас ПАВ кислого характера и некоторые
другие, вступающие с вяжущими в химическое взаимодействие.
Ill
текающую в кинетической области, добавки ПАВ влияют очень
сильно, причем даже тогда, когда их концентрация мала [50,
65] . Это еше раз подтверждает, что ПАВ не обязательно долж-
ны адсорбироваться на всей поверхности твердой фазы; их
эффект может быть обусловлен адсорбцией на активных цент-
рах и их блокированием. Кроме того, эти данные позволяют
предположить, что новообразования даже надмолекулярного
уровня, т. е по размерам отвечающие только устойчивому
трехмерному зародышу, уже содержат подобные активные
центры, к числу которых можно отнести и дефекты структуры.
Таким образом, благодаря различному влиянию ПАВ на
скорость растворения исходной и возникновения (а следова-
тельно, и роста) новой фазы удается обеспечить высокое и
длительно поддерживаемое на постоянном уровне пересыщение,
экспериментальное определение которого позволило измерить
растворимость метастабильных вяжущих веществ, в том числе
алюминатных фаз цемента [68, 93] .
Весьма примечательна и способность ПАВ изменять количест-
венное соотношение между разными гидроалюминатами, сла-
гающими искусственный камень, вплоть до практически полно-
го исключения в нем одной из фаз (С4Лщ/). Этот эффект обус-
ловлен преимущественной стабилизацией С4Ащ/ в виде высоко-
дисперсных рентгеноаморфных зародышевых фаз. Причины
этого авторы видят в том, что анионактивные гидрофилизирую-
щие ПАВ, адсорбируясь на активных центрах, стабилизируют
координационную сферу катиона [1].
Это объяснение можно использовать как основу и для кине-
тической трактовки указанного эффекта. В самом деле, в ре-
зультате действия добавки ПАВ, тормозящего образование
Рис. 35. Кинетика адсорбции
суперпластификатора меламин-
формальдегидного типа при гид-
ратации
1 - С3А; 2 - C3S; 3 - цемен-
та [132]
Рис. 36. Зависимость адсорбции а
от концентрации супертастифнка-
тора нафталинформальдегидного ти-
па при гидратации
I — высок «алюминатного цемента;
2 — низкоалюминатного цемента
[122]
одном из фаз, другая фаза образуется более интенсивно. Это,
естественно, не может не сказаться и на дисперсности новооб-
разований, так как, затормаживая рост новой фазы и обеспе-
чивая высокое пересыщение, добавки ПАВ способны изме-
нить и структуру цементного камня, особенно при введении
ПАВ в количестве до 1%. ПАВ быстрее и полнее сорбируются
на продуктах гидратации С3 А (рис. 35, 36).
Коллоидно-химические явления на границах раздела фаз
в присутствии ПАВ. В непосредственной связи со сказанным
ранее о строении молекул пластифицирующих добавок и супер-
пластификаторов находится и возможность нового подхода к
оценке их эффективности и к управлению процессами синтеза
последних. В качестве такого интегрального показателя, кото-
рый позволил бы объективно и по возможности количественно
оценить эффективность ПАВ, в [13] было использовано зна-
чение гидрофильно-липофильного баланса (ГЛБ)*, в свою
очередь сложным образом связанного с критической концентра-
цией мицеллообразования (ККМ) добавок.
В [13] впервые установлены общие закономерности, сви-
детельствующие о возможности нахождения количественной
или полуколичественнои связи между ГЛБ и пластифицирую-
щим действием ряда органических добавок. Представляется,
410 подобный подход весьма перспективен.
Дзета-потенциал. Ряд исследователей придает большое зна-
чение установившейся величине дзета-потенциала ((-потенциала)
поверхности частиц твердой фазы как фактору, во многом оп-
ределяющему механизм действия и эффективность пластифици-
рующих добавок и особенно суперпластификаторов.
Вкратце роль ( потенциала заключается в следующем. Вследствие
адсорбции добавок все частицы твердой фазы приобретают одноименный
заряд (количественно оцениваемый но величине (-потенциала), что при-
водит к их отталкиванию В результате облегчается перемещение и затруд-
няется коагуляция частиц
Однако возникает сомнение в отношении того, в какой мере
электрокинетические эффекты сами по себе обеспечивают плас-
тифицирующее действие ПАВ. Более логично, по нашему мне-
нию. предположить, что к более важным следует отнести другие
физико-химические или химические процессы, например адсорб-
цию и хемосорбцию ПАВ на поверхности гидратных фаз, тогда
как отрицательный (-потенций! от20до— 40мв -лишь ’’отклик”
на эти процессы, т. е. их следствие. Об этом могут свидетельст-
вовать некоторые экспериментальные данные. Так, существует
корреляция между значениями адсорбции добавок ПАВ и (-по-’
снимала (рис. 37) [134]
* Как известно, гидрофильные свойства определяются взаимодейст-
вием полярных функциональных групп в молекулах ПАВ с водой, липо-
фильные — неполярной группы с маслом (или, наоборот, отсутствием
взаимодействия с водой).
112
113
0,5 1 1,5 2 С,%
Рис. 37. Дзета-потенциал в зависимости
от концентрации суперпластификатопа
при гидратации С3А (1) nCjS (2) [134]
Кроме того, при достаточно существенной разнице в эффек-
тивности суперпластификаторов нафталин- и меламинформаль-
дегидного типа, с одной стороны, и лигносульфонатов — с дру-
гой, значения f-потенциала для них весьма близки.
Сказанное не означает, что изучение f-потенциала при иссле-
довании добавок ПАВ нецелесообразно. Наоборот, определе-
ние этого показателя может быть удобным мш одическим прие-
мом, позволяющим качественно оценивать выбранные добавки
и подбирать их дозировки.
Химическое взаимодействие между цементными минералами,
а также продуктами их гидратации и добавками ПАВ, особенно
если эти добавки представляют собой органические кислоты, их
производные, углеводы и растворимые в воде соли щелочных
металлов, участвующие в обменных реакциях с гидроксидом
кальция с образованием как хорошо-, так и труднорастворимых
солей кальция, а также хелатные соединения, вводимые в повы-
шенной дозировке. При этом следует учитывать разную хими-
ческую активность алюминатных (а также ферритных) и сили-
катных фаз.
Химические аспекты действия гидрофилизируюших анион-
активных ПАВ тоже весьма разнообразны. Несколько условно
мы отнесли к ним влияние добавок ПАВ и на до зародышевую
стадию возникновения новой фазы, коюрую, но-видимому,
можно рассматривать и с физико-химических позиций. Влияние
ПАВ на эту стадию удается понять, если исходить из того, что
структура растворов, особенно насыщ< иных и пересыщенных,
близка к структуре выделяющейся новой фазы и добавки
ПАВ могут изменить ее. Часто эго выражаезся в замедлении
зародышеобразования.
Прямым или косвенным следствием протекания реакций
между ПАВ и цементными минерала ии и их гидразами могут
быть:
повышение концентрации этих фаз в поровой жидкости.
Так действуют, например, добавки сахаров, образующие хо-
рошорастворимые сахараты кальция с гидроксидом кальция.
В результате может повыситься пересыщение и соответствен-
но скорость гидратации, что, в свою очередь, может привести
114
к ложному схватыванию цемента (короткие сроки схваты
вапия) или, если другие процессы, например адсорбция по
влияют на торможение реакции гидратации, к некоторому
уменьшению этого эффекта; н у
повышение концентрации кальций-, алюминатных и сили-
катных попов вследствие обра топания координационных соеди-
нении — молекулярных комплексов. В лом случае могут из-
мениться основность выкристаллизовывающихся гидратных
фат вследствие связывания преимущественно какого-либо
одного вида ионов, соотношение между их концентрацией в
поровой жидкости по той же причине, кинетика образования
। идратов и их дисперсность. Отметим, однако, что изменение
основности гидратных фаз явление редкое и наблюдается
преимущественно при повышенных дозах ПАВ;
понижение концентрации ионов вследствие образования
груднорастворимых продуктов. В результате этого типа реак-
ций ПАВ с вяжущим или продуктами их гидратации возмож-
ны: торможение процессов гидратации вследствие образования
на зернах вяжущих или в непосредственной близости от них
экранирующих пленок из этих труднорастворнмьтх веществ;
тот же эффект, но обусловленный выделением труднорастворн-
мых продуктов на зародышах новой фазы и соответственно
понижением скорости кристаллизации гидратов; некоторое по
вышеиие скорости самой ранней стадии растворения вяжущего,
если продукты сто взаимодействия с ПАВ выделяются в виде
отдельной незкрадирующей фазы; избирательное взаимодей
ствие тех или иных компонентов цемента и новообразований
с добавкой ПАВ, если опа реагирует с ними, не вступая в ре
акцию (или слабо реагируя) с другими. Как следствие, могут
измениться фазовый состав цементного камня и его дисттсрс
ность.
Имеется ряд данных о протекании химических реакций меж
ду аннонак 1И1ШЫМН ПАЬ (и сунсрнластификаторами, и добав-
ками, обладающими ттласгифицируюше-замедляющим денег
вием) и составляющими цемента и цементного камня. На наш
взгляд, наиболее детальны по этому вопросу исследования
(109—111]. В них доказано образование новых химических
соединении при введении сунернластификаторов нафталин
формальдегидною типа разной молекулярной массы в систему
’’мономиттералытое вяжущее вода” для всех минералов порт
ландцементного клинкера, а также для СА. Продукты реакции
были идентифицированы по характерным только для них пикам
па термограммах.
Естественно, что для четкой регистрации продуктов реакции
в модельную систему необходимо вводить повышенное kojtmJ
чество добавки,что, однако, не оставляет сомнений в возмож
пости подобных взаимодействий и чри меньшей концентрации
сунерпластификатора в системе ’'вяжущее вещество - вода”
11
В результате происходящих химических реакций может из-
мениться и скорость кристаллизации эттрингита. При сильном
замедлении процессов гидратационного твердения цемента их
технологическим следствием будет го, что во время транспор-
тирования и укладки бетонной смеси на ее реологические ха-
рактеристики не наложится загустевание, обусловленное начав-
шимся структурообразованисм. Кроме того, замедл-ние обра-
зования таких высоководных кристаллогидратов, как
С4А aq, С2АН8 и эттрингита повлияет и на темп твердения
бетона.
Таким образом, в первых трех случаях добавки влияли
преимущественно на физико-химические (коллоидно-химиче-
ские) процессы, а в последнем — на химические и отчасти на
кристаллохимические. Сегодня трудно количественно оценить
вклад каждого из них в пластифицирующее действие рассмат-
риваемых добавок. Тот факт, что для пластификаторов и супер-
пластификаторов наблюдается четкая зависимость их эффек-
тивности от химико-минералогического состава цементов, при-
чем с ростом содержания в них С3А и щелочей пластифицирую-
щее действие этих добавок ослабевает [8, 13, 101, 108, 109,
111], свидетельствует об определенном значении химических
процессов. Сказанное подтверждается и тем, что более инертные
в химическом отношении шлаки повышают эффективность
использования пластификаторов и суперпластификаторов. На
это же указывает и то обстоятельство, что введение подобных
добавок с оставшейся частью воды затворения после кратко-
временного перемешивания цемента или бетонной смеси с пер-
вой частью воды, когда в системе начинаются реакции гидрата-
ции и образования эттрингита, повышает их технологический
эффект.
Целесообразно проанализировать более детально механизм
действия пластификаторов и суперпластификаторов на хими-
ческие реакции, протекающие при взаимодействии составляю-
щих цемента друг с другом и с водой, и на физико-химиче-
ские процессы, не противопоставляя их друг другу.
Переходя к рассмотрению влияния пластификаторов и супер-
пластификаторов на гидратацию С3А, отметим, что при опти-
мальной дозировке они тормозят образование гексагональных
фаз и их переход в кубический С3АНв- Однако в количествен-
ном отношении конкретный результат зависит от химической
природы органической добавки, ее молекулярной массы, кон-
центрации, температуры, дисперсности твердой фазы и других
факторов. Так, при недостаточной дозировке, низкой актив-
ности добавки и высоком содержании С3А возможно даже
ускорение процесса. При введении добавок в значительных
количествах процессы могут быть сильно заторможены, и,
кроме того, возможно образование поверхностных или объем-
ных комплексов.
116
По вопросу о влиянии аиионактивных гидрофилизирующих
ПАВ на кинетику взаимодействия С3 А с гипсом с образованием
л грингита большинство авторов считают, что хотя образование
лтрингита несколько замедляется, однако в существенно
меньшей степени, чем изменяется под влиянием тех же добавок
кинетика гидратации чистого С3А. В отличие от этого те же
I идрофилизирующие ПАВ очень значительно тормозят превра-
щение С3А • 3CaSO4 31Н2О в С3А • CaSO4 - 12Н2О, хотя
термодинамически такой процесс возможен после израсходова-
ния гипса при сохранении несвязанных в эттрингит алюминат-
ных фаз. Следовательно, прослеживается некоторая общность
между действием гидрофилизирующих ПАВ на кинетику этих
процессов и на кинетику превращения гексагональных гидро-
алюминатов в кубический С3АН6.
Влияние гидрофилизирующих ПАВ на процессы гидратации
C4AF в главных чертах аналогично действию этих добавок на
С3А. Следует отметить, что поскольку C4AF гидратируется
менее интенсивно, чем С3А, все эффекты, прослеженные при
введении ПАВ в систему C4AF—Н20 или С4 AF—CaSO4—Н20,
выражены несколько слабее. Однако и при этом возможны
химические реакции и адсорбция добавок. Говоря об адсорб-
ции и частично хемосорбции, мы имеем в виду протекание
э гих процессов не на исходных фазах, а на продуктах их гидра-
тации. Адсорбция ПАВ на безводных мономинералах незна-
чтсльна по двум основным причинам: их малой удельной по-
верхности по сравнению с таковой для гидратных новообразо-
ваний и в связи с тем, что они, как метастабильные фазы, обес-
печивающие пересыщение по отношению к их термодинами-
чески более устойчивым гидратам, генерируют поток вещества,
направленный от поверхности вяжущего. Добавка, находясь
в этом потоке, в котором возникают зародыши новой фазы,
естественно сорбируется, главным образом, на таких центрах
кристаллизации.
Указанное явление позволяет объяснить и большую эффек-
тивность введения добавок ПАВ через некоторое время после
затворения цемента частью воды; адсорбция и частично хемо-
сорбция ПАВ на более крупных частицах гидратных фаз при-
водит к тому, что при том же количестве введенной добавки
ее больше остается для пластификации бетонной смеси. Отсюда
становится понятной также и важность правильного назначе-
ния дозировки добавок, зависящей от их химической природы.
Научно обоснованные расчетчые методы определения дози-
ровки суперпластификаторов, хорошо совпадающие с экспе-
риментом [78] , можно перенести и на гидрофилизирующие
добавки другой химической природы, относящиеся к категории
н л асти фи к ато ров.
Итак, адсорбция и последующая хемосорбция добавок гидро-
филизирующих ПАВ происходят преимущественно на первичных
117
гидратных фазах. Это положение, по нашему мнению, будучи
’’данью” кристаллизационному механизму гидратации минераль-
ных вяжуши х веществ, убедительно доказано в [18,131].
Эти же типы взаимодействия наблюдаются и при введении
гидрофилизируюших ПАВ в систему C3S Н2О и 0-C2S- Н2О
1108 110] . Однако, учипавая меньшую гидратационную акгин-
ность и пониженное содержание белига в товарных цементах,
ведущую роль следует отвести алиту - основной силикатной
фазе портландцемента, наиболее важной для оценки технических
свойств бетона на этом вяжущем.
На кинетической кривой гидратации C3S [107 1 09] доста-
точно четко прослеживаются эффекты, которые удобно фик-
сировать на термокинетической кривой, построенной в коор-
динатах ’’скорость тепловыделения — время” (рис 38, а-в).
На кривой после взаимодействия CjS с водой наблюдается
экзотермический эффект, завершающийся через 15 20 мин,
его связывают с теплотой смачивания и называют первым
нрсдипдукционным периодом. Затем и течение нескольких
часов происходит очень слабое взаимодействие C3S с водой
Это второй — индукционный период гидратации C3S. Вслед
за этим периодом на термокинетической кривой наблюдается
новый — основной экзотермический эффект, протекающий
с самоускорением: он лежит по времени между началом и
концом схватывания C3S. Это третий т.ериод, соответствую-
щий интенсивной гидратации C3S. В четвертом периоде ско-
рость тепловыделения сравнительно плавно снижается. Во
время последнего, пятого периода гидратируется оставшаяся
часть C3S.
При исследовании действия гидрофилизируюших добавок
на процесс гидратации C3S наибольшее внимание обращают
на первые два периода, так как именно в это время преиму-
щественно проявляется влияние ПАВ.
Особенно сильно сунсрнластификаторы и нластфнцирующпе
добавки удлиняют второй период (рис. 38, а). Предложено
несколько гипотез для объяснения подобного действия: одни
связывают его с адсорбцией ПАВ преимущественно на Са(ОН)2.
другие — на C-S-H-фазе. Отмечается также повышение продол-
жительности поддержания пересыщения в присутствии ПАВ
[2,42,50,68,80,93].
Использование преимущественно термокинетических кривых
(а также одновременно нескольких других методов) в иссле-
довании позволило авторам [110, 111] выявить ранее неиз-
вестные или спорные положения, касающиеся пластифицирую-
щего действия и изменения некоторых других свойств бетон-
ных смесей и бетонов в функции от молекулярной массы су-
перпластифика торов нафталинформальдегидною шна. Как уже
указывалось, средняя степень поликонденсации этих добавок
118
в'fa
Рис. 38. Термокинетические кривые „
гидратации C3S (а), С3А (б) и
С3А + гипс (в)
1 — без добавок; 2 — с добавкой
суперпласгификаторов иафталинфор-
мальдегидного типа; 3 — то же,
меламинформальдегидного гина; 4 —
с добавкой модифицированного лиг-
носульфоната натрия — пластифика-
тора ХДС К-Т [io?]
лежи! в интервале 4 10, что позволяет отнести их к категории
олигомеров. Однако в составе таких ПАВ присутствуют и низко-
молекулярные ’’легкие” фракции (п« 4), и высокомолекуляр-
ные ’’тяжелые” с я>10 (обычно до п —17). Оказалось, что
наибольший пластифицирующий эффект обеспечивают именно
тяжелые фракции, а не средняя ’’фракция”, как предполагалось
ранее. Более того, ’’средняя” фракция приводила к некоторому
понижению прочности образцов во все сроки твердения. Вместе
с тем полимерные соединения (»—10. . .17) замедляли сроки
схватывания и кинетику гидратации C3S (а также, очевидно,
и других мономинералов портландцементного клинкера). Кро-
ме того, с ростом длины цени увеличивалась вероятность прояв-
119
ления "мощикового” эффекта, одновременном адсорбции
таких полимерных молекул сразу на дв>х и более частицах
гидратирующегося вяжущего [110]; в результате вместо
очень ценной дезагрегирирующей способности суперпластифика-
торов может, наоборот, произойти агрегация цемента.
Таким образом, по-видимому, должны существовать ограни-
чения и в отношении предельной степени поликонденсации
полиметиленсульфонатов, а также и суперпласт ифика торов
других типов.
В отличие от тяжелой легкая фракция суперпластификатора
нафталинформальдегидного типа, слабо пластифицируя цемент-
ные материалы, выступала на ранних стадиях их гидратации
как ускоритель. С изложенными положениями согласуется
и то, что легкая фракция обладает заметным воздухововлече-
нием; это повышает пластифицирующее действие добавок, но
впоследствии отрицательно сказывается на прочности бетона.
Исходя из теоретических представлений можно наметить
четыре основных пути улучшения качества пластифицирующих
добавок и суперпластификаторов (поскольку механизм их
действия в общих чертах близок, то и сами направления тоже
сходны).
1. Сознательное регулирование средней молекулярной мас-
сой добавок и кривыми ее распределения по размерам, при
необходимости ’’отсекая” нежелательные фракции. Эти задачи
обычно решают на стадии производства добавки: проводят
их направленный синтез (так получают суперпластификаторы)
или же их разделяют на фракции. Известно несколько способов
разделения. При фракционировании ЛСТ гидроксидом кальция
с последующей обработкой Na2CO3 нейтрализуют низкомоле-
кулярные соединения, высокомолекулярные осаждают с по-
мощью Са(ОН)2, а среднюю фракцию (М = 45000. .50000)
переводят в натровые основания [39, 40] . Так получают кон-
центрат бардяной модифицированный (КБМ), эффективность
которого выше, чем ЛСТ [39]. По методу адсорбции, в ка-
честве сорбентов используют разные материалы вплоть до це-
мента. Такой прием принят, например, при получении добавки
НИЛ-20, которая содержит фракции лигносульфонатов, остав-
шиеся после удаления суспензии цемента е сорбированными на
ней составляющими [113, 119].
2. В случае, когда ПАВ представляют собой соли различных
кислот, имеет значение выбор катиона. Оитается, что при про-
чих равных условиях большей эффективностью характери-
зуются соли натрия, меньшей — соли кальция (однако послед-
ние доступнее и меньше склонны к высолам).
3. Модифицирование добавок применяют, например, при ра-
боте с лигносульфонатами: их обрабатывают механохимическим
путем [26], часто совместно с едким натром (добавка
120
ХДСК-1), что повышает их эффективность (см. рис. 37) [55
107]. Лигносульфонаты модифицируют также бихроматами в
кислой среде (хром-лигносульфонаты) [24, 25], конденсируют
с формальдегидом, обрабатывают карбамидной смолой
(ЛСТМ-2) [94, 101] или полиэтиленполиамином (НЭПА),
содержащим две первичные аминогруппы [77]. В последнем
случае с помощью инфракрасной и масс-спектроскопии было
доказано химическое взаимодействие между молекулами
лигносульфоната и ПЭПА, приводящее к повышению их мо-
лекулярной массы в результате образования сульфамидного
соединения по уравнению:
О
II
2A-S-OH + H2N-A'- NH2
II
О
О О
И . и
R — S — NH- R - NH - S-Л + 2Н2О,
II II
О О
где Л — радикал молекулы лигносульфоната; R! - ПЭПА.
Аналогичные реакции могут протекать и с другими водорас-
творимыми аминами: этилендиамином, диэтилентриамином
и др. Как показывают данные табл. 12, такое повышение мо-
лекулярной массы улучшает реологические и прочностные
свойства гипса, но только до определенного соотношения меж-
ду лит иосульфопагом и НЭПА, примерно 1:0,07 по массе. Даль-
нейшее увеличение лот о отношения нежелательно вследствие
снижения молекулярной массы образующихся соединений
из-за блокирования функциональных групп излишним коли-
чеством сшивающего агента (ПЭПА).
Таблица 12. Влияние ЛС-ПЭПА ла свойства гипсового вяжущею
Количест- во ПЭПА в ЛС-ПЭПА, Пластич- ность, мм Сроки схватывания, мин Предел проч- ности при сжатии, МПа
начало конец
0 ’60 14 22 9,5
0,04 265 19 27 10
0,07 295 35 45 10,5
0,11 295 55 65 8,9
0,15 285 75 85 7,9
121
По-видимому, возможное образование сложных эфиров
при введении в смесь лигносульфоната со щелочью полиэтилен-
гликолей обеспечило эффективность такой модифицированной
добавки, как ХДСК-3.
Точно так же модифицирование водорастворимою продук-
та конденсации салициловой кислоты с формальдегидом
(ВРП-1) мопоэтаноламином обеспечивает ее сильное ш астифи-
цируюшее действие при незначительной воздухововлекающей
способности.
Подобные принципы [13, 109-111] служат основой для
получения нового поколения высокоэффективных суперпласти-
фикаторов.
4. Усиление эффективности добавок при снижении побоч-
ного действия путем смешивания веществ одинаковой, близкой
или различной природы. Этот способ, связанный с получением
комплексных добавок, будет нами подробно рассмотрен.
Особое место среди гидрофилизирующих ПАВ занимают две
группы добавок: водорастворимые смолы и вещества на основе
салициловой кислоты. К первой группе относятся алифатиче-
1 1
ские смолы с эпоксигруппами —С — С— марок ТЭГ-1 и ДЭГ-1,
\ /
О
меламиномочевиноформальдегидная — ММФ-50 и частично
полиаминная смола № 89. Хотя они служат гидрофилизирующи-
ми добавками и применяются в ряде случаев с той же целью,
что и традиционные пластификаторы, например лигносульфона-
ты или гидроксикарбоновые кислоты, их эффективность при
введении в той же оптимальной для пластификаторов дозировке
0,15—0,2% по массе цемента заметно ниже (рис. 39). Это же
относится и к срокам схватывания цементов — смолы обладают
более слабым замедляющим действием [63]
Кроме того, если рассмотренные ранее пластификаторы и
суперпластификагоры очень чувствительны к химико-минерало-
гическому составу цементов, то влияние ТЭГ-1, ДЭГ-1 и ММФ-
-50, напротив, намного более универсально, т. е. слабо зависит
от химико-минералогического состава цемента. В результате
эти смолы вводят по обычной технологии в бетонные смеси в
очень высоких для обычных пластификаторов (и даже для
суперпластификаторов) дозах — 1—2%, что позволяет улучшить
их реологические характеристики, а главное, придать бетонам
ценные свойства: повышенную деформативность, грешино-
стойкость и непроницаемость.
Большей эффективностью характеризуются ацетонформаль-
дегидные смолы. Так, по данным [95] , такие" смолы марки
САФА, хотя и относятся к неионногенным ПАВ, хорошо раство-
ряются в воде, имеют небольшое содержание свободных моно-
Рис. 39. Изменение нормаль-
ной густоты цементного тес-
та от введения добавок смол
ММФ-50 (пунктир) и ТЭГ-1
(сплошные кривые) [62]
мерой и главным образом за счет i идроксильных и карбониль-
ных групп адсорбируются на границах раздела твердой и жид-
кой фаз*. Вследствие поверхностной активности ацетонформаль-
дегидных смол их оптимальная дозировка близка к дозировке
традиционных пластификаторов, т. е. она значительно ниже,
чем для перечисленных выше смол. Для их модифицирования
используют, в принципе, те же приемы, которые были описаны
ранее.
Гидрофилизирующие добавки ВРП-I и С-1 получают, как
уже указывалось, поликонденсацией салициловой кислоты с
формальдегидом (ВРП-1), а также дополнительно — с моно-
этаноламином (С-1). Активность этих веществ столь велика
по сравнению с традиционными пластификаторами, что их
рекомендуемые дозировки, не приводящие к существенному
торможению сроков схватывания и процессов гидратации це-
ментов. составляют всего 0,005 -0,03% по массе вяжущего.
Стоит еще раз вернуться к вопросу о правомерности вы-
деления в отдельную группу суперпластификаторов из числа
гидрофилизирующих ПАВ. Если исходить из общих законо-
мерностей действия и этих добавок, и пластификаторов, то
для такого выделения нет оснований: механизм влияния и
тех, и других на процессы гидратации важнейших минералов
портландцементного клинкера и других вяжущих, а также
на снижение их водопотребности и улучшение реологических
характеристик качественно сходен, причем это распростра-
молекулах САФА содержатся также вторичный и третичный амины.
122
123
няется и на коллоидно-химические процессы, а также на хими-
ческие взаимодействия и на адсорбцию на Iверной фазе.
Однако суперпластификаторы отличаются от обычно приме-
няемых пластификаторов химической природой их молекул,
кривой их молекулярно-массового распределения и средней
молекулярной массой, строением основной части молекулы и
характером расположения на ней функциональных групп, кото-
рые у суперпластификаторов более однотипны и, следователь-
но, обладают близкой поверхностной активностью, а их чередо-
вание более регулярно, чем у пластифицирующих добавок из
побочных или попутных продуктов ряда производств. Су-
пернластификаторы количественно отличаются от плас-
тификаторов по меньшей мере в двух отношениях:
первое отличие — их максимальный основной эффект в резуль-
тате значительной концентрации активных веществ, т. е. более
сильное по сравнению с другими ПАВ пластифицирующее дей-
ствие (и соответственно водопонижение) , второе — почти пол-
ное отсутствие у синтетических сунерпластификаторов побоч-
ного действия (или если оно и есть, то его влияние невелико),
которое заключается в удлинении сроков схватывания, замед-
лении процессов гидратации цемента (а отсюда часто и повы-
шенном водоотделении) и темпа нарастания прочности бетона,
а также воздухововлечении, причем оба этих эффекта растут
с повышением дозировки добавки.
При введении суперпластификаторов замедление процессов
гидратации вяжущих на ранней стадии процесса, как видно из
приведенных данных, также имеет место; однако его в значи-
тельной мере компенсирует дезагрегация (дефлокуляция)
твердой фазы, связанная с высокой поверхностной активно-
стью добавок — суперпластификаторов на границе раздела
твердое тело—жидкость (и32).
В результате подобной компенсации их можно вводить в
бетонные смеси в большей дозировке, чем обычные пластифици-
рующие добавки, не опасаясь их побочного деисшия. Кроме
того, иногда вследствие значительной концентрации в подоб-
ных синтетических добавках активного компонента для полу-
чения близкого пластифицирующего действия можно пони-
зить их дозировку в бетонных смесях (или при одинаковом
количестве добавок их эффекты оказываются существенно
различными).
Следует отметить, что перечисленные побочные эффекты
в общем виде нельзя безоговорочно отнести только к разряду
негативных, иногда они очень желательны. Однако несомнен-
но также, что их легче и логичнее придавать в необходимых
случаях путем комбинирования пластификаторов или супер-
пластификаторов с другими соответС1Вующими добавками,
чем избавляться от них.
124
t ледова гсльпо, при построении классификации добавок ио
т iiohiiomv техно тотичеекому лепет пито на бетонную смесь
ion, по-вичимому. ситпетчсские суперпластификаторы
но отнести одну категорию, а традиционные дластифика-
в друтую* Такое деление целесообразно в некоторых
i.ULX потому, что использование суперпластификаторов
uiaci необхо,1имос11> внесения изменений в техиолотито
> <><>и тельсзва. Помимо уже упомянутого эффекта от введения
лих добавок со второй частью воды затворения, бетонные
смеси рекомендуется обогащать мелкими фракциями запол-
а гелей и т. д.
'’унернластификаторы эффективнее вводить в жирные смеси,
в топите; они небезразличны к нодоцементпому отношению
. жесткости смеси.
I юлот ичсскис свойства, в частности вязкость, бетонных
метем с супернласгификагорами несколько отличаются от
таковых с пластификагорами-лигносульфонатами [78] .
2.5.3, Добавки второй группы — тидрофобизирующие
Основной признак гидрофобизируюших ПАВ - резкая асим-
метрия их молекул, сбалансированных таким образом, что при
лом обеспечивается их ярко выраженная дифильность. Для
гидрофобизируюших ПАВ физическая адсорбция обычно явля-
ется только первой стадией, за которой следует основная для
них хемосорбция или даже химическая реакция в объеме.
В результате углеводородная неполярная гидрофобизирующая
часть молекулы добавки оказывается прочно фиксированном
на поверхности твердой фазы [ 1 2, 112] .
К числу весьма важных в практическом отношении гидро-
фобизируюших добавок относятся битумы, вводимые обычно
в виде прямых эмульсий типа ’’масло в воде”, крсмнийоргапи-
теские жидкости, прежде всею, нолнэгилгидросилоксаны**
I <6-41 (ГЮК 94)
С2Н5
I
-О - Si - 0-
I
II
•Учитывая, что в книге принята классификация добавок по основ-
ному механизму их действия на составляющие цемента и цсментнотю
камня, мы технологическою деления добавок на категории не проводим
Могут быть использованы также нолимегил (фенил) гидросилок-
125
и их модификации, также вводимые в виде эмульсий [12],
водорастворимые метил- и эгилсиликонагы натрия (марочные
названия ГКЖ-10 и ГКЖ-11) [12, 44] , др-весный иск, неомы-
ленная и омыленная нейтрализованная абиетиновая смола
(СНВ и СДО) и некоторые другие продукты химической пере-
работки древесины, кубовые остатки высокомолекулярных
жирных кислот с числом углеводородных атомов свыше 18,
мылонафт, асидол, асидол-мылонафт и им подобные продукты
нефтяной и химической промышленности, а также синтетиче-
ские вещества, например СПД. Следует иметь в виду, что гидро-
фобизирующие добавки обладают рядом общих с гидрофили-
зируюшими ПАВ свойств. Это обусловлено близостью их приро-
ды, прежде всего углеводородной части молекул. Так, с одной
стороны, гидрофобизирующие добавки также могут обладать
пластифицирующим действием [12, 112]. Однако, во-первых,
обычно оно слабее выражено (а часто обусловлено иными при-
чинами, чем при использовании пластифицирующих ПАВ) и,
во-вторых, при введении в бетонную смесь подобных ПАВ
этот эффект является второстепенным, тогда как главным
признаком следует признать именно те результаты, которые
неносредС1Венно вытекаю! из гидрофобизирующщ о действия
ПАВ. С другой стороны, ряд гидрофилизирующих добавок
(например, ЛСТ), так же как и гидрофобизирующие, увели-
чивают воздухововлечение, но в меньшей степени, поэтому
указанный признак не может считаться ведущим для гидро-
филизирующих добавок.
Наконец, многие гидрофилизируюшие ПАВ также участвуют
в химических реакциях с вяжущими и продуктами их гидра-
тации. Однако в результате подобных реакций неполярная
углеводородная часть молекул добавки часто не фиксируется
на новообразованиях.
Основные эффекты от введения гидрофобизирующих ПАВ
следующие: значительное ухудшение смачиваемости цемента
водой (гидрофобные цементы не теряют своих свойств при
длительном хранении — гидрофобизирующая пленка на вяжу-
щем механически сдирается лишь на счадии затворения бетон-
ной смеси в бетономешалке); гидрофобизация бетона, вслед-
ствие чего снижается скорость капиллярного подсоса в него
влаги, что благоприятно влияет на долговечность бетона;
воздухововлечение, которое проявляется обычно сильнее,
чем при использовании гидрофилизирующих поверхностно-
активных добавок. Значительным воздухововлечением ха-
рактеризуется, например, абиетат натрия, широко используе-
мый в СССР и во многих странах мира.
При введении подобных добавок внутренняя поверхность
воздушных полостей в бетоне также оказывается гидрофобизи-
рованной. При оптимальном воздухововлечении (до « 5%),
несмотря на появление значительного количества воздушных
126
пузырьков, проницаемость бетона снижается, что объясняете
образованием системы условно-замкнутых воздушных пузырь-
ков [28, 41] , и только при большем воздухововлечении про-
ницаемость бетона возрастет. 1
Пластифицирующий эффект подобных добавок, слабо или
даже почти не проявляющийся при их введении в цементное
тесто, достаточно высок в бетонной смеси, подвижность кото-
рой обеспечивается самими пузырьками газовой фазы. Этот
механизм - вовлечение в бетонную смесь углеводородной
частью молекулы ПАВ неполярных воздушных пузырьков,
их диспергирование вследствие понижения работы разрушения
и стабилизация пузырьков в объеме цементного теста - важен
не только с точки зрения пластификации бетонной смеси, но и
потому, что равномерно распределенные в объеме бетона ус-
ловно-замкнутые* поры, выполняя роль своеобразных демп-
феров, обеспечивают высокую морозостойкость материала,
в несколько раз превышающую таковую для бетона без до-
бавок (в том числе при близком составе исходной бетонной
смеси и ее водоцементном отношении). Кроме того, за счет
этою эффекта и гидрофобизации нор и капилляров добавки
второй группы улучшают также солестойкость, в частности
сульфатостойкость, изделий. По этим же причинам гидрофо-
бизирующая добавка эффективное средство борьбы с вы-
солами на изделиях.
Особую популярность приобрели такие гидрофобизирующие
добанки в бетон, как 136-41. Эффект от их введения, оценивае-
мый преподе всего по очень сильному повышению морозостойх!
кости и долговечности бетона, обусловлен помимо гидрофоби-
зации стенок пор и капилляров появлением гидрофобизиро-
ванных изнутри пор, образованных пузырьками водорода,
выделяющегося при реакции добавки с водным раствором
гидроксида кальция, по схеме [I 2]
R R \ / R R \
' 1 I I 1 1 I
О-Si - O-Si-O-I f лСа(ОН)2-* -O-Si-O-Si-O- + 2nH2
I I / \ 1 1 /
> II Н /п \ О-Са-О А
Положительное влияние гидрофобизации легко обнаружить
экспериментально: только образование системы мелких газо-
вых пузырьков в теле бетона в результате введения перекиси
водорода или алюминиевой пудры совместно с ЛСТ, хотя и
*Н действительности пузырьки газа не изолированы полностью, а
чипн. мспсе доступны для проникания и них воды и растворов извне.
127
Рис. 40. Кинетика нарастания
пластической прочности рас
норных образцов (на нор1
ландцсмснтс завода ’’Ьолыно-
вик")
I без добавки; 2 — с добав-
кой 0,01% Г'КЖ-11; 3 го иа.
0,5%; 4 - то же, 4%; 5 т<*
же. 5%
повышает долговечность и морозостойкость изделий, но менее
существенно, чем при введении в бетонную смесь гидрофоби-
зирующих-газообразутоших добавок, например алкил (арил)-
гидридсилсесквиоксанов или этилполисилоксана в количе-
стве около 0,05%, хотя в обоих сравниваемых случаях объемы
газовой полости и кривые распределения пузырьков ио разме-
рам близки [12].
Иногда при рассмотрении гидрофобизирующет о действия
добавок нужно учитывать их способность вызывать кольмат
цито пор и капилляров с уменьшением их сечения. Однако
большинстве случаев эффект кольматадии мал и играет под
чиненную роль в улучшении свойств бетона, так как добавки
1IAB, как правило, вводят в малых дозировках. редко пр.
вышаюших 0,1—0,2% (для воздухововлечения С ~ 0,005.. 0.05
Чаше всего гидрофобизирующие кремнииорганические д
банки вводят в жидком виде на стадии ил отопления бетонной
смеси. В последние годы наметилась тенденция к применению
крсмнийорганических порошков; водорастворимых (алюмо
метилсиликонат натрия) [44] и нерастворимых сесквиок
нов. Последние могут быть гидрофоби тирующего тип
(/? — SiOj 5)л и гидрофобизирующе-газообразутощих обшей
формулы (А — SiOi,s) л • (HStOi,s)w , где R алкил или арил
вводимые обычно на стадии помола клинкера [ I 2] . Эти добав-
ки весьма перспективны, так как почти не дают побочных
эффектов. К их достоинствам нужно отнести также возмож-
ность раздельного введения комплексных добавок: гидрофо
бизируюшей и газообразуюшей на стадии и тготовления це-
мента, а ускоряющей твердение либо пластифицирующей
при затворении водой бетонной смеси
В отличие от рассмотренных вь.т те твердых добавок для
добавок типа алкилсиликонагов щелочных металлов, вводи-
мых в виде раствора или эмульсии, характерш нежелательно;
побочное действие, приводящее к наличию оптимума их к-ои.
нептр.зцпи, обеспечивающего паилучшин >ффек 1 Особенно Хо '
poiiio >101 оншмум прослеживаемся именно при введении доба-
вок второй группы, ине как вследствие химической реакции
норовая жидкость обогащается некоторыми нонами. Так, при
взаимодействии шдроксида кальция с лил- и метилсиликопа-
том натрия наряду с образованием труднорасгворнмои каль-
циевой соли в растворе остается новсрхностпо-инзктивный
тироксин натрия, влияние которого на процессы твердения
бетона было проанализировано раньше.
Этим и объясняется, что добавка ГКЖ-iO и ГКЖ-11 в не-
больших дозах затормаживает процессы гидратации и твердения
цемента, но после некоторой критической концентрации, наобо-
рот. ускоряет их (рис. 40)
Гаким образом, к основным задачам в области изучения
добавок четвертого класса следует отнести разработку новых
>ффективных недефицитных веществ, создание аналитического
шпарата для количественного описания их действия как на
процессы твердения бетона, так и на ряд его свойств, исследова-
ние сочетаний ПАВ и их модифицирования, изучение роли ПАВ
нс только с позиции их воздействия на вяжущие, но и па запол-
нитель, а также па такой конгломератный материал, как бетон
в целом и некоторые другие.
Глава 3. ТВЕРДЕНИЕ БЕТОНА
С КОМПЛЕКСНЫМИ ДОБАВКАМИ
Анализ результатов исследования и применения добавок в
бетон показывает, что во многих практически важных случаях
наиболее перспективны комплексные добавки. Преимущества
подобных добавок перед однокомнонетттными столь велики,
что, по нашему убеэвдению, в ближайшее время они почти пол-
ностью вытеснят последние из сферы строительного производ-
ства. < '
Назовем три важнейшие причины, по которым однокомпо-
нентные добавки в бетон, несмотря на простоту их изготовления
и технологичность использования, уступают многокомпонент-
ным. Первая из них заключается в том, что комплексные добав-
ки, как правило, обладают полифункциональттостью действия,
г. е. способностью влиять сразу на несколько характеристик
бетона*, причем часто не связанных друг с друтом (и даже
’’дозировать” соотношения между ними в бетоне), а в некото-
рых случаях и придавать ему, кроме того, некоторые новые
свойства (например, гидрофобность).
Вторая причина, привлекающая внимание к комплексным
добавкам, — возможность с их помощью существенно усилить
и углубить какой-либо эффект, предельно достшаемый при
введении однокомпонентной добавки. Таким путем удается,
в частности, получить сверхбыстросхнатывающиеся бетонные
смеси (свойство, необходимое для набрызг-бетона).
Третья причина заключается в том, что при введении комп-
лексных добавок удается резко уменьшить или практически
полностью устранить нежелательное побочное действие каж-
дой составляющей комплексной добавки. Например, поверх-
ностно-активные вещества, вводимые в количестве десятых
долей процента для пластификации бетонной смеси, одновре-
менно замедляют процессы гидратационного твердения вяжу-
щих, что отрицательно сказывается на производительности за-
водов сборного железобетона. Применение комплексной добав-
ки (ПАВ и электролита) исключает этот недостаток. В свою
очередь ПАВ устраняют нежелательное побочное действие элект-
ролитов — увеличение гигроскопичности бетона.
* Полифункциональность присуща и мнотм индивидуальным добав-
кам, однако число параметров бетона, па которые одновременно влия-
ют такие добавки, обычно невелико, а главное - ли параметры носит
случайный характер.
Перечисленные преимущества комплексных добавок объяс-
няют пристальное внимание к ним исследователей и практиче-
ских работников. Об этом же свидетельствует и зарубежный
опыт.
Нужно, однако, отчетливо понимать, что переход на комп-
лексные добавки представляет собой новый этап на пути к уп-
равлению свойствами бетона, требующий в первую очередь
шачителыюго повышения уровня научных знаний о протекаю-
щих при этом процессах и реакциях. Не будет преувеличением
сказать, что промышленное использование комплексных доба-
вок во многом определяется той информацией о поведении
бетона в их присутствии, которую смогут получить специалис-
ты, занятые приготовлением железобетонных и бетонных из-
делий.
Учитывая это обстоятельство, мы сделаем акцепт на теоре-
тические аспекты применения комплексных добавок, тем
более, что подобное рассмотрение необходимо также для раз-
работки новых оптимальных композиции и улучшения суще-
ствующих. В основу такого научного анализа положена клас-
сификация индивидуальных добавок по механизму их дей-
ствия. При этом все комплексные добавки целесообразно
разделить на две категории, состоящие из двух и более доба-
вок одного класса и сочетания добавок разных классов.
3.1. КОМПЛЕКСНЫЕ ДОБАВКИ ПЕРВОЙ КАТЕГОРИИ
3.1.1. Смеси добавок первого класса
Механизм действия электролитов — смесей добавок одной
и гой же группы — в принципиальном отношении почти ничем
ттс отличается от механизма действия индивидуальных доба-
вок этою класса. Так, и для них характерно достижение ’’по-
рога эффективности” при введении определенного количе-
ства добавок. Кроме того, если ускоряющее действие комп-
тсксных добавок первого класса, как и индивидуальных, вы-
разить безразмерным коэффициентом, показывающим во
сколько раз в их присутствии изменилась скорость твердения
бетонной смеси, то этот коэффициент оказывается мало зави-
сящим от состава последней при условии не очень сильно отли-
чающихся друг от друга по химико-минералогическому соста-
ву цементов и введения добавки в одной и той же концентра-
ции в пересчете на воду затворения.
Следовательно, не только индивидуальные электролиты,
но и их смеси практически в одинаковой степени изменяют ки-
нетику гидратации силикатных фаз цемента, если только сопос-
тавляются друг с другом эквиионно-сильные растворы добавок
131
одной группы независимо or их количества (исследовались
двух- и трехкомпонентпые смеси электролттов).
Эго есгесгвспно, гак как каждая из добавок изменяет физи-
ко-химические и cipoinejii.no icxiiojioi ичсскне choiicib.i сили-
катных фаз цемента, в основном, вследствие изменения ион
нои силы раствора. Подобная универсалы ость действии позво-
ляет. во-первых, при разработке новых комплексных добавок,
содержащих электролиты, заранее предвидеть их влияние па
наиболее важные составляющие цемента алит и белиг и,
во-вторых, использовать для расчета их эффективности ге же
зависимости, которые оказались пригодными для описания
действия индивидуальных добавок этого класса.
Отмеченные закономерности нарушаются, если совместно
вводить добавки первой и второй групп первого класса. Ранее
было показано, что электролиты, нс содержащие одноименно-
го с вяжущим иона, влияют на кинетику процесса, главным
образом, благодаря увеличению растворимости и скорости
растворения химически индефферентных для них фаз как вя-
жущих, так и новообразовании, причем процесс в целом лими-
тирует его диффузионная стадия, тогда как электролиты, со-
держащие одноименный с вяжущим ион. уменьшают раствори-
мость этих фаз, по увеличивают скорость возникновения заро-
дышей кристаллизации. Следовательно, совместное введение
в бетон такой комбинации добавок огкрьгвает возможности
для одновременного воздействия на разные стороны процесса
и получения некоторых новых эффектов. Проверка этою поло-
жения была предпринята нами на гипсобетоне. В качестве доба-
вок были использованы KCI и K2SO4
Первая иг них увеличивает значение АС — С С2 в урав-
нении типа (1.6) или (1.23). пропорциональное линейной ско-
рости роста кристаллов, оставляя почти неизменной величину
СдСк / Со , Функционально-связанную с вероятностью возник-
новения зародышей новой фазы а. Bi о тая добавка (K2Sc>4).
увеличивая значение а. уменьшает разность А С
Слсдоватслыто, можно (рис 41 ) нодюрать такие активные
концентрации обеих добавок (с учетом ионной силы раствора
и коэффициента активности сульфата салытия), чтобы полу-
чить близкую к постоянной величину. ппопорционагы1ую крис-
таллизапионному параметру аХ1 в уравнении (1.29), либо
произведению обоих множителей, т. с условию
(СЛСК / Со2) (Ср С2) const. (3.1)
В соответствии с теорией при этом остается неизменным и
время до конца кристаллизации вяжущею в гипсобетоне (см.
рис. 41).
132
Hie. 41. Зависимость продолжительности
пк-рдении нолугндрата сульфата кальция
il), величин, пропорциональных крис-
ачлишцконному параметру (III), и ве-
ntiiiociii виiiiHKiioiieiiiiH цешдюн крнс-
'оииациц (II) <> молирно! о С001НО-
с"‘‘” между хлоридом и еульфаюм
О 20 ЬО БО ВО к2so4;
100 80 60 ЬО 20 КС1, %
Микроскопические наблюдения показывают, что, используя
>мбинацию из добавок первого класса, содержащих и не со-
держащих одноименных с вяжущими ионов, удается изменить *
только интенсивность формирования структуры, но и дис-
рсность новообразований. При введении таких комплексных
лбавок (первой и второй групп) следует учщыв.пь 1акже,
1 в некоторых случаях их ускоряющее твердение действие
'жет оказаться и меньше, чем можно было бы ожидать исхо-
1 из принципа аддитивности.
Эю становится возможным в том случае и на том раннем
ине процесса, когда кинетику гидратации вяжущего лимити-
pyei шадия кристаллизации новой фазы. Поскольку добавки
(срвои группы повышают растворимое!ь и вяжущих, и ново-
образований, они могут несколько ослабить влияние добавок,
коряющий аффект от введения которых основан на ”выса-
шпацпцем” действии одноименного иона.
Это полезно, например, при возведении сооружений из моно-
итного бетона, от которого требуются не слишком короткие
роки схватывания. В известной мере указанные особенности
•ердения бетонной смеси на начальной стадии используют и
ри введении добавок в холодные бетоны* (совместное нри-
нис СаСЬ и NaCl)
3.J.2. Смеси добавок второго класса
По аналогии с комплексными добавками первого класса
сто целесообразны сочетания двух и более добавок пред-
I.ши гелей как одной и той же группы, так и разных групп
:5| . Однако возможность химическою взаимодействия между
, юавками и составляющими цемента, а в некоторых слу-
*1 стестиеино. Mio рассматринаюня термодинамически осуществимые р
ии
чаях и между самими добавками изменяет закономерности,
характерные для поведения отдельных компонентов комплек-
сных добавок второго класса. Так, при любом их сочетании
друг с другом не наблюдается аддитивности их действия, зато
появляются некоторые новые эффекты, с которыми необхо-
димо считаться при использовании таких добавок.
Действие добавок этого типа рассмотрим на примере одно-
временного введения в цементное тесго нескольких электро-
литов-представителей первой группы добавок (участвующих
в реакциях присоединения с образованием труднорастори-
мых двойных солей — гидратов). В качестве объектов для де-
тального рассмотрения их действия были выбраны смеси нитра-
та и нитрита кальция (ННК), а также нитрата, нитрита и хлорида
кальция (ННХК), поскольку они достаточно широко провс
рены в ходе лабораторных исследований и положительно заре-
комендовали себя в производственных условиях. Кроме того,
с их помощью удается проследить основные закономерности,
присущие и многим другим комбинациям добавок одной и той
же группы, химически взаимодействующим с составляющими
цемента. При анализе действия этих добавок на алюминии
содержащие фазы портландцементного клинкера будем рас-
сматривать преимущественно трехкальциевый алюминат, по-
скольку при гидратации четырехкальциевого алюмоферрита
в раствор поставляются те же, что и при гидратации С3А, алю-
минатные ионы, и общая картина взаимодействия выбранных
добавок с обеими этими фазами клинкера достаточно близка
(возможность в присутствии C4AF образования соединений,
в которых часть ионов алюминия замещена атомами железа,
не вносит принципиальных изменений в кинетические зави-
симости, излагаемые ниже).
Ранее было показано, что для добавок первой группы харак-
терны реакции присоединения. Необходимо учитывать, что в
присутствии двух- и трехкомпонентных комплексных добавок
эти реакции протекают как параллельные т. е. для изучаемых
электролитов по схеме;
*СаС12 * ** ЗСаО А12О3 СаС12 10Н2О
**Са(МОз)2-*ЗСаО А12О3 -Ca(NO3)2 10Н20
Ca(NO2)2-3CaO • А12О3 -Ca(NO2)2 10Н20.
При введении двухкомпонентной смеси ННК иэ рассмотре-
ния исключается первая реакция, а в присутствии гипса (обя-
зательного составляющего цемента) необходимо учитывать
возможность образования гидросульфоалюмината кальция.
Однако то обстоятельство, что при температуре до 80°С
вначале выкристаллизовывается высокое}льфатная форма это-
ЗСаО А]2О3 +
+ ЮН2О
134
го соединения, которая впоследствии и далеко не всегпз
жет перейти в низкосульфатную, затрудняет совместный ко™’
чсственныи анализ выбранных добавок и гипса. ПоэтоХ и ’
пне последнего будет учтено позднее. у ,ия'
Обозначив концентрацию алюмината кальция в жилке”
фазе через Сд, концентрацию СаС12; Са(КОз)2 и Ca(NO2)
через СВ[ ; и Cfb соответственно, а количество образую-
щихся труднорастворимых двойных солей: гидрохлор-, гидро
нитро- и гидронитриалюмината кальция - через Д,; Д2 и Д
гапишем скорость их образования:
И ^с/Д, /т/т=А,СлСВ1:
к2 =</Д2 /г/г = А2СаСВ2; ►
и3=ад3/с/т = ^зСдСВз ;
(3-2)
где • кг- к3 - соответствующие константы скорости реакций.
Разделив эти уравнения друг на друга, получаем, что отно-
шение скоростей реакций, которое можно определить по вы-
ходу конечных продуктов за одно и то же время, выражается
зависимостью
И • и2 . и3 A]CBi . 3
(3.3)
Если сравнить эти реакции с параллельными реакциями,
рассмотренными в предыдущей главе, то разница между ними
заключается лишь в том, что в данном случае по нескольким
’’каналам” расходуется алюминийсодержащая фаза цемента,
а не введенная добавка, как ранее. Это различие делает не-
возможным использование для расчетов обычных для гомоген-
ных реакций уравнений материального баланса и методики
исследования кинетики процесса. Однако и для гетерогенных
параллельных реакций сохраняются основные закономерности
кинетики их развития
Из уравнения (3.3) следует, что в случае параллельных ре-
акций отношения скоростей образования двойных солей-гидра-
тов зависят не от концентрации в жидкой фазе алюминийсо-
держащих фаз цементного клинкера, а лишь от значения кон-
стант и концентрации добавок-электролитов. Количество С3А
и C4AF в клинкере, естественно, также не влияет на величину
отношения скоростей реакций v, : к2 : и3, а определяет лишь
кинетику поступления алюминатных ионов в раствор (через
долю поверхности клинкера, приходящуюся на С3А и C4AF и
абсолютное количество возникающих двойных солей гидратов,
если общее содержание электролитов превосходит необходи-
135
мое но стехиометрии дня образования таких двойных солеи или
равно ему.
Кроме юго, как следует из уравнения (3.3), при введении
выбранных электролитов в эквимолярных конце»iрациях iко-
рост реакции будут опюсиы.си дру1 к ДРУ>У как сошнегс!
:<ующис константы, т. е. и, : v2 : и3=А.1 : к2 : А3, причем
-онстангы moi ут быть определены из независимых опытов.
Поскольку было установлено чю константы скорости образо-
вания анализируемых двойных солей располагаются в последо-
вательности А, А2 > А3, то при С|( = C(J = и выходы
них продуктов за одно и то же время должны подчиниться
..налотичнои зависимое!и.
Для клинкеров различного химико-минералогическо! о соста-
ва были получены близкие значения констант
Если сопоставить между собой результаты определения ио
'уравнению (2 14) кинетических характеристик при затворении
клинкеров разного состава растворами индивидуальных доба-
вок - хлорида, нитрата и нитрита кальция (см. табл. 10 и
рис. 20, а-в) и комплексной добавки, содержащей эти добавки
в разных сочетаниях (табл. 13), то обращают на себя внимание
следующие факты, находящиеся в удовлетворительном согла-
сии с теорией Прежде всего, константы скорости реакции
образования ГХАК при его введении в состав комплексной
цобавки или индивидуально различаются незначительно, кон-
станты же скорости образования гидронигро- и гидронитриалю-
мината кальция вообще практически не зависят от того, опреде-
лялись ли они только при добавлении одной соли или всех
солей совместно (методика проведения опыта и обработка
Таблица 13. Константы скорости к и коэффициенты торможения реак-
ций р образования гидрохлор-, гидронигро-и гидронитриалюминатоп
i.лишня и клинкере и цементном камне с добавками*
Добавка 1 ХАК 1 ПАК 1 ПиАК
к 103. в. ч к 106 <3’ ч А К)7 р, моль4
мин 4 МОЛЬ мин4 МОЛЬ мин4
1 .1C 12 • Ca(N<)3>2 1.5 2,5 2 2 —
i а( h з Ca(NO2)2 1,5 > — 3 2
Са (NO3)2 + Са (№2)2 (а<12 + Са(Ь1О3)2 + — — 3 2,5 3 2
* ( d ( NO2 ) 2 2 3 2 2 3 2
( dCi2 + < "d ( NOj) 2 +
ь IHHC 1 2 1,5
(. з(’12 + ( «1 (NO3) 2 +
• Ca (N(l2 ) 2 + nine 1 2 2,5 2 3 >
»Концентрация хлорида, нитрата н нигрита кальция составляла 0.5 моль/
к иоде затворения, концентрация пика - 5 '/ массы вяжущею. темнерату]
опытов - 20°С
136
щитов при использовании комплексных добавок Гж.
ими же, как и при введении индивидуальных) И
Как видно из данных табл. 13, переход от клинкеров к не
щам разного состава нс изменяет этих закономерностей
ле тою, при введении и индивидуальных, и комплексных
пок химико-минералогический состав клинкера пракчи
не сказывается па значениях констант скорости 061x130
.. соответствующих двойных солей. Наконец, совместное
.тление нескольких водорастворимых электролитов, па
мер хлорида, нитрата и нитрита кальции, не влияет па коэф
пт торможения реакции /3; ею значение остается нракти-
таким же, каким оно было при введении каждой пт ты
ы.х добавок в отдельности Интересно, что величины к >эф-
.ттстпов торможения (3 для гидрохлор-, гидронитро- и гидро-
;грш1люьшпага капыщя в пределах ошибки опыта совпадают.
ктенидии, это можно объяснить однотипностью указанных
тйпых солей. Таким образом можно заключить, что по экра-
ирутощей способности эти соли должны быть близки одно-
ттпому с ними С4Д11«/, с которым, как уже указывалось,
пи могут образовывать твердые растворы. Следовательно,
т их индивидуальные кинетические характеристики, можно
Jточно точно предвидеть и скорость образования новых
при совместном введении таких добавок, что важно для
, кгики. Например, вводя совместно трехкомпонепгнуто
ест. из близких к эквимолярным концентрации CaClj,
(NO3)2 и Ca(NO2)2, можно быть уверенным в том, что
.стрее других израсходуется на образование труднораство-
щмой двойной соли агрессивный в отношении арматуры хло-
ид кальция, тогда как нитрит кальция как превосходный
тамедлитель коррозии арматуры продолжительное время сохра-
ни тем в жидкой фазе цементного камня. Этот прогноз под-
твердился в условиях длительных натурных испытании [30,
•i|.
Уравнения (3 3) и (2.15) мот ут быть использованы также
тя вычисления примерного значения константы скорое пт
ор т топания двойной соли, для которой отсутствуют соответ-
сютпие литературные данные. Для этого нужно измерить
тыход в ирису тс ниш другой введенной в эквимолярной
концентрации добавки, константа скорости реакции которой
н твеегна.
При помощи формул (3.3) и (2.15) можно колнчествен-
сопоставить между собой реакционную способность раз-
тнчных электролитов. Однако при работе с клинкерами и гем
.«nice с цементами при качественном соответствии теории с
нернментами могут наблюдаться некоторые отклонения
количественных зависимостей вытекающих из этих урав-
птй. Это объясняется влиянием силикатных фаз цемента н
гипса, пленкообразованием, неодинаковой скоростью расхо-
дования электролитов и некоторыми другими обстоятельст-
вами. Следовательно, уравнения (3.3) и (2.15) обычно могут
быть использованы лишь для оценочных расчетов, что, одна-
ко, не умаляет их значения для нахождения полуколичествен-
ных зависимостей и определения основных направлений проте-
кания реакций в присутствии комплексных добавок.
Анализ выражения (3.3) показывает, что относительными
скоростями образования тех или иных двойных солей-гидра-
тов, а следовательно, и их выходами, можно сознательно уп-
равлять, регулируя концентрацию вводимых электролитов.
При этом удается, сильно изменяя соотношения между кон-
центрациями этих добавок, добиться такого положения, ког-
да в течение некоторого времени последовательность образо-
вания двойных солей-гидратов будет отличаться от той, кото-
рая наблюдается при равенстве концентраций добавок. Таким
образом, для реакций, далеких от равновесия, действуют толь-
ко законы кинетики и понятие термодинамической предпочти-
тельности неприменимо* что весьма существенно не только
для модельных систем, но и для бетонов на товарных цемен-
тах, при твердении которых необходимо учитывать роль гип-
са. Так, при введении 1—2 % хлорида кальция в бетонную смесь
преобладающей фазой, выкристаллизовавшейся па ранней ста-
дии процесса, будет гидросульфоалюминат кальция ГСАК-3.
Если, однако, значительно увеличить содержание хлорида
кальция, то первоначально можно наблюдать преимуществен-
ное выкристаллизовывание гидрохлоралюмината, а не гидро-
сульфоалюмината кальция, поскольку концентрация сульфата
кальция в растворе, не превышающая растворимость гипса,
оказывается примерно в 100 раз меньше концентрации хло-
рида кальция.
Подтверждением сказанному служат многочисленные дан-
ные по коррозии бетона в морской воде: количество обра-
зующегося ГСАК-3 в таких средах меньше, чем при равной
концентрации сульфат-ионов в минерализованных водах, не
содержащих большого количества хлоридов (в морской воде
содержится около 3 % NaCl).
Нужно, однако, учитывать, что в бетоне с добавками 1акое
смещение последовательности выкристаллизовывания двойных
солей-гидратов носит лишь временный характер, так как по
мере расходования одного из введенных веществ на образо-
вание труднорастворимой двойной соли изменяется и соотно-
шение между концентрациями оставшихся в жидкой фазе ионов.
Следовательно, со временем восстанавливается и обычная
последовательность выкристаллизовывания этих солей: ГСАК-3^
* Естественно, что рассматриваются термодинамически осуществимые
реакции.
ГХАК — в соответствии с большей константой скорости
образования высокосульфатной формы гидросульфоалюмииата
кальция.
В отличие от этого при коррозии бетона вследствие ноступ-
|сния злектролигов извне исходные соотношения между их
концентрациями могут сохраняться сколь угодно долго. Этот
пример показывает, чго при изучении механизма действия до-
бавок нужно, используя аналогии (в частности, между процес-
сами твердения минеральных вяжущих в присутствии электро-
литов и коррозией бетона), быть весьма осторожным при пере-
носе закономерное ion, характерных для коррозионного про-
цесса, на кинетику гидратационного твердения цементу при
введении добавок.
Наконец, как следует из уравнения (3.3) и эксперимен-
тальных данных [71], при совместном введении в вяжущее
нескольких электролитов соответствующие двойные соли-
гидраты (в анализируемом случае гидросульфо-, гидрохлор-,
гидронитро- и гидронитриалюминат кальция) могут выкристал-
гизовываться только одновременно, хотя-и с разными абсолют-
ной и относительной скоростями. Этот общий вывод распро-
страняется на гидросульфоалюминат кальция, а также на дру-
гие двойные соли: гидрокарбо-, гидроацетоалюминат кальция
п г. д., могущие образовываться в исследуемых системах. При-
менительно к важному для практики случаю введения в бетон-
ную смесь, например, добавок хлорида и нитрата кальция в
концентрации примерно по 1 %, это означает, что вскоре после
затворения практически одновременно будут выкристаллизо-
вываться ГСАК-3, ГХАК и ГНАК; однако выход
первого из них окажется значительно выше, чем выходы ос-
тальных двойных солей.
Кроме того, поскольку концентрация сульфата кальция в
жидкой фазе может н течение некоторого времени поддержи-
ваться на постоянном или близком к постоянному уровне
вследствие растворения гипса, а концентрация хлорида и нитра-
та кальция систематически убьгвает, то со временем должно
измениться в пользу ГСАК-3 и соотношение между скоростями
их кристаллизации.
Очевидно ггри введении в бетон других комбинаций добавок
электролитов будут наблюдаться принципиально те же законо-
мерности, причем также с постоянно изменяющимся соотноше-
нием между скоростями образования двойных солей-гидратов.
Переменная скорость выкристаллизовывания двойных со-
лей-гидратов вследствие изменения концентраций Сд, Св ;
Св2 и Срз в уравнениях (3.2) и (3.3) относится к весьма ха-
рактерным признакам действия добавок - смесей хорошо раст-
воримых электролитов и отличает их от действия груднораст-
воримых добавок второго класса (в частности, гипса), при-
139
менение которых позволяет в течение некоторою времени под-
держивать концентрацию электролита в жидкой фазе примерно
на одинаковом уровне.
Анализ уравнении (3.2) и (2.15) cbh>№icjii>cibv< т. что они
качес1Венно правильно передают основные ыкоиомершн. 1И
действия и добавок второй группы второю класса солеи
щелочных металлов, например NaCl и MaNO2 В ном случае
необходимо учитывать, что, во-первых, ионы кхтышя чля крис
таллизации двойных солеи поставляет в раствор тидратируто
щийся алит и, во-вторых, что в ходе реакции в ноткой фазе
сохраняются ионы натрия (которые не образ} ют трудттораст
коримых соединений) и pH среды поддерживается весьма вы-
соким*.
До сих пор мы говорили в основном об относительных зна-
чениях скоростей образования двойны:. солей-гидратов, для
определения которых, согласно уравнениям (3.3) и (2.15),
при введении комплексных добавок не нужно знать концент-
рацию алюминатных ионов. Иная картина наблюдается, если
необходимо определить абсолютные скорости кристаллиза-
ции этих солей. Проанализируем эту задачу для композиции
из добавок СаС12; Ca(NO3)2; Ca(NO2)2 и гипса.
Воспользуемся ранее принятыми обозначениями [см. урав-
нения (3.2) и (3.3)] со следующими дополнениями: скорость
и константу скорости кристаллизации т идросульфоалюминага
кальция обозначим через г4 и к4 соответственно, концентра-
цию сульфата кальция в жидкой фазе через
С учетом уравнения (3 2) суммарная скорость образования
всех двойных солей и 0^щ может быть найдена по формуле:
%бщ. =v' +^2 +^з + =СЛ(А,СВ1 +A2Clb +
Л4СВ4), (3.4)
из которой видно, что в результате одновременною протекания
параллельных реакций в единицу времени из раствора должно
связываться в труднорастворимые соли больше алюминатных
ионов, чем при взаимодействии С3А и (4AF только с одной
добавкой.
Это может привести к тому, что вскоре после затворения
цемента водными растворами добавок скорость связывания
алюминатных ионов при образовании двойных солеи превысит
скорость их поступления в раствор за счет растворения алюми-
нийсодержащих фаз. Соответственно концентрация этих ионов
в жидкой фазе в присутствии комплексных добавок окажется
заметно меньше метастабильттой растворимости С3А и C4AF и
ниже, чем при введении только одной добтвки. При этом в слу-
*11ри этом рассматриваются случаи, кот да сохраняется термодинами-
ческая возможность образования двойных солеи.
применения комш.ексноИ добавки скорость образования
' 1 и удойных солей-тицратов может оказаться меньше,
УлТ , И1ЩИ111|дуаяьнои, так как из уравнений (3.2)
L( 'Ун 1 ° скорость реакции, имеющих первый норя-
,z 4 ' чрямо пропорциональна концентрации
ттомината кальция в жидкой фазе (Сд)
Однако в отличие от гомогенных реакций, где этот вывод
требует доказательств, для гетерогенных реакций он не
>свиден, так как скорость поступления в жидкую фазу алю-
минатных ионов может быть в течение длительного времени
выше, чем скорость их расходования — ттезависимо от того
ятедепа ли индивидуальная или комплексная добавка. В тю-
тобных условиях содержание Сд в растворе будет поддержи-
ваться на уровне метастабильной растворимости алюминий-
содержащего вяжущею и согласно закону действующих масс
изменение скорости образования двойной соли будет зави-
л. гь от изменения концентрации добавки в растворе.
Иными словами, вывод о том, что при введении комплекс-
ных добавок скорость образования каждой из двойных солеи
будет меньше, чем при использовании индивидуальных доба-
вок, справедлив лишь в том случае, если вскоре после начала
реакции самой медленной (и поэтому лимитирующей) будет
тадия растворения алюминийсодержащих фаз цемента.
Следовательно, правомочна постановка и обратной задачи:
шределение лимитирующей стадии при взаимодействии С3А
и t4AF цемента с исследуемыми добавками по тому, умень-
шится ли при этом скорость образования некоторых двойных
солей. Для экспериментальной проверки этого положения были
поставлены две серии опытов: в первой добавками к портланд-
цементу служили хлорид кальция И нитрит натрия [71] , во
второй — хлорид и нитрит кальция, нитрат и нитрит кальция,
л также хлорид, нитрат и нитрит кальция.
Результаты опытов (рис. 42) позволяют утверждать, что
независимо от того, содержат ли добавки одноименные с вяжу-
щими ионы или нет, в присутствии гипса скорость образования
т идрохлор-, гидронитро- и т идронитриалюмипага кальция умень-
шается. Аналогичные результаты получены и при исследовании
комплексных добавок: СаС12, Ca(NO3)2 и Ca(NO2)2, вводи-
мых в клинкеры, скорость кристаллизации и гидронитро- и
т идронитриалюмината кальция при этом была меньше, чем
при применении каждой из названных добавок в отдельно-
сти (рис. 43).
Следовательно, вскоре после начала твердения цемента в
присутствии комплексных добавок стадия растворения С3А и
C4AF как более медленная становится лимитирующей.
Практическая важность изложенных положений опреде-
тяется тем, что в связи с меньшей скоростью образования двои-
Рис. 42. Кинетика образования гидро-
нитриалюмината кальцин
1 — 5% гипса + клинкер + 1% NjNO2 +
+ 2,85% СаС12; 2 — клинкер * 1%
NaNO2 и клинкер + 1% NaNO2 +
+ 2,85% СаС^; 3 — 5% гипса +• клин-
кер + 4% NaNO2 + 2,85% CaCl 2; 4 -
клинкер + 4% NaNC^ , 5 — клинкер
+ 4% NaNO2 + 2,85% СаС12
ных солей концентрация добавок электролитов в жидкой фазе
цементного теста в течение более длительного периода времени
поддерживается на высоком уровне; благодаря этому увеличи-
вается интенсивность гидратационного твердения основных
носителей прочности цементного камня - силикатных фаз це-
мента, на которые эти электролиты действуют в основном как
добавки первого класса, химически не взаимодействующие
с ними.
При введении добавок, содержащих одноименный с вяжущим
ион, помимо увеличения ионной силы раствора, необходимо
учитывать также высаливающий эффект этого иона, а при ис-
пользовании в качестве добавок солей щелочных металлов по-
вышение pH среды.
Таким образом, на полиминеральные цементы те составляю-
щие комплексных добавок электролитов, которые менее актив-
но реагируют с С3А и C4AF, неизбежно должны в течение неко-
торого времени действовать как добавки первого класса. Про-
должительность и степень этого влияния на силикатные фазы
цемента, зависящие от природы добавки и ее концентрации,
можно регулировать, подбирая соответствующие композиции
электролитов.
Рис. 43. Кинетика образования гидро-
хлоралюмииата кальция
• — клинкер + 5% гипса + 0,5 моль/л
СаС12; + — клинкер•+ 0,5 моль/л CaCl 2;
о — клинкер + 0,5 моль/л CaCl 2 *
+ 0,5 моль/л Ca(NO3)2; х - то же,
+ 0,5 моль/л <’а(1Ч02)г
Рис. 44. Степень гидратации силикатных фаз цемента
(незашгрихованные области) и прочности образцов
(заштрихованные области)
Г — через 3 ч нормального твердения; 11 — после подъ-
ема температуры до 85°С; Ш - после 3 ч изотермиче-
ского прогрева при 85°С; 1 - без добавок; 2-3%
ННК; 3 - 3% ННХК; 4 - 3% CaCl 2
Опыт подтвердил, что некоторые электролиты, входящие в
состав комплексных добавок, влияют в основном на гидратацию
C3S и 0-CiS цемента [35] (рис. 44 и 45). Об этом свидетельст-
вовали данные химического и количественного рентгеновского
анализов (последний был выполнен на установке УРС-50И).
Определяли степень гидратации портландцементного клинкера
в присутствии индивидуальных и комплексных добавок, подоб-
ранных таким образом, чтобы можно было проследить за раз-
личием в их поведении, проявляющемся в кинетике гидратации
C3Sh /5-C2S.
Замедленное связывание добавок электролитов в трудно-
растворимые двойные соли-гидраты имеет весьма существен-
ное значение и для бетонов, твердеющих на морозе, так как
способствует созданию высокодисперсной структуры цемент-
ного камня и понижению температуры замерзания воды в по-
рах бетона.
Однако наряду с опытами, подтверждающими вывод о неко-
тором снижении скорости реакции с С3А и C4AF отдельных
составляющих комплексных добавок электролитов по сравне-
нию со скоростью аналогичных реакций этих добавок, вводи-
мых индивидуально, были получены данные, находящиеся,
на первый взгляд, в противоречии с таким выводом. Так, при
142
143
Рис. 45. Кинетика изменения степени
гидратации силикатных фаз цемента
при изотермическом прогреве теста
(обозначении те же, что на рис. 44)
затворении цемента растворами добавок СаС12 ; Ca(NO3)2 11
Ca(NO2)2 возрастала скорость выкристаллизовывания гидро
гульфоалюмината кальция, а при введении таком же смеси
электролитов в поргландцеменгный клинкер гидрохлор-
алюмината кальция, т. е. во всех случаях гой из двойных солеи,
коюрая в этих условиях образуется быстрее других (см
табл. 14).
Чтобы установить причины этого явления, проанализируем
уравнение (3.4) при следующих дополнительных условиях.
св, - св2 ~ СВГ св^ с (5 5)
и A.J + А.2 + А.з. (3.6)
Тогда:
vo6ni- ~ + ^2 . (3.7)
Это означает, что при одинаковых или близких концентра-
циях добавок третьей группы суммарная скорость реакции
или, что то же самое, ее ’’выход”, т. е. количество одновре-
менно образовавшихся двойных солей [см. уравнение (3.2)],
зависит oi их констант скоростей реакции, а при выполнении
также и второй части условия эта скорость определяется ско-
ростью самой быстрой реакции*.
Именно этот случай реализуется при введении в бетонную
смесь растворов хлорида, нитрата и нитрита кальция (и им
подобных добавок) в малых дозировках (десятые доли процен-
та), так как константы скорости образования гидросульфо-
*В этом заключается одно из принципиальных отличии параллель-
пых реакции от носледова»сльиых, скорость коюрык он редеяясilh
скоростью самой медленной стадии реакции (процесса)
тината кальция А4 значительно превосходит константы
скоростей А], к2 иА3.
[акая же картина, естественно, наблюдается и при умень-
шении числа добавок, например при исключении из смеси
СЦ\'О3)2 или Ca(NO2)2. В этом случае при резком различии
н ш.тчетшях констант можно и не требовать строго выполнения
|<)нии (3.5). если только . что следует из
уравнения (3.4).
I[о так как остальные электролиты в соответствии с теори-
медлепнее расходуются па образование груднорастворимых
ел. то они в течение более продолжительного времени нод-
цтржпвают на высоком уровне ионную силу раствора. Если же
. качестве таких добавок использовать электролиты, содер-
жащие одноименные с вяжущим ионы, то при этом сохраняется
высаливающий эффект, что также приводит к ускорению
х рисгаллизации наиболее быстро образующейся двойной соли.
I аким образом, в действительности экспериментально обна-
руживаемые факты увеличения скорости образования той из
солеи,которая выкристаллизовывается интенсивнее остальных
со тей-гидратов, не противоречат выводам, которые можно сде-
.тть из уравнений (3.4) и (3.7).
И итоженные положения о механизме действия комплексных
добавок второго класса могут быть проверены опытным путем.
В частности, если они правильны, то кинетика кристаллизации
наиболее быстро образующейся двойной соли при одинаковой
ионной силе раствора, обеспечиваемой разными посторонними
злек гролитами, должна быть практически постоянной и не за-
висящей от их состава. Кроме того, указанная закономерность
должна выполняться при использовании вяжущих различного
химико-минералогического состава, что подтверждается экс-
периментальными данными (см. табл. 14).
Объектами исследований служили разные клинкеры; в ка-
честве наиболее быстро образующейся двойной соли был выбран
гидрохлоралюмипат кальция, а добавки состояли в одном слу-
чае из смеси СаС12, Ca(NO3)2 и Ca(NO2)2, в другом — только
из СаС12 и Ca(NO2)2 Константы скорости реакции, наиболее
объективно и к тому же количественно характеризующие кине-
тику процесса, были вычислены аналогично тому, как это было
сделано ранее при изучении кинетических констант процесса
в случае введения в минеральные вяжущие индивидуальных
добавок второго класса.
Практическая важность полученных доказательств механизма
ускоряющего действия комплексных добавок второго клас-
са на кристаллизацию наиболее быстро образующеися двой-
ной соли несомненна. Прежде всего из теоретических представ-
тснил следует, что этот эффект универсален в том смысле,
что он не зависит от состава возникающей двойной соли. Это
означает, что сделанные выводы распространяются на кинетику
кристаллизации и гидросульфоалюмината кальция, если он
образуется наиболее быстро, и гидрохлоралюмината кальция,
если гипса в системе не было или он уже практически юлностью
связан в гидросульфоалюминат кальция.
Таким образом, необходимо учитывать возможность ’’эста-
фетного” действия комплексных добавок второю класса:
после практически полного или частичного выкристаллизовы-
вания из жидкой фазы той из составляющих многокомпонент-
ной добавки, которая участвует в формировании наиболее
быстро кристаллизующейся двойной соли, ее функции ’’прини-
мает на себя” другая составляющая, занимающая следующее
за ней место по скорости образований двойной соли. Ее в свою
очередь может сменить третья составляющая комплексной
добавки — электролита и т. д.
Следовательно, удается рационально подбирать такие компо-
зиции добавок, которые обеспечили бы повышенную скорость
образования некоторых труднорастворимых двойных солей
после того, как входящие в их состав электролиты, находясь
в растворе, уже выполнили свою основную функцию — интен-
сифицировали раннюю стадию твердения бетонной смеси. Осо-
бенно важно предусмотреть подобную возможность при наличии
в составе комплексной добавки электролитов, содержащих
хлорид-ионы, опасные своей агрессивностью в отношении сталь-
ной арматуры*.
Интересно, что тот же эффект — ускорение образования гид-
рохлоралюмината кальция — наблюдался нами и тогда, когда
хлорид-ионы проникали в бетонные образцы извне, а в поровой
жидкости этих образцов содержались нитрит и нитрат кальция,
введенные ранее в виде добавок. Следовательно, целесообраз-
ность использования таких добавок, как нитрит-нитрат кальция
(ННК) в качестве замедлителей коррозии стали обусловлена
не только их пассивирующим действием в отношении арматуры,
но и тем, что в их присутствии ускоряется выкристаллизовы-
вание из жидкой фазы ГХАК и ГСАК-3 и, следовательно, умень-
шается содержание агрессивных хлорид- и сульфат-ионов, могу-
щих проникнуть в железобетонные конструкции при их контак-
те с минерализованными водами.
Анализ рентгенограмм (рис. 46) приводит еще к одному
существенному в прикладном отношении выво ту: процесс
кристаллизации гидросульфоалюмината кальция ГСАК-3 не
только значительно ускоряется, но и становится сравнительно
мало зависящим от состава клинкерной части цемента. Так,
во всех случаях линии гипса (d = 46 нм) на рентгенограммах
цементного камня с комплексными добавками исчезали уже
к первому часу после начала опытов (температура 20°С), тогда
’Данные табл. 14 и рентгенограмм подтверждают сделанные выводы.
146
Рис. 46. Участок рентгенограммы
гидратированных клинкеров с до-
бавкой 5% гипса после 12 ч тверде-
ния (1) нс комплексной добав-
кой 5% гипса + 2% CaCl 2 +3%
Ca(NO3)2 после 1 ч твердения (2)
Г — белитоалюмоферритный клин-
кер; II — белитоалюминатный,
Ш белитоалюмоферритный; 1У —
алитоалюминатньхй клинкер; э —
эттрингит; г — гипс; а — гидроалю-
минат; аф - алюмоферрит
I п ш ш
/4 12 10 в 12 10 8 12 10 8 12 Ю 8
как в цементном камне из алитоалюминатного, алитоа^юмо-
ферритного и белитоалюмоферритного цементов, твердевших
без добавок, линии гипса наблюдались даже через 12 ч гидра-
тации.
Очевидно, помимо непосредственного влияния смеси электро-
литов на кинетику кристаллизации двойных солей за счет изме-
нения ими ионной силы раствора, обеспечивающей некоторую
независимость их действия от минералогического состава це-
мента, нужно учитывать также косвенные эффекты, вызванные
введением добавок электролитов и проявляющиеся в измене-
нии условий пленкообразования труднорастворимых составляю-
щих цементного камня.
Эти побочные явления могут нарушить количественные за-
висимости, однако качественно их удается предусмотреть.
При рассмотрении механизма действия смеси добавок вто-
рого класса нам не потребовалось учитывать влияния катиона
добавки, в данных примерах одноименного с вяжущими каль-
ций-иона. Иными словами, кристаллизация наиболее быстро
образующихся двойных солей-гидратов в присутствии комп-
лексных добавок должна ускориться, налример, и при исполь-
зовании вместо СаС12 поваренной соли или хлорида калия.
Эксперимент подтвердил это положение.
Точно так же не должно произойти качественных изменений
в кинетике кристаллизации наиболее быстро образующихся
двойных солей и при использовании двухкомпонентной добав-
ки, содержащей кроме хлорида кальция нитрит натрия' (ка-
лия). Наши опыты (рис. 47) показывают, что эта последняя
составляющая добавки ускоряет кристаллизацию гидрохлор-
алюминага кальция и тем сильнее, чем выше ее концентрация,
т. с. действует аналогично нитриту кальция. При этом необ-
ходимо учитывать лишь все сказанное ранее в отношении га-
147
Рис. 47. Зависимость кинетики
образования гидрохяоралюмина- |
та кальция от концентрации доба-
вок к цементу
I - 2% СаС12; 2 - 4'4. CaCI2; i
3 2% CaCl2 + 2% N.iNO2; 4 -
4% CaCl2 + 27c NaNO2
ких эяскгролиюв, и прежде всею неизменность копиекгранни
в жидком фазе ионов щелочных металлов и повышение pH
среды.
В связи с практической важностью этого положения дтя i
прогнозирования длительности действия в бетоне электро.чи
тов — ингибиторов коррозии стали (нитритов) и соответствен-
но долговечности железобетонных конструкций в бетон вводи
ли добавку ННХК с известным соотношением в пей хлорида и
нигрита кальция. Через 7,5 лет в норовой жидкости бетона
снова определяли это соотношение. Приведенные в табл 14
данные показывают, что во всех случат х со временем соотно-
шение изменилось в пользу нитрита кальция [31,32]
Аналогичные результаты были нолучшы нами и при введе-
нии ННХК в тяжелый бетон после девягилетних натурных ис-
пытании.
Таким образом, можно дать положительный дош перечный
прогноз сохранности арматуры при введении добавки ННХК
в бетон тем более, что за 13 мег при pH 9,8 (± 0,2) и 1 1,5 кон
центрация нитрита кальция уменьши паев всего на 9 и 6,5 Ч
Таблица 14. Соотношение хлорид-и интриг-ионов ц норовой жндкоши
керамаигобеюна с добавками ННХК после 7,5 лег испытании
Лобзи- ка ННХК % но мае се не мен- га Исходное от- ношение Са( I 2 (a(NO2)2 In ННХК С одержание в поровой жидко сти, мг/| < а( 1 2 ( а ( N( )2 ) 2 после испытаний
СаС1 2 (’a (NO2) 2
1.5 6 1 04 2.5
3,5 6 3,2 0,8 3.6
2,5 2 1.7 1 2 1.4
2.5 1 0,9 1,7 0.5
1 5 0 66 0.4 1 0.4
3,5 0,66 0,9 2,4 0.4
При меча и ис Содержание нитрата кальция в добавке ННХК было в<’
всех опытах равво содержанию нигрита кальция.
соответственно (опыты проводили в модельных условиях)
[31,32].
Теоретический анализ и экспериментальные данные пока-
зывают, что при введении в бетонную смесь комплексных до-
бавок электролитов, содержащих и не содержащих одноимен-
ные с вяжущими и друг с другом ионы и способных к реакциям
присоединения или обмена с составляющими цементного клин-
кера. в китгетике их взаимодействия с С,А и C4AF появля-
ется отчетливая дифференциация: ускорение кристаллизации
той пт двойных солеи, которая в данных конкретных условиях
образуется быстрее друтих, и замедление кристаллизации осталь-
ных двойных солей.
Подобная дифференциация скоростей образования двойных
солеи-гндрагои, зависящая от соотношения между концентра-
циями добавок, со временем уменьшается, но не исключается
полностью. Это объясняется, с одной стороны, преимущест-
венным расходованием той добавки, которая входит в состав
двойной соли, кристаллизующейся с большей скоростью, и с
другой, - эстафетностью действия комплексных добавок вто-
рою класса: после связывания в двойную соль одного электро-
лита его роль будет выполнять другой, входящий в состав
их смеси, а именно тот из них, который будет участвовать в
кристаллизации двойных солей-гидратов, образующихся в
данной системе быстрее других однотипных соединений.
При введении комплексных добавок-электролитов с су-
щественно различной скоростью образования из них двойных
солеи скорость кристаллизации наиболее быстро образующейся
соли возрастаем а наиболее медленно образующейся — умень-
шается. В связи с этим существенным становится вопрос о роли
той (или тех) составляющей смеси подобных добавок, которые
ио скорости реакции образования соответствующей двойной
соли занимают промежуточное положение.
Эксперименты показали, что такие электролиты чаще всего
могу г выступать в роли дифференцирующих: они в еще большей
С1снени увеличивают разницу в скоростях кристаллизации
двойных солей, занимающих по этой кинетической
характеристике предельные положения. Заметим, однако, что
при значительной дозе подобной добавки она может и несколько
гатормозить процесс образования соли, выкристаллизовываю-
щейся с наибольшей скоростью
Что же касается непосредственно участия в формировании
собственной двойной соли, то здесь затруднительно дать какой-
то однозначный ответ: все определяется, главным образом,
концентрацией добавки и абсолютными значениями констант
скорости образования всех двойных солей данной сложной сис-
темы, от которых в конечном счете и зависит степень влияния
на кристаллизацию рассматриваемой соли остальных введен-
ных электролитов
148
149
Из анализа уравнений (3.4) и (3.7) следует, что хотя общая
скорость превращения алюминийсодержащих фаз цемента
при введении комплексных добавок увеличивается, но ана
литическое решение для данного случая затруднительно, так
как не удается количественно учесть ускоряющее влияние
одних составляющих комплексной добавки на кинетику
взаимодействия с Сз А и C4AF других ее составляющих.
При экспериментальном решении этого вопроса мы вос-
пользовались уравнением материального баланса
Л тг = С4т + Д1 + Д2 + Дз + .. • + Д, (3.8)
1де = т0 - тт - разность между исходным т0 и оставшимся к
определенному моменту времени т количеством алюминийсодержащих
фаз. Остальные обозначения — те же, Что я в уравнении (3.2).
При достаточной глубине превращений алюминийсодержащих
фаз в соответствующие двойные соли-гидраты можно принять
условие:
Q/ Д (3.9)
(напомним, что максимально достигаемая концентрация алюми-
натных ионов в жидкой фазе при комнатной температуре, от-
вечающая растворимости метастабильного трехкальциевого алю-
мината, составляет Сд ~ 7 • 10"3 моль/л (1,9 г/л).
С учетом неравенства (3.9) уравнение (3.8) позволяет про-
верить исследуемую зависимость. Сумма выходов всех получаю-
щихся в ходе реакций двойных солей (при расчете по алюмина-
там) к какому-либо моменту времени т приближенно равна
количеству израсходованных на эти превращения С3 А и С4 AF
Следовательно, из выражений (3.8) и (3.9) вытекает также
практически важная возможность установить, увеличивается
ли или уменьшается общая скорость превращения алюминий-
содержащих фаз цемента при замене в комплексной добавке
одного электролита другим, также способным к образованию
двойной соли, характеризующейся иной кинетикой кристал-
лизации.
Принципиально те же закономерности сохраняются и при
использовании двух и более добавок второй группы второго
класса. Рассмотрим их на примере совместного введения в
бетонную смесь поташа (или соды) и алюмината натрия. Для
них параллельные реакции запишутся в виде:
150
+К2СО3
CaCO3 + 2K+ + 2011
Са(ОН)2
-г +2NaA102 -^Са (Д1О2) 2 + 2Na+ + 20Н~
и соответственно скорости образования карбоната и алюмината
кальция* составят:
=А'ССа(ОН)/К2СОз ’
(3.10)
и2 =Л2 сСа(ОН)2 C2NaA102 '
Отношение скоростей оказывается независимым от концент-
рации в жидкой фазе гидроксида кальция, т. е.
Л : ^2=^1СК2СОз ; А2С2№А1О2 . (3.11)
Выход продуктов реакции при этом определяется значениями
констант скоростей реакций и концентрациями введенных до-
бавок с учетом показателей степеней при них, а также раствори-
мостью новообразований в присутствии щелочей, т. е. теми же
зависимостями, с которыми мы уже встречались при анализе
добавок второй группы второго класса (NaCl, NaNO2 и им по-
добных). В данном случае при Cj<2cq3 ~ ^NaAlOz из’за
очень низкой растворимости карбоната кальция и большего
пересыщения в ранние сроки СаСО3 будет преимущественно
выкристаллизовывающейся фазой.
Однако нужно учесть, что растворимость гидроксида каль-
ция, выделяющегося при гидратации алита, по мере накопле-
ния гидроксидов щелочных металлов уменьшается (действие
одноименного гидроксильного иона) В результате в ходе ре-
акции будут изменяться как абсолютные, так и относительные
скорости образования карбоната и гидроалюмината кальция
(последнего потому, что СаСО3 выкристаллизовывается из
раствора быстрее, чем гидроалюминат кальция).
В присутствии гипса протекающие параллельные реакции
удобнее записать в несколько ином виде:
-* +ЗК2СО3 — ЗСаСОз + 6К+ + 60Н~,
ЗСа(ОН)2
-*• +2Na3A103 + 3CaSO4 + 31H2O-^3CaO • А12О3
—>* 3CaSO4 31Н2О +6Na+ + 60Н",
’Естественно, что в конечном счете образуются кристаллогидраты
151
причем изменится и соотношение скоростей образования кар-
боната кальция и ГСЛК-3, растворимость которого значитель-
но ниже, чем у гидроалюмина!а кальция. Однако в лом слу-
чае необходимо принимать во внимание, чго сульфа!-ионы
появляются в жидкой фазе в результате гетерогенного процес-
са растворения гипса. Иными словами, записанная параллель-
ная реакция усложняется последовательно протекающим раст-
ворением гипса. Таким образом, в данном случае мы имеем
дело со схемной параллелыю-послсдон цельной реакцией;
поэтому при весьма большой скорости образования гидро-
сульфоалюмина га кальция яимитирующси может оказаться
стадия поступления в раствор сульфата кальция. Если принять
во внимание, что скорость растворения гипса, как указывалось,
достаточно велика [65, 67] и возрастает в присутствии щело-
чей, а скорость растворения алита увеличивается за счет умень-
шения содержания в жидкой фазе калышй-иоиов вследствие
кристаллизации СаСОз, то становится понятным, почему комп-
лексные добавки рассматриваемого типа относятся к очень
сильным ускорителям твердения и особенно схватывания бе-
тонной смеси.
Исследователями доказан;» также автономность влияния по-.
добных комплексных добавок на ранние сроки твердения бе-
тона, которая проявляется в том, что они поставляют в раст-
вор почти все ионы, необходимые для формирования первич-|
кого структурного каркаса. В результате абсолютные значе-
ния сроков схватывания бетонной смеси оказываются очень
малочувствительными к химико-минералогическому составу
цемента и водоцементному отношению (рис. 48, кривая 2).
Это особенно существенно для технологии набрызг-бетона,,
методика нанесения которого такова, что в отдельные моменты
времени возможны некоторые отклонения от заданного сред-1
него водоцементного отношения.
Особые преимущества применения смеси добавок второй
группы, в частности алюмината натрия и поташа, перед введе-
нием в бетонную смесь только одного из них проявляются
также в тех случаях, когда требуется получить сверхбыстрое
схватывание смеси без заметного снижения последующей проч-
ности бетона.
На рис. 49 представлены данные, полученные путем комби-
нирования этих добавок, причем за 100*% каждой из них приняты
их оптимальные в смысле ускорения схватывания бетонной
смеси дозировки. Они свидетельствуют о неаддитивности влия-
ния смеси поташа и алюмината натрия на самую раннюю стадии
структурообразования бетонной смеси, что позволяет сокра
тить время до начала схватывания до 10—20 с неэависимо or
минералогического состава цемента, а при подогреве воды до
~40°С обеспечить практически мгновенное схватывание бетон
ной смеси, столь важное для набрызг-бс'она. При необходимо-
152
®пипние водоцементного отно-
шения па сроки схватывании (начало)
цеменг но-песчаного раствора в врисут-
С1ВИИ добавки сульфата железа И ( ) и
смеси поташа н алюминат натрии в от-
ношении 0,8 : 1 по массе (2)
Сроки схватывания (начало)
100 вО 60 4# ^гС03,°/о
Рис. 49.
цементно-песчаного раствора в присут-
ствии добавок поташа и алюмината
натрия
сти одновременно повысить сульфатосгойкость бетона к этой
композиции добавляют сульфат натрия, а для дополнительной
зашиты от коррозии арматуры — нитрит натрия.
При введении с водой затворения добавок на основе алюми-
ната натрия и поташа обнаружено, чго твердение бетона в их
присутствии становится малочувствительным к внешним гиг-
рометрическим условиям. Это обусловлено повышенными
дисперсностью новообразований и непроницаемостью цемент-
ного камня, а также снижением давления пара воды над поро-
вой жидкостью бетона. Эти эффекты удается использовать на
нрак(икс, особенно при проведении работ в летнее время в райо-
нах с сухим климатом и при укладке ’’холодных” бетонов. В
результате обменной реакции поташа с гидроксидом кальция
образуется едкое кали с температурой эвтектической точки —
65°С, причем и едкое кали, и едкий натр, образующийся при
реакции алюмината натрия с 1идроксидом кальция, остаются в
коровой жидкости и, если не будут удалены путем фильтрации
или диффузии, обеспечивают сохранение жидкой фазы в бетоне.
153
3.1.3. Смеси добавок третьего класса
В практических целях затруднительно использовать для ус-
корения твердения цементов моно минеральные затравки. Это
привело к поискам доступных комплексных добавок третьего
класса. Так, имеются данные о применении для ускорения
твердения бетонов предварительно гидратированного цемента,
представляющего собой, по существу, смесь затравок разного
состава [15].
Такая комплексная добавка удобна и потому, что она в
принципе можег влиять одновременно н; кинетику тидратации
различных фаз цемента. Если при введении подобных добавок
преследуют цель воздействовать (прямо или косвенно) пре-
имущественно на одну из фаз, то комплексную добавку обо-
гащают соответствующими гидратами путем подбора исходных
материалов: цемента и раствора, в котором он гидратируется.
Так, для избирательного воздействия на С3А твердеющею це-
мента в качестве сырья при производстве комплексной добав-
ки — смеси затравок берут глиноземистый цемент или высоко-
алюминатный портландцемент; иногда его гидратируют в при-
сутствии дополнительных количеств гипса.
Для таких комплексных добавок, как и для индивидуаль-
ных добавок третьего класса, весьма важное значение имеет
тонкость помола.
3.1.4. Смеси добавок четвертого класса
Смеси добавок, состоящие из двух и более органических
ПАВ, могут быть представлены комбинациями из соединений
одной или разных групп.
Смеси добавок первой группы. Лучше изучены и шире при-
меняют на практике комплексные добавки первой i руппы —
гидрофилизирующие; к их числу относятся, по существу, все
технические лигносульфонаты, гидроксикарбоновые кислоты,
углеводы, и даже, в ряде случаев, суперпластификагоры, т. е.
вещества, в состав которых входят соединения разной природы
и молекулярной массы.
Из-за отсутствия комплексных исследовании еще затрудни-
тельно определить все закономерности их действия. Однако
можно оценить, наблюдается ли при их использовании аддитив-
ность их действия и имеет ли место синергетический )ффект.
Судя по нашим данным, основанным преимущественно на
изучении лигносульфонатов, гидроксикарбоновых кислот и
их солей, если комплексные добавки состоят из смеси близких
по природе веществ или эти соединения обладают сходным
механизмом действия на исследуемую характеристику цемен-
та, бетонной смеси либо бетона, то, хотя результирующий эф-
154
фект от их совместного введения может быть выше, чем от
введения отдельно каждой из них, но он все же, как правило,
ниже, чем требуется по правилу аддитивности (25, 40, 73—76] .
Наиболее^ четко этот результат прослеживается по реологиче-
ским свойствам бетонных и растворных смесей.
Это приводит к двум важным следствиям. Во-первых, при-
менение в качестве комплексных добавок различных фракций
технических продуктов, полученных, например, путем их сме-
шивания, не может сколько-нибудь значительно повысить их
удельную активность — даже если они обладали высоким плас-
।ифицируютим действием. Следовательно, зти смеси не в сос-
тоянии существенно изменить эффект, доведя его, скажем,
до эффекта, свойственного супернластификаторам. Но суше-
шву, указанный принцип мы уже обсуждали, когда рассмат-
ривали способы улучшения гидрофилизирующих ПАВ путем
удаления из них наименее желательных фракций: при этом,
наоборот, возрастала удельнай активность добавки.
Во-вторых, попытка получить очень сильный пластифицирую-
щий эффект за счет смешивания двух и более однотипных
пластификаторов, каждый из которых обладает невысоким
пластифицирующим действием, малоперспективна*.
Интересно, что к близким результатам независимым путем
пришли и авторы [110] , исследуя влияние различных фракций
полиметиленполинафталинсульфонатов и их искусственно сос-
тавленных смесей как пластификаторов — водопонизителей
мономинералытых вяжущих веществ. По их данным, общий
результат от введения подобных смесей был близок к аддитив-
ному. Однако при этом легкие фракции суперпластификатора
обладали способностью к воздухововлечению: система пузырь-
ков воздуха, естественно, тоже вносила свой позитивный вклад
в пластификацию теста. Следовательно, без учета этого косвен-
ного действия удельная активность смеси различных фракций
суперпластификатора была несколько ниже, чем это требуется
но правилу аддитивности.
Па этом примере, как и на ряде других, можно убедиться
и в том, что если рассматривать такие свойства бетонных смесей
и бетонов, на которые разные фракции органических ПАВ
близкого группового состава действуют по-разному, то в проти-
воположность сказанному возможен аддитивный и даже синерге-
тический эффект от их совместного введения: во всяком случае,
удельная активность подобных сочетаний ПАВ возрастает (6,
28,74,76, 100] .
В плане практического применения достаточно популярны
комбинации лигносульфонагов с УПБ**, а также лигносульфо-
*Мы не рассматриваем чисто экономическую сторону вопроса, когда
введение недефицигных фракций ПАВ может оказаться выгодным.
**УПБ - упаренная последрожжевая бражка - доступный дешевый
продукт агрохимии
155
натов или УПЬ с супернластификаторами |29, 100] При этом
решается, в основном, задача расширения сырьевой базы доба-
вок такого назначения и некоторые экономические вопросы; 1
кроме гою, сочетания пластифицирующих добавок, ЛСТ, УПБ
и других с суисрпластификагорами нередко оказываются полез-
ными и н техническом отношении например, при необходи-
мости сильною замедления процессов гидратации и cjtokob
схватывания цемента.
Иные цели преследуют при совместном введении лшносуль-
фопатов с адипинатом натрия (11ЛЩ-1)*. который обладает
достаточно низкой эвтектической температурой. В лом случае
J1C1 увеличивает воздухововлечение и пластифицирует бетон
ную смесь [79]. Для получения подобною эффекта, по-види-
мому, возможна и комбинация супернласгификаторов с ПАШ-1.
Если же требуется удлинить сроки схватывания и пластифи-
цировать бетонную смесь при снижении воздухововлечения, го
пригодно сочетание лигносульфонатов с пеногасителем. Обычно
в качестве пеногасителей используют некоторые спирты, напри-
мер, пронинол или изоамиловый спирт.
Возможна и комбинация из трех ПАВ: литносульфоната,
сунерпластификатора и пеногасителя; в подобных случаях ре
шается задача одновременной значительной пластификации
бетонной смеси или снижения ее водопотребнисти, сильною
замедления сроков схватывания и ранних стадии гидратации
цемента при минимальном воздухововлечении [7] .
Смеси добавок второй группы четвертого класса — гидрофо-
бизирующих. Во вторую группу добавок этого класса входят,
с одной стороны, продукты соответствующей обработки смол
СНВ, СПД, с другой, — кремнииорганические' 136-41, (ГКЖ-94)
и ее модификация — 136-157М (ГКЖ-94М), а также ГКЖ-10,
ГКЖ-11, этилгидридсесквиоксан (ШЭН;, алюмометилсилико-
нат натрия (АМСР), фенилэтоксисилоксан 113-63 (ФЭС-50)
и др. [12|.
Поэтому целесообразно дифференцированно подходигь к
смеси однотипных гидрофобизирующих добавок (например,
СНВ и СДО или I КЖ -10 и ГКЖ-11) и к смесям разнотипных
ПАВ второй группы.
Рассмотрим комплексные однотипные и разнотипные гидро-
фобизируюиме добавки подробнее. При этом во главу угла
положим их основное воздухововлекающее или газообразующее
действие. Эксперимент показал, что в подтверждение общих
закономерностей, сформулированных ранее при анализе гидро-
филизирующих ПАВ, введение двух однотипных ПАВ в на-
ших опытах абиетата натрия (СНВ) и омыленного древесного
пека — привело к тому, что их воздухововлекающий эффект
был близок к аддитивному при невысоких дозировках и пони-
* Щелочной сток производства капролактама - ЩСПК
156
жался при увеличении количества вводимых добавок гэ«т
Полученные результаты удается Удовлетворительно объя5нЙь
бесконкурентной адсорбцией (и хемосорбцией]эгах добХк
в первом случае и возможностью конкуренции во втопом
Очевидно, что при повышенной дозировке смеси гидрофобизи’
рующпх добавок воздухосодержапис в бетоне определяется в
основном той составляющей комплексной добавки, которая
обладав! большей поверхностной ак гивностью. !
К сожалению, нам не удалось найти литературные данные,
касающиеся применения комплекса ГКЖ-10 и ГКЖ-11 или
их сочетаний с АМСР, как не обнаружили мы и данных о сов-
местном введении однотипных гидрофобизирующих добавок
136-41 и 136-157 (ГКЖ-94 и ГКЖ-94М), поэтому априори за-
труднительно предсказать результат от их введения.
Однако сочетания разнотипных добавок второй группы —
СНВ и 136-41 оказались в известном смысле предсказуемыми
и весьма перспективными. Поскольку одна из них — СНВ сор-
бируется на твердой фазе и принадлежит к воздухововлекаю-
щим, а другая вступает в химическую реакцию с гидроксидом
кальция с выделением молекулярного водорода, т. е. механизм
их действия различен, то можно было ожидать их синергетиче-
ского действия на объем газовой фазы. Одновременно могут
различаться и кривые распределения газовой фазы по размерам.
Как показывают данные табл 15, этот теоретический прогноз
оправдался.
Смеси добавок ПАВ разных групп. Смеси добавок ПАВ
первой и второй групп: гидрофилизирующих и гидрофобизи-
рующих — в основном представлены искусственно подобран-
ными композициями и уже поэтому интереснее в теоретическом
отношении. Их основное достоинство — возможность влиять
на важные характеристики бетона в заданном направлении.
Не случаен поэтому особый интерес, проявляемый многими
специалистами к подобным комбинациям поверхностно-актив-
ных веществ. Эти комплексные добавки достаточно хорошо
проверены в лабораторных и производственных условиях и
Таблица 15.Обьсм пор и характеристика поровой структуры
цементного камня с комплексной добавкой СНВ + 1 36-41
Добавка Дозировка, % по мас- се цемента В/Ц Объе мное водопогло- щение, % Кажущаяся закрытая пористость, % Степень заполне- ния пор при водо- погл още- ним
Нет 0,43 12,31 3,56 0,76
СНВ 0,05 0,39 11.05 6,52 0,63
136-41 0,1 0,41 11,9 5,98 0,67
СНВ + 0,05+0,05 0,4 9,75 8,2 0,54
+ 136-41
6 1В2
157
внедрены в практику, хотя масштабы их применения пока
еще недостаточны. Так, имеются сведения о целесообразности
введения в гипсо- и цементобетон СНВ и СЛБ для улучшения
формовочных характеристик материала [14] Известно совмеш-
ное применение в бетонных изделиях смеси СДБ и ГКЖ-94
[12]. При этом наряду с пластифицирующим эффектом удается
сократить дозу каждой добавки и существенно повысить моро-
зостойкость гидротехнических сооружений, эксплуатируемых в
суровых условиях севера.
Авторы [32, 33] рекомендуют трехкомпонентную добавку,
проверенную в лабораторных и производственных условиях
смесь 0,1 % ССБ, 0,01% абиетата натрия и 0,02% альгината натрия
(по массе цемента). Бетон с такой комплексной добавкой
обладает высокой морозостойкостью, прич<м альгинат натрия
исключает несовместимость СДБ и СНВ (проявляющуюся иног-
да и выражающуюся в коагуляции смеси) и одновременно несет
функции кольматируюшей добавки.
На примере смеси лигносульфоната и СНВ можно проследить,
какие выгоды сулит применение комплексных ПАВ — предста-
вителей разных групп. Такая комбинация позволяет существен-
но снизить расход СНВ для получения такого же воздухововле-
чения; одновременно обеспечивается лучшая пластификация
бетонной смеси. Повышение кольматирующего эффекта при
сокращении дозировки гидрофобизирующей составляющей уда-
ется получить при использовании лигносульфоната и битумных
эмульсий. Положительно зарекомендовали себя и другие сочета-
ния гидрофобизирующих и гидрофилизируюших добавок при
их введении в бетоны различного назначения [118].
Основные цели, преследуемые при использовании подобных
комплексных добавок вместо индивидуальных,— сокращение
их оптимальных концентраций и одновременно придание бето-
ну свойств, вносимых как гидрофилизирующей, гак и гидро-
фобизирующей составляющей такой добавки.
Следовательно, более определенно можно высказаться отно-
сительно сохранения индивидуальных особенностей действия
каждой добавки и менее определенно — о возможности подоб-
ным путем взаимно усилить некоторые эффекты, в разной сте-
пени присущие и той, и другой добавке (хотя такой результат
в ряде случаев наблюдается). Так, кремнийорганические добав-
ки типа этил- и метилсиликонатов натрия (ГКЖ-10 и ГКЖ-11)
и этилполисилоксанов (ГКЖ-94) обладают значительным плас-
тифицирующим действием на бетонные смеси (особенно
ГКЖ-10 и ГКЖ-11). Их введение совместно с добавкой лигно-
сульфоната усиливает пластифицирующий эффект, причем в
бетонных смесях разной степени жирности без ухудшения
158
физико-механических свойств бетона. При этом удается также
уменьшить расход добавок [12]*.
Гаким образом, можно констатировать, не вдаваясь в дета-
ли, 'но часю при использовании смеси поверхностно-активных
веществ первой и второй групп удается сохранить как особен-
ности, характерные для каждой из них,, так и общие свойства,
которые они придают бетонным смесям. Волее строгое сужде-
ние об указанных сторонах механизма Действия комплексных
добавок ПАВ и особенно ответ на вопрос об аддитивности или
взаимном усилении действия каждой из них можно будет полу-
чи 1ь после того, как появятся количественные критерии их
влияния на отдельные свойства бетона. При этом станет воз-
можной и оценка роли химико-минералогического состава
цемента и параметров бетонной смеси на эффективность тех
или иных комплексов ПАВ. Имеющиеся сейчас данные качест-
венно свидетельствуют о большей универсальности комбина-
ций из гидрофилизируюших и гидрофобизируюших поверх-
ностно-активных веществах, о повышении их эффективности
при введении в тощие и жирные бетонные смеси (тогда как
при введении только одной гидрофобизирующей добавки на-
блюдаются существенные различия в результатах) и о некото-
рых других преимуществах смесей подобных ПАВ перед их
индивидуальным применением [12, 110] .
Популярны также комплексные добавки, состоящие из
суперпластификаторов нафталин- и меламинформальдегидно-
го типа и воздухововлекающих — обычно абиетата натрия
(СНВ). В этом случае абиетат натрия, действуя по своему ос-
новному назначению, обеспечивает бетонной смеси большую
связность, а бетону — воздухововлечение, необходимое для по-
вышения его морозостойкости.
В некоторых случаях приходится повысить содержание в бе-
тоне воздушной фазы и при использовании в качестве основной
добавки адипината натрия (ПАШ-1). Эту задачу решают, комби-
нируя ПАЩ с СНВ. Возможны также тройные смеси, содержащие
суперпластификатор, лигносульфонат и СНВ или ПАШ-1, лигно-
сульфонат и СНВ.
Напомним, что при этом каждая составляющая таких комп-
лексных добавок удачно дополняет другую (другие), внося
свой индивидуальный вклад в комплекс свойств бетонной сме-
си и бетона.
* По-видамому. аналогично действуют и модифицированные лнгносуль-
фонат ы.
159
3.2. КОМПЛЕКСНЫЕ ДОБАВКИ ВТОРОЙ КАТЕГОРИИ
3.2.1. Смеси добавок первого и второго, первого или второго
и третьего классов — электролитов и готовых центров
кристаллизации
Смеси добавок, отнесенные нами к разным классам, приме-
няются в мировой строительной практике весьма широко.
Фактически даже комбинация из однотипных электролитов,
например нитрита, нитрата и хлорида кальция, может рассматри-
ваться как комплексная добавка, по механизму действия при-
надлежащая и к первому, и ко второму классам. К числу таких
добавок относится также смесь Na2SO4 и NaOH [4] и некото-
рые другие. При этом удается усилить наиболее желательные
эффекты, обусловленные влиянием добавок первого класса
на силикатные фазы цемента, и наоборот, ослабить экранирую-
щую способность образующихся двойных солей-гидратов.
Представляет определенный научный и практический интерес
применение смеси добавок первого и третьего, а также второго
и третьего классов. Совместное введение в гипсобетон затравок
(лучше в качестве готовых центров кристаллизации использо-
вать не измельченный природный гипс, а более дисперсный
’’вторичный”) и электролитов, например поваренной соли или
хлорида кальция, позволяет ускорить процессы твердения силь-
нее, чем каждой из добавок в отдельности [65]. При этом уда-
ется несколько отодвинуть и значение концентраций добавок,
при которых достигается порог их эффективности.
Для вскрытия механизма влияния добавок первого и третье-
го классов на быстротвердеющие вяжущие типа гипсовых сле-
дует привлечь представления о лимитирующей стадии последо-
вательно протекающих процессов их растворения и кристалли-
зации. Добавки электролитов, не содержащие одноименного с
вяжущим иона, повышая растворимость исходной фазы, уско-
ряют ее растворение, а увеличивая пересыщение по отношению
к новообразованиям, — ускоряют процесс кристаллизации
последних, главным образом, за счет влияния на стадию роста
новой фазы.
Одновременное введение затравок, также ускоряющих
выкристаллизовывание гидратов, приводит к усилению ука-
занного эффекта. Аналогичная в общих чертах картина наблю-
дается и при использовании совместно с затравками добавок
электролитов, содержащих одноименный с вяжущим ион и
вводимых в концентрациях, ускоряющих процесс твердения.
В этом случае, однако, исключается повышение растворимости
исходной фазы; поэтому при выборе подобных сочетаний до-
бавок целесообразнее ориентироваться на использование ком-
бинации из добавок — готовых центров и электролитов, не со-
держащих одноименных с вяжущим ионов.
1£Л
Для вяжущих второго типа, гидратация которых в течение
почти всего процесса в целом лимитируется стадией их раство-
рения как самой медленной, добавки третьего класса могут
быть весьма эффективными, главным образом, благодаря
уменьшению степени экранирования исходных минералов
пленками из новообразований. В подобной ситуации иногда
удается значительно ускорить твердение при совместном вве-
дении добавок второго и третьего классов, например гипса
и гидросульфоалюмината кальция (ГСАК-3), в цементные
бегоны, хотя при этом, как и при введении только одних за-
травок, их ускоряющий эффект не всегда воспроизводим.
Тем не менее он зафиксирован и его удается усилить при мок-
ром помоле материала, при котором экранирующие пленки
дополнительно удаляются с зерен цемента механическим пу-
тем [71] (рис. 50). Добавку ГСАК-3 в чистом виде вряд ли
будут использовать в промышленном масштабе. В практических
целях применяют заранее гидратированный вместе с гипсом
(иногда с • хлоридом кальция) глиноземистый цемент, обога-
щенный гидросульфоалюминатом кальция, либо портланд-
цемент, содержащий повышенное количество С3 А.
Такие составы, содержащие наряду с готовыми центрами
кристаллизации алюминатных и силикатных фаз цементного
камня также добавки второго класса, в принципе, могут рас-
(C3s^s), 7о
Рис. 50. Кинетика убыли силикатных фаз (------) и гипса С )
при гидратации белгородского цемента (а) и кинетика роста прочности
бетона (б) на этом же цементе после 9 мни мокрого домола
1 — без добавки, 2 — 2,4% гипса; 3 — 4% ГСАК-3; 4 — 2,4 % гипса + 4%
ГСАК-3
161
сматриваться как эффективные ускорители твердения цемент-
ных бетонов, и есть сведения об их практическом использо-
вании [15].
3.2.2. Смеси добавок первого или второго и четвертого
классов — электролитов и ПАВ
Из этих добавок наиболее широко применяют смеси, сос-
тоящие из электролитов и ПАВ цервой группы. Многие из
них описаны и внедрены в практику — чаще всего — для пласти-
фикации и некоторого удлинения сроков схватывания бетон-
ной смеси [5, 6, 21, 43, 45,46, 64, 74—76, 79, 80, 105, 119, 120].
Смеси добавок электролитов и гидрофилизируюших ПАВ.
Комбинация из гидрофилизируюших ПАВ и поташа или соды
привлекала к себе внимание многих исследователей по несколь-
ким причинам. Во-первых, перечисленные электролиты относят-
ся к числу солей сильного основания и слабой кислоты, и в ре-
зультате их гидролиза существенно повышается pH жидкой
фазы.
При правильно подобранных дозировках добавок электро-
литов и ПАВ вначале удается использовать пластифицирующий
эффект ПАВ, а затем достаточно высокий темп твердения бетона
в результате введения электролитов. Кроме того, подобные
сочетания добавок способны корректировать темп твердения
бетонов. Так, добавки ПАВ как пластификаторы малоэффек-
тивны в высокоалюминатных цементах. Однако добавка гипса
позволяет восстановить пластифицирующее и замедляющее
твердение действие ПАВ [116]. Аналогичный эффект наблю-
дается и при введении в высокоалюминатные цементы совмест-
но с гидрофилизирующими ПАВ добавки поташа, что объясня-
ется, по-видимому, уменьшением начальной адсорбции ПАВ.
В результате удлиняются сроки до полного поглощения
гидрофилизирующих ПАВ (которые расходуются в основном
на стабилизацию зародышей новой фазы) и соответственно
удлиняется индукционный период твердения вяжущих. Этот
эффект может быть использован не только для высокоалю-
минатных, но и для других цементов, например, применяемых
в холодных бетонах с добавкой поташа.
Кроме того, совместное введение в бетонные смеси гидро-
филизирующих ПАВ и электролитов улучшает структурно-
механические свойства цементного камня, способствует сня-
тию внутренних напряжений, в частности термических — при
тепловлажностной обработке бетона, и, в конечном счете, по-
вышает его прочностные характеристики и морозостойкость.
Во-вторых, в результате обменных реакций между поташом
(содой) и гидроксидом кальция образуется карбонат кальция,
162
'по также повышает щелочность жидкой фазы. Соответственно
может выкристаллизовываться и гидрокарбоалюмипат кальция,
связывающий алюминатные фазы. Таким образом, этот случай
приближается к описанной нами ранее обработке таких гидро-
филизирующих ПАВ как лигпосульфонаты щелочью [55] ,
что модифицирует добавку, повышая ее эффективность.
Положительное действие лигносульфонатов или некоторых
других гидрофилизируюших ПАВ в подобной смеси, особенно
если поташ применяют в больших дозах как противоморозную
добавку и он, будучи очень сильным ускорителем схватывания
цемента, ухудшает структуру цементного камня, многообразно.
Э1и ПАВ выступают и как замедлители схватывания, нейтрали-
зуя действие поташа, и как пластификаторы — водопонизители
и, поскольку их часто вводят в таких случаях в повышенных
против обычного дозах, как воздухововлекающие. Как следст-
вие, поташ обычно не используют без ПАВ, которые улучшают
морозостойкость бетона.
Целесообразность введения таких комплексных добавок
и бетоны на безгипсовых портландцементе и шлакопортланд-
цементе, в том числе для зимнего бетонирования обоснована
в [56, 117] .
При этом можно использовать белитовые и высокоалюминат-
ныс клинкеры, что обеспечивает экономию топливно-энерге-
тических ресурсов и расширяет сырьевую базу производства
вяжущих.
Совместное введение гидрофилизируюших ПАВ и электро-
литов улучшает и структурно-механические свойства цемент-
ного камня, способствует снятию внутренних напряжений, в
частности, термических — при тепловлажностной обработке
бетона и, в конечном счете, повышает его прочностные харак-
теристики и долговечность [6, 74—76]. Аналогично действуют
и более сложные композиции, состоящие из нескольких элект-
ролитов и гидрофилизирующих ПАВ, например, ННК или ННХК
и лигносульфонатов, причем не только при их введении в дозах,
принятых для твердения в нормально-влажных условиях и при
тспловлажностпой обработке, но и в больших, — когда их при-
меняют в качестве противоморозных, обеспечивающих бетону
набор прочности до 25—30°С.
Весьма перспективны и некоторые другие сложные добавки —
электролиты и гидрофилизирующие, обладающие хорошими
антифризными свойствами, например, комбинация электролита
с мочевиной (карбамидом). Учитывая комплексообразующую
способность карбамида, можно было ожидать, что он с некото-
рыми электролитами, например с нитратом кальция, образует
нс механические смеси, а комплексные соединения. Исследо-
вания подтвердили, что добавка НКМ действительно комплекс-
ное соединение нитрата кальция с мочевиной состава [Са
//CO(NH2)2] (NO3)2, где п изменяется от 1 до 4. В растворе
163
комплексные ионы достаточно устойчивы, начиная с определен-
ной, характерной для каждого из них концентрации, причем
наименее устойчив комплексный ион с п — 4.
Таким образом, в жидкой фазе бетона с этой добавкой име-
ются как связанный с мочевиной ион кальция и нитрат-ионы,
так и в значительно меньших количествах свободные ионы
кальция и карбамид (мочевина). Комплексные ионы [Са •
-л/СО (NI12 ) 21 z и молекулы карбамида шыстифицируют бе-
тонную смесь, делая ее более удобоукладываемой, и позво-
ляют при той же ее подвижности уменьшить расход воды, по-
вышая плотность и прочность бетона. Кроме того, регулируется,
несколько замедляясь, связывание ионов кальция в двойные
соли-гидраты. При температуре —20°С (и особенно при —10°С)
это обстоятельство благоприятно сказывается на темпе тверде-
ния и конечной прочности бетона.
Положительно зарекомендовали себя сочетания карбамида
и с другими электролитами, в том числе сразу с несколькими.
Так установлено, что смесь нитрит-нитрат-хлорида кальция с
мочевиной (ННХКМ) характеризуется как более эффективная
противоморозная добавка, чем ННХК, а ННКМ — чем ННК
[21,28].
Перспективны и некоторые другие комбинации добавок, в
частности ЩСПК, состоящий в основном из адипината натрия
(ПАЩ-1) с электролитом, и некоторые смеси, содержащие
формиат или ацетат кальция (натрия) и органические слабо-
диссоциирующие гидрофилизирующие ПАВ.
Таким образом, комбинируя электролиты с гидрофили-
зируюшими ПАВ и меняя в зависимости от назначения дози-
ровку -добавок и их соотношения, можно успешно использо-
вать их и при зимнем бетонировании, и в условиях нормально-
го твердения, и при тепловлажностной обработке.
В табл. 16 ’приведены данные по изменению прочностных
показателей бетонов, подвергшихся пропариванию по разным
режимам в присутствии добавок электролитов и гидрофилизи-
рующих ПАВ, которые показывают, что применение комбини-
рованных добавок в ряде случаев целесообразно. При этом опти-
мальная концентрация, определенная для каждой из них в от-
дельности, может оказаться такой же, как при совместном
введении или более высокой. Однако подобный резулотат не
может считаться общим, так как электролиты обычно влияют
на эффективность ПАВ, а последние в свою очередь могут
вызвать необходимость некоторого повышения дозировки
электролитов для достижения того же, что и при отсутствии
ПАВ, ускорения твердения.
Это понятно, так как известно, что добавки электролитов
заметно влияют на так называемые полноценные мьлоподоб-
ные ПАВ с очень сильными гидрофильно-по зярными гоуппами
при развитых гидрофобных радикалах, т. е на ПАВ с хорошо
Таблица 16. Прочность на сжатие, МПа, бетонных образцов размером
10x10x10 см с добавками*
Цемент Добавка Режим тепловлажностной обработки, ч
(2+3+8+2)* (2+3+10+2)*! (2+3+12+2)*
4 4 | 28 сут. 4 ч | 28 сут. 4 ч | 28сут.
Б111 жи- Без добавки 16,8 23,5 18 26,2 19,8 24.3
iyленский Гбо- юо’ fob- Гбо Гбо- 100
2 % НИК 14,9 89~- 25,8 но- 16,9 94~- 30,2 Г15- 18,3 93-- 3(£_ 124
2 % ННК + 20,4 25,7 19,3 30,9 21,5 28,6
+ 0,150% ЛСТ ггг 110 ГбУ U8- Г09~ Г18
3% ННК 16,1 9б"- 30,4 129 19 Го5~ 26,2 Гбо- 19,3 98-" 29 Г19
3% ННК + 19,6 26,8 18,8 30,6 22 27,9
+ 0,15% ЛСТ 117 ПО 104 117 111 115
3% ННХК - 27_,7_ Г18 21,5 120 26,2 Гбо- 27_,5_ 144 3£5_ Гзо
3% ННХК + 24 34,8 27,7 35,1 28,3 34
+ 0,15% ЛСТ 143~ ГЙГ ГЙ” Г34- ГГз- 140
Шлакопорт- Без добавки 13,7 24,5 16,5 25,1 16 25,3
ландцемент Гбо- Гоо- Гбо~ Гбо- Гбо- Гбо-
2% ННХК l4’L Гоз 27,6 ГГз- £7 Гоз- 30,7 ш- 17 Гбо- 28 ,£ Г14~
2% ННХК + 14,4 28,6 16,2 29,8 19,6 26,3
+ 0,15% ЛСТ 105 117 99 119 116 104
3% ННХК £4,3 104’ 27,2 ггг ££4 81 29_,4_ Г17- 18,4 Гб9- 29,£ ГГб-
3% ННХК + 16,9 28,3 19 35,4 18,9 33,4
+ 0,15% ЛСТ 125~ Г1Т Г15- ш- Г12- ГзТ
* Выдержка при 20°С, лодьем до 80°С, изотермический прогрев, ох-
лаждение до 20°С.
Примечание. Над чертой указана прочность в МПа, под чертой — в
% от прочности эталонного бетона. Состав бетона, кг/м3 цемент - 325,
песок — 700, щебень — 1150, вода — 180—200
165
сбалансированной дифильностью, способные к образованию
ультрадисперсных двухфазных систем при критической кон-
центрации мицеллообразования (ККМ). Влияние электроли-
тов заключается в уменьшении значения КММ (’’высаливаю-
щий” эффект электролитов).
В то же время ’’неполноценные” ПАВ, слабо изменяющие
поверхностное натяжение жидкости на границе с воздухом
и не способные образовывать мицеллярные структуры, могут
в присутствии электролитов вести себя практически так же,
как и в их отсутствии. Следовательно, не может быть и едино-
го ответа на вопросы о совместном эффекте от введения тех и
других добавок в бетоны. Такой ответ может быть получен в
результате конкретного анализа выбранных композиций с уче-
том свойств их индивидуальных составляющих. Например,
суперпластификаторы нафталин- и меламинформальдегидного
типа, принадлежащие к подобным гидро фи лизирующим ПАВ,
слабо изменяющим величину о21, превосходно сочетаются с
электролитами, в том числе вводимыми в значительных до-
зах, таких, которые требуются для их работы в качестве
противоморозных добавок.
По нашим данным, комплексные добавки из электроли-
тов — солей кальция и полиметиленполинафталинсульфонатов
интересны, прежде всего, потому, что они взаимно усиливают
пластифицирующее действие друг друга. Это положение до-
казано экспериментально, причем не только в том случае, ког-
да применяли сочетания индивидуально взятых электролитов
(хлорида, нитрата, кальция), но и их смеси типа ННК и ННХК
с суперпластификаторами [6,22, 64, 74,75].
В результате подобные сочетания добавок способствуют
решению важных для практики проблем. Во-первых, откры-
вается возможность снижения дозировки все еше относитель-
но дефицитного и дорогого сунерпластификатора, обладаю-
щего одинаковым с индивидуальным ПАВ пластифицирующим
действием, или же реализуется большая водопонижающая
способность комплексной добавки.
Во-вторых, поскольку каждая иэ составляющих подобной
смеси вызывает некоторые дополнительные эффекты (в част-
ности, суперпластификатор несколько замедляет начальные
стадии гидратации цемента, а электролит — ускоряет их), то
применение смеси добавок (в зависимости от соотношения
между компонентами) позволяет в широком интервале уп-
равлять сроками схватывания и темпом гидратациоиного твер-
дения цемента.
В-третьих, так как снижение В/Ц приводит к увеличению
плотности и непроницаемости бетона вследствие изменения
поровой структуры цементного камня, то это повышает эф-
фективность электролитов как противоморозных добавок.
166
ЛО рцТ?М’ ЧТ° увеличение микро пористости цементного кам-
ня уменьшает давление пара над поровой жидкостью, т. е. дей-
ствует в том же направлении, что и сам электролит. В резуль-
тате МОЖНО ИЛИ СНИЗИТЬ его дозипов™ Р У
...т-тпп -.ппн-тг.г.пъ<тп дозировку, или при том же коли-
icctbc электролита понизить минимально допустимую тем-
пературу действия комплексной добавки [871 у у
В-четвертых, при такой комбинации добавок, как было
доказано экспериментально [64, 73], удается при одинаковой
продолжительности тегитовлажностной обработки и прочности
бетона, существенно (до 45—50°С) снизить температуру изотер-
мического прогрева
железобетона. Это, в
при изготовлении сборного
свою очередь, обеспечивает по-
вышенную долговечность конструкций и примерно 30%-ю
экономию тепло- и электроэнергии.
Можно также существенно сократить цикл тепловлажностной
обработки — при одинаковом (с эталоном) температурном ре-
жиме процесса или повысить прочность бетона при близкой
продолжительности тепловлажностной обработки. Возможны,
естественно, и промежуточные варианты.
Мы назвали лишь основные результаты от введения в бетон-
ную смесь подобной комбинации неорганического электролита
и суперпластификатора. К ним можно добавить, например,
лучшее поведение бетонной смеси в условиях сухого жаркого
климата.
Хотя при введении в бетонную смесь другой комбинации до-
бавок разных классов: электролитов — ускорителей схватыва-
ния и твердения цемента и гидрофилизирующих ПАВ — лигно-
сульфонатов мы не обнаружили их синергетического действия
на реологические свойства бетонной смеси, присущего тем же
электролитам и добавкам полиметиленполинафталинсульфона-
тов натрия, но и для них характерны все перечисленные выше
эффекты, однако выраженные слабее.
Хотелось бы обратить внимание на немаловажное обстоятель-
ство, проявляющееся при совместном введении добавок: по-
скольку электролит, будучи поверхностно-инактивным веще-
ством, повышает поверхностное натяжение, а органические
ПАВ понижают его, то в присутствии электролита поверхностная
активность ПАВ возрастает. Это выражается в том, что они
лучше сорбируются на твердой фазе.
Вывод о целесообразности сочетания электролитов с гидро-
филизирующими ПАВ, вытекающий из теоретического анализа
механизма их совместного действия и проявляющийся в улуч-
шении ряда свойств бетонных смесей и бетонов, распростра-
няется на многие комбинации таких добавок. Так, доказана
эффективность совмещения добавок ННК и ННХК с УПБ [6].
При этом получены результаты, сходные с теми, которые ха-
рактерны для сочетаний аналогичных электролитов с лигно-
167
сульфонатами. Следовательно, можно говорить о качественно
общих закономерностях, присущих подобным комбинациям
добавок, которые могут отличаться лишь в количественном
отношении.
Ранее мы рассматривали сочетания добавок четвертого
класса, содержащие пластификатор и пеногаситель. Не менее
популярны и более сложные комбинации добавок, в состав
которых входит модифицированный лигносульфопат — основ-
ной компонент такой добавки, призванный заменить супер-
пластификатор. Для этого лигносульфонат вводят в повы-
шенной дозе, что, как уже указывалось, приводит к двум не-
желательным для сборного железобетона побочным эффектам:
замедленной гидратации цемента и излишне сильному воздухо-
вовлечению, снижающему прочность бетона. Первое побочное
действие лигносульфоната устраняют путем введения электро-
лита — ускорителя твердения, второе — применяя пеногаси-
тель, в частности пропинол [119, 120]. Таким образом полу-
чена добавка НИЛ-21 [119].
Кроме рассмотренных общих закономерностей, присущих
многим комплексным добавкам — электролитам и гидрофили-
зирующим ПАВ, следует остановиться и на специфических
характеристиках некоторых комбинаций этих добавок. Так,
оригинальные результаты получены [49] при исследовании
комплексных добавок, состоящих из лигносульфонатов и
золей некоторых гидроксидов: Fe, Al, СО и др. Эксперимен-
тально доказано и теоретически обосновано повышение пено-
обраэующей способности лигносульфонатов в подобных комп-
лексных добавках*. Другие сочетания добавок первых групп
первого и четвертых классов — растворимых сильных электро-
литов и пенообразователя способствуют повышению живучес-
ти пены.
Существенно, что на ценообразование доминирующее влия-
ние оказывают часто выбор не только пенообразователя, но и
электролита. Так, при использовании рафинированных алкил-
арилсульфонатов совместно с добавкой электролита- сульфата
натрия наблюдалось сильное ценообразование, тогда как введе-
ние таких же доз кальциевых солей с этими другими анионами,
напротив, понизило его. Здесь еще раз подтверждается важность
учета химических аспектов действия комплексных добавок.
Сульфат натрия, участвуя в обменной реакции с гидроксидом
кальция — одним из продуктов гидратации цемента, увеличи-
вает щелочность жидкой фазы, что и вызывает повышение
пенообразующей способности выбранного ПАВ.
Интересные результаты получены при исследовании таких
комплексных добавок — электролитов и гидрофилизируюших
* Была обнаружена также тесная связь между пенообразованисм и кле-
ящей способностью таких смесей.
168
Рис. 51. Зависимость коэффициента
торможения скорости твердения
CaSO4 • 0,5HjО от концентрации мо-
ноэтаноламина (МЭА), вводимого с
динатрнйфосфатом, взятым в концент-
рации С. =С ; Сг < С и СЧ >
1 макс* 1 макс 3
>С
макс
ПАВ, в которых электролиты обладают пленкообразующей
способностью в результате реакции, например, с алюминатами
или с гидроксидом кальция. Удобной моделью для исследова-
ния протекающих при этом процессов и их прямого и косвен-
ного влияния на кинетику гидратации вяжущих может служить
система: полугидрат сульфата кальция — динатрийфосфат — мо-
ноэтаноламин (МЭА) — вода.
Изменение коэффициента торможения скорости твердения
гипсовых вяжущих в функции от концентрации динатрийфос-
фата имеет отчетливо выраженный экстремальный характер
(рис. 51). На этой кривой можно выделить три участка: 1) ди-
натрийфосфат введен в концентрации С\, обеспечивающий мак-
симально возможное в данных условиях торможение процес-
са 1вердения гипсового вяжущего, т. е. Ci = С 2) С2 <
< С • 31 С > С маке
макс’ 7 3 макс'
Оказалось, что в зависимости от концентрации динатрий-
фосфата эффект от одновременного с ним введения ПАВ каче-
ственно различен. Если концентрация динатрийфосфата равна
или меньше той, которая обеспечивает максимальное торможе-
ние скорости твердения строительного гипса вследствие образо-
вания фазовой пленки из фосфата кальция, т. е. С^а нро4
то поверхностно-активные вещества, адсорбируясь
на зародышах кристаллизации этой пленки, оказываются вовле-
ченными в нее в виде прослоек между кристаллами. Это ос-
лабляет барьерные функции фазовой пленки (см. рис. 51, кри-
вые 1 и 2). На рис. 52 представлены кривые изменения кон-
центрации сульфат-ионов при затворении гипсовых вяжущих
раствором динатрийфосфата концентрации = Смакс (2),
а также при введении в эту же суспензию через 10 и 60 мин
после затворения дополнительной добавки моноэтаноламина.
Как видно, ПАВ действительно ослабляет барьерные функции
фазово-выраженной пленки из фосфата кальция, в результате
чего жидкая фаза обогащается сульфат-ионами.
169
Рис. 52. Кинетика изменения кон-
центрации сульфат-нонов в растворе
при введении динатрнйсфосфата в кон-
центрации Смакс (1). и 0,02 моль/м
моноэтаноламина через 10 (2) к 60
(3) мин после начала опыта
При значительном увеличении концентрации ПАВ (см.
рис. 51) экранирующая пленка может ’’залечиваться”, однако
малые дозы добавок четвертого класса (в наших опытах моно-
этаноламина) всегда вызывали снижение ее барьерных функ-
ций — тем более сильное, чем лучше были условия для форми-
рования экранирующей пленки в отсутствие ПАВ [66].
На этом примере удается показать, что действие ПАВ нельзя
свести только к замедлению твердения бетона. Эффект от их
введения может быть различен; он зависит от конкретных ус-
ловий структурообразования вяжущих и поддается регулиро-
ванию. Напомним, что близкие зависимости наблюдались в не-
которых случаях и при введении ПАВ в бетонные смеси на
высокоалюминатных цементах. Таким образом, существует
возможность моделирования указанных процессов и углуб-
ленного изучения их механизма. Те же ПАВ, вводимые в весь-
ма небольшой концентрации совместно с динатрийфосфатом,
но взятым в дозировке С3 > Смакс> всегда дополнительно за-
медляли твердение гипсовых вяжущих (см. рис. 51), причем
по мере увеличения концентрации моноэтаноламина коэф-
фициент торможения процесса TKI tKq монотонно возрастал.
Это также хорошо согласуется с общетеоретическими поло-
жениями об условиях плепкообразования на вяжущих. Причина
наблюдаемой зависимости кинетики твердения гипсобетона в
присутствии динатрийфосфата с концентрацией Сз > Смакс кро-
ется в том, что вследствие большой скорости обменной реак-
ции между ним и вяжущим и, как следствие этого, появления
в поровой жидкости значительного количества электролита
пленки из фосфата кальция оказывается рыхлой и перистой.
В этих условиях ПАВ, уменьшая интенсивность развития об-
менной реакции, способствует тем самым процессам пленко-
образования. Кроме того, ПАВ повышают диффузионное соп-
ротивление и, закрывая поры, понижают проницаемость пленки
(подобный эффект при введении добавок второго класса в
концентрации Cj < ^макс^ наблюдался только при бэльших
дозах ПАВ).
170
Высказанные теоретические положения подтверждены не-
зависимыми опытами. Введение в суспензию (рис. 53) гипсо-
вого вяжущего динатрийфосфата в концентрации Сэ > Смакс и
моноэтаноламина тормозит скорость растворения вяжущего
по сравнению с той, которая наблюдалась при добавлении од-
ного Na2HPO4 (кривая У). Об этом свидетельствует изменение
концентрации сульфата кальция в растворе в присутствии комп-
лексной добавки (кривая 2).
Таким образом, результат от совместного введения добавок
электролитов и гидрофилизирующих ПАВ может быть весьма
разнообразен и по числовым значениям получающихся эффек-
тов, и по их характеру, а также по особенностям проявления
тех или иных свойств бетонов с такими добавками. Все же на
практике чаще приходится встречаться с использованием подоб-
ных комплексных добавок не столько для придания некоторых
дополнительных свойств бетону, сколько для ослабления неже-
лательных результатов, вызываемых каждой составляющей
таких добавок в отдельности. Кроме того, нередко комплекс-
ные добавки, содержащие электролиты и гидрофилизирующие
органические вещества, применяют для снижения расхода це-
мента.
Однако, применяя добавки электролитов и ПАВ (чаще гидро-
филизирующих), можно придать бетону и некоторые новые
свойства. Соответственно появляется возможность создания
материалов специального назначения, например для ремонта
железобетонных конструкций, эксплуатирующихся в агрессив-
ных для стальной арматуры средах и поврежденных вследствие
ее коррозии при эксплуатации сооружений. Совместное введе-
ние для этих целей нитритов и органических ПАВ—ингибиторов
коррозии (катапина, ПБ-5, ПБ-8 и некоторых аминов) оказы-
вается в подобной ситуации особенно интересным. В ненарушен-
ном бетоне замедляющий коррозию эффект обеспечивают нит-
риты, а ПАВ усиливают их действие; в бетоне же с трещинами,
особенно в условиях контакта арматуры с кислыми газами,
на первый план выступают ПАВ.
Смеси добавок первого и второго класса и гидрофобизирую-
щих ПАВ. До сих пор мы рассматривали комплексные добавки,
состоящие из добавок первого и второго классов и первой
группы четвертого класса. Сочетания электролитов с гидрофо-
бизирующими ПАВ также достаточно популярны: имеются,
например, сведения о применении хлорида и нитрата кальция с
кремнийорганическими жидкостями [12], сульфата натрия с
СНВ [53], ННК и ННХК с ГКЖ-10, ГКЖ-94 и СНВ и других
комбинаций добавок. Чаще всего гидрофобизирующие ПАВ
совместно с электролитами используют для полной или частич-
ной ликвидации замедляющего твердение и схватывание дейст-
вий ПАВ (рис. 54), повышения прочности, морозостойкости
бетона, а также ликвидации высолов на изделиях.
171
Рис. 53. Кинетика изменения кон-
центрации сульфат-ионов в растворе
в присутствии 0,2 моль/л динатрнй-
фосфата (С3 > Смакс) (О и после
дополнительного введения 0,1 моль/л
моноэтаноламина (2 )
30 60 90 120 г мин
При введении подобных комплексных добавок, содержащих
кремнийорганические вещества, для увеличения морозостой-
кости бетона используют гидрофобизацию его порового про-
странства и образование в нем системы условно-замкнутых
демпфирующих газовых полостей за счет поверхностно-актив-
ной составляющей при одновременном снижении давления
пара и соответственно температуры замерзания поровой жид-
кости, а также уменьшения микропористости бетона в резуль-
тате введения добавок электролита. Таким путем можно полу-
чить бетон с высокой морозостойкостью. Большие возмож-
ности в этом отношении открываются при использовании сов-
местно с электролитом кремнийорганических добавок типа
ГКЖ-94, характеризующихся сравнительно невысокой поверх-
ностной активностью (оцениваемой по значению поверхностно-
го натяжения о21 на границе ’’жидкость—газ”).
В последнее время повысился интерес к кремнийорганиче-
ским веществам типа алюмометилсиликоната натрия — АМСР-3.
Исследования его сочетания с электролитом — нитратом кальция
Рис. 54. Кинетика изменения
пластической прочности цемент-
но-песчаного раствора
I — без добавки; 2 — 0,1%
ГКЖ-94; 3 - 1% Ca(NO3)2;
4 - 0,1% ГКЖ-94 + 1% Ca(NO3)2
172
(в качестве уплотняющего компонента комплексной добавки
была использована бетоптонитовая глина 106]) показали, что
подобная комплексная добавка повысила долговечность бетона
путем улучшения поровой структуры цементного камня и по-
нижения проницаемости бетона.
Смеси добавок первого и второго классов со смесями доба-
вок разных групп четвертого класса. При комбинации электро-
лита с кремнииорганической добавкой типа 136-41 (ГКЖ-94),
а также при более сложном сочетании электролита, гидрофили-
зирующей и гидрофобизирующей ПАВ, удается реализовать
принцип независимости действия каждого компонента на струк-
туру цементного камня. Это объясняется тем, что составляющие
добавки воздействуют на разные уровни структуры: электро-
литы влияют преимущественно на надмолекулярный и субмик-
роскопический, ПАВ — на микро- и макроскопический. Кроме
того, различны и механизмы действия каждого компонента
смеси добавок. В результате, несмотря на то, что в отдельных
случаях одни компоненты добавок могут несколько ухудшить
тот или иной параметр (например, электролиты типа ННХК
на ~ 0,5% снижают объем воз ~уха, вовлеченный СНВ), общее
улучшение структуры цементного камня, контактной зоны
между ним и заполнителем и другие положительные факторы,
вносимые каждым составляющим смеси, столь значительны,
что бетон с такими комплексными добавками характеризуется
улучшенными физико-механическими показателями и долго-
ВСЧ11ОС1ЬЮ.
Обобщая все сказанное о применении комбинаций добавок
электролитов и поверхностно-активных веществ обеих групп,
можно констатировать, что, хотя наблюдаются различия в свой-
ствах бетонов при введении в них гидрофилизирующих и гидро-
фобизирующих ПАВ, тем не менее, во-первых, во многих слу-
чаях при использовании обоих вариантов комплексных доба-
вок: гидрофилизирующие ПАВ + электролит и гидрофобизи-
рующис ПАВ + электролит — преследуется одна и та же цель:
интенсифицировать процессы схватывания цемента в бетонной
смеси и твердения бетона, заторможенные органической состав-
ляющей добавки. Во-вторых, применение и того, и другого ва-
рианта добавок требует исследований по совместимости
электролитов и ПАВ. В-третьих, с помощью одной из составляю-
щих добавок нередко удается вызвать качественные измене-
ния в действии другой.
173
3.2.3. Смеси добавок третьего и четвертого классов —
готовых центров кристаллизации и органических ПАВ
Комплексные добавки — смеси добавок третьего и четвер-
того классов, — главным образом, на основе гидрофилизирую-
щих ПАВ, проверены и применяются в строительстве. Оправда-
ло себя, например, введение в гипсовые вяжущие при произ-
водстве гипсокартонных плит одновременно лигносульфо-
ната и двугидрата сульфата кальция, выполняющего функции
затравки. Для вяжущих первого типа, для которых, как ука-
зывалось, существенное значение имеет стадия кристаллиза-
ции новообразований как лимитирующая, введение ПАВ при-
водит к экранированию зародышей кристаллизации и потому
еще более замедляет эту стадию, т. е. введение в такие вяжущие
гидрофилизирующих ПАВ сильно тормозит процессы тверде-
ния. Добавление затравки позволяет полностью или частично
снять этот в данном случае отрицательный эффект, сохраняя
главное — пластифицирующее действие ПАВ.
Введение добавок третьего класса совместно с гидрофилизи-
рующими может оказаться полезным и при их введении в вяжу-
щие второго типа, для которых в отсутствие ПАВ длительное
время самая медленная (лимитирующая) стадия — растворение
вяжущего. Поскольку ПАВ, вводимые в небольшой дозе, слабо
влияют на скорость этой стадии (протекающей с диффузион-
ным контролем) и сильно тормозят стадию образования центров
кристаллизации, контроль эа процессом может измениться.
Соответственно в этих условиях введение высокодисперсных
кристаллических затравок становится эффективным способом
интенсификации процесса гидратации подобных вяжущих.
Кроме того, этот экспериментально доказанный факт послужил
обоснованием того, что суперпластификаторы (в опытах поли-
метиленполинафталинсульфонаты натрия (54, 108-110]) дей-
ствительно сорбируются, главным образом, на продуктах гид-
ратации C-S-H.
Наконец, целесообразно вводить затравки совместно с теми
добавками четвертого класса, которые, химически взаимодей-
ствуя с вяжущими и продуктами их гидратации, образуют соеди-
нения, отлагающиеся на вяжущем в виде экранирующих пленок.
Однако в подобных случаях при подборе затравок следует ис-
ходить из их влияния не на гидратные новообразования, а на
химические соединения, составляющие материал пленок. Имен-
но при этом может измениться их экранирующая способность:
если эти вещества будут выделяться преимущественно в объе-
ме, а не на поверхности вяжущего, то ускорится и процесс его
гидратационного твердения.
Эффект введения подобной комбинации добавок, а также
механизм их действия несколько напоминает таковые для рас-
смотренного ранее введения в гипсобетон пленкообразующего
174
электролита (ди натрии фосфа га) и ПАВ — с той, однако, разни-
цей, что гидрофилизирующая добавка и электролит выполняли
в этой модельной системе противоположные функции. В самом
Депе> если в анализируемой сейчас комплексной добавке за
пленкообразование ответственно ПАВ, то в сравниваемом -
opi эпическая добавка только усиливала либо ослабляла экра-
нирующую способность пленок, образованных на зернах вяжу-
ш го ф сфатом кальция. Соответственно при введении смеси
до эавок третьего и четвертого классов затравка действовала
как ускоритель, а в сравниваемом варианте функции ускори-
теля при определенных условиях выполняло ПАВ.
Мы сочли необходимым привести подобную аналогию для
того, чтобы еще яснее стала возможность нахождения общих
закономерностей в механизме действия комплексных добавок.
Это и понятно, так как в основе их влияния на многие процес-
сы, протекающие в цементных материалах, лежит единая схема
их превращений при взаимодействии с водой - растворение
исходных метастабильных фаз, образование растворов, пересы-
щенных относительно гидратных новообразований и их выде-
ление из таких пересыщенных растворов с образованием слож-
ных структур твердения.
Наконец, открывается возможность с общехимических
позиций проанализировать и наметить главные технологические
приемы получения добавок.
Анализ множества приведенных примеров позволяет ут-
всрждать, что современная технология индивидуальных и комп-
лексных добавок в бетон основывается на тех же общих кон-
цепциях, на которых строятся и многие другие химические
производства.
На химическом производстве, как и в практике получения
высокоэффективных добавок, в основу закладывают один
из двух принципиально разных способов. Первый — использо-
вание синтетических продуктов, обладающих ’’концентриро-
ванным” основным эффектом и минимальным (в идеале нуле-
вым) побочным действием. При необходимости придать тако-
му синтетическому продукту полифункциональность, в него
вводят другие чистые вещества. Такой принцип в первом при-
ближении использовали при синтезе суперпластификаторов.
Подобный подход существует и при выборе ряда добавок элект-
ролитов для бетона.
Второй, противоположный, принцип заключается в примене-
нии попутных техногенных продуктов ряда производств весьма
неопределенного, хотя и не обязательно нестабильного во вре-
мени состава. В этом случае обычно их эффективность по основ-
ным показателям ниже, чем у синтетических веществ и к тому
же для них характерно побочное действие, для устранения кото-
рого необходимо или рафинировать вещество, что зачастую
крайне сложно, или вводить в него эффективные компенсаторы.
175
Популярность и перспективность комплексных добавок
объясняется тем многообразием свойств, часто даже противоре-
чивых, которые нужно придать бетону в связи с чрезвычайно
различными технологией его производства, нестабильностью
состава, включая разный химико-минералогический и вещест-
венный состав цемента и других компонентов бетона, и усло-
виями его эксплуатации.
Именно поэтому так важен химический и физико-химиче-
ский подход к изучению добавок в бетон.
СПИСОК ЛИТЕРАТУРЫ
1. Абуева З.А., Лукьянова О.И. О фазовом составе продук-
тов гидратации трехкальциевого алюмината с добавками лигно-
сульфонатов кальция (ССБ) // Кол. ж-л, 1969. Т. 31. № 3. -
2. Андреева Е.П., Иванова Е.В., Стукалова Н.П. Изучение
механизма влияния сахарозы на процессы гидратации /3-двух
и трехкальциевого силиката и разбавленных суспензиях II Кол
ж.-л, 1980. Т. 42, № 1. С. 3-10.
3. Ахвердов И.Н., Далевский А.К. и др. Фенольный пласти-
фикатор для бетона // Бетон и железобетон 1986 № 2 — С
27 -28.
4. А.с. № 214364. Мчедлов-Пегросян О.П., Воробьев Ю.Л.,
Бирюков А.И., Жильцов В.П. // Б.И. № 11. 1968.
5. А.с. № 303301. Мчедлов-Пегросян О.П., Питерский AM
и др.// Б.И. №16,1971.
6. А.с. № 939419. Ратинов В.Б., Сытник Н.И., Файнер Mill
и др. // Б.И. № 24,1982.
7. Бабушкин В.И. Физико-химические процессы коррозии
бетона и железобетона. — М.: Стройиздат, 1968. — 187 с.
8. Баженов Ю.М., Бабаев Ш.Т., Чумаков Ю.М, Влияние супер-
пластификаторов 10-03 и 30-03 на свойства бетонной смеси и
бетона с учетом химико-минералогического состава цементов. //
Применение химических добавок в технологии бетона. МДНТП.
1980.- С. 54-56.
9 Байрамов Ф.А., Оруджев Ф.М., Кузнецова Т.В. и др. Влия-
ние сунерпластификатора с высоким содержанием гидрофиль-
ной группы на гидратацию и твердение цементов. // Цемент
1986. №5.-С. 14-15.
10. Батраков В.Г., Иванов Ф.М., Силина Е.С. и др. Строи-
тельные материалы и изделия: Обзор, информ. Вып. 2. Сер. 7.
Применение суперпластификаторов в бетоне // ВНИИИС. 1982. —
58 с.
11 Батраков В.Г. Суперпластификаторы — исследование и
опыт применения // Применение химических добавок в техно-
логии бетона / МДНТП. — М.: Знание, 1980. — С. 29—36.
12. Батраков В.Г. Повышение долговечности бетона с до-
бавками кремнийорганических полимеров. — М.: Стройиздат,
1968.
13. Батраков В.Г., Тюрина Т.Е., Фаликман В.Р. Пластифици-
рующий эффект сунерпластификатора С-3 в зависимости от
состава цемента // Бетоны с эффективными модифицирующими
добавками / НИИЖБ. — М., 1985. — С. 8—14.
14. Боженов П.И., Кавалерова В.И. Повышение механической
прочности гипсовых форм// Тр. совещ. по производству формо-
вочного гипса и его применению в различных отраслях
пром-сти. — М., 1957, — С. 30—39.
177
15. Вавржин Ф., Крмча Р. Химические добавки в строитель- •
стве. — М.: Стройиздат, 1964. — 288 с.
16. Волков О.С., Соколов П.Н. К вопросу о гидратации и
твердении индивидуальных клинкерных минералов // Тр_
НИИАсбестоцемента. 1962. № 14— С. 3—24.
17. Вольнов И.И. О термической устойчивости гидроксихло-
ридов кальция // Изв. сектора физико-химического анализа
АН СССР. Т. 27. 1956.-С. 251.
18. Глекель Ф.Л. Гидратационное сзруктурообразование.
Основы его регулирования с помощью добавок // Успехи кол-
лоидной химии. — Ташкент: Фан. — С. 191 — 198; Физико-хими-
ческие основы применения добавок к минеральным вяжущим. —
Ташкент: Фан, 1975. — 197 с.
19. Горбунов С.П., Трофимов Б.Я. Особенности гидратации >
и твердения цементов с добавками электролитов и ПАВ // *
Цемент, 1984. № 12. - С. 19-20.
20. Грачева О.И. Некоторые физико-химические и техничес- d
кие свойства синтетических г гидроферритов и сульфоалюмо- '
ферритов кальция // Тр. НИИАсбестоцемента. — М., 1962, № 14,—
С. 50-63.
\/2 1. Грапп В.Б., Ратинов В.Б. Применение химических доба-
вок для интенсификации процесса производства и повышения
качества бетона и железобетона / ЛатНИИНТИ. — Рига, 1979. —
28 с.
22. Грапп А.А., Грапп В.Б., Баркан Р.Д. Перспективы при-
менения в технологии бетонов добавок суперпластификаторов /
ЛатНИИНТИ. - Рига, 1982. - 21 с.
23. Горчаков Г.И., Орентлихер Л.П., Савин В.И. и др. Состав,
структура и свойства цементных бетонов. — М.: Стройиздат,
1976.- 145 с.
24. Грушко И.М., Дегтярева Э.В. и др. Новый суперпласти-
фикатор для бетона // Бетон и железобетон. 1983. № 3. — С. 27—
28; Бетоны с эффективными модифицирующими добавками //
НИИЖБ.- М.» 1985.-С. 107-113.
25. Грушко И.М., Дегтярева Э.В. Влияние комплексных до-
бавок на прочность бетона // Строительные материалы и кон-
струкции. 1985, № 3. — С. 26—27.
26. Гусев Б.В., Усов Б.А., Галкина Т.Ю. Повышение эффек- •
тивности пластифицирующих добавок обработкой в РПА //
Совершенствование технологии бетона за счет применения но-
вых химических добавок / МДНТП. — М.: Знание, 1984. — i
С. 103-106.
27. Дворкин Л.И., Кизима В.П. Эффективные литые бетоны.—
Львов: Вища школа, 1986. — 142 с.
\J 28. Добролюбов Г.Г., Ратанов В.Б., Розенберг Т И. Прогно-
зирование долговечности бетона с добавкгми. — М.: Стройиздат,
1983.-212 с.
178
29. Долгополов Н.Н., Колюцкий В.Н., Суханов М.А. Совер-
шенствование технологии сборного железобетона за счет приме-
нения суперпластификаторов // Совершенствование технологии
бетона за счет применения новых химических добавок I
МДНТП. - М.: Знание, 1984. - С. 22-26.
30. Дьяченко Ю.К., Енишерлова С.Г., Кучеряева Г.Д. и др.
Влияние хлорид-нитрат- и нитритсодержащих добавок на кор-
розию предварительно напряженной арматуры в тяжелом бето-
не // Защита металлов, № 4, 1987. - С. 41-42.
31 Дьяченко Ю.К., Енишерлова С.Г., Кучеряева Г.Д. и др.
Сюнкость конструктивного керамзитобетона с предварительно
напряженной арматурой в присутствии нитрит-, нитрат-и хлорид-
содержащих добавок I/ Бетон и железобетон. № 9, 1987.
32. Иванов Ф.М. Добавки в бетоны и перспективы примене-
ния суперпластификаторов // Бетоны с эффективными супер-
пластификаторами / НИИЖБ. — М„ 1979. — С. 6—20.
33. Иванов Ф.М. Современное состояние применения хими-
ческих добавок в технологии бетона // Применение химических
добавок в технологии бетона / МДНТП. — М.: Знание, 1980. —
С. 11-12.
34. Иванов Ф.М., Батраков В.Г., Лагойда А.В. Основные на-
правления применения химических добавок к бетону // Бетон
и железобетон. 1981, № 9 — С. 3—4.
35. Иноземцев Г.П., Алимов Ш.С., Ратинов В.Б. Повышение
эффективности тепловлажностной обработки бетонов путем
введения химических добавок // Бетон и железобетон. 1972.
№ 10. - С. 21-23.
36. Иочинская И.А. Влияние комплексных добавок на про-
цессы гидратации и твердения портландцемента: Автореф.
дис. на соиск. уч. степ. канд. техн. наук. — М., 1974.
37. Колбасов В.М. Структурообразующая роль суперпласти-
фикаторов в цементном камне бетонов и растворов // Бетоны
с эффективными модифицирующими добавками / НИИЖБ. —
М„ 1985. -С. 126- 134.
38. Комар А.А., Бабаев Ш.Т. Комплексные добавки для вы-
сокопрочного бетона // Бетон и железобетон. 1981. № 9. — С. 16—
17.
39. Коренюк А.Г., Бессараб А.Н. Модифицированная СДБ
в качестве суперпластификатора // Строительные материалы и
конструкции. 1981. № 2. — С. 21—22.
40. Коренюк А.Г., Соколов О.М., Бессараб А.Н. К вопросу
обоснования выбора способа модификации лигносульфонатов —
эффективных разжижителей бетонных смесей // Повышение
качества и эффективности изготовления бетонных и железо-
бетонных конструкций за счет химических добавок: Тез. докл,—
М., 1981.-С. 71-72.
41. Кунцевич О.В. Бетоны высокой морозостойкости для
сооружений Крайнего Севера. — Л.: Стройиздат, 1983. — 131 с.
179
42. Курбатова И.И. Химия гидратация портландцемента. -
М.’ Стройиздат, 1981, — 158 с.
\/43. Кучеряева Г.Д., Розенберг Т.Н., Ратинов В.Б. Влияние
добавок на основе хорошо растворимых солей кальция на
структурно-механические свойства цементного- камня и моро-
зостойкость цементных материалов // Новые эффективные
виды цементов / НИИЦемент. — М., 1981. — С. 110—115.
44. Лагздинь Э.А., Вайвад А.Я. Стабильность растворов алю-
мометилсиликоната натрия в зависимости от pH // Изв.
АН ЛатвССР. 1965, № 1,- 21-27.
45. Лагойда А.В., Королева Н.А. Сокращение энергозатрат
на производство сборного железобетона введением добавок //
Бетон и железобетон, 1982, № 2. — С. 14—15.
46. Лагойда А.В. Эффективные противоморозные добавки
для бетона // Совершенствование технологии бетона за счет
применения химических добавок. — М., 1984. — С. 93—103.
47. Ларионова З.М. Формирование структуры цементного
камня и бетона. — М.: Стройиздат, 1971. — С. 161.
48. Левич В.Г. Физико-химическая гидродинамика. — М.:
Физматгиз, 1961. — 699 с.
49. Лукоянов А.П., Долгорев А.В., Варламов В.Л. Повыше-
ние клеящей и пенообразующей способности лигносульфона-
тов // Повышение эффективности производства и применения
гипсовых материалов и изделий / ВНИИСТРОМ. — М., 1985.
Вып. 60(87). - С. 127-133.
50. Лукьянова О.И., Сегалова Е.Е., Ребиндер П.А. О природе
индукционного периода гидратации портландцемента с добав-
ками гидрофильного пластификатора // ДАН СССР. Т. 117.
№6.- С. 1034-1036.
51. Лыков А.В. Теория сушки. — М.: Энергия, 1968. — 470 с.
52. Маркова О.А. Исследование в области гидроксихлоридов
кальция, стронция и бария: Автореф. дне. на соиек. уч. степ,
канд. техн. наук. — М.: 1973.
53. Москвин В.М., Батраков В.Г., Кунцевич О.В. и др. Струк-
тура и морозостойкость гидротехнического бетона с добавкой
ГКЖ-94// Бетон и железобетон. 1980. № 7. - С. 20—21.
54. Мчедлов-Петросян О.П., Урженко А.М., Ушеров-Мар-
шак А.В. Калориметрические исследования кристаллохимиче-
ской активации процессов твердения вяжущих веществ // ДАН
СССР. Т. 233. 1977. № 3. - С. 439-441.
к 55. Мчедлов-Петросян О.П., Братчиков В.Г. и др. Особенно-
сти гидратации цементов в присутствии пластификаторов
ХДСК-1 /I Цемент. 1984. № 4. - С. 8-9.
I 56. Овчаренко Г.И., Тамаш Ф.Д. Влияние состава клинкера
на свойства смешанных цементов с добавкой ’’щелочь-лигно-
сульфонат” // Цемент. № 2. 1987. — С. 15—17.
57. Окороков С.Д. Взаимодействие минералов портландце-
ментного клинкера в процессе твердения цемента. — Лл
Стройиздат, 1945. - 150 с.
58. Орлова Н.А., Каприелов С.С., Башлыков Н.Ф. Влияние
натриевых солеи оксикислот на свойства цементных систем //
гпХ'-г С ^ФФекгнвными модифицирующими добавками /
НИИЖЬ. - М., 1985. - С. 113-119.
59. Пантелеев А.С., Колбасов В.М. Цементы с минеральными
добавками-микронаполнителями // Тр. совещ. по химии це-
мента. — М., 1961; То же // Новое в химии и технологии цемен-
та. - М., 1962. - С. 155-164.
60. Пауэрс Т.К. Физическая структура портландцементного
теста // Химия цементов / Под ред. Тейлора Х.Ф.У: Пер. с
англ. — М.: Стройиздат, 1969. — С. 300—319.
61. Пименова С.М., Ратинов В.Б., Смирнова И.А. Исследова-
ние кинетики и механизма гидратации основных минералов
портландцементного клинкера при твердении // Сб. тр.
ВНИИЖелезобетон. — М.: Стройиздат, 1962. № 6. — С. 138—148.
62. Полак А.Ф. Твердение мономинеральных вяжущих ве-
ществ. — М.: Стройиздат, 1966. — 213 с.
63. Попова О.С. Основные свойства бетонных смесей и бето-
нов с добавками водорастворимых смол // Бетоны с эффектив-
ными суперпластификаторами / НИИЖБ. — М., 1979. — С. 177—
188.
64. Рапопорт Б.Е. и др. Оптимизация тепловлажностной об-
работки бетонов с помощью добавок // Бетон и железобетон,
1981. №8.-С. 24-25.
65. Ратинов В.Б., Забежинский Я.Л., Розенберг Т.И. Иссле-
дование механизма твердения гипсовых вяжущих веществ в
присутствии добавок // ДАН СССР, 1956. 109. № 5. - С. 979;
К вопросу о теории твердения минеральных вяжущих веществ //
Сб. тр. / ВНИИЖелезобетон. Вып. 1. — М., 1957. — С. 3—35.
66. Ратинов В.Б., Розенберг Т.И. Основные закономерности
образования пленок при твердении вяжущих веществ и хими-
ческие методы воздействия на процесс формирования и свой-
ства пленок И Сб. тр. № 2 / ВНИИЖелезобетон. — М., — С. 7—36.
67. Ратанов В.Б., Григорян В.А. Температурная зависимость
скорости взаимодействия гипса и извести с водой // Строитель-
ные материалы. 1960. № 3. — С. 32—33.
68. Ратинов В.Б., Кучеряева Г.Д. и др. Термодинамические
и диффузионные характеристики основных составляющих це-
мента при их растворении в воде // Изв. вузов. Сер. Строитель-
ство и архитектура, 1961. № 6. — С. 135—145; То же // ДАН
СССР, 1961. Т. 136, № 4. - С. 875-878.
69. Ратинов В.Б., Лавут А.П. Исследование кинетики гидра-
тации минералов портландцементного клинкера // ДАН СССР.
Т. 146. №1. 1962.-С. 148-151.
180
181
70. Ратинов В.БЛ Розенберг Т.Н., Рубинина Н.М. Исследова-
ние кинетики кристаллизации гидросульфоалюмината каль-
ция//ДАН СССР. Т. 145, №5. 1962.-С. 1089-1091.
71. Ратинов В.Б., Розенберг Т.И., Смирнова И.А. О механиз-
ме действия добавок — ускорителей твердения бетона // Бетон
и железобетон, № 6. 1964. — С. 282—285.
72. Ратинов В.Б., Розенберг Т.Н., Алимов UI.C. Исследование
механизма действия гидролизующихся со; ей в качестве доба-
вок в бетон // Строителни материали и силикатна промыш-
ленност. — НРБ, № 1. 1968. — С. 3—9.
73. Ратинов В.Б., Иванов Ф.М. Химия в строительстве. — М.,
Стройиздат, 1977. — 220 с.
74. Ратинов В.Б., Розенберг Т.Н., Кучеряева Г.Д. Рациональ-
ные области применения в бетоне комплексных добавок, со-
держащих электролиты // Применение химических добавок
в технологии бетона / МДНТП. — М.: Знание, 1980. — С. 57—
60; Комплексные добавки для бетона // Бетон и железобетон.
1981. №9.- С. 970.
75. Ратинов В.Б., Гусев Б.В. и др. Особенности структуры
бетона и фазового состава цементного камня на основе шлако-
портландцемента с суперпластификатором ”НФ” // ЖПХ. № 12.
1982.-С. 2771-2774.
76. Ратинов В.Б. Ускорение твердения бетона железобетон-
ных конструкций за счет применения комплексных добавок //
Совершенствование технологии бетона за счет применения но-
вых химических добавок / МДНТП. — М.: Знание, 1984. — С. 44—
49.
77. Ратинов В.Б., Просвирин А.А., Баскакова Р.Р. О влиянии
полиамина на лигносульфонаты щелочного металла // ДАН
СССР, 1987. - С. 655-659.
78. Рекомендации по применению добавок суперпластифи-
каторов в производстве сборного и монолитного железобетона/
НИИЖБ и ЦНИИОМТП Госстроя СССР. - М.: Стройиздат,
1987.-С. 95.
79. Романова Н.А. Комплексные добавки для зимнего бето-
нирования // Совершенствование технологии бетона за счет
применения новых химических добавок. — М.: Знание, 1984. —
С. 137-138.
80. Розенберг Т.И., Рубинина Н.М., Ратинов В.Б. Управление
скоростью твердения гипса с помощью многокомпонентных
добавок // ДАН СССР, 1957. Т. 112, № 5. - С. 919-922.
81. Розенберг Т.Н., Ратинов В.Б. Методика определения ко-
эффициентов активности и растворимости гипса в растворах,
пересыщенных собственными ионами и содержащих ионы
посторонних электролитов // Сб. тр. № 1 / ВНИИЖелезобетон. —
М., 1957.- С. 36-48.
82. Розенберг Т.Н., Рубинина Н.М. Петрографические иссле-
дования метастабильных фаз, образующихся в системах
СаО - А12О3 - CaS04 - Н2О, СаО - Fe2O, -ai о г сп
- Н2О и СаО - А12О3 - CaS04 - SiO2 л Н,О Д Tn’ ч 4 "
по экспериментальной и техн. минепалогиииР’7'Г°СОВжЩ’
АН СССР.-М.: Наука, 1966.-С. 85-90Р петрографии
83. Розенберг Т.Н., Алимов Ш.С и пп
валентных солей железа в качестве добавок 2Д^Х”Ие Тре*’
твердения бетона // Тр. Междуиар. симпозиума
в раствор и бетон / РИЛЕМ. - Брюссель, 1967. - С 171-^80
84. Розенберг Т.Н., Брейтман Э.Д., Грачева О.И. Исследова-
ние продуктов взаимодействия нитрата кальция с тоехкаль
циевым алюминатом // ДАН СССР. Т. 200. № 2. 1971. - С 352-
85. Розенберг Т.Н., Брейтман Э.Д., Казанский В.М , Граче-
ва О.И. Исследование систем ЗСаО • А12О3 - Ca(N03), - Н-,О
и ЗСаО • А12О3 - Са(ОН)2 - Ca(NO3)2 - Н2О // ЖПХ. Т. 46
№ 2. 1973. - С. 980-985.
86. Розенберг Т.Н., Медведева В.И., Кучеряева Г.Д. и др.
Исследование продуктов взаимодействия нитрата и нитрита
кальция с гидроокисью кальция при температуре ниже 0°С //
ЖПХ. Т. 46, № 4. 1973. - С. 946-948.
87. Розенберг Т.Н. и др. Исследование процессов твердения
бетонов с комплексными добавками при температуре ниже
0°С // Тр. 2-го Междунар. симпозиума по зимнему бетонирова-
нию. - М.; Стройиздат, 1975. — С. 152—162.
88. Розенберг Т.И., Кучеряева Г.Д. и др. Исследование но-
вых соединений, образующихся в системах СаО — Ca(NO3)2 —
— Н2О и СаО — Ca(NO2)2 — Н2О, и их роль в процессах тверде-
ния ’’холодных” бетонов с добавками на основе нитрата и нитри-
та кальция // Тр. совещ. ’’Эксперимент в области технического
минералообразования” / АН СССР. - М.: Наука, 1975. - С. 119—
122.
89. Саввина Ю.А., Лейрих В.Э., Серб-Сербнна Н.Н. Процессы
твердения и свойства ’’холодного” бетона // Органе ргострой. —
Куйбышев, 1957.
90. Самойлов О.В. Структура водных растворов электролитов
и гидратация ионов / АН СССР. — М., 1957. — 180 с.
91. Сватовская Л.Б., Сычеь М.М., Досмагамбетова Т.С. Влия-
ние кристаллохимических и валентных характеристик вводимых
соединений на твердение цемента // ЖПХ. Т. 54, № 3. 1981. —
С. 501-506.
92. Сватовская Л.Б., Сычев М.М. Активированное твердение
цементов. — Л.: Стройиздат, 1983. — 161 с.
93. Сегалова Е.Е., Соловьева Е.С., Ребиндер П.А. Определение
величины пересыщения в водной среде суспензий трехкальциево-
го алюмината и кинетики ее изменения // ДАН СССР. Т. 117.
№5. 1957.-С. 841-844.
183
182
94. Сергеева В.Н., Тарнаруцкий Г.М. и др. Лигносульфонаты
как пластификаторы цемента // Химия древесины. 1979. № 3. —
С. 3-12.
95. Соломатов В.И., Тахиров М.К., Короткий М.М. Бетон с
АЦФ-добавкой для транспортного строительства. — М.: Транс-
порт, 1986. — 62 с.
96. Справочник по химии цемента. — Л.: Стройиздат, 1980. —
221 с.
97. Стейнор Г. Реакции и термохимия гидратации цемента
при обычной температуре // Тр. 3-го Междунар. конгресса по
химии цемента. — М., 1958. — С. 177—201.
V 98. Стукалова Н.П., Андреева Е.П. Влияние хлористого каль-
ция на процессы химического взаимодействия в водных суспен-
зиях трехкальциевого алюмината // Кол. ж-л. Т. 30. № 5. 1968. —
С. 761-765.
99. Ступаченко П.П. Влияние структурной пористости гидро-
технического бетона на его свойства и долговечность // Защита
строительных конструкций от коррозии // НИИЖБ. — М. Строй-
издат, 1966. — С. 67—84.
100. Сытник Н.И., Андрианова Г.С., Забродский А. Г. Опыт
и перспективы применения добавки УПБ // Совершенствование
технологии бетона за счет применения новых химических доба-
вок I МДНТП. — М.: Знание, 1984. — С. 111—113.
101. Тарнаруцкий Г.М., Малинин Ю.С. и др. Новые пластифи-
цирующие добавки к цементу и бетону // Цемент. 1980. № 9. —
С. 13-15.
102. Таубе П.Р., Чумаков Ю.М., Ратинов В.Б. Изменение
дисперсности цемента при его гидратации в присутствии доба-
вок // Цемент. 1980. №1. — С. 10—11.
103. Тейлор Х.Ф.У. Кристаллохимия продуктов гидратации
портландцемента // 6-й Междунар. конгресс по химии цемен-
та. — М.: Стройиздат, 1976. Т. 2. — С. 192—207; Гидросиликаты
кальция // Химия цементов. — М.: Стройиздат, 1969. — С. 104—
166.
104. Тодес О.М. Кинетика процессов кристаллизации и кон-
денсации. Проблемы кинетики и катализа / АН СССР. — М.,
1949. Т. 7,- С. 91-122.
V 105. Тринкер Б.Д. Сравнительные исследования эффектив-
ности химических добавок // Применение химических добавок
в технологии бетона / МДНТП. — М.: Знание, 1980. — С. 81—89.
106. Угулава Л.Г. Повышение водозащитных свойств легко-
го бетона комплексной химической добавкой: Автореф. дис.
на соиск. уч. степ. канд. техн. наук. — Тбилиси, 1986.
107. Ушеров-Маршак А.В., Осенкова Н.Н., Циак М. Скорость
и полнота ранних стадий гидратации цемента в присутствии
суперпластификаторов // Бетоны с эффективными модифици-
рующими добавками / НИИЖБ^— М., 1985. — С. 38—42.
108. Ушеров-Маршак А.В., Осенкова НИ Фали^ D
яг
109. Фаликман В.Р. Физико-химические предпосылки поиска
и разработка новых химических добавок для совершенствова
ния технологии бетона // Совершенствование технологии бетона
за счет применения новых химических добавок / МДНТП - м •
Знание, 1984.-С. 71-76.
110. Фаликман В.Р., Булгакова М.Г., Вовк А.И., Савидо-
ва Л.А. Зависимость свойств бетона с суперпластификатором
С-3 от степени поликонденсации полиметиленполинафталин-
сульфонатов // Бетоны с эффективными модифицирующими
добавками / НИИЖБ. — М., 1985. — С. 15—24.
111. Фаликман В.Р., Вовк А.И. Особенности взаимодействия
полиметиленполинафталинсульфонатов разного молекулярного
веса с мономинералами портландцементного клинкера // Эф-
фективные химические добавки для бетона / НИИЯФ. — М.:
Стройиздат, 1987. — с.
112. Хигерович М.И., Байер В.Е. Гидрофобнопластифицирую-
щие добавки для цементов, растворов и бетонов. — М.: Строй-
издат, 1979. — 125 с.
113. Черкинский Ю.С., Юсупов Р.К. и др. Высокоэффектив-
ный пластификатор бетонных смесей: Реф. информ. / ВНИИЭСМ.
Сер. Промышленность сборного железобетона, 1978. Вып. 4;
То же // БетсТн и железобетон, 1980. № 6.
114. Черкинский Ю.С. Особенности пластификации бетон-
ных смесей суперпластификаторами //.Применение химических
добавок в технологии бетона / МДНТП. — М.: Знание, 1980. —
С. 37-40.
115. Шейкин А.Е., Чеховский Ю.В., Бруссер М.И. Структура
и свойства цементных бетонов. — М.: Стройиздат, 1979. — 344 с.
116. Шестоперов С.В. Долговечность бетона. — М., 1966. —
500 с.
117. Шпынова Л.Г., Островский М.А. и др. Бетоны для строи-
тельных работ в зимних условиях / ЛГУ. — Львов, 1985. —
79 с.
« 118. Эккель С.В. Исследование структурообразования в це-
ментных системах с пластифицирующими добавками ПАВ //
Исследование дорожного бетона с комплексными добавками /
СоюздорНИИ. — М., 1984. — С. 41—56.
* 119. Юсупов Р.К., Бочаров Н.А., Иванов В.И. Разработка
методов модификации лигносульфонатов и новая пластифици-
рующая добавка к бетону марки НИЛ-21 // Совершенствование
технологии бетона за счет применения новых химических доба-
вок / МДНТП. — М.: Знание, 1984. — С. 50—54.
« 120. Юсупов Р.К., Карпис В.З., Гольдштейн В.А. Повышение
эффективности добавок лигносульфонатов // Бетон и железо-
бетон. 1985. № 10. - С. 14—15.
184
185
121. D’Ans L, Eich H. Das System CaO—AI2O3-H2O bei
20°C und das Erharten // Zement— Kalk- Gips. 1953. N 6.-
S. 197-210.
122. Burk A.A., Gaidis I.M., Rosenberg A.M. Adsorption of
Naphthalene—Based Syperpdasticizers on different cements ff
IT Intern. Confer. Superplaticizcrs in Concrete. Ottawa
4 Canada), 1981. — 23 p.
123. Collepard M., Corradi M., Valente M. Influence of
polymerization of sulfonated Nathalcne condensate and its
Interaction with cement—Amer, concr. Inst. SP—68, 1980. V. 3.—
P. 20-25.
124. Diamond S. Interaction between cement minerals and
Hydroxycarboxylic Acid Retarders //T Apparent Adsorption
of Solicylis Acid on cement and Hybrated cement compounds.—
Jounal of Amer. Ceram, soc. 54. — P. 273—276 1971. N 55.—
P. 405-408, 1972.
125. Foret J. Recherche sur les combinasions entre les seis
de calcium et les aluminates de calcium.—Paris,—1935.
126. Kondo R., Daimon M., Sakai E. Interaction between
cement and organic polyelectrolytes //Cement. 1978. V. 75,
N 3.-P. 225-230.
127. Lafuma H. Recherches sur les Aluminates de chloride
et le sulfate de calcium. — Paris, 1932.
128. Masazza F, Costa V., Barilla A. Interaction between
superplastificizers and calcium aluminate hydrates //I. Am.
ceram. soc. 1982. V. 65. N 4. — P. 203-207.
129. Monosi S., Moriconi G., Pauri M., Collepardy M. Influ-
ence of lignosulphonate, glucose and gluconate on the C3A
hydration ft Cem. Concr. Res., 1983. V. 13. N 4. — P. 568—574.
130. Monosi S., Moriconi G., Collepardi M. Combined effect
of lignosulphonate and carbonate on pure portland clinker
compounds hydration //ITT Hydration on cricalcium silicate
alone and in the presence of tricalcium aluminate. Cem. Am.
Concr. Res., 1982. V. 12. N 4..— P. 425--435, I Tetracalcium
Aluminoferrite Hydration. N 10. P. 455—462 1980.
131. Ramachandran V.S., Feldman R.F., Beudon 1.1. Concrete
science. Heyden §Son Ltd., 1981,—427 p.
132. Ramachandran V.S. Influence of superplasticizers on
the Hydration of cement H 3—rd Intern. Congs. Polymers in
concrete. — Koriyama (Japan ), 1981.— P. 1071 — 1081.
133. Ramachandran V.S. Adsozption and Hydration
Behavior of Tri calcium Aluminate — Water and Tricalcium
Aluminate-Gypsum-Water Systems in the presence of
Syperplasticisers //Joum. Amer, concr. Inst., 1983. N 80. —
P. 235-241.
134. Roy D.M., Daimon M. Effects of Admixtures upon
electrokinetic Phenomena During Hydration of C3S, C3A and
Portland cement. //7—th Intern, congr. Chem. ccm. — Paris, 1980,
V. 2. - P. 242-246.
186
ОГЛАВЛЕНИЕ
ГЛАВА 1. СОСТАВ ЦЕМЕНТНОГО КАМНЯ. МЕХАНИЗМ и КИНРТи 3
КА ГИДРАТАЦИИ ПРИ ТВЕРДЕНИИ ВЯЖУЩИХ ВЕЩЕСТВ ЕТИ'
1.1. Фазовый состав цементного камня в бетоне
1.2. Основы механизма и кинетики процесса гидратации при тверде- 5
нин минеральных вяжущих веществ
1.3. Кинетика протекания процессов растворения вяжущих веществ *'
и кристаллизации новообразований из пересыщенных растворов i
1.4. Качественные и количественные закономерности кинетики гидра-
тации при твердении минеральных вяжущих веществ 2i
1.5. Уровни структуры и энергия связи между составляющими це-
ментного камня в бетоне
ГЛАВА 2. КЛАССИФИКАЦИЯ ДОБАВОК В БЕТОН И МЕХАНИЗМ
ИХ ДЕЙСТВИЯ ,
2-1. Основные принципы построения классификации добавок 37
2.2. Добавки первого класса - электролиты, изменяющие раство-
римость вяжущих веществ 33
2.2.1. Добавки, ие содержащие одноименных с вяжущим ионов 41
2.2.2. Добавки, содержащие одноименные с вяжущими ионы 45
2.3. Добавки второго класса, реагирующие с вяжущими веществами
с образованием труднорастворимых или малодиссоциированиых
соединений 55
2.3.1. Добавки первой группы, вступающие с вяжущими веществами
в реакции присоединения 55
2.3.2. Добавки второй группы, вступающие с вяжущими веществами
в обменные реакции 79
2.4. Добавки третьего класса — готовые Центры кристаллизации
(кристаллические затравки) 97
2.5- Добавки четвертого класса - органические поверхностно-актив-
ные вещества 101
2.5.1. Выбор классификации добавок четвертого класса jqj
2.5.2. Добавки первой группы - гидрофилизирующие Ю5
2.5.3. Добавки второй группы - гидрофобизирующие 125
ГЛАВА 3. ТВЕРДЕНИЕ БЕТОНА С КОМПЛЕКСНЫМИ ДОБАВКАМИ 130
3.1. Комплексные добавки первой категории 131
3.1.1. Смеси добавок первого класса 131
3.1.2. Смеси добавок второго класса 133
3.1.3. Смеси добавок третьего класса 154
3.1.4. Смеси добавок четвертого класса 154
3.2. Комплексные добавки второй категории 160
3.2.1. Смеси добавок первого и второго, первого или второго и третье-
го классов — электролитов и готовых центров кристаллизации 160
3.2.2. Смеси добавок первого или второго и четвертого классов —
электролитов и ПАВ 162
3.2.3. Смеси добавок третьего и четвертого классов — готовых центров
кристаллизации и органических ПАВ 174
СПИСОК ЛИТЕРАТУРЫ 177
Проект- ОТКРЫТЫЙ ДОСТУП
Над оцифровкой данной книги работали:
Ружинский С.И. rygmskifaiaport.ги
Ружинский Ю.И.
Раенко А.С.
август 2005, г. Харьков, Украина
г.Харьков, ул. Чкалова 1
МП «Городок»
Популяризация применения химических добавок и оригинальных технологий в строительной индустрии.
ryginski@aport.ru
+38(057)315-32-63
Здесь может быть Ваша реклама!
Закажи книгу по бетоноведению или строительству на оцифровку и размести в ней свою рекламу.
Дополнительная информация: ryginski@aport.ru